Автор: Любашенко С.Я.
Теги: медицинские науки биология клетки и субклеточных частиц цитология ветеринария микробиология
Год: 1982
Текст
УЧЕБНИКИ И УЧЕБНЫЕ ПОСОБИЯ ДЛЯ ВЫСШИХ
СЕЛЬСКОХОЗЯЙСТВЕННЫХ УЧЕБНЫХ ЗАВЕДЕНИЙ
ВЕТЕРИНАРНАЯ
МИКРОБИОЛОГИЯ
ПОД РЕДАКЦИЕЙ ПРОФЕССОРА Е. В. КОЗЛОВСКОГО и П. А. ЕМЕЛЬЯНЕНКО
Допущено Главным управлением высшего и среднего сельскохозяйственного образования Министерства сельского хозяйства СССР в качестве учебника для студентов высших сельскохозяйственных учебных заведений по специальности «Ветеринария»
www.vetvrach.com
ветеринарная библиотека
МОСКВА «КОЛОС» 1982
ББК 48
В39
УДК 619 : 676.8(075.8)
Авторы: П. А. Емельяненко, Г. В. Дунаев, Д. Г. Кудлай, |С. Я. Любашенко\, Б. Л. Матвиенко, В. И Пол-гев, В. И. Ротов, С. Т. Рягин, В. С. Рягузов, И. В. Тарасевич, К. П. Чепуров
Рецензенты: профессора Р. Д. Кадымов н В. П. Кивалкина
Ветеринарная микробиология/П. А. Емельяненко, В39 Г. В. Дунаев, Д. Г. Кудлай и др.; —304 с., ил. — (Учебники и учеб, пособия для высш. с.-х. учеб, заведении).
Учебник написан с учетом новейших донных микробиологической науки и практики и включает в себя общую и частную микробиологию. В отличие от прежних учебников по-новому представлены систематика микроорганизмов, структура микробной клетки, генетика микробов, раздел инфекции и иммунн-тетя, упорядочен материал по чвсткрП микробиологии.
Для студентов ветеринариях вузов и факультетов.
380502000Q-293 240_82
035(01)—82
ББК 48
636.09
Издательство «Колос», 1982
Микробиология (micros — малый, bios — жизнь, logos — учение) — наука, изучающая строение, функции, распространение и специфическую Активность микроорганизмов (микробов). Большая часть этих организмов в диаметре не превышает 0,1 мм и поэтому невооруженным глазом невидима.
k' Микробы первыми заселили нашу планету, распространились во ’ всех ее средах и, несмотря на исключительно малую величину, по массе протоплазмы значительно превосходят массу животных. Благодаря функционированию этих миниатюрных существ постоянно происходит круговорот веществ в природе, поддерживается жизнь растений и животных.
Длительная адаптация микробов к определенной среде обитания обусловила специфическую активность представителей мйкромира разных классов. В настоящее время их используют для обезвреживания газов при разработках каменного угля, для добычи цветных металлов, утилизации товарной упаковки, производства бумаги, очистки трубопроводов. Широкое применение микроорганизмы нашли в хлебопечении, виноделии, пивокурении, производстве молочнокислых продуктов, витаминов, лекарственных веществ, в производстве и консервировании кормов. Не случайно поэтому большое значение придается всемерному развитию микробиологической промышленности.
Изучению микробной модели значительное место отводится в экзо-биологий, генетике, геронтологии, других биологических науках, а также при решении проблем охраны окружающей среды.
Благодаря развитию микробиологии установлена этиология и изучен патогенез большинства инфекционных болезней растений, животных, человека. Микробиология явилась колыбелью иммунологии. Современная иммунология не только обогатила арсенал специфических средств диагностики, профилактики инфекционных болезней, но и позволила четко сформулировать представление о механизмах поддержания гомеостаза с учетом межорганизменных связей и генеалогических аспектов /' эволюции живой природы.
Мир микробов обширен. В него включены одноклеточные простейшие, сине-зеленые водоросли, микроскопические грибы, актиномицеты, бактерии, микоплазмы, риккетсии и вирусы.
; Углубленное изучение микробов различных классов привело к фор-мированию в пределах микробиологии таких самостоятельных наук, /как бактериология, микология, вирусология, риккетсиология, микоплаз-матология и т. п. Каждая из них детализирует наши знания биологии и роли определенного микрообъекта. Вместе с тем в зависимости от задач микробиология подразделяется на общую и отраслевые науки. Общая микробиология изучает общие функционально-морфологические закономерности микромира, тогда как отраслевые науки исследуют преимущественно прикладную роль микроорганизмов. Например, промышленная микробиология изучает технологические аспекты использования микро-; бов в народном хозяйстве, сельскохозяйственная микробиология исследует роль микробов преимущественно в растениеводстве, медицинская и ветеринарная микробиологии изучают в основном значение микробов в
1*
3
патологии человека и животных» а следовательно» и разрабатывают меры борьбы с возбудителями болезней.
Курс ветеринарной микробиологии включает разделы общей и частной микробиологии в соответствии с учебной программой, предусматривая ознакомление студентов с полезной деятельностью микроорганизмов, изучение основ санитарной микробиологии и главным образом специфической болезнетворной функции микробов. В связи с этим в учебнике нашли отражение особенности патогенных микробов, отличительные признаки отдельных возбудителей болезней и различия механизмов взаимодействия болезнетворных микробов с макроорганизмом. Существенное внимание при этом уделено специфическим методам тестирования патогенности микробов и иммунной реакции организма, а также технологии изготовления и контролю качества профилактических и лечебных биопрепаратов.
В системе подготовки ветеринарного врача курс микробиологии, следовательно, непосредственно направлен на формирование профессионального мышления будущего специалиста широкого профиля, способного принять активное участие в реалйзации комплексной Продовольственной программы.
КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ МИКРОБИОЛОГИИ
Несмотря на то, что микробиологические процессы использовались человеком издавна, а живая природа возбудителей заразных болезней предполагалась еще до» нашей эры, развитие микробиологии обязано опытам голландского исследователя Антони ван Левенгука (1632—1723). Увлекаясь шлифованием линз, Левенгук при помощи самодельного микроскопа впервые в истории человечества увидел микроскопические существа, которые мы называем теперь микробами. Хотя его оптическое устройство составляло лишь третью часть максимального увеличения современного микроскопа» Левенгуку почти за полувековой срок исследования микромира удалось обнаружить и описать многих простейших, водорослей, дрожжей и бактерий. Первый рисунок микроорганизмов был сделан им в 1683 г., а в 1695 г. вышла первая монография по микробиологии, названная «Тайны природы, открытые Антони ван Левенгуком». Она явилась результатом наблюдений за микробами, находящимися в настоях, зубном налете, уксусе и т. д., которые он тщательно описал в 120 письмах, направленных Лондонскому Королевскому Обществу.
Работы Левенгука послужили началом так называемого морфологического периода в развитии микробиологии, который был малорезультативным, однако продолжался 100 лет, пока не изменилось качество микроскопов. Но уже с середины XVIII в. ставили микробиологические опыты, чтобы доказать отсутствие самозарождения жизни. Удар по теории самозарождения нанесли результаты исследований итальянского священника Лаццаро Спалланцани, затем Франсуа Аппера, Луи Пастера, английского физика Джона Тиндаля. Они доказали, что живые существа не возникают спонтанно из неживой природы, а проникают в питательный настой, который использовали в экспериментах, вместе с воздухом. Эти работы нашли впоследствии применение для обеззараживания путем прогревания герметизированных продуктов, жидких сред однократно или дробно.
Наш соотечественник М. М. Тереховский (1740—1796) в 1775 г. в г. Страсбурге защитил диссертацию по инфузориям, в которой впервые применил экспериментальный метод. Воздействуя физически и химически, он доказал живую природу встречающихся в настоях микробов, чувствительность их к температуре, электричеству, кислоте, сулеме и потребность в кислороде. М. М. Тереховский ввел кипячение инструментов как способ их обеззараживания.
Французский ученый-химик Луи Пастер (1822—1895) доказал, что наряду с морфологическими различиями микробы отличаются друг от друга особенностями метаболизма. Кроме того, Пастер изучил процессы брожения и обнаружил анаэробную жизнь некоторых микробов.
После изучения болезни шелковичных червей Пастер задумывается над ролью микробов как возбудителей болезни. До его работ в этой области болезнь рассматривали как самопроизвольное изменение крови и соков. Опытами с сибиреязвенным микробом, выделенным в чистую бульонную культуру, Пастер доказал этиологию сибирской язвы. (Опыт, проведенный еще в 1855 г. Брауэлем в Дерптском, ныне Тартуском, университете по воспроизведению инфекции путем заражения патологическим материалом, содержащим палочковидный микроб, у оппонентов вызывал сомнение из-за возможности пассивного переноса некоего вещества флагестона). В исследованиях Пастера гибель животных вызывал осадок бактерий, тогда как после введения прозрачной надосадочной жидкости питательного бульона заболевания не наступало.
Л. Пастер (1822—1895)
Р. Кох (1843—1910)
л
И, И. Мечников (1845—1916)
С. Н. Виноградский (1856—1953)
Поскольку болезни животных вызывают микробы, Пастер приступает к разработке средств борьбы с ними. Случай с ослаблением вирулентности возбудителя холеры кур (названного позже пастереллой) в результате длительного хранения на питатель-, ной среде при беспрепятственном доступе воздуха Пастер использовал для обоснования возможности аттенуации, то есть устойчивого ослабления вирулентности возбудителей, что делало их пригодными для вакцинации. В 1881 г. он разрабатывает технологию приготовления вакцины против сибирской язвы, затем против рожи свиней и бешенства. Несмотря на то, что впервые вакцина была изготовлена (и названа) в 1796 г. Дженнером, научно обоснованные методы ослабления вирулентности возбудителей являются приоритетом Пастера. Не случайно поэтому его называют отцом иммунологии. Всемирное признание заслуг ученого выразилось в открытии в Париже в 1888 г. института для Пастера, выстроенного на средства, собранные по международной подписке.
Л. С. Ценковский (1822—1887)
Д. И. Ивановский (1864—1920)
Другим крупным ученым в области микробиологии был немецкий врач Роберт Кох (1843—1910). Он окончательно доказал этиологию сибирской язвы, открыл спорообразование у сибиреязвенного микроба, открыл возбудителя туберкулеза, разработал метод выделения чистой культуры бактерий иа плотных питательных средах, автоклавирование, ввел понятие о дезинфекции, изобрел туберкулин.
С Пастером сотрудничал наш соотечественник Илья Ильич Мечников (1845— 1916). Известей ряд его работ в области микробиологии и иммунологии, в частности по воспроизведению сифилиса, изготовлению цитотоксических сывороток; но наиболее популярными и важными являются исследования взаимодействия молочнокислых и гнилостных бактерий и фагоцитоза. Первые развились в учение об антагонизме и послужили теоретической предпосылкой для открытия антибиотиков и изыскания способов продления жизни человека. Вторые сложились в стройную теорию иммунитета. Мечников первым попытался осмыслить механизм противомикробной защиты и предугадать огромное значение фагоцитарной реакции для защиты организма. В 1908 г. Мечников получил первую Нобелевскую премию по иммунологии вместе с Паулем Эрлихом (1854—1916), автором теории боковых цепей.
Значительный вклад в развитие микробиологии внес С. Н. Виноградский (1856— 1953). Им разработаны накопительные питательные среды, получены в чистой культуре нитрифицирующие бактерии, открыты свободноживущие азотфиксирующие бактерии (Cl. pasterianum, 1892) и, самое главное, впервые доказано, наличие у микробов хемосинтеза — процесса синтеза органических веществ из углекислоты и воды. До этого биосинтез считался единственным процессом у бактерий.
Дмитрий Иосифович Ивановский (1864—1920) открыл новый мир микробов — вирусы. Произошло это в 1892 г., когда 28-летний ботаник исследовал мозаичную болезнь табака.
В развитии ветеринарной микробиологии большую роль сыграли исследования Леффлера и Фроша, открывших первого вируса, поражающего животных — возбудителя ящура (1897), Нокара и Ру — открывших возбудителя перипневмонии крупного рогатого скота, относящегося, как оказалось впоследствии, к микоплазмам.
Серьезный вклад в микробиологию внес Л. С. Ценковский (1822—1887), много внимания уделивший изучению простейших и водорослей и изготовивший в 1883 г. I и II вакцины против сибирской язвы. X. И. Гельмаи в 1891 г. впервые применил с диагностической целью сапной и туберкулезный аллергены. В разработку диагностических и лечебно-профилактических средств и методов внесли свой вклад С. Н. Выше-лесский, А. А. Владимиров, П. Н. Андреев, Н. А. Михии и другие отечественные уче--ные, конкретная заслуга которых описана в разделе «Частная микробиология».
ОБЩАЯ МИКРОБИОЛОГИЯ
СИСТЕМАТИКА МИКРООРГАНИЗМОВ
р
Несмотря на большое многообразие, обитающие на нашей планете существа имеют филогенетическое родство. Чем теснее родственная связь, тем большим числом общих признаков они обладают. Группированием живых организмов по наибольшему общему сходству занимается специальная отрасль биологической науки — систематика, или таксономия. Процесс установления и характеристики систематических групп (таксонов) называется классификацией, а способ их наименования — номенклатурой.
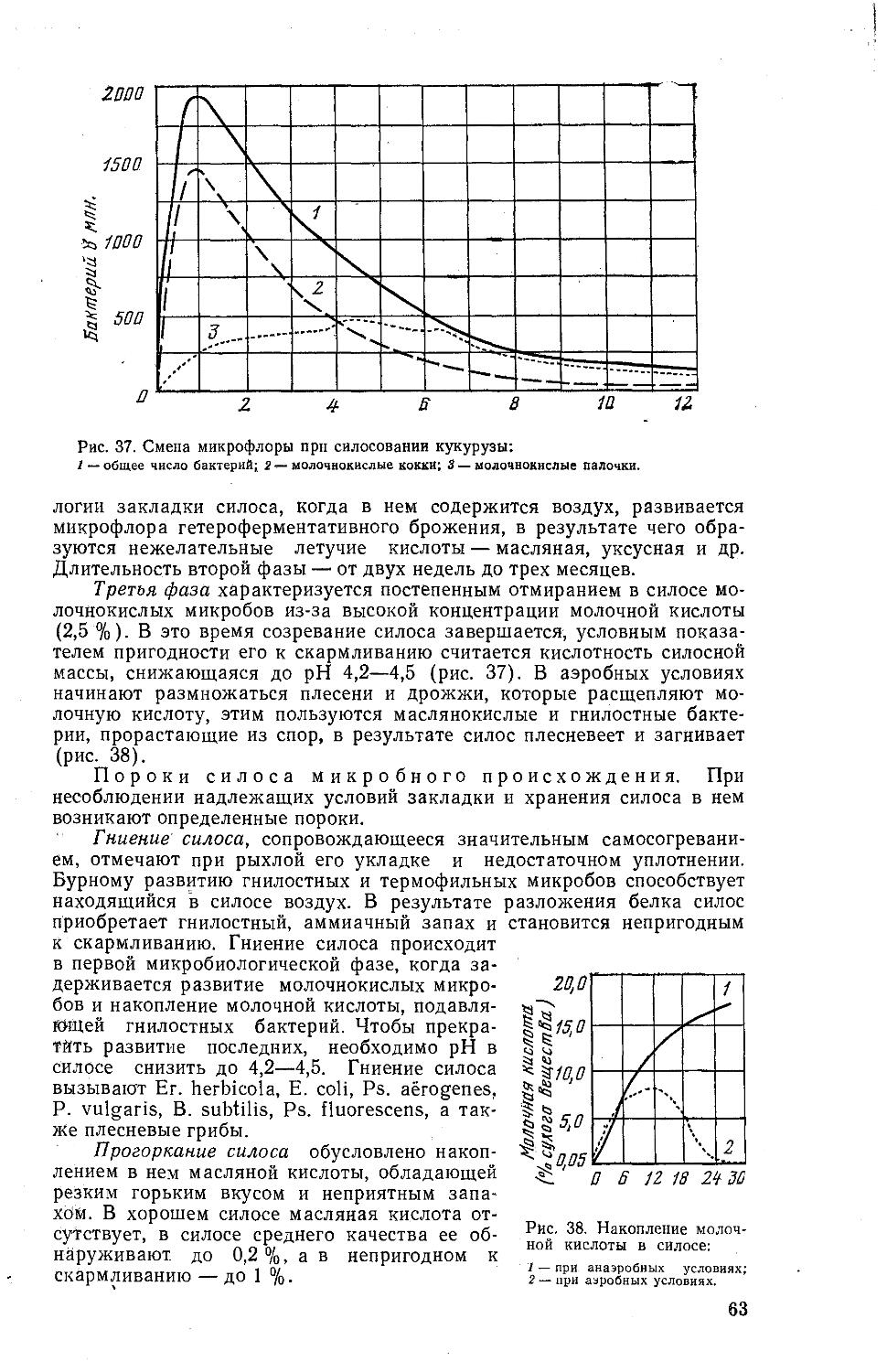
Все организмы с клеточной организацией (по предложению Chatton, 1937) подразделяют на прокариотов (доядерных) и эукариотов (ядер-ных). К прокариотическим организмам относят сине-зеленые водоросли, бактерии, риккетсии, актиномицеты и микоплазмы. От истинных ядер-ных клеток, таких, как простейшие, грибы, растительные и животные клетки, прокариоты отличаются неотделенной оболочкой однокольцевой молекулой ДНК, отсутствием внутриплазматического ретикулума (кроме участвующего в фотосинтезе аппарата сине-зеленых водорослей), наличием в оболочке каркасообразующего гликопептида (кроме микоплазм и галлобактерий), жгутикового локомоторного аппарата, накоплением запасного вещества поли-бета-оксибутирата и другими уникальными признаками.
Для группирования прокариотов принята иерархическая система классификации, в соответствии с которой вид, как низший таксономический ранг, включается в род, последний в семейство, семейство в порядок, порядок в класс, класс в отдел, а отдел — в высшую категорию таксономической иерархии — в царство.
Под видом подразумевают совокупность родственных микроорганизмов, имеющих общий корень происхождения и близкие свойства. В роды, объединяют близкие по большинству общих признаков виды. В семейства и более высокие таксоны микробов группируют по этому же принципу. Наиболее четко можно сформулировать принципы объединения в роды палочковидных спорообразующих микроорганизмов: к роду Bacillus относят спорообразующие аэробных бактерий, к роду Clostridium — спорообразующих анаэробных бактерий. При группировании микробов в остальные таксономические категории имеются большие условности.
Чтобы облегчить общение микробиологов, всем микробам присваивают научные названия в соответствии с Международным кодексом номенклатуры бактерий. Для этого пользуются универсальным латинским языком и алфавитом. Названия родов и более высоких таксонов унитарны, то есть состоят только из одного слова, преимущественно суще-ствительнрго в единственном (родов) или множественном (семейств) числе. В Последнем случае название обычно имеет окончание асеае.
Видовое название является бинарным, то есть оно состоит из родового названия, к которому относится микроб (пишется с прописной бук-
7
вы), и названия самого вида (пишется со строчной буквы). Например, Bacillus subtilis. Названия подвидов (или вариетет) — тринарные, так
как состоят из трех слов: название вида из двух слов и третье слово обозначает подвид. При этом предпочтительнее перед подвидовым названием указывать ранг словом subsp. (subspecies — подвид). Напри-
мер, Bacillus subtilis subsp. niger. Для обозначения инфраподвидовых таксонов вместо типов сейчас рекомендовано использовать суффикс var.
Например, морфовар, серовар, фаговар, а не морфотип, серотип, фаго
тип и т. п.
Выделенную из органов, тканей, экскретов организма или из объектов внешней среды культуру называют штаммом. Он может быть того или иного вариетета данного вида микроба.
Идентификацию микроорганизмов проводят по специальным определителям. Современное популярное руководство по отождествлению микробов — определитель бактерий Берги (1974, 8-е издание), в котором все бактерии эмпирически подразделены на 19 частей. Используя удобный ключ, можно быстро идентифицировать выделенную культуру микробов. К патологии животных имеют отношение микроорганизмы, объединенные в части 5-й — спирохеты, 7-й — грамотрицательные аэробные палочки и кокки, 8-й — грамотрицательные факультативно-анаэробные палочки, 9-й — грамотрицательные анаэробные бактерии, 14-й — грамположительные кокки, 15-й — палочки и кокки, образующие эндоспоры, 16-й — грамположительные аспорогенные палочковидные бактерии, 17-й — актиномицеты и родственные организмы, 18-й — риккетсии, 19-й — микоплазмы.
МОРФОЛОГИЯ И СТРОЕНИЕ МИКРООРГАНИЗМОВ
Ветеринарная микробиология изучает бактерии, риккетсии, микоплазмы, актиномицеты и микроскопические грибы, являющиеся в основном возбудителями болезней животных. Величина микробов настолько мала, что для ее измерения пользуются микрометрами (мкм). Размер бактерий в среднем 0,5—1,0X2,0—10,0 мкм, объем около 1 мкм3, а масса приблизительно равна 4-10~13 г. Такие величины лежат за пределами разрешающей способности сетчатки человеческого глаза, поэтому большинство микроорганизмов обнаруживают с помощью микроскопов и специальных методов окрашивания препаратов. Отдельные органеллы (органоиды) и субмикроскопические структуры измеряют в нанометрах (нм), просматривая их в основном в электронном микроскопе.
Для всех перечисленных микроорганизмов характерна’ клеточная организация. В зависимости от видовой принадлежности микробы могут быть одно- или многоклеточными, а в зависимости от жесткости оболочки их формы — постоянными или полиморфными. У бактерий формообразующим, каркасным, или ригидным, слоем, придающим жесткость оболочке, является пептидогликан. Прослойка его у разных микробов неодинакова, с чем связаны различная степень жесткости оболочки, выраженность полиморфизма, фйльтрабильности и различное отношение к окраске по Граму.
МОРФОЛОГИЯ БАКТЕРИЙ
Бактерии по форме подразделяют на шаровидные (кокки), палочковидные (бактерии, бациллы и клостридии) и извитые (вибрионы, спириллы) (рис. 1).
Кокки (Coccus, греч. — ягода, лат.—кокк, шарообразный) в большинстве случаев имеют правильную форму шара, но могут быть слегка сплющенными или вытянутыми по обоим полюсам или с одного конца. После деления кокки по-разному располагаются относительно друг дру-в
4
Рис. 1. Основные формы бактерий:
/ — микрококки; 2 — диплококки; 3 — стрептококки; 4 — стафилококки; 5 —сарцины; 6 — палоч* ковндные; 7 — спириллы; 8 — вибрионы.
га, что послужило основанием подразделить их на отдельные группы.
Микрококки (Micrococcus, греч. — малый) — беспорядочно расположенные одиночные клетки, заселяющие преимущественно объекты внешней среды.
Диплококки (Diplococcus, греч. — двойной) — попарно сцепленные клетки как результат деления особи в одной плоскости и сохранения связи между дочерними клетками после деления. К болезнетворным микробам этой группы относится возбудитель диплококковой инфекции телят.
Стрептококки (Streptococcus, греч. — витой), располагающиеся в виде цепочки, связанные между собой клетки также в результате деления кокков в одной плоскости. Стрептококки вызывают такие специфические заболевания сельскохозяйственных животных, как мастит (воспаление молочной железы) и мыт лошадей.
Тетракокки (Tetracoccus, греч. — четыре) — сцепленные по
четыре кокка как результат последовательного деления клеток в двух взаимно перпендикулярных плоскостях. Непосредственного отношения к патологии сельскохозяйственных животых не имеют.
Сарцины (Sarcina, лат. — соединяю) — тюкообразные формы сцепления кокков, располагающихся ярусами по 8—16 особей как ре
зультат последовательного деления клеток в трех взаимно перпендикулярных плоскостях. Обычно встречаются в воздухе, но могут усиливать действие токсигенной микрофлоры.
Стафилококки (Staphylococcus, греч. — виноградная гроздь), располагающиеся иногда в виде виноградных гроздей скопления относи-
тельно крупных кокков как результат деления клеток в различных плоскостях. Причиняют существенный урон животноводству вследствие поражения молочной железы у коров, желудочно-кишечного тракта у молодняка сельскохозяйственных животных.
Палочковидные
рормы.
Бактерии (Bacteria, греч. — палочка) —
не образующие спор клетки микробов обычно цилиндрической формы (сокр. Bact.). Концы у них могут быть закруглены, как бы обрублены, или заострены. В последнем случае клетки имеют эллипсовидную или овоидную форму. Типичный представитель бактерий — кишечная палочка (Escherichia coli), возбудители рожи свиней (Erysipelothrix rhusiopathiae), пастереллезов и др. В результате деления они могут располагаться попарно или соединяться в виде цепочек. Эти формы по аналогии с кокками называют дипло- и стрептобактериями/
Бывают также палочковидные бактерии с разветвлениями, напоминающими грибы. Такие микробы называют микобактериями, например возбудитель туберкулеза — М. tuberculosis.
Внутри некоторых, чаще грамположительных палочковидных бактериальных клеток формируются споры. Бактериальные эндоспоры в силу структурных различий резко преломляют свет, чем легко отличаются от содержащих их вегетативных клеток. Споры образуются преимущественно во время пребывания микроба во внешней среде. Исключение составляет возбудитель эмфизематозного карбункула рогатого скота, который спорулирует как в организме, так и вне его. Это обстоя-
9
У»
тельство, а также то, что из каждой споры образуется одна микробная клетка, дает основание утверждать, что бактериальная спора является формой сохранения вида микроба при неблагоприятных условиях существования.
Палочковидные микробы, образующие споры, называют по-разному. Если споры не превышают диаметра формирующей их бактериальной клетки, микробы называют бациллами (лат. палочка, сокр. Вас.; например, Вас. anthracis — возбудитель сибирской язвы). Если диаметр спор превышает поперечник формирующей их микробной клетки — это клостридии (сокр. С1.; например, Cl. tetani — возбудитель столбняка). Споры у бацилл локализуются преимущественно в центре микробной клетки, споры у клостридий располагаются центрально, эксцентрично, субтерминально и терминально, что придает микробной рлетке вид веретена, ракетки или барабанной палочки. Расположение спор — видовой признак клостридий, поэтому морфологическая характеристика возбудителей при бактериологической диагностике имеет важное значение.
Извитые формы бактерий в зависимости от выраженности и количества витков спирали подразделяют на вибрионы, спириллы и спирохеты.
Вибрионы (Vibrio, лат. — извивать) имеют вид слегка изогнутой запятой, у них лишь часть витка не превышает четверти оборота спирали. К вибрионам относят возбудителей вибриоза крупного рогатого скота, холеры человека.
Спириллы (Spirillum, греч. spira — изгиб, извив) — бактерии, тело которых имеет штопорообразную форму при наличии одного или нескольких оборотов спирали. К патогенным спириллам относят возбудителя содоку (Sp. minus) — болезнь, передающаяся через укус мышевидных грызунов.
СТРОЕНИЕ БАКТЕРИЙ
Бактериальная клетка состоит из оболочки, цитоплазмы с ядерным •аппаратом, рибосомами, ферментами и включениями питательных веществ (рис. 2).
Оболочка бактерий представлена тремя структурами: внешним капсульным слоем, стенкой и цитоплазматической мембраной.
Капсульный слой как бы чехлом покрывает бактериальную клетку. Он гомогенный и в зависимости от видовой принадлежности микроба состоит из различных химических веществ, имеет неодинаковую плотность и толтцину.]У одних микробов капсула представлена четко не оформленным рыхлым слоем вязкой слизи, у других — повторяющим очертания бактериальной клетки толстым (капсула) или едва заметным под микроскопом тонким слоем (микрокапсула}И В_ естественных условиях обитания у строго патогенных микробов капсула образуется при размножении микроба в организме животного Предполагают, что она защищает клетку от противомикробных факторов организма.
г — за1дИтный механизм капсульного вещества зависит не только от I химического состава, но и оптической конфигурации молекул, составля-ющих это вещество (см. о факторах патогенности микробов). Тем не J менее основным материалом капсульного вещества являются полисаха-Риды (преимущественно' у кокков) или полипептиды определенных а ми-। нокислот (преимущественно у бацилл).
< ^Наличие капсул у микробов используют в качестве дифференцирующего морфологического признака. Например, из всего рода бацилл только Вас. anthracis, а из всего рода клостридий только Cl. perfringens образует в организме животных капсулы. Выявляют капсулы в свежем материале или специальных средах при культивировании в течение первых суток. Окрашивают капсулы длительно, обычно кислыми красками, стремясь комбинировать их с основными красителями иных спектраль-10
Пол о бы в трубочка Слизис^ ^кслил^ слой' Реснички
Плазмиды Рликоген
OKEuSymupam
Клеточная 'мембрана, -липидные капли
гПолирабосомы иФа Включение серы
Мезрсомы
Нуклеоид
Рис. 2. Строение бактериальной клетки (схема).
ных характеристик для контрастирования тела бактерии. Классический пример такого окрашивания — использование смеси азура с эозином.
Бактериальные капсулы выявляют также негативным контрастированием, непосредственно обработав мазок тушью и каким-либо основным красителем. На черном фоне поля зрения четко просматриваются неокрашенные капсульные зоны, окружающие окрашенное тело бактерии. Если нужно не просто выявить капсулу, а точно определить вид или даже вариант бактерий, используют иммунохимические методы идентификации (в частности, иммунофлуоресцентный метод), основанные на особенностях антигенного строения бактериальных капсул.
Лишь у некоторых микроорганизмов, например микобактерий, внешний слой представлен воскоподобным липидом (тригалозо-б-б'-ди-миколат). Локализация его у возбудителей туберкулеза неодинакова. У микобактерий туберкулеза млекопитающих липид прикрывает микробную оболочку снаружи, у микобактерий птичьего туберкулеза он как бы пропитывает — йМпрегнирует оболочку. Поэтому поверхностно расположенный" липид объединяет растущие микобактерии туберкулеза млекопитающих в косички, шнуры или корды, что послужило основанием назвать это вещество) корд-факторрм.1 Возбудитель туберкулеза птиц и сапрофитные микобактерии 'растут по отдельности или собираются в пучки.'Эту особенность используют для дифференциации микобактерий.
"Липид сообщает гидрофобность (водоотталкивающие свойства) микобактериям. Поэтому их окрашивают с обязательным подогреванием первого красителя. Кроме непосредственного воздействия на липидный покров клетки, высокая температура повышает поверхностную активность воды как растворителя, и микобактерии окрашиваются наравне с другими микробами. Используемые затем водные растворы кислот и дополнительных красителей в холодном виде вновь отталкиваются воскоподобным покровом микобактерий, обесцвечивая и изменяя окраску только некислотоупорных бактерий. На этом принципе основан метод окраски Циль — Нильсена.
Клеточная стенка — основная формообразующая структура оболочки, придающая также механическую прочность бактериальной клетке и, возможно, играющая определенную роль в движении и размножении бактерий. Наличие разнообразных форм бактерий зависит от состава и конфигурации стенки. А ее прочность, кроме того, обусловливает устойчивость клетки к осмотическому лизису в гипотонической среде. Последнее чрезвычайно важно для жизнедеятельности бактерий,
4'
поскольку внутреннее осмотическое давление иных видов в десятки раз превышает застеночное давление.
Оснодок ригидного (лат. rigidus — жесткий, твердый) сло.а_схенки бактерий является пептидогликан, само название которого говорит о двойственной химической природе соединения. Гликаны представлены остатками двух ацетилированных аминосахаров — N-ацетилглюкозамина и N-ацетилмурамовой кислоты, которые соединены в цепь (3-(1->4)-глюкозидными связями, а пептиды — цепью четырех лево- и правовращающих аминокислот, присоедйненньгх к карбоксильной группе мурамовой кислоты. Соседние цепи аминокислот в полипептиде соединены между собой поперечными сшивками или межпептидными мостиками. Таким образом, благодаря гликозидным связям. гликаны собираются в полимер, а при помощи полипептидных связей они образуют между собой своеобразный молекулярный каркас. Как собран этот каркас, такую форму и имеет бактериальная клетка. Если каркасный слой будет иметь форму вытянутого мешка, бактерия 'приобретет палочковидную форму, если каркас сферический — шарообразную форму;
Переплетающиеся в виде решетки микрофибриллы пептидогликана формируют поры,' диаметром около 1 мкм, через которые поступают необходимые для клетки вещества извне и выбрасываются метаболиты наружу. Через эти же поры с различной скоростью проникают органические растворители, разрушающие окрашенные комплексы, что и обусловило подразделение бактерий на две разные группы по отношению к окраске по Граму. Данный метод разработан в 1884 г. X. Грамом. Фиксированные теплом препараты вначале обрабатывают раствором кристаллического фиолетового красителя и йодосодержащим раствором Люголя, после чего на очень короткое время наносят спирт или ацетон, промывают водой и докрашивают раствором фуксина основного. Микробов, сохраняющих интенсивную сине-черную окраску, называют грампо-дожительными, а воспринимающих красную краску — грамотрицатель-нымиЛПоскольку решающим в обесцвечивании комплекса фиолетового ^красителя с йодом является фактор времени, легко предположить наличие у грамположительных бактерий более толстого и менее защищенного слоя пептидогликан а/Об этом же свидетельствуют относительно более высокая чувствительность грамположительных бактерий к пенициллину и лизоциму, различающиеся между собой L-формы грамположительных и грамотрицательных бактерий.
Действительно, оказалось, что стенка у грамположительных бактерий является фактически однослойной, так как до 90 % состоит из пептидогликана, с которым, видимо, ковалентно связаны также линейные полимеры тейхоевой кислоты (глицерин или рибитфосфаты) и полисахариды, образуя гомогенную структуру. С внешней стороны со стенкой некоторых грамположительных бактерий связаны белки (например, у кокков) или липиды (у микобактерий).
Стенка грамотрицательных бактерий устроена сложнее, поскольку в ее структуре более или менее четко установлено четыре слоя, представленных различными, химическими соединениями. Непосредственно на .цитоплазматической мембране расположен ригидный пептидогликановый •слой. Он имеет толщину 2—3 нм вместо 10—50 нм у грамположительных бактерий. Причем структурные микрофибриллы грамотрицательных бактерий сшиты гораздо слабее, чем у грамположительных бактерий, поэтому поры в пептидогликане грамотрицательных бактерий всегда будут значительно шире, чем в каркасном слое у грамположительных.
Над слоем пептидогликана грамотрицательных бактерий находится неплотно упакованный слой молекул белка, за которым следует прерывающийся каналами липополисахаридный слой (ЛПС) и, наконец, самый наружный дискретный липопротеидный слой, прикрывающий ЛПС отдельными плоскими и сосочковидными пластинками.
12
Фактически, как показывают последние исследования, указанная последовательность химически разнородных слоев в стенке грамотрииа-тельных бактерий может быть несколько нарушена за счет вертикального расположения молекул белка и фосфолипида над пептидогликановым остовом, что структурно сближает верхние слои стенки с цитоплазматической (клеточной) мембраной.
Цитоплазматическая мембрана подобно другим элементарным мембранам представляет собой непрерывистую структуру, состоящую из двух слоев молекул фосфолипида, между которыми полностью или частично погружены молекулы белка или полипептида. "
На долю фосфолипидов приходится до 30 % сухой массы мембран, на долю белков свыше 50 %. Причем в отличие от эукариот в клеточной мембране большинства бактерий липиды состоят только из насыщенных или мононенасыщенных жирных кислот. Молекулы фосфолипидов располагаются гидрофильными «головками» наружу, а гидрофобными «хвостиками» внутрь, составляя таким образом регулярную двухслойную структуру мембраны. f
В отдельных местах в липидный слой мембраны погружены частично или на всю ее толщу молекулы мембранных белков, в основном участвующих в транспорте питательных веществ и метаболитов (пермеаз) и липидсинтезирующих ферментов.
У многих бактерий клеточная мембрана в местах деления клетки образует дивертикулы (впячивания в цитоплазму) — мезосомы^ которые, видимо, участвуют в формировании поперечной перегородки. У аэробных бактерий с ними связывается и локализация центров дыхания. Между мембраной и стёнкой бактерий расположены также нуклеазы, фосфатазы и некоторые другие ферменты.
Структурное своеобразие и насыщение жизненно важными ферментами делает клеточную мембрану основным осмотическим барьером бактерий. Благодаря мембране бактериальная клетка поддерживает состояние тургора и осуществляет обмен с окружающей средой путем избирательного поступления в цитоплазму необходимых питательных веществ и выхода из нее метаболитов.
Однако без жесткого пептидогликанового каркаса клеточная мембрана не в состоянии поддерживать бактериальную клетку в пределах видовых форм. Микроорганизмы, утратившие привычные формы из-за полного или частичного лишения пептидогликана, называют L-формами (в честь Лондонского института имени Листера, где впервые изучены эти формы).
Они могут быть продуктом модификаций (фенотипическая изменчивость) или мутаций (генотипическая изменчивость).
Подобные формы можно получить из известных микроорганизмов путем воздействия на гликопептид лизоцимом, пенициллином или другими подобными агентами. Лизоцим, являясь ферментом муреиназной активности, разрывает гликозидные связи между остатками N-ацетил-глюкозамина и N-ацетилмурамовой кислоты в гликане. А пенициллин, относящийся к (3-лактамам, подавляет синтез пептидогликана в-растущей бактериальной клеточной стенке. В результате от грамположитель-ного микроба остается цитоплазма, заключенная только в клеточную мембрану. Такая форма приобретает нечеткие сферические очертания, является неустойчивой в гипотонических растворах и называется протопластом.
У грамотрицательных бактерий данные агенты вызывают соответствующий эффект лишь в комбинации с хелатобразующими соединениями, поскольку пептидогликан у них сверху прикрыт другими слоями. Таким образом, экранированный ригидный слой грамотрицательных бактерий остается на месте и, поддерживаемый клеточной мембраной и
*
13
Фактически, как показывают последние исследования, указанная последовательность химически разнородных слоев в стенке грамотрицательных бактерий может быть несколько нарушена за счет вертикального расположения молекул белка и фосфолипида над пептидогликановым остовом, что структурно сближает верхние слои стенки с цитоплазматической (клеточной) мембраной.
Цитоплазматическая мембрана подобно другим элементарным мембранам представляет собой непрерывцстую структуру, состоящую из двух слоев молекул фосфолипида, между которыми полностью или частично погружены молекулы белка или полипептида.
На долю фосфолипидов приходится до 30 % сухой массы мембран, на долю белков свыше 50 %. Причем в отличие от эукариот в клеточной мембране большинства бактерий липиды состоят только из насыщенных или мононенасыщенных жирных кислот. Молекулы фосфолипидов располагаются гидрофильными «головками» наружу, а гидрофобными «хвостиками» внутрь, составляя таким образом регулярную двухслойную структуру мембраны. ,
В отдельных местах в липидный слой мембраны погружены частично или на всю ее толщу молекулы мембранных белков, в основном участвующих в транспорте питательных веществ и метаболитов (пермеаз) и липидсинтезирующих ферментов.
У многих бактерий клеточная мембрана в местах деления клетки образует дивертикулы (впячивания в цитоплазму) — мезосомы^ которые, видимо, участвуют в формировании поперечной перегородки. У аэробных бактерий с ними связывается и локализация центров дыха-,ния. Между мембраной и стенкой бактерий расположены также нуклеазы, фосфатазы и некоторые другие ферменты.
Структурное своеобразие и насыщение жизненно важными ферментами делает клеточную мембрану основным осмотическим барьером бактерий. Благодаря мембране бактериальная клетка поддерживает состояние тургора и осуществляет обмен с окружающей средой путем избирательного поступления в цитоплазму необходимых питательных веществ и выхода из нее метаболитов.
Однако без жесткого пептидогликанового каркаса клеточная мембрана не в состоянии поддерживать бактериальную клетку в пределах видовых форм. Микроорганизмы, утратившие привычные формы из-за полного или частичного лишения пептидогликана, называют L-формами (в честь Лондонского института имени Листера, где впервые изучены эти формы).
Они могут быть продуктом модификаций (фенотипическая изменчивость) или мутаций (генотипическая изменчивость).
Подобные формы можно получить из известных микроорганизмов путем воздействия на гликопептид лизоцимом, пенициллином или другими подобными агентами. Лизоцим, являясь ферментом муреиназной активности, разрывает гликозидные связи между остатками N-ацетилглюкозамина и N-ацетилмурамовой кислоты в гликане. А пенициллин, относящийся к (3-лактамам, подавляет синтез пептидогликана в-растущей бактериальной клеточной стенке. В результате от грамположитель-ного микроба остается цитоплазма, заключенная только в клеточную мембрану. Такая форма приобретает нечеткие сферические очертания, является неустойчивой в гипотонических растворах и называется протопластом.
У грамотрицательных бактерий данные агенты вызывают соответствующий эффект лишь в комбинации с хелатобразующими соединениями, поскольку пептидогликан у них сверху прикрыт другими слоями. Таким образом, экранированный ригидный слой грамотрицательных бактерий остается на месте и, поддерживаемый клеточной мембраной и
13
Рис. 3. Расположение жгутиков у бактерий.
ь
расположенными сверху слоями, образует более или менее правильную и постоянную шарообразную форму — сферопласт.
Сферопласты более устойчивы к перепаду застеночного осмотического давления, но их также лучше выделять и культивировать на специальных средах с высоким осмотическим давлением.
Клеточная мембрана вместе с мезосомами формирует непрерывную обособленную структуру оболочки бактерий. У датогенных бактерий она не образует внутриплазматическую сеть элементарных мембран, как у эукариотов, но дает начало поверхностным органеллам — жгутикам и пили (ворсинкам).
Жгутики и пили — нитевидные трубочки, состоящие из спиралевидно упакованных субъединиц белка, который называется соответственно флагеллином и пилином. Белки эти отличаются от поверхностных белков бактериальной клетки и являются антигенами, что широко используется при их идентификации. Внешний флагеллиновый участок жгутиков у поверхности микробной клетки прикрепляется к более широкому крючку, построенному из другого белка, а он, в свою очередь, соединен с базальным тельцем. Последнее представляет образование в форме стержня, на который как бы нанизаны одна (у грамположитель-ных бактерий) или две пары колец (у грамотрицательных бактерий), закрепляющие тельце непосредственно, видимо, в клеточной мембране, а у грамотрицательных бактерий дополнительно еще в пептидогликане/ Благодаря жгутикам бактерии совершают плавательные движения за счет относительного вращения нижней пары колец, закрепляющей стержень жгутика в пространстве между клеточной мембраной и клеточной стенкой. Поэтому жгутики совершают движения вокруг своей оси, перемещая клетку в пространстве. Энергетической основой вращательного движения жгутиков считают образование клеткой АТФ или трансмембранного электрохимического потенциала.
В зависимости от количества и локализации жгутиков подвижные /бактерии делят на группы монотрихов (с одним полярно расположен-f ным жгутиком), амфитрихов (с двумя полярно расположенными жгутиками, целыми пучками жгутиков), лъфътрихов (с одним пучком жгутиков на конце) и перитрихов (с большим числом отдельно расположенных жгутиков, покрывающих всю поверхность бактериальной клетки) (рис. 3). Несмотря на условность данного подразделения бактерий, оно помогает в их идентификации. С целью определения подвижности используют молодые культуры микробов, выращенные при пониженной температуре; при этом диффузность роста наблюдают в полужидкой
...
14
среде, направленность движения в висячей или раздавленной капле, а непосредственно подсчитывают и измеряют жгутики на электронно-микрограммах.
Бактерии с полюсным расположением жгутиков передвигаются целенаправленнее и быстрее, чем перитрихи. Но кувыркательные движения последних зависят не от разнонаправленной активности жгутиков, а от попеременного вращения их то по часовой стрелке, то в обратном направлении.
Реснички (пили) в отличие от жгутиков короче, уже и чаще имеют вид прямой нити. Они также закреплены в протопласте и проходят через клеточную оболочку. Их подразделяют на простые, обычные пили и половые — секс-пили. У энтеробактерий первые представлены несколькими типами, как и жгутики кодируются ДНК нуклеоида и обусловливают в основном прилипание бактерий. Вторые подразделяют на два типа в зависимости от детерминирующего внехромосомного фактора фертильности и колициногенности. Они предназначены для передачи генетического материала при конъюгации бактерий и рецепции фаговых частиц. Число обычных пилей достигает нескольких сотен на клетке, а секс-пилей — от одного до пяти.
Цитоплазма бактерий—безоболочечная коллоидная часть клетки с гранулярной (зернистой) структурой, заключенная в оболочку. Основную массу гранул составляют рибосомы преимущественно с константой седиментации 70 S, которые участвуют в синтезе белка. Зернистую структуру цитоплазме придают также равномерно разбросанные включения запасных органических веществ. Среди резервных безазотистых веществ, служащих источником углерода и энергии, у бактерий преобладают полисахариды, крахмал, гликоген и полиэфир р-оксимасляной кислоты. При некоторых условиях количество этих запасных веществ может достигать половины сухой массы клетки. Гранулы пол-р-окси-масляной кислоты преломляют свет и легко обнаруживаются при помощи светопольной, особенно фазово-контрастной микроскопии. Однако они (и в первую очередь запасные полисахариды) лучше выявляются при окрашивании бактерий судаковым черным и раствором йода в йодистом калии. У некоторых бактерий в цитоплазме отмечают окрашиваемые метиленовым синим в красный цвет гранулы волютина, из-за чего их называют метахроматическими. По существу, они представляют собой неорганический полифосфат, служащий, вероятно, источником фосфора.
Центральную часть цитоплазмы занимает ядерный аппарат — нуклеоид и плазмиды.
Нуклеоидом называют ядро прокариотов, поскольку оно в отличие от эукариот представлено единственной гигантской хромосомой, не изолированной от цитоплазмы мембраной. Молекула двухцепочечной ДНК-хромосомы бактерий замкнута в кольцо и своеобразно упакована в виде волокнистого тяжа, напоминающего перекрученный жгут соломы. Считают, что компактная форма бактериальной ДНК поддерживается одноцепочечной рибонуклеиновой кислотой, в свою очередь, связанной с РНК-полимеразой и катионными белками, подобными гистонам эукариотов. Длина вытянутой молекулы ДНК-нуклеоида достигает 1 мм, что значительно превышает среднюю длину самой бактерии, равную примерно 2 мкм.
Вокруг ДНК нуклеоида в цитоплазме бактерий расположены в сотни раз более короткие двухцепочные нити внехромосомной ДНК — плазмиды. Их в бактериальной клетке обычно несколько, они детерминируют многие свойства микробов, связанные с размножением, устойчивостью к лекарственным средствам, патогенностью бактерий и др.
При неблагоприятных для микробов условиях (температура 10— 43 °C) в цитоплазме бацилл, клостридий и очень редко других микро
15
организмов образуются споры. Формируются они внутри вегетативной клетки и, по существу, являются эндоспорами. Однако их образование не является результатом простого сгущения цитоплазмы бактерий, поскольку по структурным физико-химическим и биологическим свойствам споры резко отличаются от вегетативных клеток бактерий. В отличие от исходных вегетативных клеток эндоспоры более компактны, у них меньше цитоплазмы и большее число оболочечных слоев. Поверхность их с характерным для определенного вида выраженным рельефным рисунком и типом вырастов. По мере созревания в спорах накапливаются катионы магния и особенно кальция, а также синтезируется характерная только для спор дипиколиновая (2,6-пиридиндикарбоновая) кислота, образующая дипиколинат кальция — хелатное соединение, способствующее прорастанию спор.
В отличие от стенки вегетативных клеток в состав кортекса бациллярных эндоспор входят другие пептидогликаны, они менее специфичны у отдельных видов бацилл. Кроме того, наружная оболочка эндоспор включает большую часть устойчивых к протеолизу споровых белков, состоящих в основном из серосодержащих и гидрофобных аминокислот.
Сильно обезвоженный споровый материал своеобразно упакован, что резко отличает его от цитоплазмы вегетативной клетки по светопреломляющим свойствам, делает труднодоступным для бактериальных красок и резистентным к физическим факторам и химическим дезинфектантам. Однако и в покоящейся споре полностью не прекращаются окислительно-восстановительные процессы. Высказывается мнение о способности их к питанию и даже к размножению.
В каждой бактериальной клетке формируется одна эндоспора. Эндоспоры бацилл обычно локализуются в центре и не превышают диаметра материнской клетки, у клостридий они располагаются эксцентрично, субтерминально или терминально, всегда при этом превышая диаметр сформировавших их вегетативных клеток. Поэтому морфологически содержащие споры клетки бацилл разных видов между собой практически неразличимы, тогда как клостридии имеют форму веретена (CL perfringens), разливательной ложки (Cl. Chauvoei), ракетки или барабанной палочки (Cl. tetani) (рис. 4).
На примере развития бациллярных спор доказано, что они начинают формироваться в момент перехода вегетативной клетки к стационарной фазе роста, претерпевая в процессе спорогенеза ряд последовательных стадий (рис. 5 — Д, Б, В, Г, Д, £, Ж, 3).
1. Подготовившаяся к споруляции клетка содержи? два нуклеоида, которые вскоре объединяются в палочковидное образование.
2. В одном из концов клетки возникает спорогенная зона, поперечная перегородка из впячиваний клеточной мембраны с мезосомой. Она отделяет свободную от липопротеиновых зерен меньшую часть цито-
Рис. 4. Локализация спор в бактериальной клетке: 1 — бацилл; 2 — клостридий.
16
Рис. 5. Стадии спорогенеза у бацилл.
плазмы и ДНК от остального содержимого клетки, формируя участок будущей споры.
3. Мембрана большей части клеточного содержимого в качестве второго слоя окружает изолированный участок. В результате образуется проспора с двойной мембраной, опоясанная цитоплазмой материнской клетки. Ядерное вещество проспоры обнаруживают только специ
альным методом окрашивания.
4. Вслед за этим развивающаяся спора формирует новые структуры. Пространство между собственной споровой и материнской клеточной мембраной расширяется и стано-
вится гомогенным, образуется так называемый кортекс, благодаря которому спора уже отличается оптической плотностью.
5. Окончательное формирование споры завершается с образованием вокруг наружной мембраны, покрывающей кортекс, споровой оболочки. Из всех структур споры она отличается наибольшей способностью рассеивать электроны.
У некоторых видов бацилл споровая оболочка дополнительно покрыта внешним более рыхлым и тонким слоем — мантией или экзоспориумом. Обычно он строго не повторяет очертаний споры. У клостридий он имеет вид чехла с порами, представлен несколькими слоями мембран, зачастую состоящими из регулярных субъединиц.
После созревания эндоспоры наступает лизис материнской клетки и освобождение спор.
Таким образом, ультраструктура зрелой покоящейся споры будет представлена следующими основными слоями: а) спороплазма (сердцевина),
2—Ветеринарная микробиология
Рис. 6. Ультраструктура зрелой покоящейся споры бацилл:
7 — сердцевина; 2 — цитоплазматическая мембрана; 3 —внешняя мембрана; 4 — зародышевый слой клеточной стенки; 5 — кортекс; 6 — слой цитоплазмы между внешней мембраной н оболочкой-7 — внутренний и 8 — наружный слой оболочки; 9 — выросты на спорах; 10 —- подушечка, прикрепляющаяся к споре; 11 — линзовидная структура из гранулярного вещества.
17
деУЖБЫ КАР0Д6С
содержащая конденсированную ДНК и цитоплазму; б) цитоплазматическая внутренняя мембрана споры; в) кортекс, состоящий из пип-тидогликана, из внутреннего слоя которого формируется оболочка, об-* разующаяся при прорастании споры, и в нем же, вероятно, локализован дипиколинат; г) внешняя мембрана споры; д) слой цитоплазмы между внешней мембраной и оболочкой споры; е) оболочка споры; ж) экзо-спориум (рис. 6).
МОРФОЛОГИЯ И СТРОЕНИЕ
СПИРОХЕТ
Морфологическая обособленность спирохет заключается в неповторимости формы и способа движения этих микробов. У них очень тонкие и длинные спиралевидные клетки, которые в отличие от спирилл способны изгибаться. Эта уникальная особенность обусловлена системой эластичных аксиальных (опорных) центральных фибрилл, расположенных между клеточной мембраной и стенкой. По строению эти фибриллы подобны бактериальным жгутикам. Закрепляются они на концах клеток вблизи полюсных утолщений и, видимо, центральными свободными концами перекрывают друг друга где-то посредине клетки. Благодаря такому креплению аксиальных фибрилл спирохеты могут не только изгибаться, но и сокращаться, перемещаясь винтообразно.
Спирохеты плохо воспринимают красители. Из-за данного свойства и незначительного диаметра (0,1—0,6 мкм) патогенные спирохеты лучше наблюдать в микроскопе с темным полем.
Среди спирохет имеются патогенные виды микробов, вызывающие лептоспироз у человека и многих видов животных, возвратный тиф и сифилис человека.
МОРФОЛОГИЯ И СТРОЕНИЕ МИКОПЛАЗМ
Микоплазмы — мелкие (0,3—0,9 мкм) микроорганизмы, полностью лишенные пептидогликана. Из-за этого у них чрезвычайно изменчивы формы: в одной и той же колонии микроба почти не встречают морфологически идентичных клеток. Они имеют вид прямых или спирализон-ных нитей, шаров с выростами различной длины и формы, кеглей и т.п. (рис. 7).
Морфологическая пластичность делает их способными проникать через бактериальные фильтры (фильтруемость) и сообщает внешнее сходство с L-формами микробов. Эти хрупкие микроорганизмы можно
культивировать только на средах с высоким осмотическим давлением. Клеточная мембрана микоплазмы
Рис. 7. Морфология микоплазм.
состоит из стериновых липидов, что сближает их с эукариотами и отличает от других прокариот. Считают также, что геном микоплазмы содержит примерно в 2 раза меньше генетической информации, чем ядерный аппарат других прокариот.
Микоплазмы широко распространены в природе и имеют важное значение в патологии. Среди них можно назвать возбудителей плевропневмонии крупного рогатого скота, инфекционной агалактии коз, овец, микоплаз
моза птиц и др.
18
г
МОРФОЛОГИЯ И СТРОЕНИЕ РИККЕТСИЙ
Риккетсии—клеточные микроорганизмы, но обладающие абсолютным паразитизмом. Названы в честь американского исследователя Рик-кетса, погибшего от сыпного типа. Их объединяют также с хламидиями, в биологическом цикле которых в отличие от риккетсий отсутствуют беспозвоночные в качестве промежуточных хозяев.
Морфологически риккетсий подразделяют на три основные группы—кокковидные, палочковидные и нитевидные. Причем последние могут достигать длины 40 мкм. Клетки риккетсий по строению напоминают грамотрицательных бактерий, но имеют, вероятно, более рыхлую оболочку. Предполагают, что эта структурная особенность связана с поступлением в клетку риккетсий энергоемких органических материалов, за счет чего они поддерживают энергетический обмен. Поскольку другие виды метаболизма у риккетсий автономны, их принято называть энергетическими паразитами. Свыше 30 видов риккетсий являются патогенными. Они вызывают сыпной тиф у человека, Ку-лихорадку животных, гидроперикардит крупного рогатого скота и другие опасные болезни.
МОРФОЛОГИЯ И СТРОЕНИЕ АКТИНОМИЦЕТОВ
Актиномицеты (Actinomyces—лучистые грибы)—длинные одноклеточные ветвящиеся микроорганизмы. Хотя по строению стенки, цитоплазмы, ядерного аппарата и тинкториальным свойствам актиномицеты подобны грамположительным бактериям, наличие истинного ветвления позволяет именовать микробные клетки гифами, а образуемые ими переплетения—мицелиями. В отличие от бактерий у актиномицетов специализированные органы размножения—спорангии. В зависимости от вида актиномицетов форма спорангий будет в виде прямых, волнистых или спирально закрученных веточек, которые располагаются последовательно, мутовчато или пучкообразно (рис. 8).
Споры (конидии) появляются на воздушном мицелии, который развивается обычно на поверхности кожистого вегетативного мицелия. Лишь в отдельных случаях они формируются на субстратном мицелии. При этом споры образуются фрагментационным или сегментационным способом. В первом случае в спороносной гифе развивается процесс, подобный спорообразованию у бактерий, во втором — происходит простое деление спороносных клеток путем образования поперечных
ЧХ 7
Рис. 8. Морфология актиномицетов: / — мицелий; 2 — спорангий.
2*
19
перегородок. В том и другом случае в одной гифе образуется несколько спор, каждая из которых прорастает в новую гифу. Споры актиномице-тов более устойчивы, чем вегетативные клетки, имеют различную форму.
В патологическом материале актиномицеты образуют так называемые друзы — неравномерно окрашенный мицелий из полиморфных гифов. При окраске по Граму центральная часть друзы окрашивается в синечерный цвет, периферическая—в красный. При внимательном просмотре выявляют, что такую необычную окраску имеют одни и те же гифы. В центре они интактны и грамположительны, на периферии—колбовидно расширены и грамотрицательны. По всей видимости, периферические участки мицелия в организме животного подвергаются большему воздействию лизоцима и других литических факторов, воздействующих на полигликан, что приводит к образованию протопластов и, таким образом, дополнительно подтверждают предполагаемый механизм окраски по Граму.
Хотя актиномицеты играют одну из важнейших ролей в круговороте веществ в природе и являются основными , продуцентами эффективных антибиотиков и других полезных биологически активных веществ, некоторые из них причиняют большой вред как патогенные микробы (например, возбудитель актиномикоза).
Кроме типичных актиномицетов, к этой группе относят проактиноми-цеты, микококки и микобактерии. Проактиномицеты образуют ветвления мицелия только в ранней стадии развития. Микобактерии не образуют настоящего мицелия, хотя и способны ветвиться. Поэтому их рассматривают как переходную форму микробов между актиномицетами и эубактериями.
МОРФОЛОГИЯ И СТРОЕНИЕ
МИКРОСКОПИЧЕСКИХ ГРИБОВ
Грибы (Fungi)—это бесхлорофильные размножающиеся спорами эукариотические организмы, основной вегетативной структурой которых является мицелий (грибница), состоящий из переплетающихся тонких ветвящихся нитевидных клеток (гифов). По внешнему виду, способу питания путем всасывания, неограниченному преимущественно верхушечному росту они напоминают растения. Однако в отличие от растений грибы лишены хлорофилла, запасным веществом у них является гликоген (а не крахмал), внутриструктурным элементом оболочки—хитин, а продуктом обмена—мочевина. Последние две характеристики свойственны также и животным.
Наравне с мицелиальными микроскопическими грибами часто встречаются делящиеся почкованием одноклеточные овоидные организмы, по размерам превышающие бактериальные клетки. Поэтому условно грибы нитевидных форм, обычно образующих пушистый мицелий, называют плесенью. Грибы, которые развиваются преимущественно в виде одноклеточных округлых организмов, называют дрожжами.
Грибы с неподеленным перегородками (септами) мицелием называют низшими, с разделенной на клетки грибницей (септированной)—высшими.
К низшим грибам относят фикомицеты (phycomycetes), вегетативные споры которых чаще образуются эндогенно, то есть внутри шаровидных вздутий—спорангий (греч. ангиа—сумка или оболочка). Продуктом полового процесса наземных фикомицетов является зигоспора (греч. зигос — ярмо). Причем половой процесс у них состоит в слиянии двух гаметангиев (клеток, содержащих половые клетки гаметы); последние подобно ярму соединяют две родительские гифы (рис. 9). При этом половую функцию выполняют боковые короткие ответвления гиф— копулирующие отроги, растущие навстречу друг другу. Отроги могут
20
быть морфологически отличными (гетерогамными) и неотличимыми (изогам-ними).
Водные фикомицеты имеют морфологически четко различимые мужские и женские гаметангии (антеридии и оогонии •соответственно), в результате слияния которых образуются ооспоры. Бесполое размножение у них происходит при П0М0Щ?’ подвижных зооспор.
Типичные представители наземных фикомицетов — мукоровые грибы, или го ловчатая плесень. Большая часть из них сапрофиты, развиваются в почве и особенно в навозе травоядных животных. Некоторые мукоровые грибы продуцируют антибиотики (рамицин), органические кислоты или их используют для ферментативного производства продуктов питания из бобовых и злаков, а также для получения спирта из злаков. Вместе с тем эти грибы часто вызывают порчу кормов и плодов, мукоромикозы внутренних органов человека и животных, являются причиной абортов у свиней и крупного рогатого скота.
К высшим грибам относят сумчатые, или аскомицеты (Ascomycetes ascus— сумка) и базидиомицеты (Basidio-mycetes).
Аскомицеты содержат дрожжеподобные и нитевидные формы. Вегетативная стадия развития последних представлена мицелием, поделенным поперечными перегородками, имеющими срединные отверстия — поры. Благодаря порам перегородки не являются преградой Для цитоплаз-> мы и ядер, содержащихся в гифах. Поэтому многоклеточность нитчатых форм аскомицетов только кажущаяся.
От септированного мицелия отходят конидиеносцы, на концах которых располагаются пигментированные экзоспоры — конидии. У одних аскомицетов конидии располагаются радиально расходящимися цепочками на специальных подставках стеригмах (например, аспергилл), у других они вместе со стеригмами крепятся на более мощных отростках метулах, что приводит к значительному их разветвлению (например, пенициллиум).
Каждая зрелая конидия в благоприятных условиях может прорастать, давая начало новому мицелию. Возможно также и вегетативное размножение плесени при помощи эндоспор—артроспор, хламидоспор и реже бластоспор.
Артроспоры (лат. articulus — сочленение, сустав), или оидии (греч. оидиум — яйцевидное тело), представляют собой не выходящую за пределы толщи гифы часть ограниченного септами мицелия эллиптической или неправильной цилиндрической формы, стыкующиеся концы которых напоминают суставные сочленения (рис. 10).
Хламидоспоры (греч. хламидо—плащ или защитное покрывало) также образуются при распаде гиф на отдельные короткие клетки, но •они имеют более толстую и окрашенную оболочку, за счет чего превышают диаметр гифы и обеспечивают стойкость к вредным воздействиям внешней среды. У голосумчатых грибов на гифах образуются почковидные выросты, последние округляются и отделяются от мицелия. Та-
Рис. 9. Морфология органов плодоношения у грибов;
1 — пеницилл; 2 — аспергилл; 3 — му-коровых.
21
Рис. 10, Эндоспоры плесневых грибов:
1 — артроспоры; 2 — хламидоспоры; 3 — бластоспоры.
кие дрожжеподобные почки называют бластоспорами (biaston—пузы-рек).
В ряде случаев мицелий гриба одновременно содержит хламидио-споры и скопления бластоспор, что рассматривается как диморфизм микроорганизма.
Половой процесс аскомицетов происходит путем переливания через трихогину в аскогон, вместе составляющие женский половой орган архикарп, содержимого антеридия. В архикарпе мужские и женские половые ядра спариваются, но не сливаются, образуя дикарион. Вслед за этим из аскогона развиваются аскогенные гифы, на концах которых после смешения ядер (кариогамия) образуются сумки, или аски. Диплоидное ядро претерпевает ряд делений, в том числе одно редукционное, образуя в конечном итоге аскоспоры.
Сумки большинства аскомицетов заключены в образованные гифами плодовые тела или аскокарпы трех основных типов: клейстотеции (совершенно замкнутые сферические плодовые тела), перитеции (частично открытые бутылкообразные плодовые тела), апотеции (полностью открытые чашеобразные плодовые тела).
Каждая аскоспора при благоприятных условиях прорастает в гаплоидный мицелий.
Другая группа сумчатых грибов—дрожжи—морфологически представлены крупными разновеликими сферическими или палочковидными клетками (5—10 мкм). Истинного мицелия не образуют. Размножаются преимущественно почкованием, реже изоморфным делением. При почковании дочерние клетки, не отрываясь от материнской, сами делятся, что приводит к скоплениям взаимосвязанных клеток — псевдомицелий.
При делении в дрожжевой клетке поровну распределяется ядерное вещество, затем цитоплазма разъединяется на две части, каждая из которых окончательно оформляется в самостоятельную дочернюю клетку. Вновь образованные дочерние клетки отделяются одна от другой после удвоения и расщепления разделившей материнскую клетку оболочки.
Образование половых спор у большинства дрожжей происходит по аскомицетному типу. После копуляции двух клеток и слияния ядер зигота превращается в сумку, где после 2—3-кратного деления образуется 4 или 8 аскоспор. Каждая из аскоспор может прорастать в новую дрожжевую клетку, размножающуюся почкованием. Аскоспоры имеют различ-22
ные внешние очертания и значительно более устойчивы к внешним факторам, чем дрожжевая клетка. Однако по устойчивости они существенно уступают бактериальным спорам.
Строение грибной клетки отличается от бактериальной рядом особенностей (рис. И). Стенка ее содержит хитин, составляющий значительную часть полисахарида: от 40 % У фикомицетов, до20—25у аскомицетов. Однако подавляющая часть полисахаридов (до 80—90 %) клеток аскомицетов состоит из глюкана, представленного полимером D-глюкозы с иными, чем в целлюлозе, связями между мономерами. У водных фикомицетов основной полисахаридный компонент стенки — целлюлоза.
Цитоплазма пронизана цитоплазматическим ретикулумом, содержит митохондрии, лизосомы и дифференцированные одно или несколько ядер, окруженных двойной мембраной. В ядре четко различают ядрышко и хромосомы (ДНК).
Типичным представителем нитчатых форм аскомицетов являются плесневые грибы пенициллиум и аспергиллиум. Они хорошо развиваются на-увлажненном белковом субстрате и известны в основном как активные гнилостные микроорганизмы. В микробиологической промышленности их используют в качестве продуцентов-антибиотиков (пенициллин), органических кислот и витаминов. Однако эта плесень имеет важное значение в патологии. Аспергиллы, в частности, являются возбудителями аспергилломикозов, аспергиллотоксикозов и образуют афлатоксины, обладающие онкогенным действием.
Дрожжи играют важную роль в круговороте углерода в природе. Их часто используют в производстве хлеба, пива, вина, ценных молочнокислых продуктов, сдобренных кормов для животных, но и среди них имеются патогенные микробы—грибы из родов Candida, Cryptococcus, вызывающие микозы.
Рис. 11. Строение клетки гифомицетов:
1 — стенка; 2 — клеточная мембрана; 3 —цитоплазматический ретикулум; 4 — ядро.
Рис. 12. Строение дрожжевой клетки:
1 — оболочка; 2 — ядро; 3 — митохондрии.
23
Клетка у дрожжей построена подобно другим грибам (рис. 12). В стенке их, кроме гликанов, содержатся полимеры маннозы (маннаны). Некоторые дрожжи не содержат хитин. Протопласт дрожжевой клетки характеризуется такими мембранными образованиями, как комплекс Гольджи, фагосомы и, вероятно, пиноцитозные пузырьки.
Базидиомицеты представлены в основном шляпочными грибами. Они не относятся к микроорганизмам и изучаются в курсе ботаники.
Микроскопические грибы с развитым септированным мицелием, у которых не установлена половая стадия развития, относят к несовершенным грибам (Fungi imperfecti). Они размножаются в основном при помощи конидий. Поскольку структурно подобные им нитчатые высшие грибы на конечной стадии размножения образуют аски, которые являются совершенной формой плодоношения, то плесень с конидиальной формой плодоношения называют несовершенной формой. По этим же соображениям относят к несовершенным и грибы, у которых не установлена способность образовывать базидии. Но, учитывая наличие двуполости у высших грибов и частую возможность изоляции культуры только одного пола, трудно согласиться с отрицанием наличия у накопленных в лабораториях штаммов полового процесса. По мере установления последнего несовершенные грибы, видимо, будут отнесены к аско- или базидиомицетам.
В зависимости от строения конидиального аппарата несовершенные грибы подразделяют на гифомицеты (конидиеносцы расположены отдельно или соединены в пучки), меланкониевые (конидиеносцы образуют ложа—плотный палисадный слой на сплетении субстратного мицелия) и сферопсидные (конидиеносцы развиваются внутри замкнутых шаровидных полостей, состоящих из плотно упакованных гиф—пикнид).
К несовершенным грибам относят возбудителей микозов, в частности дерматомикозов (стригущего лишая, парши, эпидермофитии) и микотоксикозов (стахиботриотоксикоза, фузариотоксикоза).
Миланкониевые и сферопсидные грибы являются в основном фито-патогенными, поражают преимущественно фруктово-ягодные, цветочные растения и злаки. Среди микроорганизмов этой группы И. И. Мечниковым был открыт паразитирующий на хлебном жуке гриб метаризиум, изучение которого положило начало использованию микробиологического метода борьбы с вредными насекомыми (так называемых энтомопа-тогенных микробов).
Некоторые гифомицеты (например, фузариум) являются продуцентами антибиотиков и стимуляторов роста ряда растений (гиббереллин).
МОРФОЛОГИЯ И СТРОЕНИЕ ФАГОВ
У микроорганизмов, видимых в световом микроскопе, имеются свои паразиты, рассмотреть которые можно только под электронным микроскопом. Французский ученый Д’Эрелл в 1917 г. впервые выделил их из фекалий больных дизентерией людей, доказал способность лизировать клетки возбудителя болезни и назвал бактериофагами, то есть «пожирателями бактерий». В дальнейшем оказалось, что они паразитируют не только у бактерий, но и у микробов других систематических групп. Поэтому их стали обозначать общим термином «фаги», в случае необходимости конкретизации прибавляя приставку, состоящую из названия микроорганизма, который они лизируют. Например, фаги, разрушающие кишечную палочку, называют колифагами, микобактерии — микофагами, актиномицеты—актинофагами и т. д.
По существу, фаги являются вирусами, поэтому их частицы (вирионы) не имеют клеточного строения и измеряются в нанометрах (нм) или ангстремах. Тем не менее форма вирионов разнообразна, что
24
позволяет подразделить известные фаги на шесть морфологических типов (см. рис. 13)*.
К фагам I морфологического типа относят вирионы нитевидной (палочковидной) формы размером 700—850X5— 8 нм. Фаги II типа включают частицы шестигранной (гексагональной) формы размером 23—30 нм в диаметре. Фаги III типа объединяют такие же мелкие гексагональные частицы, но с многочисленными короткими выступами. Фаги IV типа объединяют частицы, имеющие вид многогранной головки, размером от 40 до 64 мкм в диаметре и короткий отросток — «хвостик» размером 7X20 нм. Фаги V типа наиболее распространены, также имеют вид спермия, но гексагональная головка у них 50— 425 мкм в диаметре, а «хвостик»— 170—500X7—12 нм, то есть значительно больших размеров, при этом чехол отростка не сокращается,
типа по распространению, морфологии и размерам почти соответствуют частицам V типа, но хвостовой чехол у них способен сокращаться, из-за чего внутренний стержень отростка частично оголяется (рис. 13).
Схематическое строение вириона (фага VI морфологического типа) представлено на рисунке 14.
Головка фага (капсид) покрыта оболочкой, состоящей из спирально упакованных белковых субъединиц—капсомеров. Головки содержат нуклеиновую кислоту—дезоксирибонуклеиновую (ДНК) или рибонуклеиновую (РНК), а также белок и в незначительных количествах углеводы и нейтральные жиры.
В зависимости от нуклеиновой кислоты фаги подразделяют на ДНК-овые. и РНК-овые. Фаги I, IV, V и VI типов являются ДНК-овыми, II— РНК-овыми, а III—содержат ту или другую нуклеиновую кислоту. Причем в частицах ДНК-содержащих фагов нуклеиновая кислота в основном двухцепочечная, реже (например, фаги I морфологического типа) одноцепочечйая; в РНК-содержащих фагах нуклеиновая кислота одноцепочечная.
Нуклеиновые кислоты являются носителями генетической информации, благодаря им фаги размножаются в клетке-хозяине, предварительно инфицированной фаговой нуклеиновой кислотой.
Прикрепление фаговых частиц к специальным рецепторам бактериальной поверхности, как жгутики или пили, осуществляется при помощи базальной пластинки вириона. Нити хвостового отростка служат для фиксации фагов на пили (жгутиках) бактерий. Закрепившись на них, они затем соскальзывают к основанию отростка и инъецируют свою нуклеиновую кислоту через бактериальную стенку.
Специфичность адсорбции вирионов и их литической активности обусловила широкое использование фагов для дифференциации микробов, лечения и профилактики вызываемых ими болезней и для санитарной оценки воды. Вместе с тем в промышленной технологии, особенно при производстве молока и молочных продуктов, вирусы-паразиты полезных микробов причиняют значительный экономический ущерб.
Однако важно помнить, что способность фагов специфически лизировать клетки-мишени не связана с их структурными особенностями.
* Рисунки с ссылкой «см.» — даны на вклейке.
25
Морфологически идентичные фаги могут лизировать бактерии различных таксономических групп, в то же время коли-фаги, лизирующие эшерихий, относятся ко всем шести морфологическим типам.
ГЕНЕТИКА МИКРООРГАНИЗМОВ (НАСЛЕДСТВЕННОСТЬ И ИЗМЕНЧИВОСТЬ)
В XIX столетии практической иммунологией была доказана возможность ослаб-» лення вирулентности микробов и изготовления вакцин.
В это же время определились и теоретические направления в оценке изменчивости микробов. Наблюдая многообразие изменений морфологических и физиологических свойств микроорганизмов, К. Негели и его ученики создали теорию плеоморфизма, по которой считалась биологически естественной возможность превращения безвредных сапрофитов в возбудителей заболеваний. Эту теорию оспаривали мономорфи-сты, во главе которых стояли Ф„ Кон и Р. Кох. Они отстаивали постоянство, неизменяемость определенных форм и видов микроорганизмов. Гетерогенность (разнородность) популяций и изменения, возникавшие в разных условиях культивирования микробов, моиоморфисты объясняли загрязиеиием или дегенеративными процессами, ведущими к вырождению и гибели культур.
Принципиальные требования моиоморфистов к выделению чистой культуры и сохранению стабильности свойств микроорганизмов способствовали разработке более совершенных методов исследований. Введение в практику бактериологических лабораторий плотных питательных сред давало возможность более точного изучения свойств микроорганизмов и определения этиологической роли их отдельных видов в возникновении инфекционных болезней. В то же время строгость принципов мономорфизма ограничивала широту наблюдений за изменчивостью микроорганизмов.
Первая четверть XX в. обогатилась огромным количеством исследований, результаты которых сохраняют значение до настоящего времени и служат феноменологической основой явлений наследственности и изменчивости микроорганизмов, сущность и механизмы которых изучаются на современном методическом уровне.
Так, в 1906—1907 гг. Нейссер и Массиии описали появление «дочерних» колоний йишечной палочки, в отличие от материнской не ферментирующих лактозу, и назвали их Coli mutabile. Этот термин применяется в определении мутации — наследственных изменений в свойствах микроорганизмов.
В 20-х годах нашего столетия сложились теоретические концепции по трактовке интенсивно накапливающихся наблюдений разнообразных форм изменчивости, известные в литературе как «теория циклогении» и «учение о диссоциации».
В 1921 г. П. де Крюн описал расщепление культуры возбудителя септицемии кроликов на вирулентные и авирулентиые варианты и впервые применил термин «диссоциация микробов» для обозначения этого явления. Тогда же Аркрайт установил последовательность изменений вирулентности, антигенных свойств, стабильности взвеси микробов в солевом растворе, возникновения различных форм колоний на плотной среде у бактерий семейства кишечных. Для этих бактерий в качестве исходной была принята S-форма, имеющая колонии с маслянистой гладкой поверхностью (отсюда и обозначение smooth—англ, гладкий), за нею следовала М-форма — мукоидная, слизистая, затем G-форма — гоиидиальиая и, наконец R-форма — шероховатая (от аигл. rough), спонтанно переходящая в исходную S-форму (см. рис. 15).
В 1925 г. Хедли расширил эти наблюдения на основе аналогичных собственных данных об изменчивости у других видов микробов. В тот же год Эидерлейи предложил сложную теорию «циклического» развития бактерий, которое совершается путем смены фаз, различающихся по морфологическим и физиологическим признакам в закономерной последовательности. Сторонников теорий диссоциации и циклогеиии объединяло представление об онтогенетическом развитии бактерий по замкнутому кругу. В монографии Хедли (1927) диссоциация бактерий рассматривается как расщепление «чистой линии» культуры на несколько характерных типов и форм, резко отличных от исходной по внешнему виду колоний, а также культуральными биохимическими и серологическими свойствами. Возникают они в определенной последовательности и представляют собой фазы нормального физиологического цикла развития.
Диссоциативные изменения, описанные Хедли и др., особенно часто наблюдаются при длительном хранении культур на искусственных средах. У некоторых патогенных микроорганизмов (Вас. anthracis, М. tuberculosis) нормальной является шероховатая форма колоний при сохранении вирулентности, а гладкая — соответствует штаммам со сниженной вирулентностью (патогенностью). То же относится и к патогенным стрептококкам: у них гладкая блестящая (glossi) форма колоний отмечается у мало-вирулентных штаммов, а матовая (matti)—аналог шероховатой — типична для обладающих высокой вирулентностью.
Все вышеупомянутые термины и обозначения встречаются в практических руководствах для бактериологических лабораторий.
По современным представлениям «фазы диссоциации» соответствуют различным
26
типам стабильных мутаций, спонтанно возникающих в естественной среде и при лабораторном культивировании.
В практической работе биологических лабораторий наиболее часто наблюдаются S- и R-формы энтеробактерий. Мукоидная (слизистая) и гонидиальная (мелкие, однотипно «росинчатые» колонии) менее жизнеспособны и на них мало обращают внимания. Практически важное различие между S- и R-формами энтеробактерий заключается в том, что у шероховатых форм либо полностью утрачивается способность синтезировать специфические 0-антигены (с которыми связана вирулентность бактерий), либо она существенно изменяется. Этим определяются различия и в степени вирулентности диссоциативных форм.
МАТЕРИАЛЬНЫЕ ОСНОВЫ НАСЛЕДСТВЕННОСТИ МИКРООРГАНИЗМОВ
На любом уровне биологической организации основой жизни является способность к самовоспроизведению живого организма. Возможность накопления биомассы микроорганизмов в нужном количестве за короткое время, а также получение отдельных популяций в неограниченном количестве генераций для самых разнообразных исследований сделали микробов незаменимой моделью для изучения генетических и молекулярно-биологических проблем.
Принципиально новые возможности изучения материальных основ
наследственности и изменчивости микроорганизмов и механизмов передачи наследственной информации определились при использовании биохимических методов анализа. Начало исследований в этом направлении было положено Гриффитсом (1928), который показал, что можно искусственно изменить серовар пневмоккоков. Он вводил под кожу лабораторным мышам смесь живой культуры пневмококка II типа вместе с убитыми нагреванием при 60 °C пневмококками III типа и из смешанного
инокулята выделил бактерий, обладавших вирулентностью и способностью образовывать капсулу, характерную для пневмококка III типа.
В 1931 г. Даусон и Сиа воспроизвели in vitro этот феномен, который был назван трансформацией, а в 1944 г. Эвери, Мак Лед и Мак Карти установили, что трансформирующая активность пневмококков III типа связана с ДНК, содержавшейся в экстрактах из этих пневмококков, ис-
пользованных в опытах трансформации вместо интактных бактерий. Трансформирующая активность экстрактов не снижалась при обработке их рибонуклеазой, протеолитическими ферментами, прогреванием при температуре, разрушающей белки
микробной клетки. Отсутствие эффекта трансформации наблюдалось только при обработке экстракта дезоксирибонуклеазой — ферментом, разрушающим ДНК. Это были первые доказательства
того, что ДНК является специфическим субстратом, несущим генетическую информацию, которую можно передать от клетки клетке.
Нуклеиновые кислоты, как биохимические вещества, были
Цитозин, Н
открыты Ф. Мишером (1869) и идентифицированы в конце прошлого века. К началу нашего столетия уже стало известно, что в их состав входят пурины, пиримидины, фосфорные компоненты и сахара — пентозы (рибоза и дезоксирибоза) . Рибоза была впервые выявлена в нуклеиновой кислоте дрожжей, получившей на-
Дезоксирибоза.
О
II н-о:-р-о-н
о ।
й фссрат
Рис. 16. ДНК: четыре вида оснований (аденин, гуанин, тимин, цитозин), сахар (дезоксирибоза), фосфат.
27
звание рибонуклеиновой (РНК); дезоксирибоза найдена в нуклеиновой кислоте тимуса теленка, названной поэтому дезоксирибонуклеиновой
(ДНК).
В состав ДНК входят два пуриновых основания (аденин и гуанин) и два пиримидиновых (тимин и цитозин). Эти азотистые основания объединяются с сахаром в комплексы, именуемые нуклеозидами, которые, в свою очередь, соединяются с фосфатным компонентом (остаток фосфорной кислоты) и образуют нуклеотиды. Они и являются строительными
блоками, из чего формируются длинные полинуклеотидные цепи (рис. 16).
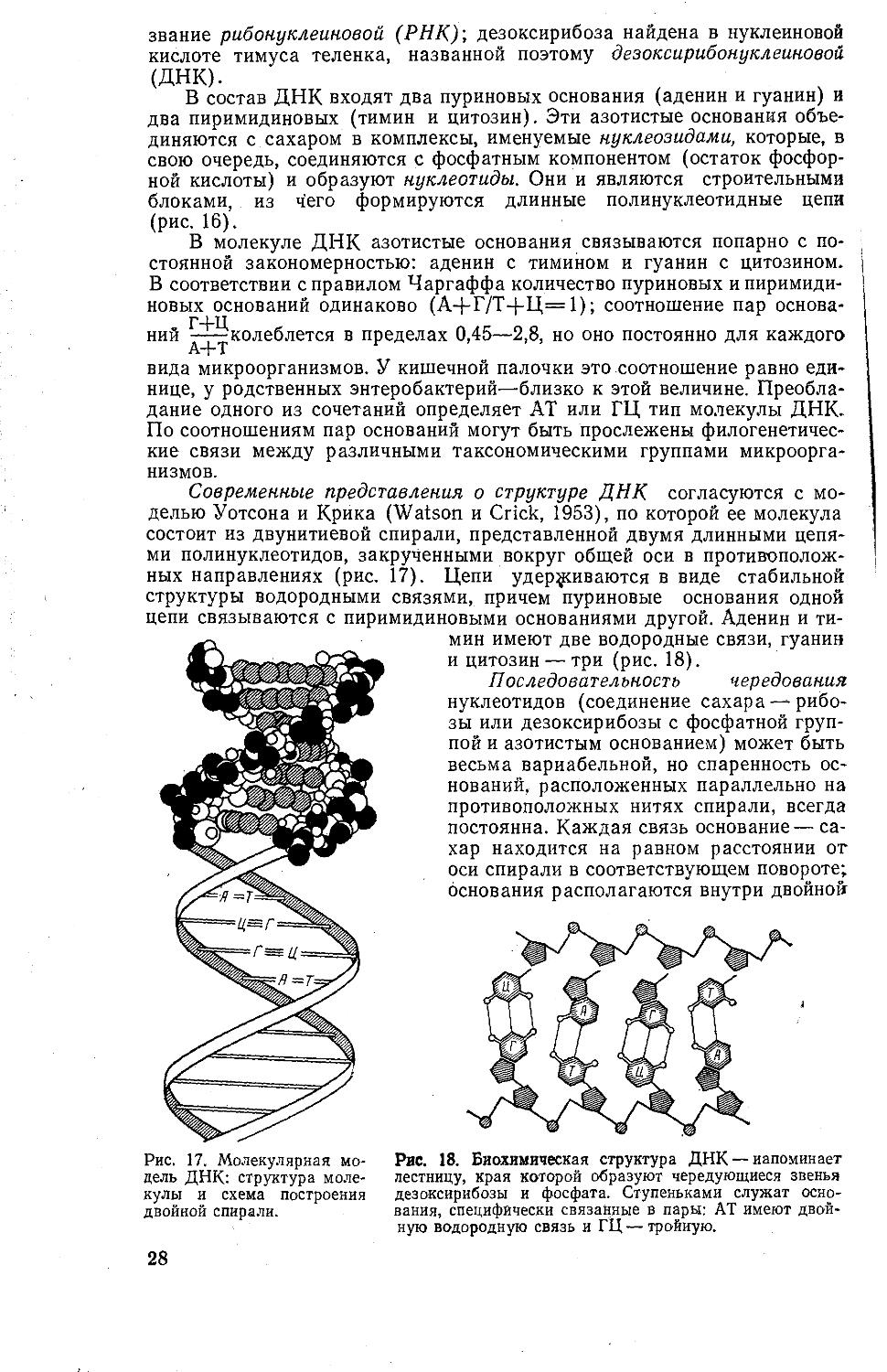
В молекуле ДНК азотистые основания связываются попарно с постоянной закономерностью: аденин с тимином и гуанин с цитозином. В соответствии с правилом Чаргаффа количество пуриновых и пиримидиновых оснований одинаково (А+Г/Т+Ц=1); соотношение пар основа-
Г+Ц
ний ---колеблется в пределах 0,45—2,8, но оно постоянно для каждого
вида микроорганизмов. У кишечной палочки это соотношение равно единице, у родственных энтеробактерий—близко к этой величине. Преобладание одного из сочетаний определяет АТ или ГЦ тип молекулы ДНК. По соотношениям пар оснований могут быть прослежены филогенетичес
кие связи между различными таксономическими группами микроорганизмов.
Современные представления о структуре ДНК согласуются с моделью Уотсона и Крика (Watson и Crick, 1953), по которой ее молекула состоит из двунитиевой спирали, представленной двумя длинными цепями полинуклеотидов, закрученными вокруг общей оси в противоположных направлениях (рис. 17). Цепи удерживаются в виде стабильной структуры водородными связями, причем пуриновые основания одной цепи связываются с пиримидиновыми основаниями другой. Аденин и ти-
Рис. 17. Молекулярная модель ДНК: структура молекулы и схема построения двойной спирали.
мин имеют две водородные связи, гуанин и цитозин — три (рис. 18).
Последовательность чередования нуклеотидов (соединение сахара —рибозы или дезоксирибозы с фосфатной группой и азотистым основанием) может быть весьма вариабельной, но спаренность оснований, расположенных параллельно на противоположных нитях спирали, всегда постоянна. Каждая связь основание—сахар находится на равном расстоянии от оси спирали в соответствующем повороте; основания располагаются внутри двойной
Рис. 18. Биохимическая структура ДНК —напоминает лестницу, края которой образуют чередующиеся звенья дезоксирибозы и фосфата. Ступеньками служат основания, специфически связанные в пары: АТ имеют двойную водородную связь и ГЦ — тройную.
спирали, а сахарофосфатные группы — на ее внешней стороне. Структура молекулы ДНК отличается исключительной упорядоченностью и стабильностью, обеспечивающей соответствующие генетические особенности клеток высших и низших организмов.
Характер последовательности спаренных оснований определяет специфику генетической информации, заложенной в молекуле ДНК. Носителем генетической информации может быть также РНК, из которой состоят многие вирусы, в том числе бактериофаги. По структуре РНК отличается от ДНК тем, что в норме она состоит из одной поли-нуклеотидной цепи и в числе азотистых оснований в ней находится вместо тимина урацил, а вместо дезоксирибозы—рибоза.
Генетическая роль РНК была изучена на модели вируса табачной мозаики (ВТМ). Френкель-Конрат и Вильямс (1955) впервые доказали возможность получения полноценных инфекционных частиц ВТМ путем искусственного соединения очищенного белка и РНК и последующего заражения клеток растения. Позднее были выделены и изучены нуклеиновые кислоты многих вирусов человека и животных, содержащих как РНК, так и ДНК (бактериофаги, вирусы полиомиелита, энцефалита, ящура и др.).
Введенная в клетки хозяина (микро- или макроорганизма) изолированная нуклеиновая кислота вируса выполняет те же биологические функции, что и полноценный вирус. Следовательно, в молекуле нуклеиновой кислоты содержится вся необходимая генетическая информация для воспроизведения биологической активности вируса, соответствующей исходному типу.
ДНК-ХРОМОСОМЫ И ПЛАЗМИД
У высших растительных и животных организмов вся генетическая информация заложена в ядре, содержащем полный набор хромосом. Эквивалентом ядра у бактерий является нуклеоид, состоящий из одной компактно уложенной или развернутой молекулы ДНК (в зависимости от физиологического состояния клетки, определяющего ее функциональную активность).
Двунитевая молекула ДНК-хромосомы бактерии (Е. coli) состоит из 1,7ХЮ7 нуклеотидных пар, имеет длину около 1 мм. Молекулярная масса (около 109) составляет примерно 3 % от сухой массы клеток бактерий.
Метод аутографии (по Кернсу, 1962—1963) выявляет, что перед началом деления клетки спираль ДНК «раскручивается» на две отдельные нити, образуя репликационную вилку (рис. 19). Оказаки (1969) показал, что, начиная от точки разделения вилки, достройка молекулы ДНК на каждой нити осуществляется прерывисто, образуя фрагменты, состоящие из 1000—2000 нуклеотидов. Такие фрагменты (называемые фрагментами Оказаки) синтезируются в одном направлении (рис. 20, по часовой стрелке). Таким образом, фрагментарный синтез комплементар-
(
Рис. 19. Передача генетической информации:
А — удвоение молекулы ДНК (репликационная вилка); В — транскрипция ДНК и РНК.
29
ных нитей ДНК от точки репликации идет одновременно, но в противоположных направлениях. Последующее смы-! какие фрагментов осуществляется с помощью фермента ДНК-лигазы, действующего строго специфически. Лигаза катализирует образование фосфодиэфирных связей между соседними сегментами цепи молекулы ДНК, один
из которых несет 5’фосфат, а второй — свободную груп-
пу 3’ — ОН. С интактной цепью ДНК-сегменты соединяются водородными связями. Полагают, что лигаза участвует в восстановлении структуры ДНК при различных повреждениях, а также в процессах рекомбинации. После разделения ДНК на основе каждой нити, используемой в качестве матрицы, достраивается комплементарная нить и восстанавливается двунитевая структура, идентичная
исходной ДНК, несущей закодированную в ней информа
цию, передаваемую потомству.
ДНК плазмид, так же как и ДНК-хромосомы, представляет собой в состоянии покоя двунитевую замк-
нутую структуру, принимающую различные конфигурации в разных условиях. Молекула ДНК может быть
«сверхзакрученной», открытой кольцевой или линейной двунитевой.
Длина плазмидной ДНК составляет примерно 1/100 хромосомной, и точно идентифицировать ее в общей массе нелегко. Плазмиды составляют большой класс вне-
хромосомных элементов, разнообразных по генетическим
5f Sf свойствам и по молекулярным размерам. Молекулярная масса плазмид от 4,5Х1О6 до 94Х106. Она минимальна
Рис. 20. Схема
прерывистого синтеза ДНК (фрагменты
у колициногенных факторов группы Е, не обладающих трансмиссивностью (см. ниже), среднее место занимает плазмида, и наибольшая молекулярная масса выявлена у рекомбинантных плазмид, представляющих сочетание нескольких внехромосомных элементов.
Оказаки).
Для накопления плазмидной ДНК в количествах, необходимых для молекулярно-биологических экспериментов, довольно широко используются так называемые мини-клетки (Адлер и др., 1967). Последние, известные у Е. coli и некоторых других бактерий, представляют собой мутанты с нарушенным механизмом клеточного деления. Отделяемые от них мелкие сферические дефектные формы (см. рис. 21) не содержат хромосомной ДНК в определяемых количествах, но сохраняют физиологическую активность исходных клеток.
Введенная в мини-клетки внехромосомная ДНК нормально реплицируется и может быть передана полноценным реципиентным клеткам или накоплена в нужных количествах и выделена в чистом виде. Миниклетки используют также для изучения молекулярной биологии плазмид н для получения практически полезных веществ за счет интенсивного увеличения числа копий плазмид, контролирующих соответствующие специфические синтезы.
ГЕНЕТИЧЕСКИЙ КОД И ПЕРЕДАЧА ИНФОРМАЦИИ
Четкость и стабильность процессов передачи генетической информации обеспечиваются уникальной прочностью генетического кода, гипотезу которого предложил Гамов (1954), а затем (60-е годы) ее дополнили Крик и другие. В соответствии с этой гипотезой вся генетическая информация зашифрована в молекуле ДНК- Как ни трудно себе это представить, оказывается, что все необозримое многообразие живой природы, и в том числе микроорганизмов, определяется последовательностью чере-
30
I
1. Генетический код Е. coil (по данным Уэлса, Моргана и Кораны, 1966)
. О йй
IE fl СП /11 «А
Среднее основание
У ц А Г .
0
УАУ
УЦУ
УУУ фенилаланин
АУЦ
УАА
УЦЦ сернн
УЦА
тирозин охр*
УГУ
цистеин
УГЦ УГА?
УУЦ
УУА
лейцин
УУГ
УЦГ
У АГ
амбер*
УГГ триптофан
ЦУУ
ццу
ЦУЦ
лейцин ЦУА
ЦЦЦ пролнн
ЦАУ гистидин
ЦАЦ
ЦГУ
ЦГЦ аргинин
ЦУГ
ЦЦА
ЦЦГ
ЦАА
глутамин
ЦАГ
ЦГА
ЦГГ
АУУ
АЦУ
АУЦ изолейцин АУА
АУГ метионин
АЦЦ треонин АЦА
АЦГ
ААУ
аспарагин
ААЦ
ААА лизин
ААГ
АГУ
серин
АГЦ
АГА
аргинин
АГ Г
ГУУ
ГУЦ валин
ГЦУ
ГЦЦ аланин
ГАУ аспарагин ГАЦ
ГУА
ГУГ
ГЦА ГЦГ
ГАА глутамин ГАГ
ГГУ
ГГЦ
глицин
ГГА ГГГ
Примечание.
Примечание. Ориентация нуклеотидов следует в согласованном порядке — с 5'-фосфа-тами слева и З'-фосфатами справа от символов У, Ц, А и Г (урацил, цитозин, аденин и гуании).
* «Амбер» и«охр» — термины обозначают некоторые мутанты бактерий. Два триплета, УАА и УАГ, возможно, действуют как сигналы для прекращения синтеза полипептидных цепочек.
дования четырех оснований ДНК, обеспечивающей специфику собственных макромолекул и детерминирование синтеза всех существующих белков.
Белки состоят из 20 аминокислот различной структуры; из них построены длинные полипептидные цепи, содержащие часто по нескольку сотен аминокислотных молекул, которые в каждом белке располагаются в соответствии с закодированной последовательностью оснований ДНК клетки бактерии. Схему кодирования синтеза белка можно представить как запись фразы с помощью алфавита из четырех букв А, Г, Ц, Т (по числу оснований ДНК). Слова в этой фразе {кодоны) составляются из различных комбинаций букв—по три для каждой аминокислоты, соответственно трем основаниям ДНК, кодирующим данную аминокислоту. Поэтому генетический код называется триплетным. Каждый кодон представляет самостоятельную функциональную единицу детерминирования отдельной аминокислоты, и поэтому код называют неперекрывающимся. Теоретически было рассчитано, что наиболее экономичным и соответствующим гипотезе должен быть код, состоящий из 64 триплетов (кодо-нов), исчерпывающих возможные сочетания четырех оснований (4X4X Х4=64). В таблице 1 представлен генетический код Е. coli.
Генетический код является универсальным для всех живых систем, что свидетельствует о единстве происхождения живой материи.
Процесс синтеза белка, закодированный в молекуле ДНК, осуществляется в несколько этапов и требует участия трех типов РНК: инфор-
31
I' •
i1-
сомы и регуляция этого процесса.
Рис. 24. Позитивный контроль реплика* ции хромосомы бактерии с участием инициатора и роль клеточной мембраны, (В) даюшей сигнал к началу формиро* вания дочерней хромосомы:
а — точка прикрепления хромосомы к мембра* не; б — разделение точек прикрепления в про* цессе роста мембраны (в); г—деление клетка.
На модели лактозного оперона i экспериментально доказан двойной генетический контроль экспрессии генов оперона: «негативный контроль», осуществляемый геном-регулятором с участием репрессора, и «позитивный контроль», который выполняется геном-регулятором другого типа, контролирующим синтез белка-активатора (или инициатора), необходимого для транскрипции структурных генов.
По принципу «позитивного контроля» совершается репликация ДНК-бактериальной хромо-Модель репликона для объяснения
механизма репликации хромосомы предложили Жакоб с соавт. в 1963 г. (рис. 24).
Каждый репликон имеет два локуса: один — несущий структурный ген, контролирующий синтез специфического белка — цитоплазматического инициатора (ген-регулятор); второй — несущий ген-репликатор (или оператор репликации), который включается в процесс репликации
хромосомы по сигналу инициатора, получающего импульс со стороны клеточной мембраны в определенный момент физиологической зрелости клетки. Инициатор дает сигнал к раскручиванию спирали ДНК на две нити, которые служат матрицами для синтеза новых молекул ДНК.
Репликоном может быть назван любой генетический элемент, способный к автономной репликации: хромосомы клетки бактерии, или вне-хромосомные элементы — бактериофаги, плазмиды, эписомы.
ГЕНЕТИЧЕСКИЙ ОБМЕН У БАКТЕРИИ И РОЛЬ ВНЕХРОМОСОМНЫХ ЭЛЕМЕНТОВ
Общий для всех живых организмов путь генетических рекомбинаций, так же как и другие пути, свойственные только одноклеточным (трансформация, трансдукция, конъюгация), осуществляется при наличии системы скрещивания, состоящей из двух обязательных компонентов — донора и реципиента. Эти компоненты должны обладать необходимой степенью гомологии в структуре ДНК, а также качествами, специфическими для каждого из них.
Рекомбинация определена Кларком (1971), как «любая сумма событий, при которой взаимодействие элемента нуклеиновых кислот приводит к изменению сцепления генов либо их частей». В результате контактов бактерий донора и реципиента формируются рекомбинанты, представляющие собой физиологическую основу клетки с полноценной хромосомой — реципиента и включенными в нее фрагментами хромосомы донора. Для осуществления скрещивания донор должен обладать свойством фертильности (англ, fertility — плодовитость). Оно опреде-
г
34
ляется по способности бактерий адсорбировать специфические донорские фаги на специальных поверхностных структурах (пили), синтез которых детерминируется F-плазмидой, или на специфических участках поверхности клетки донора при отсутствии таких пилей у некоторых видов бактерий (см. рис. 25).
Рекомбинация совершается при наличии у реципиента гес-генов (рекомбинационная система, гес+), а также при отсутствии факторов ограничения экспрессии чужеродной ДНК.
Т р а н с ф о р м а ци я — передача генетической информации путем введения в клетку реципиента изолированной ДНК-бактерии донора. Эффективность трансформации зависит от степени гомологии в структуре ДНК-донора и реципиента. Поэтому трансформация более эффективна в пределах одного вида, между его представителями с различными характеристиками по отдельным признакам. Даже и при этих условиях трансформанты образуются только с «компетентными» клетками реципиента. Компетентность — кратковременное состояние реципиентных клеток (их бывает от 1 до 15 % популяции), наблюдаемое обычно в конце экспоненциальной фазы развития; суть компетентности заключается в изменении проницаемости клеточной стенки (не до конца выясненной природы), позволяющей проникать в клетку высокомолекулярным структурам ДНК.
На поверхности клетки реципиента имеются специфические ферментативно активные рецепторы, на которых фиксируются фрагменты ДНК-донора, и затем проникают в клетку. В оболочке каждой компетентной клетки от 30 до 70 рецепторных участков, способных адсорбировать фрагменты ДНК. Проникшие в клетку фрагменты расщепляются на комплементарные нити, из которых одна включается в хромосому реципиента. Частота трансформации отдельных наследуемых признаков (маркеров) зависит от частоты рекомбинаций, специфической для конкретного участка хромосомы, величины включаемого генетического локуса, степени гомологии нуклеотидного состава ДНК-компонентов.
При существенных различиях частота получения трансформантов ограничена, тем не менее межвидовая трансформация воспроизведена у бактерий рода Haemophilus, Neisseria между различными видами Bacillus, между пневмококками и стрептококками.
У энтеробактерий реципиенты более восприимчивы к трансфекции в виде сферопластов.
Трансдукция — перенос генетического материала от донора реципиенту с помощью умеренных бактериофагов, которые в отличие от вирулентных не всегда вызывают лизис клетки бактерии. Они существуют либо в цитоплазме в автономном состоянии, либо включаются в структуру ДНК в виде профага, представляющего геном фагового вируса. В интегрированном состоянии геном умеренного фага передается потомству клетки наравне с другими хромосомными генами.
Переходя в автономное состояние такие фаги могут присоединять к собственному геному небольшие фрагменты хромосомы, расположенные рядом с местом включения в нее профага. При инфицировании нового хозяина умеренные фаги, несущие хромосомные гены, выполняют функции переносчика генетического материала от клетки донора (прежнего хозяина) клетке реципиенту (новому хозяину). Трансдукция широко распространена и хорошо изучена у энтеробактерий. У Е. coli это фаги X и Р-1; у шигелл Р-1, у сальмонелл (Salm, typhimurium) Р-22. Известны трансдуцирующие фаги также у стафилококков, сенной палочки, у бактерий родов Pseudomonas, Proteus и др.
Явление трансдукции впервые было установлено в начале 50-х годов Ледербергом и Циндером и оказалось очень важным для генетических исследований, поскольку с помощью некоторых умеренных фагов может быть передан любой участок хромосомы бактерий. Такую пере-з* 35
дачу, называемую общей или неспецифической трансдукцией, могут осуществлять фаги Р-1 и Р-22 у эшерихий, шигелл, сальмонелл.
Кроме того, существует специализированная трансдукция, хорошо изученная на модели умеренного фага Е. coli— К (лямбда). Трансдуци-рующие частицы этого фага в норме могут передавать только гены-расположенные в галактозном локусе (Гал), непосредственно примыкающем к месту включения профага к; фаг кишечной палочки Ф-80 может включаться вблизи локуса, контролирующего синтез триптофана, и передавать его затем также путем специализированной трансдукции.
Некоторые умеренные фаги сальмонелл и дизентерийных бактерий способны при трансдукции осуществлять так называемую лизогенную или фаговую конверсию антигенов одновременно с лизогенизацией клетки-реципиента.
При конверсии вместе с фагом передается фрагмент хромосомы, контролирующий синтез соматического антигена, что изменяет антигенную структуру реципиента за счет привнесенных детерминантов синтеза, в норме ему несвойственного. Практически важное значение имеет фаговая конверсия, выявленная у дифтерийных бактерий Фрименом (1951). Один из умеренных бактериофагов Corynebacterium diphtheriae одновременно с лизогенизацией сообщает бактериям свойство токсигенности. У этих бактерий способность синтезировать токсин находится под генетическим контролем генома фага и утрачивается одновременно с потерей последнего.
При изучении трансдукции у сальмонелл было обнаружено явление, получившее название абортивной трансдукции (Озеки, 1956). Оно заключается в том, что фрагмент хромосомы донора, перенесенный умеренным бактериофагом в клетку реципиента, не включается в его хромосому, а остается в цитоплазме в автономном состоянии в виде так называемого экстра-гена, контролирующего синтез пуринов. Фенотипическое выражение его активности проявляется в формировании мельчайших колоний на синтетической среде, не содержащей пуринов. Полагают, что абортивную трансдукцию могут осуществлять некоторые частицы фагов, которым свойственна генерализованная трансдукция.
Широкое распространение лизогенности у стафилококков, энтеро^ бактерий и других дает основание предполагать значительную роль трансдукции в формировании «атипичных» бактерий, выделяемых из природных источников, что может осложнять эпидемиологический и эпизоотологическией анализ. Наглядно это проявляется в антигенной конверсии (особенно у сальмонелл), влекущей за собой изменение антигенной структуры близкородственных бактерий, у которых серологическая характеристика — основа дифференциальной диагностики.
Конъюгация — процесс передачи генетической информации путём непосредственного контакта физиологически полноценных клеток донора и реципиента. Первые доказательства односторонней передачи генетического материала (различного поведения в скрещивании бактерий) — доноров и реципиентов — получили Ледерберг и Тетум (1964), использовав для скрещиваний ауксотрофные мутанты. Е. coli штамма К-12. В итоге скрещиваний получено потомство прототрофных колоний, что и явилось доказательством рекомбинации генов в результате передачи генетического материала от клетки клетке.
В последующих работах супругов Ледербергов, Кавалли и Хейса в опытах по скрещиванию бактерий Е. coli было показано, что донорская активность определяется наличием в клетке внехромосомного генетического элемента F-фактора (sex-фактор). По современной номенклатуре (1976) эти термины упразднены. Клетки, составляюЩйё конъюгирующую пару, называются донором и реципиентом вместо старых терминов «мужские» и «женские» клетки. То же относится и к дифференцирующим фагам: те из них, к которым чувствительны только
36
клетки доноров — fl, f2, MS2 и другие, именовались мужскими фагами, в настоящее время их рекомендуют называть донор-специфическими. На поверхности Р+-клеток располагаются специальные отростки пили, адсорбирующие специфические фаги, которые отличаются от других типов поверхностных структур (жгутиков, ресничек и др.) по количеству (2—3 на клетку), величине и внутреннему диаметру. Диаметр канала пилей у Е. coli равен примерно 25 А (Бринтон, 1965), что позволяет проходить через него нити ДНК-донора при контакте с клеткой реципиента. Внехромосомные элементы, с участием которых совершаются процессы конъюгации, называются конъюгативными плазмидами.
Конъюгативная плазмида — генетический элемент, осуществляющий в процессе конъюгации перенос от клетки донора реципиенту собственной молекулы ДНК, находящейся в цитоплазме в автономном состоянии и ориентирующий на передачу хромосому, будучи в интегрированном с нею состоянии. Кроме фактора фертильности (плазмиды F), к числу конъюгативных плазмид относят плазмиды, контролирующие резистентность бактерий одновременно к нескольким лекарственным веществам (в их числе — антибиотикам), R-плазмиды; некоторые колициногенные факторы, контролирующие синтез антагонистически активных белковых субстанций, колицинов (плазмиды Col J, Col v2, Col v3); плазмиду Ent, контролирующую синтез энтеротоксина у патогенных эшерихий; плазмиду Н1у, контролирующую синтез гемолизинов и гемотоксинов; плазмиду вирулентности—vir, а также плазмиды, контролирующие синтез поверхностных антигенов кишечной палочки — К-88, К-99 и некоторые другие.
Особенностью конъюгативных плазмид является наличие в их структуре генетического элемента трансмиссивности (фактора передачи)— частицы «tra», обеспечивающей передачу генетической информации. Плазмиды, не имеющие такой частицы и соответственно неспособные к самопередаче, называются неконъюгативными. К ним относят большинство колициногенных факторов (их известно более 25), некоторые факторы резистентности и детерминанты синтеза антагонистических субстанций у разных видов микроорганизмов, называемых бакте-риоцинами вообще, а индивидуально — по названию микроба-продуцента: туберкулоцины, пестицины, вибриоцины и др. Неконъюгативные плазмиды (tra~) могут быть «мобилизованы» плазмидами tra+ и образовывать при этом комплексные структуры, которые вместе передаются й вместе элиминируются.
У конъюгативной плазмиды R, контролирующей резистентность, факторы передачи, аналогичные tra-элементу, назывались ранее RTF (resistance transfer factor) или Д-фактор (греч. дельта); они способны существовать в свободном состоянии в цитоплазме (Андерсон, 1965) и При соответствующих условиях вступать в ассоциацию (соединение) с отдельными детерминантами резистентности, образуя комплексную R-плазмиду. В среде без соответствующего вещества (например, антибиотика) такие комплексы могут реассоциироваться (рис. 26).
Внедряясь в клетку реципиента (как бы инфицируя ее), конъюга-тивные плазмиды сообщают ей свойства донора. Они могут оставаться в цитоплазме, сохраняя автономное состояние и реплицируясь независимо от хромосомы, заражать новые клетки популяции реципиента, «эпидемически» распространяясь в ней. Будучи в автономном состоянии, плазмиДы могут быть элиминированы (выведены) из клетки путем обработки акридиновыми красителями (в безвредных концентрациях) и некоторыми другими агентами (этидиум бромид, додецил сульфат) (см. рис. 27). Переходя в интегрированное состояние (встраивание Н структуру хромосомы), F-плазмида сообщает клетке свойства донора, способного формировать при скрещиваниях с реципиентом рекомбинанты с высокой частотой; такие штаммы обозначают символом Hfr (high
37
Рост 8 среде, свободной от лекарств
RTF г~ детерминант R-фактор
Рис. 26. Ассоциация и реассоциация плазмиды R (R-фактора, по Ватанабе).
frequence recombination). В месте интеграции F-плазмиды хромосома разрывается и из кольцевой структуры она превращается в линейную, причем интегрированная плазмида оказывается на дистальном конце хромосомы. Передача реципиенту линейной структуры начинается с конца, противоположного локализации фактора фертильности (плазмиды F); для каждого штамма Hfr место интеграции F-плазмиды строго постоянно. Известно 17 локусов, которые может занимать F-плазми-да на хромосоме. Точка начала передачи хромосомы обозначается символом О (origin). С наибольшей частотой Hfr штаммы передают реципиенту близлежащие к точке О
фрагменты хромосомы, иногда значительные; крайне редко—всю хромосому. Поскольку F-плазмида, ориентирующая передачу хромосомы, расположена на конце ее линейной структуры, она обычно в клетку реципиента не попадает, так как в процессе конъюгации часто возникают разрывы нити ДНК. При этом жиз
неспособность клетки не нарушается.
Интегрированная F-плазмида не поддается элиминации акридино-
выми красителями и другими элиминирующими агентами, что харак
терно для плазмид, находящихся в автономном состоянии.
Хотя свойства донора бактериальной клетке сообщает любая
конъюгационная плазмида, между ними имеются отличия от доноров, несущих F-плазмиду. Они заключаются в том, что клетки, несущие плазмиды R и ColJ, передают их реципиенту с высокой частотой только в течение первых генераций после инфицирования, примерно до семи генераций (по Ватанабе, 1963), после чего активность плазмид подавляется цитоплазматическим репрессором, который синтезируется под контро
лем хромосомных генов.
Плазмиды ColV2 и ColV3 репрессии не подвергаются и передаются реципиенту с частотой, близкой к частоте передачи плазмиды F.
Плазмиды резистентности и колициногенности, имеющие фактор передачи (tra+), подобно F-плазмиде сообщают клеткам-донорам способность формировать поверхностные структуры со своими особенностями по строению и по типу адсорбции донорспецифических фагов.
На рисунке 28 (см.) показана клетка, несущая плазмиду R (слева) и реципиентная клетка Е. coli без поверхностных структур, способствующих передаче генетического материала. На ворсинке R+'бактерии адсорбированы корпускулы специфического фага.
В естественных условиях выявляется значительное количество Е. coli, способных осуществлять конъюгационную передачу плазмид и хромосомных маркеров. Так, по данным А. П. Пехова (1977), одна треть штаммов, типируемых по серологическим свойствам, скрещивались с Е“-клет-ками кишечной палочки Е. coli К-12, с последующим выделением клонов типа Hfr. Экспериментально доказана возможность скрещивания Е. coli К-12 с шигеллами, сальмонеллами, с бактериями группы протеев и ерсиний. Известны данные о возможности межродовых скрещиваний у бактерий, относящихся к родам: Proteus, Pseudomonas, Yrsinia, VibtiO. Многочисленные наблюдения дают основание предполагать возможность широкого генетического обмена в естественных микробных ассоциациях между бактериями, несущими конъюгативные плазмиды.
38
2. Характеристика общности конъюгативных плазмид
Свойства плазмид (эписом)
Биохимическая природа — ДНК
Конъюгативность (инфек-циоииость)
Элиминируемость (чувствительность к АО)
Иммунитет к гомологичной плазмиде
Интеграция с хромосомой
Летальность для клетки-хозяина
Продукт специфического белкового синтеза
Col-фактор г Г Плазмиды Е. coli
F R Н1у Ent Vir К/а ит 88,99
| »" 1 * »" 1 * »" 1 * »" 1 *
й I to • •
1 Ь -н 1 1 Н- 4 • ♦
Коли-цин Пилин Фермент Гемолизин Токсин Токсин Полиса ха -рйдобел-ковые комплексы
Обозначения: + наличие свойства; — отсутствие; • не уточнено. Символы плазмид: Col — колициногенность; F — фертильность; R — резистентность; Н1у — гемолитическая активность; Ent — энтеротоксигенность; Vir — вирулентность; К — синтез антигена.
В таблице 2 представлена характеристика конъюгативных плазмид, из которой можно видеть, насколько разнообразны и значительны могут быть дополнительные свойства трансконъюгантов, образующихся при контакте носителей плазмид с бесплазмидными бактериями в благоприятных условиях.
Кроме приведенных в таблице, известны плазмиды, контролирующие ряд метаболических процессов: ферментацию углеводов, образование H2S, резистентность к действию солей тяжелых металлов (ртути), синтез ферментов, разрушающих камфору, нафталин, салицилат, октаны.
РОЛЬ ПЛАЗМИД В ФОРМИРОВАНИИ УСЛОВНОПАТОГЕННЫХ БАКТЕРИЙ
В принципе патогенные и условнопатогенные микроорганизмы различаются степенью стабильности генетических факторов, контролирующих инвазивность, продукцию экзо- и эндотоксины. В большинстве случаев критерии идентификации патогенных микроорганизмов с учетом названных свойств хорошо изучены и в ряде случаев доказана хромосомная природа их детерминантов. В последнее десятилетие интенсивно накапливаются наблюдения о внехромосомных факторах наследственности, влияющих на формирование патогенности у энтеробактерий. Выше упоминалось о связи лизогенности и токсигенности у кори-небактерий дифтерии. Патогенетический эффект у лизогенных сальмонелл может усиливаться по сравнению с нелизогенными бактериями того же вида за счет высвобождения эндотоксинов при лизисе в результате спонтанной или индуцированной активации профагов.
В конце 60-х годов доказана внехромосомная природа детерминантов синтеза гемолизинов и гемотоксинов у E.coli, выделяемых от поросят, больных энтероколитами (колибактериозы). Смит и Холле (1967) обозначили этот внехромосомный элемент символом Н1у. Несколько позднее (1969) Д. Г. Кудл ай с сотр. выявили конъюгативную плазмиду Н1у в штаммах кишечной палочки, выделенных от детей и взрослых, больных токсической диспепсией. В 1974 г. Гебел и сотр. опубликовали
39
данные по изучению молекулярной структуры плазмид Н1у кишечной палочки, выделенную от человека, свиней, рогатого скота.
Плазмиды Н1у с высокой частотой передаются путем конъюгации (см. рис. 29), элиминируются акридиновыми красителями и этидиум-бромидом. Одновременно с продуцированием гемолизинов плазмида Н1у передает реципиентам патогенность для мышей. В опытах на безмик-робных цыплятах доказана возможность формирования гемолитически активных трансконъюгантов в условиях живого организма.
В начале 70-х годов Смит и соавторы опубликовали данные о новых факторах патогенности внехромосомной природы, выявленных у Е. coli от ягнят, поросят и телят при энтеритах. По трансмиссивности и элиминируемости эти факторы также отнесены к конъюгативным плазмидам, и получили следующие обозначения: плазмида Ent — сообщает бактерии-хозяину способность продуцировать энтеротоксины; плазмида Vir— контролирует вирулентность; плазмиды К-88 и К-99 — контролируют синтез соответствующих К-антигенов. Новую конъюгативную плазмиду, контролирующую у Е. coli синтез термолабильного К-антигена, выявил Ю. А. Ратинер (1974).
Идентификацию плазмид, сообщающих бактериям свойства патогенности, проверяют на животных, а также по дополнительным тестам, которыми выявляют продукты специфического синтеза (гемолизины, токсины), коррелирующего с показателями токсигенности и вирулентности бактерий. Так, для плазмид Н1у характерна, кроме токсигенности, способность продуцировать гемолизины типа а, р, у; у плазмиды Vir установлена корреляция вирулентности со способностью продуцировать колицины типа V; для плазмид К используют специфические серологические тесты, применяемые для идентификации соответствующих антигенов. Токсигенность бактерий, несущих плазмиды Hly, Vir, К, проверяют при внутривенном или интраперитонеальном введении лабораторным мышам взвеси бактерий или фильтратов культур.
Наличие плазмиды Ent, контролирующей синтез энтеротоксинов, проверяют на лигированном кишечнике молодых поросят или на тканевых культурах.
Значение в патологии микроорганизмов, несущих плазмиды, детерминирующие патогенность, возрастает за счет плазмид, ответственных за выживание бактерий в организме животного. К ним относят плазмиды R, контролирующие множественную устойчивость к лекарственным препаратам (в первую очередь к антибиотикам); колициногенные факторы, сообщающие бактериям свойство синтезировать антагонистически активные субстанции, подавляющие развитие родственных бактерий в ассоциациях; факторы фертильности (плазмиды F, F7), которые обеспечивают конъюгационную передачу хромосомных маркеров, способствующих обогащению генома реципиента дополнительными характеристиками.
Основные характеристики плазмид энтеробактерий представлены в таблице 2 (см. выше). Из таблицы видно, что бактериальные плазмиды, выявляемые преимущественно у штаммов условнопатогенных бактерий, имеют значительно больше общих черт, чем различий.
Бактериоцины активны в отношении филогенетически родственных бактерий. К собственным бактериоцинам и к проникновению в клетку гомологичного внехромосомного элемента инфицированные плазмидами бактерии иммунны. Эти особенности имеют важное биологическое значение для обеспечения относительной стабильности микробиоценоза й природной конкурентоспособности.
В этом плане надо рассматривать и биологическую несовместимость некоторых других типов плазмид. Так, плазмиды R могут подавлять репликацию F-плазмид или ColJ, контролирующих синтез специфических ворсинок, на которых адсорбируются разные донорспецифи-
40
ческие фаги. На этой основе разработаны критерии несовместимости плазмид, которыми пользуются для их идентификации, при характеристике природных штаммов, несущих одну или несколько плазмид.
Одновременное существование нескольких плазмид в одной популяции, в том числе контролирующих патогенность или способствующих выживаемости условнопатогенных микроорганизмов, — явление широко распространенное. Например, у энтеробактерий, псевдомонад, стафилококков трудно выделить из естественных субстратов штаммы, свободные от плазмид. Гораздо чаще встречается носительство двух, трех и даже четырех плазмид, контролирующих одновременно антагонистическую активность, множественную устойчивость к лекарственным веществам, лизогенность, чувствительность к донорспецифическим фагам. Кроме того, у условнопатогенных бактерий (особенно у эшерихий, вызывающих заболевания молодняка) часто выявляются плазмиды, контролирующие свойства, прямо связанные с патогенностью.
Особенности полиплазмидных систем условнопатогенных бактерий практически важно учитывать при анализе причин возникновения у животных (особенно у молодняка) острых энтеритов, токсикозов, колибак-териозов при отсутствии облигатно патогенных возбудителей заболеваний.
ТИПЫ ИЗМЕНЧИВОСТИ МИКРООРГАНИЗМОВ
Наследственность и изменчивость неразделимо связанные категории биологических явлений, определяющих направление эволюционного процесса развития живых организмов на любом уровне биологической организации. Наследственность характеризуется уникальной стабильностью и стройностью генетической структуры материального субстрата, а изменчивость — исключительной пластичностью живых организмов (в том числе и микроорганизмов), обладающих системами сложной регуляции функций аппарата наследственности, восстановительными механизмами повреждений ДНК, системами рекомбинационных перестроек как за счет хромосомных генов, так и путем экзогенного инфицирования вирусами бактерий, плазмидами.
В зависимости от характера генетического детерминирования различают, так же как и наследственность, хромосомную и внехромосомную изменчивость микробов. По характеру выражения той и другой определяют генотипическую и фенотипическую изменчивость.
Стабильные изменения в структуре генов, ведущие к утрате определенных признаков или резкому их изменению, называют мутациями. Мутировать может любой ген независимо от его локализации — в структуре хромосомы или во внехромосомном элементе (эписомы, плазмиды). Последствия мутаций, отраженные в изменении свойств микроорганизмов, называют мутационной изменчивостью. Примером последней является диссоциация бактерий, рассмотренная выше. В настоящее время известно, что кажущаяся последовательность фаз диссоциации по замкнутому циклу объясняется разной жизнеспособностью мутантов и их способностью к возвращению (реверсии) в исходное состояние.
Различия между S- и R-формами по способности синтезировать специфические полисахариды объясняются мутациями хромосомных генов трех областей: 1) области, детерминирующей структуру ядра О-антигена; 2) области, включающей детерминанты синтеза боковых цепей специфических полисахаридов; 3) области расположения генов, контролирующих структуру энзимов, удлиняющих боковые цепи полисахаридов. S-формы бактерий имеют полный набор хромосомных генов трех перечисленных областей, а R-формы представляют собой мутанты по любой из них.
41
Различные мутационные изменения плазмидных генов используются в экспериментальной генетике в качестве генетических маркеров, по которым можно дифференцировать хромосомное и внехромосомное детерминирование различных метаболических и регуляторных процессов (температурно-чувствительные мутанты, по маркерам резистентности к лекарственным препаратам, резистентность к определенным типам специфических для донора или реципиента фагов, резистентность к действию УФ-лучей и др.).
Существует термин модификационная изменчивость. Она известна у фагов и проявляется в изменении спектра литической активности, под влиянием клетки-хозяина.
Фенотипические модификации в корне отличаются от мутационных изменений. Они не наследуются и при последующем инфицировании модифицированным фагом другого хозяина полностью утрачиваются. У бактерий также возможны модификации при некоторых типах скрещивания партнеров с различной специфичностью ДНК.
ФИЗИОЛОГИЯ МИКРООРГАНИЗМОВ
Физиология микроорганизмов рассматривает химический состав, процессы питания, дыхания, роста и размножения микробов.
Химический состав микроорганизмов. Микроорганизмы, так же как высшие растения и животные, имеют сложное химическое строение. В их состав входят органогены—азот 8—15%, углерод 45—55, кислород 25—30 и минеральные вещества 2—15%. К последним относят макроэлементы (серу, фосфор, калий, кальций, магний, железо, сици-лий, хлор) и микроэлементы (марганец, молибден, кобальт, цинк, медь, никель, ванадий, бор).
Азотистые вещества микроорганизмов представлены самыми сложными природными химическими соединениями — белками, которые содержатся во всех частях микроорганизма: цитоплазме, микробной стенке и др. Представлены они простыми белками —протеинами и сложными белками — протеидами. Протеины состоят из аминокислот, а протеиды, кроме протеина, содержат еще небелковую простетическую группу, состоящую или из жироподобных веществ —липоидов (липопротеиды), или из металлосодержащих соединений (хромопротеиды или цитохромы), или из нуклеиновых кислот (нуклеопротеиды). Нуклеиновая кислота представлена дезоксирибонуклеиновой кислотой (ДНК)» передающей наследованные свойства микроорганизма. Протеины и протеиды каждого вида микроорганизма имеют свое особое антигенное строение, определяемое серологическими реакциями.
Ферменты микроорганизмов синтезируются самой микробной клеткой и имеют сложное строение. Некоторые из них состоят только из белка— протеина, а другие ферменты представляют собой протеиды, состоящие из белка — апофермента и небелковой группы — кофермента. В этом случае апофермент соединяется с активной группой изменяемого вещества, а необладающий специфичностью кофермент способствует течению реакции.
Ферменты обладают высокой специфичностью, то есть способностью изменять продукты в строго определенном направлении. Например, фермент эстераза расщепляет жир, протеаза—белок, каталаза—перекись водорода. Их активность очень высокая. Так, 1 г химозина может свернуть 12 т молока, а 1 г амилазы превратить I т крахмала в сахар. Оптимум действия микробных ферментов совпадает с оптимумом жизнедеятельности того микроорганизма, из которого он выделен.
По решению биохимического конгресса (1961) все ферменты делят на шесть классов: 1) оксидоредуктазы. — ферменты переноса водорода и кислорода, это ферменты дыхания, брожения; 2) трансферазы—фермен-42
ты переноса радикалов РОз, Нг, СНз, моносахаров; 3) гидролазы—ферменты присоединения или отщепления частичек воды у белков, жиров и углеводов; 4) лиазы—ферменты, отщепляющие или присоединяющие без участия воды различные соединения с двойной связью; 5) изомеразы— ферменты, производящие глубокие внутримолекулярные перестройки (например, превращающие глюкозу в левулезу); 6) липазы (синтетазы) —ферменты, соединяющие две молекулы с одновременным разрывом фосфатных связей.
Каждый класс ферментов обозначается четырьмя цифрами. Первая цифра означает класс фермента; вторая—подкласс, указывающий соединение, на которое действует фермент; третья—подподкласс и четвертая—номер фермента. Все эти цифры разделяются точками. Так, каталаза обозначается 1.11.1.6. Каждый фермент имеет окончание «аза», подчеркивающее его принадлежность к данной группе.
Для определения вида микроорганизма пользуются определением у него наличия или отсутствия ферментов третьего класса — класса гидролаз.
Метаболизм микроорганизмов*. Микроорганизмы лишены специализированных органов пищеварения, дыхания и выделения. Все эти функции выполняют ферменты, благодаря которым питательные вещества поступают в клетку, подвергаются внутриклеточным превращениям в энергоемкие и структурные соединения. Эти процессы являются сопряженными и лишь отражают разные стороны обмена веществ, поэтому весь процесс утилизации микробами питательных веществ целесообразно именовать метаболизмом (англ, metabolism—обмен веществ). Вместе с тем пищеварительные ферменты начинают обработку субстрата еще до поступления их в клетку, тогда как дыхательные ферменты завершают процесс обезвреживания продуктов энергетического обмена уже за пределами клетки. Эти и другие особенности обменных реакций (питание, дыхание и внутриклеточный обмен) с учебной целью целесообразно рассмотреть в отдельности.
Питание микроорганизмов. Под питанием понимают получение из окружающей среды источников энергии и веществ, необходимых для биосинтеза клеточных компонентов. В отличие от животных и простейших, заглатывающих плотные частицы пищи (голозойный тип питания), микробные клетки способны поглощать лишь растворимые вещества (голофитный способ питания), что сближает их с растениями. Это не означает, однако, что микробы не могут использовать плотную пищу. При помощи гидролитических энзоферментов они осуществляют внешнее переваривание, то есть расщепляют белки, жиры и углеводы до простых молекул, которые и поступают внутрь клетки. Есть микроорганизмы, способные утилизировать некоторые элементы в газообразном состоянии или из неорганических соединений.
Самым необходимым химическим элементом для бактерий является углерод, поскольку он служит каркасом биомолекул (белка, углеводов, жирных кислот). Если источником клеточного углерода являются СОг или карбонаты, микробов называют автотрофными (греч. авто — сам, трофик—питающийся). Из этих простых соединений автотрофные микроорганизмы синтезируют собственные белки, полисахариды, нуклеиновые кислоты, витамины и другие необходимые структурные и функциональные молекулы. Если источником углерода служат органические соединения, микробов именуют гетеротрофными (греч. гетеро—другой). К ним относят возбудителей брожения, гниения и болезней. В зависимости от субстрата гетеротрофов подразделяют на метатрофы (греч. мета':—после), или сапрофиты (греч. сапрус—гнилой, фит—растение), которые используют углерод только мертвого субстрата, и паратрофы
* Метаболизм микроорганизмов написан П. А. Емельяненко
43
(греч. пара — возле), или паразиты (греч. сотрапезник), размножающиеся в живых организмах.
Микробов, способных размножаться только в живых клетках, например вирусов, риккетсий, называют абсолютными внутриклеточными паразитами (лат. absolute — совершенно, безусловно). Микроорганизмы, способные длительно переживать н размножаться в клетках хозяина и на искусственных питательных средах, например пастереллы, листерии, францисселы, микобактерии, ерсинии, сальмонеллы, бруцеллы и др., именуют факультативными внутриклеточными паразитами (лат. facul-tas—возможность использовать). Встречаются также микробы, например хламидии, обладающие «энергетическим» паразитизмом. Они имеют собственный метаболизм, ио зависят от энергетического обмена клеток хозяина. Деление микроорганизмов на группы из-за источника питания условно, многие паратрофы могут развиваться и на мертвых питательных средах.
Необходимую при этом энергию микробы получают за счет света или за счет окислительно-восстановительных реакций. Первых называют фототрофными, вторые—хемотрофными. Фототрофы используют солнечный свет с помощью фотосинтетических пигментов. У микробов различают три группы поглощающих свет пигментов: хлорофиллы (поглощают свет в двух спектральных областях —около 400 и 600—800 нм), каротиноиды (поглощение в пределах 450—550 нм) и фикобилипротеиды (поглощающие свет между 550 и 650 нм).
Хемотрофы получают энергию за счет окисления, например, таких неорганических соединений, как азотистая кислота, по уравнению: 2HNO2+O2—>2НЫОз4-35000 кал, или таких органических соединений, как глюкоза.
Микроорганизмы, способные использовать в качестве доноров электронов неорганические соединения (H2S, NH3, Fe44- СО2 и др.), называют литотрофными (греч. литы—камень), а использующих органические соединения—органотрофными.
Поступление питательных веществ в микробную клетку оптимально происходит при состоянии тургора за счет высокого (минимум 3 атм) внутриклеточного давления. Неэлектролиты под действием разности концентраций, а электролиты под действием разности электрических потенциалов по обе стороны микробной оболочки частично могут постук пать путем пассивной диффузии. Из-за снижения или повышения застеночной концентрации солей наступает плазмоптис или плазмолиз соответственно (рис. 30 и 31) и поступление питательных веществ нарушается. Ультрафильтрация связана и с химическим строением растворенных веществ: крупные молекулы обычно поступают медленнее, чем мелкие. На обмен через оболочку между клеткой и средой влияет также обменная адсорбция: электрический заряд поверхности клетки обусловливает
Рис. 30. Плазмолиз бактерий разных видов.
Рис. 31. Плазмопсис холерных вибрионов.
44
адсорбцию противоположно заряженных ионов из питательной среды. Если среда кислее изоэлектрической точки коллоидов цитоплазмы, знак будет положительным, если щелочнее—отрицательным. Связано это с участием в обмене с Н+ и НСО^“ ионов, концентрация которых в поверхностных слоях цитоплазмы во много раз выше, чем в окружающей среде. Роль ионообменников могут выполнять также некоторые полимеры микробных стенок. Например, отрицательно заряженные гликопептиды регулируют прохождение через стенку положительно заряженных ионов. Однако основным барьером, препятствующим поступлению питательных веществ в клетку, является клеточная мембрана. И большинство веществ проходит через нее путем активного переноса благодаря белковых молекул-переносчиков, действующих в каналах мембраны по принципу парома, которые называются пермеазами, С помощью АТФ пермеазы захватывают растворенные вещества у наружной стороны мембраны, транспортируют их к внутренней стороне мембраны, откуда они высвобождаются в цитоплазму. Молекулы-паромщики осуществляют активный перенос веществ против градиента концентрации. Количество их, видимо, велико; так, у Е. coli только пермеаз р-галактозидазы (расщепляющей лактозу) насчитывается около 8000.
Внутриклеточные обменные реакции. Питательные вещества, попавшие внутрь клетки, подвергаются серии последовательных химических превращений, то есть метаболизируются. Метаболизм происходит только в водной среде и совершенно прекращается, если воды остается в бактериальной клетке менее 20, а в гифе грибов—12 %. Под действием эндоферментов каждое питательное вещество внутри микробной клетки может превращаться по катаболитическому пути — диссоциировать на менее сложные низкомолекулярные соединения или по анаболитическому пути — ассимилироваться в более сложные клеточные компоненты, то есть участвовать в биосинтезе. В последнем участвуют также продукты распада (катаболизма) обычно с образованием пред-шественников—аминокислот, азотистых оснований, органических кислот, фосфатов, сахаров и др. Из этих предшественников строятся конечные продукты биосинтеза — полимерные биомолекулы (белки, нуклеиновые кислоты, полисахариды, запасные и структурные компоненты микробной клетки).
Если процессы расщепления веществ идут с выделением энергии, биосинтетические реакции из-за обилия воды (до 85%) в цитоплазме, нейтрального pH и сравнительно низкой температуры нуждаются в источнике энергии. Поэтому обмен веществ в микробной клетке постоянно сопряжен с энергетическим обменом. В качестве энергии микроорганизмы могут использовать многие окисляемые органические соединения, в процессе катаболизма которых одновременно образуется несколько предшественников синтезируемых биополимеров. Своего рода «разменной монетой» энергетического обмена микроорганизмов являются соединения с макроэргическими (богатые энергией) фосфорными связями. Их подразделяют на производные фосфорной кислоты (например, АТФ) и производные карбоновых кислот (например, ацетил-КоА). В форме АТФ биологическая энергия лучше запасается, сохраняется и более доступна для синтетических реакций. Образуется АТФ тремя путями: в результате фотосинтеза, субстратного фосфорилирования и транспорта электронов. В первом случае за счет энергии возбужденных фотонами электронов, во втором—в результате катализа субстрата на аде-нозйндифосфат (АДФ) переносится фосфат с богатой энергией связью. В третьем случае в самих клеточных мембранах или лизосомах бактерий АТФ образуется в результате переноса электронов от окисляемого субстрата до конечного акцептора с помощью дыхательных цепей. Таким образом, энергетический метаболизм осуществляется через дыхание и брожение.
45
Дыхание микробов. Исходя из сказанного, под дыханием микробов можно понимать метаболический процесс с образованием АТФ, в течение которого одни соединения окисляются, отдавая электроны, а другие восстанавливаются, принимая их. При этом в качестве доноров электронов могут служить как органические, так и неорганические соединения, тогда как акцепторами электронов являются только неорга-нические соединения. Если конечным акцептором электронов служит молекулярный кислород, дыхание называют аэробным (греч. аэр—воздух, атмосфера), В случае конечной акцепции электронов сульфатами, нитратами и карбонатами дыхание называют анаэробным (греч. ана — отрицание). Энергетические процессы, при которых органические соединения служат одновременно и донорами и акцепторами электронов, называют брожением.
При классификации микробов по типу дыхания учитывают степень их потребности в молекулярном кислороде, Облигатные аэробы (лат. oblrgatus — обязательный), такие, как микобактерии туберкулёза, для своего развития требуют не менее 20 % кислорода в среде культивирования. Облигатные анаэробы, клостридии, например, наоборот, в присутствии молекулярного кислорода не развиваются. А факультативные анаэробы, такие, как эщерихи, молочнокислые бактерии, могут развиваться как в присутствии, так и при отсутствии, в среде атмосферного кислорода. Наконец, микроаэрофилы (греч. микры —малый), например, бруцеллы, лептоспиры, развиваются При наличии в среде культивирования не более 1 % молекулярного кислорода.
В строгом смысле дыхание у микробов является биологическим окислением, при котором энергия освобождается в процессе переноса электронов. Поскольку электроны не остаются в свободном состоянии, каждое окисление донора сопровождается восстановлением акцептора. Следовательно, биологическое окисление есть одновременный процесс окисления—восстановления. Этот процесс обычно демонстрируют примером превращения частично окисленного двухвалентного железа в полностью окисленное трехвалентное железо и обратно по уравнению:
окисление _
Fe®+ , ,.> уеа+ е
восстановление
Дыхание у бактерий происходит по типу прямого окисления и непрямого окисления, или дегидрогенирования.
Прямое окисление регистрируется у большинства сапрофитов. Оно осуществляется с помощью оксидаз путем непосредственного окисления атмосферным кислородом неорганического субстрата—молекулярного водорода, окиси углерода и серы по уравнению:
Нг + 1/3Oi -» Н2О + энергия
Непрямое окисление путем дегидрогенирования сопровождается одновременным переносом двух электронов, причем от субстрата отщепляется два протона (Н+). При ферментативном отщеплении водорода субстрата при помощи дегидрогеназ освобождается два электрона (энергия) подобно образованию ацетальдегида из этилового спирта: С2НбОН— 21I^-CaIIiO-f2H (акцептор)+2е~.
Дегидрогеназ у бактерий несколько, они называются по донору во<-дорода (например, алкогольдегидрогеназа, лактатдегидрогеназа), но большинство их переносит водород на один из двух коферментов—нико-тин амид а деиин динуклеотид (НАД+) или никотинамидадениндинуклео-тидфосфат (НАДФ+). Оба кофермента легко отделяются от одной дегидрогеназы и связываются с другой дегидрогеназой, перенося водород на другой акцептор. НАД-Н (+Н+) переносит водород преимущественно на предшественников брожения или в дыхательную цепь, НАДФ-Н (+Н+) участвует в основном в биосинтезе.
46
Аэробное дегидрогенирование происходит в присутствии кислорода и у таких микробов, как бациллы, например, акцептором водорода является кислород, в результате чего в зависимости от набора ферментов образуется вода или перекись водорода,
Для этого у аэробных бактерий имеются цитохромоксидаза и система геминовых ферментов цитохромов. Цитохромоксидаза катализирует конечное связывание водорода с атмосферным кислородом вне клетки. Если цитохромоксидаза переносит две пары водородных ионов, образуется вода:
4Fe*+ + 4ц+ + O2^4Fe3+ + Н2О.
Если она связывает с кислородом воздуха только одну пару водородных ионов, в качестве конечного продукта образуется перекись водорода:
2Fe2+ + 2Н+ + 02->2Fes+ + НА-
Поскольку перекись водорода токсична для бактерий, она моментально разлагается каталазой или пероксидазой. Облигатные анаэробы каталазу не содержат, чем частично можно объяснить токсичность для них кислорода.
Анаэробное дегидрогенирование осуществляется в отсутствие молекулярного кислорода, акцепторами водорода в данном случае являются другие неорганические элементы—азот, углерод, сера. Они легко соединяются с водородом, восстанавливаясь до аммиака, метана и сероводорода.
Брожение приводит к образованию конечного акцептора водорода за счет самого субстрата. Например, при брожении глюкозы цепочка сахара, состоящая из 6 атомов углерода, вначале соединяется с фосфором (фосфорилируется), а затем расщепляется на две молекулы, содержащие по 3 атома углерода. Одна из этих молекул после отщепления фосфора в конечном счете превращается в молекулу пировиноградной кислоты. Образование пировиноградной кислоты сопровождается потерей водорода (окисления), при восстановлении ее образуется молекула молочной кислоты.
В анаэробных условиях многие микробы лишь частично окисляют субстрат. Конечные продукты такого окисления (органические кислоты, спирты, ацетон) сохраняют еще значительную часть энергии исходного субстрата (до 90 %).
Рост и размножение микроорганизмов. Рост микроорганизма — это увеличение его массы за счет ассимиляции питательных веществ, а размножение—увеличение числа особей.
Большинство микроорганизмов при благоприятных условиях делятся пополам через каждые 20—30 мин. При такой скорости деления из одного микроорганизма через 5 ч будет 1024, а через 5 суток живая масса микробов могла бы при наличии питательных веществ заполнить все моря и океаны. В действительности этого не бывает, так как их развитие ограничивается недостатком питательных веществ и наличием неблагоприятных условий.
Многие микроорганизмы размножаются бесполым путем— изоморфно (изо—равный, морфо—форма), сохраняя в пределах своего вида одинаковое строение и форму. В процессе деления микроорганизма происходит репликация, или удвоение ДНК. При этом у делящегося микроорганизма водородные связи разрываются и образуется одиночная спираль ДНК. Каждая одиночная дочерняя цепь ДНК восстанавливает водородные связи и снова создается двойная цепь ДНК.
Такие микроорганизмы, как грибы и актиномицеты, размножаются путем спорообразования. У многих микроорганизмов имеется рудимен-тированный половой процесс.
При засеве микроорганизмов в питательную среду наблюдается следующая смена фаз их размножения (рис. 32):
47
Время
32. Кривая роста микроорганизмов при оптимальных условиях.
1) фаза исходная стационарная — в течение некоторого времени (30 мин — 1 ч) размножения не происходит; 2) фаза задержки размножения или лаг-фаза— начинается слабое размножение с постепенным нарастанием (длится 1— 2 ч); 3) фаза логарифмического роста —
характеризуется максимальным размно
жением, причем микроорганизмы имеют уменьшенные размеры (длительность фазы 4—5 ч); 4) фаза отрицательного ус-
корения— деление микроорганизмов за-
медляется (длительность 1—2 ч); 5)
за стационарного максимума—число размножающихся микроорганизмов равно числу отмирающих (продолжительность фазы 2—3 ч); 6) фаза ускорения гибели — отмирание микроорганизмов идет быстрее размножения (продолжительность 2—4 ч); 7) фаза логарифмической гибели — отмирание происходит с возрастающей скоростью (длительность фазы 5—7 ч); 8) фаза уменьшения скорости отмирания —оставшиеся микроорганизмы длительно сохраняются.
Продолжительность отдельных фаз может значительно варьировать в зависимости от внешних факторов. При этом микроорганизмы изменяются в пределах вида от S-(гладких) к R-формам (шероховатым).
Культивирование микроорганизмов. Микроорганизмы культивируют на питательных средах. Среды делят на общеупотребительные (универсальные) , элективные, дифференцирующие и консервирующие.
К универсальным средам относят мясо-пептонный агар и мясопептонный бульон. Первая характеристика изучаемого микроорганизма определяется способностью его роста на универсальных средах. На плотных питательных средах многие микроорганизмы образуют характерные колонии (см. рис. 33). Их различают по размерам, форме, цвету, характеру поверхности, профилю, краям, структуре при малом увеличении микроскопа. Колония, как правило, представляет чистую культуру. Ее отвивка обычно служит методом получения чистой культуры.
Для микроорганизмов, не растущих на обычных средах, подбирают специальные среды. Для выделения каких-либо определенных видов, отличающихся особенностями роста, применяют элективные (или обогатительные) среды, на которых другие виды не растут или слабо растут.
Для длительного хранения микроорганизмов применяют консерви-
рующие среды —с глицерином, мелом и др.
Протеолитические ферменты микроорганизмов определяют по способности их разжижения желатины и пептонизации (просветлению) молока. Для выявления гемолитических свойств применяют кровяной агар, для определения ферментов на углеводы—цветные среды, содержащие один из видов углевода. Чтобы установить способность того или иного вида микроорганизма расщеплять определенные углеводы, к среде добавляют индикатор, например, Андредэ, Барсикова и др. При наличии у изучаемого микроорганизма соответствующего углевода происходит изменение цвета среды.
Микроорганизмы живут при определенных концентрациях водородных ионов. Большинство патогенных бактерий развиваются в слабощелочной среде—pH 7,2—7,6, а грибов —при pH 3,0—6,8. Степень аэробности выражают окислительно-восстановительным потенциалом, обозначаемым показателем гН2. У водного раствора, насыщенного водородом, показатель гН2—0, а у насыщенного кислородом гН2=41. Шкала от 0 до 41 служит показателем аэробности: облигатные аэробы живут при гН2 от 3 до 10, анаэробы—от 10 до 35 и факультативно-анаэробные—при гН2 от 10 до 30.
48
РАСПРОСТРАНЕНИЕ МИКРОБОВ В ПРИРОДЕ
Микроорганизмы в природе распространены повсеместно. Они населяют почву, воздух, растения, организмы животных и человека. Особенно обильно проявляется микробная жизнь в почве.
МИКРОФЛОРА
ПОЧВЫ
В почве живут и развиваются самые разнообразные микроорганизмы. Здесь находят себе благоприятные условия амёбы, инфузории, грибы, водоросли, актиномицеты и бактерии. Распределение микроорганизмов в почве характеризуется неравномерностью как в общем количественном отношении их, так и по видовому составу различных групп микробов, что зависит от многих условий почвенной среды и общих климатических воздействий.
Поверхностный слой почвы значительно беднее микробами, так как на них непосредственно влияют вредно действующие факторы внешней среды: высушивание, ультрафиолетовые лучи, солнечный свет, повышенная температура и пр. Наибольшее количество микроорганизмов находится на глубине 5—15 см, меньше— на глубине 20—30 см и еще менее— в почвенном горизонте на глубине 30—40 см. Ниже количество их уменьшается, и на глубине уже 3—6 м встречаются лишь единичные микроорганизмы.
Почвы, богатые бактериями, биологически более активны. Между плодородием почвы и содержанием в ней микроорганизмов имеется определенная зависимость. Подсчеты показали, что на каждый гектар малоплодородной почвы приходится 2,5—3 т микробной массы, высокоплодородной— до 16 т.
На количество микроорганизмов в почве влияет также и растительный покров. В ризосферной части почвенной микрофлоры (микробное население в окружности корневой системы растений) содержится значительно больше, чем в почве, взятой вне корневой зоны. Такое увеличение числа микробов в ризосфере объясняется их развитием за счет корневых выделений, а также усвоением продуктов, образующихся при разложении отмирающего эпителия корневых волосков.
К типичным почвенным бактериям относят Вас. subtilis, Вас. mycoi-des, Вас. mesentericus, Вас. megatherium и др. Из неспороносных бактерий особенно часто встречаются представители родов Pseudomonas и Chromobacterium. Соотношение между отдельными систематическими группами микроорганизмов изменяется в зависимости от типа почвы. Так, в почвах пустынь обнаруживают значительно больше спороносных бактерий и актиномицетов, чем в почвах тайги и тундры (Е. Н. Мишустин, 1970).
Микроорганизмы условно принято подразделять на особые физиологические группы. Групповой анализ бактерий проводят путем посева различных разведений почёы в воде на ряд элективных питательных сред. \
Взаимоотношения между микроорганизмами различных групп могут быть сведены к следующем основным типам: симбиоз, метабиоз, антагонизм и паразитизм.
Симбиоз—тип взаимоотношений, при котором два микроба, обмениваясь продуктами своей жизнедеятельности, оказывают благоприятное влияние друг на друга и совместно развиваются значительно луч-; ше, чем каждый из них в отдельности. Например, жизнь анаэробных бактерий в поверхностных слоях почвы становится возможной лишь в результате снижения окислительно-восстановительного потенциала, осуществляемого аэробными микроорганизмами, которые, в свою очередь,
4—Ветерииарная микробиология
49
используют органические кислоты, образуемые анаэробными микробами.
М е т а б и о з—-последовательная смена одних групп микробов другими на основе утилизации продуктов жизнедеятельности предшествую^ щих групп. Например, аммонифицирующие микробы образуют аммиак, который в дальнейшем окисляется до нитратов нитрифицирующими бактериями.
Антагонизм—взаимодействие между различными видами микроорганизмов, в результате чего один из них угнетает другого за счет образования вредных продуктов. Подобного рода воздействия, препятствующие жизненным проявлениям микроорганизмов, носят название антибиоза. Отсюда и произошло название—антибиотики.
Паразитизм—взаимоотношения между микроорганизмами, когда один из них использует другого в качестве источника пищи. Были обнаружены бактерии, паразитирующие на грибе фузариум, который, в свою очередь, паразитирует на льне. Эти бактерии названы миколити-ческими.
В ряде случаев почва представляет резервуар некоторых патогенных микроорганизмов, попадающих с выделениями и трупами животных. Длительность выживаемости патогенных бактерий в почве зависит от их свойств и условий среды. Наиболее длительное время в почве живут спорообразующие микроорганизмы: возбудители столбняка, злокачественного отека, ботулизма и др. Споры бацилл сибирской язвы могут сохраняться в почве на протяжении десятилетий. При благоприятных условиях могут выживать относительно долго и неспороносные патогенные бактерии: возбудители туберкулеза, брюшного тифа, дизентерии, туляремии, бруцеллеза, рожи свиней, пастереллеза и др. В результате этого почва имеет определенное значение в распространении отдельных инфекционных болезней. Попавшие в почву патогенные микробы (с испражнениями, трупами) в дальнейшем распространяются через воду, траву, овощи или посредством грызунов и насекомых. Кроме того, патогенные бактерии вместе с пылевыми частицами могут попадать в дыхательные пути животных и человека.
С целью исследования почвы на наличие патогенных микроорганизмов пробы берут из разных мест участка и перемешивают для получения среднего образца. Если исследуют глубокие слои почвы, то для взятия пробы пользуются почвенными бурами. Пробы почвы помещают в стеклянные стерильные банки. В дальнейшем исследование проводится путем посева на питательные среды и заражения животных.
МИКРОФЛОРА
ВОДЫ
Вода, так же как и почва, —естественная среда обитания микробов. Основная масса микробов поступает в воду из почвы, некоторая часть из воздуха с оседающей пылью. Скорость размножения микроорганизмов в воде зависит от содержания в ней доступных для них источников питания и энергии. Особенно много микробной флоры в открытых водоемах и реках, причем наибольшее количество микроорганизмов обнаруживают в поверхностных слоях прибрежной зоны. Микрофлора воды рек зависит от степени их загрязнения. Реки, протекающие около крупных городов, всегда богаты микробами. Однако уже на расстоянии нескольких километров от города число микроорганизмов резко падает (процесс самоо чищен ия рек).
Микроорганизмы широко распространены также в водах морей и океанов. Их находили на различных глубинах (3700—10 000 м).
Качественный состав микрофлоры воды бывает самый разнообразный и носит случайный характер. В то же время некоторые сапрофиты 50
составляют постоянную микрофлору естественных водоемов. К ним относятся Bact. fluorescens, Bact. aquatilis, В. violaceum и др., способные развиваться за счет очень небольшого количества органического вещества.
В воде в зависимости от источника может быть различное количество микробов. В 1 мл воды из артезианских скважин содержатся сотни или тысячи микробов, тогда как в 1 мл речной воды их количество достигает 5-106. J
Количество микробов в морях и океанах тоже велико, но значительно меньше, чем в пресноводных водоемах. Вода колодцев, родников, ключей беднее микробами, так как в эти источники вода попадает, пройдя через почвенные породы, которые играют роль естественных фильтров.
При групповом анализе в воде можно обнаружить присутствие самых различных физиологических групп микроорганизмов,
В зависимости от степени загрязнения в водоемах определенное время могут сохранять жизнеспособность патогенные микроорганизмы. Так, возбудитель сибирской язвы может сохраняться в загрязненных источниках до трех лет; бруцеллы бычьего типа оставались жизнеспособными в стерильной канализационной воде при температуре от 0° до 18°С в течение 106 дней, а при температуре 37°C—от 19 до 27 дней. Возбудитель туберкулеза сохраняется в речной воде до одного года и несколько месяцев — в сточных водах. Туляремийная палочка выживает в воде при температуре 13—15°С до 92—95 дней, риккетсии при 37 °C—свыше 3 ч, а возбудитель сапа в водопроводной воде — до 96 дней.
Таким образом, вода может стать источником распространения инфекционных болезней и возникновения эпизоотий.
Для санитарно-бактериологической оценки воды проводят следующие исследования: 1) определение микробного числа воды, 2) определение коли-титра и коли-индекса, 3) обнаружение в воде патогенных микроорганизмов.
Для бактериологического исследования отбирают 400—500 мл воды в стерильную бутыль, которую наполняют на 74 объема и закрывают простерилизованной пробкой. Из открытых водоемов пробы воды берут на глубине 10—15 см от поверхности, а из мелких—на уровне 10—15 см от дна. Из водопровода предварительно в течение 10 мин спускают воду, кран обжигают. Пробы воды доставляют в лабораторию в течение 1—3 ч.
Общая микробная обсемененность определяется количеством микроорганизмов, содержащихся в 1 мл воды. Водопроводная вода считается хорошей, если общее количество микробов в 1 мл равно 100, сомнительной—100—150, загрязненной—500 микробов и более. В воде колодцев и открытых водоемов число микробов в 1 мл не должно быть более 1000.
Определение коли-титра и коли-индекса. Кишечная палочка является постоянным обитателем кишечника животных и человека. Поэтому Присутствие ее в воде, особенно если в ней одновременно содержатся хлориды, сульфаты, азотистые соединения и повышена окисляемость, свидетельствует о загрязнении ее фекалиями. Чем сильнее вода загрязнена кишечной палочкой, тем большая вероятность обсеменения ее патогенными микроорганизмами.
Результаты обнаружения кишечной палочки в воде выражаются в виде коли-титра и коли-индекса. Коли-титром называется то наименьшее количество жидкости в миллилитрах или сухого вещества в граммах, в котором содержится одна кишечная палочка. Коли-индексом называется то количество особей кишечной палочки, которое находится в 1 л воды или 1 кг исследуемого материала. Для перевода коли-титра з Г 51
коли-индекс 1000 делят на'показатель коли-титра, а для перевода коли-индекса в коли-титр 1000 делят на число, выражающее коли-индекс.
Обнаружение и количественный учет кишечной палочки проводят методом мембранных фильтров и методом двухфазной бродильной пробы (см. Практикум) .
МИКРОФЛОРА
ВОЗДУХА
Воздух является неблагоприятной средой для размножения микроорганизмов. Отсутствие питательных веществ, солнечные лучи и высушивание обусловливают быструю гибель микроорганизмов в воздухе.
Микрофлора воздуха в основном зависит от микрофлоры почвы и воды, откуда микроорганизмы вместе с пылью, капельками влаги, пыльцой растений, волосами, различными волокнами увлекаются в атмосферу. Все это обозначается как «аэрозоль» (физическая система из мелких твердых или жидких частиц, взвешенных в газовой среде), который перемещается в воздухе в горизонтальном и вертикальном направлении. Чем больше в воздухе аэрозоля, тем больше он содержит микроорганизмов. Каждая частица пыли или дыма обладает способностью адсорбировать на своей поверхности множество микроорганизмов.
Микроорганизмы в воздухе могут находиться в капельной, капельно-ядерной и пылевой фазах бактериального аэрозоля.
Состав микробов воздуха весьма разнообразен. В воздухе часто встречаются пигментные сапрофитные бактерии (микрококки, сарцины), споровые (сенная, картофельная и другие палочки), актиномицеты, плесневые, дрожжевые грибы и др.
Количество микробов в 1 м3 воздуха колеблется от нескольких клеток до многих десятков тысяч. Наибольшее количество микроорганизмов содержится в воздухе крупных промышленных городов. В воздухе сельской местности меньше микробов, особенно их мало в воздухе над лесом, горами, морями, местами, покрытыми снегом, и т. д.
Значительные изменения претерпевает микрофлора воздуха в зависимости от времени года. Максимальное количество микробов обнаруживают в июне—августе, а минимальное—в декабре—январе.
Очищению воздуха от микробов способствуют атмосферные осадки, вместе с которыми микроорганизмы оседают на землю и воду. Количество микроорганизмов в воздухе помещений обычно выше, чем в воздухе открытых мест, особенно при недостаточном их вентилировании и несоблюдении санитарных мер.
В окружении больных животных и людей, инфицированных мышевидных грызунов, членистоногих и насекомых в пыли могут находиться патогенные микроорганизмы. Из патогенных видов в воздухе закрытых помещений обнаруживали гноеродные кокки, туберкулезные микобактерии, сибиреязвенные споры, бактерии туляремии, риккетсии, Ку-лихорадки, возбудителей газовой гангрены и др. Многие заразные болезни животных передаются преимущественно через воздух (оспа овец, грипп, ларинготрахеит кур и др.). Больные животные при кашле, чихании, фырканье выбрасывают вместе с каплями слизи или мокроты патогенных бактерий в окружающую среду радиусом на 2— 2,5 м и более.
Санитарно-гигиеническая характеристика бактериального загрязнения воздуха определяется общим количеством микроорганизмов, содержащихся в 1 м3 воздуха, наличием отдельных микроорганизмов (стрептококк зеленящий и гемолитический), которые могут служить биологическим показателем загрязненности воздуха. Для определения общего количества микроорганизмов в воздухе используют седиментационные и аспирационные методы.
52
В животноводческих помещениях содержание более 500—1000 бак терий в 1 м3 служит показателем загрязнения воздуха.
МИКРОФЛОРА ТЕЛА
СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Одни виды микробов являются постоянными обитателями тела животных, они составляют так называемую нормальную микрофлору организма; другие находятся в организме временно, попадая из почвы, воздуха, с водой и кормом.
Микрофлора кожи. Постоянные обитатели кожи — преимущественно кокковые формы: стафилококки, стрептококки, сарцины, микрококки. Из палочковидных форм обнаруживают кишечную, синегнойную, псев-додифтерийную и сенную бактерии. Питание их обеспечивается выделениями жировых и сальных желез, отмершими клетками и продуктами распада. Кроме постоянной, на коже попадается случайная микрофлора, например, из группы почвенных микробов—анаэробов и аэробов. Количество микробов на коже зависит от условий содержания животных: при плохом уходе на 1 см2 поверхности кожи может находиться до 1—2 млрд, микробных тёл.~ При ослаблении организма/повреждениях кожи данная микрофлора может вызывать заболевания в виде абсцессов, фурункулов и др.
Микрофлора вымени. Многочисленными исследованиями установлено, что, как правило, в стерильно взятых пробах молока из здорового вымени обнаруживают микробов и лишь незначительная часть проб оказывается свободной от микроорганизмов. Среди бактерий, обнаруживаемых в нормальном молоке, наряду с редко встречающимися стрептококками, коли-бактериями и сардинами находили преимущественно Coryn^blCterium bovis и стафилококки. Патогенные стрептококки (Str. agalactiae) встречаются в вымени очень редко. Микрококки, выделенные из вымени, относятся главным образом к апатогенным и реже к патогенным видам.
Микрофлора конъюнктивы. На слизистой глаз содержится сравнительно небольшое количество микробов: стафилококков, стрептококков, сарцин; реже встречаются микоплазмы, микрококки, актиномицеты, дрожжевые и плесневые грибы.
Микрофлора дыхательных путей. У новорожденных животных в дыхательных путях микроорганизмов нет. При дыхании на слизистые верхних дыхательных путей, в частности на слизистые носа, оседают из воздуха различные бактерии, актиномицеты, плесневые и дрожжевые грибы, микоплазмы и др. Постоянными ~о&йтЯТёлями слизистых носоглотки, зева в основном являются кокковые формы бактерий—стрептококки, стафилококки, микрококки, реже обнаруживаются сарцины, диплокок-~ ки. ЬГа слизистой гортани, верхней, средней и нижней части трахеи микробов становится все меньше. Альвеолы легких и конечные ветви бронхов у здоровых животных обычно стерильны.
При ослаблении защитных сил организма постоянные обитатели Дыхательных путей становятся способными вызывать заболевания (острые катары дыхательных путей, ангины, пневмонии, бронхиты и
Микрофлора полости рта. Постоянная температура, щелочная реакция среды, остатки кормов—все это весьма благоприятные условия для жизнедеятельности и развития самых различных микроорганизмов. К наиболее характерным представителям микрофлоры ротовой полости относятся диплококки, стафилококки, сарцины, микрококки, ацидофильная палочка, вибрионы, спирохеты, микоплазмы, дрожжи и др. Болезни зубов и десен, как правило, сопровождаются увеличением числа микробов в полости рта. ✓
53
Микрофлора желудочно-кишечного тракта. После принятия корма желудочно-кишечный тракт новорожденных заселяется разнообразной
микрофлорой, которая в дальнейшем несколько изменяется, но в основном сохраняется до конца жизни животного. Количественный и качественный состав микрофлоры зависит от^возраста, вида животного, кормления и химического состава корма. Изменение рациона сказывается на
составе микрофлоры. В самом раннем возрасте, пока животное питается молоком, в кишечнике находятся главным образом молочнокислые бактерии. С переходом к грубым кормам химический состав корма соответствующим образом влияет на микробиологические процессы, протекающие в кишечнике, и преобладание в нем той или другой группы микро
организмов. Так, например, введением в рацион углеводистых кормов в микрофлоре кишечника увеличивается количество кислотообразующих бактерий. С прекращением кормления молоком и переходом к грубым кормам микрофлора кишечника молодняка полностью сменяется микрофлорой взрослых животных. Установлено, что в разных участках
пищеварительного канала она неодинакова.
Микрофлора желудка относительно бедна в результате бактерицидного действия желудочного сока, имеющего высокую кислотность. В содержимом желудка выживают споровые и кислотоустойчивые бактерии, сарцины, энтерококки, молочнокислые бактерии, дрожжи, плесневые грибы, актиномицеты. С понижением кислотности начинают обильно развиваться гнилостные бактерии, дрожжи и др.
В желудке свиньи находят молочнокислые бактерии, различные кокки. Микрофлора желудка лошади более многочисленна и разнообразна: встречаются молочнокислые бактерии, микрококки, целлюлозные, маслянокислые, гнилостные, актиномицеты, дрожжи, плесневые грибы И др.
Микрофлора рубца жвачных. Процесс пищеварения у жвачных весьма своеобразен. Почти все вещества, входящие в состав кормов, подвергаются воздействию микроорганизмов, обитающих в рубце жвачных. Популяция микроорганизмов и организм животного находятся в тесных симбиотических отношениях.
Микроорганизмы рубца играют важную роль в белковом, углеводном и жировом обмене у жвачных. Усвоенне-клетчатки (основного компонента грубых кормов) хщоисходйГ благодаря деятельности целлюлозолитических бактерий, вегетируИцГюс в ргубце и в других отделах пище-варитедтьного--.каццла. Энергетические потребности у жвачных в основном удовлетворяются за счет летучих жирных кислот, которые образуются в результате рубцового брожения. Частично потребность в углеводах возмещается за счет полисахаридов, откладывающихся в клетках бактерий и простейших рубца. Растительные белки корма при поступлении в рубец большей частью гидролизуются под воздействием микробных протеиназ. Значительная часть образующихся при этом процессе аминокислот дезаминируется. Образующийся в рубце микробный белок является более полноценным, чем растительный, так как содержит все п незаменимые аминокислоты. Потребность жвачных животных в витами-г нах группы В и К полностью возмещается за счет микроорганизмов рубца. У молодняка эти витамины синтезируются по мере становления рубцовой микрофлоры.
Помимо указанного, рубцовые микроорганизмы осуществляют еще целый ряд превращений: принимают участие в липидном обмене, обладают способностью редуцировать сульфаты и нитраты. Карбамид, применяемый в качестве химической добавки в корм жвачных, усваивается, непосредственно многими видами микрофлоры рубца, которая синтезирует из него микробный белок. В дальнейшем микроорганизмы в желу-; дочно-кишечном тракте жвачных перевариваются, обеспечивая их микробным белком высокой биологической ценности. ,
54
Рубец жвачных обильно заселен большим числом видов бактерий и простейших. Анатомическое строение и условия в рубце почти идеально отвечают требованиям для жизнедеятельности микроорганизмов. В среднем, по данным различных авторов, количество бактерий составляет 109—1010 клеток в 1 г рубцового содержимого.
Помимо бактерий, в рубце осуществляют расщепление кормов и синтез важных органических соединений для животного организма также различные виды дрожжей, актиномицетов и простейших. Инфузорий в 1 мл может быть несколько (3—4) миллионов.
Видовой состав рубцовых микроорганизмов со временем претерпевает изменения. В молочный период в рубце у телят преобладают лактобациллы и определенные виды протеолитических бактерий. Полное становление рубцовой микрофлоры завершается при переходе животных на кормление грубыми кормами. У взрослых жвачных видовой состав рубцовых бактерий, по мнению некоторых авторов, постоянен, сущест* венным образом не изменяется в зависимости от кормления, времени года и ряда других факторов. Представляют наиболее важное в функциональном отношении значение следующие виды бактерий: Bacteroides succinogenes, Butyrivibrio fibrisolvens, Ruminococcus flavefaciens, R. albus, Cillobacterium cellulosolvens, Clostridium cellobioparus, Clostridium locheadif и др.
Основными продуктами сбраживания клетчатки и других углеводов являются масляная кислота, углекислота и водород. В превращении крахмала принимают участие многие виды рубцовых бактерий, в том числе и целлюлозолитические. Из рубца выделены: Bact. amylophilus, Bact. ruminicola н др. В расщеплении крахмала большое участие принимают также определенные виды инфузорий. Основными продуктами брожения являются уксусная, янтарная, муравьиная кислоты, углекислый газ и в некоторых случаях сероводород.
Утилизация в рубце жвачных моносахаридов (глюкоза, фруктоза, ксилоза и др.), поступающих с кормом, а главным образом образующихся при гидролизе полисахаридов, осуществляется в основном рубцовыми микроорганизмами. Из-за наличия в рубце анаэробных условий углеводы в клетках рубцовых микроорганизмов окисляются не полностью, конечными продуктами брожения являются органические кислоты, углекислота, этанол, водород, метан,
Часть продуктов гликолиза (молочная, янтарная, валериановая кислоты и некоторые другие вещества) используется самими бактериями в качестве источника энергии и для синтеза клеточных соединений. Конечные продукты углеводного обмена в рубце жвачных—летучие жирные кислоты—используются в обмене веществ животного-хозяина. Ацетат, один из основных продуктов рубцового метаболизма, является предшественником жира молока и источником. знергди для^Ж^Пропионат и бутират используются животными для синтеза углеводов.
В содержимом рубца широко представлены виды бактерий, утилизирующих различные моносахара. Кроме описанных выше, обладающих ферментами, разрушающими полисахариды и дисахариды, в рубце жвачных находится целый ряд видов бактерий, предпочтительно использующих моносахара, главным образом глюкозу. К ним относятся: Lachnos-pira multiparus, Selenomonas ruminantium, JLactobacillus_acidophilus,
Bifrdobacterium bifidum, Bacteroides coagulans, LaHobacillus^ermentum и др. .....'
В настоящее время известно, что белок в рубце расщепляется под действием протеолитических ферментов микроорганизмов с образованием пептидов и аминокислот, которые, в свою очередь, подвергаются воздействию дезаминаз с образованием аммиака. Дезаминирующими свойствами обладают культуры, относящиеся к видам: Selenomonas ruminantium, Megasphaera elsdenii, Bacteroides ruminicola и др.
55
Рубец жвачных обильно заселен большим числом видов бактерий и простейших. Анатомическое строение и условия в рубце почти идеально отвечают требованиям для жизнедеятельности микроорганизмов. В среднем, по данным различных авторов, количество бактерий составляет 109—1010 клеток в 1 г рубцового содержимого.
Помимо бактерий, в рубце осуществляют расщепление кормов и синтез важных органических соединений для животного организма также различные виды дрожжей, актиномицетов и простейших. Инфузорий в 1 мл может быть несколько (3—4) миллионов.
Видовой состав рубцовых микроорганизмов со временем претерпевает изменения. В молочный период в рубце у телят преобладают лактобациллы и определенные виды протеолитических бактерий. Полное становление рубцовой микрофлоры завершается при переходе животных на кормление грубыми кормами. У взрослых жвачных видовой состав рубцовых бактерий, по мнению некоторых авторов, постоянен, существенным образом не изменяется в зависимости от кормления, времени года и ряда других факторов. Представляют наиболее важное в функциональном отношении значение следующие виды бактерий: Bacteroides succinogenes, Butyrivibrio fibrisolvens, Ruminococcus. flavefaciens, R. albus, Cillobacterium cellulosolvens, Clostridium cellobipparus, Clostridium locheadt и др.
Основными продуктами сбраживания клетчатки и других углеводов являются масляная кислота, углекислота и водород. В превращении крахмала принимают участие многие виды рубцовых бактерий, в том числе и целлюлозолитические. Из рубца выделены: Bact. amylophilus, Bact. ruminicola и др. В расщеплении крахмала большое участие принимают также определенные виды инфузорий. Основными продуктами брожения являются уксусная, янтарная, муравьиная кислоты, углекислый газ и в некоторых случаях сероводород.
Утилизация в рубце жвачных моносахаридов (глюкоза, фруктоза, ксилоза и др.), поступающих с кормом, а главным образом образующихся при гидролизе полисахаридов, осуществляется в основном рубцовыми микроорганизмами. Из-за наличия в рубце анаэробных условий углеводы в клетках рубцовых микроорганизмов окисляются не полностью, конечными продуктами брожения являются органические кислоты, углекислота, этанол, водород, метан,
Часть продуктов гликолиза (молочная, янтарная, валериановая кислоты и некоторые другие/вещества) используется самими бактериями в качестве источника энергии и для синтеза клеточных соединений. Конеч-ные продукты углеводного обмена в рубце жвачных—летучие жирные кислоты—используются в обмене веществ животного-хозяина. ^Ацетат, один из основных продуктов рубцового метаболизма, .является предшественником жира молока и источникам. энергии для пионат и бутират используются животными для синтеза углеводов.
В содержимом рубца широко представлены виды бактерий, утилизирующих различные моносахара. Кроме описанных выше, обладающих ферментами, разрушающими полисахариды и дисахариды, в рубце жвачных находится целый ряд видов бактерий, предпочтительно использующих моносахара, главным образом глюкозу. К ним относятся: Lachnos-pira multiparus, Selenomonas ruminantium, Lactobacillus acidophilus, Bifrdobacterium bifidum, Bacteroides coagulans, Lactobacillus Termentum и др.
В настоящее время известно, что белок в рубце расщепляется под действием протеолитических ферментов микроорганизмов с образованием пептидов и аминокислот, которые, в свою очередь, подвергаются воздействию дезаминаз с образованием аммиака. Дезаминирующими свойствами обладают культуры, относящиеся к видам: Selenomonas ruminantium, Megasphaera elsdenii, Bacteroides ruminicola и др.
55
Большая часть потребляемого с кормом растительного белка превращается в рубце в белок микробиальный. Как правило, процессы рас-* щепления и синтеза белка идут одновременно. Значительная часть рубцовых бактерий, являясь гетеротрофами, для синтеза белка использует неорганические соединения азота. Наиболее важные в функциональном отношении рубцовые микроорганизмы (Bacteroides ruminicola, Bacteroides succinogenes, Bacteroides amylophilus и др.) для синтеза азотистых веществ своих клеток используют аммиак.
Ряд видов рубцовых микроорганизмов (Streptococcus bovis, Bacteroides succeinogenes, Ruminococcus flavefaciens и др.) для построения серосодержащих аминокислот используют сульфиды при наличии
в среде цистина, метионина или гомоцистеина.
Тонкий отдел кишечника содержит сравнительно небольшое количество микроорганизмов. В этом отделе кишечника чаще всего находятся устойчивые к действию желчи энтерококки, кишечная палочка, ацидофильные и споровые бактерии, актиномицеты, дрожжи и др.
Толстый отдел кишечника наиболее богат микроорганизмами. Основные обитатели его—энтеробактерии, энтерококки, термофилы, ацидофилы, споровые бактерии, актиномицеты, дрожжи, плесени, большое количество гнилостных и некоторых патогенных анаэробов (Cl. sporogenes, Cl. putrificus, Cl. perfringens, Cl. tetani, F. necrophorum). В 1 г экскрементов травоядных может содержаться до 3,5 млрд, различных микроорганизмов. Микробная масса составляет около 40 % сухого вещества испражнений.
В толстом отделе кишечника протекают сложные микробиологичес-
кие процессы, связанные с расщеплением клетчатки, пектиновых ве
ществ, крахмала.
Микрофлору желудочно-кишечного тракта принято делить на облигатную (молочнокислые бактерии, Е. coli, энтерококки, Cl. perfringens, CL sporogenes и др.), которая адаптировалась к условиям этой среды и стала постоянным ее обитателем, и факультативную, изменяющуюся
в зависимости от вида корма и воды.
Микрофлора мочеполовых органов. Матка, яичники, семенники в норме не содержат микробов. На слизистой наружных частей уретры обитают стрептококки, стафилококки, дифтероиды, Mycobacterium smegmatis, микоплазмы и др. Микрофлора влагалища состоит из мо-
лочнокислых и кокковых бактерий, кишечной палочки, Haemophilus vaginalis vulgare и др. При изменениях физиологического состояния организма и особенно при различных гинекологических заболеваниях (эндометрит, метрит, воспаление яичников и др.), а также после абортов данная микрофлора изменяется.
Постоянно обитающая микрофлора тела обладает антагонистическими свойствами в отношении гнилостных и патогенных микроорганизмов. Например, кишечная палочка — антагонист возбудителя сибирской язвы, туберкулеза; Cl. sporogenes — антагонист Cl. tetani. г
МИКРОФЛОРА МОЛОКА И МОЛОЧНЫХ ПРОДУКТОВ
Молоко представляет собой высокопитательный продукт не только для млекопитающих, но и для микробов. В молоке всегда содержится определенное количество микроорганизмов, при благоприятной температуре они быстро размножаются, вызывая различные его пороки. Экс-г периментально доказано, что при тщательном обмывании вымени и сос-^ ков в 1 мл первых порций молока содержится 16 000 микробов, в средних — 480 и последних — 360.
Микробы попадают в молоко из самых различных источников.
56
Размножение и изменение микрофлоры молока во время хранения зависят от загрязненности его микробами, температуры и сроков хранения. Особенности размножения и состав микрофлоры в различные периоды хранения молока позволяют различать несколько фаз.
Бактерицидная фаза — период времени, в течение которого в све-жевыдоенном молоке не размножаются микробы. Она обусловлена иммуноглобулинами, лизоцимом, лактоферрином и другими противо-микробными веществами.
Длительность бактерицидной фазы зависит от срочности охлаждения свежего молока, температуры охлаждения и количества микробов, содержащихся в нем. Очень быстро размножаются микробы в свежевы-доенном неохлажденном молоке (особенно в теплое время года), что сопровождается повышением его кислотности. Размножение бактерий резко замедляется в молоке, охлажденном до 10 °C, и почти полностью прекращается при 2—4 °C. При этих температурах молоко сохраняется 48 ч, при более длительном хранении технологические качества его заметно снижаются. В свежевыдоенном молоке, охлажденном до 2—4 °C, кислотность не увеличивается 24 ч, при охлаждении до 12 °C она не изменяется 12 ч, неохлажденное же молоко за это время свертывается. В молоке, охлажденном дсгЮ—12 °C, количество микроорганизмов увеличивается за сутки в 10 раз, при температуре 18—20°C — в сотни раз, при температуре 30—35°C — в сотни тысяч раз.
Первая фаза размножения микрофлоры в молоке (или фаза смешанной микрофлоры). После разрушения бактерицидных веществ в молоке находящиеся в нем гнилостные, молочнокислые и другие микробы, если температура превышает 10°C, начинают размножаться. Преобладающая роль здесь принадлежит гнилостным бактериям. На вкус такое молоко неприятное, кисловатое. При его скармливании молодняку у него возникают энтериты.
Во второй фазе наиболее энергично размножаются молочнокислые микробы и особенно стрептококки. Накапливающаяся этими микробами молочная кислота в количество до 1 % угнетает развитие гнилостной микрофлоры, и она в значительной степени отмирает. Казеин под влиянием молочной кислоты набухает, и молоко свертывается.
В третьей фазе размножаются преимущественно молочнокислые палочки, при этом концентрация молочной кислоты достигает 2,5—3,5%, поэтому стрептококки и кишечная палочка отмирают.
В четвертой фазе концентрация молочной кислоты удерживается на высоком уровне, она подавляет развитие и самих молочнокислых бактерий, вследствие чего количество микробов в свернувшемся молоке резко снижается. В дальнейшем в свернувшемся молоке начинают усиленно размножаться дрожжи и молочная плесень.
При хранении молока в условиях низкой температуры (2—4 °C) в HgM размножаются преимущественно флуоресцирующие бактерии. При температуре 5—10 °C начинают развиваться и гнилостные микробы. Из-за них молоко, хранящееся при низкой температуре, прогоркает и становится непригодным в пищу, а также для скармливания молодняку животных.
Нормальная микрофлора молока. В свежевыдоенном молоке всегда
присутствуют определенные виды микроорганизмов, носящие название обычной или нормальной микрофлоры.
Молочнокислые микробы вызывают молочнокислое брожение, они продуцируют главным образом молочную кислоту и небольшое количество уксусной, муравьиной и янтарной кислот. Газа они поч-ти:не образуют. Делятся на две группы: стрептококки и лактобактерии (рис. 34, 35).
При сбраживании сахаров эти микробы образуют только молочную кислоту, поэтому их называют типичными или гомоферментативными.
57
Рис. 34. Lactobacterium bulgaricum.
Рис. 35. Bacterium acidophilum.
Все они неподвижны, не образуют спор, положительно окрашиваются по Граму.
Кроме этих бактерий, в молоке присутствуют микроорганизмы, сбра« живающие сахара с образованием не только молочной кислоты, но и других продуктов. Такое брожение получило название гетерофермента-тивного, его возбудителями являются, например, Е. coli. Эти бактерии мало накапливают молочной кислоты, медленно свертывают молоко, об
разуют преимущественно пропионовую, масляную, уксусную кислоты, значительное количество углекислоты и водорода, спирт. В молоке присутствуют также возбудители пропионовокислого, маслянокислого брожения, дрожжи и другая микрофлора.
Необычная, анормальная, микрофлора молока — это в основном возбудители заболеваний человека и животных, а также микроорганизмы, обусловливающие его пороки.
Обеззараживание и консервирование молока. Для этой цели ши-
роко используют пастеризацию и стерилизацию.
Пастеризация — прогревание молока в специальных аппаратах (пастеризаторах) при определенной температуре и заданной экспо-
зиции с целью уничтожения вегетативных форм микробов. На молочных фермах и молочных заводах применяют длительную пастеризацию (при температуре 65°C в течение 30 мин), кратковременную (при температуре 75°C — 20 с) и моментальную (при температуре 90°C — 2 с). Эффективность пастеризации зависит от наличия в молоке механических
частиц: грубых кормов, шерсти, навоза. Для удаления их молоко необходимо процеживать или фильтровать.
Споры маслянокислых, термофильных и других микроорганизмов при пастеризации не погибают. Некоторые возбудители, например туберкулеза, устойчивы к прогреванию. Поэтому молоко коров неблагополучного по туберкулезу стада пастеризуют при температуре 85 °C в течение 30 мин.
Стерилизация — прогревание молока с целью полного уничтожения всех вегетативных и споровых форм микробов. Осуществляется в заводских условиях в автоклавах несколькими способами.
Пороки молока микробного происхождения. Затхлое молоко получается при хранении его в теплое время года во флягах, при закрытых крышках и без охлаждения. Бактерицидная фаза у такого молока длится 2—3 ч, а затем в нем начинают усиленно размножаться гнилостные микробы, разлагающие белок с выделением сероуглерода, аммиака,
58
сероводорода. Молоко, насыщенное этими газами, издает неприятный затхлый запах и к употреблению в пищу непригодно. При его скармливании молодняку возможно развитие энтерита.
Травяной запах молока появляется при поедании коровами большого количества зеленого, легкобродящего корма, а также при развитии в молоке кишечной палочки и флуоресцирующих бактерий.
Бродящее молоко характеризуется накоплением значительного количества газа в результате интенсивного развития гнилостных и маслянокислых бактерий и дрожжей. Возникает чаще всего в теплое время года в сыром молоке и в сливках, вызывается кишечной палочкой и дрожжами, а в пастеризованных продуктах — маслянокислыми бактериями. Такое молоко в пищу непригодно.
Горький вкус обусловливается гнилостными бактериями, разлагающими белки; при этом маммококки вызывают этот порок в сыром молоке, а спорообразующие гнилостные бактерии — в пастеризованном.
Прогорклый вкус возникает при длительном хранении молока при низкой температуре (10 °C). Вызывается флюоресцирующими бактериями, вырабатывающими при разложении жиров масляную кислоту, альдегиды, эфиры, придающие молоку горький вкус.
Мыльный вкус появляется при размножении в молоке мыльных молочных бактерий. Эти бактерии обладают свойствами образовывать в молоке щелочи, омыляющие молочный жир. Мыльное молоко при хранении не скисает, не свертывается, на дне посуды, где оно хранится, образуется слизистый осадок. Попадают в молоко эти бактерии из сена и соломы.
Преждевременное свертывание наблюдается при нагревании молока — пастеризации, стерилизации, кипячении — вследствие того, что оно имеет повышенную кислотность, обусловленную наличием большого количества маммококков и микрококков, вырабатывающих ферменты, сходные с сычужным.
Тягучее молоко имеет слизистую консистенцию в результате развития в нем Leuconostoc lactis, образующей слизистую капсулу. Тягучее молоко не свертывается из-за щелочной реакции. В других случаях молоко прокисает и свертывается, но образующийся сгусток не рыхлый, а тягучий, слизистый. Этот порок вызывается молочнокислыми стрептококками, образующими одновременно значительное количество слизи.
Окраска молока — следствие размножения в нем бактерий, образующих пигменты. Розовый или красный цвет молоко приобретает в результате развития в нем чудесной палочки Serratia marcescens, вырабатывающей красный пигмент. Синий цвет молока дает Ps. aerugino- * sa, желтый — Myxococcus xanthus, Ruminococcus flavefaciens.
Микробиология кисломолочных продуктов. Приготовление кисломолочных продуктов основано на жизнедеятельности молочнокислых бактерий и дрожжей.
Бактерии расщепляют лактозу до молочной кислоты, а дрожжи до спирта. Вместе с этим при созревании кисломолочных продуктов происходят и другие сложные биохимические процессы: расщепление белков до пептонов и даже аминокислот, благодаря чему усвояемость их значительно повышается. Одновременно накапливаются витамины из групп В и РР, а также антибиотические вещества. Следовательно, диетическое действие кисломолочных продуктов основано на их высокой усвояемости и бактерицидном действии молочной кислоты и антибиотиков на гнилостную микрофлору кишечника.
: Ацидофильное молоко приготовляют из цельного пастеризованного молока на закваске, содержащей ацидофильную палочку. При температуре 10 °C его можно хранить 2—3 суток. Скармливание молод-
59
Рис. 36. Кефирные зерна.
няку ацидофильного молока предупреждает желудочно-кишечные заболевания и увеличивает приросты.
Ацидофильную простоквашу готовят из цельного пастеризованного молока с использованием молочнокислых стрептококков и ацидофильной палочки, в результате чего получают диетический продукт приятного вкуса.
Простокваша изготовляется из цельного, обезжиренного, пастеризованного молока с использованием закваски из термофильного молочнокислого стрептококка и болгарской палочки. Хранят простоквашу при температуре 10 °C до двух суток.
Кефир готовят из цельного, обезжиренного или пастеризованного молока с добавлением закваски из кефирных зерен, которые состоят из кефирных дрожжей,
молочнокислых стрептококков, молочнокислых палочек, пленчатых дрожжей и палочек стромы (рис. 36). Оптимальная температура для созревания кефира 16—17°. Готовый кефир имеет полужидкую консистенцию, слабый кислый вкус и запах. Он обладает диетическим и лечебным действием при желудочно-кишечных заболеваниях.
Кумыс готовят из сырого или пастеризованного молока кобылиц и коров. В качестве закваски используют сухой кумыс — «кор» или жидкую закваску — «катык». Закваска содержит молочнокислые палочки, сходные с болгарской, и весьма активные молочные дрожжи, накапливающие до 3—4 % спирта. При изготовлении кумыса преобладает спиртовое брожение, чему способствует наличие в молоке кобыл 6% сахара.
Микробиология сыроделия. Сыр — высокопитательный продукт, содержащий молочный белок, жир, соли кальция, фосфора и витамины. Изготовление его основано на микробиологических процессах. Технология производства сыров состоит из следующих процессов.
Заквашивание молока производится с помощью молочнокислых бактерий и сычужного фермента, в результате чего казеин расщепляется на параказеин и сывороточный белок.
Прессование сырной массы проводят после второго подогревания, при этом микробиологические процессы, начавшиеся в котле, продолжаются, благодаря чему в 1 г сыра микроорганизмов может содержаться до 1 млрд.
Посолка сыра делается при низкой температуре в ваннах, содержащих 30 % раствора соли.
Созревание сыра проводят вначале в теплом подвале, при этом молочнокислые стрептококки размножаются до полного исчезновения сахара, а молочнокислые палочки, продолжая свою жизнедеятельность, используют пептоны, образующиеся в результате расщепления белков. Формирование грубого рисунка в сырах (крупных глазков) происходит вначале под воздействием углекислоты и водорода, которые продуцируют кишечные палочки. Затем эти бактерии под влиянием молочной кислоты отмирают, а пропионовокислые бактерии, разлагающие накопившуюся молочную кислоту, интенсивно размножаются и выделяют углекислоту, формирующую тонкий рисунок (мелкие глазки). Для окончательного созревания сыр переносят в прохладное помещение, гдё' происходит распад белков, что придает продукту пластичность и нежный вкус,
Микробиология масла. Молочная промышленность изготовляет три сорта масла: сладкосливочное, кислосливочное и мелешинское. В каждом из них содержится различное количество микрофлоры. Сладкосливочное масло готовят из свежих, сладких сливок, в 1 г его содержится 2—3 млн. преимущественно микрококков, молочнокислых стрептококков и флюоресцирующих бактерий. При хранении такого масла при температуре 10 °C количество микробов вначале увеличивается, а через 4—6 недель уменьшается до 1 млн. на 1 г.
Кислосливочное масло приготавливают из сметаны (кислых сливок), в 1 г его вначале содержатся десятки миллионов преимущественно молочнокислых стрептококков и незначительное количество дрожжей и плесневых грибков. Через 4—6 недель хранения при температуре 15—17 °C в таком масле находится всего лишь несколько десятков тысяч микроорганизмов.
Мелешинское масло готовят по непрерывно-поточному методу Мелешина в специальной установке, состоящей из пастеризатора, сепаратора, промежуточной ванны и охладителя. Мелешинское масло содержит незначительное количество микробов (несколько тысяч в 1 г), обладает большой стойкостью при хранении.
МИКРОФЛОРА КОРМОВ
На поверхностных частях рас
тений постоянно присутствует разнообразная микрофлора, называемая эпифитной. На стеблях, листьях, цветах, плодах наиболее часто встречаются следующие неспоровые виды микроорганизмов: Bact, herbicola составляет 40 % всей эпифитной микрофлоры, Ps. fluorescens — 40 %, молочнокислые бактерии — 10 %, им подобные — 2 %, дрожжи, плесневые грибы, целлюлозные, маслянокислые, термофильные бактерии — 8 %.
После скашивания и потери сопротивляемости растений, а также в силу механического повреждения их тканей эпифитная и прежде всего гнилостная микрофлора, интенсивно размножаясь, проникает в толщу растительных тканей и вызывает их разложение. Именно поэтому продукцию растениеводства (зерно, грубые и сочные корма) от разрушительного действия эпифитной микрофлоры предохраняют различными
методами консервирования.
Известно, что в растениях имеется связанная вода, входящая в состав их химических веществ и свободная — капельно-жидкая. Микроорганизмы могут размножаться в растительной массе только при наличии в ней свободной воды. Одним из наиболее распространенных и доступных методов удаления из продуктов растениеводства свободной воды и, следовательно, их консервирования является высушивание и силосование.
Сушка зерна и сена предусматривает удаление из них свободной воды. Поэтому микроорганизмы на них размножаться не могут до тех пор, пока эти продукты будут сухими.
В свежескошенной неперестоявшей траве воды содержится 70— 80 %, в высушенном сене только 12—16 %, оставшаяся влага находится в связанном состоянии с органическими веществами и микроорганизмами не. используется. Во время сушки сена теряется около 10 % органических веществ, главным образом при разложении белков и сахаров. Особенно большие потери питательных веществ, витаминов и минеральных соединений происходят в высушенном сене, находящемся в прокосах (валках), когда часто идут дожди. Дождевая дистиллированная вода вымывает их до 50 %.
61
Значительные потери сухого вещества происходят в зерне хпри его самосогревании. Этот процесс обусловлен термогенезом, то есть созданием тепла микроорганизмами. Возникает он потому, что термофильные бактерии используют для своей жизни только 5—10 % энергии потребляемых ими питательных веществ, а остальная выделяется в окружающую их среду — зерно, сено.
Силосование кормов. При выращивании кормовых культур (кукурузы, сорго и др.) с одного гектара удается получить в зеленой массе значительно больше кормовых единиц, чем в зерне. По крахмальному эквиваленту питательность зеленой массы при сушке может снизиться до 50 %, а при силосовании только до 20 %. При силосовании не теряются мелкие листья растений, обладающие высокой питательностью, а при высушивании они опадают. Закладку силоса можно производить и при переменной погоде. Хороший силос является сочным, витаминным, молокогонным кормом.
Сущность силосования состоит в том, что в заложенной в емкости измельченной зеленой массе интенсивно размножаются молочнокислые микробы, разлагающие сахара с образованием молочной кислоты, накапливающейся до 1,5—2,5 % к массе силоса. Одновременно размножаются уксуснокислые бактерии, превращающие спирт и другие углеводы в уксусную кислоту; ее накапливается 0,4—0,6 % к массе силоса. Молочная и уксусная кислоты являются сильным ядом для гнилостных микробов, поэтому размножение их прекращается.
Силос сохраняется в хорошем состоянии до трех лет, пока в нем содержится не менее 2 % молочной и уксусной кислот, а pH составляет 4—4,2. Если размножение молочнокислых и уксусных бактерий ослабевает, то концентрация кислот снижается. В это время одновременно начинают размножаться дрожжи, плесени, маслянокислые и гнилостные бактерии и силос портится. Таким образом, получение хорошего силоса зависит прежде всего от наличия в зеленой массе сахаров и интенсивности развития молочнокислых бактерий.
В процессе созревания силоса различают три микробиологические фазы, характеризующиеся специфическим видовым составом микрофлоры.
Первая фаза характеризуется размножением смешанной микрофлоры с некоторым преобладанием гнилостных аэробных неспоровых бактерий — кишечной палочки, псевдомонас, молочнокислых микробов, дрожжей. Спороносные Гнилостные и маслянокислые бактерии размножаются медленно и не преобладают над молочнокислыми. Основной средой для развития смешанной микрофлоры в этой стадии является растительный сок, выделяющийся из тканей растений и заполняющий пространство между измельченной растительной массой. Это способствует созданию анаэробных условий в силосе, что угнетает развитие гнилостных бактерий и благоприятствует размножению молочнокислых микробов. Первая фаза при плотной укладке силоса, то есть в анаэробных условиях, продолжается всего 1—3 дня, при рыхлой укладке в аэробных условиях она более продолжительна и длится 1—2 недели. За это время силос разогревается благодаря интенсивным аэробным микробиологическим процессам.
Вторая фаза созревания силоса характеризуется бурным размножением молочнокислых микробов, причем вначале развиваются преимущественно кокковые формы, которые затем сменяются молочнокислыми бактериями. Благодаря накоплению молочной кислоты прекращается развитие всех гнилостных и маслянокислых микроорганизмов, при этом вегетативные их формы погибают, остаются лишь спороносные (в форме спор). При полном соблюдении технологии закладки силоса в этой фазе размножаются гомоферментативные молочнокислые бактерии, образующие из сахаров только молочную кислоту. При нарушении техно-62
Рис. 37. Смена микрофлоры прн силосовании кукурузы:
1 — общее число бактерий; 2 молочнокислые коккй; 3 — молочнокислые палочки.
логин закладки силоса, когда в нем содержится воздух, развивается микрофлора гетероферментативного брожения, в результате чего образуются нежелательные летучие кислоты — масляная, уксусная и др. Длительность второй фазы — от двух недель до трех месяцев.
Третья фаза характеризуется постепенным отмиранием в силосе молочнокислых микробов из-за высокой концентрации молочной кислоты (2,5 %). В это время созревание силоса завершается, условным показателем пригодности его к скармливанию считается кислотность силосной массы, снижающаяся до pH 4,2—4,5 (рис. 37). В аэробных условиях
начинают размножаться плесени и дрожжи, которые расщепляют молочную кислоту, этим пользуются маслянокислые и гнилостные бакте
рии, прорастающие из спор, в результате силос плесневеет и загнивает (рис. 38).
Пороки силоса микробного происхождения. При несоблюдении надлежащих условий закладки и хранения силоса в нем
возникают определенные пороки.
Гниение силоса, сопровождающееся значительным самосогревани-
ем, отмечают при рыхлой его укладке и недостаточном уплотнении. Бурному развитию гнилостных и термофильных микробов способствует находящийся в силосе воздух. В результате разложения белка силос приобретает гнилостный, аммиачный запах и становится непригодным
к скармливанию. Гниение силоса происходит в первой микробиологической фазе, когда задерживается развитие молочнокислых микробов и накопление молочной кислоты, подавля-ЮЩей гнилостных бактерий. Чтобы прекратить развитие последних, необходимо pH в силосе снизить до 4,2—4,5. Гниение силоса вызывают Er. herbicola, Е. coli, Ps. aerogenes, Р. vulgaris, В. subtilis, Ps. fluorescens, а также плесневые грибы.
Прогоркание силоса обусловлено накоплением в нем масляной кислоты, обладающей резким горьким вкусом и неприятным запахом. В хорошем силосе масляная кислота отсутствует, в силосе среднего качества ее обнаруживают до 0,2%, а в непригодном к скармливанию — до 1 %.
Рйс. 38. Накопление молочной кислоты в силосе:
1 — при анаэробных условиях;
2 — при аэробных условиях.
63
Возбудители маслянокислого брожения способны превращать молочную в масляную кислоту, а также вызывать гнилостный распад белков, что усугубляет их отрицательное действие на качество силоса. Маслянокислое брожение проявляется при медленном развитии молочнокислых бактерий и недостаточном накоплении молочной кислоты, при pH выше 4,7. При быстром же накоплении молочной кислоты в силосе до 2 % и pH 4—4,2 маслянокислого брожения не происходит.
Основные возбудители маслянокислого брожения в силосе: Ps. fluo-rescens, Cl. pasteurianum, Cl. felsineum.
Перекисание силоса наблюдается при энергичном размножении в нем уксуснокислых, а также гнилостных бактерий, способных продуцировать уксусную кислоту. Уксуснокислые бактерии особенно интенсивно размножаются при наличии в силосе этилового спирта, накапливаемого дрожжами спиртового брожения. Дрожжи и уксуснокислые бактерии — аэробы, поэтому значительное содержание уксусной кислоты в силосе и, следовательно, его перекисание отмечают при наличии в силосе воздуха.
Плесневение силоса происходит при наличии в силосе воздуха, что благоприятствует интенсивному развитию плесеней и дрожжей. Эти микроорганизмы всегда обнаруживают на растениях, поэтому при благоприятных условиях начинается их быстрое размножение.
Кормовые дрожжи представляют собой хороший белково-витамин-ный корм. В дрожжах содержится легкопереваримый белок, провитамин D (эргостерин), а также витамины А, В, Е. Размножаются дрожжи очень быстро, поэтому в промышленных условиях удается получать большое количество дрожжевой массы при культивировании их на патоке или осахаренной клетчатке. В настоящее время в нашей стране сухие кормовые дрожжи готовят в большом количестве. Для их изготовления используется культура кормовых дрожжей.
МИКРОФЛОРА
НАВОЗА
Максимально микробы размножаются в навозе при оптимальной температуре и хорошей аэрации. В таких условиях их количество достигает 50—70 млрд, в 1 г. Накапливаясь в навозе в большом количестве, микроорганизмы энергично разлагают органические вещества, что приводит в конечном счете к их потере. При хранении навоза в рыхлом, не уплотненном виде эти потери особенно велики. При анаэробных условиях органические вещества разлагаются в основном до промежуточных соединений, в том числе до органических кислот. Последние задерживают дальнейшее развитие микроорганизмов, чем и объясняется меньшая потеря сухого вещества.
Клетчатку в навозе разлагают аэробные микроорганизмы из рода Cytophaga и ^reptomyces^cellylo^ae, Из термофильных микроорганизмов наиболее часто присутствуют nubact. cellulosolvens. Вместе с названными бактериями в навозе интенсивно размножаются актиномицеты и плесневые грибы, особенно Aspergillus, Penicillium, Monillia, Cla-dosporium.
Азотистые вещества навоза разлагаются аммонифицирующими микробами, при этом в начале хранения кокковые формы составляют 57 %, Proteus vulgaris—18, Е. coli—11,7, Вас. mycoides и Вас. mesenteri-cus — 4,5 %. В перегнившем навозе видовой состав аммонифицирующих микробов меняется, при этом бациллы составляют 73 %, а кокковые формы — 6,6%.
Хранение навоза в уплотненных буртах является основным методом, предупреждающим потери азота. В таких условиях нитрифицирующие бактерии почти не размножаются и не накапливают азотистую и азот-
64
ную кислоты. Из денитрифицирующих бактерий в навозе наиболее часто обнаруживают Ps. fluorescens и Ps. stutzeri.
Потери фосфора в навозе при доступе воздуха достигают 20—40 %. Они происходят в результате деятельности гнилостных микроорганизмов, восстанавливающих фосфаты до фосфорной кислоты, а также до фосфористого водорода, которые улетучиваются из навоза.
В настоящее время применяется
Анаэробный способ (или холодное хранение). Навоз равномерно размещают в типовом навозохранилище. По мере заполнения хранилища навоз уплотняют, в результате чего из него вытесняется воздух и создаются анаэробные условия, предупреждающие размножение микробов, обусловливающих потери азота. Этот способ получил название холодного хранения потому, что температура в навозе не поднимается выше 30—35°.
Аэробно-анаэробный способ. Навоз вначале укладывают без уплотнения, рыхло, поэтому в нем создаются аэробные условия. Затем, когда навоз разогреется и температура в нем достигнет примерно 70°, его уплотняют и создают анаэробные условия. Сверху на него кладут новый слой навоза. Такое послойное загружение продолжается до заполнения навозохранилища. Аэробно-анаэробное хранение позволяет получать хорошо перегнивший навоз, в котором погибают семена сорняков, яйца гельминтов и вегетативные формы патогенных микроорганизмов. Потери азота при этом способе несколько больше, чем при холодном хранении.
Биотермическое обеззараживание навоза применяют для уничтожения патогенных не спорообразующих микробов, яиц гельминтов и семян сорняков. Для этого на вырытую в почве площадку глубиной 50 см, шириной 4—5 м и длиной 15—20 м настилают солому, а затем на нее укладывают инфицированный навоз. Высоту бурта можно доводить до 2 м. Сверху бурт обкладывают соломой, а затем дерном толщиной до 15 см (рис. 39). При данном способе в результате жизнедеятельности термофильных микробов в навозе поднимается температура до 70—75° и сохраняется длительное время.
I
РОЛЬ МИКРОБОВ В ПРЕВРАЩЕНИИ ВЕЩЕСТВ В ПРИРОДЕ
При самом активном, широком участии микроорганизмов в природе, главным образом в почве и гидросфере, постоянно осуществляется два противоположных процесса: синтез из минеральных веществ сложных органических соединений и, наоборот, разложение органических веществ до минеральных. Единство этих диалектически противоположных процессов лежит в основе биологической роли микроорганизмов в круговороте веществ в природе. Среди различных процессов превращения веществ в природе, в которых микроорганизмы принимают активное участие, важнейшее значение для осуществления жизни растений, животных и человека на Земле имеют круговорот азота, углерода, фосфора, серы, железа.
Роль микробов в круговороте азота в природе. Жизнь, по определению Ф. Энгельса, представляет собой существование особой формы белковых тел, характерной особенностью которых является постоянный обмен с окружающей средой. Важнейший элемент, входящий в состав белков, а следовательно, имеющий исключительное значение для жизни— это азот. В природе запасы его огромны. В воздухе над каждым
5—Ветеринарная микробиология gg
I'*..’". *• rMt Vi rw L-r A S-. Al- t-,
гектаром нашей планеты, содержится около 80 тыс. т молекулярного азота. Для получения высоких урожаев его хватило бы на миллион лет. В действительности же получение низких урожаев происходит преимуществ венно вследствие азотистого голодания растений, так как они не могут усваивать молекулярный азот воздуха без микроорганизмов. В живых существах, населяющих планету, содержится примерно 15—20 млрд, т азота, в почвах (в 30-сантиметровом слое) на каждом гектаре имеется в среднем 5—15 т азота, свя-
Рис. 40. Азотобактер.
занного с гумусом, а также в виде минеральных соединений. Азот, входящий в состав органических соединений почвы, также не может использоваться растениями, пока его не минерализуют микроорганизмы.
Таким образом, азотистое питание растений зависит от деятельности микроорганизмов. В круговороте азота в природе с участием микроорганизмов различают следующие этапы: усвоение атмосферного азота, аммонификацию, нитрификацию, денитрификацию.
Усвоение азота из атмосферного воздуха а з о т-фиксирующнми бактериями. Среди микробов, усваивающих атмосферный азот, различают две группы — свободноживущих и клубеньковых.
Свободноживущие азотфиксаторы живут и фиксируют азот в почве независимо от растений. Основные виды этих микробов: Azotobacter chroococcum, Cl, pasteurianum. Азотобактер в молодых культурах представляет собой подвижные крупные палочки (4—6 мкм), часто соединенные попарно, в последующем микробы приобретают овальную или круглую форму. Шаровидные клетки азотобактера часто соединены попарно, в виде диплококков или сарцин — пакетами и окруженными слизистой капсулой (рис. 40). Микроб окрашивается анилиновыми красками и положительно по Граму. Старые, особенно подсыхающие культуры, приобретают бурую окраску, в них превалируют скопления кокковых форм, окруженных обшей капсулой. Азотобактер на площади в 1 га в течение года фиксирует от 20 до 50 кг газообразного азота, повышая плодородие почвы. Наиболее интенсивно этот процесс идет при хорошей аэрации почвы.
Cl. pasteurianumвпервые в чистой культуре этот микроб выделил в 1893 г. С. Н. Виноградский на среде, не содержащей азотистых соединений. Микроб полиморфный, в вегетативной стадии он представляет собой короткие и длинные палочки, после образования спор приобретает веретенообразную форму (рис. 41). Споры его треугольной формы, окружены характерной студенистой капсулой. Клостридий Пастера повсеместно распространен в природе, особенно в почве, его особенностью является способность фиксировать атмосферный азот в анаэробных условиях, вместе с этим он вызывает маслянокислое брожение, обусловливая прогоркание жиров.
Клубеньковые бактерии — активные фиксаторы атмосферного азота в симбиозе с бобовыми растениями. Наличие бактерий в клубеньках бобовых растений установлено М. Ворониным. В чистой культуре эти микробы выделены Бейеринком в 1888 г. и названы Bact, radicicola (современное— род Rhizobium). Особенностью этих бактерий является их развитие по определенному циклу. Некоторые из них имеют ветвистую
66
Рис. 41. Clostridium pasteurianum.
Кокки
Рис. 42. Bacterium radicicola.
форму и называются бактероидами, которые распадаются на кокковидные формы и снова превращаются в палочки (рис. 42).
В определенной мере клубеньковые бактерии специфичны для каждого вида бобовых растений: клевера, сои, люцерны, гороха, фасоли, люпина, вики. При достаточной аэрации почвы, влажности и температуре клубеньковые бактерии могут зафиксировать на 1 га за один год до 200 кг атмосферного азота, тем самым значительно повышая плодородие почвы (рис. 43).
В растениеводстве в качестве бактериальных препаратов, повышающих плодородие почвы, используют азотобактерин и нитрагин. Азотобактерин состоит из живой культуры азотобактера, выращенной на нейтральном торфе. Вместе с посевным материалом его вносят под небобовые культуры, главным образом технические (картофель, свекла). Нитрагин состоит из живых клубеньковых бактерий, выращенных на стерильной почве; вносят его под бобовые культуры.
Аммонификация представляет собой микробиологический процесс, в результате которого происходит гидролиз азотосодержащих органических веществ с образованием промежуточных соединений —
пептонов, аминокислот, амидокислот, жирных кислот, индола, скатола и др. Конечные продукты аммонификации — аммиак, сероводород, сероуглерод, водород, углекислота, метан. Таким образом, аммонификация — это минерализация азотсодержащих органических веществ, протекающая под воздействием аммонифицирующих микробов, выделяющих протеолитические ферменты. Благодаря аммонификации представителей растительного и животного мира и их продуктов жизнедеятельности (мочевины, испражнений) почва обогащается азотом и другими соединениями. Одновременно с этим аммонифицирующие микробы выполняют огромную санитарную роль, очищая почву и гидросферу от разлагающегося органического субстрата. Ос-
Рис. 43. Клубеньки на корнях люцерны.
67
новными представителями широкораспространенных в природе аммонифицирующих микробов являются следующие.
Микроорганизмы, разлагающие мочевину: Вас. probatus (рис. 44) — крупная палочка, подвижная, образует споры и Sporosarcina ureae (рис. 45) образует крупные шарообразные клетки, соединенные в пакеты, имеет большое количество длинных жгутиков, энергично разлагает мочевину до аммиака и углекислоты.
Подсчитано, что весь животный мир земного шара за сутки выделяет 150 тыс. т мочевины. За год это составляет более 50 млн. т мочевины, или 20 млн. т азота.
Спорообразующие аэробы — это Вас. mesentericus (картофельная бацилла), широко распространенная в природе подвижная палочка величиной 1,5—5 мкм,- нередко располагающаяся цепочками; Вас. megatherium (капустная бацилла), по своим свойствам сходная с картофельной бациллой; Вас. subtilis (сенная бацилла), весьма широко распространенная в природе подвижная палочка, интенсивный аммонификатор; Вас. mycoides (грибовидная бацилла), повсеместно распространенная подвижная палочка величиной 1,6—3,6 мкм. Не образующие спор аэробные аммонификаторы — это Е. coli, широко распространенная в природе подвижная палочка; Proteus vulgaris, полиморфная подвижная палочка, широко распространена в природе. Ps. fluorescens, подвижная мелкая палочка, постоянный обитатель почвы, образует зеленоватый пигмент.
К анаэробным спорообразующим аммонификаторам относятся Cl. putrificum (газообразующая клостридия), подвижная палочка величиной 5—6 мкм, при разложении белков образует большое количество газа, обнаруживается в кишечнике животных, навозе, почве, Cl. sporogenes (клостридия), подвижная палочка величиной 3,7 мкм, при разложении интенсивно образует сероводород, сбраживает углеводы, обнаруживается в навозе, почве.
Аммонификацию вызывают также актиномицеты, пенициллиумы, триходермы, живущие в почве.
Н и т р и ф и к а ц и я — следующий за аммонификацией этап превращения азота микроорганизмами. Этот процесс представляет собой окисление аммиака, образующегося при разложении органических азотсодержащих соединений в почве, гидросфере сначала в азотистую, а затем в азотную кислоту. Протекает нитрификация в две фазы. В первой фазе аммиак окисляется в азотистую кислоту по схематическому уравнению:.
Рис. 45. Planosarcina ureae.
Рис. 44. Bacillus probatus,
68
... 2Ш3+ Э02 = 2HNO2 + Г58 кая.
Во второй фазе азотистая кислота окисляется в азотную:
2HNO2 + О2 = 2HNO3 + 48 кал.
Образовавшаяся азотная кислота в почве вступает в соединение с щелочами, в результате чего образуется селитра:
HNO3 + КОН = KNOg + Н2О; 2НЫО3 + Са (ОН) 2 = Са (NO3>a + 2Н^О.
Селитры хорошо растворяются в воде и усваиваются растениями, в результате чего повышается плодородие почвы. В чистой культуре впервые нитрифицирующие бактерии выделил С. Н. Виноградский. Он доказал, что нитрификацию вызывают три рода бактерий Nitrosomonas, Nitrosocystis и Nitrosospira. Бактерии рода Nitrosomonas подвижны, овальной формы, в значительных количествах встречаются в почве. Nitrosocystis — кокки, окруженные общей капсулой и формирующиеся в зооглеи. Nitrosospira — бактерии спиральной формы, достигающие длины 15—20 мкм.
Денитрификация, протекающая под воздействием микробов, представляет собой восстановление нитратов с образованием в качестве конечного продукта — молекулярного азота, возвращающегося из почвы в атмосферу. Вызывается этот процесс денитрифицирующими бактериями. Наиболее распространенные из них в природе: Tiolacillus denitrifi-cans — палочка, не образующая спор, факультативный анаэроб; Ps. fluo-rescens — подвижная палочка, выделяет зеленоватый пигмент, быстро разлагает нитраты; Ps. aeruginosa — бактерия сходна с предыдущей; Ps. Stutzeri — небольшая палочка, образующая цепочки, разлагает нитраты в анаэробных условиях.
Роль микробов в круговороте углерода. Важнейшим органогеном, входящим в состав микробов, растений, животных, является углерод. В клеточном веществе этот элемент составляет около 50 % сухого вещества.
Автотрофные микробы для превращения углекислоты, не имеющей энергетических свойств, в органические энергетические соединения нуждаются в тепловых источниках, которыми для них служит солнечная энергия или химическая энергия окисления минеральных веществ. Усвоение углерода с использованием солнечной энергии называется фотосинтезом, а с использованием химической энергии — химиосинтезом. К фотоавтотрофам относят цветные бактерии: зеленые содержат в цитоплазме хлорофилл, а пурпурные красный или коричневый пигмент. Наиболее значимы из них нитрифицирующие бактерии, окисляющие аммиак в соли азотистой кислоты. Источником углерода для синтеза клеточного вещества у них служит углекислота. Тионовые бактерии относятся к химиоавтотрофам, они окисляют серу до серной кислоты. Таким образом, автотрофные микробы, используя солнечную или химическую энергию, превращают углекислоту в органическое вещество. Основной процесс, возвращающий углекислоту в атмосферу, — разложение органических соединений под влиянием микроорганизмов. Этот процесс разложения органических безазотистых соединений называется брожением. В природе существует много типов брожений, вызывающихся определенными видами микробов. Приведем только имеющие наибольшее значение для круговорота углерода.
Брожение клетчатки. В природе огромные запасы углерода сосредоточены в клетчатке (целлюлозе) растений. После их гибели идет разложение клетчатки с высвобождением углерода в виде углекислоты, возвращающейся в атмосферу. Наиболее интенсивно клетчатка разлагается целлюлозными микробами в пищеварительном аппарате травоядных животных. Различают анаэробное и аэробное брожение клетчатки.
69
Анаэробное брожение клетчатки происходит в два этапа, в первом она осахаривается по следующему суммарному уравнению:
(С6Н10О6)п + п (Н2О)->л С6Н12Ое.
Во втором этапе сахар разлагается в зависимости от типа брожения на спирты, молочную, масляную кислоту, углекислоту, водород, метан и др. В. Л. Омельянский впервые выяснил, что в природе имеется два типа анаэробного брожения клетчатки — водородное и метановое. Водородное брожение сопровождается выделением водорода, а также образованием уксусной, масляной кислот, углекислоты и других продуктов. Вызывается оно Вас. cellulosae hydrogenicum— длинной палочкой, на конце образующей споры, напоминающей барабанные палочки. Метановое брожение сопровождается образованием большого количества метана, масляной, уксусной кислот, СО2, вызывается короткой спороносной палочкойчВас. cellulosae metanicum.
В ветеринарии водородное и метановое брожение клетчатки в преджелудках крупного рогатого скота имеет особое значение. При поедании этими животными большого количества зеленой массы бобовых растений (люцерны, клевера), особенно влажной от росы или дождя, в их преджелудках происходит весьма интенсивное брожение с образованием большого количества водорода, метана, углекислоты. Эти газы вызывают острое вздутие рубца — тимпанию.
Интенсивно разлагают клетчатку в навозе в анаэробных условиях термофильный микроб Cl. termocelum, согревая его до 60—65 °C.
Аэробное брожение клетчатки наиболее интенсивно происходит под влиянием следующих трех родов микроорганизмов, широко распространенных в природе: Cytophaga — подвижных длинных палочек с заостренными концами, Celvibrio — изогнутых палочек, Celfacicula — коротких палочек. В аэробных условиях клетчатку разлагают также актиномицеты и плесневые грибы родов Aspergillus, Penicillium и др.
Целлюлозные микроорганизмы выполняют огромную санитарную роль, разлагая клетчатку отмерших растений, благодаря чему в почве накапливается гумус, повышающий ее плодородие.
Для ветеринарии среди грибов, разрушающих клетчатку, особое значение имеет Stachybotris alternans, вызывающий тяжелое заболевание животных.
Весьма вредоносный разрушитель одревесневшей клетчатки (древесины) — домовой гриб Merulium lacrymans. Этот гриб, разрастаясь в древесине, приводит ее в полную негодность (трухлое состояние), разрушая деревянные постройки, особенно потолки и полы в животноводческих помещениях.
Брожение пектиновых веществ. Разрушение отмерших растений происходит при активном участии микроорганизмов, вызывающих брожение пектиновых межклеточных веществ, связывающих растительные клетки. При нагревании пектиновые вещества приобретают студневидную консистенцию (пектис — студень). Возбудители этого брожения — Cl. pectinovorum — спорообразующие подвижные крупные палочки. Большое практическое значение пектиновокислое брожение имеет при мочке волокнистых растений (льна, конопли).
Спиртовое брожение вызывается дрожжевыми грибами, разлагающими сахара ферментом зимазой с образованием этилового сп-ирта и углекислоты, по следующему уравнению:
СеН12О6 = 2СН3СН2ОН + 2СО2 + 27 ккал.
Дикие дрожжи широко распространены в природе, они живут на цветах, листьях и стеблях растений, особенно в большом количестве на плодах. Культурные дрожжи используются в хлебопечении. Кефир изготовляется также с участием дрожжей. Вся промышленность по изго-70
товйёййЮ Этилового спирта, различных вин, пива основана на деятельности дрожжей. В животноводстве применяются жидкие и сухие кормовые дрожжи, богатые белками, жиром и витаминами.
Saccharomyces cerevisiae — пекарские, хлебные дрожжи — представляют собой овальные клетки величиной 8—10 мкм. Эти дрожжи вызывают верховое и низовое брожение. Верховое брожение происходит при температуре 14—24 °C с обильным выделением газа, при этом дрожжи поднимаются вверх, образуя пленку. Этот вид брожения используется в хлебопечении и виноделии. Низовое брожение протекает при температуре 4—10 °C , дрожжи размножаются медленно в нижних слоях, используется в пивоварении.
Tarula utilis — кормовые дрожжи — крупные, круглые клетки, обладающие энергичным ростом, цитоплазма их богата жиром. Torula kephir — кефирные дрожжи — овальные и круглые клетки, сосредоточивающиеся в кефире колониями.
Молочнокислое брожение. Микробиологический характер этого процесса установил Л. Пастер. В результате молочнокислого брожения, главным образом сахара, а также многоатомные спирты и белки расщепляются до молочной кислоты. Схематически этот процесс можно представить следующим уравнением:
С6Н12О6 = 2С3НбО3 (молочная кислота).
Молочнокислое брожение — анаэробный процесс, протекающий без кислорода. Оно давно и широко используется человеком для изготовления различных молочных продуктов — масла, сыра, кефира, кумыса, простокваши. Приготовление силоса, квашение и соление овощей основано также на молочнокислом брожении. Возбудители этого брожения весьма широко распространены в природе, их обнаруживают в почве, воде, воздухе, на растениях, в животноводческих помещениях, на коже животных, в жилых помещениях.
Streptococcus lactis — шарообразные или овальные клетки этого микроба располагаются попарно, но чаще цепочками; образует 0,8—1 % молочной кислоты. Bact. bulgaricum впервые выделена И. И. Мечниковым из болгарской простокваши; это неподвижная длинная, не образующая спор палочка, оптимальная температура для нее 40—-48 °C, накапливает 3—3,5% молочной кислоты. Bact. acidophilum — морфологически и физиологически сходна с болгарской палочкой. Bact. casei — неподвижная палочка, встречаются короткие и длинные формы, располагающиеся цепочками. Bact. Delbrucki — неподвижная, длинная, бесспоровая палочка, накапливает более 2 % молочной кислоты, а в среде с мелом до 10 %, в промышленных условиях является продуцентом молочной кислоты. Bact. brassicum — основной возбудитель брожения при сквашивании капусты, накапливает около 2 % молочной кислоты. Bact. cucumeris fermentati — возбудитель брожения при засолке огурцов, накапливает 1 % молочной кислоты.
Все молочнокислые бактерии являются антагонистами гнилостных микробов. На этом основано применение диетических молочнокислых продуктов для профилактики и лечения желудочно-кишечных заболеваний, вызванных гнилостными микробами у человека и новорожденных животных.
Уксуснокислое окисление — микробиологический процесс окисления этилового спирта в уксусную кислоту. Природу его впервые установил Л. Пастер, доказав ведущую роль в нем бактерий. Последние широко распространены в природе, их обнаруживают в почве, воздухе, на растениях, в жилых помещениях и на животноводческих фермах.
Род уксуснокислых бактерий — Acetobacter — состоит из 11 видов, среди них главной является Bact. aceti — уксусная палочка. Это непо-
71
движная, короткая, бесспоровая, аэробная палочка, располагается изолированно, но чаще длинными цепочками.
При длительном хранении пива, сухих (не крепленных спиртом) вин на их поверхности появляется морщинистая пленка, носящая название «уксусная матка», или Mycoderma aceti. Она состоит из трех наиболее распространенных в природе уксуснокислых бактерий — Acetobacter-асе-ti, A. pasteurianum и A. kiitringianum. В промышленности уксус получают с использованием этих бактерий путем размножения их на буковых опилках, обильно увлажненных раствором этилового спирта.
Уксуснокислое брожение имеет важное практическое значение при силосовании кормов.
Маслянокислое брожение впервые изучил Л. Пастер, вызывается оно маслянокислыми микробами, разлагающими углеводы с образованием масляной кислоты, по следующему суммарному уравнению:
СбН12Об - СН3-СН2.СН2СООН + 2СО2 + 2Н2 + 20 ккал
Маслянокислые микробы в большинстве анаэробы, они широко распространены в природе, их обнаруживают в почве, воде, воздухе, на растениях, продуктах питания и кормах. Одновременно с углеводами они разлагают жиры и белки, при этом вначале образуются промежуточные продукты — пировиноградная кислота, уксусный альдегид, затем масляная кислота и побочные продукты — ацетон, бутиловый спирт, углекислота, водород. Маслянокислое брожение вызывает около 25 видов микроорганизмов.
Основные из них: Cl. pasteurianum, Cl. pectinovorum, Cl. felsineum. Это подвижные крупные палочки с закругленными концами, образуют споры, приобретая характерную веретенообразную форму. В цитоплазме этих микробов содержится гликоген и гранулеза, поэтому они хорошо окрашиваются раствором йода в синий и бурый цвет. Споры микробов весьма устойчивы к теплу и могут переносить стерилизацию при температуре 120 °C, оставаясь живыми, например, в мясных и рыбных консервах. Размножаясь в консервах, они образуют газы, вызывающие вздутие банок (бомбаж). Одновременно в этих продуктах накапливаются и ядовитые вещества. Поэтому консервы с бомбажем в пищу непригодны.
Маслянокислое брожение нередко является причиной прогоркания семян подсолнечника, сои, прогоркание растительных масел и жиров животного происхождения. При накапливании в силосе масляной кислоты в количестве 0,3—0,4 % он плохо поедается животными. Маслянокислые микробы участвуют в самосогревании влажного зерна, сена.
фор входит в состав белков и липоидов. Особенно много его в ядрах клеток, головном мозге человека и животных. Микроорганизмы, участвующие в превращении фосфора, живут в почве, воде. Их роль сводится к двум процессам: минерализации фосфора, входящего в состав органических веществ, и превращению'фосфорнокислых солей из слаборастворимых в хорошо растворимые. Минерализацию фосфора вызывают гнилостные бактерии, в частности Вас. megatherium. Образующаяся при этом фосфорная кислота связывается со щелочами почвы и превращается в слаборастворимые соли кальция, железа, магния и, следовательно, малодоступные для растений. В дальнейшем под действием почвенных кислотообразующих бактерий, особенно нитрифицирующих, эти соли превращаются в растворимые соединения фосфорной кислоты, доступные для растений.
Железо входит в состав белка гемоглобина, содержащегося в эритроцитах. Этим объясняется его важная роль в прдцессе дыхания человека и животных.
; Г
г-
- < '> V! 1. '
Основные представители железобактерий — нитчатые бактерии родов Crenotrix, Chlamydothrix, Cladothrix. Эти бактерии представляют длинные нити, покрытые общим слизистым влагалищем, в котором отлагается гидрат окиси железа. После отмирания бактерий образуется болотная и озерная железная руда, залегающая островами в десятки и сотни квадратных метров. Железобактериям принадлежит важная роль в образовании железомарганцевых отложений в природе.
В состав белка растительного и животного происхождения входит и сера, этим объясняется важность этого элемента в круговороте веществ.
Бактерии, усваивающие соединения серы, называют серобактериями. Живут они в почве, воде, навозе. При разложении в почве органических серосодержащих веществ, а также при восстановлении солей серной, сернистой и серноватистой кислот образуется сероводород, ядовитый для растений и животных. Этот газ превращается в безвредные, доступные для растений соединения серобактериями.
Различают серобактерии бесцветные и пурпурные. У последних в цитоплазме содержится пигмент бактериопурпупин, обладающий действием, сходным с хлорофиллом растений. Поэтому пурпурные бактерии могут синтезировать серу, используя солнечную энергию.
ВЛИЯНИЕ ФАКТОРОВ ВНЕШНЕЙ СРЕДЫ НА МИКРООРГАНИЗМЫ
ВЛИЯНИЕ ФИЗИЧЕСКИХ ФАКТОРОВ
Влияние температуры. Микробы обладают по сравнению с высшими организмами значительно большей приспособляемостью к температурным условиям. Так, некоторые виды сохраняют жизнеспособность при —190 °C, а споры при —253 °C. Для каждого вида микробов существуют температурные границы, определяющие интенсивность их развития — минимум, оптимум и максимум.
Микроорганизмы по их адаптации к определенным температурным условиям объединяют в три физиологические группы: психрофилы (греч. psichros — холодный, philein — любить), мезофилы (mesos — средний) и термофилы (termos — теплый).
Психрофильные микроорганизмы — обитатели холодных источников, глубоких озер и океанов с оптимальной температурой 15— 20 °C. Рост их возможен в пределах от 0° (минимум)-до 30—35 °C (максимум). К ним относят светящиеся бактерии, некоторые железобактерии и др.
Мезофильные бактерии живут при средних температурах с оптимумом 30—37°, минимумом от 3° и максимумом до 45—50 °C. К ним относят большинство сапрофитов и все патогенные микроорганизмы.
Термофильные бактерии развиваются нормально при высоких температурах (максимум до 70—80°, оптимум 50—65° и минимум 28—35 °C). Они часто и в большом количестве встречаются в почве и воде, в теплых минеральных источниках, сточных водах, навозе, молоке и экскрементах человека и животных. Высокими температурами осуществляется стерилизация (лат. sterilis — бесплодный), которая заключается в полном уничтожении живых как вегетативных, так и споровых форм микроорганизмов. Существует несколько способов стерилизации: прокаливание на огне, кипячение, стерилизация сухим жаром, стерилизация паром под давлением, текучим паром, тиндализация, пастеризация.
Влияние высушивания. Высушивание, приводящее к обезвоживанию, действует губительно на микроорганизмы. Вследствие обезвоживания жизненные процессы в бактериальной клетке сильно ослабевают, процесс размножения приостанавливается. Споровые же формы микро
73
бов в высушенном состоянии могут сохраняться многие годы (Вас. anthracis, CL tetani и др.). Жизненные функции спор находятся в покое, количество свободной воды в них значительно уменьшено (до 40%), оболочки уплотнены. Поэтому для спор высушивание не является фактором, нарушающим их физиологическое состояние. Более чувствительны к высыханию вегетативные формы бактерий.
В лабораторной практике для сохранения микробных культур широко применяют метод лиофилизации. Это процесс высушивания из замороженного состояния под вакуумом. При этом свободная вода и вода, непрочно связанная с гидрофильными веществами клеток, подвергается замораживанию и затем происходит сублимация льда, то есть переход его из твердого состояния в парообразное, минуя жидкую фазу. После этого остается сухая пористая масса, которая при добавлении к ней воды легко суспендируется. Этим методом высушивают вакцины, лечебные и диагностические сыворотки, бактериофаги, антибиотики и другие биопрепараты.
Влияние на бактерии гидростатического давления. Многие микроорганизмы хорошо растут и размножаются в условиях обычного атмосферного давления. Однако микробы, обитающие в глубинах океана ив нефтяных скважинах (баротолерантные), также хорошо развиваются в условиях значительно большего гидростатического давления (200— 300 атм). При давлении выше 500 атм, как правило, микроорганизмы расти не могут. Правда, встречаются бактерии, которые выдерживают более высокое давление. Известно, например, что на самом дне Тихого и Индийского океанов, где давление достигает 1160 кг/см2, живут и размножаются некоторые виды бактерий. Особенно высокая устойчивость выражена у спор (до 20 000 атм),
При изучении ингибирующего влияния высокого гидростатического давления установлено, что в таких условиях денатурируется ряд важных ферментов клетки, а также нарушается функция цитоплазматической мембраны.
Действие различных типов излучения на микроорганизмы. Действие видимого света (300—1000 нм). Способностью использовать энергию видимого света обладают окрашенные формы организмов. Микроорганизмы, не имеющие пигмента, можно искусственно сделать чувствительными к видимому свету, если окрасить их метиленовой синькой, эозином и др. Это явление обычно называют фотосенсибилизацией, а действие — фотодинамическим.
Действие космических и рентгеновских лучей. Эти ионизирующие излучения (длина волны от 0,006 до 10 нм) обычно оказывают летальное или мутагенное действие на микроорганизмы. К действию таких лучей наиболее чувствительны ядерные структуры, и в частности нуклеиновые кислоты, хотя повреждается также и цитоплазма. Обычно поражаются гены, в результате чего возникают мутации. Микроорганизмы к действию ионизирующих излучений наиболее чувствительны в присутствии кислорода. Кроме того, на разрушительное действие ионизирующих излучений большое влияние оказывают температура и pH среды.
Действие ультрафиолетовых лучей. По сравнению с ионизирующими излучениями ультрафиолетовые лучи (100—380 нм) обладают меньшей энергией и, поглощаясь веществом, вызывают не ионизацию, а возбуждение молекул, то есть переход электронов на более высокий энергетический уровень. Ультрафиолетовые лучи с длиной волны 260—300 нм обладают либо летальным, либо мутагенным действием, в цепях ДНК между остатками тимина образуются ковалентные связи, что приводит к частичному или полному подавлению репликации ДНК. Облучение ультрафиолетом в микробных клетках вызывает также повреждения рибонуклеиновых кислот (особенно м-РНК)» 74
Повреждения, вызываемые ультрафиолетовыми лучами, частично обратимы, особенно если микроорганизмы обработать светом большой интенсивности (длина волны 320—400 нм). При этом многие из микробов, которые могли бы погибнуть, оказываются жизнеспособными. Этот процесс носит название фотореактивации — происходит синтез или активация определенных ферментов, ускоряющих разрыв связей в димерах тимина. Ультрафиолетовое облучение применяют для обеззараживания воздуха и предметов в помещениях, в лабораториях и промышленных цехах (бродильной промышленности, производства антибиотиков и др.), а также создания асептических условий посевов.
Влияние электричества. Происхождение постоянного или переменного тока через культуру микроорганизмов само по себе, вероятно, оказывает весьма слабое действие. Установлено, что длительное пропускание тока высокого напряжения может привести к электрофорезу некоторых компонентов среды. Возникающие при этом соединения оказывают инактивирующее действие на микробную клетку. Кроме того, прохождение электрического тока сопровождается повышением температуры среды, действующей губительно на микроорганизмы.
Влияние ультразвука. Ультразвуковые волны, то есть волны с частотой колебаний более 20 000 Гц/с, не воспринимаемые человеком, являются бактерицидными. Механизм бактерицидного действия объясняется в основном двумя теориями: кавитационной механической и кавитационной электрохимической. Первая из них заключается в том, что при прохождении ультразвуковых волн через жидкость в местах разряжения образуются кавитационные пузырьки, которые заполняются парами жидкости. При внезапном сжатии кавитационного пузырька в жидкости (вблизи поверхности пузырька), возникает огромное давление порядка 10 000 атм. Происходящий при этом «удар» и вызывает механическое разрушение и гибель бактерий. Интенсивность ультразвука, необходимая для образования кавитации, составляет 0,3—0,5 Вт/см2 поверхности вибратора.
Вторая теория (электрохимическая) объясняется возникновением в кавитационных полостях озвучиваемой водной среды больших электрических напряжений и появлением гидроксильных радикалов и атомарного водорода (И. Е. Элпинер, 1955). Экспериментально доказано, что при частотах колебаний 1—1,3 мГц через 5—10 мин погибают все бактерии. В настоящее время ультразвук применяют для стерилизации пищевых продуктов, изготовления вакцин и дезинфекции предметов.
Аэроионизация используется для оздоровления цехов предприятий, жилых помещений, а также в медицинской и ветеринарной практике. Аэроионы, несущие положительный или отрицательный заряд, возникают в результате искусственной или естественной ионизации воздуха. Наибольшее влияние на бактерий оказывают отрицательно заряженные ионы, они действуют уже в средних концентрациях (5-Ю4 в 1 см3 воздуха). Аэроионы положительные задерживают рост бактерий лишь в больших концентрациях (106). Сила действия ионов зависит от дозы — числа аэроионов на 1 см3 воздуха, длительности экспозиции, расстояния от источника ионов.
ДЕЙСТВИЕ ХИМИЧЕСКИХ ВЕЩЕСТВ
Ядовитые вещества, попадая в бактериальную клетку, взаимодействуют с ее жизненно важными компонентами и нарушают их функции. Это вызывает остановку роста микроорганизма (бактериостатическое действие) или его гибель (бактерицидное действие). Действие химических веществ на микроорганизмы зависит от природы вещества, физико-химического состава среды, концентрации, продолжительности контакта, температуры.
75
Бактерицидным действием обладают химические вещества различных групп: кислоты, щелочи, спирты, поверхностно-активные вещества, фенолы и их производные, соли тяжелых металлов, окислители, группа формальдегида, газообразные вещества и др. Большое разнообразие природы и химической структуры указанных веществ обусловливает и различные механизмы их бактерицидного действия на микробную клетку.
Бактерицидное действие кислот зависит от их электролитической диссоциации, то есть концентрации Н-ионов в растворах и их окисляющего действия. Чувствительность к кислотам различна у разных микроорганизмов. Так, показано, что если оптимальная концентрация Н-ионов для Cl. botulinum соответствует 7,6, то при доведении pH до 4,6 наступает гибель этих бактерий. Самое низкое значение pH, при которой еще наблюдался рост, — это 4,8; при pH 4,7 могут прорастать только споры, а при pH 4,6 наступает прекращение роста вообще.
Бактерицидная активность едких щелочей зависит от степени диссоциации и концентрации ОН-ионов. Наибольшей бактерицидной силой обладает КОН, затем следуют NaOH и другие щелочи. Так же как и в отношении кислот, бактерии обладают определенной щелочной устойчивостью.
Спирты. При разведении спирт приобретает бактерицидные свойства, причем наибольшей бактерицидностью обладает 70 %-ный спирт. Более высокие концентрации свертывают белок, который выпадает на поверхности бактерий и уменьшает проникновение спирта в глубь клетки. Бактерицидность спиртов увеличивается с возрастанием молекулярной массы в ряду: метиловый — этиловый — пропиловый — бутиловый — амиловый ит. д.
Поверхностно-активные вещества — это жирные кислоты, мыла, детергенты. Все они изменяют энергетические соотношения на поверхности раздела, устремляются к поверхности раздела клетки и повреждают клеточную оболочку, не затрагивая внутренних структур клетки.
Красители. К красителям с бактерицидными свойствами относят бриллиантовый зеленый, этакридин, флавакридин и др. В основе их действия лежит выраженное сродство с фосфорнокислыми группами нуклеопротеидов.
Фенолы и их производные первоначально повреждают клеточную стенку, а затем и белки бактериальной клетки.
Соли тяжелых металлов (свинец, медь, цинк, серебро, ртуть) и их соли оказывают коагулирующее влияние на цитоплазму либо на ферментные системы, связывая их сульфгидрильные группы.
Окислители — хлор, йод, марганцовокислый калий, перекись водорода и др., окисляют существенные компоненты цитоплазмы (сульфгидрильные группы активных белков, фенольные, тиоэтильные, индольные, аминные).
Формальдегид также денатурирует белки, он убивает как вегетативные формы, так и споры. Его применяют для обезвреживания дифтерийного и столбнячного токсинов, благодаря чему они превращаются в анатоксины.
Химические вещества (хлор, формальдегид, щелочи, кислоты, фенол и др.) используются в практике в качестве дезинфицирующих веществ. Дезинфекция заключается в уничтожении патогенных микробов. К ней обычно прибегают для обеззараживания помещений, скотных дворов, территории.
Оценка качества проведенной профилактической или вынужденной дезинфекции животноводческих помещений при заболеваниях, возбудители которых относятся к неспорообразующим микробам, осуществляется бактериологическим контролем. Методика основана на выделении с поверхности обеззараживаемых объектов кишечной палочки (Е. coli,
76
Citrovorum aerogenes) и стафилококка (Staph, albus, aureus, citreus). По наличию кишечной палочки определяют качество дезинфекции при паратифозных инфекциях, роже свиней, бруцеллезе, пастереллезе, а по наличию стафилококка — качество дезинфекции при лептоспирозе и туберкулезе.
Для бактериологического исследования после проведения дезинфекции пробы берут стерильным тампоном с 10—20 различных участков поверхности полов, стойл и проходов, со стен и т. п. и помещают их в стерильный нейтрализующий раствор.
При использовании для дезинфекции раствора едкого натра в качестве нейтрализующего раствора берут раствор уксусной кислоты, при дезинфекции формалином — раствор нашатырного спирта, при дезинфекции хлорной известью — раствор гипосульфита и при дезинфекции щелочным раствором формальдегида — смесь растворов уксусной кислоты и нашатырного спирта. Отмытые от дезинфектанта и нейтрализующего раствора осадки высевают на видоизмененную среду Хейфеца (для индикаций кишечной палочки) или 50 %-ный сахарозный мясо-пептон-ный бульон (для индикации стафилококка) и через сутки учитывают результат. Готовят нейтрализующие растворы в концентрации, в 10 раз меньшей, чем концентрация применяемого дезинфектанта.
Действие химиотерапевтических препаратов. В отличие от дезинфицирующих веществ химиотерапевтические препараты избирательно действуют на микробов, не оказывая в лечебных дозах вредного влияния на клетки и органы больного животного. Эти препараты поражают определенные виды микробов (специфический спектр действия), оказывая дезорганизующее действие на ферментативные системы клеток. В результате микробная клетка или не размножается (бактериостатическое действие), или погибает (бактерицидное действие).
ДЕЙСТВИЕ БИОЛОГИЧЕСКИХ
АКТОРОВ
I *
Действие биологических факторов проявляется, прежде всего в антагонизме микробов, когда продукты жизнедеятельности одних микробов обусловливают гибель других. С проблемой микробного антагонизма непрерывно связано современное учение об антибиотиках.
Антибиотики (греч. anti — против, bios — жизнь) — вещества микробного, животного и растительного происхождения, подавляющие развитие и биохимическую активность чувствительных к ним микробов.
По происхождению антибиотики можно разделить на следующие группы.
1. Антибиотики, выделенные из грибов. Наиболее активными продуцентами антибиотиков являются плесневые грибы и актиномицеты. Плесень пенициллиум образует широко используемый антибиотик пенициллин, а аспергиллус и мукор — фумигации, аспергиллин и клавицин. Большинство антибиотиков выделено из актиномицетов: стрептомицин, тетрациклины, хлоромицетин, биомицин, неомицин, нистатин, стрепто-трицин и др.
2. Антибиотики, выделенные из бактерий. Продуцентами этой группы антибиотиков являются разнообразные бактерии. В основном это сапрофиты с интенсивно выраженной биохимической активностью, обитающие в почве. К названной группе антибиотиков, имеющих наибольшее значение, относят грамицидин и грамицидин С, пиоцианин, субти-лин, бацитрацин, полимиксины. Эффективность у них значительно ниже, чем у антибиотиков грибного и актиномицетного происхождения.
3. Антибиотики животного происхождения. В биологическом отношении к антибиотикам близки некоторые вещества, выделяемые животными тканями, способные избирательно поражать отдельные виды микробов. К ним относится эритрин, выделяемый из эритроцитов различных
77
животных, и экмолин, полученный из тканей рыб. Последний активен в отношении стафилококков, стрептококков и др.
4. Антимикробные вещества высших растений. Ядовитые летучие вещества, выделяемые высшими растениями, были открыты Б. П. Токи-ным в 1928 г. Эти вещества он назвал фитонцидами. Они обладают антибактериальными свойствами и рассматриваются многими учеными как антибиотики растительного происхождения. Вследствие своей нестойкости они до сих пор не выделены в чистом виде, что является препятствием для широкого применения в лечебной практике.
Наиболее сильной бактерицидностью обладают лук и чеснок, а также хрен, горчица, алоэ, крапива, можжевельник, почки березы, листья черемухи. Антимикробное действие фитонцидов обусловлено различными продуктами жизнедеятельности растительных организмов: эфирных масел, глюкозидов, органических кислот, дубильных веществ, смол и др.
Химическая природа антибиотиков весьма разнообразна. Они отличаются друг от друга химической структурой и биологическими свойствами. Антибиотики, выделенные из грибов, относятся к сложным, преимущественно циклическим, соединениям. Антибиотики из бактерий являются полипептидами.
Противомикробная активность антибиотиков определяется по подавлению роста чувствительных тест-микробов на жидких питательных средах методом серийных разделений или на чашках с плотной питательной средой. В качестве тест-микробов используют: для пенициллина — золотистый стафилококк № 209, для стрептомицина — Вас. subtilis, Вас. mycoides, Е. coli и т. д.
Противомикробная активность антибиотиков измеряется тем наименьшим количеством препарата, которое оказывает антимикробное действие и выражается в международных единицах. За международную единицу (ME) пенициллина принимают наименьшее количество препарата, подавляющего рост эталонного штамма стафилококка. В настоящее время единицы действия антибиотиков выражают в микрограммах сухого вещества. Так, за единицу пенициллина принимают 0,6 мкг чистой кристаллической соли, за единицу стрептомицина — 1 мкг чистого сухого препарата и т. д.
По механизму действия на микробов антибиотические вещества делятся на бактерицидные (пенициллин, стрептомицин, грамицидин) и бактериостатические (другие антибиотики). В малых концентрациях антибиотики могут действовать бактериостатически, в больших — бактерицидно.
Все известные антибиотики по их действию на микробов можно условно разделить на две большие группы: 1) нарушающие синтез клеточной стенки и ее мембран; 2) нарушающие синтез ДНК, РНК и белка. Так, пенициллин подавляет синтез полимеров, входящих в состав клеточной стенки, изменяет обмен белков и нуклеопротеидов. Стрептомицин и другие антибиотики этого класса нарушают проницаемость клеточных мембран. Вступая в соединение с ДНК и РНК, они нарушают считывание генетического кода в процессе синтеза белка. Антибиотики обладают избирательным действием на микроорганизмы, то есть имеют определенный антимикробный спектр действия. Одни антибиотики активны к грамположительным, другие — к грамотрицательным, а некоторые подавляют рост тех и других; имеются антибиотики, губительно действующие на грибы, но не активные против бактерий.
У фитонцидов — своя специфичность: сок того или иного растения губительно влияет на одни микробы и безвреден для других. Практически фитонциды оказались эффективными при лечении инфицированных ран, амёбной дизентерии и др.
Назначение антибиотиков требует соблюдения некоторых условий: правильный выбор лекарственного вещества и рациональная его дози-78.
ровка в соответствии с чувствительностью макроорганизма, недопустимость слишком длительного применения одного и того же антибиотика, контроль за действием его в организме и в случае необходимости своевременная замена другим препаратом.
Применение антибиотиков без учета этих требований может сопровождаться различными осложнениями. Так, в результате интенсивной длительной терапии антибиотиками при пероральном введении может повлечь за собой резкое изменение обычного состава микрофлоры желудочно-кишечного тракта. При этом возникает так называемый дисбактериоз, при котором наряду с микробами — возбудителями болезни — подавляются группы нормальной микрофлоры. В связи с угнетением естественных антагонистов возможны секундарные инфекции. В желудочно-кишечном тракте могут активизироваться условнопатогенные бактерии — стафилококки, протей, дрожжевой гриб (Candida albicans) и др. Ко многим антибиотикам развивается аллергия.
Устойчивость микробов к антибиотикам. Особое значение для результатов антибиотикотерапии имеет возникновение устЬйчивых форм микроорганизмов. Некоторые микроорганизмы при воздействии на них бактериостатических или суббактерицидных доз антибиотика снижают или даже полностью утрачивают чувствительность к данному препарату. Этот процесс рассматривается как развитие устойчивости, или появление резистентности. Антибиотикорезистентность, как правило, носит специфический характер, то есть у микроорганизма возникает устойчивость только по отношению к тому антибиотику, воздействию которого он подвергался, или к антибиотикам, родственным по биологическим свойствам (перекрестная устойчивость). Так, резистентность, возникшая к тетрациклину, может создавать резистентность к другим антибиотикам тетрациклинового ряда.
Механизм образования устойчивых форм микроорганизмов довольно сложный. Некоторые виды микробов обладают способностью вырабатывать адаптивные ферменты, разрушающие химиопрепарат, например пенициллиназу, разлагающую пенициллин. Такого типа ферменты, вероятно, образуются и против других антибиотиков. Кроме того, микробная клетка обладает способностью увеличивать синтез естественных метаболитов, ингибирующих действие антиметаболитов химиопрепаратов. Например, устойчивые к сульфаниламидам микробы усиленно вырабатывают парааминобензойную кислоту, и эти бактерии становятся нечувствительными к данному препарату. Резистентность к антибиотикам может формироваться в результате мутаций, а также трансформации, трансдукции и конъюгации.
Целый ряд микробов под влиянием антибиотиков образуют резистентные L-формы. У антибиотикоустойчивых микробов изменяются ферментативные свойства и антигенная структура. Устойчивые формы бактерий (например, стафилококки) приобретают более высокую степень вирулентности и контагиозности.
Приспособление микроорганизма к антибиотику может быть настолько выражено, что он способен расти только в присутствии данного препарата. Такие виды микробов или отдельные штаммы называются антибиотикозависимыми. Возникновение резистентных штаммов микробов снижает или даже полностью исключает возможность применения с лечебной целью антибиотиков и других химиотерапевтических препаратов. Чтобы предупредить возникновение резистентности при лечении больных животных, назначают комбинированное лечение разными антибиотиками или антибиотиками и химическими средствами. При такой схеме антибиотикотерапии наблюдается синергидное их действие. Например, применение стрептомицина и пенициллина, их сочетание с экмо-лином значительно увеличивает лечебный эффект этих препаратов и предупреждает возникновение антибиотикоустойчивости.
79
Бактериофаги. Противомикробное действие оказывают посредством лизиса микробной клетки. Открыты они д’Эррелем в 1917 г. В настоящее
время известны фаги почти у всех патогенных и многих непатогенных микроорганизмов. Их выделяют из воды, почвы, сточных вод, организма животных и человека, молока, испражнений, из лабораторных культур микробов.
Фаг обладает хорошо выраженными антигенными свойствами. При парентеральном введении фага в организме образуются антитела, нейтрализующие литическую активность фага и обладающие высокой специфичностью. По антигенным свойствам фаги делят на серологические ва
рианты.
По степени специфичности фаги могут быть разделены на три группы: полифаги лизируют родственных бактерий, монофаги— бактерий одного вида, а фаговары — только определенные варианты данного вида бактерий. Фаги обладают большой адаптивной способностью, один вид фага можно адаптировать к действию на другие виды бактерий путем пассирования.
Большинство фагов инактивируется при температуре 65—70 °C. Более низкая температура снижает активность фага. Относительно легко фаги переносят замораживание при —185 °C, а также хорошо выдерживают высушивание. К дезинфицирующим веществам фаг более устойчив, чем бактерии.
Взаимодействие фага и бактерий. Фаг действует только на живые клетки бактерий в процессе их активного роста. В зависимости от характера проявляемого действия различают вирулентные и умеренные фаги. Вирулентные фаги при проникновении в клетку бактерий размножаются в ней и вызывают лизис; умеренные фаги не вызывают лизиса, а остаются в состоянии лизогении (рис. 46).
Процесс взаимодействия фага с клеткой осуществляется в несколько фаз. В клеточной стенке бактерий расположены рецепторные участки, на которых и адсорбируются соответствующие фаги. Фаги прикрепля
ются к поверхности клетки концевыми нитями отростков.
После адсорбции ДНК-фага через отросток проникает в бактериальную клетку. У некоторых фагов на конце отростка обнаружен фермент лизоцим, вызывающий разрушение ригидного мукополимерного слоя бактерии, способствующий проникновению вируса в клетку.
После внедрения фаговой ДНК внутрь бактериальной клетки в течение скрытого периода фаговые частицы не обнаруживаются. В этот период в бактериальной клетке начинаются синтезы фаговой информационной РНК, внутреннего белка фага и так называемых ранних белков фага, которые участвуют в биосинтезе фаговой ДНК. ДНК фаг можно обнаружить в клетке через 8—9 мин. К 12-й минуте синтез ранних белков прекращается, а синтез ДНК и структурных белков фага
продолжается до конца латентного периода.
Последний этап размножения фага завершается формированием зрелых частиц путем соединения белковой части с молекулами фаговой ДНК. затем наступает лизис зараженных бактерий лизоцимом, накапливающимся внутри клетки в процессе репродукции фага. Количество зрелых фаговых частиц у разных клеток различно— от единиц до нескольких тысяч. Частицы фага из разрушенных клеток высвобождаются и вновь внедряются в еще не зараженные клетки и, таким образом, процесс бактериофагии повторяется.
При контакте умеренного фага с микробной клеткой последняя не лизируется и становится носителем бактериофага. Подобное сожительство бактериальной клетки с фагом называют лизогенией, а культуры, которые являются носителями фага, — лизогенными культурами. В таких культурах умеренный фаг находится в форме профага. Частиц фага в клетке нет, а имеется лишь ДНК-фага, в которой заложена генетиче-
80
Шаговая ДНК
Рис. 46. Схема развития вирулентного фага в восприимчивой бактериальной клетке.
ская информация, необходимая для его образования. ДНК-фага связана с наследственным аппаратом бактериальной клетки и в таком состоянии может передаваться из поколения в поколение вместе с делящейся клеткой.
В неблагоприятных для лизогенной культуры условиях (ультрафиолетовое облучение, действие ядовитых веществ) профаг переходит в вегетативную форму, быстро репродуцируется и клетка разрушается.
Выделение и титрование фагов. Для выделения фагов обычно используют испражнения животных, гной ран, сточные воды, молоко, старые культуры и другие субстраты. Суспензии фильтруют через мелкопористые фильтры. Затем фильтрат вносят в соответствующие молодые культуры бактерий. При наличии фага в испытуемом материале бактерии растворяются, жидкость просветляется, а на поверхности агара на месте нанесения фильтратов образуются «стерильные пятна».
Бактериофаг проверяют на чистоту, специфичность, а также опре-. деляют его титр. Титром бактериофага называется то его наибольшее разведение, которое способно вызывать растворение соответствующих бактерий.
Практическое применение бактериофага. В связи с высоким специфическим действием бактериофаги нашли широкое применение для дифференциации и индикации бактерий. Например, бактериофаг применяют для идентификации возбудителя сибирской язвы в культурах, например, методом стекающей капли по поверхности скошенного агара. Этот метод может быть использован для определения сибиреязвенного возбудителя в комплексе с другими принятыми методами исследования при данном заболевании. Фагодиагностику проводят при
?
6—Ветеринарная микробиология fil
многих инфекционных болезнях (сальмонеллезы, колибактериоз, бруцеллез, пастереллез, рожа свиней и др.).
С помощью фага возможна также индикация патогенных бактерий во внешней среде (вода, выделения животных, пищевые продукты и другие субстраты) с помощью реакции нарастания титра фага.
В исследуемую воду или другой субстрат добавляют определенное количество индикаторного фага, исходя из того, что фаг размножается > благодаря высокой специфичности на гомологичных бактериях. Если в воде искомые гомологичные бактерии имеются, то в результате контакта и заражения их индикаторным фагом последний в них размножается, что будет установлено путем нарастания титра индикаторного фага.
В лабораторной практике при проведении эпидемиологического и эпизоотологического анализа используется фаготипирование бактериальных культур (брюшнотифозных, дизентерийных, стафилококковых, рожистых и др.) с целью уточнения источников и путей распространения инфекционных заболеваний.
В ряде случаев фаг является эффективным средством терапии и профилактики многих инфекционных заболеваний (гнойные и анаэробные инфекции, паратиф и колибактериоз телят и поросят, пуллороз цыплят и др.).
Важным биологическим фактором, губительно действующим преимущественно на родственные микробные клетки, являются бактерио-цины, они синтезируются представителями всех семейств и называются по виду бактерий — колицины (синтезируемые Е. coli), туберкулоцины (синтезируемые М. tuberculosis) и т. п.
УЧЕНИЕ ОБ ИНФЕКЦИИ И ИММУНИТЕТЕ У
Окружающая среда, кожный покров и выстланные слизистой оболочкой полости тела животных постоянно заселены множеством микробов, значительная часть которых находится в симбиозе с макроорганизмом, то есть их существование тесно связано с жизнью хозяина.
Симбиотические образования могут быть выгодными для обоих организмов (мутуалистическими) или лишь для одного из них (паразитическими), причем в первом случае складываются благоприятные условия для питания и защиты симбионтов. В связи с этим микробы постепенно и последовательно адаптируются к определенным условиям обитания в организме, занимают определенные физико-химические ниши. Например, пищеварительный тракт животных заселяет специализированная по ферментативной активности микрофлора, которая, получая энергию из поступающих в организм питательных веществ или метаболитов организма и защиту от перепадов температуры и влажности, помогает животному утилизировать корма, участвует в формировании лимфоидной системы кишечника и создает неблагоприятные условия для выживания многих патогенных микробов.
Взаимозависимость партнеров при таком типе симбиоза приводит к появлению постоянной популяции микробов, то есть нормальной для желудочно-кишечного тракта. Эта микрофлора адаптировалась к метатрофному типу питания, добывая необходимые для роста и развития вещества из мертвых органических соединений.
Во втором случае микроб постепенно приспосабливается к обмену веществ организма-хозяина, что связано с проникновением микроба внутрь клетки животного, переживанием и размножением в ней. Причем степень зависимости микроба от макроорганизма обусловлена степенью использования метаболизма хозяина. Например, вирусы и риккетсии являются облигатными, а микобактерии, листерии, сальмонеллы, пастерел-лы, ерсинии, бруцеллы и франциселлы — факультативными внутрикле
82
точными паразитами. При этом паразитизм вирусов обусловлен полным отсутствием автономного синтеза, а хламидий — частичным. У последних отсутствует лишь собственный энергетический обмен, из-за чего данную форму симбиоза называют энергетическим паразитизмом. Поскольку паразиты высоко специализировались к определенным тканям и клеткам, размножение их приводит к деструкции клеток, нарушению функционирования целых систем животного организма, то есть сопровождается болезнетворным или патогенным действием.
Некоторые микроорганизмы, например клостридии ботулизма, несовершенные грибы, ведя сапрофитический образ жизни, своими метаболитами токсически воздействуют на животного. Таким образом, в организм может проникать целый ряд микробов паразитов или сапрофитов (их токсинов), обладающих болезнетворными свойствами. Эта особенность у них закодирована в хромосоме, она передается по наследству, поэтому данные микроорганизмы именуют возбудителями тех или иных болезней.
Однако при определенных условиях патогенетическое значение приобретает нормальная микрофлора организма животного, из-за чего она получила название условнопатогенной. Как известно, это становится возможным благодаря внехромосомным факторам наследственности, детерминирующим определенные признаки патогенности бактерий.
Наличие плазмид, контролирующих штаммовые различия по антагонистической активности (бактериоциногения), множественной лекарственной устойчивости (прежде всего к антибиотикам), ответственных за синтез поверхностных антигенов (К-88, К-99) избирательно способствует выживанию в организме хозяина токсигенных микробов.
Из описанного следует, что инфекционная патология не обязательно должна быть связана с непосредственным внедрением в организм микроба-паразита или его метаболитов; патогенетические признаки микробам-симбионтам передаются и трансмиссивными факторами наследственности.
Организм животного не остается безучастным к поражающим факторам микробов. Его внешние покровы, особенности обмена веществ, специализированные внутренние механизмы защиты создают постоянное противодействие патогенному микроорганизму. Но способность противостоять болезнетворности микроба у каждого организма выражена по-своему; в большей степени она зависит от окружающей симбионтов среды, поскольку к действию внешних факторов весьма чувствительны как макро-, так и микроорганизмы.
ИНФЕКЦИЯ
Под инфекцией (лат. inficio — заражать, infecto — отравлять) подразумевается совокупность процессов, происходящих в макроорганизме при внедрении и размножении в нем патогенных микробов. Эволюционно сложившееся взаимодействие животного организма и болезнетворного микроба в определенных условиях окружающей среды, сопровождаемое явным или скрытым нарушением постоянства внутренней среды организма, называется инфекционным процессом.
Обусловленные в основном специфичностью паразита и состоянием барьерных механизмов хозяина инфекции могут протекать локализован-но или. генерал изованно. В последнем случае бактерии лишь транспортируются кровотоком (бактериемия), размножаются в крови (сепсис) или^новременнофаспространяются кровькГи размноЖитотопг^ейЦойл^ тйкопиемия). Пиемическаяинфекция при этом характеризуется очаго-вымГразКШожением микробов в органах, формированием в них гнойных очагов. Иногда микроб остается на месте внедрения, а вырабатываемый
6*
83
им токсин отравляет весь организм как, например, клостридии столбняка. Такие инфекции называют токсиноинфекциями.
По числу микробов, вызывающих инфекционный процесс, инфекции делят на простые, или моноинфекции, если они вызываются одним видом возбудителя, и смешанные, если они вызываются двумя или большим числом видов микробов.
По последовательности включения одного и того же возбудителя в процесс инфекции подразделяют на суперинфекции, если заболевание возобновляется до выздоровления животного, реинфекции, если организм заражается повторно уже после перенесенного заболевания. В отличие от последнего вида инфекции, возникающие повторно за счет оставшихся в организме возбудителей, то есть без повторного заражения, обозначают как рецидив болезни.
При включении в уже развившийся процесс нового возбудителя инфекцию называют вторичной, или секундарной, Примером данного вида инфекции служит чума свиней, вызываемая вирусом и осложняемая сальмонеллой суипестифер — сочетание настолько воспроизводимое, что сальмонеллу первоначально приняли за возбудителя чумы (отсюда и ее название).
В зависимости от происхождения возбудители инфекции бывают экзогенные (возбудитель поступает из внешних источников) и эндогенные (реализуются патогенные потенции находящихся в организме микробов обычно при ослаблении резистентности).
Наиболее яркое клиническое проявление инфекционного процесса называют инфекционной болезнью, которая отличается от заболеваний иной природы наличием специфической причины — живого возбудителя, специфической реакцией на него организма животного, приобретением переболевшим организмом невосприимчивости к повторному заражению данным микробом, а также заразностью.
В ряде случаев после выздоровления в организме животного длительное время сохраняется микроб. Это состояние называется микро-боносителъством и имеет важное эпизоотологическое и социальное значение, так как микробоносители могут быть источником инфекций, а Полученные от них продукты — источником пищевых отравлений.
Подчеркивая специфическую роль микроорганизмов в возникновении инфекции, Генле и Кох разработали критерии, известные как триада Коха, необходимые для признания микроба возбудителем определенной болезни: микроб должен всегда встречаться только при данном, а не при другом заболевании и тем более не в здоровом организме (1); он должен быть получен в чистой культуре (2), которая способна экспериментально воспроизвести заболевание, соответствующее естественно протекающей форме болезни (3).
Хотя современные представления о возбудителях инфекционных болезней не совсем укладываются в рамки требований триады, историческая ее роль заключается в мобилизации внимания исследователей к изучению свойств болезнетворных микроорганизмов. Накопленные сведения позволяют вычленять возбудителей из общей массы микробов, характеризовать их специфические функции.
ПАТОГЕННОСТЬ И ВИРУЛЕНТНОСТЬ t
В результате длительного приспособления к условиям существования в (на) организме животного или растений возбудители болезней приобрели специфическую функцию болезнетворности, то есть патогенности. Это свойство в полной мере выявляется только в организме животного, хотя большая часть бактерий, актиномицетов, микроскопических грибов может переживать и даже размножаться во внешней среде.
84
Данная функция присуща микробу до тех пор, пока в геноме сохраняются неизменными детерминирующие ее факторы наследственности, то есть она является генетическим признаком возбудителей болезней. Поэтому под патогенностью понимают потенциальную способность микробов вызывать инфекционный процесс. Патогенность является эволюционно закрепленной характеристикой вида. Например, среди микробов обширного рода Bacillus патогенными для млекопитающих являются лишь Вас. anthracis и в меньшей степени — Вас. cereus, другие .бациллы болезнетворными свойствами не обладают.
Однако в пределах вида патогенность каждого штамма микроба может колебаться. Для характеристики степени патогенности определенного штамма микроба предложен термин вирулентность (лат. virulentus — ядовитый). Вирулентность, таким образом, характеризует индивидуальное качество патогенного микроба, его способность реализовать свойства патогенности при определенных условиях зараже
ния животных.
Измеряют вирулентность в условно таииятых единипах, выражаю-щих_детальныиДл атГПИаТПз — смертельный) мнотифицирующий эф-фект^атОгатБГк микробов по отношению к экспериментальным живот-ным. Наиболее точно вирулентность определяют количеством микробов. убивающих 50 % (ЬР^)~идшинфицирующих 50-%—(ID50) взятых в опыт животныхГТПервый показатель обычно используют для характеристики степени патогенности возбудителей острых инфекционных заболеваний, второй — для определения вирулентности возбудителей хронических инфекций. Обе эти единицы всегда должны сопровождаться описанием конкретных условий их определения. Кроме характеристики особенностей культивирования микроба, обязательно следует указывать вид, линию, возраст, массу, условия содержания подопытных животных и способ их заражения. Необходимость подробной информации об условиях определения вирулентности микробов вызвана, с одной стороны, неодинаковой чувствительностью к микроорганизму животных, с другой — изменчивостью вирулентности микробов под влиянием различных факторов среды обитания.
В силу последнего обстоятельства вирулентность микробов можно повысить или ослабить.
Повышение степени патогенности достигается многократным пасса-< 1|И .. ..JIWIIIM— цм_ lirLill —4UI-WIII —
жем болезнетворных микробов через организм чувствительного живот-ного. введения в .микробную клетку фрагментов нуклеиновых кислот, определяющих патогенность путем естественного генетического обмена .. — W Illi * Wl*>l W I*' MW П1И11ЭД1" - •
или посОДШПм методов генной инженерии, а также обработкой экзо-продуктов тйксигеннои микрофлоры протеолитическими ферментами
_ ill *• -MKrtHflir-Anir Т...-3 1—-1Й ULI 111 I I 'I "I1...II WlWII^I mill, ! Il Ihllllll . * Т|.1ВИ|Д II* , II микробного илтГЖГГЗОТного происхождения.
УсилениевирулеИтности путем пассажа возбудителя через организм
чувствительного животного продемонстрировано классическими опытами Луи Пастера на моделях: вирус бешенства — кролик, возбудитель рожи свиней — голубь. Примерами усиления вирулентности микробов путем генетического обмена могут быть случаи повышения вирулентности пневмококков посредством трансформации (передача участков ДНК капсулообразующего пневмококка), а эшерихий посредством конъюгации (передача умеренно токсигенному штамму плазмиды, контролирующей синтез К-антигена) или трансдукции (передача способности к биосинтезу токсина нетоксигенному штамму Cl. botulinum типа D конвертирующим фагом, выделенным из культуры токсигенной клостридии типа С).
Усиление токсигенности под действием протеолитических ферментов можно наблюдать у Cl. perfringens при естественной ассоциации с возбудителями гниения (например, сардинами) или при искусственном воздействии ферментом животного происхождения (например, трипсином).
85
Связан этот эффект со способностью протеаз активировать протоксины, то есть предшественники эпсилон-токсина типов В и D и йота-токсина типа Е Cl. perfringens.
Представление о реальных возможностях усиления вирулентности микроорганизмов имеет практическое значение при разработке биометодов борьбы с вредными насекомыми, мышевидными грызунами, а также при постановке биопробы для установления патогенности выделенных микробов. Знание путей повышения степени патогенности возбудителей болезни постоянно используется при поддержании музейных культур, особенно производственных штаммов, предназначенных для изготовления диагностических и лечебных сывороток.
Ослабление вирулентности микроорганизмов необходимо^основнем при изготевленкгсвакцинных препаратов. Ослабить вирулентность бактерий можно биологическими, химическими и физическими методами.— Из биологическихмётбдоъ’стойкога^сТГаШёТО^ лее эффективным является многократный дассаж микробов через, орга-низмкнечувствительных к ним животных. Таким путём была ослаблена вирулентность возбудителя рожи свиней при пассаже через организм кролика и возбудителя пастереллеза птиц при пассаже через организм травяной лягушки. В лабораторных условиях можно ослабить вирулентность культивированием микробов на питательных средах, содержащих специфические иммунные сыворотки или желчь животных. Так, французские исследователи Кальметт и Герен в результате 13-летнего культивирования возбудителя туберкулеза на глицериновом картофеле, содержащем бычью желчь, получили вакцинный штамм микобактерии, названный БЦЖ (BCG — Bacterium Calmett—Guerin).
Ослабление вирулентности бактерий достигается добавлением к культуральным средам таких химических веществ, как фенол, двухромовокислый калий, сулема, перекись водорода и другие мутагены. Благодаря стойкому изменению свойств ДНК-нуклеоида такие микроорганизмы утрачивают исходную вирулентность, что позволяет их использовать в качестве вакцинных штаммов.
Французским ученым Рамоном впервые разработан способ обезвреживания бактериальных токсинов химическими веществами. После обработки формальдегидом в небольших концентрациях экзотоксины теряют ядовитость, но сохраняют антигенные свойства и способность вырабатывать соответствующие антитела при введении в организм животного.
Физинескими факторами, способствующими снижению вирулентности микроорганизмов, являются свет. в_ысу_шивание, высокая температура. Первая вакцина ветеринарного назначеншГбшта^ благодаря случайному открытию возможности ослабления вирулентности путем длительного выращивания возбудителя пастереллеза кур вне организма на искусственной питательной среде при широком доступе света и кислорода воздуха. В последующем им были получены вакцины против сибирской язвы путем длительного выращивания возбудителя при температуре 42,5 °C и вакцина против бешенства с применением щадящих методов высушивания вируссодержащих тканей животного. На основании этих опытов Пастером были сформулированы принципы ате-нуации, то есть стойкого ослабления вирулентности микробов, которые лежат в основе современной технологии изготовления вакцинных препаратов.
Патогенный микроб в процессе длительной эволюции приобрел способность проникать в организм чувствительного животного, преодолевать его защитные системы и нарушать нормальное функционирование физиологических систем. Для этого в отличие от непатогенных микроорганизмов возбудители болезней обладают инвазивностью и токсиген-носхью.
86
Инвазивность (лат. invasio — нашествие, нападение) — способность микроба преодолевать защитные приспособления организма”)! размножаться в нем. Благодаря этой способности патогенный микроб может проникнуть в организм, выжить в нем и увеличить размеры своей популяции. С учетом выживания возбудителя во внешней среде при передаче другому организму данный атрибут (существенный признак) патогенности обусловливает способность микроба вызывать инфекционный процесс в естественных условиях, то есть инфективность, или заразительность.
Реализуются инвазивные способности возбудителя обычно в начале инфекционного процесса, когда он протекает еще бессимптомно. Осуществляются инвазивные свойства патогенного микроба при помощи ферментов, расщепляющих соединения, мешающие микробу про’нйкать, распространяться и выживать в меняющихся условиях организма, а так-же благодаря поверхностным структу£ам,^дю^^ шитныхсистем организма.
Т одцлх£н н о cj^b, или токсичность (греч. taxicum — яд и лат. genus —происхождение), — способность микроба продуцировать вещества, нарушающиепостоянство внутренней среды организма путем изменения его метаболических функций.
' В результатеэтого атрибута патогенный микроб вызывает специфический синдром поражения, а также гибель организма. Реализуется способность на заключительных стадиях инфекционного процесса, когда в организме накапливается достаточное количество токсических веществ. Осуществляются хоксигшгныесвойств а патогенных микробов за счет, их ядовитых мета^юдитсщДэкз^ со-
единений (эндотоксинов). Первые влияют на проявление^симптш^комхс-. Лекса забрлевйцпЫс^^ ванно.
Инвазивность и токсигенность характеризуются относительной самостоятельностью и способностью изменяться независимо друг от друга. При наличии обоих атрибутов бактерии способны вызывать генерализованный инфекционный процесс; при наличии у микробов только токси-генных свойств возможны системные поражения. Бактерии, обладающие только инвазивностью, представляют опасность для формирования локальных инфекционных процессов или носительства.
Отмеченные особенности взаимодействия патогенных бактерий с макроорганизмом обусловлены структурно-функциональными свойствами факторов патогенности.
ФАКТОРЫ ПАТОГЕННОСТИ МИКРОБОВ
Под факторами патогенности понимают приспособительные механизмы болезнетворных микробов к меняющимся условиям макроорганизма, синтезируемые в виде специализированных структурных или функциональных молекул, при помощи которых они участвуют в осуществлении инфекционного процесса. В настоящее время их можно разделить по функциональному значению на четыре группы: 1) микробные ферменты, деполимиризующие структуры, препятствующие проникнове-ншо нераспространению возбудителя в микроорганизме: 2) поверхностные' структуры. бактерий, способствующие акроорга.-
нйзм^ЗЬпов^ж цйтарным действием- _4) Факторыдятхдэджцгтис циеи.
При этом факторы патогенности первых трех групп обусловливают инвазивность, последней— токсичность патогенных микроорганизмов. Однако механизмы реализации свойств факторов каждой группы различны.
87
Бактериальные ферменты, деполимиризующие структуры, препятствующие проникновению и распространению возбудителя. На пути внедрения микробов в организм постоянно встречаются структуры, препятствующие их проникновению и распространению. Эти структуры представлены полимерными молекулами мукополисахаридов (как, например, гиалуроновая кислота), гликопротеинов (сиаловые кислоты), дезоксирибонуклеиновой кислотой (ДНК-лейкоцитов), молекулами белка (фибрина) или полипептида (коллагена). Играя определенную роль в поддержании гомеостаза, эти структуры выполняют барьерную функцию в. про-тивоинфекционной защите, физически препятствуя распространению возбудителей болезней. Для их преодоления у патогенных микроорганизмов выработался целый ряд ферментов, специфически разрушающих полимерные структуры, то есть деполимеризующих их. В результате вязкость среды снижается, что способствует внедрению и распространению микробов.
Учитывая выраженную субстратспецифичность ферментов, определенные условия для проявления их активности (pH, наличие Са или Mg++) и локализацию структур, предполагают, что распространение микробов может быть повсеместным, а также ограничено воспалительным очагом или отдельной системой. Патогенные микроорганизмы со слабо выраженными факторами чаще вызывают локальные инфекционные процессы (например, микобактерии туберкулеза, пиогенный стрептококк). Поэтому в данную группу факторов патогенности можно объединить микробные ферменты, обусловливающие диффузионную (лат. diffusio — распространение, расширение) активность бактерий за счет специфического расщепления субстрата. Сюда относят бактериальные нейраменидазу, ДНК-азу, гиалуронидазу, коллагеназу, фибринолизин и им подобные ферменты.
Нейраминидаза отщепляет от различных углеводов связанные с ни-
ми гликозидной связью концевые сиаловые кислоты. По существу, это
фермент сиалидаза, деполимиризующая соответствующие поверхностные
структуры эпителиальных и других клеток организма и разжижающая назальный секрет, муцинозный слой кишечника. Синтезируется она па-стереллами, ерсиниями, некоторыми клостридиями, стрепто-, диплококками, вибрионами и др.
ДНК-аза (дезоксирибонуклеаза) деполимеризует нуклеиновую кислоту, обычно появляющуюся при разрушении лейкоцитов в воспалительном очаге на месте внедрения микробов. Продуцируется фермент стафилококками, стрептококками, клостридиями и некоторыми другими микробами.
Гиалуронидаза расщепляет гиалуроновую кислоту, богато представленную в межклеточных пространствах макроорганизма. Синтезируют этот фермент Cl. perfringens, гемолитические стрептококки, бруцеллы.
Коллагеназа гидролизует входящие в состав коллагена, желатина и других соединений пептиды, содержащие пролин. В результате расщепления коллагеновых структур наступает расплавление мышечной ткани. Вырабатывают фермент клостридии злокачественного тока, особенно обильно Cl. histolyticum.
Фибринолизин превращает плазминоген в протеолитический фермент плазмин, который растворяет фибрин, чем способствует распространению возбудителей в очаге воспаления. Биосинтез фермента установлен у стрептококков, стафилококков и ерсиний.
Поверхностные структуры, способствующие закреплению бактерий в макроорганизме. Из многочисленных структур поверхности бактерий лишь недавно стали выделять факторы патогенности, способствующие закреплению возбудителя в макроорганизме. Это прежде всего относится к обитателям открытых полостей организма, в частности к эшери-хиям, выделенным от больных кишечной формой колибактериоза сви
ней и телят. Штаммы эшерихий К-88 и К-99 продуцируют соответствующие белковые поверхностные антигены, сообщающие бактериям выраженные адгезивные свойства, то есть способность прилипать. Благодаря именно этим поверхностным структурам бактерии прикрепляются к слизистой тонкого, а не толстого кишечника (где они обычно скапливаются в большом количестве) и, таким образом, колонизируют передние отрезки пищеварительного канала.
Укрепившись в слизистой оболочке, они могут продуцировать токсины и поражать организм, не выходя за пределы пищеварительной трубки. В эксперименте показано, что эшерихии даже с умеренной ток-сигенностью с помощью этих поверхностных структур вызывают сильно выраженную диарею.
На свойстве адгезивности в настоящее время разрабатывают методы оценки энтеропатогенности эшерихий.
Поверхностные структуры бактерий, обладающих антифагоцитар-ным действием. Поверхностные структуры клеток имеют непосредственное отношение к патогенности, поскольку они отражают особенности строения ДНК-бактерий. Поверхностная локализация этих структур сама по себе предполагает неизбежность контакта противомикробных факторов именно с ними. Поэтому поверхностные структуры прежде всего должны выполнять защитную роль для микробной клетки, то есть противостоять действию циркулирующих в кровотоке противомикробных, белков и клеток. Не случайно многие из них образуются только в организме животного или на соответствующих средах.
В действительности поверхностные структуры микробов широко используются в качестве естественных маркеров при разработке методов индикации и идентификации возбудителей болезней, а также при подборе вакцинных штаммов микроорганизмов.
В этой группе факторов патогенности представлены постоянные и временные структурные образования поверхности микробной клетки, которые защищают бактерии от фагоцитоза. Химическая природа и механизм антифагоцитарного действия данных структур у разных бактерий неодинаковы. Поэтому целесообразно сгруппировать их в зависимости от того, на какой стадии фагоцитоза преимущественно проявляется их защитное (для микроба) действие — в процессе хемотаксиса, опсонизации или переваривания микроорганизмов.
К антихемотоксическим факторам можно отнести прежде всего корд-^.фактор микобактерий туберкулеза. Это производное миколовой кислоты (трегалозо-б-б'-димиколат) является токсической структурой поверхности микробной клетки и угнетает подвижность нейтрофилов. Сходным, но также еще не до конца выясненным механизмом, видимо, обладают структурно-связанные с поверхностью клетки коринебактерий (С. ovis или С. pseudotuberculosis) коринемиколовые кислоты с меньшим числом атомов углерода, чем в миколовой кислоте.
фа&то&ам следует отнести поверхностные антигенные структуры кокков: капсульные полисахариды пневмококков, МТпротеин стрептококков группы А и особенно протеин А стафилококков. Все они обладают повышенным сродством к Бс^фрагментам иммуноглобулинов, за счет чего способны присоединять молекулы обычно IgG без соответствующих антител к ним. Образовавшийся комплекс капсульного вещества с иммуноглобулином, в свою очередь, фиксирует комплемент. Таким образом, из циркуляции выводятся иммуноглобулины и комплемент, являющиеся основными опсоническими и хемотаксическими факторами организма. В результате фагоцитарная реакция резко снижается.
Иммунодепрессивный эффект этих факторов усиливается возможностью самостоятельного участия поверхностных структур кокков в активации альтернативного пути комплемента. Возможно также подавляю
89
I
щее действие факторов данной группы (например, протеина А стафилококков) непосредственно на лимфоциты из-за конкурентного связывания : с Fc-фрагментами иммуноглобулиновых рецепторов на их внешних мембранах.
У некоторых грамотрицательных бактерий поверхностные антигены,, представленные кислыми полисахаридами (К-антиген, Vi-антиген), спо-: собны блокировать фиксацию комплемента. В результате ослабляется опсонизирующий эффект последнего и предотвращается лизис бактерий, обработанных антителами.
К этой же группе факторов патогенности можно причислить нетоксичные неантигенные капсульные структуры некоторых стрептококков (например, группы А), построенные из гиалуроновой кислоты. Ввиду общности с межклеточным веществом макроорганизма они, вероятно, не распознаются хозяином и остаются нефагоцитабельными.
Своеобразный защитный экран от гуморальных и клеточных факторов организма образуют патогенные стафилококки, продуцирующие коагулазу. Под действием плазмокоагулазы фибриноген плазмы переводится в фибрин, который тут же оседает на поверхность клетки в виде капсулы. Микроб, покрытый собственным белком организма, не распознается как чужеродный, опсонические факторы лишаются возможности рецептировать с его поверхностными структурами, и фагоцитоз снижается.
Наконец, поверхностные структуры некоторых микроорганизмов, не влияя на другие звенья фагоцитарной системы, защищают бактерий от переваривания. Так, капсульное вещество сибиреязвенного микроба почти целиком состоит из полипептида d-глутаминовой кислоты, то есть из, оптического изомера аминокислоты, обычно в природе не встречающегося. Поэтому у травоядных животных, видимо, еще не выработались внутриклеточные ферменты, способные разрушать эти соединения.
Данный фактор патогенности сибиреязвенного микроба настолько важен, что его используют в качестве критерия для оценки степени вирулентности возбудителя сибирской яЗвы, а в медицинской и ветеринарной практике успешно используются вакцины (СТИ и ВГНКИ) против этой болезни, представляющие собой взвесь жизнеспосбных спор бес-капсульных штаммов сибиреязвенных бацилл. Подобно капсульному веществу предыдущих микроорганизмов поверхностные белковые и липопротеиновые V—W-антигены способствуют выживанию и размножению ерсиний внутри моноцитов, а образующиеся в последующем капсулы (так называемая фракция F-1) •—в нейтрофилах лабораторных животных.
Близко по механизму антифагоцитарного действия и капсульное вещество пневмококков. Оно представлено, правда, полисахаридом, но построено из повторяющихся сахаров в основном правовращающих. Особенно вирулентными и резистентными к внутриклеточному перевариванию считаются пневмококки III типа, капсульное вещество которых состоит из целлобиуроновой кислоты (дисахарида — соединенных р-1,4-гликозидной связью d-глюкуроновой кислоты и d-глюкозы). Защищают от переваривания фагоцитами и полисахаридные детерминанты О-антигена (эндотоксина) грамотрицательных бактерий.
Таким образом, поверхностно локализованные структуры бактериальной клетки обладают выраженным противофагоцитарным эффектом, поэтому подавляющее фагоцитоз действие их проявляется в основном на различных звеньях системы клеточной защиты, хотя в ряде случаев поверхностные факторы патогенности влияют на несколько звеньев этой системы одновременно. Последнее важно учитывать при исследовании антифагоцитарного действия факторов патогенности бактерий.
Факторы патогенности с токсической функцией. В отличие от описанных факторов токсические вещества бактерий, нарушая структуры 90
СООН
Липид Й
Остоё R
Рис. 47. Субъединицы липополисахарида (ЛПС) энтеробактерий.
или функции макроорганизма, обусловливают развитие специфических патологических признаков и даже гибель пораженных животных. Поэтому их считают основными факторами патогенности.
Раньше токсические вещества, входящие в качестве структур клеточной стенки бактерий, называли эндотоксинами, а выделяемые за пределы микробной клетки вещества — экзотоксинами. Однако подразделение токсинов по локализации оказалось неправильным, поскольку в ряде случаев внутри клеток содержится больше экзотоксина, чем в культуральной жидкости, а концентрация эндотоксина в окружающей среде подчас превышает таковую в поверхностных структурах бактериальной клетки. К тому же у некоторых бактерий токсические вещества расположены не в стенке, а непосредственно на клеточной мембране.
Тем не менее прежнее название бактериальных токсинов укоренилось, что, вероятно, связано с их структурными и функциональными различиями.
Эндотоксины — это мицелиевидные биомолекулы стенки грамотрицательных бактерий, представляющие комплексное соединение липополисахарида (ЛПС) с белком. Они относятся к структурным соединениям и определяют антигенную активность бактериальной клетки, являясь так называемым соматическим, или О-антигеном. Белковая часть эндотоксина усиливает антигенные свойства сложной молекулы, специфичность которых определяется концевыми участками полисахаридов.
Липополисахаридная часть биомолекулы построена в среднем из трех мономерных субъединиц ЛПС, каждая из которых состоит из липида А, базисной структуры (остов R) и О-замещенных боковых цепей полисахарида (рис. 47).
Липид А следует непосредственно за слоем рыхло упакованных молекул белка и состоит из двух остатков глюкозамина, этерифицированных длинноцепочечными жирными кислотами — лауриновой, миристиновой, пальмитиновой, 3-ОН-тетрадекановой, додекановой, гексадекановой. Он осуществляет гидрофобное взаимодействие с липопротеидом внешней мембраны бактериальной клетки и одновременно углеводным компонентом 2-кето-3-дез оксиокта нов ой кислоты (КДО) связан с базисной структурой.
Базисная структура включает три-четыре вида сахаров ((глюкоза, галактоза, глю-козамин) и два необычных соединения — КДО и гептозу. Она соединена с гидрофильной частью ЛПС — длинной О-замещенной боковой цепью, обычно построенной из повторяющихся в различной последовательности трех-шести моносахаров (рамнозы, маннозы, галактозы, глюкозы, глюкозамина и галактозамина). Однако встречаются отдельные штаммы бактерий, боковые цепи ЛПС которых представлены гомополисахаридами, состоящими только из маннозы (например, Е. coli 08 и 09). Эти концевые участки полисахарида выступают на расстоянии около 30 нм над поверхностью микробной клетки в качестве детерминант О-антигена.
Липополисахаридная фракция является носителем основных биологических свойств эндотоксина. Она обладает пирогенными, токсичными, иммуногенными, антикомплементарными и митогенными свойствами, причем биологическая активность эндотоксина связана в основном с липидом А.
Пирогенность, то есть повышение температуры тела животных, эндотоксином осуществляется опосредованно: токсины высвобождают эн-
91
n
догенные пирогенные вещества из гранулоцитов, моноцитов и макрофагов, которые непосредственным воздействием на регулирующий центр в головном мозге повышают температуру. У взрослой лошади или кролика повышается температура незначительными дозами очищенного ЛПС — всего 0,001 мг. Пирогенное действие ЛПС не зависит от видовой принадлежности мцкробов, то есть носит неспецифический характер.
Эндотоксины повышают порозность мелких кровеносных сосудов, выход из капилляров и разрушение лейкоцитов с образованием новых пирогенов, что свидетельствует о них как воспалительных агентах.
Взаимодействуя непосредственно с третьим компонентом комплемента СЗ, эндотоксин активирует комплемент по альтернативному пути. В связи с этим он вызывает системную и локальную анафилаксию, что может завершаться шоком или феноменом Шварцмана. Антикомплемен-тарное действие эндотоксина приводит к снижению в организме концентрации основных хемотаксических и опсонизирующих факторов. Липополисахарид к тому же ингибирует дыхательную функцию митохондрий клеток печени и сердца лабораторных животных. При этом токсический эффект эндотоксина также не связан с видовой принадлежностью микроорганизмов и, видимо, обусловлен общей структурой токсофорной группы, предположительно обусловленной липидным компонентом. Благодаря именно этому компоненту эндотоксин взаимодействует с гидрофобными аминокислотами гликопротеина, являющегося, вероятно, основной структурой сложного клеточного рецептора для эндотоксина грамотрицательных бактерий. Предполагают, что связывание эндотоксина с клеточными рецепторами осуществляют карбоновые кислоты.
Липид А вместе с тем обладает стимулирующим действием на резистентность организма. Он избирательно усиливает митоз и пролиферацию в плазматические клетки В-лимфоцитов, пролонгирует действие антигена, тормозя его поступление в предшественники антителопродуцирующих клеток. Эндотоксины являются также активными неспецифическими индукторами интерферона, вызывая его максимальную продукцию уже через 2 ч.
Из-за стимулирующего действия эндотоксина наступающая сразу после введения ЛПС резкая чувствительность мышей к заражению энтеробактериями снижается примерно в 1000 раз уже через 24 ч и сохраняется 3—5 дней.
Однако липидный участок ЛПС, очевидно, не связан с инвазивными свойствами грамотрицательных бактерий, потому что менее вирулентные R-формы бактерий, сохраняющие липид А и базисную часть полисахарида, обычно более легко и быстро разрушаются гуморальными факторами резистентности организма и ферментами фагоцитов. Поэтому вряд лй возможна реализация токсических свойств ЛПС вариантными, негладкими формами энтеробактерий и других грамотрицательных микроорганизмов, что не позволяет рассматривать бактериальный липополисахарид как фактор патогенности с чисто токсической функцией.
Экзотоксины в отличие от эндотоксинов обладают выраженным специфическим токсическим действием, в большинстве своем характерным для определенных видов микробов.
Основная часть экзотоксинов секретируется в окружающую микробную клетку— среду культивирования — и может вызвать патологический эффект в отсутствие клетки-продуцента. Другие экзотоксины частично (лейкоцидины стафилококков и стрептококков, тетаноспазмин, ботулинические нейротоксины) или полностью (гемолизин пневмококков, лейкоцидин синегнойной палочки, энтеротоксин Cl. perfringens, эн-томопатогенный токсин Вас. thuringiensis) связываются с микробной клеткой, причем биосинтез последних двух токсинов связан с процессом споруляции у микробов.
лл
Специфическое действие этих факторов патогенности обусловлено в основном белками. При этом такие токсины, как ботулинические, синтезируются в форме одноцепочечного полипептида предшественника (протоксина), который под действием протеолитических ферментов превращается в токсическую систему, состоящую из связанных фрагментов протоксина. Тетаноспазмин в активной форме представлен димером, а каждый входящий в его состав мономер построен из двух полипептид-ных цепей, соединенных дисульфидной связью. Наконец, молекула экзотоксина сибиреязвенного микроба представляет собой смесь из трех нетоксичных компонентов, которая токсична только в макрокомплексной организации.
Многокомпонентность активированного экзотоксина не случайна. Она необходима для реализации двух обязательных функций молекулы — рецепторной и активаторной. Первая выполняет связь молекулы токсина с клеточным рецептором макроорганизма, вторая осуществляет специфическую активность молекулы. Однако рецепторный компонент токсической молекулы по молекулярной массе обычно почти вдвое превышает активаторный компонент и имеет универсальное строение. Строение активаторного компонента каждого белкового токсина в основном уникально, с чем, вероятно, и связана специфичность действия экзотоксинов.
В качестве рецепторов для многих экзотоксинов служат специфические образования на внешней мембране эритроцитов, клеток мозга и различных внутренних органов, составленные из двухатомного аминоалкоголя сфингозина, жирных и нейраминовых кислот. Гликосфинголипиды, содержащие сиаловые кислоты, называют ганглиозидами. Почти все ганглиозиды имеют стабильную гидрофобную часть, представленную углеводородами преимущественно стеариновой кислоты, и варьирующую углеводную часть. Углеводный компонент обусловливает различие в строении ганглиозидов, и, видимо, связь с молекулой токсина, тогда как роль липидного компонента, вероятно, сводится к участию в реализации специфической функции токсина.
Важно отметить, что многие патогенные бактерии синтезируют по нескольку экзотоксинов, особенно с гемолитической активностью. В то же время разные типы одного и того же вида микроба могут продуцировать различные токсические продукты, причем независимо от сходного конечного эффекта механизм повреждающего действия токсинов зачастую бывает неодинаковым. Отличающиеся по своему действию экзотоксины одного вида микроба принято обозначать малыми буквами греческого алфавита — а (альфа), р (бета), у (гамма), S (дельта), е (эпсилон), г] (эта), 0 (тета), i (йота), х (каппа), X (лямбда), ц (мю), v (ню), а гомологичные токсины, различающиеся по антигенным свойствам — заглавными буквами латинского алфавита — А, В, С, D и т. д. По последним называют соответствующий тип токсинопродуцирующего микроба, то есть серовар.
По основному феноменологическому проявлению повреждающего действия экзотоксины подразделяют на гемолизины, лейкоцидины, нейротоксины, энтеротоксины и гистотоксины.
Гемолизины — токсические вещества, лизирующие мембраны эритроцитов животных. Вырабатываются преимущественно грамположитель-ными бактериями. Некоторые из них обладают фосфатазной (лецитиназной или сфингомиелиназной) активностью, которая оптимально проявляется при температуре тела животного и в присутствии ионов Са2+ и Mg2+. Сюда относят р-гемолизин Staph, aureus, гемолизин Coryne-bacterium ovis, а-гемолизии Cl. perfringens, p- и у-токсины Cl. novyi.
Поскольку эти ферменты катализируют гидролитическое расщепление липопротеинов, которые локализованы во внешних мембранах многих клеток макроорганизма, поражающее действие гемолизинов не огра-
93
ничивается разрушением только эритроцитов. Так, а-гемолизинGE рег-fringens лизирует эритроциты, лейкоциты и тучные клетки, что сопровождается повышением концентрации в крови гистамина.
Среди бактериальных гемолизинов выделяют группу разрушающих эритроциты токсинов, специфическая активность которых легко подавляется кислородом и для регенерации требует обработки восстановите* лей (например, цистеина). Эти гемолизины вызывают в основном внутрисосудистое разрушение эритроцитов животных. Как и фосфатидазы, они одновременно способны к токсическому действию на лейкоциты, макрофаги, тромбоциты и клетки миокарда.
Описанными свойствами обладают О-стрептолизин гноеродного стрептококка, а-пневмолизин пневмонийного диплококка, гемолизин листерий, 0-гемолизин Cl. perfringens, тетанолизин столбнячного микроба, цереолизин Вас. cereus, тюрингиолизин Вас. thuringiensis.
Токсическое действие на мембраны эритроцитов и некоторых других клеток оказывают не активируемые цистеином а-, £- и у-гемолизи-ны стафилококка, S-стрептолизин, а- и р-гемолизины патогенных эше-рихий.
Следует отметить, что литическое действие гемолизинов различного происхождения и разных типов по отношению к эритроцитам различных животных проявляется неодинаково. На этом принципе основано тестирование разнотипных бактериальных гемолизинов.
Лейкоцидины — экзотоксины бактерий, избирательно лизирующие поли- и мононуклеарные лейкоциты путем изменения их проницаемости. Считают, что механизм цитотоксического действия лейкоцидинов заключается в активации ими К+-зависимой ацилфосфатазы лейкоцитарных мембран, благодаря чему изменяется их проницаемость и повышается выход из клеток глюкозы и ионов К+ Лейкоцидины обнаружены как частично или полностью связанные токсины с клетками золотистого стафилококка, гноеродного стрептококка и синегнойной палочки.
Нейротоксины — термолабильные токсические вещества бактерий, обладающие повышенным сродством к нервной ткани. Одни из них обладают выраженной тропностью к центральной нервной ткани (тетанолизин) , другие — к периферической (ботулинические нейротоксины), третьи («мышиный» токсин чумного микроба) —к отдельным звеньям симпатической нервной системы, четвертые (Е-токсин CL perfringens) — к нейрогуморальной системе, регулирующей расход гликогена в печени.
Нейротоксины бутолинического микроба неоднородны в антигенном отношении. По этому признаку их подразделяют на типы А, В, С (Ci и С2), D, Е, F и G, причем в патологии животных (водоплавающей птицы, пушных зверей, рогатого скота и лошадей) наибольшее значение имеют токсины типов Ci, С2 и D. Ботулинические нейротоксины повышают проницаемость внешних мембран а-моторных нейронов передних рогов спинного мозга путем снижения уровня их поляризации, что приводит к параличу мышечной ткани.
Тетанолизин Cl. tetani по аксонам проникает в центральную нерв-вую систему, фиксируется на концевых пластинках синапсов и изменяет активность а- и у-мотонейронов, что приводит к извращению процесса передачи нервного импульса на мышечное волокно, вызывая их напряжение.
Нейротоксины чумного микроба повреждают прежде всего адреналовую систему путем торможения потребления кислорода митохондриями надпочечников. В результате снижается уровень гликогена, свободных жирных кислот, инсулина в крови. Е-токсин Cl. perfringens во многом приводит к обратным процессам в организме, вызывая специфический неврологический синдром при дизентерии животных.
Основными методами идентификации нейротоксинов являются реакции нейтрализации и иммунофлуоресценции.
94
.ci Эктеротоксины — преимущественно низкомолекулярные, устойчивые к действию протеолитических ферментов желудочно-кишечного тракта белки, вызывающие диарею у животных. К ним относят термолабильные (холероген, HL-энтеротоксины эшерихий, энтеротоксин Cl. perfringens типов А и С) и термостабильные (энтеротоксины золотистого стафилококка, HS-энтеротоксин эшерихий и энтеротоксин пневмонийных клебсиелл) экзопродукты энтеротропного действия.
Механизм повреждающего действия их заключается в основном в способности повышать проницаемость сосудов и выход жидкости, ионов натрия и хлоридов в просвет кишечника, нарушать обменные процессы в митохондриях, активировать аденилциклазу клеток слизистой оболочки тонкого отдела кишечника, вызывать повреждение верхушечных участков ворсинок кишечника, слущивание эпителия, нарушение всасывания воды из кишечника, что приводит к развитию диарей.
Механизм, например, холерогена и подобного ему по действию термолабильного энтеротоксина эшерихий после связывания со специфическими рецепторами мембран эпителиальных клеток тонкой кишки сводится к активации мембранной аденилатциклазы. Это приводит к возрастанию концентрации аденозинмонофосфата (АМФ) в клетках, в результате чего повышается выход электролитов и воды из клеток. Потеря жидкости тканями обусловливает ацидоз и шок. Дальнейшая потеря жидкости и электролитов может привести животное к гибели.
Некоторые энтеротоксины (например, HL- и HS-токсины эшерихий) одновременно обладают цитотоксическим и дермонекротическим действием.
Свойства вызывать проницаемость капилляров, дилатацию кишечника, выпот в него жидкости, цитотоксический и рвотный эффекты используются для обнаружения энтеротоксинов в тестах изолированной петли кишечника, биопробы на котятах, цитопатогенного действия на культуру клеток, отека лап белых мышей, дезагрегации тромбоцитов и т. д. Однако специфичным из них считается только тест отека лап белых мышей, поскольку он выявляет туморогенные свойства лишь HL-эн-теротоксина эшерихий.
Вместе с тем в природе имеются штаммы кишечной палочки, которые продуцируют только HL-, HS-энтеротоксины или оба одновременно. Поэтому HL-токсин целесообразнее индицировать иммунохимиче-скими методами, так как он обладает хорошо выраженными антигенными свойствами. Иммунохимическая идентификация особенно необходима для энтеротоксинов золотистого стафилококка, которые по антигенным свойствам подразделяют на типы А, В, С (С2), D и Е. При этом наиболее практичной является реакция иммунодиффузии в агаровом геле.
Гистотоксины — ядовитые экзопродукты бактерий белковой природы с выраженным цитотоксическим действием. К ним относят так называемые летальные токсины (стрептококков группы А и гноеродного, коринебактерий, Вас. anthracis и Вас. cereus, CL perfringens типов В, С и F, Cl. histolyticum и Cl. novy типов А и В), дермонекротические токсины (дермонекротизин коринебактерий, эксфолиатин стафилококков, эритрогенин гноеродных стрептококков, отечный фактор сибиреязвенных бацилл), а также гистотоксины (дифтерийной и синегнойной палочек).
Летальные токсины при внутривенном введении лабораторным животным непосредственно поражают определенные клетки-мишени макроорганизма. Например, токсин Str. pyogenes некротизирует гепатоциты, 0-токсин Cl. perfringens изъязвляет слизистую оболочку тонкого ки-’ шечника молодняка лошадей и рогатого скота^ а-токсин Cl. histolyticum лизирует 0-клетки поджелудочной железы, летальный токсин Вас. anthracis вызывает альтерацию альвеол и т. д.
Дермонекротические токсины при внутрикожном введении вызывают соответствующие их названию изменения посредством деструкции
95
клеток ретикулоэндотелиальной системы или активации протеолитических ферментов. Гистотоксины повреждают клетки-мишени также опо-средственно, в частности путем инактивации трансфераз, что приводит к блокированию синтеза белка. Летальный и отечный гистотоксины сибиреязвенного микроба вызывают характерное для них повреждающее действие в совокупности с протективным антигеном этого же микроба, что указывает на возможную рецепторную роль последнего.
Тестируется специфическое действие токсинов этой группы в основном биопробой на лабораторных животных.
Таким образом, возбудители инфекционных болезней в отличие от непатогенных микробов обладают специализированным механизмом адаптации к условиям макроорганизма, обеспечивающим проникновение, размножение и специфическое функционирование их в тканях хозяина. Каждая из этих стадий биоцикла паразита сопровождается нарушением определенных защитных систем организма животного и осуществляется соответствующими факторами патогенности микроба.
Наиболее полно патогенные свойства микроба реализуются сочетанием инвазивных и токсических структур и молекул, поскольку без диффузионных и антифагоцитарных факторов даже сильно токсигенные микроорганизмы не вызывают серьезные патологические изменения.
Биосинтез многих важных факторов патогенности бактерий является результатом фаговой конверсии или детерминирования внехромосом-ными факторами наследственности, что поддерживает постоянство популяции микроорганизмов, обладающей болезнетворными свойствами. К последним относят адгезивность, гемолитичность и токсигенность. Избирательному отбору патогенных штаммов и их репродукции способствует наличие у бактерий плазмид, детерминирующих бактериоциноге-нию и множественную лекарственную устойчивость.
Учитывая сказанное, идентификацию болезнетворных микроорганизмов следует проводить не по одному, а по нескольким свойствам патогенности, а оценку их этиологической роли — с учетом экологических аспектов патогенности. Множественность факторов патогенности у возбудителей обусловливает и индивидуальные характеристики инфекционного процесса, что, в свою очередь, предполагает наличие своеобразия в защитных системах макроорганизма.
ИММУНИТЕТ
Современное представление об иммунитете неразрывно связано с развитием концепции о биологической индивидуальности, то есть о существовании индивидуальных структурных различий между населяющими Землю микро- и макроорганизмами на молекулярном уровне. Соматические различия организмов обусловлены уникальным строением нуклеиновой кислоты, что выражается неповторимой структурой молекул поверхностных мембран клеток и их метаболитов (например, экзотоксинов). Эти молекулы являются как бы отметинами особого устройства ДНК или РНК у данного существа и сохраняются до тех пор, пока нуклеиновая кислота остается неизменной. Поскольку в определенном одно-или многоклеточном организме имеется всего одна нуклеиновая кислота или она всегда однотипна, каждый микро- или макроорганизм обязательно должен быть наделен генетически однородным набором подобных структур. Поэтому любое внедрение микробов или их метаболитов в макроорганизм, появление в нем собственных мутированных клеток, по существу, представляет покушение на биологическую индивидуальность последнего и сопровождается специфической защитной реакцией организма. При этом клетки, органические соединения или отдельные молекулы, несущие на себе признаки генетической чужеродности, отождествляют с антигенами, а защитную реакцию, направленную
96
на поддержание генетического постоянства макроорганизма с иммунитетом (лат. immunitas — освобожденность).
Специфическая реакция организма на Антигенное раздражение называется иммунным ответом, в результате которого в организме вырабатываются специфические антитела и специфически сенсибилизированные лимфоциты. Они соответственно нейтрализуют или разрушают индуцировавшие их антигены. Поэтому иммунную реакцию относят к индуцибельным защитным механизмам макроорганизма.
Несмотря на важную роль специфических механизмов в защите, выживание отдельных организмов и целых видов животных вряд ли было бы возможным без наличия уже Готовых противомикробных факторов в интактном макроорганизме. Такие врожденные защитные механизмы хозяина называют конститутивными, а составляющие их клеточные и гуморальные компоненты — факторами естественной резистентности. Конститутивные механизмы также осуществляют надзор за генетическим постоянством внутренней среды и участвуют преимущественно в разрушении и выведении из организма антигенов, причем им присуща уже групповая специфичность.
Однако невосприимчивость макроорганизма обусловлена не только названными защитными механизмами. Во многих случаях определяющее значение имеет отсутствие в оргацизме животного определенного вида необходимых для возбудителя ростовых веществ или рецепторов для их токсических метаболитов, причем данная видовая особенность животных передается по наследству.
Следовательно, невосприимчивость животных к инфекционным болезням можно подразделить на врожденную, обусловленную наследуемыми факторами, препятствующими размножению патогенных микробов или реализации их токсических свойств, и приобретенную, обусловленную системой иммунитета. Факторы естественной резистентности, очевидно, играют важную роль при обоих типах невосприимчивости, поскольку каждый из них сопряжен с необходимостью дезинтеграции и элиминации (удаление) антигенов.
Приобретенный иммунитет принято подразделять на активный и пассивный. В первом случае невосприимчивость приобретается в результате переболевания (естественный активный иммунитет) или вакцинации животных (искусственный активный иммунитет), а во втором — в результате передачи потомству материнских антител (естественный пассивный иммунитет) или введения животному иммунной сыворотки (искусственный пассивный иммунитет). Активно приобретенный иммунитет длится несколько месяцев или лет, тогда как пассивный сохраняется несколько недель.
Если невосприимчивость сопровождается полной элиминацией возбудителя из организма, иммунитет называют стерильным; в случае сохранения невосприимчивости пока в организме персистирует (сохраняется) возбудитель, иммунитет называют нестерильным.
АНТИГЕНЫ
Антигены (лат. anti — против и genus — происхождение, род, племя)— генетически чужеродные вещества, способные вызывать в организме специфические иммунные реакции и взаимодействовать с продуктами этих реакций. Вещества, которые вызывают иммунные реакции и взаимодействуют с их продуктами, называют полноценными антигенами; вещества, взаимодействующие лишь со специфическими продуктами организма, называют неполноценными антигенами или гаптенами.
Антигенами для организма могут быть собственные клетки с измененным геномом и образуемые ими молекулы; клетки другого животного, растительного организма и синтезируемые ими вещества; микро-
7—Ветеринарная микробиология
97
организмы, продукты их метаболизма или распада, а также синтетические органические молекулы. Но по химической природе они могут быть белками, полипептидами, полисахаридами, липополисахаридами или нуклеиновыми кислотами.
Однако лучшими антигенными свойствами обладают вещества с большей молекулярной массой и белковой природы. Из всех известных антигенов наилучшими считаются глобулины сыворотки крови животных. При этом важно учитывать чужеродность антигенов. Чем больше выражено генетическое родство между животными, тем хуже проявляются антигенные свойства их веществ. Белки бычьей сыворотки крови, например, не антигенны для крупного рогатого скота, будут слабо анти-генны для мелкого рогатого скота и обладать выраженными антигенными свойствами для лошадей, кроликов, птиц и других животных.
Антигенность, таким образом, зависит от природы, молекулярной организации и степени родства генетически чужеродных веществ и служит их качественной характеристикой. Обычно говорят о большей, меньшей или слабой способности таких веществ вызывать иммунный ответ организма.
Независимо от природы по физическому состоянию антигены под-. разделяют на корпускулярные (частичковые) и растворимые (молекулярно-дисперсные). Те и другие обязательно имеют концевые структуры, обычно выступающие над поверхностью молекулы антигена, — антигенные детерминанты. Участки детерминант, специфически связывающиеся непосредственно антителами, называют гаптенной группой, которые в зависимости от свойств окружающей среды структурно могут оформляться по-разному, удерживаясь на носителе силами Ван-дер-Ваальса.
Гаптены, являясь неантигенными молекулами, при' соединении с белком определяют его специфичность: при введении в организм животного, конъюгированного с белком гаптена, специфические антитела образуются именно на последний, и не на носитель. Подобным образом синтезируются антитела на неантигенные вещества, с которыми контактирует организм (сульфаниламидные препараты, антибиотики, пикриловая кислота, фенолфталеин и др.), что приводит к развитию аллергии. По-видимому, в большинстве случаев роль аллергенов (антигенов, вызывающих аллергию) выполняют гаптены.
Антигенными детерминантами белков и полипептидов являются расположенные на их поверхности остатки определенных аминокислот, особенно имеющих кольцевую структуру подобно тирозину. Детерминантами антигенных полисахаридов и липополисахаридов являются расположенные на поверхности их молекул моносахариды. Детерминанты нуклеиновых кислот образуются с участием оснований нуклеотидов.
Растворимые антигены содержат более или менее однородные, а корпускулярные антигены, как правило, разнородные антигенные детерминанты. Но количество их на полноценном антигене всегда большое, поэтому их считают поливалентными.
Антигены животного происхождения по специфичности подразделяют на видовые, групповые, органные и стадиоспецифичные.
Видовая специфичность антигенов лежит в основе иммунных реакций и позволяет дифференцировать представителей различных видов животных. Видоспецифические свойства антигенов используются в судебной экспертизе, при идентификации хозяев крови, ветсанэкспертизе при определении фальсификаций мяса и мясопродуктов путем применения антивидовых сывороток. Максимально видоспецифичными свойствами обладают сывороточные белки. Поэтому лечебные сыворотки и тканевые вакцины стремятся получать на видоидентичных животных, а при введении животным чужеродных лечебно-профилактических препаратов учитывают возможные последствия антигенного несоответствия вводимых белков.
98
Групповая специфичность характеризует антигенные различия животных по полисахаридам эритроцитов, белкам сыворотки крови, поверхностным антигенам ядерных соматических клеток. Антигены, обусловливающие внутривидовые различия индивидуумов или групп особей между собой, называют изоантигенами (например, групповые эритроцитарные антигены, трансплантационные антигены). Наличие группоспецифичных антигенов учитывается при переливании крови, пересадках органов и тканей, а также используется в селекционной работе в качестве естественных генетических маркеров.
Органоспецифичность связана с неодинаковой антигенностью обычно изолированных от иммунной системы органов, таких, как мозг, хрусталик глаза, спермин. При нарушении гистогематобарьеров антигены этих органов могут иммунизировать собственный организм, поэтому их называют аутоантигенами. В результате аутоиммунизации наступает повреждение органов и нарушение их функций. М. П. Тушнов использовал этот принцип для разработки иммунологического способа стерилизации самцов.
Часто регистрируют также случаи бесплодия скота из-за выработки самками спермоантител к семени определенных производителей. Чем чаще самка осеменяется таким производителем, тем выше в ее организме титр антител к его спермиям и тем меньше шансов на оплодотворение. Чтобы избежать подобных ситуаций, предназначенных для осеменения самок проверяют на наличие антител к конкретной сперме.
При раковых, лучевых, ожоговых, холодовых, медикаментозных поражениях, микробных инфекциях и интоксикациях могут развиваться аутоиммунные процессы, обусловленные появлением в организме антигенов с патологической специфичностью.
Стадиоспецифичные антигены возникают в процессе эмбриогенеза и четко характеризуют определенный этап внутриутробного развития животного, отдельных его паренхиматозных органов. Эти антигены поступают в кровоток матери и вызывают образование на себя антител. По этим антителам можно определить глубину стельности, протекание дифференцировки эмбриональных тканей, а также тератогенные свойства вводимых беременным животным веществ.
В некоторых случаях присутствие в крови взрослых животных ста-диоспецифичных антигенов используется в качестве показателя функционального состояния отдельных внутренних органов. Например, при раке печени в сыворотке крови появляются альфа-фетопротеины, обычно синтезируемые фетальной печенью.
Антигены бактериальной клетки по локализации подразделяют на капсульные, соматические, жгутиковые и антигены экзопродуктов.
Капсульные, или К-антигены, являются самыми внешними постоянными структурами поверхности микробной клетки. По химическому строению их идентифицируют в основном как полисахариды, хотя прежнее подразделение К-антигенов эшерихий на L- и В-термолабиль-ные антигены допускало и белковую природу этих структур. Их основу у пневмококков составляют повторяющиеся сахара — D-глюкоза, D-галактоза и L-рамноза.
В антигенном отношении капсульные полисахариды неоднородны. У пневмонийных стрептококков, например, различают более 80 серологических вариантов (сероваров), что широко используется в диагностической и лечебно-профилактической работе. К более однородным К-анти-генам полисахаридной природы относят Vi-антигены энтеробактерий, бруцелл, франциселл; белково-полисахаридной природы V—W-антиге-ны ерсиний; белковой природы М-протеин стрептококков группы А, протеин А стафилококков, К-88 и К-99 антигены эшерихий.
Из других внешних структур, обладающих антигенными свойствами можно назвать корд-фактор микобактерий, полипептидные капсулы си
во
W
7*
биреязвенного микроба, но их из-за непостоянства не относят к капсульным антигенам.
Соматические, или О-антигены, представляют собой боковые полисахаридные цепи липополисахаридов стенки грамотрицательных бактерий (эндотоксина), выступающие над поверхностью микробной клетки. Завершающиеся различными концевыми сахарами и оформленные по-разному, стерически они, по существу, представляют антигенные, детерминанты. У сальмонелл насчитывают около 40 таких детерминант, до четырех на поверхности одной клетки. По их общности сальмонелл объединяют в О-группы. Однако специфичность О-антигена сальмонелл связана с дидезоксигексозами (паратозой, колитозой, абеквозой, тивелозой и аскарилозой), уникальные С-концевые участки которых наиболее удалены от поверхности клетки и непосредственно связываются с активными центрами антител.
Белковая часть О-антигена (вернее, эндотоксина) ответственна за антигенные связи энтеробактерий, то есть за неспецифические серологические реакции.
Соматическими эти антигены назвали, когда еще не знали точной их локализации. Фактически и К- и О-антигены являются поверхностными. С той лишь разницей, что К-антиген всегда экранирует О-антигены. Поэтому для обнаружения О-антигена взвесь исследуемых бактерий подвергают предварительной температурной обработке.
Жгутиковые, или Н-антигены, имеются у всех подвижных бактерий. Представляют собой термолабильные белковые комплексы жгутиков, обладающие у многих энтеробактерий двумя наборами детерминант— специфической (первой) и неспецифической (групповой, или второй) фазой.
Полная антигенная формула грамотрицательных бактерий записывается в последовательности О : Н : К. Антигены при этом являются наиболее стабильными маркерами определенных возбудителей, благодаря чему удается сделать серьезный эпизоотологический или эпидемиологический анализ.
Антигены экзопродуктов включают метаболиты бактериальной клетки белковой природы, среди которых наиболее изучены экзотоксины. Антигенные свойства экзотоксинов характеризуются высокой специфичностью и сохраняются после обработки формальдегидом в невысоких концентрациях. Обработанный подобным образом экзотоксин называют.анатоксином, который используют в качестве вакцинного препарата.
Однако для экзотоксинов многих микробов характерна антигенная неоднородность. На этом основании экзотоксины Cl. perfringens, Cl. botulinum, Staph, aureus подразделяют на сероварианты.
Антигенными свойствами обладают также бактериаль н ые споры. Они содержат антиген, общий вегетативной клетке, и, собственно, споровый антиген. ? :
Таким образом, постоянные, временные структуры и формы бактерий, а также их метаболиты обладают самостоятельными антигенными свойствами, характерными, однако, для определенных вцдов микроорганизмов. Поскольку все они являются маркерами особого устройства ДНК у данного вида бактерий, часто на поверхности микробной клетки и в ее метаболитах содержатся общие антигенные детерминанты.
Последний факт имеет важное значение для совершенствования способов идентификации микроорганизмов. Так, например, вместо трудоемкой, дорогостоящей и не всегда воспроизводимой реакции нейтрализации для определения сероваров ботулинического микроба можно применять экспресс-метод, основанный на выявлении поверхностных детерминант при помощи иммунофлюоресценции. п
В отличие от антигенов другого происхождения среди бактериаль-100
цых антигенов выделяют так называемые протективные, или з а-щитные антигены. Выработанные на эти антигены антитела защищают организм от данного микроба. Протективными свойствами обладают капсульные антигены пневмококков, М-протеин стрептококков, А-протеин стафилококков, белок второй фракции экзотоксина сибиреязвенных бацилл, белковые молекулы нижних слоев стенки некоторых грамотрицательных бактерий и др. Очищенные протективные антигены не обладают пирогенными, аллергизирующими свойствами, хорошо сохраняются и поэтому приближаются к идеальным вакцинным препаратам.
Протективные антигены обусловливают иммуногенность микробных антигенов. Антигены не всех микроорганизмов способны создавать одинаково выраженный иммунитет. Для повышения иммуногенности в ряде случаев антиген смешивают с адъювантами — неспецифическими стимуляторами иммуногенеза минеральной или органической природы. Чаще с этой целью используют гидроокись алюминия, алюми-ниево-калиевые квасцы, ланолин, вазелиновое масло, липополисахарид бактерий, препараты бордетелл и др. Наиболее популярным у исследователей является адъювант Фрейнда, состоящий из вазелинового масла, ланолина (неполный адъювант) и микобактерий туберкулеза (полный адъювант).
Сущность адъювантного действия названных препаратов заключается в сдерживании поступления смешанного с ними антигена в организм, что пролонгирует его иммунизаторное действие, снижает реакто-генность, а в некоторых случаях вызывает и бласттрансформацию. Однако при изготовлении антисыворотки для иммунохимического анализа, особенно с целью установления природы антигенов или антигенных связей, использования микробных адъювантов избегают, поскольку они снижают специфичность антисыворотки. Происходит это за счет гетерогенности, или гетерофильности антигенов, то есть антигенной общности микробов различных таксономических групп, тканей растений, животных и человека.
В основе антигенного родства, вероятно, лежит схожесть строения липидов или полисахаридов организмов отдаленных видов. Например, форсмановский антиген обнаружен в эритроцитах коз, овец, лошадей, морских свинок, кур. Эритроциты имеют антигенную связь с бактериями практически всех семейств, большая часть которых, в свою очередь, образует перекрестные серологические реакции с тканями млекопитающих, птиц, рыб, червей, растений.
Благодаря наличию общих антигенных детерминант микробы легче преодолевают защитные барьеры организма и размножаются в нем, вызывая локальные или системные поражения. У некоторых патогенных микроорганизмов (например, холерного вибриона) эта черта сильно выражена и прямо коррелирует с их вирулентностью. Часто гетерогенность обусловливает перекрестные серологические и аллергические реакции, что приводит к искажению результатов диагностических исследований.
г>
ИНДУЦИБЕЛЬНЫЕ ЗАЩИТНЫЕ МЕХАНИЗМЫ МАКРООРГАНИЗМА
Как уже отмечалось, макроорганизм способен одинаково специфично реагировать на аутоантигены, половые и соматические клетки другого организма, растительные и микробные антигены. Поэтому противоинфек-ционную защиту организма следует рассматривать как частный случай поддержания генетического постоянства его внутренней среды. Дифференцированная реакция организма на генетически чужеродные молекулы и структуры осуществляется при помощи морфологически обособленной и функционально специализированной иммунной системы.
101
Иммунная система организма — это совокупность лимфоидных органов и тканей, генерирующих клетки, способные самостоятельно или путем синтезированных ими антител специфически взаимодействовать с антигеном. В ее состав входят центральные и периферические органы. К центральным органам иммунной системы относят тимус, сумку Фабрициуса, пейеровы бляшки и костный мозг. К периферическим органам причисляют кровь, лимфатические узлы и селезенку. Главным продуктом этой системы является лимфоцит.
Тимус, или вилочковая железа, закладывается в первый месяц эмбриогенеза и достигает максимума по массе к концу внутриутробного периода развития организма. С возрастом животных она инволюциони-рует, но совсем не исчезает. Корковый слой железы плотно заселен скоплениями малых лимфоцитов, отгороженными друг от друга эпителиальной тканью органа. Эти лимфоциты именуют тимоцитами.
Сумка (или бурса) Фабрициуса представлена в виде дивертикула клоаки птиц небольшим лимфоузлом с мозговой и корковой зонами. У кур она формируется между 12-м и 13-м днем эмбрионального развития, а после седьмой недели жизни цыплят начинает атрофироваться. В корковой зоне находятся зрелые, а в мозговой — незрелые лимфоциты.
Пейеровы бляшки локализованы под слизистой оболочкой тонкого кишечника и лимфоциты в них упакованы подобно сумке Фаб-
рициуса.
Костный мозг является поставщиком гемопоэтических стволовых клеток — родоначальниц всех клеток крови, в том числе и лимфоидных стволовых клеток, которые затем дифференцируются в эффекторы иммунитета. Все эти клетки располагаются в ячейках ретикулярной
стромы.
Кровь является дискретной тканью периферической иммунной системы, она представлена отдельными лимфоидными клетками различного назначения и разной степени зрелости, а также гранулоцитами и моноцитами. Кровоток животных насыщается лейкоцитами за счет лим-. фы и лимфоидных органов уже в период эмбриогенеза, но не одновременно. В первые месяцы внутриутробного развития организма крупного рогатого скота в периферической крови появляются лимфоциты, затем моноциты, эозинофилы и нейтрофилы. Лейкограмма периферической крови плодов крупного рогатого скота начиная с 2-месячного возраста внутриутробного развития характеризуется постоянным содержанием лимфоцитов. В начале онтогенеза они представлены преимущественно зрелыми, а с возрастом и незрелыми лимфоидными клетками. Моноциты поступают в периферическую кровь 2-месячных, а эозинофилы и нейтрофилы — 3-месячных эмбрионов.
Селезенка обладает собственно лимфоидной тканью в виде белой пульпы. Из-за отсутствия лимфатических сосудов белая пульпа посредством трабекул и синусов связана с кровотоком, снабжая его стволовыми и лимфоидными клетками. Построена белая пульпа по типу лимфатических узлов.
Лимфатические узлы — компактные образования, которые кроме непосредственной связи с кровотоком, постоянно поставляют через грудной проток в переднюю полую вену преимущественно малые лимфоциты.
ПОПУЛЯЦИИ ЛИМФОЦИТОВ
Появление и становление лимфоцитов как эффекторов иммунитета можно представить следующим образом (рис. 48).
В начальный период внутриутробного развития животного в желточном мешке появляются стволовые кроветворные клетки. Морфоло-
102
1
Халезша
Г кл,:
Гемопоэтическая стВолобая клетка.
(§) ---------т—-------(
Желчный Эмбриональная меток л очень
Тимус
Бостный мозг. '
ЛимфоиВная L стВолоВия клетка
Бурса Фабрициуса *
Яимд^узел
-ВМ~~
Тт
Л амер, органы
—*/Г/гл
—*- (толькоТдМ) § <ь §
Рис. 48. Схема развития иммунокомпетентных клеток.
гически они схожи с моноцитами или большими лимфоцитами, способны пролиферировать и дифференцироваться в кроветворные и лимфоидные клетки. Вскоре они заселяют эмбриональную печень, а затем и костный мозг.
Образующиеся из кроветворной стволовой клетки лимфоидные стволовые клетки с кровотоком мигрируют в тимус и под действием его гормонов (тимозина) дифференцируются в Т-лимфоциты (Т0-клетки). Последние расселяются по тимусзависимым зонам периферических лимфоидных органов, где и созревают под влиянием тимозина, трансформируясь в Т1- и Т2-клетки. При этом Ti-клетки локализуются преимущественно в периартериальных зонах фолликулов селезенки, а Т2-клетки — в перикортикальных зонах лимфоузлов.
Клетки Ti слабо реагируют на действие лучистой энергии и являются предшественниками эффекторов клеточного иммунитета; клетки Т2 высокорадиочувствительны, долго живут, способны к рециркуляции и являются антигенреактивными.
Антигенчувствительные или антигенраспознающие Т-лимфоциты в отличие от субпопуляции Тгклеток обладают рецепторами для Fc-фраг-ментов иммуноглобулинов. К этим лимфоцитам относят так называемые клетки иммунной памяти (Тт — memory—память), обусловливающие более быстрый и сильный иммунный ответ организма на повторный стимул гомологичным антигеном.
Среди многочисленной популяции эффекторных Т-лимфоцитов выделяют также дифференцирующие клетки (Td) —влияют на направление дифференцировки стволовых клеток в сторону Т-лимфоцитов; кил-лерные клетки (Тк — killer — убийца) — осуществляют клеточноопосредованный иммунитет; клетки-усилители (Та — amplifier — усилитель) — усиливают функции киллеров; клетки-помощники (Th — helper — помощник)— гуморальный иммунный ответ В-лимфоцитами; клетки-супрессоры (Ts — suppression — подавление) — подавляют действие клеток хелперов и усилителей и тормозят пролиферацию иммунокомпетентных клеток и некоторые другие.
При миграции костномозговых стволовых лимфоидных клеток в фабрициеву бурсу у птиц или ее эквивалента у млекопитающих лимфоциты трансформируются в В-клетки, способные реагировать самостоятельно на полисахаридный, а при взаимодействии с Th-клетками на белковый антиген. В-лимфоциты колонизируют периферические лимфоидные органы, заселяя их тимуснезависимые зоны — красную пульпу селезенки, корковое вещество лимфоузлов, лимфоидные пакеты кишечника. В процессе перехода из костного мозга в селезенку В-клетки последовательно превращаются из предшественниц в незрелые, а затем в зрелые В-лимфоциты. В конечном итоге появляется целая популяция В-клеток, выполняющих различные функции. Bi-клетки не несут на поверхностной
103
3. Основные отличительные признаки Т- и В-лимфоцитов
Признаки
Т-клетки
В-клетки
Центральный орган, обусловливающий иммунную компетентность лимфоцитов Локализация в периферических лимфоидных органах
Поверхностные антигены зрелых лимфоцитов
Поверхностные иммуноглобулиновые детерминанты (плотность)
Специфичность детерминант
Рецепторы, для Fc-фрагментов, 1g- и СЗ-компонента
Чувствительность к кортикостероидам
Митотический эффект
Кон-А, ФГА н АЛС
/Митотический эффект липида А, ЛПС и АГС
Преимущественное эффектирование реакций
Тимус
Белая пульпа артериальных влагалищ селезенки, па-ракортикальная зона лимфоузлов
Н=2++ Ly+, 0+
К носителю антигена
Клеточноопосредованные иммунные
реакции
Фабрициева сумка или ее эквивалент
Центры размещения, красная пульпа селезенки, миелиновые шнуры лимфоузлов
MBLA (В-антиген)
К гаптенной антигена
части
Опосредованные иммуноглобулинами реакции
Примечание. Кон-А — коивалин А; ФГА — фитогемагглютинин; АЛС — антилимфоцитар-ная сыворотка; АГС — антиглобулииовая сыворотка.
мембране рецепторы и способны после взаимодействия с антигеном без участия Т-хелперов и макрофагов трансформироваться в антителопро-Дуцирующие плазматические клетки, синтетизирующие только IgM-B2-лимфоциты, филогенетически появились позже (после развития у животных тимуса) и, кроме поверхностных IgD и IgM, имеют на мембране рецепторы для Fc-фрагментов иммуноглобулинов СЗ и Га-антигены. Благодаря последним В-лимфоциты способны взаимодействовать с Т-клетками при ответе на тимусзависимый антиген. В-лимфоциты под действием антигенов способны трансформироваться в антителообразующие клетки, которые продуцируют иммуноглобулины всех классов.
Некоторые исследователи к В-лимфоцитам причисляют К-клетки, не имеющие антигенных маркеров, но содержащие на поверхностной мембране рецепторы для Fc-фрагментов преимущественно IgG. Посредством данного рецептора К-клетки взаимодействуют с антителами IgG-класса, покрывающими опухолевые клетки, клетки, пораженные вирусом, клетки трансплантата, вызывая их цитолиз. В отличие от Т-киллеров, таким образом, К-клетка вызывает лизис клеток-мишеней не за счет непосредственного контакта с сенсибилизированными лимфоцитами, а посредством взаимодействия через иммуноглобулины.
Кроме предшественниц плазмоцитов и киллеров, популяция В-лимфоцитов содержит Клетки иммунной памяти (Вт-клетки) и клетки-супрессоры (В8-клетки), участвующие соответственно во вторичном иммунном ответе и подавлении гуморального ответа.
Иммунокомпетентные клетки, определяющие основные иммунные реакции макроорганизма, можно различить по ряду признаков, которые определяют в основном при помощи реакции розеткообразования с нативными, обработанными иммуноглобулинами или иммунными комплексами эритроцитами барана, а также реакции бласттрансформации и иммунофлюоресценции (табл. 3).
104
ИММУННЫЙ ОТВЕТ ОРГАНИЗМА
На антигенное раздражение организм может отвечать антителооб-разованием, гиперчувствительностью немедленного типа, гиперчувствительностью замедленного типа, иммунологической памятью и иммунологической толерантностью. Все эти реакции развиваются в организме на один и тот же антиген, носят специфический характер и имеют значение самостоятельной формы иммунного ответа. Основу различий каждой формы иммунного ответа организма составляют разные эффекторы, механизмы и результаты реакций. Важно поэтому представлять сущность каждой формы иммунного ответа и методы их регистрации.
Антителообразование
Антителами называют глобулины, специфически связывающиеся с антигенами, на которые они обычно и образуются. Антитела, образованные на неизвестный микробный, изо- или пищевой антиген называют нормальными или естественными в отличие от антител известного происхождения, которые именуют специфичными. Для связывания с антигенами молекулы антител имеют активные центры. Если таких центров два и больше, антитела называют полными; если молекула глобулина обладает одним функционирующим активным центром, антитела называют неполными.
Основная биологическая функция антител состоит в распознавании и образовании иммунных комплексов с антигенами с последующей дезинтеграцией их посредством фиксации комплемента, опсонизации и проявления цитофильности.
По феноменологическому проявлению взаимодействия с антигенами антитела подразделяют на преципитирующие, агглютинирующие, комп-лементфиксирующие, нейтрализующие и лизирующие. Проявление того или иного феномена, однако, обусловлено наличием разнотипных молекул антител. Поскольку антитела образуются в ответ на антигенный стимул, глобулины, соединяющиеся с антигенами по принципу компле-ментарности, теперь именуют иммуноглобулинами и обозначают символом Ig.
Различают пять основных классов иммуноглобулинов; IgG, IgM, IgA, IgE и IgD. Каждый из них имеет прежде всего различную первичную структуру.
Молекулярная структура IgG (рис. 49) представлена соединенными между собой дисульфидными связями четырьмя полипептидными цепочками— двумя крайними более короткими, или легкими — L (англ, light), и двумя центральными более длинными, или тяжелыми — Н (англ, heavy). L- и Н-цепи состоят из С-области (constant) с постоянным аминокислотным составом и V-области (various) — с непостоянной аминокислотной последовательностью. Причем молекула иммуноглобулина построена так, что V-области всех полипептидных цепей сориентированы в одном направлении, компонуются на одном уровне и завершаются амидогруппами, тогда как С-области легких и тяжелых цепей заканчиваются на разных уровнях карбоксильными остатками аминокислот. N-концевые части вариабельных участков L- и Н-цепей участвуют в формировании активного центра, связывающегося с антигенной детерминантой. Поскольку в молекуле IgG две пары тяжелых и легких цепей, она потенциально обладает двумя активными центрами, или ан-тигенсвязывающими фрагментами (Fab).
Путем обработки папаином удается разделить молекулу IgG на два самостоятельных антигенсвязывающих Fab-фрагмента и свободный от L-цепей участок тяжелых цепей, который из-за способности кристаллизоваться назван Fc-фрагментом. Обработкой другим протеолитическим
105
Рис. 49. Молекулярная структура иммуноглобулинов:
IgG (а, б— домены); IgA (в — секреторного) и IgM (г).
ферментом — пепсином молекулу IgG можно расщепить лишь на две части— (Fab)г-фрагмент и Fc-фрагмент. При этом количество полученных фрагментов молекулы иммуноглобулина зависит от точки приложения протеолитического фермента—за или впереди дисульфидных мостиков, связывающих Н-цепи в начале Fc-фрагмента.
Дисульфидные связи имеются не только в межцепьевых пространствах молекулы иммуноглобулина, но и локализуются внутри цепей, связывая отдельные фрагменты полипептидов. В L-цепи IgG их насчитывают две, в Н-цепи IgG—четыре. Места нахождения внутрицепьевых дисульфидных мостиков в отличие от прямолинейной первичной структуры не связанных ими аминокислотных остатков утолщены и называются доменами. Домены вариабельных участков легких и тяжелых цепей обозначают Vb и Vh соответственно, константных участков — Сд и СН1,2,з, где цифры обозначают порядковый номер домена.
Именно домены вариабельных участков сообщают молекуле иммуноглобулина четвертичную структуру, формируя ее активные центры. Начальные домены константных участков легких полипептидов определяют антигенные различия L-цепей, а тяжелых полипептидов — различия антигенного строения субклассов. Последующие два домена Н-цепей формируют участки, при помощи которых молекула иммуноглобулина фиксирует комплемент и присоединяется к клеткам организма.
В интактном состоянии молекула IgG имеет форму буквы Т, после взаимодействия с антигеном приобретает форму буквы Y, причем в последнем случае обнажаются домены ее Fc-фрагмента, ответственные за фиксацию комплемента. °
Поскольку активные центры иммуноглобулинов соединяются только с гомологичным антигеном, а свободные участки их тяжелых цепей взаимодействуют с клетками и комплементом независимо от антительной активности, Fab-фрагменты считают ответственными за специфическую функцию молекул иммуноглобулина, а Fc-фрагмент — за неспецифическую.
Между Hi- и Н2-доменами IgG локализован шарнирный участок, позволяющий вращаться фрагментом молекулы иммуноглобулина.
Уникальность антигенного строения молекулы иммуноглобулина определенного класса или субкласса связана со структурой тяжелых цепей. По этому принципу в соответствии с количеством классов насчи-
106
тывают пять типов тяжелых цепей иммуноглобулинов, которые обозначают малыми буквами греческого алфавита: у (гамма) —Н-цепь IgG, ц (мю) — Н-цепь IgM, а (альфа) — Н-цепь IgA, 6 (дельта) — Н-цепь IgD и е (эпсилон) — Н-цепь IgE. Антигенные различия по Н-цепи имеются только внутри класса IgG: у человека четыре, у большинства сельскохозяйственных животных два субкласса. Их обозначают как
По антигенному строению легкие цепи иммуноглобулинов всех классов одинаковые и у каждого из них могут быть только х (каппа) или реже X (лямбда) типов.
Молекула иммуноглобулина класса М состоит из пяти тетрапеп-тидных фрагментов, подобных IgG, поэтому ее именуют пентамером. Полимеризация молекулы осуществляется соединяющей цепью j (англ, joining chain), представляющей замкнутые в кольцо дисульфидные мостики на уровне свободных концов Fc-фрагментов. Последние, кстати, несколько длиннее Fc-фрагментов IgG и имеют дополнительный пятый домен (рН5). Она более эффективно фиксирует комплемент, чем молекула IgG.
Молекула IgM существует в двух вариантах — сывороточном и секреторном (SIgM). Соединяющая цепь секреторного IgM в отличие от сывороточного экранирована секреторным компонентом, или S-фрагментом, защищающим j-цепь от расщепления протеолитическими ферментами. Секреторный компонент вырабатывается эпителиальными клетками желудочно-кишечного тракта, дыхательных, мочеполовых путей, глаз и синовий и присоединяется к молекуле иммуноглобулина в момент ее перехода из кровотока через слизистую оболочку этих органов. Секреторный компонент обладает антигенными свойствами, отличными от антигенов молекул иммуноглобулинов.
Молекулы иммуноглобулина класса А также существуют в сывороточном (в основном мономеры и меньше димеры) и секреторном (димер) вариантах. Димерные молекулы поддерживаются j-цепью, которая у секреторных молекул защищена S-фрагментом, как м у SIgM, SIgA способен фиксировать комплемент.
Структурной особенностью молекулы IgE является то, что мономерным строением она напоминает молекулу IgG, однако активные центры ее взаимодействуют только с аллергенами, а Fc-фрагменты примерно в 2 раза массивнее, не фиксируют комплемент, но обладают чрезвычайно выраженным сродством к гомологичным и гетерологичным гранулоцитам, особенно к тучным и базофильным клеткам. В отличие от молекулы IgG, которая фиксирует комплемент после присоединения антигена, молекула IgE фиксируется на клетках организма еще до образования комплекса с аллергеном.
Молекула IgD принципиально построена по типу молекулы IgG, но изучена недостаточно. Данный иммуноглобулин отличается повышенным сродством к лимфоцитам собственного организма (гомоцито-фильность), поэтому в циркуляции находится в наименьшем количестве.
Различия в молекулярном строении сказываются и на физических свойствах иммуноглобулинов разных классов. Наибольшая молекулярная масса и коэффициент седиментаций у IgM, затем у димерного IgA и мономерных иммуноглобулинов. По-разному они мигрируют в электрическом поле—IgM крупного рогатого скота с бета-, IgG с гамма-глобулинами. При температуре 65°C бычьи IgM теряют антительную активность, IgG сохраняют.
В ответ на антигенный стимул антитела образуются в определенной последовательности. Первыми появляются антитела IgM, затем IgG, IgA и др. При этом синтез IgM является тимуснезависимым, а секреторного IgA — тимусзависимым.
В сыворотке крови, однако, превалирующими будут IgG, затем IgM,
107
в меньшей степени содержатся IgA и в мизерных количествах IgE и IgD-классов. Так, на долю сывороточных иммуноглобулинов коров сразу после отела в осенний период приходится свыше 80 % IgG, свыше 15 % IgM и около 1,5 % IgA.
Реакцией взаимодействия антигенов и антител выявляют сходство строения антител позвоночных в широком филогенетическом диапазоне. Примерно одинаково построены у них антигенсвязывающие участки (активные центры), размеры которых соответствуют величине 2—7 мо-о носахаридных остатков, а средняя глубина составляет 11,5 А.
Стерически соответствующие друг другу подобно ключу замочной скважине противоположно заряженные гаптенные группы детерминант и антигенсвязывающие участки образуют при помощи электростатических и межмолекулярных сил комплекс антигена с антителом, или иммунный комплекс. В его формировании участвуют возникающие между ионными группами кулоновские силы и силы притяжения Ван-дер-Ваальса, а также связывающие неионные группы реагентов полярные силы и силы Лондона. Процесс связывания приводит к конформационным изменениям реагирующих молекул, в результате которых, например, молекула антитела становится более устойчивой к протеолитическому перевариванию, иной формы и обнажает участки Fc-фрагмента, ответственные за присоединение к клеткам и фиксацию комплемента.
Силу связи антитела с антигеном характеризуют такими понятиями, как аффинитет и авидность. Под аффинитетом понимают степень стерического соответствия детерминанты и связывающего участка антитела, характеризуя таким образом «входимость» активного центра антитела. Под авидностью имеют в виду количество (валентность) и расположение активных центров, характеризующие «жадность» связывания с антигеном всей молекулы антитела. При этом принимается во внимание потенциальная энергия, затраченная на синтез молекулы иммуноглобулина, которая реализуется при взаимодействии с антигеном.
Учитывая более выраженную аффинность у IgG-антител, а авид-ность у IgM-антител, можно объяснить особенности их связывания с антигенами различного физического состояния. И корпускулярные, и растворимые (молекулярно-дисперсные) полноценные антигены имеют несколько детерминант, то есть они всегда поливалентны. Однако химическая и структурная однородность, а также упорядоченность их на поверхности молекулы будут более выражены у растворимых, чем у корпускулярных антигенов. Поскольку молекулы IgG имеют лишь два активных центра, расположенных на близком расстоянии друг от друга, а запасы энергии у них невелики, антитела данного класса будут более энергично взаимодействовать и физически поддерживать комплекс с растворимым антигеном. Иммуноглобулин М имеет пять подобных фрагментов, в состоянии их перемещать в пространстве и таким образом удерживать как бы на растяжках тяжелые корпускулярные антигены. Таким же образом взаимодействуют с корпускулярным антигеном и димерные IgA.
Следовательно, мономерные иммуноглобулины преимущественно взаимодействуют с растворимыми антигенами, формируя феномен преципитации, а полимерные иммуноглобулины — с корпускулярными антигенами, формируя феномен агглютинации (рис. 50).
В том и другом случае образование иммунного комплекса протекает в две фазы — неспецифической абсорбции антител на антигене и специфического взаимодействия этих реагентов с образованием осадка из-за изменения физико-химических условий системы. При этом важно знать оптимальные условия образования преципитатов и атглютинатов.
Первое из них— оптимальное соотношение ингредиентов реакции. Только в точке «эквивалентности» происходит максимальное образо-108
Рис. 50. Взаимодействие иммуноглобулинов с антигенами:
Л—мономерного IgG с глобулами растворимого антигена (преципитация); Б— пентамерного IgM с корпускулярным антигеном (агглютинация).
вание иммунных комплексов. Происходит это благодаря взаимодействию активных центров с соответствующим количеством антигенных детерминант. В результате детерминанты занимают все реагирующие участки с образованием пространственной решетки, приводящей к формированию конгломерата, воспринимаемого визуально в качестве преципитата или агглютината. При избытке антител или антигена видимый макроагрегат не образуется, наступает так называемая «прозона». Происходит это в первом случае потому, что образованию решетки мешают излишки антител, которые блокируют антигенные детерминанты; во-втором, избыток антигена занимает все валентности антител, мешая им объединяться в макроагрегаты.
Образование иммунных комплексов между полным антителом и неполноценным антигеном (гаптеном), равно как и между полноценным антигеном и неполным антителом, всегда будет протекать авизуально. Для выявления подобных комплексов нужны специальные методы тестирования.
Однако во всех случаях образования комплексов антиген — антитело нуждается в определенной концентрации электролитов (обычно 0,85 %-ный раствор хлорида натрия), водородных ионов (pH около 7,0) и лучше протекает при температуре тела животного. В неспецифической фазе образование комплексов при температуре 5°C характерно лишь для небольшого числа криофильных антител.
Входящие в иммунный комплекс антиген и антитело сохраняют свои исходные свойства, что используется для выделения специфических антител. Диссоциацию комплекса производят изменением концентрации водородных ионов в ту или иную сторону, концентрации хлорида натрия, антигена, повышением температуры или сильным разведением нейтральной жидкости (в случае взаимодействия токсина с антитоксином) ит.п.
Несмотря на обратимость процесса, комплексообразование между антигеном и антителом играет положительную роль в защите организма, которая сводится к опсонизации, нейтрализации, иммобилизации и ускоренной элиминации антигенов.
. За несколько часов или даже минут антитела покрывают корпус-I кулы антигена слоем толщиной до 3 нм. Опсонизированная таким обра-/ зом частица легко прикрепляется к поверхности фагоцитов, поглощается? и переваривается ими. Фагоциты для этого на внешней мембране несут рецепторы для Fc-фрагментов иммуноглобулинов.
109
Заглушенные антителами антигенные детерминанты растворимых антигенов (токсинов, ферментов), мелких вирусных частиц лишаются возможности рецептировать с ганглиозидами или иными специальными образованиями на клетках макроорганизма и, следовательно, осуществлять свои токсические функции. Токсическое действие вредных для организма веществ, таким образом, нейтрализуется.
Корпускулярные и растворимые антигены, в том числе живые микроорганизмы и их метаболиты, обусловливающие токсичность и инва-зивность микробов, агглютинируются или преципитируются антителами, то есть скучиваются, а живые микробы обездвиживаются. Иммобилизированные, таким образом, антигены лишаются возможности распространяться по поверхности органа или полости, проникать в клетку, межклеточное пространство или в толщу органа и резорбироваться (дис-симинировать).
Иммобилизованные антигены или нейтрализованные токсины быстрее удалются с химусом, мекониями или захватываются фагоцитами, то есть элиминируют из организма.
Защитная роль антител, обладающих способностью фиксировать комплемент, еще больше возрастает и качественно отличается от предыдущих. Корпускулы антигена, образующие комплекс с комплементфик-сирующими антителами, в результате присоединения комплемента лизируются. Впервые этот феномен был установлен на грамотрицательных бактериях Пфейфером в 1894 г. Следовательно, к отмеченным уже процессам, имеющим защитное значение в результате комплексообразования, надо отнести и цитолиз.
Исходя из описанных особенностей взаимодействия моно- и полимерных иммунных глобулинов с антигенами, легко представить защитную роль антител в зависимости от принадлежности их к определенному классу. Теперь становится понятной цитолитическая функция IgM, поскольку они взаимодействуют преимущественно с корпускулярным антигеном (клетки микроорганизмов, чужеродные клетки собственного или другого организма) и максимально фиксируют комплемент, вызывающий лизис обработанной антителом клетки.
Скучивание и лизис микробных клеток на поверхости слизистых вызывают секреторные иммуноглобулины классов Ми А.
Мономерный IgG, взаимодействуя преимущественно с растворимыми антигенами, обычно метаболитами микроорганизмов, будет обладать детоксицирующей функцией.
В свете сказанного легко представить целесообразность эволюционно выработанной последовательной смены синтеза IgM на синтез IgG, поскольку в начале инфицирования необходимо полностью лизировать или хотя бы снизить концентрацию микробных клеток в организме, а затем уже обеззараживать накопившийся экзотоксин или высвободившийся в результате разрушения микробных клеток эндотоксин.
С врачебной точки зрения важно представлять связь IgM с бактериемией, IgG с пиемическими процессами, токсикоинфекцией и вирусными инфекциями, a SIgA и SIgM — с противомикробной защитой слизистых покровов пищеварительного, дыхательного трактов, мочеполовых путей, глаз, сйновильных полостей. Однако принципиально важно знать, что защитный эффект иммуноглобулинов этих трех классов повышается прямо пропорционально увеличению их концентрации. Однако в ряде случаев данные иммуноглобулины и постоянно IgE вызывают иммунопатологию, причем степень ее тяжести опять-таки сопряжена с количеством соответствующих антител. Эти антитела получили название реагинов, и эффектируют они гиперчувствительность немедленного типа. • I* ч
110
Гиперчувствительность немедленного типа (ГНТ)
Под этой формой иммуногенного ответа имеются в виду опосредуемые иммуноглобулинами реакции, направленные на поддержание генетического постоянства внутренней среды организма, развитие которых, однако, обусловливает патологические состояния. Не случайно первый исследователь реакций данного типа Рише назвал одну из форм проявления анафилаксией, то есть беззащитной, а Пирке вскоре назвал подобные реакции аллергией, что в переводе с греческого означает иное действие или измененную реактивность организма обычно на повторную встречу с антигеном. Не случайно поэтому укоренился термин «аллергены», которым обозначают антигены, вызывающие гиперчувствительность немедленного или замедленного типов, как теперь называют аллергические реакции.
До недавнего времени инфекционисты ГНТ почти не придавали серьезного значения, полагая, что инфекционные болезни сопровождаются почти исключительно гиперчувствительностью замедленного типа. Поэтому именно ГЗТ именовали инфекционной аллергией. Теперь становится очевидной необходимость учета реакций немедленного типа, поскольку они часто появляются в организме при образовании комплексов антиген — антитело.
Крикзенс и Бриоди (1974) различают три группы реакций гиперчувствительности немедленного типа — классическая немедленная, цитолитическая и цитотоксическая, а также болезни иммунных комплексов.
Классическая немедленная гиперчувствительность опосредуется —комплементом, фармакологическими
агентами, гистамином, SRS-A (медленнодействующей липопротеиновой субстанцией), простагландинами, кининами. Развивается через 15— 20 мин, клинически выражается в форме системных поражений вроде анафилаксии и локальных процессов—астмы, сенной лихорадки, аллергического ринита, аллергий от укусов насекомых, пищевых и лекарственных аллергий, которые именуют еще атопическими заболеваниями (лат. — atopia — странные болезни).
При повторном контакте организма с гомологичным аллергеном последний образует комплексы преимущественно с IgE, в большинстве своем уже фиксированным на тучных клетках и базофилоцитах. Фиксация реагиновых антител происходит при помощи рецепторов на поверхностной мембране гранул этих клеток. В результате комплексооб-разования Fc-фрагменты иммуноглобулинов активируются, усиливают мет ябшш^м r гранулах и последние экскретируют гистамины. Одно -временно под действием иммунного комплекса из~ тромбоцитов выделяется серотонин, гепарин и другие биологические активные вещества, которые ускоряют сокращения волокон гладкой мускулатуры, повышают проницаемость сосудов и предотвращают тромбообразование. Под влиянием ферментов из плазменных белков образуется брадикинин, вызывающий более глубокое сокращение гладких мышц и расширяющий сосуды. Медленно реагирующая липопротеиновая субстанция обусловливает сокращения бронхиол. Простагландин Е увеличивает уровень циклического аденозинмонофосфата в тучных клетках. Выделенные медиаторы раздражают гладкую мышечную ткань, вызывая удушье, рвоту, непроизвольные акты мочеиспускания, дефекации, а также сильные гемодинамические изменения у животных.
ГНТ не у всех животных связана только с дегрануляцией тучных клеток. У крупного рогатого скота и морских свинок, например, анафилактические реакции обусловлены преимущественно IgG. Связываясь с поверхностной мембраной нейтрофилов посредством рецепторов для Fc-фрагментов, он образует комплекс с антигеном, а затем фикси-
111
t
рует комплемент. В результате активации комплемента клетки-носители разрушаются, высвобождая лизосомные ферменты, которые повреждают новые клетки, а также образуется анафилатоксин (субкомпонент третьего компонента комплемента). Последний повышает проницаемость капилляров и привлекает новые партии полинуклеаров. Пораженный участок будет отечным и инфильтрирован этими клетками.
Высокую чувствительность и специфичность реакций данной группы доказывает возможность развития у морских свинок анафилактического шока при инъекции им 10"6 мл чужеродной сыворотки крови (сенсибилизирующая доза ) с последующим внутривенным введением через 1—2 недели 10-2 мл этой же сыворотки (разрешающая доза).
Зависимость реакции от гуморальных медиаторов доказывается возможностью воспроизведения пассивной анафилаксии, когда аллергический шок вызывают однократной внутривенной инъекцией аллергена здоровой морской свинке, которой предварительно ввели сыворотку крови сенсибилизированного животного.
Цитолитические и цитотоксические реакции опосредуются IgG, IgM и комплементом, развиваются через несколько часов или дней и клинически проявляются вызванной лекарствами тромбоцитопенией, агранулоцитозом, гемолитической анемией, а также индуцированной антигенами гемолитической болезнью новорожденных, аутоиммунными болезнями, реакцией отторжения аллотрансплантата.
Изменившийся под действием лекарств антиген клеток хозяина или адсорбированный на них чужеродный антиген связывается на поверхности клеток-носителей с антителами IgG или IgM. Образовавшийся иммунный комплекс фиксирует комплемент, который повреждает или разрушает клетки-носители антигена.
Болезни иммунных комплексов возникают под действием IgG, IgM, IgE, комплемента и лизосомных гидролаз нейтрофилов и эозинофилов. Время их появления варьирует от нескольких минут до нескольких дней после контакта с аллергеном и проявляется в виде системной (например, сывороточная болезнь) или локальной (реакция Артюса, аллергический альвеолит) аллергии.
Сывороточная болезнь возникает при введении животным большого количества чужеродной сыворотки крови. В таком случае даже в не-сенсибилизированном организме развивается аллергический процесс, поскольку антиген выводится из организма настолько медленно, что образовавшиеся антитела успевают прореагировать с его остатками. Появившиеся преципитаты осаждаются вокруг капиллярных сосудов, на нейтрофилах, эозинофилах и под действием комплемента высвобождают лизосомные гидролитические ферменты, обладающие также цитотоксическим эффектом.
При внутрикожном введении аллергена сенсибилизированному животному развивается локальная реакция, известная как феномен Артюса. В течение часа на месте введения аллергена появляется острое экссудативно-геморрагическое воспаление, в очаге которого ткани инфильтрированы в основном полиморфноядерными лейкоцитами. Последние быстро склеиваются, прилипают к эндотелию капилляров и вместе с комплексом антиген — антитело, а также другими форменными элементами крови формируют тромбы. На поздних стадиях процесса стенки мелких кровеносных сосудов некротизируются.
Развитие системной и локальной реакций можно отменить предварительным (за 1—2 ч до инъекции разрешающей дозы) введением животному подкожно небольшого количества антигена. Этот феноэдрн называют десенсибилизацией. Данный метод разработан А. М. Без-редка и используется при введении животным лечебной сыворотки.
112
Гиперчувствительность замедленного типа (ГВТ)
Неудачная попытка Р. Коха разработать профилактический препарат против туберкулеза завершилась открытием им в 1890 г. нового иммунологического феномена — гиперчувствительности замедленного типа. В настоящее время ГЗТ рассматривается как самостоятельная форма иммунного ответа организма и широко используется для аллергической* прижизненной диагностики инфекционных заболеваний, вызываемых в основном абсолютными или факультативными внутриклеточными паразитами. Кроме инфекционной патологии макроорганизм реагирует в форме ГЗТ при отторжении трансплантатов, онкологических, аутоиммунных процессах, при контактном дерматите, силикозе. Опосредуется гиперчувствительность замедленного типа Т-лимфоцита-ми, макрофагами и их растворимыми медиаторами (лимфотоксин, ингибирующий миграцию макрофагов фактор и др.).
Обязательным условием при этом является непосредственный контакт с аллергеном сенсибилизированных клеток макроорганизма. Поэтому реакция развивается от нескольких часов до нескольких дней, а на месте встречи эффекторов и аллергена скапливаются не полиморфноядерные лейкоциты^ как при ТНТ, а_мононукпрарьь Классическим примером ГЗТ является туберкулиновая проба, хотя она сопровождает многие хронические болезни бактериальной, вирусной, грибной и паразитарной этиологии.
Предполагается, что аллергены животного и микробного происхождения разрушаются различными субпопуляциями киллерных Т-клеток. В ряде случаев параллельно с ГЗТ повышается резистентность, которая носит неспецифический характер. Обычно повышение резистентности сопровождает гиперчувствительность, индуцированную живыми микроорганизмами. Наиболее вероятным объяснением данного феномена является ирспепифичрский клеточный—иммунитет^обусловленный макрофагами, которые в ГЗТ кооперируют с Т-лимфоцитами., Специфичность ГЗТ доказывается развитием аллергических реакций только на гомологичный сенсибилизирующему антигену аллерген, а также соответствующей реакцией мононуклеаров в тестах бласттрансформации и подавления миграции макрофагов. Зависимость реакции от клеточного компонента демонстрируется воспроизведением положительной аллергической реакции у здорового животного, которому предварительно ввели отмытые от плазмы лимфоциты сенсибилизированного животного. ГЗТ индуцируется слабоантигенными белками с низкой молекулярной массой, что обычно достигается гидролитическим расщеплением естественных антигенов, а также липополисахаридами и гаптенами. В последнем случае ответ развивается на гаптен и на носитель.
Наиболее эффективно ГЗТ воспроизводится внутрикожным введением аллергена сенсибилированному животному, что связывается с особой ролью в этом процессе липополисахаридов кожи.
ГЗТ вызывают не только аллергены, поступающие из внешней среды. Структурные изменения макромолекул организма в результате соматических мутаций, разрушения микроорганизмами, присоединения к ним экзогенных гаптенов или белков приводят к появлению аутоантигенов и развитию аутоаллергических реакций. Среди них особенно важными являются ревматоидные и другие процессы, которые объединяются общим признаком (фибриноидная дегенерация коллагеновых волокон с одновременной деполимеризацией гиалуроновой кислоты) и называются коллагенозами. .1
Яммунологичеекия память "л *.
ж Под иммунологической памятью, или анамнестической иммунной реакцией, понимают форму иммунного ответа по вхпричнпму типу, ха-
8—Ветеринарная мякробиодогил
рактеризующуюся более быстрым, интенсивным и повсеместным синтезом антител преимущественно IgG-класса. /
Первичный иммунный ответ, то есть реакция организма на первый антигенный стимул, выражается последовательно сменяемыми фазами антителообразования.^Первая фаза от введения антигена до ускорения титра антител протекает скрыто и называется индуктивной.l/Она сменяется продуктивной фазой логарифмического экспоненциального прироста антител, титр которых достигает максимума. ЛЗатем наступает фаза стабилизации уровня антител на определенном отрезке времени и наконец антителообразование завершается фазой снижения продукции антител.^Каждая фаза в зависимости от антигена и вида животного имеет определенные временные границы. (Причем первыми, как правило, появляются антитела, ассоциированные с IgM, затем образуются антитела IgG-, IgA-класса и т. д.
Если через~ несколько месяцев в организм ввести тот же антиген, иммунный ответ будет протекать как вторичный — более быстро, в более высоком титре и не только в лимфоузлах, близких к месту введения антигена, а антительная активность будет почти сразу же связана с иммуноглобулином G-класса.
Подобный эффект характерен не только для антителообразования и обусловлен существованием клеток памяти — Т- и В-мемореальных клеток. По мере выведения антигена из организма и затухания иммуногенеза в организме накапливаются малые лимфоциты определенного клона, репопулируют различные периферические лимфоидные органы и при повторном стимуле гомологичным или близким антигеном быстро и повсеместно превращаются в клетки-эффекторы иммунитета.
Клетки памяти долго сохраняются, обеспечивая невосприимчивость организма. Например, при оспе иммунитет фактически пожизненный.
В практике широко пользуются анамнестическими иммунными реакциями. Они служат основой реиммунизации животных, разработки более экономной технологии эксплуатации продуцентов сывороток, а также серологической дифференциации вакцинальных и инфекционных процессов.
Иммунологическая толерантность
Иммунологической толерантностью (лат. tolerantia — терпение, терпеливость) называют специфическую неотвечаемость организма на определенный антиген при одновременном сохранении реактивности на другие а'нтигеньг/УЭта форма иммунного ответа может быть высоко-, частично-11 слабовыраженной.
Как иммунологический феномен, толерантность экспериментально обоснована независимо друг от друга Гашеком и Медаваром с сотрудниками в 1953 г., хотя первое наблюдение было описано Оуэном еще в 1945 г. Они воспроизводили иммунологическую толерантность на животных в период внутриутробного развития и новорожденности, и поэтому укрепилось мнение, что данная форма иммунного ответа присуща только неонатальным животным. Однако еще в 1949 г. Фелтон под названием иммунологического паралича описал специфическую неотвечаемость взрослых животных на большие дозы антигена. В последующем другими исследователями была показана возможность создать состояние толерантности у взрослых животных неагрегированными белками путем многократного введения больших или очень малых количеств антигена. У развивающихся животных, особенно с внутриутробной neJ редачей материнских антител, просто ее легче воспроизвести. Это потому, что соотношение иммунокомпетентных клеток и антигена будет не в пользу первых; кроме того, этому будут способствовать высокоаф-
114 р..
финные материнские антитела, конкурирующие за антиген с фетальными иммуноглобулинами.
В настоящее время идентифицированы популяции Т- и В- лимфоцитов, аффектирующие иммунодепрессивные реакции. Супрессорные Т-клетки локализуются преимущественно в селезенке и тимусе, прилипают к стеклянной вате и несут на внешней мембране Ьу2- и 1а-антиге-ны. Они выделяют специальные низкомолекулярные белки (около 45 000 дальтон), которые отличаются от иммуноглобулиновых детерминант, но синтезируются под контролем генов иммунного ответа Н-2 комплекса. Эти растворимые медиаторы осуществляют антигенспеци-фическую супрессию посредством взаимодействия с Т-хелперами, имеющими комплементарные им рецепторы. Клетками-мишенями медиаторов Ts-лимфоцитов могут быть также предшественницы киллеров. Кроме того, Т-супрессоры выделяют антигеннеспецифические медиаторы, подавляющие пролиферацию и клонообразование клетками-мишенями.
В отличие от Т-супрессоров В5-клетки не прилипают к стеклянной вате, не несут маркеров Т-лимфоцитов, а имеют поверхностные иммуноглобулиновые детерминанты. Они постоянно локализуются и активно пролифирируют в костном мозге, селезенке и лимфоузлах и отличаются чувствительностью к циклофосфамиду. Кроме того, они обладают также антигенспецифическим и антигеннеспецифическим супрессорным действием; могут подавлять первичный, вторичный иммунный ответ, ан-тителогенез и клеточно-опосредованные реакции иммунитета. При этом для выработки гуморального фактора, подавляющего продукцию антител, необходим прямой контакт В8-клеток с антигенстимулированными лимфоцитами. Субпопуляций В^-лимфоцитов, видимо, много; их активация приводит к снижению фактически всех иммунных реакций организма, а подавление активности — к развитию аутоиммунных реакций.
МЕХАНИЗМ ИММУННОГО ОТВЕТА
Современные теории иммуногенеза можно подразделить на инструктивные и селективные. Инструктивные теории предусматривают образование комплементарных антигенным структурам антител путем видоизменения синтезируемых в рибосомах полипептидов в результате непосредственного контакта с ними антигена (теория прямой матрицы Гауровица—Полинга) или путем стойкого изменения генотипа клеток-предшественниц антителопродуцентов (теория непрямой матрицы Бернета—Феннера). Селективные теории предусматривают отбор комплементарных антигену молекул нормальных антител с последующей передачей иммунного комплекса через фагоцитов продуцентам антител (теория естественной селекции Йерне) или иммунокомпетентных клеток, обладающих соответствующими рецепторами, которые пролиферируют в клоны плазматических клеток, образующих гомологичные антитела (клонально-селекционная теория Бернета).
По современным представлениям, иммуннопоэз основан на функционировании Т- и В-лимфоцитов, которые кооперативно взаимодействуют между собой и с макрофагами, или клетками А (от англ, adherent— свойство прилипать к стеклу). Развитие иммунных реакций начинается с распознавания антигена. Наиболее сложный механизм распознавания белкового тимусзависимого антигена. Т-хелперы и эф-фекторы гиперчувствительности замедленного типа реагируют ня симплекс носителя антигена (а не гаптена) с белком Га, образование которого кодируется генами иммунного ответа. Т-киллеры лизируют измене нные клетки организма, на поверхности которых антигены образуют комплекс с белками, кодируемыми генами гистосовместимости. При 3jOM генотип взаимодействующих клеток-мишеней, Т-, В- и А-клеток 8* 115
должен быть идентичным. В таком случае Т-лимфоциты при помощи
рецепторов для Fc-фрагментов иммуноглобулинов воспринимают модифицированный антиген макрофагов, дополнительно усиливают его la-белком и передают В-лимфоцитам. Последние, получив дополнительный митогенный сигнал от иммунного комплекса, присоединенного при помощи рецептора для СЗ, начинают пролиферировать и трансформироваться в клоны плазматических клеток. Процессы бласттранс-формации начинаются в результате активации аденилциклазы и образования циклического аденилмонофосфата (ц-АМФ).
Полисахариды и агрегированные белковые антигены с регулярной жесткой структурой (например, полимеризованый флагеллин) вызывают трансформацию В-лимфоцитов в плазмоциты без вспомогательной функции Т-лимфоцитов. Правда, даже на полимерный белковый антиген без участия Т-хелперов образуется только IgAL
Иммуноглобулины синтезируются под действием м-РНК в виде отдельных цепей полипептидов в полирибосомах, связанных с мембранами цитоплазматического ретикулума плазмоцитов. Экскреция иммуноглобулинов плазматическими клетками осуществляется отдельными цепями полипептидов или целыми молекулами. Основная сборка иммуноглобулинов происходит в цистернах цитоплазматического ретику-лумЬ. При этом L-цепи из легких рибосом подходят к Н-цепям тяжелых рибосом и объединяются с ними в молекулу иммуноглобулина. Каждая плазматическая клетка секретирует от 50 до 700 молекул иммуноглобулина в секунду.
Синтез мебранных и секретируемых иммуноглобулинов, как и образование вариабельного и константного участков каждого полипептида, кодируется разными генами. Поскольку образование иммуноглобулинов подчинено общим закономерностям биосинтеза белков, на индукции антителообразован ия сказывается положительно действие
соматотропного гормона и отрицательно — адренокортикостероидов.
МЕТОДИЧЕСКИЕ ПРИНЦИПЫ РЕГИСТРАЦИИ ИММУННОГО ОТВЕТА
Разнообразие форм иммунного ответа предопределяет широкий набор методов их регистрации. Однако каждой форме иммунореагирования соответствует только свой, определенный набор методов исследования, что важна знать для правильного подбора методов тестирования иммунного состояния организма.
При регистрации антителообразования необходимо учитывать наличие циркулирующих в крови и лимфе антител, секреторных, или местных, образующихся локально слизистыми покровами антител, и антител, содержащихся в клетках-продуцентах.
Сывороточные антитела представлены преимущественно IgG и IgM, которые, как уже указывалось, взаимодействуют в основном с растворимыми и корпускулярными антигенами соответственно. Следо-1 вательно, антитела, ассоциированные с IgG, можно обнаружить, при помощи реакций, основанных на феноменепрТТЦПпитации, а связанные с IgM — при помощи реакций, основанных на, феномене агглютинации. Антитела, участвующие в формировании феномена преципитации (пре-ципитины) выявляют в реакциях кольцевой преципитации (пробирочная) и преципитации в гелях (пластинчатая). В обоих вариантах ингредиенты реакции должны быть прозрачными, чтобы визуально зарегистрировать образовавшийся преципитат в виде кольца на границе двух сред при постановке пробирочной РП или в виде линий межг ду лунками с реагентами при постановке реакции диффузионной прециг питации (РДП).
Антитела, участвующие в формировании феномена агглютинации (агглютинины) выявляют в реакциях агглютинации — пробирочной, 116
4. Минимальная потребность иммуноглобулинов (мг/мл) при взаимодействии с препаратами гомологичных корпускулярных антигенов эшерихий
Препараты Тесты IgM IgG
О-антиген К-антиген О-антиген К-антиген
РА РИФ РИГА 0,00059 0,00950 0,00007 0,00030 0,00015 0,00007 0,01640 0,06563 0,01640 0,03281 0,03281 0,06560
пластинчатой, кольцевой в различных вариантах. Агглютинат обычно хорошо виден глазом в форме беловато-сероватых трудно разбиваемых при встряхивании комочков. Для выявления агглютининов в молоке реакцию ставят с подкрашенным антигеном.
Для повышения чувствительности серологических (лат. serum — сыворотка) реакций обычно растворимые антигены закрепляют на какой-либо крупной частице, получая искусственный корпускулярный антиген (например, в реакциях латекс-агглютинации или непрямой гемагглютинации), или вводят вторую, индикаторную систему (например, в реакции связывания комплемента).
Во всех этих реакциях уровень антител определяют в титрах, принимая за последний наибольшее разведение сыворотки, обеспечивающее положительный результат реакции.
Для определения количества антител к растворимому антигену можно применить метод Гейдельбергера или иммунорадиохимический. Первый метод наиболее доступный, основан он на учете прироста белка в преципитате, полученном с определенным количеством антигена в зоне эквивалентных соотношений реагентов.
Если циркулирующие с кровотоком антитела окажутся неполными, применяют тест Кумбса, основанный на использовании антивидовой сыворотки. Последняя объединяет в видимые агрегаты антитела, связанные одним функционирующим активным центром с антигенами. Таким же образом, но более полно, независимо от класса и полноценности будет выявлять антитела метод флуоресцирующих антител в непрямом варианте (см. ниже), поскольку в отличие от других серологических реакций он обнаруживает антитела, связавшиеся с фиксированным антигеном. Однако титры антител, выявляемые разными реакциями, не будут совпадать, что в определенной мере зависит и от качества антигена. Для примера приведем результаты взаимодействия взвешенных натуральных корпускулярных (в реакции агглютинации— РА), фиксированных натуральных корпускулярных (в реакции иммунофлуоресценции— РИФ) и взвешенных искусственных корпускулярных (в реакции непрямой гемагглютинации — РИГА) О- и К-антигенов эшерихий с IgM и IgG, выделенными из гомологичной сыворотки крупного рогатого скота (табл. 4).
Табличные данные подтверждают более эффективное связывание с корпускулярными антигенами эшерихий препаратов IgM и одновременно свидетельствуют о предпочтительном взаимодействии IgM-антител с К-антигеном, а IgG-антител— с О-антигеном эшерихий.
Практически же приходится часто использовать целый набор серологических методов диагностики для одной какой-либо болезни. Особенно показателен в этом отношении бруцеллез. Для его диагностики применяют две серологические реакции — РА и РСК. Первой выявляют свежие случаи болезни, второй — развитие инфекционного процесса. В качестве арбитражного метода используют и третий тест-реакцию Кумбса, поскольку синтез неполных антител опережает и
117
Рис. 51. Принципы серологического тестирования бруцеллезного процесса у рогатого скота.
завершает образование полных антител, улавливаемых в РА и РСК-Кроме того, экспериментально доказано совпадение результатов исследования скота на бруцеллез реакциями агглютинации, связывания комплемента, Кумбса (РК) с показаниями метода флуоресцирующих антител (МФА) в непрямом варианте. Таким образом, последняя реакция принципиально информативнее всех предыдущих диагностических тестов (рис. 51). Она может регистрировать антитела классов М, G как полные, так и неполные.
Однако ни один из диагностических серологических тестов не позволяет строго разграничить вакцинальный и эпизоотический процессы у бруцеллезного скота. Их можно разграничить при исследовании классов иммуноглобулинов в динамике. Если, скажем, через 1,5—2 месяца синтез IgM снизится или заместится синтезом IgG, то это будет характеризовать эпизоотический процесс, связанный с репликацией возбудителя в организме.
Наличие иммуноглобулинов определенного класса важно исследовать и в других случаях. Количество их устанавливают с помощью методов радиальной иммунодиффузии, а при низкой концентрации — им-мунорадиоассея. Метод радиальной иммунодиффузии основан на прямой зависимости диаметра кольца преципитата, который образуют иммуноглобулин пробы с антисывороткой, смешанной с гелем. Имму-норадиоассей основан на учете радиоактивного антигена, оставшегося над осадком из-за конкурентного связывания нативного антигена. Последний метод более чувствителен (позволяет определять антиген в пикограммах), но требует специального оборудования и меченых реагентов.
При определении титра секреторных антител к бактериям используют реакцию агглютинации со слизью. Уровень секреторных антител не совпадает с содержанием сывороточных антител и в десятки раз превышает последние.
Реже обнаруживают антителопродуцирующие клетки. Их индицируют при помощи меченых антител или антигенов. В первом случае наиболее популярным является сэндвич-тест (англ, sandwich — многослойный), смысл которого сводится к последовательному нанесению на мазок-отпечаток или срез лимфоидной ткани сначала взвеси или раствора соответствующего антигена, а затем гомологичной им меченной флуорохромом антисыворотки. Светящийся антиген локализуется на клетках, продуцирующих антитела, высвечивая их контуры.
Если нужно обнаружить не антитело, а иммуноглобулинпродуци-рующие клетки, используют прямой и непрямой варианты МФА (см. ниже) с применением меченой антивидовой сыворотки ко всем глобулинам или к иммуноглобулинам определенного класса. *
118
Антитела можно также тестировать in vitro в реакциях торможения агглютинации, преципитации, в реакциях лизиса, конглютинации, иммунного прилипания, опсонизации, a in vivo — в реакции защиты.
Гиперчувствительность немедленного типа, протекающую как системная или локальная анафилаксия (атопии), тестируют посредством выявления IgE. Поскольку последний не участвует в обычных серологических реакциях, используют антигенные свойства его Н-цепей или цитофильные свойства Fc-фрагмента. Тестирование, основанное на использовании антигенных свойств иммуноглобулина, состоит в применении ативидовых сывороток с помощью методов радиальной иммунодиффузии или более чувствительных иммунорадиохимических методов. Из-за низкой концентрации IgE-антител в сыворотке последние более предпочтительны.
Реагиновую активность IgE-антител тестируют путем выявления гомоцитотропности Fc-фрагмента молекулы иммуноглобулина с помощью реакции, разработанной Праусницем и Кюстнером в 1921 г. на людях. Здоровому человеку внутрикожно вводят сыворотку больного в разных разведениях, а через 1—2 суток в эти же точки инъецируют предполагаемый аллерген. В положительном случае развивается острое катаральное воспаление, по степени выраженности которого судят о количестве реагиновых антител. На сельскохозяйственных животных эту пробу учитывать трудно, поэтому можно использовать способность IgE-реагинов вызывать дегрануляцию тучных клеток собственного организма или животных гомологичных видов. Можно также воспользоваться реакцией пассивной кожной анафилаксии (ПКА) на видоидентичных животных. Внутрикожно этим животным вводят испытуемую сыворотку в различных разведениях, а через 1—2 ч внутривенно инокулируют предполагаемый аллерген с синькой Эванса. Через несколько минут животное убивают и со стороны мездры воспаленного участка кожи учитывают диаметр окрашенных пятен, величина которого прямо пропорциональна количеству IgE-антител.
Гиперчувствительность немедленного типа, обусловленную реакциями иммунных комплексов, особенно обусловленных IgG-антитела-ми, тестируют также с помощью ПКА-пробы, но на морских свинках. IgG обладают гетероцитофильностью и могут эффектировать ГНТ на негомологичных животных. IgG-реагины можно выявить и в тесте дегрануляции базофилоцитов, но опять-таки животного другого вида, например кролика.
Гиперчувствительность замедленного типа тестируют на животных и лабораторными методами. При определении ГЗТ на животных предположительно сенсибилизированным вводят внутрикожно (предпочтительно), подкожно, наносят на скарифицированную кожу или на слизистую оболочку глаз аллерген. В положительном случае через 12—48 ч на месте аппликации последнего развивается продуктивное воспаление, по степени выраженности которого судят о контакте организма с микробом, гомологичным применному аллергену. Таким образом диагностируют туберкулез, паратуберкулезный энтерит рогатого скота, сап, ме-лоидоз, псевдотуберкулез, туляремию, листериоз, бруцеллез, сальмонеллез и др.
Из лабораторных тестов чаще других используют реакцию бласт-трансформации лимфоцитов и реакцию задержки подвижности (миграции) макрофагов. Реакцию трансформации сенсибилизированных лимфоцитов в бласты (большие клетки с сетчатым хроматином в отличие от глыбчатых бухтовок хроматина зрелых малых лимфоцитов) под действием гомологичного аллергена можно поставить в пенициллиновых флаконах со средой 199. Если через 3—5 дней культивирования лейкоцитов во флаконах с гомологичным аллергеном будет больше лим
119
фобластов, чем во флаконах без аллергена, реакцию считают положительной.
Реакцию миграции макрофагов ставят также в среде 199, которой заливают фиксированные на две чашки Петри капилляры, заполненные тщательно отмытыми лейкоцитами предположительно сенсибилизированного животного. В среде с гомологичным аллергеном миграция макрофагов из капилляров подавляется соответствующим фактором лимфоцитов; в среде, не содержащей гомологичного аллергена, макрофаги выходят и распространяются по дну чашки Петри вокруг выходного отверстия капилляров на гораздо больших площадях. Данная реакция является чувствительным и специфичным тестом на ГЗТ и вместе с реакцией бласттрансформации лимфоцитов используется для диагностики туберкулеза.
Состояние гиперчувствительности замедленного типа безотносительно к сенсибилизирующему антигену можно выявить по нарастанию клеток-эффекторов ГЗТ. Для этого наиболее доступными являются иммуноцитохимические методы, основанные на использовании специфических антисывороток, конъюгированных с флуорохромами или ферментами (например, пероксидазой). Эту реакцию можно использовать также в иммунологии рака и трансплантационной иммунологии.
Иммунологическую память практически тестируют по признакам вторичного иммунного ответа. В частности, учитывают превалирующее повсеместное содержание IgG в высоких концентрациях и сильно выраженные реакции клеточноопосредованного иммунитета.
Иммуногологическую толерантность идентифицируют по неотвечае-мости на какой-либо определенный антиген при сохранении реакции организма на другие антигены. При этом учитывают возрастные особенности иммунореактивности организма, ареактивность, связанную с нарушением физиологического статуса животных (например, в результате чрезмерной эксплуатации и пр.).
Практически в инфекционной иммунологии методы регистрации форм иммунного ответа используют для специфической диагностики болезней, вызываемых микроорганизмами. Однако правильно установить диагноз можно не только посредством определения иммунных реакций организма, но и непосредственным обнаружением и идентификацией возбудителя болезни или его токсинов. Для этого все чаще используют также серологические реакции, которые более правильно называть иммунохимическими. Смысл таких исследований заключается в' учете результатов взаимодействия специфических антисывороток или их препаратов (например, иммуноглобулинов определенного класса) с антигенными детерминантами микробной клетки, продуктов ее обмена или распада. Именно эти реакции и составляют основу обнаружения и идентификации антигенов.
СОВРЕМЕННЫЕ МЕТОДЫ АНТИГЕННОГО АНАЛИЗА
Микробные клетки несут на своей поверхности разнообразные антигены, среди которых имеются детерминанты, общие нескольким микроорганизмам или даже идентичные животным клеткам и уникальные, присущие только данному виду или варианту микроскопических существ. Токсигенные штаммы обычно содержат эти специфичные детерминанты и в экзопродуктах. Для успешного проведения иммунохи-мического анализа очень важно получить антисыворотку (то есть иммунную сыворотку) на максимально очищенные специфичные для вида или варианта антигены. Достигается это предварительной дезинтеграцией микробных структур, выделением и очисткой необходимых антигенных комплексов, а также путем специфической адсорбции антисыворотки, полученной на взвесь целых микробных клеток к их оболочкам или
120
на раствор экзотоксина. Пользуются и разведением антисыворотки, чтобы избавиться от неспецифических реакций. Специфичную антисыворотку используют для иммунохимической идентификации антигенов в нативном виде или в виде конъюгатов с видимыми под обычным световым микроскопом ферментами, обнаруживаемыми под люминесцентным микроскопом флуорохромами или видимыми под электронным микроскопом контрастёрами.
В ветеринарной практике приходится также анализировать растворимые антигены микроорганизмов. Иммунохимической идентификации обычно подвергают клостридии, эшерихии, стафилококки и некоторые другие продуценты экзотоксинов, а также органы и ткани животных, инфицированных сибиреязвенным микробом. Причем в первом случае экзотоксины накапливают обычно культивированием бактерий на специальных средах, во втором — преципитиноген экстрагируют изотоническим раствором хлорида натрия. В лабораториях чаще идентифицируют взвесь микробных клеток, то есть корпускулярный антиген.
Для обнаружения и идентификации растворимых антигенов применяют целый ряд методов, основанных на феномене преципитации. Наиболее популярной в ветеринарной практике является кольцевая реакция преципитации (РП), предложенная Асколи в 1902 г. для обнаружения сибиреязвенного антигена в кожевенном сырье. Ставят ее в специальных узких пробирках и при появлении помутнения на границе между антисывороткой и антигеном можно идентифицировать гомологичный антисыворотке антиген в течение нескольких минут. Простота и доступность пробирочной РП обеспечили широкое применение ее в ветеринарно-санитарной экспертизе и криминалистике для определения видовой принадлежности мяса нли идентификации крови.
При постановке РП с меченным радиоактивным йодом антигеном, не превышающим молекулярную массу альбумина (то есть не выпадающим в осадок при 50 %-ном насыщении сульфатом аммония), можно установить общее количество образовавшихся антител. Этой методикой Фарра экспериментаторы пользуются для определения антигенсвя-зывающей способности антител.
На принципе преципитации основана также реакция нейтрализации, сущность которой сводится к прединкубации токсинов, ферментов или реже вирусов с гомологичными антисыворотками с последующим воздействием смеси ингредиентов на живую систему (организм, культуру тканей или клеток). В результате предварительного выдерживания смеси антител с растворимым антигеном в пробирке последний обезвреживается, что подтверждается реакцией живой системы. Реакцию впервые продемонстрировали Беринг и Китазато в 1890 г. на модели столбнячных токсина и антитоксина. В настоящее время ее используют для видовой и особенно внутривидовой идентификации токсигенных Cl. perfringens, Cl. botulinum и некоторых других микроорганизмов.
Применение реакции преципитации в жидкой среде не позволяет, однако, характеризовать гетерогенность антигенов, то есть количество и концентрацию антигенов в препарате. Данные сведения можно получить, если поставить РП в геле (чаще в агаровом) или реакцию диффузионной преципитации (РДП).
Обладая разной скоростью передвижения, различные антигены препарата неодинаково диффундируют, образуя в толще прозрачного геля на месте встречи с гомологичным антителом преципитаты. Локализация и конфигурация линий преципитатов будут характерны для каждого компонента антигенного препарата, что служит критерием оценки его качества. Путем разведения препарата можно характеризовать относительное содержание в нем антигенов.
Если в среде геля диффундирует один реагент (обычно антиген),
121
реакцию называют простой или одномерной диффузии, а если навстречу друг другу одновременно диффундируют оба реагента (антиген и антитело), ее называют реакцией двумерной или двойной диффузии.
Реакцию одномерной диффузии можно поставить в пробирке и на стеклянной пластинке. Пробирочный вариант РДП был впервые разработан в 1946 г. Оудином. На дно узкой пробирки помещали антисыворотку, смешанную с агаровым гелем и сверху заливали раствором антигена, покрытым слоем вазелинового масла. Антиген диффундировал в подлежащий слой геля и, вступая в реакцию с антителами, образовывал в нем линии преципитации. По их количеству и локализации судили о качестве антигенного препарата.
Манчини в 1965 г. предложил пластинчатый вариант одномерной РДП, который получил название реакции радиальной иммунодиффузии (РИД) из-за того, что антиген диффундирует из лунок радиально в гель, смешанный с антисывороткой, в результате чего вокруг лунок образуются кольца преципитации. Диаметр этих колец прямо пропорционален концентрации антигена. На этом основании РИД используют для определения содержания растворимых антигенов (иммуноглобулинов всех классов, токсинов, ферментов, антигенных гормонов).
Но еще в 1948 г. Оухтерлони разработал метод двойной иммунодиффузии в агаровый гель. Для этого в пластинке агара вырезалось несколько лунок — центральная и периферические. В центральную лунку помещали антисыворотку, в периферические — растворы различных антигенов или раствор одного антигена в разных разведениях. Диффундирующие реагенты взаимодействуют, образуя линии преципитации в промежутке геля между центральной и периферическими лунками. Таким образом устанавливают количество антигенов в препарате, примерную их концентрацию и степень родства. В последнем случае обращают внимание на совпадение локализации и конфигурации линий преципитации сравниваемых антигенов (реакция идентичности), пересечение этих линий (реакция неидентичности) и наличие шпор у скрещивающихся линий преципитации. Реакция идентичности свидетельствует о тождественности сравниваемых антигенов, неидентичности— об их различиях, а наличие шпор — о содержании в сравниваемых разных препаратах общих антигенных детерминант.
Данная реакция является самым распространенным методом тестирования антигенных свойств растворимых препаратов в экспериментальной работе и широко внедряется в практику диагностических лабораторий из-за своей простоты и высокой чувствительности.
В 1953 г. Оакли и Фултроп предложили более четко воспроизводимый вариант метода Оудина. Он заключается в том, что в стандартные пробирки оба реагента помещают в смеси с агаром и встреча их происходит в пограничном слое геля такой же концентрации. По чувствительности он превосходит метод Оухтерлони.
В 1953 г. Грабар и Вильямс предложили комбинированный метод анализа растворимых антигенов, включающий в себя электрофорез антигена (центральная лунка) в агаровом геле с последующим взаимодействием его с антисывороткой (в боковых канавках) по типу реакции Оухтерлони. Этот метод называется иммуноэлектрофорезсм (ИЭФ) и позволяет более четко разделять антигены в испытуемом препарате, то есть более полно характеризовать набор антигенов в препарате. Однако для постановки ИЭФ требуется довольно высокая концентрация реагентов, особенно антигенов (табл. 5). ;
ИЭФ -можно ставить с меченными радиоактивными веществами реагентами, тогда получится радиоиммуноэлектрофорез, С помощью фотоэмульсии он позволяет выявлять самые незначительные количества иммунных глобулинов.
122
Г
I j •
1 j
*
j 4 и
5. Минимальное количество препаратов растворимых антигенов Е. coll 078: К-80, необходимое для образования видимого преципитата при взаимодействии
с препаратом IgG крупного рогатого скота (мг/мл)
Тест Конечная концентрация IgG (мг/мл) ч Потребность гексоз
О-антнгена К-антнгена
РДП 11,12 0,0461 0,0630
РИД 8,40 0,0923 0,1250
ИЭФ 8,40 2,9500 2,0000
]•
Растворимые антигены можно также анализировать специфическими реагентами и на довольно высоком уровне чувствительности путем нагружения ими неспецифических носителей — частиц латекса, . эритроцитов барана как наиболее резистентных к перепадам осмотического давления. В таких случаях, правда, будет уже не реакция преципитации, а реакции непрямой агглютинации или торможения непрямой гемагглютинации.
Для индикации и идентификации корпускулярных антигенов применяют серологические реакции, основанные на феномене агглютинации, а также иммунохимические методы, сочетающие принципы серологического и микроскопического анализов и представляющие, по существу, феномен микропреципитации меченых антител. К последним относят антитела, меченные ферментами (для светопольной микроскопии), флуорохромами (для люминесцентной микроскопии) и конт-растёрами (для электронной микроскопии).
Антигенный анализ с помощью реакций агглютинации производится со взвесью микроорганизмов, содержащей тысячи и миллионы микробных тел, то есть на уровне популяции, а иммунохимический анализ с использованием меченых антител — на уровне отдельных клеток. Причем для применения агглютинационного теста обязательно выделение микроба в чистую культуру, имхмунохимический анализ на уровне отдельной клетки может производиться и в смешанной культуре или взвеси микробов.
Реакция агглютинации (РА) пробирочная или пластинчатая выявляет только поверхностные антигенные детерминанты К-, О- и Н-антигенов микробной клетки. Поскольку К-антиген бактерий покрывает детерминанты О-антигена, РА ставят с гретой и нативной взвесью идентифицируемой культуры. При этом культуру берут в стационарной фазе роста, когда все поверхностные антигены полностью экспрессированы. Для выявления Н-антигена культуру исследуют раньше.
РА широко используют в ветеринарии для идентификации эшерихий, сальмонелл и ряда других бактерий. Однако необходимость в выделении микробов в чистую культуру и накопления бактериальной массы снижают чувствительность данного теста и требуют много времени для его осуществления. К тому же при постановке РА не учитываются индивидуальные антигенные свойства бактерий исследуемой популяции, исключается возможность визуальной характеристики антигенов. ~
Указанных недостатков лишен метод флуоресцирующих антител (МФА), основанный на микропреципитации меченных флуорохромами антител на фиксированном антигене. Оседая на гомологичной частице, меченые антитела специфически взаимодействуют с отдельными клетками, будь то в чистой или смешанной культуре. Поскольку преципитирующие на частице антитела мечены, они избирательно высвечивают индицируемые объекты. Поэтому даже единичные клетки будут видны в поле зрения микроскопа подобно тому, как свер-
123
Рис. 52. Основные варианты метода флуоресцирующих антител (схема):
а — прямой одноступенчатый; б — непрямой двухступенчатый; в — непрямой трехступенчатый (ан-тикомплементарный): 1— антиген; 2 —немеченая сыворотка I ступени (б, в); 3 —меченая сыворотка против искомого антигена (а), антиглобулнновая И (б) и антикомплементарная Ш (в) ступеней; 4 — комплемент сыворотки крови морской свинки.
кают звезды на темном небосклоне. Отсюда более высокая чувствительность МФА по сравнению с РА и возможность использования иммунохимического анализа смешанных антигенов. Последнее делает возможным применение МФА для обнаружения антигенов непосредственно в патологическом материале, что не позволяет ни один серологический метод-
Из-за того, что отпадает необходимость выделять микроорганизмы в чистую культуру и сокращается время на постановку реакции примерно в 20 раз, метод флуоресцирующих антител считается экспрессным. Принципиально важным преимуществом МФА является также возможность дополнительно характеризовать морфологию исследуемых корпускул, что невозможно сделать при использовании серологических методов. Наконец, в отличие от РП и РА метод флуоресцирующих антител выявляет антигенные детерминанты, взаимодействующие с иммуноглобулинами не отдельных (IgM или IgG), а всех классов, причем с функцией как полных, так и неполных антител.
В лабораторной практике наибольшее распространение получили три варианта МФА: прямой, непрямой двухступенчатый и непрямой трухступенчатый (рис. 52).
Прямой вариант заключается в том, что на фиксированный на стекле антиген наносят меченую антисыворотку и инкубируют при температуре тела животного 20 — 45 мин. Мазок отмывают от несвязав-шихся антител, покрывают нефлуоресцирующей жидкостью (например, диметилфталатом) и просматривают под люминесцентным микроскопом. В положительном случае в поле зрения микроскопа видны ярко сверкающие клетки микроорганизмов. При этом микробы с развитым ригидным веществом по периферии светятся более ярко из-за суммации света от флуоресцирующих молекул, зафиксировавшихся по боковым участкам стенки клеток. Микроорганизмы с неразвитым ригидным слоем в стенке (например, вибрионы, лептоспиры, микоплазмы) обычно уплощаются при фиксации на стекле и поэтому светятся всей поверхностью равномерно. 4
Прямой вариант достаточно чувствителен, специфичен, прост в исполнении и требует мало времени. Но экономически не выгоден, так как на каждый антиген нужно иметь меченую сыворотку. К тому же он пригоден лишь для обнаружения антигенов, то есть для прямой индикации.
Непрямой двухступенчатый вариант сводится к тому, что на фиксированный антиген вначале наносят антисыворотку в немеченом виде (сыворотка I ступени), а затем уже антивидовую меченую сыворотку (сыворотка II ступени). В положительном случае между антигеном и сывороткой I ступени образуется иммунный комплекс, для выявления которого мы наносим меченую сыворотку II ступени, содержащую антитела, к иммуноглобулинам сыворотки I ступени. Таким образом, иммуноглобулины сыворотки I ступени будут антителами для индицируемого антигена и одновременно антигенами для сыворотки II ступени.
124
Сыворотка I ступени физически увеличивает размеры светящегося комплекса, поэтому данный вариант чувствительнее прямого и пригоден для обнаружения даже самых мелких микроорганизмов (например, вирусов). Так как сыворотка I ступени применяется в немеченом виде, непрямой вариант можно использовать не только для прямой, но и для обратной индикации, то есть для обнаружения антител. Кроме того, данный вариант экономичнее прямого, так как для его осуществления надо иметь столько меченых антивидовых сывороток, сколько имеется продуцентов сыворотки I ступени. Сыворотку I ступени обычно получают на кроликах, лошадях, волах, баранах, свиньях, и курах. Следовательно, располагая набором из 5 — 7 антивидовых меченых сывороток, производственная лаборатория в состоянии выявлять все интересующие ее антигены и антитела.
Непрямой трехступенчатый, или антикомплементарный, вариант заключается в последовательной обработке фиксированного на стекле антигена немеченой антисывороткой (сыворотка I ступени), немеченым комплементом (сыворотка II ступени) и, наконец, меченой антикомпле-ментарной — антивидовой сывороткой (сыворотка III ступени). При наличии в препарате гомологичного сыворотке I ступени антигена между ними образуется иммунный комплекс, на который фиксируется комплемент (сыворотка II ступени). Для выявления последнего мы и наносим антикомплементарную сыворотку (III ступени) в меченом виде.
В качестве источника комплемента (сыворотки II ступени) может служить сыворотка любого животного, но наиболее активен комплемент морской свинки. Поэтому обычно на II ступени применяют сыворотку крови морской свинки, а на III ступени — меченую кроличью сыворотку против белков крови морской свинки. Таким образом, при наличии лишь одного меченого реагента можно выявлять любой антиген или любое антитело.
В качестве флуорохромов для метки антител чаще используют флуо-£есцеинтиоизоционат (ФИТЦ), светящийся изумрудно-зеленым цветом* Но в арсенале пригодных для метки антител флуорохромов имеются красители, светящиеся желтым, оранжевым, синим и другими цветами. Если каждым из них пометить антисыворотки различной специфичности, в одном и том же препарате можно наблюдать одновременно совершенно разные антигены или антигенные детерминанты, что также выгодно отличает МФА от серологических методов антигенного анализа.
В случае метки антител светорассеивающими ферментами (например, пероксидаза хрена) иммунные комплексы можно выявлять под обычным светопольным микроскопом, что расширяет возможности и деЛает более доступным иммунохимический анализ с применением меченых антител. Данный метод обладает многими достоинствами МФА. Однако и он не позволяет рассмотреть детали антигенного строения поверхности микробной клетки и тем более ее внутренних структур. Это удается сделать с помощью иммунохимического анализа, основанного на’использовании антител, меченных контрастирующими, то есть рассеивающими электроны веществами на уровне электронной микроскопии. С Зтой целью антитела конъюгируют с железосодержащим белком печени лошадей или других животных ферритином, ртутьсодержащим соединением—диазофенилмеркуриацетатом или с йодом. Благодаря непроницаемости контрастирующих веществ можно определить количество и локализацию антигенных детерминант на клеточном и субклеточном уровне.
ЕСТЕСТВЕННАЯ РЕЗИСТЕНТНОСТЬ
Сразу после рождения, а часто и в период внутриутробного развития организм животного атакуют мириады микробных антигенов, но на
125
1 ►
образование специфических факторов защиты нужно время. Поэтому поддержание генетического статуса организма осуществляется не только эффекторами1 Иммунитета, то есть сенсибилизированными лимфоцитами и специфическими антителами. В процессе эволюции у животных выработались специализированные системы защиты, существующие в организме в готовом виде с самых ранних этапов онтогенеза и имеющие более универсальный механизм разрушения микробов, причем универсальность их действия основана на общности точек первичного приложения и не является беспредельной. Точки первичного приложения представлены определенными структурами, которые повторяются у ря* да микроорганизмов, часто далеко не родственных друг другу. Благодаря этому складывается впечатление о неспецифическом действии этих противомикробиых факторов. Однако прн более внимательном анализе механизма их действия выявляется определенная закономерность, позволяющая утверждать о наличии у них групповой специфичности. Одни из них, например, избирательно дезинтегрируют грамотри-цательные, другие грамположительные бактерии, третьи преимущественно подавляют развитие в организме микробов, являющихся факультативными внутриклеточными паразитами. Поэтому под естественной резистентностью можно понимать врожденные внутренние механизмы поддержания генетического постоянства организма, обладающие широким диапазоном противомикробного действия.
Различают клеточные и гуморальные факторы естественной резис-
тентности.
Клеточные факторы естественной резистентности участвуют в защи-
те организма путем фагоцитоза и подразделены И. И. Мечниковым на
макро- и микрофаги. 1
Клеточная система, включающая «профессиональные» макрофаги; обозначается теперь как система мононуклеарных фагоцитов и состоит из промоноцитов, моноцитов и собственно макрофагов. Мононуклеар-ные фагоциты, включенные в эту систему, берут начало от костномозговых предшественников, транспортируются в периферическую кровь как моноциты. Затем через капиллярные стенки выходят в ткани, где становятся тканевыми макрофагами — гистиоцитами, купферовскими клетками, альвеолярными, свободными и фиксированными макрофагами
лимфоузлов, костного мозга, микроглии, серозных полостей и остеокла
стами.
Микрофаги представлены гранулоцитами — обычно зрелыми нейтрофилами и реже эозинофилами.
Процесс фагоцитоза протекает стадийно: направленное перемещение клеток к объекту фагоцитоза (хемотаксис), захватывание и переваривание объекта фагоцитоза.
Хемотаксис осуществляется под действием пептидов фильтрата культур бактерий, комплемента (СЗа, С5а, С567) и иммуноглобулинов классов G и М, полученных под влиянием SH-зависимой протеазы нейтрофилов (лейкогрезин). Направленная миграция клеток в ответ на действие пептидов объясняется связыванием их с рецепторами клетки и последующим расщеплением под влиянием пептидазы. Мононуклеары, участвующие в гиперчувствительности замедленного типа и других клеточных реакциях, передвигаются к объекту фагоцитоза под влиянием хемотаксических факторов, вырабатываемых лимфоцитами.
Кроме участия в хемотаксисе, комплемент и иммуноглобулины стимулируют фагоцитоз путем опсонизации микробов (opsono — приготовлять в пищу). Под действием опсонических факторов изменяется по-: верхность микробных клеток и усиливается прикрепление (аттракций) их к внешней мембране фагоцитов. Различают два основных опсонйчес-ких фактора сыворотки крови — термостабильный IgG и термолабйль-
126
I ный СЗ. Комплемент в состоянии опсонизировать грамотрицательные ]
бактерии в R-форме при отсутствии иммуноглобулинов. Иммуноглобу- i
лины специфические опсонизируют микробов самостоятельно, нормальные— в синергизме с СЗ. Усиливающий эффект комбинированного воздействия объясняется также тем, что СЗ определяет связывание частиц с фагоцитами, a IgG стимулирует их поглощение и разрушение.
Для распознавания и захватывания чужеродного материала на поверхностной мембране имеются рецепторы для Fc-фрагмента IgG и СЗ. Первый непосредственно взаимодействует с IgG, второй — с иммунными комплексами, образованными иммуноглобулинами всех классов. Опсонины связываются с поверхностью частиц и прикрепляют их к рецепторам фагоцитов. Это взаимодействие генерирует сигнал, который передается внутриклеточно и приводит к вытягиванию псевдоподий, примыкающих к прикрепленным частицам. Прикрепленные к частице филоподии формируют мембрану, покрывающую частицу, и она оказывается внутри клетки.
Переваривание начинается после умерщвления захваченных микробов. Фагоцитарная вакуоль сливается с лизосомами, образуя фагосомы. Под действием гидролитических ферментов совершается дезинтеграция частиц. В результате происходит так называемый завершенный фагоцитоз. При незавершенном фагоцитозе патогенные микроорганизмы не погибают, сохраняют способность к размножению и разрушению фагоцитировавшей клетки.
После обработки гидролазами мононуклеаров иммуногенность антигена резко повышается. Образующаяся метаболически стабильная форма антигена в виде комплексов с РНК фагоцитов обеспечивает продолжительную стимуляцию Т- и В-лимфоцитов и иммунологическую память. Причем превращение антигена в иммуноген происходит эффективнее в клетках с более низкой концентрацией гидролаз, быстро и полно «перевариваемый» антиген не индуцирует образования антител, и фагоцитоз заканчивается фазой неспецифической защиты.
Неспецифическая фаза иммунитета проявляется в самостоятельной способности макрофагов разрушать или подавлять рост микроорганизмов внутри клеток, что определяет течение инфекционных болезней, вызываемых факультативными внутриклеточными паразитами — микобактериями туберкулеза, паратуберкулеза, лепры, бруцеллами, фран-циселлами, листериями, сальмонеллами, микоплазмами, нокардиями и др. Причем макрофаги иммунизированных этими микробами животных проявляли более высокую выживаемость и защитную активность не только к гомологичным, но и к гетерологичным бактериям. Например, проведен широкий производственный опыт, доказывающий реальную возможность профилактирования псевдотуберкулеза овец вакцинным штаммом БЦЖ. Эта неопосредованная гуморальными факторами макрофагальная защита в данном случае носит групповой характер и не относится к внеклеточным микробам-паразитам.
Фагоциты, утилизируя антиген, не только освобождают организм от чужеродного материала, но и переводят его в формы, необходимые для индукции специфического иммунного ответа. Кооперируясь с Т-лимфоцитами, макрофаги участвуют в осуществлении ими функции клеточного иммунитета и активизируют вспомогательную функцию при запуске В-лимфоцитов на выработку специфических антител. Т-лимфоциты и иммуноглобулины, в свою очередь, становятся активаторами фагоцитоза. Таким образом, фагоцитоз как бы замыкает круг реакций, образуемых клеточными и гуморальными факторами иммунитета.
Интегрирующую роль фагоцитоз выполняет и в неспецифической защите. Захватывая и переваривая антигены, различные по происхождению и по свойствам, зачастую без посреднической роли сывороточ-
127
ных белкрв, фагоциты осуществляют роль клеточного фактора естественной резистентности. Функционируя в таком виде, они Сиесте с тем синтезируют ряд растворимых продуктов, которые вместе с иммуноглобулинами составляют гуморальные факторы естественной резистентности, обладающие важными защитными свойствами.
Гуморальные факторы естественной резистентности включают естественные, или нормальные иммуноглобулины, лизоцим, бета-лизины, комплемент, пропердин и ряд других веществ, обладающих противо-микробным действием.
Естественные иммуноглобулины можно характеризовать как и специфические IgG, IgM и IgA с учетом более низкой их аффинности и большей зависимости от литических факторов естественной резистентности. Они служат источником хемотаксических пептидов, являются опсонинами, входят в рецепторный аппарат лимфоцитов и фагоцитов и в комбинации с комплементом вызывают лизис микроорганизмов.
Лизоцим — фермент с мурамидазной активностью. Его специфическая активность проявляется в гидролизе бета- (1 — 4)-гликозидной связи полиаминосахаридов клеточной стенки микроорганизмов. Абсорбируясь на мукопептиде клеточной стенки, лизоцим расщепляет его с освобождением N-ацетилмурамовой кислоты и N-ацетилглюкозамина. В результате нарушается осмотическое равновесие и наступает гидролиз микробной' клетки. Поскольку мукополипептид у грамположитель-ных бактерий составляет фактически единственный слой стенки, лизоцим самостоятельно лизирует преимущественно грамположительные микроорганизмы. Поэтому последних используют в качестве тест-мик-робов при определении лизоцимной активности. Особенно популярным в этом отношении является Micrococcus lysodeikticus. Грамотрицатель-ные микробные клетки лизоцим лизирует только в синергизме с комплементом, который, расширяя отверстия в липополипептидных слоях, обеспечивает доступ лизоциму к его субстрату.
Лизоцим синтезируется макро- и микрофагами, но первые выделяют его постоянно в процессе жизнедеятельности, вторые — лишь после разрушения. Попадая в лимфо-, кровоток и экскреты, лизоцим фактически насыщает все биологические жидкости организма. Например, у круп-ног рогатого скота он содержится в околоплодной жидкости, в молозиве, в содержимом тонкого кишечника, в сыворотке крови, в секретах слизистой глаз, носовой полости, потовых желез и других экскретах. Однако наибольшая концентрация регистрируется в околоплодной жидкости, затем в первых порциях молозива.
Лизоцим используют для консервирования черной икры, лечения желудочно-кишечных заболеваний у молодняка, маститных коров, а ли-зоцимный показатель — в качестве критерия состояния фагоцитарной системы организма.
Бета-лизины играют вспомогательную роль в литическом действии лизоцима. Они вырабатываются тромбоцитами и действуютчяа грамположительные микроорганизмы.
Комплемент состоит из девяти компонентов (С1—С9) глобулиновой природы и рассматривается как комплекс проэнзимов, требующих активации. Синтезируется комплемент преимущественно мононуклеар-ными фагоцитами. Первый компонент представлен тремя субъединица--ми (С1д, С1г, Cls). Под действием иммунного комплекса макромолекула С1 активируется путем последовательного включения в реакцию Clq, С1Г и Cls, последний из которых и катализирует образование СЗ-кон-вертазы — фермента, расщепляющего третий компонент комплемента.
В реакции иммунного гемолиза показано, что стабилизированная ионами Са++ макромолекула С1 физически связывается с мембраной
128
сенсибилизированных гемолизинами эритроцитов (ЕА), образуя с нею комплекс ЕАС1, который присоединяет С4. С комплексом ЕАС14 реагирует С2, образуя активатор для СЗ в виде С42а. При этом важную роль играют катионы магния и кальция. Последние два компонента фиксируют СЗ и при взаимодействии с С1 (черточка над цифрами обозначает активированную форму фрагмента) расщепляют его молекулу на связанный с эритроцитами (в) и свободный (а) продукты.
Сочлененный с клеткой СЗв является участком связывания С5, который расщепляется С5-конвертазой, образованной взаимодействием активированных С4, С2 и СЗ компонентов. К фиксированному на эритроцитах С5 присоединяются С6 и С7. Получившийся трехмолекулярный комплекс образует связь для одной молекулы С8, с которой посредством абсорбции связываются три молекулы С9. Терминальные компоненты, начиная с присоединения С5в, формируют трансмембранные каналы в эритроцитах, образование которых завершается после погружения в мембрану С9. В результате в эритроците образуются отверстия, через них выходят низкомолекулярные вещества и поступает внутрь вода, которая повышает внутриклеточное осмотическое давление, что в конечном итоге приводит к разрыву клеточной оболочки.
Аналогичный повреждающий механизм отмечают и при взаимодействии комплемента с микроорганизмами, сенсибилизированными иммуноглобулинами.
Каскад ферментативных реакций, приводящий к последовательной активации всех компонентов комплемента, начиная с первого, называют классическим путем активации комплемента, то есть в этом случае обязательна фиксация ранних компонентов комплемента. Однако прибавление к сыворотке ЛПС бактерий, полисахаридов зимозана, инулина, пневмококка, полимера флагеллина вызывает усиленную активацию (фиксацию) поздних компонентов — СЗ... и т. д. Такой обходной путь, характеризующийся активацией поздних компонентов комплемента, начиная с СЗ, называется альтернативным. В настоящее время отмечают ряд способов альтернативного пути активации комплемента, который наблюдается только в отсутствии катионов кальция.
В защите от инфекции эффективно именно сочетание классического и альтернативного путей активации комплемента, связь которых осуществляется через СЗв. Например, активация комплемента под действием липида А эшерихий происходит по классическому, а под действием полисахарида ЛПС этих же бактерий—по альтернативному пути. Не случайно поэтому фагоциты и В-лимфоциты имеют рецепторы именно для СЗ, а не для других компонентов комплемента.
Многие сельскохозяйственные животные, (свиньи, лошади, рогатый скот) имеют слабоактивные ранние компоненты, поэтому фиксация их комплемента и, следовательно, проявление им литической активности почти всецело зависят от альтернативного пути активации. Для этого у животных данных видов существует особый природный альтернативный механизм, который называется пропердиновым путем активации комплемента.
Комплемент принимает участие в защите организма, выводя из него аллергены посредством комплексообразования и образования анафи-латоксина, который представляет собой субкомпоненты СЗ и С5. Ана-филатоксин увеличивает порозность капилляров, чем и способствует выведению аллергенов и иммунных комплексов из кровотока. Для этого одни только СЗ или С5 высвобождают гистамин из базофилоцитов быстрее, чем под действием аллергена. Причем процесс этот не сопровождается разрушением гранул базофилоцитов, они секретируют гистамин.
Таким образом, защитная функция комплемента обусловлена участием его компонентов в хемотаксисе, иммуноадгезии (прилипании), 9—Ветеринарная микробиология 129
лизйсе сенсибилизированных клеток и в анафилаксии. Следовательно, система комплемента функционирует синергично с системами клеточного и гуморального иммунитета.
Пропердин (лат. perdo— губить, разрушать) открыт в 1954 г. Пиллемером и представляет собой белок, мигрирующий в бета-глобу-линовой области. Находится в крови в виде предшественника, переход которого в пропердин связан с конформационными изменениями в молекуле белка. Под действием добавленных к сыворотке полисахаридов (ЛПС, зимозана, инулина) или иммуноглобулина А пропердин активируется и превращает СЗ-проактиватор (СЗРА) в энзим, способный активировать СЗ с образованием СЗв. В этом и заключается сущность альтернативного пути активации комплемента.
Для синтеза превращающей СЗ-конвертазы необходимо наличие в сыворотке комплекса СЗРА с СЗв. Последний образуется под действием СЗв-независимого или инициирующего фермента (IF).
Появившийся СЗв (фактор А) соединяется с СЗРА (фактором В) и делает его доступным для расщепления и активации СЗРА-конверта-зой (фактор D). В результате появляется активный комплекс СЗвВв, способный расщеплять СЗ как в жидкости, так и на поверхности клеток и частиц.
Для предотвращения спонтанной активации альтернативного пути в сыворотке имеется регуляторный белок СЗвИМА (фактор С). Путем расщепления СЗвВв-конвертазы инактивирующее действие C3bINA усиливается pIH-белком. Нативный пропердин, наоборот, стабилизирует СЗ/С5-конвертазу путем уменьшения скорости ее разрушения, за счет чего начинается лизис клеток. Пропердин таким образом, является регулятором, усиливающим альтернативный путь. Сказанное можно проиллюстрировать опытом по влиянию пропердина на лизис клеток эшерихий. Система из СЗ, факторов В, D, С, pIH-белка и компонентов С5, С6, С7, С8, С9 вызывает существенные морфологические изменения бактерий, которые дезинтегрируются под дополнительным воздействием лизоцима. При добавлении пропердина в физиологических количествах бактериолитическая способность системы увеличивается в 3 раза.
Кроме стабилизации СЗвВв-конвертазы на поздних этапах гемолитического процесса, пропердин участвует в качестве раннедействующего компонента альтернативного пути активации комплемента в результате образования медиаторных эритроцитов, присоединяясь к ним за счет разности зарядов. Эритроциты с адсорбированным пропердином могут быть лизированы последовательным действием позднодействую-щих компонентов комплемента С6 — С9, причем этот процесс происходит без участия каких-либо иммуноглобулинов.
В силу описанного механизма запуска альтернативного пути пропердин является основным литическим фактором у животных, содержащих гемолитически малоактивный комплемент (рогатый скот, лошади, свиньи и др.), особо важным в защите от грамнегативных микроорганизмов.
Иным механизмом противомикробного действия обладает лактоферрин— негиминовый гликопротеид, обладающий железосвязывающей активностью. Представлен он полипептидом с одной углеводной субъединицей молекулярной массой 77 000 g. Лактоферрин связывает два атома трехвалентного железа, конкурируя с микроорганизмами, из-за чего их рост ингибируется.
Лактоферрин синтезируется полиморфноядерными лейкоцитами и гроздевидными клетками железистого эпителия. Он отсутствует в сыворотке крови и является специфическим компонентом секрета желез — молочной, слезных, слюнных, пищеварительного, дыхательного, мочеполового трактов и др. Поэтому лактоферрин можно считать фактором местного иммунитета, защищающим от инфекций эпителиальные покро-130
вы. С содержанием лактоферрина коррелируют также противомикроб-. ные свойства экскретов, например коровьего молока.
Бактерицидная активное ть сыворотки крови (БАС) является интегрированным выражением противомикробных свойств входящих в ее состав гуморальных факторов естественной резистентности. Основными системными бактериолитическими компонентами являются лизоцим (против грамположительных микробов) и комплемент (против грамотрицательных микробов). Иммуноглобулины специфически направляют действие последнего. Поэтому компоненты БАС никогда не будут постоянными, несмотря на поддержание активности на одном уровне. Следовательно, при изучении факторов, определяющих БАС, каждый раз нужно учитывать содержание гуморальных компонентов. Нашими исследованиями, например, показано, что лимитирующими БАС-факторами у здоровых новорожденных телят являются IgG, у больных острыми желудочно-кишечными заболеваниями IgM, а при бронхопневмонии—комплемент.
Кроме системного, имеется местный, или локальный иммунитет. Его компоненты: клеточные (Т-лимфоциты, макрофаги, нейтрофилы) и гуморальные факторы (SIgA-, SIgM-лизоцим, лактоферрин и др.). При этом происходит максимальное взаимодействие между компонентами, поскольку известно, что Т-лимфоциты регулируют активность макрофагов, последние являются продуцентами лизоцима, а он усиливает бактерицидность секреторных иммуноглобулинов. Поэтому факторы, определяющие местный иммунитет, также надо учитывать индивидуально. * 1
ВОЗРАСТНЫЕ ОСОБЕННОСТИ ИММУНОЛОГИЧЕСКОГО СТАТУСА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
При внутриутробном развитии у всех копытных животных передача материнского иммунитета отсутствует. Иммунологический статус организма сельскохозяйственных млекопитающих в данный период характеризуется аутосинтезом защитных факторов эмбриональной и фетальной тканью. При этом синтез факторов естественной резистентности опережает развитие механизмов специфического реагирования.
Из факторов естественной резистентности первыми появляются клеточные: вначале моноциты, затем нейтрофилы и эозинофилы. Еще в эмбриональный период они функционируют как фагоциты, обладая захватывающей и переваривающей способностью. Причем последняя преобладает и существенно не изменяется даже после приема новорожденными животными молозива (рис. 52 а). К концу эмбрионального периода в кровотоке животных накапливаются лизоцим, пропердин й в меньшей степени комплемент. С возрастом плодов уровень этих факторов постепенно повышается. В предплодный и плодный периоды в -фетальной сыворотке крови появляются иммуноглобулины в основном класса М и реже класса G. Они обладают функцией антител, преимущественно неполных. Однако концентрация иммуноглобулинов, особенно IgG, с возрастом животных изменяется неравномерно.
У новорожденных содержание всех факторов защиты повышается, но количественно достигает уровня кровотока материнского организма лишь лизоцим, пропердина в это время, наоборот, больше, чем в сыворотке крови коров-матерей. После приема молозива в организме новорожденных и их матерей содержание всех факторов, за исключением комплемента, сближается. Концентрация последнего не достигает материнского уровня даже в сыворотке 6-месячных телят.
Бактерицидная активность сыворотки крови по отношению к глад-
9* 131
и
100
то
80
100
Рис, 52а. Уровень факторов естественной резистентности плодов и новорожденных телят относительно матерей:
% фН — процент фагоцитоза нейтрофилов; % фм — процент фагоцитоза моноцитов; фин,— фагоцитарный индекс нейтрофилов; фим — фагоцитарный индекс моноцитов; изф — индекс завершенности фагоцитоза; бас — бактерицидная активность сыворотки крови; 3, 5, 7, 9 — месяцы внутриутробного развития; о — период новорожденности до приема молозива; зд — телята, принимающие молозиво в течение трех дней после рождения.
I
ким формам эшерихий постоянно регистрируется лишь после рождения животных и приравнивается к уровню материнского организма в моло-зивный период. Шероховатые формы эшерихий лизирует и фетальная сыворотка крови сельскохозяйственных животных.
В амнионе и аллантоисе зародыша содержится лишь лизоцим, продуцируемый макрофагами, и комплемент. Взаимодействие этих факторов контролирует практически всю микрофлору околоплодной жидкости. Однако корреляции между уровнем гуморальных факторов естественной резистентности в амниотической жидкости и сыворотке крови плодов не отмечается, что свидетельствует об их автономном синтезе.
Насыщение кровотока новорожденных копытных иммунными факторами происходит лишь колостральным путем. В молозиве коров содержатся в убывающем количестве IgGl, IgM, IgA и IgG2. Иммуноглобулин G1 примерно за две недели до отела селективно переходит из кровотока коров и накапливается в вымени. Остальные молозивные иммуноглобулины синтезируются молочной железой. В ней же образуются лизоцим и лактоферрин, которые вместе с иммуноглобулинами представляют гуморальные факторы локального иммунитета вымени.
Молозивные иммуноглобулины переходят в лимфо-, а затем кровоток неизменными путем пиноцитоза. В криптах тонкого отдела кишечника имеются специальные клетки, избирательно транспортирующие молекулы молозивных иммуноглобулинов. Причем селективность перехода их, например, у крупного рогатого скота, временная: IgG пиноцити-руется 27, IgA — 22, a IgM— 16 ч. Процесс перехода молозивных глобулинов связан с образованием гликокаликса и контролируется кортикостероидами. Лучше иммуноглобулины всасываются при спаивании молозива телятам в первые 4 — 5 ч путем подсоса, или из поилки вблизи от матери.
В эмбриональный период развития животные содержат Т- и В-лимфоциты, несущие на своей поверхности иммуноглобулиновые рецепторы. Несмотря на более выраженный клеточный иммунитет, плоды способны реагировать на различные антигены (в том числе и микробные) ан-тителообразованием. Экспериментальным введением в фетальную ткань крупного и мелкого рогатого скота, свиней и лошадей бактерий, вирусов, токсоидов и других антигенных препаратов обоснована возможность пренатальной иммунизации животных. Сформировавшиеся плоды обычно четче отвечают на антигенный стимул, чем новорожденные животные, принявшие молозиво. Снижение иммунореактивности новорожденных животных в молозивный период связано с повышенным содержанием в кровотоке сразу после рождения кортикостероидов, а также с доминирующей концентрацией в нем материнских IgG, которые конкурируют с телячьими иммуноглобулинами при взаимодействии с антигеном. Поэтому вакцинацию приплода целесообразно проводить до приема новорожденными животными молозива или через несколько недель, по завершении элиминации материнских иммуноглобулинов.
У грызунов (например, кроликов) материнские антитела могут переходить в кровоток плодов через желточный мешок, а потом через молозиво. Поэтому собственный иммуногенез у них будет долго подавленным. У птиц (например, кур) материнские антитела передаются приплоду трансовариально. Они сохраняются в лецитиновой фракции желтка и, видимо, несущественно влияют на аутосинтез иммуноглобулинов эмбрионами.
Однако независимо от видовой принадлежности животных в раннем периоде онтогенеза патогенные микробы сравнительно легко вызывают различные эмбрио- и фетопатии. В итоге нарушаются процессы эмбриогенеза, а внутриутробно инфицированные животные после рож-г
133
дения отстают в развитии и вскоре заболевают. При нарушениях пр^цес-сов сорбции молозивных иммуноглобулинов или при иммунодефицитном состоянии выпаиваемого молозива у новорожденных телят развиваются приобретенные острые желудочно-кишечные заболевания.
Механизм естественной резистентности изменяется в соответствии с состоянием организма животных. У здоровых новорожденных телят бактерицидную активность сыворотки и фагоцитарную активность лейкоцитов крови определяют IgG. На начальных этапах развития острых желудочно-кишечных заболеваний, вызванных эшерихиями и сальмонеллами, лимитирующим фактором будет IgM, а на фоне развития врожденной бронхопневмонии кокковой этиологии — комплемент. • *
ИММУНОДЕФИЦИТНЫЕ состояния
Иммунодефицитные состояния (или недостаточность иммунитета) могут быть результатом генетических дефектов развития определенных звеньев системы иммунитета или результатом недостаточного питания, воздействия иммунодепрессантов, ионизирующего излучения, нарушения сорбции иммуноглобулинов. Нарушения защитных систем, происходящие на генетической основе, называются первичными иммунодефицитами; нарушения защитных систем приобретенные именуют вторичными иммунодефицитами. Иммунодефицитные состояния поэтому обусловливаются качественными и количественными изменениями защитных факторов или их компонентов.
Дефицит клеточного иммунитета может быть на уровне стволовой клетки, макрофага, Т-лимфоцита, а дефицит гуморального иммунитета— на уровне стволовой клетки, В-лимфоцита, плазмоцита, поверхностных иммуноглобулиновых рецепторов, молекул иммуноглобулинов, а также связан с нарушением выработки секреторного компонента.
Возможны нарушения в биосинтезе или функционировании отдельных компонентов комплемента, а также рецепторов для регуляторов иммунопоэза на иммунокомпетентных клетках.
: Иммунодефицитные состояния сопровождаются развитием у животных бактериальных (при нарушениях гуморального иммунитета), вирусных инфекций или микозов (при нарушениях клеточного иммунитета); молодняк поражается обычно в первые 1,5 месяца жизни, причем у него повышена чувствительность к слабопатогенным микроорганизмам.
В качестве примера первичного иммунодефицита можно привести синдром Чедьяк — Хигаши, характеризующийся снижением переваривающей способности моноцитов и нейтрофилов у скота герефордской породы. Животные с врожденной дисфункцией фагоцитов склонны к бактериальным инфекциям. Врожденным считается также породный дефицит IgG2 у скота красной датской породы, что делает его высокочувствительным к пиемическим инфекциям, приводит к развитию маститов. У скота черной датской породы и скота фризской породы описан наследственный летальный признак А-46. Он связан с нарушением функции Т-системы лимфоцитов, обусловленным повышенной потребностью животных в цинке.
Вторичные иммунодефицитные состояния возникают у молодняка сельскохозяйственных животных при сниженном количестве IgA и лизоцима в молозиве, при нарушении сорбции молозивных иммуноглобулинов и т. п.
Иммунодефицитные состояния необходимо учитывать при проведении генетических работ, при разработке лечебно-профилактических мероприятий в хозяйстве. Знание дефектов иммунной системы основывается на использовании объективных и чувствительных методов тести- > 134
ровЙиЙ состояния иммунной системы. Для этого предлагаются специальные тесты на иммунореактивность с учетом функционирования Т- и В-лимфоцитов и на естественную резистентность организма посредством определения активности клеточных и гуморальных факторов.
ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ УЧЕНИЯ ОБ ИНФЕКЦИИ И ИММУНИТЕТЕ С
Учение об инфекции и иммунитете имеет не только познавательное, но и прикладное значение. Зарождалось оно как сугубо практическая необходимость, поэтому практический аспект учения развивался опережающими темпами. В настоящее время борьба с инфекционными заболеваниями немыслима без специфической диагностики, профилактики болезней и специфической терапии животных.
Знание механизмов повреждающего действия микробов прежде всего повысило эффективность микробиологической диагностики. Выделение ведущих факторов патогенности микробов позволяет правиль* но отобрать, быстро и точно исследовать материал. Например, диагноз на стахиоботриотоксикоз, фузариотоксикоз, ботулизм и другие подоб-ные болезни устанавливают по наличию в кормах экзотоксина возбудителей. Диагноз септических болезней, обусловленных наличием у микробов инвазивных факторов, определяют, исследуя кровенаполненные органы. И, наоборот, локальные процессы, вызванные микрофлорой с неразвитыми инвазивными свойствами, диагностируют непосредственным обнаружением возбудителей в пораженной ткани. При этом учитывают выраженный тропизм, то есть избирательное отношение возбудителей к определенным тканям хозяина.
В ряде случаев четкое знание факторов патогенности определяет направление исследований патологического материала. Например, обнаружение капсул у палочковидного микроба и корд-фактора у микобактерий ориентирует на выявление возбудителей сибирской язвы и туберкулеза млекопитающих соответственно. Наличие у микроорганизмов антигенных детерминант, отражающих их патогенность, используется для производства диагностических биологических препаратов, или ди-агностикумов.
Диагностикумы включают в себя антигены, аллергены, антисыворотки и комплемент. Антигены готовят в виде взвеси убитых бактерий (агглютиногены), растворимых антигенных препаратов (преци-питиногены) или сенсибилизированных антигенами эритроцитов (эритроцитарные диагностикумы для реакции непрямой гемагглютинации). Иногда готовят взвесь подкрашенных бактерий (например, для РА с молоком на бруцеллез). Во всех случаях изготовления диагностикумов исходные культуры микроорганизмов должны по всем свойствам максимально соответствовать видовым признакам. Для сохранения антигенной структуры микроорганизмов используют щадящие консерванты, такие, как бета-пропиолактон, формальдегид и др.
В антигенных препаратах нет примесей гетерологичных микроорганизмов, они должны взаимодействовать только с гомологичными сыворотками.
Необходимым требованием к диагностикам является также определенное содержание бактериальных клеток, белка или углевода.
Аллергены представляют собой гидролизаты бактериальной массы и используются для прижизненной диагностики туберкулеза, паратуберкулеза, сапа, бруцеллеза и других хронических инфекций. Выпускают их в виде бесцветной или окрашенной прозрачной жидкости, запаянной в ампулы. Контроль качества аллергенов тестируют путем установления стерильности и специфической активности. Стерильность проверяют вы
135
севом аллергенов на плотные и жидкие питательные среды, прежде всего оптимальные для исходного микроорганизма, и выдерживанием засеянных сред в аэробных и анаэробных условиях. Специфическую активность проверяют на здоровых и реагирующих на аллерген животных параллельно со стандартным аллергеном. Во всех случаях показания испытуемого и стандартного аллергенов должны совпадать.
Антисыворотки в зависимости от назначения называют агглютинирующими, преципитирующими, флуоресцирующими и т.п. Их обычно получают путем гипериммунизации (длительным введением нарастающих доз антигена) кроликов или более крупных продуцентов. Для повышения специфичности антисыворотки, особенно предназначенные для иммунофлуоресценции, адсорбируют гетерологичными антигенами (взвесью отмытых бактерий, выращенных на МПА). Антисыворотки должны быть стерильными и вступать в реакцию только с гомологичными антигенами. По этим свойствам и проверяют их качество.
Для постановки реакции связывания комплемента биофабрики выпускают гемолизин-сыворотку кроликов, полученную после иммунизации их отмытыми эритроцитами барана, и комплемент-сыворотку крови морских свинок с определенным титром комплемента.
К диагностическим препаратам, не основанным, правда, на антигенных свойствах, относят также фаги. Выпускают их в виде взвеси или в лиофильном состоянии. Они не должны содержать примеси иных фагов и микроорганизмов и быть литически активными в определенном титре. Специфичность их определяется способностью лизировать лишь гомологичные бактерии в определенном диапазоне.
Вакцины предназначены для специфической профилактики инфекционных болезней. Они представляют собой взвесь живых ослабленных, инактивированных микроорганизмов или раствор обезвреженных экзотоксинов, а также протективных антигенов (так называемые химические вакцины). Вакцинные препараты из живых микроорганизмов более активны, поскольку обусловливают большее накопление протективных антигенов в организме. Но они менее стабильны, плохо хранятся и часто дают осложнения. Химические же вакцины в этом отношении являются идеальными.
Технология изготовления вакцинных препаратов сводится к получению стандартной взвеси микробных клеток, их инактивации химическими или физическими средствами или к выделению протективных антигенов и экзотоксинов с последующим обезвреживанием их формальдегидом или иным химическим веществом, не разрушающим антигенной структуры.
Взвесь или раствор антигенов обычно соединяют с адъювантами. Для этого используют органическое или минеральное масло, нейтральные соли или иные индифферентные сорбенты. Эмульгированный или адсорбированный антиген будет более концентрированным, при введении в организме он депонируется и поступает в организм с места введения небольшими дозами. Медленная резорбция депонированного антигена пролонгирует иммунизаторный эффект вакцины и снижает ее пирогенные, токсичные и аллергические свойства. В случае применения в качестве адъювантов липополисахаридов или липидов энтеробактерий, микобактерий, бордетелл и других микроорганизмов дополнительно развивается бласттрансформация лимфоцитов.
Качество вакцинных препаратов определяют путем установления стерильности (или чистоты роста живых микробов), безвредности и специфической активности. Безвредность обычно определяют инъекцией больших доз препарата лабораторным животным. На протяжении 10 дней у них не должно быть отмечено никаких отклонений от физиологического статуса. Специфическую активность принципиально устанав-136
ливают в реакции защиты: чувствительным животным вводят вакцину, а через 1 —2 недели их же заражают летальной дозой гомологичного микроба. Подопытные животные должны полностью или почти полностью выжить при обязательной гибели всех животных контрольной группы (не вакцинированные животные-аналоги).
В зависимости от количества входящих антигенов вакцины подразделяют на моно-, ди-, поливакцины и ассоциированные вакцины, содержащие разнородные антигены.
Лечебные сыворотки предназначены для лечения больных животных или профилактики болезни в угрожаемых зонах. Получают их посредством двухэтапной гипериммунизации крупных продуцентов. На первом этапе животным 1 —2 раза вводят вакцину, а затем в нарастающем количестве длительно вводят вирулентную культуру так называемого производственного штамма микроба.
По завершении цикла иммунизации по определенной схеме животных обескровливают. Отстоявшуюся сыворотку собирают и исследуют на стерильность, безвредность и специфическую активность по аналогии с вакцинами. Принципиальное отличие испытания специфической активности сыворотки заключается в том, что ее вводят одновременно или после заражения подопытных животных гомологичным микробом в летальной дозе.
Лишь в некоторых случаях специфическую активность сыворотки испытывают не в качественной реакции защиты, а оценивают количественно в единицах активности. Так, например, принято проверять качество антитоксических ботулинической и столбнячной сывороток.
В настоящее время получают также лечебные сывороточные или молозивные препараты, содержащие определенные фракции глобулинов и лактоглобулинов или иммуноглобулины определенных классов и ан-тительной активности, то есть они также являются специфическими лечебными биопрепаратами.
В последние годы иммунологические исследования животных в норме и при патологии доказали принципиальную возможность прогнозировать развитие болезней у молодняка. Сравнительное иммунологическое исследование организма животных открыло новые перспективы объективной оценки иммунологического статуса и развития патологии посредством установления иммунодефицитного состояния. Точное знание иммунограммы организма позволяет не только констатировать недостаточность защитных систем, но и применять заместительную терапию или коррегирующие средства.
ЧАСТНАЯ МИКРОБИОЛОГИЯ
ПАТОГЕННЫЕ КОККИ
Патогенные кокки относятся к классу Schysamicetes (бактерий), отряду Eubacteriales, семействам Micrococcaceae и Streptococcaceae, родам Staphylococcus и Streptococcus. Они широко распространены в природе, обитают на кожном покрове и слизистых оболочках дыхательных путей, пищеварительных и половых органов животных. При снижении устойчивости организма являются причиной многих заболеваний.
ч
СТАФИЛОКОККИ
Стафилококк впервые выделен из гноя фурункула человека Л. Пастером в 1880 г., изучен и описан Розенбахом в 1884 г.
В настоящее время различают Staph, aureus, St а р h^P_i_der mi d i s и Staph, saprnphy ficus Из трех видов патогенным является Staphilococ-cus aureus.
В патологии животных этиологическая роль стафилококков за последнее время значительно возросла. Эти микробы часто вызывают мастит, послеродовой эндометрит у коров, пневмонию, септицемию, энтерит у молодняка, абсцессы, флегмоны, артриты, гнойное воспаление ран. У кур данный микроб является возбудителем септического заболевания — стафплококкоза, сопровождающегося массовой гибелью птицы. У лошадей, свиней и реже у крупного рогатого скота стафилококки обусловливают развитие ботриомикоза, характеризующегося формированием в семенном канатике после кастрации гнойных очагов, окруженных плотной капсулой.
судате располагаются изолированно по одному, по два, цепочками или небольшими скоплениями. Диаметр кокков 0,5—1,5 мкм, капсул, жгу-тиков-ть.аюр эти микробы не образуют. Неподвижны. Вмазках из
свежих бульонных -культур имеют вид одиночных кокков или диплококков, в мазках из агаровых культур стафилококки расположены в виде отдельных: "’скоплений,^напоминающих гроздь винограда (см. рис. 53). В бульонных культурах могут встречаться инволюционные формы— крупные, неправильной формы или очень мелкие кокки. Грам-положительные.
Культивирование- Стафилококки хорошо растут на простых питательных средах при температуре 35—37° С с pH 7,2—7,4, в аэробных и анаэробных условиях. На а га ре_ _о бразуют круглые, с ровными краями несколько выпуклые колонии в диаметре от 2 до 5 мм, окрашенные в золотисто-желтей^, лимонно-желтый или белый цвет. Пигментообразо-вание^осоЗенно отчетливо наблюдается в культурах, выращиваемых на агаре, содержащем 10% молочного обрата, а также на ка'ртофеле в аэробных условиях при рассеянном свете. Для повышения интенсивности пигментации колоний картофельные_культуры рекомендуют выращивать при температуре 25° С. В бульоне эти микробы растут до-138
врдьно интенсивно, вызывая равномерное помутнение среды с рыхлым осалкгли. Кровяной__агар — лучшая среда для выращивания стафилококков из патологического материала, на этой среде их колонии окружены широкой зоной гемолиза^
Биохимические свойства. Стафилококки разлагают с образованием кислоты без,газа глюкозу, фруктозу, сахарозу, мальтозу, ксилозу, глицерин, маннит, не разлагают салицин, дульцит, инулин, раффинозу. Эти микроорганизмы продуцируют уреазу, каталазу, сероводород, восстанавливают нитраты в нитриты, не разлагают крахмал, инсулин, гиппуровокислый натрий, не.образуют индол.
На желатине уже через 1—2 суток отмечают довольно интенсивный рост по уколу, к 4—5-му дню отчетливо видно разжижение среды в форме воронки. Наличие у патогенных стафилококков протеолитичес-ког офе рмента'~)б у с л ов л и в а ет их свойство разжижать желатину и свернутую кровяную сыворотку, а также свертывать и пептонизировать обычное и лакмусовое молоко.
Устойчивость стафилококков к неблагоприятным факторам внешней среды высокая) Они превосходно переносят высыхание, оставаясь жизнеспособными в гнойном экссудате до 200 дней, длительно сохраняются в навозе, замораживание их консервирует. На питательных средах, в частности на полужидком агаре, сохраняются без пересевов более шести месяцев. При нагревании, например в молоке, погибают при температуре 70° С через 1 ч, при 85° С — через 30 мин, кипячение убивает их мгновенно. Из дезинфицирующих веществ 1%-ный раствор формалина и 2%-ный раствор едкого натра убивает этих микробов в течение 1 ч, а 1 %-ный раствор хлорамина — в течение 2—5 мин. Наиболее чувствительны стафилококки к кристаллвиолету, пиоктанину, малахитовой зелени, которые в концентрации 1:300 000 обладают выраженным бактериостатическим действием, что позволяет с успехом использовать эти краски при стафилококковых поражениях кожи, фурункулезе, нагноении ран. Весьма устойчивы стафилококки к антибиотикам, особенно пенициллину, стрептомицину, а также сульфаниламидным препаратам. Учитывая высокую устойчивость стафилококков, их используют в качестве тест-объекта при испытании различных бактерицидных веществ — новых антибиотиков или дезинфицирующих веществ. )
Патогенность проявляется способностью вызывать нагноительные процессы. Отсюда стафилококки — типичные гноеродные микроорганизмы. Вирулентность у этих микробов обусловлена рядом факторов и колеблется в широких пределах. По способности токсинообразования и плазмокоагуляции определяется вирулентность выделенной культуры стафилококков. Патогенные стафилококки продуцируют несколько токсинов, обладающих разносторонним патогенным действием на организм.
Г и с т о т о к с и н — летальный и дермонекротический. Летальный токсин общего действия — при внутривенном введении его через 15— 30 мин наступает смерть животного с клиническими признаками острой токсемии, сопровождающейся одышкой, резко учащенным сердцебиением и парезами. Накапливается этот токсин и в бульонных культурах. Некротоксик вызывает некроз тканей. Наличие и действие его отчетливо обнаруживаются при внутрикожном введении стафилококковой культуры кроликам, на месте инъекции ее развивается омертвение кожи.
f емотоксин обладает выраженным гемолитическим действием— ра<тъоряет_эр2гтрр^гиты^животных. Наличие его легко обнаруживают при высевах стафилококков на кровяной агар вдаиде обширной зоны гемолиза, окружающей колонии микробов. " '
Э нте р отокс ин вызывает гастроэнтерит. Попадание с пищей
139
этого токсина животным (например, кошкам) сопровождается присту-пами_рвоты, резко выраженной слабостью, энтеритом. Токсин накапливается в бульонных культурах, а также в молоке от коров, больных стафилококковым маститом- Наличие токсина в молочных продуктах (молоко, сливки, творог) обусловливает пищевую стафилококковую токсикоинфекцию.
Лейкоцидин вызывает гибель лейкоцитов, которые теряют подвижность^ преобретают зернистость, а затем распадаются и лизируются. Накапливается он в бульонных культурах со щелочным pH.
Кроме перечисленных токсинов, стафилококки продуцируют коагулазу, под воздействием которой плазма крови.животных коагулируется, а также фибринрлишш—фермент, растворяющий фибрин. Выраженная патогенетическая активность стафилококков обусловлена также наличием у этих микроорганизмов гиалуронидазы или диффузионного фактора — способность микробов проникать в ткани.
Токсины стафилококков имеют белковую природу, обладают свойствами полноценных антигенов и поэтому при гипериммунизации ими животных удается получать антитоксическую лечебную сыворотку. Последняя нейтрализует летальное, гемолитическое, энтеротокси-ческое, некротическое и лейкоцитоксическое действие токсинов.
Патогенез. Стафилококки вызывают у животных различные заболевания, характеризующиеся в одних случаях местным гнойным воспалением, в других — общим заражением крови. Такая широкая амплитуда стафилококковых заболеваний объясняется различной устойчивостью организма и вирулентностью возбудителя. Местный гнойный процесс может быть источником обширных нагноений или даже септицемии, проникновение стафилококков в кровоток происходит по лимфатическим путям с развитием лимфангита. Попадание единичных стафилококков в кровь из гнойного очага у животных с достаточной устойчивостью сопровождается быстрым уничтожением их, в ослабленном организме ведет к появлению гнойных очагов в различных органах илй септицемии. В развитии патологических процессов при стафилококковой инфекции имеет значение токсикоз организма продуктами жизнедеятельности возбудителя.
Антигенная структура. Стафилококки имеют общий для всех видов и вариантов белковый антиген, характерный для патогенных кокков полисахаридный антиген А и для непатогенных стафилококков полисахарид Б, а также специальный полисахаридный антиген С.
Энтеротоксины стафилококков по антигенному строению подразделяются на серовары А, В, Ci (С2), D и Е.
Иммунитет при стафилококках носит преимущественно ^антитоксический характер. Подтверждением этого является выраженный эффект от применения противостафилококковой антитоксической сыворотки.. В естественных условиях в организме животных, перенесших стафило-^ кокковую инфекцию, накапливаются антитоксины, что обусловливает их повышенную устойчивость к повторным заболеваниям.
Диагностика. Для определения этиологической роли стафилококков в различных патологических процессах при жизни животных исследу-^ ют раневой экссудат, гной абсцессов, ран, молоко при маститах, выде^ ления из половых органов при эндометрите, кровь из яремной вены при септицемии. Из патологического материала готовят мазки, окрашивав ют фуксином Пфейфера, по Граму и микроскопируют. Одновременй^0 делают посевы на кровяной и молочно-солевой агар в чашки Петри. Из11 выросших колоний производят отсев наМПА в пробирках для выделения чистой культуры и ее идентификации, ставят реакцию плазмоко-агуляции'с'чйстой культурой, для чего кровь кролика смешивают с 5%-ным раствором лимоннокислого натра. Полученную плазму разводят 1 :4 физраствором, разливают по 0,5 мл в стерильные пробирки, засевают исследуемой культурой и ставят в термостат (37 °C) на 3 ч.. Реакцию учитывают через 1—2—3—18 ч. Свойство свертывать цитра^а ную плазму крови кролика является характерной особенностью пат$к генных стафилококков.
140 qи
; Г'ф1 Г /
6. Дифференциация стафилококков
Свойства
Вирулентные
Авирулеитные
Гемолитические Плазмокоагуляция Дермонекротические А-белок на поверхности а-токсин
Разжижение желатины Ферментации маннита Образование пигмента
Образуют золотистый или белый
Образуют лимонножелтый или белый
—- -
Наличие гемолитического токсина стафилококков определяют по следующей методике: выделенную культуру выращивают на казеиновом бульоне в течение 5 суток в эксикаторе с содержанием в атмосфере выращивания 20 % СО2. Затем культуру центрифугируют, верхний слой отсасывают, разводят физраствором 1:10, 1:20, 1:40, 1:80, 1 :160, 1 :320, разливают в пробирки по 1 мл и добавляют по одной капле эритроцитов кролика, трижды отмытых физраствором и разведенных 1 :2, Пробирки выдерживают в термостате при 37° С 1 ч и такое же время при комнатной температуре и учитывают наличие гемолиза.
Потенциальную гемолитическую способность стафилококков выявляют па кровяном агаре подобно КАМП-тесту (В. А. Байрак).
Дермонекротические свойства определяют на кроликах, для чего готовят взвесь стафилококков в физрастворе с содержанием в 1 мл 2 и 4 млрд, микробов и вводят внутрикожно кролику в выбритую кожу в дозе 0,1 мл. Наличие некроза в местах инъекции учитывают на четвертые сутки.
Фаготипирование стафилококков проводят набором 22 типовых стафилококковых бактериофагов, которые по литическому родству составляют четыре группы. Размножают каждый тип фага иа соответствующем штамме стафилококка. Для типирования выделенной культуры ее выращивают на глюкозном бульоне, затем высевают на глюкозный агар в чашку Петри, разделенную на четыре квадрата, в каждый из них наносят петлю бактериофага, принадлежащего к одной из указанных выше групп, С помощью фаготипирования можно идентифицировать стафилококки, выделенные из различных источников.
т О дифференциальных признаках стафилококков см. таблицу 6.
Биопрепараты применяют преимущественно при хронических процессах, вызванных стафилококками.
Аутовакцина представляет собой смыв агаровой культуры микроба, выделенного из организма больного животного, прогретый при 70— 7^° С в течение 1—1,5 ч.
е Местно можно применять антивирус-фильтрат 2—3-недельной буль-ойной культуры стафилококка и взвесь стафилококкового бактерио-фга.
; Антибиотики широкого спектра действия применяют одновременно с сульфаниламидными препаратами.
СТРЕПТОКОККИ
Впервые стрептококка выделил и определил его патогенность для человека Л. Пастер в 1880 г., описал Розенбах в 1884 г. В настоящее в]$емя составляют самостоятельный род (21 вид) семейства Streptococ-са&еае,
Патогенные стрептококки обнаруживают на слизистых оболочках и реже кожном покрове животных и человека. У животных они явля
141
ются возбудителями специфических заболеваний — мастита коров, мыта цельнокопытных, а также неспецифических нагноительпых процессов. У поросят и птицы вызывают септическое заболевание — стрептококков.
Нередко стрептококки обусловливают осложнения вирусных инфекций. Дифференцировать стрептококков по какому-либо одному признаку оказалось невозможным. Американские исследователи (Лен-сфильц), ориентируясь на наличие у стрептококков групповых специфических полисахаридных антигенов, разделили их при помощи реакции преципитации на четыре основные группы: группа А — гноеродные стрептококки, вызывающие заболевание людей ангиной, скарлатиной, рожей и т. д.; группа В — гноеродные стрептококки, вызывающие мастит коров; группа С — гноеродные стрептококки, вызывающие заболевания животных (мыт цельнокопытных, мастит, эндометрит, сепсис); группа D— энтерококки и большинство сапрофитных стрептококков.
В дальнейшем установлено, что стрептококков, отнесенных в группу В и С — вызывающих заболевания у животных, выделяли и при заболеваниях людей рожей, пневмонией, ангиной. Ввиду того что важнейшим свойством стрептококков является их патогенность, следует признать наиболее рациональной классификацию, основанную на наличии у этих микроорганизмов способности вызывать заболевания. В зависимости от этих заболеваний стрептококков, патогенных для животных, разделяют на возбудителей специфических инфекций и неспецифических нагноительных процессов.
Возбудитель мастита — Str. agalactiae.
Морфология. При остром течении мастита в мазках из молока обнаруживают преимущественно короткие цепочки, при хроническом — стрептококки имеют вид длинных переплетающихся между собой цепочек. Микроб грамположительный, неподвижен.
Культивирование. Маститный стрептококк аэроб, температурный оптимум 37—38° С, на обычных средах растет слабо, образуя в МПБ легкое помутнение й небольшой осадок, на МПА вырастают очень мелкие, круглые, с ровными краями колонии. Лучшая среда для микроба — кровяной агар с 1 % глюкозы, pH 7,2—7,6. На этой среде он образует круглые, слегка голубоватые колонии, окруженные зоной гемолиза типа р. Гемолитическим свойством обладают культуры первой генерации.
Биохимические свойства. Хорошо растет в виде хлопьев на полужидком агаре с 10% крови телят и 1% глюкозы. Разлагает глюкозу, сахарозу, лактозу, мальтозу. Не редуцирует метиленовое молоко. На лакмусовом молоке образует кислоту и свертывает его (см. рис. 54).
Устойчивость. Во внешней среде маститный стрептококк значительно устойчив, в высушенном гнойном экссудате сохраняется 2—3 м&с. В молоке погибает при нагревании до 85° С, в течение 30 мин, при воздействии 2%-ного раствора едкого натра, 1%-ного раствора формалина гибнет за 10—15 мин. Замораживание консервирует его. К пенициллину стрептококк довольно устойчив, что объясняется широким применением его в последние годы для лечения мастита и появлением устойчивых рас возбудителя. Чувствителен к окситетрациклину, пойи-миксину, особенно в сочетании с сульфадимезином, н
Патогенность. Маститный стрептококк продуцирует несколько токсинов. Эритрогенный токсин вызывает воспалительную местную реакцию тканей, гемолитический токсин растворяет эритроциты, что"характеризует вирулентность культуры и отчетливо наблюдается на кровяном si аре, некротический токсин обуславливает некроз тканей, лейкоцидин— гибель и растворение лейкоцитов. Кроме этого, вируЛнт-ные штаммы вырабатывают ферменты—фибринолизин и гиалурЙЙи-дазу, усиливающие патогенное воздействие стрептококка.
142
Вирулентность маститного стрептококка непостоянна. Наиболее вирулентные стрептококки содержатся в гнойном экссудате из вымени коров, больных острым маститом. При внутрибрюшинном введении такого экссудата мышам в дозе ОД—0,2 мл они гибнут в течение суток, а из крови их сердца выделяется культура гемолитического стрептококка. Выращенные па питательных средах, особенно без крови, культуры этого микроорганизма слабо вирулентны. Культуры стрептококка, выделенные при хроническом течении мастита, менее вирулентны, культуры. 2—3 раза пересеянные на простые питательные среды, авиру-лентны. К патогенному воздействию маститного стрептококка весьма чувствительны ткани вымени. При введении в вымя коров через канал соска свежевыделенной культуры стрептококка в дозе 0,5 мл развивается острая форма мастита.
Патогенез обусловлен воздействием на ткани вымени и всего организма стрептококковых токсинов и ферментов.
Стрептококки, размножаясь на* слизистых оболочках, вызывают катарально-гнойное воспаление. Проникая в глубь тканей, обусловливают нагиоительные процессы. Патогенез мастита тесно связан с послеродовым эндометритом, так как из воспаленной после родов матки стрептококки гематогенным путем проникают в вымя и вызывают мастит. (
Антигенную структуру стрептококков изучали Гриффитс и Ленс-фильд на оснЬве реакций агглютинации и преципитации. Реакцией преципитации полученного гидролизом бактерий полисахарида Ленс-фильд подразделяла стрептококков на четыре серологические группы: А, В, С и D. Внутр» этих групп реакцией агглютинации с поверхностным белковым антигеном Гриффитсом установлено по несколько серологических вариантов. По капсульному полисахариду с помощью реакции агглютинации пневмококков подразделяют более чем на 80 серологических вариантов. При обработке стрептококков химическими веществами были выделены четыре фракции М, Т, С и Р. Выделен также М-протеин, обусловливающий вирулентность и иммуногенность стрептококков.
Иммунитет йодвержен значительным колебаниям. В одном и том же стаде одни жмвотные болеют, другие остаются здоровыми. Постинфекционный имЯ^ВЙтет непродолжительный и недостаточно напряжен-ный. Он обусловлен антитоксическими и антибактериальными факторами.
Диагностика. Материалом для исследования служит молоко коров, больных ^маститом. Берут его из воспаленных долей (первые пор-дии сдаивают в отдельную посуду и уничтожают) в стерильные пробирки с пробками и тут же отправляют в лабораторию. При необходимости молоко^ консервируют замораживанием. Из молока готовят ;.мазки, окрашивают фуксином, по Граму или Романовскому. Под микроскопом обнаруживают стрептококки, лейкоциты и продукты воспаления. Высевы производят на МПА, МППА и на кровяной агар. Выросшие колонии с йравяного агара пересевают для дифференциации. Одновременно внутрибрюшинно заражают молоком в дозе 0,5 мл двух молодых мышей^Июсле гибели их вскрывают и из крови сердца делает высевы на МПА; выросшие культуры дифференцируют. Путем постановки биопробы Дается выделить чистую культуру возбудителя мастита. .
Биопрепараты Не разработаны. Для лечения широко применяют антибиотики в сочетании с сульфаниламидными препаратами. Вводят .да через канал соска в молочную цистерну.
Возбудитель мыта — Streptococcus equi (Шютц, 1888). „т£реди гемолитических гноеродных стрептококков его считают обособившимся видом? Мыт— инфекционное заболевание преимущественно молодняка цельнокопытных животных, характеризующееся катараль-
143
V , V
но-гноиным воспалением верхних дыхательных путей, а также подче-
люстных и заглоточных лимфатических узлов.
Mopiфология. В мазках из гноя возбудитель имеет вид длинных
цепочек, состоящих из кокков как бы сдавленных в поперечнике, а в
мазках из культур — коротких цепочек. Размер кокков 0,4—1 мкм. Капсул и спор не образует. Неподвижен. Хорошо окрашивается анилиновыми красками и по Граму.
Культивирование. В высевах из гноя на обычных средах стрептококк растет слабо, на средах, содержащих кровь или сыворотку, значительно лучше. На кровяном агаре вырастают мелкие, круглые колонии, окруженные зоной гемолиза типа на сывороточно-глюкозном
агаре интенсивно растет в виде мелких, прозрачных, похожих на капельки росы колоний, постепенно сливающихся между собой. Мытный стрептококк не свертывает обычное и лакмусовое молоко, а также не обесцвечивает метиленовое. Не ферментирует сорбит, лактозу.
Устойчивость. Во влажном гное сохраняется до шести месяцев, в навозе месяц, гибнет при температуре 70 °C за 1 ч, при 85 °C —за полчаса, 1%-ный раствор формалина, 2%-ный раствор едкого натра убивает его за 10—25 мин.
Патогенность и изменчивость. Мытом болеет _ддолодняк цельнокопытных животных, в лабораторных условиях воафшймчивы кошки и мыши. Мытный гной весьма вирулентный для же]Йбя*|\ но культуры данного стрептококка, в том числе свежевыделенные сывороточном или кровяном агаре, авирулентны. Причина этого явления до сих пор полностью не выяснена. Токсинообразование выражен^ слабо.
Мытный стрептококк весьма изменчив, на питательных средах он теряет вирулентность уже в первых генерациях, одновременно образуются клетки атипичных форм, расположенные по одной, две или скоп
лениями.
Патогенез. Носители стрептококка являются взрослые лошши, переболевшие мытом. Заражение молодняка происходит через рот или слизистую оболочку носа и , сопровождается накоплением возбудителя в окологлоточном лимфатическом кольце, где и начинает развиваться катарально-гнойное воспаление.
Иммунитет у переболевших животных пожизненный. Искусствен-
но, с помощью вакцин, создать иммунитет пока не удалось.
Диагностика. Материалом для бактериологического исследования служит гнойный экссудат носовой полости или цунктат подчелюстных нагноившихся лимфоузлов. Из гноя готовят мазкм, окрашивают по Граму. Романовскому. Под микроскопом обнаруживают длинные стрептококки. Для выделения культуры делают высевы на кровяной и сывороточный агар, где вырастают характерные колонии. Одновременно учитывают отсутствие изменений в посевах на метдденовом, лакмусовом и обычном молоке.
Биопрепараты не разработаны. При мыте весьма эффективны антибиотики (пенициллин, окситетрациклин). Вводят мл внутримышечно на 0,25 %-ном растворе новокаина, 1 раз в сутки и дозе 4000—5000
ЕД/кг,
Стрептококк, вызывающий цессы у животных, — Streptococcus кокк вызывает также неспецифические нагноителыше процессы, как
нагаоиельные п р о-pyogenes. Данный стрепто-
абсцесс, флегмону, артрит, эндометрит, а также' септицемию, осложнения вирусных инфекций. Стрептококк этот лишь по некоторым биохимическим свойствам активнее маститного и мытного* £ в остальном он
типично гемолитический гноеродный. Некоторые _>х0следователи считают, что Strep, pyogenes основной и из него обоссйЙЛись другие вида стрептококков, в частности маститный и мытный (см. рис. 55 и 56).
Энтерококки, или фекальные стреяе^кокки,— Streptococcus faecalis. Постоянно живут в кишечнике. В сочетании с кишеч-
144
Рис. 13. Фаг VI морфологического типа.
Рис. 15. Формы колоний энтеробактерий при диссоциации: 1 — S-форма; 2 — R-форма; 3 — М-мукоидиая форма; 4 — S—R.
Ю—Ветеринарная микробиология
Рис. 21. Мини-клетки Е. coll. На полюсах мутантной формы бактерий отшнуровывают ся сферические образования, не содержащие ДНК.
Рис. 25. Адсорбция доиорспецифи-ческого фага на ворсинках Е. coli F+. Свободные от фаговых корпускул тонкие нити—фимбрии; плотные — жгутики.
Рис. 27. Элиминация внехромо-сомных элементов по методу градиента концентрации в плотной среде. В центре чашки с агаром нанесена капля элиминирующего красителя (акрифлавина). По периферии негативные колонии «радужного лизиса» Р. aeruginosa в зоне, недоступной действию элиминирующего агента (малой концентрации).
S'
Рис. 28. Адсорбция донорспецифического фага R. Справа — клетка-реципиент того же вида.
на ворсинке Е. coli, несущей плазмиду
Рис. 29. Передача Hly-плазмиды Е. coli бактериям того же вида. Точки, окруженные светлыми зонами (гемолиз эритроцитов), — колонии реци-пиентных бактерий на кровяном агаре, воспринявших плазмиду Н1у.
10*
Вас. subtilis; в) Вас. mesentericus.
Рис. 33. Колонии на агаре: а) Вас. mycoides: б)
Рис. 53. Колонии Staphilococcus aureus на агаре.
Рис. 54. Колонии Streptococcus aga-lactiae на агаре.
Рис. 55. Streptococcus pyogenes в мазке из культуры, выделенной от больной эндометритом коровы.
Рис. 57. Streptococcus pneumoniae в мазке из экссудата матки коровы, больной эндометритом (Микрофото 1100).
Рис. 56. Streptococcus pyogenes haemolyticus на кровяном агаре. Колонии окружены широкой зоной гемолиза.
Рис. 58. Е. coli:
а — мазок из культуры; б — колонии.
Рис. 59. Е. coli: видны цитоплазма, клеточная стенка и жгутики (X 17 000).
Рис. 60. Е. coli — стационарная фаза. Видны электронноплотный материал на поверхности клеточной стенки:
мембранные структуры;
Ч-к— трехслойная цитоплазматическая мембрана; мс— кольцевые включения мелкогрануляриой структуры; н — нуклеоид (Х80 000).
Рис. 61. Proteus vulgaris. Видны жгутики (XI7 000).
Рис. 62. S. typhimurium:
a — мазок из культуры; б — колонии.
Рис. 63. S. abortus-eque:
а — колония S-формы; б — колония R-формы.
Рис. 64. Группа клеток S. dublin. Видны жгутики, состоящие из нитей, завернутых в спираль (Х13 500).
Рис. 65. Вакцинный штамм S. cholerae-suis (ТС-177). Видны выраженная капсула и жгутики (Х18 000).
Рис. 66. Вакцинный штамм S. typhimurium (Тр, Вг-1). Видны жгутики с 4—5 завитками (X 6100).
Рис. 67. Пастереллы птиц (селезенка, X 1600).
Рис. 68. Пастереллы при увеличении в 13 000 раз (по Скалинскому).
Рис. 69. Brucella abortus (X 900).
Рис. 70. Капсулы Вг. melitensis (X 30 000).
Рис. 71. Листерии (X 900)
Рис. 72. Культура листерий в столбике агара.
Рис. 73. Рожистая палочка. Увеличение Х900.
Рис. 74. Вегетативные клетки из бульонной культуры.
Рис. 75. Интактные «лет» »аМил антР»«а • .«трон,- —
Рис. 77
Рис. 79. Колонии возбудителя эмфизематозного карбункула:
Z иа глюкозо-кровяном агаре; 2 — на глюкозо-кровяном агаре в форме виноградного листка.
Рис. 80. CL septicum:
мазок из культуры; 2 - препарат-отпечаток из серозных покровов печени; 3-рост на поверх-ности кровяного агара с глюкозой.
Рис. 81. Cl. novyi:
1 — мазок из культуры; 2 — рост иа поверхности кровяного агара с глюкозой.
Рис. 82. Cl. perfringens:
/ — мазок из культуры; 2 — рост на поверхности кровяного агара с глюкозой.
Рис. 83. Возбудитель столбняка — мазок из культуры.
Рис. 84. Cl. botulinum:
1—палочки со спорами; 2—ко лоиии с зоной гемолиза иа ага ре кровью.
11 Ветеринарная микробиология
из патологического материала.
Рис. 85. Fusobact. necrophorum—мазок
Рис. 86. Микобактерии туберкулеза I — в обычном микроскопе
Рис. 86 (продолжение). Микобактерии туберкулеза в электронном микроскопе: а — M.bovis; б — M.tuberculosis; в — M.aviunu
Рис. 86а. I — актиномицеты:
1 — мицелий; 2 — прорастающие споры; 3—спороносцы.
11*
актиномикозная друза из гноя грану-
Рис. 86а (продолжение). П
лемы.
по Романов-
ж
$
Рв, 87. С. wm« °'Vm
скому — Гимзе (X 1000)
3 $
*
r,sj> г
ой'
Рис. 88. Тонкое строение Е. cams (культура моноцитов собаки):
ЕВ — элементарное тельце; РМ— цитоплазматическая мембрана; CW — клеточная стенка; VW мембрана вакуоли.
Рис. 89. N. helminthoeca в мазке из
лимфоузла собаки (Л, Б),
Рис. 90. L. tarassovi (/), L. grippotyphosa (2) (X 450)
Рис. 91. L. icterohaemorrhagiae (/) и L. pomona (2) (X 15 000).
Рис. 92. Гистологический срез. Лептоспиры окрашены
по методу Левадити.
Р ис. 93. Histoplasma farciminosus в гное.
Рис. 94. Бластоспоры Candida albicans
Рис. 95. Волос коровы, пораженный трнхофитоном.
Рис. 9и. Мицелий и артроспоры Тг. faviforme.
I
Рис. 97. M. lanosum:
/ — культура на сусло-агаре; 2 — макроконидии.
Рис. 98. Конидиеносцы рода Aspergillus.
Рис. 99. Конечные головки конидиеносцев A. flavus
Рис. 100. Продольный срез стромы Claviceps paspali. Видны плодовые тела -— перитеции.
Рис. 101. Колосья ржи, пораженные спорыньей.
Рис. 102. Сумчатая стадия Claviceps purpurea.
Рис. 103. Конидиеносцы и конидии Stachy-botrys alternans на агаре Чапека.
Рис. 104. Черный сажистый налет Stachybotrys alternans помещенных иа среду Чапека. Рост на 8-е сутки.
на соломинках,
Рис. 105. Fusarium sporotrichioides;
1 — микроконидии;
Рис. 105. (продолжение). Fusarium sporotrichio' 2__серповидные макроконидии.
Рис. 106. Хламидоспоры F. sporotrichoides.
Рис. 107. Рост гриба Fusarium graminearum на пораженных зернах
пшеницы.
Рис. 108. Спорангии Mucor racemosus, заполненные спорангиеспорами
7. Дифференциация стрептококков
Группа
Г емолитиче-ские
Гноеродные
Streptococcus equi
Streptococcus mastitidis
Streptococcus pyogenes animals
Виды стрептококков
Дифференциальные признаки
; тип гемолиза свертывание простого мол ока редукция лакмусового молока обесцвечивание метиленового молока сбраж ивание рост
лактозы с орбита маннита салицина в среде о pH 9,6 В среде о 6,5 % NaCl при 10 °C при 45 °C теплоустойчивость прн 60 °C—“30 мин патогенность
P
P
P
Зеленящие
Негемолити- Streptococcus ческие can- lactis рофиты
Streptococcus faecalis
ной палочкой, играют определенную этиологическую роль в возникновении желудочно-кишечных заболеваний у новорожденных животных. Характеризуются полиморфностью, широкой приспосабливаемостью к питательным средам и температуре. На кровяном агаре энтерококки обусловливают слабый гемолиз с позеленением среды вокруг колоний, за что отнесены в группу «зеленящих».
Морфология. Форма у энтерококков—сферическая, овоидная или ланцетовидная. Располагаются попарно или короткими цепочками. Диаметр кокков 0,5—1 мкм. Хорошо окрашиваются анилиновыми красками. На кровяном агаре растут в виде тонкого ровного сероватого налета. Могут разжижать желатину, продуцировать фибринолизин. Температурный диапазон роста 10—45° С, устойчивы к высокой температуре, не погибают при 60° С в течение 30 мин. Растут при pH 9,6, а также на средах с 6,5% NaCl. Устойчивы к антибиотикам, особенно пенициллину. Наличие энтерококков, например, в молоке свидетельствует о загрязнении его фекалиями животных.
Среди сапрофитных стрептококков наиболее распространены в природе молочнокислые, вызывающие скисание молока и сливок.
О дифференциальных признаках стрептококков см. таблицу 7.
Стрептококки, вызывающие диплококковую инфекцию (Str. pneumoniae). Как диплококк открыт в 1871 г. Л. Пастером в слюне ребенка, погибшего от бешенства.
Пневмонийный стрептококк— постоянный обитатель слизистых оболочек респираторных органов, пищеварительного аппарата, иногда вымени. После тяжелых родов у коров, свиней, овец он вызывает мастит, эндометрит, у новорожденного молодняка септицемию, пневмонию, энтерит. Иногда данный микроорганизм называют диплококком пневмонии. Однако чаще диплококки обусловливают септицемию молодняка, а затем уже энтерит, артриты и реже пневмонию.
Морфология и тинкториальные свойства. В мазках из патологического материала (труп молодняка, выделения из половых органов при эндометрите, молоко при остром мастите у коров, овец, свиней)
J2—Ветеринарная микробиология
145
клетки стрептококка располагаются попарно или короткими цепочками в виде диплострептококков. Форма отдельных клеток овальная, реже ланцетовидная (см. рис. 57)- При хронически протекающих процессах микроб чаще имеет форму диплострептококка. В мазках из свежих культур преобладает диплококковая форма, из старых — диплост-рептококковая. Размеры клеток 0,8—1,25 мкм. Мелкие ланцетовидные стрептококки выделяют от крупного рогатого скота; у свиней, овец и лошадей они крупнее, овальной формы. Подвижностью и спорообразованием стрептококк не обладает. Анилиновыми красками и по Граму окрашивается хорошо. Капсулообразование (в виде бледно-розового ободка) наблюдается преимущественно в организме животных (крупного рогатого скота), в первых генерациях после высева из патологического материала. Оно тесно связано с вирулентностью. Обнаруживают капсулу при окраске по Романовскому.
Культивирование. Культуры диплококка выделяют при высевах на питательные среды из крови сердца, селезенки, печени, почек, головного и костного мозга, лимфатических узлов, синовии суставов павших животных, патологических выделений матки, молока коров и овец, больных стрептококковым эндометритом нлн маститом.
На МПА молодые колонии стрептококка прозрачные, мелкие, гладкие, круглые, с ровными краями. В старых же культурах они крупные и мутные. В МПБ микроб образует равномерное помутнение с небольшим осадком. При посевах из трупов на агаре и в бульоне он часто не вырастает, тогда как на полужидком агаре растет в виде рыхлых хлопьев хорошо. В желатине рост нитевидный, без разжижения. Молоко свёртывает. На кровяном агаре образует мелкие колонии голубоватого цвета. Гемолиз дают только вирулентные стрептококки.
Биохимические свойства. На жидких средах стрептококки растут слабо, и ферментативные свойства их оценить трудно, поэтому готовят полужидкий агар с бромтимолбляу. Среда с этим реактивом весьма чувствительна к изменению pH. Культуры стрептококка ферментируют с образованием кислот без газа, левулёзу, маннозу, глюкозу, галактозу, лактозу, мальтозу, сахарозу, ксилозу, инулин и маннит; не ферментируют декстрозу, раффинозу, арабинозу и дульцит. Пневмонийный стрептококк— факультативный аэроб, пигмента и индола на средах не образует.
Устойчивость. Во внешней среде — почве, навозе, в помещениях — стрептококки погибают в течение 3—4 недель, особенно губительно на них действуют солнечные лучи и высушивание. Нагревание до 85° С, в частности в молоке, убивает их за 30 мин, а 1%-ный раствор формалина, 2%-ный раствор едкого натра, 10%-ная взвесь свежегашеной извести— за 1—2 мин.
Патогенность и изменчивость. На средах с кровью и 1% глюкозы стрептококк продуцирует токсин, обнаруживающийся в фильтратах культур. Наиболее токсигенны свежевыделенные культуры из трупов молодняка, павших от диплококковой инфекции при токсикосептической форме. Токсины данного стрептококка специфичны. Нейтрализуются они только противодиплококковой сывороткой. Эта же сыворотка, предварительно введенная животным, предохраняет их от смертельных доз диплококкового токсина.
Патогенез. При внедрении в слизистую оболочку респираторных органов, пищеварительного аппарата, матки или вымени вирулентные диплококки продуцируют токсические вещества, отрицательно влияющие на фагоцитоз. Кроме того, капсульные диплококки противостоят разрушительному действию фагоцитарных ферментов. Будучи поглощены фагоцитами, диплококки не погибают, а, наоборот, вызывают гибель поглотивших их фагоцитов, Токсические вещества увеличивают проницаемость стенок сосудов, вследствие чего появляется отечность тканей и кровоизлияния. Они также вызывают перерождение тканей, особенно ярко выраженное в печени, мышце сердца и почках. Размножение диплококков в крови обусловливает септицемию, что может
146
привести к гибели новорожденных животных. При достаточной сопротивляемости организма или применении лечебных препаратов предупреждаются явления токсикоза и септицемии. Животные выздоравливают, приобретая иммунитет. После переболевания в молодом возрасте животные могут оставаться длительное время скрытыми носителями диплококков на слизистых оболочках половых органов и вымени. После тяжелых родов или задержания последа вследствие ослабления устойчивости организма, диплококки размножаются, обусловливая эндометрит и мастит.
Антигенная структура. Серологические свойства пневмонийного стрептококка изучены путем постановки реакции агглютинации с антигенами, приготовленными из культур этого микроба, и пневмококковыми агглютинирующими сыворотками всех сероваров. Установлено, что в слабых разведениях (1 :25; 1 :50) пневмококковые сыворотки I— VII и других серологических вариантов агглютинируют пневмококковые антигены. С помощью перекрестной реакции агглютинации определено близкое серологическое родство пневмонийного микроба, выделенного от молодняка различных видов сельскохозяйственных животных.
Возбудитель подвержен изменчивости в значительной степени. Процесс изменчивости первоначальных свойств этого микроба сопровождается формированием на агаре переходных, а затем шероховатых колоний, потерей капсулы, вирулентности гемолитических и иммуноген
ных качеств, а также повышения биохимической активности.
Иммунитет при диплококковой инфекции обусловлен наличием
главным образом антитоксинов, действующих против токсических веществ, выделяемых этими микробами во внешнюю среду, а также содержащихся в их капсуле и цитоплазме. После естественного перебо-
левания чаще формируется нестерильный иммунитет, сопровождающийся скрытым носительством диплококков в организме животных.
Диагностика. При диплококковой инфекции наиболее достоверным является бактериологическое исследование. У коров,
овец, свиней исследуют выделения из половых органов при эндометрите, а также молоко при мастите. При заболевании молодняка в лабораторию посылают трупы или головной мозг, трубчатые кости, суставы, селезенку, кровь сердца. Высевы делают на МПА, МПБ, но обязательно на полужидкий и кровяной агар. Пульпой селезенки, разведенной МПБ 1 : 5, заражают внутрибрюшинно мышей в дозе 0,5 мл. При наличии стрептококков мыши гибнут в течение суток. Из крови сердца производят высевы на среды, готовят мазки и окрашивают их по Романовскому. Стрептококки окружены нежной розовой капсулой. На пи
тательных средах вырастают характерные колонии.
Для прижизненной диагностики используют метод получения гемокультур. Для этого у больных телят, ягнят стерильным шприцем берут кровь из яремной вены и засевают по 2—3 мл в пробирки с полужидким агаром, хорошо смешивают со средой и помещают в термостат. Через 1—2 суток из иих делают высев на кровяной агар, выращивают сутки. При положительном диагнозе на кровяном агаре вырастают колонии, окруженные зоной гемолиза, а в мазках обнаруживают стрептококки.
Биопрепараты. Для профилактики стрептококковых заболеваний молодняка применяют диплококковую формолвакцину и противодип-лококковую сыворртку. Вакцину, а также антиген для гипериммунизации волов-продуцентов сыворотки готовят из трех иммуногенных штаммов, выделенных от телят, ягнят и поросят путем выращивания их на питательной среде в реакторах, с последующим обезвреживанием формалином. Активность вакпины проверяют на белых мышах, которых иммунизирую* под кожу, а заражают внутрибрюшинно. Сыворотку готовят путем гипериммунизации волов живой диплококковой культурой. Активность сыворотки проверяют также на мышах.
В стационарно неблагополучных хозяйствах с профилактической
12*
147
Jfi
* ,r?.r .,^,<5 i: ,ъ, .> Л1(к... ,-.,,. ,л; v
целью, а также вынужденно (если на ферме возникло заболевание) молодняк прививают в возрасте от 8 дней до 1—3 месяцев. Вакцину вводят внутримышечно в области внутренней поверхности бедра, дважды, телятам в дозе 5 мл и 10 мл с интервалом в 10—14 дней, ягнятам и поросятам по 5 мл оба раза. Иммунитет у привитых животных создается на 4 мес. При массовых диплококковых эндометритах и маститах у коров их иммунизируют за 1—2 месяца до отела, дважды, с промежутками в 10—14 дней, в дозе по 30 мл каждый раз, под кожу, в средней трети шеи.
Сыворотку вводят внутримышечно, главным образом молодняку с лечебной целью в дозе 0,5—1 мл/кг. Из антибиотиков при диплококко-вой инфекции рекомендуют пенициллин. Вводят его одновременно со стрептомицином. С успехом применяют окситетрациклин, биомицин, полимиксин М. Ввиду того что при этом заболевании наблюдается токсикоз, а антибиотики антитоксическим действием не обладают, одновременно с антибиотиками используют противодиплококковую сыворотку. Выраженный лечебный эффект дает одновременное применение сульфадимезина и противодиплококковой сыворотки у животных, больных эндометритом или маститом.
ЭНТЕРОБАКТЕРИИ
Семейство кишечных бактерий —Enterobacteriaceae — относится к порядку Eubacteriales — собственно бактерии. По современной классификации оно включает 12 родов: Escherichia, Edwarsiella, Citrobacter, Salmonella, Shigella, Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Yersinia и Erwinia. В патологии домашних животных наибольшее зна
чение имеют роды Escherichia, Salmonella, Proteus и Yersinia.
Энтеробактерии широко распространены в природе. Среди них имеются патогенные, условнопатогенные и сапрофитные виды. Патогенные
виды и типы вызывают болезни, отличающиеся по клиническим проявлениям (кишечные инфекции, бактериемии, пневмонии и массовые аборты у животных, артриты, маститы и т. д.). Поэтому название се
мейства больше соответствует месту их обитания и способам заражения. Замечено, что ферментативная активность энтеробактерий больше вы-
ражена у сапрофитных и условнопатогенных видов, в меньшей степени у более облигатных видов, как проявление одной из форм эволюции паразитизма. Поэтому наряду с большой универсальностью поражать многие виды животных имеются виды обособленные, вызывающие болез
ни только у одного вида, иногда с выраженным тропизмом к определенным тканям и органам (сальмонеллы аборта овец и лошадей, брюшного тифа, дизентерийные бактерии и др.).
ЭШЕРИХИИ
Род Escherichia представлен одним видом — Е. coli (известная как кишечная палочка). Выделена она Эшерихом в 1885 г. из фекалий человека. Е. coli — постоянный обитатель толстого отдела кишечника человека, млекопитающих, птиц, рыб, рептилий, амфибий и насекомых. Микроб вегетирует на многих растениях. Обнаруживают его в почве, воде и на различных предметах. Патогенные серотипы вызывают колибакте-риоз (колибациллез, колиэнтерит) — весьма распространенную болезнь у новорожденных домашних животных, иногда у птенцов и эмбрионов птиц.
Морфология. Е. coli — полиморфные палочки, размером от мелких коккобактерий (0,2—0,5 мкм) до более крупных, толстых палочек длиной 3 мкм и шириной 0,6—0,8 мкм. Палочки прямые, с закругленными концами, располагаются чаще одиночно. Имеются подвижные и непод-148
вижные особи (без жгутиков). Некоторые образуют легко обнаружив ваемую капсулу (см. рис. 58, 59). Под электронным микроскопом цитоплазма губчатого строения, нуклеоид (ядро) в форме неправильных закруглённых нитей (см. рис. 60).
Культивирование. Кишечная палочка аэроб или факультативный анаэроб, оптимальная температура роста 37 —38 °C, pH 7,2— 7,5. Рост и размножение бактерий возможен при значительных колебаниях pH среды (5,0 — 8,0) и температурного режима (15 — 45 °C). К питательным средам неприхотлива. На плотных средах формируются слабовыпуклые, полупрозрачные сероватые колонии в диаметре 2— 3 мм, с ровными краями, сочные, с блестящей поверхностью. В жидких средах образует равномерное помутнение и небольшой осадок. На среде Эндо колонии окрашиваются в цвет фуксина с металлическим оттенком. Встречаются штаммы, образующие неокрашенные колонии. На среде Левина (агар с эозином и метиленовой синькой) колонии окрашиваются в темно-фиолетовый или черный цвет.
Биохимические свойства. Кишечная палочка продуцирует многообразные ферменты, разлагающие углеводы с образованием кислоты и газа: арабинозу, ксилозу, галактозу» левулёзу, лактозу (существенное отличие от других родов), мальтозу, маннит, рамнозу, непостоянно сахарозу и дульцит (чаще сахарозу чем дульцит), раффинозу, салицин, глицерин, свертывает молоко, не изменяет адонит и инозит. Е. coli не разжижает желатину, не разлагает мочевину, как правило, образует индол, восстанавливает нитраты в нитриты, дает положительную реакцию с метилротом и отрицательную Фогес — Проскауэра (не образует ацетил-метилкарбинол).
Устойчивость. Эшерихии неустойчивы к высокой температуре. При температуре 60°С погибают в течение 15 мин, при 100°С — моментально. Губительно действуют на них многие дезинфицирующие вещества (формалин, фенол, хлорная известь, едкий натр и др.). Кроме того (по данным многих авторов), эшерихии чувствительны к неомицину, полимиксину, ампициллину, хлорамфениколу, тетрациклинам, нитрофурановым и сульфаниламидным препаратам. Менее чувствительны к стрептомицину; к пенициллину не чувствительны или слабо чувствительны (продуцируют внутриклеточную пенициллиназу).
Однако в связи с широким использованием лечебных средств и кормовых добавок отмечается всевозрастающая устойчивость эшерихий к основным антибиотикам и другим антибактериальным препаратам. Применение антибиотиков и химиотерапевтических препаратов привело к формированию устойчивых штаммов.
A. Gracia в 1925 г. обнаружил в культуре кишечной палочки антибиотическое вещество, подавляющее рост других гомологичных штаммов. Это вещество осаждается ацетоном и разрушается трипсином (протеиновой природы). Подобные вещества выявлены у многих штаммов эшерихий, дизентерийных и других бактерий и.названы колицина-ми. Эшерихии продуцируют до 24 типов колицинов/Специфичность действия колицинов объясняют наличием на поверхности клеток рецепторов, на которых они могут адсорбироваться.
Патогенность у эшерихий выражена слабее, чем у родов Salmonella и Proteus. У домашних и лабораторных животных удается воспроизвести колибактериоз при заражении свежевыделенными культурами (из трупного материала) в больших дозах. Четкие результаты о степени вирулентности эшерихий на лабораторных животных (белых мышах, кроликах, котятах и др.) получить не удается. Вирулентность разных штаммов одного и того же серотипа варьирует.
Наиболее чувствительны к внутрибрюшинному заражению белые мыши, к пероральному — котята и щенята. Патогенные серотипы кишечной палочки вызывают гибель куриных эмбрионов и цитопатическое
149 f
i
действие в культуре клеток, что может быть использовано в диагностической практике.
Кишечная палочка обладает термостабильным эндотоксином энтеро-тропного действия. Он вызывает лихорадочную реакцию, сменяющуюся гипотермией, диарею, геморрагии в желудочно-кишечном канале, лейкопению с последующим лейкоцитозом.
В свежевыделенных культурах обнаруживают термолабильный и термостабильный экзоэнтеротоксины. Имеются серотипы, продуцирующие довольно сильный гемолизин (гемолитические штаммы кишечной палочки).
У патогенных эшерихий имеется определенная связь колициноген-ности и антигенной структуры (Д. Г. Кудлай и сотр., 1964). В ряде стран колициногенность используется в диагностической практике для типирования эшерихий.
Антигенная структура. Общепризнанная серологическая классификация эшерихий по Кауфману основана на анализе О-, К- и Н-антиге-
нов.
О-антигены—термостабильные соматические, не разрушающиеся при 100°С и от действия алкоголя. По химической природе липополи
Является групповым специфическим
сахариднобелковый комплекс.
антигеном и содержится в основном в клеточной стенке. Разные серо-
группы кишечной палочки отличаются по углеводному составу полиса
харидов.
К-a н ти г е н ы — поверхностные или капсульные, обозначаемые L, А и В. Большая часть их — кислые полисахариды, но имеются штаммы протеиновой природы (L-антигены) или различного химического состава. L-антигены термолабильны, разрушаются при 100 °C в течение 1 ч. Штаммы эшерихий, имеющие L-антигены, образуют мутные, непрозрачные колонии, весьма токсичны. Живые культуры не агглютинируются О-сыворотками. При разрушении L-антигена агглютинабильность с О-сыворотками хорошо выражена. В-антиген термолабильный, при 100°С утрачиваются антигенные свойства, но агглютинабильность сохраняется. В-антиген строго специфичен для каждого типа кишечной палочки и содержится у большинства патогенных серотипов.
А-антиген термостабильный, при 100°C не разрушается в течение 2,5 ч. Культуры с А-антигеном слизистые и непрозрачные, устойчивы к фагоцитозу. Показателем наличия К-антигенов является О-инагглюти-
и
набильность живых бактерий в гладкой форме и агглютинабильность их К-сыворотками.
Е. coli, содержащие К-антигены, более вирулентны по сравнению с К-минус вариантами. К-антитела обладают большей защитной активностью по сравнению с О-антителами.
Н-антиген (жгутиковый) содержится у подвижных штаммов эшерихий, термолабильный, белковой природы. Не специфичен, один и тот же антиген может встречаться в разных О-группах.
Кауфман, Книпшильд и Вэлне предложили обозначать антигенное строение эшерихий арабскими цифрами (например, О111:В4:Н2). У эшерихий установлено более 150 типов О-антигенов, 88 К-антигенов и 49 типов Н-антигенов. Сочетание различных антигенов определяет специфичность серологических типов кишечной палочки, систематика ко
торых имеет важное эпизоотологическое значение.
Колибактериоз телят (колибациллез, эшерихиоз) — широко распространенное заболевание во многих странах и в СССР, наносит огромный экономический ущерб.
По данным Я- Е. Колякова с сотр. (1970), наиболее распространенными эшерихиями у телят являются серогруппы: 08, 09, 015, 078, 086,
150
0101, 041, 0115, 0117, 0119, 0137, 02, 026, 020, 0127, 055, 035, некоторые из них (026, 055, 086, 0119 и др.) являются возбудителями колиэнтеритов у детей.
Патогенез. Основным путем инфицирования телят считают алимеитариый. Возможно заражение через носоглотку и виутриутробио.
Различают две основные формы колибактериоза — эитеротокеемическую (встречается более часто) и септицемическую. При эитеротоксемической форме эшерихии размножаются в тонком кишечнике и часто в сычуге, где накапливаются экзоэнтеротоксины и огромная биомасса бактерий, в результате отмирания которых высвобождаются эндотоксины, вызывающие местный воспалительный процесс. Кроме того, эндотоксины проникают в лимфатическую систему, вследствие чего наступает тяжелая токсемия и телята погибают в ближайшие сутки. При септицемии эшерихни проникают через стенку кишечника сначала в брыжеечные лимфатические узлы, затем в общий лнмфоток, что сопровождается энтеритом и сепсисом. Кишечиые формы колибактериоза вызывают преимущественно эшернхин, продуцирующие термолабильный н термостабильный экзотоксины.
По мнению многих авторов, в патогенезе колибактериоза большую роль играют возрастные анатомо-физиологические особенности: низкая кислотность желудочного сока, повышенная проницаемость эпителия кишечника, слабая барьерная функция лимфатических узлов и печени, отсутствие (или низкое содержание) в кровн гамма-гло-булииов. Важным фактором тяжелого течения колибактериоза в период массовых отелов является высокая вирулентность эшерихий в результате пассирования на телятах. Течение колибактериоза нередко осложняется вульгарным протеем (Preteus vulgaris) и другими представителями кишечиых бактерий. Штаммы протея устойчивы или быстро приобретают устойчивость к антибиотикам, обладают большой энергией размножения. В случаях смешанной инфекции течение еще более усугубляется. Возникновению болезни способствует запоздалая дача молозива.
Иммунитет. Для повышения активности гуморальных и клеточных факторов защиты в неблагополучных хозяйствах практикуют в первый день жизни теленку вводить гамма-глобулины (иммунная сыворотка или кровь матери). У телят старше 10—-14-дневного возраста отмечается естественная невосприимчивость к колибактериозу.
Диагностика. Прижизненная бактериологическая диагностика достаточно разработана. С этой целью от больных телят из прямой кишки стеклянной палочкой или стерильным тампоном берут фекалии, суспендируют их в физиологическом растворе 1 : 10 и по 1—2 капли рассеивают в 2—3 чашки Петри со средой Эндо или Левина. Подозрительные колонии (окрашенные в цвет фуксина или темно-фиолетовые) отсевают на скошенный агар (до 10 колоний). Полученные культуры микроскопируют, исследуют в реакции агглютинации сначала с комплексной колисывороткой (состоит из нескольких типовых сывороток), а затем с типовыми сыворотками. Для постановки РА на стекле или в пробирках из каждой культуры готовят два антигена: взвесь убитой культуры (при 100°С в течение 1 ч) для определения О-антигена и взвесь живой культуры для определения В-антигена (концентрация 5—6 млрд, микробных тел в 1 мл). Если используется типоспецифическая О-колисыворотка, то готовят один антиген — убитую взвесь бактерий.
При постановке реакции с серотипами, имеющими А-антиген, взвесь автоклавируют. Одновременно изучают тинкториальные свойства (окраска по Граму) и биохимические (ферментация лактозы, образование индола, положительная реакция с метилротом). При необходимости ставят биопробу на белых мышах. Дополнительно идентифицируют штаммы, продуцирующие экзоэнтеротоксины. К недостатку метода следует отнести, что исследование идет в течение нескольких суток.
Посмертная диагностика. В лабораторию направляют свежий труп, а при невозможности — трубчатую кость, часть селезенки, печени с желчным пузырем, брыжеечные лимфоузлы, участок тонкого отдела кишечника (перевязанный с двух сторон). Посевы проводят на МПА, МПБ и среду Эндо или Левина. Из органов и головного мозга лучше делать отпечатки разрезанной поверхностью кусочка органа или ткани. Из сычуга и тонкого отдела кишечника посевы проводят на
151
среду Эндо по Дригальскому. При выделении культуры эшерихий из большинства органов или из содержимого сычуга, кишечника и брыжеечных лимфатических узлов (обильный рост) проверять вирулентность на лабораторных животных не обязательно. Для установления диагноза болезни в кишечных формах выделять микроб из паренхиматозных органов нецелесообразно. Культуры типируются, как указано выше.
Во всех случаях (прижизненная или посмертная диагностика) определяют чувствительность кишечной палочки к антибиотикам методом
стандартных индикаторных дисков или методом серийных разведений.
Биопрепараты. Новорожденным телятам с профилактической целью вводят (подкожно, внутривенно, внутримышечно, перорально) гиперим-
мунную сыворотку или гамма-глобулин, которые оказывают опсонизирующее действие, активизируют фагоцитоз и обладают антитоксически-
ми свойствами. В СССР готовят поливалентную сыворотку путем иммунизации волов наиболее распространенными штаммами эшерихий (24 штамма) и колипаратифозную сыворотку. Активность иммунных сыво-
роток проверяют на белых мышах или молодых морских свинках: сначала вводят сыворотку, а через 24 ч внутрибрюшинно оттитрованную дозу культуры кишечной палочки.
В ряде стран с успехом вакцинируют стельных коров. В этом случае теленок получает с молозивом специфические антитела. Молозивный (колостральный) иммунитет, как и сывороточный, сохраняется в течение 2—3 недель. В нашей стране готовят колипаратифозную вакцину, которая представляет убитую формалином культуру из многих штаммов Е. coli и из нескольких штаммов сальмонелл. Вакцинация глубокостельных коров двукратная с интервалом в 10—14 суток. Рекомендуют также колипротектант ВИЭВ (взвесь убитых нагреванием эшерихий) с первыми дачами молозива неоднократно.
В СССР готовят поливалентный коли-гертнер-фаг, состоящий из нескольких фагов кишечной палочки и фага в отношении сальмонелл. Фаг применяют телятам энтерально, внутримышечно и подкожно. Эффективность его повышается при одновременном применении вместе с антибиотиками. Кроме антибиотиков, рекомендуются сульфаниламидные и нитрофурановые препараты.
Ко л ибактериоз поросят. По времени возникновения и характеру болезни различают колибактериоз новорожденных поросят (до 3—4-недельного возраста) и отечную болезнь поросят (колиэнтеро-токсемия) отъемного возраста (чаще до 75 суток). Основными патогенными серогруппами эшерихий у поросят считают 08, 0138, 0139, 0141, 026, 018, 045, 055, 0127, 0142.
У поросят раннего возраста болезнь протекает остро и проявляется в виде выраженных явлений токсемии и сепсиса, при подостром течении— токсемии и диффузного поноса. Отечную болезнь наблюдают у хорошо упитанных поросят. Она протекает сверхостро (животные погибают через 18—24 ч) и подостро с симптомами диареи. Из-за резкого повышения порозности сосудов развивается сильный отек век, стенки кардиальной части желудка, брыжейки, дифтероидное воспаление слизистой толстого отдела кишечника. Смерть наступает от токсикоза. Считают, что в патогенезе имеют значение интоксикация и аллергическая реактивность организма. Вызывается отечная болезнь гемолитическими штаммами кишечной палочки, содержащими К-антигены 88, 82 или 91. Гемолитические штаммы эшерихий продуцируют экстрацеллюлярный гемолизин высокой активности.
Клиническая картина болезни зависит от серотипа, способного продуцировать энтеро- или нейротоксин. В последнем случае развиваются признаки поражения центральной нервной системы, болезнь принимает форму отечной болезни (К. Lutter> 1974). % *
152
Диагностика. При посмертной диагностике суспензию содержимого кишечника дробно высевают на чашки Петри со средой Эндо. Прижизненно исследуют фекалии. Выделенные культуры идентифицируют по общепринятым методикам. Дополнительно изучают гемолитическую активность (на кровяных средах). При необходимости проверяют дермонекротизирующие (на кроликах) и плазмокоагулирующие свойства, а также вирулентность на белых мышах (внутрибрюшинно 0,5 мл суточной бульонной культуры).
Биопрепараты. В ряде стран применяют специфическую поливалентную сыворотку (5—15 мл) или гамма-глобулин (5—10 мл) отиммуни-; зированных свиней (за несколько суток до отъема). Хорошие результаты получены при иммунизации супоросных свиноматок вакциной, изготовленной из местных штаммов за 3—4 недели до опороса, а также поросят 5-недельного возраста или поросят за неделю до и после отъема.
С лечебно-профилактической целью можно использовать антибиотики (неомицин, хлорамфеникол), нитрофурановые и сульфаниламидные
препараты.
Колибактериоз ягнят — остропротекающая болезнь ягнят новорожденных и после отъема, сопровождающаяся диареей (поносом), быстро нарастающей слабостью и гибелью животных в течение нес-
кольких суток. В отъемном возрасте колибактериоз протекает в сверхострой и септицемической форме. У больных ягнят обнаруживают эше-рихии серогрупп 08, 09, 015, 020, 026, 035, 078, 0101, 0119, 0137, 041.
Диагностика — как при колибактериозе телят.
Биопрепараты не разработаны. Рекомендуют антибиотики, нитрофурановые и сульфаниламидные препараты.
Колибактериоз птиц — энзоотическая септицемическая бо
лезнь цыплят, индюшат, гусят и утят в возрасте 3—14 суток. Болезнь протекает остро, иногда подостро и хронически (колиэнтерит). При острой форме отмечается усиление жажды, потеря аппетита, явление токсикоза. При подострой и хронической — профузный понос и жажда.
Колибактериоз птиц регистрируется во многих странах. Патогенные эшерихии проникают через скорлупу, вызывают замирание зародышей, а выведенные цыплята являются носителями возбудителя и причиной вспышки колибактериоза (фекалии, зараженный корм и вода).
От цыплят чаще выделяют эшерихии следующих серотипов: 035, 041, 086, 0101, 0103, 0117, 0137, 408.
С профилактической целью наряду с общими зоогигиеническими мероприятиями важное место занимает прединкубационная обработка яиц (особенно эффективно ртутно-кварцевое облучение в сочетании с диспергированным формальдегидом). Из лечебных средств рекомендуют антибиотики и нитрофурановые препараты 3 раза в течение 6—10 суток.
Колибактериоз пушных зверей — болезнь щенков пушных зверей. У щенков голубых песцов и серебристо-черных лисиц 1—10-диёв-ного возраста отмечается понос, отставание в росте, иногда нервные явления (менингоэнцефалит). У беременных животных возможны аборты и рождение мертвых плодов.
Г1ри типизации эшерихий установлены своеобразные серотипы и лишь в единичных случаях выявлены серотипы, встречающиеся у других животных. Штаммы эшерихий, выделенные от щенков, вирулентны для песцов и белых мышей. К некоторым патогенным серотипам выделены фаги (В. С. Слугин, 1969).
Биопрепараты. Наряду с диетическим кормлением рекомендуют иммунную сыворотку против колибактериоза телят, антибиотики (биомицин 0,025 г/кг), фурацилин (0,05—0,1 г/кг) и ацидофилин (С,Я. Лю-башенко, А. М. Петров, 1962),
153
ПРОТЕЙ
J 4
Бактерии рода Proteus — подвижные (перитрихиальные) полиморфные палочки с различной биохимической активностью. На плотных средах образуют характерный сливающийся рост (феномен роения). Протей* разжижает желатину, гидролизует мочевину, непостоянно образует индол и сероводород, не разлагает лактозу и маннит. Весьма разнообразны по антигенной структуре. По Кауфману и Перчу, различают 49 О-антигенов и 19 Н-антигенов. Имеется определенная связь между антигенной структурой и биохимической активностью (см. рис. 61).
Протей обладает большой энергией размножения, осложняет острые кишечные инфекции, особенно колибактериоз. Проникая через яичную скорлупу, вызывает замирание зародышей птиц. Серотипы протеев у Животных не изучены. По сообщению Р. Коли с соавт. (1968) внутривенное заражение телят вызывает септический процесс. При повторном заражении отмечают слабую реакцию, появление агглютининов, свидетельствующих о приобретенной устойчивости. Во время болезни вирулентность протея повышается в 5 раз, через 36—48 ч после смерти телят — в 100 раз.
Протей устойчив против большинства антибиотиков и других антибактериальных препаратов (лишь высокие концентрации оказывают бактериостатическое действие). Лучший эффект получают от препаратов нитрофуранового ряда.
САЛЬМОНЕЛЛЫ
Род Salmonella — паратифозные бактерии, в серологическом отношении родственны, патогенны для людей и животных или одновременно для тех и других. Данный род назван в честь американского исследователя Сальмона.
Сальмонеллы могут вызывать первичные инфекции (сальмонеллезы у молодняка животных, аборты у овец и кобыл, пуллороз птиц, брюшной тиф человека и др.), а также вторичные, осложняющие бактериальные и вирусные болезни (пневмонии молодняка, аборты у овец, чума свиней и др.).
При употреблении инфицированных продуктов животного происхождения (мясо, молоко, яйца) сальмонеллы вызывают у людей токси-коинфекции.
► У животных весьма распространены латентные инфекции (сальмо-неллоносительство).
Животные являются основным резервуаром сальмонеллезной (паратифозной) инфекции во всех странах мира. Отмечается всевозрастающая их роль как источников сальмонеллезных болезней человека. В этой связи сальмонеллезы представляют важную ветеринарную и медико-биологическую проблему.
В настоящее время насчитывают свыше 1500 вариантов сальмонелл, различающихся по антигенной структуре и ферментативной активности, из них примерно 150 типов постоянно обнаруживают в Европе.
Морфология. Палочки с закругленными краями, реже овоидные формы, средние размеры 2—4 мкм в длину и 0,2—0,6 мкм в ширину. Иногда встречаются нитевидные формы (в старых культурах, при интенсивном культивировании).
За редким исключением (S. gallinarum) они подвижны, с перитри-хиально расположенными жгутиками, легко окрашиваются анилиновыми красками, грамотрицательные.
Культивирование. Сальмонеллы — аэробы или факультативные аэробы. Хорошо развиваются на обычных питательных средах, оптимальная температура роста 37 °C, при pH среды 7,2—7,6, многие виды растут 154
(медленнее) и при комнатной температуре (см. рис. 62). Для выделения и идентификации сальмонелл предложено много питательных сред.
Гладкие — S-формы в бульоне образуют равномерное помутнение, на плотных средах — круглые, блестящие, выпуклые, влажные, четко очерченные колонии, на проникающем свете голубоватого оттенка. Шероховатые — R-формы на жидких средах образуют осадок с прозрачной недостаточной жидкостью, иногда хлопьевидный рост и осадок. Колонии неправильной формы, с волнообразными, кружевными краями и уплотненным центром, тусклые и более сухие (см. рис. 63). Некоторые сальмонеллы формируют на МПА мелкие компактные колонии (S. abortus-ovis) или способны к слизистому валообразованию вокруг колоний (S. paratyphi В.).
Биохимические свойства варьируют в зависимости от вида и типа, а иногда и штамма сальмонелл (биохимические варианты). Сальмонеллы не ферментируют мочевину, лактозу, сахарозу, адонит и салицин, большинство видов не разлагает желатину и не образует индола и ацетил-метилкарбинола. Сальмонеллы ферментируют с образованием кислоты и газа глюкозу, галактозу, маннозу, фруктозу, арабинозу, ксилозу, рамнозу, маннит, мальтозу, глицерин, дульцит и сорбит, умеренно восстанавливают нитраты в нитриты, образуют сероводород и разлагают d- и 1-тартрат (право- и левовращающая винная кислота), продуцируют лизиндекарбоксилазу.
Устойчивость. Сальмонеллы сравнительно устойчивы к температуре (60—75 °C), солям высоких концентраций и некоторым кислотам. При температуре 60°С погибают в течение 1 ч, при 100°С — моментально.
Несколько месяцев сохраняются в соленых и копченых продуктах, а также в проваренном мясе (варить 2—2,5 ч). При комнатной температуре выживают несколько месяцев. От прямых солнечных лучей погибают в течение 5—10 ч. В почве и других объектах внешней среды остаются жизнеспособными от 20 до 120 суток, в трупах до 100 суток, в сухих экскрементах несколько лет. Дезинфицирующие растворы оказывают губительное действие. Чувствительны к неомицину, тетрациклинам, левомицетину, стрептомицину, нитрофурановым и сульфамидным препаратам.
Патогенность. В естественных условиях сальмонеллы являются возбудителями септицемических инфекций, поражений желудочно-кишечного тракта, пневмоний, а также абортов у животных. Сальмонеллезы поражают телят, ягнят, поросят, птиц (куры, утки, гуси, индейки, голуби, воробьи, канарейки, зяблики, попугаи и др.), грызунов (мыши, крысы, кролики и др.), жеребят, пушных зверей (серебристо-черные лисицы, песцы, норки, нутрии).
Неблагоприятные факторы — неудовлетворительное кормление и содержание способствуют возникновению болезни. Большинство распространенных видов и типов сальмонелл вирулентны для лабораторных животных. Особую чувствительность проявляют белые мыши. В то же время вирулентность может варьировать в широких пределах.
Сальмонеллы образуют термостабильный эндотоксин, который высвобождается при разрушении бактерий или может извлекаться химическим путем (обработка трихлоруксусной кислотой, трипсином и др). При внутрибрюшинном введении лабораторным животным он вызывает воспаление кишечника, диарею, парезы и судороги. Вопрос о продуцировании сальмонеллами экзотоксина изучен недостаточно.
Патогенез. Заражение происходит преимущественно через пищеварительный канал, а также аэрогенно, внутриутробно и трансовариальио (птицы). При острой и подострой формах сальмонеллы вначале размножаются в кишечнике, затем через кишечные ворсинки проникают в лимфатические образования кишечника (пейеровые бляшки и солитарные фолликулы) и брыжеечные лимфатические узлы. Здесь происходит интенсивное размножение бактерий, вследствие чего развиваются первые воспалительные
155
8. Антигенная структура сальмонелл (из схемы Кауфмана — Уайта)
Серотип Соматический Жгутиковый антиген
антиген 1-я фаза 2-я фаза
Группа A
S. paratyphi А
I 1, 2, 12
Группа В
S. schottmuelleri (S. paratyphi В)
S. typhimurium
S. abortus-equi
S. abortus-ovis
S. abortus-bovis
S. heidelberg
S. derby
S. Stanley
S. bran den burg
S. esseri
S. hirschfeldii (S. paratyphi C)
S, cholera-suis
S. typhi-suis
S. braenderup
S. thompson
S. infantis
S. muenchen
S. newport
S. bovismorbificans
S. typhi
S. enteritidis
S. dublin
S. rostok
S. moskow
S. sendai
S. gallinarum
S. pullorum
1, 4, 5, 12
1, 4, 5, 12
4, 12
4, 12
1, 4, 12, 27
4, 5, 12 h 4, 12
4, 5, 12
1, 4, 5, 12
4, 12 Группа Ci
6t 7, Vi
6, 7
6, 7
6, 7
6, 7
6, 7 Группа Сг
6, 8
6, 8
6, 8
Группа D
9, 12, Vi
1, 9, 12
1, 9, 12
1, 9, 12
9, 12
1, 9, 12
1,9, 12
9, 12
b
i
c b
r f. g d
1. v
g. m
C C C e, h k r
d
e, h r
d g, m g> P g> P, u g, q a
1, 2
1, 2
e, n, x
1, 6
e, n, x
1, 2
1, 2
1, 2
6» П» 15
1, s
1, 5
1, 5
1, 5
1, 5
1, 2
1, 2
1, 5
Группа Ei
S. anatum
S. Ion don
3, 10
3, 10
e, h
1, v
1, 6
1, 6
процессы. После этого бактерии проникают в общий лимфо- и кровоток и наступает бактериемия, сопровождающаяся паренхиматозной диффузией (локализация и размножение сальмонелл в лимфатических узлах, легких, иногда в костном мозге). У беременных животных (овцы, кобылы, промысловые животные) сальмонеллы локализуются главным образом в матке, обусловливая воспалительные процессы в ней, а также плодных оболочек, сепсис плода и аборты.
В последующем сальмонеллы обильно выделяются с содержимым кишечника, из родовых путей (в период и после аборта) и с носовой слизью (пневмонии). В этот период происходит значительное возрастание антител и резко активизируется система РЭС.
В результате размножения сальмонелл происходит накопление огромной биомассы и при распаде бактерий высвобождаются эндотоксины. Последние вызывают целый комплекс воспалительных, дистрофических, иекробиотнческих и грануломатозных изменений в тканях органов, множественные кровоизлияния в них, под серозным покровом и в слизистых оболочках кишечника и мочевого пузыря.
После клинического выздоровления животные в течение нескольких недель и месяцев могут оставаться сальм онеллоносителями.
При сальмонеллезах птиц развиваются сепсис, катаральный энтерит, дистрофические изменения в печени, яичниках.
Антигенная структура разработана Кауфманом и Уайтом (табл. 8).
Т56
У сальмонелл (кроме S. gallinarum ) два основных антигенных комплекса: О-антиген (соматический) термостабильный; Н-антиген (жгутиковый) термолабильный, белковой природы (см. рис. 64).
Детерминантная группа О-антигена (способность вступать в реакцию) принадлежит сахарам. Серологическая специфичность и иммунологическая активность определяется полисахаридами полного антигена.
Частью соматического антигена являются полисахариды R-остова, присутствующие как у R-, так и у S-форм. Чтобы избежать образования шероховатых форм, рекомендуют использовать среды для хранения штаммов без углеводов, редкие пересевы и лиофильное высушивание.
Н-антигены (жгутиковые) обладают как специфическими свойствами, характерными для определенного вида и типа (антигены 1-й фазы), так и неспецифическими (антигены 2-й фазы). Если сальмонеллы содержат оба жгутиковых антигена, их называют двухфазными, если один — однофазными. Каждый тип (или вид) сальмонелл может содержать несколько соматических и жгутиковых антигенов.
О- и Н-антигены вызывают образование различных антител, отличающихся по характеру агглютината. О-агглютинация мелкозернистая, клетки соединяются полярными поверхностями, образуя мелкие агрегаты. Н-агглютинация характеризуется образованием хлопьевидного рыхлого агглютината, клетки соединяются своими жгутиками, происходит их полное обездвиживание.
На основании общности соматических антигенов, сальмонеллы объединены в серологические группы, которые обозначены прописными буквами латинского алфавита: А, В, С, D и др. Всего основных серологических групп 13 и одна дополнительная. Дополненная таблица Кауфмана—Уайта (1970) включает 65 серологическую группу, из них 21 группа основных. Внутри группы сальмонеллы дифференцируются на основании особенностей Н-антигенов, при этом 1-я фаза обозначается строчными буквами латинского алфавита (а, в, с, d, еит. д.),2-я фаза — арабскими цифрами или латинскими буквами (1, 2, 5; е, п, х и т. д.).
Для идентификации сальмонелл путем иммунизации кроликов готовят монорецепторные сыворотки к каждому антигену (например, к О-антигенам 4, 5, 7, 9 и т. д. и Н-антигенам i, 1, 2, с, др. и т. д.). На основании изучения антигенных свойств сальмонелл сначала определяют по О-антигену групповую принадлежность микробов (реакция агглютинации на стекле или пробирочным методом), а затем при помощи Н-моно-рецепторных сывороток устанавливают типовую принадлежность. Этен метод позволяет судить о полноценности антигенной структуры и определять антигенные вариации (изменение или утрата какого-либо антигена).
Знание антигенной структуры сальмонелл особенно необходимо при отборе штаммов в процессе изготовления вакцин и конструирования химических вакцинных препаратов.
Установлена антигенная общность сальмонелл с бактериями следующих родов: Escherichia, Citrobacter, Brucella, Listeria, Pasteurella, Aeromonas. Особое значение имеют антигенные связи бруцелл и сальмонелл: сыворотки животных, больных бруцеллезом, реагируют с саль-монеллезными антигенами, что может повлечь диагностические ошибки (за счет общности О-антигена 12).
Иммунитет. Выздоровление связано с развитием иммунитета достаточного напряжения, в основе которого лежат гуморальные и клеточные факторы защиты. Полагают, что при сальмонеллезах иммунитет носит антиинфекционный характер. Наряду с этим, по-видимому, определенное значение имеет и антитоксическая защита. В ответ на антигенное раздражение в организме животных накапливаются агглютинины, преципитины, комплементсвязывающие антитела и бактериолизины. Количество антител постепенно возрастает и достигает максимума
157
через 2—3 недели. Антитела обычно сохраняются в течение нескольких месяцев с постепенным снижением титра. Несмотря на это иммунитет сохраняется, что свидетельствует о существенной перестройке клеточной реактивности.
При сальмонеллезах ярко выражены клеточные реакции в виде резкой активизации фагоцитоза, грануломатозных разращений клеток РЭС с образованием многочисленных узелков в паренхиматозных органах и лимфатических узлах. Следует отметить, что между выраженностью гуморальных факторов и степенью защищенности нет параллелизма (высокие титры антител не всегда свидетельствуют о напряженности иммунитета), в то время как клеточные реакции продуктивного типа в большей степени отображают выраженность иммунитета.
Для формирования стойкого иммунитета необходима определенная степень и продолжительность антигенного воздействия (циркуляция бактерий на больших тканевых поверхностях). По этой причине у животных, леченных антибиотиками в ранней стадии болезни, иммунитет может быть недостаточным. При сальмонеллёзах отмечают довольно длительную фазу нестерильного иммунитета (связанная с персистенцией сальмонелл).
Ведущим антигеном в иммуногенезе считается О-антиген. Н-антиге-ны существенного значения в формировании невосприимчивости не имеют. Иммунный ответ характеризуется образованием иммуноглобулинов IgM и IgG. Предполагается, что иммуноглобулины (антитела) обладают специфическим действием против полисахаридных комплексов клеточной стенки бактерий. Имеются указания о высокой иммуногенной активности поверхностных антигенов сальмонелл (термолабильного L-антигена), которые являются фосфолипопротеидами. Считают также, что нетоксические белки сальмонелл являются носителями про-тёктивных свойств.
При хронической и латентной формах сальмонеллезов иммунологические реакции выражены в различной степени. Бактерионосительство, таким образом, формируется в иммунном организме и является выражением своеобразного сосуществования макро- и микроорганизма. В этой связи большинство исследователей считают, что у носителей угнетены иммунологические функции (бактерицидность крови и фагоцитарная реакция). Вследствие недостаточной активности гуморальных и клеточных факторов защиты элиминация бактерии замедляется, что приводит к длительному носительству.
Диагностика осуществляется на основании клинико-эпизоотологических, патологоанатомических данных, а также результатов бактериологического и серологического исследований.
Бактериологическое исследование. Для прижизненной диагностики исследуют кровь (метод гемокультуры), носовую слизь, истечения из родовых путей и фекалии (метод копрокультуры). Метод гемокультуры лучше применять в период бактериемии (выраженная температурная реакция) и при подостром течении сальмонеллеза (телята, ягнята). С этой целью 5—10 мл крови, взятой из яремной вены, засевается в 5—6 пробирок или 2—3 флакона с МПБ и 10—20 % бычьей желчи или на полужидкий агар. На следующие сутки делают посевы на чашки Петри с плотными дифференциальными средами (Эндо, Плоскирева, Левина или висмут-сульфатный агар).
Посевы носовой слизи и истечений из родовых путей делают в чашки Петри со средой Эндо или Плоскирева. При исследовании фекалий материал берут с помощью стеклянной трубки или ватного тампона и засевают в чашки Петри с дифференциальными средами, а также на среды накопления (селенитовая, Мюллера, Кауфмана).
Для посмертной диагностики в лабораторию направляют свежие трупы животных и абортированные плоды. От трупов крупных живот-158
ных посылают паренхиматозные органы с учетом наибольшей локализации сальмонелл (печень с желчным пузырем и лимфатическими узлами, селезенку, измененные участки легких, почку, брыжеечные лимфатические узлы, трубчатую кость). Исследуемые объекты предварительно микроскопируют (готовят мазки и окрашивают по Граму).
На МПБ, МПА и одну из дифференциальных сред засевают кровь, взятую из сердца, материал из паренхиматозных органов, лимфатических узлов, костного мозга и желтков яичника (птицы). При подозрении на хроническую форму дополнительно высевают материал на одну из сред накопления (селенитовая, Мюллера, Кауфмана, Килиана).
Полученные культуры дифференцируют и идентифицируют на основании культуральных, биохимических и антигенных свойств, при необходимости прибегают к постановке биологической пробы на лабораторных животных (чаще на белых мышах). На среде Эндо сальмонеллы в отличие от эшерихий вырастают бесцветными колониями (не ферментируют лактозу); на висмут-сульфитном агаре (кроме группы С) растут в виде черных колоний с металлическим блеском.
Важное значение придается биохимической характеристике. По биохимическим свойствам можно идентифицировать близкие типы и определять отдельные варианты (биовары) (табл. 9). Культуры, типичные для сальмонелл, не ферментирующие лактозу и сахарозу, не образующие индола, испытывают в реакции агглютинации (на стекле) сначала с поливалентными О-сыворотками серологических групп В, Ci, С2, D и Еь При положительной реакции определяют принадлежность к серологической группе с помощью О-агглютинирующих сывороток соответствующих групп, а затем с монорецепторными Н-сыворотками до типа.
В производстве монорецепторных агглютинирующих сывороток в качестве продуцентов используют в основном кроликов (по разработанным схемам). Полученные сыворотки проверяют на активность (титр антител) и выпускают в жидком или сухом (лиофилинизиро-ванном) состоянии.
Серологическая диагностика используется для поста-
новки диагноза на сальмонеллез при жизни животного, а также для выявления скрытых форм сальмонеллоносительства. С этой целью исследуют сыворотку крови в реакции агглютинации (у кур ставят реакцию кровекапельной агглютинации).
Метод флуоресцирующих антител. Это экспресс-ме-
тод обнаружения сальмонелл, особенно в мясе и патологическом материале, даже с признаками разложения. Из исследуемого материала готовят препараты-отпечатки, фиксируют их метиловым или этиловым спиртом, после чего обрабатывают смесью сальмонеллезных флуоресцирующих сывороток. При обнаружении характерного свечения (зе
леновато-желтое свечение культуры клеток) дополнительно готовят
мазки отпечатки и окрашивают раздельно флуоресцирующими сыворотками, которые брали в смеси.
Фаготипирование сальмонелл. Фаги наделены значи-
тельной специфичностью и могут лизировать сальмонеллы, принадлежа-
щие к определенной группе и типу. Вопрос о фаготипах сальмонелл
изучен еще недостаточно. У S. typhi обнаружено 78 фагов, у S. typhitrui-rium — 13, у S. paratyphi А и В — шесть фаготипов.
С диагностической целью чаще используют групповые и типовые
£аги. При испытании в жидкой среде в две пробирки засевают суточ-
ную культуру сальмонелл; в одну добавляют 3—4 капли фага, вторую оставляют для контроля. В пробирке с фагом через 12—24 ч отмеча
ется значительное просветление, указывающее на лизис бактерий. На плотной среде в чашках равномерно распределяют суточную культуру сальмонелл и затем наносят каплю фага. На следующий день
159
9. Биохимические свойства некоторых сальмонелл
Серотип Г люкоза Арабиноза Ксилоза Маииит Дульцит Инозит Рамиоза Бульон Штерна Трегалоза Мальтоза Сорбит d-тартрат Желатина <л м X
Группа А
S, paratyphi А
Группа В
S. schottmuelleri *
S. typhimurium
S. abortivoequina**
S. abortus-ovis
S. abortus-bovis
S. heldelberg
S. derby
S. Stanley
S. brandenburg
S. essen
Группа Ci
S. hirschfeldii ***
S. cholerae-suis
S. typhi-suis
S. braenderup
S. thompson
S. infantis
Группа C2
S. muenchen
S. newport
S. bovismorbificans
Группа D
S. typhi
S. enteriditis
S. dublin
S. rostok
S. mo scow
S. sendai
S. gallinarum
S. pullorum
V V V
S. anatum
S. london
Группа Ei
Обозначения: + положительный результат: — отрицательный результат; X — поздннй и непостоянный положительный или отрицательный; v—различные биохимические типы, положительный или отрицательный результат.
По Кауфману: * S. paratyphi В; S. abortns-equi; ♦*♦ S. paratyphi С.
ч.
160
на месте внесения фага роста не будет или образуются стерильные пятна (колонии фага).
Нужно иметь в виду, что у сальмонелл широко распространена лизогения (фагоносительство), способствующая возникновению «атипнч-ности» и нечувствительности к фагам*.
Возбудители сальмонеллеза (паратифа) телят. Основным возбудителем является S. dublin, а также S. enteritidis, S. ros-tok и S. typhimurium. Последний вид наряду с S. dublin все обнаруживают более часто. Встречаются и другие серотипы сальмонелл.
Возбудители сальмонеллеза телят представляют большую опасность для человека. При употреблении мяса больных животных и контаминированных молочных продуктов могут возникать токсикоинфек-
ции.
Основные источники возбудителя болезни—больные животные, а также реконвалесценты и клинически здоровые носители. Очень важным источником массового инфицирования телят может быть молоко или обрат, постоявшие в летнее время несколько часов. За это время сальмонеллы, попадая в молоко с фекалиями, интенсивно размножаются и при выпойке могут вызывать массовую болезнь среди телят, даже привитых против паратифа (И. И. Архангельский).
Из организма больных и носителей сальмонеллы выделяются во внешнюю среду с фекалиями и носовой слизью (особенно обильно от больных телят), с родовыми истечениями, заражая помещения, корма, воду, предметы ухода и одежду.
Патогенность. При парентеральном и энтеральном заражении телят воспроизводится типичная картина болезни. Подкожное заражение 1—Р/г-месячных телят в дозе 2 млрд. м.т. и энтеральное в дозе 5—10 мл суточной бульонной культуры S. dublin ведет к смертельному заболеванию (септическая форма). Меньшие дозы вызывают переболе-вание различной тяжести.
При внутривенном заражении смерть телят наступает в течение трех суток. При энтеральном заражении телят через 15мин сальмонелл обнаруживают в периферической крови, через 18 ч — в паренхиматозных органах, а спустя четверо суток в фекалиях.
К возбудителям сальмонеллеза телят очень чувствительны белые мыши: при подкожном, внутрибрюшинном (1—10 тыс. м. т.) и энтеральном (100 тыс.— 1 млн. м. т.) заражении наступает заболевание со смертельным исходом в течение 3—10 суток.
Иммунитет. После выздоровления у телят создается довольно напряженный иммунитет и такие животные, находясь в контакте с больными, повторно не заболевают. При заражении морских свинок и телят сублетальными (несмертельными) дозами животные легко пере-болевают. Последующее заражение (спустя 2—4 недели и более) сопровождается кратковременным, сравнительно легким переболеванием. В ответ на заражение у животных накапливаются антитела в высоких титрах, усиливается фагоцитарная реакция, в тканях органов активизируется пролиферация клеток РЭС (Б. А. Матвиенко).
При естественной инфекции многими исследователями отмечается формирование у телят хронического сальмонеллоносительства с преимущественной локализацией бактерий в желчном пузыре, в желчных протоках и длительное выделение возбудителя с фекалиями.
Диагностика. Основывается на клиннко-эпизоотологических данных (возраст животных, картина болезни, неблагополучие хозяйства, сезонность и т. д.), патологоанатомическом вскрытии, а также результатах бактериологических и серологических исследований.
* Для обнаружения сальмонелл в различных субстратах можно применять реакцию нарастания титра фага: при контакте со специфическим микробом происходит размножение фага и увеличение количества фаговых корпускул.
J3—Ветеринарная микробиология
161
Бактериологическая диагностика прижизненная. Метод гемокультуры наиболее пригоден в ранних стадиях болезни (в первые 1—5 суток), в период бактериемии, когда из крови больного животного легко выделить возбудителя. При подостром и хроническом течении от телят с симптомами пневмонии в большинстве случаев удается выделить сальмонелл из носовой слизи (среды Плоскирева, Эндо и др.). Путем дифференциации культур монорецепторными сыворотками диагноз на сальмонеллез можно поставить в течение 2—3 суток. Для ускоренной диагностики рекомендуется метод флуоресцирующих антител, что позволяет по характерному свечению обнаружить сальмонелл в мазках-отпечатках. Таким же образом получают культуры из влагалищной слизи (особенно после аборта), препараты окрашивают люминесцирующими сыворотками.
В начальной и более поздней стадии болезни для диагностики сальмонеллеза телят заслуживает метод копрокультуры (посевы фекалий на дифференциальные питательные среды). Неточные результаты этого метода зависят от периодичности и не всегда достаточной об-семененности фекалий сальмонеллами.
Серологический метод (исследование сыворотки крови в РА) рекомендуют при хроническом сальмонеллезе. Титр агглютининов 1:200 и выше свидетельствует о положительной реакции (антигеном служат убитые культуры сальмонелл). Положительные реакции от начала болезни выявляют на 7—10-е или на 15—30-е сутки. У некоторых больных титры агглютининов могут быть 1:1600—1:3200 и выше. Лучшие результаты получают при повторном исследовании сыворотки крови: повышение титра агглютининов указывает на большую достоверность диагноза.
Посмертная диагностика. Лучшим материалом исследования служит свежий труп. Вполне пригодны также кусочки паренхиматозных органов (печень с желчным пузырем, селезенка, пораженные участки легких), лимфатические узлы и трубчатая кость. В зимний период можно доставлять материал в замороженном виде. В летнее время допускается материал консервировать 30 % глицерина (в жаркое время он предотвращает гнилостные процессы только несколько дней). Посевы делают на обычные (МПБ, МПА) и одну из дифференциальных питательных сред (Эндо, Плоскирева и др.). Если животных лечили антибиотиками, то последние часто ингибируют (задерживают) рост культуры.
Полученные культуры (прижизненная и посмертная диагностика) микроскопируют, изучают их биохимические свойства и агглютинабильность сальмонеллезными сыворотками. При необходимости ставят биопробу на лабораторных животных (лучше на белых мышах) и проводят фаготипирование. На основании этого определяют тип принадлежности сальмонелл.
Биопрепараты. В СССР опыты по вакцинации гретыми и фенолизированными бульонными культурами проведены П. Н. Тихоновым (1931). С. Н. Вышелесский с сотр. (1932) приготовили бульонную фор-молвакцину, а затем Н. А. Михин (1932) агаровую формолвакцину. В последующем убитые вакцины совершенствовались путем использования адъювантов и изготовления препаратов из нескольких наиболее часто встречающихся серотипов (поливалентная вакцина).
К достоинству убитых вакцин можно отнести их безопасность для животных и продуктов их убоя. В то же время многолетний отечественный и зарубежный опыт свидетельствует о слабой иммуногенной активности убитых вакцин: иммунитет создается недостаточного напряжения и длительности. Слабая эффективность убитых вакцин объясняется неполноценностью антигена (частичная деградация в процессе 162
воздействия химическими веществами) и недостаточностью антигенно
го раздражения.
Имеются доказательства, что колостральный (лат. colostrum—молозиво) иммунитет в последующем неблагоприятно отражается на вакцинации новорожденных телят (антитела, полученные с молозивом и молоком, тормозят иммунологический ответ).
О несовершенстве убитых вакцин свидетельствуют необходимость многократных прививок (дважды коровы и трижды телята) и низкий индекс иммуногенности (соотношение иммунизирующей дозы в общей сложности 20 млрд. м. т. и заражающей 2 млрд .м. т., то есть 10: 1). Убитые вакцины в комплексе с другими мероприятиями не всегда обеспечивают ликвидацию сальмонеллеза телят.
Учитывая недостаточную эффективность убитых вакцин, в ряде стран разработаны и успешно апробируются живые вакцины из аттенуированных штаммов сальмонелл. Аттенуированные штаммы отличаются пониженной способностью размножаться в организме животных, большей чувствительностью к фагоцитозу и неспособностью к размножению внутри лейкоцитов.
Фагопрофилактика апробирована в нашей стране и за рубежом. Новорожденным телятам в первый день жизни назначают энтерально 30—50 мл фага, предварительно за полчаса до этого желательно животному дать 20—25 мл 5%-кого раствора соды, а можно вообще фаг выпаивать натощак. Дачу фага необходимо повторять через каждые 5—7 суток в течение двух месяцев. И. И. Архангельский рекомендует комбинировать фагирование с вакцинацией.
Поливалентную сыворотку против паратифа телят и других животных или бивалентную сыворотку против паратифа и колибактериоза телят получают путем гипериммунизации волов (в нарастающих дозах по разработанной схеме). Активность сыворотки проверяют на лабораторных животных. С профилактической целью сыворотку вводят внутримышечно или подкожно в дозах 10—30 мл; с лечебной (в начале болезни)—40—80 мл — подкожно, внутримышечно, иногда внутривенно. При подостром и хроническом течении сыворотка малоэффективна.
Для лечения сальмонеллеза телят применяют антибиотики широкого спектра действия, а также в сочетании с сульфаниламидными и нитрофурановыми препаратами. Чтобы избежать сальмонеллоно-сительство, антибиотики рекомендуют назначать сравнительно длительное время, во всяком случае не менее 5—7 суток после исчезновения клинических симптомов болезни. Лучшие результаты получены от применения хлоромицетина или его синтетического аналога левомицетина— 10—20 мг/кг (400—600 мг на теленка). Эффективны также тетрациклины—10—20 мг/кг (300—600 мг на теленка) и неомицин — 20 тыс. ед/кг. В связи с тем, что пневмонии сальмонеллезной этиологии осложняются другой микрофлорой, целесообразно указанные выше антибиотики сочетать с внутримышечной инъекцией бициллина или с ампициллином (10—20 тыс. ед/кг), а также дачей сульфаниламидных
препаратов.
По данным ряда исследователей, применение нитрофурановых и сульфаниламидных препаратов приводило к выздоровлению телят, но они оставались носителями инфекции.
Возбудители сальмонеллеза
(паратифа)
свиней:
в подавляющем большинстве является S. cholerae-suis (серологическая
группа С, антигенная формула 0—6,7; Н — с, 1,2), реже близкий тип S. typhisuis (0—6, 7; Н—1,5). Довольно часто обнаруживают S. typhimu-rium (0—1, 4, 5, 12; Н—i, 1, 2), S. dublin (0—1, 9, 12; H—др), а также сальмонеллы серологической группы В (S. Stanley, S. derby, S. branden-burg, S. heidelberg) и др.
13*
163
Наиболее восприимчивый возраст поросят от 1,5 до 4 месяцев, с преобладанием в предотъемный и послеотъемный период.
Патогенность. При энтеральном заражении поросят болезнь воспроизводится непостоянно и больше протекает в субклинической форме. При внутримышечном заражении в больших дозах удается вызвать заболевание. Типичную картину острого паратифа получают при внутривенном заражении, причем патоморфологические изменения во многом напоминают чуму свиней.
Сальмонеллез, вызванный S. typhimurium, протекает острее и поражает больше молодых поросят (Gibson Е., 1971).
Сальмонеллы часто осложняют чуму свиней. Дифтеритические и некротические процессы в кишечнике при чуме свиней являются результатом секундарной инфекции, вызванной сальмонеллами. S. cholerae-suis иногда обнаруживают у коров при метритах и энтеритах, часто у серебристо-черных лисиц и у собак.
Патогенез. При экзогенном заражении инкубационный период может быть от трех суток до месица, при эндогенном же инфицировании (сальмонеллоносительстве) учету он ие поддается. В этих случаях активизация сальмонелл происходит в результате стрессовых факторов, после противорожистых и противочумных прививок. Таким образом, можно отметить, что болезнь в подавляющем большинстве возникает вследствие предшествовавшего сальмонеллоносительства. Поросята заражаются более часто через пищеварительный канал (корм, подстилка, вода). Заражение возможно аэрогенное (контакты животных) и внутриутробное (мертворождение и аборты). Болезнь может протекать в острой, подострой и хронической форме.
При острой форме сальмонеллы размножаются в кишечнике, затем проникают в лимфатические образования кишечника, в общий лимфо- и кровоток, обусловливая септицемию. По желчным протокам сальмонеллы вновь попадают в кишечник и выделяются с калом, а при поражении почек — с мочой. Существенным отличием сальмонеллеза поросят считается развитие воспалительно-некротических процессов и дифтероидных поражений толстого отдела кишечника. При подостром и хроническом течении у поросят развивается пневмония, диффузный некроз слизистой толстого кишечника и истощение (заморыши).
Иммунитет. Поросята, переболевшие сальмонеллезом, приобретают иммунитет значительного напряжения. При экспериментальном инфицировании S. cholerae-suis также возникает напряженный иммунитет, животные противостоят последующему заражению смертельной дозой. После естественного переболевания иммунитет, по-видимому, чаще носит инфекционный характер, так как сальмонеллы у поросят сохраняются в желудочно-кишечном тракте, в желчном пузыре и желчных ходах, в лимфатических образованиях и лимфатических узлах кишечника. Можно предположить, что при значительных поражениях кишечника болезнь не завершается, а принимает субклиническое течение, формируется постоянное сальмонеллоносительстве.
Диагностика проводится, как и при сальмонеллезе телят. Наряду с посмертной диагностикой следует больше внимания уделять прижизненной бактериологической (методы гемокультуры, копрокультуры, люминесцентно-микроскопическое обнаружение возбудителя в фекалиях) и серологической диагностике (исследование сыворотки крови от больных поросят и свиноматок в РА) *.
Биопрепараты. М. М. Иванов (1948) разработал и внедрил в производство комплексную формолвакцину, состоящую из анатоксинов (культура 8—10-суточного роста) и бактерийной массы (2-суточная культура) S. cholerae-suis, S. dublin и S. typhimurium. В качестве депонента используется хлористый кальций. Безвредность вакцины проверяется на белых мышах и голубях (внутрибрюшинное введение), активность на голубях или морских свинках. Поросят вакцинируют трехкратно начиная с 15-дневного возраста с интервалом в 7—10 суток.
* По данным Sweeney (1971), при хроническом и подостром течении бактериологические исследования часто дают отрицательные результаты. Также редко возбудитель выделяется из фекалий поросят. При серологическом исследовании титр антител не превышает уровень у здоровых животных.
164
А. Г. Малявиным (1955) предложена поливалентная вакцина против сальмонеллеза, пастереллеза и диплококковой септицемии поросят.
Кроме прививок поросят моно- и поливалентными вакцинами, в неблагополучных хозяйствах рекомендуется свиноматок прививать во второй половине супоросности трехкратно с интервалом в 8—10 суток (5, 10 и 15 мл).
Как свидетельствует многолетний опыт, инактивированные вакцины против сальмонеллеза свиней недостаточно эффективны.
В ряде стран внедрены живые вакцины из аттенуированных штаммов S. cholerae-suis и их производство осуществляется в промышленном масштабе (Англия, СССР, США). В СССР применяется сухая живая вакцина против сальмонеллеза свиней из штамма S. cholerae-suis ТС-177 (Б. А. Матвиенко). Данный штамм получен путем последовательного пассирования на средах с возрастающими концентрациями химического мутагена (см. рис. 65).
Живая вакцина против сальмонеллеза свиней представляет лиофилизированную культуру, выращенную на плотной или жидкой питательной среде (в реакторе), в 1 ампуле или флаконе содержится 50 млрд. м. т. Остаточную вирулентность контролируют на белых мышах (подкожное заражение в дозе 100 млн. м. т.) и морских свинках (подкожно 4 млрд. м. т.). Активность проверяют на морских свинках (вакцинация в дозе 300 млн. м. т. и последующее заражение через 16 — 18 суток смертельной дозой S. cholerae-suis).
Учитывая, что сальмонеллез свиней может вызываться возбудителями из различных серологических групп (главным образом В и С), в производственных условиях апробирована живая ассоциированная вакцина из аттенуированных штаммов S. cholerae-suis (ТС-177) и S. typhi-murium (штамм Тр Вг-1), а также рекомендуется комплексная иммунизация живыми вакцинами против сальмонеллеза (указанными штаммами), чумы (АСВ) и рожи свиней (ВР2) (Б. А. Матвиенко, М. Я* Ярцев, 1972) (см. рис. 66).
Иммунную сыворотку получают от волов, которых подвергают гипериммунизации формолквасцовым антигеном. Активность сыворотки проверяют на голубях (голубям вводят 1 мл сыворотки, а через сутки заражают смертельной дозой S. cholerae-suis). Сыворотку рекомендуют применять с профилактической и лечебной (в начале болезни) целями. Профилактическая доза поросятам-сосунам 10—15 мл, отъемышам 15 мл, лечебная — в 2—3 раза больше. Однако, по данным многих исследователей и практических специалистов, эффективность данной сы
воротки все еще недостаточна.
Антибиотики в качестве лечебно-профилактических средств более эффективны по сравнению с иммунными сыворотками и фагами. Лучшие результаты получают от неомицина (10 — 20 тыс. ед/кг), тетрациклинов (очищенных или кормовых 15 — 20 мг/кг), левомицетина (30 — 40 мг на животное), а также при сочетании их с нитрофурановьь ми и сульфамидными препаратами. Несмотря на клиническое выздоровление, поросята после лечения чаще, чем другие животные, могут быть сальмонеллоносителями.
Возбудители
сальмонеллеза
овец.
(п а р ати
Сальмонеллез овец вызывает S. abortus-ovis (серологическая группа В, антигенная формула 0 — 4, 12; Н — с, 1, 6), иногда S. typhimurium. Описаны сальмонеллезы овец, вызванные S. dublin, а также S. bovismorbifi-
cans (Новая Зеландия).
Сальмонеллез овец довольно распространенная болезнь во многих странах, характеризуется абортами во второй половине беременности и рождением мертвых плодов. Болезнь может принимать массовое распространение и часто сопровождается гибелью овцематок от послеродового сепсиса. У новорожденных ягнят болезнь протекает в виде бакте-
165
риемии и энтерита, а в более позднем возрасте развиваются пневмония
и артриты.
Морфология. S. abortus-ovis палочка с закругленными концами, по
сравнению с другими сальмонеллами несколько меньшего размера,; длина ее 0,8 — 3 мкм, ширина 0,4—0,6 мкм. На обычных средах растет до* вольно скудно, формируя мелкие (с булавочную головку) просвечивающие колонии с приподнятым центром. При посеве из патологического
материала рост диффузный, едва заметный, в виде нежного наложения.
В затемненном поле зрения просматривается радиальная исчерчен-ность колоний. На бульонах (Хоттингера и Мартена с сывороткой крови) S. abortus-ovis растет довольно пышно, бактериальные клетки более крупные и существенно не отличаются от других сальмонелл. На бульоне образует умеренное помутнение и незначительный осадок. На полужидком агаре рост в виде кольца у поверхности среды. Ферментирует галактозу, глюкозу, мальтозу, маннит, дульцит и сорбит. Сахарозу, лактозу, арабинозу, инозит, рамнозу, раффинозу и глицерин не разлагает. Сероводород, как правило, не образует или дает слабую реакцию. Патогенность выражена слабо. При энтеральном и интраназальном
заражении овец вызвать заболевание в большинстве случаев не удается. Внутримышечное заражение приводит к гибели ягнят и переболеванию овец. Суягные овцы абортируют. Внутривенное и внутрибрюшинное за
ражение ягнят и овец вызывает картину острого токсикоза, септицемии и гибель животных в течение 3 — 7 суток.
Из лабораторных животных большая чувствительность отмечается у белых мышей (кроме энтерального заражения).
Патогенез. Достаточно не изучен. Инкубационный период у овец (также и у коз) учету не поддается. Можно лишь отметить, что животные инфицируются через пищеварительный канал (с кормом, водой, на пастбищах). Особенно интенсивное заражение происходит в период массовых абортов. У зараженных животных болезнь клинически не проявляется. В этом периоде сальмонеллы могут локализоваться в желчном пузыре и протоках, в лимфатических узлах и кишечнике. У беременных животных лимфогенным и, возможно, гематогенным путем сальмонеллы проникают в матку, плодовые оболочки и ткани плода. Здесь они находят благоприятные условия для размножения. В последующем развиваются воспалительные процессы (главным образом аль-теративно-некротнческие) в матке, плодовых оболочках, сепсис и гибель плода, что приводит к тяжелому токсикозу и изгнанию плода (аборт). В послеродовой период часто развивается плацентит, эндометрит, вызываемые как сальмонеллами, так и сопутствующей микрофлорой, что ведет к развитию сепсиса и гибели овцематок.
Ягнята заражаются также через пищеварительный канал (главный источник овцематки), возможно и внутриутробно, а в более старшем возрасте аэрогенио при контакте с больными.
Иммунитет. После естественного переболевания у овец создается напряженный иммунитет и такие животные за небольшим исключением повторно не заболевают. У абортировавших овцематок в сыворотке крови накапливаются антитела (агглютинины и комплементсвязывающие вещества) в значительных титрах: в течение первых двух недель максимально 1 : 1600 — 6400, а через три месяца снижаются до 1 :50. У части
животных агглютинины в диагностических титрах могут сохраняться шесть месяцев и более. Довольно быстрое угасание, а также непостоянно выраженные иммунологические (серологические) реакции являют
ся препятствием ретроспективной диагностики сальмонеллеза овец. Остаются неясными вопросы напряженности иммунитета у сальмонел-лоносителей и частоты формирования носительства.
Переболевшие ягнята тоже становятся иммунными к сальмонел-
лезу, но только неизвестно, на какой период.
При сальмонеллезе овец довольно выражены клеточные реакции защиты — лейкоцитарная реакция, пролиферация элементов РЭС. На
ряду с этим отмечается значительная выраженность гуморальных
ак-
торов защиты — накопление антител в значительных титрах. Резко по*
166
вышается антитоксическая устойчивость. Последняя демонстрируется в опытах на морских свннках: предварительное субннфицирование (или иммунизация живой вакциной) защищает морских свинок от внутрибрюшинного заражения токсической культурой S. abortus-ovis, в то время как контрольные животные погибают от токсикоза в течение 12 — 18 ч (Б. А. Матвиенко).
Диагностика. Прижизненная диагностика. Применяют реакцию агглютинации. Кровь от овец лучше брать на 8—12-е сутки после аборта (высокие титры антител). Положительная реакция считается в титре 1 : 100 и выше. Этот же метод можно использовать для диагностики сальмонеллеза ягнят (2 — 7-месячного возраста).
Заслуживает большого внимания метод гемокультуры. Для получения первичных культур используют полужидкие среды (ПЖА), а также среды с добавлением сыворотки крови животных (жидкие н плот-
ные). Через 24 — 48 ч первичные культуры рассеиваются на плотные среды в чашках Петри. Характерные колонии отсевают, полученные
культуры соответствующим образом изучают.
В отдельных случаях проводят бактериологическое исследование екалий (непостоянные результаты) и влагалищной слизи.
Посмертная диагностика. В лабораторию направляют
абортированный плод (при отсутствии плодовые оболочки), органы н лимфатические узлы от павших овец и трупы павших ягнят.
Из содержимого сычуга, крови (сердце), паренхиматозных органов, лимфатических узлов и костного мозга абортированного плода обильно высевается S. abortus-ovis. Часто культура выделяется из головного
мозга. При получении первичных культур можно использовать обычные (нежный рост) или полужидкие среды (более обильный рост). В дальнейшем изучают морфологические (с обязательной окраской по Граму}, культурально-биохимические свойства и агглютинабильность с монорецепторными сыворотками. Вирулентность проверяют на белых мышах путем внутрибрюшинного заражения 20-часовыми культурами, выращенными на полужидком агаре или сывороточном бульоне в дозах 0,1 и 0,3 мл.
Так же исследуют материал (кроме содержимого желудка) от
павших овец и ягнят.
Биопрепараты. В 1950 г. Н. И. Николаенко и А. Н. Нефедьев разработали и предложили для практического применения анатоксинвак-цииу (содержит анатоксин и микробные тела), а затем более усовершенствованную— концентрированную формолквасцовую вакцину против паратифа ягнят и овец. Указанной вакциной овец прививают трехкратно: перед случкой (5 мл), второй раз за 30 — 35 суток до окота (5 — 8 мл) и третий — за 15 — 20 суток до окота (8— 10 мл). Ягнят вакцинируют с 2-дневного возраста с интервалом в 5 — 7 суток (2 — 3 мл и 4 — 5 мл).
Указанная вакцина недостаточно эффективна, а трехкратная вакцинация овец, из них дважды во второй половине беременности (за 30 и 15 суток до окота), нежелательна. В связи с этим проводятся исследования по получению более совершенных вакцинных препаратов, например формолтиомерсановоквасцовой вакцины. По данным М. М. Агабабяна, тиомерсан (мертиолат) не повреждает бактериальные протеины, стабилизирует свойства препарата и уменьшает реактивность. Эта вакцина более эффективна по сравнению с формолвакцнной и предупреждает аборты сальмонеллезной этиологии.
Иммунная сыворотка против сальмонеллеза овец получена А. Н. Не-федьевым (1953) при иммунизации овец и волов, а затем М. Н. Никольским (1956). Ее рекомендуют применять с профилактической целью (15— 20 мл для ягнят и 30 — 40 мл для овец) и в начальной стадии болезни (лечебная доза удваивается) . А. Г. Малявиным (1962) изготовле-
167
на бивалентная сыворотка против паратифа и колибактериоза ягнят. По результатам опытов сыворотки обладают лечебными и профилактическими свойствами.
М. М. Агабабяном (1974) получена более активная сыворотка от овец, гиперим-мунизированных комбинированным антигеном (формолтиомерсановоквасцовой вакциной и эндотоксином). Сыворотка обладает антибактериальными и антитоксическими свойствами, защищает 90 % мышей от заражения вирулентной культурой и 100 % мышей, получавших смертельную дозу эндотоксина. Она весьма эффективна также в опытах на ягнятах.
Антибиотикотерапия общепризнана. Более эффективными препаратами при сальмонеллезе ягнят и овец являются тетрациклины (5 30 мг/кг), неомицины (10—20 тыс. ЕД/кг), левомицетин (10—40 мг/кг), нитрофураны в сочетании с антибиотиками. Высокий эффект достигается при одновременном внутримышечном введении гамма-глобулина и неомицина. Хорошие результаты получены от применения пролонгирующих препаратов—дибиомицина и дитетрациклина (30 — 50 тыс. ЕД/кг), которые создают лечебную концентрацию в крови в течение нескольких суток и особенно пригодны для лечения ягнят старшего возраста (пневмонии сальмонеллезной и смешанной этиологии). Большинство исследователей считают, что прекратить аборты с помощью антибиотиков не удается.
✓ Возбудители сальмонеллеза лошадей (паратифозного аборта кобыл). Болезнь вызывается преимущественно S. abortivoequina (S. abortus-equi), серологическая группа В, антигенная формула 0— 4,12; Н-епх (2-я фаза); иногда S. typhimurium (та же серологическая группа), редко S. dublin (серологическая группа D).
Сальмонеллез — распространенная болезнь жеребых кобыл, характеризуется преждевременными родами кобыл (аборты) или рождением нежизнеспособного плода. Нередко аборты у кобыл принимают массовый характер. У жеребят болезнь протекает в виде бактериемии и общего токсикоза, энтерита (в раннем возрасте), хронического полиартрита и истощения ( в 3 — 6-месячном и старшем возрасте), приводящих к гибели животных. Возбудитель открыт в 1893 г. Smith и Kil-borne в Америке и в 1901 г. Д. В. Поляковым в России.
S. abortus-equi легко культивируется на обычных питательных средах: на МПБ образует равномерное помутнение со слизистым осадком, на МПА — серовато-голубоватые опалесцирующие колонии, вокруг которых иногда образуются периферические валики. При хранении культуры довольно быстро диссоциируют в R-формы. S. abortus-equi не изменяет инозит, глицерино-фуксиновый бульон, раффинозу, салицин; сероводорода, как правило, не образует.
Патогенность. В естественных условиях восприимчивы только однокопытные животные — лошади (отмечены случаи болезни у ослов). Искусственно удается заразить беременных кобыл и вызвать аборт при введении культуры S. abortus-equi в матку и внутривенно. Из лабораторных животных более чувствительны белые мыши (энтеральное и парентеральное заражение); морских свинок удается заразить со смертельным исходом внутрибрюшинно и непостоянно подкожно.
Патогенез изучен мало. Инкубационный период по данным экспериментального заражения кобыл длится несколько недель и более. Животные заражаются через пищеварительный канал, особенно в период абортов. У зараженных кобыл клинически выраженных симптомов болезни нет, сальмонеллы локализуются в желчных протоках и кишечнике, периодически выделяются с фекалиями.
У беременных кобыл, вероятно, лимфогематогенным путем сальмонеллы проникают в матку, плодовые оболочки, ткани плода, где интенсивно размножаются и вызывают воспалительные процессы, гибель плода, сопровождающиеся в большинстве случаев абортом.
Жеребята заражаются внутриутробно и вскоре после рождения погибают при явлениях бактериемии и токсикоза. В более поздний период жеребята заражаются через пищеварительный канал, болезнь у них принимает подострое и хроническое те* чение.
168
Иммунитет. У абортировавших кобыл создается повышенная устойчивость к возбудителю и эндотоксину. Повторные аборты встречаются редко. Вместе с тем после аборта кобылы остаются определенное время сальмонеллоносителями и, по-видимому, вслед за нестерильной фазой в последующем развивается достаточно напряженный стерильный иммунитет.
В сыворотке крови абортировавших животных обнаруживают агглютинины и комплементсвязывающие антитела в высоких титрах (1:1600—1:3200 и выше), которые через три месяца после аборта обычно угасают. На основании иммуноморфологических исследований экспериментальной инфекции можно предположить, что в основе иммунитета при сальмонеллезе лошадей лежат гуморальные и клеточные факторы защиты.
Диагностика — бактериологическая и серологическая.
Для бактериологического исследования лучшим материалом служат абортированный плод, а также плодовые оболочки и истечения из родовых путей.
Посевы делают на МПА и МПБ из крови сердца, селезенки, печени, легких, почек, содержимого желудка, лимфатических узлов, костного мозга плода и плодовых оболочек. Часто культуру удается выделить из головного мозга. Из свежего материала обычно легко удается выделить культуру сальмонелл (как правило, обильный рост), которую затем дифференцируют по культурально-биохимическим и антигенным свойствам. При необходимости ставят биопробу на белых мышах (подкожное заражение в дозах 50 и 200 млн. м. т.), а также испытывают чувствительность культуры к фагу. Иногда возбудителя обнаруживают в плодовых оболочках при отсутствии в тканях плода (связано, видимо, с поздним инфицированием или недостаточной генерализацией инфекционного процесса).
Для выявления сальмонеллоиосительства в отдельных случаях исследуют фекалии (посевы на элективные и дифференциальные среды); Более эффективные результаты получают при даче лошадям слабительной соли за 10—20 ч до взятия кала.
При отрицательном бактериологическом результате в материале (особенно плодовая жидкость) рекомендуют исследовать наличие фага: в культуру лабораторного штамма S. abortus-equi вносят фильтрат материала и определяют его литическую активность. Наличие лизиса указывает на присутствие специфического фага.
Е. В. Козловским с сотр. (1974) для экспресс-диагностики сальмо-неллезного аборта кобыл разработан метод флуоресцирующих антител.
Серодиагностика. Как дополнительный метод применяется реакция агглютинации (так же разработана РСК). Кровь для исследования берут у кобыл на 8— 12-е сутки после аборта (в период накопления агглютининов). Титр агглютининов до 1 :400 считается сомнительным, 1:400 и выше — положительным. Недостатком метода считают непостоянство выраженности иммунологических реакций (у части абортировавших кобыл титры агглютининов в пределах нормы). По этой же причине РА не позволяет выявлять сальмонеллоносителей и не имеет прогностического значения.
Биопрепараты до последнего времени в достаточной степени не разработаны.
В качестве средства антибактериального действия рекомендуется норсульфазол: внутривенно в виде 5 %-ного раствора в течение двух суток 2 раза в день из расчета 0,005 г/кг; в последующие дни по 0,0025 г/кг 2 раза в сутки до нормализации температуры. Эффективны также антибиотики. По данным Р. Кулашбековой (1972), S. abortus-equi высокочувствительна к неомицину и левомицетину, чувствительна к тетрациклинам.
169
Возбудител и
сальмонеллеза
Л
пушных
зверей. Сальмонеллез пушных зверей более часто вызывается S. cholerae-suis, S. dublin, S. typhimurium. Это довольно распространенная болезнь серебристо-черных лисиц, песцов, нутрий, реже норок, енотов, соболей и речных бобров. Болезнь протекает в большинстве случаев остро, характеризуется высокой температурой, энтеритом, истощением. У беременных животных аборты, рождение мертвых плодов или нежизнеспособных щенят, которые погибают в первые 10 суток.
Патогенез. Заражение происходит через корм и внутриутробно (плоды и новорожденные щенята). Инкубационный период — 3—20 суток. Искусственное энтеральное заражение массивными дозами не дает результатов и только при нарушении проницаемости слизистой оболочки желудочно-кишечного канала (введение тетрахлорэтилена, четыреххлористого углерода, хеноподиевого масла) удается инфицирование со смертельным исходом (С. Я. Любашенко с сотр.). Предполагается, что и в естественных условиях заражение связано с нарушением проницаемости слизистой желудочно-кишечного канала, развитием воспалительных процессов, что создает условия для проникновения возбудителя, с последующим развитием бактериемии или сепсиса.
Иммунитет. Звери, переболевшие сальмонеллезом, приобретают иммунитет достаточного напряжения. Переболевшие животные в течение
длительного времени остаются сальмонеллоносителями, но длительность нестерильной фазы иммунитета неизвестна. В дальнейшем, по-видимому, развивается стерильный иммунитет (происходит элиминация возбудителя). Вопросы иммунологии при сальмонеллезах промысловых
животных почти не освещены.
Диагностика. Посмертное бактериологическое исследование (трупы, абортированные плоды) проводят по таким же принципам, как и при сальмонеллезах других животных. Для ранней прижизненной диагностики рекомендуют метод гемокультуры: кровь берут из ушной вены и засевают на МПБ, МПА или желчный бульон (С. Я. Любашенко). Полученную культуру дифференцируют соответствующим образом.
Биопрепараты. Для иммунизации серебристо-черных лисиц и песцов предложена сулемовая бивалентная вакцина из штаммов S. cholerae-suis, S. dublin (С. Я. Любашенко, 1938). В дальнейшем рекомендованы усовершенствованные препараты — поливалентная формолтиомер-сановая вакцина, а затем поливалентная вакцина против паратифа и колибактериоза. Плановую вакцинацию молодняка (двукратную) проводят в мае — июне. Самок прививают также двукратно за 25 — 15 суток до покрытия или на 20 — 30-е сутки беременности.
С профилактической целью или в начале болезни используют сыворотку против паратифа телят или поросят. При повторном введении
сыворотки спустя две недели и более проводят десенсибилизацию по Безредке.
Из лечебных препаратов рекомендуют давать ацидофильную закваску, пропионовоацидофильную бульонную культуру (ПАБК).
Возбудитель пуллороза
птиц отнесен к виду
S. gallinarum. Это безжгутиковый вид, относится к серологической группе D, с антигенной формулой 0— 1, 9, 12. Антиген 12 является сложным комплексом, состоит из трех фракций— 12ь 12г, 123.
Пуллороз кур весьма распространенная болезнь во всех странах мира. У цыплят в первые 10 —15 суток болезнь характеризуется ост
рым течением с явлениями сепсиса, энтерита и гибелью в течение не
скольких суток.
S. gallinarium — неподвижная грамотрицательная палочка, ферментирует глюкозу, галактозу, левулёзу, маннит и рамнозу без газообразования, иногда глюкозу с образованием кислоты и газа; ксилозу, арабинозу, сорбит и дульцит ферментирует непостоянно. Так же не? постоянно образует сероводород. Микроб длительное время сохраняет
170
ся в почве (более года), в воде (до 200 суток) и помете (100 суток и более).
Патогенность. К пуллорозу более восприимчивы цыплята в первые дни жизни. К возбудителю чувствительны также индюшата, утята, фазаны, голуби, воробьи и др. Экспериментально легко удается заразить 1м-.3-дневных цыплят, взрослая птица заражению поддается трудно. К возбудителю чувствительны молодые индейки, а из лабораторных животных—белые мыши и морские свинки; голуби и кролики заражаются не всегда.
Патогенез. Заражение кур и цыплят происходит перез пищеварительный канал, а также аэрогенно (вдыхают вместе с высохшим пушком и частицами помета). Кроме того, различают пуллороз конгенитальный, когда цыплята выводятся из инфицированных яиц {трансовариальное заражение).
Во время инкубации возбудитель быстро размножается и эндотоксины вызывают гибель эмбрионов. Зараженные цыплята погибают от сепсиса или медленно выздоравливают. У взрослых птиц возбудитель чаще всего локализуется в желточных фолликулах.
Иммунитет при пуллорозе птиц, по-видимому, носит нестерильный характер. Вместе с тем, судя по эффективности иммунизации убитыми вакцинами, можно предположить о возможности создания стерильного иммунитета.
Диагностика. При бактериологическом исследовании трупов цыплят и взрослых птиц посевы делают из паренхиматозных органов, крови, костного мозга, яичников и нерассосавшегося желтка (цыплята). Выделенную культуру дифференцируют на основании культурально-биохимических и антигенных свойств.
Серодиагностика. Для массового обследования птиц на тиф применяют кровекапельную реакцию агглютинации (ККРА). В качестве антигена используют специально подобранные штаммы S. gallinarum с полноценными антигенными свойствами (0—9,12) и с выраженными парциальными антигенами (122, 123). Лучшие результаты получают при обследовании птицы в период яйцекладки (активизация функции яичников и иммунологического ответа). В выявлении больных большую роль играет соблюдение техники постановки реакции. Чтобы избежать неспецифических реакций, за 6—8 ч до исследования корм давать не рекомендуют. При постановке реакции на предметное стекло предварительно наносят пипеткой 2—3 капли антигена и петлей из неокисля-емой проволоки подмешивают каплю крови, взятую из кончика зубца гребня (уколом иглой, иногда отрезанием кончика зубца). Реакцию учитывают не ранее 45 с при частом покачивании реагентов (лучше в грелке-качалке М. А. Артемичева). При положительной реакции (наличие в крови агглютининов) быстро образуется видимая зернистость; при отсутствии реакции смесь остается гомогенной.
В ряде стран применяют аллергическую диагностику (кожноаллергический метод). В качестве аллергенов используют убитые культуры или полипептидно-полисахаридный комплекс S. gallinarum.
Биопрепараты отработаны недостаточно. По данным 3. Куюмжи (1971), инактивированные вакцины не сообщают иммунитета достаточного напряжения у кур и индеек до 2-месячного возраста. При вакцинации кур в 5-месячном возрасте получены хорошие результаты, позволившие в короткие сроки оздоровить хозяйства.
В Англии применяют убитую и живую вакцины. Живые вакцины готовят из аттенуированных штаммов S. gallinarum R-9 и S-9 (R. F. Gordon, 1959). Птицу вакцинируют не моложе двух месяцев и до начала яйцекладки.
К. А. Петерсон (1968) сообщил, что введение в воздушную камеру на 12-е сутки инкубации формалинизированного антигена и подкожно цыплятам в первые сутки повышает их резистентность к S. gallinarum.
По мнению ряда авторов, профилактически эффективен пуллорный
171
фаг. Применяют внутрь (энтерально) цыплятам и индюшатам утром за 1—2 ч до кормления (в поилках), лучше с 1-го дня жизни в течение десяти суток. Цыплятам и индюшатам фаг дают по 0,5—1 мл, взрослой птице по 2—3 мл. Лечебные дозы удваивают.
С лечебно-профилактической целью применяют антибиотики и нитрофурановые препараты. Однако они не обеспечивают полной ликвидации сальмонеллоносительства. Под влиянием указанных препаратов возможна селекция резистентных штаммов (R-фактор). Важной профилактической мерой сальмонеллеза кур считается прединкубацион-ная обработка яиц (ультрафиолетовое облучение парами формалина, смесью формалина и калия перманганата), а также снижение инфици-
рованности кормов.
Возбудители сальмонеллеза плавающей птицы. Наиболее частым
во до-является
возбудителем
S. typhimurium (серологическая группа В), реже встречаются S. essen, S. anatum, S. london и др.
Сальмонеллез птиц—распространенная, часто энзоотически протекающая болезнь утят и гусят. Болеют также индюшата, цыплята, до
машние голуби и дикие птицы.
Патогенность. Экспериментально удается заразить утят и цыплят в первые дни их жизни. Взрослые утки заражению не поддаются. К возбудителю чувствительны лабораторные животные, в особенности белые
мыши. Культуры, выделенные от павших птенцов, обладают высокой
вирулентностью.
Патогенез. Заражение происходит через пищеварительный канал (корма, вода) и трансовариально (эмбрионы), а также аэрогенно и через слизистую глаза. При трансовариальном заражении наступает гибель эмбрионов и вспышка болезни в первые дни инкубации.
Иммунитет. Взрослые птицы (утки, гуси) обладают естественной устойчивостью к сальмонеллезу. Полагают, что после переболевания у птиц формируется нестерильный иммунитет. Вместе с тем доказана возможность создания иммунитета путем вакцинации уток и гусынь-несушек (трансовариальная передача иммунитета), а также птенцов (утят, гусят, индюшат, голубей).
Диагностика основывается главным образом на бактериологических методах исследования трупов павшей птицы. Посевы делают на обычные и дифференциальные питательные среды из желтка, печени, желчного пузыря и мозга молодых птиц и из измененных фолликулов от взрослой птицы. Полученные культуры дифференцируют.
Для ориентировочной проверки благополучия маточного поголовья (утки, гуси) можно использовать РА. Кровь берут из подкрыльцовой вены и ставят развернутую реакцию в пробирках. Титр агглютининов 1:50 и выше считается положительным. Разрабатываются методы постановки ускоренной реакции с цельной кровью (кровекапельная реакция) .
Биопрепараты. М. Г. Прокофьева и И. Н. Дорошко с положительными результатами испытали кристаллвиолетквасцовую вакцину. А, Г. Малявиным и С. Я. Любашенко предложена поливалентная вакцина против паратифа и колибактериоза. В хозяйствах, стационарно неблагополучных по сальмонеллезу, взрослую племенную птицу рекомендуют вакцинировать двукратно с 7—10-дневным интервалом за 30—45 суток до начала яйцекладки. В этом случае иммунитет передается трансовариально. Молодняк вакцинируют в возрасте 7—10 суток.
Из лечебных препаратов применяют антибиотики и нитрофурановые препараты. Биомицин солянокислый дают с кормом по 15 мг на утенка 2 раза в день, а с профилактической целью в течение 5—6 дней также с кормом биомицин или левомицетин по 5—10 мг на прием. Хо
172
роший результат оказывает фуразолидон—2—5 мг с кормом на прием 2—3 раза в день до прекращения болезни.
Важной профилактической мерой считается прединкубационная обработка яиц путем облучения ультрафиолетом (лампа ПРК-7) и парами формальдегида.
ЕРСИНИИ
ВОЗБУДИТЕЛЬ АНТРОПОЗООНОЗНОЙ ЧУМЫ
Возбудитель антропозоонозной чумы — Yersinia pestis— вызывает острую инфекционную болезнь, характеризующуюся тяжелой интоксикацией, поражением лимфатической системы, тенденцией к септицемии. Чума—природно-очаговая болезнь, возбудитель которой в естественных условиях сохраняется благодаря циркуляции среди грызунов. Здоровых животных заражают переносчики, в первую очередь блохи. Из сельскохозяйственных животных к чуме наиболее восприимчивы верблюды. Они заражаются в периоды интенсивных эпизоотий чумы грызунов и представляют опасный источник заражения людей.
Бактерия чумы была открыта и выделена в чистой культуре в 1894 г.Китазато и Ерсеном во время эпидемии чумы в Гонконге. В честь Ерсеиа бактерия получила родовое название «ерсиния».
Морфология и тинкториальные свойства. Yersinia pestis — полиморфная грамотрицательная палочка размером в длину 1—2 мкм и в ширину 0,3 — 0,5 мкм. Спор и жгутиков не образует. При выращивании на влажных и кислых питательных средах при 37 °C вокруг палочек образуется мукоидная оболочка, которую рассматривают как капсулу. В препаратах из органов и крови ее находят очень редко.
Бактерия чумы окрашивается биполярно всеми анилиновыми красителями, лучше всего синькой Леффлера и по Романовскому—Гимзе. Микробы в форме палочек обнаруживают в мазках из органов и крови животных, погибших от острой формы чумы, при хроническом течении процесса бактерии шарообразные, плохо воспринимают окраску. В мазках из 1—2-суточных бульонных культур возбудитель окрашивается биполярно и располагается в виде коротких и длинных цепочек, а в культурах на пластинке агара в чашке Петри — в виде мелких коротких палочек с плохо выраженной биполярностью; в препаратах из культур с влажного скошенного в пробирках мясо-пептонного агара и особенно из конденсационной жидкости биполярная окраска четкая.
Культивирование. Факультативный анаэроб, хорошо растет на обычных питательных средах при температуре 28—30 °C и pH 7—7,2. Темп роста замедленный, поэтому в питательные среды добавляют различные стимуляторы (кровь, сульфат натрия и др.). На пластинках агара растет в виде блестящих, серовато-белых, прозрачных суховатых колоний с выпуклым мелкозернистым центром и плоскими волнистыми краями, напоминающими кружева. Со временем центр колоний приобретает коричневый оттенок, становится более грубым и менее прозрачным. Колонии, выращенные при 37 °C, маслянистые, легко суспендируются, иногда тянутся за петлей. На скошенном агаре в пробирке образуют сероватый, вязкий, нежный, прозрачный налет. В бульоне отмечают агглютинативный рост с поверхностной нежной пленкой, при малейшем движении падающей на дно в виде сталактитов и образующей рыхлый осадок.
В первичных культурах чаще выделяются типичные шероховатые колонии R-формы, они, как правило, вирулентные. При длительном культивировании возбудителя на искусственных питательных средах вырастают гладкие авирулентные S-формы. Среди них при определенных условиях могут быть и вирулентные клоны. Гладкие формы нестой-
173
ки и при пересевах очень быстро образуют шероховатые и переходные формы. Таким образом, микробные популяции природных и музейных штаммов возбудителя чумы в генетическом отношении неоднородны.
Биохимические свойства. Бактерия чумы обладает определенной ферментативной активностью. Она разлагает глюкозу, арабинозу, леву-лёзу, мальтозу и маннит без газа. Лактозу и сахарозу обычно не сбраживает, молоко ие свертывает, гемолитическая активность непостоянна. Может выделять сероводород, индол не продуцирует. лМочевину не разлагает, метиленовой синий не редуцирует, восстанавливает нитраты до нитритов.
По биохимическим признакам все штаммы возбудителя чумы делят на две эколого-географические формы—способные и неспособные ферментировать глицерин. Первые выделяют преимущественно на территории Евразии («континентальные» штаммы), вторые в тропических странах («океанические» штаммы).
Устойчивость. Бактерия чумы малоустойчива к действию физических и химических факторов. Вне организма погибает быстро. Низкие температуры переносит хорошо (при—22°C сохраняется четыре месяца). При кипячении гибнет через 1 мин, сухой жар при температуре 100 9С убивает микроб через 20 мин. Чувствителен к дезинфектантам: 3%-иый раствор лизола убивает через 1,5 мин, 3 %-ный раствор карболовой кислоты — 5—10 мии, 70°-ный спирт — 3—5 мин.
Патогенность. Вирулентность различных штаммов возбудителя чумы неодинакова. Это относится и к штаммам, изолированным от животных и людей. Бактерия чумы выделена более чем от 160 видов грызунов. Этот микроб патогенен для верблюдов, ослов, кошек, шакалов, лисиц, хорьков и ласок, которые могут заразиться в естественных условиях и заболеть. Восприимчивы обезьяны и люди. В эксперименте удается заразить белых мышей, крыс, морских свинок, кроликов, сурков, песчанок, ондатр, водяных крыс и др. Морские свинки и белые мыши проявляют значительную инфекционную чувствительность к чуме и поэтому их используют для биопробы. Возбудитель чумы вырабатывает токсические вещества типа эндо- и экзотоксинов; в составе экзотоксина обнаружены ферменты патогенности фибринолизин и гиалуронидаза.
Антигенная структура. У этого микроба выделено около десяти антигенов. Важнейшими из них являются оболочечный или капсульный К (А1) термолабильный белок и О-аитиген соматический термостабильный полисахарид. Оба антигена иммуногенны. У бактерий вирулентных штаммов субстратом вирулентности является антигенная система VW. Антиген V — белок клеточной стенки, W — антиген липопротеин, выделяемый в процессе роста в среду. Комплекс VW угнетает фагоцитоз чумной палочкй. Существует специфический чумной бактериофаг, применяемый для индикации микроба.
Диагностика. Чума—высококонтагиозная инфекция, поэтому выделение и идентификацию ее возбудителя проводят в специальных противочумных лабораториях с соблюдением строгих мер предосторожности. Для данной диагностики применяют микроскопический, бактериологический и серологический методы. Мазки фиксируют погружением полностью в жидкость Никифорова в течение 20 мин, остатки спирта сжигают. Обязательно красят по Граму и на биполярность метиленовым синим по Леффлеру. Микроскопическое исследование имеет лишь ориентировочное значение. Подтверждение диагноза требует выделения чистой культуры. Материал засевают на МПБ, МПА, агар и бульон Хоттингера. Культуру выращивают при температуре 28—30 °C в течение 12—24 ч. Для дифференциации микроба ставят пробу с бактериофагом. Разработана также реакция нарастания титра фага (РНФ), которую используют для постановки ускоренного ориентировочного диагноза 174
чумы. Обязательной является биопроба. Заражают белых мышей или морских свинок. Гибель животных, зараженных подкожно, наступает на 5—7-е сутки. Серологические методы имеют ограниченное применение и в основном для ретроспективной диагностики. Предложены РСК» реакции непрямой гемагглютинации (РИГА), торможения непрямой гемагглютинации (РТНГА), нейтрализации антигена (РНАг) и нейтрализации антител (РНАт). При эпизоотическом обследовании чаще ставят РИГА. Для обнаружения антигена чумного микроба в организме животных рекомендуется реакция иммунодиффузии в геле.
Биопрепараты. Для профилактики чумы человека предложены живые и инактивированные вакцины. Наибольшее распространение получила живая вакцина из оригинального штамма EV. Этой же вакциной можно прививать верблюдов. Бактерия чумы чувствительна к стрептомицину и тетрациклину, поэтому указанными антибиотиками успешно лечат бубонную и легочную чуму.
ВОЗБУДИТЕЛЬ ПСЕВДОТУБЕРКУЛЕЗА V
Псевдотуберкулез—межзональная природно-очаговая инфекционная болезнь, характеризующаяся циклическим течением, интоксикацией, узелковыми поражениями внутренних органов (легкие, печень, селезенка, почки, лимфатические узлы) и общей аллергической реакцией.
Термин «псевдотуберкулез» был предложен в 1883 г. Эбертом на основании внешнего сходства поражений в органах животных с теми, которые известны при туберкулезе. Однако возбудитель псевдотуберкулеза не имеет ничего общего с микобактериями туберкулеза и название
«псевдотуберкулез» сегодня представляет лишь исторический смысл.
Возбудителем болезни является Yersinia pseudotuberculosis из семейства энтеробактерий (Enterobacteriaceae), рода ерсиний (Yersinia).
Морфология и тинкториальные свойства. Yersinia pseudotuberculosis
по морфологии практически неотличима от возбудителя чумы. Это полиморфная бактерия. Встречаются овоидные (кокковидные) формы длиной 0,8—2,0 мкм и шириной 0,4—0,8 мкм, а также палочки с закругленными концами длиной 1,5—6 мкм и шириной 0,4—0,8 мкм. Подвижна, имеет жгутики (5—9), спор не образует, иногда синтезирует капсулу. В мазках из жидких сред и в препаратах из органов погибших животных может располагаться одиночно или цепочками. Микроб окрашивается биполярно всеми анилиновыми красками, грамотрицателен.
Возбудителя псевдотуберкулеза овец по определителю Берги относят к po/ty Corynebacterium группы коринеформных бактерий, имеющих близкое родство с микобактериями и нокардиями.
Возбудитель псевдотуберкулеза овец (Corynebacterium ovis—или С. pseudotuberculosis) — полиморфная, мелкая, неподвижная палочка длиной 1—2,5 мкм и шириной 0,4—0,7 мкм. Жгутиков нет, капсул и спор не образует, грамположительна.
Культуральные и биохимические свойства. Ерсиния псевдотуберкулеза — факультативный анаэроб, хорошо растет на обычных (МПА и МПБ) «голодных» питательных средах при pH 6,0—8,0 (оптимум 7,2—7,4) и температуре 28—30 °C. При пониженных температурах (4— 22 °C) бактерия' приобретает жгутиковый аппарат и становится подвижной, чем и отличается от возбудителя чумы. Может обитать и размножаться в холодных водоемах. На пластинках агара формирует
круглые, выпуклые, прозрачные, серовато-желтые, маслянистые колонии с ровными краями, приподнятым мутноватым центром и плоской периферией с радиальной исчерченностью (S-форма). Нередко дает шероховатые колонии, не отличающиеся от типичных колоний чумного микроба. S-форма более вирулентна. На скошенном агаре вырастает в виде массивного сплошного серовато-желтого прозрачного налета с
175
блестящей волнистой поверхностью и извилистыми краями. В бульоне дает равномерное помутнение, со временем жидкость просветляется и выпадает вязкий осадок, иногда отмечают пристеночный рост.
Ферментирует до кислоты без газа глюкозу, галактозу, мальтозу, рамнозу, глицерин, маннит, не расщепляет лактозу, сахарозу, в первые сутки сбраживает мочевину, индол не образует, выделяет аммиак, иногда сероводород, восстанавливает нитраты в нитриты. Желатину не разжижает.
Возбудитель псевдотуберкулеза овец на агаре растет в виде колоний с зазубренными краями и складчатой или зернистой поверхностью. Через 6—8 дней они достигают величины чечевичного зерна. На свернутой сыворотке в течение суток формирует характерные золотисто-желтые или оранжевые колонии. На бульоне растет без заметного помутнения с образованием зернистого осадка и на поверхности—ломкой пленки.
Патогенность. Ерсиния псевдотуберкулеза обладает значительной экологической вирулентностью, то есть поражает большое число видов животных. В настоящее время спонтанная зараженность ерсиниями отмечена у 60 млекопитающих и 27 видов птиц. В естественных условиях восприимчивы зайцы, дикие кролики, ондатры, серые крысы, домовые мыши, песчанки, выхухоль, куницы, хорьки, куры, индейки, фазаны, голуби, канарейки и др. Экспериментально удается заразить овец и свиней. Лошади, коровы, ослы, козы, собаки и кошки маловосприимчивы. Из лабораторных животных чувствительны белые мыши, кролики, морские свинки. Болеет человек.
Ерсинии псевдотуберкулеза синтезируют экзотоксин и обладают активными эндотоксинами белковой природы. Некоторые штаммы ер-синий в бульонных культурах образуют сильный токсин.
Антигенная структура. Данный микроб имеет сложную антигенную структуру: в его состав входят 5 жгутиковых (Н)— а, в, с, d, е и 12 соматических гладких (О) — 1—12 антигенов, кроме того, имеется один шероховатый антиген, общий для всех ерсиний. Гладкие антигены являются типовыми и соответственно им различают пять серологических типов, однако повсеместно преобладают бактерии первого типа. Шероховатый (R) антиген имеют все ерсинии, он общий и с возбудителем чумы.
Диагностика. Материалом для бактериологического исследования являются трупы грызунов, от погибших животных — лимфатические узлы, кусочки патологически измененных паренхиматозных органов. Для серологического диагноза можно использовать .сыворотку. Схема исследования включает: бактериоскопию, выделение чистых культур и биологический метод.
Из исследуемого материала готовят мазки, которые окрашивают по Граму и Романовскому — Гимзе. Посевы проводят на МПА, МПБ, а также специальные обогащенные среды, дифференциальную среду Серова или агар Хоттингера с генцианвиолетом в концентрации 1 : 200 000. Заражают подкожно белых мышей или лучше морских свинок. Мыши гибнут на 3—7-е, свинки на 3—13-е сутки.
При исследованиях на псевдотуберкулез овец в лабораторию направляют трупы овец или измененные участки паренхиматозных органов и лимфатические узлы. Схема исследований аналогична описанной выше. Возбудитель псевдотуберкулеза овец легко дифференцируется от ерсиний псевдотуберкулеза: это неподвижный, грамположительный, не окрашивающийся биполярно и не ферментирующий глюкозу микроб.
Ерсинию псевдотуберкулеза необходимо отличать от возбудителя зооантропонозной чумы. При этом ориентируются по таким признакам: бактерия чумы неподвижна, лизируется чумным бактериофагом, не растет на среде Бессоновой (голодный агар), не разлагает мочевину, пато-176
генна в R-форме, обладает пестиногенностью; ерсиния псевдотуберкулеза подвижна, лизируется псевдотуберкулезным фагом, растет на среде Бессоновой, разлагает мочевину с образованием щелочи, патогенна в S-форме, пестиногенностью не обладает.
ПАСТЕРЕЛЛЫ
ВОЗБУДИТЕЛЬ ПАСТЕРЕЛЛЕЗА L
Пастерелл впервые выделил Л. Пастер в 1880 г. при изготовлении вакцины против холеры кур. Долгие годы считали, что заболевания млекопитающих и птиц вызываются самостоятельными видами пастерелл. В последующем была доказана перекрестная патогенность и иммуногенность возбудителя пастереллеза и определен единый вид Pas-teurella multocida. Он входит в род Pasteurella, который включает также Р. haemolytica, Р. pneumotropica и Р, ureae. Гемолитическая пас-терелла вызывает пневмонии у рогатого скота и сепсис у ягнят, Р. multocida — пастереллез.
Пастереллез — болезнь многих видов сельскохозяйственных и ди-
ких животных и птиц, характеризуется явлениями септицемии и воспалительно-геморрагическими процессами. Иногда пастереллез протекает
подостро и хронически или в виде вторичной болезни, осложняя вирус-
ные (чума свиней) и бактериальные инфекции.
Морфология. Р. multocida — короткие эллипсоидные палочки дли-
ной 0,3—1,5 мкм и шириной — 0,15 — 0,25 мкм. Располагаются изолированно, иногда парами и реже цепочками. Величина и форма палочек
несколько варьирует в зависимости от происхождения: культуры, выделенные от крупного рогатого скота, однородны, вытянутой формы; от свиней более овальные; от птиц — более округлые.
При культивировании на щелочном агаре и в жидких средах с углеводами пастереллы располагаются в виде цепочек. Пастереллы грам-
отрицательны, неподвижны, в мазках из крови и органов характерна биполярная окраска, иногда с выраженной капсулой (особенно штаммы, выделенные от свиней) с высоким содержанием гиалуроновой кислоты (см. рис. 67, 68).
Культуральные и биохимические свойства. На агаре образуют мелкие прозрачные колонии. По внешнему виду различают три основных типа колоний: слизистые (М) гладкие (S) и шероховатые (R). В лучах видимого света отмечают своеобразную флуоресценцию или радужность (лучи, падающие сбоку), что связано с капсулообразованием. На бульоне равномерное помутнение среды (S-формы), в то время как R-формы в бульоне дают хлопьевидный или зернистый осадок. М-формы пастерелл вызывают помутнение среды и образуют слизистый осадок.
Пастереллы не обладают протеолитическими (желатина) и гемолитическими свойствами. Р. multocida чувствительна к желчным кислотам (лизируется желчью крупного рогатого скота). Вместе с тем желчь овцы не вызывает лизис пастерелл. Оптимальная температура размножения 37 °C при pH 7,2 — 7,4. Могут расти и при комнатной температуре (замедленно).
Пастереллы — аэробы и факультативные анаэробы. Образуют индол и сероводород, реакция Фагес — Проскауэра отрицательная, нитраты восстанавливают до нитритов. Мочевину не разлагают, разрушают
перекись водорода.
Ферментируют сахара, спирты и глюкозиды с образованием только кислоты: глюкозу, сахарозу, фруктозу, сорбит, галактозу, маннозу, как правило, маннит, ксилозу и трегалозу. Не ферментирует лактозу, дульцит, раффинозу, рамнозу, адонит, декстрин, инулин, глицерин, салицин, мальтозу и арабинозу. Однако ферментация углеводов непостоянна и
14—Ветеринарная микробиология
177
видовым признаком считается стоеобнссть ферментировать глюкозу, сахарозу, маннозу и галактозу. Встречаются биохимические варианты (штаммы, ферментирующие арабинозу, дульцит и лактозу, не ферментирующие ксилозу и т. д.), что не дает оснований к внутривидовой дифференциации пастерелл.
Пастереллы растут на разнообразных средах, но лучше в присутствии крови (или сыворотки крови), на средах Хоттингера и Мартена. Обязательными компонентами среды должны быть никотинамид и пан-тотенад, а ростовыми факторами — гуанин, ксантин, глютамин, инозит, пиридоксин, п-аминобензойная кислота, витамин Ви, фолиевая кислота, биотии и гематин.
Устойчивость сравнительно невысокая. Быстрая гибель пастерелл во внешней среде наступает при высушивании, действии высокой температуры и солнечных лучей. При температуре 70 — 90 °C пастереллы погибают в течение 5— 10 мин, 58 °C — 20 мин, при кипячении гибнут моментально. При низких температурах сохраняются длительно. В замороженных трупах птиц пастереллы в состоянии сохраняться годами (Е. В. Кожевников, 1975), в почве до одного месяца, в помете птиц более двух месяцев. Весьма чувствительны к дезинфицирующим веществам— растворам фенола, крезола, хлорной извести, формалину и т. д. Пастереллы высокочувствительны к тетрациклинам, хлоромицети-ну, стрептомицину, чувствительны к пенициллину и эритромицину.
Патогенность. Р. rnultocida обладает широким диапазоном патогенности. Наряду с этим встречаются штаммы, патогенные для определенного вида животных. Еще большей изменчивости подвержена вирулентность. Замечено, что пастереллы, выделенные из трупов через 6 — 9 ч после гибели животных, в 10 раз вирулентнее (для белых мышей) по сравнению с теми же культурами, выделенными в момент смерти животных. Свежевыделенные штаммы, как правило, патогенны для мышей, кроликов и голубей. Штаммы от крупного рогатого скота весьма вирулентны для белых мышей и кроликов, но не вирулентны для уток и кур, штаммы же от птиц вирулентны для лабораторных животных и птиц. В лабораторных условиях пастереллы утрачивают или резко снижают свою вирулентность. Доказано, что она связана с гладкой формой колоний; слизистые менее вирулентны, шероховатые — слабовирулентны или совсем непатогенны.
По данным многих исследователей, штаммы, образующие капсулу, высоковирулентны для мышей (капсулу рассматривают как фактор вирулентности). К числу важных свойств относится образование токсинов (эндотоксинов).
Предполагается, что сужение диапазона патогенности Р. multoci-da — следствие утраты способности противостоять ингибиторному действию крови соответствующих видов животных.
Патогенез. Достаточно не изучен. Пастереллез возникает спонтанно в результате распространенного носительства или заносится больными и переболевшими животными. Инкубационный период может быть от 1 до 5 суток, а при пастереллоносительстве неопределенный срок.
Развитие и тяжесть патологического процесса зависят от состояния животного и вирулентности возбудителя. Состояние биологического равновесия при носительстве пастерелл обеспечивается иммунной перестройкой организма. Переход па стере лл он о-сительства в клинически выраженную стадию болезни происходит при ослаблении защитных свойств микроорганизма под действием различных предрасполагающих факторов. При остром течении болезни возбудитель интенсивно размножается в крови и паренхиматозных органах. В развитии патологических процессов важную роль играют токсические продукты пастерелл (эндотоксины), а также высокая степень агрессивности возбудителя, вероятно, связанная с капсулообразованием.
Антигенная структура. Р. rnultocida имеет два антигена: капсульный (К-антиген) и соматический (О-антиген). По Картеру К-антигены делят на четыре серологических типа: А, В, D и Е. К-антиген присущ
178
гладкому варианту и не встречается у шероховатых форм. У слизистых культур (М-форма) К-антиген или отсутствует, или не определяется из-за наличия гиалуроновой кислоты. Утрата способности реагировать с капсульными сыворотками — признак диссоциации культуры. К-анти-гены состоят из белка и полисахаридов. В химическом отношении О-антигены представляют собой липополисахариднобелковый комплекс, а по биологическим свойствам сходны с соответствующими антигенами других бактерий и являются эндотоксинами. В состав полисахарной части эндотоксина входят галактоза, глюкоза, глюкозамин и гептозы. Кроме К- и О-антигенов, P.rnultocida содержит многие другие, из них только растворимых обнаружено 18.
В силу полиморфности антигенной структуры отдельные штаммы пастерелл могут резко отличаться друг от друга.
Иммунитет. Вопрос об антигенах, стимулирующих иммунитет при пастереллезе, не совсем ясен. По-видимому, главную роль играют К- и О-антигены. После перенесенной болезни и вакцинации создается, как правило, нестерильный иммунитет. Поэтому животные могут оставаться пастереллоносителями (особенно птицы).
Сыворотки крови переболевших животных агглютинируют гомологичные и гетерологичные штаммы пастерелл. Защитная активность им-мунных^сывороток обычно направлена против тех типов пастерелл, которые вызвали болезнь. Наряду с этим имеются указания, что при пастереллезе птиц отмечается клеточная реакция.
Диагностика. Материалом для бактериологического исследования служат трупы животных. Из крови, паренхиматозных органов, лимфатических узлов, костного мозга делают посевы на МПБ и МПА, а также готовят препараты и окрашивают их по Романовскому — Гимза или метиленовой синькой. При микроскопии препаратов обнаруживают биполярно окрашенные овоиды и палочки.
Выделенной культурой заражают лабораторных животных: культурой от млекопитающих рекомендуют заражать кролика (подкожно); от птиц — голубя (внутримышечно), белую мышь (подкожно) или кролика. Для биопробы с успехом можно использовать кровь или суспензию из паренхиматозных органов от павших животных (высокая вирулентность). Через 24 — 36 ч после заражения животные обычно погибают. На основании морфологии, культурально-биохимической характеристики и биопробы ставят диагноз на пастереллез.
При хронической форме пастереллеза свиней и птиц материал для мазков и посевов берут из казеозных и некротических очагов и из костного мозга. Этим же материалом заражают подопытных животных.
При идентификации пастерелл важно учитывать наличие гемолитического токсина и роста на агаре Мак-Конки у Р. haernolytica в отличие от Р. multocida, а также образование последним индола.
Пастереллоносительство у птиц можно диагностировать на основании обнаружения Р. multocida в носовой слизи (прижизненно) или органах дыхания (посмертно). При бактериологическом исследовании посевы лучше делать на среду Хоттингера. Кровекапельная реакция (в качестве антигена применяют убитую культуру пастерелл) достоверна при групповом и многократном исследовании: увеличение количества положительно реагирующих птиц в группе и рост титр& антител расценивается как показатель активного инфекционного процесса в стаде птиц.
Биопрепараты. Возможность создания активного иммунитета у птиц была доказана еще Пастером (1880). В настоящее время для профилактики пастереллеза у животных применяют убитые и живые вакцины. Испытываются также микробные дериваты (бактерины — лизатвакци-ны, глюцидо-липидопротеиновые комплексы). Аттенуированные штаммы пастерелл получают под действием антибиотиков и путем пассирования на морских свинках. Для повышения активности убитых вакцин используют депоненты. В последние годы в СССР при пастереллезе
14* 179
млекопитающих и птиц в практику введены эмульгированные вакцины (Н. М. Никифорова и А. В. Лукьяненко).
Большое значение придается подбору штаммов (М-варианты создают слабую защиту, так как иммуногенез угнетается гиалуроновой кислотой). Подбирают и используют несколько штаммов, выделенных от крупного рогатого скота, овец, буйволов, свиней, а также от птиц.
Безвредность вакцины против пастереллеза птиц проверяют на пяти белых мышах и трех курах (мышам подкожно 0,3 мл, курам внутримышечно 5 мл). Через десять дней животные должны остаться живыми. Активность проверяют на пяти курах (однократная вакцинация в дозе 1,5 мл). Через 30 суток после вакцинации пять подопытных кур и трех контрольных заражают заранее оттитрованной смертельной дозой вирулентного штамма пастерелл. Вакцина считается активной при гибели всех контрольных кур и выживании не менее трех вакцинированных.
Безвредность вакцины против пастереллеза млекопитающих проверяют на пяти мышах и двух кроликах; активность — на пяти кроликах: вакцинируют однократно в дозе 1,5 мл и спустя 30 суток заражают вакцинированных и трех контрольных кроликов вирулентной культурой пастерелл. Вакцина считается активной, если все контрольные животные погибают, а из пяти кроликов остаются в живых не менее трех.
Эмульгированные вакцины применяют однократно: курам и уткам в дозе 1,5 мл, овцам 2 мл, крупному рогатому скоту и свиньям 3 мл. Вакцины создают иммунитет длительностью 6 — 12 месяцев.
Имеются данные об эффективности иммунизации убитыми вакцинами кроликов и пушных зверей.
В птицеводческих хозяйствах используют также живые вакцины из аттенуированных штаммов пастерелл: из французских авирулент-ных штаммов и отечественных штаммов АВ и К. Вакцины из французских штаммов безвредны при внутримышечном введении (первая и вторая вакцины с интервалом в 8—10 суток), иммунитет наступает на 4—5-е сутки и сохраняется до трех месяцев. Штамм второй вакцины К весьма иммуногенный, но сохранил значительную остаточную вирулентность (Н. М. Никифорова).
По данным Е. М. Кожевникова, после иммунизации птиц живыми вакцинами может формироваться пастереллоносительство.
При появлении в хозяйствах среди млекопитающих пастереллеза животным применяют иммунную сыворотку. Сыворотку против пастереллеза крупного рогатого скота, буйволов, овец и свиней готовят путем гипериммунизации волов культурами из многих штаммов пастерелл, выделенных от соответствующих животных. Активность сыворотки крови, полученной от волов, проверяют на кроликах: им вводят подкожно сыворотку (2 мл/кг), а затем через 24 ч кроликов заражают культурой пастерелл.
С профилактической целью сыворотку вводят молодняку 10— 30 мл, взрослым — 30—40 мл. Пассивный иммунитет сохраняется до 7 суток.
Из лечебных препаратов рекомендуют антибиотики и сульфаниламидные препараты.
БРУЦЕЛЛЫ
ВОЗБУДИТЕЛЬ БРУЦЕЛЛЕЗА
Возбудитель бруцеллеза открыт Брюсом в 1886 г. Род бруцелл включает шесть видов: Brucella melitensis с тремя биотипами, Вг. abortus с девятью биотипами Br. suis с четырьмя биотипами и без установленных биотипов, Вг. neotome, Вг. ovis и Вг. canis (табл. 10).
Бруцеллез сельскохозяйственных животных в начальном периоде
180
10. Виды и биотипы бруцелл и их дифференциальные признаки
Внд
Вг. melitensis
Be abortus
Br. suis
Br. neotome
Br. ovis
Br. canis
Рост на средах с красками
Агглютинация
моноспеци-фнческне сыворотки R-антисыворотка d-аланин L-алаиии
А М
Аминокислоты Углеводы
я СЗ гамин [ИТНН рулнн НИИ X иноза СП СО О н X СЗ СП СП со О
СП К и 2 ори пнт рги нзн раб СП ч СП о с; 'Й S S о
СП 1 1 СП СП Си
1 ^5 в t в V f 9 •
I || 1 || 1 1 1 l II »|| II 1 1 II И | II
—|.... + || 1 || 1 mL.
Л
Основной хозяин
Козы И ОВЦЫ
То же
Крупный рогатый скот
То же
»
Свиньи
Свиньи, зайцы
Свиньи
Северные олени
Древесная крыса Овцы (бараны) Собаки
Примеча положительный;
и
и е
: результат исследования положительный, встречается отрицательный; — результат нсследования^риц^
концентрация
красителя
I : 25 000; II
— концентрация красителя
1 : 50 000;
Ill — концентрация красителя 1 : 100 000;
+ результат исследования
энзоотии проявляется массовыми абортами и осложнениями, возникающими после аборта — задержанием последа, эндометрит, бесплодие.
Серьезное эпизоотологическое и эпидемиологическое значение
имеет миграция бруцелл с одного вида животных на другой. При миграции Br. rnelitensis на крупный рогатый скот и свиней эти животные
становятся источником заболевания людей бруцеллезом (Е. В. Козловский, 1954, 1956, и др.). Установлена также миграция Br. suis на коров и мелкий рогатый скот, a Br. abortus на коз, овец и свиней.
Морфология. Бруцеллы представляют собой небольшие полиморф-
ные клетки: коккобактерии или палочки величиной 0,5X0,7—0,6Х ХК5 мкм (см. рис. 69). Спор не образует. Неподвижны. Расположение
в препарате при микроскопии одиночное или парное; при электронной микроскопии, кроме монодиплобактериальных форм, наблюдаются короткие стрептобактерии. Некоторые исследователи наблюдали капсульные формы у вирулентных штаммов бруцелл (см. рис. 70).
Бруцеллы размножаются перешнуровыванием, почкованием и дроблением с образованием измельченных клеток — почек и фильтрующихся форм, лежащих за пределами разрешающей силы светового
микроскопа.
Тинкториальные свойства. Бруцеллы окрашиваются всеми анилиновыми красителями. Грамотрицательны. Е. В. Козловский (1936) предложил дифференциальный метод окраски бруцелл. По этому способу препараты, высушенные на воздухе, фиксируют на пламени и окрашивают 2%-ным водным раствором сафранина с подогреванием до появления пузырьков; затем препарат промывают водой и дополнительно окрашивают 0,75—1 %-ным водным раствором малахитовой зелени в течение 30 с. Бруцеллы сохраняют красный цвет, а другие бактерии и тканевые клетки окрашиваются в зеленый цвет.
Кроме этого, для окрашивания бруцелл применяют модифицированный метод Циля — Нильсена, модифицированный метод Кюстера
и др.
Культивирование. Бруцеллы культивируют на обычных питательных средах нейтральной или слабощелочной реакции (pH 6,8—7,2). Оптимальными средами являются печеночный агар и бульон с добавлением глюкозы и глицерина, картофельный агар, глюкозо-глицериновый агар, мясо-пептонный агар с лошадиной сывороткой, сухая среда D из рыбного и дрожжевого гидролизата Н. В. Плоскирева и др.
Выделение культур бруцелл на питательных средах в первых генерациях из содержимого желудка абортированного плода, паренхиматозных органов, лимфоузлов и других патологических материалов удается в среднем спустя Va—1 месяц, а иногда и позже. Первые генерации Br. abortus выращивают с добавлением 5—10 % СО2, Br. rnelitensis и Br. suis при обычных условиях. Лабораторные культуры бруцелл, в том числе Br. abortus, развиваются уже через 1—2 суток в аэробных условиях. Объединенный комитет экспертов ФАО/ВОЗ по бруцеллезу (1970) для выделения первичных культур и дальнейших пересевов их рекомендует сывороточно-декстррзный агар, картофельный агар плюс сыворотка; триптозно-соевый и триптозный агар; кровяной агар (5 % овечьей крови в агаре основной среды). Для выделения культурыбруцелл из загрязненных посторонней микрофлорой патологических материалов пользуются этими же средами после добавления к ним антибиотиков (полимиксин, бацитрацин, циклогексамид, антидион), угнетающих постороннюю микрофлору и не препятствующих росту бруцелл.
Засеянная на скошенный агар взвесь бруцелл образует нежный, блестящий, прозрачный слой; со временем мутнеет и становится менее прозрачным, с голубоватым оттенком. Вирулентные эпизоотические штаммы на агаровых пластинках образуют S-колонии, бесцветные, круглые, выпуклые с гладкой поверхностью, прозрачные с голубоватым
182
оттенком (со временем более мутные и отщепляющие переходные к R-форме колоний). В бульонных культурах вирулентные S-штаммы бруцелл образуют равномерное помутнение среды. Со старением бульонных культур на дне пробирок появляется осадок, поднимающийся при встряхивании в виде вязкой косички. R-штаммы дают неравномерное помутнение бульона с просветлением и с крошковатым осадком.
Для дифференциации основных S- и R-форм колоний бруцелл Уайт и Вильсон (1951) предложили специальный метод их окраски. Исследуемую культуру засевают на агар-альбими, разлитый в чашки Петри и подсушенный в течение 24 ч. После выращивания при температуре 37 °C в течение 96 ч на поверхность агара с выросшей культурой наливают водный раствор кристаллвиолета (1 :2000) на 15 с. Краску сливают в дезинфицирующий раствор, а колонии рассматривают под лупой или микроскопом. S-колонии светлые, а R-колонии фиолетовые.
Биохимические свойства. У бруцелл нет протеолитических фермен-тов, они не разжижают желатину и не свертывают молоко. Сахароли-"ТПческая активность у них слабая) Лишь некоторые штаммы бруцелл ферментируют декстрозу, галактозу, ксилозу, левулёзу и сбраживают рабинозу. В процессе метаболизма Вг. abortus и Br< suis при росте на питательных средах выделяют сероводород при отсутствии сероводо-родообразования у Вг. rnelitensis. Однако сероводородообразование у Вг. rnelitensis наблюдается на питательных средах с добавлением веществ, содержащих серу (цистин, цистеин, тиогликолевая кислота).
Ряд авторов установили каталазную активность у бруцелл.
Устойчивость. Культуры бруцелл на плотных питательных средах в запарафинированных пробирках сохраняют жизнеспособность в течение нескольких недель, лиофильно высушенные — годами. В поверхностных слоях почвы бруцеллы выживают до 40 дней, на глубине 5— 8 см — до 60, а в унавоженной почве — до 100 дней; в воде при интенсивном заражении бруцеллы сохраняются от 45—90 до 150 дней (П. Ф. Здродовский, 1953), а по П. Н. Жованику (1975) более 15 месяцев.
Выживаемость бруцелл (по данным П. А. Вершиловой и А. А. Голубевой, 1972) в молоке достигает 10—273 дней, в масле—10—142 дня, в сыре — от 25 дней до года, в брынзе — до 45 дней, в кислом молоке — 2—30 дней, в замороженном мясе — более 320 дней, в соленом масле — 30—ИЗ дней, в шерсти—14—19 дней, в шкурах ягнят — до 2 месяцев.
Прямой солнечный свет в зависимости от интенсивности убивает бруцелл в период от нескольких минут до 3—4 ч; рассеянный свет через 7—8 дней. От ультрафиолетовых лучей бруцеллы, засеянные на пластинки агара, погибают через 3—5 мин в зависимости от густоты посевов и расстояния от источника УФЛ. 2%-ный раствор фенола, 1 %-ный раствор креолина, 0,5%-ный лизол, 1 %-ная хлорная известь, 1—2 %-ный раствор формалина, 0,01 %-ный хлорамин, 1 %-ный раствор НС1 и 9 %-иый раствор NaOH убивают бруцелл в течение нескольких минут.
Для дезинфекции помещений применяют осветленный раствор хлорной извести, содержащий 2% активного хлора, 2%-ный раствор едкого натра, 20 %-ную взвесь свежегашеной извести, 2 %-ный раствор формальдегида, 4 %-ную горячую эмульсию креолина, 5 %-ную эмульсию нафтализола, 5 %-ный горячий раствор кальцинированной соды.
Молоко пастеризуют при температуре 70 °C в течение 30 мин или при температуре 85—90 °C в течение 20 с.
Патогенность. Бруцеллы — факультативные внутриклеточные паразиты. Живут и размножаются преимущественно внутри клеток ретикулоэндотелиальной системы зараженного организма животных. Вирулентность бруцелл — изменяющееся свойство, измеряемое минимальной инфицирующей дозой (ИД). По данным комиссии МСХ СССР (1973), ин
183
фицирующая доза, вызвавшая генерализованную бруцеллезную инфекцию у контрольных телок, составляла 2,5 млн. м. т.
Патогенез. Входными воротами бруцеллезной инфекции являются слизистые оболочки ротовой полости и дыхательных путей, конъюктива, кожа. Морские свинка заражаются даже небольшими дозами высоковирулентных культур Br. rnelitensis, Br. abortus, Br. suis при подкожном введении, конъюнктивально, перорально, аэрогенно, при нанесении на неповрежденную кожу.
У морских свинок генерализованная бруцеллезная инфекция возникает через 1,5—3,5 месяца после заражения. Высеваемость бруцелл из органов и лимфоузлов в это время достигает 100 % случаев: спустя 4—12 месяцев — 42,6 %; а спустя 13— 26 месяцев — 17,1 % случаев (П. Ф. Здродовский, 1953). Через 1—2 года у многих морских свинок наступает самовыздоровление после экспериментального заражения (Е. С. Орлов, 1942).
Антигенная структура. У бруцелл в S-форме всех трех основных видов установлен общий термостабильный антиген и два серологически дифференцированных антигена А и М. По Майлсу, отношения антигена А и М у Br. rnelitensis 1:20, у В. abortus—20: 1; клетки Br. suis содержат несколько большее количество антигена М, чем клетки Вг. abortus. Майлс и Пири (1949) выделили из бруцелл специфическое растворимое вещество SSS (substanse soluble specifique) и состоящее из фракций BI, АР, S/Р АР. Фракция АР содержала, по мнению автора, А- и М-антигены, не была токсична и антигенна.
Из бруцелл всех трех основных видов экстрагированием трихлоруксусной кислотой извлекается соматический комплекс—антиген Буавена (эндотоксин), весьма токсичный для животных. При иммунизации буа-веновскйм антигеном образуются агглютинины, преципитины, компле-ментсвязывающие вещества и опсонины. При внутрикожном введении он вызывает у бруцеллезных животных специфическую местную реакцию.
При исследовании антигенного комплекса методом преципитации в агаровом геле с гомологичными сыворотками установлено шесть различных антигенов.
Иммунитет животные приобретают после переболевания. Продолжительность переболевания и .самовыздоровления от бруцеллеза у различных животных определяется различной видовой и половозрастной чувствительностью к этой инфекции. Так, морские свинки являются высокочувствительными, а белые мыши менее чувствительны. При энзоотиях с массовым поражением крупного рогатого скота или овец среди лошадей, находящихся на неблагополучной ферме, массового заболевания бруцеллезом не бывает. Неполовозрелые животные (молодняк) устойчивее к бруцеллезу по сравнению со взрослым поголовьем.
Установление самовыздоровления советскими исследователями явилось основанием для признания двух фаз противобруцеллезного иммунитета: инфекционной — нестерильной и постинфекционной — стерильной.
Продолжительность инфекционного процесса, нестерильной и стерильной фаз иммунитета определяется степенью приживаемости и продолжительностью сохранения бруцелл в макроорганизме. В период развития естественной бруцеллезной инфекции организм животных реагирует выработкой специфических антител — агглютининов, преципитинов и комплементсвязывающих веществ, которые постепенно утрачиваются с переходом инфекционного процесса в нестерильную, а затем в стерильную фазу иммунитета. Следовательно, наличие специфических антител свидетельствует скорее об инфекции, чем об иммунитете.
Диагностика. Своевременное выявление больных бруцеллезом животных имеет важнейшее значение в ликвидации этого опасного заболевания. Диагностика бруцеллеза осуществляется бактериоскопией, выделением культур бруцелл, биопробой на лабораторных животных, а при массовых исследованиях — иммунобиологическими методами.
184
Бактериологическая диагностика с выделением культуры и положительной биопробой наиболее точная. Однако ее можно применить только для послеубойного исследования животных с латентной формой инфекции, у которых бруцеллы локализуются в лимфоузлах или других тканях. ;
Для прижизненной диагностики в лабораторию направляют' абортированный плод или желудок с его содержимым, плаценту и плодовые оболочки, молоко, содержимое абсцессов и гигром. На инфекционный эпидидимит баранов исследуют содержимое секвестров придатков, измененные участки семенников, предстательные железы, а от овцематок— абортированные плоды и выделения из половых путей. Для посмертной диагностики от животных направляют в лабораторию паренхиматозные органы и лимфоузлы.
Бактериоскопия. Мазки из исследуемого материала высушивают, фиксируют над пламенем спиртовки и красят по Граму и Козловскому. По Граму бруцеллы окрашиваются в красный цвет на фиолетовом фоне, по Козловскому — в красный цвет на зеленом фоне. Положительные результаты бактериоскопии получают главным образом при исследовании мазков из содержимого желудка абортированного плода. Однако они имеют ориентировочное значение.
Посевы из патологического материала производят на питательные среды, из которых наибольшее признание получили печеночный бульон и агар (pH 7,2). Для выделения культур бруцелл из загрязненного материала используют среды с веществами, задерживающими рост посторонней микрофлоры. С этой целью к ним добавляют генпианвиолет из расчета содержания его в среде 1 : 100 000—1 :250 000; малахитовую зелень — 1 : 500 000 или кристаллвиолет 1 : 100 000 и др.
Первые генерации бруцелл при посевах из патологического материала растут медленно. Первые мелкие колонии эпизоотических штаммов появляются не ранее 5—10 дней. Поэтому засеянные среды выдерживают в термостате не менее 30—35 дней, проверяя их еженедельно. Выделенные культуры идентифицируют по морфологическим, тинкториаль-ным и агглютинабильным свойствам с помощью методов СОг- и H2S-o6-разования, бактериостатического, серологического, чувствительности к фагу ТБ (см. практические руководства по ветеринарной микробиологии). Из них наиболее часто используют бактериостатический метод (табл. 11).
11. Дифференциация видов бруцелл по бактериостатическому методу
Вид бруцелл Основной фуксин 1:25 000 Тионин 1:25 000
Br. abortus
Br. rnelitensis 1 1
Br. suis
Биопробу ставят на морских свинках, не реагирующих при предварительном исследовании в РА даже в разведении сыворотки 1 :5. Двум морским свинкам инокулир^ ют подкожно 1—2 мл суспензии из тканей. Одну из свинок убивают для бактериологического исследования через три недели после инокуляции, другую — через шесть недель. Посевы производят из подчелюстных, шейных, паховых, гипогастральных лимфоузлов, селезенки, печени и костного мозга. Рекомендуется также исследовать в РА сыворотку морских свинок после инокуляции через 10, 20 и 30 дней в разведениях 1 : 10, 1 : 20, 1 :40, 1 :80. Положительной РА считается уже с разведения 1 : 10.
185
Из серологических реакций для диагностики бруцеллеза наибольшее применение находят реакции агглютинации, связывания комплемента.
Пробирочную реакцию агглютинации ставят в объеме 1 мл в чистых пробирках с ровным выпуклым дном в четырех разведениях. Сыворотки крови свиней, овец, коз, оленей, собак в разведениях 1 :25, 1 : 50, 1 : 100, 1 :200; крупного рогатого скота, лошадей и верблюдов — в разведениях 1 :50, 1 : 100, 1 :200, 1 :400. При массовых исследованиях допускается постановка РА в двух разведениях, но тогда сыворотки, давшие положительную реакцию, исследуют повторно в четырех разведениях.
Положительной реакция считается при наличии агглютинации сыворотки крови свиней, овец, коз, оленей и собак, начиная с разведения 1 :50 и выше, а для крупного рогатого скота, лошадей и верблюдов — с разведения 1 : 100 и выше. Сомнительной реакция будет при наличии агглютинации только в разведении 1 :25 с сывороткой крови свиней, овец, коз, оленей и собак и разведении 1 :50 с сывороткой крупного рогатого скота, лошадей и верблюдов. При сомнительной реакции сыворотку крови от данного животного исследуют повторно через 3—4 недели. Животных, неблагополучных по бруцеллезу ферм, давших повторно сомнительную РА, относят к положительно реагирующим.
Предложен также ускоренный вариант пластинчатой РА.
Кольцевая реакция с молоком. Была предложена в 1937 г. Флейш-хауером для диагностики бруцеллеза у лактирующих коров. Сущность ее состоит в том, что при наличии в молоке специфических агглютининов происходит скучивание окрашенного бруцеллезного антигена, образовавшийся агглютинат адсорбируется сливками молока и поднимается с ними вверх, образуя окрашенное кольцо, при обесцвечивании остальной части молока.
Реакцию ставят в бактериологических пробирках, в которые наливают 2 мл цельного молока и добавляют к нему по 0,2 мл (две капли) антигена. Пробирки тщательно встряхивают до равномерного распределения антигена в молоке и выдерживают 1 ч в водяной бане или в термостате при температуре 37—38 °C. Реакцию учитывают по следующей схеме: при наличии четко выраженного кольца в верхней части столбика молока (остальная часть белая) — положительная Н—|—|—|- и Н—|— достаточно выраженное синее кольцо в слое сливок и синеватый цвет остального молока — положительная -j—|-. Необходимо учитывать, что молоко коров, вакцинированных штаммом № 19, дает положительную КР (П. А. Триленко, 1956).
Реакция связывания комплемента (РСК) для диагностики инфекционного аборта у коров впервые применена Холсом (1909). При дальнейшем параллельном изучении РСК с РА для диагностики бруцеллеза многие исследователи установили, что РСК является более четкой, постоянной и длительной и выявляет значительно большее количество больных бруцеллезом животных, чем РА, особенно в стадах с давним течением энзоотии.
В качестве арбитражного метода часто используется тест Кумбса, обнаруживающий неполные антитела. Имеются также сведения об успешном применении метода флуоресцирующих антител в непрямом варианте.
Аллергическая реакция у больных бруцеллезом животных проявляется на внутрикожное введение бруцеллезных аллергенов. В настоящее время для диагностики бруцеллеза у мелкого рогатого скота и свиней применяют аллерген бруцеллизат ВИЭМ из неагглютиногенного штамма Вг. abortus. Аллергическая проба признается положительной при обнаружении хорошо выраженной припухлости на месте введения ал- 4 лергена.
186
Биопрепараты. Активная иммунизация против бруцеллеза была начата еще в 1906 г. Бангом. Из живых вакцин, получивших мировую известность, явилась вакцина из слабовирулентного штамма Br. abortus. Штамм № 19 был выделен Буком в 1923 г. в вирулентной форме из молока коровы. В процессе десятилетнего пассажирования на картофельном агаре культура штамма № 19 спонтанно понизила свою вирулент
ность.
Общепризнано, что вакцина из штамма № 19 является иммуногенной, но о ее полной безвредности, продолжительности иммунитета существуют принципиальные противоречия. Применение этой вакцины в общем комплексе борьбы с бруцеллезом профилактировало аборты, однако сопровождалось длительной серопозитивностью, недифференцируемой от серопозитивности у зараженных бруцеллезом животных. Дли
тельное сохранение поствакцинальной серопозитивности у привитых вакциной из штамма № 19, при отсутствии методов дифференциации от постинфекционной серопозитивности, при выявлении реагирующих в РА в титрах 1 : 50; 1 : 100; 1 :200 не позволяло судить об истинном эпизоотологическом состоянии в стаде. Это определило необходимость изыскания более совершенных живых бруцеллезных вакцин — стабильных, слабовирулентных, безвредных (неабортогенных), иммуногенных, не стимулирующих образование антител, не реагирующих с обычным бруцеллезным антигеном.
В нашей стране с 1972 по 1974 г. комиссией МСХ СССР было проведено сравнительное изучение новых вакцинных штаммов бруцелл: Вг. abortus В-1; Вг. abortus 16/4, Br. abortus 21, Вг. abortus 82, Br. abortus 4004/1, Br. abortus B-8, Br. abortus 519, Br. melitensis H-12.
В результате практическое применение нашли вакцины из штамма
Протизобруцеллезная. сыворотка. Ряд советских исследователей (М. К. Юсковец, П. Н. Жованик, А. Г. Уваров, К- П. Студенцов и др.) получали достаточно эффективные иммунные сыворотки для лечения бруцеллеза у людей и животных путем иммунизации лошадей и кроликов.
Антибиотикотерапия и химиотерапия бруцеллеза у животных не разработаны.
ФРАНЦИСЕЛЛЫ
ВОЗБУДИТЕЛЬ ТУЛЯРЕМИИ^
Возбудитель туляремии (Francisella tularensis) вызывает природноочаговую, факультативно-трансмиссивную инфекционную болезнь животных, характеризующуюся лихорадкой, увеличением лимфатических узлов, абортами и известную под названиями: туляремия, чума зайцев, тулярецеллез. Болезнь распространена и в ряде стран Америки и Ев
разии, в основном в пределах северного полушария.
Бактерия туляремии была выделена в 1912 г. Мак-Коем и Чепиным при изучении «чумоподобного» заболевания у сусликов в округе Туляре (Калифорния). Род Francisella назван в честь Френсиса, впервые изучившего биологию этого микроба. Внутри вида F. tularensis различают три географические расы: голарктическую, среднеазиатскую и неаркти-
ческую, отличающиеся некоторыми биологическими особенностями.
Морфология и тинкториальные свойства. В окрашенных мазках воз-
будитель туляремии имеет кокковидную или палочковидную форму размером 0,3—0,7X0,2—0,4 мкм; кроме того, встречаются более мелкие клетки: от 0,15 мкм и меньше, способные проходить через бактериальные фильтры. Кокковидные формы чаще находят в культурах, палочковидные— в организме животных. Для бактерии характерен полимор-
187
физм, выявляемый при росте на питательных средах: в препаратах из культур наряду с типичными бактериями могут попадаться шаровидные и нитевидные их формы.
Микроб неподвижен, спор не образует, имеет небольшую капсулу; в культурах продуцирует слизь, легко обнаруживаемую при изготовлении мазков. Возбудитель окрашивается всеми анилиновыми красками, но заметно бледнее других бактерий, грамотрицательный. В мазках-отпечатках из органов павших животных хорошо красится по Романовскому— Гимзе, приобретая сиреневый цвет. В тканях бактерии биполярно не окрашиваются, чем и отличаются от пастерелл.
Культивирование. Бактерия не растет на универсальных питательных средах. Для ее культивирования применяют свернутую желточную среду Мак-Коя, состоящую из 60 % желтка куриных яиц и 40 % физиологического раствора; среду разливают в пробирки и свертывают при 80 °C в течение 1 ч. Используют также среду Френсиса (2,5 °/о мясопептонного агара, 0,1 % цистина, 1 % глюкозы и 5—10 % дефибриниро-ванной кроличьей крови), полужидкую желточную среду Дрожевкиной (10 % куриного желтка и 90 % стерильного физраствора), кровяной рыбно-дрожжевой агар с глюкозой и цистином и др.
Туляремийная бактерия — строгий аэроб, температурный оптимум у нее 36—37 °C, pH 7,2—7. На свернутой желточной среде при обильном засеве микробы растут в виде блестящего тонкого налета с извилистой («шагреневой») поверхностью; при скудном засеве вырастают небольшие блестящие выпуклые колонии или группы колоний. На средах Френсиса и Емельяновой имеют вид изолированных (1—2 мм) круглых, выпуклых гладких блестящих с ровными краями колоний беловатого цвета с голубоватым оттенком; рост отмечается через 2—3 суток. Колонии вирулентных штаммов соответствуют S-форме. В жидких питательных средах туляремийный микроб растет (только на поверхности среды) значительно хуже, чем на плотных. Бактерия хорошо размножается также в желточном мешке развивающегося куриного эмбриона.
Биохимические свойства. Бактерия туляремии не обладает выраженной биохимической активностью. Способность сбраживать углеводы и спирты у этого микроба ограничена и может быть достоверно выявлена лишь на специальных плотных средах с пониженным содержанием белка и с определенным pH. Среды Гисса для этой цели непригодны. Бактерия ферментирует с образованием кислоты без газа глюкозу, мальтозу, в ряде случаев — левулёзу и маннозу; не сбраживает лактозу, сахарозу, рамнозу, маннит, образует сероводород и редуцирует тионин, метиленовый голубой, малахитовый зеленый.
Устойчивость. Микроб в воде или влажной почве при 4 °C сохраняется без снижения вирулентности свыше четырех месяцев, при 20—25 °C в воде — 10—15 дней, в зерне и соломе при температуре ниже 0 °C — до шести месяцев, при 8—12 °C —56 дней, при 20—30 °C —не более 20 дней. В мороженом мясе возбудитель сохраняется до 93 дней, в молоке и сливках при 8—10 °C — не менее трех недель, в замороженном молоке — до 104 суток. В замороженных трупах животных, павших от туляремии, сохраняется свыше трех месяцев, в их шкурах при 8— 12 °C— более месяца, при 32—33 °C — одну неделю. Микроб устойчив к высушиванию и сохраняет вирулентность в шкурках больных грызунов до 45 дней. Особенно чувствителен к этиловому спирту (погибает через 0,5—1 мин). Чувствителен к дезинфектантам — лизолу, фенолу, креолину; в принятых концентрациях надежно обезвреживает бактерию хлорная известь.
Патогенность. Бактерия патогенна для многих видов млекопитающих.
По степени чувствительности к туляремийной инфекции принято выделять три группы животных. Первая группа — зайцы, полевки, во-188
дяные крысы, хомяки, песчанки, домовые мыши, землеройки. У них даже при минимальных заражающих дозах заболевание протекает по типу острой септицемии; возбудитель в большом количестве выделяется с мочой и калом. Животные погибают на 6—10-й день с исключительно интенсивным обсеменением бактериями внутренних органов и крови. Вторая группа — суслики, серые и черные крысы, ежи. Они менее чувствительны к туляремии. Инфекционный процесс у них часто заканчивается выздоровлением и отмечается умеренное обсеменение бактериями паренхиматозных органов и крови. Третья группа—хищные животные (кошки, собаки, волки, енотовидные собаки, лисицы, хорьки и др.). У них болезнь даже при заражении массивными дозами возбудителя может протекать без видимых клинических проявлений.
Сельскохозяйственные животные относительно устойчивы к туляремии, заболевают спорадически, и болезнь у них часто протекает скрыто. Наиболее восприимчивы ягнята и поросята, заболевают лошади, ослы. У крупного рогатого скота болезнь сопровождается увеличением лимфатических узлов и маститом. Чувствительны буйволы, верблюды, северные олени, а также свиньи в возрасте до 2—4 месяцев. Взрослые овцы устойчивы к заболеванию, еще более резистентны козы. Восприимчивы кролики, заболевание у них протекает нехарактерно и может иметь сходные признаки с псевдотуберкулезом, бродячей пиемией и хроническим пастереллезом. Из птиц восприимчивы куры, особенно цыплята, глухари, рябчики, перепела, фазаны, коростели, водяные курочки, крачки, речные чайки, коршуны. Воробьи, сороки и вороны малочувствительны, индейки, утки, гуси и голуби проявляют высокую устойчивость к заражению.
Из лабораторных животных наиболее чувствительны морские свинки и белые мыши.
Туляремией болеет и человек, однако заболевание протекает относительно доброкачественно и больной не представляет опасности для окружающих.
Истинный экзотоксин у этого микроба не выделен, но он синтезирует факторы^распространения: аспарагиназу, гиалуронидазу, глутацина-зу, дезаминазу, каталазу, трансмидазу, уронидазу, фибринолизины. Уро-нидазу обнаруживают только у вирулентных штаммов. Считают, что патогенное действие туляремийного микроба в основном связано с эндотоксином.
Патогенез. Заражение происходит алиментарным, воздушно-пылевым и трансмиссивным путями. Бактерии могут проникать в организм через неповрежденные кожные покровы, слизистые глаза, дыхательные пути. Возбудитель, размножаясь на месте внедрения, сначала попадает в лимфатические узлы, затем проникает в кровь, распространяется и вызывает септицемию. Снмптомокомплекс при данной болезни определяется видовой и возрастной устойчивостью животных, а также способностью возбудителя размножаться в органах, богатых ретикулоэндотелиальными элементами. Гибель животных наступает, когда концентрации бактерий в кровн достигает терминальной фазы. -----
Антигенная структура. Вирулентные варианты возбудителя туляремии (S-форма) имеют два антигенных комплекса, локализованных на поверхности клетки. Первый из них Vi-антиген содержит липиды и белки, он определяет вирулентность и иммуногенность микроба; второй — О-антиген (расположен в клеточной стенке и капсулоподобном слое бактерии)—термостабильный гликопротеид. Оба эти комплекса обладают аллергенными и антигенными свойствами, индуцируют образование агглютинирующих, преципитирующих и комплементсвязываю-щих антител, а также гиперчувствительность замедленного типа. Функцию аллергена у этой бактерии выполняет полисахариднополипептидный комплекс. Vi-антиген варулентных вариантов возбудителя туляремии обладает сходством с аналогичным антигеном бруцелл.
Иммунитет. У переболевших животных создается стойкий и дли
189
тельный иммунитет, имеющий в своей основе тканевые и гуморальные механизмы. В сыворотках переболевших животных закономерно обнаруживают агглютинины, довольно рано формируются клеточные реакции защиты. Замедленная повышенная чувствительность предшествует образованию сывороточных антител и при туляремии может быть кри-
терием определения иммунитета.
Диагностика. Материал в лабораторию доставляют и исследуют на туляремию, соблюдая предосторожности, предусмотренные правилами работы с особо опасными инфекциями. Материалом для исследования служат печень, почки, седезенка, увеличенные лимфатические узлы от трупов крупных животных; трупы грызунов целиком. Схема исследования включает бактериоскопию, выделение чистых культур, биологическую пробу. Мазки-отпечатки из органов животных окрашивают по Ро-мановскому—Гимзе. Бактериоскопию следует рассматривать как ориентировочный метод и учитывать, когда в препаратах обнаруживаются большие скопления коккобактерий сиреневатого цвета. Для индикации бактерий предложена реакция прямой иммунофлуоресценции. Однако этот способ является сигнальным и положительные результаты его должны подтверждаться выделением культуры возбудителя.
Посев на питательные среды проводят в основном для выделения культуры бактерий из органов павших животных. Для этой цели используют специальные питательные среды (свернутая желточная среда МакКоя, среды Дрожевкиной и Емельяновой). Одновременно делают контрольные посевы на МПА и МПБ, которые инкубируют в аэробных и анаэробных условиях. При обильном засеве в термостате при 37 °C рост туляремийных бактерий на свернутой желточной среде появляется в виде сплошного налета уже через 18—24 ч и достигает максимума на 2—3-и сутки; при скудном засеве разрозненные колонии становятся заметными на 3—5-й день и позднее. Поэтому посевы рекомендуют инкубировать 10—14 дней. На среде Дрожевкиной культура растет диффузно и наличие микробов контролируется микроскопически. Свежевыделенную культуру идентифицируют по данным морфологии (неподвижные коккобактерии), тинкториальным свойствам (грамотрицательные бактерии), характеру роста на свернутой желточной среде, отсутствию
роста на универсальных питательных средах, а также по результатам пробирочной РА со специфической сывороткой.
Биологическая проба является самой чувствительной и надежной для обнаружения туляремийных бактерий в любом материале. Заражают белых мышей или реже морских свинок. Суспензию из кусочков органов и лимфатических узлов вводят в дозе 0,5 мл подкожно или интраперитонеально. Материал можно также втирать в свежевыстри-женный участок кожи. Белые мыши погибают на 3—4-е сутки, иногда через 8—12 дней, морские свинки — на 4—6-е сутки, при слабой инфицированное™ материала — в течение 8—20 дней.
Серологический диагноз осуществляется с помощью реакций агглютинации, преципитации, непрямой гемагглютинации и нейт
рализации антител.
Реакция агглютинации — достаточно точный метод исследования на туляремию. Антигеном для РА служит туляремийный диагностикум, приготовленный из микробных клеток, убитых формалином. Перед употреблением антиген разводят физраствором, получая суспензию, содержащую в 1 мл 1 млрд. м. т. РА ставят двумя способами: пробирочным и кровяно-капельным. Диагностическими титрами при туляремии принято считать 1 : 25 и 1 : 50. Заведомо здоровые животные во всех случаях по РА дают отрицательные результаты. Реакцию непрямой гемагглютинации (РИГА) ставят с эритроцитами, синсибилизированными туляремийным антигеном, или с антительным эритроцитарным диагностикумом. С первым ее применяют для исследования сывороток сельскохозяйствен
но
I
ных и диких животных, со вторым — для определения антигена в трупах животных. Реакция преципитации при данной болезни обладает относительно небольшой чувствительностью, ее применяют в основном для исследования трупов грызунов.
Аллергический метод. Гиперчувствительность замедленного типа у животных при туляремии развивается рано (до пятого дня болезни) и сохраняется длительное время. Поэтому аллергический метод может быть использован для ранней и ретроспективной диагностики туляремии. В качестве аллергена используют тулярин; препарат вводят внутрикожно, реакцию учитывают дважды — через 24 и 48 ч.
Биопрепараты. Для профилактической иммунизации человека применяют накожную сухую живую вакцину против туляремии, предложенную в 1946 г. Н. А. Гайским и Б. Я. Эльбертом. Сельскохозяйственных животных не вакцинируют.
Активны против возбудителя туляремии антибиотики: стрептомицин, левомицетин, дигидрострептомицин, олететрин, тетрациклин, хлор-тетрациклин.
ПАТОГЕННЫЕ ПСЕВДОМОНАСЫ
Псевдомонасы составляют самый обширный род и дают название семейству широко распространенных в природе, особенно в почве и водоемах теплых регионов микроорганизмов. Среди известных 29 видов псевдомонасов три обладают патогенностью: Pseudomonas aeruginosa (синегнойная палочка) вызывает нагноительные процессы, Ps. mallei является возбудителем сапа, a Ps. pseudomallei — возбудителем мелио-доза (ложного сапа).
ВОЗБУДИТЕЛЬ САПА
Возбудитель сапа Pseudomonas mallei открыт в 1882 г. Ф. Леффлером и А. Шютцем. Относится к роду Pseudomonas семейства Pseudomo-nadaceae. Вызывает преимущественно хронически протекающую болезнь однокопытных, характеризующуюся появлением специфических
узелков во внутренних органах, на слизистых и кожных покровах, при
распаде которых образуются язвы.
Возбудитель
сапа
Морфологические и тинкториальные свойства.
неподвижен, спор и капсул не образует, имеет вид прямой или слегка изогнутой палочки размером 0,5—0,2x2,25 мкм. В жидкой питательной среде старые культуры образуют нитевидные формы, которые могут ветвиться и образовывать войлокообразные сплетения. Микроб хорошо воспринимает анилиновые красители, особенно содержащие кислоты или щелочи, грамотрицателен. За счет гранул поли-р-гироксибутирата, который используется микробом как запасной источник углерода, цитоплазма бактерий имеет зернистую структуру. Зерна в старых культурах окрашиваются метахроматиЧно, что обусловливает биполярность окрашивания коротких форм бактерий.
Культивирование. Бактерии\сапа всегда, кроме культивирования на средах с нитратами, облигатные аэробы. Соли серной кислоты они денитрифицируют, то есть растут как анаэробы. Оптимальная температура культивирования 37 °C, pH 6,6—6,8. Микроб неприхотлив к питательным веществам, в факторах роста не нуждается. Отдельные штаммы сапного микроба можно использовать в качестве единственного источника углерода при культивировании от 47 до 67 различных органических соединений. В отличие от возбудителя мелиоидоза он утилизирует D-ксилозу, глицин и DL a-аминобутират. Однако более пышный рост их наблюдается на свернутой сыворотке крови лошадей и верблюдов и на средах, содержащих глицерин (глицеринофилия)*
191
Рост микроба на МПБ с 2—4 % глицерина характеризуется помутнением среды с образованием через 2—3 недели на поверхности жирной слизистой пленки. На МПА с 4—5 % глицерина на вторые сутки появляется слизистый вязкий серовато-белый налет, который постепенно приобретает коричневый цвет. Глицериновый картофель является дифференцирующей средой. На нем через 2—3 дня появляются мелкие полупрозрачные колонии, которые, сливаясь, затем образуют слизистый медообразный налет. Его янтарно-желтый цвет к концу недели становится буро-коричневым или красноватым.
Биохимические свойства. Большинство штаммов возбудителя сапа денитрифицируют нитраты, положительно реагируют на аргининдигидролазу, гидролизуют желатину и твин-80 (этилен сорбитан моноомат), индол не образуют, молоко свертывают медленно, лактозу и глюкозу расщепляют с образованием кислоты без газа.
Устойчивость микроба зависит от субстрата, в котором он находится, и внешнего фактора. В воде и гниющем материале микроб сохраняется до 14—30 дней, в моче только до 4 ч. В высушенном носовом секрете он погибает через 1—2 недели, а под действием солнечных лучей уже через сутки. Нагревание до 80 °C убивает микроб через 5 мин, хлорная— известь, едкий натр, фенол в невысоких концентрациях—в течение часа.
Патогенность возбудителя сапа обусловлена эндотоксином, хотя патогенетическое значение других структур микробной клетки еще не исследовано. Продукты гидролиза сыпных палочек вызывают гиперчувствительность замедленного типа.
Благодаря этим факторам патогенности сапной микроб в естественных условиях вызывает заболевание у копытных (лошадей, ослов, мулов), когтекопытных (верблюдов) и кошачьих (степная кошка, рысь, лев, пантера, леопард). Больные животные являются источником инфекции для человека. Сапом можно экспериментально заразить домашних кошек, морских свинок и серых мышей.
Патогенез. Попадающие в организм через поврежденные покровы или с вдыхаемым воздухом бактерии оседают в мелких капиллярах, где окружаются мононуклеарами и формируют сапные узелки. Под действием фагоцитов и Т-киллеров в центре узелка образуются некротические фокусы. Повышенная порозность стенок мелких сосудов вокруг фокусов приводит к появлению инфильтратов и повышенному проникновению возбудителя в лимфо- и кровоток и заносу его в другие паренхиматозные органы и лимфатические узлы. Вновь формирующиеся фокусы сливаются, образуя каверны подобно тому как это происходит при туберкулезе. В легких в таких случаях развивается лобулярно-лобарная пневмония. В коже и на слизистых распадающиеся сапные узелки образуют своеобразные язвы с изрытыми неровными краями и саловидным дном, которые вяло заживают с зведчатым рубцеванием. Усиливающаяся интоксикация вызывает лихорадку, приводит к истощению и гибели ослабленных животных.
В организме резистентного животного гранулематозный процесс не расширяется, вокруг единичных некротических фокусов образуется соединительнотканная капсула. В инкапсулированных фокусах микроб может переживать годами, не распространяясь за пределы очага. Чаще, однако, такие патологические очаги обызвествляются, а микробы в них погибают. В подобных случаях наступает самовыздоровление животных.
Антигенная структура. В опытах по гибридизации ДНК экспериментально доказано тесное родство сапного микроба с возбудителем мелиоидоза и отдаленное родство с псевдомонасами некоторых других видов. Вследствие этого в клетках Ps. mallei имеются антигенные детерминанты, общие для возбудителей сапа и ложного сапа, и антигенные детерминанты, встречающиеся только у сапных бактерий. Видоспецифичные детерминанты представлены полисахаридом.
Иммунитет. Заражение животных сапом сопровождается вначале антителообразованием, а затем гиперчувствительностью замедленного типа. Антитела появляются через 1—2 недели после заражения лошадей, аллергические реакции развиваются через 2—3 недели.
Иммунитет при сапе имеет выраженный двуфазный характер. В первой фазе выздоравливающие животные с латентной или хрониче-
192
ской инфекцией относительно устойчивы к повторному заражению, что характерно для нестерильного (инфекционного) иммунитета. Выздоровевшие животные легче заражаются сапным микробом, то есть у них развивается состояние стерильного иммунитета.
Диагностика сапа основана преимущественно на аллергическом, реже серологическом и в исключительных случаях на бактериологическом исследованиях.
Аллергический диагноз является наиболее доступным. Устанавливают его с помощью маллеина, который впервые был предложен в 1891 г. независимо друг от друга ветеринарными врачами X. И. Гельманом и О. И. Кальнингом в виде экстракта сапных убитых бактерий, выращенных на картофеле. Современный препарат представляет собой светло-желтый фильтрат убитой нагреванием 4-месячной культуры сапного микроба, выращенной на МПБ с 4 % глицерина. Качество маллеина проверяют путем установления его стерильности, безвредности и специфической активности. Для определения стерильности содержимое 10—15 ампул каждой серии маллеина высевают на МПА, МПБ с 2 % глицерина и на среду Китт—Тароцци. Безвредность определяют на белых мышах. Специфическую активность проверяют в РСК с сапной сывороткой (отсутствие реакции), а также на здоровых лошадях и лошадях-маллеинщиках. В последнем случае маллеин наносят на конъюнктиву или вводят подкожно, сравнивая реакцию животных на стандартный маллеин.
Срок годности маллеина не менее 10 лет.
Серологический ставят с помощью реакций конглютинации, агглютинации, гемагглютинации или связывания комплемента. Основным серологическим тестом у нас считается РСК. Ее ставят со стандартным антигеном, представляющим собой прозрачный экстракт сапных палочек, выращенных на МПА с 2 % глицерина.
Микробиологический анализ заключается в последовательном проведении микроскопического исследования, выделении чистой культуры и заражении патологическим материалом или микробной культурой экспериментальных животных.
В качестве патологического материала в лабораторию направляют пораженные участки органов, пунктаты закрытых абсцессов, лимфоузлов, отделяемое язв. Для микроскопии препараты окрашивают по Граму или по Романовскому — Гимзе. Для выделения чистой культуры материал засевают на глицериновый картофель и агар, пересевая характерные колонии на свежие среды. Биологическую пробу предпочтительнее ставить на кошках, вводя им под кожу затылка растертый с физиологическим раствором материал. В положительном случае у кошек развивается генерализованный процесс с формированием абсцессов на месте введения суспензии и изъязвления различных участков кожи. Обычно животные погибают через 1—2 недели. Чтобы избежать рассеивания возбудителя, клетки с зараженными кошками накрывают обильно пропитанной фенолом марлей. Из трупа кошки выделяют и идентифицируют культуру возбудителя.
Самцов морских свинок заражают внутрибрюшинно, что в положительном случае приводит к развитию гнойного орхита (так называемого скротального феномена Штрауса).
Биопрепараты для лечения и профилактики сапа не разработаны. Санных животных уничтожают.
ВОЗБУДИТЕЛЬ МЕЛИОИДОЗА
Возбудитель мелиоидоза Pseudomonas pseudomallei открыт в 1912 г. А. Уайтмором и К. Кришнасвами. Входит в род Pseudomonas семейства Pseudomonadaceae. Вызывает сапоподобное заболевание преимущест-
—Ветеринарная микробиология
193
венно септикопиемического характера, сопровождающегося образовани
ем глубоких абсцессов.
Морфюлогия и тинкториальные свойства. Короткие палочки, разме-
ром 0,8Х 1,5 мкм, располагающиеся поодиночно или в коротких цепочках. Спор и капсул не образуют. Подвижны за счет полярно расположенного пучка жгутиков. На средах, бедных азотом, накапливают в ка
честве источника углерода поли-р-гироксибутират, гранулы которого обусловливают биполярное окрашивание микроба. ХорЪшо восприни
мают все анилиновые красители, грамотрицательны.
Культивирование. Микроб неприхотлив к питательным веществам, не требует дополнительных факторов роста. Отдельные его штаммы способны утилизировать в качестве единственного источника углерода от 77 до 88 различных органических компонентов питательной среды. Характерными источниками углерода являются углеводы (например, D-арабииоза, D-фруктоза, трегалоза, мальтоза, целлобиоза, салицин, крахмал), насыщенные дикарбоновые кислоты (от С4 до Сю) и др. В отличие от возбудителя сапа утилизируют D-рибозу, эритритол и этано-ламин. Облигатный аэроб, исключая среды с нитратом. Оптимум температуры 37°C, pH 6,8—7,2.
На плотных средах образует R- и S-формы колоний, часто слизистые и окрашенные от кремового до ярко-оранжевого цвета. На глицериновом картофеле постепенно развиваются медообразные наложения.
Биохимические свойства. Возбудитель мелиоидоза по биохимическим свойствам напоминает сапную палочку. Основное отличие состоит в утилизации источников углерода (см. выше). Не свертывает молоко, вызы
вая его пептонизацию.
Устойчивость возбудителя мелиоидоза более высокая, чем сапной палочки. В почве он сохраняется около одного, а в воде— 1,5 месяца, растворы распространенных дезинфектантов убивают медленнее.
Патогенность в естественных условиях проявляется заболеванием грызунов. Восприимчивы к микробу человек, обезьяны, лошади, собаки, мелкий рогатый скот. Основным выявленным фактором патогенности является эндотоксин, свежевыделенные штаммы продуцируют гемолизин, а продукты гидролиза возбудителя мелиоидоза вызывают гиперчувствительность замедленного типа.
Патогенез подобен описанному при сапе. Септикопиемический характер инфекции обусловливает очаговость поражения организма гнойниками. Появлению абсцессов, видимо, способствует также отсутствие у микроорганизмов инвазивных факторов.
Антигенная структура. Ps. pseudomallei представлена О-, Н-, К- и М-антигенами. Соматический антиген имеет общность с О-антигеном сапной бактерии или сохраняет видоспецифичность. Н-антигены присущи только возбудителю ложного сапа. К- и М-антигены являются самыми поверхностными структурами и обусловливают инагглютинабиль-ность.
Иммунитет при мелиоидозе принципиально, очевидно, сходен с механизмом невосприимчивости при сапе, хотя и менее выражен. При хронических формах болезни появляются агглютинины и комплементфик-сирующие антитела, а также развивается непостоянная аллергическая реакция на продукты гидролиза возбудителей сапа или мелиоидоза.
Диагностика основана преимущественно на бактериологическом и серологическом исследованиях.
Бактериологическое исследование складывается из микроскопии, выделения чистой культуры и постановки биологической пробы с материалом абсцессов, пораженных участков паренхиматозных органов или крови животных. Морских свинок заражают аппликацией материала на слизистые (развиваются местные гнойно-воспалительные процессы с гибелью животных через одну неделю), подкожно (развиваются местные некротические процессы с гибелью животных через три недели) или
194
в брюшную полость (развивается орхит и перитонит с повсеместными казеозными фокусами и гибелью животных).
Выделенную от экспериментальных животных культуру идентифицируют по подвижности, способности утилизировать определенные источники углерода (см. Культивирование), пептонизировать молоко и быстрее развиваться на питательных средах. При этом учитывается вид заболевших животных.
При серодиагностике обычно исследование проводят дважды, титр агглютининов в положительных случаях варьирует от 1:80 до 1:640.
Биопрепараты в виде лечебных сывороток или аутовакцины терапевтическим эффектом не обладают. Больных лечат соответствующими антибиотиками и сульфаниламидными препаратами.
ЛИСТЕРИИ
ВОЗБУДИТЕЛЬ ЛИСТЕРИОЗА
Листериоз — распространенное зоонозное заболевание. Оно зарегистрировано в 44 странах, в том числе СССР. Вызывается листериоз Listeria monocytogenes (род Listeria).
Морфология и тинкториальные свойства. L. monocytogenes подвижная бактерия с одним очень длинным полярным жгутиком. Имеет вид небольших палочек (0,5X1 >0—2,0 мкм), с закругленными краями, на некоторых средах — слабо изогнутые. Располагаются поодиночно, в виде римской пятерки, параллельно друг другу, парами и короткими цепочками. Спор и капсул не образуют (см. рис. 71).
Листерии хорошо окрашиваются всеми анилиновыми красками. Грамположительны. После 2—5-дневного культивирования становятся лабильными к окраске по Граму, с каждым днем появляется все больше грамнегативных клеток. На средах, содержащих глюкозу, обусловливает более стабильную грампозитивность.
Культивирование. Листерии —L факультативные аэробы, неприхотливы, размножаются при температуре 37 °C на обычных средах при pH 7,0—7,2, культуры вязкой консистенции, издают неприятный резкий, кислый запах. На МПБ вызывают небольшое помутнение среды с образованием слизистого осадка. На МПА образуются мелкие, росинчатые или беловатые с перламутровым оттенком плоские, гладкие, блестящие колонии. На печеночном агаре колонии слизистые. На кровяном агаре вокруг колоний образуется узкая зона гемолиза. Характерный рост наблюдают при посеве на плотную питательную среду (печеночный бульон + 8 % желатины + 0,25 % агара-М % глюкозы), при посеве в столбик этой среды листерии по ходу укола растут в виде сероватого «шнура», от которого под прямым углом отходят в глубь питательной среды как бы сливающиеся облачка (см. рис. 72).
Биохимические свойства. Листерии ферментируют с образованием кислоты без газа глюкозу, левулёзу, рамнозу и салицин, медленнее — сахарозу, декстрин, растворимый крахмал и глицерин; некоторые культуры разлагают лактозу и мальтозу. Не ферментируют арабинозу, дульцит, инулин, сорбит. Расщепление салицина дифференцирует листерий от рожистой бактерии. Листерии не образуют индола и сероводорода, не разжижают желатину, не восстанавливают нитраты в нитриты, выделяют бета-гемолизин. Разлагают перекись водорода с выделением пузырьков кислорода. Дают положительную пробу на каталазу.
Устойчивость. В бульонных культурах листерии погибают при 100 °C через 10—15 мин, при 70 °C — через 30 мин; в агаровых культурах, смытых водой, шри 60—70° С— через 5—10 мин, при 55°С — через 1 ч; 2,5%-ный фенол (карболовая кислота) убивает листерии через 5 мин, 2,5%-ный едкий натр, 2,5%-ный формалин — через 20 мин, 70%-ный 15* 195
спирт, 2,5 %-ный марганцовокислый калий и растйор сулемы 1: ’1000 — через 5 мин. В крови, консервированной 0,25 %-ным фенолом, микробы сохраняются не менее года, а в высушенном состоянии — 7 лет.
Длительное время листерии живут во внешней среде, могут размножаться в мертвых тканях при низкой температуре. Жизнеспособность сохраняется в отрубях и овсе до 105 дней, в сене и мясо-костной муке до 134 дней, погибают в солонине при низкой температуре. В прудовой воде при 35—37 °C остаются жизнеспособными до 346 дней, при температуре 15—20 °C — до 299 дней, в холодильнике (2—8 °C) и во льду — 790—928 дней. В навозе животноводческих помещений листерии выживают весной до 48 дней, летом — 25, а осенью— 130 дней, в трупах, зарытых в земле, — от 45 дней до четырех месяцев.
Патогенность. В естественных условиях листериозом заболеваюъов-цы, козы, крупный рогатый скот, свиньи, лошади..кролики, куры, гуси, уткиГ йндюкиГП^личные виды грызунов, зайцы, суслики, песчанки, крысы, мыши, морские свинки, водяные крысы, лисы, еноты, соболи, белки, косули, дикие свиньи, козы, жошки, собаки, обезьяны; из диких птиц — глухари, тетерева, куропатки, фазаны, канарейки. Для экспериментального изучения инфекции наиболее подходящими являются кролики и мыши, которые погибают после внутривенного или интраперитонеального, а мыши и после подкожного заражения вирулентными листериями. Инъекция от 0,000001 до 0,2 мл суточной культуры на са^ харном бульоне приводит к гибели этих животных через 1—5 (иногда 10—14) дней. Для воспроизведения листериозной инфекции у морских свинок требуются большие дозы.
Листерии продуцируют нейротоксин, г^мптоксин и ряд распространения.
Патогенез листериоза еще недостаточно изучен. Допускают возможность заражения лабораторных животных алиментарным путем с последующей локализацией возбудителя в органах центральной нервной системы, что подтверждается выделением листерий только нз мозга. Развитие энцефаломиелита у кроликов и мышей после введения нм убитых культур объясняют наличием у листерий нейротропного токсина. Когда же листерии локализуются в лимфатических узлах и паренхиматозных органах, заболевание протекает в форме инфекционного мононуклеоза с клинической картиной ангины.
Способность листерий проникать через гематоэнцефалический барьер в центральную нервную систему Сахаров объясняет наличием у культур листерий гиалуронидазы. У животных, павших от спонтанного и экспериментального 'листериоза, устанавливают трн типа локализации листерий в органах: 1) в головном мозге при отсутствии их во внутренних органах; 2) в головном мозге и во внутренних органах; 3) во внутренних органах при отсутствии их в головном мозге.
М. М. Халимбеков в крови ягнят через 2 ч после подкожного заражения обнаружил листерий, а гемокультуру выделял на протяжении 5—7 дней, что указывало на септическую форму инфекции. Листериозная инфекция у грызунов и свиней протекает преимущественно в септической форме, с некоторыми поражениями отдельных органов и моноцнтозом. У крупного рогатого скота, овец н коз поражается в основном центральная нервная система. Менингоэнцефалит рассматривается как одна нз форм проявления этого заболевания. Листериоз у крупного рогатого скота и у овец может сопровождаться абортами.
Антигенная структура. Листерии имеют два антигена: соматический и жгутиковый. Установлено четыре основных серотипа листерий (1, 2, 3, 4), при этом четвертый серотип делят на пять подтипов (a, b, с, d, е).
Тип антигенов определяют с помощью реакции агглютинации.
Иммунитет изучен недостаточно. В процессе переболевания листериозом в крови животных накапливаются агглютинины и комплемент-связывающие вещества.
Диагностика. Бактериологический диагноз. В ранних стадиях септической листериозной инфекции материалом исследования служит кровь для выделения гемокультур, а после смерти животного — печень, селезенка, лимфоузлы, надпочечники, сердце, мозг, мозжечок, легкие. От абортированных плодов крупного рогатого скота и овец бе
196
рут сычуг; от беременных животных — матку, яичники; молочную железу. До исследования материал рекомендуется сохранять при низкой температуре или в замороженном виде.
В редких случаях при подозрении на листериоз применяют бакте-риоскопический диагноз. Листерии обнаруживают в мазках, из материала, свободного в нормальном состоянии от микробов (меконий новорожденного), окрашенных по Граму. В мазках находят грампозитив-ные, короткие палочки, располагающиеся экстра- и интрацеллюлярно вместе с лейкоцитами и с мононуклеарными элементами.
При наличии листерий в материале выращивание их на питательных средах не представляет особых трудностей. Они хорошо размножаются на агаре с глюкозой, на кровяном или сывороточном агаре, в мясном бульоне и мясо-пептонном бульоне Тароцци. Учет высевов на кровяном и триптозном'агаре производится на 2, 4, 7 и 12-й день. Выращивание не всегда удается.
Некоторые авторы рекомендуют прибегать к биопробе на восприимчивых животных, а затем выделять возбудителя из органов этих животных.
Для диагностики листериоза применяют и конъюнктивальную пробу на морских свинках. У них возникает кератоконъюнктивит.
Иммунофлуоресцентную диагностику применяют для обнаружения возбудителя листериоза в патологическом материале, идентификации выделенных чистых культур и в смешанных культурах. Для исследования готовят мазки-отпечатки из патологического материала.
Дифференциация листерий. В связи с морфологическим и культуральным сходством листерий и рожистых бактерий их необходимо различать по следующим признакам (табл. 12).
12. Дифференциальные признаки листерии и рожистых бактерий
Окраска по Граму
Подвижность
Сбраживание салицина
Заражение морских свинок (конъюнктивальная проба)
Перекрестная агглютинация
Листерии
Бактерии рожи
Учитывая указанные признаки в таблице 12, необходимо однако иметь в виду, что исследования на подвижность и окрашивание по Гра-му следует производить в культурах не позднее суточного возраста, в старых культурах теряется подвижность и появляются грамнегативные клетки. Для установления подвижности листерий рекомендуют выращивать при комнатной температуре, так как при культивировании при 37/°С термолабильные жгутики у микробов разрушаются и подвижность их прекращается.
Серологический диагноз. Антигеном для РА является взвесь листерий в физиологическом растворе, консервированная 0,7 %-ним фенолом. При изготовлении антигена необходимо иметь в виду, что некоторые штаммы листерий склонны к самоагглютинации. Комп-лементсвязывающие вещества появляются лишь на короткий период времени. Положительной РА считается с разведением 1: 100 для свиней, овец и коз, сомнительной 1 :50, положительной для крупного рогатого скота 1 :200 и сомнительной 1 : 100.
Оценку результатов РА, РСК проводят с большой осторожностью.
Биопрепараты. Рекомендована и разрешена ГУВ МСХ СССР (1974 г.) для широкого производственного применения вакцина АУФ.
нН*
ряда (биомицин, террамицин, тетрациклин).
197
ЭРИЗИПЕЛОТРИКСЫ
ВОЗБУДИТЕЛЬ РОЖИ СВИНЕЙ
Рожа свиней — септическое антропозоонозное инфекционное забо-
левание, характеризующееся геморрагическим гастроэнтеритом, нефритом, кровоизлияниями на серозных и слизистых оболочках, увеличением селезенки. При несвоевременной запоздалой диагностике и принятии мер многие животные погибают.
Рожа свиней распространена в ряде стран. Возбудитель рожи свиней— Erysipelothrix rhusiopathiae, открыт Пастером в 1882 г. Его обнаруживают у свиней, мышей, ягнят, телят, индеек, уток, рыб, а также
человека. Поэтому правильнее называть эту группу заболеваний не ро-
жей свиней, а эрисипелоидом.
Морфология и тинкториальные свойства. Е. rhusiopathiae — поли-
морфная, короткая палочка размером 0,2—0,3x0,5—1,5 мкм, располагается одиночно и цепочками. Неподвижна. Спор и капсул не образует.
По данным электроноскопических исследований, в лизирующейся клетке видны протоспоры (Л. А. Степанова). Бактерии размножаются перешнуровыванием с образованием гетероморфных клеток. В старых культурах, а также в мазках из разращений эндокарда, из мозговых оболочек Е. rhusiopathiae образует длинные, извилистые нити или клубки
(см. рис. 73). В мазках из почек, печени, селезенки бактерии располагаются одиночно, парно или небольшими гнездами. Обнаруживают также и фагоцитированные бактерии.
Микроб хорошо окрашивается обычными анилиновыми красками,
грамположительный.
Культивирование. Е. rhusiopathiae — микроаэрофил. Неприхотлив к питательным средам. Культивируется на ПМБ, МПА, МПЖ, молоке, полужидком агаре (МПБ с 0,05—0,15 % агара), кровяной сыворотке, средах с углеводами, элективной среде Сент-Иваньи (агаровая среда, содержащая 0,1 % кристаллвиолета и 1 % азида натрия). Рост на питательных средах с pH 7,2—7,6 наблюдается при оптимальной температуре 37°C уже через сутки в аэробных и микроаэрофильных условиях. На бульоне появляется слабое помутнение, незначительный сероватый
осадок;^ на агаре колонии мелкие, нежные, прозрачные в виде капелек росы; на желатине при посеве уколом через 6—10 дней от сероватобелого стержня отходят горизонтальные, нежные, бахромчатые отростки, напоминающие собой форму ламповой щетки. Желатина не разжижается.
Биохимические свойства. Микроб образует H2S; ферментирует с образованием кислоты лактозу, глюкозу, левулёзу, галактозу, в слабой степени ксилозу, а иногда арабинозу, мальтозу и рамнозу.
Устойчивость. Несмотря на то что Е. rhusiopathiae не образует спор, она весьма устойчива к внешним воздействиям. Жизнеспособность ее в жидких средах в запаянных ампулах сохраняется до 17—35 лет, в загнившем трупном материале — месяцами, в речной воде — до 73 дней, моче — до 203, фекалиях — до 94, в почвенной взвеси — до 108 дней. Высушивание выдерживает до трех недель.
Однако нагревание убивает рожистую бактерию уже при 50 °C через 15 мин, а при 70°С — через 5 мин. Но при варке толстых кусков мяса бактерия гибнет лишь через 2,5 ч. Переживает в течение зимы. Жарение и тушение не стерилизуют мясо от рожистой бактерии. Бактерию находили в копченой свинине через 90, а в солонине — через 170 дней после изготовления. Обычные дезинфицирующие растворы эффективны. Чувствительна к УФ-лучам.
Патогенность. Рожистая бактерия широко распространена в животном мире. В естественных условиях патогенна для' свиней, ягнят, ин
198
деек, кур, уток, голубей. Ее встречают у ворон, воробьев, дроф, фламинго и других птиц, у тюленей, дельфинов, а также у иксодовых клещей и млекопитающих зоопарка — белок, пятнистых оленей. Для речных и морских рыб рожистая бактерия является сапрофитом. К рожистой бактерии восприимчив и человек, у которого наблюдается эри-сипелоид в форме местного (чаще на ладонях, кистях рук, суставах запястья) серозного воспаления кожи с расширением лимфатических ходов без некроза. К экспериментальному подкожному заражению восприимчивы особенно белые мыши и голуби, которые гибнут спустя 2—5 дней, менее чувствительны кролики, которые после внутривенного заражения гибнут через 3—6 дней.
Инкубационный период рожи свиней от 1 до 8 дней. У клинически здоровых свиней широко распространено бактерионосительство рожистой бактерии. Ее обнаруживали у 30—50 % здоровых свиней в миндалинах и кишечнике в неблагополучных хозяйствах. В таких хозяйствах широко распространено бактериопоснтсльства~у крыс и мышей до 20,3% (Тилга).
Различные формы рожи свиней: молниеносные, острые, подострые, хронические и бессимптомное бактерионосительство, определяются изменчивостью рожистой бактерии и различной реактивностью свиней.
Патогенез. Возбудитель рожи проникает в организм животного различными путями. При пероральном заражении бактерии первоначально оседают в миндалинах и солитарных фолликулах кишечника, а при заражении через кожные царапины — в лимфатических щелях пораженного участка, вокруг которого возникает местный воспалительный процесс. Через несколько дней микробы преодолевают защитные барьеры, проникают в кровь, размножаются в ней и распространяются по организму. Септический процесс вызывает лихорадочную реакцию, нарушение тканевого обмена, дистрофические и некротические изменения в паренхиматозных органах и сердечно-сосудистой системе, что ведет к образованию тромбов, отеков и к летальному исходу.
Прн хорошо выраженной реактивности животного организм организует действенную защиту против возбудителя, который своими агрессинами тормозит в начале заболевания противодействие лейкоцитов и макрофагов РЭС, и, хотя оии фагоцитируют микробов, лизиса последних не наступает (незавершенный фагоцитоз). С появлением агглютининов, преципнтинов н комплементсвязывающих веществ, антиагрессинов сочетанное действие фагоцитоза с антителами приводит к ликвидации возбудителя.
Антигенная структура. Рожистая бактерия содержит два антигена: термолабильный групповой и термостабильный видовой. На основании серологических исследований (реакции преципитации, агглютинации, гемагглютинации) установлено два серовара. Серовар А для свиней более вирулентен, а серовар В менее вирулентен. Серовар А выделяется в культурах от больных рожей свиней наиболее часто (до 95 %). Общим видовым является антиген N.
Иммунитет. Свиньи, переболевшие рожей, приобретают стойкий иммунитет. Он определяется повышением активности макро- и микрофагов, усилением опсонизирующих свойств крови, образованием специфических агглютининов, преципитинов, антиагрессинов, комплементсвязывающих веществ, развитием аллергического состояния.
Диагностика. Бактериологический диагноз включает бактериоскопию, выделение культур и биопробу. В лабораторию направляют кусочки селезенки, печени, почку, трубчатую кость, кусочки кожи (при крапивнице), сердце (при эндокардите), невскрытые суставы (при артритах). Патологический материал консервируют 30—40 %-ным глицерином или насыщенным раствором NaCL Трубчатую кость, очищенную от мышц и сухожилий, обертывают марлей, смоченной 2 %-ным раствором карболовой кислоты.
Из свежего патматериала готовят мазки, окрашивают их по Граму и микроскопируют. В мазках обнаруживают грамположитеяьные бактерии, расположенные одиночно и группами, внутри и Вне лейкоцитов, а в мазках-отпечатках с поверхности сердечных клапанов при эндокар-
199
дите — сплетения микробных нитей. Загнивший материал непригоден для бактериоскопий.
Культуры рожистой бактерии выделяют из селезенки, почки, а если материал несвежий, то из мозга трубчатых костей, лимфоузлов, а также
из пораженных участков кожи.
Материалом для заражения лабораторных животных (биопроба), которые гибнут через 3—5 дней, служит эмульсия из паренхиматозных органов на|стерильном физрастворе. Из загнившего трупа берут кусочки кожи или мозг из трубчатых костей. Заражают в основном голубей, так как в загнившем материале может быть В. murisepticus, патогенный для белых мышей.
Серологическая диагностика. Для выявления хронических и латентных форм рожи используют реакцию агглютинации в двух модификациях: пластинчатый (ускоренный) с сывороткой или цельной кровью исследуемого животного и, пробирочный способ с исследуемой сывороткой. '
Для постановки РА необходимо два компонента: антиген и иссле-
дуемая сыворотка или кровь. Срок годности антигена — шесть месяцев, при хранении в темном сухом помещении при температуре от 8° до 15 °C.
Пластинчатую реакцию ставят на обезжиренном и досуха протертом стекле. Из полученной пробы берут каплю крови (величиной 0,004— 0,006 мл) или сыворотки (0,002—0,003 мл), наносят ее на предметное стекло в каплю антигена и перемешивают. Затем стекло с нанесенными каплями (антиген + кровь или сыворотка) держат над спиртовкой, слегка подогревая, кругообразно покачивают. Реакцию учитывают над темным фоном. Положительной реакцией считается образование в течение 1—2 мин от периферии к центру капли макроскопически хорошо заметных мелких или крупных серовато-белого цвета хлопьев или крупинок. При неполном выпадении реакцию считают сомнительной.
В пробирке реакцию ставят с разведением сыворотки 1: 50 и 1: 100.
Следует учитывать, что агглютинины у свиней появляются на 2— 5-й день болезни и сохраняются в крови выздоровевших животных 2—3 недели. После вакцинации свиней РА с диагностической целью можно ставить не ранее чем через 2 месяца, а после прививки противорожистой сыворотки — через 1 месяц.
Для обнаружения рожистых бактерий в патологическом материале, а также для идентификации чистых выделенных культур можно применять метод флуоресцирующих антител.
Биопрепараты. Профилактика рожи свиней осуществляется путем создания активного (вакцинного) или пассивного (сывороточного) иммунитета. Первые живые вакцины против рожи свиней создали Пастер и Тюлье в 1883 г. путем аттенуации (ослабления) рожистой бактерии. Они установили, что возбудитель рожи при пассажировании через кроликов усиливает вирулентность для них и ослабляет для свиней; пассажи через голубей усиливают вирулентность микроба для свиней и голубей. На основе принципа Пастера и Тюлье в России Боровский (1896), а затем Конев (1899) получили собственные вакцины. I вакцина Конева была ослаблена пассажированием вирулентной рожистой бактерии через семь кроликов. Эта вакцина не убивала голубей, но вирулентна для мышей. II вакцина Конева была ослаблена пассажированием через четырех кроликов. Матрикс II вакцины убивает молодых голубей и мышей. Вакцины Конева применяли более 30 лет. В 1933—1935 гг. они были модифицированы в ВГНКИ в связи со снижением у них остаточной вирулентности и иммуногенности.
В настоящее время используют несколько вакцин. Депонированная вакцина представляет собой живую культуру матрикса II Конева, адсорбированную на фосфатно-буферном растворе гидрата окиси алюми
200
ния. Вакцина имеет беловато-мутный цвет; при длительном хранении на дне флакона образуется беловатый осадок с прозрачной надосадочной жидкостью. При встряхивании флакона осадок легко разбивается с образованием равномерной взвеси. Вакцину можно применять при установлении: 1) типичного роста на питательных средах при высевах из флаконов и чистой культуры при бактериоскопии мазков; 2) авиру-лентности для голубей, которые остаются живыми в течение 10 суток после внутримышечного заражения в дозе 0,5 мл и при гибели мышей через 5—12 суток после подкожного заражения их в дозе 0,1 мл.
Живая вакцина из слабовирулентногъ штамма VR2. Вакцинный штамм VR2 был выделен из трупа свиньи в 1931 г. румынским исследователем В. Виноградником. В процессе многократных пересевов на искусственных питательных средах штамм постепенно ослабил свои первоначальные вирулентные свойства, стал авирулентным для свиней и кроликов и слабовирулентным для белых мышей и голубей.
Вакцина VR2 культивируется на полужидкой питательной среде бульона Мартена, бульона Хоттингера или МПБ. Она представляет собой слегка опалесцирующую вязкую жидкость желтовато-соломенного цвета с незначительным осадком на дне флакона, который при встряхивании легко разбивается, образуя равномерную взвесь.
Вакцина признается пригодной при установлении: 1) чистого типичного роста культуры рожистой бактерии с соответствующей морфологией клеток, грампозитивностью в мазках; 2) безвредности для 20 белых мышей в течение 10—12 дней наблюдения после заражения вакциной в дозе 0,2 мл; 3) иммунитета у них и выживаемости против заражения при гибели через 3—5 дней контрольных трех белых мышей, зараженных 10 минимальными смертельными дозами.
Вакцину считают также активной при выживаемости не менее 75 % вакцинированных белых мышей. Срок годности вакцины 6 месяцев со дня изготовления при хранении в сухом темном помещении при температуре 2—10 °C. Вакцину применяют с профилактической целью, прививая все поголовье свиней с 2,5-месячного возраста. С вынужденной целью в неблагополучных хозяйствах вакцинируют с 2-месячного возраста. Свиноматок прививают не позднее 15—20 дней до случки. Иммунитет при вакцинации VR2 наступает через 8—10 дней и сохраняется 4—6 месяцев.
Сухая вакцина ССВР является слабовирулентной культурой вакцинного штамма рожистой бактерии VR2, концентрированная буферной взвесью гидрата окиси алюминия и высушенная с защитной сахарозожелатиноагаровой средой. Она представляет собой аморфную или мелкозернистую массу беловатого или светло-желтого цвета. При разведении вакцины растворителем образуется опалесцирующая жидкость желтого цвета, содержащая равномерную взвесь рожистых бактерий.
Вакцина признается пригодной к практическому применению при установлении: 1) морфологической чистоты в мазках из типичной культуры, высеянной из вакцины, с грампозитивной окраской клеток; 2) безвредности, выживаемости 20 белых мышей, привитых разведенной 1 : 10 в бульоне или физрастворе вакциной в дозе 0,2 мл, при наблюдении в течение 10—12 дней; 3) иммуногенности и выживаемости 20 белых мышей, вакцинированных после заражения их 10 минимальными смертельными дозами вирулентного штамма рожи свиней и при гибели трех контрольных белых мышей в течение 3—5 суток. Вакцина признается активной и при выживаемости 75 % вакцинированных белых мышей. Срок годности ее 12 месяцев при условиях хранения в сухом месте (температура не выше 10°С). Иммунитет наступает на 8— 10-й день и сохраняется до 6—8 месяцев.
201
т г ? Прйменение вакпнны осуществляется в соответствии с действующей инструкцией по борьбе с рожей свиней и наставлений по применению противорожистых вакцин.
Концентрированная гидроокисьалюминиевая формолвакцина представляет собой адсорбированную на гидрате окиси алюминия и инактивированную формалином культуру возбудителя рожи свиней. Это вязкая желтоватого цвета жидкость с осадком на дне, который при встряхивании разбивается в равномерную муть. Вакцина пригодна к применению при установлении: 1) стерильности высевов на питательных средах; 2) безвредности при проверке на белых мышах; 3) иммуногенности при испытании на голубях.
Годность вакцины один год при условии хранения в темном сухом помещении (температура 4—10°C). Используют ее для предохранительных и вынужденных прививок свиней против заболевания рожей. Вакцинируют только здоровых животных. При наличии в хозяйствах других заразных заболеваний (чума, ящур, болезнь Ауески, инфлюэнца и др.) вакцину прививать нельзя; в этом случае применяют противоро-жистую сыворотку.
Иммунную противорожистую сыворотку получают путем гипериммунизации свиней, лошадей, волов или овец культурой возбудителя рожи. Ее проверяют на стерильность, безвредность и активность.
Стерильность проверяется высевами из не менее пяти флаконов на мясо-пептонный бульон, агар и мясо-пептонный печеночный бульон под вазелиновым маслом. Сыворотку признают годной, если посевы, выдержанные при температуре 37 °C в течение 10 дней, остаются стерильными.
Безвредность контролируют введением испытуемой сыворотки подкожно в дозе 0,5 мл двум белым мышам (масса 15—18 г) и одной морской свинке (масса не менее 400 г) в дозе 10 мл. В течение 10 дней привитые сывороткой животные должны остаться живыми.
Активность противорожистой сыворотки проверяют титрованием на здоровых белых мышах (масса 15—18 г) в дозах 0,01; 0,02; 0,03 мл (по три белых мыши на дозу). Сыворотку разводят физраствором до указанных концентраций и вводят белым мышам интраперитонеально. Через 1—1,5 ч всем привитым мышам и трем непривитым контрольным инъецируют подкожно вирулентную суточную культуру рожи свиней. Культуру титруют заранее и вводят в дозе 0,001—0,002 мл. Эта доза вызывает гибель контрольных мышей на 3—4-е сутки. Сыворотка считается активной при условии выживания всех девяти мышей, привитых сывороткой в указанных дозах после заражения их вирулентной культурой рожи свиней, или если погибают белые мыши, привитые сывороткой в дозе 0,01 мл.
Противорожистая сыворотка контролируется также и на девяти голубях. Шести голубям прививают сыворотку в грудную мышцу, а спустя полчаса им вводят вытитрованную вирулентную культуру возбудителя. Три контрольных голубя только заражаются культурой рожистой бактерии. Сыворотку вводят в дозах 0,1; 0,3; 0,5 мл по два голубя на каждую дозу. Сыворотка считается активной, если остаются живыми:
1) все голуби привитые ею; 2) голуби, привитые в дозе 0,3 и 0,5 мл; 3) три голубя из числа привитых сывороткой в дозе 0,3 и 0,5 мл при условии гибели всех контрольных голубей.
Сыворотка, консервированная фенолом или хинозолом, пригодна 4 года. Противорожистую сыворотку применяют с профилактической и лечебной целью. Иммунитет у животных сохраняется от 14 дней до месяца.
Антибиотики, особенно пенициллин, являются эффективным средством лечения рожи свиней. Вначале его лучше применять одновременно с противорожистой сывороткой, а затем вводят 3—4 раза через каж* 202
дыеу8Ш12 ч в дозе 2^-3-тыс. ЕД/кг.г ЭКМОйойбЦиллин
в дозах 5—10 тыс. ЕД/кг 2—3 раза с интервалом в 24 ч. Лечебное действие других антибиотиков изучено еще недостаточно.
ПАТОГЕННЫЕ БАЦИЛЛЫ
ВОЗБУДИТЕЛЬ СИБИРСКОЙ ЯЗВЫ
Возбудитель сибирской язвы— Вас. anthracis (Cohn, 1872) —является типичным представителем патогенных бацилл, относится к отряду Eubacteriales, семейству Bacillaceae и роду Bacillus. Микроб сибирской язвы часто называют бациллой антракса.
Сибирская язва (Anthrax); — зооантропозооноз. К ней восприимчивы животные многих видов, особенно травоядные, и человек. Инфекционный процесс протекает преимущественно остро с явлениями септицемии или с образованием различной величины карбункулов. Заболевание регистрируют в виде спорадических случаев, возможны энзоотии и даже эпизоотии. Название болезни «сибирская язва» предложил в 1789 г. С. С. Андриевский, который изучал ее на Урале и в Сибири.
Микроскопически бацилла сибирской язвы обнаружена Полленде-ром в 1849 г. Французские исследователи Давэн и Рейе (1850), а в России профессор Дерптского ветеринарного училища Брауэлл (1857) отметили также в крови больных и погибших от сибирской язвы овец наличие нитевидных неподвижных и неветвящихся телец. Брауэлл один из первых выявил бациллы в крови человека, умершего от сибирской язвы, и экспериментально воспроизвел типичное заболевание у животных при заражении их кровью, содержащей микроскопически видимые палочки. Однако значение этих палочек оставалось невыясненным до 1863 г., до тех пор, когда Давэн окончательно установил роль этих образований в качестве патогенных возбудителей сибирской язвы.
Чистые культуры бациллы антракса выделены в 1876 г. вначале Р. Кохом, а затем Л. Пастером; независимо один от другого они при помощи этих культур воспроизвели заболевание у животных. В России первую культуру сибиреязвенного микроба получил В. К. Высокович в 1882 г. Исследованиями Р. Коха в 1876 г, было доказано, что вегетативные клетки сибиреязвенного микроба обладают способностью формировать споры, в 1888 г. Серафини обнаружена капсула.
Морфология и тиикториальиые свойства. Бацилла антракса довольно крупная (1—1,3X3,0—10,0 мкм) палочка, неподвижная, образующая капсулу и спору. Микроб встречается в трех формах; в виде вегетативных различной величины клеток (капсульных и бескапсуль-ных), в виде спор, заключенных в хорошо выраженный экзоспориум и в виде изолированных спор. В препаратах из крови и тканей больных или погибших от сибирской язвы животных бактерии в неокрашенном состоянии имеют форму гомогенных прозрачных палочек с четко закругленными концами. Лежат они изолированно или соединяются в короткие цепочки. Морфология неокрашенных бактерий из культур, выращенных на плотных или жидких питательных средах, аналогична описанной выше.
В мазках из культур штаммов, дающих типичный рост в жидких питательных средах в виде хлопьевидного осадка, палочки располагаются длинными цепочками (см. рис. 74). Бактерии из культур с атипичным диффузным ростом в жидких средах образуют короткие цепочки. Интактные клетки, контрастированные негативно фосфорно-воль-фрамовой кислотой, в электронном микроскопе напоминают цилиндры с правильно загруженными краями, имеют неодинаковую длину и соединены между собой оптически плотными промежутками (см. рис. 75).
203
В окрашенных препаратах концы образующих цепочки палочек, обращенных друг к другу, прямые, резко обрубленные, свободные же концы бактерий слегка закруглены. Иногда цепочки имеют форму бамбуковой трости (см. рис. 76); в этом случае микробные клетки как бы обрублены, отчасти вдавлены в середину и в местах сочленения симметрично утолщены. Такие морфологические формы встречаются только у бактерий, образующих капсулу при росте на белковых средах или в организме животных.
Возбудитель сибирской язвы интенсивно окрашивается спирто-водными растворами основных анилиновых красок. Мазки и отпечатки из тканей погибших животных, а также мазки из крови очень хорошо окрашиваются леффлеровской метиленовой синькой. Препараты из культур можно окрашивать 1—2 мин разведенным 1 :10 фуксином Циля и метиленовой синькой. Данная бактерия (вегетативная форма) грампо-ложительная, но в молодых и старых культурах встречаются и грамотрицательные клетки.
В организме или при культивировании на искусственных питательных средах с большим содержанием нативного белка и СОз сибиреязвенная бацилла образует выраженную капсулу. На ультратонких срезах капсульных форм бациллы антракса из органов зараженных животных капсула представлена мощным компактным слоем, тесно примыкающим к стенке вегетативной клетки. У большинства бактерий капсула имеет гранулярное строение.
Сибиреязвенная бацилла при неблагоприятных условиях существования обладает способностью формировать споры. В каждой вегетативной клетке, или спорангии, образуется только одна эндоспора, чаще располагающаяся центрально, реже — субтерминально. Споры бациллы антракса овальные, иногда округлые, сильно преломляющие свет образования. Размеры зрелых спор колеблются в пределах 1,2—1,5 мкм в длину и 0,8—1 мкм в поперечнике, незрелые споры (проспоры) несколько меньше. При температуре ниже 12°C и выше 42°C, а также в живом организме или невскрытом трупе, в крови и сыворотке крови животных споры не образуются.
Культивирование. Наиболее благоприятны для роста бациллы антракса питательные среды, содержащие в своем составе частично гидролизованные до пептонов и полипептидов белковые комплексы. Бактерия может также интенсивно размножаться и в безбелковых синтетических средах, состоящих из определенного набора аминокислот. В качестве источника энергии могут быть использованы различные соединения углерода: глюкоза, сахароза, мальтоза, глицерин и др.
Сибиреязвенный микроб по способу дыхания относят к факультативным анаэробам: он одинаково хорошо развивается в условиях повышенной аэрации, в том числе и в атмосфере кислорода, и в строго анаэробных условиях. v
Бацилла антракса нетребовательна к питательным средам и хорошо растет на универсальных средах (МПБ, МПА, МПЖ, картофеле, молоке). Кроме того, ее выращивают на различных растительных субстратах: настоях соломы, сена, экстрактах гороха, сои, вики, ломтиках вареного картофеля, свеклы, моркови и т. п.
Опитимальная температура роста на МПА 35—37°C, в бульоне 32—33 °C. Рост ниже 12° и выше 45 °C не происходит. Оптимум pH сред лежит в пределах 7,2—7,6, однако значение pH от 6,7 до 8,5 не угнетают рост культур.
На поверхности МПА в аэробных условиях при температуре 37 °C первые признаки роста можно заметить через 3 ч с момента посева, 17—24-часовые культуры состоят из серовато-беловатых тонкозернистых колоний с серебристым оттенком, похожих на снежинки. Диаметр колоний не превышает 3—5 мм. От их краев отходят завитки, ко-204
снчки, которые состоят из параллельно лежащих длинных нитеи (см. рис. 77). Свойство бациллы образовывать на плотных питательных средах завитки, с выходящими за пределы колонии нитями, дало повод сравнивать колонии этого микроба с мифической головой Медузы Горгоны. Такие колонии имеют шероховатый рельеф, они характерны для типичных вирулентных штаммов и обозначаются как R-форма.
На сывороточном агаре и свернутой лошадиной сыворотке в присутствии 10—50 % углекислоты обнаруживаются гладкие полупрозрачные колонии (S-форма), а также слизистые (мукоидные) тянущиеся за петлей колонии (М-форма), состоящие из капсульных палочек. Бескап-сульные варианты на указанных средах образуют шероховатые R-фор-мы колоний. В МПБ и других жидких средах сибиреязвенная бацилла (R-форма) через 16—24 ч на дне пробирки образует рыхлый белый осадок, надосадочная жидкость остается прозрачной, при встряхивании бульон не мутнеет, осадок разбивается на мелкие хлопья. Ряд штаммов растет в виде нежных отдельных хлопьев, взвешенных в столбике бульона, которые через 48 ч оседают на дно. Некоторые штаммы на 3—4-е сутки дают рыхлое пристеночное кольцо по мениску бульона, пленка на поверхности среды никогда не образуется.
В сыворотке крови и жидких сывороточных средах (среда ГКИ) растет интенсивно с образованием обильного хлопьевидного осадка, капсульные варианты синтезируют мощные капсулы.
Весьма характерный рост отмечают в столбике желатины при посеве уколом. В этой среде на 2—5-е сутки появляется желтовато-белый стержень, от которого под прямым углом радиально отходят нежные боковые отростки — более длинные по мере приближения к поверхности среды (лучшие условия аэрации) и значительно укорачивающиеся в направлении книзу. Такая культура напоминает елочку, перевернутую верхушкой вниз. Постепенно верхний слой желатины начинает разжижаться, принимая сначала форму воронки, затем мешочка. В молоке размножается быстро, вырабатывает кислоту и через 2—4 дня свертывает его с последующей пептонизацией сгустка. На картофеле образует обильный, сухой, серо-белый налет, который иногда приобретает кремовый оттенок. Агаровые и бульонные культуры некоторых штаммов интенсивно окрашиваются в коричневый цвет вследствие окисления тирозина. Сибиреязвенная бацилла также хорошо размножается в 8—12-суточных куриных эмбрионах, вызывая их гибель в период 2—4 дней с момента заражения.
Биохимические свойства. У бациллы антракса выявлены ферменты: липаза, диастаза, протеаза, желатиназа, дегидраза, цитохромокси-даза, пероксидаза, каталаза и др. Некоторые штаммы образуют сероводород, особенно это свойство выражено в средах, богатых пептонами; эта бактерия выделяет аммиак. Ферментирует с образованием кислоты без газа: глюкозу, мальтозу, медленно сахарозу, трегалозу, фруктозу и декстрин. На средах с глицерином и салицином возможно слабое кислотообразование. Арабинозу, рамнозу, галактозу, маннозу, раффинозу, инулин, маннит, дульцит, сорбит, инозит не сбраживает. Утилизирует цитраты, образует ацетилметилкарбинол и вследствие этого дает положительную реакцию Фогес — Проскауэра. Синтезирует лецитиназу и медленно коагулирует растворы желтка куриного яйца. Редуцирует метиленовый синий и неактивно восстанавливает нитраты и нитриты. Вырабатывает желатиназу, а также протеазу и достаточно быстро гидролизует желатину и свернутую сыворотку.
Устойчивость и длительность выживания у вегетативных клеток и спор возбудителя сибирской язвы различны. Первые относительно лабильны, вторые достаточно резистентны.
В невскрытом трупе вегетативная форма микроба в результате воздействия протеолитических ферментов разрушается уже в течение
205
2—3 суток, в зарытых трупах может сохраняться до четырех дней, через семь суток завершается лизис бактерий даже в костном мозге. В желудочном соке при 38 °C гибнет через 30 мин, в замороженном мясе при —15 °C остается жизнеспособной 15 дней, в засоленном мясе — до 1,5 месяца. Навозная жижа, смешанная с сибиреязвенной кровью, убивает вегетативные клетки через 2—3 ч, споры же остаются в ней вирулентными в течение месяцев.
В отличие от вегетативных клеток споры бациллы антракса более длительно сохраняются во внешней среде. Резистентность спор во многом зависит от того, насколько они быстро сформировались. Так, споры, образовавшиеся при 18—20 °C, более резистентны, чем споры, сформировавшиеся при температуре 35—38 °C. Споры сибиреязвенных вакцин Ланге сохраняли жизнеспособность в течение 80-летнего срока наблюдения (В. П. Кивалкина). В запаянных ампулах с бульонными культурами споры могут оставаться жизнеспособными и вирулентными до 63 лет, в почве — более 50 лет. Особенно благоприятны для длительного сохранения спор почвы, богатые гумусом и нейтральным pH. В этих почвах при элективных режимах температуры, влажности и аэрации не исключена вегетация спор (К. А. Миротворский, 1940).
К воздействию различных химических веществ вегетативные клетки малоустойчивы. Спирт, эфир, 2%-ный формалин, 5 %-ный фенол, 5—10 %-ный хлорамин, свежий 5 %-ный раствор хлорной извести, перекись водорода их разрушает в течение 5 мин. Для уничтожения споровой формы возбудителя требуется более длительная экспозиция. Этиловый спирт в концентрациях от 25 % до абсолютного убивает споры в течение 50 дней и более, 5 %-ный фенол, 5—10 %-ный растворы хлорамина обезвреживают споры через несколько часов и даже суток, 1 %-ный раствор формалина — через 2 ч, 2%-ный формалин —через 10—15 мин, 3 %-ный раствор перекиси водорода — через 1 ч, 4 %-ный марганцовокислый калий — через 15 мин, 10 %-ный едкий натрий — че* рез 2 ч. Важное значение имеет температура дезинфицирующего раствора и концентрация спор.
Вегетативные клетки также малоустойчивы и к температурным факторам. При нагревании до 50—55 °C гибнут в течение 1 ч, при 60 °C — через 15 мин, при 75 °C — через 1 мин, при кипячении —мгновенно. Они чувствительны к высушиванию, однако при медленном высушивании наступает спорообразование и микроб не гибнет. Низкие же температуры их консервируют. Так, при —10 °C бактерии сохраняются 24 дня, при —24 °C—12 дней, даже при температуре жидкого азота (—196 °C) не гибнут в течение 24 ч. Воздействие прямого солнечного света обезвреживает бактерии через несколько часов.
На споры высушивание вообще не оказывает губительного действия. Сухой жар при 120—140 °C убивает споры только через 2—3 ч, при 150 °C — через 1 ч, текучий пар при 100 °C — через 12—15 мин, автоклавирование при 110 °C — через 5—10 мин, кипячение — через 1 ч.
Возбудитель сибирской язвы проявляет высокую чувствительность к литическому действию лизоцима. Бактериостатическим эффектом на протяжении 24 ч обладает свежевыдоенное молоко коров.
Может также проявляться антагонистическое влияние на бациллу антракса ряда микроорганизмов: сальмонелл, кишечной палочки, протея, стафилокков, актиномицет и др. Антагонизм энтеробактерий отчасти объясняет причину редкого возникновения кишечных форм сибирской язвы у животных.
На этот вид микроба может оказывать влияние ризосфера некоторых высших растений. В. В. Архипов (1951) констатировал, что корневые выделения клевера, ревеня, вики, пшеницы, ржи и чеснока подавляют размножение сибиреязвенной бациллы в почве.
Сибиреязвенные бациллы выделяют специфический ДНК-овый фаг.
206
Под вйияййем пенициллина в присутствии сыворотки крови у возбудителя сибирской язвы могут образовываться нестабильные и стабильные L-формы. Они возникают в результате блокирования синтеза клеточной стенки и рассматриваются как проявление фенотипической изменчивости.
Патогенность. Бацилла антракса образует сложный экзотоксин. Этот токсин состоит из трех компонентов (факторов), которые обозначаются; эдематогенный фактор (EF), протективный антиген (РА) и летальный фактор (LF) или соответственно I, II и III факторы. Все они синтезируют капсульные и бескапсульные варианты микроба. Эдематогенный фактор вызывает местную воспалительную реакцию — отек и разрушение тканей. В химическом отношении это липопротеин. Протективный антиген — носитель защитных свойств, обладает выраженным иммуногенным действием. В чистом виде не токсичен. Летальный фактор сам по себе не токсичен, но в смеси со вторым фактором (РА) вызывает гибель крыс, белых мышей и морских свинок. Протективный антиген и летальный фактор гетерогенные в молекулярном отношении белки. Все три компонента токсина составляют синергическую смесь, оказывающую одновременно эдематогенное и летальное действие, каждый из них обладает выраженной антигенной функцией и серологически активен.
Инвазивные свойства обусловлены капсульным d-глутаминовым полипептидом и экзоферментами.
Антигенная структура. В состав антигенов бациллы антракса входят неиммуногенный соматический полисахаридный комплекс и капсульный глутамин-полипептид. Полисахаридный антиген не создает иммунитета у животных и не определяет агрессивных функций бациллы, его всегда обнаруживают как у вирулентных, так и авирулентных штаммов. В связи с тем, что полисахарид тесно связан с телом бактериальной клетки, он получил название соматического антигена. Сибиреязвенный соматический антиген очень часто обозначается буквой С, капсульный полипептид — буквой Р. Капсульный антиген бациллы антракса представлен сложным полипептидом d-глутаминовой кислоты и рассматривается как группоспецифическое вещество, так как он дает перекрестные серологические реакции с полипептидом Вас. subtilis, Вас. cereus и Вас. megaterium. Активными антигенами также являются все три компонента сибиреязвеннного экзотоксина.
Иммунитет. Сейчас значительно расширились представления о механизмах иммуногенеза при сибирской язве. Установлено, что соматический полисахарид и капсульный полипептид глутаминовой кислоты бациллы антракса не способны обусловить синтез защитных антител. Эту функцию у бациллы антракса выполняет протективный антиген: будучи одним из факторов патогенности, он обусловливает формирование иммунитета к этой инфекции по типу антитоксического,
В настоящее время защитные антитела обнаружены при помощи РСК, РДП и непрямого варианта метода флуоресцирующих антител в сыворотках животных, вакцинированных сибиреязвенным протективным антигеном или живыми споровыми вакцинами.
Важнейшим фактором антимикробного противосибиреязвенного иммунитета является фагоцитоз, о чем еще в 1901 г. сообщал И. И. Меч
ников.
Переболевание животного сибирской язвой или же его вакцина-
ция сопровождаются развитием чувствительности замедленного типа. Аллергенной активностью обладают фракции бациллы антракса с пре*
имущественным содержанием белка.
В результате естественного заражения и переболевания сибирской язвой у животных возникает длительный и стойкий иммунитет.
иагностика. Для лабораторного исследования на сибирскую язву
207
чаще всего направляют ухо павшего животного. Можно взять кровь из надреза сосуда и нанести толстую каплю на предметное стекло. При вынужденном убое или подозрении на сибирскую язву во время вскрытия осторожно отбирают кусочки селезенки, печени, измененные лимфоузлы. От трупов свиней берут кусочки воспаленных тканей в области глотки и заглоточные лимфоузлы. Материал должен быть свежим: в разложившихся тканях бацилла антракса лизируется. Исследуют также пробы почвы, фуража, воды, шерсти и кожевенно-мехового сырья; объектами для серологического исследования по реакции преципитации служат пробы кожевенно-мехового сырья и разложившиеся ткани.
Исследование проводится по схеме: микроскопия мазков, выделение и изучение свойств чистой культуры, биопроба на лабораторных животных, при необходимости серологические исследования — реакция преципитации и иммунофлуоресцентный анализ.
Бактериоскопия. Из патологического материала для микроскопии готовят мазки, часть красят по Граму и обязательно на капсулы по Ми-хину, Ребигеру, Ольту и др. Важным диагностическим признаком является обнаружение типичных по морфологии капсульных палочек.
Посев на питательные среды. Исходный материал засевают на МПБ и МПА (pH 7,2—7,6), инкубируют посевы при температуре 37 °C в течение 18—24 ч, при отсутствии роста их выдерживают в термостате еще двое суток. Культуры просматривают, определяют их типичность, готовят препараты, микроскопируют.
Биологическая проба осуществляется на лабораторных животных (белых мышах, морских свинках, кроликах) одновременно с посевом материала на питательные среды. Белых мышей заражают подкожно в заднюю часть спины (по 0,1—0,2 мл), морских свинок и кроликов — под кожу в область живота (по 0,5—1 мл). Мыши погибают через 1—2 суток, морские свинки и кролики — через 2—4 суток. Павших животных вскрывают, делают мазки и посевы из крови сердца, селезенки, печени и инфильтрата на месте инъекции исследуемого материала.
Идентификация бациллы антракса. В природе существует ряд видов аэробных споровых сибиреязвенноподобных сапрофитов. К ним относят: Вас. cereus, Вас. megaterium, Вас. mycoides, Вас. subtilis, Вас. mesen-tericus, а иногда в качестве самостоятельных видов еще Вас. antraco-ides и Вас. pseudoanthracis (синонимы Вас. cereus). Так как они по морфологии и культуральным признакам во многом сходны с бациллой антракса, то часто при лабораторных исследованиях возникает необходимость решить вопрос, выделена культура возбудителя сибирской язвы или подобного ему сапрофита.
Идентификацию и дифференциацию культуры проводят на основании главных и дополнительных признаков. К первым относится патогенность, капсулообразование, тест жемчужного ожерелья, лизабельность фагом, иммунофлуоресцентный тест. Дополнительными являются неподвижность, отсутствие гемолиза, лецитиназная активность, образование фосфатазы (Э. Н. Шляхов, 1973) .
Бацилла антракса патогенна для лабораторных животных, сибиреязвенноподобные сапрофиты не вызывают их гибель, за исключением Вас. cereus, которая может убить белых мышей при внутрибрюшинном заражении. Массивную с четкими контурами капсулу образует только возбудитель сибирской язвы.
Тест жемчужного ожерелья (предложили в 1953 г. Йенсен и Клее-мейер) основан на подавлении пенициллином синтеза клеточной стенки бациллы антракса и образовании L-форм. Испытуемую трехчасовую бульонную культуру высевают на МПА в чашки Петри: в первой чашке содержится 0,5, во второй — 0,05 ЕД пенициллина на 1 мл среды, третья — контрольная. Посевы инкубируют 3 ч при 37 °C. На агаре с пенициллином бацилла антракса растет в виде цепочек, состоящих из 208
шарообразных форм, напоминающих ожерелье из жемчуга. Восковидная бацилла и другие сибиреязвенноподобные сапрофиты на агаре с пенициллином этого феномена не дают.
Проба бактериофагом (лизабельность фагом). Сибиреязвенный фаг, взаимодействуя с гомологичной культурой, вызывает ее лизис. Эта реакция высокоспецифична и ее применяют для идентификации бациллы антракса, а также дифференциации ее от ложносибиреязвенных бацилл. В качестве индикаторных у нас в стране выпускают два штамма фагов: «К» ВИЭВ и «Гамма» MBA. Разработаны пробирочный метод, микрометод и реакция нарастания титра фага.
Иммунофлуоресцентный тест. Идентификация возбудителя сибирской язвы при помощи флуоресцирующих антител ориентировочный метод и требует дополнительного изучения вирулентности, капсулообра-зования, фагочувствительности.
Подвижность устанавливается микроскопически или путем посева культуры уколом в столбик 0,3 %-ного агара. Неподвижные культуры растут только по ходу укола, подвижные — дают диффузный рост.
Возбудитель сибирской язвы неподвижен, многие спорообразующие аэробные сапрофиты подвижны.
Гемолитическая активность не может быть надежным критерием дифференциации бациллы антракса, как правило, эта бактерия не гемолизирует эритроциты барана или же лизирует их очень медленно, но этот признак у различных штаммов вариабелен.
Лецитиназная активность у возбудителя сибирской язвы низкая: этот микроб или очень медленно свертывает, или вообще не свертывает желток куриного яйца. Бацилла же cereus интенсивно синтезирует лецитиназу и вызывает свертывание желтка через 6—10 ч. Не образует бацилла антракса и фосфатазу, в то время как сапрофитные споровые аэробы ее продуцируют.
Серологическое исследование. Для обнаружения сибиреязвенных антигенов применяют реакцию преципитации по Асколи. Эту реакцию используют для исследования на сибирскую язву кожевенного и мехового сырья, загнившего патологического материала, в котором происходит лизис бациллы антракса, а также для исследования свежего патологического материала и серологической идентификации выделенных культур. Реакция преципитации по Асколи — достоверный и широко применяемый в практике тест серологической диагностики сибирской язвы. В качестве серологического теста, главным образом для изучения антигенного спектра бациллы антракса, применяют реакцию диффузионной преципитации (РДП).
Для выявления свежих случаев и ретроспективной диагностики сибирской язвы у человека предложен аллерген антраксин (Э. Н. Шляхов, 1961). Им выявляют и специфическую поствакцинальную сенсибилизацию у сельскохозяйственных животных. Лучшиё результаты получены у крупного рогатого скота и овец.
Биопрепараты. Активная защита животных от сибирской язвы путем вакцинации — надежное средство профилактики данного заболевания. С этой целью применяют живые споровые сибиреязвенные вакцины.
Первые вакцины получены в 1881 г. Пастером. Они представляли отселекционированные из популяции вирулентого штамма бациллы антракса иммуногенные мутанты с пониженной вирулентностью.
В 1883 г. в Харьковском ветеринарном институте профессор Л. С. Ценковский получил отечественные сибиреязвенные вакцины. Им были приготовлены вакцины двух степеней ослабления. Вирулентную культуру бациллы антракса засевали в мясной куриный бульон и инкубировали при 42,5 °C в течение 12 суток для получения I вакцины и шесть суток для получения II вакцины. Последняя в основном состояла из капсульных бактерий и была менее ослабленной. Вегетативные клет--Ветеринарная микробиология ?пп
ки переводились в споры при 35 °C на протяжении шести суток. Споры стабилизировались путем заключения в 30%-ный раствор глицерина.
Вакцины Пастера и Ценковского имели достаточно высокую остаточную вирулентность и обладали выраженной реактогенностью, вызывая иногда поствакцинальные осложнения. Поэтому возникла необходимость создания вакцин нового типа.
Н. Н. Гинсбург в 1940 г. селекционировал из культуры вирулентного штамма «Красная Нива» на свернутой нормальной сыворотке лошади вакцинный бескапсульный отекообразующий мутант СТИ-I. С 1942 г. вакцину, приготовленную из этого варианта, стали использовать для профилактики сибирской язвы животных, она быстро зарекомендовала себя как высокоиммунный препарат и получила название вакцины СТИ.
С. Г. Колесов в период с 1946 по 1949 г., используя метод чередующихся пересевов на свернутую нормальную лошадиную сыворотку ’и беспептонный агар вирулентного штамма «Шуя-2», выделенного из трупа свиньи, получил слабовирулентный бескапсульный иммуногенный вариант «Шуя-15». В 1951—1952 гг. С. Г. Колесов и Ю. Ф. Борисович изготовили из этого штамма с добавлением глицерина и гидроокиси алюминия высокоэффективную и практически ареактогенную вакцину ГНКИ. С 1961 г. ее выпускают в сухом виде.
Живые споровые вакцины СТИ и ГНКИ из бескапсульных мутантов бациллы антракса обладают высокими иммуногенными свойствами и при введении в организм животного формируют иммунитет в пределах 1—2 лет.
Для пассивной профилактики и лечения сибирской язвы с успехом применяются противосибиреязвенные сыворотка и глобулин. Гипериммунную сыворотку независимо друг от друга получили в 1895 г. Склаво и Маршу. В России активная сыворотка была приготовлена в 1906 г. Н. А. Покшишевским, в последующем она совершенствовалась С. Н. Вы-шелесским, Н. А. Михиным, С. Г. Колесовым. У животных, привитых противосибиреязвенной сывороткой, иммунитет развивается быстро и сохраняется до 14 дней.
Противосибиреязвенный глобулин получают из гипериммунной противосибиреязвенной сыворотки осаждением этанола, содержит наиболее иммунологически активные компоненты сыворотки — гамма- и бета-глобулины и освобожден от неактивных альбуминов и альфа-глобулина. Используют глобулин для профилактики и лечения сибирской язвы у всех видов животных.
В качестве лечебных средств против сибирской язвы применяют также антибиотики. Чувствительность бациллы антракса четко выражена к пенициллину, стрептомицину, хлортетрациклину, левомицетину. Лучшие результаты дает комбинированное лечение противосибиреяз-венным глобулином и антибиотиками.
ПАТОГЕННЫЕ АНАЭРОБЫ
К числу микроорганизмов, обладающих способностью вызывать тяжело протекающие инфекционные или интоксикационные процессы у животных и человека, относится группа патогенных анаэробов. Патогенные анаэробы — это преимущественно клостридии, но к ним также относятся неспоровые фузобактерии (например, возбудители некробак-териоза).
Клостридии — многочисленная группа почвенных анаэробных бактерий, включающая 93 вида. Однако только восемь из них истинные патогенные микроорганизмы. Они обладают рядом общих характеристик. В молодых культурах и препаратах из тканей окрашиваются грам-положительно, в старых — грамотрицательно. Большинство из них перитрихи. Образуют овальную или цилиндрическую эндоспору, распо-210
ложенную центрально, субтерминально или терминально. Спорообразованию предшествует увеличение поперечного измерения клеток, они раздуваются и приобретают веретенообразную (клостридиальную) форму. Растут на специальных питательных средах, в состав которых входят компоненты, обеспечивающие энергетический метаболизм в анаэробных условиях. Характерная особенность микробов данной группы — отсутствие фермента каталазы, они образуют протеазы, расщепляющие нативные и свернутые белки, ряд видов обладает сахаролитической активностью. Синтезируют высокоактивный экзотоксин, в составе которого дифференцируются гемолитический, некротический, летальный и другие компоненты.
Различные виды клостридий имеют общие антигены. Эту закономерность устанавливают не только у жгутиковых и соматических антигенов, но и у антигенов экзотоксинов.
Экологической особенностью различных представителей рода клостридий является их способность к сапрофитическому существованию, высокая устойчивость к неблагоприятным воздействиям среды, обеспечиваемая спорообразованием, и широкое их распространение практически на всех континентах («географический космополитизм»). Типичным местом их обитания и размножения служит желудочно-кишечный тракт животных.
Патогенные клостридии относятся к классу шизомицетов (Schizomy-cetes), порядку истинных бактерий (Eubacteriales), семейству бацилл (Bacillaceae), роду клостридий (Clostridium). Важнейшими возбудителями анаэробных клостридиозов являются такие виды: Cl. chauvoei, Cl. perfringens, Cl. novyi, Cl. septicum, Cl. histolyticum, Cl. bifermentans (патогенный вариант Cl. sordellii), CL tetani, Cl. botulinum.
Первый вызывает эмфизематозный карбункул, пять следующих — злокачественный отек, брадзот овец, анаэробную дизентерию ягнят, инфекционную энтеротоксемию овец, телят и др., два последних соответственно столбняк и ботулизм.
Возбудитель некробактериоза также патогенный анаэроб, ио не имеет ничего общего с клостридиями, относится к классу шизомицетов, порядку истинных бактерий, семейству бактероидов (Bacteroidaceae), роду фузобактерий (Fusobacterium).
- Это неподвижная, неспоровая, полиморфная, грамотрицательная бактерия.
ВОЗБУДИТЕЛЬ ЭМФИЗЕМАТОЗНОГО КАРБУНКУЛА
Эмфизематозный карбункул (эмкар) у крупного рогатого скота вызывается Cl. chauvoei (впервые его обнаружил Фезер в 1865 г. в подкожной клетчатке погибшей коровы). Поражаются преимущественно молодые животные. Описаны редкие случаи заболевания буйволов, овец и коз. У овец Cl. chauvoei — основной возбудитель злокачественного отека.
-л Эмфизематозный карбункул — острая неконтагиозная инфекционная болезнь, характеризующаяся развитием крепитирующих отеков в массивных группах мышц, хромотой и быстрой гибелью животных. Распространен почти во всех странах мира с развитым скотоводством, встречается также и в нашей стране.
Морфология и тинкториальные свойства. Cl. chauvoei — прямые или слегка изогнутые с закругленными концами палочки размером 0,6— 1,0x2—8 мкм (см. рис. 78). В препаратах из тканей располагаются одиночно, парами, очень редко по 3—4, нитей не образуют. Микроб обладает значительным полиморфизмом, особенно в мазках из животных тканей, где нередко приобретает форму веретена, лимона, груши, шара и т. д. Бактерия бескапсульная, подвижна, имеет 6—8 боковых жгути
1&*
211
ков (перитрих). В организме и внешней среде образует центрально или субтерминально расположенную спору. В культуре спорообразование отмечается через 24 ч, через 48 ч становится значительным. Вегетативные клетки хорошо окрашиваются спирто-водными растворами анилиновых красок, часто воспринимают окраску неравномерно, более интенсивно на полюсах, в цитоплазме иногда обнаруживают зернистость. По Граму в молодых культурах и препаратах из тканей красятся положительно, в старых культурах — отрицательно.
Культивирование. Cl. chauvoei — строгий анаэроб, требует создания вакуума не менее 8—15 мм ртутного столба. На универсальных средах (МПБ и МПА) даже с добавлением глюкозы не растет. Для культивирования применяют специальные среды, дополнительными ингредиен-
тами которых является кровь, сыворотка, кусочки печени, мозга, мышц. Наиболее часто используют мясо-пептонный печеночный бульон (МППБ) или среду Китт — Тароцци, бульон Мартена, бульон Хоттингера, среду из ферментативного гидролизата казеина, мозговую среду, полужидкий агар, глюкозо-кровяной агар Цейсслера, глюкозный агар с 10—12% бычьей сыворотки. Оптимальные значения pH 7,2—7,6, температуры — 36—38 °C, рост возможен и при 14 °C. В среде Китт — Тароцци уже через 12—24 ч дает пышный рост с газообразованием и легким помутнением, на 2—3-и сутки среда светлеет и на дно выпадает рыхлый беловатый осадок, аналогично растет и в бульоне Мартена. Молодые культу
ры запаха не издают, в старых обнаруживается запах прогорклого масла. При росте в мозговой среде отмечается газообразование и сдвиг pH в кислую сторону, почернение не наступает, и лишь через несколько
дней роста в глубине среды отмечается нежное покраснение. В глубине сывороточного агара растет в форме чечевицеобразных .или круглых колоний с нежными отростками. На пластинке глюкозо-кровяного агара Цейсслера через 24—48 ч инкубирования вырастают круглые, в виде
перламутровой пуговицы или в
орме виноградного листа, плоские, с
ровным краем и приподнятым центром сине-фиолетовые блестящие ко-
лонии, окруженные незначительной зоной светлого гемолиза (бета-гемолиз) (см. рис. 79).
Биохимические свойства. Cl. chauvoei синтезирует протеазу, мед-
ленно разжижающую желатину, свернутую сыворотку и яичный белок не разжижает; коагулирует молоко на 3—6-е сутки роста, сгусток его имеет вид мягкой губчатой массы, пептонизация сгустка не наступает. Индол не образует, большинство штаммов продуцирует незначительное
количество сероводорода, нитраты в нитриты не редуцирует, метиленовую синьку не обесцвечивает. Ферменты каталазу и лецитиназу не вырабатывает. Расщепляет с образованием кислоты и газа глюкозу, сахарозу, лактозу, мальтозу, галактозу, левулёзу и не разлагает маннит, салицин, глицерин, дульцит, изодульцит и инулин. Лакмусовое молоко коагулирует с выделением кислоты и газа. Отношение разных штаммов к сахарам непостоянно, однако реакции на сахарозу и салицин являются индикаторными: Cl. chauvoei в отличие от Cl. septicum ферментирует сахарозу и не сбраживает салицин.
Устойчивость. Вегетативная форма Cl. chauvoei малоустойчива к воздействию различных факторов внешней среды, споры же весьма резистентны. В гниющих трупах споры сохраняются до трех месяцев, в навозе с примесью крови и остатками тканей — до шести месяцев, а на дне водоемов неблагополучных территорий — свыше 10 лет. В кислых почвах, бедных органическими веществами, споры погибают значительно раньше. Имеются предположения, что в почве споры сохраняют жизнеспособность до 20—25 лет. При соответствующих условиях в почве могут вегетировать и размножаться. Споры Cl. chauvoei в гниющих мышцах погибают через шесть месяцев, в высушенных мышцах выдерживают кипячение до шести часов, а в свежем мясе — до двух часов, в
212
солонине сохраняются более двух лет. В высушенном состоянии споры теряют жизнеспособность при нагревании до 100—105 °C за 2—12 мин, при 80 °C — через 2 ч, но не разрушаются текучим паром на протяжении 40—50 мин. Прямые солнечные лучи убивают их через 24 ч.
На споры возбудителя губительно действует 3 %-ный раствор формалина в течение 10—15 мин, 3 %-ный фенол действует слабо. В 6 %-ном растворе NaOH споры погибают через 6—7 дней, в 12 %-ном растворе — через 24 ч и в 25 %-ном — через 14 ч, но в подогретом до 40°C — через 50 мин (А. А. Поляков, 1975).
Патогенность. В естественных условиях преимущественно заболевает крупный рогатый скот и овцы. Редкие случаи заболевания наблюдают у коз, буйволов, оленей и лосей. Cl. chauvoei был также выделен из трупов норок как возбудитель кормового отравления.
Наиболее восприимчив молодняк крупного рогатого скота в возрасте от трех месяцев до четырех лет. Животные старше четырех лет резистентны за счет иммунизирующей субинфекции, телята до 3-месячного возраста — благодаря колостральному иммунитету. Однако изредка отмечались заболевания телят 3-дневного возраста и скота в возрасте 10—12 лет. Племенные животные, особенно мясных пород, более восприимчивы, чем степной и рабочий скот. Независимо от породы повышенной чувствительностью обладают упитанные животные: их мышечная ткань содержит больше гликогена, необходимого для развития микроба.
Лошади и ослы невосприимчивы, отмечали отдельные случаи заболевания свиней. Верблюды в естественных условиях не болеют, искусственно же их заразить удавалось. Собаки и кошки невосприимчивы. Описана вспышка болезни у пресноводных рыб (Ф. И. Каган, 1976). Человек к возбудителю эмфизематозного карбункула практически невосприимчив.
Из лабораторных животных наиболее восприимчивы морские свинки, они гибнут через 16—48 ч с момента заражения. Белые мыши и крысы заражаются с трудом и непостоянно, серые крысы невосприимчивы. Кролики устойчивы, но могут быть иногда заражены большими дозами вирулентной культуры, заражение их смесью культуры с молочной кислотой, хлористым кальцием, а также с культурами чудесной палочки и сенной бациллы приводят к гибели. Куры, голуби и воробьи в большинстве случаев невосприимчивы.
Возбудитель эмфизематозного карбункула синтезирует и выделяет активный экзотоксин. Образование его происходит как в организме, так и при выращивании микроба в жидких питательных средах. В составе токсина обнаружены гемотоксический и некротизирующий компоненты. Cl. chauvoei имеет общую летальную и некротизирующую фракцию токсина альфа1 с Cl. septicum, в то время как фракция альфа2 у токсина возбудителя эмкара отсутствует. Поэтому антитоксическая сыворотка Cl. septicum инактивирует гомологичный токсин и токсин С1. chauvoei, антисыворотка же Cl. chauvoei нейтрализует только гомоло* гичный токсин.
Возбудитель эмкара обладает также ферментами патогенности. К ним относятся дезоксирибонуклеаза (фактор бета), гиалуронидаза (фактор гамма), токсическим компонентом является и фактор дельта — кислородолабильный гемолизин. Токсин Cl. chauvoei не содержит лецитиназу. Растворимый токсин, синтезируемый микробом при росте в жидких средах, разрушается при 60 °C в течение 4 ч; токсин, связанный с бактериальными клетками, более резистентный: при 60 °C через 10 ч не происходит его разрушение.
Токсин обладает антигенной функцией и при обработке формалином переводится в анатоксин. Описаны агрессины — атоксические вещества, парализующие защитные силы организма и способствующие
213
развитию микроба в организме животного. Будучи сами безвредными^ они обладают способностью максимально повышать вирулентность отмытых культур Gl. chauvoei в том случае, если их вводить одновременно с этими бациллами. Различают естественные агрессины — фильтрат пораженных мышц и искусственные агрессины — культуральный фильтрат. Агрессины обладают выраженным иммунизирующим действием. Понятие «агрессины» скорее гипотетическое. Их функцию, видимо, выполняют отдельные фракции экзотоксина.
Патогенез. Заражение происходит при попадании спор в пищеварительный тракт с кормом и питьевой водой. Проникновению спор благоприятствуют травмы слизистой оболочки, в том числе и микротравмы. Личинки оводов, мигрируя из пищеварительного канала в мышцы, способствуют внедрению возбудителя эмфизематозного карбункула и создают условия для его размножения. Возбудитель может проникать также через ранки на поверхности тела, среди которых важная роль отводится укусам кровососущих насекомых. Иногда отмечается непосредственная локализация процесса в грудной полости, что вызывает предположение о возможности пылевого заражения через органы дыхания. С током крови возбудитель попадает в мышцы и места, наиболее благоприятные для его развития,— гематомы, размозженные и разорванные ткани, участки некроза. Первичный очаг инфекционного процесса возникает после короткого инкубационного периода и имеет тенденцию к бурному развитию. В местах оседания микробы интенсивно размножаются, выделяют токсин и образуют газ. Компоненты токсина подавляют фагоцитоз, вызывают нарушение целостности кровеносных сосудов и другие повреждения, ведущие к отеку и некрозу тканей, газы же обусловливают крепитацию образовавшихся отечных припухлостей.
Продукты распада тканей и токсины возбудителя являются причинами развития лихорадки, нарушения сердечной деятельности и расстройства дыхания. Перед гибелью животных резко повышается концентрация микробов в тканях и отмечается бактериемия. Инфекционный процесс может протекать и без образования карбункула в виде сепсиса. <
Антигенная структура. В составе антигенов возбудителя эмфизематозного карбункула выделены термостабильный соматический О-анти-ген и термолабильный жгутиковый Н-антиген. Они обладают видовой специфичностью и являются общими у всех штаммов. Однако имеются наблюдения, что Н-антиген Cl. chauvoei, выделяемого от крупного рогатого скота и овец, различен. Кроме того, дифференцирован споровый S-антиген. Этот антиген общий с Cl. septicum, что приводит к перекрестной агглютинации у этих двух клостридий.
Иммунитет. У крупного рогатого скота и овец естественного иммунитета нет, но с возрастом восприимчивость их к данному заболеванию снижается. В результате переболевания животные приобретают длительный активный иммунитет. По своей природе иммунитет при эмфизематозном карбункуле антитоксический и антимикробный.
Диагностика. Материалом для лабораторного диагноза служат кусочки пораженных мышц, печени, селезенки, почек, отечный экссудат, кровь, взятые тотчас после гибели животного. Необходимо помнить, что вскрытие трупов животных, погибших от эмфизематозного карбункула, недопустимо (почвенная инфекция). Поэтому кусочки мышц отбирают без полного вскрытия трупа. Если же труп случайно вскрыт, берут кусочки паренхиматозных органов. При пересылке лучше всего использовать хорошо высушенные мышцы. Для этого их режут стерильными ножницами на тонкие полоски и тщательно высушивают в стерильных чашках. Патологический материал можно пересылать и в стерильном 30—40 %-ном глицерине. Исследование проводят по схеме: микроскопия мазков, посевы на питательные среды в анаэробных и аэробных условиях и заражение лабораторных животных.
Микроскопия имеет ориентировочное значение. Мазки окрашивают по Граму и Муромцеву. Cl. chauvoei — грамположительная, полиморфная, спорообразующая, толстая с закругленными краями палочка. Бактерии располагаются одиночно или парами.
Чистую культуру Cl. chauveoi удается выделить, если посевы про-214
водяТТфа'зу -же после гибели животного. Но, как правило, материал бывает сильно загрязнен посторонней микрофлорой. Поэтому применяют ряд методов подавления сопутствующей микрофлоры. Материал можно высушивать в термостате, при этом вегетативные клетки гибнут, споры сохраняют жизнеспособность; рекомендуется также проводить посев на жидкую элективную среду с добавлением фенола, кристалл-виолета или азида натрия, которые ингибируют постороннюю микрофлору и не препятствуют росту возбудителя эмфизематозного карбункула. Иногда материал прогревают при 80 °C в течение 15 мин и высевают на твердые питательные среды или выдерживают в термостате кусочки мышц, печени с 10 %-ным раствором антиформина для разрушения вегетативных форм. Исследуемый материал засевают пастеровской пипеткой на среду Китт — Тароцци, МПБ, МПА и глюкозо-кровяной агар в чашках (агар Цейсслера), посевы инкубируют в анаэробных условиях при 37 °C в течение 24—48 ч. Со среды Китт —Тароцци для выделения чистой культуры делают дробный посев на чашки с глюкозокровяным агаром. Наличие характерных колоний на агаре и типичных по морфологии палочек в препаратах из этих колоний дают основание для постановки предварительного диагноза. В необходимых случаях изучают сахаролитические и протеолитические свойства культуры. Для окончательного диагноза необходима биопроба.
Вирулентностью обладают только свежевыделенные культуры. При хранении они утрачивают свою первоначальную вирулентность. Для восстановления ее такие культуры после пересева вводят морским свинкам в больших дозах в смеси с молочной кислотой или хлористым кальцием. Биопробу ставят на морских свинках. Их заражают подкожно в области живота взвесью из мышц, паренхиматозных органов или культурой в дозе 0,5—1 мл. Наблюдение за ними продолжается 8 дней. Как правило, животные погибают через 16—48 ч при наличии характерной патологоанатомической картины. У только что павших животных на месте инъекции появляется кровянистый выпот и точечные кровоизлияния, кожа плохо отделяется от мышц, подкожная клетчатка отечна и геморрагично инфильтрирована, мышцы темно-красного цвета, сухие, ломкие, газообразование незначительно или отсутствует полностью, кишечник не вздут.
Обязательно проводят микроскопию препаратов-отпечатков с места заражения и серозного покрова печени.
Иногда возникает необходимость дифференцировать Cl. chauvoei от бациллы антракса и Cl. septicum.
Возбудителя сибирской язвы можно отличить без особого труда: это капсульная бактерия, хорошо растет на универсальных средах в аэробных условиях, в культурах неподвижна, добавление в элективные для анаэробов среды стрептомицина подавляет ее рост и не оказывает влияния на Cl. chauvoei.
Септический вибрион дифференцируют на основе морфологических и биохимических характеристик. В препаратах-отпечатках с серозных покровов печени морской свинки, павшей в результате экспериментального заражения, Cl. chauvoei имеет вид равномерно или зернисто окрашенных палочек, расположенных одиночно или парно, Cl. septicum формирует длинные нити. Cl. chauvoei ферментирует сахарозу и не разлагает салицин, в то время как Cl. septicum ферментирует только салицин и не изменяет среду с сахарозой.
г Для дифференциации культур применима также реакция агглютинации, гомологичные сыворотки агглютинируют культуры в титре до 1:1000, гетерологичные — не более 1 : 100. Можно воспользоваться реакцией нейтрализации на морских свинках. Антитоксическая сыворотка Cl. septicum нейтрализует гомологичный и гетерологичный токсин, защищая животное от заражения септическим вибрионом и возбудителем
215
эмфизематозного карбункула; антитоксическая сыворотка Cl. chauvoei защищает только от заражения гомологичной культурой.
В настоящее время методом адсорбции, по Кастеллани, с последующим высаливанием глобулиновой фракции получены флуоресцирующие сыворотки, позволяющие отличить CL chouvoei и Cl. septicum при помощи реакции иммунофлуоресценции.
Биопрепараты. Первые вакцинные препараты для активной профилактики эмфизематозного карбункула готовили из тканевых субстратов животных, погибших от этого заболевания. Так, в 1887 г. Арбуан, Кор-невен и Тома предложили использовать для прививок порошок, приготовленный из высушенных при 37 °C пораженных мышц и тканевого сока животных, павших от эмфизематозного карбункула. У нас в стране скот вакцинировали блеклегоидами, которые представляли собой ослабленный нагреванием и спрессованный в виде шариков порошок пораженных мышц. Однако эти вакцины были нестандартными и обладали высокой реактогенностью.
В 1928 г. Леклени и Валле приготовили культуральную формолвак-цину нового типа, обладающую эффективным иммунизирующим действием. Культуральная формолвакцина против эмфизематозного карбункула в нашей стране была получена в 1929 г. С. Н. Муромцевым. Эту вакцину с 1931 г. начали производить промышленным способом для практического применения. Она представляла собой 24—48-часовую бульонную культуру Cl. chauvoei, выращенную при 37 °C и обезвреженную добавлением 0,5—0,7 %-кого формалина при последующем выдер* живании в термостате в течение 48—75 ч.
С 1958 г. вакцину заменили концентрированной гидроокисьалюминиевой формолвакциной против эмфизематозного карбункула крупного рогатого скота и овец, предложенной Ф. И. Каган и А. И. Колесовой. Иммунитет после прививки этой вакциной наступает через 14 дней и продолжается до шести месяцев, она не защищает от возбудителей злокачественного отека.
Путем гипериммунизации молодняка крупного рогатого скота, а также жеребят возможно приготовить иммунную сыворотку против эмфизематозного карбункула, обладающую профилактическим и терапевтическим действием.
Для лечения эмфизематозного карбункула применяют антибиотики. Хорошие результаты дает внутримышечное введение хлортетрациклина или пролонгированного препарата дибиомицина.
КЛОСТРИДИИ ЗЛОКАЧЕСТВЕННОГО ОТЕКА
Злокачественный отек (газовая инфекция, раневой газовый отек, 'анаэробная инфекция, газовая гангрена) — острая неконтагиозная раневая инфекция, вызываемая группой патогенных клостридий.
Заболевание характеризуется быстро распространяющимся болезненным отеком мягких тканей, их разрушением, образованием в пораженных тканях газа и общей интоксикацией организма. Встречается злокачественный отек в виде спорадических случаев повсеместно. Обычно заболевание развивается после обширных и глубоко проникающих ранений. Болезнь поражает животных и человека. У крупного рогатого скота злокачественный отек может наблюдаться после отелов, особенно после тяжелых родов, сопровождающихся повреждениями и ранениями родовых путей, а также после абортов.
Злокачественный отек — заболевание полимикробной этиологии. В развитии инфекционного процесса основную роль играют следующие виды бактерий из рода клостридиум: Cl. septicum, Cl. novyi, Cl. perfringens, Cl. histolyticum и Cl. sordellii. У сельскохозяйственных животных возбудителем заболевания чаще является CL septicum, нередко наблю
216
дается смешанная инфекция. У овец возбудителем может быть С1. chauvoei (Ф. И. Каган, Л. В. Кириллов, 1976). В пораженных тканях иногда обнаруживают протеолитическую анаэробную бактерию Cl. spo-rogenes, которая способствует гнилостному распаду тканей, в результате чего осложняется течение болезни. Выделяют и сопутствующую аэробную микрофлору (стрептококки, стафилококки, кишечная палочка, протей).
Clostridium septicum (Vibrion septique) — анаэробная бактерия, выделена из трупа коровы Пастером и Жубертом в 1877 г.
Морфология и тинкториальные свойства. Cl. septicum — полиморфная грамположительная бескапсульная подвижная палочка (перитрих), длиной 2—10 мкм и шириной 0,8—2 мкм. Споры овальной формы, располагаются центрально или субтерминально (см. рис. 80,/), образуются в культурах и трупе. В мазках из культур находят отдельные палочки, цепочки и нити. Микробные клетки из старых культур грамотрицатель
ные и плохо окрашиваются спирто-водными растворами анилиновых красителей. В препаратах-отпечатках из серозных покровов печени и других органов обнаруживают длинные нити (2).
Культивирование. Cl. septicum — строгий анаэроб. Оптимальная температура 37 °C, pH 7,6. На среде Китт — Тароцци растет интенсивно, через 16—24 ч наступает равномерное помутнение среды с газообразованием. Через 48 ч микробы оседают на дно и бульон просветляется. При росте в мозговой среде почернения не наступает, но образуется газ. В агаре столбиком растет в виде нежных хлопьеподобных колоний диаметром 1—2 мм с уплотненным центром и радиально отходящими перепутанными нитями, а на поверхности кровяного агара с глюкозой (агар Цейсслера) — в виде кружевных сплетений нитей-арабесок с зоной гемолиза (5). Молоко свертывается медленно (через 3—5 дней), пепто-
низации сгустка казеина нет.
Биохимические свойства. Ферментирует с образованием кислоты и газа глюкозу, лактозу, галактозу, мальтозу, левулёзу и салицин, не разлагает глицерин и маннит. Очень редко разлагает сахарозу. Это свойство используется при дифференциальной бактериологической диагностике для идентификации Cl. septicum и Cl. chauvoei, так как последний микроб сахарозу ферментирует постоянно. Разжижает желатину и свертывает лакмусовое молоко с образованием кислоты и газа. Не переваривает коагулированную сыворотку и яичный белок, не образует индола, обычно не восстанавливает нитраты в нитриты и не вырабатывает большого количества сероводорода.
Устойчивость. Вегетативные формы микроба быстро гибнут под влиянием различных факторов внешней среды, они довольно чувствительны к кислороду. Споры относительно устойчивы и выдерживают кипячение в течение 2—15 мин. В почве этот микроб может вегетировать и сохраняться годами.
Патогенность. Данный микроб вызывает газовую гангрену у животных и человека, а также брадзот овец. К заражению чувствительны лошади, крупный рогатый скот, овцы, свиньи. Патогенен для всех лабораторных животных, но в основном используют морских свинок. Животные, зараженные подкожно или внутримышечно, погибают через 8—20 ч с признаками газового отека. На месте инъекции у них легко снимается шерсть, происходит выпотевание красноватой жидкости. При вскрытии кожа легко отделяется, подкожный слой красного цвета, мышцы отечны, геморрагично инфильтрированы и пропитаны пузырьками газа. В грудной и брюшной полостях скапливается значительное количество жидкости. Кишечник вздут. Культуру легко удается изолировать из крови сердца и из печени, где обычно имеются очаги размножения микроба..
217
Cl. septicum синтезирует высокоактивный экзотоксин сложного состава. Токсин может быть выделен из фильтрата культур на бульоне Мартена (pH 7,6—7,8), на средах из кислотного и ферментативного гидролизата казеина. В составе токсина обнаруживают четыре растворимых компонента (а, р, у и б). Альфа-токсин — кислородостабильный летальный, некротический и гемолитический фактор. Скорее всего фермент, не относящийся к лецитиназам. Гемолизирует эритроциты овцы в течение 60 мин при условии, если в растворе нет сахарозы. Бета-токсин — кислородолабильный гемолизин. Является ферментом дезоксирибонуклеазой. Вызывает быстрый гемолиз. Нейтрализуется также антисывороткой Cl. perfringens. Гамма-токсин — фермент гиалуронидаза. Дельта-токсин — кислородолабильный гемолизин, лизирующий эритроциты барана, лошади и человека. В культуральных фильтратах этого микроба, кроме указанных токсических компонентов, обнаружены еще фибринолизин и коллагеназа, которые могут играть некоторую роль в деструктивных процессах при газовой гангрене.
Антигенная структура. В составе Cl. septicum выделены О- и Н-антигены. Установлено, что имеется общность споровых антигенов у С1. septicum и Cl. chauvoei, но они могут четко дифференцироваться по О-антигену. С помощью Н-агглютинации внутри вида Cl. septicum выяв
лено шесть серологических групп.
Clostridium novyi (CL oedematiens) выделен Нови в 1883 г.
из трупа морской свинки, его этиологическая роль как возбудителя га-
зовой гангрены установлены в 1915 г. Вейнбергом и Сегеном.
Морфология и тинкториальные свойства.
Крупная полиморфная
прямая или слегка изогнутая с закругленными, иногда обрубленными краями палочка, длиной 4—8 мкм и шириной 1—1,5 мкм (см. рис. 81,7); бактерии могут располагаться короткими цепочками по 3—5 и более клеток. Капсул не образует. В молодых культурах палочки подвижны (перитрихи), в присутствии кислорода подвижность быстро теряется. Образует круглые или овальные субтерминальные споры, которые обычно обнаруживаются через 24 ч роста культуры. Процесс спорообразования более интенсивный на щелочных средах, обедненных питательными веществами и разлагаемыми углеводами. Хорошо окрашиваются спиртоводными растворами обычных анилиновых красок. Молодые вегетатив
ные клетки грамположительные, из старых культур — грамотрицатель-
ные.
Культивирование. Cl. novyi — один из наиболее строгих анаэробов. Оптимальная температура 37 °C, pH 7,8. На среде Китт — Тароцци даёт обильный рост со сплошным помутнением и слабым газообразованием. Культуры издают неприятный запах. Для получения активно растущей культуры нередко требуется около 48 ч инкубирования. В последующем бульон просветляется и на дне образуется хлопьевидный осадок, в случае обильного раннего роста микробы уже через 24 ч оседают на дно. На кровяном агаре с глюкозой растет в виде шероховатых серого цвета плоских колоний с неправильными бахромчатыми краями и отростками, образующими на периферии колоний параллельные петли (2). Колонии окружены зоной гемолиза. В глубине столбика агара с глюкозой колонии этой бактерии имеют форму линзы, комочков ваты, снежных хлопьев, часто с уплотненным желтоватым или коричневатым центром, окруженным короной спутанных нитей. Через 36—48 ч с момента посева можно наблюдать разрыв агара за счет образования газов. Мозговая среда не чернеет. Молоко свертывается медленно с выпадением мелких Хлопьев, пептонизация не наступает.
Биохимические свойства. Сахаролитические свойства выражены слабо и различны у отдельных типов. Cl. novyi типа А, В и С ферментирует глюкозу, фруктозу и мальтозу, а тип D .только глюкозу; глицерин разлагают все типы, кроме некоторых штаммов типа В. Способность 218
разлагать углеводы изменяется в зависимости от штамма. Протеолитические свойства выражены слабо. Желатина разжижается медленно* свернутая сыворотка крови, вареное мясо, казеин и свернутый яичный белок не разжижаются. Нитраты восстанавливаются в аммиак без прохождения стадии нитритов. Сульфаты не восстанавливаются в сероводород, индол не образуется.
Устойчивость. Вегетативные формы по своей устойчивости не отличаются от других видов патогенных анаэробов. Они погибают от воз-1 действия прямых солнечных лучей через 24—48 ч, ультрафиолетовых лучей через 20—30 мин. Нагревание до 80 °C убивает их за 20 мин, кипячение — за 5 мин. Споры могут сохраняться в почве в течение 7—8 лет и выдерживать кипячение 1—2 ч.
Патогенность. Злокачественный отек, обусловленный Cl. novyi может возникать вследствие любого ранения, инфицированного этим возбудителем. Исход болезни, как правило, смертельный. Поражаются животные различных видов: лошади и другие непарнокопытные, рогатый скот, овцы, козы, свиньи, дикие млекопитающие, киты, птицы, черепахи (Ф. И. Каган, Л. В. Кириллов, 1976). Из лабораторных животных исключительно восприимчивы морские свинки. У них на месте введения культуры отмечается желатинозный студенистый бесцветный или слабо-розовый отек с небольшим количеством газа. Мышцы гиперемированы, без запаха.
Cl. novyi в организме и при росте на элективных питательных средах синтезирует и выделяет очень активный и сложный токсин, в составе которого обнаружено восемь компонентов. К числу лучше изученных относят альфа-, бета-, гамма- и дельта-токсины. Альфа-токсин — термолабильный, летальный, некротический, капиллярный яд. Вызывает некроз тканей, желатинозный отек и гибель животных. Бета-токсин — фос-форлипаза С (лецитиназа). Обладает некротическим, гемолитическим и летальным действием. Гамма-токсин—фосфорлипаза D. Некротизирующий и гемолитический факторы. Дельта-токсин — кислородолабильный гемолизин. Экзотоксин Cl. novyi по активности превосходит токсины других возбудителей газовой гангрены. Он сильнее других токсинов угнетает фагоцитоз и обладает четким гемолитическим действием, которое нейтрализуется специфической антитоксической сывороткой, ему присущи летальные и некротические свойства и диффузионная активность. Токсин разрушается при нагревании до 50 °C в течение 30 мин.
Этот микроб также образует ферменты патогенности — гиалуронидазу, фибринолизин, дезоксирибонуклеазу, протеиназы.
Антигенная структура. По составу растворимых антигенов токсина различают четыре типа Cl. novyi — А, В, С и D.
Тип А — Cl. novyi (Cl. oedematiens) —вызывает газовую гангрену у человека и животных, выделяется также при брадзоте. Вырабатывает альфа-, гамма- и дельта-токсины. Тип В — CL gigas — является возбудителем брадзота овец, инфекционного некротического гепатита овец, ’~а "также газовой гангрены человека и травоядных. Может вызывать у крупного рогатого скота и свиней инфекционный некротический гепатит. Вырабатывает альфа- и бета-токсины. Тип С — Cl. bubalorum — вызывает хронический остеомиелит у буйволов, продуцирует гамма-токсин. Тип D — Cl. haemolyticum — вызывает инфекционную иктерогемоглоби-нурию у крупного рогатого скота, очень редко у овец и в единичных случаях у свиней. Синтезирует бета-токсин, а также эта- и тэта-токсины. Первый из них фермент тропомиозиназа, расщепляет миозин и повреждает мышцы.
Clostridium perfringens (Вас. perfringens, Cl. welchii) открыт и описан в 1892 г. Уэлчем и Нетталом. Широко распространен в природе и встречается повсеместно, особенно большое количество его обнаруживают в почве, богатой гумусом. Патогенные штаммы микроба
219
выделяются из почвы главным образом весной в местах, где почва загрязняется фекалиями животных. Основной резервуар сохранения пато-.
генных штаммов — здоровые животные, в желудочно-кишечном тракте которых интенсивно размножается Cl. perfringens и выделяется с фекалиями во внешнюю среду. Так происходит загрязнение кормов, пастбищ, почвы вначале вегетативными формами, а затем спорами: микроб быст
ро спорулирует и длительное время сохраняется.
Cl. perfringens— самый нетребовательный анаэроб, очень активный в биохимическом отношении и весьма патогенный.
Морфология и тинкториальные свойства.
Cl. perfringens всех ти-
пов— неподвижные без жгутиков с закругленными концами довольно
толстые палочки длиной 4—8 мкм и шириной 0,6—1,5 мкм (см. рис. 82,7). Под воздействием различных факторов (антибиотики, состав среды и др.) форма бактерий может сильно изменяться. Поэтому в культуре
наряду с типичными клетками обнаруживают короткие толстые палочки, почти кокковидной формы или же длинные с заостренным краем нити, достигающие 100—145 мкм. Палочки нередко бывают изогнутыми. Сильно измененные клетки по ошибке иногда принимают за кокки или бактерии нитевидной формы.
В организме животных микроб образует капсулу. Капсула окружает тело микроба в виде светлого ободка, который хорошо виден при окраске бактерий простым способом. Существует мнение, что у вирулентных штаммов капсула шире и они более резистентны к фагоцитозу. Кап
сула может сохраняться и при выращивании культур на питательных средах, содержащих нативный белок. При длительном хранении или после частых пересевов на среды, бедные нативным белком, способность к образованию капсулы утрачивается.
При выращивании на щелочных средах, богатых белками и несодержащих углеводы, образует крупные овальные центральные или суб-терминальные споры. Спорообразование также происходит на свернутой лошадиной сыворотке и особенно интенсивно при засеве молодой культуры на влажный песок, который медленно подсушивается.
Эта бактерия хорошо красится метиленовым синим и другими основными красками. В молодых культурах грамположительна, в ста
рых — грамотрицательна.
Культивирование. Cl. perfringens не относится к строгим анаэробам. На среде Китт—Тароцци дает равномерную муть и газообразование уже через 2—3 ч после посева. Газообразование происходит за счет сбраживания глюкозы и изомальтозы при расщеплении гликогена мышц или печени, находящихся в среде. Через 3—5 дней среда просветляется и на дно выпадает обильный белый осадок за счет осевших микробов. Культура издает запах масляной кислоты. Рост также можно получить на простом бульоне с глюкозой. При росте на кровяном агаре, по Цейс-слеру, через 12—18 ч образуются мелкие (до 2—4 мм) колонии, мутные или сероватые, окруженные одной или двумя зонами гемолиза (2); в дальнейшем под влиянием кислорода эти колонии становятся зелено
ватыми.
Существует три устойчивых варианта колоний: гладкий (S), слизистый (М) и шероховатый (R), иногда появляется смешанный (О) ва-
риант. Гладкие колонии на пластинке агара в начале роста напоминают нежные капли росы, затем теряют прозрачность и приобретают серова-
тую или белую окраску. Они круглые, сочные, куполообразные с гладкой блестящей поверхностью и ровным краем. В сахарном агаре столбиком колонии имеют чечевицеобразную форму. В мазках из S-форм колоний обнаруживают короткие бескапсульные клетки. Слизистые
(М) колонии похожи на гладкие и отличаются более высоким куполом и слизистой консистенцией. В Составе их обнаруживают капсульные
клетки. Шероховатые колонии неправильной формы, с изрезанным «фес-
220
тончатйй» краем? иногда с отростками 6 виде шипов, поверхность их неровная, бугристая. В мазках обнаруживают нити или цепочки из коротких палочек.
На молоке через 16—24 ч появляется плотный губчатый сгусток, часто приподнятый газом до пробки, молочная сыворотка в такой пробирке прозрачная. При росте на среде Вильсон—Блера в результате восстановления железы уже через 2—4 ч наступает сплошное почернение агарового столбика и одновременно сильное газообразование. Мозговая среда не чернеет.
Биохимические свойства. Cl. perfringens обладает слабыми протеолитическими свойствами. Свернутую сыворотку и вареные кусочки мяса разжижает медленно (на 2—7-й день) . Однако у большинства штаммов типа А протеолитическая активность выражена в значительной степени. Этот микроб вырабатывает ферменты, расплавляющие через 24 ч желатину. Характерное свойство для CL perfringens — способность свертывать лакмусовое молоко с образованием сгустка кирпичного цвета и полным просветлением молочной сыворотки. Все штаммы сбраживают с образованием кислоты и газа глюкозу, галактозу, мальтозу, лактозу, левулёзу, сахарозу и не ферментируют маннит и дульцит. Некоторые штаммы могут разлагать глицерин и инулин. Синтезирует ферменты патогенности: лецитиназу, кроллагеназу, дезоксирибонуклеазу, гиалуронидазу.
Устойчивость. Вегетативные клетки малоустойчивы, резистентность же спор напротив очень высокая. Имеются данные, что споры различных штаммов типа А этого вида микроба выдерживают температуру 100 °C в течение 1—3 ч.
Патогенность. Все типы Cl. perfringens способны вызывать газовую гангрену у человека и животных. Отдельные варианты являются возбудителями специфических инфекционных процессов у различных видов животных: брадзота овец, анаэробной дизентерии ягнят, энтеротоксемии овец, телят и т. д. В экспериментальных условиях весьма чувствительны к заражению голуби, воробьи, морские свинки, более устойчивы кролики, белые мыши, крысы.
Особенности действия культур и культуральных фильтратов Cl. perfringens на лабораторных животных зависят от штамма, питательной среды, на которой получена культура, от спектра главных летальных токсинов, вырабатываемых данным штаммом, а также от пути введения культуральной жидкости и количества смертельных доз токсинов. Морская свинка при введении культуры подкожно или в мышцу гибнет через 12—24 ч. При вскрытии отмечают характерные патологоанатомические изменения.
Cl. perfringens вырабатывает сложный экзотоксин — сложный комплекс, образующий не менее 15 факторов патогенности.
Основными токсическими факторами являются: альфа-токсин— фосфолипаза (лецитиназа С) — один из главных факторов, обладающий летальным, некротическим, гемолитическим и цитопатогенным действием; бета-токсин — летальный некротический фактор; гамма-токсин представляет собой летальный, не обладающий гемолитической активностью фактор; дельта-токсин — летальный и гемолитический яд; эпсилон-токсин — летальный некротический протоксин, активирующийся трипсином; тэта-токсин характеризуется резко выраженными гемолитическими и в слабой степени летальными и некротическими свойствами; йота-токсин — летальный, некротический протоксин, активирующийся трипсином; каппа-токсин представлен коллагеназой, действующей на нативный коллаген; лямбда-токсин — желатиназа, действующая на денатурированный коллаген и желатину; ми-токсин — гиалуронидаза; ни-токсин— дезоксирибонуклеаза. В составе экзопродуктов обнаружены также нейраминидазный, плазмокоагулазный компоненты — и фибринолитический
221
фермент. Сложный состав экзопродуктов бактерий этого видат‘определяет разностороннее его повреждающее действие и спектр патогенности.
Антигенная структура. Дифференциация Cl. perfringens на типы основана на свойстве преимущественного выделения различных летальных токсинов, обладающих биологическим действием и нейтрализуемых специфической антисывороткой. Описано шесть типов (сероваров) Gl. perfringens: А, В, С, D, Е, F.
Тип А — Cl. perfringens Тур A (Cl. Welchii)—вызывает газовую гангрену (злокачественный отек) у людей и животных, пищевые токси-коинфекции у людей, является основным возбудителем энтеротоксемии телят и взрослых свиней, может также вызывать некротический мастит овец, коз и крупного рогатого скота. Вырабатывает альфа-, тэта- и каппа-токсины.
Тип В — Cl. perfringens Тур В (Lamb dysentery bacillus) — вызывает анаэробную дизентерию (некротический энтерит) ягнят, козлят, телят, поросят, жеребят и цыплят. В числе токсических компонентов обнаруживают альфа-, бета-, эпсилон-токсины, а также протеиназа и гиалуронидаза.
Тип С — Cl. perfringens Тур С (Вас. paludis) —вызывает геморрагическую энтеротоксемию овец, иногда энтеротоксемию телят, ягнят, поросят, коз и верблюдов. Синтезирует альфа- и бета-токсины.
Тип D — Cl. perfringens Тур D (Вас. ovitoxicus) — является возбудителем инфекционной энтеротоксемии овец («мягкая» почка), выделяется также при энтеротоксемии коз, телят и при «травяной болезни» у лошадей. Обладает альфа- и эпсилон-токсинами.
Тнп Е — Cl. perfringens Тур Е — выделен при энтеротоксемии телят и ягнят. Имеет альфа- и йота-токсины, а также активные коллагеназу и протеиназу. Тип F — Cl. perfringens Тур F (Вас. enterotoxicus) — описан как возбудитель некротического энтерита людей, выделяет альфа- и бета-токсины.
Clostridium histolyticum (греч. — растворяющий ткани) выделен в 1916 г. Вейнбергом и Сегеном из раневого содержимого человека, пораженного газовой гангреной. При раневой анаэробной инфекции обнаруживают реже других микробов, не более чем в 1 —18 % случаев. Как правило, встречается в ассоциации с другими патогенными клостридиями, значительно осложняя течение болезни. У лошадей известны случаи, когда Cl. histlyticum был единственным возбудителем раневой инфекции. Этот микроб является естественным обитателем kHl шечника человека и животных.
Морфология и тинкториальные свойства. Среди других патогенных анаэробов Cl. histolyticum самый небольшой микроб. Это грамположи-тельная палочка длиной 3—5 мкм и шириной 0,2—0,5 мкм, хорошо обг
разующая в старых культурах овальные, расположенные центрально или субтерминально (в виде игольного ушка) споры; в организме споры не формируются. Перитрих, подвижный в свежих культурах. Капсулу не имеет. Легко окрашивается спирто-водными растворами анилиновых
красок.
Культивирование. Нестрогий анаэроб. В аэробных условиях дает слабый рост и не образует спор. На среде Китт—Тароцци растет без газообразования, в виде равномерного помутнения с последующим просветлением среды и образованием осадка. При росте на агаре с кровью, по Цейсслеру, через 24—48 ч отмечаются мелкие росинчатые колоний диаметром 0,5—1 мм, они полусферические, прозрачные, блестящие с ровным краем и узкой зоной гемолиза вокруг. Чаще гемолиз отсутствует. Старые колонии теряют прозрачность, становятся серыми или белыми с неровными краями. В глубине сахарного агара столбиком штаммы; обладающие подвижностью, образуют колонии-пушинки с уплотненным
222
центром. Неподвижные штаммы формируют колонии-чечевйцы, иногда с отростками. На мозговой среде на 2—3-и сутки роста начинается почернение, максимум которого наступает на 7—9-й день.
Биохимические свойства. Этот микроорганизм не ферментирует ни один из сахаров. Только некоторые штаммы сбраживают глюкозу, кислоту при этом не обнаруживают, она нейтрализуется аммиаком, образующимся при протеолизе белков. Обладает высокой протеолитической активностью, разлагая желатину, свернутую сыворотку, яичный белок, коллаген. Кусочки нативных мышц, помещенные в жидкую питательную среду v интенсивно растущей культурой Cl. histolyticum, подвергаются быстрому протеолизу. Индол не образуется, сероводород в куль
турах выделяется в значительном количестве.
Устойчивость сравнима с другими патогенными анаэробами — возбудителями газовой гангрены. Однако устойчивость спор может меняться в зависимости от штамма, но обычно они погибают при кипячении в течение 1 ч.
Патогенность. Самостоятельно вызванная этим микроорганизмом инфекция встречается исключительно редко. Патогенными бывают только штаммы в гладкой форме. Газовая гангрена с участием Cl. histolyticum протекает тяжело, с явлениями быстрого глубокого распада мягких тканей и часто заканчивается смертью. При внутримышечной инъекции 0,5—1 мл свежей культуры или токсина в конечность морской свинки
отмечаются покраснение кожи, отек, множественные кровоизлияния, расплавление мышечной и соединительной ткани. На месте введения образуется язва, затем расплавление мягких тканей до костей. Гибель животного наступает через 18—28 ч, газ и запах отсутствуют. В расплавленных мышцах и перитониальной жидкости обнаруживаются бактерии. Для выделения культуры лучше всего производить посев из тканей в месте заражения.
На жидких средах Cl. histolyticum образует сложный термолабильный токсин, в составе которого обнаружено пять компонентов. Альфа-тоКсин — летальный, некротический яд. Поражает центральную нервную систему: при внутривенном его введении гибель животных наступает при явлениях судорог и конвульсий. Бета-токсин — коллагеназа, разрушает нативный и денатурированный коллаген, а также желатину. Гамма-токсин — протеиназа, активируется цистеином, разрушает желатину и казеин, на коллаген не действует. Дельта-токсин — эластаза, протеолитический фермент. Эпсилон-токсин — гемолизин, чувствителен к действию кислорода. Cl. histolyticum синтезирует также дезоксирибонуклеазу. Среди токсических компонентов этого микроба преобладают протеолитические ферменты.
Антигенная структура. Антигены бета-, гамма- и дельта-токсинов различны и нейтрализуются только гомологическими антисыворотками.
Clostridium sordellii (Cl. oedematoides, CL oedematis sporogenes) выделен Сорделли в 1922 г. при заболевании газовой гангреной человека. Этот микроб рассматривают как патогенный вариант Cl. tnfermentans типа В.
Морфология и тинкториальные свойства. Cl. sordellii — полиморф-
ные палочки с закругленными концами длиной 3—8 мкм и шириной 1,2— 1,5 мкм. Бактерии располагаются изолированно, по 2—3 вместе, редко цепочками. Образует овальные, центральные или субтерминальные споры, обнаруживаемые в культурах. Имеет жгутики, перитрих, активно подвижен в молодых культурах. Капсулу не синтезирует. По Граму кра
сится положительно.
Культивирование. Относится к строгим анаэробам. На среде Китт— Тароцци в течение 24 ч дает интенсивное помутнение и газ, в старых культурах часто образуется слизь в виде нитей, культуры издают неприятный гнилостный запах; на кровяном агаре* по Цейсслеру, через
223
24—48 ч появляются слабо выпуклые серовато-белые колонии с неровными краями, окруженные узкой зоной гемолиза. В глубине агара столбиком колонии имеют форму чечевицы, иногда с выростами по краю.
Биохимические свойства. Ферментирует глюкозу, мальтозу, фруктозу и не расщепляет лактозу и сахарозу. Синтезирует активные протеазы, уреазу и фибринолизин. Молоко пептонизирует, разжижает желатину и свернутую сыворотку, переваривает мясо и яичный белок. Вырабатывает аммиак и сероводород, индола не образует, нитраты в нитриты не восстанавливает.
Патогенность. Этот микроб обнаруживался у крупного рогатого скота при заболевании анаэробной гемоглобинурией и энтеротоксемией, а также при брадзоте и энтеротоксемии овец.
К экспериментальному заражению чувствительны морские свинки, кролики, мыши, кошки и голуби. Бульонная культура 48-часового роста при внутримышечном и подкожном введении вызывает гибель животных через 24 часа. В месте введения заражающего материала развивается подкожный желатинозный бесцветный или розово-красного цвета отек. Иногда наблюдаются пузырьки газа, гнилостного запаха нет. Кишечник и желудок инъецированы и геморрагичны.
Вирулентные штаммы Cl. sordellii вырабатывают высокоактивный термолабильный летальный, некротический токсин, вызывающий желатинозный отек (разрушается при 60 °C) . Этот токсин напоминает альфа-токсин Cl. novyi и нейтрализуется специфической антисывороткой. Синтезирует также лецитиназу С, лизирующую эритроциты мышей, в меньшей степени— кролика и почти не действует на эритроциты овцы. Имеет общие антигенные субстанции с лецитиназой Cl. perfringens А. Вырабатывает гиалуронидазу и кислотолабильный гемолизин типа тэта-токсина Cl. perfringens. Ферментами патогенности у этого микроба также являются уреаза и фибринолизин.
Патогенез злокачественного отека. В патогенезе газовой инфекции различают две фазы: инфекционную и токсическую (В. М. Львов, 1971).
Инфекционная фаза характеризуется усиленным размножением микроорганизмов в очаге поражения и быстрым распространением по всем тканям и органам. Уже через час микробов обнаруживают в мышцах и во внутренних органах.
Токсическая фаза возникает в результате действия токсинов, всосавшихся в ткани, и характеризуется появлением в них соответствующих изменений. Динамика патологического процесса прежде всего определяется спектром токсических компонентов, синтезируемых клостридиями. Выхождение плазмы и форменных элементов крови из сосудов в окружающие ткани приводит к развитию отека. Из-за наличия в отечной жидкости токсинов, обладающих некротизирующими и протеолитическими свойствами, разрушаются соединительная и мышечная ткани, одновременно в очаге поражения происходит интенсивное газообразование как результат ферментативного действия клостридий. Сложные деструктивные изменения тканей (протеолиз и некроз) создают благоприятные условия для быстрого размножения клостридий и накопления токсина. Параллельно угнетается фагоцитарная активность лейкоцитов и макрофагов. В итоге интоксикации поражается центральная нервная система, дыхательный центр, нарушается сердечная деятельность и наступает смерть.
Диагностика. Материалом для бактериологического исследования служат тканевый экссудат, кусочки пораженных мышц, паренхиматозные органы, а от трупов овец, кроме того, часть сычуга и тонкого отдела кишечника с содержимым (для одновременного исследования на брадзот и энтеротоксемию). При исследовании материала проводят микроскопию мазков, посевы на питательные среды, заражение лабораторных животных.
Мазки окрашивают по Граму и Муромцеву. Наличие в препаратах большого количества грамположительных палочек служит ориентировочным признаком при подозрении на клостридиальную инфекцию. Предложен также люминесцентно-серологический метод идентификации патогенных анаэробов, однако он еще недостаточно разработан для широкого практического применения.
224
13. Схема постановки реакции нейтрализации на мышах или морских свинках (К. И. Матвеев, Б. Д. Быченко, 1973)
№ пробирки Исследуемая куль- тура, мл Антитоксические сыворотки Физиологический раствор
Cl. perfringens, тип А Cl. novyi, типы А и В Cl. septicum Cl. histolyticum Cl. sordellii
1 0,9 0,6 мл 50 АЕ ** <М
2 0,9 —— 0,6 мл 50 АЕ 1 1
3 0,9 1 ' 0 ,6 мл 100 АЕ II ! ! «ж
4 0,9 < fcl 0,6 мл 100 АЕ «ж
5 0,9 — ! 0,6 мл 100 АЕ
6 (контроль) 0,9 II м II 0,6 мл
Свежий материал пастеровской пипеткой засевают на среду Китт— Тароцци, а также МПБ и МПА. Среду Китт—Тароцци предварительно регенерируют — прогревают на водяной бане при 100 °C в течение 15—30 мин, после чего быстро охлаждают до 45—50 °C. Если материал несвежий, то готовят суспензию на физиологическом растворе, прогревают ее 15—20 мин при 80 °C с целью разрушения вегетативных клеток сопутствующих бактерий и проводят высевы. Одновременно материал засевают на глюкозо-кровяной агар в чашках. Посевы инкубируют в анаэробных условиях 24—48 ч, после чего изучают рост на среде Китт— Тароцци и глюкозо-кровяном агаре. Устанавливают морфологию и подвижность бактерий из культур на среде Китт—Тароцци.
С жидкой питательной среды для выделения чистой культуры делают дробные посевы на чашки с глюкозо-кровяным агаром. Наличие характерных колоний и крупных грамположительных палочек в мазках дает основание для постановки предварительного микробиологического диагноза. В ряде случаев возникает необходимость изучить биохимические показатели выделенной культуры. Сахаролитические свойства определяют путем посевов на полужидкий агар с углеводами и индикатором, протеолитические — посевами на молоко, мозговую среду, желатину и свернутую сыворотку.
Диагноз подтверждается биологическим исследованием. С этой целью производят подкожное или внутримышечное заражение морских свинок взвесью из патологического материала в дозе 1 мл и наблюдают за ними 7—8 дней. При наличии возбудителей злокачественного отека животные погибают через 16—48 ч с характерными патологоанатомическими изменениями, вызываемыми определенным видом анаэроба.
Для определения вида возбудителя применяют реакцию нейтрализации. Культуру или ее центрифугат в дозе 0,2 мл вводят внутривенно (можно внутрибрюшинно) белым мышам или по 0,1 мл внутрикожно морским свинкам. В случае гибели мышей в течение первых суток или появления некроза кожи у морских свинок ставят реакцию нейтрализации на мышах и морских свинках с диагностическими сыворотками Cl. perfringens типа A, Cl. novyi типов А и В, Cl. septicum, Cl. histolyticum и Cl. sordellii по приведенной схеме (табл. 13).
Смеси токсин-антитоксин выдерживают 40 мин при 37 °C в термостате и затем вводят по 0,5 мл внутривенно белым мышам из расчета две мыши на каждую пробирку или по 0,2 мл внутрикожно морской свинке. Результаты учитывают через 5—6 ч и окончательно на третьи сутки. Видовую и типовую принадлежность изучаемой культуры уста-
17—Ветеринарная микробиология
225
навливают по нейтрализующему действию гомологичной антитоксической сыворотки.
Биопрепараты. В связи со спорадичностью, полимикробностью этиологии и быстрым течением болезни активная профилактика злокачественного отека не нашла практического применения. Когда имеется угроза инфицирования травматических повреждений, рекомендуется пассивная иммунопрофилактика поливалентной антитоксической сывороткой, а также применение антибиотиков широкого спектра и пролонгированного действия (Ф. И. Каган и Л. В. Кириллов. 1976). При лечении газовой инфекции основным мероприятием является возможно ранняя хирургическая обработка очага поражения. Раны орошают слабыми растворами марганцовокислого калия, перекиси водорода, хлорамина и присыпают сульфамидными препаратами и антибиотиками.
ВОЗБУДИТЕЛИ БРАДЗОТА ОВЕЦ
Брадзот — острая неконтагиозная болезнь овец, характеризующаяся геморрагическим воспалением сычуга и двенадцатиперстной кишки (отек, геморрагии, иногда некрозы) с образованием газа в пищеварительном тракте. Болезнь заканчивается гибелью животного. Распространена во всех странах, где развито овцеводство. Источником инфекции служат больные овцы. Способствуют распространению болезни пастбища и водоисточники, инвазированные возбудителем, отрицательное действие оказывает поедание мерзлого корма и охлаждение организма. Поэтому брадзот чаще возникает осенью, зимой и весной, летом наблюдается редко. Описаны случаи заболевания брадзотом коз и свиней.
Возбудителями брадзота являются Cl. septicum и Cl. novyi Тур В (Вас. gigas). Чаще выделяют первый из них.
В лабораторию для бактериологического исследования направляют перевязанную часть сычуга и двенадцатиперстной кишки с содержимым, паренхиматозные органы, мышцы, отечную ткань, трубчатую кость. Пригоден только свежий материал, так как у овец после гибели в кишечнике происходит быстрое размножение анаэробных бактерий и проникновение их в органы и ткани; результаты исследования материалов от несвежих трупов не учитывают. Схема микробиологического диагноза аналогична описанной при злокачественном отеке.
У нас в стране для профилактики брадзота овец в течение ряда лет применяли полужидкую вакцину А. А. Волковой и бивалентную вакцину против брадзота и инфекционной энтеротоксемии А. В. Ляушкина. В настоящее время используют концентрированную поливалентную гидроокисьалюминиевую вакцину против брадзота, инфекционной энтеротоксемии, злокачественного отека овец и дизентерии ягнят, предложенную Ф. И- Каган и А. И. Колесовой (1958). Вакцина обладает иммуногенными свойствами против Cl. novyi, Cl. septicum, Cl. perfringens типов В, С и D. Ее вводят с профилактической целью двукратно с интервалом в 20—30 дней овцам с 3-месячного возраста. Иммунитет наступает через 10—12 дней после второй прививки и продолжается до 4—5 месяцев. Вакцинация практически обеспечивает необходимый иммунитет против брадзота.
В связи с исключительно острым течением инфекционного процесса лечение брадзота малоэффективно.
ВОЗБУДИТЕЛИ ИНФЕКЦИОННОЙ АНАЭРОБНОЙ ЭНТ С ОТОКСЕМИИ
Инфекционная анаэробная энтеротоксемия — болезнь, характеризующаяся общей токсемией и бактериемией. Поражаются практически все виды сельскохозяйственных животных. Описаны следующие нозологические единицы: 1) анаэробная дизентерия ягнят; 2| геморрагическая
226
энтеротоксемйя овец; 3) инфекционная энтеротоксемйя' овец; 4) энтёрб-токсемия овец, вызываемая Cl. perfringens типа А; 5) энтеротоксемйя коз; 6) энтеротоксемйя крупного рогатого скота; 7) анаэробная энтеротоксемия взрослых свиней; 8) некротический энтерит поросят; 9) энтеротоксемия лошадей; 10) энтеротоксемйя верблюдов; 11) энтеротоксе-мия зебу, зубров, сайгаков и 12) энтеротоксемйя птиц.
т/Возбудитель анаэробной дизентерии ягнят. Это острая токсикоин-(|Икция, поражающая новорожденных ягнят в первые пять дней жизни. Болезнь характеризуется геморрагической энтеротоксемией и сопровождается высокой смертностью. Вызывается Cl. perfringens Тур В (Lamb dysentery bacillus, сокращенно D-bacillus). Распространена во всех странах Европы, Америки, Африки, Азии.
Материалом для лабораторного исследования служит свежий труп или перевязанный отрезок пораженного кишечника, части паренхиматозных органов, брыжеечные лимфоузлы, трубчатая кость и стерильно взятое содержимое тонкого отдела кишечника. Лабораторный диагноз ставят на основании данных обнаружения токсийа в содержимом тонкого отдела кишечника при помощи биопробы на белых мышах или кроликах и выделения чистой культуры.*""'
При обнаружении токсина в фильтрате содержимого кишечника определяют его тип в реакции нейтрализации на белых мышах с типоспецифическими сыворотками Cl. perfringens. Реакцию нейтрализации можно ставить также с выделенной чистой культурой и прежде всего в том случае, если в содержимом кишечника не бйтли обнаружены токсины.
В настоящее время для профилактики дизентерии ягнят применяют концентрированную поливалентную гидроокиСьалюминиевую вакцину против брадзота, инфекционной энтеротоксемии, злокачественного отека овец и дизентерии ягнят. В хозяйствах, неблагополучных по дизентерии ягнят, вакцинируют двукратно суягных маток. После рождения ягненок с молозивом получает антитела и у него создается высокая концентрация бета- и эпсилон-антитоксинов, защищающих животных от заболевания. • •
Для пассивной профилактики и лечения рекомендуют сыворотку против дизентерии ягнят и бивалентную антитоксическую сыворотку против анаэробной дизентерии ягнят и инфекционной энтеротоксемии овец. С профилактической целью в отарах овец, стационарно неблагополучных по дизентерии ягнят, сыворотку вводят всем новорожденным ягнятам через 1—2 ч после рождения однократно, иммунитет у животных сохраняется до 14 дней.
Возбудитель геморрагической энтеротоксемии овец. Геморрагическая энтеротоксемйя овец — остропротекающая болезнь взрослых овец, заканчивающаяся внезапной смертью. При этом типе энтеротоксемии овец наблюдаются резко выраженные геморрагические инфильтраты в подкожной клетчатке подгрудка, пахов и других мест. Слизистая оболочка тонкого кишечника геморрагически воспалена, с обширными кровоизлияниями, местами встречаются некротизированные участки ткани. Почки без особых изменений. Вызывается заболевание CL perfringens Тур С (Вас. paludis). Основным токсином этого типа является бета-токсический компонент. Регистрируют в США, Франции, Турции, Новой Зеландии, Югославии и других странах, описано также в нашей стране. В связи с очень быстрым течением лечить болезнь практически невозможно.
Возбудитель инфекционной энтеротоксемии овец (болезнь «мягкой» почки). Инфекционная энтеротоксемйя — заболевание овец всех возрастов, развивающееся в результате всасывания из кишечника токсинов, синтезируемых возбудителем. Болезнь может протекать молниеносно, остро и хронически' При молниеносном течении болезнь возникает вне
запно и животные гибнут быстро. При вскрытии животных чёрез^нё-сколько часов после их гибели обнаруживают характерное размягчение одной или двух почек. Вызывается заболевание CL perfringens Тур D (Вас. ovitoxicus). Основным токсическим фактором этого микроба является эпсилон-токсин. Встречается болезнь во всех странах. Переболевшие и оставшиеся живыми овцы приобретают иммунитет продолжительностью 7—10 месяцев.
Энтеротоксемия овец, вызываемая CI. perfringens типа А, проявляется различными симптомами и почти всегда сопровождается гибелью овец с явлениями гипертрофии печени, селезенки, сердца, перикарда, пульпозной почки, гиперемии легких, экссудативного плеврита. Случаи этого заболевания регистрировали во Франции, США, Индии, Югославии и у нас в стране. Число заболевших овец увеличивалось при интенсивной системе ведения овцеводства.
Для диагностических целей в лабораторию посылают свежий труп или пораженные участки тонкого отдела кишечника (предварительно перевязанные), кусочки печени, почки, других органов, асептически полученное содержимое тонкого отдела кишечника. Исследование включает обнаружение токсина в фильтрате содержимого тонкого отдела кишечника, бактериоскопию и выделение чистой культуры.
Наличие токсина в фильтрате устанавливается в реакции нейтрализации на белых мышах. Реакцию проводят с антитоксическими сыворотками Cl. perfringens типов: А, В, С, D, Е, F. Обнаружение в содержимом кишечника токсинов Cl. perfringens типов С или D дает полное основание для постановки микробиологического диагноза. Мазки готовят из паренхиматозных органов и содержимого тонкого отдела кишечника, окрашивают по Граму. В положительном случае обнаруживают большое количество грамположительных толстых, коротких палочек с закругленными концами. Бактериоскопия имеет ориентировочное значение.
Для бактериологического исследования делают посевы из паренхиматозных органов и содержимого тонкого отдела кишечника на предварительно регенерированную среду Китт—Тароцци. Засеянные пробирки прогревают на водяной бане при 65 °C в течение 10 мин и инкубируют 16—18 ч при 37 °C, затем культуру микроскопируют и пересевают на глюкозо-кровяной агар Цейсслера. Чашки помещают в анаэробные условия в термостат. На агаре Цейсслера Cl. perfringens образует гладкие с неровными краями, Слегка выпуклые к центру колонии серого цвета. После извлечения чашек из вакуума в обычных атмосферных условиях колонии постепенно становятся зеленоватого цвета. Материал из характерных колоний отсевают на среду Китт—Тароцци. Полученную чистую культуру высевают на молоко, на котором данный микроб растет весьма характерно, образуя через 16—24 ч губчатый сгусток с выделением прозрачной жидкости. Исследование заканчивают определением типа выделенной чистой культуры биологическим методом в реакции нейтрализации с типоспецифическими сыворотками.
Биопрепараты. Активная иммунизация является надежным методом профилактики энтеротоксемии овец. В настоящее время для этой цели выпускают несколько препаратов. 1. Квасцовый концентрированный анатоксин против инфекционной энтеротоксемии овец, вызываемой Cl. perfringens типа D, представляет собой преципитированный квасцами эпсилон-токсин Cl. perfringens типа D; иммунитет у животных образуется на 15—20-й день после второй прививки и сохраняется до пяти месяцев. 2. Анатоксинвакцина против инфекционной энтеротоксемии овец представляет собой активированную панкреатином и убитую формалином культуру Cl. perfringens типа D; время наступления и продолжительность иммунитета аналогичны предыдущей вакцине. 3. Концентрированная поливалентная гидроокисьалюминиевая вакцина против брадзота*
инфекционной энтеротоксемии, злокачественного отека овец и дизентерии ягнят (описана выше).
Для пассивной иммунизации и специфического лечения применяют, антитоксическую сыворотку против анаэробной дизентерии ягнят и инфекционной энтеротоксемии овец. Сыворотку получают из крови крупного рогатого скота, гипериммунизированного анакультурами и токсинами CL perfringens типов В, С и D.
Возбудители энтеротоксемии крупного рогатого скота. Анаэробная энтеротоксемия — остропротекающее тяжелое заболевание телят, характеризующееся геморрагическим энтеритом, часто кровоизлияниями на слизистых носовой и ротовой полостей, выраженной токсемией. Чаще поражает новорожденных телят, но может встречаться у животных до 1,5—2-месячного возраста. Возникает болезнь спонтанно, без занесения из других хозяйств. Основным резервуаром сохранения возбудителей служит желудочно-кишечный тракт животных, в котором они размножаются и выделяются с фекалиями во внешнюю среду. Энтеротоксемия встречается практически во всех странах с развитым животноводством. В связи с очень тяжелым течением, значительным отходом больных телят и не всегда успешными результатами лечения это заболевание может приносить значительный экономический ущерб животноводству.
Возбудителями энтеротоксемии крупного рогатого скота являются типы А, В, С, D и Е Cl. perfringens. Особую опасность представляет тип А, так как вызывает тяжелое течение болезни и массовую гибель телят. Заболевание может быть вызвано каждым типом отдельно, обнаружены также случаи смешанной инфекции, обусловленной типами А, В, С и D.
Микробиологический диагноз аналогичен описанному при энтеротоксемии овец.
Вакцины, обеспечивающие эффективную профилактику анаэробной энтеротоксемии телят, еще не предложены, но исследования в этом направлении проводятся. Применение с лечебной и профилактической целью различных химиотерапевтических препаратов и антибиотиков не дает положительных результатов. Некоторые исследователи рекомендуют для лечения телят, больных энтеротоксемией, использовать биомицин, биоветин и неомицин.
Возбудитель некротического энтерита (анаэробной энтеротоксемии) поросят. Некротический энтерит поросят — острое инфекционное заболевание новорожденных поросят, характеризующееся диареей, общей токсемией и высокой смертностью. Болезнь распространена во всех странах Европы и США; встречается преимущественно в свиноводческих хозяйствах интенсивного направления. Вызывает некротический энтерит поросят Cl. perfringens тип Е. Имеются также сообщения о выделении от больных и погибших поросят клостридий типов В и С. Микробиологический диагноз проводится так, как и при энтеротоксемии овец.
С целью предохранения от заболевания новорожденных поросят иммунизируют супоросных свиноматок. Для этого Ф. И. Каган и В. И. Соломатин (1973) разработали методику изготовления концентрированной формолвакцины из Cl. perfringens типа С. В производственных опытах эта вакцина дала положительные результаты. Из этого типа также готовится вакцина и за рубежом. Вследствие очень быстрого течения заболевания лечение больных поросят не эффективно. Положительные профилактические результаты могут быть достигнуты при введении антитоксической сыворотки (антибета-токсин Cl. perfringens) поросятам в первые часы после их рождения.
Энтеротоксемия других видов животных вызывается различными типами Cl. perfringens. Диагностические исследования проводят по схе
229
ме, описанной выше. Биопрепараты имеются только для профилактики энтеротоксемии коз (они аналогичны применяемым при энтеротоксемии овец) и анаэробной энтеротоксемии взрослых свиней.
ВОЗБУДИТЕЛЬ СТОЛБНЯКА
Возбудитель столбняка (Cl. tetani) вызывает остропротекающую неконтагиозную раневую инфекцию, при которой происходит поражение нервной системы экзотоксином микроба. Болезнь возникает в результате различных травм и ранений при условии внесения в них спор возбудителя, что возможно при попадании почвы, и сопровождается тоническими и клоническими сокращениями мышц. Возбудитель столбняка обнаружен в 1883 г. русским ученым Н. Д. Монастырским в раневом отделяемом больного человека (эти наблюдения были опубликованы в 1885 г.). Николайер в 1884 г., прививая кроликам и морским свинкам садовую землю, вызвал у них столбняк и обнаружил его возбудителя. Чистая культура этого микроба была выделена в 1889 г. Китазато.
Морфология и тинкториальные свойства. Клостридии столбняка — крупные тонкие палочки с закругленными концами длиной 3—12 мкм и шириной 0,3—0,8 мкм (см. рис. 83). В препаратах из пораженных тканей бактерии располагаются отдельно и группами по 2—3 клетки, из культур, особенно молодых, на жидких средах, отмечаются длинные изогнутые нити. Столбнячная палочка подвижна (перитрих), может иметь до 20 и более жгутиков; в старых культурах преобладают клетки без жгутиков. Микроб капсулу не синтезирует. Образует терминальные круглые споры, в 2—3 раза шире клетки, в результате этого бактерия приобретает вид барабанной палочки. Споры формируются в культурах обычно через 2—3 суток, они также образуются и в организме. Палочки со спорами неподвижны. На 4—6-е сутки культуры на жидких средах состоят исключительно из спор и почти не содержат вегетативных клеток: они лизируются.
Вегетативные клетки хорошо окрашиваются спирто-водными растворами анилиновых красок. Грамположительны, но в старых культурах часть бактерий грамотрицательна. В окрашенных, по Граму, мазках из молодых культур споры так же, как и палочки, прокрашиваются равномерно в фиолетовый цвет, в препаратах из старых культур терминальные и расположенные изолированно споры имеют вид колечек.
Культивирование. Возбудитель столбняка — строгий анаэроб, очень чувствительный к кислороду, на поверхности плотных питательных сред растет при остаточном давлении не выше 4—5 мм ртутного столба. Оптимальным являются pH 7,4—7,6 (питательные среды могут иметь и слабокислую реакцию до pH 6,8) и температура 36—38 °C, границы роста лежат в пределах 14—43 °C.
Gl. tetani может развиваться и в условиях без особой защиты от атмосферного кислорода, если в составе среды имеются редуцирующие вещества: 0,2—1 % глюкозы, 0,3 % муравьинокислого натрия, кусочки мышц. Этот микроб для своего роста требует наличия в среде в качестве донаторов водорода аминокислот: аргинина, гистидина, тирозина, валина, изолейцина и триптофана. В состав синтетических питательных сред обязательно должны входить такие витамины, как тиамин, рибофлавин и никотиновая кислота.
На среде Китт—Тароцци растет медленно, обычно через 24—36 ч появляется неинтенсивное равномерное помутнение с незначительным газообразованием в виде единичных пузырьков, к 5—7-м суткам выпадает рыхлый осадок, среда при этом становится прозрачной. Культуры, особенно к 3—5-м суткам роста, издают своеобразный запах жженого рога*
230
уНа'глюкозо-кровяном агаре Цейсслера образует нежные беловато-серые колонии с отростками и приподнятым центром, иногда они бывают мелкими круглыми и напоминают капельки росы. Колонии окружены слабой зоной гемолиза (2—4 мм). Если чашки дополнительно выдержать при комнатной температуре, зона гемолиза увеличится, при обильном посеве гемолиз может быть по всей поверхности среды. В высоком столбике агара через 1—2 суток вырастают плотные колонии, напоминающие чечевичное зерно, иногда диск (R-форма) или же пушинку с плотным центром (S-формы).
При посеве материала в конденсационную жидкость скошенного агара и инкубировании в анаэробных условиях культура возбудителя столбняка растет в виде тонких нитевидных отростков, вползающих на поверхность агара. Этот метод можно использовать для выделения чистой культуры данного микроба. В столбике желатины через 5—6—12 дней появляется рост в виде елочки и происходит медленное разжижение субстрата. Молоко свертывается медленно с образованием на 5—7-е сутки мелких хлопьев, мозговая среда чернеет через очень продолжительное время.
Биохимические свойства. В отличие от других патогенных клостридий возбудитель столбняка характеризуется слабой биохимической активностью. Этот микроб не сбраживает моносахариды и многоатомные спирты. Однако некоторые штаммы могут ферментировать глюкозу. Данная их особенность находится в прямой зависимости от концентрации в среде ионов железа. Cl. tetani вырабатывает две протеазы, но обладает слабыми протеолитическими свойствами, вызывая медленную ферментацию протеинов и пептонов до аминокислот, которые затем разлагаются с образованием угольной кислоты, водорода, аммиака, летучих кислот и индола. Реакции Фогес—Проскауэра и с метилрот отрицательные, нитраты в нитриты не восстанавливает, обесцвечивает нейтральрот и сафранин. Возбудитель столбняка не синтезирует цитохромоксидазы и цитохромы, у него также отсутствует пероксидаза и каталаза. Поэтому кислород воздуха обладает губительным действием на культуры столбнячных бактерий.
Устойчивость. Вегетативные клетки CL tetani малоустойчивы к воздействию различных факторов внешней среды. Температура 60—70 °C убивает столбнячные палочки в течение 30 мин, растворами обычных дезинфицирующих препаратов обезвреживаются через 15—20 мин.
Споры, напротив, весьма резистентны. В почве, высохшем кале, на различных предметах (гвозди, щепки, сельскохозяйственные орудия, колючки растений), защищенных от света, они сохраняются в течение многих лет (так, например, на кусочке сухого дерева — до 11 лет). Прямой солнечный свет инактивирует споры через 3—5 суток. Во влажной среде при нагревании до 80 °C сохраняют жизнеспособность 6 ч, а до 90 °C — 2 ч. При кипячении споры погибают через 30—50 мин, сухой жар при температуре 115 °C разрушает их только через 20 мин. Они также относительно устойчивы к различным дезинфектантам. Гибнут при воздействии 1 %-ного раствора сулемы и 5%-ного раствора фенола через 8— 10 ч, 5%-ного раствора креолина — 5 ч, 1 %-ного раствора формалина — 6 ч, 0,5 %-ного раствора соляной кислоты — 30 мин, 10 %-ный настойки йода — 10 мин, 1 %-ного раствора азотнокислого серебра — 1 мин.
Необходимо помнить, что препараты спороцидного действия (настойка йода и др.), если споры проникли в глубину раны, не способна предупредить заболевание столбняком.
Патогенность. К столбняку восприимчивы все виды сельскохозяйственных животных. Среди них наиболее чувствительны лошади. Болеют также собаки, кошки и дикие млекопитающие. В литературе описаны случаи столбняка кур, гусей и индюков. К токсину возбудителя столб
231
няка исключительно восприимчив человек. Холоднокровные — лягушки, змеи, черепахи, крокодилы — невосприимчивы к столбняку при температуре ниже 20 °C, но введенный токсин длительное время циркулирует в их организме. При повышении температуры до 25—37 °C лягушки за* болевают столбняком.
Из лабораторных животных наиболее восприимчивы белые мыши, морские свинки и кролики. Инкубационный период у белых мышей продолжается до 36 ч, у морских свинок — до 48 ч, у кроликов до 3—4 дней. Заболевание у них развивается по типу общего или восходящего (tetanus ascendes) столбняка. Особенно характерно клиническая картина проявляется у белых мышей. У них отмечается ригидность хвоста и инокулированной лапки. Конечность вытянута, ограничена в подвижности, туловище искривлено в сторону инокулированной лапки, постепенно процесс захватывает вторую половину тела, положенная на спину мышь не может самостоятельно перевернуться. Погибающие животные принимают характерную позу с искривлением тела и вытянутыми лапками. Гибель их наступает в сроки от 12 ч до 5 суток.
У крупных животных и человека заболевание принимает форму нисходящего столбняка (tetanus descendes). Вначале изменяется мышечный тонус в области головы, и в первую очередь жевательных мышц, затем процесс распространяется на мускулатуру всего тела. У лошадей же первым симптомом столбняка является неподвижный и поднятый хвост, у слона перестает сгибаться и становится неподвижным хобот.
Возбудитель столбняка лишен факторов инвазивности, не обладает способностью синтезировать экзотоксин высокой активности. Столбнячный токсин был получен и описан в 1890 г. Берингом и Китазато. С этим токсином связана вся специфика патогенеза и клинической картины столбняка.
В составе столбнячного экзотоксина выделено два компонента-тета-носпазмин и тетанолизин (тетаногемолизин). Первый избирательно действует на нервную систему и вызывает тонические сокращения поперечнополосатых мышц, второй — неспецифический гемолиз эритроцитов.
Основным токсическим фактором этого микроба является тетаноспазмин, выполняющий функцию нейротоксина, поражающего моторные нейроны центральной нервной системы. Цитопатический эффект в отношении клеток других тканей не проявляет. Он вырабатывается в организме и культурах, появляясь на вторые сутки инкубирования и достигая максимума к 5—7-му дню. Очищенный кристаллизованный тетаноспазмин— термолабильная протеаза, состоящая из 13 аминокислот с количественным преобладанием аспарагина. Молекулярная масса в пределах 67 000—68 000, изоэлектрическая точка соответствует значению pH 5,1. Исключительно ядовит: токсичность кристаллического тетаноспазмина составляет 6,6- 10е ЛД50 для белых мышей на 1 мг азота токсина.
Тетанолизин — разрушающийся в присутствии кислорода гемолизин, имеющий общие свойства с тета-токсином CL perfringens, пневмо-лизином пневмококков и О-стрептолизином гемолитических стрептококков. В культуральной жидкости накапливается в значительном количестве уже через 20—30 ч, в старых культурах разрушается. Обладает гемолитическим, кардиотоксическим и летальным действием, во многом напоминая биологический эффект сапонина. Считают, что тетанолизин в патогенезе столбняка не играет существенной роли. Однако имеются данные, что эта токсическая субстанция может вызывать местный некроз тканей и разрушение фагоцитов.
Столбнячный токсин синтезируется внутри бактериальной клетки и секретируется наружу через специализированные каналы в клеточной стейке, а также освобождается в результате локального или тотального лизиса бактериальных клеток.
232
Процессы образования тетаноспазмина и тетанолизина взаимно не обусловлены: имеются штаммы, продуцирующие большое количество тетанолизина и малое количество тетаноспазмина.
Экзотоксин возбудителя столбняка нестоек и легко разрушается при высокой температуре (при 60 °C — через 30 мин, при 65 °C —через 5 мин), а также при действии прямых солнечных лучей, рентгена, радия, ионизирующих излучений, марганцовокислого калия, азотнокислого серебра, йода, кислот, щелочей. Антибиотики и сульфаниламиды не разрушают этот токсин. Он не проникает через стенку кишечника и не инактивируется ферментами желудочно-кишечного тракта. Под воздействием формалина при 35—38 °C переходит в анатоксин — нетоксический иммуногенный препарат.
К ферментам патогенности клостридий столбняка следует отнести РНК-азу и фибринолизин. РНК-аза токсична для лейкоцитов и ингибирует фагоцитоз; предполагают, что фибринолизйн способствует всасыванию тетаноспазмина.
Патогенез. Возбудитель столбняка — некропаразит, размножающийся в участках омертвевших тканей. Сам по себе он не обладает инвазивностью. Ведущая патогенетическая роль при столбняке принадлежит экзотоксину, и в первую очередь тетаноспазмину, являющемуся нейротоксином. Он не поражает кожу и не оказывает цитотоксического действия. Ферменты протеазы и фибринолизин, расплавляя кровяные сгустки и тромбы, способствуют распространению токсина за пределы очага размножения микробов.
При ранении споры в условиях анаэробиоза быстро вегетируют, происходит интенсивное размножение бактерий и синтез токсина. Вопрос о способе распространения токсина в организме остается дискуссионным. Скорее всего он транспортируется по осевым цилиндрам двигательных нервов, периневральным и эндоиевральным периферическим сосудам. Столбнячный токсин связывается с мозговым веществом, в данном случае роль рецептора токсина выполняет водорастворимый ганглиозид. В связанном состоянии они не разрушают друг друга. Факторами, определяющими степень связывания токсина с ганглиозидом, является сиаловаи кислота и гексозамин, содержащиеся в ганглиозиде.
Экзотоксин поражает двигательные нервные центры, спинной и головной мозг, что в конечном итоге и определяет основной симптомокомплекс столбняка. Под влиянием токсина снижается активность холинэстеразы и соответственно гидролиз ацетилхолина, неизбежно ведущий к избыточному его образованию, вследствие чего концевая пластинка нервно-мышечного синапса приходит в состояние повышенного автоматического возбуждения. Судороги приводят к расстройству внешнего дыхания, развивается ларинготрахеоспазм, наступает гипоксия, респираторный и метаболический ацидоз. Под действием избыточного количества молочной кислоты может развиваться отек мозга. Животные погибают в результате асфиксии или паралича сердца.
Антигенная структура. Подвижные штаммы клостридий столбняка в своем составе имеют соматический О- и жгутиковый Н-антигены, неподвижный только О-антиген. Термолабильный Н-антиген определяет типовую специфичность микроба. Описано 10 серологических типов возбудителя столбняка, различающихся по структуре Н-антигена, обозначаемых цифрами I, II, III, IV и т. д. В природе чаще других встречаются штаммы I и II серологических типов. Все они продуцируют иммунологически однородный экзотоксин, нейтрализуемый противостолбнячной сывороткой. Термостабильный О-антиген является групповым, так, например, серологические типы I, III, VI, VII, VIII обладают общим О-анти-геном.
Антигенная структура столбнячного токсина изучена недостаточно. Принято считать, что токсины различных штаммов имеют одинаковую иммунологическую структуру. Тем не менее высказывается мнение, что такая точка зрения неубедительна. При помощи реакции диффузионной преципитации в агаре показано, что столбнячный токсин состоит из смеси растворимы^ антигенов и гаптенов. В нативном препарате токсина может быть выявлено от 8 до 15 антигенных веществ, которые у различных штаммов качественно сходны, но содержатся в неодинаковых количествах,
233
Иммунитет. У некоторых видов животных имеются элементы Естественного иммунитета к столбняку. Известно, что крупный рогатый скот и свиньи заболевают реже, чем другие животные. Предполагают/что у них с кормом происходит поступление спор возбудителя столбняка, которые вегетируют в пищеварительном тракте и образуется токсин, всасывающийся в очень небольших количествах и вызывающий иммунитет. В нативных сыворотках коров, зебу, буйволов, баранов обнаруживают столбнячный антитоксин, в меньшем количестве его находят в сыворотках лошадей и верблюдов и совсем не выявляют в сыворотках свиней и собак.
Принято считать, что иммунитет при столбняке в основном антитоксический. Вакцинация животных столбнячным анатоксином сообщает им стойкий и напряженный иммунитет, продолжающийся несколько лет.
Противостолбнячный иммунитет может быть плацентарного и колострального происхождения. Так, новорожденные дети получают от иммунных матерей через плаценту антитоксин, который предохраняет их от заболевания столбняком. Экспериментально доказано аналогичное явление и у кроликов. Установлено также, что вакцинированные кобылы передают жеребенку иммунитет к столбняку через спаиваемое молозиво. Иммунитет новорожденных имеет особо важное значение: они исключительно чувствительны к заболеванию и могут заражаться через пуповину, загрязненную спорами клостридий столбняка.
Диагностика. В лабораторию для исследования направляют кусочки тканей из глубоких слоев раневых поражений, гной, инородные тела, тампоны, перевязочный материал, содержащий выделения из ран, в котором могут находиться клостридии столбняка. При генерализации процесса возбудителя обнаруживают во внутренних органах. В этом случае берут от трупа кусочки печени и селезенки по 20—30 г и кровь в количестве 10 мл.
При возникновении столбняка после родов или аборта направляют выделения из влагалища и матки, а при подозрении столбняка у новорожденных животных посылают труп целиком.
При исследовании выделяют возбудителя столбняка и его токсин.
Мазки окрашивают по Граму. Наличие в препаратах грамположи-' тельных палочек с круглыми терминальными спорами дает основание подозревать столбняк. Однако нередко находят сапрофитные бактерии (Cl. tetanomorphum и Cl. putrificum), очень похожие на клостридии столбняка. Поэтому микроскопия имеет только ориентировочное значение.
Материал засевают на среду Китт—Тароцци, желательно предварительно его прогреть в течение одного часа при 80 °C с целью уничтожения вегетативных клеток сопутствующих бактерий. Культуру микро-скопируют и, если она загрязнена, прогревают 20 мин при 80 °C или 2—3 мин при 100 °C. Затем производят пересев методом фракционирования на чашки Петри с глюкозо-кровяным агаром Цейсслера и посевы выращивают в анаэробных условиях. После получения роста отбирают характерные колонии и для выделения чистой культуры производят отсев.
Биопробу проводят для обнаружения токсина в патологическом материале и культуре. Исследуемый материал растирают в стерильной ступке с кварцевым песком, добавляют двойной объем физраствора. Смесь выдерживают 60 мин при комнатной температуре, после чего фильтруют через ватно-марлевый или бумажный фильтр и вводят фильтрат внутримышечно в бедро задней лапки двум мышам в дозе 0,5—1 мл. Для получения более быстрого результата рекомендуют вводить материал в область корня хвоста в смеси с хлористым кальцием или стерильным порошком пемзы.
234
Если исследуют культуру, то для накопления токсина ее предварительно выдерживают при 37—38 °C в термостате 6—10 дней, фильтруют или центрифугируют и вводят в дозе 0,3—0,5 мд двум белым мышам.
Биопробу можно проводить и на морских свинках. Животные погибают обычно в срок от 12 ч до 5 суток. Наблюдают за подопытными животными не менее 10 дней.
Для контрольной идентификации столбнячного токсина проводят реакцию нейтрализации. С этой целью двум мышам вводят 0,5—1 мл экстракта патологического материала или 0,5 мл фильтрата культуры, а двум другим те же дозы заражающего материала в смеси с противостолбнячной сывороткой. Ее готовят из расчета по 0,5 мл разведенной сыворотки, содержащей 200 АЕ, на каждый 1 мл материала. Смесь выдерживается в термостате 45 мин. В положительном случае животные, зараженные фильтратом с сывороткой, остаются живыми: происходит нейтрализация токсина антитоксином.
Столбнячный токсин в культурах может также быть обнаружен и при помощи реакции непрямой гемагглютинации (РИГА) с танизиро-ванными эритроцитами.
Для идентификации клостридий столбняка в различных объектах в настоящее время предложен иммунофлуоресцентный метод с применением противостолбнячных антимикробных сывороток, меченных изо-тиоционатом флуоресцеина.
Биопрепараты. В 1924 г. французские исследователи Рамон и Де-комбе получили анатоксин, которым в дальнейшем активно профилак-тировали столбняк. У нас в стране рекомендуют высокоэффективный концентрированный столбнячный анатоксин, представляющий собой преципитат 1 %-ного квасцового анатоксина, изготовленный из нативного столбнячного токсина путем обработки его формалином, теплом, алюмокалиевыми квасцами и фенолом. Применяют его с профилактической целью в местностях, энзоотически неблагополучных по столбняку, особенно там, где отмечали частые случаи заболевания взрослых животных и молодняка. Иммунитет наступает через 30 дней после прививки и сохраняется у лошадей в течение 3—5 лет, у других видов животных не менее года.
Для пассивной иммунизации и лечения больных животных готовят антитоксическую противостолбнячную сыворотку. Ее получают путем гипериммунизации столбнячным анатоксином лошадей. Для получения сыворотки можно также гипериммунизировать крупный рогатый скот или овец.
В качестве профилактики при всех случаях ранения, обширных ожогах, перед кастрацией или другими хирургическими операциями в неблагополучных по столбняку местностях применяют антитоксическую сыворотку; ее вводят новорожденным ягнятам или суягным овцам за несколько дней до ягнения в районах, где болезнь у молодняка часто была обусловлена инфицированием пуповины. Профилактическая доза сыворотки для крупных животных составляет 8000 АЕ, для мелких — 4000 АЕ; лечебная доза для крупных животных равняется 80 000 АЕ, для мелких — 40 000 АЕ.
В первые 2—4 дня болезни сыворотку инъецируют ежедневно, затем — по показаниям. Больным животным ее инъецируют одновременно в равных частях под кожу и внутривенно, а также вокруг очага поражения и по ходу нервных стволов пораженной части тела животного.
ВОЗБУДИТЕЛЬ БОТУЛИЗМА
Возбудитель ботулизма — Cl. botulinum — вызывает остропроте-кающую кормовую токсикоинфекцию. Заболевание развивается вследствие воздействия ботулинического токсина на организм, характеризу
235
ется поражением центральной нервной системы и сопровождается на* резами двигательной мускулатуры.
Ботулизм описан в середине XVIII столетия, его название связано с первым наблюдением заболевания у людей, развившегося в результате употребления в пищу кровяной колбасы (лат. botulus — колбаса) > Возбудитель был открыт в 1896 г. ван Эрменгемом, который выделил его из зараженной ветчины, а также селезенки и толстого кишечника человека, погибшего от ботулизма. Это открытие вскоре было подтверждено русским исследователем С. В. Констансовым. Дальнейшее изучение показало, что в природе существует шесть типов Cl. botulinum (А, В, С, D, Е и F), которые различаются по антигенной структуре, синтезируе-
мых ими экзотоксинов.
Морфология и тинкториальные свойства. Cl. botulinum в окрашен-
ных препаратах имеет вид палочек с закругленными концами длиной 4—9 мкм и шириной от 0,6 до 0,8 мкм. Бактерии располагаются изолированно или парами, иногда в виде коротких цепочек. Микроб подвижен, имеет от 4 до 35 перитрихиально расположенных жгутиков; часть бактерий из молодых культур лишена жгутиков, большинство клеток из старых культур без жгутиков. Образует споры, располагающиеся субтерминально, редко центрально. Палочки со спорами имеют вид теннисных ракеток (см. рис. 84,7). Капсулы не имеют.
Вегетативные клетки хорошо окрашиваются спирто-водными рас-
творами анилиновых красок, грамположительны в молодых культурах и на препаратах из тканей, в старых культурах — грамотрицательные.
Культивирование. Возбудители ботулизма — строгие анаэробы. На поверхности плотных питательных сред растут при условии, если остаточное давление воздуха не превышает 3—10 мм ртутного столба. Хорошо растут в предварительно регенерированных жидких средах. Для культивирования применяют специальные среды: глюкозо-кровяной агар Цейсслера, печеночный агар с глюкозой, желатину с глюкозой, агар столбиком с глюкозой, среду Китт-Тароцци, бульон Хоттингера под вазелиновым маслом с кусочками мяса или печени и добавлением непосредственно перед посевом 0,5—1 % глюкозы. Используют также бульоны из кислотных или триптических гидролизатов казеина, мяса и других субстратов, содержащих белки.
Оптимальная температура для роста и токсинообразования бактерий типов А, В, С и D — 35 °C, для типов Е и F — 28—30 °C; споры возбудителей ботулизма типов Е и F могут прорастать, размножаться и образовывать токсин даже при 4 °C, развитие и токсинообразование типов А и В возможно при температуре 10—55 °C (Т. И. Булатова, К. И. Матвеев, 1973). Элективное значение pH 7,4—7,7.
На среде Китт—Тароцци образует помутнение, затем появляется осадок и жидкость светлеет, культура издает запах прогорклого масла. На агаре Цейсслера вырастают прозрачные колонии — росинки величиной в несколько миллиметров с ровными или изрезанными краями и блестящей поверхностью, окруженные зоной гемолиза (2). Окрашены колонии в слегка коричневатый или серовато-мутный цвет, их середина вогнутая или выпуклая. Крупные колонии более плоские. В пределах одного штамма встречаются колонии нескольких типов. Одни штаммы дают полный гемолиз, другие только обесцвечивают агар.
При росте на желатине образуются круглые, блестящие, прозрачные с сероватым оттенком колонии, иногда они окрашены в коричневатый цвет и окружены вязкой зоной разжиженной желатины. В агаре столбиком колонии имеют форму чечевиц или комочков ваты с уплотненным центром. . V
Биохимические свойства. Cl. botulinum при посеве на среды с сахарами ферментирует с образованием газа и кислоты: глюкозу, левулёзу, мальтозу, глицерин, декстрин, салицин, адонит, инозит и не разлага
236
ет галактозу, сахарозу, дульцит, маннит, арабинозу и рамнозу. Однако эти свойства непостоянны и не могут служить критерием идентифика? ции микроба и дифференциации его типов. Бактерии типов А и В обладают высокой протеолитической активностью: они полностью переваривают кусочки печени и мышц в жидких средах; протеолитические свойства у типа F выражены слабее и минимальны у типов С, D и Е.
Устойчивость. Вегетативные клетки возбудителя малоустойчивы к воздействию различных факторов внешней среды. Температура 80 °C убивает их через 30 мин, кипячение — через 2—5 мин. Резистентность спор высока. В высушенном состоянии они могут сохранять жизнеспособность десятилетиями. К нагреванию споры более устойчивы в среде, содержащей значительное количество жира. Наличие в среде ионов железа, кальция, высокая концентрация сахарозы также повышает их устойчивость к нагреванию.
Споры клостридий ботулизма типов А, В, и F наиболее устойчивы к кипячению; наименее резистентны споры типа Е. Споры типов С и D имеют промежуточную степень терморезистентности. Так, споры типов А и В хорошо переносят кипячение при температуре 100 °C в течение 5 ч и погибают только через 6 ч. При нагревании до 105 °C споры погибают не ранее чем через 2 ч, при 120 °C — через 20—30 мин. Поэтому надежным способом обезвреживания спор возбудителя ботулизма является автоклавирование не менее 30 мин при 120 °C. Молодые споры из 6—10-дневных культур типов А и В более устойчивы к температуре, чем споры этих типов из старых культур.
Споры хорошо переносят низкие температуры и не погибают при —190 °C. При —16 °C сохраняются до года, но часть их при этом разрушается. Поэтому замороженные субстраты, содержащие большое количество спор, могут быть ядовитыми. Споры типов А и В также обладают более высокой радиорезистентностью. Они могут переносить облучение 2,5—3 Мрад, но эта способность у различных штаммов неодинакова и зависит от состава среды, ее pH и концентрации спор. Желудочный сок н пищеварительные ферменты их не разрушают: при высеве спор в желудочный, кишечный и панкреатический сок, а также желчь они прорастают, бактерии размножаются и синтезируют токсин.
Устойчивы споры и к различным химическим бактерицидным веществам. В 5 %-ном феноле они сохраняются одни сутки, 10 %-ный раствор соляной кислоты убивает их при комнатной температуре через 1 ч, 40 %-ный формалин в двойном разведении — через 24 ч, в этиловом спирте они могут сохранять жизнеспособность 2 месяца. Такой же срок выдерживают они в среде, содержащей 14 % поваренной соли (Т. И. Булатова, К. И. Матвеев, 1973).
Ботулинический токсин в жидких средах разрушается при кипячении через 15—20 мин, в твердых субстратах — через 2 ч. Протеолитические ферменты желудочно-кишечного тракта (пепсин, трипсин), не разрушают токсины типов А, В, С, D, F и усиливают активность токсина типа Е, что связано с тем, что у типа Е протоксин не активируется эндогенными протеазами. В кислой среде при pH 3,5—6,8 устойчивость токсинов больше, чем в щелочной среде, при pH 7,8 они значительно снижают свои токсические свойства, pH выше 8,5 их инактивирует. В зерне токсин может сохраняться месяцами; солнечный свет и высушивание его ослабляет, но полностью не обезвреживает зерно в течение 93 дней. Зерно, обработанное 1 %-ным раствором едкого натра, теряет токсические свойства через 3—6 ч (Р. Ф. Сосов, 1976).
Патогенность. В анаэробных условиях в организме животных, субстратах растительного и животного происхождения, а также на специальных питательных средах Cl. botulinum сийтезирует чрезвычайно активный экзотоксин, относящийся к группе нейротоксинов. Самый сильный токсин вырабатывает тип А. Этот токсин превосходит по своей силе
237
все известные природные яды, 10 мт кристаллического токсина способны отравить население всего земного шара (С. Мартынов, 1969).
Каждый из шести типов возбудителя ботулизма обладает оригинальным токсином, имеющим только ему присущую антигенную структуру. В составе токсина различают не менее пяти факторов: нейротоксин, гемолизин, гемолизин-гемагглютинин, липазу и протеазу. Токсическими факторами Cl. botulinum также являются ферменты патогенности и среди них протеиназы, лецитиназы и декарбоксилазы.
Наиболее чувствительны к ботулиническому токсину лошади, у них заболевание чаще вызывается токсинами типа В, реже типов А и С. Крупный рогатый скот поражается токсинами типов С и D, овцы и козы также чувствительны к типам С и D; у коз ботулизм встречается чрезвычайно редко, но они очень чувствительны к токсину типа С. Свиньи в естественных условиях проявляют к ботулизму значительную устойчивость, однако экспериментально заболевание можно вызвать всеми типами токсина, причей животные наиболее чувствительны к типам В и F, известны случаи заболевания свиней, обусловленные токсином типа А. Собаки, кошки, волки, кайоты, другие хищники, серые крысы резистентны к заболеванию. Исключение составляют норки, которые проявляют высокую чувствительность к ботулизму и поражаются чаще всего токсином типа С.
Описан ботулизм песцов, черно-бурых лисиц и ондатр.
К ботулизму восприимчивы птицы, известно более 36 видов птиц, у которых зарегистрировано это заболевание и среди них куры, индейки, утки, гуси, чайки, голуби. Ботулизм у птиц вызывается преимущественно токсинами типов С, А и В.
Восприимчив к ботулизму и человек, в качестве этиологических факторов заболевания у человека обнаружены клостридии типов А, В и Е.
Рыбы, амфибии и рептилии к ботулизму практически невосприимчивы. Лабораторные животные: белые мыши, морские свинки и кролики — восприимчивы к ботулиническим токсинам всех типов.
Патогенез. Ботулизм является токсикоинфекцией. Токсин в организм попадает с кормом, и его удается обнаружить в тонком и толстом отделах кишечника, крови, печени, желчи, моче, иногда в мозге. Особенно сильно при ботулизме поражается центральная нервная система. Первыми повреждаются мышцы, инервируемые черепномозговыми нервами. В настоящее время доказано одновременное действие токсина как на периферические, так и на центральные отделы нервной системы.
Из кровн токсин проникает в органы, поражая нервные элементы. Действуя на нейроны спинальных моторных центров и продолговатого мозга, вызывает развитие паралитического синдрома; поражение же периферических моторных нервно-мышечных приборов сопровождается нарушением передачи возбуждения с нерва на мышцу. Прн этом полная блокада передачи импульсов не наступает.
В больших дозах токсин угнетает тканевое дыхание головного мозга, а также является сосудистым ядом, поражающим нервную систему сердца и сосудов. Это приводит к нарушениям экстра- и интракардиального иннервационного аппарата (нервной трофики), дистрофин миокарда и понижению сократительной способности мелких кровеносных сосудов.
Длительное время считалось, что ботулинический токсин блокирует терминальные участки нервных волокон н тем самым тормозит выброс ацетилхолина в пресинапти-ческих окончаниях. В результате нарушается проведение возбуждения в синапсах центральной нервной системы и в мионевральных аппаратах. Однако последние исследования показали, что изменение обмена ацетилхолина не играет специфической роли в механизме поражения моторных и чувствительных нейронов при ботулизме (Ю. В. Езепчук, 1977). Все факты свидетельствуют о том, что ботулинический токсин действует на нервную систему, ио каким способом неизвестно.
Большой интерес представляет новое направление в изучении механизма действия токсина, ставящее цель определить нервный рецептор для токсина. Предполагается, что молекулы ботулинического токсина с их выраженными полярными свойствами взаимодействуют с клеточными рецепторами, в структуру которых входят сиаловые кислоты, обладающие высоким отрицательным зарядом.
Кроме специфического действия, лежащего в основе патологического синдрома, характерного для ботулизма, токсин клостридий ботулизма ингибирует бактерицидную активность лейкоцитов.
Фагоцитоз спор Cl. botulinum токсином не подавляется. Приблизительно через
238
8 ч после поглощения спор лейкоцитами они прорастают и переходят в вегетативные клетки. К этому времени бактерицидное действие лейкоцитов резко угнетается и фагоцитированные бактерии не разрушаются. Таким образом, захват спор лейкоцитами обеспечивает сохранение возбудителя в условиях макроорганизма, последующее ингибирование токсином способности переваривать вегетативные клетки создает условия для развития бактерий.
Заражение ботулизмом может произойти также аэрогеиио при вдыхании пылн, содержащей токсин.
Антигенная структура. Все шесть серологических типов экзотоксина обладают иммунологической специфичностью, выявляемой в реакции нейтрализации. Специфичность токсинов типов А, В и Е очень высока, С и D несколько ограничена. Токсины этих двух типов не нейтрализуются антитоксинами А, В и Е, но небольшие дозы токсинов С и D перекрестно нейтрализуются большими количествами антитоксинов D и С. Известен также факт перекрестной нейтрализации специфическими антисыворотками ботулинических токсинов типов Е и F.
В пределах типов А и В в реакциях агглютинации, преципитации и связывания комплемента по антигенам бактериальных клеток выявлены отдельные серологические группы; у типа Е обнаружено три серологические группы, у типов С, D и F такого разделения не установлено.
Возбудители ботулизма имеют жгутиковый Н- и соматический О-ан-тигены, четко различающиеся в реакции агглютинации. О-антиген является групповым антигеном, общим для протеолитических штаммов Cl. botulinum типов А, В и Cl. sporogenes. Н-антиген типоспецифичен. Наблюдается совпадение Н-антигенов (идентичность) у бактерий, различающихся по типу экзотоксинов.
Структура антигенных детерминант ботулинических токсинов еще окончательно не изучена, но установлено, что дисульфидные группировки молекул экзотоксинов определяют их иммуногенную активность.
Иммунитет по своей природе антитоксический. Механизм противо-ботулинического иммунитета остается до сих пор мало изученным. У восприимчивых животных естественного иммунитета к ботулизму не существует. Описаны случаи индивидуальной устойчивости к ботулиническому токсину людей и животных. Перенесенное заболевание также не оставляет иммунитета ни у человека, ни у животных.
В сыворотках здоровых людей и животных неоднократно обнаруживали в высоких титрах агглютинины к антигенам клостридий ботулизма. Эти антитела не проявляли защитного эффекта и, как предполагают, возникали в результате скрытой иммунизации малыми дозами спор, случайно попадавшими с пищей и кормом.
Доказана возможность создания стойкого антитоксического иммунитета к ботулизму путем искусственной вакцинации специфическим анатоксином.
Диагностика. Материалом для исследования служат пробы кормов, послуживших причиной заболевания, содержимое желудка, кишечника, кровь, паренхиматозные органы свежих трупов погибших животных. Основным методом лабораторного диагноза ботулизма является обнаружение в исследуемых субстратах токсина; параллельно проводят выделение культуры, но это удается не всегда.
Микроскопия первичного материала в данном случае диагностического значения не имеет.
Бактериологическое исследование. Для выделения культур исследуемый материал тщательно растирают в ступе со стерильным песком и заливают двойным количеством физиологического раствора. Посевы лучше всего делать на регенерированных жидких питательных средах с 0,5 % глюкозы (Китт—Тароцци, бульон Хоттингера, мясо-казеиновый гидролизат и др.); pH должно быть в пределах 7,2—7,4. Среду заливают слоем вазелинового масла толщиной 0,5 см.
Посевы проводят в два флакона, один из них прогревают 20 мин при
239
80 °C на водяной бане для освобождения от неспоровых форм бактерий» Культуры выращивают при 35—37 °C; если имеется подозрение на типы Е и F, то при 28—30 °C. Типичный рост появляется на 2—3-и сутки. Культуру микроскопируют и дополнительно высевают на глюкозо-кровяной агар Цейсслера. Перед посевом культуру обязательно прогревают при 80 °C в течение 20 мин.
Для выделения культуры сеять можно в высокий столбик агара с глюкозой.
Биологическое исследование осуществляют для обнаружения ботулинических токсинов. Материал растирают и разводят, как и в предыдущем случае, затем для экстрагирования выдерживают при комнатной температуре 1—2 ч, пропускают через ватно-марлевый фильтр, можно центрифугировать при 3000 об/мин — 30 мин. Цитратную кровь и сыворотку не разводят, но исследуют сразу после взятия: токсин в них разрушается очень быстро.
Для обнаружения токсина берут четыре белые мыши по 16—18 г каждая. Двум из них исследуемый материал (0,5—0,8 мл) вводят внутрибрюшинно или внутривенно (в хвостовую вену), две другие остаются контрольными. Им инокулируют предварительно прогретый в течение 30 мин при 100 °C экстракт.
При наличии ботулинического токсина две первые мыши гибнут через 1—4 дня, контрольные остаются живы.
Для серологического диагноза используют реакцию нейтрализации токсинов гомологичными антитоксическими сыворотками. С этой целью берут 5 пробирок, в каждую из них вносят 2,4 мл исследуемого экстракта и добавляют по 0,6 мл антисыворотки типов А, В, С, Е (каждый тип в одну пробирку), пятая пробирка контрольная и содержит вместо сыворотки 0,6 мл физиологического раствора. Смеси выдерживают 30 мин при 37 °C в термостате и содержимое каждой пробирки вводят внутрибрюшинно в дозе 1 мл двум мышам. Результаты учитывают через 4—6 ч, затем через 24 ч и далее в течение четырех дней. Мыши, получившие смесь токсина и гомологичной сыворотки, выживают, остальные и контрольные гибнут.
В качестве диагностических тестов на ботулизм предложены метод определения фагоцитарного показателя и реакция непрямой гемагглютинации. Эти методы непригодны для обнаружения ботулинических токсинов в кормах, пищевых продуктах и патологическом материале, их используют только как ориентировочные.
Биопрепараты. Для специфической профилактики ботулизма используют анатоксины, преципитированные квасцами или сорбированные на гидрате окиси алюминия.
Из животных вакцинируются только норки. Они очень чувствительны к токсину типа С и при поедании недоброкачественных кормов заболевают ботулизмом.
У нас в стране готовят вакцину против ботулизма норок, которая представляет собой анакультуру штаммов типа С, преципитированную квасцами. Вводят ее (как молодняку, так и взрослым норкам) однократно по 1 мл в мышцу с внутренней стороны бедра. Иммунитет наступает через 2—3 недели после прививки и продолжается не менее года.
Разработана также ассоциированная вакцина против ботулизма и пастереллеза норок, предложенная в 1967 г. Ф. И. Каган и Н. М. Никифоровой. Вакцина представляет собой смесь инактивированной формалином и концентрированной алюмокалиевыми квасцами анакультуры Cl. botulinum типа С (С-альфа-норка) и культуры Pasteurella septicum «Норка». Препарат вводят внутримышечно однократно в дозе 1,5 мл независимо от возраста. Иммунитет наступает через 2—3 недели и продолжается не менее 12 месяцев.
240
i-B США используют ассоциированную вакцину против вирусного энтерита и ботулизма норок.
Для медицинских целей выпускают антитоксическую сыворотку.
ВОЗБУДИТЕЛЬ НЕКРОБАКТЕРИОЗА
Возбудитель некробактериоза — Fusobacterium necrophorum из семейств Bacteroidaceae, рода Fusarium. Микроб выделен Р. Кохом в 1881 г. из изъязвленной роговицы барана, пораженного оспой, в 1882 году он был обнаружен и подробно описан Леффлером при дифтерии телят. В последующем его выявляли Шютц и М. Г. Тартаковский. Чистую культуру F. necrophorum первыми получили Банг (1890) и Шморл (1891).
Некробациллез — антропозооноз, характеризуется гнойно-некротическими поражениями кожи, слизистых оболочек подлежащих тканей,
иногда паренхиматозных органов.
Морфология и тинкториальные свойства. Микроб полиморфный.
В препаратах из свежих культур и свежих некротических фокусов имеют форму палочек или длинных зернисто-окрашенных четкообразных переплетающихся нитей длиной 100—300 мкм (могут быть и короче — 30—50 мкм) (см. рис. 85), отдельные нити достигают 400 мкм. Некоторые нити формируют шаровидные и колбовидные вздутия. Длина изолированных палочек 2—5 мкм.
В мазках из старых культур и отпечатках из хронических очагов поражения, особенно инкапсулированных, бактерия некроза имеет форму коротких палочек длиной 0,7—4 мкм и шириной 0,3—0,5 мкм. Окрашиваются они зернисто, неравномерно, часто по концам более интенсивно (биполярно). В таких препаратах встречаются также кокковидные формы. Бактерия неподвижна, жгутиков не имеет, спор и капсулу не образует.
Спирто-водными растворами анилиновых красителей окрашивается неравномерно, с промежутками, по Граму отрицательно. Хорошо красится фуксином Циля, синькой Леффлера, по Романовскому—Гимзе и особенно по Муромцеву.
Культивирование. Бактерия некроза — строгий анаэроб. Для его культивирования используют среду Китт—Тароцци, бульон Мартена, печеночный бульон Хоттингера, сывороточный и глюкозо-кровяной агар, полужидкий агар, мозговую среду. Добавление к среде Китт—Тароцци 10—20 % свежей бычьей сыворотки и 0,2—0,5 % глюкозы приводит к более интенсивному росту микроба и повышению газообразования. Температурный оптимум 36—38 °C, pH среды 7,4—7,6.
На среде Китт—Тароцци через 24—48 ч появляется помутнение и на кусочках печени образуется хлопьевидный осадок; газообразование слабое, но у отдельных штаммов оно выражено хорошо. Через 5—8 суток
наступает просветление среды и выпадение крошковатого осадка, разбивающегося при встряхивании в равномерную муть. При посеве в высокий столбик сывороточного агара через 4—5 дней образуются чечевицеобразные, мелкозернистые, с радиальными отростками колонии.
На поверхности глюкозо-кровяного агара растет при создании вакуума до 4—10 мм ртутного столба, на 2—3-и сутки появляются мелкие круглые или продолговатые росинчатые колонии, увеличивающиеся в размерах к 4—5-му дню. Иногда колонии окружены слабой зоной зеленоватого гемолиза. Поверхность колоний гладкая, матовая. При помещении культуры в аэробные условия колонии продолжают расти, но становятся непрозрачными и шероховатыми.
Микроб хорошо растет на мозговой среде и при добавлении 0,05 % сернокислого железа вызывает ее почернение за счет образования сероводорода.
18—Ветеринарная микробиология
241
Биохимические свойства. Бактерия некроза ферментирует с обраво< ванием кислоты и небольшого количества газа арабинозу, глюкозу, галактозу, левулёзу, мальтозу, сахарозу, салицин и непостоянно — глицерин, дульцит, маннит и инулин. Лактозу ферментирует слабо. Желатину и свернутую сыворотку не разжижает, не переваривает яичный белок, слабо и непостоянно пептонизирует молоко, образует индол и сероводород. Аммиак не вырабатывает. Не восстанавливает нитраты в нитриты.
Устойчивость. Возбудитель некробактериоза относительно нестойкий микроб, но может длительное время сохраняться в различных объектах внешней среды. В фекалиях сохраняет жизнеспособность до 50 суток, в моче — до 15 суток, на поверхности почвы, покрытой травой, — до 10 суток, в почве летом — 15 дней, зимой — не более 60 дней, в водопроводной и дистиллированной воде — до 15 суток, молоке — до 35 суток, в физрастворе — до 45 суток. При воздействии прямых солнечных лучей погибает через 12 ч. Культуры, высушенные при доступе воздуха, теряют жизнеспособность через 72 ч, лиофильно высушенные и помещенные в анаэробные условия сохраняют ее до 15 месяцев; в замороженном состоянии в культурах бактерии выживают 30—40 дней. При нагревании до 65 °C бактерии гибнут в течение 15 мин, при 70 °C — через 10 мин, при кипячении — моментально.
Возбудитель некробактериоза чувствителен к дезинфектантам: 5°/о-ные растворы едкого натра или калия убивают его через 10 мин; 2,5 %-ный креолин — через 20 мин; 5 %-ный лизол —- через 9 мин; 2 %-ный фенол — через 2 мин; 2,5 %-ный формальдегид — через 13 мин; перманганат калия 1 : 1000 — через 10 мин.
Бактерия некроза высокочувствительна к антибиотикам тетрациклинового ряда, в меньшей мере — к пенициллину и стрептомицину; устойчива к мицерину и колимицину (И. С. Бычков, 1976).
Патогенность. В естественных условиях некробактериозом заболевают лошади, крупный рогатый скот, буйволы, олени, овцы, козы, свиньи, собаки, кошки, куры, гуси, а также дикие животные — косули, сибирские козероги, лоси, архары, антилопы, ламы, зебры, бегемоты, бобры, сурки, ондатры, суслики, песчанки, пресмыкающиеся. К некро-бактериозу восприимчив человек. Из лабораторных животных чувствительны кролики и белые мыши.
У лошадей некробактериоз протекает в форме гангренозного мокреца. У взрослого крупного рогатого скота поражаются нижние части конечностей, кожа вымени, слизистая оболочка влагалища и матки; у телят наблюдается дифтеритическое воспаление слизистых оболочек ротовой полости, гортани и внутренних органов. Для северных оленей характерен некробактериоз копыт (копытная болезнь). Взрослые свиньи болеют редко, но восприимчивы поросята-сосуны; у них отмечают некротический стоматит, ринит, дерматит и энтерит. У овец наиболее часто повреждаются конечности. У собак развивается флегмонозный и пустулезный дерматит с подкожными абсцессами. У кур поражаются глотка, корень языка, гортань, пищевод, внутренние органы.
Бактерии некроза продуцируют экзотоксин, эндотоксин и гемотоксин. Экзотоксин вырабатывается при культивировании микроба в жидких питательных средах, максимальная концентрация его достигает в 24—36-часовых культурах. Более интенсивно его синтезируют штаммы, выделенные от лошадей. Этот токсин нестоек и разрушается при 55 °C в течение 10 мин, при 100 °C — через 5 мин. Добавление к экзотоксину 0,3 % формалина переводит его в анатоксин. Эндотоксин образуется при распаде микробных клеток, обладает сильным некротизирующим действием.
Гемотоксин интенсивно продуцируется на средах из свежего мяса с добавлением пептона, 0,5 % глюкозы, фосфата натрия и небольшого ко-242
личеств^ крови; обладает термолабильными свойствами и разрушается при 48 °C через 15 мин, при 56 °C полностью инактивируется, при 4 °C сохраняется 2 месяца. Лизирует эритроциты лошади, крупного рогатого скота, барана, свиньи, морской свинки, кролика и голубя.
Патогенез. Некробактериоз — послераневая инфекция. Бактерия некроза интенсивно размножается в травмированных тканях: они недостаточно снабжаются кислородом вследствие нарушения целостности капилляров. Это приводит к созданию анаэробных условий. В здоровых тканях, нормально насыщенных кислородом, возбудитель не размножается. Особенно благоприятные условия для своего развития бактерии находят в крови гематом.
В организме бактерия некроза синтезирует токсические компоненты, блокирующие внутриклеточные ферментные системы и вызывающие некроз окружающих тканей. Процесс осложняется механической закупоркой капилляров интенсивно размножившимися микробными клетками.
Из очага поражения микроб гематогенным путем может распространяться по организму, в значительной степени этому способствует поражение стенок кровеносных сосудов и отрыв тромбов, инфицированных бактериями некроза. В результате процесс распространяется на соседние ткани, возникают вторичные очаги в коже, сухожилиях, костях. Проникновение бактерий в кровь приводит к развитию септицемии и образованию метастатических некротических очагов в легких, сердечной мышце, печени. Заболевание приобретает злокачественное течение и нередко закапчивается смертью.
Антигенная структура. Опыты с адсорбцией антител показали, что у бактерии некроза имеются штаммы, идентичные в антигенном отношении. Наряду с этим установлено наличие отдельных серологических типов, различающихся по составу антигенов. Обнаружено также присутствие общих антигенов у возбудителя некробактериоза и фузобактерий.
Иммунитет. У переболевших животных иммунитет не вырабатывается: они могут повторно заболевать некробактериозом. Его невозможно также создать искусственно.
При внутривенной иммунизации кроликов убитыми или живыми бактериями некроза в их сыворотках обнаруживали специфические пре-ципитины, агглютинины и комплементсвязывающие антитела. Эти же антитела выявляли в сыворотках больных животных и людей. Однако их защитная функция невелика.
Диагностика. В бактериологическую лабораторию направляют кусочки пораженных органов и тканей с прилегающей здоровой тканью, целые трупы мелких животных и птиц. Содержимое из некротизированных очагов можно набирать в пастеровские пипетки, запаивать и пересылать в лабораторию.
Для прижизненного исследования берут некротические поражения на границе омертвевшей и здоровой ткани после предварительной механической очистки от распавшейся ткани и гноя. Одновременно из этих же участков готовят несколько препаратов-отпечатков на предметных стеклах. При поражении ротовой полости, кроме некротических наложений, материалом для биологического исследования может быть слюна больного животного. В лабораторию пробы отправляются в свежем виде (с нарочным) или же в 30 %-ном стерильном глицерине.
Мазки, приготовленные из некротизированной ткани, фиксируют спирт-эфиром 10 мин и окрашивают синькой Леффлера (лучше с подогреванием 3—4 мин), по Муромцеву, Романовскому—Гимзе, а также Граму. В мазках обнаруживают зернистоокрашенные нити или тонкие длинные грамотрицательные палочки. Микроскопическое исследование дает основание поставить только предварительный диагноз.
Бактериологическое исследование. Для посевов используют кусочек некротизированной ткани, отобранной на границе со здоровой. Его помещают в среду Китт—Тароцци с 10 % свежей крови или сыворотки крупного рогатого скота и 0,5 % глюкозы, дополнительно можно засевать на полужидкий агар. Посевы инкубируют 2—3 суток при температуре 37 °C. Для определения сопутствующей аэробной микрофлоры дополнительно производят посевы на МПА и МПБ.
18*
243
При выделении культур на глюкозо-кровяном агаре кусочек некротизированной ткани растирают, суспендируют в физиологическом растворе и дробно засевают на поверхность агара. Сахарный агар высоким столбиком расплавляют, охлаждают до 45 °C и вносят материал. Культуры выращивают в анаэробных условиях, рост обычно появляется через 2—3 суток. Материал часто бывает загрязнен сопутствующей микрофлорой, поэтому для выделения чистой культуры бактерии некроза необходимо предварительно заразить лабораторное животное.
Биологическое исследование. Для выделения из патологического материала чистой культуры бактерии некроза наиболее пригодны кролики, можно использовать и белых мышей. Кролика заражают под кожу уха в дозе 0,5—1 мл материала или бульонной культуры. Через 2—4 дня на месте введения развивается некротический очаг, распространяющийся на все ухо и мягкие ткани головы. Материал из пораженного очага используют для приготовления мазков и посевов. На 6—10-й день кролик обычно погибает. При вскрытии обнаруживаются некротические очаги в мышцах головы, брюшной стенки, сердце, печени и других паренхиматозных органах. В результате внутривенного заражения животное погибает на 3—5-е сутки. Наблюдают за подопытным кроликом 10 дней.
Белых мышей заражают 0,3—0,5 мл бульонной культуры подкожно в области корня хвоста. На 8-й день в окружности инъекции развивается припухлость и нагноение, на 5—6-й день — некроз, на 8—10-й день хвост отпадает. Мыши погибают на 10—14-й день с явлениями некроза мышц в области заражения, гнойными очагами в печени, легких, сердце.
Для серологического диагноза некробактериоза в 1945 г. Я. Е. Коляков и И. В. Захаров предложили РСК. В качестве антигена использовали экстракт из бактерийной массы 3-недельных культур бактерии некроза на печеночном бульоне с титром до 1 : 40. По предварительным наблюдениям, положительные показания реакции совпадали с клиникой некробактериоза у 95 % животных. С этой целью испытывалась также реакция агглютинации. Однако ни РСК, ни другие серологические реакции не получили практического применения в качестве тестов иммунологического диагноза некробактериоза.
Биопрепараты. Вакцины и сыворотки для специфической профилактики и терапии некробактериоза не разработаны. Предложена комплексная терапия с использованием химиопрепаратов. Эффективными средствами лечения оказались сульфаниламиды (сульфадимезин) и антибиотики тетрациклинового ряда (хлортетрациклин, террамицин и дибиомицин).
ПАТОГЕННЫЕ МИКОБАКТЕРИИ
Микобактериями называют микроорганизмы, обладающие способностью при культивировании на питательных средах образовывать длинные нити. На концах этих нитей появляются вздутия в виде колбочек. Некоторые нити разветвляются. Данная культура под микроскопом похожа на мицелий плесневых грибов. Наличие таких признаков сближает микобактерии с актиномицетами (лучистыми грибами).
Микобактерии широко распространены в природе. Среди них различают .патогенные виды и сапрофиты. Последние обитают в почве, водоемах, навозе, молоке, на траве. Патогенные микобактерии вызывают заболевание людей и животных. В основном это микобактерии туберкулеза. В их число входят также возбудитель проказы у человека и возбудитель паратуберкулеза рогатого скота.
Патогенные микобактерии (возбудители туберкулеза человека, крупного рогатого скота и птиц) в таксономической системе (по Берги) относятся к порядку Actinomycetales, семейству Mycobacteriaceae и роду 244
Mycobacterium. Все эти микобактерии в некоторых случаях могут мигрировать на людей или животных другого вида и являться причиной болезни. Они могут вызывать также заболевание туберкулезом у свиней, коз, овец, верблюдов и других домашних и диких животных (особенно при содержании последних в неволе). Были описаны микобактерии холоднокровных и возбудитель туберкулеза мышей.
К роду Mycobacterium относится много видов потенциально-патогенных и непатогенных микобактерий, которые получили название атипичных. В их числе М. Kansasii, М. marinum, М. gastri, М. scrofulaceum, М. intracellulare, М. xenopi, М. ulcerans, М. phlei, М. smegmatis, М. for-tuitum и др. Некоторые атипичные бактерии вызывают заболевания у людей, именуемые микобактериозами, а у животных они могут быть причиной аллергических реакций. По классификации Раниона возбудитель туберкулеза птиц тоже отнесен к атипичным микобактериям.
Микобактерии медленно окрашиваются растворами анилиновых красок, а если и окрасятся, то не обесцвечиваются под воздействием минеральных кислот и этилового спирта. Поэтому микобактерии называют кислото- и спиртоустойчивой группой микроорганизмов.
ВОЗБУДИТЕЛЬ ТУБЕРКУЛЕЗА
Возбудитель туберкулеза был открыт Робертом Кохом в 1882 г. и получил название Mycobacterium tuberculosis. В дальнейшем возбудители туберкулеза были разграничены на пять типов. В последнее время принято называть не типы, а виды микобактерий. Возбудителя туберку
леза человека называют М. tuberculosis, возбудителя туберкулеза крупного рогатого скота М. bovis, возбудителя туберкулеза птиц М. avium,
возбудителя туберкулеза мышей-полевок — М. murium, возбудителя туберкулеза холоднокровных М. poykilothermorum.
Туберкулез — инфекционное заболевание человека, млекопитающих животных и птиц, протекающее в большинстве случаев хронически и сопровождающееся образованием в пораженных органах и тканях типич
ных узелков — туберкулов, предрасположенных к творожистому распаду (казеозу).
Морфология и тинкториальные свойства. Микобактерии туберкуле-
за в большинстве случаев имеют форму тонких, прямых или слегка изогнутых палочек с закругленными краями длиной в среднем 0,8—5,5 мкм и шириной 0,2—0,6 мкм (см. рис. 86, А). Размеры их непостоянны и зависят от вида бактерий, условий обитания, питательных сред, возраста культуры и других причин. По сравнению с М. tuberculosis, М. bovis обычно более короткие и толстые. В тканях животных микобактерии бо
лее удлиненные, чем выращенные на питательных средах. В старых же культурах нередко встречаются длинные формы и иногда с ветвлением. В патологическом материале, взятом от животных, и в мазках из культур они располагаются изолированно или образуют небольшие группы. Неподвижны, спор и капсул не образуют.
При электронной микроскопии в цитоплазме находят различные по форме и размеру зерна (зерна Муха); крупные из них располагаются, как правило, на полюсах бактериальной клетки (Б). Зерна Муха обнаруживают свободнолежащими в культурах, в серозных экссудатах, а иногда в мокроте. Кроме того, в цитоплазме имеются микрогранулы и вакуоли. Из мельчайших микрогранул образуются макрогранулы, которые разрастаются и по размеру достигают диаметра бактериальной клетку, а иногда превосходят его, вследствие чего образуется неровная бугристая поверхность последней.
Фонтес в 1910 г. обнаружил фильтрующиеся формы микобактерий туберкулеза. L-формы микобактерий были описаны в 1945 г. Alexander— Jackson. При фазово-контрастной микроскопии они просматривались в
245
виде мелких зерен или шаровидных тел различных размеров с мелкшад гранулами. Получают L-формы на питательных средах с добавлением индуцирующих веществ. Считают, что при антибактериальной терапии L-формы могут образовываться в организме больного и играть определенную роль в длительности иммунитета у вакцинированных детей. L-формы обладают способностью к реверсии.
Микобактерии туберкулеза, атипичные и некоторые сапрофитные обладают кислото- спирто- и антиформиноустойчивостью. На этом свойстве микобактерий основаны методы окраски.
Метод Циль — Нильсена. Сделанный на предметном стекле мазок из патологического материала или культуры, высушенный и фиксированный на пламени горелки, покрывают полоской фильтровальной бумаги. На поверхность ее наносят карболовый фуксин Циля и препарат подогревают на пламени до появления паров, добавляя краску в течение 2—3 мин. Затем препарат промывают водой и обесцвечивают 2 мин в 5 %-ной серной или 25 %-ной азотной кислоте. Кислоту отмывают водой, а мазок дополнительно в течение 3—5 с обесцвечивают 70— 90 %-ным этиловым спиртом. Можно обесцвечивать 3 %-ной соляной кислотой в 95 %-ном этиловом спирте. После тщательного промывания препарата водой его докрашивают водным раствором метиленовой синьки или малахитовой зеленью 30—60 с, еще раз промывают водой, высушивают и рассматривают под микроскопом с иммерсионной системой. На синем или светло-зеленом фоне видны ярко-красные микобактерии туберкулеза, причем зерна их более интенсивно воспринимают окраску, чем цитоплазма.
Из-за гидрофобности оболочек грамокраску микобактерий производят по модифицированному методу Грамм—Муха. Мазок окрашивают карболовым метилвиолетом с подогреванием до появления паров. Краску сливают и мазок обрабатывают раствором. Люголя. Затем его обесцвечивают поочередно 5 %-ной азотной кислотой, 3 %-ной соляной кислотой и смесью ацетона и алкоголя. Наконец, дополнительно окрашивают препарат сафранином или разведенным фуксином. При микроскопии на красном фоне видны фиолетовые микобактерии или зерна.
В последнее время для бактериоскопического исследования применяют люминесцентный анализ: простое флуорохромирование или иммунофлуоресцентный метод.
Культивирование. Возбудитель туберкулеза — строгий аэроб. Оптимальная температура выращивания: М. tuberculosis — 37—38 °C; М. bovis — 38—39 °C; М. avium — 39—41 °C. Оптимум pH среды 6,8— 7,4. Микобактерии туберкулеза обладают глицеринофильностью. При наличии в питательных средах глицерина, который является источником углерода, наблюдается обильный рост культур. Для размножения микобактерий необходимы фосфор, калий, магний и сера. Стимулируют рост препараты железа. Источниками азота являются белки среды, аминокислоты, соли аммония.
Питательные среды для культивирования микобактерий делят на простые, или глицериносодержащие, и элективные — белковые и безбел-ковые (синтетические). К числу первых относят глицериновый мясо-пептонный бульон и агар, а также глицериновый картофель.
Добавляя к мясо-пептонному бульону глицерин из расчета 4 % по объему или 5 % по массе, получают глицериновый мясо-пептонный бульон, а при добавлении в эту среду 2—2,5 % агара получают глицериновый мясо-пептонный агар. Стерилизуют эти среды 20 мин при 120 °C.
Для приготовления глицеринового картофеля моют и очищают клубни, из которых вырезают клинья и выдерживают в 1 %-ном растворе двууглекислой соды 1 ч. Затем их опускают в пробирки «Ру» (с перехватом), заполненные 5 °/о-ным глицериновым бульоном или 5%-ной глицериновой водой. Стерилизуют при 120 °C 15— 20 мин. Можно использовать простые широкие пробирки, в которые на дно помещают кусочки стеклянных трубочек для подставки под картофельные клинья.
246
*Из ^ элективных белковых используют среды Петраиьяии, Гельберга, Левеиштей-иа — Иеисена и др., из синтетических (безбелковых) — среды Сотоиа, Модели и др.
Для приготовления среды Петраньяни берут молоко цельное 300 мл, крахмал картофельный 12 г, пептои 2 г, картофель очищенный и мелко нарезанный (2 клубня размером с куриное яйцо). Эти ингредиенты помещают в колбу и несколько минут кипятят в водяной бане и выдерживают в ней еще 1 ч. К охлажденной до 50 °C смеси добавляют 8 целых яиц и 2 желтка, 24 мл глицерина и 20 мл 2 %-ного стерильного раствора малахитовой зелени. Хорошо смешивают, фильтруют через воронку с двойным слоем марли, разливают по пробиркам и стерилизуют.
Для приготовления среды Гельберга в колбу с бусами разбивают 6 целых яиц и добавляют 4 желтка, встряхивают, затем добавляют по 100 мл молока, картофельного отвара, солевого раствора и 7,5 мл раствора малахитовой зелени, тщательно размешивают, разливают по пробиркам и стерилизуют. Молоко, картофельный отвар и солевой раствор готовят заранее. Для приготовления солевого раствора берут двуоснов-иой фосфорнокислый калий, лимоннокислый натр, сернокислый магний по 1 г, пептон 6 г, глицерин 30 мл, воды дистиллированной 1000 мл. Раствор фильтруют через бумажный фильтр и стерилизуют.
Для среды Левенштейна— Йенсена в колбу с бусами разбивают яйца и хорошо размешивают. К 1 л яичной массы добавляют 600 мл солевого раствора и 20 мл 2 %-ного стерильного раствора малахитовой зелени. Тщательно встряхивают и разливают по пробиркам. Солевой раствор содержит однозамещеииого фосфорнокислого калия 2,4 г, сернокислого магния 0,24 г, лимоннокислого натрия 0,6 г, аспарагина 3,6 г, глицерина 12 мл, воды дистиллированной 600 мл. Все элективные яичные среды, разлитые в пробирки, ставят в аппарат при 85 °C для свертывания в течение двух дней по 30 мни, а затем выдерживают в термостате 2—3 суток.
Рост культур микобактерий туберкулеза на жидких питательных средах с глицерином появляется через 10—30 дней после посева, а иногда и позже в виде пленки. М. tuberculosis образует толстую складчатую пленку, поднимающуюся на стенки сосудов, М. bovis — пленку петлистую с бородавчатыми выростами, а М. avium — на 7— 10-й день тонкую, нежную, беловатую, а к 21-му дню мощную морщинистую пленку.
На плотных средах вначале образуются едва заметные микроколонии, которые затем увеличиваются и приобретают различные размеры. На поверхности среды обычно видны мелкие либо крупные, блестящие или матовые, гладкие или шероховатые единичные колонии, либо сплошной рост, когда колонии сливаются и образуют налет беловато-желтого цвета.
Атипичные микобактерии. Кроме туберкулезных различных видов или типов, как называли раньше, были описаны атипичные микобактерии. В настоящее время их считают отдельными видами. Оии были выделены от больных людей, животных и птиц. Их характерным свойством является появление пигментации колоний при выращивании в темноте либо при диевиом свете, быстрота роста и т. п. В одних случаях атипичные микобактерии были причиной заболевания, в других — они выделены от совершенно здоровых животных.
Атипичные микобактерии у крупного рогатого скота иногда вызывают аллергию, что осложняет туберкулииодиагиостику этого заболевания. Вместе с тем они могут ие только инфицировать, ио и вызывать заболевания. Некоторые заболевания у людей, вызванные атипичными микобактериями, называют микобактериозами.
Вопрос о происхождении атипичных микобактерий окончательно не решен. Одни исследователи считают их вариантами туберкулезных микобактерий (А. И. Каграмаиов, Р. О. Драбкина и др.), другие же считают их самостоятельными видами микобактерий, способными вызывать туберкулезоподобиые изменения в организме. Атипичные микобактерии представляют собой гетерогенную группу микробов.
Раииои иа основании быстроты роста и образования пигмента разделил атипичные микобактерии на четыре группы: группа I — фотохромогенные — их колонии при содержании на свету окрашиваются в желтый или желто-ораижевый цвет; группа II— скотохромогеииые — колонии окрашиваются в оранжевый цвет в темноте; группа III— иефотохромогеииые — колонии пигмента ие образуют, группа IV — быстрорастущие.
Советские микробиологи (А. И. Каграмаиов, Р. О. Драбкина, А. А. Клебанова и др.) установили генетическое родство большинства атипичных микобактерий с патогенными микобактериями туберкулеза и рассматривают их как проявление изменчивости последних. А. И. Каграмаиов предложил иную классификацию атипичных микобактерий, где в основу взяты ие пигмеитообразоваиие и быстрота роста, а патогенность.
Атипичные микобактерии вызывают иногда у людей ряд заболеваний: легочный микобактериоз, язвеииое поражение кожи и др.
Устойчивость микобактерий довольно значительна. В культурах они обычно погибают через 8—10 месяцев. В мокроте сохраняются 5—6 ме-
247
сяцев, в фекалиях крупного рогатого скота на пастбищах летом — до двух, зимой — до пяти месяцев, а в некоторых случаях значительно дольше. Наиболее устойчивые М. avium. Они выживают в почве 17—18 месяцев, в воде на свету семь, а в условиях затемнения— 18 месяцев. М. bovis сохраняются в почве четыре месяца, в речной воде — до четырех, а в болотной— 10 месяцев. М. tuberculosis остаются жизнеспособными в воде 5—10 месяцев. К высушиванию, гниению, низким температурам туберкулезные микобактерии очень устойчивы, так в гниющих материалах они сохраняются от 3—12 месяцев, при замораживании до —76 °C — до 180 дней. М. bovis в навозе, соломенной подстилке гибнут через 2—12 месяцев, а М. avium в глубокой несменяемой подстилке через пять лет. В молоке, сырах, масле и других продуктах животноводства микобактерии могут сохраняться длительное время. В молоке и сливках замороженных (—8 °C) они гибнут через 120 дней. В свежемороженом мясе возбудитель туберкулеза сохраняется длительное время, а в соленом погибает через 1,5 месяца. Солнечные лучи губительны для микобактерий туберкулеза. Высокая температура быстро обезвреживает их: 50 °C — через 12 ч, 60 °C — через 1 ч, 70 °C — через 10 мин, 90 °C — через 1 мин и 100 °C — моментально.
Микобактерии туберкулеза довольно устойчивы к дезинфицирующим средствам. Наилучшее влияние на них оказывают хлорсодержащие препараты. Применение 3—5 %-ного раствора хлорамина оказывает на них губительное действие. Осветленный раствор хлорной извести, содержащий 5 % активного хлора, убивает их через 6 ч, а 10 %-ный раствор однохлористого йода через 3 ч. Для дезинфекции помещений применяют щелочной раствор формальдегида, содержащий 3 % формальдегида и 3 % едкого натра. Проводят побелку хлорной либо свежегашеной известью. Для дезинфекции навоза применяют биотермическое обеззараживание. Навозную жижу в жижесборнике смешивают с сухой хлорной известью из расчета 0,5 кг ее на 20 л навозной жижи. В последние годы была предложена карболово-керосиновая эмульсия для дезинфекции при туберкулезе и ряд других дезосредств.
Антигенная структура. Антигены туберкулезных бактерий сравнительно малоактивны. Протективные свойства антигена микобактерий связаны с соединением миколовой кислоты.
Иммунитет при туберкулезе нестерильный, клеточный (обусловлен Т-лимфоцитами). Для образования и поддержания напряженности иммунитета необходимо, чтобы в организме находились живые микобактерии туберкулеза, что связано с образованием микоматов.
Роль живых возбудителей болезни в образовании иммунитета при туберкулезе подтверждается опытами Р. Коха по повторному заражению больных морских свинок. При первичном подкожном заражении их на месте введения через 10—15 дней образуется сперва узелок, а потом незаживающая язва. Наряду с этим наблюдается воспаление окружающих лимфатических узлов. После повторного же заражения через 4—6 недель в месте инъекции появляется отечно-воспалительный очаг, кожа некротизируется, отторгается и образуется язва, которая быстро заживает. При этом лимфатические узлы в процесс не вовлекаются. Этот опыт, названный феноменом Коха, показывает, что вторично введенные микобактерии туберкулеза встречаются в организме с наличием частичного иммунитета, вследствие чего реактивное воспаление, быстро развивающееся в месте заражения, локализирует и удаляет вторичный ин-фект, ликвидируя таким образом реинфекцию (ГЗТ). В этом случае повышенная чувствительность организма препятствует распространению микобактерий туберкулеза и способствует удалению их из организма, ч
Живые микобактерии вакцинного штамма БЦЖ после вакцинации длительно сохраняются в организме животного, поддерживая напряженность иммунитета. В последние годы установлено, что микобактерии вак-248
данного штамма БЦЖ подвергаются в организме вакцинированных интенсивной L-трансформации, которая начинается уже с первых дней после вакцинации и заканчивается к 11-му месяцу— 1 году с момента вакцинации переводом всех сохранившихся в организме особей вакцины БЦЖ в состояние нестабильных и условностабильных L-форм (И. Р. До-
рожкова).
иагностика складывается из бактериологического, серологическо-
го и аллергического исследований. Бактериологическая диагностика животных имеет очень важное значение. Окончательный диагноз на тубер
кулез в хозяйстве ставят только на основании положительных результатов вскрытия или бактериологического исследования. Определение вида микобактерий важно также для выявления источника инфекции.
При проведении бактериологического исследования используют бак-териоскопический, культуральный и биологический методы.
Для исследования необходимы кусочки печени, селезенки, легких и лимфоузлы от убитых или павших животных. При наличии туберкулезных изменений в органах берут пробы из пораженных участков. При пересылке взятый материал консервируют в 30%-ном растворе глицерина. От живых животных исследуют молоко, мокроту, слизь, гной и фекалии.
Для бактериоскопии из материала делают мазки, фиксируют их на пламени, окрашивают по Циль—Нильсену и исследуют под микроскопом. Микобактерии обнаруживаются не в каждом случае, поэтому просматривают 100—200 или даже 500 полей зрения.
Иногда в материале, присланном в лабораторию, туберкулезных микобактерий мало и обнаружить их трудно. Тогда прибегают к методам обогащения: центрифугированию либо флотации. Для этого материал измельчают, растирают в ступке, заливают 1 %-ным раствором едкого натра, размешивают и переносят в колбу, которую встряхивают 10—15 мин. Затем содержимое центрифугируют 10 мин, надосадочную жидкость сливают, осадок нейтрализуют кислотой и из него делают мазки. Метод флотации основан на адсорбции углеводородами (ксилолом, бензином, лигроином) микобактерий туберкулеза и всплывании последних вместе с ними. Его используют чаще всего при исследовании молока и мокроты, реже бронхиальной слизи, экссудата, суспензий из рас
тертых органов и т. п.
При исследовании молока 30 мл его наливают в стерильные флаконы с узким горлом емкостью 100 мл и добавляют равное количество 5 %-ного раствора едкого натра. Смесь энергично встряхивают 2— 3 мин, а затем флаконы ставят в водяную баню при температуре 50— 60 °C на 1 ч. Затем к содержимому флакона добавляют 1 мл ксилола, бензина или лигроина и снова встряхивают в течение 15 мин в шуттель-аппарате. После встряхивания во флакон добавляют дистиллированную воду, пока его содержимое не поднимется до узкой части горлышка. После отстаивания в течение 1—2 ч в нем образуется сливкообразное кольцо. 3—4 капли из него наносят пастеровской пипеткой на слегка подогретое предметное стекло. По мере подсыхания наносят на предметное стекло по 3—4 капли еще 2—3 раза, чтобы получить толстый мазок. Мазки высушивают в сушильном шкафу, обезжиривают эфиром, фиксируют на пламени, окрашивают по Циль — Нильсену и микроскопируют.
Для получения культур микобактерий туберкулеза материал перед посевом подвергают обработке по методу Гона, Левенштейна — Сумио-ши или Аликаевой. При обработке, по Гону, кусочки органов и тканей измельчают и растирают в ступке, затем заливают 3—10 %-ным раствором серной кислоты и центрифугируют 10—15 мин при 3 тыс. оборотов в 1 мин. Период воздействия кислотой не должен превышать 20—30 мин. Затем надосадочную жидкость сливают, в осадок добавляют несколько капель стерильного физраствора и делают посевы на питательные сре
249
ды, а также готовят мазки. Применяя метод Левенштейна—Сумиоши, материал обрабатывают таким же образом, но перед посевом осадок отмывают от серной кислоты 1—2 раза физиологическим раствором с помощью центрифуги. По методу А. П. Аликаевой материал разрезают на кусочки размером 0,5 см3, помещают в ступку и заливают 3—6%-ным раствором серной кислоты на 10—20 мин. Затем кусочки тканей промывают 5 мин физраствором и растирают. Из полученной суспензии делают посевы и мазки.
При исследовании мокроты, гноя, слизи, мочи и др. материалов их центрифугируют, осадок обрабатывают серной кислотой, а затем делают посевы и мазки.
Для получения культур микобактерий делают посевы на питательные среды (Петраньяни, Гельберга и др.). Каждый материал высевают на 5—10 пробирок со средой. Пробки заливают расплавленным парафином. Посевы просматривают не реже одного раза в неделю и выдерживают в термостате не менее трех месяцев. В случае отсутствия роста с поверхности среды делают соскоб платиновой петлей, готовят мазок для бактериоскопии и в случае обнаружения в нем микобактерий делают пересев на свежую среду.
Для биологического исследования используют тот же материал, который был приготовлен для посева, а наличие в нем серной кислоты нейтрализуют стерильным 10%-ным раствором двууглекислой соды.
Заражают трех кроликов и трех морских свинок, а при необходимости еще и трех кур и ведут за ними наблюдения, как описано выше.
Дифференциация видов туберкулезных микобактерий. Микобактерии различаются между собой по скорости и характеру роста на питательных средах, по морфологии, по патогенности и другим свойствам. Раньше определение вида их называли типированием, поскольку они делились на типы. Для определения вида микобактерий туберкулеза предложено немало методов: бактериоскопический, культуральный, биохимический, биологический и др. М. bovis растут на плотных питательных средах очень медленно и образуют сухие, гладкие и шероховатые колонии; М. tuberculosis растут быстрее, но по характеру роста отличить их от М. bovis трудно; М. avium растут значительно быстрее, чем М. tuberculosis и М. bovis. Колонии их гладкие, мелкие, круглые с ровными краями.
Для определения вида чаще всего используют биологический метод. С этой целью ставят биопробу на трех морских свинках и трех кроликах, а если необходимо, то и на трех курах. Культуру микобактерий вводят животным в дозе 1 мг сырой бактериальной массы, суспендированной в 1 мл стерильного физиологического раствора, морским свинкам подкожно в области паха, кроликам — внутривенно в краевую вену уха, курам — в подкрыльцовую вену. У морских свинок при развитии туберкулезного процесса через 2—4 недели на месте введения культуры образуется язва, а также увеличение и уплотнение регионарного лимфатического узла. Свинки прогрессивно худеют. Через 30 дней их исследуют туберкулиновой пробой. У кроликов и кур при развитии туберкулеза наблюдают истощение и снижение аппетита. Кур исследуют туберкулином. Через три месяца морских свинок, кур и кроликов убивают, вскрывают и проводят бактериологическое исследование паренхиматозных органов.
Принадлежность исследуемой культуры к тому или иному виду определяют по таким данным:
— при генерализованном процессе у морских свинок и кроликов — М. bovis;
— при генерализованном процессе у морских свинок, а у кроликов отсутствие поражений или единичные очажки в легких — М. tuberculosis;
— при генерализованном процессе у кур и сепсисе у кроликов — М. avium.
250
М. М. Иванов и Л. В. Кириллов предложили для определения М. avium исследуемую культуру вводить двум курам внутрикожно в бородку в дозе 0,1 мг. На месте введения М. avium вызывают сперва припухлость, а к 25—30-му дню язву. Иногда наблюдается перфорация бородки.
Серодиагностика. Для этой цели изучали реакции преципитации, агглютинации, диффузионной преципитации, связывания комплемента, гемагглютинации и гемолиза. Реакция преципитации и реакция агглютинации у млекопитающих животных оказались не эффективными. Лишь у кур кровекапельная реакция агглютинации дала обнадеживающие результаты.
Наиболее изучена реакция связывания комплемента (РСК). Ее применяют как дополнительный метод при отборе животных для диагностического убоя среди реагирующих на туберкулин. В РСК большую роль играет качество антигена. Лучшим из них ранее считали метиловый антиген Негр и Бокэ. В последние годы более активными были признаны сложносмешанный антиген Т. А. Луценко и комплексный антиген Ю. Я. Кассича. В основу сложносмешанного антигена был взят полисахаридный комплекс, полученный из микобактерий туберкулеза. В состав комплексного антигена Ю. Я. Кассича входит полисахаридный комплекс, метаноловый экстракт туберкулезных микобактерий и водный экстракт легочной ткани здорового крупного рогатого скота.
Для постановки реакции исследуемые сыворотки инактивируют в водяной бане при 60 °C в течение 30 мин. Антиген и комплемент титруют. В пробирки разливают испытуемые сыворотки в разведениях: 1 :5, 1:10, 1:20, 1 :40 и 1 :80 по 0,25 мл и добавляют антиген и комплемент тоже по 0,25 мл. Затем штативы с пробирками ставят на 30 мин в водяную баню при 37-—38 °C, потом вынимают и добавляют в каждую пробирку гемолитическую систему, которая состоит из 0,25 мл 2%-ной взвеси эритроцитов барана и 0,25 мл гемолизина в рабочем титре. Затем штативы снова помещают в водяную баню на 15 мин. Реакцию учитывают предварительно после бани и окончательно через 16—18 ч. Оценку производят по задержке гемолиза. Получение положительной РСК в титре 1 :20 и выше указывает на наличие у животного активного туберкулезного процесса.
Реакцию гемагглютинации предложили Мидлбрук и Дюбо. Сущность ее заключается в том, что антиген, содержащийся в вытяжках из микобактерий туберкулеза, обладает способностью адсорбироваться на поверхности эритроцитов и сенсибилизировать их к сыворотке крови туберкулезных животных, которая вызывает агглютинацию таких эритроцитов.
Реакция гемолиза заключается в том, что после учета реакции гемагглютинации в каждую пробирку добавляют комплемент. В пробир* ках, где содержалась сыворотка туберкулезных животных, наступает гемолиз.
Аллергическая диагностика. У животных, зараженных Туберкулезом, через 15—20 дней появляется аллергия, что выражается повышением чувствительности к продуктам жизнедеятельности микобактерий.
На протяжении многих лет для аллергической диагностики туберкулеза применяли только альттуберкулин Коха, хотя было предложено немало других туберкулинов. В настоящее время для выявления болезни у млекопитающих животных и птиц, применяют альттуберкулин и сухой очищенный туберкулин (ППД — протеин пурифиед дериват).
Альттуберкулин готовят на биофабриках, выращивая культуры микобактерий туберкулеза бычьего и человеческого вида на мясо-пептонном глицериновом бульоне в течение 6—8 недель, после чего культуру взбалтывают и стерилизуют в автоклаве при 120 °C 30 мин, а затем вы-
251
паривают при 80—90°С до Vio первоначального объема, отстаивают и фильтруют через фильтры Зейтца. Полученный таким путем туберкулин прозрачен, коричневого цвета, имеет специфический запах. Он содержит около 40—50 % глицерина.
Сухой очищенный туберкулин (ППД) готовят, выращивая культуры микобактерий туберкулеза на синтетической среде. В фильтрат 8-недельной культуры добавляют трихлоруксусную кислоту для осаждения протеинов. Осадок обрабатывают, очищая от следов этой кислоты, и высушивают. Полученный препарат представляет собой аморфную массу светло-коричневого цвета с сероватым оттенком. К сухому очищенному туберкулину биофабрики выпускают растворитель, который представляет собой бесцветную прозрачную жидкость с легкой опалесценцией. Туберкулин и растворитель выпускают в ампулах или флаконах.
Применяют туберкулин для внутрикожной и глазной пробы.
Для внутрикожной туберкулинизации млекопитающих животных (кроме свиней и обезьян) применяют сухой очищенный туберкулин либо альттуберкулин для млекопитающих, для свиней — одновременно сухие очищенные туберкулины для млекопитающих и для птиц, обезьянам— сухой очищенный туберкулин для млекопитающих, птицам — сухой очищенный туберкулин для птиц. Учитывают реакцию у крупного рогатого скота, буйволов, зебу, верблюдов и оленей через 72 ч после введения препарата, у коз, овец, свиней, собак, обезьян, пушных зверей через 48 ч, а у птиц через 30—36 ч. У животных реакция на месте введения туберкулина проявляется в виде разлитого отека тестоватой или мягкой консистенции, не имеющей, как правило, четких границ с окружающей тканью, что сопровождается местным повышением температуры, а иногда болезненностью. При учете реакции место введения препарата пальпируют, а при обнаружении изменения толщину кожной складки измеряют кутиметром, сравнивая ее с толщиной складки неизмененной кожи вблизи места введения туберкулина. Крупный рогатый скот, буйволов, зебу, верблюдов и оленей считают реагирующими на туберкулин при утолщении кожной складки на 3 мм и более; коз, овец, свиней, собак, обезьян, пушных зверей, кур и других птиц — при образовании припухлости в месте введения туберкулина, норок — при опухании века.
Глазную туберкулинизацию (офтальмопробу) применяют у лошадей, а иногда у крупного рогатого скота одновременно с внутрикожной пробой. Ее проводят двукратно с интервалом в 5—6 дней. Глазной пипеткой на конъюнктиву нижнего века наносят 3—5 капель туберкулина. Учитывают реакцию через 6, 9, 12, 24 ч после первого и через 3, 6, 9, 12 ч после повторного введения. Реакция выражается в выделении слизисто-гнойного или гнойного секрета и гиперемии конъюнктивы.
Биопрепараты. В начале нашего столетия была создана вакцина, приготовленная из культур микобактерий туберкулеза человеческого вида, ослабленных путем высушивания в безвоздушном пространстве (Беринг, Ремель и Руппель). Затем Климмер предложил для прививки крупного рогатого скота вакцину под названием «антифиматоль». Были попытки применить в качестве вакцины культуры микобактерий туберкулеза холоднокровных, выделенные от черепахи. Однако все эти вакцины не обладали достаточной иммуногенностью.
Во Франции Кальметт и Герен ослабили вирулентные штаммы микобактерий туберкулеза бычьего вида путем 230 пересевов в течение 13 лет на глицериновом картофеле с желчью. Данные культуры не вызывали туберкулеза у крупного рогатого скота. Приготовленная из этих культур вакцина получила название БЦЖ (бациллы Кальметта — Герена). На протяжении многих лет и в настоящее время вакцину БЦЖ с большим успехом применяют в медицинской практике для вакцинации детей. Однако крупный рогатый скот вакциной БЦЖ не прививают. Од-252
на из основных причин — появление у вакцинированных животных аллергии и отсутствие пригодных для практики методов дифференциации поствакцинальных реакций на туберкулин от постинфекционных. В ряде государств Западной Европы вакциной БЦЖ прививают телят до 15-дневного возраста. В Чехословакии используют вакцину, полученную из культуры микобактерий туберкулеза мышиного вида.
ВОЗБУДИТЕЛЬ ПАРАТУБЕРКУЛЕЗА
Возбудитель болезни Mycobacterium paratuberculosis. Паратуберкулез, или паратуберкулезный энтерит, крупного рогатого скота — хроническое заболевание, характеризующееся сильной диареей, что сопровождается истощением и гибелью животного. Иногда заболевают овцы, реже олени и козы. На вскрытии находят утолщение кишечных стенок и образование продольных и поперечных складок слизистых оболочек наподобие извилин мозга. Был описан Johne в 1910 г.
Морфология и тинкториальные свойства. Микобактерии полиморфны, представляют собой короткие палочки длиной 0,5—1,5 мкм и шириной 0,2—0,5 мкм. В старых культурах можно наблюдать кокковидные, зернистые, а иногда длинные ветвистые формы. Хорошо окрашиваются по Циль7—Нильсену и Хальбергу. Грамположительны.
Культивирование. Микобактерии паратуберкулеза удается культивировать с большим трудом. Для стимуляции роста к питательным средам добавляют экстракты из кислотоустойчивых сапрофитов, особенно из микобактерий Тимофеевой травы. На обычных питательных средах микобактерии паратуберкулеза не растут. Для их выращивания применяют яичные среды Петраньяни и Левенштейна, агаризированную среду Сотона. Наиболее элективной для культивирования их является среда Данкина, куда входят свежие яйца, печеночный экстракт, глицерин, вытяжка из микобактерий Тимофеевой травы и спиртовой раствор ген-цианвиолета. Среду уплотняют в аппарате для свертывания и стерилизуют. А. П. Аликаева получила первичную культуру микобактерий паратуберкулеза на модифицированной плотной среде Смита. В числе жидких сред использовали синтетические среды Данкина, Бока, Дорсе, а также синтетическую среду Вишневского, содержащую аспарагин, щавелевокислый аммоний, сернокислый магний, сернокислое железо и глицерин.
Возбудитель паратуберкулеза аэроб, температурный оптимум 38,5 °C. Рост на плотных средах появляется через 1,5—2 месяца (иногда позже) в форме беловато-желто-серых сморщенных сухих колоний. На поверхности жидких питательных сред образуется нежная, беловатая пленка, которая постепенно к 3—4-му месяцу утолщается и опускается на дно.
Устойчивость микобактерий паратуберкулеза во внешней среде большая. На пастбище они могут сохраняться и заражать животных в течение 2—3 сезонов. 3—5 %-ный фенол убивает культуры микобактерий через 5 мин, 5 %-ный едкий натр через 2 ч, 10 %-ное хлорное молоко через 1 ч.
Антигенная структура микроба еще достаточно не изучена. Установлено, однако, что он имеет антигенное родство с М. avium.
Иммунитет мало изучен. Считают, что при этой болезни, как и при туберкулезе, создается нестерильный иммунитет. В клинической стадии паратуберкулеза у больного животного появляются агглютинины, ком-плементсвязывающие и другие антитела. В зависимости от течения болезни титры антител то повышаются, то понижаются. Аллергия возникает обычно в ранней стадии болезни, а при появлении клинических признаков она начинает угасать и к концу болезни животные нередко становятся реактивными (анергия).
253
Диагностика основана на бактериологическом, серологическом и преимущественно аллергическом исследовании.
Бактериологическая диагностика. Для исследования направляют испражнения больного животного. В фекальных массах выбирают комочки слизи или кровяные сгустки, размазывают их тонким слоем на предметном стекле. Мазок фиксируют на пламени и окрашивают по Циль — Нильсену или Хальбергу. Исследуют 8—10 препаратов, так как микобактерии паратуберкулеза выделяются животными нерегулярно. Исследование испражнений повторяют несколько раз. Кроме испражнений, можно брать соскобы из прямой кишки, готовить из них мазки, фиксировать и окрашивать. При микроскопии в препаратах обнаруживают красного цвета микобактерии, расположенные кучками или палисадами. После смерти животного в лабораторию посылают участки пораженного кишечника и увеличенные брыжеечные лимфоузлы. При пересылке материал консервируют в 30%-ном стерильном глицерине.
Заражение лабораторных животных в ветеринарной практике не применяют.
Серодиагностика основана на РСК. В качестве антигена используют спиртовые, ацетоновые или эфирные экстракты из культур микобактерий паратуберкулеза. Однако эта реакция может быть полезной лишь при исключении у животных туберкулеза ввиду близкого антигенного родства возбудителей этих болезней. У клинических больных животных в 80 % случаев РСК подтверждает диагноз.
Аллергическая диагностика. Для этой цели можно применять паратуберкулин (ионин), полученный из культур микобактерий паратуберкулеза, либо сухой очищенный туберкулин для птиц. Оба препарата вводят внутрикожно в области средней трети шеи. В практике обычно используют сухой очищенный туберкулин для птиц, хотя больные животные реагируют на паратуберкулин в 94 %, на туберкулин для птиц — в 80 % и на бычий туберкулин — в 10—30% случаев. Такие реакции дают больные в латентной форме, а у клинических больных они могут отсутствовать. Поэтому перед аллергическим исследованием крупного рогатого скота из стада удаляют и отправляют на убой всех клинически больных, затем исследуют на туберкулез и реагирующих животных тоже удаляют и лишь после этого проводят исследование на паратуберкулез.
Биопрепараты с лечебно-профилактическим эффектом не разработаны.
ПАТОГЕННЫЕ АКТИНОМИЦЕТЫ
Актиномицеты (греч. mykos — гриб, actis — луч) — одноклеточные микроорганизмы, входят в порядок Actinomycetales, семейства Actino-mycetaceae, рода Actinomyces, а также семейства Nocardiaceae, рода Nocardia. До настоящего времени актиномицеты называют лучистыми грибами, так как по морфологическому строению (нитевидный микроорганизм) и некоторым биологическим свойствам они приближаются к микроскопическим грибам, образующим мицелий.
Болезни сельскохозяйственных животных, вызываемые актиноми-цетами, известны под следующими названиями: актиномикоз, актинобациллез (псевдоактиномикоз), нокардиоз, микотический дерматит.
ВОЗБУДИТЕЛЬ АКТИНОМИКОЗА
Актиномикоз — хроническое инфекционное заболевание животных и человека, характеризующееся образованием вначале плотных диффузных малоболезненных узлов, а затем формированием гранулем, абсцессов и извилистых фистул, из которых периодически вытекает небольшое 254
количество густого гноя. Наиболее часто поражается крупный рогатый скот, реже свиньи, овцы и другие животные. Заболевают актиномикозом взрослые животные и молодняк, чаще в зимне-весенний период, особенно при скармливании грубых кормов, пораженных актиномицетами.
Возбудитель актиномикоза у крупного рогатого скота является Act. bovis, обнаруженный в 1877 г. К. Гарцем, и Act. israelii, выделенный в 1891 г. Израелем от больных актиномикозом людей.
Морфология и тинкториальные свойства. Клетки актиномицетов имеют нитевидную ветвящуюся форму. Ширина нитей составляет 0,2— 1,2 мкм, длина их 100—600 мкм. Располагаются нити преимущественно радиально, напоминая лучи, расходящиеся от центра. Такое лучистое образование, включающее множество ветвящихся нитей, представляет собой одну клетку. В пораженных тканях животного актиномицеты располагаются в виде зернистых скоплений специфической структуры, называемых друзами. Характерно, что нити в друзах, радиально расходящиеся из центрального ядра, имеют на концах булавовидные утолщения (см. рис. 86а).
Микроорганизмы в культуре грамположительны. Друзы окрашиваются неодинаково: центральная часть в темно-фиолетовый цвет, а колбовидные радиальные лучи — в розовый или красный цвет.
Культивирование. Выделение первичной культуры возбудителя актиномикоза крупного рогатого скота проводят в анаэробных условиях при 37 °C. Исследуемый материал (суспензия из пораженных тканей или гной) обрабатывают раствором антибиотиков пенициллина и стрептомицина из расчета 100 ЕД/мл в отношении 1 : 5 и центрифугируют при 1500—2000 об/мин в течение 15—20 мин. Осадок отмывают физраствором и засевают в расплавленный агар Сабуро или глюкозо-кровяной агар, разлитые по пробиркам. Культура микроорганизма развивается медленно. На 15—20-е сутки после посева появляются мелкие белые или желтоватые колонии в толще агара. Колонии прочно срастаются со средой; их поверхность как бы посыпана известковым порошком — это воздушный мицелий, на концах которого развиваются споры, придающие колониям желтоватую или красную окраску.
Выращивание возможно на свернутой сыворотке крупного рогатого скота, среде Китт—Тароцци, обычном МПА (лучше с добавлением сыворотки), МПЖ, МПБ, в молоке и на картофеле. В бульоне растет в виде зернышек на дне пробирки или пушинок, состоящих из густых сплетений мицелиальных нитей. В дальнейшем в культуре появляется желтоватая морщинистая пленка, бульон остается прозрачным, но приобретает иную окраску.
Биохимические свойства актиномицетов выражены умеренно. Act. bovis ферментирует с образованием кислоты глюкозу, галактозу, глицерин, разжижает МПЖ-
Устойчивость. Актиномицеты очень устойчивы к высушиванию, особенно их споры. При температуре 70—80 °C актиномицеты погибают в течение 5 мин; под влиянием солнечных лучей —через 3 ч, лучей ртутно-кварцевой лампы — через 30 мин. В качестве дезинфицирующих веществ рекомендуют использовать 5 %-ный раствор хлорамина (экспозиция 3 ч), 5 %-ный раствор лизола (30 мин), 3 %-ный раствор формальдегида (20 мин) и др.
Патогенность изучена недостаточно. Одни авторы считают, что патогенные актиномицеты содержат эндотоксин, другие — экзотоксин типа некротоксина, который способствует некротизации тканей.
Патогенез. Источником заражения могут быть крупный и мелкий рогатый скот, лошади, свиньи, собаки, кролики, дикие животные, а также объекты внешней среды: почва, растения, воздух, различные отходы зерновых культур. Актиномикоз может развиваться в результате эндогенной инфекции при проникновении возбудимости из пищеварительного тракта.
255
Попав в поврежденные тканн, актиномицеты оседают на месте внедрения или мигрируют по межклеточным пространствам на более нлн менее значительное расстояние. По поврежденным лимфатическим сосудам возбудитель достигает лимфатических узлов, а попав в кровь, заносится в различные участки тела.
На месте внедрения актиномицетов образуются колонии в виде друз. Каждая друза состоит нз мицелиальных нитей. По периферии друзы мицелия образуют густое сплетение, а в центре более редкое. Наружный слой друзы состоит нз колбовндных утолщений, расположенных радиально в виде лучей. Это и послужило Гарцу основанием назвать возбудитель актиномикоза лучистым грнбком.
В актиномикозном очаге развиваются пролиферативные явления, сопровождающиеся образованием грануляционной тканн. В центре инфильтрата происходит гнойное размягчение тканей, что приводит к прорыву гноя наружу, образуется незаживающий свищ нлн язва. Выделяющийся нз ннх гной содержит друзы, достигающие размеров, видимых простым глазом в виде желтоватых крупинок.
Антигенная структура. Act. bovis принадлежит к серогруппе В, Act. israelii — к серогруппе D; у обоих видов выявлены серовары 1 и 2, которые идентифицируются с помощью флуоресцирующих антител.
Иммунитет после перенесения болезни не образуется, возможны повторные заболевания. У переболевших животных в крови обнаруживают агглютинины, преципитины, комплементсвязывающие антитела, которые не являются показателем устойчивости макроорганизма к патогенным актиномицетам. В процессе болезни развивается гиперчувствительность
замедленного типа.
иагностика. Диагноз ставится на основании клинических призна-
ков, по характеру гноя и наличию в нем друз. С этой целью производят исследование неокрашенных и окрашенных (по Граму) препаратов гноя. В тех случаях, если друз в гное нет, целесообразно дополнительно исследовать гистологические срезы кусочков пораженных тканей. Реко
мендуют также кожно-аллергическую реакцию с актинолизатом по Г. О. Сутееву. Другие методы — выделение чистой культуры, биопроба, серодиагностика (РСК) применяют редко. Продолжительность полного лабораторного исследования на актиномикоз 15—20 суток, микроскопического — одни сутки.
Биопрепараты для специфической профилактики и терапии актиномикоза отсутствуют. До настоящего времени основным лечением при актиномикозе остается оперативный метод. Лучшие результаты получают при сочетании его с антибиотиками и сульфаниламидными препаратами, которые подавляют актиномицеты и сопутствующую микрофлору. Хорошие результаты дает йодотерапия особенно в начальной стадии, до образования актиномикозного абсцесса.
ПАТОГЕННЫЕ МИКОПЛАЗМЫ
Микоплазмы — мельчайшие свободноживущие прокариоты без клеточной стенки. У них функции собственно мембраны клеточной стенки выполняет цитоплазматическая мембрана (Г. Я. Каган, 1979).
Микоплазмы характеризуются следующим комплексом признаков: 1) обладают полиморфизмом клеток, состоящих из ветвистых, цепочных, шаровидных разной оптической плотности особей и мельчайших репродуцирующих элементов размером 100—450 нм; 2) имеют наружную трехслойную цитоплазматическую мембрану, в которой сосредоточено большинство биосинтетических и регуляторных функций: 3) геном представлен одной молекулой ДНК, формирующей кольцевую хромосому, реплицирующуюся полуконсервативным путем, нуклеотидный состав ДНК характеризуется низким содержанием гуанина и цитозина; 4) по объему генетической информации занимают промежуточное положение между Е. coli и Т-фагами; 5) имеют множественный путь репродукции: почкование, сегментацию ветвистых и цепочных форм, простое деление (интегральный способ); 6) нуждаются для роста в стеринах (за исклю
256
i
чением ахолеплазм) и нативном белке; 7) на плотных средах формируют колонии с приподнятым центром под названием яичницы-глазуньи; 8) нечувствительны к пенициллинам и другим антибиотикам, угнетающим синтез пептидогликанов клеточной стенки бактерий; 9) вызывают гемадсорбцию, гемагглютинацию и лизис эритроцитов различного происхождения; 10) имеют четко выраженные антигенные различия.
Уникальной особенностью микоплазм является их сходство с L-фор-мами бактерий. И прежде всего это относится к морфологическим, культуральным и биохимическим признакам. Поэтому долго обсуждался вопрос о возможном родстве бактериальных L-форм с микоплазмами. В настоящее время общепризнано, что сходство между ними имеет поверхностный характер и не отражает эволюционного родства. L-фор-мы— это фенотипические модификации или мутанты бактерий, частично или полностью утратившие способность синтезировать пептидогликаны клеточной стенки. Таким образом, L-формы—бактерии, дефектные по клеточной стенке.
Различают стабильные и нестабильные L-формы бактерий. Первые полностью лишены ригидной клеточной стенки, что сближает их с протопластами; они крайне редко реверсируют в классические, исходные бактериальные формы. Вторые могут обладать элементами клеточной стенки, в чем они проявляют сходство со сферопластами; в отсутствие фактора, вызвавшего их образование, реверсируют в исходные бактериальные формы. L-формы бактерий в отличие от протопластов и сфе-. ропластов обладают относительно высокой жизнеспособностью и хорошо выраженной способностью к репродукции.
По своим культуральным и морфологическим свойствам L-формы резко отличаются от исходных бактерий, что обусловлено утратой клеточной стенки и изменением метаболической активности. Вследствие дефекта клеточной стенки L-формы осмотически неустойчивы и их можно культивировать только на специальных средах с высоким осмотическим давлением. На плотных питательных средах L-формы разных видов бактерий образуют два типа колоний — А и В. Колонии А (ранее обозначенные — ЗА) образуют стабильные L-формы. Это мелкие, округлые диаметром 50—100 мкм колонии, вырастающие в относительно большом количестве. Они нежные беловатые с перламутровым оттенком, при длительном выращивании слегка пигментируются. Растут лучше в аэробных условиях. Присутствие или отсутствие L-индуцирующего фактора не влияет на их рост. Колонии В (ранее обозначаемые — ЗВ) формируют нестабильные L-формы. Они более крупные, диаметром 0,5— 2 мм, с нежным кружевным краем и врастающим в среду центром, хорошо различимы невооруженным глазом. В их структуре преобладают крупные шаровидные тела. Колонии В легко и быстро реверсируют в исходные бактериальные формы на средах, не содержащих L-индуцирующего фактора.
Процесс образования L-форм получил название L-трансформации, или L-индукции. Способностью к L-трансформации обладают практически все виды бактерий, в том числе и патогенные.
В связи с тем, что L-формы бактерий имеют важное значение в инфекционной патологии животных и человека, им в настоящее время уделяется большое значение. Инфекционный процесс, вызванный L-фор-мами бактерий, характеризуется атипичностью, длительностью течения, тяжестью заболевания, трудно поддается химиотерапии. Нестабильные L-формы играют большую роль в рецидивирующих инфекциях.
Как было сказано выше, микоплазмы и L-формы бактерий — различные микроорганизмы. L-формам несвойственны потребности в питательных веществах, характерные для микоплазм; у L-форм частично сохраняется дефектная клеточная стенка, и они генетически почти идентичны тем бактериям, от которых произошли. Один из существенных 19—Ветеринарная микробиология 257
отличительных признаков L-форм — их способность реверсировать в исходные бактериальные формы.
Происхождение микоплазм остается невыясненным. Высказывается гипотеза, что микоплазмы, как наиболее просто организованные прокариотные организмы, являются предками современных бактерий на пути прогрессивной эволюции. Другая гипотеза допускает, что микоплазмы произошли от соответствующих бактериальных форм аналогично тому, как осуществляется переход от бактерий к L-формам. Предлагается также рассматривать микоплазмы в качестве возможных предшественников эукариотов.
Этиологическое значение микоплазм в патологии животных было установлено впервые при контагиозной перипневмонии крупного рогатого скота в 1893 г. Нокаром и Ру. Они изолировали из плеврального экссудата больных животных фильтрующийся агент и разработали способ его выращивания на мартеновском бульоне с сывороткой крови. Микоплазмы изучались многими учеными из различных стран. Русские ученые М. Г. Тартаковский и Е. П. Джунковский в начале XX столетия разработали эффективный метод культивирования возбудителя контагиозной перипневмонии крупного рогатого скота и изучали его биологию. Эдвард и Фройндт (1956) предложили первую классификацию и номенклатуру микоплазм. Значительный вклад в развитие микоплазматологии внесли советские ученые В. Д. Тимаков и Г. Я- Каган.
Классификация микоплазм. Все микоплазмы объединены в один класс мягкокожих — Mollicutes (лат. mollia— мягкий, гибкий, cutes — кожа). Класс Mollicutes относится к царству прокариотов (Procaryotae) и включает один порядок — Mycoplasmatales, который, в свою очередь, состоит из двух семейств: микоплазм (Mycoplasmataceae) и ахолеплазм (Acholeplasmataceae), а также дополнен родами Thermoplasma и Апа-eroplasma.
Семейство микоплазм подразделяется на два рода: микоплазм (Mycoplasma) и уреаплазм или Т-микоплазм (Ureaplasma). Все представители рода микоплазм стеролозависимые и нуждаются для роста в экзогенном холестерине, не гидролизуют мочевину. Род включает 50 видов. В инфекционной патологии животных и человека главным образом имеют значение следующие виды: Mycoplasma hominis, М. pneumoniae, М. mycoides, М. bovigenitalium, М. bovirhinis, М. mycoides capri, М. aga-lactiae, M. hyorhinus, M. suipneumoniae, M. gallisepticum.
Род уреаплазм (Т-микоплазм) представлен восемью серотипами. Это стеролозависимые, гидролизующие мочевину уреалитические микоплазмы, образующие мелкие колонии, оптимум их роста находится в диапазоне pH 6,0—7,0, жизненный цикл составляет 16—18 ч. Они растут в виде мельчайших колоний диаметром 20—25 мкм. Типовым представителем является Ureaplasma urealyticum.
Семейство ахолеплазм объединяет стеролонезависимые, то есть не нуждающиеся в холестерине микроорганизмы. Описан один род Acho-leplasma, включающий пять видов. Характерными представителями рода являются Acholeplasma laidlawii и A. granularum.
Морфология и тинкториальные свойства. Микоплазмы исключительно полиморфные микроорганизмы. Эта особенность определяется отсутствием у них ригидной клеточной стенки.
В мазках из пораженных органов и из культур они имеют форму подковообразных, сферических, нитевидных, овоидных палочковидных или напоминающих кольца образований. Преобладание тех или иных форм определяется составом среды, методом культивирования, фазой роста, способом фиксации и окраски.
Данные о размерах микоплазм у различных авторов не совпадают, но они вкладываются в параметры 300—400—1000—1400 нм. Мелкие жизнеспособные элементы принято называть минимальными репродуци-258
рующими единицами, их размеры около 75—250 нм. Существуют морфологические элементы микоплазм, видимые в световом микроскопе, и структуры за пределами разрешающей способности этого вида микроскопии. Микоплазмы грамотрицательны, хорошо окрашиваются по Романовскому— Гимзе, для витальной окраски применяют специальный метод Динеса.
Ультраструктура микоплазм напоминает субмикроскопическую организацию бактерий, но у них нет ригидной клеточной стенки. Клетки микоплазм снаружи имеют трехслойную мембрану толщиной около 75 А, состоящую из двух электронноплотных и промежуточного оптически светлого слоев; внутри содержится цитоплазма и дифференцированный нуклеоид, представленный замкнутой в кольцо молекулой ДНК, формирующей одну хромосому. В цитоплазме находятся рибосомы, их размер О
составляет 150 А и соответствует величине рибосом бактерий. У микоплазм также обнаружены внутрицитоплазматические мембранные структуры, выполняющие функцию субстрата синтеза энергии, и отсутствуют типичные мезосомы.
Химический состав микоплазм сложный. Наиболее хорошо изучены липиды. Они входят в состав липопротеинового комплекса трехслойной клеточной мембраны микоплазмы. Главный липидный компонент паразитических микоплазм — холестерин. Он обладает свойством стабилизировать мембраны и придавать им эластичность, а также обеспечивает структурную целостность клеток, способствует проникновению жирных кислот и их утилизации, оказывает детоксирующее действие на жирные кислоты, лизирующие микоплазмы, и, наконец, служит энергетическим материалом. Белки микоплазм менее изучены, они входят в состав цитоплазмы и мембран, в их составе различают 17 аминокислот. Гидрофобные компоненты мембранных белков микоплазм обладают выраженной антигенностью.
Количество углеводов у микоплазм варьирует в зависимости от вида.
Культивирование. Микоплазмы размножаются в бесклеточных питательных средах, содержащих полноценный белок, холестерин, стероиды, нуклеиновые кислоты, углеводы, витамины и минеральные соли. Патогенные виды нуждаются в сыворотке крови млекопитающих, удовлетворяющей их пищевые потребности в протеине, стероле, фосфолипиде и ацетонрастворимом липиде. Наилучшая добавка к искусственной питательной среде — сыворотка крови лошади и свиньи.
Истинным (стеринзависимым) микоплазмам для синтеза и нормального функционирования наружной Цитоплазматической мембраны необходим стерол, фосфолипиды же стимулируют рост микоплазм и выполняют функцию растворителя стеринов, облегчая их включение в цитоплазматическую мембрану. Источником витаминов группы В в средах для культивирования микоплазм служит дрожжевой экстракт. В процессе роста микоплазмы нуждаются в углеводах, которые являются источником углерода и обеспечивают их энергетические потребности; ими могут быть: глюкоза, фруктоза, мальтоза, лактоза.
Для культивирования микоплазм предложено ряд сред. Основа их — триптический перевар бычьего сердца, перевар Хеттингера, пептон Мартена, отвар сердечной мышцы. К основной среде в зависимости от вида микоплазмы добавляют дрожжевой экстракт, нормальную сыворотку лошади или крупного рогатого скота, витамины, нуклеиновые кислоты, углеводы, чаще глюкозу.
Микоплазмы можно культивировать на мартеновском МПБ и МПА с добавлением 15—20 % сыворотки крови лошади или крупного рогатого скота и 1 % глюкозы (pH 7,4—8). Широко используют среду Эдварда, основу которой составляет отвар сердца крупного рогатого скота с добавлением 1 % пептона, 20 °/о сыворотки лошади и 10% дрожжевого 19* 259
экстракта, а также полужидкий и плотный агар Эдварда. Для получения полужидкого агара к бульону добавляют 0,3 % агар-агара, а для плотного—2%. Большое практическое применение получила среда такого состава: основа — перевар Хеттингера, 0,3 % поваренной соли, 0,5 % пептона, 0,5 % двузамещенного фосфорнокислого натра, 0,5 % глюкозы и 20 °/о стерильной сыворотки лошади.
В жидких питательных средах первичные культуры микоплазм вызывают незначительную опалесценцию; адаптированные же к среде культуры дают заметное помутнение. Более обильный рост отмечают ближе к стенке или непосредственно на стенке стеклянного сосуда. Одни виды микоплазм дают придонный, другие — поверхностный рост. Это их свойство определяется потребностью в кислороде. Отдельные виды и штаммы могут образовывать на поверхности бульона едва заметную, легко разбивающуюся маслянистую пленку. В полужидких питательных средах микоплазмы растут по уколу или же формируют крошковатые колонии различной конфигурации, равномерно взвешенные в среде, а на плотных средах — характерные колонии, напоминающие по форме яичницу-глазунью. Это типичные колонии микоплазм, они врастают в агар и имеют более темный центр; периферия колоний более светлая и менее гранулированная. У них есть сходство с колониями L-форм бактерий типа А, но характеризуются меньшими размерами и более зернистой поверхностью. Размер колоний, как правило, не превышает 0,25— 2,0 мм. При продолжительном культивировании на сывороточных средах многие виды микоплазм образуют в глубине среды пятна преципитата.
Рост в первичных высевах наблюдается на 3-7-е сутки, адаптированные к среде штаммы растут значительно быстрее. Для первичного выделения микоплазм можно использовать 5—7-суточные куриные эмбрионы, их заражают в желточный мешок. Гибель эмбрионов отмечается с 3—5-го пассажа. Получены также положительные результаты при заражении микоплазмами клеточных культур.
Биохимические свойства. Микоплазмы обладают сложными ферментными системами. По характеру метаболизма микоплазмы подразделяют на три вида: ферментативно активные стеринзависимые, ферментативно активные стериннезависимые и ферментативно неактивные. Первые (истинные микоплазмы) нуждаются для роста в стеринах и ферментируют с образованием кислоты: глюкозу, мальтозу, маннозу, фруктозу, крахмал и гликоген. Вторые (ахолеплазмы) также расщепляют с образованием кислоты приведенные выше углеводы; некоторые штаммы разлагают сахарозу и галактозу. Третьи восстанавливают тетр азол евые соединения, окисляют лактат и глутанат, но не ферментируют углеводы. Микоплазмы не восстанавливают нитриты и не образуют индола, некоторые штаммы выделяют сероводород и аммиак.
От животных и людей выделены так называемые Т-штаммы микоплазм (уреаплазмы), синтезирующие уреазу и расщепляющие мочевину.
Некоторые виды микоплазм в сывороточных средах редуцируют метиленовую синьку, обладают пероксидазной активностью, имеют гемагглютинин и продуцируют гемолизин, вызывая 0- или а-гемолиз.
Патогенность. У некоторых видов микоплазм выделены экзотоксины. М. gallisepticum продуцирует экзотоксин нейрогенного действия, который у индеек вызывает симптомы, указывающие на поражение центральной нервной системы. Небольшие дозы этого экзотоксина у птиц вызывают изменение в мозге и суставах. Экзотоксин также образует М. neurolyticum. Эндотоксические субстанции продуцируют М. mycoides и М. mycoides Subsp. capri; они известны под названием галактана и глюкана.
Микоплазмы имеют важное значение в инфекционной патологии животных: они могут поражать отдельные органы, системы органов и вы-260
14. Патогенность микоплазм
Род И ВИД
Основной хозяин
Заболевание; место выделения
М. mycoides
Ml. mycoides subsp, capris
M. bovigenitalium
M. bovimastitidis
M. bovirhinis
M. dispar
M. bovoculi
M. alcalescens
M. agalactiae
M. ovipneumoniae
M. hyorhinus
M. hyosinoviae
M. suipneumoniae
M. canis
M. felis
M. neurolyticum
M. pneumoniae
M. hominis
M. gallisepticum
M. meleagridis
M. synoviae
M. anatis U. urealyticum
A. laidlawii
A. granularum
Крупный рогатый скот
Овцы, козы
Крупный рогатый скот
То же
Овцы, козы
Свиньи
Собаки
Кошки
Крысы, мышн
Человек
»
Птнцы
Индейки
Куры, индейки
Утята
Т-штаммы выделяются от различных видов животных н человека
Приматы, крупный рогатый скот, лошади, свиньи, собаки, кошки, мыши, птицы
Крупный рогатый скот, свиньи, человек
Контагиозная перипневмоиня Плевропневмония
Маститы, воспаление гениталий Маститы, воспаление гениталий Бронхопневмония телят Бронхопневмония, артриты Конъюнктивиты
Полисерозиты
Агалактия овец и коз
При пневмонии из легких Серозиты, артриты » »
Энзоотическая пневмония
Из респираторных органов, прн пневмонии из легких
Из полости носа
Продуцирует экзотоксин, поражает центральную нервную систему
Первичная атипичная пневмо* ния, острые респираторные заболевания
Фарингиты, острые респираторные заболевания
Респираторный микоплазмоз Инфекционный синусит
Инфекционный синовнт Инфекционный синусит Хронические воспалительные процессы урогенитальных органов. Патологи я плода. Пиелонефриты. Выделяются из семенной жидкости быков
Выделяется прн респираторных заболеваниях, урогенитальной патологии, маститах
Выделяется из респираторных и других органов
зывать специфические заболевания. К ним относят контагиозную перипневмонию крупного рогатого скота, контагиозную плевропневмонию овец и коз, инфекционную агалактию овец, энзоотическую пневмонию свиней, респираторный микоплазмоз птиц, инфекционный синусит индеек и др. Эти микроорганизмы также являются этиологическими агентами микоплазмозных маститов, артритов, конъюнктивитов, полисерозитов, урогенитальных микоплазмозов. Спектр патогенности микоплазм для млекопитающих и птиц представлен в таблице 14.
Антигенная структура микоплазм очень сложна и имеет видовые, а также типовые различия, которые можно установить, используя реакцию агглютинации, пассивной гемагглютинации, связывания комплемента, иммунодиффузии в геле, реакцию ингибиции роста и др. Функцию антигенов у микоплазм выполняют липидные, полисахаридные и белковые компоненты, избирательная активность которых зависит от вида и типа микоплазмы.
ВОЗБУДИТЕЛЬ ПЛЕВРОПНЕВМОНИИ КРУПНОГО РОГАТОГО СКОТА
Плевропневмония (перипневмония, повальное воспаление легких, ПВЛ)—контагиозный микоплазмоз крупного рогатого скота, характеризующийся экссудативным поражением легких с выраженным серозным воспалением междольчатых перегородок, серозно-фибринозным
261
плевритом, скоплением в грудной полости большого количества экссудата и образованием инкапсулированных очагов в легких, длительное время содержащих возбудителя.
Возбудитель заболевания — М. mycoides.
Морфология и тинкториальные свойства. Микроорганизм имеет форму кокков, диплококков, колец, нитей, звезд, дисков или гроздевидных образований. Нитевидные структуры достигают длины 125—240 мкм, отдельные овальные формы имеют размеры 0,2—0,8 мкм. Особенно полиморфизм выражен в бульонных культурах. Возбудитель проходит через бактериальные фильтры. В препаратах из культур микоплазма хорошо окрашивается по Романовскому — Гимзе, а также карболовым раствором анилиновых красителей.
Культивирование. Для выделения культур чаще всего используют мартеновский бульон с 10—15 % сыворотки крови крупного рогатого скота или лошади, добавление 10 % свежего дрожжевого экстракта стимулирует рост. Можно использовать среду Эдварда. Элективной плотной средой является мартеновский агар, который готовят путем добавления к бульону 1,5—3 % агара. Посевы инкубируют при 37—38 °C. В бульоне рост отмечается на 2—3-и сутки в виде опалесценции различной интенсивности или появления при встряхивании муаровых волн. На агаре возбудитель растет в виде характерных круглых с ровными краями колоний, напоминающих яичницу-глазунью, центр колонии в виде нежного сосочка или глазка оптически более плотный, врастает в толщу среды. На кровяном агаре формирует зону а-гемолиза.
Биохимические свойства. М. mycoides ферментирует глюкозу, мальтозу, маннозу, крахмал, образует сероводород.
Патогенность. Возбудитель обладает выраженной патогенностью для крупного рогатого скота и близких ему видов: буйволов, бизонов, зебу, яков. Естественное заражение происходит через дыхательные пути, при вдыхании капелек или пылинок с возбудителем, выделяемым больными со слизью из респираторных органов и мочой. В условиях эксперимента материалом от больных животных удается заразить овец, Коз, верблюдов и северных оленей. Заболевание у них протекает с повышением температуры тела, образованим на месте инъекции в подкожной клетчатке отеков и развитием артритов без смертельного исхода, из серозной жидкости и лимфатических узлов удается выделить культуру. В условиях лаборатории 'для заражения используют белых мышей и куриные эмбрионы.
Устойчивость микроба во внешней среде незначительная. Высушивание и действие солнечных лучей на пастбище уничтожают микроб через 5—'24 ч, экссудат из грудной полости при 4—8 °C сохраняет вирулентность до 8 суток, нагревание до 58 °C убивает в течение часа, бульонные культуры при 37 °C гибнут через 3 недели. В замороженных легких и лимфе возбудитель может сохраняться от нескольких месяцев до года, 'в лиофилизированных бульонных культурах и экссудате— более 5 лет. Едкий натр, хлорная и свежегашеная известь, формалин в обычных концентрациях обезвреживают возбудителя через 3—4 ч.
Иммунитет. Переболевшие плевропневмонией животные приобретают длительный иммунитет. Его продолжительность точно не установлена. Напряженность поствакцинального иммунитета также высока и продолжается до двух лет.
Диагностика. Микробиологическая диагностика основана на выделении культуры микоплазм из плеврального экссудата на специальных сывороточных средах. С этой целью проводят 2—3 пассажа. При первичном возникновении заболевания в благополучной зоне рекомендуется ставить биологическую пробу на 2—3 здоровых 6—8-ме-сячиого возраста телятах. Им вводят подкожно в области подгрудка, ин-262
тратрахеально или интраплеврально экссудат от больных животных или культуру и ведут наблюдение до 30 дней.
Серодиагностика. Достаточно хорошо зарекомендовала себя РСК как метод прижизненного выявления больных и инкубатиков в стаде. В комплексе с другими методами исследования эта реакция имеет исключительное значение. Первые антигены были приготовлены из плеврального экссудата больных животных, прогретого при 100°С. Затем стали готовить антиген из культур микоплазм, выращенных на сывороточном бульоне. Однако необходимо помнить, что РСК с сывороткой крови животных-носителей М. bovigenitalium и других видов микоплазм может давать ложноположительные результаты.
В качестве диагностического теста испытана реакция непрямой гемагглютинации, чувствительность которой с сыворотками, взятыми в острой фазе болезни, выше, чем РСК. Напротив, с сыворотками хронически больных она по чувствительности уступает РСК- Положительные результаты получены также при испытании реакций иммунодиффузии в геле, ингибиции роста и иммунофлуоресценции.
Биопрепараты. Наблюдения о развитии у переболевшего скота значительной устойчивости к повторному заболеванию послужили основанием для разработки профилактической вакцинации. Методы прививок постоянно совершенствовались. Первым был предложен метод Вил-лемса (1852), который заключается в том, что легочную плевропневмо-нийную лимфу вводили крупному рогатому скоту в надрез кожи кончика хвоста. Пастер предложил вакцинировать секундарной лимфой (пассажным «вирусом»), получаемой из местного подкожного плевропнев-монийного инфильтрата искусственно зараженных телят.
Более прогрессивным методом оказались культуральные прививки, которые позволили резко снизить процент поствакцинальных осложнений и получить более эффективный иммунитет. Для прививочного материала культуры микоплазм выращивали 5—6 суток в сывороточном бульоне (8—10 % стерильной сыворотки крупного рогатого скота; pH 7,8—8,0). Вакцинный препарат сохраняли в запаянных ампулах в темном и прохладном месте до 1,5 месяца. Прививали культуру под кожу тыльной поверхности хвоста. Доза для взрослых животных — 0,25 мл, телят до года—0,1 мл. Вакцина обладала высокой реактоген-ностью и в промежутке между 10—15-м днем после прививки развивалась реакция в виде отечно-воспалительной припухлости в области инъекции и повышение температуры тела, иногда (у 4—5 % животных) наблюдались некрозы кожи и более глубоких тканей хвоста.
В настоящее время в странах, где встречается заболевание, животных прививают живыми вакцинами, изготовленными из специально селекционированных Штаммов. Наиболее широкое распространение получила вакцина из штамма Ть У привитых животных в крови регистрируют комплементсвязывающие антитела.
ВОЗБУДИТЕЛЬ ИНФЕКЦИОННОЙ АГАЛАКТИИ МЕЛКОГО РОГАТОГО СКОТА
Инфекционная агалактия овец и коз — контагиозное заболевание, вызываемое Mycoplasma agalactiae, характеризующееся прекращением секреции молока, поражением молочной железы, суставов и глаз. У беременных животных наступают аборты. Возбудитель выделен в 1923 г. Бридре и Донатьеном.
Морфология и тинкториальные свойства. Возбудитель характеризуется выраженным полиморфизмом, проходит через бактериальные фильтры и его минимальные репродуцирующиеся единицы имеют размеры в пределах 250—400 нм. В мазках из бульонных культур обнаруживают шаровидные, овальные, дисковидные, кольцевидные или мицеллярные (до 25 мкм) структуры.
263
Микоплазмы красятся хорошо по Романовскому—Гимзе, азурэо-зином, импрегнируются серебром по Морозову и не красятся по Граму.
Культивирование. Для выращивания возбудителя применяют специальные среды с сывороткой крови лошади или крупного рогатого скота. С этой целью используют среду Эдварда или среду, приготовленную на основе мартеновского бульона. На жидких питательных средах рост М. agalactiae сопровождается слабой опалесценцией, достигающей максимума на 3—5-е сутки выращивания. При росте на твердых питательных средах образует характерные округлые колонии с мелкозернистой поверхностью и более темным врастающим в агар центром. В полужидкой питательной среде появляется интенсивное нежное помутнение у поверхности среды и по уколу.
~ Биохимические свойства. Микроб не сбраживает глюкозу, не редуцирует метиленовую синь, не образует индола и сероводорода. Обладает выраженной гемолитической активностью, особенно в отношении эритроцитов лошади, овец и кур. Лабораторные животные к возбудителю невосприимчивы, но он хорошо развивается в куриных эмбрионах, которые заражают в желточный мешок.
Устойчивость. На кормах, предметах ухода и в стойлах микоплазма сохраняется 2—3 недели, в пастбищной почве — не более 25 дней, в навозе— свыше 5 суток; исключительно устойчива к низким температурам. Дезинфектанты в обычных концентрациях (креолин, формалин) убивают микроб в течение четырех часов.
Патогенность. В естественных условиях болеют овцы и козы обоего пола, всех пород и возрастов. Наиболее восприимчивы лактирующие животные, козлята и ягнята до месячного возраста. Молодняк старших возрастных групп, нелактирующие матки и самцы более резистентны.
• Иммунитет у переболевших животных стойкий, нестерильный.
Диагностика. Бактериологическое исследование. Материалом для исследования служит молоко, выделения из пораженного глаза, жидкость из суставов и отеков; от павших и вынужденно убитых животных — паренхиматозные органы, кровь и лимфатические узлы. Микроскопию используют преимущественно для исследования культур. Препараты окрашивают по Романовскому — Гимзе. Выделить культуру можно лишь при условии доставки совершенно свежего материала, не обсемененного посторонней микрофлорой. В жидких питательных средах рост появляется через 5—6 дней, на плотных — через 10—12 дней в виде одиночных очень мелких колоний. Часто в первичных посевах рост не регистрируется, поэтому и бывает необходимость проводить не менее пяти последовательных пассажей. Бактериологический диагноз сложный и трудоемкий.
При необходимости проводят биопробу на лактирующих козах и козлятах. В качестве заражающего материала используют молоко, жидкость из суставов, суспензию внутренних органов, обработанные пенициллином и ацетатом таллия, а также свежевыделенные культуры. Заражение проводят подкожно или в молочную цистерну, вводят 5—10 мл материала. Инкубационный период при экспериментальном заражении 2—14 дней.
Разрабатывались также методы серологической диагностики этого заболевания: РСК, реакция агглютинации, иммунодиффузии в геле. Однако они еще не нашли широкого применения в практике.
- Биопрепараты. В ряде стран испытывали живые и убитые вакцины против инфекционной агалактии овец и коз. Наблюдения свидетельствуют, что они создают иммунитет достаточной напряженности в течение одного года. Сыворотки же реконвалесцентов и гипериммунизированных животных обладают незначительным предохранительным действием и практически не оказывают лечебного эффекта.
264
ВОЗБУДИТЕЛЬ РЕСПИРАТОРНОГО МИКОПЛАЗМОЗА ПТИЦ
Респираторный микоплазмоз — инфекционная контагиозная болезнь птиц, характеризующаяся развитием респираторного синдрома, полисерозитами, воспалительными процессами суставов и сухожильных влагалищ. Заболевание вызывается Mycoplasma gallisepticum. Возбудитель был изолирован в 1936 г. Нельсоном.
Морфология и тинкториальные свойства. М. gallisepticum представляет собой кокковидные клетки размером 500—800 нм. Зрелые клетки и минимальные репродуктивные единицы проходят через бактериальные фильтры. Вирулентные штаммы обладают относительной морфологической стабильностью, авирулентные же разновидности полиморфны. Как и все микоплазмы грамотрицательны, по Романовскому—Гимзе окрашиваются в фиолетовый цвет.
Культирование. Выращивают микроб на жидких и плотных питательных средах Эдварда и УНИИЭВ. Последнюю среду готовят на основе гидролизата мясного фарша, она содержит пептон (0,5—1 %), автолизат пекарских дрожжей (1 %), глюкозу (0,5 %), 20% сыворотки лошади. Применимы также среды, для изготовления которых использованы пептон Мартена или перевар Хеттингера. На жидких питательных средах микроб растет в виде легкого, слабого помутнения; на плотных— формирует бесцветные прозрачные росинчатые колонии размером от 10 до 200 мкм, трудно или почти неразличимые невооруженным глазом. Колонии врастают в среду, их центр более темный с сосочком или без него, поверхность колонии гладкая, иногда шероховатая. Возбудитель возможно культивировать в куриных эмбрионах, их гибель наступает на 3—5-е сутки после заражения.
Биохимические свойства. Большинство штаммов сбраживает с образованием кислоты без газа глюкозу, мальтозу, сахарозу и после многократного пассирования — галактозу и декстрин, встречаются ферментативно инертные культуры. Патогенные штаммы агглютинируют эритроциты птиц.
Устойчивость. В птичнике при температуре 5—10 °C возбудитель сохраняется до 28 суток, при температуре 12—18°С — 23 суток. Прямые солнечные лучи и температура 45—50 °C убивают его через 20— 40 мин, низкие температуры консервируют микроб. В лиофилизированном состоянии возбудитель может сохранять жизнеспособность до 10 лет. Данный вид микоплазм высокочувствителен к раствору хлорной извести (2 % хлора), горячему 1,5—2%-ному раствору едкого натра, 2 %-ному формалину.
Патогенность. М. gallisepticum патогенна для куриных и индюшиных эмбрионов, цыплят, индюшат, кур, индеек, цесарок, фазанов, куропаток, перепелов и голубей. В яйцо микоплазмы проникают в период его формирования в яичнике и прохождения по яйцеводу. В основном передача инфекции вертикальная — через инкубационное яйцо, а также с инфицированным инвентарем, кормом, водой и аэрогенная.
Иммунитет. Переболевшая птица приобретает стойкий активный иммунитет, цыплята могут получать защитные антитела из желтка яиц кур-реконвалесцентов.
Антигенная структура у птичьих микоплазм очень сложная: описано большое количество различных серологических типов. Наиболее стабильным по патогенным и серологическим свойствам является штамм S6. Эдвард классифицирует микоплазмы на два серотипа: патогенные микоплазмы серотипа А с выраженными антигенными признаками (в эту группу относят штаммы М. galliseplicum) и серотип С — слабопатогенный с низкой антигенной активностью, куда относятся М. gallinarum и М. iners.
265
Диагностика. Бактериологическое исследование. "Материалом для лабораторного анализа служат соскобы со слизистых оболочек гортани, трахеи, головной мозг, стенки воздухоносных мешков, кусочки легких от свежих трупов или убитых больных птиц. Исследуют также желточный мешок, легкие, трахею эмбрионов последних дней инкубации и 1—2-суточных цыплят. Возбудитель лучше сохраняется в замороженном материале.
Из патологического материала готовят суспензию на МПБ (1 : 10), которую для подавления бактериальных контаминатов обрабатывают пенициллином (5000—10 000 Ед/мл) и уксуснокислым таллием. Смесь выдерживают при комнатной температуре 40 мин и высевают на среду Эдварда или другую специальную питательную среду.
Патогенность выделенной культуры микоплазмы определяют путем заражения куриных или индюшиных 9-дневных эмбрионов в аллантоисную полость. Биопроба считается положительной при условии гибели не менее 50 % зараженных эмбрионов. Для этой же цели можно заражать куриные эмбрионы в желточный мешок. Биопробу также проводят на 1—2-месячных цыплятах или индюшатах; их заражают интраназаль-но, интратрахеально и наблюдают в течение двух месяцев.
Серологическое исследование. Для прижизненной диагностики применяют реакцию капельной агглютинации с цельной кровью (ККРА) или сывороткой крови (СКРА). Антиген для нее готовят из культур трех различных серологических типов микоплазм, инактивированных формалином и мертиолатом. Из серологических тестов используют также реакцию задержки гемагглютинации, реакцию ингибиции роста, реакцию связывания комплемента, метод иммунофлуоресценции, а для анализа антигенного состава микоплазм — реакцию преципитации в агаровом геле. Серологические методы для диагностики респираторного микоплазмоза птиц еще нуждаются в совершенствовании.
Биопрепараты. Для специфической профилактики предложен ряд вариантов инактивированных и живых вакцин, но они еще находятся в стадии изучения и совершенствования.
Наиболее эффективными ингибиторами микоплазм оказались антибиотики: тилозин, спиромицин, хлорамфеникол, тетрациклин, хлор-тетрациклин, окситетрациклин, стрептомицин, канамицин, неомицин, линкомицин. Описаны мутанты микоплазм, резистентные к антибиотикам.
РИККЕТСИИ
Риккетсии объединяют обширную группу микроорганизмов, в которую входят виды порядков Rickettsiales и Chlamydiales. На основании строения клеточной стенки, содержания РНК и ДНК и ряда других свойств микроорганизмы этих порядков относятся к бактериям и являются одними из самых мелких их представителей. Основное отличие от других бактерий — облигатный внутриклеточный паразитизм.
Внутри порядка Rickettsiales имеются значительные различия, вследствие чего собственно риккетсиями являются только виды трибы Rickettsiales. Это возбудители риккетсиозов — сыпного тифа, клещевых пятнистых лихорадок, Ку-лихорадки и др. Остальных представителей данного порядка следует именовать риккетсиоподобными и, учитывая значительные различия между ними, целесообразно представителей рода Ehrlichia называть эрлихиями, род Cowdria — коудриями, род Neorickettsia — неориккетсиями, семейство Bartonellaceae — бартонеллами, семейство Anaplasmataceae — анаплазмами, а вызываемую ими патологию соответственно называть эрлихиозом, коудриозом, неориккет-сиозом, бартонеллезом, анаплазмозом.*
* По Берги (1977) порядок Rickettsiales включает микробов трех семейств и 17 родов, порядок Chlamydiales — одно семейство и один род.
266
15. Риккетсии и вызываемые ими заболевания (порядок Rickettsiales, семейство Rickett-siaceae, триба Rickettsieae)
Род Rickettsia Род Rochalimaea Род Coxiella
Вид Заболевание Вид Заболевание Вид Заболевание
R. prowazeki R. typhi R. Canada R. rickettsii R. sibirica R. conorii R. akari R. parkeri R. tsutsugamushi R. australis Эпидемический сыпиой тиф и болезнь Брилля Крысиный сыпной тиф Не названо Пятнистая лихорадка Скалистых гор Клещевой сыпиой тиф Северной Азин Марсельская лихорадка Везикулезный риккет-сиоз Неизвестно Лихорадка цуцугамуши Клещевой тиф Северного Квинсленда R. quintana Волынская лихорадка ч. " -- С. burnetii Ку-ЛИХО радка
Риккетсии названы в честь американского микробиолога У. Рик-кетса, открывшего возбудителя пятнистой лихорадки Скалистых гор и погибшего от сыпного тифа. Известно 12 видов риккетсий, относящихся к трем родам (табл. 15). Риккетсии — облигатные внутриклеточные паразиты широкого круга животных. Характерен паразитизм у членистоногих. Представляют собой плеоморфные микроорганизмы, кокковидной, палочковидной, бациллярной и нитевидной формы. Преобладают кокковидные (0,3 мкмХ0,4 мкм) или палочковидные (до 2,5 мкм) риккетсии, часто образуют диплоформы. Обладают трехслойной клеточной стенкой, трехслойной цитоплазматической мембраной, расположенным между ними пептидогликановым слоем, что типично для грамотрицательных бактерий. Не имеют жгутиков, неподвижны, грамотрицательны, окрашиваются основными анилиновыми красителями по Гимзе—Романовскому, Макиавелло, Здродовскому, Гименесу. Размножаются бинарным делением только в живых или переживающих тканях. Содержат РНК и ДНК, белки, углеводы, липиды, липополисахариды. Состав оснований ДНК равен у Rickettsia — 30 mol %, у Coxiella — 43 mol %, у Rochalimaea — 38,5 mol %. Чувствительны к антибйотикам тетрациклинового ряда.
Являются возбудителями риккетсиозов животных и человека (Ку-лихорадка, сыпной тиф и др.).
Риккетсиоподобные (эрлихии, коудрии, неориккетсии, бартонеллы, анаплазмы) имеют выраженные различия в биологических свойствах, цитотропизме, естественных переносчиках и носителях, вызываемой патологии.
Их характеристику см. в таблице 16.
Эрлихии — мелкие плеоморфные микроорганизмы, размножающиеся в цитоплазме циркулирующих лейкоцитов восприимчивых хозяев. Описан цикл развития: элементарное тельце — инициальное тельце (ретикулярное)—промежуточное тельце — элементарное'тельце. Грамотрицательны, окрашиваются по Гимзе — Романовскому в синий цвет, неподвижны. Не растут в бесклеточных средах или на куриных эмбрионах. Чувствительны к тетрациклину. Возбудители болезней крупного рогатого и мелкого рогатого скота, лошадей, представителей семейства собачьих.
Описано два случая заболевания людей эрлихиозом собак.
267
? и Мен; 4.$. л ph,,,Т!
16. Риккетсиоподобные и вызываемые ими заболевании (порядок Rickettsiales)
Семейство Rickettsiaeceae, триба Ehrlichieae
Семейство Rickettsiales
Семейство Anaplasmataceae
Возбудитель
Заболевание
Возбудитель
Заболевание
Возбудитель
Заболевание
Род Ehrlichia
Е. canis Эрлихиоз собак
Е.phagocyte- Эрлихиоз phile жвачных
и всеядных
Род Bartonella
В. bacilli for- Лихорадка mis Оройя
Род Anaplasrria
A. marginale
Болеют коровы, зебу, буйволы, бизоны, оленн
и др.
Род Cowdria
С. rumina- Гидропери-ntium кардит
Род Grachamella
G. talpae
G. peromysci
Род Neorickettsia
N. helmint- Неориккетсиоз hoeca собак
Болезнь кротов Болезнь грызунов
Род Paranaplasma
| Болеют коровы Род Aegyptianella
| Болеют коровы Род Haemobartonella
Триба Wolbachieae
| Возбудители болезней насекомых
Паразитируют на диких грызунах, кошках и собаках
Род Eperythrozoon
Паразит белых
мышей, крыс,
кроликов и хомячков
Коудрии—плеоморфные кокковидные или эллипсовидные микро- , организмы, 0,2—0,5 мкм в поперечнике. Размножаются в цитоплазме эндотелия сосудов жвачных. Неподвижны, грамотрицательны. Красятся в синий цвет анилиновыми красителями по Гимзе — Романовскому. Не растут в бесклеточных средах. Чувствительны к сульфамидам и тетрациклину. Переносятся иксодовыми клещами рода Amblyomma. Трансовариальная передача у клещей неизвестна. Вызывают сердечную водянку— септическую болезнь домашних жвачных в Африке. Вирулентные штаммы вызывают гибель 20—95 % животных.
Неориккетсии — мелкие плеоморфные организмы 0,3—0,4 мкм в поперечнике, размножаются преимущественно в цитоплазме ретикулярных клеток лимфоидных тканей собачьих. Грамотрицательны, неподвижны. Красятся анилиновыми красителями в синий цвет. Не растут на бесклеточных питательных средах или на куриных эмбрионах. Чувствительны к тетрациклину. Переносчик — трематода. Вызывают заболевание семейства собачьих на среднем и западном побережье США.
Бартонеллы — паразиты эритроцитов человека и других позвоночных. Округлые и эллипсоидные формы или тонкие, прямые, кривые или изогнутые палочки внутри эритроцитов или на их поверхности размером менее 3 мкм в диаметре. Окрашиваются анилиновыми красителями, лучше всего по Гимзе после фиксации метиловым спиртом. В результате в них не обнаруживается эукариотического ядра, что отличает их от простейших, паразитирующих в эритроцитах. Грамотрицательны. Культивируют на средах без живых клеток. Род Bartonella имеет клеточную оболочку. Размножаются бинарным делением. В культурах образуют жгутики на одном полюсе. Вызывают бартонеллез человека. Обнаружены у москитов. Болезнь известна на Южноамериканском континенте. Род Grachamella обнаружен только в эритроцитах млекопитающих. Имеют клеточную стенку. Неподвижны. Жгутики не обнаружены. Грамотрицательны. Вызывают грахамеллез грызунов. Имеют широкое географическое распространение.
268
17. Хламидии и вызываемые ими заболевания
(порядок Chlamydiales, семейство Chlamydiaceae, род Chlamydia)
Ch. trachomatis
Пневмония мышей
Трахома человека
Конъюнктивит человека
Венерическая лимфогранулема человека
Уретрит человека
Артериит человека
Ch. psittaci
Орнитоз птиц и человека
Доброкачественный лимфоретикулез человека
Энзоотический аборт овец
Энзоотический аборт крупного рогатого скота
Пневмония кошек, овец, крупного рогатого скота, коз, лошадей, кроликов, свиней
Полиартриты овец, крупного рогатого скота и свиней
Спорадический энцефаломиелит крупного рогатого скота
Энтерит крупного рогатого скота
Конъюнктивит морских свинок
Конъюнктивит овец
Септицемия кроликов
Субклиническая кишечная инфекция у крупного рогатого скота и овец
Меиингопневмония мышей
Перикардит свиней
Анаплазмы— облигатные паразиты эритроцитов диких и домашних позвоночных. Палочковидные, сферические, кокковидные или кольцеобразные тельца 0,2—0,4 мкм в диаметре. Красятся по Гимзе анилиновыми красителями в красный цвет. Грамотрицательны.
Хламидии — облигатные внутриклеточные паразиты эукариот, в отличие от риккетсий не паразитируют у членистоногих. Впервые описаны при трахоме Провацеком и Гальберштедтером в 1907 г. При развитии (как и у эрлихий) происходит закономерное преобразование инфекционного элементарного тельца в вегетативную форму — инициальное (ретикулярное) тельце, которое через промежуточные формы вновь превращается в элементарное. Цикл развития происходит в фагоцитарных вакуолях, окруженных плазмалеммой. Элементарное тельце имеет сферическую форму около 0,3 мкм в поперечнике. Окружено трехслойной клеточной оболочкой и цитоплазматической мембраной, между которыми находится пептидогликановый (ригидный) слой, характерный для грамотрицательных бактерий. Обладает невыраженной биохимической активностью. Инициальное тельце достигает 0,5—1,2 мкм в поперечнике. Окружено двумя такими же трехслойными мембранами, однако ригидный слой' отсутствует. Обладают выраженной биохимической активностью. Окрашиваются анилиновыми красителями по Гимзе, Макиавел-ло, Гименесу, Кастаньеде и др. Грамотрицательны. Чувствительны к антибиотикам тетрациклинового ряда. Культивируют в желточном мешке и культуре клеток. Известно два вида хламидий (табл. 17), вызывающих разнообразную патологию у животных, в том числе птиц, и человека.
ВОЗБУДИТЕЛЬ КУ-ЛИХОРАДКИ I
Ку-лихорадка вызывается Coxiella burnetii (син. Rickettsia burneti и R. diaporica). Отличается от видов рода Rickettsia тем, что размножается в вакуолях цитоплазмы, а не в цитоплазме или в ядре клеток хозяина, а также чрезвычайной устойчивостью к воздействию различных физических и химических агентов.
Данная болезнь — зооноз, поражающий животных (в том числе и птиц), а также человека. Обычно Ку-лихорадка у животных не проявляется в виде клинически выраженного заболевания. Могут развиваться риниты, маститы, наблюдаются аборты, но, как правило, у естественно зараженных животных при наличии риккетсий в плаценте аборты ред
269
ки, лейкоцитоз и состояние молочных желе^ в'нОрМе. ЭйсперййсШ'^л^-
ная инфекция у животных протекает тяжело, с поражением селезенки и других внутренних органов, абортами.
Болезнь впервые описана Дерриком в Австралии в 1937 г. как лихорадки скотобоен. Впоследствии названа лихорадкой Ку по первой букве английского слова «неясный, неопределенный». Независимо от Деррика возбудитель был выделен американскими учеными из иксодо-
вых клещей.
плеоморфный
Морфология и тинкториальные свойства. С. burnetii —
микроорганизм, преобладают кокковидные и палочковидные формы размером 0,2—0,4X0,4—1,0 мкм (см. рис. 87). Тонкое строение такое, как у других представителей трибы Rickettsia. Клеточная стенка содержит мурамовую и диаминопимелиновую кислоту, различные протеины. Микробы окрашиваются фуксином в розовый цвет. Грамотрицательны, при некоторых условиях окрашиваются по Граму положительно. Размножаются бинарным делением. Неподвижны. Не имеют жгутиков.
Культивирование. Используют только живые клетки. Обильно размножаются в желточных мешках куриных эмбрионов при температуре 35°C, клеточных культурах (фибробласты, клетки L и др.), органах и
тканях лабораторных животных.
Устойчивость. К воздействию различных агентов внешней среды устойчивы, в высохшей крови сохраняются 180 дней, в сухих фекалиях клещей — 586 дней, в молоке при 4 °C — от 40 до 150 дней, в молоке после кипячения (при 63°C) —в течение 30 мин, в масле и сыре при 4 °C — около 40 дней, в моче и навозе — несколько недель. Не погибают от воздействия 1 %-ного фенола или 1 %-ного формалина в течение 24 ч.
Патогенность обусловлена, видимо, эндотоксином. В естественных условиях указывают зараженность млекопитающих 70 видов, 50 видов птиц и 40 видов иксодовых и аргаловых клещей.
Патогенез при Ку-лихорадке изучен на моделях человека и экспериментальных животных. Входными воротами инфекции являются поврежденные кожные покровы и слизистые оболочки верхних дыхательных путей, глаз, органов пищеварения. Характерна генерализованная инфекция с обильным размножением риккетсий в ретику-ло-эндотелиальной системе. Отмечен тропизм к генитальной системе, в результате чего для Ку-лихорадки характерны аборты, выделение риккетсий с околоплодной жидкостью, плацентой, молоком.
Антигенная структура отлична от р. Rickettsia и серологических перекрестов с другими риккетсиями не установлено. Выявлено образование фаз, аналогичных гладким и шероховатым формам бактерий. Фаза I — естественная форма существования этого микроорганизма, она выделяется от больных людей, животных, клещей. Фаза II образуется в результате пассажей на куриных эмбрионах и, в свою очередь, переходит в фазу I в результате пассажей через организмы восприимчивых животных. Установлено различие фаз в тонком строении, патогенных, антигенных свойствах и др.
Риккетсии в фазе I содержат поверхностный полисахаридный антигей, в фазе II — корпускулярный антиген. Реакция связывания комплемента с антигеном из фазы I становится положительной на 40—60-й день, а с антигеном из фазы II — на 7—10-й день. Высокий титр антител из фазы I свидетельствует о хронической инфекции и используется в диагностических целях. Патогенные и иммуногенные свойству риккетсий в фазе I более выражены, чем в фазе II.
Иммунитет изучен неполно. Отмечена склонность к хроническому течению инфекционного процесса,' рецидивам заболевания и случаям повторного заражения.
Диагностика Ку-лихорадки у животных осуществляется с помощью реакции связывания комплемента, метода иммунофлуоресценции, мето-
270
домг биопроб. РСК специфична с титра 1: 10. Лучшие результаты (в 8 раз) получены в результате применения антигена из риккетсий в фазе I. Биопрепараты специфические не разработаны. Эффективны антибиотики тетрациклинового ряда.
ВОЗБУДИТЕЛЬ ЭРЛИХИОЗА СОБАК
Эрлихиоз собак* вызывается Ehrlichia canis (син. Rickettsia canis). Это облигатный внутриклеточный паразит моноцитов, лимфоцитов,
тромбоцитов и нейтрофилов.
Эрлихиоз — трансмиссивное лихорадочное заболевание, характеризующееся истощением, панцитопенией, геморрагиями на слизистой оболочке и коже, длительным переживанием возбудителя в крови. Клиническое течение болезни условно разделено на лихорадочную, субклини
ческую и две терминальные фазы.
Морфология и тинкториальные свойства. У Е. canis цикл развития следующий: элементарное тельце — инициальное (ретикулярное) тель-
це — морула — элементарное тельце. Элементарное тельце — кокковидное или овальное образование около 0,4 мкм в поперечнике, окруженное двойной мембраной (см. рис. 88). Оно обладает инфекциозностью и поражает здоровую клетку. В клетке начинается размножение элементар-
ных телец, которые преобразуются в инициальное тельце — гомогенное образование неопределенной формы, достигающее в поперечнике 1 — 2 мкм. Постепенно в течение внутренней перестройки инициальное тельце становится похожим на ягоду шелковицы. Это типичное для цикла развития Е. canis образование, размеры его могут достигать 2—4 мкм. Морула отделена от цитоплазмы одной оболочкой. Внутри морулы
просматриваются элементарные тельца, на которые она распадается. Все формы Е. canis окрашиваются по Гимзе в голубой, по Романовскому — в розовый цвет.
Культивирование. Е. canis выращивают в культуре моноцитов собак в среде Игла с добавлением 20 % собачьей сыворотки крови при температуре 37 °C.
Биохимические свойства и устойчивость к химическим и физическим агентам Е. canis не изучены.
Патогенность. Менее вирулентны штаммы из Арканзаса, поражающие нейтрофилы, более вирулентны штаммы из Оклахомы, поражающие моноциты и лимфу, высоковирулентны штаммы, выделенные в Юго-Восточной Азии. Патогенность Е. canis варьирует в зависимости от штаммо-вой принадлежности возбудителя. Наиболее чувствительны к эрлихиозу собак немецкая овчарка и гончая. Экспериментальная инфекция воспроизводится на собаках, у которых возбудитель обнаруживается в крови на 12—14-й день после заражения. К Е. canis восприимчивы также макаки-резусы, лисы, койоты. Лабораторные животные (мыши, крысы, хомячки, морские свинки) и куриные эмбрионы невосприимчивы.
Патогенез. E.canis размножается в циркулирующих лейкоцитах, приводя к резкой лейкопении, тромбопении, панцитопении. У погибших животных отмечается геморрагия в подкожной клетчатке и большинстве внутренних органов, из которых наиболее поражаются сердце, легкие, желудок, кишечный тракт и урогенитальные пути. Летальность при массовых заболеваниях достигала 18,5—19,4 %.
Иммунитет нестерильный, возбудителя обнаруживают в крови более года. Перекрестный иммунитет с возбудителем неориккетсиоза собак не отмечен. Антитела к Е. canis у собак выявляются на 7-й день и относятся к IgM и IgA.,На 21-й день появляются глобулины класса IgG.
Диагностика. Простым и надежным способом является выявление морул возбудителя в лейкоцитах у собак (световая микроскопия мазков,
* В отечественной литературе известен как риккетсиозный моноцитоз (Доро-феевг 1975), в английской — риккетсиоз собак (Donatien et Lestoquard, 1935).
271
терны для рода Chlamydia. Состав оснований ДНК для 10 штаммов равен 39,4—43,05 mol %. Культивируют в желточном мешке куриных эмбрионов при 37—30 °C и в культуре клеток на лабораторных животных.
Возбудитель выделен более чем из 100 видов диких и домашних птиц и животных. Передается ингаляционным и орально-фекальным путем. Описан трансплацентарный путь передачи.
Диагностика осуществляется с помощью реакции связывания комплемента с групповым антигеном в титрах с 1 : 10, биологическим методом и путем микроскопии. Необходим дифференциальный диагноз с бруцеллезом, сальмонеллезом, вибриозом, листериозом, лептоспирозом, Ку-лихорадкой и токсоплазмозом.
Лечение антибиотиками не эффективно в разгар болезни. Предпочтительнее применять антибиотики тетрациклинового ряда с профилактической целью в случной период или при первичных случаях заболевания.
ПАТОГЕННЫЕ СПИРОХЕТЫ
ВОЗБУДИТЕЛЬ ЛЕПТОСПИРОЗА
Лептоспирозом болеют животные многих видов, а также человек. У животных болезнь проявляется кратковременной лихорадкой с наличием анемии, желтухи, гемоглобинурии, геморрагического диатеза, некроза слизистых оболочек и кожи, атонии органов пищеварения, иногда отмечали аборт, рождение мертвого или нежизнеспособного приплода. Лептоспирозная этиология этой болезни была впервые доказана: у крупного рогатого скота— В. И. Терских (1938—1939 гг.); у серебристочерных лисиц, песцов, коз — С. Я. Любашенко (1938—1939 гг.); у свиней и овец—В. И. Терских (1940 г.); у лошадей — С. Я. Любашенко и Л. С. Новиковой (1946 г.). Возбудителями данного заболевания являются лептоспиры, которые по ряду морфологических и физиологических признаков выделены в самостоятельный род семейства спирохет — Leptospira (lepto — нежная, spira — спираль). По современной классификации род лептоспир состоит из двух видов: паразитарный (L. interrogans) и сапрофитный (L. biflexa). В виды входят многочисленные серологические типы (серовары), отличающиеся по антигенным свойствам. Серотипы, близкие в антигенном отношении, объединены в серологические группы. Список патогенных лептоспир включает около 170 серотипов, разделенных на 18 серологических групп. Основными возбудителями лептоспироза сельскохозяйственных и промысловых животных на территории Советского Союза являются лептоспиры следующих серологических групп: Pomona, Grippotyphosa, Tarassovi, Icterohaemorrha-giae, Hebdomadis, Canicola, объединяющие 13 сероваров.
Морфологические и тинкториальиые свойства. Тело лептоспиры передвигается благодаря проходящим через все тело двум длинным и тонким осевым нитям, на которые винтообразно накручена цитоплазматическая спираль. Первичные завитки спирали очень мелкие и тесно прижаты один к другому (см. рис. 90). Помимо первичных завитков, обнаруживают более крупные изгибы ее тела. В зависимости от формы и величины изгибов лептоспиры приобретают форму букв С, S, X (см. рис. 91), иногда цифры 8. Концы лептоспиры загнуты в виде крючков, но встречаются и бескрючковые формы. У некоторых особей в концевом участке имеется округлое утолщение. Длина клетки 7—15 мкм, бывают длинные особи (30 мкм и более), толщина 0,1—0,25 мкм. Спор и жгутиков лептоспира не образует. Активная подвижность — один из суще-" ственных диагностических признаков рода микроорганизмов Leptospira. , „
274
Возбудитель плохо окрашивается обычными анилиновыми красками. Специальные методы (импрегнация серебром по Левадити, окраска по Романовскому — Гимзе) дают удовлетворительные результаты.
Культивирование. Лептоспиры на обычных средах не растут. Для их культивирования используют жидкие слабощелочные (pH 7,2—7,4) среды (Терских, Ферворт — Вольфа, Любашенко), содержащие сыворотку крови кролика или барана (5—10 %).
На плотных питательных средах лептоспиры образуют колонии — матовые, прозрачные или полупрозрачные гомогенные диски.
По типу дыхания лептоспир относят к аэробам. Размножаются они поперечным делением. При этом в средней части клетки возникает истончение, которое делит клетку на две части. Разрыв перетяжки происходит в результате активного движения двух дочерних половин клетки. Для роста температурный/штимум 25—30°C. Большинство культур вырастает через 7—20 дней, иногда через 3—5 дней и редко через 1—2 месяца и больше.
Биохимические свойства изучены очень слабо. Большинству исследователей не удалось установить ассимиляцию углеводов и многоатомных спиртов патогенными лептоспирами или усиленное размножение их в присутствии этих веществ. Более того, при концентрации 500 мг на 1 л среды лактозы, мальтозы, глюкозы и других углеводов отмечают угнетение роста и гибель лептоспир. Эти наблюдения дают основание утверждать, что процесс ферментации углеводов лептоспирами маловероятный.
Устойчивость. Лептоспиры весьма устойчивы к воздействию факторов внешней среды. Сроки выживания их в речной, прудовой, озерной и болотной воде колеблются от 3 до 20 дней. В сухой стерильной почве лептоспиры погибают в течение 1—1,5 ч, в сырой — они сохраняются до трех дней, при перенасыщении ее водой — до 193 дней.
В щелочной моче травоядных лептоспиры остаются живыми до 48 ч, в кислой моче плотоядных — до 4 ч. Раствор желчи (3—10%) крупного рогатого скота лизирует лептоспиры через 30—60 мин. Они сохраняют свою жизнеспособность в свежем молоке от 8—24 ч, в кипяченом и пастеризованном — 24—48 ч. В органах и тканях убитых животных в зависимости от pH и температуры хранения сроки выживаемости лептоспир колеблются от 1 до 12 суток; в почках свиней при комнатной температуре— 1—2 дня, в рефрижераторе — 7—12 дней; в мясе телят, ягнят, поросят и кроликов погибают в течение 10 дней хранения при — 10°С (pH не выше 6,2). При высыхании, кипячении и воздействии обычных концентраций дезинфицирующих веществ лептоспиры гибнут моментально. При замораживании лептоспир в питательной среде при температуре от —30° до —70 °C они могут оставаться жизнеспособными до 27г лет и вирулентными до 238 дней. Лептоспиры очень чувствительны к раствору поваренной соли — 2,8 %-ная концентрация убивает их за 15 мин. В гниющем органическом материале они погибают через 3—5 суток.
Патогенность. В естественных условиях наиболее восприимчивы к лептоспирозу крупный рогатый скот, свиньи, овцы, лисицы, песцы, менее— лошади, козы, буйволы, олени, ослы, собаки, кошки, куры и многие виды мышевидных грызунов. Кроме этих животных, к экспериментальному заражению восприимчивы золотистые хомяки, суслики, молодые кролики и молодые морские свинки. Установлено, что фактором, определяющим тяжесть течений заболевания, служат не антигенные различия между соответствующими серотипами лептоспир, а вирулентность штаммов возбудителя инфекции.
Вирулентность свежевыделенных штаммов лептоспир в пределах серотипа весьма изменчива. При культивировании на питательных сре-20* 275
дах они относительно быстро теряют свою вирулентность. Пассажами на восприимчивых животных ее можно повысить и сохранить довольно длительное время.
В культурах лептоспир обнаружен гемолизин, активность которого наиболее выражена по отношению к эритроцитам жвачных и в особенности к эритроцитам барана. Гемолизин в течение 10 мин разрушается ори температуре 56 °C ив лиофилизированном виде сохраняется не менее 4 месяцев. Наибольшую активность он проявляет при pH 7,4—8,0 и температуре 37 °C. Антитела в ответ на введение в организм гемолизина не образуются, однако он нейтрализуется при добавлении иммунной сыворотки, то есть ведет себя как гаптен. Установлено, что штаммы, принадлежащие к разным серотипам, обладают неодинаковой способностью к образованию гемолизина. Гемолитическая активность почти постоянно выявляется у лептоспир серотипов Grippotyphosa, Pomona, Canicola. На возможную патогенетическую роль гемолизина указывают результаты внутривенного введения больших доз гемолизина лептоспир ягнятам и молодым оленям, у которых развивается заболевание, напоминающее естественную лептоспирозную инфекцию, заканчивающееся летальным исходом. Поскольку убедительные доказательства существования экзотоксина у лептоспир отсутствуют, предполагают, что важную роль в патогенезе инфекции имеют эндотоксины, образующиеся при распаде лептоспир в организме.
Патогенез. Возбудители проникают в организм животных чаще через поврежденные слизистые оболочки и кожу. Уже через 12 ч их можно обнаружить в печени, где они накапливаются до появления лихорадки. В период лихорадки лептоспиры появляются в крови и число их резко увеличивается ие только в печени, но и в почках, надпочечниках, реже в мышце сердца, легких и лимфатических узлах. С появлением желтухи температура снижается и лептоспиры постепенно исчезают из крови, печени, легких, ио число их увеличивается в почках и моче, что совпадает с фазой накопления антител в крови больного животного. При лептоспирозе в результате интоксикации закономерно поражается нервная система, вследствие чего нарушается нормальная функция различных органов.
Антигенная структура. Несмотря на то что все патогенные и сапрофитные лептоспиры имеют одинаковую морфологию, между ними существуют антигенные различия, что подтверждается наличием многочисленных серотипов. Иммунохимическим анализом препаратов, приготовленных путем разрушения культур лептоспир ультразвуком, доказано наличие в них типо- и родоспецифических антигенов. При этом антигенная функция ультразвукового антигена лептоспир связана с его белковой фракцией. В клетках лептоспир различных серотипов обнаружены также преципитиногены, обладающие высокоспецифическими свойствами. По своей природе они сложны и представлены в различных сочетаниях у различных серотипов и даже у отдельных штаммов одного и того же типа лептоспир.
Наибольшее практическое значение до настоящего времени придается агглютиногенам. Возбудители лептоспироза дифференцируются почти исключительно в реакции агглютинации. Эта реакция служит основой для разработки метода серологической диагностики, а также классификации лептоспир. Антигенный анализ лептоспир с помощью последовательной абсорбции агглютининов из исследуемой сыворотки антигенами многих серотипов дает возможность изучать более полно антигенную структуру лептоспир.
Иммунитет. Переболевшие животные приобретают довольно стойкий и напряженный типоспецифический иммунитет, механизм которого связан с наличием антител. В сыворотке крови больных животных на 3—5-й день болезни обнаруживают агглютинины в титре 1 :500— 1 : 10 000 и выше, которые сохраняются в течение многих лет. Однако при наличии иммунитета часть переболевших животных длительное вре-276
• мя остается лептоспироносителями. Следовательно, при данной инфекции может быть стойкий иммунитет (стерильный и нестерильный). ‘
Диагностика. Бактериологическое исследование проводят методами микроскопии, выделения культуры лептоспир с последующей ее идентификацией и биопробой на лабораторных животных.
Для исследования материалов, содержащих лептоспир, пользуются микроскопией в темном поле и реже окрашенными или импрегнирован-ными серебром препаратами. При нормальной настройке «темного поля» в препарате ясно видны серебристо-белые подвижные лептоспиры с первичными завитками, имеющие вид тесно примыкающих друг к другу пауков. В срезах из органов (почек, печени и др.) лептоспир обнаруживают после импрегнации серебром по методу Левадити (см. рис. 92); при окраске мазков по Романовскому — Гимзе, они окрашиваются в светло-розовый цвет.
Получение культуры лептоспир из крови, ликвора и мочи больных, а также из органов павших животных удается не всегда. Кровь и ликвор для посева лучше брать у больных животных в ранний период болезни (на 3—5-й день) при наличии повышенной температуры тела и вносить по 3—5 капель в 5—7 пробирок с жидкой питательной средой. Мочу для посева берут в поздней стадии болезни. Для посевов из органов павших или вынужденно убитых животных пользуются (печень, почка и др.) только свежим материалом. Посевы выдерживают при температуре 28—30 °C в течение трех месяцев. При появлении роста лептоспир внешний вид среды не изменяется. Поэтому для обнаружения роста лептоспир через каждые пять дней культивирования из каждой пробирки берут капли среды и просматривают их под микроскопом. Рост лептоспир чаще выявляют на 5—20-й день, иногда через 1—2 месяца и редко через 2—3 месяца культивирования. Из пробирок, где обнаружен рост лептоспир, делают пересев в 3—5 пробирок со свежей питательной средой. При длительном хранении культуру лептоспир пересевают через каждые 10—15 дней.
Биологическую пробу ставят на золотистых хомяках 20—30-днев-ного возраста, крольчатах в возрасте 10—20 дней, молодых морских свинках в 3—5-недельном возрасте. Указанных животных заражают.для выделения культур лептоспир из патологического материала и объектов внешней среды, а также с целью определения степени их вирулентности и очистки культур лептоспир от посторонней микрофлоры. Для выделения культур исследуемый материал (кровь, мочу, суспензию из паренхиматозных органов животных) вводят под кожу или внутрибрюшинно: хомякам 0,5—1 мл, крольчатам 2—3, морским свинкам 1—2 мл. У крольчат и морских свинок после заражения измеряют температуру. В период лихорадки (на 3—5-й день) берут кровь из уха или сердца для микроскопии и посева. Если животные не погибают, их убивают на 14—16-й день после заражения. Сыворотку крови животных исследуют в реакции микроагглютинации с лептоспирами 13 серологических групп. Положительная РМА в разведении 1 :10 и выше указывает на наличие лептоспир в исследуемом материале. Высевы от убитых и павших животных делают из сердца, печени и почек. Золотистые хомяки и крольчата, зараженные культурой патогенных лептоспир, содержащей 70—80 лептоспир в поле зрения, в дозе 0,1—0,2 мл погибают на 5—12-й день. Морские свинки гибнут только при заражении их L. icterohaemorrhagiae.
Серологическое исследование основано на выявлении специфических антител в сыворотке крови животных реакцией микроагглютинации (РМА) и реакцией макроагглютинации (РА).
При взятии крови у животных следует учитывать, что антитела в сыворотке появляются с 3—7-го дня болезни и достигают максимума к 12—14-му дню (титр 1 :10 000 и выше). В случае выздоровления животного антитела в крови могут сохраняться довольно длительное вре-
277
ЗЯ
мя (до двух и более лет). К исследованию пригодна сыворотка свежая, замороженная, консервированная фенолом или борной кислотой, высушенная на фильтровальной бумаге. Сыворотки для реакции разводят физиологическим раствором в отношениях 1:10, 1 : 100; 1 : 200; 1 : 400; 1 : 800 и далее до титра.
При постановке реакции микроагглютинации (РМА) используют живые культуры лептоспир различных серологических групп в возрасте 5—15 дней с плотностью 60—80 клеток в поле зрения микроскопа без признаков агглютинации и лизиса. Реакцию ставят в агглютинацион-ных пластинках из плексигласа или в пробирках. Контролем служит взвесь лептоспир в физиологическом растворе. После добавления культуры лептоспир в каждое разведение сыворотки пластинки или пробирки встряхивают и выдерживают в термостате 2 ч при температуре 30°С. Затем из каждого разведения готовят препарат раздавленная капля и исследуют в темном поле микроскопа при увеличении 20ХЮ или 20 X 7X1 >5.Результаты реакции оценивают в крестах по четырехбалльной системе. Агглютинация проявляется в склеивании лептоспир и образовании «паучков». Реакцию признают положительной при титре 1 : 400-!—сомнительной — 1:200 + . В сомнительных случаях рекомендуют повторное исследование крови через 5—7 дней для выявления нарастания титра антител.
Реакцию макроагглютинации (РА) ставят с убитыми формалином концентрированными лептоспирозными антигенами различных серологических групп. Реакцию ставят при комнатной температуре на стекле, на которое наносят каплю разведенной 1 : 100 сыворотки и к каждой капле добавляют такое же количество антигена. Сыворотку с антигеном смешивают стеклянной палочкой. Агглютинация наступает при наличии в сыворотке специфических антител в срок от нескольких секунд до 10 мин. Учитывают РА в проходящем свете. Капли освещают снизу осветителем типа ОИ-19. Оценивают реакцию в крестах по четырехбалльной системе в зависимости от степени просветления жидкости и образования хлопьев. Положительной считают реакцию в два креста и выше, сомнительной — в один крест.
Биопрепараты. Специфическая профилактика и терапия лептоспироза сельскохозяйственных и промысловых животных впервые разработана и внедрена в ветеринарную практику нашей страны С. Я. Любашенко (1941). Для активной иммунизации применяют поливалентную феноловую вакцину против лептоспироза сельскохозяйственных и промысловых животных, а также депонированную поливалентную вакцину ВГНКИ в двух вариантах. Первый вариант содержит лептоспиры серогрупп помона, тарассови, иктерогеморрагия и каникола. Им вакцинируют свиней и собак. Второй вариант содержит лептоспир серогрупп помона, тарассови, гриппотифоза и четырех сероваров группы гебдомадис. Им иммунизируют крупный и мелкий рогатый скот. (В зависимости от этиологической структур^ болезни для вакцины могут быть использованы культуры лептоспир и других серологических групп.)
Специфическую активность вакцины контролируют по титру антител у привитых кроликов. Через сутки титр антител в РМА должен быть не ниже 1 :400 или не ниже 1 : 100 в зависимости от принадлежности микроба к серогруппе.
Иммунитет у животных наступает через 14—20 дней после введения вакцины и длится от шести месяцев у молодняка и до года у взрослого скота.
Для пассивной иммунизации применяют поливалентную противо-лептоспирозную сыворотку, которую получают путем гипериммунизации крупного рогатого скота смесью культур лептоспир, из которых готовят вакцину. Сыворотка признается активной, если титр антител в РМА в 278
ней будет 1 :25000 и выше. Сыворотку вводят под кожу в дозах от 5 до 60 мл. Продолжительность пассивного иммунитета до 15 дней. Срок годности сыворотки два года. Для лечения больных животных используют гипериммунную сыворотку и стрептомицин.
Животные, подвергнутые лечению сывороткой при остром течении лептоспироза, выздоравливают, но часто остаются лептоспироносите-лями. Стрептомицин применяют для лечения животных при остром течении болезни и для лечения животных-лептоспироносителей. Препарат вводят в течение 4—5 дней по 10—12 тыс. ЕД на 1 кг массы животного.
ПАТОГЕННЫЕ КАМПИЛОБАКТЕРЫ
В род Campylobacter объединены микробы с небольшим числом витков трех видов: С. sputorum, С. fecalis и С. fetus. Все они встречаются в генитальных органах крупного и мелкого рогатого скота, но только последний вызывает поражение репродуктивной системы животных, которое именуется кампилобактериозом (вибриозом).
ВОЗБУДИТЕЛЬ КАМПИЛОБАКТЕРИОЗА (ВИБРИОЗА)
Вибриоз проявляется у коров и нетелей поражением половых органов, бесплодием, частыми перегулами, абортами, а у овец — массовыми абортами во второй половине суягности. Возбудителем является плодовый вибрион — Campylobacter fetus, относящийся к извитым формам бактерий из семейства Spirillaceae. Впервые он был открыт в 1913—1918 гг. Мак-Федиеном и Штокманом. В настоящее время доказано существование трех подвидов патогенного плодового вибриона. С. fetus subsp. fetus патогенен для крупного рогатого скота, морских свинок и куриных эмбрионов. В кишечнике человека и животных он не размножается. С. fetus subsp. intestinalis вызывает аборты у овец, спорадически у коров и редко инфицирует человека. Он хорошо растет в кишечнике и желчном пузыре человека и животных. С fetus subsp. jejuni вызывает аборты у овец, редко поражает человека. Содержится в кишечнике здорового рогатого скота, свиней и птиц.
Морфология и тинкториальные свойства. Кампилобактер в молодых культурах имеет форму запятой, длина 3—7 мкм, ширина 0,2— 0,5 мкм. В мазках из патологического материала может иметь форму запятой, летящей чайки, спириллы. Возможно скопление, а также образование нитей из вибрионов, что дает впечатление длинных спирилл. Вибрион на одном конце имеет жгутик, очень подвижен, спор и капсул не образует. Хорошо красится анилиновыми красками, особенно карболовым фуксином; при окраске по Романовскому — Гимзе в теле клетки обнаруживают зернистость.
Культивирование. C.fetus относят к микроаэрофилам, культуру выращивают в присутствии 10 % COg. Температурный оптимум 37,5°С. . Для получения первичной культуры используют полужидкие и плотные питательные среды с добавлением крови или ее сыворотки. На полужидком печеночном 0,2 %-ном агаре (ПЖА) спустя 2—7 суток около самой поверхности среды в пробирке появляется рост в виде сероватобелого кольца. На 2 %-ном мясо-печеночном пептонном агаре (МППА) слабый рост отмечают с 3—4-го дня в виде мелких колоний или сплошного налета. На кровяном или сывороточном бульоне рост скудный, в виде нежного облачка. На полужидком пептонном агаре культура выживает не более 10—20 дней. Для сохранения на более длительный срок ее пересевают в полужидкую среду или среду Китт — Тароцци и хранят в холодильнике.
Для выделения возбудителя из патологического материала предложена также сафранино-железо-новобиоциновая среда (СЖН).
279
Биохимические свойства. С. fetus не ферментирует углеводы, не изменяет лакмусовое молоко, выделяет каталазу, редуцирует нитраты, не растет в МПБ с 3,5 % NaCl. Вибрионы, выделенные от овец, часто слабо образуют сероводород. Токсинообразование не установлено.
Устойчивость. Возбудитель вибриоза быстро разрушается в гниющем материале, неустойчив к высоким температурам. При 55°С погибает через 10 мин, при высушивании — через 3 ч. Но при 18—20 °C он сохраняется в сене, навозе, воде, почве до 20 дней; при 6 °C — до месяца. К низким температурам микроб проявляет выраженную устойчивость. Обычные растворы дезинфицирующих веществ (хлорная известь, свежегашеная известь, едкие щелочи и др.) убивают его через 5—10 мин.
Патогенность. В естественных условиях вибриозом поражается крупный рогатый скот и овцы независимо от породы. Иногда болеют козы. К экспериментальному заражению культурой вибрионов восприимчивы беременные овцы, козы, морские свинки, хомяки, а также телки. Заражать их удается при внутрибрюшинном, внутривлагалищном, подкожном и оральном введении культуры. Кампилобактер патогенен и для куриного эмбриона. Микроб размножается в аллантоисной жидкости эмбриона, вызывая гибель его на 7—12-й день.
Пдтогенез. У зараженных быков-производителей при отсутствии заметных патологических изменений вибрионы обнаруживают очень длительное время (годы) в семенниках, их придатках, препуциальном мешке и выделяемой сперме. Попав во влагалище коровы или телки, вибрионы быстро размножаются и проникают в матку. Развивается катаральный вагинит, эндометрит, вследствие чего оплодотворенная яйцеклетка не приживается или эмбрион погибает в начальной стадии развития. В некоторых случаях беременность вначале не прерывается, ио вибрионы внедряются в материнскую плаценту, плодные оболочки и вызывают воспалительный процесс, нарушающий плацентарное кровообращение. Это ведет к абортам на более поздних стадиях развития эмбриона.
У овец уже через 3—4 дия после алиментарного заражения вибрионы обнаруживают в крови. Затем они проникают в беременную матку и вызывают воспалительно-некротические процессы, ведущие к аборту.
Антигенная структура вибрионов изучена недостаточно. Установлено, что штаммы возбудителя вибриоза крупного рогатого скота по антигенным свойствам отличаются от штаммов возбудителя болезни овец. Некоторые исследователи (Марч и Фирегаммер, 1958) считают, что среди штаммов, выделенных от овец, имеется четыре типа, различающихся по антигенным свойствам; а бычьи штаммы относят к пятому
типу.
Иммунитет. У животных, переболевших вибриозом, повторных абортов не бывает. Очевидно, они приобретают иммунитет, что подтверждается наличием в крови специфических антител, выявляемых в реакциях иммунитета (РА, РСК, РДСК). Развивается также местный
иммунитет.
Диагностика. Бактериологическое исследование проводят методами микроскопии, выделения культуры вибрионов с последующей дифференциацией ее и биопробой на телках и лабораторных животных. Обычно в лабораторию направляют: от коров, нетелей и овцематок — абортированный плод, плаценту, слизь с шейки матки, взятую стерильно в первые 3—4 дня после аборта или в период охоты; от быков-производителей — препуциальную слизь, сперму и секрет придаточных половых желез; от животных, убитых с диагностической целью,— влагалище, матку, лимфатические узлы тазовой полости.
Для микроскопического исследования материала готовят мазки, которые окрашивают по Граму или фуксином Циля в разведении 115 (1—2 мин). В мазках вибрионы имеют вид запятой, S-образной формы, в виде длинных спирилл, малоизвитых нитей, мелких кокков. Обна
ружение вибрионов в патологическом материале и смешанных культурах^ удается также методом флуоресцентной микроскопии*
28а
18. Некоторые дифференцирующие признаки кам пи л о б актер о в *
№
Название микроба
Каталаза Восстановление нитрита Образование H2S (обнаруживаемого свиицово-ацетатными бумажками) Рост на питательных средах, содержащих Рост при 25 °C
I % глицина 3,5 % NaCl
1.
2.
3.
С. fetus subsp. fetus
С. fetus subsp., intestinalis
C. fetus subsp. jejuni
C. sputorum subsp. sputorum
C. sputorum subsp. bu-bulus
C. fecalis
• Заимствована из Краткого определителя бактерий Берги (М..: Мир, 1980. с. 107).
Получение культуры возбудителя вибриоза из первичного материала удается при посеве на полужидкие и плотные питательные среды. Выделенные культуры вибрионов часто бывают загрязнены посторонней микрофлорой. Для очистки полученной культуры производят "посев её на чашку Петри с плотной средой (МППА) с последующим отсевом отдельных колоний на полужидкий мясо-печеночный пептонный (ПЖА) агар.
Биопробу ставят: для обнаружения вибрионов в патологическом' материале, очистки загрязненной посторонней микрофлорой культур, определения степени вирулентности культуры вибрионов. Для этих целей заражают беременных морских свинок внутрибрюшинно или во влагалище с последующим высевом материала из абортированных плодов. Если в течение 10—12 дней аборта не бывает, свинок убивают и высевы делают из эмбрионов и полости матки. Для определения зараженности быков-производителей вибрионами проводят биопробу на половозрелых телках.
Дифференциацию патогенных типов вибрионов от непатогенного С. sputorum subsp. bubulus проводят по культуральным, биохимическим и серологическим свойствам, пользуясь при этом показателями, приведенными в таблице 18.
Для серологического исследования крупного рогатого скота по реакции агглютинации (РА) в лабораторию направляют пробы влагалищной слизи, полученной от телок, используемых для био-пробы, а также от коров, у которых наблюдается расстройство полового цикла. Слизь берут в период полового покоя животных марлевым тампоном и готовят экстракт. Профильтрованный экстракт используют для реакции в разведениях 1 :50, 1 : 100, 1 :200, 1 :400. В пробирку, содержащую 0,5 мл каждого разведения сыворотки, добавляют 0,5 мл кам-пилобактериозного антигена I серологического типа, разведенного физраствором 1 :9. Пробирки выдерживают 24 ч в термостате при 37°С и при комнатной температуре 3—6 ч. Диагностика кампилобактериоза овец по РА заключается в выявлении специфических антител в сыворотке крови больных животных. Для этой цели пригодна свежая и консервированная борной кислотой сыворотка, полученная от абортировавших (в первые 1—20 дней) овцематок и вибриозный антиген II серологического типа. Результат реакции оценивают по четырехбалльной системе: положительная ( + + + + или +Н—[-), сомнительная (++ или +), отрицательная (—). По данным П. А. Триленко и других, вибриоз крупного рогатого скота можно диагностировать также по реакции дли
тельного связывания комплемента (РДСК) и реакции связывания; комплемента.
Для индикации и идентификации возбудителя кампилобактериоза используют также кампилобактериозные люминесцентные сыворотки.
Биопрепараты. В литературе имеются данные, указывающие на возможность вакцинопрофилактики вибриоза овец.
В неблагополучных хозяйствах по вибриозу крупного рогатого скота и овец применяют антибиотики. Для профилактики и лечения быков, коров и нетелей используют смесь стрептомицина и пенициллина; больных овцематок лечат стрептомицином, пенициллином, бициллином-3, тетрациклином, хлортетрациклином; баранов — стрептомицином и пенициллином.
ПАТОГЕННЫЕ ГРИБЫ
ВОЗБУДИТЕЛИ МИКОЗОВ
Грибы относят к растительным гетеротрофным организмам — эукариотам, лишенным хлорофилла. Различают макро- и микроскопические формы грибов. К первым относят шляпные (съедобные, несъедобные, ядовитые и др.), среди вторых выделяют патогенные, токсигенные и сапрофитные виды.
Для ветеринарии наибольшее значение представляют бластомице-ты (дрожжеподобные грибы), совершенные плесневые грибы — фикоми-цеты (мукор или головчатая плесень), пенициллы (кистевидная плесень), аспергиллы (леечная плесень); несовершенные грибы — стахи-ботрис, фузариум, дендрохиум. Несовершенные грибы включают также большую группу дерматомицетов, к которым относят возбудителей трихофитии, микроспории и фавуса. Последние, как и некоторые другие грибы, вызывают микозы.
Микозы — это группа специфических заболеваний, вызываемых патогенными грибами. В естественных условиях они встречаются у сельскохозяйственных животных, пушных и хищных зверей и грызунов, а также у рыб и пчел. Многие болезни являются общими для животных и человека.
ВОЗБУДИТЕЛЬ ЭПИЗООТИЧЕСКОГО ЛИМФЛНГИТЛ
Эпизоотический лимфангит (гистоплазмоз) — хроническая инфекционная болезнь однокопытных, характеризующаяся воспалением лимфатических сосудов кожи и подкожной клетчатки с образованием гнойных фокусов и язв. Возбудитель болезни — Histoplasma farciminosus — открыт Ривольта в 1873 г.
Морфология и тинкториальные свойства. Возбудитель эпизооти-
ческого лимфангоита Н. farciminosus относится к дрожжеподобным организмам. В патологическом материале, в отделяемом язв обнаружива-
ют криптококки яйцевидной или лимоннообразной формы, обладающие четко выраженной двухконтурной оболочкой, заостренные на одном или обоих концах. Размеры криптококка 3—5 мкм длины и 2,0—3,5 мкм ширины. В гное находят по 2 — 3 криптококка, соединенных своими полюсами, а иногда целыми цепочками (см. рис. 93). Часть криптококков
может быть в лейкоцитах. Центральная часть криптококков представляет собой гомогенное, полужидкое вещество, содержащее блестящее зернышко (иногда их насчитывают 2 или 4), которое находится в бес-
прерывном и оживленном вращательном движении.
Криптококки исследуют в неокрашенном виде, так как они и без того достаточно четко различимы. Практическое значение имеет окраска по Граму и по Романовскому — Гимзе. Эти методы позволяют хоро
шо видеть гранулы в цитоплазме, двухконтурная же оболочка их не окрашивается.
Культивирование. Криптококки выращивают в аэробных условиях на печеночном агаре, МПА с 2 % глюкозы и 2,5 % глицерина, яичной среде с добавлением 2 %'глюкозы и 1 % глицерина, агаре Сабуро и др. Оптимальный температурный режим 22—28°С. На плотных средах через 10—12 дней появляются отдельные колонии величиной 1—2 мм, затем они постепенно увеличиваются и принимают форму серо-желтых, иногда кремовых наложений. При подсыхании среды и в старых культурах колонии становятся желтовато-коричневыми. В культурах криптококковая форма отсутствует; вне организма животного возбудитель представлен мицелиальной формой. Мицелий септированный, ветвящийся, на концах нитей бывают колбовидные утолщения.
Устойчивость криптококков довольно значительна. Из попадающих вместе с гноем во внешнюю среду криптококков образуются мицелиальные формы гриба, которые разрушаются в почве и навозе только через 2—2,5 месяца. В сухих гнойных корочках, находящихся в относительно стерильных условиях, элементы гриба могут сохраняться до 5 лет.
Раствор хлорной извести с содержанием 1% активного хлора убивает криптококков через 2 мин, 3 %-ный раствор креолина — через 5 мин, 3 %-ный раствор едкого натра — через 25 мин. Мицелиальная форма гриба несколько устойчивее. Раствор с содержанием 1 % активного хлора убивает ее через 10, а 3 %-ный раствор креолина — через 20 мин.
Патогенность. Эпизоотическим лимфангитом болеют только однокопытные: лошади, ослы и мулы. Попытки заразить лабораторных животных обычно не дают положительных результатов. Некоторым исследователям удавалось вызвать у кроликов локальное воспаление кожи в месте инокуляции патогенного материала. При введении под кожу гноя от больного лимфангитом животного или культуры криптококка у лошади на месте введения возникает, но непостоянно лимфангитный узел или абсцесс.
Патогенез. Бластомицеты попадают в организм — в крнптококковой или в мицелиальной форме через поврежденную кожу. На месте проникновения возбудителя развиваются гнойные фокусы, которые инкапсулируются или вскрываются с образованием язв. Инкапсулированные фокусы постепенно рассасываются, а язвы подвергаются рубцеванию. При недостаточной резистентности организма происходит слабое инкапсулирование гнойных фокусов, что ведет к образованию гнойных очагов в регионарных лимфатических узлах, возникновению множественных гнойных фокусов в коже и подкожной клетчатке. Происходит генерализация процесса. Развитие обширных поражений кожи, всасывание токсических продуктов распада тканей ведет к существенным расстройствам в организме. К основному возбудителю присоединяется вторичная инфекция, в результате чего возникает сепсис, а затем наступает смерть животного.
Антигенная структура. В настоящее время известно, что в качестве антигена для постановки РСК используют экстракты из культуры криптококка, выделяют также аллерген из 1—3 месячных культур криптококка.
Иммунитет. Лошади, переболевшие эпизоотическим лимфангитом, прибретают в большинстве случаев пожизненный иммунитет. Механизм иммунитета остается невыясненным как и связь его с образованием комплементсвязывающих антител.
Диагностика. Микологическое исследование. Постановка точного диагноза в основном сводится к микроскопии гноя из абсцесса или язв. Из гноя готовят суспензию в физрастворе (1 : 10) и просматривают в раздавленной капле. Для растворения клеточных элементов гноя применяют 30 %-ный раствор едкого натра. Если возникает необходимость исследовать отпечатки с поверхности разреза по
283
раженного лимфоузла, то их можно окрасить по Романовскому—Гимзе в течение часа. Под микроскопом отпечатка хорошо видны криптококки в лейкоцитах или вне их.
Аллергическое исследование цроводят только при атипичном течении болезни, а также в предклинический период. Для этой цели предложено три препарата: гистоплазмин, бластомицин и крипто-кокковый аллерген. Аллерген вводят внутрикожно в области средней трети шеи в дозе 0,3—0,4 мл. Образование болезненной припухлости на месте введения препарата через 18—72 ч свидетельствует о заболевании лошади эпизоотическим лимфангитом.
Биопрепараты не разработаны. Основную роль играет хирургическое лечение—иссечение язв, воспаленных лимфатических узлов и сосудов, а также удаление гнойных фокусов.
ВОЗБУДИТЕЛЬ клндидлмикозл
Кандидамикоз (кандидоз, монилиаз, молочница, оидомикоз) — заболевание животных и человека, характеризующееся поражением слизистых оболочек пищеварительного тракта с образованием пленок, напоминающих творожистые массы, и иногда гранулематозных процессов во внутренних органах. У млекопитающих обнаруживают поражение ротовой полости, молочной железы у коров, кишечника у свиней, в некоторых случаях органов дыхания и кожи.
Возбудителя кандидамикоза выделили немецкие ученые Б. Лан-генбек в 1839 г. и Т. Берг в 1848 г.
Основным возбудителем кандидамикоза признан вид Candida albicans. Согласно современной классификации, грибы рода Candida принадлежат к семейству Cryptococcaceae,. классу Deuteromycetes (Fungi imperfecti).
Мор ।фология и тинкториальные свойства. Дрожжеподобные грибы рода Candida — одноклеточные организмы относительно большой величины (от 1,5X1,5 до 6X10 мкм), овальной, округлой, иногда овально-вытянутой формы. Они образуют псевдомицелий (нити из удлиненных клеток), бластоспоры (клетки-почки, сидящие на перетяжках псевдомицелия) (см. рис. 94) и хламидоспоры (споры с плотной двойной оболочкой). Размножаются грибы рода преимущественно многополюсным почкованием.
Дрожжевые формы гриба представляют собой овальные или круглые клетки, встречаются в материале, полученном от больных животных, в мазках из культур, из гладких колоний. Псевдомицелиальные формы чаще выявляют при культивировании на специальных средах, обнаруживают в мазках из старых культур, из шероховатых колоний и реже — в патологическом материале.
Изучение ультратонких срезов клетки гриба и псевдомицелия позволило выявить три слоя в клеточной стенке (наружный, внутренний и основной зернисто-фибриллярный), наличие трехслойной плазматической мембраны, образующей много инвагинаций в цитоплазму, а в мелкогранулярном веществе цитоплазмы — митохондрии, эндоплазматическую сеть и ядро, покрытое выраженной трехслойной оболочкой, имеющей поры, заполненные мелкими гранулами.
Грибы этого рода хорошо окрашиваются простыми методами, а также по Граму, Романовскому—Гимзе, гематоксилин-эозином и др. С успехом эти грибы можно микроскопировать в живом неокрашенном состоянии в капле воды.
Культивирование. Грибы рода Candida сравнительно быстро растут (1—5 суток) в аэробных условиях на плотных и жидких питательных средах, лучше с добавлением углеводов — глюкозы, декстрозы, мальтозы. Оптимальные pH 5,8—6,5,„температура — 21—27 °C. Для пер
вичного выделения грибов применяют агар Сабуро, агар Лнтмана, среду Пагано — Левина и другие с добавлением антибиотиков для подавления роста другой микрофлоры.
Candida albicans на плотных средах с углеводами образует довольно крупные (около 1 см), напоминающие сметану колонии молочно-белого цвета, вначале гладкие влажные, позднее более выпуклые, иногда с морщинистым центром. На жидких средах (агар Сабуро, сусло-агар) — помутнение, осадок, и тонкое кольцо.
Биохимические свойства. Биохимические свойства разных видов грибов рода Candida различны, что используется для их дифференциации. При идентификации в основном определяют ферментацию и ассимиляцию пяти углеводов: глюкозы, галактозы, сахарозы, мальтозы, лактозы. С. albicans ферментирует глюкозу, мальтозу с образованием кислоты и газа, сахарозу — с образованием кислоты, лактозу не изменяет. Для быстрой идентификации используют пересев колоний из первичных посевов на 0,5 мл сыворотки крови животных, помещенной в капилляры. После 2-часового культивирования в термостате при температуре 37—42 °C дрожжевидные клетки дают короткие блестящие ростки. Для этих же целей можно использовать посев колоний на висмут-дрож-жевую среду, на которой С. albicans образует черные колонии. ••
Устойчивость. При воздействии высокой температуры (100°С) гриб инактивируется через 10—15 мин, сухого жара (90—110°С) —в течение 20—30 мин; ультрафиолетовые лучи губительно действуют спустя 30 мин; хорошо сохраняется при высушивании и замораживании; в воде и почве гриб выживает 3—7 месяцев. Из химических дезинфицирующих веществ наиболее-эффективны 5 %-ный раствор фенола, 10 %-ный раствор лизола, 5 %-ный раствор хлорамина. Фунгицидное действие этих веществ проявляется через 3—6 ч. Срок пересева культуры гриба Г месяц, температура хранения 4°С.
Патогенность. Из клеток различных видов Candida выделен эндотоксин. При введении его мышам наблюдается мгновенная гибель. Несвязанные липиды С. albicans тоже токсичны для животных при внутривенном и внутрибрюшинном введении. Из них выделен крупномолекулярный компонент — кандидатоксин и гликопротеин.
В естественных условиях грибы рода Candida патогенны для домашних птиц, млекопитающих и рыб. Поражается преимущественно молодняк домашней птицы (кур, индеек, фазанов, цесарок, гусей, уток, голубей) и реже — поросята, ягнята, телята, щенята. Выявлена высокая зараженность этими грибами диких голубей.
В лабораторных условиях патогенность С. albicans определяют на кроликах, белых мышах, морских свинках, белых крысах, куриных эмбрионах 9—10-дневного возраста.
Суспензию гриба, выращенного на питательных средах в течение 24—48 ч, вводят внутривенно кроликам или внутрибрюшинно мышам в дозе 200—400 тыс. клеток в 1 мл. Если штамм высоковирулентен, кролики погибают в течение 3—10 суток, если слабовирулентен — спустя 30 суток. При вскрытии трупов в корковом слое почек обнаруживают множественные некротические очаги серо-белого цвета. Белые мыши погибают на 2—10-е сутки после введения культуры гриба. При вскрытии трупов находят мелкие некротические очаги в печени, селезенке, почках и легких.
Куриные эмбрионы заражают на хориоаллантоисную оболочку в дозе 0,2 мл (10 млн/мл). Эмбрионы гибнут через 24—48 ч.
Патогенез. В эксперименте на обезьянах и собаках показано, что грибы рода Candida могут пронйка 1 ь в организм^ерёГ~~слйзистые~оболодки кишечного тракта и поступать в кровь/ -у—
Ведущий-фактор в патогенезе кандидозной инфекции — состояние макроорганизма. Плохие условия ухода, содержания и кормления приводят к снижению реактивности,
285
угнетению неспецнфнческой иммунной защиты, в результате чего создаются условия для активизации, размножения грибов и развитию кандндамнкоза. Многие исследователи считают, что одним нз главных предрасполагающих факторов является нерациональная антнбнотнкотерапня, особенно при использовании препаратов широкого спектра действия нлн комбинации антибиотиков.
Антигенная структура. Экспериментально доказано, что С. albicans при иммунизации животных вызывает развитие гиперчувствительности замедленного типа, обусловленной белковой фракцией гриба, и гиперчувствительности немедленного типа, детерминированной маннансодержащими фракциями аллергенов (М. А. Кишкина, 1974).
Под влиянием среды у гриба изменяется морфологическая структура, биохимические, антигенные свойства и значительно снижается вирулентность. Наиболее вирулентны гладкие варианты.
Иммунитет. У экспериментальных животных введение грибов кан-дида может сопровождаться образованием антител: агглютининов, пре-ципитинов, комплементсвязывающих антител.
При изучении аллергической перестройки организма при экспериментальном кандидамикозе (генерализованная форма) с введением из различных культур патогенных штаммов устойчивой положительной реакции на аллерген выявить не удалось.
Диагностика на кандидамикоз довольно трудная ввиду большого сходства его с другими болезнями. Диагноз в основном ставят путем микроскопии соскобов из очагов поражения, выделения чистой культуры возбудителя, заражения восприимчивых животных, гистологического анализа пораженных органов. Материалом для исследования служат глубокие соскобы с видимых очагов поражения (используют только свежие трупы или убитых больных животных с диагностической целью). При просматривании под микроскопом окрашенных и неокрашенных препаратов из соскобов обнаруживают в большом количестве развитый псевдомицелий и бластоспоры. Параллельно выделяют культуру возбудителя, определяют его вид, а затем и патогенность на лабораторных животных или цыплятах суточного возраста. Продолжительность полного микологического анализа до 30 суток.
Биопрепараты не разработаны. Из антибиотиков применяют нистатин.
ВОЗБУДИТЕЛЬ кокцидиоидомикозл
Кокцидиоидомикоз — глубокий микоз, протекающий в виде доброкачественной гранулемы дыхательных путей у рогатого скота и злокачественной диссеминированной прогрессирующей гранулемы у собак. Кокцидиоидомикозом болеет и человек.
Впервые болезнь у рогатого скота обнаружена Джильтнером на бойне в Сан-Диего (Калифорния) в 1918 г. Автор обнаружил гриб Coccidioides immitis и успешно воспроизвел заболевание у морских
свинок, кроликов, собак, коровы, овцы и свиньи.
Возбудитель — гриб Coccidioides immitis, входит в класс Deutero-
mycetes (Fungi imperfecti).
Морфология. Гриб С. immitis представляет собой сферические,
толстостенные дрожжевидные клетки (сферулы), достигающие в тканях и экссудатах размеров от 10 до 80 мкм в диаметре. Цитоплазма кокцидиоида зернистая и содержит в себе большое число сферических спор от 2 до 5 мкм в диаметре, освобождающихся из сферулы после разрыва ее оболочки. Мицелиальная форма гриба образуется на питательных средах, к которым он неприхотлив. Мицелий ветвящийся сеп
тированный, распадается на многочисленные артроспоры — прямоу
гольные или эллипсовидные клетки.
Культивирование гриба удается на кровяном агаре, глюкозном ага* ре Сабуро, среде Литмана и др. На питательных средах гриб растет как
286
при комнатной температуре, так и при 37°C. На глюкозном агаре Сабуро при температуре 20 °C (pH 5,6) рост появляется на 3—4-й день, а при температуре 37 °C — в течение 24 ч. Растет гриб в виде белых хлопьевидных колоний, позднее приобретающих желтую или рыжевато-бурую
окраску.
Мицелий разветвленный септированный, 2,5 мкм в диаметре. С возрастом мицелий распадается на отдельные клетки, превращающиеся в артроспоры, размером от 2,5 до 5 мкм. Образование сферул можно получить в средах, содержащих живые лейкоциты. Образование сферул рассматривается как защитное приспособление.
Гриб на 3-й день после посева растет и разжижает желатину, пепто-
низирует и коагулирует молоко.
Устойчивость. Сухие споры гриба быстро погибают при 50 °C. При 10 %-ной относительной влажности и температуре 37 °C споры гибнут через 2 месяца, а при 50 %-ной — через 2 недели. В физиологическом растворе споры сохраняли жизнеспособность при 4 °C в течение 6 месяцев, а при 20—25 °C — в течение 3 месяцев. Замораживание при —15°C резко снижает их жизнеспособность. В насыщенном растворе поваренной соли споры остаются живыми в течение 6 месяцев при 4 °C, а в дистиллированной воде при 4 °C — в течение И месяцев.
Наиболее выраженными фунгицидными свойствами обладают хлорамин (2,5—10 %-ный), фенол (2,5—5 %-ный), формалин (1—10 %-ный), раствор Люголя и спирт (Т. М. Кокушина, 1964).
Патогенность. Экспериментально воспроизвести кокцидиои до микоз удается у крупного рогатого скота, овец, свиней, собак, кроликов, морских свинок и мышей. Эти животные заболевают, если сферулы вводят внутрибрюшинно, подкожно или внутривенно. Внутрибрюшинное заражение морских свинок и мышей вызывает у них обширные милиарные
поражения печени, селезенки, почек, легких и миокарда в виде гранулематозных очагов. При внутривенном введении культуры гриба морским свинкам, кроликам, овцам, телятам быстро развивается генерализованный процесс. Подкожное заражение рогатого скота вызывает образование абсцессов в регионарных лимфоузлах, а у морских свинок, кроликов и собак возникает общее заболевание.
Иммунитет. У экспериментальных животных (лошадей, морских свинок) после искусственной иммунизации различными вакцинами, приготовленными из мицелия, артроспор, сферул, убитых формалином, создается некоторая устойчивость к последующему заражению грибом. Иммунологическая реактивность у переболевших животных характеризуется появлением в крови агглютининов, преципитинов и комплемент-
связывающих антител и развитием аллергии.
Диагностика. Диагноз ставят на основании лабораторных исследований, включающих микроскопическое исследование патологического материала, выделение гриба, заражение восприимчивых лабораторных животных и иммунологические исследования.
Под микроскопом просматривают неокрашенные мазки, приготовленные из гноя или из некротических очагов. Обнаружение характерных паразитарных форм гриба (сферул) с содержащимися в них эндоспорами имеет значение для предварительного диагноза.
Микологическое исследование заключается в выделении гриба в чистую культуру. Патологический материал (гной и др.) засевают на глюкозный агар Сабуро, содержащий определенное количество антибиотиков для задержки развития бактерийной микрофлоры исследуемого материала. Обычно применяют пенициллин (20 ЕД в 1 мл), стрептомицин (40 ЕД в 1 мл) и актидионом (0,5 мг в 1 мл).
Восприимчивых лабораторных животных заражают испытуемой культурой гриба. Морским свинкам (самцам) вводят в тестикулы суспензию гриба из культуры. На 7-й день у зараженных животных разви
287
вается гнойный орхит. Мышам суспензию из культуры гриба вводят в брюшную полость (0,4—0,5 мл) .
Аллер г и чес кая диагностика осуществляется с помощью кокцидиоидина, который впервые предложил Девис в 1947 г. В настоящее время препарат модифицирован и представляет собой фильтрат культуры гриба С. immitis на синтетической аспарагиновой среде. Аллерген животным вводят внутрикожно в дозе 0,1 мл в разведений 1 : 100, а давшим отрицательные и сомнительные реакции — 0,1 мл в разведении 1: 10. Реакцию учитывают через 48 ч. При наличии на месте введения препарата утолщения до 5 мм (иногда сохраняющегося в течение нескольких дней) реакцию считают положительной.
Серологические исследования заболевания являются дополнительным диагностическим методом. Реакцию преципитации ставят с полисахаридными антигенами, а при постановке РСК в качестве антигена используют кокцидиоидин, применяемый для аллергической диагностики. Для реакции агглютинации в качестве антигена используют только убитые культуры.
Биопрепараты. Специфические лечебные и профилактические препараты не разработаны.
ВОЗБУДИТЕЛИ ДЕРМАТОМИКОЗОВ
Дерматомикозы — инфекционые заболевания кожи и ее производных. Поражаются сельскохозяйственные животные всех видов, пушные и хищные звери, грызуны. Болеет и человек.
Возбудителей дерматомикозов (стригущего лишая и парши) относят к несовершенным грибам (Fungi imperfecti), к порядку Hyphomycetales, родам Trichophyton, Microsporum и Achorion.
Возбудители трихофитии. Трихофития — заразное заболевание, характеризующееся появлением на коже резко ограниченных очагов с шелушащейся отрубевидной поверхностью или воспалительной реакцией кожи и фолликулов.
Проникают они в организм контактным путем. В 1845 г. одного из возбудителей открыл шведский ученый М. Мальмстен и дал ему название Trichophyton. В настоящее время известен уже целый ряд видов грибов этого рода. Tr. faviforme, Tr. gypseum, Tr. equnum и др.
Морфология грибов. Трихофитоны в препаратах из патологического материала, обработанного 10 %-ным раствором щелочи, обнаруживаются в пораженном волосе. Гифы мицелия прямые с перегородками, лежат правильными рядами по длине волоса. Споры одноклеточные, круглые или овальные, располагаются на волосе или внутри него в виде цепочки у основания волоса и образуют чехол из спор (см. рис. 95). Следует отметить, что мицелий и споры располагаются или внутри волоса (endoth-rix), или вокруг волоса (ectothrix), а могут находиться как внутри, так и вне его (neoendothrix), но обязательно вдоль волоса и правильными рядами.
Культивирование. Грибы рода Trichophyton медленно растут на питательных средах. Для выращивания гриба используют агар Сабуро. При посеве патологического материала, содержащего споры этого гри-ба, на 10—20-е сутки при 26—28 °C в аэробных условиях появляются колонии кожистые, гладкие, складчатые, иногда с периферической мучнистой зоной. Грибы дают глубокие, мощные ветвления в субстрат. Различают четыре разновидности микроконидий: эндо-, или артроспоры (3—7 мкм); экзоспоры, или конидии (3—5 мкм); алейрии (3—7 мкм); хламидоспоры (7—10 мкм), а также макроконидии (крупные веретенообразные споры длиной 12—50 мкм, шириной 3—5 мкм, состоящие из 5—8 камер), сосредоточенные на концах мицелия одиночно или пучками (см. рис. 96)^
Устойчивость. В пораженном волосе грибы живут свыше 4—7 лет. В патологическом материале сохраняют вирулентность в течение Р/г лет, а при попадании в почву до двух месяцев, однако, некоторые из них (Tr.gypseum) в почве могут вегетировать и давать характерные для вида спороношения. УФЛ убивают грибы в течение 30 мин как в культуре, так и в патологическом материале. В воде, нагретой до 80—90 °C, трихофитоны погибают в течение 7—10 мин, в кипящей— через 2 мин, от сухого жара (температура 60—62 °C) —через 2 ч, под воздействием 5—8 %-ных растворов щелочей —за 20—30 мин, 2—3 %-ных растворов фенолов — в течение 20—30 мин, а от 2 %-ного раствора формалина — за 2—3 мин.
Патогенность. Грибы рода Trichophyton патогенны в естественных и экспериментальных условиях для крупного рогатого скота, лошадей, овец, свиней, ослов, мулов, верблюдов, кошек, морских свинок, кроликов, белых мышей, крыс, пушных и хищных зверей, собак. В естественных условиях наиболее восприимчивы крупный рогатый скот и лошади, несколько менее собаки и кошки.
Заболевание весьма контагиозное, поражающее преимущественно молодняк.
Патогенез. В основе патогенеза дерматомнкозов животных лежит паразитирование грибов в организме с поражением главным образом кожи и ее роговых придатков. Большая роль также принадлежит макроорганизму. При наличии предрасполагающих условий для развития грибы внедряются в волосяные фолликулы, где и происходит их дальнейшее размножение. На месте внедрения и прорастания гриба появляется воспаление. Вследствие иабухаиия клеток корневого влагалища волосы становятся хрупкими и при выходе из устьев фолликулов обламываются иа грани фолликулярной и воздушной части. Из очагов поражения элементы гриба проникают в кровь и лимфу через стенки расширенных кровеносных сосудов, затем по кровяному руслу и лимфатическим сосудам попадают опять в кожу и вызывают новые диссеминированные очаговые микотические процессы.
Антигенная структура. Споры и мицелий трихофитонов содержат полисахаридные и протеиновые антигены.
Иммунитет. У переболевших животных формируется длительный и напряженный иммунитет, после которого животные становятся невосприимчивыми к повторному заражению. В сыворотке больных и переболевших трихофитией животных обнаруживают агглютинины, преципи-тицы и комплементсвязывающие антитела. Максимальный тнтр антител в разгар болезни сохраняется в течение 2—3 месяцев. Аллергическая реакция отмечалась у 70—80 % животных в период появления клинических признаков болезни.
Диагностика. Для исследования делают соскобы пораженного эпидермиса с захватом волос на границе со здоровой тканью. Соскобы обрабатывают 10 %-ным раствором щелочи (КОН или NaOH) в течение 15—30 мин. Приготовленный препарат (раздавленная капля) микроско-пируют под объективом сухой системы средней степени увеличения. На пораженном волосе внутри и снаружи его отчетливо видны расположенные рядами круглые, хорошо преломляющие свет короткие гифы мицелия гриба (эндоспоры). При сомнительном результате делают посев на плотную среду Сабуро с целью выделения чистой культуры возбудителя. Материал после обработки щелочью хорошо промывают стерильным физиологическим раствором при центрифугировании. Обломки волос длиной 1—2 см переносят на агар Сабуро. Культивируют при 26—28 °C в аэробных условиях. Вследствие сильной загрязненности патологического материала в питательную среду добавляют пенициллин и стрептомицин по 100—200 ЕД/мл.
Биопрепараты. Коллективом авторов (А. X. Саркисов, С. В. Петрович, Л. И. Никифоров, Л. М. Яблочник, 1974) получена вакцина ЛТФ-130 для специфической профилактики й терапии трихофитии (стригущего лишая) крупного рогатого скота и опытная вакцина С-П для профилак-
21—Ветеринарная микробиологи* 289
года.
Возбудители микроспории. Микроспория
тики и лечения трихофитии лошадей. С лечебной целью препарат ЛТФ-130 вводят больным животным внутримышечно в удвоенных дозах. С профилактической целью его применяют внутримышечно в область крупа, двукратно с интервалом между введениями в 10—14 дней. Срок хранения жидкой вакцины 4 месяца, сухого препарата ЛТФ-130 —до
(микроспороз, стригущий лишай)—инфекционное заболевание кожи и ее производных, характеризующееся высокой контагиозностью, клинически проявляющееся в трех основных формах: поверхностной, глубокой или фолликулярной, стертой или атипичной. Поражаются лошади, собаки и кошки.
У собак, кошек, свиней, обезьян, пушных и хищных зверей микроспороз проявляется в тех же клинических формах, однако степень выраженности их различная.
Основные возбудители, вызывающие энзоотические вспышки среди животных: 1) Microsporum equinum—поражает лошадей; 2) М. lanosum (син. М. canis, М. felineum)—возбудитель микроспории кошек, собак, пушных и хищных зверей, морских свинок, обезьян; 3) М. lanosum Bodin (син. Achorion gypseum) — паразитирует у кошек, собак, лошадей, телят, морских свинок, крыс, мышей. Выделен от обезьян и тигров.
Морфология. Грибы рода Microsporum в патологическом материале имеют разветвленный, септированный мицелий, который, распадаясь, образует округлые, одноклеточные споры. Вокруг пораженного волоса образуется чехол или муфта, состоящая из спор грибка. Споры расположены беспорядочно в виде густой мозаики. Величина спор 3—6 мкм.
Культивирование. Гриб культивируют на глюкозном агаре Сабуро при 26—28 °C. М. equinum образует кожистые, складчатые, плотно прилегающие к среде колонии, покрытые серо-белым воздушным мицелием. Зрелая колония желтого или коричневого цвета. Мицелий септиро-ван. Микроконидии грушевидные. Макроконидии многоклеточные (15—20X12—17 мкм).
М. lanosum на сусле-агаре образует круглые с концентрическими кругами серовато-белые колонии с мучнистым центром (см. рис. 97). Мицелий септированный, разветвленный в молодых культурах. Макроконидии многокамерные, суженные к обоим концам, длина 40—80 мкм. М. gypseum на сусле-агаре образует плоские, мучнистые колонии, мицелий ракетообразный, макроконидии многоклеточные, 8—12x30—50 мкм.
Ферментативные свойства дерматомицетов вообще разнообразны и в большинстве своем непостоянны, вследствие этого они не могут быть использованы при дифференциации видов грибов.
Устойчивость. Микроспороны в патологическом материале (волосы, кожные соскобы) при хранении их в бумажных пакетах и при комнатной температуре остаются жизнеспособным 3—4 года и более. Сухой жар в 110 °C убивает гриб за 30 мин, а в 80 °C — за 2 ч, кипячение—за 2—3 мин.
Для дезинфекции используют 5 %-ный серно-карболовый раствор. Суконные и холщовые предметы кипятят до 15 мин. Халаты, полотенца, повязки и другую спецодежду обеззараживают кипячением в 2 %-ном мыльно-содовом растворе в течение 15 мин, или замачивают в 5 %-ном растворе хлорамина (3 ч), 5 %-ном растворе лизола (20 мин), 1 %-ном растворе бензилфенола (60 мин) или подвергают параформалиновой дезинфекции (40—50 мин).
Дерматофиты сохраняют жизнеспособность в пораженной шерсти 2—7 лет, в навозе — 8 месяцев, в почве — 142 суток.
Патогенность. Грибом М. equi удается экспериментально вызвать стригущий лишай у лошади, из лабораторных животных восприимчивы к заражению морские свинки; культуру гриба или патологический ма--290
JI
териал (пораженные волосы, кожные соскобы) втирают в скарифицированную кожу животного.
Антигенная структура мало изучена. Возможна идентификация видов и родов возбудителей трихофитии и микроспории методом флуоресцирующих антител. Различие в антигенном строении разных видов дер-матомицетов имеет значение в создании профилактических специфических биопрепаратов.
Диагностика. При подозрении на микроспорию для подтверждения клинического диагноза прибегают к микроскопическому исследованию соскобов из пораженных очагов. В необходимых случаях выделяют возбудитель в чистую культуру. Кроме того, необходимо проводить дифференциацию трихофитии от микроспории. Для этой цели используют люминесцентный анализ, который осуществляется с помощью ПРК-4 с фильтром Вуда в темном помещении. При наличии возбудителя микроспории обнаруживают характерное зеленоватое свечение под действием ультрафиолетовых лучей. Возбудитель трихофитии не флуоресцирует. Возможна идентификация родов и видов возбудителей трихофитии и микроспории методом флуоресцирующих антител.
Биопрепараты. Специфической терапии не разработано. Для местного лечения используют те же препараты, что и при трихофитии. Рекомендованы препараты высокого фунгицидного действия: юглон, фенотиазин, однохлористый йод, амиказол, йод-вазоген и др. Специфические средства профилактики также отсутствуют.
Возбудители фавуса (парши). Фавус—заразное заболевание, характеризующееся поражением кожи, перьев, волос и когтей. Могут поражаться и внутренние органы. Заболевают преимущественно птицы, редко млекопитающие. Фавус у птиц характеризуется появлением на гребне, сережках и вблизи клюва серовато-белых корок — ску-тул. При слиянии очагов поражения гребень и сережки покрываются сплошным, серо-белым, сухим, толстым струпом. Наблюдается генерализованная форма с захватом обширной поверхности оперенной части головы, туловища, а также и поражением носоглотки, зоба, тонкого отдела кишечника. У кошек, собак и кроликов фавус протекает в скуту-лярной форме. Поражается кожа вокруг оснований когтей лап и головы.
Основные возбудители фавуса относятся к несовершенным грибам, семейству Moniliaceae, роду Achorion. Заболевание у птиц вызывает гриб Ach. gallinae, у человека Ach. schoenleini; спорадически болеют собаки, кошки, обезьяны, редко телята.
Морфология. Грибы рода Achorion в патологическом материале имеют мицелий, состоящий из часто ветвящихся гифов, образующих густые сплетения в виде войлока. Мицелий тонкий, септированный, встречается широкий, состоящий из прямоугольных клеток с двуконтурной оболочкой. Споры образуются сегментацией мицелия; форма их округлая или многогранная, располагаются они цепочкой и группами. Размеры их 4—8 мкм в диаметре. Кроме спор, в волосе обнаруживают пузырьки воздуха в виде черных длинных тяжей.
Культивирование. Возбудителя парши культивируют на глюкозном агаре Сабуро. Колония начинает расти с 4—5-го дня в виде маленького сероватого бугорка, к 10-му дню достигает диаметра 10—20 мм. Вначале гладкая, голая, кожистая, желтовато-белого цвета. Позже колония делается восковидной, сильно морщинистой, похожей на греческую губку, куполообразно возвышается над уровнем питательной среды.
Старые культуры высокие, сухие, порошковатые, серо-белые. При микроскопическом исследовании мицелий вначале тонкий (1,5—2 мкм), затем грубый (5 мкм), четко сегментированный (от 4 до 20 мкм), нередко с веретенообразными и боковыми вздутиями, утолщениями стенки (тельца Краля) по ходу и ветвлениями на концах («рога северного 21* 291
оленя»). Встречаются «гребешковые органы», много интеркаларных и концевых хламидоспор, «фавозные гвозди», 4—6x18—25 мкм в диаметре. Имеется артроспоровый мицелий. Макроконидии 5—8-клеточные, тонкосептированные, размерами 6—10X30—80 мкм. Колонии бывают окрашены в розовый, розово-красный или малиновый цвет.
Патогенность. Культурой грибка или патологическим материалом относительно легко заразить мышей, у которых развивается характерная скутула. Можно также заразить и вызывать типичное поражение на гребне здоровых кур. Экспериментально удается заражать морских свинок и кроликов, у которых картина болезни сходна с лишайным заболеванием.
Диагностика. Для постановки точного диагноза проводят микроскопическое исследование патологического материала, фавозных щитков и измененных волос. Фавозный щиток (скутула) представляет собой колонию гриба, состоящую из мицелиальных масс в виде коротких искривленных нитей, которые местами разветвлены, а концы их булавовидно утолщены. Споры фавозных грибов различной величины и формы. Волос не заполняется элементами гриба, видны пузырьки воздуха в виде черных тяжей, заполняющих пораженную грибом ткань волоса.
Биопрепараты. Специфические средства терапии и профилактики не разработаны.
ВОЗБУДИТЕЛЬ ДСП ЕРГИЛЛ ЕЗ А
Аспергиллез — заболевание различных видов домашних и диких птиц, реже млекопитающих. Болеет и человек. Клинически аспергиллез протекает как острый или хронический микоз, характеризующийся поражением органов дыхания. У птиц поражаются главным образом легкие, трахея, воздухоносные мешки, редко органы брюшной полости и центральная нервная система.
Основным возбудителем аспергиллеза птиц и млекопитающих являются грибы рода Aspergillus (относятся к несовершенным грибам, а некоторые представители к сумчатым). Массовые вспышки аспергиллеза птиц вызывает гриб Asp. fumigatus. Описаны энзотии среди цыплят и утят, вызванные грибом Asp. flavus.
Морфология. В пораженных органах, мокроте и пунктатах закрытых полостей можно обнаружить нити мицелия с характерными для вида органами плодоношения: конидиеносцы с терминальным вздутием, стеригмами на нем и цепочками конидий (см. рис. 98).
Культивирование. Грибы рода Aspergillus растут и развиваются на многих питательных средах (агар Сабуро, среда Чапека и др.) при температуре 20—25°С. Для некоторых аспергиллов наиболее благоприятной является температура 37°С. Оптимальная среда при pH 5—6,5. На агаре Чапека колонии гриба A. fumigatus гладкие или клочковатые зеленые, с возрастом почти черные. Конидиеносцы гладкие, 300—500 мкм длины и 2—6 мкм ширины. На верхнем конце конидиеносца расположено обратноколбовидное вздутие 18—40 мкм в диаметре, на верхней половине которого имеются стеригмы размером 5,5—8 мкм длины и 2—3 мкм ширины. Конидии (споры) шаровидные, 2—4 мкм в диаметре в массе темно-зеленые. Колонии гриба A. flavus на агаре Чапека желто-зеленые. Конидиеносцы гладкие, 350—800 мкм длины. Верхушечное вздутие круглое. Стеригмы одноярусные и двухъярусные. Конидии грушевидные или шаровидные—2,5—6 мкм. Обильно образуются склероции (темно-коричневые или черные круглые образования из сплетений мицелия) (см. рис. 99) .
Устойчивость. 1,5 %-ный раствор креолина, 2,5 °/о-ный раствор фенола, 1—5 %-ный раствор хлорной извести убивают аспергиллы в течение 3 ч, а 2 %-ный раствор формальдегида через 10 мин.
292
Патогенность. Аспергиллы продуцируют термостабильные и термолабильные токсические вещества местного и общего действия. В организме животных гриб выделяет протеолитические ферменты и эндотоксин.
Патогенез. Споры пэиба попадают с воздухом в верхние дыхательные пути и оседают на слизистой оболочке гортани и бронхов, где быстро начинают прорастать. Развивается воспаление с выделением в бронхи и гортань большого количества серозно-геморрагического экссудата. Развивается пневмония. Всасывающиеся токсины гриба вызывают отравление организма. В результате закупоркн бронхов й гортани экссудатом наступает смерть животного от асфиксии. Болезнь протекает остро и подостро, часто хронически.
Болезнетвориость аспергилл обусловлена сложной мозаикой факторов патогенности, затрудняющих профилактику заболеваний животных. Токсины этих грибов обладают гемолитическим, дермаиекротическнм, нейротоксическим действием, а продукты метаболизма ряда аспергиллов свойствами канцерогенов.
Антигенная структура полностью не изучена. Антигенными свойствами обладает эндотоксин, полученный из аспергилл. Выделены корпускулярные (конидиальные и мицелярные) и растворимые (полисахаридные и белковые) антигены. Иммунные сыворотки получены в корпускулярному и растворимому антигенам токсичных штаммов аспер
гилл.
иагностика. В лабораторию направляют трупы птиц, а от других
видов животных — кусочки органов с гранулематозными очагами. Ис
следования проводят путем микроскопии патологического материала и выделения из пораженных органов чистой культуры возбудителя. Мицелий гриба легко различим в свежих неокрашенных мазках из гноя
некротических очагов или в препаратах, приготовленных из содержимого гранулем в капле 10 %-ного едкого натра. Гриб выделяют из экссудата и гранулем. Для этого части пораженной ткани обжигают над пламенем и стерильными ножницами вырезают из середины кусочки, которые раскладывают на поверхность агара Чапека. Культивируют при температуре 37°С.
Для дифференциации грибов рода Aspergillus дополнительно к
микологическим методикам рекомендуют применять: реакции агглютинации, преципитации, иммунофлуоресценции и иммуноэлектрофореза. Биопрепараты. Специфическая терапия и профилактика не разработаны.
ВОЗБУДИТЕЛИ МИКОТОКСИКОЗОВ
К микотоксикозам относят заболевания сельскохозяйственных животных, возникающие при скармливании им кормов, пораженных токсическими грибами. В данную группу болезней включают клавицепс-токсикоз, эрготизм, дендрохиотоксикоз лошадей, стахиботриотоксикоз, фузариотоксикоз, токсикозы от заплесневелых растительных продуктов. Грибы, вызывающие микотоксикозы, относятся преимущественно к несовершенным (Fungi imperfecti) и к сумчатым (Ascomycetes).
Возбудитель клавицепстоксикоза. Клавицепстокси-козом называют отравление, вызванное токсинами гриба Claviceps pas-pali, паразитирующего на диких злаках рода Paspalum. Отравление характеризуется поражением центральной нервной системы, протекающее при наличии непрерывного тремора, повышенной рефлекторной возбудимости, локомоторной и статической атаксии и клонально-тонических судорог. Течение заболевания чаще острое.
Морфология. Склероции гриба С. paspali имеют форму шаровидную, полушаровидную и овальную. Цвет желто-бурый, напоминающий обожженную глину. Величина склероций в диаметре 1,4^3,2 мм. Прорастающие склероции дают по нескольку стром на цилиндрических желтоватых ножках 5^-16 мм длины. Головки шаровидные 1—2 мм-в
293
диаметре, желтоватые. Перитеции овальные, реже цилиндрической формы. Каждый перитеций содержит множество цилиндрических сумок. В сумках развиваются нитевидные бесцветные споры (аскоспоры), по семь в каждой сумке. Размеры перитециев, сумок, спор зависят от условий развития. Конидии бесцветные, овальные, эллипсовидные 8,5—11,65X4—4,5 мкм. Склероции начинают прорастать при температуре от 10 до 25—27 °C. Образование и созревание стром происходят в течение 18—20 дней.
Культивирование. Гриб развивается на отваре из семян паспалум, моркови, хлебе, на среде Сабуро и др. при температуре 23—25°С, pH 6,4—7 (см. рис. 100).
Устойчивость. Конидии гриба в колосках растений при температуре 7—8°С и в условиях нормальной влажности воздуха сохраняют жизнеспособность до 235, а при температуре 22—23°С — до 165 дней. Патогенность. Токсичными свойствами обладает только одна стадия гриба — склероции. Из них токсины извлекают эфиром, спиртом, хлороформом и водой. Патогенна в основном жировая фракция. В естественных условиях наиболее чувствительны к токсину гриба ослы, лошади, овцы, крупный рогатый скот и свиньи, а из лабораторных животных кролики, морские свинки, мыши. Отравление возможно у кошек и собак.
При скармливании склероциев кроликам в дозе 1,5—3 г/кг клинические признаки (мышечная дрожь, судороги и параличи) появляются через 24 ч. У мышей наступает смерть через 18—24 ч после скармливания склероциев. У морских свинок экспериментальный токсикоз воз-производят при введении экстрактов или склероциев.
Патогенез. Токсические вещества гриба содержат нейротропные яды и поражают главным образом центральную нервную систему. Изменения во внутренних органах выражены слабее и характеризуются явлениями нарушения гемодинамики и белковой дистрофии. Воспаление отмечается только в желудочно-кишечном тракте.
Диагностика основана на обнаружении склероциев в сене или на траве. Обследуют пастбище и анализируют корма иа присутствие гриба, При необходимости проводят биопробу на лабораторных животных.
Биопрепараты. Специфические средства лечения и профилактики не разработаны.
Возбудитель эрготизма. Эрготизмом называют отравления, возникающие при скармливании животным хлебных и дикорастущих злаков (травы, сена), пораженных спорыньей в стадии склероция (Claviceps purpurea). Токсикоз чаще всего возникает на пастбищах при поедании растений, пораженных этим грибом, или в стойловый период содержания при скармливании муки, отрубей, зерновых отходов с примесью рожков спорыньи.
По своему систематическому положению Cl. purpurea относится к сумчатым грибам — пиреномицетам (класс Ascomycetes, Pyrenornyce-tes, порядок Hypecreales, семейство Clavicepitatae, род Claviceps). В своем развитии гриб проходит три стадии: сумчатую — стадия плодоношения (половое размножение), конидиальную — стадия спороно-шения (бесполое размножение) и покоящуюся (зимующую)—склеро-циальную стадию.
Морфология. Склероции Cl. purpurea (рожки спорыньи) по форме напоминают семена злаков, на которых они развиваются, однако, как правило, рожки всегда крупнее и темнее зрелых зерен растения, в связи с чем они всегда выдаются из колосков и легко отличимы (см. рис. 101). На хлебных злаках склероции гриба удлиненные, иногда искривлены в виде рожка, прямые, закругленные, трехгранные. Величина их от нескольких миллиметров до 5 см. Цвет от светлого до темного,1 почти черного. Сердцевина белая. При прорастании склероции дают головчатые стромы на ножке 1—5 см длины. Головки шаровидные 1,5— 294
2 мм в диаметре. Сумки цилиндрические. Аскоспоры нитевидные, 50— 80 мкм длины и до 1 мкм ширины. Конидии бесцветные, эллипсовидные, овальные, размеры 8X1,5 мкм (рис. 102).
Патогенность. Химический состав рожков спорыньи сложен. Склероции содержат шесть пар алкалоидов с изомерами (эрготамин и эргозин; эрготоксин, который представляет смесь трех алкалоидов: эрго-кристина, эргокриптина и эргокорнина; в третью группу эргобазина входит алкалоид эргометрин со своим изомером). Наиболее активен эрготоксин, содержание которого в спорынье превалирует. Спорынья ядовита для сельскохозяйственных животных и многих лабораторных.
Патогенез. Токсические вещества спорыньи воздействуют на гладкую мускулатуру, уменьшают зрачок, суживают кровеносные сосуды, вызывают нарушение питания тканей, что завершается гангреиой определенных участков тела. Парализуют двигательные симпатические нервы.
иагностика. Диагноз ставят на основании клинического проявле-
ния болезни, анализа кормов для выявления спорыньи на растениях и определения степени поражения злаков. Токсической дозой склероциев для животных считается 2—3 г/кг при одновременном скармливании такого количества спорыньи. Отравление спорыньей возможно при поедании животными сена, муки, отрубей, комбикорма, зараженных склероци-ями. В этих случаях зараженность определяют лабораторным анализом кормов: органолептическим (сено, трава), люминесцентным и химическим (мука, отруби, комбикорм).
Биопрепараты. Специфические средства лечения и профилактики не разработаны.
Возбудитель стахиботриотоксикоза. Стахиботри-отоксикоз — тяжелое инфекционное заболевание животных, возникающее в результате поедания кормов, пораженных токсическим грибом Stachybotrys alternans. К токсину гриба чувствителен также и человек. Впервые заболевание было установлено у лошадей на Украине в 1930— 1931 гг. Восприимчивы лошади, крупный и мелкий рогатый скот и свиньи. Из лабораторных животных наиболее чувствительны кролики. Заболевание характеризуется некрозами слизистой ротовой полости и
последующих отделов пищеварительного тракта, слюнотечением.
Гриб Stachybotrys alternans относится к несовершенным грибам (Fungi imperfecti), порядок гифомицеты (Hyphomycetales), семейство Dematiaceae, род Stachybotrys.,
Морфология. У гриба септированный многоклеточный мицелий; молодой мицелий бесцветный или слабо-оливковый, с возрастом приобретает оливково-бурый цвет. Толщина гиф зависит от возраста (2— 3 мкм). От гифов отходят конидиеносцы, заканчивающиеся лепестковидными выростами—стеригмами (5—7) яйцевидной формы, расположенными в виде розетки. На стеригмах образуются легкоопадающие клетки — конидии. Они одноклеточные, яйцевидные, с возрастом приобретают темно-коричневую или почти черную окраску. Размеры их 6,2—12,6Х 5,2—8,4 мкм. Конидиеносцы длиной до 45,2—52 мкм, диаметр их 3—4 мкм (см. рис. 103).
Культивирование. Гриб растет и развивается как на естественных субстратах, богатых клетчаткой (соломе, сене, зерне), так и на различных искусственных жидких и плотных питательных средах (среды Сабуро, Чапека, сусле-агаре и др.). На соломе, зерне гриб образует черный, легко снимающийся налет. На среде Чапека вырастает двухзонная коло-
ния, центральная зона которой складчатая, черная, по периферии с белой прозрачной каемкой. Оптимальная температура для роста и развития гриба — 24—26 °C, конидии прорастают уже через 4—5 ч, а кониди-альное спороношение появляется через 5—7 суток (см. рис. 104).
Устойчивость. При температуре пара 100°С гриб на влажной соломе гибнет в течение 2 мин. Сухой жар (120 °C) убивает конидии в
295
течение 1 ч, горячая вода (88 °C) — за 30 мин. Мороз до 35 °C на гриб не действует. Прямые солнечные лучи при экспозиции 10—15 мин замедляют прорастание конидий гриба; рассеянный свет, рентгеновские и ультрафиолетовые лучи не оказывают на них никакого влияния.
Губительны для гриба 1 %-ный раствор формалина — разрушает конидии за 1 ч, 5 %-ный водный раствор аммиака— за 30 мин, 2—т 3 %-ный креолин — за сутки.
Патогенность. Гриб образует токсические вещества как на естественных субстратах, так и на различных искусственных питательных средах. Они образуются в стеригмах, конидиях и конидиеносцах, а также в хламидоспорах. Грибы из рода Stachybotrys продуцируют токсины резорбтивного действия, вызывающие токсинемию.
Патогенез. Из пищеварительного тракта токсические вещества всасываются в кровь и лимфу и разносятся по всему организму. Они проникают и в центральную нервную систему. Токсины гриба обусловливают гиперемию, отек, кровоизлияния и дегенеративные изменения в мозге, а также поражают стенку кровеносных сосудов, вызывая в ней воспалительный процесс. Стенки сосудов становятся дряблыми и по-розными, что ведет к нарушению кровообращения, возникновению гиперемии, к застойным явлениям, геморрагическому диатезу, отеку легких, нарушению морфологического состава крови и, наконец, к некробиотическим процессам.
Диагностика. В лабораторию для микроскопического исследования посылают пробы соломы, взятые из пораженных участков скирды, в количестве 20—30 г каждая. На исследование направляют также сено, зернофураж, кал лошадей, пораженные участки кишечника и преджелудков жвачных.
Лабораторную диагностику проводят комплексно, с использованием микроскопии, метода выделения чистой культуры и биологической пробы, позволяющей установить токсичность гриба. Для исследования соломы, сена и зернофуража отбирают образцы соломинок или подозрительных зерен, покрытых черным сажистым налетом
Для микроскопии соскабливают черный налет и помещают его в каплю воды на предметное стекло, сверху кладут покровное стекло. Просматривают под малым и средним увеличением микроскопа. Обнаруживают характерные конидиеносцы, стеригмы и конидии.
Выделение культуры осуществляют путем посева соломинок или зерен на питательные среды. Для этой цели отбирают соломинки с черным сажистым налетом и нарезают на кусочки 1,5—2 см длины. Эти соломинки или зерна раскладывают стерильным (прокаленным) пинцетом в чашки с питательной средой Чапека иа фильтровальную бумагу на расстоянии 1—2 см одну от другой. Культивируют при 22—24 °C. Через 3—5 дней на соломинках появляется черный налет, состоящий из спор: гриба. я
Выделенную культуру гриба испытывают на токсичность. Накопление токсических веществ гриба производят на среде, состоящей из нарезанной кусочками соломы, увлажненной жидкой средой Ван—Итерсона или Чапека (1 : 1 к массе соломы). Культуру гриба выращивают в течение 2—3 недель, после чего ее убивают текучим паром в течение 1 ч, вынимают соломинки из колб и высушивают при 40—45 °C. Экстрагиро-6 вание токсического вещества из высушенной соломы производится в аппарате Сокслета экстрагированием эфиром в течение 24 ч при комнатной температуре и высушиванием до кашицеобразного состояния. J
Можно использовать более простой способ получения экстракта из исследуемого материала. Корм или культуру, снятую из плотной пита-/ тельной среды, измельчают и заливают стерильным 0,85%-ным раствором поваренной соли и оставляют на сутки при 4—6°С для экстрагирования токсических веществ. Затем смесь встряхивают и фильтрую^ через ватно-марлевый фильтр. В фильтрате определяют наличие тот^г> синов.
296
Для испытания на токсичность экстракт наносят на выбритый участок кожи (3X3 см) кролика. На такой же кожный участок на другой стороне тела наносят контрольную вытяжку из свежей соломы (экстракция аналогичная). При наличии в пробе токсина через 3—4 суток на месте нанесения испытуемого экстракта развивается отечность с дальнейшим некрозом кожи, а спустя 10—15 дней образуется плотная толстая корка. На контрольном участке кожи видимых изменений не обнаруживают.
Биопрепараты. Специфические средства лечения и профилактики не разработаны.
Возбудитель дендродох иотоксикоза. Дендродохио-токсикоз — отравление животных при скармливании им кормов, пораженных грибом Dendrodochium toxicum. Заболевание характеризуется молниеносным и острым течением с признаками нарушения функции центральной нервной системы. В естественных условиях этот токсикоз установлен у лошадей, экспериментально воспроизведен на лошадях, овцах, свиньях, курах и лабораторных животных.
Возбудитель относится к группе несовершенных грибов (Fungi imperfecti), к порядку спородохиальных (Acervulales). Это сапрофит, развивается на кормах, богатых целлюлозой (солома, полова).
Морфология. Мицелий гриба септированный шириной 1—4 мкм, белого цвета и спородохии (спороложка)—образования округлой формы, размером 0,2—1 мм. зеленоватого цвета. Спородохии представляют собой своеобразные плодовые тела, состоящие из стеригм, которые имеют вид мутовки. На стеригмах располагаются конидии (длина 7,5—8 мкм, ширина 2,7—3,5 мкм). На соломе чаще появляется мицелий гриба и очень редко конидии.
Культивирование. Оптимальная температура роста 20—25°С. При более низкой температуре гриб образует только мицелий. Он растет на естественных средах: сене, ячмене, а также на обычных питательных средах: сусло-агаре, агаре Чапека, Сабуро и др. Оптимальная кислотность среды для роста и развития гриба pH 6,0—7,0.
На растительных субстратах на 3—4-й день после посева появляются небольшие мицелиальные подушечки, вскоре образуются и споро-дохими. На агаре Чапека растет пушистый воздушный мицелий, колонии круглые.
Устойчивость. Едкий натр в 2 %-ной концентрации убивает споры в течение 10 мин, 1 %-ный раствор формалина при воздействии в течение 10 мин задерживает развитие спор, а двухминутная экспозиция убивает их; 3,5 %-ный раствор соляной кислоты убивает споры в течение 10 мин.
Патогенность. Грибы из рода Dendrodochium выделяют очень сильные токсины (дендродохин) общего действия, образующиеся в мицелии и. в спородохиях. Максимальное накопление токсических веществ в субстратах происходит в сроки от 10 до 15 дней. Токсины термостабильны, температура 120°С не разрушает их в течение часа. Они оказывают отрицательное влияние на нервный и гладкомышечный аппарат сердечно-сосудистой системы и обусловливают резкое снижение кровяного давления, а также множественные различные нарушения функциональной деятельности желудочно-кишечного тракта.
Токсичность культур определяют методом кожной пробы на кроликах, а также скармливанием подсвинкам ячменя, пораженного грибом. Культурой можно заразить кроликов и морских свинок.
Диагностика. В лаборатории проводят комплексный анализ: микроскопия, выделение чистой культуры и биологическая проба, позволяющая установить токсигенность гриба.
Биопрепараты. Специфические средства лечения и профилактики не разработаны»
29?
* Возбудители а с пер ги л л о токсикоз а. Аспергиллоток-сикоз — отравление животных кормами, пораженными грибами рода Aspergillus. На кормах часто встречаются грибы — A. fumigatus, A. flavus, A. niger, A, clavatus, A. wentii, A. chevalieri.
Грибы рода Aspergillus относятся к классу аскомицетов, порядку Plectoascales, семейству Aspergilloceae.
Морфология. Грибы имеют расчлененный (септированный) мицелий и одноклеточный конидиеносец; на его верхнем вздутом конце веерообразно расположен ряд коротких стеригм, от которых отшнуро-вываются цепочками споры — конидии (греч. пыль). При микроскопическом исследовании аспергилл расположение спор в плодоносящей части напоминает собой струйки воды, выливаемой из лейки, отсюда и название «леечная плесень».
Мицелий и конидиеносцы чаще не окрашены, конидии у большинства видов окрашены в зеленый и черный цвет.
Культивирование. Грибы хорошо растут на среде Чапека с оптимальным pH 5—6,0, при температуре от 23 до 26 °C. Однако гриб A. fumigatus развивается при температуре 37°С и выше.
Патогенность. Аспергиллы образуют токсические продукты как на естественных субстратах — зернофураже, на грубых кормах, так и на различных синтетических и полусинтетических средах. Известно около 30 видов и разновидностей рода аспергиллус, обладающих токсическими свойствами. Различают 14 токсических фракций токсинов грибов данного рода. Наиболее токсичными являются фракции Вь В2, которые обладают канцерогенным действием. Эти токсины названы афлатоксинами, так как впервые был получен токсин из экстракта арахисовой муки, пораженной грибом Aspergillus flavus. По химическому строению афлатоксин относится к группе кумаринов.
Гриб A, fumigatus также способен выделять биологически активные вещества. Известно, что этот гриб образует ряд токсических метаболитов; фумагиллин, гельволивую кислоту, глиотоксин и др. Все они термостабильны, способны вызвать токсикоз, обладают гемолитическими и антигенными свойствами.
Патогенез. Токсические вещества аспергиллов обладают местным и общим действием. Местный процесс характеризуется воспалением кожи н ее придатков, слизистых дыхательных путей и коньюнктивы. Общее действие в основном проявляется симптомокомплексом поражения центральной нервной системы. Токсические дозы нарушают обмен веществ, вызывают днстрофнческне нзменення паренхиматозных органов.
Диагностика. При подозрении на отравление аспергиллами в лабораторию направляют свежий патологический материал (трупы мелких животных, пораженные органы или часть их, соскобы с пораженных участков кожи, некротическую ткань глаз, уха, слизистых оболочек, яйца и др.)- Для выявления источника инфекции на исследование направляют пробы корма, отходы инкубации и др. Основными методами диагностики являются микроскопический и микологический. Токсичность полученных культур определяют подкожным введением белым мышам культуральной жидкости гриба, а также реакцией кожной токсичностц (РКТ).
Для установления афлатоксинов применяют методику тонкослойной хроматографии.
Биопрепараты. Специфические средства лечения и профилактики не разработаны.
Возбудители фузариотоксикоза. Фузариотоксикозами называют незаразные заболевания животных, возникающие в результате скармливания им кормов или при выпасе их на пастбище, по стерне хлебных злаков, пораженных грибами рода Fusarium. Они чаще развиваются на злаковых растениях.
298
Отравление фузариозными грибами зарегистрировано у всех видов сельскохозяйственных животных. Заболевание протекает остро и хронически и характеризуется расстройством функции желудочно-кишечного тракта, поражением центральной нервной системы, развитием токсической алейкии. Наиболее часто заболевание животных (включая птиц) вызывают грибы Fusarium sporotrichioides, F. роае, F. graminearum, F. monileforme.
По систематике В. И. Билай (1977) род фузариум представлен
9 секциями, 31 видом, 27 разновидностями. Грибы рода Fusarium отно-
сятся к порядку гифомицетов (Hyphomycetales), несовершенных грибов, (Fungi imperfecti), семейству Tuberculariaceae.
Морфология. Возбудители фузариотоксикоза содержат следующие
морфологические элементы: несептированный мицелий белого или крас-
новатого цвета, грушевидные или лимоноподобные микроконидии (длина 3,8—6,6 мкм), располагающиеся группами на отходящих от мицелия коротких отростках. Макроконидии многоклеточные (3—9 клеток), ве-
ретеновидно-серповидные, часто с ножкой у основания, с верхушечной клеткой, большей частью сильно согнутой или постепенно утолщающейся, заостренной или притупленной (см. рис. 105).
Хламидоспоры шаровидные, грушевидные, яйцевидные, одно-двух-клеточные, располагаются цепочкой или клубком на конце гиф или по ходу мицелия; образуются в гифах мицелия, в строме, конидиях (см. рис. 106), конидиеносцах. Цвет их чаще бывает коричневый. Неко
торые представители этого рода имеют и сумчатые стадии.
Культивирование. Грибы рода Fusarium выращивают на среде Чапека. Для этого берут щуплое, трухлявое зерно светло-серого или розового цвета, раскладывают на питательный субстрат. Через 3—5 дней инкубирования при 22—25 °C проявляется рост пышных желтоватых колоний (см. рис. 107). Для получения чистой культуры выросшие колонии пересевают на сусло-агар или картофельный агар. Выросшую культуру микроскопируют. По форме конидий, по величине и количеству в них перегородок, пигментации устанавливают родовую принадлежность гриба.
Патогенность. Фузарии выделяют токсины местного и общего действия в различных температурных условиях (8—26 °C).
В 1906 г. О. Е. Габрилович методом экстрагирования 50—60 %-ным спиртовым раствором пораженных фузариозом зерен впервые из фильтрата гриба F. graminearum выделила сероватый порошок, который оказался азотистым гликозидом. При введении лягушкам больших доз экстракта наступали параличи и смерть. Л. Е. Олифсон (1951) из зерна, искусственно пораженного грибом F. sporotrichioides и F. роае, выделил два яда кардитонического действия — спорофузарин и поэфузарин. В 1969 г. Л. И. Ерохина из гриба F. moniliforme изолировала 13 физиологически активных веществ, объединенных под названием «гиберел-лйны», отличающиеся друг от друга биологической активностью и химическим строением.
Установлено, что грибы рода Fusarium секции Sporotrichiella продуцируют метаболиты, которые относятся к группе трихотецинов, образуемые грибом Trichothecium roseum, представляет собой сложный эфир. Выделено еще несколько метаболитов, продуцируемых грибами рода Fusarium. Особый интерес представляют микотоксины Т-2 и Ф-2. Токсин Т-2 — продукт жизнедеятельности гриба, высокотоксичен (ЛД50 4 мг/кг массы), не обладает кумулятивными свойствами. Зеараленон (Ф-2) выделен из гриба F. graminearum, слаботоксичен, но может вызывать аборты, а также бесплодие у крупного рогатого скота и свино-маток.
Патогенез. Токсины гриба, поступая с кормом в пищеварительный тракт, проникают в кровеносную систему и разносятся по всему организму. Онн поражают в первую очередь центральную нервную систему.
299
иагностика.
Токсичность пробы корма, заряженного фузарием,
< проверяют на кроликах кожной реакцией (РКТ) или подкожным введе-
нием белым мышам. У них возникают парезы, а затем наступает смерть.
Для первичного определения токсичности культур фузарий, а также ток-- синов фузарий используют Paramaecium caudaturn. Кроме того, для определения токсинов грибов предлагается использовать аквариумныхрыбок, 1,5—2-месячных цыплят, 9-дневных куриных эмбрионов, а также введение экстракта в бородку курам в количестве 0,1—0,2 мл:
Для серологического диагноза используют реакцию связывания ком-
племента, преципитации и иммунодиффузии.
Биопрепараты для специфической профилактики и лечения фуза-
риотоксикоза отсутствуют.
Возбудители пенициллотоксикоза. Пенициллотокси-коз — отравление сельскохозяйственных животных токсическими веществами грибов рода Penicillium. В США (1962) отмечали массовое заболевание свиней, возникшее в результате поедания кормов, пораженных грибом Penicillium rubrum. Наблюдается микотоксикоз у цыплят после скармливания зерна, пораженного грибами Penicillium rubrum, Р. pur-
purogenum.
Род Penicillium относят к классу аскомицетов. Типовой вид — Penicillium glaucum. Более 30 видов патогенны для человека и животных. Этот род гриба широко распространен в природе. Его обнаруживают в кормах, молочных продуктах, на влажных предметах, старых кожах,
в чернилах, варенье.
следующие
Морфология. Возбудители пенициллотоксикоза имеют
элементы: септированный мицелий (2—8 мкм), плодовые тела, состоящие из продолговатых конидиеносцев — стеригм, на которых образуются цепочки конидий (3—5 мкм). Стеригмы располагаются в виде вилки, поэтому плодовое тело гриба в целом напоминает кисточку.
Культивирование. Грибы выращивают в аэробных условиях на агаре Сабуро или Чапека, кровяном агаре (pH 6,0—7,0) в чашках Петри при 18—25 °C. Культура гриба представляет собой пушистый налет на
поверхности среды, зеленого цвета.
Устойчивость. Токсические вещества многих пенициллов не разрушаются температурой (180 °C) и ультрафиолетовыми лучами. Кормй, пораженные токсическими пенициллами, не обезвреживаются запариванием (токсичность кормов снижается незначительно), токсические вещества не разрушаются щелочами и кислотами.
Патогенность. В чистом виде получены токсические вещества: ру-гулозин, Исландии, рутроскарин, патулин, вызывающие у свиней, крупного рогатого скота, птиц воспалительные процессы и некрозы тканей. Токсичный антибиотик патулин действует на клетки культуры тканей, снижает количество лимфоцитов крови, ингибирует ряд ферментов. ЛД50 патулина для белых мышей 10—15 мг/кг массы внутривенно, 25—35 мг/кг подкожно и 35 мг/кг внутрь. Он обладает антидиуретиче-ским действием, повышает проницаемость кровеносных сосудов, тормо-
зит заживление ран.
иагностика.
Определяют токсичность пораженных кормов на ры-
бах гуппи и кожной пробой на кролике. В необходимых случаях выделяют чистые культуры грибов. Продолжительность микологического исследования от 10 до 25 суток.
Биопрепараты для специфической профилактики и лечения пени-
циллотоксикоза отсутствуют.
Возбудители м у ко р ом и коза. Мукоромикоз (фикомикоз)— незаразное заболевание сельскохозяйственных животных различных видов, возникающее вследствие отравления токсинами грибов рода Mucor. Мукоромикоз установлен у крупного рогатого скота, овец, свиней, лошадей, птиц. Мукоровые грибы растут и развиваются на гру-
300
бых кормах, зерне, корнеплодах, силосе при неправильном их хранении (повышенная влажность грубых кормов и зерна, хранение силоса при доступе кислорода воздуха и пр.). В результате активного размножения грибов в кормах происходит накопление их токсинов. В некоторых случаях размножение грибов происходит в пораженных органах и тканях животных.
Свыше 15 патогенных видов грибов могут вызывать у животных и человека мукоромикозы. Кроме токсикоза, грибы поражают легкие и печень: по клиническому течению подобное заболевание во многом сходно с туберкулезом.
Основными возбудителями мукоромикоза в настоящее время считаются М. racemosus, М. pusillus. Грибы рода Mucor отнесены в класс совершенных грибов — оомицетов. Одни виды обитают в воде, другие —
в почве.
Морфология. Тело мукоровых грибов состоит из несептированного
мицелия в виде сильно разветвленной клетки, от которой ответвляются плодоносящие гифы — спорангиеносцы с шарообразным расширением наверху — спорангиями, наполненными эндоспорами, несущими функцию размножения. Мукоровые грибы размножаются и половым путем.
В гранулематозных и некротических очагах широкий (15—20 мкм) несептированный, разветвленный мицелий, часто он обнаруживается в гигантских клетках. Окрашивается по Романовскому—Гимзе, Циль— Нильсену н Гочкису—Мак-Манусу.
Культивирование. М. pusillus — колонии на агаре Чапека до 1 мм в высоту, гладкие, серые. Спорангиеносцы с ответвлениями, прямостоящие, размер 160—400 мкм. Споры шаровидные, до 3—5 мкм в диа
метре.
Гриб М. racemosus на агаре Чапека образует колонии желтоватобелого цвета, рыхло-войлочные. Спорангиеносцы кистевидно разветвленные. Споры шаровидные, овальные желтоватые. Образует многочисленные хламидоспоры (см. рис. 108).
Диагностика. Определяют токсичность кормов н выделенных из них чистых культур путем кожной пробы на кроликах. Для определения токсичности кормов используют также рыбок гуппи, простейшие, куриные эмбрионы. Для постановки алиментарной пробы берут белых мышей, морских свинок, кроликов, цыплят, утят, голубей.
Из патологического материала готовят препараты-отпечатки и просматривают их в микроскоп в неокрашенном виде.
Биопрепараты. Специфическая профилактика и терапия не разработана.
СОДЕРЖАНИЕ
Введение (П. А. Емельяненко)................................................ 3
Краткая история развития микробиологии..................
ОБЩАЯ МИКРОБИОЛОГИЯ...........................
Систематика микроорганизмов (П. А. Емельяненко)
Морфология и строение микроорганизмов (П. А. Емельиненко) Морфология бактерий....................... ,
Строение бактерий . . . . - . . . . .
Морфология Морфология Морфология Морфология Морфология Морфология Генетика микроорганизмов (наследственность н изменчивость). (/ Материальные основы наследственности микроорганизмов ДНК-хромосомы и плазмид....................................
Генетический код и передача информации ....................
Хромосомный контроль синтеза белка.........................
Генетический обмен у бактерий и роль виехромосомиых элементов Роль плазмид в формировании условиопатогенных бактерий Типы изменчивости микроорганизмов..........................
Физиология микроорганизмов (В. И. Полтев) . . .
Распространение микробов в природе (С. Т. Рягии) . . . .
Микрофлора Микрофлора Микрофлора Микрофлора Микрофлора Микрофлора Микрофлора
и строение спирохет , и строение микоплазм................
и строение риккетсий .
и строение актиномицетов
и строение микроскопических грибов и строение фагов....................
Кудлай^
почвы........................................ .
ВОДЫ • ***«*»» * * * • * < •
воздуха , ....................................
тела сельскохозяйственных животных...............
молока и молочных продуктов (К. П. Чепуров) кормов...........................................
навоза...........................................
Роль микробов в превращении веществ в природе . . ...
, Влияние факторов внешней среды на микроорганизмы (С. Т. Рягин) Влияние физических факторов ...................................
Действие химических веществ . .........................
Действие биологических факторов...........................
УЧЕНИЕ ОБ ИНФЕКЦИИ И ИММУНИТЕТЕ (П. А. ЕМЕЛЬЯНЕНКО)
Инфекция..................-..................................
Патогенность и вирулентность.................................
Факторы патогенности микробов....................
Иммунитет....................................................
Антигены
Индуцибельные защитные механизмы макроорганизма ....
Популяции лимфоцитов
Иммунный ответ организма . ..........................
Антителообразоваиие ....................................
Гиперчувствительность немедленного типа (ГТН)
Гиперчувствительность замедленного типа (ГЗТ) .... Иммунологическая память ................................
Иммунологическая толерантность..........................
Механизм иммунного ответа . . ;.......................
Методические принципы регистрации .иммунного ответа . Современные методы антигенного анализа.......................
Естественная резистентность ... ..........................
Возрастные особенности иммунологического статуса сельскохозяйст животных.....................................................
Иммунодефицитные состояния . .............................
Практическое использование учення об инфекции и иммунитете .
вей
ных
4
7
7
8
8
10
18
18
19
19
20
24
26
27
29
30
33
34
39
41
42
49
49
50
52
53
56
61
64
65
73
73
75
77
82
83
84
87
96
97
101
102
105
105
111
113
113
114
115
116
120
125
131
134
135
302
ЧАСТНАЯ МИКРОБИОЛОГИЯ .
Патогенные кокки (К. П. Чепуров)
\ Стафилококки................
Стрептококки...................
и- Энтеробактерии (Б. А. Матвиенко)
Эшерихии .... . . .
дротей . . .......
Шонедлы..>..............!. .
ерсинии (Г. В. Дунаев) . . . j. ЧЙ Возбудитель антропозооноз ной чумы ‘/о Возбудитель псевдотубёркулеза J .
Пастереллы (Б. А. Матвиенко) .
Возбудитель пастереллеза
Бруцеллы (В. С. Рягузов)
Возбудитель бруцеллеза <
Франциселлы (Г. В. Дунаев)
Возбудитель туляремии , .
Патогенные псевдомонасы (П. А. Емельяненко)
* * Возбудитель сапа .... J . .
*
я
138 138 138 141
148 148 154 J54 173 173 175 177
«
180
180
оксемии
Г
Листёрйи(В? С, Рягузов) \ .
у * Возбудитель листериоза ...... Эризипелотрнксы (В. С. Рягузов) . 1 !• * Возбудитель рожи свиней...............
Патогенные бациллы (Г. В. Дунаев) . . .
/ Возбудитель-сибирской язвы . . .
Патогенные анаэробы (Г.; В. Дунаев) . .
Возбудитель эмфизематозного карбункула Кл остри ЛИИ я ПТАУ я " ..
т *Возбудители брадзота овец . . . .
♦ Возбудители ннфекцноииой анаэробной энтерот Возбудитель столбняка .
V ^Возбудитель ботулизма ....
> f Возбудитель некроба^териоза Патогенные микобактерии (В. И. Ротов) Возбудителе туберкулеза
-г Возбудитель паратуберкулеза
ПятсшемныА яктино^рпеты (С. Т. Рягин) Возбудитель актиномикоза
Патогенные ми коп о эмы- (Г. В. Дунаев)
Возбудитель плевропневмонии крупного рогатого скота
• Возбудитель инфекционной агалактин мелкого рогатого скат .^Возбудитель респираторного микоплазмоза птиц
Риккетсии. (И. В. Тарасевич) . \ .................
* Возбудитель Ку-лихорадки' . . . • ' .
Возбудитель эрлихиоза собак . . .
* Возбудитель эрлнхноза жвачных и всеядйых . .
< г Возбудитель гндропернкардйта (коудрноза) \ .
Возбудитель неорнккетсйоза фобак . ., . . .
V Возбудитель орннтоза и. других хламидиозов...........
187 1^1
191
“ 193 195 195 198
198 203
210
211
216
230
241
244
245
261
263
271
* Возбудитель лептоспирозаj . . . . . . . . .. .
Патогенные кампилобактеры (|С. Я. Любашенко|) .........................
'/^'’бозбудат^ь^амЁЗйобактериоза вибриоза , . . . . . .
Патогенные грцбм" (с. Т. Рягин) . .
Возбудители Микозов......................... ..........................
’ Возбудите эпизоотического лнмфангнта , .............................
/ Возбудитель кандндамнкоза . . ...............................
Возбудитель кокциднондомнкоза ...........
„„.Возбудители дерматомнкозрр . . . ...........................
Возбудитель аспергиллёза............................................
Возбудители микотоксикозов ............................................
Возбудитель клавицепстокснкоза (293). Возбудитель эрготизма (294). Возбудитель стахиботрнотокснкоза (295). Возбудитель дендродохиотокси-коза (297). Возбудители аспергиллотоксикоза (298). Возбудители фуза-рнотоксикоза (298). Возбудители п^инциллот оксикоз а (300). Возбудители мукоромикоза (300).,
273
274
274
279
279
286
303
Петр Алексеевич Емельяненко, Георгий Васильевич Дунаев, Дарья Гавриловна Кудлай и др.
ВЕТЕРИНАРНАЯ МИКРОБИОЛОГИЯ
Заведующий редакцией В. Г. Федотов
Редактор Н. И. Емельянова
Художник В. М. Лукьянов
Художественный редактор Е. Г. Прибегина
Технический редактор В. А. Боброва
Корректор Н. Я- Туманова
ИБ № 2291
Сдано в набор 12.04.82. Подписано к печати 19.10.82. Т-18371. Формат 70X108’/ie. Бумага тип. Nt 2. Гарнитура литературная. Печать высокая. Усл. псч. л. 29.4. Усл. кр.-отт. 29.4. Уч.-изд. л. 30.95. Изд. № 145. Тираж 30 000 экз. Заказ № 96. Цена 1 р. 40 к.
Ордена Трудового Красного Знамени издательство «Колос». 107807. ГСП, Москва, Б-53. ул. Садовая-Спасская. 18.
Владимирская типография «Союзполиграфпрома» при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли ЫХХЮО. г. Владимир, Октябрьский проспект, д. 7
304