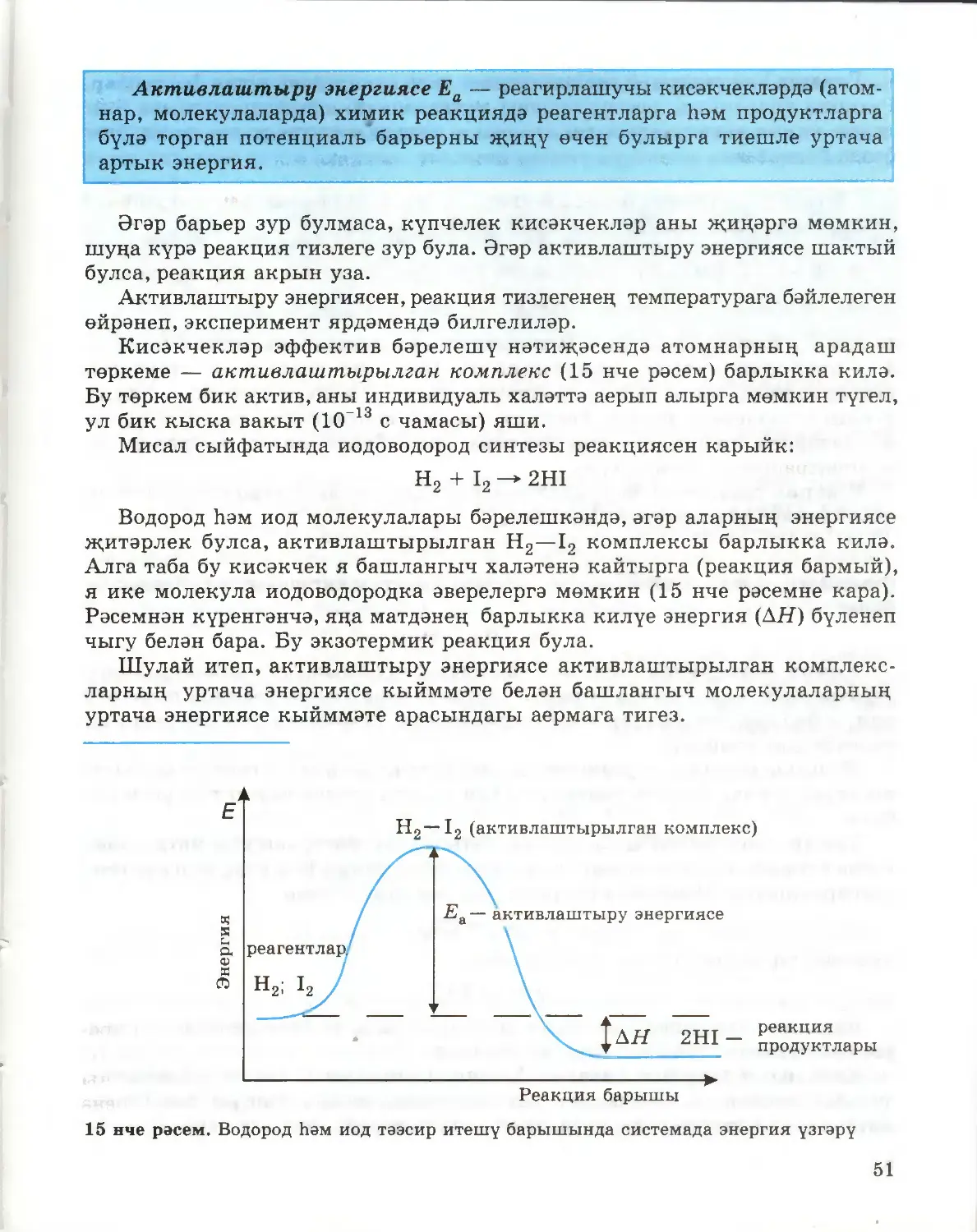
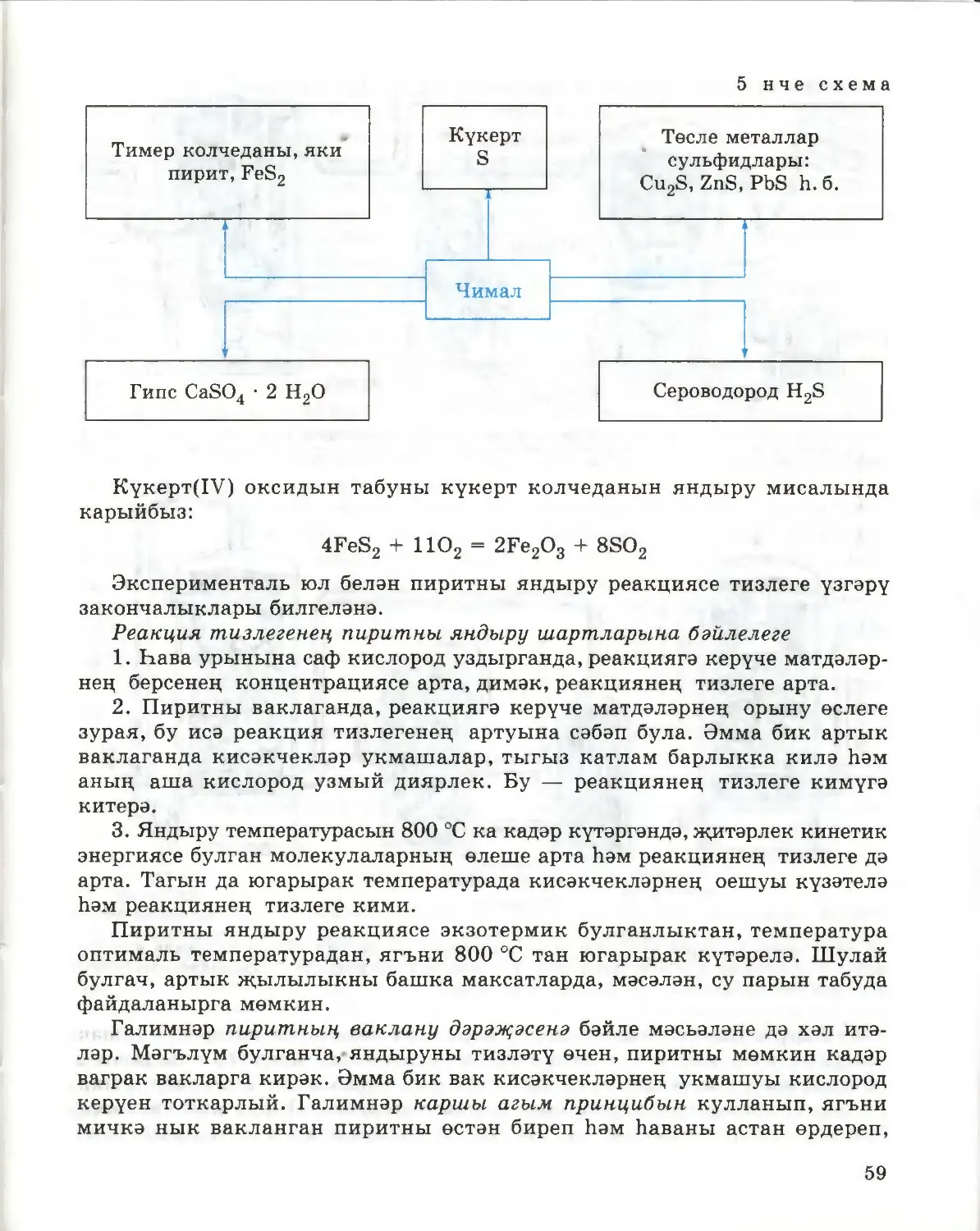
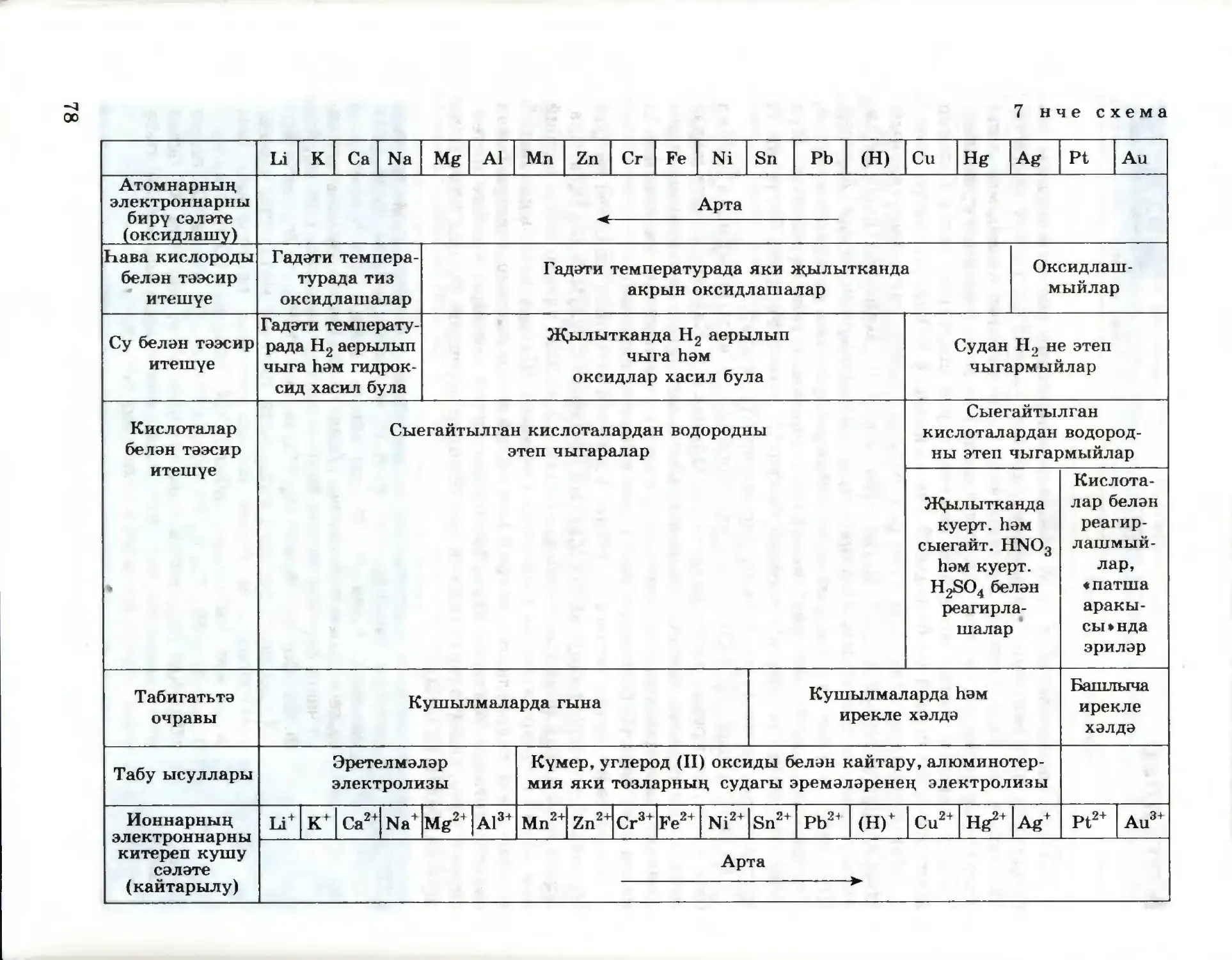
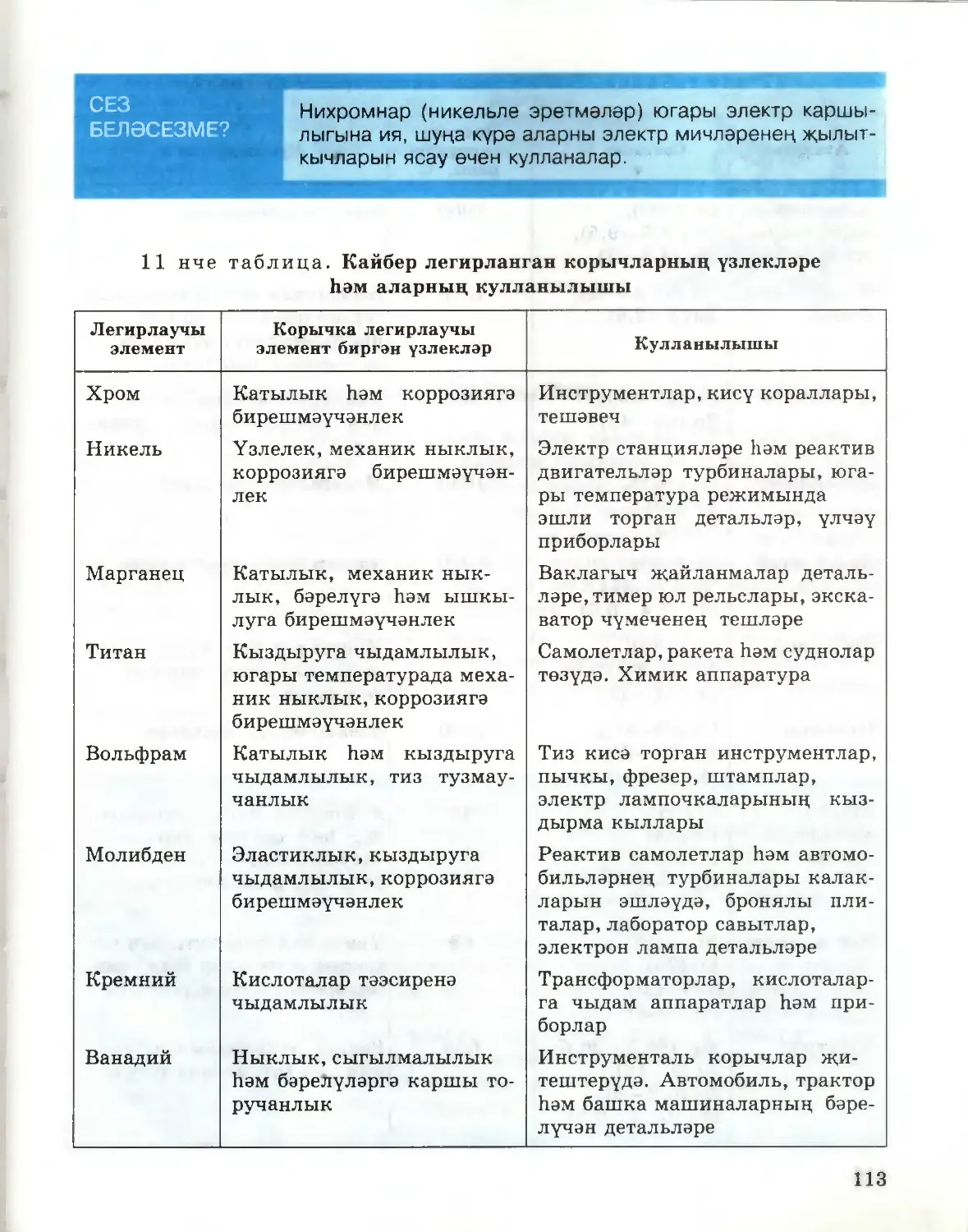
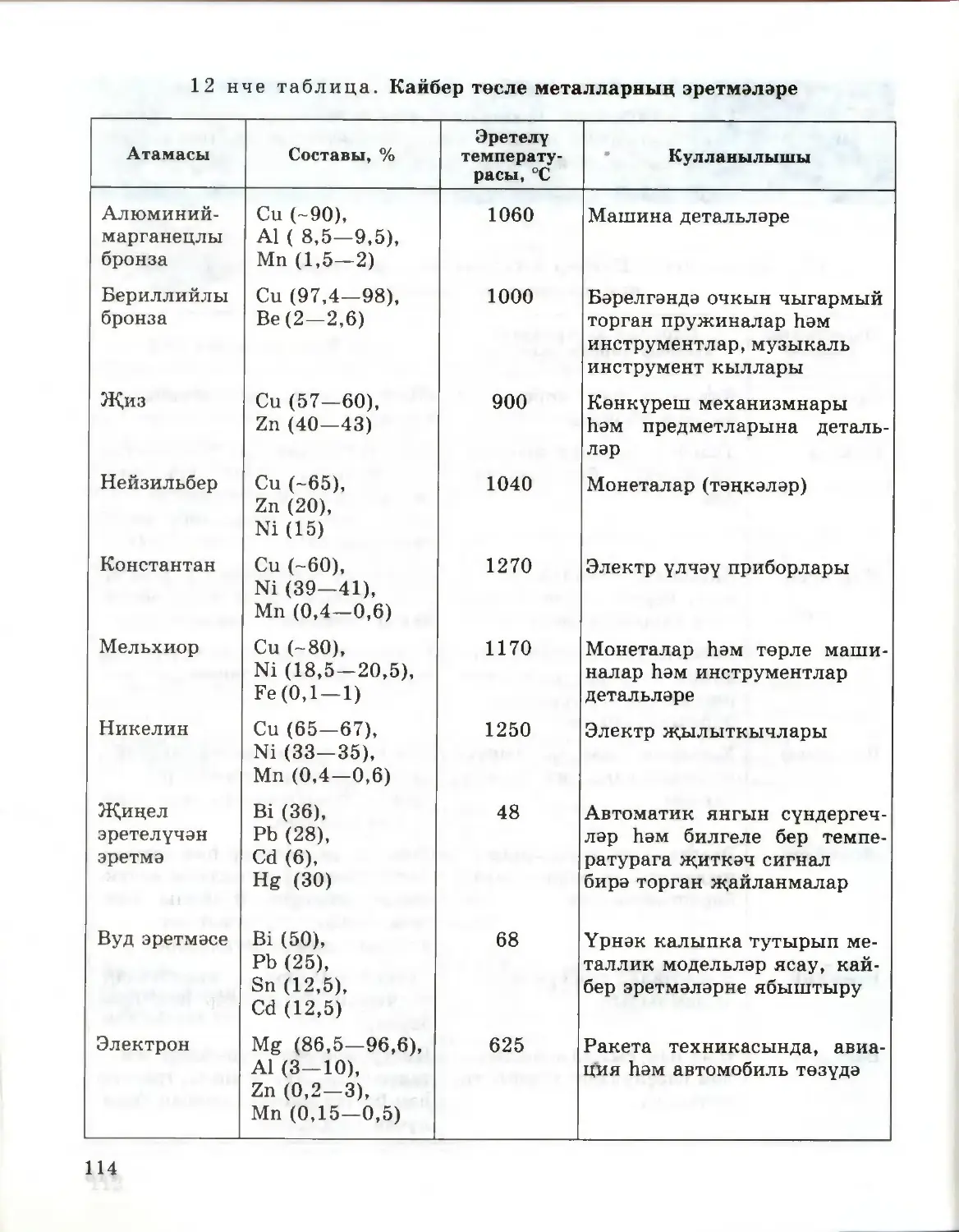
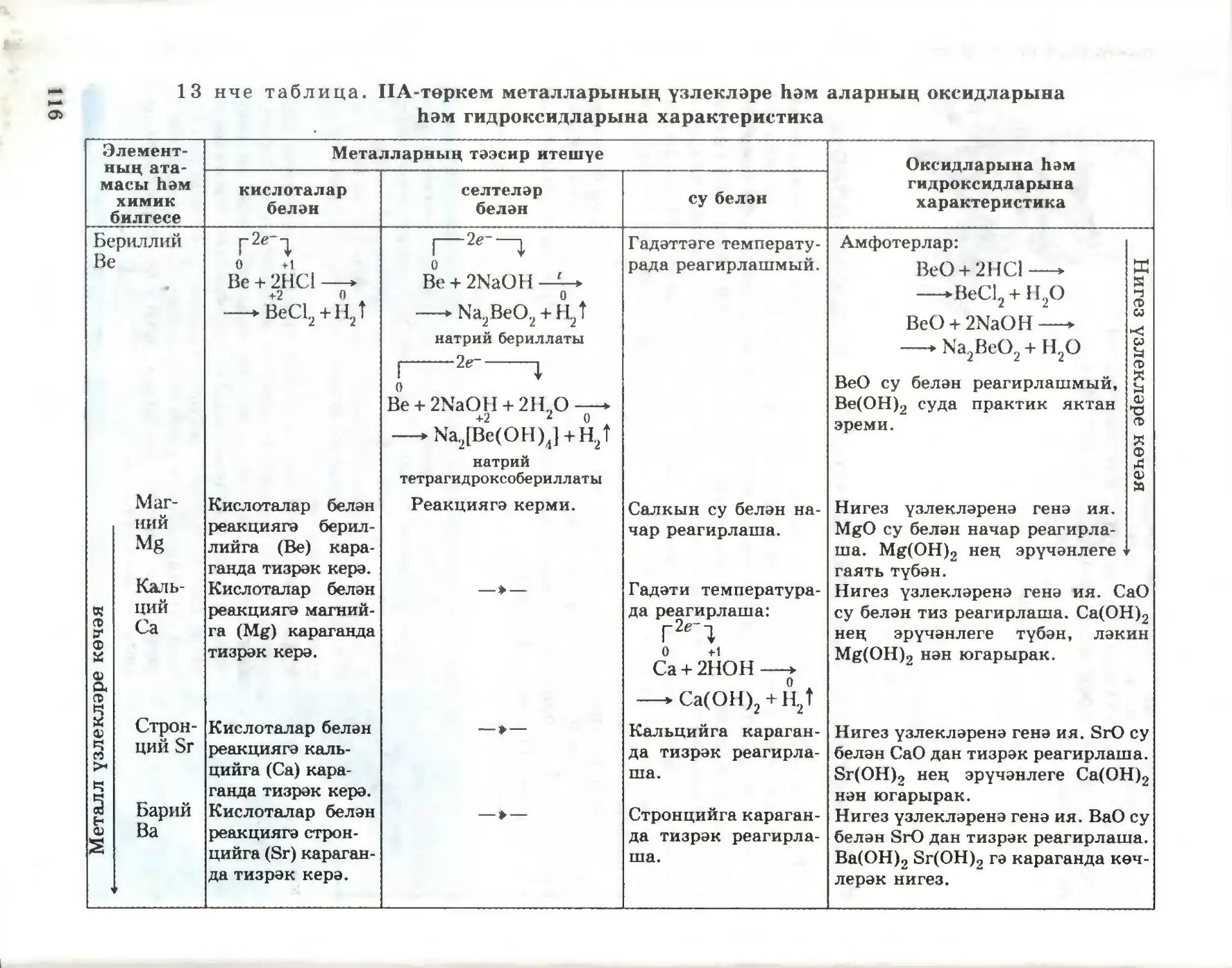
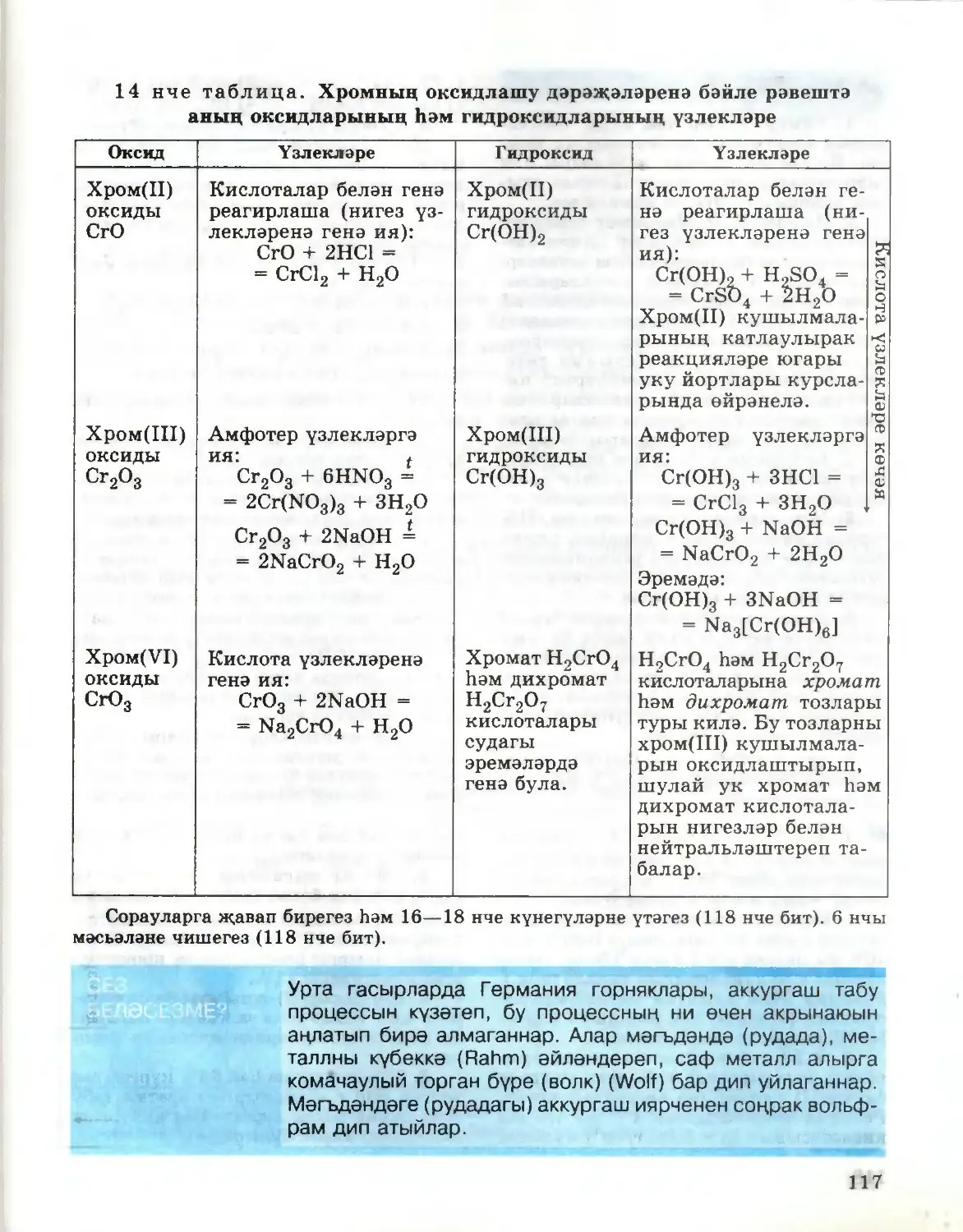
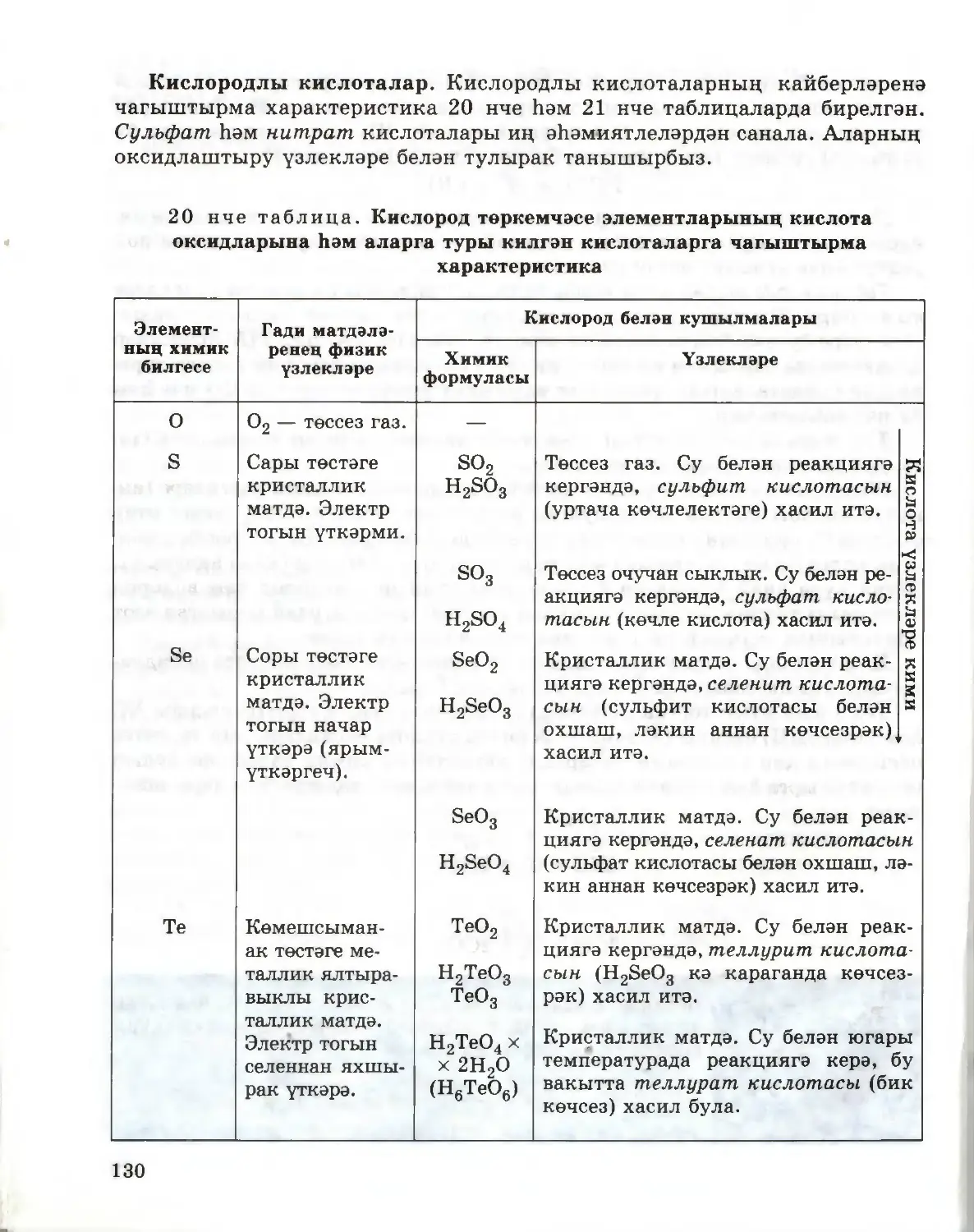
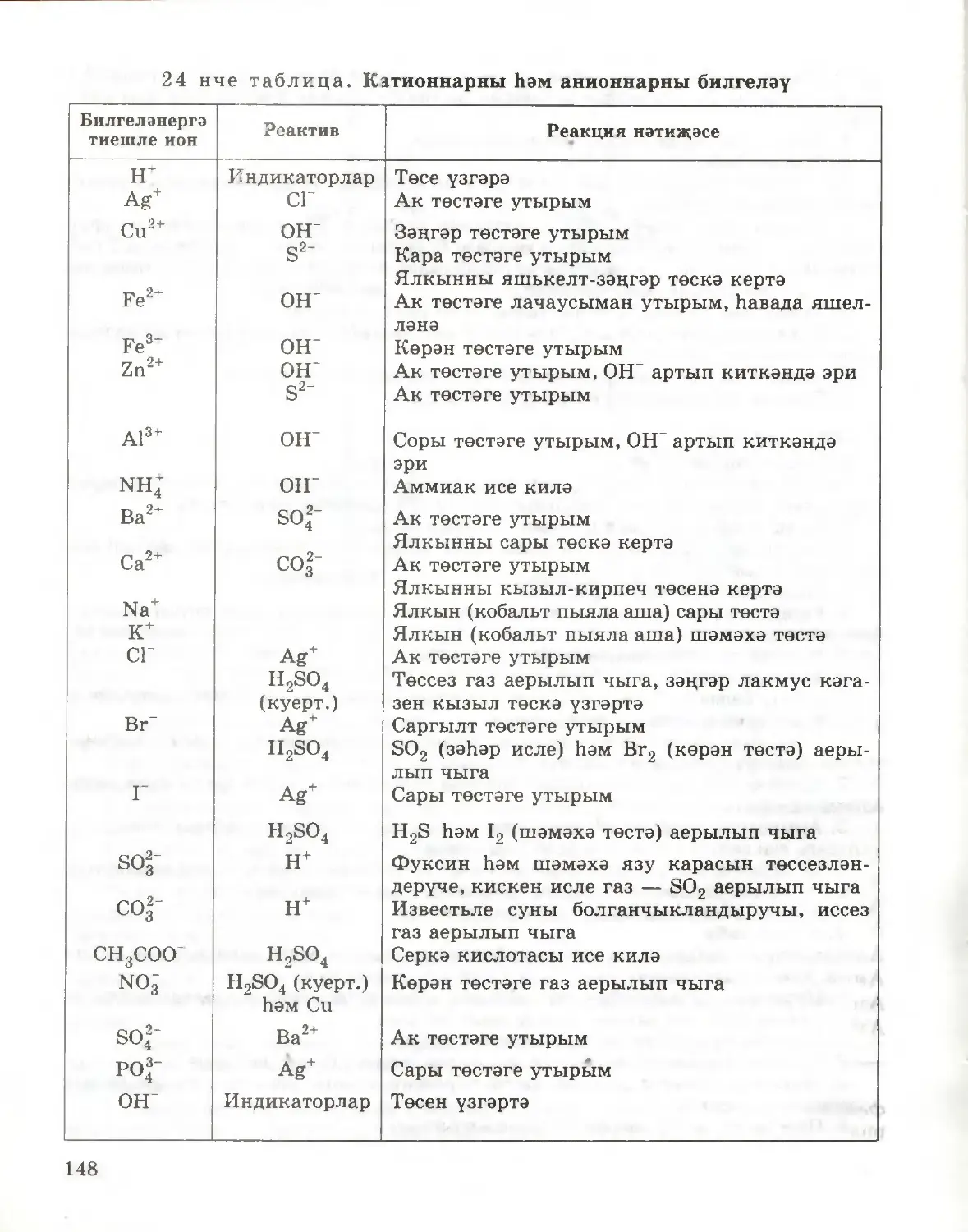
Текст
41
Г. Е. РУДЗИТИС, Ф. Г. ФЕЛЬДМАН
ХИМИЯ
ГОМУМИ ХИМИЯ НИГЕЗЛӘРЕ
ТАТАР УРТА ГОМУМИ БЕЛЕМ БИРҮ МӘКТӘБЕНЕҢ
11 НЧЕ СЫЙНЫФЫ ӨЧЕН ДӘРЕСЛЕК
Төп белем
Россия Федерациясе
Мәгариф һәм фән министрлыгы,
тарафыннан тәкъдим ителгән
Казан · «Мәгариф» нәшрияты
Москва · «Просвещение»
2009
УДК 373.167.1:54*11
ББК 24.1 я721
Р71
Рудзитис Г. Е.
Химия : основы общ. химии : учеб, для 11 кл. общеобразоват.
учреждений : базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман.—
11-е изд., перераб.— M.: Просвещение, 2008.
Дәреслеккә Россия фәннәр академиясе һәм Россия мәгариф академиясе
тарафыннан уңай бәяләмәләр бирелде.
Переводное издание учебника выпущено в свет по Сублицензионному договору
№3/89 от 15 июля 2009 года. Экземпляры переводного издания подлежат рас¬
пространению исключительно в Республике Татарстан, а также среди татарской
диаспоры на территориях других субъектов Российской Федерации.
Охраняется действующим законодательством об авторских и смежных
правах (Гражданский кодекс РФ, ч. 4, гл. 70). Воспроизведение всей книги или
ее части на любых видах носителей запрещается без письменного разрешения
издательства.
Кабатлау өчен материал
Өстәмә материал
Үз белемеңне тикшерү өчен
сораулар һәм күнегүләр
Мәсьәләләр
Рудзитис Г. Е.
Р71 Химия: гомуми химия нигезләре: Татар урта гомуми белем бирү
мәкт. 11 нче с-фы өчен д-лек: төп белем / Г. Е. Рудзитис, Ф. Г. Фельд¬
ман; Русчадан Р. 3. Закирова, Ф. Г. Иштирәкова тәрж,.— Казан: Мәга¬
риф, 2009.— 159 б.: рәс. б-н.
ISBN 978-5-7761-2045-9
ISBN 978-5-7761-2045-9
© Издательство «Просвещение», 2008
© Художественное оформление.
Издательство «Просвещение», 2008
Все права защищены
© Татарчага тәрҗемә. «Мәгариф» нәшрияты, 2009
Дәреслектән ничек файдаланырга
Кадерле укучылар!
Бу дәреслектә химия фәненең теорияләре һәм законнары, химик
процесслар һәм производстволар турындагы белемнәр системага салына
һәм тирәнәйтелә.
Ныклы һәм тирән белемнәр алу максатларында, төп уку материалын
кабатлый һәм ныгыта белергә генә түгел, бәлки аларны мөстәкыйль рәвештә
гомумиләштерергә һәм системага сала белергә өйрәнү аеруча әһәмиятле’.
Белемнәрне төрле схемалар һәм таблицалар ярдәмендә системага салырга
һәм гомумиләштерергә мөмкин. Алар иң әһәмиятлесен һәм иң кирәклесен
аера белергә мөмкинлек бирәчәк.
Шундый сорау туа: белемнәрне гомумиләштерү нәрсә ул? Моның өчен
гаять күп сандагы конкрет химик күренешләрне чагыштырып карарга
һәм алар арасында нинди уртаклык булуын, аларның бер-берсеннән нәрсә
белән аерылуларын ачыкларга кирәк. Алар турындагы белемнәрегезне сез
шундый чагыштырма анализ ярдәмендә гомумиләштерә аласыз.
Бу дәреслекнең төп максатларыннан берсе — сезнең химиядән белем¬
нәрегезне киңәйтү һәм беркадәр тирәнәйтү. I бүлектә китерелгән мате¬
риал, мәсәлән химик элемент, матдәнең массасы саклану законы, химик
реакцияләр барышында энергия саклану һәм әверелү законы, матдәнең
составы даимилеге законы кебек аеруча әһәмиятле төшенчәләр һәм законнар
турында күзаллауларыгызны киңәйтер һәм тирәнәйтер. II бүлектәге мате¬
риалда электроннарның атомнардагы торышы, энергетик һәм кече энергетик
дәрәҗәләр, атомнарның валентлык мөмкинлекләре һәм башка төшенчәләр
турында күзаллаулар югарырак дәрәҗәдә бирелә.
Аннан соң матдә төзелеше, химик элементларның периодик системасында
төп металл һәм неметалл элементлар турындагы материал тирәнрәк карала.
Әгәр сез бу дәреслектә һәм моннан алдагы сыйныфларның химия дәрес-
лекләрендә китерелгән барлык сорауларга җавап биреп, барлык күнегүләрне
үти һәм барлык мәсьәләләрне чишә алсагыз, ул вакытта химиядән имтихан
бирергә һәм белем алуыгызны дәвам иттерергә яхшы әзерләнгәнсез дии
ышанырга мөмкин.
Өстәмә материал һәм теманы тирәнтен үзләштерү өчен бирелгән уку
материалы тексты башлану ■ билгесе белән, тәмамлануы горизонталь
сызык белән билгеләнгән.
Химиядән белем дәрәҗәгезне күтәрү өчен, белешмә материаллардан һәм
химия буенча башка әдәбияттан өстәмә файдалана аласыз. Китап ахырында
күрсәткеч китерелгән, анда III һәм IV рим цифрлары белән химия буенча
10 нчы һәм 11 нче сыйныф дәреслекләре күрсәтелгән.
3
I БҮЛЕК
Иң әһәмиятле химик төшенчәләр
һәм законнар
§ 1. Химик элемент. Изотоплар
Химиядә иң әһәмиятле төшенчәләрнең берсе — химик элемент.
Химик элемент ул — химик яктан бер-берсе белән бәйләнмәгән, төш
корылмалары бердәй булган атомнар төре.
Бу билгеләмәдән күренгәнчә, химик элемент — ниндидер бер атом түгел,
бәлки төш корылмасы (протоннар саны) бердәй булган атомнар җыелмасы.
Бер үк элемент атомнары төшләрендәге нейтроннар саны аерылырга мөмкин.
Мәсәлән, хлор элементы, төшендәге нейтроннар саны белән аерылып торучы
ике төрле атомнардан — 17CI атомнарыннан һәм ^Cl атомнарыннан тора.
Бу атомнарны хлорның изотоплары дип атыйлар.
Бер үк химик элемент атомнарының төш корылмалары бертөрле,
ләкин масса саннары (төштәге протоннар һәм нейтроннар саны суммасы)
төрлечә булган аерым төрләрен изотоплар дип атыйлар.
Бер үк химик элемент изотопларының масса саннары, ягъни массалары
төрлечә булганлыктан, күпчелек элементларның атом массалары ваклан¬
малы сан белән күрсәтелә. Мәсәлән, табигый хлорның 75,53% ы θ|01 изото¬
быннан һәм 24,47% ы ^С! изотобыннан тора. Нәтиҗәдә хлор элементы¬
ның уртача чагыштырма атом массасы 35,45 кә тигез. Шуңа күрә «хлор
элементы» төшенчәсенә шушы изотопларның җыелмасы керә.
Шулай итеп, химик элементның иң мөһим характеристикасы булып
а) аның атомнарының периодик таблицадагы тәртип (атом) номерына туры
килгән төш корылмасы; б) чагыштырма атом авырлыгы тора.
Химик элементлар турындагы хәзерге карашлар «химик элемент» һәм
«гади матдә» төшенчәләрен аерып күрсәтергә мөмкинлек бирә. Мәсәлән,
без су составына водород һәм кислород керүен беләбез инде, ләкин алар
гади матдәләр рәвешендә түгел, бәлки водород һәм кислород атомнары
рәвешендә керә, ягъни су ике химик элемент — водород һәм кислород —
атомнарыннан тора.
1—3 нче күнегүләрне үтәгез (7 нче бит).
4
§ 2. Химик реакцияләр вакытында матдәнең
массасы саклану законы, энергия саклану
һәм әверелү законы, матдәләр составының
даимилеге законы
Матдәнең массасы саклану законы 1748 елда рус галиме М. В. Л о мо¬
но с о в тарафыннан ачыла. Бу законны француз галиме А. Л.Лавуазье
1756 елда тәҗрибәдә (металларны авызы эретеп ябыштырылган ретортада
кыздырып) исбат итә. Законның хәзерге формулировкасы түбәндәгечә:
Химик реакциягә кергән матдәләрнең массасы реакция нәтиҗәсендә
хасил булган матдәләрнең массасына тигез.
Атом-молекуляр теория күзлегеннән караганда бу законның асылы
яхшы аңлашыла. Чөнки химик реакция нәтиҗәсендә атомнарның фәкать
яңача урнашуы гына була, ягъни атомнар арасындагы элекке бәйләнешләр
җимерелә, һәм бәйләнешләрнең яңалары хасил була, ләкин реакциягә кадәр
һәм реакциядән соң атомнарның саны үзгәрешсез кала. Шуңа күрә химик
реакцияләрдә матдәләрнең гомуми массасы үзгәрмәскә тиеш.
Ләкин Μ. В. Ломоносов тарафыннан бирелгән формулировка аның бу
законны тагын да тирәнрәк аңлавын күрсәтә:
Табигатьтә була торган барлык үзгәрешләрнең асылы шуннан гыйбарәт: бер
җисемнән күпме нәрсә алынса, икенчесенә нәкъ шулкадәр өстәлә. Әгәр берәр
җирдә материя берничә тапкыр кимесә, икенче җирдә шулкадәр үк артыр. Бу —
гомуми табигать законы хәрәкәт кагыйдәләренә дә кагыла, чөнки җисемне үз көче
исәбенә хәрәкәт иттерүче икенче җисем хәрәкәт итүче беренче җисемгә күпме
хәрәкәт бирсә, үзе шулкадәр үк югалта.
By формулировкадан күренгәнчә, матдәнең массасы саклану законын
М. В. Ломоносов энергия саклану законы белән бердәм итеп караган һәм
аны табигатьнең гомуми законы итеп аңлаган.
Энергия саклану законын беренче булып немец галиме P. M а й е р әйтә.
Масса белән энергия арасындагы үзара бәйләнешне А. Эйнштейн үзенең
математик тигезләмәсе белән исбат итә:
E = тс2,
биредә E — ирекле җисемнең тикторыш хәлендәге энергиясе, т —
җисемнең массасы, с — яктылыкның вакуумдагы тизлеге.
СЕЗ
БЕЛӘСЕЗМЕ?
Ак фосфор кызыл фосфорга әверелгән чакта, 20,934 Дж/моль
энергия аерылып чыга, һәм бу вакытта массаның кимүе
2 · Ю"10 г гына тәшкил итә.
5
СЕЗ
БЕЛӘСЕЗМЕ?
MiililiaiIiIlW
Молекуляр булмаган төзелешле матдәләрнең составның
даимилек законыннан тайпылуларын академик H. C. Kyp-
наков күреп ала. Составның даимилеге законына буй¬
сына торган молекуляр төзелешле матдәләрне аның
тәкъдиме буенча дальтонидлар дип (инглиз галиме
Дж. Дальтон истәлегенә багышлап), ә молекуляр булмаган
төзелешлеләрен бертоллидлар дип (мондый кушылмалар
барлыгын алдан белеп әйткән француз физигы К. Бер-
толле хөрмәтенә) атыйлар.
Монда бер сорау туа: ни өчен химик реакцияләр вакытында энергия
аерылып чыгу исәбенә массаның үзгәрүен белергә мөмкин булмаган? Әгәр
с2 кыйммәтенең гаять зур булуын искә алсак, бу сорауга җавап бирергә
мөмкин. Химик реакцияләр барышында аерылып чыга һәм йотыла торган
энергиягә бик кечкенә масса туры килә. Мәсәлән, хлорның водород бе¬
лән реакциясе нәтиҗәсендә бер моль хлороводород HCl хасил булганда,
92,3 кДж энергия аерыла. Бу энергиягә нибары IO-9 г гына масса туры
килә.
Эйнштейн тигезләмәсенең, ягъни масса белән энергия арасындагы үзара
бәйләнешнең дөреслеген, энергиясе химик реакцияләр энергиясеннән
миллионнарча тапкыр артыграк булган төш реакцияләрен тормышка
ашырганда исбат итәргә мөмкин булды.
Билгеле булганча, масса саклану законы — химиянең төп законнарыннан
берсе. Шул законга таянып, химик реакцияләрнең тигезләмәләрен төзиләр
һәм төрле исәпләүләр башкаралар.
Энергия саклану һәм әверелү законы нигезендә массаны гына түгел, бәлки
химик реакция вакытында аерылып чыга яки йотыла торган энергияне дә
исәпкә алып, термохимик реакцияләр төзиләр.
4—6 нчы сорауларга җавап бирегез (7 нче бит).
Матдә составының даимилеге законы барлык матдәләрнең дә молеку¬
лалардан торуы турындагы күзаллаулар нигезендә ачыла һәм әйтелә.
Моннан соңгы тикшеренүләр барлык неорганик матдәләрнең фәкать 5%
чамасының гына молекуляр төзелешле булуын күрсәтә. Матдә составының
даимилеге законы бары тик алар өчен генә дөрес. Молекуляр булмаган
төзелешле матдәләр бу законга тулысынча буйсынмыйлар. Мәсәлән, хәзерге
төгәл тикшеренүләр ярдәмендә табылган мәгълүматларга караганда, ти-
мер(П) сульфиды FeS формуласы белән түгел, бәлки Fe1-JS формуласы
белән күрсәтелергә тиеш, монда х ның кыйммәте 0 дән 0,05 кә кадәр үзгәрә,
ә титан(1Ү) оксиды TiO2 формуласы белән түгел, бәлки TiO1 9_2 0 белән күр¬
сәтелергә тиеш. Ләкин бу тайпылышлар бик кечкенә, шуңа күрә химик
формулаларны язганда, без аларны исәпкә алмаячакбыз.
6
Составның даимилеге законы хәзер түбәндәгечә әйтелә:
Молекуляр төзелешле һәр саф матдәнең сыйфат һәм микъдари составы,
нинди ысул белән табылуына карамастан, даими була.
Молекуляр булмаган төзелешле матдәләр төгәл даими составка ия
түгелләр. Аларның составы матдәнең табылу шартларына бәйле.
Матдәнең молекуляр һәм молекуляр булмаган төзелеше турындагы
хәзерге күзаллаулар химиядәге башка әһәмиятле төшенчәләргә дә төгәллек
кертергә мөмкинлек бирә. Мәсәлән, әгәр валентлыкны бәйләнешләр
санына карап билгеләү кабул ителә икән, бу фәкать органик матдәләргә
һәм молекуляр төзелешле бик аз сандагы неорганик матдәләргә генә
кагылырга тиеш. Шуңа күрә молекуляр булмаган төзелешле матдәләр
өчен — «оксидлашу дәрәҗәсе» төшенчәсен, ә молекуляр төзелешлеләре
өчен «валентлык» төшенчәсен кулланалар. «Структур формула» төшенчәсен
кулланганда да боларны истә тотарга кирәк. Еш кына бу төшенчәне,
«молекула» төшенчәсе кебек үк, шартлыча молекуляр булмаган төзелешле
матдәләргә күчереп кулланалар.
7 иче күнегүне үтәгез. 1, 2 нче мәсьәләләрне чишегез.
1
2
3
4
1. Атомында 19 протон булган химик
элемент:
1) селен 2) технеций 3) калий 4) хлор
2. Бер элементның изотоплары бер-
берсеннән аерыла:
1) нейтроннар саны белән
2) протоннар саны белән
3) электроннар саны белән
4) төш корылмасы белән.
3. Химик элемент исеме белән төштәге
протоннар саны арасындагы тәңгәллекне
билгеләгез:
1)калий
А.
16
2) хлор
Б.
19
3) күкерт
В.
12
4) магний
Г.
17
ф 1. Составында масса өлеше 15%
ком булган 1 кг акбурны кыздырганда
табылган углерод (IV) оксидының күләмен
исәпләгез.
4. Масса саклану законының химия
фәнендә һәм практикада нинди әһәмияте
бар?
5. Масса саклану, энергия саклану һәм
әверелү законнарының бердәмлеген бе¬
ренче булып кем алдан күргән? Масса белән
энергия арасындагы бәйлелекне кем ачкан
һәм математик юл белән дәлилләгән? Бу
фәнни ачышларның әһәмияте нәрсәдә?
6. Масса белән энергия арасындагы
бәйләнеш физикада һәм химиядә нинди
тәҗрибәләр белән исбат ителгән?
7. Матдә составының даимилеге за¬
конының формулировкасын исегезгә тө¬
шерегез һәм ни өчен аңа төгәллек кертергә
кирәк булуын аңлатыгыз.
2. 67,2 м3 водород белән 44,8 м3 азот
арасында (н.ш.) реакция уздырганнар.
Табылган аммиак нинди газ белән пыч¬
ранган булыр?
7
Атом тезелеше тәгълиматы
нигезендә химик элементларның
Д. И. Менделеев ачкан периодик
законы һәм периодик системасы
Il БҮЛЕК
Неорганик химияне өйрәнгәндә, сез Д. И. Менделеевның перио¬
дик законны ачуы һәм бу законның аның тарафыннан бирелгән форму¬
лировкасы белән танышкан идегез. Шулай ук сез атом төшләренең төзе¬
леше, электроннарның орбитальләр яки энергетик дәрәҗәләр буенча ничек
урнашуларын да белдегез. Атом төзелеше тәгълиматы нигезендә периодик
закон түбәндәгечә әйтелә:
Химик элементларның һәм алар хасил иткән гади һәм катлаулы
матдәләрнең үзлекләре шул элемент атомнарының төш корылмасыннан
периодик бәйлелектә тора.
Электроннарның энергетик дәрәҗәләрдә урнашу закончалыкларын
билгеләү нәтиҗәсендә, периодиклык күренешенең асылы нәрсәдә булуына
төшенергә мөмкин булды: валентлык электроннары бер үк санда булган
элемент атомнарының төш корылмалары арта барганда, элементларның
охшаш үзлекләре периодик рәвештә кабатлана.
Атомнар төзелешенең хәзерге теориясе иҗат ителгәнгә кадәр химик
элементларның Д. И. Менделеев ачкан периодик системасында һәм перио¬
дик законында күренгән башка закончалыкларны да аңлатып булмаган.
Мәсәлән, периодларда элементларның саны ни өчен 2—8—18—32 сан¬
нарына тиңдәшле рәвештә артуы, ягъни ни өчен 1 нче периодта фәкать
ике генә элемент, ә 2 нче һәм 3 нче периодларда — сигезәр, 4 нче һәм
5 нче периодларда — унсигезешәр, 6 нчыда утыз ике булуы аңлашылмый
иде. Шулай ук төп һәм ян төркемчәләрдәге (А- һәм Б-төркемнәрдә)
элементларның үзлекләренең нилектән бер-берсеннән аерылып торуларын
да аңлатырга мөмкин түгел иде. Электроннарның атомнардагы торышын
өйрәнү нәтиҗәсендә, хәрәкәт итү характерына һәм энергиясенә карап,
электроннарның s-, р-, d- һәм /-электроннарга бүленүе билгеле була.
Фәкать шуннан соң гына бу сорауларга җавап табыла.
§3. Кече һәм зур период атомнарында электроннар¬
ның урнашу үзенчәлекләре, s-, р-, d-, f-Электроннар
S-, р-, d-Электроннар, шулай ук S-, р- һәм d-элементлар турында төп
мәгълүматлар неорганик химия курсында бирелгән (8 нче сыйныф, §37).
8
Шуны исегезгә төшерик: s-электрон орбитальләре шарсыман формада
була (1 нче рәсем). s-Орбиталендәге электроннар саны икедән арта алмый
(әгәр анда ике электрон булса, аларның спиннары капма-каршы була), шуңа
күрә 1 нче периодта фәкать ике элемент — водород һәм гелий урнашкан.
р-Орбиталь гантельсыман формада (2 нче рәсем). Бирелгән квант санында
мондый орбитальләр өчәү (3 нче рәсем). р-Электроннар да үзләренең
спиннары белән аерылып тору сәбәпле, бирелгән энергетик дәрәҗәдә бердән
алып алтыга кадәр р-электроннар урнаша ала.
Сезгә билгеле N = 2п2 формуласы буенча икенче
энергетик дәрәҗәдә сигез электрон урнаша ала, алар¬
ның икесе — s-электрон, ә калган алтысы — р-элек-
трон. 2 нче периодта ни өчен сигез элемент урнаша
алуы нәкъ менә шуның белән аңлатыла.
2 нче период неон Ne элементы белән тәмамлана.
Неон атомында s- һәм р-электроннарының урнашуын
электронлы формула белән күрсәтергә мөмкин:
+10Ne ls22s22p6,
монда s- яки р-хәрефләре алдындагы цифр — төп
квант саны; ул бирелгән орбитальдәге электрон белән
төш арасындагы уртача ераклыкны сыйфатлый,
ягъни орбитальнең үлчәмен һәм беркадәр дәрәҗәдә
аның энергиясен күрсәтә. s,p,d хәрефләре тиешле
кече энергетик дәрәҗәдәге электрон болытының
формасын (шулай ук беркадәр дәрәҗәдә энергиясен дә)
чагылдыра. Хәрефтән өстәрәк уңдагы цифр бирелгән
кече энергетик дәрәҗәдәге электроннар санын күрсәтә.
Күргәзмәле итү өчен, электронны еш кына кечкенә
квадрат эченә урнаштырылган ук белән билгелиләр,
квадрат алдына элементның символын язалар (4 нче
рәсем). Бу вакытта электроннарның орбитальләрдә
урнашуын, әйтик, неон атомыныкын, түбәндәгечә
күрсәтергә мөмкин:
1 нче рәсем. s-Элек-
трон болытының фор¬
масы
2 нче рәсем. р-Электрон бо- 3
лытының формасы
нче рәсем. р-Электрон
болытларының простран-
ствода мөмкин саналган
юнәлешләре
9
2 нче период неон Ne элементы белән тәмамлана һәм шуның белән икенче
энергетик дәрәҗәнең электроннар белән тутырылуы да тәмамлана.
3 нче период унберенче элементтан — натрийдан Na башлана. Икенче
энергетик дәрәҗә электроннар белән тулган булу сәбәпле, натрий элемен¬
тыннан башлап өченче энергетик дәрәҗәдә тутырыла башлый. Ул катлау¬
лырак, чөнки анда N = 2п2 формуласы буенча унсигез электрон урнаша ала.
Унберенче элементтан — натрийдан Na башлап унсигезенче элементка —
аргонга кадәр өченче энергетик дәрәҗәнең тутырылуы нәкъ икенче энергетик
дәрәҗәнең тутырылуы кебек бара. Ә инде K элементының унтугызынчы
электроны һәм кальций Ca элементының егерменче электроны, өченче
энергетик дәрәҗәнең электроннар белән тулмаган булуына карамастан,
дүртенче энергетик дәрәҗәдә урнаша. Аннары моннан соң тәртип буенча
килүче ун элементның, егерме беренче скандий Sc элементыннан алып
утызынчы цинк Zn элементына кадәр, тәртип буенча баручы электроннары
өченче энергетик дәрәҗәгә урнашканнар. Өченче энергетик дәрәҗәнең
унсигез электронга кадәр тулуы шуның белән тәмамлана.
Шундый сорау туарга мөмкин: скандийдан алып цинк элементына
кадәр элементларның энергетик дәрәҗәләрен тутырган ун электрон нидән
гыйбарәт? Бу электроннар хәрәкәт иткәндә, тагы да катлаулырак формада
орбитальләр хасил итәләр (5 нче рәсем). Мондый формадагы орбитальләрнең
пространство да биш төрле юнәлештә урнашуы исбат ителгән. Болытларның
формасы шундый булган электроннарны d-электроннар дип йөртәләр.
Электроннарның капма-каршы (антипараллель) спиннарга ия була алуын
исәпкә алсак, d-электроннар атомнарда бердән алып унга кадәр булырга
мөмкин. Димәк, өченче энергетик дәрәҗәдә ике s-электрон, алты р-электрон
һәм ун d-электрон, ягъни барлыгы унсигез электрон урнаша. Болар белән
танышканнан соң, инде 4 нче, зур период элементлары атомнарының энер¬
гетик дәрәҗәләре ничек тулуы белән танышырбыз.
Is1
H
Is2
He
Is2
+ιοΝθ
2s2
2р6
4 иче рәсем. Водород һәм- гелий атом¬
нарында электроннарның энергетик
дәрәҗәләрдә һәм орбитальләрдә ничек
урнашуларын күрсәтүче схема
5 нче рәсем. d-Болытының формасы р-бо-
лытыныкына караганда шактый катлау¬
лы, һәм ул чәчәкнең таҗ яфракчыгына
охшаган
10
Инде әйтеп үткәнебезчә, калий һәм кальций элементлары атомнарының
унтугызынчы һәм егерменче электроннары дүртенче энергетик дәрәҗәгә
урнаша, ә өченче дәрәҗә тулмыйча кала:
3s2 Зр6 Зй?° 4s1
Электроннарның орбитальләрдә ничек урнашуларын еш кына кыскача
күрсәтәләр:
3s2 Зр6 34° 4s1
Кальций Ca (тәртип номеры 20) элементы атомнарының егерменче
электроны шулай ук дүртенче энергетик дәрәҗәгә 4а-орбитален тутырып
урнаша: 3s2 Зр6 Зг/о 4s2
+20Са...
Скандий Sc (тәртип номеры 21) элементыннан башлап яңадан өченче
энергетик дәрәҗәгә электроннар тула башлый һәм егерме беренче электрон
өченче энергетик дәрәҗәнең d-орбиталенә урнаша, ә дүртенчесендә ике
s-электроны саклана:
3s2 Зр6 3d1 4s2
СЕЗ
БЕЛӘСЕЗМЕ?
XX гасырның 20 нче елларында Н. Бор һәм башка га¬
лимнәр, периодик системага нигезләнеп, элементларның
атомнарында электроннар конфигурацияләре формалашу
теориясен иҗат итәләр. Бу теория буенча, периодик
система периодларына кергән элемент атомнарында төш
корылмасы арта барган саен, энергетик дәрәҗәләрнең
электроннар белән тулуы түбәндәге схема буенча була:
1
1s
4
4s 3d Ap
6
6s4f5d6p
2
2s 2р
5
5s Ad 5p
7
7s5f6d7p
3
3s 3p
3
□.3
я 2-
о O-
s ω
CL Σ
Φ O
11
Скандий атомнарының электроннары энергетик дәрәҗәләргә түбәндәгечә
урнашкан:
+21Sc 2е~, 8е~, 9е“, 2е“
Моннан соңгы элементларның утызынчы цинк Zn элементына кадәр
(аның үзен дә кертеп) электроннары өченче энергетик дәрәҗәнең d-орби¬
тальләренә тула. Монда түбәндәге закончалык күзәтелә: башта электрон¬
нар буш орбитальләргә (бу очракта Sd-орбиталенә) берәмләп урнашалар,
фәкать шуннан соң гына, ягъни һәр орбитальдә берәр электрон урнашкач,
аларның парлашуы башлана. Мәсәлән, титан Ti (тәртип номеры 22) эле¬
менты атомнарында егерме икенче электрон егерме беренче электрон белән
парлашмый, бәлки буш d-орбиталенә урнаша:
3s2 Зр6 Зб/2 4s2
+22Ti...l —L
Марганец Mn (тәртип номеры 25) элементы атомнарының парлашмаган
мондый d-электроннары инде бишкә җитә, ягъни һәр Зd-opбиτaлeнә берәр
электрон урнаша:
3s2 Зр6 Зб/5 4s2
+25Mn...l————Ll ————— —L
Шуңа күрә аннан соң килгән тимер Fe (тәртип номеры 26) элементы
атомнарында электроннарның парлашуы башлана:
3s2 Зр6 Зб/6 4s2 4р°
+26Fe...——L :: :l —l —
Моннан соң килгән элемент электроннарының парлашуы дәвам итә һәм
ул цинк Zn (тәртип номеры 30) элементы атомнарында тәмамлана:
3s2 Зр6 Зб/10 4s2
+зо Zn... —'■ ■ ■
Цинк атомнарында электроннар энергетик дәрәҗәләргә түбәндәгечә
урнашалар:
+30Zn 2е~, 8е“, 18е~, 2е~
Электроннарның орбитальләрне тутыру эзлеклелегендә чыгарылмалар да
бар. Мәсәлән, гомуми закончалык буенча, хром Cr һәм бакыр Cu элементлары
атомнарында электроннар орбитальләрдә түбәндәгечә урнашырга тиеш
иде:
12
Sdi
4s2
4s2
3d9
Ләкин бу элемент атомнарында дүртенче энергетик дәрәҗәдәге бер
электрон өченче энергетик дәрәҗәгә күчеп урнаша, шуңа күрә хром һәм
бакыр элементлары атомнарында электроннарның орбитальләрдә урнашуы
Мондый күренеш кайбер башка элемент атомнарында да күзәтелә.
Димәк, S-, р-, d-электроннары бер үк энергетик дәрәҗәдә урнашырга
мөмкин. Ләкин бер үк дәрәҗәдә булсалар да, аларның төш белән бәйләнеш
энергияләре бер-берсенекеннән беркадәр аерыла. Шуңа күрә энергетик
дәрәҗәләрне кече энергетик дәрәҗәләргә бүлеп йөртәләр. Беренче энергетик
дәрәҗәдә бер генә кече s-дәрәҗәсе бар. Бу очракта «энергетик дәрәҗә» һәм
«кече энергетик дәрәҗә» төшенчәләре үзара тәңгәл килә.
Икенче энергетик дәрәҗәдә s- һәм р-кече дәрәҗәләре, ә өченчесендә
S-, р- һәм d-кече дәрәҗәләре бар. Монда шундый закончалык күзәтелә:
кече энергетик дәрәҗәләр саны энергетик дәрәҗә номерына туры килә.
Дөрестән дә, дүртенче энергетик дәрәҗәдә S-, р- һәм d-электроннарыннан
тыш, d-орбитальләргә караганда да катлаулырак формалы электрон орби¬
тальләре хасил итүче электроннар бар. Бу электроннарны f-электроннар
дип йөртәләр. Аларның орбитальләре пространство да җиде төрле юнәлештә
урнашырга мөмкин. Электроннар бер-берсеннән үзләренең спиннары
белән аерылганлыктан, барлыгы ундүрт /-электроны булырга мөмкин.
Моны исәпкә алсак, дүртенче энергетик дәрәҗәдә ике s-электроны, алты
р-электроны, ун d-электроны һәм ундүрт /-электроны, ягъни барлыгы утыз
ике электрон урнаша.
Галлий Ga (тәртип номеры 31) элементы атомнарында, дүртенче энергетик
дәрәҗәнең гомуми сыйдырышлылыгын күрсәтү өчен, электроннарның
орбитальләрдә урнашуын түбәндәгечә сурәтләргә мөмкин:
4s2 4/)1 4d° 4/0
+31Ga
13
' Алдарак әйтеп үткәнебезчә, моннан соң килгән һәр электрон буш
р-орбиталенә урнаша, аннары электроннарның парлашуы Kr элементына
кадәр дәвам итә: 4S2 4^6
36Kr...l
Мондый кыскартылган язулардан файдаланганда, схемалардагы күп
нокталарның нәрсәне аңлатуын төгәл күз алдына китерергә кирәк.
5 нче периодтагы рубидий Rb һәм стронций Sr элементлары атомнарының
чираттагы (утыз җиденче һәм утыз сигезенче) электроннары бишенче
энергетик дәрәҗәнең s-орбитальләренә урнашкан. Иттрий Y (тәртип
номеры 39) элементыннан кадмий Cd (тәртип номеры 48) элементына кадәр
электроннар 4й-орбитальләренә урнаша. Индий In (тәртип номеры 49)
элементыннан ксенон Xe (тәртип номеры 54) элементына кадәр чираттагы
электроннар бишенче энергетик дәрәҗәнең р-орбитальләренә урнаша:
4</10
+54Хе...
5р6
4/0
Ксенон элементы атомнарында электроннарның энергетик дәрәҗәләрдә
урнашуы түбәндәгечә була:
+54Хе 2е~, 8е~, 18е~, 18е“, 8е~
6 нчы периодтагы цезий Cs һәм барий Ba элементлары атомнарының илле
бишенче һәм илле алтынчы электроннары алтынчы энергетик дәрәҗәнең
бз-орбитальләренә урнаша.
Лантан La (тәртип номеры 57) элементы атомнарында илле җиденче
электрон 5</-орбиталенә урнаша:
+57La Is21 2s22p61 3s23p63d1014s24p64d104/° | 5s25p65d15f° | 6s2
Церий Ce (тәртип номеры 58) элементыннан башлап лютеций Lu (тәртип
номеры 71) элементына кадәр урнашкан элемент атомнарының тәртип белән
баручы электроннары дүртенче энергетик дәрәҗәнең /-кече дәрәҗәсенә
урнашалар. Бу элементларның электроннары эчкәреге 4/-кече дәрәҗәләрен
(тышкы яктан өченче) тутыра башлавы аркасында, тышкы яктагы электрон
дәрәҗәләренең төзелеше үзгәрешсез кала. Нәтиҗәдә лантаноидлар дип
аталган бу элементларның химик үзлекләре бер-берсенә бик якын була.
Гафнийдан Hf (тәртип номеры 72) алып терекөмешкә Hg (тәртип номеры
80) кадәр урнашкан элементларның атомнарЬхнда бишенче энергетик
дәрәҗәне (5<2-кече дәрәҗәсен) тутыру дәвам итә, шуннан соң таллийдан Tl
(тәртип номеры 81) алып радонга Rn (тәртип номеры 86) кадәр урнашкан
14
элементларның электроннары алтынчы р-кече дәрәҗәсен тутыралар.
6 нчы период радон Rn элементы белән тәмамлана. Анда барысы утыз ике
элемент.
Тәмамланмаган 7 нче периодның электроннар белән тулуы 6 нчы
периодныкына охшаган.
Без электроннарның энергетик дәрәҗәләрдә урнашу закончалыклары
белән таныштык. Инде хәзер периодик закон һәм химик элементларның
периодик системасы белән атом төзелеше теориясе арасындагы бәйлелек
тулырак күренә.
Без электроннарның, атомнардагы хәрәкәт характерларына карап, з-,
р-, d- һәм f-электроннарга бүленүен һәм аларга тиңдәшле s-, р-, d- һәм
f-кече дәрәҗәләр булуын да белдек. Шуңа бәйле рәвештә s-, р-, d- һәм
f-элеменгплар дип әйтү кабул ителгән. Бу элементларга лантаноидлар һәм
актиноидлар керә.
Периодлардагы элементлар саны (2—8—18—32) аларның тиңдәшле
энергетик дәрәҗәләрендәге мөмкин саналган максималь электроннар санына
туры килә: беренчедә — ике, икенчесендә — сигез, өченчесендә — унсигез,
ә дүртенчесендә — утыз ике электрон.
Белгәнебезчә, химик элементларның периодик таблицасы периодик
законның график гәүдәләнеше булып тора. Хәзерге вакытта таблицаның
берничә йөз варианты билгеле, ләкин безнең илдә хәзерге көнгә кадәр
Д. И. Менделеев тәкъдим иткән вариант (кыска вариант) кулланыла. Монда
элементларның төп төркемчәсен A хәрефе белән, ә ян төркемчәсен Б хәрефе
белән билгелиләр. A — s- һәм р-элементлар, Б — d-элементлар.
Соңгы елларда ИЮПАК тәкъдим иткән озын вариант (беренче форзацны
кара) киңрәк тарала башлады. Ул химик элементларның 18 вертикаль
төркеменнән тора (өченче энергетик дәрәҗәдә максималь электроннар саны
шулкадәр булырга мөмкин). Бер юлда 18 элемент язылган. Периодлар саны
кыска вариантта да, озын вариантта да бертөрле. Беренче өч период —
s- һәм р-элементлар. 4 нче һәм 5 нче периодларда 18 әр элемент, 6 нчы
периодта 32 элемент, 7 нче период тәмамланмаган.
Сорауларга җавап бирегез һәм 1—7 нче күнегүләрне үтәгез (22 нче бит).
§ 4. Периодик системада водород, лантаноид,
актиноид һәм ясалма юл белән табылган
элементларның урыны
•
Химик элементларның Д. И. Менделеев периодик системасын¬
да водородның урыны. Водородның химик билгесе, гадәттә, I төркем¬
нең төп төркемчәсенә (IA-төркемгә) һәм VII төркемнең төп төркемчәсенә
15
(VIIA-төркемгә) урнаштырылуын сез, ихтимал, күреп алгансыздыр. Сорау
туа: ул ни өчен шулай? Аңа җавап бирү өчен, гади матдә буларак водо¬
родның химик үзлекләрен искә төшерербез.
Водород — кайтаргыч (кайтаручы), ягъни ул электроннар доноры.
Водородның үзлекләре белән металл характерлы элементларның
үзлекләре арасында охшашлык булуны исәпкә алып, водородның химик
билгесен IA-төркемгә урнаштыралар.
Ләкин водород IA-төркемдәге металлик элементлар белән дә реакциягә
керә. By реакцияләрдә водород оксидлаштыру үзлекләрен күрсәтә һәм ул
-1 оксидлашу дәрәҗәсен ала:
Г2е’1
0 0 +1-1
2К + H2 = 2КН
VIIA-төркемдәге неметаллар IA-төркемдәге металлар белән реакциягә
кергәндә дә шуңа охшашлы процесс күзәтелә:
Г2е"1
0 0 +1-1
2К + Cl2 = 2КС1
Шуңа нигезләнеп, водородның химик билгесен VIIA-төркемгә дә ур¬
наштыралар. Ләкин водородка оксидлаштыру үзлекләренә караганда
күбрәк кайтару үзлекләре хас булганлыктан, VII төркемдә аның химик
билгесен, гадәттә, җәяләр эченә алалар. (ИЮПАК водородны I төркемгә
генә урнаштырырга тәкъдим итә.)
Периодик системада лантаноидларның һәм актиноидларның урыны.
Лантаноидларга церийдан Ce алып лютецийга Lu кадәр (тәртип номерлары
58—71) барысы ундүрт химик элемент керә. Аларның атомнарында
/-электроннар булганлыктан, лантаноидларны /-элементларга кертәләр.
Ирекле хәлдә лантаноидлар — типик металлар.
Актиноидларга торийдан Th алып лоуренсийга Lr кадәр буган ундүрт
химик элемент (тәртип номерлары 90—103) керә. Бу элементларның
атомнарында да шулай ук /-электроннар бар, шуңа күрә актиноидларны
да, лантаноидлар кебек үк, /-элементларга кертәләр.
Актиноидлар семьялыгы элементлары атомнарында электроннар,
лантаноидлардагы шикелле үк, тышкы яктан өченче энергетик дәрәҗәләрне
(5/-кече дәрәҗә) тутыра башлыйлар. Тышкы һәм, кагыйдә буларак,
СЕЗ
БЕЛӘСЕЗМЕ?
Церий практик яктан иң әһәмиятле лантаноидлардан са¬
нала. Аның тимер катнаштырылган эретмәсе ышкыганда
бик җиңел чаткы бирә, шуңа күрә аннан кабызгычлар өчен
ташлар ясыйлар. Аз гына церий өстәлгән эретмәләрнең
коррозиягә бирешмәүчәнлеге, кызуга чыдамлылыгы, ка¬
тылыгы, ныклыгы һәм пластиклыгы яхшыра.
16
СЕЗ
БЕЛӘСЕЗМЕ?
Лантаноидларның төрле кушылмалары электрон-хисап-
лау җайланмаларында кулланыла. Лантаноидлы кушыл¬
малар катнаштырылган пыялалар ультрамиләүшә нур¬
ларны тоткарлыйлар. Шуңа күрә мондый пыяладан ме-
талларны эретеп ябыштыру эшләрен башкаручылар,
пыяладан өреп әйберләр ясаучылар, металлурглар өчен
саклагыч күзлекләр, шулай ук даруларны саклау өчен
савытлар ясыйлар.
аннан алда килгән электрон дәрәҗәләре үзгәрешсез кала. Шуңа күрә
актиноидларның химик үзлекләре үзара охшаш.
Барлык актиноидлар да радиоактив. Торий Th, протактиний Pa һәм уран
U табигатьтә ярымтаркалу периоды зур булган изотоплар рәвешендә очрый.
Актиноидларның калганнары, нигездә, ясалма юл белән табылган.
Уран U, плутоний Pu һәм башка актиноидлар төш энергиясе табу өчен
файдаланыла.
Периодик системада лантаноидлар һәм актиноидларның химик бил¬
геләре, гадәттә, химик элементлар төркемнәре астына ике рәт итеп урнаш¬
тыралар (беренче форзацны карагыз).
Ясалма рәвештә табыла торган химик элементлар төш реакцияләрендә
хасил була (8 нчы сыйныф, § 37). Периодик таблицада алар атомнарының
электронлы төзелешенә тиңдәшле рәвештә урнаштырылган.
Инде күп кенә химик элементлар синтезланган. Аерым алганда,
менделевий Md элементы (тәртип номеры 101) 1955 елда эйнштейний
атомнарына α-кисәкчек белән тәэсир итеп табыла:
2QgEs + пНе > ioiMd
Сорауларга җавап бирегез, 8—10 нчы күнегүләрне үтәгез (22 нче бит). 1, 2 нче
мәсьәләләрне чишегез (23 нче бит).
§ 5. Валентлык һәм атомнарның
валентлык мөмкинлекләре
Валентлык. «Валентлык» төшенчәсе химиядәге әһәмиятле төшенчәләрдән
санала. Химик бәйләнешләр турындагы тәгълиматның үсеше бу төшенчәнең
физик мәгънәсен аңларга мөмкинлек бирде.
■ „ ■ ....Ul— ... — . .- ■
Хәзерге вакытта химик элементларның валентлыгын бирелгән
атомның башка атомнар белән кушылгандагы ковалент бәйләнешләр
саны белән билгеләү кабул ителгән.
17
Химик бәйләнешләр ясалуда, нигездә, төгәлләнмәгән тышкы энергетик
дәрәҗәләрдәге электроннар катнаша. Шуңа күрә элементларның макси¬
маль валентлыгы, ягъни ковалент бәйләнешләрнең максималь саны,
шул энергетик дәрәҗәләрдәге электроннар саны белән билгеләнә. Ка¬
гыйдә буларак, бу электроннар башка элемент атомнарының тышкы
электроннары белән уртак пар электроннар хасил итәргә сәләтле. Шуңа күрә
элементларның валентлыгын химик бәйләнеш хасил иткән пар электрон¬
нар саны белән дэ билгелиләр.
Атомнарның валентлык мөмкинлекләре. Сезгә билгеле булганча,
валентлыкның санча кыйммәте күпчелек очракта химик элементларның
Д. И. Менделеев периодик системасындагы төркем номерына туры килә.
Ләкин чыгармалар да бар.
Мәсәлән, 2 нче периодтагы элементлар — азот N, кислород O һәм фтор
F бу кагыйдәгә буйсынмыйлар. Ни өчен кагыйдәдән тайпылу күзәтелә?
Бу сорауны конкрет мисалларда тикшерик.
Ни өчен фосфор P төркем номерына туры килгән +5 саны белән үзенең
югары валентлыгын күрсәтә, ә азотка N ул хас түгел. Бу күренеш азот
атомында фәкать өч кенә парлашмаган электрон булуы һәм азотның,
мәсәлән водородлы кушылмаларда, өч валентлы булуы белән аңлатыла.
Электрон парларны аерырга мөмкин түгел, чөнки азот атомының тышкы
энергетик дәрәҗәсендә буш орбитальләр юк:
2s2 2р3
Is2 2s2 2р3
Is Is' Is' Is'
H+HHH
6 нчы рәсем. Аммоний ионы ясалу
Азотның иң зур валентлыгы, 6 нчы
рәсемдә күрсәтелгәнчә, фәкать дүрткә
генә тигез булырга мөмкин. Рәсемнән
күренгәнчә, парлашмаган электроннар¬
ны антипараллель спиннар белән уртак-
лаштырганда, азот атомы белән өч во¬
дород атомы арасында өч ковалент
СЕЗ
БЕЛӘСЕЗМЕ?
«Валентлык» төшенчәсен 1853 елда инглиз галиме
Э.Франкленд кертә, ә 1858 елда немец галиме А. Кекуле
углерод атомының дүрт валентлы булуы турында фикер
әйтә. Органик химияне үстерүдә бу фикернең әһәмияте
гаять зур була.
18
бәйләнеш хасил була. Ә дүртенче ковалент бәйләнеш исә, азот атомы белән
водород ионындагы H+ ирекле s-орбиталенең уртак пар электроннары
исәбенә ясала. Азот атомының ни өчен югарырак валентлыкны күрсәтә
алмавы инде аңлашыла.
Тагын бер мисал тикшерик. Кислород VI төркемдә урнашкан булуына
карамастан, гадәттә, ике валентлы, ә күкертнең валентлыгы үзенең төркем
номерына туры килә. Нилектән?
Күкерт атомындагы электроннарның орбитальләрдә урнашуы түбәндәгечә
була:
3s2 Зр4
3d0
Схемадан күренгәнчә, күкерт атомында парлашмаган ике электрон бар.
Дөрестән дә, күкертнең ике валентлы кушылмалары бар, әйтик, сероводород
H2S. Күкерт атомнарының тышкы энергетик дәрәҗәсендә буш d-орбитальләр
бар, шунлыктан Зр- һәм Зз-электрон парларның бүленүе нәтиҗәсендә
парлашмаган дүрт яисә алты электрон хасил булырга мөмкин:
Күкертнең ни өчен дүрт валентлы була алуы (мәсәлән, күкерт(1Ү)
оксидында SO2) һәм алты валентлы булуы (мәсәлән, күкерт(У1) оксидында
SO3) моннан ачык күренә.
Кислород атомында электроннар орбитальләрдә түбәндәгечә урна¬
шалар:
Is2 2s2
+8О
2р4
Кислород атомында, күкерт атомындагы кебек үк, парлашмаган
ике электрон бар, тышкы энергетик дәрәҗәдә буш орбитальләр булмау
сәбәпле, электрон парларның бүленүе булмый. Шуңа күрә кислород ике
валентлы.
Инде безгә билгеле булганча, кислород атомы, үзенең бүленмәгән бер
пар электроннарын водород ионының буш орбиталенә биреп, гидроксоний
ионы хасил итә ала. Гидроксоний ионы ясалу процессы аммоний ионы
ясалу процессына охшаган:
19
яки
I 1 н
H++ H :0: H—*[ΗΌ: H]+,
H+ + H9O > H4O+
Z ο
Схемадан күренгәнчә, аммоний ионы ясалганда, азот атомы уртак пар
электроннарын биргән кебек, кислород атомы да уртак пар электроннарын
бирә, ягъни ул — донор, ә H+ ионы акцептор булып тора. Шулай итеп,
схемада донорлы-акцепторлы механизмлы ковалент бәйләнеш сурәтләнгән.
Димәк, гидроксоний ионында кислород өч валентлы.
Аммоний һәм гидроксоний ионнарының ясалу процессы түбәндәге
нәтиҗәне ясарга мөмкинлек бирә:
Атомнарныц валентлык мөмкинлекләре парлашмаган электроннар
саны белән генә түгел, бәлки башка элемент атомнарының буш
орбитальләренә күчәргә сәләтле бүленмәгән пар электроннарының саны
белән дә билгеләнә.
Ләкин валентлыкны бирелгән атомның башка атомнар белән тоташ¬
кандагы бәйләнешләр саны белән билгеләү кабул ителгәнлектән, әлеге
билгеләмә ковалент бәйләнешле кушылмаларга гына карый, чөнки ионлы
кушылмаларда ионнар арасындагы бәйләнешләр саны валентлык берәм¬
лекләре санына туры килми.
Атомнар валентлыгының һәм үлчәмнәренең периодик үзгәрүе.
Элементларның валентлыклары һәм, димәк, үзлекләренең периодик
рәвештә үзгәрүе атомнарның төш корылмалары арта барганда электронлы
төзелешләре охшаш элементларның периодик рәвештә кабатлануына
бәйләнгән. Мәсәлән, литий Li, натрий Na һәм калий К; бериллий Be, магний
Mg һ.б.
Бу элементлар атомнарының радиуслары да периодик эзлеклелектә арта.
Мәсәлән, 2 нче периодта литий Li элементыннан алып фтор F элементына
кадәр урнашкан атомнарның радиуслары акрынлап кими, ә инде фтор
F элементыннан натрий Na элементына кадәр урнашкан атомнарның
радиуслары кискен рәвештә арта. Бу күренеш болай аңлатыла.
Литийдан Li фторга F күчкәндә, андагы элемент атомнарының төш
корылмасы арта бара. Шуңа бәйле рәвештә бу рәттә тышкы электроннарның
төшкә тартылу көче арта, ә атомнарның үлчәмнәре кечерәя. Ә инде фтор F
элементыннан натрий Na элементына күчкәндә, моннан соң килгән электрон
төштән ерактарак торган өченче энергетик дәрәҗәгә урнаша. Шуңа күрә
натрий Na элементының үлчәмнәре шактый зурая.
20
СЕЗ
БЕЛӘСЕЗМЕ?
Кислород үзенең максималь валентлыгы 4 не күрсәткән
кушылмалар да бар. Андый кушылмалар югары мәктәп
курсында өйрәнелә.
■ ·ί , '.■■■ I И.И. ...И. HI i . !■ Ulllll
Атомнарның үлчәмнәре үз чиратында аларның үзлекләренә йогынты
ясый. Мәсәлән, литий Li, натрий Na, калий K элементлары атомнарының
үлчәмнәре шул ук периодлардагы башка элемент атомнарыныкына караганда
зуррак. Шул сәбәпле селтеле металл атомнарының тышкы электрон¬
нары төштән ерактарак урнашкан, төшкә аз көч белән тартылалар һәм
җиңел генә аннан читкә китә алалар. Селтеле металларның ни өчен
электроннар доноры, ягъни көчле кайтаргыч булуы нәкъ шуның белән
аңлатыла. Периодларда типик металл элементлардан галогеннарга
күчкәндә, атомнарның үлчәмнәре кечерәя, тышкы электроннарның төшкә
тартылу көче арта, ә ул кайтару үзлекләренең кимүенә һәм оксидлаштыру
үзлекләренең артуына китерә.
Химик элементларның валентлыклары периодик рәвештә үзгәрүе
аркасында, аларның оксидларының һәм водородлы кушылмаларының
(гибридларның) формалары (составы, төзелеше) һәм үзлекләре периодик
рәвештә үзгәрә. Мәсәлән, литий оксиды Li2O, натрий оксиды Na2O, калий
оксиды K2O үзләренең составлары һәм төзелешләре белән генә түгел,
бәлки үзлекләре белән дә үзара охшашлар. Аларның барысы да су белән
көчле реакциягә керә һәм көчле селте үзлекле нигезләр хасил итә. Ләкин
бу оксидлар арасында аермалыклар да бар. Литий оксидыннан калий
оксидына күчкәндә, ягъни төркемдә өстән аска төшкәндә, оксидларның
нигез үзлекләре көчәя. Мәсәлән, калий оксиды натрий оксидына караганда
чагыштырмача көчлерәк селте хасил итә.
Башка А-төркемнәрдә дә шундый ук закончалык күзәтелә. Мәсәлән,
IVA-төркемнең югары оксидлары — углерод(ГУ) оксиды CO2, кремний(ГУ)
оксиды SiO2, германий(ГУ) оксиды GeO2, аккургаш(1У) оксиды SnO2,
Kypram(IV) оксиды PbO2 — составлары белән дә һәм кайбер үзлекләре белән
дә бер-берсенә охшаганнар. Ләкин углерод (IV) оксиды CO2 ул — кислота
оксиды. Ә кремний(ГУ) оксидының SiO2 кислота үзлекләре азрак беленә.
Ә аккургаш(1У) оксиды һәм Kypram(IV) оксиды — амфотер үзлекле кушыл¬
малар: аларның кислота үзлекләре тагын да азрак беленә.
Гидридларның да формалары һәм үзлекләре периодик рәвештә үзгәрә.
I—III төркемнәрнең төп төркемчәсендәге (А-төркемнәрендәге) металлар
водород белән очмаучан водородлы кушылмалар хасил итәләр. Мәсәлән,
литий гидриды LiH, натрий гидриды NaH, калий гидриды KH формалары
белән дә, үзлекләре белән дә үзара охшаганнар.
IV—VII төркемнәрнең төп төркемчәсе (А-төркемнәр) элементлары
водородлы очучан кушылмалар хасил итәләр. Бу кушылмаларның да
21
формалары һәм үзлекләре периодик рәвештә үзгәрәләр. Мәсәлән, галоген¬
нарның водородлы кушылмалары — фтороводород HF, хлороводород
HCl, бромоводород HBr, иодоводород HI — формалары белән дә, шулай ук
үзлекләре белән дә бер-берсенә охшаганнар.
Сорауларга җаваплар бирегез һәм 11 —17 нче күнегүләрне үтәгез. 3—4 нче
мәсьәләләрне чишегез (23 нче бит).
?
1. Периодик законның Д. И. Менделеев
биргән формулировкасын хәзерге форму¬
лировкасы белән чагыштырыгыз. Фор¬
мулировканы ни өчен шулай үзгәртергә
кирәк булганын аңлатыгыз.
2. Периодлардагы элементларның
саны ни өчен 2—8—18—32 саннарына
туры килә? Электроннарның энергетик
дәрәҗәләрдә урнашуын исәпкә алып, бу
закончалыкны аңлатыгыз.
3. Атомнар төзелеше теориясеннән
чыгып, элементлар төркемнәренең ни өчен
төп (А-төркеменә) һәм ян төркемчәләргә
(Б-төркеменә) бүленүен аңлатыгыз.
4. Нинди билгеләргә карап элемент¬
ларны 8-, р-, d- һәм /-элементларга бүлеп
йөртәләр?
5. Химик элементларның Д. И. Мен¬
делеев периодик системасы таблицасыннан
файдаланып, ванадий V, никель Ni һәм
мышьяк As элементлары атомнарында
электроннарның орбитальләрдә һәм энер¬
гетик дәрәҗәләрдә урнашулары схемасын
төзегез. Бу элементларның кайсылары
р-элементларга һәм кайсылары d-элемент¬
ларга керә һәм ни өчен?
6. Элемент атомында электроннарның
энергетик дәрәҗәләр буенча бүленешенә
түбәндәге саннар рәте туры килә:
2—8—18—7. Периодик таблицада бу
элемент урнашкан төркем:
1) IVA 2) VIIA 3) IVB 4) VIIB
7. Химик элемент белән аның нейт¬
раль атомнарының электронлы конфигу¬
рациясен туры китерегез:
1) N A. Is2 2з2 2рв 3s1
2) Ar Б. Is2 2s2 2р6 3s2 Зр5
3) Na B. Is2 2з2 2р3
4) Cl Г. Is2 2s2 2р6 3s2 Зр°
1
2
3
4
8. Водородның химик билгесен ни өчен,
гадәттә, I төркемнең төп төркемчәсенә һәм
шулай ук VII төркемнең төп төркемчәсенә
урнаштыралар? Аңлатыгыз.
9. Электроннарның орбитальләргә
таралып урнашу закончалыгына таянып,
лантаноидлар белән актиноидларның ни
өчен охшаш химик үзлекләргә ия булу¬
ларын аңлатыгыз.
10. Ясалма юл белән табылган, сезгә
билгеле элементларның исемнәрен әйтегез,
химик элементларның Д. И. Менделеев
периодик системасы таблицасында алар-
ның урыннарын күрсәтегез һәм шул эле¬
мент атомнары электроннарының орби¬
тальләрдә ничек урнашуын күрсәтүче
схемаларны сызыгыз.
11. Атомнарның төзелеше һәм химик
бәйләнешләр ясалу турында хәзерге ка¬
рашлардан чыгып, «валентлык» төшен¬
чәсенең асылын аңлатып бирегез.
12. Ни өчен валентлыкның санча кыйм¬
мәте тышкы энергетик дәрәҗәләрдәге элек¬
троннар санына һәрвакытта да туры килми?
13. 2 нче периодтагы элементларның
югары валентлыгы ни өчен 4 тән артмый?
14. Азотның нитрат кислотасындагы
валентлыгын, углеродның һәм кислород¬
ның углерод(П) оксидындагы валентлы¬
гын чагылдыручы электронлы схемалар
төзегез.
15. Хәзерге карашлар буенча «валент-
лык» төшенчәсе ни өчен ионлы кушыл¬
маларга карата кулланыла алмый?
16. Периодларда сулдан уңга таба
һәм бер периодтан икенчесенә күчкәндә,
атомнарның радиуслары нинди законча¬
лык буенча үзгәрә?
17. Периодик законның Д. И. Мен¬
делеев әйткән һәм хәзерге формулиров¬
каларын исегезгә төшерегез. Конкрет
мисаллар белән химик элементларның
үзлекләре генә түгел, бәлки аларның ку¬
шылмаларының формалары һәм үзлекләре
дә периодик рәвештә үзгәрүен раслагыз.
22
ф 1. 0,68 г билгесез матдә тулысынча
янганда 1,28 г күкерт(1У) оксиды һәм
0,36 г су барлыкка килгән. Яндырыл¬
ган матдәнең химик формуласын та¬
быгыз.
2. 10 г натрий гидроксиды булган
эремә аша 20 г сероводород уздыралар. Бу
вакытта нинди тоз барлыкка килә? Аның
массасын һәм микъдарын табыгыз.
3. 100 г алюминий хлориды крис-
таллогидратыннан AlCl3 · 6Н2О ничә
грамм алюминий оксиды табарга мөм¬
кин?
4. 18 г техник алюминийга артыграк
алынган натрий гидроксиды эремәсе белән
тәэсир иткәннәр. Бу вакытта 21,4 г газ
(н. ш.) аерылып чыккан. Әгәр техник
алюминий составындагы катышмаларда
натрий гидроксиды белән реакциягә
керергә сәләтле башка матдәләр булмаса,
катышманың микъдарын процентларда
исәпләгез.
Матдә тезелеше
WM Ж!'
Ill БҮЛЕК
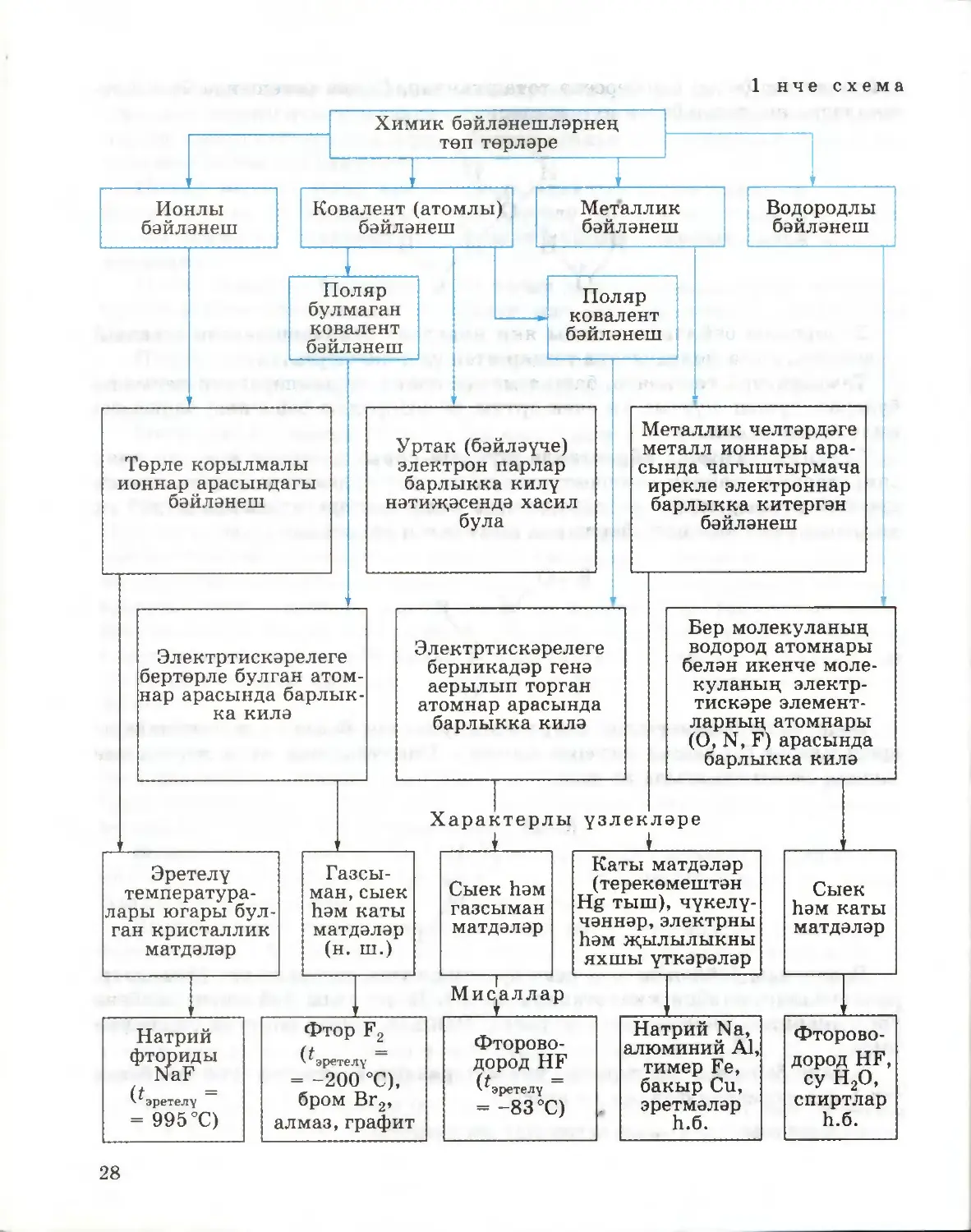
§ 6. Химик бәйләнешнең төп төрләре
Атомнарның, бер-берсенә кушылып, гади матдәләр дә, катлаулы матдәләр
дә хасил итә алулары сезгә VIII сыйныфның химия курсыннан мәгълүм
инде. Бу очракта төрле химик бәйләнешләр: ионлы, ковалент (поляр
булмаган һәм поляр), металлик һәм водородлы бәйләнешләр барлыкка
килә. Атомнар арасында нинди бәйләнеш: ионлымы, әллә ковалент
бәйләнешме барлыкка килүен билгеләүче мөһим күрсәткечләрнең берсе
булып электртискэрелек, ягъни атомнарның башка атомнардан үзләренә
электроннарны тарта алу сәләте торуын хәтергә төшерик. Шуның белән
бергә, атомнарның электртискәрелеге эзлекле рәвештә үзгәрүен дә игътибарга
алырга кирәк. Периодик системадагы периодларда электртискәрелекләрнең
санча кыйммәтләре сулдан уңга арта, ә төркемнәрдә өстән аска таба кими.
Бәйләнеш төре кушылучы атомнарның электртискәрелеге кыйммәтләре¬
нең аермасына бәйле булганга күрә, химик бәйләнешнең аерым төрләре
арасына чик куярга мөмкин түгел. Химик бәйләнеш үзенең табигате буенча
чиктәш очракларның кайсына якынрак торуына карап, аны ионлы яки
поляр ковалент бәйләнешкә кертәләр.
Ионлы бәйләнеш. Ионлы бәйләнеш электртискэрелеклэре кискен
аерылып торган атомнар үзара тәэсир итешкәндә ясала. Мәсәлән, литий Li,
натрий Na, калий К, кальций Ca, стронций Sr, барий Ba типик металлары
типик неметаллар, нигездә, галогеннар белән ионлы бәйләнеш барлыкка
китерәләр.
Практик яктан тулы мәгънәсендә ионлы бәйләнеш ясалмавын исәпкә
алырга кирәк. Хәтта ионлы кушылмаларда да электроннар бер атомнан
икенчесенә тулысынча күчмиләр; электроннар өлешчә уртак файдалануда
кала. Мәсәлән, литий фторидында 80% — ионлы бәйләнеш, ә 20% —
ковалент бәйләнеш.
Иң актив металларның галогенидларыннан тыш, ионлы бәйләнеш
селтеләргә һәм составларына актив металлар һәм кислород атомнары
кергән тозларга да характерлы. Мәсәлән, натрий гидроксидында NaOH
һәм натрий сульфатында Na2SO4 бары тик натрий һәм кислород атомнары
арасында гына ионлы бәйләнеш күзәтелә. Калганнары — поляр ковалент
24
бәйләнешләр. Сыегайтылган судагы эремәләрендә селтеләр һәм тозлар болай
диссоциацияләшәләр:
NaOH = Na+ + OH-
Na2SO4 = 2Na+ + SO4
Ионнар арасында электростатик тартылу көчләре тәэсир итә. Шунлыктан
ионлы кушылмаларның эретелү температуралары чагыштырмача югары.
Поляр булмаган ковалент бәйләнеш. Электртискэрелеклэре бертөрле
атомнар кушылганда, поляр булмаган ковалент бәйләнешле молекулалар
барлыкка килә. Мондый бәйләнешнең, мәсәлән, бертөрле атомнардан
торучы газ хәлендәге матдәләрнең H2, F2, Cl2, O2, N2 молекулаларына хас
булуын хәтергә төшерик. Бу очракларда химик бәйләнешләр уртак электрон
парлар исәбенә, ягъни атомнар бер-берсенә якынлашканда, үзара электрон-
төш тәэсиренә бәйле рәвештә, тиешле электрон орбитальләре аралашканда
барлыкка киләләр.
Поляр булмаган ковалент бәйләнешле матдәләрнең (азот молекуласы N2
мисалында) электронлы формулаларын төзү эзлеклелеген тикшерик.
1. Азот атомындагы электроннарның энергетик дәрәҗәләрдә һәм кече
дәрәҗәләрдә бүленеше схемасын язалар:
Is2 2s2 2р3
2. Азот атомында өч парсыз электрон булуын, шуңа күрә азот атомнары
арасында бәйләүче өч пар электроннар барлыкка килүен билгелиләр:
NHN
3. Ьәр азот атомының тышкы электрон дәрәҗәсендәге бүленмәгән пар
электроннарны болай билгелиләр:
:Ν·:Ν:
Матдәләрнең электронлы формулаларын язганда, нокталар белән
күрсәтелгән уртак электрон парлар тиешле электрон орбитальләре
аралашудан барлыкка килгән яңа болытлар булуын истә тотарга кирәк.
Азот молекуласындагы р-электрон орбитальләре аралашудан бер σ- һәм ике
π-бәйләнеш хасил була. Бу очракта нык өчле бәйләнеш ясала.
Ионнарның үзара тәэсир итешүеннән аермалы буларак, аерым нейтраль
молекулалар арасындагы тартылу көчләре зур түгел, шунлыктан поляр
ковалент бәйләнешле матдәләргә түбән эретелү температуралары хас.
25
Поляр ковалент бәйләнеш. Электртискәрелекләре берникадәр генә
аерылып торган атомнар үзара тәэсир итешкәндә, уртак бәйләүче электрон
парлар электртискәрелеге зуррак булган атомга таба авышалар, һәм поляр
ковалент бәйләнеш барлыкка килә.
Поляр молекулалар арасында да электростатик тартылу көчләре
булганлыктан, бу кушылмаларның эретелү һәм кайнау температуралары
поляр булмаган ковалент бәйләнешле кушылмаларныкыннан шактый
югарырак.
Поляр ковалент бәйләнешләргә тагын донорлы-акцепторлы механизм
буенча ясалган бәйләнешләр дә керәләр, мәсәлән, гидроксоний һәм аммоний
ионнарында.
Поляр ковалент бәйләнеш — химик бәйләнешләрнең аеруча киң
таралган төре, ул неорганик кушылмаларда да, органик кушылмаларда да
очрый.
Металлик бәйләнеш. Кристаллик челтәрдәге металл ионнары арасында
чагыштырмача ирекле электроннар барлыкка китергән бәйләнеш металлик
бәйләнеш дип атала.
Металлик бәйләнеш барлыкка килүнең асылы түбәндәгедән гыйбарәт.
Металл атомнары тышкы электроннарын җиңел бирәләр, һәм аларның
кайберләре уңай корылмалы ионнарга әвереләләр. Атомнардан аерылып
киткән электроннар металларның хасил булган уңай корылмалы ионнары
арасында чагыштырмача иркен күчәләр. Бу кисәкчекләр арасында металлик
бәйләнеш туа, ягъни электроннар металлик челтәрдәге уңай корылмалы
ионнарны цементлап куйгандай итәләр (12 нче рәсем, г). Металларның
шундый төзелеше аларның үзенчәлекле физик үзлекләрен билгели дә
инде.
Электр һәм җылы үткәрүчәнлек металлик челтәрләрдә ирекле электрон¬
нар булуга бәйле. Металларның чүкелүчәнлеге һәм пластиклыгы металлик
челтәрдә металл атомнарының һәм ионнарының бер-берсе белән турыдан-
туры бәйләнештә тормавы һәм аларның аерым катламнары бер-берсенә
карата ирекле күчә алуы белән аңлатыла.
Водородлы бәйләнеш. Бер молекуланың водород атомнары һәм икенче
молекуланың электртискәре элементларының атомнары (O, N, F) ара¬
сындагы бәйләнеш водородлы бәйләнеш дип атала.
Шундый сорау туарга мөмкин: ни өчен нәкъ менә водород шулай үзен¬
чәлекле химик бәйләнешләр хасил итә ала соң? Ул шуңа бәйле ки, водород
атомының радиусы бик кечкенә, һәм бердәнбер электроны авышканда яки
аны биргәндә, водород чагыштырмача көчле уңай корылмага ия була. Бу
корылма матдәләрнең молекулаларындагы электртискәре элементларга
тәэсир итә дә инде. Кайбер мисалларны тикшереп узыйк. Без суның
составын H2O формуласы белән күрсәтергә гадәтләнгәнбез, әмма суның
составын (H2O)n формуласы белән билгеләү дөресрәк булыр иде (монда п
2, 3, 4 һ. б. га тигез), чөнки суның аерым молекулалары водородлы
26
бәйләнешләр белән бер-берсенә тоташканнар. Схема рәвешендә бу бәйлә¬
нешләрне нокталар белән күрсәтәләр:
Водородлы бәйләнеш ионлы яки ковалент бәйләнешләрдән шактый
көчсезрәк, әмма молекулаара тәэсир итешүдән көчлерәк.
Температура төшкәндә, башка матдәләрнең күләмнәреннән аермалы
буларак, суның күләме ни өчен артуы да водородлы бәйләнеш барлыкка
килү белән аңлатыла.
Органик химияне өйрәнгәндә шундый сорау да туган иде: ни өчен
спиртларның кайнау температуралары тиешле углеводородларныкыннан
шактый югарырак? Бу — спиртларның молекулалары арасында шулай ук
водородлы бәйләнешләр барлыкка килү белән аңлатыла:
R-O4
4H R
··. «■/
O
H
Водородлы бәйләнешләр спирт молекулалары белән су молекулалары
арасында да барлыкка килергә мөмкин. Спиртларның суда эрүчәнлеге
шуның белән аңлатыла да инде:
H I
°\
H
Водородлы бәйләнеш күп кенә органик кушылмаларга хас (феноллар,
альдегидлар, карбон кислоталары һ. б.). Водородлы бәйләнеш исәбенә
аксымнарның икенчел структурасы, ДНКның икеле спирале барлыкка
килә.
Химик бәйләнешләр турында уку материалын йомгаклау максаты белән
сез 1 нче схемадан файдалана аласыз.
1—4 нче сорауларга җавап бирегез (41 нче бит).
27
1 нче схема
28
■ § 7. Неорганик һәм органик матдәләр
молекулаларының пространстволы төзелеше
Молекулаларның пространстволы төзелешен билгеләүче фактор була¬
рак ковалент бәйләнешнең юнәлешлелеге. Электрон орбитальләренең
формалары һәм пространстводагы юнәлешләре нинди булуга бәйле рәвештә,
алар үзара аралашканда сызыкча һәм почмаклы формадагы молекулалар
барлыкка килергә мөмкин.
Неорганик һәм органик химия курсларыннан белгәнегезчә, химик
бәйләнешләрнең юнәлешлелеге электрон орбитальләренең пространствода
төрлечә урнашулары белән аңлатыла.
Электрон орбитальләре үзләренең формаларын гибридлашу нәтиҗәсендә
үзгәртә алу ихтималы да сезгә билгеле. Гибрид электрон орбитальләре
пространствода шулай ук төрлечә урнаша алалар.
Органик химия курсын өйрәнгәндә сез sp3-, sp2- һәм sp-гибридлашу
белән танышкан идегез. Гибридлашуның бу төрләре кайбер неорганик
кушылмаларда да күзәтелә. Гибрид орбитальләрнең пространствода төр¬
лечә урнашуларына бәйле рәвештә дә сызыкча һәм почмаклы төзелешле
молекулалар барлыкка килүе мөмкин.
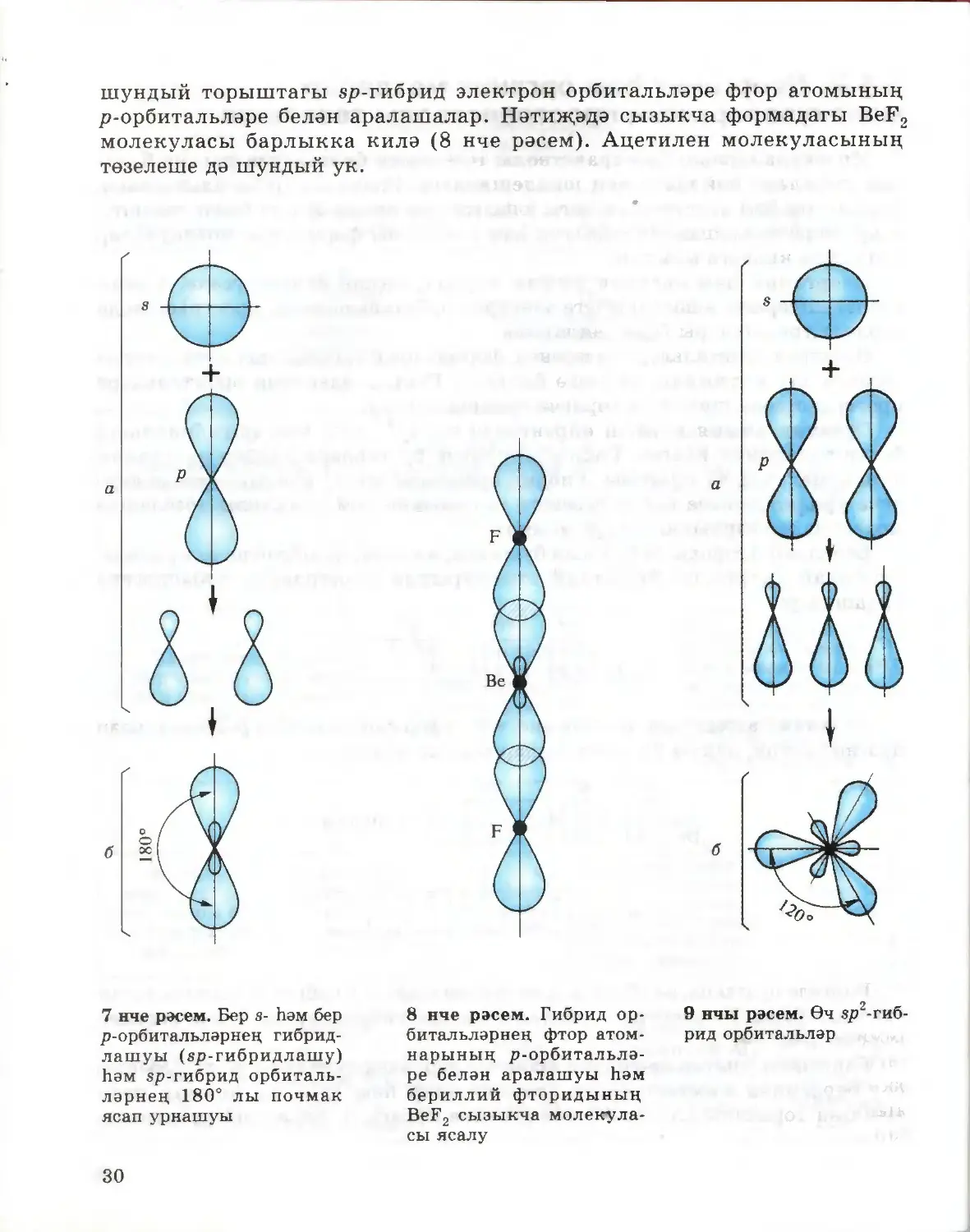
Бериллий фториды BeF2 хасил булганда, мәсәлән, sp-гибридлашу күзәтелә.
Ул болай аңлатыла. Бериллий атомнарында электроннар түбәндәгечә
урнашалар:
Is2 2s2 2р°
Бериллий атомының икенче энергетик дәрәҗәсендә буш р-орбитальләр
булганлыктан, парлы 2в-электроннар аерыла алалар:
Is2 2s2
+4Ве
+ энергия
2s1 2pf
Билгеле булганча, s-орбиталь шар формасында, ә р-орбиталь гантельсыман
формада була. Бу электрон орбитальләренең гибридлашуы 7 нче рәсемдә
күрсәтелгән.
Барлыкка килгән sp-гибрид орбитальләр, электростатик этелү сәбәпле,
бер-берсеннән мөмкин кадәр ераклашалар һәм 180° лы почмак ясап
юнәлгән торышны алалар (7 нче рәсемне карагыз). Бериллий атомының
29
шундый торыштагы sp-гибрид электрон орбитальләре фтор атомының
р-орбитальләре белән аралашалар. Нәтиҗәдә сызыкча формадагы BeF2
молекуласы барлыкка килә (8 нче рәсем). Ацетилен молекуласының
төзелеше дә шундый ук.
7 нче рәсем. Бер s- һәм бер
р-орбитальләрнең гибрид-
лашуы (зр-гибридлашу)
һәм зр-гибрид орбиталь¬
ләрнең 180° лы почмак
ясап урнашуы
8 нче рәсем. Гибрид ор¬
битальләрнең фтор атом¬
нарының р-орбитальлә-
ре белән аралашуы һәм
бериллий фторидының
BeF2 сызыкча молекула¬
сы ясалу
9 нчы рәсем. Өч зр2-гиб-
рид орбитальләр
30
Төзелеше зр2-гибридлашу белән аңлатыла торган молекулага мисал
булып бор хлориды BCl3 молекуласы тора. Бор атомындагы электроннарның
орбитальләрдә урнашуы болай күрсәтелә:
Is2 2s2 2р1
+5В
Энергия өстәлгәндә, 28-электроннар аерылалар һәм бор атомында өч
парсыз электрон барлыкка килә:
Is2
+5
2s1 2р2
8р2-Гибридлашу торышында, бер яссылыкта урнашып, бер-берсенә
120° лы почмак ясап юнәлгән өч гибрид болыт хасил була (10 нчы рәсем).
Бу өч гибрид электрон болыты хлор атомының р-электрон болытлары белән
аралаша, һәм өчпочмаклы формадагы яссы молекула — BCl3 барлыкка
килә (10 нчы рәсем).
sp-Гибридлашу процессында сузынкы очлары тетраэдр түбәсенә юнәл¬
гән, ягъни бер-берсенә 109°28' лы почмак ясап урнашкан дүрт гибрид
орбиталь барлыкка килә. Сезгә билгеле булганча, мондый гибридлашу метан
молекуласы барлыкка килгәндә күзәтелә.
Cy молекуласында бәйләнешләр арасындагы почмак 104,5° тәшкил итә.
Аммиак NH3 молекуласында (11 нче рәсем) бу почмак тагын да зуррак
(107,3°), ягъни тетраэдрныкына (109°28') якынлаша. Моны нәрсә белән
аңлатып була соң? Югыйсә химик бәйләнеш ясалганда, кислород атомын¬
нан ике парсыз гантельсыман р-электрон, ә азот атомыннан өч пар¬
сыз р-электрон катнаша бит. Ә гантельсыман р-электрон орбитальләре
пространствода үзара перпендикуляр яссылыкларда урнашуларын сез
беләсез инде. Шуңа күрә алар арасындагы почмак 104,5° яки 107,3° тү¬
гел, ә 90° тәшкил итәргә тиеш. Бу сорау өстендә уйланып, галимнәр, су
һәм аммиак молекулалары хасил булганда, метан молекуласы барлыкка
килгәндәге кебек үк, орбитальләрнең sp3 тибындагы гибридлашуы турында
нәтиҗәгә килгәннәр.
Шундый сорау да туа: әгәр су һәм аммиак моле¬
кулаларына орбитальләрнең sp-гибридлашуы хас
икән, ни өчен бәйләнешләр арасындагы почмак
тетраэдрныкы белән чагыштырганда кечерәк булып
чыга соң? Бу сорауга җавап бирү өчен, метан CH4,
аммиак NH3 һәм су H2O молекулаларының төзелешен
чагылдырган схемаларны тикшереп узыйк (11 нче
рәсем). 11 нче рәсемнән (а) күренгәнчә, углерод ато¬
мының барлык дүрт вр3-гибрид орбитальләре дә
бәйләүче электрон парлар белән тулган. Азот
JLci
'ν^ν120°
С/Cl сгО
10 нчы рәсем. Бор
трихлоридының BCl3
өчпочмаклы яссы мо¬
лекуласы
31
11 нче рәсем. Водород атомының s-орбитальләре белән үзәк атомның вр3-гибрид орби¬
тальләре аралашу нәтиҗәсендә метан (а), аммиак (б) һәм су (е) молекулалары ясалу
атомында (11 нче рәсем, б) өч 8р3-гибрид орбитальләрне генә бәйләүче
электрон парлар биләп алган, ә дүртенче вр3-гибрид орбитальдә бер пар
уртак булмаган электроннар урнашкан. Кислород атомында исә (11 нче
рәсем, в) бәйләүче электрон парлар бары тик ике зр3-гибрид орбитальләрдә
генә урнашканнар, ә калган икесен уртак булмаган электрон парлар би¬
ләп алган. Димәк, тетраэдрдагы почмак зурлыгыннан (109°28' тан) авышу
8р3-гибрид орбитальләрендәге уртак булмаган электрон парлар тәэсиренә
бәйлелектән килә. Азот атомында шундый электроннар бер пар, шуңа күрә
почмакның тетраэдрныкыннан авышуы зур түгел, һәм почмак 107,3° тәш¬
кил итә. Кислород атомында алар инде ике пар, шунлыктан почмакның
тетраэдрныкыннан авышуы зуррак, һәм почмак 104,5° тәшкил итә.
Cy молекуласы очрагында һәм кайбер башка очракларда гибридлашу
төшенчәсен аңлату шартлы булуын әйтергә кирәк.
Сорауларга җавап бирегез һәм 5—6 нчы күнегүләрне башкарыгыз (41 нче бит).
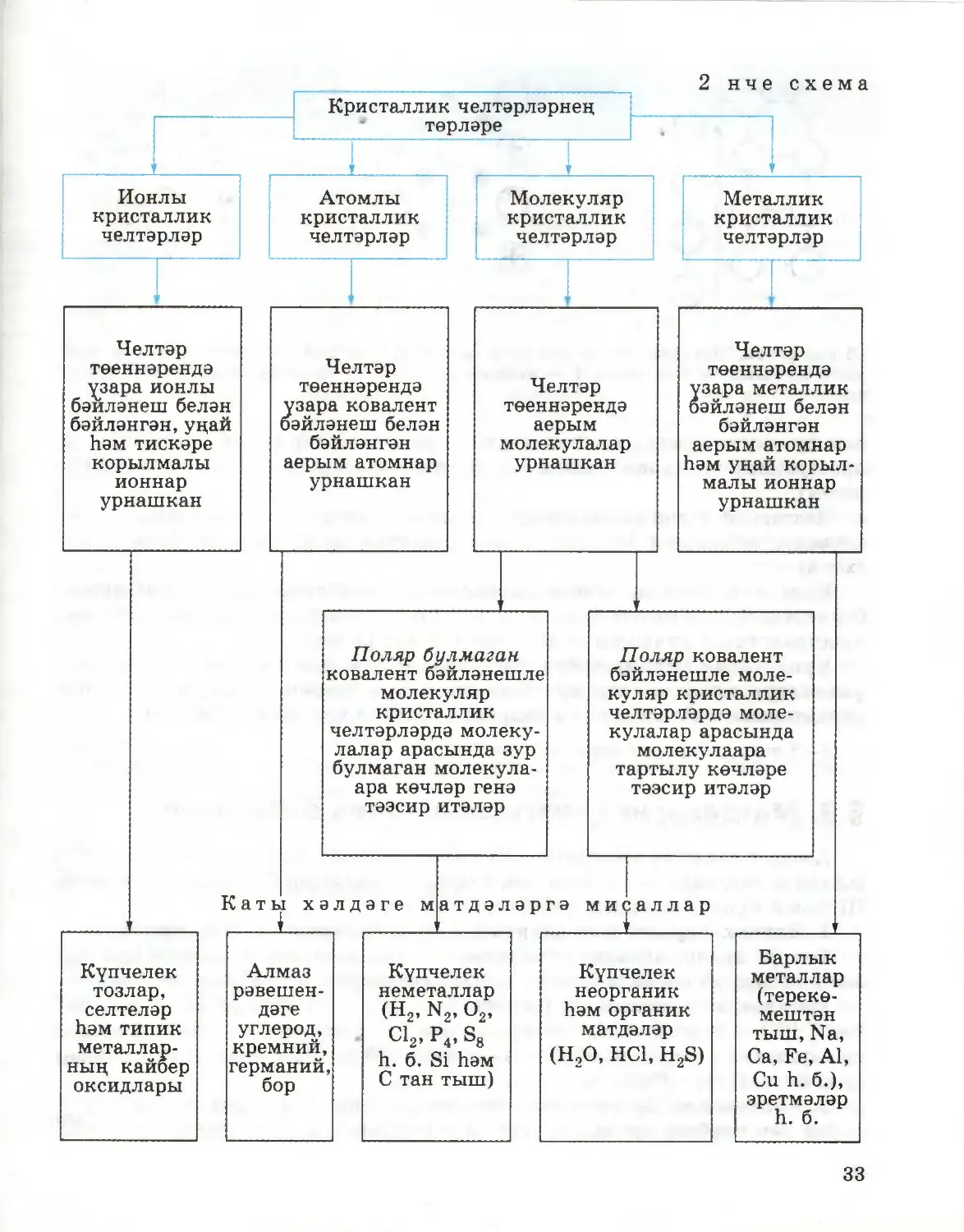
§ 8. Кристаллик челтәрләрнең төрләре
һәм матдәләрнең үзлекләре
Каты матдәләр, кагыйдә буларак, кисәкчекләре пространствода бары тик
периодик рәвештә билгеле бер тәртиптә урнашкан, кристаллик төзелешкә
ия булып торалар. Барлык кисәкчекләрне нокталар белән билгеләсәк
12 нче рәсем. Кристаллик челтәрләрнең
г) металлик
O металл атомы
@ металл катионы
с электрон
типлары': а) атомлы, б) ионлы, в) молекуляр,
32
2 нче схема
Кристаллик челтәрләрнең
төрләре
i
ү
Ионлы
кристаллик
челтәрләр
Атомлы
кристаллик
челтәрләр
Молекуляр
кристаллик
челтәрләр
Металлик
кристаллик
челтәрләр
33
13 нче рәсем. Матдәләрнең кристаллик челтәрләренең төзелеше белән механик нык¬
лыгы арасындагы бәйләнеш: 1 — атомлы челтәр; 2 — металлик челтәр; 3 — ионлы
челтәр
Һәм бу нокталарны кисешеп үтүче туры сызыклар белән тоташтырсак,
пространстволы каркас сыман кристаллик челтәр барлыкка килә (12 нче
рәсем).
Челтәрнең төеннәрендә нинди кисәкчек урнашуга бәйле рәвештә, ионлы,
атомлы, молекуляр һәм металлик кристаллар челтәрләре була (2 нче
схема).
Кристаллик матдәләрнең үзлекләре кисәкчекләр арасындагы химик
бәйләнеш төренә генә бәйле түгел, ә бу кисәкчекләрнең бер-берсенә карата
пространствода урнашуына да бәйле (13 нче рәсем).
Кристаллик челтәрләрнең төп төрләре һәм кристаллик матдәләрнең
үзлекләре кисәкчекләр арасындагы үзара тәэсир итешү көчләренең
характерына бәйлелеге сезгә неорганик химия курсыннан билгеле.
7—8 нче күнегүләрне үтәгез (41 нче бит).
§ 9. Матдәләрнең күптөрлелегенең сәбәпләре
Хәзерге вакытта нибарысы 118 химик элемент билгеле, ә алар берничә
миллион төрледән-төрле гади һәм катлаулы матдәләр барлыкка китерәләр.
Шундый күптөрлелекнең сәбәбе нәрсәдә соң?
1. Элементларның һәм аларның кушылмаларының изотопиясе.
Бер үк химик элемент атомнарының масса саннары төрлечә булырга
мөмкин булуын сез инде беләсез. Андый атомнарны изотоплар дип атыйлар.
Мәсәлән, водородның өч изотобы бар: *Н — протий, jH(D) — дейтрий
һәм θΗ(Τ) — тритий. Алар кислород белән катлаулы матдә — төрле составлы
су барлыкка китерәләр: H2O — гади табигый су, D2O — авыр су (табигый
суда була, H: D = 6900:1).
2. Аллотропия. Бу күренешне без кислород һәм озон; графит, алмаз, фул¬
лерен һәм карбин; кызыл, ак һәм кара фосфор һ. б. мисалларда карадык.
34
Химик элементның берничә гади матдә рәвешендә булу күренешен
аллотропия дип атыйлар.
Бер үк элементтан барлыкка килгән гади матдәләрне аллотроп үзгәргән
төрләр, яки аллотроп модификацияләр дип атыйлар.
Аллотропия күпчелек неметаллар өчен характерлы. Ләкин аллотропия
металларда да булырга мөмкин. Металларның кристаллик челтәрләренең
рентгеноструктур анализы аларның күбесе (Na, Be, Ca, Cr, W, Mn, Fe, Co,
Ni, Sn h. б.) берничә аллотроп модификация барлыкка китерергә сәләтле
булуын күрсәтте. Алар барысы да кристаллик структурасы белән аерылалар.
Мәсәлән, тимернең дүрт аллотроп үзгәргән төре бар: α, β, γ, δ.
3. Изомерия. Бертөрле составлы, ләкин молекулада атомнарның тоташу
эзлеклелеге, аларның пространствода урнашуы һәм шуңа күрә дә үзлекләре
белән аерылып торучы кушылмалар бар. Бу кушылмаларны изомерлар
дип атыйлар, ә күренеш изомерия дип атала. Бу күренеш неорганик һәм
органик кушылмалар арасында очрый. Органик химияне өйрәнгәндә, сез
бу күренеш белән тулырак таныштыгыз.
4. Гомология шулай ук матдәләрнең күптөрлелегенең сәбәбе булып тора.
Бу күренеш органик кушылмаларның һәр классы өчен хас. Гомологлар —
төзелеше һәм химик үзлекләре бертөрле, ләкин составы буенча CH2
төркемнәренең бөтен санына аерылып торучы кушылмалар. Гомологик
рәттә бер матдәнең химик үзлекләрен белеп, органик кушылмалар классын
тулысынча характерларга мөмкин.
5. Безнең әйләнә-тирәбездәге матдәләр табигый матдәләр генә түгел.
Бик күп сандагы матдәләрне ясалма юл белән химик синтез ярдәмендә
табалар. Шуңа күрә химик синтез шулай ук химик кушылмаларның
күптөрлелегенең сәбәбе булып тора.
Шулай итеп, изотопия, аллотропия, изомерия, гомология, химик синтез —
болар барысы да матдәләрнең күптөрлелегенең сәбәбе.
9 нчы күнегүне үтәгез (41 нче бит). 1—2 нче мәсьәләләрне чишегез (41 нче бит).
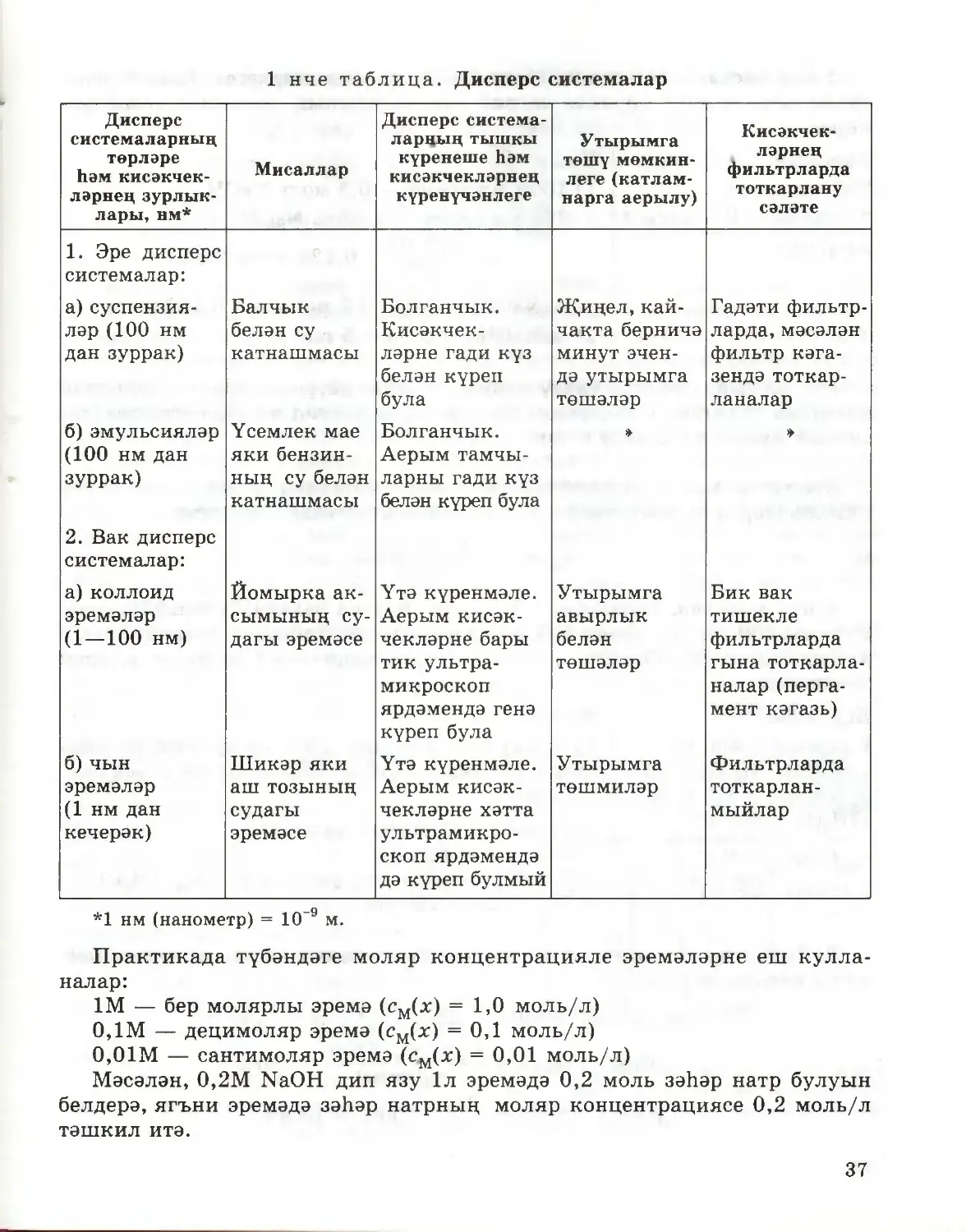
§10. Дисперс системалар
Неорганик химияне өйрәнгәндә, эремәләр һәм матдәләрнең суда
эрү процессы турында сез беренче күзаллауларны алдыгыз. Шунда ук,
матдәләрне су белән катнаштырганда, беришле системалар да (эремәләрнең
характерлы үзлеге), төрле ишле системалар да, ягъни суспензияләр һәм
эмульсияләр хасил булуы турында да әйтеп кителгән иде. Ә сез уйлан¬
дыгызмы икән, ни өчен кайбер матдәләр су белән беришле система, ә баш¬
калары төрле ишле система барлыкка китерәләр соң? Бу сорауга җавап
бирү өчен, матдәләрнең суда эрү процессының асылын ачыкларга кирәк.
Эрегәндә матдәләр вакланалар. Шунлыктан чын эремәләрне, шулай ук
35
суспензияләрне һәм эмульсияләрне дисперс системаларга (диспергирлау
«ваклау» дигән мәгънәне аңлата) кертәләр. Күп кенә дисперс системалар
билгеле. Нинди кисәкчекләр (каты, сыек, газсыман) һәм нинди тирәлектә
(сыек, газсыман) аралашуына карап, алар бер-берсеннән аерылып торалар.
Әйтик, мәсәлән, шундый дисперс системаларның берсе булып төтен яки
һавадагы тузан тора: һава — газлар катнашмасы, ә кисәкчекләр — бик нык
вакланган каты матдәләр. Томан —дисперс система, биредә һава — тирәлек,
ә сыеклыкның вак тамчылары — диспергирланган кисәкчекләр.
Практикада тирәлеге судан һәм башка төрле сыеклыклардан торган
дисперс системаларның әһәмияте аеруча зур. Аралашкан кисәкчекләрнең
зурлыкларына карап, бу системалар чын эремәләргә, яки гадиләштереп
әйткәндә эремәләргә, коллоид эремәләргә һәм эре дисперс системаларга,
яки суспензияләргә һәм эмульсияләргә бүленәләр (1 нче таблица). Димәк,
чын эремәләр шулай ук дисперс системаларга керәләр, әмма аларның дис¬
пергирланган кисәкчекләре бик вак. Нәкъ менә шуңа күрә дә чын эремә¬
ләрне беришле системалар дип атыйлар, чөнки аларның төрле ишлелеген
хәтта ультрамикроскоп ярдәмендә дә күреп булмый. Чын эремәләрдә дис¬
пергирланган кисәкчекләр булып аерым молекулалар, ионнар яки аларның
гидратлары тора. Бу кисәкчекләрнең зурлыклары 1 нм (Ю-9 м) дан да
кимрәк.
Чын эремәләрне куллану өлкәләре гаять киң. Нигездә, алар сезгә таныш.
Бу — промышленность һәм авыл хуҗалыгы, медицина һәм көнкүреш.
Мәктәп химия лабораториясендә эшләгәндә, сез, тозлар, кислоталар, селтеләр
белән реакцияләрне башкару өчен, кагыйдә буларак, бу матдәләрнең судагы
эремәләре кулланылуына ышандыгыз.
Шулай ук үсемлекләрнең минераль ашламаларны бары тик эрегән хәлдә
генә үзләштерүләре турында да сезгә билгеле. Шуңа күрә, югары уңыш алу
һәм үсемлекләрне корткычлардан һәм авырулардан саклау өчен, тиешле
матдәләрнең эремәләрен хәзерли белү мөһим.
Эрегән матдәнең масса өлеше бирелгән эремәне ничек әзерләргә сез инде
беләсез. Лаборатория тикшеренүләрендә билгеле бер молярлыклы эремәләр
белән файдалану уңайлырак. Билгеле бер моляр концентрацияле эремәләр
әзерләүне карарбыз.
Эремәнең моляр концентрациясе (молярлыгы) дип эрегән матдә
микъдарының эремә күләменә чагыштырмасы атала.
с (х} = и*)
tMW У(эремә)
Моляр концентрацияне үлчәү берәмлеге (см) — моль/л.
36
1 нче таблица. Дисперс системалар
Дисперс
системаларның
төрләре
һәм кисәкчек¬
ләрнең зурлык¬
лары, нм*
Мисаллар
Дисперс система-
ларның тышкы
күренеше һәм
кисәкчекләрнең
күренүчәнлеге
Утырымга
төшү мөмкин¬
леге (катлам¬
нарга аерылу)
Кисәкчек¬
ләрнең
фильтрларда
тоткарлану
сәләте
1. Эре дисперс
системалар:
а) суспензия¬
ләр (100 нм
дан зуррак)
б) эмульсияләр
(100 нм дан
зуррак)
2. Вак дисперс
системалар:
а) коллоид
эремәләр
(1—100 нм)
б) чын
эремәләр
(1 нм дан
кечерәк)
Балчык
белән су
катнашмасы
Үсемлек мае
яки бензин¬
ның су белән
катнашмасы
Йомырка ак¬
сымының су¬
дагы эремәсе
Шикәр яки
аш тозының
судагы
эремәсе
Болганчык.
Кисәкчек¬
ләрне гади күз
белән күреп
була
Болганчык.
Аерым тамчы¬
ларны гади күз
белән күреп була
Үтә күренмәле.
Аерым кисәк¬
чекләрне бары
тик ультра¬
микроскоп
ярдәмендә генә
күреп була
Үтә күренмәле.
Аерым кисәк¬
чекләрне хәтта
ультрамикро¬
скоп ярдәмендә
дә күреп булмый
Җиңел, кай-
чакта берничә
минут эчен¬
дә утырымга
төшәләр
»
Утырымга
авырлык
белән
төшәләр
Утырымга
төшмиләр
Гадәти фильтр¬
ларда, мәсәлән
фильтр кәга¬
зендә тоткар¬
ланалар
»
Бик вак
тишекле
фильтрларда
гына тоткарла¬
налар (перга¬
мент кәгазь)
Фильтрларда
тоткарлан¬
мыйлар
*1 нм (нанометр) = 10 9 м.
Практикада түбәндәге моляр концентрацияле эремәләрне еш кулла¬
налар:
IM — бер молярлы эремә (см(х) = 1,0 моль/л)
0,1М — децимоляр эремә (см(х) = 0,1 моль/л)
0,01М — сантимоляр эремә (см(х) = 0,01 моль/л)
Мәсәлән, 0,2М NaOH дип язу 1л эремәдә 0,2 моль зәһәр натр булуын
белдерә, ягъни эремәдә зәһәр натрның моляр концентрациясе 0,2 моль/л
тәшкил итә.
37
1 нче мәсьәлә. 250 мл 0,5М лы NaOH эремәсе әзерләгез. Моның өчен
эремә әзерләү өчен кирәкле натрий гидроксидының массасын исәпләргә
кирәк.
Бирелгән:
250 мл эремә
cM(NaOH) = 0,5 моль/л
Tn(NaOH) — ?
Чишү:
1) 1000 мл эремә — 0,5 моль NaOH
250 мл эремә — х моль NaOH
250 · 0,5 р. 1 ок nt ли
х = —1000 = 0,125 моль NaOH
яки
V(NaOH) = 0,25 · 0,5 моль/л = 0,125 моль
2) Tn(NaOH) = M-V=Sr
250 мл сыйдырышлы үлчәү колбасына зәһәр натрның исәпләп табылган
массасын салыгыз, аны берникадәр күләмдәге дистиллят суда эретегез һәм
тиешле күләмгә кадәр су өстәгез.
Эремәнең моляр концентрациясе эрегән матдәнең масса өлеше белән
(процентларда күрсәтелгән) түбәндәге чагыштырмада бәйләнгән:
, , _ W(X) · р(эремә)
Щх)
2 нче мәсьәлә. Тыгызлыгы 1,2 г/см3 булган бакыр(П) сульфатының
25% лы 400 мл эремәсенә 250 мл су өстәгәннәр. Табылган эремәдә бакыр
купоросының (CuSO4 · 5Н2О) моляр концентрациясен һәм масса өлешен
исәпләгез.
Бирелгән:
V1(OpeMa) = 400 мл
w1(CuSO4 · 5Н2О) = 25%
P1 (эремә) = 1,2 г/см3
V(H2O) = 250 мл
Cm2(CuSO4-SH2O)-?
w2(CuSO4 · 5Н2О) — ?
2) Табылган эремәнең
масса өлешен исәплибез:
Чишү:
1) Бакыр купоросының 25% лы эремәсенең мас¬
сасын һәм андагы CuSO4 · 5Н2О ның массасын бил¬
гелибез:
/п4(эремә) = ^(эремә) · р1(эремә) =
= 400 -1,2 = 480 (г)
m1(CuSO4 · 5Н2О) = ш1(эремә) · w1(CuSO4 · 5Н2О) =
= 480-0,25 = 120 (г)
массасын һәм бу эремәдәге бакыр купоросының
тп2(эремә) = 480 г + 250 мл · 1 г/мл = 730 г
W2(CuSO4-SH2O) = · 100%
w2(CuSO4 · 5Н2О) = · 100% = 16,4%
38
3) Табылган эремәнең күләмен һәм аның моляр концентрациясен исәп¬
либез:
И2(эремә) = 400 + 250 = 650 мл = 0,65 л
V(CUSO4 ■ SH2O) - = - 0,48 (моль)
%(CuSO, ■ SH2O) - V,Cg;2H,0) = « 0,74 моль/л - 0,74 M
Коллоид эремәләрнең дә әһәмияте зур. Коллоид эремәләрне золълар
дип атыйлар. 1 нче таблицадагы мәгълүматлардан күренгәнчә, алар чын
эремәләрдән эрегән матдә кисәкчекләренең зурлыклары һәм специфик
үзлекләре белән дә аерылып торалар. Чын эремәләрдә кисәкчекләрнең
диаметры 1 нм дан кимрәк булса, коллоид эремәләрдә кисәкчекләрнең
зурлыгы 1—100 нм тәшкил итә. Ьәм хәтта аннан да артып китә. Бу кисәк¬
чекләр, гадәттә, күп санлы молекулалардан яки атомнардан торалар.
Кайбер югары молекуляр төзелешле матдә молекулаларының зурлык¬
лары 1 нм дан артыграк булганлыктан, бу матдәләрнең, мәсәлән аксым¬
нарның, эремәләре коллоид эремәләргә керәләр. Гомуми биология курсын¬
нан белгәнегезчә, мондый зурлыктагы кисәкчекләрне яктылыкның чәчелүе
принцибына нигезләнеп эшләүче ультрамикроскоп ярдәмендә күреп була.
Шул сәбәпле, аның аша караганда, коллоид кисәкчек караңгы фонда якты
нокта булып күренә.
Коллоид эремәләр кайбер югары молекуляр төзелешле матдәләр, мәсәлән
аксымнар, суда эрегәндә, шулай ук химик реакцияләр барышында хасил
булалар. Әйтик, силикатларның эремәләре кислоталар белән үзара тәэсир
итешкәндә, су белән коллоид эремә барлыкка китерүче силикат кислотасы
аерылып чыга.
Коллоид эремәләрнең характерлы үзлеге булып аларның үтә күренмә¬
лелеге тора. Моның белән алар чын эремәләргә охшаганнар. Әмма бу
коллоид эремәләр аша яктылык нуры үткәргәндә, аларның аерымлыкларын
белергә була: нур коллоид эремә аша
узганда, якты конус (14 нче рәсем)
күрергә мөмкин, чөнки коллоид ки¬
сәкчекләре чын эремәдәге кисәк¬
чекләргә караганда эрерәк һәм шун¬
лыктан узучы яктылыкны чәчәләр.
Иң киң таралган эреткеч булып
су санала. Судан башка, эреткечләр
итеп башка сыеклыкларны да кулла¬
налар.
Суспензияләрдән һәм эмульсия¬
ләрдән аермалы буларак, коллоид
эремәләр озак вакыт дәвамында
а б
14 нче рәсем. Яктылык нурын эремәләр
аша уздыру: a — натрий хлоридының чын
эремәсе; б — тимер(Ш) гидроксидының
коллоид эремәсе
39
СЕЗ
БЕЛӘСЕЗМЕ?
Күп кенә туклану продуктлары (мәсәлән, сөт) коллоид
эремәләр булып торалар. Коллоид хәлендәге матдәләрне
катализаторлар итеп кулланалар. Нык вакланган буяулар
өслекне яхшырак каплыйлар. Яхшы вакланган азык про¬
дуктларын организм тизрәк үзләштерә.
тонмыйлар, чөнки алардагы кисәкчекләр чагыштырмача кечкенә һәм
эреткеч молекулалары тәэсирендә даими рәвештә хәрәкәт итеп торалар.
(Физика курсыннан Броун хәрәкәте турындагы материалны кабатлагыз.)
Үзара бәрелешкәндә коллоид кисәкчекләр ни өчен бер-берсенә ябыш¬
мыйлар соң? Бу шуның белән аңлатыла: коллоид, ягъни бик вакланган
хәлдә матдәләрнең өслеге зур була. Бу өслектә я уңай корылмалы, я тис¬
кәре корылмалы ионнар адсорбцияләшәләр. Мәсәлән, натрий силика¬
тының гидролизы вакытында табылган силикат кислотасы эремәдә
натрий силикатының диссоциациясе нәтиҗәсендә күп тупланган тискәре
корылмалы SiOg- ионнарын адсорбцияли:
Na2SiO4 —* 2Na+ + SiO*-
Δ о о
nH2SiOo + TnSiO4- —* [H2SiO4L · TnSiO4-
Δ о ο u Δ oJn о
коллоид ионнарны адсорбцияләгән
кисәкчек коллоид кисәкчек
Бер исемдәге корылмалы кисәкчекләр үзара этеләләр һәм шуңа күрә
бер-берсенә ябышмыйлар.
Кайбер коллоид эремәләрне кайнатканда, корылмалы ионнарның
десорбциясе күзәтелә, ягъни коллоид кисәкчекләр корылмаларын югалталар,
оеша башлыйлар һәм утырымга төшәләр. Нинди дә булса электролит
өстәгәндә дә шундый күренеш күзәтелә. Бу очракта коллоид кисәкчек
үзенә капма-каршы корылмалы ионны тартып ала һәм аның корылмасы
нейтральләшә.
Коллоид кисәкчекләрнең бер-берсенә ябышуы һәм эремәдән төпкә
утыруы коагуляция дип атала.
Коллоид эремәләр табигатьтә киң таралган. Мәсәлән, йомырка аксымы,
кан плазмасы — физиологик процесслар бара торган коллоид эремәләр.
СЕЗ
БЕЛӘСЕЗМЕ?
Майлар суда яхшы эремиләр, әмма алар бензинда, угле¬
род тетрахлоридында CCI4 һәм башка органик эреткеч¬
ләрдә эриләр. Тукымалардагы май тапларын бетерү, ор¬
лыклардан май алу һ. б. әйтеп кителгән эреткечләрнең
шушы үзлегенә нигезләнгән. Төрле лакларны һәм буяу¬
ларны эретү өчен спирт һәм ацетон кулланалар.
40
Туфракның коллоид эремәләренең дә әһәмияте зур. Производствода
да аларның әһәмияте гаять зур. Төрле җилемнәр, лаклар һәм буяулар,
нигездә, — коллоид эремәләр.
Кайбер коллоид эремәләр коагуляция вакытында гель (студень) дип
аталган койкасыман (дерелдәвексыман) масса хасил итәләр. Мәсәлән,
желатинның җылы судагы 3% лы эремәсе гель, яки койка барлыкка
китерә. Бу исә коллоид кисәкчекләренең бик күп су молекулалары белән
бәйләнешкә керүенә бәйле.
Гельләрнең күбесе белән сез көндәлек тормыштан таныш (желе, марме¬
лад, ит койкасы, шампуньнар, косметик гельләр һ. б.).
Дисперсион тирәлеге сыеклык булган зольләрдән тыш, аэрозольләр була,
аларда дисперсион тирәлек булып газ хезмәт итә. Аэрозольләргә мисал —
томан һәм төтен.
10—13 нче сорауларга җавап бирегез. 3—4 иче мәсьәләләрне чишегез (42 нче бит).
7
1. Химик бәйләнешнең төп төрләренең
асылына характеристика бирегез һәм
матдәләрнең үзлекләре аларның төзе¬
лешенә бәйле булуын мисалларда аңла¬
тыгыз.
2. Калий хлориды, хлороводород,
кислород, этанол матдәләре бирелгән.
Бу матдәләр үзләренең төзелеше һәм
бәйләнеш төрләре буенча нәрсә белән
аерылып торалар?
3. Атом номерлары 8 һәм 16 булган
элемент атомнары арасындагы бәйлә¬
неш:
1) металлик
2) ионлы
3) ковалент
4) водородлы
4. Матдәдәге бәйләнеш төре белән
химик кушылманың формуласы туры
килүне билгеләгез:
1) ионлы A. Fe
2) поляр ковалент Б. (H2O)x
3) металлик B. BaCl2
4) водородлы Г. H2O
бар, һәм алар төзелеше буенча нәрсә белән
аерылалар?
7. Матдәләрнең үзлекләре кристаллик
челтәрләрнең тибына бәйле булуны мисал¬
ларда аңлатып бирегез.
8. Матдәнең исеме белән аның крис¬
таллик челтәренең тибы туры килүне
билгеләгез:
1) кальций хлориды А. Молекуляр
2) алюминий Б. Атомлы
3) иод В. Ионлы
4) карборунд Г. Металлик
1
2
3
4
1
2
3
4
5*. sp-, sp2- һәм зр3-гибридлашу ниге¬
зендә хасил булган неорганик һәм органик
матдәләргә мисаллар китерегез.
6*. Метан, аммиак һәм су молекула¬
ларының төзелешендә нинди охшашлык
9. Матдәләрнең күптөрлелегенең сә¬
бәпләренең берсе булып изомерия тора.
«Органик кушылмаларның изомерия-
сенең төрләре» дигән схема төзегез. Изо-
мериянең теге яки бу төренә мисаллар
китерегез.
10. Дисперс системаларга мисаллар
китерегез һәм аларның охшашлыкла¬
рын һәм аерымлыкларын күрсәтеп би¬
регез.
11. Коллоид эремәләрне тасвирлагыз.
Чын эремәләрдән алар нәрсә белән аеры¬
лып торалар?
12. Коллоид кисәкчекләрнең төзелеше
нинди? Аларның шундый төзелеше нәрсә
белән аңлатыла һәм ул коллоид эремә¬
ләрнең үзлекләрендә ничек чагыла?
13. Коллоид эремәләрнең әһәмияте
нинди?
41
• 1. Составында 24% калий нитраты
булган 200 г эремәгә 800 мл су өстәгәннәр.
Хасил булган эремәдә калий нитраты¬
ның масса өлешен (процентларда) исәп¬
ләгез.
2. Тимер(П) сульфатының FeSO4
3,8% лы эремәсен хәзерләү өчен, 27,8 г
тимер(П) сульфаты кристаллогидратын
FeSO4 · 7Н2О эретергә кирәкле суның
массасы күпме булырга тиеш?
3. 12,6 г нитрат кислотасы булган
эремәгә составында 7,2 г натрий гидрок¬
сиды булган эремә өстәгәннәр. Күпме тоз
барлыкка килер? Нинди матдә артып ка¬
лыр? Аның массасы күпме булыр?
4. Калий гидроксидының 0,5М лы
500 мл эремәсенә бакыр(П) хлориды
эремәсен өстәгәннәр. Барлыкка килгән
утырымның массасын һәм матдә микъда¬
рын исәпләгез.
1 нче практик эш
Бирелгән моляр концентрацияле эремәләр әзерләү. Практик эшкә әзерләнгәндә
10 нчы параграфны кабатлагыз.
I. Эремә әзерләү өчен алырга кирәкле тозның массасын исәпләгез:
Беренче вариант — натрий хлоридының 0,1 M лы 100 мл эремәсен әзерләргә.
Икенче вариант — калий хлоридының 0,2М лы 100 мл эремәсен әзерләргә.
II. Эш барышы.
1. Тозның үзегез исәпләп тапкан массасын үлчәп алыгыз; тозны 100 мл сыйдырышлы
үлчәү колбасына салыгыз.
2. Тозны бераз дистиллят су салып эретегез, аннан соң колбаның тамгасына кадәр
итеп су өстәгез.
Cy түгелмәсен өчен, соңгы тамчыларын пипетка ярдәмендә салыгыз.
3. Үлчәү колбасын бөке белән каплагыз һәм бөкене бармагыгыз белән тотып,
колбаны берничә тапкыр астын өскә әйләндерегез. (Колбаны әйләндергән саен, кол¬
бадагы эремә «нормаль» торышка килгәч, бөкене алыгыз.)
III. Эш турында ирекле формада отчет языгыз.
Әгәр кабинетта үлчәү колбалары җитәрлек булмаса, моляр эремәне үлчәү
цилиндрында яки бүлмә температурасында суның күләмен күрсәтә торган бүлемнәре
булган химик стаканда әзерләргә мөмкин. Бу савытларда эремәне болгату өчен, чиста
пыяла таякчык кулланалар, аны, болгатканнан соң, өстәлгә куярга ярамый; чиста
пробиркага (стаканга) урнаштырып торырга кирәк.
Химик реакцияләр
IV БҮЛЕК
§11. Химик реакцияләрнең классификациясе
Неорганик һәм органик химия курсларында сез шулай ук химик реак¬
цияләрнең төрле типлары белән .танышкан идегез. Хәзер бу материалны
йомгаклап тикшереп узыйк.
Сез өйрәнгән химик реакцияләрне түбәндәге билгеләре: реагирлашучы
матдәләр составына керүче атомнарның оксидлашу дәрәҗәләре үзгәрү
(оксидлашу-кайтарылу реакцияләре); башлангыч һәм хасил булучы, мат¬
дәләрнең саны һәм составы (таркалу, кушылу, алмаштыру, алмашу реак¬
цияләре); җылылык эффекты (экзотермик һәм эндотермик реакцияләр);
кайтмалык билгесе (кайтма һәм кайтма булмаган реакцияләр) буенча
классификациялиләр.
I. Оксидлашу дәрәҗәсе үзгәрү буенча (3 нче схема).
Барлык химик реакцияләрне аларда атомнарның оксидлашу дәрәҗәләре
үзгәрә торган һәм аларда атомнарның оксидлашу дәрәҗәләре үзгәрми
торганнарга бүләләр.
3 нче схема
2Li2O
оксидлаштыргыч
оксидлаша
г4е”1
0+1+2 о
Zn + 2НС1 = ZnCl2 + H2T
Г4е'1
O O
4Li + O2 =
о о t
2А1 + 3S =
\ /
1 +2 -2χί о о
2HgO = 2Hg + 02ΐ
/ X -
кайтаргыч
кайтарыла
+3 -2
Al2S3
+1 о
2СН3СООН + Mg —»
+2 0 *
—+ (CH3COO)2Mg + H2I
2СН3СОО-+ 2Н+ + Mg—»
— 2+ θ A
—*2СН3СОО + Mg + H2T
Г2е'1
θ + 2+ θ A
Mg + 2Н = Mg + H2T
г4е’ч
O O t -4 +1
C + 2Н2 CH4
* Күрсәтелгән үрнәк буенча барлык оксидлашу-кайтарылу реакцияләренең дә
тигезләмәләрен анализларга мөмкин.
43
Элемент атомнарының оксидлашу дәрәҗәсе үзгәрү, ягъни бер элемент
атомнарыннан икенче элемент атомнарына электроннар күчү яки авышу
белән бара торган процесслар оксидлашу-кайтарылу реакцияләре дип
атала.
3 нче схемада күрсәтелгән типларга кермәгән оксидлашу-кайтарылу
реакцияләре дә бар, мәсәлән:
I—
0 +5 +2 +5 +4
Cu + 4HNO3 = Cu(NO3)2 + 2ΝΟ2ΐ+ 2Н2О
(куерт.)
Оксидлашу-кайтарылу реакцияләренең тигезләмәләрендә коэффициент¬
лар куйганда, электроннар балансы методын кулланалар. Бу методны
кулланганда, реагентларның һәм реакция продуктларының формулаларын,
реагирлашучы матдәләрнең составындагы атомнарның оксидлашу дәрә¬
җәләре ничек үзгәрүен белергә кирәк. Моның өчен электроннар күчешен
күрсәткән ярдәмче тигезләмәләр төзиләр, мәсәлән:
-3 O -2
1) 2NH3 + ЗО2 = N2 + 6Н2О
-3 O
2Ν - 6e’-^N2
O -2
O2 + 4е -> 20
+5 -1
4 2; оксидлашу
6 3; кайтарылу
+7
2) 4КС1О3 = KCl + ЗКС1О4
+5 _ -1
Cl + 6е —* Cl 2 1; кайтарылу
+5 _ +7
Cl - 2е —> Cl 6 3; оксидлашу
1, 2 нче сорауларга җавап бирегез (48 нче бит).
IL Башлангыч һәм хасил булучы матдәләрнең саны һәм
составы буенча (4 нче схема).
4 нче схемада тиешле реакцияләрнең аерым мисаллары гына бирелгән.
Бу схеманың төп максаты теләсә нинди химик реакциянең тигезләмәсен
анализлауда ярдәм итүдән гыйбарәт. Шуның белән бергә, мондый сорауларга
аеруча игътибар бирергә кирәк:
1. Бирелгән реакциянең оксидлашу-кайтарылу реакцияләренә керүен
яки кермәвен ачыкларга. Әгәр сез төзегән тигезләмә оксидлашу-кайтарылу
процессын чагылдырса, әлбәттә, тиешле химик элементларның билгеләре
өстенә оксидлашу дәрәҗәләрен язып куярга, электроннар күчешен һәм
нәрсә оксидлашуын, нәрсә кайтарылуын, нәрсә оксидлаштыргыч һәм нәрсә
кайтаргыч булуын күрсәтергә кирәк.
44
4 нче схема
Башлангыч һәм реакция нәтиҗәсендә барлыкка килгән матдәләрнең саны
һәм составы буенча химик реакцияләрнең классификациясе
Химик реакцияләр
таркалу
кушылу
Бер матдәдән ике яки берничә
башка матдә хасил булу белән
бара торган реакцияләр:
12е-
+5-2 , -1 O
2КС1О3 ± 2КС1 + ЗО21
2СН4 = C2H2I + 3H2t
Ике яки берничә матдәдән бер яңа матдә
хасил була торган реакцияләр:
F6e'Ί¬
ο о
2Fe + ЗС12
Н—CsC-H+H2O
f +3 -1
= 2FeCl3
кат.
.0
H
алмаштыру
Гади һәм катлаулы матдәләр ара¬
сында, гади матдә атомнары катлау¬
лы матдәдәге элементларның берсе¬
нең атомнарын алмаштыру белән
бара торган реакцияләр:
Г~2е~~\
+10+2 O
2 AgNO3 + Fe = Fe(NO3)2 + 2 Ag J
CH4 + с12яктыль‘” CH3Cl + HCl
L
алмашу
i
Катлаулы ике матдә арасында состав
өлешләренең урыннары алмашу бе¬
лән бара торган реакцияләр:
Fe2(SO4)3 + ЗВаС12 =SBaSO4I + 2FeCl3
Ba2+ + SO4-= BaSO4J-
HCOOH + NaOH —» HCOONa + H2O
H+ + OH- —> H2O
Органик матдәләргә характерлы реакцияләр
▼
1
радикаллар механизмы буенча бара торган* ионлы механизм буенча бара торган
+ H
: —» Н:С:С:Н +:Вг
/HH
ионнар х,''
8+ 8-
Н:С:С:Н + Н:Вг:
HH
+НЛ.''' / BrH
Н:С:С:Н + :Вг: —> Н:С:С:Н
HH HH
CH4 + Cl2 CH3Cl + HCl
•/^]·/^]· v •/"’i· i .pi. ирекле
•ү.ьт*· * ..1 >"· радикаллар
н Ή—:''''' :
Н:С:Н + Cl: —> Н:С’ + H=Cl:
H H I
H 1 H ί
Н:С- + :С1:С1: —> Н:С:С1: + Cl:
H H
* Неорганик химиядә кайбер реакцияләр шулай ук радикаллар механизмы
буенча узалар, мәсәлән, хлорның водород белән тәэсир итешүе:
:С1:С1: :С1' + Cl: Н:Н + Cl: —+ Н:С1: + H'
ирекле радикаллар
45
2. Китерелгән химик реакция тигезләмәсен молекуляр рәвештә генә
ту гел, ә ионлы тигезләмә рәвешендә дә язарга кирәк түгелме икәнлегенә
игътибар бирергә. Әгәр бу алмашу яки алмаштыру реакциясе судагы эремәдә
узса һәм анда ионнар катнашса, аның молекуляр тигезләмәсеннән тыш,
тагын тулы һәм кыскартылган ионлы тигезләмәләрен дә төзергә кирәк.
Ионнар алмашу реакцияләренә мисаллар китергәндә, аларның түбәндәге
очракларда азаккача баруын истә тотарга кирәк:
1) әгәр реакция нәтиҗәсендә газ хәлендәге матдә аерылып чыкса;
2) әгәр реакция нәтиҗәсендә утырым төшсә;
3) әгәр реакция нәтиҗәсендә аз диссоциацияләшә торган матдә барлыкка
килсә.
3, 4, 7, 8 нче сорауларга җавап бирегез (48 нче бит).
III. Җылылык эффекты буенча
Белгәнегезчә, кайбер химик реакцияләр җылылык аерылып чыгу белән,
ә башкалары җылылык йотылу белән узалар.
Реакция нәтиҗәсендә аерылып чыга яки йотыла торган җылылык
микъдары бирелгән реакциянең җылылык эффекты дип атала.
Җылылык эффекты буенча, химик реакцияләрне ике төркемгә: экзо-
термик һәм эндотермик реакцияләргә бүләләр.
Җылылык аерылып чыгу белән бара торган реакцияләр экзотермик
реакцияләр дип аталалар.
Мисал:
H2 (г) + Cl2 (г) = 2НС1 (г) + 184,6 кДж
Җылылык йотылу белән бара торган реакцияләр эндотермик реак¬
цияләр дип аталалар.
Мисал:
V2N2 (г) + V2O2 (г) = NO (г) - 90,4 кДж
Практикада «ясалу җылылыгы» һәм «яну җылылыгы» төшенчәләрен
кулланалар. Бу төшенчәләр бер моль матдәгә карата кулланыла.
Гади матдәләрдән бер моль кушылма барлыкка килгәндә аерылып чыга
яки йотыла торган җылылык микъдары ясалу җылылыгы дип атала.
46
Әйтик, мәсәлән 2 г (бер моль) водород һәм 16 г (0,5 моль) кислородтан
бер моль сыек хәлдәге суның ясалу җылылыгы 285,8 кДж тәшкил итә:
H2 (г) + 1Z2O2 (г) = Η2θ (сыек) + 285,8 кДж
Бер моль матдә янганда аерылып чыга торган җылылык микъдары яну
җылылыгы дип атала.
Мәсәлән, ацетиленның яну җылылыгы 1300 кДж тәшкил итә:
C2H2 (г) + 21/^ (г) = H2O (г) + 2СО2 (г) + 1300 кДж
Реакция вакытында аерылып чыга яки йотыла торган җылылык
микъдары күрсәтелгән химик тигезләмәләр термохимик тигезләмәләр
дип аталалар.
Ясалу һәм яну җылылыклары — мөһим физик зурлыклар, аларның
санча кыйммәтләрен тиешле белешмәлекләрдән табарга була.
IV. Кайтмалык билгесе буенча
Азаккача, ягъни реагирлашучы матдәләрнең берсе тулысынча тотылып
беткәнче бара торган реакцияләр кайтма булмаган реакцияләр дип
аталалар.
Мисаллар:
+6-2 f “I θ .
2КС1О3 = 2КС1 + 3Ο2ΐ
AlCl3 + 3AgNO3 = 3AgCl I + Al(NO3)3
Al3+ + ЗСГ + 3Ag+ + 3NO3 = 3AgCl! + Al3+ + 3NO3
Ag+ + CF = AgCl I
Бирелгән шартларда үзара капма-каршы юнәлешләрдә узучы химик
реакцияләр кайтма реакцияләр дип аталалар.
Мисаллар:
N2 + ЗН2 ?=t 2NH3 + Q
N2 +O2 +=* 2ΝΟ — Q
.0 H2SO4, t О
СН,-С< + H-O-C2H5 »=* CH-C C + H2O
С/М С/ С^М^
47
Химик реакцияләрнең кайтмалыгы химия технологиясендә күп проб¬
лемалар тудыра. Реакция продуктының чыгышын арттыру өчен, кирәкле
шартларны булдырырга кирәк. Моның өчен химик тигезләнешне авыштыру
кагыйдәләрен белергә кирәк (13 нче параграфны карагыз).
5, 6 нчы сорауларга җавап бирегез һәм 1, 2 нче мәсьәләне чишегез.
1. Аеруча мөһим билгеләре буенча
химик реакцияләрнең төп типларын
тасвирлап бирегез. Мисаллар китерегез.
2. 3 нче схема буенча таркалу, ку¬
шылу һәм алмаштыру реакцияләренә
күрсәтелгән мисаллардан тыш тагын
икешәр мисал китерегез. Аларның реак¬
ция тигезләмәләрен языгыз. Оксидлашу-
кайтарылу реакцияләренең тигезләмәлә¬
рендә оксидлашу дәрәҗәләрен куегыз һәм
электроннар күчешен күрсәтегез.
3. Түбәндәге химик реакцияләр нинди
типка керүен билгеләгез һәм аларның
асылын аңлатыгыз: а) тимер(Ш) хлориды
эремәсенең натрий гидроксиды белән
тәэсир итешүе; б) җылытканда калий
хлоратының таркалуы; в) күкерт(ГУ)
оксидының оксидлашуы; г) җылытканда
кальций карбонатының таркалуы; д) алю¬
минийның күкерт белән тәэсир итешүе. Бу
реакцияләрнең тигезләмәләрен төзегез.
4. Түбәндәге оксидлашу-кайтарылу
реакциясендә, электроннар балансы мето¬
дын кулланып, коэффициентлар куегыз:
HCl + MnO2 —♦ MnCl2 + Cl2 + H2O
Оксидлаштыргычны һәм кайтаргычны
күрсәтегез.
5. Конкрет мисалларда «реакциянең
җылылык эффекты», «ясалу җылылыгы»
һәм «яну җылылыгы» төшенчәләренең
мәгънәләрен аңлатып бирегез.
6. Нинди реакцияләр кайтма һәм
ниндиләре кайтма булмаган реакцияләр
дип аталалар? Конкрет мисаллар ките¬
регез.
7. Нинди шартларда ионлы реакцияләр
азаккача уза? Нәр очрак өчен икешәр
мисал китерегез һәм бу реакцияләрнең
тигезләмәләрен молекуляр, тулы һәм кыс¬
картылган ионлы рәвештә языгыз.
8. Реагентлар белән реакциянең ион-
лы-молекуляр тигезләмәсе туры килүне
билгеләгез:
1) KOH + H2SO4
2) Cu(OH)2 + HCl
3) Na2CO3 + HNO3
4) Na2CO3 + CO2 + H2O
A. Cu(OH)2 + 2Н+ = Cu2+ + 2Н2О
Б. COf + CO2 + H2O = 2НСО3
B. H+ + OH' - H2O
Г. COf + 2Н+ = CO2 + H2O
1
2
3
4
1. 3,27 г цинк янганда 174 кДж
аерылып чыга. Цинк оксидының ясалу
җылылыгын (җылылык эффектын) исәп¬
ләп чыгарыгыз.
2. IOO г тимер(Ш) оксидыннан алю¬
миний ярдәмендә тимерне кайтарганда,
476,0 кДж аерылып чыккан. Бу реак¬
циянең җылылык эффектын исәпләгез.
48
§12. Химик реакцияләрнең тизлеге. Катализ
Неорганик химия курсында (9 нчы сыйныф) «химик реакцияләрнең
тизлеге» төшенчәсе белән сез танышкан идегез инде. Хәзер аны тагын да
тулырак итеп тикшерик.
Практикада сез эремәләр арасында бара торган һәм газсыман хәлдәге
матдәләр, мәсәлән, аммиакны синтезлаганда азот һәм водород арасында уза
торган реакцияләр белән очрашкан идегез. Бу очракларда тирәлек беришле,
ягъни гомоген булып тора (матдәләр арасында эчке бүленү чиге булмый).
Сезгә реагирлашучы матдәләр гомоген тирәлек булдырмаган реакцияләр
дә билгеле. Моңа мисал булып күмернең һәм башка каты матдәләрнең
януы тора. Бу реакцияләр төрле ишле, ягъни гетероген (эчке бүленү чиге
булган) тирәлектә узалар. Шулай булгач, химик реакцияләрнең тизлеге
турындагы сорауны тикшергәндә, гомоген һәм гетероген системаларда бара
торган реакцияләрне аерып карау мөһим.
Химиянең химик реакцияләрнең тизлеген һәм аның төрле факторларга
бәйлелеген өйрәнә торган бүлеген химик кинетика дип атыйлар.
Гомоген реакцияләрдә матдәләрнең кисәкчекләре системаның барлык
күләмендә бертөрле реагирлашалар, гетероген реакцияләрдә — өслектә генә
(бүленү чигендә). Әйтик, мәсәлән, күмер янганда, кислород молекулалары
бары тик өслектәге углерод атомнары белән генә реагирлашалар. Күмерне
ваклаганда, аның өслеге зурая һәм яну тизлеге дә арта.
Химик реакциянең тизлеге реагирлашучы матдәләрнең берсенең
вакыт берәмлегендә системаның күләме үзгәрешсез булганда концентра¬
циясе үзгәрүе белән билгеләнә.
Монда сүз реакциядә катнашучы кайсы матдә турында барса да барыбер:
алар барысы да реакция тигезләмәсе белән бәйләнгән, һәм матдәләрнең
СЕЗ
БЕЛӘСЕЗМЕ?
Катализ турындагы беренче күзаллаулар матдә төзе¬
лешенең атом теориясе белән бер үк вакытта диярлек
барлыкка килгән. 1806 елда Н. Клеман һәм Ш.Дезорм,
сульфат кислотасын камера ысулы белән җитештер¬
гәндә, SO2 не оксидлаштыру процессының азот оксид¬
лары катнашында тизрәк баруы турында мәгълүматлар
бастырып чыгаралар. Алты елдан соң К.С. Кирхгоф
сыегайтылган минераль кислоталарның крахмал гидроли¬
зына тәэсир итүе турында язып чыккан. Шул заман өчен
гадәттән тыш саналган бу күренешләргә Й. Я. Берцелиус
1835 елда гомуми атама — катализ атамасы биргән
(грекча «каталио» — җимерү).
49
берсенең концентрациясе үзгәрүе буенча барлык калганнарының концентра¬
цияләре үзгәрүе турында фикер йөртергә мөмкин. Концентрацияне моль/л да,
ә вакытны секундларда яки минутларда күрсәтәләр.
Түбәндәге тигезләмә буенча узучы гомоген реакциянең тизлеген гомуми
рәвештә билгелибез:
A + B = C + D
Әйтик, A матдәсенең концентрациясе вакытның ниндидер моментында
(J1) C1 моль/л булды ди. Күпмедер вакыттан соң (i2), A матдәсе күпме
тотылуга карап, аның концентрациясе кимеячәк — C2 моль/л. Ул вакытта
реакциянең тизлеген түбәндәгечә билгеләргә мөмкин булачак:
C2 — C1 AC
<2 - <1 Δί
«Минус» тамгасы реагентларның концентрациясе кимүен күрсәтә
(реакция барганда һәр реагентның микъдары кими).
Реакция продуктлары өчен ДС — уңай зурлык, чөнки продуктларның
Δ0
концентрациясе реакция барышында арта. Бу вакытта и = ±-^-, чөнки
реакциянең тизлеге уңай зурлык кына булырга мөмкин.
Гомоген реакциянең тизлеге реакциягә керүче яки реакция нәти¬
җәсендә хасил булучы матдәләрдән берсенең вакыт берәмлегендә кон¬
центрациясе үзгәрү белән билгеләнә.
Реакциянең тизлеге һәрвакыт үзгәреп торганлыктан, реакциянең мизгел
тизлеге, ягъни вакытның бирелгән моментындагы тизлеге турында әйтергә
мөмкин.
Гетероген реакцияләрдә тизлекне концентрация аша күрсәтмиләр, чөнки
матдәләр барлык күләмдә реагирлашмыйлар, ә бары тик өслектә генә
реагирлашалар.
Гетероген реакциянең тизлеге вакыт берәмлегендә реакциягә керүче
яки реакция нәтиҗәсендә хасил булучы матдәләрнең өслек берәмлегендәге
мольләр саны белән билгеләнә.
Ләкин өслек мәйданы һәм орыну мәйданы тиз үзгәрә, шуңа күрә исәп¬
ләүләр бик специфик һәм катлаулы.
Активлаштыру энергиясе. Химик реакцияләр реагирлашучы матдә¬
ләрнең кисәкчекләре бәрелешкәндә генә бара. Шуның белән бергә, бәре¬
лешү эффектив булырга, атомнарның яңача төркемләшүенә һәм яңа мат¬
дәләр барлыкка килүенә китерергә тиеш. Моның өчен реагирлашучы
кисәкчекләрнең энергияләре җитәрлек булырга тиеш, бу энергия исәбенә
атомнарның электрон болытларының этелүен җиңәргә мөмкин.
50
Активлаштыру энергиясе Ea — реагирлашучы кисәкчекләрдә (атом¬
нар, молекулаларда) химик реакциядә реагентларга һәм продуктларга
бүлә торган потенциаль барьерны җиңү өчен булырга тиешле уртача
артык энергия.
Әгәр барьер зур булмаса, күпчелек кисәкчекләр аны җиңәргә мөмкин,
шуңа күрә реакция тизлеге зур була. Әгәр активлаштыру энергиясе шактый
булса, реакция акрын уза.
Активлаштыру энергиясен, реакция тизлегенең температурага бәйлелеген
өйрәнеп, эксперимент ярдәмендә билгелиләр.
Кисәкчекләр эффектив бәрелешү нәтиҗәсендә атомнарның арадаш
төркеме — активлаштырылган комплекс (15 нче рәсем) барлыкка килә.
Бу төркем бик актив, аны индивидуаль халәттә аерып алырга мөмкин түгел,
ул бик кыска вакыт (1(Г13 с чамасы) яши.
Мисал сыйфатында иодоводород синтезы реакциясен карыйк:
H2 + I2 — 2HI
Водород һәм йод молекулалары бәрелешкәндә, әгәр аларның энергиясе
җитәрлек булса, активлаштырылган H2—12 комплексы барлыкка килә.
Алга таба бу кисәкчек я башлангыч халәтенә кайтырга (реакция бармый),
я ике молекула иодоводородка әверелергә мөмкин (15 нче рәсемне кара).
Рәсемнән күренгәнчә, яңа матдәнең барлыкка килүе энергия (ΔΗ) бүленеп
чыгу белән бара. Бу экзотермик реакция була.
Шулай итеп, активлаштыру энергиясе активлаштырылган комплекс¬
ларның уртача энергиясе кыйммәте белән башлангыч молекулаларның
уртача энергиясе кыйммәте арасындагы аермага тигез.
15 нче рәсем. Водород һәм йод тәэсир итешү барышында системада энергия үзгәрү
51
Гомоген һәм гетероген реакцияләрнең тизлегенә тәэсир итүче факторлар.
Реакция тизлегенең реагирлашучы матдәләрнең концентрациясенә бәй-
лелеге химик кинетиканың төп законы — тәэсир итешүче массалар законы
белән билгеләнә:
Химик реакциянең тизлеге реагирлашучы матдәләрнең концентрация¬
ләре тапкырчыгышына туры пропорциональ.
A + B = C + D реакциясе өчен закон түбәндәге тигезләмә белән күрсәтелә:
и = fe · Ca · Св,
монда Ca Һәм Cb — A һәм B матдәләренең концентрациясе (моль/л),
k — пропорциональлек коэффициенты (реакция тизлеге константасы,
реагирлашучы матдәләрнең концентрациясе 1 моль/л булганда, химик
реакция тизлегенә тигез). Реакция тизлеге константасы реагирлашучы
матдәләрнең табигатенә һәм температурага бәйле, ләкин матдәләрнең
концентрациясенә бәйле түгел.
Реакция тизлегенең югарыда бирелгән аңлатмасын реакциянең кинетик
тигезләмәсе дип атыйлар. Мәсәлән,
2Н2 + O2 = 2Н2О
реакциясе тигезләмәсе өчен реакциянең кинетик тигезләмәсе түбәндәгечә
була:
V = k- [H2]2 · [O2]
Химик реакциянең кинетик тигезләмәсендәге матдә концентрациясе
дәрәҗәсенең күрсәткечен бирелгән матдә буенча химик реакция тәртибе
дип, ә барлык реагентлар күрсәткечләренең суммасын тулаем реакция
тәртибе дип атыйлар.
Югарыда китерелгән реакция водород буенча икенче тәртиптәге реакция,
кислород буенча беренче тәртиптәге һәм тулаем өченче тәртиптәге реакция
була.
Тәэсир итешүче массалар законы каты хәлдә реагирлашучы матдәләрне
күздә тотмый, чөнки аларның концентрациясе даими һәм алар өслектә генә
реагирлашалар. Мәсәлән, күмернең яну реакциясе өчен
C + O2 = CO2
кинетик тигезләмә түбәндәгечә булачак:
v = k · [O2]
Катализ күренешен һәм төрле факторларның кайтма реакцияләрнең
узуына тәэсирен тулырак итеп өйрәнербез.
Катализаторлар һәм катализ. Химик реакцияләрне тизләтүдә, мәсәлән,
сульфат кислотасы, аМмиак, нитрат кислотасы, этанол, этаналь һәм башка
матдәләрне җитештерүдә, катализаторларның роле искиткеч зур.
52
Катализ, катализаторлар һәм каталитик реакцияләр турындагы төп
мәгълүматларны йомгаклап узыйк.
Кайбер матдәләр катнашында химик реакцияләрнең тизлеге арту күре¬
неше катализ дип, ә аларның тизлеген киметү күренеше ингибирлаштыру
дип атала.
Химик реакцияләрдә актив катнашып, аларның тизлеген арттырып та,
нәтиҗәдә үзләре сарыф ителми торган матдәләр катализаторлар дип
аталалар.
Химик реакцияләрнең тизлеген акрынайтучы матдәләр ингибиторлар
Rvm аталалар.
Катализаторлар тәэсирендә уза торган реакцияләр каталитик реак¬
цияләр дип аталалар.
Шундый сорау туарга мөмкин: катализ күренешенең асылын ничек
аңлатырга соң?
Катализаторларның тәэсирен тикшергәндә, реакцияләрнең гомоген
һәм гетероген тирәлекләрдә узу мөмкинлеген исәпкә алырга кирәк.
Химик реакциянең нинди тирәлектә баруына карамастан, катализаторлар
тәэсиренең асылы бер үк: төрле арадаш кушылмалар хасил итеп, катали¬
заторлар химик реакциядә актив катнашалар. Мисал итеп сезгә таныш
булган реакцияне — этиленның су белән тәэсир итешүен, ягъни этиленнан
этанол табу реакциясен тикшерик.
Этиленның су белән реакциясен тормышка ашырганда, төрле катали¬
заторлар кулланыла. Этанол җитештерүдә аеруча нәтиҗәле катализатор
булып ортофосфат кислотасы, ә лаборатория шартларында сульфат кис¬
лотасы тора. Этилен су белән турыдан-туры реагирлашмый икән, ә сульфат
кислотасы белән реакция уза:
CH2=CH2 + H-O-SO2-OH —* CH3-CH2-O-SO2-OH
этилсульфат
Этилсульфат су белән реагирлаша:
CH3-CH2-O-SO2-OH + HOH * CH3-CH2-OH + HO-SO2-OH
Тигезләмәдән күренгәнчә, этилсульфат реакциянең тизлеген арттыручы
арадаш матдә булып тора.
Күп каталитик реакцияләр гетероген тирәлектә бара. Андый процесска
характерлы мисал — сульфат кислотасын контакт ысулы белән җитеш¬
тергәндә күкерт(ГУ) оксидының күкерт(У1) оксидына оксидлашуы (14 нче
параграфны карагыз). Бу реакциядә катализатор сыйфатында вакланган
53
хәлдә ванадий(Ү) оксидын V2O5 кулланалар. Катализатор бик нык вакланган
хәлдә яки куышлыклы структуралы булса, аның каталитик үзлекләре көчәя.
Гетероген тирәлектә бара торган каталитик реакцияләрдә адсорбциянең
роле шуның белән аңлатыла. Адсорбция процессы реакциянең тизлеген
ике юнәлештә арттырырга булышлык итә:
1) реагирлашучы матдәләрнең адсорбцияләнгән (йотылган) молекулалары
тыгызрак орыналар;
2) реагирлашучы молекулаларның катализатор өслегенә тартылуы
алардагы химик бәйләнешләрне йомшарта, ягъни аларның өзелүенә һәм
арадаш, тотрыксыз үтә актив кисәкчекләр барлыкка килүенә китерә,
реакция продуктлары хасил булуны тизләтә.
Хәтерегезгә төшерик, температураны күтәрү — молекулаларның
активлашуы өчен кирәкле шарт, чөнки бу вакытта молекулалардагы
химик бәйләнешләрнең өзелүенә сәләтлелек арта. Катализатор кулланып,
реакциянең тизлеген түбәнрәк температурада да арттырырга мөмкин,
чөнки катализатор да химик бәйләнешләрнең өзелүенә булышлык итә.
Аммиак синтезы процессы — химик реакцияләрне тизләтүдә температура
һәм катализаторның үзара ролен дәлилләүче характерлы мисал.
Химик реакцияләрнең тизлегенә йогынты ясаучы төп факторлар 2 нче
таблицада күрсәтелгән.
2 нче таблица. Химик реакцияләрнең тизлегенә йогынты ясаучы
төп факторлар
Фактор
Мисаллар
Теоретик дәлилләү
!.Реагирлашучы мат¬
дәләрнең табигате
2. Концентрация (эре¬
гән хәлдәге матдәләр
һәм газлар өчен)
*
Металлар (калий, натрий)
бер үк матдә — су белән
төрле тизлектә реагирла-
шалар (бер үк хәлдә һәм
бертөрле шартларда).
Матдәләр саф кислородта
кислородның концентра¬
циясе 5 тапкыр диярлек
кимрәк булган һавада ян-
гандагыдан активрак яна¬
лар.
Металлар белән су арасын¬
дагы реакцияләрнең асылы
шуннан гыйбарәт ки, ме¬
талл атомнары электронна¬
рын бирәләр, ягъни оксид¬
лашалар. Калий атомнары¬
ның радиусы натрий атом-
нарыныкыннан зуррак һәм
шуңа күрә электроннарны
җиңелрәк бирәләр.
Реакция узсын өчен, реа¬
гирлашучы матдәләрнең
молекулалары үзара бәреле¬
шергә тиеш. Бәрелешүләр¬
нең ешлыгы исә күләм бе¬
рәмлегендәге молекулалар
санына, ягъни концентра¬
циягә бәйле.
54
Дәвамы
Фактор
Мисаллар
Теоретик дәлилләү
3. Реагирлашучы мат¬
дәләрнең өслеге (каты
хәлдәге матдәләр өчен
химик реакцияләрнең
тизлеге реагирлашучы
матдәләрнең өслегенә ту¬
ры пропорциональ була)
4. Температура (тем¬
пература күтәрелгәндә
күпчелек химик реакция¬
ләрнең тизлеге арта*)
5. Катализаторлар (хи¬
мик реакцияләрне тиз¬
ләтә торган матдәләр)
яки ингибиторлар (хи¬
мик реакцияләрнең тиз¬
леген акрынайта торган
матдәләр) булу
Каты хәлдәге тимер һәм
күкерт аларны алдан вак¬
лаганда һәм катнаштыр¬
ганда гына җитәрлек тиз
реагирлаша.
Күп матдәләр белән кис¬
лород гадәттәге темпера¬
турада ук сизелерлек тиз¬
лектә реагирлаша башлый
(акрын оксидлашу). Тем¬
пература күтәрелгәндә,
оксидлашу тизлеге кис¬
кен арта һәм көчле реак¬
ция башлана (яну).
Бертолле тозының һәм во¬
дород пероксидының тар¬
калуы марганец(ГУ) окси¬
ды катнашында тизләшә.
Ингибиторлар катнашкан¬
да хлорид кислотасы ме¬
талларга карата инертла-
ша.
Матдәне ваклаганда, реа¬
гирлашучы матдәләрнең
орыну өслеге арта.
Бәрелешкәндә, кинетик
энергиясе җитәрлек бул¬
ган молекулалар гына
реагирлашалар. Темпера¬
тураны күтәргәндә, актив
молекулалар өлеше арт-
каннан-арта бара.
Катализаторлар тәэсирен¬
дә, чагыштырмача түбән¬
рәк температурада да моле¬
кулалар реакциягә керә
алалар. Мәсәлән, бертолле
тозы 400 0C та гына реак¬
циягә керә ала, ә MnO2
катнашында ул 200 0C та
да реакциягә керә.
* Температура һәр IO0C ка күтәрелгән саен, химик реакциянең тизлеге уртача ике-
дүрт тапкыр арта. Моны математик рәвештә түбәндәгечә күрсәтергә мөмкин:
% =%γ 10 >
биредә Vt2 — реакциянең температура күтәрелгәндәге тизлеге; Vt^ — реакциянең
башлангыч температурадагы тизлеге; γ — температура коэффициенты.
1—6 нчы сорауларга җавап бирегез (62 нче бит). 1—2 нче мәсьәләләрне чишегез
(63 нче бит).
СЕЗ
БЕЛӘСЕЗМЕ?
Каты хәлдәге катализаторлар үзләренең активлыкларын
тиз югалталар: каталитик агу дип аталучы билгеле бер
матдәләр булганда агуланалар.
Промоторлар — катализаторларның активлыгын арттыра
торган матдәләр.
55
СЕЗ
БЕЛӘСЕЗМЕ?
1918 елда Түбән Новгородта һәм башка урыннарда соляр
мае һәм мазут рәвешендә нефть калдыклары бик күп
микъдарда тупланган була. Шул ук елда Н. Д. Зелинский,
катализатор итеп аммоний хлоридын кулланып, соляр
маеның эре молекулаларын ваграк молекулаларга вак¬
лауга һәм процесс ахырына составы бензинныкына
охшаган катнашма табуга ирешә. Ярты елдан бензинны
Н. Д. Зелинский ысулы белән җитештерү Кусково заво¬
дында инде тормышка ашырыла. Н. Д. Зелинский: «Тор¬
мышка ашырылмаслык реакцияләр юк, әгәр реакция бар¬
мый икән, димәк, әлегә катализатор табылмаган»,— дип
әйтергә яраткан.
§13. Химик тигезләнеш һәм аның авышу шартлары
Бирелгән шартларда азаккача бармаган химик реакцияләр билгеле.
Әйтик, мәсәлән, күкерт(1Ү) оксиды суда эрегәндә, билгеле бер микъдарда
гына сульфит кислотасы хасил булырга мөмкин. Бу шуның белән аңлатыла
ки, сульфит кислотасы тотрыклы түгел һәм кире реакция, ягъни күкерт(1Ү)
оксидына һәм суга таркалу күзәтелә. Димәк, әлеге реакция азаккача
бармый, чөнки бер үк вакытта ике реакция — туры (күкерт(ГУ) оксиды
һәм су арасында) һәм кире (сульфит кислотасының таркалуы) реакция
бара:
SO2 + H2O H2SO3
Белгәнегезчә, бер үк вакытта капма-каршы ике юнәлештә узучы мондый
химик реакцияләрне кайтма реакцияләр дип атыйлар.
Химик тигезләнеш. Химик реакцияләрнең тизлеге реагирлашучы
матдәләрнең концентрациясенә бәйле булганлыктан, башта туры реакция¬
нең тизлеге (V1) максималь булырга, ә кире реакциянең тизлеге (V2) нульгә
тигезләшергә тиеш. Реагирлашучы матдәләрнең концентрациясе вакыт узу
белән кими, ә реакция продуктларының концентрациясе арта. Шуңа күрә
туры реакциянең тизлеге (V1) кими, ә кире реакциянең тизлеге (ν2) арта.
Билгеле бер моментта туры һәм кире реакцияләрнең тизлеге тигезләшә:
V1 = V2.
Системаның туры реакция тизлеге кире реакция тизлегенә тигезләшкән
халәтен химик тигезләнеш дип атыйлар.
Химик тигезләнеш халәтендә реагирлашучы матдәләр һәм реакция
продуктлары арасындагы микъдар нисбәте даими булып кала: вакыт
56
берәмлегендә ничә молекула реакция продукты барлыкка килсә, шулкадәр
үк таркала да. Әмма химик тигезләнеш халәте реакция шартлары:
концентрация, температура һәм басым үзгәргәнгә кадәр саклана.
Химик тигезләнешнең авышуы. Күп кенә химик продуктларны кайтма
химик реакцияләр нәтиҗәсендә табалар. Шуңа күрә нинди шартларда
тигезләнеш халәтендә продуктның чыгышы артуын белү зарури. Әгәр
шартларны (концентрация, температура, басымны) үзгәрткәндә химик
тигезләнеш халәтендә продуктның чыгышы артса, тигезләнеш уңга, әгәр
кимесә, сулга авышты дип исәплиләр.
Әйтик, мәсәлән, сульфат кислотасын җитештергәндә, күкерт (IV) оксидын
күкерт(Ү1) оксидына оксидлаштыру таләп ителә. Бу — экзотермик һәм
кайтма реакция:
2SO2 + O2 ?=s 2SO3 + Q
Эксперименталь юл белән бу реакцияне түбәнрәк температурада, әмма
югары басым астында уздыру нәтиҗәлерәк булуы раслана. Температура
үзгәрүнең күкерт(ГҮ) оксиды оксидлашу процессына йогынтысы 3 нче
таблицада күрсәтелгән.
3 нче таблица. Күкерт(VI) оксидының төрле температураларда
тигезләнеш халәтендәге массасы
Реакция баргандагы
температура (0C ларда)
SO3 нец газлар катнашмасындагы
массасы (% ларда)
IOOO
5
600
73,0
500
93,5
400
99,2
Күп санлы тикшеренүләр химик тигезләнешнең авышуы Ле Шателье
принцибы дип аталучы кагыйдәгә буйсынуын күрсәттеләр.
Тышкы шартларны үзгәрткәндә, химик тигезләнеш әлеге тышкы
йогынтыны киметүче реакция (туры яки кире) ягына авыша.
Температураны күтәргәндә, тигезләнеш эндотермик реакция ягына
авыша:
2SO3 2SO2 + O2-Q
Шуңа күрә күкерт(Ү1) оксидының газлар катнашмасындагы массасы кими
(3 нче таблицаны карагыз).
57
Басымны арттырганда, тигезләнеш күләмнең кимүенә китерә торган
реакция ягына авыша:
2SO2 + O2 ?=* 2SO3 + Q
Тигезләмәдән күренгәнчә, өч күләм газ катнашмасыннан ике күләм
күкерт(Ү1) оксиды барлыкка килә, шуңа күрә система эчендә басым кими.
Кайсы да булса бер компонентның концентрациясен арттырганда, ти¬
гезләнеш бу компонентның кимүе ягына авыша. Әгәр, мәсәлән, 400 0C та
химик тигезләнеш халәтендәге катнашмада күкерт(Ү1) оксидының кон¬
центрациясе артса, тигезләнеш башлангыч матдәләр ягына авыша.
Катализаторлар туры, реакцияне дә, кире реакцияне дэ бер үк дәрәҗәдә
тизләтәләр һәм шуңа күрә тигезләнешне авыштырмыйлар, әмма тигезләнеш
башлануны тизләтәләр. Катализаторның роле шуннан гыйбарәт: алар актив
молекулалар санын арттыралар. Шул сәбәпле химия производствосында
күкерт(ГҮ) оксиды белән химик реакцияне түбәнрәк температурада үткә¬
рергә мөмкин. Күкерт(ГҮ) оксидын күкерт(Ү1) оксидына оксидлаштыруны
400 oC та, катализатор катнашында уздыру файдалы, чөнки мондый
температурада катализаторсыз реакциянең тизлеге җитәрлек булмый.
7—8 нче сорауларга җавап бирегез (63 нче бит). 3 нче мәсьәләне чишегез
(63 нче бит).
§14. Сульфат кислотасын контакт ысулы белән
җитештерү
Сульфат кислотасы — химия промышленностеның төп продуктларының
берсе. Җитештерү күләме һәм кулланылышы буенча минераль кислоталар
арасында ул беренче урында тора. Сульфат кислотасы производствосының
чимал чыганаклары шактый күптөрле (5 нче схема).
Сульфат кислотасын җитештерү заводлары илебезнең төрле районна¬
рында урнашкан. Ьәрбер завод үзенә якында чыгарыла торган теге яки
бу чималдан файдалана. Соңгы елларда сульфат кислотасын җитештерүне
үстерүдә табигый чималдан комплекслы файдалануга йөз тоту күбрәк урын
ала. Мәсәлән, төсле металлар сульфидларын яндырганда хасил була торган
күкерт(ГҮ) оксидын яки ташкүмерне кокслаганда яки кайбер табигый
газларны эшкәрткәндә аерылып чыгучы сероводородны кулланалар. Төрле
химия производстволарын берләштерү принцибы шулай саклана.
Сульфат кислотасын җитештерүдә процессларның химик асылы
чималны күкерт(Ү1) оксидына кадәр оксидлаштыруга һәм аны кислотага
күчерүгә кайтып кала.
Күкерт(1Ү) оксидын табу. Сульфат кислотасын җитештерүдә беренче
стадия — чималны күкерт(ГҮ) оксидына кадәр оксидлаштыру. Чимал чыга¬
наклары күптөрле булуга карамастан, хәзергә кадәр чимал сыйфатында
башлыча күкерт һәм күкерт колчеданын (пирит) кулланалар. Монда чимал
балансында колчедан өлеше кими, ә күкерт өлеше арта.
58
5 нче схема
Күкерт(ГУ) оксидын табуны күкерт колчеданын яндыру мисалында
карыйбыз:
4FeS2 + HO2 = 2Fe2O3 + 8SO2
Эксперименталь юл белән пиритны яндыру реакциясе тизлеге үзгәрү
закончалыклары билгеләнә.
Реакция тизлегенең пиритны яндыру шартларына бәйлелеге
1. Ьава урынына саф кислород уздырганда, реакциягә керүче матдәләр¬
нең берсенең концентрациясе арта, димәк, реакциянең тизлеге арта.
2. Пиритны ваклаганда, реакциягә керүче матдәләрнең орыну өслеге
зурая, бу исә реакция тизлегенең артуына сәбәп була. Әмма бик артык
ваклаганда кисәкчекләр укмашалар, тыгыз катлам барлыкка килә һәм
аның аша кислород узмый диярлек. Бу — реакциянең тизлеге кимүгә
китерә.
3. Яндыру температурасын 800 oC ка кадәр күтәргәндә, җитәрлек кинетик
энергиясе булган молекулаларның өлеше арта һәм реакциянең тизлеге дә
арта. Тагын да югарырак температурада кисәкчекләрнең оешуы күзәтелә
һәм реакциянең тизлеге кими.
Пиритны яндыру реакциясе экзотермик булганлыктан, температура
оптималь температурадан, ягъни 800 0C тан югарырак күтәрелә. Шулай
булгач, артык җылылыкны башка максатларда, мәсәлән, су парын табуда
файдаланырга мөмкин.
Галимнәр пиритның ваклану дәрәҗәсенә бәйле мәсьәләне дә хәл итә¬
ләр. Мәгълүм булганча, яндыруны тизләтү өчен, пиритны мөмкин кадәр
ваграк вакларга кирәк. Әмма бик вак кисәкчекләрнең укмашуы кислород
керүен тоткарлый. Галимнәр каршы агым принцибын кулланып, ягъни
мичкә нык вакланган пиритны өстән биреп һәм һаваны астан өрдереп,
59
16 нчы рәсем. Сульфат кислотасын җитештерү: 1 — кайнап торган катламда яндыру
миче; 2 — циклон; 3 — электрофильтр; 4 — киптерү башнясы; 5 — җылыалмаштыргыч;
6 — контакт аппараты; 7 — йоттыру башнясы
һава бирүне пирит кисәкчекләрен һәрвакыт хәрәкәткә китереп, көпшәк
тотарлык итеп көйләргә мөмкин дигән нәтиҗәгә киләләр (16 нчы рәсем).
Мондый вак кисәкчекләр катламын кайнаучы .катлам дип атаганнар, чөнки
ул пар бәреп кайнап торган сыеклыкны хәтерләтә. Пирит кисәкчекләре
бик вак булырга мөмкин: кайнап торган катламда алар укмашмый, һава
60
белән яхшы аралаша. Шуңа күрә яндыру процессы бик тиз уза. Әгәр
элек пиритны яндыру өчен 5—6 сәг кирәк булса, кайнап торган катламда
яндырганда, нибарысы бернңчә секунд кына таләп ителә. Мондый мичләрдә
эш тулысынча механикалаштырылган: мичкә ленталы транспортер белән
вакланган пирит өзлексез бирелә, ә компрессорлар һава өрдерә. Барлыкка
килгән күкерт(ГҮ) оксиды автоматик рәвештә тагын да эшкәртүгә җибәрелә.
Бирелгән технологик режим (температура, һава һәм вакланган пирит бирү)
автоматик рәвештә көйләнелә.
Күкерт(1Ү) оксидын чистарту. Төрле катышмалар катализаторны агула¬
ганлыктан, ягъни алар каталитик үзлекләрен югалтканлыктан, күкерт(1Ү)
оксидын бик җентекләп чистартырга кирәк. Газлар катнашмасыннан
тузанны суырту өчен, аны циклон дип аталып йөртелә торган аппарат
аша (16 нчы рәсем) уздыралар. Ул берсе эченә икенчесе кертеп куелган
ике цилиндрдан гыйбарәт. Газлар катнашмасы тышкы цилиндрга керә
һәм спираль буйлап өстән аска хәрәкәт итә. Циклонда газлар хәрәкәте
тәэсирендә тузан кисәкчекләре цилиндрның тышкы стенасына ыргытыла,
аннан аска төшеп, читкә чыгарыла.
Бик вак тузан кисәкчекләре газда кала. Алардан арындыру өчен, катнаш¬
маны электрофильтрга юнәлтәләр. Бу аппаратлар металлдан эшләнгән
иләкләрдән тора, алар арасыннан нечкә чыбык уздырылган. Аңа югары көчә¬
нешле (60 000 В) даими электр тогы тоташтырыла. Чыбык — тискәре, ә иләк
уңай корыла. Газлар катнашмасы камерага астан керә. Көчле электр кыры
тәэсир итүе нәтиҗәсендә тузан кисәкчекләре тискәре корылма ала, иләккә
тартылып, анда үзенең корылмасын югалта һәм махсус бункерга төшә.
Газлар катнашмасын су парларыннан киптерү башнясында арындыралар.
Бу башняга газлар катнашмасы астан керә, ә өстән, каршы агым булып,
куертылган сульфат кислотасы ага. Газ һәм сыеклыкның орыну өслеген
арттыру өчен, башняны керамик боҗралар белән тутыралар.
Күкерт(1Ү) оксидының күкерт(У1) оксидына оксидлашуы. Яхшылап
чистартканнан соң, күкерт(ГҮ) оксиды һәм һава контакт аппаратына керә
(16 нчы рәсем), анда катализатор (VgOg) катнашында оксидлашу уза:
2SO9 + O9 —i. 2S0g + Q
Реакция башлансын өчен, газлар катнашмасын башта җылытырга кирәк,
чөнки чистарту процессында ул суынган була. Шуңа күрә контакт аппараты
алдына җылыалмаштыргыч урнаштыралар. Контакт аппаратыннан
чыккан кайнар газлар катнашмасын җылыалмаштыргыч көпшәләре буенча
уздыралар, ә алар арасыннан капма-каршы юнәлештә җылынырга тиешле
газлар катнашмасы уздырыла. Нәтиҗәдә җылылык алмашу була, ягъни
реакция продуктлары үзләренең җылысын контакт аппаратына керә торган
газлар катнашмасына бирәләр. Бер үк вакытта ике максатка ирешелә:
реакция өчен алынган матдәләр җылыналар, ә реакция продуктлары тиешле
температурага кадәр суыналар.
61
Контакт аппаратында шүрлекләр ясалган, аларга катлам-катлам
катализатор — ванадий(У) оксиды V2O5 урнаштырылган. Катализатор
катнашында күкерт(ГУ) оксиды түбәнрәк температурада да оксидлаша һәм
химик реакция тигезләнеше уңга авыша.
Сульфат кислотасын күкерт(У1) оксидын гидратлаштырып табу. Җы-
лыалмаштыргычта суытылган күкерт(У1) оксидын йоттыру башнясына
юнәлтәләр (16 нчы рәсем). Күкерт(УТ) оксидын су белән йоттырырга тиештер
кебек тоела. Әмма су урынына масса өлеше 98% булган сульфат кислотасын
кулланалар.
Ни өчен соң күкерт(У1) оксидын йоттыру өчен су кулланырга ярамый?
Күкерт(У1) оксиды су белән орынганчы аның парлары белән реагирлашуы
һәм сульфат кислотасының су белән йотылмый торган вак тамчылар —
сульфат кислоталы томан хасил итүе ачыкланды. Куертылган сульфат
кислотасы өстендә су парлары практик яктан булмый. Күкерт(УТ) оксиды,
куертылган сульфат кислотасы белән йоттырылып, андагы су белән реак¬
циягә керә:
SO3 + H2O = H2SO4 + Q
Шулай итеп, сусызландырылган сульфат кислотасы барлыкка килә, анда
күкерт(У1) оксидын эреткәндә олеум хасил була.
Сульфат кислотасын җитештерү темасын өйрәнгәндә, сез танышып үткән
төп фәнни принциплар (производство процессларын механикалаштыру һәм
автоматлаштыру, химик реакцияләр узуы өчен оптималь шартлар булдыру,
химик реакцияләр җылысын файдалану һ. б.) гомуми принциплар булып
тора һәм башка барлык химия производстволарында диярлек кулланыла.
Әйләнә-тирәлекне саклау. Безнең илебездә әйләнә-тирәлекне саклауга
зур игътибар бирелә. Сульфат кислотасын җитештерү заводларында
аппаратураның герметиклыгын тәэмин итеп һәм газ чистарту җайланмалары
кулланып әйләнә-тирәлекнең пычрануы кисәтелә.
9—11 нче күнегүләрне үтәгез (63 нче бит). 4 нче мәсьәләне чишегез (63 нче бит).
1. Химик реакциянең тизлеге нәрсә ул
һәм аны ничек билгелиләр?
2. Производствода яки көнкүрештә
тизлеген арттыру яки киметү уңай яки
тискәре әһәмияткә ия булган реакцияләргә
мисаллар китерегез.
3. 2 нче таблицада (54 нче бит) хи¬
мик реакцияләрнең тизлегенә йогынты
ясаучы факторлар күрсәтелгән һәм
мисаллар бирелгән. Ьәрбер фактор өчен
тагын бер-ике өстәмә мисал китерегез,
реакцияләрнең тигезләмәләрен төзегез һәм
аларны тормышка ашыруны нигезләгез.
4. Катализаторлар ни өчен химик
реакцияләрнең тизлеген арттыралар?
Конкрет мисаллар китерегез.
5. Каты хәлдәге матдә катнашкан
химик реакциянең тизлеге кайсы очракта
арта:
1) реагирлашучы матдәләрнең концентра¬
циясе үзгәргәндә
2) температура төшкәндә
3) басым үзгәргәндә
4) реагирлашучы матдәләрнең орыну өсле¬
генең мәйданы артканда?
6. Неорганик һәм органик химия
курсларыннан каталитик реакцияләргә
өч-дүрт мисал китерегез.
62
7. Нинди системаны тигезләнешле
система дип атыйлар? а) Экзотермик
реакциянең; б) эндотермик реакциянең
химик тигезләнешен авыштыру өчен
нинди шартлар кирәк?
8. Реакция тигезләмәләре бирелгән:
2HgO ₽=* 2Hg + O2 - Q
N2 + ЗН2 ?=± 2NHo + Q
N2 + O2 2N0 - Q
2Н2 + O2 2Н2О + Q
а) Температура күтәрелгәндә; б) басым
күтәрелгәндә тигезләнеш кайсы якка авы¬
шыр?
9*. Тәэсир итешүче массалар законын
химик реакцияләрнең тизлегенә һәм хи¬
мик тигезләнешкә карата тәгъбир итегез.
10. Сульфат кислотасын түбәндәге
башлангыч матдәләрдән табарга мөмкин:
а) цинк сульфиды; б) сероводород; в) сөрмә
сульфиды Sb2S3. Тиешле реакцияләрнең
тигезләмәләрен төзегез.
11. Пиритны яндыру мичен корганда,
чималның ваклану дәрәҗәсен арттыруга
һәм яндыру температурасын күтәрүгә
бәйле рәвештә реакциянең тизлеге үсү
закончалыгыннан чыгып эш иткәннәр.
Бу шартларны үтәүдә нинди кыенлыклар
туган һәм аларны ничек бетергәннәр,
аңлатып бирегез.
12. Күкерт(1У) оксидын күкерт(У1)
оксидына әверелдерү өчен нинди шартлар
кирәк, аңлатып бирегез.
ф 1. Әгәр A матдәсенең баштагы кон¬
центрациясе 0,22 моль/л, ә 10 секундтан
соң 0,215 моль/л булса,
A + B » 2С
реакциясенең уртача тизлеген исәпләп
чыгарыгыз. B матдәсенең концентрациясе
бу вакыт эчендә ничек үзгәрә?
2. Әгәр температура 10 0C ка күтәрел¬
гәндә реакциянең тизлеге өч тапкырга
артса, температураны 150 дән 200 0C ка
кадәр күтәргәндә, реакция тизлеге ничә
тапкырга артыр?
3. 60% ы пириттан FeS2 торган 16 т
рудадан күпме масса сульфат кислотасы
табарга мөмкин булыр иде?
4. 2,4 т пириттан 98%лы сульфат
кислотасы эремәсен ничә тонна табарга
мөмкин?
§15. Электролитлар һәм неэлектролитлар.
Электролитик диссоциация
«Электролитлар», «неэлектролитлар» һәм «электролитик диссоциация»
төшенчәләре белән сез 9 нчы сыйныфта җентекләп таныштыгыз. Электро-
литларның судагы эремәләре электр тогын үткәрә. Электролитларга неор-
ганик кушылмаларның иң әһәмиятле класслары — кислоталар, нигезләр,
тозлар керә. Матдәнең су белән үзара тәэсир итешү характеры матдәнең
табигатенә, химик бәйләнеш төренә, температурага һәм башка кайбер фак¬
торларга бәйле.
Кислоталар, нигезләр, тозлар ионлы һәм /яки поляр ковалент бәйлә¬
нешле. Ионлы кушылмалар каты кристаллик хәлдә электр тогын үткәр¬
миләр, чөнки бу очракта ионнар ирекле булмый, ә кристаллик челтәр¬
ләрнең төеннәрендә нык береккән була. Эремәләрдә исә суның диполь
молекулалары кристаллны әйләндереп ала, ионнар арасында бәйләнеш
йомшый, ионнар кристаллдан эремәгә күчә, гидратлашкан ионнар барлыкка
килә, кристаллар челтәре җимерелә. Кристаллик челтәрләр эретелмәләрдә
дә җимерелә. Бу процесс электролитик диссоциация дип атала.
63
Поляр кушылмалар суда эрегәндә, поляр ковалент бәйләнеш диполь су
тәэсиреннән ионлы бәйләнешкә әверелә һәм эремәдә гидратлашкан ионнар
хасил була. Нәкъ менә алар электролит эремәләрендә (яки эретелмәләрендә)
корылмалар йөртүчеләр булып торалар. Шулай итеп, электролитлар —
икенче төр үткәргечләр, ягъни ионлы үткәрүчәнлеккә ия булган матдәләр.
(Металлар — беренче төр үткәргечләр; аларда корылмаларны йөртүчеләр
булып электроннар хезмәт итә.)
Электролитларның судагы эремәләренең үзенчәлекләрен аңлату өчен,
1887 елда швед галиме С. Аррениус электролитик диссоциация теориясен
тәкъдим итә. Ләкин галим эремәләрдә бара торган күренешләрнең барлык
катлаулылыгын исәпкә алмаган. Ул ионнарны эреткеч молекулаларыннан
бәйсез булган ирекле кисәкчекләр итеп караган.
Электролитларның эремәләре турындагы күзаллаулар алга таба рус
химигы И. А. Каблуков тарафыннан үсеш ала. Ул электролитик диссо-
циацияне Д. И. Менделеевның эремәләрнең химик теориясеннән башка
аңлатып булмавын күрсәтә. Билгеле булганча, Д. И. Менделеев эрегән матдә
эреткеч белән үзара тәэсир итешкәндә химик кушылмалар барлыкка килүен
эксперименталь юл белән нигезли.
Электролитлар арасында кислоталар һәм нигезләр бик әһәмиятле урын
алып торалар.
Аррениус теориясе буенча, кислоталар — су тирәлегендә водород
ионнарын барлыкка китереп диссоциацияләшә торган электролитлар.
HCl = H++ СГ
H2SO4 = 2Н+ + SOf
Аррениус буенча, нигезләр — су тирәлегендә гидроксид-ионнар
барлыкка китереп диссоциацияләшә торган электролитлар.
KOH = K++ OH
NaOH = Na++ ОН’
Кислота-нигез тәэсир итешүе. Электролитик диссоциация теориясе
матдәләрнең сусыз эремәләрдә үзләрен ничек тотуын тасвирлый алмаган.
Матдәләрнең сусыз эремәләрдә үзләрен ничек тотуын аңлата торган иң
танылган теория булып данияле физик-химик И. Бренстед һәм инглиз
64
химигы Т. Лоури тарафыннан бер үк вакытта (1928—1929) тәкъдим ителгән
кислоталарның һәм нигезләрнең протолитик теориясе санала.
Бу теория буенча, кислоталар — бирелгән реакциядә протоннар аерып
чыгара торган матдәләр, молекулалар яки ионнар; нигезләр — үзләренә
протоннар куша торган матдәләр, молекулалар яки ионнар.
Кислоталар һәм нигезләрнең гомуми исеме — протолитлар.
Кислота һәм нигез иярмә парлар кебек булалар, һәм алар үзара түбәндәге
тигезләмә белән бәйләнгән:
Кислота ?=± Нигез + H+
Протон ирекле хәлдә була алмый, суда ул гидроксоний ионын H3O+
барлыкка китерә:
H2SO4 + H2O ?=± H3O+ + HSO4
кислота нигез иярмә иярмә
кислота нигез
Протон күчү белән, үзара тәэсир итешүче кушылмалар рольләрен алма¬
шалар: сульфат кислотасы — иярмә нигез HSO4 кә, ә су (нигез) иярмә
кислота H3O+ га әверелә.
Серкә кислотасы CH3COOH судагы эремәдә көчсез кислота үзлекләрен
күрсәтә:
CH3COOH + H2O H3O+ + CH3COO-
кислота нигез иярмә иярмә
кислота нигез
Сульфат кислотасын серкә кислотасы белән
нигез ролен уйный:
катнаштырганда, соңгысы
H2SO4 + CH3COOH ?=± CH3COOHj + HSOJ
кислота нигез иярмә иярмә
кислота нигез
Кислота-нигез тәэсир итешүе протон бирү процессы буларак карала.
Китерелгән мисаллар матдәләрне кислоталарга һәм нигезләргә бүлүнең
чагыштырма характерда булуын күрсәтә.
Протолитик теория, судагы эремәләрдә һәм сусыз эремәләрдә бара торган
күренешләрне аңлатып, электролитик диссоциация теориясенә караганда
кислоталарның һәм нигезләрнең гомумирәк теориясе булып тора.
Сорауларга җавап бирегез һәм 1—4 нче күнегүләрне үтәгез (68 нче бит). 1, 2 нче
мәсьәләләрне чишегез (68 нче бит).
65
§16. Көчле һәм көчсез электролитлар. Диссоциация
дәрәҗәсе һәм константасы
«Электролитик диссоциация дәрәҗәсе» төшенчәсе белән сез инде таныш.
Бу — әһәмиятле микъдар характеристикасы. Диссоциация дәрәҗәсен грек
хәрефе α (альфа) белән билгелиләр.
Электролитик диссоциация дэрээуэсе α — эремәдә ионнарга
таркалган молекулалар санының эремәгә (яки эретелмәгә) кертелгән
башлангыч молекулаларның гомуми санына чагыштырмасы ул.
α ның кыйммәте 0 дән (матдә — неэлектролит) 1 гә кадәр (көчле
электролит) үзгәрә. Еш кына бу зурлыкны процентларда күрсәтәләр.
Төрле электролитларның көчен аларның бертөрле шартларда электролитик
диссоциация дәрәҗәсен чагыштырып бәяләргә мөмкин. 18 oC температурада
һәм электролитның концентрациясе 0,1 моль/л булганда, диссоциация
дәрәҗәсенә бәйле рәвештә электролитларны түбәндәге төркемнәргә аералар:
• көчле электролитлар: а> 30% (тозлар, селтеләр, көчле кислоталар);
• уртача көчлелектәге электролитлар: 3% <а<30% (H3PO4, H2SO3);
• көчсез электролитлар: а<3% (HF, HClO, H3BO3, H2S, органик кис¬
лоталар, нигезләр).
Диссоциация дәрәҗәсе
• эремәнең концентрациясенә (эремә никадәр күбрәк сыегайтылса, α
шулкадәр зуррак);
• эремәнең температурасына (температураны күтәрү белән α зурая);
• эреткечнең табигатенә (поляррак эреткеч диссоциацияне көчәйтә) бәйле.
Көчсез электролитлар өчен тагын бер характеристика — диссоциация
константасы (Kjs) бар.
Көчсез электролитлар эремәсендә химик тигезләнеш урнаша, мәсәлән:
CH3COOH ?=* CH3COO" + H+
Биредә тәэсир итүче массалар законын кулланырга мөмкин:
[CH8COO"] · [H+]
КЯ ~ [CH3COOH] ’
монда Kjs — диссоциация константасы.
Диссоциация константасы температурага, электролит һәм эреткеч табига¬
тенә бәйле, ләкин электролит концентрациясенә бәйле түгел.
Көчле электролитлар өчен диссоциация константасы кыйммәтен билге¬
ләмиләр, чөнки эремәдә ионнарга таркалмаган молекулалар практик як¬
тан булмый. Kjs никадәр зуррак булса, эремәдә ионнар шулкадәр күбрәк,
электролит шулкадәр көчлерәк була.
■ Эремәнең водород күрсәткече (pH). Cy — бик көчсез электролит. Суның
һәр миллиард молекуласыннан икесе генә ионнарга таркала:
66
СЕЗ
БЕЛӘСЕЗМЕ?
Без нәрсә -ашаганга бәйле рәвештә, безнең авызда
pH үзгәрә. Шикәрне күп итеп ашау селәгәйнең кисло-
талылыгын арттыра. Селәгәй өчен pH ның 5,5 кә тигез
булган кыйммәте куркынычсыз санала. pH ның түбәнрәк
кыйммәте тешләрнең бозылуын китереп чыгара.
H2O ?=± H+ + OH-
Ионнар концентрациясен 1 л дагы ионнарның мольләрендә күрсәтәләр.
Суның диссоциациясе тигезләмәсеннән H+ ионнары һәм OH- ионнары
концентрацияләре бертөрле булуы күренә ([H+] = [ОН]). Тәҗрибә юлы
белән бер литр суда бүлмә температурасында (22 0C) IO-7 моль су гына
диссоциациягә дучар булуы билгеләнгән һәм бу вакытта Ю”7 моль/л H+
ионнары һәм 10”' моль/л ОН” ионнары барлыкка килә.
Судагы водород ионнары һәм гидроксид-ионнарның концентрацияләре
тапкырчыгышын суның ионнар тапкырчыгышы (Kc) дип атыйлар. 22 0C
температурада Kc — даими зурлык, санча Ю”14 кә тигез:
Kc = [Н+] · [ОН”] = Ю”14
Нейтраль эремә өчен [Н+] = [OH”] = IO 7 моль/л.
Әгәр нейтраль эремәгә кислота өстәсәң, [Н+]10”7 моль/л дан артып
китәчәк, ә [ОН”] кимеячәк, эремәнең тирәлеге әче булачак. Әгәр нейтраль
эремәгә селте өстәсәң, [ОН”] Ю”7 моль/л дан артып китәчәк, ә [Н+] кимеячәк,
эремә селтеле булачак.
Эремәнең кислоталылыгын һәм селтелелеген [Н+] ның концентрациясе
аша күрсәтү кабул ителгән. Нейтраль тирәлек өчен [Н+] = Ю”7, әче тирәлек
өчен [Н+] > 10” , селтеле тирәлек өчен [Н+] < Ю”7. Тискәре дәрәҗә күрсәт¬
кечле саннарны куллану уңайсыз. Водород ионнары концентрациясен pH
(пэ-аш) символы белән билгеләнүче водород күрсәткече аша күрсәтү кабул
ителгән.
Водород күрсәткече pH — водород ионнары концентрациясенең тис¬
кәре тамга белән алынган унарлы логарифмы ул.
Нейтраль эремә өчен: pH = -Ig [Н+] = -Ig [Ю”7] = 7.
Әче эремәләр өчен pH < 7, селтеле эремәләр өчен pH > 7.
Эремәнең pH ын белеп, эремәдәге H+ ионнарының моляр концентрациясен
исәпләргә мөмкин:
[Н+] = 1О’рН
pH ны билгеләүнең практик эшчәнлектә әһәмияте зур. Бу күрсәткеч
лабораториядә тикшеренүләрдә, промышленностьта, авыл хуҗалыгында
һәм бакчачылыкта киң кулланыла. Медицина максатында кеше организмы
эремәләренең (мәсәлән, канның) pH ын үлчиләр.
67
Эремәнең pH ын төрле ысуллар белән билгелиләр. pH ны төгәлрәк
билгеләү өчен, иономерлар яки pH.-метрлар дип атала торган электронлы
приборлар кулланалар. Электролитларның судагы эремәләренең кислота-
лылыгын сезгә инде билгеле булган үзенә бертөрле матдәләр — индикатор¬
лар (лакмус, фенолфталеин, метилоранж, универсаль индикатор) ярдәмендә
якынча билгеләргә мөмкин.
Сорауларга җавап бирегез һәм 5—9 нчы күнегүләрне үтәгез. 3 нче мәсьәләне
чишегез.
? ШШЯИЯИШШЯял
1. Түбәндәге матдәләрнең кайсыла¬
ры электролитларга, кайсылары не-
электролитларга керә: этил спирты,
калий гидроксидының судагы эремәсе,
калий гидроксиды эретелмәсе, бакыр(П)
сульфатының судагы эремәсе, хлорид
кислотасы, глюкозаның судагы эремәсе,
кислородның судагы эремәсе?
2. Түбәндәге электролитларның
диссоциация тигезләмәләрен төзегез:
NaOH1 Na3PO4, HNO3, CH3COONa, FeCl3,
Al2(SO4)3, Cu(OH)Cl, KH2PO4.
3. Кайсы очракта диссоциация вакы¬
тында катионнар сыйфатында H+ ионнары
гына барлыкка килә?
1) KOH 3) KHCO3
2) HNO3 4) Na2HPO4
4. Кайсы очракта диссоциация вакы¬
тында анионнар сыйфатында OH- ионнары
гына барлыкка килә?
1) NaOH 3) Al(OH)2Cl
2) Cu(OH)Cl 4) Na2CO3
5. Эремәдәге матдәнең диссоциация
дәрәҗәсе 97% тәшкил итә. Матдә —
1) көчле электролит
2) көчсез электролит
3) уртача көчлелектәге электролит
4) неэлектролит
6. Көчсез электролит —
1) калий гидроксиды
2) серкә кислотасы
3) сульфат кислотасы
4) натрий бромиды
7*. 0,001 M ле хлорид кислотасы эре¬
мәсенең pH ы ничәгә тигез?
8*. Na2SO4, КОН, HNO3 матдәләренең
судагы эремәләренең pH ы 7 дән зурракмы,
кимрәкме яки 7 гә тигезме?
9*. Ни өчен яңгыр суының pH ы һәрва¬
кыт 7 дән кимрәк? Ул нәрсәгә бәйле?
• 1. Бакыр(П) сульфатының (тыгызлыгы
1,19 г/мл) 20% лы 400 мл эремәсеннән,
температура төшкәндә, массасы 50 г бул¬
ган CuSO4 ■ 5Н2О кристаллогидраты уты¬
рымга төшкән. Калган эремәдә бакыр(П)
сульфатының масса өлеше нинди булыр?
2. 3 моль NaOH 1 моль H3PO4 белән
тәэсир итешкәндә табылган тоздагы нат¬
рийның масса өлешен (процентларда)
исәпләгез.
3. 30% лы 150 г хлорид кислотасын
натрий карбонатының 0,5 моль тоз булган
эремәсе белән катнаштырганда аерылып
чыккан газның күләмен (н. ш.) исәпләгез.
§17. Ионнар алмашу реакцияләре
9 нчы сыйныфта сез инде ионнар алмашу реакциясен ж,ентекләп өйрән¬
дегез.
Ионнар арасында бара торган реакцияләрне ионнар алмашу реак¬
цияләре дип атыйлар.
68
Ионнар алмашу реакцияләре судагы эремәләрдә кайтмас һәм кайтма
булып узарга мөмкин. Ионнар алмашу реакцияләре нәтиҗәсендә әгәр
эреми торган, газ хәлендәге яки аз диссоциацияләшүче матдәләр барлыкка
килсә, алар кайтмас, яки азакка кадәр узалар. Кайтмас ионнар алмашу
реакцияләрен электролитик диссоциация теориясе карашыннан чыгып
тикшерик.
Бакыр(П) сульфаты һәм натрий гидроксиды эремәләрен кушканда
баручы реакцияне карыйк:
CuSO4 + 2NaOH = Cu(OH)2H Na2SO4
Көчле электролитлар судагы эремәләрендә тулысынча ионнарга
диссоциацияләшәләр, шуңа күрә бу реакциянең тулы һәм кыскартылган
ионлы тигезләмәләре түбәндәгечә булыр:
Cu2+ + SO2- + 2Na+ + 20Н~ = Cu(OH)2 ! + 2Na+ + SO4-
Cu2+ + 20Н- = Cu(OH)21
Кыскартылган ионлы тигезләмә, реакциядә Cu2+ һәм OH- ионнары тәэсир
итешеп, нәтиҗәдә көчсез электролит — Cu(OH)2 матдәсе барлыкка килүен
күрсәтә.
Монда бу ионнар аларның тәэсир итешүенә кадәр нинди матдәләрнең
составына кергән булуы роль уйнамый. Түбәндәге кыскартылган ионлы
тигезләмәгә туры килгән реакция барсын өчен, ике валентлы бакырның
теләсә нинди суда эрүчән тозын һәм теләсә нинди селтене алырга мөмкин,
мәсәлән:
CuCl2 + 2К0Н = Cu(OH)2R 2КС1
Cu2+ + 2СГ + 2К+ + 20Н~ = Cu(OH)2!+ 2К+ + 2СГ
Cu2+ + 2он- = Cu(OH)2;
Алмашу реакциясе нәтиҗәсендә газ хәлендәге матдә барлыкка килгән
икенче очракны карыйк:
K2S + 2НС1 = 2КС1 + H2S t
Бу ДҮРТ матдәнең беренче өчесе — көчле электролитлар, сероводород —
молекуляр төзелешле газ хәлендәге матдә:
2К+ + S2- + 2Н+ + 2СГ = 2К+ + 2СГ + H2S ΐ
2Н+ + S2- = H2S ΐ
Кыскартылган ионлы тигезләмә бу реакция нәтиҗәсендә көчле электро¬
литлар составына керүче ионнардан көчсез электролит (неэлектролит)
молекулалары барлыкка килүен күрсәтә. Ьәм бу очракта сероводород кисло¬
тасының теләсә нинди эрүчән тозы башка кислота белән тәэсир итешкәндә,
газ хәлендәге матдә — H2S барлыкка килә.
69
Ионнар алмашу реакциясе нәтиҗәсендә аз диссоциацияләшүче матдә
барлыкка килә торган өченче очракны карыйк:
2КОН + H2SO4 = K2SO4 + 2Н2О
2К+ + 20Н- + 2Н+ + SO4- = 2К++ SO4- + 2Н2О
H+ + OH- = HOH
Бу реакция нәтиҗәсендә дә көчле электролитлар молекулаларының
ионнарыннан көчсез электролит — су молекулалары барлыкка килә.
Шулай итеп, гомуми кагыйдә чыгарырга мөмкин:
Әгәр көчле электролитлар ионнарының тәэсир итешүе көчсез электро¬
лит (неэлектролит) барлыкка килү белән барса, электролитларның эремә¬
ләрендә реакцияләр кайтмас булып бара.
Әгәр реакция нәтиҗәсендә аз диссоциацияләшүче (яки диссоциацияләшми
торган) кушылма барлыкка килмәсә, андый реакция һәрвакыт кайтма була,
ягъни эремәдә ионнар катнашмасы барлыкка килә:
KCl + NaNO3 NaCl + KNO3
K+ + СГ + Na+ + NO3 Na+ + СГ + K+ + NO3
1—3 нче күнегүләрне үтәгез (74 нче бит), 1, 2 нче мәсьәләләрне чишегез
(74 нче бит).
§18. Органик һәм неорганик кушылмалар гидролизы
Неорганик һәм органик химия курсында сез гидролиз реакцияләре белән
танышкан идегез. Гидролиз — ул алмашу реакциясенең бер төре. Реакция
башлангыч матдә белән су арасында бара, реакция нәтиҗәсендә башлангыч
матдә су тәэсиреннән таркала.
Гидролиз,— нигездә, кайтма процесс. Тигезләнешне кирәкле якка ничек
авыштырырга? Бу процессны төрле мисалларда карарбыз.
Органик химиядә сез катлаулы эфирлар гидролизын өйрәндегез:
сн— с
3 xO-C3H5+ H2O <=* C2H5OH + CH3-C <тт
серкә кислотасының этанол серкә
этил эфиры кислотасы
1
Тигезләнеш реакция продуктлары ягына авышсын өчен, гидролизны
селте катнашында үткәрергә кирәк, ул вакытта кислота урынына аның
тозы барлыкка киләчәк һәм реакция кире якка бармаячак.
70
Майлар гидролизы да, глицерин һәм сабын (югары төзелешле карбон
кислоталарының натрий тозы) барлыкка китереп, шулай ук уза. Промыш¬
ленностьта бу реакциянең әһәмияте бик зур. Ул икенче төрле сабынлану
дип атала.
Углеводлар гидролизы минераль кислоталар катнашында уза:
полисахаридлар —
—> декстриннар —* дисахаридлар —> моносахаридлар
H+
(C6Hi0O5)n + TiH2O > TiC6Hi2O6
крахмал
H+
(C6Hi0O5)n + TiH2O * TiC6Hi2O6
целлюлоза
Аксым гидролизы аны кислота яки селте катнашында җылытканда
бара:
аксымнар ► полипептидлар > эре пептидлар > вак пептидлар ►
» дипептидлар > аминокислоталар
Гидролиз реакцияләренең практик һәм биологик әһәмияте зур. Tepe
организмнарда алар ферментлар катнашында бара.
Неорганик химиядә тозлар гидролизына зур әһәмият бирелә.
Тозлар гидролизы — тоз ионнарының су белән аз диссоциацияләшүче
электролитлар барлыкка китереп тәэсир итешүе ул.
Теләсә нинди тозны кислотаның нигез белән тәэсир итешү продукты,
ягъни кислота-нигез тәэсир итешүе нәтиҗәсе буларак карарга мөмкин
(6 нчы схема).
Тозларның типлары
6 нчы схема
71
Тозлар гидролизының типик очракларын карыйбыз.
I. Көчле кислота һәм көчсез нигездән барлыкка килгән тозлар.
Алюминий хлориды AlCl3 эремәсенә берничә тамчы лакмус өстибез: ул
алсу төскә үзгәрә. Димәк, бу тозның эремәсендә әче тирәлек.
HCl — көчле кислота
AlCl3 —-
Al(OH)3 — көчсез нигез
Судагы эремәдә алюминий хлориды тулысынча диссоциацияләшә, чөнки
ул көчле электролит, һәм су молекулалары бераз диссоциацияләшә:
AlCl3 =
H2O
Al3+
ОН”
+ зсг
+ H+
Көчсез нигез катионнары Al3+ гидролиз реакциясендә катнашалар:
көчсез электролит AlOH2+ катионы барлыкка килә, эремәдә ирекле водород
ионнары H+ кала һәм эремәнең тирәлеге әчегә әйләнә:
Al3+ + H2O
AlOH2+ + H+
Ионлы тигезләмәгә түбәндәге молекуляр тигезләмә туры килә:
AlCl3 + H2O ?=* AlOHCl2 + HCl
AlCl3 + H2O
II. Көчле нигез һәм көчсез кислотадан барлыкка килгән тозлар.
Натрий сульфиды Na2S эремәсенә берничә тамчы фенолфталеин өстибез:
ул кура җиләге төсенә үзгәрә. Димәк, бу тозның эремәсендә селтеле ти¬
рәлек.
NaOH — көчле нигез
H2S — көчсез кислота
Судагы эремәдә тоз тулысынча диссоциацияләшә, чөнки ул көчле
электролит, һәм су молекулалары бераз диссоциацияләшә:
Na2S
H2O
2Na+ + S2”
OH- +
H+
Көчсез кислота анионнары S2-, көчсез электролит — HS- анионы хасил
итеп, гидролиз реакциясендә катнаша, эремәдә ОН” гидроксид-ионнары
барлыкка килә һәм эремәнең тирәлеге селтелегә әйләнә:
S2” + H2O
HS” + ОН”
72
Лаборатор тәҗрибәләр
1. Химик реакцияләрнең тизлегенә төрле факторларның йогынтысын
өйрәнү
1 нче тәҗрибә. Ике пробиркага икешәр кисәк цинк салыгыз. Беренче пробиркага—
2 мл сыегайтылган (1:2) хлорид кислотасы, икенчесенә 2 мл сыегайтылган серкә
кислотасы (1:2) агызыгыз.
2 нче тәҗрибә. Бер пробиркага — бераз тимер порошогы, икенчесенә шулкадәр
үк тимер вагы салыгыз. Ике пробиркага да 2 шәр мл сыегайтылган сульфат кислотасы
(1:2) агызыгыз.
3 нче тәҗрибә. Ике пробиркага икешәр кисәк цинк салыгыз. Беренче пробиркага —
2 мл сыегайтылган сульфат кислотасы (1:5), икенчесенә 2 мл сыегайтылган сульфат
кислотасы (1:10) агызыгыз.
4 нче тәҗрибә. Ике пробиркага икешәр кисәк цинк салыгыз. Ике пробиркага да
2 шәр мл сыегайтылган сульфат кислотасы (1:10) агызыгыз. Бер пробирканы җиңелчә
җылытыгыз, икенчесен чагыштыру өчен калдырыгыз.
Бирем. Башкарган тәҗрибәләргә нигезләнеп нәтиҗә ясагыз, нинди факторлар
химик реакцияләр тизлегенә йогынты ясый һәм тиешле реакцияләрнең тигезләмәләрен
языгыз.
2. Универсаль индикатор белән тирәлек реакциясен билгеләү. Сезгә
түбәндәге матдәләрнең эремәләре салынган пробиркалар бирелгән: HCI1 CH3COOH1
AICI3, NaCI1 Na2CO3, NaOH.
Һәр эремәнең тирәлеген тикшерегез. Моның өчен һәр пробиркага (чиратлап)
пыяла таякчык төшерегез (алдан таякчыкны су белән юыгыз), аннан пыяла таякчыкны
индикатор кәгазенә тидерегез һәм табылган төсне шкала белән чагыштырыгыз. pH
кыйммәтен дәфтәрегезгә языгыз. Нинди эремәләр нейтраль, әче, селтеле булды?
Табылган мәгълүматларны белешмәлектәгеләр белән чагыштырыгыз.
Кислоталар, тозлар, нигезләр эремәләренең
pH кыйммәтләре (0,1 моль/л)
Кушылмаларның классы
Матдәнең формуласы
Эремәнең pH ы
Кислоталар
HCI
1,0
HNO3
1,0
CH3COOH
2,9
H2S
4,1
Тозлар
AICI3
3,0
NH4CI
5,1
NaCI
7,0
KNO3
7,0
Na2CO3
11,6
Na3PO4
12,5
Нигезләр
NaOH
13,0
KOH
13,0
NH3 эремәсе
11,1
3. Тозларның гидролизы. Судагы эремәләрендә бертөрле тирәлекле (нейтраль,
селтеле яки әче) матдәләрне таблицаның колонкаларына бүлеп урнаштырыгыз: натрий
сульфаты, бакыр(Н) нитраты, калий хлориды, цинк сульфаты, натрий карбонаты, калий
75
Ионлы тигезләмәгә түбәндәге молекуляр тигезләмә туры килә:
Na2S + H2O ?=* NaHS + NaOH
III. Көчле нигез һәм көчле кислотадан барлыкка килгән тозлар.
Бу тозлар белән гидролиз бармый.
Бу тозларның судагы эремәләрендә нәрсә булуын карыйк.
-~* NaOH — көчле нигез
NaCl =
HCl — көчле кислота
Натрий хлориды — көчле электролит. Эремәдә аз диссоциацияләшә
торган матдә барлыкка килми, һәм эремәнең тирәлеге нейтраль булып
кала:
NaCl = Na+ + СГ
H2O <=* OH- + H+
IV. Көчсез нигез һәм көчсез кислотадан барлыкка килгән тозлар.
Бу очракта катион да, анион да көчсез электролитлар барлыкка китереп,
гидролиз реакциясендә катнашалар, һәм эремәнең тирәлеге нейтральгә
якынлаша:
CH3COONH4 <=*
CH3COO-
+
NH+
H2O=F=*
H+
+
OH-
CH3COO- + NH4 + H2O «=* CH3COOH + NH3 · H2O
CH3COONH4 + H2O <=± CH3COOH + NH3 · H2O
Кайтма гидролиз тулысынча JIe Шателье принцибына буйсына.
Ләкин кайтмас гидролиз да, була, бу вакытта тоз тулысынча су тәэси¬
реннән таркала. Андый тозлар судагы эремәләрдә була алмыйлар, һәм
аларны ике тозның судагы эремәләре арасындагы алмашу реакцияләре
белән табып булмый:
Al2(CO3)3 + ЗН2О = 2Al(OH)3l + 3CO2t
- Гидролиз — кислота-нигез алмашу процессы. Аны кислота-нигез тәэсир
итешүе карашыннан чыгып аңлатырга мөмкин.
Протолитик теория буенча, протон су молекуласыннан билгеле бер ионга
яки ионнан су молекуласына күчәргә мөмкин:
CH3COO- + H2O «=* CH3COOH + OH-
NH4 + H2O «=* H3O+ + NH3
4—12 нче сорауларга җавап бирегез (74 нче бит). 3, 4 нче мәсьәләләрне чишегез
(74 нче бит).
73
1. Электролитик диссоциация теориясе
карашыннан чыгып, судагы тирәлектә бара
торган реакцияләрнең асылын аңлатыгыз.
2. Судагы эремәләрдә бара торган
реакцияләрнең тигезләмәләрен молеку¬
ляр һәм ионлы формада языгыз.
1) AgNO3 + FeCl3 * ...
2) Ba(OH)2 + HNO3 * ...
3) CuSO4 + NaOH * ...
4) Na2SO4 + BaCl2 ♦ ...
5) K2CO3 + H2SO4 * ...
6) Ba(HCO3)2 + Ba(OH)2 —♦ ...
3. Түбәндәге схемаларга туры килүче
икешәр ионнар алмашу реакцияләре
тигезләмәләрен мисалга китерегез:
а) H++ OH- = H2O
б) Pb2+ + 20Н“ = Pb(OH)21
4. Түбәндәге тозларның кайсылары
гидролиз реакциясенә керер: тимер(Ш)
хлориды, натрий сульфаты, литий карбо¬
наты, натрий нитраты. Моны нинди тәҗ¬
рибәләр белән тикшерергә мөмкин?
5. а) Алюминий сульфаты; б) калий
нитраты; в) натрий карбонаты эремәләренә
метилоранжны өстәгәндә, ул нинди төскә
үзгәрер? Ни өчен?
6. Түбәндәге тозларның судагы эремә¬
ләренең тирәлеге нинди?
1) Na2S 3) CuSO4
2) NaCl 4) K2CO3
7. Судагы эремәсенең тирәлеге сел¬
теле
1) аммоний хлоридының
2) калий нитратының
3) бакыр(П) хлоридының
4) натрий карбонатының
8. Тозның формуласы белән аның
судагы эремәсенең тирәлеге туры килүне
билгеләгез:
1) Na2CO3 А. Нейтраль
2) KCl Б. Селтеле
3) FeCl3 В. Әче
4) CH3COONa
1
2
3
4
9. Гидролизлата торган органик мат¬
дәләргә мисаллар китерегез.
10. Организмда аминокислоталар нин¬
ди матдәләрнең гидролизы вакытында
барлыкка килә?
1) майлар 3) аксымнар
2) углеводлар 4) тозлар
11. Метиламинның судагы эремәсе
тирәлегенең реакциясе:
1) әче 3) нейтраль
2) селтеле 4) бераз әче
12*. Натрий ортофосфаты һәм орто¬
фосфат кислотасы эремәләренең составын¬
дагы охшашлыкларны һәм аерымлык¬
ларны күрсәтегез.
• 1. 1 л 21% лы фосфат кислотасы эре¬
мәсендә (тыгызлыгы 1,12 г/мл) 28,4 г фос-
фор(У) оксидын эреткәннәр. Табылган эре¬
мәдәге матдәнең масса өлешен исәпләгез.
2. IOO мл 6% лы натрий карбонаты
эремәсен (тыгызлыгы 1,06 г/мл) нейтраль¬
ләштерү өчен, 20% лы сульфат кислотасы
эремәсе (тыгызлыгы 1,14 г/мл) нинди кү¬
ләмдә кирәк булыр?
3. 200 мл 20% лы нитрат кислотасы
эремәсен (тыгызлыгы 1,115 г/мл) табу
өчен кирәкле калий нитратының массасын
билгеләгез.
4. 11,4 г аш серкәсен нейтральләштерү
өчен, концентрациясе 0,5 моль/л булган
18,24 мл натрий гидроксиды эремәсе кирәк
булган. Эремәдәге серкә кислотасының
масса өлешен исәпләгез.
сульфаты, алюминий хлориды. Үзегезнең классификациягезне, химик эксперимент
ярдәмендә, метилоранж, лакмус һәм фенолфталеин кулланып тикшерегез. Нәтиҗәләрне
дәфтәрегезгә таблица рәвешендә языгыз.
Эремәнең тирәлеге
әче
нейтраль
селтеле
Матдәләрнең формулалары
Химик эксперимент нәтиҗәсе
(гидролиз тигезләмәсе)
2 нче практик эш
Химик реакцияләрнең тизлегенә төрле факторларның йогынтысы. Практик
эшкә әзерләнгәндә 2 нче таблицадан файдаланыгыз. Кислоталар һәм водород перок¬
сиды белән эшләгәндә, куркынычсызлык техникасын үтәгез.
1. Реагирлашучы матдәләрнең табигатенең йогынтысы.
1) Өч пробиркага хлорид кислотасы агызыгыз. Беренче пробиркага — магний
кисәге, икенчесенә — цинк кисәге, өченчесенә бакыр кисәге салыгыз. Нәрсә күзәтәсез?
Реакцияләрнең кайсысы иң тиз бара?
2) Бер пробиркага — хлорид кислотасы, икенчесенә шулкадәр үк микъдарда серкә
кислотасы салыгыз (кислоталарның концентрациясе бертөрле). Һәр пробиркага икешәр
гранула цинк төшерегез. Кайсы реакция тизрәк баруын билгеләгез.
2. Реагирлашучы матдәләрнең концентрациясенең йогынтысы.
Ике пробиркага берәр гранула цинк урнаштырыгыз. Бер пробиркага — 1 мл (1:3)
хлорид кислотасы, икенчесенә шулкадәр үк (1:10) хлорид кислотасы салыгыз.
Кайсысында реакция көчлерәк бара? Ни өчен?
3. Реагентларның орыну өслегенең йогынтысы.
Бер пробиркага — акбур кисәге, икенчесенә акбур порошогын салыгыз. Про¬
биркаларга 1,5 шәр мл хлорид кислотасы агызыгыз (бертөрле концентрацияле). Газ
аерылып чыгу тизлегендә аерма бармы?
4. Температураның йогынтысы.
Ике пробиркага берәр гранула цинк төшерегез. Һәр пробиркага бертөрле
концентрацияле 1 әр мл хлорид кислотасы салыгыз. Бер пробирканы кайнар сулы
стаканга төшерегез. Водород куыклары бүленеп чыгу көче буенча, химик реакцияләрнең
тизлегенә температураның йогынтысы турында нәтиҗә ясагыз.
5. Катализаторның йогынтысы.
Пробиркага 1 мл водород пероксиды салыгыз һәм пыскып торган чыраны, сыеклыкка
тидермичә генә, пробиркага кертегез. Нәрсә күзәтәсез? Водород пероксидына марга-
нец(!\/) оксидының MnO2 берничә кристалын өстәгез һәм яңадан пыскып торган чыраны
кертегез. Нәрсә күзәтәсез? MnO2 нинди роль уйный?
Эш турында ирекле формада отчет төзегез һәм гомуми нәтиҗә ясагыз.
Металлар
к шеи·
V БҮЛЕК
Химик элементларның Д. И. Менделеев периодик системасындагы пе¬
риодларда һәм төркемнәрдә элементларның үзлекләре үзгәрү законча¬
лыкларын сез инде беләсез. Бу закончалыкларга тәңгәл килеп, металлик
элементлар периодик системаның сул ягында һәм аскы өлешендә урнашкан.
Элементларның металларга һәм неметалларга шартлыча гына бүленеп
йөртелүе сезгә шулай ук билгеле (8 нче сыйныф, § 34).
Металлик элементларның атом радиуслары неметаллик элементларның
атом радиусларыннан зуррак. Шуңа күрә металлик элементларның атом¬
нары. үзләренең валентлык электроннарын чагыштырмача җиңел бирәләр.
Шул сәбәпле алар уңай корылмалы ионнар барлыкка китерергә сәләтле,
ә кушылмаларда фәкать уңай оксидлашу дәрәҗәсен генә күрсәтәләр. Күп
кенә металлик элементлар, мәсәлән, бакыр Cu, тимер Fe, хром Cr, титан Ti
кушылмаларда төрле оксидлашу дәрәҗәсен күрсәтәләр.
Металл атомнары валентлык электроннарын чагыштырмача җиңел
биргәнлектән, ирекле хәлдә алар — кайтаргычлар. Кайтару сәләте төрле
металларда төрлечә. Металларның стандарт электродлар потенциаллары
рәтендә (электрохимик көчәнешләр рәтендә) ул алтыннан Au литийга Li
кадәр арта бара (II форзацны һәм 7 нче схеманы карагыз).
Бу рәттә иң актив металл — литий. Ул литий ионының радиусы натрий
һәм калий ионнары радиусыннан шактый кечкенәрәк булуы белән аңлатыла.
Шуңа күрә литий ионнары тирәсендә барлыкка килгән электр кыры натрий
һәм калий ионнарыныкына караганда көчлерәк. Шуның аркасында литий
ионнарының гидратлашуы натрий һәм калий ионнары гидратлашуы белән
чагыштырганда көчлерәк бара. Нәтиҗәдә литий ионнары эремәгә интен¬
сиврак күчә, аның электрохимик көчәнешләр рәтендәге урыны нәкъ менә
шуның белән аңлатыла.
СЕЗ
БЕЛӘСЕЗМЕ?
Борынгы заманда һәм Урта гасырларда нибары җиде генә
металл бар дип уйлаганнар: алтын, көмеш, бакыр, аккургаш,
кургаш, тимер, терекөмеш. 1789 елда гади матдәләр исемлегенә
ул чакта билгеле булган барлык унҗиде металлны (Sb, Ag, As,
Bi1 Co, Cu, Sn, Fe, Mn, Hg, Mo1 Ni, Au, Pt, Pb, W, Zn) кертәләр.
XIX гасырның беренче яртысында платина металлары ачыла,
электролиз юлы белән кайбер селтеле, селтеле-җир һәм
сирәк-җир металлары табыла. XIX гасырның 60 нчы еллары
башында — Rb, Cs, In, Te1 соңрак Ga, Sc, Ge ачыла. XIX гасыр
ахырында радиоактив элементларны эзләү башлана, XX гасыр
уртасыннан башлап, төш реакцияләре ярдәмендә табигатьтә
очрамаган радиоактив элементлар табыла.
77
QO
7 нче схема
Li
K
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Ni
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
Атомнарның
электроннарны
бирү сәләте
(оксидлашу)
Арта
Ьава кислороды
белән тәэсир
итешүе
Гадәти темпера¬
турада тиз
оксидлашалар
Гадәти температурада яки җылытканда
акрын оксидлашалар
Оксидлаш¬
мыйлар
Cy белән тәэсир
итешүе
Гадәти температу¬
рада H2 аерылып
чыга һәм гидрок¬
сид хасил була
Җылытканда H2 аерылып
чыга һәм
оксидлар хасил була
Судан H2 не этеп
чыгармыйлар
Кислоталар
белән тәэсир
итешүе
ь
Сыегайтылган кислоталардан водородны
этеп чыгаралар
Сыегайтылган
кислоталардан водород¬
ны этеп чыгармыйлар
Җылытканда
куерт, һәм
сыегайт. HNO3
һәм куерт.
H2SO4 белән
реагирла-
шалар
Кислота¬
лар белән
реагир-
лашмый-
лар,
«патша
аракы¬
сы »нда
эриләр
Табигатьтә
очравы
Кушылмаларда гына
Кушылмаларда һәм
ирекле хәлдә
Башлыча
ирекле
хәлдә
Табу ысуллары
Эретелмәләр
электролизы
Күмер, углерод (II) оксиды белән кайтару, алюминотер¬
мия яки тозларның судагы эремәләренең электролизы
Ионнарның
электроннарны
китереп кушу
сәләте
(кайтарылу)
Li+
K+
Ca2+
Na+
Mg2+
Al3+
Mn2+
Zn2+
Cr3+
Fe2+
Ni2+
Sn2+
Pb2+
(H)+
Cu2+
Hg2+
Ag+
Pt2+
Au3+
Арта
►
Металларның физик үзлекләрендәге уртаклык (югары электр һәм җылы
үткәрүчәнлек, чүкелүчәнлек, пластиклык) аларның кристаллик челтәр¬
ләренең төзелеше охшаш булуы белән аңлатыла. Кайбер характерлы физик
үзлекләре, мәсәлән тыгызлыгы, катылыгы, эретелү температурасы буенча
металлар бер-берсеннән шактый аерылалар.
Иң җиңел металл — литий Li (р = 0,53 г/см3), иң авыры — осмий Os
(р = 22,6 г/см3). Тыгызлыгы 5 г/см3 дан кимрәк булган металларны җиңел
металлар, ә 5 г/см3 дан зурракларын авыр металлар дип йөртәләр.
Металлар катылыклары буенча да бер-берсеннән аерылалар. Иң йом¬
шаклары — селтеле металлар. Аларны пычак белән дә ансат кисеп була.
Металларның эретелү температурасы гаять төрле. Иң җиңел эретелү-
чән металл — терекөмеш Hg: аның эретелү температурасы -38,9 0C. Цезий
Cs һәм галлийның Ga эретелү температуралары 28,4 0C һәм 29,8 °C. Иң авыр
эретелүчән металл — вольфрам W: аның эретелү температурасы 3390 °C.
Шуңа күрә ул кыздырма лампа кылларын ясауда кулланыла. Эретелү темпе¬
ратуралары 1000 oC тан югары булган металларны авыр эретелүчән, түбән¬
рәк температурада эретелә торганнарын җиңел эретелүчән дип атыйлар.
Алга таба без A- һәм Б-төркемнәр металларын табу ысулларын, алар¬
ның электронлы төзелешендәге үзенчәлекләрне, шулай ук үзлекләрен
гомумиләштереп һәм системалаштырып тикшерербез.
Сорауларга җавап бирегез һәм 1—4 нче күнегүләрне үтәгез (88 нче бит). 1 нче
мәсьәләне чишегез ( 89 нчы бит).
§19. Металларны табуның гомуми ысуллары.
Электролиз
Металларны табуның гомуми ысуллары белән сез неорганик химия курсын
өйрәнгәндә таныштыгыз. Алар 4 нче таблицада гомумиләштерелеп бирелә.
4 нче таблица. Металларны табу нигезендәге реакцияләр
Металларны кайтару
күмер һәм углерод(П)
оксиды белән
электр тогы белән
(электролиз)
алюминий белән
(алюминотермия)
водород белән
Г-2е'П
+2 0 *
ZnO + C =
0 4-2
= Zn +COt
+3 +2 t
Fe2O3+ ЗСО =
0 +4 .
= 2Fe + 3CO2t
+3 0
2Fe + 6е'-* 2Fe 1
4-2 +4
С-2е'—*С 3
NiSO4 = Ni2++ SO4"
HOH Я=* H+ + ОН"
Анодта:
ОН" - е"—»0Н°
40Н° —* 2H2O+O2t
Катодта’.
Ni2++ 2е"—"Ni0I
(Ni2+ ионнарының кон¬
центрациясе H+ ионнары
концентрациясеннән ар¬
тыграк булырга тиеш)
г~12^
O +4 t
4А1 + ЗМпО9 =
+3 0
= 2А12О3 + ЗМп
0 +3
Al - Зе'—*А1 4
+4 0
Mn+ 4е —» Mn 3
г~6е"—1
+6 0 /
WO3 + 3H2i
0 +1
= W + SH2O
+2 0 t
CoO + H2 =
0 +1
= Co + H2O
79
17 нче рәсем. Ба-
кыр(П) хлориды эре¬
мәсенең электролизы
Металларны электр тогы (электролиз) ярдәмендә
табуны тулырак тикшерик.
Электролизның асылы. Электролиз процессы
белән 17 нче рәсемдәгечә җыелган прибор ярдә¬
мендә танышып була. Ике графит электрод куел¬
ган U-сыман көпшәгә бакыр(П) хлориды эремәсе
салалар һәм приборны даими ток чыганагына
тоташтыралар. Катодта — металлик бакыр, ә анод¬
та хлор аерылып чыга.
Катод һәм анод янында нәрсә була соң?
Белгәнегезчә, тозлар, шул исәптән бакыр(П)
хлориды да, суда эрегәндә диссоциацияләшәләр:
CuCl2 = Cu2+ + 2СГ
Даими ток уздырганда, катионнар ( бу очракта Cu2+ ионнары) — катодка,
ә анионнар (бу очракта СГ ионнары) анодка таба хәрәкәтләнәләр.
Катод — тискәре корылган электрод.
Катод өслегендә артыгы белән электроннар туплана. Бакыр ионнары
Cu2+ катодтагы электроннарны куша. Даими токның Cu2+ ионнарына
тәэсире водородның бакыр(П) оксидына тәэсиренә охшаш, анда да водород
атомнары электроннарын оксидлашу дәрәҗәсе +2 булган бакыр атомнарына
бирә. Бәр ике процессны схемада болай күрсәтергә мөмкин:
Cu2+ 4- 2е~ *Си
Анод — уңай корылган электрод.
Анодта электроннар җитми, шуңа күрә анод тискәре корылган ион¬
нардан, бу очракта хлорид-ионнардан үзенә электроннарны тартып китер¬
гәндәй була: 0
2СГ - 2е~—-Cl2T
Димәк, электролиз оксидлашу-кайтарылу процессы икән.
+2 -1 электролиз о о
CuCl2 * Cu + Cl2T
Электролиз — электролитның судагы эремәсе яки эретелмәсе аша
даими электр тогын уздырганда, электродларда барган оксидлашу-кай¬
тарылу реакцияләре ул.
80
Эретелмәләр электролизы. Тозлар һәм селтеләр эретелгәндә, суда эрегән¬
дәге кебек үк, ионнарга таркалалар. Әгәр бу электролитларның эретелмәләре
аша даими электр тогын үткәрсәк, электролиз күзәтелер. Натрий хлориды
эретелмәсенең электролизы схемасын тикшерик:
катодта
Na+ + е —* Na0
Натрий ионнары
нейтраль атомнарга
кайтарыла, ягъни
металлик натрий
барлыкка килә.
кайтарылу
анодта
СГ - е —* Cl0
Cl0 + Cl0 * Cl2T
Хлорид-ионнар
нейтраль атомнарга
оксидлаша, алардан хлор
молекулалары
барлыкка килә.
оксидлашу
+1 -1 электролиз о о
2NaCl * 2Na + Cl2 T
Натрий гидроксиды эретелмәсенең электролизы схемасы:
катодта
Na+ + е~ —* Na0
Натрий ионнары
нейтраль атомнарга
кайтарыла, ягъни
металлик натрий
барлыкка килә.
анодта
ОН" - е —* OH0
40Н° >2Н2О + O2T
Гидроксид-ионнар
нейтраль төркемнәргә
оксидлаша. Бу төркемнәр
тотрыксыз, су һәм
кислород хасил итеп
таркалалар.
кайтарылу оксидлашу
+1 -1 электролиз о о
4NaOH * 4Na + O2T + 2H2O
Электролизны үткәрү приборы электролизер дип атала.
Электролизерларда катод белән анод арасына бүлге куела. Ни өчен
шулай, аңлатып бирегез.
Судагы эремәләр электролизы. Судагы эремәләр электролизы вакы¬
тында, реакциядә электролит ионнарыннан тыш, су диссоциацияләшүе
нәтиҗәсендә барлыкка килгән водород ионнары яки гидроксид-ионнар
катнашырга мөмкин. Барлыкка килгән ионнар тиешле электродларга таба
хәрәкәт итәләр. Катодка электролит катионнары һәм водород H ионнары,
ә анодка электролит анионнары һәм гидроксид-ионнар ОН" туплана.
81
Нинди ионнар катодта кайтарылачак һәм анодта оксидлашачак соң?
Бу сорауга җавап бирү өчен, химик реакцияләрнең тизлеге реагирлашучы
матдәләрнең табигатенә (активлыгына) һәм концентрациясенә бәйле
булуын искә төшерик. Шулай булгач, нинди ионнарның активрак булуын
белү кирәк: әлеге электролитның катионнарымы яки H+ ионнарымы,
электролитның анионнарымы яки гидроксид-ионнармы? Катионнарның
активлыгын стандарт электродлар потенциаллары рәте (электрохимик
көчәнешләр рәте) буенча белеп була. Бу рәтне караганнан соң, без ионнар¬
ның химик активлыгы аларның үзләренә туры килгән металларның актив¬
лыгы үзгәрү юнәлешенә капма-каршы юнәлештә үзгәрергә тиеш дигән
нәтиҗәгә киләбез. Әйтик, мәсәлән, әгәр бу рәттә калий атомнары иң актив
булса, аның ионнары иң түбән активлыкка ия:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
химик активлык кими бара
K+, Ca2+, Na1, Mg2+, Al3+, Zn2+, Fe2+, Ni2+, Sn2+, Pb2+, Cu2+, Hg2+, Ag+, Pt2+, Au3+
химик активлык арта бара
Бу рәттән күренгәнчә, бертөрле шартларда судагы эремәләрдә катодта
Cu2+ дән алып Au3+ кә кадәр (аны да кертеп) катионнар кайтарыла, ә H+
ионнары, активлыклары кимрәк булганлыктан, эремәдә кала. K+ дән алып
Pb2+ гә кадәр катионнары булган тозлар электролизында бертөрле шарт¬
ларда H+ ионнары кайтарыла. Химик реакцияләрнең тизлеге реагирлашучы
матдәләрнең концентрациясенә бәйле булганлыктан, водород ионнарының
концентрациясе түбән булганда (нейтраль тирәлектә), катод янында электро¬
химик көчәнешләр рәтендә водородка кадәр урнашкан кайбер металлар¬
ның катионнары кайтарыла ала. Бу үзлектән никельләгәндә, аккургаш-
лаганда (аккургаш йөгерткәндә), хромлаганда һ. б. очракларда файдала¬
налар.
Анионнарны, аларның оксидлашу сәләтенә карап, түбәндәге тәртиптә
урнаштыралар:
Г, Br", S2~, CF, OH", SO2" Һәм кислородлы кислоталарның башка анионнары
химик активлык кими
СЕЗ
БЕЛӘСЕЗМЕ?
Хәзерге вакытта титанны, Уильям Кролл методына нигез¬
ләнеп (1940), титан тетрахлоридын магний белән кайтарып
табалар. Бу метод белән табылган титанның үзкыйммәте
шактый югары. Кембридж университетында (Бөекбритания)
1998 елда титанны электролиз белән табу методы эшләнә,
өстәвенә катод булып арзанлы һәм киң таралган титан
диоксиды пластиналары хезмәт итә. Электролиз процессын¬
да кислород, «үз артыннан» тотрыклы каты формадагы титан
калдырып, катодтан графит анодка күчә.
82
Бу рәттән файдаланып, кислородсыз кислоталарның анионнары, гид-
роксид-ионнарга OH- караганда, активрак дип әйтергә мөмкин.
Югарыда күрсәтелгән закончалыкларны исәпкә алып, теләсә нинди
электролитның судагы эремәсенең электролизы ничек узачагын алдан
билгеләргә мөмкин.
Тозларның судагы эремәләре электролизының берничә мисалын
тикшерик (барлык очракларда графит электродлар алынган).
а) Калий хлориды электролизы — KCl, H2O
Катод: Анод:
2Н2О + 2ё—>Н2Т+2ОН“ 2С1"-2ё—> Cl2
Водород катионнары, K+ ионнарына караганда, җиңелрәк кайтарыла,
шуңа күрә катодта су газсыман водородка кадәр кайтарыла.
Кислородсыз кислоталарның һәм аларның тозларының анионнары
үз электроннарын, суның гидроксид-ионнарына караганда, йомшаграк
тотып торалар, шуңа күрә анодта хлорид-ионнар газсыман хлорга кадәр
оксидлашалар.
Калий хлоридының судагы эремәсе электролизының суммар тигезләмәсе
болай күрсәтелә:
электролиз
2КС1 + 2Н2О * H2T+ Cl2T+ 2К0Н
б) Бакыр(Н) сульфаты электролизы — CuSO4, H2O
Катод: Анод:
Си2+ + 2ё—> Cu0 2Н2О-4ё—>О2Т+4Н+
Бакыр катионнары H+ ионнарыннан җиңелрәк кайтарылалар, шуңа күрә
катодта металлик бакыр аерылып чыга.
Кислородлы кислоталарның һәм аларның тозларының анионнары
электроннарын, суның гидроксид-ионнарына караганда, көчлерәк тотып
торалар, шуңа күрә анодта су оксидлаша һәм кислород аерылып чыга.
Бакыр(П) сульфатының судагы эремәсе электролизының суммар тигез¬
ләмәсе болай күрсәтелә:
электролиз
2CuSO4 + 2Н2О * 2Cu + O2T + 2H2SO4
83
в) Калий сульфаты электролизы — K2SO4, H2O
Катод:
2Н2О-2ё—>H2t+2OH~
Анод:
2Н2О-4ё—>O2t+4H+
Әгәр электролиз актив металл һәм кислородлы кислота тозына үткәрелсә,
катодта һәм анодта суның электролитик таркалуы күзәтелә:
6Н2О —* 2Н2Т + 40Н + O2T + 4Н+
4Н+ + 40Н = 4Н2О
Суммар тигезләмә:
электролиз
2Н2О * 2H2t + O21
Электролизны куллану. Электролизны аеруча актив металларны (K, Na,
Ca, Mg, Al) тапканда киң кулланалар. Бу ысул белән табылган металлар саф
булулары белән аерылып торалар. Кайбер металларны (Cu, Ni, Pb, Ag, Au)
катышмалардан чистарту (электролитик рафинадлау) өчен дә электролиздан
файдаланалар. Электролиз методы белән кайбер актив неметалларны
(Cl2, F2), шулай ук катлаулы матдәләрне (NaOH, КОН, KClO3) табалар.
Электролиздан металл предметларны никель, хром, цинк, аккургаш, алтын
һ. б. белән каплау өчен файдаланалар.
5—10 нчы сорауларга җавап бирегез (88—89 нчы битләр). 2—3 нче мәсьәләләрне
чишегез (89 нчы бит).
§ 20. Металларның коррозиясе һәм аны кисәтү
Тимер әйберләрнең һава һәм дым тәэсиреннән тутыгуын һәркайсыбыз
белә. Шуның нәтиҗәсендә металл конструкцияләр, машина детальләре
акрынлап ашала һәм төрле инструментлар яраксызга чыга. Бу ел саен
илебез хуҗалыгына шактый зыян китерә.
Металларның ашалу процессын коррозия (латинча Corrodere — ашалу)
Jivm атыйлар.
Коррозия — металлар һәм аларның эретмәләренең әйләнә-тирә
тәэсиреннән химик һәм электрохимик челтәрләнеп ашалуы ул.
84
СЕЗ
БЕЛӘСЕЗМЕ?
■■■ввнмнннвамовя·········
Автомобильләр, трактор һәм башка авыл хуҗалыгы ма¬
шиналары коррозиясенең төп сәбәпләреннән берсе —
аларның ачык һавада саклануы.
Коррозия процессының асылы. Тимер һәм аның эретмәләре коррозиягә
нык дучар ителә. Бу процессның асылы шуннан гыйбарәт: тимер атомнары
кислород, су һәм водород ионнары тәэсирендә акрынлап оксидлаша. Тимер
һәм аның эретмәләре коррозиясен гомуми рәвештә болай сурәтләргә
мөмкин:
0
Fe - 2е —> Fe2+
Fe2+ - е —> Fe3+
Гадәттә, оксидлаштыргыч булып кислород тора:
0 0+2-2
Fe + HOH + [0] —* Fe(OH)2
θ 4е- J,
2Fe+ 2Н0Н +O2 = 2Fe(OH)2
+2 2е~ i
2Fe(OH)2 + HOH + [0] —♦ 2Fe(OH)3
I 4β- ;
4Fe(OH)2 +2Н0Н +O2 = 4Fe(OH)3
һавада углерод(ГУ) оксиды һәм күкерт(1Ү) оксиды булганлыктан, алар
су белән тәэсир итешүе нәтиҗәсендә кислоталар хасил була. Ә кислоталар
диссоциацияләшкәндә водород ионнары барлыкка килә, алар шулай ук
металл атомнарын оксидлаштыра:
Г2е ‘1
Fe + 2Н+ = Fe2+ + H2T
Китерелгән мисаллар химик коррозиягә мисал булып тора.
85
Химик коррозия дип метилларның, әйләнә-тирәлектәге газлар һәм
электролитлар белән контактта булганда, системада электр тогы барлыкка
килмичә генә ашалуы (таркалуы) атала.
Тәҗрибә юлы белән ачыкланганча, әгәр металл активлыгы түбәнрәк
металл белән контактта булса, аны водород ионнары тизрәк оксидлаштыра.
Әйтик, мәсәлән, цинк кисәген сульфат кислотасы эремәсенә урнаштырсак,
реакция башта көчле бара, ә аннары акрыная башлый. Ләкин шунда
цинк кисәгенә бакыр чыбык тидерсәң (18 нче рәсем), реакция сизелерлек
тизләшә. Ни өчен?
Эш шунда ки, бу очракта химик процесслар (электроннарны бирү)
белән беррәттән электр процесслары да (электроннарның бер участоктан
икенчесенә күчерү) бара.
Цинк — җиңел оксидлаша, ягъни Zn2+ катионнарын эремәгә бирә торган
актив металл:
Zn0 - 2ё * Zn2+
Бу катионнарның эремәгә күчүе нәтиҗәсендә, электроннар цинк
пластинкада туплана, һәм ул тискәре корыла. Әгәр цинк пластинканы
бакыр пластинка белән тоташтырсаң, бу электроннар бакырга —
активлыгы түбәнрәк металлга эләгәчәк. Кислота эремәсендәге водород
ионнары, бу электроннарны кабул итеп һәм кайтарылып, бакырга таба
хәрәкәтләнәчәк:
2Н+ + 2ё —> H2T
Шулай итеп, цинк — тискәрерәк потенциалга, ә бакыр уңайрак потен¬
циалга ия була, ягъни алар арасында потенциаллар аермасы һәм, шуның
нәтиҗәсе буларак, электроннар агымы (электр тогы) барлыкка килә. Оксид-
18 нче рәсем. Бакыр
белән контактта бул¬
ганда, цинк белән
сульфат кислотасы
арасында реакция
тизләшә
лашучы цинк — анод (оксидлашу процессы бара
торган электрод), ә бакыр катод (кайтарылу процессы
бара торган электрод) була, чөнки анда водород
кайтарыла.
Бакыр цинктан электроннарны тартып алган
кебек була һәм цинкны тизрәк эрергә мәҗбүр итә.
Шул ук вакытта бөтенләй саф цинк күпмедер вакыт
кислотада аның тәэсиренә дучар ителмичә тора ала.
Тикшерелгән күренеш цинк һәм бакырга гына
түгел, ә бәлки теләсә нинди ике төрле металл өчен
характерлы. Электролит катнашында үзара кон¬
такттагы металларның берсе (электрохимик көчә¬
нешләр рәтендә сулдарак урнашканы) тискәре ко¬
рыла, ә икенчесе уңай корыла. Әгәр бу металларны
гальванометр аша үткәргеч белән тоташтырсаң, ток
86
(гальваник элемент*) барлыкка килгәнен күрергә була. Активрак металл
ашала (таркала) (19 нчы рәсем).
Электрохимик коррозия дип металлның электролит тирәлегендә
система эчендә электр тогы барлыкка килү белән бара торган челтәрләнеп
ашалуы атала.
Гадәттә, беришле булмаган эрет¬
мәләрнең дә коррозиясе шулай
бара. Электролитлар катнашында
(әйләнә-тирәлектә алар һәрвакыт
була) эретмә өслегенең бер участо¬
гы катод, ә икенчесе анод хезмәтен
үти.
Димәк, коррозия металл эрет¬
мәләренә һәм металларга кисло¬
род, су яки водород ионнары
тәэсир итүенә генә түгел, ә бәлки
эретмәләрдә металлар һәм беришле
булмаган төрле чит кисәкчекләр
арасында контакт булудан килеп
чыккан электрохимик процессларга
да (электроннар күчешенә) бәй¬
ләнгән.
Коррозиягә каршы көрәш чара¬
лары. Бу методларның иң әһәмият-
леләре 8 нче схемада күрсәтелгән.
Коррозиядән саклауның чагыш¬
тырмача яңа методы — конструк¬
цияләрне адсорбер җайланмалар
19 нчы рәсем. Электролит тирәлегендә ике
металл контактта булганда, металларның
берсе — тискәре, ә икенчесе уңай корыла
20 нче рәсем. Металлдан эшләнгән ике де¬
тальне активрак металлдан ясалган уңкы
(заклёпка) ярдәмендә беркетү
ярдәмендә киптерү — чагыштырма
дымлылык 40% тан түбән булган¬
да металлның бөтенләй коррозия-
ләшмәвенә нигезләнгән. Бу икъти¬
сади яктан отышлы һәм әйләнә-
тирәлек өчен куркынычсыз ме¬
тодтан күперләр төзегәндә яки
реконструкцияләгәндә файдала¬
налар.
21 нче рәсем. Коррозиядән сакланыла тор¬
ган металл җайланмага активрак металл
(мәсәлән, цинк) пластинкаларын беркетә¬
ләр
* Гальваник элементта катод — уңай, анод тискәре корыла, ә электролизерда катод
тискәре, анод уңай.
87
8 нче схема
11—13 нче сорауларга җавап бирегез (89 нчы бит). 4, 5 нче мәсьәләләрне чишегез
(89 нчы бит).
?
1. Металл атомнарының төзелеше
неметалл атомнары төзелешеннән нәрсә
белән аерыла һәм бу — метилларның хи¬
мик үзлекләрендә ничек чагылыш таба?
2. Металлар өчен химик бәйләнешнең
нинди төре характерлы?
3. Металлар өчен кристаллик чел¬
тәрнең нинди тибы характерлы? Метил¬
ларның нинди үзлекләре аларның крис¬
таллик төзелешенә бәйле?
4. Атом төзелешенә нигезләнеп, ти¬
пик метилларның гомуми һәм аермалы
физик үзлекләрен тасвирлагыз. Мисаллар
китерегез.
5. Тимер оксидыннан Fe3O4 алюмино¬
термии ысул белән тимер табып була.
Бу реакциянең тигезләмәсен төзегез һәм
электроннар күчешен күрсәтегез.
6. Пириттан FeS2 тимер табарга мөм¬
кинлек биргән реакцияләрнең тигезлә¬
мәләрен төзегез. Оксидлашу дәрәҗәләрен
куеп чыгыгыз һәм электроннар күчешен
күрсәтегез.
7. Күмер электродлар кулланып, тү¬
бәндәге тозларның: KCl, CuSO4, KI эретел-
мәләре һәм эремәләренең электролизы
схемасын төзегез.
88
8. Аңлатып бирегез, ни өчен метал¬
лик калийны калий хлоридының суда¬
гы эремәсен электролизлап күмер элект¬
родларда табып булмый, ләкин бу тозның
эретелмәсенә электролиз үткәреп табарга
мөмкин?
9. Көмеш нитратының судагы эремә¬
сен электролизлаганда катодта нәрсә бар¬
лыкка килә?
1) Ag 2) NO2 3) NO 4) H2
10. Бромны а) калий бромиды эре¬
мәсенә хлорлы су белән тәэсир итеп;
б) калий бромидына электролиз үткәреп
табарга мөмкин. Бу процессларның асы-
лында нинди уртаклык бар, һәм алар
нәрсә белән аерылалар?
11. Хлорид кислотасы эремәсендәге
тимер кисәгенә цийк чыбык тидерәләр.
Бу — тимер белән кислота арасында бар¬
ган химик реакциянең тизлегенә һәм ха¬
рактерына йогынты ясармы?
12. Тимер детальләрне беркетү та¬
ләп ителә. Детальләрнең коррозиясен
акрынайту өчен нинди уңкылар (заклеп¬
калар) файдаланырга кирәк: бакырмы яисә
цинкмы? Җавабыгызны дәлилләгез.
13. Промышленность объектларына
якын урыннарда ни өчен машиналарның
күп детальләре тизрәк коррозияләтә?
ф 1. Әгәр реакция продуктының чыгышы
82% тәшкил итсә, пиритның FeS2 масса
өлеше 0,7 булган 250 т рудадан күпме
масса саф тимер табарга була?
2. Натрий хлориды эремәсен элек¬
тролизлаганда, 7,2 л водород (н.ш.) аеры¬
лып чыга. Эремәдә массасы һәм матдәнең
микъдары буенча күпме натрий гидрокси¬
ды барлыкка килүен исәпләп чыгарыгыз.
3. Бакыр(П) хлориды эремәсен элек¬
тролизлаганда, катодның массасы 8 г
га арта. Нинди газ аерылып чыга, аның
массасы һәм күләме нинди (н.ш.)?
4. Көмеш(1) нитратының судагы эре¬
мәсен электролизлаганда, 5,6 л газ аеры¬
лып чыга. Катодка ничә грамм металл
утыра?
5. Калий хлоридының судагы эремә¬
сен электролизлаганда, 112 кг калий
гидроксиды барлыкка килә. Нинди газ¬
лар аерылып чыга һәм нинди күләмдә
(н.ш.)?
§21. А-төркемнәрнең металлик
элементларына күзәтү
Металлик s- һәм р- элементларның гомуми химик үзлеге булып алар-
ның атом радиусы неметаллик элементларның атом радиусы белән
чагыштырганда шактый зуррак булуы аркасында, валентлык электроннарын
җиңел бирә алулары тора. Шуңа күрә алар барлыкка китергән гади матдәләр
химик реакцияләрдә кайтаргычлар функциясен үтиләр.
СЕЗ
БЕЛӘСЕЗМЕ?
Производствода табылган барлык металл массасының
94% ы — кара металлар һәм фәкать 6% ы гына — төсле
металлар.
Mooc шкаласы буенча металларның катылыгы:
Na-0,4 Pb-1,5
K-0,5 Sn-1,8
Li — 0,6 Mg - 2,0
Ca-1,5 Zn-2,5
Au - 2,5
Fe - 4,5
Ag - 2,7
Ni - 5,0
Al - 2,9
W-7,0
Cu - 3,0
Cr-9,0
89
СЕЗ
БЕЛӘСЕЗМЕ?
Австралия галимнәре диңгездәге металл вышкаларны ту¬
тыгудан сакларга өйрәнделәр: моның өчен металл конст¬
рукцияләр аша ток уздырыла, һәм бу вакытта металл
өслегендә диңгез суында эрегән кушылмаларның химик
элементларыннан элпә хасил була
Тәҗрибә ясаганда, цезий Cs, рубидий Rb, калий K һәм натрийның да Na кай¬
тару үзлекләре бик көчле булуын, аларның гади һәм катлаулы матдәләр белән
реакцияләре вакытында шартлау ихтималын истән чыгарырга ярамый.
Металларның гади матдәләр белән тәэсир итешүе. Металларның кай¬
тару сәләте аларның галогеннар һәм кислород белән реакцияләрендә аеруча
көчле күренә:
Г2е~Т,
O O t +1 -1
2Na + Cl2 = 2Na Cl
R R
О О ί +3 -1
2А1 + ЗС12 = 2А1С13
R4iR
О О t +2 -2
2Mg + O2 = 2MgO
T12eR
О 0++3-2
4А1 + ЗО2 = 2А12О3
Металлар күкерт белән акрынрак реагирлаша:
T2eR
O O + +1 -2
2Na + S = Na2S
R6e' -Ί¬
ο 0,+3-2
2А1 + SS = Al2S3
Металлар, VA- төркем неметаллары — азот һәм фосфор белән күкерткә
караганда да реакциягә авыррак керәләр:
R6e’R
O O / +2 -3
3Mg + N2 = Mg3N2
I—^R
O Oi +2»-3
ЗСа + 2Р = Ca3P2
90
А-төркемнәрнең активрак металлары — бик көчле кайтаргычлар,
хәтта водородны да -1 оксидлашу дәрәҗәсенә кадәр кайтарып, гидридлар
барлыкка китерәләр:
Г2е-^
0 0 t +2 -1
Ca + H2 = CaH2
Металларның катлаулы матдәләр белән тәэсир итешүе. Металларның
кайтару үзлекләре кислоталар, тозлар һәм су кебек катлаулы матдәләр
белән реакцияләрдә дә күренә.
Металлар кислоталар белән төрлечә реагирлаша (7 нче схема).
Электрохимик көчәнешләр рәтендә водородка кадәр урнашкан металлар
водород ионнарын сыегайтылган кислоталардан (HNOg нең водород
ионнарын исәпкә алмаганда) кайтаралар, водородтан соң урнашкан
металлар исә әлеге кислота ясаучы элемент атомын кайтаралар, мәсәлән:
I— 2еГ~~Ъ
O +6 +2 +4
Cu + 2H2SO4 = CuSO4 + SO2T + 2Н2О
Тозларның судагы эремәләре белән реакциягә кергәндә, электрохимик
көчәнешләр рәтендә сулдарак урнашкан металлар бу рәттә үзләреннән
уңдарак урнашкан металларны кайтаралар.
Бу закончалык төп һәм ян төркемчә металларына да хас, мәсәлән:
Zn + Pb(NO3)2 = Zn(NO3)2 + Pbl
Zn + Pb2+ + 2NO3 = Zn2+ + 2NO3 + Pb I
Г2е 1
Zn + Pb2+ = Zn2+ + Pb I
Ләкин шуны истән чыгарырга ярамый: көчле кайтару үзлекләренә ия
металлар (мәсәлән, Li, Na, K, Ca) бу шартларда тиешле тоздан металлны
түгел, бәлки суның водородын кайтарачак.
СЕЗ
БЕЛӘСЕЗМЕ?
Бакыр рудникларында «купорослы суга» эләккән тимер
әйберләрнең кызыл төстәге бакыр катлавы белән кап¬
лануы руда чыгаручыларга Урта гасырларда ук билгеле
булган.
Әгәр көмеш(1) нитратының сыегайтылган эремәсенә аз
гына терекөмеш өстәсәң, көмеш төсендә бик матур агач
үсеп чыгар... Сәбәбен аңлатыгыз.
91
СО
to
5 нче таблица. Литий, натрий, калий — IA-төркемнең металлик элементлары
Литий Li
Натрий Na
Калий К
Электроннарның орбитальләрдә урнашуы
Is2 2s1 2р°
I
Is2
2s2 2р®
3s1
3s2
Зр6
3J0
4s1
, ,.Na
п
Il П Il Il
I
K... J -
I Il Ii
Iil I
I
+11
+ 19
Гади матдәләренең физик үзлекләре
Бу металлар сизелер-сизелмәс төсмерле көмешсыман-ак төстә, җиңел (судан җиңел), йомшак (пычак
белән кисеп була), түбән температураларда эретеләләр. Эретелү температуралары литийдан цезийга
таба закончалыклы рәвештә төшә (Li — 179,0 °C; Na — 97,8 °C; K — 63,5 °C; Cs — 28,4 0C).
Химик үзлекләре
Кайтару (металлик) үзлекләре көчәя
1. Гади матдәләр белән тәэсир итешүләре
Г2в’1
0 0 , +1 -1
2Li + Cl2 = 2LiCl
Г2е 1
О О t +1 -1
2Na + Cl2 = 2NaCl
Г4®’!
0 0^+1-2
4Li + О2 = 2Ы2О
Γ2β 1
0 Oi +1-1
2Li + H2 = 2LiH
Γ2β’1
0 0,+1-1
2Na + O2 = Na2O2
Г2е 1
О О , +1 -1
2Na + H2 = 2NaH
Г 2e’l
о о t +1 -1
2К + Cl2 = 2КС1
Кислород белән реакциягә кереп, төрле
составлы кислородлы кушылмалар бар¬
лыкка китерәләр (K2O, K2O2, K2O4)
Г2е’1
о о t +1 -1
2К + H2 = 2КН
2. Катлаулы матдәләр белән тәэсир итешүләре
Г2е'1
0 +1 +1 -1 0
2Li + 2НС1 = 2LiCl + H21
Γ2β"Ί·
0+1 +1 0
2Li + 2НОН = 2LiOH + H2T
Γ2β’1
0+1 +10
2Na + 2HC1 = 2NaCl + H21
0+1 +1 о
2Na + 2НОН = 2NaOH + H2I
Кислоталар һәм су белән реакцияләр
бик көчле, хәтта шартлау белән уза.
Бу реакцияләрне, гадәттә, лаборато¬
рияләрдә ясамыйлар.
Куллану
1. Атом-төш реакторларында
суыткыч
2. Металлургиядә азот, кү¬
керт һәм башка катышма¬
лардан арындыру өчен
3. Тритий табу өчен:
|Li + Jn —+ =Jh + JHe
CD
OO
1. Калий белән эретмәсе атом-
төш реакторларында суыткыч
хезмәтен үти
2. Подшипниклар вкладыш¬
лары (эчмәкләре) ясау өчен
эретмәләр составында (кургаш
белән)
3. Күп кенә органик синтез¬
ларда катализатор
4. Авыр эретелүчән кайбер
металларны тапканда кайтар¬
гыч
5. Натрий пероксиды Na2O2
табу өчен
1. Натрий белән эретмәсе атом-төш ре¬
акторларында суыткыч хезмәтен үти.
2. Калийдан су асты көймәләрендә һәм
космик корабльләрдә СО2не йоттыру
һәм кислородны регенерацияләү өчен
кулланыла торган калий пероксиды
K2O2 табалар. Шул ук максатларда
Na2O2 дә ярый.
3. Кайбер органик синтезларда
CD
6 нчы таблица. Бериллий, магний, кальций — ПА-төркемнең металлик элементлары
Бериллий Be
Магний Mg
Кальций Ca
Электроннарның орбитальләрдә урнашуы
Is2 2s2
Is2 2s2 2р®
3s2
з</°
+4Ве
+12Mg
+20 Ca-
4s2
3s2 Зр6
U U 4 Il
Il
Гади матдәләренең физик үзлекләре
Көмешсыман-ак төстәге металлар, бериллий һәм магний гына ялтыравыгын үзгәртми. Алар
барысы да алюминийдан җиңелрәк. Селтеле металларга караганда катырак һәм эретелү темпе¬
ратуралары да югарырак. Магний 651 0C та эретелә.
1. Гади матдәләр
Г2е~1·
0 0 t +2 -1
Be + Cl2 = BeCl2
Г4е“1
0 0 t +2 -2
2Ве + O2 = 2ВеО
BeH2 не арадаш ысуллар
белән генә табалар.
Химик үзлекләре
Кайтару (металлик) үзлекләре көчәя
>.
белән тәэсир итешүләре
r2e”l·
0 0,+2-1
Mg + Cl2 = MgCl2
Г4е’1
0 0,+2-2
2Mg + O2 = 2MgO
Γ2β’1
0 0. +2-1
Mg + H2 MgH2
Г2е1
0 0 t +2-1
Ca + Cl2 = CaCl2
Г4е1
O O t +2 -2
2Ca + O2 = 2CaO
T2e-J
O 0,+2-1
Ca + H2 = CaH2
2. Катлаулы матдәләр б
Г2е"1
0+1+2 0
Be + 2НС1 = BeCl2 + H2T
Бериллий су белән реак¬
циягә керми, саклагыч
элпә BeO белән каплана.
I 2с I
0 +1
Be + 2NaOH + 2Н2О =
+2 0
= Na2[Be(OH)J + H21
елән тәэсир итешүләре
Г2е"^
0+1+2 0
Mg + 2НС1 = MgCl2 + H2T
Г2в 1
0 +1 t +2 0
Mg + H2O = MgO + H2I
Әгәр янып торган магний¬
ны суга төшерсәң, аеры¬
лып чыккан водород янып
китә һәм MgO хасил була.
Реакция көчле бара.
r2e’i
0+1+2 0
Ca + 2НС1 = CaCl2 + H2T
Г2<ГТ·
0+1 +2 Oa
Ca + 2НОН = Ca(OH)2 + H2T
1. Очу аппаратларына де¬
тальләр эшләгәндә җиңел
һәм каты эретмәләр җи¬
тештерү өчен
2. Атом техникасында нейт¬
роннар табу өчен
Куллану
1. Самолетлар һәм автомо¬
бильләр төзү производство¬
сында җиңел һәм үтә җиңел
эретмәләр табу өчен
2. Титан, уран, цирконий һәм
башка металларны тапканда
кайтаргыч
3. Органик синтезларда
4. Яктырту һәм кабызу раке¬
талары эшләү өчен
Подшипниклар җитештерүдә кирәк¬
ле кургаш-кальций эретмәләре табу
өчен
7 нче таблица. Алюминий — ША-төркемнең металлик элементы
Электроннарның орбитальләрдә урнашуы
Is* 1 2 3 4 5
2s2
2р6
3s2
Зр1
34°
..Al П
п
I. L L
'!
+13 .
I
Гади матдәнең физик үзлекләре
Алюминий — көмешсыман-ак төстәге җиңел металл (р = 2,7 г/см3), 660 oC та
эретелә, бик пластик, аны чыбык итеп сузарга да, табак һәм фольга итеп
җәяргә дә мөмкин. Электр үткәрүчәнлеге буенча көмеш һәм бакырдан
гына калыша.
Химик үзлекләре
1. Гади матдәләр белән
тәэсир итешүе
2. Катлаулы матдәләр белән
тәэсир итешүе
Г6е‘3
0 0 t +3 -1
2А1 + ЗС12 = 2А1С13
Г12П
0 0 t +3 -2
4А1 + ЗО2 = 2А12О3
Г6е~^
0 0 t +3 -2
2А1 + 3S = Al2S3
Г6е‘1
0+1+3 0
2 Al + 6НС1 = 2 AlCl3 + 3H2t
2А1 + 6Н = 2А1 +3H2t
I 6с I
0 0
2А1 + 2NaOH + 6Н2О = 2Na[ Al(OH)4] + 3H2t
Г6П
θ θ onn oC +3 ~3
2А1 + N2 800 С> 2Α1Ν
натрий тетрагид-
роксоалюминаты
Амальгамаланган алюминий су белән га-
Алюминий водород белән ту-
рыдан-туры реакциягә керми,
ләкин аның гидриды AlH3
арадаш ысуллар белән табыл¬
ган.
дәттәге шартларда реагирлаша:
F6e-!
0+1+3 0
2А1 + 6НОН = 2А1(ОН)31 + ЗН2Т
Куллану
1. Җиңел эретмәләр табу өчен (дюралюминий — самолет һәм ракета төзүдә,
төзелештә) ,
2. Электрүткәргечләр җитештерү өчен *
3. Корыч һәм чуен әйберләрне алитирлау (тышкы өслекне туендыру) өчен
4. Металлургиядә алюминотермия ысулы белән башка металлар табу өчен
5. Көнкүреш предметлары эшләп чыгаруда
96
СЕЗ
БЕЛӘСЕЗМЕ?
Металлар бер-берсе белән химик тәэсир итешеп, интер-
металлик кушылмалар, яки интерметаллидлар хасил
итә ала. Аларның күбесе техник кулланылыш тапты.
SmCo5 интерметаллиды — көчле магнитлар өчен иң яхшы
материал. Nb3Ge интерметаллиды — гадәттән тыш үткә-
рүчәнлеге ягыннан рекордчы, ә AISb һәм InSb — бик яхшы
ярымүткәргечләр.
Иң актив металлар (Cs дан Ca га кадәр) гадәти шартларда су белән
реакциягә керә. Бу реакцияләрдә суда эрүчән нигезләр (селтеләр) хасил
була һәм водород аерылып чыга:
Γ2β’1·
0+1 +1 0
2Na+ 2Н0Н = 2NaOH + H2T
Г2е’7
0+1+2 О
Ca + 2НОН = Ca(OH)2 + H2 T
Активлыгы түбәнрәк булган металлар су белән югарырак температурада
реагирлашалар. Реакция нәтиҗәсендә водород аерылып чыга һәм тиешле
металлның оксиды хасил була:
Γ2βΊ
0 +1 t +2 0
Zn + H2O = ZnO + H2 T
IA-, IIA-, һәм IIIA-төркемнәрнең әһәмиятле металл ары турында уку
материалын кабатлау һәм системалаштыру өстендә мөстәкыйль эшләүне
җиңеләйтү максатында, гомумиләштерүче 5, 6 һәм 7 нче таблицалар
(92—96 нчы битләр) бирелгән. Үзлекләрне тасвирлаганда тиешле метал-
ларның атомнарында тышкы электроннар санына игътибар итегез. Уку
материалын кабатлаганда һәм гомумиләштергәндә, бу таблицаларда
бирелгән планнан файдаланып эш итәргә кирәк. Таблицаларда шулай ук
А-төркемнәр металларының мөһим химик үзлекләрен чагылдырган харак¬
терлы мисаллар да бирелгән. Бу таблицалардан файдаланып, сез охшаш
химик реакцияләрнең тигезләмәләрен үзегез төзи аласыз.
1—10 нчы күнегүләрне үтәгез (97—98 нче битләр). 1—3 нче мәсьәләләрне чишегез
(98 нче бит).
1. ни өчен таоигатьтә селтеле пәм
селтеле-җир металлар саф килеш очра¬
мыйлар?
2. Атомда электроннары электрон
катлауларында 2, 8, 8, 1 булып бүленгән
химик элементның Д. И. Менделеев пе¬
риодик системасындагы урыны:
1) 4 нче периодта, I төркемдә
2) 4 нче периодта, II төркемдә
3) 3 нче периодта, I төркемдә
4) 3 нче периодта, II төркемдә
97
3. Электроннарның электрон катлау¬
ларында 2, 8, 8, 2 бүленеше нинди эле¬
ментның атом төзелешенә туры килә:
1) углеродның 3) алюминийның
2) кальцийның 4) кремнийның
4. Металлик үзлекләрне иң ачык күр¬
сәткән гади матдә атомнарының электрон
катлауларының төзелеше:
1) 2, 3 3) 2, 8, 18, 3
2) 2, 8, 3 4) 2, 8, 18, 18, 3
5. Түбәндә китерелгән нинди матдәләр
натрий гидроксиды белән тәэсир итешә:
күкерт, цинк, күкерт(ГУ) оксиды, барий
оксиды, калий гидроксиды, хлорид кис¬
лотасы, кырмыска кислотасы, тимер(Ш)
хлориды, барий сульфаты, этанол, гли¬
церин? Мөмкин булган химик реакция¬
ләрнең тигезләмәләрен языгыз. Ионнар
алмашу реакцияләренең ике тигезләмәсен
(үзегез сайлап) тулы һәм кыскартылган
ионлы формаларда төзегез.
6. Бериллий Be һәм магний Mg химик
элементларның Д. И. Менделеев периодик
системасының бер үк төркемендә бул¬
салар да, бу металларның химик үзлек¬
ләре аерыла. Аңлатып бирегез, ни өчен
шулай? Җавабыгызны тиешле реакция-
ф 1. Алюминий һәм хлорид кислотасы
арасында барган реакция тигезләмәсен
языгыз. Электроннар балансы методы
белән коэффициентлар куеп чыгыгыз.
Әгәр реакция өчен 5,4 г металл һәм 21 г
кислота файдаланылса, реакция бары¬
шында аерылып чыккан газның күләмен
(н. ш.) һәм тозның массасын исәпләп
табыгыз.
2. Составындагы катышмаларның
масса өлеше 5% тәшкил иткән 8 кг
ләрнең тигезләмәләре белән дәлиллә¬
гез. Бериллий һәм магнийның кулла¬
нылышын тасвирлагыз.
7. Алюминий гидроксидының хи¬
мик үзлекләрен характерлаган химик
реакцияләрнең тигезләмәләрен язы¬
гыз. Алюминий гидроксиды һәм маг¬
ний гидроксидының нейтральләшү реак¬
цияләре нәрсә белән аерыла? Ионнар
алмашу реакцияләренең ике тигезләмәсен
(үзегез сайлап) тулы һәм кыскартылган
ионлы формаларда төзегез.
8. Көнкүрештә каты суны өлешчә
йомшарту ысулларын санап чыгыгыз:
а) химик реактивлардан файдаланмыйча;
б) өйдә булган чаралардан файдаланып.
9. Түбәндәге матдәләр катнашкан
химик реакцияләрнең тигезләмәләренә
мисаллар китерегез: а) натрий гидроксиды
һәм өч төрле органик матдә; б) кальций
гидроксиды һәм ике төрле органик матдә.
10. Селтеле һәм селтеле-җир металларны
аларның тозлары эретелмәләрен элект¬
ролизлап табалар. Ни өчен бу металларны
тозларының эремәләренә электролиз үткә¬
реп табып булмый? Андый реакцияләрдә
кайтаргыч булып нәрсә хезмәт итә?
известьташны таркату өчен, нинди
микъдарда җылылык кирәк булыр?
Термохимик тигезләмәсе:
CaCO3(K) = CaO(K) + СО2(г)- 177,650 кДж
3. 117 г натрий хлориды һәм артыгы
белән алынган сульфат кислотасы тәэ¬
сир итешкәндә, хлороводород табылган.
Табылган хлороводород 227 г су белән
йотылган. Табылган эремәдәге хло-
роводородның масса өлешен исәпләгез.
§22. Б-төркемнәрнең металлик элементларына
гомуми күзәтү
Б-төркемнәрнең металлик элементлары d-элементлар булып торалар.
Бу атомнарның, кагыйдә буларак, тышкы энергетик дәрәҗәсендә ике
s-электрон саклана, ә чираттагы, яки тәртип номерын билгеләүче элект¬
роннары тышкы энергетик дәрәҗәдә түгел, ә бәлки соңгыдан алдагы энер¬
гетик дәрәҗәләрдә урнашалар. Кайбер элементларның, мәсәлән, хром Cr
һәм бакыр Cu атомнарының тышкы электроннары «сикерә» һәм тышкы
дәрәҗәдә берәр генә электрон кала. Аларның үзлекләрендәге аерымлык
менә шуның белән аңлатыла да инде.
98
Ватаныбыз химигы һәм металлургы, ака¬
демик (1932). Бакыр һәм сөрмә эретмә¬
ләренең үзлекләрен тикшерә. Тимерне
хлороводород белән ашату процессларын
өйрәнә. Оксидлашу-кайтарылу процесс¬
лары теориясен үстерә.
Байков
Александр
Александрович
(1870-1946)
Б-төркемнәрдәге элементларның химик активлыгы үзгәрү законча¬
лыклары өстән аска таба А-төркемнәрнекенә караганда башкачарак.
Б-төркемнәрдәге металларның химик активлыгы (кайбер чыгарылмалар
белән) кими бара. Мәсәлән, алтынның химик активлыгы бакырныкына
караганда түбәнрәк.
Әмма Б-төркемнәрнең металлик элементларында да кайбер гомуми
закончалыклар күзәтелә. Аларның иң әһәмиятлеләрен билгеләп үтик.
1. ШБ—УПБ-төркемнәрнең р-элементларында иң югары уңай оксид¬
лашу дәрәҗәсе төркем номерына туры килә.
2. УШБ-төркемнең кайбер d-элементлары, мәсәлән, рутений Ru һәм
осмий Os да иң югары оксидлашу дәрәҗәсе +8 гә тигез булган, ягъни
төркем номерына туры килгән кушылмалар хасил итәләр.
3. Б-төркемнәр металларының оксидлашу дәрәҗәләре арту белән,
аларның оксидлары һәм гидроксидларының нигез үзлекләре кими, ә кислота
үзлекләре көчәя. Мәсәлән, CrO — нигез оксиды, Cr2O3 — амфотер оксид,
CrO3 — кислота оксиды. Соңгы оксидка түбәндәге кислоталар һәм тозлар
туры килә: H2CrO4 — хромат кислотасы; Na2CrO4, K2CrO4 — хроматлар;
H2Cr2O7 — дихромат кислотасы; Na2Cr2O7, K2Cr2O7 — дихроматлар.
Б-төркемнәр металларының практик яктан иң әһәмиятлеләре: бакыр
Cu, цинк Zn, титан Ti, хром Cr һәм тимер Fe. Аларның үзлекләрен һәм
кулланылышларын аерым тикшерербез.
1—3 нче сорауларга җавап бирегез (118 нче бит). 1 нче мәсьәләне чишегез
(118 нче бит).
§ 23. Бакыр
Химик элементларның периодик системасында бакырның урыны һәм
атом төзелеше. Бакыр — I төркемнең ян төркемчәсе (1Б-төркем) элементы.
Аның электронлы формуласы:
+29Cu Is21 2s22p61 3s23p63d101 4s1
Бакыр атомнарында унынчы d-электрон дүртенче s-кече энергетик
дәрәҗәдән күчеп өченче d-кече энергетик дәрәҗәгә урнашканлыктан,
99
бу электрон хәрәкәтчән була. Шунлыктан кушылмаларда бакырның
+1 +2
оксидлашу дәрәҗәсе +1 (мәсәлән, Cu2O) һәм +2 (мәсәлән, CuO).
Табигатьтә очравы. Табигатьтә бакыр башлыча бәйле хәлдә очрый һәм
бакыр ялтыравыгы. Cu2S, куприт Cu2O, бакыр колчеданы CuFeS2, малахит
(CuOH)2CO3 минераллары составына керә. (Биредә һәм алга таба да формула
белән минералның төп состав өлеше күрсәтелә.)
Табу. Бакырны табу процессы гаять катлаулы. Бу максатта күбрәк
оксидлар файдаланыла. Кокс һәм углерод(П) оксиды ярдәмендә төсле
металлургиядә бакырны куприттан (Cu2O) табалар:
Г"2е’“1
+1 0 0+2
Cu2O + C = 2Cu + CO
Ψ-2β’“Ί
+1 +2 0 +4
Cu2O + CO = 2Cu + CO2
Сульфид рудаларын һәм карбонат кушылмаларын махсус мичләрдә
оксидларга кадәр яндыралар.
Мондый ысул белән табылган бакырда катышмалар була. Электролиз
ысулы белән чистарак бакыр табыла.
Физик үзлекләре. Бакыр — алсу төстәге, сузылучан, үзле металл, җиңел
җәелә (прокатлана). 1083 oC та эретелә. Электр тогын бик яхшы үткәрә
(көмештән генә калыша).
Химик үзлекләре. Коры һавада һәм гадәти температурада бакыр үзгәрми
диярлек. Югары температурада гади матдәләр белән дә һәм катлаулы
матдәләр белән дә реакциягә керә.
Гади матдәләр белән тәэсир итешүе:
Г2е~1
O O t +2 -1
Cu + Cl2 = CuCl2
Г4е’1
O 0,+2-2
2Cu + O2 = 2СиО
Г2в”1
O 0,+2-2
Cu + S = CuS
СЕЗ
БЕЛӘСЕЗМЕ?
-.'C"; '
Кайчак табигатьтә бакырның саф хәлендәге шактый гына
зур кисәкләре очрый. Мәсәлән, 1857 елда АКШның Олы
Күлләр районында массасы 420 тонна булган бакыр та¬
была. Аның җир өстенә-чыгып торган өлешләре таш бал¬
талар белән китеп алына. Утыз ел элек бакырның 7 тон¬
налы кисәге Кемерово өлкәсендә табыла.
100
СЕЗ
БЕЛӘСЕЗМЕ?
Бакырның күп минераллары ачык матур төстә. Ковеллин
(бакырлы индиго) салават күперенең барлык җиде төсен
бирә. Бакыр ялтыравыгы күгелҗем-соры төстә. Халько¬
пирит алтынсыман ялтырый. Азуритның куе зәңгәр һәм
ачык зәңгәр төстәгеләре бар.
Бакыр күптәннән бирле акча ясау өчен кулланыла. Иң зур
бакыр тәңкә 20 килограммлы швед тәңкәсе була. Рос¬
сиядә Петр I заманында бакырдан 1, 2, 5 һәм 10 тиенлек
тәңкәләр ясаганнар. Аларның кайберләре шактый зур
булган. Мәсәлән, 16 кг бакырдан барысы 10—15 сумлык
акча ясаганнар.
Катлаулы матдәләр белән тәэсир итешүе:
Г-26--Ι¬
ο +6
Cu + 2H2SO4
(куерт.)
j. +2 +4
= CuSO4 + SO2T + 2Н2О
Г2е~~1I
O +5 . +2 +4
Cu + 4HNO3 = Cu(NO3)2 + 2ΝΟ2ΐ + 2Н2О
(куерт.)
F-6*--!
O +5 f +2 +2
3Cu + 8HNO3 = SCu(NO3)2 + 2Ν0Ϊ + 4Н2О
(сыег.)
Куллану. Саф бакыр (99,9% Си) электротехник промышленностьта электр-
үткәргечләр, кабельләр ясау өчен һәм җылыалмаштыргыч аппаратларда
кулланыла. Ул төрле эретмәләр составына керә. Бакыр кушылмалары
киң кулланыла. Мәсәлән, бакыр(П) сульфаты кристаллогидраты (бакыр
купоросы) CuSO4- 5Н2О үсемлек корткычларына һәм авыруларына каршы
көрәшү өчен файдаланыла. Ә инде яңа гына әзерләнгән бакыр(Н) гид¬
роксиды Cu(OH)2 белән, сезгә мәгълүм булганча, органик кушылмаларда
альдегид төркемен (группасын) билгелиләр:
CH3-C C н + 2Cu(OH)2 CH3-C C он + Cu2O + 2Н2О
зәңгәр кызыл
4 нче сорауга җавап бирегез (118 нче бит). 3 нче мәсьәләне чишегез (118 нче бит).
IOl
■ § 24. Цинк
Химик элементларның периодик системасында цинкның урыны
һәм атом төзелеше. Цинк — ПБ-төркем элементы. Аның электронлы
формуласы:
+30Zn Is2 I 2s22p6 I 3s23p63d10 I 4s2
Цинк атомнарында иң соңгыдан алдагы d-кече энергетик дәрәҗә тулы
булганлыктан, кушылмаларында цинк +2 оксидлашу дәрәҗәсен генә
күрсәтә.
Табигатьтә очравы. Табигатьтә цинк кушылмаларда гына очрый. Алар-
ның иң әһәмиятлеләре — цинк ялганы (цинк обманкасы) ZnS һәм цинк
шпаты ZnCO3.
Табу. Алда әйткәнебезчә, әгәр табигатьтә металл күкерт белән кушылмада
очраса, ирекле хәлдәге металлны табу өчен, руданы яндыралар һәм оксидтан
металлны кайтаралар:
F12drI
+2-2 Of +2 -2 +4 -2
2ZnS + ЗО2 = 2ZnO + 2SO2t
Г2е“П
+2 0 t 0 +2
ZnO + C = Zn + COt
Физик үзлекләре. Цинк — зәңгәрсу-көмешсыман металл. Гадәти
температурада уалучан. IOO—150 0C та юка итеп җәеп (прокатлап) була.
200 0C тан югары температурада бик уалучан хәлгә килә. 419,5 oC та
эретелә.
Химик үзлекләре. Цинк һавада тотрыклы, чөнки ул оксидлашудан
саклый торган юка оксид катлавы белән каплана. Гадәти температурада су
СЕЗ
БЕЛӘСЕЗМЕ?
Цинкның бакыр һәм аккургаш белән эретмәләрен б. э. к.
1200 ел элек үк Һиндстанда белгәннәр. Кытайда цинкны
б. э. к. 6 гасыр элек тапканнар. Борынгы Мисырның ар¬
хеологик казылмаларында составына цинк кергән җиз
предметлар табылган. Vll-Xlll гасырларга караган Кытай
һәм Һинд чыганакларында цинк җитештерү процессына
охшашлы металлургия процесслары турындагы тасвир¬
ламаларны табарга була.
102
СЕЗ
БЕЛӘСЕЗМЕ?
Ж
Борынгы греклар, мисырлылар җиз эшли алганнар, ләкин
саф цинк табу ысулын белмәгәннәр, чөнки 1000—1100 oC та
цинк оксидын ZnO күмер белән җылытканда хасил булган
цинк пары, һавада янып, кабат әлеге оксидка әверелгән.
Борынгы Һиндстан һәм Кытай осталары, һава кертмичә,
цинк парларын куертырга өйрәнгәннәр. Европада шуңа
охшаш ысулны немец химигы А. С. Маргграф эшләгән
(1746). Цинк шулай ук ZnSO4 тозы эремәсеннән электро¬
лиз юлы белән дә табыла.
Соңгы елларда, космик ракеталар җибәргәндә, старт
конструкцияләрен саклау өчен, цинктан файдалана баш¬
ладылар. Ракетаның реактив агымыннан чыккан җылылык,
цинк өслек парга әйләнгәндә, өлешчә йотыла һәм җибәрү
конструкцияләре яхшырак саклана.
цинкка тәэсир итми. Югарырак температурада цинк активлаша һәм гади
матдәләр — галогеннар, кислород һәм күкерт белән реагирлаша·.
Г2в~^
0 0 t +2 -1
Zn + Cl2 = ZnCl2
г2е~1
0 0t+2-2
2Zn + O2 = 2ZnO
Г2е’1
0 0(+2-2
Zn + S = ZnS
Реакция шартларына бәйле рәвештә цинк катлаулы матдәләр — кис¬
лота, селте эремәләре һәм су белән төрлечә реагирлаша. Цинкның сульфат
кислотасы белән реакциясе тигезләмәләре 31 нче параграфта карала. Биредә
цинкның селте һәм су белән реакциясе тигезләмәләрен язабыз:
I—2е~—1
0 +1(+2 0
Zn + 2NaOH = Na2ZnO2 + H2I
(крист.)
о—2е~—i
Zn + 2NaOH + 2Н2О = Na2IZn(OH)4] + Η2ΐ
Г2е’1
0+1(+2 О
Zn + H2O = ZnO + Η2ΐ
103
Әлеге мисаллардан күренгәнчә, цинк (алюминий кебек үк) ике төрле
табигатьле, ә аның оксиды һәм гидроксиды амфотер үзлекләргә ия.
Куллану. Цинкка гадәти шартларда һава кислороды да, су да тәэсир
итмәгәнлектән, ул башлыча калай·һәм корыч әйберләрнең өслегенә саклагыч
каплам ясау өчен тотыла. Цинкны, бакыр (җиз), алюминий һәм никель
белән кушып, техник яктан әһәмиятле эретмәләр табу өчен, шулай ук төрле
батареяларда файдаланыла торган цинк-күмер гальваник элементлары
җитештерү өчен кулланалар.
5 нче күнегүне үтәгез (118 нче бит).
■ § 25. Титан
Химик элементларның периодик системасында титанның урыны
һәм атом төзелеше. Титан — IVB-төркем элементы. Аның электронлы
формуласы:
+22Ti Is2 I 2s22p6 I 3s23p63d21 4s2
Башка бик күп d-элементларныкы кебек үк, титан Ti атомында да
тышкы энергетик дәрәҗә электроннары гына түгел, бәлки d-кече энергетик
дәрәҗәнең ике электроны да хәрәкәтчән. Шуңа күрә кушылмаларда
титанның оксидлашу дәрәҗәсе +2 һәм +4 (сирәк кенә +3).
Табигатьтә очравы. Составында титан булган иң әһәмиятле минераллар:
титаномагнетитлар FeTiO3 · nFe3O4, ильменит FeTiO3, рутил TiO2 һ.б.
Титан рудалары чагыштырмача киң таралса да, алар титанга әллә ни
бай түгел.
Табу. Җир кабыгында титанга бай рудалар булмаганлыктан, аларны
баетырга туры килә. Титанны баетылган рудаларны хлорлау, ә аннары
барлыкка килгән титанЦҮ) хлоридын магний (сирәгрәк натрий) белән
кайтару ысулын кулланып табалар:
ψ—^е~—I
+4 O t +2 O
TiCl4 + 2Mg = 2MgCl2 + Ti
Табылган титанда катышмалар була. Саф титанны аерып алу өчен, бар¬
лыкка килгән катнашманы вакуумда җылыталар. Бу вакытта магний һәм
магний хлориды парга әйләнә. Аерып алынган титанны кабат эретәләр һәм
компактлы чүкелүчән металл табалар. Әлеге производство процессында
кыйммәтле магний Mg металы файдаланылганлыктан, титанның үзкыйм¬
мәте гаять зур.
104
СЕЗ
БЕЛӘСЕЗМЕ?
Бер-берсе белән белешмичә, ике галим — инглиз галиме
У. Грегор (1789) һәм немец галиме М.Клапорт (1795—
1797) титан оксидын TiO2 ача. 1825 елда швед химигы
Й. Я. Берцелиус беренче булып бу металлны катнашмалар
хәлендә таба. 1925 елда гына Голландия галимнәре
А. ван Аркель һәм И. де Бур саф титан табалар.
Физик үзлекләре. Титан — көмешсыман-ак төстәге металл. Чагыш¬
тырмача җиңел — алюминийдан аз гына авыррак, ләкин аннан өч тапкыр
ныграк. Авыр эретелүчән (1665 0C). Гадәти шартларда бик нык һәм үзле
булуы белән аерылып тора. Төрле эшкәртүләргә җиңел бирелә.
Химик үзлекләре. Титан,— алюминий кебек үк, шактый актив металл.
Ләкин металл өслегендә саклагыч тыгыз оксид элпәсе хасил булганлыктан,
аның коррозиягә тотрыклылыгы тутыкмаучан корычныкыннан югарырык.
Гадәти шартларда титанга һава кислороды да, диңгез суы да, хәтта «патша
аракысы» да тәэсир итми. Югары температурада исә аның химик актив¬
лыгы арта. Әйтик, мәсәлән, титан хлор белән реакциягә керә:
г4е’ч
O O t +4 -1
Ti + 2С12 = TiCl4
Югары температурада кислород белән реакциягә керә:
Г 4irI-
O O ,+4-2
Ti + O2 - TiO2
Нитрат кислотасы титанга (порошогын исәпләмәгәндә) тәэсир итми,
ә сыегайтылган сульфат кислотасы аның белән реакциягә керә:
F
2ΊΊ + SH2SO4 = Ti2(SO4)3 + 3H2t
Куллану. Титан һәм аның эретмәләре җиңел, нык, югары температурага
һәм коррозиягә тотрыклы, шуңа күрә аларны самолетлар, космик корабль,
ракета, су асты көймәләре, үткәргеч торбалар, югары басым казаннары,
химия промышленносте өчен төрле аппаратлар эшләү өчен кулланалар.
Судноларның корпусларын диңгез суына бирешми торган итеп эшләү өчен,
титан белән тышлау киң кулланылыш таба.
105
СЕЗ
БЕЛӘСЕЗМЕ?
Яхшы итеп эшкәртелгән үтә күренмәле рутил TiO2 крис-
талларын ювелир бизәнү әйберләре сыйфатында кулла¬
налар.
Титан, тантал кебек үк, организмның тере тукымалары өчен зарарсыз
булганлыктан, бу металларның кушылмалары һәм эретмәләре сынган сөяк¬
ләрне ялгау өчен хирургиядә кулланыла.
Төп состав өлешен титан(1Ү) оксиды TiO2 тәшкил иткән буяуларның
сыйфаты бик югары.
6 нчы сорауга җавап бирегез (118 нче бит). 2 нче мәсьәләне чишегез (118 нче
бит).
■ § 26. Хром
Химик элементларның периодик системасында хромның урыны
һәм атом төзелеше. VIB-төркем хромнан башлана. Аның электронлы
формуласы:
+24Cr Is21 2s22p61 3s23p63d51 4s1
Хром атомында электроннарның энергетик дәрәҗәләрдә һәм орбиталь¬
ләрдә урнашу схемасы:
Is2 2s2
+24^Г
2p6
3s2
3p6
3d5
4s1
Энергетик дәрәҗәләрнең һәм кече дәрәҗәләрнең (орбитальләрнең) тулу
закончалыклары буенча, хром атомының дүртенче энергетик дәрәҗәсендә
(s-кече дәрәҗәсендә) ике электрон булырга тиеш. Ләкин ике электронның
берсе өченче энергетик дәрәҗәгә, тулы булмаган d-орбитальгә күчә. Мондый
СЕЗ
БЕЛӘСЕЗМЕ?
Hihhhhhhhhhhhhmmhhmhhhhhbhhhhhhhmhhhhhhhhhhhhhhmmi
Хромны беренче булып (1797) француз галиме Л. Воклен
кызыл кургаш рудасыннан PbCrO4 таба. Башта ул
PbCrO4 + K2CO3 = K2CrO4 + PbCO3
тигезләмәсе буенча реакция уздыра. K2CrO4 не хлорид
кислотасы белән җылытып CrCI3, аннары Cr2O3 не таба.
Аны күмер белән бик нык җылытып, хромны таба.
106
Француз химигы, академик. Аның фәнни
хезмәтләре нигездә аналитик химиягә ка¬
рый. 1797 елда Себер кызыл кургаш руда¬
сында (PbCrO4) хром дигән яңа элементны
ача һәм 1798 елда аны ирекле хәлдә
таба.
Воклен
(Вокелен)
Луи
Никола
(1763-1829)
күренеш ян төркемчәнең кайбер башка элементлары атомнарында да
күзәтелә.
Хром +1 дән +6 га кадәр оксидлашу дәрәҗәсен күрсәтә ала. Оксидлашу
дәрәҗәсе +2, +3, +6 булган хромның кушылмалары тотрыклырак.
Табигатьтә очравы. Безнең илдә иң күп очрый торган хром рудасы —
хромлы тимерташ, яки тимер хромиты Fe(CrO2)2. Табигатьтә шулай ук
хром(Ш) оксиды Cr2O3 һәм тагын кайбер башка кушылмалары очрый.
Табу. Хромлы тимерташны күмер белән нык җылытканда, хром һәм
тимер кайтарыла:
+2+3 O t O O +2
FeO · Cr2O3 + 4С = 2Cr + Fe + 4C0t
Бу реакция нәтиҗәсендә хромның тимер белән эретмәсе — феррохром
барлыкка килә. Саф хром табу өчен, аны хром(Ш) оксидыннан алюминий
белән кайтаралар:
■ί——I
+3 O t +3 O
Cr2O3 + 2А1 = Al2O3 + 2Сг
Гадәттә, Cr2O3 һәм CrO3 оксидлары катнашмасын кулланалар.
СЕЗ
БЕЛӘСЕЗМЕ?
Саф платина табигатьтә сирәк очрый. Аның 9,63 кило¬
граммлы иң зур кисәге безнең көннәргә кадәр саклан¬
маган. Массасы 8,395 килограммлы платина XX гасыр
башында Исы елгасы бассейнында табыла (алмаз фонды
коллекциясендә саклана).
107
9 нчы схема
Тимер белән бергә эретеп (феррохром), югары темпера¬
турага чыдам, яхшы сыйфатлы каты корыч табалар
(металл кисү инструментлары ясау өчен).
Металлик
хромның
кулланылышы
Тимергә хром өстәп (12% чамасы), тутыкмаучан корыч
табалар (хирургик инструментлар һ. б. ясау өчен).
Коррозияне булдырмау өчен, корычтан ясалган
әйберләрне хромлыйлар (хром белән каплыйлар).
Физик үзлекләре. Хром — металлик ялтыравыклы көмешсыман-ак
төстәге металл, тышкы күренеше белән корычка охшаган. Аның тыгызлыгы
7,19 г/см3, эретелү температурасы 1890 °C.
Химик үзлекләре. Хромның өслеге бик юка һәм үтә күренмәле оксид
элпәсе белән капланган була. Ул — химик яктан үтә тотрыклы, хәтта
кислоталарга да шактый тотрыклы металл. Бу элпә булганлыктан, хром
коррозиягә иң тотрыклы металларның берсе булып тора. Ул хәтта дымлы
һавада да үзгәрми. Сыегайтылган хлорид һәм сульфат кислоталары хром
белән күпмедер вакыттан соң гына (элпәсе җимерелгәч кенә) реакциягә
керәләр: о +i +2 о
Cr + H2SO4 = CrSO4 + H2 t
Нитрат кислотасы хромны пассивлаштыра (оксид элпәне ныгыта).
Хромның кулланылышы 9 нчы схемада күрсәтелгән.
Сорауларга җавап бирегез һәм 7—9 нчы күнегүләрне үтәгез (118 нче бит).
§ 27. Тимер, никель, платина
ҮШБ-төркемдә барлыгы тугыз элемент, аларның практик яктан иң
әһәмиятлесе — тимер. Тимергә оксидлашу дәрәҗәсе +2 һәм +3 булган
кушылмалар хас. Тимер +6 оксидлашу дәрәҗәсе күрсәткән кушылмалар да
бар, ләкин алар тотрыклы түгел. Тимернең төп үзлекләрен 8 нче таблицадан
карагыз.
СЕЗ
БЕЛӘСЕЗМЕ?
Шундый горелка уйлап табыла: анда сульфат кислотасы
белән цинк тәэсир итешкәндә аерылып чыккан водород
яну реакциясенең катализаторы — платина порошогы
катнашында гына кабынып китә.
108
8 нче таблица. Тимер
Электронлы формуласы
+26Fe ... 3s23p63d64s2
Физик үзлекләре
Көмешсыман-ак төстәге металл. Саф тимер — йомшак, пластик металл. Ты¬
гызлыгы 7,87 г/см3, эретелү температурасы 1539 °C. Күп металлардай аерма¬
лы буларак, тимер магнитлану үзлекләренә ия.
Химик үзлекләре
Гади матдәләр белән
тәэсир итешүе
Катлаулы матдәләр белән
тәэсир итешүе
1. Кислород белән:
1. Сыегайтылган кислоталар белән:
п8е'^
0 0 f +3 -2 +2-2
3Fe + 2О9 = Fe9O4 · FeO
яки Fe(FeO2)2 — тимер(П)
ферриты
Дымлы һавада кислород белән
реагирлашып, Fe2O3 · пН20 ха¬
сил итә.
Fe + 2НС1 = FeCl2 + H2I
0 „ O
Fe + 2Н+ + 2СГ = Fe2+ +2СГ + H91
г2е“1
0 „ O
Fe + 2Н+ = Fe2+ + H2 T
2. Куертылган сульфат кислотасы белән:
I— —ψ
θ +6/+3 +4
2. Хлор белән:
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2t+ 6H2O
n6*—1
O O t +з -1
2Fe + ЗС12 = 2FeCl3
3. Тозлар белән (судагы эремәсендә):
Fe + CuSO4 = FeSO4 + Cu I
3. Күкерт белән:
Fe + Cu2+ + SO4- = Fe2+ + SO4- + Cu 4
г2е’д
O Ot +2-2
Fe + S = FeS
Г2е ’7
Fe + Cu2+ = Fe2+ + Cu I
4. Cy парлары белән:
П8е--1
O +1 t +3 +2 Oi
3Fe + 4Н2О = Fe2O3 · FeO + 4H2t
Кулланылышы
Саф тимер тиз магнитлана һәм тиз магнитын югалта ала, шуңа күрә
аны трансформаторлар, электромотор, микрофон мембраналары ясау өчен
кулланалар. Практикада тимер башлыча эретмәләр — чуен һәм корыч
сыйфатында кулланыла (10, 11 нче таблицалар).
109
9 нчы таблица. Никель һәм платина — VIIIB-төркем металлары
Никель Ni
Платина Pt
Электронлы
+28Ni ... 3s23p63d84s2
Физик үз
Көмешсыман-ак төстәге, бик каты ме¬
талл. Яхшы чүкелә һәм шомартыла.
Тимер кебек үк магнитка тартыла.
Шактый ук югары температурада
(1453 °C) эретелә.
Химик үз
Химик актив
1. Гади матдәләр бе
Оксид элпә белән капланган булу
сәбәпле, кислород, галогеннар, кү¬
керт белән югары температурада гы¬
на реагирлаша:
Г2е’Ч
0 0 t +2 -1
Ni + Cl2 = NiCl2
Г4е'7
0 0 t +2-2
2Ni + O2 = 2NiO
2. Катлаулы матдәләр
Гадәти шартларда сыегайтылган кис¬
лоталар белән акрын реагирлаша:
Ni + 2НС1 = NiCl2 + H2!
Г 2е~Л
Ni + 2Н+ = Ni2+ + H2T
Ni + H2SO4 = NiSO4 + H2!
Г 2e^
Ni + 2Н+ = Ni2+ + H2!
Нитрат кислотасы белән төрлечә реа¬
гирлаша (§ 31).
•
формуласы
+78Pt ... 5s25p65d96s1
леклэре
Ак төстәге, пластик һәм чүкелүчән
металл, эретелү температурасы юга¬
ры (1769 0C). Авыр металларның
берсе (р = 21,5 г/см8).
леклэре
лыгы кими
лән тәэсир итешүе
Химик яктан бик тотрыклы. Га¬
дәти шартларда гади матдәләр
(Cl2, S, O2) белән реакциягә керми.
Вакланган хәлдә югары темпера¬
турада хлор һәм күкерт белән реа¬
гирлаша.
белән тәэсир итешүе
Кислоталар платинага тәэсир итми.
Ул «патша аракысы» белән генә ре¬
акциягә керә.
IlO
Дәвамы.
Никель Ni
Платина Pt
Кулла
1. Төрле эретмәләр җитештерү өчен
(12 нче таблица)
2. Башка металларны йөгертү (никель¬
ләү) өчен
3. Күп кенә химик процессларда ката¬
лизатор сыйфатында
нылышы
1. Төрле производстволарда һәм ла¬
бораторияләрдә кулланыла торган
аппаратураның коррозиягә чыдам
детальләрен ясау өчен
2. Лаборатор электр мичләренең юга¬
ры температура датчикларын, тем¬
пература үлчәү приборларын ясау
өчен
3. Төрле химик производстволарда
катализатор сыйфатында
4. Химик яктан тотрыклы лаборатор
савытлар ясау өчен
ҮШБ-төркем элементлары арасында, тимердән тыш, никель Ni һәм
платина Pt практик яктан әһәмиятле.
Кушылмаларында никель +2 һәм +3 оксидлашу дәрәҗәсен күрсәтә.
Тимердән аермалы буларак, никельнең оксидлашу дәрәҗәсе +3 булган
кушылмалары тотрыксыз.
Платина үзенең кушылмаларында +2 һәм +4 оксидлашу дәрәҗәсен
күрсәтә.
Бу металларның төп үзлекләрен һәм аларның кулланылышын 9 нчы
таблицадан карагыз.
10—12 нче күнегүләрне үтәгез (118 нче бит). 4 нче мәсьәләне чишегез (118 нче
бит).
§ 28. Металларның эретмәләре
Сез A- һәм Б-төркемнәрнең иң әһәмиятле металлары белән инде
таныштыгыз. Хәзер «эретмәләр» төшенчәсенә билгеләмә бирергә мөмкин.
Металларның эретмәләре — ике яки берничә элементтан торган һәм
аларның һич югында берсе металл булган металлик үзлекле матдәләр.
Эретмәләрне, түбәндәге билгеләренә карап, төркемнәргә аералар:
1) компонентларының саны буенча (икеле, өчле һ. б.);
2) структурасы буенча (гомоген — бер фазалы һәм гетероген — берничә
фазадан торган катнашмалар);
Ill
Аносов
Павел
Петрович
(1799-1851)
Pyc металлургы һәм тау инженеры.
Ул — корычның структурасын тикшерүдә
1831 елда ук микроскоп кулланган беренче
тикшеренүче. Корычтан коелган әйберләрне
кысылган һава агымында чыныктыру ысулын
уйлап таба. Коелма корыч табуга ирешә
һәм күп кенә завод механизмнарын һәм
мичләрен камилләштерә.
3) эретмәнең нигезен тәшкил итүче металлның характеры буенча (кара —
корыч, чуен, төсле — алюминий, бакыр, никель һ. б. ның эретмәләре);
4) характерлы үзлекләре буенча (авыр эретелүчән, җиңел эретелүчән,
кыздыруга чыдам, үтә нык, каты, коррозиягә тотрыклы)·,
5) технологик билгеләре буенча (эретеп коела торган — эретеп кою
ысулы белән детальләр ясау өчен һәм деформациялэнүчэн — чүкелә,
штамповкалана, прокатлана, пресслана һәм төрлечә эшкәртеп була торган
эретмәләр).
Чуенның, легирланган корыч һәм төсле металларның кайбер эретмә¬
ләренең составы, үзлекләре һәм кулланылышлары белән сез 10, 11 һәм
12 нче таблицалардан танышырсыз.
Сорауларга җавап бирегез һәм 13—15 нче күнегүләрне үтәгез (118 нче бит).
10 нчы таблица. Чуенның төрләре һәм үзлекләре
Чуенның төре
Составы
Үзлекләре
Кулланылышы
Соры чуен
(кремний күп
катнашкан)
Ак чуен
(кремнийның
микъдары аз)
C — 1,7-4,3% ;
Si — 1,25—4,0%
һәм Mn—1,5% ка
кадәр. Кремний¬
ның микъдары
күп булу углерод¬
ның эрүчәнлеген
киметә. Шуңа күрә
углерод графит рә¬
вешендә аерылып
чыга.
C — 1,7-4,3%;
Mn— 4% тан ар¬
тыграк; Si — бик
аз гына. Углерод
башлыча цемен¬
тит — тимер кар¬
биды Fe3C рәве¬
шендә.
Чагыштырмача
йомшак, шуңа кү¬
рә механик эшкәр¬
түгә җиңел бире¬
лә. Ирекле углерод
чуенга йомшаклык
бирә.
Каты һәм уалучан.
Бу үзлекләрне аңа
каты цементит
бирә.
Төрле детальләр
(шестерня, тәгәр¬
мәчләр, торбалар
һ.б.) кою өчен
Корыч кою өчен
112
СЕЗ
БЕЛӘСЕЗМЕ?
Нихромнар (никельле эретмәләр) югары электр каршы¬
лыгына ия, шуңа күрә аларны электр мичләренең җылыт¬
кычларын ясау өчен кулланалар.
11 нче таблица. Кайбер легирланган корычларның үзлекләре
һәм аларның кулланылышы
Легирлаучы
элемент
Корычка легирлаучы
элемент биргән үзлекләр
Кулланылышы
Хром
Катылык һәм коррозиягә
бирешмәүчәнлек
Инструментлар, кисү кораллары,
тешәвеч
Никель
Үзлелек, механик ныклык,
коррозиягә бирешмәүчән¬
лек
Электр станцияләре һәм реактив
двигательләр турбиналары, юга¬
ры температура режимында
эшли торган детальләр, үлчәү
приборлары
Марганец
Катылык, механик нык¬
лык, бәрелүгә һәм ышкы¬
луга бирешмәүчәнлек
Ваклагыч җайланмалар деталь¬
ләре, тимер юл рельслары, экска¬
ватор чүмеченең тешләре
Титан
Кыздыруга чыдамлылык,
югары температурада меха¬
ник ныклык, коррозиягә
бирешмәүчәнлек
Самолетлар, ракета һәм суднолар
төзүдә. Химик аппаратура
Вольфрам
Катылык һәм кыздыруга
чыдамлылык, тиз тузмау-
чанлык
Тиз кисә торган инструментлар,
пычкы, фрезер, штамплар,
электр лампочкаларының кыз¬
дырма кыллары
Молибден
Эластиклык, кыздыруга
чыдамлылык, коррозиягә
бирешмәүчәнлек
Реактив самолетлар һәм автомо¬
бильләрнең турбиналары калак¬
ларын эшләүдә, бронялы пли¬
талар, лаборатор савытлар,
электрон лампа детальләре
Кремний
Кислоталар тәэсиренә
чыдамлылык
Трансформаторлар, кислоталар¬
га чыдам аппаратлар һәм при¬
борлар
Ванадий
Ныклык, сыгылмалылык
һәм бәрелүләргә каршы то-
ручанлык
Инструменталь корычлар җи¬
тештерүдә. Автомобиль, трактор
һәм башка машиналарның бәре-
лүчән детальләре
113
12 нче таблица. Кайбер төсле металларның эретмәләре
Атамасы
Составы, %
Эретелү
температу¬
расы, 0C
Кулланылышы
Алюминий-
марганецлы
бронза
Cu (-90),
Al ( 8,5-9,5),
Mn (1,5—2)
1060
Машина детальләре
Бериллийлы
бронза
Cu (97,4—98),
Be (2—2,6)
1000
Бәрелгәндә очкын чыгармый
торган пружиналар һәм
инструментлар, музыкаль
инструмент кыллары
Җиз
Cu (57—60),
Zn (40—43)
900
Көнкүреш механизмнары
һәм предметларына деталь¬
ләр
Нейзильбер
Cu (-65),
Zn (20),
Ni (15)
1040
Монеталар (тәңкәләр)
Константан
Cu (-60),
Ni (39—41),
Mn (0,4-0,6)
1270
Электр үлчәү приборлары
Мельхиор
Cu (-80),
Ni (18,5—20,5),
Fe(O1I-I)
1170
Монеталар һәм төрле маши¬
налар һәм инструментлар
детальләре
Никелин
Cu (65—67),
Ni (33—35),
Mn (0,4-0,6)
1250
Электр җылыткычлары
Җиңел
эретелүчән
эретмә
Bi (36),
Pb (28),
Cd (6),
Hg (30)
48
Автоматик янгын сүндергеч¬
ләр һәм билгеле бер темпе¬
ратурага җиткәч сигнал
бирә торган җайланмалар
Вуд эретмәсе
Bi (50),
Pb (25),
Sn (12,5),
Cd (12,5)
68
Үрнәк калыпка тутырып ме¬
таллик модельләр ясау, кай¬
бер эретмәләрне ябыштыру
Электрон
Mg (86,5—96,6),
Al (3—10),
Zn (0,2—3),
Mn (0,15—0,5)
625
Ракета техникасында, авиа¬
ция һәм автомобиль төзүдә
114
Pyc металлургы. Корыч кою, чүкү һәм
термик эшкәртүнең иң кулай шарт¬
ларын уйлап таба (1868). Конвертор
процессында кислород өрдерүнең өс¬
тенлеген әйтә.
Чернов
Дмитрий
Константинович
(1839-1921)
§ 29. Металларның оксидлары һәм гидроксидлары
Оксидлар һәм гидроксидларның химик үзлекләре бу элементның
Д. И. Менделеев периодик системасындагы урынына да, аның оксидлашу
дәрәҗәсенә дә бәйле. Белгәнегезчә, төркемнәрдә өстән аска таба элемент¬
ларның атом радиусы зурая һәм, димәк, металл үзлекләре көчәя. Бу бигрәк
тә төп төркемчә элементларына хас. Шул ук юнәлештә бу элементларның
оксидлары һәм гидроксидларының нигез үзлекләре көчәя. Моңа 13 нче
таблицада бирелгән элементлар, аларның оксидлары һәм гидроксидлары
үзлекләрен чагыштырып ышанырга мөмкин.
Мондый закончалык бар: кушылмада элементның оксидлашу дәрәҗәсе
никадәр югары булса, аның кислота үзлекләре шулкадәр көчлерәк беленә.
Бу — хромның оксидлары һәм гидроксидлары үзлекләрен чагыштырганда
ачык күренә (14 нче таблица).
СЕЗ
БЕЛӘСЕЗМЕ?
Платина, испан теленнән тәрҗемә иткәндә, «көмештәй»
дигән мәгънәне аңлата. Табигый платинадан аның ияр¬
ченнәрен табу 1803—1804 елларда тормышка ашырыла,
ә рутений 40 елдан соң гына беленә. Аны Казан химигы
К. К. Клаус ача. Рутений исеме латинча Ruthenia (Русь)
сүзеннән алынган.
Җирдә тимернең метеоритлар белән төшкәннәре дә,
үзендә барлыкка килгән табигый хәлдәгеләре дә очрый.
XX гасыр башында Владивосток тирәсендә табигый чуен
табыла, аның составында 3,2% углерод була. Үзенә бер¬
төрле саф тимер Ай грунтында табыла. Ул һавада тутык¬
мый, кислород белән реакциягә керми. Бу озак вакытлар
вакуум шартларында металл өслеге кояштан нурланыш
алуы белән аңлатыла.
115
116
13 нче таблица. IIА-төркем металларының үзлекләре һәм аларның оксидларына
һәм гидроксидларына характеристика
Элемент¬
ның ата¬
масы һәм
химик
билгесе
Бериллий
Be
Маг¬
ний
Mg
Каль¬
ций
Ca
Строн¬
ций Sr
Барий
Ba
Металларның тәэсир итешүе
кислоталар
белән
селтеләр
белән
су белән
Оксидларына һәм
гидроксидларына
характеристика
Г2<г1
о +1
Ве + 2НС1—>
+2 0
—> BeCI2 +H2 ΐ
Кислоталар белән
реакциягә берил¬
лийга (Be) кара¬
ганда тизрәк керә.
Кислоталар белән
реакциягә магний¬
га (Mg) караганда
тизрәк керә.
I—2^- —1
0
Be + 2NaOH —
—* Na2BeO2+H2T
натрий бериллаты
I 2е~ 1
O
Be + 2NaOH + 2H,O—>
+2 2O
—> Na2IBe(OH)4]+H21
натрий
тетрагидроксобериллаты
Реакциягә керми.
Гадәттәге температу¬
рада реагирлашмый.
Салкын су белән на¬
чар реагирлаша.
Амфотерлар:
ВеО + 2НС1—>
—-BeCl2+ H2O
BeO + 2NaOH—>
—♦ Na2BeO2 + H2O
BeO су белән реагирлашмый,
Be(OH)2 суда практик яктан
эреми.
K
S
ф
ω
й
о
Я
fcl
ф
Ό
to
Я
Ф
Λ
ф
M
Кислоталар белән
реакциягә каль¬
цийга (Ca) кара¬
ганда тизрәк керә.
Кислоталар белән
реакциягә строн¬
цийга (Sr) караган¬
да тизрәк керә.
Гадәти температура¬
да реагирлаша:
Г2е’1
0 +1
Са + 2НОН—>
—♦ Ca(OH)2 +H2T
Кальцийга караган¬
да тизрәк реагирла¬
ша.
Стронцийга караган¬
да тизрәк реагирла¬
ша.
Нигез үзлекләренә генә ия.
MgO су белән начар реагирла¬
ша. Mg(OH)2 нең эрүчәнлеге ■ ■
гаять түбән.
Нигез үзлекләренә генә ия. CaO
су белән тиз реагирлаша. Ca(OH)2
нең эрүчәнлеге түбән, ләкин
Mg(OH)2 нән югарырак.
Нигез үзлекләренә генә ия. SrO су
белән CaO дан тизрәк реагирлаша.
Sr(OH)2 нең эрүчәнлеге Ca(OH)2
нән югарырак.
Нигез үзлекләренә генә ия. BaO су
белән SrO дан тизрәк реагирлаша.
Ba(OH)2 Sr(OH)2 гә караганда көч¬
лерәк нигез.
14 нче таблица. Хромның оксидлашу дәрәҗәләренә бәйле рәвештә
аның оксидларының һәм гидроксидларының үзлекләре
Оксид
Үзлекләре
Гидроксид
Үзлекләре
Хром(П)
оксиды
CrO
Хром(Ш)
оксиды
Cr2O3
XpoM(VI)
оксиды
CrO3
Кислоталар белән генә
реагирлаша (нигез үз¬
лекләренә генә ия):
CrO + 2НС1 =
= CrCl2 + H2O
Амфотер үзлекләргә
ия: t
Cr2O3 + 6HNO3 =
= 2Cr(NO3)3 + ЗН2О
Cr2O3 + 2NaOH =
= 2NaCrO2 + H2O
Кислота үзлекләренә
генә ия:
CrO3 + 2NaOH =
= Na2CrO4 + H2O
Хром(П)
гидроксиды
Cr(OH)2
Хром(Ш)
гидроксиды
Cr(OH)3
Хромат H2CrO4
һәм дихромат
H2Cr2O7
кислоталары
судагы
эремәләрдә
генә була.
Кислоталар белән ге¬
нә реагирлаша (ни¬
гез үзлекләренә генә
ия): *
Cr(OH)2-FH2SO4= g
= CrSO4 + 2Н2О о
Хром(П) кушылмала- S
рының катлаулырак ·<
реакцияләре югары ъ
уку йортлары курсла- я
рында өйрәнелә. §
Ό
Амфотер үзлекләргә
ия: ©
Cr(OH)3 + ЗНС1 = ί
= CrCl3 + зн2о Iм
Cr(OH)3 + NaOH =
= NaCrO2 + 2Н2О
Эремәдә:
Cr(OH)3 + 3NaOH =
= Na3[Cr(OH)6]
H2CrO4 һәм H2Cr2O7
кислоталарына хромат
һәм дихромат тозлары
туры килә. Бу тозларны
хром(Ш) кушылмала¬
рын оксидлаштырып,
шулай ук хромат һәм
дихромат кислотала¬
рын нигезләр белән
нейтральләштереп та¬
балар.
Сорауларга җавап бирегез һәм 16—18 нче күнегүләрне үтәгез (118 нче бит). 6 нчы
мәсьәләне чишегез (118 нче бит).
Урта гасырларда Германия горняклары, аккургаш табу
процессын күзәтеп, бу процессның ни өчен акрынаюын
аңлатып бирә алмаганнар. Алар мәгъдәндә (рудада), ме¬
таллны күбеккә (Rahm) әйләндереп, саф металл алырга
комачаулый торган бүре (волк) (Wolf) бар дип уйлаганнар.
Мәгъдәндәге (рудадагы) аккургаш иярченен соңрак вольф¬
рам дип атыйлар.
117
1. Тимер, бакыр һәм хром атомна¬
рының электронлы формулаларын төзе¬
гез. Бу элементларның оксидлары һәм
гидроксидларының формулаларын язы¬
гыз, аларның табигатен ачыклагыз.
2. Ни өчен Д. И. Менделеев периодик
таблицасының Б-төркемнәр химик эле¬
ментларыннан барлыкка килгән метиллар¬
ның тиешле А-төркемнәр металларыны-
кына хас валентлык мөмкинлекләре юк?
3. IA- һәм 1Б-төркемнәр элемент¬
ларының үзлекләрен чагыштырыгыз.
Бакыр һәм калий атомнарының төзе¬
лешенә һәм аларның үзлекләренә ни¬
гезләнеп, IA- һәм 1Б-төркемнәр эле¬
ментларының охшашлыгы һәм аерым¬
лыгы нәрсәдә күренүен аңлатып бирегез.
4. Бакырның үзлекләрен һәм кулла¬
нылышын тасвирлагыз. Тиешле реак¬
цияләрнең тигезләмәләрен китерегез.
5. II төркемнең ян төркемчәсе (ПБ-
төркем) вәкиле буларак цинкның химик
үзлекләрен чагылдырган реакцияләрнең
тигезләмәләрен төзегез һәм цинкның кай¬
да кулланылуын аңлатыгыз.
6. Заманча техникада титанның иң
әһәмиятле металларның берсе булуын
нәрсәгә нигезләнеп дәлилләргә мөмкин?
7. Хромга нинди оксидлашу дәрә¬
җәләре хас? Мисаллар китерегез. Хром
атомында электроннарның орбитальләрдә
урнашу схемасын төзегез.
8. Cr CrCl3 -2U- Cr(OH)3 әвере¬
лешләре схемасында X һәм Y ка туры
килгән матдәләр:
• 1. 1 л 18% лы бакыр(П) сульфаты
эремәсе аша (р = 1,12 г/см3) 23,2 л серово¬
дород уздыралар. Утырымга нинди матдә
төшә? Аның массасы күпме булыр?
2. Металлик алюминий һәм аның окси¬
дыннан торган 9 г катнашмага NaOH ның
40% лы эремәсе (р = 1,4 г/см3) белән тәэсир
иткәндә 3,36 л газ аерылып чыккан (н.ш.).
Реакция өчен алынган катнашманың
составын (% ларда) һәм реакциягә кергән
NaOH ның күләмен билгеләгез.
3. 1,28 г бакырны кислород агы¬
мында кыздырганда табылган матдәне
бакыр(П) хлоридына әверелдергәннәр.
Реакция өчен тотылган 4% лы хлорид
кислотасының (р = 1,02 г/см3) күләмен
1) Cl2 һәм H2O 3) NaCl һәм KOH
2) Cl2 һәм NaOH 4) HCl һәм KOH
9. Хромны куллану өлкәләрен әйтегез.
10. Тимернең гади һәм катлаулы
матдәләр белән реакцияләренең тигез¬
ләмәләрен төзегез. Электроннар күчешен;
нәрсә оксидлашуын һәм нәрсә кайтары¬
луын; оксидлаштыргычны һәм кайтар¬
гычны күрсәтегез.
11. Тимер кайтару үзлекләрен күр¬
сәткән реакция:
1) Fe2O3 + SII2SO1 = Fe2(SO4)3 + ЗН2О
2) 2FeCl2 + Cl2 = 2FeCl3
3) 2Fe(OH)3 = Fe2O3 + ЗН2О
4) FeCl2 + 2К0Н = Fe(OH)2 + 2КС1
12. Ни өчен саф тимерне куллану чик¬
ләнгән?
13. Эретмәләр дип нәрсәгә әйтәләр һәм
аларны ничек төркемлиләр?
14. Чуенның, иң әһәмиятле легирлан¬
ган корычларның составын һәм үзлек¬
ләрен, кулланылу өлкәләрен тасвирлагыз.
15. Төсле металларның әһәмиятле
эретмәләрен, аларның якынча составын,
үзлекләрен һәм кулланылышын әйтегез.
16. Металл оксидларының һәм гидрок¬
сидларының үзлекләре нинди факторлар¬
га бәйле?Конкрет мисалларда аңлатыгыз.
17. Mg(OH)2-Ca(OH)2-Sr(OH)2-
Ba(OH)2 рәтендә нигез үзлекләре:
1) көчәя 3) периодик рәвештә үзгәрә
2) көчсезләнә 4) үзгәрми
18. Селен һәм хлорның югары оксид¬
ларының формулаларын языгыз. Алар¬
ның характерын билгеләгез һәм су белән
реакцияләренең тигезләмәләрен языгыз.
(мл ларда) һәм хасил булган CuCl2 нең
массасын исәпләгез.
4. 100 кг магнитлы тимерташтан
Fe3O4 углерод белән кайтарып табылган
тимернең массасын исәпләгез. Магнитлы
тимерташның 10% ы катышмалар. Реак¬
циянең ахыргы продуктының производ¬
ство югалтулары 15%.
5. 16 г бакыр(П) сульфаты булган эре¬
мәгә 4,8 г тимер вагы салганнар. Барлык¬
ка килгән матдәләрнең массасын исәп¬
ләгез.
6. 34% аккургаш һәм 66% кургаштан
торган 500 г ябыштыргыч эретмә табу
өчен күпме масса кургаш һәм аккургаш
оксидлары кирәк булыр?
118
Неметаллар
Vl БҮЛЕК
§ 30. Неметалларга күзәтү
Неметаллик элементлар металлик элементлар белән чагыштырганда
азрак. Химик элементларның Д. И. Менделеев периодик системасында
аларның ничек урнашуы 15 нче таблицада күрсәтелгән.
15 нче таблицадан күренгәнчә, неметаллик элементлар, нигездә, периодик
системаның уң ягында, өске өлешендә урнашканнар. Периодларда сулдан
уңга таба элементлар атомнарының төш корылмалары арта һәм атом
радиуслары кечерәя, ә төркемнәрдә өстән аска таба атом радиуслары
зурая, шулай булгач, неметалл атомнары тышкы электроннарын металл
атомнарына караганда ни өчен ныграк тартып торуын аңлап була. Шуңа
бәйле рәвештә неметалларның оксидлаштыру үзлекләре өстенлек итә.
Көчле оксидлаштыру үзлекләрен, ягъни электроннарны куша алу сәләтен,
аеруча 2 нче һәм 3 нче периодларда VIA—VIIA-төркемнәрнең неметаллары
күрсәтә. Иң көчле оксидлаштыргыч булып фтор исәпләнә. Чагыштырма
электртискәрелекләренең санча кыйммәтләренә тиңдәшле рәвештә,
неметалларның оксидлаштыру сәләтләре түбәндәге тәртиптә арта бара:
Si, B, H2, P, C, S, I2, N2, Cl2, O2, F2
15 нче таблица
Период
Неметаллик элементларның периодик системада
төркемнәрдә урнашуы
IA
IIA
IIIA
IVA
VA
VIA
VIIA
VIIIA
(затлы газлар*)
1
H
He
2
B
C
N
O
F
Ne
3
Si
P
S
Cl
Ar
4
As
Se
Br
Kr
5
Te
I
Xe
6
Rn
7
* Затлы газларның атомнарында тышкы электрон дәрәҗәләре электроннар белән
тулысынча тулган, шуңа күрә алар үзенә бертөрле үзлекләргә ия.
119
СЕЗ
БЕЛӘСЕЗМЕ?
Бромны беренче булып француз фармацевты һәм химигы
Ж. Балар 1826 елда диңгез суүсемнәре көленнән таба.
Йодны беренче булып француз химигы В. Куртуа 1811 ел¬
да диңгез суүсемнәре көленнән таба. Бу элементның
исеме грекча iodes — шәмәхә сүзеннән алынган.
Димәк, водород һәм металлар белән барыннан да тизрәк фтор реагир-
лаша:
Г4еД
0 0 +1-1
H2 + F2 = 2HF
Кислород акрынрак реагирлаша:
Г4е’Д
0 0 +1-2
2Н2 + O2 = 2Н2О
Фтор — иң типик неметалл, аңа кайтару үзлекләре хас түгел, ягъни
химик реакцияләрдә электроннарын бирү сәләте юк.
Кислород исә фтор белән кушылмаларында (OF2, O2F2) уңай оксидлашу
дәрәҗәсен күрсәтә, ягъни кайтаргыч була ала.
Калган барлык неметаллар кайтару үзлекләрен күрсәтәләр. Шул ук
вакытта аларның бу үзлекләре кислородтан кремнийга таба эзлекле рәвештә
көчәя бара:
O2 Cl2 N2 I2 S C P H2 B Si
Әйтик, мәсәлән, хлор турыдан-туры кислород белән кушылмый, әмма
+1 -2 +4-2 +7 -2
арадаш ысуллар белән аның оксидларын (Cl2O,ClO2,Cl2O7) табарга мөмкин,
аларда хлор уңай оксидлашу дәрәҗәсен күрсәтә. Югары температурада
азот турыдан-туры кислород белән кушыла, димәк, кайтару үзлекләрен
күрсәтә:
Г4е’Д
O O , +2-2
N2 + O2 2NO
Кислород белән күкерт тагын да җиңелрәк реагирлаша:
г4е ι
O O +4-2
S + O2 = SO2
120
Күкерт оксидлаштыру үзлекләрен дә күрсәтә. Мәсәлән, күкерт парларын
водород белән җылытканда, түбәндәге реакция бара:
. Г2е^
0 Of +1-2
H2 + S H2S
Гади матдәләрнең — неметалларның төзелеше. Иң типик неметалл ар —
молекуляр төзелешле, ә типик булмаганнары — молекуляр булмаган
төзелешле. Аларның үзлекләрендәге кискен аерымлык шуның белән аңла¬
тыла да. Бу 10 нчы схемада ачык күренә.
10 нчы схема
СЕЗ
БЕЛӘСЕЗМЕ?
Фторны ирекле хәлдә беренче булып француз химигы
А. Муассан 1886 елда таба. Бу элементның исеме грекча
phtoros — һәлакәт, җимерелү, бетерү сүзеннән алынган.
Астатны АКШ галимнәре Д. Корсон, К. Мак-Кензи һәм
Э. Cerpe 1940 елда түбәндәге атом-төш реакциясе ярдә¬
мендә табалар:
2S93Bi + <Не —> 21815At + 210п
121
Углерод һәм кремнийның, шулай ук молекуляр төзелешле неметаллар-
ның үзлекләре һәм аларның кулланылышы неорганик химия курсының
(9 нчы сыйныф) тиешле бүлекләрен өйрәнгәндә тикшерелде. Кристаллик
борның B (кристаллик кремний кебек үк) эретелү температурасы бик югары
(2075 °C), һәм ул гаять каты. Температура күтәрелү белән, борның электр
үткәрүчәнлеге нык арта, бу аны ярымүткәргечле техникада кулланырга
мөмкинлек бирә. Борны корычка һәм алюминий, бакыр, никель һәм
башкаларның эретмәләренә өстәү аларның механик үзлекләрен яхшырта.
Борның изотобы 1^B атом-төш техникасында кулланыла.
Боридлар (борның кайбер металлар белән, мәсәлән, титан белән кушыл¬
малары: TiB, TiB2) реактив двигательләрнең детальләрен, газ турбина¬
ларының калакларын эшләү өчен кирәк.
Гади матдәләр буларак, углерод С, кремний Si, борның B үзгәргән ике
төре: кристаллик һәм аморф төрләре очрый. Бу элементларның кристаллик
үзгәргән төрләре бик каты, эретелү температуралары югары. Кристаллик
кремний ярымүткәргеч үзлекләренә ия. Бу элементлар барысы да метал¬
лар белән кушылмалар — карбидлар, силицидлар һәм боридлар (CaC2,
Al4C3, Fe3C, Mg2Si, TiB, TiB2) хасил итәләр. Аларның кайберләре бик каты,
мәсәлән Fe3C, TiB. Кальций карбидын, белгәнегезчә, ацетилен табу өчен
кулланалар.
IV, V, VI һәм VII төркемнәрнең иң әһәмиятле неметалларының үзлек¬
ләре һәм кулланылышы турындагы уку материалын мөстәкыйль кабатлау
һәм системалаштыруны җиңеләйтү өчен, 16,17,18,19 нчы таблицалардан
файдаланыгыз.
Бу таблицалардан ничек файдаланырга соң?Алар ятлап хәтердә калдыру
өчен бирелмәгән. Таблицаларга нигезләнеп, сез периодик системаның
төркемнәрендә урнашкан элементлар, аларның кушылмалары, үзлекләре
һәм кулланылышы турындагы иң мөһим, иң кирәкле материалны
кабатларга һәм гомумиләштерергә тиеш. Мәсәлән, фтор F һәм хлор Cl
атомнарында электроннарның орбитальләрдәге бүленеше схемасына күз
төшерүгә (19 нчы таблица), сез аларның уртак һәм үзләренә генә хас
химик үзлекләрен исегезгә төшерерсез. Бу схемалардан фтор һәм хлор
атомнарында нормаль хәлдә берәр парлашмаган электрон барлыгы күренә.
Бу элементларның уртак үзлекләре шуның белән аңлатыла да инде: фтор,
хлор һәм башка галогеннар ирекле хәлдә ике атомлы молекулалар: F2, Cl2,
Br2,12 хасил итәләр һәм I валентлы булалар; металлар һәм водород белән
-1 -1 -1
кушылмаларында исә, әйтик, NaF, NaCl, HCl һ. б. да барлык галогеннарның
да оксидлашу дәрәҗәсе -1.
Әгәр фтор, хлор һәм башка галогеннар атомнарында электроннарның
орбитальләрдә урнашуын чагыштырсак, аларның үзлекләрендәге аерым¬
лыклар турында фикер йөртә алабыз. Фтор атомында буш орбитальләр
юк. Шуңа күрә фтор атомнары фәкать I валентлы һәм оксидлашу дәрәҗәсе
122
-1 генә була ала. Башка галогеннар атомнарында, мәсәлән, хлор атомында
шул ук энергетик дәрәҗәдә буш d-орбитальләр була:
3s2 Зр5 3d0
Шунлыктан, схемаларда күрсәтелгәнчә, электроннар парсызланырга
мөмкин:
3s2 Зр4 3d’
3s2 Зр3 3d2
A
3s’ Зр3 3d3
Моннан шундый нәтиҗәләр ясарга була:
Беренче очракта хлор +3 оксидлашу дәрәҗәсен күрсәтә һәм хлорит
+3
кислотасын HClO2, аның тозларын — хлоритларны, мәсәлән калий хлори¬
тын KClO2, хасил итә ала.
Икенче очракта хлор оксидлашу дәрәҗәсе +5 булган кушылмалар
хасил итә ала. Хлорат кислотасы HClO3 һәм аның тозлары — хлоратлар,
мәсәлән калий хлораты KClO3 (бертолле тозы), шундый кушылмалар булып
иәпләнә.
Өченче очракта хлор +7 оксидлашу дәрәҗәсен күрсәтә, мәсәлән, пер-
+7
хлорат кислотасында HClO4 һәм аның тозлары перхлоратларда, мәсәлән
+7
калий перхлоратында KClO4.
19 нчы таблицада характерлы реакцияләрнең тигезләмәләре бирелгән.
Сез хлор һәм башка галогеннар катнашкан бүтән химик реакцияләрне дә
искә төшерергә тиеш.
Хлорның һәм башка галогеннарның кулланылышын тасвирлаганда,
сезгә аларны куллануның нигезендә яткан үзлекләрен искә төшерергә һәм
тиешле реакцияләрнең тигезләмәләрен төзергә кирәк булачак.
Башка таблицалардан да шул рәвешле файдалана аласыз.
Сорауларга җавап бирегез һәм 1—4, 13(a) нче күнегүләрне үтәгез (138 нче бит).
1 нче мәсьәләне чишегез (138 нче бит).
123
16 нчы таблица. Углерод һәм кремний — IVA-төркем неметаллары
Углерод C
Кремний Si
Электроннарның орбитальләрдә урнашуы
Is2 2s2 2р2 3s2 Зр2 3d°
Характерлы химик үзлекләре
1. Оксидлаштыру үзлекләре:
1. Оксидлаштыру үзлекләре:
г2еп
0 0 t +2 -1
2С + Ca = CaC2
г4еп
0 0 ¢-4+1
C + 2Н2 = CH4
2. Кайтару үзлекләре:
Г4е;
0 0 t +4-2
C + O2 = CO2
г4е"~1
O O t +2-2
2С + O2 = 2С0
(тулысынча янмый)
Г4е3
0+2+4 O
C + 2CuO = CO2I+ 2Си
г4ея
O O ( +2 -4
Si + 2Mg = Mg2Si
2. Кайтару үзлекләре:
F4eT-
O O ¢ +4-1
Si + 2 F2 = SiF4
F4eT-
O Of +4-2
Si + O2 = SiO2
I F4eI
O +1 +1 t +4 O
Si + 2NaOH + H2O = Na2SiO3 + 2H2t
Кислоталар (HF һәм HNO3 катнаш¬
масын исәпләмәгәндә) кремнийга
тәэсир итмиләр.
Гади матдәләренең кулланылышы
1. Алмазлар — тау токымнарын бо¬
раулау өчен
2. Графит — электродлар, атом реак¬
торларында нейтроннарны акры¬
найтучылар, техникада майлау
материалы
3. Күмер — адсорбент; сыек ягулык,
кальций карбиды, кара буяу табу
өчен кулланыла.
1. Кислотага чыдам корыч җитеш
терүдә
2. Ярымүткәргечләр җитештерүдә
3. Фотоэлементлар табу өчен
4. Карборунд табу өчен
5. Алмаш токны турайткыч сыйфа·
тында
124
17 нче таблица. Азот һәм фосфор — VA-төркем неметаллары
Азот N
Фосфор P
Электроннарның орбитальләрдә урнашуы.
3s2 Зр3 3J0
Характерлы химик үзлекләре
1. Оксидлаштыру үзлекләре:
F6eI
0 0 t +2 -3
3Mg + N2 = Mg3N2
["6eI
0 Ot +3-3
2А1 + N2 = 2A1N
1. Оксидлаштыру үзлекләре:
г6е’з
О 0+2-3
ЗСа + 2Р = Ca3P2
2. Кайтару үзлекләре:
F6eF
о о
N2 + ЗН2
400—500 °C, 15-30 МПа
катализатор -3+1
ί 2ΝΗ3
2. Кайтару үзлекләре:
Г 4eI
0 0 2000 °C +2-2
N2 + O2 2ΝΟ
P20e }
О О +5-2
4Р + 5О2 = 2Р2О5
F6e^
О 0(+3-2
2Р + 3S = P2S3
|—30е--|
О +5 -1 +5
6Р + 5КС1О3 = 5КС1 + ЗР2О5
Гади матдәләренең кулланылышы
1. Башлыча аммиак синтезлау өчен,
ә соңгысы исә нитрат кислотасы
һәм азотлы минераль ашламалар
җитештерү өчен
2. Электр лампаларына тутыру өчен
1. Ярымүткәргечләр сыйфатында фай¬
даланыла торган фосфидлар (GaP,
InP) табу өчен
2. Кызыл фосфор шырпы җитештерүдә
кулланыла.
125
18 нче таблица. Кислород һәм күкерт — VIA-төркем неметаллары
Кислород O
Күкерт S
Электроннарның орбитальләрдә урнашуы
Is1 2 3 2s2 2р4 5 3s2 Зр4 34°
Характерлы химик үзлекләре
!.Оксидлаштыру үзлекләре:
Г4е1
0 0 t +2 -2
2Mg + O2 = 2MgO
Г4е1
O O t +4-2
C + O2 ~ CO2
Г20е’1
О О +5-2
4Р + 5О2 = 2Р2О5
Г4е’1
О 0,+1-2
2Н2 + O2 = 2Н2О
2. Кислородның кайтару үзлекләре
фтор белән реакцияләрендә генә
күренә:
O -2 -10
2F2 + 2Н2О = 4HF + O2
!.Оксидлаштыру үзлекләре:
Г2е1
O O t +1 -2
2Na + S = Na2S
Г6е 1
O 0(+3-2
2А1 + 3S = Al2S3
Г2е"1
O O t +1 -2
H2 + S = H2S
2. Кайтару үзлекләре:
Г4е1
O O +4-2
S + O2 = SO2
O O +6-1
S + 3F2 = SF6
Гади матдәләренең кулланылышы
1. Химик реакцияләрне (шул исәптән
металлургия дә) тизләтү өчен
2. Металл арны кисү һәм ябыштыру өчен
3. Сыек хәлдә ракета двигательләрендә
4. Авиация һәм су асты көймәләрендә
сулау өчен
5. Медицинада
1. Сульфат кислотасы җитештерүдә
2. Каучукны вулканлаштыру өчен
3. Үсемлек корткычларына һәм авы¬
руларына каршы
4. Сероуглерод җитештерүдә
5. Медицинада
6. Шырпы җитештерүдә
126
19 нчы таблица. Фтор һәм хлор — VIIA-төркем неметаллары
Фтор F
Хлор Cl
Is1 2 3 4 5 2s2
Электроннарның орбитальләрдә урнашуы
2P5
3s2
Зр5
3d0
+9
+ 17
Характерлы, химик үзлекләре
1. Оксидлаштыру үзлекләре
(бик көчле оксидлаштыргыч):
г4ет
0 0 t +4 -1
2F2 + Xe = XeF4
0 -2+1-10,
2F2 + 2Н2О = 4HF + Ο2ΐ
0 0 +1-1
F2 + H2 = 2HF
2. Фтор кайтару үзлекләрен күр¬
сәтми.
1. Оксидлаштыру
үзлекләре:
Г2е”1
0 0
2Na + Cl2 =
F6eT-
0 0
2Fe + ЗС12
Г2еТ
0 0 .
H2 + Cl2 =
Г2е’Т
+1-1 0
2NaI + Cl2
t +1 -1
= 2NaCl
f +3 -1
= 2FeCl3
2НС1
+1 -1 о
= 2NaCl + I2
2.Кайтару үзлекләрен кисло¬
родлы матдәләр катнаша торган
реакцияләрдә генә күрсәтә:
+5 -2 t -1 0
2КС1О3 = 2КС1 + ЗО2Т
Гади матдәләренең кулланылышы
1. Фторопластлар (тефлон) җитеш¬
терү өчен
2. Авыл хуҗалыгы корткычларына
каршы кулланыла торган төрле
фторлы кушылмалар җитеште¬
рүдә
3. Криолит Na3AlF6 табу өчен
4. Фторид (плавик) кислотасын табу
өчен
5. Суыту машиналарында кулланыла
торган дифтордихлорметан CF2Cl2
(фреон) табу өчен
1. Органик кушылмаларны хлорлау
өчен (пластмасса, буягыч матдәләр,
медикаментлар табуда)
2. Тукымалар, кәгазьләр агарту өчен
3. Эчәргә яраклы суны зарарсызлан-
дыру өчен
4. Хлороводород синтезлау өчен
5. Химия лабораторияләрендә оксид¬
лаштыргыч
127
§ 31. Неметалларның оксидлары һәм кислородлы
кислоталар
Неметалларның оксидлары. Белгәнегезчә, периодларда сулдан уңга таба
югары оксидларның (ягъни составына әлеге төркемнең югары оксидлашу
дәрәҗәсенә ия элементы кергән оксидларның) үзлекләре акрынлап нигез
үзлекләреннән кислота үзлекләренә үзгәрәләр.
Мисалга 3 нче период элементлары оксидларының үзлекләре натрийдан
Na хлорга Cl таба үзгәрүен тикшерик:
Na2O —» MgO > Al2O3 * SiO2 * P2O5 * SO3 * Cl2O7
Натрий оксиды Na2O һәм магний оксиды MgO — типик нигез оксидлары,
аларга нигезләр (NaOH һәм Mg(OH)2) туры килә. Алюминий оксиды Al2O3
амфотер үзлекләргә ия. Кремний(ГУ) оксидына SiO2 бик көчсез кислота
туры килә, аның гадиләштерелгән формуласы H2SiO3. P2O5, SO3 һәм Cl2O7
оксидларының кислота үзлекләре көчәя бара. Күкерт(Ү1) оксидына SO3
сульфат кислотасы H2SO4 туры килә, ул — көчле кислота. Хлор(УП) окси¬
дына Cl2O7 иң көчле кислоталарның берсе — перхлорат кислотасы HClO4
туры килә.
Ни өчен Na2O > MgO —> Al2O3 * SiO2 ♦ P2O5 * SO3 * Cl2O7
рәтендә оксидларның кислота үзлекләре көчәя? Бу сорауга җавап бирү
өчен, әлеге оксидларга туры килгән гидроксидларның һәм кислоталарның
диссоциациясен тикшерик.
Натрий оксиды Na2O су белән тәэсир итешкәндә, көчле нигез — натрий
гидроксиды NaOH хасил була. Судагы эремәдә һәм эретелмә хәлендә натрий
ионнары белән гидроксид-ионнар арасындагы бәйләнеш өзелә һәм натрий
гидроксиды көчле нигез буларак диссоциацияләшә:
NaOH = Na+ + 0Н~
Магний гидроксиды Mg(OH)2 — көчсезрәк нигез. Бу шуның белән
аңлатыла: магний ионы натрий ионы белән чагыштырганда зуррак уңай
корылмага һәм кечерәк радиуска ия, шунлыктан магний ионнары белән
гидроксид-ионнар арасындагы бәйләнеш ныграк була һәм нигез тибында
диссоциация авырлаша.
Cl2O7 оксидына бик көчле перхлорат кислотасы HClO4 туры килә. Тик¬
шерелә торган рәттә хлор иң зур уңай корылмалы һәм ионы иң кечкенә
СЕЗ
БЕЛӘСЕЗМЕ?
Селенның аз гына микъдарда кеше һәм хайваннар өчен
кирәк булуы 1957 елда ачыклана, организмда аның җит¬
мәве бавыр һәм мускулатура авыруларына китерә.
Катышмалардан чистартылган кремний кристалы диэлект¬
рик (ярымүткәргеч) хезмәтен үти.
128
радиуслы булуы белән характерлана. Шуңа күрә перхлорат кислотасы
молекуласында кислород һәм хлор арасында бәйләнеш ныгый, ә кислород
һәм водород арасындагы бәйләнеш йомшый. Шуның нәтиҗәсендә бу
кушылма эремәдә көчле кислота буларак диссоциацияләшә:
HCio4 = н+ + Cio4
Димәк, периодларда сулдан уңга элементларның югары оксидларының
кислота үзлекләре көчәю акрынлап уңай төш корылмалары зураю һәм ион
радиуслары кечерәю белән аңлатыла.
Төркемнәрдә өстән аска таба югары оксидларның кислота үзлекләре
кими бара. Бу турыда әлеге оксидларга туры килгән кислоталарның
үзлекләре буенча фикер йөртергә мөмкин. Мисалга VA- һәм VIA-төркемнәр
элементлары барлыкка китергән кислота оксидларының һәм аларга туры
килгән кислоталарның үзлекләре акрынлап үзгәрүен карагыз (20 нче һәм
21 нче таблицалар).
Төп төркемчәләрдә өстән аска таба неметалларның югары оксидла¬
рының кислота үзлекләре кими бара.
Әйтик, мәсәлән, VA-төркемдә a30T(V) оксидының кислота үзлекләре (иң
көчле кислоталарның берсе булган нитрат кислотасын HNO3 хасил итә),
φοοφορ(ν) оксидыныкына P2O5 караганда көчлерәк. Бу — фосфорның
атом радиусы азот атомыныкына караганда зуррак булуы белән аңлатыла.
Шуңа күрә уңай корылган фосфор ионнарының кислород һәм водород
ионнарына тәэсире, зурлыгы ягыннан шактый кечерәк, уңай корылган азот
ионнарының шундый ук тәэсиренә караганда көчсезрәк.
Кабатлаганда сезгә мөстәкыйль эшне җиңеләйтү өчен, кислота оксидла¬
рының химик үзлекләре 22 нче таблицада бирелде.
Тоз хасил итми торган (битараф) оксидлардан сезгә азот(П) оксиды NO
һәм углерод(П) оксиды CO таныш. Аларны кислота оксидлары дип тә, нигез
оксидлары дип тә булмый. Аларның характерлы химик үзлекләре булып
оксидлашырга һәм кислота оксидларына әверелергә сәләтле булулары исәп-
+2 O +4
2Ν0 + O2 = 2ΝΟ2
+2 O
2С0 + O2
t +4
- 2СО2
СЕЗ
БЕЛӘСЕЗМЕ?
Перхлорат кислотасы HCIO4 — иң көчле кислота. Аңа суны
аерып алучы матдәләр белән тәэсир иткәндә, xnop(VII)
оксиды CI2O7 хасил була:
PoOc
2НСЮ4 CI2O7 + H2O
129
Кислородлы кислоталар. Кислородлы кислоталарның кайберләренә
чагыштырма характеристика 20 нче һәм 21 нче таблицаларда бирелгән.
Сульфат һәм нитрат кислоталары иң әһәмиятлеләрдән санала. Аларның
оксидлаштыру үзлекләре белән тулырак танышырбыз.
20 нче таблица. Кислород төркемчәсе элементларының кислота
оксидларына һәм аларга туры килгән кислоталарга чагыштырма
характеристика
Элемент¬
ның химик
билгесе
Гади матдәлә¬
ренең физик
үзлекләре
Кислород белән кушылмалары
Химик
формуласы
Үзлекләре
O
S
Se
Te
O2 — төссез газ.
Сары төстәге
кристаллик
матдә. Электр
тогын үткәрми.
Соры төстәге
кристаллик
матдә. Электр
тогын начар
үткәрә (ярым¬
үткәргеч).
Көмешсыман-
ак төстәге ме¬
таллик ялтыра¬
выклы крис¬
таллик матдә.
Электр тогын
селеннан яхшы¬
рак үткәрә.
SO2
H2SO3
SO3
H2SO4
SeO2
H2SeO3
SeO3
H2SeO4
TeO2
H2TeO3
TeO3
H2TeO4 X
X 2Н2О
(H6TeO6)
Төссез газ. Cy белән реакциягә Я
кергәндә, сульфит кислотасын ®
(уртача көчлелектәге) хасил итә. §
P
к!
Төссез очучан сыклык. Cy белән ре- §
акциягә кергәндә, сульфат кисло- я
тасын (көчле кислота) хасил итә. «
Ό
Ф
Кристаллик матдә. Cy белән реак- я
циягә кергәндә, селенит кислота- g
сын (сульфит кислотасы белән S
охшаш, ләкин аннан көчсезрәк),,
хасил итә.
Кристаллик матдә. Cy белән реак¬
циягә кергәндә, селенат кислотасын
(сульфат кислотасы белән охшаш, лә¬
кин аннан көчсезрәк) хасил итә.
Кристаллик матдә. Cy белән реак¬
циягә кергәндә, теллурит кислота¬
сын (H2SeO3 кә караганда көчсез¬
рәк) хасил итә.
Кристаллик матдә. Cy белән югары
температурада реакциягә керә, бу
вакытта теллурат кислотасы (бик
көчсез) хасил була.
130
21 нче таблица. Азот төркемчәсе элементларының
югары оксидларына һәм аларга туры килгән кислоталарга
чагыштырма характеристика
Элемент¬
ның
химик
билгесе
Гади матдәләренең
физик үзлекләре
Югары оксидлашу дәрәҗәле кислородлы
кушылмалары
Химик
формуласы
Үзлекләре
N
N2 — төссез газ, суда
начар эри. Кайнау тем¬
пературасы 196 0C
N2O5
HNO3
Төссез кристаллик матдә. Cy бе¬
лән реакциягә кергәндә нитрат
кислотасын хасил итә.
P
Берничә аллотропии
төре бар. Иң әһәмият-
леләре:
1) ак фосфор — төс¬
сез каты матдә, пычак
белән кисеп була (су
астында);
2) кызыл фосфор —
порошоксыман матдә;
3) кара фосфор —
каты матдә, графитны
хәтерләтә.
P2O5
(P4O10)
HpO3
H3PO4
Ак төстәге порошоксыман гигро¬
скопик матдә. Cy белән реакциягә
кергәндә, гадәти температурада —
метафосфат кислотасын, ә җы¬
лытканда, ортофосфат кислота¬
сын (кислоталарның икесе дә
нитрат кислотасыннан көчсезрәк
һәм уртача көчлелектәге кисло¬
талар булып торалар) хасил итә.
As
Металлик ялтыравык¬
лы уалучан кристал¬
лик матдә
As2O5
H3AsO4
Ак төстәге пыяласыман матдә,
һавада таралып китә. Cy белән
реакциягә кергәндә, арсенат кис¬
лотасын (H3PO4 тән көчсезрәк)
хасил итә.
Sb
Металлик ялтыравык¬
лы уалучан кристал¬
лик матдә
Sb2O5
H(Sb(OH)6)
Саргылт порошок. Тозларының
составына караганда бу оксидка
бер нигезле көчсез стибат кисло¬
тасы туры килә. Аның тозлары —
KSb(OH)6 һ. б. билгеле.
Bi
Кызгылт-ак төстәге
уалучан кристаллик
матдә
Hi3O3
HBiO3
Саф хәлендә табылмаган. Тозла¬
рының составына караганда (нат¬
рий висмутаты NaBiO3 һ.б.) бу
оксидка тотрыксыз һәм көчсез
висмутат кислотасы туры килә.
131
22 нче таблица. Кислота оксидларының химик үзлекләре
Кислота оксидларының
химик үзлекләре
Мисаллар
Кислота оксидлары реагирлашалар:
1) нигезләр белән
2) нигез оксидлары белән
3) су белән (күпчелек кислота оксидла¬
ры)
4) кайбер тозлар белән (азрак очучан кис¬
лота оксидлары тозлардан ныграк очучан
кислота оксидларын этеп чыгара)
Ca(OH)2 + CO2 = CaCO31 + H2O
2NaOH + SO2 = Na2SO3 + H2O
CaO + SiO2 = CaSiO3
Li2O + N2O5 = 2LiNO3
ЗН9О + P9O5 = 2Н,РО4
H2O + P2O5 = 2НРО3
H2O + SO2 <■ ■ * H2SO3
H2O + SO3 = H2SO4
ί
CaCO3 + SiO2 = CaSiO3 + CO2T
Ca3(PO4)2 + 3SiO2 = SCaSiO3 + P2O5
Сульфат кислотасы. Сыегайтылган сульфат кислотасының электрохи¬
мик көчәнешләр рәтендә водородка кадәр урнашкан металлар белән реак¬
циягә керүен сез инде беләсез (9 нчы сыйныф). Бу реакцияләрдә водород
ионнары — оксидлаштыргычлар, мәсәлән:
Zn + H2SO4 = ZnSO4 + H2T
Zn + 2Н+ + SO4- = Zn2+ + SO2" + H2T
Γ~2β:·3
Zn + 2Н+ = Zn2+ + H2T
Куертылган сульфат кислотасы металлар белән тәэсир итешкәндә,
оксидлаштыргыч булып оксидлашу дәрәҗәсе +6 булган күкерт тора.
Җылытканда, куертылган сульфат кислотасы металлар белән, гадәттә,
SO2 гә кадәр (Au, Pt ны исәпләмәгәндә), кайбер очракларда (металлның
активлыгына бәйле) S ка һәм хәтта H2S ка кадәр кайтарыла:
Cu + 2H2S O4 = CuSO4 + SO2T + 2Н2О
O +2
Cu- 2е~ >Cu 1
+6 +4
S + 2е"—>S 1
O +6/+2 O ,
3Zn + 4H2SO4 = SZnSO4 + SI + 4H2O
О +2
Zn - 2е > Zn 3
+6 о
S + бе" —* S 1
132
Pyc химик-технологы. Төп фәнни хезмәтләре
гамәли химия һәм химик технологиягә ба¬
гышланган. Аммиакны платина катализатор
катнашында оксидлаштырып, нитрат кисло¬
тасы табу ысулын эшли (1915), Макеевкада
тәҗрибә-сынау җайланмасын төзетә.
Аның проекты буенча 1917 елда Юзовкада
(Донецк) нитрат кислотасы һәм аммоний
нитраты җитештерү заводы эшли башлый.
Андреев
Иван
Иванович
(1880-1919)
Тимер, алюминий һәм хромны куертылган сульфат кислотасы пассив-
лаштыра, ягъни реакция бармый. Шуңа күрә сусызландырылган сульфат
кислотасын тимер яки алюминий сыемнарда сакларга һәм корыч цистер¬
наларда күчереп йөртергә мөмкин. Якынча 70% лы кайнар сульфат кисло¬
тасы белән тимер реакциягә керә:
0 +6 у +3 +4
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2t + 6Н2О
о +3
Fe - Зе ■ * Fe 2
+6 +4
S + 2е >S 3
Кайбер неметалларны куертылган сульфат кислотасы белән җылытканда
да, оксидлашу-кайтарылу процесслары бара:
S + 2H2SO4 = 3SO2t+ 2Н2О
0 +6 +4 +4
C + 2H2SO4 = 2SO2T+ CO2T + 2Н2О
Нитрат кислотасы. Нитрат кислотасының специфик үзлекләре неор-
ганик химия курсында тикшерелде. Хәзер инде нитрат кислотасының
оксидлаштыру үзлекләре белән тулырак танышырбыз. Шундый сорау
туарга мөмкин: нитрат кислотасының металлар белән тәэсир итешүенең
характеры нәрсә белән аңлатыла, ягъни ни өчен бу реакцияләрдә водород
урынына күбрәк төрле азот оксидлары, хәтта азот һәм аммиак аерылып
чыга? (Сыегайтылган нитрат кислотасының судагы эремәләренә активрак
металлар тәэсир иткәндә, өлешчә водород аерылып чыга.) Болар барысы да
СЕЗ
БЕЛӘСЕЗМЕ?
Полифосфат кислотасы ортофосфат H3PO4, дифосфат
H4P2O7, трифосфат H5P3O10 һәм тетрафосфат H6P4O13
кислоталарының катнашмасы булып тора. Полифосфат
кислотасын куертылган минераль ашламалар җитештерү
өчен кулланалар. Аның натрийлы тозын синтетик юу мат¬
дәләре җитештерү өчен файдаланалар.
133
+5 оксидлашу дәрәҗәсендә азот атомының көчле оксидлаштыру үзлекләренә
ия булуы белән аңлатыла: азот атомы, металл атомнарын оксидлаштырып,
үзенең +5 оксидлашу дәрәҗәсен +4, +2, +1 һәм хәтта 0 һәм -3 кә кадәр
үзгәртә. Мисалларда тикшерик.
1. Нитрат кислотасы (куертылган) металлар белән тәэсир итешә (металл¬
ның активлыгына бәйсез рәвештә). Бу вакытта тиешле нитратлар барлыкка
килә һәм азот(1Ү) оксиды аерылып чыга:
0 +5 +2 +4
Mg + 4HNO3 = Mg(NO3)2 + 2NO2t + H2O
(куерт.)
о +2
Mg - 2е —»Mg 1
+5 +4
N+Ie'—»N 2
Hg + 4HNO3 = Hg(NO3)2 + 2NO2t + 2H2O
(куерт.)
о +2
Hg - 2е“—»Hg 1
+5 +4
N + е~—>N 2
2. Нитрат кислотасы (сыегайтылган) металлар белән сыегайтылу дәрә¬
җәсенә бәйле рәвештә төрлечә тәэсир итешә:
O +5 +2 +2
3Mg + 8HNO3 = SMg(NO3)2 + 2N0T + 4Н2О
(30% лы)
O +2
Mg - 2е —*Mg 3
+5 +2
N + Зе~—>N 2
O +5 +2 +1
4Mg + IOHNO3 = 4Mg(NO3)2 + N2Ot+ 5Н2О
(якынча 20% лы)
о +2
Mg - 2е > Mg 4
+5 +1
2N + 8е~ —* 2N 1
0+5+2 O
5Mg + 12HNO3 = SMg(NO3)2 + N2T+ 6Н2О
(якынча 10% лы)
о +2 *
Mg - 2е > Mg 5
+5 O
2N + IOe' *N2 1
134
СЕЗ
БЕЛӘСЕЗМЕ?
Селитрадан нитрат кислотасының табылуы турында бе¬
ренче язма Россиядә Петр I тарафыннан ясала. Инде
шул вакытларда ук нитрат кислотасы тукымалар тукуда,
шифаханәләр эшендә, шулай ук алтын һәм көмешне аеру
өчен кулланыла.
0 +5 +2 -з
4Mg + IOHNO3 = 4Mg(NO3)2 + NH4 NO3 + ЗН2О
(~ 2—3 % лы)
0 +2
Mg - 2е >Mg 4
+5 -3
N + 8е~ * N 1
Сорауларга җавап бирегез һәм 5—10, 13 нче (б, в) күнегүләрне үтәгез. 2 нче
мәсьәләне чишегез (138 нче бит).
§ 32. Неметалларның водородлы кушылмалары
Водородлы кушылмаларның гомуми формулалары 23 нче таблицада
китерелгән.
23 нче таблица. Водородлы кушылмаларның (гидридларның)
гомуми формулалары
Водородлы кушылмаларның гомуми формулалары
IA
IIA
IIIA
IVA
VA
VIA
VIIA
+1-1
RH
+2-1
RH2
+3-1
RH3
-4+1
RH4
-3+1
RH3
+1 -2
H2R
+1-1
HR
Очучан булмаган водородлы кушылмалар
Очучан водородлы кушылмалар
Металлар белән водород (кайбер очракларны исәпкә алмаганда) очучан
булмаган кушылмалар хасил итә. Болар —молекуляр булмаган төзелешле
каты матдәләр. Шуңа күрә аларның эретелү температуралары чагыш¬
тырмача югары. Бу матдәләр суда җиңел таркалалар:
NaH + H2O = NaOH + H2T
CaH2 + 2Н2О = Ca(OH)2 + 2Н2Т
Неметаллар белән водород молекуляр төзелешле очучан матдәләр хасил
итә. Гадәти шартларда алар — газлар яки очучан сыеклыклар.
Периодларда сулдан уңга таба неметалларның очучан водородлы ку¬
шылмаларының үзлекләре ничек үзгәрүен күзәтик. Мисал өчен, 2 нче пе-
-4 -3 -2 -1
риод элементларының водородлы кушылмалары: CH45NH3, H2O, HF ның
судагы эремәләренең үзлекләрен тикшерик.
Метан (CH4) суда эреми.
Аммиак (NH3) суда эри һәм аммоний ионнары, гидроксид-ионнар хасил
ИТӘ: NH3 + H2O ?=* NH4 + OH-
135
Аммиак молекуласында азот атомының бүленмәгән пар электроны, ә
су молекуласында водород атомының буш орбитале булганлыктан, өстәмә
ковалент бәйләнеш (донорлы-акцепторлы механизм буенча) ясала. Бу
процессны схемада болай күрсәтергә мөмкин:
I ?. Н I+
H Ό: H + H :N: H ?=* H :N: H + [:О: н]
H
Cy (H2O) — бик көчсез электролит:
H2O «=* H+ + ОН
Суның диссоциациясе (таркалуы) тигезләмәсеннән күренгәнчә, H+ ион¬
нары һәм OH- ионнарының концентрациясе бер үк төрле ([H+]) — [ОН-]).
Суны амфотер кушылма итеп карарга мөмкин.
Фтороводород (HF) суда чикләнмәгән күләмдә эри. Фтороводородның
судагы эремәсе (фторид кислотасы) кислота үзлекләрен күрсәтә. Фто¬
рид кислотасы эремәдә димерлар — H2F2 молекулалары рәвешендә була,
шуңа күрә ул урта тозларны да (фторидларны), әче тозларны да (гидро-
фторидларны) барлыкка китерә:
H2F2 H++HF2
Димәк, периодларда сулдан уңга неметалларның очучан водородлы
кушылмаларының судагы эремәләрендә кислота үзлекләре көчәя.
Хәзер ни өчен фторның водородлы кушылмасы — фтороводород HF —
судагы эремәсендә кислота үзлеген күрсәтүен, ләкин хлороводород кисло¬
тасына караганда көчсезрәк булуын карарбыз. Бу фтор ионнарының
радиусы хлор ионнары радиусыннан шактый кечкенәрәк булуы белән
аңлатыла. Шуңа күрә фтор ионнары водород ионнарын, хлор ионнарына
караганда, үзенә көчлерәк тарта. Шуңа бәйле рәвештә фтороводород кис¬
лотасының диссоциация дәрәҗәсе хлорид кислотасыныкы белән чагыш¬
тырганда шактый түбән, ягъни фтороводород кислотасы хлорид кис¬
лотасыннан көчсезрәк.
СЕЗ
БЕЛӘСЕЗМЕ?
Сыек аммиактагы азот атомы һәрвакыт күчеп тора һәм
алмашлап нигез яссылыгының я өстендә, я астында
булып чыга. Төгәл билгеле бер ешлыктагы электромагнит
нурланыш шушы күренеш (инверсия) белән бәйләнгән.
Моңа нигезләнеп, Н.Г. Басов һәм А. М. Прохоров (1955)
мазер дип аталган яңа төр генератор уйлап табалар.
Аммиаклы мазер («мәҗбүри нурланыш нәтиҗәсендә мик-
родулкыннарның көчәюе» мәгънәсендәге термин) Җир
тәүлегенең озынлыгы ел саен уртача 0,00043 с ка арта
баруын ачыкларга мөмкинлек бирә.
136
Химик-органик, академик. Төп фәнни хезмәт¬
ләре фтор кушылмаларына багышлана. Фос-
форорганик, гетероциклик һәм кайбер башка
кушылмаларны өйрәнә.
Кнунянц
Иван
Людвигович
(1906-1990)
Китерелгән мисаллардан түбәндәге гомуми нәтиҗәләрне ясарга мөм¬
кин:
1. Периодларда сулдан уңга таба элементлар атомнарының төш
корылмасы арта һәм радиусы кечерәя. Шул сәбәпле элементларның очучан
водородлы кушылмаларының судагы эремәләрендә кислота үзлекләре
көчәя.
2. Төркемнәрдә өстән аска таба тискәре корылган анионнарның (мәсәлән,
F-, СГ, Br-, Г) уңай корылган водород ионнарын H+ тарту көче кими бара.
Шул сәбәпле водород ионнарының H+ аерылып чыгу процессы ансатлаша
һәм водородлы кушылмаларның кислота үзлекләре көчәя.
3. Неметалларның судагы эремәләрдә кислота үзлекләрен күрсәтүче
водородлы кушылмалары селтеләр белән реагирлаша. Неметалларның
судагы эремәләрдә нигез үзлекләрен күрсәтүче водородлы кушылмалары
исә кислоталар белән реагирлаша.
4. Төркемнәрдә өстән аска таба неметалларның водородлы кушыл¬
маларының кайтару активлыгы арта. Мәсәлән, водородлы кушылмадагы
HF фторны химик ысул белән оксидлаштырып булмый, ә хлорны водородлы
кушылмадан HCl төрле оксидлаштыргычлар белән оксидлаштырырга
мөмкин. Бу төркемнәрдә өстән аска таба атом радиусларының зурлыгы
кинәт артуы, шул сәбәпле электроннарны бирүнең ансатлашуы белән
аңлатыла.
Сорауларга җавап бирегез һәм 11—12 нче күнегүләрне үтәгез (138 нче бит). 3 нче
мәсьәләне чишегез (138 нче бит).
СЕЗ
БЕЛӘСЕЗМЕ?
Фосфин PH3 составында һавада кабынучан дифосфин
P2H4 катышмасы була. Фосфиннар катнашмасы кайчак
мәет таркалганда кабердән чыга. Каберлектә утлар җе¬
мелдәве PH3 нең үзеннән-үзе кабынып китүенә бәйле.
Андый утлар элек төрле ырымнарга ышанучыларга курку
салган.
1771 елда швед химигы К. Шееле кислота таба һәм аны
плавик кислотасы дип атый. А. Лавуазье аны флуорит кис¬
лотасы дип атый. 1816 елда «флуор» атамасы «фтор»га
алмашына (грекча «фторос» — һәлакәт, үлем).
137
·>
1. Металлар һәм неметалларның атом¬
нары һәм гади матдәләренең төзелеше
нәрсә белән аерыла?
2. Химик элементның тышкы элект¬
рон катлавының формуласы 4з24р3. Ачык¬
лагыз: а) бу нинди химик элемент; б) аның
атом төшенең корылмасы, төшендәге
протоннар һәм нейтроннар саны; в) ул S-,
р-, d- яки f-элементмы; әгәр булса, аның
югары оксидының һәм очучан водородлы
кушылмасының формуласын төзегез.
3. Периодик системага нигезләнеп,
неметалларның оксидлашу-кайтарылу үз¬
лекләре үзгәрү закончалыкларын ачык¬
лагыз.
4. 16—19 нчы таблицалардан файдала¬
нып, иң әһәмиятле неметалларның химик
үзлекләрен һәм аларның кулланылышын
тасвирлагыз.
5. Периодларда һәм төркемнәрдә кис¬
лота оксидларының үзлекләре үзгәрүдә
нинди закончалыклар күзәтелә?
6. Кислота оксидларының формула¬
лары бирелгән: а) N2O5, CO2, Cl2O7 һәм
SO3; б) P2O5, As2O5, N2O5 һәм Sb2O5. Бу
формулаларны кислота үзлекләре арту
тәртибендә урнаштырыгыз.
7. 22 нче таблицадан (132 нче бит)
файдаланып, 1,2 нче һәм 3 нче пунктларга
өстәп, башка кислота оксидлары катнаш¬
кан икешәр-өчәр реакция тигезләмәсе
языгыз.
8. Сульфат һәм нитрат кислоталарының
охшаш һәм аерылып торган химик үзлек¬
ләрен күрсәтегез.
9. Куертылган сульфат кислотасы ти¬
мер белән реакциягә кергәндә, күкертнең
оксидлашу дәрәҗәсе +6 дан алып +4 кә
кадәр үзгәрә. Бу реакциянең тигезләмәсен
төзегез.
• 1. 12,8 г бакырга, җылытканда, кирә¬
геннән артык алынган куертылган суль¬
фат кислотасы белән тәэсир иткәннәр.
Аерылып чыккан газның массасын, кү¬
ләмен (н.ш.) һәм микъдарын исәпләп та¬
быгыз.
2. 0,9 моль кальций карбонатына 540 мл
8% лы хлорид кислотасы (р = 1,04 г/см3)
10. Магний куертылган нитрат кис¬
лотасы белән реакциягә кергәндә оксид¬
лаштыргыч: 1) Mg2+ 2) H+ 3) Mg0 4) NO3
11. Ни өчен очучан булмаган водород¬
лы кушылмалар очучан водородлы ку¬
шылмалардан бик нык аерылалар?
12. Периодларда һәм төркемнәрдә очу¬
чан водородлы кушылмаларның үзлекләре
үзгәрүдә нинди закончалыклар күзәтелә?
Аларның асылын тасвирлагыз.
13. Түбәндәге әверелешләрне тормыш¬
ка ашырырга мөмкинлек бирүче реак¬
цияләрнең тигезләмәләрен языгыз:
а)
Ca(ClO)2
KClO3 —*
, HCl —► CaCl2 —· AgCl
—-С12<
2^FeCl3-Fe(OH)3
—* H2SO4—* Fe2(SO4)3—» BaSO4
в)
Ν.
NO
NO2
,NO
HNO3^ kNH4NO3
NH3
(Узарга мөмкин булган реакцияләрнең
тулы яки кыскартылган ионлы тигезлә¬
мәләрен языгыз. Ике оксидлашу-кайтары¬
лу реакциясе тигезләмәсен сайлап, алар-
ны электроннар балансы методы белән
тигезләгез.)
белән тәэсир иткәннәр. Нинди газ һәм
күпме күләмдә аерылып чыгар?
3. Әгәр тозның чыгышы теоретик як¬
тан исәпләнгәннең 80% ын тәшкил ит¬
сә, 11,2 г кальций оксиды белән 25,6 г
нитрат кислотасы эремәсе тәэсир итешүе
нәтиҗәсендә хасил булган тозның масса¬
сын исәпләп чыгарыгыз.
138
§ 33. Неорганик һәм органик матдәләр арасында
генетик бәйләнеш
Неорганик һәм органик матдәләр арасында кискен чик бар дигән
фикернең XIX гасырга кадәр өстенлек итүе сезгә инде билгеле. Ләкин
органик матдәләрнең беренче синтезлары ук бу карашларның нигезсез
икәнлеген күрсәтә. Әйтик, немец химигы Ф. Вёлер 1824 елда неорганик
матдәләрдән органик матдә, атап әйткәндә, кайбер үсемлекләрдә, мәсәлән,
кузгалакта була торган кузгалак кислотасын табу мөмкинлеген исбат итә.
Лаборатория шартларында неорганик матдәләрдән кузгалак кислотасы
түбәндәге ысул белән табыла. Электр дугасында азот белән углерод тәэсир
итешкәндә, дициан C2N2 хасил була:
C=M
2С + N2 ^-20-00 °С> I
C=N
Дициан — үзенчәлекле исле төссез агулы газ. Ул гидролизлашканда,
кузгалак кислотасының аммоний тозы хасил була:
C=N COONH4
I + 4Н2О = I
C^N COONH4
By тозга минераль кислота белән тәэсир иткәндә, кузгалак кислотасы
хасил була:
COONH4 COOH
I +H2SO4 = I +(NH4)2SO4
COONH4 COOH
Неорганик матдәләр белән органик матдәләр арасында кискен чик бул¬
мавын исбатлаучы, икенче бер тарихи синтез булып мочевинаны синтезлау
тора. Бу шулай ук 1828 елда Ф. Вёлер тарафыннан эшләнә. Ул чакта неор¬
ганик матдә — аммоний цианаты NH4CNO билгеле була. Ул түбәндәге схема
буенча синтезлана:
2С ——C2N2 —?2 > HCN ——■> NH4CN -θ2· ■■■> NH4CNO
Дициан C2N2, галогеннар кебек үк, водород белән реагирлаша:
C2N2 + H2 = 2HCN
синиль
кислотасы
Синиль кислотасының тозлары — цианидлар KCN, NaCN — һава
составындагы кислород белән оксидлашырга һәм цианатларга — KCNO,
NaCNO, NH4CNO га әверелергә сәләтле. Аммоний цианаты NH4CNO —
неорганик матдә. Аммоний цианатының судагы эремәсен җылытып,
139
Ф. Вёлер органик матдә — мочевинаны таба. Ә моңа кадәр мочевина тере
организмнарда гына барлыкка килә дип уйлаганнар.
Аммоний цианатын җылытканда, атомнарның башкача төркемләшүе
турында соңрак беленә:
NH4-O-C=N
аммоний цианаты
N-С—N:
мочевина (карбамид)
Бу синтезлар галимнәргә органик матдәләр неорганик матдәләрдән хасил
була ала дигән мөһим нәтиҗә ясарга мөмкинлек бирә.
Болар беренче синтезлар була. Алардан соң неорганик һәм органик
матдәләр арасында бәйләнеш булуын раслаучы тагын башка күп кенә
синтезлар үткәрелә.
Түбәндә органик һәм неорганик матдәләр арасындагы генетик бәйләнешне
чагылдыручы, сезгә билгеле әверелешләрнең кайбер схемалары бирелә:
а) C * CH4 —> C2H2 * CH2=CH-C=CH —>
♦ CH2=CH—C=CH2 ♦ хлоропрен каучук
Cl
б) C ♦ C2H2 * C2H4 —* HO-CH2-CH2-OH *
—* ноос—соон
кузгалак кислотасы
в) CaCO3 * CaO —» CaC2 * C2H2 —>
> CH3-COOH —> H2N-CH2-COOH
г) CaCO3 * CaC2 > C2H2 —> C6H6 » CO2 —* CO(NH2)2
x4C6H5NH2
Д) C >
CO
/ о
CH3-OH —> H-C C
H
CH3COOH
CH3-C C
O-CH3
Күнегүне үтәгез (143 нче бит).
-CH2-C
HC
• CH
140
§ 34. Химия — көнкүрештә
Шулай итеп, сез мәктәптә химия курсын өйрәнеп чыктыгыз. Әйтик,
сез химик булырга җыенмыйсыз. Ә бит хәтердә барыбер нәрсәдер калырга
тиештер. Әлбәттә, сез дәрестә үзегез башкарган яки укытучыгыз күрсәткән
көчле тәэсир ясый торган тәҗрибәләр онытылмый. Ләкин иң мөһиме —
дәрестә белгәнне көндәлек тормышта куллана алу.
Сез һәр көнне юынасыз, ризык әзерлисез, кер юасыз, өйдә җыештырасыз.
Әгәр авырып китсәгез, дару эчәсез. Кагыйдә буларак, тормыш-көнкүреш
өчен бөтен әйберне диярлек шәһәр кешесе кибеттә сатып ала. Теләсә
нинди товарның этикеткасы була. Анда нәрсә язылганын игътибар белән
укып чыгарга онытмагыз! Аңлы кулланучылар буларак, сез нәрсә сатып
алуыгызны һәм аның ни дәрәҗәдә куркынычсыз булуын белергә тиеш.
Туклану продуктлары. Әгәр сез туклану продуктын сайлыйсыз икән,
иң элек аның яраклылык срогына игътибар итегез. Этикеткада шулай ук,
һичшиксез, бу продуктны әзерләгәндә тотылган ингредиентлар күрсәтелгән
булырга тиеш. Аның белән танышыгыз, сәламәтлегегез сезгә андый продукт¬
ларны куллану мөмкинлеге бирәме, шуны ачыклагыз. Мәсәлән, арахиска
(җир чикләвеге) яки йомырка аксымына еш кына аллергия күзәтелә, ә
шикәр авыруы (диабет) белән авырган кешегә шикәрсез (аны, мәсәлән,
фруктоза белән алмаштыралар) продукттан файдаланырга киңәш ителә. Әгәр
сез сәламәт яшәү рәвешен яклыйсыз икән, гидрогенлаштырылган майлы
продуктларны кулланмаска тырышыгыз. Аларны үсемлек майларыннан,
шул исәптән көнбагыш яки соя майларыннан, югары температурада водород
кушып (өлешчә гидрогенлаштырып) ясыйлар. Гидрогенлаштыру үсемлек
маеның катылануына булышлык итә, бу маргарин кебек каты майларны
җитештерү өчен кирәк, өстәвенә майның саклану срогы озыная. Ләкин
гидрогенлаштырылган майлар, үзләренең табигый аналогларыннан аермалы
буларак, йөрәк-кан тамырлары системасы өчен куркынычлы.
Көнкүреш химиясе. Куркынычсызлык — көнкүреш химиясе товарларын
сатып алганда игътибар ителергә тиешле төп критерийларның берсе.
Көнкүреш химиясе матдәләре өйдә һәрвакыт була, шуның өчен аларның
балаларга да, өлкәннәргә дә зарарсыз булуы бик мөһим. Үзегез сайлап алган
матдәнең этикеткасына нәрсә язылганын, аның составы турында игътибар
белән укып чыгыгыз. Менә кайчан искә төшерергә кирәк химия дәресләрен.
Игътибар итегез: аны перчаткасыз файдаланырга ярыймы. Зур концентра¬
циядә кислоталы яки селтеле, хлор кушылмаларыннан (нат¬
рий гипохлориты), аммиактан (аммонийдан) торган чистарту
матдәләре бар: алар тирегә, күзнең лайлалы катлавына
эләксә пешерә, сулыш юлларын ялкынсындыра. Бу хлорлы
агарту матдәләренә дә кагыла. Андый матдәләрнең этикет¬
касында махсус кисәткеч тамга була, ул кисешкән ике сөякне
хәтерләтә (22 нче рәсем). Бу матдәләр сезнең киемегез өчен
дә куркынычлы! 22 нче рәсем
141
Көнкүреш химиясе матдәләрен яхшы ябыла торган савытларда һәм кеше
сирәгрәк керә торган бүлмәләрдә сакларга кирәк; порошокларга караганда
гель, сыек яки гранула хәлендәге матдәләр куллану яхшырак булып санала
(сулыш органнарына андый матдәләрнең йогынтысы азрак сизелә).
Бизәкләү материаллары. Йорт эчен төзәтү яки бизәкләү өчен кулланыла
торган матдәләрнең күбесе шулай ук тире һәм сулыш системасы өчен
куркынычлы. Болар — буяулар, җилем, лак, герметиклар һ. б. Мондый
матдәләр белән эш итү химик эксперимент үткәрү белән бер үк: перчатка,
күзлек, респиратор, саклагыч кием кияргә һәм куркынычсызлык техникасы
кагыйдәләрен үтәү таләп ителә. Бу матдәләрнең этикеткаларында шулай ук
кулланучыга киңәшләр, ягъни инструкция була, аны, һичшиксез, өйрәнү
сорала, һәм әлбәттә, гигиеник сертификаты булган һәм торак биналарда
кулланырга рөхсәт ителгән төзелеш һәм бизәкләү материалларын гына
файдаланырга ярый.
Фатирларда һәм офис биналарында еш кына винил обойлар файдалана¬
лар. Аларның өске катлавы поливинилхлорид (ПВХ) элпә белән капланган
була, һәм шуңа күрә алар шулай атала. Сыйфатлы винил обойлар утка,
суга чыдам, файдалану сроклары озак. Төргәктә, барлык тамгалардан тыш,
бу обойларның, һичшиксез, экологик куркынычсызлыгы, тамгасы булырга
тиеш, моның өчен һәр илнең үз тамгасы бар. Барлык винил обойларда да
экологик куркынычсызлык сертификаты булырга тиеш. Әгәр ул булмаса,
бу обойлар экологик куркынычсызлыкка кирәкле тестларны узмаган,
һәм алар кояш нурлары яктылыгында яки югары температурада зарарлы
матдәләр бүлеп чыгарырга мөмкин. Теләсә нинди очракта да, әгәр хәтта
винил обойлар куркынычсызлык стандартларына җавап бирсәләр дә, аларны
яхшы җилләтелә торган бүлмәләрдә генә ябыштырырга киңәш ителә.
Линолеум һәм төрле синтетик келәмнәр, түшәү материаллары агулы
ароматик углеводородлар чыганаклары булып торырга мөмкин.
Йорт җиһазлары (мебель). Өй эчендәге һаваның чисталыгы күбесенчә
йорт җиһазларының сыйфатына бәйле: мәсәлән, агач йомычкаларыннан
эшләнгән плиталар (ДСП дип йөртеләләр) феноллар һәм формальдегид
(кырмыска альдегиды, метаналь) бүлеп чыгара. Бу үзенчәлекле исле төссез
газ агач җилеме җитештерүдә мөһим компонет булып тора. Бөтендөнья
сәламәтлек саклау оешмасы формальдегидны канцероген (яман шешләргә
китерүче) матдә дип тапты. Ул шулай ук сулыш юлларын тынычсызлый,
астмага ук җиткергән аллергик реакцияләр, баш авыртулары, депрессия,
буын авыртулары, хроник талчыгучанлык китереп чыгарырга мөмкин. Фор¬
мальдегид җилемдә, политура, буяу, косметикада һәм көнкүреш химиясе
матдәләрендә бар. Әгәр сезнең өегездә ДСП дан җыелган мебель бар икән,
ә ремонт вакытында полимер материаллар һәм пластик түшәмнәр файда¬
лансагыз, бүлмәләрне ешрак җилләтегез! *
Дару препаратлары. Дару тартмасының тышкы ягына һәрвакыт табиб
рецептыннан башка файдаланырга яраклылыгы турында мәгълүмат языла, ә
эчендә инструкция кәгазе була, анда препаратның тәэсир итү механизмы, аны
142
куллану ысулы һәм дозасы, шулай кулланырга ярамый торган очраклары һәм
өстәмә тәэсире күрсәтелә. Инструкцияне игътибар белән укып чыгыгыз!
Хәзерге кешенең тормышы аның тау куышларында яки алачыкларда
яшәгән бабаларының яшәү рәвешен аз хәтерләтә. Чисталык стандартлары
да үзгәрде, һәм нәкъ менә химия казанышлары гына кешегә шушы яңа
стандартларга яраклашырга мөмкинлек бирә. Ул һәр көнне душта юына
һәм чиста кием кия, димәк, көн саен теш пастасыннан, сабын, шампунь,
душ өчен гель һәм юу порошогыннан файдалана. Бу матдәләр һәм көнкүреш
химиясенең башка матдәләре составына кергән ингредиентларның барысы
да биотаркалуга дучар ителми яки чистарту корылмаларының фильтр¬
ларында тоткарланып калмый. Мәсәлән, юу порошоклары составына кергән
фосфатлар агынты сулар белән сулыкларга эләгә һәм анда, ашлама ролен
уйнап, цианобактерияләрнең күпләп үрчүенә сәбәп була (суның «чәчәк
атуы»н китереп чыгара). Бу хәл сулыклардагы башка тереклекнең юкка
чыгуына китерә, чөнки суга цианобактерияләрнең тереклек эшчәнлеге
нәтиҗәсендә барлыкка килгән агулы продуктлар чыга.
Әйе, хәзерге йорт күп яктан химик лабораторияне хәтерләтә. Шулай
булгач, йортта үзеңне тоту кагыйдәләре химикның лабораториядәге кагый¬
дәләре белән охшаш булырга тиеш. Иң элек сезнең « лаборатория »гә яхшы
җилләткеч кирәк. Барлык «реактивлар» (дарулар һәм көнкүреш химиясе
матдәләре) махсус капларда һәм балаларның кулы җитмәслек урыннарда
сакланырга тиеш. Андый реактивларны кирәкле микъдарларда гына һәм
куркынычсызлык техникасын саклаган хәлдә генә файдаланырга кирәк.
Ә инде сезгә «лабораториягез» өчен яңа «реактивлар» кирәк булса, ярдәмгә
химиядән белемнәрегезне һәм сәламәт акылыгызны эшкә җигегез.
Органик һәм неорганик матдәләр ара- түбәндәге схема буенча реакцияләрнең
сындагы генетик бәйләнешне чагылдырган тигезләмәләрен төзегез:
a) Ca —» CaO —» CaCO3—» CaC2
I
CH4—^H-C = C-H—»СН3—СС^Н—* CH3-C^oh—* (CH3COO)2Mg
CH2==CH2 C6H6 — C6H5NO2 — C6H5NH2
C2H5OH HO-CH2-CHi-OH
HOOC- COOH —* HOOC-COONa
б) CH3-CH3—-х
I ^o
C2H5OH—.-CH3-CH2-C с н —>Ү—*со2—>Ca(OH)2 —^Ca(HCO3)2
в) C —» C2H2 —* C2H6 —* C6H14 —» циклогексан —» бензол
143
3 нче практик эш
Неорганик химиядән эксперименталь мәсьәләләр чишү
Практик эшкә әзерләнгәндә, 24 нче таблицадан файдаланыгыз.
1. Калий хлориды һәм тимер(Ш) сульфатыннан торган катнашма бирелгән.
Хлорид-ионнарны СГ һәм Fe3+ ионнарын билгеләү өчен, тәҗрибәләр ясагыз. Тиешле
реакцияләрнең тигезләмәләрен молекуляр, тулы һәм кыскартылган ионлы рәвештә
языгыз.
2. Бакыр(П) сульфаты кристаллогидраты, магний карбонаты, натрий гидроксиды,
тимер, хлорид кислотасы, тимер(Ш) хлориды бирелгән. Бу матдәләрне файдаланып,
а) тимер(Ш) оксиды; б) магний оксиды; в) бакыр; г) магний хлориды табыгыз. Үзегез
башкарган реакцияләрнең тигезләмәләрен молекуляр, тулы һәм кыскартылган ионлы
рәвештә төзегез.
3. Өч пробиркада, исемнәрен язмыйча, кристаллик матдәләр бирелгән: а) аммоний
сульфаты; б) бакыр(П) нитраты; в) тимер(Ш) хлориды. Тәҗрибә ярдәмендә һәр про¬
биркада нинди матдә булуын ачыклагыз. Тиешле реакцияләрнең тигезләмәләрен моле¬
куляр, тулы һәм кыскартылган ионлы рәвештә төзегез.
4. Пробиркаларда каты матдәләр бирелгән: а) натрий сульфаты, натрий сульфиды,
натрий сульфиты; б) калий карбонаты, калий сульфаты, аммоний хлориды; в) аммоний
сульфаты, алюминий сульфаты, калий нитраты. Кайсы пробиркада нинди матдә икәнен
ачыклагыз.
5. Түбәндәге әверелешләрне практик яктан тормышка ашырыгыз:
a) Fe —* FeCI2 » Fe(OH)2 » Fe(OH)3 * Fe2O3
, NaAIO2
б) Al > AI2(SO4)3 » AI(OH)3 ζ'
NafAI(OH)4J
в) Cu *■ CuSO4 > Cu(OH)2 *■ CuO *■ Cu
4 нче практик эш
Органик химиядән эксперименталь мәсьәләләр чишү
1. Биш пробиркада, исемнәрен язмыйча, түбәндәге матдәләр бирелгән:
Беренче вариант
а) этанол; б) серкә кислотасы; в) глюкоза; г) глицерин; д) этаналь.
Икенче вариант
а) серкә кислотасы; б) этаналь; в) глицерин; г) этанол; д) глюкоза.
Сезгә бирелгән һәр матдәне тәҗрибә ярдәмендә билгеләгез. Тиешле реакцияләрнең
тигезләмәләрен языгыз.
2. Түбәндәге әверелешләрне практик яктан тормышка ашырыгыз::
Беренче вариант
* C2H2Br,
a) CaC2 —* C2H2C"
^CO2
_>0
^CH3-CtT
б) C2H5OHC" н
^co2
144
Икенче вариант
^C2H4
a) C2H5OH
C2H4
—-CO2
—» CH2-CH2
I I
он он
б) C3H7-OH —► CH3-C C —- со2
37 3 xO-C3H7 2
5 нче практик эш
Практик исәпләү мәсьәләләрен чишү
Беренче вариант
1,5 г алюминий порошогы бирелгән. Тәҗрибә ярдәмендә алюминий сульфатын
табыгыз һәм аның практик чыгышын теоретик чыгышына карата процентларда
исәпләгез.
Икенче вариант
5 мл сульфат кислотасы эремәсе (р = 1,143 г/см3) бирелгән. Тәҗрибә ярдәмендә
натрий сульфатын табыгыз һәм аның практик чыгышын теоретик чыгышына карата
процентларда исәпләгез.
Өченче вариант
1. 3,25 г цинк бирелгән. Цинк хлоридын табыгыз һәм аның практик чыгышын
теоретик чыгышына карата процентларда исәпләгез.
2. 5 мл натрий гидроксиды эремәсе (р = 1,255 г/см3) бирелгән. Тәҗрибә ярдәмендә
натрий сульфатын табыгыз һәм аның практик чыгышын теоретик чыгышына карата
процентларда исәпләгез.
6 нчы практик эш
Газларны табу, җыю һәм танып белү. Практик эшкә әзерләнгәндә, кислородны,
водородны, углекислый газны, аммиакны, метанны, этиленны лабораториядә табу
ысулларын кабатлагыз.
Газларны ике ысул белән: һаваны этеп чыгару (23 нче рәсем, а—в) һәм суны этеп
чыгару (23 нче рәсем, г) юлы белән җыялар.
Газларны табу өчен, приборлар пробиркалардан гына түгел, ә башка савытлардан
да, мәсәлән бөкеле һәм газүткәргеч көпшәле йомры төпле колбалардан, Вюрц
колбаларыннан, газ җыю приборыннан торырга мөмкин.
Бирем: Газсыман матдә табыгыз һәм химик тәҗрибәләр белән аның составын һәм
үзлекләрен раслагыз.
Беренче вариант
1. Водород табу
Янучан матдәләр белән куркынычсыз эшләү кагыйдәләрен кабатлагыз. Химик
экспериментны үткәрү процессында бу кагыйдәләрне үтәгез.
1. Кислота һәм металлны реакциягә кертеп, водород табыгыз.
145
23 иче рәсем. Газлар табу һәм җыю өчен приборлар: а, б — каты матдәләрне кыздырып
газ табу өчен; б очрагында, реакция өчен алынган матдәләрне җылытканда, су хасил
була; в — каты матдә сыеклык белән тәэсир итешкәндә газ табу өчен; г — газны су
өстенә җыю өчен
2. Водородны һаваны этеп чыгару юлы белән яки су өстендә (үзегез сайлап) ике
пробиркага җыегыз. Газның чисталыгын тикшерегез.
3. Водородны бер пробиркадан икенчесенә бушатыгыз һәм икенче пробиркада газ
булуын раслагыз.
4. Приборның пробиркасын очы бер якка борылган 3—5 см озынлыктагы газүткәргеч
көпшәле бөке белән каплагыз. Водородны яндырып җибәрегез.
5. Практик эш нәтиҗәләрен тасвирлап языгыз.
2. Углекислый газ табу
Пыяла химик савытлар белән куркынычсыз эшләү кагыйдәләрен кабатлагыз.
Приборлар белән эшләгәндә, шулай ук эремәләр әзерләгәндә һәм җылытканда, бу
кагыйдәләрне төгәл үтәгез.
1. Yrnepofl(IV) оксидын мәрмәр белән хлорид кислотасы арасында алмашу реак¬
циясе үткәреп табыгыз.
2. Газны һаваны этеп чыгару юлы белән химик стаканга җыегыз һәм газ җыелуын
раслагыз.
3. Газны лакмус эремәсе аша уздырыгыз һәм углерод(1У) оксидының судагы эре¬
мәсе нинди тирәлек (әче, нейтраль яки селтеле) барлыкка китерүен тәҗрибә ясап
дәлилләгез.
4. Башта аз гына микъдарда углерод(1У) оксидын яңа әзерләнгән үтә күрен¬
мәле известьле су аша реакция билгеләре күренгәнчегә кадәр уздырыгыз. Аннары
146
бу эремәдән проба агызып алып, аның аша артыгы белән алынган углерод(1\/)
оксиды уздырыгыз. Табылган эремәдән дә проба агызып алыгыз һәм аны кай¬
натыгыз.
5. Практик эш нәтиҗәләрен тасвирлап языгыз.
3. Этилен табу
Куертылган кислоталар һәм тиз кабынучан матдәләр белән куркынычсыз эшләү
кагыйдәләрен кабатлагыз.
1. Этилен табу өчен башлангыч матдәләр — этанол белән куертылган сульфат
кислотасы катнашмасы. Газүткәргеч көпшәле бөке белән капланган пробиркада 2 см3
катнашманы «җиңелчә» утта җылытыгыз (пробирканы ялкын өстендә тотыгыз). Этиленны
су өстендә ике пробиркага җыегыз.
2. Этиленның бромлы су белән тәэсир итешүен тикшерегез.
3. Этиленның калий перманганаты (калий манганаты(\/11) эремәсе белән оксидлашу
мөмкинлеген тикшерегез.
4. Этиленның (пробиркада җыелганның) янучанлыгын тикшерегез.
5. Практик эш нәтиҗәләрен тасвирлап языгыз.
Икенче вариант
1. Кислород табу
Газлар табу өчен җылыткыч приборлар белән куркынычсыз эшләү кагыйдәләрен
кабатлагыз. Химик эксперимент үткәргәндә, бу кагыйдәләрне төгәл үтәгез.
1. Калий перманганатын таркатып, кислород табыгыз.
2. Кислородны су өстендә яки һаваны этеп чыгару юлы белән (үзегез сайлап) ике
пробиркага җыегыз.
3. Кислородның җыелуын раслагыз.
4. Күкертнең (яки күмер кисәгенең) һавада һәм кислородта ничек януын тәҗрибә
ясап тикшерегез.
5. Практик эш нәтиҗәләрен тасвирлап языгыз.
2. Аммиак табу
Селтеләр белән куркынычсыз эшләү кагыйдәләрен кабатлагыз. Химик эксперимент
үткәргәндә бу кагыйдәләрне төгәл үтәгез.
1. Аммиакны каты матдәләр — аммоний хлориды һәм кальций гидроксиды катнашма¬
сыннан алмашу реакциясе үткәреп табыгыз.
2. Җыелган газның аммиак булуын билгеләргә мөмкинлек бирүче физик үзлекләрен
тасвирлагыз.
3. Аммиакның суда ничек эрүен һәм аның судагы эремәсенең тирәлеген (әче,
нейтраль яки селтеле) тәҗрибә ясап билгеләгез.
4. Бу практик эштә файдаланылган матдә мисалында, шулай ук йод мисалында
корылай кууның (сублимация) нинди процесс булуын аңлатып бирегез.
5. Практик эш нәтиҗәләрен тасвирлап языгыз.
3. Метан табу
Шартлаучан матдәләр һәм селтеләр белән куркынычсыз эшләү кагыйдәләрен кабат¬
лагыз. Химик эксперимент үткәргәндә, бу кагыйдәләрне төгәл үтәгез.
1. Метанны каты матдәләр — натрий ацетаты һәм натрий гидроксиды катнашмасын
(катнашманы лаборант әзерли) файдаланып табыгыз.
2. Метанны су өстендә ике пробиркага җыегыз.
3. Җыелган газның янучан булуын химик тәҗрибәләр белән раслагыз.
4. Метанның бромлы суга һәм калий перманганатының алсу төстәге эремәсенә
тәэсирен тикшерегез.
5. Практик эш нәтиҗәләрен тасвирлап языгыз.
147
24 нче таблица. Катионнарны һәм анионнарны билгеләү
Билгеләнергә
тиешле ион
Реактив
Реакция нәтиҗәсе
H+
Ag+
Cu2+
Fe2+
Fe3+
Zn2+
Al3+
NH4
Ba2+
Ca2+
Na+
K+
CF
Br-
Г
sof
CO?-
O
CH4COO-
NO3
SO42-
POf
OH-
Индикаторлар
CF
OH-
S2-
OH-
OH-
OH-
S2-
OH-
OH-
SO2-
CO32-
Ag+
H2SO4
(куерт.)
Ag+
H2SO4
Ag+
H2SO4
H+
H+
H2SO4
H2SO4 (куерт.)
һәм Cu
Ba2+
Ag+
Индикаторлар
Төсе үзгәрә
Ак төстәге утырым
Зәңгәр төстәге утырым
Kapa төстәге утырым
Ялкынны яшькелт-зәңгәр төскә кертә
Ак төстәге лачаусыман утырым, һавада яшел¬
ләнә
Көрән төстәге утырым
Ак төстәге утырым, OH- артып киткәндә эри
Ак төстәге утырым
Соры төстәге утырым, OH- артып киткәндә
эри
Аммиак исе килә
Ак төстәге утырым
Ялкынны сары төскә кертә
Ак төстәге утырым
Ялкынны кызыл-кирпеч төсенә кертә
Ялкын (кобальт пыяла аша) сары төстә
Ялкын (кобальт пыяла аша) шәмәхә төстә
Ак төстәге утырым
Төссез газ аерылып чыга, зәңгәр лакмус кәга¬
зен кызыл төскә үзгәртә
Саргылт төстәге утырым
SO2 (зәһәр исле) һәм Br2 (көрән төстә) аеры¬
лып чыга
Сары төстәге утырым
H2S һәм I2 (шәмәхә төстә) аерылып чыга
Фуксин һәм шәмәхә язу карасын төссезлән¬
дерүче, кискен исле газ — SO2 аерылып чыга
Известьле суны болганчыкландыручы, иссез
газ аерылып чыга
Серкә кислотасы исе килә
Көрән төстәге газ аерылып чыга
Ак төстәге утырым
Сары төстәге утырым
Төсен үзгәртә
148
КҮРСӘТКЕЧ*
А
Агалтын (платина) IV, IlO
Аденин III, 164
Азот IV, 125
Азотлы нигезләр III, 166
Аккургашлау (лужение) IV, 82
Аксым молекуласының структу¬
расы
- беренчел III, 159
~ икенчел III, 159
~ өченчел III, 160
- дүртенчел III, 160
Аксымнар III, 158
Активлаштыру энергиясе IV, 51
Активлаштырылган комплекс IV, 51
Активлаштырылган күмер III, 168
Актиноидлар IV, 16
Алдавыч цинк кабырчыгы (цинковая
обманка), сфалерит IV, 102
Алкадиеннар III, 44
Алкеннар III, 34, 35
Алкоголизм III, 86, 168
Аллотропия IV, 35
Аллотроп модификацияләр IV, 35
Альдегид төркеме III, 100
Альдегидлар III, 100
Алюминий IV, 96
Аминогруппа III, 150
Аминокислоталар III, 153
Аминопластлар III, 104
Аминосеркә кислотасы (глицин) III,
153
Аминнар III, 150
Амоксициллин III, 167
Андреев И. И. IV, 133
Анилин III, 151
Анионнар IV, 80
Анод IV, 80
Аносов Π. Π. IV, 112
Ареннар III, 57
Аспирин III, 167
Атомнарның валентлык мөмкинлек¬
ләре IV, 20
Ацетальдегид III, 100
Ацетилен III, 50
Ацетиленидлар III, 54
Ацетилцеллюлоза III, 143
Ацетон III, 100
Аэрозоль IV, 41
Ә
Әйләнә-тирәлекне саклау IV, 62
Б
Бакелит 111,104
Бакыр IV, 99
Бакыр колчеданы IV, 100
Бакыр ялтыравыгы, халькозин IV,
100
Бензин III, 70
* Күрсәткечтә III цифры белән 10 нчы сыйныф дәреслеге (Рудзитис Г.Е.
Фельдман Ф.Г. Органик химия.— M.: Просвещение, 2007; Казан: «Мәгариф» нәш¬
рияты, 2009), IV цифры белән 11 нче сыйныф дәреслеге билгеләнгән.
149
Бензол III, 57
Бериллий IV, 94
Бертло Μ. III, 4, 125
Бертоллидлар IV, 6
Биополяр ион III, 156
Боридлар IV, 122
Бутлеров А. Μ. III, 4,7
В
Вазелин III, 70
Валентлык IV, 17
Вёлер Ф. Ill, 4; IV, 139
Винилбензол (стирол) III, 60
Водород IV, 15
Водород күрсәткече IV, 67
Вюрц А. III, 21
Г
Газойль (дизель ягулыгы) III, 70
Газолин III, 70
Галогенлы кушылмалар III, 24
Галогеннар III, 22
Гексахлорбензол III, 65
Гексозалар III, 131
Гель (дерелдәвек) IV, 40
Гербицидлар III, 65
Гетеролиз (бәйләнешнең ионлы өзе¬
лүе) III, 12
Гетероциклик кушылмалар III, 162
Гидридлар IV, 91,135
Гидролиз(ы)
аксымнар - III, 161; IV, 71
кайтмас ~ IV, 73
катлаулы эфирлар - III, 123; IV,
70
крахмал ~ III, 141
майлар ~ IV, 71
тозлар ~ IV, 71
углеводлар ~ IV, 71
целлюлоза - III, 142
Гликоген III, 141
Глицерин III, 91
Глюкоза III, 131, 141
Гомолиз (бәйләнешнең радикаль
өзелүе) III, 12
Гомологлар III, 18; IV, 35
Гомологик аерма III, 18
Гуанин III, 164
Гудрон III, 71
д
Дальтонидлар IV, 6
Данилевский А. Я. Ill, 158
Дәрәҗә(се)
полимерлашу ~ III, 170
электролитик диссоциация - IV,
66
Дезоксирибоза III, 136
Декстриннар III, 141
Денатурация III, 160
Десорбция IV, 40
Дизель ягулыгы (газойль) III, 70
Динитроцеллюлоза (коллоксилин)
III, 144
Дисахаридлар III, 131
Дисперс системалар IV, 36
Дисульфид күперчек III, 160
Дихлорметан III, 27
•vr/·
Λν
Жераф Ш. Ill, 7
җ
Җылылык алмашу IV, 61
Җылылык ясалу IV, 47
3
Закон(ы)
матдәләрнең массасы саклану ~
IV, 5
матдәләрнең составы даимилеге -
IV, 6
периодик - IV, 8
тәэсир итешүче массалар ~ IV, 52
150
энергия саклану һәм әверелү -
IV, 6
Зелинский Н. Д. Ill, 60
Зинин H. H. Ill, 152
И
Изомерия III, 9; IV, 35
оптик (көзгедәгечә) - III, 132
пространстволы (стереоизоме¬
рия) - III, 38
Изомерлар III, 8
тпранс-изомерлар III, 38
цис-изомерлар III, 38
Изопентил спирты III, 87
Изотоплар IV, 4, 34
Ильменит IV, 104
Ингибирлаштыру IV, 53
Ингибитор IV, 53
Индикаторлар IV, 67
Инсектицидлар III, 65
Инсулин III, 161
Интерметаллидлар IV, 97
Интерферон III, 168
Иономерлар (рН-метрлар) IV, 67
Иярмә химик бәйләнешләр III, 44
Иярчен нефть газлары III, 68
К
Кайтаргычлар (кайтаручылар) IV,
77
Калий IV, 92
Кальций IV, 94
Капрон III, 179
Карбамид сумала III, 104
Карбидлар IV, 122
Карбокатион III, 40
Карбоксил төркеме III, 106
Карбонил төркеме III, 100
Карбон кислоталары III, 106
бер нигезле чикле - III, 106
чиксез - III, 115
Катализ IV, 52
Катализатор IV, 53, 55
Катионнар IV, 80
Катлаулы эфирлар III, 12
Катод IV, 80
Каучук III, 47
синтетик - III, 176
Кекуле Ф. III, 5, 7, 58
Керосин III, 70
Кетоннар III, 100
Кислород IV, 126
Кислородлы органик кушылмалар
III, 80
Кислота(сы)
арсенат - IV, 131
висмут - IV, 131
метафосфат ~ IV, 131
нитрат - IV,130, 133-135
ортофосфат - IV, 131
стибат - IV, 131
сульфат - IV, 130-133
Кислоталар IV, 64, 65
Кислоталар һәм нигезләрнең прото-
литик теориясе IV, 64, 73
Коагуляция IV, 40
Коллоид эремәләр IV, 36
Кольбе A. B. Ill, 4
Коррозия IV, 84
химик - IV, 86
электрохимик - IV, 87
Крахмал III, 139
Крекинг III, 71
Кремний IV, 124
Кристаллик челтәр IV, 34
Кумоль методы III, 103
Купер А. III, 7
Күкерт IV, 126
Кырмыска кислотасы III, 109, 113
Л
Лавсан III, 180
Лавуазье А. Л. IV, 5
Лантаноидлар IV, 16
Лебедев С. В. III, 45
151
Литий IV, 92
Ломоносов М. В. IV, 5
M
Магний IV, 94
Мазут III, 70
Майер P. IV, 5
Майлар III, 124
Макромолекулалар III, 170
Малахит IV, 100
Малликен P. III, 12
Марковников В. В. III, 30
Марковников кагыйдәсе III, 30
Матдәләр
минераль ~ III, 4
молекуляр төзелешле - III, 4
молекуляр булмаган төзелешле -
III, 4
органик - III, 4
Менделеев Д. И. III, 73; IV, 8
Металлар IV, 79
авыр - IV, 79
авыр эретелүчән ~ IV, 79
җиңел ~ IV, 79
җиңел эретелүчән ~ IV, 79
Металларның стандарт электродлар
потенциаллары рәте (электрохимик
көчәнешләр рәте) IV, 77
Металларның электрохимик көчә¬
нешләр рәте (стандарт электродлар
потенциаллары рәте) IV, 82
Метаналь (кырмыска альдегиды) III,
103
Метанол (метил спирты) III, 85
Метилциклогексан III, 31
Моляр концентрация IV, 36
Мономерлар III, 170
Моносахаридлар III, 131
H
Наркомания III, 168
Натрий IV, 92
Нафтеннар (циклоалканнар) III, 30
Неметалл оксидлары IV, 128
Нефть III, 69
Нигезләр IV, 64, 65
Никель IV, 110
Никельләү IV, 82
Нитроглицерин III, 91
Нитроний катионы III, 62
Нобель A. B. Ill, 91
Нуклеин кислоталары III, 165
дезоксирибонуклеин к.-ы III, 165
рибонуклеин к.-ы III, 165
Нуклеотидлар III, 165
Нуклеофиллар III, 13
О
Олеум IV, 62
Олефиннар III, 36
Орбитальләр гибридлашуы
зр-гибридлашу III, 50; IV, 29
зр2-гибридлашу III, 35; IV, 31
зр3-гибридлашу III, 18; IV, 31
Органик химия III, 5
П
Парафин III, 71
Парафиннар III, 16
Парацетамол III, 167
Патока (бәрәңге балы) III, 141
Пентозалар III, 131
Пептид (амид) төркеме III, 156
Пиридин III, 163
Пиримидин III, 164
Пиролиз III, 72
Пиррол III, 163
Полимерлар III, 170
термореактив ~ III, 176
Полимерның структурасы
~ стереорегул яр III, 171
~ стереорегуляр булмаган III, 171
Полимерның структур буыны III,
170
152
Полинг Л. Ill, 12
Полипептидлар III, 156
Полипропилен III, 171
Полисахаридлар III, 131
Политетрафторэтилен (тефлон) III,
173
Полиэтилен III, 171
Принцип (принцибы)
JIe Шателье ~ IV, 5 7
каршы агым ~ IV, 60
Протолитлар IV, 65
Пурин III, 164
P
Радикал III, 12
Реакциялэр(е)
алмашу ~ IV, 45
алмаштыру ~ IV, 45
галогенлау ~ III, 62
гидрирлау ~ III, 30, 64
дегидрирлау ~ III, 31, 38
ионнар алмашу ~ IV, 68
ирекле радикаллар ясалу меха¬
низмлы - III, 13
кайтма ~ IV, 47
кайтмас - IV, 47
катал итик ~ IV, 53
кушылу ~ III, 46, 48, 52, 63;
IV, 45
нитролау ~ III, 62, 96
оксидлашу ~ III, 53, 63
оксидлашу-кайтарылу ~ IV, 44
поликонденсация - III, 140
полимерлашу - III, 41, 53
таркалу - IV, 45
чылбыр ~ III, 24
экзотермик - IV, 46
эндотермик - IV, 46
этерификация - III, 122
Реакциянең кинетик тигезләмәсе IV,
52
Реакциянең җылылык эффекты IV,
46
Резин III, 48
Ректификация колоннасы III, 71
Рибоза III, 136
Риформинг III, 73
Рутил IV, 104
C
Сабын III, 114
Сахароза III, 137
Семенов H.H. Ill, 25
Серкә кислотасы III, 114
Силицидлар IV, 122
Синтетик сүсләр III, 179
Синтетик юу матдәләре III, 126
Соляр мае III, 70
Сополимерлашу III, 177
Спиртлар
ароматик - III, 93
бер атомлы чикле ~ III, 80
күп атомлы ~ III, 89
Стирол (винилбензол) III, 60
Структур формулалар IV, 7
Суның электролитик таркалуы IV,
84
Суның ионнар тапкырчыгышы IV,
67
Сульфат кислотасы җитештерү IV,
58
Суспензияләр IV, 35
Сыйфат реакцияләре
аксымнарга - III, 160
альдегидларга ~ III, 103
крахмалга - III, 141
күп атомлы спиртларга - III, 90
фенолга ~ III, 95
T
Табигый газ III, 68
Термопластиклык III, 172
Тетрахлорметан III, 27
Тефлон (политетрафторэтилен) III,
173
153
Тизлек (тизлеге)
гетероген реакция - IV, 50
гомоген реакция ~ IV, 50
химик реакция ~ IV, 49
Тимер IV, 109
Тимин III, 164
Титан IV, 104
Титан хлориды III, 172
Титаномагнетитлар IV, 104
Толуол III, 64
Тринитротолуол III, 64
Тринитрофенол III, 96
Тринитроцеллюлоза (пироксилин)
III, 144
Трихлорметан III, 27
Триэтилалюминий III, 172
У
Углеводородлар(ы) III, 16
ароматик ~ (ареннар) III, 57
ацетилен рәте - III, 34, 50
диен ~ (алкадиеннар) III, 34, 44
этилен рәте - (алкеннар) III, 34
Углерод IV, 124
Углеродның асимметрии атомы III,
132
Углеродның беренчел атомы III, 82
Углеродның икенчел атомы III, 82
Углеродның өченчел атомы III, 82
Ф
Фенолформальдегид сумалалар III,
96,104,174
Феноллар III, 93
Фенопластлар III, 104
Ферментлар III, 84
Фишер Э. III, 158
Формалин III, 105
Формальдегид III, 100
Фосфор IV, 125
Франклад Э. III, 7
Фруктоза III, 133
Фтор IV, 120, 127
Фунгицидлар III, 65
Функциональ төркем (группа) III,
14,81
X
Химик бәйләнеш
берле ~ III, 35
водородлы ~ III, 84, 159; IV, 26
икеле - III, 35
ионлы - IV, 24
ковалент поляр - IV, 25
ковалент поляр булмаган - IV,
25
металлик - IV, 26
өчле ~ III, 50
пептид (амид) - III, 156
π-бәйләнеш III, 11
σ-бәйләнеш III, 11
Химик реакция тәртибе IV, 52
Химик синтез IV, 35
Химик тигезләнеш IV, 56
Химик тигезләнешнең авышуы IV,
57
Химик элемент IV, 4
Химик төзелеш III, 7
Хлор IV, 127
Хлорметан III, 26
Хромлау, хром йөгертү IV, 82
Хром оксиды IV, 117
Хромлы тимерташ IV, 107
ц
Целлюлоза III, 143
Цементит IV, 112
Циклик кушылмалар III, 6
Циклоалканнар (нафтеннар) III, 29
Циклогексан III, 31
Циклопропан III, 31
Цинк IV, 102
Цинк шпаты, смитсонит IV, 102
Цитозин III, 164
154
ч
Чернов Д. К. IV, 115
Чуен
ак ~ IV, 112
соры ~ IV, 112
Чын эремәләр IV, 36
э
Эбонит III, 49
Эйнштейн А. IV, 5
Эластиклык III, 48
Электролиз(ы) IV, 80
судагы эремәләр ~ IV, 80
эретелмәләр ~ IV, 81
Электролитик диссоциация IV, 64
Электролитлар IV, 63
Электроннар балансы методы IV,
44
Электртискәрелек IV, 24
Электрофиллар, электрофил кисәк¬
чекләр III, 13
Эмульсияләр IV, 35
Эре дисперс системалар IV, 36
Эретмәләр IV, Ill
Этаналь (серкә альдегиды) III, 104
Этанол (этил спирты) III, 80
Этиленгликоль III, 90, 91
Эфирлар гидролизы (омыление) III,
123
Я
Яну җылылыгы IV, 47
МӘСЬӘЛӘЛӘРГӘ ҖАВАПЛАР
I бүлек
1. 190,4 л CO2. 2. Азот белән (22,2 м3 азот реакциягә керми).
II бүлек
1. H2S. 2. 14 г NaHS; 0,25 моль. 3. 21,12 г. 4. 4,45%.
III бүлек
1. 0,08, яки 8%. 2. 372,2 г. 3. 15,2 г NaNO3; 1,26 г HNO3. 4. 12,25 г
Cu(OH)2; 0,125 моль.
IV бүлек
§ 11. 1. 279,2 кДж. 2. 761,6 кДж.
§ 14. 1. 0,005 моль/л-с,яки 5-10 4 моль/л-с. B матдәсенең концентра¬
циясе 5 · 10 3 моль/л га кими. 2. 243 тапкыр. 3. 15,68 т. 4. 4 т.
§ 16. 1. 9,5%. 2. 42,1%. 3. 11,2 л CO2.
§ 18. 1. 23,9% H3PO4. 2. 25,8 мл H2SO4. 3. 71,5 г KNO3. 4. 4,82%
CH3COOH.
V бүлек
§ 20. 1. 66,97 т Fe. 2. 0,64 моль NaOH, яки 25,6 г NaOH. 3. 8,875 г Cl2;
2,8 л Cl2. 4. 108 г. 5. 22,4 м3 H2 һәм 22,4 м3 Cl2.
§ 21. 1. 25,6 г AlCl3; 6,44 л H2. 2. 710,6 кДж. 3. 24,3%.
§ 29. 1. 99,4 г CuS. 2. 30% Al һәм 70% Al2O3; 15,96 мл NaOH эремәсе.
3. 35,78 мл; 2,7 г. 4. 55,42 кг Fe. 5. 5,5 г Cu; 13,03 г FeSO4. 6. 355,51 г
PbO һәм 215,71 г SnO2.
VI бүлек
1. 12,8 г; 4,48 л; 0,2 моль SO2. 2. 13,79 л CO2. 3. 26,24 г Ca(NO3)2.
ӘДӘБИЯТ ИСЕМЛЕГЕ
1. Рудзитис Г. Е. Химия. Неорганик химия. Татар урта гомуми белем
бирү мәкт. 8 нче с-фы өчен д-лек / Г. Е. Рудзитис, Ф. Г. Фельдман. —
Казан: Мәгариф, 2008.
2. Рудзитис Г. Е. Химия. Неорганик химия. Органик химия. Татар
урта гомуми белем бирү мәкт. 9 нчы с-фы өчен д-лек / Г. Е. Рудзитис, Ф. Г.
Фельдман. — Казан: Мәгариф, 2009.
3. Рудзитис Г. Е. Химия. Органик химия. Татар урта гомуми белем
бирү мәкт. 10 нчы с-фы өчен д-лек / Г. Е. Рудзитис, Ф. Г. Фельдман. —
Казан: Мәгариф, 2009.
4. Единый государственный экзамен: контрольные измерительные мате¬
риалы: химия / Под ред. А. А. Кавериной; М-во образования РФ.— M.:
Просвещение, 2002, 2003, 2004, 2006.
5. Единый государственный экзамен. Химия. Контрольные измери¬
тельные материалы 2006—2007.— M.: Просвещение; СПб.: Филиал изд-ва
«Просвещение», 2007.
6. Каверина А. А. Единый государственный экзамен. Химия. Сб. за¬
даний/ А. А. Каверина, Д. Ю. Добротин, А. С. Корощенко, Ю.Н. Медведев.—
M.: Просвещение, Эксмо, 2006.
7. Оржековский П. А. Единый государственный экзамен 2005. Химия.
Репетитор / П. А. Оржековский, Η. Н. Богданова, В. В. Загорский и др.—
M.: Просвещение, Эксмо, 2005.
8. Оржековский П. А. Единый государственный экзамен. Химия. Сб.
заданий / П. А. Оржековский, Η. Н. Богданова, В. В. Загорский и др. — M.:
Просвещение, Эксмо, 2006.
9. Лидин Р. А. Тесты по химии для обучения и текущего контроля
знаний: 10—11 кл. / Р.А. Лидин, Н.Н. Потапова. — M.: Просвещение,
2002.
10. Радецкий А. М. Дидактический материал по химии: 10—11 кл. /
А. М. Радецкий, В. П. Горшкова, Л. Н. Кругликова.— M.: Просвещение,
2003.
11. Радецкий А. М. Проверочные работы по химии: 8—11 кл. / А. М. Ра¬
децкий. — M.: Просвещение, 2000.
12. Радецкий А. М. Химический тренажер: 8—9, 10—11 кл. / А. М. Ра¬
децкий. — M.: Просвещение, 2007.
ЭЧТӘЛЕК
Дәреслектән ничек файдаланырга 3
I бүлек. Иң әһәмиятле химик төшенчәләр һәм законнар
§ 1. Химик элемент. Изотоплар 4
§ 2. Химик реакцияләр вакытында матдәнең массасы саклану законы,
энергия саклану һәм әверелү законы, матдәләр составының даимилеге
законы 5
II бүлек. Атом төзелеше тәгълиматы нигезендә химик элементларның
Д. И. Менделеев ачкан периодик законы һәм периодик системасы
§ 3. Кече һәм зур период атомнарында электроннарның урнашу үзенчә¬
лекләре. S-, р-, d-, /-Электроннар 8
§ 4. Периодик системада водород, лантаноид, актиноид һәм ясалма юл белән
табылган элементларның урыны 15
§ 5. Валентлык һәм атомнарның валентлык мөмкинлекләре 17
III бүлек. Матдә төзелеше
§ 6. Химик бәйләнешнең төп төрләре 24
§ 7. Неорганик һәм органик матдәләр молекулаларының пространстволы
төзелеше 29
§ 8. Кристаллик челтәрләрнең төрләре һәм матдәләрнең үзлекләре .... 32
§ 9. Матдәләрнең күптөрлелегенең сәбәпләре 34
§10. Дисперс системалар 35
1 нче практик эш 42
IV бүлек. Химик реакцияләр
§11. Химик реакцияләрнең классификациясе 43
§12. Химик реакцияләрнең тизлеге. Катализ 49
§13. Химик тигезләнеш һәм аның авышу шартлары 56
§14. Сульфат кислотасын контакт ысулы белән җитештерү 58
§ 15. Электролитлар һәм неэлектролитлар. Электролитик диссоциация 63
§ 16. Көчле һәм көчсез электролитлар. Диссоциация дәрәҗәсе һәм кон¬
стантасы 66
§17. Ионнар алмашу реакцияләре 68
§18. Органик һәм неорганик кушылмалар гидролизы 70
Лаборатор тәҗрибәләр 75
2 нче практик эш 76
V бүлек. Металлар >
§ 19. Металларны табуның гомуми ысуллары. Электролиз 79
§ 20. Металларның коррозиясе һәм аны кисәтү 84
§ 21. А-төркемнәрнең металлик элементларына күзәтү 89
158
§ 22. Б-төркемнәрнең металлик элементларына гомуми күзәтү 98
§ 23. Бакыр 99
§ 24. Цинк 102
§ 25. Титан 104
§ 26. Хром 106
§ 27. Тимер, никель, платина 108
§ 28. Металларның эретмәләре Ill
§ 29. Металларның оксидлары һәм гидроксидлары 115
Vl бүлек. Неметаллар
§ 30. Неметалл арга күзәтү 119
§31. Неметалларның оксидлары һәм кислородлы кислоталар 128
§ 32. Неметалларның водородлы кушылмалары 135
§ 33. Неорганик һәм органик матдәләр арасында генетик бәйләнеш .... 139
§ 34. Химия — көнкүрештә 141
3—6 нчы практик эшләр 144—145
Күрсәткеч 149
Мәсьәләләргә җаваплар 156
Әдәбият исемлеге 157
Учебное издание
Рудзитис Гунтис Екабович
Фельдман Фриц Генрихович
ХИМИЯ
Основы общей химии
Учебник для 11 класса татарской средней
общеобразовательной школы
Базовый уровень
Казань. Издательство «Магариф». 2009
Перевод с русского на татарский язык
Уку-укыту басмасы
Рудзитис Гунтис Екабович
Фельдман Фриц Генрихович
ХИМИЯ
Гомуми химия нигезләре
Татар урта гомуми белем бирү мәктәбенең
11 нче сыйныфы өчен дәреслек
Төп белем
Редакция мөдире Л. X. Мөхэммэтҗанова
Редакторы Р. 3. Закирова
Корректоры А. А. Дэүлэтова
Компьютерда биткә салучысы Г. Р. Галимҗанова
Рәсемнәрне компьютерда эшкәртүчеләре Л. Р. Вафина,
Г. Р. Галимҗанова
Оригинал-макеттан басарга кул куелды 20.10.2009.
Форматы TOxOO1Z16. Офсет кәгазе. «Школьная» гарнитурасы.
Офсет басма. Шартлы басма табагы 11,7 + форз.0,29.
Нәшер-хисап табагы 9,83+ форз.0,48. Тиражы 5 900 д. Заказ В-1610.
«Мәгариф» нәшрияты. 420059. Казан, Оренбург тракты, 20а.
Тел./факс (843) 277-52-62; 277-52-88.
E-mail: magarif@mail.ru »
http://www.magarif.com
«Идел-Пресс» полиграфия-нәшрият комплексы» ААҖ.
420066. Казан, Декабристлар урамы, 2.