Текст
’’Ц Л. А. Цветков
ОРГАНИК
ХИМИЯ
РЕАКТОР
I. Промышленностьта метаннан ацетилен табу җайланмасы.
II, Майларны гидрирлый торган автоклав.
Л. А. Цветков
ОРГАНИК
ХИМИЯ
Татар урта гомуми белем мәктәбенең
10-11«
сыйныфлары өчен дәреслек
Россия Федерациясенең Мәгариф министрлыгы
тарафыннан тәкъдим ителгән
Тәрҗемә Татарстан Республикасы
Мәгариф министрлыгы тарафыннан
расланган
КАЗАН • «МӘГАРИФ» НӘШРИЯТЫ
МОСКВА • «ВЛАДОС»
2002
УДК 373.167.1:547
ББК 24.2я721
Ц31
Дәреслеккә 1974 елда СССР Дәүләт премиясе бирелде.
Цветков Л. А.
Органическая химия: Учеб, для учащихся 10—11 кл.
общеобраэоват. учеб, заведений.— М.: Гуманит. изд. центр
ВЛАДОС, 1999-
Охраняется Законом РФ «Об авторском праве и смежных
правах*. Воспроизведение всей книги или ее части на любых
видах носителей запрещается без письменного разрешения изда
телъства.
Шартлы билгеләр:
ф — кагыйдәләр, билгеләмәләр
J — практик биремнәр
* — катлаулы биремнәр
Цветков Л. А.
Ц31 Органик химия: Татар урта гомуми белем мәкт.
10—11 иче с флары өчен д-лек /Русчадан Р. А. Шаһмо-
ратова тәрҗ.— Казан: Мәгариф. 2002 — 288 б.: рас. б-н.
ISBN 5 7761 0692 3
Орган н к химиядән бу классик дәреслек 25 тапкыр нәшер ителүгә
иреште. Анын ачтәлеге химиядән урта белем бирү буенча Дәүләт
стандартына, шулай ук табигать фәннәре профилендәге мәктәпләрдә
бу фәнне өйрәнү таләпләренә тулысынча җавап бнрә.
Дәреслекнең бу яңа басмасында органик химияне төрле дәрәҗәдә
өйрәнү мөмкинлеге каралган. Химиядән мәҗбүри минимум белем
бирү сыйныфларында китап битенең киңлеген тулысынча тутырып
торган текстны ойрәнү белән чикләнергә мөмкин. Ә инде табигать
фәннәрен яки химияне тирәнтен өйрәнү сыйныфларында текстның
уңга күчерелгән өлеше дә өстәмә рәвештә өйрәнелә.
ВЭ — 7(60) — 39 — 2000/2001
ISBN 5-7761 0692 3
© Цветков Л. А., 1999
© «Гуманитарный издательский
центр ВЛАДОС», 1999
©Татарчага тәрҗемә,
«Мәгариф» нәшрняты, 2002
КЕРЕШ
Оргавик химия. Без, неорганик химияне өйрәнгәндә,
составлары төрле-терле булган матдәләр белән таныштык, лә¬
кин нинди дә булса бер химик элементның һәр матдә соста¬
вында булуын очратмадык. Органик матдәләрнең составына
исә, башка элементлар белән беррәттән, һәрвакыт углерод
керә. Углерод кушылмаларын, аларның тезелешен, химик
әверелешләрен органик химия өйрәнә.
Органик һәм неорганик матдәләр. Органик матдәләр сос¬
тавына, углерод белән беррәттән, еш кына водород, кисло¬
род Һәм азот керә; ә инде күкерт, фосфор, галогеннар һәм
башка элементлар чагыштырмача сирәк очрый. Билгеле бул¬
ган органик кушылмалар саны берничә миллион исәпләнә,
неорганик матдәләрнең савы исә шактый ким. Химик эле¬
ментлар арасында тик углерод кына шулкадәр күп кушыл¬
малар бирә.
Органик матдәләрне һәр җирдә очратабыз. Алар барлык
үсемлек һәм хайван организмында, димәк, без туклана торган
азык (икмәк, ит, яшелчәләр һ. б.) составында да бар, кием
тегү ечен материал булып хезмәт итәләр, терле ягулыклар
барлыкка китерәләр. Органик матдәләрне без дару, буягыч¬
лар, ашлыкларны корткычлардан саклау чарасы һ. 6. сыйфа¬
тында файдаланабыз.
Органик матдәләрнең барысы да диярлек я ну чан һәм
җылытканда җиңел таркалалар. Яндырганда углерод (IV)
оксиды хасил булудан яки кыздырганда матдәнең күмерлә¬
нүеннән аның органик кушылмалар рәтенә керүен бик җиңел
белергә мөмкин.
Органик һәм неорганик матдәләр арасында кискен чик
юк. Углерод оксидлары, карбонат кислотасы, аның тозлары
һәм кайбер башка матдәләр, үзләрендә углерод булуга карап,
органик матдәләр рәтенә керергә тиеш булсалар да, үзлекләре
ягыннан шундый типтагы неорганик матдәләргә якынрак
торалар, һәм аларны, гадәттә, неорганик химиядә өйрәнәләр.
Неорганик матдәләрдән органик кушылмалар хасил булуы
һәм, киресенчә, органик кушылмаларның неорганик матдә¬
3
ләргә әверелүе сезгә биологиядән билгеле. Табигатьтәге бар¬
лык матдәләр үзара бәйләнгән, алар арасында бердәмлек бар.
Органик химиянең фән буларак тууы. Органик матдәләр
белән кешеләр инде бик борынгы заманнардан бирле таныш.
Безнең бик борынгы бабаларыбыз тукымаларны табигый
буяулар белән буяганнар, ашамлык итеп үсемлек һәм терлек
майларын, камыш шикәрен файдаланганнар, спиртлы сыек¬
лыкларны әчетеп, серкә алганнар Һ. 6.
Әмма углерод кушылмалары турындагы фән XIX гасыр¬
ның беренче яртысында гына барлыкка килә. Моңа кадәр хи¬
миядә матдәләрне, килеп чыгуларына карап, өч төркемгә —
минераль матдәләргә, үсемлек һәм хайван матдәләренә бүлеп
йөрткәннәр һәм ал арның һәркайсын аерым өйрәнгәннәр.
Химик анализ методлары камилләшү белән, үсемлекләр
һәм хайваннар барлыкка китергән матдәләр составында угле¬
род булу ачыклана. Швеция химигы Я. Берцелиус (1807) тере
организмнардан алынган матдәләрне — органик матдәләр,
ә аларны өйрәнә торган фәнне органик химия дип атарга
тәкъдим итә.
Ләкин Я. Берцелиус һәм ул чорның башка химиклары
органик матдәләр неорганик матдәләрдән принципиаль аеры¬
лып тора: аларны, неорганик матдәләрне тапкан кебек, ла¬
боратор юл белән табып булмый, алар «тереклек көче» тәэси¬
рендә бары тик тере организмнарда гына барлыкка килә
алалар дип санаганнар. Икенче төрле әйткәндә, виталистик
дип йөртелә торган «тереклек көче» турындагы бу тәгълимат
тамырыннан ялгыш һәм идеалистик тәгълимат була, чөнки
ул ниндидер материаль булмаган, табигатьтән өстен көчләргә
ышануга китерә (латинча vita — тереклек).
Виталистик тәгълимат органик матдәләрне неорганик
матдәләрдән алырга мөмкин түгел дип раславы белән фән
үсешен тоткарлап килде. Ләкин ул табигатьне танып белү
процессының һаман алга баруын туктата алмады, әлбәттә.
1828 елда Я. Берцелиусның шәкерте — немец галиме Ф. Ве¬
лер неорганик матдәдән органик матдә — мочевина синтезлау¬
га ирешә. 1845 елда немец химигы А. Кольбе ясалма юл бе¬
лән серкә кислотасы таба. 1854 елда француз химигы М. Берт-
ло ясалма юл белән май синтезлый. Рус галиме А. М. Бутле¬
ров 1861 елда беренче тапкыр шикәрле матдә синтезлап таба.
Элек тере организмнарда гына барлыкка киләләр дип
исәпләнгән матдәләр бер-бер артлы синтез юлы белән табыла
башлый. «Тереклек көче* турындагы идеалистик тәгълимат
тулысынча юкка чыга.
4
Хәзерге вакытта табигатьтә очрый торган матдәләр генә
түгел, хәтта табигатьтә булмаган күп кенә башка матдәләр дә,
мәсәлән: төрле-төрле пластмасса һәм каучуклар, һәртөрле
буяулар, шартлаучан матдәләр, дару препаратлары синтез
юлы белән табыла.
Хәзер инде синтетик юл белән табылган матдәләр саны
табигатьтә очрый торган матдәләрдән артып китте һәм алар-
ның саны артканнан-арта бара. Органик матдәләрнең иң
катлаулыларын — аксымнарны синтезлау тормышка ашы¬
рыла башлады.
«Органик матдәләр» терминының башлангыч мәгънәсе
инде күптән шактый киңәйде. Хәзер бу термин организмнар
составына керә торган матдәләрне генә түгел, шулай ук
синтетик юл белән табыла торган һәм организмнарга һич
катнашы булмаган матдәләрне дә үз эченә ала. Ләкин, тарихи
яктан урнашкан традиция буенча, составына углерод кергән
бик күп матдәләргә карата да шушы термин кулланыла.
«Органик химия» фәне дә үзенең беренче мәгънәсен югал¬
тып, шуңа бәйле рәвештә мәгънәсен киңәйтә төште. Аның бу
аталышы яңача да расланды дип әйтергә мөмкин, чөнки
хәзерге органик химиянең таныл белүдәге төп бурычы орга¬
низм күзәнәкләрендә бара торган процессларны молекулалар
дәрәҗәсендә тирәнтен өйрәнүдән, тереклек күренешләренең
материаль нигезен тәшкил итүче катлаулы механизмнарны
ачыклаудан гыйбарәт.
Шулай итеп, органик матдәләр химиясен өйрәнү безнең
табигать турындагы белемнәребезне киңәйтә. Матдәләр ара¬
сында нинди бәйлелек булуын, аларның иң гадиеннән —
неорганик матдәләрдән башлап тере организмны тәшкил
итүче иң катлаулыларына кадәр ничек катлаулана баруын
ачыклау безгә табигатьнең үсеш картинасын күз алдына
китерергә, табигатьтә була торган процессларны һәм шул
процесслар нигезендә ята торган закончалыкларны тирәнрәк
аңларга мөмкинлек бирә.
Органик химиянең казанышлары хәзерге производствода
бик киң кулланыла. Табигый матдәләрне эшкәртүне һәм
төрле органик матдәләр синтезлауны киң масштабларда
тормышка ашыра барып, органик химия промышленносте
промышленностьның башка тармаклары, авыл хуҗалыгы,
мәдәният һәм көнкүреш өчен күп төрле матдәләр һәм мате¬
риаллар җитештерә.
Органик химиянең барлык бу яклары белән фәнне алга
таба өйрәнү процессында танышырсыз.
5
1. ОРГАНИК КУШЫЛМАЛАРНЫҢ ХИМИК
ТӨЗЕЛЕШ ТЕОРИЯСЕ. ХИМИК
БӘЙЛӘНЕШЛӘРНЕҢ ЭЛЕКТРОНЛЫ ТАБИГАТЕ
§ 1. ТӨЗЕЛЕШ ТЕОРИЯСЕН
КИТЕРЕП ЧЫГАРГАН АЛШАРТЛАР
Без, неорганик химиядә элементларны һәм аларның ку¬
шылмаларын өйрәнгәндә, химик элементларның Д. И. Мен¬
делеев периодик законы һәм периодик системасыннан чыгып
эш иткән кебек үк, органик химиядә дә матдәләрне өйрән¬
гәндә химик тезелеш теориясен? таянып эш итәчәкбез.
Химик төзелеш теориясе, нигездә, XIX гасырның 60 нчы
елларында барлыкка килә.
XIX гасырның беренче яртысында органик химиянең төп
бурычы табигатьтәге кушылмаларның составын һәм үзлек¬
ләрен өйрәнүдән, аларны практикада куллануның рациональ
ысулларын эшләп бирүдән гыйбарәт була. Промышленность
һәм сәүдәнең үсеше, шәһәрләрнең зураюы органик химия
алдына тагын да зуррак таләпләр куя. Текстиль промышлен¬
ностенда төрле буяуларга мохтаҗлык туа; азык промышлен¬
ностеның үсеше өчен авыл хуҗалыгы продуктларын эшкәр
түнең камилләшкәнрәк ысуллары талап ителә; табигый ма
териалларны куллануга таянып, үсеп килгән шәһәрләрне як¬
тырту проблемасын дя хәл итү мәсьәләсе алга баса; халыкның
даруларга ихтыяҗын канәгатьләндерергә кирәк була Һ.б.
Ләкин органик химиядә теоретик күзаллаулар артта кал¬
ганлыктан, аның үсеше әкренәя башлый. Матдәләрне тик¬
шереп өйрәнгәндә ачылган яңа күренешләр үзләрен систе¬
малаштыруны һәм бердәм караштан чыгып аңлатуны таләп
итәләр. Тик ул замандагы теорияләрнең моңа көче җитми
әле. Органик химия яңа матдәләр синтезларга тиеш була,
ләкин теоретик мәгълүматлар синтезның нинди юнәлештә
булырга тиешлеген күрсәтә алмыйлар.
Органик химиядә яңа теоретик карашларның кирәклеге
яхшырак аңлашылсын өчен, бу өлкәдәге безгә билгеле булган
кайбер фактларны тикшереп үтик.
Неорганик химия курсын өйрәнгәндә, без углеродның,
водород белән кушылып, углеводородлар дип йөртелә торган
6
бик күп кушылмалар барлыкка китерүен белгән идек. Мәсә¬
лән, янучан табигый газ составына иң гади углеводород
метан СН4 белән беррәттән этан С2Нв, пропан С3Н8, бутан
С4Н10 һәм башкалар керә; ташкүмерне термик таркатканда
бензол С6Н6, толуол С7Н8 һ. б. барлыкка килә; нефть соста¬
вында күп терле углеводородлар бар. Шуңа бәйле рәвештә
мондый сораулар туа: ни өчен ике элемент шулкадәр күп
кушылмалар хасил итә ала һәм, гомумән, ни өчен органик
матдәләр неорганик матдәләргә караганда шактый күп?
Хәзер углеводородларның, мәсәлән, табигый газдагы угле¬
водородларның составы белән танышыйк. Углеродны без
дүрт валентлы элемент буларак беләбез, ләкин ул бары тик
метанда гына СН4 бу валентлыгын саклаган кебек күренә.
Этанда С2Н6 исә, әгәр без күнеккән күзаллауларга таянып эш
итсәк, углерод өч валентлы булырга тиеш, ә пропанда С3Н8
хәтта вакланмалы сан килеп чыга. Органик кушылмаларда
углеродның валентлыгы нинди соң?
Башка фактларны тикшереп карыйк. Биологиядән сезгә
глюкоза дигән матдә таныш, аның формуласы СвН12Ов.
Фруктозаның да (бал һәм җиләк-җимешләр составына керә
торган шикәрсыман матдәнең) формуласы нәкъ шундый.
Төрле матдәләрнең молекуляр составлары бер үк төрле бу¬
луын неорганик химиядә без бер тапкыр да очратмадык.
Органик химиядә исә мондый фактлар XIX гасыр башла¬
рыннан ук туплана. Составлары бер үк, ләкин үзлекләре
төрле булган матдәләрне Я. Берцелиус изомерлар дип атый.
Изомериянең сәбәбен дә фән нигезендә аңлатырга кирәк
була.
Органик химиядә килеп чыккан бу хәлне Ф. Вёлер үзенең Я. Бер-
целиуска язган хатында (1835 ел) болай сурәтли: «Органик химия хәзер
теләсә кемне акылдан яздыра ала. Ул миңа гаҗәеп бай һәм үтеп чыга
алмаслык куркыныч кара урман кебек тоела».
Без монда теоретик аңлатуны таләп итә торган бары тик
берничә проблемага гына кагылдык. Ул заманның галимнә¬
ре алдында хәл ителергә тиешле катлаулы башка мәсьәләләр
дә күп була.
1. XIX гасырның урталарында органик химиядә тупланган фәнни
фактлар белән ул замандагы теоретик карашлар арасында килеп чык¬
кан каршылыкларга мисаллар китерегез.
2. Валентлык турындагы гадәттәге күзаллаулардан чыгып: а) бен¬
золда, б) толуолда (составлары югарыда китерелде) углеродны ничә
валентлы дип исәпләргә тиешбез?
7
$ 2. ХИМИК ТӨЗЕЛЕШ ТЕОРИЯСЕ
Яңа теория нигезләрен 1861 елда Казан университеты
профессоры Александр Михайлович Бутлеров эшли.
Ул вакытларда химиядә атомистика идеяләре инде шак¬
тый таралган була. Элек бер-берсеннән ачык аерылып тор¬
маган атом һәм молекула тәшенчәләренә химикларның
1860 елда үткәрелгән халыкара съездында төгәл билгеләмә
бирелә. Ләкин галимнәр молекулаларның атомнардан ничег¬
рәк төзелүенә әле әһәмият итмиләр һәм бу төзелешне химик
методлар белән танып белү мөмкин түгел дигән нәтиҗә ясый¬
лар. Атом һәм молекулаларның барлыгына, гомумән, ышан¬
маучы галимнәр дә була.
А. М. Бутлеров атомнарны һәм молекулаларны матдәнең
реаль кисәкчекләре итеп санау белән генә чикләнми, бәлки
атомнар молекулаларда тәртипсез урнашмаганнар, ә билгеле
бер ээлеклелектә үзара бәйләнгәннәр, һәм бу ээлеклелекне
химик методлар белән билгеләргә, формулада күрсәтергә
мөмкин дип исәпли.
А. М. Бутлеров үз теориясенең төп идейсен түбәндәгечә
аңлата: «Катлаулы кисәкчекнең химик табигате аны тәшкил
иткән элементар кисәкчекләрнең табигате, аларның микъ¬
дары һәм химик төзелеше белән аңлатыла*. Без күнеккән
терминнар белән аңлатканда, бу — молекуланың химик үз¬
лекләре аны тәшкил итүче атомнарның үзлекләренә, алар¬
ның санына һәм молекуланың химик төзелешенә бәйле була
дигән сүз.
Бутлеров фикеренчә, химик төзелеш — молекулада атом¬
нарның тоташу эзлеклелеге, аларның үзара бәйлелек һәм
бер берсенә тәэсир итү тәртибе ул. Атомнарның молекула¬
ларга кушылуы аларның атомлыкларының (валентлыклары)
нинди булуына карый дип күрсәтә Бутлеров.
Атомнарның молекулаларга кушылганда бер-берсенә
йогынты ясауларын неорганик химия мисалларында кү¬
реп була. Мәсәлән, водород белән кислород кушылып су
хасил иткәч, үзара тәэсир итешүдән бик нык үзгәрәләр.
Нәтиҗәдә водород инде янмый, ә кислород януга ярдәм
итми, суда водородның да, кислородның да үзлекләре юк.
Водородның HCI, Н2О, NH3 кебек башка кушылмала¬
рын үзара чагыштырып карыйк. Бу кушылмаларда водо¬
род үзен төрлечә тота. Хлорид кислотасында аны метал-
ларның күбесе җиңел генә алыштыра, суда — бик актив
металлар тәэсир иткәндә генә алышыну була, ә аммиакта
8
водородны алыштыру аеруча читен. Димәк, бу матдәләр¬
нең молекулаларында водород белән бәйләнгән атомнар
водородка төрлечә йогынты ясыйлар.
Н2СО3, НРО3, H2SO4 кислоталарының көчләрен чагыш¬
тырып карагыз. Монда да углерод, фосфор һәм күкерт
атомнарының водородка төрлечә йогынты ясауларын кү¬
рергә мөмкин.
A. М. Бутлеровның югарыда китерелгән фикерләренә ни¬
гезләнеп, химик төзелеш теориясенең асылын түбәндәге төп
положениеләр рәвешендә әйтергә мөмкин:
1. Молекулада атомнар тәртипсез урнашмыйлар, ва
лентлыкларына карап, алар бер берсе белән билгеле бер
эзлеклелектә тоташалар.
2. Матдәнең үзлекләре аның молекуласы составына нин
ди элементларның атомнары керүенә һәм аларның күпме
шәр булуына гына түгел, бәлки бу атомнарның молекулада
нинди эзлеклелектә тоташуларына, бер берсенә йогынты
ясау тәртибенә бәйле.
Бу положениеләрнең беренчесен безгә билгеле углеводо¬
родлар мисалында тикшереп карыйк. Иң гади углеводород —
метан молекуласында атомнар үзара нинди эзлеклелектә
тоташканнар? Без метан молекуласындагы һәрбер водород
атомының углерод атомына тоташкан булуын беләбез инде.
Моның башкача булырга мөмкин түгеллеге бик җиңел аңла¬
шыла. Әгәр, мисал өчен, нинди дә булса ике водород атомын
бер-берсенә турыдан-туры тоташкан дип уйласак, ул вакытта,
валентлыклары файдаланылып бетү сәбәпле, алар башка
Александр Михайлович Бутлеров
(1828—1886)
Казан. Петербург университетлары про¬
фессоры, академик. Ул химик төзелеш тео¬
риясен иҗат итә һәм шуның белән хәзерге
заман органик химиясенә нигез сала. Бу тео¬
риягә таянып, күп кенә яңа кушылмалар ту¬
рында алдан әйтә һәм беренче тапкыр алар-
пы синтез юлы белән таба. Чиксез углеводо¬
родларның полимерлашу реакциясен ача, шу¬
ның белән югары молекуляр кушылмалар
синтезын башлап җибәрә. Аның этиленны
гидратацияләү буенча үткәргән эшләре этил
спирты табуның хәзерге ысулларыннан бер¬
сенә нигез итеп алынды. Ул химия тарихында
беренче талкыр шикәрле матдә синтезлый.
9
атомнар белән бәйләнешкә керә алмыйлар. Элементларның
валентлыгын шартлыча сызыкчалар белән билгеләсәк, метан
молекуласындагы атомнарның бәйләнеш тәртибе түбәндәгечә
күрсәтелер:
Н
I
Н-С—Н
I
н
Этан С2Нб молекуласында барлык углерод һәм водород
атомнары үзара тоташып бер кисәкчек хасил итсеннәр өчен,
углерод атомнары үзара бәйләнгән булырга тиешләр. Үзара
бәйләнешкә кергәндә, берәр валентлыкларын сарыф иткәннән
соң, углерод атомнарының тагын өчәр валентлык берәмлек¬
ләре буш кала, шушы берәмлекләр исәбенә алар алты водород
атомын тотып торалар:
Н Н
и—<!;—с-н
п н
Пропан С3Н8 һәм бутан С4Н10 молекулаларында атомнар
түбәндәге эзлеклелектә тоташалар:
Н Н Н Н Н Н Н
III I I I I
н-с-с-с-н н—с—с—с—с—н
III I I I I
н н н н н н н
Углеводородларның төзелешен өйрәнгәннән соң, без зама¬
нында галимнәрне борчыган сорауларның кайберләренә җа¬
вап бирә алабыз.
Углерод кушылмаларының күп төрле булуының сәбәбе
нәрсәдә соң? Күргәнебезчә, моның сәбәбе углерод атомна¬
рының бер-берсе белән, чылбыр хасил итеп, тоташа алуында
икән.
Без тикшергән кушылмаларда элементларның валент-
лыгы бозыламы? Юк, углерод һәр кушылмада дүрт валентны
килеш кала.
Ф Молекулаларда атомнарның тоташу тәртибен күрсә
тә торган химик формулалар структур формулалар яки
төзелеш формулалары дип атала.
Структур формулалар атомнарның бер-берсе белән тоташу
тәртибен генә чагылдыра, аларның пространствода ничек
урнашуын күрсәтми. Моны һәрвакыт истә тотарга кирәк.
10
Шуңа күрә пропанның структур формуласын Ничек КСНӘ
язсак та:
Н Н Н Н Н
„ I 1 I „ II
Н С-С-С Н яки Н С С-Н
С
ул бер үк молекуланы күрсәтә, чөнки атомнарның тоташу
тәртибе һәм эзлеклелеге югалмый.
Матдәләрнең структур формулаларын еш кына кыскар¬
тып язалар, мәсәлән, СН3—СН2—CHS. Гадиләштерелгән мон¬
дый формуладагы сызыкчалар углерод атомнары арасындагы
бәйләнешне генә күрсәтәләр, углерод атомнары белән водород
атомнары арасындагы бәйләнешне чагылдырмыйлар.
3. Химик тезелеш теориясенең асылы нәрсәдә? Бу теориянең моле¬
кулаларда атомнарның тоташу тартибе турындагы положениесен
ничек аңлыйсыз, мисаллар өстендә аңлатыгыз
4. Атомнар үзара кушылып молекула тәшкил иткәндә, атомнарның
бер берсенә йогынты ясавына һәм нәтиҗәдә аларның үзлекләре үзгә¬
рүгә неорганик химиядән мисаллар китерегез.
5. Бу параграфта китерелгән формулаларга охшатып, түбәндәге
углеводородларның: а) пентанның CsHn, б) гексанның С«Нн структур
формулаларын тезегез.
5 3. ИЗОМЕРИЯ
Хәзер атомнарның молекулада тоташу тәртибе матдә үз¬
лекләренә ничек Йогынты ясавын карап үтик.
Башта тарихи фактларны искә төшерик. А. М. Бутлеров
углеводород молекулаларының төзелешен өйрәнеп, бу мат¬
дәләрнең, бутаннан башлап, молекулаларының составы бер үк
төрле булса да, атомнарның кушылу тәртибе төрлечә булырга
мөмкин дигән нәтиҗәгә килә.
Мәсәлән, бутанда С4Н,0 углерод атомнарының ике төрле
тәртиптә — туры (тармаксыз) һәм тармакланган чылбыр
рәвешендә урнашуы мөмкин:
Беренче очракта һәрбер углерод атомы бер (әгәр ул кы¬
рыйда булса) яки ике углерод атомы белән тоташкан, икенче
11
очракта углерод атомнарының берсе берьюлы оч углерод
атомы белән тоташкан. Сыйфат һәм сан ягыннан составы
бердәй булган молекулаларда атомнарның тоташу тәртибе
үзгәрсә, химик төзелеш теориясе буенча, матдә дә үзгәрә. Әгәр
бу теория дөрес булса, төзелеше һәм үзлекләре белән бер-
берсеннән аерылып торган ике бутан булырга тиеш. Ул ва¬
кытларда әле бер генә бутан билгеле булганлыктан, А. М. Бут
леров синтез юлы белән икенче төрле төзелешле бутанны
тапмакчы була. Табылган матдәнең составы шундый ук —
С4Н10, ә үзлекләре башкачарак, мәсәлән, кайнау темпера¬
турасы түбәнрәк булып чыга. Бутаннан аеру өчен, яңа матдә¬
не изобутан дип атыйлар (грекча «иэөс* —тигез).
СН, —СН,—СН,— СН,
Бутан
(клйнлемп. -0.5
СН3—CH СН,
СН,
Изей утл н
4кейн темп. -11,7 °C)
Пентанның CSHIZ мөмкин булган төзелешләрен тикшереп
караганнан соң, A. М. Бутлеров мондый составлы өч төрле
углеводород булырга тиеш дигән нәтиҗәгә килә:
СН,—СН2 СН3—СН,- СН
(клйп темп Зв.2 ”С)
а
СН,-СН-СН,-СНЭ
сн3
(клйн. тема. 28 °C)
СН,
СН,—С—СН,
сн3
(кайа. теми, 9,5 ''Cj
Бу матдәләрнең өчесе дә табыла.
Молекулада углерод атомнарының саны арту белән, соста¬
вы бер үк төрле булган матдәләрнең саны бик тиз арта.
Мәсәлән, теория буенча, С,0Нг2 составлы — 75 төрле углеводо¬
род, С14НЗО формуласы белән 1858 төрле матдә булырга мөм¬
кин. Изомерия күренеше, ягъни бер үк составлы төрле матдә¬
ләрнең булуы инде күптәннән билгеле. Ләкин аны химик
төзелеш теориясе генә ышандырырлык итеп аңлатып бирде.
Хәзер без нинди матдәләрнең изомерлар дип аталуын төгәл¬
рәк әйтә алабыз.
12
R Молекулаларының составы бердәй (молекуляр форму¬
ласы бер ук төрле), ә химик төзелеше төрлечә булган һәм
шуңа курә үзлекләре бер береннән аерылып торган матдәләр
изомерлар дип атала.
Химик төзелеш теориясенең дөреслеген раслаучы дәлил¬
ләр фәндә елдан-ел арта бара. Акрынлап аны барлык галим¬
нәр кабул итә, һәм ул инде менә йөз елдан артыграк органик
химиянең төп теориясе булып тора. Бу теория башта органик
матдәләрнең төзелеше турындагы теория буларак әйтелсә дә,
соңрак химиянең гомуми теориясенә әверелә, чөнки ул моле¬
кулалардан торган неорганик кушылмалар өчен дә дөрес
(мәсәлән, су, аммиак, нитрат һәм сульфат кислоталары моле¬
кулаларының төзелешен исегезгә төшерегез). Бу теориянең
фәнни әһәмияте шунда: ул матдә төзелеше турындагы безнең
белемнәребезне тирәнәйтте, молекулаларның эчке төзелешен
аңларга юл ачты, химиядә тупланган күп кенә фактларны
аңларга, яңа матдәләр барлыгын алдан әйтергә һәм аларны
синтезлау юлларын табарга мөмкинлек бирде. Боларның
барысы да органик химиянең һәм химия промышленнос¬
теның тһз үсүенә ярдәм итте.
A. М. Бутлеров химик төзелеш теориясен эшләгәндә
үаеннән элек эшләгән галимнәрнең хезмәтләренә таяна.
Бу теориянең нигезе итеп, беренче чиратта, элементлар
ның валентлыгы төшенчәсе алына. Валентлык төшенчәсен
XIX гасырның 50 иче елларында фәнгә инглиз химигы
К. Франкланд кертә, ә углерод атомының дүрт валентлы
икәнен немец галиме А. Кекуле билгели, органик химия
өчен моның әһәмияте аеруча зур була. Углерод атомна¬
рының чылбырда бер-берсе белән тоташулары турындагы
фикерне дә А. Кекуле белән А, Купер әйтә. Әмма болар
әле аерым идеяләр генә була. Матдәләрнең химик тезеле¬
ше, матдә үзлекләренең химик төзелешкә бәйлелеге, бу
төзелешне өйрәнеп белергә һәм табигатьтә яңа матдәләр
барлыгын алдан әйтергә мөмкин булуы турындагы бөтен
бер тәгълиматны A. М. Бутлеров барлыкка китерә.
A. М. Бутлеров теорияне эшләп, аның дөреслеген яңа ку¬
шылмалар синтезлап раслаганнан соң да бу теорияне абсолют
һәм үзгәрешсез дип санамый. Ул теориянең үсәргә тиеш¬
леген әйтә һәм бу үсешнең теоретик белемнәр белән яңа
фактлар арасындагы каршылыкларны хәл итү юнәлешендә
барачагын алдан күрә.
13
Химик тезелеш теориясе, А. М. Бутлеров алдан әйткәнчә,
үзгәрешсез калмый. Аның киләчәк үсеше нигездә үзара
бәйле ике юнәлеш буенча китә.
Аның беренчесен А. М. Бутлеров үзе алдан ук әйтә. Ул бу
фән киләчәктә атомнарның молекулада үзара бәйләнеш тәр¬
тибен генә түгел, хәтта аларның пространствода урнашу тәр¬
тибен дә билгели алыр дип исәнли. Молекулаларның про-
странстволы тезелеше турындагы стереохимия тәгълиматы
фәнгә XIX гасырның 80 нче елларында килеп керә (грекча
«стереос» — пространство). Бу тәгълимат элекке теоретик кү¬
заллаулар кысасына сыймаган фактларны аңлатырга һәм
яңаларын алдан күрә белергә мәмкинлек бирде.
Икенче юнәлеш физикада XX гасырда үсеш алган атом¬
нарның электронлы төзелеше турындагы тәгълиматны орга¬
ник химиядә куллануга бәйле. Бу тәгълимат атомнарның
химик бәйләнеше табигатен аңларга, аларның бер-берләренә
йогынтысының асылы нәрсәдә булуын ачыкларга, матдәнең
теге яисә бу химик үзлекләренең сәбәбен аңлатырга мөмкин¬
лек бирде.
6. Матдәнең үзлекләре аның химик төзелешенә бәйле дигән химик
төзелеш теориясенең положениесен мисалларда аңлатыгыз.
7. Түбәндә ничә төрле матдәнең структур формулалары язылган?
Җавабыгызны аңлатып бирегез;
Н Н Н Н
I I
нссссн
I I
н н н н
н н
СНа-СН,-СН, H-i-6-H
I Н
Н-С-Н
н
н
I
СН,—С—СН,
СН,
н н н
I I I
н-с-с—с—н
I I I
н н н
СН,
сн2-сн2-сн3 снэ-с-н
СН, СН,
8. а) Сероводород, б) углерод (IV) оксиды, в) фосфат кислотасы
молекулаларында атомнарның үзара тоташу тәртибен структур форму¬
лаларда күрсәтегез.
*9. Нинди фәнни положениеләр һәм идеяләр химик төзелеш тео¬
риясе очен алшарт булып хезмәт иткән? Алар нинди галимнәр тара¬
фыннан әйтелгән?
14
§ 4. КЕЧКЕНӘ ПЕРИОДЛАРДАГЫ ЭЛЕМЕНТ
АТОМНАРЫНЫҢ ЭЛЕКТРОНЛЫ ТӨЗЕЛЕШЕ.
ХИМИК БӘЙЛӘНЕШ
Атом төзелеше турында сезгә билгеле кайбер мәгълү¬
матларны исегезгә төшереп үтик.
I Элемент атомындагы тискәре корылмалы электроннар
саны атом төшенең уңай корылмасына һәм химик элемент¬
ларның Д, И. Менделеев периодик таблицасындагы шул эле¬
ментның тәртин номерына тигез.
2. Атомнарда электроннар катлау-катлау булып урна-
'шалар; монда катлаулар саны таблицада элемент урнашкан
период номерына тигез.
3. Кечкенә периодлардагы элемент атомнарының тышкы
катлаудагы электроннар саны элемент урнашкан төркем
номерына тигез. (Моңа бер генә элемент буйсынмый. Кайсы
элемент ул? Аның үзгәлеге нидән гыйбарәт?)
4. Төш тирәли электроннар гаять зур тизлек белән хәрәкәт
итәләр; бу вакытта аларның хәрәкәтенең билгеле бер траек¬
ториясен күзәтергә мөмкин түгел. Пространствоныц элек¬
тро» булу ихтималлыгы зур булган өлкәсен электрон болы¬
ты дин атау кабул итенгән.
Хәзер без атомнарда электроннарның халәте һәм элек¬
троннарның сүрүләренең төзелеше турында күбрәк бе¬
лербез.
Электрон болытлары, ягъни электроннар булу мөмкин¬
леге зуррак булган өлкәләр, үзләренең формалары, үлчәм¬
нәре, пространство да юнәлешләре булу белән аерылалар. Без
моны беренче периодлар элементлары мисалында тикшереп
карыйк.
Водород атомының бердәнбер электроны хәрәкәт иткәндә,
тискәре корылган сферик (шарсыман) формалы болыт хасил
итә. Бу болытның иң тыгыз урыны төштән 0,053 им ерак¬
лыкта (1 пм = Ю 9 м). Сферик болыт барлыкка китерүче
электроннарны з-электроннар дип атыйлар. Водород ато¬
мында бер s-электроп бар.
Гелий атомында — ике s-электроп. Аларның болытла¬
ры бер үк торле (сферик) формада, иң тыгыз урыннары да
тоштэп бер үк ераклыкта. Бу исә аларның электрон болыт¬
лары бергә урнашалар һәм икс электронлы ургак бер болыт
хасил итәләр дигән сүз. Мондый электроннарны парлашкан
диләр.
15
Бер ук исемдә корылган электроннар бер-берсеннән
этелергә, бергә урнашмаска тиеш кебек күренә. Әгәр элек¬
троннар бер-берсеннән бер үзлекләре — спиннары төрле
булу белән аерылып торсалар, йЪндый берләшүнең булуы
мөмкин. Спин (инглизчә spin —орчык) — электронның үз
күчәре тирәсендә әйләнүе. Спиннары капма-каршы (төрле
юнәлешле) булган ике электрон гына бергә урнаша ала.
Литий атомының, 2 нчё периодтагы элементка хас бул¬
ганча, ике электрон катлавы бар. Беренче катлауны, гелий
атомындагы шикелле үк, парлашкан ике s-электрон тәшкил
итә. Өченче электрон үзеннән алдагы электроннар белән бергә
урнаша алмый. Ул да шулай ук сферик формадагы болыт
хасил итә, ләкин аның үлчәмнәре эчке ике электронлы болыт
үлчәмнәреннән шактый зур була. 2 нче периодтагы элемент
атомнарының икенче электрон катлавы нәкъ шул s-элек¬
троннан тулылана башлый. Безгә билгеле булганча, икенче
катлау электроны, беренче ике электронга караганда, төшкә
азрак тартыла һәм аны оксидлашу-кайтарылу реакциялә¬
ре вакытында башка атомнар үзләренә җиңелрәк тартып
алалар.
Бериллий атомының дүртенче электроны шулай ук
s-электрон. Аның сферик болыты өченче электрон болыты
белән бергә урнаша. Шулай итеп, бериллий атомының эчке
катламында парлашкан ике s-электрон һәм тышкы катла¬
вында да парлашкан ике s-электрон бар.
Бор атомының тышкы катлавында өченче электрон килеп
чыга. Ул үзеннән алдагы s-электроннар белән бергә урнаша
алмын. Бу электрон хәрәкәт иткәндә, күләмле сигезле яки
гантель формасындагы болыт хасил итә. Аның иң зур тыгыз¬
лыклы урыннары төшнең ике ягына таба симметрияле рә¬
вештә сузылып урнашкан (1 нче рәсем). Күләмле сигезле фор¬
масындагы болыт хасил итүче электроннарны р-электрон нар
дип. йвртэлэр.
Углерод атомының тышкы катлавындагы ике s электрон
һәм бер р-электрон белән бер рәттән тагын бер р-электрон бар.
s-Электроннардан аермалы буларак, бу электрон беренче
р-электрон белән уртак болыт хасил итми. Бу электрон, бер
үк исемдә корылган р-электрон болытыннан этелергә омты¬
лып, хәрәкәт иткәндә үзеннән алдагы электрон болытына
перпендикуляр юнәлгән күләмле сигезле рәвешендәге болыт
хасил итә. Димәк, углерод атомының тышкы катлавында
парлашкан ике s-электрон һәм парлашмаган ике р-электрон
16
1 иче рәсем. 2 иче периодның кайбер элементлары атомнарының
тезелеш схемасы (эчке ике электронлы катлау схемада күрсәтелмәгән).
бар; соңгыларының болытлары бер-берсенә перпендикуляр
урнашкан.
Азот атомының тышкы катлавындагы бишенче электрон
шулай ук р-электрон булырга тиеш дип алдан әйтә алабыз.
Ул да шулай ук башка р-электроннар белән бергә урнаша
алмый һәм башка ике р-электрон болытларына перпендику¬
ляр булган шундый ук формадагы болыт хасил итә. Шулай
итеп, аэот атомының тышкы катлавында парлашкан ике
s-электрон һәм парлашмаган өч р-электрон бар; күләмле
сигезле формасындагы соңгы электроннарның болытлары
үзара перпендикуляр. Күреп үткәнебезчә, электрон болыт¬
лары үзләренең үлчәмнәре, формалары һәм пространствода
юнәлеше белән дә бер-берләреннән аерылырга мөмкин. Азот
атомында парлашмаган өч р-электрон булу аның водород
белән реакциягә кергәндә өч валентлы булуын билгели.
Кислород атомындагы дүртенче р-электрон башка р-элек-
троннардан бертигез ераклыкта хәрәкәт итә алмый, чөнки
үзара перпендикуляр юнәлешләрнең берсе дә буш түгел.
Аның электрон болыты р-электроннарның берсенең болы¬
тына тәңгәл килә; ике р-электронның парлашкан электрон
болыты барлыкка килә. Шулай итеп, кислород атомының
тышкы катлавында парлашкан ике s-электрон, парлашкан
17
ике р-электрон һәм парлашмаган (сыңар) ике р-электрон бар.
Парлашмаган ике р-электрон булу кислородның ике валент-
лы булуын аңлата.
Фтор атомының төзелешенә килсәк, аның бишенче
р-электроны, инде сез үзегез дә нәтиҗә ясый аласыз, парлаш¬
мый калган бер р-электрон белән уртак болыт хасил итә,
нәтиҗәдә тышкы катлауда парлашмаган бер электрон кала
һәм ул фторның бер валентлы булуын билгели.
Неон атомының тышкы катлавындагы барлык электрон¬
нар да — ике 8-электрон һәм алты р-электрон парлашкан
булып чыга. Бу электрон катлавы тәмамланган санала һәм
ул матдәнең химик инертлыгын аңлата.
3 иче период элементлары атомнарының электрон төзе¬
леше нәкъ шундый ук. Натрий атомының өченче электрон
катлавында — бер s-электрон, магний атомында парлашкан
ике s-электрон бар, ә беренче р-электрон алюминий атомында
гына күренә һ. б. Бу периодның моннан соң килгән элемент¬
ларының атомнарында электрон сүрүләре ничек төзелгән¬
леген карап чыгыгыз.
Хәзер атомнар арасындагы химик бәйләнеш турында алган
белемнәребезне искә төшереп кабатларга һәм тулыланды¬
рырга кирәк.
Ике төрле химик бәйләнештән (ионлы һәм ковалент) орга¬
ник кушылмаларга бигрәк тә ковалент бәйләнеш хас.
Химик тәэсир итешү вакытында ике атом бер-берсенә
якынлашканда, бер атомның электрон болытын икенче атом¬
ның төше, ә икенче атомның электрон болытын беренче
атомның төше тарта башлый. Нәтиҗәдә электрон болытлары
бер-берсен өлешчә канлый (уңай корылган атом төшләренең
бер-береннән этелүе атомнарның ныграк якынаюына кома¬
чаулый) һәм ике электрон болытыннан ике атом өчен уртак
ике электронлы бер молекуляр болыт ясала (2 нче рәсем, А)1.
Төшләр арасындагы пространствода бу болытның тыгызлыгы
зуррак була. Электроннарның ике төш кырында хәрәкәт
итүе һәм алар арасындагы пространствода электрон болы¬
тының куеруы молекулада тартылу көчләренең артуына ки¬
терә, һәм шул чакта энергия аерылып чыга. Барлыкка кил¬
гән молекулаларның энергия запасы аерым атомнарны¬
кына караганда азрак булу сәбәпле, молекула аларга кара¬
ганда тотрыклырак була.
1 Химик бәйләнешне капма-каршы спинлы электроннар тәшкил
итәләр.
18
2 нче рәсем. Бәйләнешләр ясалганда электрон болытларының
аралашу схемасы:
A — s- һәм в-электроннар; Б — в һәм р-алек трон нар; В — р- һәм р-электронвар.
Атомнар тоташканда аларның электрон болытлары
бер-берсен никадәр күбрәк капласа, энергия шулкадәр күбрәк
аерылып чыга һәм химик бәйләнеш тә шулкадәр ныграк
була.
2 нче рәсемдә (А) s-электрон болытлары бер-берсен кап¬
лаганда, ковалент бәйләнеш барлыкка килүе күрсәтелгән.
Мондый бәйләнешләр s- һәм р-электрон болытлары, р- һәм
р-электрон болытлары бер-берсен каплаганда, мәсәлән, НС1
һәм С12 молекулалары барлыкка килгәндәге кебек (2 нче
рәсем, Б һәм В) урнашырга мөмкин.
Нинди атомнарның үзара тәэсир итешүенә карап, кова¬
лент бәйләнеш барлыкка килү картинасы беркадәр үзгәрә.
Әгәр бер үк элемент атомнары үзара тоташса, электрон болыт¬
ларының каплану өлкәсе (электрон тыгызлыгы зуррак бул¬
ган өлкә) төшләр арасында симметрияле булып урнаша, һәм
бәйләнеш поляр булмый.
Әгәр ковалент бәйләнеш электртискәрелеге төрлечә бул¬
ган элемент атомнары арасында урнашса, мәсәлән, хлоро¬
водород барлыкка килгәндә, электрон болытларының бер-
берсе белән каплану өлкәсе электртискәрерәк атом төшенә
таба авыша. Нәтиҗәдә атомнарның берсендә электроннар
азрак булып кала һәм шуның өчен ул (төш корылмасы исә¬
бенә) өлешчә уңай корылма ала, ә икенчесе, электроннары
артыграк булу сәбәпле (төш корылмасы белән чагыштыр¬
ганда), өлешчә тискәре корылма ала. Мондый ковалент бәй¬
ләнеш поляр бәйләнешкә әйләнә. Ләкин монда (ионлы бәйлә¬
неш ясалгандагы кебек электронның бер атомнан икенчесенә
тулысынча күчмәве, бары бераз авышуы аркасында) тулы
корылмалар түгел, бәлки өлешчә корылмалар хасил булуын
2* 10
истә тотарга кирәк. Өлешчә корылмаларны 5+ Һәм 6- хәреф¬
ләре белән тамгалау кабул ителгән. Шулай булгач, хлорово¬
дород молекуласында электроннар тыгызлыгының урнашуы
6+ 6-
һәм молекулада бәйләнеш характеры Н—CI формуласы белән
күрсәтелер. Кайчакта химик бәйләнешнең электроннар ты¬
гызлыгы авышуын ук белән генә күрсәтәләр: Н —С1. Шуннан
чыгып, С — С1 ковалент бәйләнешенең электроннар тыгыз¬
лыгы кайсы якка авышуын һәм бу очракта атомнарның
элешчә корылмалары1 ничек урнашуын күрсәтегез.
Без атомнар арасында ковалент бәйләнешнең ничек яса¬
луын каран уздык. Ләкин химик реакцияләр вакытында бер¬
төрле бәйләнешләр өзелә, һәм яңа бәйләнешләр ясала.
Ковалент бәйләнешләрнең өзелүе төрлечә булырга мөм¬
кин!
А1:В—А +В А:;Н -А+В’
Af!JB — А» + В-
Беренче Һәм икенче очракларда химик бәйләнешне тәш¬
кил иткән пар электроннар молекуланың бер өлешендә бөтен
килеш кала (бәйләнешнең симметриясез өзелүе), Валент
лык электронының бер атомнан икенчесенә тулысынча күчүе
нәтиҗәсендә, бер кисәкчек — уңай корылган ионга, ә икен¬
че кисәкчек тискәре корылган ионга әверелә. Өзелүнең
өченче очрагында парлашкан электрон аерыла (симметрияле
өзелү). Нәтиҗәдә молекула нейтраль кисәкчекләргә таркала.
Һәм кисәкчекләрнең һәркайсында берәр парлашмаган (сы¬
ңар) электрон кала.
ф Сыңар электроны булган кисәкчекләрне ирекле ради¬
каллар дип атыйлар.
Гадәттә, алар бик тотрыксыз, химик яктан гаять актив
булалар һәм тиз арада тотрыклы молекулага әвереләләр,
ф Шулай итеп, гомумиләштереп болай дип әйтә алабыз: ко¬
валент бәйләнеш бер берсеннән үзгә ике торле ысул белән —
ион ясалу һәм ирекле радикаллар ясалу белән взелэ ала. Теге
яисә бу реакция вакытында бәйләнешләрнең кайсы ысул
белән өзелүе атомнарның табигатенә һәм реакция шартла
рына бәйле. Боларның барысын да соңрак конкрет мисал¬
ларда тикшерербез.
1 Атомнарда өлешчә корылмалярпың санча кыйммәтләре турында
tO.1S o.1B +о.33 -0.ee
түбәндәге мисалдан чыгып фикер йөртергә мөмкин: HCI, Н4О.
20
10. Хлор атомының электрон катлаулары төзелешен аңлатыл
бирегез.
11. Нинди элемент атомының өченче электрон катлавында ике
з электрон һәм ике р-электрон бар? Бу электроннар парлашканмы,
юкмы? Электрон катлавының схемасын 1 нче рәсемдә күрсәтелгәнчә
сурәтләгез.
12. а) Углерод, б) кислород, в) азот атомнарының тышкы электрон
катлауларының төзелеш схемасын, андагы s- һәм р-электроннарны
күрсәтеп, дәреслектәге рәсемгә карамыйча гына сурәтләгез.
13. а) Углерод һәм азот, б) кислород һәм күкерт атомнарының
электронлы төзелешендә нинди уртаклык һәм нинди аерма бар?
14. Кислород атомы электрон болытларының водород атомы элек¬
трон болытлары белән аралашуын күрсәтеп, су молекуласының төзе¬
леш схемасын сурәтләгез.
15. Бромоводород молекуласы мисалында ковалент бәйләнешнең:
а) ионлы, б) ирекле радикаллы өзелүен күрсәтегез. Неорганик химия
курсыннан сезгә билгеле реакцияләрдә бәйләнеш өзелүнең бу ике төре
сезгә очрадымы?
16. Метан молекуласында С—Н бәйләнешенең берсенең ирекле
радикаллы өзелү схемасын сурәтләгез. Барлыкка килгән углеводород
радикалында ничә электрон булыр?
2. ЧИКЛЕ УГЛЕВОДОРОДЛАР
Органик кушылмаларны өйрәнүне без бары тик ике генә
химик элементтан — углерод һәм водородтан торган, гаять
күп матдәләрне эченә алган углеводородлар классыннан баш¬
ларбыз. Барлык углеводородларның составын гомуми рә¬
вештә С„НОТ формуласы белән күрсәтергә мөмкин. Углеводо¬
родларның берничә төркеме (рәте) бар. Иң элек чикле угле¬
водородлар белән танышырбыз. Югарыда сөйләнгән метан,
этан, пропан, бутан нәкъ менә шундыйлардан санала. Таби¬
гатьтә чикле углеводородлар нефть һәм янучан табигый
газлар составына керә.
§ 5. МЕТАН, АНЫҢ ТӨЗЕЛЕШЕ
Матдәләрнең чикле углеводородлар төркеменә керү-кер-
мәве аларның төзелеш үзенчәлекләре белән билгеләнә. Башта
иң гади төзелешле углеводородны — метанны тикшереп ка¬
рарбыз.
Метан СН4 — иссез һәм төссез газ, һавадан ике тапкыр
диярлек җиңелрәк (исәпләү юлы белән моны исбат итегез).
Ул табигатьтә үсемлек һәм хайван калдыклары һавасыз
шартларда таркалганда барлыкка килә. Шуңа күрә ул саз¬
лы сулыкларда, ташкүмер шахталарында очрарга мөмкин.
Метанның иң күбе хәзер көнкүрештә һәм производствода
ягулык итеп файдаланыла торган табигый газда.
Метан молекуласында водород атомнары белән углерод
атомнары арасындагы химик бәйләнеш ковалент характерлы
була.
Әгәр бәйләнешләр ясалганда бер-берсе белән аралашучы
электрон болытларын ике нокта яки валентлык сызыкчасы
белән билгеләсәк, метанның төзелешен түбәндәге (электрон¬
лы яки структуралы) формулалар белән күрсәтергә мөмкин:
Н *1
Н:С:Н яки н-с-н
н А
22
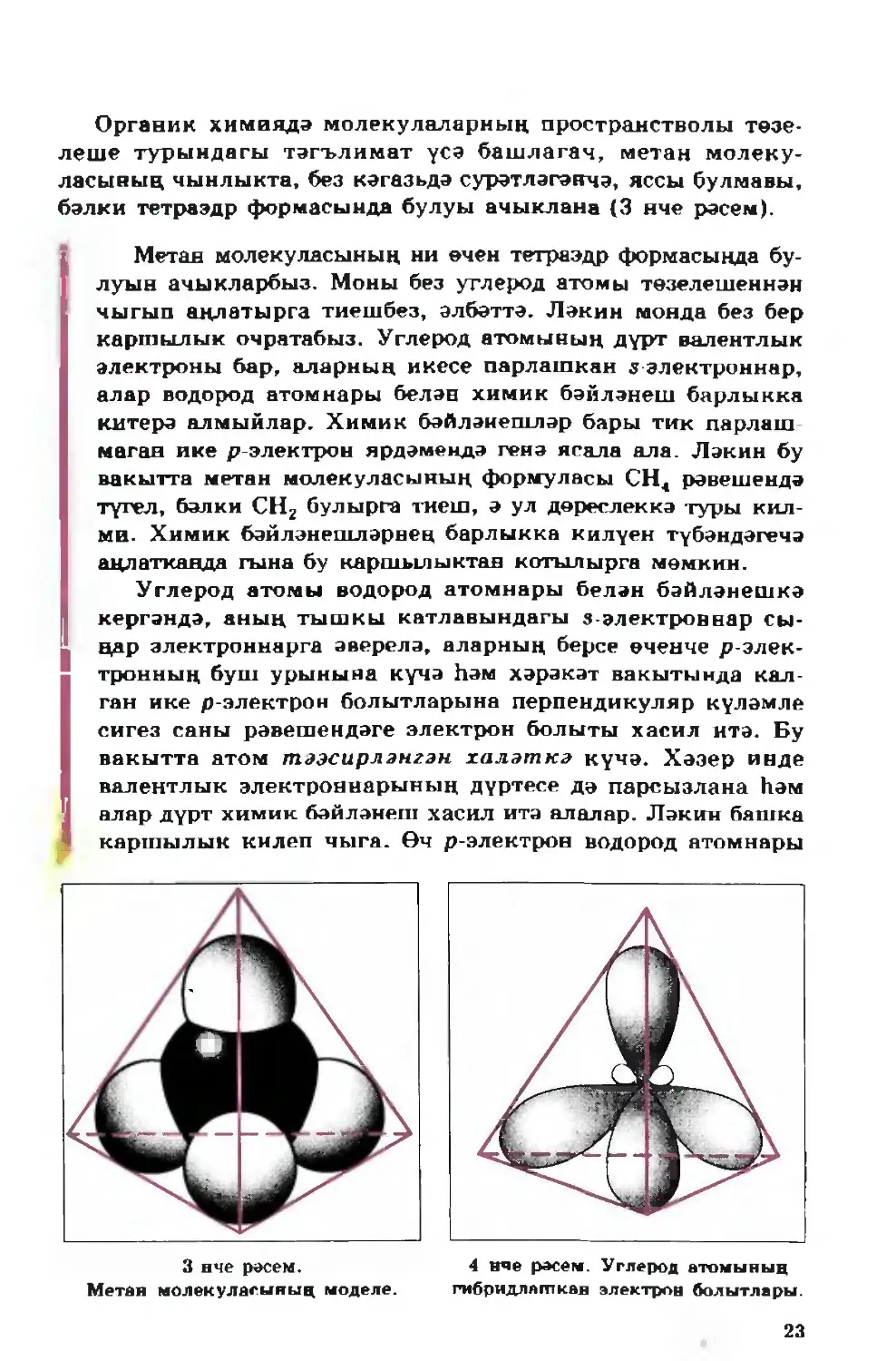
Органик химиядә молекулаларның пространстволы төзе¬
леше турындагы тәгълимат үсә башлагач, метан молеку¬
ласының чынлыкта, без кәгазьдә сурәтләгәнчә, яссы булмавы,
бәлки тетраэдр формасында булуы ачыклана (3 нче рәсем).
Метан молекуласының ни өчен тетраэдр формасында бу¬
луын ачыкларбыз. Моны без углерод атомы төзелешеннән
чыгып аңлатырга тиешбез, әлбәттә. Ләкин монда без бер
каршылык очратабыз. Углерод атомының дүрт валентлык
электроны бар, аларның икесе парлашкан з электроннар,
алар водород атомнары белән химик бәйләнеш барлыкка
китерә алмыйлар. Химик бәйләнешләр бары тик парлаш¬
маган ике р-электрон ярдәмендә генә ясала ала. Ләкин бу
вакытта метан молекуласының формуласы СН4 рәвешендә
түгел, бәлки СНг булырга тиеш, ә ул дөреслеккә туры кил¬
ми. Химик бәйләнешләрнең барлыкка килүен түбәндәгечә
аңлатканда гына бу каршылыктан котылырга мөмкин.
Углерод атомы водород атомнары белән бәйләнешкә
кергәндә, аның тышкы катлавындагы s-электроннар сы¬
ңар электроннарга әверелә, аларның берсе өченче р-элек-
тронның буш урынына күчә һәм хәрәкәт вакытында кал¬
ган ике р-электрон болытларына перпендикуляр күләмле
сигез саны рәвешендәге электрон болыты хасил итә. Бу
вакытта атом тәэсирләнгән халәткә күчә. Хәзер инде
валентлык электроннарының дүртесе дә парсызлана һәм
алар дүрт химик бәйләнеш хасил итә алалар. Ләкин башка
каршылык килеп чыга. Өч р-электрон водород атомнары
3 нче рәсем.
Метан молекуласының моделе.
4 нче рәсем. Углерод атомының
гибридлапткав электрон болытлары.
23
белән үзара перпендикуляр, ягъни 90° лы почмак ясап
юнәлгән өч химик бәйләнеш хасил итәргә тиеш, ә водо¬
родның дүртенче атомы, з-электронның болыты сферик
формада булу сәбәпле, теләсә кайсы юнәлештә кушыла
алыр иде. һәм бу бәйләнешләр, ихтимал, үзлекләре буенча
аерылырлар иде. Ләкин, билгеле булганча, метан молеку¬
ласындагы барлык С—Н бәйләнешләре бер үк төрле һәм
алар арасындагы почмак 109°28'. Бу каршылыкны хәл
итәргә электрон болытларының гибридлашуы турындагы
күзаллаулар ярдәм итә.
Химик бәйләнешләр ясалу процессында углерод ато¬
мының барлык валентлык электроннарының болытлары
(бер з- һәм өч р-электрон) тигезләшә, бертөрле булып кала
(4 нче рәсем). Бу вакытта аларның барысы да тетраэдр
түбәсенә таба сузылган симметриясез күләмле сигезле фор¬
масын ала (электрон тыгызлыгының симметриясез таралып
урнашуы, электронның төшнең бер ягында булу мөмкин¬
леге икенче ягындагыга караганда күбрәк икәнен күрсәтә).
Гибридлашкан электрон болытларының күчәрләре ара¬
сындагы почмак 109"28' ка тигез, бу исә аларга, бер үк
исемдә корылганлыктан, бер-берсеннән максималь ерак¬
лашырга мөмкинлек бирә. Тетраэдр түбәләренә таба су¬
зылган хәлдә мондый болытлар водород атомнарының
электрон болытлары белән шактый аралата алалар, ә бу
инде энергиянең күбрәк аерылып чыгуына һәм үзлекләре
бер үк төрле булган ныклы химик бәйләнеш ясалуга ки
терә (5 нче рәсем, А).
5 нче рәсем. Метан молекуласында ковалент хнмпк бәйләнешләр:
углерод атомының электрон болытлары белән водород
атомнарының электрон болытлары аралашуы (А>;
С—Н бәйләнешләрендә уртак электрон болытлары ясалу (Б),
24
Төрле сандагы электрон болытлары гибридлашырга
мөмкин. Углерод атомы дүрт водород атомы белән ко¬
валент бәйләнеш хасил иткән очракта, гибридлашуда
тәэсирләнгән атомның тышкы катлавындагы барлык дүрт
электронының да болытлары: бер s-электрон Һәм өч
р-электрон болытлары катнаша. Шуңа күрә гибридла-
шуның бу төрен зр3-гибридлашу дип атыйлар (ул эс-пэ-өч
дип укыла).
Шулай итеп, метан молекуласының тетраэдрик форма¬
сы химик кушылмада углерод атомының гибридлашкан
дүрт электрон болыты тетраэдр түбәләренә таба юнәл¬
гәнлектән була.
Ковалент бәйләнешләр барлыкка килгәндә, электроннар
үзара бәйләнгән ике атомның да төшләрен чолгап алган
уртак болытлар тәшкил итү сәбәпле, метан молекула¬
сының электронлы төзелешен 5 нче рәсемдә (Б) күрсә¬
телгәнчә дә сурәтләргә мөмкин.
Алмазның төзелешен искә төшерик. Анда углеродның
һәр атомы башка дүрт углерод атомына ныклы ковалент
бәйләнеш ярдәмендә тетраэдр үзәгеннән аның түбәләренә
таба юнәлештә тоташкан. Без алмазның төзелешен атом¬
ның валентлык электрон болытларының $р3-гибридла-
шуыннан чыгып аңлата алабыз.
Органик матдәләрне өйрәнгәндә, без еш кына молекула
модельләреннән файдаланырбыз. 3 нче рәсемдә метан мо¬
лекуласының масштаблы моделе күрсәтелгән. Модельнең
элемент атомнарын сурәтли торган детальләре билгеле бер
масштабта эшләнә, шуңа күрә модель
тырмача зурлыкларын һәм молеку¬
ланың тетраэдрик формасын дөрес
чагылдыра. 6 нчы рәсемдә молекула¬
ның шарлы-таякчыклы моделе сурәт¬
ләнгән. Анда атомнарны чагылдырган
детальләр бер-берсеннән берникадәр
ераклыкта валентлык бәйләнешен
символлаучы таякчыклар ярдәмендә
тоташтырылган. Мондый модель кай¬
сы атомнарның кайсылары белән тота¬
шуын күз алдына китерергә мөмкин¬
лек бирә, ләкин ул молекуланың ча¬
гыштырмача үлчәмнәрен дә, тышкы
формасын да чагылдырмый.
атомнарның чагыш-
6 нчы рәсем. Метан
молекуласының
шарлы-таякчыклы
моделе.
25
Шарлы-таякчыклы модель нигезендә молекуладагы
атомнар бер-берсеннән шактый еракта урнашканнар дип
уйларга мөмкин. Чынлыкта исә ул алай түгел, әлбәттә.
Белгәнебезчә, атомнар бер-берсенә турыдан-туры орынып
торганда гына (тышкы электроннар тәэсир итешкән¬
дә) алар арасында химик тәэсир итешү булырга мөмкин.
Мондый модельләрдән файдаланганда ялгышлык килен
чыкмасын өчен, шарларны атомнар итеп түгел, бәлки атом
үзәкләре, ягъни атом төшләре итеп күз алдына китерергә,
ә алар арасындагы пространством шарларны бер-беренә
тоташтырган таяклар юнәлешендәге химик бәйләнешне
тәшкил итүче электрон болытлары тулган дип исәпләргә
кирәк.
1. Метанда углерод һәм водородның масса өлешләрен (күңелдән)
исәпләгез.
2. Газ хәлендәге матдәләрне: азот, метан, водород, пеон һәм кисло¬
родны (бер үк шартларда) тыгызлыклары арта бару тәртибендә бер
рәткә языгыз.
*3. Метан молекуласының тетраэдрик төзелешеп пичек аңлатырга?
§ 6. МЕТАН РӘТЕНДӘГЕ УГЛЕВОДОРОДЛАРНЫҢ
ТӨЗЕЛЕШЕ ҺӘМ НОМЕНКЛАТУРАСЫ
Углеводородларның төзедеме. Табигый газда Һәм бигрәк
тә нефтьтә төзелеше һәм үзлекләре метанныкына охшаган
башка бик күп углеводородлар бар. Аларның кайберләре
турында мәгълүматлар 1 нче таблицада күрсәтелгән. Алар¬
ның исемнәренә һәм фнэик үзлекләренә игътибар итегез.
1 нче таблица. Чикле углеводородлар (тармакланмаган төзелешле)
Углеводе
родның
исеме
Молекуляр
формуласы
Төзелеш формуласы
Температура (°C да)
эрү
кайнау
Метан
сн4
сн4
-182
162
Этан
С2Н€
СН2-СН3
-183
-89
Пропан
С3Н„
снэ—сн2— сн3
-187
-42
Бутан
сн3—сн2—сн2—сн3
-138
-0,5
Пентан
C5HIZ
СНа—(СН2)3—сн3
-130
+36
Гексан
с6н14
СН3—(CH2)4—СН3
-95
+69
Гептан
С,Н|,
СНЯ—(CH2)S—СНЭ
-91
+98
Октан
СвН|в
СН,-(СНЛ-сня
-57
+-126
Нонан
СНЯ—(СН2)7—сн,
-54
+151
Декан
CioH22
СНЯ-(СН3Ь-СН-
-30
+•174
һ.б.
26
Бу рәттәге беренче дүрт матдәнең исемнәре тарихи.
Ә инде пентамнан башлан матдәләрнең күбесенә исем саннар¬
ның грекча исемнәреннән чыгып бирелгән.
Барлык чикле углеводородларны исемләү өчен уртак -ан
кушымчасы кулланыла.
Таблицада китерелгән мәгълүматлардан матдәнең чагыш¬
тырма молекуляр массасы арту белән углеводородларның
эрү һәм кайнау температураларының эзлекле рәвештә арта
баруы күренә. Беренче дүрт матдә —С4) гадәттәге шартлар¬
да — газлар; аннан соңгы унбер углеводород (С5—С15)—сыек¬
лыклар; С16Н31 углеводородыннан башлап — каты матдәләр.
Барлык чикле углеводородлар суда эремиләр, ләкин орга¬
ник эреткечләрдә эри алалар.
Матдәләрнең молекуляр формулаларын караганда, без
рәтнең бер вәкиленнән икенчесенә күчкәндә молекула соста¬
вының даими рәвештә СН2 атомнары группасына (бу группа
метилен дип атала) үзгәрүен күрәбез. Һәр молекуладагы
углерод атомнарының санын п дип билгеләсәк, бу углеводо¬
родларның составын гомуми формуласы белән күрсә¬
тергә мөмкин.
Молекулада углерод атомнары санын белгән хәлдә,
матдәнең молекуляр массасын җиңел табып була. Мәсә¬
лән, әгәр молекулада биш углерод атомы булса, молекуляр
масса Мг - 12-5 + 2 • 5 + 2 = 72. Һәм, киресенчә, чикле
углеводородларның молекуляр массасын белгәндә, гомуми
формула буенча аның молекуляр формуласын билгеләргә
мөмкин. Мәсәлән, әгәр Л/г=100 булса, бер билгесезле
тигезләмәне чишеп: 100= 12п + 2л + 2, п - 7 икәнен та¬
бабыз, димәк, улеводородның формуласы С7Н|в.
Составның микъдари үзгәрешләре нәтиҗәсендә яңа матдә¬
ләр ясалу күренешен без химиядә һәрвакыт очратабыз. Мә¬
сәлән, кислород белән озон, азот оксидлары һәм углерод
оксидларының молекулалары составындагы һәм үзлеклә¬
рендәге аерманы исегезгә төшерегез. Углеводородлар миса¬
лында бу күренеш бигрәк тә ачык чагыла. «Химияне состав¬
ның микъдари үэгәрешләреннән барлыкка килгән җисем¬
нәрнең сыйфат үзгәрешләре турындагы фән дип атарга мөм¬
кин» (Ф. Энгельс).
A. М. Бутлеров теориясен өйрәнгәндә чикле углеводород¬
ларның химик төзелеше белән без танышкан идек инде.
Углеводородлар рәтендә бер үк составлы төрле матдәләр булу
мөмкинлеген булдыручы изомерия күренеше, ягъни моле-
27
7 нче рәсем. Пропан һәм бутан молекулаларының модельләре.
кулаларының углерод скелеты изомериясе хас булуы да бил¬
геле. Бу кушылмаларның пространстволы һәм электронлы
төзелешләрен тикшереп карыйк.
7 нче рәсемдә пропан һәм бутан молекулаларының мо¬
дельләре күрсәтелгән. Без монда углерод атомнарының
структур формулаларда язылганча туры сызык буенча түгел,
бәлки сынык сызык ясап урнашуын күрәбез. Моның сәбә¬
бе — углерод атомнарының валентлык бәйләнешләре тетраэдр
буйлап юнәлгән булуында.
Бер углерод атомына икенче углерод атомы тоташкан дип
күз алдына китерик. Бу соңгысының өч ирекле валентлыгы
кала, ал арның барысы да тетраэдр түбәләренә таба юнәлгән.
Икенче углерод атомы шул юнәлешләрнең бары берсенә генә
тоташа ала. Бу очракта углерод чылбыры һәрвакыт сынык
сызык формасын ала. Мондый чылбырда углерод атомнарын
тоташтырган ковалент бәйләнешләр арасындагы почмак, ме¬
тан молекуласындагы кебек үк, 109°28' ка тигез.
Углерод атомнарының сынык сызык рәвешендәге чыл¬
быры төрле пространстволы формаларга керә ала. Бу хәл
молекулада атомнарның химик бәйләнеш тирәсендә ирекле
әйләнә алуларына бәйле. 8 нче рәсемдә (А) күрсәтелгәнчә,
пентан молекуласы моделен җыегыз, һәм дүртенче атомны,
аны өченче атомга тоташтыра торган күчәр әйләнәсендә,
180° ка борыгыз. Углерод чылбыры бик нык бөгелгән хәлгә
килер (8 нче рәсем, Б). Әгәр тагын икенче атомны да нәкъ
шулай ук борсак, молекула балдаксыман диярлек формага
керер (8 нче рәсем, В). Молекулаларда мондый әйләнү җылы¬
лык хәрәкәте нәтиҗәсендә булып тора (әгәр моны тоткарлый
торган факторлар булмаса). Атомнар бер-берсеннән иң ерак
торган А формасы энергетик яктан иң уңайлысы булып са¬
нала. Ләкин бу формалар бер-берсенә бик җиңел күчә ала.
28
8 вче рәсем. н-Певтан
молекулаларыпын модельләре.
шуның белән бергә аларның химик төзелеше (молекулалар¬
да атомнарның бәйләнеш тәртибе) үзгәрешсез кала һәм бер
генә формула белән күрсәтелә: СН3—СНг—СН2—СНг—СНЯ.
Углерод атомнарының бер-берсенә тоташып, озын чыл¬
быр хасил итә алу үзлеге аның химик элементларның
Д. И. Менделеев периодик системасындагы урыны һәм
атомнарының төзелеше белән аңлатыла.
Углерод икенче кечкенә периодта урнашкан һәм
IV төркем элементларының төп төркемчәсе башында то¬
ра. Аның атомының радиусы артык зур түгел, атомның
тышкы электрон катлавында дүрт электроны бар. Химик
реакция вакытында углерод атомының валентлык элек¬
троннарының дүртесен дә тулысынча аерып алу, шулай
ук тулы октет ясалганчы башка атомнардан аңа шулкадәр
үк электроннар кушу кебек
үк, бик читен. Шуңа күрә уг¬
лерод бөтенләй диярлек ион¬
лы кушылмалар хасил итми.
Ләкин ул ковалент бәйлә¬
нешләрне бик җиңел бар
дыкка китерә. Ковалент бәй¬
ләнеш урнашканда, аның
электроннарны бирү Һәм тар¬
тып алу үзлекләре бертөрле
диярлек булганлыктан, мон¬
дый бәйләнешләр углерод
атомнары арасында да бар¬
лыкка килә (9 нчы рәсем).
Ковалент бәйләнешләр бар¬
лыкка килгәндә бер-берсе белән
аралашучы электрон болытла¬
рын, элеккеге кебек үк. ике
нокта белән билгеләсәк, чикле
углеводородларның электрон¬
лы формулаларын, мәсәлән,
шулай күрсәтергә мөмкин:
н н н н
Н:С:С:С:С:Н
н н н н
Бу формулалар аларның сы¬
нык сызык рәвешендәге төзе¬
лешен чагылдырмый.
29
9 вчы ртсем. Углерод атомнары арасында ковалент бәйләнеш ясалу.
Бәйләнешләр өзелгәндә углеводород молекулалары ирекле
радикалларга әверелә алалар. Молекуладан бер водород ато¬
мын аерып алганда, алар бер сыңар электроны булган бер
валентлы радикал хасил итәләр, мәсәлән!
н н
Н:С:С«
н Н
яки
Н Н
I I
н—с—с—
I I
н н
Мондый радикалларның исемнәре үзләренә тиңдәш угле¬
водородларның исемнәрендәге ан кушымчасын ил кушым
часына алыштырып ясала! метил СН3—, этил C2HS—, про
пил СаН2— һ. 6.
Реакция процессында радикаллар ясалуы һәм бигрәк тә
аларның органик матдәләр составында булуы белән (бу оч¬
ракта алар ирекле радикаллар дип аталмыйлар) без алга таба
органик химияне өйрәнгәндә еш очрашырбыз.
Углеводородларның тезелешен белгәндә, аларның физик
үзлекләренең молекуляр массага ничек бәйләнгән булуын аң¬
ларга мөмкин. Углеводород чылбыры озынайган саен моле¬
кулалар арасындагы тартылу көчләре дә арта бара, һәм бу
көчләрне җиңү, ягъни матдәне эретү яки кайнату өчен һаман
саен югарырак температура таләп ителә. Физик үзлекләр
молекулаларның пространстволы төзелешенә дә бәйле. Мәсә¬
лән, атомнары тармакланган чылбыр тәшкил иткән углеводо¬
родлар, аларның тармакланмаган изомерларына караганда,
түбәнрәк температурада кайныйлар. Бутан һәм изобутанның,
нормаль төзелешле пентан һәм аның ике изомерының кай¬
нау температураларын чагыштырып, моңа бик җиңел ыша¬
нырга мөмкин (12 нче бит).
30
Бу күренешне түбәндәгечә аңлатырга мөмкин. Тармак¬
ланмаган төзелешле молекулалар тармакланган төзел еш-
леләренә караганда бер-берсенә якынрак урнашкан һәм
үзара көчлерәк тәэсир итешәләр, шуңа күрә молекулалар
арасындагы көчләрне җиңү өчен беренче очракта ныграк
җылыту сорала; молекулалар никадәр күбрәк тармаклан¬
ган булса, молекулалар арасындагы үзара тәэсир итешү
шулкддәр кимрәк һәм кайнау температурасы да шулкадәр
түбәнрәк була.
Углеводородларның номенклатурасы. Изомерия күренеше
белән танышканнан соң, безгә моңа кадәр файдаланып кил¬
гән исемнәр генә җитми башлый. Мәсәлән, матдәне пентан
(12 нче бит) дип атаганда, без аның кайсы изомеры турында
сүз баруын күрсәтмибез. Углерод скелетының ничек төзе¬
лүенә карап, изомер матдәләрнең үзләренә аерым исем бирү
кирәклеге туа.
Органик кушылмаларны исемләүнең төрле системалары
бар. Химикларның халыкара киңәшмәләрендә халыкара
систематик номенклатура эшләнде. Нормаль төзелешле
(тармакланмаган) углеводородларның исемнәре: метан, этан,
пропан, бутан, пентан һ. б. номенклатураның нигезе итеп
алына.
Тармакланган чылбырлы углеводородның исемен төзү
өчен, аны нормаль углеводородта водород атомнары уг¬
леводород радикалларына алмаштырылган продукт итеп
карыйлар. Гамәл тәртибе монда түбәндәгечә булырга мөм¬
кин:
а) структур формулада углерод атомнарының озынрак
чылбырын аерып алалар һәм тармаклануга якынрак торган
очыннан башлап бу углерод атомнарына номерлар сугып
чыгалар;
б) алмаштырылган группаның (радикалның) кайсы угле¬
род атомы янында булуын матдәнең исемендә цифр белән
билгелиләр;
в) алмаштырылган группалар берничә булса, аларның
һәркайсын цифрлар белән күрсәтеп чыгалар;
г) тармаклану төп чылбырның очларыннан бертигез ерак¬
лыктагы углерод атомнарыннан башланганда, номерлауны
чылбырның гадирәк төзелешле радикалы якынрак урнашкан
очыннан башлыйлар.
31
Моны сез түбәндәге мисалларда
1 2 3 *
CH,-CH—CHj-CH,
CH,
ЗМстмлбутАн
■ 2 3 4 5
сн,—сн—сн—снг—сн3
сн, сн,
2.3-Димепа«осптая
күрә аласыз:
сн,
I 2 | 1
СНЭ- C-CH,
СН,
2,2-Лимети^проо«в
I 2 3 4 5 6
СН,—СН—СН,—СН—СН,—СН,
сн, сгн5
2 Мегил-4 х«яг*нсб«
Нормаль төзелешле углеводородларны билгеләү өчен, исе¬
ме алдыннан н хәрефе куялар: н-бутан, я-гексан һ. б.
4. Углерод чылбырының сынык сызык рәвешендә тезелүен элек¬
трон теориясе нигезендә ничек аңлатырга?
5. Чикле углеводородлар рәтендәге матдәләрнең физик үзлекләре
ничек үзгәрүен мисаллар белән күрсәтегез. Углеводород молекула¬
сындагы атомнар саны белән аларның берәр физик үзлеге арасындагы
бәйлелек не күрсәткән график сызыгыз.
6. Молекулалары составында: а) унсигез углерод атомы, б) егерме
бер углерод атомы, в) егерме сигез водород атомы булган метан рәтен¬
дәге углеводородларның молекуляр формулаларын тезегез.
7. Формулалары түбәндә китерелгән матдәләрнең кайсылары
чикле углеводородларга керә: С2Н4. CjHh, СюНм, СлНл, С12Н24?
8. Молекуласында: а> унике углерод атомы, б) утыз водород атомы
булган чикле углеводородның молекуляр массасын табыгыз.
9. Молекуляр массасы: а) 86, 6> 142 булган чикле углеводородның
молекуляр формуласын языгыз.
10. Түбәндәге формулалар беләгү ничә матдә күрсәтелгән:
/ СН,
СН,—СН—СН,—СН, СН,—СН,—СН,—СН, /СН—сн,
СН, Снз
*11. м-Гексанның барлык изомерларының структур формулаларын
тезегез.
12. Формулалары түбәндә китерелгән матдәләрнең кайсылары
изомерлар булуын күрсәтегез:
СН,
I
СН,—СН,—CH—СН, СН,—СН—СН, СН,—С—сн,
J £ Ла J J J
I !
сн, сн, сн,
сн,—сн,—сн2—сн—сн, сн,-снг—снг-сн, сн,
сн3
32
СН,
СН, СН2—СН,-СН, сн3—сн—с—сн3
СН3 СН,
13. а) N Пентанның C»H|g> б) изобутанның СН,—СН—СН,
электронлы формулаларын сурәтләгез. 3
*14. Түбәндәге формулалар белән күрсәтелгән матдәләрнең исем¬
нәрен систематик номенклатура буенча әйтегез:
СН,
а) СН,—СН—СН, в) СН3—С—СН,—СН,
СН3 СН3
б) СН,—СН—СН—СН, г) СН,—СН—СН,—СН,—СН,
СН, СН, СН,—СН,
*15. а) З-Этилгептанның; б) 2,4 диметилгексанның; в) 2-метил-З-
этил гептанның; г) 3-метил-5-әтилгептанның структур формулаларын
тезегез.
16. Массасы буенча 82,8% углеродтан һәм 17,2% водородтан тор¬
ган, нормаль шартларда тыгызлыгы 2.59 Г/л булган матдәнең молеку¬
ляр формуласын табыгыз.
*17. Кайсы углеводородның—ч-гексанныңмы әллә аңа изомер булган
2.2 диметилбутанныңмы кайнау температурасы югарырак һәм ни
өчен?
■ Пластилиннан яки башка материалдан к гексан молекуласының моде¬
лен ясагыз Һәм аны бер бер артлы үзгәртүләр юлы белән изомер угле¬
водородлар молекулаларының модельләрен ясагыз.
§ 7. ЧИКЛЕ УГЛЕВОДОРОДЛАРНЫҢ ХИМИК ҮЗЛЕКЛӘРЕ
Химик үзлекләре. Углеводородлар һавада явалар. Һәм
янганда бик күп микъдарда җылылык аерылып чыга. Метан¬
ның януы түбәндәге тигезләмә белән күрсәтелә:
СН4 + 20, СО, + 2Н,0 + 880 кДж'
Яну продуктларын тикшереп, метанда углерод һәм водо¬
род барлыгын расларга мөмкин. Пыяла цилиндрга җыелган
1 Органик химиядә реакция тигезләмәләре төзегәндә тигезлек бил¬
гесе, гадәттә, ук (яки капма-каршы юнәлгән ике ук) белән алмаш¬
тырыла. Моның сәбәбе соңрак аңлашылыр.
2 Б-177
33
газны яндырып җибәрик. Газ янып беткәннән соң, без ци¬
линдрның эчке стеналары тирләгәнен күрербез. Аннары
цилиндрга бераз известьле су салсак, су болганчыкланыр. Бу
күзәтүләр метан янганда су һәм углерод (IV) оксиды бар¬
лыкка килүен күрсәтә. Бу матдәләрне хасил итү өчен кирәк¬
ле водород һәм углерод метан составына кергән дигән нәти¬
җә чыга.
Кабызганда метанның кислород яки һава белән катнаш¬
масы шартларга мөмкин. Метан белән кислород күләмнәре
ягыннан 1:2 чагыштырмасында (тигезләмәне карагыз) кат¬
наштырылса, шартлау аеруча көчле була. Метанның һава
белән шартлавы өчен 1; 10 чагыштырмасындагы күләмнәр
иң уңай санала (ни өчен?). Күләмнәренең чагыштырмасы
башкача булганда да катнашма шартлый, тик шартлау көч¬
сезрәк була. Шуңа күрә ташкүмер шахталарында, завод ко¬
тел ьныйларында, квартираларда метан белән һава катнаш¬
масы аеруча куркынычлы. Шахтада эшләүне куркынычсыз
итү өчен, шахталарга газ барлыкка килүе турында сигнал
бирүче автоматик приборлар — анализаторлар һәм шулай ук
куәтле вентиляцион җайланмалар куялар.
Пропанның януы да шуңа охшашлы тигезләмә белән күр¬
сәтелә:
С3Н8 + 5Ог —- ЗСО2 + 4НгО + Q
Молекуляр массасы зур булган углеводородлар янганда,
без кайбер үзенчәлекләрне күрә алабыз. Каты углеводородлар
катнашмасыннан торган парафин кисәген фарфор чынаякка
салып эретик һәм яндырып җибәрик. Янган чакта бик күп
корым барлыкка килүен күрербез. Газ хәлендәге матдәләр
янганда һава белән яхшы аралашу сәбәпле, тулысынча янып
бетәләр. Эрегән парафин янганда исә барлык углеродның
янып бетүе өчен кислород җитешми, һәм углерод ирекле
хәлдә аерылып чыга. Бик нык кыздырганда, углеводородлар
гади матдәләргә — углерод һәм водородка таркалалар:
СН4 —- С + 2Н, - Q
C2Hfi - 2С f ЗН2 Q
Бу реакцияләр матдәнең молекуляр формуласын раслый:
метан таркалганда, башта алынган газ күләме белән чагыш¬
тырганда — ике күләм водород, ә этан таркалганда өч күләм
водород хасил була (каты матдә буларак углерод күләме
исәпкә алынмый).
Углеводородларның галогеннар белән, атап әйткәндә хлор
белән, реакциягә керүе үзенчәлекле күренеш. Әгәр метан
34
белән хлор катнашмасы тутырылган ябык пыяла цилиндрны,
кояш нурлары туры төшмәслек итеп, яктыга куйсак (кояш
нуры төшкәндә шартлау булырга мөмкин), метан белән тәэсир
итешүе нәтиҗәсендә хлорның саргылт яшел төсенең әкрен¬
ләп кимегәнен күрергә мөмкин. Башта түбәндәге реакция
бара:
Н Н
1 „ I „ „
Н С—Н + С1, Н—С—С1 + HCJ
I ■ I
н н
Хлорметан
Ләкин реакция, гадәттә, хлорметан ясалу стадиясендә генә
тукталып калмый. Хлор җитәрлек булганда, ул дәвам итә:
С1
I
Н—С—Н + С17
I
н
С1
„ I
—■ Н-С-С1 + НС!
I
н
Ди * лорм РТДМ
С1 С]
С1-С-Н + С1,
—* С1-С-С1 + НС1
1
н
н
Трихлорметы
С1
С]
1
CI-C-H +С12
1
1
— Cl—С—Cl +НС1
С1
1
С1
Т»тр«»ларм»тхи
Метанның хлорлашу реакцияләренең эзлекле әверелеш¬
ләр чылбырын кыскача түбәндәге схема ярдәмендә күрсәтергә
МӨМКИН!
»ci. *с>, _ _ <ci. .ci.
СН4 — CHjCJ — СНгС12 —- СНСЦ — СС14
Югарыда китерелгән тигезләмәләр кайсы матдәләрнең
реакциягә керүен һәм кайсыларының реакция нәтиҗәсендә
табылуын күрсәтә, ләкин молекула эчендә була торган про¬
цессларны чагылдырмый. Чынлыкта исә реакцияләр ирек¬
ле радикаллар ясалу белән бара.
I Безгә билгеле булганча, химик реакция бертөрле бәй¬
ләнешләрнең өзелүеннән һәм яңаларының ясалуыннан
гыйбарәт. Беренче чиратта азрак энергия сарыф итү сора¬
3
35
ла торган нык булмаган бәйләнешләр өзелә. Бу очракта
хлор молекуласындагы CI—CI бәйләнешләренең ныклыгы
метан молекуласындагы Н—С бәйләнешләренекеннән
кимрәк. Аларны өзү өчен хлор молекуласы ала торган
яктылык энергиясе дә җитә;
:С1Чс1: -:С]-+-С1:
оө
Барлыкка килгән хлор атомнарының тышкы катлаула¬
рында парлашмаган берәр электроннары була, башкача
әйтсәк, алар ирекле радикалларга әвереләләр. Химик як¬
тан үтә актив мондый радикал-атом метан молекуласы
белән бәрелешкәндә, аның электроны водород атомының
электрон болыты белән тәэсир итешә башлый. Бу атомнар
арасында ковалент бәйләнеш урнаша һәм хлороводород
молекуласы барлыкка килә:
н н
+ —> Н:С-+Н:С|:
Н J Н
Хәзер инде метан молекуласы бер сыңар электронлы
кисәкчеккә әверелә. Барлыкка килгән метил радикалы
башка хлор молекуласы белән реакциягә кереп, анда атом¬
нар арасындагы бәйләнешне өзә һәм хлорметан молекула¬
сы хасил итә:
Г н 1 Н
IWC-+ —» Н:С:&: + -ё|:
L_ it _ _Г н"
Хлор атомы метанның икенче молекуласы белән тәэсир
итешә. Реакция барышында ирекле радикаллар барлыкка
килү тукталганга кадәр процесс шулай дәвам итәргә мөм¬
кин, ә ул исә, мәсәлән, радикаллар үзара тоташканда тук¬
талырга мөмкин:
Н Н Н Н
II II
Н—C't-C— Н — “ н—с—с—н
II II
н н н н
Эзлекле әверелешләр чылбырыннан торган мондый
реакцияләрне чылбыр реакцияләр дип йөртәләр.
Чылбыр реакцияләр теориясен эшләүдә академик
Н. Н. Семеновның роле аеруча зур булды. Бу өлкәдәге
хезмәтләре өчен аңа Нобель премиясе бирелде.
Эв
Башка углеводородлар белән дә хлор нәкъ менә шулай
тәэсир итешә, мәсәлән:
СН,-СН. + С1, СН,-СНгС1 + НС1
Хлвратвн
СН, -СН,С1 + С], — СНЭ-СНС17 + НС1
1,1 Дихлорэтан
Органик матдәдә водород атомнарының хлор атомнары
белән алмашыну процессы хлорлау реакциясе дип атала.
Реакция нәтиҗәсендә, гадәттә, тиешле углеродның хлор бе¬
лән алмаштырылган катнашмасы хасил була.
Тикшерелгән бу реакция неорганик химияне өйрән¬
гәндә танышкан алмаштыру реакциясеннән беркадәр
аерыла. Анда реакция нәтиҗәсендә һәрвакыт катлаулы
һәм гади матдә хасил булган иде. Ә бу реакциядә кат¬
лаулы ике матдә ясала. Шулай итеп, монда реакцияне бу
типка кертүдә башта алынган органик матдәдәге үзгәреш¬
ләрнең нинди характерда булуы хәлиткеч билге санала, ә
анда, һичшиксез, бертөрле атом икенче төрлесе белән
алмашынды.
Систематик номенклатурадан чыгып, атомы хлор белән
алмаштырылган молекуладагы галоген атомнарының то¬
рышын, углеводород радикаллары торышын күрсәткән
шикелле, матдә исемендә цифр белән күрсәтәләр. Пропан¬
ның галоген белән алмаштырылганнарын түбәндәгечә
атап йөртәләр, мәсәлән:
1 2 Э
СН2 -СН, -СН,
CI
1 Xлпрпропди
сн,-сн-сн,
I
С1
2-Х лорпрлпян
С1
1 12 а
СН,—С— сн3
С1
2.2-Дмж ллрпропяя
Әгәр углеводородларның молекуласында углерод атом¬
нарының саны дүрттән ким булмаса, алар изомерлата
алалар. Мәсәлән, бутанны алюминий хлориды катнашын¬
да җылытканда, ул изобутанга әверелә:
СН3-СН2-СН2-СН2
СН,—CH-CHj
СН»
Молекуласында углерод атомнары аз булган углеводо¬
родларның ни өчен изомерлашу реакциясенә кермәүләрен
аңлатыгыз.
37
Матдәнең химик үзлекләрен билгеләгәндә еш кына аның
кислоталар, селтеләр һәм оксидлаштыручылар тәэсиренә
бирешү-бирешмәвен тикшерәләр. Бу реагентлар гадәттәге
шартларда мондый углеводородларга тәэсир итмиләр. Мәсә¬
лән, әгәр метанны көчле оксидлаштыргыч булып саналган
калий перманганаты КМпО4 эремәсе аша уздырсак, шәмәхә
эремәнең төсе үзгәрмәс, димәк, калий перманганаты (төсле
МпО« ионы) үзгәрми, үзенең оксидлаштыру тәэсирен күр¬
сәтми.
Тикшерелгән углеводородлар башка матдәләр белән ку¬
шылу реакциясенә дә кермиләр, чөнки алардагы углерод
атомнарының валентлыклары тулысынча файдаланылган,
өстәмә ковалент бәйләнеш булдыру өчен башка валентлык
электроннары юк. Бу кушылмалар водород атомнары белән
тулысынча туенган. Менә шуңа күрә дә алар чикле яки туен
дырылган углеводородлар дип атала. Аларны шулай ук пара
финнар дип тә йөртәләр (латинча рагшп affinis — аз охшаган).
Без чикле углеводородларның химик үзлекләре үзара
охшаш булуын күреп үттек, бу хәл аларның химик төзелеш¬
ләренең бер характерда булуы белән аңлатыла. Ләкин үзлек¬
ләр охшашлыгы аларның тулы бердәйлеге дигән сүз түгел
әле. Бер үк үзлекнең төрле матдәләрдә төрлечә чагылуын
исегезгә төшерегез. Без моны күрсәтеп үткән идек инде.
I Тезелешләре һәм химик үзлекләре үзара охшаш, э моле
кулаларының составлары бер берсеннән бер яки берничә СН2
атомнары группасы белән аерылган матдәләрне гомологлар
дип атыйлар, һәм алар гожологик рәт хасил итәләр. Без
тикшергән углеводородлардан — метан, этан, пропан, бу¬
тан һ. б. — гомологлар; алар Чикле углеводородларның яки
парафиннарның гомологии рәтен хасил итәләр. Атомнарның
метилен группасы СНг составның гомологик аермасы дип
атала.
Чикле углеводородларның химик үзлекләрен өйрән¬
гәндә, без органик кушылмаларның яңа классы —водоро
ды галогеннар белән алмаштырылган углеводородлар —
углеводородларның галогенлы кушылмалары белән та¬
ныштык. Алариың электронлы төзелешендә кайбер үзен¬
чәлекләр бар.
Хлорметан молекуласында хлор һәм углерод атомнары
бәйләнешендә электроннар тыгызлыгы иң зур булган
(электрон болытларының бер-берсе белән аралашкан) уры¬
ны электртискәрерәк элемент саналган хлор атомына
38
табарвк тайпылган. Шуның нәтиҗәсендә хлор атомы
өлешчә — тискәре корылма, ә углерод атомы өлешчә уңай
корылма ала:
Н. 5. (н
нЛс—С1
Н
яки
Н
I
Н—С — С1
I
н
Хлорның йогынтысы моннан соң бөтен молекулага
тарала. Углерод атомы үзендә барлыкка килгән уңай
корылманы өлешчә тулыландыру өчен, С Н бәйләнеш¬
ләренең электрон тыгызлыгын үз ягына таба авыштыра.
Хлорметан молекуласындагы водород атомнарының угле¬
род атомы белән нык бәйләнмәгән булуының һәм метан
молекуласындагы беренче водород атомына караганда
хлор атомына җиңелрәк алмашына алуының бер сәбәбе
нәкъ менә шунда. Ләкин атомнарның бер-берсенә йогын¬
тысы ике яклы. Монда хлор атомы метил радикалы атом¬
нарына йогынты ясап кына калмый, бәлки үзе дә аларның
йогынтысына дучар була. Мәсәлән, көмеш нитраты эре¬
мәсе матдәсенә хлор белән тәэсир иткәндә, ул СГ ионы
рәвешендә бүленеп чыкмый һәм көмеш хлориды булып
төпкә утырмый.
Дихлорметан СН2С12 молекуласының электронлы төзе¬
лешен тикшереп карагыз. Хлорметан СН3С1 молекуласы
белән чагыштырганда углерод атомындагы уңай корылма¬
ның әһәмияте һәм С—Н бәйлэнешләрендәге электрон ты¬
гызлыгының авышуы турында нәрсә әйтә аласыз?
18. Тәҗрибә ярдәмендә метанны водородтан ничек аерырга?
19. 5 моль метан янганда нинди күләмдә углерод (IV) оксиды
(н.И1- га күчереп исәпләгәндә) барлыкка килә?
20. Массасы 8,8 г булган углеводород янганда 26,4 г углерод (IV)
оксиды барлыкка килә. Матдәнең нормаль шартлардагы тыгызлыгы —
1,96 г/л. Аның молекуляр формуласын табыгыз.
21. 2 моль метан тулысынча термик таркалганда нинди күләмдә
водород (н. Ш. да) хасил була?
22. 3 моль метан белән 20 л этан катнашмасын тулысынча янды¬
рып бетерү өчен, нинди күләмдә һава (н. ш. да) кирәк булыр?
23. Бром метанга хлор шикелле үк тәэсир итә. Метанны эзлекле
бромлаштыру реакцияләренең тигезләмәләрен языгыз.
*24. Хлорметанда пар электронның углерод атомыннан хлор ато¬
мына таба авышуы нәтиҗәсендә углерод атомы ни өчен — өлешчә уңай
корылма, ә хлор атомы өлешчә тискәре корылма ала? Ни өчен ул
корылмалар бөтен түгел, өлешчә?
39
•25. Тетрахлорметавиың тыгызлыгы Һава тыгызлыгыннан вмчә тап¬
кыр зуррак булуын исәпләп чыгарыгыз. Бу матдәнең янмаучан булуы,
сезнеңчә, нәрсә белән аңлатыла?
26. а> Бик нык кыздырганда пропанның гади матдәләргә таркалу
реакциясе тигезләмәсен, 6) пропанны әзлекле хлорлаштыруның нке-оч
реакциясе тигезләмәсен төзегез. Таркалу реакциясен пропанның моле¬
куляр формуласын раслау ечен, пичек файдаланырга икәнен аңлатыгыз.
*27. Тезелеше СНэ—СНг—CHz—СНг—CHj булган матдәнең ике
гомологы һәм ике изомерының структур формулаларын языгыз.
9 8. ЧИКЛЕ УГЛЕВОДОРОДЛАРНЫ КУЛЛАНУ ҺӘМ ТАБУ
Углеводородлармы куллану. Углеводородлар янганда бик
күп җылылык аерылып чыгу сәбәпле, ал арны ягулык итеп
файдаланалар. Табигый газ составындагы метан көнкүрештә
һәм промышленностьта аеруча киң кулланыла. Шул ук
максатларда хәзер «сыегайтылган газ» хәлендә пропан һәм
бута и н ы куллану арта бара. Бу бигрәк тә табигый газ үткә¬
релмәгән урыннарда киц кулланыла. Сыек углеводородлар
автомашиналарда, самолетларда һ. б. машиналарда эчке яну-
лы двигательләр өчен ягулык булып хезмәт итә.
Метан, иң күп очрый торган углеводород буларак, химик
чимал сыйфатында торган саен күбрәк кулланыла бара.
Метанның яну һәм таркалу реакцияләре типография
буявын һәм каучуктан резина әйберләрне ясауга китә торган
корым җитештерүдә файдаланыла. Шул максат белән махсус
мичләргә метан белән бергә метанның беркадәр өлеше генә
янарлык микъдарда һава кертелә. Яну температурасы югары
булу нәтиҗәсендә газның калган өлеше таркалып, аеруча вак
корым хасил итә.
Метан —аммиак һәм башка органик кушылмалар син¬
тезлау өчен промышленностьта водород табуның төп чыга¬
нагы булып санала. Метаннан водород табуның иң киң
таралган ысулы — аңа су пары белән тәэсир итү. Реакцияне
400 Ч? чамасы температурада, 2—3 МПа басым астында алю-
моникель катализатор катнашында трубасыман мичләрдә
үткәрәләр:
СН4 + Н2О — ЗН. + СО
Кайбер синтезлар өчен, барлыкка килгәы газлар кат¬
нашмасын турыдан-туры файдаланалар. Әгәр дә моннан
соңгы процессларда (аммиак тапкандагы кебек) саф водо¬
род таләп ителсә, углерод (II) оксидын катализатор катна¬
шында су пары белән оксидлаштыралар:
со + н±о - - со2 + н2
40
Ә инде углерод (IV) оксидыннан арындыру артык кат¬
лаулы эш түгел. Моныц өчен сез нинди ысуллар тәкъдим
итәр идегез?
Хлорлау реакциясе ярдәмендә метанның хлор белән ал¬
маштырылган кушылмаларын табалар. Аларның барысы да
практикада кулланыла.
Хлорметан СНЭС1 — газ хәлендәге матдә. Газ хәленнән бик
тиз сыек хәлгә күчә ала һәм яңадан парга әйләнгәндә, бик
күп микъдарда җылылык йота торган матдә буларак, ул
суыткыч установкаларда салкынлык тудыру агенты итеп
кулланыла.
Дихлорметан СНгС1г, трихлорметан (хлороформ) €НС1Э
һәм тетрахлорметан СС1« — сыек хәлдәге матдәләр, аларны
эреткеч нтеп кулланалар. Моннан тыш, тетрахлорметан ян¬
гын сүндерү өчен (бигрәк тә су кулланырга ярамаган очрак¬
ларда) файдаланыла, чөнки бу матдәнең парга әйләнгәндә
хасил булган янмаучан авыр парлары, яна торган әйберне
чолгап алып, аңа һава кислороды керүне туктата.
Метанны хлорлаганда бик күп хлороводород барлыкка
килә (тигезләмәләрне карагыз). Аны суда эретеп хлорид кис¬
лотасы табалар.
Соңгы вакытта күп кенә органик матдәләрне синтезлау
өчен кирәкле ацетиленны метаннан табалар.
Иэомерлашу реакциясе ярдәмендә метан гомологларыннан
тармакланган төзелешле углеводородлар табалар. Алар кау¬
чук һәм югары сортлы бензин җитештерүдә файдаланыла.
Югары төзелешле углеводородлар синтетик юучы матдәләр
табуда беренчел матдә хезмәтен үтиләр.
Химик эшкәртү юлы белән чикле углеводородларны еш
кына химик яктан активрак булган чиксез углеводородларга
әверелдерәләр, ә алардан исә гаять күп төрле органик мат¬
дәләр синтезлыйлар.
Углеводородларны табу. Чикле углеводородлар табигый
газда һәм нефтьтә күп микъдарларда була. Ягулык һәм
химик чимал сыйфатында файдалану өчен, аларны шушы
табигый чыганаклардан табалар.
Теоретик яктан караганда, метанны синтез юлы белән табу
игътибарга лаеклы, чөнки ул гади матдәләрдән органик ку¬
шылмаларга күчү мөмкинлеген күрсәтә. Реакция порошок-
сыман никель катализатор катнашында углеродны водород
белән бергә җылытканда бара:
С + 2Н, — СН,
41
Бу реакцияне метанның термик таркалуы белән (34 нче
бит) чагыштырып карасак, без аның кайтма реакция булуы
турында нәтиҗә ясарбыз. Реакциянец җылылык эффектын
исәпкә алып, түбәндәге тигезләмәне язарга мемкин:
С + 2Н2 = СН, + 75 кДж
Бу тигезләмәдән чыгыл, нинди шартларның химик тигез¬
ләнешне метан табу ягына таба авыштыруын, ә ниндиләре-
нец метанның таркалуына китерүен алдан әйтергә мемкин.
Метанны синтезлау экзотермнк реакция булу сәбәпле, бик
нык җылыту табыла торган продуктның артуына китермәя¬
чәк; тигезләнеш алынган продуктлар ясалу ягына таба авы¬
шачак. Түбәнрәк температурада җылытканда метан ясалу
тизлеге җитәрлек булмаячак. Шуңа күрә метан синтезлау¬
ның иң уңайлы температурасы 500 °C чамасы, ә аны таркату
очен 1000 °C тан югарырак температура таләп ителә.
Химик тигезләнешнең авышуына басым үзгәрү дә йогын¬
ты ясый. Реакция сулдан уңга таба барганда газ күләме ки¬
мү сәбәпле, басымның артуы метан барлыкка килүгә ярдәм
итәчәк, ә инде басымның кнмүе, киресенчә, аны таркатуга
китерәчәк.
28. Метанның су пары белән тәэсир итешүе — кайтма реакция.
Шуннан чыгып, 40 нчы биттә китерелгән реакция тигезләмәсен үзгәр¬
теп языгыз. Басымны арттырганда химик тигезләнешнең нинди юнә¬
лештә авышачагын аңлатыгыз.
*29. 2-Метилбутан изопрен каучук синтезлау очен башлангыч матдә
сыйфатында файдаланыла. Бу углеводородны н-оентаннан алырга
мемкин. Реакция тигезләмәсен төзегез. Бу реакция нинди типка керә?
30. Суыткыч установкаларда салкынлык тудыру агенты итеп кул¬
ланыла торган дифтордихлорметан (фреон-12> — сыек хәлгә бик җиңел
күчә ала торган газ хәлендәге матдә. Дифтордихлорметанның структур
һәм электронлы формулаларын тезегез.
31. Түбәндәге схема буенча чикле углеводородлар турындагы мәгъ¬
лүматларны гомумиләштерүче таблица тезегез: а) углеводородларның
үзлекләре, б) химик реакция мисаллары, в) кулланылышы.
Торле атомнарны күрсәтү ечен төрле төстәге пластилиннан фай¬
даланып: а> хлорэтан, б) дифтордихлорметан молекулаларының модель¬
ләрен өегездә ясагыз. Модель ясау юлы белән түбәңдәге формулаларның
бер үкме әллә икесе нке матдәме икәнен ачыклагыз:
F F
I I
Cl—С-Cl CI—С—F
I I
F С1
42
б 9. ЦИКЛ ОПАРАФИНН АР
Атомнары ачык чылбырлы чикле углеводородлардан — па¬
рафиннардан ты in, йомык, циклик тезелешле углеводородлар
да бар. Аларны циклопарафин нар дип атыйлар, мәсәлән;
н,с СН,
н,с сн,
HSC — снг
Цыклоп*атав
Цммлобутам
сн3
н,с сн,
Н,С^ ^СН,
сн,
Ци к логекои
Алар үзләренә тиңдәш парафиннардан молекулалары сос¬
тавындагы водород атомының икегә ким булуы белән аеры¬
ла. Шул атомнарның аерылып китүе исәбенә, углерод чыл¬
быры йомылып, боҗра хасил була*. Схема рәвешендә моны
болай күрсәтергә мөмкин:
Н Н
I Г — • . — — 1 I
н-с-н н-с-н
I v ..... ■> I
н,с сн,
сн,
н,с — сн,
/ \
+ н,
Шуңа күрә циклопарафиннарның гомуми формуласы
с«н2. була.
Пеитанны циклопентанга әверелдерү мөмкин икәнлеген
ачыграк күз алдына китерү өчен, углерод атомнарының бәй¬
ләнешләр тирәсендә әйләнүләре нәтиҗәсендә, углеводород
молекулаларының төрле формага керә алуларын искә төше¬
рик. Бу вакыт углеродның кырый атомнары бер-берсенә бик
якын килә алуларын алдарак күреп узган идек инде (29 нчы
бит). Бу хәл молекулага боҗра рәвешендә йомылырга мөм¬
кинлек бирә (10 нчы рәсем).
Циклопарафин молекулаларында еш кына ян-якка сузыл
ган углеводород чылбырлары була, мәсәлән:
СН,
Н,С СН-СН,
\ /
н,с—сн,
М етклцм клопа нтан
сн,
Н,С сн—сн,—сн.
I I
н,с сн,
сн,
/¥ги лцм к лог^кглн
1 Практикада циклик углеводородларның синтезы башка терле юл
белән үткәрелә.
43
10 НЧЫ рәсем. Циклопарафи и молекулаларының модельләре:
А — циклолентанның шарлы-таякчыклы моделе; Б — циклогексанның
масштаблы моделе (водород атомнарының барысы да күренми).
Мондый төзелешле циклопарафиннар күп кенә яклары
белән парафиннарга охшаган: химик яктан алар артык актив
түгел, янучан, алардагы водород атомнарын галогеннар ал¬
маштыра ала.
Биш һәм алты буынлы циклопярнфиннярны беренче тап¬
кыр Мәскаү университеты профессоры В. В. Марковников
нефтьтә таба. Шуннан чыгып, аларны икенче исем белән
нафтеннар дип йөртәләр. Күп төрле нефтьләрнең һәм алар-
дан ялына торган нефть продуктларының төп өлешен тәшкил
иткән матдә буларак, аларның практик әһәмияте зур.
32. Циклогексанны н-гексанның: я) изомеры, б) гомологи дип исәп¬
ләргә мөмкинме? Җавапны аңлатыгыз.
33. Циклогексанның: а) ике гомологының, 6) ике изомерының
структур формулаларын тезегез.
*34. Молекуласында өч һәм дүрт углерод атомы булган циклопа рафии-
ның углерод атомнары бәйләнешләре арасындагы почмак 10д“28' тап
кнмрәк булганда, ни өчен циклопарафинның тотрыклылыгы кимрәк
булуын аңлатыгыз.
35. а) Циклопентанның тулысынча янып бетү реакциясенең, б) цик-
лопентаннан хлорциклопентан табу реакциясенең тигезләмәләрен тө¬
зегез. Хлорциклопентанның электронлы формуласын языгыз.
1. а) Цикло пентан, б) метилциклопентан молекулаларының мас¬
штаблы модельләрен пластилиннан ясагыз.
2. Өегездә гексанның шарлы-таякчыклы моделен ясагыз; аларның
аерым звеноларын борып карау юлы белән нинди конфигурация вакы¬
тында чылбырның боҗрага йомылуына ышаныгыз.
44
3. ЧИКСЕЗ УГЛЕВОДОРОДЛАР
Углеводородлар арасында чиксеэ кушылмалар гаять зур
төркем тәшкил итәләр. Аларның үзенчәлекләре белән та¬
нышыйк.
Чикле углеводородлар рәте метаннан башланган кебек,
чиксеэ углеводородларның гаять зур төркеме аларның иң
гадие этиленнан башлана.
$ 10. ЭТИЛЕН, АНЫҢ ТӨЗЕЛЕШЕ
Этилен — һавадан бераз җиңелрәк, бөтенләй диярлек иссез
һәм төссез газ. Аның углеводородлар төркеменә керүен,
метан составын сыйфат ягыннан билгеләгәндәге кебек, эти¬
ленның яну продуктларын тикшереп беләләр.
Аның молекуляр формуласын чыгарып карарбыз. Нормаль
шартларда этиленның тыгызлыгы — 1,25 г/л. Шулай булгач,
газның моляр массасы 1,25 г/л * 22,4 л/мольз=28 г/моль,
ә моннан этиленның чагыштырма молекуляр массасы 28 гә
тигез икәне табыла.
Мондый молекулада ничә углерод һәм водород атомы
булырга мөмкин соң?
Әлбәттә, молекулада бер генә углерод атомы була алмый,
чөнки бу вакытта аңа уналты водород атомы кушылырга
тиеш, ә моның булуы мөмкин түгел. Шулай ук молекулада
углерод атомы икедән артык була алмый, чөнки аларның
гомуми атом массасы ннде 24 кә тигез. Җитешмәгән массаны
(28—24) бу очракта дүрт водород атомы тутыра дип кабул
итәсе генә кала, ягъни этиленның молекуляр формуласы С2Н4
Инде сез бу газның һавадан авырмы әллә җиңелме икәнен
тикшерә аласыз.
Ләкин без этилен формуласын яхшылабрак карасак, тагын
капма-каршылык очратабыз. Аның молекуласында углерод
атомнарына бәйләнгән водород атомнарының саны этан мо¬
лекуласындагы га караганда азрак. Углеродның дүрт валент-
лыгы монда ничек саклана алган соң? Бу сорауга җавап бирү
өчен, матдәнең төзелешен тикшереп карыйк.
45
Этилен молекуласының симметрияле булуы ачыкланды,
ягъни андагы һәр углерод атомы икешәр водород атомы бе¬
лән бәйләнгән. Молекулада атомнар арасындагы бәйләнешне
моннан элекке очраклардагыча сызыкча белән күрсәтеп, фор¬
муласын язабыз:
Н-С—С—Н
I I
Н Н
Ләкин бу формула этиленның тезелешен сурәтләми. Угле¬
род атомнарының дүртенче валентлык берәмлекләре ирекле
хәлдә кала алмый, монда алар үзара тоташып, углерод атом¬
нары арасында икенче бәйләнеш ясала:
Н
Н
н
н
>с-с<
Моңа кадәр углеводородларны ейрәнгәңдә, безгә атомнар
арасында бары гади, ягъни ординар (французча ordinaire —
гади) химик бәйләнеш кенә очраган иде.
Этилен молекуласында икеле бәйләнеш урнаша.
Углерод атомының һәр валентлыгы аның тышкы элек¬
трон катлавында сыңар электрон булуга бәйле булу сәбәпле,
углерод атомнары арасында икеле бәйләнеш урнашканда,
алар очен уртак икенче пар электрон ясала:
Н:С:С:Н — H:C|CH яки Н:£::С:Н
НН НН Н н
Шулай итеп, этилен молекуласында, элеккеге шикелле үк,
углеродның дүрт валентлыгы һәм аның атомнары өчен октет
кагыйдәсе саклана. Структур формуладагы һәрбер валентлык
сызыгы, моннан элек өйрәнгәндәге кебек үк, электроннарның
бер нарын күрсәтә.
Ләкин монда шундый бер хәл игътибарны үзенә җәлеп
итә. Моңа кадәр безгә углерод атомында валентлык элек¬
троннарының атом үзәгеннән тетраэдрның түбәләренә
таба юнәлгән химик бәйләнеш хасил итүләре билгеле иде.
Ә монда исә ике бәйләнеш бер үк юнәлештә диярлек —
углерод атомнары үзәкләрен тоташтыручы сызык буенча
урнаша. Моны аңлау өчен, икеле бәйләнеш ясалганда
электроннарның үзара ничек тәэсир итешүен җентек¬
ләбрәк тикшереп карыйк.
Физик методлар белән тикшерүләр этилен молекула¬
сындагы барлык атом төшләренең, элек өйрәнгән угле-
11 нче рәсем. Этилен молекуласында
с-бәйләнешләре ясалу схемасы.
12 нче рәсем. Этилен молекуласында
п-бәйләнеш ясалу схемасы:
А — р-электрон болытларының бер-
берсе белән аралашуы; Б — п-бәй-
ләнеше уртак болытларының атом
төшләре яссылыгы өстендә һәм яс¬
сылык астында урнашуы.
водородлардан аермалы буларак, бер үк яссылыкта ятуын
һәм молекулада валентлык почмакларының 109°28' тү¬
геллеген, бәлки 120° ка тигез булуын күрсәтте (11 нче
рәсем).
Мондый төзелеш метан молекуласының тетраэдрик
формалы төзелешенә сәбәп булып торган зр3-гибридлашуы
турындагы безгә билгеле карашка нигезләнеп аңлатыла
алмый. Ьәр углерод атомы монда башка дүрт атом белән
түгел, бәлки өч атом (бер углерод атомы һәм өч водород
атомы) белән тоташкан, шуңа күрә алар белән бәйләнеш¬
ләр ясалу өчен гибридлашуга фәкать өч электрон болы¬
ты — бер s-электрон һәм ике р-электрон болыты дучар
була. Монда зр2-гибридлашуы була. Гибридлашкан болыт¬
лар бер якка таба һәм бер үк төрле симметриясез сузыл¬
ган күләмле сигезле формасында була. Химик бәйләнеш¬
ләр барлыкка китергәндә алар, метандагы шикелле үк,
бер-берсеннән ераккарак китәргә омтылалар (ни ечен?),
күчәрләре арасындагы почмак 120° булгач кына моңа
ирешелә.
Ләкин углерод атомнарының тагын берәр р-электроны
кала. Бу электронның болыты гибридлашмаган, аның
тышкы күренеше дә үзгәрмәгән, элеккечә күләмле сигезле
формасында һәм электрон тыгызлыгы төштән ике якка
47
таба бертигез таралып урнашкан. Бу электрон болытлары¬
ның күчәрләре атом төшләре яссылыгына перпендикуляр
булачак, чөнки бу очракта алар химик бәйләнешкә кергән
электрон болытларыннан ерактарак булып калалар. Бу
күләмле сигезле формасындагы электрон болытлары атом
төше яссылыгыннан өстә һәм аста бер-берсе белән берка¬
дәр аралашып, углерод атомнары арасында икенче бәйлә¬
неш барлыкка китерәләр (12 иче рәсем, А).
Әмма электрон болытларының бер берсе белән мон¬
дый аралашулары, атом үзәкләрен тоташтыручы туры
сызык юнәлешендә тәэсир итешкән болытларга караганда,
азрак дәрәҗәдә күзәтелә; өстәвенә ул атом үзәкләреннән
ерактарак була. Шуңа күрә этиленда икенче бәйләнеш
беренче бәйләнешкә караганда көчсезрәк була. Шулай да
бу икенче бәйләнеш урнашу белән атомнар бер-берсенә
тагын да якынаялар; этан молекуласында атомнарның
төшләре арасындагы ераклык — 0,154 нм, ә этилен моле¬
куласында бу ара 0,134 нм була.
Электрон болытлары бер берсе белән атом үзәкләрен то¬
таштыручы туры сызык юнәлешендә аралашканда барлыкка
килә торган беренче ныграк бәйләнешне — а (сигма) бәйлә
Hpui дип, Ә электрон болытлары атомнар төшләре яссылыгын¬
нан читтә үзара аралашканда барлыкка килгән икенче көч
сезрәк бәйләнешне п (пи)-бэйлэнеш. дип йөртәләр. Углерод
атомнары белән водород атомнары арасында урнаша торган
гадәттәге ковалент бәйләнешләр — шулай ук л-бәйләнешләр
алар. Димәк, чикле углеводород молекулаларында фәкать
п бәйләнешләр генә була.
13 нчс рәсем. Эти лея молекуласының модельләре:
А — шарлы-таякчыклы; Б — масштаблы.
48
я-Бәйләвеш электроннары, с-бәйләнешләр барлыкка кил¬
гәндәге кебек үк, билгеле бер атомныкы гына булудан туктап,
ике углерод атомы өчен дә уртак электронга әверелә һәм
с-бәйләнеше яссылыгының өстендә дә, астында да электрон
тыгызлыгы бертөрле булган уртак электрон болыты хасил итә
(12 нче рәсем, 2>).
Этилен молекуласының төзелешен шарлы-таякчыклы һәм
масштаблы модельләр ярдәмендә күрсәтергә мөмкин (13 нче
рәсем). Беренче тип модельләрдә углерод «атомнарын» икеле
бәйләнешкә охшатып ике туры яки бөгелгән таякчыклар
ярдәмендә тоташтыралар. Икенче очракта углерод шарчык¬
ларының үзәкләрен бер-берсенә тагын да якынайталар.
Молекуладагы углерод атомнары арасында о-бәйләнеш
булганда гына углерод атомнары ирекле әйләнә алалар;
я-бәйләнеш булганда әйләнә алмыйлар. Моны аңлау
өчен молекулаларның электронлы төзелешен искә төше¬
рик (11, 12 нче рәсемнәр). о-Бәйләнеш атомнарны тоташ¬
тырган туры сызык буенча юнәлү сәбәпле, алар әйләнгән
чакта электрон болытларының бер-берсе белән аралашуы
бозылмый, шуңа күрә атомнар химик бәйләнгән килеш
кала. Ә инде атомнар арасында икеле бәйләнеш булса,
аларның әйләнүе өчен я-бәйләнешнең электрон болытла¬
рын бер-берсеннән аерырга туры килер иде, ләкин бу хәл
молекула төзелешенең үзгәрүе булыр иде.
Соңрак без икеле бәйләнеш тирәсендә ирекле әйләнеш¬
нең булмавы нинди нәтиҗәгә китерүен белербез.
1. Этиленның; а) водород буенча, б) һава буенча тыгызлыгын исәп¬
ләгез.
*2. Этилен молекуласында о-бәйләнеш белән я-бәйләнеш арасында
нинди аерма бар?
*3. Икеле бәйләнеш булганда, углерод атомнарының ни эчен ирекле
әйләнә алмавын аңлатыгыз. *'
•4. Этилен молекуласында углерод атомнарының үзәкләре арасын¬
дагы ераклык ни очен этан молекул асындагыдан кимрәк?
§11. ЭТИЛЕН РӘТЕҢДӘГЕ УГЛЕВОДОРОДЛАРНЫҢ
ТӨЗЕЛЕШЕ ҺӘМ НОМЕНКЛАТУРАСЫ
Углеводородларның төзелеше. Этилен — молекуласында
углерод атомнары арасында икеле бәйләнеше булган матдә¬
ләрнең гомологии рәтенең беренчесе (2 нче таблица). Этилен¬
ның иң якын гомологлары: пропилен СН2 = СН— СН3 белән
бутилен СН2 = СН — СН2 — СНа.
40
2 нче таблиц». Этвлеи ротендогг углеводородлар
(чикле углеводородлар белән чагыштырып бирелә)
Чикле
утлеводородляр
Чиксез углеводородлар
Метан
СН»
—
Этан
СгНе
Этилен (этен)
СгН,
Пропан
с,н.
Пропилен (пропен)
С?Нв
Бутан
с,н„
Бутилен (бутен)
С,Не
Пентан
с»н1г
Амилен (пентен)
СьН,о
Гексан
с.н„
Гексилен (гексен)
СбНц
һ. б.
Һ. 6.
Этилев рәтендәге углеводородларның исемнәре үзләренә
тиңдәш чикле углеводородларның исемнәрендәге -ан кушым¬
часын -илен кушымчасына алыштырып ясала (этилен, про¬
пилен һ. б.). Ләкин мондый номенклатура белән беррәттән,
хәзер систематик (халыкара) номенклатура күбрәк кулланыла
бара. Бу номенклатура буенча углеводородларның исемнәре
ен кушымчасы белән бирелә (этен, пропен, бутен һ. б.).
Тезелешләре белән үзара охшаш булсалар да, гомологлар
бер берсеннән молекулаларының составлары буенча СН2
атомнары группасына аерылырга тиеш. Матдәләрнең бу рә¬
тендә әлеге шартның үтәлү-үтәлмәвен тикшереп карагыз.
Икеле бәйләнеш ясалу сәбәпле, һәрбер чиксез углеводород
молекуласында үзенә тиңдәш чикле углеводород молеку-
ласындагыга караганда водород атомы икегә ким була. Шуңа
күрә этилен (этен) рәтендәге углеводородларның составын
С.1Ц, формуласы белән күрсәтәләр. Тагы нинди углеводород¬
лар шундый ук гомуми формулага ия?
Чиксез углеводородлар радикаллар хасил итә ала. Мә¬
сәлән, этиленның бер валентлы радикалының тезелеше
СН2 = СН— яки Н:С::С- һәм ул винил дип атала.
Й Н
Чиксез углеводородларга изомерия күренеше хас.
Чикле углеводородлардагы шикелле, монда да углерод
скелетының иаомериясе бар. Мәсәлән, гомуми формуласы
CSH1O булган углеводородлар изомерлар була:
СН2=СН—СН,—СН„—CH, СН..-СН— СН-СН,
I
сн3
Моннан тыш, изомерия күренеше углерод чылбырындагы
икеле бәйләнешнең кайда урнашуына бәйле, шуңа күрә С5Н10
50
формуласы белән күрсәтелә торган матдәләр арасында түбән¬
дәгеләре дә булачак:
СНа-СН=СН СН?--СН., СН,—СН=СН—СН,
СН,
Шулай итеп, этилен рәтендәге углеводородлар арасында
структур изомериянең ике төре күзәтелә: а) углерод ске¬
летына бәйле изомерия, б) углерод чылбырында икеле бәйлә¬
нешнең урынына бәйле изомерия.
Этилен рәтендәге углеводородларның номенклатурасы.
Этилен рәтендәге углеводородларның индивидуаль исемнәре
түбәндәгечә ясала:
а) структур формулада углерод атомнарының икеле бәй¬
ләнеше булган иң озын чылбырын аерып алалар һәм аларны
икеле бәйләнешкә якын очыннан башлап нумерлыйлар;
б) исем алдыннан алмаштыручы группаның (радикалның)
кайсы углерод атомы янында булуын сан белән күрсәтәләр;
в) алмаштыручы группалар берничә булса, аларның һәр-
кайсын сан белән билгелиләр;
г) исемнең ахырында икеле бәйләнешнең торышын шул
бәйләнеш башланган углерод атомының номеры белән бил¬
гелиләр, мәсәлән:
1 2 3 4 1 2 3 4
СН2=СН—СН2-СН3 СН3—СН=СН СН3
Бутев 1 Вутен 2
12 3 12 3 4 5 6
СН2=С-СНЭ снэ —с=сн— сн—сн2—сн3
сн3 снэ С2Н5
2-Метил пропен 2-Метил4-этилсексев2
(иэобуталев)
Югарыда исемсез бирелгән углеводородларны, структур
формулаларына карап, исемләп чыгыгыз.
Геометрик изомерия. Этилен мисалында без икеле бәй¬
ләнеш аша тоташкан атомнарның ирекле әйләнә алмау¬
ларын күрен уздык. Бу хәл моңа кадәр чикле углеводо¬
родларда булмаган яңа төр изомериягә китерә.
Бутан молекуласының моделен туры сынык сызык
һәм бөгелгән сынык сызык рәвешендә төрлечә ясарга
мөмкин булуын без беләбез инде. Әмма бу модельләр төрле
матдәләрне түгел, бәлки бер үк матдәне күрсәтәләр, чөнки
чикле углеводородлардагы углерод атомнары ирекле әй¬
ләнә ала һәм шул вакыт бер форма җиңел генә икенчесенә
әверелә.
4
51
14 нче рәсем. Бугеи-2 иең пространство л ы изомерларының шарлы-
таякчыклы һәм масштаблы модельләре.
Углерод атомнарының саны шундый ук булган чиксез
углеводородларның төзелешен тикшереп карыйк.
Бутен-2 молекуласының моделен да без ике төрле күр¬
сәтә алабыз (14 нче рәсем). Ләкин монда бер-берсенә икеле
бәйләнеш аша тоташкан углерод атомнары ирекле рәвештә
әйләнә алмыйлар (ни өчен икәнен исегезгә төшерегез).
Шуңа күрә бер конфигурациянең молекуласы икенче
төрле конфигурация молекуласына (өстәмә энергия тот¬
мыйча торып) әверелә алмый; әгәр дә молекулаларның
һәр ике төзелешлесе табылган икән, бу инде бер-берсенә
изомер ике төрле матдә булыр.
Структур изомериядән аермалы буларак, иэомериянең
бу төре молекулада атомнарның төрле эзлеклелектә тота¬
шуына да, икеле бәйләнешнең урынына да бәйле түгел,
бәлки ул атомнарның пространствода төрлечә урнашуын¬
нан килеп чыга. Бу — пространстволы изомериянең (сте-
реоизомериянең) бер төре.
52
15 нче рәсем. Вутен-2 пен цис трамс-нэомериясе:
А—цис-изомер: Б —транс изомер.
Әгәр изомердагы алмаштыручы группалар (бу очракта
этиленда водород атомнарын алмаштыручы СҢ3 группа¬
лары) икеле бәйләнеш яссылыгының бер ягында гына ур¬
нашса, ул цис-изомер, ә икеле бәйләнеш яссылыгының ике
ягында да урнашса, транс изомер була (15 нче рәсем).
Изомериянең мондый төре цис транс-изомерия дип
атала (латинча cis алкушымчасы—бу якта, ә trans — аша).
Бу шулай ук геометрик изомерия дип атала.
Изомериянең мондый төре структур формулалар бе¬
лән түбәндәгечә күрсәтелә:
цис Иаеылр
(»PV «ми —138.9 С,
кийи. «ип. 3,7*0
н.с. н
>с-с<
н сн,
трансИзомер
(эрү Teran — lOS.&^C,
кяЯи. темп 0,9*С)
Тикшерелгән мисалдан күренгәнчә, геометрик изомерия
молекулада икеле бәйләнеш белән тоташкан, һәр углерод
атомы чиратында башка төрле ике атомга яки атом
нар группасына тоташканда килеп чыга. Әгәр дә икеле
бәйләнеш янындагы нинди дә булса углерод атомы төрле
атомнарга тоташмыйча бердәй атомнарга яки атомнар
группасына тоташса, геометрик изомерия була алмый,
Нх / СНЭ
мәсәлән, >С-С< кушылмасында метил группасы
Н' Н
икеле бәйләнешнең кайсы ягында гына торса да ул бер үк
_ . , Н\„ _ Л»
матдә булачак, шулай булгач, >С-С< матдәсе өчен дә
Н XI
мондый изомериянең була алмавы аңлашыла.
53
5. Молекуляр мяссасы: а) 98. б) 126 булган этилен углеводороды¬
ның молекуляр формуласын табыгыз.
в. 5,6 л (в. ш. га күчереп исәпләгәндә) гаэсыман углеводород
янганда 16.8 л углерод (IV) оксиды һәм 13,5 г су табылса, газсымав
углеводородның молекуляр формуласын табыгыз.
7. Составында массасы буенча углерод микъдары 85,7% булган
углеводородның молекуляр формуласын табыгыз. Матдәнең водород
буенча тыгызлыгы 28 га тигез.
*8. Молекуляр массасы 56 булган изомер углеводородларның струк¬
тур формулаларын төзегез. Изомер матдәләрнең исемнәрен әйтегез.
9. Углеводородның формуласы С*Ни. Шуннан чыгып бу углеводо¬
родны этиленның гомологии рәтенә керә дип әйтеп буламы? Ни өчен?
1О. Формулалары түбәндә китерелгән матдәләрдән изомер булган¬
нарын күрсәтегез:
а) СН2-С—СН, г) СН,-СН—СН-СН,
СН,
б) СН,—СН—СН, д) СН,—СН,
I I I
СН,—СН2 СН, СН,
в) СН,—СН-СН—СН, сн, г
е) СН,—СН-СН—СН,
*11. Систематик номенклатура буенча түбәндәге углеводородларга
исемнәр бирегез:
a) СН.-С—СН,—СН,
сн,
СН,
в) СН,-СН—С—СН,
СН,
б) СН,—СН-С СН—СН,—СН,
г) СН,—СН -С-СН,
СН, СН,
СН, С,И,
12. Формулалары түбәндә китерелгән матдәләрнең кайсылары пен
тен-2 нең СН3—СН—СН—СН,—СНЭ: а) изомерлары, б) гомологлары
икәнен күрсәтегез:
а) СН,—С-СН—СН,
СН,
б) СН,—СН,-СН,-СН-СН,
в) СН-СН
I I
сн,сн,
г) СН,—СН,—СН,—СН,—СН,
д) Н,С-СН,
Н,С СН,
сн,
54
*13. Түбәндәге углеводородларның структур формулаларын тезегез:
а) З-этилгептен-2. 6) З.З-диметилпентеи-1, в) 3-метнл-4-этилгексев>2.
*14. Түбендә китерелгән кушылмаларның кайсында цис-транс изо-
мериянөң булуы мамкин: а) бутен-1, б) пентен-2, в) 2-метнлбуген-2>
Г) 2-метнлпропен? Изомерларының формулаларын языгыз.
Модель төзү юлы белән: а) изобутиленның, б) 1,2-дихлорэтенның
СНС1=СНС1 пространстволы цыс-транс-изомериясе булу-булмавын
күрсәтегез.
§12, ЭТИЛЕН РӘТЕНДӘГЕ УГЛЕВОДОРОДЛАРНЫҢ
ХИМИК ҮЗЛЕКЛӘРЕ
Химик үзлекләре. Бу кушылмалар, чикле углеводородлар
шикелле, бер үк төрле химик элементлардан (углерод һәм
водородтан) торганлыктан, аларның уртак үзлекләре бар —
алар янучан. Мәсәлән, этиленны кабызып җибәрсәк, ул Һа¬
вада яна һәм су белән углерод (IV) оксиды барлыкка килә:
С,Н4 + 30, • 2СО, + 2Н2О + Q
Метаннан аермалы буларак, этилен якты ялкын белән
яна, ә ул исә иң элек этиленда углерод микъдарының
күбрәк булуыннан килә: җылытудан этилен молекуласы
таркалганда хасил булган углерод тиз генә янып бетми,
башта аның кисәкчекләре кызып, ялкынны яктырак итә¬
ләр, бары шуннан соң гына ялкынның тышкы өлешендә
яналар.
Ләкин молекулаларның составы буенча этилен Һәм аның
гомологлары чикле углеводородларга охшаш булсалар да
төзелешләре буенча алардан аерылалар: аларның молеку¬
лаларында икеле бәйләнеш бар. Аларның химик үзлекләренә
моның йогынтысы бармы?
Метан һәм аның гомологларының үзлекләрен аларга
нинди матдәләр белән тәэсир итеп ачыклаган булсак, чиксез
углеводородларга да шул ук матдәләрнең ничек тәэсир итүен
тикшереп карарбыз.
Этиленны калий перманганаты КМпО4 эремәсе аша уз¬
дырыйк. Эремәнең шәмәхә төсе бик тиз югалуын күрербез,
димәк, калий перманганаты (МпО4 ионы) этиленны оксид¬
лаштыра. Мондый шартларда чикле углеводородларның
оксидлашмавын без беләбез инде. Молекуласында икеле бәй¬
ләнеше булган башка углеводородлар да җиңел оксидла¬
шалар.
55
Этиленны калий перманганаты белән оксидлаштыр¬
ганда ике атомлы спирт — этиленгликоль хасил була. Әгәр
оксидлаштыручыны шартлыча кислород дип билгеләсәк,
реакция тигезләмәсен түбәндәгечә язарга мөмкин:
CHj-CHj + О + Н,О — СН,—СН,
он он
Хәзер этиленны һәм метанны бромлы су (бромның су¬
дагы эремәсе) аша уздырып карыйк. Этиленны уздырганда
бромның кызгылт керән төсе бик тиз юкка чыга, ә метан исә
бромлы суга тәэсир итми. Димәк, бу очракта да этиленның
реакциягә керү сәләте чикле углеводородларныкына караган¬
да көчлерәк. Этилен бром белән тәэсир итешкәндә, дибром-
этан С2Н4Вгг — төссез сыеклык хасил була, ягъни бром моле¬
куласы этилен молекулаларына кушыла:
СН2=СН2 + Вг, — СН,—СН2
Вг Вг
Күреп үткәнебезчә, бром атомнары икеле бәйләнеш исә¬
бенә кушылалар һәм икеле бәйләнеш гади бәйләнешкә әве¬
релә. Чиксез углеводородларның башкалары да этилен кебек
үк бромны үзләренә җиңел кушалар, мәсәлән:
СН2-СН—СН2 + Hr, — CHj—СН—СНа
Вг Вг
Калий перманганаты эремәсе һәм бромлы су чиксез угле¬
водородлар очен реактив санала, аларның төсе үзгәрүенә
карап бу органик кушылмалар барлыгын беләләр.
Катализатор (платина, никель) катнашында чиксез угле¬
водородларга водород кушыла ала. Мәсәлән:
СН2=СН2 + н2 — СНЭ—СНа
СН2-СН СНЭ + Н2 —■ СН3-СН2- СН.
Бу реакция вакытында углерод атомнары водород атом¬
нары белән тулысыңча туена һәм нәтиҗәдә туенган, яки
чикле углеводородлар барлыкка килә. Башлангыч матдәләр
исә туенмаган була һәм алары чиксез углеводородлар дип
йөртелә,
ф Матдәгә водород кушылу белән бара торган реакция¬
ләрне гидрирлашу реакцияләре дип атыйлар.
Әле тикшерелгән мисалда этилен һәм пропиленның гид-
рирлашуы нәтиҗәсендә этан һәм пропан барлыкка килә.
Икеле бәйләнеш янындагы углерод атомнары гидрир-
лашу процессында ар2-гибридлашу халәтеннән sp3-гибрид -
лашу халәтенә күчәләр, шуның нәтиҗәсендә молекула¬
ның пространстволы тезелеше үзгәрә. Мәсәлән, гидрир-
лашканда этиленның яссы молекуласыннан күләмле этан
молекуласы хасил була.
Пропиленны гидрнрлаштырганда молекуласының тезе¬
леше ничек үзгәрүен тикшереп карагыз.
Чиксез углеводородлар гади матдәләр белән генә түгел,
катлаулы матдәләр белән дә кушылу реакциясенә керәләр.
Мәсәлән, этилен бромоводород белән реакциягә бик җиңел
керә:
СЛ.СН2 + НВг - СН3—СН2Вг
Брсмятан
Чикле углеводородларның галогенлы кушылмаларын чик¬
сез углеводородлардан әнә шулай табарга мөмкин.
Чиксез углеводородларга хас кушылу реакциясенең
ничек узуын җентекләбрәк тикшерик. Чикле углеводо¬
родларда алмаштыру реакциясеннән аермалы буларак, ку¬
шылу реакциясе ирекле радикаллар барлыкка килү белән
түгел, бәлки ионнар ясалу белән бара.
Бромоводород молекуласындагы ковалент бәйләнеш
поляр була; водород атомының өлешчә уңай корылмасы,
ә бром атомының өлешчә тискәре корылмасы була. Эти¬
лен молекуласына якынлашканда, уңай корылган водород
атомы үзенә якынрак, молекуланың тышындагы диярлек
n-бәйләнеш электроннары белән тәэсир итешеп, аларны
үзенә таба тарта, галогеноводород молекуласыннан протон
рәвешендә аерыла, һәм шул электроннар ярдәмендә үзе
углерод атомының берсенә кушыла:
. ..
Н:С;С:Н + Н сВг: — №С:С:Н+:Вг:
нн ~ нн “
Н—Вг бәйләнеше өзелгәндә ирекле радикаллар түгел,
бәлки ионнар барлыкка килә. Электроннары читкә китү
сәбәпле, этилен молекуласының икенче углерод атомы
(төш корылмасы исәбенә) уңай корылмага әверелә. Шушы
уңай корылган атомга тискәре корылмалы бром ионы
57
тартыла, һәм аның бер пар электроны исәбенә алар ара*
сында да ковалент бәйләнеш урнаша:
+ Ң <ф ВгН
№СФ:Н+:Вг: — Н:С:С:Н
нн нн
Этилен углеводородлары бер-берсе белән кушылып озын
молекулалар чылбыры хасил итә алалар. Мәсәлән, югары
температура һәм югары басым астында этиленнан һәркемгә
мәгълүм полиэтилен табалар. Бу вакыт этиленның йөзләрчә
һәм меңнәрчә молекулалары, үзара тоташып, озын чылбыр
тәшкил итәләр. Схематик рәвештә моны түбәндәгечә күрсә¬
тергә мөмкин:
СН,-СНг + СН,-СНг + СН,-СН, + ... —
— —СН2-СН2— + —СНг—СНг— + — СН2—СН2— ... —*
—- —СН2—СН2—СН2—СН2—СН2—СНг— —
Сызыкча макромолекулалардан (грекча «макрос»—зур,
озын) торган югары молекуляр матдә хасил була.
Бердәй молекулаларның үзара кушылып зур молекулалар
тәшкил итү процессы — полимерлашу реакциясе, ә хасил булган
продукт полимер дип атала. Полиэтилен — полимер ул, аның
молекуляр массасы берничә йез меңгә җитә. Этиленның поли¬
мерлашу реакциясен кыскача түбәндәгечә күрсәтергә мөмкин:
лСН2—СН2 —- (—СН2-СН2-),
Пропилен да шуңа охшашлы рәвештә полимерлаша, Һәм
үзлекләре полиэтиленга охшаган полипропилен хасил була:
сн,=сн + сн,=сн + сн,-сн + ... —
I II Г
сна сн, сн,
—► —СН2—СН—СН,—СН—СН,—СН— ...
1 ’ 1) II
СН, СН, СНЭ
яки
пСН2-СН —* (—СН2 —СН — )„
СН, СН,
Чиксез углеводородларга хас тикшерелгән реакцияләрдән
атомнар арасындагы икеле бәйләнешнең ике гади бәйләнеш
суммасы булмавы күренә; икеле бәйләнеш ул — сыйфат ягын¬
нан үзенә бертөрле бәйләнеш, аның берсе нык түгел, матдә¬
нең реакциягә керү сәләтенең югары булуы шуннан килә.
58
Марковников кагыйдәсе. Этилен гомологларына кат¬
лаулы матдәләр кушылуның бер үзенчәлеге бар. МӘСӘЛӘН,
хлороводород белән пропилен тәэсир итешкәндә, реакция
түбәндә бирелгән ике юнәлешнең берсе буенча барыр, яки
галоген атомы төрлечә урнашкан ике матдә катнашмасы
барлыкка килер дип алдан ук әйтеп куярга мөмкин:
СН3—СН,—СН2С1
/ 1 -Хлорарооая
СН,-СН-СНг+НС1 '
4 СН,—СНС1-СН,
2-Хлорирован
В. В. Марковников реакциянең күбесенчә икенче юнә¬
леш буенча баруын, ягъни водород атомы икеле бәйләнеш
янындагы углеродның водород атомнары күбрәк тоташ¬
канына, ә галоген атомы углеродның водород атомнары
азрак булганына тоташуын әйтте. Бу закончалык химия¬
дә Марковников кагыйдәсе дигән исем белән йөртелә. Та¬
бигый бер сорау туа: бу закончалыкның сәбәбе нәрсәдә?
Мөмкин саналган аңлатмаларның берсен тикшереп ка¬
рыйк.
Пропилен үзенең молекуласында — СН3 радикалы булу
белән этиленнан аерылып тора. Кушылуның тәртипсез
булмыйча, билгеле бер юнәлештә узу факты шушы ради¬
калның икеле бәйләнешкә йогынтысы нәтиҗәсендә килеп
чыга. Ләкин бу йогынтының асылы нәрсәдә соң?
Владимир Васильевич Марковников
(1838—1904)
Мәскәү университеты профессоры. Бутле
роввыц шәкерте һәм аның эшен дәвам итте¬
рүче. Химик тезелеш теориясе нигезендә ал¬
дан әйтелгән күп кенә кушылмаларны син¬
тезлый. Ул Бутлеровиыц молекулада атом¬
нар бер-берсенә тәэсир итәләр дигән идеясен
үстерә һәм бу өлкәдә күп кенә закончалык¬
ларны ача Россиянең табигый байлыкларын
өйрәнүгә, бигрәк тә нефть ятмаларын өйрәнү
гә зур әһәмият бирә. Кавказ нефтьләре соста
вында углеводородларның яңа классы — наф¬
теннар (циклонарафиннар) булуын ача һәм
бу кушылмаларны җентекләп өйрәнә. Рос¬
сиядәге тозлы күлләрвен һәм минераль су
чыганакларының составын тикшерә.
59
Элементларның электртискәрелекләре төрлечә булу сә¬
бәпле, метил радикалында С— Н бәйләнешләре берка¬
дәр полярлаша. Углерод атомы водород атомнары белән
булган бәйләнешләрнең электрон тыгызлыгын үз ягына
таба авыштыра һәм шуңа күрә елешчә тискәре корылмага
ия була. Шул корылма йогынтысында радикал белән күр¬
ше углерод атомы арасындагы бәйләнешнең электрон
тыгызлыгы шушы углерод атомына таба авыша, ә бу исә
үтә хәрәкәтчән п-бәйләнеш болытының иң кырый угле¬
род атомына авышуын китереп чыгара. Бу электрон авы¬
шулары структур формулада түбәндәгечә күрсәтелә:
Н
I -
н —■ с • сн - сн..
1
н
Нәтиҗәдә икеле бәйләнеш симметрияле төзелешен
югалта, полярлаша:
s+ 8-
сн3 —* сн-сн,
Хлороводород молекуласында атомнар арасындагы бәй¬
ләнеш поляр була. Шуңа күрә пропилен молекуласы белән
бәрелешкәндә уңай корылган водород атомы аңа таба
тайпылган л-бәйләнеш электроннары ярдәмендә — СН2
звеносына, ә тискәре корылган хлор ионы СН звеносына
тоташа. Димәк, реакция хлороводород молекуласында
ионлы бәйләнеш өзелү белән бара:
S+, 8-
Н|:С1 н* +Cl-
Икеле бәйләнешнең полярлашуына башка углеводо¬
род радикаллары да, мәсәлән, бутен-1 дате этил шундый ук
йогынты ясаячак: C2HS —- СН= СН2. Шуңа күрә галоге-
новодород монда да Марковников кагыйдәсе буенча ку¬
шылачак.
*18. Бромоводород кушылганнан соң. этилен молекуласының про-
странстволы тезелеше ничек үзгәрә? Җавапны аңлатыгыз.
1в. Метанны этилен катнашмасыннан ничек чистартырга?
17. Этиленны бромлы су аша уздырганда бромлы савытның масса¬
сы 14 г га арта. Бу вакытта этиленның нивди күләме (н. ш. га күче¬
реп исәпләгәндә) йотыла? Ничә грамм дибромэтан табыла?
60
18. Лабораториядә, производствода һәм кен к үрештә ягулык сыйфа¬
тында файдаланыла торган газда чиксез углеводородлар булу-булмавын
практикада ничек белергә?
19. Метан һәм пропилен катнашмасы якты ялкын белән яна. Кат¬
нашманы бромлы су аша уздырганнан соа, ялкынның яктылыгы ки¬
ми. Бу күренешне аңлатыгыз.
20. Чиксез углеводород хлор белән үзара тәэсир итешкәннән соң,
молекуляр массасы 113 булган матдә барлыкка килә. Бу углеводород¬
ның формуласын табыгыз.
21. а) 100 мл пролей, б) 3,5 г пентен үзләренә нинди күләмдә водо¬
род куша ала?
22. Пропилен һәм пропанның үзлекләрен чагыштырып карагыз.
Алар кай яклары белән үзара охшаганнар, ә кай яклары белән аеры¬
лып торалар? Җавапны реакция тигезләмәләре белән аңлатыгыз.
23. 0,56 г этилен гомологи үзенә 1,6 г бром куша алса, этилен
гомологының молекуляр массасы күпме булыр?
*24. Бутилен (бутен-1) белән бромоводород арасындагы реакция
тигезләмәсен языгыз. Реакция механизмын аңлатып бирегез. Хасил
булган органик матдәнең исемен әйтегез.
*25. Трифторпропенга CF?—СН = СНг бромоводород кушылу Мар-
ковников кагыйдәсенә буйсынмый. Бу күренешнең сәбәбен аңлатыгыз.
§ 13. ЭТИЛЕН УГЛЕВОДОРОДЛАРЫН
КУЛЛАНУ ҺӘМ ТАБУ
Углеводородларны куллану. Этилен рәтендәге углевод о
родлар химик яктан үтә актив булулары аркасында күп кенә
органик матдәләрне табуда кыйммәтле чимал булып санала,
шуңа күрә ул ягулык сыйфатында файдаланылмый.
Органик химияне өйрәнгәндә, чиксез углеводородларга
нигезләнгән синтезларны без бик еш очратырбыз. Матдәләрне
табуда иң күп кулланылганы—Этилен,
Этиленның хлор белән тәэсир итешүеннән 1,2-дихлорэтан
табалар:
CHj-CHo + CI, — СНгС1 СН,С1
Дихлорэтан —очучан һәм бик озак кабынучан сыеклык.
Күп кенә органик матдәләрне бик яхшы эретүче буларак, ул
сумалаларны эретү, тукымаларны чистарту өчен кулланыла.
Организмнарга тәэсир итүче матдә буларак, дихлорэтан авыл
хуҗалыгында ашлык амбарларын эарарсызлау һәм виноград
филлоксерасына каршы көрәшү өчен файдаланыла.
Этиленга хлороводород кушу юлы белән хлорэтан табалар:
СН,-СН2 + НС1 —■ СН3 СН2С1
61
Хлорэтан — сыеклыкка бик җиңел әверелә торган газ
(Ш төсле таблицаны карагыз). Әгәр уч төбенә аз гына хлор¬
этан салсаң, ул бик тиз парга әйләнер һәм кулны суытыр;
аның бу үзлеге медицинада җиңел операцияләр ясаганда
өшетү — билгеле бер урында анестезия өчен файдаланыла.
Этиленга су кушылу реакциясе этанол (этил спирты) җи¬
тештерүнең нигезе булып тора:
С2Н4 + Н2О —• С2Н,0
Этил спирты
Ә этил спирты синтетик каучук табу өчен бик күп микъ¬
дарда кулланыла.
Этиленны һәм пропиленны полимерлаштырып, техникада
һәм көнкүрештә бик киң кулланыла торган полиэтилен һәм
полипропилен табалар.
Этиленның яшелчәләрне һәм җиләк-җимешләрне (поми¬
дор, груша, кавын, лимон һ. б.) тиз өлгертүе кебек әһәмиятле
үзлеге дә практикада кулланыла. Яшелчәләр һәм җиләк-
җимешләр яхшырак саклансын өчен, аларны өлгереп җит¬
мәгән килеш өзеп, кирәкле урыннарга озаталар һәм һавасына
этилен кушылган ябык биналарда өлгертәләр.
Углеводородларны табу. Этилен рәтендәге углеводородлар,
химик яктан актив булу сәбәпле, табигатьтә очрамыйлар.
Әгәр алар җир астында зур басым астында ятучы табигый
газлар яки нефть составына керсәләр, ул матдәләр белән нәрсә
булыр иде, уйлап карагыз әле.
16 нчы рәсем. Лабораториядә
этилен табу.
62
17 нче рәсем. Бутадиен
молекуласының моделе.
Промышленностьта бу углеводородларны нефть продукт¬
ларын югары температурада таркату, чикле углеводород¬
ларны дегидрирлау, ягъни аларның водородын аерып алу
(de-алкушымчасы аерып алуны аңлата) юлы белән табалар,
мәсәлән:
Н Н Н Н
II II
н—С—С- Н ST Н-С=С-Н + Н,
I I
н н
Этөв Этилен
СН3—СН—СН3 = СН2-С—сн3+н2
I I
сн3 сн3
ИзоСутав Изобутилен
Без элегрәк капма-каршы процесс — углеводородларны гид-
рирлау белән танышкан идек. Димәк, бу — кайтма реакция.
Чиксез углеводородларны лабораториядә төрле ысуллар
белән табарга мөмкин. Мәсәлән, этиленны, этил спиртын
С2Н6О сульфат кислотасы белән җылытканда, су элемент¬
ларын аерып алу юлы белән табалар, ягъни промышлен¬
ностьта этиленнан спирт табуга капма-каршы процесс үткә¬
релә (16 нчы рәсем):
С2НЪО —> С2Н4 + Н,О
26. Пропиленны гидрирлау һәм пропанны дегидрирлау реакциялә¬
ренең тигезләмәләрен языгыз. Гидрирлауның экэотермик процесс икә¬
ненә таянып, бу процессларны бер химик тигезләмә белән күрсәтегез.
27. Гидрирлауның экзотермик процесс булуыннан чыгып: а) темпе¬
ратура, б) басым күтәрелгәндә тигезләнешнең кайсы якка таба күчүен
аңлатыгыз.
28. Хлорэтанны нинди ике юл белән табарга мөмкин? Шул реакция
тигезләмәләрен языгыз.
29. 1 моль этилен белән 11,2 л хлор (н. ш. да) катнашмасыннан
ничә грамм дихлорэтан табарга мөмкин?
30. Тетрафторэтилен газы CF2 = CF2 химик яктан аеруча тотрыклы
полимер хасил итә ала: хәтта җылытканда да аңа кислоталар, гадэти
оксидлаштыручылар тәэсир итмиләр. Югарыда этиленның полимер¬
лашу реакциясен язган кебек, тетрафторэтиленның полимерлашу
реакциясе тигезләмәсен языгыз.
31. Водороды галогеннар белән алмаштырылган углеводородлар¬
ның: а) эреткеч, б) суыткыч агент, в) янгын сүндерү чарасы итеп
кулланыла торганнарын әйтегез.
■ Пропиленны гидрирлаганда аның молекуласының п ростра н ствол ы
төзелеше ничек үзгәрүен модель ясау юлы белән күрсәтегез.
63
§ 14. ДИЕН УГЛЕВОДОРОДЛАР
Төзелеше һәм номенклатурасы. Молекуласында ике
икеле бәйләнеше булган, ягъни этилен рәтендәге угле¬
водородларга караганда чиксезрәк булган углеводородлар
да билгеле. Молекуласында бер генә икеле бәйләнеш бу¬
луын матдәләр исеменә -ен кушымчасы өстәп билгеләү
сәбәпле, ике икеле бәйләнеше булган углеводородларны
диен углеводородлар дип йөртәләр, мәсәлән, бутадиен:
СН2=СН- -СН = СН2. Диен углеводородларның гомуми
формуласы: С„Н2я_2.
Мондый кушылмаларда икеле бәйләнешләр бер-берсенә
карата төрлечә урнаша алалар, мәсәлән:
1 2 3 4 5
СН2-С-СН—сн2 — снэ
1,2
12 3 4 5
СН2=СН —сн2—сн-сна
Пент*ли«н-1,4
118 4}
СНо-СН—сн=сн—сн,
П«нтадиен-1,3
1 2 3 4 S
сн,—сн - С - СН—сн,
П««таднен-2,3
Молекулаларында икеле бәйләнешләр гади (ординар)
бәйләнеш белән бүленгән диен углеводородларның прак¬
тик әһәмияте аеруча зур.
Аларның иң әһәмиятлеләре: бутадиен-1,3, ягъни диви¬
нил, СН2=СН—СН-СН2 — сыеклыкка бик җиңел (—3°С та)
әверелә торган газ (17 нче рәсем), 2-метилбутадиен-1,3,
яки изопрен, СН2-С — СН=СН,— җиңел кайный торган
сыеклык.
Химик үзлекләре. Молекулаларында икеле бәйләнеш¬
ләре булу сәбәпле, диен углеводородлар гадәттәге кушылу
реакцияләренә керәләр, мәсәлән, бромлы суны төссезлән¬
дерәләр, галогеноводородларны үзләренә кушалар һ. б.
Ләкин кушылу реакцияләренең монда үзләренә генә хас
үзенчәлекләре бар. Бутадиен молекуласы бром яки га-
логеноводородның бер молекуласы белән реакциягә кер¬
гәндә, кушылу күбесенчә теләсә кайсы икеле бәйлә¬
неш өзелгән урында түгел, бәлки молекуланың очларын¬
да була. Схема рәвешендә моны менә ничек күрсәтергә
мөмкин:
СН2-СН-СН-СН2 + Вг2 — СН2—СН—СН —СН2
I I
Вг Вг
64
Икенче һем өченче углерод атомнарының ирекле ва¬
лентлык лары үзара тоташып, молекула уртасында икеле
бәйләнеш хасил итәләр:
СН:-СН-СН—СН2
Вг Вг
Бром микъдары җитәрлек булганда, бутадиен моле¬
куласы икеле бәйләнеш ясала торган урында тагын бер
галоген молекуласын үзенә куша ала. Бу реакциянең ти¬
гезләмәсен төзегез.
Икеле бәйләнешләре булу аркасында, диен углеводород¬
лар бик җиңел полимерлашалар. 2-Метилбутадиен-1,3 нең
(изопренның) полимерлашу продукты булып табигый кау¬
чук санала.
*32. Изопреиныц электронлы формуласын тезегез.
*33. а| Кутаннан, б) бутен-1 дэн ничек итеп бутадиен-1,3 не табарга?
Реакция тигезләмәләрен языгыз.
34. Бутаднен-1,3 не гидрнрлап нниди матдәләр табарга момкин?
Реакция тигезләмәләрен языгыз.
*35. Тезелеше СНх=СН—СН-СН- булган бутадиенны дивинил дип тә
йертәләр. СН,-С=€Н—СН, тезелешле бутадиенны да шулай атап була¬
мы? Нн өчен? By метдәнең исемен систематик номенклатура буенча атагыз.
*36. Изопренның С,Н, момкнн булган изомерларының структур
формулаларын төзегез.
*37. Бутадиен молекуласына: а) бер бром молекуласын, б) бер бро¬
моводород молекуласын, в) ике бром молекуласын кушудан килеп
чыккан матдәнең, систематик номенклатура буенча, исемен әйтегез.
*33. 1,12 л (н.ш. да) бутадиен белән кушылу реакциясенә керә ала
торган бромның максималь массасын табыгыз.
§ 15. КАУЧУК
Табигатьтә каучук. Каучукның үзлекләре. Табигый кау¬
чукны кайбер үсемлекләрнең, нигездә Бразилиядә үсә тор¬
ган гевея агачының, сөтсыман сыекчасыннан табалар.
Сыекча алу өчен гевея агачында кисемнәр ясыйлар. Шул
кисемнәрдән агып чыккан сөтсыман сыекчаны — каучукның
коллоид эремәсен җыялар. Аннан соң электролит (кислота
эремәсе) белән тәэсир итеп, яки җылытып коагуляциялиләр.
Коагуляция нәтиҗәсендә каучук бүленеп чыга.
Каучукның иң әһәмиятле үзлеге—аның эластиклыгы,
ягъни артык зур булмаган тышкы көч тәэсирендә формасын
үзгәртүе, мәсәлән, сузылуы, кысылуы, ә аннан соң, көч тәэси¬
ре тукталгач, яңадан элекке формасына кайтуы.
3 B-I7T
65
18 нче рәсем. Җылытканда
каучукиыв таркалуы.
Каучукның үзе аша газ
һәм су үткәрмәве дә прак¬
тикада куллану өчен әһәми¬
ятле үзлекләреннән санала.
Европада каучуктан ясал¬
ган әйберләр (галошлар, су
үткәрми торган киемнәр)
XIX гасыр башында тарала
башлый. Ләкин бу әйберләр
уртача температурада гына
уңайлы булып чыгалар, эс¬
седә алар йомшарып, ябы-
шучан булып китәләр, сал¬
кында каты һәм уалучанга
әйләнәләр. Каучукны вул¬
канлаштыру, ягъни аны кү¬
керт белән җылытып рези¬
нага әверелдерү ысулы ачылганнан соң гына, бу кимчелекне
бетерергә мөмкинлек туа.
Резина тагын да сыгылмалырак булып чыга, эластиклыгы
ягыннан бер материал да аңа тиңләшә алмый. Өстәвенә ул
каучуктан ныграк һәм температура үзгәрүләренә дә биреш-
мәүчанрәк.
Вулканлаштыру процессы ачылганнан соң, каучук (ре¬
зина рәвешендә) көннән-көн күбрәк кулланыла бара. Хәзер
каучук әйберләр кулланылмаган бер генә тармак та юк.
Каучук халык хуҗалыгында үзенең әһәмиятлелеге ягын¬
нан корыч, нефть һәм ташкүмер белән бер рәттә тора.
Табигый каучукның составы һам тезелеше. Сыйфат
анализы каучукның ике элементтан — углерод һәм водо¬
родтан торганлыгын күрсәтә, ягъни каучук углеводородлар
классына керә.
Аның микъдари анализыннан иң гади формула С5Н8
килеп чыга. Молекуляр массасын исәпләү аның бер¬
ничә йөз мең (150000—500000) икәнен күрсәтә. Димәк,
каучук — табигый полимер. Аның молекуляр формуласы
(С5Н8)„.
Бу матдәнең төзелешен аңлау өчен, аның макромоле¬
кулаларын таркатып карыйк. Бу максат белән каучукны
үткәргеч көпшәле пробиркага салып (18 нче рәсем) җылы¬
табыз, Без полимерның таркала башлавын һәм таркал¬
ганда хасил булган сыек продуктларның көпшә төше¬
66
релгән икенче пробиркада җыелуын күрербез. Бромлы су
белән тикшереп карагач, без аның чиксез углеводород
икәнен беләбез. Каучукны таркатканда табылган төп про¬
дукт — молекуляр формуласы каучукның иң гади фор¬
муласы белән бердәй булган углеводород. Бу изопрен:
СН,-С-СН=СН,
сн3
Каучук макромолекулалары изопрен молекулаларын¬
нан тора дип исәпләргә мөмкин.
Бу процессны схема рәвешендә күз алдына китереп ка¬
рыйк. Башта икеле бәйләнешләр өзелү исәбенә ике изо¬
прен молекуласы бергә кушыла:
СН2=С—СН-СН, + СН,=С—СН=СН2 —*
сн3 сн,
II II
— — СН,—С—СН—СН,— + — СН,—С—СН—СН,— —-
сн3 сн3
—■ — сн,—с=сн—СН,—СН2—С=СН—СН,—
сн, сн3
Бу вакытта уртадагы углерод атомнарының ирекле ва-
лентлыклары йомылып, молекула уртасында икеле бәйлә¬
нешләр хасил була, һәм алар үсә барган чылбырның зве¬
ноларына әверелә.
Барлыкка килгән кисәкчеккә изопренның икенче мо¬
лекуласы килеп кушыла:
— СН,—С = СН—СН,—СН,—С-СН—СН,—+
СН, СН3
I I
+ —СН2—С—СН—СН, .
СН3
— —СН,—С-СН -(СН2)2 -С=СН—(СН2>,—С=СН—СН,—
СН, СН, СН,
Мондый процесс шулай дәвам итә. Барлыкка килгән
каучукның формуласын түбәндәгечә күрсәтергә мөмкин:
(—СН,—С=СН—СН,—)„
СН,
5
67
19 вчы рәсем. Вулклнлаштырылган каучук
тезелешенең схемасы. Кызыл түгәрәкләр —
каучук макромолекулалары звеноларын,
ә кара түгәрәкләр күкерт атомннрыниаи
торган күперчекләрне сурәтли.
Макромолекулалары атомнарның озын чылбырыннан тор¬
ган полимерлар белән очрашкан идек инде. Әмма алар каучук
шикелле эластик түгелләр иде. Аның үзенә генә хас бу үзле¬
ген ничек аңлатырга соң?
Каучук молекулалары сызыкча төзелешле булуларына
карамастан, алар туры сызык буеича сузылып урнашмаган,
бәлки күп тапкырлар бөгәрләнеп, йомгак кебек чорналган.
Каучукны сузганда, мондый молекулалар турая, нәтиҗәдә
алынган каучук кисәге озыная. Сузуны туктаткач, звено¬
ларның эчке җылылык хәрәкәте нәтиҗәсендә молекулалар
баштагы бормаланган хәлләренә кайта, һәм каучук кечерәя.
Әгәр каучукны тагы да ныграк тартып сузсаң молекулалар
тураеп кына калмас, бәлки бер-берләренә карата авышыр,
шунлыктан каучук кисәге өзелергә мөмкин.
Бик тиз үсә барган таләпләрне тулысынча канәгатьләндерү
өчен, каучукның табигый чыганаклары гына җитми. Хәзерге
вакытта синтетик каучук җитештерү масштаблары арта бара.
Синтетик каучукларның әһәмиятле төрләре белән соңрак
танышырбыз.
Каучукны вулканлаштыру. Табигый һәм синтетик кау¬
чукны күбесенчә резина хәлендә кулланалар, чөнки аның
ныклыгы, эластиклыгы аеруча яхшы һәм башка кыйммәтле
88
сыйфатлары да бар. Резина алу ечен каучукны вулканлаш¬
тыралар.
Каучукны күкерт, тутырмалар (корым иң әһәмиятле ту¬
тырмалардан санала) һәм башка матдәләр белән катнаш¬
тырып, ясаласы әйбер формасына кертәләр һәм җылыталар.
Бу шартларда күкерт атомнары каучукның сызыкча молеку¬
лалары белән кайбер икеле бәйләнеш урыннарында химик
реакциягә кереп, молекулаларны бер-берләренә «тегеп» куй¬
гандай итәләр (19 нчы рәсем). Нәтиҗәдә пространствода
озынлыгы, кинлеге һәм калынлыгы кебек өч үлчәнеше бул¬
ган гигант молекулалар барлыкка килә. Полимер простран
стволы структураны ала.
Мондый каучук (резина) вулканлаштырылмаган каучук¬
тан, әлбәттә, ныграк була. Полимерның эрүчәнлеге дә үзгәрә:
каучук әкрен булса да бензинда эри, ә резина фәкать бүртә генә.
Әгәр каучукка күкерт резина ясалу өчен кирәк булганнан
күбрәк салынса, вулканлашу вакытында сызыкча молеку¬
лалар бик күп урыннарда үзара «тегелгән» булып чыга һәм
материал үзенең эластиклыгын югалтып, катып китә — эбо¬
нит хасил була. Хәзерге пластмассалар барлыкка килгәнче,
эбонит иң яхшы изоляторлардан санала иде.
39. Каучукның эластик булуы тезелешенең нинди үзенчәлекләре
белән аңлатыла?
40. Каучукның чиксез углеводород булуын тәҗрибә юлы белән
ничек исбат итәргә?
41. Резина ни өчен каучукка караганда ныграк Һәм органик эрет¬
кечләрдә эреми?
42. Резинаның төзелеше эбонит тезелешеннән нәрсә белән аерыла?
Бу аерманы схематик рәсем белән күрсәтегез.
Өйдә резина һәм каучук белән түбәңдәге тәҗрибәләрне ясагыз:
а) эластиклыгын һәм ныклыгын чагыштыру, б) җылытканда ничек
үзгәрүләрен, в) бензин тәэсиренә би ре ш ү-би реш мә үчә илекләрен,
г) калий перманганаты эремәсенең каучукка тәэсирен тикшерегез.
§ 1в. АЦЕТИЛЕН ҺӘМ АНЫҢ ГОМОЛОГЛАРЫ
Молекуласында бер һәм ике икеле бәйләнеше булган угле¬
водородлардан тыш, башка чиксез углеводородлар да бар. Без
андый кушылмаларның тагын бер группасы белән танышыр¬
быз. Бу группаның иң гади вәкиле — ацетилен.
Ацетиленның төзелеше. Ацетилен рәтендәге беренче мат¬
дә — суда аз гына эрүчән төссез газ, аның молекуляр фор¬
муласы С2Н2.
69
20 иче рееем. Ацетилен молехуласывда я-бейләнешлэр ясалу схемасы:
А -р алектрои болытларыаыд ян-яктан бер-берсе белая пар-оар булып
үзара аралашуы; £ — rt-байланешләр барлыкка килә торган үзара
перпендикуляр ике яссылык.
Ацетилен молекуласында водород атомнарының саны
этилен молекуласыядагыдан икегә кимрәк, шуңа күрә монда
углерод атомнары арасында өченче бәйләнеш ясала. Ацети¬
ленның структур формуласы:
Н-С=€-Н якв НС=СН
Ацетилен молекуласындагы өчле бәйләнеш углерод атом¬
нарының үзара өч пар электрон белән бәйләнгәнлеген күр¬
сәтә: •
Н:С-С:Н яки Н:С:;С:Н
Ацетилен молекуласының төзелешен тикшереп кара¬
гач, андагы барлык атомнарның бер туры өстендә яткан¬
лыгы һәм молекуланың сызыкча төзелешле булуы ачык¬
лана. Углерод атомнары үзара бер о-бәйләнеш һәм ике
л-бәйләнеш аша тоташканнар. Мондый молекулада һәр
углерод атомы о-бәйләнеш аша бары тик башка ике атомга
(углерод атомына һәм водород атомына) гына тоташкан
булу сәбәпле, гибридлашуга монда ике электрон болыты —
бер $-»лектрон һәм бер р-электрон болытлары гына кат¬
наша. By — sp-гибридлашу очрагы. Барлыкка килгән сим¬
метриясез күләмле сигезле формасындагы ике гибрид
болыт бер-берсеннән ныграк ераклашырга омтыла һәм,
капма-каршы юнәлештә башка атомнар белән 180° почмак
ясап, бәйләнешкә керә. Калган ике р-алектрон болытлары
гибридлашуга катнашмый, алар элеккечә үк симметрия¬
ле күләмле сигезле формасын саклый һәм шундый ук
икенче углерод атомы болытлары белән яннан аралашып,
70
иче рәсом. Ацетилен молекул асын ыц м одел ьл ере.
I үзара перпендикуляр яссылыкларда урнашкан ике я-бәй-
ләнеш хасил итә (20 нче рәсем).
Өченче бәйләнешнең барлыкка килүе углерод атомнарының
тагын да якынаюына китерә: аларның төшләре арасывдагы
ераклык 0,120 нм га тигез. Модельдә моны аңлату өчен,
углерод атомнарын сурәтләгән шарларны ныграк явьчеп
күрсәтәләр (21 нче рәсем).
Ацетиленның гомологлары. Метан һәм этан шикелле үк,
ацетилен да гомологии рәтнең башында тора. Ул — молеку¬
ладагы углерод атомнары арасында бер өчле бәйләнеше булган
ацетилен углеводородлары рәте.
Систематик номенклатура буенча, өчле бәйләнеше булган
углеводородларның исемнәре үзләренә тиңдәш чикле угле¬
водородлар исемендәге -ав кушымчасын -ин кушымчасына
алыштырып ясала. Этилен углеводородларындагы шикелле үк,
монда да углерод атомнарын чылбырның кабатлы (бу очракта
өчле) бәйләнешкә
гып чыгалар:
якынрак торган очыннан башлап номер су*
СН—СН СН — С— сн2-сна
Этм Бутии!
СН - C-(hi,-CH-<hi2-СН2
CHj—С—А-СН»
Вутвк-2
CHj
4 Метил гексив-1
Ацетиленның гомологии рәтенә углерод скелетының тар¬
маклануына һәм өчле бәйләнешнең кайда урнашуына бәйле
изомерия күренеше хас. Формулалары югарыда күрсәтелгән
матдәләр арасыннан изомерларны табыгыз.
71
Ацетилен рәтендәге углеводородларга изомер булган мат¬
дәләрне башка углеводородлар арасыннан да табарга мөмкин.
Нинди углеводородлар арасыннан? Бу сорауга җавап бирү
өчен, ацетилен рәтендәге углеводородларның гомуми форму¬
ласын төзегез һәм аны сезгә билгеле булган башка гомологии
рәттәге углеводородларның формулалары белән чагыштырып
карагыз.
Химик үзлекләре. Бу рәттәге углеводородларның үзлек¬
ләрен практик яктан әһәмияте аеруча зур булган матдә була¬
рак ацетилен мисалында тикшереп карарбыз.
Метан һәм этиленнан аермалы буларак, ацетилен корым¬
лы ялкын белән яна. Углеводородларның процентларда күр¬
сәтелгән составын чагыштырып, бу күренешне аңлатыгыз.
I Төзелешләрдә, мастерскойларда һәм заводларда эре¬
теп ябыштыру эшләрендә ацетиленның бик якты ялкын
белән януын сезнең күргәнегез бардыр, әлбәттә. Анда
корым ясалуы күренми. Ацетиленның корымлы ялкы¬
нын күзне чагылдырырлык якты ялкынга әверелдерергә
мөмкин. Моның өчен ялкынга махсус труба аша өстәмә
һава өрдерергә кирәк. Углерод кисәкчекләре ялкынның
урта өлешендә бик нык кызып, ялкынны көчле яктыртыр
һәм шул вакыт корым хасил итмичә тулысынча янып бе¬
тәр. Эретеп ябыштыру эшләрендә һава урынына кислород
кулланалар; ул ацетиленны яндырып бетерү белән бергә
ялкынның температурасын 3000 °C ка кадәр күтәрә. Аце¬
тиленның һава һәм кислород белән катнашмасы шартлау
чан була.
Ацетиленның электронлы төзелешенә таянып, без мондагы
л бәйләнешләрнең ныклыгы буенча төп а-бәйләнештән калы¬
шуын һәм шушы п-бәйләнеш урынында оксидлашу һәм ку¬
шылу реакцияләре булу мөмкинлеген әйтә алабыз.
Ацетиленның чиксез углеводород үзлекле булуын тикше¬
рү өчен, ацетилен газы тутырылган цилиндрга калий перман¬
ганаты эремәсе салып карыйбыз. Эремә бик тиз төссезләнә.
Димәк, ацетилен, этилен шикелле үк, бик тиз оксидлаша.
Кушылу реакцияләреннән ацетиленга бром белән тәэсир
итешү реакциясе хас. Бу реакция дә аның этиленга бик нык
охшаганлыгын күрсәтә. Реакция ике стадиядә уза. Бром баш¬
та л-бәйләнешнең берсе урынында кушыла:
Н—С»С Н + Вг? — Н-С=С-Н
Вг Вг
1,2 Дибромзтеи
72
Аннан соң бромның икенче молекуласы кушыла:
Вг Вг
I I
Н—С-С-Н + Вг2—• Н-С-С-Н
Вг Вг Вг Вг
1,1,2,2-Татрабромта
Катализатор (платина, никель) катнашында ацетиленга
водород кушыла ала. Бу вакытта ацетилен башта — этиленга,
аннары этанга әверелә:
CH—CH + Hj — СНг-СН2
СН2-СН2 + Н2 —* СН,-СНЭ
Ацетиленга катлаулы матдәләрнең молекулалары да ку¬
шыла ала. Бәйләнешләрнең берсе урынына хлороводород
кушылу нәтиҗәсендә (катализатор — терекөмеш (II) хлориды
катнашында), газ хәлендәге матдә хлорәтең хасил була:
СН—СН + НС1 —* СН2-СН
А(
Ацетиленны куллану. Молекуласында өчле бәйләнеше
булган углеводородлардан иң күп кулланылганы — ацетилен.
Әле күптән түгел генә ул газ белән эретеп ябыштыру һәм
металл кисү эшләрендә ягулык итеп кенә файдаланыла иде.
Хәзер ацетилен органик кушылмалар синтезлау өчен, һаман
саеи киңрәк кулланыла бара.
Ацетиленга хлор кушылу нәтиҗәсендә, 1,1,2,2-тетрахлор-
этан дигән эреткеч табыла:
СН=СН + 2С12 — СНС1,-СНС12
Тетрахлорэтанны тагын да эшкәртү юлы белән водороды
хлор белән алыштырылган башка кушылмалар табалар. Мәсә¬
лән, аның хлороводородын аерып алганда югары сыйфатлы
эреткеч трихлорэтен барлыкка килә. Ул киемнәрне чистарту
өчен кулланыла:
• С1 Н •
Н-С-С-С1 — СНС1 = СС12+НС1
jL| 0 1.1.2 Тряиор»т
Ацетилен бик күп микъдарда хлорэтен, яки винилхлорид
җитештерү өчен кулланыла, ә хлорэтенкы поли мер лаштырып,
поливинилхлорид табалар:
73
n€H,€ll -* |-CH2 CH I
Cl [ ci J«
Поливинилхлорид электр үткәргечләрен изоляцияләү,
плащлар тегү өчен, клеенка, ясалма күн, торбалар һ. 6. әзер¬
ләүдә кулланыла.
Ацетиленнан пластмасса, каучук һәм синтетик сүсләр җи¬
тештерү өчен кирәкле башка төрле полимерлар да табалар.
Ацетилен синтетик серкә кислотасы табуда да кулланыла.
Ацетилена ы табу. Лабораториядә һәм промышленностьта
ацетиленны күбесенчә карбид ысулы белән табалар. Әгәр каль¬
ций карбиды кисәкчекләрен сулы савытка салсаң яки каль¬
ций карбиды өстенә су агызсаң, шунда ук бик көчле рәвештә
ацетилен аерылып чыга башлый:
СаС, + 2НОН — С,Н2 + Са|ОН)2
Ләкин карбид ысулы ацетиленга үсә барган таләпләрне,
бигрәк тә полимер материаллар җитештерү промышленностен,
канәгатьләндерә алмый, чөнки кальций карбидын табу бик
күп электр энергиясе сарыф итүгә бәйле.
Кальций карбидын электр мичләрендә 2000 °C темпера¬
турада күмергә (кокска, антрацитка) известь белән тәэсир
итеп табалар:
CaO I ЗС * CaCj + CO
Соңгы елларда ацетиленны аеруча киң таралган химик чи¬
малдан— табигый газдан (метаннан) табу ысулы кулланыла
башлады.
Метанны югары температурага кадәр җылытканда, аның
углеродка һәм водородка таркалуын без беләбез инде. Бу
реакциядә ацетилен арадаш продуктларның берсе:
2СН, —*■ С2Н2 + зн2
С2Н2 - 2С I Н,
2СН, - 2С + 4Н2
Метаннан ацетилен табу идеясе ацетиленны ара стадиядә
аерып алуга, аңа углеродка һәм водородка таркалырга ирек
бирмәүгә нигезләнгән. Моңа ирешү өчен, хасил булган ацети¬
ленны югары температура зонасыннан тиз генә аерып алып
суытырга кирәк.
74
Бу производство нигезендә башка фикерләр дә ята- Ме-
танны таркату өчен, реакторда югары температура булды¬
рырга кирәк. Монда метан үзе җылылык чыганагы хезмәтен
үти ала: аның бер өлеше тиешле температура булдыру өчен
ягулык итеп, ә калган өлеше тиешле продукт алу өчен химик
чимал итеп файдаланыла.
I Ысулларның берсендә бу процесслар түбәндәгечә тор¬
мышка ашырыла (I форзацтагы таблицаны карагыз). Эчке
ягы кызуга чыдам кирпечтән эшләнгән цилиндрик реак¬
торга зур тизлек белән күләмнәре якынча 2: 1 чагыш¬
тырмасында катнаштырылган, алдан җылытылган, таби¬
гый газ (метан) белән кислород кертелә. Газлар реактор¬
ның махсус камерасында аралашып, тар каналлар аша
реакция камерасына узалар. Монда метанның бер өлеше
яна, һәм шуның аркасында температура 1500 °C чамасына
җитә, ә калган өлеше бу шартларда ацетиленга һәм водо¬
родка таркала.
Реакция камерасына газлар зур тизлек белән кергән¬
лектән, реакция продуктлары да югары температуралы
зонада секундның меңенче өлеше кадәр генә булалар;
аннан узып киткәч, алар су белән бик тиз суытыла, та¬
былган ацетилен әнә шулай стабильләшә, «чыныкты¬
рыла».
Реакция продуктларында, ацетилен белән водородтан
тыш, корым, углерод оксидлары һәм башка матдәләр Д»
була. Корым газны су белән юдырганда аерыла. Аннары
кушылмадан реакциянең төп продукты ацетилен аерып
алына. Бу процесс вакытында табылган водородны аммиак
һәм башка органик матдәләр синтезлау өчен файдаланыр¬
га мөмкин.
43. Молекуляр массаларын исәпләп чыгармыйча гына этан,
этен һәм этанның, чагыштырма тыгызлыклары турында нәрсә әйтә
аласыз?
44. Молекуласында дүрт углерод атомы һәм эчле бәйләнеше булган
тармакланган структуралы углеводородмын булуы мөмкинме? Җа¬
вапны аңлатып бирегез.
45. Бутинга изомер булган, ләкин углеводородларның башка рәтенә
караган матдәнең структур формуласын языгыз.
*46. Систематик номенклатура буенча түбәндәге матдәләргә исем
бирегез:
сн3-с«с-сн-сн, СН,—СН2 СН—с «*сн
СН, СН,
75
сн,—сн—сн— сн=сн—сн,
сн,
сн,
I
сн<-с с сн,
сн.
^Г'
*47. Түбәндә бирелгән матдәләрдән тезелеше СН ян С—СН? СНг—СН,
булган матдәнең аерым гомологларын, изомерларын язын алыгыз һәм
аларга исем бирегез: f • .
СН,=СН—СН,—СН,
СНг=СН СНг-сн=снг
сн»с сн-сн,
нс==сн сн,—с=сн ’ 1
1 1
сн,
-г
н,с сн,
сн, ( (г
*48. Ацетилен углеводородларына цис транс изомерия хасмы? Җа
ванны аңлатыгыз.
49. Марковпнков кагыйдәсенә таянып, бромоводородның пропннга
Кушылу реакциясе (беренче стадиянең) тигезләмәсен языгыз. Ннндн
матдә барлыкка килә?
50. Ацетиленның тулысынча янып бетү тигезләмәсен языгыз һәм
13 г ацетиленны (н.ш. да) яндыру очен нинди күләмдә кислород
сарыф ителүен исәпләп табыгыз.
51. 11,2 Г ацетилен белән (н. ш. дя) бромның граммнарда үлчәнгән
күпме максималь массасы кушылу реакциясенә керә ала?
52. Ацетиленнан 1,2 дихлорэтан табу реакцияләренең тигезләмәдә^
рем тезегез.
53. Ацетиленнан ничек хлорэтан табалар? Реакция тигезләмәләрен
языгыз.
54. Составында 30 % чит катышма булган 1 кг техник кальций
карбидыннан нинди күләм (н. ш. да) ацетилен табарга момкнн?
55. Органик химиядә реакция тигезләмәләреңдә тигезлек билгесен,
гадәттә, укка (яки икесе ике якка юнәлгән уклар) алмаштыруларын
ничек аңлатырга?
5в. Углеводородларны нйрәнгәндә сезгә билгеле булган галогеннар
белән алмаштырылган углеводородлар турындагы мәгълүматларны
гомумиләштерегез: аларның исемнәрен, формулаларын язып чыгыгыз,
үзлекләрен һәм кулланылуларын әйтегез.
4. АРОМАТИК УГЛЕВОДОРОДЛАР
Бу төркем кушылмаларның иң беренче билгеле булган-
нарыннан хуш ис килгәнгә аларны ароматик дип атаганнар.
Соңга табарак төзелеше һәм химик үзлекләре белән шул ук
төркемгә керә торган матдәләрнең күбесеннән хуш ис кил¬
мәгәнлеге билгеле булды. Ләкин бу кушылмалар әле хәзер дә
шул тарихи барлыкка килгән гомуми исем белән йөртеләләр.
Ароматик углеводородларның иң гади һәм иң әһәмият-
леләреннән берсе — бензол.
§ 17. БЕНЗОЛ
Физик үзлекләре. Бензолның төзелеш проблемасы. Бен¬
зол — бик тиз кайный, суда эреми торган, үзенә бертөрле исле,
төссез сыеклык. Суытканда ул эрү температурасы 5,5 °C
булган ак кристаллик масса хасил итеп ката.
Бензолның молекуляр формуласы СвНв. Моннан бензол¬
ның нык туендырылмаган кушылма икәне күренә: чикле
углеводородларның состав формуласына җиткерү өчен, аның
молекуласында сигез водород атомы җитми.
Әгәр дә бензолны бромлы суга яки калий перманганаты
эремәсенә салып болгатсак, чиксез кушылмаларга хас булган
реакцияләр бармавын күреп гаҗәпкә калабыз. Моның сәбәбен
матдәнең химик төзелешеннән чыгып аңлатырга кирәктер.
Бензолның төзелешен ачыклауны аның синтезыннан
башлый алабыз. Бензолны 650 °C ка кадәр җылытылган,
активлаштырылган күмер тутырылган көпшә аша ацетилен
уздырып табарга мөмкин.
Ацетилен С,Н2 һәм бензол СвН# молекулаларының состав¬
ларын чагыштырып карасак, без һәр өч ацетилен молекула¬
сыннан бер бензол молекуласы ясалуын, ягъни полимерлашу
(тримерлашу) реакциясе барганлыгын күрербез:
ЗСгН2 ♦ с„нв
Ләкин бу факт бензолның төзелеше турында фикер йөртү
өчен җитәрлек түгел, чөнки без ацетилен молекулаларының
77
үзара ничек тоташуын белмибез. Бу вакытта СвНв составлы,
чылбыр һәм циклик тезелешле төрле матдәләр барлыкка ки¬
лүен күз алдына китерергә мөмкин, мәсәлән:
СН2-СН—С -С—СН=СН2
Бу мәсьәләне ачыклауны дәвам иттерү өчен, матдәнең хи¬
мик үзлекләрен тикшереп карарга кирәк. Әгәр катализаторлы
кыздырылган көпшә аша бензол белән водород парлары кат¬
нашмасын уздырсак, һәрбер бензол молекуласына өч водород
молекуласы кушыла һәм реакция нәтиҗәсендә төзелеше сезгә
яхшы таныш булган циклогексан барлыкка килә.
Башта алынган продуктны циклик төзелешле дип уйла¬
ганда гына бензол молекуласына өч водород молекуласы ку¬
шылудан циклогексан хасил булуын аңларга мөмкин:
сн^ сн2
нс^ сн н,с сн2
I II +зн2 — I I
нс<\ ^сн Н2С^ /СН,
^сн сн2
Чыннан да, әгәр бензолның углерод атомнары чылбыры Йо¬
мык булмаса, молекуланың тулысынча туенуы өчен өч кенә
водород молекуласы җитмәс, бәлки дүрт водород молекуласы
кирәк булыр иде (СвНв + 4Н2—* С6Н|4). Әмма мондый хәл тәҗ¬
рибәгә каршы килә.
Өч ацетилен молекуласыннан бензолның циклик молеку¬
ласы хасил булуны түбәндәгечә күз алдына китерергә мөмкин:
СН
СН
Шулай итеп, без бензолның структур формуласы циклик
төзелешле дигән нәтиҗәгә киләбез.
Бензолның югарыда китерелгән структур формуласын
беренче тапкыр немец галиме А. Кекуле (1865 ел) тәкъдим
78
22 нче рәсем. Бензол молекуласында о-бәйләпешләр ясалу схемасы.
итә. Бу формула галимнәрне канәгатьләндереп җиткермәсә дә,
аннан инде йөз елдан артыграк файдаланалар. Бәлки сездә дә
аның дәреслегенә карата шик тугандыр.
Чыннан да, без тәҗрибәдә бензолның бромлы су һәм ка¬
лий перманганаты эремәсе белән тәэсир итешмәвен күреп уз¬
дык; шулай да, формуладан чыгып карасак, аның молекула¬
сында оч икеле бәйләнеш бар. Матдә төзелешен тирәнтен өйрә¬
нү, ягъни молекулада атомнар арасындагы химик бәйләнеш¬
нең характерын ачыклау бу каршылыкны аңларга ярдәм
итте.
Бензолның электронлы төзелеше. Хәзерге физик методлар
ярдәмендә бензол молекуласының циклик төзелешле икәне
һәм углерод атомнарының алтысының да бер яссылык өстен
дә ятуы билгеле булды. Шулай итеп, Кекуле формуласында
атомнар тоташу тәртибенең дөрес күрсәтелүе исбат ителде.
Молекулада атомнарның үзара ничек тоташуларын гына
ачыкларга кирәк иде.
Тикшеренүләр молекулада углеродның күрше атомна¬
рының төшләре тигез ераклыкта — 0,140 нм булуын күрсәт¬
те. Бу хәл үзе генә дә бензол молекуласында гади һәм икеле
бәйләнешләрнең булмавын күрсәтә, чөнки бу очракта углерод
атомнары арасындагы ераклык бер урында якынча 0,154 нм,
ә башка урында 0,134 нм булыр иде.
Электрон теориясе бу күренешне түбәндәгечә аңлата.
Бензол молекуласындагы углерод атомнарының барысы
да sp2 гибридлашу хәлендә. Углеродның һәр атомының су¬
зынкы күләмле сигезле формасындагы гибридлашкан өч
электрон болытлары боҗра яссылыгында күрше углерод
79
23 нче рәсем. Бензол молекуласында я-бәнләнешләр ясалу схемасы:
А һәм Б — р-электрои болытларының ян-яктаң бер-берсе белән үзара
аралашуын күрсәткән нке проекция; В — атом тешләре яссылыгының
аскы һәм еске ягында молекуляр л-болытының электрон тыгызлыгының
таралып урнашуы.
атомнары белән ике а бәйләнеш һәм водород атомы белән
бер о-бәйләнеш барлыкка китерәләр; бу оч бәйләнеш ара¬
сындагы почмаклар 120° булырга тиеш (22 нче рәсем).
Гибридлашугя катнашмаган һәм симметрик күләмле си¬
гезле формасын саклаган дүртенче электроннарның бо¬
лытлары а-бәйләнеш яссылыгына перпендикуляр ур¬
нашкан. Мондый болытларның һаркайсы күршесендәге
ике углерод атомының болытлары белән тигез аралаша
(23 нче рәсем, А). Молекула яссылыгына төшерелгән про¬
екциядә бу электрон болытлары, 23 нче рәсемдәгечә (Б).
берсен-берсе каплый торган түгәрәкләр рәвешендә күре¬
нер. Молекулада аерым аерым өч л-бәйләнеш түгел, бәлки
барлык углерод атомнары өчен уртак булган һәм алты
электроннан торган бердәм л-электрон бәйләнешләр сис¬
темасы ясала (23 нче рәсем, В). Молекула өчен шушы
уртак л-электрон болыты тәэсирендә углерод атомнары
арасындагы ераклык 0,154 нм дан 0,140 нм га кадәр ки¬
ми. Бензол молекуласының масштаблы моделе 24 нче рә¬
семдә күрсәтелгән.
Молекулада электроннар тыгызлыгы тигез бүленгән¬
лектән, углерод атомнары арасындагы бәйләнешләр дә бер¬
төрле булып чыга.
Бензол молекуласында электрон тыгызлыгының тигез
таралып урнашуын еш кына эченә түгәрәк сызылган ал-
80
гыпочмак рәвешендә сурәт¬
лиләр:
Ләкин әле хәзер дә күбе¬
сенчә Кекуле формуласыннан
файдаланалар, тик бу очракта
ул формуланың молекула тө¬
зелешен шартлыча гына су-
рәтләвен исәпкә алалар.
Химик үзлекләре. Башка
барлык углеводородлар кебек,
бензол — янучан матдә. Янганда
ул бик корымлый; моны бик
җиңел аңлатып була, «өики бен¬
золда углеродның масса өлеше
ацетилендагы шикелле үк.
Алдарак күреп узганыбызча,
бензол суда зрегән бром белән
реакциягә керми. Ләкин башка
шартларда бензол бром белән
реакциягә керә.
Озын вертикаль көпшәсе су¬
ыткыч хезмәтен үти торган кол
бага (25 нче рәсем) бензол һәм
бераз бром белән тимер вагы
салыйк (тимер вагы катализатор
FeBra хасил итү өчен кирәк).
Озак та үтмәс, без прибор көп¬
шәсеннән «төтен* чыкканын кү-
24 иче рәсем. Бензол
молекуласының моделе.
25 нче рәсем. Бензолны бром л ау.
рербез. Аерылып чыга торган газны суда эретеп, эремәгә кө¬
меш нитраты салсак, бром белән бензол реакциягә кереп
бромоводород НВт хасил итүләрен күрербез. Реакциядән соң
колба төбендә авыр сыеклык — бромбензол С6Н5Вг кала.
Бензолны бромлау реакциясен түбәндәге тигезләмә белән
күрсәтергә мөмкин:
^СН СН
НС"^ СН НС^ СВг
I || + Br± — I II + НВг
НС^ сн нс.^ ,СН
сн' СН
Брсмбеяэол
81
Моннан бромның бу шартларда бензолга кушылмавын, бәл¬
ки алмаштыру реакциясенә керүен күрәбез.
Бу реакция чикле углеводородларның алмаштыру ре¬
акциясеннән аерыла. Реакция вакытында ирекле радикал¬
лар ясалмый һәм ул чылбыр реакциясе дә түгел. Тимер
бромиды FeBr3 йогынтысында бром молекуласы полярла¬
ша Вг®+:Вг6 . Уңай корылган бром алты электрон болыты
булган бензол молекуласына тартылып, углерод атомна¬
рының берсе белән ковалент бәйләнеш хасил итә, шул ва¬
кытта этеп чыгарылган водород протоны тискәре корылган
бром ионы Вг” белән кушылып, бромоводород молекула¬
сын барлыкка китерә:
сн сн
НС^ с:н 6. 5. НС^ С:Вг 6+s
+ Вг : Вг — | | + НВг
нс^ /Сн НС^ fa
сн сн
Бензолның нитрат кислотасы белән реакциягә керүе үзен¬
чәлекле. Әгәр куертылган нитрат һәм сульфат кислоталары
катнашмасына бензол кушып, катнашманы бераз җылытсак,
реакция нәтиҗәсендә әче миндаль исле саргылт төстәге авыр
сыеклык — нитробензол С6Н5—NO2 хасил була. Монда нитро
группа дип аталган NO2 — атомнары группасы, әлеге реак¬
циядәге бром кебек, водород атомы урынын ала. Бу нитро-
лау реакциясен түбәндәге тигезләмә белән күрсәтергә мөмкин
(бу реакциядә куертылган сульфат кислотасының нинди роль
уйнарга тиешлеген әйтеп карагыз):
* • ~ 1
“+'[hoj —no2
сн no.
нс^ "o'
I II + н;о
нс^ ^сн
сн
Составының чиксез булуына карамастан, алмаштыру реак¬
циясенә керү үзлеге белән бензол беркадәр чикле углеводород¬
ларга охшаш.
Билгеле шартларда бензол кушылу реакцияләренә да керә
ала. Мондый реакцияләрнең берсен — водород белән тәэсир
итешүне без беләбез инде. Гадәттәге молекуляр формулалардан
файдаланып, бу реакциянең тигезләмәсен языгыз.
82
Хлор белән бензол катнашмасына яктылык тәэсир иткәндә,
хлор бензолга кушыла ала. Шулай итеп, гексахлорциклогек-
сан — безгә исеме таныш гексахлоран дигән кристаллик матдә
табыла:
СН
+ ЗС1г —
Бензолның водород һәм хлор белән кушылу реакциясенә
керүе аның чиксез углеводородларга да беркадәр охшаганлы¬
гын күрсәтә.
Үзенең химик үзлекләре белән бензол чикле һәм чиксез
углеводородлар арасында тора. Ул углеводородларның һәр
икесенә хас реакцияләргә керә, ләкин алмаштыру реакциясе
монда чикле углеводородларга караганда җиңелрәк, ә кушылу
реакциясе чиксез кушылмалардагыга караганда авыррак ба¬
ра. Бензолның электронлы төзелешендәге үзенчәлекләре
аның үзлекләрендә әнә шулай чагыла.
Бензолны куллану. Бензол күп кенә органик кушылмалар
синтезлауда башлангыч матдә итеп кулланыла. Нитролау
реакциясе ярдәмендә нитробензол C6H.NO, табалар; бензолны
хлорлау юлы белән хлорбензол С6Н,.С1 (эреткеч) һәм бензол¬
ның хлор белән алмаштырылган башка кушылмаларын та¬
балар. Бензол дарулар һәм хуш исле матдәләр, төрле буя¬
гычлар, югары молекуляр төзелешле матдәләр синтезлауда
мономерлар табу һ. 6. өчен башлангыч матдә итеп кулланыла.
Ул эреткеч итеп һәм мотор ягулыгының сыйфатын яхшырту
өчен аңа өстәмә итеп тә файдаланыла.
Бензолның һәм башка углеводородларның хлор белән
алмаштырылган кушылмалары авыл хуҗалыгында үсем¬
лекләрне химик саклау чарасы итеп кулланыла. Мәсәлән,
бензолдагы водород атомнарын хлорга алмаштырып табылган
матдә — гексахлорбензол С6С16 орлыкка калдырылган бодай
һәм арышны каты кисәү авыруына каршы агулау өчен
кулланыла. Башка углеводородның галогеннар белән алмаш¬
тырылган кушылмаларыннан виноград плантацияләрендә
филлоксерага каршы көрәштә кулланыла торган бутадиен-1,3
шикелле үк төзелешле гексахлорбутадиенны С4С1^ күрсәтергә
мөмкин. Гексахлорбензол һәм гексахлорбутадиенның струк¬
тур формулаларын язып күрсәтегез.
е* вә
Бөҗәкләргә каршы көрәштә, чүп үләннәрне бетерү, үсем¬
лекләрне авырулардан саклау һ. б. өчен авыл хуҗалыгында
күп кенә башка төрле агулы химикатлар файдаланыла. Алар-
ның кайберләре белән без соңрак танышырбыз. Агулы
химикатлардан файдаланганда ал арның үзенчәлекләрен яхшы
белеп эш итү һәм тиешле кагыйдәләрне җиренә җиткереп
үтәү таләп ителә, чөнки дөрес эш итмәгәндә алар кеше өчен
зарарлы һәм шулай ук әйләнә-тирә табигатькә зур зыян
китерергә мөмкин.
Бензолны табу. Ташкүмерне кокслау бензол табуда иң әһә¬
миятле чыганак санала. Кокслау — һава кертмичә бик нык
кыздыру — процессында күп кенә очучан продуктлар хасил
була, шул продуктлардан башка матдәләр белән беррәттән
бензол да аерылып алына.
Рус галимнәре ароматик булмаган углеводородлардан бен¬
зол табу ысулын ачтылар. Н. Д. Зелинский циклогексанга
якынча 300 °C температурада катализатор сыйфатында
платина яки палладий белән тәэсир иткәндә бензолның бик
җиңел хасил булуын күрсәтә:
сн2
Hjc/ сн,
I I
Hj€ ^CH2
CH,
+ 3H,
Шулай ук тиешле катализатор катнашында н-гексанны
җылытканда аның бензолга әверелә алуы билгеле булган:
СН,
Н,С СН,
I
Н2С. ^СН,
СН,
+ 4Н2
Бензолга таләп арта барганлыктан, аны чикле углеводород¬
лардан һәм циклопарафиннардан табу реакцияләренең хәзер
практик әһәмияте аеруча зур.
*1. Кекуле ачкан структур формула белән бензолның үзлекләре ара¬
сында нинди каршылык бар һәм электрон теориясе аны ничек аңлата?
*2. Бензолның структур формуласын еш кына эчендә түгәрәге бул¬
ган алтыпочмаклык белән күрсәтәләр. Бу түгәрәк, сезнеңчә, нәрсәне
аңлата?
84
3. Өч сыеклык — бензол С*Н«, гексан С*Нн һәм гексенны UH,, хи¬
мик үздекләреннән чыгып ничек танып белергә?
4. Бензолның: а) чикле, б) чиксез углеводородлар белән охшашлы
гын күрсәткән реакцияләргә мисаллар китерегез. Үзлекләрендәге
аерымлыкларны күрсәтегез.
5. Неорганик химияне өйрәнгәндә, без катлаулы һәм гади мат¬
дәләрнең алмаштыру реакциясенә керүен һәм реакция нәтиҗәсендә
катлаулы һәм гади матдәләр барлыкка килүен күреп узган идек. Бен¬
золны иитролаганда ике катлаулы матдә реакциягә керә, һәм нәтиҗәдә
шулай ук катлаулы ике матдә табыла. Бензолны нитролауны органик
химиядә ни очен алмаштыру реакциясенә (нинди төп билгедән чыгын)
кертәләр?
в. Бензолны өйрәнгәндә танышкан реакцияләр арасыннан бер бер
сенә капма каршы юнәлештәге ике реакцияне эзләп табыгыз. Аляриы
бер химик тигезләмә белән күрсәтегез. Нинди шартларда процессның
билгеле бер юнәлештә генә баруын күрсәтегез.
7, Метаннан ничек итеп бензол табарга? Реакция тигезләмәләрен
языгыз һәм я ларның нинди шартларда бара алуын күрсәтегез.
*8. Гексахлорбутадиев-1,3 нең структур формуласын төзегез. Бу
матдәнең янучан булу-буямавы турында нәрсә әйтә аласыз?
9 18, БЕНЗОЛМЫН ГОМОЛОГЛАРЫ
Бензол гомологларыныц тезелеше. Алда тикшерелгән
углеводородлар шикелле, бензол да үзенә бер гомологии рәт
тәшкил итә.
Аның гомологдарын бензол молекуласындагы бер яки
берничә водород атомын торле углеводород радикалларына
я ямаштырудан табылган продукт дип карарга мамкин. Моле¬
куланың уртак я-электрон системасын түгәрәк рәвешендә
сурәтләүдән файдаланып, һәм бензол боҗрасында водород
атомнарын, гадәттә, кабул ителгәнчә билгеләп чыкмыйча гына
бензолның иң якын гомологларының формулаларын ките¬
рәбез:
Метилбензол
(толуол)
Опдбешлж
Пропжлбвмэол
Бу кушылмаларның составларын чагыштырып карагыз.
Бу рәттә СН, гомологии аерма саклануына ышанырсыз.
85
Молекулаларында бензол боҗрасына берничә углеводород
радикалы тоташкан матдәләрне исемләү өчен, формуладагы
углерод атомнарына номер сугып чыгалар һәм алмаштыручы
группаның торышы матдәнең исемендәге цифрлар белән
күрсәтелә, мәсәлән:
1,2-Диметял
бевао-Л
1 Метил-
3-этилбензол
Бензол гомологларыныц химик үзлекләре. Бензол
гомологлары үзлекләренең күп яклары белән бензолга
охшасалар да, аларның үзләренә генә хас үзенчәлекләре
бар. Моны берничә мисал өстендә карап үтик.
Кискен шартларда нитролаганда бензол һәм толуол
молекуласына С6Н5СН3 өч нитрогруппа кертергә мөмкин.
Толуол бензолга караганда җиңелрәк нитролаша икән. Бу
вакытта шартлаучан 2,4,6-тринитротолуол хасил була, аны
тол яки тротил дип йөртәләр.
2,4,6 торышларында бензол боҗрасының реакциягә
керү сәләтенең зур булуы боҗрага —СН3 радикалының
йогынтысы белән аңлатыла.
Молекулада атомнарның үзара йогынтысының ике
яклы булуы бу мисалда бигрәк тә ачык күренә.
86
Толуолны молекуласында бер водород атомы метил
группасына алмаштырылган бензол ител кенә түгел, бәлки
бер водород атомы ароматик радикал феннлга —СеНъ ал¬
маштырылган метан итеп тә карарга мөмкин;
Метанның оксидлаштыручылар тәэсиренә аеруча би-
решмәүчән булуын без беләбез инде. Әгәр толуолга калий
перманганаты эремәсе салып, катнашманы җылытсак,
шәмәхә эремә әкренләп төссезләнер. Бу толуолдагы — СН3
группасының оксидлашуы белән аңлатыла.
Толуолга калий перманганаты эремәсе тәэсир иткәндә,
аның метил группасы оксидлашып карбоксил группасына
әверелә һәм бензой кислотасы хасил була. Оксидлашты¬
ручы тәэсирен шартлыча кислород атомнары белән алыш¬
тырып, бу реакцияне мондый тигезләмә белән күрсәтергә
мөмкин;
,О
С.Н^-СН, + 30 — С^-С * + Н,0
хон
Шулай итеп, без тәҗрибәләр ярдәмендә толуолдагы
метил группасының бензол боҗрасына йогынты ясавын
һәм (2,4 һәм 6 торышларында) алмаштыру реакциясенең
барышын җиңеләйтүен, э бензол боҗрасының метил груп
пасына йогынты ясап, оксидлаштыручылар тәэсиренә тот-
рыклылыгын киметүен күрдек.
Бу күренеш нигезендә атомнарның электронлы струк¬
турасының бер берсенә йогынтысы ята. Бензол боҗ¬
расының реакциягә керү активлыгының артуын гомуми
рәвештә түбәндәгечә аңлатырга мөмкин. Безгә билгеле
булганча, кушылмадагы метил группасы бәйләнеш элек¬
троннарын үзеннән авыштыра (Марковников кагыйдәсен
исегезгә төшерегез). Толуолдагы пар электронны бензол
боҗрасына таба авыштырып (СНа —• < [ ) )), ул анда¬
гы я-электрон болытының тигез таралып урнашуын боза.
2,4,6 торышларында электрон тыгызлыгы арта һәм бу
урыннар алмаштыручылар «атакасына* дучар була.
87
Ароматик углеводородлар, нитролаудаи тыш, бензолга
хас башка реакцияләргә дә керәләр. Мәсәлән, алар галоген¬
нар белән реакциягә керә (бензол боҗрасындагы водород
атомнары урынында һәм ян чылбырда), водородны үзенә
куша алалар һ. б. Бу реакцияләрнең тигезләмәләрен үзе¬
гез төзегез.
Бензолның гомологларын куллану һәм табу. Бензолның
гомологлары эреткечләр сыйфатында һәм шулай ук төрле
буягычлар, дарулар, шартлау чан һәм хуш исле матдәләр һ. б.
җитештерүдә кулланыла. Аларны ташкүмерне кокслаганда
алына торган продуктлардан, шулай ук бензолны тапкандагы
шикелле үк. парафиннардан һәм циклопарафиннардан —
циклогексан гомологларыннан табалар.
Мәсәлән, толуолны метнлциклогексанны дегидрирлау
юлы белән табарга мөмкин:
яки н гептанны бер үк вакытта дегидрирлап һәм циклга
тоташтырып табалар;
CHj
сн.
н,с
1
сн,
1
1
Н,СЧ
1
CHJ
сн,
+ 4Н2
9. Бензол в ы ң гомологи к рәтендәге углеводородларның гомуми
формуласын чыгарыгыз.
10. Углеводородның формуласы С?Н,. Ул бромлы суны төссезлән¬
дерми, ләкин үзенә водород кушып, метилциклогексанга әверелә. Бу
углеводородның структур формуласын языгыз.
*11. Провилбенэолга изомер булган ароматик углеводородларның
структур формулаларын төзегез һәм аларның исемнәрен языгыз.
88
12. Пропинны СН=С-СН, полимерлаштырганда (трнмерлаштыр
ганда) бензолның гомологи барлыкка килә. Реакция тигезләмәсен
языгыз һәм гомологвың исемен әйтегез.
*13 Толуол бром белән тәэсир итешкәндә, реакциянең нинди шарт¬
та баруына карап, алмаштыру реакциясе бензол боҗрасында яки метил
группасында бара. Сезнеңчә: а) катализатор булганда, б) матдә кат¬
нашмасын яктыртканда реакция нинди юнәлештә барыр? Җавапны сез
ничек нигезлисез?
14. Массасы 200 г булган гептан толуолга әверелгәндә водород
нинди күләмдә (н. Hi- да) барлыкка килә? Шул ук микъдардагы гексан
бенэол1-а әверелгәндә водород күбрәк бүленеп чыгармы, әллә азракмы?
16. Эгилциклогексанны дегидрирлау юлы белән ароматик углеводо¬
родка әверелдерергә мөмкин. Нинди углеводородка? Бу реакциянең
тигезләмәсен төзегез.
16. 1,3,5-Триметилциклогексанны ароматик углеводородка де-
гндрирлау реакциясенең тигезләмәсен төзегез. Реакция нәтиҗәсендә
табылган матдәнең исемен әйтегез.
17. Бензолның чикле углеводородлар белән генә түгел, бәлки
чиксез углеводородлар белән алмаштырылган ян чылбырлары булуы да
мөмкин. Аларның иң гадие стирол (сыеклык):
СН-СН2
Ул бромлы сумы һәм калий перманганаты эремәсен төссезләндерә. Бу
реакцияләрнең беренчесенең тигезләмәсен төзегез. Стирол бензолның
гомологымы? Бу матдәне тагын нинди углеводородның алмашты¬
рылганы дип исәпләргә мөмкин?
б 19. УГЛЕВОДОРОДЛАРНЫҢ КҮПТӨРЛЕЛЕГЕ. ГОМОЛОГИИ
РӘТЛӘРНЕҢ ҮЗАРА БӘЙЛӘНЕШЕ
Без углеводородларның берничә төркеме белән таныштык.
Углеводородларның күптөрлелеге без тикшергән мисаллар
белән ген» чикләнми. Мәсәлән, чиксез углеводородлар ара¬
сында берничә икеле яки берничә өчле бәйләнеше булган,
шулай ук бер үк вакытта икеле дә, өчле дә бәйләнешләре бул¬
ган кушылмалар очравы мөмкин. Ароматик кушылмалар
арасында молекуласында берничә бензол боҗрасы булган мат¬
дәләр шактый күп.
Ике генә химик элементтан
родлар мисалында без органик
төрле була алуын күрдек. Инде
торган матдәләр — углеводо-
кушылмаларның чиксез күп
беэгә бу күренешнең сәбәплә¬
ре дә аңлашыла, иң элек ул углерод атомнарының нормаль,
тармакланган чылбыр һәм цикллар хасил итеп тоташу, гади
(ординар), кабатлы (икеле, өчле), ароматик бәйләнешләр бар¬
лыкка китерү үзлекләре белән аңлатыла. Без органик ку¬
шылмаларның күптөрлелегенең гомологик рәтләр барлыкка
китерүдә дә, изомерия күренеше булуда да чагылуын күргән
идек.
Өйрәнелгәннәрдән чыгып, тагын бер әһәмиятле нәтиҗә
ясарга тиешбез. Углеводородларның без өйрәнгән барлык
гомологик рәтләре бер-берсеннән аерылып тормыйлар, алар
арасында уртаклык, бер-берләренә әверелә алу бәйлелеге бар.
Чикле углеводородлардан — чиксез углеводородлар, цикло-
парафиннардан ароматик углеводородлар табарга, чиксез
углеводородлар чикле углеводородларга әверелергә мөмкин.
Углеводородларның гомологик рәтләре арасындагы безгә
билгеле булган үзара әверелешләрне схема белән күрсәтергә
мөмкин;
Чиксез
Ци клопа рафнннар
Химик ысуллар кулланып, гомологик рәтләр арасында
югарыдагы схемада күрсәтелмәгән башка төрле әверелешләрне
Николай Дмитриевич Зелинский
(1861 — 1953)
Мәскәү университеты профессоры. Ака¬
демик. Социалистик Хезмат Герое. Совет¬
лар Союзында тимик-органикларның иң зур
мәктәбенә нигез салучы. Вик күп санда угле¬
водородлар һәм башка тор органик кушыл¬
малар синтезлап таба. Циклопарафиннарны
каталмтмк юл белән ароматик углеводород¬
ларга әверелдерүне, нефтьтәге углеводород¬
ларның каталитик крекингын, активлашты-
рылган күмер ярдәмендә ацетиленнан бензол
синтезлауны ача. Хәзерге катализ теориясен
тудыручыларның берсе. Аксым химиясе ал-
кәсевдә күп кепә тикшеренүләр үткәрә. Уии
версаль противогаз уйлан таба.
90
дә тормышка ашырырга мөмкив. Углеводородларның үзара
әверелешләрен өйрәнүдә Н. Д. Зелинский һәм аның мәктә¬
бенең хезмәтләре нигез итеп алынган.
18. Түбәндәге углеводородлар кайсы гомологии рәткә керәләр:
CeHs—С3Н7 С,Н14 СвНе С4Н10
сна—сн-сң—снэ
сн8
СНз
нс=с—СНз
19. Сезгә билгеле гомолог ик рәтләрнең гомуми формулаларын язы¬
гыз. Кайсы гомологии рәтләрдә молекулаларындагы атомнар саны
тигез булган матдәләр бер-берсенә изомер була?
20. Нинди изомерия төрләрен беләсез? Шуларга мисаллар ките¬
регез.
*21. Валентлык электрон болытлары гибридлашуының нинди төр¬
ләрен беләсез? Шуларга тиңдәшле кушылмаларга мисаллар китерегез.
Углерод атомының химик бәйләнеше юнәлешенә гибридлашу төре
ничек йогынты ясый?
22. Молекулаларында: а) гади, б) кабатлы, в) ароматик бәйләнеш
булган углеводородларга нинди химик үзлекләр хас? Җавапны реакция
тигезләмәләре белән раслагыз.
23. Схемада уклар белән күрсәтелгән углеводородларның бер-бер-
сенә әверелү реакцияләренең тигезләмәләрен языгыз.
24. Углерод белән водородтан чыгып, торле углеводородлар: пара¬
финнар, циклопарафин нар, чиксез һәм ароматик углеводородлар табар¬
га мөмкин булуын раслый торган реакция тигезләмәләрен языгыз. Сез
язган һәр реакциянең нинди шартларда бара алуын күрсәтегез.
5. УГЛЕВОДОРОДЛАРНЫҢ ТАБИГЫЙ
ЧЫГАНАКЛАРЫ
Без өйрәнгән углеводородларның әһәмияте алар мисалында
органик химиянең топ теоретик мәсьәләләрен өйрәнергә мом
кинлек биргән кушылмалар булулары белән генә чикләнми.
Аларның халык хуҗалыгында да әһәмияте бик зур, чөнки
алар хәзерге органик синтез промышленностенда табыла тор¬
ган барлык продуктлар өчен диярлек кыйммәтле чимал хезмә¬
тен үтиләр һәм энергетик максатларда киң кулланылалар.
Табигый һәм иярчен нефть газлары, нефть, ташкүмер —
углеводородларның аеруча әһәмиятле чыганаклары.
§ 20. ТАБИГЫЙ ҺӘМ ИЯРЧЕН НЕФТЬ ГАЗЛАРЫ
Табигый газ. Табигый газ турында инде без күп кенә нәр¬
сәләр беләбез, чөнки без метанны шактый җентекләп өй¬
рәндек. ә метан исә бу газларның төп состав өлешләреннән
санала. Табигый газда, метаннан тыш, аның иң якын гомо-
логларыннан — этан, пропан, бутан бар. Углеводородның
молекуляр массасы никадәр зур булса, табигый газда аның
микъдары шулкадәр азрак була. Табигый газның төрле ятма¬
лары составы буенча төрлечә. Аның уртача составы (күләмгә
карата процентлар белән) түбәндәгечә:
сн4
С,Н4
с,нв
С.Н..
CSH1±
N, һ. б. газлар
80—97
0.Б-4.0
0.2—1,6
0.1-1.0
0—1,0
2-13
Ягулык буларак, табигый газның сыек һәм каты ягу¬
лыкларга караганда зур өстенлекләре бар. Аиың яну җылы¬
лыгы шактый зур, янганда көле калмый, яну продуктлары
экологик яктан күпкә чистарак.
Табигый газ җылылык электростанцияләрендә, заводның
казан установкаларында, промышленность мичләрендә: домна,
мартен, пыяла эретү һ. б. мичләрдә кулланыла. Домна мичлә¬
рендә табигый газ яндыру коксны азрак сарыф итәргә, чуен¬
дагы күкерт микъдарын киметергә һәм мичнең җитеште-
92
рүчәнлеген шактый арттырырга мөмкинлек бирә. Көнкүрештә
табигый газ файдалануның гаять зур әһәмияте һәркайсы-
бызга билгеле.
Хәзерге вакытта газ (югары басым астында баллоннарга
тутырып) автотранспортта кулланыла башлады. Ул бензинны
экономияләргә, двигательнең тузуын киметергә һәм ягулык¬
ның тулысывча янып бетүе аркасында һава бассейнының
чисталыгын сакларга мөмкинлек бирә.
Табигый газ — химия промышленносте өчен әһәмиятле чи¬
мал, бу мәсьәләдә аның роле һаман артачак. Метаннан во¬
дород, ацетилен, корым табуларын сез беләсез инде. Этанны
дегидрирлап этилен табалар, ә аның нигезендә күп төрле
синтезлар башкарыла. Табигый газдагы башка углеводородлар
да файдаланыла.
Иярчен нефть газы. Иярчен нефть газы чыгышы ягыннан
шулай ук табигый газ булып санала. Ул нефть белән бергә бул¬
ганга, анда эрегән хәлдә яки «бүрек» тәшкил итеп нефть өстендә
ятканга күрә аны шулай аерым исем белән иярчен газ дин
атаганнар. Нефть скважина буйлап җир өстенә күтәрелгәндә
басымның кискен кимүе аркасында газ нефтьтән аерыла.
Элек бу газ файдаланылмаган, аны нефть чыккан урында,
промыселда ук яндырганнар. Хәзер газны җыялар, чөнки
иярчен газ, табигый газ кебек үк, яхшы ягулык һәм кыйм¬
мәтле химик чимал булып санала. Иярчен газны файдалану
мөмкинлекләре табигый газны файдалану мөмкинлеклә¬
реннән хәтта күпкә киңрәк тә: чөнки аның составында метан¬
нан тыш шактый микъдарда башка углеводородлар — этан,
пропан, бутан, пентан бар. Шуңа күрә иярчен газны химик
эшкәртү юлы белән аннан табигый газдан алганга караганда
күбрәк матдәләр табарга мөмкин.
Иярчен газны рациональ файдалану өчен, аны составында
кушылмалары күп булмаган аерым катнашмаларга аералар.
Гадәттәге шартларда сыек хәлдәге пентан, гексан һәм
башка углеводородлар (аларның беркадәре нефтьтән газлар
белән бергә аерылып чыга) катнашмасы газ бензинын хасил
итә. Аннан соң пропан белән бутан катнашмасы аерыла. Газ
бензины һәм пропан-бутан катнашмасы аерылып чыкканнан
соң, коры газ кала. Ул, нигездә, этан һәм метаннан тора.
Двигательне эшләтә башлаганда бензин яхшырак кабын¬
сын өчен, аңа очучан сыек углеводородлардан торган газ бен¬
зины кушалар. Сыек хәлдәге пропан белән бутан ягулык
буларак көнкүрештә һәм автомобиль транспортында бик киң
кулланыла. Составы ягыннан табигый газга охшаган коры газ
93
ацетилен, водород һәм башка матдәләр табу өчен, шулай ук
ягулык итеп тә кулланыла.
Иярчен газдан химик эшкәртү өчен аерым углеводород
лар — этан, пропан, н бутан һ. б. ларны аерып алалар. Бола-
рыннан исә чиксез углеводородлар табалар. Нинди реакцияләр
ярдәмендә моны эшләргә мөмкин булуын исегезгә төшерегез.
1. Табигый газдан (метаннан) водород, корым, ацетилен, хлорга
алмаштырылган кушылмалар табу реакцияләренең тигезләмәләрен
языгыз.
2. Иярчен нефть газыннан нинди продуктлар аерып алалар һәм
аларны кайда кулланалар?
3. Газ бензины гадн бензинга караганда двигательдә ни очен тиз¬
рәк кабына, моны ничек аңлатырга?
4. Иярчен нефть газы составындагы бутанны химик куллануның
мом к и н саналган юнәлешләрен күрсәткән берничә реакция тигез
ләмәсен языгыз.
$ 21. НЕФТЬ. НЕФТЬ ПРОДУКТЛАРЫ
Нефтьнең физик үзлекләре һәм составы. Нефть — үзенә
бертөрле исле, карасу төстәге майсыман янучан сыеклык. Ул
судан җиңелрәк һәм суда эреми.
Нефтьнең нигездә углеводородлар катнашмасы булуын
тәҗрибәдән бик ансат күрергә мөмкин. Әгәр нефтьне 26 нчы
рәсемдәге кебек приборда җылытсак, без аның аерым мат¬
дәләргә хас булганча билгеле бер температурада куылмавын,
бәлки температураның киң интервалында куылуын күрер¬
без. Башта, әкрен җылытканда, күбесенчә молекуляр массасы
кечкенә, ә кайнау температурасы түбән булган матдәләр куы¬
ла, аннан соң. температура күтәрелә башлагач, молекуляр
массасы зуррак булган матдәләр куыла.
Нефтьнең составы бертөрле түгел. Ләкин аларның һәр-
кайсы өч төрле углеводородлардан — парафиннардан (кү¬
бесенчә нормаль төзелешле), цнклопарафиннардан (нафтен¬
нар) һәм ароматик углеводородлардан тора. Бу углеводород¬
ларның микъдари чагыштырмасы төрле ятмаларда төрлечә.
Мәсәлән, Мангышлак нефте чикле углеводородларга бай
булса, Баку районындагы нефть цнклопарафиннарга бай.
Нефть составында, углеводородлардан тыш, аз гына микъ¬
дарда булса да кислород, азот, күкерт һәм башка элементлар¬
ны эченә алган органик кушылмалар да бар. Сумала һәм
асфальт матдәләре кебек югары молекуляр төзелешле кушыл¬
малар да керә. Нефть шундый йөзләрчә кушылмалардан тора.
94
26 нчы рәсем. Лабораториядә нефть куу.
Нефть продуктлары һәм аларны куллану. Нефть — торле
молекуляр массалы һәм төрле температураларда кайный
торган углеводородлар катнашмасы булганлыктан, аны куып
төрле фракцияләргә (дистиллятларга) аералар. Ә ал ардан
40 тан алып 200 °C ка кадәр температура интервалында кай¬
ный торган С5—Си углеводородларыннан торган бензин;
150—250 °C температурада кайный торган С8—С14 углево¬
дородларыннан торган лигроин; кайнау температурасы
180—300 °C булган Cj2—С18 углеводородларын эченә алган
керосин, ә аннан соң газойль алалар. Болары нефтьнең үтә
күренмәле продуктлары дип йөртелә.
Бензин пешкәкле двигательле автомашиналар һәм само¬
летлар өчен ягулык итеп файдаланыла. Ул шулай ук май¬
ларны, каучукны эретүче итеп, тукыма һ. б. чистарту өчен
кулланыла. Лигроин трактор ягулыгы булып санала. Керо¬
син — трактор, реактив самолет һәм ракета ягулыгы. Газойль
дизель ягулыгы сыйфатында кулланыла.
Нефтьне куып, үтә күренмәле продуктларны аерып алгач,
үзле кара сыеклык — мазут кала. Мазутны өстәмә рәвештә
куып, автотрактор, авиация, дизель һәм башка төр техниканы
майлау өчен майлар алалар. Өстәмә куып, майлар алудан
тыш, химик эшкәртү юлы белән мазуттан бензин да алалар
(алдарак карагыз), шулай ук казан установкаларында сыек
ягулык итеп тә файдаланалар.
95
Нефтьнең кайбер сортларыннан каты углеводородлар кат¬
нашмасын — парафинны аерып алалар; каты һәм сыек угле¬
водородларны катнаштырып, вазелин алалар. Парафин һәм
вазелинның кайларда кулланылуын исегезгә төшерегез.
Бензиннарның детонацион ныклыгы. Детонацион нык¬
лык — һәрбер бензин өчен, сыек ягулык буларак, иң әһә¬
миятле сыйфатлардан санала.
Детонация күренешен аңлау өчен, эчке янулы авто¬
мобиль двигателенең ничек эшләвен искә төшерик. Дви¬
гатель цилиндрына һава белән аралашкан бензин парлары
суырыла, бу катнашма пешкәк ярдәмендә кысыла һәм
электр чаткысы ярдәмендә кабынып китә. Углеводородлар
янганда хасил булган газлар киңәя һәм эш башкара.
Бензин парлары белән һава катнашмасы никадәр ныграк
кысылса, двигательнең егәрлеге шулкадәр зуррак була,
һәм ягулык та чагыштырмача азрак тотыла. Ләкин бен¬
зинның барлык сортлары да артык югары басымны күтәрә
алмавы беленде. Кыскан чакта кайбер углеводородлар
вакытыннан элек кабынып китә һәм, гаять зур тизлек бе¬
лән яна башлап, шартлау китереп чыгара. Шартлау дул¬
кыны пешкәккә килеп бәрелүдән цилиндрда кискен бәре¬
лү тавышлары ишетелә, бәрелүдән детальләр вакытыннан
элек туза, двигательнең егәрлеге кими. Бензинның шулай
шартлап яну күренеше детонация дип йөртелә.
Нормаль төзелешле парафиннар детонациягә аеруча чы¬
дамсыз. Тармакланган төзелешле, шулай ук чиксез һәм аро¬
матик углеводородлар детонациягә тотрыклырак, аларның
янучан катнашмасын ныграк кысарга мөмкин, димәк, алар
зуррак егәрлекле двигательләр эшләргә мөмкинлек бирәләр.
Бензиннарның детонацион ныклыгын микъдар ягыннан
характерлау өчен октан шкаласы эшләнгән, һәр углеводород
һәм бензинның һәр сорты билгеле бер октан саны белән
характерлана. Детонацион ныклыгы бик зур булган изо-
октанныц (2,2,4-триметилпентанның) октан саны 100 гә
тигез итеп кабул ителгән. Детонациягә бик тиз бирелүчән
н-гептанның октан саны 0 итеп кабул ителгән. Гептан һәм
изооктан катнашмаларының октан саны алар составындагы
изооктанның процент саны белән күрсәтелә. Шундый шкала¬
дан файдаланып, бензиннарның октан санын табалар. Әгәр
бензинның октан саны 76 булса, бу исә 76 % ы изооктаннан
һәм 24 % ы гептаннан торган катнашма кебек үк детонация¬
сез кысыла ала дигән сүз.
96
Нефтьтән алына торган бензиннарның, бигрәк тә парафин¬
га бай нефтьтән алына торганнарының, октан саннары ча¬
гыштырмача түбән була. Махсус эшкәртү юлларын кулланып
(без аларны алдарак өйрәнербез), октан саны зуррак булган
бензин табалар.
5. Нефть составын бер генә молекуляр формула белән күрсәтеп
буламы? Җавабыгызны аңлатыгыз.
в. а) Бензин, б) лигроин, в) керосивиын кайнау температуралары¬
ның якынча интервалларын күрсәтегез.
7. а) Детонация, б) октан савы нәрсә ул?
8. Углеводородларның тезелеше аларнын, детонацион ныклыгына
ничек йогынты ясый?
9. Иң әһәмиятле нефть продуктларын санап чыгыгыз һәм аларнын
кайда кулланылуын әйтегез.
■ Заводыгыздагы, колхозыгыздагы һәм мәктәбегездәге автомашиналарда
нинди маркалы бензин кулланылуын белегез. Аның октнн савы нинди?
§ 22. НЕФТЬНЕ ЭШКӘРТҮ
Хәзер халык хуҗалыгы өчен кирәкле нефть продуктларын
промышленностьта ничек табулары белән танышырбыз.
Табигый нефтьтә һәрвакыт су, минераль тозлар һәм төрле
механик катнашмалар була. Шуңа күрә нефтьне химик эш¬
кәртә башлаганчы аны судан, тозлардан арындыралар һәм
күп кенә өстәмә әзерлек операцияләре үткәрәләр.
Нефтьне куу. Нефтьтәге төрле фракцияләрне, лаборато¬
риядә (05 нче бит) эшләгән кебек, бер-бер артлы куу юлы
белән нефть продуктларын аерып алу промышленность шарт¬
лары өчен ярамый. Бу ысулның җитештерүчәнлеге бик тү¬
бән, зур чыгымнар таләп итә һәм углеводородларның мо¬
лекуляр массаларына карап төгәл аерылуын тәэмин итми.
Нефтьне өзлексез куа торган торбалы установкаларда бу
кимчелекләр юк (27 нче рәсем).
Установка нефтьне җылыта торган торбасыман мичтән
һәм ректификация колоннасыннан тора. Монда нефть, кай¬
нау температураларына карап, фракцияләргә (дистиллят¬
ларга) — аерым углеводородларның катнашмаларына — бен¬
зинга, лигроинга, керосинга һ. б. аерыла.
Торбасыман мичтә уралмалы көпшә рәвешендәге озын
үткәргеч труба урнашкан. Мичне мазут яки газ ягып җы¬
лыталар. Торба буйлап өзлексез нефть килеп тора, ул анда
320—350 °C ка кадәр җылына һәм сыеклык белән пар кат¬
нашмасы хәлендә ректификация колоннасына керә.
4 в-17? 97
27 в’* рәсем. Нефтьне валексеа куа торган торбалы
установканың схемасы: / — торбалы мич;
2 — ректификация колоннасы; 3—«суыткыч.
Ректификация колоннасы — биеклеге 40 м чамасы булган
корыч цилиндрик аппарат. Аның эчендә бик күп тишемле
горизонталь бүлгелэр тезелеп киткән. Алар тәлинкәләр дип
йөртелә. Колоннага кергән нефть парлары өскә күтәрелеп
тәлинкәләрдәге тишемнәр аша уза. Югарыга күтәрелгән саен
алар акрынлап суына һәм, кайнау температураларына карап,
теге яисә бу тәлинкәдә сыеклыкка әверелә. Артык очучан
булмаган углеводородлар, беренче тәлинкәләрдә үк куерып,
газойль фракциясен хасил итәләр; тагын да очучанрак угле¬
водородлар, өстәрәк җыелып, керосин фракциясе тәшкил
итәләр; аннаә өстәрәк лигроин фракциясе җыела; аеруча очу¬
чан углеводородлар, колоннадан пар хәлендә чыгып, бензин
хасил итәләр. Бензинның бер өлеше сугару өчен яңадан
колоннага кертелә, ул өскә күтәрелә торган нефть парларына
суынырга һәм куерырга ярдәм итә.
08
Колоннага кергән нефтьнең сыек өлеше тәлинкәләрдән аска
агып төшеп мазут рәвешендә җыела. Мазутта тотылып калган
очучан углеводородларның парга әйләнүен җиңеләйтү өчен,
агып төшә торган мазутка каршы кайнар пар җибәрелә.
Төрле биеклекләрдә хасил булган фракцияләр колоннадан
тышка чыгарыла. Аннан соң табылган дистиллятлар сульфат
кислотасы, селтеләр ярдәмендә һәм башка ысуллар белән кат¬
нашмалардан чистартыла. Нефть куу установкаларында еш
кына лигроин һәм керосин аерым табылмый, бәлки катнаш
лигроин-керосин фракциясен — реактив ягулык фракциясен
бергә җыеп алалар.
Нефтьне куганнан соң калган мазут күп кенә авыр угле¬
водородлар катнашмасыннан торган кыйммәтле продукт са¬
нала. Инде әйтелгәнчә, аны өстәмә рәвештә куып, майлау мате
риаллары алалар. Куу процессында мазутны фракцияләргә
аерырга мөмкин булсын өчен, авы, нефтьне беренче тапкыр
кугандагы кебек, 350 °C ка кадәр генә җылыту җитми, күрәсең,
чөнки ул бу температурада сыек килеш кенә кала, аны югары¬
рак температурага кадәр җылытырга кирәк. Ләкин мазут соста
вына кергән углеводород молекулалары шулкадәр югары темпе¬
ратураны күтәрә алмыйлар, таркала башлыйлар. Шуңа күрә
процессны түбән басым астыңда вакуум установкаларда алып
баралар. Мондый шартларда мазут углеводородлары таркал¬
мыйча гына шактый түбән температурада парга әйләнәләр.
Вакуум-установка тышкы күренеше белән нефтьне куу
установкасын хәтерләтә. Башта мазутны торбалы мичтә җы¬
лыталар, аннан соң ул ректификация колоннасына керә.
Югарыда тикшерелгәнгә охшаш процесслар нәтиҗәсендә
мазут парлары фракцияләргә бүленә, һәм аларны чистарт¬
каннан соң төрле майлау материаллары табыла. Мазутның
куылмый торган өлешен —гудронны колонна төбеннән читкә
агызалар.
Нефть һәм мазут куу установкаларын гадәттә бергә тоташ¬
тырып атмосфера вакуум установкалары рәвешендә төзиләр.
Нефтьне — установканың атмосфера өлешендә, ә мазутны
вакуум өлешендә куалар (28 нче рәсем).
Нефть продуктлары крекингы. Нефтьне куганда табылган
бензин гына бензинга үсә барган ихтыяҗларны канәгать¬
ләндерә алмый. Нефть эшкәртү промышленносте алдына бик
җитди мәсьәлә — бензин табуда өстәмә чыганаклар эзләү
мәсьәләсе куела. Нефтьне куганда, яның составындагы җиңел
кайнаучы барлык углеводородлар инде алынып бетә, шулай
булгач, өстәмә бензинны каян алырга соң?
7* »9
Мазутны атмосфера басымы астында куарга ярамаганлы-
гын искә төшерик,чөнки югары температурада аның молеку¬
лалары таркала башлый. Бензинның өстәмә чыганагын нәкъ
шушы күренештән чыгып табарга мөмкин. Әгәр бик нык
җылытканда эрерәк углеводород молекулалары кечерәк моле¬
кулаларга таркалалар икән, бензин фракциясенә туры килә
торган молекулаларны нәкъ шушы юл белән табарга мөмкин.
Бу күренеш белән тәҗрибәдә танышыйк.
Көчле ялкында кыздырыла торган тимер көпшәгә бүрәнкә¬
дән тамчылап кына керосин яки берәр майлау материалы
кертик (29 нчы рәсем). Озак та үтмәс, U-сыман көпшәдә —
сыеклык, ә цилиндрдагы су өстенә газ җыела башлаганын
күрербез. Болар көпшәдә химик реакция барганны күрсәтә.
Табылган продуктларны тикшереп караганнан соң да нәкъ
шул нәтиҗәгә килергә мөмкин. Сыеклык та, газ да бромлы
суны төссезләндерәләр, ә башта алынган продукт, әгәр ул
тиешенчә чистартылган булса, бромлы суны төссезләндерми.
Тәҗрибә нәтиҗәләрен углеводородларны җылытканда
аларның таркалуы белән аңлатырга мөмкин, мәсәлән;
н„ — С.Н.. + с.н1в
Гексщми Oktir Омт?в
Монда молекуляр массасы бензинның молекуляр масса-
28 нче расем. Атмосфера-вакуум установкасының гомуми күренеше.
Алгы якта торбасыман мичләр күренә.
100
29 нчы рәсем. Лабораториядә керосин крекингы үткәрү.
сына туры килгән кечерәк молекуляр массалы чикле һәм
чиксез углеводородлар катнашмасы хасил була.
Табылган матдәләр өлешчә тагын да таркала ала, мәсәлән:
С8Н1Ө * С4Н1Г|*С.Н.
С4Н10 — C2He + CJI4
С4Н |0 ■ С3Нв + СН4
Мондый реакцияләр газсыман матдәләр хасил булуга
китерә, без моны тәҗрибәдә дә күрдек.
Углеводородларның югары температурада таркалуы
ирекле радикаллар ясалу белән бара. Бу процессны пентан
мисалында карап үтәрбез. Бик көчле җылытканда моле¬
куладагы химик бәйләнешләрнең ныклыгы кими, алар-
ның кайберләре ирекле радикаллар хасил итеп өзелә:
СН3—СН,—CHfjjCH2—СН3 — СНЭ—СН?—СН,-+-СН?—СН3
Парлашмаган электроннары булган кисәкчекләрнең
озак яшәмәүләрен һәм аларның стабильләшергә тиеш¬
леген без беләбез инде. Ул төрлечә башкарылырга мөм¬
кин. Мәсәлән, бер очракта икеле бәйләнеш күрше углерод
атомыннан водород атомы аерылу сәбәпле барлыкка ки*
лергә мөмкин:
СН2-СН,- —- СН2-СН2 + Н»,
Н
101
9 икенче очракта, киресенчә, водород атомы ирекле ради¬
калга тоташа:
СН,—СН,—СН3-+ Н- —* СН,—СН3—СН,
ф Нефтьтәге углеводородларның тагы да очучанрак мат¬
дәләргә таркалу процессы крекинг дип атала (инглизчә
cracking — таркалу). Крекинг нефтьтән бензин чыгышын
шактый арттырырга мөмкинлек бирә.
Промышленностьтагы крекинг-процессны 1891 елда рус
инженеры В. Г. Шухов уйлап таба.
Крекингның төп ике төре бар — термик һәм каталитик
крекинг. Термик крекинг вакытында углеводородлар юга¬
ры температурада таркатыла, ә каталитик крекингта тар¬
калу катализатор катнашында һәм югары температурада
бара.
Промышленностьта термик крекинг нефть продукт¬
ларын, мәсәлән мазутны, торбасыман мич аша уздыр¬
ганда була, ул анда берничә мегапаскаль басым астында
(углеводородлар мөмкин кадәр сыек хәлдә калсыннар
өчен) якынча 470—550 °C ка кадәр җылытыла. Бу шарт¬
ларда углеводородлар крекингы уза — югарыда әйтелгән
реакцияләргә охшаш реакцияләр бара. Барлыкка килгән
сыек һәм газсыман матдәләр катнашмасын бер-береннән
аеру өчен, крекинг продуктларын ректификация колонна¬
сына җибәрәләр.
Термик крекинг юлы белән табылган бензин турыдан-
туры куып табылган бензиннан үзенең составында чиксез
углеводородлар булуы белан аерыла. Аларның октан саны
чикле углеводородларныкына караганда югарырак булу
сәбәпле, крекинг бензинының детонацион ныклыгы да,
турыдан-туры куып табылган бензинныкына караганда,
югарырак була. Ләкин мондый бензинны озак саклап бул¬
мый, чөнки чиксез углеводородлар оксидлашып һәм поли¬
мерлашып сумалага әвереләләр. Бу сумаласыман про¬
дуктлар бензин үткәрү трубаларына сылана, цилиндр сте¬
наларына, двигательнең клапаннарына һәм башка өлеш¬
ләренә утыра. Крекинг-бензин озак саклансын өчен, аңа
сумалалануга комачаулый торган матдә — антиоксидлаш-
тыргыч кушалар. Термик крекинг газлары чиксез угле¬
водородларга бай була (30 нчы рәсем).
Крекинг температурасы никадәр югары булса, молеку¬
лалар шулкадәр яхшырак ваклана, чиксез кушылмаларга
бай газлар шулкадәр күбрәк хасил була. Шуңа күрә газ хә-
102
30 нчы рәсем. Термик
крекинг вакытында табылган
газларнын якынча составы.
лендәге чиксез углеводородлар
табарга кирәк булганда, нефть
продуктларын махсус рәвештә
югары температурада тарката¬
лар (ул пиролиз дип атала). Бу
очракта процессны 650 -750 °C
температурада алып баралар.
Каталитик крекингны та¬
бигый яки синтетик алюмоси¬
ликатлар катнашында үткәрә¬
ләр. Катализатор куллану про¬
цессны түбәнрәк температурада
(450—500 °C), шактый зур тиз¬
лек белән алып барырга һәм
яхшы сыйфатлы бензин алырга
мөмкинлек бирә.
Каталитик крекинг шартларында, таркалу реакциялә¬
реннән тыш, изомерлашу реакциясе, ягъни нормаль төзе¬
лешле углеводородларның тармаклы углеводородларга
әверелү реакциясе бара. Чиксез углеводородлар монда тер¬
мик крекинг вакытындагыга караганда кимрәк барлыкка
килә. Бу исә барлыкка килгән бензинның сыйфатына
йогынты ясый, чөнки тармаклы углеводородлар бензин¬
ның октан санын бик нык арттыра, ә инде чиксез кушыл¬
маларның кимүе бензинны озак саклауга чыдамлы итә.
Каталитик крекингны техник яктан тормышка ашыру
аеруча катлаулы була. Крекинг вакытында углеводород¬
лар таркалудан хасил булган очмаучан продуктлар ката¬
лизаторны тиз арада каплап ала, ягъни катализатор кокс-
лана һәм берничә минуттан үзенең активлыгын югалта.
Катализаторны яңадан актив итү өчен, крекингны тукта¬
тып, барлыкка килгән коксны яндырырга туры килә иде.
Крекинг-процессны тагын да яхшыртырга мөмкин түгел
кебек күренә иде. Ләкин монда инженерлар осталыгы яр¬
дәмгә килде. Катализаторны циркуляцияләү принцибы
буенча эшләүче махсус установкалар конструкцияләнде
(катализатор реактордан регенераторга өзлексез кереп тора,
монда ул үзенең активлыгын яңадан кайтарганнан соң,
шулай ук өзлексез агым булып реакторга керә). Моннан
тыш процессны кайнау катлавында алып бару ысулы тор¬
мышка ашырылды (ул сезгә сульфат кислотасын житеш-
терү буенча билгеле). Бу типтагы установкаларның төзе¬
леше һәм эшләве белән танышып китик (31 нче рәсем).
103
31 иче рәсем. Кайнау катлавында к атал итик крекинг установкасы.
104
Торбасыман мичтән чыккан чимал (газойль) җылытыл¬
ган тузан хәлендәге катализатор белән аралаша, парга әй¬
ләнә һәм үткәргеч торба аша әзлексез рәвештә реакторга
кереп тора. Реакторның күләме зур булу сәбәпле, анда
кергәч, агымның тизлеге кинәт бик нык кими һәм ката¬
лизатор кисәкчекләре сирәк катлау хасил итәләр, анда
алар кайнап торган сыеклыктагы кебек интенсив аралаша¬
лар. Крекингның теп процессы нәкъ шушында уза.
Крекинг продуктлары реакторның өске өлешенә күтә¬
релә һәм, ияреп менгән катализатор кисәкчекләреннән
арындыру өчен, чистарткычлар аша уздырыла, аннары
ректификациягә җибәрелә.
Крекинг вакытында таркалу продуктлары белән кап¬
ланган катализатор өзлексез рәвештә реактордан чыгары¬
ла, һәм һава агымы белән регенераторга кертелә.
Катализатор өстенә утырган катышмалар кайнау кат¬
лавы принцибы белән регенераторда яңадан яндырыла.
Аннан соң ул, бару юлында чимал агымы белән аралаш-
тырылып, яңадан реакторга кертелә.
Термик һәм каталитик крекинг нефть эшкәртүдәге
икенчел дип аталган процесслардан санала, ягъни ул
нефтьнең үзен түгел, бәлки аны беренчел эшкәртү нәти¬
җәсендә табылган фракцияләрне эшкәртүгә керә. Башка
каталитик процесслар да, мәсәлән, нефть продуктларын
риформинглау икенчел процессларга керә.
Риформинг ул — бензиннарны платина катализатор
катнашында җылыту юлы белән ароматлаштыру процес-
|сы. Парафиннарны һәм циклопарафиннарны ароматик
углеводородларга әверелдерү реакцияләре дә шундый ук
шартларда бара, нәтиҗәдә бензиннарның октан саны бик
нык арта. Ароматлаштыру процессы шулай ук нефтьнең
бензин фракцияләреннән индивидуаль ароматик углево¬
дородлар табу өчен дә файдаланыла. Ароматик булмаган
углеводородлардан нинди реакцияләр ярдәмендә, мәсәлән,
бензол һәм толуол табуны исегезгә төшерегез.
Хәзер халык хуҗалыгы өчен кирәкле күп кенә органик
матдәләрне нефтьтәге һәм газдагы углеводородларны химик
эшкәртү юлы белән табалар. Бу эш белән производствоның
махсус тармагы — нефть-химия промышленносте шөгыль¬
ләнә. Нефтьне химик эшкәртү процесслары белән без әле
соңрак, органик матдәләрне табу ысулларын өйрәнгәндә, еш
очрашырбыз.
105
Нефть чыгару һәм аны эшкәртү масштаблары үсә барган
саен мохитне нефть продуктлары белән пычранудан саклау¬
ның әһәмияте арта бара. Әйләнә-тирәлек төрле сәбәпләрдән
нефтьне бер урыннан икенче урынга диңгез суднолары яки
башка транспорт средстволары белән күчергәндә нефтьнең тү¬
гелүеннән, предприятиеләрдән агып чыга торган ташландык
сулар белән нефть продуктларының сулыкларга эләгүен¬
нән һ. б. дан пычранырга мөмкин. Нефть продуктлары юка
гына катлау булып су өстенә җәелеп су белән атмосфера
арасындагы газлар алмашын боза, шуның белән акватория¬
дәге үсемлек һәм хайван организмнарын нормаль яшәү шарт¬
ларыннан мәхрүм итә. Мондый күренешләрне булдырмау
өчен төрле саклану чаралары күрәләр. Мәсәлән, нефть эшкәр¬
тү заводларында чистарту корылмалары — махсус буалар эш¬
лиләр. Монда нефть продуктлары һәм башка органик кушыл¬
малар микроорганизмнар ярдәмендә таркатыла.
Промышленность энергетик установкаларында, җылылык
электростанцияләрендә, автомобиль транспортында нефть про¬
дуктлары янганда аерылып чыккан зарарлы калдыклар белән
һава бассейнының пычрануы тагын да куркынычрак. Нефть
продуктларындагы күкертле һәм азотлы матдәләр (нефть
составындагы элементларны исегезгә төшерегез) янган чакта
күкерт һәм азот оксидлары барлыкка килә, алар аппаратлар
коррозиясен китереп чыгара, ә атмосферага эләккәч һава
агымнары белән төрле якка таралып, һәр тере организмга
үтергеч тәэсир итә. Бу химик элементларны аерып алу мак¬
саты белән нефть продуктларына водородлы чистарту үткә¬
рәләр— водород катнашында катализаторда җылыталар.
Болай эшләгәндә күкертле һәм азотлы матдәләр таркала,
нәтиҗәдә сероводород H2S һәм аммиак NH3 барлыкка килә,
ә болардан котылу җиңелрәк. Сероводородны күкерт һәм
сульфат кислотасы җитештерүдә файдаланалар. Производ¬
ство «калдыгыннан* табылган сульфат кислотасы колчедан
нигезендә җитештерелгәннән арзангарак төшә.
Нефть эшкәртү һәм нефтехимия заводларында әйләнә-
тирәлекне саклауның башка чаралары да бар.
10. Нефтьне фракцияләргә аеру нигезендә нинди физик күренеш¬
ләр ята?
11. Крекинг-процесс* белән нефтьне куу процессы арасында нинди
охшашлык һәм аерма бар?
12. С|?Нг« углеводородына крекинг ясаганда уза торган кайбер
реакция тигезләмәләрен языгыз.
106
*13. а) Термик крекинг, б) катал итик крекинг процессы нинди
шартларда үткәрелә?
*14. Термик һәм каталитнк крекинг газларының составы нинди
яклары белән бер-берсеннән бик нык аерыла?
*15. Югары температурада үткәрелә торган крекингның (пиролиз¬
ның) нинди үзенчәлекләре бар? Пиролиз ни ечен кирәк?
16. Турыдан-туры куыл табылган бензин белән крекинг-бензинның
составларын һәм детонацион ныклыкларын чагыштырып карагыз. Бу
ике сорт бензинны тормышта пичек таный белергә?
*17. Нефть продуктларының каталитик крекингы установкасының
эшендә башка производстволар белән нинди уртак фәнни принциплар
күрсәтә аласыз?
18. Углеводородларны ароматлау нәрсә ул? Бу процесс нинди мак¬
сатта кулланыла?
*19. Дннонилсульфидның С»Н|»—S—C»Hlt водород белән реакциясе
нонан һәм сероводород ясалу белән бара. Шул реакция тигезләмәсен
һәм сероводородтан сульфат кислотасы табу реакцияләре тигезләмә¬
ләрен тезегез.
§ 23. КОКСОХИМИЯ ПРОИЗВОДСТВОСЫ
Ташкүмерне кокслау, нефтьне эшкәртү белән беррәттән,
промышленностьта ароматик углеводородлар табуның иң
әһәмиятле чыганакларыннан берсе санала.
Ташкүмерне кокслау процессын лабораториядә үткәрергә
мемкин (32 нче рәсем). Әгәр ташкүмерне тимер көпшәгә са¬
лып, һава кертмичә бик нык кыздырсак, беркадәр вакыттан
32 нче рәсем. Ташкүмерне лабораториядә кокслау.
107
33 нче рәсем. Кокслау миченең бата ре ясы
108
соң газ һәм пар аерылып чыгуын күрергә мөмкин. U-сыман
көпшә төбендә начар исле сумала, ә аның өстендә аммиаклы
су җыела. Газлар, бу көпшә аша узып, савыттагы су өстенә
җыела. Тәҗрибәдән соң тимер көпшә төбендә кокс кала.
Җыелган газ яхшы яна, аны кокс газы дип йөртәләр.
Шулай итеп, ташкүмерне һава кертмичә кыздырганда,
төп дүрт төрле продукт: кокс, ташкүмер сумаласы, ам¬
миаклы су һәм кокс газы хасил була.
Коксохимия производствосы, нигездә, ташкүмерне лабо¬
раториядә кокслауга охшаган, тик аның масштабы гына
лабораториядәгегә караганда зуррак була.
Промышленностьтагы кокс миче (33 нче рәсем) тар
гына озын камерадан һәм яндыру аралыкларыннан тора.
Ташкүмерне камерага өстәге тишекләр аша тутыралар
һәм яндыру аралыкларындагы каналларда газсыман
ягулык (кокс газы яки домна газы) яндыралар. Мондый
камераның берничә дистәсе кокслау мичләре батареясын
хасил итә. Яну температурасын югарырак итү өчен, газ
белән һаваны яндырыр алдыннан, мартенда корыч койган¬
дагы шикелле, камералар астындагы регенераторларда
җылыталар.
1000 °C ка кадәр җылытканда, күмердәге катлаулы
органик матдәләр химик әверелешләр уза, нәтиҗәдә кокс
һәм очучан продуктлар хасил була.
Кокслау процессы 14 сәгать чамасы дәвам итә. Бу
процесс тәмамлану белән, хасил булган коксны — «кокс
бәлешен* — камерадан вагонга бушатып, су белән сүнде¬
рәләр; камерага ташкүмернең
яңа порциясен тутыралар һәм
кокслау процессы яңадан баш¬
лана.
Суынгач, коксны сортларга
аералар һәм металлургия за¬
водларындагы домна мичләренә
озаталар.
Барлыкка килгән очучан
продуктлар, камера өстендәге
тишекләр аша чыгып, гомуми
газҗыйгычка килеп керә һәм
алардан, безнең тәҗрибәдәге
шикелле, сумала белән аммиак- 34 нче рәсем. Кокс газының
лы су конденсацияләнә. якынча составы.
109
Конденсацияләнми калган газдан аммиак һәм җиңел
ароматик углеводородлар (нигездә бензол) аерып алалар.
Аммиакны аерып алу очен, газны сульфат кислотасы эре¬
мәсе аша уздыралар; барлыкка килгән аммоний сульфаты
азотлы ашлама сыйфатында файдаланыла.
Ароматик углеводородларны эреткечләр белән йотты¬
рып һәм аннан соң хасил булган эремәдән кудыру юлы
белән аерып алалар.
Ташкүмер сумаласыннан, аны фракцияләргә аеру юлы
белән, бензол гомологлары, фенол (карбол кислотасы),
нафталин һәм башка күп кенә матдәләр табалар.
Составында янучан матдәләр күп булу сәбәпле, чистар¬
тылган кокс газы промышленность мичләрендә ягулык
итеп кулланыла (34 нче рәсем). Аны хнмнк чимал итеп тә
файдаланалар. Мәсәлән, терле матдәләр синтезлау очен
кокс газыннан водород һәм этилен аерып алалар.
Коксохимия заводларында ташкүмерне камераларда
кокслау процессы периодик рәвештә башкарыла, һәрбер
периодик процесстагы кебек үк монда да кимчелекләр бар.
Төп кимчелекләрне сез үзегез дә күрсәтә аласыз.
Галимнәр һәм технологлар хәзер ташкүмерне өзлексез
кокслау процессын булдыру өстендә эшлиләр.
•20. Кокс газының составыннан чыгып (34 нче рәсем), сезнеңчә, аны
нинди органик матдәләр табу өчен файдаланырга мөмкин?
*21. Коксохимия заводында камералар периодик рәвештә эшләсәләр
дә, ни өчен газны өзлексез метод белән эшкәртергә мөмкин?
•22. Аммиаклы суда аммиак эрегән хәлдә дә, тоз хәлендә дә була.
Андагы аммиакны мөмкин кадәр күбрәк алу өчен, сез нинди ысул
тәкъдим итәр идегез?
•23. Кокслау мичләренең камераларын ни өчен киң итеп ясамый¬
лар, тар итәләр? Камера киң булса, аңа ташкүмерне күбрәк салып
булыр иде бит.
*24. Коксохимия производствосында нинди гомуми фәнни принцип¬
ларны күрсәтергә мөмкин?
♦25. Ароматик углеводородларны промышленностьта табуның сезгә
билгеле булган барлык ысулларын тасвирлап, аңлатып бирегез.
*26. а) Табигый газ, б) иярчен нефть газлары, в) термик һәм ката
литнк крекинг газлары, г) пиролиз газлары, д) кокс газының составы
һәм аларны файдалану мөмкинлекләре турында сезгә билгеле мәгъ¬
лүматларны гомумиләштерегез.
6. СПИРТЛАР ҺӘМ ФЕНОЛЛАР
Моңа кадәр без ике терле элементтан — углерод һәм водо¬
родтан гына торган органик матдәләрне ойрәндек. Составына
бу элементлар белән беррәттән кислород та керә торган күп
кенә матдәләр билгеле. Кислородлы органик кушылмаларны
өйрәнүне спиртлар классыннан башларбыз.
§ 24. БЕР АТОМЛЫ ЧИКЛЕ СПИРТЛАРНЫҢ ТӨЗЕЛЕШЕ
Этил спиртының тезелеше. Бу класска кергән кушыл¬
малар төзелешенең үзенчәлекләрен өйрәнүне аларның мәгъ¬
лүм вәкиле этил спиртыннан башларбыз.
Эгил спирты С2НвО — үзенә бертөрле исле, төссез сыеклык,
судан җиңелрәк (тыгызлыгы 0,8 г/см’), 78,3 °C та кайный,
суда яхшы эри һәм үзе дә күп кенә органик һәм органик
булмаган матдәләрне яхшы эретә.
Спиртның молекуляр формуласыннан һәм элементлар¬
ның валентлыгыннан чыгып, аның тезелешен сурәтләп ка¬
рыйк. Без ике структур формула яза алабыз:
Н Н
I I
н-с-о- с-н <п
н н
н н
I I
H-с—СОН (2)
t I
н н
Бу формулаларның кайсы этил спирты молекуласының
төзелешенә туры килә?
Формулаларны чагыштырып карап, без шуны күрәбез:
әгәр беренче формула дөрес икән, спирт молекуласындагы
барлык водород атомнары углерод атомнарына тоташкан
булып чыга һәм аларның үзлекләре бердәй дип әйтергә мөм¬
кин. Әгәр дә икенче формула дөрес икән, ул чакта молеку¬
ладагы бер водород атомы углерод атомына кислород атомы
аша тоташкан булып чыга, һәм ул башка водород атомна
рыннан аерылып торыр. Спирттагы водород атомнарының
үзлекләре бер төрлеме, түгелме икәнлеген тәҗрибәдә тикше¬
реп белергә мөмкин.
ill
35 нче ржем. Этил спиртыннан
водород табу (водороА микъдарын
билгеләү тәҗр^әсе).
Спирт (су кушылмаган)
салынган пробиркага натрий
кисәге ташлыйк. Шунда ук
газ аерылып чыгу белән бара
торган реакция башлана. Бу
газның водород икәнен белүе
кыен түгел. Катлаулырак
башка тәҗрибә ярдәмендә, ре*
акция вакытында спиртның
һәр молекуласыннан ничә во¬
дород атомы аерылып чыгу-
ыв билгеләргә мемкин. Вак¬
ланган натрий кисәкчекләре
салынган колбага (35 нче рә¬
сем) бүрәнкәдән тамчылап
кына билгеле бер микъдарда,
мәсәлән, 0,1 моль (4,6 г) спирт
салыйк. Спирттан аерылып чыккан водород ике авызлы пыя¬
ла савыттагы сунь> цилиндрга куа. Цилиндрга күчкән суның
күләме аерылып чыккан водород күләме кадәр үк була.
Тәҗрибә 0,1 моль спирттан (н. ш. да) 1,12 л чамасы
водород табылуын күрсәтә. Бу исә натрий 1 моль спирттан
11,2 л, ягъни 0,5 моль водород кысрыклап чыгара дигән сүз.
Башкача әйтсәк, спиртның һәр молекуласыннан натрий
бары бер генә водород атомын кысрыклап чыгара. 1 нче фор¬
мула (1) мондый фактны аңлата алмый. Бу формулада водо¬
род атомнарының барысы да бердәй. Киресенчә, 2 нче фор¬
мула (2) бер водород атомының үзенә бертөрле торышта бу¬
луын күрсәтә: ул углерод атомына кислород аша тоташкан,
нәкъ менә шушы водород атомы молекулада бик үк нык бәй¬
ләнмәгән, ул хәрәкәтчәнрәк һәм аны натрий җиңел этеп чы¬
гара дигән нәтиҗә ясарга мөмкин. Димәк, китерелгән формула¬
ларның икенчесе этил спиртының структур формуласы була.
Спирт молекуласында углеводород радикалына бәйләнгән
гидроксил группасы (гидроксогруппа) — ОН барлыгын күр¬
сәтү өчен, этил спиртының молекуляр формуласын еш кына
болай язалар:
СН3—СН2-ОН яки С2Н5ОН
Спирт молекуласында углеводород радикалына кислород
аша тоташкан водород атомы ни өчен үзенә бер үзлеккә ия
дигән сорау туа. ₽ез монда тагын атомнарның бер берсен*
йогынтысы белән очрашабыз. Бу йогынтының асылын аңлау
112
өчен, спирт молекуласының электронлы төзелешен тикшереп
карарбыз.
С—С һәм С—Н бәйләнешләренең характерын без яхшы
беләбез, алар — ковалент о-бәйләнешләр. Кислород атомы
водород атомы һәм углеводород радикалы белән шундый ук
бәйләнеш хасил итә һәм аның тышкы электрон катлавы
октетка кадәр тулылана. Бу очракта спирт формуласын тү¬
бәндәгечә күрсәтергә мөмкин:
Н Н
Н:С:С:б:Н
Йн"
Ләкин спирт молекуласында электроннар тыгызлыгы,
углеводородлардагы шикелле, һәр җирдә бертөрле түгел.
0—Н бәйләнеше поляр, чөнки аның электроннарының иң
тыгыз урыны электртискәре элемент булган кислород ато¬
мына таба авышкан була. Водород атомы электроннардан
күбрәк бушангандай, молекула белән азрак бәйләнгәндәй
була, шуңа күрә дә аны натрий шактый җиңел этеп чыгара.
Электроннар тыгызлыгының авышуын формулада түбән¬
дәгечә күрсәтеп була:
Н Н
I I 8 *•
Н—С—С—О — н
н н
Спирт молекуласында атомнарның пространствода ничек
урнашуын 36 нчы рәсемдәге модельләр буенча күзалларга
мөмкин. Рәсемнәрдә кислород атомының башка атомнар бе¬
лән ковалент бәйләнешкә туры сызык буенча түгел, бәлки
беркадәр почмак ясап керүен күрәбез. Аның тышкы электрон
катлавында парлашкан ике s-электрон һәм парлашкан ике
р-электрон белән беррәттән парлашмаган ике р-электрон бу-
36 ачы рәсем. Этил спирты молекулаларының модельләре.
113
луын иск» төшерик. Бу электрон болытларының күчәрләре
үзара перпендикуляр. Кислород атомының башка атомнар
белән ковалент бәйләнешләре шул болытлар юнәлешендә
барлыкка килә (гнбридлашу күренеше булу аркасында һәм
башка факторлар тәэсирендә чынында валентлык почмагы
туры почмактан беркадәр тайпыла). Су молекуласының да
пространстволы төзелеше шундый булуын сез беләсез инде.
Спиртларның гомологии рәте. Этил спирты — гомологик
рәттәге спиртларның берсе. Бу рәттәге башка спиртларның
да химик һәм электронлы төзелеше шундый ук. Гомологик
рәтнең беренче вәкиле метил спирты:
Н
I
Н-С-О—Н
I
н
Этил спиртының иң якын торган икенче гомологы —
пропил спирты:
Н Н Н
I I I
Н—с—с—с—о—н
III .
н н н
Спиртларның гомологик рәте турындагы мәгълүматлар
3 нче таблицада китерелгән.
3 нче таблице. Бор атомлы чикле синрглармыц гомологик pare
Соортаыц исеме
Формуласы
Кайнау
температурасы
(“Сла)
Метил (метанол)
снйон
64.7
Этил (этанол)
С2Н5ОН
78,3
Пропил (пропавол-1)
СЭН7ОН
97,2
Бутил (бутавол-1)
с,н,он
117,7
Амил (пентанол-1)
CsHt1OH
137,8
Гексил (гексанол-1)
€\Н13ОН
157,2
Гептил (гептанол-1) Һ. б.
CjH.jOH
176,3
Бу рәттә молекулалар составының СН2 атомнары группа¬
сына аерылуына, гомологик аерма саклануына ышанырсыз.
Спиртлар молекуласында бер генә түгел, бәлки ике һәм оч
гидроксил группасы булырга мөмкин.
Спирт өчен характерлы реакцияләр, ягъни аларның хи¬
мик функциясе спирт молекуласында гидроксил группасы
114
булуына бәйле икәнен натрий белән реакциягә керүеннән
күргән идек, без моны соңрак та күрербез. Атомнарның мон¬
дый группасы функциональ группа дип атала.
Молекулаларында углеводород радикалы белән бәйлән¬
гән бер яки берничә функциональ гидроксил группасы бул¬
ган органик матдәләр спиртлар дип атала.
Шуңа күрә аларны молекуласында бер якн берничә водо¬
род атомы гидроксил группага алмашынган углеводородлар
итеп карарга мөмкин. Гомологии рәте югарыда китерелгән
спиртларны молекулаларында бер водород атомы гидроксил
группасы белән алмаштырылган чикле углеводородларның ку
шылмалары итеп карарга мөмкин. Ул бер атомлы чикле
спиртларның гомологик рәте. Бу рәттәге матдәләрнең гому¬
ми формуласы С.Н^^ОН. яки R—ОН.
Башта бер атомлы спиртларны өйрәнербез.
Систематик номенклатура буенча спиртларга исем биргән¬
дә, тиңдәш углеводород исеменә -ол кушымчасы өстиләр;
гидроксил группасы булган углерод атомын сан белән күрсә¬
тәләр (3 нче таблица). Углерод атомнарының тәртип номе
рын функциональ группага якын торган очыннан башлыйлар.
Спиртлар изомериясе углерод скелеты нзомериясенә һәм
гидроксил группасының кайда урнашуына бәйләнгән. Моны
бутил спиртлары мисалында тикшерик.
Углерод скелетының ничек тезелүенә карап, бутан һәм
изобутанга туры килүче спиртлар изомер булыр:
4 3 2 1
СН3-СН,—СН?-СН,-ОН
Бутйвол-1,
ДИМ Һ бутил спыртм
сн,
a |г I
CHj—СН—сн2 он
2 Метки проп*ноя I.
яки итоб/тия спирты
Гидроксил группасының кайда урнашуына карап, тагын
ике изомер спиртның булуы мөмкин:
I 2 2 4
СНа-СН-СН,-СНэ
он
сн,
I 12 3
Н3С—С—снэ
он
Бутамол 2
2-Метмд лролйиол-2
Молекулалар арасында водородлы бәйләнеш. Спиртлар¬
ның физик үзлекләре. Элек тикшерелгән чикле һәм чиксез
углеводородлардан аермалы буларак, бу гомологик рәттә газ
хәлендәге матдәләр булмавына, аның беренче вәкиле — метил
спиртының сыеклык булуына сез, һичшиксез, игътибар ит¬
кәнсездер,
в* 115
37 жче рәсем. Молекулалар
арасында водородлы бәйләнешләр
ясалу: А — спирт молекулалары;
Б — су молекулалары: В — су һәм
спирт молекулалары.
Матдәләрнең кайнау тем¬
пературалары күтәрелүен ни¬
чек аңлатырга? Бәлки, моны
матдә молекуласы составына
кислород атомы кергәндә мат¬
дәнең молекуляр массасы
бик нык артуы белән аңла¬
тыргадыр? Ләкин метил спир¬
тының молекуляр массасы 32,
пропанныкы 44, шулай булу¬
га карамастан, метил спир¬
ты — сыеклык, ә пропан —
газ. Хлорметанның СНаС1 мо¬
лекуляр массасы тагын да
зуррак — 50,5, ләкин ул да
газ хәлендәге матдә.
Метил спиртының шактый
җиңел молекулаларын сыек
хәлдә нәрсә тотып тора соң?
Без спирт молекуласында¬
гы углеводород радикалы һәм
водород атомы кислород ато¬
мы белән бер туры өстендә ят¬
мыйча, бер-беренә беркадәр
почмак ясап ятуын алдарак
күргән идек инде. Ә кислород
атомының бәйсез пар элек¬
троннары да бар. Шуңа күрә
ул башка молекуланың (элек¬
троннары кислород атомына
авышудан беркадәр уңай ко¬
рылмага ия булган) водород
атомы белән бәйләнешкә керә
ала (37 нче рәсем, А). Атом¬
нар арасында водородлы бәй¬
ләнеш шулай барлыкка килә
һәм ул формулада нокталар
белән күрсәтелә:
а- а а- а- ь а
Н-0 . . . Н—О ... н—о
I I I ■
сна сн3 сн3
Водородлы бәйләнеш гадәт-
116
тэге ковалент бәйләнештән шактый кемсезрәк (10 тапкыр
чамасы).
Спирт молекулалары водородлы бәйләнешләр исәбенә ассо¬
циация ләшкән, ягъни бер-берләренә ябышкандай була. Шуңа
күрә, молекулалар ирекле хәлгә күчсен һәм матдә очучанга
әверелсен ечен, бу бәйләнешләрне өзәргә өстәмә энергия са¬
рыф итәргә кирәк була, Спиртларныц үзләренә тиңдәшле
углеводородлар белән чагыштырганда югарырак температу¬
рада кайнаулары нәкъ шуның белән аңлатыла.
Молекуляр массасы кечкенә булуга карамастан, суның ни
өчен гадәттә булмаганча югары температурада кайнавы инде
аңлашыла (37 нче рәсем, Б).
Су һәм спирт молекулалары арасында да водородлы бәй¬
ләнеш урнаша ала (37 нче рәсем, В). Углеводородлардан аер¬
малы буларак, спиртның суда эрүчәнлеге нәкъ шуның белән
аңлатыла да. Углеводородлар исә, С—Н бәйләнешләре бик
аз полярлашкан булу сәбәпле, су белән водородлы бәйләнеш
хасил итә алмый һәм шуңа күрә суда эремиләр.
Ләкин спиртларның суда эрүчәнлеге төрлечә (гомологии
рәттәге вәкилләрнең үзлекләре үзара охшаш булуга карамас¬
тан, аларның үзләренә генә хас үзенчәлекләре дә булуын искә
төшерик). Әгәр тигез күләмдә итеп су салынган стаканнарга
бер үк микъдарда (мәсәлән. 5 әр мл) метил, этил, пропил,
бутил һәм амил спирты өстәп болгатып чыксак, беренче өч
спиртның тулысынча эреп бетүен, ә бутил спиртының һәм
бигрәк тә амил спиртының суда азрак эрүен күрербез. Спирт¬
ларның эрүчәнлекләре кимүен түбәндәгечә аңлатырга мөм¬
кин. Спирт молекуласындагы углеводород радикалы никадәр
зур булса, гидроксил группасына мондый молекуланы водо¬
родлы бәйләнешләр исәбенә эремәдә тотарга шулкадәр читен¬
рәк була (углеводородлар суда эремиләр),
1. С,Н,>ОН формуласына туры килә торган барлык изомер спирт¬
ларның структур формулаларын төзегез.
2. а> 2-Метнлбутанол-1, б) 3,3-диметилпентанол-2 спиртларының
структур формулаларын төзегез.
3. Молекуласында углерод атомнары савы арта барган саен спирт¬
ларның, кайнау температуралары күтәрел», ә углерод скелеты тар¬
макланганда кими. Бу закончалыкларны аңлатыгыз.
4. Вер атомлы спиртларның молекуляр массалары артканда ни очен
суда әрүчәнлекләре кимүен аңлатыгыз.
5. Гомуми формуласы С-Н«О булган изомер матдәләр ни өчен төрле
температурада кайныйлар?
6. Сыек аммиак молекулалары арасында водородлы бәйләнешләр бар.
Бу күренешне ничек аңлатырга? Бәйләнешләр ясалу схемасын сурәтләгез.
117
§ 25. БЕР АТОМЛЫ ЧИКЛЕ СПИРТЛАРНЫҢ
ХИМИК ҮЗЛЕКЛӘРЕ ҺӘМ АЛАРНЫ КУЛЛАНУ
Химик үзлекләре. Углерод һәм водородка бай матдә була¬
рак, спиртлар кабызгач җылылык чыгарып яналар. Мәсәлән:
C,H_OH + 30г — 2СОг + ЗН2О + 1374 кДж
Ләкин аларның януларында аерма күзәтелә.
Фарфор чынаякларга 1 әр мл төрле спирт салып, аларны
кабызып җибәрик. Гомологик рәтнең башында торган спирт¬
ларның бик тиз кабынып китеп, бөтенләй диярлек яктыр¬
мый торган зәңгәрсу ялкын белән януын күрербез. Моле¬
куляр массасы зур булган спиртлар исә якты ялкын белән
яналар һәм, янып беткәч, чынаяк төбендә кара кунык кала.
Бу күренешләрне аңлатыгыз.
Функциональ группасы ОН булуга бәйле үзлекләреннән
без этил спиртының натрий белән реакциягә керүен белә¬
без инде!
2С,Н5ОН + 2Na 2CzH5ONa + Нг
Этил спиртының водородын натрий белән алмаштыру¬
дан табылган продукт натрий этилаты дип атала. Аны
реакциядән соң каты хәлдә аерып алырга мөмкин. Суда
эрүчән башка спиртлар да селтеле металлар белән нәкъ шу¬
лай реагирлап үзләренә тиңдәш алкоголлтлар хасил итәләр.
Мисал өчен, натрий пропилаты хасил булу реакциясе тигез¬
ләмәсен төзегез.
Спиртларның металлар белән реакциясе поляр О—Н бәй¬
ләнешенең ионлы таркалуы белән бара һәм ул түбәндәгечә
күрсәтелә.
2C,Hs-5:£ + - Н, + 2Na' + 2[СгН5О:}
Мондый реакцияләрдә спиртларның кислота үзлекләре
күренә—водородны протон рәвешендә аерып чыгара дип әйтә
алабыз. Ләкин спиртларны кислоталар классына кертеп бул¬
мый, чөнки аларның диссоциацияләшү дәрәҗәсе хәтта суны¬
кыннан да кимрәк, спирт эремәсе индикаторның төсен үз¬
гәртми.
Спиртларның диссоциацияләшү дәрәҗәсенең суны¬
кыннан түбәнрәк булуы углеводород радикалының йогын¬
тысы белән аңлатыла: С—О бәйләнеше электрон тыгыз¬
лыгының радикал тарафыннан кислород атомына таба
авышуы кислород атомының өлешчә тискәре корылмасы
артуга китерә. Шуңа күрә ул водород атомын үз янында
ныграк тота.
118
38 ячр рәсем. ch-ил спиртыннан бромэтан табу.
Әгәр спирт молекуласына химик бәйләнеш электрон¬
нарын үзенә тарта торган алмаштыргыч кертелсә, спирт¬
ларның диссоциацияләшү дәрәҗәсен арттырырга мөмкин.
Мәсәлән, Z-хлорэтанолның С1СН2—СН2ОН диссоциациясе
этанолныкына (этил спиртыныкына) караганда берничә
тапкыр арта. Моны түбәндәгечә аңлатырга мөмкин:
С1 — СН, — СН, — О Н
Хлор атомы С1—С бәйләнешенең электрон тыгызлы¬
гын үзенә таба авыштыра, ә углерод атомы бу вакытта
өлешчә уңай корылма алу сәбәпле, С — С бәйләнешенең
электрон тыгызлыгын үз ягына таба авыштыра. С — О бәй¬
ләнешенең электрон тыгызлыгы да шул сәбәпле беркадәр
углерод атомына таба, ә О—Н бәйләнешенең тыгызлыгы
водород атомыннан кислородка таба авыша. Шунлыктан
водородның протон рәвешендә аерылу мөмкинлеге арта,
нәтиҗәдә матдәнең диссоциацияләшү дәрәҗәсе да арта.
Спиртларның гидроксилдагы водород атомы гына түгел,
бәлки гидроксил группасы тулысынча химик реакциягә керә
ала. Әгәр суыткыч белән тоташтырылган колбада (38 нче рә¬
сем) этил спиртын галогеноводород кислотасы, мәсәлән, бро¬
моводород кислотасы белән бергә җылытсак (бромоводород
хасил итү өчен, калий бромиды яки натрий бромиды белән
сульфат кислотасы катнашмасы алына), беркадәр вакыттан
соң җыйгыч савытта су катлавы астында авыр сыеклык
бромэтан җыелуын күрербез:
119
C,H5iOH + H'Br —* С,Н,Вг + н„о
L — — J
Бу реакция дә шулай ук С—О ковалент бәйләнешенең
ионлы таркалуы белән бара:
• • • ••, s-
С2Н^0Н + Щ:Вг — С2Н5Вг + НгО
Ул нигез реакцияләрен хәтерләтә. Метил спиртыннан
бромметан нәкъ шулай хасил була:
СНа>ОН + Н'Вг — СН,Вг + н,о
* — —' • •
Куертылган сульфат кислотасын катализатор сыйфатында
спиртка кушып җылытканда, спирт бик тиз дегидратлаша,
ягъни суны аерып чыгара. Бу вакытта этил спиртыннан
этилен барлыкка килә:
Н Н
I I
н—С—С—Н —■ сн,=сн, + н,о
Г Ь -I- ,
Н OHI
L _ — — J
Моннан соңгы гомологларны дегидратлаштыру башка чик¬
сез углеводородлар табылуга китерә:
Н Н Н
I I I
Н-С-С-С-Н — сн,-сн=сн2 + нао
I r I- -I- . - 2 2
Н I Н ОН I Пропилен
* • • ш •
Берникадәр башкачарак шартларда спиртларның дегид-
ратлашуы су молекуласын һәр спирт молекуласыннан аерып
алу белән түгел, бәлки ике молекуладан аерып алу белән
булырга мөмкин. Мәсәлән, этил спиртын сульфат кислотасы
катнашында түбәнрәк температурада (140 °C тан арттыр¬
мыйча һәм спиртны артыграк салып) җылытканда диэтил
эфиры барлыкка килә:
С2Н;О Н + HO C2HS —- С2Н5-О—C2HS + Н,0
L - _ — J
Диэтил эфиры — очучан, җиңел кабынучан сыеклык, эрет¬
кеч итеп һәм медицинада наркоз өчен файдаланыла. Ул мо¬
лекулалары кислород атомы ярдәмендә тоташкан ике
углеводород радикалыннан торган органик матдәләр —
гади эфирлар классына керә. Гади эфирларның гомуми фор¬
муласы R—О—R.
120
Башка гади эфирларны этил спирты гомологларын
молекулаара дегидратлаштыру юлы белән табалар;
CHjO Н + НО' СН? —- СН. О—СНЭ + Н/>
с — — — J
Әгәр мондый реакция өчен төрле спиртлар алынса,
төзелеше симметриясез эфирлар барлыкка килә:
СН3ОН + НО'С7Н4 — СН,-О—С,НЬ + Нг0
I Монда башка төрле эфирларның да ясалуы мөмкин.
Аларның исемнәрем әйтегез һәм реакция тигезләмәләрен
төзегез.
Этил спиртының төзелешен тикшергәндә, без диметил
эфиры белән танышкан идек инде. С2Н,0 формуласына туры
килгән мөмкин саналган ике структур формуланың без спирт
үзлекләрен аңларга мөмкинлек бирә торганын сайлап алдык.
Ә кабул ителмәгән икенче формула валентлык кагыйдәлә¬
ренә буйсынса да диметил эфирының төзелешен күрсәтә.
Молекуляр формулалары бер үк төрле булган бу ике матдә
органик кушылмаларның ике төрле классына карасалар да
изомер булып саналалар. Шулай итеп, бер атомлы чикле
спиртларга молекуласында углерод атомнары сан ягыннан
бердәй булган гади эфирлар изомер була. Пропанолга, сез¬
неңчә, нинди эфир изомер була?
Спиртлар организмга тискәре йогынты ясыйлар. Бигрәк тә
метил спирты агулы. Бик аз гына эчкәндә дә ул күрү нерв¬
ларын үтерә һәм мәңгелеккә сукырайта. 5—10 мл спирт
организмның көчле агулануына китерә, ә 30 мл үлемгә ките¬
рергә мөмкин.
Этил спирты —наркотик. Суда бик яхшы эрүчан булуы
аркасында, эчкәч, ул канга бик тиз сеңә һәм организмга
көчле тәэсир итә. Спирт йогынтысында кешенең игътибары
кими, реакциясе тоткарлана, хәрәкәт корреляциясе бозыла,
кеше йөгәнсезләнә, лихачлык, әдәпсезлек күрсәтә һ. б. Болар
кешене җәмгыятьтә күңелгә ятышсыз итәләр. Ләкин алко¬
голь куллануның нәтиҗәләре тагың да куркынычырак, чөн¬
ки эчкән кеше аңа күнегә, аның белән һәлакәтле мавыга Һәм
ахыр чиктә алкоголизм белән каты авырый башлый. Спирт
ашказаны-эчәк трактының лайлалы катлавына зыян ки¬
терә, ә ул гастритка, ашкаэанында, уникеилле эчәктә җәрә¬
хәт башлануга китерә. Организмда спиртның таркалуын
121
булдырып торырга тиешле бавыр зур йөкләмәне күтәрә ал¬
мый, анда үзгәрешләр килеп чыга, бу циррозга китерергә
мөмкин. Кан белән баш миенә үтеп, спирт нерв күзәнәкләренә
агулы йогынты ясый, ә ул кешенең аңы, сөйләшүе, акыл
сәләте бозылуда, психиканың бик нык какшавында чагыла
һәм шәхеснең деградациясенә китерә. Үсә торган организмда
матдәләр алмашы процессы бик интенсив барганлыктан һәм
алар агулы тәэсирләргә аеруча сизгер булганлыктан, алкоголь
бигрәк тә яшьләр өчен зарарлы. Шуңа күрә алкоголизм
авыруы яшьләрдә өлкәннәрдәгегә караганда тизрәк баш¬
ланырга мөмкин. Яшьләр спиртлы эчемлекләрнең бер генә
төрен дә кулланмаска тиеш.
Спиртларны куллану. Спиртлар күп производстволарда
эреткеч сыйфатында кулланыла. Химия промышленностенда
аларны төрле-төрле синтезлар өчен файдаланалар.
Метил спирты пластмасса, серкә кислотасы һәм башка
органик матдәләр җитештерү өчен китә торган формальдегид
табуда күп микъдарларда тотыла. Хәзерге вакытта метил
спиртын башлангыч матдә итеп файдалануга нигезләнгән күп
төрле яңа технологик процесслар эшләнә. Шуңа күрә халык
хуҗалыгына кирәкле матдәләр һәм материалларны про¬
мышленность производствосында җитештерүдә аның роле
һаман саен артачак.
Метил спиртын мотор ягулыгы итеп файдалану перспек¬
тивалы санала, чөнки аны бензинга өстәү янучан катнаш¬
маның октан санын арттыра, янганда чыккан газларда була
торган зарарлы матдәләрне киметә.
Этил спиртының күп өлеше синтетик каучуклар җитеш¬
терүгә китә. Спиртны оксидлаштыру юлы белән аш тәмләткеч
итеп кулланыла торган серкә кислотасы алалар. Аны дегид
ратлаштырып диэтил (медицина) эфиры әзерлиләр, хлорово
дород белән тәэсир итеп, операция ясаласы урынны өшетү
өчен кулланыла торган хлорэтан табалар. Спирт күп кенә
дарулар ясаганда файдаланыла. Парфюмериядә ул ислемай
һәм одеколон ясау өчен тотыла. Кайбер илләрдә аны, октан
санын арттыру өчен, мотор ягулыгына өстәмә итеп файда
ламалар.
7. Янганда 56 л углерод (IV) оксиды (н ш.да) хасил булса, күпме
метил спирты янганлыгын исәпләп чыгарыгыз.
8. Массасы 23 г булган этил спиртын яндыру очен күпме күләм
(н. ш. да) һава кирәк? Бу вакытта ничә моль углерод (IV) оксиды һәм
су табылыр?
122
•9. Спиртларда кислота үзлекләре булуын ничек аңлатырга?
10. 230 г этил спиртыннан натрнй максималь күләмдә (и. ш. да)
күпме водород кысрыклап чыгара ала?
11. Сезнеңчә, спиртлар нинди металл белән натрийга караганда
көчлерәк реакциягә керер? Реакциянең ионлы тигезләмәсен төзегез.
*12. 2,2-Дихлорэтанолиың СҺСН—СНгОН диссоциацияләшү дәрә¬
җәсе 2-хлорэтанолныкына CICHj—СН?ОН караганда югарырак. Моның
сәбәбен аңлатыгыз.
13. Хлороводородны метил спирты аша уздырганда, метанның га¬
логен белән алмаштырылган кушылмасы хасил була. Реакция тигез¬
ләмәсен языгыз һәм нинди матдә табылуын әйтегез.
14. Этил спиртыннан хлорэтаыны ничек табарга? Бу матдәне тагын
ничек табып була? Реакция тигезләмәләрен языгыз.
16. а) Тиешле спирттан 1-бромпропан, б) натрий метилаты ясалу
реакцияләре тигезләмәләрен языгыз.
16. Этил һәм пропил спиртларының катнашмасын куертылган
сульфат кислотасы белән җылытканда катнаш әтил-пропил эфиры
барлыкка килә. Бу реакциянең тигезләмәсен языгыз. Бу очракта
тагын нинди эфирларның ясалуы мөмкин?
*17. Нинди реакцияләр ярдәмендә пропавол-1 не иропавол-2 г»
әверелдерергә мөмкин?
18. Эчке молекуляр дегидратлашу вакытында 30 г ыннаи 9 г су
аерып чыгара торган бер атомлы спиртның молекуляр формуласын
табыгыз.
§ 26. СПИРТЛАР-ВОДОРОДЫ ГИДРОКСИЛ ГРУППАСЫНА
АЛМАШТЫРЫЛГАН УГЛЕВОДОРОДЛАР АЛАР.
МЕТАНОЛНЫ ПРОМЫШЛЕННОСТЬТА СИНТЕЗЛАУ
Спиртлар һәм углеводородлар арасында генетик бәй¬
ләнеш. Алдарак без спиртларны водороды гидроксил группа¬
сына алмаштырылган углеводородлар дип карарга мөмкин
булуын раслап узган идек. Аларны шулай ук өлешчә оксид¬
лашкан углеводородларга да кертергә мөмкин, чөнки спирт¬
лар составында углерод һәм водородтан тыш кислород та бар.
Водород атомын турыдан туры гидроксил группасы белән
алмаштыру яки углеводород молекуласына кислород атомын
кертү бик читен. Моны углеводородларның галогенлы ку¬
шылмалары аша эшләү җиңелрәк.
Мәсәлән, этаннан этил спирты табу өчен, башта бромэтан
табарга мөмкин:
С2НП + Br2 — CjH^Br + НВг.
123
ә аннан соң бромэтанны селте катнашында су белен җылы¬
тып спиртка әверелдерергә кирәк;
С2Н(*Вг + н.он гг С2Н5ОН + НВг
• — — —. -3
Селте биредә бромоводородны нейтральләштерү эчен һәм
аның спирт белән реакциягә керү мөмкинлеген бетерү, ягъни
химик тигезләнешне тиешле продукт барлыкка килү юнәле¬
шенә авыштыру өчен кирәк.
Шундый ук юл белән метаннан метил спирты табарга
мөмкин:
СН, — СН,Вг —- СН,ОН
Промышленность өчен спиртларны бу ысул белән табуның
әһәмияте юк, аны кайвакыт лабораторияләрдә генә кулла¬
налар. Ләкин аның теоретик яктан әһәмияте зур, чөнки ул
чикле углеводородлар, углеводородларның галогенлы кушыл¬
малары һәм спиртлар арасында генетик бәйләнешне күрсәтә.
Спиртлар чиксез углеводородлар белән дә генетик бәйлән¬
гән. Чиксез углеводородлар хәзерге органик синтез өчен күп
очрый торган чимал булу сәбәпле, аларны еш кына промыш¬
ленностьта этил спирты һәм аның гомологларын табу өчен
файдаланалар. Мәсәлән, этиленны гндратлаштырып этанол
табалар:
СН,=СН, + Н,О — СН3-СН,-ОН
Реакция 280 300 °C температурада һәм 7—8 МПа басым
астында катализатор буларак ортофосфат кислотасы кат¬
нашында бара.
Метанолны промышленностьта синтезлау. Чиксез угле¬
водородны гндратлаштырып, метил спиртын табарга мөмкин
түгел икәне билгеле. (Ни өчен?) Аны углерод (II) оксиды
белән водород катнашмасыннан торган синтез-газдан табалар.
Белгәнебезчә, синтеэ-газ югары температурада метан (таби¬
гый газ) белән су пары үзара тәэсир итешкәндә табыла. Бу
реакция тигезләмәсен төзегез.
Метил спиртын синтез-газдан түбәндәге реакция буенча
табалар: со + CHiOH + q
Бу синтезны промышленностьта тормышка ашыруның .
оптималь шартларын ачыклыйк.
Реакция катнашманың күләме кимү ягына таба бара,
шуңа күрә басымның күтәрелүе тигезләнешне тиешле про¬
дукт ясалу ягына авыштырырга булышлык итәчәк. Реакция
җитәрлек тизлек белән барсын өчен, катализатор һәм югары
124
температура кирәк. Ләкин ул экзотермик реакция, шуңа күрә
артык нык җылыту җылылык йотылу белән бара торган
реакциянең тизлеген арттырачак, ягъни хасил булган спирт¬
ның таркалуына, тигезләнешнең кире юнәлешкә авышуына
китерер. Барлык бу факторларны исәпкә алып, промышлен¬
ностьта спирт синтезлауның түбәндәге оптималь шартлары
билгеләнгән: 250—300 °C температура, 10 МПа басым, ката¬
лизатор куллану (цинк, хром, бакыр оксидлары).
Реакция кайтма булу сәбәпле, башлангыч матдәләр реак¬
тор аша узганда, табигый ки, реакциягә тулысынча кереп
бетмиләр. Матдәләрне экономияле файдалану максатында
барлыкка килгән спиртны аерып алырга, ә реакциягә керми
калган газларны реакторга кире җибәрергә, ягъни цирку¬
ляция процессын тормышка ашырырга кирәк. Тагын шуны¬
сын белү әһәмиятле: энергия чыгымнарын экономияләү мак¬
сатында. экзотермик реакция калдыкларын синтезга баручы
газларны җылыту эчен файдаланырга кирәк.
Процессның фәнни нигезләрен ачыклаганнан соң, аның
технологиясен карауга (39 нчы рәсем) күчәргә мәмкин. Син-
теэ-газны компрессор белән кысалар һәм, реакциягә керми
калган газ белән катнаштырып, җылыалмаштыргычка җибә¬
рәләр. Газ катнашмасы монда оэатылучы калдык газлар
белән тиешле температурага кадәр җылына. Аннары газлар
катнашмасы синтез колоннасына керә. Синтез колоннасын¬
нан чыга торган реакция продуктлары, җылыалмаштыргычка
кереп, синтезга бара торган газ катнашмасын җылыталар,
аннары суыткыч конденсатор аша узып, сепараторга керәләр.
39 нчы рәтем. Промышленностьта метанол табу схемасы:
/- турбокомпрессор; 2--жылыалмаштыргыч; 3—синтез колоннасы;
4—суыткыч конденсатор; 5 — сепаратор; 6—метавол җыйгыч.
125
Монда спирт реакциягә керми калган газлардан аерыла, ә ул
газлар циркуляцион компрессор ярдәмендә технологик про¬
цесска кире кайтарыла.
Төрле конструкцияле синтез колонналары була; алар төзе¬
лешләре белән күбесенчә аммиак синтезлау колонналарына
охшаган. (Аларның ничек эшләүләрен исегезгә төшерегез.)
Аммиак һәм метил спирты синтезының технологик схема¬
ларында уртаклыклар күп булуын бик җиңел күреп була. Бу
уртак билгеләрне табыгыз.
Ләкин процессларны тормышка ашыруда җитди аерма да
бар. Аммиактан аермалы буларак, метил спиртын синтез¬
лаганда өстәмә реакцияләр дә бара; нәтиҗәдә күп кенә өстәмә
продуктлар барлыкка килергә мөмкин; зуррак молекуляр
массалы спиртлар, диметил Һәм башка эфирлар, углеводо¬
родлар һ. б. Бу хәл катализаторларны сайлап алуга аеруча
югары таләпләр куя. Монда төп реакцияне тизләтүче һәм
мөмкин булган башка процессларны баса торган селектив
дип аталган катализаторлар кирәк (латинча selectio — сай¬
лау). Цинк, хром, бакыр оксиды шундый үзлекләргә ия.
19. а} Метаннан метанол, б) бутаннан бутанол-1 табу реакциялә¬
ренең тигезләмәләрен языгыз.
20. Этениаи нинди ике ысул белән этанол табарга мемкин?
21. Пропанны пропил спиртыннан ничек табарга? Реакция тигезлә¬
мәләрен языгыз.
*22. Промышленностьта пропанол-2 спиртын пропенны гидратлаш-
тырып табалар. Бу Марковников кагыйдәсенә туры киләме? Моңа
электронлы тезелеш күзаллауларына таянып аңлатма бирегез.
23. Түбәндәге әверелешләрне тормышка ашырырга мөмкинлек
бирүче реакция тигезләмәләрен төзегез:
, ?
с,нв * с2ньон
Бу реакцияләрне нинди шартларда тормышка ашырырга мөмкин?
*24. Промышленностьта метил спирты синтезлауның оптималь
шартларын әйтегез.
*25. Промышленностьта метил спирты табуда химия производство¬
сының нинди гомуми принциплары кулланыла?
*26. Этиленны гидратлаштыру реакциясе экзотермик реакция, аны
тормышка ашыруның оптималь шартлары югарыда китерелде, кон¬
такт аппараты аша бер тапкыр узганда башлангыч этиленның 5 % ы
чамасы спиртка әверелә. Менә шушы мәгълүматлардан чыгып, про¬
мышленностьта этил спирты синтезлауның технологик схемасын
эшләгез.
126
§ 27. КҮП АТОМЛЫ СПИРТЛАР
Тезелеше һәм физик үзлекләре. Күп атомлы спиртлар
ның молекуласында углеводород радикалы белән тоташкан
берничә гидроксил группасы була.
Әгәр углеводород молекуласында ике водород атомы гид¬
роксил группалары белән алмашынган булса, мондый спирт
ике атомлы дип атала. Мондый спиртның иң гадие—эти
ленгликоль (этандиол-1,2);
СН—СН,
I ' I
он он
Әгәр углеводород молекуласында оч водород атомы гидрок¬
сил группалар белән алмашынган булса, өч атомлы спирт
хасил була. Өч атомлы спиртның иң гадие—глицерин (про-
пантриол-1,2,3):
СН,—СН—СНг
ОН ОН ОН
Күбрәк атомлы спиртлар да бар.
Күп атомлы спиртларның барысында да гидроксил груп¬
палары төрле углерод атомнарына тоташкан. Бер углерод ато
мына ике гидроксил группасы тоташкан спирт табарга мөм¬
кин түгел; мондый кушылма тотрыксыз булып чыга.
Бер углерод атомына тоташкан ике гидроксил груп¬
пасының тотрыксыз икәнен без неорганик химиядә
карбонат кислотасын өйрәнгәндә үк очраткан идек.
/ОН
Билгеле булганча, бу кислота О-С<^ эремәдә килеш
хон
кенә саклана ала, аны саф хәлендә табарга омтылу кис¬
лотаның углерод (IV) оксидына һәм суга таркалуына
китерә.
Күп атомлы спиртларның әһәмиятлеләреннән — этилен¬
гликоль һәм глицерин—татлырак тәмле, суда яхшы эри
торган сиропсыман төссез сыеклыклар. Бу үзлекләр күп
атомлы башка спиртларга да хас. Этиленгликоль агулы.
Химик үзлекләре. Составларында гидроксил группалары
булу сәбәпле, этиленгликоль һәм глицеринның бер атомлы
спиртлар белән охшаш үзлекләре бар. Мәсәлән, натрий реак¬
циягә кереп, алардан водородны этеп чыгара:
СН?ОН
СН7ОН
f 2Na
СЩ-ONa + щ
СН2—ONa
127
Спиртларга галогеноводород кислоталары белән тәэсир ит¬
кәндә гидроксил группасы алмашына:
СН.ОН-CH2iQH + H'CI -* €Н,ОН—CHjCl + Н2О
Ләкин күп атомлы спиртларның үзләренә генә хас үзлек¬
ләре дә бар.
Әгәр селте эремәсе салынган пробиркага берничә тамчы ба¬
кыр купоросы эремәсе тамызып, хасил булган бакыр (II)
гидроксидыыа глицерин салсаң, ачык зәңгәр төстәге үтә кү¬
ренмәле бакыр глицераты эремәсе барлыкка килә (барлыкка
килгән матдәнең тезелеше катлаулы булу сәбәпле, формуласы
китерелми). Бу — күп атомлы спиртлар очен характерлы
реакция.
Күп атомлы спиртлар мисалында без микъдар үзгәреш¬
ләренең сыйфат үзгәрешләренә күчүенә яңадан ышандык:
молекулада гидроксил группаларының туплануы, аларның
үзара тәэсир итешүе нәтиҗәсендә, бер атомлы спиртларны-
кыннан аермалы яңа үзлекләр барлыкка килүгә китерә.
Күп атомлы спиртларны табу һәм куллану. Бер атомлы
спиртлар кебек үк, күп атомлы спиртларны үзләренә тиешле
углеводородлардан аларның галогенлы кушылмалары аша
табалар.
Иң күп кулланыла торган күп атомлы спирт — глицерин¬
ны майларны таркату юлы белән табалар (гомуми биология
курсыннан майларның составын исегезгә төшерегез), ә хәзер¬
ге вакытта күбесенчә нефть продуктларын таркатканда хасил
булган пропиленнан синтетик юл белән табалар.
Этиленгликоль, кайбер органик кушылмаларны синтезлау
өчен, мәсәлән, лавсан сүсен җитештерүдә файдаланылучы
югары молекуляр матдә табуда кулланыла. Этиленгликоль
антифризлар — түбән температурада ката торган сыеклыклар
әзерләү өчен шактый күп тотыла.
Автомобиль белән азмы-күпме таныш булган һәр кеше
кыш көне машинаны карау читен булуын, двигательне
суыта торган суның катуы һәм нәтиҗәдә киңәеп, двига¬
тельгә зыян китерүе мөмкин икәнен белә. Әгәр суда эти¬
ленгликоль эретелсә, мондый эремәнең кату температу¬
расы шактый түбәнәя. Мәсәлән, 25 % этиленгликоль
катнашкан эремә -12 °C та, ә этиленгликоль 55 % булса,
-40 °C та гына ката.
Глицеринның күп кенә кулланылышы аның гигроскопик
булуына нигезләнгән. Медицинада ул кул тиресен йомшарту
128
һәм төрле мазьлар ясау өчей, ә күн эшләү производствосын¬
да — күнне кибүдән саклау, текстиль промышленностенда
йомшаклык һәм эластиклык бирү максаты белән тукыма¬
ларны эшкәртү һәм башкалар өчен кулланыла. Глицерин
шулай ук синтетик сумалалар һәм шартлаучан матдәләр,
мәсәлән, нитроглицерин табу өчен кулланыла.
*27. Дүрт атомлы эритрит спиртын СН;ОН—СНОН—СНОН—CHtOH
глицеринның гомологы дип карарга мәмкинме? Нигезле җавап би¬
регез.
*28. а) Этиленгликоль һәм б) глицеринның иң якын гомологлары-
ның структур формулаларын языгыз. Систематик номенклатура буен¬
ча аларның исемнәрен языгыз.
29. Этиленгликоль һәм глицеринның: а) сыеклык булуларың,
б) чагыштырмача югары температурада кайнауларын, в) суда яхшы
эрүләрен ничек аңлатырга?
30. 1,2,3-Трихлорпропаннан СН2С1 — СНС1 — CHiCl ничек итеп
глицерин табарга? Реакция тигезләмәләрен тезегез һәм аны үткәрү
шартларын күрсәтегез.
31. 1 моль глицериннан натрий күпме максималь күләмдә (н. ш.да)
водород кысрыклап чыгара ала?
32. Глицеринны этил спиртыннан химик юл белән ничек аерырга?
□ Сез яши торган урында автомобильләрдә аитифризлар кулланы¬
ламы? Аларның составы, үзлекләре һәм куллану кагыйдәләре белән
танышыгыз.
§ 28. ФЕНОЛЛАР
Ачык чылбырлы углеводородларның гидроксиллы ку¬
шылмалары булган кебек, ароматик углеводородларның да
гидроксиллы кушылмалары бар. Мондый кушылмаларда
гидроксил группалары ян чылбырдагы углерод атомнары
янында яки бензол боҗрасындагы углерод атомы белән туры-
дан-туры бәйләнгән була, мәсәлән:
СН2—СН,ОН
ОН
он
Водороды гидроксил белән алмаштырылган матдәләрдә
функциональ группалары ям чылбырда булса, алар спиртлар
классына керә.
5 В-177 129
• Водороды гидроксил белая алмаштырылган ароматик
углеводородларның молекулаларында функциональ группалар
бензол боҗрасы белән бәйләнгән булса, алар феноллар дип
атала.
Бер водород атомы гидроксил белән алмаштырылган бен¬
зол СвН5ОН, яки ОН фенолларның иң гадие санала»
аны» гадәттә» фенол дип кенә йөртәләр. Фенол молекуласы¬
ның моделе III төсле рәсемдә күрсәтелгән.
Фенолның үзлекләре. Фенол — үзенә бертөсле исле, төссез
кристаллик матдә. Ьавада беркадәр оксидлашуы нәтиҗә¬
сендә, ул, гадәттә, алсу төстә була. Фенол бик җиңел эрете-
лүчән матдә, моңа ышану өчен аны пробиркага салып, җылы
суга батыру җитә: фенол бик тиз эри башлый (аның эретелү
температурасы 42 °C).
Фенол молекуласында углеводород радикалына бәйләнгән
гидроксил группасы булганлыктан, фенол химик үзлекләре
белән бер атомлы спиртларга беркадәр охшаган. Мәсәлән, әгәр
фенолны җиңелчә генә җылытып (эрегәнче), аңа металлик
натрий салсаң, водород аерылып чыга. Бу вакытта натрий
феноляты CeH5ONa хасил була:
Алкоголятлардан аермалы буларак, фенолятлар фенолга
селте эремәсе белән тәэсир иткәндә дә хасил булалар: бу
вакытта каты хәлдәге фенол суда бик тиз эри торган натрий
фенолятына әверелә:
С„Н5ОН + NaOH — CeHsONa + Н2О
Бәйләнешләрнең ионлы механизм буенча таркалуын
исәпкә алсак, тигезләмә түбәндәгечә язылыр:
6- .8 +
CeH5O:^H + Na+ + ОН —
[С4Н5О:]' + Na+ + Н2О
Бу реакцияләрдә фенолның кислота үзлекләре күренә.
Фенолның диссоциацияләшү дәрәҗәсе суныкыннан һәм чик¬
ле спиртларныкыннан зуррак, шуңа күрә аны карбол кисло¬
тасы дип тә йөртәләр. Шулай да фенол көчсез кислота: хәтта
карбонат кислотасы да аннан көчлерәк, һәм ул фенолны
натрий фенолятыннаи этеп чыгара ала.
130
Фенолда кислота үзлекләре артуның, ягъни бер атомлы
спиртларга караганда протонны җиңелрәк аеруының сәбә¬
бе нәрсәдә соң? Бу матдәләр составлары буенча бер-берсен-
нән углеводород радикаллары белән генә аерылалар, шуңа
күрә ароматик фенил радикалы —С6Н5, этил — СгН& ради¬
калыннан аермалы буларак, гидроксил группасына йогын¬
ты ясый һәм андагы водород атомы белән кислород атомы
арасындагы бәйләнешне йомшарта. Бу йогынтының асы¬
лы шунда: бензол төшенең алты электронлы я-болыты
гидроксил группасындагы кислород атомының р-электрон
пары белән аларны үз системасына тарткандай тәэсир ите¬
шә. Шул сәбәпле О—Н бәйләнешенең электрон тыгызлы¬
гы водородтан кислородка таба күбрәк авыша һәм бәйлә¬
нешнең полярлыгы арта теш?. Нәтиҗәдә водород атомы¬
ның протон рәвешендә аерылу мөмкинлеге арта.
Хәзер бу кушылмада бензол боҗрасындагы водород
атомнары үзләрен ничек тотуларын, аларның үзлекләре
бензолдагы водород атомнарыныкы кебек булу-булмау-
ларын тикшереп карыйк.
Бензолның бромлы су белән реакциягә кермәвен искә
төшерик. Әгәр дә фенол эремәсенә бромлы су салсак, без
трибромфенолның ак төстәге утырым рәвешендә хасил
булуын күрербез:
ОН ОН
нтАтн Вг>АгВг
|( )| + ЗВг2 | + ЗНВг
Н Вг
Бензол боҗрасының реакциягә керергә сәләтлерәк бу
луының сәбәбен фенол молекуласында гидроксил группа
сы булудан эзләргә кирәк, чөнки фенол белән бензолның
төзелешендә башка аерма юк. Кислород атомының р-элек-
троннары, бензол боҗрасына тартылып, аның ^пектрон
тыгызлыгын арттыра. Толуол мисалында күреп үткәне¬
безчә, 2,4,6 торышларында бу тыгызлык бигрәк зур, бром¬
ның тәэсире шуңа юнәлә дә инде. Шулай итеп, без монда
да атомнарның бер-берләренә йогынты ясау күренешен
очраттык: фенол молекулаларында гидроксил группасына
бензол боҗрасы тәэсир итеп, аның кислоталылыгын арт¬
тырып кына калмый, бәлки бензол боҗрасына гидроксил
группасы үзе дә тәэсир итә һәм андагы водород атомнарын
җиңел алмаштырыла торган итә.
9
131
Фенолны куллану һәм табу. Күп кенә микроорганизм¬
нарны үтерә торган матдә буларак, фенолны инде күптәннән
бирле судагы эремә рәвешендә биналарны, мебельне, хирургия
инструментларын һәм башкаларны дезинфекцияләүдә кулла¬
налар. Ул — буяулар, күп кенә дару матдәләре табу өчен то¬
тыла. Фенолның күп өлеше аеруча киң таралган фенолфор¬
мальдегид пластмассалар җитештерү өчен китә.
Промышленность ихтыяжлары өчен, беренче чиратта, тягп.
күмер сумаласыннан алынган фенол файдаланыла. Ләкин бу
чыганак фенолга булган ихтыяҗны тулысынча канәгатьлән¬
дерә алмый. Шуңа күрә аны бик күп микъдарда синтетик юл
белән бензолдан табалар.
Фенолны җитештергәндә һәм промышленностьта куллан¬
ганда составында фенол булган промышленность калдык¬
ларыннан табигатьне саклау мәсьәләсе бик әһәмиятле пробле¬
малардан санала, чөнки мондый калдыклар хайван һәм
үсемлек организмнары өчен аеруча куркынычлы санала. Бу
очракта нефть эшкәрткәндәге шикелле микробиологик чис¬
тарту кулланырга ярамый, чөнки фенол бактерицид үзлек¬
ләргә ия буларак (латинча caedo—үтерәм), үзе микроорга¬
низмнарны үтерә. Шуңа күрә фенолның әйләнә-тирә мохиткә
эләгүен булдырмау өчен, төрле методлар кулланыла: соста¬
вында фенол булган газларны каталитик оксидлаштыралар,
ташландык суларны озон белән эшкәртәләр, фенолны эрет¬
кечләр белән аерып алалар һ. б. Әйләнә-тирә мохитне саклау¬
ның нәтиҗәле башка чараларын эзләү эшләре алып барыла.
33. Формулалары түбәндә китерелгән матдәләр кушылмаларның
кайсы классына керә?
34. Шундый төзелешле матдә бирелгән:
С6Н1ЭОН
Бу матдә: а) натрий белән, б) зәһәр натр (натрий гидроксиды)
белән ничек тәэсир итешәчәк? Реакция тигезләмәләрен языгыз. Бу
матдә тагыв винди матдәләр белән тәэсир итешә?
132
35. Фенолның кристаллик тезелеше авың молекулалары арасында
водородлы бәйләнешләр булудан килә. Бер атомлы спиртлардагы водо¬
родлы бәйләнешләр белән чагыштырганда бу бәйләнешләрнең ныклы¬
гы турында нәрсә әйтергә мөмкин? Фенолның водородлы бәйләнешлә¬
рен схемада сурәтләгез.
36. Натрий феволятының судагы эремәсе аша углерод (IV) окси¬
дын уздырганда эремә ни өчен болганчыклана? Реакция тигезләмәсен
ЯЗЫГЫЗ.
37. Фенол нитрат кислотасы белән бик җиңел реакциягә керә. Бу
вакытта 2,4,6-тривитрофенол (пикрин кислотасы) хасил була. Реакция
тигезләмәсен языгыз.
38. Фенолны түбәндәге әверелешләр юлы белән табарга мөмкин:
С«Н« —С»Н5С1 —»С»Н5ОН. Бу әверелешләрнең һәркайсыи ничек тор¬
мышка ашырыр идегез? Реакция тигезләмәләрен языгыз.
7. АЛЬДЕГИДЛАР ҺӘМ КАРБОН КИСЛОТАЛАРЫ
Без спиртларны углеводородлар оксидлашканда хасил
була торган матдәләр итеп караган идек.
Альдегидлар һәм карбон кислоталары — спиртларны ок¬
сидлаштыруны дәвам иттереп табылган продуктлар алар.
§ 29. АЛЬДЕГИДЛАР
Төзелеше һәм физик үзлекләре. Альдегидларга хас төзе¬
лешне күз алдына китерү өчен, аларның иң гадие — кыр¬
мыска альдегиды белән танышыйк.
Альдегид составын өйрәнү аның молекуляр формула¬
сының СН2О икәнен күрсәтә. Шуннан чыгып, аның мөмкин
булган бердәнбер структур формуласын яза алабыз:
Бу рәттәге башка матдәләрнең төзелеше дә шуңа охшаган.
Альдегидларның иң гади вәкилләре турындагы мәгълүмат¬
лар 4 нче таблицада китерелгән.
Молекулаларында углеводород радикалына тоташкан
Z
функциональ атомнар группасы —С булган органик мат-
ХН
дәләрне альдегидлар дип йөртәләр.
(Кырмыска альдегидында функциональ группа водород
атомына тоташкан.)
Бу класска керүче матдәләрнең гомуми формуласы:
>° z°
R—С * Атомнар группасы —С/ карбонил дип атала.
ХН 4
Альдегид молекулаларының модельләре 40 нчы рәсемдә
һәм IV төсле таблицада сурәтләнгән.
134
4 нче таблица. Альдегидларның гомологик рәте
Альдегндларвын
исеме
Формуласы
Кайнау
температурасы
ГС Д«)
Кырмыска альдегиды
н '■"°
-19
(формальдегид)
Серкә альдегиды
н
.о
+21
(ацетальдегид)
Пропион альдегиды
' н
Z
сн3-сн2-с z
+50
Май альдегиды
Н о
сна—сн2—сн2—с £
+75
Валериан альдегиды
СН3—сн, сн2 сн2—с 7
+ 120
һ. б.
хн
Альдегидларны молекулаларында карбонил группасы
jP
—€ углеводород радикалына һәм водород атомына
тоташкан органик кушылма итеп тә карарга мөмкин.
Альдегидлар классы шуның белән карбонил группасы ике
углеводород радикалына тоташкан кетоннар классыннан
аерылып тора.
Кетоннарның гомуми формуласы R—С—R. Кетоннар-
0
ның иң әһәмиятлесе — ацетон СН3—С—СН3 (форзацтагы
|
О
IV төсле таблицаны карагыа) үзенә бертөрле исле төссез
сыеклык. Ацетон көнкүрештә һәм производствода эреткеч
итеп бик киң кулланыла.
Альдегидларның электронлы төзелешен тикшереп ка¬
рыйк. Карбонил группасының углерод атомы, башка өч
атом белән тоташып, сгбәйләнешләр барлыкка китерә һәм,
димәк, этилен молекуласындагы кебек, зр2-гибридлашу
торышында була. Безгә билгеле булганча, мондый бәй¬
ләнешләр бер яссылыкта ята һәм алар арасындагы почмак
135
40 нчы рәсем.
Формальдегид молекуласыпыц
моделе.
41 нче рәсем. Альдегидларның
карбонил группасында
х-бәйләнеше ясалу.
120° ка тигез. Углерод атомындагы р-электронның гибрид
лашмаган болыты белән кислород атомындагы р-электрон
болыты (бу атомның икенче электроны С—О о-бәйләнеше
ясалуда катнаша) ян-яктан бер-берсе белән аралашып
п-бәйләнешен хасил итәләр (41 нче рәсем).
Альдегид белән этилен молекулаларындагы икеле бәйлә¬
нешнең электронлы тезелешендә күп кенә уртаклыклар бар,
әмма алар арасында аерма да бар. Этиленнан аермалы була¬
рак, альдегидларның атомнары арасындагы икеле бәйләнеш
электртискәрелеге ике торле булган элемент атомнары ара¬
сында барлыкка килә, шуңа күрә ул поляр була. Электрон
тыгызлыгы (нигездә, хәрәкәтчәнрәк л-бәйләнешнең электрон
тыгызлыгы) углерод атомыннан кислород атомына таба тай¬
пыла, шуның аркасында аларның берсе өлешчә уңай корыл¬
ма, икенчесе өлешчә тискәре корылма ала. Шуңа күрә альде¬
гидларның электронлы төзелешен мондый формулалар белән
күрсәтергә мөмкин:
Альдегидларның 4 нче таблицада күрсәтелгән үзлекләрен¬
нән күренгәнчә, рәтнең беренче матдәсе генә—кырмыска аль¬
дегиды — газ хәлендә, аннан соң — сыеклыклар, ә югары тө¬
зелешле альдегидлар — каты матдәләр. Бу рәтнең баштагы
матдәләре суда эри, ә молекуляр авырлыклары арта барган
саен альдегидларның эрүчәнлеге кими, югары төзелешле
альдегидлар суда эремиләр.
136
Спиртлардан аермалы буларак, альдегидларда молекулаара
водородлы бәйләнеш ясалмый, чөнки С—Н бәйләнешенең,
полярлыгы зур булмау сәбәпле, альдегид группасындагы во¬
дород атомының уңай корылмасы икенче альдегид группа¬
сының тискәре корылган кислород атомы белән мондый
бәйләнеш урнаштыру өчен җитәрлек тугел. Шул сәбәпле
альдегидларның кайнау температуралары молекуласындагы
углерод атомнары саны альдегидныкы кадәр үк булган спирт¬
ларның кайнау температураларыннан түбәнрәк. Гомоло¬
гик рәтнең башында торган матдәләрнең суда эрүчәнлеген
алардагы водород атомнарының су молекуласы белән водо¬
родлы бәйләнешләр хасил итүләре белән аңлатырга мөмкин.
Ацетальдегид һәм су молекулалары арасында шундый бәй¬
ләнешләр ясалу схемасын төзегез.
Альдегидларның исемнәре альдегидлар оксидлашкан¬
да барлыкка килгән кислота исемнәреннән алынган. Мә¬
сәлән, кырмыска альдегиды, ягъни формальдегид исеме
кырмыска кислотасы исеменнән алынган, кырмыска аль¬
дегиды оксидлашып, кырмыска кислотасы хасил итә (кыр¬
мысканың латинча исеме — formica); серкә альдегидына,
ягъни ацетальдегидка исем серкә кислотасыннан чыгып
бирелгән.
Кырмыска альдегиды (формальдегид) — буылдыргыч кис¬
кен исле, бик агулы матдә. Аның судагы 40 процентлы эре¬
мәсе формалин дип йөртелә,
Систематик номенклатура буенча, альдегидларның
исемнәре аларга туры килгән чикле углеводородның исем¬
нәренә -аль кушымчасы өстәп ясала:
О
H-cf
н
Метаньль
Этаналк
сна-сн,—с
һ. б.
Прппяняль
Химик үзлекләре. Альдегидларның химик үзлекләре иң
элек аларның молекуласында карбонил группасы булуга
бәйләнгән. Андагы икеле бәйләнеш урынында кушылу реак¬
цияләре барырга мөмкин.
Мәсәлән, әгәр кыздырылган никель катализатор өстеннән
формальдегид парларын водород белән бергә уздырсаң, фор¬
мальдегидка водород кушыла. Формальдегид метил спиртына
137
кайтарыла. Бу процессны схематик рәвепгтә түбәндәгечә күр¬
сәтергә мөмкин: н
1
Н-С" + Н2 — Н-С-ОН
'« А
Мондый реакция тигезләмәләрен башка альдегидлар өчен
дә төзергә мөмкин.
Икеле бәйләнешнец поляр характерлы булуы альдегид¬
ларның башка реакцияләргә керүенә дә, мәсәлән, су белән
кушылуына, сәбәп була. Бу бигрәк тә формальдегид өчен
хас:
»-
Н—С + н>:он
ХН
ОН
I
5= н—С— ОН
I
Н
Биредә түбәндәгеләр күзәтелә. Карбонил группасында¬
гы өлешчә уңай корылмалы углерод атомына кислород
атомының пар электроны исәбенә гидроксил группасы то¬
таша; л-бәйләнешнең пар электроны карбонил группасы¬
ның кислород атомына күчә, һәм, аның аша кислородка
протон тоташкач, икенче гидроксил группасы барлыкка
килә. Формальдегидның судагы эремәсе күбесенчә шун¬
дый гидрат формасында була (бу кайтма реакциянең
тигезләнеше уңга таба бик нык авышкан).
Альдегидлар карбонил группасындагы кислород атомы
тәэсирендә альдегид группасындагы С—Н бәйләнеше урынын¬
нан оксидлашалар. Әгәр чиста пробиркага оксидлаштыручы
итеп (ни өчен?) көмеш оксидының Ag2O* аммиактагы эремә¬
сен салсак, һәм, аңа альдегид эремәсе өстәп, катнашманы
саклык белән генә җылыта башласак, озак та үтмәс, пробирка
стеналарына ялтырап торган көмеш куныгы утырыр. Бу
оксидлашу-кайтарылу реакциясендә альдегид кислотага әве¬
релә (аммиак артык булу сәбәпле аммоний тозы барлыкка
килә), ә көмеш саф килеш аерылып чыга:
СН3—С * + Ад .О —- СНЭ—С 7 + 2Ag
ЧН ОН
Серка гвшгкы
Бу реакция көлдеш көзге реакциясе дип атала.
Альдегидларны оксидлаштыручы итеп бакыр гидроксидын
1 Кемеш (I) оксиды суда эреми. Аммиак белән ул эри торган ку¬
шылма AgfNHshOH хасил ит».
138
да Cu(OH)2 файдаланырга мом к ин. Әгәр аңа альдегид груп¬
пасы өстәп, катнашманы җылыта башласак, башта сары
төстәге бакыр (I) гидроксиды утырымы күзәтелер, аннан соң
ул кызыл төстәге бакыр (1) оксидына әверелер. Бу очракта ба¬
кыр (II) гидроксиды альдегидны кислотага оксидлаштыра,
ә үзе бакыр (1) оксидына кадәр кайтарыла.
Бу реакцияне гомуми рәвештә күрсәтик:
✓° Z°
R—С + 2Cu(OH>2 —* R- С v + 2СиОН + Н,О
хн он
2СиОН — СигО + НгО
Көмеш (I) оксидының аммиактагы эремәсе һәм бакыр (II)
гидроксиды белән булган реакцияләр альдегид барлыгын белү
өчен хезмәт итә алалар.
Альдегидлар өчен фуксинсульфит кислотасы белән реак¬
ция дә хас. Бу кислотаны буягыч матдә фуксинның ачык ал¬
су төстәге судагы эремәсе аша күкерт (IV) оксидын уздырып
табалар. Күкерт (IV) оксиды фуксинга кушылу аркасында
эремә төссезләнә. Шул төссез эремәгә альдегид өстәгәндә кү¬
керт (IV) оксидының молекуласы аерыла һәм эремәнең төсе
кайтарыла. Шуңа күрә фуксинсульфит кислотасын альдегид¬
лар өчен реактив итеп файдаланалар.
Альдегидларны куллану. Альдегидлардан формальдегид
һәм ацетальдегид (серкә альдегиды) аеруча күп кулланыла.
Формальдегид, гадәттә, аның судагы эремәсе — формалин рәве¬
шендә кулланыла. Аның күп кенә урыннарда кулланылуы ак¬
сымны оету үзлегенә нигезләнгән. Авыл хуҗалыгында фор¬
малин чәчүлек орлыкларны агулау өчен бик кирәк. Күн эшләү
производствосында да формалин күп тотыла, чөнки ул тиредәге
аксымга тәэсир итеп, аны катырак һәм череми торган хәлгә
китерә. Биология препаратларын саклау өчен формалин кулла¬
ну да аның нәкъ шул үзлегенә нигезләнгән. Формальдегидка
аммиак белән тәэсир итен, уротропин дигән дару матдәсе таба¬
лар. Ләкин аның төп массасы фенолформальдегид пластмас¬
салар табу өчен тотыла. Ә аннан электротехника әйберләре,
машина детальләре һәм башка бик күп нәрсәләр ясыйлар.
Пластмассалар белән җентекләп соңрак танышырбыз.
Ацетальдегид (серкә альдегиды) серкә кислотасы табу өчен
бик күп тотыла. Кайбер илләрдә ацетальдегидны кайтару
юлы белән этил спирты табалар.
Альдегидларны табу. Альдегидларны табуның гомуми
ысулы — спиртларны оксидлаштыру. Бу ысулны аңлау өчен
139
бер тәҗрибә ясап карыйк. Бакыр чыбыктан ясалган спираль¬
не, спирт лампасы ялкынында кыздырып, спиртлы пробир¬
кага төшерик. Шул вакыт без кыздырганда бакыр (И) окси¬
дының карасу куныгы белән капланган спиральнең спиртта
яңадан ялтырый башлавын күрербез; бер үк вакытта альде¬
гид исе дә сизелә:
[«------¬
I I Г 3
R—С—О Н + Си О'
| i—i i_i
Н
+ Си + НгО
Промышленностьта формальдегидны әлеге реакция ярдә¬
мендә табалар. Моның очен метил спирты парларының һава
белән катнашмасын кызган бакыр яки көмеш челтәрле реак¬
тор аша уздыралар.
Альдегидларны лаборатор ысул белән тапканда спирт¬
ларны оксидлаштыру өчен башка төрле оксидлаштыручылар¬
дан да, мәсәлән, калий перманганатыннан файдаланырга
мөмкин. Гадилек өчен оксидлаштыручыны атом хәлендәге
кислород белән билгеләп, тиешле спирттан серкә альдегидын
табу реакциясенең тигезләмәсен языгыз.
Спиртларны оксидлаштыру аларның молекулаларын¬
нан ике водород атомын аерып алуга кайтып кала (тигез¬
ләмәне карагыз).
Альдегид ясалган чакта спирт, ягъни алкоголь дегид-
рирлашуга дучар була. «Альдегид* сүзе шушы ике сүзнең
баштагы хәрефләреннән ясалган, һәм ул водородсыз кал¬
ган алкоголь дигәнне аңлата.
Промышленностьта ацетальдегидны күбесенчә рус гали¬
ме М. Г. Кучеров ачкан (1881 ел) реакция нигезендә аце¬
тиленны терекөмеш тозлары катнашында гидратлаштыру
■олы белән табалар.
Башта д-бәйләнешнең берсе буенча ацетиленга су ку¬
шыла да винил спирты хасил була (винил радикалының
структур формуласын исегезгә төшерегез). Ләкин чиксез
спиртларда гидроксил группасы икеле бәйләнеш белән
углерод атомына тоташкан булу сәбәпле, мондый спирт
тотрыксыз була һәм җиңел иэомерлаша. Шуңа күрә ви¬
нил спирты альдегидка әверелә:
СН СН + НОН
СН,—С
мо
42 нче рәсем. Ацетиленны гндратлаштырып серкә альдегиды табу.
Ацетиленны сульфат кислотасы һәм терекөмеш (П) ок¬
сиды (42 нче рәсем) салынган җылы су аша үкәргәндә, бу
реакция җиңел уза; берничә минуттан соң җыйгыч савытта
альдегид эремәсен күрергә була.
Ацетальдегидны промышленностьта бу ысул белән та¬
буның бер кимчелеге бар: терекөмеш кушылмалары белән
эш итәргә туры килә, ә ул организмга эләгеп агулану
китереп чыгарырга мөмкин.
Соңгы елларда, палладий һәм бакыр хлоридлары катна¬
шында этиленны оксидлаштырып^ ацетальдегид табу ысулы
эшләнде, һәм ул киң кулланыла бара:
О
2СН2=СН, + Oj. 2СН3—С 9
ХН
Бу ысул иң перспективалы ысуллардан санала, чөнки
хәзерге вакытта этилен ацетиленга караганда күбрәк табыла
һәм органик синтез өчен арзанлы чималлардан санала. (Ни
өчен?)
*1. Систематик номенклатура буенча түбәндәге альдегидларга исем
бирегез: Ф q
СН,—СН—СН,— С Г СН,—СН-СН-СН2—cf
Н ‘ ' н
сн3 С2Н5
СН3
*2. Серкә альдегидыннан ничек итеп ике стадиядә бромэтан табарга?
Реакция тигезләмәләрен төзегез.
141
3. «Кемеш кеэге» реакциясендә бер үк вакытта 0,01 моль квмеш
кайтарылганда күпме пропион альдегиды (граммнарда! оксидлашыр?
*4. Альдегидлар су белән реакциягә кергәндәге шикелле икеле
бәйләнеш аша үзләренә спиртларны да куша алалар. Серкә альдеги¬
дының метил спирты белән реакциясе тигезләмәсен тезегез һәм аны
электронлы тезелеш күзаллауларына нигезләп аңлатыгыз.
5. Бакыр (II) гидроксиды ярдәмендә ничек итеп глицеринны һәм
серкә альдегидын танып белергә?
6. Ацетиленнан ничек итеп ике ысул белән этил спирты табарга?
Реакция тигезләмәләрен языгыз һәм бу реакцияләрнең узу шартларын
күрсәтегез.
7. Түбәндәге әверелешләрне ничек тормышка ашырырга:
Реакция тигезләмәләрен языгыз.
*8. Бензил спиртының • —СН-ОН бензой альдегидына оксид¬
лашу реакциясен языгыз. Шушы юл белән феноллар альдегидларга
әверелә аламы? Җавапны ацлатып бирегез.
9. 2 моль метил спирты оксидлашканда хасил булган формаль¬
дегидны 100 г суда эретәләр. Бу эремәдә формальдегидның масса өле¬
шен исәпләргә. О
*10. Трихлорсеркә альдегидына ССҺ—С су кушылудан хасил
'Н
булган продукт тотрыклылыгы зур булу белән аерылып тора: ул крис¬
талл хәлендә. Бу кушылманың формальдегид гидратына караганда
күпкә нык булуын ничек аңлатырга?
g 30. БЕР НИГЕЗЛЕ КАРБОН КИСЛОТАЛАРЫ
Кислоталарның тезелеше һәм физик үзлекләре. Альде¬
гидларның үзлекләрен өйрәнгәндә, сезгә кислоталарның
структур формулаларын язарга туры килгән иде. Сез ул мат-
О
дәләрнең төзелеше аларда —С атомнар группасы булу
ОН
белән аерылып торуына, әлбәттә, игътибар иткәнсездер. Бу —
карбоксил группасы. Ул карбонилдан —С
һәм гидрок-
силдан — ОН торганга күрә шулай аталып йөртелә.
142
• Молекулаларында углеводород радикалына бәйләнгән
О
бер яки берничә карбоксил группасы —С булган ор¬
ОН
ганик матдәләрне карбон кислоталары дип атыйлар1.
Молекулада ничә карбоксил группасы булуга карап, кис¬
лоталар бер нигезле, ике нигезле һ. б. була.
Бер нигезле карбон кислоталарының рәте 5 нче таблицада
китерелгән.
5 нче таблица. Бер игезле карбон кислоталарыныц гомологии рәте
Кйслоталериыа
исеме
Формуласы
Кайнау
температурасы
(°C да)
Кырмыска кислотасы
Серка кислотасы
Пропион кислотасы
Май кислотасы
Валериан кислотасы
Капрон кислотасы
Энант кислотасы
Пальмитки кислотасы
Маргарин кислотасы
Стеарин кислотасы
Һ. 6.
Н—СООН
CHj-COOH
СН,-СН,-СООН
СН,—СН,—СН,—СООН
СН,-СН2-СН2-СН2-СООН
СН,—(СН2),—СООН
СН,—(СН,)а—СООН
СН,—(СН,)М—СООН
СН,—(СН,)|4—СООН
СН,—(СН,)1а СООН
101
118
141
163
186
205
223
Каты
матдвлдр
Бер нигезле карбон кислоталарының төзелешен бер тому*
О
ми формула R—С
мөмкин.
он
, яки R—СООН белән күрсәтергә
Систематик номенклатура буенча кислота исемнәре
тиешле углеводород исеменә кислота сүзе өстәп ясала, мә-
0
сәлән: метан
кислотасы Н—С/ , пропан кислотасы
о 4 ОН
СНа—сн2-с*
һ. б., ләкин бу исемнәр практикада аз
4 ОН
кулланыла.
1 Кырмыска кислотасы молекуласында карбоксил группасы водород
атомы белав тоташкан.
143
Альдегидлардан аермалы буларак, кислоталар арасында
газ хәлендәге матдәләр юк (5 нче таблицаны карагыз). Рәт¬
нең түбән төзелешле кислоталары суда эри торган кискен
исле сыеклыктан гыйбарәт. Молекуляр авырлыклары арту
белән, аларның суда әрүчәнлеге кими. Югары төзелешле кис¬
лоталар — иссез каты матдәләр, суда эремиләр.
Газ хәлендәге матдәләрнең булмавын без спиртларның
гомологик рәтендә очраткан идек инде. Бу күренешнең сәбәбе
безгә билгеле. Карбон кислоталары рәтендә дә газ хәлендәге
матдәләрнең булмавын молекулаларның водородлы бәйлә¬
нешләр ярдәмендә тоташуына бәйле дип уйларга мөмкин.
Чыннан да, сыек кислоталарның молекуляр массасын
билгеләп карау, аларның куш (икеләтелгән) молекулалар¬
дан — димерлардан торуын күрсәтә. Кырмыска кислотасы
хәтта пар хәлендә дә димерлардан тора. Серкә кислотасы
парлары гади һәм куш молекулалар катнашмасыннан тора.
Карбон кислоталары димерларының төзелешен шулай күз
алдына китерергә мөмкин:
О...НО
^с-«
ОН...О
Ике молекула арасында монда ике водородлы бәйләнеш
урнашырга мөмкин, димер молекулаларының шактый нык
булуы нәкъ шуннан килә булса кирәк.
Спиртларның суда эрүчәнлеген без алдарак су белән ку¬
шылганда водородлы бәйләнешләр барлыкка килү белән аң¬
латкан идек. Бу күренеш кислоталарга да хас. Өстәвенә
матдәнең молекуляр массасы арта барган саен, ягъни аның
молекулаларында углеводород радикалы арткан саен, монда
да эрүчәнлек кими.
Спиртларның һәм альдегидларның электронлы төзеле¬
шен белүебездән чыгып, карбон кислоталарының да элек¬
тронлы төзелешен күз алдына китерә алабыз, чөнки аларның
функциональ группасы карбонил һәм гидроксил группала¬
рын үз эченә алган:
Кислоталарның электронлы төзелеше аларда кислота үз¬
лекләренең килеп чыгуын, ягъни протонның җиңелрәк аеры¬
луын аңлатып бирергә тиеш.
144
Кислоталарның төзелеше спиртлардан молекулаларын¬
да ике водород атомы урынына бер кислород атомы булу
белән аерыла. Димәк, гидроксил группасындагы водород
атомының үзлекләре карбонил группасындагы кислород
атомы йогынтысында үзгәргән. Альдегидлар мисалында
күреп узганыбызча, С=О бәйләнешенең (бигрәк тә д-бәнлә-
иешенең) электрон тыгызлыгы электртискәрерәк элемент
булган кислородка таба авышкан. Шуның нәтиҗәсендә
карбонил группасындагы углерод атомы өлешчә уңай
корылма ала. Бу корылманы компенсацияләү өчен, ул
гидроксил группасындагы кислород атомының электронна¬
рын үзенә якынрак тарта. Кислород атомындагы электрон
тыгызлыгы кими һәм ул О—Н бәйләнешенең электрон
тыгызлыгын үз ягына таба авыштыра. Гидроксил группа¬
сындагы бәйләнешнең полярлыгы арта һәм водород про¬
тон рәвешендә җиңелрәк аерылып китә. Электроннарның
мондый күчешен формулада уклар белән күрсәтәләр:
с о- и
Химик үзлекләре. Спиртлардан аермалы буларак, суда эри
торган кислоталар үзенә бертөрле әче тәмле, алар лакмусны
кызыл төскә кертәләр, үзләре аша электр тогын уздыралар.
Судагы эремәләрендә аларның диссоциациясен түбәндәге
тигезләмә белән күрсәтергә мөмкин:
R СООН н + R ООО
Диссоциация дәрәҗәсе буенча кырмыска кислотасы гына
көче уртача булган электролитлардан санала. Калган карбон
кислоталары көчсез электролитларга керә, өстәвенә моле¬
куляр массасы арткан саен, аларның диссоциациялашү дәрә¬
җәсе кими.
Кайбер металлар карбон кислоталарының эремәләре белән
тәэсир итешкәндә, водород аерылып чыга һәм тоз барлыкка
килә, мәсәлән:
2СНа—СООН + Mg —■ Н2 + Mg(CH3COOh
Мйгняй «петйти
Бу реакциянең ионлы тигезләмәсе:
2СНаСООН + Mg — Н, + Mg*’ + 2СНаСОО‘
145
Табигый ки, водород аерылып чыгу металл белен көчле
кислоталар — сульфат һәм хлорид кислоталары — арасында¬
гы реакциягә караганда әкренрәк бара.
Кислоталар нигез оксидлары һәм нигезләр белән тәэсир
итешкәндә тозлар хасил була:
СН3-СНг-СООН + NaOH СН3-СН, -COONa + Н,0
Натрий прооиоиати
яки ионлы тигезләмәсе:
СН3—СНг-СООН + Na* + ОН —► Н2О + Na* - СН3—СН2— С00‘
Тозлар белән реакциягә кереп, кислоталар көчсезрәк һәм
очучанрак кислоталарны кысрыклап чыгаралар. Серкә кисло¬
тасы белән кальций карбонаты арасындагы реакция вакы¬
тында кальций ацетаты барлыкка килә һәм углерод (IV)
оксиды аерылып чыга.
Карбон кислоталары неорганик кислоталарның без өйрән¬
гән үзлекләреннән тыш башка реакцияләргә дә керәләр.
Серкә кислотасы салынган пробиркага этил спирты өстик.
Без башта бернинди дә реакция билгеләрен сизмибез. Ләкин
аз гына сульфат кислотасы өстәп, катнашманы җылытсак, озак
та үтми серкә кислотасының этил эфиры исе килә башлый:
О О
СН С 5 _ _Г+ H’oCjHj СН3-С + Н20
он J о-с2н4
Моннан элегрәк өйрәнелгән гади эфирлардан аермалы
буларак (121 нче битне карагыз), серкә кислотасының этил
эфиры катлаулы эфирлар классына керә.
Кислоталарның без өйрәнгән барлык үзлекләре аның
молекуласында гидроксил группа булуга байле. Карбонил
группа монда үзенең үзлекләрен саклап каламы икән, безгә
менә шуны ачыклау әһәмиятле.
Белгәнебезчә, альдегидларда кушылу реакцияләре икеле
бәйләнеш С=О исәбенә бик җиңел бара. Тәҗрибәләр кислота¬
лардагы карбонил группаларының кушылу реакциясенә бик
авырдан керүен күрсәтә, икеле бәйләнеш монда тотрыклырак,
мәсәлән, водород атомы альдегидлардагыга караганда аеруча
кыен шартларда гына кушыла ала.
С=О бәйләнеше үзлекләренең мондый үзгәреше молеку¬
лада гидроксил группасы булу белән аңлатыла: электроннар¬
ның бу группадан углерод атомына таба авышуы аның уңай
корылмасын өлешчә нейтральләштерә, ә бу исә карбонил
146
группаның реакциягә керү сәләтенә йогынты ясый. Димәк,
без монда да молекулаларда атомнарның бер яклы гына
тәэсир итүен түгел, бәлки үзара тәэсир итешүен очратабыз.
Карбон кислоталарының молекулаларында химик ре¬
акция барырлык тагын бер участок бар, ул — углеводород
радикалы. Бу радикалда водород атомы галогеннар белән
алмаштырыла ала. Алмашыну карбоксилга якын торган
углеводород звеносында аеруча җиңел бара, мәсәлән:
Н 0
и v
+ CI
ОН
+ НС1
Хлор С«ркэ КЙСЙ<ГТЙСЫ
Н
Галоген атомнарының кислота молекуласына керүе
кислотада үзгәрешләр китереп чыгара. Алар тәэсирендә
кислотаның диссоциацияләшү дәрәҗәсе бик нык арта.
Мәсәлән, хлор-серкә кислотасы серкә кислотасыннан
100 тапкыр диярлек көчлерәк. Галоген атомнарын кисло
тага кертүдән ни очен кислотаның көче артуын аңлатып
карагыз.
Кислоталарны табу. Карбон кислоталарын табуның иң
гомуми ысулы тиешле альдегидларны оксидлаштырудан
гыйбарәт:
О ,О
R-C + О R—СГ'
ХН ОН
Бу очракта оксидлаштыручы итеп калий перманганатын
КМпО4, хром катнашмасын (калий дихроматы К2Сг2О7 белән
куертылган сульфат кислотасы катнашмасы) һәм башка көч¬
сезрәк оксидлаштыручы матдәләрне кулланырга мөмкин.
Альдегидлар, үз чиратында, спиртларны оксидлаштыр¬
ганда табылганлыктан һәм аннан кислоталарга җиңел генә
әверелгәнлектән, кислоталарны практикада, альдегидларны
арадаш продукт итеп аерып алмыйча, турыдан-туры спирт¬
ларны оксидлаштырып табалар. Мондый оксидлашуны сум¬
мар тигезләмә белән күрсәтергә була:
Н
1
°
R—C—Н + 20 — К—С
1 '
ОН
+ н,о
4 он
10
147
Углеводород чималы күп һәм арзан булганлыктан, хәзер
чикле углеводородларны оксидлаштыру юлы белән кислота¬
лар табу кәннән-кон киңрәк кулланыла.
*11. Кузгалак кислотасы (кузгалакта табылган) НООС—СООН ике
нигезле кислоталарның иң гади вәкиле. Аны кырмыска кислотасы¬
ның гомологи дип исәпләргә момкиаме? Нигезләнгән җавап бирегез.
*12. Карбоксил группасындагы углерод атомы зр’-гнбридлатуы
торышында була дип нәрсәгә таянып әйтә алабыз? Карбоксил группа¬
сының күләмле тезелешендә ул ничек чагыла?
13. а) Кырмыска альдегидының, б) пропион альдегидының тиңдәш
кислоталарга оксидлашу реакцияләренең тигезләмәләрен языгыз.
14. Кырмыска кислотасының; а) цннк, 6) натрий гидроксиды,
в) натрий карбонаты белән реакциясенең ионлы тигезләмәләрен язы¬
гыз. Ьәр очракта реакция баруын нинди билгеләргә карап белергә?
15. 0.1 моль карбон кислотасын нейтральләштерү очен 8 г натрий
гидроксиды тотылган. Молекуляр авырлыгы 104 булудан чыгып,
кислотаның ничә нигезле булуын табыгыз Һәм структур формуласын
языгыз.
*16. Кислота молекулаларында карбонил һәм гидроксил группа¬
ларының бер-берсенә йогынты ясавын нинди тәҗрибәләр белән күрсә¬
тергә момкин? Электрон теориясеннән чыгып бу йогынтыны пнчек
аңлатырга?
*17. Чиксез углеводородларга карата кушылу реакцияләре механиз¬
мын ойрәнгәндә. без андагы углеводород радикалының үзеннән элек¬
троннарны икеле бәйләнеш янындагы углерод атомына авыштыруын
күреп узган идек. Серкә кислотасының диссоциацияләшү дәрәҗәсе
кырмыска кислотасыныкына караганда кимрәк. Бу фактны кислота
молекуласында метил радикалы килен чыгу белән аңлатып буламы?
Нигезләнгән җавап бирегез.
*18. Кайсы кислотаның диссоциацияләшү дәрәҗәсе зуррак: а) хлор-
серкә кислотасыныкымы әллә трихлорсеркә кислотасыныкымы.
6) трихлорсеркә кислотасыныкымы әллә трифторсеркә кислотасы¬
ныкымы? Ни очен?
*19. Кислоталарның кайсысы көчлерәк: хлор-серкә С1СН,—СООН
кислотасымы әллә хлор-май С1СНг—СНг—CHt—СООН кислотасымы?
Ни очен?
§ 31. БЕР НИГЕЗЛЕ КАРБОН КИСЛОТАЛАРЫНЫҢ
ВӘКИЛЛӘРЕ
Кырмыска кислотасы. Чикле кислоталарның гомологик
рәтендәге беренче вәкиле кырмыска кислотасы — кырмыс¬
калар бүлеп чыгарган әче сыеклыкта, кычытканда, чыршы
ылысында була.
Әйтеп үткәнчә, кырмыска кислотасы бер нигезле карбон
кислоталары рәтендә иң көчле кислоталардан санала. Ләкин
148
43 нче рәсем.
Кырмыска кислотасы
молекуласының моделе.
аның башка үзенчәлекләре дә бар.
Аның төзелешенә игътибар белән ка¬
рагыз (43 нче рәсем). Кислота моле¬
куласында карбоксил группасы гына
О
түгел, альдегид группасы НО—С z
U
булуын да күрергә мөмкин.
Дөрестән дә, кырмыска кислота¬
сының, кислоталарга гына хас үзлек¬
ләреннән тыш, альдегид үзлекләре дә
бар. Мәсәлән, ул көмеш (I) оксиды¬
ның аммиактагы эремәсендә бик
җиңел оксидлаша. Бу реакциянең
тигезләмәсен языгыз. Кырмыска кислотасы оксидлашканда
нинди матдәләр хасил була?
Җиңел оксидлашуыннан файдаланып, кырмыска кисло¬
тасын техникада кайтаручы матдә итеп кулланалар. Кыр¬
мыска кислотасын спиртлар белән реакциягә кертеп, кат¬
лаулы эфирлар табалар. Катлаулы эфирларны эреткечләр
һәм хуш исле матдәләр итеп кулланалар.
Серкә кислотасы. Серкә кислотасы үсемлекләрдә, хайван
бүлендекләрендә бик еш очрый, органик матдәләр оксид¬
лашканда хасил була. Аның молекуласының моделе IV төсле
таблицада күрсәтелгән. Ул карбон кислоталары арасында иң
күп кулланыла торганы. Серкә кислотасының судагы эре¬
мәсе — ак серкәнең тәм бирүче, консервлаучы матдә (азыкка
тәм керткеч, гөмбәләрне, яшелчәләрне маринадлау һ. б.)
буларак кулланылуы сезгә билгеле инде.
Тоз ясалу белән бара торган төрле реакцияләр ярдәмендә
серкә кислотасы тозлары — ацетатлар табалар. Кислота
белән спиртлар үзара тәэсир итешкәндә төрле катлаулы эфир¬
лар табыла; кырмыска кислотасының эфирлары кебек, алар
да эреткечләр һәм хуш исле матдәләр буларак кулланыла.
Серкә кислотасы ацетат тукыма, төрле буягычлар (мәсәлән,
индиго, дару матдәләре (мәсәлән, аспирин) һәм башка матдә¬
ләр синтезлаганда файдаланыла.
Серкә кислотасыннан табылган кайбер матдәләр авыл
хуҗалыгында чүп үләннәр белән көрәшү өчен кулланыла.
Чүп үләннәргә каршы көрәшү өчен кулланыла торган
матдәләрне гербицидлар дип йөртәләр (латинча herba —
үлән, caedo — үтерәм)
149
2,4-Дихлорфеноксисеркә кислотасы (2,4-Д) нигезендә
табылган гербицидлар аеруча киң кулланыла. Аның тезе¬
леше түбәндәгечә: _
О—СН2-
/С1
Cl
2,4 Дмхлорфевокснсерка
КИСЛОТАСЫ
Гербицидлар итеп бу кислотаның башка тозлары һәм
кушылмалары, мәсәлән, 2,4-дихлорфеноксисеркә кисло¬
тасының натрий тозы кулланыла (аның структур форму¬
ласын төзегез). Бу матдәләр күбесенчә бөртекле культура
чәчүлекләрендәге ике өлешле чүп үләннәргә каршы кулла¬
ныла.
2М-4Х препараты да танылган гербицидлардан санала.
Ул — 2-метил-4-хлорфеноксисеркә кислотасының натрий
тозы, һәм 2,4-дихлорфеноксисеркә кислотасының натрий
тозыннан фенил радикалында бер хлор атомы урынында
метил группасы булу белән аерыла.
Авыл хуҗалыгында чүп үләннәргә каршы көрәштә
башка төрле гербицидлар да кулланыла.
Промышленностьта серкә кислотасын күбесенчә ацеталь-
дегидларны (серкә альдегидын) оксидлаштырып табалар:
2СН3—
хн
+ о2
О
2СНЭ—■С
он
Бу реакция өчен кирәкле ацетальдегидның, үз чиратында,
ацетиленнан, ә ацетиленның метаннан табылуын искә алсак,
табигый чималдан серкә кислотасы табылуга китерә торган
эзлекле әверелешләр чылбырын түбәндәге схема белән күрсә¬
тергә мөмкин:
сн«
.О
СН3-С '
сн3
он
Бутанны Һава кислороды белән оксидлаштырып, серкә
кислотасы табу хәзерге вакытта аеруча перспективалы санала:
2СН3—СН,4сН3-СН3 + 50, —- 4СН,СООН + 2Н,О
Реакция вакытында хасил булган матдәләр катнашмасын¬
нан серкә кислотасы аерып алалар.
150
Пальмитин һәм стеарин кислоталары. Югары тезелешле
бер нигезле чикле карбон кислоталарының иң әһәмиятлеләре
түбәндәгеләр:
О 0
СН3—(СН2)1Ч—< СН3—(СН,)1в—с
хон 'он
Пальметве кислотасы Стеарин кислотасы
Глицеринның катлаулы эфирлары рәвешендә алар үсем¬
лек һәм хайван майлары составына керә.
Пальмитин һәм стеарин кислоталары — суда эреми торган
ак төстәге каты матдәләр. Аларның молекулаларындагы
углеводород радикаллары о-бәйләнешләр белән тоташкан
унбиш һәм унҗиде углерод атомыннан торган тармаклан¬
маган чылбырдан гыйбарәт (44 нче рәсем). Алар башка кар¬
бон кислоталарына хас булган реакцияләргә керәләр. Мәсә¬
лән, селте эремәсе белән реакциягә кереп, алар тоз хасил
итәләр:
ClsHatCOOH + NaOH — С,5Нэ,СООМа + Н,0
Бу кислоталарның натрийлы тозлары (пальмиат һәм стеа-
ратлар) суда эри. Юу үзлеге булганлыктан, алар гадәттәге
каты сабынның нигезен тәшкил итәләр.
Сабын составындагы карбон тозларыннан яңадан кислота
алырга мөмкин. Моның өчен аның судагы эремәсенә көчле
кислота белән тәэсир итәргә кирәк, мәсәлән:
С17НЗЬСОО’ + Na* + Н* + HSO; — С17НЭ5СООН + Na* + HSO4
Югары төзелешле карбон кислоталарының кальцийлы
Һәм магнийлы тозлары суда эреми. Каты суда сабынның юу
үзлеге кимү, шул тозларның утырым хасил итүләре белән
аңлатыла. Югарыда күрсәтелгән тоз формулаларына карап,
стеарин кислотасының эреми торган тозларының форму¬
лаларын языгыз.
44 нче рәсем. Пальмитин кислотасы молекуласының моделе.
151
Югары тезелешле карбон кислоталарының эри торган
тозларында юу үзлеге аеруча яхшы булганлыктан, алар төрле
сорт сабын ясау өчен кулланыла.
Олеин кислотасы —бер нигезле чиксез карбон кислота¬
ларының берсе. Углеводород радикалындагы углерод атом¬
нары арасында бер яки берничә икеле бәйләнеше булган
кислоталар да бар.
Бер икеле бәйләнеше булган чиксез кислоталарның гомо-
О
логик рәте акрил кислотасыннан СН2=СН—С башлана,
ХН
аны пропиленның алмаштырылганы дип карап була. Югары
төзелешле чиксез кислоталарның берсен — олеин кислота¬
сын СпНззСООН, яки СН3—(СН,)7—СН=СН—(СН,)7—СООН
җентекләбрәк тикшерербез. Пальмитин һәм стеарин кислота¬
лары белән беррәттән, ул глицеринның катлаулы эфиры
рәвешендә май составына керә.
Олеин кислотасы молекуласының чылбыры уртасын¬
да икеле бәйләнеш бар. Төзелешендәге мондый үзгәлек
матдәнең үзлекләрендә чагыла: стеарин кислотасыннан
аермалы буларак, олеин кислотасы — сыек матдә. Моның
сәбәбе менә нәрсәдә. Молекуланың углеводород радика¬
лында икеле бәйләнеш булу аркасында монда цис-транс-
изомериянең булуы мөмкин.
Н\ /Н
/с~с\ Н (СН2|7-СООН
СНЭ—(СН2>7 (СН2),--СООН һәм >с-с<
СН3—(СН2)7 н
ццг-Изомер транс-Изомер
Олеин кислотасы — чис-иэомер. Аның молекулала¬
рының формасы молекулалар арасында тәэсир итешү
көченең чагыштырмача зур булмавына китерә һәм матдә
сыек хәлдә була, транс Изомер молекулалары исә сузын¬
кырак формада һәм алар бер-берсенә ныграк якыная ала¬
лар, алар арасында үзара тәэсир итешү көче зуррак, шул
сәбәпле матдә каты хәлдә — монысы элаидин кислотасы.
Олеин кислотасының карбоксил группасыннан тыш тагын
бер икеле бәйләнеше булганлыктан, ул кислоталарга хас
реакцияләргә генә кермичә, бәлки чиксез кушылмаларга кас
реакцияләргә дә керә, ягъни ул ике терле химик функцияле
була (кислота һәм чиксез углеводородлар функцияләре).
152
Мәсәлән, икеле бәйләнеш янында ул бромны һәм водородны
үзенә куша ала. Водород кушылганда олеин кислотасы стеа¬
рин кислотасына әверелә:
0 0
г и + н - г м
'-'17П33 \ ' п2 ' ^17-^35—\
он он
20. Серкә кислотасының көчсез кислота булуын нинди эксперимен¬
таль дәлилләр белән исбат итәргә мөмкин?
21. Серкә кислотасын: а) кальций карбонатыннан, б) метаннан табу
реакцияләренең тигезләмәләрен төзегез.
22. Этаннан ничек итеп: а) гади эфир, б) катлаулы эфир табарга?
Реакция тигезләмәләрен языгыз.
23. Этиленны файдалану нигезендә сез ничек итеп серкә кислотасы
табар идегез? Реакция тигезләмәләрен языгыз.
24. а) Стеарин кислотасы белән селте, б) натрий пальмиаты белән
кальций гидрокарбонаты арасындагы реакцияләрнең ионлы тигезлә¬
мәләрен языгыз. Соңгы реакция нинди күренешне аңлата?
25. Сабынның каты суда юу үзлеген ничек арттырырга? Җавапны
аңлатыгыз. О
*26. Бромоводород акрил кислотасына СНз—СН—С икеле
ХОН
С-С бәйләнеше урыныннан кушылуы белән Марковников кагыйдәсенә
буйсынмый. Реакция тигезләмәсен төзегез. Аңлатма бирегез,
27. Бер нигезле чиксез кислоталар рәтендәге беренче кислота моле¬
куласында углерод атомнары санының ни өчен өчтән дә ким була
алмавын аңлатыгыз. Бу кислота, сезнеңчә, нинди реакцияләргә керә
ала? Тигезләмәләрен языгыз. .
28. Олеин кислотасы бромлы суны төссезләндерә. Бу реакциянең
тигезләмәсен языгыз.
■ Серкә кислотасы белән өйдә эшләргә мөмкин булган барлык реак¬
цияләрне (саклану чараларын күреп) ясап карагыз, мәсәлән: а) серкә
кислотасының акбурга, содага, кайбер металларга тәэсир итү-итмәвен
тикшерегез, б) үсемлек сокларының төсен үзгәртәме, в) серкәне нинди
күләмдә сыегайтканда, аның әче тәме сизелүен белегез.
§ 32. УГЛЕВОДОРОДЛАР, СПИРТЛАР, АЛЬДЕГИДЛАР
ҺӘМ КИСЛОТАЛАР АРАСЫНДАГЫ БӘЙЛӘНЕШ
Без углеводородлар белән спиртлар арасында генетик бәй¬
ләнеш булуны күреп узган идек инде. Углеводородларны
аларның водороды галоген белән алмаштырылган матдәләргә
әверелдерергә, ә инде галоген белән алмаштырылган матдә¬
ләрдән спиртлар табарга мөмкин. Кушылмаларның моннан
соң килгән классларын өйрәнгәндә, без спиртлардан альде¬
153
гидларга, ә альдегидлардан карбон кислоталарына күчәргә
мөмкин икәнен белдек. Шулай итеп, без өйрәнгән кушыл¬
маларның углеводородлардан алып кислоталарга кадәр бар¬
лык класслары үзара тыгыз генетик бәйләнештә. Аларны
органик кушылмаларның төзелеше катлаулана барган аерым
баскычлары дип карарга мөмкин.
Шул ук вакытта спиртларны, альдегидларны һәм карбон
кислоталарын углеводородларның бер-бер артлы оксидлашу
продукты итен тә карарга мөмкин. Әгәр бу кушылмаларның,
„О -О
мәсәлән, СН4, СНЭОН, Н—С' һәм Н—<ч составля¬
ли 4 он
рын үзара чагыштырып карасак, аларда кислородның масса
өлеше артуын, ягъни матдәнең һаман саен ныграк оксидлаша
баруын күрергә мөмкин.
Электрон теориясенә таянып та шул ук нәтиҗәгә ки¬
лергә мөмкин: метан молекуласы спирт молекуласына әве¬
релгәндә, углерод атомының бер валентлык электроны
кислород атомына таба авыша, альдегид молекуласы хасил
булганда кислород атомы углерод атомының ике электро¬
нын үзенә авыштыра, кырмыска кислотасы молекуласын¬
да инде оч электрон кислород атомнарына авыша, ягъни
углерод атомы ныграк оксидлаша бара. Аның моннан соң¬
гы оксидлашуы, молекуласында углерод атомының барлык
валентлык электроннары кислород атомына таба авышкан,
углерод (IV) оксиды хасил булуга китерүе аермачык.
Органик матдәләрнең төрлелеге кушылмаларның без
өйрәнгән класслары белән генә чикләнми. Кислоталар һәм
башка матдәләрнең күп төрле әверелешләре өр-яңа класс¬
ларның килеп чыгуына һәм, шулай итеп, органик кушылма¬
ларның төрлелеге артуга китерә. Күп төрле бу кушылмалар¬
ны органик матдәләр классының — углеводородларның ку¬
шылмалары дип карарга мөмкин. Углеводородлар, үз чира¬
тында, углерод белән водородтан яки неорганик матдәләрдән
табылырга мөмкин булганлыктан, табигатьтәге барлык мат¬
дәләр— неорганик һәм органик матдәләр арасында генетик
бәйләнеш, бердәмлек бар.
29. Күрсәтелгән әверелешләрне практик яктан тормышка ашы¬
рырга мемкин булган реакция тигезләмәләрен языгыз:
//Q
с - сн, — ? —- сн,он — * ? — Н С"
х он
154
30. Түбәндәге әверелешләрне уздырырга мөмкин булган реакция
тигезләмәләрен языгыз:
О О
С2Н6 -— С2Н,Вг ' ' - С,Н5ОН -°-*- СН,—С '"'-СН,-</
хн хон
31. Кислоталарны лабораторияләрдә еш кына, альдегидлар аеры¬
лып чыгу стадиясен читләтеп, спиртларны оксидлаштыру юлы белән
табалар. Тиешле спиртларны оксидлаштыру юлы белән: а) серкә кис¬
лотасын, б) пропион кислотасын табу тигезләмәләрен языгыз.
32. Сезгә билгеле булган неоргавик һәм органик кислоталарны,
төрле билгеләренә карап, классларга бүлү схемасын төзегез. Мисаллар
китерегез.
*33. Формулалары түбәндә китерелгән матдәләрдән: а) гомолог
матдәләрнең формулаларын, б) изомер матдәләрнең формулаларын
аерым язып алыгыз. Систематик номенклатура буенча матдәләргә
исемнәр бирегез:
СН,— СНг—ОН
СН3—СН2—сна—с'
ОН
сн3—сн,—cf
хн
СН, СН СН2—с,
сн, он
СН,-СН2-СН2-С^ „
Н
Z/o
СНа-С^
сн, н
О
сн,—сн—с^ .
сн, он
сн
>сн-сна-он
сн/
сн,—сн2—сн2—сн2-он
сн,он
34. СН, —- ? —•- ? —• CHjCOOH әверелешен ничек тормышка
ашырырга? Реакция тигезләмәләрен языгыз һәм аларның узу шарт¬
ларын күрсәтегез.
*35. Формулалары түбәндә китерелгән матдәләрнең кайсыларында
цис транс-изомерия булу мөмкинлеген күрсәтегез:
а) СН3—ОСН- СН3
СН3 о
б) СН, СН-СН С '
ХН
в) СН2=СН—СН20Н
г) ноос—сн-сн-соон
цис-, транс-изомерларның формулаларын языгыз.
156
36. Формулалары түбәндә китерелгән кайсы матдәләрнең моле,
кулалары арасында водородлы бәйләнешләр барлыкка килә ала:
а) С,Нб, б) С,Н,ОН. в) С,Н,„ г) HOCH?-CHrOH, д) НСООН? By бәйлә
иеш матдәләрнең үзлегендә ничек чагыла?
*37. Түбәндә китерелгән матдәләрнең кайсылары; а) натрий белән,
б) натрий гидроксиды белән реакциягә керә? Реакция тигезләмәләрен
языгыз.
О
CH,-CH-C'Z
ц
сн, ”
СНэ-СН,—сн,—с
СН,—СН-СН,-сн,-он
сн,
.0
СН,-СН—сн,-с^
он н
*38. Гептаннан бензоВ кислотасы С«Н,—СООН табу эчен нинди
реакцияләр үткәрергә кирәк? Реакция тигезләмәләрен языгыз һәм
аларны үткәрү шартларын күрсәтегез.
8. КАТЛАУЛЫ ЭФИРЛАР. МАЙЛАР
Кислоталарны өйрәнгәндә безгә алардав табылган матдә¬
ләр—катлаулы эфирлар белән күп тапкырлар очрашырга
туры килде. Хәзер инде матдәләрнең бу классын җентек¬
ләбрәк өйрәник һәм шул класска керә торган биологик әһә¬
миятле матдәләр — майлар химиясе белән якыннан таны¬
шыйк.
§ ЭЗ. КАТЛАУЛЫ ЭФИРЛАР
Катлаулы эфирларны табу һәм аларның төзелеше. Без
катлаулы эфирларның кислоталар белән спиртлар тәэсир
итешкәндә барлыкка килүен беләбез инде. Катлаулы эфирлар
табуны түбәндәге гомуми тигезләмә белән күрсәтергә мөмкин:
ЛО ,О
R-СГ _ j + Н O-R, - R-C + Н2О
' OH ХО-R,
Кислот» Спирт Катлаулы эфир
• Кислоталар белән спиртлар арасында катлаулы эфирлар
ясалу белән бара торган реакция этерификация реакциясе
дип атала (латича aether—эфир). Бу реакция күбесенчә көчле
минераль кислоталар катнашында уза, чөнки водород ион¬
нары катализатор рәвешендә тәэсир итәләр.
Катлаулы эфирларның исемнәре тиңдәш кислота һәм
Z
спирт исемнәреннән ясала, мәсәлән: СН3—С. серкә
о °-сна
. „ - S
кислотасының метил эфиры, Н—С. кырмыска кис-
р Р TI
лотасының этил эфиры һ. б. '2“5
Кислоталардагы функциональ группаның водород атомы
спиртлардагыга караганда хәрәкәтчәнрәк булганлыктан, эте¬
рификация реакциясе вакытында водород атомы кислота
молекуласыннан, ә гидроксил группа спирт молекуласыннан
аерылырга тиеш һәм югарыда күрсәтелгән схема ялгыш дип
157
фикер йөртергә мөмкин. Реакциянең чынлыкта ничегрәк
баруы тамгалы атомнар ярдәмендә ачыкланган.
Карбон кислотасына составында гадәттәге кислород уры¬
нына массасы 18 гә тигез кислородның авыр изотобы булган
спирт белән тәэсир итәләр:
//* ..
R—С + Н-,вО—СН3 — R—+ Н-О-Н
хо-н \(во-сн,
Реакция узганнан соң, кислородның авыр изотобы кат¬
лаулы эфир составына кергәнлеге билгеле була. Димәк, эте¬
рификация реакциясе вакытында спирт молекуласыннан
гидроксил группасы түгел, бәлки водород атомы гына аерыла,
ә гидроксил группасы кислота молекуласыннан аерыла.
Физик үзлекләре һәм табигатьтә очравы. Бер нигезле
карбон кислоталарының катлаулы эфирлары — тәмле җиләк
исе килә торган сыеклыклар. Мәсәлән, кырмыска кислота¬
сының этил эфирыннан ром исе килә, ә май кислотасының
бутил эфиры ананас исен хәтерләтә һ. б.
Чәчәкләр һәм җиләк-җимешләрдән хуш ис килү, гадәттә,
аларда теге яисә бу катлаулы эфир булудан килә. Эфир¬
ларның бу үзлеге практикада да файдаланыла.
Синтетик катлаулы эфирларны «җиләк-җимеш эссенция¬
се» рәвешендә башка тәмле исле матдәләр белән беррәттән
җиләк-җимеш сулары, конфетлар, ислемай һәм одеколоннар
ясаганда кулланалар. Кайбер катлаулы эфирлар (мәсәлән,
серкә кислотасының этил эфиры) эреткеч булып хезмәт итә.
Химик үзлекләре. Катлаулы эфирларның су белән реак¬
циягә керүе аларның әһәмиятле үзлекләреннән санала. Әгәр
берәр эфирны, мәсәлән, серкә кислотасының этил эфирын,
неорганик кислота катнашында су белән җылытсаң, серкә
кислотасы һәм этил спирты хасил була:
сн3—cf + Н,О CH3-Cf + С,Н5ОН
О-С2Н4 4 он
Мондый реакция гидролиз дип атала. Ул — катлаулы эфир
хасил булу реакциясенә капма-каршы реакция. Шуңа күрә
спирт белән карбон кислотасы катнашмасын җылытканда
этерификация реакциясе генә түгел, бәлки хасил була торган
эфирның гидролиз реакциясе дә бара. Димәк, этерификация
реакциясе кайтма реакция дигән сүз. Этерификация вакы¬
тында кире процессның тизлеге катнашмада эфир һәм су
158
микъдары арткан саен арта бара. Ниһаять, этерификация
һәм гидролиз реакцияләренең тизлеге тигезләнү моменты
килеп житә. Шулай итеп, химик тигезләнеш урнаша, һәм
катнашмадагы эфир микъдары артмый башлый.
Гомуми рәвештә тигезләмә түбәндәгечә булыр:
Л
R-C + HO -R, Xi R-C ' + Н,0
OH Х O-R,
Бу реакциянең тигезләнешен катлаулы эфир ясалу ягына
таба авыштыру ечен, хасил була торган матдәләрнең бер-
берсе белән реакциягә керүләренә комачауларга, мәсәлән,
эфирны реакциягә керә торган матдәләр катнашмасыннан
аерып алырга яки хасил була торган суны үзенә су сеңдерә
торган матдәләр белән бәйләргә мөмкин.
Әгәр, киресенчә, эфирны гидролизларга, ягъни аны су яр¬
дәмендә кислота һәм спиртка таркатырга кирәк булса, реак¬
цияне селте катнашында үткәрәләр. Ул — кислотаны тозга
әверелдерә һәм, шулай итеп, аңа спирт белән реакциягә ке¬
рергә мөмкинлек бирми. Ә аннан соң тоздан кирәкле кисло¬
таны табуы бик җиңел.
1. а) Серкә кислотасы белән 3-метил бутанол-1, 6) май кислотасы
белән проаанол-1 арасында барган этерификация реакцияләренең
тигезләмәләрен тезегез. Барлыкка килгән эфирларның үзлекләре
турында нәрсәләр әйтергә мөмкин? q
2. Түбәндәге эфирларның исемнәрен әйтегез: a) CjHi—С.' ,
ХОС|Н5
б) НСООСэН,
3. а) Метаннан — кырмыска кислотасының метил эфирын, б) эти¬
леннан серкә кислотасының этил эфирын табу реакцияләренең ти¬
гезләмәләрен языгыз.
СИ, о
*4. Төзелеше СН,-С—С' булган метилакрил (метакрил) кисло-
ОН
тасының метил эфиры органик пыяла дип йөртелгән полимер җитеш¬
терүгә тотыла. Бу эфирны метакрил кислотасы белән метил спиртын¬
нан табу реакциясенең тигезләмәсен языгыз.
5. Беэ спиртлар белән гади эфирлар арасында изомерия күренешен
очраткан идек инде. Шуның кебек үк, бер нигезле карбон кислоталары
белән катлаулы эфирлар арасында да (молекулада углерод атомнары
бер үк санда булганда) изомерия бар. CjHtA формуласына туры килә
торган барлык изомер кислоталарның һәм катлаулы эфирларның
формулаларын төзегез.
159
6. Парларының тыгызлыгы водород буенча 30 га тигез ике изомер
матдә бирелгән. Аларның берсеннән гидролиз вакытында кислородлы
ике төрле матдә барлыкка килә, ә икенчесе спиртлар белән этери¬
фикация реакциясенә бик җиңел керә. Бу матдәләрнең структур
формулаларын һәм биредә әйтелгән реакция тигезләмәләрен языгыз.
7. Молекуляр формуласы С3Н6О2 булган төссез сыеклык бирелгән.
Бу матдә металлик натрий белән реакциягә керми, ләкин натрий
гидроксиды эремәсе белән җылытканда тоз — натрий ацетаты хасил
була. Бу матдә кушылмаларның кайсы классына керә? Анын структур
формуласын һәм натрий ацетатын табу реакциясенең тигезләмәсен
языгыз.
§ 34. МАЙЛАР
Табигатьтә мийлар, Аларның физик үзлекләре. Майлар
табигатьтә бик күп таралган. Углеводлар һәм аксымнар
белән беррәттән, алар үсемлек һәм хайван организмнары
составына керә һәм азыгыбызның тел өлешләреннән берсен
тәшкил итә.
Хайван майлары, кагыйдә буларак, каты матдәләр. Үсем¬
лек майлары күбесенчә сыек була.
Ләкин хайван майларының сыек (мәсәлән, балык мае),
ә үсемлек майларының каты (мәсәлән, кокос мае) булуы да
билгеле.
Барлык майлар да судан җиңел. Алар суда эреми, ләкин
күп кенә органик эреткечләрдә (дихлорэтанда, бензинда һ. б.)
яхшы эри.
Майларның тезелеше. Майларның тезелеше француз хи¬
миклары М. Шеврель һәм М. Бертло хезмәтләре ярдәмендә
билгеле була. XIX гасыр башларында ук инде М. Шеврель
майларны (селте катнашында) су белән җылытканда, майлар¬
ның. суны үзләренә кушып, глицеринга һәм карбон кислота¬
ларына — стеарин, олеин кислоталарына һ. б. таркалуын
билгели. М. Бертло (1854 ел) моңа капма-каршы реакцияне
эшләп карый. Ул, глицерин белән кислоталар катнашмасын
җылытып, майларга охшашлы матдәләр таба. М. Шеврель-
ның катлаулы эфирны гидролизлау реакциясен, ә М. Бертло-
ның этерификация реакциясен, ягъни катлаулы эфирны
синтезлау реакциясен үткәргәнлеге ачык күренә. Бу мәгълү¬
матлар нигезендә майларның төзелеше турында бик җиңел
нәтиҗә ясарга мөмкин.
Майлар — вч атомлы спиртлар — глицеринның һәм кар¬
бон кислоталарының катлаулы эфирлары.
160
Мондый эфирлар күбесенчә ниндидер бер төр кислота
белән генә түгел, бәлки төрле кислоталар белән барлыкка
кнләләр, аны түбәндәге тигезләмә белән күрсәтергә мөмкин:
О
г” — "
CH2-OiH HO — С—Ri
I • 'О
I I II
CH- OlH + HO- C Ku -¬
I * 1 о
I I II
CH2—ОIH HO I —C—R„)
о
II
CH2 О C—R,
сн—О—C—R„ + 3H,0
o
II
СНг—О—C—Rnl
Күп кенә очракларда майлар югары төзелешле чикле
һәм чиксез карбон кислоталарыннан, нигездә пальмитин
СИНЯ1—СООН, стеарин С1ТНЯ5—СООН, олеин С17НМ-СООН.
линоль С;7Н3,—СООН һәм башка кислоталардан барлыкка
килә. Түбән төзелешле кислоталар май хасил итүдә бик аз
катнашалар. Мәсәлән, май кислотасы СЭН7—СООН (ак май¬
да), капрон кислотасы С5НИ—СООН һ. б. очрый.
Күбесенчә чикле кислоталардан барлыкка килгән майлар
каты була (сыер мае, сарык мае), Майда чиксез кислоталар
микъдары арту белән, майларның эрү температурасы түбәнәя,
алар җиңел эрүчәнгә әйләнәләр (дуңгыз мае, ак май). Сыек
майлар нигездә чиксез кислоталардан хасил булганнар (җи¬
тен, көнбагыш мае һ. б. майлар).
Химик үзлекләре. Майларның химик үзлекләре аларның
катлаулы эфирлар классына керүләре белән билгеләнә. Шуңа
күрә гидролиз алар өчен иң характерлы реакция санала.
Марселев Пьер Эжен Бертло
‘(1827—1907)
Франциянең органик химия алкасецдаге
күренекле галиме. Синтезлау юлы белая бик
күп санда органик кушылмалар таба, алар
арасында метан (сероводородның углерод
сульфиды белая реакциясеннан), ацетилен
(углеродны турыдан-туры водород белая ку¬
шып), бензол (ацетиленнан), этил спирты
(этилеинав), кырмыска кислотасы (кислота
ның тозы, калий гидроксиды белая угле¬
род (П) оксидын реякцияга кертеп), майлар
(глицеринны тиешле кислота белая җылы¬
тып) һ. б. бар. Ул ацетиленга водород кушу
юлы белая этилен, ә аннары этян таба. Термо
химия, агрохимия һәм химия тарихы буенча
күп хеаматлар яза.
6 Б-177
161
Майларның гидролиз реакциясе, башка катлаулы эфир¬
ларныкы кебек үк, кайтма реакция. Моны гадиләштерелгән
тигезләмә белән күрсәтик:
I О
. Н
СН,-О-, С R
• О
. и
I
но, н
I
СН -Оч-С—R + HO-t-H
:? :
CHj—OJ-C—R HO'-H
сн,—он
I z
CH -ОН + 3R-C
хон
сн,—он
Тигезләнешнең глицерин һәм карбон кислотасы ясалу
ягына авышуына, сезнеңчә, нинди шартлар булышлык итә?
Азык матдәләре буларак майлар. Майлар азыкның әһә¬
миятле состав өлеше булып санала. Организмда майлар ок¬
сидлашканда, шундый ук микъдарда аксым һәм углеводлар
оксидлашкандагыга караганда, ике тапкыр артыграк җылы¬
лык аерылып чыга.
Суда эремәү сәбәпле, майлар ашкайнату органнарыннан
турыдян-туры организмга сеңә алмый. Ашказаны асты бизе
һәм эчәк сыекчасы ферменты тәэсирендә алар нечкә эчәк¬
ләрдә глицеринга Һәм карбон кислоталарына таркала. Гидро
лиэ продуктлары эчәклекнең төксыман үсентеләре аша сеңеп
яңадан майга, ләкин шушы организмга хас майга әвереләләр.
Синтезланган май, лимфа системасы аша канга үтеп кереп,
май тукымасына күчерелә. Ә ул моннан организмның башка
органнарына, тукымаларына керә һәм организмда даими
булып торган матдәләр алмашы процессында күзәнәкләрдә
яңадан гидролизлата. Ә аннары әкренләп оксидлашуга дучар
була. Ахыр чиктә май углерод (IV) оксиды Һәм су барлыкка
килгәнгә кадәр оксидлаша. Организмга тереклек итү өчен
кирәкле энергияне шушы экэотермик реакцияләр биреп тора.
Сарыф ителгән май организмның туклануы процессында
тулылана.
Техникада майларның гидролизы. Техникада гидролиз
реакциясе майлардан глицерин, карбон кислоталары һәм
сабын табу өчен кулланыла.
Глицерин һәм кислоталар табу өчен, майны су белән бергә
автоклавларда җылыталар.
Сабын табу өчен кислоталарны натрий карбонаты эремәсе
белән җылыталар (бу реакциянең тигезләмәсен төзегез).
Сабынны аерып алу өчен, эремәгә тоз (натрий хлориды) сала¬
лар; шуннан сабын каты катлау — ядрә булып өскә җыела.
162
Шушы массадан ядре сабын — кер сабынының гадәттәге
сортларын әзерлиләр.
Исле сабын ясау очен, ядрә сабынны киптерәләр дә аңа
буягыч, хуш исле матдәләр кушалар һәм пластик эшкәрт¬
кәннән соң, кирәкле форма биреп штамплыйлар. Исле
сабынны турыдан-туры кислоталардан табу ысуллары да
бар.
Майлармы гидрнрляу. Сабын һәм башка матдәләр табу
өчен, нигездә каты майлар кирәк. Ләкин каты майлар кыйм¬
мәтле азык продуктлары булып исәпләнә. Шуңа күрә күптән
үк инде, арзанлы үсемлек майларын каты майларга әверел¬
дереп, бу майларны кирәгенчә техник эшкәртү фикере туа.
Сыек майлар каты майлардан составларының чиксез,
ягъни углеводород радикалларында икеле бәйләнешләр булуы
белән генә аерылуын искә төшерик. Димәк, чиксез сыек
кислоталарны яларга водород кушу юлы белән каты кисло¬
таларга әверелдергән шикелле, сыек майларны да шул ук юл
белән каты майларга әверелдерергә момкин.
Бу ысулның асылы шунда — бик нык вакланган ката
лиэатор (никель яки бакыр-никель) катнаштырылган майны
җылытын, шул катнашма аша берничә атмосфера басым
астында водород уздыралар (II төсле таблицаны кара). Шул
вакытта водород углеводород радикалларындагы икеле бәйлә
иеш урыннарында кушыла. Һәм май каты майга әверелә,
мәсәлән:
СН2 О CO—(СН2)2—СН=СН—<СН2)7—СН,
СН- О CO (СН,Һ—СН-СН—(СН,Һ сн, + зн2 —*
СН2-О СО-(СН2)7-СН=СН—(СН,),-СН2
СН2—О-СО—(СН,),,—сн,
СН О СО-(СН^ сн,
СН2-О—СО-ССН^-СН,
Гидрирлау процессы промышленностьта үзара бер-бер
артлы тоташтырылган автоклавларда өзлексез метод белән
уздырыла. Автоклавлар системасы аша узганда, май Һаман
ныграк гидрирлаша бара; нәтиҗәдә ул тыгызлыгы һәм каты¬
лыгы белән туң майны хәтерләтә торган массага әверелә. Шу-
11
163
ңа күрә гидрирлашкан майны (русча «сало» сүзеннән) сало¬
мас дип тә йөртәләр. Саломасны катализатордан фильтрлап
аерып алалар.
Гидрирлашкан май сабын ясау өчен тулы кыйммәтле
продукт булып санала» майның билгеле бер сортларын кул¬
ланганда, аны азык итеп тә, мәсәлән, маргарин составында
файдаланырга мөмкин.
Синтетик юучы матдәләр. Сабын ясау өчен бик күп май
таләп ителә. Ә май — аеруча кыйммәтле азык продукты. Май¬
ларны азык итеп кенә файдалану өчен, сабынны азык итеп
кулланылмый торган башка чималдан кайнатырга кирәк.
Мондый мөмкинлекне безгә органик химия бирә.
Сабын составына карбон кислоталарының тозлары
керүен искә төшерик. Мондый кислоталарны хәзер про¬
мышленностьта парафин составына керә торган углеводо¬
родларны оксидлаштыру юлы белән табалар. Процесс ко¬
лонналы аппаратларда алып барыла. Углеводородларның
эретелгән катнашмасына катализатор буларак марганец
кушылмалары өстәп, шул катнашма аша 120 °C чамасы
температурада һава уздыралар (45 нче рәсем). Бу вакыт
крекинг процессындагы кебек углеводород молекулалары
45 нче рәсем. Парафинны оксидлаштыру юлы белән промышленностьта
карбон кислотасы табу схемасы;
1 — оксидлаштыру колоннасы; 2 — борма көпшәләр;
3 — юдыру колоннасы; 4 — сепаратор; S — тондыргыч
164
чылбыры өзелә Һәм барлыкка килгән очлардагы группа¬
лар карбоксил группаларына оксидлаша, мәсәлән:
2СН3-(СНг)и-СН,-^СНг—(СНг)и-€Н3 + 50, —
—> 4СН,—(СНг)и-С'' + 2НгО
ОН
Нәтиҗәдә төрле кислота һәм кислоталы башка орга¬
ник кушылмалар катнашмасы хасил була. Аны аералар.
Тозлар кислоталарны нейтральләштерү юлы белән табыла.
Мондый тозлар (тутырмалар белән катнаштырганнан соң)
исле сабын һәм кер сабыны ясау очен тотыла.
Синтетик кислоталардан табыла торган сабыннарның
химик табигате гадәттәге сабын шикелле үк, аларга шул ук
кимчелекләр хас. Мәсәлән, алар каты суда начар күбекләнә.
Шуңа күрә хәзер башка төрле юучы матдәләр эшләнә.
Синтетик юучы матдәләрнең бер төре югары төзелешле
спиртлар белән сульфат кислотасы кушылудан барлыкка
килгән катлаулы әче эфирлар тозыннан гыйбарәт. Аны
табу схемасын гомуми рәвештә түбәндәгечә күз алдына
китерергә мөмкин;
R—СН,— ОН + №О SO, ОН — R—СН,—O—SO,—ОН + Н,О
Синрт һам сульфб? кисдотАсыйшч
кдглдулы ач» эфиры
R—СН,-О SO,-ОН + NnOH —- R—СН,—О SO,—ON»+H,O
Кйтллулы лфмрһЫҢ
ндчрмЯ тозы
Мондый тозларның төзелеше гадәттәге сабынны тәш¬
кил итә торган тозларга охшаган; алар шулай ук суда
эреми торган озын углеводород чылбырыннан һәм атом¬
нарның эри торган функциональ группасыннан тора. Шу¬
ңа күрә алар, сабын кебек үк, актив өслекле матдәләр һәм
аларның юу сыйфатлары яхшы була. Гадәттәге сабыннан
аермалы буларак, мондый матдәләр каты суда да юу үз¬
лекләрен югалтмыйлар, чөнки бу вакытта барлыкка кил¬
гән кальций һәм магний тозлары эри, нәтиҗәдә актив
өслекле матдә төпкә утырмый, суда кала.
Синтетик юучы матдәләр һәркемгә билгеле күптөрле кер
юу порошоклары составына керә.
1«5
Синтетик порошоклар җитештерү — органик химия про¬
мышленностеның неруча тиз үсә торган юнәлешләреннән
берсе.
Файдалану процессында юучы матдәләр таркалмыйлар;
юынтык сулар белән сулыкларга эләгеп, алар әйләнә-тирә
мохитне пычратырга мөмкин. Шуңа күрә яңа препаратлар
эшләгәндә, аларга яхшы юу сыйфатлары биреп кенә кал¬
мыйлар, бәлки бу матдәләрнең бнотаркалуын да, ягъни кай¬
бер микроорганизмнарның тереклеге нәтиҗәсендә табигатьтә
зарарлы матдәләрнең юкка чыгарылуын тәэмин итәләр. Без¬
нең илдә чыгарыла торган синтетик юучы матдәләргә куела
торган мәҗбүри таләп — аларның табигать шартларында
биологик таркалуы.
8. Майларның төзелешен ничек белгәннәр? М Шеврель һәм
М. Бертло ясап караган реакцияләрнең тигезләмәләрен языгыз.
9. Каты һәм сыек майлар төзелеше арасында нинди аерма бар?
*10. Глицеринга май, олеин һәм стеарин кислоталары белән тәэсир
иткәндә табыла торган катлаулы эфирның структур формуласын язы¬
гыз.
*11. Олеин кислотасының цис төзелешле булуын белүегездән чы¬
гыл, бу кислотадан ясалган майларның ни өчен сыек булуын аңла¬
тыгыз.
12. Нефтьне куганда табыла торган майлагыч матдәне җитен маен¬
нан ничек итеп химик юл белән аерырга?
13. Триаконтан оксидлашканда, молекуласында унбиш угле¬
род атомы булган бер нигезле чикле кислота барлыкка килүен исәпкә
алып, оксидлашу реакциясенең тигезләмәсен языгыз.
14. Каты суда кер юганда шактый күп сабын тотыла. Моны ничек
аңлатырга?
15. Югарыда өйрәнелгән төрдәге синтетик юучы матдәләрне каты
суда эреткәндә, алар ни өчен йомшак судагы шикелле үк яхшы күбек
ләна?
*16. Парафинны оксидлаштырып карбон кислоталары табуның
технологик процессын 45 нче рәсем буенча аңлатып бирегез.
SI Өйдә түбәндәге тәҗрибәләрне ясап карагыз: а) киемдәге май тап¬
ларын беязин белән бетерегез; б) каты суда гадәти сабың һәм синтетик
порошокның күбекләнүен чагыштырып карагыз; в) кер содасы салып
яки кайнатып, суны йомшартыгыз һәм тәҗрибә нәтиҗәләрен чагыш
тырыц карагыз.
9. УГЛЕВОДЛАР
Табигатьтә углеводородлар гаять күп, һәм ялар кеше тор¬
мышында аеруча әһәмиятле роль уйныйлар. Аларның бер
төрлеләре, мәсәлән, крахмал, төп азык матдәләреннән санала;
икенчеләре (целлюлоза, яки клетчатка) тукыма, кәгазь, ясал¬
ма сүс һәм башкалар җитештерү очен китә.
«Углевод» дигән исем бу класстагы кушылмаларның иң
беренче өйрәнелгән вәкилләре углерод һәм судан торган
кебек күренүдән килеп чыккан, чөнки аларның составы
гомуми СЯ(Н2О)Ж формуласы белән күрсәтелгән. Хәер, соңга
табарак бу формулага туры килмәгән, ләкин башка билгеләре
буенча шушы класс матдәләренә керә торган углеводлар да
табыла.
Углеводларның иң гадиләреннән берсе булып глюкоза
исәпләнә.
С 35. ГЛЮКОЗА
Физик үзлекләре һәм табигатьтә очравы. Глюкоза — суда
яхшы эри торган, тәме татлы (латинча «глюкос» —баллы),
төссез кристаллик матдә. Үсемлекләрнең барлык органна¬
рында диярлек: җимешләрендә, тамыр, яфрак һәм чәчәклә¬
рендә глюкоза бар. Виноград суында һәм өлгергән җнләк-
җимешләрдә ул бигрәк тә күп була. Глюкоза хайваннар һәм
кеше организмында да бар. Кеше канында глюкоза микъдары
0,1% чамасы.
Глюкозаның төзелеше. Глюкозаның составы СвН12Ов фор¬
муласы белән күрсәтелә. Бу углеводның төзелешен ачыклап
карыйк.
Глюкоза составында кислород булу сәбәпле, анда безгә
инде билгеле атомнарның функциональ группалары юкмы
икән дигән сорау туа.
Глюкоза молекуласында кислород атомнарының чагыш¬
тырмача күп булуыннан чыгып, без аның күп атомлы спирт¬
ларга карарга тиешлеген чамалый алабыз. Әгәр яңа гына
тондырылган бакыр (II) гидроксидына глюкоза эремәсе сал-
167
сак, глицерин белән ясалган тәҗрибәдәге шикелле үк, ачык
зәңгәр төстәге эремә хасил була. Шулай итеп, тәҗрибә глюко¬
заның күп атомлы спирт икәнлеген күрсәтә.
Ләкин тагын бер сорау туа: глюкоза молекуласында ничә
гидроксил группасы бар соң?
Глюкозаның бер катлаулы эфиры молекуласында биш
серкә кислотасы калдыгы барлыгы билгеле. Моннан глюкоза
молекуласында биш гидроксил группасы бар дигән нәтиҗә
чыга. Глюкозаның суда яхшы эрүе һәм татлы тәме шушы
факт белән аңлатыла.
Молекуладагы тагын бер кислород атомының характерын
гына ачыклыйсы кала. Әгәр глюкоза эремәсен көмеш (I)
оксидының аммиактагы эремәсе белән җылытсак, безгә бил¬
геле «көмеш көзге» ясала. Димәк, глюкоза молекуласындагы
алтынчы кислород атомы альдегид группасы составына керә.
Глюкозаның ничек төзелгән булуын тулысынча күз алды¬
на китерү өчен, молекула скелетының төзелешен белергә
кирәк. Кислород атомнарының алтысы да функциональ груп¬
палар составына кергәнлектән, скелетны тәшкил итүче угле¬
род атомнары бер-берсенә турыдан-туры тоташкан булырга
тиешләр дигән нәтиҗә ясый алабыз. Углерод атомнарының
чылбыры туры, тармакланмаган икәне билгеле. Ниһаять,
шуны искә алыйк: альдегид группасы углерод чылбырының
очында гына була ала (ни өчен?), һәм гидроксил группалары
төрле углерод атомнарында урнашсалар гына тотрыклы була
алалар.
Шушы мәгълүматлар нигезендә глюкозаның химик төзе¬
лешен түбәндәге формула белән күрсәтергә мөмкин:
е°
СН,—СН—СН—СН—СН—С/
I I 1 I I \н
он он он он он н
Димәк, глюкоза — берьюлы ике төрле матдә: альдегид һәм
күп атомлы спирт, ягъни ул — алъдегидоспирт.
Ләкин монда каршылык килеп чыга. Глюкоза молеку¬
ласында —С. атомнары группасы бар икән, аның аль-
Н
дегидларга хас башка реакцияләргә дә керүе, мәсәлән,
фуксинсульфит кислотасы белән тәэсир итешүе күзәтелер¬
гә тиеш. Ләкин бу матдәләрнең эремәләрен катнаштыр¬
ганда реакция барышын күрсәтүче кызгылт миләүшә төс
168
барлыкка килми. Моның сәбәбе глюкоза тезелешенең
үзенә генә хас ниндидер үзенчәлекләре булуында, күрәсең.
Галимнәрнең тикшеренүләренә караганда, глюкоза эре¬
мәсендә ачык чылбырлы молекулалар гына түгел, бәлки
альдегид группасы кермәгән циклик чылбырлар да бар.
Фуксинсульфит кислотасы эремәсенең төсе үзгәрсен очен,
альдегид группасы кергән төзелешле молекулалар булу
гына җитми икән.
Глюкозаның циклик төзелешле молекулалары нин¬
дирәк соң?
Чылбыр төзелешле молекулаларның атомнары ординар
бәйләнешләр тирәсендә ирекле әйләнә алулары сәбәпле,
аларның күләмле төрле формаларга керә алуларын искә
төшерик (28 нче бит). Мондый очракта альдегид группасы
(тетраэдр почмакларын үзгәртмичә генә) бишенче углерод
атомына якын килергә Һәм глюкоза молекуласы башка
форманы алырга мөмкин. Бу вакытта глюкоза гидроксил
группасы белән, суның альдегидларга кушылуы (138 нче
бит) шикелле үк, тәэсир итешәчәк: гидроксил группасының
тискәре корылмалы кислород атомы карбонил группаның
уңай корылмалы углерод атомы белән бәйләнешкә керер,
ә гидроксилдагы водород атомы, карбонил группасының
тискәре корылмалы кислород атомы янына күчеп, яңа гид
рокснл группасы хасил итәр. Бу хәл молекуланың кислород
атомы аша алты буынлы боҗра тәшкил итеп йомылуына
китерә; мондый молекулада альдегид группасы булмый:
.CH/JH
“?\?н үл1
но у Ун
Н ОН
Альдегид формасының циклик формага әверелүе —
кайтма процесс. Эремәдә алар арасында хәрәкәтчән ти¬
гезләнеш урнаша. Бу тигезләнеш циклик форма ясалуга
таба авышкан булу сәбәпле, глюкозаның фуксинсульфит
кислотасы белән реакциясе ачык күренсен өчен, альдегид
группалы молекулалар саны җитеп бетми.
Матдәләрнең циклик төзелешен еш кына, югарыда ки¬
терелгән шикелле, формулалар белән сурәтлиләр. Аларны
перспектив формулалар дип йөртәләр. Мондый формула¬
1«<>
лар белән эш иткәндә, без молекулага алдан да, өстән дә
карагандай, аны перспективада күргәндәй булабыз. Пер¬
спектив формулалар, молекулаларда атомнарның бәйлә¬
неш эзлеклелеген күрсәтүче химик төзелешен генә түгел,
бәлки атомнарның молекулада пространстволы урнашуын
да күз алдына китерергә мөмкинлек бирәләр. Формулага
карап, мәсәлән, гидроксил группалар молекулада боҗра
яссылыгының кайсы ягында (өстәме яки аскы ягындамы)
урнашкан булуы турында фикер йөртергә мөмкин.
Глюкоза молекулаларының башка төрле циклик фор¬
масы да булырга мөмкин. С2—бәйләнеше тирәсендә
альдегид группасының ирекле әйләнүе нәтиҗәсендә цикл
йомылганда барлыкка килгән гидроксил группасы боҗра
яссылыгы өстендәге яки яссылык астындагы беренче угле¬
род атомы янында булырга мөмкин. Нәтиҗәдә ике төрле
циклик форма барлыкка килә:
« в
СН2ОН СН.,ОН
М о SI„
О
3 2
Н он н он
Глюкозаның о форымы Глюкозан и ц [i формасы
Гидроксил группасы боҗраның икенче углерод атомы
янындагы гидроксил группасы урнашкан ягында барлык¬
ка килсә, мондый циклик форма ct-форма дип атала. Әгәр
гидроксил группа икенче атом янындагы гидроксил груп¬
пасы белән икесе ике якта булса, монысы глюкозаның
$ формасы була.
Югарыда альдегид формалы молекулалардан глюко¬
заның p-формалы молекулалары ясалуы тикшерелгән иде.
Кристаллик глюкоза «формалы циклик молекулалар¬
дан тора. Суда эрегәндә Р-формалы молекулалар да хасил
була. Бу әверелеш альдегид формалы арадаш молекулалар
ясалу белән була:
Глюкозаның р альдегид а глюкозаның
a-формасы ’ формасы р-формасы
Эремәдә Р-форманың өстенлеге белән (һәм, әйтелеп үт¬
кәнчә, чагыштырмача аз гына альдегид формалы молеку¬
лалар катнашында) өч төрле форманың хәрәкәтчән тигез¬
ләнеше урнаша.
170
Химик үзлекләре. Глюкозаның альдегид формасының хи¬
мик үзлекләрен тикшереп карарбыз. Аның тезелешеннән
чыгып, без глюкозаны ике төрле химик функцияле матдә дип
әйтә алабыз.
Күп атомлы спирт буларак, глюкоза катлаулы эфирлар
барлыкка китерә.
Альдегид буларак, ул оксидлаша ала. Комеш (I) оксиды¬
ның аммиактагы эремәсенең глюкозага оксидлаштыручы
буларак тәэсир итүе белән танышып узган идек инде. Хәзер
бу реакциянең тигезләмәсен төзи алабыз1:
сн,он— снон снон—СНОНСНОН—С z + —*
н
■О
— СН7ОН СНОН—СНОН—СНОНСНОН-С + 2А«
4 он
Глпжон кмлотйсы (санрт квслота)
Глюкозаның альдегид группасын бакыр (II) гидроксиды да
оксидлаштыра ала. Яңа гыня тондырылган бакыр (II) гидрок¬
сиды эремәсен аз гына алып, аңа глюкоза эремәсе салсак, бу
катнашманы җылытканда, кызыл төстәге бакыр (I) оксиды
хасил булыр. Глюкозаның бакыр (II) гңдроксидыннан оксид¬
лашу реакциясе альдегидлар өчен карап үтелгән реакция
кебек үк булачак.
Глюкозаның альдегид группасы кайтарыла ала. Бу вакыт¬
та алты атомлы спирт хасил була:
сн2он— снон—снон—снон—снон—СН2ОН
Глюкозаның органик катализаторлар — микроорганизм¬
нар тарафыннан эшләп чыгарыла торган ферментлар тәэси¬
рендә әчешүе аның әһәмиятле химик үзлекләреннән санала.
Әчешүнең берничә торе билгеле. Спиртлы эчешү чүпрә
ферменты тәэсиреңдә бара. Бу процессның катлаулы химиясе
суммар рәвештә түбәндәге тигезләмә белән күрсәтелә:
С,Н„Ов —* 2C,HSOH + 2СО2
Сөт кислотасы бактерияләренең ферментлары тәэсирендә
глюкозаның сөт кислоталы эчешүе була:
С.Н12О. — 2СН, —СН— СООН
ОН
С®1 кмслотмы
1 Бу реакция вакытында башка тарле оксидлашу продуктлары да
ясала.
171
Хасил булган сат кислотасы — ике төрле химик функция¬
ле кушылма, айда спирт һәм карбон кислотасы үзлекләре бар.
Сөт кислотасы сөт әчегән чакта барлыкка килә. Сөттә
кислота барлыкка килүне лакмус ярдәмендә белергә мөмкин.
Авыл хуҗалыгы продуктларын эшкәртүдә сөт-кислоталы
әчешү процессының әһәмияте аеруча зур. Сөттән күп кенә
продуктлар — оеган сөт, эремчек, каймак, сыр, катык хәзерләү
шул процесска нигезләнгән. Сөт кислотасы кәбестә тозла¬
ганда, силосланган терлек азыкларында әчешү процессында
барлыкка килә. Һәм бу вакытта ул консервлаучы матдә хез¬
мәтен үти. Ул, тыгызланган силос массасында барлыкка ки¬
леп, әче тирәлек хасил итә, ә мондый тирәлектә аксым черү
һәм башка зарарлы химик әверелешләр була алмый; бу исә
терлекләргә яхшы сыйфатлы һәм туклыклы, тәмле азык бул¬
дыруга ярдәм итә.
Глюкозаны куллану. Глюкоза — кыйммәтле азык матдәсе.
Биологиядән билгеле булганча, азыктагы крахмал ашкайнату
трактында глюкозага әверелә һәм кан белән организмның
барлык тукымаларына тарала. Күзәнәкләрдә глюкоза оксид¬
лаша. Бу процесс бер бер артлы уза торган бик күп стадия¬
ләрдән тора һәм энергия аерылып чыгу белән бара. Глюкоза
оксидлашудан барлыкка килгән ахыр чик продуктлар —
углерод (IV) оксиды һәм су;
С«Н12О. + 60, — 6СО, + 6Н20
Оксидлашу реакциясе баскычлы рәвештә барганлыктан,
оксидлашучы матдәләрдә тупланган энергия дә аз-азлап чыга.
Бу энергия исәбенә организм үзенең күп санлы функция¬
ләрен башкара (мускулларның кыскаруы, эчке секреция,
матдәләр синтезы һ. б.).
Глюкоза, организмда җиңел үзләштерел үч ә н матдә Һәм
энергия чыганагы буларак, турыдан-туры организмны ныгы¬
тучы дәвалау чарасы итеп тә кулланыла. Аның татлы булуы
кондитер эшендә мармелад һәм карамель ясау, прәннек пеше¬
рү (патока составында) һ. б. шундыйлар өчен файдаланыла.
Кайтаргыч матдә буларак, ул көзгеләр һәм ялтыравыклы
елка уенчыклары ясау (көмешләү) өчен кулланыла. Текстиль
промышленностенда глюкоза тукымаларны махсус эшкәртү
өчен файдаланыла. Глюкозаны әчетү юлы белән сөт кисло¬
тасы һәм башка продуктлар табарга мөмкин.
Техникада глюкозаны катлаулырак төзелешле углевод¬
лардан, күбесенчә крахмалдан, су белән бергә катализатор¬
лар — минераль кислоталар катнашында җылытып табалар.
172
Фруктоза — глюкозаның изомеры. Составы СвН12Ое
формуласы белән күрсәтелә торган башка углеводлар да
бар. Шулай булгач, аларның барысы да үзара изомер була
һәм молекулаларында алты углерод атомы булган матдә
буларак, алар гексозалар дип аталалар. Аларның иң күп
таралганы — фруктоза:
сн,он -снон-снон-снон-с-сн,он
II
о
Тезелешеннән күренгәнчә, фруктоза ул — кетоноспирт.
Фруктоза татлы җиләк-җииешләр составына керә, берти¬
гез микъдардагы фруктоза белән глюкоза табигый бал¬
ның төп өлешен тәшкил итә.
Фруктоза глюкозадан һәм гади шикәрдән татлырак.
1. Глюкоза шикелле үк молекуласы составында алты углерод ато¬
мы булган бер атомлы спиртлар һәм бер нигезле карбон кислоталары¬
ның суда эремәвен, ә глюкозаның суда яхшы эрүен ничек аңлатырга?
2. Нинди тәҗрибәдән чыгып, глюкозаның тезелеше турыңда нәти¬
җә ясарга момкин? Шул тәҗрибәләрне сейләп бирегез.
3. а) Глюкозаны бакыр (II) гидроксиды белән оксидлаштыру һам
б) глюкозаны алты атомлы спиртка кайтару реакцияләренең тигез¬
ләмәләрен чагыштырып карагыз.
4. 0,1 моль глюкоза әчегәндә хасил булган углерод (IV) оксцдын из¬
вестья е суда йоттырсаң, ничә грамм кальций карбонаты хасил булачак?
5. 1 моль глюкоза тулысынча оксидлашканда, күпме углерод (IV)
оксиды барлыкка килә?
6. Бер үк реактив ярдәмендә: а) глицеринны, б) альдегидны.
в) серкә кислотасын, г) глюкозаны ничек танып белергә? Җавапларны
реакция тигезләмәләре белән раслагыз.
*7. Глюкозаның альдегид формасыннан циклик формасы барлыкка
килү процессын химик бәйләнешләр турында электрон күзаллаулардан
чыгып аңлатыгыз.
Тб- Сет кислотасының спирт һәм кислота үзлекләре булуын искә
алып, аның: а) натрий белән, б) натрий гидроксиды белән реакциягә
керү тигезләмәләрен языгыз.
9 36. РИБОЗА ҺӘМ ДЕЗОКСИРИБОЗА
Молекуласында биш углерод атомы булган углевод¬
лар — пентозалар билгеле. Аларның икесе — рибоза һәм
дезоксирибоза белән танышырбыз.
Физик үзлекләре, составы һәм тезелеше. Рибоза
CjHiqOj Һәм дезоксирибоза С5Н10О4 — татлы тәмле, суда
эрүчән кристаллик матдәләр.
173
Дезоксирибозаның составы барлык углеводлар өчен
уртак саналган Сл(Н2О)т формуласына туры килмәвен
күрмичә мөмкин түгел. Дезоксирибоза составындагы үзен¬
чәлекләр аның исемендә чагылыш талкан. Дез алкушым¬
часы, <?е алкушымчасы кебек үк нәрсәнеңдер булмавын,
нәрсәнеңдер төшеп калуын күрсәтә. (Дегидрирлашу, дегид-
ратлашу, шулай ук дезактивлашу, дезинформация атама¬
ларын исегезгә төшерегез.) Дезоксирибоза рибозадан моле¬
куласында бер гидроксил группасының (окси-грулпаның)
булмавы, водород атомына алмаштырылуы белән аерыла.
Матдәнең исеме (дезоксирибоза) менә шуннан алынган.
Пентозаларның структур формулалары түбәндәгеләр:
*
сн,
о
< з г 1 А
-СН-СН-СН-С
сн,
—СН—СН-СН—с
0
1
он
он он он н
1
он
1'1 '
он он н
Н
Рвбои Дезоксирибоза
Алар дезоксирибозаның нинди углерод атомы янында
гидроксил группасы булмавын төгәл күрсәтә.
Пентозаларның молекулалары да, глюкоза молекула¬
лары шикелле үк, альдегид формасында гына түгел, цик¬
лик формада да була. Аларда боҗраның йомылуы да глю¬
козаныкы шикелле. Аерма фәкать шунда гына: карбонил
группасы гидроксилның бишенче углерод атомы белән
түгел, дүртенчесе белән тәэсир итешә, һәм нәтиҗәдә, атом¬
нар яңадан группаларга бүленгәндә, алты буынлы цикл
урынына биш буынлы цикл барлыкка килә:
Дезоксирибозаның пространстволы формуласы глюко¬
заның монда китерелгән пространстволы формуласыннан
нәрсәсе белән аерылуын күрсәтегез.
Глюкоза очрагындагы шикелле үк, пентозаларның да
ике төрле циклик формасы (а һәм 0) билгеле; аларның су¬
дагы эремәсе альдегид формасы белән хәрәкәтчән тигез¬
ләнеш хәлендә була. Безгә соңрак бу матдәләрнең [3-фор-
масын белү кирәк булачак.
174
Химик үзлекләре. Рибоза һәм дезоксирибозаньщ тезе¬
лешләрендә глюкоза белән уртаклыклар күп булу сәбәпле,
аларның химик үзлекләре дә глюкозага охшаган. Мәсәлән,
альдегид группасы буенча оксидлашканда, алар кислота
хасил итәләр:
х°
СН2—сн—СН—СН—С + О — снг—сн—сн—сн—с
ОН ОН ОН он Н ОН ОН ОН он он
Рввом Рибов каедетасы
Кайтару реакциясе нәтиҗәсендә пентозалар күп атомлы
спиртларга әвереләләр. Рнбозаны водород белән биш атом¬
лы спиртка — рибитка кайтару реакциясе тигезләмәсен
языгыз.
Рибоза һәм дезоксирибоза зур биологик әһәмияткә ия.
Алар организм күзәнәкләрендә аксымнар синтезлау һәм
нәселдәнлек билгеләрем күчерү функциясен башкаручы
нуклеин кислоталары составына керә.
*9. Санча кыйммәтләрен исәпләмичә генә: а) глюкоза белән рибоза,
б) рибоза белән дезоксирибозаньщ молекуляр массалары арасындагы
аерманы табыгыз.
*10. Рибоза һем дезоксирибозяның составын һәм тезелешен белүе¬
гездән чыгып, бу матдәләрнең ни вчен: а) татлы, б) суда яхшы эрүчән
булуларын аңлатыгыз.
*11. Рибоэавың альдегидлы формасын оксидлаштырганда, молеку¬
ласында атомнарның саны шулкадәр ук булган ике нигезле кислота
табыла ала. Реакция тигезләмәсен тезегез. By кислота суда эриме? Ни
эчен?
*12. Дезоксирибозавың альдегид формасы белән циклик формасы
арасыңда үзара әверелешләр схемасын югарыда рибоэага карата күрсә¬
телгәндәгечә сурәтләгез.
§ 37. САХАРОЗА
Сахарозаның физик үзлекләре һәм табигатьтә очравы.
Сахароза безгә гадәттәге шикәр хәлендә билгеле. Ул — суда
бик яхшы эри торган, тәме татлы булган төссез кристаллик
матдә. Сахарозаның җылыдан эрү температурасы 160 °C;
эретелгән сахароза каткан вакытта үтә күренмәле аморф
масса — карамель ясала.
Сахароза күп кенә үсемлекләрдә — каен һәм өрәңге суын¬
да, кишердә, кавында бар. Шикәр чөгендерендә һәм шикәр
камышында ул бигрәк тә күп. Сахароза шушы үсемлекләрдән
алына.
176
Төзелеше һәм химик үзлекләре. Сахарозаның молекуляр
формуласы С12НггОп. Сахарозаның төзелеше глюкозаныкына
караганда катлаулырак. Иң элек глюкоза составындагы функ¬
циональ группаларның сахароза составына керү-кермәвен
ачыкларбыз.
Сахароза молекуласында гидроксил группалары барлыгын
аның металл гидроксидлары белән реакциягә керүеннән бик
җиңел белергә мөмкин. Бакыр (11) гидроксидына сахароза
эремәсе салсак, ачык зәңгәр төстәге бакыр сахараты эремәсе
(бакыр глицератын исегезгә төшерегез) барлыкка килә.
Сахарозада альдегид группасы барлыгын берничек тә бе¬
леп булмый: сахароза эремәсен көмеш (I) оксидының ам¬
миактагы эремәсе белән бергә җылытканда, «көмеш көзге*
ясалмый, бакыр (II) гидроксиды белән җылытканда, кызыл
төстәге бакыр (I) оксиды хасил булмый. Димәк, сахароза,
глюкозадан аермалы буларак, альдегид түгел.
Сахарозаның төзелеше турында фикер йөртү өчен, аның
су белән реакциясен өйрәнеп, әһәмиятле мәгълүматлар алыр¬
га мөмкин. Сахароза эремәсен берничә тамчы хлорид кисло¬
тасы яки сульфат кислотасы салып кайнатыйк. Аннан соң
кислотаны селте белән нейтральләштереп, эремәне бакыр (II)
гидроксиды белән җылытыйк. Кызыл төстәге утырым төшә.
Димәк, сахароза эремәсен кайнатканда, альдегид группала¬
ры булган молекулалар барлыкка килә, бу группалар исә
бакыр (II) гидроксидын бакыр (I) оксидына кадәр кайтаралар.
Бу реакцияне өйрәнү кислотаның каталитик тәэсире астыңда
сахарозаның гидролиэлашуын һәм нәтиҗәдә глюкоза һәм
фруктоза хасил булуын күрсәтә:
С12НиОц+ Н2О • С6Н|2О6 + СвН12Ов
Димәк, сахароза молекуласы узара тоташкан глюкоза
һәм фруктоза молекулалары калдыкларыннан тора дип
санарга мөмкин.
Сахарозаның изомерлары. Молекуляр формуласы
С12Н220ц булган сахарозаның изомерларыннан мальтоза
һәм лактозаны әйтеп үтик.
Мальтоза крахмалга солод белән тәэсир итүдән табы¬
ла. Шуңа күрә аны солод шикәре дип тә йөртәләр. Гидро¬
лиз вакытында ул глюкоза барлыкка китерә:
,+ Н20 —»• 2СвН)2Ов
Мдльтоза Глюкоза
176
I Лактоза (сот шикәре) соттә була. Ул — аеруча туклыклы
матдә. Гйдролиз вакытыңда лактоза глюкозага һәм глюко¬
за белән фруктозаның изомеры булган галактозага таркала.
13. Төрле пробиркаларга салынган глюкоза һәм сахароза эремәлә¬
рен ничек танып белергә?
14. Стакандагы шикәрле чәйдә сахарозаның гидролизлашамы-
юкмы икәнен пичек тикшерергә?
15. 5 моль сахарозаны гидролизлап, күнме глюкоза табарга мам¬
кин: а) мольләрдә, б> граммнарда? Бу вакытта барлыкка килгән фрук
тозаныц массасы турында нәрсә әйтергә момкнн?
16. Сахароза эремәсенә «известь соте» (кальций гндроксидының
судагы суспензиясен) салып катнашманы болгатсак, утырымның эрүен
күрербез. Бу күренешне аңлатыгыз.
а) Җылытканда шикәрнең ничек үзгәрүен, б) аның бүлмә темпера¬
турасындагы суда эрүчәнлеген өйдә тәҗрибәләр ясап тикшерегез.
§ Зв. КРАХМАЛ
Крахмалның физик үзлекләре һәм табигатьтә очравы.
Крахмал — суда эреми торган ак порошок хәлендәге матдә,
кайнар суда ул бүртә һәм коллоид эремә — клейстер хасил итә.
Үсемлекләрнең яшел (хлорофиллы) күзәнәкләрендә угле¬
род (IV) оксңдын үзләштерүдән барлыкка килгән продукт бу
ларак, крахмал үсемлекләр дөньясында аеруча күп таралган.
Бәрәңгедә — 20% чамасы, бодай һәм кукурузда — 70% чама¬
сы, дөгедә 80% чамасы крахмал бар.
Крахмал — кеше очен кирәкле туклыклы матдәләрнең
берсе.
Крахмалның тезелеше. Крахмал (СвН10Оь)я — табигый
полимер. Биология курсыннан билгеле булганча, ул үсемлек¬
ләрдә кояш нурланышы энергиясе йотылу исәбенә бара
торган фотосинтез эшчәнлеге нәтиҗәсендә барлыкка килә.
Башта күп кенә процесслар нәтиҗәсендә углекислый газ
белән судан глюкоза синтезлана. Моны гомуми рәвештә тү¬
бәндәгечә күрсәтергә мөмкин:
6СО2 + 6Н±О — СвН12О4 + 6О2
Аннары глюкоза крахмалга әверелә:
пСвН1гО. — (С1Н,.О,). + яН2О
Крахмалның макромолекулалары зурлыклары ягыннан
бертигез түгел: алардагы С4Н10О5 звеноларының саны да төр¬
лечә — берничә йөздән алып берничә меңгә кадәр була, шуңа
177
46 нчы рәсем. Крахмал
молекулаларының төзелеше.
күрә аларның молекуляр массасы
да бердәй түгел. Алар тезелеш¬
ләре белән дә аерылалар (46 вчы
рәсем): молекуляр массасы берни¬
чә йөз меңгә тигез булган сызык¬
ча структуралы молекулалар бе¬
лән беррәттән, молекуляр массасы
берничә миллионга җиткән тар¬
маклы структуралы молекулалар
да очрый.
Химик үзлекләре. Галогеннар¬
ны өйрәнгәндә, крахмалның йод
белән реакциягә кереп, зәңгәрлә¬
нүен күргән идек инде. Киселгән
бәрәңгегә яки икмәк телеменә йод тамызсак, бу төсне бик
ансат күрергә мөмкин.
Углеводларның әле генә өйрәнелгән үзлекләре крахмалда
бармы соң?
Крахмал клейстерын бакыр (II) гидроксиды белән бергә
җылытыйк. Бу очракта бакыр (I) оксиды барлыкка килми.
Димәк, крахмал глюкозага хас булган кайтару реакцияләренә
керми.
Ә хәзер сахарозага хас үзлекләрнең, ягъни гидролиэлашу
үзлегенең крахмалда булу-булмавын тикшерик. Аз гына
сульфат кислотасы салынган крахмал клейстерын кайнатып,
эремәне нейтральләштерик һәм соңыннан бакыр (II) гидрок¬
сиды белән реакция үткәреп карыйк. Бакыр (I) оксидының
характерлы утырымы хасил булуын күрербез. Димәк, су һәм
кислота катнашында җылытканда, крахмал гидролизлата,
гидролиз продуктларында бакыр (II) гидроксидын бакыр (I)
оксидына кайтаручы матдә була.
Мәгълүм булганча, крахмал макромолекулаларын су бе¬
лән таркату процессы акрынлап бара. Иң элек молекуляр
массасы крахмалныкыннан кимрәк булган арадаш продукт¬
лар — декстриннар, аннан соң сахарозаның изомеры — маль¬
тоза һәм, гидролизның соңгы продукты буларак, глюкоза
барлыкка килә.
Глюкоза барлыкка килү процессын схематик рәвештә
түбәндәгечә күрсәтергә мөмкин:
- <CeH,A-f-CeHl0Os-i-CeH10O5-«-C.H10O5 - лсвн12о.
H-j-OH Н } ОН Н4-0Н H-i-OH
1111
яки кыскача: (CeHlftO5)„ + «Нч0 — пСвН|2Ов
178
Сульфат кислотасының каталитик тәэсире астында крах¬
малның глюкозага әверелү реакциясен 1811 елда рус галиме
К. Кирхгоф ача. Глюкоза табуның ул тәкъдим иткән ысулы
нигездә хәзер дә кулланыла.
Крахмал гидролизы нәтиҗәсендә табылган соңгы про¬
дуктның глюкоза икәненнән чыгып, без крахмал макромо¬
лекуласының төзелешен җентекләбрәк тикшерә алабыз.
Крахмал макромолекулаларының циклик а-глюкоза
молекулалары калдыкларыннан торуы билгеле (аның бе¬
ренче углерод атомы янындагы гидроксил группасының
I ничек урнашуын исегезгә төшерегез). Макромолекулалар
ясалу процессын схематик рәвештә түбәндәгечә күз алды¬
на китерергә мөмкин:
Молекуланың циклик звеноларында альдегид группа¬
лары булмау сәбәпле, крахмал бакыр (П) гидроксидын
бакыр (I) гидроксидына кадәр кайтармый. Аның гидро¬
лизы вакытында Ct-формалы глюкоза барлыкка килә, һәм
ул башка формалар, мәсәлән, альдегидлы формасы белән
эремәдә тигезләнеш хәлендә булачак; глюкозаның нәкъ
менә бу соңгы формасы бакыр (П) гидроксидын кайтара.
Азык матдәсе буларак крахмал. Крахмал безнең азыгы¬
быздагы төп углевод булып санала. Ләкин ул организмда ту-
рыдан-туры үзләштерелә алмый. Майлар шикелле үк, ул баш¬
та гидролиэлаша. Бу процесс, төкерек ферменты тәэсирендә,
азыкны чәйнәгәндә үк башлана. Аннан соң крахмал гидро¬
лизы ашказанында һәм эчәклектә дәвам итә. Хасил булган
глюкоза эчәк стеналары аша канга сеңә һәм кан белән бавыр¬
га килә, ә аннан организмның барлык тукымаларына китә.
12* 179
Артык глюкоза югары молекуляр углевод — гликоген рәве¬
шендә бавырда кала. Гликоген үзенең төзелеше буенча крах¬
малдан молекулаларының ныграк тармакланган булуы белән
аерыла. Бер ашаудан икенче ашауга кадәр арада күзәнәк¬
ләрдә глюкоза сарыф ителгән саен запас гликоген глюкозага
әверелә. Глюкоза оксидлашканда ахырда нинди продуктлар
барлыкка килүен исегезгә төшерегез.
Крахмал гидролизы вакытыңда хасил булган ара продукт¬
лар (декстриннар) крахмалның үзенә караганда организмда
җиңелрәк үзләшә, чөнки алар кечкенәрәк молекулалардан тора
һәм суда яхшырак эри. Азык әзерләү еш кына крахмалны
декстриннарга әверелдерүгә кайтып кала. Крахмалның өлешчә
гидролизы, мәсәлән, бәрәңге, икмәк пешергәндә була. Пешкән
икмәкнең һәм кыздырылган бәрәңгенең кабык белән капла¬
нуы ябышучан декстриннар хасил булу белән аңлатыла.
Крахмалны куллану һәм аны крахмаллы продуктлардан
алу. Крахмал азык продукты итеп кенә кулланылып калмый.
Азык промышленностенда аннан глюкоза һәм патока да
әзерлиләр.
Глюкоза табу өчен крахмалны, сыегайтылган сульфат кис¬
лотасы эремәсе салып, берничә сәгать җылыталар. Гидролиз
процессы тәмамланганнан соң, кислотаны акбур белән ней¬
тральләштерәләр, хасил булган кальций сульфаты утырымын
фильтрлыйлар һәм эремәне парга әйләндерәләр. Эремә суын
гаңда, кристаллик глюкоза хасил була.
Гидролиз процессын ахыргача җиткермәгәндә, татлы куе
масса — декстриннар белән глюкоза катнашмасы — патока
барлыкка килә. Ул кондитерлык эшендә конфетларның кай¬
бер сортларын, мармелад, прәннек һәм башка шундыйларны
ясау очен тотыла. Патока белән әзерләнгән кондитер әйбер¬
ләре күңел кайтаргыч баллы тоелмый, шикәр белән ясал¬
ганнарына караганда тәмлерәк була һәм озак искерми.
Крахмалдан алынган декстриннар җилем итеп кулла¬
ныла. Крахмал керләрне крахмаллау өчен кулланыла: кай¬
нар үтүк тәэсирендә крахмал декстриннарга әверелә, декс¬
триннар исә, тукыманың җепселләрен ябыштырып, тукы¬
маны тиз керләнүдән саклаучы тыгыз элпә хасил итәләр.
Крахмалны күбесенчә бәрәңгедән алалар. Бәрәңгене юып,
механик кыргычларда ваклыйлар һәм барлыкка килгән мас¬
саны иләккә салып су белән юалар. Бүлбе күзәнәкләреннән
чыккан крахмал бөртекләре, су белән бергә иләк аша үтеп,
чан төбенә утыра. Крахмалны яхшылап юалар, судан аералар
һәм киптерәләр.
180
17. Югары молекуляр продукт буларак, крахмалга характеристика
бирегез.
18. Гидролиз вакытында крахмал глюкозага әверелә дно исәпләсәк,
хасил булган глюкозамын массасы алынган крахмал массасыннан
артырмы, әллә ким булырмы? Җавабыгызны дәлилләгез.
19. Пешкән бәрәңгенең ябыштыру үзлеген ннчек аңлатырга?
*20. Крахмалдан сөт кислотасы (171 нче битне карагыз) табу реак¬
цияләренең тигезләмәләрен төзегез:
1 2
(С,Н10О4). —* С„н|2о, — СНЭ—СН(ӨН)-СООН
1 һәм 2 реакцияләр ннчек атала?
21. Өлгермәгән алма суы йод белән реакциягә керә. Өлгергән алма
суы көмеш оксидының аммиактагы эремәсен кайтара. Бу күренеш¬
ләрне ничек аңлатырга?
■ Өйлә түбәндәге тәҗрибәләрме ясагыз;
а) бераз гына йод настойкасы алып, аны су белән 10 тапкырга
сыегвйтыгыО Һәм шул эремә белән пешкән бәрәңгене, ак икмәкне,
бәрәңге онын, вакланган дөгене, пудраны, теш порошогын һәм башка
матдәләрне сынап карагыз; б) крахмалдан клейстер ясагыз; аны мод
белән җылытканда һәм суытканда, төсенең үзгәрүен тикшерегез;
в) тукыма кисәген крахмаллагыз.
§ 39. ЦЕЛЛЮЛОЗА
Табигатьтә очравы. Физик үзлекләре. Целлюлоза, яки
клетчатка барлык үсемлекләрнең дә составына керә һәм
аларның күзәнәк тышчаларын хасил итә. Аның исеме дә
шуннан килеп чыккан (латинча ♦целлула»— күзәнәк). Цел¬
люлоза үсемлекләргә тиешле ныклык һәм сыгылмалылык
бирә һәм аларның скелетын този.
Мамык җепселләренең 98% ы целлюлозадан тора; җитен
һәм киндер сүсләре дә нигездә целлюлозадан тора; үзагачта
ул 50% чамасы. Кәгазь, мамык-җеп тукымалар целлюлозадан
эшләнә. Чистартылган мамык һәм фильтр кәгазе (җилемлән-
мәгән) бөтенләй дип әйтерлек саф целлюлозадан торалар.
Табигый материаллардан аерып алынган целлюлоза — су¬
да һәм гадәттәге органик эреткечләрдә эреми торган сүс-
сыман каты матдә.
Целлюлозаның тезелеше. Крахмал шикелле үк, целлюло¬
за да табигый полимер. Бу матдәләрнең хәтта структур зве¬
ноларының составы да бер үк терле — глюкоза молекулалары
калдыгы, димәк, аларның молекуляр формулалары да уртак:
(СвН|0О5)л. Шулай булгач, бу ике төрле матдәнең үзлек¬
ләрендәге аерма нәрсәдән килеп чыга соң дигән сорау туа.
181
Крахмал һәм целлюлоза макромолекулалары бер-берсен¬
нән структур звеноларының саны яки структурасы белән
аерылалар дип фикер йөртә алабыз. Чыннан да, целлюлозада
п ның кыйммәте крахмалныкына караганда югарырак: аның
уртача молекуляр массасы берничә миллионга җитә. Ләкин
крахмал белән целлюлоза арасындагы төп аерма молекула¬
ларының структурасы төрле булуда. Күреп үткәнебезчә, крах¬
мал молекулалары сызыкча һәм тармакланган структуралы,
ә целлюлоза молекулалары исә сызыкча структуралы гына
була:
СвН]()О4— CeH]0Os—С4Н10С\—CeH10Os— ...
47 вч* рәсем. Целлюлоз*
макромолекулаларының
билгеле бер юнәлештә
ур ваш у тәртибе.
Целлюлозаның мамык, җитен
һәм башка шундый сүссымав ма¬
териаллар тәшкил итүе нәкъ шу¬
ның белән аңлатыла да. Табигый
сүс җепселләрендә целлюлоза мак¬
ромолекулалары бер юнәлештә ге¬
нә урнашалар, аларны сүс үзәге
буйлап урнашкан диләр (47 вче
рәсем). Бу вакытта макромолеку¬
лаларның гидроксил группалары
арасында барлыкка килгән водо¬
родлы бәйләнешләр сүс җепселлә¬
ренең үтә ныклыгын тәэмин итә¬
ләр. Киҗе-мамык, җитен һ. б. ны
эрләгәндә, бу элементар сүс җеп¬
селләре, бер-берсенә үрелеп, ОЗЫВ-
рак җепләр хасил итәләр. Үзагач
целлюлозасыннан җеп эрләмиләр. Бу түбәндәгечә аңлатыла:
агач целлюлозасы макромолекулаларының структурасы сы¬
зыкча төзелешле булуына карамастан, бер юнәлештә генә
урнашмаган, бәлки тәртипсез урнашкан.
Крахмалдан аермалы буларак, целлюлоза макромолеку¬
лалары ^-глюкоза молекулалары калдыкларыннан төзел¬
гән. Аларның үзара тоташу процессын түбәндәгечә күрсә¬
тергә мөмкин:
182
Крахмал белән целлюлоза үзлекләрендәге җитди аерма
аларның макромолекулаларының төрле циклик формалы
глюкозадан төзелүеннән килә. Крахмал әһәмиятле азык
продукты санала, ә целлюлоза бу максатта файдаланыла
алмый. Моның сәбәбе крахмал гидролизына булышлык
итүче ферментларның целлюлозадагы р-глюкоза калдык¬
ларына тәэсир итмәвендә. Шуңа күрә целлюлоза кеше
организмында үзләштерелә алмый. Целлюлозаны гидро¬
лизларга сәләтле ферментларны күшәүче хайван орга¬
низмындагы микроорганизмнар эшләп чыгара, шуңа күрә
аны күшәүче хайваннар үзләштерә.
Химик үзлекләре. Көндәлек тормыштан безгә целлюлоза¬
ның яхшы януы билгеле.
Агачны һава кертмичә җылытканда, целлюлоза термик
таркала. Бу вакытта очучан органик матдәләр, су һәм агач
күмере барлыкка килә. Агач таркалганда табылган органик
продуктлар арасында метил спирты, серкә кислотасы, аце¬
тон бар.
Целлюлоза макромолекулалары крахмалныкы шикелле
звенолардан торганлыктан, без аны гидролизлата һәм гидро¬
лиз продукты, крахмалныкы шикелле үк, глюкоза булырга
тиеш дип фараз итә алабыз. Куертылган сульфат кисло¬
тасында чылатылган фильтр кәгазен (целлюлозаны) фарфор
савытта изик. Барлыкка килгән боламыксыман массага су
өстик, кислотаны селте белән нейтральләштерик һәм монда
да, крахмалдагы кебек, эремәнең бакыр (II) гидроксиды белән
реакциягә керү-кермәвен сынап карыйк. Без бакыр (I) окси¬
ды барлыкка килүен күрербез.
Димәк, реакциядә целлюлоза гидролизы була. Гидролиз
процессы, крахмалдагы шикелле, монда да баскычлы процесс,
ул глюкоза хасил булганчы дәвам итә.
Шулай итеп, целлюлоза гидролизын суммар рәвештә крах¬
мал гидролизы тигезләмәсе белән күрсәтергә мөмкин:
(СаН|оО5)„ + пН2О - лСвН12Ов
183
Целлюлозаның структур звеноларында (крахмал звено¬
ларындагы шикелле үк) өчәр гидроксил группасы бар.
Кайчакта аларны түбәндәгечә аерып күрсәтәләр:
ОН
С6Н7О2< ОН
4 он
яки
[С6Н7О2(ОН)3] „
Шушы группалар исәбенә целлюлоза гади һәм катлау¬
лы эфирлар барлыкка китерә ала.
Целлюлозаның нитрат эфирлары аеруча әһәмиятле.
Аларны целлюлозага сульфат кислотасы катнашкан нит¬
рат кислотасы белән тәэсир итеп табалар. Нитрат кислота¬
сының концентрациясенә һәм башка шартларга карап,
этерификация реакциясенә целлюлоза молекуласындагы
һәр звеноның бер, ике яки барлык өч гидроксил группасы
керә, мәсәлән:
|С6Н7О2(ОН)а]„ + 3nHNO3 [CeH7O2(ONOz)3]n + ЗпНгО
Целлюлоза нитратларының гомуми үзлеге — аларның
бик тиз кабынучанлыгы. Целлюлозаның пироксилин дип
йөртелгән тринитраты — аеруча шартлаучан матдә, ул тө¬
тенсез шартлый торган дары җитештерү өчен кулланыла.
Целлюлозаның серкә кислотасы эфирлары — целлю¬
лоза диацетаты һәм целлюлоза триацетаты — әһәмиятле
кушылмалардан санала:
О-С0-СН3
СвН7О, <-О—CO—СН3
" ОН
Целлюлозл днлцетлты
о-со сн,
С.Н-О, Zo-CO-CH,
CO—сн3
Целлюлоза триацетаты
Целлюлозаның диацетаты һәм триацетаты тышкы кү¬
ренеше белән целлюлозага охшаганнар. Алар ясалма аце¬
тат сүс әзерләү өчен кулланыла.
Целлюлозаны куллану. Целлюлоза бик күп урыннарда
кулланыла. Механик яктан нык булганга аны үзагач соста¬
вында төзү эшендә файдаланалар, аннан төрле агач әйберләр
ясыйлар. Җепсел материал буларак (мамык, җитен, киндер),
җеп эрләү, тукыма туку, аркан ишү өчен дә кулланалар.
Агачтан аерып алынган (иярчен матдәләрдән арындырылган)
целлюлоза кәгазь ясау өчен тотыла. Целлюлозаны гидролиз-
лау һәм шул вакытта табылган глюкозаны әчетү юлы белән
этил спирты табалар. Целлюлоза эфирлары нитролаклар, ки-
184
но плен кал ар, медицинада кул¬
ланыла торган коллодий, ясал¬
ма сүс җитештерү өчен то¬
тыла.
Ацетат сүс табу. Кеше ин¬
де бик борынгы заманнардан
бирле сүссыман табигый ма¬
териалларны үзенә кием тегү
һәм көнкүрештә төрле әй¬
берләр ясау өчен файдаланып
килә. Мондый материаллар¬
ның бертөрлеләре үсемлекләр¬
дән алына һәм целлюлозадан
тора, мәсәлән, җитен, мамык;
икенчеләре исә хайваннардан
алына һәм аксымнардан тора,
мәсәлән, йон, ефәк.
Үсә барган техниканың
һәм халыкның тукымага бул¬
ган ихтыяҗлары арту белән,
сүссыман материалларның
җитешмәве сизелә башлый.
Сүсне ясалма юл белән табар¬
га кирәк була. Алар чылбыр
төзелешле макромолекулалар¬
ның сүс бөртегенең үзәге
буйлап тәртипле рәвештә ур¬
нашулары белән характерла¬
на. Шулай булгач, тәртипсез
структуралы табигый поли¬
мерны берәр төрле эшкәртү
юлы белән молекулалары
тәртипле урнашкан матери¬
алга әверелдерү идеясе туа.
48 нче рәсем.
Ацетат сүсне формалау схемасы:
1 — эрләү голоокасы; 2 — фильера:
3 — хасил булган сүсләр; 4 — тахта.
Ясалма сүс әзерләү өчен, башлангыч матдә итеп, агачтан
яки мамык орлыкларында калган мамыктан алынган таби¬
гый целлюлозадан файдаланалар.
Полимерның сызыкча молекулаларын ясалма сүснең үзә¬
ге буйлап урнаштыру өчен, аларны иң элек бер-берсеннән
аерып алып, хәрәкәтчән, күчеп йөри ала торган итәләр. Мо¬
ның өчен полимерны җылытып эретергә яки берәр эремәдә
эретергә кирәк. Целлюлозаны җылытып эретергә мөмкин
түгел: җылытканда ул таркала. Шулай булгач, целлюлозаны
185
эремәдә эретү мөмкинлекләрен эзләп табарга кирәк. Моңа
химик эшкәртү юлы белән ирешергә мөмкин.
Целлюлозаны сульфат кислотасы катнашында серкә ан¬
гидриды1 белән эшкәртәләр (серкә ангидриды серкә кисло¬
тасына караганда көчлерәк этерификацияләгеч булып са¬
нала).
Этерификация продуктын — целлюлоза триацетатын ди-
хлорметан СН2С12 белән этил спирты катнашмасында эретә¬
ләр. Хасил булган үзле эремәдә полимер молекулалары хәрә¬
кәт итә һәм кирәкле тәртиптә урнаша алалар.
Сүс җепселләре алу өчен, полимер эремәне вак-вак ти¬
шекле металл колпаклар, ягъни фильералар аша узды¬
ралар (48 нче рәсем). Эремәнең нечкә генә агынтыларын
җылы һава уздырыла торган 3 м биеклектәге вертикаль
тахтага төшерәләр.
Җылылык тәэсирендә эреткеч парга өйләнә, ә инде
целлюлоза триацетаты нечкә озын җепселләр хасил итә,
соңыннан алар җеп булып катыла һәм тагын да эшкәртүгә
озатыла. Макромолекулалар фильера аша узганда, бүрә
нәләр тар елгадан акканда бер тәртиптә яткан кебек, эремә
агынтысы буйлап урнаша башлыйлар. Моннан соң узды¬
рыла торган эшкәртү вакытында макромолекулалар тагын
да тәртиплерәк урнаша. Бу — җепселләрнең һәм җепнең
ныклылыгын арттыра.
Ясалма сүсне еш кына озын җеп (ефәк) рәвешендә
түгел, бәлки штапель рәвешендә — берничә сантиметр
озынлыгында кискәләнгән, катылмаган килеш файда¬
ланалар. Штапельне башка төр сүсләргә, мәсәлән, йонга
кушып эрләү өчен файдаланырга мөмкин.
Ацетат сүс юеш хәлдә вискоза сүскә караганда ныклыгын
азрак югалта. Җылы үткәрүчәнлеге түбән булу сәбәпле, җы¬
лыны да яхшырак саклый. Моннан тыш, бу сүс үзенең аеруча
йомшак, аз бөгәрләнүчән, юганда азрак утыруы, матур ялты¬
равы белән аерылып тора. Бу үзлекләре аркасында ул кыйм¬
мәтле текстиль материал булып санала.
1 Серкә ангидридын серкә кислотасыннан суын аерып алу нәти¬
җәсендә табылган матдә дип карарга мөмкин:
"С-СНз — СН,-С^ ^С-СНэ + Н.0
ОН НО О'
186
Ләкин гигиена таләпләре буенча ацетат сүс киҗе-мамык
сүстән калыша. Ацетат сүстәге күпчелек гидроксил группа¬
лары этерификациягә дучар булу сәбәпле, су молекулалары¬
ның водороды белән бәйләнешкә керү мемкинлеге азрак,
шуңа күрә аның гигроскопиклыгы кимрәк, дымны үзенә
азрак сеңдерә.
22. Целлюлоза һәм крахмалның тезелешләре кайсы яклары белән
бер-берсенә охшаган һәм кайсы яклары белән аерылып тора?
23. а) Җитен сүсендәге (М. = 5900000), б) киҗе-мамык сүсендәге
(М,= 1750000) целлюлоза молекуласында ничә СвНюОу звеносы бар?
(Молекуляр формуласында п ничәгә тигез?)
24. Ни өчен целлюлозадан сүс алып була, ә крахмалдан мөмкин
түгел?
26. Каучук һәм целлюлоза молекулалары сызыкча структуралы.
Ләкин ни өчен соң каучук һәм целлюлоза җепселләре бер-береннән
бик нык аерыла (каучук җепселләре нык түгел, ә целлюлоза җепсел¬
ләре каучукныкы кебек сыгылмалы түгел)?
26. Сахароза, крахмал һәм целлюлозаның уртак нинди химик үз¬
лекләре бар? Җавапны реакция тигезләмәләрен язып раслагыз.
*27. а) Целлюлоза динитраты. 6) целлюлоза триацетаты табу реак¬
цияләренең тигезләмәләрен языгыз.
*28. Ацетат сүс табу производствосы нинди тоц стадияләрдән тора?
Эремәне ничек итеп җепселләр рәвешенә китерәләр?
10. АМИННАР, АМИНОКИСЛОТАЛАР.
АЗОТЛЫ ГЕТЕРОЦИКЛИК КУШЫЛМАЛАР
Без, углеводородлар һәм кислородлы органик кушыл¬
маларны өйрәнгәндә, составына азот кергән кушылмаларны
да очраткан идек. Составына азот кергән матдәләрнең халык
хуҗалыгында әһәмияте гаять зур. Аларның табигатьтәге
роле бигрәк тә зур, чөнки аларга аксым, нуклеин кислота¬
лары кебек әһәмиятле биологик кушылмалар керә. Хәзер
азотлы органик кушылмаларның кайбер класслары белән
танышырбыз.
§ 40. АМИННАР
Амнннарның төзелеше һәм үзлекләре. Органик кушыл¬
маларда азот нитрат кислотасы калдыгы рәвешендә генә
булмый. (Нитробензол CeH5NO2 һәм катлаулы эфир — целлю¬
лоза тршштратын [CeH7O2 (ONO2)3]„ исегезгә төшерегез.) Сос
тавына азот аммиак калдыгы рәвешендә кергән күп кенә
органик кушылмалар барлыгы билгеле, мәсәлән:
сн,—ы/
хн
Метлами
СН,
>N-H
М ти гт мем ■■
СН,
>N—Н
СН,
Дввютиламии
/Н
ел* \н
снэ
СН,Лы
сн/
с.н.
(емияия)
Дмфен ил ома в
Бу кушылмалар барысы да аминнар классына керә.
• Аминнарны аммиак молекуласының бер яки берничә водо¬
род атомы углеводород радикалларына алмаштырылган
матдәләр дип карарга мамкин.
Без нигездә функциональ группа сыйфатында аминогруп¬
па дип йөртелә торган бер валентлы аммиак калдыгы — NH2
булган аминнарны өйрәнербез. 49 ичы рәсемдә иң гади амин
молекуласының моделе күрсәтелгән.
188
49 нчы рәсем. Метиламин
молекуласының моделе.
Аминнар белән аммиак арасын¬
дагы охшашлык формаль охшашлык
кына түгел. Аларның, кайбер уртак
үзлекләре дә бар.
Аминнарның чикле рәтендәге тү¬
бән төзелешле вәкилләре газ хәлендә
һәм ал ардан аммиак исе килә. Шуңа
күрә элек аларны аммиак дип бел¬
гәннәр. Аммиактан аермалы буларак,
аларның һавада янулары беленгәч
кенә, бу мәсьәлә ачыкланган (аммиакның нинди шартларда
януын исегезгә төшерегез):
4СН3—NH2 f 90, —- 4С0, + ЮН2О + 2N2
Әгәр берәр аминны суда эретеп, эремәне лакмус белән
сынап карасак, без аммиактагы шикелле үк эремәдә селте
реакциясе булганын белербез. Димәк, аминнар — нигез үзлек¬
ле матдәләр.
Аминнар белән аммиак арасындагы охшашлыкны алар¬
ның электронлы төзелешеннән аңларга мөмкин.
Билгеле булганча, аммиак молекуласында азот атомының
биш валентлык электронының өчесе генә водород атомнары
белән ковалент бәйләнешкә керә. Бер пар электрон ирекле
килеш кала: „
Н
H:N:
Н
Аминнарның электронлы төзелеше аммиакныкы шикелле
үк. Азот атомының да ирекле пар электроны бар:
Н Н
H:C:N:
Н Н
Су белән тәэсир итешкәндә бу матдәләр ирекле пар элек¬
трон урыныннан үзләренә протон кушалар, бу хәл гидроксид-
ионнар туплануга китерә, шуңа күрә аларның эремәләре сел¬
теле реакция күрсәтә:
Ң Б+. J-
H:N: + Н£ОН
Н
И И S+ 6-
H:C:N: + H£OH
Н Н
* Н ~
H:N:H
Н
+ 0Н
* нн *]
H:C:n:H
Н Н _
+ 0Н’
18»
Металл атомнары бер яки берничә гидроксил группасы бе¬
лән тоташкан матдәләрне без неорганик химиядә нигез үзлек¬
ле матдәләргә керткән идек. Нигезләр ул — киңрәк мәгънәле
төшенчә. Аларның үзлекләре кислота үзлекләренә капма-
каршы. Шуңа күрә әгәр химик реакция барышында кислота¬
лар өчен протон аеру хас булса, нигезләр өчен, киресенчә,
протон кушу характерлы. Димәк, су белән тәэсир итешүдән
хасил булган продуктлары гына түгел, аммиак һәм аминнар
үзләре дә — нигез үзлекле матдәләр. Аминнарны органик
нигезләр дип тә йөртәләр.
Нигез буларак, аминнар, кислоталар белән реакциягә кереп,
тоз хасил итәләр. Бу реакция аммиакның сезгә билгеле реак¬
цияләренә охшаган һәм шулай ук протон кушылу белән була:
Н 8* 5-
Н
’ Н “Г
H:N:H
сг
н
Аммовий хлориды
нн к
«• 0
" S 6* 6-
H:C:N: + н|:С1
Н Н
" Н Н ■
H:C:N:H
♦*
сг
н н
Метилам моиий хлориды
Бу матдәләрнең үзлекләре нигез буларак охшасалар да,
аермалары да юк түгел. Аминнар, чикле углеводородларның
алмаштырылганнары буларак, аммиакка караганда көчлерәк
нигез санала. Аминнар аммиактан молекулаларында углево¬
дород радикаллары булу белән генә аерылганлыктан, бу ради¬
калларның азот атомына йогынтысы сизелә булса кирәк.
Безгә углеводород радикалының ковалент бәйләнеш
электроннарының авышуына йогынты ясау мисаллары да
билгеле. —СН3 радикалы тәэсирендә аминнарда С—N бәй¬
ләнешенең электрон болыты беркадәр азотка таба авыша,
шуның нәтиҗәсендә азотның электрон тыгызлыгы арта,
һәм ул водород ионын молекулада үзенә ныграк тартып
тора. Шунлыктан суның гидроксил группалары иреклерәк
булып китә һәм эремәнең селте үзлекләре арта.
Аминнарның үзлекләрен практик әһәмияте аеруча зур
булган ароматик амин — анилин мисалында өйрәнербез.
Анилин (( NH2 — суда аз эри торган, төссез, майсы-
190
ман, бик нык агулы сыеклык, һавада бераз оксидлашканга
күрә, ул коңгырт төстә була.
Анилин молекуласының моделе IV төсле рәсемдә күр¬
сәтелгән.
Анилинның нигез үзлекләре аммиакныкына һәм чикле
рәттәге аминнарныкына караганда көчсезрәк. Анилин лакмус¬
ның төсен үзгәртми, ләкин кислоталар белән тәэсир итеш¬
кәндә, тоз хасил итә. Мәсәлән, анилинга куертылган хлорид
кислотасы салсаң, экзотермик реакция бара, катнашманы
суытканнан соң, тоз кристаллары ясалуын күрергә мөмкин:
CsH;NH2 + НС1 - * [C,HSNH3]C1
Ф«ннл»ммо1ий хлоради
Әгәр дә фениламмоний хлоридына селте эремәсе белән
тәэсир итсәң, яңадан анилин аерылып чыга:
[СвНБҺГН,]+ + СГ + Na+ + ОН НгО + CeH3NH2 + Na* + Cl’
Ни өчен соң анилин, чикле углеводородлар рәтендәге
аминнарга караганда, көчсезрәк нигез булып чыкты?
Монда ароматик фенил радикалының —СеН5 йогын¬
тысы сизелә булса кирәк. Фенолның С6Н5ОН ароматик
радикалы, гидроксил группасындагы кислород атомының
электроннарын үзенә тартып, матдәнең кислота үзлек¬
ләрен көчәйтүен исегезгә төшерегез әле. Бу очракта бензол
боҗрасы аминогруппадагы азотның бүленмәгән пар элек¬
троннарын үзенә авыштыра. Нәтиҗәдә азотның электрон¬
нар тыгызлыгы кими, һәм ул водород ионын көчсезрәк то¬
тып тора, ә бу исә матдәнең нигез үзлекләре азрак сизелә
дигән сүз.
Николай Николаевич Зивмн
(1612—1880)
Казан университеты, аннал сон Петербург¬
та медицина.хирургия академиясе профессо¬
ры. Академик. Нитробензолның анилинга
кайтарылу реакциясен ача. Күп кенә яңа ор¬
ганик матдәләрне — нитрокушылмаларны
кайтарудан табылган продуктларны синтез¬
лый. «Зинин нитробензолны анилинга әве¬
релдерүдән башка ачыш ясамаган хәлдә дә,
авың исеме химия тарихына алтын хәрефләр
белән язылган булыр иде»,— дип яза аның
бер замандашы. Зинин Казанда органикхи-
миклар мәктәбенә нигез сала. Казан универ¬
ситетының химия кафедрасы буенча, Зинин-
вың укучысы һәм аның эшен дәвам иттерү¬
че А. М. Бутлеров була.
191
Без амин группасы, үз чиратында, бензол боҗрасына
тәэсир итә дип тә уйлый алабыз. Судагы эремәсендә бром¬
ның бензол белән реакциягә кермәвен сез беләсез инде.
Әгәр дә анилин эремәсенә бромлы су салсаң, төптә три-
броманилинның ак утырымы хасил була:
+ ЗВг2
+ ЗНВг
Нинди атомнар группасы
циягә керү сәләтен арттыруын
бензол боҗрасының реак-
шушы ук ысул белән күзә¬
түегезне исегезгә төшерегез.
Анилинга оксидлаштыручылар (мәсәлән, хром катнаш¬
масы) белән тәэсир иткәндә, бер-бер артлы төрле төстәге мат¬
дәләр хасил була. Соңгы продукт сыйфатында кара анилин —
уңмый торган нык буяу барлыкка килә.
Анилин — химия промышленностеның әһәмиятле про¬
дуктларыннан берсе. Ул күп кенә анилинлы буяулар табуда
башлангыч матдә булып хезмәт итә, кыйммәтле дарулар, мә¬
сәлән, сульфаниламид препаратлары, шартлаучан матдәләр,
югары молекуляр кушылмалар һ. б. табуда кулланыла. Казан
университеты профессоры Н. Н.Зининның (1842 ел) ансат юл
белән анилин табу ысулын ачуы химия фәненең һәм химия
промышленностеның үсешендә бик зур роль уйнады.
Органик синтез промышленносте буягычлар эшләп чыга¬
рудан башланып китә, ә бу производствоның киң үсеше
хәзер химиядә Зинин реакциясе дип йөртелә торган анилин
табу реакциясен файдалану нәтиҗәсендә генә мөмкин булды.
Бу реакция нитробензолны кайтарудан гыйбарәт, ул схема
рәвешендә түбәндәге тигезләмә белән күрсәтелә:
С6Н5—ЫО2 + 6Н — СвН,—NH,+2Н2О
Анилин табуның промышленностьта киң кулланыла тор¬
ган ысулы нитробензолны әче тирәлектә металлар, мәсәлән,
тимер (чуен вагы) белән кайтарудан гыйбарәт.
Тиешле төзелештәге нитрокушылмаларны кайтару —
аминнар табуның гомуми ысулы.
1. Пропиламинның СН»—СНг—СНг—NH, барлык изомерларының
формулаларын төзегез.
2. Этила ми в янганда, азот ирекле хәлдә аерылып чыга дип исәпләп,
яну реакциясенең тигезләмәсев төзегез.
192
*3. Диметиламинның селте үзлекләре метиламинныкына караган
да кемлерәк булуын ничек аңлатырга?
4. а) Аммиак һәм амин нарның тоз ясалуда, 6) селте белән тәэсир
иткәндә, тозлардан аммиак һәм амнннар аерылып чыгуда охшашлык¬
ны раслый торган реакция тигезләмәләрен языгыз.
*5. Ароматик амипнарның нигез үзлекләре, чикле рәттәге амин
нарныкына караганда, көчсезрәк булуын ничек аңлатырга?
*6, Сезнеңчә, дифениламин (CeH*feNH феи и ламин га (анилинга) ка
раганда көчлерәк нигезме әллә көчсезрәкме? Җавабыгызны аңлатып
бирегез.
♦7. Түбәндәге матдәләрне: диэтнламин, анилин, аммиак, этиламин,
днфениламинны нигез үзлекләре арту тәртибендә бер рәткә урнаш¬
тырыгыз.
8. Әгәр анилинның чыгышы 80% булса. 246 г нитробензолдан
ничә грамм анилин табарга мөмкин?
9. Башлангыч матдә итеп кальций карбиды алынса, ничек итеп
анилин табарга? Әверелешләр схемасын языгыз һәм реакция шарт¬
ларын күрсәтегез.
10. а) Нитроэтанны, б) нитротолуолны СНлС*Н>НОг аларга тиңдәш
аминнарга кайтару реакцияләренең тигезләмәләрен төзегез.
11. а) Этил спирты белән серкә кислотасы, б) бутил спирты белән
фенол, в) бензол белән анилин катнашмаларын нинди химик ысул
белән аерырга мөмкин?
*12. Фотографиядә кулланыла торган лминофенолның төзелеше
HO— C»Hi — NHi- Аның химик үзлекләрен тасвирлагыз. Реакция ти¬
гезләмәләрен языгыз.
5 41. АМИНОКИСЛОТАЛАР
Азотлы органик матдәләр арасыңда ике функцияле кушыл¬
малар бар. Аларның иң әһәмиятлеләре — аминокислоталар.
Тезелеше һәм физик үзлекләре. Аминокислоталар — мо¬
лекулаларында бер үк вакытта аминогруппа — NH2 һәм кар¬
боксил группасы — СООН булган матдәләр алар. Мәсәлән:
СН.-СООН
NH2
МЫСЛОТАСЫ
СН,-СН2-СООН .
NH,
Амм И л п рописн
кислотасы
IV төсле таблицада аминокислота молекулаларының мо¬
дельләре күрсәтелгән.
Аминокислоталар — суда яхшы эри торган төссез кристал¬
лик матдәләр; аларның күбесенең тәме татлы.
Аминокислоталарны молекулаларында радикалның водо¬
род атомы аминогруппага алмаштырылган карбон кислотасы
7 К 177
193
дип карарга була. Шулай булган хәлдә аминогруппа төрле
углерод атомнары янында торырга мөмкин, бу күренеш ами¬
нокислоталар изомериясенең бер төрен китереп чыгара.
6 нчы таблицада аминогруппасы углеводород чылбырының
очына урнашкан аминокислоталар рәте китерелгән.
6 нчы таблица. Аминокислоталарвыц кайбер вәкилләре
Кислоталарвыц исеме
Формуласы
Аминосеркә кислотасы
Аминопропион кислотасы
Аминомай кислотасы
Аминовалериан кислотасы
Аминокапрон кислотасы
Аминоэнант кислотасы
H?N—СН?—СООН
H2N—СН2—СН2—СООН
HN СН2—СН2—СН2—СООН
H,N-(CH2h—СООН
H2N—(СН2)Ь—СООН
HjN—(СНаҺ—СООН
Аминокислота молекуласында углерод атомнары ника¬
дәр күп булса, аминогруппасы карбоксил группага карата
төрлечә урнашкан изомерларның саны шулкадәр күбрәк бу¬
луы мөмкин.
Карбоксилга карата —NHZ группасының торышын изо¬
мер исемендә күрсәтеп булсын өчен, аминокислота молеку¬
ласындагы углерод атомнарын грек алфавитындагы хәрефләр
белән билгелиләр:
« 4 У. > <■
снэ-сн,-сн,-сн2—сн-соон
NH,
а Амннонэирон кнслотьсы
< S у Р а
СН, СН,- СН,-СН-СН2-СООН
й
nh2
рАмниокюрон кислотасы
Аминокислоталар иэомериясе углерод скелеты тармак¬
ланудан да булырга мөмкин. Югарыда китерелгән амино¬
капрон кислоталарына изомер булган һәм алардан углерод
чылбырының төзелеше белән аерыла торган берничә амино¬
кислотаның структур формулаларын языгыз.
Аминокислоталар табигатьтә бик күп таралган. Югары
молекуляр табигый углеводлар — крахмал һәм целлюлоза
өчен глюкоза молекулалары төзү материалы булган кебек,
барлык үсемлек һәм хайван организмнарындагы аксымнар
өчен аминокислота молекулалары — төзү материалы. Аерма
194
бары тик шунда: крахмал һәм целлюлозаны тәшкил иткән
мономер хезмәтен бер генә матдә — глюкоза гына үти, ә һәр
аксым составына төрле аминокислоталар керә. Табигатьтә
аминокислоталар ирекле хәлдә дә һәм төрле кушылмалар
составында да очрый.
Химик үзлекләре. Аминокислоталарның төзелешеннән
чыгып, аларның химик үзлекләре турында нәрсә әйтә алабыз?
Бу матдәләрнең составына химик үзлекләре безгә билгеле
булган функциональ группалар керә, шуннан чыгып, амино¬
кислоталарның кислота үзлекләре дә, нигез үзлекләре дә
булуын фараз итәргә мөмкин.
Шулай булгач, аминокислоталар индикаторларга, мәсәлән,
лакмуска, ничек тәэсир итәр соң? Тәҗрибә аларның эремәләре
нейтраль булуын күрсәтә. Бер функциональ группаның инди¬
каторга тәэсире икенче группаның капма-каршы тәэсире
белән нейтральләшә булса кирәк.
Кайбер аминокислоталарның молекулаларында ами¬
ногруппа һәм карбоксил группа саны бердәй булмый, мә¬
сәлән:
°\ z
^С-СН2—СН2-СН-СЛ
HO nh, он
Глутамин кислотасы
z
CH,-CHa-CH2-CH2-CH-C\
NH, NH, OH
Лизни
Мондый аминокислоталарның индикаторга тәэсире
алардагы функциональ группаларның кайсылары артыг¬
рак булу белән билгеләнә.
Аминокислоталарның ике төрле химик функцияле булуы
турындагы фикер аларның башка матдәләр белән тәэсир
итешүе вакытында раслана.
Кислота буларак, алар, нигезләр белән реакциягә кереп,
тозлар хасил итәләр, ә спиртлар белән тәэсир итешеп, кат¬
лаулы эфирлар барлыкка китерәләр, мәсәлән:
H.N—СН2—СООН + NaOH
H,N—СН,— СООН + HOR
—• H2N—СН2—COONa + Н2О
Z
—’ H>N—СН>—Cf + Н2О
4-R
13*
195
Нигез буларак, алар, кислоталар белән реакциягә кереп,
тоз хасил итәләр, мәсәлән:
H2N—СН2—СООН + HCI [Н3Ы-СНг—COOHJ'CI
Без монда органик химиядәге амфотерлык күренешен
очраттык. Аминокислоталар — органик амфотер кушыл
малар алар.
Аминокислоталар белән неорганик амфотер кушылмалар
арасында шактый аерма бар, әлбәттә. Аминокислоталарның
кислота һәм нигез үзлекләре атомнарның төрле группалары
булудан килеп чыкканга күрә, аларның молекулалары бер-
берсе белән реакциягә керә ала, мәсәлән:
/° Г - V °
/ I— II
HjN—CHZ—С. . . _i + Н —N—СН2—<? —
ХОН ЧОН
- |
1 _
— H2N—СН2—С—N—СН2—С ' + Н.О
Х0Н
Барлыкка килгән молекула аминокислотаның өченче мо¬
лекуласы белән нәкъ шулай ук реакциягә керә, һәм реакция
шулай дәвам итә ала.
Мондый реакция нәтиҗәсендә аминокислота звенолары
күп булган молекулалар синтезлана ала. Аминокислоталар
үзара тәэсир итешкәндә хасил була торган —CO—NH— атом¬
нары группасын — пептид яки амид группасы дип. ә анда
углерод белән азот атомнары арасындагы бәйләнешне пептид
(амид) бәйләнеш дип йөртәләр.
Соңрак без аксым молекуласында аминокислота калдык¬
ларының бер-берсенә пептид бәйләнеш ярдәмендә тоташуын
күрербез.
Аминокислоталарны куллану. Кеше һәм хайваннар орга¬
низмда аксым төзү өчен кирәкле аминокислоталарны аксым¬
лы азыктан алалар. Әмма аминокислоталарны бу максат өчен
турыдан-туры кулланырга да мөмкин. Бик нык ябыккан һәм
авыр операция кичергән кешеләргә, шулай ук азыкны аш-
кайнату трактына кертмичә генә авыруларны тукландырырга
кирәк булган очракларда аминокислоталар турыдан-туры
кулланыла. Аминокислоталар кайбер авыруларны дәвалау ча¬
расы итеп тә файдаланыла (мәсәлән, глутамин кислотасы —
нерв авыруларын, гистидин ашказаны җәрәхәтен дәвалаганда
кулланыла).
196
Аминокислоталарның кайберләрен авыл хуҗалыгында
терлекләрне өстәмә тукландырганда бирәләр, ул — терлек¬
ләрне тизрәк үстерергә ярдәм итә.
Функциональ группалары молекулаларның очларында
урнашкан тармакланмаган төзелешле аминокислоталарның
техник әһәмияте бар: амннокапрон һәм амнноэнант кисло¬
талары (194 нче биттәге 6 нчы таблицаны карагыз) капрон
һәм энант дип йөртелә торган синтетик сүс хасил итәләр.
Аминокислоталарны табу. Биологик яктан аеруча әһә¬
миятле аминокислоталарны, югары молекуляр углеводо¬
родлардан глюкоза тапкан кебек, гидролиз юлы белән
аксымнан табалар.
Аминокислоталарны синтетик юл белән табу ысуллары
да бар. Без монда аминокислоталар белән безгә инде та¬
ныш кушылмалар классы арасында генетик бәйләнеш бу¬
луын күрергә мөмкинлек бирә торган ысулны өйрәнербез.
Башлангыч матдә сыйфатында карбон кислотасы алып,
аның углеводород радикалындагы водород атомын амино-
группага алмаштыралар. Практикада моны ашләү өчен,
башта безгә билгеле хлорлау реакциясе ярдәмендә бер
водород атомын хлор атомына алмаштыралар, ә аннан соң,
матдәне аммиак белән реакциягә кертеп, хлор атомын
аминогруппа белән алмаштыралар, мәсәлән:
СН, СООН + Cl2 — CHj-COOH + НС1
Cl
Хлор KKUOTOCU
<—» /Н
СН,—COOH + Hr-N< —* CHj-COOH + HCI
'сГ _ J Н NH,
Амниосерна кисшлмы
13. Сезгә ике герле химик функцияле нинди органик кушылмалар
билгеле? Аларныц структур формулаларын языгыз һәм үзлекләрен
кыскача санап чыгыгыз.
*14. Барлык изомер: а> аминомай, б) аминовалернан кислотала¬
рының структур формулаларын тезегез.
15. Амннопропион кислотасыныц этил эфирын ничек табарга?
Реакция тигезләмәсен тезегез.
*14. Аминокапрон кислотасының ике терле типтагы тозларының
формулаларын тезегез.
17. Ничек итеп метан нигезендә аминосеркә кислотасы табарга?
Реакция тигезләмәләрен языгыз.
*18. Пропил спиртыннан (пропанол-1) ничек итеп а-аминопропион
кислотасы табарга? Реакция тигезләмәләрен тезегез.
8 Б-177
187
s 42. СОСТАВЫНА АЗОТ КЕРГӘН ГЕТЕРОЦИКЛИК
КУШЫЛМАЛАР
Углеводородларны һәм кислородлы органик матдә¬
ләрне өйрәнгәндә, без атомнар чылбыры ачык булган ку¬
шылмаларны гына түгел, бәлки аларныц циклик төзе-
лешлеләрен дә тикшергән идек. Циклопярафиннар, бензол
һәм фенолны искә төшерик. Составына азот кергән ку¬
шылмалар арасында циклик тезелешле матдәләр бигрәк тә
күп. Глюкоза, рибоза, дезоксирибозаныц циклик моле¬
кулаларына кислород атомнары кергән кебек, цикллар
составына углерод атомнары белән беррәттәи азот атом¬
нары да кергән кушылмалар аеруча әһәмиятле.
• Составына углерод атомнары белән беррәттән башка
элемент атомнары кергән циклик кушылмалар гетеро¬
циклик кушылмалар дип атала (грекча «гетерос» —
башка).
Гетероциклларныц күп төрле булу мөмкинлеге — ор¬
ганик кушылмаларның чиксез күп булуын күрсәтүче
сәбәпләренең тагын берсе.
Без фәкать азотлы гетероциклик кушылмалар белән
генә танышырбыз.
Пмрмднн | || — циклда бер азот гетероато-
НС^ СН
N
мы булган алты буынлы гетероциклик кушылма. Ул —
тәмсез исле, суда яхшы эри торган төссез сыеклык. Пири¬
дин һәм аның гомологлары ташкүмер сумаласында була,
аны шуннан алалар.
Структур формуласыннан чыгып, пирндинның үзлек¬
ләре турында ике төрле фикер әйтергә мөмкин. Моле¬
куласында икеле бәйләнешләр булуы аның реакциягә
керү сәләте зур булырга тиеш дигән фикергә китерә, ә
иңде төзелешенең бензолга охшаганлыгы матдәнең химик
яктан тотрыклылыгы зур булырга тиеш дип фараз итәргә
мөмкинлек бирә. Фикерләрнең икенчесе дөрес булып чы¬
га: төзелеше белән дә, үзлекләре белән дә пиридин бензол¬
га охшаган.
Бензол молекуласында зр2-гибридлашу хәлендәге һәр
углерод атомы үзенең өч электронын G-бәйләнешкә, ә бер¬
сен молекула өчен уртак я-болыты барлыкка китерүгә тота
198
(ян-яктан алты р-электрон болыты белән аралаша). Пири¬
дин молекуласында үзгәлек бар: бер СН группасы азот
атомы белән алмашынган, һәм шул азот атомы күрше ике
углерод атомы белән о-бәйләнешкә керү өчен — ике элек¬
тронын, ә л-болыты системасына бер электронын «бирә»,
нәтиҗәдә, бензол молекуласындагы шикелле үк, тотрыклы
электроннар секстеты барлыкка килә. Моннан соң азот
атомының бер нар бәйсез электроннары кала. Шуннан
чыгып, пиридин молекуласын төгәлрәк формула белән
(боҗрадагы СН группаларын язмыйча гына) күрсәтергә
мөмкин:
Бензол шикелле үк, пиридин да оксидлаштыручылар
тәэсиренә бирешми: ул калий перманганаты эремәсен
хәтта җылытканда да төссезләндерми.
Пиридин нитролаша, ләкин реакция бензолныкына
караганда кискенрәк шартларда бара, һәм нитропиридин
барлыкка килә:
Бензолдагы шикелле үк, монда да гидрирлашу реакция¬
сенең булуы мөмкин, бу вакытта пиперидин барлыкка килә:
Бу ике реакциянең тигезләмәләрен төзегез.
Азот атомы янында ирекле бер пар электроннары булу
белән пиридин аминга охшаган. Бу аның үзлекләрендә дә
чагыла: бүленмәгән пар электроннар якында ул үзенә про¬
тон куша ала, ягъни нигез үзлекләрен күрсәтә. Мәсәлән,
пиридин эремәсе лакмусны зәңгәр төскә кертә.
199
Пиридин, кислоталар белән реакциягә кереп, тоз хасил
итә. Амин (һәм аммиак) белән реакцияләрен язган кебек,
аныц хлорид кислотасы белән реакциясе тигезләмәсен
языгыз.
Барлык әйтелгәннәрдән чыгып, гетероциклик пиридин
кушылмасын — ароматик характерлы азотлы нигез дип
әйтә алабыз.
Пиридинныц ароматик һәм нигез үзлекләреннән фай¬
даланып төрле дару препаратлары, буягычлар, инсекти¬
цидлар һәм башка матдәләр синтезлыйлар; болардан тыш
пиридин тәмсез ис кертү максаты белән этил спиртын
денатуратлау өчен кулланыла.
НС — СН
u п
Пиррол НС СН — циклында бер азот атомы булган
V
I
н
биш буынлы гетероциклик кушылма. Ул — суда аз эрүчән
төссез сыеклык, пиридин шикелле үк, ул да ташкүмер су¬
маласында була.
Молекуласында кабатлы бәйләнешләр булуга таянып,
пирролга чиксез кушылма үзлекләре хас дип әйтә алабыз.
Чынлыкта исә ул аз сизелә торган ароматик характерлы.
Алты электронлы л-болыты хасил булуын монда ничек күз
алдына китерергә?
О-Бәйләнешләрен булдыру өчен, углерод атомнары өчәр
электроннарын биргәннән соң, уртак электрон болыты бул¬
дыруга алты электрон урынына фәкать дүрт р-электронын
гына бирә алалар. Азот атомында бнш валентлык электроны
булуын искә төшерик. Аларның өчесе водород атомы һәм
углерод атомнары белән бәйләнеш урнаштыруга китә, ә ике¬
се алты электронлы п-болыты ясауга катнаша. Пнридин-
нан аермалы буларак, бу электроннарны структур форму¬
лада нокталар белән боҗра эчеңдә тамгалау максатка яраш¬
лырак булыр: нс-СН
НС СН
NH
Пирролныц ароматик характерлы булуын гомуми фор¬
мула белән күрсәтергә мөмкин:
NH
200
Азот электроннарын бу очракта цикл эчендә ике нокта
белән тамгаларга мөмкин түгел. (Ни өчен?)
Яңа сорау туа: азот атомының пар электроннары моле¬
куланың гомуми л-системасына катнашуы аның үзлек¬
ләрендә чагыламы? Башка сүзләр белән әйтсәк, пирролның
пиридинныкы шикелле нигез үзлекләре бармы? Әгәр чик¬
ле рәттәге амин белән чагыштырганда анилинның нигез
үзлекләренең ни сәбәпле кимүен искә төшерсәк, пиррол¬
ның нигез үзлекләрен ни сәбәпле югалтуы ачыкланыр
(азотның нар электроннары молекуланың ароматик сексте¬
тына «алынган»).
Пиррол төрле органик кушылмалар, шул исәптән дару
матдәләре синтезлау өчен кулланыла. Молекулаларында
пиррол структуралары булуы—хлорофилл, гемоглобин
һәм кайбер аминокислоталар өчен характерлы күренеш.
*19. Тикшереп үткән гетероциклик кушылмаларның гомологлары
һәм тврле кушылмалары күп. Пирндннныц гомологи — этиллири
дннның структур формуласын тезегез. Җавап бер генә мәгънәлеме?
Аңлатыл бирегез.
*20. Пиридинии пиперидинга кайтару тигезләмәсен языгыз. Пине
ридинның: а) ароматик кушылма үзлекләре, б) нигез үзлекләре бармы?
Җавапны нигезләгез.
*21, Пиридин һам пиррол формулаларында азот атомының бүлен
магән пар электроннары тор леча билгеләнүен ничек аңлатырга?
*22. Пирролның нигез үзлекләре бик аз беленә. Аны гидрирлап
н,с СН,
табылган продукт — пирролидин Н,С СН, кәчле нигез булып са
NH
нала. Үзлекләрнең мондый үзгәреше ни сәбәптән килеп чыкты? Пир-
ролидинның хлорид кислотасы белән реакциясенең ионлы тигезләмә¬
сен языгыз.
*23. Ни очей пиридин суда яхшы эри, ә пиррол аз эри?
*24. Пирролның кислота үзлекләре аз (фенолныкына караганда
азрак). Мәсәлән, металлик калий белән ул пиррол калий тозын хасил
итә. Бу вакытта, сезнеңчә, кайсы водород атомы алмаштырыла? Ни
ечен ул мондый үзлек күрсәтә? Реакция тигезләмәсен языгыз.
§ 43. ПИРИМИДИН ҺӘМ ПУРИН НИГЕЗЛӘР
Составына азот кергән гетероциклларның типик вәкил¬
ләре — пиридин һәм пиррол турында алынган белемнәргә
таянып, молекуласында гетероатомы бердән артык булган
кушылмалар белән танышырбыз.
201
.< н
,сн
п N''
сн
ы'
с
—N
Пиримидин |
II.
Һәм пурин |
н
и
НС^
/сн
НС.
СН
'N
N
NH
төссез кристаллик матдәләр. Аларның беренчесе пиридин
кебек алты буынлы циклдан тора, тик аннан молекула¬
сында СН группасы урынында тагын бер гетероатом (азот)
булу белән генә аерыла. Икенчесе — бициклик матдә.
Аның молекуласында пиримидин һәм безгә билгеле пир-
ролның циклик структуралары үзара тоташкан кебек
урнашканнар. Монда да бер СН группасы икенче азот
атомына алмашынган.
Бу матдәләрнең ароматик структурасы ничек барлыкка
килүен һәм аларның ни өчен нигез үзлекләренә ия булу¬
ын (элегрәк тикшерелгәннәргә таянып) аңлатып карагыз.
Безне пиримидин һәм пурин үзләре түгел, бәлки яларга
хас структуралы матдәләр — пиримидин һәм пурин нигез¬
ләр кызыксындыра. Ә алар организмнарда аксым синте¬
зын башкаручы табигый югары молекуляр матдәләр —
нуклеин кислоталары составына керәләр:
Пиримидин нигезләр
NH,
I
N^'CH
Xk 7:н
О NH
Ц|пип
HN
-С
О
II
С
сн
II
NH
сн
Ураган л
о NH
Тимин
О
Пурин нигезләр
NHa
А
N C—N
1 П и
нс^ £ сн
N NH
О
II
HN С
I II
с г
HaN N
-N
1^Н
NH
Аденме
Гуьяин
Күргәнегезчә, алар — гаять катлаулы кушылмалар.
Башта алынган матдәләр — пиримидин һәм пурин белән
чагыштырганда, аларның составында һәм төзелешендә
нинди үзгәрешләр килеп чыгуын тикшерегез. Аларның
барысының да ни өчен уртак бер исем белән «азотлы
лигезләр» дип йөртелүен ачыклагыз.
202
*25. а) Пиримидин һәм пуринның углерод һәм (углерод атомы
янындагы) водород атомнарын билгеләмичә генә гадиләш терелгән
структур формулаларын, б) цитозин һәм аденинныд (яки урацил һәм
гуанинның) структур формулаларын алда әйтелгәнчә тәзегеа.
*26. Түбәндә гетероциклик кушылмаларның зур практик әһәмия¬
тен сурәтләү өчен кайбер матдәләрнең структур формулалары китерел¬
гән; химик күзлегеннән чыгып, аларга аңлатма бирегез:
N—С
II II
нс сн
Vh
сн2-сн-соон
NH,
Триптофан
(аминокислота)
Гистидин
{им ил ох в слота)
И^г—Cz KCH2—8O2ONa
h,c-Nn
C.H.
CHjOH
НОХ А СН2ОН
С-S с
В<5 витамины
(тире авыруларын
булдырмый)
Аяальгвв
(ялкынсынуга
карту чара)
11. АКСЫМНАР. НУКЛЕИН КИСЛОТАЛАРЫ
Без, углеводородларны һәм составында кислород булган
органик кушылмаларны өйрәнгәндә, түбән төзелешле кушыл¬
малар белән генә түгел, табигый югары молекуляр төзелешле
кушылмалар (полимерлар) белән дә танышкан идек. Хәзер
составына азот кергән табигый югары молекуляр төзелешле
матдәләр — аксымнар һәм нуклеин кислоталары белән таны¬
шырбыз.
5 44. АКСЫМНАР
Табигатьтә аксымнар. Аксымнар — организмның иң әһә¬
миятле состав өлеше. Алар барлык үсемлек һәм хайван орга¬
низмнарының күзәнәк протоплазмасы һәм төше составына
керә һәм тереклек өчен төп кирәкле матдә санала. Аксым
булмаган җирдә тереклек тә юк. «Тереклек — аксымлы җи¬
семнәрнең яшәү формасы ул»,— дип билгеләде Ф. Энгельс.
Аксымнарның молекуляр массасы уннарча һәм йөзләрчә
углерод берәмлеге белән үлчәнә, ә кайбер аксымнарның моле¬
куляр массасы берничә миллионга җитә.
Аксымнар организмда күп төрле функцияләр башкара.
Организмдагы тоташтыргыч, мускул һәм япма тукымаларны
тәшкил иткән пластик материал аксымнан тора. Аксым
ярдәмендә организмда матдә бер урыннан икенче урынга
күчерелә, мәсәлән, кислородны үпкәдән тукымаларга күчерү,
ә хасил булган углерод (IV) оксидын организмнан чыгару
аксымнар ярдәмендә башкарыла.
Аксымферментлар организмдагы күп төрле химик реак¬
цияләрдә катализатор хезмәтен үтиләр. Гормоннар (аларның
аксым табигатьлеләре дә бар) органнарның ярашып эшләвен
тәэмин итәләр. Организмда эшләнә торган антитәнчекләр
рәвешендә аксымнар организмны инфекциядән саклыйлар.
Организмда меңнәрчә төрле аксымнар була, һәм аларның
һәркайсы билгеле бер функцияне генә башкара. Организмда
уза торган һәрбер химик реакциянең үзенә генә хас аксым-
катализаторы (ферменты) була.
204
Аксымнарның организмда күн төрле функция үтәүләре
һәм тереклек процессларында аеруча әһәмиятле роль уйнау¬
лары нәрсәдән килә?
Аксымнарның составы Һәм төзелеше. Аксымнарның сос¬
тавы һәм төзелеше турындагы төп мәгълүматлар аларның
гидролиз продуктларын өйрәнгәндә тупланган. Теләсә нинди
аксымны гидролизлаганда а-аминокислоталар катнашмасы
табыла, ә аксымнар составында күбесенчә 20 аминокислота
була.
Аксымнарны тәшкил иткән кайбер «-аминокислоталар¬
ның төзелеше 7 нче таблицада китерелгән.
7 нче таблица. Аксымнардан аерып алынган кайбер
аиннокнсл ота ларның тезелеше
Кислотаның исеме
Формуласы
Глицин (аминосеркә)
Н—СН—СООН
1
NH,
Аланин
СН3—CH—СООН
ын2
Цистеин
hs-ch2—сн-соон
nh2
Серин
но—сн2—сн—соон
NH2
Глутамин
ноос—сн2—сн2—сн- соон
nh2
Лизин
h,n—ch2—ch2—ch2—ch2-сн-соон
/7=С\ NH2
Фенилаланин
/( У> -СН„ сн соон
nh2
Тирозин
НО—/^2)\-СН2—сн—соон
4—' nh2
Аксымны тәшкил иткән аминокислоталарның төзелешен
уртак бер структур формула белән күрсәтергә мөмкин икәне
ачык күренә:
R—СН—СООН
I
nh2
205
Радикал составында ачык һәм йомык чылбырлар һәм
төрле функциональ группалар булуы мөмкин. Югарыда ките¬
релгән аминокислота молекулаларының радикалында —SH,
—ОН, —СООН, —ЫН3 атомнар группасы һәм хәтта бензол
боҗрасы да бар.
Аминокислоталар ничек итен аксым молекуласын тәшкил
итә сон,?
XIX гасырның 80 нче елларында ук инде рус биохимигы
А. Я. Данилевский аксым молекуласында пептид группалары
булуын күрсәтә. Немец галиме Э. Фишер XX гасыр башла¬
рында полипептид теориясен тәкъдим итә. Бу теория аксым
молекуласын пептид (амид) бәйләнешләре аша тоташкан
аминокислоталарның озын чылбырыннан тора дип аңлата.
Э. Фишер һәм башка галимнәр молекулаларына үзара пеп¬
тид бәйләнешләр аша тоташкан төрле аминокислота калдыкла¬
ры кергән полипептидларны синтетик юл белән табуга ирешә.
Полипептид синтезлауны, гадиләштереп, түбәндәгечә күз
алдына китерергә мөмкин:
H,N—СН2—С j+H.-N-CH-C. —
СН, он
Гляцип Аллпин
° И о
1 J
- Н2Ы—СН2—C-N-CH-C^ Н,о
сн, х°н
Дниептнл
H,N—СН,—C-N CH-C ' J’+H — N—СН - С^
CH, LO_H_ □ сн2 он
SH
Ц истем и
о н
о н
» I
H,N—CH,—C-N-CH-CN CH C
' I I
CH. CH,
о
+ н,о
он
Аксым төзелеше турындагы полипептид теориясе хәзерге
вакытта кабул ителгән теорияләрдән санала. Табигый аксым¬
нар югары молекуляр төзелешле кушылма булу сәбәпле,
аларның полипептид чылбырында аминокислота калдыклары
206
50 нче рәсем. Аксым молекуласының беренчел структурасы,
күп тапкырлар кабатлана, һәм һәр аксымда аминокислота
звенолары тегәл бер тәртип, эзлеклелек белән урнаша.
Әлифбадагы билгеле сандагы хәрефләрдән төрле сүзләр
төзегән кебек, егерме аминокислота чиксез күп санда аксым
тәшкил итә ала.
Полипептид чылбырында төрле аминокислота звенола¬
рының чиратлашу эзлеклелеге аксым молекуласының
, беренчел структурасы дип атала (50 нче рәсем).
Рәсемдә күрсәтелгән сузынкы полипептид чылбырында
g аксымнар саны артык күп түгел (мәсәлән, табигый ефәк¬
нең — фиброиниың структурасы шундый). Күпчелек ак-
| сымнарның полипептид чылбырлары шактый урында
спиральсыман чорналган була. Полипептид чылбыр кабул
иткән пространство конфигурациясе аксымның икенчел
структурасы дип атала (51 нче рәсем). Мондый струк¬
тураның саклануы спиральнең күрше уралмаларындагы
—СО— һәм —NH— группаларын күп санлы водородлы
бәйләнешләр тотып торудан килә.
Полипептид чылбыр опиральгә чорналганда амино¬
кислота звеноларының радикаллары тышкы якка таба
юнәлеп урнашалар. Өченчел структура барлыкка китерүдә
моның әһәмияте аеруча зур. Өченчел структура ул —
спиральсыман чорналган полипептид чылбырның про-
странствода алган конфигурациясе (52 нче рәсем).
Өченчел структура полипептид чылбыр радикалла¬
рының функциональ группалары тәэсир итешүе нәтиҗә¬
сендә барлыкка килә. Мәсәлән, карбоксил һәм амино¬
группа бер-берсенә якынлашканда тоз күпере ясалырга
мөмкин, ә инде карбоксил группа белән гидроксил — кат¬
лаулы эфир күперен, ә күкерт атомнары дисульфид күпер¬
ләр (—S—S—) барлыкка китерәләр һ. 6.
207
51 нче рәсем. Аксым
молекуласының икенчел
(спиральсыман) структурасы.
52 нче рәсем. Миоглобин аксымы
молекуласының моделе (оченчел
структура!.
Функциональ группалары тышка карап торган чыгын¬
тылар һәм керентеләр рәвешендәге билгеле бер күләмле
конфигурацияле өченчел структура аксым молекуласы¬
ның специфик биологик активлыгын тәэмин итә.
Функциональ группалары күп төрле булу сәбәпле, аксым¬
нарны органик кушылмаларның безгә билгеле булган берәр
классына кертергә мөмкин түгел; анда төрле класс билгеләре
тупланган, алар бөтенесе бергә булганда өр-яңа бер сыйфат
бирәләр. Аксым ул — органик матдәләр үсешенең иң юга¬
рыгы формасы.
Аксымнарның үзлекләре. Төзелешләре аеруча катлаулы
булганлыктан, аксымнарның үзлекләре дә гаять күп төрле.
Аксымнарның бер төрлеләре, мәсәлән тавык йомыркасы¬
ның аксымы, суда эреп, коллоид эремә хасил итә, ә икенче
төрлеләре сыегайтылган тоз эремәләрендә эри. Кайбер аксым¬
нар бөтенләй эреми.
Аксым молекулаларында (аминокислота звеноларының
радикалларында) —СООН һәм — NH2 группаларының булуы
аксымнарны амфотер үзлекле итә.
Аксымнарның әһәмиятле үзлеген—аның гидролизла-
шуын без беләбез инде. Гидролизны ферментлар тәэсирендә
яки аксымны кислота яисә селте эремәсе белән җылытып
үткәрәләр.
208
Мисал өчен бер трипептидның тулы гидролиз реакция¬
сенең тигезләмәсен китерәбез:
ОН ОН
II , I II , I
H2N СН2 -C-J-N-CH - С—N—СН—СООН
но4н СН7Н0 - Н сн7
' I ' I
OH SH
H2N—СН2—СООН + H,N—СН—СООН + H2N—СН—СООН
сн2
ОН
сн,
SH
7 нче таблицадан файдаланып, табылган кислоталарга
исем бирегез.
Күп кенә факторлар (җылыту, радиация тәэсире, хәтта
көчле селкетү) йогынтысында аксым молекуласының конфи¬
гурациясе — аның икенчел һәм өченчел структурасы бозы¬
лырга мөмкин. Бу процесс аксымның денатурациясе дип ата¬
ла. Аның асылы молекуланың икенчел яки өченчел структу¬
расын тәэмин итүче водородлы бәйләнешләрнең, тоз һәм ион
күперчекләренең җимерелүеннән гыйбарәт. Бу бәйләнешләр
җимерелгәч, молекула үзенә хас булган специфик күләмле
формасын югалта, аның ориентациясе бозыла (53 нче рәсем),
һәм ул үзенең биологик тәэсирен югалта. Йомырканы пе¬
шергәндә, җылытып аш-су әзерләгәндә һәм башка очраклар¬
да аксымның денатурациясе була.
Бик нык җылыту аксымның
лән генә чикләнми, бәлки очу-
чан продуктлар аерылып чыгу
белән була торган таркалуын
да китереп чыгара.
Аксымнар үзләренә хас төсле
реакцияләр бирәләр, шул реак¬
цияләр буенча аларны башка
матдәләрдән аерып танырга мөм¬
кин. Мәсәлән, әгәр аксым эре¬
мәсенә куертылган нитрат кисло¬
тасы салсаң, эремә сары төскә ке¬
рә (бензол боҗралары нитрола-
ша). Лабораториядә нитрат кис¬
лотасы белән саксыз эш иткәндә,
бу реакцияне бармак битләрендә
дә күзәтергә мөмкин.
денатурациясен булдыру бе-
53 нче рәсем.
Денатурация вакытында
аксым молекуласының
конфигурациясе бозылу.
209
Аксымның организмда әверелешләре. Әйтеп үткәнебезчә,
хайваннар организмында аксымнар азык белән кергән аксым
аминокислоталарыннан төзелә. Шуңа күрә майлар һәм угле¬
водлар белән беррәттән аксымнар азыгыбызның мәҗбүри
компоненты булып санала.
Ашкайнату процессында ферментлар тәэсиреннән азык¬
тагы аксымнар гидролизлата. Ашкаэанында алар кечерәк
«кисәкләргә» — полипептидларга таркалалар, ә эчәкләргә
кергәч, аминокислоталарга кадәр гидролизлашалар. Амино¬
кислоталар эчәктәге тексыман үсентеләр аша канга сеңәләр
һәм организмның барлык тукымаларына, күзәнәкләренә үтеп
керәләр. Углеводлар һәм майлардан аермалы буларак, амино¬
кислоталар запаска тупланмый.
Организмда аминокислоталарның язмышы терлечә. Алар¬
ның төп массасы аксымнар синтезына китә, ә аксымнар үсеш
процессында организмның аксым массасын арттыруга, терек¬
лек эшчәнлеге нәтиҗәсендә сарыф ителгәннәрен яңартуга
тотыла. Аксымнар синтезы энергия йотылу белән бара. Ами
нокислоталар организмда аксым булмаган азотлы кушылма¬
лар, мәсәлән нуклеин кислоталары синтезлау өчен дә файда¬
ланыла.
Аминокислоталарның бер өлеше акрынлап таркалуга һәм
оксидлашуга дучар була. Бу вакытта азот аммиак рәвешендә
аерыла һәм, мочевинага әверелеп, организмнан сидек белән
чыгарыла. Углерод һәм водород исә углерод (IV) оксиды
белән суга кадәр оксидлашалар. Бу процесслар барганда
энергия аерылып чыга. Ләкин аксымнар, энергия чыганагы
буларак, углеводлар һәм майлардан кала икенче урында
тора. Аксымнарның организмдагы төп роле бөтенләй башка.
Сез аны хәзер үзегез дә җитәрлек тулы характерлый аласыз.
Аксымнарны химик синтезлау проблемасы. Аксымнарны
химик синтез юлы белән табу мәсьәләсе галимнәрне инде
күптәннән бирле кызыксындыра, ләкин бары соңгы вакытта
гына бу өлкәдә беркадәр уңышка ирешелде.
Ни өчен соң аксымны, башка югары молекуляр матдә¬
ләрне тапкан кебек, синтетик юл белән табу шушы вакытка
кадәр хәл ителмәгән? Моның сәбәбе аксым молекулалары¬
ның аеруча катлаулы төзелешле булуында. Безгә кирәкле
аксымны табу өчен, аны тәшкил иткән аминокислоталарның
составын белергә, беренчел структураны, ягъни аминокислота
звеноларының ничек чиратлашуын ачыкларга, аксым моле¬
куласының күләмле конфигурациясен төгәл билгеләргә, ә
аннан соң боларны ясалма юл белән булдырырга кирәк.
210
54 нче рәсем. Инсулин молекуласының беренчел структурасы.
Ике полипептид чылбыр (А һәм Б) S—S-күперләре белән үзара
тоташкан (рәсемдә кара төстәге турыпочмаклыклар белән күрсәтелгән).
Аминокислота звеноларының исемнәре кыскартып бирелгән.
Аксымның нинди аминокислоталардан торуын гидролиз
юлы белән билгеләү — иң җиңел ысул.
Беренчел структурасы нинди икәне ачыкланган беренче
аксым инсулин (1954 ел) була. Ул кандагы шикәр микъда¬
рын билгеле бер дәрәҗәдә тоту хезмәтен үти. Инсулинда ами¬
нокислоталарның урнашу тәртибен ачыклауга ун ел чамасы
вакыт китә. Инсулин молекуласының ике полипептид чыл¬
бырдан торуы, аларның берсендә — егерме бер, ә икенчесендә
утыз аминокислота калдыгы барлыгы билгеле була; чылбыр
үзара ике дисульфид күпере белән тоташкан (54 нче рәсем).
Хәзерге вакытта күп кенә аксымнарның, шул исәптән
аларның шактый катлаулы төзелешлеләренең дә, беренчел
структуралары ачыкланган.
Аксым табигатьле матдәләрне синтезлау беренче тапкыр
гипофизның ике төрле гормоны (вазопрессин һәм окситоцин)
мисалында үткәрелде. Алар — һәркайсы нибары тугыз амино¬
кислотадан торган, молекуляр массасы кечкенә булган поли-
пептидлар. Инсулинны һәм рибонуклеазаны синтезлау зур
фәнни казанышлардан санала. Мондый синтезның катлаулы-
лыгын күз алдына китерү өчен, бер мисал җитә: инсулинның
бер полипептид чылбырын табу өчен — 89 реакция, ә икен¬
чесе өчен 138 реакция үткәрергә туры килә.
14* 211
Аксымны ясалма юл белән табу ысулларын эзләгәндә, га¬
лимнәр аларның организмда синтезлау механизмын күп көч
куеп, җентекләп өйрәнәләр. Организмда синтез «йомшак*
шартларда, аеруча төгәл һәм гаять тиз башкарыла (аксым
молекуласы күзәнәктә нибары 2—3 секундта ясала). Организм¬
да аксымнарның башка төрле югары молекуляр матдәләр —
нуклеин кислоталары ярдәмендә синтезлануы ачыкланды.
Кешелек дөньясы биосинтез механизмын тирәнтен өйрән¬
гәч һәм күзәнәкләрдә бара торган процессларның законча¬
лыкларын белгәч, бәлки киләчәктә аксымны ясалма юл белән
табу да шул органик дөнья үсешендә камилләшкән принцип¬
лар нигезендә башкарылыр.
Хәзерге вакытта аксымнарны ясалма юл белән табу мик¬
робиологик синтез ярдәмендә башкарыла. Кайбер микро¬
организмнар үзләренә яраклы туклыклы тирәлектә үрчеп,
гаять күп микъдарда аксым массасы булдыра алалар икән.
Мәсәлән, үзагачтан гидролиз юлы белән спирт җитештерү
производствосы калдыкларында терлекчелек өчен азык чүп¬
рәсе әзерлиләр. Нефть парафиннарын файдаланып, микро¬
биологик синтез юлы белән аксым җитештерү дә бик тиз үсә.
Микроорганизмнар ярдәмендә башка төрле матдәләр дә, мәсә¬
лән, кайбер аминокислоталар, витаминнар җитештерелә.
Микробиологик синтез продуктларын терлекчелектә куллану
аның продуктлылыгын арттырырга мөмкинлек бирә.
1. Аксым молекуласында бер генә күкерт атомы бар дип уйлаган
очракта, составында 0,32% күкерт булган аксымның якынча моле¬
куляр авырлыгын исәпләп чыгарыгыз.
*2. Түбәндә формуласы язылган кушылма гидрол излашканда бар¬
лыкка килгән матдәләрнең формулаларын һәм исемнәрен языгыз:
ОН ОН он
II I II I II I
H2N—СН,—С—N—СН—С—N—СН—С—N—СН2—СООН
СН3 СН2
СООН свн6
*3. Өч төрле аминокислота калдыгым төрлечә урнаштыру юлы белән
ничә трииептид табарга мөмкин? 7 нче таблицадан өч аминокислота
сайлап алыгыз һәм алардан төзергә мөмкин булган барлык трипеп-
тидларның формулаларын языгыз.
*4. Аксым молекуласына 7 нче таблицада китерелгән барлык ами¬
нокислоталар керә дип уйлап, сезнеңчә, мондый аксымга хас саналган
химик реакцияләргә мисаллар китерегез.
5. Аксым молекуласын төзүдә водородлы бәйләнешләрнең нинди
роле бар? Үзлекләре водородлы бәйләнеш булуга бәйләнгән тагын
нинди матдәләр беләсез? Мисаллар китерегез.
212
6. Аксымнарның денатурацмясе нәрсә ул? Ул нәрсәдән килә? Де-
ватурациянең практик әһәмияте бармы?
7. а) Майлар, б) углеводлар, в) аксымнар гидролизлашканда орга¬
низмда нинди матдәләр хасил була? Гидролиз продуктлары кая китә,
һәм алар организмда нәрсәгә сарыф ителә?
8. Ни очен аксымлы азык урынына составында майлар һәм угле¬
водлар гына булган азыкны озак кулланырга ярамый?
И 1. Сөттә туклану матдәләренең өч төре дә — аксымнар, майлар һәм
углеводлар бар. Өегездә сөттән башта майны, аннан соң кислота белән
тәэсир итеп, аксымны аерып алыгыз. Әчегән сөтне чәй содасы салып
һәм сода салмыйча җылытканда, сөтнең ничек үзгәрүен чагышты¬
рыгыз. Бу күренешләрне аңлатыгыз.
2, Иң гади ысул кулланып: а) йоннан эрләнгән җепне киҗе-мамык
җептән, б) вискоза ефәкне табигый ефәктән, в) табигый күнне ясалма
күннән аерыгыз.
6 45. НУКЛЕИН КИСЛОТАЛАРЫ
Нуклеин кислоталары — табигый полимерлар алар.
Аларны XIX гасырда ук инде күзәнәк тешләрендә (латинча
nucleus — төш) табалар,'ләкин нуклеин кислоталарының
организм тереклегендәге роле галимнәргә озак вакытлар
буена билгеле булмый. Моннан нибары берничә дистә ел
элек кенә нуклеин кислоталарының төзелеше ачыклана,
аларның нәселдәнлек информациясен саклау һәм күчерүдә
төп рольне уйнаулары һәм күзәнәктә аксым синтезын тәэ¬
мин итеп торулары билгеле була. Табигать фәннәрендәге
бу гаять зур казаныш үзенең әһәмияте ягыннан атом энер¬
гиясен үзләштерү, космонавтикадагы уңышлар, хәзерге
электрон-хисап техникасын файдалану белән янәшә тора.
Нуклеин кислоталарының составы. Табигый югары
молекуляр матдәләрнең, мәсәлән, крахмал, целлюлоза, ак¬
сымнарның составы турында без аларның гидролизы про¬
дуктларына карап фикер йөрттек. Бу вакытта нинди про¬
дуктлар ясалуын исегезгә төшерегез. Нуклеин кислотала¬
ры да гидролизлата, нәтиҗәдә, крахмал һәм целлюлоза
очрагындагы кебек, бер генә продукт түгел, бәлки, аксым¬
нардагы кебек, берничә продукт хасил була: а) углевод
(пентоза), б) азотлы гетероциклик кушылмалар (пирими¬
дин һәм пурин нигезләр), в) ортофосфат кислотасы.
Организмнарда ике төрле нуклеин кислотасы була: ри¬
бонуклеин (РНК) һәм дезоксирибонуклеин (ДНК) кисло¬
талары. Исемнәреннән үк күренгәнчә, алар бер-берсеннән
углевод компонентының — пентозаның характеры белән
213
аерылалар. Кислоталарның бер төрлеләре гидролнзлаш-
канда рибоза барлыкка килә, Һәм бу очракта ул — рибо¬
нуклеин кислоталары (РНК) дигән сүз; икенче төрлелә¬
ренең гидролизы вакытында дезоксирибоза барлыкка
килә, болары — дезоксирибонуклеин кислоталары (ДНК).
/ Нуклеин кислоталары бер-берсеннән составларына
кергән азотлы нигезләр белән дә аерылалар. РНК һәм
ДНК ның икесенә дә без танышкан биш нигезнең дүрте-
шәре керә. Монда, һичшиксез, пурин нигезләрнең икесе
дә — аденин һәм гуанин, пиримидин нигезләрнең берсе —
цитозин керә. Нуклеин кислоталарындагы нигезләрнең
дүртенчесе (икенче пиримидин) төрлечә була: РНК соста-
нындагысы — урацил, ә ДНКдагысы — тимин.
Нуклеин кислоталарының молекуляр массасы да төр¬
лечә; РНКның массасы берничә дистә меңнән берничә
миллионга кадәр җитә.
Нуклеотидларның төзелеше. Нуклеин кислоталарының
макромолекулалары ничек төзелгән дигән сорау туа. Крах¬
мал һәм целлюлоза молекулаларында глюкоза молекулала¬
рының калдыклары, ә аксымнарда (полипептидларда) төрле
аминокислота калдыклары кабатланган шикелле нуклеин
кислоталарында кабатлана торган структур звенолар бармы?
Нуклеин кислоталарының структур звенолары нуклео
тидлар дип йөртелә. Аларны, таркалу процессын ахырга
ча җиткермичә соңгы продукт ясалганчыга кадәр, арадаш
гидролиз продукты буларак аерып алалар. (Крахмал һәм
целлюлоза гидролизында арадаш продуктларны исегезгә
төшерегез.) Нуклеотидларны төзүдә башлангыч компо¬
нентларның өчесе дә катнаша: пентоза (рибоза яки дезок¬
сирибоза), азотлы нигез (пиримидин яки пурин) һәм орто¬
фосфат кислотасы.
Ике нуклеотидның формулаларын китерәбез:
214
Бу нуклеотидлардагы азотлы нигезләрнең формулала¬
рын моннан элек тикшерелгәннәре белән чагыштырып ка¬
расак, беренчесенә — цитозин молекуласының калдыгы,
ә икенчесенә гуанин молекуласының калдыгы керүен кү¬
рербез (соңгысы бераз үзгәртеп язылган, ләкин анда азот
атомнарының тоташу тәртибе сакланган), һәр очракта
азотлы нигез рибоза молекуласының калдыгы белән то¬
ташкан, ә ул исә. үз чиратында, ортофосфат кислотасы
молекуласының калдыгы белән тоташкан. Нуклеотидлар¬
ның монда китерелгәннәре рибонуклеотидлар булып сана¬
ла. Алар дезоксирибонуклеотидларның тезелешен чагыл¬
дырсын очен, формулаларга нинди үзгәрешләр кертергә
кирәк?
Полннуклеотмдларныц тезелеше. Хәзер полинуклеотид
макромолекуласында нуклеотидларның үзара ничек тота¬
шуларын ачыкларга кирәк. Мисал эчен ДНК фрагменты¬
ның төзелешен карарбыз:
НО—Р—О
о
Беренче карашка мондый структура аңлап булмаслык
катлаулы кебек күренә, ләкин, әгәр нуклеотидларның төзе¬
лешен яхшы аңлаган булсагыз, аңа төшенү бик җиңел. ДНК
макромолекуласының төп структур сызыгын күзәтегез: ул
215
үзара бер-бер артлы тоташкан пентоза һәм ортофосфат
кислотасы звеноларыннан гына тора. Азотлы нигезләр
углевод звеноларына ян-яктан гына тоташканнар; кай¬
чагында аларны нуклеин кислотасы макромолекуласының
«чачагын» тәшкил итә дин тә әйтәләр. Ортофосфат кисло¬
тасының калдыклары, углеводород звеноларын үзара то¬
таштырып, бер пентоза молекуласының өченче углерод
атомы гидроксилы белән икенче пентоза молекуласының
бишенче углерод атомы гидроксилы арасында химик бәй¬
ләнеш (су молекуласы аерылып чыгу исәбенә) барлыкка
китерүенә игътибар итегез. Монда фосфат кислотасы кал¬
дыкларының диссоциацияләшергә сәләтле тагын берәр
гидроксил группасы саклана, нәкъ менә бу хәл макромоле¬
кулаларга кислота үзлекләрен тәэмин итә. Азотлы гетеро
цикллар булуы исә аларга бер үк вакытта нигез үзлек¬
ләрен бирә.
Нуклеин кислоталары тезелешендәге иң әһәмиятле
үзенчәлек шул: пентоза һәм фосфат кислотасы калдык
ларыннан торган төп чылбырга «тагылган» азотлы (пири¬
мидин һәм пурин) нигезләрнең нинди эзлеклелектә урна¬
шуы, башкача әйтсәк — макромолекулада нуклеотидлар
ның эзлеклелеге. Аларның күзәнәктәге биологик функция¬
ләре нуклеотидларның билгеле эзлеклелегенә, ягъни нук¬
леин кислоталарының беренчел структурасына бәйләнгән.
ДНКныц икеле спирале. Хәзер дезоксирибонуклеин
кислоталарын җентекләбрәк тикшерүгә күчәрбез. Бирел
гән биологик тор нәселдәнлегенең барлык информациясе
нәкъ шул дезоксирибонуклеин кислоталары молекула
ларында нуклеотидларның төрле эзлеклелеге рәвешендә
шифрла нган.
ДНК макромолекулалары уртак бер күчәр тирәсендә
бөтерелгән ике чылбыр спираленнән тора. Бу аларның
икенчел структурасы (55 нче рәсем). Икенчел структураны
саклауда, аксымнардагы шикелле үк, водородлы бәйлә¬
нешләрнең әһәмияте аеруча зур. Аксым молекуласы ра
дикалларыннан аермалы буларак, алар монда спиральнең
тышкы ягында түгел, бәлки аның эчке ягындагы макро¬
молекулаларның төрле чылбырларындагы пиримидин
һәм пурин нигезләр арасында барлыкка киләләр.
Моңа кадәр без водородлы бәйләнешләрнең шактый
зур (өлешчә булса да) уңай корылмалы водород атомнары
белән тискәре корылмалы кислород атомнары арасында
барлыкка килүен белә идек. Без монда азот атомнарының
216
җитәрлек тискәре корылмасы булганда, мондый бәйлә¬
нешләрнең шулай ук водород һәм азот атомнары арасын¬
да да урнаша алуын күрербез. Түбәндә ДНКның төрле
чылбырларының азотлы нигезләре арасындагы бәйләнеш
мисаллары китерелгән; водородлы бәйләнешләр барлыкка
килгән атомнарда уңай һәм тискәре корылмаларның ки¬
леп чыгуын аңлатыгыз:
Азотлы нигезләр бер-берсен тулыландыргандай билгеле
бер принцип буенча тоташалар: пиримидин нигезләр фә¬
кать пурин нигезләр белән һәм кире¬
сенчә тоташалар, монда молекула чыл¬
бырлары арасында һәрвакыт өч гетеро-
циклдан (икедән дә Һәм дүрттән дә тү¬
гел) торган бердәй баскычлар ясала. Мо¬
ның белән барлык ДНК молекуласы тө¬
зелешендә тигез таралып урнашу тәэмин
ителә. Икеле спиральнең гомуми схема¬
сында (55 нче рәсем) исемнәренең бе¬
ренче хәрефләре белән тамгаланган азот¬
лы нигезләр арасындагы водородлы бәй¬
ләнешләр күрсәтелгән.
Нуклеин кислоталарының организм¬
дагы функцияләре гомуми биология
курсында каралачак. Сез анда нуклеин
кислоталарының күзәнәкләрдә ничек
синтезлануы, нәселдәнлек билгеләренең
ДНК молекулалаларына (нуклеотидлар
эзлеклелеге) ничек салынуы, төрле нук¬
леин кислоталарының аксһм синтезы¬
на ничек катнашуы, ген нәрсә ул һәм
аңа ничек йогынты ясап булуы турында
белерсез.
Аксымнар һәм нуклеин кислоталары
химиясе һәм биохимиясе үзләренен үсе¬
ше белән яңа фәннәр — биоорганик хи¬
55 нче рәсем.
ДНКның икеле
спираленең
тезелеш схемасы.
9 Б 177
217
мия, молекуляр биология, геннар инженериясен барлыкка
китерде. Алар, тереклек серләренә бик тирән үтеп керү
һәм ирешелгән закончалыкларны практик максатларда
һаман киңрәк файдалану өчен, кешелек дөньясына исәп-
сез-хисапсыз мөмкинлекләр ача.
*9. Үзендәге барлык элементларның атомнарын тулысымча билге
ләп, берәр нуклеотидный структур формуласын сурәтләгез.
*10. Нуклеотидларда химик бәйләнешләр урнаштыра дип фараз
ителгән реакция тигезләмәләрен тезегез: а) ортофосфат кислотасы
молекуласының ике рибоза (яки дезоксирибоза) молекуласы белән,
б) азотлы нигезләрнең пентоза белән.
*11. ДНК молекуласында пурин һәм пиримидин звенолары саны¬
ның бердәй булуын ничек аңлатырга?
*12. Метан -161,5СС һәм метилен -7,6 QC температурада кайный.
By аерманы ничек аңлатырга?
*13. Сезгә билгеле табигый югары молекуляр кушылмаларны мөм¬
кин кадәр күбрәк билгеләре буенча үзара чагыштырыгыз.
12. СИНТЕТИК ЮГАРЫ МОЛЕКУЛЯР ТӨЗЕЛЕШЛЕ
МАТДӘЛӘР ҺӘМ АЛАР НИГЕЗЕНДӘГЕ
ПОЛИМЕР МАТЕРИАЛЛАР
Органик химияне өйрәнгәндә, без табигый югары молеку¬
ляр төзелешле матдәләр — каучук, крахмал, целлюлоза, ак¬
сымнар, нуклеин кислоталары белән җентекләп таныштык.
Ә инде синтетик югары молекуляр төзелешле матдәләр ту¬
рында исә үзләре синтезлана торган түбән молекуляр төзе¬
лешле матдәләрне өйрәнүгә бәйле рәвештә кыскача гына
әйтелде. Шуңа карамастан синтетик югары молекуляр төзе¬
лешле матдәләр һәм алар нигезендә табыла торган полимер
материаллар — күп санлы пластмассалар, сүсләр, каучуклар —
промышленностьның барлык тармаклары, авыл хуҗалыгы,
транспорт, элемтә үсешендә һаман саен зуррак әһәмияткә ия
була бара. Алар илебездә фән техника прогрессын тизләтүдә
әһәмиятле фактор булып санала; көндәлек хезмәт эшчәнле-
гендә, көнкүрештә без даими рәвештә алар белән эш итәбез.
Синтетик югары молекуляр төзелешле матдәләр химиясе
һәм халык хуҗалыгында файдаланыла торган иң әһәмиятле
полимер материаллар белән танышырбыз.
§ 46. СИНТЕТИК ЮГАРЫ МОЛЕКУЛЯР ТӨЗЕЛЕШЛЕ
МАТДӘЛӘРНЕҢ ГОМУМИ ХАРАКТЕРИСТИКАСЫ
Полимерларның төзелеше. Чиксез углеводородларның
полимерлашу продуктлары (ниндиләре?) мисалында без син¬
тетик югары молекуляр кушылмаларның төзелеше турында
белдек. Полимерлашу реакциясе, полимер, макромолекула —
безгә таныш төшенчәләр. Шулай ук без полимерлашу реак¬
циясе тигезләмәсен кыска формада яза беләбез, мәсәлән,
пропиленнан полипропилен табу реакциясе;
пСН2=СН —*(-СН2—СН—),
CHS СН3
Өстәмә берничә билгеләмә кертербез. Полимер синтезлана
торган түбән молекуляр матдә — мономер дип, макромоле¬
кулада күп тапкырлар кабатлана торган атомнар группасы
структур звенолар дип атала.
219
56 нчы рәсем. Полимер
маиромолекулиларынык
геометрик формасы:
А — сызыкча; Б — тармакланган;
В — пространстволы (оч үлчәнешле).
Мономер молекуласы һәм
макромолекуланың структур
звеносы составлары белән бер¬
дәй, ләкин тезелешләре ягын¬
нан терлечә. Әлеге очракта
пропилен молекуласында атом¬
нар арасында икеле бәйләнеш
бар, ә полипропиленның струк¬
тур звеносында ул юк (ни сә¬
бәпле?).
Полимер формуласындагы
л саны макромолекулада ннчә
мономер молекуласы кушылу
ын күрсәтә. Ул полимерлашу
дәрәҗәсе дип атала.
Полимер макромолекуласы¬
ның геометрик формасы тор
лечә булырга мемкин (56 нчы
рәсем): я) сызыкча структура
лы (сынык сызыксыман); аның структур звенолары, берсе
артыннан икенчесе килеп, бер бер артлы тоташкан озын чыл¬
быр тәшкил итә (безгә билгеле полиэтилен Һәм полипропилен
нәкъ шундый структуралы), б) тармакланган (без аны крах
мал мисалында очраттык), в) сызыкча молекулалары үзара
химик бәйләнешләр белән тоташкан пространстволы струк¬
туралы (мәсәлән, вулканлаштырылган каучукта — резинада).
Полимерларның геометрик формасы аларның үзлекләрендә
бик нык сизелә, без моны соңрак күрербез.
Полимерлар кристаллик һәм аморф тезелешле булырга
мөмкин.
Полимерларның кристаллылыгы дигәннән андагы макро
молекулаларның тәртипле (параллель) урнашуын аңлыйлар.
Аморфлы төзелеш тәртипле урнашу булмау белән харак¬
терлана. Бу күренешне полимер молекулалары тулысынча
кристаллик хәлдә, яки тулысынча аморф хәлендә дип аңлар¬
га ярамый. Гадәттә, кристаллик һәм аморф өлкәләр аша бер
үк молекулалар уза: макромолекулалар өлкәләрнең берсендә
бер-берсенә карата тәртиплерәк, ә икенчеләрендә тәртипсезрәк
урнашалар (57 нче рәсем). Бер үк полимерның крнстал-
лылыгы үзгәрергә мөмкин. Мәсәлән, полимерны сузу аның
молекулаларының параллель урнашуына китерә, бу вакытта
аның кристаллылыгы арта.
220
Полимерлар өчен молекуляр масса төшен¬
чәсенең кайбер үзенчәлекләре бар. Полимер¬
лашу процессында үсә барган полимер чыл¬
бырының кайчан өзелүенә бәйле рәвештә
макромолекулага төрле сандагы мономер
молекулалары тоташа. Шул сәбәпле, төрле
озынлыктагы һәм, шулай булгач, төрле мас¬
салы макромолекулалар хасил була. Шуңа
күрә мондый матдәнең күрсәтелгән моле¬
куляр массасы аның уртача кыйммәтен генә
белдерә, аерым молекулаларның массасы бу
кыйммәттән теге яисә бу якка таба авышыр¬
га мөмкин. Мәсәлән, полимерның молекуляр
массасы 28 000 икән, анда чагыштырма мас¬
сасы 26 000, 28 000. 30 000 һ. б. молекулалар¬
ның да булуы ихтимал. Полимерларның мо¬
лекуляр массасы үзенчәлекләрен белүдән чы¬
57 иче рәсем.
Полимерларның
аморф һәм крис¬
таллик тезелеше;
а — кристаллик
тезелешле елеше;
б — аморф тезе
лешле елеше.
гып, полимерлашу дәрәҗәсе алынган үрнәк
полимерның барлык молекулалары өчен дә даими булу-бул-
мавы турында сез үзегез дә әйтә аласыз.
Полимерларның үзлекләре. Полимерларның төзелеш
үзенчәлекләреннән нинди нәтиҗәләр чыгуын тикшереп
карыйк.
Түбән молекуляр төзелешле матдәләр, гадәттә, бил¬
геле бер эрү-кайнау температуралары булу һәм башка
константаларның булуы белән характерлана. Әгәр дә без
сызыкча структуралы берәр полимерны җылытып кара¬
сак. аның башта йомшаруын, аннары температура кү¬
тәрелгән саен әкренләп эрүен һәм үзле сыеклыкка әве¬
релүен күрербез. Полимерны куарга теләп, җылытуны
дәвам иттереп карыйк. Без полимерның куыла алма¬
вын, бәлки химик таркалуга дучар булуын күрербез.
Пространстволы структуралы полимерларны җылыткан¬
да, алар хәтта үзле сыеклыкка да әверелеп тормыйча
таркалалар.
Полимерларның күбесе эрү>фнлекләре начар булу бе¬
лән характерланалар. Сызыкча структуралы матдәләр теге
яисә бу эреткечләрдә, бик кыенлык белән булса да эреп,
бик үзле эремәләр хасил итәләр. Пространстволы полимер¬
лар бөтенләй эремиләр. Аларның кайберләре, мәсәлән,
резина эреткечләрдә бүртә генә.
221
Механик яктан аеруча нык булулары полимерларның
әһәмиятле үзлекләреннән санала, башка үзлекләре (җиңел¬
леге, химик биреш мәүчәнлеге һ. 6.) белән бергә, полимер¬
ларны киң кулланырга мөмкинлек бирә. Кагыйдә була¬
рак, пространстволы структуралы полимерлар бигрәк тә
нык булулары белән аерылып торалар. Полимерларның
мондый үзлекләрен ничек аңлатырга?
Матдә эресен, ларга әйләнсен яки эремә хәленә килсен
өчен, җылытып яки эреткеч белән тәэсир итеп, аның моле¬
кулалары арасындагы үзара тартылу көчен җиңәргә ки¬
рәк, Югары молекуляр матдәнең молекулалары арасында
тәэсир итешү көче түбән молекуляр матдәнекенә караган¬
да шактый зур, чөнки алар бер-берсенә гаять күп санда¬
гы звенолар аша тартылалар. Җылыткан чакта полимер
йомшара башлый, бу исә аерым макромолекулалар ара¬
сындагы тәэсир итешү көченең кимүен һәм җылылык
хәрәкәте тәэсирендә аларның хәтта бер-берсенә карата
урын алыштыра алуын күрсәтә. Эрерәк макромолекулалар
арасында тәэсир итешү көче зуррак була, һәм, хәрәкәт
итәрлек хәлгә китерү өчен, мондый макромолекулаларны
ныграк җылытырга кирәк. Югары молекуляр матдәләр
нең билгеле бер эрү ноктасы булмавы нәкъ шуның белән
аңлатыла.
Ә инде матдәне кудыру өчен, аны тагын да югарырак
температурага кадәр җылытырга кирәк. Полимерларның
зур молекулалары, ихтимал, бик нык җылытканда гына
очучан хәлгә килергә мөмкиндер. Ләкин алар югары тем
ператураларны күтәрә алмыйлар, атомнар арасындагы
химик бәйләнеш өзелә, һәм, кудыру процессы башланганга
кадәр үк, матдә таркала башлый.
Эреткечләрнең кечкенә молекулалары ярдәмендә дә
макромолекулаларны бер-берсеннән аеруы кыен. Сызыкча
структуралы полимерларда моны эшләргә мөмкин әле.
Ә пространстволы структуралы полимерларны эретеп бул¬
мый, чөнки аларның сызыкча молекулалары үзара химик
бәйләнешләр белән «тегелгән*. Әгәр мондый бәйләнешләр
артык күп булмаса, эреткеч молекулалары, полимер эченә
үтеп кереп, аны бүрттерә.
Югары молекуляр кушылмаларның механик ныклыгы
да молекулаара көчләрнең зур булуы белән аңлатыла.
Полимерларны синтезлау. Югары молекуляр матдә¬
ләрне синтезлауда күбесенчә ике ысул — түбән молекуляр
222
тезелешле матдәләрне полимерлаштыру һәм ооликонден-
сацияләү кулланыла.
Без полимерлашу реакциясенең, молекулалар үзара
кушылып, зуррак молекулалар хасил нтү процессы икә¬
нен беләбез инде. Мондый реакциягә нинди матдәләр керә
ала? Этилен, пропилен һәм башка матдәләрнең (бу реак¬
ция белән без шулар мисалында танышкан идек) тезе¬
лешләрен чагыштырып карасак, без аларның молекула¬
ларында икеле бәйләнешләр булган кушылмалар икәнен
җиңел күреп алырбыз. Бу очраклы туры килү түгел. Юга¬
ры молекуляр матдә барлыкка килсен өчен, мономерның
һәр молекуласы кимендә башка ике молекула белән («сул
яктан» һәм «уң яктан») тоташа алырга тиеш. Чиксез
кушылмалар ясалу нәкъ шушы шартка туры килә, чонки
молекулада кабатлы бәйләнешләрнең берсе өзелгәндә ике
валентлык бушанып, башка молекулалар белән тоташу
мөмкинлеге туа.
Башлангыч мономерны гомуми формула СНг=СН
X
белән билгеләп (монда X — этилен молекуласында во¬
дород атомын алмаштыручы атом яки атомнар груп¬
пасы), полимерлашу процессын җентекләбрәк тикше¬
рербез.
Полимерлашкан чакта мономер молекулалары, шундук
үзара тоташып, макромолекула барлыкка китерәләр дип
уйларга ярамый. Процесс еш кына ирекле радикаллар
ясалу белән акрынлан бара. Макромолекула үзенең үсә
башлаган вакытыннан алып үсеше тукталганга кадәр
ирекле радикалдан, ягъни реакциягә керү сәләте зур бул¬
ган кисәкчектән гыйбарәт: ул, мономер молекулаларын¬
дагы икеле бәйләнешләрне өзеп, һаман саен яңа мономер
молекулаларын үзенә тоташтыра.
Ирекле радикаллар ясалу башлансын өчен, мономерга
бик аз гына микъдарда инициатор — ирекле радикалларга
таркалуга сәләтле тотрыксыз кушылма өстиләр. Мондый
радикалны R- белән билгеләрбез (символ янындагы нок¬
та сыңар электронны күрсәтә). Ирекле радикал мономер
молекуласы белән бәрелешкәндә, аның электроны я-бәй-
ләнешкә тәэсир итә һәм аның бер электроны белән парла¬
ша; радикалның мономер молекуласы белән ковалент
бәйләнеш әнә шулай урнаша. я-Бәйләнешнең икенче
223
электроны ирекле килеш кала, нәтиҗәдә бетен кисәкчек
ирекле радикалга әверелә;
„I ! .. .. „
R-» СН,:СН — R:CH,:CH-
’I I
X X
Барлыкка килгән ирекле радикал мономерның икенче
молекуласына тәэсир итеп, аны үзенә тоташтыра, нәтиҗә¬
дә яңа радикал барлыкка килә;
R:CH2:CH ■' + СН, |сн — R:CH,:CH;CH,:CH *
I *1 I II
XX XX
Чылбыр реакциясе барышында молекулаларның шун¬
дый бер-бер артлы ялгануы чылбыр өзелгәнче дәвам итә
(мәсәлән, үсә торган радикаллар үзара тоташканда өзелү).
Реакция нәтиҗәсендә молекуляр массасы ун һәм йөз мең¬
нәрчә булган полимер табыла.
Поликонденсация реакциясе — өстәмә түбән молекуляр
продукт (күбесенчә су) аерылып чыгу белән бара торган
түбән молекуляр матдәләрдән югары молекуляр матдәләр
ясалу процессы.
Поликонденсация реакциясе барсын өчен, шулай ук
башта алынган матдә молекулаларының башка ике моле
кула белән реакциягә керүе кирәк. Ләкин бу очракта ул
кабатлы бәйләнешләр исәбенә түгел, бәлки молекулаларда
атомнарның кимендә ике функциональ группасы булу
аркасында ирешелә. —СООН һәм —NH2 функциональ
группалары булган аминокислоталарны өйрәнгәндә, без
мондый реакция мисалын күргән идек иңде.
Мәсәлән, пептңдлар түбәндәгечә ясала:
О н u Н о _
4 s
H2N СН2—С • H-rN—СН—С « Н , N сн2-сү+ ...» —
>оц снэ »ОҢ' 'ОН/
он он о
.... ,... J I II I II
— HjN—СН, C-N СН С-N-CII,-С— ... + »Н,О
сн,
Поликонденсация реакциясенә аминокислоталар очра¬
гындагы кебек молекуласында төрле функциональ группа¬
лар булган матдәләр генә түгел, бәлки молекуласында бер
үк төрле функциональ группалар булган матдәләр дә керә.
224
Мондый очракта чылбырның үсеше булсын өчен, функ¬
циональ группалары беренче матдә белән тәэсир итешә ала
торган икенче матдәнең катнашуы кирәк.
Поликонденсациянең мондый торен схематик рәвештә
днкарбон кислотасының ике атомлы спирт белән реак¬
циясе тигезләмәсе аша күрсәтергә мөмкин:
% Ч Z-.
/С-<СН1).-С<'+ Н О-(СНг)„-О’Н + (CHj).-C/* ... —
но , он.' ’ло7; Г оң'
о о о о
1 _ к 1 „
С-(СНг),-С-О (СН2)„ о—С—(СНЛ -С— + „11.0
но
*!• —ОН?—СП,— ве ни очей полиэтиленның структур звеносы JU*“
исәпләү Кабул ителгән? Ни очей -СН; не түгел?
*2. Мономер молекуласы белән яннан ясала торган полимерның
структур звеносы арасында нинди уртаклык һәм нинди аерма бар?
*3. Аеруча киң таралган полимер полихлорвинилның (полнвипил
хлорид) тезелеше:
-сн.-си-сн.-сн-сн.^н-.
Cl Cl CI
Полимерның структур звеносын табыгыз һәМ шуннан чыгып МОно-
мерныц структур формуласын билгеләгез.
*4. Молекуляр массасы 500 чамасы булган полиэтилен — үзле сыек¬
лык. Шундый полиэтиленның полимерлашу дәрәҗәсен исәпләп чыга¬
рыгыз.
*5. «Полимерларның молекуляр массасы» тонкичәсенең нинди үэен
чалеге бар?
*в. а) Югары молекуляр кушылмаларның очучан булмавын, б) алар
иың эремәләренең үзле булуын ничек аңлатырга?
т7. Макромолекуланың озынлыгы артканда сызыкча полимерның
ныклыгы артуын ничек аңлатырга?
*в. Полимер макромолекулаларының молекуляр авырлыклары ара
сындагы аерма никадәр зур булса, полимерның эрү температуралары
интервалы да шулкадәр зур була һәм киресенчә. Бу күренешне аңла
тыгыз.
*в. Инициатор һәм катализатор бе|> үк мәг-ьнале тшиеичәләр түгел.
Аларның принципиаль аермасы нәрсәдә?
*М>. а) Полимерлашу, б) поликонденсация реакциясенә керә торган
матдәләрнең нинди характерлы билгеләре булырга тиеш?
*11. Полимерлашу нәтиҗәсендә табылган макромолекуланың масса¬
сы авы тәшкил иткән молекулалар массаларының суммасына тигез. Бу
раслау поликонденсация pea к ңи Ясе нигезендә табылган матдәләргә
карата да кулланыламы? Җавабыгызны аңлатыгыз.
225
§ 47. ПЛАСТМАССАЛАР
Полимерлар нигезендә ясалучы, җылытканда тиешле фор¬
мага кереп, суытканнан соң шул форманы саклый торган
материалларны пластмассалар дип атыйлар. Җитештерү мас¬
штаблары буенча алар полимер материаллар арасында берен¬
че урында торалар. Механик ныклыгы зур, тыгызлыгы кечке¬
нә, химик яктан бик тотрыклы булулары белән беррәттән,
алар яхшы җылылык изоляторы, электр изоляторы үзлек¬
ләренә ия һ. б. Пластмассаларны арзан чималдан җитеште¬
рәләр, алар эшкәртүгә җиңел бирелә һәм алардан бик күп
төрле әйберләр ясарга мөмкин. Болар барысы да халык хуҗа¬
лыгының барлык тармакларында һәм техникада, көндәлек
тормышта аларның киң кулланылуын тәэмин итә.
Пластмассаларда полимердан тыш (еш кына аны сумала
диләр) һәрвакытта да диярлек материалга билгеле сыйфат
бирүче башка компонентлар була; полимер матдәсе алар өчен
бәйләгеч матдә булып санала. Пластмасса составына: мате¬
риалның үзкыйммәтен киметүче һәм аның механик үзлек¬
ләрен яхшырта торган тутырмалар (агач оны, тукыма, ас¬
бест, пыяла сүс һ. б.), эластиклыгын арттыра, уалучанлыгын
бетерә торган пластификаторлар (мәсәлән, югары температу¬
рада кайнаучы катлаулы эфирлар), эшкәртү процессында һәм
файдаланганда пластмассаның үзлекләре саклануга булыш¬
лык итүче стабилизаторлар (антиоксидантлар, яктылык
стабилизаторлары), материалны тиешле төскә кертүче буягыч¬
лар Һ. б. матдәләр керә.
Пластмассалар белән дөрес эш итү өчен, аларны ясаучы
полимерларның термопластик үзлеклеме әллә термореак-
тивмы икәнен белергә кирәк.
Термопластик полимерлар (мәсәлән, полиэтилен) җылыт¬
канда йомшаралар һәм бу хәлдә формаларын бик җиңел
үзгәртәләр. Суынганда алар яңадан каты хәлгә кайталар һәм
бирелгән форманы саклыйлар. Яңадан җылытканда алар
тагын йомшаралар, һәм аларны икенче төрле яңа формага
кертеп була һ. б. Термопластик полимерлардан җылыту һәм
басым ясау юлы белән төрле әйберләр ясарга һәм, әгәр кирәк
булса, аларны яңадан шул ук юл белән эшкәртергә мөмкин.
Термореактив полимерлар җылытканда башта пластик
булып китәләр, ләкин аннары пластиклык үзлеген югалталар,
җылытканда йомшармый һәм эреткечләрдә эреми торганга
әвереләләр, чөнки аларның сызыкча макромолекулалары
үзара химик тәэсир итешү аркасында (каучук резинага әве¬
226
релгәндәге кебек) полимерның күләмле структурасы бар¬
лыкка килә. Мондый материалны яңадан эшкәртеп яңа әйбер
ясарга мөмкин түгел: ул, пространстволы структура алган¬
лыктан, яңадан эшкәртү өчен кирәкле пластиклык үзлеген
югалта.
Полимерлар турында гомуми мәгълүматлардан чыгып,
киң таралган кайбер полимерлар белән танышырбыз.
Полиэтилен (—СН2—СН2—)п — ак төстәге термопластик
каты материал. Ул кулга парафин кебек майлы булып тоела.
Әгәр полимерның төзелеше буенча зур молекуляр массалы
чикле углеводород (парафин) икәнен исәпкә алсак, бу охшаш¬
лыкны аңларга мөмкин. Моннан чыгып, полиэтиленның яну-
чанлыгы, аның реагентларга карата химик тотрыклылыгы
турында алдан әйтергә мөмкин. Полиэтилен аз гына яктыра
торган зәңгәрсу ялкын белән яна. Кислота, селте, оксидлаш¬
тыручы (калий перманганаты) эремәләр аңа тәэсир итми.
Куертылган нитрат кислотасы полиэтиленны җимерә.
Бу полимерның күп кенә кулланылышлары сезгә һич¬
шиксез билгеле. Яхшы диэлектрик буларак, аны төрле элемтә
чараларында, югары ешлыклы установкаларда электр үткәр¬
гечләрен һәм кабельләрне изоляцияләү өчен кулланалар.
Полиэтилен пленкаларның суны һәм газны үткәрмәве
аларны төрле әйберләрне, азык продуктларын төрү материа¬
лы итеп кулланырга мөмкинлек бирә. Авыл хуҗалыгында
мондый пленкалар теплицалар кору, каналларда һәм сусак-
58 нче рәсем. Термопластик полимердан торба ясау машинасы.
Полимер электр тогы белән җылытыла торган цилиндрда йомшара
һәм машинаның баш өлешендәге балдаксыман тишемнән
әйләнә торган шнек ярдәмендә кысып чыгарыла;
суынганнан соң торба үэенә бирелгән форманы саклый.
15
227
лагычларда суны фильтрлаганда югалтуларны булдырмау,
җнләк-җимеш культураларын һәм яшь агачларны каплап
салкын тиюдән саклау һ. б. өчен кулланыла.
Полиэтиленның химик яктан тотрыклы булуы, аны терле
торбалар, химик аппаратлар төзү эшендә детальләр эшләү,
химик агрессив сыеклыкларны саклау һәм күчереп йөртү
ечен савытлар ясауда кулланырга мөмкинлек бирә (58 нче
рәсем). Полиэтиленнан бик күп санда көнкүреш әйберләре:
шешәләр, кружкалар, терү пакетлары һ. б. ясыйлар.
Полиэтиленны промышленностьта югары басым (150—
300 МПа, 200—280 °C) һәм түбән басым (0,2—2,5 МПа,
80—100 °C) шартларында табалар.
Югары басым шартларында табылган полимерның тө¬
гәл сызыкча структурасы булмый, аның макромолеку¬
лалары чылбырында тармакланулар килеп чыга. Түбән
басым полимеры махсус катализатор йогынтысында төгәл
сызыкча структура ала, шуңа күрә аның молекулалары
бер-берсенә тыгызрак урнаша (кристаллылык дәрәҗәсе
арта), ә ул материалның үзлекләрендә сизелерлек чагыла:
Үзлекләре
Югары басым
Полиэтилены
Түбен басым
ПОЛИЭТАЛ^ЯЫ
Кристаллылык дәрәҗәсе, %
Тыгызлыгы, г/см3
Эрү температурасы. °C
Молекуляр массасы
50—65
0,91—0.93
105—108
80 000— 500 000
75-90
0,95—0,97
120—130
80 000—800 000
Полиэтиленның кайсы төренең ныграк булуын сез үзе¬
гез үк әйт» аласыз.
Полиэтиленнан ясалган әйберләр белән эш иткәндә, үз¬
лекләрендә аермалар булу мөмкинлеген исәпкә алырга
кирәк. Мәсәлән, югары басым полимерыннан ясалган әй¬
берләр 60—70 °C ка кадәр температураларда эксплуатация¬
ләнә ала, ә түбән басым полимерын 100 °C ка кадәр тем¬
пературада файдаланырга мөмкин.
Полмпропиленныц (—СН2—СН—)„ полиэтилен белән күп
СНЭ
кенә уртак яклары бар. Ул да шулай ук тотып карауга май-
лысыман, ак төстәге термопластик материал. Полиэтилен ке¬
бек үк аны да югары молекуляр чикле углеводородларга
228
(молекуляр массасы 80 000—200 000) кертергә мөмкин.
Бу полимер агрессив тирәлекләргә чыдам. Полиэтиленнан
аермалы буларак, ул югарырак температурада (160—170 °C)
йомшара һәм аңа караганда ныграк та. Беренче карашка
бу хәл аңлашылмый. Полипропиленның ян-ягында — СН3
группалары күп булу макромолекулаларның бер-берсенә ты¬
гыз тиеп торуына комачаулый кебек күренә. Мондый очрак¬
та полимерның ныклыгы һәм эрү температурасы күтәрелер¬
гә түгел, бәлки түбәнәергә тиеш. Бу «каршылыкны» аңлау
өчен, матдә төзелешен җентекләбрәк тикшереп карарбыз.
Полимерлашу процессында пропилен (яки шундый ук
төзелешле башка мономер) молекулалары үзара төрлечә
тоташа алалар, мәсәлән:
—СН,—СН—СН2—CH—СН2—СН—CHa—СН—
СН3 CHj СН3 СН3
яки
-СН,-СН-СН-СН,-СН?—сн-сн-сна-
I ' I 1
сн3 сн3 сн3 сн3
Беренче ысулны «баштан — койрыкка», икенчесен
«баштан — башка» дип атыйлар. Тоташуның катнаш тәр¬
тибе дә мөмкин.
Пропиленның полимерлашуы катализатор катнашын¬
да алып барыла. Катализатор монда мөмкин саналган
барлык изомерлардан «баштан — койрыкка» принцибы
буенча чылбырдагы метил группалары дөрес чиратлашып
килгән регуляр төзелешле полимер барлыкка килүгә бу¬
лышлык итә.
Мондый полимерлашу вакытында —СН3 группалары
болардан тыш регуляр пространстволы юнәлеш ала. Әгәр
сынык сызык рәвешендәге макромолекуланы хасил итүче
углерод атомнары бер яссылыкта ята дип күз алдына
китерсәк, ул чагында метил группалары бу яссылыкның
фәкать бер ягында гына булырга яки аның ике ягына да
дөрес чиратлашып урнашырга тиеш (59 нчы рәсем).
Бу вакытта полимер стереорегуляр төзелеш ала диләр.
Мондый полимер макромолекулалары бер-берсенә тыгыз
килеп урнашалар (кристаллылыкның югары дәрәҗәсе),
алар арасында үзара бер-берсенә тартылу көче арта, менә
шул аларның үзлекләрендә чагыла да инде.
229
59 ячы рәсем. Полипропилен макромолекулаларының стереорегуляр
тезелеше. Тоташ кара сызыклар — углерод атомнары чылбыры яткан
яссылык естендәге химик бәйләнешләрне, пунктир сызык яссылык
астындагы ларын сурәтли.
Полипропилен үтә чыдамлы изоляция, торбалар, машина
детальләре, химик аппаратуралар ясау ечен тотыла. Күп тап¬
кырлар бөгел ү-сыгыл уларга һәм ышкылуларга шактый чы¬
дам булуы аркасында аннан бик нык арканнар ишәргә, ятьмә
ясарга, техника өчен тукымалар әзерләргә мөмкин. Ноли про¬
пиленнан эшләнгән әйберләр, полиэтиленнан эшләнгәннәренә
караганда, югарырак температураларда (120—140 ’С ка кадәр)
кулланыла ала.
12. а) Гадәттәге температурада, б) җылытканда сезгә билгеле пластик
материалларны санап чыгыгыз.
13. Полиэтилен һәм полипропиленның чикле углеводородлар белән
тезелешләрендә һәм үзлекләрендә нинди охшашлыклар бар?
*14. Изобутиленны полимерлаштыру юлы белән югары молекуляр
матдә — поли изобутилен табыла. Изобутиленны полимерлаштыру реак
циясе тигезләмәсен тезегез. Полимерның структур звеносын күрсәтегез.
*15. Югары һәм түбән басымлы полиэтилен үзлекләре арасында
аерма нәрсәдә? Бу аерманы ничек аңлатырга?
•16. Полипропилен макромолекулаларының етереорегуляр струк¬
турасын характерлагыз. Сезнеңчә, полипропиленның кайсы струк¬
турасы стереорегуляр Булмас?
*17. Полипропиленның уртача молекуляр массасын 100 000 дип
кабул итеп, аның полимерлашу дәрәҗәсен исәпләп чыгарыгыз.
*18. Формальдегид, этилен шикелле, молекуласында икеле бәйләнеш
урыныннан полимерлашырга мемкин. Бу вакытта чылбырында углерод
һәм кислород атомнары чиратлашын урнашкан полиформальдегид бар¬
лыкка килә. Полимер яхшы механик үзлекләргә ия, һәм ул машина
детальләре, пленкалар, сүс һ. б. ясау эчен файдаланыла. Формальде¬
гидның полимерлашу реакциясе схемасын тезегез, хасил булган поли¬
мерның структур звеноларының формулаларын күрсәтегез.
230
§ 48. ПЛАСТМАССАЛАР (дәвамы)
Поливинилхлорид (—СНг—СН—)„ — сызыкча макро-
I
Cl
молекулалары «баштан — койрыкка* тибында тезелгән
термопластик полимер (Мг 10 000 нән 150 000 гә кадәр).
Аны табу, таркалганда чылбырны үстерә башлау ечен,
ирекле радикаллар бирүче инициатор катнашында хлор¬
винилны (винилхлоридны) СН2=СН радикаллы полимер-
II
С1
лаштыруга нигезләнгән.
Эзлекле рәвештә ирекле радикаллар ясалу аша үсә
барган полимер макромолекуласының схемасын тезегез
(224 нче битне карагыз).
Составы һәм төзелеше буенча полнвинилхлоридны
полиэтиленның хлор белән алмаштырылганы итеп карар¬
га мөмкин. Водород атомнарының бер өлешен алмаштыр¬
ган хлор атомнары углерод атомнары белән бик нык то¬
ташкан. Шуңа күрә поливинилхлорид кислоталар һәм
селтеләр тәэсиренә бирешми, яхшы диэлектрик үзлекләр¬
гә, механик ныклыкка ия. Ул янмый, ләкин җылыткан¬
да чагыштырмача тиз таркала, бу вакытта хлороводород
аерылып чыга.
Поливинилхлорид нигезендә ике типтагы пластмасса:
шактый каты винипласт һәм йомшаграк пластикат
табыла. Полимерның таркалуын булдырмау өчен, пласт¬
массага стабилизаторлар өстиләр, йомшак пластикат тап¬
канда, моннан тыш, пластификаторлар да кушалар.
Винипласттан химик яктан тотрыклы торбалар, химик
аппаратлар өчен детальләр, аккумулятор банкалары һ. б.
күп нәрсәләр ясыйлар. Пластикат исә линолеум, ясалма
күн, клеенка, су үткәрми торган плащлар әзерләү өчен
тотыла, үткәргечләрне, шул исәптән су асты кабельләрен,
изоляцияләү өчен файдаланыла.
Полистирол (—СН2—СН—)п. Бу полимерның мономе-
Свн5
ры — стирол СН2“СН. Аның молекуласы чиксез углеводо-
II
сйн5
род белән ароматик углеводородтан тора кебек. Аны моле¬
куласында бер водород атомы ароматик фенил радика¬
лына —СвНц алмаштырылган этилен яки бер водород ато-
231
мы винил радикалына CH2sCH — алмаштырылган бензол
дип карарга мөмкин.
Полистирол — сызыкча структуралы полимер. Аның
молекуляр массасы 50 000 нән 300 000 гә кадәр җитә.
Аны мономерны радикаллы полимерлаштыру юлы белән
инициатор катнашында табалар. «Баштан — койрыкка*
тибындагы бу реакциянең схематик тигезләмәсен төзегез.
Полистиролның төзелеше буенча аның үзлекләре ту¬
рында әйтә алабыз. Ул — бик яхшы диэлектрик үзлекле
термопластик материал, селтеләр тәэсиренә һәм нитрат
кислотасыннан кала барлык кислоталарга химик биреш-
мәүчән. (Моны сез ничек аңлатырсыз?)
Моңа кадәр өйрәнелгән полимерлардан аермалы була¬
рак, җылытканда полистирол шактый җиңел деполимер-
лаша, ягъни башта алынган мономерларга таркала:
—СН, CH-i-CH,—CH-j-CHj—СН->- ... — лСН2=СН
I i . I :
ceH5 свнл С.Н5
Мондый процессны мәктәп лабораториясендә дә эшләп
карарга мөмкин: полимерны сыеклык куа торган приборга
салып җылыткач, хасил булган мономер җыйгычта тупла¬
ныр. Стиролда икеле бәйләнеш булуын да тәҗрибә юлы
белән бик җиңел исбат итеп була. (Моны ничек эшләргә?)
Үтә термопластик материал буларак, полистиролдан
төрле формадагы бик күп төрле әйберләр ясыйлар. Яхшы
диэлектрик буларак, аны электр- һәм радиоаппаратура
детальләре, кабель изоляциясе җитештерү өчен тоталар.
Аннан декоратив бизәү әйберләре, төрле панельләр, ташла¬
гыч плиталар һәм бик күп башка нәрсәләр ясыйлар. Ул
көнкүреш әйберләре — яктырту аппаратурасы, савыт-саба¬
лар, галантерея әйберләре, балаларга уенчыклар һәм баш¬
ка нәрсәләр эшләү өчен киң кулланыла.
Полистиролның куллану мөмкинлекләрен чикләп кил¬
гән кимчелекләреннән берсе — бәрелгәндә чагыштырмача
тиз уалучан булуы. Хәзерге вакытта полимерны синтезлау
процессында каучук кулланып, бәрелүгә чыдамлы поли
стирол (бәрелү үзлеге зур булган) табалар. Хәзер күбрәк
шундый полистирол кулланалар.
Полистирол полимерга күбекләндерүче матдәләр өстәп
пенополистирол табалар. Андый полистирол ябык күзә¬
нәкле катып калган күбек структурасын ала. Бу материал
бик җиңел. Пенополистирол, җылылык һәм тавыш изоля¬
м:
цияләүче материал буларак, төзелештә, суыткычлар техни¬
касында, мебель җитештерү промышленностенда кулла¬
ныла. Аның белән үткәргеч торбаларны изоляциялиләр,
транспортлана торган приборларны, азык продуктларын
һ. б. төрәләр.
СН,
I ’
Полиметилметакрилат (— СН2—С—)„. Мономерның хи-
к°
^о—сн,
мик атамасы — метил акрил (кыска ча метакрил) кислота-
СН3 л
. J. ~
сының метил эфиры СН2*С—С, . Әгәр чиксез кар-
ч0—СН3
бон кислоталары рәтендәге беренче буынның — акрил кис-
О
лот асының формуласын СН2=СН—С. исегезгә төшер-
ХОН
сәгез, бу матдәнең исемен аңларсыз.
Полимер — сызыкча структуралы, термопластик үзлек¬
ле, аны табу өчен мономерны инициатор катнашында
радикаллы полимерлаштыралар. Реакция икеле бәйләнеш¬
ләр өзелеп һәм «баштан — койрыкка» тибы буенча бару
сәбәпле, аның схемасын түбәндәгечә сурәтләү җайлырак:
СН3 СН3 СН3
пСН,—с — —СН,—С—СН2—С— ...
СООСН3 СООСН, СООСН,
Полиметилметакрилат — төссез, үтә күренмәле һәм
яктылыкка чыдамлы каты матдә. Ул бәрелгәндә уалмый,
кислота һәм селте эремәләренә бирешми. Үтә күренмәле
булуы аркасында полимерны органик пыяла дип йөртәләр.
Аны буярга да мөмкин. Гадәттәге силикат пыяладан аер¬
малы буларак, органик пыяланы механик ысуллар белән
теләгәнчә эшкәртергә, ябыштырырга мөмкин.
Полиметилметакрилат самолет, судно, автомобиль тәрә¬
зәләренә кую, яктылык техникасы кирәк-яраклары эшләү,
линзалар, зурайтып күрсәтүче пыялалар ясау өчен һәм ла¬
зер техникасы материалы буларак һ. б. файдаланыла.
Фенолформальдегид пластмассалар. Пластмассалар
нигезен тәшкил итүче югары молекуляр фенолформаль¬
дегид сумаланы полимерлаштыру юлы белән түгел, бәлки
233
поликонденсация реакциясе ярдәмендә синтезлыйлар. Үз¬
лекләре белән ул термопластик түгел, бәлки термореак¬
тив үзлекле санала. Башка пластмассалардан ул шушы
ике билгесе белән аерыла.
Сумала синтезлау өчен фенолны формальдегид белән,
катализатор сыйфатында кислота яки селте катнашында
җылыталар. Түбән молекуляр продукт — су аерылып чыгу
белән бара торган поликонденсация процессының схема¬
сын түбәндәгечә күрсәтергә мөмкин:
Без фенолда водород атомнарының 2,4,6 торышла¬
рында реакцияләрнең чагыштырмача җиңел баруын белә¬
без инде. Бу очракта поликонденсация реакциясе 2 һәм
6 торышлардагы водород атомнары урынында бара. Фор¬
мальдегид җитәрлек микъдарда булганда, реакциягә водо¬
род атомнарының 4 торыштагылары да катнаша. Бу ва¬
кытта сызыкча молекулалар СН2 группасы ярдәмендә
үзара тоташалар һәм пространстволы структуралы югары
молекуляр кушылма барлыкка килә. Полимерның термо¬
реактив үзлеге, гадәттә, икенче процесс вакытында поли¬
мердан әйбер ясаган чакта барлыкка килә.
Кагыйдә буларак, фенолформальдегид сумалаларны
төрле композиция материаллары белән бергә файдала¬
налар. Бәйләгеч ролен уйный торган полимер белән бер-
рәттән, аларга тутырмалар, катыручы матдәләр, буягычлар
һ. б. компонентлар өстиләр. Әйберләрне ясау процессын¬
да, мәсәлән, җылытып пресслаганда, башта — форманы
тигез тутыра торган термопластик үзлекле пластмасса,
соңрак җылыту һәм басым тәэсире астында простран¬
стволы структура ала: каты монолит эшләнмәгә әверелә.
Фенолформальдегид пластмасса нигезендә эшләнгән
әйберләр механик яктан нык, җылытуга үтә чыдамлы,
кислоталарга бирешмәүчән булулары һәм диэлектрик үз¬
лекләре яхшы булу белән характерланалар.
234
Тутырма итеп агач онын файдаланып, фенолформаль¬
дегид пластмассалардан пресс порошок әзерлиләр. Ә аны
җылытып пресслау юлы белән, радио һәм электротехника
кирәк-яракларының киң ассортиментын (штепсельләр,
розеткалар, радиодетальләр, телефон трубкалары һ. б.) һәм
шулай ук конкүрештә кулланыла торган күп кенә прибор¬
лар ясыйлар.
Тутырма сыйфатларында җепселле материаллар, мәсә¬
лән, мамык чүбе, тукыма калдыгы файдаланып, волокнит
дип атала торган пластмассалар табалар. Алардап күп
кенә техник детальләр, рейкалар, втулкалар, фланецлар,
электр ялгагычлары һ. б. ясыйлар.
Тутырма сыйфатында киҗе-мамык тукыма файдалан¬
ганда текстолит (текстиль таш) дип йөртелә торган нык
пластмасса барлыкка килә. Аннан машиналарның аеруча
җаваплы детальләрен: шестерня, подшипник вкладыш¬
лары, детальләр арасына кыстыру балдаклары, шкивлар
һ. б. эшлиләр.
Агач катламлы пластиклар киң таралган. Мондый
пластикларны бик юка итеп ясалган агач табакларын —
агач шпоннарны—фенолформальдегид сумала белән эш¬
кәртеп (аннары пресслап) ясыйлар. Алар нык та, арзан да
Һәм шуңа күрә машиналар төзүдә конструкцияләү мате¬
риалы буларак, транспортта, техниканың башка өлкәлә¬
рендә һәм шулай ук мебель җитештерүдә уңышлы кулла
нылалар.
Тутырма сыйфатында пыяла тукыма кулланып эшлән¬
гән пластиклар — пыяла текстолитлар (стеклотексто-
литлар) бик киң кулланыла. Алар — аеруча нык, җылы¬
туга бик чыдамлы, яхшы электр изоляцияләү материалы.
Аларны автомобильләр, суднолар төзү эшендә, транспорт
та зур габаритлы һәм катлаулы конструкцияләр җитеш¬
терү өчен файдаланалар.
Безнең халык хуҗалыгында бик күп төрле башка
пластмассалар да киң кулланыла.
*19. Поливиннлхлоридта хлорның масса элешен (полимерның
молекуляр массасын исәпләмичә генә) табыгыз.
*20. Бирелгән пластмасса үрнәгенең поливинилхлорид икәнен тәҗ¬
рибә юлы белән ничек белергә?
*21. Җылыткан чакта поливннилхлори^ның таркалуын деполи-
мерлашу реакциясе дип әйтеп буламы? Ни ечен?
*22. 200 °C тан югарырак температурага кадәр җылытканда, полн-
метилметакрилат полистирол кебек деполимерлаша. Деполимерлашу
реакциясе тигезләмәсен тезегез.
235
•23. Пол «метилметакрилатның химик тезелешен белүегездән чы¬
гып, аныц моннан злек өйрәнелгән полимерларга караганда, кислота
һәм селте эремәләренә биреш мәүчәвлеге кимрәк булуын (җылытканда)
аңлатыгыз.
*24. Фенолформальдегид сумаладан торле тутырмалар кулланып
табыла торган полимер материалларга характеристика бирегез.
*25. Текстолиттан эшләнгән деталь ватыкларын җылытып пресслау
методы белән яңадан монолит деталь ясарга мемкинме? Җавабыгызны
аңлатып бирегез.
*26. Бензол боҗрасының 4 торышындагы водород атомнары уры¬
ныннан (формальдегид молекулалары катнашында) ике сызыкча моле¬
куланы тоташтыру юлы белән фенолформальдегид сумаланың про-
странстволы төзелеш схемасын сурәтләгез.
б 49. СИНТЕТИК СҮСЛӘР
Сүсләр һәм тукымалар җитештерү — синтетик югары мо¬
лекуляр төзелешле матдәләрне халык хуҗалыгында кулла¬
нуның икенче зур олкәсе.
Турыдан-туры табигый материаллардан (җитен, мамык,
йон) ялына торган сүсләрдән тыш, без ясалма сүс табылуын
да беләбез. Аңетнт сүс аларның бер мисалы. Ләкин аны да
шулай ук табигый полимердан — целлюлозадан әзерлиләр.
Моның очен баштя яны, химик юл белән эшкәртеп, әрүчән
итәләр, ә аннары эремәне җепкә әверелдерәләр. Целлюлозаны
ни очен әрүчән итәргә кирәк булуын һәм бу максат белән
аның нинди химик әверелешләргә дучар ителүен исегезгә
төшерегез.
Табигый полимерларны эшкәртүгә нигезләнеп ясалма
сүсләр җитештерү сүссыман материалларга булган үсә барган
таләпләрне канәгатьләндерә алмый. Сүсләрне синтетик югары
молекуляр төзелешле кушылмалардан алу кирәклеге туа.
Ясалма сүсләрдән аермалы буларак, синтетик полимер¬
лардан алына торганнарын синтетик сүсләр дип йортәләр.
Ясалма һәм синтетик сүсләр химик сүсләрнең уртак бер
группасын тәшкил итә, чөнки аларның икесе дә химик ме¬
тодлар белән җитештерелә (60 нчы рәсем).
Лавсан сүс. Лавсан җитештерү өчен файдаланыла тор¬
ган полимерны ике атомлы спирт — этиленгликоль СН2—СН2
ОН ОН
белән ароматик рәттәге ике нигезле терефталь кислотасын
236
60 ичы рәсем. Сүсләрнең классификациясе.
поликонденсацияләү юлы белән синтезлыйлар. Матдәләр
этерификация реакциясе тибында үзара тәэсир итешәләр Һәм
бу реакция күп тапкырлар кабатланып, полиэфир макрО¬
молекуласы ясалуга китерә;
Мондый сызыкча макромолекуланың структур звеносы
спирт һәм кислота молекулалары калдыкларыннан торырга
тиеш икәне күренә:
Табылган полимер сумала рәвешендә була. Аның макро¬
молекулалары тәртипсез урнашкан, ә сүс тиешенчә нык бул¬
сын очен, аның җепселләре сүс күчәре юнәлешендә урна¬
шырга тиешләр. Синтезланган сумаланы ^шул максатта җы¬
лытып эретәләр һәм бик күп тишемле фильералар аша узды¬
ралар (185 нче бит). Полимерның нечкә генә агынтыларын
салкын һава керә торган шахтага төшерәләр. Суынганда
агынтылар нечкә генә җепселләргә әверелә. Ацетат сүс очра¬
2Э7
гындагы шикелле эретмәне фильера тишемнәре аша уздыр¬
ганда ук макромолекулаларның торышы үзгәрә. Төрле тиз¬
лек белән әйләнә торган барабаннарда сүсне моннан соң
сузганда аларның юнәлеп урнашуы көчәя. Бөрешкән сыман
макромолекулалар бу вакытта тураялар, полимерның крис-
таллылык дәрәҗәсе һәм, димәк, ныклыгы сизелерлек арта.
Барлыкка килгән җепселләрне җеп итеп каталар һәм аларны
моннан соң эшкәртүгә озаталар.
Лавсан1 сүс — үтә нык, тиз тузмый, яктылыкка һәм җы¬
лыга чыдамлы. Ул — яхшы диэлектрик, уртача концентра¬
цияле кислота һәм селте тәэсирләренә бирешми (куертылган
кислоталар аңа җимергеч тәэсир итә).
Лавсан, гадәттә, җеп һәм штапель рәвешендә башка сүсләр
белән катнаштырып кулланыла. Аннан эшләнгән әйберләр
киң таралган. Алар киемнәр тегү өчен төрле тукымалар, три¬
котаж әйберләр, тюль, мебель тышлау материаллары һ. б.
җитештерү өчен тотыла. Химик төзелешеннән үк күренгәнчә,
лавсан гигроскопик материал түгел, шуңа күрә кием тегү
өчен тукымалар җитештергәндә, аңа күбесенчә башка төрле
сүсләр өстиләр: лавсан ныклык бирә, аны тиз тузмый торган
итә, башка сүсләр аның гигиена таләпләренә туры килүен
тәэмин итәләр. Лавсан (яки лавсанлы) тукымалар бөгәрләнми
торган булулары белән характерлана, бу аның кулланылу
сыйфатын күтәрә.
Лавсанның бик нык булуы аркасында аннан техника өчен
кирәкле әйберләр — арканнар, транспортер ленталары, фильтр¬
лау тукымалары, янгын сүндерү җиңсәләре һ. б. җитеште¬
рергә мөмкин. Термик ныклыгының чагыштырмача югары
булуы лавсаннан эшләнгән техника әйберләрен шактый зур
температура интервалларында (-70 тан +170 “С ка кадәр)
кулланырга мөмкинлек бирә.
Капрон сүс. Бу сүсне табуда кулланыла торган поли¬
мерны Е-аминокапрон кислотасының поликонденсациясе
продукты итеп карарга мөмкин:
_ A,, £. I > Z
H?N—СН5-СН2—СН2—СН, сн,-с.
4 он
Реакцияне, гадиләштереп, түбәндәгечә күз алдына ките¬
рербез:
1 Сүснең исеме шул сүс эшләнгән лабораториянең русча исеменең
беренче хәрефләреннән тезелгән: лаборатория высокомолекулярных,
соединений Академии наук СССР.
238
о н п я о
rm 1 ./r^i 1 _
HyN- (CH^-C z+ H--N-(CH,K - С. tH'-N-fCHjVCf +.
L'OH J fOH, [OH
он он о
II JI II
— H,N—(CH,)»—C—N—(CH2)»—C—N—(CH,)»—C— ... + aH20
Производство шартларында капрон табу ечен, амино¬
капрон кислотасының алмаштырылганы — капролактам¬
ны кулланалар. Аны аминокислота молекуласы эчендә
карбоксил группа белән аминогруппаның үзара тәэсир
итешү продукты итеп карарга момкин:
,0
СН, СН,-СН,—С.
УН 'он
СН,—CH2—N
Н
СН,—СН,—СН,%
хсо + Н2О
СН,—СН,—NH z
Кллрлляктам
Полимерны синтезлау процессында цикллар амид бәй¬
ләнеше буенча ачылып сызыкча макромолекулаларга то¬
ташалар.
Барлыкка килгән молекулалар сызыкча структуралы
булалар, һәм алар күп тапкырлар кабатланучы аминокап¬
рон кислотасы калдыкларыннан тора. Полимерның төзе¬
леше түбәндәге формула белән күрсәтелергә мөмкин:
н О
I II
(-N-(CH2)s-C-)„
Лавсан очрагындагы шикелле үк, монда да сумаласы-
ман полимер барлыкка килә. Эретмәдән сүсләр формалаш¬
тыру технологиясе дә шундый ук. Сузганнан соң капрон
сүсләр үтә нык булып китәләр, чөнки полимер макромоле¬
кулалары арасында гадәттәге молекулаара көчләр генә
тәэсир итеп калмый, бәлки күп санлы водородлы бәйлә¬
нешләр дә урнаша:
ОН Н
II I I
—Н—С—(CH,)»N—C(CH,)»—N—С—(СН,)»—
н О о
♦ • 4 .
о н н
I I I
_C—N—(СН,)Л—C—N—(СН,)5—C—N—
I I
но о
239
Үтә нык булулары белән беррәттән, капрон сүсләр ыш¬
кылуларга, күп тапкырлар деформацияләүгә (бөгүләргә)
чыдамлы. Аларга дым сеңми, пгуңа күрә юеш хәлдә алар¬
ның ныклыгы кимеми.
Капрон сүснең кимчелекләре дә бар. Алар кислоталар
тәэсиренә чыдамсыз — капрон макромолекулалары амид
бәйләнешләре урыныннан гидролизлаша. Капронның җы¬
лытуга чыдамлыгы да зур түгел: җылытканда аның нык¬
лыгы кими, ә 215 °C та эри. Менә шуңа күрә дә капрон
әйберләрне кайнар үтүк белән үтүкләргә ярамый.
Капрон (яисә капрон катнашкан) әйберләр көнкүрештә
гадәти нәрсәләргә әверелде. Алар — матур кофталар, ирләр
күлмәкләре, шарфлар, оекбашлар, ясалма мех, коверлар,
мебель тышлау материаллары һ. б. Капрон сүс балык тоту
ятьмәләре, фильтр материаллары эшләүдә, авто- һәм авиа-
покрышкалар каркасын ясау өчен корд тукыма җитеш¬
терүдә тотыла.
Термопластик булу сәбәпле, капрон сумала үтә нык
һәм ышкылуга чыдамлы машина детальләре һәм меха¬
низмнары — тешле тәгәрмәчләр, втулкалар, подшипниклар
һ. б. ны ясау өчен пластмасса сыйфатында да файдала¬
ныла.
Капрон сүс полиамид сүсләр группасына керә. Макро-
I молекулаларында аминокислота звенолары амид (пептид)
бәйләнешләр —СО—NH— ярдәмендә тоташкан булу сәбәп¬
ле, аларга шундый исем бирелгән. Энант, анид (нейлон)
һәм кайбер шундыйлар полиамид сүсләргә керә.
*27. Сүсләрнең, кайберләре ни өчен полимер эремәсеннән, ә баш¬
калары аның эретмәсеннән ясала? Технологик процессларны ча¬
гыштырып карагыз. Аларда нинди уртаклыклар һәм нинди аерма¬
лар бар?
*28. Капронны синтезлаганда ни өчен башлангыч матдә итеп а-, 0-
яки ү-аминокапрон кислоталары түгел, бәлки £-аминокапрон кислотасы
алына? Моны ничек аңлатырга?
*29. Корд тукыма өчен ныгытылган капрон сүсне аеруча нык сузып
әзерлиләр. Моның ни өчен икәнен аңлатырга.
*30. Үзенең яктылыкка үтә чыдам булуы белән капроннан аеры¬
лып торган полиамид сүс энантны аминоэнант кислотасын
HzN—(СНг)«—СООН поликонденсацияләп табылган продукттан алалар.
Бу кислотаны поликонденсацияләү реакциясе тигезләмәсен төзегез.
*31. Анид (нейлон) исемле полиамид сүсне гексаметилендиамннны
H.N —(СН2)в—NH2 адипин кислотасы НООС—(СНг),—СООН белән бергә
поликонденсацияләп табылган продукттан алалар. Реакция тигезлә¬
мәсен языгыз.
240
*32. Нитрон сүс башка барлык сүсләргә караганда да тышкы кү¬
ренеше белән Йонга күбрәк охшаган. Ул җитәрлек нык һәм җылыны
яхшы саклый. Аннан костюмнар, свитерлар, спорт киемнәре өчен
тукымалар һәм шулай ук ясалма мех ясыйлар. Акрил кнслотасыныц
нитрилы СНг=СН нитрон табу очен мономер булып санала.
C=N
Акрил кислотасы нитрилынын икеле бәйләнеш буенча полимер¬
лашуы реакциясенец тигезләмәсен языгыз.
■ Өегездә капрон эретмәсеннән җепләр сузып карагыз. Моның өчен
сумала якн таушалган капрон әйберләр кисәген фарфор чынаякта яисә
калай банкада эретегез. Эретмәгә таяк белән кагылып, артыннан җеп
суздырып, аны читкә алыгыз. Сузып табылган капрон җепнең нык¬
лыгын элеккеге әйберләрдән алынган җепнең ныклыгы белән чагыш¬
тырыгыз.
§ 50. СИНТЕТИК КАУЧУКЛАР
Табигый каучук ресурсларының бнк чикләнгән булуы, »
үсә барган техниканың, барыннан да элек авто- һәм авиа¬
транспортның, каучукка булган ихтыяҗның һаман саен арта
баруы галимнәр алдына үтә сыгылмалы синтетик материал¬
лар табу мәсьәләсен куя. Бу мәсьәлә бездә бигрәк тә кискен
куела, чөнки табигый каучукның төп чыганагы булган гевея
агачы бездә үсмәү сәбәпле, без каучукны чит илдән кертергә
мәҗбүр идек.
Синтетик бутадиен каучук. Күпьеллык киеренке хезмәт
нәтиҗәсендә, профессор (соңрак академик) С. В. Лебедев җи¬
тәкчелегендә эшләүче бер төркем Ленинград галимнәре кау¬
чукны синтетик юл белән табу ысулын эшлиләр, һәм мондый
каучук безнең илебездә 1932 елдан башлап җитештерелә.
Сергей Васмлъевяч Лебедев
(1674—1934)
Ленинград Кәрбимедицииа академиясе-
иең профессоры, академик. Чиксез углеводе
родларны полимерлаштыруга һ»м гидрир
лаштыруга багышланган классик хезмәтләре
белән танылган галим. Спирттан бер стадиядә
бутадиен (дивинил! табу (дегидрнрлаштыру
һәм дегидратлаштыру катализаторлары кат
нашмесывда), металлик натрий катнашында
бутадиенны полммерлаштырыа. каучук табу
ысулларын эшлн. С. В. Лебедев җитәкчеле
гендә Советлар Союзында беренче синтетик
каучук җитештерү заводы салына һәм эшли
башлый.
241
Каучукны синтезлау ысулын эшләгәндә С. В. Лебедев таби¬
гатькә иярү юлыннан бара. Табигый каучук диен углеводо¬
родының полимеры (нинди икәнен исегезгә төшерегез) булу
сәбәпле, С. В. Лебедев та ясалма каучук табу өчен диен угле¬
водородларының иң гадиеннән һәм арзан саналганыннан —
бутадиеннан СН2=СН—СН=СН2 файдалана. Этил спирты бута¬
диен табу өчен чимал булып хезмәт итә.
Бутадиен табу спиртны дегидрирлау һәм дегидратлау
реакцияләренә нигезләнгән. Спирт парларын тиешле ката¬
лизаторлар катнашмасы өстеннән уздырганда, бу реак¬
цияләр бер үк вакытта бара:
Н Н Н Н
1 J.,---, 1 1
н—С- С-Н + Н-С-С-Н — СН,=СН—СН=СН2+2Н2ОЧ-Н,
L I ’ ' 1 *
н он’ н он’
L- _ _ — -» L___J
Бутадиенны С. В. Лебедев методы буенча полимерлаш¬
тыру катализатор итеп металлик натрийны кулланып үт¬
кәрелә. Бу процессны кыскача түбәндәгечә язарга мөмкин:
СН2-СН—СН-СН2 + СН2-СН—сн-сн, + ... —
-СН2-СН-СН—СНа- + —СН2—СН—СН—СН2— +
-- _сн2 сн-сн- сн2 сн2—сн-сн—сн2
Бутадиен (полибутадиен) каучукның төзелеше түбәндәге
формула белән күрсәтелә:
(—СН2—СН-СН-СН2—)„
Бу ысул белән табыла торган бутадиен каучук суны һәм
газны үткәрми. Ныклыгын һәм эластиклыгын арттыру өчен,
авы да табигый каучук кебек үк вулканлаштыралар.
Бутадиен каучукны төрле резина-техник әйберләр җитеш¬
терүдә киң куллану илебезнең халык хуҗалыгын үстерүдә
зур роль уйнады.
Хәзерге вакытта безнең промышленностьта күп кенә баш¬
ка төрле каучуклар эшләп чыгарыла. Аларның бер төрлелә¬
ре — механик яктан бик нык, икенчеләре — химик яктан тот¬
рыклы, ә өченчеләре эреткечләр тәэсиренә бирешмәүләре
белән характерлана. Аларның һәркайсы үзләренең үзлеклә¬
ренә карап билгеле бер өлкәдә кулланыла.
|Стереорегуляр төзелешле каучуклар. Синтетик каучук¬
лар аерым үзлекләре буенча табигый каучуктан өстен
торсалар да, бер үзлеге, ягъни эластиклыгы буенча аннан
калышалар. Ә каучукның бу үзлеге хәрәкәт вакытында
242
күп тапкырлар деформацияләнә торган автомобиль яки
самолет шины кебек детальләр ясаганда аеруча әһәмиятле.
Табигый каучук ул — изопрен каучук. Шуңа күрә галим¬
нәр инде күптән синтетик изопрен каучук синтезлауны
үзләренә бурыч итеп куялар.
Һәм изопрен каучук синтез юлы белән табыла. Ләкин
табигый каучук үзлекләренә тулысынча ирешергә мөмкин
булмый. Табигый каучукның пространстволы төзелешен
өйрәнгәннән соң гына моның сәбәбе ачыклана. Табигый
каучукның стереорегуляр тезелешле булуы беленә. Аның
формуласын искә төшерик:
(— СН2—СН=С-' СН2—)„
снэ
Икеле бәйләнеш янындагы углерод атомнары һәр звено¬
да төрле атомнар (атомнар группалары) белән тоташкан.
Шуңа күрә монда геометрик изомерия булуы мөмкин.
Каучук макромолекулаларында СН2 группалары тәртипсез
урнашмаган, бәлки һәр звенода икеле бәйләнешнең бер
генә ягында урнашкан, ягъни бу группаларның цис-торы-
шын белдерә.
СН3 Н СН3 СНг
уС-С< С-С<
—снг сн2— -СН, Н
цигФорме транс Форма
Макромолекула звеноларында бәйләнеш булдыручы
СН2 группаларының мондый урнашуы макромолекула¬
ның йомгак ясап табигый чорналуына китерә, ә ул кау¬
чукның үтә эластиклыгын тәэмин итә. Звенолар транс-
төзелешле булганда исә, макромолекулалар сузынкырак
була һәм эластиклыгы да кимрәк була.
Химик синтез шартларында стереорегуляр төзелешкә
ирешелмәгән, бу исә полимерның үзлекләрендә чагылган.
Шулай да изопрен каучукны синтезлау проблемасы
хәл ителде. Үсә торган полимер чылбырына мономер зве¬
ноларын, стереорегуляр полипропилен синтезлагандагы
шикелле итеп, регуляр урнаштырырга ярдәм итүче ката¬
лизаторлар табылды. Хәзер төзелеше һәм үзлекләре белән
табигый каучукны хәтерләткән изопрен каучук безнең
промышленностьта бик күп җитештерелә.
Стереорегуляр төзелешле бутадиен каучук та табылды.
Мондый каучукны, төзелеше регуляр булмаган бутадиен
16* 243
каучуктан аеру өчен, дивинил каучук дип йөртәләр. Ыш¬
кылуга чыдамлыгы ягыннан дивинил каучук хәтта таби¬
гый каучуктан да өстенрәк. Бу сыйфаты аны шиннарның
аеруча тиз туза торган протекторларын (тышкы өлешен)
ясау өчен аеруча кыйммәтле итә.
Стереорегуляр төзелешле изопрен һәм дивинил кау¬
чукларны җитештерү — ватаныбызның органик синтез
промышленностендагы иң әһәмиятле казанышларыннан
берсе.
Синтетик каучук җитештерүнең чимал базасында да җит¬
ди үзгәрешләр булды. С. В. Лебедев яшәгән заманнардан бир¬
ле бутадиенны — этил спиртыннан, ә спиртны бәрәңге һәм
ашлыктан алалар иде. Изопрен табу мәсьәләсе дә катлаулы
иде. Икътисад мәнфәгатьләре арзанрак һәм уңайлырак баш¬
ка чимал чыганаклары эзләүне таләп итте. Хәзерге вакытта
каучукны синтезлау өчен, нефть газларындагы һәм нефтьне
эшкәртү продуктларындагы углеводородлар файдаланыла.
Бутадиен буганны дегидрирлаганда табыла:
СН,—СН—СН-СН, СН,-СН— СН-СН, + 2Н,
r L _ _ L _ _1_ _ 1 /
Н Н Н Н
U — — — — _
Изопренны изопентаннан (2-метилбутаннан) табарга мөм¬
кин:
СН3 СН СН,- СН3 — СНа-С-СН-СНг + 2Н,
СН3 СН3
Изопентан ресурслары җитәрлек булмаган очракта, нор¬
маль пентанны изомерлаштырырга мөмкин:
СН3—СН,— СН,—СН2 СН3 —* СН3—СН—СН,—СНа
СНа
Болар барысы да каталитик процесслар. Хәзерге вакытта
алар каучук синтезлау өчен, мономерлар табу максатында
промышленностьта киң кулланыла.
33. Эластиклык һәм пластиклык үзлекләре арасында нинди аерма
бар?
34. Каучук һәм сүс макромолекулаларының төзелешләрендә нинди
уртаклыклар бар һәм алар нәрсәләре белән аерыла? Бу аерма аларныц
үзлекләрендә нинди чагылыш таба?
*35. Бутадиен каучук таркалганда С,Нв составлы углеводород хасил
була. Нәрсәгә нигезләнеп, ул диен углеводородларга керә дип әйтергә
мөмкин? Моның дөреслеген тикшерү өчен, нинди микъдари тәҗрибә
ясарга кирәк?
244
*36. а) Бутадиенны, 6) изопренны нолнмерлаштыруныц кыскар¬
тылган тигезләмәләрен языгыз. (Башка полимерлар очен полимер-
лаштыру тигезләмәләрен язган кебек.)
*37. Полибутадиев чылбыры бүлемтегенең тезелешеп цис- һәм
тронс-формада сурәтләгез.
*38. Хлоронренны СНа=СН—С=СН, полимерлаштырып, яктылык.
I
CI
җылылык һәм эреткечләр тәэсиренә бик чыдамлы хлоропрен каучук
табалар. Хлоропревның полимерлашу реакциясе тигезләмәсен һәм
полимерның структур звеносының формуласын языгыз.
*39. Бутадиен-1,3 белән стнролны бергә полимерлаштырып, меха¬
ник ныклыгы үтә зур булган бутадиен-стнрол каучук табалар. Башлан¬
гыч матдәләрдән ясалган звеноларның макромолекулада регуляр
кабатлануын исәпкә алып, сополнмерлашу реакциясе тигезләмәсен һәм
сополимер структур звеносының формуласын тозегез.
*40. Бутадиен-1,3 белән акрил кислотасы пнтрилын СН2=СН C=N
бергә полимерлаштырып. эреткечләргә (бензин, керосин һәм башка
углеводородларга) чыдам булган бутадиен-нитрил каучук табалар.
Сополимерлашу реакциясен һәм бу каучукның структур формуласын
языгыз.
■ 1- Резина һәм каучук белән оегеэдә түбәндәге тәҗрибәләрне ясагыз:
н) эластиклыкларын һәм ныклыкларын чагыштырыгыз, б) җылытып,
в) бензин белән, г) калий перманганаты эремәсе белән тәэсир итеп
карагыз.
2. Стереорегуляр тезелешле бутадиен каучук макромолекуласы
фрагментының моделен пластилиннан ясагыз.
ЙОМГАКЛАУ
Органик химияне өйрәнгәндә, без матдәләр дөньясы ту¬
рында бик күп нәрсәләр: органик кушылмаларның әһәмият¬
ле класслары, аларның күптөрлелегенең сәбәпләре, төзелеше
һәм үзлекләренең үзенчәлекләре, безнең тормышта аларның
әһәмиятләре арта баруы турында белдек. Хәзер безгә кайбер
йомгаклаулар ясарга кирәк.
Иң элек бу фәнне безнең теоретик күзаллауларыбызны
ничек баетуын, органик химия курсын өйрәнү нәтиҗәсендә
бу өлкәдә алган белемнәребезнең ни дәрәҗәдә булуын ачык¬
ларбыз.
Органик матдәләрнең төзелеше һәм үзлекләре. Органик
кушылмаларның төзелеше турындагы тәгълимат А. М. Бут¬
леровның химик төзелеш теориясенә нигезләнгән. Фән үсеше
процессында бу тәгълимат атомнарның молекулаларда про¬
странстволы торышын өйрәнүче стереохимии теория, ә анна¬
ры молекулаларда атомара бәйләнешләр характерын тасвир¬
лаучы электрон теориясе белән тулылана. Үзара бәйләнгән
бу өч теория хәзерге тезелеш теориясенең асылын тәшкил
итә. Аларның һәркайсыиың эчтәлеген без хәзер тулырак ача
алабыз.
Химик тезелеш теориясе молекулада атомнарның тоташу
тәртибен һәм ээлеклелеген өйрәнә, бу тәртипнең матдәләр
үзлегенә йогынтысын тикшерә. Монда атомнарның тоташу
тәртибе дигәннән аларның бер-берсенә үзара йогынты ясау
тәртибе күздә тотыла. Бу үзара йогынтының асылы соңрак
электрон теориясе нигезендә ачыклануын без беләбез инде.
Атомнарның матдә үзлекләрен билгеләүче нинди тоташу
тәртипләре белән таныштык соң?
Органик матдәләрнең төзелеше углерод атомнарының
үзара тоташып ачык чылбыр һәм йомык цикллар хасил итү
үзлегенә нигезләнгән. Без углерод чылбырларының ачык
һәм циклларга йомылган булуын беләбез. Ачык чылбыр
туры һәм тармакланган була, циклик структуралар ачык
чылбыр белән бергә була ала Һ. б. Углерод чылбырларының
характерын тикшергәндә үк, без матдә үзлекләренең андагы
атомнарның нинди тәртиптә тоташуына бәйле булуын очра-
246
габыз. Изомер чикле углеводородларның үзлекләрендәге аер¬
маны исегезгә төшерегез.
Органик матдә молекулалары составына, углерод белән
водородтан тыш, башка химик элементлар да керсә, атом¬
нарның яңача тоташу тәртибе барлыкка килә. Безгә атом¬
нарның түбәндәге функциональ группалары билгеле: гид-
0
роксил —ОН, альдегид —С; , карбоксил — С , амн-
н о-н
вогруппа —NHZ, гади эфирларның R—0—R һәм катлаулы
О
эфирларның R- С атомнар төркемнәре. Матдәләрнең
О—R,
характерлы үзлекләре һәм аларның теге яисә бу кушылма
классына керүе шушы функциональ группаларга бәйле.
Молекулаларда атомнарның нинди тәртиптә тоташуы һәм
аның матдә үзлекләренә йогынты ясавы турында без курсны
өйрәнә башлаган вакытлардагы га караганда күпкә тулырак
беләбез.
Химик төзелеш теориясендә гомология һәм изомерия тө¬
шенчәләре аеруча әһәмиятле. Углерод атомнарының чылбыр
ясап тоташу үзлегеннән тыш, алар органик кушылмаларның
күптөрлелеге сәбәпләрен ачалар. Бу төшенчәләрнең билге¬
ләмәләрен әйтегез. Углеводородларның сезгә билгеле гомоло¬
гии рәтләренә һәм кислородлы органик матдәләргә мисаллар
китерегез.
Курсны өйрәнгәндә без изомериянең төрле төрләре белән
таныштык. Аларны искә төшереп үтик:
1. Углерод скелетының изомериясе. Чикле углеводород¬
ларны өйрәнгәндә без аны җентекләп тикшердек, углерод
скелетының төзелеше матдәнең физик үзлекләренә йогынты
ясавын билгеләп үттек. Изомериянең бу төре башка класс
матдәләренә дә хас. Мәсәлән, С5НПОН формуласына нинди
изомер спиртлар туры килә?
2. Кабатлы бәйләнешнең торышына бәйле изомерия. Без
аның белән чиксез углеводородларны өйрәнгәндә танышкан
идек. Мисал өчен монда гексен-1, гексен-2 һәм гексен-3 нең
структур формулаларын китерегез. Чиксез карбон кисло¬
талары рәтендә изомериянең бу төрен формулалар белән
күрсәтегез.
3. Углерод чылбырында алмаштыручыларның торышына
бәйле изомерия. Мондый мисалларны искә төшерик: 1-бром-
пропан һәм 2-бромпропан, бутанол-1 һәм бутанол-2.
247
4. Функциональ группаларның үзара торышларына бәйле
изомерия. Без аны кислородлы кайбер матдәләрдә, мәсәлән,
углеводород радикалында алмаштыручы (галоген) терле то¬
рышта булган карбон кислоталарында күзәттек. Аминокисло¬
таларны өйрәнгәндә без аның белән тулырак таныштык.
Изомер аминокапрон кислоталарының структур формулала¬
рын төзегез.
5. Органик кушылмаларның төрле классларына керүне
матдәләр изомериясе. Этилен углеводородларының һәм цик-
лопарафиннарның (молекулада углерод атомнарының саны
бер үк), ацетилен һәм диен углеводородларының, бер атомлы
спиртлар һәм гади эфирлар, бер нигезле карбон кислоталары
һәм катлаулы эфирларның изомериясе. Санап киткән Һәр
очракны структур формулалар белән раслагыз.
(Атомнарның молекулада пространстволы урнашуын
өйрәнүче стереохимии теория моңа кадәр аңлашылмаган
күп кенә күренешләргә аңлатма бирде. Углерод атомының
дүрт валентлык бәйләнешләре тетраэдр түбәләренә таба
юнәлгән. Һәм бу — метан молекуласының тетраэдрик төзе¬
лешен, углерод чылбырының сынык сызык рәвешендә тө¬
зелешен билгели; атомнарның ординар бәйләнешләр тирә¬
сендә әйләнүе аркасында углерод чылбыры төрле про¬
странстволы формаларга керә ала. Без этилен Һәм бензол
молекулаларының төзелеше — яссы, ә ацетилен молеку
ласының сызыкча тезелешле икәнен белдек.
Молекулаларның пространстволы төзелешле булуы
матдәнең физик үзлекләренә йогынты ясый икән. Тар¬
макланган Һәм тармакланмаган углеводородлар, регуляр
Һәм регуляр булмаган төзелешле полимерлар мисалында
без моңа ышандык.
Икеле бәйләнешле кушылмаларда кабатлы бәйләнеш
янындагы һәр углерод атомы төрле атомнар яки атомнар
группалары белән тоташкан очракларда барлыкка килә
торган изомериянең яңа төре — геометрик яки цис-транс¬
изомерия билгеле булды. Мисал өчен 1,2-дихлорэтен һәм
бутен-2 нең цис һәм транс изомерларының тезелешләрен
китерегез.
Геометрик изомерияне белү безгә табигый каучукның
төзелешен, аның эластиклыгының сәбәбен аңларга һәм
галимнәрнең ни өчен озак вакытлар буена табигый кау
чук кебек үзлекле синтетик каучук таба алмауларын тө¬
шенергә мөмкинлек бирде.
248
Макромолекулаларның пространстволы төзелешен
ачыклаганда, без, каучук белән целлюлозаның икесе дә
төгәл сызыкча төзелешле булуларына карамастан, алар¬
ның үзлекләренең ни өчен бөтенләй башка төрле булуын
аңладык. Аксым молекулаларының пространстволы төзе¬
лешенең бик катлаулы булуын Һәм ДНКның икеле спи¬
рале нәрсәне аңлатуына төшендек.
Электрон теориясе матдәнең төзелеше Һәм химик
әверелешләренең асылы турында безне аеруча тирән бе¬
лем белән коралландырды. Электрон болытларының гиб-
ридлашуы турындагы күзаллаулар безгә углерод атомы¬
ның $рэ-гибридлашуы вакытында барлыкка килгән дүрт
о-бәйләнешнең ни өчен тетраэдр юнәлешле булуын (мәсә¬
лән, метан молекуласында), ә зр2-гибридлашуы вакытында
өч о-бәйләнешнең бер берсенә 120° ясап юнәлеп, бер ук
яссылык өстендә ятуын (этилен молекуласында), sp-гиб-
ридлашуы вакытында исә, ике G-бәйләнешнең бер туры
сызык өстендә ятуын (ацетилен молекуласында) аңларга
мөмкинлек бирде. Без шулай ук гибридлашуга катнаш¬
мый торган р-электрон болытларының, бер-берсе белән
аралашып, молекулаларда л-бәйләнешләр барлыкка ките¬
рүләрен дә беләбез.
Атомнарның төзелеше Һәм химик бәйләнешләрнең та¬
бигатеннән чыгып, электрон теориясе үзеннән алда килгән
теорияләр рамкасында аңлатыла алмаган күп кенә нәрсә¬
ләрне аңлатып бирде. Атомнарның тоташу тәртибе ни
өчен матдәләрнең үзлекләренә йогынты ясый? Атомнар¬
ның үзара Йогынтысының асылы нәрсәдә? Кабатлы бәйлә¬
нешләр ординар бәйләнешләргә караганда ни өчен реак
цинга керергә сәләтлерәк? Составының үтә чиксез булуына
карамастан, ни өчен беизол чикле һәм чиксез углеводород¬
ларның үзлекләренә ия? Кайбер азотлы гетероциклик ку¬
шылмалар ни өчен ароматик үзлекләргә ия? Алга таба текст¬
ны укый башлаганчы бу сорауларга җавап биреп карагыз.
Без бу теория нигезендә молекулаларда атомнарның
бер-берсенә йогынтысының асылы нәрсәдә икәнен белдек:
матдәнең бу йогынты нәтиҗәсендә килеп чыккан яңа
үзлекләренең шул матдәне тәшкил итүче химик элемент¬
ларның суммар үзлекләренә туры килмәвен, бәлки атом¬
нарның электрон структураларының үзара йогынтысы
белән аңлатылуын белдек.
Углеводородларның галоген белән алмаштырылган иң
гади мисалларында без молекулага галоген атомы керүе
10 BI77
249
ничек итеп молекула үзлекләренә йогынты ясавын күрдек.
Хлорметанда С — С1 бәйләнешенең электрон тыгызлыгын
үзенә таба авыштыручы хлор атомы йогынтысында моле¬
куладагы водород атомнарының моннан соңгы алмашы¬
нуы җиңеләя. Шул ук вакытта хлор атомы үзлекләрендә
аның углерод атомы белән бәйләнеш характерының йогын¬
тысы да сизелә. Ул ничек сизелә?
Молекулада электроннар йогынтысын ачыклау безгә
Марковников кагыйдәсен аңларга мөмкинлек бирде. Угле¬
водород радикалы G-бәйләнешнең электрон тыгызлыгын
үзеннән читкә авыштыру үзлегенә ия, шуннан чыгын,
пропиленга хлороводород кушылуның ни өчен күбесенчә
түбәндәге схема буенча баруын аңлатыгыз:
СН3 СН = СН2 + НС1 — СНа - СНС1 - СН,
Инде сезгә билгеле органик матдәләр молекулаларында
атомнарның үзара йогынтысының асылы нәрсәдә булуын
үзегез мөстәкыйль рәвештә (кирәк булганда дәреслектән
карап) тикшереп карагыз. Моның өчен, мәсәлән, а) бензол,
фенол һәм этил спиртының; б) бер атомлы спирт, фенол
һәм карбон кислотасының; в) чикле аминнар, аммиак һәм
ароматик аминнарның үзлекләрен чагыштырып карагыз.
Түбәндәге сорауларга җавап бирегез: ни өчен спиртлар¬
ның кислота үзлекләре бар? Шулай да ни өчен аларның
диссоциация дәрәҗәсе суныкыннан кимрәк? Әгәр угле¬
водород радикалына галоген атомы кертелсә, диссоциация
дәрәҗәсе ни өчен арта? Ни өчен фенолның кислота үзлек¬
ләре спиртларныкына караганда күбрәк, ә карбон кислота¬
ларыныкы тагын да ныграк беленә? Кырмыска кислотасы
нилектән бер нигезле карбон кислоталарыннан иң көчлесе
санала? Галогенның кислота радикалында тоткан урыны
аның диссоциация дәрәҗәсенә ничек йогынты ясый? Ни
өчен чикле рәттәге аминнар аммиакка караганда көчлерәк
нигез, ә ароматик аминнар көчсезрәк нигез санала? Пири¬
дин ни өчен нигез үзлекләренә ия, ә пирролның бу үз¬
лекләре бик аз сизелә?
Югарыда сөйләгәннәргә таянып, гомуми нәтиҗә ясый
алабыз: органик матдәләрнең үзлекләре аларның состааына.
молекулаларының химик, пространстволы һәм электронлы
төзелешенә бәйле.
Хәзер сезнең алга, теоретик белемнәргә таянып, органик
кушылмаларның иң әһәмиятле үзлекләрен гомумиләштереп
карау бурычы куела. Дәреслектән файдаланып, органик мат¬
250
дәләрнең төрле класслары өчен химик реакция тигезләмә¬
ләрен тасвирлап дәфтәрләрегезгә языгыз:
1) чикле углеводородлар өчен — яну, гади матдәләргә тар¬
кату, алмаштыру, дегидрирлау, дегидроцикллаштыру, изомер-
лаштыру, карбон кислоталарына кадәр оксидлаштыру реак¬
цияләре;
2) чиксез углеводородлар өчен — гидрирлау, галогеннарны,
галогеноводородларны, суны кушу һәм полимерлаштыру
реакцияләре;
3) ароматик углеводородлар өчен — бензолга: кушу һәм
алмаштыру реакцияләре; толуолга: оксидлашу һәм алмаш¬
тыру реакцияләре;
4> бер атомлы спиртлар өчен — селтеле металлар, галогено-
водородлар белән реакцияләре, молекула эчендә һәм моле¬
кулаара дегидратлашу, оксидлашу, катлаулы эфирлар ясалу
реакцияләре;
61 иче рәсем. Органик кушылмаларның генетик бәйләнеш схемасы.
251
5) альдегидлар өчен — кайтарылу һәм оксидлашу реак¬
цияләре;
6) карбон кислоталары өчен — металлар, металл оксид¬
лары, нигезләр белән реакцияләр, этерификация реакцияләре.
Башка класс матдәләренә хас сезгә билгеле реакцияләрне
әйтегез.
Органик кушылмаларның химик үзлекләрен тикшереп
өйрәнгәндә, аларның бер-берсенә әверелүләре аша үзара ты¬
гыз бәйләнгән булуларын күрми калырга мөмкин түгел: эз¬
лекле әверелешләр ярдәмендә бер класс матдәләреннән күп
кенә башка класс матдәләрен табарга мөмкин. Чынлыкта иң
гади кушылмалардан — углеводородлардан теге яисә бу ысул
белән аларның барысын да табып була. Углеводородлардан
алып иң катлаулы органик матдәләргә кадәр эзлекле шушы
әверелешләрнең генетик чылбыры схемада (61 нче рәсем)
сурәтләнгән.
Әгәр органик кушылмалар нигезен тәшкил итүче угле¬
водородларның, үэ чиратында, углерод һәм водородтан син¬
тезлана алуын искә алсак, органик матдәләр белән неорганик
матдәләр генетик үзара бәйләнгән дигән нәтиҗә чыга. Орга¬
ник булмаган кушылмалардан ацетилен барлыкка килү очра¬
гында да бу бәйләнешне күрергә мөмкин. Мондый химик
әверелешләргә тиңдәш схеманы төзеп карагыз.
Органик синтез промышленносте. Углеводородлардан
барлык башка кушылмаларны табуны теоретик яктан гына
тикшереп яисә тиңдәшле синтезларны лабораториядә тор¬
мышка ашырып кына калмыйлар. Углеводородлардан про¬
мышленностьта гаять күп микъдарларда органик матдәләр
Һәм халык хуҗалыгы өчен кирәкле материал алалар.
Углеводородларның иң бай табигый чыганагы — нефть
һәм табигый газ. Алар составындагы матдәләрне химик
эшкәртү буенча халык хуҗалыгының яңа тармагы — нефте¬
химия промышленносте булдырылды, һәм ул бик тиз үсә.
Нәкъ менә нефтехимия безгә органик химия курсыннан ях¬
шы билгеле синтетик продуктларны — галогеноуглеводород-
лар, спиртлар һәм феноллар, альдегидлар һәм кетоннар,
карбон кислоталары һәм аларның алмаштырылганнарын,
полимер матдәләр синтезлау өчен мономерлар, синтетик юучы
матдәләр, агулы химикатлар һ. б. продуктларны бик күп
тонналап җитештерә.
Безгә билгеле булганча, чыгарыла торган нефтьнең төп өле¬
ше төрле ягулыклар җитештерү өчен тотыла; углеводород чи¬
малының фәкать 5% чамасы гына органик синтез өчен фай-
252
дала ныла. Углеводород чималының хәзерге органик синтез
промышленностендагы әһәмиятен, үтелгән курс буенча, сезгә
билгеле процессларны түбәндәге схемадан күрергә мөмкин.
Схема. Углеводород газлары влгезавдв
каАбар промышленность синтезлары
С, н,
(СО + Нг)
СНЭС1, СНгС1„ CHCl2, СС1.
сгн,
СгН6ОН
СНгС1-СН2С1 СНг-СНС1
CZHSC1
(—СН,—СН,—)я
CSHS-C,HS — сан4-сн-сн2
CHjC
CHClj-CHCI, CHCi-CCI2
CH2-CHCI —► (-CH2—CHCI—)„
z
CH,=CH-C /
OH
Курсны өйрәнгәндә күреп үткәнебезчә, химия промыш¬
ленносте халык хуҗалыгының һәм техниканың күп тармак¬
ларына төрле матдәләрнең һәм материалларның гаҗәп бай
ассортиментын бирә. Полимерлар — пластик массалар һәм
синтетик сумалалар, химик сүсләр, синтетик каучуклар —
җитештерү үсешен тизләтүгә аеруча әһәмият бирелә. Инже¬
нер-техник максатларда куллану өчен конструкция материал¬
лары, югары полимер тутырмалы композитлар, каучукның
яңа төрләрен җитештерү тизләтелгән темплар белән үсәчәк.
Синтетик сүсләр җитештерүнең өлеше артачак, һәм техника
өлкәсендә табигый сүсләр куллану, ихтимал, тулысынча
синтетик сүсләргә алмаштырылыр.
253
Химия производствосы алдына куелган зур масштаблы
бурычлар бу өлкәдә фәнни-техник прогрессны тизләтүне
таләп итә.
Күп стадияле химик-технологик процесслар урынына икъ¬
тисади яктан нәтиҗәлерәк аз стадияле процесслар произ¬
водствога кертелә, мәсәлән, метаннан ацетилен табу, угле¬
водородларны турыдан-туры оксидлаштыру юлы белән карбон
кислоталары, этиленны оксидлаштырып серкә альдегиды
табу.
Периодик процесслар җитештерүчәнлеге күпкә югарырак
булган өзлексез процесслар белән алмаштырыла. Хәзер нефть
продуктларының крекингы фәкать өзлексез эшләүче уста¬
новкаларда гына тормышка ашырыла. Полимерлар талканда
полимерлашу процессы өзлексез эшләүче реакторларда бара.
Сезгә өзлексез технологик процессларның башкалары да
билгеле. Киләчәктә ташкүмерне өзлексез кокслау процессын
үзләштерү бурычы алда тора.
Органик продуктлар җитештерү процессларының барысы
да диярлек — каталитик процесслар. Шуңа күрә нәтиҗәлерәк
катализаторлар, аларның бигрәк тә сайлап тәэсир итә торган¬
нарын (селектив тәэсирле) интенсив эзләнүләр бара. Күреп
үткәнебезчә, органик матдәләр белән реакцияләр вакытында
еш кына төрле матдәләр хасил була, шуңа күрә күбесенчә
табылырга тиешле продуктның чыгышын тизләтүче катали
эаторлар таләп ителә.
Калдыксыз җитештерүне гамәлгә кертү әһәмиятле мәсь¬
әләләрдән санала. Ул материаль ресурсларны экономиялерәк
сарыф итәргә, чималны тулырак файдаланырга һәм әйләнә
тирә табигатьне производство ташландыклары белән пычра¬
тудан сакларга мөмкинлек бирә. Кайбер производстволарда,
иярчен продуктларны файдаланырга мөмкин булмаган очрак¬
ларда, ташландык суга тиешле өстәмәләр салып яки микро¬
биологик ысул белән аларны таркаталар. Хәзер күпчелек
химия производстволарында су белән тәэмин итүнең йомык
системасы тормышка ашырыла: үзенә технологик процесс
калдыкларын иярткән су әйләнә-тирәлеккә чыгарып таш¬
ланмый, бәлки чистартыла һәм яңадан производство циклына
җибәрелә. Хәзер яңа заводлар күбесенчә калдыксыз эшли
торган производство рәвешендә әйләнә-тирә мохиткә зыян
китермәслек итеп проектлана һәм төзелә.
Өзлексез принцип буенча эшләүче химик производстволар
технологик процессларны автоматлаштыру өчен зур мөмкин
лекләр тудыра. Промышленностьның бу өлкәсе автоматлашу
254
дәрәҗәсе буенча халык хуҗалыгында алдынгы урыннарның
берсен алып тора. Барлык яңа төзелешләр — югары автомат-
лаштырылган предприятиеләр алар. Бу — эшчеләрнең эш ха¬
рактерын билгели. Производствода химик процесслар ябык
установкаларда уза. Технологик процессларның төрле этап¬
ларда барышын характерлый торган барлык параметрлар
(агым тизлеге, температура, басым, матдә чыгымы һ. б.)
контроль-үлчәү приборлары белән автомат рәвештә күзәтелә.
Приборларның күрсәтүләре аерым бинадагы идарә пуль¬
тында күзәтелә. Операторның төп эше — технологик процесс¬
ны инструкция һәм контроль-үлчәү приборларының күрсә¬
түләре буенча алып бару, бирелгән режимнан читкә тайпы¬
лулар килеп чыкканда, процессны нормальләштерү өчен ки¬
рәкле чараларны тиз күрә белү. Мондый катлаулы һәм җа¬
ваплы функцияләрне уңышлы башкару өчен, операторның
химиядән, химик технологиядән һәм башка фәннәрдән төпле
белеме булырга тиеш.
Органик химия табигать турындагы фәннәр рәтендә.
Органик химия табигать турындагы фәннәрдән неорганик
химия белән биология арасында тора. Матдәләрнең акрынлап
катлаулана бару процессын, аларның төрле әверелешләрен
ача барып, органик химия табигатьтә матдәнең эволюциясен,
организмнарның тереклек эшчәнлегенең материаль нигез¬
ләрен, материя хәрәкәтенең иң югары биологик формасының
асылын аңларга ярдәм итә.
Без органик матдәләрнең, неорганик матдәләр шикелле үк,
үзара бәйләнгән икәненә ышандык. Бу бәйләнешнең асылы
түбәндәгедән гыйбарәт: һәр органик матдә билгеле бер класс¬
ка керә, башка класс матдәләре белән тәэсир итешә, кушыл¬
маларның барлык класслары үзара генетик бәйләнгән. Орга¬
ник матдәләр неорганик матдәләр белән дә үзара бәйләнештә:
алар неорганик матдәләрдән синтезлана һәм неорганик мат¬
дәләргә әверелә алалар.
Химик төзелеш теориясен өйрәнү безгә фәнни танып белү¬
нең атом һәм молекулалар дөньясына һаман саен ныграк
үтеп керүен, микродөнья күренешләрен һәм закончалык¬
ларын тирәнрәк ачыкларга мөмкинлек бирүен күрсәтте. Хә¬
зерге вакытта атом һәм молекулаларның реальлегенә бер¬
кемнең дә шиге калмады, хәтта инде без күбрәк тә: атомнар¬
ның молекулаларда нинди тәртиптә тоташуын, аларның
пространствода ничек урнашуларын, атомара бәйләнешнең
нинди характерда булуын, атомнарның бер-берсенә ничек
йогынты ясавын, химик әверелешләрнең электронлы меха¬
255
низмы нинди булуын һ. б, белдек. Бу белемнәрнең дөреслеге,
объектив характерда булуы теориягә нигезләнеп проектлаш¬
тырыла һәм тормышка ашырыла торган күп санлы синтезлар
белән практикада раслана. Химик әверелешләрнең нигезендә
микродөньяда булып торган материаль процесслар ятуына,
аларның ниндидер илаһи көчләр йогынтысында түгел, бәлки
матдә төзелешенә бәйле үз законнары буенча булып торуына
без һаман саен күбрәк ышанабыз. Болар дөнья турындагы
безнең материалистик карашларыбызны ныгыта һәм үстерә.
Шул ук вакытта ул безгә матдәнең эчке дөньясын өйрәнеп
булуын, белемиәребезнең күренешләрдән башлап аларның
асылын тирәитен ачуга таба үсә баруын күрсәтә (төзелеш
теориясенең үсеш этапларын исегезгә төшерегез).
Химик төзелеш теориясе, аннары матдәнең простран¬
стволы һәм электронлы төзелеше тәгълиматы белән таныш¬
канда, без гомуми закончалык — теоретик белемнәрнең кар¬
шылыклар туу һәм аларны чишү аша үсүе белән очрашкан
идек. Ул каршылыклар иң элек яңа табылган фактлар белән,
шул фактларны аңлату өчен җитәрлек булмаган элеккеге
теоретик карашлар арасында туа.
Органик химия башка фәннәр белән бергә җәмгыятьнең
турыдан-туры куәтле җитештерүче көченә әверелә бара.
Илебездә химия фәненең һәм химия производствосының
югары үсеш дәрәҗәсе, фәнни-техник прогрессны тизләтү
бурычлары химияне яхшы белүче, инициативалы, яхшы әзер¬
лекле кадрлар килүен таләп итә. Урта мәктәпне тәмамлап
чыгучылар алдына үзләренең белемнәрен күтәрү һәм химия
фәнен, химия производствосын үстерүдә иҗади катнашу өчен
зур мөмкинлекләр ачыла.
ЛАБОРАТОР ТӘҖРИБӘЛӘР
1. Углеводород молекулалары модельләре
Пластилиннан яки детальләр җыелмасыннан түбәндәге модельләрне
төзегез:
1. Метан молекуласының моделе. Аксыл төстәге пластилиннан зур
булмаган дүрт шарчык, ә караңгырак төстәге пластилиннан диаметры
әлеге шарларныкыннан 1,5 тапкыр зуррак булган бер шарчык ясагыз;
болай эшләү углерод һәм водород атомнары арасындагы нисбәтне яхшы
чагылдыра, «Углерод» шарчыгы өслегендә бер-берсенвән бертигез ерак¬
лыкта итеп дүрт төртке ясагыз да шул урыннарга шырпы кертеп «водо¬
род» шарчыкларын тоташтырыгыз. Модель нык булсын өчен пластилин
шарчыкларны бер-берсенә җиңелчә генә баскаларга кирәк, шул чакта
шарчыклар бераз яньчелер, әмма ул үзара тоташкан атомнарның элек¬
трон болытларының бер берсе белән аралашуын дөрес сурәтли.
2, Пропан молекуласының моделе. Метан молекуласы моделеннән
бер «водород» шарчыгын алып, аның урынына өслегендә тетраэдрик
урнашкан дүрт нокталы «углерод» шарчыгын куеп, җиңелчә генә янь
чеп тоташтырыгыз. Калган ике ноктасына шырпы белән ике «водород
атомын», ә дүртенче ноктага, тиешле «водород атомы» санына Туры
китереп, өченче «углерод атомын» тоташтырыгыз. Атомнары сынык
сызык буенча урнашкан пропан молекуласының моделе килеп чыга.
Я. Бутан һам изобутан молекулаларының моделе. Бу модельләрне
моннан алда язылган ысул буенча ясагыз. Аларны 7 нче рәсемдә су¬
рәтләнгән модель белән чагыштырып карагыз. Модельләрне нык итеп
ясагыз. Атомнарның С—С бәйләнеше тирәсендә әйләнү мөмкинлеген
тикшереп карагыз,
2. Каучукның һам резинаның үзлекләре
1. Вулканлаштырылмаган каучуктан һәм резинадан бертигез ка¬
лынлыкта һәм бертигез озынлыкта юка гына тасмалар кисеп алыгыз.
Тасмаларны сузып карагыз. Сузганнан соң аларның кайсы элекке
хәленә тизрәк кайта, ягъни кайсы эластиграк?
Тасмаларны өзелгәнче сузып карагыз. Аларның кайсы ныграк:
каучукмы әллә резинамы?
2. Ике пробиркага 2—3 әр мл бензин салыгыз. Пробиркаларның
берсенә вулкаялаштырылмаган каучук кисәге, ә икенчесенә шундый ук
зурлыктагы резина кисәге төшерегез. Пробиркаларны кайры бөке белән
ябып, киләсе дәрескә кадәр штативка куеп калдырыгыз. Каучук һәм
резинада нинди үзгәрешләр була? Каучук һәм резинаның эрүчәнле-
гепдәге аерма нәрсә белән аңлатыла?
257
3. Глицеринның үзлекләре
1. Пробиркадагы 1 мл суга шулкадәр үк күләмдә глицерил салып
болгатыгыз. Аввав соң тагып шулкадәр үк глицерин өстәгез. Аның
суда эрүчәилеге турында нәрсә әйтә аласыз?
2. Фильтр кәгазенә 2—3 тамчы глицерин һәм кәгазьнең икенче бер
урынына берничә тамчы су тамызыгыз. Кайсы сыеклыкның тизрәк ки¬
бүен күзәтегез. Тәҗрибә нәтиҗәләрен ничек аңлатырга?
3. Пробиркада 2 мл селте эремәсенә берничә тамчы бакыр купоросы
эремәсе өстәгез. Хасил булган бакыр (II) гидроксидына глицерин агы¬
зып, катнашманы болгатыгыз. Нинди үзгәрешләр күрдегез? Реакция
тигезләмәләрен языгыз.
4. Фенолның үзлекләре
11. Сезгә бирелгән фенолның судагы эмульсиясен ике пробиркага
бүлеп салыгыз. Бер пробиркадагы эмульсиягә 2—3 мл су салыгыз.
Катнашманы болгатыгыз. Фенол суда тулысы нча эреп бетәме?
2. Катнашманы җылытканда һәм аннан соң аны суытканда,
фенолның суда эрүчәилеге үзгәрү-үзгәрмәвен тикшерегез.
3. Икенче пробиркадагы фенол эмульсиясенә берничә тамчы
селте эремәсе салып болгатыгыз. Нәрсә күрәсез? Бу күренешне
аңлатыгыз.
4. Моннан алдагы тәҗрибәдә табылган эремәгә бераз кислота
(сульфат яки хлорид кислотасы) өстәгез. Эремәнең ни сәбәпле
болганчыклануын аңлатыгыз. Бу һәм моннан алдагы реакция тигез¬
ләмәләрен языгыз.
5. Пробирканы үтә күренмәле фенол эремәсе белән чайкагыз һәм
аңа ак төстәге йөзмә хасил булганчы куертылган бромлы су салы¬
гыз. Күзәтелә торган күренешне аңлатыгыз. Реакция тигезләмәсен
языгыз.
S Күрсәтм». Фенол белән тәҗрибә ясаганнан соң, кулларыгызны
яхшылап юыгыз.
5. Формальдегидның үзлекләре
1. Пробирканы сода эремәсе, ә аннан соң су белән яхшылап юы¬
гыз. Аңа 1—2 мл көмеш (I) оксидының аммиактагы эремәсен* салы¬
гыз һәм пробирка стенасыннан агызып кына 4—5 тамчы су кушып
сыегайтылган формалин өстәгез. Шуннан соң пробирканы алдан
әзерләп куелган кайнар сулы стаканга урнаштырыгыз. Пробирка
стеналарында металлик көмеш утырымы хасил булырга тиеш. Реак¬
ция тигезләмәсен төзегез.
1 Көмеш (I) оксидының аммиактагы эремәсен әзерләү өчен, 2 процентлы
көмеш нитраты AgNO3 эремәсенә дистиллирланган су белән 10 тапкыр сыегай¬
тылган 25 процентлы аммиак эремәсен башта хасил булган утырым эреп бет¬
кәнче салырга кирәк.
258
2. Пробиркадагы 3—4 тамчы бакыр купоросы эремәсен» 2—3 мл
натрин гидроксиды эремәсе салыгыз. Барлыкка килгән утырымга
1—2 мл су кушылган формалин өстәп, катнашманы җылытыгыз.
Утырымның төсе’ничек үзгәрә? Бакыр сульфатының селте белән
һәм бу вакытта хасил булган матдәнең формальдегид белән реак¬
циягә керү тигезләмәләрен языгыз.
3. Пробиркадагы 1 мл төссез фуксинсульфит кислотасы эремә¬
сенә 2—3 тамчы формальдегид өстәгез. Кызгылт миләүшә төс бар¬
лыкка килүен күзәтегез. Бу күренешне ничек аңлатырга?
в. Спиртның альдегидка
оксидлашуы
1. Бакыр чыбыкның очында 5—6 уралмалы спираль ясагыз.
2. Пробиркага 1 мл этил спирты салыгыз, бакыр спиральне кара
төстәге оксид белән капланганчы спиртовка ялкынында кыздырыгыз да
тиз генә пробиркадагы спиртка батырыгыз. Моны берничә тапкыр
кабатлагыз. Хасил булган альдегидның исенә, спиральдәге үзгәреш¬
ләргә игътибар итегез.
3. Кыздырганда бакырның оксидлашу реакциясе һәм бакыр (П>
оксидыннан спиртның альдегидка оксидлашу реакцияләренең тигез¬
ләмәләрен языгыз.
7. Майларның үзлекләре
1. Оч пробиркага 1 әр мл су, спирт һәм бензин салып, аларга бер¬
тигез күләмдә берәр каты май кисәге салыгыз яки берничәшәр тамчы
үсемлек мае тамызыгыз. Пробиркаларны селкеп болгатканда нәрсә
күзәтелә? Сыеклыкларның кайсында май яхшырак эри?
2. Майның спирттагы һәм бензиндагы эремәләрен фильтр кәгазенә
тамызыгыз. Эреткеч парга әйләнгәч, нәрсә күзәтелә?
в. Сабынның һәм синтетик юучы матдәләрнең
үзлекләрен чагыштыру
Днстиллирланган суда 25—30 ар мл 1 процентлы кер сабыны һәм
«Лотос» порошогы яки башка төрле синтетик юучы матдә эремәләре
әзерләгез. Ике пробиркага 3—4 әр мл каты су салыгыз. Пробирка¬
ларның берсенә тамчылап кына сабын эремәсе, икенчесен» порошок
эремәсе салыгыз, һәр тамчыны салган саен пробиркадагы сыеклыкны
болгатыгыз. Тотрыклы күбек хасил булганчы кайсы эремәне күбрәк са¬
лырга туры килә? Кайсы препарат каты суда да үэенең юу үзлекләрен
югалтмый?
17
25»
9. Глюкозаның үзлекләре
1. Пробиркадагы 3—4 тамчы бакыр купоросы эремәсенә 2—3 мл
натрий гидроксиды эремәсе салыгыз. Табылган утырымга шундый ук
күләмдә глюкоза салыгыз һәм катнашмамы болгатыгыз. Эремәнең төсе
ничек үзгәрә? Ни өчен?
2. Пробиркадагы катнашманы җылытыгыз. Нинди үзгәрешләр
күзәтелә? Бу тәҗрибә глюкоза молекуласында нинди функциональ груп¬
па барлыгын күрсәтә? Глюкозаның бакыр (II) гидроксиды белән оксид¬
лашу реакциясе тигезләмәсен языгыз.
3. Көмеш (I) оксидының аммиактагы эремәсен чиста пробиркага
салып, аңа эремәнең яртысы күләмендә глюкоза эремәсе өстәгез. Кат¬
нашманы спиртовка ялкынында саклык белән генә җылытыгыз (тигез
һәм әкрен җылытырга кирәк). Нәрсә күзәтәсез? Күзәтелгәннәрне аңла¬
тыгыз.
4. Глюкозаның фуксине у льфит кислотасы белән тәэсир итешүен
тикшерегез (моның өчен матдәләрнең берничәшәр тамчы эремәләре
җитә). Тәҗрибә нәтиҗәләрен аңлатыгыз.
10. Сахарозаның металл гмдрокеңдлары белен
тәэсир итешүе
1. Алда күрсәтелгәнчә, пробиркада бакыр (II) гидроксидын табыгыз.
Аңа сахароза (шикәр) эремәсе өстәп, катнашманы болгатыгыз. Эремәнең
төсе ничек үзгәрде? Бу нәрсәне күрсәтә?
2. Сахарозаның стакандагы 20 процентлы эремәсенә аз-азлап кына
известь сөте (известь суы түгел!} салыгыз һәм өзлексез болгатыгыз.
Известь эриме? Ни өчен?
11. Крахмалның үзлекләре
1. Пробиркага яхшылан уылган крахмал салыгыз да аңа бераз су
өстәп, яхшылап болгатыгыз. Алдан әзерләп куйган кайнар сулы ста¬
канга катнашманы болгаткалап акрын гына агызыгыз, аннан кайнатып
алыгыз. Крахмал клейстеры ясала.
2. Пробиркага 2—3 мл крахмал клейстеры салып, аны су белән
сыеклагыз һәм йодның спирттагы эремәсен бер тамчы тамызыгыз.
Нәрсә күзәтәсез?
3. Катнашманы җылытыгыз. Нинди үзгәрешләр күрерсез? Катнаш¬
маны суытканда элекке төсе калтамы?
4. Крахмал клейстерын әле генә әзерләнгән бакыр (П) гидроксиды
утырымы белән пробиркада җылытыгыз. Бу гидроксид крахмал белән
кайтарыламы?
5. Арыш икмәге кисәген яхшылап чәйнәгез. Төкерек белән чылатып
чәйнәлгән икмәкне пробиркага салыгыз һәм, бакыр гидроксиды утыры¬
мы хасил булсын өчен, аның өстевә берничә Тамчы бакыр сульфаты
һәм селте эремәсе өстәгез. Шуннан соң катнашманы ҖЫЛЫТЫГЫЗ. Нәр¬
сә күрәсез? Күзәтүләрне аңлатыгыз.
260
12. Аксымнарның үзлекләре
1. Пробиркага салынган 2 мл аксым эремәсенә шулкадәр үк кү¬
ләмдә селте эремәсе салыгыз һәм берничә тамчы сыегайтылган бакыр
купоросы эремәсе тамызыгыз. Аксым кызгылт миләүшә төскә керә.
2. Вак кына туралган итне суга салып кайнатыгыз. Сыеклыкны
мамык аша фильтрлап, анда аксым булу-булмавын төсле реакция ярдә¬
мендә сынап карагыз.
3. Берәр тукымадан суырып алынган берничә җепне яндырыгыз
һәм, шуның исенә карап, тукыманың нинди (киҗе-мамык яки йон)
булуын белегез.
13. Полиэтиленның үзлекләре
1. Полиэтилен үрнәген (кыскыч белән тотып) спиртовка яки газ
ялкынында аз гына җылытыгыз. Полимерның башта акрынлап йомша¬
руын, ә аннары эри башлавын күзәтерсез. Пыяла яки агач таяк белән
йомшарган полиэтилен кисәгенең формасын үзгәртегез һәм аның суы¬
нуын көтегез. Полиэтиленның формасын гадәттәге температурада үз¬
гәртергә тырышып карагыз. Күзәтелгән күренешләр полиэтиленның
нинди үзлегенә нигезләнгән? Аның нинди практик әһәмияте бар?
2. Полиэтилен кисәгенә ут төртегез. Ялкыннан алгач та ул янамы?
Ялкынның төсе нинди? Бу вакытта корым барлыкка киләме? Яиу про¬
дуктларының исе бармы?
3. Бромлы су һәм калий перманганаты эремәсе салынган пробирка¬
ларга вакланган полиэтилен кисәкчекләре салыгыз. Эремәләрнең төсе
үзгәрерме, күзәтегез. Бу матдәләр полимерга тәэсир итәме?
4. Сульфат кислотасы һәм селте эремәләре салынган пробиркаларга
вакланган полиэтилен кисәкләрен төшерегез.
Ясалган тәҗрибәләрдән чыгып, полимерның химик үзлекләре ту¬
рында нинди нәтиҗә ясарга мөмкин?
14. Поливинилхлоридның үзлекләре
1. Кечерәк кенә поливинилхлорид (пленка, электр изоляциясе)
кисәгенә ут кабызыгыз һәм аның ничек януын күзәтегез. Поли¬
мерны ялкыннан алгач, аның яну-янмавын күзәтегез.
2. Поливинилхлорид (каты материал буларак винипласт яхшы¬
рак) кисәкләрен пробиркага салып, башта акрын гына җылытыгыз.
Пыяла таяк белән полимерның термопластиклык үзлеге күренү-
күренмәвен тикшерегез.
3. Поливинилхлорид таркалганчы җылытуны көчәйтегез. Зәңгәр
лакмус кәгазен дымландырып, яки көчле аммиак эремәсенә чыла¬
тылган таякны пробирка авызына якын китерегез. Тәҗрибә нәтиҗә¬
ләре нәрсәне күрсәтә?
261
15. Синтетик сүсләрмен үзлекләре
1. Капрон сумала (капрон әйбер) кисәген кыскыч яки пробирка
тоткычы белән ялкын өстендә тотып, җмңелчә җылытыгыз. Поли¬
мер агучан-үэле булып киткәч, аңа чыра яки пыяла таяк белән
кагылыгыз һәм, аны читкә алып, капрон сүс сузыгыз. Тәҗрибәне
берничә тапкыр кабатлагыз. Бу тәҗрибәдә полимерның нинди
үзлеге күренде?
2. Сульфат кислотасы һәм селте эремәләре салынган ике пробир¬
кага капрон сумала кисәкләре яки капроннан эшләнгән берәр три¬
котаж әйбер кисәге теше регез. Полимерга реактивларның кайсысы
тәэсир итүен күзәтегез. Бу тәэснр нидән гыйбарәт? Башка полимер
материаллар белән чагыштырганда, капронның чыдамлылыгы ту¬
рында нәрсә әйтергә мөмкин?
Лавсан белән дә шундый ук тәҗрибә ясап карагыз. Нәтиҗә
ясагыз.
ПРАКТИК ЭШЛӘР
1. Органик матдәләрдә углерод, водород
һәм хлорны сыйфат ягыннан билгеләү
1. Сыек һәм каты углеводородларның сыйфат составын аларны ба¬
кыр (П) оксиды белен оксидлаштырып белергә мемкин.
Коры пробиркага 1 г бакыр (II) оксиды порошогы салып, аңа аз
гына (0,2 г) парафин, керосин яки вазелин мае өстәгез. Сыек нефть
продуктлары бакыр (II) оксидына сеңәргә тиешләр. Каты нефть про¬
дукты эресен өчен, парафинлы пробирканы җылытырга кирәк.
Пробирканы горизонталь хәлдә тотып, аңа сусызландырылган бакыр
купоросы порошогы салыгыз һәм газүткәргеч көпшәле бөке белән
каплагыз. Бакыр (П) сульфаты бөке янында булсын. Газүткәргеч көп¬
шәнең очын известьле су салынган пробиркага төшерегез (62 нче
рәсем).
Матдәләр катнашмасын җиңелчә генә җылытыгыз. Пробирка сте¬
наларында ниләр күзәтәсез? Бакыр (П) сульфаты һәм известьле су белән
нинди үзгәрешләр була?
Тәҗрибәне туктатыгыз. Пробирка суынганнан соң, андагы бакыр (II)
сульфатын һәм реакция продуктларын аерып алыгыз. Углеводородлар
оксидлашканда бакыр (II) оксиды нәрсәгә әверелә?
63 нче рәсем. Этилен табу.
62 нче рәсем. Углеводород¬
лардагы углерод һәм водородны
сыйфат ягыннан билгеләү.
263
Үткәрелгэв тәҗрибә нигезендә нефть продуктларының сыйфат
составы турында нәрсә әйтә аласыз? Молекуласы составында 14 углерод
атомы булган чикле углеводородның бакыр (II) оксиды белән тулысын-
ча оксидлашу реакциясе тигезләмәсен төзегез.
2. Хлор барлыгын белү очен, органик матдәне бакыр белән җылы¬
талар: хлор бакыр белән очучан тоз хасил итә Һәм ялкынны яшел төскә
кертә.
Бакыр чыбыкның очыннан спираль ясагыз һәм аны горелка ялкы¬
нында ялкынның төсе үзгәргәнче кыздырыгыз.
Спиральне сынала торган сыек матдәгә (мәсәлән. 2—3 тамчы дихлор¬
этан яки тетрахлорметанга) тыгып алыгыз Һәм аның калдыклары бе¬
лән спиральне яңадан горелка ялкынына кертегез.
Алынган органик матдәдә хлор барлыгын раслый торган күренеш
буларак, ялкынның яшел төскә керүен күзәтегез.
Сезгә бирелгән башка матдәләрдә дә хлор булу-булмавын шул ук юл
белән тикшерегез.
2. Этилен табу һәм анын белән тәҗрибәләр ясау
Эгил спиртын куертылган сульфат кислотасы белән җылытып, эти¬
лен табу реакциясенең тигезләмәсен языгыз.
Тәҗрибә ясау очен 63 нче рәсемдә күрсәтелгәнчә прибор җыегыз
һәм аның герметиклыгын тикшерегез. Киң пробиркага (колбага) спирт
белән сульфат кислотасының сезгә бирелгән 5 мл катнашмасын (1 кү¬
ләм спиртка 3 күләм сульфат кислотасы) салыгыз, кайнаганда сыеклык
ташымасын очен катнашмага беркадәр ком (бераз утта кыздырып) ЯКИ
пемза өстәгез. Пробирканы газүткәргеч көпшәле бөке белән каплагыз
да, рәсемдә күрсәтелгәнчә, штативка беркетегез. Катнашманы (зур
саклык белән!) җылытыгыз.
Реакция башлангач, газүткәргеч көпшәне 2—3 мл (аннан артмасын)
бромлы су салынган пробирка төбенә төшереп, барлыкка килгән газны
шул пробиркага үткәрегез. Катнашманы җылытудан туктатмагыз,
югыйсә пробиркадагы сыеклыкның приборга күчүе мөмкин. Бромлы су
ничек үзгәрә?
Этиленны калий пер манган атының шул ук микъдарда алынган
сыек кына эремәсе аша үткәреп карагыз. Нәрсә күзәтерсез?
Газүткәргеч көпшәне эремәдән алып, көпшәнең авызын өскә кара¬
тыгыз һәм аерылып чыккан газны кабызыгыз Этилен ничек яна: якты
ялкын беләнме әллә тонык булыпмы?
Горел каны сүндерегез. Этилен аерылып чыгу акрынлап кимер.
Күзәткәннәрегезне аңлатып бирегез. Реакция тигезләмәләрен ЯЗЫГЫЗ.
Э. Бромэтан табу
|Этил спирты, сульфат кислотасы һәм калий бромиды катнаш¬
масыннан этил бромиды табу реакциясенең тигезләмәсен төзегез.
Тәҗрибә ясау өчен 64 нче рәсемдә күрсәтелгәнчә прибор әзерлә¬
гез. Лаборатория өстәлләренә су үткәрелгән булса, һава суыткычы
264
64 иче рәсем. Бромэтан табу.
урынына сулы суыткыч куллану яхшырак, чонкн бромэтан — очу¬
чан матдә <аныц кайнау температурасы 38.4 °C). конденсацияләү
өчен аны нык суытырга кирәк.
50—100 мл сыешлы колбага этил спирты белән куертылган
сульфат кислотасы (8—10 мл) салыгыз, акрынлап кына 3 мл су һәм
5 г калий бромиды яки натрий бромиды остәгез.
Колбаны суыткыч копшә үткәрелгән боке белән каплагыз һем
копшәнец очын бозлы су салынган икенче бер колбага яки савытка
төшерегез.
Колбадагы катнашманы сулы савытка утыртып якн челтәр аша
утка куеп, саклык белән акрын гына җылытыгыз. Суыткыч кеншәдә
бромэтан парларының куеруын һәм җыйгычтагы су астында авыр
сыеклык катлавы хасил булуын күзәтегез.
Җыйгычка майсыман тамчылар агып төшми башлагач, җыйгыч¬
ны алыгыз һәм колбаны ждәлытуны туктатыгыз.
Җыйгычтагы сыеклыкны (бозын кертмича! f бүлгеч бүрәнкәгә
салып, аныц тонганын кетегез һәм төптә җыелган бромэтанны
аерып алыгыз. Табылган матдәне укытучыга тапшырыгыз.
4. Карбон кислоталарын табу һәм аларның үзлекләре
1. Пробиркага 3—4 г натрий ацетаты салыгыз һәм 2—3 мл чамасы
сульфат кислотасы (1:1) эстәгез. Пробирканы газүткәргеч көпшәле боке
белән каплап, копшәнец икенче очын буш пробиркага төше регез (65 нче
рәсем). Җыйгыч пробиркада 1—2 мл сыеклык җыелганчы катнашманы
горелка ялкынында җылытыгыз. Серкә кислотасының исенә игътибар
итегез.
266
65 нче рәсем.
Серкә кислотасын табу.
2. Табылган кислотаны ике өлеш¬
кә бүлегез. Аның бер өлешен лакмус
эремәсе белән сынап карагыз һәм
селте эремәсе белән нейтральләште¬
регез. Икенче елешен бераз су белән
сыеклан, табылган эремәгә магний
тасмасы кисәкчеген яки магний по¬
рошогын салыгыз. Нәрсә күзәтелә?
Реакция тигезләмәләрен тезегез.
3. Серкә кислотасының берәр ме¬
талл оксиды һәм тоз белән реакция¬
ләрен ясап карагыз.
4. Кырмыска кислотасы көмеш (!)
оксидының аммиактагы эремәсе бе¬
лән оксидлашамы, шуны тикшерен
карагыз.
5. Пробиркада җылытып, кер сабынының судагы эремәсен әзерлә¬
гез (моның өчен сабынны юка гына итеп телгәләгез).
6. Пробиркага 2—3 мл сабын эремәсе салыгыз һәм утырым ясал¬
ганчы аңа хлорид кислотасы өстәгез. Утырым нәрсәдән гыйбарәт? Реак¬
ция тигезләмәсен тезегез. Утырымның селте эремәсендә эрү-эремәвен
тикшерегез. Бу күренешне аңлатыгыз.
7. Пробиркага 2—3 мл сабын эремәсе салып, аңа кальций хлориды
эремәсе естәгез. Нәрсә күзәтәсез? Реакция тигезләмәсен языгыз. Бу
тәҗрибәдә сабынның нинди үзлеге күренә?
8. Олеин кислотасының чиксез кислота булуын тәҗрибә белән ис¬
бат итегез.
5. Эксперименталь мәсьәләләр чишү
1. Полиэтилен составына углерод һәм водород керүен тәҗрибә белән
исбат итегез.
2. Полихлорвинил (поливинилхлорид) (—СН»—СН—). җылытканда
I
CI
таркала, һәм хлороводород аерылып чыга. Моны тәҗрибә ясап исбат
итегез.
3. Пробиркага этил спирты, куертылган сульфат кислотасы (1:1)
һәм аш тозы катнашмасын аз гына салып җылытыгыз. Аерылып чык¬
кан газны кабызыгыз. Ялкынның яшел төсенә игътибар итегез. Нинди
матдә шундый ялкын белән яна?
4. Бирелгән пробиркаларга: а) этил спирты, б) глицерин эремәсе,
в) фенол эремәсе салынган. Кайсы пробиркада яинди матдә булуын
химик юл белән белегез.
5. Пробиркага 1—2 мл этил спирты салып, аңа шулкадәр үк күләмдә
калий перманганаты эремәсе һәм берничә тамчы сульфат кислотасы
өстәгез. Катнашмавы җылытыгыз. Эремәнең төсе ни өчен үзгәрә? Исенә
караганда, нинди матдә барлыкка килә?
266
6. Пробиркаларга: а) кырмыска кислотасы, б) серка кислотасы са¬
лынган. Кырмыска кислотасының кайсы пробиркада булуын химик юл
белән билгеләгез.
7. Сезгә бирелгән матдәнең: а) чиксез углеводород, б) ароматик уг¬
леводород, в) куп атомлы спирт, г) альдегид, д) карбон кислотасы
булуын тәҗрибә юлы белән исбат итегез.
8. Бирелгән матдәләрне аларга хас реакцияләр ярдәмендә билге¬
ләгез: а) бензин (турыдан-туры куылган), крекинг-бензин, б) серкә
кислотасы, фенол, этил спирты эремәләре.
6. Серкә кислотасының этил эфирым табу
Серкә кислотасы һәм этил спиртыннан катлаулы эфир барлыкка
килү реакциясенең тигезләмәсен тезегез.
Тәҗрибә ясау әчеп 64 нче рәсемдә күрсәтелгән приборны түбәндәгечә
үзгәртеп файдаланыгыз.
Колбага 10—12 мг сезгә бирелгән этил спирты, серкә кислотасы
һәм сульфат кислотасы катнашмасын салыгыз. Колбага сулы яки һава
суыткычы тоташтырып, аныц аскы очын бозлы суга урнаштырылган
җыйгычка төшерегез. Катнашманы сулы савытка утыртып якн челтәр
аша (саклык бшк zck»!) җылытыгыз. Җитәрлек микъдарда эфир җые
лып. куу акрынайгач, тәҗрибәне туктатыгыз.
Эфирны спирт һәм кислота катнашмасыннан аеру очен. табылган
продуктка су салып болгатыгыз. Аннан соң бүлгеч бүрәнкә ярдәмендә
эфирны аерып алыгыз.
7. Эксперименталь мәсьәләләр чишү
1. Сезгә пробиркаларда: а) глицерин, б) альдвнш. в) глюкоза эре¬
мәләре бирелгән. Бер үк реактивлар ярдәмендә* һәр матдәне танып
белегез.
2. Пробирканың берсенә — нефтьтән алынган машина мае, икенчесе¬
нә үсемлек мае салынган. Кайсы пробиркада нинди май булуын химик
юл белән билгеләгез.
3. Этил Спиртыннан чыгып: а) гади эфир, 6) альдегид, в) кислота,
г) катлаулы эфир табыгыз.
4. Гадәттәге шикәрдә углерод булуын тәҗрибә юлы белән исбат
итегез.
5. а) Бәрәңгедә һәм ак икмәктә крахмал булуын, б) олгергән алмада
глюкоза барлыгын тәҗрибә ясап исбат итегез.
6. Тәкъдим ителгән һәр еч матдәне үзләренә хас реакцияләр ярдә¬
мендә билгеләгез: а) крахмал, шикәр, глюкоза, б) глицерин, сабын,
крахмал (эремәләре).
267
8. Пластмассаларны танып белү
Номерлар сугылган пакетларга пластмасса үрнәкләре салынган.
Түбәндә китерелгән мәгълүматлардан чыгып, кайсы номерлы пакетта
нинди пластмасса булуын билгеләгез.
Полиэтилен. Ярым үтә күренмәле, эластик, тотып карауга майлы-
сыман материал. Җылытканда йомшара, эретмәне җеп итеп сузып
була. Эрегән парафин исе чыгарып зәңгәрсу ялкын белән яна, ялкын¬
нан алгач та януын дәвам итә.
Поливинилхлорид. Эластик яки каты материал, җылытканда бнк
тиз йомшара, таркалганда хлороводород аерылып чыга. Корымлы ал¬
кын белән яна, ялкыннан алгач сүнә.
Полистирол. Үтә күренмәле булырга һәм үтә күренмәле булмаска
да мемкин, күбесенчә уалучан. Җылытканда йомшара, ә эретмәсеннән
җеп бик җиңел сузыла. Корымлы ялкын белән яна, ялкыннан алгач та
януын дәвам итә. Янганда стирол исе килә,
Поли метилметакрилат. Гадәттә, үтә күренмәле, төрле тоел әрдә бу¬
лырга мемкин. Җылытканда йомшара, ләкин җеп булып сузылмый.
Зәңгәрсу каймалы саргылт ялкын белән, үзенә бер терле чатырдап,
эфир исе чыгарып яна.
Фенолформальдегид пластмасса. Караңгы төсләрдә (керән төстән
алып кара төскә кадәр) була. Җылытканда таркала. Бик кыенлык
белән кабына, ялкыннан алгач, акрынлап сүнә. Янганда феиол исе
килә.
9. Сүсләрне танып белү
Номерлар сугылган пакетларга төрле сүс үрнәкләре салынган.
Түбәндә китерелгән мәгълүматлардан чыгып, кайсы номерлы пакет¬
та нинди сүс булуын белегез.
Киҗе-мамык. Койган кәгазь исе чыгарып, тиз яна, янып беткәч, со¬
ры төстәге кал кала.
Йон, чын ефәк. Койган каурый исе чыгарып, әкрен яна. Янып бетү
га, кул белән уганда бик җиңел порошокка әверелә торган кара шарчык
хасил була.
Ацетат сүс. Тиз ява. Янганда кара корән төстәге уалмаучан каты
шарчык ясала. Башка сүсләрдән аермалы буларак, ацетонда эри.
Капрон. Җылытканда йомшара, аннары эри, эремәсеннән җеп сузып
була. Начар ис чыгарып яна.
Лавсан. Җылытканда эри, эремәсеннән җеп сузып була. Корымлы
ялкын белән яна, янып беткәч, карасу төстәге ялтыравыклы шарчык
хасил була.
АТАМАЛАР КҮРСӘТКЕЧЕ
Аденин 202
Аксым 4, 204, 214
Аланин 205, 206
Алкоголятлар 118
Алмаз 25
Альдегидлар 134
бевэой альдегиды 142
валериан альдегиды 135
кырмыска альдегиды 135, 137,
139
май альдегиды 135
пропион альдегиды 135
серка альдегиды 135, 142
Альдегидоспирт 168
Аминогруппа 188
Аминокислоталар 193
Аминнар 188
ароматик аминнар 191
чикле рәт аминнары 190
Амфотерлык
органик кушылмаларның
амфотерлыгы 196, 208
Анальгин 203
Ангидрид
серка ангидриды 186
Анилин 190
кара анилин 192
Антиоксидлаштыручылар 102
Антифриз 128
Ароматлаштыру 105
Аспирин 149
Атомнарның электронлы -пкгелеше
15, 16, 17. 18
Атомнарның үзара тәэсир итешүе
9, 39. 59. 119. 131. 191
Ацетальдегид 135. 139
Ацетатлар 145, 149. 186
Ацетилен 69. 74. 93, 140
Ацетон 135
Бензин 95
газ бензины 100
катал и тик крекинг бензины 103
термик крекинг бензины 102
Бензол 77, 109, 251
Бромбензол 81
Бромметав 120
Бромэтан 120, 123
Бутадиен 64, 241, 242
Бутап 11. 26, 40, 92. 150, 244
Бутен 50, 51
Бутин 71
Бәйләнеш
водородлы бәйләнеш 116, 144,
182, 207, 217, 239
икеле бәйләнеш 46
ковалент бәйләнеш 18
ординар (гади) бәйләнеш 46
поляр бәйләнеш 19
пептид бәйләнеш 196
ечле бәйләнеш 70
Вазелин 96
Вазопрессин 211
Винилхлорид 73, 231
Винипласт 231
Витамин Be 192
Водородлы чистарту (нефть про¬
дуктларын) 106
Газ
кокс газы 109
иярчен нефть газы 93
сыегайтылган газ 40
табигый газ 7, 22, 40, 74. 92
Газлар
пиролиз газлары 103
термик крекинг газлары 103
269
Газойль 98
Галактоза 176
Гексаметилендиамин 240
Гексан 26
Гексахлорбензол 83
Гексахлорбутадиен 83
Гексахлорциклогексав 83
Гексев 50
Гексозалар 173
Гептан 26
Гербицидлар 149
Гетероатомнар 198
Гетероциклик кушылмалар 198
Гибридлашу
электрон болытларының гиб-
рцдлашуы 24, 249
зр3-гибридлашу 25, 57, 249
®р2-гибридлашу 46, 57, 249
зр-гибридлашу 70. 249
Гидратлашу 124, 138
Гидрирлау 56
ацетиленны гидрирлау 73
бензолны гидрирлау 78
майларны гидрирлау 163
этилен углеводородларын гид¬
рирлау 56
Гидролиз
аксым гидролизы 209
катлаулы эфирлар гидролизы
158
крахмал гидролизы 178
лактоза гидролизы 177
мальтоза гидролизы 176
майлар гидролизы 162
нуклеин кислоталарының гид¬
ролизы 213
целлюлоза гидролизы 183
Гистидин 196
Гликоген 180
Глюкоза 167
Глюкозаның циклик формалары
170
Гомологик аерма 38
Гомологик рәт 38
Группалар
амид группасы 196
карбоксил группасы 142
карбонил группасы 134
пептид группасы 196
функциональ группа 115
Гуанин 202
Гудрон 99
Дегидратлашу (спиртларның) 120
Дегидрирлау 63
бутавны дегидрирлау 242
изопентанны дегидрирлау 244
метилциклогексанны дегидрир¬
лау 88
циклогексанны дегидрирлау 84
Дезоксирибоза 174, 214
Дезоксирибонуклеотидлар 215
Декан 26
Декстриннар 178, 180
Денатуратлау 200, 209
Деполимерлашу 232
Детонация 96
Диметилбензол 86
Дионилсульфид 107
Дипептид 206
Дифениламин 188
Дифтордихлорметан 42
Дихлорметан 41
Дихлорэтан 37
Диэтиламин 193
ДНК ның икеле спирале 216
Зинин реакциясе 192
Изобутан 12
Изобутилен 63
Изомер ла шу
Изомерия 11, 247
аминокислоталар изомериясе
194
ацетилен углеводородлары изо¬
мериясе 71
геометрик изомерия (цис-транс)
53
диен углеводородлары изоме¬
риясе 64
пространстволы (стерео) изоме¬
рия 52
спиртлар изомериясе 115
структур изомерия 51, 247
270
этилен углеводородлары иэоме-
риясе 50
Изомерлар 13
Изооктан 96
Изопрен 67, 244
Индиго 149
Инициатор (реакция инициаторы!
223
Инсулин 211
Кальций карбиды 74
Капролактам 239
Капрон 239
Карбонил 134
Катализатор (селектив катализа¬
тор) 126
Каучук
бутадиен каучук 241
дивинил каучук 244
синтетик изопрен каучук 244
стереорегуляр каучук 243
табигый каучук 66
хлоропрен каучук 245
Каучукны вулканлаштыру 68
Керосин 95
Кетоннар 135
Кетоноспирт 173
Кислота
адм пин кислотасы 240
акрил кислотасы 153, 233
аминовалериан кислотасы 194
амннокапров кислотасы 194
аминомай кислотасы 194
амнвопропион кислотасы 193
амнвосерка кислотасы 193
аминоәнаят кислотасы 194
бенэой кислотасы 87
валериан кислотасы 143
глутамин кислотасы 195
глюков кислотасы 171
дихлорфеноксисеркә кислотасы
150
капрон кислотасы 143
кузгалак кислотасы 148
кырмыска кислотасы 143
линоль кислотасы 161
май кислотасы 143, 161
маргарин кислотасы 143
метакрил кислотасы 233
олеин кислотасы 161
пальмитин кислотасы 143, 161
пропион кислотасы 143
рибон кислотасы 175
серкә кислотасы 143, 149
стеарин кислотасы 143, 161
терефталь кислотасы 236
хлор-май кислотасы 148
алаидин кислотасы 152
энант кислотасы 143
Кислоталар
дезоксирибонуклеин кислота¬
лары 213
карбон кислоталары 143
нуклеин кислоталары 213
рибонуклеин кислоталары 214
Коагуляция 65
Кокс 109
Композиция материаллары 234
Корым 40
Крахмал 177
Крекинг
каталитик крекинг 103
нефть продуктлары крекингы 99
термик крекинг 102
Кучеров реакциясе 140
Лавсан 236
Лактоза 176
Лигроин 95
Лизин 205
Мазут 95
Майлагычлар (майлар) 95
Майлар 160
сыек майлар 161
каты майлар 161
Макромолекула 219
Мальтоза 176
Маргарин 164
Марковннков кагыйдәсе 59
Метан 22
Метанол 114
Метил 30
Метиламин 188
271
Метилбензол 85
Метилен 27
Метил эфиры
метакрил кислотасының метил
эфиры 233
серкә кислотасының метил эфи¬
ры 157
Метилциклогексав 88
Молекула модельләре
молекулаларның масштаблы
модельләре 25
молекулаларның шарлы-таяк¬
чыклы модельләре 25
Молекуляр масса < полимерларның)
221
Мономер 219
Нафталин 110
Нафтеннар 44
Нефть продуктлары 94
Нефтехимия промышленносте 105
Нефть 94
Нефтьне куу 97
Нигезләр
азотлы нигезләр 200
органик нигезләр 190
пиримидин нигезләр 201
пурин нигезләр 201
Нитробензол 82
Нитролву 82
Нитроглицерин 129
Нитрогруппа 82
Нитрон 241
Нитропиридии 199
Номенклатура
аминокислоталар номенклату¬
расы 194
альдегидлар номенклатурасы 137
ароматик углеводородлар Но¬
менклатурасы 85
ацетилен углеводородлары но¬
менклатурасы 71
диен углеводородлары номен¬
клатурасы 64
карбон кислоталарының но¬
менклатурасы 143
спиртларның номенклатурасы
115
углеводородларның галогенлы
кушылмаларының номенклату¬
расы 37
чикле углеводородларның но¬
менклатурасы 31
этилен углеводородларының
номенклатурасы 51
Новая 26
Нуклеотидлар 214
Оксидлашу
альдегидларның оксидлашуы
138, 147
спиртларның оксидлашуы 140,
147, 251
чикле углеводородларның ок¬
сидлашуы 150, 165
Окситоцин 211
Октан саны 96
Пальмиатлар 151
Парафин 96
Парафиннар 38, 96
Патока 180
Пенополистирол 232
Пентядиеннәр 64
Пентян 26. 244
Пентозалар 173
Пиперидин 199
Пиридин 198
Пиримидин 201
Пироксилин 184
Пиролиз 103
Пиррол 200
Пирролидин 201
Пластикат 231
Пластификаторлар 226
Пластмассалар 226
термопластик пластмассалар 226
термореактив пластмассалар 226
фенолформальдегид пластмас¬
салар 233
Поливинилхлорид 74, 231
Поликонденсация 224, 234
Полимер 58, 178, 182, 204
Полимерлашу 58, 219, 223
Полиметилметакрилат 233
Полимерлашу дәрәҗәсе 220
272
Полняуклеотидлар 215
Полипептидлар 206
Полипропилен 58, 228
Полистирол 231
Полиэтилен 58, 227
Пропан 7, 10, 26
Пропев 50
Пропила мин 192
Пропилбеизол 85
Пурин 201
Радикаллар 30
ирекле радикаллар 36
Реакцияләр
алмаштыру реакциясе 37, 82
кушылу реакциясе 56, 64, 78,
138
көмеш көзге реакциясе 138
хлорлау реакциясе 37
чылбыр реакциясе 36. 223
этерификация реакциясе 157
Резина 66
Ректификация колоннасы 98
Рибит 175
Рибоза 173
Рибоиуклеотидлар 215
Риформинг 105
Сабын 151
Саломас 164
Сахароза 175
Серкә 149
серкә ангидриды 186
Синтез-газ 124
Синтетик юучы матдәләр 164
Спин 16
Спирт 111
амил спирты 114
бензил спирты 142
винил спирты 140
гексил спирты 114
гептил спирты 114
метил спирты 114, 122, 124
пропил спирты 114
этил спирты 111, 112
Спиртлар 111
бер атомлы спиртлар 111
бутил спиртлары 114
ике атомлы спиртлар 127
күп атомлы спиртлар 127
чикле спиртлар 111
чиксез спиртлар 140
өч атомлы спиртлар 127
Стабилизаторлар 226
Стеаратлар 151
Стереохимия 14
Стирол 89, 231
Структура
аксымнарның беренчел, икен¬
чел, өченчел структуралары 207
полимерларның сызыкча,
тармакланган, пространстволы
структуралары 220
полимерларның стереорегуляр
структурасы 229
Структур формулалар 10
Структур звенолар (полимерлар¬
ның! 219
Сыегайтылган газ 40
Сүс
ацетат сүс 185, 236
вискоза сүс 186
капрон сүс 238
киҗе-мамык сүс 237
лавсан сүс ^36
нейлон сүс 240
энант сүс 240
Сүсләр
полиамид сүсләр 240
синтетик сүсләр 236
табигый сүсләр 237
ясалма сүсләр 236
химик сүсләр 237
Ташкүмерне кокслау 107
Ташкүмер сумаласы 109
Теория
полипептид теориясе 206
стереохимии теория 14, 248
химик төзелеш теориясе 8, 13,
246
электронлы төзелеш теориясе
14, 249
Тетрахлорметан 35
273
Тетрабромэтан 73
Тимин 214, 215
Тирозин 205
Толуол 85, 87, 251
Триаконтан 166
Триброманнлнв 192
Трибромфенол 131
Триметиламив 188
Тринитротолуол 86
Трннитрофенол 133
Трипептид 206
Триптофан 203
Трифторпропев 61
Трнхлорметап 35
Три хлор этен 73
Тротил (тол) 86
Углеводлар 167
У глеводородл ар
ароматик углеводородлар 77, 251
ацетилен рәте углеводородлары
69
диен углеводородлар 64
чикле углеводородлар 22
чиксеэ углеводородлар 45, 55,
249
этилен рәте углеводородлары 49
Углеводородларның галогенлы ку¬
шы лмалары 38
Урацил 202, 214
Уротропин 139
Фенил 87. 131
Фенилаланин 205
Фениламин 188
Фенол 130
Феноллар 129
Фенолятлар 130
Ферментлар 204
Фиброин 207
Фильера 185
Формалин 139
Формальдегид 135
Формула (гомуми)
альдегидларның гомуми форму¬
ласы 134
аксымнарның гомуми формула¬
сы 205
бер нигезле карбон кислотала¬
рының гомуми формуласы 143
гади эфирларның гомуми фор¬
муласы 120
дней углеводородларның гому¬
ми формуласы 64
катлаулы эфирларның гомуми
формуласы 157
чикле бер атомлы спиртларның
гомуми формуласы 115
чикле углеводородларның гому¬
ми формуласы 27
углеводларның гомуми форму¬
ласы 167
цн клопа рафи анарның гомуми
формуласы 43
Формулалар
перспектив формулалар 169
төзелеш (структур) формулалары
10
электронлы формулалар 22, 46,
70
Фреон-12 42
Фруктоза 173
Хлорбензол 83
Хлорвинил 231
Хлоридлар
метнламмоний хлориды 190
февиламмоний хлориды 191
Хлорметан 35
Хлоропрен 245
Хлороформ 41
Хлорофилл 201
Хлората н 37
Целлюлоза 181
целлюлоза дяацетаты 184
целлюлоза нитратлары 184
целлюлоза триацетаты 184
циклобутан 43
циклогексан 43
циклопарафиннар 43, 88, 94,
105
цнклопентав 43
цнстенв 205
цнтоэин 215
274
Штапель 186
Эбовит 69
Эластиклык 65
Электрон болыты 15
Электртискәрелек 19
Энант 197, 240
Эссенция (җиләк-җимеш эссен¬
циясе) 158
Этан 7, 10, 26
Этанол 111, 120, 124
Этил 30
Этиламин 192
Этилбензол 85
Этилен 45
Этиленгликоль 127
Этил эфиры
кырмыска кислотасының этил
эфиры 157
серкә кислотасының этил эфи¬
ры 158
Этилциклогексан 43
Эфир
диметил эфиры 121
диэтил эфиры 120
Эфирлар
гади эфирлар 120
катлаулы эфирлар 157
целлюлоза эфиры 184
Эчешү
спиртлы әчешү 171
сет-кислоталы әчешү 171
18*
ИСЕМНӘР КҮРСӘТКЕЧЕ
Бертло М. 160, 161
Берцелиус Я. 4, 7
Бутлеров А. М- 8, 9, 13, 246
Велер Ф. 4, 7
Данилевский А. Я. 206
Зелинский Н. Д. 90
Зинии Н. Н. 191
Кекуле А. 78
Кирхгоф К. 179
Кольбе А. 4
Купер А. 13
Кучеров М. Г. 140
Лебедев С. В. 241, 244
Морковников В. В. 59
Семенов Н. Н. 36
Фишер 3. 206
Франкланд К. 13
Шеврель М. 160
Шухов В. Г. 102
Энгельс Ф. 27
ЭЧТӘЛЕК
Кереш 3
1. Органик кушылмаларның химик тезелеш теориясе. Химик
бәйләнешләрнең электронлы табигате
§ 1. Тезелеш теориясен китереп чыгарган алшартлар 6
§ 2. Химик төзелеш теориясе 8
§ 3. Изомерия 11
§ 4. Кечкенә периодлардагы элемент атомнарының электронлы
төзелеше. Химик бәйләнеш 15
2. Чикле углеводородлар
$ 5. Метан, аның төзелеше 22
§ 6. Метан рәтендәге углеводородларның төзелеше һәм
'■ номенклатурасы 26
§ 7. Чикле углеводородларның химик үзлекләре 33
§ 8. Чикле углеводородларны куллану һәм табу 40
§ 9. Циклопарафиннар 43
3. Чиксез углеводородлар
§ 10. Этилен, аның төзелеше 45
§ 11. Этилен рәтендәге углеводородларның төзелеше һәм
номенклатурасы 49
§ 12. Этилен рәтендәге углеводородларның химик үзлекләре . . 55
§ 13. Этилен углеводородларын куллану һәм табу 61
§ 14. Диен углеводородлар 64
§ 15. Каучук 65
§ 16. Ацетилен һәм аның гомологлары 69
4. Ароматик углеводородлар
§ 17. Бензол 77
§ 18. Бензолның гомологлары 85
§ 19. Углеводородларның күптөрлелеге. Гомологик
рәтләрнең үзара бәйләнеше 89
277
5. Углеводородларның табигый чыганаклары
§ 20. Табигый һәм иярчен нефть газлары 92
§ 21. Нефть. Нефть продуктлары 94
§ 22. Нефтьне эшкәртү 97
§ 23. Коксохимия производствосы 107
в. Спиртлар һәм феноллар
§ 24. Бер атомлы чикле спиртларның тезелеше 111
§ 25. Бер атомлы чикле спиртларның химик үзлекләре һәм
аларны куллану 118
§ 26. Спиртлар — водороды гидроксил группасына алмашты-
рылгаү углеводородлар алар. Метанолны промышлен¬
ностьта синтезлау 123
§ 27. Күп атомлы спиртлар 127
§ 28. Феноллар 129
7. Альдегидлар һәм карбон кислоталары
§ 29. Альдегидлар 134
§ 30. Бер нигезле карбон кислоталары 142
§ 31. Бер нигезле карбон кислоталарының вәкилләре 148
§ 32. Углеводородлар, спиртлар, альдегидлар һәм кислоталар
арасындагы бәйләнеш 158
8. Катлаулы эфирлар. Майлар
§ 33. Катлаулы эфирлар 157
§ 34. Майлар 160
9- Углеводлар
§ 35. Глюкоза 167
§ 36. Рибоза һәм дезоксирибоза 173
§ 37. Сахароза 175
§ 38. Крахмал 177
§ 39. Целлюлоза 181
10. Аминнар. Аминокислоталар. Азотлы гетероцнклик ку¬
шылмалар
§ 40. Аминнар 188
§ 41. Аминокислоталар 193
§ 42. Составына азот кергән гетероңиклик кушылмалар 198
§ 43. Пиримидин һәм пурин нигезләр 201
278
11. Аксымнар. Нуклеин кислоталары
§ 44. Аксымнар 204
§ 45. Нуклеин кислоталары 213
12. Синтетик югары молекуляр тозелеюле матдәләр һәм алар
нигезендәге полимер материаллар
§ 46. Синтетик югары молекуляр төзелешле матдәләрнең
гомуми характеристикасы 219
§ 47. Пластмассалар 226
§ 48. Пластмассалар (дәвамы) 231
5 49. Синтетик сүсләр 236
§ 50. Синтетик каучуклар . 241
Йомгаклау 246
Лаборатор тәҗрибәләр 257
Практик ашләр . ................ 263
Атамалар күрсәткече 269
Исемнәр күрсәткече 276
Учебное издание
Цветков Леонид Александрович
ОРГАНИЧЕСКАЯ ХИМИЯ
Учебник для 10—11 классов
татарской средней общеобразовательной школы
(перевод с русского на татарский язык)
Редакция мвдире Р. С. Вафина
Редакторы Р. 3. Закирова
Бизәлеш редакторы Р. А. Сэйфуллина
Техник редакторы Ә. С. Трофимова
Корректорлары А. М. Дзминова, Т. Н. Сагдуллина, А. А. Дзулэтова
Компьютерда биткә салучысы Р. Ф. Мебарэкҗанова
Нәшриятка 183 нче номерлы лицензия 1997 елның 7 апрелендә
бирелгән. Оригинал-макеттан басарга кул куелды 23.04.2002.
Форматы 60x90’/,,. Офсет кәгазе. «Школьная* гарнитурасы.
Офсет басма. Басма табагы 17,5 + форэ. 0,25.
Нәшер-хисап табагы 17,37 + форэ. 0,39.
Тиражы 25 500 д. Заказ Б-177.
«Мәгариф» нәшрияты. 420111. Казан, Бауман урамы, 19.
Издательство «Магариф». 420111. Казань, ул. Баумана, 19.
Тел./факс (8432) 92-57-48.
E-mail: magarif@maii.ni
Http://magarif.kazan.ru/
«Идел-Пресс» полиграфия-непгрият комплексы.
420066. Казан, Декабристлар урамы, 2.
5
М. Органам матданар молекуяапармныц модальләре:
1 —иэогексан; 2 — хлорэтан; 3 — дихлорәталмын цис һәм транс-иэомерлары;
4 —этил спирты; 5 —фенол.
IV. Органик матдәләр молекулаларының модельләре
1 - ацетальдегид; 2-ацетон; 3 - серкә кислотасы; 4- анилин;
5 - аминосеркә кислотасы; 6 - аминокапрон кислотасы.