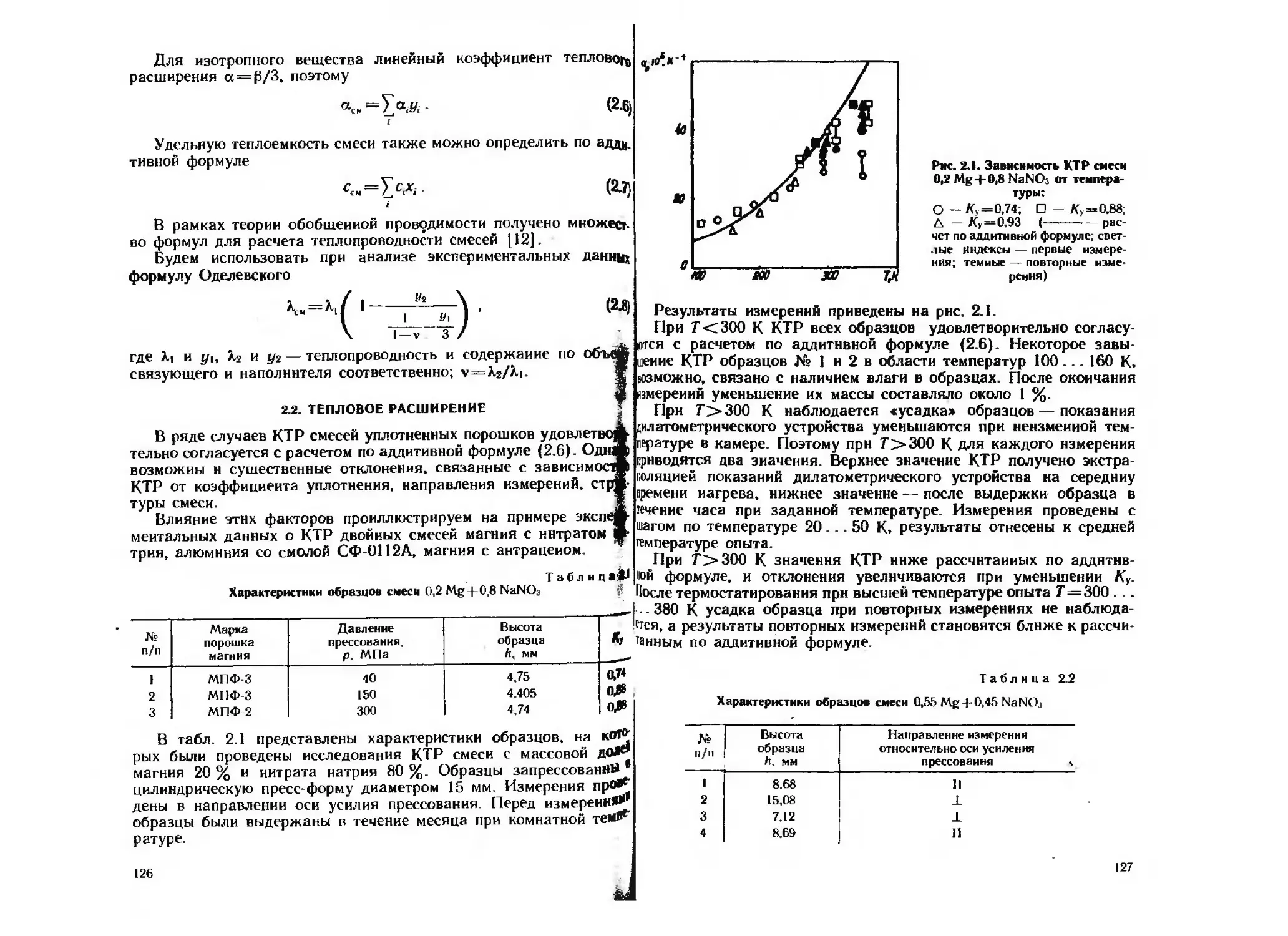
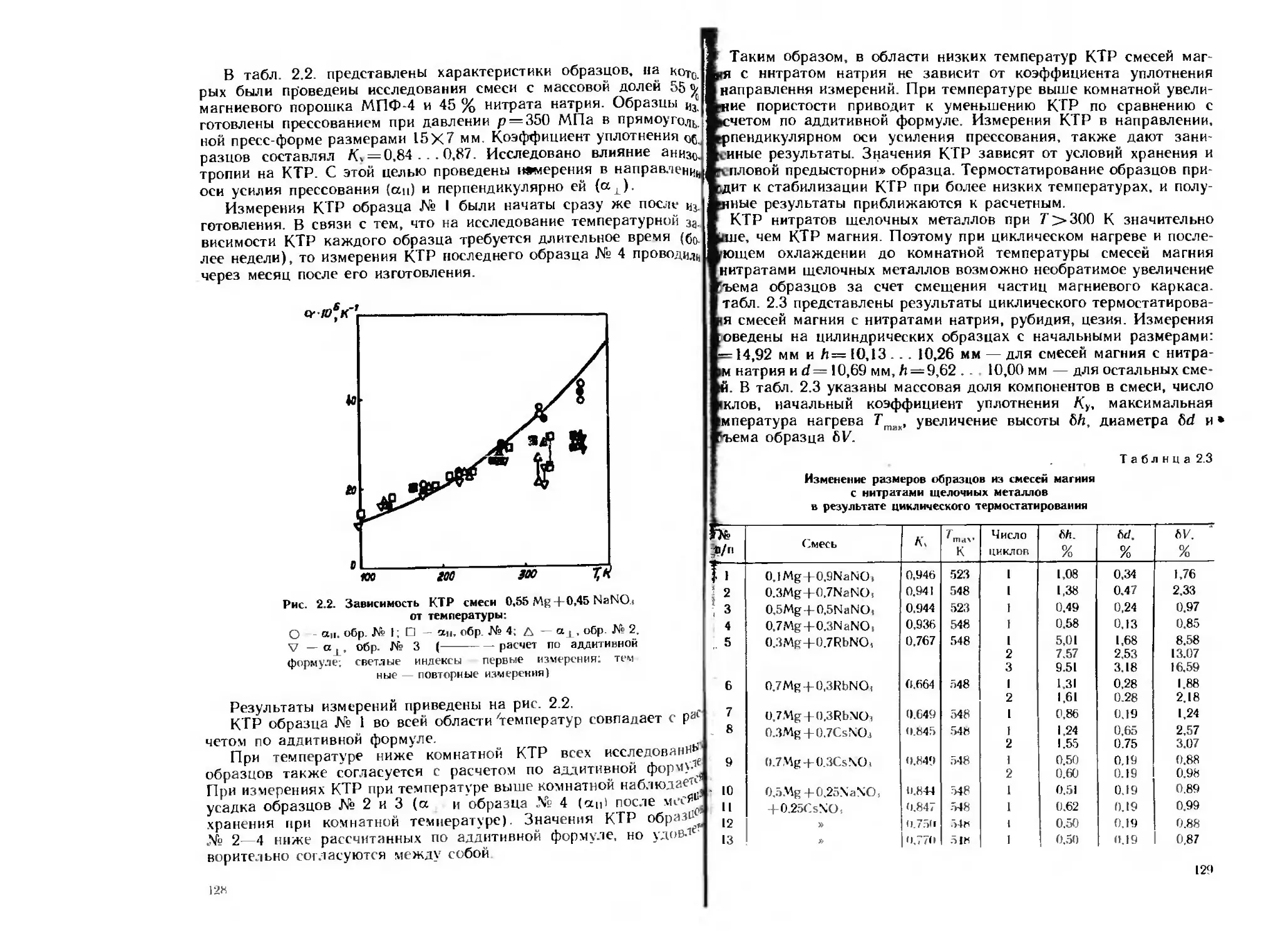
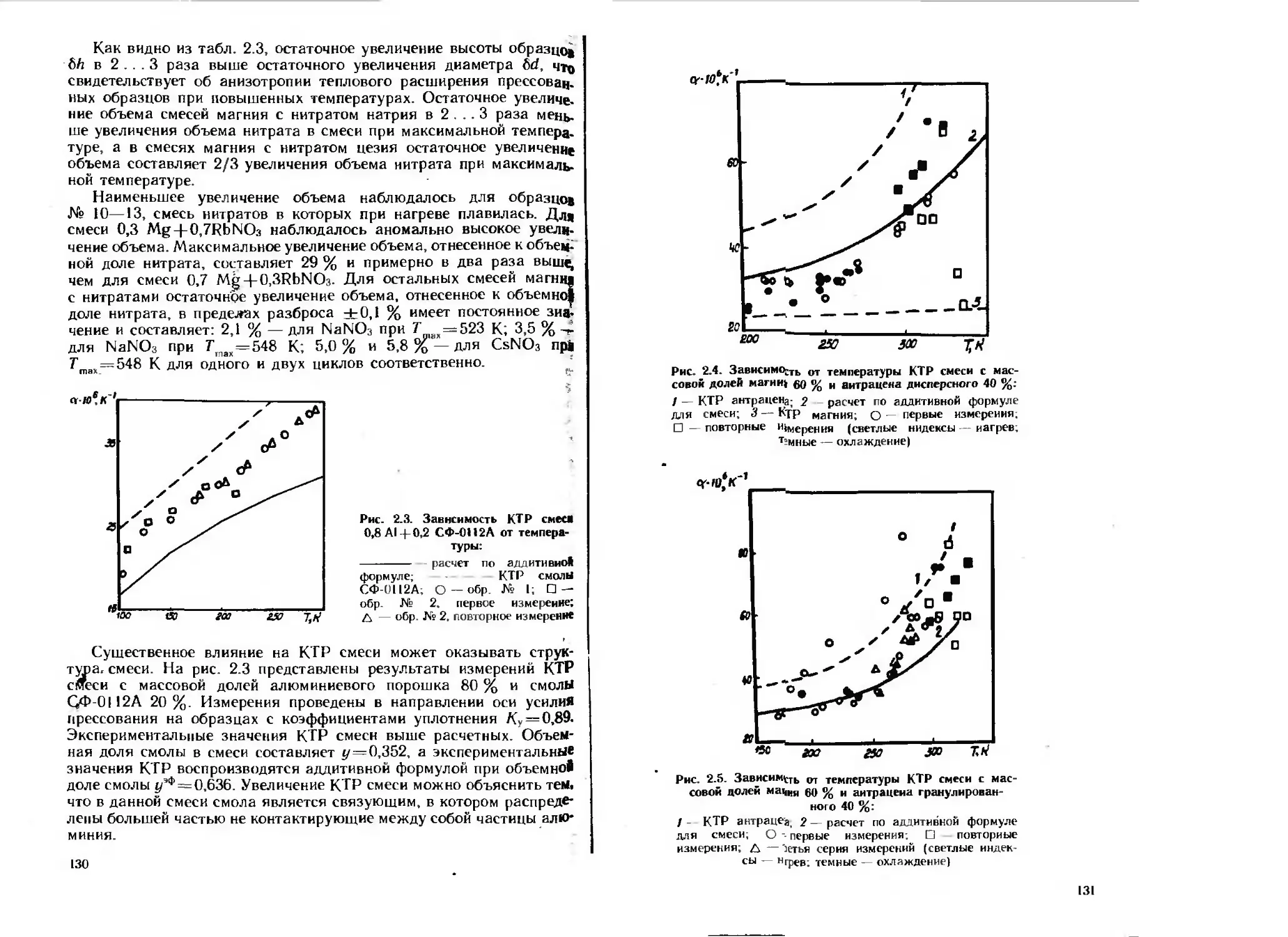
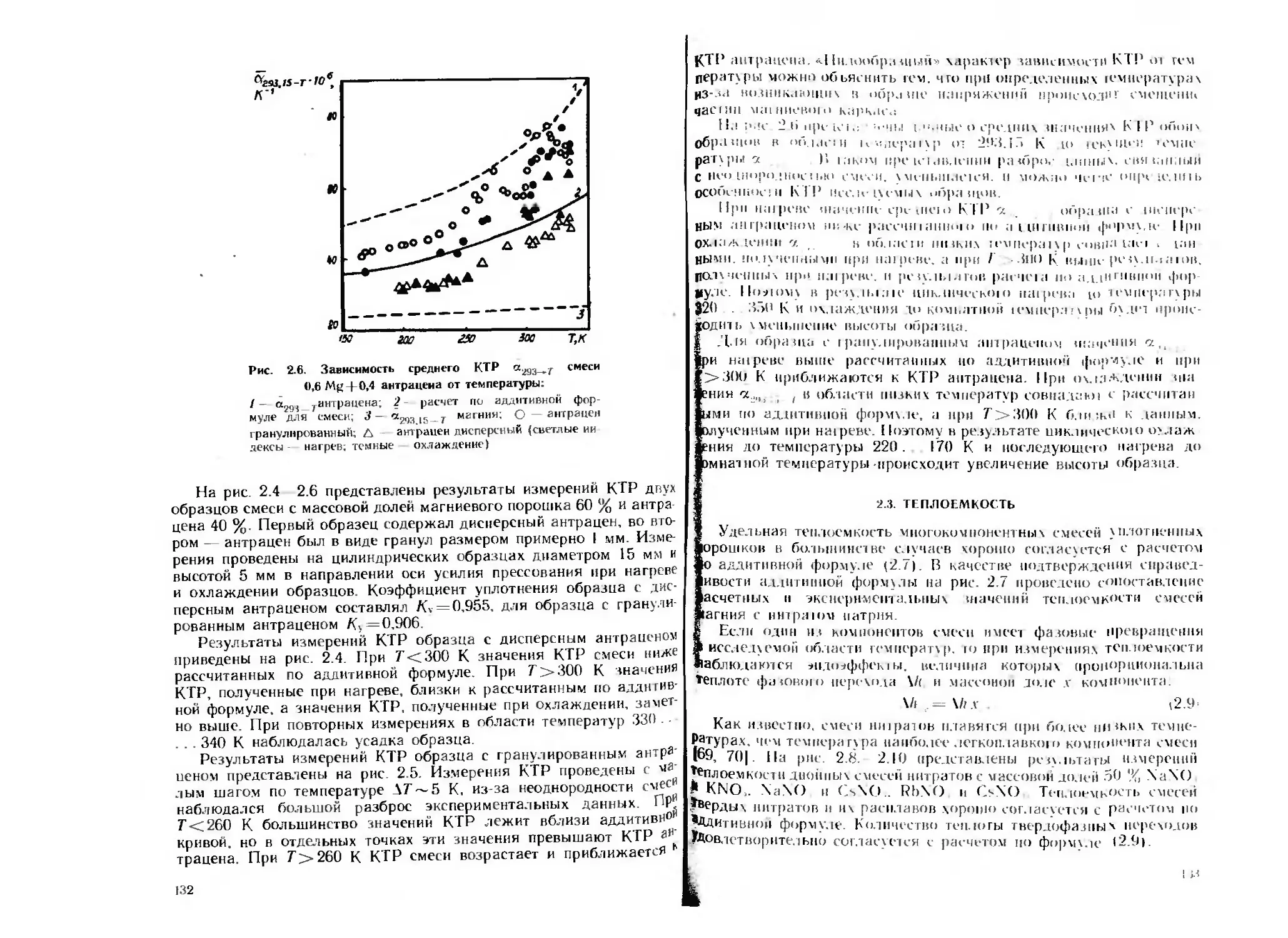
Текст
Научно-производственное объединение
«Информация и технико-экономические
исследования»
Ю. Е. ШЕЛУДЯК, Л. Я. КАШПОРОВ,
Л. А. МАЛИНИН, В. Н. ЦАЛК.ОВ
ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА
КОМПОНЕНТОВ
ГОРЮЧИХ СИСТЕМ
СПРАВОЧНИК
Под редакцией д-ра техн, наук проф. Н. А. Силина
МОСКВА
1992
УДК (536.413 + 536.63 +536.211:662
Систематизированы и табулированы в зависимости от темпера-
туры данные о коэффициенте теплового расширения, теплоемкости
и теплопроводности основных компонентов конденсированных горючих
систем: металлов, неметаллических элементов, сплавов, оксидов, нит-
ратов. хлоратов, перхлоратов и других неорганических солей, орга-
нических соединений, смол, полимеров, взрывчатых веществ и нитро-
глицериновых порохов (всего около ста индивидуальных веществ). Рас-
смотрены основанные на внализе экспериментальных данных методы
оценки теплофизических свойств смесей уплотненных порошков. Из-
ложена методология применения теплофизических свойств горючих
систем для анализа экспериментальных двниых о скорости горения
и приведены полученные в результате такого анализа определяющие
параметры волны горения основных классов горючих систем: газовых
смесей, взрывчатых веществ, порохов, пиротехнических и СВС-систем.
Для инженерно-технических и научных работников в области го-
рения и теплофизики.
ВВЕДЕНИЕ
Процессы горения использовались человечеством с древнейших
времен, однако систематические научные исследования процессов
горения были начаты в конце прошлого века [1. 2]. В качестве го-
рючих систем применяется множество веществ и смесей — балли-
ститные пороха и взрывчатые вещества [3], пиротехнические си-
стемы [4], системы самораспространяющегося высокотемператур-
ного синтеза (СВС-системы) [5], традиционные твердые, жндкне
и газообразные топлива, а в качестве компонентов горючих систем
может найти применение большинство известных веществ.
Развитие теплотехники, химической технологии н других обла-
стей практической деятельности, связанных с тепловыми процес-
сами. требует надежных сведений о теплофизических свойствах
веществ н материалов. Поэтому проводятся экспериментальные и
теоретические исследования теплофизических свойств веществ и ма-
териалов в широком диапазоне параметров состояния. Для наи-
более важных в техническом отношении веществ такие исследова-
ния доведены до уровня стандартных справочных данных, обя-
зательных к применению во всех отраслях народного хозяйства.
Однако целенаправленные и систематические исследования теп-
лофизических свойств горючих систем не проводились. Если и су-
ществуют надежные и подробные данные о теплофизических свой-
ствах каких-либо горючих систем и их компонентов, то обычно это
обусловлено применением данных веществ и материалов для це-
лей, не связанных с горением.
Обычно в теории горения вместо реальных зависимостей теп-
лофизических свойств от параметров состояния используются не-
которые постоянные коэффициенты, в большинстве случаев отно-
сящиеся к нормальным условиям. Это вызвано тем, что в существу-
ющих теоретических моделях процессов горения предполагается,
что скорость горения определяется скоростью химических реакций
прн максимальной температуре горения, а все процессы, происхо-
дящие при более низких температурах, являются незначительными.
Учет реальных зависимостей теплофнзических свойств от темпера-
туры сильно усложняет решение задачи н только затемняет фи-
з
зический смысл процесса, не приводя к существенному улучшению
получаемых результатов [6].
С другой стороны, существует и противоположное мнение о зна-
чимости теплофизнческих свойств для анализа процесса горения:
«. . . лишь в немногих моделях учитывается зависимость теплофи-
зических параметров от температуры, а именно на этом учете осно-
ваны наиболее точные модели горения, позволяющие рассчиты-
вать температурный коэффициент скорости горения твердого топ-
лива> [7].
Но особое значение надежные данные о теплофизических свой-
ствах горючих систем имеют при энтальпийном подходе к анализу
процесса горения [8, 9], в рамках которого из экспериментальных
данных о скорости горения можно получать информацию о важней-
ших характеристиках волны горения и исследовать влияние раз-
личных факторов на скорость горения.
Теплофизические свойства горючих систем необходимы также
для решения задач воспламенения, зажигания, пожаро- и взрыво-
безопасности и проведения расчетов в процессе проектирования
изделий и тепловых устройств различного назначения.
Настоящий справочник предназначен для обеспечения пользо-
вателей исходными данными о теплофизических свойствах наиболее
распространенного класса горючих систем — гетерогенных конден-
сированных систем (ГКС) н содержит следующие сведения'
данные о температурах н теплоте фазовых превращений, темпе-
ратурных зависимостях плотности, коэффициента теплового рас-
ширения, теплоемкости, теплопроводности и температуропроводно-
сти наиболее распространенных компонентов в ГКС — металлов,
неметаллических элементов, сплавов, оксидов, нитратов, хлоратов,
перхлоратов, различных неорганических солен, органических соеди-
нений, смол, полимеров, порохов и взрывчатых веществ (всего
около ста индивидуальных веществ);
экспериментальные данные о теплофизнческих свойствах смесей
уплотненных порошков и основанные на анализе эксперименталь-
ных данных методы оценки теплофизических свойств смесей по
рецепту смеси и данным о теплофизических свойствах компонен-
тов;
методологию применения теплофизнческих свойств горючих
систем при анализе экспериментальных данных о скорости горения
н полученные в результате такого анализа определяющие параметры
волны горения различных горючих систем: взрывчатых веществ, пи-
ротехнических систем, СВС-систем.
1. ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА
ИНДИВИДУАЛЬНЫХ КОМПОНЕНТОВ
ГЕТЕРОГЕННЫХ КОНДЕНСИРОВАННЫХ СИСТЕМ
1.1 ОБЩИЕ СВЕДЕНИЯ
Представленные в этом разделе справочные данные о теплофи-
зических свойствах компонентов ГКС получены на основании обоб-
щения имеющихся в литературе сведений и экспериментальных ис-
следований авторов. Частично результаты авторских исследований
теплофизнческих свойств компонентов ГКС приведены в работах
[Ю, 11]
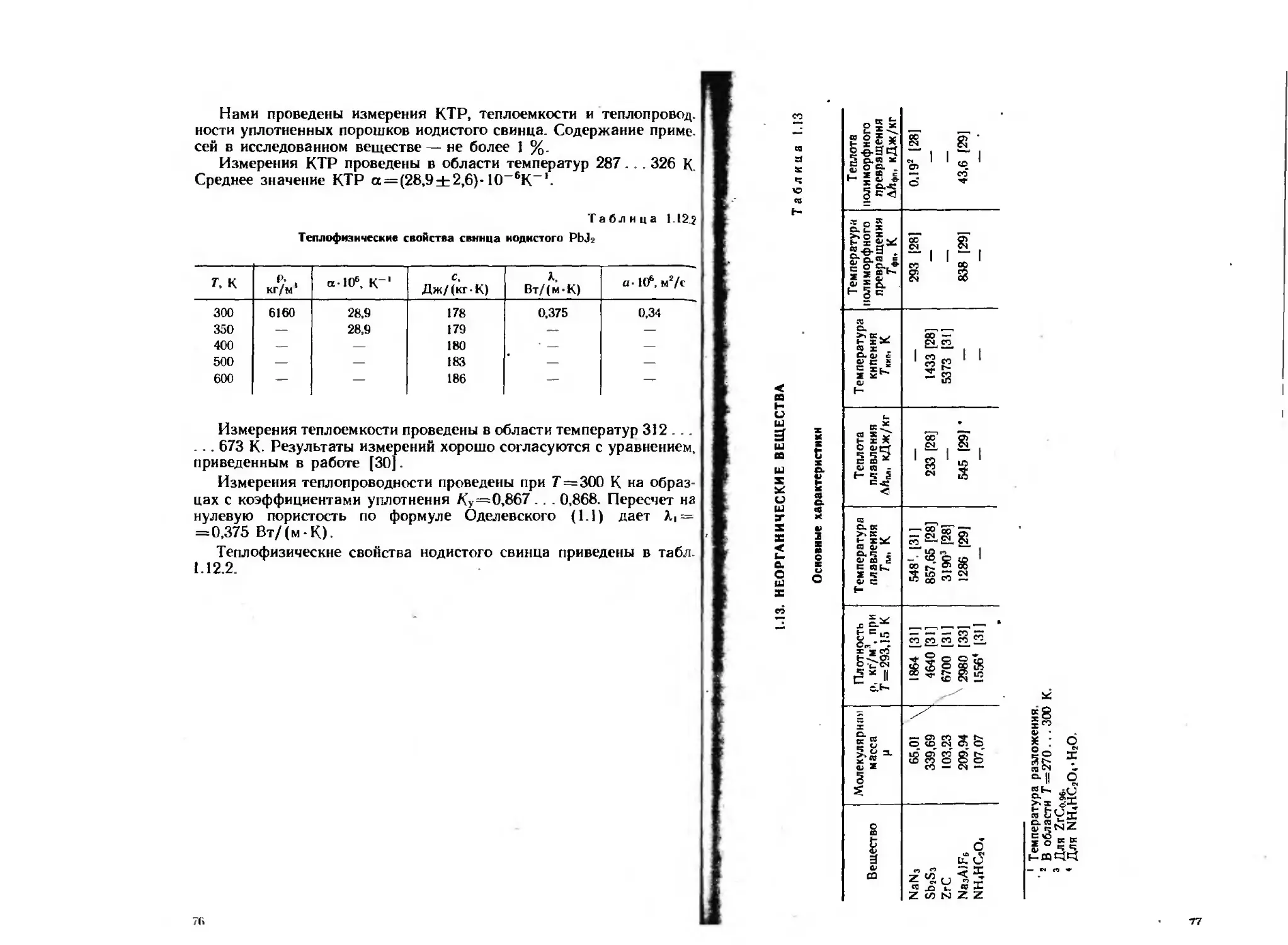
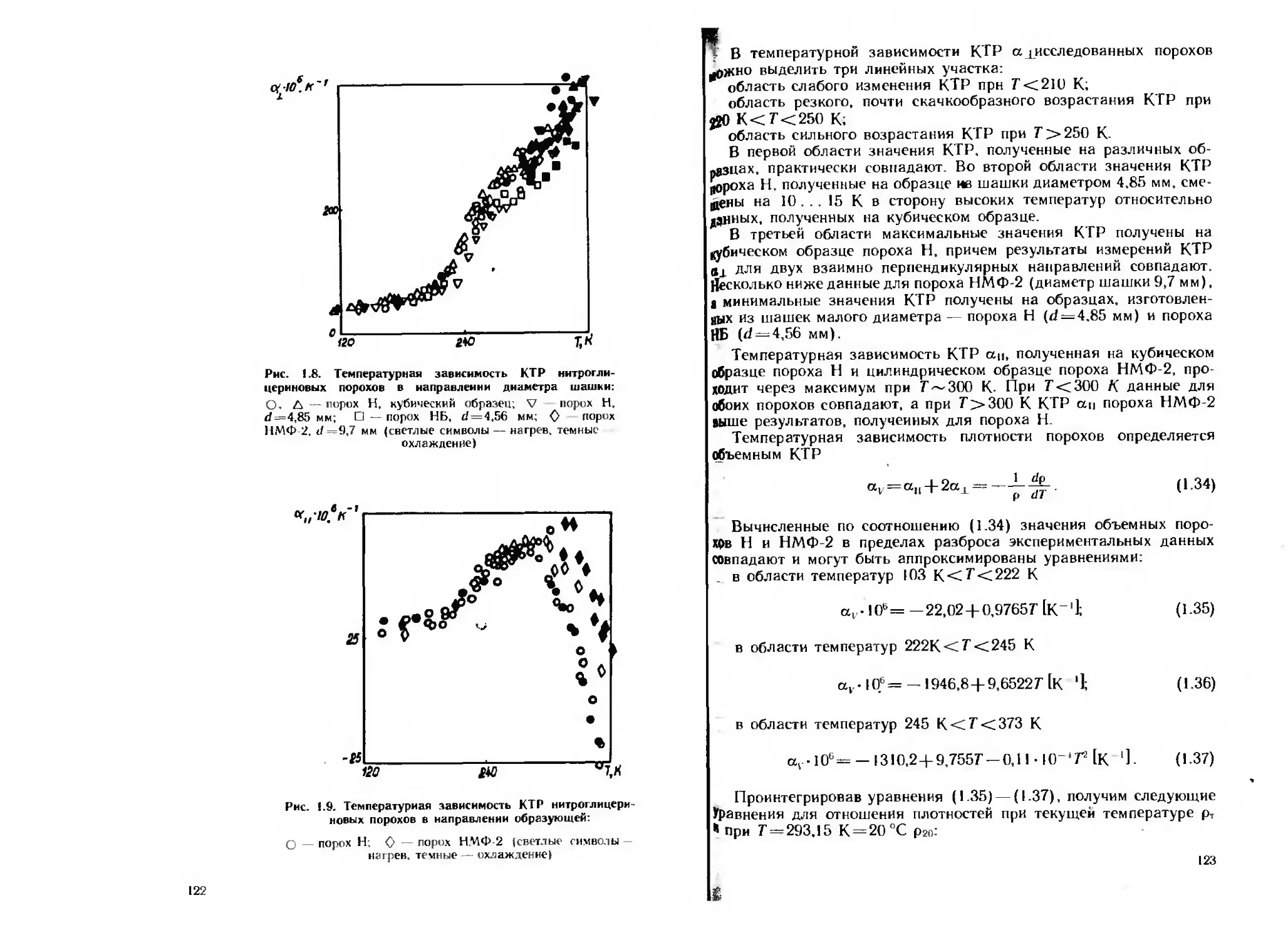
Измерения коэффициента теплового расширения (КТР) прово
дили на кварцевом дилатометре, выполненном по двухштоковон
оптико-механической схеме, в области температур от 90 до 380 К
(для отдельных веществ до темперауры 470 К).
Измерения теплоемкости осуществляли методом монотонного
разогрева на установке ИТ С-400 в области температур 150 . . 670 К
По результатам измерений теплоемкости определяли также эндо-
и экзотермические эффекты в исследованной области температур.
Измерения теплопроводности при нормальных условиях выпол-
няли на установке, использующей модифицированный метод регу
лярного режима первого рода. Температурную зависимость тепло-
проводности определяли методом монотонного разогрева на уста
новке ИТ-Х-400 в области температур 170 . . . 700 К.
Большинство экспериментальных данных получено на образ-
цах, изготовленных уплотнением порошков различной дисперсности.
Давление прессования составляло от 30 до 1000 МПа.
Исследование теплофизнческих свойств веществ на образцах,
изготовленных уплотнением порошков, сопряжено с определенными
трудностями. На теплофизические свойства уплотненных порошков
может оказывать влияние ряд факторов: давление прессования, ко-
эффициент уплотнения Ку=1—ш, где т — пористость образца,
размеры и форма частиц В ряде случаев порошки обладают более
высокой химической активностью и гигроскопичностью по сравнению
с монолитными образцами.
При измерении КТР наблюдаются усадка или аномальный рост
образцов, вызванные первоначальной деформацией частиц порошка
в результате прессования Термостатирование образцов приводит к
стабилизации КТР при более низких температурах, причем полу-
4
чаемые результаты в широком диапазоне изменения пористости
близки к данным для монолитных образцов.
Прн измерениях теплоемкости часто наблюдаются эндотерми веществ наблюдается более сильная зависимость теплопровод
ческин эффект при Г~400 К. вызванный испарением содержащейся ностц от пористости, чем по формуле (1.1). Для этих веществ мож
в образце влаги, и экзотермический эффект при повышенных тем- „0 использовать формулу Оделевского с поправочным множителем
пературах, вызванный началом окисления частиц исследуемого
вещества. — = 1 1----------—-------\ (1 — Ст), (1.4)
Теплопроводность уплотненных порошков сильно зависит от по- xi \ 1_____1 ~ т I
ристости. Наиболее удобной для практических расчетов эффектив- I — v 3
ной теплопроводности двойных смесей является формула Оделев- где с — эмпирический коэффициент, выбираемый из условия луч
ского [12] шег0 описания зависимости теплопроводности от пористости.
у-=1——---------. m,+m2=l. (1.1)
г.| I 1
1 — v 3
где Xi и >.! — теплопроводность связующего и наполнителя соответ-
ственно; т, и тг — объемная доля связующего и наполнителя
соответственно; v=Z2/Zi. Для уплотненных порошков основное
вещество является связующим, а воздух — наполнителем. Ввиду
малой теплопроводности воздуха (Х2 = 0,0263 Вт/(м-К) прн Г=
=300 К) v«rO и формулу (1.1) можно записать в виде
к _ 2(1- т) _ 2К,
X, 2 + т 3 - К,
По формуле (1.2) легко определить теплопроводность вещества при
нулевой пористости из экспериментальных данных о теплопровод-
ности пористого образца:
з — к
’•'=Z-2<^' (1'3)
Пренебрежение в формуле (1.3) теплопроводностью воздуха
приводит к завышению оценки значения Xi, однако в области
v = 0,01 ... 0,1 и Ку=0,7 ... 0,95, как видно из табл. 1.1, эти откло-
нения лежат в пределах погрешности экспериментального опреде-
ления теплопроводности.
Таблица 1.1
Погрешность оценки теплопроводности при нулевой пористости
по формуле (1.3) 6?.|, %
V А\ 0,4
0,95 0,9 0.8 0.7 О.6 0.5
0,01 0.1 0.2 0.5 0,9 1.2 1.8 2.6
0.02 0,2 0.5 1.0 1.7 2.5 з.ь 5.2
0.05 0,6 1.2 2.5 4.2 6.2 8.9 12,9
0,1 1.1 2,3 4.9 8.2 12.2 17.7 25.6
Теплопроводность уплотненных порошков большинства иссле-
дованных авторами неорганических соединений и органических ве
ществ хорошо согласуется с расчетом по формуле (1.1). Для ряда
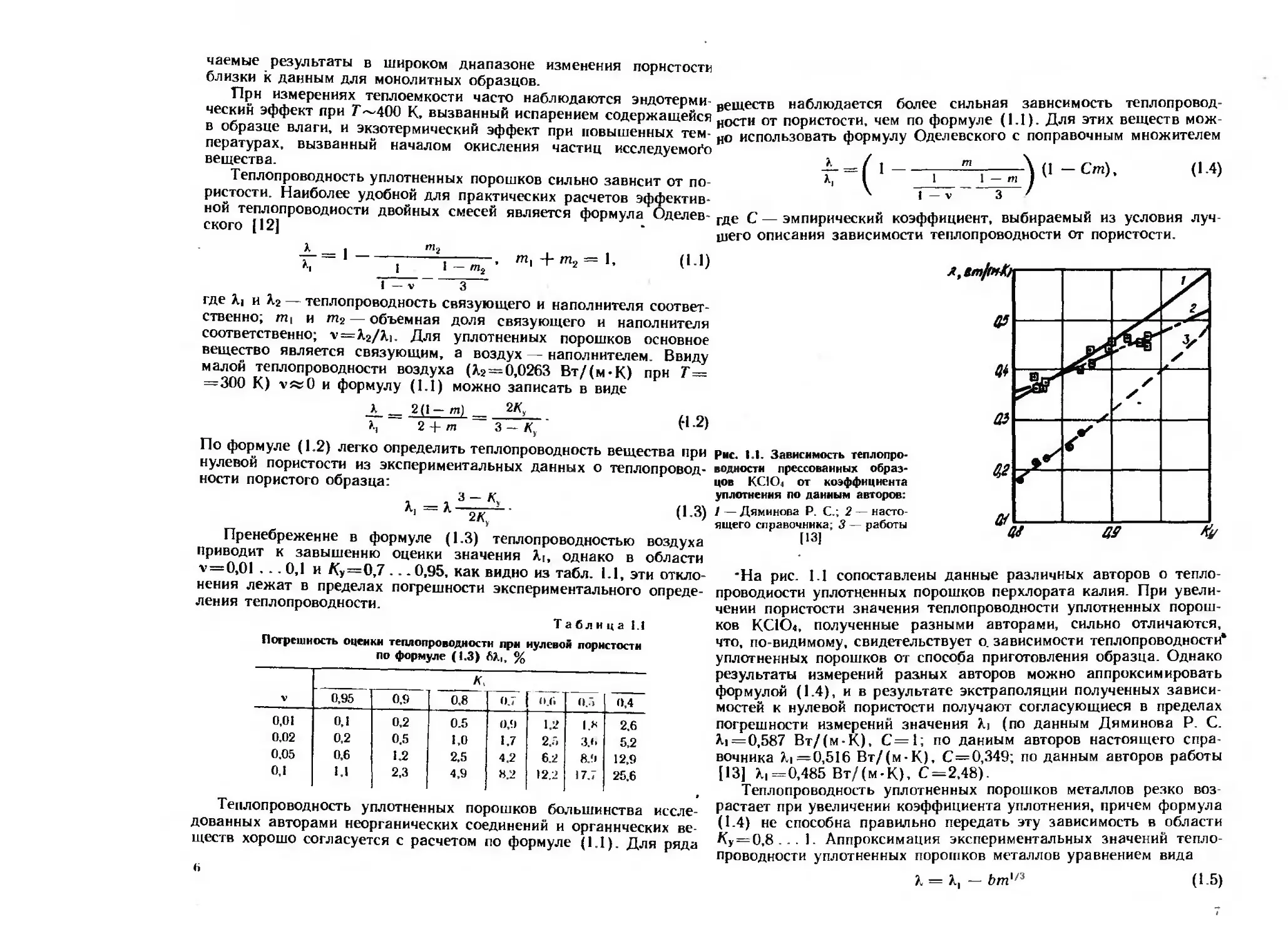
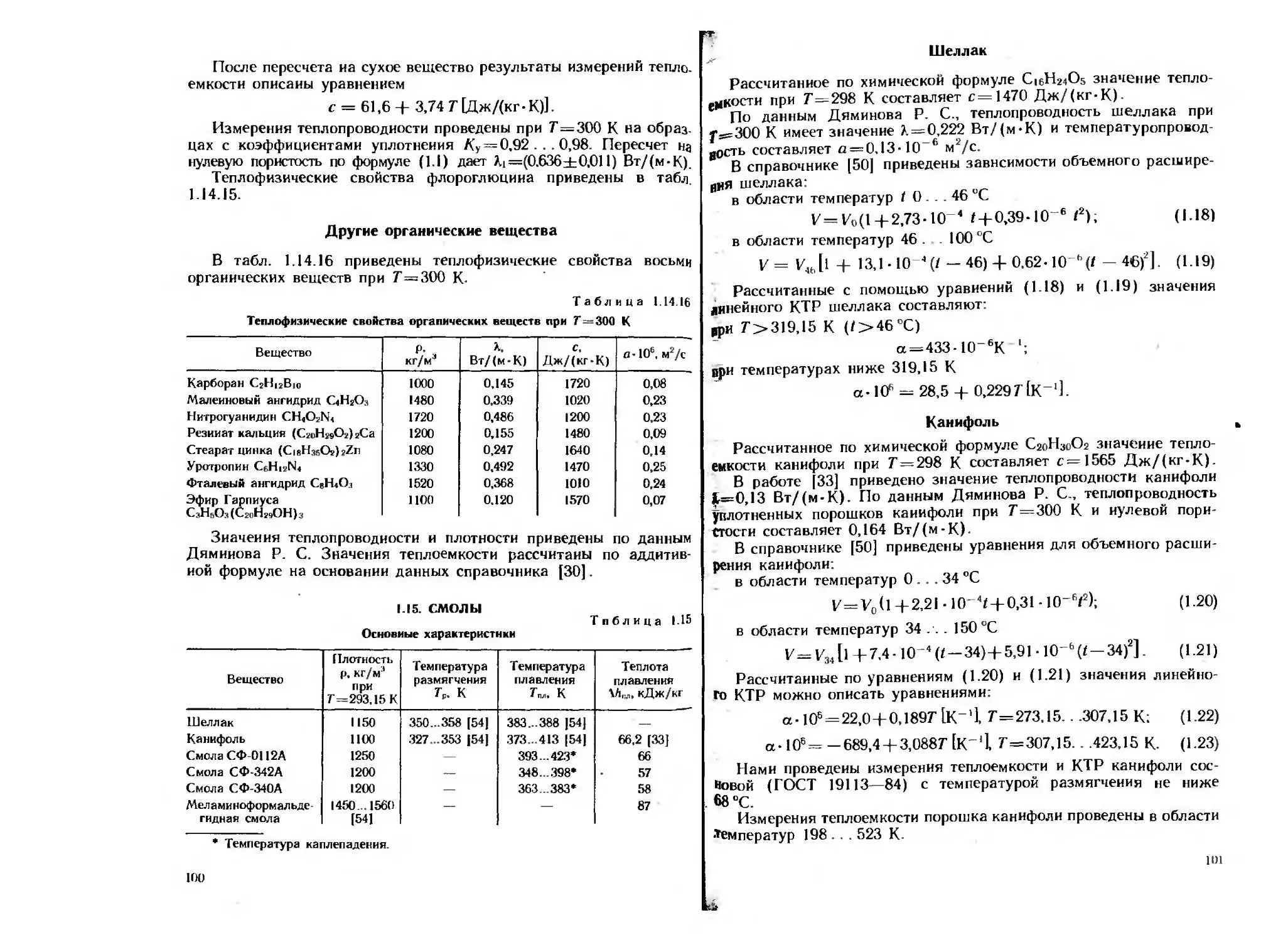
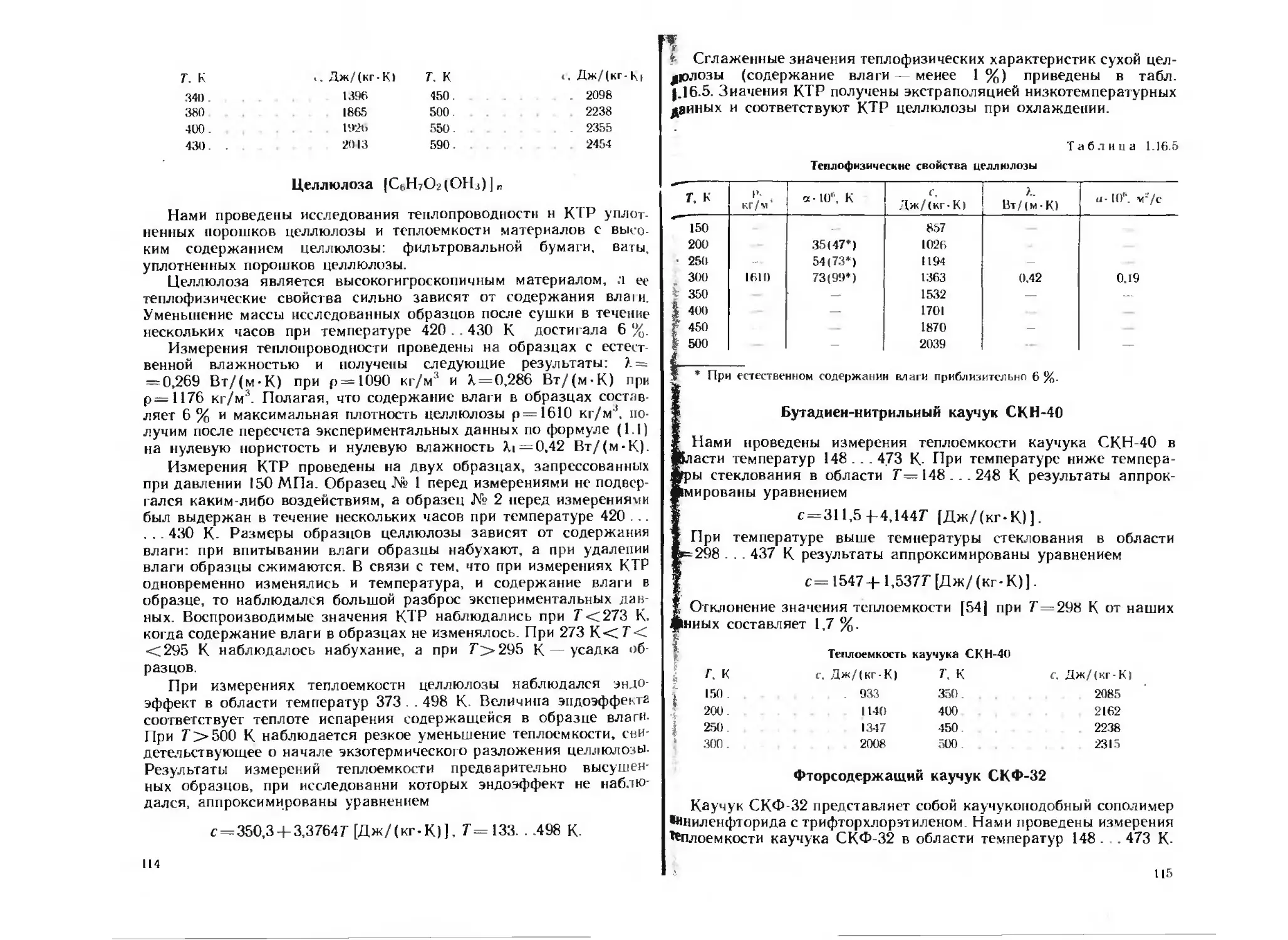
Рис. 1.1. Зависимость теплопро-
водности прессованных образ-
цов KCIO4 от коэффициента
уплотнения по данным авторов:
/ — Дяминова Р. С.; 2 — насто-
ящего справочника; 3 — работы
1131
•На рис. 1.1 сопоставлены данные различных авторов о тепло-
проводности уплотненных порошков перхлората калия. При увели-
чении пористости значения теплопроводности уплотненных порош-
ков КС1О1, полученные разными авторами, сильно отличаются,
что, по-видимому, свидетельствует о. зависимости теплопроводности*
уплотненных порошков от способа приготовления образца. Однако
результаты измерений разных авторов можно аппроксимировать
формулой (1.4), и в результате экстраполяции полученных зависи
мостей к нулевой пористости получают согласующиеся в пределах
погрешности измерений значения X, (по данным Дяминова Р. С.
М = 0,587 Вт/(м-К), С=1; по данным авторов настоящего спра-
вочника >.i =0,516 Вт/(м-К), С=0,349; по данным авторов работы
[13] Х|=0,485 Вт/(м-К), С=2,48).
Теплопроводность уплотненных порошков металлов резко воз
растает при увеличении коэффициента уплотнения, причем формула
(1.4) не способна правильно передать эту зависимость в области
Ку—0,ё . . . I. Аппроксимация экспериментальных значений тепло-
проводности уплотненных порошков металлов уравнением вида
X = X, - Ьт,/3
(1.5)
позволяет получить значение Хь близкое к литературным данным t
теплопроводности металлов.
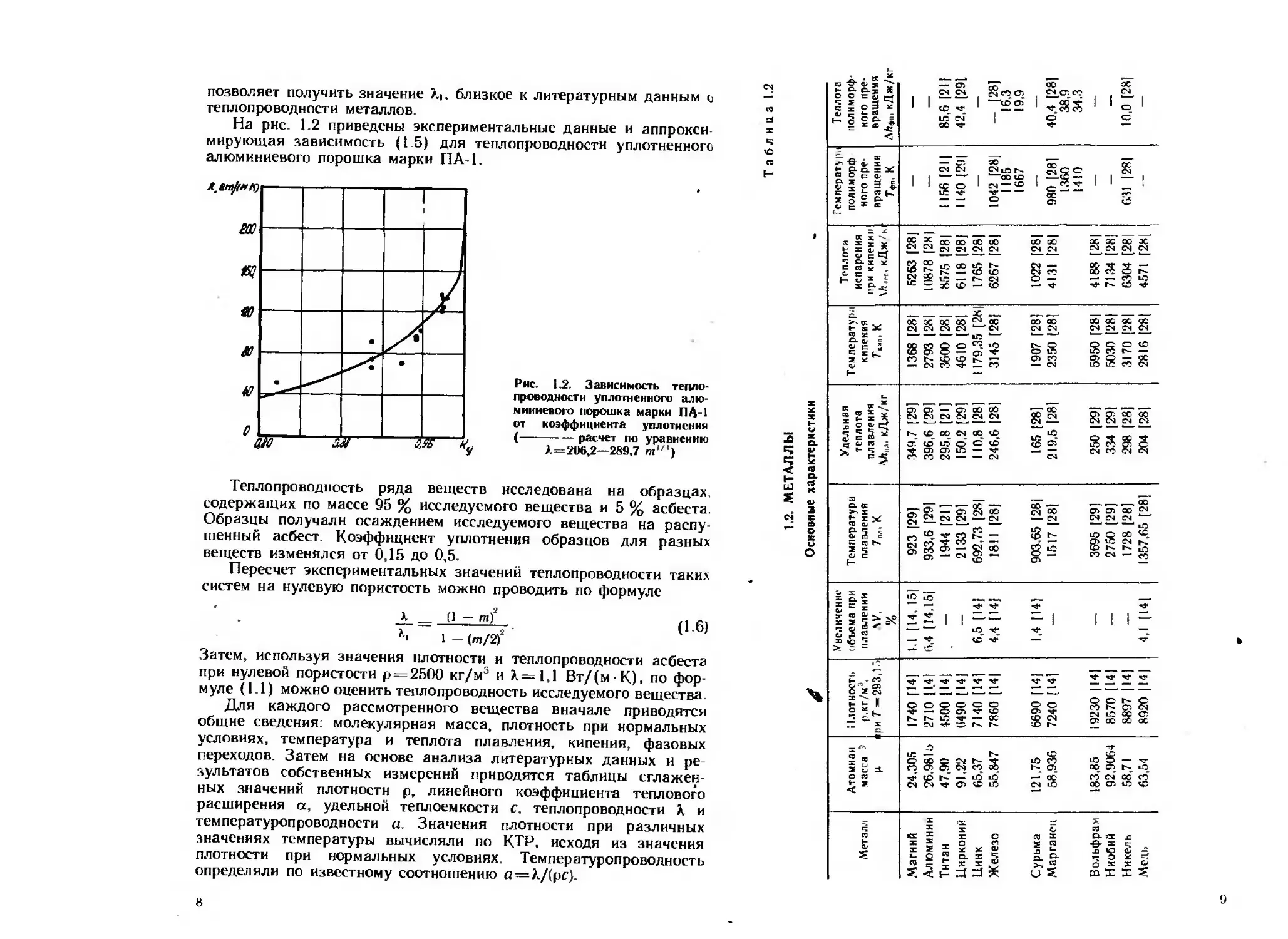
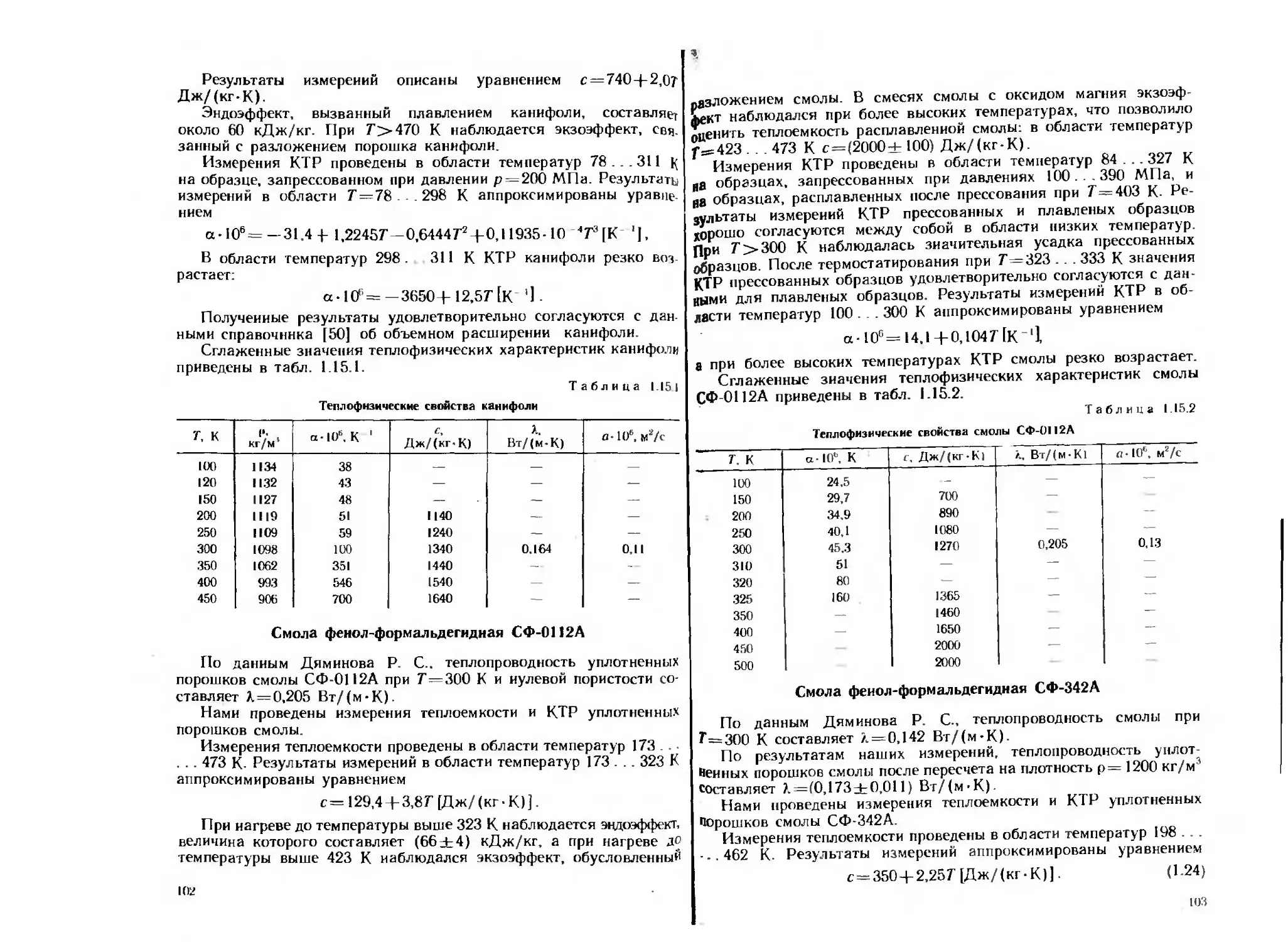
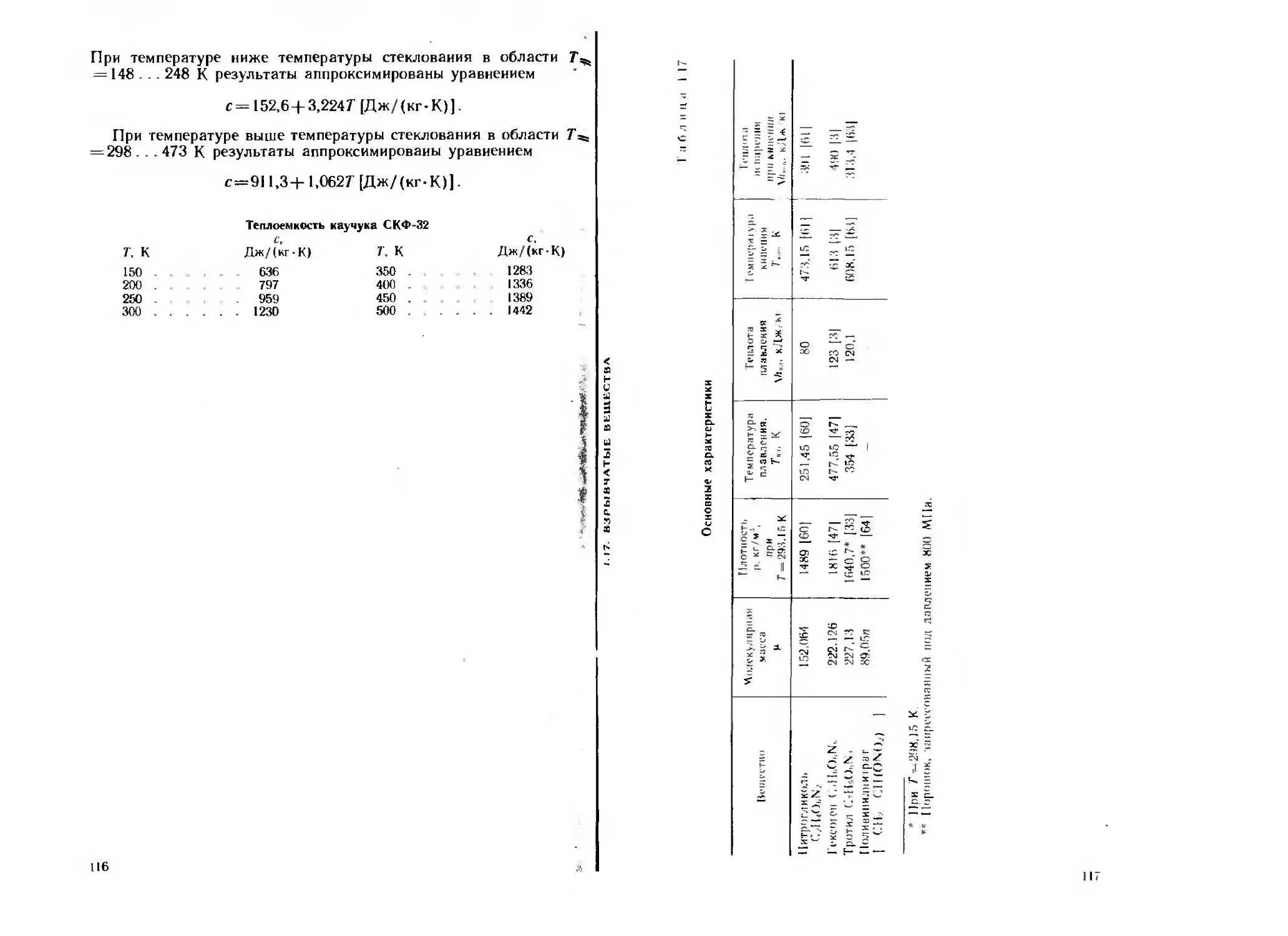
На рнс. 1.2 приведены экспериментальные данные и аппрокси-
мирующая зависимость (1_5) для теплопроводности уплотненного
алюминиевого порошка марки ПА-1.
Рнс. 1.2. Зависимость тепло-
проводности уплотненного алю-
миниевого порошка марки ПА-1
от коэффициента уплотнения
(--------расчет по уравнению
Л.=206,2—289,7 т(/‘)
исследована на образцах.
(1.6)
Теплопроводность ряда веществ
содержащих по массе 95 % исследуемого вещества и 5 % асбеста.
Образцы получали осаждением исследуемого вещества на распу-
шенный асбест. Коэффициент уплотнения образцов для разных
веществ изменялся от 0,15 до 0,5.
Пересчет экспериментальных значений теплопроводности таких
систем на нулевую пористость можно проводить по формуле
X _ (1 - m)z
1 — (т/2)'
Затем, используя значения плотности и теплопроводности асбеста
при нулевой пористости р = 2500 кг/м3 и Х=1,1 Вт/(м-К). по фор-
муле (11) можно оценить теплопроводность исследуемого вещества
Для каждого рассмотренного вещества вначале приводятся
общие сведения: молекулярная масса, плотность при нормальных
условиях, температура и теплота плавления, кипения, фазовых
переходов. Затем на основе анализа литературных данных и ре-
зультатов собственных измерений приводятся таблицы сглажен
ных значений плотности р, линейного коэффициента теплового
расширения а, удельной теплоемкости с. теплопроводности X и
температуропроводности а Значения плотности при различных
значениях температуры вычисляли по КТР, исходя из значения
плотности при нормальных условиях. Температуропроводность
определяли по известному соотношению а = Х/(рс).
9
8
Магний
Измерения теплоемкости и КТР проведены на образцах, изго-
товленных прессованием магниевых порошков МПФ-1 и МПФ-4.
Содержание магния в исследованных образцах — не менее 98,5 %.
Результаты измерений теплоемкости в пределах ±3% согласуют-
ся со справочными данными [14, 16].
Результаты измерений КТР в области температур 90 .. . 380 К
аппроксимированы уравнением
а-106 = 31,24 + 1,293-10-3Г —-!^-[К~*1 (1.7)
Среднее квадратичное отклонение экспериментальных значе-
ний КТР от уравнения (1.7) составляет 2 %.
В области температур 100.. . 550 К расчет по уравнению (1.7)
согласуется со справочными данными работы [17] в пределах ±3 %.
Экстраполяция уравнения (1.7) в область более высоких темпера-
тур дает заниженные значения КТР — отклонения от данных ра-
боты [17] составляют 10 % при 7'=700 К и 14 % при Г=800-К-
Табл и ца 1.2.1
Теплофизические свойства магния
ЛК р. кг/м3 а-106. К1 Дж/(кг-К) К Вт/(м-К) а-106, м’/с
100 1763 15,4 648 195 172
120 1761 17,6 729 190 149
150 1758 20,0 837 185 126
200 1752 22,8 936 174 106
250 1746 24,6 992 167 96
300 1739 25,8 1025 160 90
350 1732 26,5 1051 153 84
400 1725 27,3 1076 147 79
450 1718 28,1 1099 142 75
500 1711 29,0 1122 137 71
550 1703 30,0 1144 132 68
600 1696 31,0 1166 127 64
650 1689 32.0 1188 122 61
700 1681 33,0 1210 117 58
800 1665 35,0 1260 НО 52
1000 1543 — 1384 98 46
1200 1543 — 1249 98 51
1400 — — 1133 — —
1600 — 1142 __ —
Значения плотности при температуре до 7=700 К рассчитаны
по температурной зависимости КТР, а при более высоких температу-
рах приняты по данным работы [15].
Ю
Значения теплопроводности получены графической обработ-
кой справочных данных [14, 15]. Различие между данными работ
[14] и [15] не превышает 5 %. Теплоемкость жидкого магния при-
ведена по данным работы [18].
Сглаженные значения теплофизнческих характеристик магния
приведены в табл. 1.2.1.
Алюминий
Измерения теплоемкости, КТР и теплопроводности проведены
на образцах, изготовленных прессованием алюминиевых порошков
ПА-1 и ПЛ-4.
Содержание алюминия в исследованных образцах — ие меиее
99%.
Результаты измерений теплоемкости в пределах ±4 % согла
суются со справочными данными [14—16, 18].
Результаты измерений КТР в области температур 90. . . 380 К
аппроксимированы уравнением
а-106 = 24,81 + 8,788-10-3Т--1^Я-[К“‘]. (1-8)
В области температур 100. . .650 К расчет по уравнению (1.8)
согласуется со справочными данными [17] в пределах ±3%.
Экстраполяция уравнения (1.8) в область более высоких темпе-
ратур дает заниженные значения КТР — отклонения от данных
[17] составляют 4 % при температуре 700 К и 10 % при темпера-
туре 850 К-
Измерения теплопроводности проведены при 7= 300 К на
14 образцах с коэффициентами уплотнения Ку = 0,817 ... 0,983.
Разброс экспериментальных данных при одинаковых значениях
Ку достигал 20 %
Экспериментальные данные были аппроксимированы уравне-
нием (1.5) при =206,2; 6=289,7 Вт/(м-К)
Экстраполяция данных для прессованного алюминия к нуле-
вой пористости дает значение теплопроводности, близкое к лите-
ратурным данным [14, 16, 20].
Сглаженные значения теплофизических свойств алюминия приве-
дены в табл. 1.2.2. Значения теплоемкости при температуре ниже
300 К приведены по данным [16, 19], выше 300 К — по данным
[14, 15]. Значения теплопроводности приведены поданным [14, 16,
20], КТР — по табличным данным [17]. Значения плотности в об-
ласти температур 100 . . .700 К вычислены по температурной за-
висимости КТР (1.8) н р = 2710 кг/м3 при 7 = 293 К. При более
высоких температурах значения плотности приведены по данным
[15]
и
Теплофнзические свойства алюминия Таблица 1.2,2
т. к . кг/м а-ИЛК"' Дж/(кг-К) X. Вт/(м«К) a* I06. №/с
100 2740 12,3 481 243 186
120 2738 14,6 578 240 153
150 2734 17.3 683 235 127
200 2726 20,2 791 228 111
250 2718 22.0 854 223 97
300 2709 23,3 899 217 90
350 2699 23,8 921 213 86
400 2689 24,5 944 209 83
450 2679 25,3 967 205 79
500 2669 26,2 990 201 76
550 2658 27,1 1012 198 74
600 2647 28.1 1035 195 71
650 2636 29.1 1058 192 69
700 2625 30,2 1081 190 67
800 2600 32.6 1127 186 64
900 2575 — 1173 184 62
1000 2352 — 1086 61 24
1200 2300 — 1086 j 62 25
Титан
Измерения КТР, теплоемкости и теплопроводности проведены
на образцах, изготовленных прессованием титановых порошков
ПТМ.
Содержание титана в исследованных образцах — не менее 99 %.
Измерения КТР проведены в области температур 160 . .. 380 К
В области температур 160 ...300 К результаты измерений согла-
суются со справочными данными (17] в пределах ±4 %. При более
высоких температурах разброс экспериментальных значений КТР
достигает ±20 %.
Измерения теплоемкости проведены в области температур
150 . 673 К. В области низких температур результаты измерений
хорошо согласуются с литературными данными [16. 21J. При
Г>300 К результаты наших измерений выше данных [21, 22],
теплоемкость имеет максимум при Т«615 К, характерный для
фазовых переходов второго рода. При Т'>400 К на результаты
измерений оказывает сильное влияние окисление образца.
Образование оксида титана ТЮ проходит с выделением коли’
чества теплоты 8119 кДж/кг [23J. Поэтому при измерениях тепло-
емкости окисляющегося титана будет затрачиваться меньше теп-
лоты на разогрев образца и измеряемая эффективная теплоемкость
будет меньше теплоемкости чистого титана. После нагрева частицы
титаиа покрываются плотным слоем оксида, препятствующим даль-
нейшему окислению, и результаты повторных измерений должны
быть близки к теплоемкости чистого титана
По разности теплоемкостей при первом и последующих изме-
рениях можно определить количество теплоты, выделяющейся
при окислении. По массе вступившего в реакцию кислорода, опре-
деляемой как разность масс образца до и после нагрева, можно
оценить массу образовавшегося оксида титана На основании этих
данных можно рассчитать количество теплоты образования оксида
титана.
Оцененные на основании наших измерений теплоемкости зна-
чения количества теплоты образования оксида титана на 20 . . . 30 %
ниже литературных данных. Отклонения можно объяснить боль-
шой погрешностью определения массы оксида титана
Погрешность определения количества теплоты окисления по
результатам измерений теплоемкости не превышает 10 %. Поэтому
по результатам измерений теплоемкости и - литературным данным
о количестве теплоты образования оксида титана можно с доста-
точно высокой точностью определить количество образовавшегося
оксида при каждом значении температуры
Изменения теплоемкости проведены на образцах с К,—0,68. .
.. .0,70, запрессованных при давлении 400 МПа. Для этих образ-
цов начало окисления заметно уже при 7=400 К, и масса образо-
вавшегося оксида составляет 0,005 % первоначальной массы об-
разца. При более высоких температурах масса образовавшегося
оксида составляет 0,07 % при температуре 500 К, 0,16% при
550 К, 0,32 % — при 600 К и 0,65 % — при 700 К.
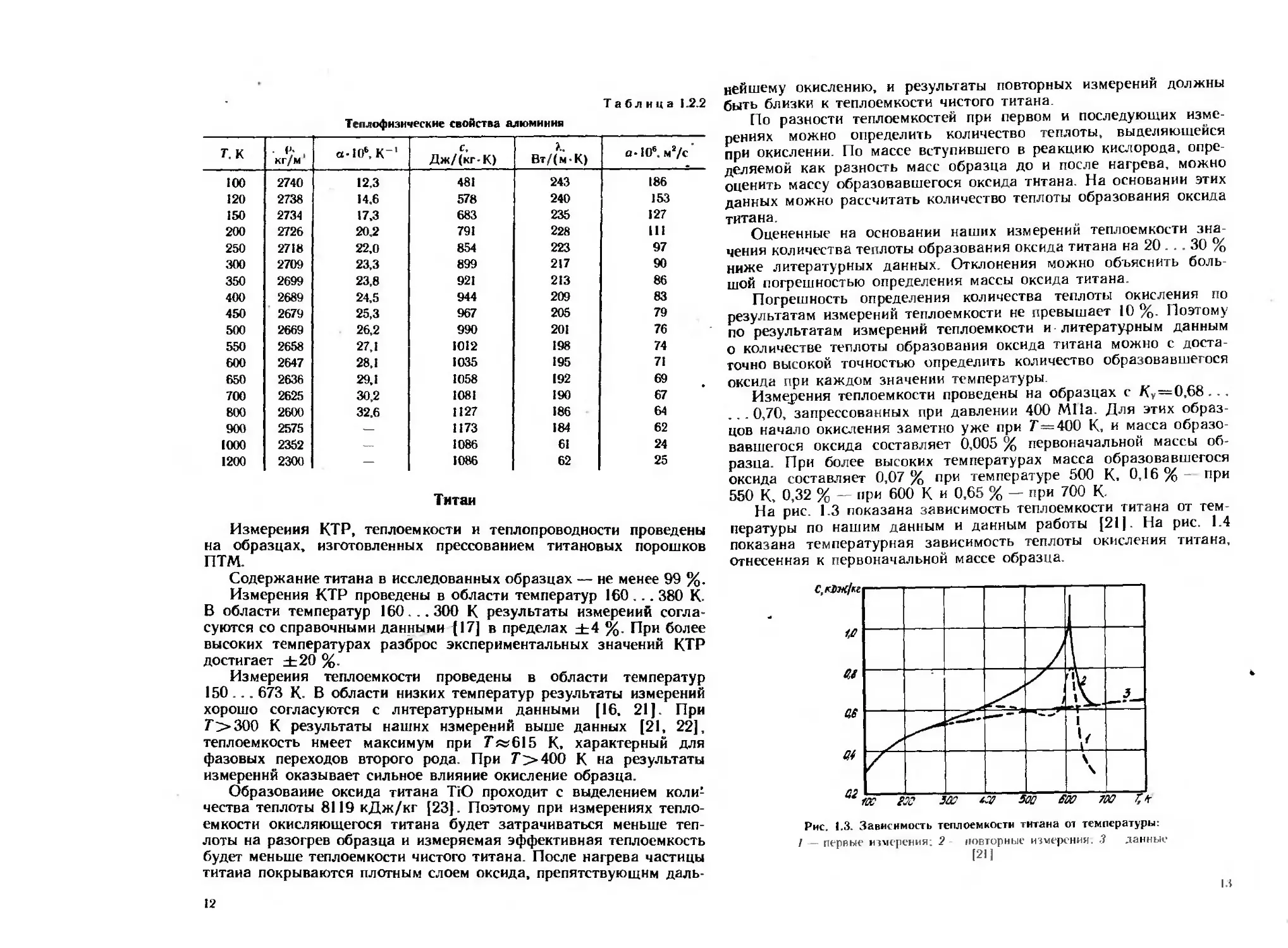
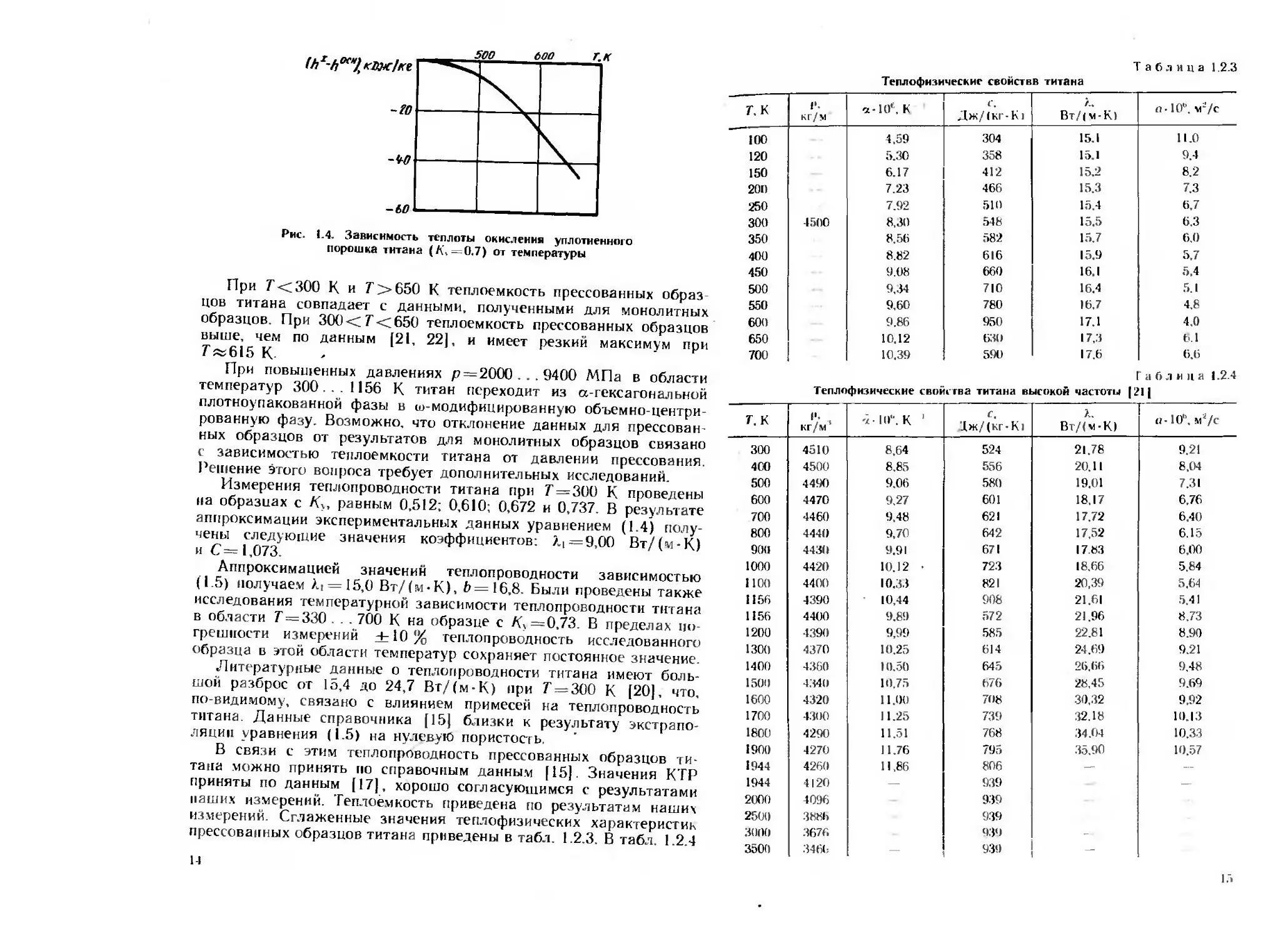
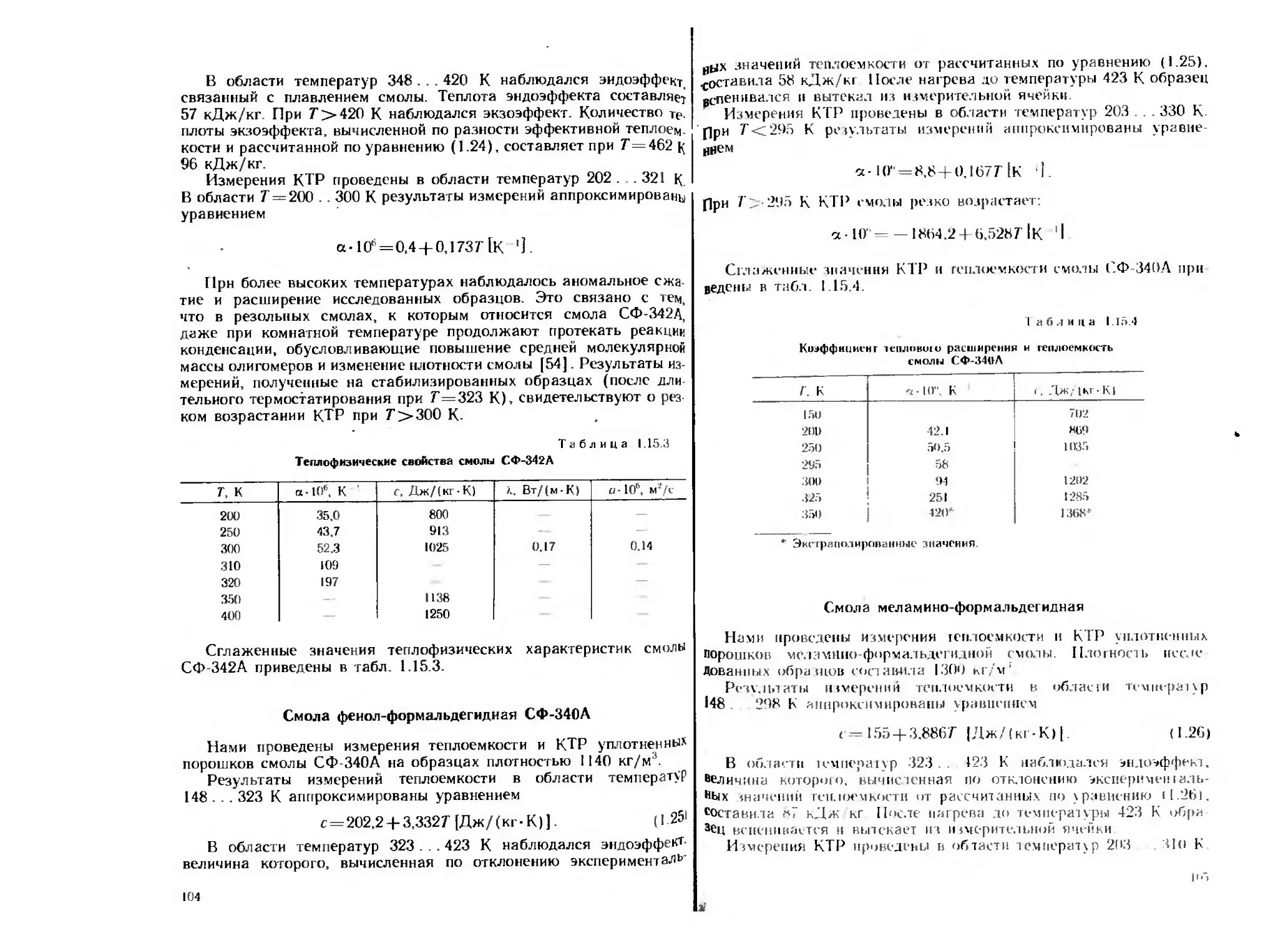
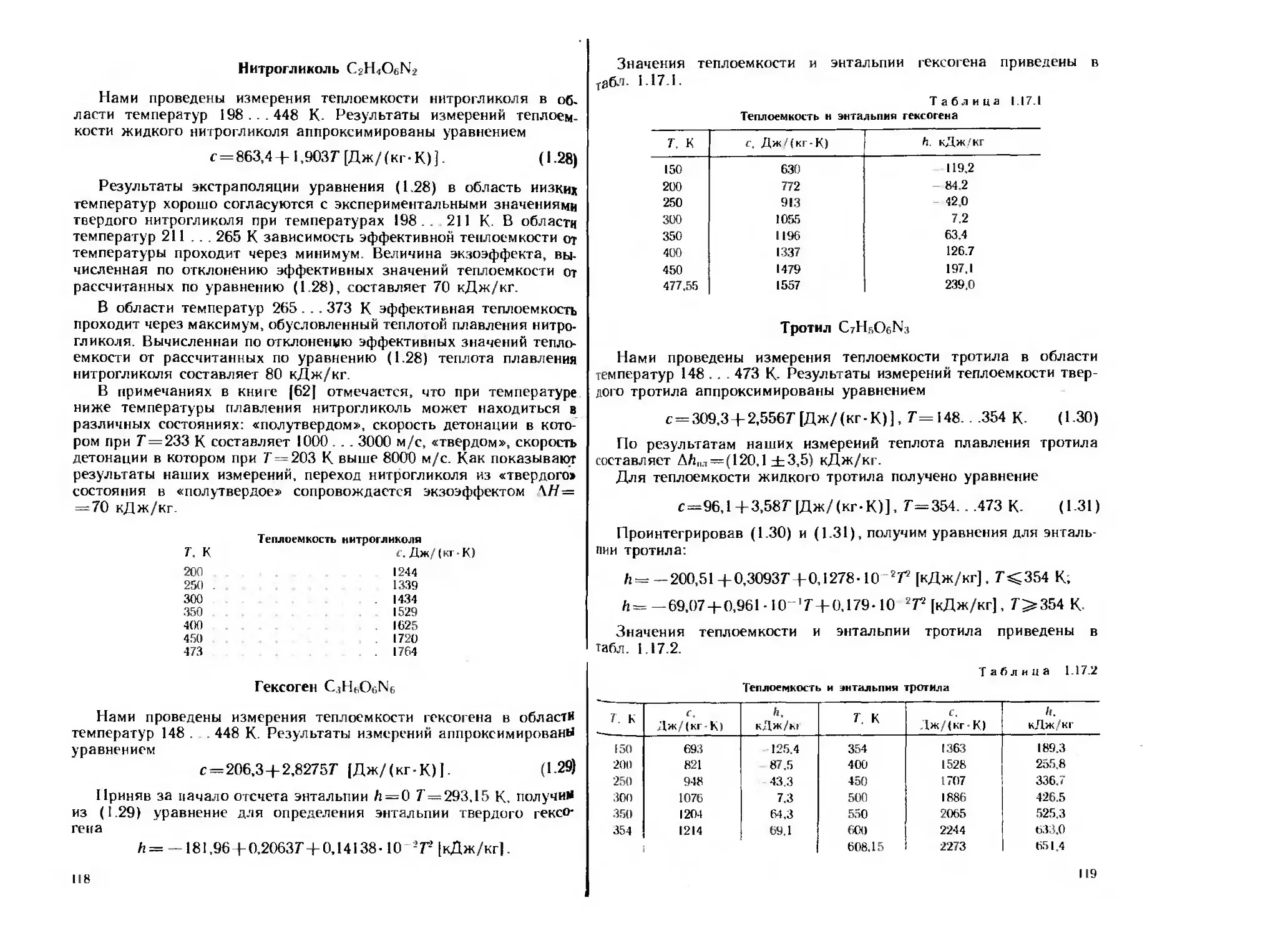
На рис. 1.3 показана зависимость теплоемкости титана от тем-
пературы по нашим данным и данным работы [211. На рис. 1.4
показана температурная зависимость теплоты окисления титана,
отнесенная к первоначальной массе образца.
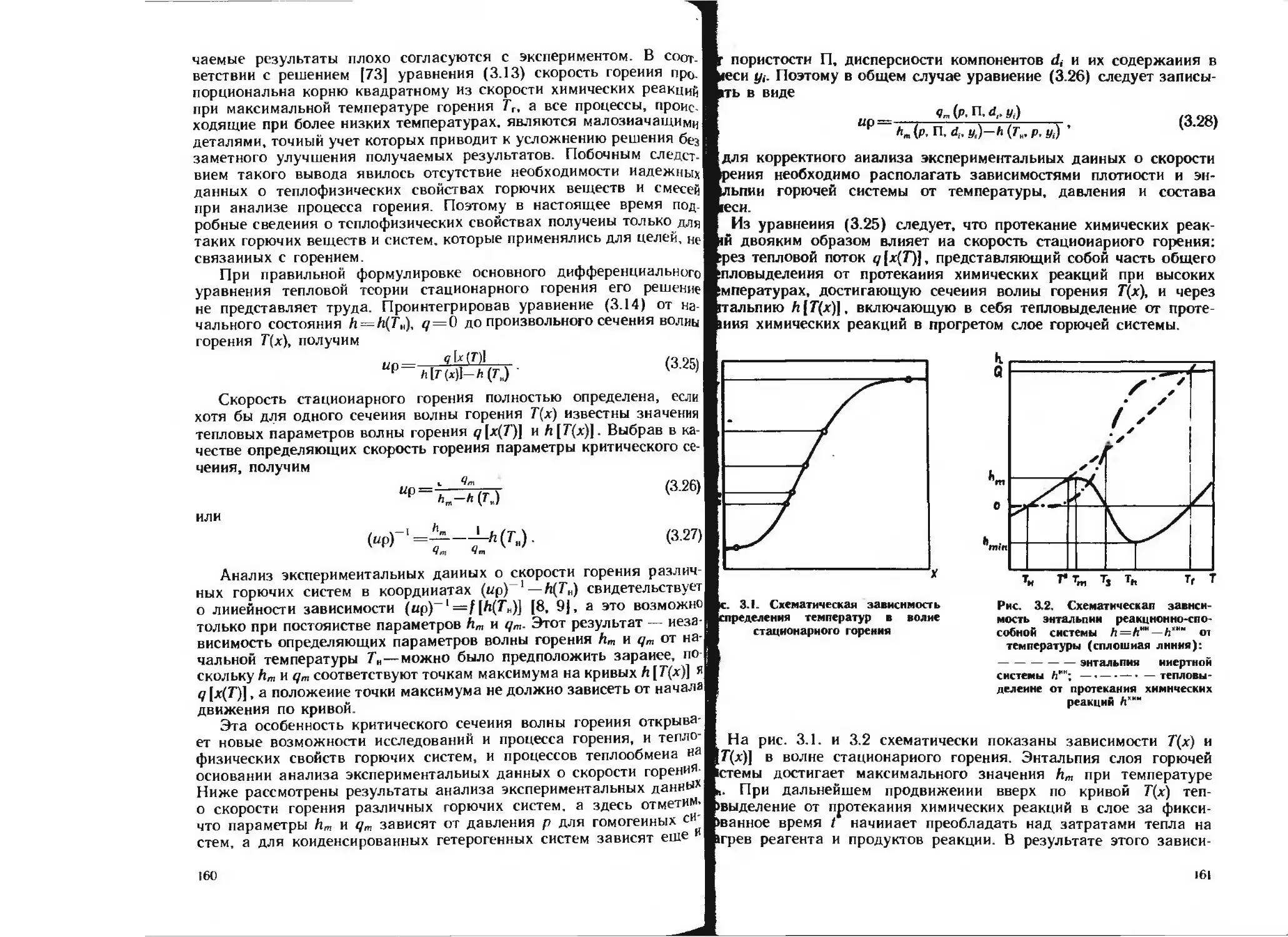
Рис, 1.3. Зависимость теплоемкости титана от температуры:
/ — первые измерения; 2 повторные измерения. ,? данные
(21]
13
12
Таблица 1.2.3
Рис. 1.4. Зависимость теплоты окислении уплотненного
порошка титана (А\ — 0.7) от температуры
При Г<300 К и Г>650 К теплоемкость прессованных образ
цов титана совпадает с данными, полученными для монолитных
образцов. При 300 <7’<650 теплоемкость прессованных образцов
выше, чем по данным (21, 22], и имеет резкий максимум при
Г«615 К
При повышенных давлениях р = 2000 . . . 9400 МПа в области
температур 300... 1156 К титан переходит из а-гексагональной
плотноупакованной фазы в ^-модифицированную обьемно-центри-
рованную фазу. Возможно, что отклонение данных для прессован-
ных образцов от результатов для монолитных образцов связано
с зависимостью теплоемкости гитана от давлении прессования.
Решение этого вопроса требует дополнительных исследований.
Измерения теплопроводности титана при Т = 300 К проведены
па образцах с Ку, равным 0.512; 0,610; 0,672 и 0,737. В результате
аппроксимации экспериментальных данных уравнением (1.4) полу-
чены следующие значения коэффициентов; >.|=9,00 Вт/(м-К)
и С =1,073.
Аппроксимацией значений теплопроводности зависимостью
(1.5) получаем ki = 15,0 Вт/(м-К), Ь=16.8. Были проведены также
исследования температурной зависимости теплопроводности титана
в области 7 = 330 . . . 700 К на образце с А, =0.73. В пределах по-
грешности измерений ±10 % теплопроводность исследованного
образца в этой области температур сохраняет постоянное значение.
Литературные данные о теплопроводности титана имеют боль-
шой разброс от 15,4 до 24,7 Вт/(м-К) при Г = 300 К (20], что,
по-видимому, связано с влиянием примесей на теплопроводность
титана. Данные справочника [15] близки к результату экстрапо-
ляции уравнения (1.5) на нулевую пористость,
В связи с этим теплопроводность прессованных образцов ти-
тана можно принять по справочным данным [15]. Значения КТР
приняты по данным (17], хорошо согласующимся с результатами
наших измерений. Теплоёмкость приведена по результатам наших
измерений Сглаженные значения теплофизических характеристик
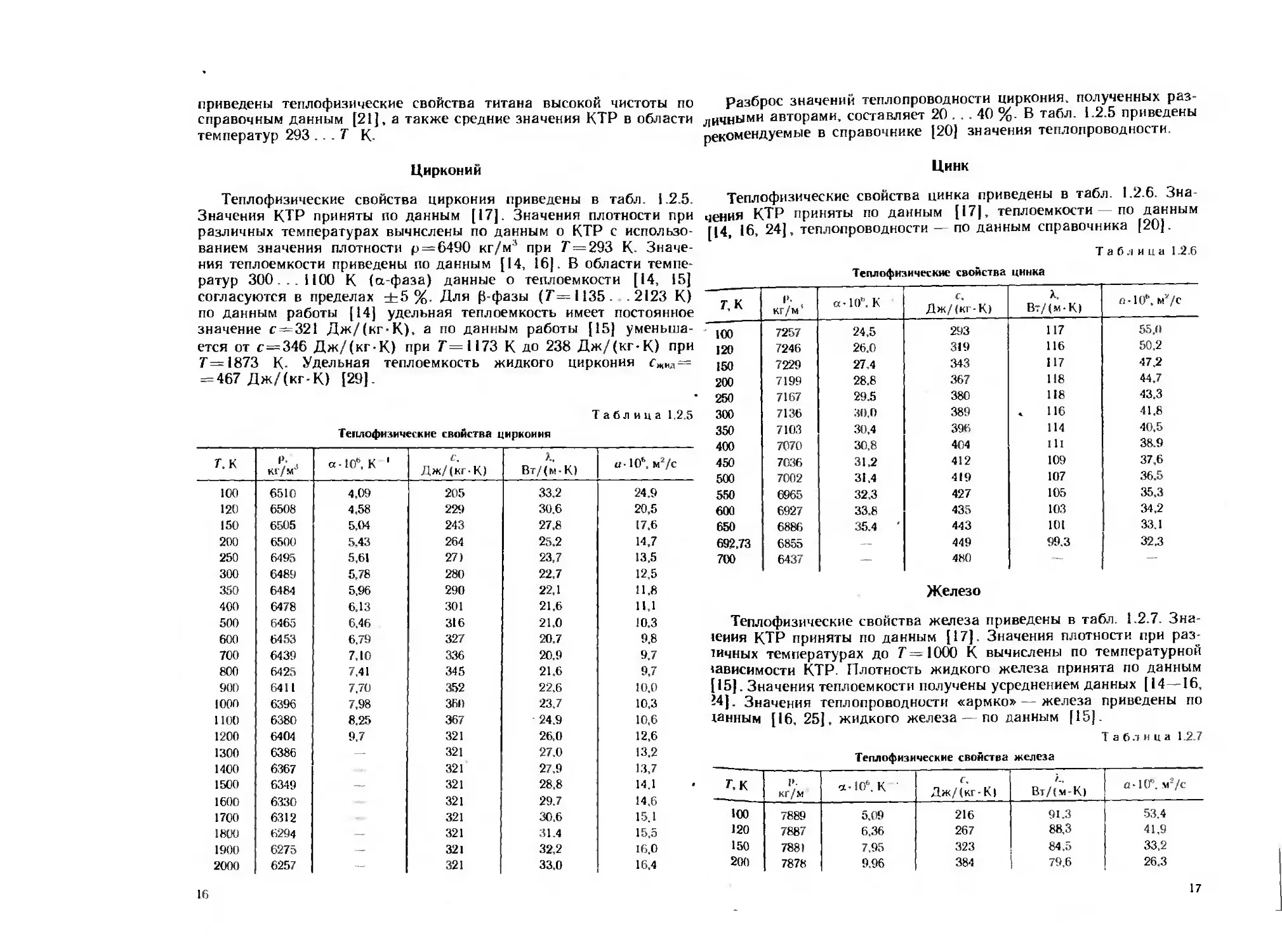
прессованных образцов титана приведены в табл. 1.2.3. В табл. 1.2.4
Теплофизические свойстве титана
7. К кг/м а-10е. К Дж/(кг-К j Вт/(м-К) д. 10". м2/с
100 4.59 304 15.1 11.0
120 5.30 358 15.1 9.4
150 6.17 412 15,2 8.2
200 7.23 466 15.3 7.3
250 7.92 510 15.4 6.7
300 4500 8.30 548 15.5 6.3
350 8.56 582 15.7 6,0
400 8.82 616 15.9 5,7
450 9.08 660 16,1 5.4
500 9,34 710 16.4 5.1
550 9,60 780 16.7 4.8
600 9.86 950 17.1 4,0
650 10.12 630 17.3 6.1
700 10.39 590 17.6 6.6
а блица 1.2.4
Теплофизические свойства титана высокой частоты [211
т. к Р. кг/м 'М0“. К 1 Дж/(кг*К> 7., Вт/(ч-К) а -10”. м2/с
300 4510 8,64 524 21.78 9.21
400 4500 8.85 556 20.11 8,04
500 4490 9.06 580 19.01 7.31
600 4470 9,27 601 18,17 6.76
700 4460 9.48 621 17.72 6.40
800 4440 9,70 642 17,52 6.15
900 4430 9.91 671 17.83 6,00
1000 4420 10.12 • 723 18.66 5.84
1100 4400 10.33 821 20,39 5.64
1156 4390 10,44 908 21.61 5.41
1156 4400 9.89 572 21.96 8.73
1200 4390 9.99 585 22.81 8.90
1300 4370 10.25 614 24.6$) 9.21
1400 4360 10.50 645 26.66 9.48
1500 4.340 10.75 676 28,45 9.69
1600 4320 11.00 708 30,32 9.92
1700 4300 11.25 739 32.18 10.13
1800 4290 11.51 768 34.04 10.33
1900 4270 11.76 795 35,90 10.57
1944 4260 11.86 806 —
1944 4120 939 —
2000 4096 939
2500 3886 939
3000 3676 939
3500 3461: — 939 —
14
15
приведены теплофизические свойства титана высокой чистоты по
справочным данным [21], а также средние значения КТР в области
температур 293 . . Т К-
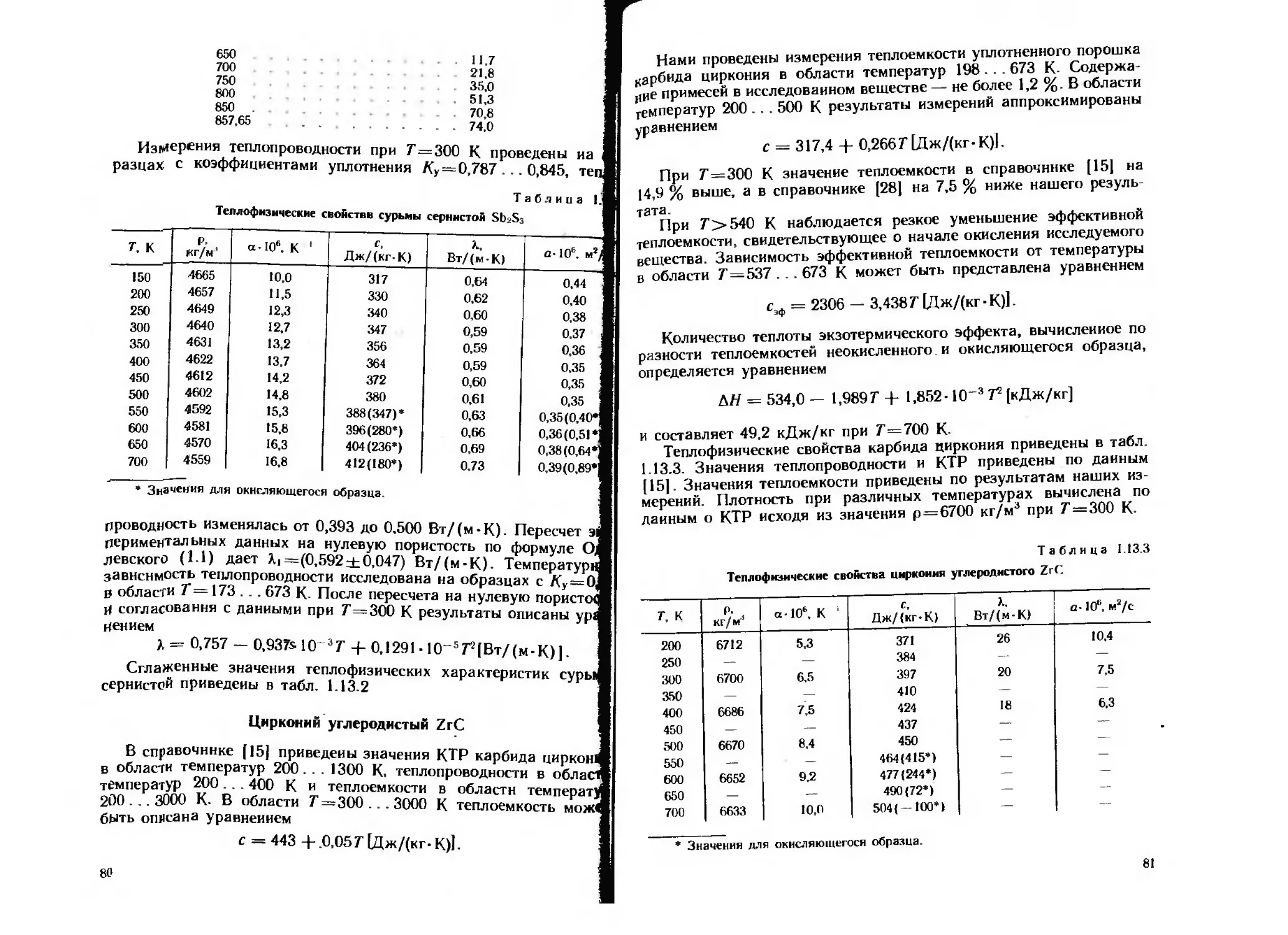
Цирконий
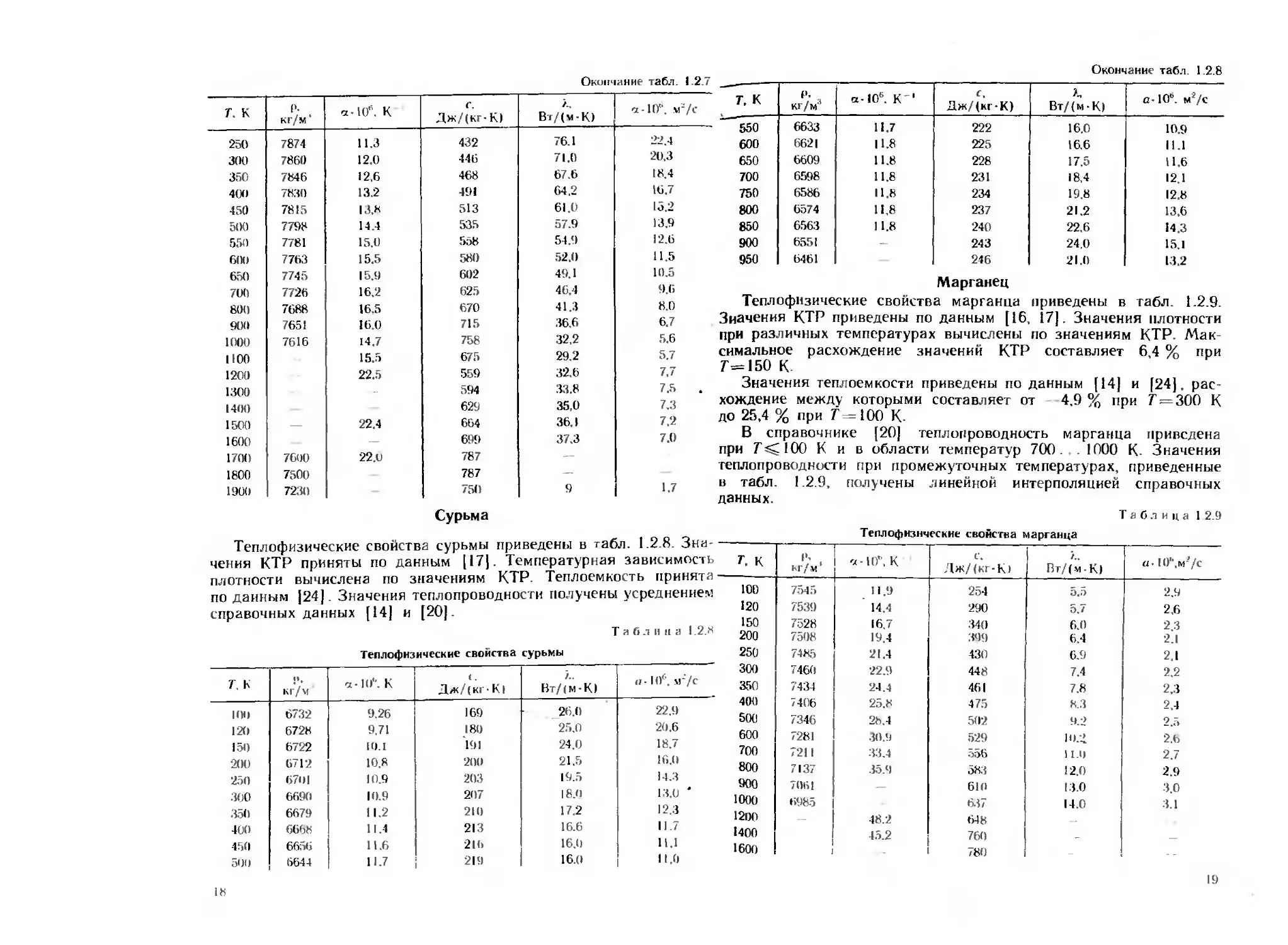
Теплофизические свойства циркония приведены в табл. 1.2.5.
Значения КТР приняты по данным [17]. Значения плотности при
различных температурах вычислены по данным о КТР с использо-
ванием значения плотности р=6490 кг/м' при Т = 293 К- Значе-
ния теплоемкости приведены по данным [14, 16]. В области темпе-
ратур 300... 1100 К (а фаза) данные о теплоемкости [14, 15]
согласуются в пределах ±5 %. Для p-фазы (Г= 1135. .2123 К)
по данным работы [14] удельная теплоемкость имеет постоянное
значение с=321 Дж/(кг-К), а по данным работы [15] уменьша-
ется от с=346 Дж/(кг-К) при Г=1173 К до 238 Дж/(кг-К) при
7=1873 К- Удельная теплоемкость жидкого циркония сжид =
= 467 Дж/(кг-К) [29].
Таблица 1.2.5
Тецлофнзические свойства циркония
т. к Р. кг/м”5 а • 10ь, К 1 Дж/(кг-К) Л. Вт/(м-К) а -10**, м2/с
100 6510 4,09 205 33,2 24.9
120 6508 4,58 229 30.6 20,5
150 6505 5,04 243 27,8 17,6
200 6500 5,43 264 25.2 14,7
250 6495 5,61 27) 23,7 13.5
300 6489 5,78 280 22,7 12.5
350 6484 5,96 290 22,1 11,8
400 6478 6,13 301 21,6 11,1
500 6465 6.46 316 21,0 10,3
600 6453 6.79 327 20,7 9.8
700 6439 7,10 336 20,9 9.7
800 6425 7.41 345 21.6 9,7
900 6411 7.70 352 22.6 10.0
1000 6396 7,98 360 23.7 10,3
1100 6380 8.25 367 - 24.9 10,6
1200 6404 9.7 321 26,0 12,6
1300 6386 — 321 27.0 13.2
1400 6367 321 27,9 13,7
1500 6349 — 321 28.8 14.1
1600 6330 321 29.7 14.6
1700 6312 321 30.6 15.1
1800 6294 — 321 31.4 15,5
1900 6275 — 321 32,2 16.0
2000 6257 — 321 33,0 16,4
Разброс значений теплопроводности циркония, полученных раз-
личными авторами, составляет 20 ... 40 %. В табл. 1 2.5 приведены
рекомендуемые в справочнике [20] значения теплопроводности.
Цинк
Теплофизические свойства цинка приведены в табл. 1.2.6. Зна
чения КТР приняты по данным [17], теплоемкости — по данным
[14, 16, 24], теплопроводности — по данным справочника [20].
Таблица 1.2.6
Теплофизические свойства цинка
7, К Р. кг/м1 а-10". К с. Дж/(кг-К) X. Вт/(м-К) п-10", м*/с
100 7257 24,5 293 117 55.0
120 7246 26.0 319 116 50.2
150 7229 27,4 343 117 47.2
200 7199 28.8 367 118 44.7
250 7167 29.5 380 118 43,3
300 7136 30,0 389 < 116 41.8
350 7103 30,4 396 114 40,5
400 7070 30,8 404 III 38.9
450 7036 31,2 412 109 37,6
500 7002 31.4 419 107 36.5
550 6965 32.3 427 105 35,3
600 6927 33,8 435 103 34,2
650 6886 35.4 ' 443 101 33.1
692,73 6855 — 449 99.3 32.3
700 6437 — 480 -
Железо
Теплофизические свойства железа приведены в табл. 1.2.7. Зна-
геиия КТР приняты по данным [17]. Значения плотности при раз-
1ичных температурах до Т=1000 К вычислены по температурной
(ависимости КТР Плотность жидкого железа принята по данным
[15]. Значения теплоемкости получены усреднением данных [14—16,
14]. Значения теплопроводности «армко» железа приведены по
ханным [16. 25]. жидкого железа — по данным [15].
Таблица 1.2.7
Теплофизические свойства железа
Г. к Р. кг/м а-106. К ’ с. Дж/(кг-К) Вт/(м-К) а -1 (Г. м2/с
100 7889 5.09 216 91.3 53.4
120 7887 6.36 267 88,3 41,9
150 7881 7.95 323 84,5 33,2
200 7878 9.96 384 79,6 26.3
16
17
Окончание табл. 1.2.8
Окончание табл. 1.2.7
г. к Р. кг/м ‘ а-10й. К Дж/(кг- К) Вт/(М-К) а-10”. м'/с
250 7874 11.3 432 76.1 22.4
300 7860 12.0 446 71.0 ‘20,3
350 7846 12.6 468 67.6 18.4
400 7830 13.2 491 64.2 16.7
450 7815 13,8 513 61.0 13.2
5(Ю 7798 14.4 535 57.9 13,9
550 7781 15.0 558 54.9 12.6
600 7763 15.5 580 52.0 11.5
650 7745 15.9 602 49.1 10.5
700 7726 16.2 625 46,4 9.6
800 7688 16,5 670 41.3 8.0
900 7651 16.0 715 36.6 6.7
1000 7616 14.7 758 32.2 5.6
1100 15.5 675 29.2
1200 22.5 559 32.6 7.7
1300 594 33.8 7.5
1400 629 35,0 7,3
1500 — 22.4 664 36,1 7.2
1600 699 37.3 7.0
17(H) 7600 22.0 787
1800 7500 787 —
1900 7230 750 9 1.7
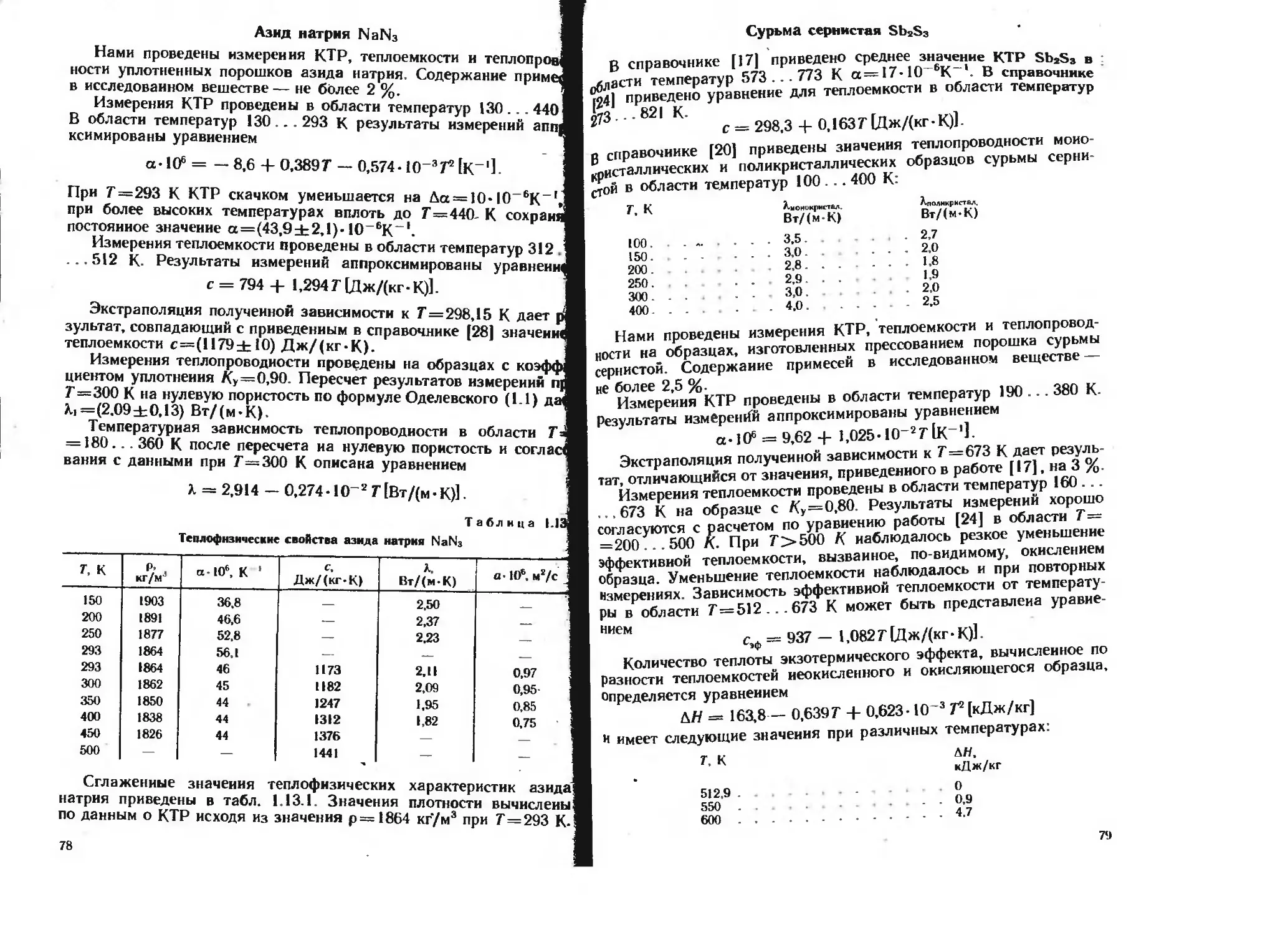
Сурьма
т. к р. кг/м3 а-Ю6. К'1 с, Дж/(кг-К) Л, Вт/(м-К) а-106. м2/с
550 6633 11.7 222 16,0 10.9
600 6621 11.8 225 16.6 11.1
650 6609 11,8 228 17.5 11.6
700 6598 11.8 231 18,4 12.1
750 6586 11.8 234 19.8 12.8
800 6574 П.8 237 21.2 13,6
850 6563 1 1.8 240 22.6 14,3
900 6551 — 243 24,0 15.1
950 6461 246 Марганец 21.0 13,2
Теплофнзические свойства марганца приведены в табл. 1.2.9.
Значения КТР приведены по данным [16, 17]. Значения плотности
при различных температурах вычислены по значениям КТР. Мак-
симальное расхождение значений КТР 7 = 150 К. составляет 6,4 % при
Значения теплоемкости приведены по данным [14] и [24], рас-
хождение между которыми до 25,4 % при 100 К. составляет от 4,9 % при Т = 300 К
В справочнике (20| теплопроводность марганца приведена
при 7^100 К и в области температур 700. . 1000 К. Значения
теплопроводности при промежуточных температурах, приведенные
в табл, данных. 1.2.9, получены линеинои интерполяцией справочных Таблица 1 2.9
Теплофизические свойства сурьмы приведены в табл. 1.2.8. Зна-
чения КТР приняты по данным [17]. Температурная зависимость
плотности вычислена по значениям КТР. Теплоемкость принята
по данным [24]. Значения теплопроводности получены усреднением
справочных данных [14] и [20].
Таблица 1.2.8
Теплофизические свойства сурьмы
Т. К кг/м а -10*'. К Дж/(к| -К| Вт/(м - К) <j • 106. м*/с
ИН) 6732 9.26 169 26.0 22.9
120 6728 9.71 180 25,0 20.6
150 6722 10.1 191 24.0 18.7
•200 6712 10.8 201) 21.5 16.0
250 6701 10.9 203 19.5 14.3
300 6690 10.9 207 18.0 13,0 *
350 6679 11.2 210 17.2 12.3
400 6668 11.4 213 16.6 11.7
450 665(5 11.6 216 16,0 11.1
500 6644 11.7 21» 16.0 11.0
Теплофизнческие свойства марганца
Т. к 19 кг/м’ 9-10’. К Дж/(кг-К) Вт/(эд. К) а - 1()”,м~/с
100 7545 11.9 254 5.5 2.9
120 7539 14.4 290 5.7 2,6
150 7528 16.7 340 6,0 2.3
200 7508 19.4 399 6.4 2.1
250 7485 21.4 430 6.9 2.1
300 7460 22.9 448 7.4 2.2
350 7434 24.4 461 7.8 2,3
400 7406 25.8 475 8.3 2.4
500 7346 28.4 502 9.2 9 ".
600 7281 30.9 529 10.2 2.6
700 7211 33.4 556 11.D 2.7
800 7137 35.9 583 12.0 2.9
900 7061 — 610 13.0 3.0
1000 6985 637 14.0 3.1
1200 ..._ 48.2 648 —
1400 45.2 760
1600 780 -
19
Окончание табл. 1.2.11
Вольфрам
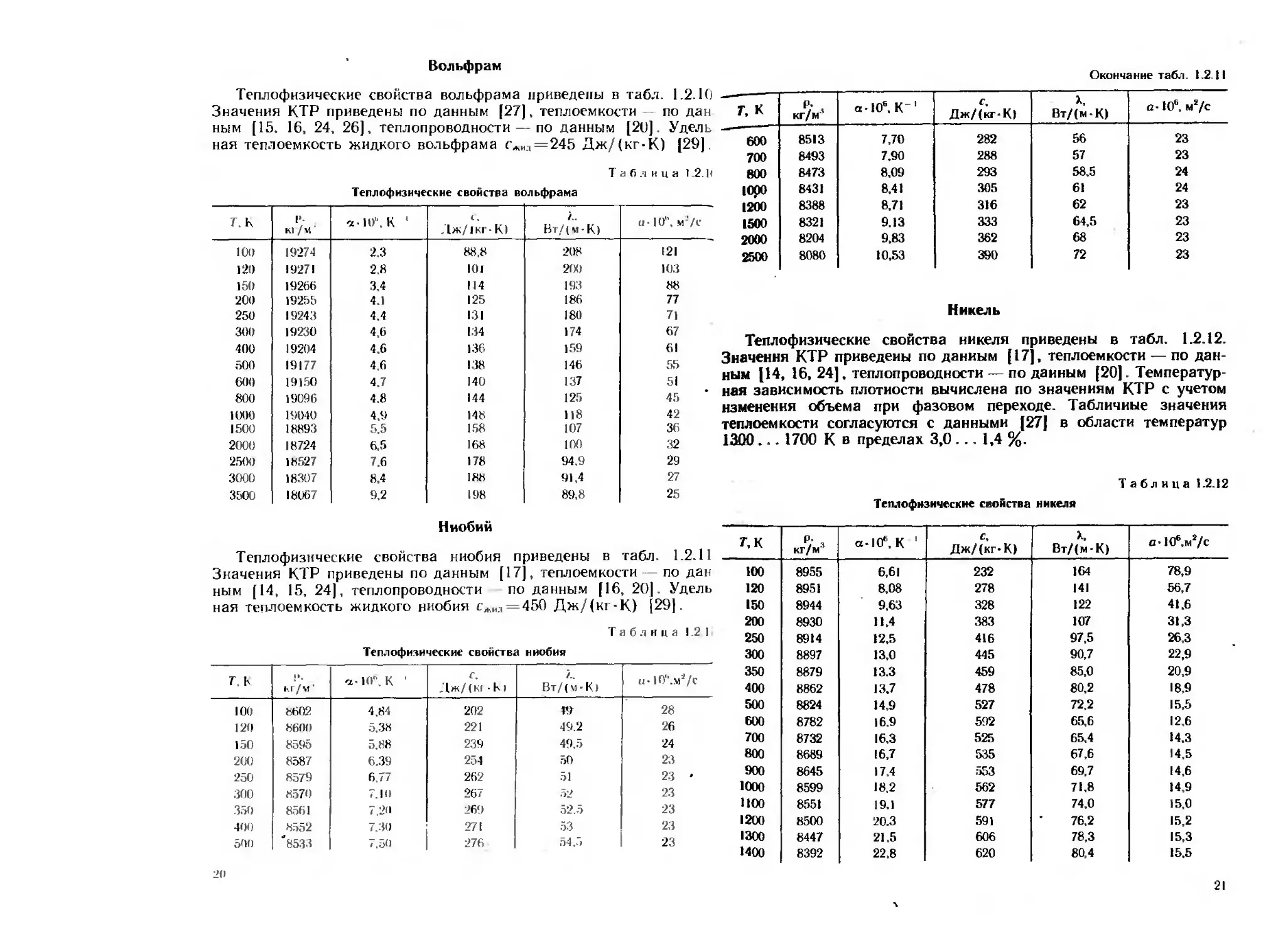
Теплофнзические свойства вольфрама приведены в табл. 1.2.10
Значения КТР приведены по данным [27], теплоемкости — по дан
ным [15. 16, 24, 26), теплопроводности — по данным [20]. Удель
ная теплоемкость жидкого вольфрама <*„.,=245 Дж/(кт-К) [29)
Таблица 1.2. И
Тенлофнзнческне свойства вольфрама
Г. К К1 / м ’ а-10". К 1 Дж/1 кг- К) Вт/(м-К) а -10”, м'/с
100 19274 2.3 88.8 208 121
120 19271 2.8 101 200 103
150 19266 3.4 114 193 88
200 19255 4.1 125 186 77
250 19243 4,4 131 180 71
300 19230 4.6 134 174 67
400 19204 4.6 136 159 61
500 19177 4.6 138 146 55
600 19150 4.7 140 137 51
800 19096 4.8 144 125 45
1000 19040 4.9 148 118 42
1500 18893 5.5 158 107 36
2000 18724 6,5 168 100 32
2500 18527 7.6 178 94.9 29
3000 18307 8,4 188 91,4 27
3500 18067 9.2 198 89,8 25
Ниобий
Теплофизические свойства ниобия приведены в табл. 1.2.11
Значения КТР приведены по данным [17], теплоемкости — по дан
ным [14 15, 24], теплопроводности по данным [16 20] Удель
ная теплоемкость жидкого ниобия сАИД = 450 Дж/(кг-К) [29]
Таблица 1.2.1
Теплофизические свойства ниобия
Г. к кг/м1 а- 10”. К 1 <?. Дж/(К1 к) Вт/(м-К) и • 1(У‘.ма/с
100 8602 4.84 202 19 28
120 8600 5.38 221 49.2 26
150 8595 5.88 239 49.5 24
200 8587 6.39 254 50 23
250 8579 6.77 262 51 23 *
300 8570 7.10 267 5? 23
350 8561 7.2(1 269 52 5 23
400 8552 7.3<> 271 53 23
500 '8533 7.50 276 54.5 23
г, к Р. t кг/м а-106. К~' с, Дж/(кг-К) к Вт/(м-К) а -106. м2/с
600 8513 7,70 282 56 23
700 8493 7.90 288 57 23
800 8473 8,09 293 58,5 24
Оро 8431 8,41 305 61 24
1200 8388 8,71 316 62 23
1500 8321 9.13 333 64,5 23
2000 8204 9.83 362 68 23
2500 8080 10,53 390 72 23
Никель
Теплофизические свойства никеля приведены в табл. 1.2.12.
Значения КТР приведены по данным [17]. теплоемкости — по дан-
ным [14, 16, 24]. теплопроводности — по данным [20]. Температур-
ная зависимость плотности вычислена по значениям КТР с учетом
изменения объема при фазовом переходе. Табличные значения
теплоемкости согласуются с данными [27] в области температур
1300... 1700 К в пределах 3,0 ... 1,4 %.
Таблица 1.2.12
Теплофизнческие свойства никеля
т.к ₽/ 3 кг/м' а-Ю'.К 1 Дж/(кг-К) X, Вт/(м-К) nlOW/c
100 8955 6,61 232 164 78,9
120 8951 8,08 278 141 56,7
150 8944 9.63 328 122 41.6
200 8930 11.4 383 107 31,3
250 8914 12,5 416 97.5 26.3
300 8897 13,0 445 90,7 22,9
350 8879 13.3 459 85,0 20,9
400 8862 13,7 478 80,2 18,9
500 8824 14,9 527 72,2 15,5
600 8782 16.9 592 65,6 12.6
700 8732 16,3 525 65,4 14.3
800 8689 16,7 535 67,6 14.5
900 8645 17.4 553 69,7 14,6
1000 8599 18.2 562 71,8 14.9
1100 8551 19.1 577 74.0 15.0
1200 8500 20.3 591 76,2 15,2
13оо 8447 21.5 606 78,3 15,3
1400 8392 22.8 620 80.4 15.5
20
21
Окончание табл. 1.2.12
т. к Р. кг/м а-106-К-' Дж/(кг-К) к, Вт/(м-К) а-106, м!/с
1500 8333 24,3 635 82.6 15^6
1600 8272 — 650 — —
1700 8212 — 664 — —
1800 — -— 656 —
1900 — — 656 — —
Медь
Теплофизические свойства меди приведены в табл. 1.2.13.
Значения КТР твердой меди приведены по данным [17], жидко-
сти— по данным [15]. Значения теплоемкости получены усредне
нием данных [14, 16, 24]. Теплопроводность приведена по данным
[20]. Значения плотности при различных температурах вычислены
по данным о КТР с учетом изменения объема при плавлении.
3
ч
ч
Т а 6 л н ц а 1.2.13 g
Теплофизические свойства меди S
т. к Р- .. кг / м а -10е, К с. Дж/(кг-К) X. Вт/(м-К) а- 10е. м!/с ”
100 8999 10,5 256 482 209
120 8993 12,0 285 452 176
150 8982 13,6 323 429 148
200 8963 15,2 357 413 129
250 8942 16,0 374 406 121
300 8920 16,7 386 401 116
350 8897 17,0 393 396 113
400 8875 17,3 396 393 112
500 8828 17,9 409 386 107
600 8780 18,6 418 379 103
700 8730 19,4 426 373 100
800 8678 20,1 435 366 97
900 8625 20,9 444 359 94
1000 8570 21.8 453 352 91
1100 8513 22,8 460 346 88
1200 8454 23,8 468 339 86 '
1300 8392 25,0 477 332- 83
1400 7993 33,5 494 — —
1500 7913 — 494 — —
1600 7833 34,2 494 — —
1 Температура и теплота возгонки. Плввится при 7 = 866 К, р = 4,6 МПа, 4ftnJ» = 541 кДж/кг 128].
2 Для второй моноклинной фазы при 7 = 388,36 К. Первая моноклинная фаза переходит во вторую при 7 = 374,15 К [28|.
При давлении 4864 Мпа При р=12,6 МПа TV, = 4020 К [28}.
4 Температура сублимации.
5 Теплота сублимации при 7=298.15 К.
23
22
Бор
Теплофизические свойства бора кристаллического приведет
в табл. 1.3.1. Значения теплоемкости приняты по данным [14—16J
Значения теплопроводности приведены по рекомендуемым зиаче
ниям справочника [20]. Данных о КТР бора кристаллического мало
В справочнике [17J приведено значение а=8,3-10~6 К-1 npi
7=658 К; в работе [15] — а = 8,3- 10~ 6 К' при 7=300 . . . 1000 К
в работе [14] —а = 8-10-6 К1 при 7=273 К- С учетом этих зна
чений КТР рассчитана плотность бора кристаллического.
Нами проведены измерения КТР, теплоемкости и теплопровод
ности бора аморфного, полученного пиролизом диборана. Измере
ния проведены на образцах, изготовленных прессованием порошке
бора при давлениях 100, 400 и 800 МПа.
Таблица 1.З..
Теплофнзические свойства бора кристаллического
7, К р, кг/м‘1 с. Дж/(кг-К) Вт/(м-К> a-106. м2/с '
100 2341 99,2 190 818
120 2340 166 143 368
150 2338 300 93,5 131
200 2336 560 55,1 42
250 2333 816 37.1 19,5
300 2330 1032 (1037*) 27,0 11,2
350 2327 1193 (1286*) 20,9 7,5
400 2324 1278 (1472*) 16,8 5,7
500 2318 1448 (1724*) 12.5 3,7
600 2312 1619 (1898*) 10,6 2.8
700 2307 1789 (2031*) 9,81 2,4
800 2301 1960 (2138*) 9.60 2.1
900 2295 2130 (2229*) 9,69 2,0
1000 2290 2300 (2306*) 9,85 1.9
1100 2284 2471 (2374*) — —
1200 2278 2641 (2432*) — —
1500 — (2572*) -—
2000 — (2731*) — —
2348 —- (2829*) — —
2348 — (2905*) — —
3000 — (2905*) — —
* По данным [29|
При 7> 290 К наблюдался большой разброс значений КТР.
что связано с влиянием первоначальной деформации иа свойства
исследованных образцов. Для образца, запрессованного при
р=800 МПа, после выдержки в течение пяти дней при комнатной
температуре длина увеличилась на 0,2 %, а диаметр — на 0,5 %.
Измерения на образцах, предварительно выдержанных при
т=673 К, в области температур 290. . . 300 К дают результат
a=_(8-t 1)-10-6 К~', согласующийся с литературными данными,
а при более высоких температурах наблюдается повышение КТР.
п области низких температур получены следующие значения КТР.
„=5 0-Ю~6 К-1 при 7=180 К; а = 5,7-10 6 К 1 при 7 = 200 К;
a=7J-10 fc К"' при 7 = 250 К.
Измерения теплоемкости бора проведены на образцах, запрес-
сованных при давлениях 800 и 100 МПа. На первом образце про-
ведено шесть серий измерений при нагреве до температуры 673 К.
Исследованные образцы содержали значительное количество вла
ти. После первого нагрева до температуры 673 К снижение массы
образца составляло 3,8 %. Испарение влаги приводит к резкому
повышению эффективной теплоемкости образцов прн первом из-
мерении в области температур 373 . 473 К- При повторном и по-
следующих измерениях зависимость теплоемкости бора в этой об
ласти температур имеет монотонный характер. Тепловой эффект,
рассчитанный по разности теплоемкостей при первом и последую-
щих измерениях Ай = 59,3 кДж/кг соответствует количеству тепло-
ты испарения воды, умноженному на убыль массы образца и отне-
сенному к первоначальной массе образца.
После третьей серии измерений, когда образец уже обезвожен,
наблюдается не уменьшение, а увеличение массы образца. Этот
эффект можно объяснить окислением бора, что подтверждается
снижением эффективной теплоемкости при 7 >463 К- При после-
дующих измерениях образовавшаяся оксидная пленка препятст-
вует дальнейшему окислению бора, а температурная зависимость
теплоемкости имеет вид монотонно возрастающей кривой. Тепловой
эффект, связанный с окислением бора, в области температур 463 .. .
... 673 К составляет 84,7 кДж/кг.
Сглаженные значения теплоемкости бора аморфного, получен-
ные после пятой и шестой серий измерений, в области температур
300., 600 К на 2 ... 10 % выше данных [14, 15] для бора кристал
лического. При 7С 300 К результаты измерений в пределах раз-
броса экспериментальных данных согласуются со справочными
данными [16] для бора аморфного. Отклонения от данных [29]
составляют 5... 15%. Максимальное отклонение наблюдается
прн 7 = 700 К, где на результаты наших измерений оказывает влия
ние окисление образца.
Измерения теплопроводности проведены в области температур
170... 700 К на образцах, запрессованных при давлении р =
=400 МПа. Коэффициент уплотнения образцов составил 0,512
Результаты измерений аппроксимированы уравнениями:
в области 7=170. . . 400 К
?. = 0,274 + 0,415-10-’7;
в области 7 = 400 . . . 700 К
X = 0,04 ф- 1,0-10~37.
24
25
После пересчета на нулевую пористость по уравнению
получим: ’
>. = 1,30+ 1,97-10 3 Т, Т = 170... 400 К;
X = 0,19 + 4,75-10~3 Т, 7 = 400... 700 К.
После пересчета на нулевую пористость результаты наших из-
мерений теплопроводности удовлетворительно согласуются со
справочными данными [20] для бора аморфного.
Сглаженные значения теплофизических свойств бора аморф
ного приведены в табл. 1.3.2.
Теплофизнческне свойства бора аморфногс Таблица 1.3-2
т. к с. Дж/(кг-К) X. Вт/ (м - К) а 106. м2/с
100 125 1,50 5,22
120 225 1,54 2,98
150 360 1,60 1,93
200 600 1.69 1.22
250 860 1,79 0,90
300 1060 1,89 0,78
350 1220 1,99 0.71
400 1360 2,09 0,67
450 1510 2.33 0,67
500 1620 2.56 0.69
550 1700 2,80 0.72
600 1725 3,04 0.77
650 1735 3,28 0,82
700 1750 3,51 0,87
Фосфор
Модификации — белый, красный, черный фосфор.
Белый фосфор. Теплоемкость белого фосфора по данным [29]
и теплопроводность по данным [16] приведены в табл. 1.3.3.
Т а б я и ц а. 1.3.3
Теплоемкость и теплопроводность фосфора белого
Параметр / к
км» 120 150 195.1 IU5.I 2111. 230 300 317.3 317.3
с, Дл/(кг-К) 443 448 559 682 675 681 728 ' 7711 783 843’
Вт/(м-К) 0.55 0.44 0.31 - - 0.29 0.26 0.26 —
В работе [33] для теплопроводности белого фосфора приведено
значение Х=0,56 Вт/(м-К) при Т=298 К-
КТР белого фосфора при Т = 293 К составляет а = (124,5 +
±5)-10~6 К ' [17].
Уменьшение плотности при плавлении Др = 4,3 % [14].
Красный фосфор. При Т = 300 К а=66,5-10-6 К-1 [17] (рас-
четное значение).
Данных о теплопроводности нет.
При Т=298,15 К с=685 Дж/(кг-К) [28]. При более высоких
температурах теплоемкость красного фосфора по данным различ-
ных авторов приведена в табл. 1.3.4.
Более надежными представляются данные [32], так как они
лучше других согласуются со значением теплоемкости при Т—
=298.15 К.
Таблица 1.3.4
Теплоемкость с, Дж/(кг-К), фосфора красного по данным различных работ
Литератур ный источник Г. к
3(М> 150 400 150 500 550 ыю 1..1П , 1И1 75и 800
[32[ 666 721 776 830 885 940 495 1049 1 ни 1159 1214
|14| [24,30[ 799 758 825 880 852 1002 878 1123 901 1245 9.31 9.>/ 98Л 1010 1036 1062
Теплофизические свойства красного фосфора сильно зависят
от способа получения образца, наличия примесей, степени полиме-
ризации, что приводит к большому разбросу справочных данных.
Черный фосфор. При давлении 2,84 МПа и температуре 839 К
превращается в красный фосфор, теплота превращения ЛЛ=(270±
±81) кДж/кг [28].
Данных о КТР нет.
Значения теплоемкости и теплопроводности при низких темпе-
ратурах по данным [16] приведены в табл. 1.3.5.
Таблица 1.3.5
Теплоемкость н теплопроводность фосфора черного по данным (16)
т, к с, Дж/(кг-К) X, Вт/(м»К)
100 292 29 (36*)
120 360 26 (-•)
150 444 22.5 (24*)
200 560 18,6 (19*)
250 630 16,2 (-♦)
300 700 14,0 (13*)
* По данным [20|.
Сера
Теплофизические свойства серы приведены в табл 1.3.6. Зна-
чения теплоемкости приведены по данным [14, 16], КТР — по дан-
ным [16, 17]. Значения теплопроводности приведены для поли-
крнсталлической серы по данным [20], для жидкой серы - по дан-
ным [33]. Плотность ромбической фазы принята по данным [14].
27
26
моноклинной — по данным [15, 32], плотность жидкой серы вычис.
лена по уравнению р=2123,8—0,81632 Т, полученному по данным Кремний
[33]. Теплофизические свойства кремния приведены в табл. 1.3.7.
Данные различных работ о теплоемкости твердой серы хорошо^нацення КТР приведены по данным [17], теплоемкости — по дан-
согласуются между собой, а для жидкой серы при 7>400 К раз.,ыы 114. 16], теплопроводности — по данным [20].
брос значений теплоемкости превышает 10 %. Отклонения таб-
личных значений теплоемкости от данных [29] не превышают 3,5 % Таблица 1.3.7
Теплофизические свойства кремния
~ « Таблица 1.3. Тенлофилическне свойства серы т. к а-106. К"1 с. Дж/(кг-К) Z. Вт/(м-К) а-106. м2/с
т, к Р. кг/м4 a-10s, К г. Дж/(кг-К] 1, Вт/(м-К) а-106. иг/с 100 —0,34 259 884 1465
120 0,00 328 638 835
100 42 406 0,562 0,66 150 0,50 426 409 412
120 — 46 464 0,500 0,52 200 1,43 556 264 204
150 — 51 536 0,430 0.38 250 2,11 648 191 127
200 — 57 627 0,355 0.27 300 2,54 714 148 89
250 — 60 668 0,305 0,22 350 2.83 759 119 67
300 2085 64 712 0,269 0,18 400 3,05 793 98,9 54
350 — — 753 0,242 0.15 500 3,39 837 76,2 39
368.5 — — 768 0,233 0.15 600 3,68 865 61,9 31
368,5 1920 800 0,154 0,10 700 3.95 885 50,8 25
392,5 — 821 0,150 0.095 800 4.19 901 42.2 20
392.5 1803 — 987 0,154 0,087 900 4,43 914 35,9 17
400 1797 992 0.154 0,086 1000 4,65 926 31,2 14,5
450 1756 — 1028 9,154 0,085 1200 — 966 25,7 11,4
разброс значений КТР серы. В работе
[33]
при-
1400
1600
1700
1800
1900
1006
1027
1048
1057
1066
23,5
22,1
10,0
9,2
при-
Углерод
Модификации — графит и алмаз.
Графит переходит в алмаз при р= 12500 МПа
150) К [28].
и
Г=(4100±
Очень большой
ведены следующие значения КТР для ромбической фазы:
Г, К а-106, к 1
280 45,7
305 74.3
337 . 86,3
361............. . . 206.3
377 ................................... 103.2
КТР серы обладает сильной анизотропией. В работе [17]
ведены следующие значения КТР по различным кристаллогра-± 150) К [28].
фическим направлениям при 7^300 К: ai=67-10'to, аг—78-Ю'6 Графит. Значения теплофизических характеристик графита
и аз = 20- 10-Ъ К-1- 4меют большой разброс, что связано с их зависимостью от способа
В справочнике [14] приведено значение теплопроводности мо-лсхдучення графита, изготовления образца и условий проведения
некристаллической серы: при 7=285 К Х=0,47 Вт/(м-К)- В спра-эпыта. Для графита плотностью, близкой к теоретической, получены
вочнике [20] приведены значения теплопроводности аморфнойзначення теплопроводности при 7=300 К от 220 до 1500 Вт/(м-К)
серы при различных температурах: ”
т, К
100 . .
120 . .
150 . .
200 .
250
300 .
350 .......... .
к, Вт/См'К)
. 0.165
, 0,168
. 0,175
0,185
. 0.195
. 0,206
. 0.216
120]. При 7=373 К значения КТР составляют: 2,5-10“6 К-1 —
Vifl пиролитического графита; 7,5-10-6 К"1 — для графита на
основе нефтяного кокса; 15,2-10“6 — для графита иа основе
ламповой сажи [15].
Теплофизические свойства графита приведены в табл. 1.3.8.
значения теплоемкости приведены поданным [15, 16]. КТР и тепло-
фоводность графита обладают сильной анизотропией. Зиачеиия
КТР приведены по данным [17] в направлениях параллельно (а„)
и перпендикулярно (ах) главной осн кристалла.
28
29
Значения теплопроводности пересчитаны на нулевую попистое, Алюмиикево-магниевый сплав
по формуле н 1 ’
, ,, По данным Дяминова Р. С., теплопроводность монолитного
X, = X (А ) 3 ~ >6pBSUa при Г=300 К составляет (89±9) Вт/(м-К). Для образ-
v ia изготовленного прессованием порошка марки ПАМ-4, мы полу-
по даииым [15| для плотности 1700 кг/м3 и приведены для наппа.'Й3"84^^ v7d ,66 Вт/(м'К) п₽н *>=0-776 и 7=300 К.
леиий параллельно Х„ и перпендикулярно X, прессованию Цмерения КТР проведены на образцах, изготовленных прессо-
3 1 -1 “ртст-иваиию. |ав|вм порошков марок ПАМ-1 и ПАМ-4, в области температур
Таблица и^.л-^ЗО К. Результаты измерений аппроксимированы уравнением
Теплофизические свойства графита
т.к *11-ю4. к I ^х-106.К-' | с. Дж/(кс-К) Ли, Вт/(м-К)
100 — 1.07 17.6 139 414 316
120 — 1,19 19,8 185
150 — 1,3 22,2 268
200 — 1,33 24,9 417 375 286
250 —1,3 26,0 567
300 — 1,22 26,7 714 335 256 .
400 —0,91 27,5 их» 296 227
500 —0,53 ’ 28,1 1230 237 197
600 —0,18 28,5 1390 217 174
700 0,13 28,7 1510 197 148
800 0,39 28,9 1630 158 128
900 0,59 29,1 1710 138 112
1000 — — 1790 132 106
1100 — — 1860 120 101
1200 — — 1900 114 97
1300 — — 1940 ПО 93
1400 — — 1980 106 89
1500 — — 2020 105 85
1600 • - — 2040 103 81
1700 — — 2060 101 79
1800 — — 2080
1900 — — 2090
2000 - — 2100 — __
а-10* = 27,4 + 1,31.10-’Г--SyUK '1-
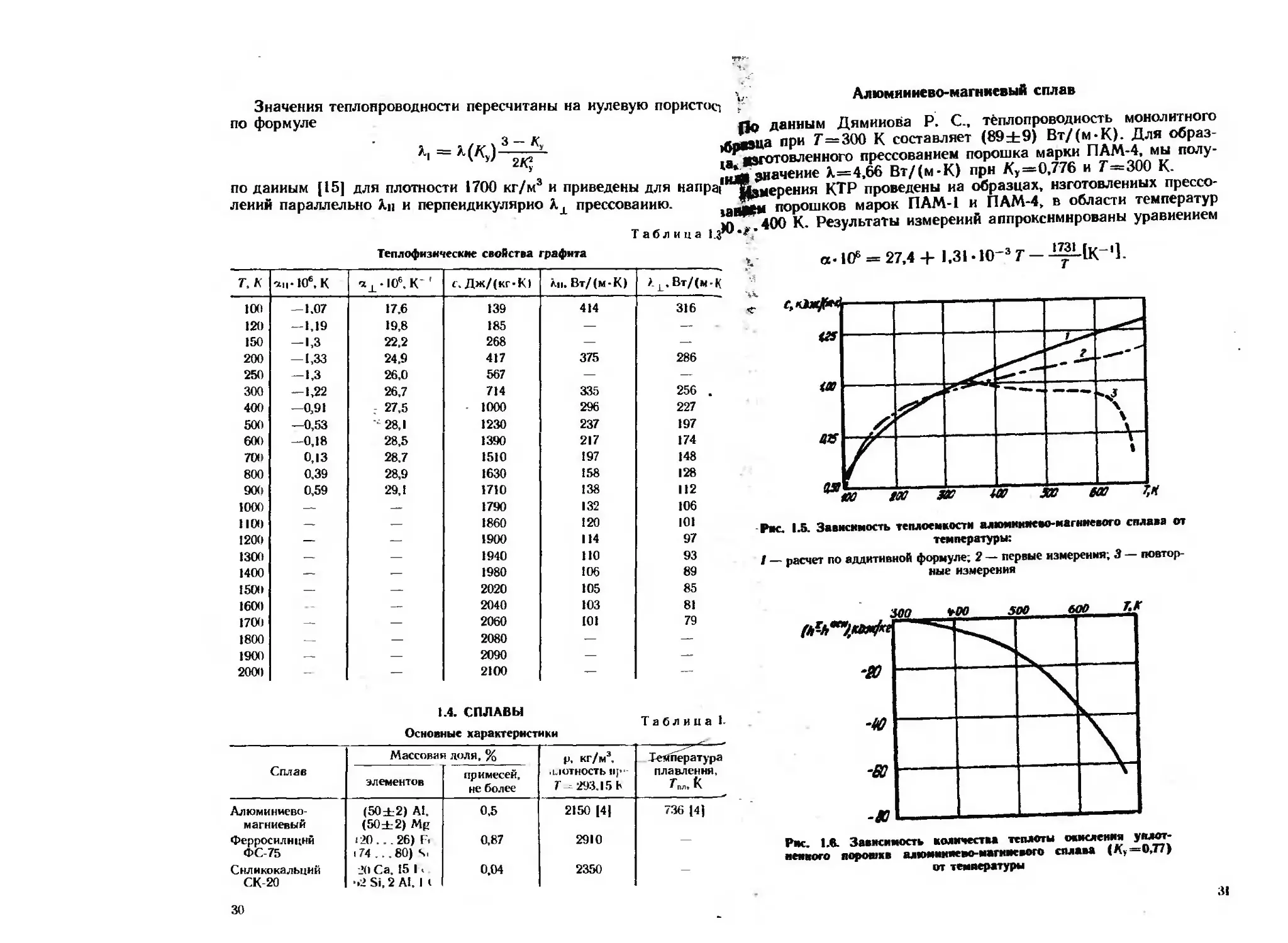
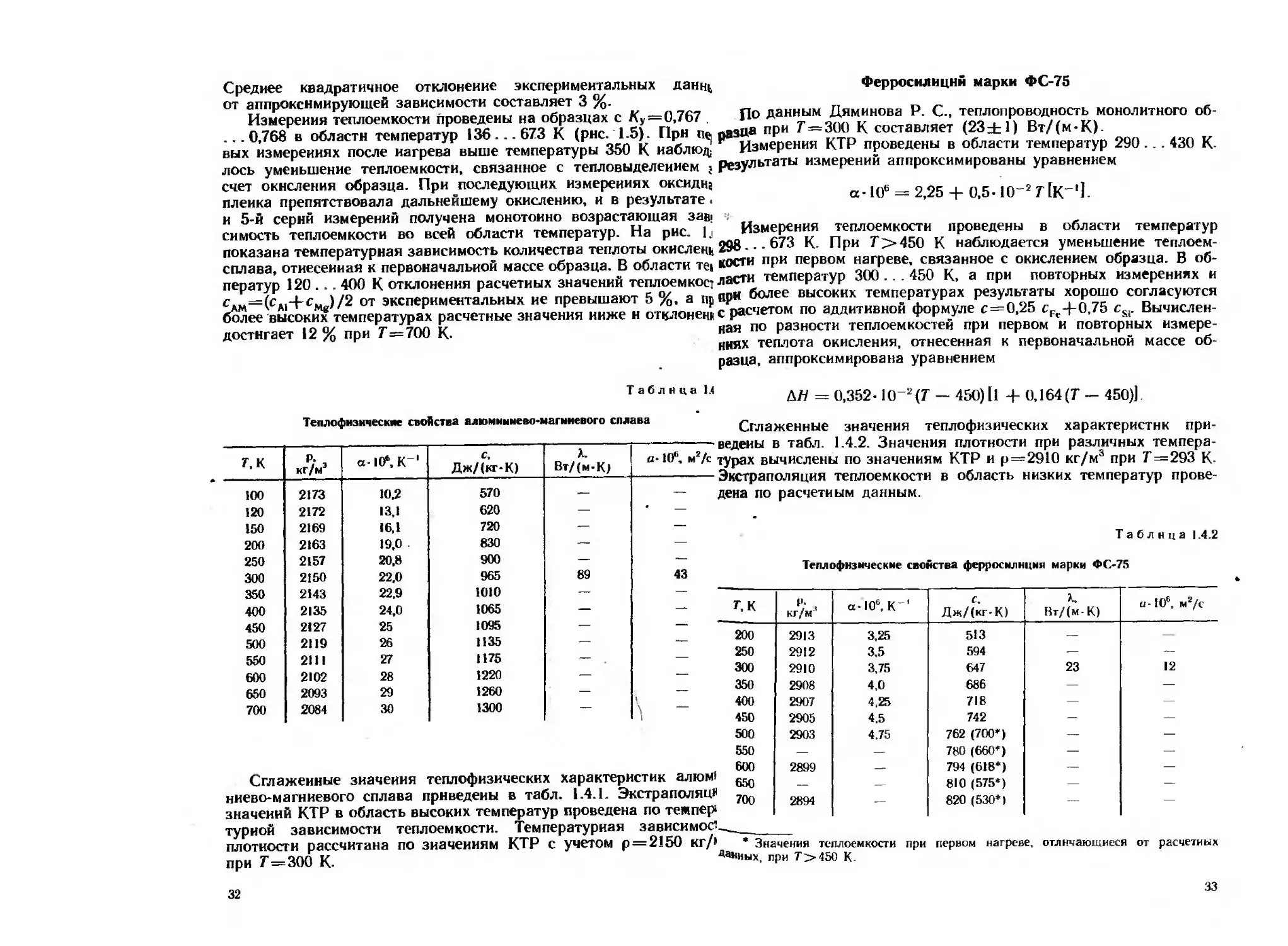
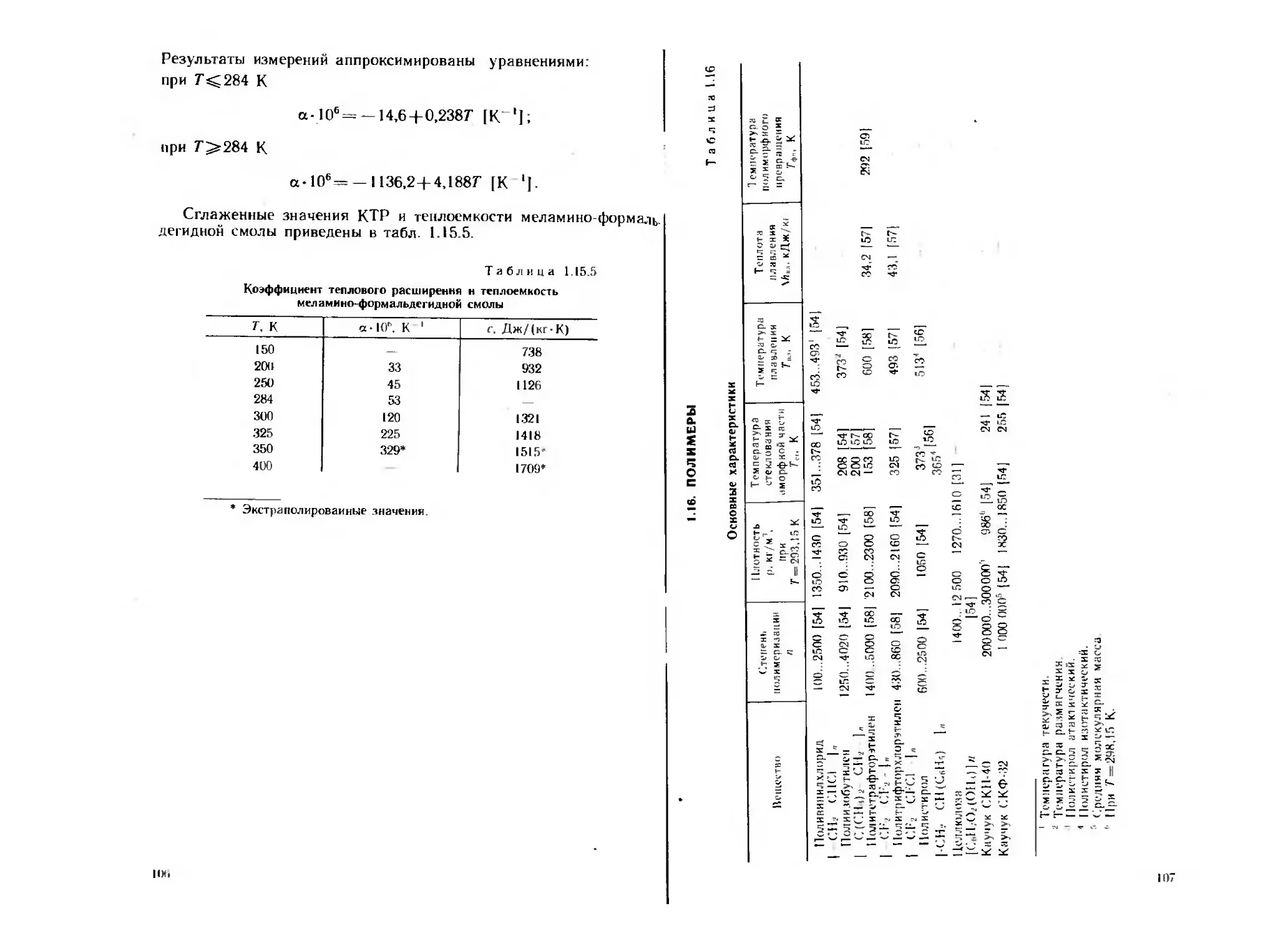
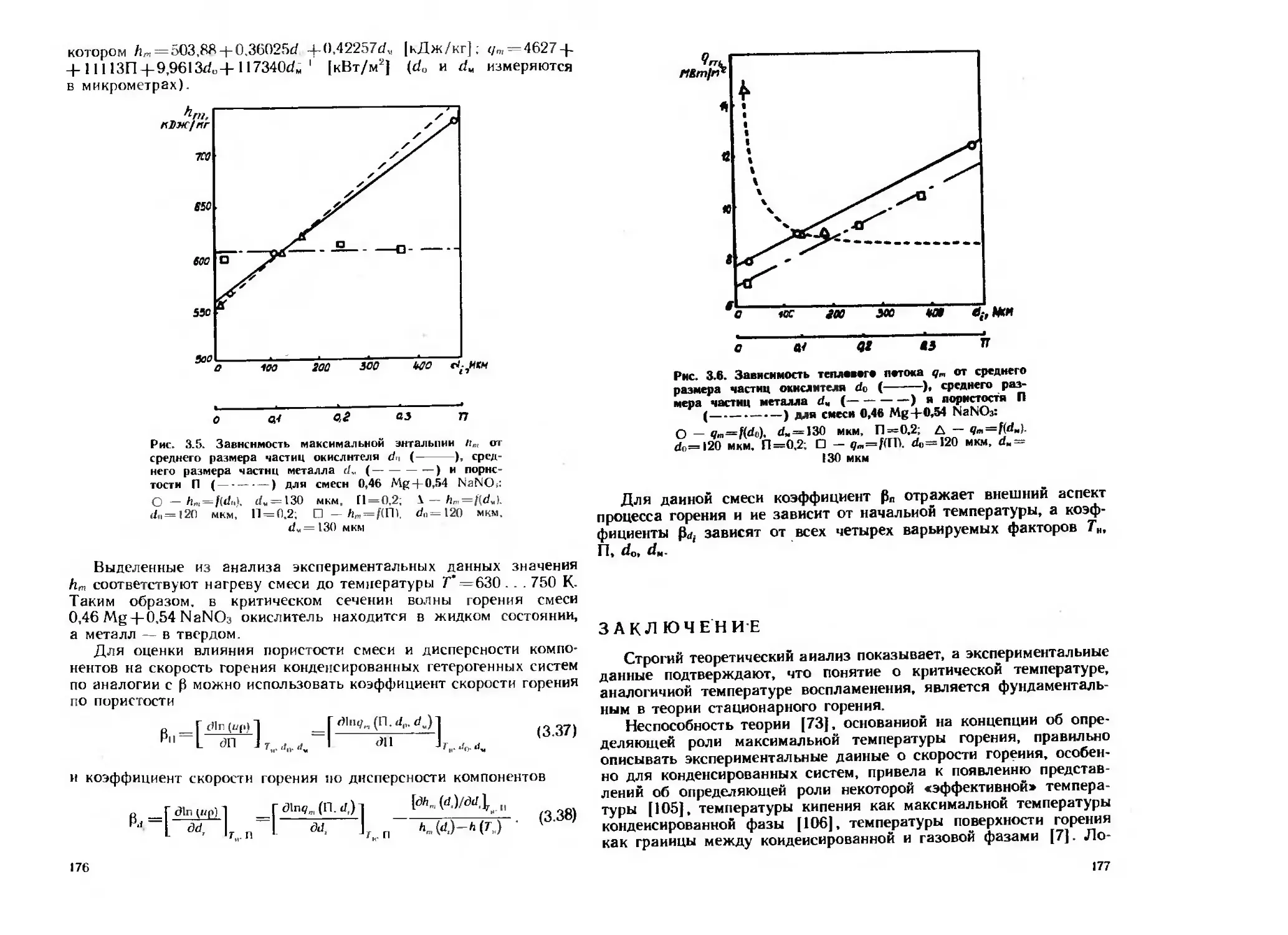
Рис. 1.5. Зависимость теплоемкости алюмиияеео-магниевого сплава от
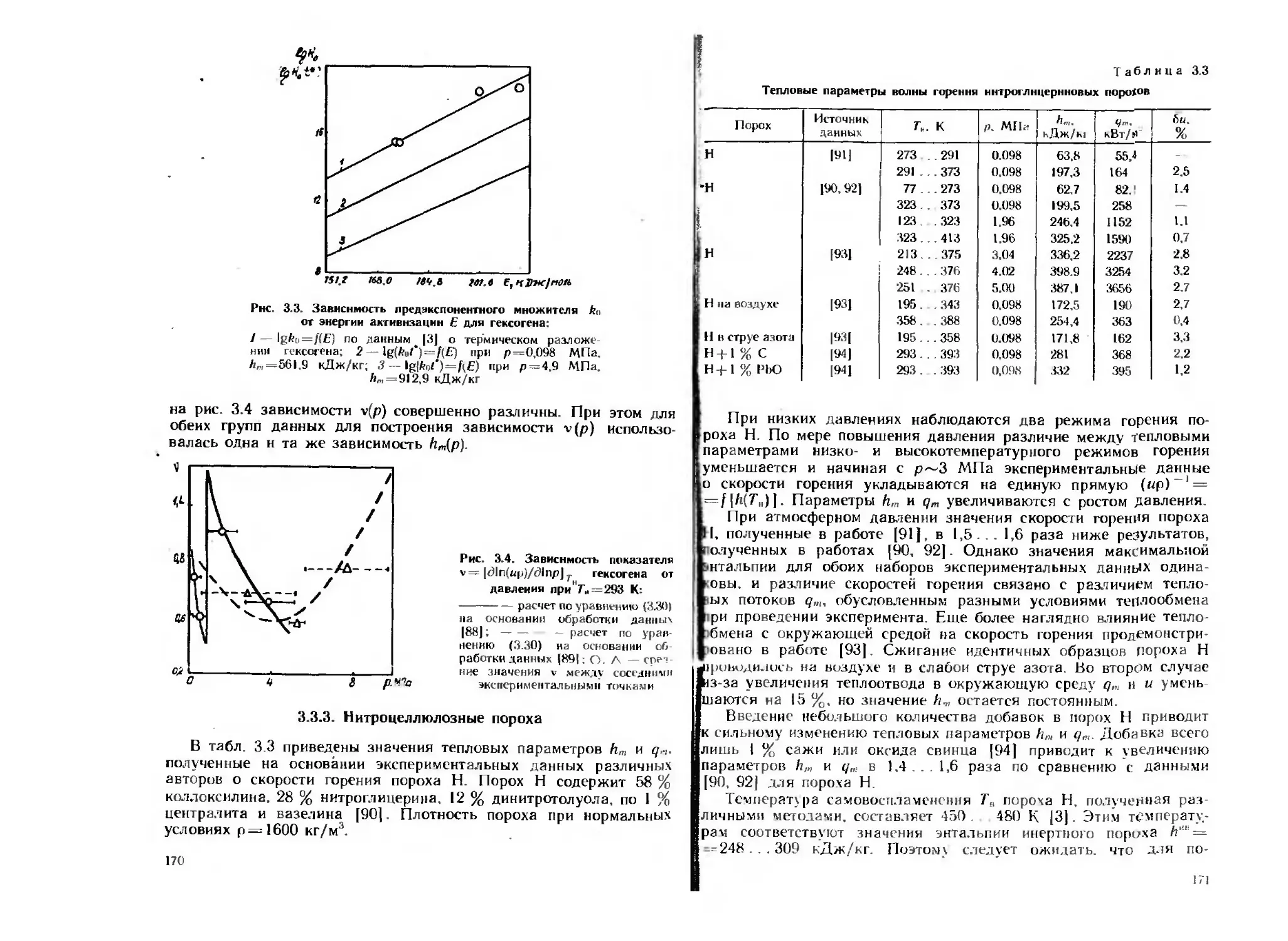
температуры:
/ — расчет по аддитивной формуле; 2 — первые измерения; 3 — повтор-
ные измерения
1.4. СПЛАВЫ
Основные характеристики Таблица 1-
Массовая доля. % , о
— - — р, КГ/м . Температура
примесей. 1.1 ОТ НО СТ Ь ир- плавления.
не более Т 293.15 b г™. К
Алюминиево- (50±2) AI, 0,5 2150 (4| 736 |4)
магниевый (50±2) Мд
Ферросилиций '20. .26) 1, 0,87 2910
ФС-75 । 74 ... 80) Ч.
Снликокальций 20 Са. 15 1 . 0,04 2350
СК 20 >2Si.2Al. 1 (
Рис. 1.6. Зависимость количества теплоты окисления уплот-
ненного порошке алюмиииево-магиисвого сплава (Ку =0,77)
от температуры
30
31
Среднее квадратичное отклонение экспериментальных данщ Ферросилиции марки ФС-75
от аппроксимирующей зависимости составляет 3 %. „
Измерения теплоемкости проведены на образцах с Ку=0,767 . По данным Дяминова Р. С., теплопроводность монолитного об-
...0,768 в области температур 136... 673 К (рис. 1.5). При № раз№ ПРИ составляет (23±1) Вт/(м-К).
вых измерениях после иагрева выше температуры 350 К иаблюд, Измерения КТР проведены в области температур 290 ... 430 К.
лось уменьшение теплоемкости, связанное с тепловыделением ; результаты измерений аппроксимированы уравнением
счет окисления образца. При последующих измерениях оксидщ . _ _ in-srlv-'l
пленка препятствовала дальнейшему окислению, и в результате. a-HI 2,25 + 0.5-10 / IK 1.
и 5-й серий измерений получена монотонно возрастающая зав, ч
симость теплоемкости во всей области температур. На рис. lj Измерения теплоемкости проведены в области температур
показана температурная зависимость количества теплоты окислено 298- - 673 К При Г>»450 К наблюдается уменьшение теплоем-
сплава, отнесенная к первоначальной массе образца. В области те» кости при первом нагреве, связанное с окислением образца. В об-
ператур 120 . . . 400 К отклонения расчетных значений теплоемкост ласти температур 3(Х). 450 К, а при повторных измерениях и
с -|-с )/2 от экспериментальных ие превышают 5 %, а яр при более высоких температурах результаты хорошо согласуются
более высоких температурах расчетные значения ниже и отклонен с расчетом по аддитивной формуле с=0,25 cFe~|-0,75 cSi. Вычислен-
достнгает 12 % при Г—700 К. ная по Разности теплоемкостей при первом и повторных измере-
0 нкях теплота окисления, отнесенная к первоначальной массе об-
разца, аппроксимирована уравнением
Таблица 1.4
ДЯ = 0,352-10"2(Т - 450)[1 + 0,164(7* - 450)].
Теплофизнческне свойства алюмнниево-магниевого сплава Сгла женные значения теплофизнческих характеристик при- в табл. 1.4.2. Значения плотности при различных темпера- ^числены по значениям КТР и р=2910 кг/м3 при Т=293 К. оляция теплоемкости в область низких температур прове- расчетиым данным. Таблица 1.4.2 Теплофизнческне свойства ферросилиция марки ФС-75
лк р. кг/м3 а -106. К ' Дж/(кг-К) Z. Вт/(м-К) а- Ю6. м!/с турах В1
100 120 150 200 250 300 350 400 450 500 550 600 650 700 Сгла ниево-м< значеии туриой ПЛОТИОС1 при Т— 2173 2172 2169 2163 2157 2150 2143 2135 2127 2119 2111 2102 2093 2084 жеиные згниевог й КТР в зависим ги расс^ 300 к. 10,2 13,1 16,1 19,0 20,8 22,0 22,9 24,0 25 26 27 28 29 30 значения о сплава п область вы л ост и тепл итана по з 570 620 720 830 900 965 1010 1065 1095 1135 1175 1220 1260 1300 геплофизически] рнведеиы в та( соких тем перат] □емкости. Тем г иачеииям КТР 89 характеры 5л. 1.4. L Э1 /р проведен; тературиая с учетом р — деиа по 43
- т, к Г. кг/м а-106, К 1 с, Дж/(кг-К) X. Вт/(м-К) и-Ю6. мг/с
200 250 300 350 \ — 400 450 500 550 600 стик алюм» <страполяця 7(Ю по Temnepi зависимое’^, = 2150 Кг/> ♦ Зна ДаКНых, П 2913 2912 2910 2908 2907 2905 2903 2899 2894 чения те ри Т>4& 3,25 3,5 3,75 4,0 4,25 4.5 4.75 плоемкости при к. 513 594 647 686 718 742 762 (700* > 780 (660*) 794 (618*) 810 (575*) 820 (530*1 первом нагрев 23 е, отлнчающиес 12 я от расчетных
32
33
Силикокальцин марки СК-20
Проведены измерения КТР в области температур 290 . . . 440 1
и теплоемкости в области температур 298 . . . 673 К- Значения КТ(
аппроксимированы уравнением
а-106 = 6,36 + 1,36-10 2 У (К '].
Результаты измерений теплоемкости аппроксимированы урав
нением
с = 468 + 0,475 7-[Дж/(кг-К)]_
Сглаженные значения теплоемкости и КТР приведены е
¥абл. 1.4.3.
1 Теплота сублимации при 7 = 298,15 К.
2 Температура разложения
* При 7 = 291.15 К.
Таблица 1.4.3
Теплоемкость и КТР сплава СК-20
т. к а-10'. К с, Дж/(кг-К)
200 9,0 563
250 9,8 587
300 10,4 608
350 11,1 634
400 11,8 658
450 12,5 682
500 13,1 705
550 — 729
600 — 753
650 •— 777
700 — 800
Таблица 1.5.2
Теплофизические свойства оксида магнии MgO
Теплофизические свойства оксида алюминия поиведены в табл т. к Р. , кг/м4 а-Ю", К 1 Дж/(кгК) к, Вт/(м-К) G. 106, М2/с
1.5.1.’ Значения теплоемкости приведены по данным [J6, 23]. Зна- 100 3594 6,91 212 242 318
чения теплопроводности приведены по данным [10, 23]. Значение 120 3594 7,37 330 150 135
КТР вычислены из температурной зависимости параметров кристал 150 3592 8,00 466 114 68
лической решетки по данным [34]. Плотность при высоких темпе 200 3589 8,92 677 89 37
250 3585 9,9 820 73 25
Таблица 1.5. 300 3580 10.4 925 59 18
350 3573 10,8 995 41 11,5
Теплофизические свойства оксида алюминия AlaOi 400 3567 11,2 1042 1097 35 27 9.4 6,9
Р. кг/м‘ А, Вт/(м-К) 500 3554 11,6
Т. К а - 10". К Дж/(кг-К) a-10" м2/с 600 3541 12,1 1143 1171 20,5 16 5,1 3,9
700 3526 12,6
100 — — 125 400 ' 806 800 3510 13,1 1194 13,3 3,2
120 — — 196 — — 1000 3478 13,7 1231 9,4 2,2
150 — 313 — — 1200 3443 14,5 1262 7.5 '9
200 — 501 — — 1400 3406 15,2 1291 6,3 1,4
250 — — 657 — — 1600 3367 15,8 1318 6,0 1.4
300 3970 7.82 775 40 13 1800 3328 16,4 1345 7,8 1,7
350 3965 — 886 32 9.1 2000 л 3288 16,9 1371 9,0 2,0
400 3961 8,00 959 28 7,4 2500 3182 18,2 1436 — —
500 3951 8,18 1050 21 5,1
600 3941 8,36 1105 15,7 3,6 Теплоемкость жидкого оксида магния сжо = 2084 Дж/(кг-К)
700 3931 8,55 1143 12,5 2,8 [291-
800 3921 8,73 1173 10,5 2,3 = Нами проведены измерения теплопроводности прессованных
1000 3900 9,09 1223 7,8 1.6 образцов MgO при Т=300 К. Коэффициент уплотнения исследо-
1200 3879 9,44 1268 6,4 1.3 ванных образцов 0,576 . . 0,620, теплопроводность изменялась
1400 3856 9,80 1310 5.6 1.1 от 1,21 цо 1,44 Вт/(м-К). Экстраполяцией экспериментальных дан-
1600 3833 10,15 1349 5,5 1.1 них иа нулевую пористость по формуле
1800 3810 10,50 1388 6 1 1 , 2/ч
2000 3785 10.85 1425 7 1.3 > — 3 - к
2200 3760 11,20 1463 — — получено значение М = 4,38 ±0,12 Вт/(м К).
ратурах вычислена по данным о КТР исходя из значения р = Оксиды титана
= 3970 кг/м3 при Т=293 К. Значения теплоемкости закиси титана TiO и полуторного ок
Теплоемкость жидкого оксида алюминия сж„„=1598 Дж/(кг-К) сЧда титана Т12Оз по данным [29] приведены в табл. 1.5.3.
Т и блица 1.5.3
Оксид магния MgO
Теплофизические свойства оксида магния приведены в табл. 1.5.2.
Значения теплоемкости приведены по данным [23]. Значения теп-
лопроводности получены графическим сглаживанием данных [20, 23]
для монокристаллических образцов. Значения среднего КТ₽ в диа-
пазоне температур от комнатной до указанной приведены по дан-
ным [16, 23]. Значения плотности вычислены по значениям КТР
с учетом р = 3580 кг/м3 прн У = 293 К-
Удельная теплоемкость оксидов титана , Дж/(кг-К)
т. к TiO Ti2O,
100 200 183
200 480 492
300 628 669
400 729 829
464 — 1077
37
36
Окончание табл. 1.5
Т, К ТЮ ПЮз
500 770 996
580 — 949
600 794 948
700 814 954
800 838 965
1000 904 998
1200 1003 1037
1265 1042 —
1265 1031 —.
1400 1059 1079
1600 1099 1122
1800 1138 1166
1810 . 1140 —.
1810 1093 —.
2000 1126 1211
2030 1132 —
2030 1095 —
2100 ' 1095 1234
2110 — 1236
2110 — 1182
Окончание табл. 1.5.4
"7. К р. кг/м а-10®, К ' Дж/(кг-К) ао, Вт/(м-К) <1„-10®, м2/е Ам. Вт/(м-К)
"бОО 4232 7,4 844 4,2 1.2 6.8
ТОО 4221 7,6 868 3.9 1.1 6.2
600 4211 7.8 889 3,7 1.0 5,9
1000 4187 8.2 926 3,5 0.90 6.2
1200 4163 8.6 959 3,3 0,83 —
1400 4136 9,0 991 3,3 0,81 —
1600 4106 9.5 1023 -— — —
№00 4076 9.9 1053 — — —
2000 — — 1084 — — —
2100 — — 1099 — — —
2185 — —- 1111 — -— —
2185 — 1252 — — —
Теллофизические свойства диоксида титана Ti02
Теллофизические свойства диоксида титана Ti02 приведены
в табл. 1.5.4. Значения теплоемкости приведены по данным. [29].
Значения среднего КТР в диапазоне температур от комнатной до
указанной в таблице получены сглаживанием справочных данных
[Й] для КТР и температурной зависимости относительного уд-
лаиення. Плотность определена по значениям КТР, исходя из
Pf=4260 кг/м3 при Т=293 К. Значения теплопроводности поли-
кристаллических и монокристаллических Хм образцов получены
темп) усреднением приведенных в справочниках [20, 23| данных. Зиаче-
Значения среднего КТР закиси титана ТЮ в диапазоне .......
ратур от комнатной до указанной, вычисленные по приведение температуропроводности вычислены для поликристаллических
в справочнике [23] графической зависимости относительного удли РЯразцов.
нения от температуры, приведенной ниже: 1
Диоксид циркония ZrO2
7, К а-10®. К-1 ''Теплофизические свойства диоксида циркония приведены в
.табл. 1.5.5. Значения теплоемкости приведены по данным [29].
350 ... . 8,05 Значения среднего КТР в диапазоне температур от комнатной до
400 8,25 указанной в таблице приведены на основании данных [23] для
500 . 8,6 стабилизированного диоксида циркония. Разброс значений КТР,
6(Х) 9,0 обусловленный наличием примесей и способом изготовления об-
800 , 9,8 разца, составляет 20 %.
1000 10,8 Значения теплопроводности получены усреднением данных
1200 . . . . 12,0 1Г5, 20, 23] для нулевой пористости. Данные для пористых образ-
1400 13.3 ВДВ пересчитывали иа нулевую пористость по уравнениям
Оя-106, м2/с
Ао,
Вт/(м-К)
Таблица 1.5
Теплофизнческие свойства диоксида титана Т1О2
*«.
Вт/(м-К1
27
Т, К кг/м а-10®, К 1 Дж/(кг-
100 4276 6,4 236
200 4268 6,6 617
300 4260 6,8 691
350 4256 6,9 730
400 4251 7,0 769
500 4242 < 7,2 813
К)
9,5
7,0
6,0
5,0
3,2
2,3
1,8
1,4
11
8,9
7,7
Таблица 1.5.5
Теплофизические свойства диоксида циркония ZrO?
7. К р. кг/м ’ а-10®. К С, Дж/(кГ’К) А, Вт/(м• К) а-10®, мг/с
100 154 — —
200 — — 347 1,60 0,82
зоо 5700 — 455 1,64 0,63
400 — — 516 1,67 0,57
500 5678 6.5 548 1,70 0,54
38
39
Окончание табл. 1.5.6
Окончание табл. 1.5.5^ г, к р- А. а-106, м2/с
т, к Р. , п-I06 Дж/(кг- К) А, о-10е. м2/с . кг/м Дж/(кг-К) Вт/(м-К,
кг/м Вт/(м-К) 500 5.35 578 16 4.9
600 5663 7,1 568 1,74 0,54 600 5634 5,6 595 13 3.9
700 5648 7,6 584 1.77 0.54 700 5624 5.8 608 10 2.9
800 5631 8.1 596 1,80 0,54 800 5614 5,9 619 7.8 2.2
1000 5597 8,7 617 1,88 0,55 1000 5594 6.1 636 5,4 1.5
1200 5564 9.0 635 1,94 0.55 1200 5573 6.3 • 650 —
1400 5527 9.4 652 2,03 0.56 1400 5552 6,5 664 —
1600 5494 9.5 634 2,10 0.60
1800 5466 9.4 634 2,17 0.63
2000 5435 — 634 2,25 0,65 • Экстраполяция.
2620 — — 634 — —
2620 2983 — — 649 649 — — Оксиды железа
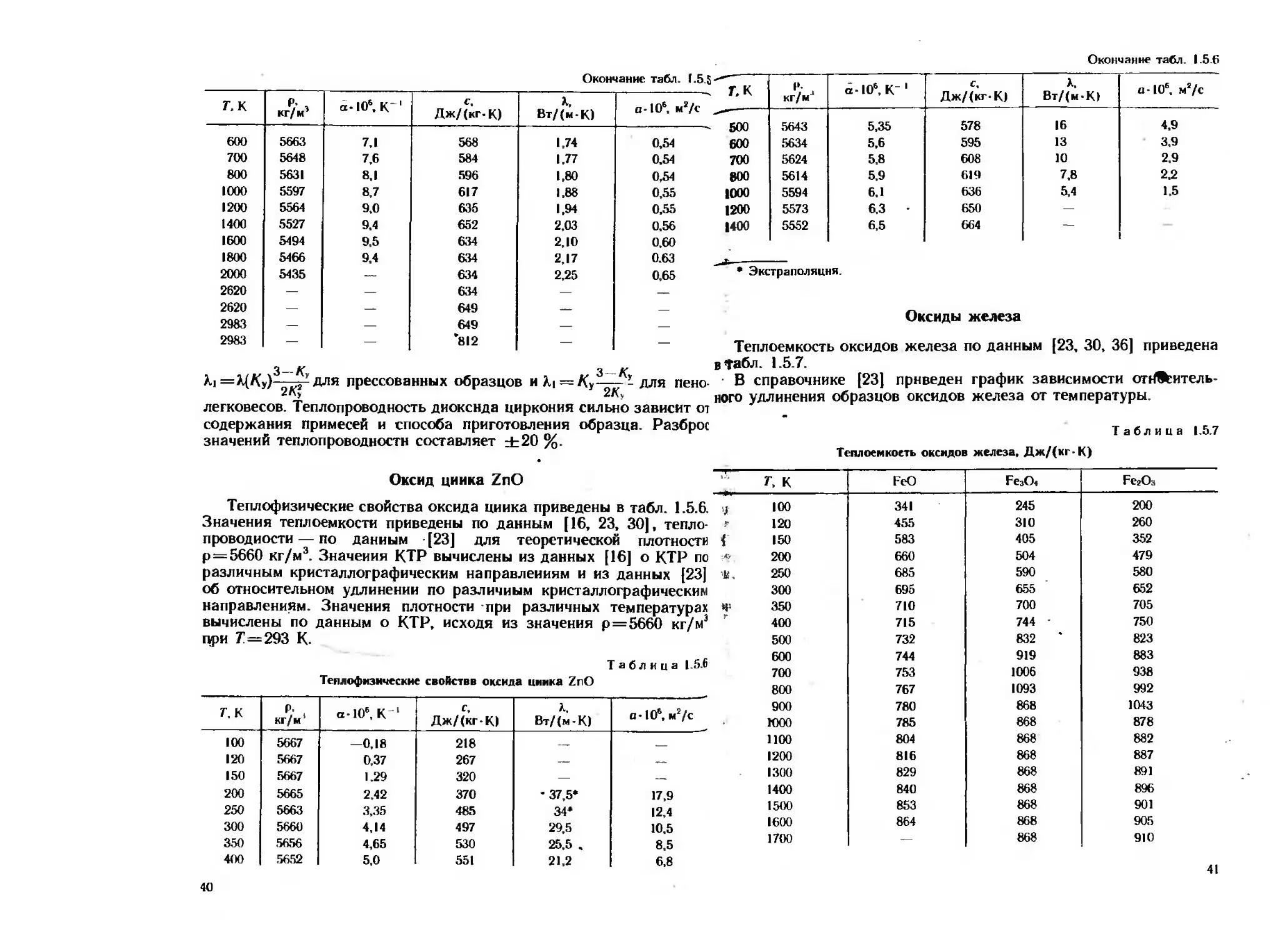
2983 — — *812 — — Теплоемкость оксидов железа по данным [23, 30, 36] приведена
3 „ в Табл. 1.5.7.
Ai=A(K,)——для прессованных образцов нА, = К,-— -для пенс- В справочнике [23] приведен график зависимости опЖитель-
2"> него удлинения образцов оксидов железа от температуры.
легковесов. Теплопроводность диоксида циркония сильно зависит от
содержания примесей и способа приготовления образца. Разброс Таблица 157
значений теплопроводности составляет ±20 %.
Теплоемкость оксидов железа, Дж/(кг-К)
Оксид цинка ZnO
Теплофизические свойства оксида циика приведены в табл. 1.5.6.
Значения теплоемкости приведены по данным [16, 23, 30], тепло-
проводности— по данным [23] для теоретической плотности
р = 5660 кг/м3. Значения КТР вычислены из данных [16] о КТР по
различным кристаллографическим направлениям и из данных [23]
об относительном удлинении по различным кристаллографическим
направлениям. Значения плотности при различных температурах
вычислены по данным о КТР, исходя из значения р=5660 кг/м3
при 7!=293 К.
Таблица 1.5.6
Теллофнзнческие свойстве оксида цинка ZnO
Г, К Р- . кг/м а-106, К 1 с, Дж/(кг-К) А, Вт/(м-К) а-106, м2/с
100 5667 —0,18 218 —
120 5667 0,37 267 — —
150 5667 1.29 320 — —
200 5665 2.42 370 • 37,5* 17,9
250 5663 3,35 485 34* 12,4
300 5660 4,14 497 29,5 10.5
350 5656 4,65 530 25,5 ч 8.5
400 5652 5,0 551 21,2 6,8
г, к FeO Fe3O4 Ре-гОз
у 100 341 245 200
₽ 120 455 310 260
4 150 583 405 352
200 660 504 479
250 685 590 580
300 695 655 652
4s 350 710 700 705
400 715 744 - 750
500 732 832 * 823
600 744 919 883
700 753 1006 938
800 767 1093 992
900 780 868 1043
ГООО 785 868 878
1100 804 868 882
1200 816 868 887
1300 829 868 891
1400 840 868 896
1500 853 868 901
1600 864 868 905
1700 868 910 41
40
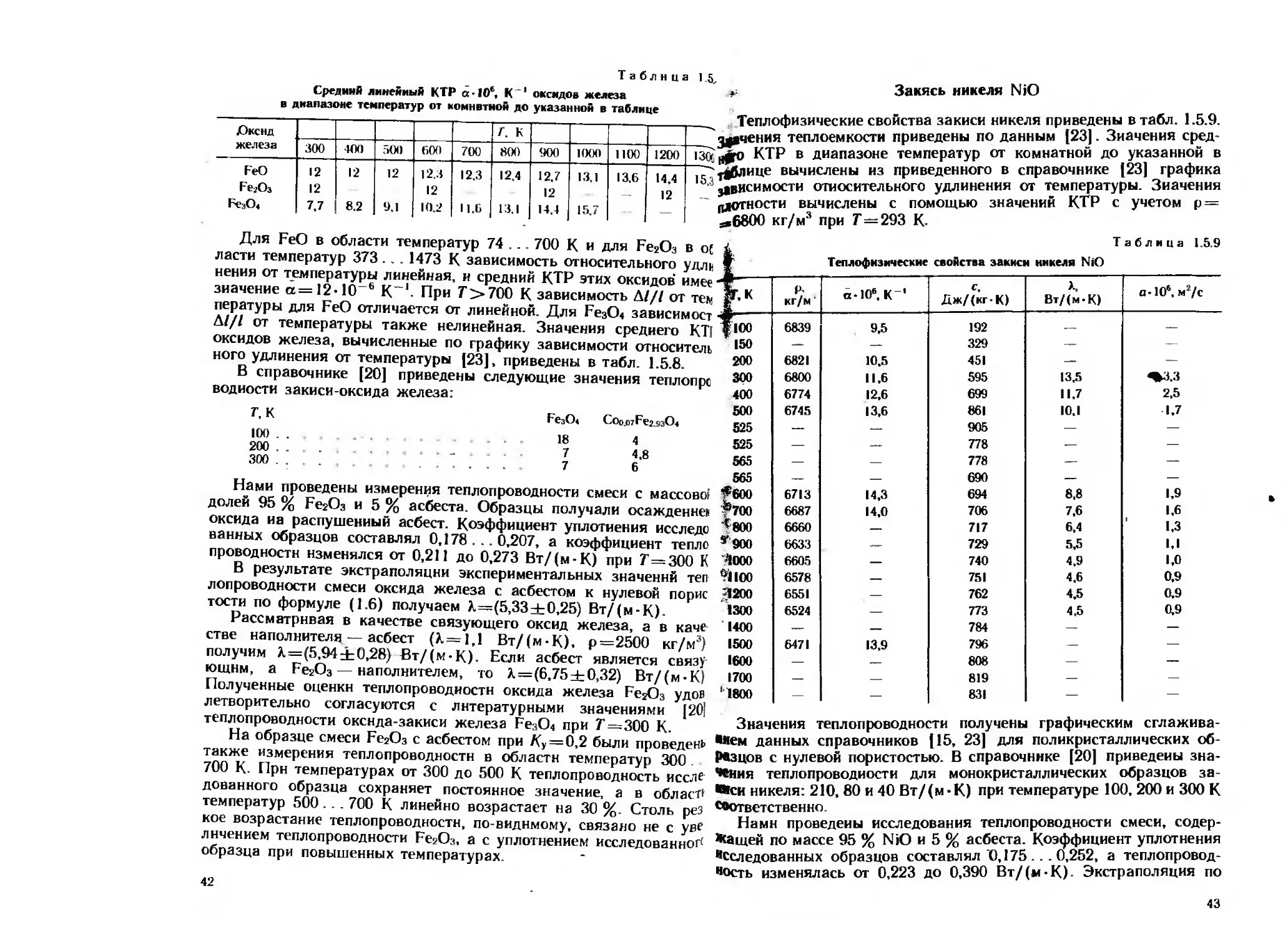
Таблица 1.5,
Средний линейный КТР сс-106, К‘* оксидов железа
Закись никеля NiO
в диапазоне температур от комнвтион до указанной в таблице
£)кснд
железа
FeO
Fe2Oa
Fe3O4
г. к
300
12
12
7.7
400
12
8.2
500
12
9.1
60(1
12
10.2
700
12.3
11.6
800
12.4
900
12.7
12
14,4
1000
13.1
15.7
1 КМ)
13.6
1200
14.4
12
__х Теплофизические свойства закиси никеля приведены в табл. 1.5.9.
дачения теплоемкости приведены по данным [23|. Значения сред*
13(7ц<о КТР в диапазоне температур от комнатной до указанной в
"7^ таблице вычислены из приведенного в справочнике [23] графика
* зависимости относительного удлинения от температуры. Значения
-----------------— - — —-.л ГЧ1Г VTD г» Т/ИГЗТГХ». П —
' плотности вычислены с помощью значений КТР с учетом р —
-,6800 кг/м3 при Г=293 К-
Для . .. .. .. „---
ласти температур 373 .. 1473 К зависимость относительного
нения от температуры линейная, и средний КТР этих оксидов ..,то
значение а=12-10-6 К-1- При Г>700 К зависимость А/// от тек
пературы для FeO отличается от линейной. Для FeaO< зависимост
A//Z от температуры также нелинейная. Значения среднего KTI
оксидов железа, вычисленные по графику зависимости относитель
него удлинения от температуры |23], приведены в табл. 1.5.8.
В справочнике [20] приведены следующие значения теплопрс
водности закиси-оксида железа:
Т, К Fe3O<
100 . . 18
200 .. . 7
300 .. . ... 7
Нами проведены измерения теплопроводности смеси с массово!
долей 95 % РегОз и 5 % асбеста. Образцы получали осаждение!
оксида иа распушенный асбест. Коэффициент уплотнения исследо
ванных образцов составлял 0,178 ... 0,207, а коэффициент тепло
проводностн изменялся от 0,211 до 0,273 Вт/(м-К) при Т=300 К
В результате экстраполяции экспериментальных значений теп
лопроводности смеси оксида железа с асбестом к нулевой порис
тости по формуле (1.6) получаем >.=(5,33+0,25) Вт/(м-К)-
Рассматрнвая в качестве связующего оксид железа, а в каче
стве наполнителя — асбест (1=1,1 Вт/(м-К), р=2500 кг/м3)
получим Х=(5,94±0,28) Вт/(м-К). Если асбест является связу
ющнм, а РегОз — наполнителем, то Х=(6,75 ±0,32) Вт/(м-К)
Полученные оценки теплопроводности оксида железа FejOa удов
летворительно согласуются с литературными значениями [20]
теплопроводности окснда-закиси железа Fe O. при 7 = 300 К.
На образце смеси FesOs с асбестом при К, = 0,2 были проведен!
также измерения теплопроводности в области температур 300
700 К. Прн температурах от 300 до 500 К теплопроводность иссле
дованного образца сохраняет постоянное значение, а в облает!
температур 500. . . 700 К линейно возрастает на 30 %. Столь рез
кое возрастание теплопроводности, по-видимому, связано не с уве
лнчением теплопроводности FesOa, а с уплотнением исследованной
образца при повышенных температурах.
FeO в
области температур
74 . .. 700
К и для Fe2O3
в Of
У дли
имее
Co0.07Fe2.93O4
4
4.8
6
Таблица 1.5.9
Теплофизическне свойства закмсн никеля NiO
|г.к P’ kf/n ' a-106, K' Аж/(кг-К) X, Вт/(м-К) a-106. m2/c
1100 6839 9.5 192 — —
150 — — 329 — —
200 6821 10.5 451 — —
300 6800 11.6 595 13.5
400 6774 12,6 699 11.7 2,5
500 6745 13,6 861 10.1 1.7
525 — — 905 — —
525 — — 778 — —
565 — — 778 — —
565 — — 690 — —
*600 6713 14,3 694 8.8 1,9
*700 6687 14,0 706 7.6 1.6
*800 6660 — 717 6.4 ' 1,3
*900 6633 — 729 5,5 l.l
<1000 6605 — 740 4.9 1,0
*?lioo 6578 — 751 4.6 0,9
4200 6551 — 762 4.5 0,9
1300 6524 — 773 4.5 0.9
1400 — — 784 — —
1500 6471 13.9 796 — —
1600 — — 808 — —
1700 — — 819 — —
'1800 — — 831 — —
графическим
сглажива-
Значения теплопроводности получены
•нем данных справочников (15, 23] для поликристаллических об-
Резцов с нулевой пористостью. В справочнике [20] приведены зна-
чения теплопроводности для монокристаллических образцов за-
вей никеля: 210, 80 и 40 Вт/(м-К) при температуре 100. 200 и 300 К
соответственно
Нами проведены исследования теплопроводности смеси, содер-
жащей по массе 95 % NiO и 5 % асбеста. Коэффициент уплотнения
Исследованных образцов составлял 0,175... 0,252, а теплопровод-
ность изменялась от 0,223 до 0,390 Вт/(и-К) Экстраполяция по
42
43
Таблица 1.5.10
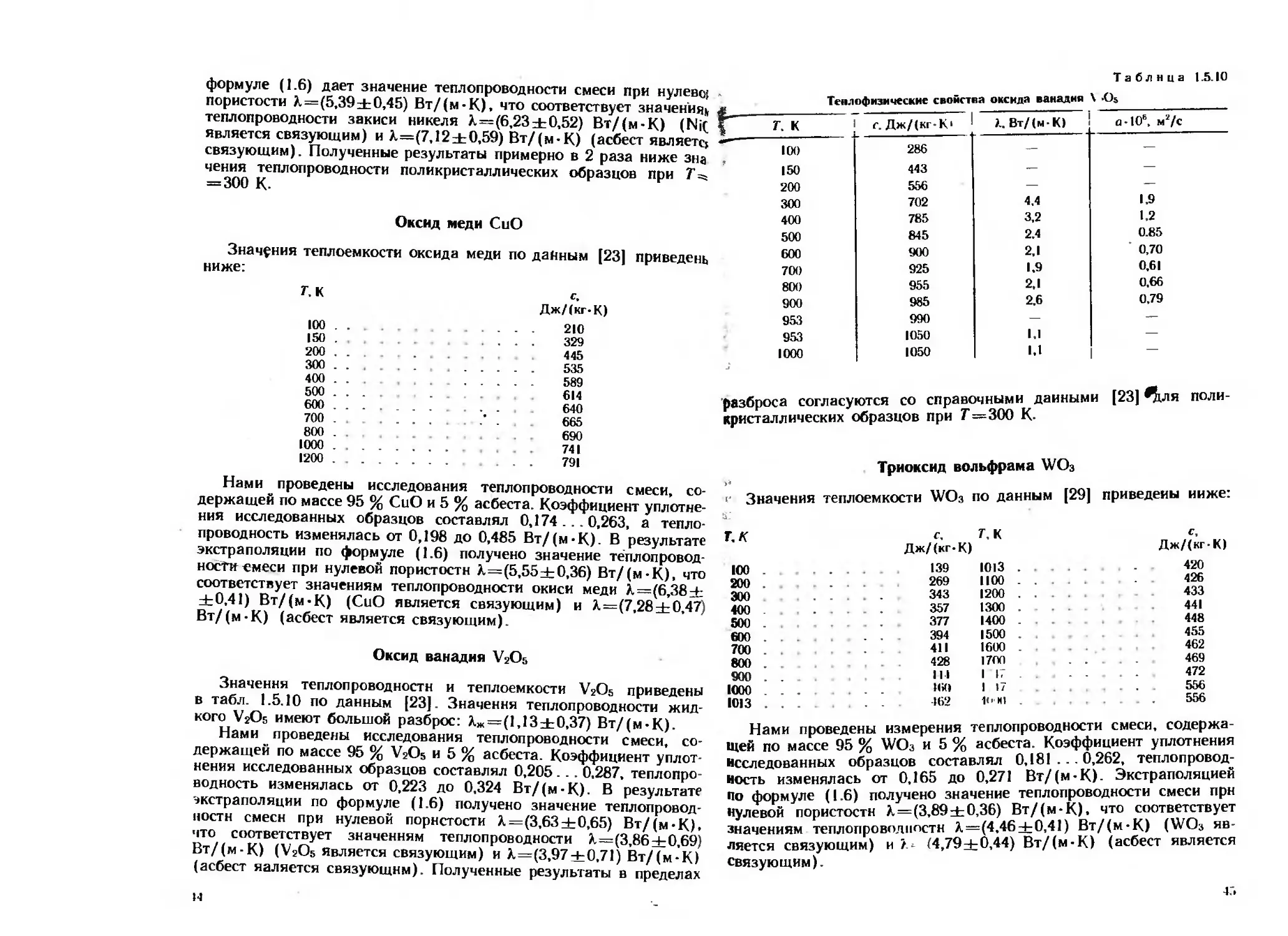
формуле (1.6) дает значение теплопроводности смеси при нулево!
пористости А.=(5,39±0,45) Вт/(м-К), что соответствует значения,
теплопроводности закиси никеля А.=(6,23±0,52) Вт/(м-К) (Ni(
является связующим) и Л=(7,12±0,59) Вт/(м-К) (асбест являет^
связующим). Полученные результаты примерно в 2 раза ниже зна
чения теплопроводности поликристаллических образцов при Т =,
= 300 К.
Оксид меди СпО
Значения теплоемкости оксида меди по данным [23] приведена
ниже:
7, К Дж/(кг-К)
100 . . ... 210
150 . 329
200 . . 445
300 . . . . 535
400 . . 589
500 . . . 614
600 . . . 640
700 . . . . . 665
800 , 690
1000 . 741
1200 , . 791
Нами проведены исследования теплопроводности смеси, со-
держащей по массе 95 % СиО и 5 % асбеста. Коэффициент уплотне-
ния исследованных образцов составлял 0,174 ... 0,263, а тепло-
проводность изменялась от 0,198 до 0,485 Вт/(м-К). В результате
экстраполяции по формуле (1.6) получено значение теплопровод-
ности емеси при нулевой пористости А.=(5,55±0,36) Вт/(м-К), что
соответствует значениям теплопроводности окиси меди А=(6,38±
±0,41) Вт/(м-К) (СиО является связующим) и А=(7,28±0,47)
Вт/(м-К) (асбест является связующим).
Оксид ванадия V2O5
Значения теплопроводности и теплоемкости V2O5 приведены
в табл. 1.5.10 по данным (23]. Значения теплопроводности жид-
кого УгОь имеют большой разброс: Аж=(1,13±0,37) Вт/(м-К).
Нами проведены исследования теплопроводности смеси, со-
держащей по массе 95 % V2O5 и 5 % асбеста. Коэффициент уплот-
нения исследованных образцов составлял 0,205. . . 0,287. теплопро-
водность изменялась от 0,223 до 0,324 Вт/(м-К). В результате
экстраполяции по формуле (1 6) получено значение теплопровод-
ности смеси при нулевой пористости А=(3,63±0,65) Вт/(м-К).
что соответствует значениям теплопроводности А=(3,86±0,69)
Вт/(м-К) (V2O5 является связующим) и А.=(3,97±0.71) Вт/(м-К)
(асбест яаляется связующим) Полученные результаты в пределах
Теплофизические свойства оксида ванадия \ Os
7. К г. Дж/(кг-К‘ Вт/(м-К) Д*10”, м7с
ЛИ" 100 286 — —
7 150 443 —
200 556 —
300 702 4,4
400 500 600 700 800 900 785 845 900 925 955 [ 985 3,2 2.4 2,1 1,9 2,1 1 2’6 1,2 0.85 0,70 0,61 0.66 0,79
953 990 —
953 1050 1.1
1000 1050 1.1 1 -
разброса согласуются со справочными данными [23| ^кля поли
кристаллических образцов при Г=300 К.
Триоксид вольфрама WO3
е Значения теплоемкости WOs по данным (29) приведены ниже.
Г, К
100
200 .
300
400
500 .
600
700 .
800
900
1000
Ю13
с. Т.к
Дж/(кг-К)
139 1013 .
269 1100 .
343 1200 . .
357 1300 .
377 1400
394 1500 .
411 1600 .
428 1700
111 I 17
160 I 17
162 1<"*1
Дж/(кг-К1
420
426
433
441
448
455
462
469
472
556
556
теплопроводности смеси, содержа-
асбеста. Коэффициент уплотнения
Нами проведены измерения
Щей по массе 95 % WO3 и 5 %_________
исследованных образцов составлял 0,181 ... 0,262, теплопровод-
ность изменялась от 0,165 до 0,271 Вт/(м-К). Экстраполяцией
по формуле (1.6) получено значение теплопроводности смеси прн
нулевой пористости А=(3,89±0,36) Вт/(м-К), что соответствует
значениям теплопроводности А=(4.46±0,41) Вт/(м-К) (WO3 яв-
ляется связующим) и А (4,79±0,44) Вт/(м-К) (асбест является
связующим).
Диоксид марганца МпО2
Значения теплоемкости диоксида марганца по данным спра-
вочника [23] приведены ниже:
100
150
200 .
300 .
400 .
500 .
600 .
700 .
800
с.
Дж/(кг-К)
287
386
498
627
730
783
818
844
864
Значение среднего КТР в области температур 293 . . . 773 К.
вычисленное из приведенных в (23] графиков относительного уд-
линения МпО2 по различным кристаллографическим направле-
ниям, составляет а=6,9-10~6 К •
В справочнике [20] приведено значение теплопроводности мо-
нокристалла закиси марганца МпО при 7=300 К: 1=11 Вт/(м-К)
Нами проведены измерения КТР прессованных образцов в об-
ласти температур 100. . . 400 К и теплоемкости порошка в области
температур 298... 673 К.
Содержание диоксида бария в исследованных образцах — не
менее 90 %.
Отклонение наших данных о теплоемкости при 7= 300 К от
значения приведенного в работе (28|, составляет 4,6 % и нахо-
дится в пределах погрешности измерений.
Сглаженные значения теплофизических характеристик диоксида
бария приведены в табл. 1.5.11.
Отношение экспериментальных значений теплоемкости и КТР
в области перекрывающихся температур 300 . .. 400 К имеет посто-
янное значение с/а=22,3-106 Дж/кг. В предположении сохранения
достоянного значения этого отношения проведена экстраполяция
Зависимости теплоемкости в область низких температур и зависи-
мости КТР в область высоких температур.
Значения плотности вычислены по значениям КТР с учетом
р=5000 кг/м3 при 7=300'К- f
Диоксид бария ВаОг
В справочнике [28] приведено значение теплоемкости диоксида
бария при 7=298,15 К: с=(396±5) Дж/(кг-К)- По данным Дями-
нова Р. С., теплопроводность прессованных образцов диоксида
бария при нулевой пористости составляет 1,34 Вт/(м-К)
Таблица 1.5.11
Теплофизические свойства диоксида бария ВаО2
г. к Р. кг/м' а-10е. К ' Дж/(кг-К) А, Bt/(n-K) п-106, м7с
100 5049 10,3 229
120 5046 12,7 283 —
150 5040 15,6 347
200 5027 17,5 390 —
250 5014 17.8 396
300 5000 18,7 415 1,34 0,65
350 4986 19,2 430 — —
400 4971 19,7 440
450 4956 20,3 450
500 4941 20,7 460
550 4926 21.1 470
600 4909 23.1 515 —
660 4891 26,9 600
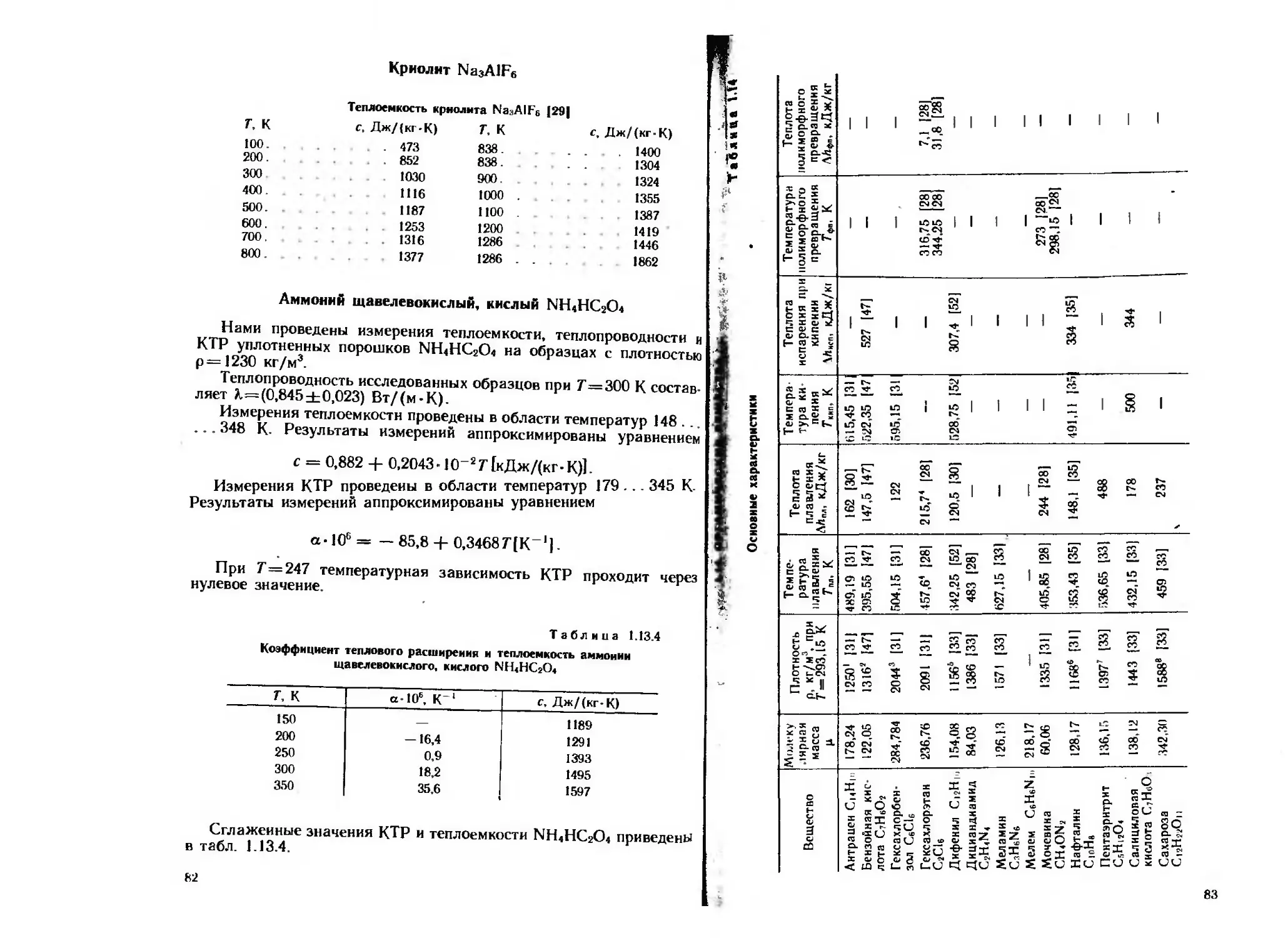
700 4870 31.4 700 —
Основные характеристики
’ Температура разложения.
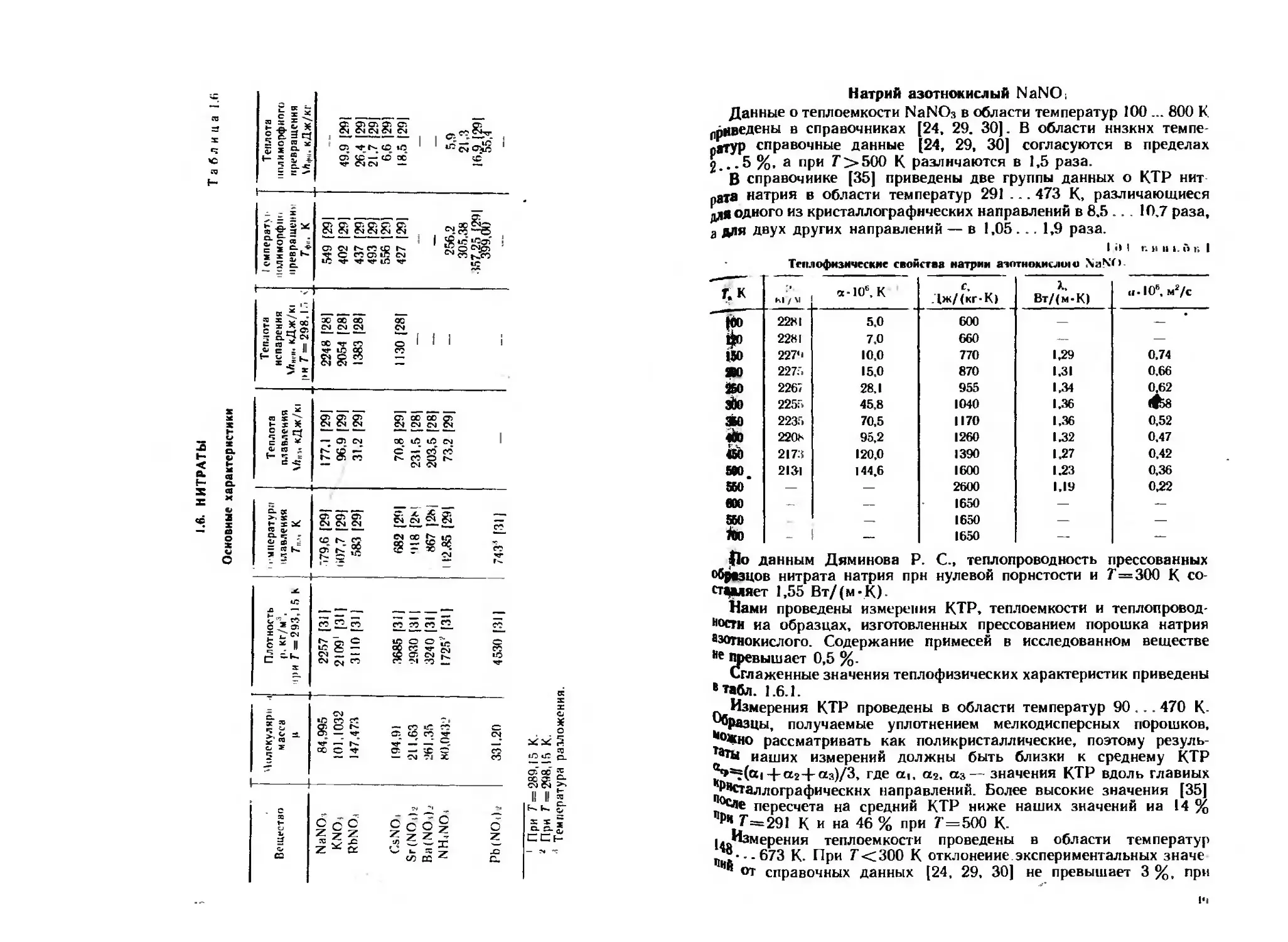
Натрий азотнокислый NaNO;
Данные о теплоемкости NaNOs в области температур 100 ... 800 К
приведены в справочниках [24, 29. 30]. В области ннзкнх темпе-
ратур справочные данные [24, 29, 30] согласуются в пределах
j>...5 %, а при 7>500 К различаются в 1,5 раза.
В справочнике [35] приведены две группы данных о КТР нит
пата натрия в области температур 291 ... 473 К, различающиеся
дай одного из кристаллографических направлений в 8.5... 10.7 раза,
а для двух других направлений — в 1,05... 1,9 раза.
I И I t. и ц i. о к |
Теплофмзмческне свойства натрии азотнокислою XaN'f>
г. к К| / м а-106, К с, Дж/(кг-К) X. Вт/(м-К) .1.10', м2/с
про 2281 5.0 600 — —
2281 7.0 660 — —
150 227‘< 10.0 770 1.29 0.74
ао 2275 15.0 870 1.31 0.66
№> 2267 28.1 955 1.34 0.62
зйо 2255 45.8 1040 1.36 <^8
3» 2235 70,5 1170 1.36 0.52
4ЙЮ 2208 95,2 1260 1,32 0.47
«О 2173 120,0 1390 1.27 0,42
*0. 2131 144,6 1600 1.23 0,36
560 — — 2600 1,19 0,22
его — — 1650 — —
560 — 1650 — —
ito __ - 1650 — —
(1о данным Дяминова Р. С., теплопроводность прессованных
образцов нитрата натрия прн нулевой пористости и 7=300 К со-
стдаляет 1,55 Вт/(м-К).
Нами проведены измерения КТР, теплоемкости и теплопровод-
ности иа образцах, изготовленных прессованием порошка натрия
•зогнокислого. Содержание примесей в исследованном веществе
нс превышает 0,5 %.
Сглаженные значения теплофизических характеристик приведены
•табл. 1.6.1.
Измерения КТР проведены в области температур 90. .. 470 К-
^бразцы, получаемые уплотнением мелкодисперсных порошков,
*°Жио рассматривать как поликристаллические, поэтому резуль-
1атЫ наших измерений должны быть близки к среднему КТР
®*»=5(ai +«г+<хз)/3, где oti. а?. а3— значения КТР вдоль главных
"РПсгаллографическнх направлений. Более высокие значения [35]
"Оспе пересчета на средний КТР ниже наших значений иа 14 %
4>к 7=291 К и на 46 % при 7= 500 К.
(.Измерения теплоемкости проведены в области температур
m2”-673 К. При 7<300 К отклонение.экспериментальных значе
" от справочных данных [24, 29, 30] не превышает 3 %, при
Калий азотнокислый KN Оз
7=300... 500 К справочные данные (24, 30] выше наших н; '
2 ... 8 %, а данные [29] — на 5,5 ... 11,8 % (максимальное от ; Данные о теплоемкости KNO3 в области температур 100 .. . 800 К
клонение —при 7=500 К). При 7>500 К теплоемкость иссле Ливедеиы в справочниках [24, 29, 30]. В справочнике [35] приве-
дованиых образцов нитрата натрия, так же как и по данным [29] v ........ J ................
резко возрастает и при Т=550 К отклонение от приведенного (
работе [29] значения теплоемкости составляет 2,3 %. Теплое»,
кость жидкого нитрата натрия хорошо, согласуется с данным,
[29, 37].
При измерениях теплоемкости методом монотонного разогре
ва область резкого возрастания эффективной теплоемкости, выз
ванного теплотой фазового превращения, составляет около 50 К
Ввиду близости температуры фазового перехода к температуре плав
ления вычисленная по результатам измерений теплоемкости тепле
та плавления нитрата натрия Дйгл=(195,1 ±2,5) кДж/кг должн,
включать и теплоту плавления, и теплоту фазового перехода npi 1
7=549 К- Полученный результат на 10 % выше приведенного i F
справочнике [29] значения теплоты плавления NaNO3. Я
Измерения теплопроводности при 7=300 К проведены иа об ЯРР<
разцах, изготовленных из порошков различной дисперсности (орел жР<
ний диаметр частиц 54, 120, 150, 200, 217 мкм). Коэффициент ул Г.-
£ны значения КТР KNO3 для различных кристаллографических
Управлений в области температур 303 . . . 363 К-
j По данным Дяминова Р. С., теплопроводность прессованных
Уразцов нитрата калия при нулевой пористости и 7 = 300 К со-
ставляет 0,92 Вт/(м-К).
* Нами проведены измерения КТР, теплоемкости, теплопровод-
стн KNO3 на образцах, изготовленных прессованием порошка
дня азотнокислого. Содержание примесей в исследованном ве-
естве не превышает 0,15 %.
' Сглаженные значения теплофизнческих свойств нитрата калня
введены в табл. 1.6.2.
.Измерения КТР проведены в области температур 90.. . 470 К.
вультат для среднего КТР при 7= 333 К [35] ниже наших данных
Г6,2 %. В области температур 300. .. 400 К КТР KNO3 резко
“эастает, а при 7 = 402 . . . 470 К сохраняет постоянное значение.
Результаты измерений КТР аппроксимированы уравнениями:
нии диаметр частиц эд, izu, iou, zoo, zi/ мкм,. коэффициент yu ?|n6 _ 1K R nK7.R щ-i T , haw 10-372. r — on * o7Kv.
лотиения исследованных образцов-0,824...0,983, теплопроводност ~ 18-7В “ °-Ь74В’10 7 + и-4794-10 1 , / - 90 - 27b К
X изменялась от 1,01 до 1,37 Вт/(м-К). Пересчет эксперименталь + U-9)
ных данных на нулевую пористость проводили по формуле е. 10б = 2о4 6р _ ] 6445 7 + 0 38085-10“2 Т2’ 7 = 216 — 402 К
По результатам всех измерений при 7=300 К и К, = 1 полу
чено Xi=(l,360±0,037) Вт/(м-К).
Теплопроводность прессованных образцов нитрата натрия npi
изменении размеров частиц от 54 до 200... 217 мкм увеличиваете
на 5... 7 %. Зависимость теплопроводности NaNO3 от размер!
частиц аппроксимирована уравнениями:
ЦЛС1>) = 1,298 + 0,4597- IO3 dcp;
X(dcp)= 1,411-^,
«ср
где dcp — размер частиц, мкм.
Были проведены также измерения теплопроводности
содержащей по массе 95 % NaNO3 и 5 % асбеста. Коэффициент уП
лотнения исследованных образцов составлял 0,375 ... 0,510, тел
лопроводность изменялась от 0,257 до 0,393 Вт/(м-К). Экстрапо
ляция на нулевую пористость по формуле (1.6) дает значение тел
лопроводности смеси Х=(1,481 ±0,114) Вт/(м-К), что соотве!
ствует значению теплопроводности NaNO3 X=(1,50± 0,12) Вт/ (м - К
смес*
Таблица 1.6.2
Теллофизические свойства калия азотнокислого KNOi
fr.к ж кг/м а-106. К' Дж/(кг-К) X, Вт/(м-К) а-10е, м’/с
л too 2140 16,8 600 — —
120 2138 17,8 630 — —
•^150 2135 19,4 685 0,758 0,52
200 2128 24,5 780 0,745 0,45
з.250 2119 31,9 865 0,732 0,40
-.300 2.105 54,1 950 0,720 0.36
2.-350 2082 96 1040 0.707 0,33
4400 2045 156 1140 0,694 0,30
•1450 1956 90 1220 0,655 0,27
Жил) 1928 90 1240 0,674 0,28
>550 1900 — 1300 0.694 0,28
увоо 1873 — 1410 0,714 0,27
7®о — — 1270 — —
J700 — — 1270 — —
Исследование температурной зависимости теплопроводное^ ^Максимальные значения КТР в области температур 300 ... 400 К,
NaNOs проведено на образце с Ку=0,97 в области температу! всыпаемые уравнением (1.10), наблюдались при первых измере-
179...527 К-
51
ннях образцов После неоднократного термоциклирования (темр(
ратура нагрева ие превышала 400 К) значения КТР постепенна' 7(/Q = 7, _* (1 —Ст),
уменьшались и приближались к значениям, рассчитанным по ypaj ~
нению (1.9). гДе 7(=0,720 Вт/(м-К); С=0.369.
Прн измерениях КТР в области фазового перехода наблюда Измерения температурной зависимости теплопроводности про-
«ись гистерезисные явления: при нагреве температура фазовог^деиы на образце с Л'у = 0,923. После пересчета на нулевую по-
перехода составляла 401,5 ..402.3 К. а при охлаждении бьиц^тость результаты измерений аппроксимированы уравнениями:
на 4 ... 6 К ниже. к
При первых измерениях различных образцов относительно.^ X, = 0,7974— 0,2609-10“3 Т= Т = 170 . . . 402 К;
удлинение при фазовом переходе составляло около 1 %, при nt v , = 0 477 + 0 395-10 3 Т’ Г = 402 527К
следующих измерениях уменьшалось до 0,2 .. . 0,3 %. Всего был, 1 — ’ *'
проведено 11 циклов нагрев — охлаждение при фазовом переходе
После неоднократного нагрева выше температуры фазовоц Рубидий азотнокислый RbNO3
перехода и последующего охлаждения образцы растрескивались —
Результаты измерений КТР, проведенных на образце, подверга! Нами проведены измерения теплоемкости, теплопроводности
шемся нагреву выше температуры фазового перехода, значителыькгКТР на образцах, изготовленных прессованием порошка рубидия
ниже результатов, полученных при первых измерениях, и близки азотнокислого. Содержание примесей в исследованном веществе
данным [35| для кристаллографического направления с мин, в» превышает 1%.
мальным КТР. Результаты измерений КТР этого образца в облает Измерения КТР проведены в области температур 90 .. 420 К.
температур 190. . . 390 К аппроксимированы уравнением Результаты измерений аппроксимированы уравнением
а-106^ — 6 + 9-10-гТ1К_|]. (II а 106 = 59,6 + 7,94-10 2 7[К“'1.
Измерения теплоемкости проведены в области температу '
148... 673 К- Отклонения сглаженных значений теплоемкости с Измерения теплоемкости проведены в области температур
справочных данных [29] для твердого нитрата в основном лежа ИВ . 673 К. Результаты измерений теплоемкости низкотемпера-
в пределах 1 %, исключая область значений вблизи температур яркой фазы RbNO3 в области температур 150. . . 437 К аппрок-
фазового перехода, где наши данные выше (при 7=400 К отклоы вмированы уравнением
иие составляет 3,6 %). Справочные данные [29] о теплоемкост | i пятГп ini
жидкого нитрата калия на 9,8 % выше наших результатов. Даинь < с = 340 + 1,087|Дж/(кг-К)[ (1-12)
справочника [24] о теплоемкости жидкого KNO3 на 4 % выш Согласуются с данными [29. 38] в пределах +1,5 %,
а данные работы [371 на 1,3 % ниже наших результатов. _
Вычисленные из данных о теплоемкости значения теплоты ф: В пРеделах погрешности измерении значение теплоемкости
зового перехода = (53,8±2,3) кДж/кг н теплоты плавлен»®^0 нитРата рубидия £=(995 + 34) Дж/(кг-К) согласуется
ДЛ„л=(100 + 3) кДж/кг удовлетворительно согласуются со справок справочными данными [ 9].
ными данными [29] и данными работы [37]. , Область аномального возрастания эффективной теплоемкости.
Измерения теплопроводности при 7 = 300 К проведены на обра “званного теплотой фазового перехода, при измерениях методом
цах, изготовленных уплотнением порошков со средним размере фотонного Разогрева со скоростью изменения температуры при-
частии от 50 до 150 мкм. Коэффициент уплотнения К, исследова» ®РНО 0.1 К/с составляет оО . 75 К. Температуры соседних фа
ных образцов составлял 0,805. .. 0,959, теплопроводность к из
менялась от 0.480 до 0,697 Вт/(м-К). Влияние размера частиц >'
теплопроводность прессованных образцов не обнаружено. Пересч?
экспериментальных данных на нулевую пористость по формуле
дает значение 7, =(0,692 ± 0.025) Вт/(м-К), но при этом значив
7 увеличиваются при уменьшении пористости tn. С более высо^
точностью воспроизводит экспериментальные данные уравнение
Эбвых переходов RbNO3 отличаются на 27 ... 62 К, поэтому по-
и жученные нами значения теплоемкости высокотемпературных фаз
RbNO3 на 5 ... 18 % выше справочных данных [29].
Количество теплоты фазовых переходов, оцененное по разно-
сти эффективных значений теплоемкости между температурами
Фазовых переходов и значений, рассчитанных по уравнению (1.12).
составляет: (27,3+1,3) кДж/кг — для области 7 = 437... 493 К:
(26,О±3,6) кДж/кг — для области 7= 493... 556 К; (7,5±
42.5) кДж/кг — для области 7 = 556..583 К; 30.1 кДж/кг для
®бластн 7 = 583 . . . 623 К (при более высоких температурах эффек
т*вцая теплоемкость RbNOa имеет постоянное значение).
Измерения теплопроводности проведены при Г=300 К на об-
разцах с Ку = 0,877. Значения теплопроводности Z лежат в пределах
0,367... 0,371 Вт/(м-К), экстраполяция на нулевую пористость
по формуле Оделевского (1.1) дает А, =0,44 Вт/(м-К).
Сглаженные значения теплофизических свойств RbNCh приве-
дены в табл. 1.6.3. Значения теплоемкости высокотемпературных
фаз RbNO3 приведены поданным [29]. Значения плотности вычис-
лены по температурной зависимости КТР, исходя из значения
р—3110 кг/м3 при 7 = 293 К-
Таблица 1.6.3
Теплофизнческне свойства рубидия азотнокислого RbNO,
т, к Р- с кг/м’ а-10е. к Дж/(кг-К) К, Вт/(м-К) а-10е. м!/с
100 3212 35 430 — —
120 3206 43 462 — —
150 3192 50 500 — —
200 3165 60 556 —- —
250 3136 67 610 — —
300 3106 73 664 0,44 0,21
350 3071 78 718 — —
400 3035 84 772 — —
437 3006 87 819 — —
437 — — " 919 — —
493 — — 971 — —
493 — — 888 — —
500 — — 891 — —
556 — — 1037 — —
556 — — 990 — —
583 — — 990 — —
600 — — 990 — —
700 — — 990 — —
Цезий азотнокислый CsNO3
Нами проведены измерения теплоемкости, теплопроводности »
КТР на образцах, изготовленных прессованием порошка цезии
азотнокислого. Содержание примесей в исследованном веществ?
не превышает 0,5 %.
Измерения КТР проведены в области температур 150 . . . 450 К
Данные для низкотемпературной фазы CsNOs в области темпера
тур 150 .. . 427 К аппроксимированы уравнением
а-106 = 75,09 — 1,962-10 2 ?[К']
Относительное удлинение прн фазовом переходе составляв
0 7%.
Измерения теплоемкости проведены в области температур
|$ф...673 К. Результаты измерений аппроксимированы уравне-
ниями.
с = 265 + 0,75 7 Дж/(кг-К), 7 = 170 . . 427 К;
с = 641 + 0,15 7 Дж/(кг-К), 7 = 427 . . . 673К-
й; Отклонения полученных нами значений теплоемкости от дан-
ных [29, 39] в основном не превышают 2 %. Вычисленное по ре-
зультатам измерений теплоемкости количество теплоты фазового
пзрехода CsNO3 составляет (19,2+1,6) кДж/кг.
Таблица 1.6.4
Теплофизические свойства цезии азотнокислого CsNOn
ш г. к Р. . кг/м а -106, К ' Дж/(кг-К) X, Вт/(м-К) а-10е, мг/с
л< 100 3804 — 338 — —
” 120 3795 — 360 — —
4 150 3779 47.8 387 0,356 0,243
200 3749 56,4 424 0,350 0.220
‘ 250 3716 61,9 460 0,343 0,201
300 3680 65,9 492 0,337 0.186
350 3642 69,0 537 0,331 00.169
400 3603 71.6 578 0,324 0,156
427 3582 72,9 601 0,321 0,149
427 3512 75 657 0,302 0,131
450 3490 75 672 0,314 0,134
500 3450 — 697 0,339 0,141
560 3420 —. 713 0,363 0.149
600 3380 — 723 0,388 0,159
650 3340 — 727 0,413 0,170
682 3314 — 730 0,429 0,177
682 —• — 767 —
700 — , — 767 —
Измерения теплопроводности при 7 = 300 К проведены на образ
Нах с коэффициентами уплотнения Ку = 0,856... 0,966. Пересчет
по формуле Оделевского дает значение теплопроводности при ну-
левой пористости Xi= (0.34+ 0,01) Вт/(м-К). Проведены также
Измерения теплопроводности в области температур 173... 606 К
Па образце с Ку=0,942. После приведения к нулевой пористости
результаты описаны уравнениями:
X = 0,376 - 1,28-10 4 7Вт/(м-К), 7= 170 . . . 427 К;
А = 0,089 + 4,99-IO"4 7Вт/(м-К), 7 = 427. . 606 К-
Теплофизические свойства нитрата цезня приведены в табл. 1.6.4.
Значения теплоемкости приведены по данным [29, 39] Темпера-
турная зависимость плотности рассчитана по КТР исходя из зна
54
чения р = 3685 кг/м3 при Т=293 К с учетом уменьшения плотности
иа 2 % при фазовом переходе.
Стронций азотнокислый Sr (NO.,) 2
В справочнике [28] приведено значение теплоемкости Sr(NO3)s
при 7=298,15 К с=(709 ±8) Дж/(кг-К). в справочнике [24] при
Ведено среднее значение теплоемкости в области температур 290
... 320 К-
По данным Дяминова Р. С., теплопроводность ). прессованных
образцов нитрата стронция при нулевой пористости и Т = 300 К
составляет 0,797 Вт/(м-К)
В работе (40] получено среднее значение КТР в области тем-
ператур 301 ... 583 К. В справочнике [35] приведено уравнении
для КТР Sr(NOs)2 в области температур 348 .. . 698 К-
Нами проведены измерения КТР, теплоемкости и теплопровод
ности на образцах, изготовленных прессованием порошка строи
цня азотнокислого. Содержание примесей в исследованном веще
стве не превышает 1 %.
Измерения КТР проведены в области температур 82 . . 378 К
Результаты измерений аппроксимированы уравнением
а-106 = 31,58 + 0,6367-10“-2 7 — ^-[К"1].
Экстраполяция зависимости для КТР в область высоких темпе-
ратур проведена по уравнению
а-106 = 17,3+3.852-10'27 [К-'],
полученному из уравнения для теплоемкости, исходя из постоян
ства отношений с и а в области температур 200.. . 380 К.
Наши данные выше значения [40] на 12,5 %. Отклонения от
уравнения [35] составляют — 5 % при температуре 350 К и 4,5 %
при температуре 700 К.
Измерения теплоемкости проведены в области температур
136... 673 К В области 7 = 200... 700 К температурная зависи-
мость теплоемкости близка к линейной:
с = 422 + 0,958 Т [Дж/(кг - К)!
Полученные нами результаты совпадают с данными справоч-
ника [28] прн 7 = 298,15 К н на 5.9 % ниже значения, приведенного
в справочнике [24] для области температур 290. . . 320 К
Измерения теплопроводности при 7 = 300 К проведены на об
разцах с Ку = 0,892. В результате экстраполяции на нулевую по
ристость по формуле Оделевского (1.1) получено X, =0,92 Вт/(м-К)
Температурная зависимость теплопроводности исследована на об
разцах с К, =0,90 . 0,94 В пределах погрешности измерений
теплопроводность прессованных образцов нитрата стронция в об
ласти Т— 170 700 К не зависит от температуры.
.’>6
₽ Сглаженные значения теплофизических свойств нитрата строн-
ция приведены в табл. 1.6.5.
Таблица 1.6.5
Теллофизические свойства стронция азотнокислого Sr(NO3)2
¥Г, к Р- , кг/м а-106. К ' с. Дж/ (кг- К) К Вт/(м-К) а-106. м2/с
100 2971 16,2 430 — —
120 2968 19,0 470 — —
! 150 2963 21.9 515 — —
200 2952 24,8 605 0,92 0,51
, 250 2940 26,8 655 — 0,48
> 300 2928 28,8 710 0,92 0,44
Г 350 2915 30,9 765 — 0.41
1 400 2901 32.7 810 0,92 0,39
f 450 2887 34.6 860 — 0,37
500 2872 36,6 905 0,92 0,35
Г 650 2856 38.5 950 — 0,34
j 600 2839 40,4 1000 0.92 0,32
650 2821 42,3 1045 — 4 0.31
700 2803 44,3 1080 0,92 0,30
Барий азотнокислый Ви (NO.-,)2
Значения теплоемкости Ba(NO3)2 в области температур 100 .. .
...850 К приведены в справочниках [24, 30, 41], в работе [42].
Рекомендуемое значение теплоемкости при 7= 298,15 К с=(581±
±2,4) Дж/(кг-К) [28].
По данным Дяминова Р. С., теплопроводность X прессованных
образцов нитрата бария при 7 = 300 К и нулевой пористости со-
ставляет 0,712 Вт/(м-К). В книге [43] приведены значения теп-
лопроводности монокристаллов BafNOa)?: при 7 = 273 К Х =
= 1,746 Вт/(м-К) и при температуре плавления Х=0,549 Вт/(м-К)
В работе [42] получены значения КТР Ba(NO3)e в области
температур 260 . . 767 К. В справочнике [35] приведено уравнение
для КТР Ba(NO3)2 в области температур 348 . . . 523 К.
Нами проведены измерения КТР, теплоемкости и теплопровод-
ности на образцах, изготовленных прессованием порошка бария
азотнокислого. Содержание примесей в исследованном веществе ие
превышает 0,5 %.
Измерения КТР проведены в области температур 85 . 448 К
Результаты измерений аппроксимированы уравнением
а-106 = 12,48 --5^3 + 0,2432-10-' 7 [К ’]
Приведенное в справочнике [35] среднее значение КТР в об-
ласти температур 197 .. . 288 К выше наших данных на 4,5 %, откло-
нения приведенного в работе [35] уравнения для КТР Ba(NO3)2
от наших данных составляют — 3,9 % при 7 =350 К и 4,4 % при -j
7=550 К- Отклонения данных работы [42] от наших результатов л.
составляют 3,4 % при 7= 260 К; — 9,4 % при 7=450 К и —16,6 % Т К
при 7 = 700 К. цо •
Измерения теплоемкости проведены в области температур JJO • •
148 . . . 673 К. В области 7 = 200 . . . 700 К температурная зависи- JS? ’
мость теплоемкости близка к линейной и может быть представлена Ед
уравнением £6.2
с = 346 + 0,72 7 [ДжДкг - К)]
Теплоемкость аммония азотнокислого NH.NCh 123]
Дж/(кг-К) т, К Дж/(кг-К) Т. К Дж/(кг-К)
748 256.2 1543 399 . . . . 1917
859 300 . . , 1742 399 . . . 1993
1036 305.38 . . , 1765 400 , , 1995
1312 305.38 - 1491 442.85 . . . 2065
1601 357,25 . . 1618 442,85 . . . 2011
1637 357,25 . . 1841 450 . . 2011
Отклонения данных [14, 30,.41. 42] от наших результатов со-
ставляют 0,8... 5,9 %. Приведенное в работе (28] значение теп-
. лоемкости при 7 =298.15 К на 2 % выше наших данных.
Таблица 1.6.6 Теплофизнческне свойства бария азотнокислого Ba(NO->)2
7, К Р. кг/м4 а -10е, К 1 Дж/(кг-К) X, Вт/(м-К) а-106, м2/с
100 3267 9.9 350
120 3265 И.2 380
150 3262 12,8 420 . _...
200 3255 14,8 480 0.63 0,40
250 3247 16,6 535 — 0,36
300 3239 18.1 570 0,63 0,34
350 3230 19.5 602 .— 0.32
400 3220 20,9 635 • 0,63 0.31
450 3210 22,3 668 -- __ 0,29
500 3199 23.6 700 0,63 0,28
550 3187 24,9 736 — 0.27
600 3175 26,2 774 0,63 0,26
650 3162 27,5 816 — 0,24
700 3148 28,8 870 0,63 0,23
Измерения теплопроводности при 7 = 300 К проведены на об-
разцах с коэффициентами уплотнения Ку — 0,837 ... 0,845. Пере-
счет на нулевую пористость по формуле Оделевского (1.1) дает
Zi =(0,618 + 0,032) Вт/(м-К). Исследования температурной за-
висимости теплопроводности проведены на образцах с /(/=0,839 . . -
. . . 0,849. В области температур 173 . . . 673 К теплопроводность ис-
следованных образцов практически не зависит от температуры.
Сглаженные значения теплофизнческих свойств нитрата бария
приведены в табл. 1.6.6.
Аммоний азотнокислый NH.NO3
По данным Дяминова Р. С., теплопроводность К прессованных
образцов нитрата аммония при 7=300 К и нулевой пористости
составляет 0,595 Вт/(м-К).
Свинец азотнокислый Pb(NO3)?
** По данным Дяминова Р. С., теплопроводность >. прессованных
Дорошков нитрата свинца при 7=300 К и нулевой пористости со-
ставляет 0,595 Вт/(м-К).
Р В справочнике [24] приведено среднее значение теплоемко-
сти нитрата свинца в области температур 286... 320 К С—
=460 Дж/(кг-К).
* В справочнике [35] приведено среднее значение КТР нитрата
ршнца в области температур 348 ... 453 К а = 31,6-10-6 К-1-
Основные характеристики
Вещество Молекулярная масса И Плотность р, кг/мэ. при 7=293,15 К Температура плавления 7„. К Теплота плавления ДЛ„. кДж/кг
NaClOa КСЮз • При 7=288. 106,44 122,55 15 К- 2490* (31] 2320 (3lj 536 (28] 630 (28] 200 (28] 171 |31]
Натрий хлорноватокислый NaCIO3
В книге [43] приведены значения теплопроводности монокри-
сталлического хлората натрия Х.= 1,28 Вт/(м-К) при 7=273 К
и А.=0,64 Вт/(м-К) при температуре плавления. В справочнике
[16] приведено значение теплопроводности монокристаллического
хлората натрия при 7= 273 К 1=1,12 Вт/(м-К) и значение теп-
лоемкости при 7 = 300 К с=940 Дж/(кг-К).
В работе [44] приведены данные о теплоемкости NaCIO3 в об-
ласти температур 100... 300 К, в справочниках [24, 30] приве-
дены значения теплоемкости твердого я жидкого хлората натрия
а области 7 = 273. . . 572 К. При 7 = 300 К данные [30] на 1,2 %
выше значения, приведенного в работе [44].
58
59
Теплоемкость натрия хлорноватокислого NaCIOs [44, 301
т, к Дж/(кг-К) т, к с. Дж/(кг-К) т, К с. Дж/(кг-Х|
100 . 514 3(М) . 944 536 . 1371
120 . . 580 350 . . . 1026 536 . . . 1250
150 . 663 400 . . . 1118 550 . - 1250
200 . 773 450 . . . 1211
250 . 862 500 . . 1304
Калин хлорноватокислый КСЮз
В справочниках [24, 30J приведены значения теплоемкости
хлората калия в области температур 100... 298,15 К. В справоч
нике [24| приведено среднее значение теплоемкости в области
289 .. . 371 К.
По данным Дяминова Р. С., теплопроводность Л. уплотненны*
порошков хлората калия прн 7 = 300 К и нулевой пористости со-
ставляет 0,847 Вт/(м-К).
Нами проведены измерения КТР, теплоемкости н теплопровод-
ности на образцах, изготовленных прессованием Порошка калия
хлорноватокислого. Содержание примесей в исследованном вещест-
ве не превышает 0,2 %.
Измерения КТР проведены в области температур 142 . . . 382 К.
В области температур 150.. . 300 К результаты измерений аппрок
симированы уравнением
а-106 = — 252,9 4- 4,04677 — 0,180972.10“1 Т2 +
+ 0,274323-10-*7 3 [К'1].
При 7 > 300 К КТР линейно зависит от температуры:
а-10®= —62,7 + 0,456 7 [К”']. (1.13)
Для расчета плотности хлората калия При высоких температу
рах использованы значения КТР, полученные экстраполяцией ли
нейной зависимости (1.13).
Измерения теплоемкости проведены в области температур,
186. . . 598 К- Результаты измерений согласуются с данными [24.
30| в пределах 2 %, В области температур 100 . . 460 К результаты
наших измерений совместно с данными [24, 30| описаны уравнением
с = 307,9 + 2.35347 - 0,20567-10“2 Г|Дж/(кг-К)1-
При 7=(465±5) К теплоемкость КСЮз скачком возрастает на
100 Дж/(кг-К). В области температур 460 . . . 600 К результаты из
мерений описаны ураанением
с = 4372,5 - 14,402 7 + 0,156828 1 О'1 Г Шж/(кг - К)].
! !
Измерения теплопроводности проведены на образцах с
2,0,895 . . . 0,958 при 7 = 300 Кив области температур 173 .. . 548 К-
|1ересчет данных при 7 = 300 К на нулевую пористость по фср
муде Оделевского дает М =(0,62±0,01) Вт/(м-К) Температурная
^нсимость теплопроводности хлората калия после пересчета
зиспериментальных данных на нулевую пористость и согласования
с данными при 7 = 300 К описана уравнением
>. = 0,914 - 0,1468-10"2 7 + 0,1626-10"5 7[Вт/(м-К)]-
Сглаженные значения теплофизических характеристик хлорага
кадия приведены в табл. 1.7.1.
Т аблица 17.1
Теплофизические свойства калия хлорноватокислого КСЮз
т _____________________________
-«г Ж к 4» 1». кг/м1 а-1(7, К ' с, Дж/(кг-К) К Вт/(м-К) а-106, м2/с
100 — — 523 — —
120 — — 561 — —
150 2374 40 615 — —
200 2358 51,5 696 0,69 0,42
250 2339 57,5 768 0,65 0,36
„300 2317 74 829 0,62 0,32
.350 2287 97 880 0,60 0,30
400 2250 120 920 0,59 0,28.
.450 2207 142 950 0,58 0,28
,500 2157 165 1092 0,59 0,25
550 2100 188 1195 0,60 0,24
..600 2039 211 1377 0,62 0,22
♦
60
ОС
62
Натрий хлорнокислый NaOO4
По данным Дяминова Р. С., теплопроводность А уплотненных
ророшкоа перхлората натрия при Т=300 К и нулевой пористости
составляет 0,671 Вт/(м-К).
В работе [45] проведены исследования теплоемкости перхло-
рата натрия до температуры 640 К. По данным [45], температура
фазового превращенияйоставляет 7фп = 579.2 К, теплота фазового
превращения Дйф1,=(10,62±0,03) кДж/кг.
Теплоемкость натрия хлорнокислого NaCIOi
т, к С, Дж/(кг-К) т, к с Дж/(кг- К) Т, К Дж/(кг-К)
кю . 513 350 976 579,2 . . 2385
150 . 622 400 . . . 1098 579,2 . . 1372
& . . 723 450 . . . 1240 600 . . 1312
» . 802 500 . . . 1504 640 . . 1282
зю . . 904 550 . 1972
а" Калий хлорнокислый КС|О4
По данным Дяминова Р. С., теплопроводность А уплотненных
порошков перхлората калия при 7=300 К и нулевой пористости
составляет 0,587 Вт/(м-К).
В справочниках [14,30] приведены значения теплоемкости КС1О4
при 7= 100... 298,15 К- В работе [46] представлены результаты
Мспериментальных исследований теплоемкости КСЮ4 в области
температур 298 .. . 600 К. По данным [46] температура фазового
перехода 7Ф, =571.1 К. теплота фазового перехода ДЛфп =
= 103,9 кДж/кг.
Нами проведены измерения КТР. теплоемкости и теплопровод-
ности на образцах, изготовленных прессованием порошка калия
борнокислого. Содержание примесей в исследованном веществе
не превышает 0,3 %.
Измерения КТР проведены в области температур 83. . .460 К.
Результаты измерений аппроксимированы уравнением <
а-106 = 22,6 + 0,129 7 [К“'1
Измерения теплоемкости проведены в области температур
,73...673 К. В области 7 = 300... 570 К теплоемкость линейно
’«висит от температуры: с = 428+1,12 7 [Дж/(кг-К)|.
Наши результаты ниже данных [46] на 2 -. - 3 %. Теплоемкость
®Чсокотемпературной фазы выше значения [46] на 4,4 %. Вычис-
енное на основании измерений теплоемкости количество теплоты
тазового перехода Д/1фг = (102,9+5,7) кДж/.кг хорошо согласуется
•Литературными данными.
63
Измерения теплопроводности проведены при /’ = 300 К на образ
пах с коэффициентами уплотнения Ку=0,820 ... 0,938. Пересче,
экспериментальных данных на нулевую пористость по формул,
Оделевского (1.1) дает X, =(0,495 ±0.016) Вт/(м-К). Аппроксн
мация экспериментальных данных формулой Оделевского с по
правочным множителем (1.4) дает значения X, =0,516 Вт/(м-К|
и С = 0,349.
В работе [13] приведены данные о температуропроводност,
прессованных образцов перхлората калия с Ку=0,806 . . . 0.868.
Аппроксимация данных (13) для теплопроводности формулов
Оделевского с поправочным множителем дает X, =0,485 Вт/(м-К)
С—2,48. В области Ау=0,806 . . 0,868 данные [13] в 2 ... 1,5 разг
ниже наших результатов, однако экстраполяция зависимости теп-
лопроводности к нулевой пористости удовлетворительно согласует
ся с нашими данными.
Сглаженные значения теплофизических характеристик перхлора-
та калия приведены в табл. 1.8.1. Значения теплоемкости при
Г^ЗОО К приведены по данным [46].
Таблица 181
Теплофнзическне свойства калия хлорнокислого КСЮ,
т. к 1». кг/м ’ а-1(7, К Дж/(кг-К) А. Вт/(м-К) а-К7.м7с
100 2595 35,5 470 — —
120 2590 38,1 500 — —
150 2580 42,0 560 — —
200 2563 48,4 630 — —
250 2543 54,8 715 — —
300 2521 61,3 783 0.516 0,26
350 2497 67,8 843 — —
400 2470 74,2 902 — —
450 2442 80.6 962 — —
500 2412 87,1 1021 — —
550 2380 93.7 1080 — —
571,1 1106 — —
571,1 1047 —
600 1013 — —
650 — — 1040 — —
700 1070 —
Аммоний хлорнокислый NH4CIO4
По данным Дяминова Р. С., теплопроводность X уплотненных
порошков перхлората аммония при 7 = 300 К и нулевой пористости
составляет 0,503 Вт/(м-К).
>|
Нами проаедены измерения КТР, теплоемкости и теплопровод
^гти на образцах, изготовленных прессованием порошка аммония
борнокислого. Содержание примесей в исследованном веществе
р* превышает 0,3 %.
Измерения КТР проведены в области температур 126... 360 К.
результаты измерений аппроксимированы уравнением
а-106 = 43,9 + 6,62-102 7 1К~
Измерения теплоемкости проведены в области температур 120...
...500 К Результаты измерений аппроксимированы уравнением
с = 217 + 3,0467 - 0,1114-10~2Г[Дж/(кг-К)].
‘ Измерения теплопроводности при 7=300 К проаедены на образ-
да с коэффициентами уплотнения Ау=0,850 ... 0,913. Пересчет
ненулевую пористость по формуле Оделевского (1.1) дает Х| =
=(0,426 ± 0,020) Вт/(м-К). Температурная зависимость тепло
проводности исследована в области температур 173 . . 500 К на
образцах с Ау=0,86
Результаты измерений после пересчета на нулевую пористость
н согласования с данными при 7=300 К описаны уравнением
Z = 0,370 + 0,188-10"37[Вт/(м.К)].
Сглаженные значения теплофизических характеристик перхло-
рата аммония приведены в табл. 1.8.2.
Таблица 1.8.2
Теплофизическне свойства аммония хлорнокислого NH4CIO4
г, к р. кг/м’ а-10". К ДжДкг-К) А. Вт/(м-К) а- Юь, м2/с
100 2015 50,3 500
120 2009 51,6 560 — —
150 1999 53.6 660 0,398 0.30
200 1983 56,9 800 0,407 0.26
250 1966 60,2 910 0.417 0,23
300 1947 63,4 1025 0,426 0,21
350 1929 66,7 1140 0,435 0.20
400 1909 70 1250 0.445 0.19
450 1889 73 1360 0,454 0,18
500 1867 77 1470 0,464 0,17
«Г»
Таблица 19
1.9. ХРОМАТЫ
Основные характеристики
Вещество Молекулярная масса М Плотность р, кг/м3, при 7=293,15 К Температура плавления 7,1Л, К
ВаСгО; SrCrOi 253,33 203,61 4498 {311 3895* [311 1556** [28|
• При 7=288.15 К.
** В атмосфере кислорода.
Барий хромовокислый ВаСгО,
Нами проведены измерения КТР и теплоемкости порошка хрома-
та бария. Измерения теплопроводности- проведены для двойной
смеси, содержащей по массе 95 % ВаСгО. и 5 % асбеста. Содер-
жание примесей в исследованном веществе — не более 2 %.
Измерения КТР проведены в области температур 7=292...
... 421 К. Результаты измерений аппроксимированы уравнением
а-106 = 11,2 +3-1О~2Г[К_11.
Измерения теплоемкости проведены в области температур 298 .. .
... 673 К- Результаты измерений аппроксимированы уравнением
с = 486 + О,233Т[Дж/(кг-К)].
Измерения теплопроводности проведены при Т=300 К на об-
разцах с коэффициентами уплотнения К. = 0,328 .. . 0,395. Значения
теплопроводности Z изменялись от 0,146 до 0,171 Вт/(м-К).
Экстраполяция на нулевую пористость по формуле (1.6) дает зна-
чение теплопроводности смеси хромата бария с асбестом Х= (1,07±
±0,13) Вт/(м-К). что совпадает с теплопроводностью пресован-
ного асбеста при нулевой пористости.
Сглаженные значения теплофизнческих характеристик хромата
бария приведены в табл. 1.9.1.
Т а бл и IX а 1.9.1
Теплофнзичесвис свойства бария жромововислого ВаСгО,
7. К Г- кг/м «•10-.К ' Дж/(кг-К) X, Вт/(м-К) а- 10е. ма/с
200 4521 17,2 533 — —
250 4509 18.7 544 — —
.300 4496 20.2 556 1,07 0,43
350 4482 21.7 568 — —
400 4467 23,2 579 — —
06
Окончание табл. 1.9.1
г, к Р. кг/м 1 а-106, К Дж/(кг-К) к, Вт/(м-К> . а- 10‘, м!/с
450 4431 24.7 591 — —
500 4434 26.2 603 — —
550 4416 27,7 614 — —
600 4397 29,2 626 — —
650 4378 30.7 638 — —
700 4357 32,2 649 — —
Стронций хромовокислый SrCrOt
Нами проведены измерения КТР и теплоемкости порошка хро
мата стронция. Измерения теплопроводности проведены для двой
ной смеси, содержащей по массе 95 % SrCrO, и 5 % асбеста. Содер
жание примесей в исследованном веществе — не более 2 %.
Измерения КТР проведены в области температур 296. . 438 К
Результаты измерений аппроксимированы уравнением
а-106 = 5 + 4-1О-!7'[к '].
Измерения теплоемкости проведены в области температур 298. . .
...673 К. Результаты измерений аппроксимированы уравнением
с = 672 + 0,16 Т [Дж/(кг • К)1.
Измерения теплопроводности проведены при 7=300 К на образ-
цах-с коэффициентами уплотнения К,=0,256. .0,385. Значения
теплопроводности X изменялись от 0,138 до 0,182 Вт/(м-К).
Таблица 1.9.2
Тепл «физические свойства стронция хромокислого SrCrOi
Т, К Р. кг/м а- 10е. К Дж/(кг-К| А. Вт/(м-К) а-10*', м2/с
200 3910 13 704 — —
250 3902 15 712 — —
300 3893 17 720 1.45 0.52
350 3882 19 728 — —
400 3871 21 736 — —
450 3858 23 744 — —
500 3844 25 752 —
550 3829 27 760 — —
600 3813 29 768 —
650 3796 31 776 —
700 3778 33 784 — —
.Экстраполяция на нулевую пористость по формуле (1.6) дает
Для смеси хромата стронция с асбестом А.=(1,42 ±0,28) Вт/(м-К),
что соответствует теплопроводности SrCrO. А.=(1,45 ±0,30)
Вт/(м-К).
Сглаженные значения теплофнзических характеристик хромата
стронция приведены а табл. 1.9.2.
Основные характеристики
Литий фтористый LiF
Теплофизические свойства лития фтористого приведены в табл.
[0.1. Значения теплоемкости приведены поданным [29], значения
fP — поданным [16], [35], значения теплопроводности — подан-
р [16, 43].
Таблица 1.10.1
Теллофизические свойства лития фтористого LiF
¥к p. кг/м'* a* IO6. К ’ Дж/(кг-К) К Вт/(м-К) а-106, м!/с
"у 100 2642 15.2 485 70 55
8 120 2639 23,3 674 52 29
f 150 2633 25.1 926 36.5 15
|2°° 2622 28,1 1261 23,2 7,0
Bs50 2611 30,8 1491 17,2 4,4
1эоо 2598 34,0 1616 14,2 3,3
$400 2571 37.5 1788 — —.
^Б00 2540 41,4 1900 9,5 2,0
f «00 2507 45.8 1988 — —
я-700 2471 50,7 2067 — —
£во° 2432 56,1 2140 6,4 1,2
iooo 2390 61,9 2211 — —.
tiooo 2344 68,2 2282 4,3 0.8
ft 100 2294 75,0 2352 — —
/122 2283 76,6 2367 3,0 0,6
|U22 1 — — 2460 — —
Калий фтористый KF
В области температур 298... 1131 К теплоемкость KF описыва-
я уравнением
S. с = 0,8309 + 0,2237- 10-3Т — 0,4832-10’Т~г [кДж/(кг-К)].
-Теплоемкость жидкого KF С=1210 Дж/(кг-К).
г Теплоемкость калия фтористого KF |29|
7, К Дж/(кг-К) 7, К Дж/(кг-К)
4 100 . 544 700 . . 978
200 . . , 778 800 ... . . 1002
300 . . ... 844 900 . . . 1026
5 400 . . . 890 1000 . . . 1050
500 . . . 923 1100 . 1073
% 600 . . 952 1131 . 1080
^Среднее значение КТР в области температур 273... 352 К со-
ЧЙляет 33,3-Ю~ВК~ 1 [35].--^^
.^Теплопроводность X равна 7,0 Вт/(м-К) при Т=273 К и
4Вт/(м-К) при температуре плавления [43].
Кальцин фтористый CaF2
Таблица 1.10.2
Теплофизическке свойства кальция фтористого CaF2
т. к Р. кг/м‘‘ а-106, К С. Дж/(кг-К) х. Вт/(м»К1 и -10®, №/с
100 3208 7.52 367 40 34
120 3206 9.85 474 — —
150 3203 12,5 596 — —
200 3197 15.6 728 17 7.3
250 3189 17.7 803 — —
300 3180 18.8 862 12 4,4
400 3161 20.6 959 10 3.3
500 3141 22.5 988 9.4 3.0
600 3119 24,4 1004 — —
700 3095 26,5 1023 — —
800 3070 28.6 1055 —* —
900 3042 30.9 1103 — —
1000 3013 33,3 1169 6.1 1.7
1100 2982 35.8 1187 — —
1200 2949 38.4 1321 — —
1300 — — 1394 — —
1400 — — 1958 — —
1424 — — 2271 — —
1424 — — 1768 — —
1500 — — 1606 2.7 0.6
1600 — — 1561 __ —
1691 1653 1.8 0.4
Теплофизические свойства кальция фтористого приведены в
табл. 1.10.2. Значения теплоемкости приведены по данным |29|
Теплоемкость жидкого CaF2 С=1268 Дж/(кг-К). Значения КТР
приведены по данным [17, 49|, значения теплопроводности — по
данным [20, 43).
Барий фтористый BaF2
Теплофизические свойства бария фтористого приведены в табл
1.10.3. Значения теплоемкости приведены по данным [29]. В области
температур 298,15 . . . 1240 К теплоемкость BaF2 описывается урав-
нением
с = 0.3666 + 0,17014-Ю-’Г- 0.10341-10’Г-2 [кДж/(кг-К)].
В области температур 7=1240... 1480 К с=0,719 кДж/(кг-К);
в области температур 7= 1480... 1641 К с=0.736 кДж/(кг-К).
70
Таблица 1.10.3
Теплофнзические свойства бария фтористого BaF?
В г- к р. кг/м” а-10‘. К с. Дж/(кг-К) К Вт/(м-К) а-10“. м2/с
Ж 100 4937 9,9 251 — —
120 4933 11,8 284 — —
| 150 4928 13,9 325 — —
' 200 4917 16,1 376 — —
. 250 4904 17,5 393 12,3 6,4
. 300 4891 18,0 406 11,9 6,0
1 400 4865 18,3 428 11,1 5,3
‘ 500 4838 18,7 448 10,4 4,8
* 600 4811 19.0 466 9,6 4,3
Г 800 4755 — 501 8,0 3,4
; looo 4699 — 536 6,5 2,6
‘ 1200 4641 — 570 5,0 1,9
Теплоемкость жидкого BaF2 при Т> 1641 К с=0,599 кДж/(кг-К).
[ В справочнике [35] приведено среднее значение КТР а= 18,4X
К10-6К-1 в области температур 7=273 ... 573 К, а в работе [17]
1 (риведеиы значения КТР при Т<270 К. В книге [43] приведены
иачеиия теплопроводности BaF2: при 7=273,15 К 1=12,1 Вт/(м-К)
I при температуре плавления (7=1573 К) ^=2,1 Вт/(м-К).
L В табл. 1.10.3 приведены значения к, полученные линейной ин-
ичрполяцией данных [43].
Свинец фтористый PbF2
Теплоемкость жидкого PbF2 с=444,5 Дж/(кг-К).
Теплоемкость свинца фтористого PbF2 129|
т. к Дж/(кг-К) г. к Дж/(кг
300 . . 295 716 . 610
400 . . 309 800 446
500 324 900 376
583 . . 337 1000 . 378
583 . . 334 11(И> 415
600 . 373 1103 . . . 416
700 . 562 1103 . .• . . . . 444,5
716 . . ... 610
К»
71
Таблица 1.Ц
1-11. ХЛОРИДЫ
Основные характеристики
Вещество Молеку- лярная . масса Р Плотность р. кг/м3, яри 7 = 293,15 К Температура плавлении 7„. К Теплота плавления кДж/кг Температура кипения г.„. К Теплота испарения при кипении ЛАцсп, кДж/кг
LiCI 42.394 2070 [481 883 |29| 466 [29| 1653 [48| 4563- [31]
KCI 74.5513 1989 [48] 1044 [29| 353 [29| 1773 [48] 2180 [301
NICI, 129,62 3550 [311 1274 [30| — — 1562** [30J
* Теплота возгонки при 7=883 К.
** Теплота возгонки при 7=1260 К.
Литий хлористый LiCI
По данным [35] среднее значение КТР LiCI в области темпера-
тур 273 ... 352 К а=40,6- 10~6К_| Нами проведены измерения
теплопроводности уплотненной смеси порошков, содержащей по
массе 46 % LiCI и 54 % KCI. Пористость исследованных образ-
цов составляла 4 %. Значение теплопроводности пористого образ-
ца при 7=300 К >.=(3,95 ±0,08) Вт/(м-К), а после пересчета по
формуле Оделевского иа нулевую пористость 1 = 4,3 Вт/(м-К).
Теплоемкость лития хлористого LiCI 129J
7, К Дж/(кг-К)
100 . .655
200 . . 1018
300 . . . 1134
400 . 1214
500 . . 1275
7, К Дж/(кг-К)
600 . 1330
700 . . 1381
800 . . . 1430
883 . 1470
883 ... 1491
Калий хлористый КО
Теплофизические свойства квлия хлористого приведены в табл.
1.11.1. Значения теплоемкости приведены по данным [29, 30, 35|,
значения КТР получены графическим сглаживанием справочных
данных [16, 35], значения теплопроводности приведены для моно-
кристаллического KCI по справочным данным [20, 43].
72
У
Таблица 1.11.1
Теплофизнческне свойства калия хлористого КС!
* т, к Р. кг/м3 а-10“. К Дж/ (кг-К) к. Вт/(м-К) а- 10е. м!/с
’ 100 2024 25,4 527 28 26
120 2021 26.5 564 — —
150 2018 30.8 606 — —
200 2009 33,5 649 14 11
250 1998 35,4 669 — —
300 1987 37,0 689 10 7,3
/ 400 1965 40.3 711 — —
500 1940 43.3 730 8,0 2,9
600 1914 46.4 750 — —
V 700 1887 49,6 768 — —
я 800 1858 52,7 794 5,1 3,5
С 900 1828 55,9 823 — —-
В-loco 1797 59,0 859 3.2 2,0
р|О44 1783 — 877 — —
1044 — — 966 — —
i
; Нами проведены измерения теплопроводности уплотненных по-
JOuikob KCI при температуре 7=300 К на образцах с пористостью,
равной 2,5 %. Экспериментальное значение теплопроводности со-
ставляет 6,07 Вт/(м-К), а после пересчета на нулевую пористость
(•=6,3 Вт/(м-К)
Никель хлористый NiCh
В справочнике [30] приведены значения теплоемкости никеля
хлористого при низких температурах. Нами проведены измерения
Теплоемкости уплотненных порошков NiCk в области температур
312 . . 673 К и теплопроводности при 7 = 300 К. Пористость иссле-
дованных образцов составляла 5,3 %. Экспериментальное значение
Теплопроводности при этой пористости Х=1,57 Вт/(м-К), а после
пересчета на нулевую пористость Х= 1,7 Вт/(м-К).
Теплоемкость никеля хлористого NiCh
7. К с, Дж/(кг-К) 7. \ с, Дж/(кг-К)
г loo . 372 400 618
150 483 500 . 624
200 ... 531 600 628
300 . .602 700 . . ... 632
4
73
Основные характеристики
Аммоний иодистый NH,J
Нами проведены измерения КТР, теплоемкости и теплопровод-
яости уплотненных порошков аммония йодистого. Содержание при
несем в исследованном веществе — не более 1 %.
Измерения КТР проведены в области температур 289 . . 366 К.
результаты измерений аппроксимированы уравнением
а-106 = 10,5 + 0,97 ЮТ1к lL
Измерения теплоемкости проведены в области температур 312 . . .
..636 К. Результаты измерений аппроксимированы уравнением
с=3504-0.55 Т [Дж/(кг-К)|
При 7=611 . . .623 К начинается разложение вещества с вы-
делением черного дыма. Измерения проведены на двух образцах
Снижение массы первого образца после нагрева до температуры
i 636 К составило 7,9 %. Второй образец после нагрева до температу-
ры 648 К обуглился и вытек из измерительной ячейки.
1 Измерения теплопроводности проведены на образцах с коэффи
циентамн уплотнения Ку = 0,982 . . . 0,985.
! Пересчет на нулевую пористость по формуле Оделевского (1.1)
! дает А, =(0.72 + 0,03) ВтДм-К).
Теплофизические свойства NH«J приведены в табл. 1.12.1.
I Табл и ца 1.12.1
Теолофизическне свойства аммония йодистого NH,J
т, к р. кг/м{ а-106, К-1 с, Дж/(кг-К) к, Вт/(м-К) а-106. м2/с
300 2512 39,6 515 0,72 0,56
350 24964 44,5 542 —
400 2479 49,3 570 —
450 598
500 — — 625 —
550 — — 652 —
600 — — (J80 —
Свинец иодистый PbJ2
В справочнике [30] приведено уравнение для теплоемкости PbJ2
в области температур 273 . 648 К
с = 169,6+ 2,66-10-2 7 [Дж/(кг-К)].
75
Нами проведены измерения КТР, теплоемкости и теплопровод,
ности уплотненных порошков йодистого свинца. Содержание приме,
сей в исследованном веществе — не более 1 %.
Измерения КТР проведены в области температур 287. . . 326 К.
Среднее значение КТР а = (28,9±2,6)- 10-6K_|.
Таблица 1.12.2
Теплофизические свойства свинца йодистого Pbjy
т. к Р. кг/м а-106. К-1 Дж/(кг К) К Вт/(м-К) а- 106, м2/с
300 6160 28,9 178 0,375 0,34
350 — 28,9 179 — —
400 — — 180 — —
500 — — 183 — —
600 — — 186 — —
Измерения теплоемкости проведены в области температур 312 . ..
. .. 673 К. Результаты измерений хорошо согласуются с уравнением,
приведенным в работе [30].
Измерения теплопроводности проведены при Г=300 К на образ-
цах с коэффициентами уплотнения Ку=0,867 . . . 0,868. Пересчет на
нулевую пористость по формуле Оделевского (1.1) дает ?., =
= 0,375 Вт/(м-К).
Теплофизнческие свойства нодистого свинца приведены в табл.
1.12.2.
1.13. НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Азид натрия NaN3
Нами проведены измерения КТР, теплоемкости и теплопров!
ности уплотненных порошков азида натрия. Содержание примел
в исследованном веществе — не бОлее 2 %.
Измерения КТР проведены в области температур 130. . . 4401
В области температур 130 .. . 293 К результаты измерений аппв
ксимированы уравнением
а-106 = — 8,6 + 0,3897 — 0,574-Ю-’ГЧк-1].
При 7=293 К КТР скачком уменьшается на Да = 10- 106К’»]
при более высоких температурах вплоть до 7 = 440. К сохрани
постоянное значение а=(43,9±2,1)-10_6K-’.
Измерения теплоемкости проведены в области температур 312
. .. 512 К. Результаты измерений аппроксимированы уравнение
с = 794 + 1,2947(Дж/(кг-К)].
Экстраполяция полученной зависимости к 7 = 298,15 К дает р
зультат, совпадающий с приведенным в справочнике [28] значение
теплоемкости с=(1179±10) Дж/(кг-К).
Измерения теплопроводности проведены на образцах с коэфф
циентом уплотнения ду=0,90. Пересчет результатов измерений п|
7=300Кна нулевую пористость по формуле Оделевского (1.1) да
к, =(2.09±0,13) Вт/(м-К).
Температурная зависимость теплопроводности в области 7=
= 180... 360 К после пересчета иа нулевую пористость и соглас
вания с данными при 7=300 К описана уравнением
X = 2,914 - 0,274 • 102 7 [Вт/(м • К)1.
Т а б .л ица |Ji
Теплофизнческне свойства азида натрия NaNa
7. К Р. , кг/мл а- 10\ К ' Дж/(кг*К) X, Вт/(м-К) а -106, м2/с
150 1903 36.8 — 2,50 —
200 1891 46,6 — 2,37 —
250 1877 52.8 — 2,23 —
293 1864 56.1 — — —
293 1864 46 1173 2.П 0,97
300 1862 45 1182 2.09 0,95
350 1850 44 1247 1,95 0,85
400 1838 44 1312 1,82 0,75
450 1826 44 1376 — —
500 — — 1441 — —
Сглаженные значения теплофнзических характеристик азида!
натрия приведены в табл. 1.13.1. Значения плотности вычислены!
по данным о КТР исходя из значения р=1864 кг/м3 при 7 = 293 К-
78
Сурьма сернистая Sb2S3
В справочнике [17] приведено среднее значение КТР Sb s
области температур 573 . . . 773 К а,— 17- 106К‘. В справочнике
[241 приведено уравнение для теплоемкости в области температур
973 • - 821 К.
с = 298,3 + 0,163 Т [Дж/(кг • К)] -
В справочнике [20] приведены значения теплопроводности моно-
кристаллических и поликристаллических образцов сурьмы серни-
стой в области температур 100 ... 400 К:
т, к А-монокристал. Вт/(м-К> ^лоликркстал. Вт/(м-К)
100. . .. . . . 3,5. . 2,7
150. . . 3,0. . . 2,0
200. 2,8. . . . . 1.8
250. 2,9. . . 1,9
300. . . 3,0. . 2.0
400. . . . 4,0. . , . 2,5
Нами проведены измерения КТР, теплоемкости и теплопровод-
ности на образцах, изготовленных прессованием порошка сурьмы
сернистой. Содержание примесей в исследованном веществе —
не более 2,5 %.
Измерения КТР проведены в области температур 190 ... 380 К.
Результаты измерений аппроксимированы уравнением
а-106 = 9,62 + 1,025-10 27 lK~’]
Экстраполяция полученной зависимости к 7=673 К дает резуль-
тат, отличающийся от значения, приведенного в работе [17], на 3 %.
Измерения теплоемкости проведены в области температур 160 ...
.. . 673 К на образце с К,=0,80. Результаты измерений хорошо
согласуются с расчетом по уравнению работы [24] в области Т—
=200 .. . 500 К. При Г>500 К наблюдалось резкое уменьшение
эффективной теплоемкости, вызванное, по-видимому, окислением
образца. Уменьшение теплоемкости наблюдалось и при повторных
измерениях. Зависимость эффективной теплоемкости от температу-
ры в области 7=512... 673 К может быть представлена уравне-
нием
с>ф = 937 - 1,0827[Дж/(кг-К)].
Количество теплоты экзотермического эффекта, вычисленное по
разности теплоемкостей иеокисленного и окисляющегося образца,
определяется уравнением
ДЯ == 163,8 — 0,6397 + 0,623-10’3 Г [кДж/кг]
и имеет следующие значения при различных температурах:
Т, К ДЯ,
. кДж/кг
512,9 . О
550 . . 0,9
600 ........................... 4.7
79
650 . 11,7
700 21.8
750 35,0
800 51,3
850 . 70,8
857,65 . . 74.0
Измерения Теплопроводности при 7 = 300 К проведены на
разцах с коэффициентами уплотнения К.у=0,787 . .. 0,845, Tei
Таблица |.
Теллофизические свойстве сурьмы сернистой SbySs
7. К Р. кг/м‘ а-10е, К ' с, Дж/(кг-К) к, Вт/(м-К) а-106. мг1
150 4665 10,0 317 0,64 0,44 1
200 4657 11,5 330 0,62 0,40 1
250 4649 12,3 340 0,60 0,38 1
300 4640 12.7 347 0,59 0,37 1
350 4631 13,2 356 0,59 0,36 1
400 4622 13,7 364 0,59 0,35 1
450 4612 14,2 372 0,60 0,35 I
500 4602 14.8 380 0.61 0,35 1
550 4592 15,3 388(347)* 0,63 0,35 (0,40*1
600 4581 15,8 396(280*) 0,66 0,36(0.51*1
650 4570 16,3 404(236*) 0,69 0,38(0,64*1
700 4559 16,8 412(180*) 0.73 0,39(0,89*1
* Значения для окисляющегося образца.
проводность изменялась от 0,393 до 0.500 Вт/(м-К). Пересчет Э1
периментальных данных на нулевую пористость по формуле Oj
невского (11) дает X,=(0,592 ±0,047) Вт/(м-К). Температуря
зависимость теплопроводности исследована на образцах с Ку = 0,
н области Г= 173 ... 673 К После пересчета на нулевую пористо!
И согласования с данными при 7=300 К результаты описаны ypi
пением
X = 0,757 - 0,937s Ю 37 + 0.1291 10 5Т‘(Вт/(м-К)|.
Сглаженные значения геплофизических характеристик суры
сернистой приведены в табл. 1.13.2
Цирконий углеродистый ZrC
В справочнике (15] приведены значения КТР карбида циркон!
в области температур 200. . . 1300 К. теплопроводности в облас!
температур 200 . . . 400 К и теплоемкости в области температ)
200 . . . 3000 К- В области 7 = 300 . . . 3000 К теплоемкость мож!
быть описана уравнением
с = 443 +.0,057[Дж/(кг-К)].
80
Нами проведены измерения теплоемкости уплотненного порошка
карбида циркония в области температур 198. . . 673 К- Содержа-
ние примесей в исследованном веществе — не более 1,2 %. В области
температур 200 . . . 500 К результаты измерений аппроксимированы
уравнением
с = 317,4 + 0,2667 [Дж/(кг-К)].
При 7=300 К значение теплоемкости в справочнике [15] на
14,9 % выше, а в справочнике [28] на 7,5 % ниже нашего резуль-
тата.
При 7>540 К наблюдается резкое уменьшение эффективной
теплоемкости, свидетельствующее о начале окисления исследуемого
вещества. Зависимость эффективной теплоемкости от температуры
в области 7 = 537... 673 К может быть представлена уравнением
с,ф = 2306 - 3,4387 [Дж/(кг-К)1.
Количество теплоты экзотермического эффекта, вычислеииое по
разности теплоемкостей неокисленного и окисляющегося образца,
определяется уравнением
Д// = 534,0 — 1,9897 + 1,852-10'3 Т2 [кДж/кг]
и составляет 49,2 кДж/кг при 7= 700 К.
Теплофизические свойства карбида циркония приведены в табл.
1.13.3. Значения теплопроводности и КТР приведены по данным
[15]. Значения теплоемкости приведены по результатам наших из-
мерений. Плотность при различных температурах вычислена по
данным о КТР исходя из значения р = 6700 кг/м3 при 7 = 300 К.
Таблица 1.13.3
Теллофизические свойства циркония углеродистого ZrC
т, к Р. кг/м’ а-106. К ' Дж/(кг-К) X, Вт/(м-К) а -106. м2/с
200 6712 5.3 371 26 10,4
250 — — 384 — —
<300 6700 6,5 397 20 7.5
350 — — 410 — —
400 6686 7,5 424 18 6.3
450 — — 437 — —
500 6670 8.4 450 — —
550 — — 464(415*) — —
600 6652 9.2 477(244*) — —
650 — — 490(72*) — —
700 6633 10,0 504 (-100*) — —
* Значения для окисляющегося образца-
81
Криолит Na3AIF6
Теплоемкость криолита Na3AIF6 (29|
Т, К с, Дж/(кг-К) Т, К с, Дж/(кг-К)
100. . 473 838. . 1400
200. . 852 838. 1304
300 1030 900. 1324
400. 1116 1000 . 1355
500. 1187 1100 . 1387
600. 1253 1200 1419
700. 1316 1286 1446
800. 1377 1286 . . 1862
Аммоний щавелевокислый, кислый NH4HC2O4
Нами проведены измерения теплоемкости, теплопроводности и
КТР уплотненных порошков NH4HC2O4 на образцах с плотностью
р=1230 кг/м3.
Теплопроводность исследованных образцов при /’=300 К состав-
ляет Ь=(0,845 ± 0,023) Вт/(м-К).
Измерения теплоемкости проведены в области температур 148 ...
. . . 348 К. Результаты измерений аппроксимированы уравнением
с = 0,882 + 0,2043-10 2 7 !кДж/(кг-К)1.
Измерения КТР проведены в области температур 179.. . 345 К
Результаты измерений аппроксимированы уравнением
а-106= — 85,8 + 0,3468 Т(К-1].
При Т=247 температурная зависимость КТР проходит через
нулевое значение.
Таблица 1.13.4
Коэффициент теплового расширения и теплоемкость аммонии
щавелевокислого, кислого NH4HC2O4
т, к а -106, К~‘ с, Дж/(кг-К)
150 — 1189
200 -16,4 1291
250 0.9 1393
300 18,2 1495
350 35.6 1597
Сглаженные значения КТР и теплоемкости NH4HC2O4 приведены
в табл. 1.13.4.
82
Окончание табл. 1 J4
84
Антрацен СнНю
В справочниках [30,50] приведены данные о теплоемкости антра-
цена при температурах 298, 323 373, 423 К
По данным Дяминова Р. С., теплопроводность X антрацена при
р=300 К составляет 0,477 Вт/(м-К)-
В работе [51] проведены исследования плотности жидкого ан-
трацена в области температур 490. . . 558 К- Результаты измерений
аппроксимированы уравнением
р„= 1253—0,3557-0,466-10'3 Т2 [кг/м3]. (114)
Нами проведены исследования теплофизических свойств антра-
цена каменноугольного сырого (ГОСТ 1720—76) с массовой долей
антрацена не менее 30 % и антрацена технического обогащенного
(ТУ 14-6-175- 80) с массовой долей антрацена не менее 93 %.
На образцах, изготовленных из обеих марок антрацена, про-
ведены измерения КТР, теплоемкости и теплопроводности.
Результаты измерений теплоемкости антрацена по ГОСТ 1720—76
а области температур 173...423 К аппроксимированы уравнением
£ = 333+0,7647 ±0.618-10“’ Т2 [Дж/(кг-К)] (1.15)
В области температур 411 ... 462 К теплоемкость возрастает бо-
лее резко:
с = 26215-127,877+0,1659Т2 [Дж/(кг • К)],
а при температурах 473 .. . 498 К эффективная теплоемкость имеет
аномально высокие значения, что связано с плавлением антрацена.
Температура начала плавления антрацена по ГОСТ 1720- 76 7,;., ~
~470 К почти на 20 К ниже литературных данных [31, 33] о тем-
пературе плавления чистого антрацена Теплоемкость жидкого ан-
трацена в области температур 511 .. .573 К составляет (2085 +
±180) Дж/(кг-К). Количество теплоты плавления антрацена, вы-
численное по результатам измерений теплоемкости в области тем-
ператур 462 ... 511 К. составляет 106 кДж/кг, что в 1.5 раза ниже
литературных данных.
Расчет количества теплоты плавления в области температур 423...
-. . 548 К даст более близкое к литературным данным значение =
= 154 2 кДж/кг.
Максимальное отклонение результатов измерений теплоемкости
от литературных данных [30, 50] составляет 9,3 % при 7=423 К.
Результаты измерений теплоемкости антрацена по ТУ 14-6-175—80.
в области температур 148...473 К аппроксимированы урав-
нением
г= 171,3 + 2.1757+ 0,2507-10 2 Т2 |Дж/(кг- К)] (1.16)
Вычисленные по уравнению (1.16) значения теплоемкости ниже
Результатов для антрацена по ГОСТ 1720 76 на 4 ... 6 % в об-
ласти низких и умеренных температур и на 19 % при температуре
85
Таблица 1.14.2
плавления. Максимальное отклонение от данных [50] составля.
13,6 % при 7=323 К.
Результаты измерений КТР антрацена по ГОСТ 1720 76 в
ласти температур 170. . 350 К аппроксимированы уравнение,
а-106 = - 32,7 4- 0.4567[К”'].
КТР антрацена по ТУ 14 6-175—80 несколько нищ(
в области температур 160 . . 230 К
а-10®= 23 4- 0,1 /-[К1].
в области температур 290 . 350 К
ct-106 = — 139,5 4- 0,715[К '1,
в области температур 160 . . . 300 К
а-106 = 97,1 - 0,684 7 4-0,204/ЯК '1.
В области температур 170 .. . 400 К теплопроводность антраце
на по ГОСТ 1720 76 сохраняет постоянное значение X, =(0,30^
±0,03) Вт/(м-К). Измерения теплопроводности антрацена и
Таблица 1.14
Теилофизнческие свойства антрацена СнНк,
т. к Р. кг/м ’ а-106, К с, Дж/(кг-К) Вт/(м-К) а-106, M!/c
150 1279 38 554
200 1271 43 707 —
250 1262 53 872 — —
300 1250 75 1050 0.465 0,35
350 1233 111 1240 — —
400 1209 — 1442 — —
450 1180 1658 —
489.2 1153 1835 — —
489,2 972,6 — — —
500 964.0 —
550 922.8 —
ТУ 14-6-175--80 проведены при Г=300 К на образцах с коэффи
циентом уплотнения К,. = 0.94 Пересчет на нулевую пористость nt
формуле Оделевского (11) дает Х> =(0,465 ± 0,054) Вт/(м-К)
В табл. 1 14 1 приведены сглаженные значения теплофизическн'
характеристик антрацена. Значения плотности твердого антрацен-
при различных температурах рассчитаны по значению плотностг
р = 1250 кг/м‘ при Т = 300 К и данным о КТР. Плотность жидкое
антрацена вычислена по уравнению (1.14). 1
доцюфнзические свойства антрацена каменноугольного сырого (ГОСТ 1720 76)
~~ Т, К а 10е. К i. Дж/(кг-К) Z. Вт/(м-К1 а-106. м!/с
""" 150 38 587 0,30 0,40
200 58 733 0,30 0,32
250 78 910 0.30 0.26
300 104 1118 0,30 0.22
350 127 1357 0,30 0,18
400 — 1627 0,30 0.15
450 — 2272 — —
470 — 2763 — —
470 — 2085 — —
500 — 2085 — —
В табл. 1.14.2 приведены теплофизические свойства антрацена
каменноугольного сырого (ГОСТ 1720-76).
Бензойная кислота СтНвОг
Нами проведены измерения теплоемкости и КТР уплотненных
порошков бензойной кислоты в области температур 150... 350 К
и теплопроводности при Т—300 К на образцах с пористостью т =
=4,3 . . . 5,5 %. После пересчета на нулевую пористость по формуле
(1.1) теплопроводность бензойной кислоты составляет X, —
=0,236 Вт/(м-К).
Результаты измерений теплоемкости аппроксимированы уравне-
ниями:
в области температур 148.. . 248 К
с = 230 4- 3,3367 [Дж/(кг-К)|,
в области температур 248 . 348 К
с = 705,6 4- 1,42 Т [Дж/(кг К)].
При измерениях КТР наблюдалось различие между результа-
тами, полученными при нагреве и при охлаждении образца. Зна-
чения КТР, полученные при нагреве, аппроксимированы уравнением
а-106 = 22,5 4- 0,17.38Г(К '1
Таблица 1.14.3
Теплофизнческне свойства бензойной кислоты С-Н(.О,
7. К Р. кг/м“ а I06, К Дж/(кг-К) Вт/(м-К) с-106. м-'/с
150 1352 48,6 730 — —
200 1342 57,3 897
250 1329 66,0 1061 — —
300 1315 74.7 1132 0,236 0,16
350 1300 83,4 1203 — —
87
Зависимость КТР от температуры, полученная при охлажу
нии образца, качественно подобна температурной зависимости теп.
лоемкости и аппроксимирована двумя уравнениями:
при Т <233 К
а-106 =- 25.4 + 0.3793ИК 'I.
при 7 >233 К
а-106 = 10,8 + 0,224 ТЧК.' '1.
Сглаженные значения теплофизических характеристик бензой
ной кислоты приведены в табл. 1.14.3. Значения КТР и плотности
приведены по результатам, полученным при нагреве.
Гексахлорбеизол Cede
По данным Дяминова Р. С„ теплопроводность гексахлорбензола
при 7=300 К 7 = 0,232 Вт/(м-К).
Нами проведены измерения КТР, теплоемкости и теплопровод-
ности уплотненных порошков гексахлорбензола технического Со-
держание примесей в исследованном веществе не превышает 3 %.
Измерения КТР проведены в области температур 165 . . 375 К
Результаты измерений аппроксимированы уравнением
а-106 =8,1 + 0,201 7[К“'1.
Измерения теплоемкости проведены в области температур 173 ..
...573 К. Данные о теплоемкости тнердого гексахлорбензола ап
проксимированы уравнением
с = 375 + 1,057 [Дж/(кг-К)1.
Теплоемкость жидкости составляет с=1050 Дж/(кг-К) По
результатам измерений теплоемкости определено значение теплоты
плавления гексахлорбензола АЛ,,.,= 122 кДж/кг.
Измерения теплопроводности проведены при 7 = 300 К на об-
разце с коэффициентом уплотнения К, =0,85.
Пересчет на нулевую пористость по формуле Оделевского
(1.1) дает /^ = 0,296 Вт/(м-К).
Сглаженные значения теплофизических характеристик гекса-
хлорбензола приведены в табл. 1.14.4
ан
Таблица 1.14.4
Теплофизические свойства гексахлорбензола С<,('.1„
Г. К р- кг/м а-10е. К ' Дж/(кг«К) Вт/(м-К) а- 10б, м2/с
"150 2092 38,2 520 — —
дао 2079 48,3 570 — —
S50 2062 58,4 620 — —
эоо 2043 68,4 670 0,296 0,216
J50 2020 78,4 720 — —
«0 1995 88,5 780 — —
450 1967 98,6 830 — —
|№ 1937 108.6 900 — —
0 — — 1050 — —
Гексахлорэтан С2С1е
По данным Дяминова Р. С., теплопроводность А гексахлорэтана
составляет 0,243 Вт/(м-К) при 7=300 К.
Нами проведены измерения теплоемкости и КТР образцов, из-
готовленных из гексахлорэтана дисперсного и гексахлорэтана грану-
лированного. Содержание примесей в исследованном веществе —
п более 1 %.
Результаты измерений теплоемкости гексахлорэтана дисперсного
1 области температур 200 . .. 320 К аппроксимированы уравнением
с = 94 + 2,2067 [Дж/(кг-К)1.
Теплоемкость гексахлорэтана гранулированного в этой же об-
ласти температур на 5 ... 10 % выше с = 184-2,733 Т (Дж/(кг- К) |.
Суммарное количество теплоты полиморфных превращений при
Г=316.75 К и 7 = 344,25 К составляет (39±3) кДж/кг. Для куби
ческой модификации в области температур 423 . . . 448 К получено
значение теплоемкости с = (898 ±43) Дж/(кг-К). После нагрева до
температуры 450 К и охлаждения до комнатной температуры образ-
цы растрескивались, покрывались кристаллами в виде инея. Масса
Уменьшалась на 20 %. При измерениях теплоемкость относили к
оервоначальной массе вещества. Поэтому теплоемкость высоко-
температурной модификации гексахлорэтана может быть выше ука-
занного значения и достигать 1000 . . 1100 Дж/(кг-К)
Результаты измерений КТР гексахлорэтана дисперсного аппрок-
симированы следующими уравнениями:
в области температур 189 . . . 262 К
а-106 = — 21,5 4-0,49787(К '1;
в области температур 260 . .. 316.75 К
а-106 = —628,5 4- 2,8337[К
в области температур 316,75 . . 344,25 К
а-106 = -951 4- 3,6367(К
89
г, к
Результаты измерений КТР гексахлорэтана гранулированное
области температур 212 . .. 316.75 К аппроксимированы уравнен^
«х- 10е = 319,2 — 2,97 + 0,8629-10-2Г[К’ '1.
Значения КТР гранулированного н дисперсного гексахлорэта
совпадают в области температур 290. . .316,75 К, а прн 7<
данные для гранулированного гексахлорэтана выше. Максималц
различие составляет 34 % при 7 = 250 К.
Таблица
Теплофнзические свойства гексахлорэтана C..CI.,
т. к 1». кг/м а-10е. К-1 С, Дж/(кг-К) X. Bt/(m-K) «• I06, м2/с
175 2172 66 460
200 2160 78 520 —
225 2146 91 590 —
250 2131 103 650 —
275 2111 150 710
300 2082 215 770 0.243 0,152
316,75 2057 275 790 — —
приведены сглаженные значения теплофизически ,
М>,2Я
«9
40
•>
яо
В табл. 1.14.5
характеристик низкотемпературной модификации гекса'хлорэтаи
Дифеннл С|2Ню
Подробные данные о теплофизических свойствах жидкого дифе
нила приведены в справочнике [52].
В справочнике [30] приведены значения теплоемкости дифенш
при температурах 298,15; 303,15; 323,15 и 333.15 К.
Нами получено значение теплопроводности дифенила при Т=
=300 К Х=(0,30 + 0,02) Вт/(м-К) и исследованы КТР дифенилам
области температур 150 ... 300 К и теплоемкость в области темпе
ратур 148 ... 473 К.
В области температур 150 .. . 255 К данные о КТР аппроксимв'
рованы уравнением 1
а-106 = 27,5 + 0,217 7 [К-1]. ,
При более высоких температурах КТР определяется уравнений !
а-Ю6 = —197,4 + 1,1037 [К-1]. [
Значения теплоемкости твердого дифенила аппроксимирован!
уравнением 1
с = 683,5 — 0,29927 + 0,8813-10 -Т! [Дж/(кг-К)].
Данные справочника [30] на 7.5.. . 8,4 % ниже, а справочник1
[50] на 10,9 % выше полученных результатов. ।
Справочные данные о плотности твердого дифенила [31, 33|
[ле приведения с помощью данных о КТР к одинаковой темпера-
~ различаются на 1,2 %.
Среднее значение плотности при 7 = 300 К составляет 1162 кг/м3,
этому значению плотности и температурной зависимости КТР
итаны значения плотности твердого дифенила.
Таблица 1.14.6
Теллофизические свойства дифенила CisHril
И»
«О
I»
р. кг/м u-IO6, К ' Дж/(кг-К| X, Вт/(м-К| с-10’. м’/с
1206 60.0 837 — —
1195 70,9 976 — —-
1181 81.7 1160 — -—
1162 133,5 1387 0.30 1.9
1139 180,1 1613 — —
995 — 1758 0.139 0,793
948 — 1936 0,130 0,708
908 — 2091 0,1225 0,645
866 — 2246 0,115 0.591
823 — 2401 0.1075 0,544
775 — 2556 0,100 0.505
721 — 2710 0.0935 0.479
значения теплофизических характеристик дифенила
♦^Сглаженные . . .
приведены в табл. 1.14.6. Данные для жидкого дифенила приве-
дены по справочнику [52].
Дициандиамид C2H.N4
gfB справочнике [30] приведено среднее значение теплоемкости
Жиандиамина в области температур 273 ... 477 К £=1909 Дж/(кг-К).
По данным [28], теплоемкость при 7=298,15 К с =
#•1674 Дж/(кг-К).
•.Нами проведены измерения КТР в области температур 293...
..323 К и теплопроводности при 7= 300 К на образцах, изготов-
Мвных уплотнением порошка дициандиамида технического. Со-
Мржаиие примесей в исследоваииом веществе — не более 2 %.
Среднее значение КТР в области температур 7 = 293 .. . 323 К
«==(44,5 + 3,7). 10“6К-1.
е Измерения теплопроводности проведены на образцах с коэффи-
циентами уплотнения Ку = 0,94 ... 0,95. Пересчет на нулевую по-
ристость по формуле Оделевского (1.1) дает X, =0,85+0,01 Вт/(м-К).
Значение температуропроводности при 7=300 К и нулевой по-
РНстости а=0.37-10 й м2/с.
Меламин C.3H6N6
Нами проведены исследования теплоемкости уплотненных по-
ртков меламина в области температур 148... 598 К и КТР в
91
90
области температур 183... 376 К- Результаты измерений тепло?,,
кости аппроксимированы уравнением
£ = 345,24-2,705 Т (Дж/(кг-К)|.
Значения КТР имеют постоянное значение а = 33-10 аК~' rip,
Г<270 К, а при более высоких температурах аппроксимирован,,
уравнениями:
в области 270 К<7"<310 К
а-106=-257,254-1,075 Т [К-1]:
в области 7^310 К
а-106 = — 72,8 4- 0,487[К.-1].
Измерения теплопроводности меламина проведены при Г = 300 К на образцах с пористостью т=18...22%. После пересчета ц нулевую пористость по формуле (1.1) теплопроводность м,ел амина составляет 7.1=0,566 Вт/(м-К). Сглаженные значения теплофизических характеристик меламина приведены в табл. 1.14.7. Т а б л и на 1.147
Теплофизнческне свойства меламина СзН6М(1
Т. К * кг/м4 а-10'. К С. Дж/(кг-К) к Вт/(м-К> «-10е, м2Д
150 1595 33 751 — —
200 1587 33 886 — —
250 1579 33 1021 —
300 1569 65 1157 0,566 0,31
350 1550 95 1291 — —
400 1525 119 1427 —
450 — 1562 — —
500 — — 1698 — —
550 — — 1833 — —
600 — — 1968 — —
Мелем C6H6Nio
Нами проведены измерения теплоемкости и КТР уплотненных
порошков мелема по ТУ 113-03-463—79, запрессованных при дав-
лении р=100 МПа. Плотность исследованных образцов составляла
1250 кг/м3. Содержание мелема в исследованном веществе—не
менее 80 %, содержание меламина — не более 19 %, содержание
влаги — не более 1 %.
Измерения теплоемкости проведены в области температур [48 .
. . . 348 К. Результаты измерений аппроксимированы уравнением
с = 371,4 4- 2,357 7 [Дж/(кг - К)1.
Измерения КТР проведены в области температур 167 .. .341 К
Результаты измерений аппроксимированы уравнением
92
а-106 = 12,4 + 0.953-10"' Т [К '].
Сглаженные значения теплоемкости и КТР мелема приведены
втабл. 1.14.8.
Таблица 1.14.8
Коэффициент теплового расширения
и теплоемкость мелема CeHeNio
т. к а-106. К с. Дж/(кг-К)
150 26,7 725
200 31,5 843
250 36.3 961
300 41.0 1079
350 45,8 1196
Мочевина CH«ON2
В справочниках |30, 33, 50] приведены значения теплоемкости
мочевины при температурах 293,15. . . 298,15 К.
Нами проведены измерения КТР, теплоемкости и теплопро-
водности уплотненных порошков мочевины. Содержание примесей
а исследованном веществе не превышает 1 %.
Измерения теплоемкости проведены в области температур 373 .. .
...461 К. После нагрева до температуры 460 К мочевина разлага
ется. Вычисленное из данных о теплоемкости значение теплоты плав
ления мочевины Д/гпл = 266 кДж/кг удовлетворительно согласуется
со справочными данными. Результаты измерений теплоемкости
вместе с данными [30, 33, 50] аппроксимированы уравнением
с = 472 + 3,2637 [Дж/(кг-К)]
Измерения КТР проведены в области температур 150.. . 350 К-
Результаты измерений аппроксимированы уравнением
а-106 = 31,7 — 0,2482 7 + 0,1413-10~272 1к'].
Измерения теплопроводности при 7= 300 К проведены на образ-
цах с коэффициентами уплотнения Ку = 0,864 . . 0,966. Пересчет на
нулевую пористость по формуле Оделевского (1.1) дает X., =(0.917 +
±0,030) Вт/(м-К). На образце с Ку = 0,938 проведены измерения
теплопроводности в области температур от 7=173 К до темпера-
*Уры плавления.
После пересчета на нулевую пористость и согласования с дан-
ными при 7 = 300 К результаты измерений описаны уравнением
/.= 1,241 - 0,1666- 1О 27' +0,1948- Ю ’Г [Вт/(м-К)].
Сглаженные значения теплофизических характеристик мочевины
Приведены в табл. 1.14.9.
9.4
теплоемкост!
Т абл нца 1.14.10
Теплофмзические свойства нафталина СщН-
7. I' р. кг/м' 4-105 К Дж/(кг-К) X. Вт/(м• и -1(7. м2/с
loo 1212 35.0 500 — —
120 1209 37.5 570 — —
150 1205 41.4 650 — —
200 1197 52,4 816 0.42 0.43
J50 1185 82,6 1018 0,38 0.32
300 1166 131.9 1255 0,34 0.23
350 1137 200.4 1528 0,30 0.17
353,41 1135 205,8 1548 0.30 0.17
353.41 978.8 — 1755 — —
400 939.1 — 1898 — —
450 8<Wi.8 — _ 2051 —
4» ИЬЗ.о — 2174 — —
Таблица 1,цг
Тевлофизические свойства мочевины CH4ON2
т. К Р- кг/м 1-10". к с, Дж/(кг - Ki 'к. Вт/(м-К( Q- I06. М2/с
150 1367 26 — 1.035 —
200 1360 39 1124 0.986 0,65
250 1347 58 1288 0.947 0,55
300 1333 84 1451 0.917 0.47
350 1313 118 1614 0.897 0.42
400 128G 160 1777 0,887 0.39
Нафталин СщНв
(30, 35, 50] приведены данные о
Сглаженные значения теплофизнческих свойств нафталина при-
щены в табл. 1.14.10. Теплофизические свойства твердого наф-
плнна приведены по результатам наших измерений. Теплоемкость
жидкого нафталина вычислена по уравнению
сжнд = 669 + 3,0727[Дж/(кг-К)1.
полученному иа основании данных справочника (30]
Плотность жидкого нафталина вычислена по уравнению
Р»на = 1282,3 - 0,866937 + 0,2312-10~4Г [кг/мэ],
полученному на основании совместной обработки данных (51, 53].
В справочниках
нафталина в области температур 15 . . . 463 К. В справочнике [3[
приведено значение теплопроводности нафталина при 7=273,151
>. = 0.377 Вт/(м-К). По данным Дяминова Р. С., теплопровс:
ность прессованных образцов нафталина прн нулевой пористости
7=300 К составляет 0,406 Вт/(м-К).
В работах [31, 53] приведены данные о плотности жидкого наг
талина в области температур 355 . . . 490 К.
Нами проведены измерения КТР, теплоемкости и теплопрово;
ности уплотненных порошков нафталина коксохимического (ГОС
16106- 70).
Измерения КТР проведены в области температур 130 3201
Результаты измерений аппроксимированы уравнением
а-106= 123,2-1,12 7+0,383-10 2 Т2 [К '].
Измерения теплоемкости проведены в области температур 140
. . . 350 К- Результаты измерений аппроксимированы уравнение. Пентаэритрит CsHisO.
с = 363,9 + 0,8387 + 0,7109-10-272(Дж/(кг-К)1. . Нами проведены исследования КТР и теплоемкости уплотнен-
Максимальные отклонения справочных данных от результатных порошков пентаэритрита. Плотность исследованных образцов
наших измерений составляют: 8,2 % при 7=343 К для данных (^составляла 1300 кг/м .
и —7,1 % при 7=150 К для данных [50]. Измерения КТР проведены в области температур 154 ... 385 К.
Измерения теплопроводности проведены на образцах с коэфф’"«ультаты измерений аппроксимированы уравнениями:
циентами уплотнения К, =0,935 .0,961. Пересчет на нулетФФи Т<260 К
пористость по формуле Оделевского (1.1) дает Ли =(0,342я
±0,007) Вт/(м-К). Температурная зависимость теплопроводно^'
нафталина исследована в области 7 = 200 ... 350 К. После переспи 7^ 260 К
та на нулевую пористость и согласования с данными при 7=300
результаты описаны уравнением
X = 0,575 - 0.774-10 ' 7[Вт/(м-К)].
Данные Дяминова Р. С. при 7 = 300 К выше наших резуль1’
тов на 18,7 %, данные справочника (30] при 7=273,15 К вЬ1
нашего значения на 3.8 %.
а-106 = - 12,4 + 0,2177-[К“'];
а-106 = — 90,3 + 0,517Т1К-1]
Измерения теплоемкости проведены в области температур 148 .. .
•623 К. В области температур 148. . . 448 К результаты измере-
М аппроксимированы уравнением
с = — 236,6 + 3,944 7[Дж/(кг-К)].
(117)
95
>4
При более высоких температурах наблюдается эндоэффецт |
обусловленный сублимацией и плавлением пентаэритрита. Суммар
ный эндоэффект, вычисленный по отклонению экспериментальны)
значений в области температур 448. . . 598 К от рассчитанных
уравнению (1 17), составляет 488 кДж/кг. При нагреве выше темпе
ратуры 600 К наблюдается экзоэффект, обусловленный разложение^
пентаэритрита.
Таблица 1.14 11
Коэффициент теплоаого расширения
и теплоемкость пентаэритрита CsHiXh
т. к а- 10". К ' л Дж/(кг-К)
150 20 568
200 31 765
250 42 962
300 65 1159
350 91 1357
400 116 1554
450 — 1751
Сглаженные значения КТР и теплоемкости пентаэритрита при
ведены в табл. 1.14.11.
Салициловая кислота СгНсО.ч
Нами проведены измерения теплопровод». ти, КТР и теплоем-
кости порошков салициловой кислоты. Содержание примесей в иссле
дованном веществе не превышает 0.5 %.
Измерения теплопроводности при Т=300 К проведены на об-
разцах с коэффициентами уплотнения Ку = 0,849 . . . 0,944. Пересчет
экспериментальных данных на нулевую пористость по формуле Оде-
левского (1.1) дает X, = (0,243 + 0,006) Вт/(м-К).
Измерения КТР проведены в области температур 118 . . .389 К
на образце, запрессованном при давлении р = 300 МПа. Экспери-
ментальные данные имели большой разброс, что вызвано зависи-
мостью КТР от первоначальной деформации частиц образца. При
нагреве выше комнатной температуры происходило необратимое уве-
личение размеров образца. После нагрева до Т = 319 К и охлаж-
дения до комнатной температуры диаметр образца увеличился на
0,23 %, высота на 0,30 %, объем — на 0,77 %. После нагрева до
Т = 389 К увеличение диаметра, высоты и объема образца составили
0,32; 0,71 и 1,35% соответственно, а масса образца уменьшилась
на 1,1 %.
Сглаженные значения КТР аппроксимированы уравнением
а-106 = 20,0-0,4519-10 'Т -ф 0,8215- 10“3r 1К '].
Измерения теплоемкости проведены в области температур 148 .
. . . 573 К Температурная зависимость удельной теплоемкости твер-
дой салициловой кислоты аппроксимирована уравнением
с = 716,9 - 0,6741 Т + 0,699- 10“2r [Дж/(кг-К)1
Теплоемкость жидкой салициловой кислоты составляет сКил =
₽(2760±80) Дж/(кг-К). При Тх500 К начинается испарение
Салициловой кислоты. По результатам измерений теплоемкости вы
числено количество теплоты плавления ЛЛ,,.,=(177,7 + 7,7) кДж/кг и
теплоты испарения А/гмсп = (344 ±33) кДж/кг.
Сглаженные значения теплофизнческих характеристик салици-
ловой кислоты приведены в табл. 1.14.12.
Таблица 1 14.12
Теллофизические свойства салициловой кислоты C.-Ht.Oi
т, к Р. KI /м‘ а-10". К ' Дж/(кг-К) X. Вт/(м-К) U- 10Ь. м’/с
120 1480 27 737 —
150 1476 32 773 —
200 1468 44 862 —
250 1456 60 985 — —
300 1441 84 1144 0.243 0.15
350 1420 105 1337 — —
400 1395 133 1566 — —
432 1376 154 1730
432 — — 2760
450 — — 2760 —
Сахароза С12Н22ОП
Нами проведены измерения КТР, теплоемкости и теплопровод-
ности образцов сахарозы, изготовленных уплотнением порошка при
давлениях 50, 100 н 150 МПа. Содержание примесей в исследован-
ном веществе не превышает 1 %.
Измерения КТР проведены в области температур 195,2...
... 370,7 К. Результаты измерений аппроксимированы уравнением
а-106 = 0.1271k-'].
Измерения теплоемкости проведены в области температур 133 .. .
.. . 448 К на образце массой 1,7054 г и в области температур 298 . . .
... 573 К на образце массой 0,5868 г. После нагрева до температуры
448 К масса образца практически не изменилась, после нагрева до
температуры 573 К уменьшение массы составило 51,5 %. Результаты
измерений теплоемкости в области температур 133 . . . 459 К аппрок
симированы уравнением
с = 571,4 — 0,21337 4- 0,7298-10 |Дж/(кг-К)].
В области температур 461 . . . 523 К наблюдается эндоэффект,
вызванный плавлением сахарозы. Теплота эндоэффекта составляет
Д/г,|л = 237 кДж/кг. При 7>523 К начинается интенсивное разло-
жение сахарозы, сопровождающееся экзоэффектом.
Измерения теплопроводности проведены при 7=300 К на об-
разцах с коэффициентами уплотнения /С =0,81 ...0,84. Пересчет
Таблица 1.14. Ц
Теплофизнческне свойства сахаразы С12Н22Оц
т. к Р. кг/м3 а -106, К Дж/(кг-К> X. Вт/(м-К) А-106, м2/с
120 — — 651 — —
150 — — 704 — —
200 1600 24 821 — —
250 1594 30 974 —
300 1586 36 1164 0.46 0.25
350 1577 42 1391 — —
400 1566 48 1654 — —
450 1554 — 1953 — —
экспериментальных данных на нулевую пористость по формуле Оде-
левского (1.1) дает М =(0,461 ±0,048) Вт/(м-К).
Сглаженные значения теплофизнческих характеристик сахарозы
приведены в табл. 1.14.13.
Тиомочевина CH.N2S
Нами проведены измерения КТР, теплоемкости и теплопровод-
ности уплотненных порошков тиомочевииы технической. Содержа-
ние тиомочевииы в исследованном веществе — не менее 93 %.
Измерения КТР проведены в области температур 150___ 370 К.
Результаты измерений аппроксимированы уравнением
a- I06 = 49,9 - 0,3951 Т + 0,1419- 10“2r к-1].
Измерения теплоемкости проведены в области температур 148 ...
... 511 К- После нагрева до 500 К тномочевииа вспенивается н вы-
текает нз измерительной ячейки. Результаты измерений теплоем-
кости аппроксимированы уравнениями:
в области температур 148. . .273 К
с = -582,1 + 13,5197 — 0,26114-10Г(Дж/(кг-К)|:
в области температур 273 ... 448 К
с = 443,3 + 2,6397 [Дж/(кг- К)]
Из данных об эффективной теплоемкости вычислено количество
теплоты плавления тиомочевииы Дй„л = 277 кДж/кг.
Измерения теплопроводности при 7 = 300 К проведены на образ-
цах с коэффициентами уплотнения Ку=0,894 ... 0,973. Пересчет
на нулевую пористость по формуле Оделевского (1.1) дает Zi =
=(0,647 ±0,016) Вт/(м-К).
На образце с К, = 0.964 были проведены измерения теплопро-
водности в области температур от 173 К до температуры плавления.
После пересчета на нулевую пористость и согласования с данными
при 7=300 К температурная зависимость теплопроводности описана
уравнением
ча
I
к = 0,804 - 0,52- IO-3 T [Вт/(м - К)].
Сглаженные значения теплофнзических характеристик тиомоче-
(«ны приведены в табл. 1.14.14.
Таблица 1.14.14
Теллофизические свойства ткомочсвниы CH.N-.S
Г. к Р- . кг/м‘ а-10", К ' Дж/(кг«К) К Вт/(м- К) и-106, №/с
~~ 150 1426 22,5 858 0,726 0,59
200 1421 27.6 1077 0.700 0,46
250 1413 39.8 1166 0.674 0,41
300 1403 59,0 1235 0,647 0,37
350 1388 85.4 1367 0,621 0,33
400 1367 118,9 1499 0,595 0,29
450 1339 — 1631 0,569 0,26
* Флороглюцин СбНцОз
Нами проведены исследования теплофизических свойств уплот-
ненных порошков флороглюцина, запрессованных при давлениях
100 и 200 МПа.
Значение плотности флороглюцина р=1370 кг/м3 получено
Экстраполяцией зависимости плотности от давления к 1/р=0.
р = А — В/р.
Измерения КТР проведены в области температур 186.. . 316 К-
Результаты измерений аппроксимированы уравнением
। а-106 = 24,4 + 0,492-IO-'tIK-1].
* Измерения теплоемкости проведены в области температур 160 .
... 473 К В области температур 380 . . . 440 К наблюдался эндо-
Эффект, вызванный испарением содержащейся в образцах влаги.
Содержание влаги в исследованных образцах составляло 1,4 .. .
--.2,4 %.
Т а б л и ц а 1.14.15
Теплофнзические свойства флороглюцина СбНбОз
Т, К Р. кг/м* а-106. К"' Дж/(кг-К) Л, Вт/(м-К| u-106, м2/с
150 — — 623 — —
200 — 34,2 810 — —
250 — 36,7 997 — —
300 1370 39,1 1184 0.636 0.39
350 — 41.6 1371 — —
400 — — 1558 — —
450 — — 1745 — —
492 — — 1902 — —
99
После пересчета на сухое вещество результаты измерений тепло,
емкости описаны уравнением
с = 61,6 + 3,74 Т [Дж/(кг • К)].
Измерения теплопроводности проведены при 7=300 К на образ,
цах с коэффициентами уплотнения /(, = 0,92 ... 0,98. Пересчет на
нулевую пористость по формуле (1.1) дает Л1=(0.636±0.011) Вт/(м-К).
Теплофизические свойства флороглюцина приведены в табл
1.14.15.
Другие органические вещества
В табл. 1.14.16 приведены теплофизические свойства восьми
органических веществ при 7= 300 К-
Таблица 1.14.16
Теплофизические свойства органических веществ при 7 — 300 К
Вещество р. а кг/мл А, Вт/(м-К) с, Дж/(кг-К) о-Ю6. м2/с
Карборан С2Н|2Вю 1000 0,145 1720 0,08
Малеиновый ангидрид С4Н2О3 1480 0,339 1020 0,23
Нитрогуанидин CH4O2N4 1720 0,486 1200 0,23
Резинат кальция (С2сН29О2) 2Са 1200 0,155 1480 0,09
Стеарат цинка (Ci8H35O2)2Zn 1080 0,247 1640 0,14
Уротропин CeHisNj 1330 0.492 1470 0,25
Фталевый ангидрид СвНфОз 1520 0.368 1010 0,24
Эфир Гарпиуса С3Н5О3(С20Н29ОН)3 1100 0.120 1570 0,07
Значения теплопроводности и плотности приведены по данным
Дяминова Р. С. Значения теплоемкости рассчитаны по аддитив-
ной формуле на основании данных справочника [30].
1.15. СМОЛЫ
Т о б л и ц а 1.15
Основные характеристики
Вещество Плотность р, кг/м:‘ при Т=293.15 К Температура размягчения Тр. К Температура плавления Тпл, К Теплота плавления Чйпл, кДж/кг
Шеллак 1150 350. .358 (54| 383...388 J54J —
Канифоль 1100 327...353 J54] 373...413 [54] 66,2 [33J
Смола СФ-0112А 1250 — 393... 423* 66
Смола СФ-342А 1200 — 348... 398* 57
Смола СФ-340А 1200 — 363..383* 58
Меламиноформальде гидная смола 1450 .1560 [541 — — 87
* Температура каплепадення.
100
Шеллак
Рассчитанное по химической формуле CieH^Os значение тепло-
jUKOcth при 7=298 К составляет с=1470 Дж/(кг-К)
По данным Дяминова Р. С., теплопроводность шеллака при
f==300 К имеет значение >. = 0,222 Вт/(м-К) и температуропровод
вость составляет а = 0.13-10-6 м2/с.
В справочнике |50] приведены зависимости объемного расшире-
ния шеллака:
в области температур t 0 ... 46 °C
V=VO(1-f-2,73-10 " >4-0,39-10 6 /2); (1.18)
в области температур 46 . . 100 “С
V = Vjl 4- 13,1-10 " (/— 46) 4- 0,62-10 ' (/— 46)2]. (1.19)
Рассчитанные с помощью уравнений (1.18) и (1.19) значения
линейного КТР шеллака составляют:
ирн 7>319,15 К (/>46°C)
а = 433-10-6К
при температурах ниже 319,15 К
а-106 = 28,5 4- 0,22971k '].
Канифоль
Рассчитанное по химической формуле С20Н30О2 значение тепло-
емкости канифоли при 7 = 298 К составляет с=1565 Дж/(кг-К).
В работе [33] приведено значение теплопроводности канифоли
£=0,13 Вт/(м-К). По данным Дяминова Р. С., теплопроводность
уплотненных порошков канифоли при 7 = 300 К и нулевой пори-
стости составляет 0,164 Вт/(м-К).
В справочнике [50] приведены уравнения для объемного расши-
рения канифоли:
в области температур 0 ... 34 °C
К=¥о(1 4-2.21 • 104/4-0,31 -10-6/2); (1.20)
в области температур 34 . . . 150 °C
V=V34[1 4-7.4-10 "(/-34)4-5,91-10 ь(/-34)2]. (1.21)
Рассчитанные по уравнениям (1.20) и (1.21) значения линейно-
го КТР можно описать уравнениями:
а-106=22,04-0,1897 1К~’), 7=273.15. . .307,15 К; (1.22)
а-106= -689,44-3,0887 1К '1 7=307,15. . .423,15 К. (1.23)
Нами проведены измерения теплоемкости и КТР канифоли сос-
новой (ГОСТ 19113—84) с температурой размягчения не ниже
68 °C.
Измерения теплоемкости порошка канифоли проведены в области
Температур 198 . . . 523 К
пи
Результаты измерений описаны уравнением c=740-|-2,0f
Дж/(кг-К).
Эндоэффект, вызванный плавлением канифоли, составляет
около 60 кДж/кг. При 7>470 К наблюдается экзоэффект, свя
данный с разложением порошка канифоли.
Измерения КТР проведены в области температур 78 . . . 311 Ц
на образце, запрессованном при давлении р = 200 МПа. Результату
измерений в области 7 = 78 298 К аппроксимированы уравпе.
ннем
а-10®=—31,4-[- 1,22457 — 0,64447^+0,11935-10 <7’[К '[,
В области температур 298. 311 К КТР канифоли резко воз-
растает:
а-10 = -3650+ 12,57 [к '1
Полученные результаты удовлетворительно согласуются с дан
ными справочника [50] об объемном расширении канифоли.
Сглаженные значения теплофизических характеристик канифоли
приведены в табл. 1.15.1.
Таблица 1.15 I
Тенлофнзнчсскне свойства канифоли
т, к 1». t кг/м а-1(7. К 1 Дж/(кг-К) Л. Вт/(м-К) а-106, м7с
100 1134 38 — — —
120 1132 43 — — —
150 1127 48 — -— —
200 1119 51 1140 — —
250 1109 59 1240 — —
300 1098 100 1340 0.164 0.11
350 1062 351 1440 —
400 993 546 1540 — —
450 906 700 1640 — —
Смола фенол-формальдегидная СФ-0112А
По данным Дяминова Р. С., теплопроводность уплотненных
порошков смолы СФ-0112A при 7=300 К и нулевой пористости со-
ставляет Л = 0,205 Вт/(м-К)
Нами проведены измерения теплоемкости и КТР уплотненных
порошков смолы.
Измерения теплоемкости проведены в области температур 173 . .
. . . 473 К. Результаты измерений в области температур 173 . .. 323 К
аппроксимированы уравнением
с = 129,4 + 3,87 [Дж/ (кг • К)].
При нагреве до температуры выше 323 К наблюдается эндоэффект,
величина которого составляет (66±4) кДж/кг, а при нагреве де
температуры выше 423 К наблюдался экзоэффект, обусловленный
|(й
разложением смолы. В смесях смолы с оксидом магния экзоэф-
фект наблюдался при более высоких температурах, что позволило
оценить теплоемкосгь расплавленной смолы: в области температур
f=423 . . 473 К с=(2000±100) Дж/(кг-К).
Измерения КТР проведены в области температур 84 . . . 327 К
яа образцах, запрессованных при давлениях 100 . .390 МПа, и
на образцах, расплавленных после прессования при 7 = 403 К- Ре-
зультаты измерений КТР прессованных и плавленых образцов
хорошо согласуются между собой в области низких температур.
При 7 > 300 К наблюдалась значительная усадка прессованных
образцов. После термостатирования при 7= 323 . 333 К значения
КТР прессованных образцов удовлетворительно согласуются с дан-
ными для плавленых образцов. Результаты измерений КТР в об-
ласти температур 100 . ..300 К аппроксимированы уравнением
а-106= 14.1+0,1047 1К“'],
а при более высоких температурах КТР смолы резко возрастает.
Сглаженные значения теплофизнческих характеристик смолы
СФ-0112А приведены в табл. 1.15.2.
Таблица 1.15.2
Теплофизические свойства смолы СФ-0112А
т. к а -Юь. К с, Дж/(кг-К1 а. Вт/(м-К1 п • кг-, м7с
100 24.5 — —
150 29.7 700 —
200 34,9 890 —
250 40,1 1080 — —
300 45.3 1270 0,205 0.13
310 51 — — —
320 80 — — —
325 160 1365 — •—
350 — 1460 —
400 — 1650 — —
450 2000 — —
500 2000
Смола фенол-формальдегидная СФ-342А
По данным Дяминова Р. С., теплопроводность смолы при
Т=300 К составляет 7 = 0,142 Вт/(м-К).
По результатам наших измерений, теплопроводность уплот-
ненных порошков смолы после пересчета на плотность р= 1200 кг/м ’
составляет ?.=(0,173±0,011) Вт/(м’К).
Нами проведены измерения теплоемкости и КТР уплотненных
Порошков смолы СФ-342А.
Измерения теплоемкости проведены в области температур 198 . . .
•-.462 К. Результаты измерений аппроксимированы уравнением
с=350 + 2,257[Дж/(кг.К)]. (1 -24)
НВ
В области температур 348 . . . 420 К наблюдался эидоэффект,
связанный с плавлением смолы. Теплота эндоэффекта составляет
57 кДж/кг. При 7>420 К наблюдался экзоэффект. Количество те.
плоты экзоэффекта, вычисленной по разности эффективной теплоем.
кости и рассчитанной по уравнению (1.24), составляет при 7=462 р
96 кДж/кг.
Измерения КТР проведены в области температур 202 . . 321 К
В области Т = 200 . 300 К результаты измерений аппроксимирован^
уравнением
а-1(0=0,44-0,1737 1к
Ирн более высоких температурах наблюдалось аномальное ежа
тие и расширение исследованных образцов. Это связано с тем,
что в резольиых смолах, к которым относится смола СФ-342А,
даже при комнатной температуре продолжают протекать реакции
конденсации, обусловливающие повышение средней молекулярной
массы олигомеров и изменение плотности смолы [54]. Результаты из-
мерений, полученные на стабилизированных образцах (после дли
тельного термостатиронания при 7=323 К), свидетельствуют о рез
ком возрастании КТР при 7>300 К.
Таблица 1.15.3
Теплофизические свойства смолы СФ-342А
т, к а - К)', К ' с, Дж/(кг-К) А, Вт/(м-К) а-10ь, мг/с
2(Х) 35.0 800 —
250 43,7 913 —
300 52.3 1025 0.17 0.14
310 109 —
320 197 —
350 1138
400 1250
Сглаженные значения теплофизических характеристик смолы
СФ 342А приведены в табл. 1.15.3.
Смола феиол-формальдегидиая СФ-340А
Нами проведены измерения теплоемкости и КТР уплотненны*
порошков смолы СФ 340А на образцах плотностью 1140 кг/м1.
Результаты измерений теплоемкости в области температур
148... 323 К аппроксимированы уравнением
с=202,24-3,3327 [Дж/(кг-К)]. (1.251
В области температур 323 . . . 423 К наблюдался эндоэффект-
величина которого, вычисленная по отклонению эксперименталь'
104
йух значений теплоемкости от рассчитанных по уравнению (1.25),
^оставила 58 кДж/кг После нагрева до температуры 423 К образец
вспенивался и вытекал из измерительной ячейки.
Измерения КТР проведены в области температур 203 . . . 330 К.
При Г <295 К результаты измерений аппроксимированы уравне-
нием
а-10" = 8,8 + (),1677'[К
При 7 > 295 К КТР смолы резко возрастает:
а-10= —1864.2 + 6,5287'1к 'I
Сглаженные значения КТР и гсплоемкости смолы СФ-34ОА при
ведены в табл. 1.15.4.
I а б л и ц a l .ln.4
Коэффициент тепливши расширения и теплоемкость
смолы СФ-340А
Г. к q-КГ, К i, Дж/ 1кг- К. |
150 702
2ПП 12.1 869
250 50,5 1035
295 58
300 94 1202
325 251 1285
350 420* 1368*
* Экстраполированные значения.
Смола меламино-формальдегидная
Нами проведены измерения теплоемкости и КТР уплотненных
порошков мелзмнио-формальдегидной смолы. Плотность несло
Дованиых обратной составила 1300 кг/м’
Результаты измерений теплоемкости в области температур
148 298 К аппроксимированы уравнением
с— 155-J-3.886Г | Дж/ (кг К) [.
(1.26)
В области температур 323. 123 К наблюдался энло'эффект.
Величина которого, вычисленная по отклонению эксперименталь-
ных значений ген.юемкости от рассчитанных по уравнению т 1.261,
составила ^7 кДж кг После нагрева до температуры 423 К обра
3Сц вспенивается н вытекает из измерительной ячейки
Измерения КТР проведены в обтасти температур 203 .41(1 К
Результаты измерений аппроксимированы уравнениями:
при 7X284 К
а-106 = — 14,6 + 0,2387" [КГ1];
при 7’>284 К
а-106=- 1136,2+4,1887’ |К '].
Сглаженные значения КТР и теплоемкости меламино-формаль.
дегиднон смолы приведены в табл. 1.15.5
Таблица 1.15.5
Коэффициент теплового расширения и теплоемкость
мел амино-форм альдегидной смолы
т. к а -ИЛ К ' с. Дж/(кг-К)
150 — 738
20(1 33 932
250 45 1126
284 53 —
300 120 1321
325 225 1418
350 329* 1515*
400 1709*
* Экстраполированные значения.
ИМ.
Поливинилхлорид | CHL -C.HC1- |„
Теплофизические свойства поливинилхлорида представлены e
табл 1 16.1 Значения теплоемкости и теплопроводности приведены
по данным |56|. Значения КТР приведены на основании данных
[55] об обьемном расширении поливинилхлорида: 0 = 21-10 'К
при температуре ниже температуры стеклования и 0 = 52-10 ’К
при температуре выше температуры стеклования Температурная
зависимости плотности вычислена ио данным о КТР, исходя нз зна-
чения р—1400 кг/м при 7=300 К
Данные |56| с максимальным отклонением 3 % для теплоем-
кости' и 2 % для теплопроводности можно аппроксимировать ли
нейными зависимостями:
с=156.2 + 2.646Г[Дж/(кг-К)]. 1=100. . .355 К:
с=— 127-(-4.467 [Дж/(кг-К)[, 7=355. . 420 К
Л=0,110-|-0,2-10 '7[Вт/(м-К)] Т= 100. . 355 К
Таблица 116!
Теплофизические свойства поливинилхлорида
т. к [’ кг/м а-10ь. К : Дж/(К1 -К1 Вт/(м-К) «-10*’, м’/с
150 1444 558 0.140 0,174
200 1429 70 675 0.151 0,157
250 1415 70 797 0.163 0.145
300 1400 70 953 0.170 0.127
350 1385 70 1139 0.172 0.109
360 1380 173 1475
400 1351 173 1663
420 1337 173 1741
Полиизобутилеи [ -С(СНз)г—СН2[„
В справочнике [56] приведены данные о теплоемкости и тепло-
проводности полиизобутилена в области температур 100 . . . 380 К-
Нами проведены исследования теплофизических свойств поли-
изобутилена высокомолекулярного (ГОСТ 13303 -67) марки П-200
молекулярной массой р ~ 200 000
Измерения теплопроводности проведены при 7 = 300 К Полу-
ченное значение /. = (0.13 + 0 01) Вт/ (м - К) удовлетворительно согла-
суется с литературными данными [56|.
Измерения теплоемкости проведены в области температур 211
. . . 523 К. Максимальные отклонения от данных [56] нс превыша-
ют 10 %. Результаты наших измерений совместно с данными [56]
при Т >200 К описаны уравнением
с = 508 + 4 6857 [Дж/(кг-К)]
' Теплоемкость полиизобутилеиа при температуре ниже темпе-
ратуры стеклования, по данным [56], также имеет линейный харак-
jep и может быть представлена уравнением
с= -48,34-6,0577- [Дж/(кг К)], 7=100. . .200 К
Измерения КТР проведены в области температур 225. . . 325 К.
результаты измерений аппроксимированы уравнением
а-106= —254-1,117 [К~'1 -
Сглаженные значения теплофизических характеристик полиизо-
бутилена приведены в табл. 1.16.2. Значения плотности при различ-
ных температурах вычислены по данным КТР, исходя из значе-
ния р = 930 кг/мя при 7 = 298 К.
Таблица 1.16.2
Теплофнзические свойства полиизобутилеиа
т. к Р. кг/м! а-106. К Дж/(кг-К) X. Вт/(м-К) a -107, м2/с
100 — 552 0,134 2.40
120 — 681 0.134 1.95
150 — 860 0.134 1.54
200 1002 197 1420 0,134 0.94
250 969 252 1679 0,125 0.77
300 928 308 1914 0.121 0.68
350 883 364 2148 0.121 0,64
400 833 — 2382 0,122 0.61
450 — — 2616 ._ »
500 — — 2851 —
550 — — 3085 —
Политетрафторэтилен (фторопласт-4)
[-CF2-CF2-]„
В работе [57] приведены данные о теплоемкости фторопласта-4
до температуры 720 К. В справочнике [56] приведены данные о
теплоемкости в области температур 100 .. . 725 К и значения тепло
проводности в области температур 100. . .450 К В книге [58] при-
ведены данные о КТР в области температур 213 . . .583 К-
Нами проведены исследования теплоемкости и КТР различных
образцов фторопласта 4.
Измерения теплоемкости проведены в области температур 312 . . .
...673 К иа плавленом образце плотностью р = 2120 кг/м3 при
7=293 К. Максимальные отклонения результатов измерений от
Данных [56, 57] не превышают 5 %. Вычисленное по результатам
Измерений теплоемкости значение теплоты плавления Дйп.1 =
=31 5 кДж/кг удовлетворительно согласуется с данными [57]
Измерения КТР проведены на образцах, полученных прессова
Иием порошка фторопласта-4 (ГОСТ 10007—80) при давлениях от
34,3 до 461 МПа, и на плавленом образце плотностью 2120 кг/м3
в области температур 90 .. . 350 К
109
Рис. 1.7. Зависимость среднего КТР фторопласта-4 в обла-
сти температур 308 ... 348 К от давления и направления прессования:
/ — «и, 2 —
Зависимость плотности прессованных порошков фторопласта-4
от давления прессования р (МПа) при комнатной температуре ап-
проксимирована уравнением
р = 2256 —0,127-106р-' [кг/м3).
При температурах выше 300 К наблюдается большой разброс
и плохая воспроизводимость результатов измерений КТР. Это свя-
зано с тем, что при нагреве уплотненных порошков фторопласта-4
выше температуры, при которой частицы фторопласта-4 были де-
формированы, они частично восстанавливают свои первоначальные
размеры |58|.
В области температур 213 .. . 285 К среднее значение КТР фторо-
пласта 4 а=(93.0 ±2,6)-10 6К 1 и не зависит от давления прессова
ния и направления измерений. В области 7=285 . . . 308 К, охватыва
ющей фазовый переход, среднее значение КТР а = (194,3 + 8,3)Х
X 10 еК '.В области температур 308 . . . 348 К КТР фторопласта-4
сильно зависит от давления прессования, направления измерений, ре-
жима измерений (нагрев или охлаждение). Зависимость КТР от дав
ления прессования в направлениях параллельном (ссц) и перпендп
кулярном (aj оси усилия прессования показана на рис. 1.7. Отноше-
ние ац/cc, изменяется от 1,8 до 2,8. Результаты, приведенные на
рис. 1.7, получены при первом нагреве. При охлаждении, повторном
нагреве и охлаждении получены следующие значения КТР: <хц =
= (89,1 ±4.4)-10- 6К“а± =(71,3+3,6)- 10-6К“'.
В результате нагрева и последующего охлаждения происходит
необратимое изменение размеров образцов: удлинение в направлении
оси прессования и сужение в перпендикулярном направлении. Пое-
но
* нагрева прессованных образцов фторопласта-4 до температуры
J48 К и последующего охлаждения до комнатной температуры удли-
цение в направлении оси усилия прессования составляло в сред
цем 0.2 % и сужение в направлении, перпендикулярном оси прессо-
нниия, — 0.1 % первоначальной длины образца.
Температура фазового перехода, определенная по максималь
„ому значению КТР, составляет 291 К для прессованных образцов
и 294 К для плавленого образца плотностью р = 2120 кг/м .
По результатам измерений КТР плавленого образца темпера
iypa стеклования аморфной части фторонласта-4 составляет 148 К.
дичок КТР при температуре стеклования Aa= 11,4-10 ’К" '. Для
Прессованных образцов аномалии КТР, соответствующей стеклова
нею, не обнаружено.
Сглаженные значения теплофизических свойств фторопласта-4
с® степенью кристалличности, близкой к единице, приведены в
1»бл. 1 16.3. Значения КТР при Т^300 К приведены по результатам
йших измерений, а при Г>300 К по данным [58|. Значения
Плотности при различных температурах вычислены по данным о
<ГР, исходя из значения р = 2256 кг/м3 при 7 = 295 К Табличные
Значения теплоемкости получены усреднением наших результатов и
(Ьравочных данных [56, 57]. Значения теплопроводности приведены
if) данным [56|.
Таблица 1.16.3
Теплофизические свойства политетрафторэтилена
|т, к 1’. кг/м ‘ а-101', К с, Дж/(кг- К1 Вт/(м- К) о-10“. м*/с
1 100 2367 45 389 11.232 0.252
f 120 2360 49 457 0.237 0.220
i 150 2349 51,5 551 0,242 0.187
I 200 2329 62.5 694 0.255 0.158
; 250 2304 81 841 0,260 0.134
J 270 2291 НО 932 0,256 0.120
280 2283 145 1032 0.253 0.107
» 285 2276 211)
290 2266 425 0.240
295 2256 144 —
•300 2251 126 1000 0.241 0.107
* 350 2212 108 1025 0.250 0.110
400 2175 120 1100 0.251 0,105
450 2131 155 1185 0.251 0.099
500 2073 212 1300 —
550 2(М)6 228 1430
600 1937 244 1700
600 1577 - 1332
650 1467 — 1391 —
700 1457 — 1451 —
Плотность жидкого политетрафторэтилена рассчитана по урав-
нению
р = 2900— 2,205Т [кг/м31,
полученному на основании обработки приведенных в справочнике
[56] данных об удельных объемах жидкого фторопласта-4 в области
температур 603.5 . . . 645,5 К.
Политрифторхлорэтилен (фторопласт-3)
[-CF2-CFCl-]„
В справочнике [56] приведены данные о теплопроводности
политрнфторхлорэтилена в области температур 100 . . . 350 К, в рабо
те [57] — данные о теплоемкости до 7—325 К, в книге [58| — зна-
чения КТР фторопласта-3 в области температур 213 . . . 453 К- Нами
проведены измерения КТР уплотненных порошков фторопласта-3
(ГОСТ 13744—76) марки В в области температур 90 .. . 308 К.
Значения плотности порошков фторопласта 3 при комнатной
температуре, запрессованных при давлениях от 34,3 до 461 МПа,
аппроксимированы уравнением
р=2032 - 0,6392- 106р 1 +0,1285- 107р-2 [кг/м3].
Экстраполяция зависимости р(р) к 1/р=0 дает более низкое
значение плотности фторопласта-3 по сравнению с литературными
данными для монолитных образцов.
КТР прессованных порошков фторопласта-3 при нагреве выше
комнатной температуры зависит от давления прессования. Увели
чеиие размеров образца в направлении оси усилия прессования и
сужение в перпендикулярном направлении после термоциклирования
более значительно, чем у фторопласта-4. После нагрева до темпера-
туры 308 К и охлаждения до температуры 290 К остаточное относи-
тельное удлинение в направлении оси прессования составило 0,8
и 0,6 %, а сужение в перпендикулярном направлении после на-
грева до температуры 348 К и охлаждения до 290 К составило 0,35 и
0,75 % при давлениях прессования 34,3 и 229,4 МПа соответственно.
Исследование температурной зависимости КТР фторопласта-3
проведено на образце, запрессованном при давлении 235,4 МПа в
направлении оси прессования. Результаты измерений при 7 <293 К
аппроксимированы уравнением
а-106=31,26 — 0,5555-10 'Т + 0.6924 -Ю Т2 [К ']
При более высоких температурах наблюдалось резкое возрастание
КТР, вызванное частичным восстановлением первоначальных разме-
ров деформированных частиц фторопласта-3.
Значения теплофизических свойств фторопласта-3 приведены в
табл. 1.16.4. Значения теплоемкости приведены по данным [57].
теплопроводности — по данным [56]. КТР — по результатам наших
измерений и данным [58]. Значения плотности вычислены поданным
о КТР, исходя из значения р = 2032 кг/м3 при 7 — 293 К-
U2
Таблица 1.16.4
г
Теплофизические свойства политрифторхлорэтилена
7. К !’• кг/м а-10й. К с. Дж/(кг-К) Вт/(м-К) а. КГ. м-/с
^100 2091 32.6 350 0.105 0.143
120 2086 34.6 414 0.111 0.129
150 2080 38.5 500 0.120 0.115
200 2066 47.8 626 0.130 0,101
250 2049 60.6 743 0,138 (1.091
* 300 2028 76.9 859 0.144 0.083
#• 325 2016 86.3 919 0,146 0.079
i 325 2016 I0G 1174 0.146 0.062
I 35(1 2001 . 100 1260 0.147 0.058
I 400 1970 по —
1'450 1932 150 —
Полистирол | СН2 CH(CsHs)—]„
!. Теплопроводность X полистирола при нормальных условиях со-
Ивляет 0,093 Вт/ (м • К) [54]. Коэффициент объемного расширения
»=2-10 ’К 1 при температуре ниже температуры стеклования и
=6-10 ’К-| при температуре выше температуры стеклования,
ри температуре ниже температуры стеклования данные [56] о
плоемкостн полистирола атактического и полистирола изотактичес-
нх> совпадают и могут быть аппроксимированы уравнением
с= 1,7 + 4,0737 [Дж/(кг-К)], 7=150 К. . ,Т„ .
При температуре выше температуры стеклования данные [56] для
листирола атактического можно аппроксимировать уравнением
1с = 945,3+2,564Г[Дж/(кг-К)], Т=Т„. . .590 К . (1.27)
Температурная зависимость теплоемкости полистирола изо-
тического со степенью кристалличности 0,26 . . . 0,45 проходит
через максимум в области температур 484 . . . 512 К а при осталь-
Лх температурах удовлетворительно согласуется с уравнением
0.27). Величина эндоэффекта, вычисленная по отклонению дан-
ных [56] для теплоемкости полистирола изотактического от рассчи-
Внных по уравнению (1.27), составляет 26 кДж/кг.
Теплоемкость полистирола атактического [56|
ГК с. Дж/(кг-К)
100. . .454
120. - 521
150................... 625
Т. К с. Дж/(кг-К)
200. .805
250. И) 13
300..................1220
113
т. к с. Дж/(кг«К) 7. К <. Дж/(кг-|\|
34» . 1396 450. . 2098
380 1865 500. 2238
400- 192b 550 - . 2355
430. . 2013 590. 2454
Целлюлоза |СьН7Ог(ОНз)]„
Нами проведены исследования теплопроводности н КТР уплот-
ненных порошков целлюлозы и теплоемкости материалов с высо-
ким содержанием целлюлозы: фильтровальной бумаги, ваты,
уплотненных порошков целлюлозы.
Целлюлоза является высокогигроскопичным материалом, л ее
теплофизические свойства сильно зависят от содержания влащ
Уменьшение массы исследованных образцов после сушки в течение
нескольких часов при температуре 420 . . 430 К достигала 6 %.
Измерения теплопроводности проведены на образцах с естест-
венной влажностью и получены следующие результаты: 7 =
= 0,269 Вт/(м-К) при р=1090 кг/м3 и 7 = 0,286 Вт/(м-К) при
р=1176 кг/м3. Полагая, что содержание влаги в образцах состав-
ляет 6% и максимальная плотность целлюлозы р= 1610 кг/м', по-
лучим после пересчета экспериментальных данных по формуле (1.1)
на нулевую пористость и нулевую влажность 2.1 = 0,42 Вт/(м-К).
Измерения КТР проведены на двух образцах, запрессованных
при давлении 150 МПа. Образец № 1 перед измерениями не подвер-
гался каким-либо воздействиям, а образец № 2 перед измерениями
был выдержан в течение нескольких часов при температуре 420 ..
. . . 430 К. Размеры образцов целлюлозы зависят от содержания
влаги: при впитывании влаги образцы набухают, а при удалении
влаги образцы сжимаются. В связи с тем. что при измерениях КТР
одновременно изменялись и температура, и содержание влаги в
образце то наблюдался большой разброс экспериментальных дан
ных. Воспроизводимые значения КТР наблюдались при 7<273 К.
когда содержание влаги в образцах не изменялось. При 273 К< Т<
<295 К наблюдалось набухание, а при /’>295 К — усадка об
разцов
При измерениях теплоемкости целлюлозы наблюдался эндо-
эффект в области температур 373 . 498 К. Величина эпдоэффектв
соответствует теплоте испарения содержащейся в образце влаги.
При 7>500 К наблюдается резкое уменьшение теплоемкости, сви-
детельствующее о начале экзотермического разложения целлюлозы-
Результаты измерений теплоемкости предварительно высушен-
ных образцов, при исследовании которых эндоэффект не наблю-
дался, аппроксимированы уравнением
с = 350,3 + 3,37647 [Дж/(кг-К)], 7=133. . 498 К.
114
'IF
Т Сглаженные значения теплофизических характеристик сухой цел-
люлозы (содержание влаги менее 1 %) приведены в табл.
|.|6 5. Значения КТР получены экстраполяцией низкотемпературных
данных и соответствуют КТР целлюлозы при охлаждении.
Таблица 1.16.5
Теплофнзическне свойства целлюлозы
г. к Р- кг/м’ а-106. К с, Дж/(кг-К) Z. Вт/(м-К) U- to". м7с
150 857
200 35(47-) 1026
25(1 54(73*) 1194 —
300 1610 73(99*) 1363 0.42 0.19
| 350 — 1532 —
400 — 1701
| 450 1870 —
j 500 2039 —
* При естественном содержании влаги приблизительно 6 %.
Бутадиен-нитрильиый каучук СКН-40
Нами проведены измерения теплоемкости каучука СКН-40 в
[ласти температур 148 . . . 473 К При температуре ниже темпера-
гры стеклования в области Г 148... 248 К результаты аппрок-
|мированы уравнением
с=311,5-(-4,1447 |Дж/(кг-К)].
При температуре выше температуры стеклования в области
*=298 . 437 К результаты аппроксимированы уравнением
с= 1547-1-1,5377 [Дж/(кг-К)].
Отклонение значения теплоемкости [54] при 7 = 298 К от наших
1ниых составляет 1,7%.
! 1 Теплоемкость каучука СКН-40
Г. К с. Дж/(кг-К) т. к с. Дж/(кг-К)
i 150 . . 933 350. 2085
г 200. 1140 400 2162
1 250. 1347 450. 2238
t 300. 2008 500. 2315
Фторсодержащий каучук СКФ-32
Каучук СКФ-32 представляет собой каучукоподобный сополимер
•йНиленфторида с трифторхлорэтиленом Нами проведены измерения
Теплоемкости каучука СКФ-32 в области температур 148 . 473 К.
115
При температуре ниже температуры стеклования в области
= 148 . . . 248 К результаты аппроксимированы уравнением
с =152,64-3,224Т [Дж/(кг-К)].
При температуре выше температуры стеклования в области 7"^
= 298. . .473 К результаты аппроксимированы уравнением
с=9| 1,3+ 1,0627 [Дж/(кг-К)].
Теплоемкость каучука С КФ-32
т. к с, Дж/(кг-К) т. к Дж/(кг-К)
150 - 636 350 . 1283
200 . 797 400 1336
250 . 959 450 . 1389
300 .. . . . 1230 500 . . . 1442
¥
не
Основные характеристики
117
Нитрогликоль C2H4O6N2
Нами проведены измерения теплоемкости нитрогликоля в об-
ласти температур 198... 448 К. Результаты измерений теплоем-
кости жидкого нитрогликоля аппроксимированы уравнением
с = 863,4 + 1,9037 [Дж/(кг- К)]. (1.28)
Результаты экстраполяции уравнения (1.28) в область низких
температур хорошо согласуются с экспериментальными значениями
твердого нитрогликоля при температурах 198.. 211 К. В области
температур 211... 265 К зависимость эффективной теплоемкости от
температуры проходит через минимум. Величина экзоэффекта, вы-
численная по отклонению эффективных значений теплоемкости от
рассчитанных по уравнению (1.28), составляет 70 кДж/кг.
В области температур 265. . . 373 К эффективная теплоемкость
проходит через максимум, обусловленный теплотой плавления нитро-
гликоля. Вычисленнаи по отклонению эффективных значений тепло-
емкости от рассчитанных по уравнению (1.28) теплота плавления
нитрогликоля составляет 80 кДж/кг.
В примечаниях в книге [62| отмечается, что при температуре
ниже температуры плавления нитрогликоль может находиться в
различных состояниях: «полутвердом», скорость детонации в кото-
ром при Т = 233 К составляет 1000 . . . 3000 м/с, «твердом», скорость
детонации в котором при 7 = 203 К выше 8000 м/с. Как показывают
результаты наших измерений, переход нитрогликоля из «твердого»
состояния в «полутвердое» сопровождается экзоэффектом \Н=
= 70 кДж/кг.
Теплоемкость нмтрогликоля
Т, К с. Дж/(кг-К)
200 1244
250 . 1339
300 1434
350 1529
4(Ю . 1625
450 . 1720
473 . 1764
Гексоген СлНьОг^6
Нами проведены измерения теплоемкости гексогена в области
температур 148 . 448 К. Результаты измерений аппроксимирован^
уравнением
£=206,3 + 2,82757 [Дж/(кг-К)[. (1-29)
Приняв за начало отсчета энтальпии Л = 0 7 = 293,15 К. получим
из (1.29) уравнение для определения энтальпии твердого гексо-
гена
h = — 181.96 + 0,20637 + 0,14138- Ю'Т2 [кДж/кг].
118
Значения теплоемкости и энтальпии гексогена приведены в
табл- 1-17.1.
Таблица 1.17.1
Теплоемкость н энтальпия гексогена
т, к с, Дж/(кг-К) ft. кДж/кг
150 630 119,2
200 772 84,2
250 913 42,0
300 1055 7,2
350 1196 63,4
400 1337 126.7
450 1479 197,1
477,55 1557 239,0
Тротил CjHsOcNj
Нами проведены измерения теплоемкости тротила в области
температур 148 . . . 473 К- Результаты измерений теплоемкости твер-
дого тротила аппроксимированы уравнением
с = 309.3+2,5567 [Дж/(кг-К)], 7=148. . .354 К. (1-30)
По результатам наших измерений теплота плавления тротила
составляет АЛ1|Л = (120.1 ± 3,5) кДж/кг.
Для теплоемкости жидкого тротила получено уравнение
с=96,1+3,587 [Дж/(кг-К)], 7= 354. . .473 К- (131)
Проинтегрировав (1.30) и (1.31), получим уравнения для энталь-
пии тротила:
Л= -200,51 +0,30937 + 0,1278- 10 2Г [кДж/кг]. 7<354 К;
Л=—69,07 + 0,961-10"'7 + 0,179-10 272 [кДж/кг], 7^354 К.
Значения теплоемкости и энтальпии тротила приведены в
табл. 1.17.2.
Т а б л и ц а 1.17.2
Теплоемкость и энтальпия тротила
7. К с. Дж/(кг-К) ft. кДж/ki Т. к с, Дж/(кг-К) ft. кДж /кг
150 693 125.4 354 1363 189.3
200 821 87,5 400 1528 255.8
250 948 43,3 450 1707 336.7
300 1076 7.3 500 1886 426.5
350 1204 64.3 550 2065 525,3
354 1214 69,1 600 2244 633.0
608.15 2273 651.4
119
Поливинилнитрат
Clb СН
ONO,
В работе |64| приведены значения теплоемкое!и < = 1214 Дж'(к1-К,
и теплопроводности >.=0.153 Вт/(м-К) иоливинилпитрата при кол
ватной температуре. полученные на образцах плотностью 1500 ы м
Нами проведены измерения теплоемкости полнвнпилшпрата
в области температур 148. 423 К. Вблизи комнатной темперапрц
происходит структурное превращение, сопровождающееся скачком
теплоемкости поливиннлнитрата В области 7 = 148 287 К резх.п,
таты измерений аппроксимированы уравнением
с = 535+ 1.5377" |Дж/(кг-К) |.
а в области температур 323 . . 423 К
с— 10,7 + 4.1557 |Дж/ (кг - К) ]
Теплоемкость
7 К
150
2<Н)
250 .
.300
.«hi .
.350 .
400
450
ПОливинилнм грата
<•. Ък (кг-Ki
766
М2
919
99b
1257
1465
1673
1880
Приведенное в |64| значение теплоемкости согласуется с экстра
полицией высокотемпературной записимости теплоемкости к ком-
натной температуре.
1.18. НИТРОГЛИЦЕРИНОВЫЕ ПОРОХА
Основными компонентами нитроглицериновых порохов являнлся
нитроцеллюлоза 150 60%). нитроглицерин 125 .45%). 1й"
нигроюлуол (до 15%). стабилизатор. пластификатор, гсхнически*
добавки 1до 10'f/j При Г 293.15 К плотность нитроглицерин’-
вых порохов «оставляет 1600 ki м’
Памп проведены исследования теплоемкости и КТР ннгрь;.:и-
цериновых порохов Н. ИБ и НМФ-2.
Измерения теплоемкости проведены в области температур 14-
123 К Для всех исследованных марок порохов значения те !
емкости в пределах гниреншости измерений совпадают и м”<у
быть аппроксимированы уравнениями:
)’«•
с= 116.1+ 3.2887 [Дж/(кг-К)]. 7< 248 К; (1.32)
с= — 266.3 + 4,971 Т [Дж/(кг-К)|, 7>248 К. (1.33)
Соответствующие уравнения для энтальпии имеют вид:
Л= —178.60 + 0,11617+0.1644-10 'Т2 [кДж/кг], 7^248 К:
Г Л= —135,55 — 0.26637 + 0,248567< 10 2 [кДж/кг), 7>248 К-
При нагреве до температуры выше 373 К становится заметным
Лсзоэффект, связанный с разложением пороха, н экспериментальные
зяачения эффективной теплоемкости ниже рассчитанных по урав-
нению (1.33) Малые навески пороха Н массой 0,02. .0,14 г в
условиях измерений теплоемкости воспламенялись после нагрева до
температуры 448 К.
Отклонения имеющихся в литературе сведений о теплоемкости
нитроглицериновых порохов и нитроклетчатки [65—68] от полу-
ченных нами результатов в основном не превышают 15 %.
Измерения КТР порохов проведены в области температур 103 .
... 373 К с шагом по температуре от 3 до 50 К при нагреве и охлаж-
дении образцов. Образцы для исследований КТР изготовляли из
цилиндрических шашек порохов, а измерения КТР проводили как
в направлении диаметра.ах. так и в направлении образующей аи
исходной шашки. Диаметр исходных шашек пороха составлял
4,56 мм для пороха НБ, 4,85 мм — для пороха Н; 9,7 мм — для по-
роха НМФ-2. Кроме.того, были проведены измерения КТР на куби-
ческом образце пороха Н с длиной ребра 10 мм, изготовленном из
шашки большого диаметра.
При высоких температурах наблюдалась усадка образцов, вы-
званная, с одной стороны, размягчением пороха, а с другой — умень-
шением массы пороха. Это приводило к сильному занижению резуль-
татов. полученных при нагреве. Поэтому при высоких температурах
значения КТР порохов получены в основном, при охлаждении образ-
цов после стабилизации показаний дилатометрического устройства
при максимальной температуре опыта, которая достигалась после вы
Держки образца при этой температуре в течение нескольких часов.
Линейный КТР исследованных образцов нитроглицериновых
Порохов обладает сильной анизотропией — КТР а± в направлении
Диаметра шашки намного больше, чем КТР ап в направлении об-
разующей, а при высоких температурах растягивающие усилия в
направлении диаметра шашки становятся настолько велики, что
Приводят к сжатию шашки в направлении образующей (КТР ан
становится отрицательным — образец сжимается при нагреве и
расширяется при охлаждении).
Результаты измерений КТР а порохов Н, НБ и НМФ-2 приве-
дены на рис. 1.8, а данные для КТР ап порохов Н и НМФ-2 — на
рис. 1.9
121
Рис. 1.8. Температурная зависимость КТР нитрогли-
цериновых порохов в направлении диаметра шашки:
О, Л — порох Н, кубическим образец; V порох Н,
4,85 мм; □ — порох НБ, d = 4,56 мм; О порох
НМФ-2, d = 9,7 мм (светлые символы — нагрев, темные
охлаждение)
Рис. 1.9. Температурная зависимость КТР нитроглицери-
новых порохов в направлении образующей:
О порох Н; О — порох НМФ-2 (светлые символы
нагрев, темные — охлаждение)
122
Т В температурной зависимости КТР а ^исследованных порохов
0OJKHO выделить три линейных участка:
область слабого изменения КТР прн Т<210 К,
область резкого, почти скачкообразного возрастания КТР при
220 К<Г<250 К;
область сильного возрастания КТР при Г >250 К.
В первой области значения КТР, полученные на различных об-
разцах. практически совпадают. Во второй области значения КТР
Jopoxa Н. полученные на образце ив шашки диаметром 4,85 мм, сме-
щены на 10 ... 15 К в сторону высоких температур относительно
ранных, полученных на кубическом образце.
В третьей области максимальные значения КТР получены на
дубическом образце пороха Н. причем результаты измерений КТР
для двух взаимно перпендикулярных направлений совпадают.
Несколько ниже данные для пороха НМФ-2 (диаметр шашки 9 7 мм),
1 минимальные значения КТР получены на образцах, изготовлен-
ных из шашек малого диаметра — пороха Н (d = 4.85 мм) и пороха
ЦБ (<7 = 4,56 мм).
Температурная зависимость КТР ан, полученная на кубическом
образце пороха Н и цилиндрическом образце пороха НМФ-2, про-
ходит через максимум при Т~300 К При Т<300 К данные для
обоих порохов совпадают, а при Т>300 К КТР ан пороха НМФ-2
выше результатов, полученных для пороха Н
Температурная зависимость плотности порохов определяется
объемным КТР
«i=“1i + 2a±==—(134)
Вычисленные по соотношению (1.34) значения объемных поро-
хов Н и НМФ-2 в пределах разброса экспериментальных данных
совпадают и могут быть аппроксимированы уравнениями:
в области температур 103 К <7" <222 К
а, • 10’’= -22,02+ 0,97657- [К“'1 (1.35)
в области температур 222К<Т-<245 К
а,,-106= — 1946.8 + 9,65227- (к 'I (1.36)
в области температур 245 К<7-<373 К
av-106= — 1310,2+9,755Т —0,11 • 10~'Г2 (К '1. (137)
Проинтегрировав уравнения (1.35) — (1.37), получим следующие
Уравнения для отношения плотностей при текущей температуре р,
« при 7-= 293.15 К = 20”С рм:
123
£
в области температур 103 К<7<222 К
|п(р,/р,с) = 0,51064| -10 '+0.220181 • 10 4Т—0,488247-10 ”Г';
в области температур 222 К<7<245 К
1п(р,/р2„)= -0,162447 + 0,194678-10 2Г —0,482609-10 5Г2;
в области температур 245 К<7’<373 К
1п(рг/ра>)=-0.573541-10 '+0,131022-10 -’7-0.48775-Ю-’Г-р
+ 0,36687-10 8Г’.
В работе [68] проведены исследования теплоемкости и темпе
ратуропроводности в области температур 113.. 303 К при нагреве
пластинок пороха Н световым излучением в условиях регулярного
режима второго рода. Вычисленные из данных [68] значения тепло-
проводности пороха Н в пределах погрешности измерений сохра
няют постоянное значение Х = 0,258 Вт/(м-К) в области темпера
тур 233...303 К, а при Г <233 К 7= 0,194 +0,275- IO 3 Т Вт/(м-К).
Сглаженные значения теплофизических характеристик нитрогли
церинового пороха приведены в табл. 1.18.
Тепл ©физические свойства нитроглицеринового пороха Н
т, к кг/м а,,-!!)4, К ' с. Дж/(кг К) К. Вт/(м-К) а - 10’’, м"/с
150 1671 1,24 609 0,235 0,23
200 1659 1,73 774 0,249 0,19
250 1637 4,41 976 0,258 0.16
300 1593 6,26 1225 0.258 0,13
350 1539 7.57 1474 0.258 0,11
400 1479 8,32 1722 0,258 0,10
124
£ТЕПЛОФИЗИЧЕСКИЕ свойства смесей
£ 2.1. ОБЩИЕ СВЕДЕНИЯ
йВ этом разделе рассмотрены методы оценки теплофизических
Кйств смесей уплотненных порошков по рецепту и теплофизическим
Ьйстпам индивидуальных компонентов, а также представлены ре-
ьтаты экспериментальных исследований теплофизических свойств
Которых модельных смесей. Рецепт обычно задается массовыми
ями компонентов х, (i — i-й компонент смеси).
«Одной из важнейших характеристик смеси является теорети-
Вкая плотность, вычисляемая по аддитивной формуле
1 Рт=—— • (2-1)
। . 2>/Р,
^Обычно теоретическую плотность вычисляют при нормальных
овиях. Располагая данными о плотности компонентов при раз-
иных температурах, можно определить зависимость теоретичес-
Й плотности от температуры.
Для удельного объема v= 1/р формула (2.1) примет вид
г', = Уч*1. (2 2)
Объемная доля компонента смеси определяется соотношением
И = (23)
Коэффициент объемного расширения вещества определяется
Мвнением
• ---L-ЁЕ (2.4)
н и dT р dT ' '
Продифференцировав уравнение (2.2), получим уравнение
расчета коэффициента объемного расширения смеси
= У ₽,!/.• (2-5)
125
Для изотропного вещества линейный коэффициент тепловоз
расширения а = р/3, поэтому
“ем =У “<И •
(2.6)
Удельную теплоемкость смеси также можно определить по аддц.
тивной формуле
(2.7)
В рамках теории обобщенной проводимости получено множесь
во формул для расчета теплопроводности смесей [12].
Будем использовать при анализе экспериментальных данных
формулу Оделевского
Рис. 2.1. Зависимость КТР смеси
0,2 Mg4-0,8 NaNOa от темпера-
туры:
О — Ку =0,74; □ - Ку=0.88;
Л — Ку =0,93 (-----------рас-
чет по аддитивной формуле; свет-
лые индексы — первые измере-
ния; темные — повторные изме-
рения)
Уг___\
)
v 3 /
где М и у,, Х2 и уг — теплопроводность и содержание по об'
связующего и наполнителя соответственно; v=A.2/1i.
(2.8)
2.2. ТЕПЛОВОЕ РАСШИРЕНИЕ
В ряде случаев КТР смесей уплотненных порошков удовлет
тельно согласуется с расчетом по аддитивной формуле (2.6). ОднА
возможны н существенные отклонения, связанные с зависимости
КТР от коэффициента уплотнения, направления измерений, стр»
туры смеси. Ж
Влияние этих факторов проиллюстрируем на примере экспеЯ-
ментальных данных о КТР двойных смесей магния с нитратом
трия, алюминия со смолой СФ-0112A, магния с антраценом.
Табл и uai.1
Характеристики образцов смеси 0,2 Mp40.fi NaNOs 0
№ п/п Марка порошка магния Давление прессования, р. МПа Высота образца й, мм к,
1 МПФ-3 40 4,75 0,1*
2 МПФ-3 150 4.405
3 МПФ 2 300 4,74
Результаты измерений приведены на рнс. 2.1.
При Т <300 К КТР всех образцов удовлетворительно согласу-
ется с расчетом по аддитивной формуле (2.6). Некоторое завы-
шение КТР образцов № 1 и 2 в области температур 100... 160 К,
юзможно, связано с наличием влаги в образцах. После окончания
измерений уменьшение их массы составляло около I %.
При Г>300 К наблюдается «усадка» образцов — показания
цилатометрического устройства уменьшаются при нензмеииой тем-
пературе в камере. Поэтому прн Г>300 К для каждого измерения
приводятся два значения Верхнее значение КТР получено экстра-
поляцией показаний дилатометрического устройства на середину
времени иагрева, нижнее значение — после выдержки образца в
течение часа при заданной температуре. Измерения проведены с
шагом по температуре 20... 50 К, результаты отнесены к средней
температуре опыта.
При Т>300 К значения КТР ниже рассчитанных по аддитив-
ной формуле, и отклонения увеличиваются при уменьшении
После термостатирования прн высшей температуре опыта Т=300 . . .
I . 380 К усадка образца при повторных измерениях не наблюда-
йся, а результаты повторных измерений становятся ближе к рассчи-
’анным по аддитивной формуле.
Таблица 2.2
Характеристики образцов смеси 0,55 Mg4-0,45 NaNO3
В табл. 2.1 представлены характеристики образцов, на ко<
рых были проведены исследования КТР смеси с массовой до***
магния 20 % и нитрата натрия 80 %. Образцы запрессованнй
цилиндрическую пресс-форму диаметром 15 мм. Измерения про*''
дены в направлении оси усилия прессования. Перед измерения*
образцы были выдержаны в течение месяца при комнатной тем®’’
ратуре.
№ п/п Высота образца й, мм Направление измерения относительно оси усиления прессования
1 8.68 И
2 15.08
3 7.12 X
4 8.69 11
\
126
127
В табл. 2.2. представлены характеристики образцов, па котс
рых были проведены исследовании смеси с массовой долей 55 у
магниевого порошка МПФ-4 и 45 % нитрата натрия. Образцы Изс
готовлены прессованием при давлении р = 350 МПа в прямоуголь.
ной пресс-форме размерами 15X7 мм. Коэффициент уплотнения ос
разцов составлял К, = 0,84 . . 0,87. Исследовано влияние анизо,
тропии на КТР. С этой целью проведены намерения в направлении
оси усилия прессования (ап) и перпендикулярно ей (я,).
Измерения КТР образца № I были начаты сразу же после ц3.
готовления. В связи с тем, что на исследование температурной за.
висимости КТР каждого образца требуется длительное время (бо.
лее недели), то измерения КТР последнего образца № 4 проводили
через месяц после его изготовления
Рис. 2.2. Зависимость КТР смеси 0,55 Mg 4-0,45 NaNO.t
от температуры:
О ан. обр. № I; □ ан. обр. № 4; А — а । . обр. № 2.
V — а ( . обр. № 3 (----------- - расчет по аддитивной
формуле; светлые индексы первые измерении; тем
ные — повторные измерения)
Результаты измерений приведены на рис. 2.2.
КТР образца № 1 во всей области 'температур совпадает с pal
четом по аддитивной формуле.
При температуре ниже комнатной КТР всех исследований'
образцов также согласуется с расчетом по аддитивной форм}*.
При измерениях КТР при температуре выше комнатной наблюдаем
усадка образцов № 2 и 3 (а и образца № 4 (ац) после
хранения при комнатной температуре). Значения КТР образ£‘*
№ 2—4 ниже рассчитанных по аддитивной формуле, но удовле
ворительно согласуются между собой
I2K
Таким образом, в области низких температур КТР смесей маг
«я с нитратом натрия не зависит от коэффициента уплотнения
направления измерений. При температуре выше комнатной увели
«не пористости приводит к уменьшению КТР по сравнению с
учетом по аддитивной формуле. Измерения КТР в направлении,
•рпендикулярном оси усиления прессования, также дают зани
синые результаты. Значения КТР зависят от условий хранения и
тепловой предыстории» образца. Термостатирование образцов при
щит к стабилизации КТР при более низких температурах, и полу-
иные результаты приближаются к расчетным.
КТР нитратов щелочных металлов при Т>300 К значительно
йше, чем КТР магния. Поэтому при циклическом нагреве и после-
,ющем охлаждении до комнатной температуры смесей магния
нитратами щелочных металлов возможно необратимое увеличение
[ъема образцов за счет смещения частиц магниевого каркаса,
табл. 2.3 представлены результаты циклического термостатирова-
<я смесей магния с нитратами натрия, рубидия, цезия. Измерения
юведены на цилиндрических образцах с начальными размерами:
= 14,92 мм и й= 10,13 . . . 10,26 мм — для смесей магния с нитра-
м натрия и d= 10,69 мм, й = 9,62 . 10,00 мм — для остальных сме-
й. В табл. 2.3 указаны массовая доля компонентов в смеси, число
жлов, начальный коэффициент уплотнения К,, максимальная
мпература нагрева Ттах, увеличение высоты бй, кьема образца б К диаметра fid и Таблица 2.3
Изменение размеров образцов из смесей магния с нитратами щелочных металлов в результате циклического термостатирования
Ьь Jn/ri Смесь к Число циклов 6ft. 0/ Zo fid. о/ Zo bV. о/ So
! 1 0jMg + 0.9NaNCh 0,946 523 1 1,08 0,34 1,76
i 2 0.3Mg4-0,7NaNOj 0.941 548 1 1,38 0.47 2,33
, з 0.5Mg+0,5NaNO, 0.944 523 1 0.49 0,24 0.97
4 0,7Mg+0.3NaNO, 0,936 548 1 0.58 0,13 0.85
5 0.3Mg+0.7RbNO, 0,767 548 1 5,01 1,68 8.58
2 7.57 2.53 13.07
3 9.51 3.18 16.59
6 0.7Mg4~0,3RbNO< 0.664 548 1 1.31 0.28 1.88
2 1.61 0.28 2.18
7 0,7Mg4-().3RbNOi 0.649 548 1 0,86 0.19 1.24
8 0.3Mg + 0.7CsNO.i <1.846 548 1 1,24 0,65 2,57
2 1.55 0.75 3.07
9 (L7Mg+0.3Cs\O* 0.849 548 1 0.50 0,19 0.88
2 0.60 0.19 0.98
• 10 0,5Mg + 0.25.\aSO, 0.844 54F 1 0.51 0.19 0.89
11 4-0.25Cs\O.. 0.847 548 1 0.62 0.19 0.99
12 » 0.750 54м l 0,50 0.19 0.88
13 0.770 5 IB 1 0,50 0.19 0,87
129
Как видно из табл. 2.3, остаточное увеличение высоты образцов
6Л в 2 ... 3 раза выше остаточного увеличения диаметра 6d, что
свидетельствует об анизотропии теплового расширения прессован-
ных образцов при повышенных температурах. Остаточное увеличе-
ние объема смесей магния с нитратом натрия в 2 ... 3 раза мень-
ше увеличения объема нитрата в смеси при максимальной темпера-
туре, а в смесях магния с нитратом цезия остаточное увеличение
объема составляет 2/3 увеличения объема нитрата при максималь-
ной температуре.
Наименьшее увеличение объема наблюдалось для образцов
№ 10—13, смесь нитратов в которых при нагреве плавилась. Дли
смеси 0,3 Mg-|-0,7RbNO3 наблюдалось аномально высокое увели-
чение объема. Максимальное увеличение объема, отнесенное к объе»ь
ной доле нитрата, составляет 29 % и примерно в два раза выше;
чем для смеси 0,7 Mg+0,3RbNO3. Для остальных смесей магни!
с нитратами остаточное увеличение объема, отнесенное к объемно!
доле нитрата, в пределах разброса ±0,1 % имеет постоянное зна-
чение и составляет: 2,1 % — для NaNO3 при Т =523 К; 3,5 % -Д
для NaNOs при 7’,лах = 548 К; 5,0 % и 5,8 % — для CsNO3 пр*
7’п]ах = 548 К для одного и двух циклов соответственно.
Рис. 2.3. Зависимость КТР смеем
0,8 AI 4-0,2 СФ-0112А от темпера-
туры:
-------- расчет по аддитивной
формуле; КТР смолы
СФ-0112А; О—обр. № I, □ —
обр. № 2. первое измерение;
А обр. № 2, повторное измерение
Существенное влияние на КТР смеси может оказывать струк-
ти)2г смеси. На рис. 2.3 представлены результаты измерений КТР
смеси с массовой долей алюминиевого порошка 80 % и смолы
ОФ-0112А 20 %. Измерения проведены в направлении оси усилия
прессования на образцах с коэффициентами уплотнения Ку = 0,89.
Экспериментальные значения КТР смесн выше расчетных. Объем-
ная доля смолы в смеси составляет £/=0,352, а экспериментальные
значения КТР воспроизводятся аддитивной формулой при объемной
доле смолы 1/эф = 0,636. Увеличение КТР смеси можно объяснить тем*
что в данной смеси смола является связующим, в котором распреде-
лены большей частью не контактирующие между собой частицы алю*
миния.
130
Рис. 2.4. Зависимость от температуры КТР смеси с мас-
совок долей магищ 60 % и антрацена дисперсного 40 %:
/ — КТР антрацена; 2 - расчет по аддитивной формуле
для смеси; 3—КТР магния; О первые измерения;
□ — повторные и<МСрСН1(Н (светлые индексы — иагрев;
т?мные — охлаждение)
Рис. 2.5. Зависим^ от температуры КТР смеси с мас-
совой долей ма!|НЯ 60 % и антрацена гранулирован-
ного 40 %:
I - КТР антрацеа 2 — расчет по аддитивной формуле
для смеси; О -- первые измерения-. □ повторные
измерения; Д — зетья серия измерений (светлые индек-
сы — и грев; темные — охлаждение)
131
Рис. 2.6. Зависимость среднего КТР «2эз—Г смеси
0,6 Mg 4-0,4 антрацена от температуры:
/ - a29i ^антрацена; 2 расчет по аддитивной фор-
муле для смеси; 3— a203is —г магния; О — антрацен
гранулированный; Л - антрацен дисперсный (светлые ии
дексы нагрев; темные охлаждение)
На рис. 2.4 2.6 представлены результаты измерений КТР двух
образцов смеси с массовой долей магниевого порошка 60 % и антра
цена 40 %. Первый образец содержал дисперсный антрацен, во вто-
ром - антрацен был в виде гранул размером примерно I мм. Изме-
рения проведены на цилиндрических образцах диаметром 15 мм и
высотой 5 мм в направлении оси усилия прессования при нагреве
и охлаждении образцов. Коэффициент уплотнения образца с дис-
персным антраценом составлял Kv = 0,955. для образца с гранули-
рованным антраценом К\ =0.906.
Результаты измерений КТР образца с дисперсным антраценом
приведены на рис. 2.4. При Т<300 К значения КТР смеси ниже
рассчитанных по аддитивной формуле. При Г>300 К значения
КТР, полученные при нагреве, близки к рассчитанным по аддитив-
ной формуле, а значения КТР, полученные при охлаждении, замет-
но выше. При повторных измерениях в области температур 330..
. . . 340 К наблюдалась усадка образца.
Результаты измерений КТР образца с гранулированным антра
иеном представлены на рис. 2.5. Измерения КТР проведены с м0'
лым шагом по температуре \7 ~5 К, из-за неоднородности счес*1
наблюдался большой разброс экспериментальных данных. Пр?
Т<260 К большинство значений КТР лежит вблизи аддитивн0*
кривой, но в отдельных точках эти значения превышают КТР вк
трацена. При Т>260 К КТР смеси возрастает и приближается *
132
КТР антрацена. «.Пилообращый» характер зависихюстп КТР от гем
пературы можно обьяснить гем. чго прн определенных гемнературах
ИЗ-ла возникающих н обрате напряжений происходят смещение
qaciHii хцпниевою каркаса
На ?.*с 2hiipvici.: --h!,! (.ч.ныс о средних значениях К IP обоих
образцов в облает к анера।\р от 293.15 К ц> 1ск>П1,Д! «емис
ратуры а )’» i.'ikoxi ispe на <1в.1еиин ра <бро,- ыпных. сня зинный
С иго щороднос?им» смеси. \мгш.шапся. и можно «icric ощн зелии»
ОСОбсНКОС’Н КТР I’CC.Iv 1ХСХ1ЫХ образцов.
При тирене шачгнпг ерг шею КТР а образна с Ин’пгрс
НЫМ антраценом ниже рассипанн»«1 о по a i шгивпои формуле При
охлаждении а , в облает низких ;гмпера 1 у р cohii.'i Klei . щи
НЫми. полученными при нагреве, а при / 31Ю К выше резуль;aiов.
Полученных при пл реке. и резулыагов pacneia по адди гщзпоп фор
цулс. Полому в ре зу. ил.не циклическою шнрева ц> температуры
J20 К и охлаждения ю комнатной i ем играм ры будет пропе-
рдин» хмеиыпение высоты образца.
Для образца с гранулированным ант раненом значения <z,s
ри ши реве выше рассчитанных ио аддитивной формуле и при
>300 К приближаются к КТР антрацена. При охлаждении та
ения , в области низких температур совпадаю! с рассчитан
ыми по аддитивной формхле, а при Т>300 К близь*! к данным,
слученным при на!реве. Поэтому в результате циклическою о?.лаж
ения до температуры 220 . 170 К и последующею нагрева до
омнатной температуры происходит увеличение высоты образца.
2.3. ТЕПЛОЕМКОСТЬ
Удельная теплоемкость многокомпонентных смесей у плотненных
орошков в большинстве случаев хорошо согласуется с расчетом
о аддитивной формуле (2.7). В качестве подтверждения справед-
ивости аддитивной формулы на рис. 2.7 проведено сопоставление
асчетны.х и экспериментальных значений теплоемкости смесей
(агния с ннтраюм натрия.
; Если один из компонентов смеси имеет фазовые превращения
i исследуемой области температур. то при измерениях теплоемкости
1аблюдаются эндоэффек1Ы. величина которых (|роцортюна.тьиа
Теплоте фазовою перехода \/( и массовой доле л* кох|Ноиента.
\h W/.v з2.9>
Как известно, смеси «пиратов плавятся при более ни тих темпе-
ратурах. чем температура наиболее легкоплавкою компонента смеси
169, 70|. На рис. 2.8. 2.10 представлены результаты измерений
Теплоемкости днонпых смесей нитратов с массовой долей 50 % ХаХО
KNO,. ХаХО и CsXO.. RbXO и CsXO Теплоемкость смесей
Твердых нитратов и их расплавов хорошо согласуется с расчетом но
^ДДИтивнон формуле. Количество теплоты твердофазных переходов
Удовлетворите. 1Ы1О согласуется с расчетом по формуле (2.9)
Рис. 2.7. Зависимость теплоемкости смесей магния с
нитратом натрия от температуры;
/ 0.1 Mg+0.9 NaNOb 2 0,7 Mg+ 0.3 NaNO.
f-------. расчет no аддитивной формуле.
О, Л экспериментальные значения
Рис 2.S. Зависимость теплоемкости смеси 0.5 \.i\O
-0.5 КХО от гемнературы:
И«В’.Л \ -Ч I
Рис. 2.9. Зависимость теплоемкости смеси 0.5 ХаХО +
+ 0,5 CsXO, от температуры:
/ 427 К /'<„ СьХО,. Г_.=57<».Ь К ХаХО .
/ < 682 К Т,., С*ЛО ‘----------- расчет по ах'шгив
пой формуле, экспериментальные значения
эффективной теплоемкости в области фазовых неречо-
Рмс. 2. К» (ависимость теплоемко-; > и смеси О 1 р
(1.5 ".чХ-т от гемиерапры:
Температура и reii.iOi.i плавления смесей ншрагон
Значения гемнерагуры н гениты плавления смесей шпрл,..ц
приведены в габл. 2.4
Темпераг\ра плавления смесей 0.5 ХаХО-4-0.5 КХО. и ч;,
NaNOi + 0,5 CsNO.j на 100 К ниже юмиературы плавления iihi:=.i
га натрия. а теплота плавлении на 30 % выше полусуммы ко и
честна теплоты плавлении компонентов. Для смеси 0,5 RbNO -
-J-0.5(’sN(), температура плавления на 10 . . . 13 К ниже levniepai\аы
плавления RbNOj. а теплота плавления на 10 % выше аддитивного
значения.
Рис 2.Н. Зависимость теплоемкости смеси 0.5 Чц
-г 0.25 \а\О -г 0.25 СЛО, от температуры:
Г, =427 К / < С*АО ------------ расчет по «i.uni нвной
форчх.к-. экспериментальные шачсния »<|)-
фсктивпои геплосмкости в области фаговых переходов!
На рис. 2.11 представлены результаты измерений теплоемкости
тройной смеси 0,25 ХаХ’О5 4-0.25CsXOj4-0,.) Mg Теплоемкость
смеси в области температур 140. 427 К и эндоэффскт при
— 427 К. связанный с фаювым переходом в Cs\O;. хорош»• с°
гласуюгся с расчетами по аддитивным формулам. ЭндоэфФеКТ
в области температур 460. ..548 К. связанный с плавлСНием
смеси NaNQi + CsNO.), составляет ЛЛ„.,=(47.7+ 6.7) кДж/кг. После
пересчета на 100 % смеси нитратов получим \Л„., = (9g 4 _|_
£13,4) кДж/кг. что на 40 % ниже результата, полученноь0 по
данным о теплоемкости смеси нитратов, и па 23 % ниже аддитивного
значения теплоты плавления смеси нитратов. Уменьшение эндо-
зффекта в тройной смеси 0,25 NaNOj 4-0.25 CsNO.i 4-0.5 A'lg ц0
сравнению с аддитивным расчетом может быть связано с началом
окисления магния в процессе плавления смеси нитратов.
Рис. 2.12. Зависимость от тем-
пературы разности энтальпий
смеси 0,5 Mg 4-0.25 NaNO(-f-
Ц-0.25 CsNOj и смесей с добав-
ками канифоли:
1-5%; 2 - 10%
- При повышенных температурах в некоторых смесях начинаются
^изотермические реакции, приводящие к значительному уменьцению
эффективной теплоемкости. На рис. 2.12 показана температурная
Зависимость разности энтальпий, вычисленная по результата^ из.
•ерений теплоемкости смеси 0,25 NaNO3-|-0,25 CSNO3 + O3 Mg
I смесей с добавками 5 и 10 % канифоли (массовых долей). тем-
fparypa начала экзоэффекта 7~480 К согласуется с дан1Ь1ми
лученными при исследовании канифоли, а величина экзоэффекти
рропорциональна содержанию канифоли в смеси.
В некоторых смесях экзоэффект наблюдается при температурах
более низких, чем у чистых компонентов. На рис. 2.13 приведены
результаты измерений теплоемкости смесей титана с бором аморф-
ным и бором кристаллическим. Массовая доля бора в см(»ях —
около 30 %. Теплоемкость смеси с бором кристаллическим torjla.
суется с расчетом по аддитивной формуле вплоть до 7=500 К При
более высоких температурах экспериментальные значения епло-
ем кости ниже расчетных, что связано с началом окисленгя ти_
Лаиа. При исследовании смеси титана с бором аморфным наблю-
дается резкое уменьшение теплоемкости в области емпе-
ратур 400 . . . 473 К при первом измерении, а результаты П(ВТОр.
Мых измерений близки к расчету по аддитивной формуле. П]я ис-
следовании теплоемкости чистых компонентов было устанО|Лено,
137
что экзоэффект, связанный с окислением титана, в области темпе-
ратур 400 . . . 473 К невелик (значительно меньше наблюдаемого для
смеси), а для бора аморфного в области температур 400 . . 473 К
наблюдается эндоэффект, связанный с испарением содержащейся в
образце влаги.
Рис. 2.13. Зависимость теплоемкости смеси 0.3 B-f-0.7 Ti
от температуры:
О — бор кристаллический, первые измерения; Л бор
кристаллический, повторные измерения; V бор аморф-
ный, первые измерения; v — бор аморфный, повтор-
ные измерения (—--------расчет по аддитивной формуле!
Рис. 2.14. Зависимость от температуры теплоемкости
смеси с массовой долей бора кристаллического 25 % и
NaNO',75%:
О — первые измерения; Л — повторные измерения
I----------------расчет по аддитивной формуле)
133
Аналогичные особенности изменения теплоемкости наблюдались
и при исследовании смесей бора с нитратами. На рис. 2.14 представ-
лены результаты измерений теплоемкости смесн с массовой долей
бора кристаллического 25 % и нитрата натрия 75 %.
Рис. 2.15. Зависимость от температуры теплоемкости смеси
бора аморфною с нитратом натрия при массовой доле бора
аморфного 17 %:
О — первые измерения: Л — повторные измерения
(---------------расчет по аддитивной формуле)
I
t
t
Б
J Результаты первых и повторных измерений хорошо согласуются
с расчетом по аддитивной формуле.
На рис. 2.15 и 2.16 приведены результаты измерений теплоем-
кости смесей бора аморфного с нитратом натрия с массовой долей
бора аморфного 17 и 40 %. При первых измерениях теплоемкость
проходит через минимум в области температур 400 . . . 4173 К, а ре-
зультаты повторных измерений хорошо согласуются с эасчетом
по аддитивной формуле. Величина экзоэффекта, вычисленная по
'.разности теплоемкости при первом и повторных измерениях, про-
порциональна массовой доле бора аморфного по массе..
Рис. 2.16. Зависимость от тем-
пературы теплоемкости смеси бо-
ра аморфного с нитратом нат-
рия при массовой доле бора 40%:
О — первые измерения. Д —
повторные измерения (-------
расчет по аддитивной формуле)
139
Таким образом, удельная теплоемкость смесей порошков раз.
личных веществ в области низких и умеренных температур хоро.
шо согласуется с расчетом по аддитивной формуле. Температхр^
начала эндоэффекта в смесях согласуется с температурой фазовых
переходов чистых компонентов, а величина эндоэффекта про пор.
циональна массовой доле соответствующего компонента. Если &
смеси содержится несколько неорганических солей, например, пи
тратбв, то необходимо \читывать, что температура плавления такой
смеси может быть существенно ниже температуры плавления чщ.
тых компонентов.
При повышенных температурах экспериментальные значения
теплоемкости смесей во многих случаях ниже рассчитанных по ад
дитнвной формуле. Величина экзоэффекта, вычисленная по р<ц-
иости расчетной и экспериментальной теплоемкости, пропорциональ-
на массовой доле компонента, вызывающего экзоэффект.
2.4. ТЕПЛОПРОВОДНОСТЬ
Теплопроводность смесей уплотненных порошков зависит от
многих факторов: теплопроводности и содержания компонентов,
пористости, способа изготовления образца, структуры смеси и г. д.
Рис. 2.17. Зависимость отношения экспериментальных
значений теплопроводности свободных засыпок твердых
частиц в газовых и жидких средах /,,м к рассчитанным
по формуле (2.8) значениям от отношения \ =
О - данные |12|: А данные |43|: □ данные (711
(линия рассчитана по уравнению K==|gv)
Для свободных засыпок порошков можно полагать, что частицы
порошка со всех сторон окружены газом или жидкостью. Тепло-
проводность такой смеси можно определить по формуле (2.8), рас*
с.матривая газ или жидкость в качестве связующего, а твердые ча-
стицы — в качестве наполнителя. На рис. 2.17. представлена зави-
симость отношения экспериментальных значений теплопроводности
свободных засыпок порошков в различных газовых и жидких сре-
дах и рассчитанных по формуле (2.8) для газовзвеси от отношения
теплопроводности наполнителя и связующего X,. Эксперименталь-
ные данные взяты из работ: [12] (твердые частицы — стекло, кварц,
плексиглас, карборунд, свинец; среда — вода, спирт, бензол, нефть,
глицерин, изооктан, кремнийорганика), [43] (твердые частицы
стекло, сталь, свинец; среда — воздух, Нз, Не, COJ; [71] (твердые
частицы КМпОч, КзСгзО?, Sb; среда — воздух). При v = X2/X,^. 111
экспериментальные значения теплопроводности в пределах разброса
экспериментальных данных согласуются с расчетными. При v> 10
экспериментальные значения теплопроводности выше расчетных, что
связано с переносом тепла через каркас из твердых частиц.
В работе [43] для расчета теплопроводности зернистых ма-
териалов предлагается формула
Хсм=(1 — aJX.j-f-oXj, , (2.10)
где а = 0,02; Х12 и X2i рассчитываются по формуле (2.8). когда газо-
вая среда является связующим (Х,2) и когда твердые частицы яв-
ляются связующим (>-2i). В работе [12] для расчета теплопровод-
ности зернистых материалов предложена сложная формула на
Основе структуры с взаимопроникающими компонентами. Однако и
|ри строгом расчете отклонения от экспериментальных данных
Достигают 20 ... 30 %, что связано и с погрешностью эксперимента,
| с недостаточной полнотой и надежностью исходных данных
для расчета.
В этих пределах, как видно из рис. 2.17, экспериментальные
Данные можно воспроизвести простой формулой
Лс„ = ^,2. (2.11)
Ще K = Igv = lg(X2/Xi); при Ю К=1.
Если засыпка состоит из смеси порошков нескольких веществ,
10 для расчета теплопроводности такой системы можно предложить
Следующий подход.
Сначала по формуле (2.11) рассчитывается теплопроводность
Дасыпки для каждого индивидуального компонента, а затем по фор-
муле (2.8) методом последовательного сведения к двухкомпонент-
Мой рассчитывается теплопроводность всей смеси. В табл. 2.5
сопоставлены рассчитанные по предложенной схеме значения тепло-
проводности с экспериментальными данными [71] для двойных
смесей металлов с окислителями при различных коэффициентах уп-
лотнения Ку.
В качестве расчетного приведено среднее арифметическое зна-
чение Храсч = 1/2 (Хок-мЧ-^м-ок), где Хок—«— значение тепло-
проводности, когда порошок окислителя является связующим, а
Морошок металла — наполнителем; Хм_ок — наоборот. Макси-
мальное различие между значениями ХГ|к_.„ и Х«-Ок для рассмот-
ренных смесей составляет 10 %.
141
Таблица 2.5
Сопоставление расчетных значений теплопроводности
свободных засыпок смесей металлов с окислителями с данными |71]
Смесь A. X,KC. Bt/(m -h) Вт/(мЧ-А’* «.. %
0.3Sb+U.7KMnO, 0.675 0,28 0.240 — 14.1
a«sb-f-o.2KMno, 0,663 0.32 0.270 - 15.6
l).8F<?+0.2KMnOi 0,703 0,42 0.463 10,1
D,3W+0,7K2Cr.>0 0.573 0,14 0.144 3.1
(),8W-f-0.2K--Cr2O 0.406 0,17 0.145 14.5
В отличие от свободных засыпок теплопроводность прессован-
ных порошков определяется в основном переносом тепла через
каркас из твердых частиц. В этом случае твердые частицы явля-
ются связующим, а газ — наполнителем. Пересчет эксперименталь-
ных данных о теплопроводности уплотненных смесей порошков на
нулевую пористость т — 0 будем проводить, как и для одноком-
поиентных систем, по формуле Оделевского с поправочным мно-
жителем
M1-ZLzW)(1~Cm)- (212)
' I-V 3 '
Для смесей, не содержащих металлических порошков, тепло-
проводность компонентов имеет один порядок н лежит в пределах
0,2 . . . 2 Вт/(м-К). В этом случае рассчитанные по формуле (2.8)
значения теплопроводности при перемене местами связующего и па
полнителя ?,|2 и Х21 отличаются от среднего значения >.ср = (>-|2 +
+ >.2i)/2 не более, чем на 25 %.
Преобладание структуры одного из компонентов не приводит
к существенному изменению теплопроводности смеси.
Таким образом, теплопроводность неметаллизированных двойных
смесей при Ку=1 можно рассчитать по формуле (2.10), где а = 0.5,
Xi2 и >21 — рассчитанные по уравнению (2.8) значения теплопровод-
ности, когда связующим являются компонент с низкой и высокой
теплопроводностью соответственно. Для многокомпонентных смесей
теплопроводность можно вычислить по формуле (2.8) методом по-
следовательного сведения смеси к двухкомпонентной и найти сред-
нее арифметическое значение всех возможных значений тепло-
проводности. Например, для тройной смеси, объемная доля компо-
нентов в которой составляет у\, у?, уз, необходимо вычислять значе-
ния теплопроводности для шести последовательностей компонентов:
>123, >-132, >-213, >-231, >-312, >.321- ПрН Определении теплопроводности >.121
сначала вычисляется теплопроводность смеси, в которой компонент 1
является связующим, а компонент 2 — наполнителем. Их объемная
доля определяется соотношениями:
' — У| • _ Уг
У{ У1+У2' У\+Уч '
142
Затем вычисляется теплопроводность смеси, в которой связующим
является смесь компонентов 1 и 2, а наполнителем — компонент 3.
Диалогично вычисляются значения теплопроводности для других
последовательностей компонентов.
Таблица 2.6
Сопоставление экспериментальных и расчетных значений /.
неметаллнзированиых смесей уплотненных порошков при Кг = |
Смесь Вт/(м-К)
О.25КС1СЦ 4- 0.75С7НсО< 0,273 0.278 1.7
0.5КС1О4+0.5С7Н6Оз 0,326 0,327 0.3
().75КС1О4-Н».25С7Н«О1 0.374 0.399 5.6
0,83КС1О4+О,17В* 0,703 0,690 -1.9
0,83KN03 + 0,I7B* 0,780 0,859 10,2
0,83NaNOa+0.l7B* 1.414 1,441 1,9
O.OKNOi + O.IBaO? 0,742 0,743 0,1
0,5NaNO3+0,5KNO1 0,976 0,995 1.9
0.5NaNOs+0.5CsNO., 0,917 0,848 -7,5
* Бор аморфный
В табл. 2.6 представлены экспериментальные и расчетные зна-
чения теплопроводности неметаллизированных смесей при Ку=|.
^Пересчет экспериментальных данных на нулевую пористость прово-
дили по формуле (2.12): для смесей перхлората калия и салициловой
кислоты С=0, для остальных смесей — С= 1.
(
I
I Рис. 2.18. Зависимость теплопровод-
ности смесей магния с нитратом нат-
рия при Ку = 1 от объемной доли
магния:
/ — расчет по формуле (2.8), свя-
зующее — магний (Л21). 2— расчет
по формулам (2.10) и (2.13);
3 — расчет по формуле (2.8). связу-
ющее NaNCh (112)
Для смесей, содержащих металлические порошки, теплопровод-
ность компонентов может отличаться иа два — три порядка. В этом
случае значения 1|2 и будут отличаться иа одни — два порядка.
Теплопроводность смеси сильно зависит от ее структуры. На рис. 2.18
представлены результаты расчетов и экспериментальные данные
143
о теплопроводности смесей магния с нитратом натрия. Эксперимен.
тальные данные удалось описать с помощью формулы (2.10), Где
Xi-? — теплопроводность смеси, в которой нитрат натрия связующее
а магний — наполнитель; Л21 — теплопроводность смеси, в которой
магний связующее, а нитрат натрия — наполнитель; коэффициент й
зависит от объемной доли магния:
а({/)={/(0,2644+0,1411У) (2.13)
Используя этот же вид функции а(у) (2.13), удалось в пределах
погрешности измерений описать экспериментальные данные о тепло
проводиости смесей магния и с нитратами других щелочных метал,
лов Сопоставление расчетных и экспериментальных данных о тепло,
проводиости этих смесей приведено в табл. 2.7. Пересчет эксперимен
тальных данных на нулевую пористость проводили по формуле (2.121
при С = 1.
Таблица 2.7
Сопоставление экспериментальных и расчетных значений
теплопроводности смесей магния с нитратами щелочных металлов
при К, = |
Смесь Лрасч. Bt/(m-K) M-%
0,lMg+0,9NaNO.» 2.54 + 0,11 2.41 -5,3
O.SMg+OJNaNO, 7.98 ±0.27 8,14 2.0
0.5Mg+0,5NaNO-< I9.23±I,I5 19,71 2,5
0.7Mg+0,3NaNCh 40.9 + 5,1 39,0 4,7
0.3Mg+0.7RbNO< 8.65 + 0,18 8.91 3.0
0,7Mg+0,3RbNO< 43.1+6.4 39.9 —7,4
O,3Mg + 0.7CsNOt 9,06 ±0.21 10.56 16.3
0,7Mg+0.3CsNO3 42,6+8.0 42.15 -1,2
0.5Mg+0.25NaNO3 4-0.25CsN() 2I.64±I/H 21,78 0.6
Исследования теплопроводности смесей магния с нитратами
щелочных металлов проведены на образцах с коэффициентами
уплотнения К-, = 0.95 ... 0,96, поэтому выбор коэффициента С—1
по аналогии с данными для неметаллизированных смесей не при
водит к большим погрешностям при экстраполяции значений тепло-
проводности на нулевую пористость.
Однако во многих случаях зависимость теплопроводности смесей
металлов с неорганическими соединениями от пористости определи
ется уравнением (2.12) с коэффициентом С>1
При исследовании теплопроводности смесей железа с перхло-
ратом калия 0,9 Fe + 0,1 КСЮ, и 0,74 Fe + 0.26 КСЮ4 получено
С—2 (минимальный коэффициент уплотнения составлял /(. = 0,613
для первой смеси и /(.=0,687 для второй). Экспериментальные дан-
ные можно описать двумя способами; формулой (2.10), где
114
f а (р)=р (0,0338 + 0.3586р), (2.14)
формулой (2.11), где
Л = 1+2 75у, (2.15)
J— объемная доля металла.
* На рис. 2.19 представлены результаты исследований теплопро
уодности смеси 0,5 А1 +0,5 NaNOa при различных коэффициентах
уплотнения Средний размер частиц компонентов смеси составлял
J00 мкм. Измерения проведены на кубических образцах со стороной
Ёминой /=10 мм в направлениях, параллельном Хц и перпенди
уулярном Z j оси усилия прессования. Полученные результаты сви
ельствуют о сильной анизотропии теплопроводности прессован
( смесей алюминия с нитратом натрия: Хх/Хц= 1,5 .. . 2 в об
уасти Лу=0,7 .. . 0,9.
рРис. 2.19. Зависимость теплопро-
- водности смеси 0,5 Al -f-0,5 NaNO
от коэффициента уплотнения и
направления прессования:
/ — перпендикулярно оси усилия
прессования; 2 параллельно
оси усилия прессования
i
i В результате аппроксимации экспериметальных данных уравне
|йем (2.12) получены следующие значения коэффициентов: С =1,422
|1| = 11,57 Вт/(м • К) для Хщ С = 2,21 и Z, =25,86 Вт/(м • К) для X,.
I Результаты измерений теплопроводности Хц хорошо воспроиз
|одятся формулами (2.10) и (2.11) при использовании функции
0(у) (2.14) и Л’(у) (2.15): расчет по формуле (2.10) дает значение
Оа 8,5 % выше, а по формуле (2.11) на 3,5 % ниже эксперимен
Тальиого значения. Хц.
При исследовании теплопроводности смеси с массовой долей
Магния сферического 33 % и нитрата натрия 67 %, анизотропия
Теплопроводности не обнаружена. Результаты измерений Zn и Z
совпадают в пределах погрешности измерений, и после пересчета на
Нулевую пористость теплопроводность смеси составляет Zi=(4.98±
+ 0.22) Вт/(м- К). Это значение на 28 % выше рассчитанного по фор
Муле Оделевского значения Zu и в 2 раза ниже теплопроводности
Смеси, содержащей магниевый порошок МПФ-4.
145
На рис. 2.20 представлены результаты исследований теплопро-
водности смесей антрацена с алюминием и магнием. Массовая доля
металла в двойных смесях составляла 30, 50 и 70 %. Массовая до-
ля магния в тройных смесях изменялась от 20 до 80 % через 10 %,
а содержание антрацена и алюминия подбиралось таким образом,
чтобы теоретическая плотность смеси составляла (1690+10) кг/м3.
Рис. 2.20. Зависимости теплопро-
водности смесей аитрацена с
магнием и алюминием от объем-
ной доли металла:
/ расчет для тройных смесей
антрацена с алюминием и магии
см; 2 — расчет по формуле (2.8)
для смесей антрацен-металл;
3 — расчет для двойных смесей
антрацена с магнием
Экспериментальные данные
□ — смеси антрацена с алю-
минием; А — смеси антрацена
с магнием, О — тройные сме-
си антрацена с алюминием и
магнием
Измерения теплопроводности проведены на образцах с коэффи-
циентами уплотнения Ку=0,91 . . . 0,96. Перес .. г экспериментальных
данных на нулевую пористость проводили по формуле (2.12) при
С=1.
Значения теплопроводности двойных смесей при объемной доле
металла (/„<0,33 совпадают с расчетами по формуле Оделевского.
когда антрацен является связующим, а металл — наполнителем
(М-
При большем содержании металла экспериментальные значения
теплопроводности выше значений Х12, причем смеси иа основе маг-
ния при одинаковой объемной доле металла имеют более высокую
теплопроводность, чем смеси иа основе алюминия.
Результаты измерений теплопроводности двойных смесей маг-
ния с антраценом можно воспроизвести с помощью формулы (2.10).
где а = 0 при 0,337, а при большем содержании магния по объему
а (у)=у (0,4765у - 0.1605). (2.16)
Результаты измерений теплопроводности тройных смесей ан-
трацена с алюминием и магнием удалось воспроизвести с помошь»
расчетов по следующей схеме:
вычисляется теплопроводность двойной смеси аитрацена с ал»0'
минием: , . ..
Лан-А1= А(^А|)Л|2,
где Х[2 определяется по формуле Оделевского при объемной д°-^
алюминия f/A|==t/A1/G/Aj + ^aH) • а коэффициент К — по формуле (2.1°’
при значении уд| в тройной смеси ;
146
далее расчет проводится как для смеси кагния с антраценом,
используя вместо характеристик антрацена хаоактеристики двойной
смеси антрацена с алюминием.
В качестве примера проведен расчет теплопроводности смеси,
характеристики которой приведены в табл 23.
Таблица 2 К
Характеристики тройной смеси антрацена с алимиинем и магнием
Компонент X, кг/м* Вт/(м - К) У-
Магний 0.5 1740 160 0,464
Алюминий 0.217 2710 217 0.135
Антрацен 0.283 1250 0.465 0.381
Теоретическая плотность смеси рт=1684 к'/м1, эксперименталь-
ное значение теплопроводности >,„ = 6,39 Вт/(м-К). Объемная доля
алюминия в двойной смеси составляет (/‘,=0.261. По формуле (2.8)
|ычисляем теплопроводность двойной смеси, когда антрацен являет-
ся связующим, а алюминий — наполнителем: >12=0,954 Вт/(м К)
По объемной доле алюминия в тройной смеси </д1=0,135 по фор-
муле (2.15) получим К=1,379и >а11_д,= |,31бВт/(мК) Используя
fro значение, вычисляем по формуле (2.8) теплопроводность смеси,
|огда магний является наполнителем 1,2 = 4,846 Вт/(м-К) и свя-
зующим >21 = 62,51 Вт/(м-К). Из формулы (2.16) получим при
SMg=0,484 а = 0,0339, и из формулы (2.10) определим теплопро-
водность тройной смеси: >.=6,80 Вт/(м-К). Отклонение от экспе-
риментального значения составляет 6,4 %.
Теплопроводность смесей антрацена с магнием зависит от разме-
|а частиц антрацена и резке возрастает прВ размере гранул ан-
>ацена примерно I мм.
В табл. 2.9 представлены экспериментальные данные о тепло-
эоводности смесей с массовсй долей магниерого порошка МПФ-4
) % и антрацена 40 % при различных размерах гранул антрацена
кснериментальные данные пересчитаны на нулевую пористость по
ормуле (2 12) при С = 0. В табл. 2.9. приведены также значения
/эффициента а формулы (2. 0).
Та б । и ц а 2.9
Зависимость теплопроводности смеси n,6Mg+0.4CuHi„
от среднего размера гранул антрацена
d<v мм Вт/(м-К) а
0.22 4.24 ±0,21 0,0352
0.58 5.404-0,23 0.0529
0.92 Ю.О5 ±1.03 0.1242
147
Обычно уплотненные смеси порошков содержат три группы ве-
ществ, сильно отличающихся по теплопроводности и другим фи-
зическим свойствам: металлы, неорганические соединения и органи-
ческие вещества. В этом случае число возможных структур смеси
резко возрастает. В простейшем случае тройной смеси число воз-
можных значений теплопроводности кць равно 6, и попытка устано-
вить связь ХСм=ДХ,,*) сопряжена со значительными трудностями.
Поэтому «лобовое» решение задачи прогнозирования теплопровод-
ности многокомпонентных смесей практически неосуществимо. Од-
нако проведенные нами исследования показывают, что для многоком-
понентных смесей характерны такие же закономерности, как и для
двойных смесей, и используя эти закономерности можно с приемле-
мой для .практики точностью оценивать теплопроводность много-
компонентных смесей.
В качестве примера рассмотрим смесь с массовой долей магние-
вого порошка МПФ-4 50 %, NaNO3 25 %, CsNOs 25 % и порошка
канифоли 10 % (сверх 100 %). Экспериментальное значение тепло-
проводности после пересчета на нулевую пористость по формуле
(2.12) при С=1 составляет ХЭКе=(8,16±0,15) Вт/(м-К)-
Плотность, теплопроводность и объемная доля компонентов
смеси приведены в табл. 2.10.
Характеристики компонентов смеси
Таблица 2.10
Компонент (Ь. кг/мл X, Вт/(м-К) У‘
NaNO3 2257 1.36 0.199
CsNOi 3685 0.337 0,122
Mg 1740 160 0,516
Канифоль 1100 0,164 0,163
Смесь нитратов можно рассматривать как отдельный компо-
нент теплопроводностью Х = 0,848 Вт/(м-К) с объемной долей
£/ = 0,321. Рассматриваемая система сводится к трехкомпонентной.
Обозначим характеристики нитратов индексом 1, магния — ин-
дексом 2, канифоли — индексом 3 и рассчитаем по формуле (2.8)
все возможные значения Х,; двойных смесей и X,,* тройной смеси, где
первый индекс отмечает связующее, последующие индексы — на-
полнители:
>.12=4.775;
Х21 =83,31;
/.23=108,6;
Х32= 1,700;
Х13=0,567;
Хз 1=0.473;
Х|23 = 3.745;
Х213=65.50;
Х231 =64,02;
Х321 = 1.392;
X из = 2,341;
Х312= 1.957.
Минимальное и максимальное значения Х^ отличаются в 47 раз,
а среднее геометрическое значение Х= (ПХ^) ,/б= 6,797 Вт/(м- К) по
яорядку величины согласуется с экспериментальными данными: от-
клонение составляет 6/.=— 16.7 %.
Лучшее согласие с экспериментальными данными достигается
при следующей схеме расчета:
по формуле (210) вычисляется теплопроводность смеси магния
с нитратами Х|3, причем коэффициент а вычисляется из формулы
(2.13) по содержанию магния в тройной смеси;
по формуле (2.8) вычисляется теплопроводность двойной смеси,
когда канифоль является связующим, а смесь магния с нитратами —
наполнителем X* и при обратном расположении компонентов
смесь магния с нитратами является связующим, а канифоль на-
полнителем Л(|2|3-
Теплопроводность тройной смеси определяется как среднее ариф-
метическое полученных значений;
К м = 12-3 + ^3 (12
Рассчитанное по этой схеме значение теплопроводности состав-
ляет Х( ч = 8,32 Вт/ (м - К); 5Х — 2 %.
Предложенная схема расчета дает удовлетворительные резуль-
таты для теплопроводности смесей магниевых порошков МПФ-2,
МПФ-3, МПФ-4 с порошками неорганических и органических ве-
ществ, если дисперсность компонентов одного порядка. Если же ор-
ганическое вещество применяется в виде гранул, размеры которых
намного больше размеров частиц остальных компонентов, то тепло-
проводность смеси резко возрастает, и экспериментальные данные
близки к рассчитанному по предыдущей схеме значению Хц2)3.
Иногда органические вещества вводятся в смесь в виде раствора.
В этом случае теплопроводность смеси резко уменьшается, и
экспериментальные данные согласуются с расчетом по следующей
схеме:
вычисляется теплопроводность двойной смеси неорганического
соединения с магнием, когда магний является наполнителем;
вычисляется теплопроводность тройных смесей, когда органи-
ческое вещество является наполнителем л1г»< и связующим Мц, и
И\ среднее арифметическое значение X=(X,i.’ + Xi23/2.
Если в смеси содержится несколько однотипных веществ в оди-
наковом агрегатном состоянии, то предварительно вычисляются
значения теплопроводности смеси неорганических соединений и
смеси органических веществ, и исходная многокомпонентная смесь
сводится к трехкомпонентной.
Если смесь содержит органические компоненты и в виде раство-
ра. и в виде дисперсного порошка с объемной долей t/4, расчет мо-
жно проводить по следующей схеме:
вычисляется теплопроводность смеси неорганического соедине-
ния с магнием Xi2;
148
(49
ведены значения коэффициента Л'рэс.„ вычисленные по формуле
(2.15). Пересчет экспериментальных данных на нулевую пористость
проводили по формуле (2.12) при значениях коэффициента С. ука-
занных в таблице. Большинство смесей, представленных в табл. 2.12
содержало часть органических компонентов в виде раствора
смесей № 3 п 7 измерения проведены в направлениях параллельно
и перпендикулярно осп усилия прессования. Отношение f^/лц to-
ставило 1.32 для смеси № 3 и 1.72 для смеси № 7. Значения тепло-
проводности смесей на основе магния, алюминия и для одной из сме-
сей на основе титана согласуются с расчетом по формуле (2.10)
при К. определяемом уравнением (2.15). Для остальных смесей
на основе титана и ;пя смесей на основе алюмипиево-магниешно
сплава теплоперенос по каркасу из металлических частиц значи-
тельно меньше и приводит к увеличению значения лк> всего лишь на
20 ... 30 %. Для смеси № 13. на основе циркония 1. и тепло
проводящий каркас из металлических частиц не образуется.
3. ПРИМЕНЕНИЕ ТЕПЛОФИЗИЧЕСКИХ СВОЙСТВ
ЦЛЯ АНАЛИЗА ПРОЦЕССА ГОРЕНИЯ
3.1. ОБЩИ К СВЕДЕНИЯ
Для решения любой тепловом шдачи необходимы надежные
данные о генлофи шчгскнх свойствах веществ, однако в большинстве
упцч-гву юших юоретических моделей (ирония по хчпгывастся ном-
ера туркая «ависимос!ь теплофнзнческих свойств горючих систем,
то связано с тем, что но современным представлениям скорость
прения обусловлена китч иной химических реакций, скорость ко-
орых экспоненциально зависит от температуры Все остальные
акторы, связанные с горением, более слабо, обычно степенным об-
азом, зависят от температуры. Поэтому при анализе процесса
зрения везде, где возможно, физические свойства полагают по
Тоянными [6]
Основанием современной тепловой теории горения послужили ра-
оты [72 74]. Прн различии методов решения задачи о скорости
тациоиарпого горения газовых смесей эти работы дают один и тот
ке результат скорость горения пропорциональна корню квадрат-
ому из скорости химической реакции при максимальной темпе-
атуре горения В дальнейшем эти идеи были распространены и
а горение конденсированных систем. Обзор элементарных моделей
зрения конденсированных систем проведен в работе [6]. Обшей
ертон этих моделей является пропорциональность скорости горения
орню квадратному из скорости химической реакции при максим аль-
ой температуре горения Г , если в ведущей зоне процесса горения
роисходит полное превращение горючем системы q 1, или при
ем перату ре поверхности горения Г,, если в вгптей зоне промо.хо-
ит неполное превращение горючей системы 0<з]<| tq доля
ступившей в реакцию исходной горючей он•i'mi.iI.
Однако практическое использование icopciичсскпх моделей го-
ения затруднено из за отсутствия независимых надежных данных о
мистических параметрах химических реакций при высоких темпе-
атурах. близких к Т или Л. а применение кинетических пара-
етров. полученных из низкотемпературных реакций, приводит к
олынпм расхождениям расчетных и экспериментальных значений
корости горения.
a
153
Становление современной теории горения началось с полного
и безусловного отрицания [75] предыдущих исследований в этой
области [1,2], основанных на представлении о существовании в
волне стационарного горения критической температуры 7\Р, авали-
гичной температуре воспламенения. В соответствии с данными [I]
скорость горения и, определяемая из уравнения теплового баланса
в критическом сечении волны стационарного горения при Т=Т^
обратно пропорциональна разности критической и начальной Тн-тем-
пературы:
F(T,.TJ
"Р=^ТГ’
(3 1)
где р — плотность горючей системы при начальной температуре;
F(T,. ГкР) — константа, не зависящая от начальной температуры.
В формулировке К. К. Андреева [3| уравнение Малляра и .'!<
Шателье (3.1) имеет вид
пр=
aQ
‘Т.
(3.2)
где а - коэффициент теплопередачи из зоны химических реакций
к критическому сечению волны горения; Q — тепловой эффект ре-
акции, с и С| теплоемкость исходной горючей смеси и продук-
тов реакции, соответственно.
Из уравнений (3.1) и (3.2) следует, что обратная массовая ско-
рость горения линейно зависит от начальной температуры:
(up) '=ал — aj„, (3.3)
а точка пересечения прямой (3.3) с осью абсцисс при (up) 1 =--•(>
дает значение критической температуры воспламенения горючей
смесн волной стационарного горения 7'«p = a,1/a1.
Уравнение (3.3) удовлетворительно описывает эксперименталь-
ные данные о скорости горения различных горючих систем, а опрс
деляемые с его помощью значения Тк., находятся в разумном со
гласим с экспериментальными опенками температуры воспламенения
горючих систем при достаточно интенсивном нагреве [3|. Несмо’ря
на это, представления [1.2] были признаны ошибочными из-за "1
сутствия учета в явном виде кинетики химических реакций, скачко-
образного изменения температуры от /,,, до Т и самого поия'пя
о существовании в волне стационарного горения критической тем-
пературы. аналогичной температуре воспламенения.
По-видимому, последняя попытка теоретического осмыслегмя
представлений [11 о процессе горения была сделана в работе !.'ч
Исходным для анализа процесса стационарного горения газо: >'
смесей в работе [76| было дифференциальное уравнение
аг .-о.
где 7. теплопроводность горючей смеси; л — координата, р 7 • ’
учитывает тепловые потери, и доля вступившей в реакцию и- -
». й смеси в сечении волны горения Х(Т), принимается равной нулю
I критическом сечении волны горения х(ЛР) и равной единице при
ьксимальной температуре горения Гг.
I В работе |76| рассмотрены случаи линейной зависимости фх),
жачкообразного изменения г) от 0 до 1, степенная зависимость
~ Л'г, а также квадратичная зависимость, проходящая через ми-
<мум с отрицательным значением гр Последняя зависимость учи-
гвает стадию поглощения тепла при предварительной «активации»
за. Основной вывод работы |76] — пропорциональность скорости
прения корню квадратному из скорости химической реакции Од-
>ко под скоростью химической реакции f как величины, обратно
юпорциональной времени, за которое закончится реакция, в работе
б] понималась средневзвешенная по толщине фронта горения L
юрость перемещения продуктов реакции v относительно исходной
рючей смеси:
г
'/Н>
о
В основе современной теории стационарного горения [77] ле-
нт дифференциальное уравнение теплопроводности в среде с не-
ерывно распределенными источниками тепла
.£(I^)-uf,cr^+pQfe->e'£/',r=0’ (3-5>
< feo — предэкспонентный множитель; последний член учитывает
ловыделение от протекания химических реакций; Е - энергия
гивации; R — универсальная газовая постоянная. В теории rope-
fl температурная зависимость скорости реакции является основной,
семи остальными зависимостями по сравнению с ней можно пре-
бречь. На этом основании пренебрегают температурными зави-
иостями теплопроводности и теплоемкости и уравнение (3.5) запи-
вают в виде
</л" ах ср
? a — температуропроводность.
Таким образом, для анализа процесса горения применялись два
вимонсключающнх подхода. В первом подходе процесс горения
ределяегся прогревом горючей системы до критической темпера-
ры, а тепловыделение от химических реакций рассматривается
к внешний источник тепли. Во втором подходе скорость горения
ределяется скоростью химических реакций при максимальной
Ипературе горения, а физические особенности горючей системы
1еют второстепенное значение.
В обоих подходах основной переменной при исследовании про
ссов горения является температура Г. тогда как более естествен
й переменной для описания лих процессов являются энтальпия г.
151
153
Использован не энергетический характеристики энтальпии по-
зволяет учесть химизм процесса непосредственно в церемонной h
и получить просюйшее и наиболее общее решение задачи о скорости
стационарного горения.
Важнейшим результатом энтальпийного подхода ь анализу про-
цессов горения является установление существования критического
сечения волны стационарного горения Параметры этого сечения-»
максимальная эЕпалышя ft.> и гепловой поток у.-, могут быть опреТ
делены из экспериментальных данных о зависимости скорости го-
рения оз начальной температуры Т. или внешнего теплового пен
тока </„„ при наличии сведений о температурных зависимостях эн*
талыши и плотности горючих систем при соответствующих значе*
ниях давления р. Используя значения ft, и у,, можно построить фц>
зпчески обоснованные зависимости скорости горения от темпера;
туры, давления и рецептурно-технологических факторов.
С другой стороны, из экспериментальных данных о скорости го-
рения можно извлекать определенную информацию о теплофизн-
ческих свойствах горючих систем и процессах теплообмена.
3.2. ОСНОВЫ ТЕОРИИ ТЕПЛОВОГО АНАЛИЗА ПРОЦЕССА ГОРЕНИЯ
В основе анализа любого теплового процесса, в том числе и про-
цесса горения, лежит закон сохранения энергии в элементарном
объеме. В соответствии с этим законом изменение теплового потока
у, проходящего через элементарный слой dx, равно полному из-
менению энтальпии h этого слоя:
5T=f‘77--
7/Л 67I
Представив полную производную dh/dt через частные производ-
ные в переменных координата а* время /, получим
)+'•£(>). <31
где u~dx/dt скорость перемещения слоя.
По аналогии с равновесными системами, совершающими помим
работы расширения другие виды работ [78]. энтальпию горюч»
систем можно рассматривать как сложную величину, включай
щую в себя затраты тепла па нагрев реагента и продуктов peajf
цин ft"" и уменьшение этих затрат юила на величину /i'in! = Qi] И»
та протекания в прогретом слое экзотермических химических реакЦцр
/,=/!• —<2>ь (зА
где Q гепловой эффскд реакции; i) доля петуппвшей в реакЦКР
горючей еистемы.
Подставив (3.9) в (3.8). получим дифференциальное уравнен**
закона сохранения анергии в химически реагирхющей системе
Общепринятое основное дифференциальное уравнение тепловой
деории горения [77] в принятых нами обозначениях имеет вид
<з1|>
и не содержит члена upQ(dt}/dx),. учитывающего тепловыделе-
ние от химических реакций при стационарном процессе.
Таким образом, в работах [72—74], послуживших основанием
современной тепловой теории стационарного горения, при различии
методов решения задачи о скорости стационарного горения до-
пущена одна и та же ошибка: полная производная di]/dt отож-
дествлена с частной производной U7=(dr]/d/),.
Цо поскольку
at \ dt /х' dl \дх /, ' ’
го dr\/dt=(dT\/dt)x только при условии dx/dt = u = O, характерном
для задач воспламенения зажигания, теплового взрыва Для за
дачи стационарного горения u = const>0, и соотношение (3.12)
• имеет вид
=о.
dt \dx/t\dt)x
В соответствии с уравнением (3.11) химизм процесса и в зада-
;че воспламенения, и в задаче стационарного горения определяется
скоростью химической реакции W=(дт]/д1}х, а основное дифферен-
циальное уравнение тепловой теории стационарного горения за-
писывают в виде
£=^=upCp£_pQur (3.13)
Но при стационарном горении существует только одна скорость —
скорость перемещения волны горения как целого. Все остальные
I «скорости» — частные производные от параметров волны горения
чо времени, в том числе и скорость химической реакции W = (di]/
равны нулю.
Правильное дифференциальное уравнение тепловой теории ста-
ционарного горения, вытекающее из закона сохранения энергии
в химически реагирующей системе (3.10), имеет вид
^-ч.(Э,-«р[(^),-«(г),]-
Гае с™ — изобарная теплоемкость смеси инертного реагента и про-
дуктов реакции. Из уравнения (3.14) следует, что в волне стацио-
нарного горения Т(х) при dt/dx=£O существует критическое сече
Ние, в котором выполняются условия:
155
157
(3.15)
(3 1в)
При переходе через критическое сечение производные dq/dxjk
(dh/dx)i меняют знак, и элементарный слой из теплопоглощающе^
превращается в тепловыделяющий. Поэтому критическое сечен*
волны стационарного горения является поверхностью воспламу.
нения горючей системы тепловым потоком, поступающим из зовь
химических реакций. В критическом сечении поступающий из зо2
химических реакций тепловой поток и энтальпия реагента дост!
максимальных значений qm и Температуру критического сеч*,
ния обозначим Т„.
В соответствии с определением энтальпии реакциоиио-способнЫ
системы Ж
Л""—Л
n=-Q-
Прологарифмировав выражение (3.17) и продиффереицира
результат по 1/Т, получим
(3.1
_ / <Япт| X =
1<5(1/Т)А Л“-Л
а в критическом сечений с учетом условия (3.15)
_ ( ?|п1 \ - ^C(^)
(3.
где Т" — температура, до которой можно нагреть инертную горюч;
систему количеством тепла hm.
В соответствии с уравнениями химической кинетики (79]
П = Ы; п=1~е“; 4=1—4 =
(3.
для реакции нулевого, первого, второго и третьего порядка;
k = koe Е,рт. (3-4'
При стационарном процессе все параметры в^лны горения *
зависят от времени, поэтому t в уравнениях (3.19) имеет некоторое
характерное для данного режима горения постоянное значение f •
Подставив (3.19) и (3.20) в уравнение (3.18). получим зав"
симость энергии активации от тепловых параметров волны
ния [9]
Tlcr(T„)
Е 1 ) f / \
R “ Л“" (!„)-*"'(Т*) W
A
(3-fl)
158
Функция /„(,]) для порядка реакции п имеет вид
, ) (,5ZZ’
fsbl) j-fj’fsbl) —r;)(l — r)/2)
s для малых t] может быть записана в более удобном для исполь-
;ования виде
/„(n)«l+f>l (3.23)
Пренебрегая изменением теплоемкости в области температур
от 7'” до Т„, получим из уравнения (3.21) для реакции нулевого
порядка
Е Л
Т.-Т* ’
Уравнение (3.24) совпадает с уравнением работы [80] для
температуры воспламенения газовой смеси, помещенной в сосуд с
температурой стенок Т'
Таким образом, понятие о критической температуре, аналогич-
ной температуре воспламенения, является фундаментальным в теории
стационарного горения. В этом плане классические представления
[1], основанные на уравнении теплового баланса в критическом
сечении волны горения, описывают предельный, идеализированный
процесс горения прн бесконечной энергии активации. Но из-за не-
большого различия между Т' и Тт, а оно составляет от не-
скольких градусов до нескольких десятков градусов при порядке ве-
личины Г" 500 . . . 1500 К, классический подход дает хорошие ре-
зультаты при описании экспериментальных данных о скорости го-
рения.
В последующих исследованиях классический подход подвергал-
ся критике за отсутствие учета в явном виде кинетики химических
реакций и к началу 1930-х гг. был окончательно признан ошибоч-
ным. Однако учет химизма процесса горения, принятый в современ-
ной теории, явился, по-существу, шагом назад в понимании про-
цесса стационарного горения по сравнению с классическими пред-
ставлениями Необходимо отметить, что к 1930 г. были созданы все
предпосылки для естественного развития теории горения как обоб-
щения классического подхода с учетом кинетики химических реак-
ций и существовало правильно сформулированное [76] дифферен-
циальное уравнение стационарного горения (3.5), но оно не было
Цолжным образом использовано автором.
Одиако дальнейшее развитие теории горения было основано иа
использовании уравнения (3.13), представляющего собой соедине-
гие двух несовместимых вещей — стационарного уравнения тепло-
проводности инертной среды и нестационарного тепловыделения
пт протекания химических реакций. Попытки решения уравнения
(3.13) связаны с большими математическими трудностями, а полу-
159
чаемые результаты плохо согласуются с экспериментом. В сощ.
ветствии с решением [73] уравнения (3.13) скорость горения про.
порциональна корню квадратному из скорости химических реакций
при максимальной температуре горения Тг, а все процессы, проис.
ходящие при более низких температурах, являются малозначащими
деталями, точный учет которых приводит к усложнению решения без
заметного улучшения получаемых результатов. Побочным следст-
вием такого вывода явилось отсутствие необходимости надежных
данных о теплофизических свойствах горючих веществ и смесей
при анализе процесса горения. Поэтому в настоящее время под.
ровные сведения о теплофизнческих свойствах получены только для
таких горючих веществ и систем, которые применялись для целей, ц(.
связанных с горением.
При правильной формулировке основного дифференциального
уравнения тепловой теории стационарного горения его решение
не представляет труда. Проинтегрировав уравнение (3.14) от на-
чального состояния h = h(T„), q=0 до произвольного сечения волны
горения Т(х\ получим
“P=Mrffi'(rJ- <3-25)
Скорость стационарного горения полностью определена, если
хотя бы для одного сечеиия волны горения Т(х) известны значения
тепловых параметров волны горения </[х(7')| и Л[Г(х)|. Выбрав в ка-
честве определяющих скорость горения параметры критического се-
чеиия, получим
(326)
ИЛИ
(“₽)" =“^(r-)- (3 27)
Анализ экспериментальных данных о скорости горения различ-
ных горючих систем в координатах (up)-1— й(Г„) свидетельствует
о линейности зависимости (up)~'=f[/i(t„)] [8, 9), а это возможно
только при постоянстве параметров и qm. Этот результат — неза-
висимость определяющих параметров волны горения hm и q„, от на-
чальной температуры Т„—можно было предположить заранее, по |
скольку Лт и qm соответствуют точкам максимума на кривых й[Г(х)] я
<; |х(Г)], а положение точки максимума не должно зависеть от начала
движения по кривой.
Эта особенность критического сечеиия волны горения открыва-
ет новые возможности исследований и процесса горения, и тепло-
физических свойств горючих систем, и процессов теплообмена на
основании анализа экспериментальных данных о скорости горения
Ниже рассмотрены результаты анализа экспериментальных дайны*
о скорости горения различных горючих систем, а здесь отметим,
что параметры hm и q„ зависят от давления р для гомогенных си
стем, а для конденсированных гетерогенных систем зависят еше я
160
г пористости П, дисперсности компонентов d, и их содержания в
<еси у,. Поэтому в общем случае уравнение (3.26) следует записы-
1ть в виде
UO = Ч"(р' П’ У,) И
(р. П, d„ «,)—Л (Т„, р, у,) ’
для корректного анализа экспериментальных данных о скорости
рения необходимо располагать зависимостями плотности и эн-
1ЛЫ1НИ горючей системы от температуры, давления и состава
геси.
Из уравнения (3.25) следует, что протекание химических реак-
|й двояким образом влияет иа скорость стациоиариого горения:
рез тепловой поток v(x(T)], представляющий собой часть общего
пловыделеиия от протекания химических реакций при высоких
мпературах, достигающую сечеиия волны горения Т(х), и через
ггальпию /г(Г(х)|, включающую в себя тепловыделение от проте-
|иия химических реакций в прогретом слое горючей системы.
с. 3.1. Схематическая зависимость
определения температур в волне
стационарного горения
Рис. 3.2. Схематическая зависи-
мость энтальпии реакционно-спо-
собной системы й=Л”'—й*"" от
температуры (сплошная линия):
------------ энтальпия инертной
системы h""', —«------ — тепловы-
деление от протекания химических
реакций й’им
На рис. 3.1. и 3.2 схематически показаны зависимости Т(х) и
Т(л)| в волне стационарного горения. Энтальпия слоя горючей
стемы достигает максимального значения ftm при температуре
. При дальнейшем продвижении вверх по кривой Г(х) теп-
выделение от протекания химических реакций в слое за фикси-
ванное время I начинает преобладать над затратами тепла на
грев реагента и продуктов реакции. В результате этого зависи-
161
мость Л(Г) проходит через нулевое значение при Т = затем ста-
новится отрицательной, проходя через минимальное значение Л
соответствующее максимуму тепловыделения при температуре
и в пределе при т)-*1 становится равной нулю при максимальной
температуре горения Тг. Таким образом, в волне стационарного
горения можно выделить пять характерных температур: началь-
ную Т„, максимума теплопоглощения Т„, адиабатического се-
чения волны горения Т,, максимума тепловыделения Г* и мак-
симальную температуру горения Тг. Изменение начальной тем-
пературы Т„ приводит к соответствующему изменению температур
Т, и Т,, а температуры Т„, и Г* при этом должны оставаться неизмен-
ными.
По ориентировочным оценкам, для нитроцеллюлозных порохов
температура Т, близка к экспериментально наблюдаемым значе-
ниям температуры поверхности горения на границе конденсирован-
ной и газовой фаз.
Для температуры Th трудно получить достаточно надежные
оценки, поскольку необходимо располагать точной высокотемпе-
ратурной кинетикой. Важность же для анализа процесса горения
этого второго критического сечения волны горения очень велика.
Очевидно, что устойчивое самоподдерживающееся горение возмож-
но только в том случае, если максимум тепловыделения при темпе-
ратуре Th превышает максимум теплопоглощения при температуре
Т„.
Важными характеристиками при теоретическом анализе и прак-
тическом использовании процессов горения являются температур-
ный коэффициент скорости горения
p=[dln(up)/dT]p
и показатель
v=[dln(izp)/dlnp]r .
Из уравнения (3.28) получим следующие выражения для р и v:
,зя
dh„(p) Г<МЛ.Р)1
__ dlnp„ (р) dp I др JTi
' ~ dlnp Р h„(p)-h(T„p)
Из уравнения (3.29) видно, что р определяется теплофизически-
ми свойствами горючей системы при начальных условиях и мак-
симальной энтальпией. Следовательно, р определяется природой
горючей системы и протеканием химических реакций в прогретом
слое, но не зависит от высокотемпературных химических реакции
и условий теплообмена с окружающей средой. В этом плане темпе-
ратурный коэффициент скорости горения является внутренней *я'
162
сгернстикой горючей системы и можно провести аналогицо меж-
Р и обычными равновесными термодинамическими свойствами,
увеличением начальной температуры р возрастает нз-за увели
1ия энтальпии, а при температуре фазового перехода, соп1рОвож
ощегося скачкообразным возрастанием энтальпии, происходит
лъетствующее скачкообразное возрастание р. Для ряда г<Орючих
тем в исследованном диапазоне начальных температур на|блюда-
:я изменение режима горения, сопровождающееся скачк<ообраз-
м возрастанием определяющих параметров волны горе|НИя й„
q„. При начальных температурах, соответствующих изменению
жима горения, происходит скачкообразное уменьшение ft с По-
г дующим возрастанием при дальнейшем повышении начальной
мнературы. Для многих горючих систем h„ является возр)астаю.
й функцией давления, и соответственно ₽ уменьшается П|рН уве.
чении давления.
Показатель v зависит как от протекания химических реакций
и высоких температурах, так и от протекания химических реакций
прогретом слое, но в основном отражает внешний аспект Гпроцес-
горения. Поэтому в зависимости от условий теплообмену горн-
его образца с окружающей средой, обусловленных размерами
формой образца, конструктивными особенностями устройства для
кигания обдувом или облучением образца и т. д., при од^инако-
jx р и Т„ возможны совершенно различные значения показутеЛя v,
скорости горения и, а коэффициент ₽ будет оставаться неизм енным.
Таким образом, для переноса установленных при исслед.овании
сдельных образцов закономерностей горения на реальные изде-
<я необходимо знать различия условий теплообмена в реальных
модельных условиях.
Еще одной важной закономерностью процесса стацион арного
.рения, установленной на основании анализа экспериментальных
знных, является скачкообразное возрастание определяющих па.
аметров волны горения h„ и qm после достижения некоторых пре-
рльных значений начальной температуры или внешнего теПлово-
потока. Однако при анализе экспериментальных даннь1х при
Мсоких начальных температурах следует соблюдать опреде;1енНуЮ
сторожность, так как появление нового режима горения может
1,ть кажущимся и связанным с тем, что из-за протекания химиче
них реакций за время термостатирования действительная Читаль-
ня образна будет ниже используемой при анализе эксперИмен-
альных данных энтальпии инертного образца
Таким образом, процесс горения является сложным физико-
имическим явлением, при анализе которого нельзя даже временно
ренебречь ни физической, ни химической составляющей. В основе
иализа процесса горения лежит закон сохранения энергии в хи_
шчески реагирующей среде, а для определения скорости г<эрецИЯ
еобходимо располагать данными о теплофизических свовств2Х
«агента и процессах теплообмена поверхности воспламенения
зоной высокотемпературных химических реакций и окружвющей
163
средой. Поэтому раздел физики горения и взрыва, относящийся
к стационарному горению, уместно назвать теплофизикой горения.
3.3. АНАЛИЗ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О СКОРОСТИ ГОРЕНИЯ
3.3.1. Газовые смеси
Для применения энтальпийного подхода к анализу процессов
горения необходимо располагать экспериментальными значениями
скорости горения при различных начальных температурах и зависи-
мостями энтальпии и плотности горючих систем от температуры.
Температурные зависимости энтальпии и плотности получали
интегрированием соответствующих зависимостей для теплоемкости
и коэффициента теплового расширения. Значения р и ft смесей вы-
числяли по аддитивным формулам. За начало отсчета энтальпии
А=0 принята температура То=293,15 К.
В табл. 3.1 приведены оценки тепловых параметров hm и q„ вол-
ны горения для смесей водорода с воздухом и метана с воздухом
на основании приведенных в книге [81] данных Пассауэра о ско-
рости горения при атмосферном давлении и для смесей природного
газа с воздухом на основании данных [82] о скорости горения при
различных давлениях. В табл. 3.1 указаны также диапазон началь-
ных температур Т„ и давление, при которых определялась скорость
горения, средняя квадратичная погрешность аппроксимации экспе-
риментальных данных о скорости горения би, значения темпера-
тур Т* и вычисленных при £=167,5 кДж/моль температур крити-
ческого сечения волны горения Т„.
Полученные из данных [81] зависимости (up)_ 1 =f [h(T„) ]
могут быть представлены двумя отрезками прямых, пересекаю-
щихся при Т„ = 573 ... 623 К- Это свидетельствует о существовании
двух режимов горения смесей водорода и метана с воздухом. Для
низкотемпературного режима горения полученные значения Т„
находятся в разумном согласии с имеющимися в литературе све-
дениями о температуре самовоспламенения газовых смесей.
Повышение давления, как показывает анализ данных [82], при-
водит к небольшому уменьшению ftra и сильному возрастанию qm.
Приведенные в табл. 3.1 значения ftm и q„ для смеси природного
газа с воздухом при объемной доле горючего 9,5 % можно описать
уравнениями:
ftm(p)=557,41 - 7,633р [кДж/кг]; (3.31)
<?„(р)=----------------- [кВт/м2]. (3.32)
m 7 1 + 1,2295р—0.06527л2 1/1
Уравнение (3.28) с ftm(p) (3.31) и q„(p) (3.32) воспроизводит
экспериментальные данные [82] о скорости горения метано-воз-
душной смеси в области начальных температур 7„=323... 473 К
и давлений р=0,1 ...6,9 МПа со средней квадратичной погреш-
ностью Ей = 2,5 %.
164
Тепловые параметры волны горения газовых смесей
165
В работе [83J приведены результаты исследования скорости го-
рения взвеси алюминиевого порошка со средним размером частиц
(1-5,7 мкм в воздухе. Содержание алюминия в газовзвеси состав-
ляло 0,45 кг/м3. Экспериментальные данные [83J в области Т„ =
= 348... 594 К воспроизводит уравнение (3.28) с параметрами
Л„=684 кДж/кг и qm = 139,4 кВт/м2. Значение hm соответствует
нагреву смеси до температуры плавления алюминия 933,6 К и ча
стичному расплавлению содержащегося в смеси алюминия.
В работе [84J проведены исследования скорости горения кис-
лородных смесей фторпроизводных пропилена в области /'„ = 273 .. .
.. . 500 К. В отличие от всех других горючих систем массовая ско-
рость горения этих смесей уменьшается с повышением начальной
температуры. Такое аномальное поредение зависимости up=f(T„)
связано с цепочно-тепловым механизмом горения данных смесей.
Обозначив и, не зависящую от начальной температуры состав-
ляющую скорости горения, обусловленную протеканием цепных
реакций, можно записать
взз)
где ио — обусловленная тепловым механизмом составляющая ско-
рости горения при начальной температуре 7с; а~и,./ие.
В пределе при а->-1 (когда вклад цепного и теплового механиз-
ма в процесс горения примерно одинаков) уравнение (3.33) при-
нимает вид
(3.34)
Используя уравнение (3.34) из экспериментальной зависимости
ы(7„) можно получить оценки ис и 7’ в первом приближении, а затем
проводить обычный тепловой анвлиз для разности скоростей горе-
ния и — ис. Анализ экспериментальных данных [84] для смеси с
объемной долей гексафторпропилена C^Fc 40 % и кислорода 60 %
дает ис=0,123 м/с, что составляет от общей скорости горения 79 %
при 7„=273 К и 60 % при 7„ = 500 К. Из анализа зависимости
[(« —«,)р] '=,4^7;.)] получено ft„=938 кДж/кг. /?- =
= 110,5 кВт/м2, 7*=1067 К, 7„=1147 К при £=138 кДж/моль.
Авторами работы [85] при исследовании процесса самовоспла-
менения кислородных смесей гексафторпропилена обнаружен пере-
ход от цепного воспламенения при Т=555 К, при котором происходит
разогрев смеси до Т~1000 К, к цепочно-тепловому воспламенению
при 7 = 558 К, при котором происходит резкий разогрев смеси до
7 -2500 К.
По-видимому, температура Т„ критического сечения волны го-
рения этих смесей соответствует максимальной температуре при
чисто цепном механизме горения.
166
3.3.2. Взрывчатые вещества
В табл. 3.2 приведены значения тепловых параметров hm и q„,
полученные на основании данных [86, 87] о скорости горения нит-
^огликоля при атмосферном давлении и данных [88] о скорости
горения гексогена при различных давлениях. В табл. 3.2 кроме пара-
метров, приведенных в табл. 3.1, указаны также значения темпе-
ратуры кипения 7К„П исследованных веществ при соответствующих
давлениях. При оценке Т„ использованы значения Е — 146,5 кДж/моль
для нитрогликоля и £=175,8 кДж/моль для гексогена.
Энтальпию жидкого нитрогликоля рассчитывали по уравнению
й, = ~ 28,04 + 1,3831 (7- 273,15)+0,9514 • 103 (7 - 273,15)2 [кДж/кг].
По оценке [87] количество теплоты испарения нитрогликоля
составляет ДЛИС„ = 391 кДж/кг. Температурная зависимость плот-
ности нитрогликоля была оценена по аналогии с температурной
зависимостью плотности глицерина.
Энтальпию твердого гексогена при 7475,65 К рассчитывали
по уравнению
h,„ = — 20,14 0,9786(7—273,15)+0,14137 -102(7 — 273,15)2 [кДж/кг],
а для жидкого гексогена при 7^475,65 К использовали уравнение
/г„, = 67,78 + 1,074 (7 - 273,15)+0,179 -10“2 (7 - 273,1Sf [кДж/кг].
Идя расчета плотности твердого гексогена при различных значе-
<иях температуры использовали коэффициент объемного расши-
|ения а„= 1,8-10“’ К-1-
В зависимости от диапазона начальных температур наблюда-
тся несколько режимов горения нитрогликоля. При 7<2 293 .К
m меньше энтальпии кипящей жидкости ft'=286,6 кДж/кг и кри-
ическое сечение волны горения находится в конденсированной
газе, а Т„ очень близка к температуре кипения 7КИ11. При 293 К< 7<
С 395 К hm больше энтальпии кипящей жидкости ft', но меньше
нтальпии насыщенного пара ft"=686 кДж/кг. Для этого режима
орения также 7m = 7KHn, но в критическом сечении волны горения
сщество находится в двухфазном состоянии. При 7„>373 К ftm>ft"
I критическое сечение находится в газовой фазе при Т„ на 50.. .
. . 100 К выше температуры кипения. Однако возможно, что в дей-
твительности этого третьего режима горения не существует и его
юявление обусловлено некорретностью анализа экспериментальных
(энных из-за неучета частичного разложения нитрогликоля в про-
весе термостатирования при повышенных температурах.
При горении гексогена для всех исследованных давлений кри-
тическое сечение волны горения находится в конденсированной
]>азе, а Т„ близка к температуре кипения 7КИП. Поэтому можно при-
1ять Tm = Tmu и вычислить соответствующие этому условию значе-
ния 7 и ftra, а из экспериментальных данных о скорости горения
определить согласованное с новым значением ftm значение теплового
167
168
потока q„. Скорректированные значения ft,,, во всем исследованном
диапазоне давлений воспроизводятся уравнением
ft,,, (Р) = 775.95 + 91,731пр—6,8317 (1пр/ [кДж/кг].
Зависимость р,„(р) имеет излом при р = 0,98 МПа и для ее анпрок
симации использованы два уравнения:
в области р = 0.098 . . . 0.98 МПа
(р) = —40,5 + 3854,9р — 1271,9р- IkBt/m’I
в области р = 0,98 . 4,9 МПа
q„, (р)= -2035,1 + 4968,2р-334,1 Зр~ [кВт/м2].
Уравнение (3.28) с полученными зависимостями h„,(p) и р,„(р)
описывает исходные экспериментальные данные о скорости горе
ния гексогена во всем исследованном диапазоне Т„ и р с той же
погрешностью, что и при раздельном описании экспериментальных
данных для каждого давления.
Доля вступившего в реакцию гексогена в критическом сечении
волны горения невелика и составляет несколько процентов. На
пример, при р=4,9 МПа и £=175,8 кДж/моль г;(7,„)=3,4 %.
Исходя из фиксированных значений h,„ и Г и задаваясь различ-
ными значениями энергии активации £, по уравнению (3.24) мож-
но вычислить зависимость £,„(£) и соответствующие значения эн-
тальпии Л"н|7„(£)], а по уравнению (3.17) —зависимость!; |7„(£)],
Подставив значения i;|7^(£)] в уравнения химической кинетики
(3.19), можно вычислить произведение предэкспонентного множи-
теля М>.и характерного времени / Зависимости lg(W*)=f(£),
показанные на рис, 3.3 для р = 0,098 МПа и р = 4,9 МПа, близки к
прямым Значения кинетических параметров ko и Е гексогена [3|,
полученные разными авторами и в различных условиях, также
укладываются на прямую линию в координатах £, lgft0. Расстоя-
ние между этими прямыми определяет значение которое мож-
но рассматривать как время протекания химической реакции в
прогретом слое, отнесенное к температуре Тщ. При £=175,8 кДж/моль
t составляет 0.74-10 2 с для р = 0,098 МПа и 0,11-10 5 с для р =
= 4,9 МПа.
В соответствии с уравнением (3.30) показатель v является слож-
ной функцией давления и уменьшается с ростом температуры. По
казатель v определяется не только природой горючей системы и
кинетикой химических реакций в прогретом слое, но и высокотем-
пературной кинетикой и теплообменом с окружающей средой По-
следний фактор может приводить к большим различиям значений
скорости горения и зависимостей v(p), полученных разными авто-
рами.
В частности, полученные в работе [89] значения скорости го-
рения гексогена при Г„ = 293 К и р = 0 49 МПа и р = 4,9 МПа выше
данных [88] на 43,2 и 19,4 % соответственно, а построенные
по уравнению (3.30) на основании данных [88. 89] и показанные
IBS)
Рнс. 3.3. Зависимость лредэкспонентного множителя ku
от энергии активизации Е для гексогена:
/ - |g£0=j(E) по данным [3] о термическом разложе-
нии гексогена; 2 — = ДЕ) при р=0,098 МПа.
Л„,=561.9 кДж/кг; 3 — )=f{E) при р=4,9 МПа.
Лт=912,9 кДж/кг
на рис. 3.4 зависимости v(p) совершенно различны. При этом для
обеих групп данных для построения зависимости v(p) использо-
валась одна н та же зависимость hm(p).
Рис. 3.4. Зависимость показателя
v = [dln(wp)/dlnpj j. гексогена от
давления при Ги=293 К:
----— — расчет по уравнению (3.30)
на основании обработки данных
[88]; ----- расчет по урав-
нению (3.30) на основании об-
работки данных (89|; О. А — срет-
ние значения v между соседними
экспериментальными точками
3.3.3. Нитроцеллюлозные пороха
В табл. 3.3 приведены значения тепловых параметров h,n и q,^
полученные на основании экспериментальных данных различных
авторов о скорости горения пороха Н. Порох Н содержит 58 %
коллоксилина. 28 % нитроглицерина. 12 % ди нитротолуол а, по 1 %
централита и вазелина [90]. Плотность пороха при нормальных
условиях р=1600 кг/м3.
170
Таблица 3.3
Тепловые параметры волны горення ннтроглнцернновых порогов
Порох Источник данных г„. К р. МПа Ьт* кДж/ы кВт/>1 614. %
И |Н1| 273 , 291 0.098 63,8 55?
291 .373 0,098 197,3 164 2.5
н 190, 92) 77 . .273 0,098 62,7 82.' 1.4
323. 373 0.098 199,5 258 —
123, .323 1,96 246,4 1152 1.1
323. .413 1.96 325,2 1590 0,7
н 1931 213. , 375 3,04 336,2 2237 2.8
248. .376 4.02 398.9 3254 3.2
•251 376 5.00 387,1 3656 2.7
Н на воздухе 1931 195. . 343 0,098 172,5 190 2,7
358. , 388 0,098 254,4 363 0,4
Н в струе азота |93| 195. .358 0.098 171,8 162 3.3
Н + 1 % с |94| 293. . 393 0,098 281 368 2.2
Н +1 % РЬО |941 293. . 393 0,098 .«2 395 1.2
При низких давлениях наблюдаются два режима горения по-
роха Н По мере повышения давления различие между тепловыми
параметрами низко- и высокотемпературного режимов горения
уменьшается и начиная с р~3 МПа экспериментальные данные
о скорости горения укладываются на единую прямую (нр) ' =
Параметры h,„ и qm увеличиваются с ростом давления.
При атмосферном давлении значения скорости горения пороха
Н. полученные в работе [91), в 1,5 .. . 1,6 раза ниже результатов,
полученных в работах [90, 92]. Однако значения максимальной
Энтальпии для обоих наборов экспериментальных данных одина-
ковы. и различие скоростей горения связано с различием тепло-
кых потоков qm, обусловленным разными условиями теплообмена
1ри проведении эксперимента. Еще более наглядно влияние тепло-
обмена с окружающей средой на скорость горения продемонстри-
ювано в работе [93|. Сжигание идентичных образцов пороха Н
лроводи-юсь на воздухе и в слабой струе азота. Во втором случае
из-за увеличения теплоотвода в окружающую среду q„: и и умень-
шаются на 15%, но значение Л,, остается постоянным.
I Введение небольшого количества добавок в порох Н приводит
|к сильному изменению тепловых параметров h„, и q,„. Добавка всего
лишь I % сажи или оксида свинца [94] приводит к увеличению
параметров ft,,, и </,„ в 1.4 . . 1,6 раза по сравнению с данными
[90. 92] для пороха Н
Температура самовоспламенения Гя пороха Н, полученная раз
личными методами, составляет 450 . 480 К |3]. Этим температу-
рам соответствуют значения энтальпии инертного пороха ft"" —
-=248... 309 кДж/кг. Поэтому следует ожидать, что для по-
171
роха 11 h,„>300 кДж/кг. Однако это условие выполняется только
при повышенных давлениях р>2 МПа. При атмосферном давлении
значения йга, выделенные из данных [90. 92] соответствуют темпе
ратурам Т' =341 К для низкотемпературного режима горения и
/"=449 К для высокотемпературного режима горения. Такой про-
тивоестественный результат, когда полученная в результате анализа
экспериментальных данных температура критического сечения вол
ны горения ниже температуры самовоспламенения, обусловлен
очагово пульсирующим характером горения пороха при низких
давлениях [95, 96). Выделяемые из анализа экспериментальных
данных параметры й,„ и q,„ относятся ко всей поверхности пороха
но при очагово-пульсирующем горении каждое мгновение воспла
менена только часть поверхности. Поэтому отношение Л„,/Л""(7',)
дает представление об усредненной доле воспламененной поверх
ностн при очагово-пульсирующем горении
При постоянном давлении скорость горения может изменяться
не только в результате изменения начальной температуры, но и
в результате облучения горящего образца от внешнего источника
тепловым потоком В этом случае тепловой поток в критическом
сечении волны горения определяется выражением
<7„. = <?„,„+(3-35)
где qmQ— тепловой поток в критическом сечении волны горения
в отсутствие облучения; £ доля внешнего теплового потока, до-
стигающего критического сечения волны горения.
По экспериментальным оценкам [93| при горении пороха Н
потери светового потока на поглощение в продуктах сгорания и
отражение от поверхности горения составляют 25... 30 % и
t = o,7 . . . 0,75.
Обычно исследования скорости горения порохов под действием
облучения проводят при Тк = 293 К, когда й(7’и)=0. Поэтому уравне-
ние (3.26) в этом случае принимает вид
• (3-36)
ш 11m
Скорость горения должна линейно зависеть от внешнего тег.
левого потока qm. наклон этой прямой определяет значение мак-
симальной энтальпии йя/5, а отсекаемое на оси абсцисс значение
теплового потока определяет значение
В табл. 3 4 сопоставлены тепловые параметры волны горения
нитроцеллюлозных порохов при атмосферном давлении, получен-
ные из анализа зависимостей up=f(qtH) и пр = ^[Л(7'„) | и оцененные
в результате этого сопоставления значения |. Для пороха Н полу-
ченное нами значение g очень хорошо согласуется с независимой
оценкой [93J. Зависимость up — ffqw), так же как и зависимость
(up) l=f[h(T„,)[, имеет два линейных участка, причем параметры
hm и q„,t, при малых тепловых потоках совпадают со значениями
172
173
hm и qm для низкотемпературного режима горения, а при больших
тепловых потоках — со значениями hnl и qm для высокотемператур
иого режима горения. В работе [97) проведены исследования ско-
рости горения пироксилина с 1 % сажи под действием облучения,
а зависимость скорости горения от начальной температуры не ис-
следовалась. Поэтому в табл. 3.4 в скобках приведены значения
hm и qmt пересчитанные из полученных из зависимости ыр —Д^вн)
параметров с учетом £=0,65, характерного для пироксилина.
Температура кипения летучих компонентов пороха Н и возмож-
ных продуктов разложения нитроцеллюлозы составляет 523 . . . 553 К
[87]. Этим температурам соответствует энтальпия инертного по-
роха Лин = 405 . . 478 кДж/кг, а приведенные в табл. 3.3 и 3.4 зна-
чения h,n ниже. Поэтому для всех исследованных нитроцеллюлоз-
ных порохов критическое сечение волны горения находится в кон-
денсированной фазе. Единственное исключение составляет горе-
ние пороха Н 4- 1 % РЬО под действием высокоинтёнсивного об-
лучения. Для этого режима горения 1090 кДж/кг и h,tl =
= 747 кДж/кг при £ = 0,685. Такого количества теплоты достаточно
для нагрева пороха до температуры кипения летучих компонентов
и их испарения. Поэтому в данном случае критическое сечение волны
горения должно находиться в газовой фазе.
3.3.4. Пиротехнические и СВС-системы
Пиротехнические и СВС-системы представляют собой уплот-
ненные смеси потников различных веществ. Скорость их горения
зависит не только от температуры, давления н состава смеси, как
для рассмотренных выше гомогенных систем, но и от пористости
образца, дисперсности компонентов и других факторов.
Значения тепловых параметров пиротехнических [98) и СВС си-
стем [99—103) приведены в табл. 3.5. Исследования скорости
горения пиротехнических смесей проведены при атмосферном дав-
лении в среде воздуха. Исследования скорости горения СВС-си
стем проведены в среде инертного газа (гелия или аргона). Скорость
горения исследованных СВС-систем вплоть до р—10 МПа не за-
висит от давления В табл. 3.5 указаны содержание компонентов
смесей по массе, пористость П смеси, а также значения hm. q~,. bti н
Т* для различных диапазонов начальных температур 7Н.
Для ряда смесей наблюдается два режима горения, причем
для низкотемпературного режима горения смесей 0,5 W 4-0.5 KCIOi.
0.12 В4-0.88 FejOc 0,8 Ti 4-0.2 С значения Г* заведомо ниже тем-
пературы самовоспламенения. Это свидетельствует об очагово-
пульсирующем режиме горения этих смесей при низких начальных
температурах.
Значения Г’ для устойчивых и высокотемпературных режимов
горения находятся в разумном согласии с экспериментальными
оценками температур зажигания смесей. Для смеси 0.5VV4-0.5КСЮ
fi„ соответствует началу плавления перхлората калия. Для смеси
0.31 4g4-0.69 Fe.-О» hfl соответствует началу кипения магния.
17!
Таблица 3.5
Тепловые параметры аолны горем ня пиротехнических
н СВС-снстем
Система TH, к II h„. кДж/hr q.,„ кВт/м bit. о/ To п. к
X5W+0.5KCIO4 293 . .393 0.08 126.9 1013 1.0 533
|«8[ 493 668 0.08 388.9 5708 0.8 855
X12B+0,88Fe2O« 289 - .383 0 49 257.5 6217 588
|98| 508. .668 0.49 570.4 20 690 1.6 877
6.31Mg+0,69Fe2O3 |98] 293 .673 0.32 1275 19080 2.1 1368
0.25Al+0.75Fe>0, 293 . - 573 0.42 536.7 26 530 2.4 885
(98| 573 . . 723 0,42 735,4 43 770 0.1 964
0,825Си+0.175А1 199] 623. . 773 0.4 308,2 1134 2.1 883
0,53Zr 4-0.47AI (1001 293. .673 0.4 422,3 8972 3.7 931.4
0,63Zr + 0,37Al 1100] 293 . . 573 11.4 490,7 16 190 1.4 933,6
0,46Ti + 0,54Fe 1101] 1023 . 1173 0.4 669,2 40 080 2.2 1285
0.8Ti + 0,2C* 293 . . 773 0,45 515 21 370 3.4 972
П02| 973. 1123 0.45 941 84 750 0.6 1355
0.5Ti+0,5C** (103] 1023 . 1173 0.3 1579 3935 1.4 1630
* Сажа ламповая.
'* Графит реакторный.
Цля всех смесей, содержащих алюминий, включая взвесь алюми-
(иевого порошка в воздухе [83], значения й,„ соответствуют нагреву
:месей до температуры плавления алюминия. Для смеси 0,25 А1-р
-f-0.75 FcjOj наблюдаются два режима горения, а температура
фитического сечения волны горения Т„, близка к температуре плав-
ания алюминия. Однако для низкотемпературного режима го-
>ения алюминий только начинает плавиться, а для высокотемпера-
урного режима горения весь алюминий в смеси расплавлен.
В работе [ 1(>4| проведены исследования скорости горения смеси
),46 Mg4-0,54 NaNO;, в области температур Тк = 213 . . . 473 К при
изменении пористости образцов П от 0,02 до 0,3 среднего размера
частиц окислителя d0 от 28 до 490 мкм; среднего размера частиц
магния от 18 до 182 мкм Выделенные из данных [104] значения
и qm в зависимости от d„. d„, П показаны на рис. 3.5 и 3.6. Зна-
чения h,„ смеси не зависят от пористости и линейно возрастают
при увеличении среднего размера частиц окислителя и металла.
Значения qm прямо пропорциональны П и d,. и обратно пропорции
нальны d„. Всю совокупность данных [104] о скорости горения
смеси 0.46 Mg4-0,54 NaNOa воспроизводит уравнение (3.28), в
175
котором Л„ = 503,88+ 0.36025d + 0,42257+, |кДж/кг]. </„, = 4627 +
+ 11113П + 9.9613+ + 117340с/„ 1 [кВт/м2] (d„ и d„ измеряются
в микрометрах).
о,г аз п
Рис. 3.5. Зависимость максимальной энтальпии пК1 от
среднего размера частиц окислителя d-, (----), сред-
него размера частиц металла d„ (------------) и порис-
тости П (----------) для смеси 0,46 Mg 4-0,54 NaNO>:
О — hm=f(d«), dM = 130 мкм, Г1 = 0,2; 1 —
</ii=l20 мкм, 11 = 0.2; □ — йт = /'(П). d()=l20 мкм,
dM=l30 мкм
Выделенные из анализа экспериментальных данных значения
/г„ соответствуют нагреву смеси до температуры Г’ = 630. . . 750 К.
Таким образом, в критическом сечении волны горения смеси
0,46 Mg + 0,54 NaNOa окислитель находится в жидком состоянии,
а металл — в твердом.
Для оценки влияния пористости смеси и дисперсности компо-
нентов на скорость горения конденсированных гетерогенных систем
по аналогии с |i можно использовать коэффициент скорости горения
по пористости
а _Г€,1п("1,,1 Г'’|,,<МП-4“О'
Р| 1 “ L <)П J т,,. “ I ап ~
(3.37)
и коэффициент скорости горения по дисперсности компонентов
й Г din («р) 1 [~ (П. Д,) | Н„, м
I д“- 1г„.п 1 к.п '
(3.38)
Рис. 3.6. Зависимость теплвввг* потока qm от среднего
размера частиц окислители do (-------). среднего раз-
мера частиц металла dM (-------------) я пористости П
(-----------) для смеси 0,46 Mg+0,54 NaNO3:
О - <7,n=/(do). dM = I30 мкм, П=0,2; Д — qm=f(d„).
do=l20 мкм. П=0.2; □ — do =120 мкм, dM =
130 мкм
Для дайной смеси коэффициент 0П отражает внешний аспект
процесса горения и не зависит от начальной температуры, а коэф-
фициенты зависят от всех четырех варьируемых факторов Тн,
П, do, dM.
ЗАКЛЮЧЕНИЕ
Строгий теоретический анализ показывает, а экспериментальные
данные подтверждают, что понятие о критической температуре,
аналогичной температуре воспламенения, является фундаменталь-
ным в теории стационарного горения.
Неспособность теории [73J, основанной на концепции об опре-
деляющей роли максимальной температуры горения, правильно
описывать экспериментальные данные о скорости горения, особен-
но для конденсированных систем, привела к появлению представ-
лений об определяющей роли некоторой «эффективной» темпера-
туры [105], температуры кипения как максимальной температуры
конденсированной фазы [106], температуры поверхности горения
как границы между конденсированной и газовой фазами [7]. Ло-
176
177
гическим следствием постепенного понижения определяющей тем-
пературы при попытках согласования теории с экспериментом яв-
ляется возврат к классическим представлениям [1, 2| об опреде-
ляющей роли критической температуры, аналогичной температуре
воспламенения. Однако этот возврат происходит на качественно
новой основе и при этом учитывается протекание химических ре-
акций и в прогретом слое, и в зоне высоких температур. Возможность
такого учета обусловлена использованием в качестве определяю-
щей процесс горения переменной энергетической характеристики-
энтальпии. В этом случае скорость стационарного горения опреде-
ляется в любом сечении волны горения отношением двух тепловых
параметров — теплового потока и энтальпии. Уникальность крити-
ческого сечения волны горения состоит в том, что тепловые пара-
метры hm и qm в этом сечении не зависят от начальной температуры
и легко могут быть определены из экспериментальных зависимостей
(мр) ",=/|Л(7'и) j или up=[(qB„) при наличии сведений о темпера-
турных зависимостях энтальпии и плотности горючих систем. На
основании полученных значений hm и qm можно строить обобщенные
зависимости скорости горения от температуры, давления и рецептур-
но-технологических факторов и прогнозировать характеристики
процесса горения в реальных условиях и возможности их регули-
рования в требуемом направлении.
Для многих конденсированных горючих систем критическое се-
чение волны горения соответствует температуре плавления или ки-
пения одного из компонентов. Эта закономерность позволяет прогно-
зировать процесс горения неисследованных систем по известным
теплофизическим свойствам компонентов. С другой стороны, эта
закономерность открывает возможность определения теплофизиче-
ских свойств веществ при высоких значениях температуры и дав-
ления на основании экспериментальных исследований скорости
горения.
Процессы горения могут также существенно пополнить арсе-
нал экспериментальных исследований процессов теплообмена ввиду
прямой зависимости скорости горения от теплообмена с окружаю-
щей средой.
Таким образом, корректный теоретический анализ и целенап-
равленное практическое использование процессов горения невоз-
можны без надежных сведений о теплофизических свойствах ве-
ществ. Экспериментальное определение скорости горения, явля-
щееся, по сути, прецизионным теплофизическим экспериментом,
может послужить основой новых методов исследования теплофи-
зических свойств веществ и процессов теплообмена. Поэтому пред-
ставляется, что наиболее точным названием раздела физики го-
рения и взрыва, относящегося к стационарному горению, является
теплофизика горения.
СПИСОК ЛИТЕРАТУРЫ
1. Mallard Е., Le Chalelier Н. Recherhers experimenlales et theoriques sur hi
combustion des melanges gazeux explosifs//Annales des Mines. Ser. 8. — 1883. -
Vol 4 — P. 274- 559.
2. Михельсон В. А., О нормальной скорости воспламенения гремучих газовых
смесей//Ученые записки Императорского Московского Университета.— 1893.—
Вып. 10.— С. 1—92.
3. Андреев К. К- Термическое разложение и горение взрывчатых веществ. —
М.: Наука, 1966. — 346 с.
4. Шидловский А. А. Основы пиротехники. — М.: Машиностроение, 1973. —
320 с.
5. Мержанов А. Г. СамОраспрострамяющийся высокотемпературный синтез//
Физическая химия. Современные проблемы. — М.: Химия, 1983. — С. 8—44.
6 Мержанов А. Г. Теория стационарного гомогенного горения конденсиро-
ванных веществ: Препринт. - Черноголовка, филиал Института химической фи-
зики, 1968.-49 с. (Merzhanov A. G.//Combustion and Flame. — 1969.—Vol. 13,
№ 2. - P. 143-156.)
7. Коэн И. С., Флэйниген Д. А. Зависимость характеристик твердых ракет-
ных топлив от температуры//Аэрокосмическая техника. — 1986. — № 6. —
С. 114—126. (Cohen N. S.. Flanigan D. А. //А1АА Journal.- 1985. — Vol- 23,
№ 10. P. 1538 1547.)
8. Кашпоров Л. Я., Шелудяк Ю. E., Мальцев В. M. и др. Влияние начального
теплового состояния на скорость горения конденсированных систем//Химическая
физика процессов горения и взрыва. Горение конденсированных систем: Материалы
IX Всесоюзного симпозиума по горению и взрыву. Черноголовка. — 1989. —
С. 18-21.
9. Кашпоров Л Я. и др Теплофизические аспекты процесса горения//Тепло-
физические свойства веществ и материалов. ГСССД. 1991. - Вып. 30. - С. 139—147.
10. Шелудяк Ю. Е., Кашпоров Л. Я., Малинин Л- А. и др. Теплофизические
свойства уплотненных порошков. Ч. 1. Неорганические кнслородосодержащие сое-
дииеиия//ИФЖ. — 1990. — Т. 59, № 2. С. 319 (статья депонирована в ВИНИТИ
20.03.90, per. № 1496—В90).
II. Шелудяк Ю. Е., Кашпоров Л. Я-. Малинин Л. А. и др. Теплофизические
свойства уплотненных порошков. Ч. II. Органические вещества//ИФЖ. 1990. —
Т. 59, № 2. — С. 319 (статья депонирована в ВИНИТИ 20.03.90, per. № 1497—В90).
12. Дульнев Г. Н., Заричняк Ю. П. Теплопроводность смесей и композицион-
ных материалов. —Л.: Энергия, 1974. — 264 с.
13. Eller D. Е.. а. о. Determination of the thermal diffusivity oJ pyrotechnic ma-
terials//Proceedings of the Sixth International Pyrotechnic Seminar. 17—27 July
1981, Denver, Colorado. USA. — P. 166—178.
14. Свойства элементов. Ч. I. Физические свойства: Справочник/Под ред.
Г. В. Самсонова. — М.: Металлургия, 1976. — 600 с.
15. Чиркин В. С. Теллофизические свойства материалов ядерной техники. —
М.: Атомиздат, 1968. — 484 с.
179
178
16. Новицкий Л. А., Кожевников И. Г. Теплофизические свойства материалов
при низких температурах: Справочник. — М.: Машиностроение, 1979. — 216 с.
17. Новикова С. И. Тепловое расширение твердых тел. — М.: Наука, 1974.—292 с.
18. Шпильрайн 3. 3., Каган Д. Н.. Салихов Т. П. и др.//Теплоемкость магния
в твердой и жидкой фазах до I600//TBT. — 1984. — Т. 22, № 3. — С. 619—621.
19. Downie D. В.. Martin J. F. Ап adiabatic calorimeter for heat—capacily
measurements belween 6 and 300 K- The molar heat capacity of aluminium//Journ.
Chem. Thermodynamics. — 1980. — Vol. 12. № 8. — P. 779—786.
20. Теплопроводность твердых тел: Справочник/Л. С. Охотин. Р. П. Боровикова.
Т. В. Нечаева, А. С. Пушкарский. — М.: Эиергоиздат, 1984. — 320 с.
21. Теплофизические свойства титана и его сплавов: Справочинк/В. 3. Пе-
лецкий, В. Я. Чеховской, 3. А. Бельская и др. — М.: Металлургия, 1985. — 103 с.
22. Cash W. М3 Brooks С. R. The heat capacity of a-titanium from 320 to
1020 K//Journ. Chem. Thermodynamics. — 1982. — Vol. 14. № 4. — P. 351—356.
23. Кржижановский P. E.. Штерн 3. Ю. Теплофизнческие свойства неметал-
лических материалов (Окислы). — Л.: Энергия, 1973. —333 с.
24. Термические свойства неорганических веществ/Э. В. Брицке, А. Ф. Капус-
тинская н др. — М.—Л.: Изд-во АН СССР, 1949. — 1012 с.
25. Амасович Е. С., Пелецкий В. 3. Исследование материалов для стандартных
образцов теплопроводности. Сталь 12X18HI0T, железо <Армко»//ТВТ. — 1982. —
Т. 20, № 5. — С. 891—896.
26. Тарасов В. Д. и др. Исследование энтальпий вольфрама в интервале тем-
ператур 1250—2550 К//ТВТ. — 1982. — Т. 20, № 5. — С. 988 -990.
27. Cezairliyan A., Muller А. Р. Heat capacity and electrical resistivity of nickel
in the range 1300—1700 К measured wilh pulse heating technique//Int. Journ. Ther-
moph is. — 1984. — Vol 4, № 4. — P. 389 - 396.
28. Термические константы веществ: Справочник в 10 вып./Под род. В. П. Глушко,
В. А. Медведева, Г. А. Бергмана н др. — М.: ВИНИТИ, 1965—1982.
29. Термодинамические саойства индивидуальных веществ: Справочник в 4-х т./
Л. В. Гурвич, И. В. Вейц, В. А. Медведев и др. — М.: Наука, 1978—1982.
30. Справочник химика. Т. 1/Под ред. Б. П. Никольского, О. Н. Григорова.
М. Е. Позина и др. — Л.: Химия, 1971.— 1071 с.
31. Справочник хнмнка. Т. 2./Под. ред. Б. П- Никольского. О. Н. Григорова.
М. Е. Позина н др. — Л.: Хнмня. 1971. — 1168 с.
32. Славинский М. П. Физико-химические свойства элементов. — М.: Металлург-
нздат, 1952. — 763 с.
33. Крвткая химическая энциклопедия. Т. 1—5/Под ред. И. Л. Кнунянца.
Г. Я-, Бахаровского, А. И. Бусева н др. — М.: Советская энциклопедия, 1961 —1967.
34. Aldebert Р., Traverse J. Р. a-AkOj. A high-temperature thermal expansion
standard//High Temp. — High Pressures. — 1984. — Vol. 16, № 2. — P. 127—135.
35. Таблицы физических величин: Справочиик/Под ред. И. К. Кикоина. —
М.: Атомиздат, 1976 — 1008 с.
36. Bartel J.J., Weslrum Е. F. Heat capacities of Fe3O4 and ZnFeaO* from 300 to
500 K//Journ. Chem. Thermodynamics. — 1975. — Vol. 7, Ns 7. — P. 706—708.
37. Carling R. W. Heat capacities of NaNO3 and KNO3 from 350 to 800 K//
Thermochim acta. — 1983. - Vol. 60, № 3. — P. 265- 275.
38. Березовский Г. А., Пауков И. E. Теплоемкость нитрата рубидия от 8 до
318 К//ЖФХ. — 1982. — Т. 56, № 7. — С. 1783—1784
39. Фролова Г. И., Пауков И. Е. Теплоемкость и термодинамические функ-
ции CsNO3 в области 6—302 К//ЖФХ. — 1983. — Т. 57, № 9. — С. 2314 -2315.
40. Srinivasa R. A., Bichile G. К- Thermal expansion of strontium nitrate//
fndian Journ. Pure and Appl. Phys. — 1973. — Vol. 11, № 5. — P. 368.
41. Краткий справочник физико-химических величин/Под ред. К. П. Мищенко.
В. А. Равеля. —Л.: Химия, 1974. —200 с.
42. Bichile G. К-, Kulcarni R. G. The temperature dependence of lattice para-
meter, thermal expansion, Gruneisen parameter and lattice vibrational frequences
of barium nitrate//Journ. Phys. — 1975. — Vol. 8C, № 23. — P. 3988—3992.
43. Миснар А. Теплопроводность твердых тел, жидкостей, газов и их компози-
ций. — М.: Мир. 1968. — 460 с.
44. Fransson A.. Ross R. G. Thermal conductivity, heal capacity and phase stability
J solid sodium chlorate (NaCIO3) under pressure//Journ. Phys. — 1983. —Vol. 16 C,
I 15. - P. 2861-2869
45. Шмидт H. E.. Голу шина Л. H.. Шарпатая Г. А. и др. Теплоемкость и теи-
юта превращения перхлората натрия//ЖФХ. — 1984. — Т. 58, № 12. —
Г_ 2928- 2932.
46. Шмидт Н. Е.. Гслушана Л Н.. Шарпатая Г. А. и др. Теплоемкость и теплота
фазового перехода перхлората калия//ЖФХ. — 1985. — Т. 59, № 6. — С. 1384—1387.
47. Краткая химическая энциклопедия. Т. l/Под. ред. И. Л. Кнунянца и др. —
М..: Советская энциклопедия. 1988. — 623 с.
48. Краткая химическая энциклопедия. Т. 2/Под ред. И. Л. Кнунянца и др. —
М.: Советская энциклопедия, 1990. — 671 с.
49. Schumann В.. Neumann Н. Thermal expansion of CaF, from 298 to 1173 К//
Cryst. Res. and Technol. — 1984. - Vo. 19, № I. P. K13—K14.
50. Перри Дж. Справочник инженера-химика. Т. I. /1 : Химия. 1969. —
. 9 с.
51. Shinsaka К- а. о. Densities against temperature of 17 organic liquids and of
solid 2,2 - dymethylpropane//Journ Chem. Thermodynamics. — 1985. — Vol. 17,
M 12. P 1111 — 1119
1 52. Варгафтик H. Б. Справочник по теплофизическим свойствам газов и жид-
костей. М.: Наука. 1972. — 720 с.
53. Hales J. L., Townsend R. Liquid densities from 293 Io 490 К of nine aromatic
hydrocarbons//Joiirn. Chem. Thermodynamics. — 1972. — Vol. 4, № 5. — P. 763—772.
54. Энциклопедия полимеров. T. 1—З/Под ред. В. А. Кабанова и др. — М.:
Советская энциклопедия, 1972—1977.
55. Кан К- Д- Вопросы теории теплового расширения полимеров. — Л.: Изд-во
Ленинградского университета, 1975. — 78 с.
• 56. Привалко В. П. Справочник по физической химии полимеров. Т 2. Свой-
ства полимеров в блочном состоянии. — Киев: Наук, думка, 1984. — 330 с.
i 57. Gaur U. а. о. Heat capacity and other thermodynamic properties of linear
nacromolecules. VII. Olher carbon backbone polymers//Journ. Phys, and Chem.
Ы. Data. — 1983. — Vol. 12. № 1. — P. 29-63.
58. Чегодаев Д. Д. и др. Фторопласты. — Л.: Госхимиздат, 1960. — 192 с.
59. Johnson К- №.. Raboti J. F. Far infrared measurements on the 19 °C phase
ransition in polytetrafluoroethylene//Journ. Chem. Phys. — 1973. — Vol. 58, Ns 10. —
•>. 4536-4538.
60 Химический энциклопедический словарь/Под ред. И. Л. Кнунянца и др. —
И Советская энциклопедия, 1983. — 791 с.
61. Беляев А. Ф. Механизм горения взрывчатых веществ. Дне.. .. д-ра физ.-мат
*аук. — М.: ИХФ. 1946. — 211 с.
62. Наум Ф. Нитроглицерин. — М.—Л.: ОНТИ — Госхимтехиздат,
190 с.
63. Баум Ф. А. и др. Физика взрыва. — М.: Гос. изд-во физ.-мат. лит., 1959. —
ИЮ с.
64.
|еществ//ФГВ.— 1966.
f 65. Александров В. В.. Клееной С. С. О температуре поверхности при беспламсп
юм горении нитроглицеринового пороха//ФГВ. — 1970. — Т. 6, № 4. — С. 438—443.
66. Александре В. В. и др. Измерение теплоемкости пироксилина при повышен
<ых тем пер атурах//Ф ГВ. — 1979. — Т. 6, № 1. — С. 103—107.
67. Борисов В. П. и др. Применение электротермографического метода для
изучения кинетики тепловыделения в К-фазе//ФГВ. — 1987. — Т. 23, № 4. —
56—60.
68. Жданов В. В. и др. Теплофизические коэффициенты нитроглицеринового
юроха при низких температурах//ФГВ. — 1967. — Т. 3, № 1. - С 40-44.
69. Диогенов Г. Г., Сарипцлова И Ф Системы Na. К Rb'NO н К, Rh С.ч/NO,//
Журнал неорганической химии. — 1965. —Т. 10, № 10. — С. 2375—2376.
70. Ильясов И. И. и др. Система RbNO3—Ca(NO3)j—5г(№О3)2//Журнал
неорганической химии. — 1983. — Т. 28, Ns 2. — С. 535—536.
1934. —
Максимов 3. И.. Мержанов А. Г. К теории горения конденсированных
1. 2, № 1. — С. 47 —58.
180
181
71. Beck M. W. a. о. Application of a probe technique for measuring the thermal
conductivity of pyrotechnic compositions//Journ. Phys. — 1974. — Vol. 17E. № 9_
P. 793- 799.
72. Lewis B., von Elbe G. On the theory of flame propagation//Journ. Chem
Phys. - 1934. — Vol. 2. № 8. P. 537—546.
73. Зельдович Я. Б., Франк-Каменецкий Д. А. Теория теплового распростра-
нения иламени//ЖФХ. — 1938. Т. 12. № I. С. 100—105.
74. Boys S. F., Corner J. The structure of the reaction zone in a flame//Proc
Roy. Soc. — 1949. Vol. 197A. P. 90—106.
75. Зельдович Я. Б К теории распространения пламени//ЖФХ. — 1948.
Т. 22. № 1—С. 27—48.
76. Daniell Р. J. The theory of flame motion//Proc. Roy Soc. — 1930. Vol
126A. — P. 393—405.
77. Франк-Каменецкий Д. А. Диффузия и теплопередача в химической кине-
тике. — М.: Наука, 1987. 491 с.
78. Сычев В. В. Сложные термодинамические системы. — М.: Наука, 1980
207 с.
79. Еремин Е. Н. Основы химической кинетики в газах и растворах. М.
Изд-во МГУ, 1971 384 с.
80. Семенов Н. Н. Цепные реакции. — М.: Наука, 1986. — 535 с.
81. Хитрил Л. Н. Физика горения и взрыва. — М.: Изд-во МГУ, 1957. — 442 с.
82. Бабкин В. С., Козаченко Л. С. Исследование нормальной скорости пла-
мени метано-воздушных смесей при высоких давлениях.//ФГВ. 1966. Т 2,
№ 3. С. 77—86.
83. Агеев Н. Д., Горошин С. В., Золотко А. Н. и др. Скорость стационарного
пламени в газовзвесях алюминия//Химическая физика процессов горения и взрыва.
Горение гетерогенных и газовых систем: Материалы IX Всесоюзного симпозиума
по горению и взрыву. Черноголовка, — 1989. — С. 83—85.
84. Смирнов С. Ю., Бегишев И. Р.. Дубивка В. В. и др. Горение кислородных
смесей фторопроизводных пропилена//Химическая физика процессов горения и
взрыва. Горение гетерогенных и газовых систем: Материалы IX Всесоюзного сим-
позиума по горению и взрыву. — Черноголовка, 1989. С. 36—39.
85. Смирнов С. №.. Бегишев И. Р., Полуэктов В. А. и др. Самовоспламенение
кислородных смесей гексафторпропилена//ЖФХ. - 1990. — Т. 64, № 11.—
С. 3108 3110.
86. Андреев К. К- Горение вторичных взрывчатых веществ. В ки.: Патри М.
Горение и детонация взрывчатых веществ. — М. Л.: Обороигиз, 1938 -
С. 149 -156.
87. Беляев А Ф. Механизм горения взрывчатых веществ: Дис.... д-ра физ.-мат.
наук. М.: ИХФ, 1946. 211 с.
88. Плясунов М. С. Исследование влияния начальной температуры на скорость
горения взрывчатых веществ: Дне. . . . канд. техн. наук. - М.: МХТИ им. Д. И. Мен-
делеева, 1963. — 174 с.
89. Марголин А. Д. и др. О зависимости скорости горения различных горю-
чих систем от начальной температуры//ПМТФ. — 1964. № 3. — С. 149 153
90. Зенин А. А. Процессы в зонах горения баллиститных порохов//Физиче-
ские процессы при горении и врзыве: Сб. статей. — М.: Атомиздат, 1980.-
С. 68—105.
91. Коротков А. И., Лейпунский О. И. Зависимость температурного коэффи-
циента скорости горения пороха при атмосферном давлении от температуры по-
роха//Фнзика взрыва. Изв. АН СССР. — 1953. — № 2. — С. 213 224.
92. Зенин А. А., Нефедова О. И. О горении баллиститного пороха в широком
диапазоне начальных тем перату р//Ф ГВ. 1967. —Т. 3, № I. —С. 45 53.
93. Конев Э. В- Влияние светового излучения на процесс горения баллист итнЫ*
порохов и некоторые вопросы их горения: Дис.. .. канд. хим наук. — Новосибирск
ИХКиГ, 1967. 133 с.
94. Симоненко В. Н. Исследование нестационарного горения порохов: Дис.
канд. физ.-мат. наук. Новосибирск: ИХКиГ, 1981. — 155 с.
95. Максимов Э. И Исследование пульсаций свечения при горении нитрогдиЦС'
риновых порохов//ЖФХ. — 1963. Т. 37, № 5. — С. 1129—1132.
182
96. Маршаков В. Н. Параметры очагово-пульсирующего режима горения нит-
роглицеринового пороха//Химическая физика. - 1987. Т. 6. № 4. С. 530—537.
97. Дик И. Г. и др. Об устойчивости зажигания конденсированных веществ
при воздействии импульса теплового потока//ФГВ. 1979. — Т. 15, № 3. —
С. 77—82.
98. Лукашеня Г. В.. Подгребенков А. Л. О температурном коэффициенте ско-
рости горения некоторых снстем//ЖФХ.— 1962. —Т. 36. К? 12. С. 2784 2786.
99. Итин В. И. и др. Фазовый переход при горении смесей порошков меди и алю-
миния//ФГВ. 1981. — Т 17. № 5. С. 31—34
100. Найбороденко Ю. С.. Лавренчук Г. В.. Филатов В. М. и др. Механизм
образования алюминидов циркония при безгазовом горении//Проблемы техноло-
гического горения. Т. 1. Кинетика, термодинамика, механизм и теория горения:
Материалы III Всесоюзной конференции по технологическому горению Черного-
ловка, 1981.—С. 67 70.
101. Прибытков Г А. и др. Синтез в режиме горения интерметаллидов системы
железо — титаи//ФГВ. — 1984. — Т. 20. № 5. С. 21 23.
102. Кирдяшкин Л. И и др. О механизме взаимодействия титана с углеродом
в волне гореиия//ФГВ — 1981. Т. 17. № 4. С. 33—36.
103. Табаченко А. И. и др. Взаимодействие титана с углеродом при горении
в присутствии раствора — расплааа//ФГВ. — 1984. Т. 20, № 4. С. 31—36.
104. Чернышева Е. С. Дис. ... канд. техн. наук.—Л.: ЛТИ им. Ленсовета.
1965. - 220 с.
105. Беляев А. Ф.. Лукашеня Г. В. Об эффективной температуре горения неко-
торых взрывчатых вещест в//ПМТФ. — 1963. — № 6. — С. 114—119.
106. Зельдович Я- Б. К теории горения порохов и взрывчатых вещеста//
ЖЭТФ. — 1942. — Т. 12. № 11/12. - С. 498-524.
183
ОГЛАВЛЕНИЕ
Введение........................................................... 3
I. Теплофизические свойства индивидуальных компонентов гетерогенных
конденсированных систем.............................................. 5
1.1. Общие сведения . . . . * 5
1.2. Металлы .... - 9
1.3. Неметаллы . . 23
1.4. Сплввы . 30
1.5. Оксиды . . 35
1.6. Нитраты 48
1.7. Хлораты 59
1.8. Перхлораты . . 62
1.9. Хроматы 66
1.10 Фториды . ... 68
1.11. Хлориды .... ... 72
1.12. Йодиды.................................................. 74
1.13. Неорганические вещества .... 77
1.14. Органические вещества 83
1.15. Смолы ............................................. ... 100
1.16. Полимеры .... ... ... 107
1.17. Взрывчатые вещества ... 117
1.18. Нитроглицериновые пороха . 120
2. Теплофизические свойства смесей . 125
2.1. Общие сведения ... 125
2.2. Тепловое расширение .... 126
2.3. Теплоемкость ... . . ... 13‘
2.4. Теплопроводность ... НО
3. Применение теплофизических свойств для анализа процесса горения 153
3.1. Общие сведения.......................................... 153
3.2. Основы теории теплового анализа процесса горения . . 156
3.3. Анализ экспериментальных данных о скорости гореиня . 164
3.3.1. Гвзовые смеси....................................... 164
3.3.2. Взрывчатые вещества . . . . • 167
3.3.3. Нитроцеллюлозные пороха .170
3.3.4. Пиротехнические и СВС-системы . .174
Заключение................................ 177
Список литературы !?•'
Редактор А. М. Яганшина
Технический редактор Л. С. Лукашевич
Корректор В. П. Золотова
Подписано в печать 30.06.92 г.
Объем 10,34 уч.-изд. л.
11,5 печ. л.
Формат 60x90/16
Изд. № 9454/39Т
184
Замеченные опечатки
Стр. Имеется Должно быть
2. нижняя часть — © Авторы, 1992
15, табл 1.2.4 частоты ЧИСТОТЫ
31. рис. 1.5. 1 3
2 1
3 2
49, таблица — Таблица 1.6.1
60, первое уравнение Т-з Т’
61; уравнение 0,1626- Ю ^Т 0,1626- 10 ST2
114, 2-й абзац сверху достигала достигало
123. после уравнения объемных порохов объемных КТР поре-
1 3 4 ХОВ
127. табл 2.2 усиления усилия
144, табл 2 7 2,54+0.11 2,54±0,11
146, рис. 2.20 1 3
2 1
3 2
157, 2-я строка снизу dt/tlx dTfdx
163, 2-й абзац сверху сжигания обдувом сжигания, обдувом
170. рис. 3.3 активизации активации