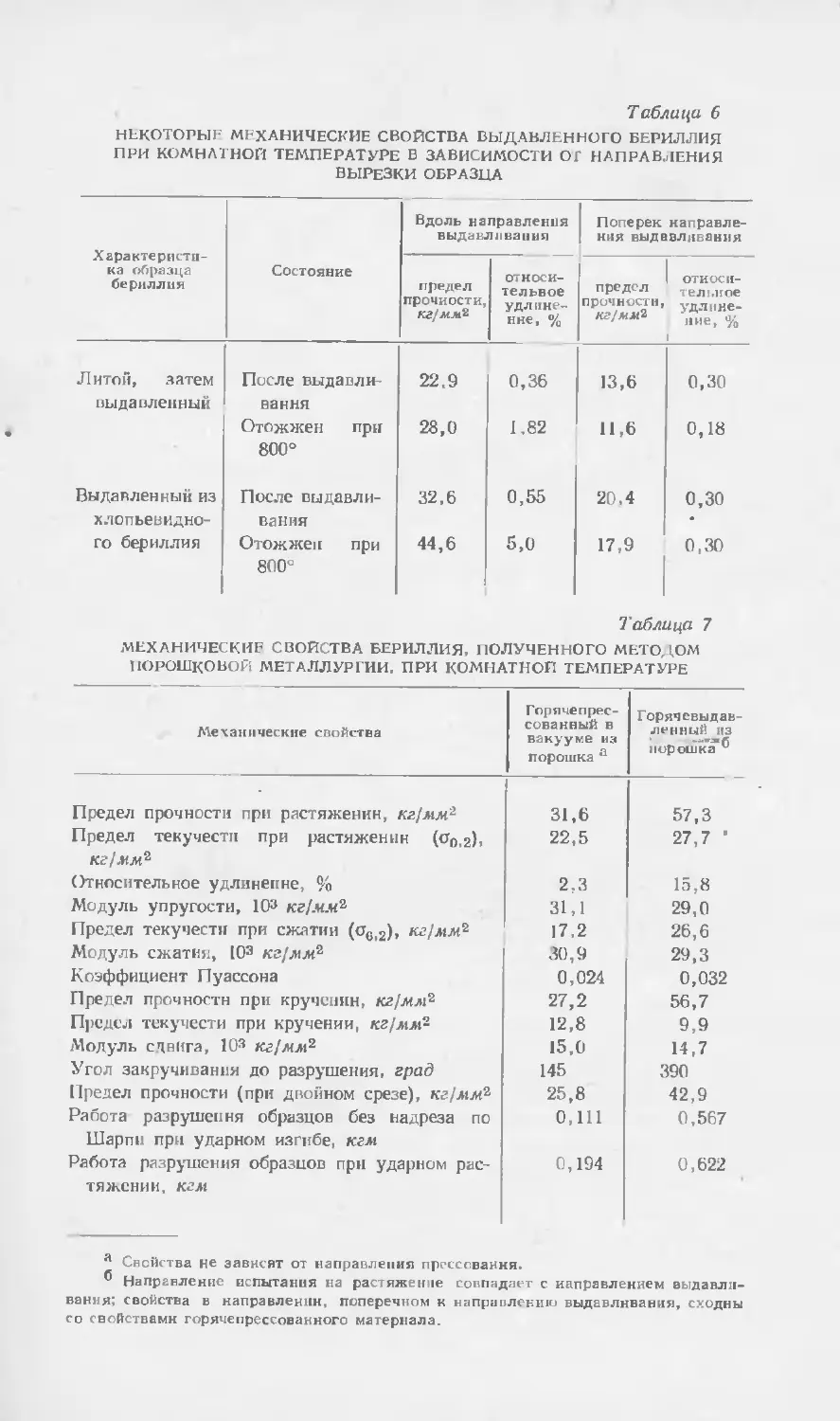
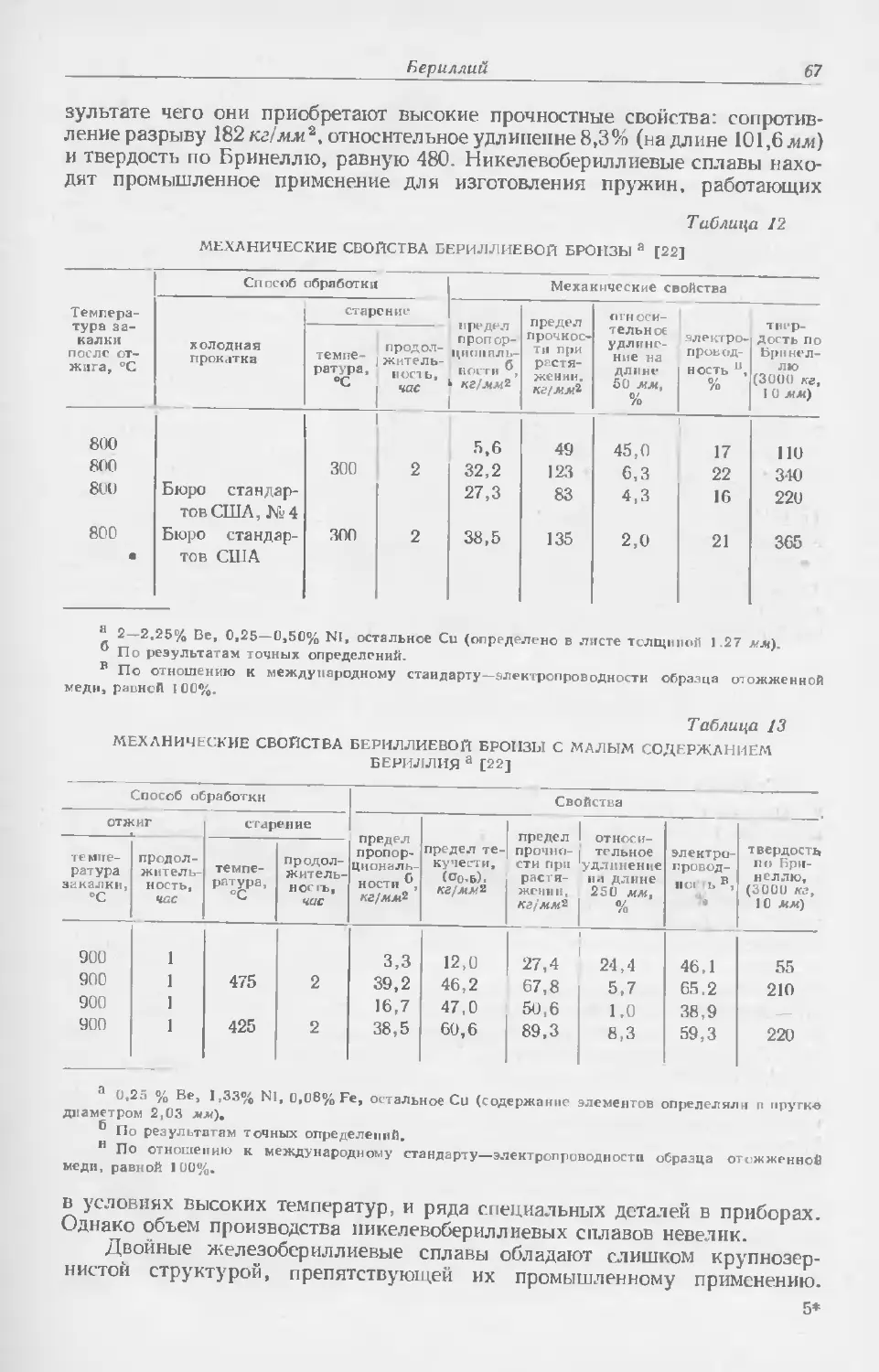
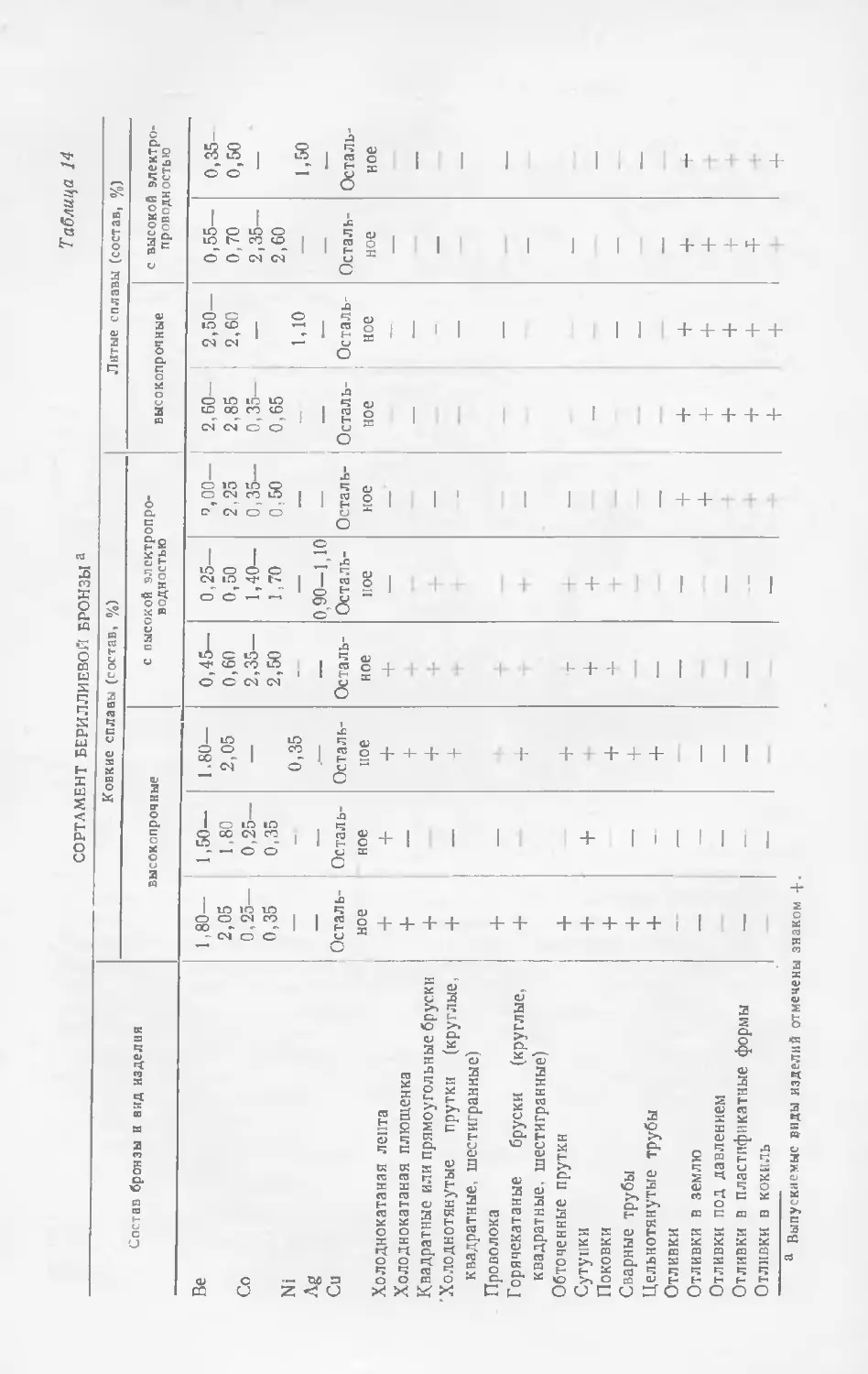
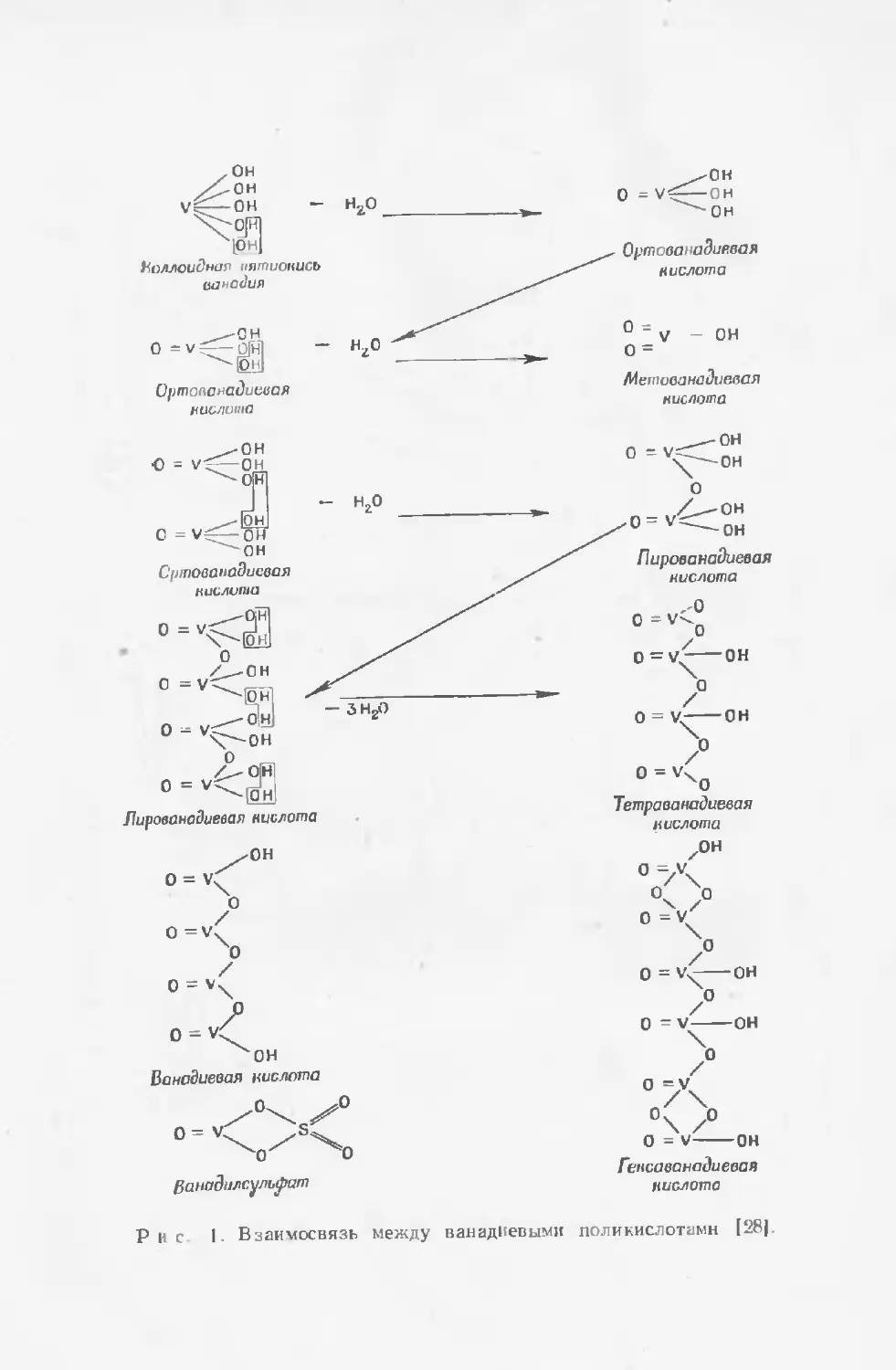
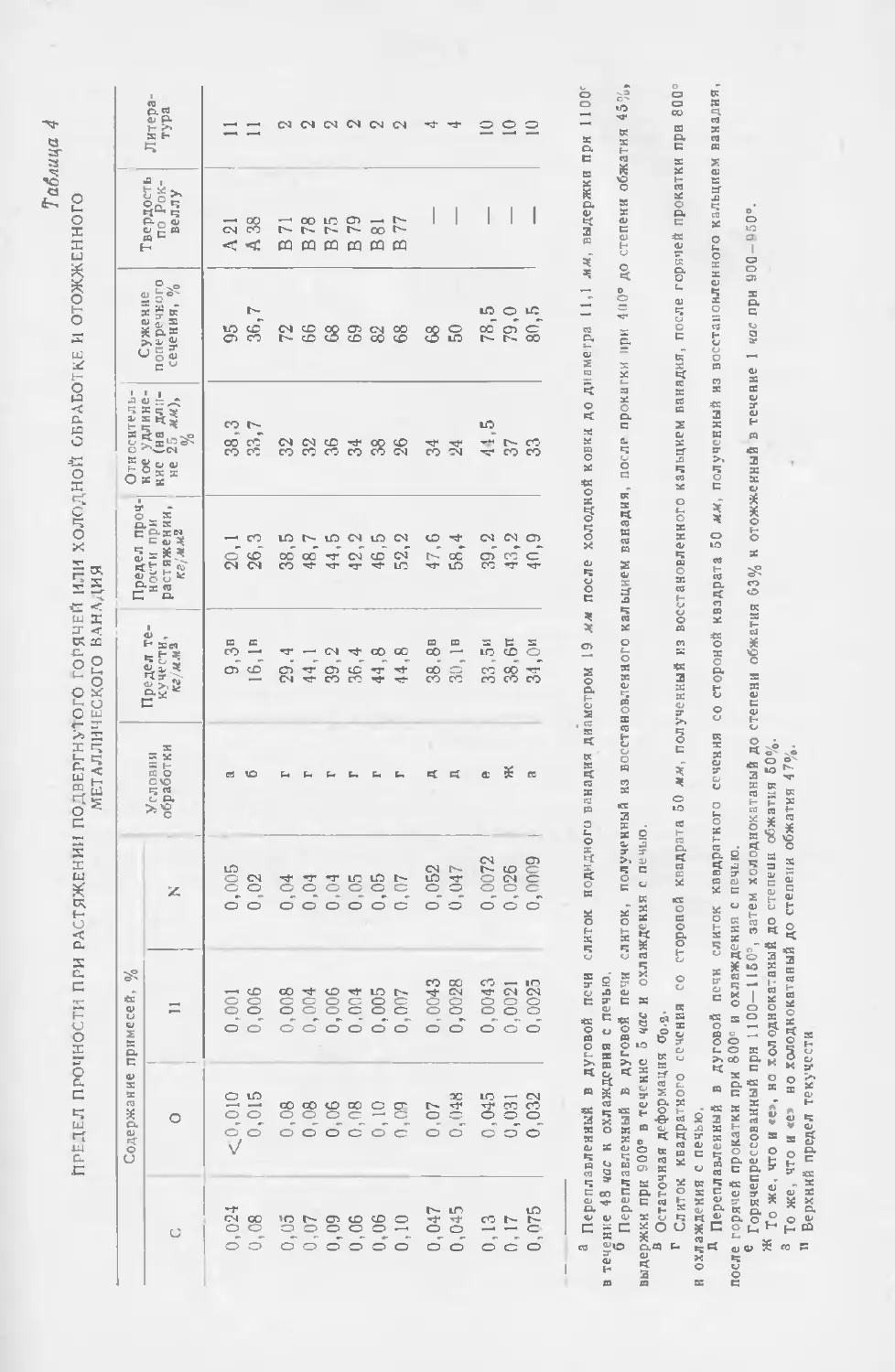
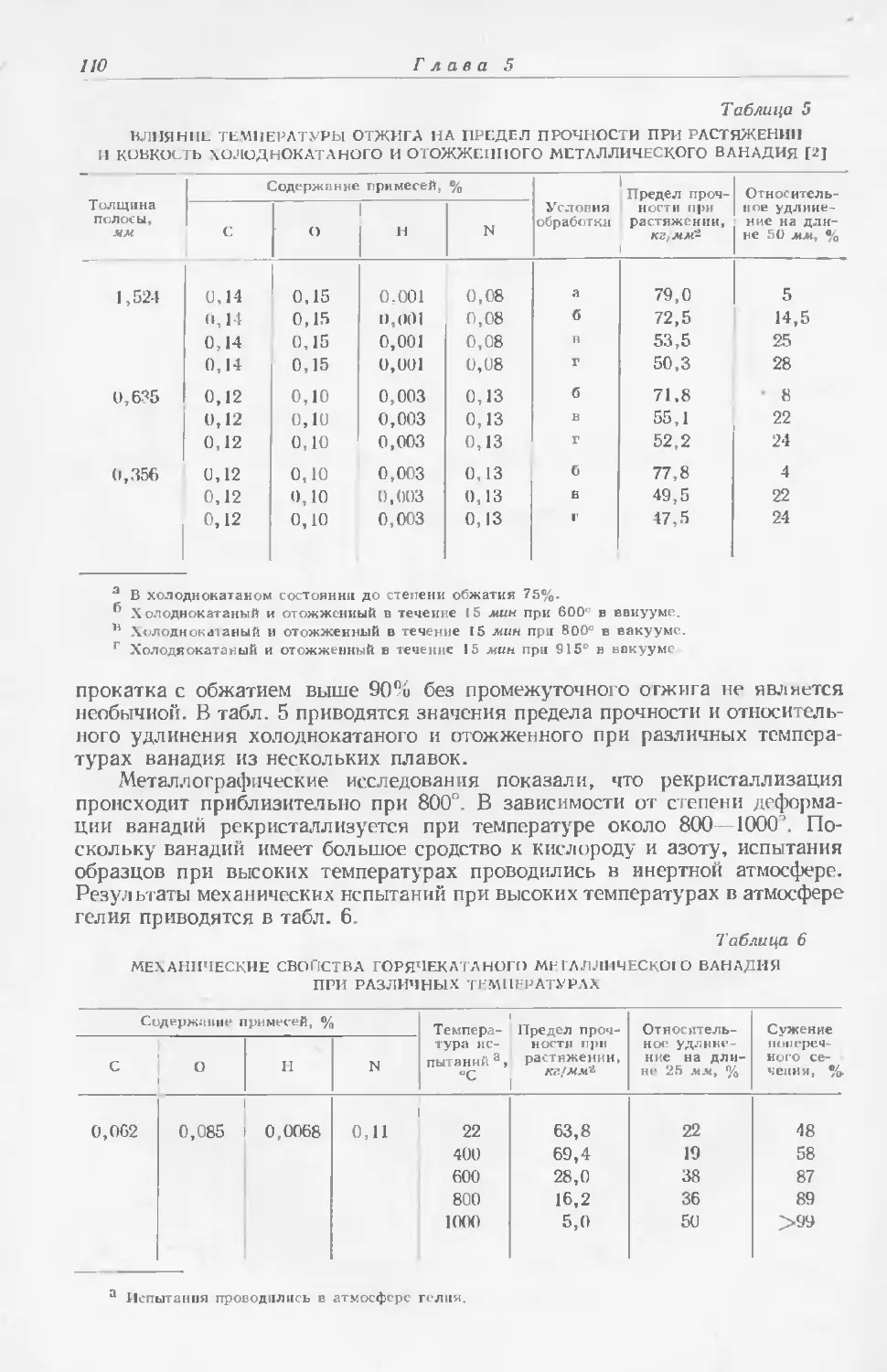
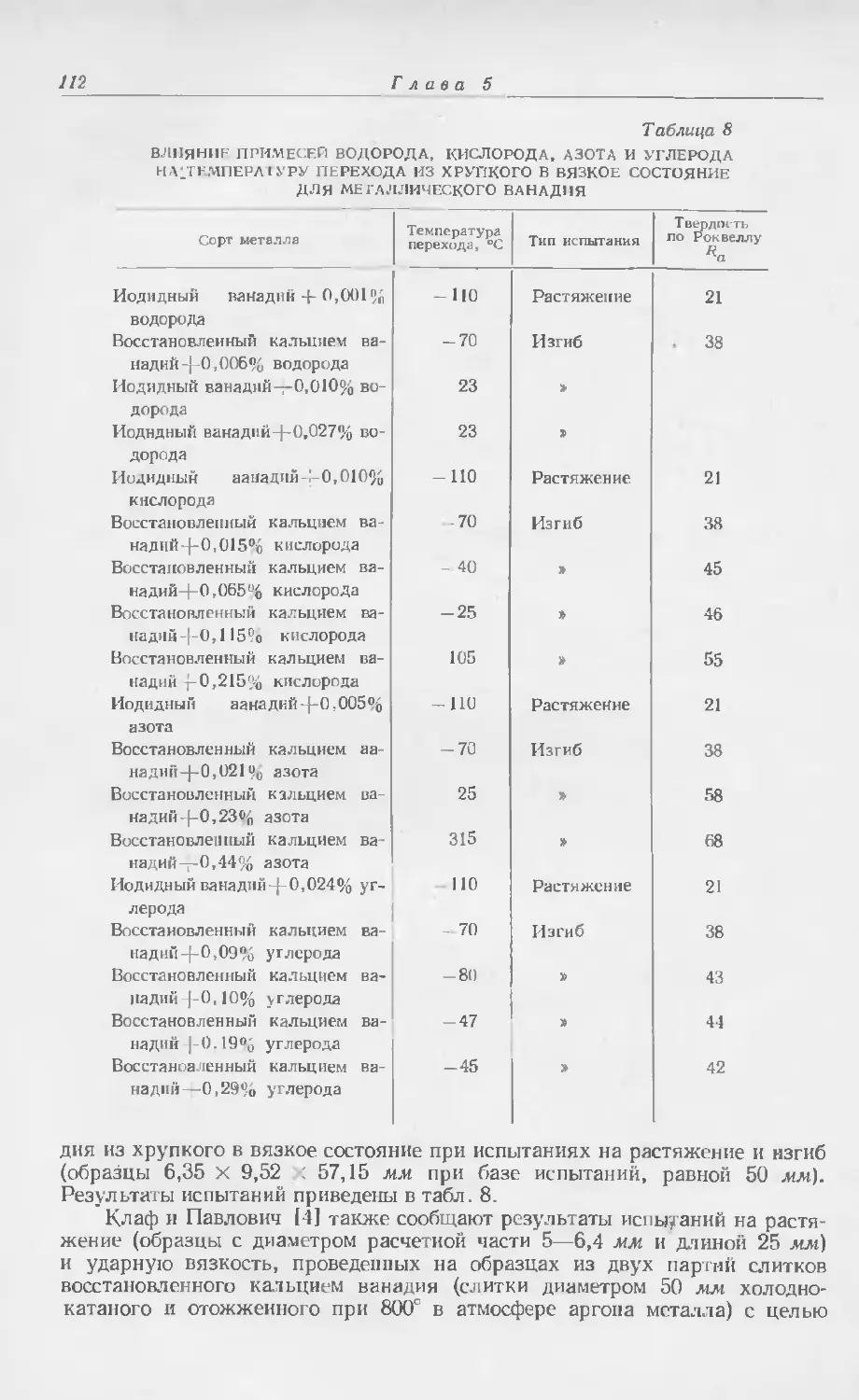
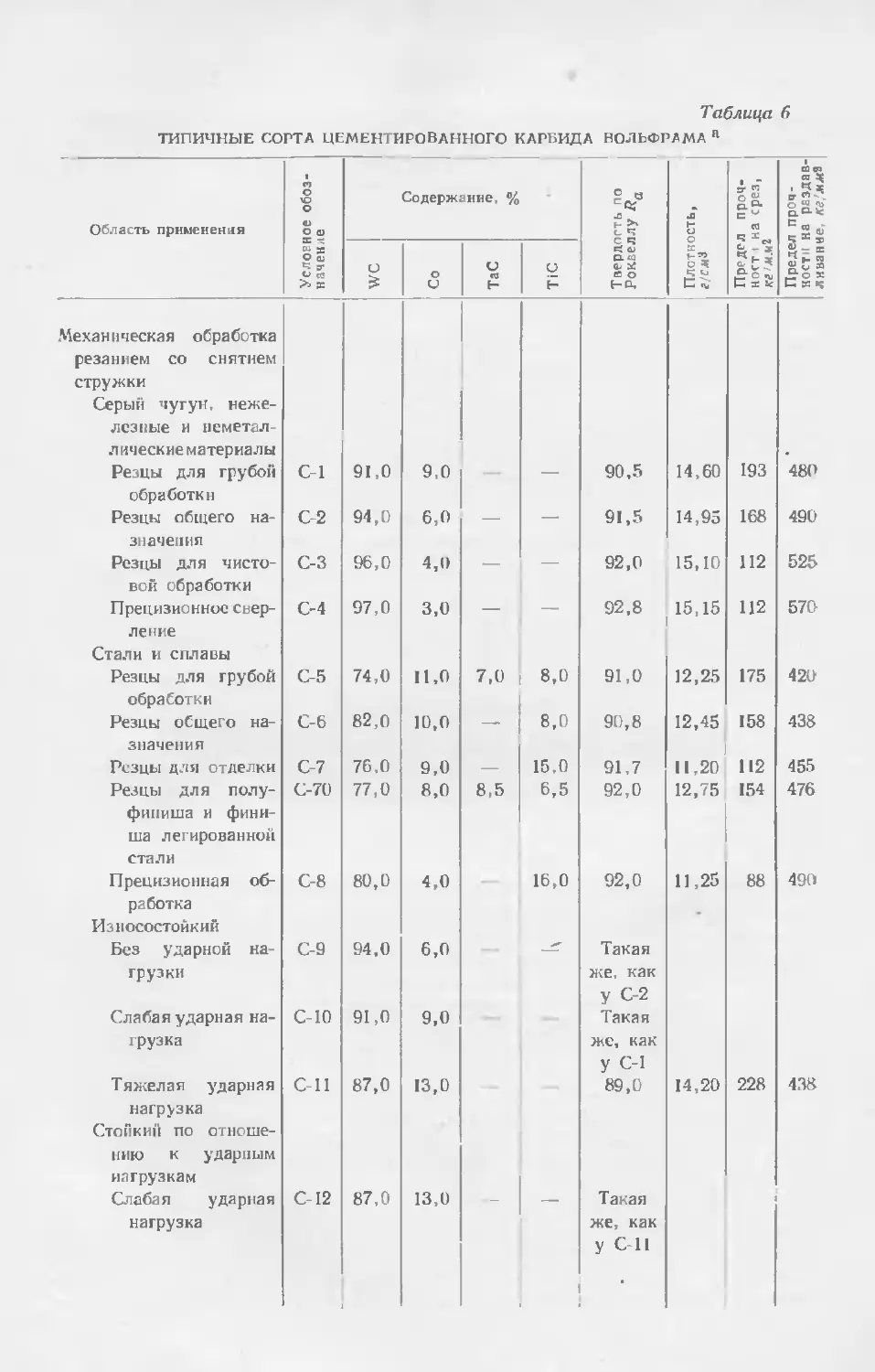
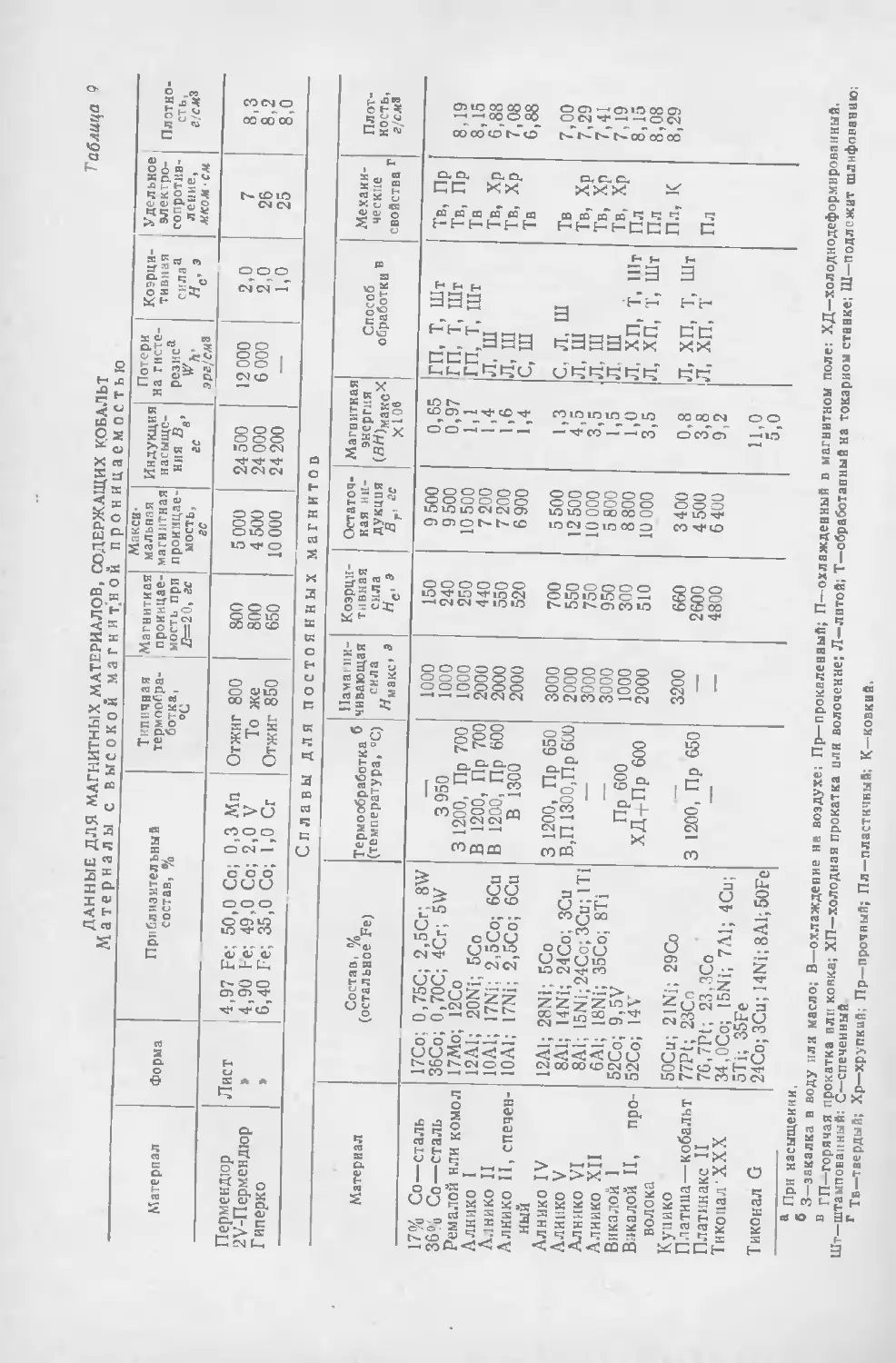
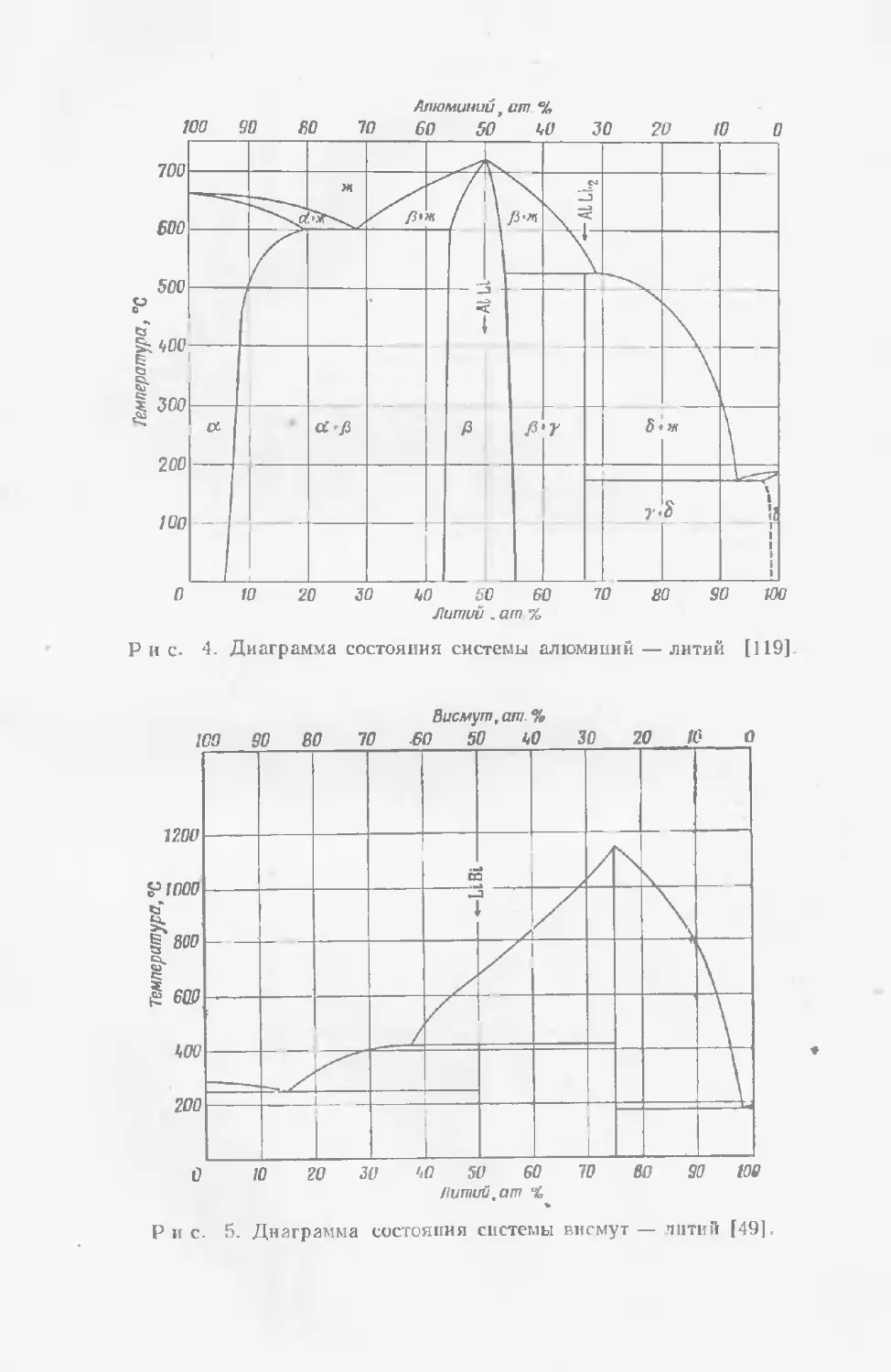
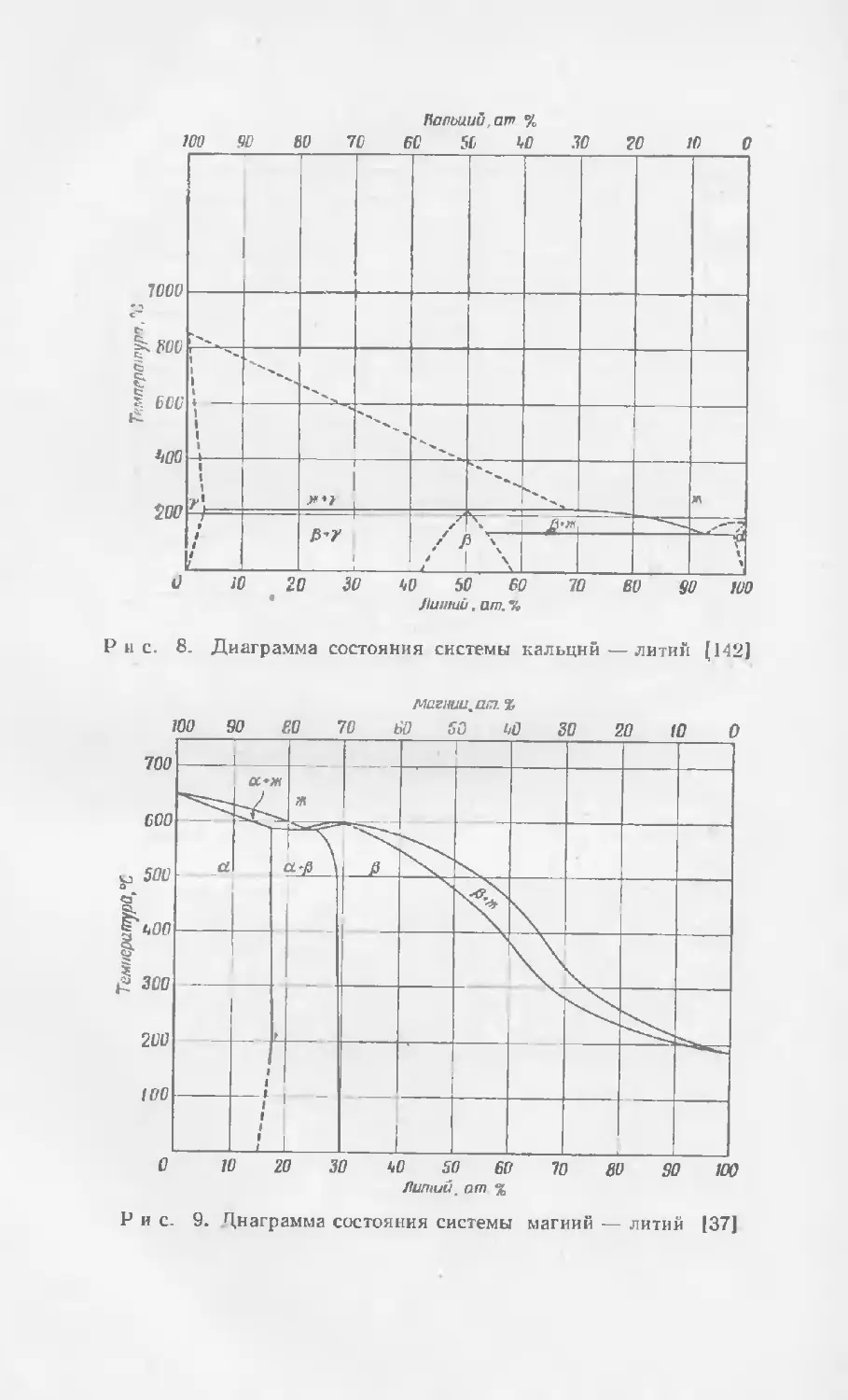
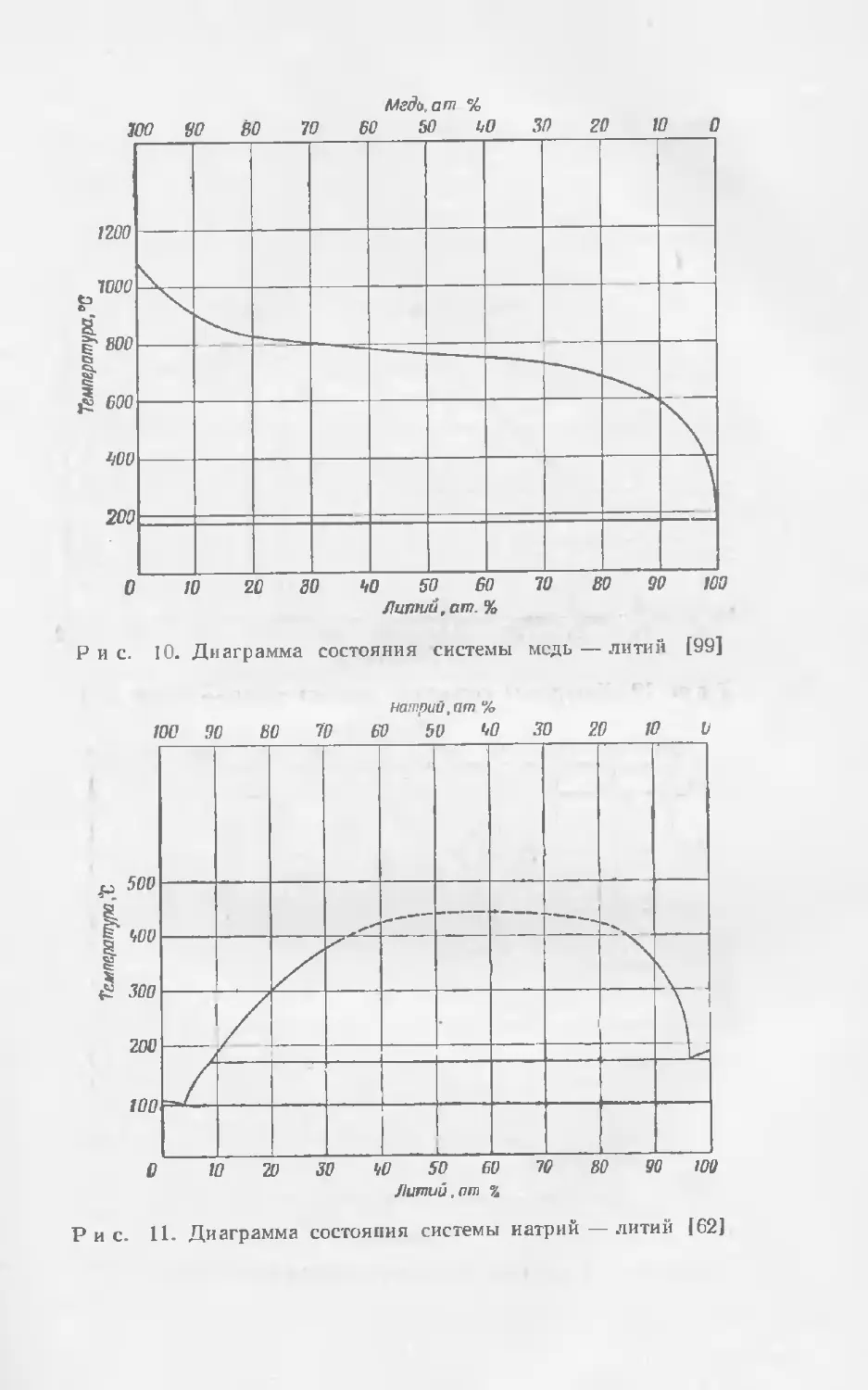
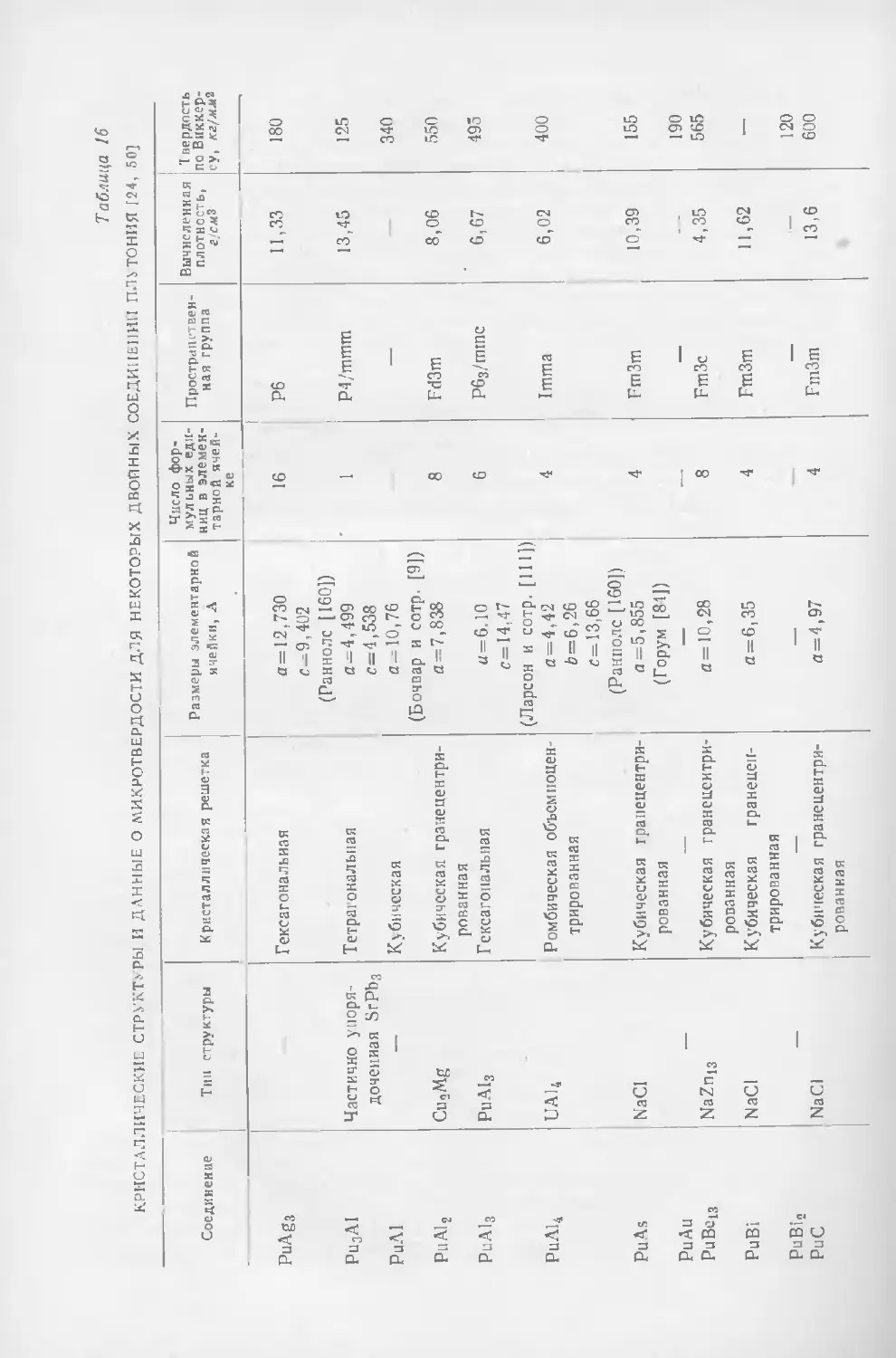
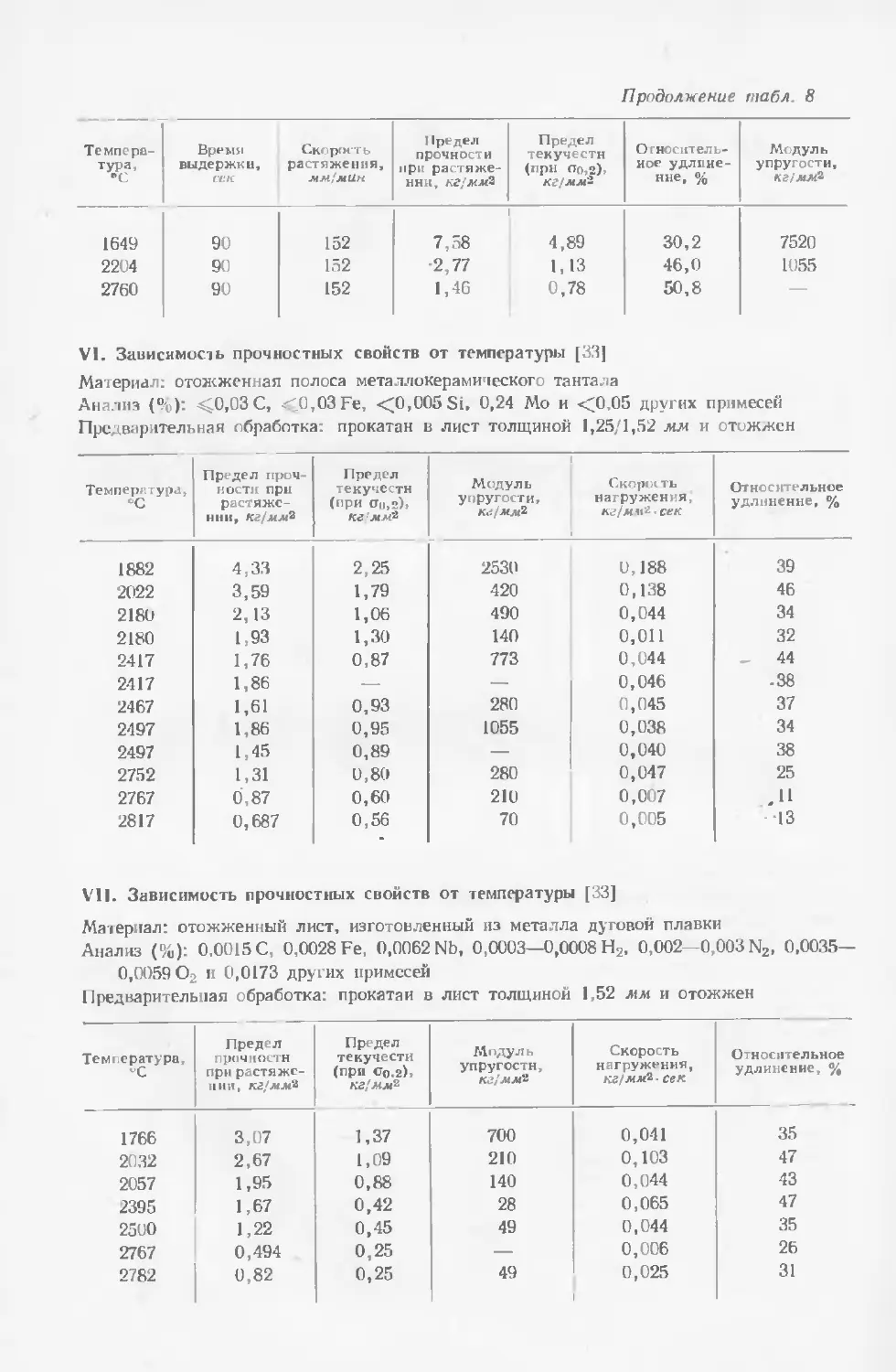
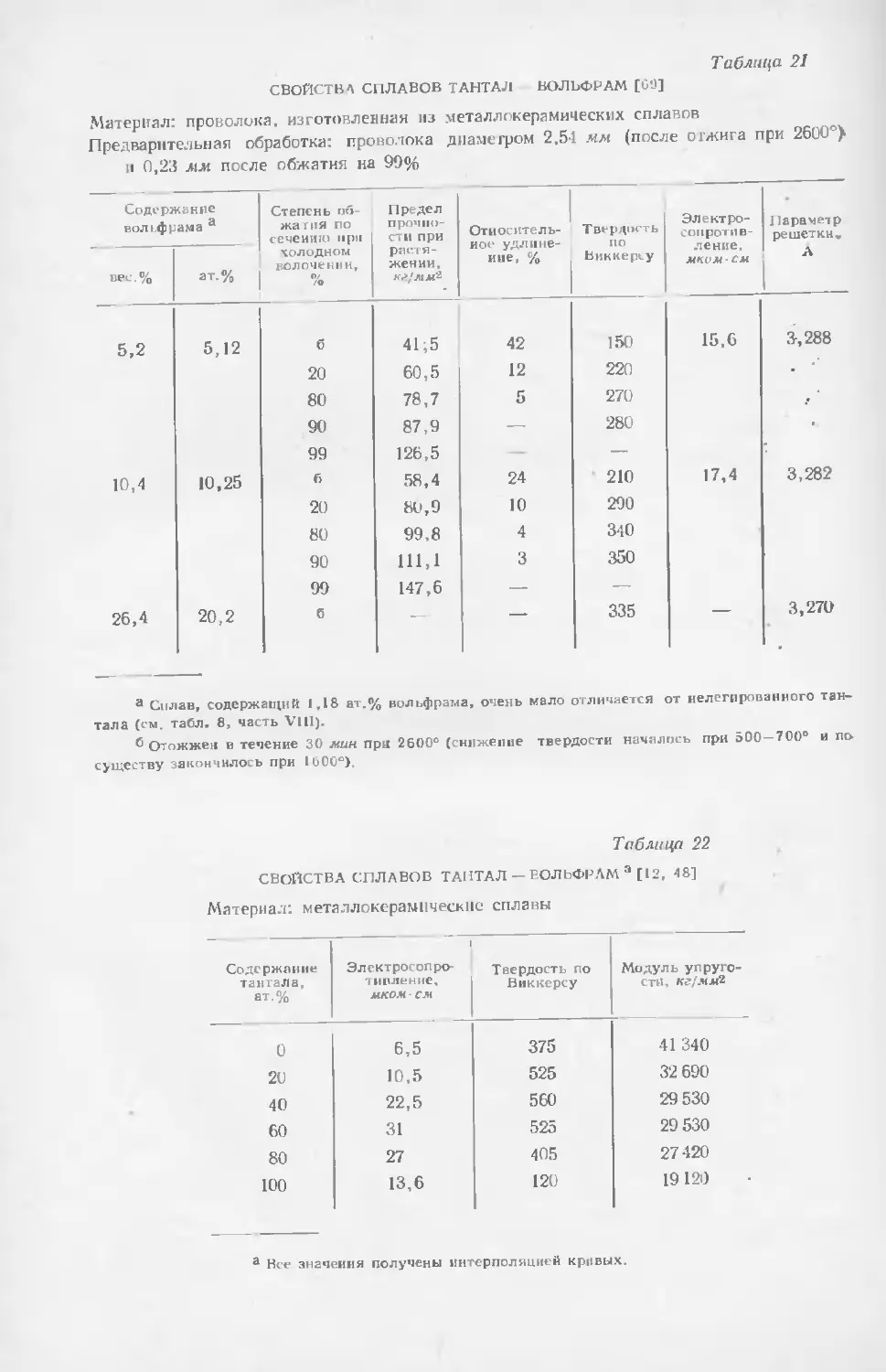
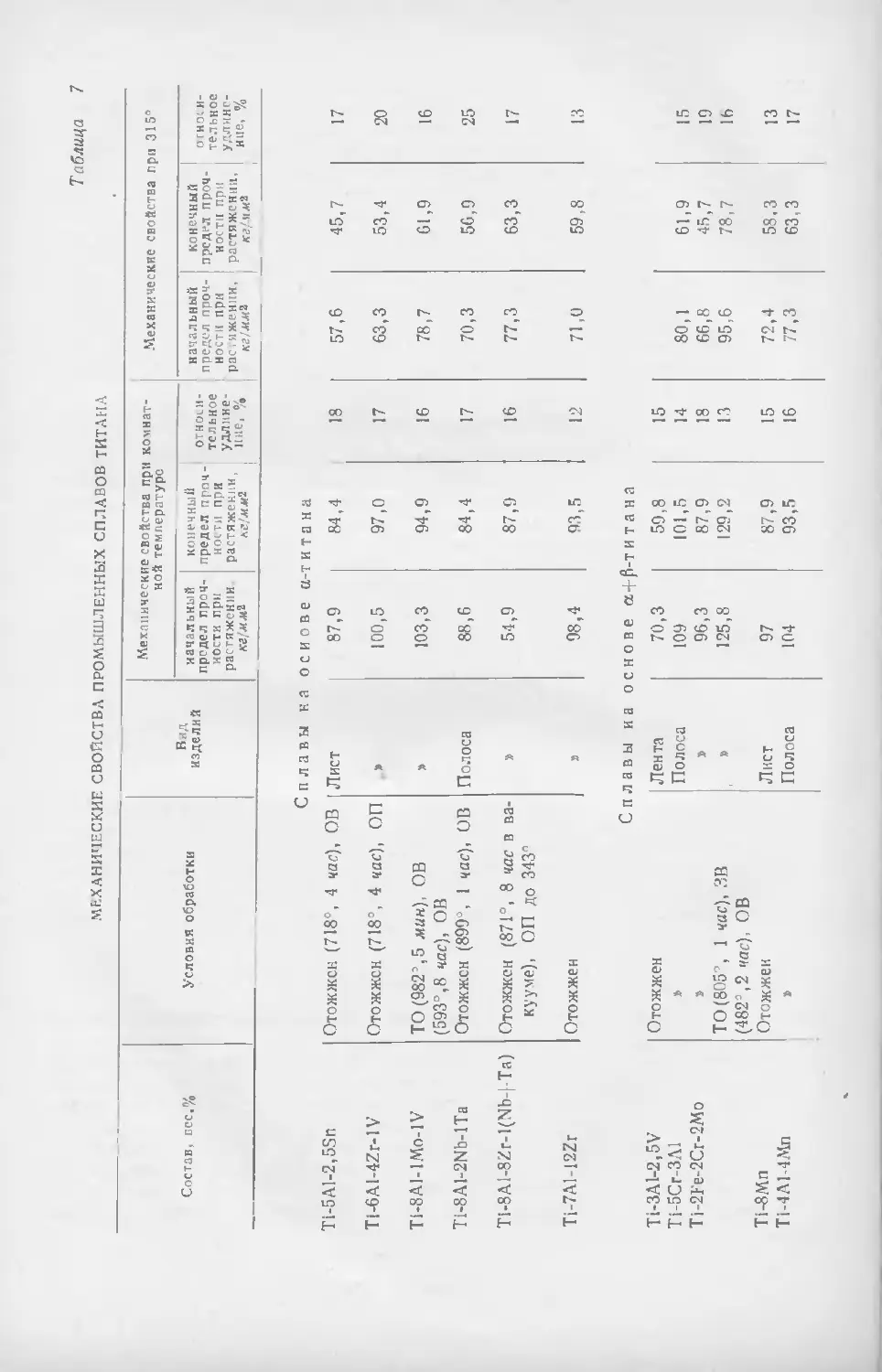
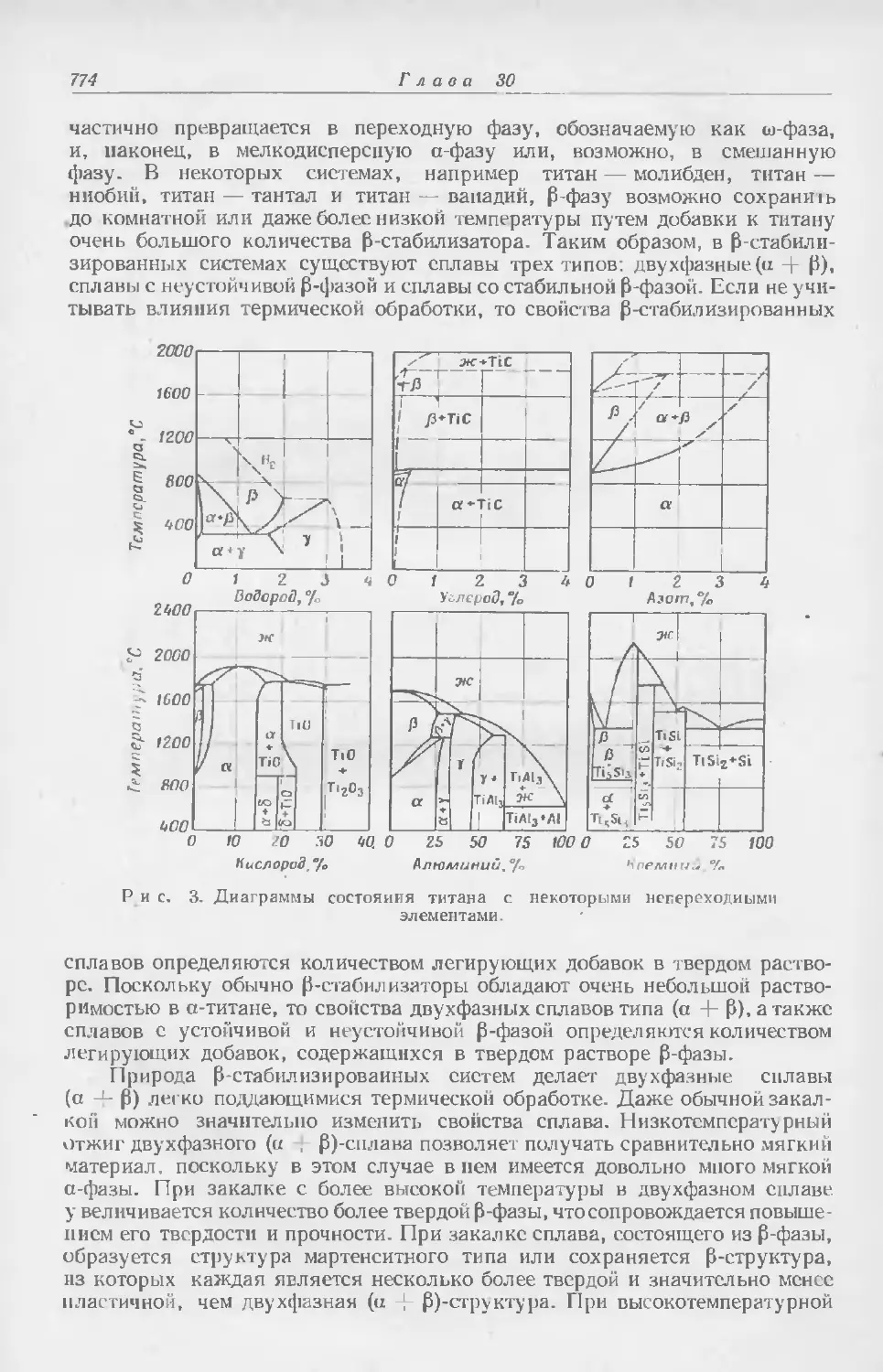
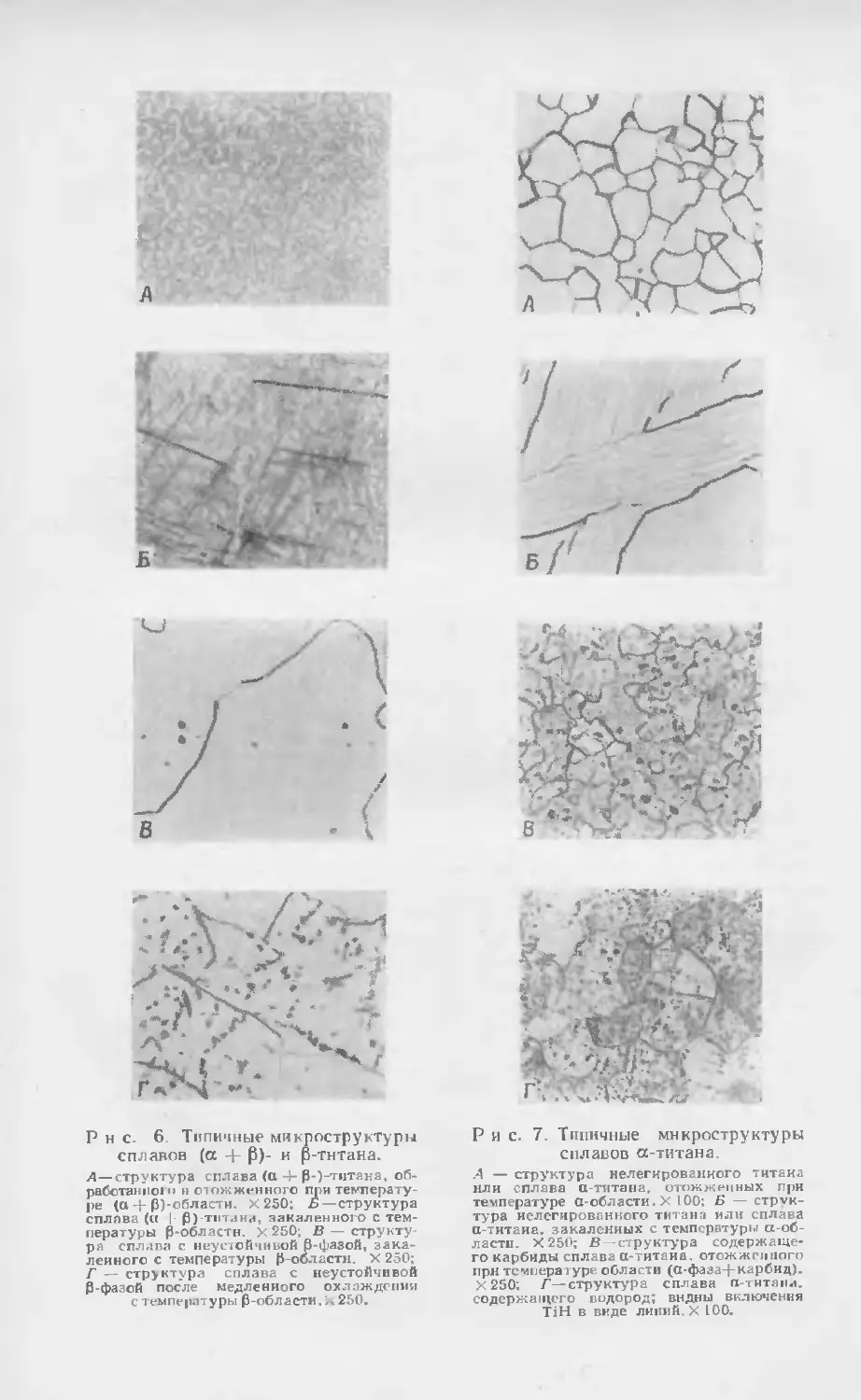
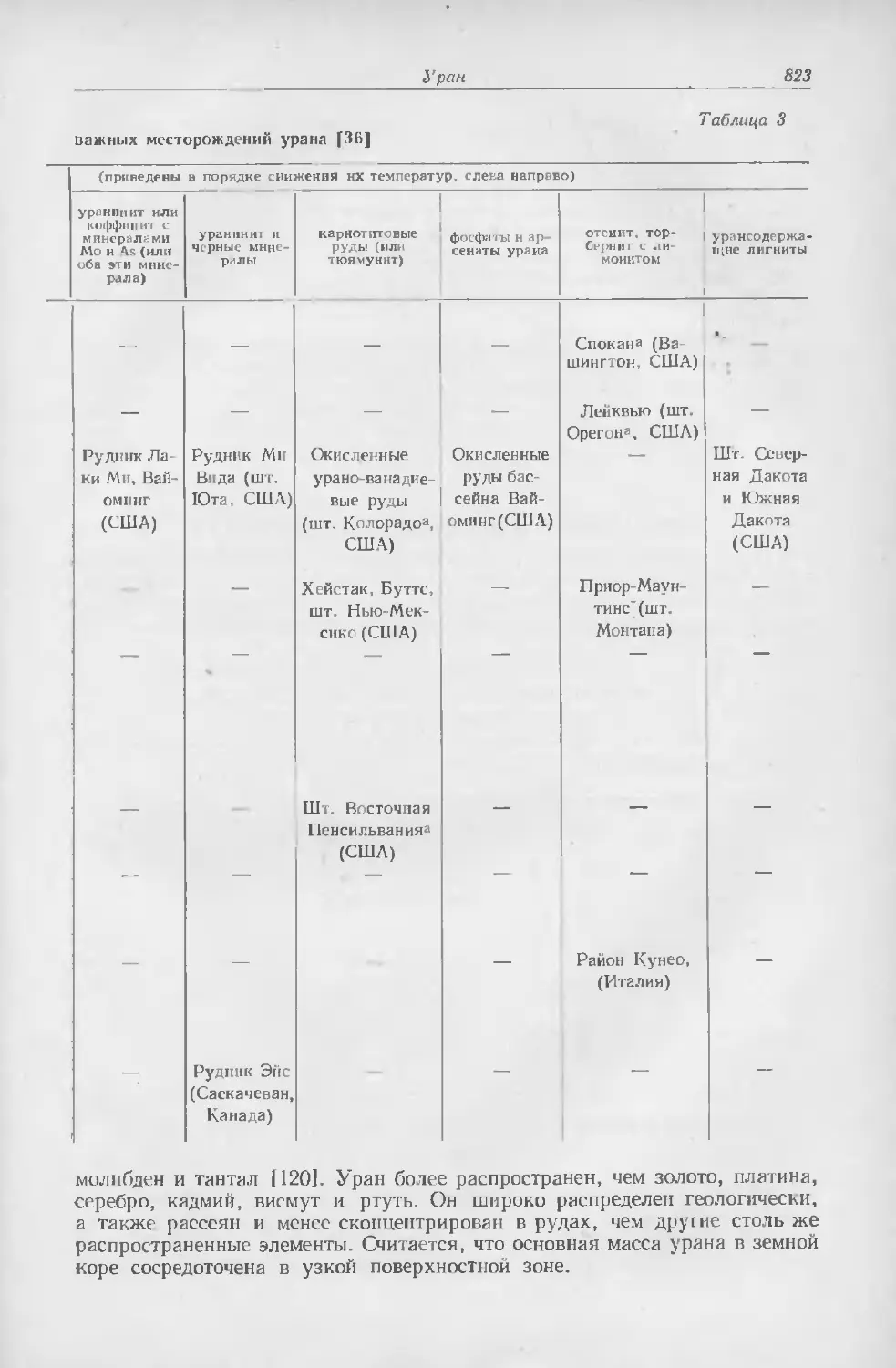
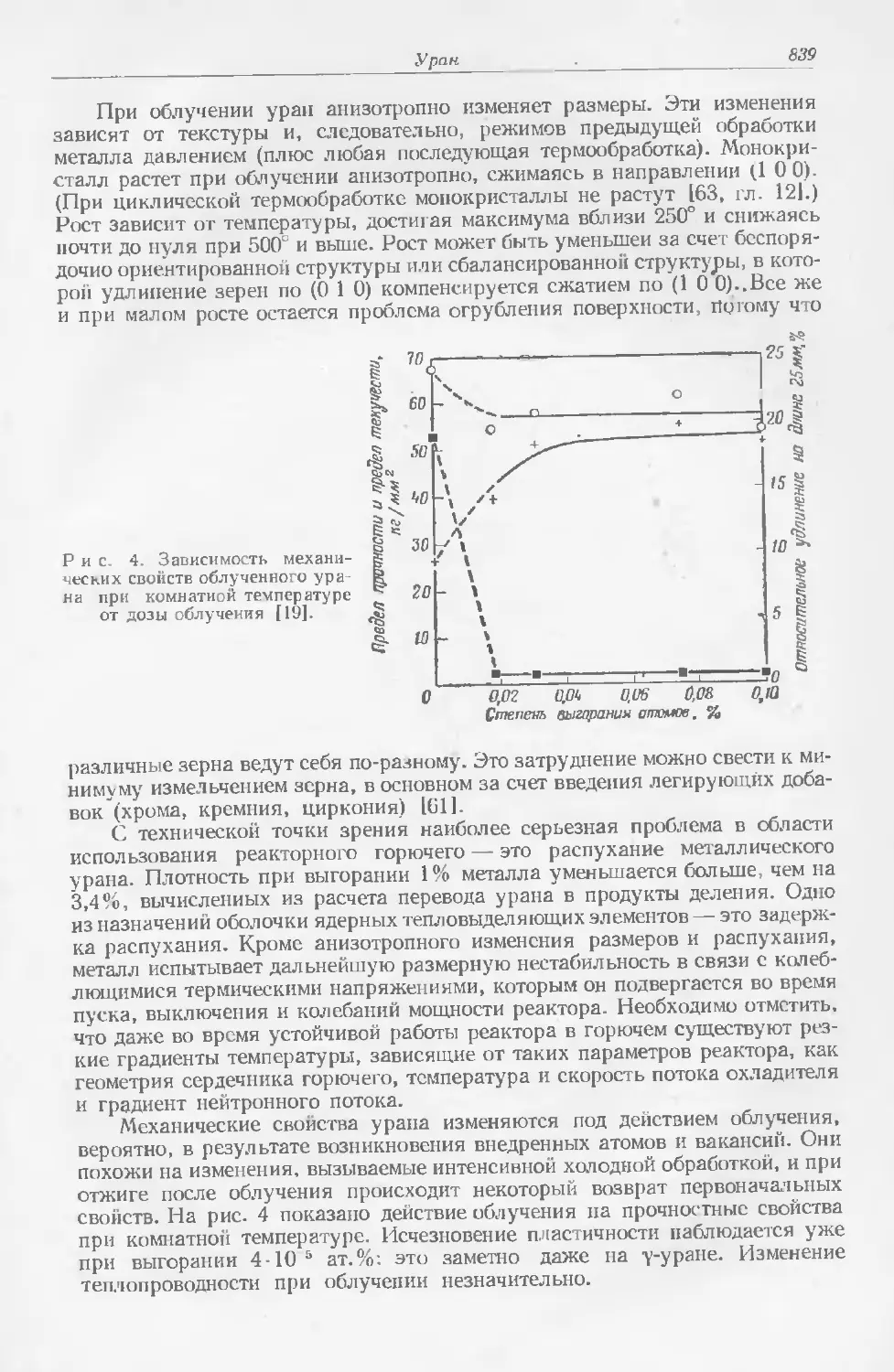
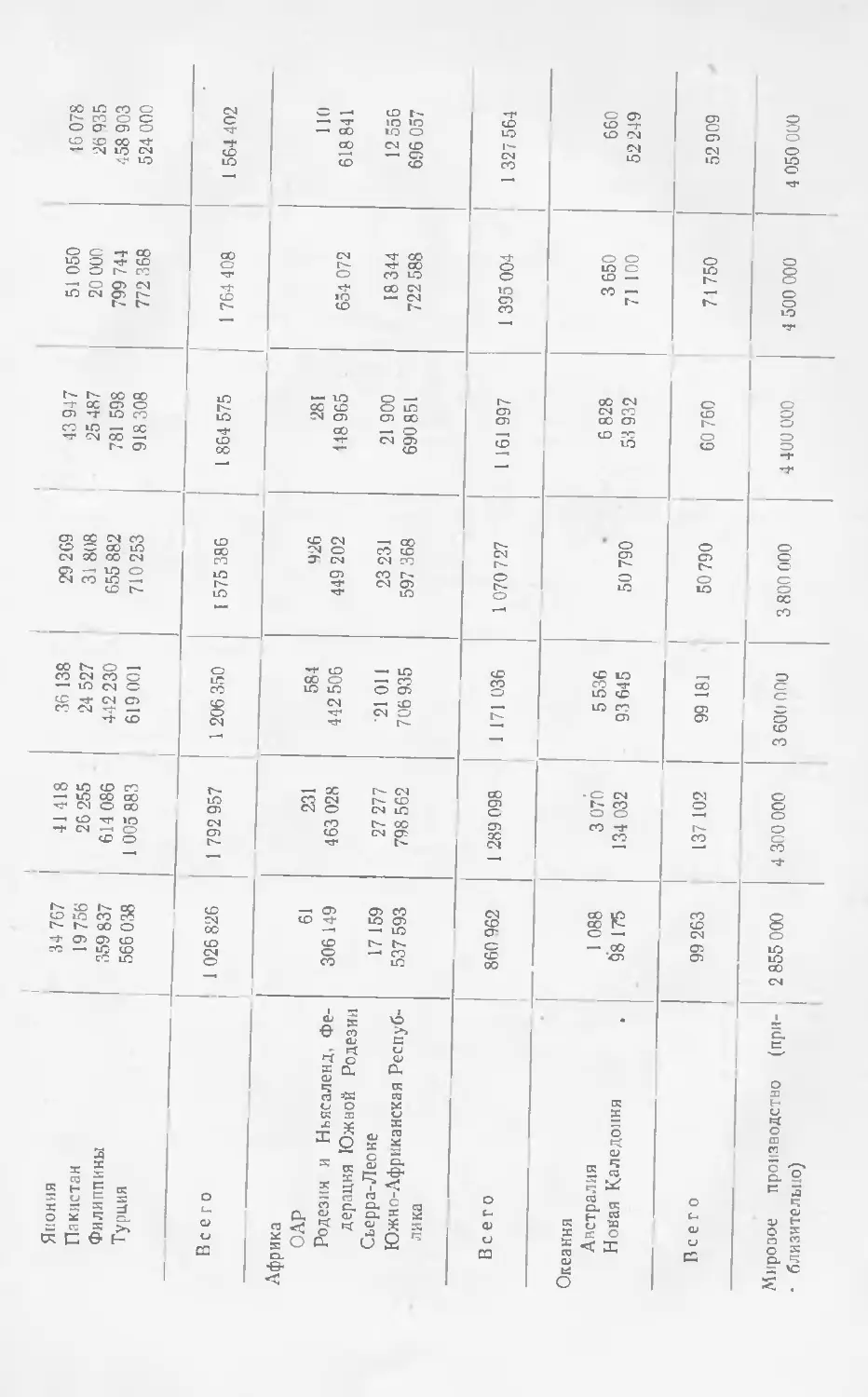
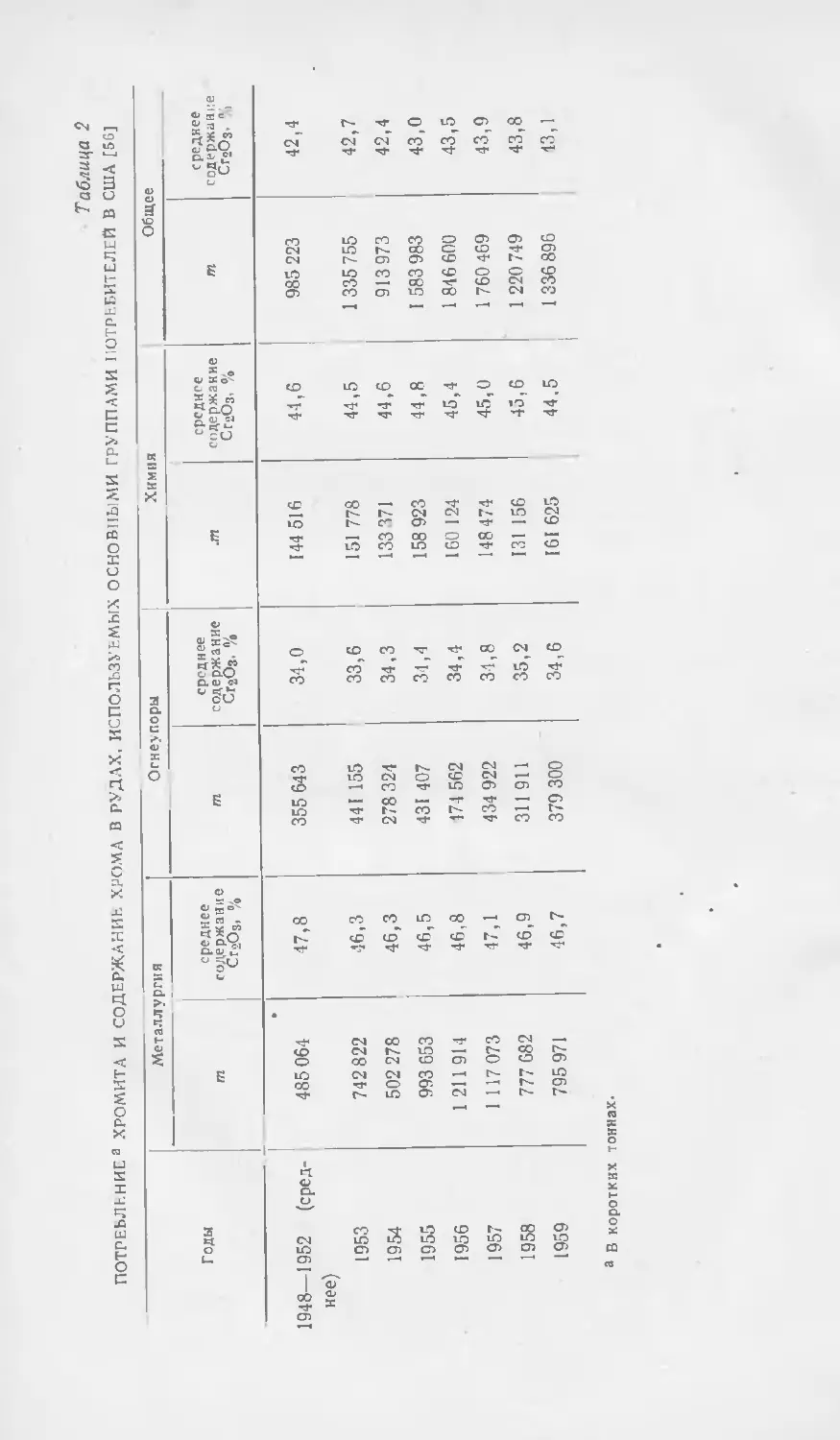
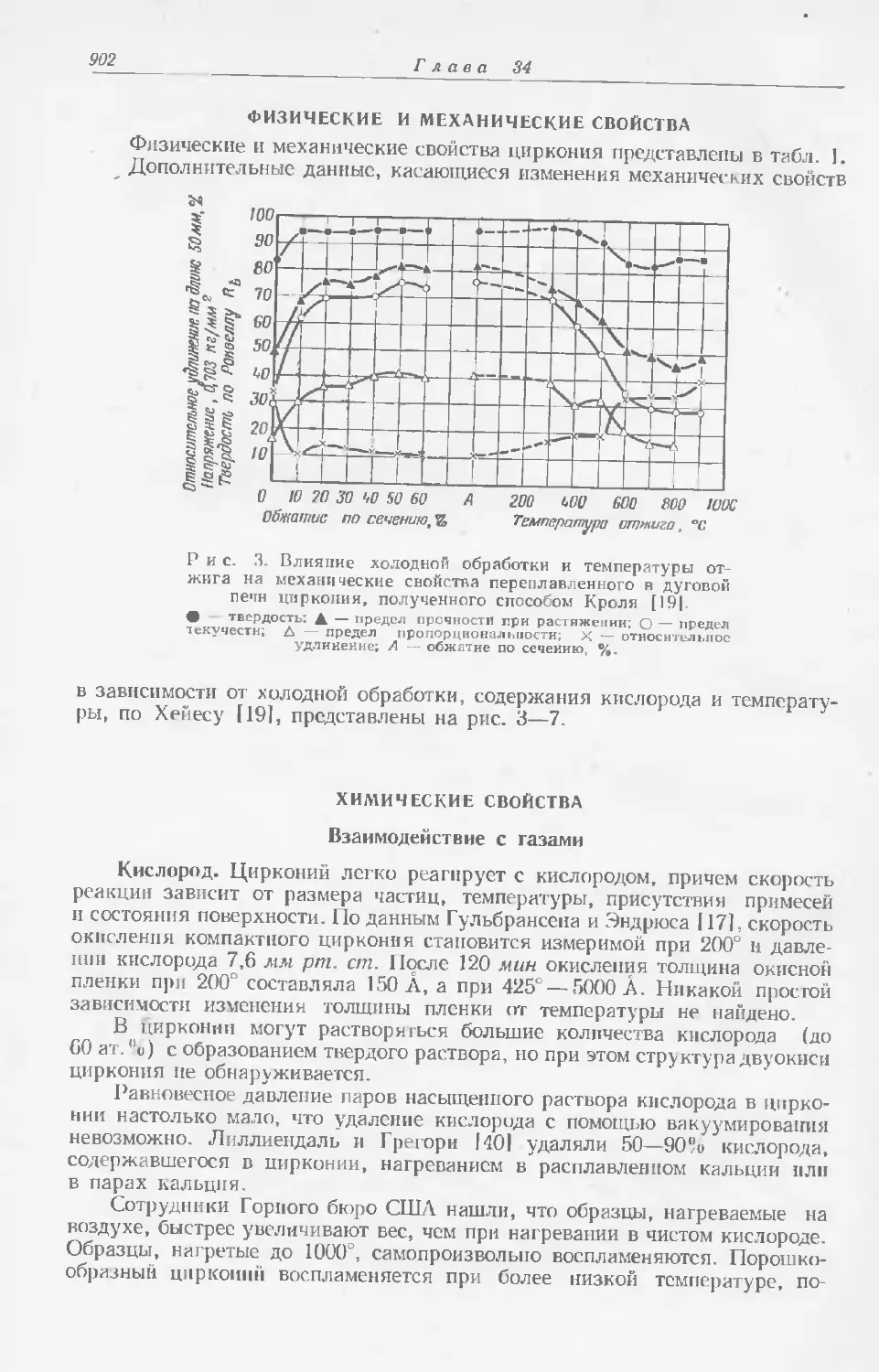
Текст
СПРАВОЧНИК
ПО РЕДКИМ
МЕТАЛЛАМ.
ПЕРЕВОД С АНГЛИЙСКОГО
ПОД РЕДАКЦИЕЙ
доктора хим. наук, проф. В. Е. Плющева
ИЗДАТЕЛЬСТВО «МИР»
Москва 1965
ПРЕДИСЛОВИЕ
Век, в который мы живем, характеризуется, если рассматрииать историю раз-
вития техники, необычайным разнообразием применяемых материалов буквально во
осех ее областях. Создание новых или улучшение свойств ранее известных материалов,
используемых в сфере науки и производства, в культуре и быту, в значительной сте-
пени определяется применением пока еще достаточно новых для техники элементов,
которые обычно называют редкими.
Эти элементы, обладающие многими ценными, а часто и уникальными свойствами,
составляют две трети от общего числа известных химических элементов, причем почти
все они в свободном состоянии являются металлами E8 из С4).
Важнейшими областями применения редких металлов являются металлургия
(производство жаростойких, жаропрочных, коррозноппостойких и сверхтвердых спла-
вов и специальных сортов стали) и машиностроение (в том числе авиа-, авто- и трак-
торостроение, а также химическое машиностроение), потребляющие литий, бериллий,
индии, титан, цирконий, ванадии, ниобий, тантал, молибден, вольфрам, редкоземель-
ные и другие металлы; электротехника (производство осветительных ламп, аккумуля-
торов и т. д.) и электронная техника (изготовление радиоламп, фотоэлектрических
приборов, рентгеновской аппаратуры и радиолокационных устройств), использующие
цезий, индии, галлий, германий, титан, цирконий, ниобий, гантал. молибден, вольф-
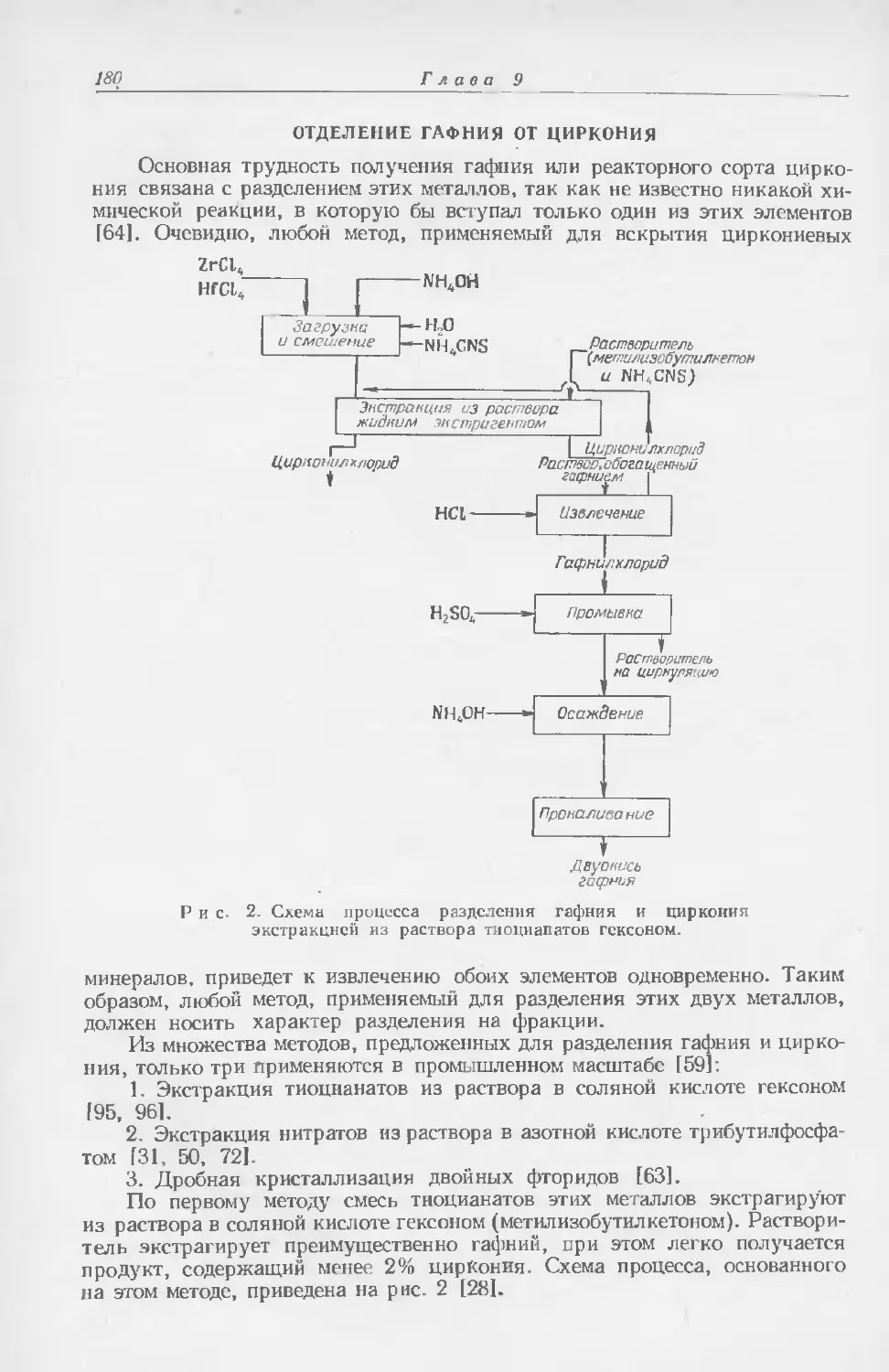
рам и некоторые другие металлы; химическая промышленность, для которой большое
значение имеют соединения редких элементов (лития, ванадия, селена, теллура, ред-
коземельных элементов); атомная техники и ядерная энср|етнка (литий, бериллий,
торий, цирконий, уран); вакуумная техника и ряд других областей.
Редкие элементы вошли в жизнь не сразу, но их роль и значение непрерывно
возрастали, и к настоящему времени положение сложилось таким образом, что без их
применения существование и дальнейшее развитие важнейших областей техники уже
невозможно. Называвшиеся когда-то элементами будущего, они стали элементами
npoi ресса.
В этих условиях вполне закономерен большой интерес со стороны специалистов
различных областей как к самим редким элементам, так и к посвященной им литера-
туре. Поэтому когдя вышло в свет первое издание справочника по редким металлам под
редакцией К- А. Гемпела, оно было встречено широкой научной общественностью
с большим одобрением, а затем приобрело известность и в специальных кругах. В даль-
нейшем выяснилось, чго книга полезна для научных работников многих смежных обла-
стей чнания, занимающихся изучением, технологическим освоением или, наконец,
применением редких металлов.
Второе издание этой книги не просто расширено в объеме и дополнено новыми
данными; оно охватывает более широкий круг металлов, и, в частности, в нем допол-
нительно рассмотрены такие металлы (рубидии, цезий, скандий, иттрий), сырьевые
ресурсы и возможности производства которых превосходят масштабы их потребления
и для которых, следовательно, актуальна проблема изыскания новых областей приме-
нения. (Эта проблема сохраняет свою остроту и для рядя других металлов, соедине-
ния которых чаще всего получают при комплексной переработке различного сырья.)
В новом издании рассмотрены редкие металлы, относящиеся ко всем группам
тон технической классификации (легкие, тугоплавкие, рассеянные, редкоземельные,
радиоактивные), которая несмотря на свою условность учитывает сходство некоторых
физико-химических свойств и методов получения редких металлов и принята
в СССР и в ряде других стран. Правда, наряду с редкими металлами в справочник не-
правомерно включены такие металлы, которые теперь относятся к другой технической
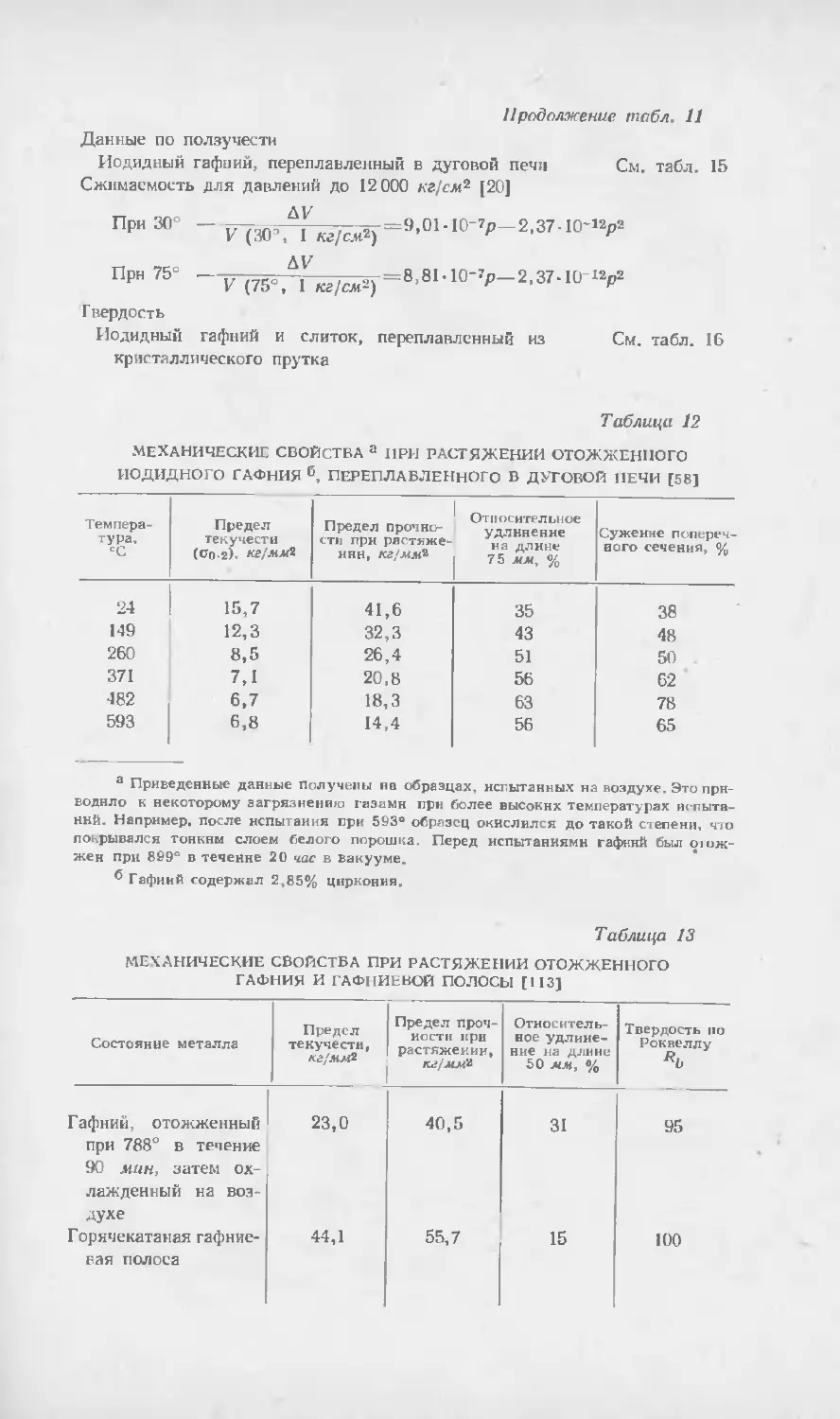
группе (кобальт) или безусловно не являются редкими (марганец, хром и др.). Тем
не менее нет необходимости акцентировать внимание на этом недостатке книги, так
как он носит частный характер.
Предисловие
В создании справочника принимали участие многие авторы; одни являются из-
вестными специалистами в области химии редких элементов. Другие — в области
их технологии, однако все они превосходно осведомлены о состоянии дел в американ-
ской промышленности и в меру своих возможностей и желания позволяют читателю
познакомиться с тем, как осваивают редкие металлы и что думают о них в США. Ко-
нечно, в тех случаях, когда освещаются, и тем более анализируются, технологические
проблемы, возможна субъективность в их оценке. Однако это неизбежно, как неизбеж-
ны некоторая пестрота (несмотря на явную увифнкацию материала книги в целом,
выполненную в результате большой работы, проведенной редактором американского
издания) и даже рапсодичность изложения, порождаемые индивидуальными вкусами
и ближними интересами авторов.
Перед ними, конечно, не ставилась задача создать справочник по всем аспектам
проблемы технического освоения редких металлов; например, в книге по существу
полностью отсутствует химия их соединений, но зато содержатся ценные сведения
о физнко-химическнх свойствах металлов (неметаллов) и их механических характе-
ристиках, на фоне которых и возникает описание отдельных вопросов технологии
получения, обработки и применения редких металлов.
В книге нашли освещение многие новые тенденции в технологии редких металлов:
показано, какое значение приобрели в последние годы процессы разделения близких
по свойствам редких элементов с получением их индивидуальных соединений, по ка-
кому пути развиваются методы получения сверхчистых соединений и как решаются
задачи создания новых конструкционных материалов. В некоторых главах можно
найти увлекательные сводки о важнейших областях освоенного или эвентуального
применения редких металлов, их сплавов и соединений, иногда в особо чистом виде.
При этом указывается также стратегическое значение редких металлов, которое отра-
жается на поисковых работах в технологии и учитывается при изучении их свойств.
Материал книги убедительно показывает насколько возросла номенклатура про-
мышленных изделий, содержащих редкие металлы, как резко увеличились размеры их
производства и до какой степени повысились требования к чистоте продукции, вы-
пускаемой промышленностью редких элементов.
В заключение хотелось бы заметить, что еще сравнительно недавно основное
внимание технологов было направлено на обеспечение редкими металлами тех обла-
стей техники, в которых они уже нашли признание, и на повышение эффективности их
использования. В последние годы во весь рост встала задача изыскания новых обла-
стей применения редких металлов. В настоящее время для успешного развития важ-
ных областей науки и техники оказалось необходимым научиться создавать новые
разнообразные материалы с заданными свойствами. Возникла новая трудная проблема.
Но если, закрыв эту книгу, читатель вынесет впечатление, что и на таком нелегком
пути неоценимую помощь технике снова окажут редкие элементы с их интересной про-
мышленной судьбой и неисчерпаемыми возможностями, значит, наша специальная лите-
ратура действительно пополнилась полезным справочником по редким металлам —
важным материалам сегодняшнего и завтрашнего технического прогресса.
В. Плющев
ПРЕДИСЛОВИЕ РЕДАКТОРА КО 2-МУ ИЗДАНИЮ
За годы, прошедшие со времени подготовки материалов для 1-го издания «Спра-
вочника по редким металлам», которые вошли в эту книгу, появилась масса новых дан-
ных. По объему этот дополнительный материал, по-видимому, превосходит ьсе то, что
было известно по указанным металлам шесть лет назад. Эти новые сведения, широкое
применение многих редких металлов и интерес к ним, а также серьезные успехи в об-
ласти их производства делают 2-е издание ценным н необходимым.
Одним из фактов, свидетельствующих о непрерывно возрастающем в настоящее
время значении редких металлов, является проведение многочисленных симпозиумов
с предварительными сообщениями о достижениях технических обществ в США и в других
странах. Другим доказательством является непрерывно увеличивающееся количество
данных по техническим характеристикам этих металлов, что свидетельствует также
о прогрессе в создании конструкционных материалов.
Характерным для такой значительной волны интереса, проявляемого к редким
металлам и к работам в этой области, является увеличение объема знаний по редко-
земельным металлам, большинство которых фактически ранее не было известно в чис-
том виде. Исследовательские работы и разработка производственных процессов
в Эймсской лаборатории (Институт атомных исследований) и в других учреждениях, про-
водящих исследования в области редкоземельных металлов, способствовали включению
в книгу сведении еще о 16 новых металлах (считая скандии и иттрий) с ценными
н особыми свойствами.
Хотя большинство металлов, которым уделено ^внимание в этой книге, нельзя
более назвать «редкими», поскольку объем их производства измеряется тоннами, они
все же включены в книгу, хотя бы просто потому, что нет никаких явных причин,
по которым их следовало бы исключить. Они до сих пор довольно необычны для
большинства металловедов, и удобная подборка сведении о них в одном томе, хотя
бы для справок, является ценной для читателей. Помимо этого, их нельзя при-
равнять к более распространенным металлам по стоимости, кроме марганца, который
дешевле олова и никеля
К числу металлов, рассмотренных ранее, добавлены некоторые новые: иттрий,
плутонии, рубидий, скандий, хром, цезий, а по ниобию и танталу включены отдельные
главы. Всего вторым изданием охвачено 55 металлов. За редким исключением в этих
главах представлен более содержательный и ценный материал, причем ие только
за счет дополнительных данных, полученных за последние несколько лет, по и за счет
рассекречивания прежде закрытой информации.
Интерес, проявленный читателями к 1-му изданию, предопределил прежнюю фор-
му подачи материала по главам с упором на сами элементы, а не иа их соединения.
Не было внесено никаких существенных изменений с точки зрения принципов вклю-
чения нового материала, которые не были бы освешепы в предисловии к 1-м\ изданию.
Редактор благодарен всем новым соавторам, а также всем тем, кто с готовностью
пересмотрел первоначальный вариант написанных им глав. Без их помощи редактор
не смог бы подготовить это издание.
Исключительная благодарность выражается Холи, ответственному редактору
отдела книг издательства «Рейнольде», и его сотрудникам за обработку рукописи
и за работу, связанную с осуществлением нового формата, котирый был выбран
для этого издания.
И, наконец, благодарю мою жену Мэрилин и дочь Кет за большую помощь
в работе.
Скоки, шт. Иллинойс, Клиффорд А. Гемпел
февраль 1961 г.
1.
РЕДКИЕ МЕТАЛЛЫ
К. А. ГЕМПЕЛ
С. A. fiampel. Consulting Chemical Fngineer, Skokie, III.
Вторая мировая война не только глубоко затронула основные области
науки и техники, но и повысила также темпы внедрения новых достижений
и расширила масштабы их применения. С тех пор эти тенденции сохраняют-
ся, причем никаких признаков замедления неуклонного прогресса не наблю-
дается.
Возник новый н разносторонний интерес к материалам, которые в состоя-
нии удовлетворить изменяющиеся и непрерывно растущие требования тех-
нологии. Для исследовательских работ и новой техники потребовачись
материалы, ранее не известные или считавшиеся научной диковинкой.
Первое место среди таких материалов занимают редкие или необычные
по своим свойствам металлы. Ускорение темпов освоения научных достиже-
ний показало, что довольствоваться получением редких металлов в лабора-
торных масштабах нельзя. Если до войны редкими металлами занимались
лишь отдельные научные работники, то теперь в данной области работают
сотни ученых, пополняя наши знания о способах получения и областях при-
менения этих металлов. Об этом свидетельствует, например, множество
научно-исследовательских программ по вопросам получения и применения
редких металлов.
Едва ли нужно напоминать общеизвестную историю с ураном (и в мень-
шей мере с торием), необходимым для получения атомной энергии, но она
показывает стремительность роста спроса на весьма дефицитный металл,
все наличие которого в чистом виде составляло в 1940 г. всего несколько
граммов. Сведения о нем в ту пору были настолько скудны, чтодажетемпе-
ратура его плавления не была точно известна. Так, в одном физико-химиче-
ском справочнике за 1943 г. указывалось, что температура плавления урана
не превышает 1850°, тогда как в настоящее время известно, что она состав-
ляет 1132°. Наряду с этим возник спрос и на бериллий высокой степени чи-
стоты для применения в качестве источника нейтронов в урановых котлах.
С тех пор работы в области ядерной энергетики вызвали повышенный
интерес и к другим металлам с особыми свойствами, в частности к галлию,
индию и висмуту, как возможным теплоносителям, к очищенному от гафния
цирконию, как к весьма коррозионностойкому конструкционному материалу
с малым поперечным сечением захвата тепловых нейтронов, к таким элемен-
там, как гадолиний, гафний и бор, высокое поперечное сечение захвата
тепловых нейтронов у которых делает их полезными материалами для регу-
лирующих стержней, и к плутонию, как к ядерному топливу.
Такая быстро развивающаяся отрасль, как электроника, нуждается
во многих редких металлах для разнообразных целей. В качестве примеров
достаточно указать, что германий и кремний требуются для изготовления
полупроводниковых триодов и других устройств иа полупроводниках;
селен нашел применение при производстве фотоэлементов и выпрямителей;
/2 Глава I
вольфрам и бериллий — для рентгеновских трубок; тантал — для элек-
тронных ламп и конденсаторов передающих устройств; молибчен — для
приемных электронных ламп; платина и вольфрам - для контактов и тел-
лур — как полупроводник в термоэлектрических устройствах.
Применение кобальтовых сплавов для работы при высоких температу-
рах и для изготовления постоянных магнитов вызывает острую потребность
в кобальте, которого раньше производилось почти столько же, сколько
и серебра. Титан, отличающийся высокой прочностью и малой плотностью,
представляет значительный интерес для авиационной и судостроительной
промышленности, и на него обратили серьезное внимание. Хотя проявляе-
мый к титану интерес то возрастает, то уменьшается в зависимости от требо-
ваний программы развития военно-воздушных сил, все жеэтот металл, несом-
ненно, займет свое место в технике среди основных конструкционных
материалов. Чтобы удовлетворить спрос на бериллий, обладающий уникаль-
ными свойствами для ядерной и космической техники, его производят в не-
прерывно возрастающих количествах. Многим другим отраслям промышлен-
ности также нужны в той или иной степени редкие металлы для удовлетво-
рения специальных требований, возникающих при практическом примене-
нии новых открытий, но приведенные примеры достаточно хорошо показы-
вают весьма разнообразный и растущий спрос па эти металлы.
Все эти металлы считаются редкими: 1) из-за ограниченности природных
запасов или малсм о содержания в земной коре; 2) вследствие низкой концен-
трации даже сравнительно распространенных металлов в доступных место-
рождениях, так что возможна только ручная разработка, и дли извлечения
даже небольших количеств нужного элемента в виде соединений или в сво-
бодном состоинии приходится перерабатывать громадную массу пустой поро-
ды, а также потому, что месторождения руд с экономически выгодной кон-
центрацией немногочисленны; 3) из-за трудностей выделения в элементар-
ном состоянии, связанных с химическими и физическими свойствами эле-
мента; 4) из-за отсутствия спроса даже на довольно доступные, но более доро-
гие по сравнению с другими материалами металлы.
Само собой разумеется, что решающим фактором здесь являются эконо-
мические соображения. Химики, инженеры и металлурги достаточно изобре-
тательны, чтобы найти способы получения того или иного металла, если
только при этом расходы не служат препятствием. Ведь прежде чем оьажется
возможным широко применять ме1алл в различных областях, его нужно
научиться получать с приемлемыми расходами. Исключение составляют
только стратегические металлы, особенно уран, стоимость производства кото-
рых, естественно, в расчет не принимается.
Производство и применение многих редких металлов могут тормозиться
при несоответствии между производством и сбытом. Так, сбыт часто ненаде-
жен, пока металл не выпускается в достаточном количестве, и, наоборот,
иногда металл не производят, так как на него нет гарантированного спроса.
Чтобы разоркать этот заколдованный круг, нужна известная смелость со сто-
роны предпринимателя, сознательно ищущего рынок и новые области при-
менения металла, который он может начать выпускать. Так обычно делается
в химической промышленности, в которой ежегодно выпускают много
новых продуктов, а затем уже находят для них области применения и рынки
сбыта. Такой же практике все больше начинают следовать и в металлургии,
чем отчасти и объясняется разносторонний интерес к редким металлам.
Большое значение для расширения знаний по вопросам, связанным
с производством, свойствами и областями применения редких металлов,
а также с ростом их применения, имеют программы исследований и развития
Редкие металлы
13
КАЭСША* и различных учреждений, работающих на оборону. Когда при
осуществлении этнх программ возникает спрос на какой-то определенный
металл, правительство часто обеспечивает поставку промышленного оборудо-
вания, необходимого для производства этого металла. В большинстве случаев
при этом на предприятиях создаются резервные производственные мощности,
так что может оказаться выгодным и экономически оправданным примене-
ние этих металлов н в мирных целях.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Хотя на применение металлов в технике, помимо спроса на них, могут
оказывать влияние многие факторы, самый важным из них — распростра-
ненность металлов в земной коре; по степени распространенности металла
в земной коре можно судить о том, насколько редким является тот или иной
металл.
Один из самых последних сводных обзоров по вопросу о среднем содер-
жании элементов в земной коре составлен Мейсоном [6, стр. 41]; за основу
им взяты главным образом последние данные Гольдшмндта (Норвегия)
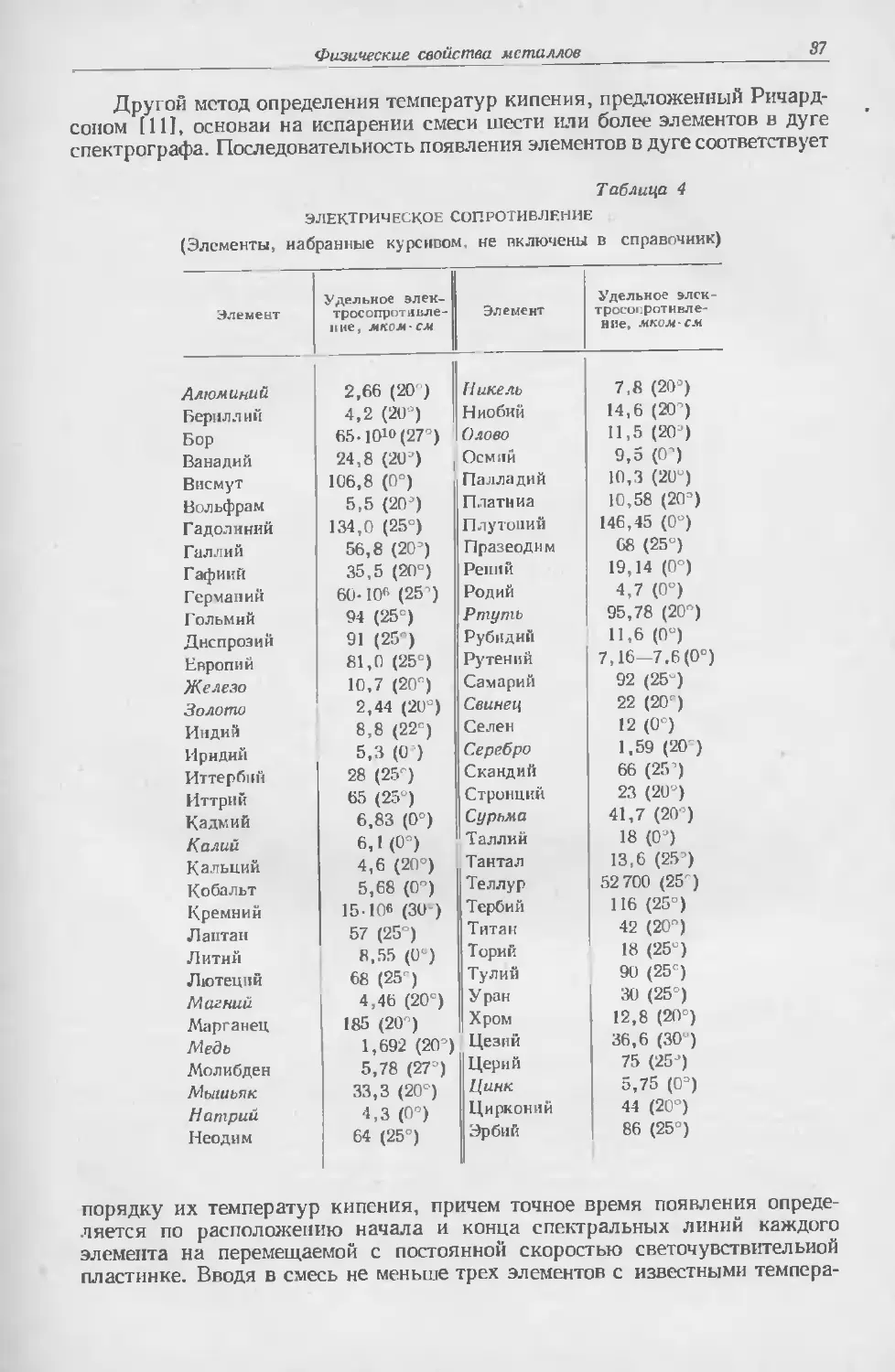
и Кларка (США). В табл. 1 указана степень распространенности элементов
в порядке убывания.
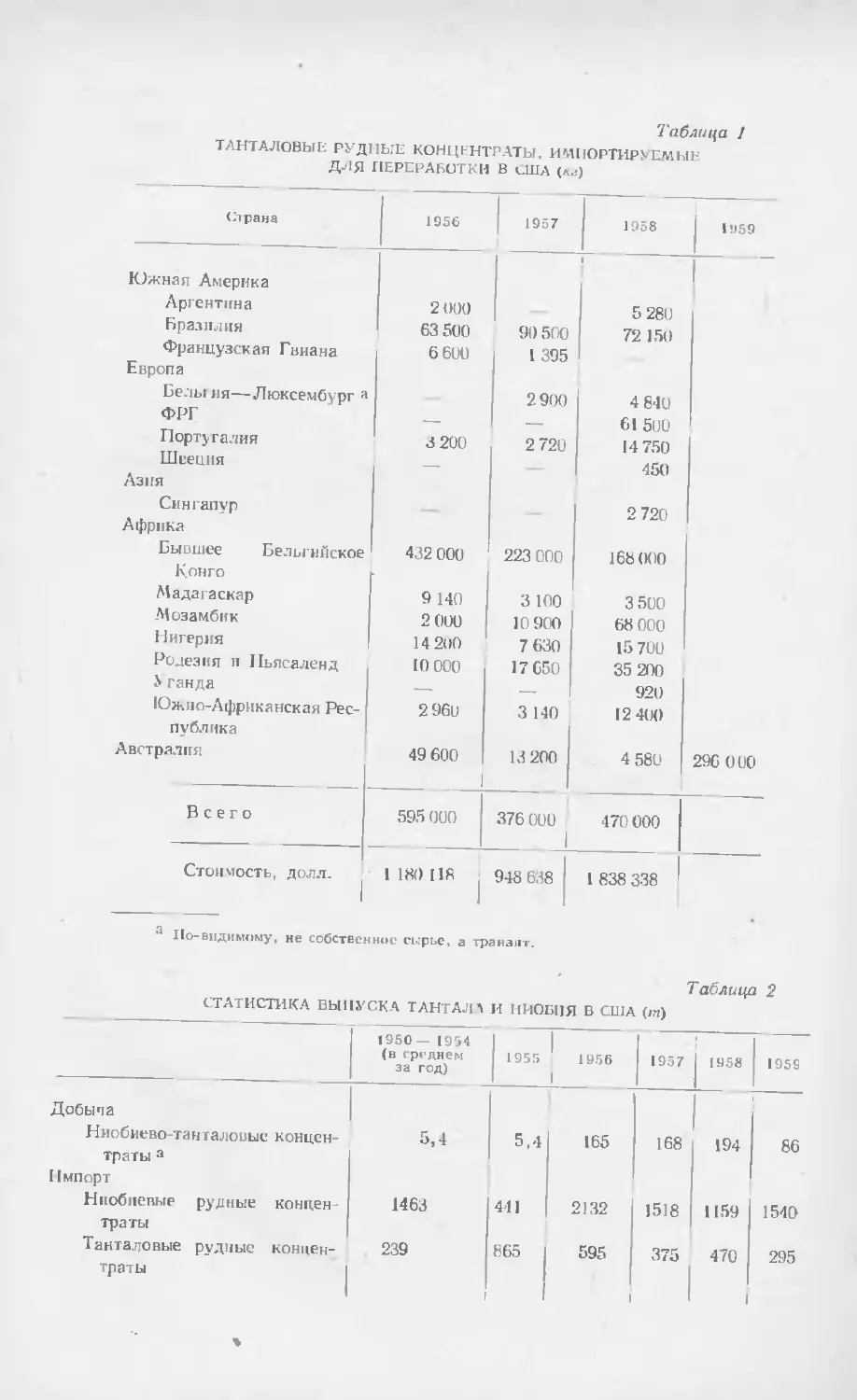
Таблица I
СРЕДИНЕ СОДЕРЖАНИЕ Э.1ЕМЬН1 (Ж В ЗЕМНОЙ ЬОРЕ ' П). rrp, 4 1]
.)ле-
о
Si
AI
Fe
Са
Na
К
Mg
Ti
н
р
Мп
S
с
CI
Rl.
F
Sr
Ва
Zr
i
Сидержс!-
466000
277 200
81 300
50 0D0
36 300
28 300
25 91H
20 900
4 400
I 100
1 180
I 000
520
320
314
310
300
300
250
220
а Содержание
Элс-
Сг
V
Zn
Ni
Си
W
Li
N
Се
Sn
Y
Nil
Nb
Co
La
Pb
Ga
Mo
Th
Cs
Ne. I\r
1 Содер-
жание,
200
150
132
80
70
69
65
46
46
40
28
24
24 |
23 1
1Я
1G
15 |
15
12 1
?|
. Xe, R,
Ge
Be
Sm
Gd
Pr
Sc
As
Hf
by
U
В
Yb
Er
Та
Br
Ho
Ни
Sb
Tb
Lu
Сид1фжа-
7
6
6,5
6,4
5,5
5
5
4.5
4,5
4
3
2,7
2,5
2.1
1,6
1.2
1.1
И?) I
0.9
0.8
TI
Hg
I
Bi
lu
Cd
Ag
In
Se
Ar
Pd
Pt
An
He
Те
Rh
Re
Ir
Os
Ru
II КОРОТКОЖКВ>ЩЦХ |]Э'1
элементов, присутствующих в количе< idzix мсныче С
зано.
,U01 г/
Содержа-
0,6
0,5
0,3
0.2
0,2
0,15
0,1
0,1
0,09
0,04
0,01
0,005
0,005
0,00.4
0,002
0,001
0,0111
0,001
0,001 (?)
0.001 (?)
OJKTHEHblX
т. не >ка-
* Комиссия по атомной энергии США.— Прим.
14 Глава 1
Подобное расположение элементов позволяет выявить много интересных
фактов. Так, на долю первых восьми элементов — кислорода, кремния, алю-
миния, железа, кальция, натрия, калия и магния — приходится около
99% веса земной коры, но из них только кислород широко распространен
D свободном состоянии и только железо (в виде чугуна и стали) применяется
главным образом в элементарной форме. Однако все большее распростра-
нение в промышленности находит алюминий, значительно расширяются
и области применения магния. Интересно отметить, что масштабы существую-
щего производства стали, алюминия и магния в США округленно выражают-
ся соотношением 3000 : 50 : 1. Натрия выпускают значительно больше, чем
магния, но применяется он чаще как химический восстановитель, а не как
металл. Налажено также производство технического кальция, но в сравни-
тельно небольших масштабах.
Сера и углерод — два самых распространенных элемента из встречаю-
щихся в природе и применяемых в элементарной форме — занимают в таб-
лице соответственно 13-е и 14-е места, а стоящий вслед за ними хлор по тон-
нажу производства и использованию в свободном состоянии уступает только
железу.
Таким образом, из первых пятнадцати элементов в таблице распростра-
ненности только кислород, сера и углерод встречаются в природе и широко
применяются в самородном состоянии. Следовательно, железо, хлор, алю-
миний, натрий и магний — вот главные элементы, для применения которых
требуется их восстановление до элементарного состояния. В наш век инду-
стрии первое место по потреблению в свободном состоянии принадлежит
кислороду, даже если не учитывать расходования его на биологические
цели. За ним идут углерод и железо.
Следует обратить внимание на значительное содержание в земной коре
многих таких сравнительно мало потребляемых элементов, как титан, руби-
дий, цирконий и ванадий. И, наоборот, содержание элементов, уже давно
играющих важную роль в судьбах нашей цивилизации, поражает своей
незначительностью. Меди в земной коре имеется приблизительно столько же,
что и вольфрама, но гораздо меньше, чем марганца, циркония и ванадия.
По своей распространенности азот стоит наравне с церием, олово уступает
литию, а содержание свинца и молибдена близко к содержанию галлии.
Тория и урана имеется больше, чем бора, а природные запасы ванадия
несколько превышают запасы цинка. Ртуть — гораздо менее распростра-
ненный в природе элемент, чем редкоземельные металлы, бериллий и тантал.
Любопытно, что рубидий, занимающий по содержанию в земной коре
16-е место среди всех элементов, стоит почти наравне с хлором, хотя этот
металл и его соединения мало известны в химии и почти не встречаются
в продаже.
МИРОВОЙ ОКЕАН КАК ИСТОЧНИК МЕТАЛЛОВ
Океаны, покрывающие более 70% земной поверхности, в среднем содер-
жат в растворенном состоянии около 3,5% твердых веществ. Это ничтожная
величина по сравнению с весом земной коры, но она приобретает чрезвычай-
ную важность благодаря легкости получения веществ из этого источника.
Еще более ценно то, что вещества находятся в растворе. Как известно, часто
растворение твердых веществ с целью дальнейшей переработки и извлечения
конечных продуктов сопряжено с затратой больших усилий и средств.
Поэтому то обстоятельство, что морская вода представляет собой раствор,
пусть даже разба&ченный, удобно в технологическом отношении.
Таблица 2
КОНЦЕНТРАЦИЯ ЭЛЕМЕНТОВ В МОРСКОЙ BOJIFa [8]
Элемент
С1
Na
Mg
s
Ca
К
Br
С (неоргани-
ческий)
Sr
(SiO2)
В
Si
С (органичес-
кий)
Al
F
N (в виде нит-
ратов)
N (органиче-
ский)
Rh
Li
Р (в виде фос-
фатов)
Ва
1
N (о виде нит-
ритов)
N (в виде ам-
миака)
As (в виде ар-
сеннтов)
Fe
Р (органиче-
ский)
Zn
Концентрации,
г/т
18 980
10 561
1272
884
400
380
65
28
13
0,01—7,0
4,6
0,02—4,0
1,2—3,0
0,16—1,9
1,4
0,001 -0,70
0,03—0,2
0,2
0,1
>0,001—0,10
0,05
0,05
0,0001—0,05
>0,005 0,05
0,003—0,024
U,002—0,02
0—0,016
0,005—0,014
Элемент
Си
Мп
РЬ
Se
Sr,
Cs
и
Mo
Ga
Ni
Th
Ce
V
La
Y
Hg
Ag
Bi
Co
Sc
Аи
Fe (в истин-
ном раство-
ре)
Ra
Ge
Ti
W
Cd
Cr
Tl
Sb
Zr
PI
Концентрация.
г/т
0,001—0,09
0,001—0,01
0,004 0,005
0,004
0,003
-0,002
0,00015—0,001fi
0,0003- 0,002
0,0005
0,0001 0,0005
<0.0005
0,0004
0,0003
0,0003
0,0003
0,0003
0,00015- 0,0003
0,0002
0,0001
0,00004
4-10 B_8.K)~6
<io-°
2.10-H—3-10" i"
Присутствует
3»
»
Присутствует
в морских
организмах
То же
» »
» >
» »
а Концентрация растворенных газов не указана.
/б Глава I
В морской воде содержится около 50 элементов, причем источником
других элементов, обнаруженных в морских организмах, также, несомнен-
но, является морская вода. В табл. 2 приводятся концентрации различных
элементов в морской воде по данным Свердрупа, Джонсона и Флеминга 181.
Соотношения концентраций весьма постоянны по всему земному шару,
что обьясняется однородностью состава воды океанов. Для многих элемен-
тов указаны интервалы концентрации в зависимости от местных условий
и биологической деятельности, неодинаковых на различной глубине.
По своей концентрации в морской воде (вода океанов и прочие массы
воды, образующие гидросферу) элементы по ряду причин располагаются
совершенно в другом порядке, чем в табл. 1, где указано их содержание
в земной коре. Соотношение растворимостен элементов в воде иное, чем
в силикатных системах, которые представляют собой главную составную
часть земной коры. Поэтому концентрации ионов, переходящих в морскую
воду в процессе естественного выщелачивания, сильно отличаются от их кон-
центраций в земной коре. Кроме того, процессы взаимодейсгнмн, происхо-
дящие в растворе, и длящееся веками избирательное извлечение определен-
ных элементов различными морскими организмами также приводят к изме-
нению содержания многих из них в морской воде. Естественная адсорбция
и ионный обмен способствуют извлечению и замещению ряда элементов.
По Гольдшмидгу 16, стр. 173], малая величина концентраций таких, токсич-
ных элементов, как мышьяк и селен, обусловлена адсорбцией их на свеже-
осажденной гидроокиси железа. Многие редкие элементы встречаются
в отложениях на дне океанов, что доказано их присутствием в разрабаты-
ваемых теперь отложениях древних морей.
Океаны часто считают богатым источником химикалий, в том числе
металлов. В настоящее время из морской воды рентабельно извлекают
натриевые и магниевые соединения, бром и металлический магний 19!.
Интересно отметить, что морская вода, содержащая всего 0,13% магния,
используется как исходное сырье для получения этого металла, хотя сущест-
вуют огромные месторождения руд с содержанием не ниже 30°г> магнии. Это
только один из примеров того, как в промышленных масштабах предпочте-
ние отдается естественному сырью с весьма низкой концентрацией по срав-
нению с более богатыми рудами. Кстати сказать, предприятия, получавшие
магний из морской воды, добились в годы второй мировой войны большего
снижения себестоимости продукции по сравнению с заводами, работавшими
на другом сырье, и продолжали функционировать в послевоенный период,
тогда как последние пришлось закрыть.
Легенда о добыче золота из морской воды, возможно, и не столь абсурд-
па, как это принято считать. Около 40 лет назад во Франции действительно
был построен завод по извлечению золота из морской воды. В конце концов
завод прогорел, хотя и был близок к тому, чтобы стать конкурентоспособ-
ным. Золото давно влечет к себе человека, но, по всей вероитности, из океа-
нов будут все-таки извлекать не золото, а другие ценные продукты, в том
числе металлы. Последние достижения в области ионного обмена, исполь-
зование диализа, адсорбции и электрохимических методов делают подоб-
ное предположение еще более вероятным.
ДРУГИЕ ИСТОЧНИКИ ПОЛУЧЕНИЯ МЕТАЛЛОВ
Не исключено, что еще более важным способом извлечения металлов
из морской воды явится специальное разведение определенных морских
организмов, которые в процессе биологической деятельности накапливают
Редкие металлы 17
один или несколько элементов. Общеизвестно, что в кораллах и устричных
раковинах отлагается карбонат кальция: диатомея (кремневая водоросль)
накапливает двуокись кремния, а устрицы и омары — медь. Менее извест-
ные организмы способны концентрировать другие элементы, например желе-
зо, ванадий, кобальт, цинк и марганец [I].
Некоторые морские водоросли, например ламинария, свыше столетия
служат источником получения калия и иода. Известны и другие морские
растения, способные накапливать те или иные элементы. Все они являются
потенциальными источниками элементов, необходимых для нужд промыш-
ленности.
Уже давно известно, что наземные растения зачастую эффективно
усваивают некоторые элементы. Примерами могут служить растения, спо-
собные накапливать селен. Astralagus, разновидность вики, известный так-
же как астрагал, хорошо произрастает только на землях, содержащих селен,
и создает концентрации этого ценного редкого элемента, достигающие 1,5%.
Известны растения, способные накапливать германий. Наличие германия
во многих сортах каменного угля объясняется подобной способностью неко-
торых растений, превратившихся в каменный уголь. Можно было бы назвать
и другие растения, способные концентрировать марганец, бор, барий и редко-
земельные металлы 121.
Следует отметить также, что способность растений накапливать опреде-
ленные элементы дает возможность находить месторождения металлов на
основании результатов анализа состава таких растений. Это позволяет судить
о наличии залежей некоторых минералов в недрах земли. Установлено, что
высокое содержание селена в растениях свидетельствует о близости место-
рождений урана 13].
Запасы многих редких металлов могут создаваться также в результате
жизнедеятельности бактерий и других микроорганизмов в средах, содержа-
щих малые концентрации отдельных элементов, которые таким образом отла-
гаются в более концентрированном виде. Самородиая сера, найденная в гор-
ных породах сводов некоторых соляных куполов, по всей видимости, обра-
зовалась вследствие бактериологической переработки содержащего серу
ангидрита в свободную серу. Известно, что анаэробные бактерии Sporovibria
dcsulfuricans (Beijerinck) Starkey восстанавливают сульфат до свободной се-
ры или до сульфида. Существуют также бактерии, способные усваивать, пере-
рабатывать и накапливать железо, марганец, кобальт и ванадий. Некоторые
геологи считают, что залежи железной руды и различных руд, содержащих
двуокись марганца, образовались в результате деятельности бактерий.
В настоящее время нас не должна интересовать справедливость этих выводов.
Важно то, что выращивание тех или иных микроорганизмов может обеспе-
чить в будущем значительные запасы редких металлов. Использование
микроорганизмов для извлечения небольших количеств многих ценных
металлов из скоплений золы и шлака или, например, из бедных месторожде-
ний открывает перед учеными и инженерами новые широкие горизонты на пу-
ти удовлетворения неуклонно растущего спроса на металлы в условиях выра-
ботки и истощения разведанных месторождений.
Уже теперь одной из самых крупных компаний по производству меди
начато извлечение в большом масштабе меди из рудничных отвалов мето-
дом, основанным на жизнедеятельности бактерий [ 10]. Встречающийся в при-
роде вид Thiobacillus ferrooxidans, который в процессе жизнедеятельности
концентрирует 1,7°6 цинка (первоначальное содержание не больше 0,015%),
1,2% меди, 0,63% алюминия, 0,5% кальция, 0,249о магния, 0,33% марган-
ца и 0,01 % молибдена, используется для окисления двухвалентного железа
2 Заказ № 239
/8 _ Глава 1
в выщелачивающем растворе до трехвалентного. Трехвалентное железо,
в свою очередь, окисляет медь до двухвалентного состояния и создает кон-
центрацию меди в выщелачивающем растворе, доступную для ее извлече-
ния. Эти бактерии являются автотрофными*, и для их роста необходимы
лишь кислород и углекислый газ, а не органические вещества. Культура
бактерий устойчива в серной кислоте, живет в ней и лучше всего разви-
вается при 15—40е и рП 1,5—2,5. В присутствии микроорганизмов проте-
кают следующие реакции:
2FeSO4+II2SO4+i/2O2 -* Fe2(SO4K+H2O,
Fe2(SO4K+6H2O - - 2Fe(OHK+3H2SO4,
4FeS2+15O2+2H2O -> 2Fe2(SO4K-|-2H2SO4,
Fe2(SO4K-f Cu - - CuSO4+2FeSO4.
КОНЦЕНТРАЦИЯ МЕТАЛЛОВ В ПРИРОДНЫХ МЕСТОРОЖДЕНИЯХ
Одной из причин большого несоответствия между распространенностью
в природе и технической доступностью металлов во многих случаях является
их концентрация в минералах, рудах и других видах промышленного
сырья.
Почти все давно известные и используемые человеком металлы — желе-
зо, цинк, медь, олово, свинец, ртуть и серебро — находятся в земной коре
в виде легко распознаваемых минералов с довольно высоким содержанием
металла. Это обстоятельство вместе с простотой вскрытия таких минералов
объясняет, почему перечисленные металлы давно поставлены человеком себе
на службу. 11аоборот, многие из более распространенных в природе металлов
входят в состав обычных минералов в незначительных количествах и почти
никогда не встречаются в сколько-нибудь заметной концентрации. Приме-
рами такого рода служат рубидий и галлий. Рубидий не образует собственных
минералов; он всегда сопутствует калиевым минералам, а галлий — в основ-
ном алюминиевым минералам. Цирконий образует собственные минералы,
главным образом циркон, но они сильно рассеяны в самых обычных горных
породах [6, стр. 42].
От руды промышленного значения требуется, чтобы концентрация нуж-
ного металла в ней делала извлечение его технически осуществимым и эконо-
мически целесообразным. Подобная минимальная концентрация бывает
различной в зависимости от химических и физических свойств металлов и их
соединений, поскольку эти свойства определяют способ извлечения их из руд.
Так, для меди минимальная концентрация может быть не больше 1%г
для магния допустима концентрация 0,13% (как, например, в морской воде),
а для алюминия и железа концентрация металла должна быть выше 30%.
Развитие технологии н изменение экономических требований непрерывно
меняют уровень минимальных концентраций металлов в руде и других
исходных материалах, идущих для промышленного производства. Нагляднее
всего это можно показать на примере меди: отходы от ее производства, кото-
рые раньше выбрасывались за ненадобностью, сейчас перерабатываются
заново, поскольку технологические достижения позволяют извлекать медь
при меньшем ее содержании в исходном сырье.
Главным источником получения многих металлов, рассматриваемых
в настоящем справочнике, служат отходы производств при извлечении
* Организмы, продуцирующие органические вещества из неорганических. —
Прим. персе.
Редкие металлы
19
обычных металлов, в процессе которого содержание редких металлов повы-
шается .до приемлемого для извлечения уровня. Платиновые металлы
извлекаются главным образом из отходов производства никеля; галлий,
германий, кадмий, индий, таллий и висмут получают из побочных продук-
тов производства свинца и цинка; селен, теллур, кобальт и рений — из отхо-
дов медеплавильного производства. Большая часть этих редких металлов
встречается в природиых месторождениях в чрезвычайно рассеянном состоя-
нии, но современная технология обогащения позволяет получать сырье
сравнительно высокой концентрации, достаточной для извлечения металла.
СПЕЦИФИЧЕСКИЕ ТЕХНОЛОГИЧЕСКИЕ ПРОБЛЕМЫ
В большинстве случаев редкие металлы труднее, чем обычные, извле-
каются из руд или другого сырья; изделия из них также сложнее изготавли-
вать, чем из обычных металлов. В связи с этим приходится применять мно-
гие способы, которые значительно отличаются от общепринятых способов,
применяемых для более обычных металлов. Так, для получения некоторых
редких металлов в чистом виде и изготовления из них изделии нужной формы
в некоторых случаях пришлось разрабатывать специальную технологию.
О взаимосвязи между распростраиенностью металлов в природе и сте-
пенью трудности их перевода в элементарное состояние можно судить
по данным табл. 3. Хотя о месте некоторых металлов в этой таблице можно
Таблица 3
РАСПРОСТРАНЕННОСТЬ МЕТАЛЛОВ В ПРИРОДЕ И СТЕПЕНЬ ТРУДНОСТИ
ИХ ПЕРЕВОДА В ЭЛЕМЕНТАРНОЕ СОСТОЯНИЕ
Редкие металлы, получаемые
ЛЕГКО
Висмут
Золото
Кадчий
Кобальт
Медь
Мышьяк
Никель
Олово
Ртуть
Свииеи
Селен
Серебро
Сурьма
Теллур
Цинк
е трудом
Барий
Бериллий
Бор
Ванадий
Вольфрам
Галлий
Гафний
Германий
Индий
Иридий
Иттрий
Литий
Молибден
Ниобий
Осмий
Палладий
Редкие металлы,
получаемые
легко
с трудом
Платина
Плутоний
Редкоземельные
Рений
Родий
Рубидий
Рутений
Скандий
Стронций
Таллий
Тантал
Торий
Ураи
Хром
Цезий
Цирконий
Распространенные метад-
лы, получаемые
легко
Железо
с трудом
Алюминий
Калий
Кальций
Кремний
Магний
Марганец
Натрий
Титан
еще спорить, приведенные данные показывают, почему обычные металлы
нашли широкое применение, будучи в ряде случаев весьма мало распро-
2*
20 Глава 1
страненными в природе. За исключением алюминия и магния, эти металлы
легко восстановить и получить в свободном состоянии. Лишь сравнительно
недавно, после разработки специальных способов производства, более туго-
плавкие алюминий и магний стали обычными металлами. То же самое отно-
сится и к другим металлам, с трудом извлекаемым из исходных мате-
риалов.
Другими словами, освоение менее известных металлов идет параллельно
с выдающимися достижениями в области теоретической и прикладной физи-
ки, чем и знаменательны последние 50 и особенно последние 20 лет. В отно-
шении многих металлов положено лишь начало изучению их свойств, спо-
собов извлечения, обработки, изготовления изделий из них и применения.
Чтобы подчеркнуть важность некоторых необычных технологических
процессов, используемых при производстве редких металлов, ниже приводит-
ся общее описание отдельных способов применительно к рассматриваемым
в настоящем справочнике металлам.
Электролитические процессы. Электролиз — один из лучших, а в неко-
торых случаях практически единственный способ получения чистых метал-
лов. Электрохимическая промышленность США является главным потреби-
телем электроэнергии, большая часть которой расходуется на извлечение,
рафинирование и потребление металлов в различных областях их приме-
нения [4J.
Р и с. 1 Электролизеры для электролнтическо-
го рафинирования индия до степени чистоты
99.98% («Консолидеитид маннинг энд смелтинг
компани оф Канада, лтд.»).
Кадмий, хром, кобальт, галлий, индий, марганец и таллий получают
осаждением из водных растворов. Важное значение электролитическое
осаждение имеет и для нанесения покрытий из многих металлов, к числу ко-
торых относятся кадмий, хром, кобальт, палладий, платина, родий, индий
и вольфрам. Сообщалось об элсктроосаждении германия из неводных
растворов.
На рис. 1 изображены электролизеры для электролитического рафини-
рования индия до степени чистоты 99,98%.
Пользуясь разностью потенциалов полуволны ряда металлов по отноше-
нию к ртути, при выделении иа ртутном катоде можно осуществить изби-
рательное извлечение нужного металла даже из разбавленных растворов.
В свою очередь, путем электролиза с использованием анода из амальгамы,
содержащей несколько металлов, и соответствующего катода можно раздель-
но получить металлы чрезвычайно высокой степени чистоты. Кроме того,
дистилляция амальгамы с целью удаления ртути позволяет получать
Редкие металлы 21
нужный металл. Подобные способы создают новую отрасль техники с боль-
шим будущим, которую принято называть «амальгамной металлургией» I5J.
Электролиз расплавленных солей сделал возможным промышленное
производство алюминия, магния и натрия. Кроме того, этим способом полу-
чают и такие металлы, как барий, бериллий, бор, кальций, церий, ниобий,
литий, редкоземельные металлы, стронций, тантал, торий и уран. Успех
электролитического производства алюминия и магния способствовал интен-
сификации исследований по разработке подобного дешевого способа и для
промышленного производства титана и циркония. Однако этим способом,
видимо, можно получать только порошковые металлы, что оставляет нере-
шенными задачи достижения высокой степени чистоты и получения метал-
лов в компактном виде.
Мсталлотермичсский способ. Принцип известного способа термического
восстановления окислов металлов металлическим алюминием по Гольд-
шмидту использовался для восстановления некоторых редких металлов
из их окислов и галогенидов кальцием, натрием и Mai нием.
Титан, гафний и цирконий получают по способу Кроля восстановлени-
ем тетрахлоридов этих металлов расплавленным магнием. Уран и бериллий
восстанавливают магнием из их фторидов.
.11I.
Рис. 2. Реактор для получения титана («Юниои ¦ . л
кэрбайд металс компания)- " Шй
Титановую губку получают восстановлен нем тетра- 'Щ*
хлпрнда титл на натрием в инертной атмосфере. Нв
фотографин виден реактор, который извлечен из печн
после окоич шин реакции. Губку извлекают из него
вместе с электродом и переплавляют в компактный ±
ишхял.п и пгик litfifirmiumiii nfl г/я пи*» R и fi ' ..
алл п печи, изображенной на рис. 6 и 6.
I
Для получения ниобия, гафния, тантала, титана и циркония из галоге-
нидов этих элементов применяется натрий. На рис. 2 изображен громадный
реактор, используемый для получения титана путем взаимодействия натрия
с тетрахлоридом титана с образованием губчатого металла.
Кальций используется для получения редкоземельных металлов, скан-
дия, иттрия, тория, плутония и ванадия главным образом путем восстанов-
ления фторидов этих металлов. Все указанные выше процессы проводят
в тщательно контролируемой инертной атмосфере, чтобы получить металлы
высокой степени чистоты.
Многиеметаллы можно восстанавливать из их обезвоженных галогенидов
амальгамой натрия, причем процесс проводится при более низких темпера-
турах. В этом случае восстановителем служит растворенный вртути натрий.
Подобно тому как железо вытесняет медь из растворов ее соединений, амаль-
22 Глава 1
гамы некоторых металлов, например амальгама цинка, будут вытеснять из
раствора некоторые металлы, ряд которых определяется разностью потенциа-
лов полуволны по отношению к цинку. Амальгаму, образующуюся при
подобном вытеснении, можно перерабатывать разными способами для извле-
чения содержащегося в ней чистого металла. В этом состоит еще одна из за-
дач «амальгамной металлургии».
Кремний получают восстановлением его тетрахлорида парами цинка,
причем степень чистоты конечного продукта зависит только от степени чи-
стоты исходного тетрахлорида, если используется чистый цинк.
Восстановление водородом. Германий, молибден и вольфрам в промыш-
ленных масштабах получают восстановлением водородом их окислов, а ре-
ний — восстановлением водородом перрсната калия или аммония. Кобальт
восстанавливают водородом из его окиси или хлорида, но его промышленное
производство не ограничивается этим способом. Многие металлы платиновой
группы получают на конечной стадии восстановлением водородом их окислов
или комплексных соединений*.
Термическая диссоциация галогенидов. Помимо получения металлов
путем восстановления их галогенидов, представляющих собой очень удоб-
ные исходные вещества благодаря достижимости высокой степени чистоты,
сравнительной простоте процесса восстановления и характерным для них
относительно низким температурам плавления и кипения, существует способ
термического разложения многих галогенидов металлов, в результате кото-
рого металлы выделяются в чистом виде. Так, иодиды титана, гафния, хрома,
циркония, ванадия, тория и урана разлагаются при соприкосновении с на-
^етий поверхностью, например накаленной вольфрамовой проволокой,
в эвакуированном контейнере, что ведет к осаждению на ней компактного
металла очень высокой степени чистоты. С технологической точки зрения
иодидный процесс должен рассматриваться скорее как метод очистки метал-
лов, чем как основной метод их получения, хотя для некоторых чистых
металлов он является почти единственным методом получения.
Термическое разложение некоторых галогенидов металлов сопровож-
дается диспропорционированием — образованием субгалогенидов и металла
либо смеси галогенидов. Например, при нагревании дихлорида титана
образуются металл и тетрахлорид, а при нагревании трихлорида титана —
смесь дпхлорнда и тетрахлорида. Несмотря на то что подобные реакции
сейчас, как известно, не используются для производства металлов, в буду-
щем они могут найти применение.
Дуговая плавка металлов в инертной атмосфере. Поскольку некоторые
редкие металлы обладают большим химическим сродством к кислороду,
азоту, водороду и углероду и, кроме того, многие из них в процессе восста-
новления получаются в виде тонкоизмельченного порошка с большой поверх-
ностью частиц, отличающихся высокой реакционной способностью, для
перевода этих металлов в компактное состояние требуются специальные
приемы. Изделия из вольфрама, молибдена, тантала и ниобия долгое время
изготовлялись методами порошковой металлургии, предполагающими спе-
кание спрессованной под высоким давлением заготовки для первых двух
металлов в атмосфере водорода и для двух других в вакууме. На рис. 3 изо-
бражен 2000-тонный пресс, применяемый для изготовления прутков из тан-
• Например, чистый иридии получают при прокаливании хлориридата аммония
(NH4J[IrCl0] в атмосфере водорода.— Прим. ред.
Редкие металлы 23
талового порошка, которые затем спекаются в высоковакуумиой печи для
спекания, изображенной на рис. 4. Эти спеченные прутки пригодны для пере-
работки их в листы, трубы и другие изделия либо для переплавки в дуговой
печн или в печи для электронно-лучевой плавки.
i
Р и с. 3. 2000-тонный пресс, применяемый для
ичготовлснип прутков из танталового порошка
(«Вах'Ченг корпорейшн»).
В матрицу засыпается порошок определенного грану-
лоыетриш-ского состава.
Указанные выше металлы, так же как титан, цирконий и гафний, теперь
выплавляют в дуговых печах и получают при этом монолитные слитки.
Спрессованный из металлического порошка пруток или губчатый металл
подают как расходуемый электрод в дуговую печь с инертной атмосферой
гелия или аргона, причем расплавленный металл собирается в охлаждаемом
у
>¦
Р н с. 4. Вь[соковак>умные сосуды для спека-
ния необожженных прутков тантала, поступаю-
щих с пресса, показанного на рис. 3 («Вах Ченг
корпорейшн»).
Спеченные пруткн превращают в листы, трубы и другие
изделия .чнб|» переплавляют в слитки в дуговой печи
или в печи для электронно-лучевой плавки.
водой медном тигле, который одновременно служит вторым электродом.
По сути дела, тиглем в этом случае является застывшая корка самого метал-
ла, чем устраняется возможность загрязнений. Электрическую дугу для рас-
плавления металла можно создавать так же с помощью нерасходуемого воль-
фрамового электрода, при этом металл подается непосредственно в расплав-
ленную ванну на нижнем электроде. Однако чтобы не допустить загрязнения
металла материалом нерасходуемого электрода, лучше пользоваться расхо-
дуемыми электродами. В дуговых печах сплавы можно получать также
путем введения в расплавленную ванну легирующих элементов.
24
Глава 1
На рис. 5 изображена схема простой дуговой печи с расходуемым
электродом для получения титановых слитков в инертной атмосфере.
Дуга возникает между расположенным вверху электродом и одним из кусков
титана, лежащих на подине охлаждае-
з— Аргон мо11 в°Д°й медной изложницы; верхний
электрод опускается по мере его рас-
плавления до тех пор, пока не запол-
нится изложница. На рис. 6 показан
слиток переплавленного электродуго-
вым способом титана весом 1800 кг
после его извлечения из промышлен-
ной дуговой печи. В такой печи можно
получать слитки весом до 4500 кг.
Known
Веда -
Рис. 5. Схема простой дуговой
печи с расходуемым электродом для
получения титановых слитков в
инертной атмосфере («Рипяблик стил
корпорейшн»).
/ — титановый электрод; 2 — охлаждае-
мые водой подающие и приводные вал-
ки; 3 — кожух печи, пхлаждаеыый водой;
4 — изоляция; 5—ыедный тигель, охлаж-
дасммН водоЛ; 6 — мгдпыЯ под, охлаж-
даемый водой; 7—подвод электроэнергии.
Применение высокого вакуума
при ведении технологических про-
цессов и при плавке редких метал-
лов предотвращает или уменьшает
попадание загрязняющих примесей.
.11
щи
л
Рис. 6. Дуговая печь с расходуемым
электродом для переплавки титановой
губки в вакууме или в инертной атмо-
сфере («Тайтэниум металс корпорейшн
оф Америка»).
В дяпном случае медную изложницу сни-
мают с титанового слитка после извлечения
изложницы со слитком из нижней части
печного агрегата, который виден на заднем
плане. Изложница (выше слитка) помещает-
ся в печь между подом к цилиндрической
верхней частью печи (непосредственно позади
рабочего. стоящего слева) Расходуемый
электрод из губчатого титана подается через
верхнее отверстие печи по мере его рас-
плавления, причем подача осуществляется
Егпрсрынио дп тех пор, пока не заполнится
изложница. Перед дальнейшей обработкой
ел итпи ппднергают механической обработке
для удаления неровностей на поверхности.
Электронно-лучевая плавка. Электронно-лучевая плавка представляет
собой новый способ переплавки тугоплавких металлов в слитки высокой сте-
пени чистоты. При этом способе плавки в качестве источника тепла исполь-
зуется пучок электронов, движущихся с большой скоростью. Электроны
Редкие металлы 25
из электронной пушки ускоряются и фокусируются на порцию расплавляе-
мого металла за счет большого потенциала, создаваемого между пушкой
и порцией металла в камере с высоким вакуумом. Расплавленный металл
собирается и затвердевает в охлаждаемой водой медной изложнице*.
Этот способ плавки не только позволяет получать слитки тугоплавких
металлов, но приводит также к уменьшению содержания примесей. При
одновременном воздействии высокой температуры и вакуума из металла
путем возгонки удаляются многие примеси. Степень очистки от примесей
определяется соотношением между давлением паров примесей и давлением
паров расплавляемого металла при температуре расплавленного металла.
В зависимости от того, какой переплавляют металл, получают слитки
диаметром до нескольких десятков сантиметров и длиной до нескольких
метров. В любых единицах измерения диаметр слитка обычно пропорциона-
лен температуре плавления металла.
Этот же метод может быть использован для сварки плавлением металлов
с высокой температурой плавления, например тантала, вольфрама, молиб-
дена, титана, циркония и ниобия. По существу высокое качество сварки обес-
печивается тем, что при этом можно поддерживать очень чистую атмосферу.
Возможность точной фокусировки пучка электронов обеспечивает высокую
точность выполняемой сварки.
Зонная очистка. Избавиться от загрязнений в прутковом металле
можно с помощью зонной очистки. Этот способ очистки состоит в расплавле-
нии небольшой зоны прутка с помощью индукционного нагрева или нагрева
пучком электронов и последующем перемещении этой расплавленной зоны
пдоль осн прутка за счет соответствующего перемещения источника нагрева.
В результате примеси перемещаются к одному концу прутка благодаря более
высокой растворимости большинства из них в жидкой фазе.
При осуществлении зонной очистки пруток крепится по концам в гори-
зонтально или вертикально расположенной кварцевой трубке, заполненной
инертным газом, и нагревается в одном месте. Расплавленный металл сохра-
няет форму прутка за счет поверхностного натяжения и эффекта удержания
его в подвешенном состоянии, создаваемого электромагнитным полем. Этот
метод имеет прикладное значение как одна из стадий промышленного про-
изводства кремния и германия очень высокой степени чистоты для полупро-
водниковой техники. Монокристаллы этих металлов в виде прутков могут
быть получены путем внесения монокристаллической затравки в первую
порцию расплавленной зоны с последующим медленным переметением этой
зоны вдоль осн прутка, обычно снизу вверх. На рис. 7 показан монокристалл
германия.
Зонную очистку можно применять для получения большого числа метал-
лов в очень чистом виде. При этом исключается попадание примесей из тигля,
что обычно происходит во время очистки другими способами.
Как правило, производство редких металлов характеризуется требо-
ваниями достижения более высокой степени чистоты, чем это нужно в случае
обычных металлов. Только на образцах очень чистых металлов можно изу-
чить их истинные свойства. Например, влияние нескольких сотых долей
процента кислорода или азота на твердость титана и циркония настолько
велико, что эти металлы длительное время считались непластичными, пока
не были получены образцы с очень низким содержанием кислорода и азота.
* В главе «Ниобий» имеется подробное описание оборудования и процесса.
26 Глава)
Несомненно, что многие диаграммы состояния, установленные на загрязнен-
ных образцах, а также другие данные, характеризующие свойства металлов,
теперь необходимо пересмотреть в связи с наличием чистых металлов.
Приводимые в настоящем справочнике сведения о способах получения,
свойствах, способах обработки и областях применения редких металлов
должны дать толчок к более глубокому изучению рассматриваемых металлов
и расширению областей их применения в современной технике и тех-
нологии.
Рис. 7. Пруток монокристалла
германия, полученный зонной плав-
кой («Игл-Пичср компания).
Таким методом получают германий очень
высокой степени чистоты для полупро-
водниковых устройств.
Следует подчеркнуть, что вся история, развития металлургии редких
илн мало изученных металлов является результатом практического исполь-
зования новых достижений в области физики, неорганической химии, физи-
ческой химии, химической технологии и металлургии. Все это способство-
вало росту наших знаний и техническому прогрессу. В будущем нас ожида-
ют еще более значительные успехи по мере дальнейшего более полного объе-
динения достижений науки и практики ради окончательного использования
всех возможностей, открываемых этими уникальными металлами.
Одним из примеров, который можно привести, является недавнее
открытие Стерном повышенной коррозионной стойкости, которую приобре-
тает титан при добавпении 0,1% палладия или какого-либо другого благо-
родного металла. В процессе разработки основных вопросов, связанных
с коррозионными явлениями, Сгерн выдвинул электрохимическую теорию,
которая объясняет замедление коррозии при пассивировании в виде функ-
ции. Исходя из этого, он предсказал, что при введении легирующих добавок
благородных металлов подобные электрохимические явления должны про-
исходить и в случае титана. Последующие исследования подтвердили эту
гипотезу [7]. При введении добавок элементов платиновой группы на поверх-
ности сплава образуются гальванические пары. Они создают на поверх-
ности более высокий усредненный потенциал, чем критический потенциал
для пассивирования титана. Кстати, механические свойства этого сплава
совершенно идентичны механическим свойствам нелегироваиного титана.
Как показывает рис. 8, титан, имеющий очень высокую коррозионную
стойкость по отношению к окислителям, при добавлении палладия ста-
новится коррозионностойкнм и по отношению к восстановителям. Этот
сводный график показывает также пределы применения других металлов
и сплавов в окислительной и восстановительной коррозионных средах
в присутствии хлоридов или без них. Окислительная среда может быть созда-
на в присутствии азотной кислоты, хлорида железа(Ш), царской водки,
хлорида меди(П), перекиси водорода и гипохлорита натрия. Восстановитель-
ная или нсокислительная среда создается в присутствии соляной, серной,
фосфорной, уксусной и щавелевой кислот и хлористого алюминия.
Тантал обладает самым широким диапазоном коррозионной устойчиво-
сти в различных условиях. Сплав титана с палладием близок по коррозион-
Редкие металлы
27
ной устойчивости к танталу, но несколько уступает ему в этом и находится
на втором месте. Цирконий явчяется подходящим материалом для работы
в восстановительной среде в присутствии кислых хлоридов н в окислитель-
ной среде, не содержащей кислых хлоридов. На нержавеющую сталь вредно
действуют хлор-ионы, а некоторые сплавы на основе никеля используются
лишь в определенных условиях.
При изготовлении сплава, содержащего 0,1% палладия, вначале при-
готавливают смесь порошков титана и палладия с большим содержанием
ND.
а
Тонтол Хяоранзидрид кислоты
Титтн блисщядныа металлы
Тштн
Сплав Ni-Cr-Mo
Цирипний
Сплав N0
(нержавеюща* сталь)
Иннонгль
Псшпееющпя столь шипи 3/?
Псрчювеющаи счшль rrnjim .wb
Цирконии
Сплав Ni-Mo
Монель
/Ионсль
Ониспитглише кислпты Бтптттитеиымгкиитты
-* Увеличение пгресешмптш грсии *-
%
г g
I г
ь 3
э
о
Рис 8. Диаграмма, характеризующая коррозионную стойкость титана и других
металлов и сплавов при действии окислительных и восстановительных кислот
в присутствии хлор-ионов и без них («Юнион кэрбайд металс компании).
Титан, легированный благородными металлами, например палладием, по коррозионной
стойкости превосходит ыелегированный тиыи.
палладия, из этой смесн прессуют расходуемые электроды, которые затем
переплавляют в инертной атмосфере электродуговым методом. Полученная
таким образом лигатура используется изготовителями размолотого титана
для приготовления бедного палладием сплава из титановой губки.
Как можно теперь видеть, многие отрасли науки и техники способству-
ют развитию производства нового коррозионностойкого конструкционного
материала.
ЛИТЕРАТУРА
1. Armstrong E F., N i a I I L. M., Raw Materials from the Sea, Constru-
ctive Publications, Ltd., Leicester, Eng., 1945.
2. Battelle Memorial Rev., 2, J* 9, 101 A953).
3. С a n n о n H., U. S. Geol. Survey Circ. 264, 1953-
4. FauslC. L., J. Electrochem. Soc, 98, № 10, 133c—137c A951).
5. H о h п Н-, Research. 3, 407—417 A950).
Principles of Geochemistry, John Wiley and Sons, Inc., New York,
6.
B.
Mason
1952.
7. Stern M.,
Stern M-,
Wissenberg H., J. Electrochem. Soc, 106, 759—76-1 A959);
Bishop С R., Paper Presented at American Society for Metal?
2.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
К. А. ГЕМПЕЛ
С. A. Hampel, Consulting Chemical Engineer, Skokie, 111.
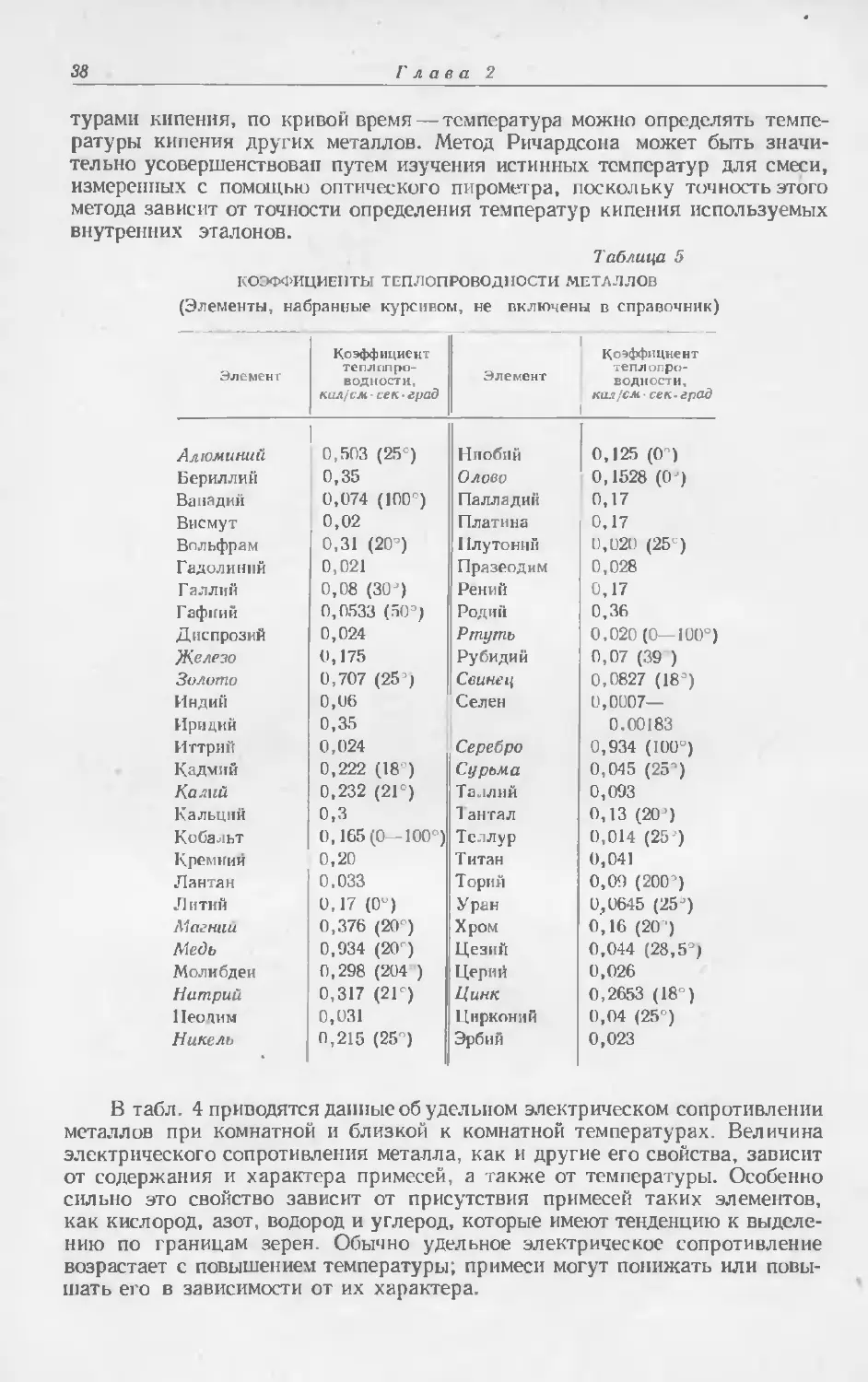
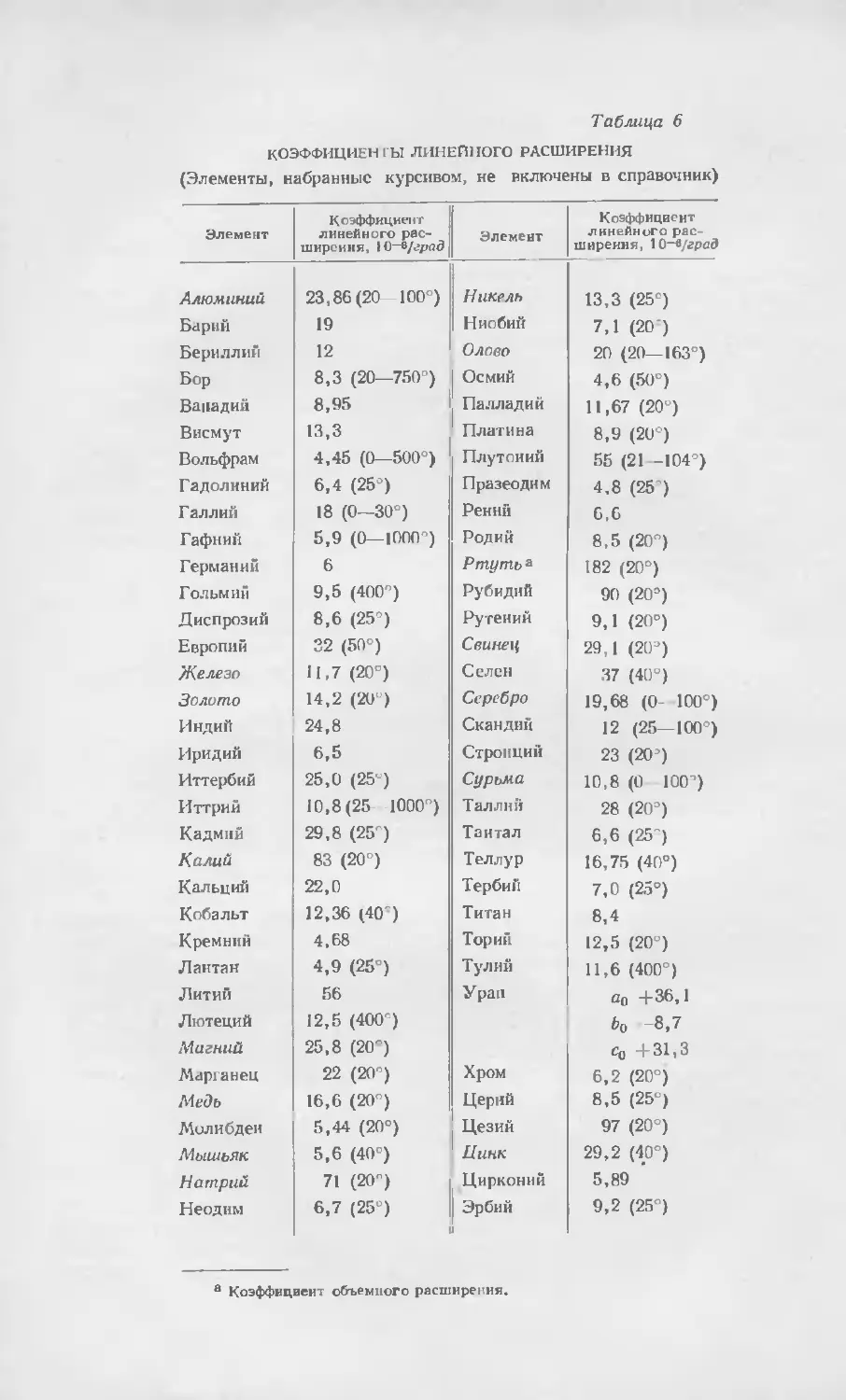
В настоящей главе приводятся в табличной форме многие данные
о физических свойствах рассматриваемых в настоящей книге металлов,
а также соответствующие данные для более распространенных металлов*.
Это позволит читателю непосредственно сопоставлять свойства различных
металлов, пользуясь удобными таблицами. Здесь же приводятся существо-
вавшие до 1960 г. цены на металлы.
Данные, приводимые для редких металлов, повозможности взяты из соот-
ветствующих глав настоящего справочника. Данные о свойствах более рас-
пространенных металлов заимствованы из различных источников, главным
образом из хорошо известных критических обзоров, составленных Горным
бюро СШ\, Национальным бюро стандартов. Американским обществом ме-
таллов и Комиссией по атомной энергии США. Более полные библиографи-
ческие сведения об этих источниках приводятся в прилагаемом в конце
главы списке литературы.
При составлении таблиц физических свойств всегда приходится стал-
киваться с трудностью выбора наиболее вероятного и точного значения
из ряда приводимых значений, которые во многих случаях совпадают
с точностью только до одного порядка. Такой выбор еще более затрудняется,
когда приходится иметь дело с металлами, которые получить в чистом виде
обычно труднее, чем большинство соединений или неметаллических элемен-
тов, что обусловлено многими факторами. Большая частыиеталлов при обыч-
ных температурах находится в твердом состоянии и не растворима в обыч-
ных растворителях. Таким образом, они не поддаются очистке и обработке
теми способами, которые применимы к многим другим материалам. Данные
о физических свойствах металлов в жидком и газообразном состоянии часто
очень трудно определить из-за технологических проблем, связанных с ра-
ботой при высоких температурах, и необходимости сохранения высокой сте-
пени чистоты металлов. Задача выбора подходящего материала для тиглей
усложняется повышением химической активности по мере нагревания, что
увеличивает вероятность поглощения загрязняющих примесей металлом
в жидком или газообразном состоянии.
Влияние даже небольшого количества примесей на свойства металлов
весьма значительно, чем и объясняется расхождение в приводимых данных,
поскольку получение металлов и поддержание их в состоянии высокой
степени чистоты сопряжены с трудностями.
За последние годы разработаны методы и оборудование для полу-
чения и обработки очень чистых металлов при повышенных температурах.
* Здесь и далее в тексте, а также в таблицах под металлами, как редкими, так
и обычными, автор подразумевает простые вещества, среди которых есть и неметал-
лы.— Прим. ред.
Таблица 1
ФИЗИЧЕСКИЕ CBOflGTBA
(Элементы, набранные курсивом, не включены в справочник)
Элемент
Алюминий
Барий
Бериллий
Бор
Ванадий
Висмут
Вольфрам
Гадолиний
Галлий
Гафний
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индий
Иридий
Иттербий
Иттрий
Кадмий
КалцЦ
—^—^———
Символ
А1
Ва
Be
В
V
Bi
W
Gd
Ga
Hf
Ge
Ho
Dy
Eu
Fe
Ли
In
Ir
Yb
Y
Cd
К
Поряд-
ковый
номер
13
56
4
5
23
83
74
64
31
72
32
67
66
63
26
79
49
77
70
39
48
19
—^ ——^
Атомный вес
26,9815
137,34
9,0122
10,811
50,942
208,980
183,85
157,25
69,72
178,49
72,59
164,930
162,50
151,96
55,847
196,967
114,82
192,2
173,04
88,905
112,40
39,102
.^—^—
Плотность
ПРН 20° 2/СЯЗ
2,7
3,5
1,845
2,34
6,11
9,8
19,3
7,895
5,907
13,29
5,32
8,803
8,й36
5,259
7,87
19,32
7,31
22,42
6,977
4,472
в,65
0,87
Температура
плавления, °С
660
710
1284
2300
1919
271,3
3410
1312
29,75
2150
936
1461
1407
826
1535
1063
156,6
2410
824
1509
320,9
63,7
Температура
кипения, "С
2450
1500
2507
2550
3000
1627
5900
3000
1983
5400
2700
2600
2600
1439
3000
2966
2075
5300
1427
3200
767
760
=^—^—
Скрытая теп-
лога плав-
ления, кал/а
96
13,3
250—275
4В9
82,5
12,5
46
23,6
19,16
29,1
111,5
24,8
25,2
15,15
66,2
14,96
6,8
32,6
12,71
46,2
13,2
14,6
—^—^^—
Скрытая теп-
лота испаре-
ния, (са.1/г
3050
262
5917
8300
2150
204,3
1038
459
1014
885
1200
405
412
276
1515
415
484
790
220
1045,В
286,4
496
Удельная теплоемкость,
кал/г 'град
0,214 B0°)
0,068 B0°)
0,425 B0°)
0,307 B5°)
0,120 @°)
0,0294 B0е)
0,032 B0°)
0,0713 @°)
0,0977 B9°)
0,0352 B0°)
0,086 B5°)
0,0391 @е)
0,0413 @°)
0,0395 @е)
0,107 B0°)
0,0312 A8°)
0,058 B0°)
0,032 B0°)
0,0347 @°)
0,074 E0°)
0,055 B8В)
0,18 A4°)
Кальции
Кобальт
Кремний
Лантан
Литий
Лютеций
Магний
Марганец
Медь
Молибден
Мышьяк
Натрий
Неодим
Никель
Ниобий
Олово
Осмий
Палладий
Платина
Плутоний
Празеодим
Прометий
Рений
Родий
Ртуть
Рубидий
Рутеиий
Самарий
Са
Со
Si
La
Li
Lu
Mg
Mn
Си
Mo
As
Na
Nd
Ni
Nb
Sn
Os
Pd
Pt
Pu
Pr
Pra
Re
Rh
Hg
Rb
Ru
Sm
20
27
14
57
3
71
12
25
29
42
33
11
60
28
41
50
76
46
78
94
59
61
75
45
80
37
44
62
40,08
58,9332
2g,0S«
138,91
6,939
174,97
24,312
54,9381
63,54
95,94
74,9216
22,9898
144,24
58,71
92,906
118,69
190,2
106,4
195,09
242
140,907
147
186,2
102,905
200,59
85,47
101,07
150,35
1,54
8 90
2,33
6,174
0,534
9,842
1,74
7,44
8,94
10,22
5,727
0,97
7,004
8,9
8,57
7,3
22,50
12,02
21,40
19,84
6,782
21,02
12,44
13,55
1,53
12,4
7,536
851
1493
1410
920
179
1652
651
1244
1083
2610
814
97,9
1024
1452
2468
232
3000
1552
1769
639,5
935
1035
3180
1960
-38,87
38,5
2250
1072
1482
3100
2480
3469
1317
3327
1103
2097
2595
5560
615 (возг.)
883
3027
2900
4927
2270
5500
3980
4530
3235
3127
2730
5900
4500
357
688
4900
1900
55,7
62
395
17,3
158
26,3
82,2
63,7
48,9
69,8
88,5
27,50
18,0
73,8
69
14,5
36,9
37,8
24,1
17,0
42,4
50,5
2,8
6,1
60,3
17,3
918
1500
2530
690
4680
515
1337
977,6
1150
1222
102 (возг.)
1005
479
1487
1782
573
790
88,3
625
336,6
560
415
815
1150
69,7
212
1340
30R
JO, 149 B0°)
О,1056 B0')
0,1597 @°)
0,048 B0°)
0,784 @°)
0,0368 @°)
0,250 B0°)
0,114 B0°)
0,092 B0е)
0,066 @°)
0,078
0,295 B0°)
0,0499 @°)
0,105 B0»)
0,0642 B0°)
0,0542 B0')
0,039 B0')
0,0584 B0°)
0,0314 B0°)
0,034 B5°)
0,0458 @°)
0,03262 B0°)
0,059 B0°)
0,03325 B0°)
0,080 @°)
0,057 B0°)
0,0431 B0°)
Продолжение табл. 1
Поряд-,
копый I Атомный вес
номер
Свинец
Селен
Серебро
Скандий
Стронций
Сурьми.
Таллий
Таитал
Теллур
Тербий
Титан
Торий
Тулий
Уран
Хром
Цезий
Церий
Цинк
Цирконий
Эрбий
РЬ
Se
Ag
Sc
Sr
Sb
Tl
Та
Те
Tb
Ti
Th
Tu
U
Cr
Cs
Ce
Zn
Zr
Kr
82
34
47
21
38
51
81
73
52
65
22
90
69
92
24
55
58
30
40
68
207,19
78,96
107,870
44,956
87,62
121,75
204,37
180,948
127,60
158,924
47,90
232,038
168,934
238,03
51,996
132,905
140,12
65,37
91,22
167,26
Плотность
при 20°, г/Ы
11,34
4,79
10,49
2,99
2,6
6,68
11,85
16,6
6,25
8,272
4,54
11,66
9,332
19,07
7,19
1,873
6,66
7,133
6,45
9,051
Температура Температура
ллавления. «С кипения, °С
327,4
217
960,5
1539
770
630,5
303
2996
449,5
1356
1668
1750
1545
1132
1875
28,5
795
419,5
1852
1497
1737
685
2212
2727
1380
1440
1457
6100
990
2800
3260
4200
1727
3813
2199
705
3468
906
3580
2900
Скрытая теп-
лота плав-
ления, ыал/г
5,89
16,5
25
85,3
25
38,3
5,04
41,5
32
24,5
104,5
19,8
26,0
19,75
61,5
3,766
15,7
24,4
60,3
24,5
Скрытая теп- улельЯая теплоемкость,
лота испаре-I °А ~- -
ния, ка.Цг
204,6
79,Ь
556
1743
383
383
189,9
995
95
440
2350
560
348
420
1474
146
679
419,5
1360
401
0,031 B0°)
0,081 B0°)
0,056 B0°)
0,1332 B0е)
0,176 B0')
0.05U4 B0°)
0,031 B0е)
0,034 @°)
0,047 B0э)
0,041 @°)
0,125 B0°)
0,0282 B0°)
0,0381 @°)
0,028 B0°)
0,1068 B0")
0,052 B0°)
0,049 B0°)
0,0925 B0°)
0,0659 B0°)
0,0398 @°)
Физические свойства металлов S3
В результате физические снойства металлов удалось опредечить еще точнее.
К известным достижениям в этой области относятся дуговая плавка и
электронно-лучевая плавка в вакууме или в инертных средах, улучшение
вакуумного оборудования и приобретение более чистых сырьевых материа-
лов, из которых получают незагрязненные металлы.
Кроме того, физические свойства металлов зависят от способа перехода
металла в твердое состояние. Предшествующая термическая обработка образ-
ца сильно влияет на величину кристаллов, а также па природу и распреде-
ление присутствующих в металле примесей, а характер первоначальной
механической обработки металла (с нагревом или на холоду) дополнительно
изменяет его свойства. Наконец, на физические характеристики металла
влияют и аллотропические превращения, благодаря которым при одной
и той же температуре могут существовать различные кристаллические моди-
фикации. В этом отношении предшествующая термообработка и первона-
чальная механическая обработка являются основными факторами, опреде-
ляющими кристаллическую структуру исследуемого образца.
Все это весьма осложняет задачу сопоставления и отбора значений физи-
ческих характеристик металлов. Однако приводимые в этой главе данные
можно рассматривать как характеристики свойств металлов, даже если они
не совсем точны и воспроизводимы. К тому же не все элементы, относя-
щиеся к металлам, охвачены таблицами, помещенными в этой главе. Кроме
металлов, рассматриваемых в настоящем справочнике, в таблицы включены
алюминий, сурьма, мышьяк, медь, золото, железо, свинец, магний, ртуть,
никель, калий, серебро, натрий, олово и цинк.
В табл. 1 приводятся порядковые номера, атомные веса, значения плот-
ности, температуры плавления, температуры кипения, скрытой теплоты
плавления, скрытой теплоты испарения и удельной теплоемкости при ком-
натной температуре редких и обычных металлов.
За некоторыми исключениями, все сведения об алюминии, сурьме,
свинце, магнии, ртути, калии, натрии, олове и цинке заимствованы нз спра-
вочника [8]. Для других металлов основными источниками данных о тем-
пературах плавления, температурах кипения, скрытых теплотах и удель-
ных теплоемкостях служили ценные критические обзоры [3—7, 10, 13].
Значения плотности взяты из данных Бюро стандартов A1 и Американского
общества металлов 19). Все эти источники включены в список литературы,
в том числе ссылки па оригинальные работы, из которых были заимство-
ваны данные.
В табл. 2 металлы расположены в порядке возрастания их плотности.
Приводимые порядковые номера металлов показывают, что между порядко-
вым номером или атомным весом элемента и его плотностью существует неко-
торая связь. Таблица позволяет наглядно сопоставлять плотности многих
металлов — от лития и до самого тяжелого элемента осмия.
Таблица раскрывает много интересных взаимосвязей. Например, сви-
нец мы всегда рассматриваем как тяжелый металл, тогда как в действитель-
ности он располагается в середине таблицы. Однако свинец — один из самых
тяжелых металлов среди распространенных и хорошо известных металлов,
если не считать ртути и золота. Все металлы, которые тяжелее свинца, за
исключением ртути, необычны по своим свойствам. Плотности давно извест-
ных и широко применяемых человеком металловлежат в пределах 6—11 г/см3.
Более легкие металлы — натрий, магний и алюминий — стали применяться
в промышленных масштабах лишь за последние годы, причем натрий —
главным образом для химических целей, а два других металла — в качестве
конструкционных материалов. Из металлов с плотностью ниже 5 за послед-
3 Зоказ № 238
Таблица 2
ПЛОТНОСТЬ МЕТАЛЛОМ
(Элементы, набранные курсивом, не ьктючсны r справочник) .
Поряд-1
ковый
номер
Литий
}\алий
Натрий
Р\ бндин
Кальций
Магний
Бериллий
ЦезиП
Кремний
Бор
С гронцип
Алюминий
Скандий
Парий
Нттрнй
Титан
Селен
Европий
Германий
Мышьяк
Глллин
Ванадий
Лантан
Теллур
Цирконий
Цернй
Сурьма
Празеодим
Пгтербмй
Неодим
Цинк
Xpov
Олово
Иилий
Марганец
3
19
II
37
2П
12
4
55
14
5
38
13
21
56
39
22
34
63
32
33
31
23
57
52
40
58
51
59
70
60
30
24
50
49
25
ШН-ТЬ.
1,'смЗ
0,534
0,87
0,97
1,53
1,54
1,74
1,845
1,873
2,33
2.34
2,6
2,7
2,99
3,5
4,472
4,54
4,79
5,259
5,32
5,727
5,907
6,11
6,174
6,25
6,45
6,66
6,68
6,782
6,977
7,004
7,13
7,19
7.3
7,31
7.44
Самарий
Железо
Гадолиний
Тербий
Диспролш
Ниобий
Кадмий
Гольмий
Никель
Кобальт
Медь
Эрбий
Тулин
Висмут
Лютеции
Молибден
Серебро
Свинец
Торий
Таллий
Палладий
Рутений
Родий
Гафний
Ртуть
Тантал
Уран
Вольфрам
Золото
Плутоний
Рений
Плагина
Иридий
Осмий
Пор ЯД
КОБЫЙ
номер
62
26
64
65
66
41
48
67
28
27
29
| 68
69
83
71
42
47
82
90
81
46
44
45
72
80
73
92
74
¦ 79
94
75
78
77
76
Плот-
ность,
г/емз
7
7
7
8
8
8
8
8
8
8
8
9
9
9
9
10
10
11
И
11
12
12
12
13
13
16
19
19
19
19
21,
21
22,
22,
,536
,87
,895
,272
,536
,57
,65
.8(«
,9
,9
94
,051
332
8
842
22
49
34
66
85
02
4
44
29
55
6
07
3
32
84
02
40
42
5
Таблица Я
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ И ТЕМПЕРАТУРА КИПЕНИЯ МПТАЛЛСЪ
(Элементы, набранные курсивом, не включены в справочник)
Элемент
Ртуть
Цезий
Галлий
Рубидий
Калий
Нитрий
Индий
Литий
Селен
Олово
Висмут
Таллин
Кадмий
Свинец
Цинк
Теллур
Сурьма
Пл) ТОНИЙ
Магний
Алю muhu.ii
Барий
Стронций
Церий
Мышьяк
Иттербий
Европий
Кальций
Лантан
Празеодим
Германий
Серебро
Неодим
Прометий
Зо lomo
Самарий
Темпера-
тура плав-
ления, °С
I
38,87
28,5
29,75
38,5
63,7
97,9
156,6
179
217
232
271,3
.-ЮЗ
321
327,4
419,5
¦1-19,5
630,5
639,5
651
660
710
770
795
814
824
826
851
920
935
936
960,5
1024
1035
1063
1072
Темпера-
тура ки-
пения, °С
357
705
1983
688
760
883
2075
1317
685
2270
1627
1457
767
1737
906
990
1440
3235
1103
2450
1500
1380
3468
615(еозг.)
1427
1439
1482
3470
3127
2700
2212
3027
2730
2066
1900
Элемент
Медь
Уран
Марганец
Бериллии
Гадолиний
Тербии
Диспрозий
Кремний
Никель
Гольмий
Кобальт
Эрбий
Иттрий
Железо
Скандий
Тулий
Палладий
Лютеции
Титан
Торий
Платина
Цирконий
Хром
Ванадий
Родий
Гафний
Рутений
Вор
Иридий
Ниобий
Молибден
Тан гал
Осмий
Рений
Вольфрам
Темпера-
т\ра плав-
лении, °С
1083
1132
1244
1284
1312
1.156
1407
141A
1452
1461
1493
1497
1509
1535
1539
1545
1552
1652
1668
1750
1769
1852
1875
1919
1960
2150
2250
2300
2410
2468
2610
2996
3000
3180
3410
Темпера-
тура ки-
пения, °С
2595
3813
2097
2507
3000
2800
2600
2480
2000
2600
3100
2900
3200
3000
2727
1727
3980
3327
326A
4200
4530
3580
2199
.1000
45U0
5400
4900
2550
5300
4927
5560
6100
5500
5900
5900
3*
36 Глава ^2
пие годы в качестве конструкционных материалов стали применять также
бериллий и титан.
В табл. 3 приводятся температуры плавления и температуры кипения
металлов, которые расположены в порядке увеличения их температур
плавления.
Самой интересной для многих металлов является область их существо-
вания в жидком состоянии. Эта область для олова является одной из самых
широких, но она еще более широка у таких делящихся материалов, как уран,
плутоний и торий; у редкоземельных металчов — церия, лантана и празео-
дима; у металлов платиновой группы — палладия, платины, родия, рутения,
оемня, нрндия; у таких тугоплавких металлов, как гафний, молиб-
ден, тантал, рений и вольфрам. Из всех элементов самой широкой
областью существования в жидком состоянии обладает, по-видимому, гаф-
ний C250°).
Следует подчеркнуть, что ошибки измерении приводимых значений
температур плавления и температур кипения выше 2200° с понышепием
температур возрастают. Кроме того, с повышением температур не только
уменьшается надежность приборов для измерения температуры, но и воз-
растают трудности, связанные с их применением. По данным Стевена [12],
платипа-платинородиевые термопары можно применять для измерения
температур примерно до 1700°, иридий-иридиевородиевые термопары —
до 2000° и вольфрам-иридиевые термопары — до 2200° при отсутствии кисло-
рода, а иридий-иридневорутениевыс A0% рутения) термопары — до 2300°.
Рений-вольфрамовые и рений-молибденовые термопары при отсутствии кис-
лорода можно применять для измерения температур выше 2200°.
Оптические пирометры применяются для измерения более высоких тем-
ператур. Температуры, значительно превышающие 3000°, измеряются опти-
ческими пирометрами с точностью ¦+ 25°. При этом необходимо вводить по-
правки на излучение, учитывающие поглощение в фильграх и смотровом
стекле.
Многие приводимые в литературе значения температур кипения метал-
лов определены по данным, полученным экстраполяцией значений давления
пара или теплоемкости, полученных путем термодинамических расчетов.
Если рассматриваемый материал ведет себя как идеальная жидкость или
идеальный газ, то такая экстраполяция полностью оправдана, но, к сожале-
нию, существуют отклонения от идеального поведения, причем их не всегда
можно учесть. Однако по мере появления более точных данных о таких
отклонениях определение различных свойств при повышенных температурах
становится более надежным.
Свойства металлов при высоких температурах определяются различ-
ными методами. Одним из таких методов является измерение скорости испа-
рения металла при повышенных температурах, например с нагреваемой
электрическим током нити накала. По соответствующим термодинамическим
уравнениям можно вычислить давление пара при различных температурах
и затем определить температуру кипения. Методы, применяемые для опре-
деления различных свойств, подробно описаны Джонсом, Лэнгмюром и Мак-
кеем 12].
Для вычисления давления пара можно воспользоваться спектроскопи-
ческими данными; результаты основываются на выводе уравнения свободной
энергии газа исходя из спектроскопически определенных энергетичес-
ких уровней. Келли излагает этот метод в первой части своею обзора
значений свободной энергии испарения и давления пара неорганических
веществ [31.
Физические свойства металлов
S7
Другой метод определения температур кипения, предложенный Ричард-
соном [11], основан на испарении смеси шести или более элементов в дуге
спектрографа. Последовательность появления элементов в дуге соответствует
Таблица 4
ЭЛЕКТРИЧЕСКОЕ СОПРОТИВЛЕНИЕ
(Элементы, набранные курсивом, не нключены в справочник)
Элемент
Алюминий
Бериллий
Бор
Ванадий
Висмут
Вольфрам
Гадолиний
Галлий
Гафиий
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индий
Иридий
Иттербии
Иттрий
Кадмий
Калий
Кальций
Кобальт
Кремний
Лантан
Литий
Лютеций
Магний
Марганец
Медь
Молибден
Мышьяк
Натрий
Неодим
Удельное элек-
тросопротивле-
ние, мком-см
2,66 B0")
4,2 B0°)
65-10H)B7o)
24,8 B0=)
106,8 @°)
5,5 B0°)
134,0 B5°)
56,8 B0')
35,5 B0°)
60- 10» B51)
94 B5°)
91 B5")
81,0 B5°)
10,7 B0")
2,44 B0°)
8,8 B2°)
5,3 @ )
28 B5")
65 B5°)
6,83 @°)
6,1@°)
4,6 B0°)
5,68 @°)
15-106 C0-)
57 B5°)
8,55 (О1-)
68 B5")
4,46 B0°)
185 B0°)
1,692 B0°)
5,78 B7°)
33,3 B0°)
4,3 @°)
64 B5°)
Элемент
Никель
Ниобий
Олово
Осмий
Палладий
Платина
Плутоний
Празеодим
Рений
Родий
Ртуть
Рубидий
Рутений
Самарий
Свинец
Селен
Серебро
Скандий
Стронций
Сурьма
Таллий
Тантал
Теллур
Тербий
Титан
Торий
Тулий
Уран
Хром
Цезий
Церий
Цинк
Цирконий
Эрбий
Удельное элек-
тросопротивле-
ние, мком-см
7,8 B0=)
14,6 B0°)
11,5 B0э)
9,5 @4
10,3 B0°)
10,58 B0°)
146,45 @°)
G8 B5°)
19,14 @°)
4,7 @°)
95,78 B0")
11,6 @°)
7,16—7.6@°)
92 B5")
22 B0")
12 @°)
1,59 B0")
66 B5')
23 B0=)
41,7 B0°)
18 @=)
13,6 B5')
52 700 B5")
116 B5°)
42 B0")
18 B5°)
90 B5е)
30 B5°)
12,8 B0°)
36,6 C0й)
75 B5J)
5,75 @=)
44 B0°)
86 B5°)
порядку их температур кипения, причем точное время появления опреде-
ляется по расположению начала и конца спектральных линий каждого
элемента на перемещаемой с постоянной скоростью светочувствительной
пластинке. Вводя в смесь не меньше трех элементов с известными темпера-
38
Глава 2
турами кипения, по кривой время — температура можно определять темпе-
ратуры кипения других металлов. Метод Ричардсона может быть значи-
тельно усовершенствован путем изучения истинных температур для смеси,
измеренных с помощью оптического пирометра, поскольку точность этого
метода зависит от точности определения температур кипения используемых
внутренних эталонов.
Таблица 5
КОЭФФИЦИЕНТЫ ТЕПЛОПРОВОДНОСТИ МЕТАЛЛОВ
(Элементы, набранные курсивом, не включены в справочник)
Элемент
Алюминий
Бериллий
Ванадий
Висмут
Вольфрам
Гадолиний
Галлий
Гафний
Диспрозий
Железо
Золото
Индий
Иридий
Иттрий
Кадмий
Калий
Кальций
Кобальт
Кремнии
Лантан
Л итнй
Магнии
Медь
Молибден
Натрий
Неодим
Никель
Коэффициент
теплопро-
водности.
кал/см-сек-град
0,503 B5°)
0,35
0,074 A00°)
0,02
0,31 B0°)
0,021
0,08 C0J)
0,0533 E0=)
0,024
0,175
0,707 B53)
0,U6
0,35
0,024
0,222 A8°)
0,232 B1°)
0,3
0,165@—100°)
0,20
0,033
0,17 @")
0,376 B0°)
0,934 B0°)
0,298 B04 )
0,317 BГ)
0,031
0,215 B5°)
Элемент
Ниобии
Олово
Палладий
Платина
11лутоннн
Празеодим
Рений
Родий
Ртуть
Рубидий
Свинец
Селен
Серебро
Сурьма
Таллий
1антал
Теллур
Титан
Торий
Уран
Хром
Цезий
Церии
Цинк
Цирконий
Эрбий
Коэффициент
теплопро-
водности.
кал/см- сек. град
0,125 @")
0,1528 @J)
0,17
0,17
0,020 B5е)
0,028
0,17
0,36
0,020@—100°)
0,07 C9 )
0,0827 A8=)
0,0007—
0,00183
0,934 A00°)
0,045 B5^)
0,093
0,13 B0э)
0,014 B5=)
0,041
0,00 B00')
0,0645 B5J)
0,16 B0')
0,044 B8,5°)
0,026
0,2653 A8°)
0,04 B5°)
0,023
В табл. 4 приподятся данные об удельном электрическом сопротивлении
металлов при комнатной и близкой к комнатной температурах. Величина
электрического сопротивления металла, как и другие его свойства, зависит
от содержания и характера примесей, а также от температуры. Особенно
сильно это свойство зависит от присутствия примесей таких элементов,
как кислород, азот, водород и углерод, которые имеют тенденцию к выделе-
нию по границам зерен. Обычно удельное электрическое сопротивление
возрастает с повышением температуры; примеси могут понижать или повы-
шать его в зависимости от их характера.
Физические свойства металлов 39
Особенно резко выражено влияние температуры на электросопротивле-
ние бора: его удельное электросопротивление при 27" равно 775 000 ом.
а с повышениемтемпературы оно снижается до 4 ом (при 600'). Электросопро-
тивление таких полупроводников, как германий и кремний, а также сплавов,
содержащих галлий, теллур и индий, не подчиняется обычным соотноше-
ниям; электросопротивление селена изменяется в зависимости от степени
освещенности. Все эти особенности делают такие металлы весьма полезными
в самых различных областях применения.
Для металлов, которые принято рассматривать как проводники, удель-
ное электрическое сопротивление изменяется в чрезвычайно широких
пределах: от 1,59 для серебра и 95,8 для ртути до 185 мком-см для марганца.
Давно известно, что действительно хороших проводников очень мало. Это
серебро, медь, золото и алюминий с удельным электросопротивлением,
равным соответственно 1,59; 1.692; 2,44 и 2,66 яком-си; за ними следуют
бериллий, натрий, магний, кальций и родий.
В табл. 5 приводятся коэффициенты теплопроводности металлов при ком-
натной и близкой к комнатной температурах. Теплопроводность зависит
от содержания примесей и добавок, а также от температуры. Изменение
теплопроводности в зависимости от температуры может быть поаожитель-
ным или отрицательным, чем теплопроводность отличается от электросопро-
тивления, которое с повышением температуры обычно возрастает.
Интересно отметить, что четыре металла с самой высокой теплопровод-
ностью — серебро, медь, золото и алюминий — располагаются по тепло-
проводности в такой же последовательности, как и по электросопротивлению,
и что первые десять мест в таблицах по этим двум свойствам занимают одни
и те же элементы. Ртуть, плутоний и редкоземельные металлы по тепло-
проводности находятся на самом последнем месте.
В табл. 6 приводятся коэффициенты линейного расширения. Как видно
из этой таблицы, самые высокие коэффициенты линейного расширения имеют
щелочные металлы. Коэффициенты линейного расширения уменьшаются
от цезия до лития в порядке уменьшения атомного веса, затем следуют плу-
тоний, селен, европий, кадмий, цинк и свинец в том же порядке. Из приве-
денных в таблице металлов самым ннзким коэффициентом линейного рас-
ширения обладает вольфрам, затем идут осмий и кремний.
Коэффициент линейного расширения фактически изменяется вдоль
кристаллографической оси, по направлению которой производится опреде-
ление, но так как кристаллы большинства металлов имеют неупорядоченную
ориентацию, измерения, как правило, дают среднюю величину этого коэф-
фициента, за исключением нескольких случаев, например для урана.
В табл. 7 приводятся значения модуля нормальной упругости. Эти
значения заимствованы из отдельных глав настоящего справочника, а также
из данных Американского общества металлов 19]. В связи с трудностью
составления краткой сводки прочих механических характеристик, например
предела прочности при растяжении, предела текучести и относительного
удлинения, эти данные не приводятся.
Спрос на атомную энергию и программы развития ракет привели за по-
следние годы к появлению многочисленных данных по механическим свой-
ствам наиболее полезных металлов. Особо следует упомянуть о данных
по свойствам при повышенных температурах.
Приводятся значения поперечного сечения захвата тепловых нейтронов
для всех элементов (табл. 8) и возможных конструкционных материалов
(табл. 9) в порядке возрастания. Приводимые значения относятся к тепло-
вым нейтронам, имеющим скорость около- 2200 м/сек и энергию 0,025 эв.
Таблица 6
КОЭФФИЦИЕНТЫ ЛИНЕППОГО РАСШИРЕНИЯ
(Элементы, набранные курсивом, не включены в справочник)
Элемент
Алюминий
Барий
Бериллий
Бор
Ванадии
Висмут
Вольфрам
Гадолиний
Галлий
Гафний
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индий
Иридий
Иттербий
Иттрий
Кадмий
Калий
Кальций
Кобальт
Кремний
Лантан
Литий
Лютеций
Магний
Марганец
Медь
Молибден
Мышьяк
Натрий
Неодим
Коэффициент
линейного рас-
ширения, lQ-й/град
23,86B0—100°)
19
12
8,3 B0—750°)
8,95
13,3
4,45 @—500°)
6,4 B5°)
18 @—30°)
5,9 @—1000°)
6
9,5 D00°)
8,6 B5°)
32 E0°)
II,7 B0°)
14,2 B0")
24,8
6,5
25,0 B5")
10,8B5^ 1000°)
29,8 B5")
83 B0°)
22,0
12,36 D0")
4,68
4,9 B5°)
56
12,5 D00°)
25,8 B0")
22 B0°)
16,6 B0°)
5,44 B0°)
5,6 D0°)
71 B0") |
6,7 B5°)
Элемент
Никель
\ Ниобий
Олово
1 Осмий
Палладий
Платина
Плутоний
Празеодим
Реннй
Родий
Ртуть а
Рубидий
Рутений
Свинец
Селен
Серебро
Скандий
Стронций
Сурьма
Таллий
Тантал
Теллур
Тербий
Титан
Торий
Тулий
Уран
Хром
Церий
Цезий
Цинк
Цирконий
Эрбий
Коэффициент
.линейного рас-
ширения, 10-в/град
13,3 B5е)
7,1 B0")
20 B0—163°)
4,6 E0°)
11,67 B0°)
8,9 B0°)
55 B1 -104°)
4,8 B5")
С,С
8,5 B0")
182 B0°)
90 B0°)
9,1 B0°)
29,1 B0=)
37 D0°)
19,68 @- 100°)
12 B5—100°)
23 B0')
10,8 @ Ю(Г)
28 B0°)
6,6 B5")
16,75 D0°)
7,0 B5°)
8,4
12,5 B0°)
11,6 D00°)
йо +36,1
Ьо -8,7
Со +31,3
6,2 B0°)
8,5 B5°)
97 B0°)
29,2 D0°)
5,89
9,2 B5°)
а Коэффициент объемного расширения.
Таблица 7
модель нормальной упругости
(Элементы, набранные курсивом, не включены в спраиочннк)
Элемент
Алюминий
Бериллий
Бор
Ванадий
Висмут
Вольфрам
Гадолиний
Гафний
Гольмий
Диспрозий
Железо
Золото
Индий
Иридий
Иттерби б
Иттрий
Кадмий
Кальций
Кобальт
Кремний
Лантан
Магний
Медь
Молибден
Неодим
Никель
Модуль упру-
гости.
юз кг/мм»
7 242
31077
44 998
12 G56—13 359
3 234
41483
5 730
14 062
6 820
6 433
21093
7 593
1 104
52 029
1814
6 764
5 625
2 109—2 812
21093
10 898
3937
4 570
11953
33 046
3 867
21П93
Элемент
Ниобий
Олово
Осмий
Палладий
Платина
Плутоний
Празеодим
Рений
Родий
Рутений
Самарий
Свинец
Селен
Серебро
Сурьма
Тантал
Теллур
Тербий
Титан
Торий
Ураи
Хром
Церий
Цинк
Цирконий
Эрбии
Модуль
упруГОСГ И,
103 кг/мм*
10 687
4 148
56248
11 250
15 468
10 195
3 593
47 108
28 9G8
42186
3 480
1828
5 706
7 734
7 945
18 984
4 219
5 864
10898
7 242
18 984
29 530
3 058
8 437
9 632
7 474
Таблица 8
ПОПЕРЕЧНЫЕ СЕЧЕНИЯ ЗАХВАТА ТЕПЛОВЫХ НЕЙТРОНОВ ЭЛЕМЕНТОВ [М]
Элемент
Дейтерий
Кислород
Углерод
Гелий
Фтор
Бериллий
Висмут
Магний
ПорЯД-
КОРЫЙ
номер
1
8
6
2
9
4
83
12
Поперечное
сечение
захвата.
барн/итом
0
<0,0002
0,0034
0,005
<0,010
0,010
0,034
0,063
Элемент
Кремний
Снннец
Цирконий.
Фосфор
Алюминий
Водород
Кальций
Натрий
Поряд-
ковый
номер
14
82
40
15
13
1
20
11
Поперечное
сечение
захвата.
барнштом
0,16
0,17
0,18
0,20
0,23
0,332
0,44
0,505
Продолжение табл. 8
Сера
Олово
Аргои
Рубидий
Церий
Цинк
Ниобий
Барий
Стронции
Игтрин
Азот
Калий
Германий
Железо
Рутений
Молибден
Неон
Галлий
Хром
Та плий
Медь
Мышьяк
Теллур
Никель
Ванадий
Сурьма
Титан
Бром
Иод
Торий-232
Уран
Палладии
Платина
Лантан
Празеодим
Селен
Марганец
Поряд-
ковый
номер
16
5U
18
37
58
30
41
56
38
39
7
19
32
26
44
42
10
31
24
81
29
33
52
28
23
51
22
35
53
90
92
46
78
57
59
34
25
Поперечное
сечение
захвата.
0,52
0,625
0,66
0,73
0,73
1,10
1,15
1,2
1,21
1.31
1,88
2,07
2,45
2,53
2,56
2,7
<2,8
2,8
3,1
3,4
3,77
4,3
4,7
4,8
4,98
5,7
5,8
6,7
7
7,56
7,68
8
8,8
9,3
11,6
12,3
13,2
Поряд-
ковый
номер
Осмий
Вольфрам
Тантал
Технеций
Скандий
Торий-230
Цечий
Криптог
Хлор
Кобальт
Иттербий
Тербий
Неодим
Серебро
Гольмий
Литий
Рений
Золото
Гафний
Лютеций
Тулнй
Родий
Нептуний-237
Эрбий
Индий
Плутоннй-240
Ртуть
Ирщий
Лктиннй
Бор
Диспрозий
Плутоний-239
Плутоний-241
Кадмий
Европий
Самарий
Гадолиний
76
74
73
43
21
90
55
36
17
27
70
65
60
47
67
3
75
79
72
71
69
45
93
68
49
94
80
77
89
5
66
94
94
48
63
62
64
Поперечник
сечение
захнлта,
Ёарн/атом
15,3
19,2
21
22
24
27
29
31
33,6
37
37
46
46
63
65
71
86
98,8
105
112
127
156
170
173
196
295
380
440
510
755
950
1026
1400
2 450
4 300
5 600
46000
Физические свойетви металлов
43
Приведенные в таблице данные, крайне важные при проектировании
ядерных реакторов, объясняют, почему некоторые элементы применяются
для этих целей. Как правило, конструкционные материалы, предназначае-
мые для ядерных реакторов, не должны сильно поглощать нейтроны, так как
Таблица 9
ПОПЕРЕЧНЫЕ СЕЧИНИЯ 3 4ХВАТА ТЕПЛОВЫХ НЕЙТРОНОВ
ВОЗМОЖНЫХ КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
Элемент
Углерод
Бериллий
Висмут
Магний
Кремний
Свинец
Цирконий
Алюминий
Олово
I (ернй
Цинк
Ниобий
Итгрий
Германий
Железо
Рутений
Молибден
Хром
Таллин
Медь
Теллур
Никель
Ванадий
Сурьма
Титан
Торий-232
Уран
Палладий
Платииа
Лантан
Празеодим
Селен
Поперечное
сечение
захы^та.
бархатом
0,0034
0,010
0,034
0,063
0.16
0,17
0.18
0,23
0,625
0,73
1,10
1,15
1,31
2,45
2,53
2,56
2,7
3,1
3,4
3,77
4,7
4,8
4,98
5,7
5,8
7,56
7,С8
8,0
8,8
9,3
11,6
12,3
Элемент
Марганец
Осмий
Вольфрам
Тантал
Скандий
Торий-230
Кобальт
Иттербий
Тербий
Неодим
Серебро
Гольмий
Рений
Золото
Гафний
Лютеций
Тулий
Родий
НептуииЛ-237
Эрбий
Ииднй
Плутонин-240
Иридии
Бор
Диспрозий
Плутошш-239
П.1утоннн-241
Кадмий
Европий
Самарин
Гадолиний
Поперечное
сечение
знхгата.
барн атом
13,2
15,3
19,2
21
24
27
37
37
46
46
63
65
86
98,8
105
112
127
156
170
173
196
295
440
755
950
1026
1 400
2 450
4 300
5 600
46000
при сильном поглощении коэффициент размножения k становится меньше
единицы, и цепная реакция прекращается. В то же время коррозионная
стойкость материала, например по отношению к химическому воздействию
теплоносителей, и такие его механические свойства, как прочность и модуль
нормальной упругости, также должны отвечать определенным требованиям.
Практически при проектировании реакторов можно поступиться тем или
Таблица 10
ЦЕНЫ МЕТАЛЛОВ A9C0 г.)
(Элементы, набранные курсивом, не включены в справочник)
Цена 1 кг металла, долл-
Алюминий
Барий
Бериллий
Бор
Ванадий
Висмут
Вольфрам
Гадолиний
Галлий
Гафннн
Германий
Гольмий
Диспрозий
Европий
Железо
Золото
Индии
Иридий
Иттербий
Иттрий
Кадмий
Колий
Кальций
Кобальт
Кремний
Лаитап
Литий
Лютеций
Магний
Марганец
Медь
Молибден
(МЫШЬЯК
Натрий
Неодим
Никель
Ниобий
Олово
Осмий
Паллвднй
Платина
Плутоний
Празеодим
Репий
Родий
0,57
13,2
103,5
700
77
5
7,7
605
3000
66
299
605
605
2 863
0,14
1 123
40,2
2 400
605
440
3,08
4,4
4,51
3,3
286
220
22
2 863
0,77
0,99
0,73
17,6
1,32
0,36
22U
1,63
79,3
2,2
2 555
517
2665
27 975
220
1 718
4 406
11ена 1 кг металла, долл.
Железо
Свинец
Цинк
Натрий
Алюминий
Сурьма
Медь
Магний
Марганец
Мышьяк
Никель
Олово
Хром
Кадмий
Кобальт
Калий
Кальций
Висмут
Ртуть
Вольфрам
Теллур
Барнй
Селен
Таллий
Титан
Молибден
Стронций
Литий
Цирконий
Серебро
Уран
Индий
Торий
Гафний
Ванадий
Тантал
Ниобий
Бериллий
Церий
Цезий
Лантан
Неодим
Празеодим
Рубидий
1 Кремний
0,14
0,26
0,29
0,36
0,57
0,64
0,73
0,77
0.99
1,32
1,63
2,2
2,53
3,08
3,3
4,4
4,51
5,0
6,25
7,7
7.7
13,2
14,3
16,5
16,83
17,6
17,6
22
24,2
29,8
40
40,2
50,6
66
77
77
79,3
103,5
220
220
220
220
220
220
286
Цена 1 смЗ мствлла, долл.
Натрий
Железо
Магний
Алюминий
Цинк
Свинец
Калий
Сурьма
Медь
Кальций
Марганец
Мышьяк
Литий
0,00037
0,0011
0,0013
0,0015
0,0021
0,0029
0,0037
0,0043
O.0U65
0,0070
0,0073
0,0076
0,0116
Никель 0,0147
Олово 0,0160
Хром
Кадмий
Кобальт
Стронций
Барий
Теллур
0,0183
0,0262
0,0293
0,0458
0,0464
0,0482
Biicmvt 0.O4BB
Селен 0,0683
Титан
Ртуть
Вольфрам
Цирконий
Молибден
Бериллий
0,0763
0,0848
0,149
0,156
0,180
0,190
Таллий U.196
Индий 0,294
Серебро
Рубидии
Цезий
Ванадий
Торий
Кремний
Ниобий
Уран
Гафний
Тантал
Лантан
Церий
Празеодим
Неодим
0,308
0,337
0,412
0,473
0,591
0,668
0,679
0,763
0,879
1,28
1,37
1,47
1,49
1.51
Физические свойства металлов
45
Продолжение табл. 10
Цснв [ кг металла, долл.
Ртуть
Рубидий
Рутений
Самарий
Свинец
Селен
Серебро
Стронций
Сурьма
Таллин
Тантал
Тербнн
Теллур
Титан
Торий
Тулий
Уран
Хром
Цезий
Церий
Цинк
Цирконий
Эрбии
6,25
220
1 762
605
0,26
14,3
29,3
17,6
U,64
16,5
77
2 863
7,7
16,83
50,6
2 863
40
2,53
220
220
0,29
24,2
605
Цеиа I кг металла, долл. Цеив I смЗ металла, долл.
Германий
Иттрий
Палладий
Диспрозий
Эрбий
Гадолиний
Гольмий
Самарий
Иттербий
Бор
Золото
Рений
Рутений
Иридий
Осмий
Платина
Енропий
Лютеций
Тербий
Тулий
Галлий
Родий
Плутоний
290
440
517
605
605
605
605
603
605
700
1 123
1 718
1762
2 400
2 555
2 665
2 863
2 863
2863
2 863
3 000
4 406
27 975
Бор
Германий
Иттрий
Иттербий
Самарий
Гадолиний
Диспрозий
Гольмии
Эрбий
Палладий
Европий
Галлий
Золото
Рутений
Тербий
ТуЛИЙ
Лютеций
Ренин
Иридий
Родий
Платина
Осмий
Плутоний
1,57
1,59
1,98
4,23
4,58
4,78
5,19
5,33
5,49
6,22
15,07
17,63
21,72
21,84
23,74
26,85
28,22
36,25
53,76
54,79
57,06
57,48
553,26
иным требованием. К сожалению, обычные конструкционные материалы —
железо, медные сплавы и легирующие сталь элементы — обладают довольно
большим поперечным сечением захвата нейтронов. Этим объясняется, поче-
му ядерные реакторы изготовляются из такого редкого металла, как цирко-
ний. Этот металл обладает высокой прочностью, хорошей коррозионной
стойкостью и стойкостью против действия жидкометаллических теплоноси-
телей, например натрия, и сравнительно малым поперечным сечением захвата
нейтронов.
Металлы, подобные гафнию, кобальту и некоторым редкоземельным
металлам с большими поперечными сечениями захвата нейтронов, важны для
целей регулирования. Здесь также необходимы хорошая прочность и корро-
зионная стойкость.
В табл. 10 указаны цены на большинство обычных и редких металлов.
Таблица состоит из трех частей: в первой части металлы указаны в алфавит-
ном порядке для удобства нахождения каждого металла, во второй части
металлы расположены в порядке возрастания их цен, а в последней части
учитывается объемный фактор — металлы расположены в порядке возраста-
ния цен на единицу объема A см3) металлов. Эти данные приведены для того,
чтобы объемный фактор можно было связать с ценой рассматриваемого метал-
ла. Во многих случаях объем и площадь, занимаемые металлом определен-
ной толщины, имеют большее значение, чем вес металла. Это особенно важно
в тех случаях, когда необходимо сравнить стоимость изделий одинаковых
размеров, или при применении коррознонностойких покрытий.
¦№ Глава 2
Указанные в таблице цены заимствованы главным образом из отдельных
глав настоящего справочника и из опубликованных в различных периодиче-
ских изданиях работ [15]. Само собой разумеется, что цены на металлы сильно
колеблются в зависимости от степени их чистоты, формы заготовок и объемов
закупаемых партий. Как правило, в этой таблице приводятся цены на высо-
косортные металлы при закупке большими партиями. Для бора, ниобия
и вольфрама приведены цены на порошки этих металлов; для мышьяка, хро-
ма и марганца - на комковый металл и стружку; для бария, рения и строн-
ция — на прутки; для цезия, галлия, ртути и рубидия — на сосуды с жидки-
ми металлами; для гафния — на крупнокристаллический пруток; для тан-
тала — на литые заготовки; для железа приведена цена на сталь в 1959 г.;
для титана — цена на прокат в 1960 г., а все остальные цены приведены для
слитков или чушек.
Для редкоземельных металлов на мировом рынке приняты следующие
цены: для церия, лантана, неодима и празеодима 220—396 долл. за 1 кг;
для диспрозия, эрбия, гадолиния, гольмия, самария и иттербия 555—
660 долл. за 1 кг; для европия, лютеция, тербия и тулия 2800—6600 долл.
за 1 кг. Эти цены относятся к металлам самой высокой степени чистоты и отра-
жают количественные факторы, а также спрос на одни металлы по сравнению
с другими, которые могут быть извлечены из сырья, содержащего все эти
элементы примерно в одинаковых количествах. В табл. 10 указаны самые
низкие из цен.
Анализ таблицы показывает, что цена может служить довольно надеж-
ным критерием того, какой металл следует считать редким.
ЛИТЕР AT УРА
I. E v er h а г t J. L., L i n d I i ef W. E., К а п eg i s J., Weissler P. C,
Siegel F., Mechanical Properties of Metals and Alloys, National Bureau of
Standards Circular C447, 1943.
2 Jones H. A., L a n R m u i r 1., M а с k а у М- F., Phys. Rev.. 30. 201 A927).
ley K. K.. U. S. Bureau of Mines Bull. 383 A935).
ley K. K., U. S. Bureau of Mines Bull. 371 A934).
ley К. К-, U. S Bureau of Mines Bull. 393 A93G).
ley K. K- U. S. Bureau of Mines Bull. 476 A949).
I ey K. K., II. S. Bureau of .Mines Hull. 477 A950).
3 К е
4. Ке
5. 1< е
G. Ке
7. К е
8. L у о п R. L., Liquid Metals Handbook, 2nd ed.. Atomic Energy Commission ¦
Department of the Navy, Washington. 1952.
9 Metals Handbook, American Society for Metals, Cleveland, 1948 (готовится к печати
новое издание).
10. Материалы Комиссии по атомной энергии США, Ядерные реакторы. III. Материалы
для ядерных реакторов, ИЛ, 1956.
П. Richardson D., Spectroscopy in Science and Industry, Proceedings of the
Fiftli Summer Conference on Spectroscopy and Its Applications, John Wiley and
Sons, Inc., New York, 1938, p. 6-1—70.
12. Camp bell I. E., Ed., High-Temperalure Technology, John Wiley and Sons,
Inc., New York, 1956, p. 335.
13. .4 t u I 1 D. R., S i n k с G. С, Thermodynamic Properties of the Elements, Ameri-
can Chemical Society, Washington, 1956.
14. Hughes D. J., S с h v, ar t z R. В., Neutron Cross Sections, 2nd ed., BNL-325,
U. S. Government Printing Office, Washington, D. C, July 1, 1958.
15. Oil, Paint and Drug Reporter; Chemical and Engineering News; Engineering and
Mining Journal.
3.
БЕРИЛЛИЙ
Б. Р. КЬЕЛЛГРЕН
В. R. Kiellgren, The Brush Beryllium Cvmpany, Cleveland, Ohio
ВВЕДЕНИЕ
Бериллий был открыт Вокеленом в 1797 г. как компонент минерала бе-
рилла. Французское наименование этого элемента «глюциний» (G1) обязано
своим происхождением сладковатому вкусу, свойственному многим соеди-
нениям бериллия.
Впервые металлический бериллий был получен Вёлером и Бюсси в 1828 г.
в пиде загрязненного примесями порошка восстановлением хлорида бериллия
металлическим калием.
Благодаря вкладу в науку, сделанному рядом исследователей, химия
бериллия получила значительное развитие еще в XIX веке."Особый интерес
представляет опубликованная в 1899 г. работа французского исследователя
Лебо 117], в которой описано получение небольших гексагональных кри-
сталлов бериллия при электролизе фторобернллата натрия Na2BeF4, а так-
же получение меднобериллиевых сплавов прямым восстановлением окиси
бериллия углеродом в присутствии меди. Представляют интерес также
работы немецкого исследователя Эстсрхельда 120], опубликовавшего
в 1916 г. диаграммы состоянии бериллия с медью, алюминием, серебром
и железом, а также исследования Кроля, Донахью и Адамоли, разработав-
ших методы получения чистого бериллии восстановлением смесей фторида
бериллия с фторидами щелочных и щелочноземельных металлов щелочно-
земельными металлами и магнием 11, 7, 161.
Промышленное производство бериллии в США начато в 1916 г. Купе-
ром, получившим первый значительный слиток металла, а также фирмой
«Браш лабораториз компани», которой в начале 20-х годов под руководством
Сойсра были предприняты исследовательские работы. Возникновение берил-
лиевой промышленности в Германии, относящееся к 1923 г., связано
с концерном «Сименс-Гальске».
Началом промышленного применения бериллиевых сплавов в США
можно считать 1932 г., когда фирма «Америкэн брас компани», применив
меднобериллиевую лигатуру, изготовленную фирмой «Бсриллиум корпо-
рейшн оф Америка», впервые получила прокатанную бериллиспую бронзу.
Технологические разработки фирмы «Браш лабораториз компани» были вне-
дрены в производство в 1931 г. «Браш бериллиум компани» — первой фир-
мой, производившей компактный бериллий с целью его выпуска на рынок.
Бериллий — первый элемент II группы периодической таблицы. Поряд-
ковый номер бериллия — 4, атомный вес — 9,0122, а его валентность, рав-
ная 2, отвечает наличию 2$-электронов на L-оболочке. В природе изотопы
бериллия не были найдены. Однако радиоактивные изотопы бериллия с мас-
совыми числами 6, 7, 8, 10 и 11 могут быть получены искусственно.
Бериллий — металл сероватого цвета, причем обычно можно разли-
чить большие кристаллы с ярким металлическим блеском. Бериллий — очень
Глава 3
легкий металл (плотность 1,845), у которого большая прочность сочетается
с высокой температурой плавления A285°).
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Известно более тридцати минералов, содержащих бериллий, однако
только три из них имеют практическое значение: берилл 3BeO-Al2O3-6SiO2,
фенакит 2BeO-SiO2 и бертрандит 4BeO-2SiO2-H2O. В настоящее время
промышленное значение имеет только берилл. Однако в последнее время
найдены довольно крупные месторождения с малым содержанием фенакита
и бертрандита. В настоящее время исследуются способы извлечения берил-
лия из этих бедных руд. Чистый берилл представляет собой алюмосиликат
бериллия, содержащий приблизительно 14% окиси бериллия (ВсО), 19%
окиси алюминия (А12О3) и 67% кремнезема (SiO2). Прозрачные окрашен-
ные разновидности берилла представляют собой драгоценные камни—
изумруд и аквамарин.
Промышленные сорта бериллового концентрата содержат приблизитель-
но 10—12% окиси бериллия. Концентраты, содержащие более 12% окиси
бериллия, встречаются редко; обычно содержание окиси бериллия составляет
9—11%. В состав концентрата входят также окись алюминия A7—19%),
кремнезем F4—70%), окислы щелочных металлов A—2%), железа A—2%)
и небольшие количества других окислов. Основными сопутствующими мине-
ралами в промьшшенных сортах бериллового концентрата являются поле-
вой шпат, кварц и слюда.
Бериллий довольно широко распространен в земной коре, где его содер-
жание составляет около 1-10~3% [3]. Однако, если не считать одного-двух
случаев, крупных месторождений берилловой руды с содержанием 10—12%
окиси бериллия, разработка которых могла бы оказаться экономически
выгодной при условии добычи только берилла, еще не найдено. Обычно
берилл добывают как попутный продукт при горных разработках пегмати-
товых даек полевого шпата, литиевых минералов или слюды, причем отби-
раются только кристаллы, пригодные по своим размерам для ручной сорти-
ровки ирудоразборки. Лучшие сорта пегматитов, подвергаемые ручной сор-
тировке и рудоразборке, содержат 1—2% берилла. Полученные при ручной
сортировке и рудоразборке попутные продукты, а также бедную берилло-
вую руду, содержащую около 0,1% берилла, перед вскрытием подвергают
обогащению. По данным Горного бюро, запасы таких бедных берилловых
руд в США. составляют в пересчете на берилл свыше 1 млн. тонн.
Недавно в Колорадо было сконструировано специальное оборудование
для обогащения бедных берилловых руд, однако экономичность работы та-
ких предприятий еще не определена.
Основные производители бериллового концентрата — Южно-Африкан-
ская Республика, Аргентина, Бразилия и Индия. Небольшие количества
берилла производят также в бывшей Британской Восточной Африке, Марок-
ко, Мозамбике, Португалии и Канаде. В США основные запасы берилла
сосредоточены в штатах Колорадо, Мэн, Нью-Гемпшир и Южная Дакота.
Многие еще не разрабатываемые месторождения берилла имеются в Кана-
де, в частности в районе Большого Невольничьего озера в северо-западных
провинциях. Большая часть берилловой руды, потребляемой бериллиевой
промышленностью США, импортируется. Промышленный спрос вплоть
до настоящего времени удовлетворяется кусковым (штуфным) бериллом,
получаемым при ручной сортировке и рудоразборке.
Бериллий
49
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Поскольку основным сырьем, потребляемым бериллиевой промышлен-
ностью, является берилл, статистические данные о поставках, потреблении
и запасах берилловой руды довольно точно отражают состояние этой отрасли
промышленности. В табл. 1 приведены подробные данные за период 1940—
1959 гг. об общем поступлении берилла из внутренних и внешних источни-
ков, о его потреблении в США и о примерных запасах, остававшихся к концу
каждого года. В таблице указаны также существовавшие в те годы
примерные цены на берилл.
Из приведенных в табл. 1 данных видно, что, несмотря на значительный
рост цен на берилловый концентрат, цена чистого бериллия по сравнению
Таблица 1
Годы
1940
1941
1942
1943
1944
1945
1946
1947
1948
1949
1950
1951
1952
1953
1954
1955
1956
1957
1958
1959
ПОСТУПЛЕНИЕ, ПОТРЕБЛЕНИЕ I
Добыча
в США а
ПО
143
244
323
352
35
91
1.42
90
431
507
439
467
681
607
454
417
473
420
297
Л ЗАПАСЫ БЕРИЛЛА В США
ЗА ПЕРИОД 1S40—1959 гг. (В ТОННАХ)
Импорт
730
2418
1860
4390
2826
1090
1078
696
1560
3457
4434
3916
5422
7254
5275
5476
11220
6612
4172
7291
Общее по-
ступление
840
2562
2104
4713
3178
1125
1169
827
1650
3888
4940
4354
5890
7936
5882
5929
11638
7085
4592
7588
Потребле-
„не "
544
1089
2134
2774
1974
1577
919
1574
1787
934
2728
3073
3153
2414
1767
3501
4019
3909
5444
7418
Запасы на
конец
года в
635
1542
1814
3 266
4 351
4 173
4 536
3810
3 266
6168
8 526
9 796
13 424
18 957
23038
25 487
33106
36 280
35 428
34 920
Примерная
ценя условной
единицы1", долл
2,50
3,85—4,50
5,60—7,50
6,50—10,40
9,00—14,50
9,00—14,50
9,00—14,50
16,00—18,00
16,00—26,00
26.00—28,00
28,00
28,00—35,00
39,00
47,00
43,00—47,00
38,00—50,00
36,00—38,00
36,00 -38,00
30,00—33,00
31,00 34,00
11 По данным Горного бюро США.
По данным Министерства торговли США.
в По подсчетам автора.
г По подсчетам автора (условная единица соответствует содержанию 1% окиси бериллня
в берилле; таким образом, 11% ВеО соответствует II условным единицам).
с уровнем 1940 г. возросла всего на 20%, что свидетельствует об увеличении
объема производства и усовершенствовании технологии. Стоимость берил-
лия, содержащегося в меднобериллиевой лигатуре, зависит от увеличения
объема производства в меньшей степени, чем стоимость чистого бериллия,
однако даже в этом случае цена бериллия в бериллиевой бронзе возросла
4 Заказ № 239
Таблица
ДАННЫЕ О ДОБЫЧЕ БЕРИЛЛОВОГО КОНЦЕНТРАТА (БЕРИЛЛА)
К США ЗА ПЕРИОД 1952—1959 гг. ПО ШТАТАМ (В ТОНН4ХK
Штат
Колорадо
Нью-Гемпшир
Нью-Мексико
Южная Дакота
Другие штаты в
Всего
Общая стоимость,
долл.
Цена за 1 т, долл.
1952
49
б
91,5
303
23,5
467
233 257
490,48
1953
68
51,5
80,5
356
125
681
354 487
520,54
1954
53
11
106
306
131
607
303 649
500,02
1955
42
18
96
267
31
454
267 927
590,15
1956
161
б
29
177
50
417
236 748
567,74
1057
165
3,6
26
243
34,4
472
275 855
584.44
1058
121
13
25
218
43
420
238 017
566,71
113
18
1U
142
16
299
170 523
570,30
а По данным Горного бюро США.
б Включено в графу «Другие штаты».
v Штаты Аризона, 1953-1958 гг.; Коввектннут, 1953—1959 гг.; Джорджия, 1952—1957 гг.;
Айдахо, 1953—1954. 1957 гг.: Мэн. 1952—1959 гг.; Мэриленд, 1954, 1957 гг.; Иьго-Гемпшнр,
1956—1957 гг.; Нью-Йорк, 1954 г.; Северная Каролина, 1953—1958 гг.; Виргинии, 1954—
1956 гг.; Вайоминг 1956—1050 гг.
Таблица 3
ДАННЫЕ О ВВОЗЕ БЕРИЛЛОВОЙ РУДЫ (БЕРИЛЛОВОГО КОНЦЕНТРАТА)
В США ИЗ РАЗЛИЧНЫХ СТРАН ЗА ПЕРИОД 1953—1959 гг. (D ТОННАХ)"
Страна
Афганистан
Аргентина
Бывшее Бельгийское
Конго
Бразилия
Бывшая Британская
Восточная Африка
Бывшее Британское
Сомали
Бывшая Британская
Западная Африка
Гонконг
Индия
Корея
Мадагаскар
Марокко
Мозамбик
Нигерия
1953
1323
—
2370
20
—
—
—
180,5
7,3
299,3
20,9
356
—
1954
9,9
—
9,9
1658
20,9
—
—
—
356
3,6
70
—
1171
—
1955
400
116
1574
84,4
—
—
766
5,5
25,4
—
562
2,7
1950
2113,3
900
2364
239
26,3
20
0,9
3048
192,3
23,6
1007
1957
1401
201
1964
51
1139
39
875
1958
700
1078
806
27
5-11
258
1959
2249
358
2570
13,6
298 4
1251
Бериллий
51
Продолжение табл. 3
Страна
Норвегия
Пакистан
Португалия
Бывшая Федерация
Родезии и Ньясален-
да
Суринам
Швеция
Бывший Южно-Афри-
канский Союз
Псе го
Общая стоимость,
долл.
1053
_
-
301
1176
—
—
1200
7254
3 752 718
1954
—
307
668
9,1
4,6
784
5275
2 574 061
1955
_
—
257
781
902
5476
2 226 068
1956
13,6
220
507
546
11221
4 459 387
1957
63
30
241
608
6612
2 526 068
1958
_
122
634
4171
1 547 466
1959
3,6
70
137
37,2
300,2
7291
а По данным Министерства торговли США.
только вдвое, тогда как стоимость бериллия в концентрате увеличилась
примерно в 15 раз.
Цены на бериллий в виде отлитых в вакууме заготовок в зависимости
от объема поставок составили в 1959 г. 103,6—187,4 долл. за 1 кг, в то время
как цена бериллия в меднобер ил лиевой лигатуре D% Be) осталась на преж-
нем уровне — 94,8 долл. за 1 кг.
Из внутренних источников США были получены ограниченные количе-
ства берилла; более 90% руды ввозилось из-за границы. Интересно просле-
дить, где именно добывался этот берилловый концентрат; в табл. 2 и 3 при-
ведены подробные данные об этом. В табл. 2 приведены данные о добыче
берилла на рудниках США за период 1952—1959 гг., в табл. 3 — данные
о ввозе берилла в США из различных стран за период 1952—1959 гг.
ВСКРЫТИЕ БЕРИЛЛА
Первой стадией применяемых в настоящее время промышленных спо-
собов получения бериллия является перевод содержащегося в концентрате
бериллия в водорастворимую соль с последующим ее выщелачиванием.
Затем из содержащих бериллий растворов выделяют гидроокись или окись
бериллия, которые служат исходным сырьем для получения бериллия и бе-
риллиевых лигатур (сплавов).
В настоящее время в США широко применяются два промышленных
способа получения окиси бериллия из бериллового концентрата.
Способ Копо — Кавецкого
В основе этого способа, применяемого фирмой «Бериллиум корпорейшн»
(Ридинг, штат Пенсильвания), лежит процесс, предложенный Копо [5].
Им было найдено, что в результате спекания смеси бериллового концентрата
4*
52 Глава 3
с кремнефторидом натрия при температуре примерно 750" образуются фторо-
бериллат натрия и криолит. Реакция сопровождается улетучиванием обра-
зующегося тетрафторида кремния. Кавецкий 113] усовершенствовал процесс
Копо, заменив кремнефторид натрия Na2SiFe железофтористым натрием*.
В результате предложенной Кавецким реакции образуются фторобериллат
натрия, окись алюминия, двуокись кремния и окись железа и выделяется
лишь незначительное количество тетрафторида кремния.
Полученный после выщелачивания спека водой раствор фторобериллата
натрия обрабатывают едким натром. Образующуюся гидроокись бериллия
Ьсрилловый
N
Выщелачивание •* Н2О
Н[Ю1 И1,ш ШГОМ ~« . Pat П11ЮР
Оютдгииг еидроониси-* ца qh
бериллия Рис. 1. Схема полу-
г \ чения гидроокиси (или
R.I0H). Раствор 0КИСи) ^Рилл"я- ПРИМ?"
2 nqf няемая фирмой «Берил-
I L лиум корпорейшн».
Проглпивпние Осатденис тепезчого^ р_ /cq \
до бсО нриопита 2 ц ъ
¦ }
No3rrr6 NozS04
(в огпвар)
отфильтровывают, промывают, сушат и прокаливают при температуре около
800° до окиси бериллия. Полученная таким образом окись бериллия содер-
жит некоторое количество фторида натрия, нотем не менее является достаточ-
но чистым исходным сырьем для изготовления меднобериллиевой лигатуры
и других бериллиевых сплавов.
Фторид натрия, образующийся наряду с гидроокисью бериллия при
обработке раствора фторобериллата натрия едким натром, извлекают из раз-
бавленного фильтрата после отделения гидроокиси, добавляя концентри-
рованный раствор сульфата железа(Ш). Образующийся при этом желез-
ный криолит осаждают, отфильтровывают и вновь используют в процессе
спекания с берилловым концентратом. Следовательно, способ Кавецкого
не только исключает потери фтора, связанные с улетучиванием тетрафторида
кремния, но позволяет также регенерировать фторид натрия, необходимый
для перевода содержащегося в концентрате бериллия во фторобериллат
натрия. Потери железного криолита возмещаются добавлением кремнефто-
рида натрия и соды.
Схема получения гидроокиси или окисн бериллия из бериллового кон-
центрата, применяемая фирмой «Бериллиум корпорейшн», показана
на рис. 1.
* Так называемым «железным криолитом» Na3FcFe.— Прим. перея.
Бериллий
53
Способ Сойера — Кьеллгрена
Этот способ [25, 26], применяемый фирмой «Браш бериллиум компани»
(Кливленд, штат Огайо), основан на том факте, что фритта стекловидного
берилла, получаемая при отливке расплавленного бериллового концентрата
в холодную воду, приобретает способность взаимодействовать с серной кис-
лотой. Берилловый концентрат обычно весьма устойчив к действию кислот,
за исключением плавиковой, применять которую невыгодно из-за наличия
в составе берилла большого количества кремнезема, также растворяющего-
ся в ней.
Ьериллоеый почцеитрат
I
Сплавление
\
Термообработка
I
Сернп я нислото -
Н20
Измельчение
I
¦
Аммиачный
раствор
Иомплснсо - —
аШюзовителъ ,—
Раствор едкого
натра
—^ Выщелачивание
J
-»- Нристилпизаиия
Образование келагпрь'*
-*¦ соединений
^Получрниб бериллентмз-*—
натрия
Гидролиз
Центрифугирование
Гидрио/гись
бериллия
{16 20% Бе;
_ А/имониинир
наисцы
Тоннодисперсиоя
гидроокись
бериллия
\
Тонкий
(а отвал)
Рис. 2. Схема получения гидроокиси бериллия, применяемая фирмой
«Браш бериллиум компант.
В раствор сульфатов алюминия и бериллия, получаемый после обработ-
ки топкоизмсльченной фритты стекловидного берилла серной кислотой,
вводят сульфат аммония для отделения большей части алюминия в виде кри-
сталлов аммонийных квасцов. После этого концентрированный маточный
раствор сульфата бериллия перед осаждением гидроокиси бериллия обра-
батывают комплексообразующими реагентами для удаления примесей;
затем вводят едкий натр, в результате чего осаждается довольно чистая
гидроокись бериллия, содержащая в качестве основной примеси небольшое
количество сульфата натрия. Прокаливанием при температуре около 750—
850° гидроокись бериллия превращают в окись.
На рис. 2 показана схема получения гидроокиси (или окиси) бериллия
из берилловой руды, применяемая фирмой «Браш бериллиум компани».
54 Г л а в а 3
ПРОИЗВОДСТВО БЕРИЛЛИЯ
Получение чистой окиси бериллия
Технически чистые сорта гидроокиси или окиси бериллия, которые
получают как промежуточные продукты для производства бериллия или
меднобериллиевой лигатуры, в качестве основных примесей содержат соли
натрия и небольшие количества элементов, имевшихся в исходном концен-
трате (кремний, железо, алюминий, медь, магний, литий, марганец и др.).
Эти примеси обычно удаляют из технической гидроокиси или уменьшают
их содержание путем растворения ее в серной кислоте и очистки образующе-
гося сульфата бериллия перекристаллизацией. Кристаллы чистого сульфата
бериллия прокаливают затем в газопламенных печах для удаления серы
(в виде SO2) и получают чистую окись бериллия. Окись бериллия для пол-
ного удаления из нее серы необходимо прокаливать в восстановительной
атмосфере при температурах 1000—1200°.
Очень чистая., но дорогая окись бериллия может быть получена
путем перевода технической гидроокиси в основной ацетат бериллия
¦ ВеО-ЗВе(С2Н3О2J- С целью удаления остающихся в этой соли примесей
основной ацетат экстрагируют хлороформом, раствор фильтруют от
нерастворимых примесей, затем испаряют хлороформ и возгоняют остаток.
Полученный таким образом чистый основной ацетат бериллия растворяют
в химически чистой серной кислоте. Образующийся чистый сульфат
бериллия разлагают, как описано выше*.
Получение бериллия
В настоящее время весь производимый в США чистый бериллий полу-
чают восстановлением фторида бериллия металлическим магнием. Приме-
няемый для этого фторид бериллия получают из гидроокиси бериллия.
В этом процессе, разработанном Кьеллгреном [14] и применяемом фир-
мой «Браш бериллиум компани», фторид бериллия берется в избытке по отно-
шению к магнию.
Реакцию восстановления проводят при температуре около 900" в футе-
рованной графитом печи в условиях точного контроля постепенно загружае-
мых магния и фторида бериллия. Выделяющееся при реакции тепло погло-
щается с той же скоростью, с которой выделяется, причем частично оно рас-
ходуется на расплавление твердого магния и фторида бериллия. Поскольку
реакция протекает ниже температуры плавления бериллия, металл получает-
ся в виде очень мелких частиц, распределенных в шлаке, состоящем из сме-
си образовавшегося в результате реакции фторида магния и избытка введен-
ного в процесс фторида бериллия.
При повышении температуры печи выше температуры плавления берил-
лия частицы металла расплавляются и сливаются воедино. При этой темпе-
ратуре шлак благодаря наличию в нем избытка фторида бериллия становит-
ся очень жидким, поэтому расплавленный бериллий отделяется и всплывает
на поверхность расплавленного шлака. Сразу же после этого расплавлен-
ный металл и шлак выливают в холодную графитовую изложницу, где эта
* Основные сведения по химии и технологии бериллия приведены в недавно
вышедшей в свет небольшой монографии Г. Ф. Силииой, Ю. И. Зарембо и Л. Э Берти-
ной «Бериллий. Химическая технология и металлургия» (Атомиздат, 1960). Многие
подробности, относящиеся к изучению химии бериллия и его техническому освоению,
можно иайти в книге Д. Уайта и Дж. Бёрка «Бериллию (ИЛ, 1960) и монографии
Дж. Дарвина и Дж. Баддери сВериллий» (ИЛ, 1962). — Прим. ред.
Бериллий
55
масса застывает. При отливке расплавленный бериллий разбивается на ко-
рольки, так что твердая масса, образующаяся в графитовой изложнице,
состоит из застывшего шлака с включенными корольками металла. Эту мас-
су измельчают, а корольки бериллия и имеющийся в шлаке избыток фторида
бериллия возвращают в процесс на операцию получения фторнда бериллия
сь бериллия
Растворениг в раствере нислого ipmnpuik? аммония -
Ссаукдение примесей поташом, двуокисью
го^Ерм аммоием
у
аммонием
V
Филыгцювииие
Выпаривание и кристаллизация
Лев (после промыв
ни еооЪи e и/ноил)
i
Кристаллы чистого
(ртороЁсриллата
оммония
Muvsctfos
oi: центрифугирование
t
Мигпоччьт раствор
v промывное воды
I
разложение
—'
Фторид бериллия
Восстановление
Вьчцглочиввнис
продуктов
реикции
|
поглощаемый^ раствором
Плрвииовой пиглоты
I
'Фторид магнияtв отвал)
бериллия
\
и
Роствор фтпридя
брил
I
\
Отлитые в вапууме
спипти бериллия
Рис. 3. Схема получения бериллия из его гидроокиси,
фирмой «Браш бериллиум компаии».
применяемая
из его гидроокиси. В этой операции гидроокись бериллия растворяют в вод-
ном растворе кислого фторида аммония. Полученный таким образом раствор
фторобериллата аммония, а также получаемый после выщелачивания
из шлака избытка фторида бериллия раствор фторобериллата аммония объе-
диняют и для отделения примесей обрабатывают двуокисью свинца, поташом
и многосернистым аммонием. После фильтрования раствора, упаривания
фильтрата и кристаллизации получают исключительно чистый фтороберил-
лат аммония. Таким образом, кристаллы чистого фторобериллата аммо-
ния получают как из исходной гидроокиси бериллия, так и из фторида берил-
лия, возвращаемого в процесс после выщелачивания шлака. Затем кристал-
лы фторобериллата аммония при нагревании разлагаются с образованием
паров фторида аммония, которые поглощают водой и возвращают на опера-
56 Г л а в а 3
цию получения фторобериллата аммония из шлака, и расплавленного фто-
рида бериллия, который собирается в виде небольших прозрачных капель
или кусочков. После выщелачивания фторида бериллия из полученной
в результате восстановления магнием массы шлака корольки бериллия лег-
ко отделяются от мелких кристаллов не растворимого в воде фторида маг-
ния. Полученные таким образом корольки металла переплавляют в тиглях
из окиси бериллия в вакуумной печи*. Степень чистоты такого металла зави-
сит от чистоты применяемых для его получения фторида бериллия и магния.
Схема получения бериллия из его гидроокиси, применяемая фирмой
«Браш бериллиум-компани», показана на рис. 3.
Способы получения хлопьевидного (чешуйчатого) бериллия электро-
лизом расплавленных смесей хлоридов бериллия и щелочных металлов,
разработанные Купером [4], Сойером и Кьеллгреиом [28], а также Морана
[19], до сих пор не нашли промышленного применения. Однако фирма
«Пешинэ» во Франции в течение ряда лет получала хлопьевидный бериллий
электролизом хлоридов; согласно сообщениям, объем этого производства
невелик по сравнению с производством в США.
Производство меднобериллиевой лигатуры
Меднобериллиевая лигатура может быть получена обычным сплавле-
нием этих двух металлов. Однако в США в настоящее время ее получают
прямым восстановлением окиси бериллия углеродом в присутствии меди,
так как этот способ оказался дешевле непосредственного сплавления.
Промышленные способы производства меднобериллиевых сплавов раз-
работаны и запатентованы Сойером и Кьеллгреиом 115], а также Гахаганом
191. Эти процессы состоят из аналогичных операций и основаны на восста-
новлении окиси бериллия углем в присутствии меди; образующиеся при этом
в виде побочных продуктов дроссы и скрап возвращаются в процесс. Реак-
ционную смесь загружают в электрическую дуговую печь с рабочей темпе-
ратурой 1800—2000". При этой температуре окись бериллия восстанавли-
вается углем, а в качестве побочного продукта выделяется окись углерода.
Реакция сопровождается также образованием карбида бериллия, особенно
заметном при увеличении содержания бериллия в получаемом медном спла-
ве. Практика показала, что самые лучшие выходы достигаются в тех случаях,
когда образуется сплав с 4—4.25% бериллия. При более высоком его содер-
жании образуется слишком много карбида бериллия, а при более низком
снижается производительность печи.
Общий расход электроэнергии на производство I кг 496-ной медиобе-
риллиевой лигатуры составляет примерно 2,75квт-ч. Полученная этим спо-
собом меднобериллиевая лигатура обычно содержит менее 0,10% железа.
0,08?о кремния и 0,06% алюминия.
ФИЗИЧЕСКИЕ СВОЙСТВА
Бериллий
В табл. 4 приведены значения физических констант бериллия, полу-
ченные Лозаио [18], Сойером и Кьеллгреном [27], данные, приведенные
* Производство бериллия и его лигатур, а также вопросы применения берил-
лия, его сплавов и соединений подробно освещены в главе «Бериллий» М Б. Рейфмана
в книге «Основы металлургии», т. 3, Металлургнздат, 1963, стр. 404—440 —
Прим. ред.
Бериллий
57
в справочнике Американского общества металлов за 1948 г., а также более
поздние данные, полученные другими авторами.
Очень большая твердость, часто приписываемая бериллию в литературе,
объясняете» наличием тонкой плеики окиси бериллия на поверхности
металла. Эта твердая окисная пленка нередко настолько прочна, что цара-
пает стекло.
Порядковый номер
Атомный пес
Плотность (опреде-
ленная рентгенов-
ским методом), г/см3
Температура плавле-
ния, "С
Температура кипения,
"С
Давление пара 1 am
0,1 am
0.01 am
0,001 am
Удельная теплоем-
кость C0 -100°),
кал/г
Скрытая теплота плав-
ления, кал/г
(жрытап теплота ис-
парения, кал/г
Коэффициент линей-
ного расширения
B0—200"), град-1
параллельно гек-
сагональной оси
перпендикуляр-
но гексагональ-
ной оси
Коэффициент тепло-
проводности при 20",
кал/см-сек-град
Электропроводность а,
%
Отражательная спо-
собность (для бело-
го цвета), %
ФИЗИЧЕСКИЕ СВОЙСТВА БЕРИЛЛИЯ
4
9,0122
1,8445
1285
2507
2100
1797
1557
0,425
250—275
5917
12-10-е
9-10-е
0,35
38,9—43,1
50—55
Твердость (по Брииел-
лю) при нагрузке
1000 кг
Скорость распростра-
нения звука, м/сек
Кристаллическая ре-
шетка при 20°
I Параметры решетки
при 20°, А
Минимальное меж-
атомное расстоя-
ние, А
Электрох им ическ ий
эквивалент, мг/к
Атомный радиус, А
Поперечное сечение
захвата тепловых
нейтронов, барн/атом
Координационное чис-
ло
Аллотропия
Магнитная восприим-
чивость при 20°,
з. м. е./г
Коэффициент Холла,
э. м. е.
Термо-э. д. с. (в паре
с платиной), же
Электродный потен-
циал, в
Таблица 4
90—120
12600
Гексагональная
плотноупако-
ванная
ао=2,2854,
со=3,5829,
св/а0= 1,5677
2,22
0,04674
1,123
0,0090±0,005-
12
Отсутствует
—1.0-10-е
0,О024±0,000|
0,16
+A,69—1,9)
По отношению н международному стандарту электропроводности образца отожженной ме-
ди, равной 100%.
58 Глава 3
Благодаря своему малому атомному весу бериллий обладает хорошей
проницаемостью для рентгеновых лучей, которая примерно в 17 раз
больше, чем у алюминия.
Бериллий (изотоп бериллий-9) имеет небольшое поперечное сечение
захвата тепловых нейтронов и является источником нейтронов при его
бомбардировке другими нейтронами, а-частицами, дейтронами и у-лучами.
Например, при бомбардировке а-частицами протекает следующая ядерная
реакция:
BeJ+HeJ -^ СУ+nJ.
Незначительная масса ядер бериллия, его малая способность к захвату
нейтронов, особенно медленных нейтронов, позволяет уменьшать скорость
нейтронов без существенных потерь энергии. Благодаря указанным свой-
ствам бериллий оказался гораздо эффективнее графита при использовании
для замедления скорости нейтронов в ядерно-энергетических установках.
Все радиоактивные изотопы бериллия являются короткоживущими,
за исключением бериллия-10, период полураспада которого составляет
2 700 000 лет. Особенно неустойчивым является изотоп бериллий-8, который
менее чем через 10~15 сек после его образования в результате ядерной реакции
распадается на две а-частицы.
Окись бериллия
Физические свойства окиси бериллия приведены в табл. 5 [33|.
Окись бериллия кристаллизуется в гексагональной системе и обладает
структурой цинковой обманки (ZnO) со спайностью по плоскости 10 10.
Кристаллы окиси бериллия имеют ионную структуру с плотиоупакованной
решеткой, состоящей из атомов кислорода н расположенных между ними
также плотноупакованных атомов бериллия.
Из табл. 5 видно, что такие выдающиеся свойства окиси бериллия, как
высокая температура плавления, высокое электрическое сопротивление
и хорошая теплопроводность в кристаллическом состоянии, позволяют ис-
пользовать ее в качестве тугоплавкого материала. Кроме того, устойчивость
и химическая инертность при высоких температурах делают окись бериллия
выдающимся тугоплавким материалом в ряде случаев, где ее применение
часто является единственным решением некоторых задач, связанных с рабо-
той при высоких температурах.
Наряду с другими уникальными свойствами окись бериллия, как и бе-
риллий, обладает малым поперечным сечением захвата тепловых нейтронов
и большой замедляющей способностью по отношению к нейтронам. В связи
с этим окись бериллия играет все возрастающую роль в области использо-
вания атомной энергии, где часто требуются высокотемпературные мате-
риалы с хорошими ядерными характеристиками*.
ХИМИЧЕСКИЕ СВОЙСТВА БЕРИЛЛИЯ
*При высоких температурах бериллий является весьма активным эле-
ментом, вследствие чего получение чистого бериллия представляет собой
технически трудную задачу. При обычных температурах бериллий совершен-
* Подробно о свойствах и применении окнеи бериллия см. в книге Р. А. Беляева
«Окись бериллия. Свойства и применение» (Атоыиздат, 1962).— Прим. ред.
Бериллий
59
Плотность, г/см3
Монокристалл
Горячепрессован-
ная
Шликерная от-
ливка после
обжига
Прессованная из
порошка после
обжига
Температура плаиле-
ния, °С
Температура кипения,
°С
Теплота ' плавления,
кал/моль
Энтропия плавления.
кал/моль-град
Теплота испарения,
кил/моль
Энтропия испарения,
кал/моль- град
Теплота возгонки в
интервале 600—
3000°, кал/моль
Теплота образования
АН" при 25°, ккал
Коэффициент тепло-
проводности горяче-
прессованной окиси
бериллия с плот-
ностью 2,87 г/см3,
кал/сп-сек-град
200°
600°
1000°
1400°
Удельная теплоем-
кость, кал/моль-град
—273°
—100°
0°
100°
400°
800'
ФИЗИЧЕСКИЕ СВОЙСТВА ОКИСИ БЕРИЛЛИЯ
Аллотропия
3,025
2,6-2,95
2,2—2,8
2,2—2,Я
2550±25
4260±160
17 000^1400
6,0±0,5
И7 000±10 500
25,8±2,3
152 000±10 000
- 149,0
0,190
0,095
0,056
0,037
0
0,3
5,5
7,7
10,5
12,3
Удельное электриче-
ское сопротиьление
спеченной окиси бе-
риллия с плотностью
2,23 г/см3,ом-см
10ПП°
1200°
1400=
1600"
1800°
2000°
Средний коэффициент
линейного расшире-
ния, град'1
25 -100'
25—300°
25- 600°
25—800°
Таблица 5
Аллотропиче-
ские преира-
шепия для
окиси берил-
лия неизвест-
ны
80 000 Он»
4 000 000
250 000
35 ОНО
6 500
1600
E,5±1)-10-в
(8,0^0,6)-10-е
(9,6±О,8)-1О-о
A0,3±0,9)-10-в
25 1000° A0,8±1)-10-в
Параметры решетки,
А
Температура, СС
"о
Со/аи
Комнатная
2,69
4,39
1,63
Показатели преломле-
ния
1025°
2,72
4,43
1,63
aD= 1,719
PD= 1,733
но устойчив против окисления на воздухе. Тщательно отполированные
поверхности чистого металла сохраняют свои блеск в течение нескольких
лет. При 700° окисление бериллия становится заметным, а при 1000° проте-
кает с очень большой скоростью. Тонкоизмсльченный бериллий медленно
60 Глава 3
взаимодействует с кислородом воздуха и сгорает с ослепительным блеском
при нагревании. При температурах выше 900° бериллий взаимодействует
с азотом, образуя нитрид бериллия Be3N2. Карбид бериллия Ве2С образует-
ся при взаимодействии бериллия с углеродом при температурах выше тем-
пературы плавления металла. Эта реакция экзотермичпа.
Бериллий легко взаимодействует с серной и соляной кислотами. Разбав-
ленная азотная кислота медленно растворяет бериллий, тогда как концен-
трированная азотная кислота на него почти ие действует. Растворы щелочей
реагируют с бериллием с выделением водорода.
Бериллий вступает в реакцию с расплавленными галогенидами щелоч-
ных металлов, восстанавливая их до металла, пока не наступает равновесие.
Бериллий не взаимодействует с расплавленными галогенидами щелочнозе-
мельных металлов и магния, но восстанавливает галогениды алюминия и тя-
желых металлов. Щелочноземельные металлы и магний можно успешно
применять для получения бериллия из его галогепидов.
По своим химическим свойствам бериллий проявляет оча1ь большое
сходство с алюминием, в связи с чем полное разделение этих элементов
является трудным.
Коррозия бериллия в воде изучена мало, хотя она имеет отношение
к процессу его производства. Химическое поведение бериллия, полученного
методом порошковой металлургии, более постоянно по сравнению с литым
металлом, по-видимому, вследствие различия величины зерен. Присутствие
в воде хлор- и сульфат-ионов, а также ионов меди и железа несколько
увеличивает скорость точечной коррозии. Заготовки из горячепрессованиого
в вакууме порошкового бериллия легко выдерживают испытания в воде
в течение S6 час при 250е. Было найдено, что некоторые из таких бериллие-
вых образцов даже более коррозионностойки в воде при 350°, чем цирконий,
тогда как другие образцы в этих же условиях полностью разрушаются.
Имеются данные, свидетельствующие о том, что коррозионная стойкость
металлического бериллия в воде при высоких температурах завнсит от содер-
жания примесей в нем, причем повышенное содержание железа оказывает
благоприятное воздействие, тогда как содержание алюминия и кремния сверх
допустимого количества является вредным.
Бериллий не взаимодействует с чистым расплааченным натрием при
500°, что важно для его применения в области ядерной энергетики. Уста-
новлено, что если расплавленный натрий содержит более 0,01% кислорода,
то при указанной температуре образуется окись бериллия.
Сведений о значительной коррозии бериллия в нагретой до высокой
температуры воде и в расплавленном натрии не имеется.
ТОКСИКОЛОГИЯ БЕРИЛЛИЯ
Токсическое действие различных элементов зависит от многих факторов,
например от типа соединения, содержащего данный элемент, количества
и концентрации элемента или соединения, времени контакта, или выдержки,
а также от того, каким образом они действуют на организм: при попадании
на кожу, в легкие при вдыхании или внутрь организма через рот.
В последние годы в медицинских исследовательских учреждениях
проведено большое количество работ по изучению влияния бериллия и его
соединений на организм человека. Хотя роль самого атома бериллия до сих
пор точно ие установлена, очевидно, что степень воздействия иа кожу
и ли слизистые оболочки значительно изменяется как в зависимости от того,
Бериллий 61
с каким элементом или элементами связаны атомы бериллия, так и от инди-
видуальных особенностей организма.
Последние исследования показали, что соединения бериллия, введен-
ные животным с пищей, не оказывают токсического действия в таких кон-
центрациях, которые для соединений многих других элементов весьма ток-
сичны. До сих гор не было отмечено случаев желудочных отравлений берил-
лием у работающих в бериллиевой промышленности, случаев заболевания
дерматитом или пневмонией людей, занятых на горных разработках берилла,
' I
*' *к
- S
Р н с. 4. Вакуумное устройство 4 * \ 1 -
для засасывания бериллневой 5 . ' ..
стружки и образующейся при "" ' ! •. , "
резании мелкой пыли в сборник <{' - ? " ¦*>
типа «Алротек» и передачи струж- -','•• ' * г
ни в аппарат для измельчения :..-."' f ~\
(«Сраш бсриллиум компанн»). v -- - . "*ii
<• : %t?J V '"
а также при механической обработке или обращении с бедными бериллиевы-
ми сплавами, например с применяемыми в настоящее время бериллисвыми
бронзами.
Однако растворимые соединения бериллия могут вызывать дерматиты,
а вдыхание туманов, пыли и дымов этих соединений или соединений, обра-
зующихся при плавке металла и его сплавов, приводит к острой пневмонии.
Восприимчивость'отдельных людей весьма различна. Некоторые люди сверх-
чувствительны к воздействию бериллия и поэтому не могут работать в берил-
лиевой промышленности. Особенно это относится к производству галоге-
нидов бериллия, которые гораздо более токсичны, чем, например, сульфат
бериллия.
Известно также, что туманы, пыль и дымы, содержащие бериллий или
его соединения, могут быть причиной хронической пневмонии, развиваю-
щейся относительно медленно в течение ряда лет. Случаи затяжной пневмо-
нии со смертельным исходом впервые наблюдались в 1943 г. в производстве
люминесцентных ламп, где применялся силикат цинка и бериллия. Этот
вид заболевания, менее известный, чем дерматиты и острая пневмония, слу-
жил предметом обширных исследований, проведенных в США многими меди-
цинскими учреждениями с целью выяснения роли бериллия и его соединений
в развитии указанного заболевания.
Для предупреждения заболеваний, вызываемых бериллием, необходима
хорошая вентиляция рабочих помещений, частое мытье рук (до плеч), лица
и шеи и принятие душа после работы. Для успешной борьбы с дерматитами
личная гигиена работающих и частая смена спецодежды перед началом каж-
дой смены имеют очень большое значение.
На предприятиях необходимо регулярно проводить медицинские осмот-
ры работающих и по крайней мере один раз в год производить рентгено-
62 Г л а в а 3
скопню грудной клетки. При появлении признаков раздражения легких
человека необходимо немедленно освобождать от работы до полного выздо-
ровления во избежание опасности заболевания острой формой пневмонии,
которая может иметь смертельный исход. Кроме того, необходимо прини-
мать меры с целью уменьшения объема туманов, пылн и дымов, содержа-
щих бериллий или его соединения. К таким мерам относятся ограждение и
вентиляция оборудования, используемого в производстве бериллия и его
соединений или при их применении, а также регулирование количества воз-
духа, выбрасываемого в окрестности предприятия, во избежание превы-
шения допустимой концентрации бериллия в окружающей атмосфере.
Многолетняя производственная практика отчетливо показывает, что
получение бериллия, его сплавов и соединений, а также обращение с ними
безопасно при условии тесного сотрудничества между инженерно-техниче-
ским персоналом, руководством предприятия и заводскими медицинскими
работниками. В этой связи интересно отметить, что затраты на установку
современного вентиляционного и пылеулавливающего оборудования необ-
ходимы не только с точки зрения техники безопасности, но и вообще выгод-
ны, так как при этом снижаются потери в процессе производства и улучшает-
ся моральное состояние работающих.
На рис. 4 показано приспособление, предназначенное для улавливания
стружки и мелкой пыли при-обработке бериллия резанием.
МЕХАНИЧЕСКИЕ СВОЙСТВА
Бериллий
Механические свойства бериллия связаны со способом его изготовления,,
однако в основном они зависят от наличия у него гексагональной плотно-
упакованной кристаллической решетки, характеризующейся высокой сте-
пенью ориентации. При комнатной температуре напряжение излома по пло-
скости базиса меньше напряжений сдвига по плоскостям призмы 10 10 [31].
Следовательно, при комнатной температуре бериллий подвержен излому
по плоскости основания, хотя он обладает значительным удлинением по
плоскостям призмы при любой степени чистоты, даже при содержании до 2%
присадок других элементов.
С другой стороны, если при комнатной температуре бериллий обладает
относительным удлинением при растяжении 0,5—3%, то при температуре
400—450° удлинение достигает 25—50%. Такое изменение пластичности
происходит вследствие перехода из хрупкого состояния в пластичное; этот
переход наблюдается в интервале температур 200—300°. При температуре
около 850е металл становится красноломким и разрушение происходит
преимущественно по границам зерен.
При обработке бериллия давлением вдоль определенных плоскостей,
например при выдавливании, значительного удлинения можно достигнуть
в направлении выдавливания даже при комнатной температуре. Соосная пла-
стичность в плоскости листа может быть достигнута и при его поперечной
прокатке. Однако если металл подвергается обработке не во всех направ-
лениях, то хотя бы в одной из плоскостей он остается хрупким при комнат-
ной температуре.
Механические свойства бериллия, горячевыдавлениого из хлопьевидно-
го (чешуйчатого) и литого металла, а также механические свойства загото-
вок, горячепрессованных в вакууме из бериллиевого порошка (QMV),
и выдавленных из них профильных изделий приведены в табл. 6 и 7.
Таблица 6
HhKOTOPblF МЕХАНИЧЕСКИЕ СВОЙСТВА ВЫДАВЛЕННОГО БЕРИЛЛИЯ
ПРИ КОМНЛГНОП ТЕМПЕРАТУРЕ В ЗАВИСИМОСТИ ОГ НАПРАВЛЕНИЯ
ВЫРЕЗКИ ОБРАЗЦА
Характеристи-
ка образца
бериллия
Литой, затем
выдавленный
Выдавленный из
хлопьевидно-
го бериллия
Состояние
После выдавли-
Отожжен при
800°
После выдавли-
вания
Отожжен при
800°
Вдоль направления
выдавливании
Поперек направле-
ния выдавливания
предел
прочности,
/2
22.9
28,0
32,6
44,6
относи-
тельвое
удлине-
ние, %
0,36
1,82
0,55
5,0
предел
прочности,
13,6
11,6
20,4
17,9
относи-
тельное
удлине-
ние, %
0,30
0,18
0,30
0,30
Таблица 7
МЕХАНИЧЕСКИЕ СВОЙСТВА БЕРИЛЛИЯ, ПОЛУЧЕННОГО
ПОРОШКОВОЙ МЕТАЛЛУРГИИ. ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ
Механические свойства
Гпрячепрес-
сованный в
вакууме из
порошка а
Горячевыдав-
ленный из
порошка""
Предел прочности при растяжении, кг/ммг
Предел текучести при растяжении (ои,2),
кг/мм2
Относительное удлинение, %
Модуль упругости, 103 кг/мм2
Предел текучести при сжатии (o0l2), кг/мм2
Модуль сжатия, [0э кг/мм2
Коэффициент Пуассона
Предел прочности при крученнн, kzjmm2
Предел текучести при кручении, кг/мм-
Модуль счвига, Ю3 кг/мм2
Угол закручивания до разрушения, град
Предел прочности (при двойном срезе), кг/мм2
Работа разрушения образцов без надреза по
Шарпн при ударном изгибе, кгм
Работа разрушения образцов при ударном рас-
тяжении, кгм
31,6
22,5
2,3
31,1
17,2
30,9
0,024
27,2
12,8
15,0
145
25,8
0,111
0,194
57,3
27,7 "
15,8
29,0
26,6
29,3
0,032
56,7
9,9
14,7
390
42,9
0,567
0,622
а Свойства не зависят от направления прессования.
б Направление испытания на растяжение совпадает с направлением выдавли-
вания; свойства в направлении, поперечном к направлению выдавливания, сходны
со свойствами горячепрессованного материала.
Таблица 8
ВЛИЯНИЕ ТЕМПЕРАТУРЫ ВЫДАВЛИВАНИЯ И ТЕРМООБРАБОТКИ
НА СВОЙСТВА БЕРИЛЛИЯ [12]
Темпера-
тура iihi-
давлива-
нии, СС
500
700
900
1060
Т2П8
Выдавленный н обработан-
ный резанием
предел проч-
висти,
кг/мм*
51,2
42,2
31,2
25,6
24,4
относитель-
ное удли-
нение, %
0,28
0,30
0,45
0,39
0,44
Выдавленный, обработанный
резанием н отожженный
при 800"
предел проч-
IIOL.ru ,
кг/мм2
36,1
33,3
31,6
36,5
35,2
относитель-
ное удли-
нение, %
3,30
2,74
2,47
3,38
3,80
Таблица 9
СВОЙСТВА КЬРИЛЛИЯ. ПОЛУЧЕННОГО ВЫДАВЛИВАНИЕМ
Темпера-
; тура ис-
пытаний,
°С
Комнат-
ная
200
400
600
8№
Состояние
Выдавленный
Отожжен прн
800°
Выдавленный
Отожжен при
800°
Выдавленный
>
»
Направление
Продольное
Поперечное
Продольное
Поперечное
Продольное
Поперечное
Продольное
Поперечное
Продольное
Поперечное
Продольное
Поперечное
Продольное
Поперечное
Хлопьевид-
ный [12]
предел
проч-
нос-
ти,
кг/мм*
32,6
20,4
44,6
17,8
-
—
—
21,4
19,5
9,5
7,8
3,4
4,1
отно-
ситель-
ное уд-
лине-
ние, %
0,55
0,30
5,0
0,3
—
—
14,8
1,9
10,6
2,5
9,1
0,3
Лнтой [12]
предел
проч-
ности ,
КР/ММ
22,9
13,6
28,0
11,6
27,9
11,6
26,5
10,0
19,4
10,1
18,1
11,2
6,5
4,8
отно-
ситель-
ное уд-
лине-
ние, %
0,36
0,30
1,82
0,18
13,2
1,1
13,4
1,4
29,0
3,0
2(),8
1,2
25,6
9,6
Порошковый
предел
проч-
ности,
кг/ммг
59,5
44,1
—
—
43,4
30,8
—
—
30,1
28,7
16,1
15,7
3,6
3,5
отно-
ситель-
ное уд-
лине-
ние, %
16,0
1,5
—
23,5
2,2
—
29,0
6,5
8,5
4,5
10,5
6,0
Таблица 10
ПОЛЗУЧЕСТЬ ГОРЯЧЕПРЕССОВАННЫХ В ВАКУУМЕ
БЕРИЛЛИЕЕЫХ БЛОКОВ (СКОРОСТЬ ПОЛЗУЧЕСТИ В ЗАВИСИМОСТИ
ОТ ВЕЛИЧИНЫ РАСТЯГИВАЮЩЕГО УСИЛИЯ)
Нагрузка, кг/мм^
Минимальная снорость полэу-
Ч1чти, %/час
При температуре 427°
5,8
7,1
8,7
10,5
12,6
0,00028
0,00056
0,0048
0,052
0,142
Бериллий
С5
Нагрузка, кг/мм*
2,9
3,5
3,7
* 1,4
1,6
1.9
2,2
0,46
0.68
0.76
0,97
При
При
Прн
Продолжение табл 10
Минимальная скорость ползу-
чести, %/час
температуре 538°
0,001
0,01
0,06
температуре 677°
0,0009
0,018
0,07
0,28
температуре 732'
0,00036
0,0072
0,051
0,3
Таблица И
СОПРОТИВЛЕНИЕ РАЗРЫВУ ГОРЯЧЕПРЕССОВА1ШЫХ
В ВАКУУМЕ БЕРИЛЛИЕВЫХ БЛОКОВ
Температура,
427
538
649
732
816
Сопротивление разрыву, кг/мм?
11) час
15,4
5,3
2,5
0,84
0,22
100 час
12,6
3,5
1,75
0,67
0,16
1000 час
9,1
3,0
1,5
0,56
2500 час
7,4
2,8
1,4
0,5
Данные табл. 7 показывают, что структурно анизотропный деформиро-
ванный металл обладает гораздо лучшими механическими свойствами в на-
правлении обработки, чем горячепрессовапиый в вакууме металл, имею-
щий изотропную структуру.
Поскольку при изменении температуры чистый бериллий не претер-
певает аллотропического превращения, единственным способом его термо-
обработки является рекристаллизация деформированного материала при
704—900°. Данные о влиянии термообработки и температуры выдавливания
на свойства литого н затем выдавленного бериллия приведены в табл. 8.
Механические свойства при повышенных температурах бериллия, горя-
чевыдавлешюго из хлопьевидного металла, а также из порошка и отливок,
приведены в табл. 9. Испытания, результаты которых приведены в этой таб-
лице, были проведены в интервале температур от комнатной до 800°. Необ-
ходимо отметить, что при 400е относительное удлинение достигает макси-
мальной величины, уменьшаясь при более высоких температурах. Наиболь-
5 Заказ .V! 23!)
66 Г л ав а 3
шей величиной прочности в поперечном направлении обладает материал,
полученный выдавливанием из хлопьевидного металла и порошка.
Данные о ползучести и сопротивлении разрыву бериллия при повышен-
ных температурах приведены в табл. 10 и 11.
Бериллиевые сплавы
При легировании бериллием некоторых тяжелых металлов, например
меди или никеля, образуются сплавы, обладающие способностью к диспер-
сионному твердению (старению). Сплавы на основе меди или никеля, в кото-
рых бериллий образует фазы, способствующие дисперсионному твердению,
характеризуются способностью растворять бериллий примерно от 0', 1%
при комнатной температуре более чем до 3% при повышенной температу-
ре. После нагревания сплава до температуры, при которой бериллий бо-
лее растворим, и последующего быстрого охлаждения такого сплава за-
калкой в воду до комнатной температуры часть бериллия, которая не рас-
творяется прн комнатной температуре, образует пересыщенный твердый
раствор. В таком состоянии сплав мягок и легко поддается обработке
при комнатной температуре. Однако после повторного нагревания до отно-
сительно низкой температуры (ниже температуры красного каления) пере-
сыщенный твердый раствор бериллия в сплаве распадается на кристаллы,
которые, вероятно, представляют собой мельчайшие частицы очень твердых
интерметаллических соединений бериллия. Эти частицы располагаются
по границам зерен сплава и, таким образом, значительно повышают его
твердость. Точно регулируя повторное нагревание, вызывающее эффект дис-
персионного твердения, можно получать сплавы с широким диапазоном
свойств — от высокопластичпых в самом мягком состоянии до сплавов
с минимальной, возможно даже нулевой, пластичностью в самом твердом
состоянии.
Свойства таких сплавов могут быть улучшены упрочнением в мягко-
отожженном состоянии холодной обработкой давлением перед их состари-
ваиием. Свойства, характерные для медноникелевобериллиевых сплавов,
указаны в табл. 12. Никель или кобальт обычно вводят в такие сплавы с це-
лью предотвращения возможности образования крупных зерен при обработке
давлением на холоду, например при прокатке и волочении.
Двойные меднобериллиевые сплавы, содержащие менее 1% бериллия,
не обладают способностью к дисперсионному твердению. Однако при введе-
нии около 1,5% никеля или кобальта можно получить сплавы, способные
к старению даже при содержании в них бериллия менее 0,2°п. Такие
сплавы с малым содержанием бериллия при их закалке на твердый раствор
и старении требуют применения температур, на 100—200° превышающих
обычно применяемые температуры. Характерные для этих сплавов свойства
приведены в табл. 13.
Меднобериллиевые сплавы с малым содержанием бериллия имеют высо-
кую электропроводность. Следует также отметить, что предел пропорцио-
нальности этих меднобер ил лиевых сплавов практически такой же, как
и у сплавов с большим содержанием бериллия.
Никелевобериллиевые сплавы обладают способностью к старению
и имеют свойства, сходные со свойствами меднобериллиевых сплавов и не-
ржавеющих сталей, за исключением высокой электропроводности, прису-
щей только бериллиевой бронзе.
Однако никелевобериллиевые сплавы, содержащие около 2% бериллия,
после отжига и холодной обработки давлением могут быть состарены, в ре-
Бериллий
67
зультате чего они приобретают высокие прочностные свойства: сопротив-
ление разрыву 182 кг/мм2, относительное удлинение 8,3% (на длине 101,6мм)
и твердость по Бринеллю, равную 480. Никелевобериллиевые сплавы нахо-
дят промышленное применение для изготовления пружин, работающих
Таблица 12
МЕХАНИЧЕСКИЕ СВОЙСТВА ЕЕРИЛЛИЕВОЙ БРОНЗЫ а [22]
Темпера-
тура за-
калки
после от-
жига, °С
800
800
800
800
Способ обработки
холодная
прок,|тка
Бюро стандар-
тов США, Us 4
Бюро стандар-
тов США
Механические свойства
предел
прonop-
темпе "РОДОЛ" цичииль-
1 спи it . житель- л
ратура, „cclbi hol-ти °
°С | час к кг/мм2
300
300
5,6
32,2
27,3
38,5
предел
прочнос-
ти при
растя-
жении.
кг/мм*
49
123
83
135
пгноси-
тельнос
удлине-
ние на
длине
50 мм,
%
проьод-
ность и,
ТП1-Р-
ДОСТЬ ПО
Бринел-
лю
C001) кг,
10 мм)
45,0
6,3
4,3
2,0
17
22
16
21
ПО
340
220
365
я 2—2,25% Be, 0,25—0,50% N1, остальное Си (определено в листе толщиной 1.27 мм).
б По результатам точных определений.
в По отношению к международному стандарту—электропроводности образца отожженной
меди, paDHcfl 100%.
Таблица 13
МЕХАНИЧЕСКИЕ СВОЙСТВА БЕРНЛЛИЕВОЙ БРОНЗЫ С МАЛЫМ СОДЕРЖАНИЕМ
БЕРИЛЛИЯ а [22]
от»
темпе-
ратура
закалки,
°С
900
900
900
900
Способ обработки
иг
продол-
житель-
ность,
час
1
1
1
1
старение
темпе-
ратура,
475
425
продол-
житель-
ность,
час
2
2
Свойства
предел
пропор-
циональ-
ности ^,
кг/мм2
3,3
39,2
16,7
38,5
предел те-
кучести,
(Oo.sO,
12,0
46,2
47,0
60,6
предел
прочно-
сти при
растя-
жении,
кг/мм*
27,4
67,8
50,6
89,3
относи-
тельное
удлинение
im длине
250 мм,
24,4
5,7
1.0
8,3
электро-
гровод-
IIOI Ь В,
46,1
65.2
38,9
59,3
твердость
по Бри-
неллю,
C00U кг,
10 мм)
55
210
—
220
а 0,25 % Be, 1,33% N1, 0,08% Fe, остальное Си (содержание элементов определяли п пругка
диаметром 2,03 мм).
По результатам точных определений.
н По отношению к международному стандарту—электропроводности образца отежженнов
меди, равной 100%.
в условиях высоких температур, и ряда специальных деталей в приборах.
Однако объем производства никелевобериллиевых сплавов невелик.
Двойные железобериллиевые сплавы обладают слишком крупнозер-
нистой структурой, препятствующей их промышленному применению.
5*
68 Г л ив а 3
Хромоникелевые стали, легированные бериллием, имеют высокую прочность
и твердость при повышенных температурах. Вполне вероятно, что бериллий
можно применять в качестве модификатора сталей в тех случаях, когда
с помощью углерода не удастся достичь желаемых свойств.
Магний, температура кипения которого A120°) ниже температуры плав-
ления бериллия A284е), образует с бериллием сплавы, содержащие мак-
симально 0,5—1% магния. Такие сплавы не нашли практического примене-
ния и свойства их не определены. Однако при введении в магний или маг-
ниевые сплавы менее 0,005% бериллия значительно уменьшается воспламе-
няемость и затрудняется их окисление при температуре плавления. Присад-
ка небольшого количества бериллия приводит к укрупнению зерна в маг-
ниевых сплавах, поэтому в настоящее время бериллием легируют только те
сплавы, для которых укрупнение зерна не имеет практического значения.
Алюминий сплавляется с бериллием в любом соотношении, однако рас-
творимость алюминия в твердом бериллин и бериллия в твердом алюминии
очень мала. Эвтектика содержит лишь незначительные количества бериллия.
Кристаллизация алюминиевобериллиевых сплавов происходит в очень
широком интервале температур — от температуры плавления бериллия
A284°) до температуры плавления эвтектики F44"). Вследствие значительной
ликвации получение крупных здоровых отливок сопряжено с большими
трудностями. Хотя полученные в лабораторных условиях алюминиевобе-
риллиевыс сплавы обладают хорошими свойствами, особенно при повышен-
ных температурах, их промышленное применение ограничено трудностями,
связанными со значительной ликвацией.
ПРОИЗВОДСТВО БЕРИЛЛИЯ И ЕГО СПЛАВОВ
Бериллий
Способы производства бериллия отливкой в вакууме заготовок с после-
дующей их горячей обработкой давлением в защитных стальных оболочках
подробно рассмотрены в статьях, опубликованных Кауфманом, Гордоном
и Лилли 111, 121. Слитки диаметром до 203мм выплавлялись в индукцион-
ных печах в тиглях из окиси бериллия в вакууме 100—500 мк. Металл отли-
вали через донное отверстие в тигле, в процессе плавки закрытое стержнем
из окиси бериллия. Отливку производили в графитовую изложницу с тепло-
изолированной верхней частью. Большое значение имеет скорость кристал-
лизации в изложнице, так как слишком быстрое охлая-депие приводит к рас-
трескиванию отливки, а слишком медленное - к получению крупнозерни-
стой структуры и частичному взаимодействию бериллия с графитовой излож-
ницей. Ковать, прокатывать и выдавливать литой бериллий можно в защит-
ной оболочке, например из стали SAE 1020, в интервале температур 317 -
ЮЭЗ3. Стержни, прутки, пластины и трубы могут быть изготовлены выдав-
ливанием. Помещенную в оболочку заготовку выдавливают при 816 1093"
через фильеру, имеющую коническую или колоколовидную форму канала.
Головной конец выдавливаемой заготовки имеет форму усеченного конуса,
на который надевают конический наконечник, из мягкой стали [12]. Из
хлопьевидного и порошкового бериллия также могут быть изготовлены
бруски, пластины, прутки и трубы; для этого его прессуют в стальных
пресс-формах и затем выдавливают так же, как и литой металл.
Однако, как правило, бериллий не получают литьем, поскольку такая
отливка слишком крупнозерниста, что является причиной ее хрупкости
Бериллий 69
ii малой прочности. В связи с этим бериллий получают обычно методами
порошковой металлургии. Металл сначала отливают в вакууме с целью полу-
чения чистых слитков, которые затем превращают резанием в стружку
(см. рис. 5). Стружку в атмосфере инертного газа измельчают в порошок,
из которого изготовляют компактные мелкозернистые изделия одним из ука-
занных ниже способов порошковой металлургии 16, 23, 24J: 1) горячим прес-
сованием в вакууме; 2) горячим прессованием на воздухе или в атмосфере
i I
Рис. 5. Многорезцовый
токарный станок для полу- НМШь.' * •"¦ l ^ ^$
чения стружки из отлитого
в вакууме бериллиевого
слитка («Браш бериллиум
компании).
инертного газа; 3) спеканием в вакууме (без уплотнения в процессе спека-
ния); 4) холодным и (или) теплым прессованием с последующими спеканием
и калибровкой; 5) холодным и (или) теплым прессованием с последующим
горячим выдавливанием или горячим прессованием.
Из всех перечисленных способов в бериллиевон промышленности широ-
ко применяется только разработанное Доддсом 161 горячее прессование
в вакууме. На практике этот способ осуществляют следующим образом.
Бериллиевый порошок загружают в стальные или графитовые пресс-формы
и затем прессуют при остаточном давлении около 50 мк. под давлением
3,5—17,5 кг/см2 при температуре 1052—1093е почти до теоретической
плотности A,8445).
Установка для получения бериллиевых блоков диаметром до 1650 мм
горячим прессованием в вакууме показана на рис. 6.
Прочность полученного таким способом металла примерно вдвое превы-
шает прочность бериллиевых изделий, изготовленных из литой заготовки.
Кроме того, в противоположность литому металлу, с трудом поддающемуся
обработке резанием, полученный методом порошковой металлургии мелко-
зернистый бериллий легко поддается механической обработке с точными
допусками.
Горячим прессованием в вакууме можно изготовлять блоки с большой
плотностью и весом более 900 кг. Горячепрессованные изделия обычно содер-
жат 0,6—2% окиси бериллия в зависимости от величины частиц и условий
окисления исходного порошка, а также от количества окиси, образую-
щейся на поверхности стружки при предварительной обработке реза-
нием.
Окись бериллия способствует сохранению мелких зерен при повышен-
ных температурах; окисная пленка является как бы барьером на границах
70
Глав
верен. В результате неупорядоченного смешения и уплотнения порошка,
загружаемого в пресс-форму перед спеканием, а также ограниченного роста
зерен в присутствии окиси бериллия полученные спеченные прессовки обла-
дают изотропной структурой и имеют пределы прочности вплоть до 35 кг/ммй
при относительном удлинении до 3%.
Бериллий можно подвергать обработке резанием, прокатке, прессова-
нию, ковке, пайке твердым и мягким припоем и чистовой обработке поверх-
ности электролитическим осаждением или химическим путем.
В качестве примера на рис. 7 показана операция обработки бериллия
резанием.
i .:.-?¦ '
Р и с. 6. Установка с печью для горячего
прессования в вакууме из порошка QMV бе-
риллиевых блоков диаметром 1650 мм («Браш
бериллиум компани»).
QMV — заводская торговая марка бериллиевого
порошка фирмы «Ьраш бериллиум компгнн>.
Рис. 7. Фрезерование
крупного бериллиевого бло-
ка («Браш бериллиум ком-
пани»).
При температурах выше 455° бериллий обладает способностью к пласти-
ческой деформации. Поскольку при температурах 749—760° бериллий ре-
кристаллизуется, область температур 454—760° считается областью теплой
обработки давлением, а область температур выше 760° — областью горячей
обработки. При горячей обработке обычно нежелательно превышать темпе-
ратуру 843°, хотя так называемое «горячее» прессование производится при
900—1150°. При «горячем» прессовании бериллий необходимо защищать
стальной оболочкой для предотвращения окисления, а также задирания филь-
ер. Прокатку листового бериллия осуществляют в интервале температур
455- 843°. Спеченные бериллиевые блоки помещают в толстостенные сталь-
ные оболочки и прокатывают их в листы толщиной примерно 3,2 мм. Эти
бериллиевые листы затем прокатывают до толщины в несколько сотых
долей миллиметра.
Поскольку бериллий очень чувствителен к надрезу, нельзя допускать
образования царапин на его поверхности. Следует также избегать перегрева
при отжиге, особенно уже обработанного давлением металла, чтобы предот-
вратить сильный рост зерен, который может происходить при разрушении
окисной пленки на границах зерен.
Бериллий 7/
Бериллиепые броизы
Бериллиевые бронзы были подвергнуты достаточно широкому изучению
[21]. Состав промышленных сортов бериллиевой бронзы и виды изготовляе-
мых из них изделий приведены в табл. 14.
Бериллиевые бронзы легко могут быть выплавлены в печи любого про-
мышленного типа. Благодаря хорошей жидкотекучести в расплавленном
состоянии бериллиевой бронзой можно заполнять сложные формы при отлив-
ке в землю, в кокиль и под давлением. Разливку высокопрочных сортов
бронзы производят в интервале температур 1010—1070°, а разливку сортов
сплавов с высокой электропроводностью — при 1177—1232°. Чтобы избе-
жать образования газовых пузырей или окиси, необходимо работать при воз-
можно более низкой температуре, сохраняя непрерывность льющейся струи.
Ковкие сплавы поддаются как холодной, так и горячей обработке дав-
лением. Горячая обработка давлением высокопрочных сплавов производится
в интервале температур 788—802°, а сплавов с высокой электропроводностью
— в интервале температур 900—927°. Как и другие сплавы на основе
меди, бериллиевую бронзу можно прокатывать на холоду, хотя она обладает
более высокой прочностью по сравнению с большинством из них. Поскольку
бериллиевая бронза может упрочняться в результате старения, ее холодная
обработка не преследует цели повышения твердости, как у других сплавов
на основе меди, что позволяет получать одинаковую величину зерен во всем
объеме сплава. Несмотря на то что бериллиевые бронзы с трудом поддаются
резанию, их можно обрабатывать этим способом, подобно другим медным
сплавам.
Свойства бериллиевой бронзы зависят от условий холодной обработки
давлением и термообработки, как это показывают приведенные в табл. 15
данные, характеризующие высокопрочный материал 130]. Закалку высоко-
прочных бериллиевых бронз на твердый раствор проводят при 788° с после-
дующим состариванием в интервале температур 316—343°; бронзы с высокой
электропроводностью закаливают при 927°, а состаривают в интервале
температур 454—482°.
Бериллиевая бронза поддается электросварке при использовании
металлических и угольных электродов, дуговой сварке в атмосфере инерт-
ного газа и шовной сварке методом сопротивления, а также пайке серебром
и мягкими припоями. Однако газовая сварка и пайка твердыми припоями
(бронзой) не дают удовлетворительных результатов. Поскольку температу-
ры, при которых производят все виды сращивания бериллиевой бронзы,
за исключением пайки мягкими припоями, превышают температуры термо-
обработки, после термообработки сварку производить нельзя.
Чтобы избежать образования окалины при сварке, пайке или термооб-
работке, эти операции необходимо производить в атмосфере разложенного
аммиака*, светильного газа или водорода. Образовавшуюся окалину можно
удалить травлением в 20—30?о-ной серной кислоте при 71—82" с последую-
щим погружением в 30%-ный раствор азотной кислоты.
области; применения
Бериллий
Самое давнее применение бериллия связано с его хорошей проницае-
мостью для рентгеновых лучей. Бериллиевые окна в рентгеновских трубках
* Так называемого формировочного газа — смеси трех объемов водорода с одним
объемом азота.— Прим. перев.
СОРТАМЕНТ БЕРИЛЛИЕВОП БРОНЗЫ а
Таблица 14
Состав бронзы и вид изделия
Be
Со
N1
Ag
Си
Холоднокатаная лента
Холоднокатаная плющенка
Квадратные или прямоугольные бруски
Холоднотянутые прутки (круглые,
квадратные, шестигранные)
Проволока
Горячекатаные бруски (круглые,
квадратные, шестигранные)
Обточенные пруткн
Сутунки
Поковки
Сварные трубы
Цельнотянутые трубы
Отливки
Отливки в землю
Отливки под давлением
Отливки в пластификатные формы
Отливки в кокиль
Кс
вкие сплавы (состав,
высокопрочные
1,80— 1,50—
2,05 1,80
0,25— 0,25—
0,35
_
—
0,35
-
—
Осталь- Осталь-
ное ное
4- 4-
+ —
4-
4-
4-
4-
4-
4-
+
+
+
—
—
4-
—
-
_ —
— —
—
—
-
—
1.80—
2,05
—
0,35
.—
Осталь-
ное
+
+
4-
+¦
4-
+
+
4-
4-
—
—
—
с пысокой электропро-
водностью
0,45—
0,60
2,35—
2,50
_
—
Осталь-
ное
+
г
+
-1-
—
—
0,25—
0,50
1,40—
1,70
090-1,10
Осталь-
ное
+
—
-
—
",00—
2,25
0,35—
0,50
—
Осталь-
ное
—
—
-
—
—
—
-I-
+
Литые сплавы (состав, %)
высокопрочные
2,60—
2,85
0,35—
0,65
_
—
Осталь-
ное
—
—
4-
+
+
4-
2,50—
2,60
1,10
—
Осталь-
ное
—
—
-
—
—
—
—
4-
+
4-
л.
с высокой электро-
проводностью
0,55—
0,70
2,35—
2,60
—
Осталь-
ное
—
—
—
—
4-
$-
0,35-
0,50
—
1,50
—
Осталь-
ное
—
—
—
—
—
-г-
4-
а Выпускаемые виды изделий отмечены знаком +.
Бериллий
73
I. Состав
Таблица IS
ХАРАКТЕРИСТИКА КОВКИХ СЕРИЛ ЧИПВЫХ БРОНЗ [3]
Be
Ni или Со
Ni+Co+Fe
Cu+Be+присадки
не менее
не более
не менее
2. Отпуск полос бериллиевой бронзы
1,80- 2,05»0
0,20%
0,80%
99,50Чо
Характер обработки
Холоднокатаные и закаленные на
твердый раствор
Холоднокатаные, закаленные на
твердый раствор и затем прока
танные с наклепом 25%
Холоднокатаные, закаленные на
твердый раствор и затем прока-
танные с наклепом 50%
Холоднокатаные, закаленные на
твердый раствор и затем про-
катанные с полным наклепом
Минимальный предел
прочности, кг/мм%
перед тер-
мообработ-
кой
42
53
60
70
после тер-
мпобпабот-
1126
119В
1260
130"
а Опьпные образцы выдерживались при 316° и течение 2—3 час.
0 Для полос специальных сортов сплава выше на 7 кг/мм* [13].
в Для полос специальных сортов сплава выше на 3,5 кг/лш2 [13].
в 17 раз более проницаемы для рентгеновых лучей, чем алюминиевые,
особенно для длинноволнового более мягкого излучения. Кроме того,
бериллиевые окна являются фильтром для электронов. Применение берил-
лия в рентгеновских трубках позволяет пользоваться более мягким излуче-
нием повышенной интенсивности для рентгенотерапии и рептгеноструктур-
ных исследований.
Позднее для ядерной энергетики потребовались детали из чистого берил-
лия для изготовлении замедлителей и отражателей для ядерных реакторов
большой мощности и экспериментальных ядерных реакторов. Такие берил-
лиевые детали применяются в реакторах для испытания материалов.и в про-
мышленных экспериментальных реакторах КЛЭ США, а также в ядерном
реакторе на подводной лодке «Морской волк». Недавно в Европе были по-
строены ядерные реакторы с бериллиевыми отражателями. В настоящее
время бериллию придается также большое значение как материалу для
изготовления оболочек топливных элементов, особенно в случае применения
в качестве топлива природного или обогащенного урана. Кроме того,
бериллий применяется как источник нейтронов, образующихся при его
облучении излучением, исходящим от радия, дейтронами в циклотроне или
нейтронами, получаемыми в ядерных реакторах.
74
Глава 3
На рис. 8 показана обработанная резанием деталь ядерного реактора.
В последнее время уникальные физические, химические и механиче-
ские свойства бериллия вызвали огромный интерес к нему как к конструк-
ционному и термостойкому материалу. Важнейшими из этих свойств берил-
лия являются его малая плотность, высокая температура плавления, очень
большой модуль упругости, большая теплоемкость, стойкость против окис-
ления, хорошие механические свойства при повышенных температурах,
а также легкость обработки резанием металла, полученного методом порош-
ковой металлургии, что позволяет получать изделия очень точных размеров.
Р и с. 8. Шестигранная де-
таль ядерною реактора,
полученная обработкой ре-
занием из горячепрессован-
ного бериллия («Браш бе-
риллиум компании).
Рис. 9. Сферическая
деталь гироскопа, полу-
ченная обработкой реза-
нием из горячепрессован-
ного бериллия («Браш
бериллиум компании).
Совокупность указанных свойств обусловила современное интенсивное раз-
витие производства катаных, кованых, прессованных и обработанных реза-
нием деталей для ракет, самолетов и космических кораблей. Эти же свойства
делают бериллий превосходным материалом для гироскопов, акселеромет-
ров, деталей вычислительных машин, приборов на станциях наведения
и ряда других деталей, для которых необходимо сочетание легкости, проч-
ности и постоянства размеров. На рис. 9 показана сферическая бериллиевая
деталь гироскопа.
Окись бериллия
Небольшое количество окиси бериллия используется в светотехниче-
ской промышленности. Окись бериллия входит в состав смеси окислов, при-
меняемой для изготовления колпачков газокалильных (ауэровских) ламп.
Окись бериллия применяется для изготовления силиката бериллия и цинка,
используемого в качестве фосфора в некоторых типах люминесцентных ламп
и тридающего свечению оттенок цвета слоновой кости.
Благодаря высокой температуре плавления, химической инертности,
прочности, теплостойкости и хорошей теплопроводности, в 10 раз пре-
в'ышающей теплопроводность окиси алюминия, плавленая или обожженная
при высокой температуре окись бериллия применяется для изготовления
огнеупорных тиглей. В таких тиглях можно вести плавку при температуре
около 2000°, особенно в тех случаях, когда допустимо лишь минимальное
Бериллий 75
взаимодействие с материалом тигля с целью сохранения чистоты расплава.
Поскольку окись бериллия сохраняет хорошие электроизоляционные свой-
ства и при высокой температуре, изготовленные из нее тигли применяются
для плавки тугоплавких металлов в печах с индукционным нагревом.
Из всех тугоплавких окисей окись бериллия высокой плотности обла-
дает наилучшим сочетанием тепловых, электрических и ядерных свойств.
Поскольку окись бериллия имеет почти такие же ядерные свойства, как
и бериллий, она используется для тех же целей. Однако окись бериллия
можно применять при более высоких температурах, чем максимально допу-
стимые температуры для металла, что представляет особый интерес для ядер-
ной техники.
Окись бериллия находит применение также в электронике, например
как хороший диэлектрик, и для изготовления окон волноводов, а также как
компонент высокопрочного стекловолокна.
Бериллиеные бронзы
Из бериллиевых бронз изготовляют ленты, прутки, проволоку, листы
и трубы. Мельницы, предназначенные для специального применения, обыч-
но футеруют бериллиевой бронзой в полностью отожженном состоянии либо
холоднокатаной до различной степени обжатия или в состоянии холодного
наклепа. Ковке подвергают заготовки, отлитые в песок, под давлением,
в кокиль, в пластифицированные изложницы, а также методами непрерывно-
го и центробежного литья.
Бериллиевые бронзы могут быть подразделены на высокопрочные и с
высокой электропроводностью. Высокопрочные сорта бронзы, содержащие
¦более 1,5% бериллия, обладают максимальными прочностью и твердостью,
тогда как сплавы, содержащие менее 0,7596 бериллия, отличаются выда-
ющимися электропроводностью и теплопроводностью.
Некоторые виды изделий из высокопрочных и очень твердых сортов
Сериллиевой бронзы перечислены ниже:
Пружины Безыскровый инструмент
Кузнечные мехи Части электронных ламп
Электрические контакты Сепараторы подшипников
Диафрагмы Электроды для сварки методом сопротивления
Подшипники (RWMA, класс 4)
Кулачки Оправкн для стыковой сварки
Детали авиационных двигателей Детали шарнирных соединений
Снарядные гильзы Пружинящие шайбы и прокладки
Пресс-формы для пластмассовых из- Прецизионные отливки
делин Валки
Вкладыши Детали орудийной арматуры
Гребные винты
Детали насосов
Шестерни
О широком применении пружин из бериллиевой бронзы свидетельствуют
данные, приведенные в табл. 16, в которой перечислены некоторые виды
военного снаряжения и других изделий.
Бериллиевые бронзы, обладающие высокой электропроводностью,
содержат 0,25—0,7% бериллия и 1,5—2,5% кобальта или никеля, вводимых
для предотвращения роста зерна в сплавах и стабилизации полученной
76 Г л а в а 3
Табшца 16
ПРИМЕНЕНИЕ ПРУЖИН ИЗ ЕЕРИЛЛИЕВОП БРОНЗЫ
В БОСНПО-ТПХПИЧССКИХ II ДРУГИХ УСТРОЙСТВАХ [2]
Электрические соединения в авиационных двигателях
Жиклеры авиационных двигателей
Тахометры авиационных двигателей
Зажимы кристаллодержателей радиоустановок в самолетах
Пружины опорных подшипников гироскопов в автопилотах
Пружины щеток авиационных электрогенераторов
Контактные пружины реле в самолетах
Немагнитные пружины для радиопередатчиков
Электрические приборы на подвижных системах
Пружины щеток электродвигателей самолетов
Контактные ножи пружинных радиопереключатслсй
Пружинные контакты для панелей радиоламп
Электрические соединения радиоустановок в самолетах
Рабочие пружины сбрасывающих устройств для авиабомб малого калибра
Контактные пружины автомагического телеграфного аппарата в самолетах
Пружины щеток для двигателей танковых башен
Соленоиды для чувствительных реле
Контак1ные пружины дли аэронавигационных маяков
Контактные пружины для автоматических счетных устройств
Нажимные пружины в полупеременных конденсаторах
Детали форсунок для дизельного топлива
Карбюраторные пружины для авиационных двигателей
Армейские телеграфные аппараты
Манометры в системе смазки авиационных двигателей
Хомутики для креплении головок радиоприемных станций
Пружины щеток электродвигателей вентиляторов
Днафрагменпые пружины для авиационных карбюраторов
Регулирующие пружины для кислородных редукторов
Пружины прерывателей приборов зажигания в авиационных двигателях
Обмотки электромагнитов системы управления в авиационных приборах
Синхронизаторы пулеметов для самолетов
Пружины ручных гранат
Контактные ножи для реле радиопередатчиков
Контактные ножи для армейских электрогенераторов
Рабочие пружины огнетушителей
Подшипниковые уплотнения для авиационных вспомогательных силовых
установок
Приборы для автоматического управления прожекторами
Ударные пружины бойков пулеметов
Автоматические телефонные передатчики
Диафрагмы радиопередатчиков
структуры. В специальные сорта бронз иногда вводят добавки серебра или
хрома или обоих этих элементов. Некоторые виды изделий, изготовляемых
из сортов берилл иевой бронзы с высокой электропроводностью, перечис-
лены ниже:
Электроды и оправки для сварки методом сопротивления (RWMA, класс 3)
Оправки и электроды для точечной, шовной, стыковой и рельефной сварки
Выключатели
Бериллий 77
Прерыватели тока
Распределительные устройства
Контактные губки стыковой машины
Зажимные губки при сварке методом сопротивления
Электрододержатели
Тормоза и тормозные барабаны судовых дизелей
Пинцеты рубильников
Скользящие контакты
Контакты электрических автоматических устройств
Наконечники токоподводов
Применение бериллиевой бронзы для изготовления перечисленных
в табл. 16 изделий обусловлено наличием у нее ряда уникальных свойств;
к ним относятся:
1. Превосходная способность к обработке давлением до термообработки
или дисперсионного твердения.
2. Возможность значительного улучшения физических свойств после
обычной термообработки.
3. Высокие электропроводность и теплопроводность.
4. Отличное сопротивление усталости и ударным нагрузкам.
5. Стойкость против коррозии, сравнимая с коррозионной стойкостью
чистой меди.
6. Устойчивость под нагрузкой и отсутствие упругого последействия.
7. Легкость обработки резанием в отожженном или полутвердом со-
стоянии.
8. Возможность широкого изменения необходимых свойств путем изме-
нения содержания бериллия или условий термообработки.
9. Очень хорошие литейные свойства.
10. Ненамагпичиваемость, отсутствие искрения при ударах и другие
специфические свойства.
11. Жаростойкость.
Никелевобериллиевые сплавы
Эти сплавы, обладающие способностью к старению, привлекают внима-
ние своей очень высокой прочностью и твердостью, хотя в настоящее время
они по различным причинам не нашли достаточно широкого приме
нения.
По своей плотности и стойкости против коррозии никелевобериллиевые
сплавы очень сходны с нержавеющими сталями, а по своей прочности, твер-
дости и модулю упругости сравнимы с высокопрочными легированными ста-
лями. Литейные свойства, а также способность никслевобериллиевых спла-
вов к обработке давлением в незакаленном или отожженном состоянии
с последующим старением превосходят соответствующие свойства многих
из указанных сталей.
Пикелевобериллиевые сплавы находят некоторое применение для изго-
товления таких изделий, как прецизионные пружины, иглы для подкожного
впрыскивания и хирургические инструменты. Отливки этих сплавов при-
меняются для изготовления матриц алмазных перок, штамповых форм для
горячего прессования пластмассоных изделий и для производства множества
других прецизионных профильных отливок, например для топливных
насосов, устанавливаемых на самолетах, ответственных деталей вычисли-
тельных машин и т. п.
78
Глава 3
Железобериллиевые сплавы
Подобно никелевобериллиевым сплавам, сплавы бериллия с железом пред-
ставляют значительный интерес, однако они не нашли достаточно широкого
промышленного применения. Кроме того, двойные железобериллиевые спла-
вы обладают слишком крупнозернистой структурой. Добавка никеля при-
водит к измельчению зерна и значительно улучшает качество сплава. Сплав,
содержащий 1% бериллия и 696 никеля, после его упрочнения закалкой и со-
стариванием может достигать твердости по Бринеллю, равной 600. Стали,
содержащие 1% бериллия, 12% хрома и 11% никеля, обладают высокими
прочностью и твердостью при повышенных температурах. О применении
таких сплавов в Германии для изготовления пружин, сохраняющих упругие
свойства при температуре красного каления, сообщалось еще в 1931 г.
Примерный состав некоторых сплавов этой группы приведен в табл. 17.
Таблица 11
ПРИМЕРНЫЙ СОСТАВ DFPIUUlHEBblX'СПЛАВОВ
Название сплава
Бериллиевый «ин-
вар»
Зериллиеьый
аэлннвар» (сни-
варокс»)
Бериллневый «кон-
трацид»
«Тикониум»
«Элджилоб*
Состав, %
Be
1,0
0,5
0,6
1,5
0,04
Ni
38
зп
СО
36
15
Сг
—
15
29,5
20
1
Мо
—
7
6
7
W
_
8
—
—
—
Со
—
—
27
40
Мп
_
—
-
2
Fe
Осталь-
ное
То же
» »
» »
Бериллиевый «элинвар» («ниварокс») широко применяют в Швейцарии
в часовом производстве для изготовления пружин. «Элинвар», предложен-
ный специально для изготовления спиральных часовых пружин, характе-
ризуется отсутствием расширения при изменении температуры. Добавка
бериллия способствует сохранению компенсирующих термоупругих свойств
таких сплавов и в то же время обеспечивает возможность их дисперсионного
твердения, придающего пружинам твердость и упругость, равную твердости
и упругости пружин, изготовленных из углеродистой стали. Кроме того,
пружины из бериллиевого «элинвара» немагнитны.
Бериллиевый «контрацид» впервые был использован в Европе для изго-
товления хирургических инструментов, пружин и других аналогичных
изделий, где требовалось сочетание высокой прочности с превосходной
стойкостью против коррозии.
«Тиконнум», в котором превосходные литейные свойства и коррозионная
стойкость сочетаются с высокой прочностью, в литом состоянии применяется
в зубном протезировании. Этот сплав производит в США фирма «Консоли-
дейтид кар хитипг» (Олбэни, штат Нью-Йорк).
«Элджилой», выпускаемый фирмой «Элджин уотч», обладает, как было
сообщено, превосходной коррозионной стойкостью и исключительными физи-
ческими свойствами, позволяющими использовать его для изготовления часо-
вых пружин, игл для подкожного впрыскивания и других аналогичных изде-
лий.
Бериллий 7У
Прочие бериллиевые сплавы
В настоящее время исследован новый бериллиевый сплав на основе
цинка, разработанный исследовательской лабораторией фирмы «Дженерал
электрик», известный под названием «Zncube» (Zn, Cu, Be). Этот сплав содер-
жит 0,1% бериллия, 2—2,5% меди, остальное цинк.
Введение небольших добавок @,1—0,5%) бериллия к алюминию нашло
значительное применение в литых алюминиевых сплавах. Бериллий улучша-
ет жидкотекучесть этих сплавов и способствует измельчению зерна.
ПЕРСПЕКТИВЫ РАЗВИТИЯ
БЕРИЛЛИЕВОЙ ПРОМЫШЛЕННОСТИ
Заглядывая в будущее, можно уверенно сказать, что объем бериллиевой
промышленности будет возрастать до пределов, ограничиваемых лишь нали-
чием запасов руды. За последние два года спрос со стороны промышленности
на берилловую руду (штуфный берилл ручной рудоразборки) обеспечивается
с избытком. Цены на окись бериллия в 1959 г. по сравнению с 1955 г. сни-
зились примерно в 1,5 раза.
Горным бюро США был разработан способ обогащения бедных берилло-
вых руд. Работы в этой области интенсивно развивались и частной промыш-
ленностью. Эти способы еще не получили экономической оценки при их про-
мышленном применении. Однако имеется обнадеживающая перспектива, что
в случае необходимости снабжение промышленности бериллом, полученным
при ручной рудоразборке, может быть увеличено за счет концентратов,
получаемых обогащением бедных берилловых или других бериллийсодержа-
щих руд.
За последнее время возможность открытия бериллийсодержаших мине-
ралов значительно возросла благодаря применению прибора, с помощью
которого присутствие бериллия обнаруживается при облучении образца
руды ^'"Излучением. Этот прибор определяет интенсивность нейтронной
эмиссии (см. главу «Физические свойства»), возникающей при наличии
бериллия в руде.
Поскольку в настоящее время чистый бериллий применяется не только
в ядерной энергетике, но также как конструкционный материал в раксто-
н самолетостроении, вполне вероятно, что в недалеком будущем применение
чистого бериллия для этих целей будет превосходить его применение в про-
изводстве бериллиевых бронз и других бериллиевых сплавов.
ЛИТЕРАТУРА
1. A d am о 1 i С, пат. США 2193363 и 2193364.
2. С а г s о n R. W., Vice President, Instrument Specialties Co., Little Falls, New Jer-
sey, July 8, 1942.
3. С 1 a r k e F. W., Washington H. S., U. S. Geol. Survey, Profess. Paper
127, 1924.
4 Cooper U.S., пат. США 1775589, September 9, 1930.
5. С о p e a u x H., С R., 168, 610 A919).
6 D о d d s H. W., пат. США 2818339, December 31, 1957.
7. Donahue W. В., пат. США 2072067.
Я. E m e 1 e u s H. J., Anderson J. S., Modern Aspects of Inorganic Chemi-
stry, D. Van Nostrand Co., Inc., New York, 1939, p. 503.
80 Глава 3
9. G a h a g a n A. J., пат. США 2193482, March 12, 1940.
10. Н a u s п е г Н. Н.. Pinto N. P.. Stuel, 127, 93 (December II, 1950).
11. К a u f m a n n A. R., G о r d о n E., Metal Progress. 387 (September 1947).
12. Kaufmann A. R., Gordon P., Lillie D. \V., Trans. Am. Soc. Me-
tals, 42, 785 A950).
13. К a wee к i H. S., пат. США 2312297. February 23, 1943.
14. Kjellgren B. R. F., пат. США 2381291, August 7, 1945.
15. "К j e 1 lg r en B. R. F., Sawyer С П., пят. США 2176906, October 24,
1939.
16. К. г о 1 1 W. J., пат. США 1359813 и 1740857.
17. L e b е я и P.. Ann. chim. et phys. 7, 16, 457—503 A899).
18. L о s а п о L., Alluminio (Milan), 8, 67—75 A939).
19. M о г а п a S. J., пат. США 2843544, July 15, 1958.
20. О e s t e r h e 1 d G.. Z. anorg. allgem. Chem., 97, 6 A916).
21. Richards .1. Т., in du Mond Т. С, Ed., Engineering Materials Manual, Rein-
hold Publishing Corp., New York, 1951, p. 173.
22. S a w у е г С. В.. Metals and Alloys, 14, 37—39 A941).
23. S a w у е г С. -В., Dodds H. \V., пат. США 2725288, November 29, 1955.
21. Sawyer С. В., Dodds H. W, пат. США 2791241, June 1, 1957.
25. Sawyer С. В.. Kjellgren В. R. F., пат. США 2018473, October 22,
1935.
26. Sawyer С. В., Kjellfiren В. R. F., пат. США 20214, December 22.
I9.J6.
27. Sawyer С. В., Kjellgren В. R. F., Metals and Alloys, II, 163—147
A940).
28. Sawyer С. П., Kjellgren В. R. F.. пат. США 2188904, February 6,
1940; пат. США 2311257, February 16, 1943.
29. S t а п 1 e у W. A., Product Eng., 21, 88 (February 1950).
30. Standard Specifications for Beryllium-Copper Alloy Plate, Sheet and Strip, ASTM
B-194-55, 1955, p. 330.
31. T u e г, К a u f m a n n, The Metal Beryllium, The American Society for Metals,
Cleveland, Ohio, 1955, Chap. VII (B).
32. L d у М. С, Shaw IT. L., Boulger F. W., Nucleonics, II, № 5, 52—59
A953).
33. Материалы Комиссии по атомне й энергии США, Ядерные реакторы. III. Материалы
для ядерных реакторов, ИЛ, Москва, 1956.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
1. Kjellgren В. R. F., Beryllium and Beryllium Alloys, in Kirk-Othmer,
Encyclopedia of Chemical Technology, Vol. 2, Interscience Publishers, Inc., New
York, 1948.
2. Kjellgren B. R. F.. Trans. F.lectrochem. Soc, 89, 247 A946); 93, 122 A918).
3. Bureau of Mines, Bulletin 556 on Beryllium, A Chapter from Mineral Facts and Prob-
lems. 1956.
4. White D. W., Jr., Burke J. E The Metal Beryllium, The American
Society for Metals, Cleveland, Ohio, 1955.
5. Encyclopedia Britannica, «Beryllium .
6. W i k 1 e K- G., Beryllium Fabrication, Reprint № 34. The Brush Beryllium Com-
pany, 1958.
4.
БОР
X. С. КУПЕР
Hugh S. Cooper, Consulting Chemist and Metal-
lurgist, Shaker Heights, Ohio
ВВЕДЕНИЕ
Бор в том или ином виде известен не меньше четырех столетий. Слово
borax происходит от арабского или персидского слова borak, что означает
белый. В давние времена арабы пользовались общим названием baurach
для обозначения множества различных солей, вероятно считая, что все они
имеют общее происхождение. Однако когда стало известно, что эти соли
отличаются одна от другой, названием baurach в конце концов стали пользо-
ваться лишь применительно к одному соединению, поступавшему из Тибета
и Индии. Эта соль сейчас хорошо известна в домашнем обиходе под назва-
нием буры.
Первыми бор начали изучать Гей-Люссак и Тенар [37], а вслед за ними
Дэви, получавшие загрязненный элемент восстановлением трехокиси бора
калием в железной трубке или электролизом борной кислоты. Спустя почти
50 лет Велер и Сент-Клер Девиль 11101 дали описание полученных ими двух
разновидностей бора. Одна из них была сходна с алмазом, другая напо-
минала графит. Однако Гампе [46] и позднее Жоли [51] показали, что алма-
зоподобнын бор состоит главным образом из борида алюминия AlBi2, а гра-
фнтоподобная разновидность бора представляет собой борокарбид состава
BjsCjAb. Бильц [12] провел исследование для выяснения этого Ronpoca
и пришел к выводу, что кристаллический бор, полученный его предшест-
венниками, в действительности являлся боридом алюминия, отвечающим
формуле AIBi2. Вейнтрауб 196] и Каленберг [53] показали, что каштаново-
коричневый порошок, получавшийся в результате взаимодействия магния
с тречокисью бора и считавшийся всеми прежними исследователями аморф-
ным бором, на самом деле является недокисью. Во всяком случае, при вос-
становлении трехокиси бора магнием никогда не образуется даже чистой
недокиси; продукт реакции обычно бывает загрязнен магнием, углеродом,
кремнеземом, железом и т. п.
Бор — элемент третьей группы периодической таблицы. Это металлоид
с порядковым номером 5 и атомным весом 10,811. Природный бор — смесь
изотопов с массовыми числами 10 A9,57°6) и 11 (80,43%).
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Бор относится к числу довольно распространенных элементов: его содер-
жание в земной коре составляет 1 ¦ 10"*9е. В природе бор никогда не встре-
чается в элементарном состоянии; чаще всего его находят в виде кислородных
соединений — борной кислоты и боратов натрия и кальция. Природная бор-
ная кислота Н3ВО3 (сассолин) содержит 56,4% В2О3 и 43,6% Н2О. Сассолин
встречается главным образом в воде и парах некоторых горячих источников.
Основные запасы этого соединения сосредоточены в Италии.
6 3aKaj № 239
82_ Глава 4
Колеманит, представляющий собой борат кальция, отвечает составу
Ca=BoOi,-5H20 или 2СаО-ЗВ2О3-5Н2О. Он содержит 50,9% В2О3, 27,2%
СаО и 21,9"о Н-.О. Значительные месторождения этого минерала обнаружены
в США.
Улексит— боронатрокальцит или борат натрия и кальция NaCaBo09-
8Н-О пли 2CaO-Na2O-5B2O.v 1GH2O; это соединение содержит 43% В2О3,
13,8% СаО, 7,7% Na2O и 35,5% Н2О. Главные месторождения улексита
находятся в США, Чили, Боливии и Перу.
В настоящее нремя самым важным источником получения бора, несом-
ненно, является минерал кернит (расорит). Большое количество этого мине-
рала добывается в Калифорнии. Крупные пласты почти чистой буры и кер-
нита обнаружены в районе Крамера. Было подсчитано, что эти пласты про-
стираются примерно на 800 м в ширину и имеют толщину более 600 м.
Вначале бура добывалась в шахтах. С января 1956 г. началась открытая
выработка, и в 1957 г. после удаления около 9 000 000 т породы покрываю-
щих пластов месторождения буры были вскрыты. Добыча ее теперь сильно
упрощена и производится непрерывно в количестве около 726 000 т в год.
На этом основании установлено, что имеющихся запасов хватит по крайней
мере на 100 лет. Обыкновенная бура — тетраборат натрия Na2B4OT- 10H2O.
Ксрнит также представляет собой борат натрия того же состава, но он содер-
жит только 4 молекулы кристаллизационной воды. Добываемый ксрнит
содержит около 75% бората натрия и 25% глинозема. Для приготовления
чистой буры минерал необходимо растворить в воде; при этом тетраборат
переходит в раствор и отделяется от глинозема. Тетраборат натрия затем
легко выкристаллизовывается из раствора.
ИСТОРИЧЕСКИЙ ОБЗОР
Приступая к беглому обзору промышленного производства буры 172],
следует отметить, что в 1864 г. (первый год зарегистрированного производ-
ства в США) было получено всего 11 т буры по цене около 720 долл. за тон-
ну. Вплоть до 1925 г. большая часть производимой в США буры извлекалась
из улексита и колеманита. Эти минералы добывались из месторождений,
расположенных в Долине Смерти, а гакже из калифорнийского озера Сёрлс.
В 1925 г. в Калифорнии было открыто новое месторождение природного
гетраоората натрия в Бороне (тогда Крамер). Этот минерал называют
кернитом.
Открытие и разработка этих месторождений оказали огромное влияние
на внутренний и внешний рынок. На новых рудниках добыча буры обходи-
лась дешевле, чем ее производство переработкой улексита и колемапита, так
чю после 1930 г. н США минералы бора практически уже не ввозились. Если
не считать периода 1940—1948 гг., внутреннее производство буры неуклонно
росло. Например, в 1949 г. ее производство составляло 424 190 т по цене
73,25 долл. за тонну. В 1956 г. оно достигло 857 240 т (при содержании В2О3
285 760 /га), а в 1959 г. производство буры составляло 562 400 т, содержав-
ших 285 110 т В2О3. Вся продукция за 1959 г. была оценена в 46 150000 долл.
Эти цифры говорят о возобновлении роста производства, прерванного спа-
дом 1958 г. Столь значительный рост производства объясняется появлением
новых областей применения соединений бора. В настоящее время в связи
с появлением бористых сталей и других сплавов, высокоэнергетических
топлив, присадок антидетонаторов к бензину [7] и многих других примеров
применения, слишком многочисленных, чтобы упоминать здесь о них, мож-
но ожидать дальнейшего расширения производства этих соединений.
Бор 83
СПОСОБЫ ПОЛУЧЕНИЯ БОРА
Вейнтрауб 196] первым получил чистый бор. Муассан [66] считал вос-
становление окиси бора магнием самым выгодным способом получения бора,
но, как это отмечалось выше, в этом случае образуется только загрязненная
недокись бора. После обстоя гельного изучения этого процесса Вейнтраубу
удалось получить продукт более высокого качества, содержавший по ана-
лизу 84°о бора, 0,6% магния, 0,2% железа, следы нитрида бора и 14,45%
кислорода. Он пришел к выводу, что получить чистый бор подобным способом
нельзя, и припиоал полученному продукту восстановления формулу В-О.
Позднее Каленбсрг [53] показал, что Вейнтрауб получал смесь продукта вос-
становлении со свободным бором и что этот продукт восстановления отве-
чает составу В3О. Кроль [57] утверждает, что основная часть примеси кисло-
рода в боре, полученном восстановлением магнием ВзО3. вносится моно-
окпсью бора. Та же окись была получена Уортиком и Эйплом в Пенсильван-
ском государственном университете [95], а также Кэндой, Кингом, Рассе-
лом и Кацем 154].
Низкосортный бор, получаемый восстановлением магнием, произво-
дится многими фирмами. По данным анализа, проведенного в лаборатории
автора, недокись одного из этих сортов содержала 89,11 °о бора, 3,9896 маг-
ния, 0,22°6 углерода, 0,18% железа, 0,47% кремния, остальное—кисло-
род. Устаноатено, что технический бор может быть в значительной
степени очищен от кислорода и магния дуговой плавкой в инертной атмосфе-
ре |57| нли обработкой в вакууме при высокой температуре [76].
В процессе получения чистого бора, окончательно разработанном Вейн-
траубом [97], трихлорид бора восстанавливается водородом в высоковольт-
ной дуге между охлаждаемыми водой медными электродами. Полученный
в виде порошка или корольков бор имел степень чистоты выше 99,8%.
В более поздней работе сотрудник Вейнтрауба Уорт [94] видоизменил эточ
процесс. Метод Уорта основан на той же реакции, но бор осаждается на рас-
каленной вольфрамовой проволоке или прутке. Вейнтрауб также получал
сплавы бора с углеродом путем одновременного осаждения этих элементов
из их соединений на нагретую поверхность [106].
bop получали также восстановлением трихлорида бора водородом в пла-
мени электрической дуги между вольфрамовыми или молибденовыми элек-
тродами [45]. Ван-Аркель [91] получал бор термической диссоциацией бро-
мида бора ВВг3 на нагретой вольфрамовой проволоке. Аналогичный процесс
описали Лаубепгейср, Хард, Ньюкирк и Хоард [5tt], но в этом случае для
восстановлении бромида бора применялся водород. Тот же метод применял
Кисслинг [55]. Он приводит данные о выходах элемента, полученных при
различных температурах, и о степени чистоты. Маккарти и Карпентер [62]
недавно сообщили о синтезе трииодида бора и о его разложении при 800- -
1000° на тантале с образованием новой кристаллической модификации бора.
Бор был получен также восстановлением диборана [67, 79]. Кроме того,
кристаллический бор образуется при пропускании смеси водорода е трихло-
ридом бора над раскаленной нитью из вольфрамотанталового сплава [11]
или титана [85]. Он может быть осажден из той же смеси на графите или на
проволоке особой формы из вольфрама, тантала или молибдена [2, 75],
По другому способу загрязненный бор получен восстановлением фторобо-
рата калия или натрия металлическим калием, натрием илн литием [84],
Еще один способ основан на восстановлении трифторида бора щелочным
металлом, находящимся в газообразном состоянии [83].
Хотя при термической диссоциации, при восстановлении хлорида или
бромида бора водородом, а также из диборана получается бор высокой
б*
84 Г лава 4
степени чистоты, выход бора в этих реакциях так мал, а стоимость настолько
высока, что эти методы применимы только в особых случаях, когда экономи-
ческий фактор не имеет большого значения. Однако наиболее значительной
по своим масштабам была попытка Феттерли [33] наладить производство
бора путем восстановления хлорида водородом на опытном заводе фирмы
«Нортон». Бор осаждался на угольных электродах, нагретых приблизительно
до 1400°. По-видимому, на поверхности электрода сначала образуется кар-
бид бора, на котором осаждается слой бора, содержащий, однако, около
3% углерода. Производительность такой установки была до 0,5 кг бора в час.
. ¦ • ¦- ; * -. .
% -. . -. ¦¦ -
• • • >**•*»** • К
.• -• .'.. •'*%*•¦ •¦», "
P и с 1. Электронияя микрофотография порошка бора. Х5000.
Андрие [4] утверждает, что ему удалось получить бор такой же степени
чистоты, как и Муассану, электролизом расплавленной смеси окиси бора,
окиси магния и фторида магния в нагретой до 1000 1100° ванне с угольным
анодом и железным катодом. Тот же автор [3] описывает другой процесс
электролиза в ванне из Na2O и В2О3 с добавкой и без добавки MgF2. В ан-
глийском [13] и американском [70] патентах описан электрашз расплавлен-
ных солей; в этом случае исходными компонентами расплавленной ванны
являются КО, KF и В2О3- Этот процесс был рассмотрен Найсом, Макип-
тайром и Фаянсом на конференции Электрохимического общества в 1958 г.
[69]. Ньюкирк дает исчерпывающий обзор этих методов получения элемен-
тарного бора [68].
Автор настоящей статьи запатентовал два метода получения бора, один
из которых пригоден для производства бора в промышленных масштабах.
По первому методу, описанному Купером [17], фтороборат калия подвер-
гается электролизу в расплаве, содержащем хлорид калия. По второму
методу [ 18] бор получают электролизом расплавленной смеси хлорида калия,
фторобората калия и окиси бора.
Бор
85
В первом процессе анодом служит графитовая футеровка тигля из жаро-
стойкого сплава, а катодом — чаще всего пластина или цилиндр иа малоугле-
родистой стали. Для предохранения графитового анода от разрушения его
Ф
Рис. 2. Электронная микрофотография порошка бора. X 37 000.
верхняя часть охлаждается водой. Катод прикрепляется болтами к охлаж-
даемому водой медному держателю, вокруг которого на поверхности ванны
затвердевает некоторое количество соли, что предотвращает загрязнение
Вода
Вог)в
Р и с. 3. Схемя электролизе-
ра для получения элементар-
ного бора.
/ — водяная рубашка; 2 — гра-
фитовая футеровка (анод); 3 — ка-
тод; 4 — тигель нз ннконеля,
5 — отверстие для форсунки.
-з ' -.
Рис. 4. Электролизер для по-
лучения элементарного бора-
бора медью. Электролизер такого типа
работает длительное время подтоком
3000 а и напряжением 6—12 в. Выход
по току составляет около 75%. В этом
процессе на аноде выделяется хлор, а освобождающийся при разложении
хлорида калин, видимо, восстанавливаетфторобораткалия до элементарно-
го бора. Постепенное накопление в ванне фторида калия сопровождается по-
вышением напряжения. Бор после удаления с катода, промывки и сушки
86 Г л ае а 4
представляет собой преимущественно крупные кристаллы, очень напоминаю-
щие кокс. По типичным аналитическим данным в таких кристаллах содер-
жится 99,41 "о бора, 0,29% углерода и 0,20% железа. Подробное описание
работы по вышеуказанному процессу на заводе «Хукср кемикл корпорейшн»
КЛЭ США дается Миллером [65].
При осуществлении второго процесса используется электролизер такой
же конструкции, как и в первом процессе, но в этом случае на аноде выде-
ляется кислород и соединяется с углеродом. Образующийся бор выделяется
преимущественно в виде мелкозернистого порошка, который легко просеи-
вается через сито с размером отверстий —325 меш. На рис. 1 воспроизводит-
ся электронная микрофотография мелкозернистого порошка бора при уве-
личении в 5000 раз, на которой видны частицы размерами приблизительно
от 0,1 до 5 мк. Однако предполагают, что более крупные частицы представ-
ляют собой образования, состоящие из очень мелких частиц. На рис. 2
показана электронная микрофотография такого же образца бора при уве-
личении в 37 000 раз. Степень чистоты этого металла такая же, как у бора,
полученного указанным выше способом. Путем специальной сортировки
и очистки можно получить бор со степенью чистоты 99,7 %, содержащий
0,05% углероца и О,15?о железа. На рис. 3 показана схема электролизера
для получения бора, а на рис. 4 — его фотография.
ПРОИЗВОДСТВО БОРА-10
Как было указано выше, встречающийся' в природе бор представляет
собой смесь изотопов — бора-10 и бора-11 —в соотношении 19,57 : 80,43.
КАЭ США заинтересовалась производством бора-Ю, так как он имеет
высокое поперечное сечение захвата нейтронов, равное 3850 барн, по срав-
нению с 38 барн для бора-11 и 775 барн для природного бора. Бор-10 при-
обрел большое значение как материал для изготовления регулировочных
стержней для ядерных реакторов, защиты от ядерного излучения и счетчи-
ков нейтронов. Бор-11 представляет интерес для других целей, так как он
слабо поглощает нейтроны.
В 1953 г. КАЭ США санкционировала строительство завода по произ-
водству бора-Ю. Этот завод вступил в строй в июне 1954 г., проработал под
руководством «Хукер кемикл корпорейшн» для нужд КАЭ США до июля
1958 г. и был законсервирован. Годовая производительность завода состав-
ляла 500 кг элементарного бора, обогащенного до 90—95% бором-10 164].
Для отделения бора-Ю от бора-11 используется комплексное соединение фто-
рида бора с диметиловым эфиром, причем разделение производится в боль-
ших разделительных колоннах [16]. Для окончательного извлечения бора
вместо осаждения на раскаленной нити [2, II, 75] был введен электролиз
расплавленных солей. В этом видоизмененном процессе комплексное соеди-
нение бора-10 из разделительной колонны реагировало с фторидом калия
[30] с образованием KBF4, в котором содержался главным образом бор-10
По методу Купера (патент США 2572248) бор-10 осаждается на металличе-
ском катоде из ванны, состоящей из KCI и KBI"F4, полученного, как описано
выше 1151.
ФИЗИЧЕСКИЕ СВОЙСТВА
Поскольку вплоть до недавнего времени имелись лишь сравнительно
небольшие количества чистого бора, многие свойства этого элемента еще не
изучены, а большая часть опубликованных данных, несомненно, требует
дополнительной проверки.
Бсф 87
По данным Уорта [941, плотность осажденного на вольфрамовой нити
бора очень близка к 2,3. Более поздние данные Формштсхера и Ришкевича
[35], видимо, следует считать более точными. В этой работе для плотности
бора, полученного из диборана, приводится величина 2,34 ± 0.01.
Истинная температура плавления бора точно еще не установлена. Герт-
лер и Пирани [431, по-видимому, принимали для температуры плавления
бора значение Вейнтрауба, близкое к 2400°. С другой стороны, по Квилле-
рону [21], температура плавления бора находится в интервале 2000—2075°.
Это измерение было проведено с бором, полученным восстановлением хло-
рида водородом в высокочастотной дуге. Образец расплавлялся в пламени
атомарного водорода. Последнее значение температуры плавления бора,
вероятно, ближе к истинному значению, хотя имеются указания на то,
что истинная температура плавления бора должна быть несколько выше,
чем приводит Квиллсрои. В некоторых проведенных автором опытах бор,
нагретый под давлением 630 кг/см- в атмосфере аргона, легко заполнял
форму; полученный продукт имел плотность 2,24. По показаниям оптического
пирометра температура перехода в пластичное состояние составляла при-
мерно 2000е. В других опытах брикет бора нагревали в заполненной аргоном
печи сопротивления с угольным нагревателем при атмосферном давлении.
При 2200° происходило значительное испарение бора, что затрудняло точ-
ное измерение температуры. В этот момент ток выключали и после охлаж-
дения получали сплавленную кристаллическую массу темного цвета. В ре-
зультате этих опытов установлено, что температура плавления бора лежит
между 2100 и 2200°. По более поздним данным [49], температура плавления
составляет 2300°, а температура кипения 2550°.
Модуль упругости бора равен примерно 44.8-103 кг:мм^, а предел проч-
ности при растяжении 160—245 кг<мм? [88].
Теплота сгорания бора в кислороде, как сообщают Джонстон, Герш
и Керр 150], составляет 13,95 ккая/г.
Коэффициент расширения бора, согласно Уорту, больше коэффициента
расширения кварца, по меньше, чем у вольфрама. Эта величина не совпадает
с данными Дюпюи и Хэкспилла [291, которые установили, что коэффициент
линейного расширения в интервале температур 20—750° равен 8,3-10"
(с точностью до 3%). В брошюре, опубликованной «Хукер электрокемикл
компания [49], коэффициент линейного расширения в интервале температур
20—750° приводится равным 1,1- 10 е— 8,3-10 6.
Ниже приводятся значения удельной теплоемкости бора при различ-
ных температурах.
Температура. "С
От-
От
От
191 до-78
-76 до 0
П до 100
100
500
900
Сдельная теплоем-
кость, кал/г
0,071
0,180
0,307
0,387
0,472
0,510
Весьма интересны электрические свойства бора, который в этом отно-
шении, вероятно, не походит на остальные элементы. Электропроводность
бора при комнатной температуре чрезвычайно мала, но она сильно возрас-
тает при нагревании. Вейптрауб [98] установил, что электрическое сопро-
тивление «холодного» бора равно 9 000 000 ом, а при температурах выше
1000" оно составляет всего несколько долей ома. Приводимые ниже данные
88
Глава 4
показывают изменение сопротивления бора при повышении температуры.
Величины электросопротивления бора, взятые из графических материалов
опубликованной работы Грейпера и Гутовского 142], очень близки к значе-
ниям, определенным ранее Вейнграубом [98]. Электрические свойства бора
описали также в своих работах Брук и Хикклинг [14], Уно, Приз, Иосида
и Синохара 190], а также Шоу, Хадсон и Даниельсон [81].
Темпера-
тура,
°С
—150
- 10
0
27
100
170
320
520
600
Уделтое элекгрск-опроп
по Греиперу
и Гутовскому
40 000 000 000
4 000 000
з ооо ооо
650 000
40000
3 000
40
1.2
0,2
нление, пм-см
по Be fiH-
траубу
775 000
66 000
7 7A0
180
7
4
Не менее интересно влияние растворенного в боре углерода. Оно на-
столько значительно, что, например, примесь даже 0,1% углерода во много
раз повышает электропроводность бора. При растворении в боре 7—8%
углерода эти особенности совершенно исчезают, и материал ведет себя,
подобно углероду.
Фрейман [36] изучал вопрос о влиянии температуры, а также видимого
и инфракрасного излучения на электрическое сопротивление бора.
Феттерли |32| приводит для бора значение прочности на изгиб, равное
53,2 кг/мм", и твердость по Кнупу при нагрузке 100 е, равную 2500. Это
значение твердости, по-видимому, несколько ниже истинного, так как карбид
кремния, применяемый при резании материалов с твердостью по Кнупу
около 2500, едва царапает бор. С другой стороны, приводимое Формштехе-
ром и Ришкевичем [35] значение 5000, несомненно, является слишком высо-
ким. Твердость по Кнупу при нагрузке 100 г для бора со степенью чистоты
выше 99,5%, полученного дуговой плавкой в лаборатории автора, найдена
равной 3300. Поскольку измерение проводилось па компактном боре, полу-
ченном дуговой плавкой, это значение твердости, вероятно, близко к истин-
ной твердости бора.
Сведения о структуре кристаллической решетки бора несколько проти-
воречивы. Образцы бора, полученные в лаборатории автора электролизом,
подвергались рентгеноструктурному анализу. Линии па рентгенограммах
этих образцов, хотя и слабые, совпадали с линиями для образца кристалли-
ческого бора, осажденного на горячей нити накала при восстановлении водо-
родом трнбромида бора [58]. В этой работе сообщается, что игольчатые моно-
кристаллы осажденного бора имеют тетрагональную пространственную груп-
пу DJ = 4/ш с параметрами а = 8,93 А и с= 5,06 А. В этой же работе ука-
зано, что в осадках, полученных при восстановлении водородом, обнаружены
монокристаллы бора другого типа — пластинчатые кристаллы ромбической
структуры с параметрами а = 10,13 А, Ь — 8,93 Л и с = 17,86 А. Сабо и То-
биас 187] приводят данные рентгеноструктурного анализа порошка бора,
Бор 89
получрнного термическим разложением бромида бора. Эти данные согла-
суются с приведенными выше данными в отношении числа модификаций
и интервалов температур, но расходятся с ними в отношении кристалличе-
ской структуры. Данные Уоррена и Годфрея 193] о кристаллической струк-
туре порошкообразного бора не со1ласуются с результатами Лаубснгсйера
и сотр. [58]. Ньюкирк [68] проанализировал факторы, оказывающие влия-
ние на модификации Сора.
ХИМИЧЕСКИЕ СВОЙСТВА
Бор легко соединяется с фтором, хлором, бромом и иодом. Чистый бор
не взаимодействует с хлором при температурах ниже 500е, но быстро соеди-
няется с ним при 550°, образуя трихлорид бора. В соляной и плавиковой
кислотах бор не растворяется даже при кипячении. Тонкоизмельченный бор
окисляется горячей концентрированной азотной кислотой, тогда как с ком-
пактным металлом эта реакция протекает очень медленно. Горячая концен-
трированная серная кислота или горячий раствор хромовой кислоты в сер-
ной кислоте почти не действуют на бор. Бор растворим в смеси азотной,
соляной и серной кислот.
Концентрированная перекись водорода медленно окисляет порошкооб-
разный бор, а горячий раствор персульфата аммония оказывает на него
лишь слабое действие. Кипящий концентрированный водный раствор едкого
натра не взаимодействуете бором. Бор энергично реагирует с расплавленной
перекисью натрия, а также с расплавленной смесью соды и нитрата калия.
При температурах ниже 500° бор не реагирует с расплавленным едким
натром, но при более высоких температурах кристаллы бора медленно им
разъедаются 158].
При нагревании спрессованного бора на воздухе заметного окисления
не происходит примерно до 750°, но при 800° на поверхности появляется бле-
стящая черная пленка, которая, очевидно, полностью предохраняет его от
дальнейшего окисления вплоть до 1000". В чистом кислороде при 1000"
окисление протекает очень быстро. Мелкие частицы чистого бора размером
0,1—10 мк при комнатной температуре окисляются медленно. Например,
при анализе образца, первоначально содержавшего 99% бора, после хране-
ния в течение нескольких месяцев в лаборатории было найдено только 92%
бора. При увеличении размеров частиц стойкость против окисления также
возрастает. В случае частиц с размерами не меньше 40 меш никаких измене-
ний состава не наблюдается. Поэтому тонкоизмельченный чистый бор сле-
дует хранить в заполненных герметичных контейнерах.
Некоторые новые свойства бора были открыты Квиллероном [22].
Смесь бора с перманганатом калия, суриком, трехокисью сурьмы или нитра-
том свинца воспламеняется от удара или при трении, по без взрыва. Реакция
бора с йодистым водородом протекает со взрывом.
Бор образует много ценных соединений с металлами и неорганических
соединении. Наибольший интерес представляют бор иды, карбид, силицид,
нитрид и гидриды. До недавнего времени свойства боридов были мало изу-
чены, так как эти соединения трудно получить в чистом виде методами вос-
становления. Теперь, когда достаточно чистый Сор, получаемый по методу
Купера, имеется в большом количестве, эти соединения можно получать
в чистом виде непосредственно из элементов. Бор иды тугоплавких металлов
могут приобрести большое промышленное значение, поэтому они подвер-
гаются интенсивному исследованию [8, 40, 73, 80]. Вообще говоря, для них
характерны высокие (выше 2000°) температуры плавления и большая твер-
90 Глава 4
дость, а для боридов алюминия (А1В12), кремния (SiBc), титана (TiB?),
циркония (ZrBs) и хрома (СгВг) очень хорошая стойкость против окисле-
ния при температурах выше 1000°. Бориды вольфрама, молибдена, тантала
и ниобии, хотя и не так стойки в окислительной атмосфере при высокой
температуре, представляют собой чрезвычайно тугоплавкие и очень твердые
соединения, которые могут найти применение при изготовлении быстроре-
жущих инструментов. Бор ид хрома в настоящее время применяется для
наварки твердых покрытий с целью увеличения стойкости к истиранию,
а также для плакирования стали с целью придания профильным сталям
стойкости по отношению к расплавленному алюминию. Бориды алюминия
(AlBiz) и кремния (SiBc), полученные в настоящее время в чистом ниде
в лаборатории автора, могут стать основой для создания новой абразивной
промышленности. В связи с этим в этой лаборатории недавно была определе-
на твердость по Кнупу при нагрузке 100 г боридов алюминия и кремния,
равная 3700 и 3400 соответственно. Карбид бора (твердость по Кнупу при
нагрузке 100 г 2800) уже в течение ряда лет производится в большом коли-
честве. Он нашел широкое применение как полирующая присадка, матери-
ал для сопла пескоструйного аппарата и т. д. Борид кальция в загрязненном
виде в течение длительного времени продавался на рынке как раскислитель
для меди. В настоящее время получен чистый борид кальция (СаВе), который
может оказаться интересным для других областей применения. Эю очень
стойкое соединение. Его температура плавления равна 2235°, а твердость
по Кнупу при нагрузке 100 г составляет примерно 2500 [77].
Бориды металлов IV группы периодической таблицы, как ни странно,
являются лучшими проводниками электричества, чем входящие в их состав
элементы; следует ожидать, что их теплопроводность также будет более
высокой. Некоторые из этих соединений поддаются обычным процессам спе-
кания и горячего прессования; в отдельных случаях полученные из них
изделия отличаются большой прочностью*.
Бор образует замечательный своими свойствами нитрид [39, 711. Это
соединение представляет собой белый порошок со средним размером частиц
около 1 мк. Температура плавления нитрида бора равна 3000°. Он устойчив
против окисления при нагревании до 650°. Истинная плотность его равна
2,2, а насыпной вес — 0,11. Электрическое сопротивление нитрида бора
очень высокое при всех температурах вплоть до 24001'. При указанной тем-
пературе он не воспринимает нагрев токами высокой частоты. Нитрид бора
имеет гексагональную пластинчатую структуру, как у графита, и применяет-
ся в качестве смазочного материала [19]. Он запатентован гакже как пиг-
ментный краситель [201. Из нитрида бора горячим прессованием мож-
но изготовлять изделия различной формы, например гигли [89]. Путем
прессования в горячем состоянии при давлении выше 700 кг/мм* и тем-
пературе выше 1650° из него был получен материал, по твердости равный
алмазу 15].
Гидриды бора — бесцветные твердые вещества, жидкости или газы, лег-
ко окисляющиеся с выделением большого количества тепла. Некоторыми
правительственными учреждениями [60] были широко изучены возможности
применения гидридев бора в качестве реактивного топлива. Наиболее высо-
кие реактивные скорости достигаются в случае применения в качестве
топлива элементов с малым атомным весом. Хотя теоретически самым совер-
* Большой интерес могут представить также бориды редкоземельных металлов,
свойства которых рассмотрены в работе Г. В. Самсонова и Ю. Б. Падерно «Бориды
редкоземельных металлов», АН УССР, 1961.— Прим. ред.
Бо? 91
шенным топливом для двигателей, вероятно, является водород, его чрезвы-
чайно трудно хранить и поэтому приходится применять в соединении с дру-
гими элементами, например бором или литием. Обычно считают, что по мно-
гим причинам для этой цели больше подходит бор. В случае реактивного
топливас большим насыпным весом следует ожидать, что очень высокие реак-
тивные скорости создаются при взаимодействии гидрида бора с окисью фто-
ра 1601 или водой. Поскольку гидрид бора является топливом, реагирующим
е водой, он чрезвычайно взрывоопасен при соприкосновении с влажным
воздухом или со следами влаги 110].
Интересно сравнить энергию, выделяемую бором, с энергией, выделяе-
мой другими топливами. При сжигании 1 м3 бора выделяется 32 075 475 икал,
при сжигании такого же количества керосина-8 419 400 ккал, а при
сжигании такого же количества бензина—7031000 ккал [32]. У борсо-
держащих топлив, применяемых в реактивных двигателях самолетов и ра-
кет, тепловыделение на 1 кг веса вдвое больше, чем у самых лучших угле-
водородных тошшн. На этом основании считают, что производство таких
борсодержащих топлив за десятилетие превратится в отрасль промышлен-
ности с капиталовложениями, оцениваемыми в 1 млрд. долл. Эти топлина
обычно получают в результате реакции гидрида лития с трихлоридом или
трифторидом бора. В результате таких реакций, видоизмененных тем или
иным образом, можно получить диборан В2Н0, пентаборан В6Н„ и декабо-
ран В,„Ни.
Хотя о различных соединениях бора еще многое должно быть выяснено,
вполне очевидно, что по мере развития исследований будут создаваться новые
отрасли промышленности, для которых бор в том или другом виде будет
играть важную роль*.
МЕТОДЫ АНАЛИЗА
Определение бора в железе и в стали весьма обстоятельно описано
в работе 1241. 1Метод определения бора описан также в работе [74]. Если
содержание бора в пробе значительно выше 90%, а тем более выше 99%,
то весьма надежные результаты дает приводимая ниже методика.
Реактивы: маннит, химически чистые серная и азотная кислоты.
Необходимые растворы: 0,2 н. раствор NaOH обычного приготовления;
раствор 1 г метилоранжа в 100 мл этилового спирта: раствор 1 г бромкре-
золового зеленого в 100 мл чтилоного спирта; растнор 2 г фенолфталеина
в 100 мл этилового спирта; 300 мл соляной кислоты A : 1).
Температура: 108—108.5°.
Количество дистиллата: приблизительно 150 мл.
Аппаратура: лучше всего небольшая бунзеновская горелка с низким
пламенем; прибор для перегонки (обработка образца и охлаждение произ-
водятся с включенным холодильником).
Методика. 200 г вещества помещают в колбу емкостью 300 мл, смынают
со стенок водой н соединяют колбу с холодильником, охлаждаемым про-
точной водой. Затем в колбу через верх холодильника приливают 50 мл
воды, 10 мл азотной кислоты, 5 мл соляной кислоты и 2 мл серной кислоты.
После этого зажигают горелку, нагревают раствор до слабого кипения
и медленно кипятят до полного растворения образца A—2 час). Затем
* Из отечественных работ по бору см. главу «Бор» С. Т. Белова, В. А. Эпельбау-
ыа, М. А. Гуревича в книге «Основы металлургии», т. 3, Металлургиздат, 1963,
стр 494—512.' — Прим. ред.
92 Глава 4
содержимое колбы охлаждают до комнатной температуры с включенным
холодильником, после чего холодильник смывают и отключают.
Раствор переливают в колбу с определенным количеством 0,1 н. рас-
твора NaOH; величина рН должна быть равна 7 (индикатор метилоранж).
Титрование проводят, медленно приливая раствор NaOH с таким расчетом,
чтобы содержимое колбы не нагревалось. После добавления бумажной
массы раствор фильтруют через ватманский фильтр №41, а осадок 5 раз
промывают горячей водой.
Фильтрат возвращают в ту же колбу. Приливают 1 н. раствор НС1
до тех пор, пока раствор не станет слегка кислым, и добавляют еще 3 капли.
Колбу снова соединяют с холодильником, раствор кипятят в течение 5 мин,
затем его охлаждают и отключают холодильник.
Добавляют 1 мл бромкрезолового зеленого и медленно, по каплям
приливают 0,1 н. раствор NaOH до полной нейтрализации (пока индикатор
снова не станет светло-зеленым). Для контроля добавляют одну каплю
0,1 н. НС1 и нейтрализуют ее одной каплей 0,1 н. NaOH.
Добавляют 1 мл фенолфталеина и 1 г маннита. Затем титруют 0,2 н.
раствором NaOH. Снова добавляют маннит и титруют до появления неис-
чезающей ярко-розовой окраски. Маннит приливают порциями по 1 г: 1 мл
NaOH соответствует 0,3% бора. Если на титрование навески 200 мг
израсходовано 66,2 мл NaOH, то образец содержит 66,2 X 0,3 X 5 =
= 99,3% бора.
Титр раствора NaOH устанавливают по раствору предварительно
переплавленного химически чистого борного ангидрида ВгО3. Параллельна
проводится слепой опыт.
СПОСОБЫ ОБРАБОТКИ
Из бора можно изготавливать различные изделия горячим прессова-
нием или холодным прессованием с последующим спеканием. Для горячего
прессования пригодно обычное оборудование, применяемое для производства
изделий из карбидов, но эта операция обычно осуществляется при более
высоких температурах, так как никакой связки, подобной никелю или
кобальту, в данном случае не применяется. Бор начинает пластически
деформироваться при 1800°, и температура его прессования не должна
превышать 2000°. При этом рекомендуется применять индукционный нагрев,
а продолжительность спекания должна быть как можно короче. Для этого
применяются графитовые пресс-формы, лучше футерованные нитридом бора.
Все операции рекомендуется проводить в защитной атмосфере аргона или
какого-либо другого газа. При прессовании бора в пресс-формах диаметром
около 9 мм оптимальными, например, можно считать следующие режимы:
потребляемая электрическая мощность 25 кет, продолжительность нагре-
ва 1,5—2 мин, давление прессования 3,5 -6,3 кг!мм-.
По другому способу [СЗ] порошок бора после прессования спекается
на подставке из ВеО в атмосфере водорода при 1800—2000°. Остальные
способы получения компактного бора подробно описаны Строкой 186],
а также Хейсом и Бурке [471. Кроме того, изделия из бора изготов-
ляют прессованием смеси порошков бора и 1,10% борного ангидрида под
давлением около 70 кг, дои2 с последующим спеканием при 800°. Предел
прочности при сжатии таких заготовок превышает 25 кг/ммЧ 107]. Бор, осаж-
денный в виде тонких пленок 128], используется для покрытия иониза-
ционных камер [67] и для многих других целей.
__ Бо? 93
ОБЛАСТИ ПРИМЕНЕНИЯ
Имеются патенты на применение бора для изготовления стартеров
двигателей, граммофонных игл Г261, громоотводов и высокотемпературных
автоматических выключателей трансформаторов [99]. Бор применяется
также в качестве уплотняющего материала для вакуумных сосудов. Реко-
мендуется эвтектический сплав бора с 96% железа, никеля или кобальта
[59]. Выдан патент [48] на электрические контакты из серебра и бора.
Бор предложено использовать также для изготовления термопар [100],
подшипников качения [101], постоянных [1021 и переменных [103] электри-
ческих сопротивлений. Все более широкое применение находит бор для
изготовления запальных устройств игнитронных выпрямителей и управ-
ляющих ламп [61, 82, 92]. Штифты таких запальных устройств спекают
из смеси бора с другими материалами при очень высоких температурах;
в результате образуются полупроводники с хорошими механическими
свойствами. Одно из таких запальных устройств показано на рис. 5 [38].
Рис. 5. Запальное устройство со штифтом, изготов-
ленное спеканием смеси бора с другими материалами
при очень высоких температурах («Дженерал электрик
компании).
Бор применяется также в ядерных реакторах как поглотитель ней-
тронов и для изготовления нейтронных термометров и сопротивлений
с высоким температурным коэффициентом [79]. Финли [34] сообщил о при-
менении бора и его соединении в ядерной технике. Для поглощения нейтро-
нов обычно применяют изотоп бор-10, так как он в 5 раз лучше поглощает
нейтроны, чем природный бор. С другой стороны, в тех случаях, когда
требуется материал с малым поперечным сечением захвата нейтронов,
например для обкладки реакторов или дли оболочек тепловыделяющих
элементов, применяется бор-11.
Бор, по-видимому, лучше всех других материалов способствует обез-
гаживанню меди; при этом получают металл с очень высокой электропровод-
ностью [104, 105]. Применение сплавов меди с бором, содержащих другие
металлы, для этих целей запатентовано фирмой «Америкэн брас компа-
ни» [1]. Меднобор истые сплавы высокой степени чистоты, содержащие до 6%
бора, выпускает в настоящее время фирма «Купер мсталлурджикл ассо-
шиэйтс». Эти сплавы применяют для введения определенных количеств бора
в медь с целью се раскисления. Эти сплавы применяются также в виде
лигатур для приготовления литейных меднобористых сплавов, а также
в качестве припоя для соединения некоторых разнородных металлов.
Бор является важной составной частью многих сплавов. Его применяют,
например, при производстве сплавов для режущих инструментов [25, 109]
н жаропрочных сплавов [44], а также для поверхностного упрочнения
[31, 781 и цементирования [561 более мягких металлов с целью повышения
их износостойкости. Бор легируют алюминием для повышения его прочности
без ухудшения электропроводности [108]. Благодаря большому сродству
бора к кислороду, его высокой активности и жидкотекучести образуемых
94 Г л а в а 4
им шлаков его часто можно использовать в качестве восстановителя в тех
же случаях, что алюминий и кремний [9].
При выплавке бористых сталей бор обычно вводят в виде ферробора
или боромаргапца [23]. Эти добавки вводят главным образом для повыше-
ния закаливаемости сталей [6, 24, 26, 41] Содержание бора при этом Может
не превышать 0,0005—О,ОО5?6. Перед введением этих добавок сталь тща-
тельно раскисляют. Потребление легированной бором стали постоянно
возрастает, так как это позволяет экономить такие более дефицитные метал-
лы, как хром, молибден и никель. Установлено, что в ближайшем будущем
производство таких сталей может легко достичь 1 800 000 т в год. Для
этого потребуется ежегодно около 90 т бора. Имеются указания, что при-
менение при производстве бористых сталей вместо сложных бористых
сплавов чистого ферробора, соответствующего по составу соединению
Fe=B. приводит к гораздо лучшим результатам, при этом отпадает необхо-
димость тщательно контролировать содержание бора. Из этого краткого
обзора, касающегося бора, его соединений и сплавов, совершенно очевидно,
что данный элемент в конце концов приобретает такое же значение, как
и родственные ему элементы углерод и кремний, и станет таким же необ-
ходимым для металлургической, химической и электротехнической про-
мышленности*.
ЛИТЕРАТУРА
1. American Brass Co., англ. пат. 53689.3. May 30. 1941.
2. А п d e r s о n R. D , Operating Instructions for Production of Product 891-A at
Stamford Research Laboratories, U. S. Army Engineering Corps., Vol. 1—3, L. C,
M-356, 1944—1946
3 A n d r i e u x L, Deiss W. J.. Bull. soc. chim France, 6, 838—841 A955).
4. Andrieux I.., C. R., 185, 119 120A927).
5. Materials and Methods, 194—196 (May 1957).
6 Archer R. S., Metal Progr., 677—686 (October 1946)
7. В a r t 1 e 5 о n J. D., пат. США 2725856, 1956; 2751285, 1956; Darling S. M.,
пат. США 2710251, 1956; 2710252, 1956; 2741548, 1956; Fay P. S., пат. США
2767069, 1957; Hughes E С. пат. США 2725857, 1956.
8. Batlelle Memorial Institute, The Formation of Refractory Coatings by Vapor-Deposi-
tion Methods, Rand Report R-137. 1949.
9. В с с k e t F. M., пат. США 924130, June 8, 1909.
10. Bell R. P., F m e I e u s 11. J., Quart Revs., London, 2, 132 151 A918)
11 В e I m о r e E. A, T e 1 1 e г A. M., The Hydrogen Reduction of Boron Trichlo-
ride on Alloy Wires, AFC Report NYO-1269. 1956
12 В i 1 tz H., Bcr.. 41, 2634—2635 A908).
13. Borax Consolidated, Ltd., англ. пат. 78181.3, August 28, 1957.
14. Bruce J. II.. II i с k 1 i n g A . Trans. Faraday Soc. 35, 1436—1439 A939).
15. С li i I t о п С. Н., Chera. Eng., 148—150 (May 1957)
16. С h г I s t R. H. et al., пат. США 2796330, June 18, 1957.
17. С о о р с г Н. S., пат. США 2572248, October 23. 1951.
18. Со op er H. S., пат. США 2572249, October 23, 1951.
19 Cooper H. S., пат. США 2156803, May 2, 1939.
20. С о о р е г Н. S., пат. США 2152536, March 28, 1939.
21. С u e i 1 1 е г о п J., С. R., 221, 698—699 A915).
• Детально ознакомиться с бором, элементом возрастающего значения, можно
по монографии Г. В. CaMCOHORa, Л. Я- Марковского, А. Ф. Жигача, М. Г. Валяшко
«Бор, его соединения и сплавы», АН УССР, I960.— Прим. ред.
Бар 95
22. С u e i 1 1 е г о n J., Ann. chim., 19, 459—486 A944).
23. D a v, е С. N , пат. США 2579369. December 8, 1951.
24. D e a n R. S., S i 1 к е s В., U. S. Bureau of Mines Inform. Circ. № 7363, 1946
25. D eG ol у er A. G., пат. США 1493191, March 6, 1924.
26. Dicker S. G., англ. пат. 326899. January I, 1929.
27. D i g g s Г. G., I r 1 s h С R., С а г w i 1 e N. L.. J. Research Kat. Bur. Standards,
41. №6, 515—574 A918).
28. D о d s о n R. W.. R u s s e 1 1 H., Preparation of Boron Films. L. С, РВ 52418,
1914.
29. D u p u у Е., Н а с к s p i 1 1 L., С R., 197, 229—230 A933).
30. E b e r 1 e A. R.. пат США 2796323. June 18, 1957.
31. Edmonds W. H.. Cole N. W., пат. США 2088838, August 3. 1937.
32. Fetterley G. H., Norton Company, частное сообщение, 1951.
33. Fetterley G. П., пат. США 2542916, April 1951.
34. F i n 1 а у G. R., Am. Ceram. Soc. Bull., 36, № 3, 109—111 A957)
35. Formstecher M., R у s к e v e с Е., С R., 221, 747—749 A945)
36. Freyinann R., С R . 199. 1109 -1110A93-1).
.57. G a y-L u s s а с J., Thenard L., Recherches Physico-Chem., 276 A811).
38. Данные фирмы «General Electric Company».
39. G i a r d i n i A. A., U. S. Bureau of Mines Inform. Circ. Ne 7664, 1953.
40. G 1 a s e r F. W., Physical Properties of Cemented Borides, Summary, Progress
Report, American Electro Metals Corp., L. С, РВ-117-522, 1954.
41. Grange R. A., Seems W. В., Holt W. S., Garvey Т. М., Effect
of Boron and Kind of Boron Additions upon Properties of Steel, Am. Soc. Metals,
Preprint №. 5, 1949.
42. G г с i n e r E. S., Gntowski J A., J. Appl. Phys., 28, № 11, 1364—1365
A957).
43. G u e r t 1 e r W., P i г а п i M., Z. Metallkunde, 11, 1—7 A919).
44. G u у A. G., пат. США 2575915. November 20, 1951.
15. Hackspill L., Stieb'er A., Hoc art R.. С R.. 193,776—778A931)
46. H am p e W., Liebig's Ann., 183, 75 A876).
47. Hays Ц Burke J. E., Plastic Bonding of Boron Powder, AECD-2279, 1944.
48. He use 1 F. R.. Emmert K. L., W i g g s J. W., пат. США 2221286,
May 23, 1939.
49. Hooker Electrochemical Co., Boron and Its Isotopes, Brochure Complied for the
U. S Atomic Energy Commission, 1957.
50. Johnston H L, Hersh H. N.. К е г r E. C, J. Am. Clicm. Soc. '
73. 1112—1117 A951).
51. J о 1 у, С. R., 97, 45C A883).
52. J os ер h J., Science and Mechanics Publishing Co., Chicago, 111., April 1957.
53. Kahlenbcrg H. H., Trans. Am. Electrochem. Soc, 47, 23—55 A925).
54 К a n d a F. A., King A. J., Russell V. A., Katz VV-, J. Am. Cliem.
Soc, 78, 1509—1510 A956).
55. К i e s s 1 i ng R., Acta Chem. Scand., 2, 707—712 A948).
5C. К о н т о р о в и ч И., Л ь r о r с к и li М., Металлург, 14, 89—98 A939).
57. К г о 1 1 W. J., Met. lud., 22 G3—17 wkly) 323—325 (October 1948).
58. L a u b e n g а у е г А. .1., Hurd D. i NewkirkA. E., HoardJ. L.,
J. Am. Chcm. Soc, 65, 1924 A943).
59 I e ii z lv, W о е к e 1 E., пат. США 2159808, May 23, 1939.
60. L e о n а г d A. S., J. Am. Rocket Soc, № 68 A946).
61. Marshall D. E., Rig rod W. W., Electronics, 20, 122—126 (May 1917).
G2. McCarty L. V., Carpenter D. R., J. Electrochem. Soc, 107, 38
A960).
96 Глава 4
63. М с К i п 1 е у Л . D., пат. США 2463401, March 1, 1949.
64. М i I 1 er G. Т., К г a I i к R. J., В е 1 m ore Е. A., D г и г у J. S., АЕС
Report A/Conf. I5/P/1836, June 27, 1958.
65. М i 1 1 er G. Т., J. Electrocliera. Soc. 106, 815 A959).
66. M о i s s a n H., Ann. chim. et phys., 6, J6 7, 296 A895).
67. Moss N., Preparation of Boron Coated Ion Chambers, L. С, РВ-91841, 1947.
68. Newkirk A. E., Preparalion and Chemistry of_Elementary Boron, Presented
al Am. Chem. Soc. Meeting, Boston, April 1959.
69. N ies N. P., J. Electrochem. Soc., 107, 817—820 A960).
70. N i es N. P. et. al., пат. США 2832730, April 29, 1958.
71. Norton Company, Tech. Bull., 1958.
72. P i с к а г d M. H., Chem. Eng., 269—272 (February 1950)
73. Pollack W., Cemented Boride Composites for Tool Bits, Armour Research
Foundation, Project N> BG87, 1958.
74. R i с h m о n d 1Л. S., T e I f о r d R. E., Nat. Bur. Stand., T. I. D. 5241,
November 1954.
75 R о с h о w T. G., Production of 891 (Crystalline Boron), AEC Report, A-1791,
1944.
76. Russell V. A., Swift R.. King A. J.. К а п d a E. A.. Methods of
Preparation of Pure Boron, Armed Services Tech. Inform. Agency, MCC-1023-TR-149,
June 1955.
77. Самсонов Г. В., Марковский Л. Я., Успехи химии, 25, Jw 2,
190—237 A956).
78. Sanderson L., Can. Mining J., 139—141 (March 1937).
79. S с h 1 e s i ng cr H. I., Schacffcr G. W., Barbaras G. D.,
W a r t i с k T , Deposition of Pure Boron, AEC, MDDC 1339, August 15, 1944.
M.Schwarzkopf P., G 1 a s e r F. W., Iron Age, 138—139 (April 1954).
81. Shaw W. С Hudson D. E., Danielson G. C, Electrical Proper-
ties of Crystalline Boron, Iowa State College, 380 A953)
82. S 1 e p i a n I., L u d w i g L. R., Trans. AIEE, Б2, 093—698 A937).
83. S p e v а с k J., пат. США 2685501, Aueust 3, 1954.
84. Stare k H. С. пат. ФРГ № S/5856 и пат. ФРГ 936745, December 22. 1955;
S о w a F. J., пат. США 2465989, April 5, 1949 и канад. пат. 493996, June 30,
1953.
85. Stern D. R., Lynds L., J. Electiuclicm. Soc, 105, 676 A958).
86. S t г о k e F. G., The Consolidation of Boron, AECD-2291, 1944.
87. S z a b о St. V. N., Tobias С W., J. Am. Chem. Soc. 71, 1882 A949).
88. T a 1 1 e у С, Metals Rev., 13 (May 1958).
89. T а у 1 о г К. М , Ind. Eng. Chem., 47, 2506 2509 A955)
90. Uno, Irie, Yoshida, Shinohara, J. Sci. Res. Inst. (Tokyo , 47,
216- 222 A953).
91. Van A r k e 1 А., пат. США 1774410, August 6, 1930.
92. W a r m a 1 t z N., Philips Research Repts., 6, J\» 5 (October 1951).
93. Warren B. E., Godfrey T. N.. J. Am. Phys, 18, 1121 A950).
94. W а г t h A. H , 1 he Element Boron, Bull. Maryland Acad. Sci., 3, № 3, 8—9
A923).
95. W a r t i k Т., Apple E. F., J. Am. Chem. Soc, 77, 6400—6401 |1955).
96. W e i n t r a u b E., Trans. Am. Electrochem. Soc, 16, 165—184 A909).
97. W e i n t г a u b E., пат. США 1046043, December 3, 1912 и 1074672, October 7,
1913.
98. W e i n t r a u b E., J. Ind. Eng. Chem., 5, 106—115 A913)
99. Weintraub E., пат. США 1019568, March 5, 1912.
10U. Weintraub E., пат. США 1079G21, November 23, 1913.
Бор 97
101. W e i n t г a u b E., пат. США 1088858. March 3, 1914.
102. Weintraub E., пат. США 1415748, May 9, 1922.
103. Weintraub E., пат. США 1110848, September 15, 1914.
104. Weintraub E., Trans. Am. Electrochem. Soc, 18, 207—210 A910).
105. Weintraub E., Bull. soc. franc, electriciens, 4, 229—230 A924).
106. Weintraub E., пат. США 1019569 и 1019394, March 5, 1912.
107. Wellborn W. W., Preparation of High Strength Shapes from Crystalline
Погол, Atomic Energy Commission Document 2732, October 26, 1949.
108. Wetzel R. Т., King W. E., пат. США 2545866, March 20, 1951.
109. W i s s I e r W. А., пат. США 1602995, October 12, 1926; Field В. Е.,
Franks R., пат. США 1626726, May 3, 1927; Field В. Е., пат. США
1750796, March 18, 1930; W iss I er W. А., пат. США 1774862, September 2,
1930; D e G о 1 у е г A. G., пат. США 2135494, November 8, 1939.
110. W 6 h I e r F., D e v i 1 1 e H. St. C, Ann. chim. et phys., 52, Mb 3, 62 A858).
5.
ВАНАДИЙ
Г. Э. ДАНН, Д. Л. ЭДЛАНД
Н. Е. Dunn, D. L. Edlund, Vanadium Corporation
of. America, New York, N. Y.
ВВЕДЕНИЕ
Ванадий впервые был обнаружен в 1801 г. профессором минералогии
Горной школы в г. Мехико Мануэлем Дель-Рива в свинцовой руде из
Замапаны (штат Гидальго). Из-за способности солей этого элемента стано-
виться красными при нагревании с кислотами Дель-Рива назвал его эритро-
иием. В 1805 г. французский химик Колле-Декости отмстил, что эритро-
ний — это не что иное, как загрязненный хром. С этим утверждением
согласился и Дель-Рива. В 1830 г. Сефстрём обнаружил в шведской желез-
ной руде табергского месторождения этот металл, который он, считая новым,
назвал ванадием в честь скандинавской богини Vanadis, так как соедине-
ния этого металла имели разнообразные красивые цвета. В 1830 г. Вёлер
показал, что эритроний и ванадий — один и тот же элемент. Хотя в 1831 г.
появилась работа Берцелиуса с описанием соединений ванадия, химия
этого металла по существу оставалась неизученной до 1860 г., пока
Роско не произвел обширного исследования ванадия и его соединений.
Серебристо-белый порошок, полученный Роско в 1867 г. восстановле-
нием хлорида ванадия VC12 водородом, был, по-видимому, первым препара-
том довольно чистого металлического ванадия. Попытки других исследова-
телей — Муассана, Элуи, Гольдшмидта, Вейсса и Эйхеля.Прандтля и Блейе-
ра, Руффа и Мартина — получить чистый металл электротермическим
восстаноачением углеродом или алюминотермическим восстановлением пяти-
окиси или трехокиси ванадия оказались безуспешными, так как в конечном
продукте всегда содержалось значительное количество восстановителя
или низших окислов ванадия. Физические свойства чистого металла опре-
делялись по способу Руффа и Мартина экстраполяцией к нулевому содержа-
нию примесей. Так, в 1904 г. Вейсс и Эйхель восстановлением пятиокиси
ванадия мншметаллом получили королек весом около 10 г, состоявший
из серебристо-бачых ромбоэдрических кристаллов с твердостью по минера-
логической шкале около 7. Они поместили ванадий в V группу периодиче-
ской таблицы в подгруппу мышьяка вместе с сурьмой и висмутом, хотя его
следовало поместить в другую подгруппу вместе с ниобием и танталом.
Теперь хорошо известно, что ванадий высокой степени чистоты (> 99%)
является ковким металлом, хотя до последнего времени было принято счи-
тать, что в подгруппу ванадия входят только хрупкие тяжелые металлы.
В 1923 г. Хаитер и Джонс восстановлением VC13 металлическим нат-
рием в стальной бомбе получили тонкий серый порошок мелкозернистой
структуры, содержавший по данным анализа 99,5—100% ванадия. Однако
крупных кристаллов, пригодных для изучения физических свойств вана-
дия, получить не удалось.
В целях поощрения подобных исследований приблизительно с этого
времени был начат выпуск слитков 95%-ного ванадия весом 100 г, содержав-
Ванадий 09
ших в качестве примесей 0,45°о углерода, 0,19% кремния, 0,06% железа,
не больше 1,0096 алюминия, остальное кислород. Из хрупких корольков
металла, полученных алюминотермичсским восстановлением чистой двуо-
киси ванадия алюминием высокой степени чистоты, удавалось изготовлять
такие детали исследовательских приборов, как антикатоды для рентгенов-
ских трубок и наконечники для электродов.
В 1927 г. Марден и Рич [13] сообщили о получении 99,3—99,8°о-ного
металлического ванадия в виде ковких шариков или дробинок диаметром
не больше 9,5 мм по реакции*
V2O5+5Ca4-5CaCl2 —*¦ 2V+5CaO.5CaCI2,
проводимой в стальной бомбе при нагревании до 900—950е в течение 1 час.
Так впервые был получен ковкий ванадий очень высокой степени чистоты,
который поддавался различным видам обработки, в достаточном количестве,
что позволило приступить к изучению его физических свойств. Тогда было
окончательно установлено, что ванадий имеет большее сходство с танталом,
а не с мышьяком и висмутом.
Хотя Ван-Лркелю [24] термическим разложением иодида ванадия
удалось получить металл несколько более высокой степени чистоты, его
способ оказался мало практичным, в связи с чем два последующих деся-
тилетня ковкий ванадий получали главным образом методом Мардена
и Рича в количестве по несколько сот граммов металла ежегодно.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Главный толчок развитию ванадиевой промышленности дали метал-
лургические исследования Шубли A896 г.), Элуи A897г.), АрнольдаA900г.)
и Гийе A904 г.). В 1896 г. французская фирма «Фирмини» выпустила три
броневые плиты из легированной ванадием стали, которые по своей проч-
ности намного превосходили броню из нелегированной стали.
В 1900 г. Арнольд провел в Шеффилде ряд опытов по изучению влияния
ванадия на свойства простой углеродистой инструментальной стали, обнару-
жив при атом значительное улучшение ее физических свойств. Однако в то
время еще не было найдено достаточно крупных ванадиевых месторождений.
В 1905 г. золотоискатель Риза Патрон впервые открыл действительно
мощные месторождения богатой ванадиевой руды в перуанских Андах
(на высоте 4840 м над уровнем моря), которые выявили перспективы про-
мышленного производства тогда еще редкого или полуредкого металла
с учетом почти всех мировых потребностей в ванадии на много лет вперед.
Ванадий — один из самых распространенных рассеянных элементов:
по содержанию в земной коре он занимает 22-е место среди всех элементов.
Хотя ванадий широко распространен в рассеянном виде, известно сущест-
вование нескольких месторождений довольно богатых руд, разработка
которых экономически целесообразна.
* Эту реакцию с образованием соединения СаО • СаС12 не следует принимать
как достоверную. К тому же обычно иа практике применялось иное молярное, а сле-
довательно, и весовое соотношение между кальцием н его хлоридом. Выбор этого соот-
ношения определяется сложной ролью СаС12 в кальциетермическнх процессах вообще
(например, в процессе получения титана из 1Юп). С одной стороны, СаС12 является флю-
сом, улучшающим контакт между реагирующими веществами, с другой стороны, он
облегчает образование более крупных частиц выделяющегося ванадия, так как в рас-
плавленном состоянии частично растворяет СаО (в температурных условиях данного
процесса в СаС12 растворяется более 20% СаО).— Прим. ред.
7*
100 Глава 5
Почти все горные породы и метеориты содержат ванадий в количестве
нескольких сотых долей процента в пересчете на VaO6 или следы ванадия.
Такой же порядок имеет содержание ванадия в каменноугольной золе.
В золе, образующейся от сжигания нефти некоторых месторождений, этот
элемент содержится в количестве, достаточном для его извлечения. Ванадий
можно извлекать также из некоторых асфальтитов, особенно перуанских
и аргентинских, при условии, что будет нагажено использование выделяю-
щегося при их сжигании тепла.
В магнетитах иногда содержится до 1 % V2Ob. Поэтому в случае необхо-
димости можно предусмотреть такую технологию их переработки в доменных
печах, конвертерах и мартеновских печах, которая позволит концентрировать
ванадий в шлаке, пригодном для последующего извлечения этого металла.
Ильменит и другие титановые минералы обычно содержат 0,1—0.3 "о
VJOS, которую сейчас собирают в виде отходов при переработке этих минера-
лов с целью получения двуокиси титана и металлического титана.
В фосфоритах, встречающихся в штатах Лйдахо и Монтана, содержится
0,11—0,45% V2O5. В течение ряда лет пятиокись ванадия извлекают из
отходов переработки этих фосфоритов сернокислотным способом на заводах,
выпускающих фосфорную кислоту и суперфосфаты.
МИНЕРАЛОГИЯ
Установлено существование более 65 минералов ванадия. Среди них
наибольшее значение имеют только следующие.
Первичные минералы. Патронит. Патронит — сульфид ванадия*
26 единственное крупное месторождение которого известно только
в Минасрагра (Перу). Это зеленовато-черный аморфный минерал, обычно
содержащий некоторое количество железа, никеля, молибдена, фосфора
и углерода.
Бравоит. В бравоите (Fe,Ni)S2 кобальт или ванадий замещают никель
и железо. Минерал встречается в небольшом количестве в месторождении
Мннасрагра в виде кубических кристаллов с металлическим блеском, как
у меди, и содержит 25% железа, 15% никеля, 5% ванадия и 45°6 серы.
Сульванит. Сульванит 3Cu2S-VzS5-—бронзово-желтый кристалличе-
ский сульфид, встречающийся только в небольших количествах в Бурра-
Бурра (Южная Австралия) и в штате Юта. Минерал содержит 51% меди,
14?6 ванадия и 35% серы.
Давидит. Давидит** — титаномагнетит из одного южноавстралийского
месторождения, содержащий некоторое количество ванадия.
Роскоэлит. Роскоэлит—ванадийсодержащая слюда 2КгО - 2А1гОз-
(Mg, Fe) О • 3V2O5- 10SiO2 • 4НгО. Этот минерал*** встречается в некото-
рых богатых золотоносных жилах, но наиболее важным источником
являются песчаники в штатах Колорадо и Юта, где он присутствует как
вторичный минерал. Роскоэлит содержит 20% V2O5, 7,5% КД), 14% А1->ОЙ,
2% MgO, 1.5% FeO, 47,5% SiO2.
Другие минералы. Все другие известные минералы ванадия являются
продуктами зоны окисления верхней литосферы п их месторождения
классифицируются следующим образом:
* Возможно, что надо рассматривать как VS2 ( 4 nS).— Прим. ред
*• По составу близок к Fejj+(Fe3+, Ce)oTieOi7. — Прим. ред.
•*• Более точно KV2(OHJ[AlSi?0,0l.— Прим. ред.
Ванадий 10/
Металлические жильные месторождения* в Мексике, в США (шта-
ты Нью-Мексико, Аризона, Невада), в Аргентине, Испании, СССР и Родезии:
Ванадинит Pb, (VO4K ¦ PbCI
Деклуазит 4 (Zn, Си, Pb) О ¦ V2O6 • НгО
Купродеклуазит 4 (Си, Zn, Pb) О • (V, AsJ-A-IIzO
Моттрамит 4 (Си, Zn, Pb) O-V2O5-H^O
Эндлихит Pb4 (V, AsO4K-PbCl
Пситтацинит 4 (Pb, Cu) O-V2O6-2H2O
Месторождения патронита ** в Перу:
Хьюэтит CaO-3V2O5-9H2O
Меланованадит 2СаО-2У2О4-ЗУЮ5
Минасрагрит V2O4 • 3SO3¦ 16Н2О
Фернандинит CaO-V2O4-5V2O5- 14H2O
Синкозит CaO-V2O5-P2O5-5H2O
Паскоит гСаО-ЗУзОб-ПНаО
Урансодержащие песчаники*** в США (штаты Колорадо, Юта и Аризона):
Карнотит KoO-2U03-V205-3H20
Уванит 2UO3 ¦ 3V2O., ¦ 15Н гО
Тюямунит CaO-2UO3-V2O5-4H2O
Роскоэлит 2K2O-2AI2O3-(Mg, Fe) O-3V2OO- lOSiO^IIaO
Ме=эт„т } CaO.3V2O,9H2O
Ваноксит 2V204-V205-8HoO
Фольбортит 6 (Си, Са, Ва) O-V2O5-15H2O
Ферванит 2Fe2D3-2Vo05-5HoO
Россит CaO-V:A,-4H2O
Месторождения в СССР:
Тюямунит"** CaO-2UO3-V2O5-4H2O
Ал ант VoOj-HoO
Ферганит***** 3UO3-V2O5-6H-O
Туранит****** 5CuO-V2O5-2H2O
• Все минералы этой группы являются вападатамн — производными ортова-
надиевой кислоты (H3VO4), и их состав правильнее выражать иначе: ранадииит
Pb.,Cl[VO4]3, деклуазит (Zn, Cu) Pb(OH)[VOJ, купродеклуазит (Си, Zn)Pb(OH)[VO4].
Мотграмит является разновидностью купродеклуазита, бедной цинком, эндлихит —
разновидностью ванадинита, содержащей до 13,5% As2O6, а пситтацинит— наиболее
бедной цинком разновидностью купродеклуазита.— Прим. ред.
** Представление о сложном составе и строении минералов данной группы дают
структурные формулы: хьюэтит CaH2V6O17 ¦ 8Н2О, меланованадит Ca2(V ОLУ^О2],
минасрагрит V^'(OHJ[SO4|3 - 15Н,О, фернандинит — CaViA/[H2Vv04]1o - 4Н2О, снн-
козит Ca(VOJ[PO4|2 - 5Н2О, паскоит Ca2Ve017 ¦ 11Н2О. Как можно видеть, многие
минералы представляют собой соли сложных ванадиевых кислот. — Примрёд.
•** Карнотит — гидратированный калийураинлванадат K2(UO2J(VO4J - ЗН=О.
Уванит — уранилванадат, возможно, (UO2JVBO17 • 15Н2О. Тюячунит — калъцнй-
уранилванадат Ca(UO2J (VO4J; обычно содержит 8 молекул кристаллизационной воды.
Метахьюэтит отличается от хьюэтита (см. выше) лишь оптическими свойствами. Фоль-
бортит — ортованадат меди и щелочноземельных металлов, состав которого точно
не установлен; приводится, например, и такая формула: CuCa(OH)[VO4]. Ферванит —
чистый ортованадат железа Fel"|VO4] • 2Н2О; нз приведенной простой структурной
формулы видно, что составы различаются только по содержанию воды. Россит —
четаваиадат кальция CaV2O6 ¦ 4Н2О.— Прим. ред.
**** Cv. примечание •**- Прим. ред.
***** Или U3O6(VOJn ¦ 6Н,О. — Прим. ред.
* Или Cub(OHL(VO4|,.— Прим. ред.
102
Глава 5
Данные рентгеноструктурного анализа четырех окислов ванадия при-
ведены в табл. 1.
Таблица 1
РЕЗУЛЬТАТЫ 1>КН1ТЕН0С1РУК1 УРНОЮ АНАЛИЗА ОКИСЛОВ ВАНАДИЯ [в]
Сое дине- |
ние
V2O2
v2o3
VOj
V2O5
Кристаллическая
решетка
Простран
ственная
I группа
Кубическая, типа NaCl
Гексагональная, типа
Fe2O3
Тетрагональная, типа
SnO,
D»
Параметры
решетки
4.08
5,43; п=53Л53'
4,54; —; 2,88
11,48; 4,36; 3,55
Число мо-
лекул в
элемен-
тарной
ячейке
ПЕРЕРАБОТКА РУД
Основными рудами ванадия являются патронит, роскоэлит, карнотит
и ванадинит [81: раньше основным его источником были месторождения
патронита в Минасрагра (Перу). Ванадий обычно извлекают после обжига
шихты, составленной из руды в смеси с поваренной солью. В результате
образуется растворимый ванадат натрия, который после обработки раз-
бавленными кислотами переводится в раствор, из которого в дальнейшем
при определенном рН выделяют пятиокись ванадия. Концентрат, содер-
жащий не меньше 80% VeOo, принято называть пятиокисью ванадия, хотя
в нем может содержаться такое количество окислов натрия и кальцин или
одного из окислов, что правильнее его было бы называть гексаванадатом
этих металлов. После повторного растворения концентрата в растворе
соды при такой величине рН, чтобы ванадий находился в пятивалентном
состоянии, добавляют хлорид аммония, при этом осаждается метаванадат
аммония NH4VO3 — белый кристаллический порошок высокой степени
чистоты. Мегаванадат прокаливают дли удаления аммиака и связанной
воды и получают пятиокись ванадия высокой чистоты, пригодную для вос-
становления до металлического ванадия.
Большое разнообразие и сложность соединений ванадия объясняются
его способностью: 1) существовать в пяти валентных состояниях; 2) про-
являть свойства металла и неметалла; 3) образовывать несколько радика-
лов и 4) входить в состав множества комплексных соединений, образовав-
шихся из ванадиевых поликислот (рис. 1). На рис. 2 показана схема основ-
ных химических и металлургических процессов переработки ванадиевых
руд с целью получения химических соединений, ферросплавов и лигатур
ванадия, необходимых для промышленного применения.
ПОЛУЧЕНИЕ ЧИСТОГО КОВКОГО ВАНАДИЯ
В последнее время предпринимались попытки получить чистый,
компактный, ковкий ванадий. О применяемом в настоящее время
методе получения чистого ванадия восстановлением окиси ванадия каль-
цием впервые сообщили Грегори [7], а также Мак-Кечни и Сейболт [12]
на симпозиуме Электрохимического общества по редким металлам в 1950 г.
-ОН
v^— он
О -v^
-ОН
-5|н|
Ортапснпдиеиая
пиелита
О = v^—он
ОртооанаЗиявая
кислота
О = v
О =¦
-он
С]лповападиевая
пиелита
О = V'
О - V,
V-OH
о
О = V'
ЛированаВиевая никлота
- Н,0
/L-- он
v<oh
Пироеанадиееая
кислота
он
о =
он
Тетраванадиевая
кислота
о.»
° °
он
Ванадиевая кислота
О = V^- ОН
О
О = V- ОН
\/
о = v он
Генсаванадиевая
кислота
Рис 1. Взаимосвязь между ванадиевыми поликислотамн [28|.
Патронит
Сульфиды
и окислы ванадия
Перу
V2S5 + nS
Роскоэлит
Ванадийсадержащая
слюда
о песчаниках
CIUAIiui Колорадо, Юта)
2К20-2А1г0,-(Мд,РеH-
3V010S0
Карнотит
Ванадат
калия и
уранила
США (шт.
Колорадо, Юта)
кго-ги 03-v2o5-3H2o
Ванадаты
металлов
fPb,Cu,Zn)
у
Моттрамит
Ванадцнит
Южная Африка,
Аргентина .Мекси -
на,СШД1шт. Аризона
невада), Г.сср
Обтцг,
выщелачивание,
осаждение
понцентрата V2O5
Обжиг,
выщелачивание,
осатдение
концентрата УцО^
Мокрое
или сухое
извлечение
щелочами,
ocnwdeitue V20
Кислотное
выщелачивание,
01,а>ш)енис
в виде наиада •
та жилеза
нлаопа с у
в Mtmmpououu
Алюмшютермичеспое
восствнооление
Аоойнал
восстановительная
плавна с кремнием
е элентропечи
Алюмино-
термичеспое
юсапанааленае
Рис- 2 Схема металлургических процессов переработки ванадиевых руд на феррованадий и ли-
гатуры [29].
Ванадий
105
Метод Грегори
Грегори [7] видоизменил процесс Мардена и Рича [131, заменив
пятиокись ванадия трехокисью, чтобы можно было поддерживать темпера-
туру реакции на уровне 1900° (несколько выше температуры плавления
металла) для получения ванадия в виде мелкого порошка. Реакция по
уравнению
V2O3 |-3Ca —»• 2V -ЗСаО
проводится в атмосфере аргона и инициируется под действием тепла при
1000°. Для реакции требуется 1 моль хлорида кальция и 3 моля ме-
таллического кальция. Из порошка, остающегося после выщелачи-
вания шлака, методами порошковой металлургии изготовляют ковкие
прутки, листы и проволоку. Спекание производят в вакуумной печи, чтобы
предотвратить загрязнение примесями кислорода, азота и водорода. По
данным анализа, спеченный металл имел следующий состав: 99,7—
99.8% ванадия, 0,05% кальция, 0,05% углерода, 0,01% железа, 0,1—0,25°»
кислорода и 0,01—0,015% азота.
Метод Мак-Кечни и Сейболта
Хотя по методам Мардена и Рича [13], Ван-Аркеля [24] и Грегори [7J
можно получать ванадий высокой степени чистоты, малая производитель-
ность и высокая стоимость металла при получении этими методами ограни-
чивали его производство. Метод Мак-Кечни и Сейболта [12] сделал воз-
можным выпуск компактного ковкого ванадия в недоступных ранее мас-
штабах, и ванадий, который прежде был лабораторной диковинкой, стал
металлом больших промышленных возможностей.
В то время как Грегори [7] видоизменил процесс Мардена и Рича,
заменив для регулирования теплоты реакции пятиокись ванадия трех-
окисью, Мак-Кечни и Сейболт [12] добились полноты восстановления
заменой хлорида кальция иодом из расчета 0,1 моля иода на каждый моль
получаемого ванадия. По Мак-Кечни и Сейболту, иод соединяется с каль-
цием при температуре около 425° с образованием иодида кальция, в резуль-
тате чего выделяется 100 ккал/люль тепла, которого достаточно для ини-
циирования главной реакции. При изменении состава шлака за счет обра-
зования иодида кальция образуются корольки металла.
Реакция проводилась в футерованном магнезитом тигле, который
вставлялся в герметичную стальную бомбу со стальной крышкой и медной
Таблица 2
СТЕПЕНЬ ЧИСГОГЫ КОВКОГО ВАНАДИЯ В КОРОЛЬКАХ
V
99,9
99,1
99,0
99,0
99,6
99,8
99,5
Fe
0,06
<0,01
<0,01
<0,01
—
—
—
Si
<),U1
0,01
0,04
U.UlUl
—
Са
<0,005
0,011
0,02.4
0,014
0,015
0,022
0,016
С
0,24
0,23
0,21
0,20
0,29
0,15
0,21
Н
0,002
0,002
0,002
0,010
0,003
N
0,05
0,01
0,01
0,02
0,005
О
0,089
0,029
0,020
0,070
0,029
J06
Глава 5
прокладкой. Бомба нагревалась в высокочастотной печи. Шихта имела
следующий состав: 300 г V2O5, 552 г кальция и 150 г иода, что соответствует
60('о-ному избытку кальция и 0,2 моля иода на каждые 2 моля ванадия.
Средний выход для шихты такого состава составлял около 125 г ванадия,
или 79% теоретического количества. Степень чистоты металла по данным
для ряда плавок указана в табл. 2.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Ковкий ванадий регулярно производится фирмами «Юнион кэрбайд
металс» и «Вэиэдиум корпорейшн оф Америка» иодио-кальциевым или
видоизмененным иодно-кальцисвым методом сотнями килограммов в сутки
и имеется в продаже в виде корольков, слитков диаметром до 150 мм и по-
ковок. Металл, полученный восстановлением, имеет следующий состав (%):
V
>9У
6
с
0.U2—0
К)
Vc
0,01— 0,U8
Si
-0,01
N1
-0,01
Сг
-0,01
0
о
,04
0,
15
0
N
,02 0,
06
0,
н
002—0
,006
Как показал анализ, после переплавки в слитки металл обычно содержит
больше 99,8% ванадия.
В настоящее время в США цена чистого ванадия, полученного восста-
новлением, составляет 66—НО долл. за 1 кг в зависимости от вида и каче-
ства изделий. Хотя эта цена гораздо ниже цены 4000 долл. за 1 кг в 1950 г.,
когда ванадий получали по способу Мардена и Рича, она все еще является
высокой по сравнению с ценами на другие чистые металлы промышленного
значения. Цены на ванадий, очевидно, могут быть снижены при расширении
масштабов его производства, но дороговизна исходного сырья и необхо-
димость строгого соблюдения технологического режима исключают воз-
можность значительного снижения цен. По всей вероятности, в любых
случаях промышленного применения ванадия его высокая стоимость должна
быть оправдана уникальными свойствами этого металла.
ФИЗИЧЕСКИЕ СВОЙСТВА
Все известные физические свойства чистого ванадия указаны в табл. 3.
В настоящее время имеются значения предела прочности и твердости горяче-
катаного и отожженного ванадия, а также ванадия, прокатанного на
Порядковый номер
Атомный вес
Изотопы
Кристаллическая решетка
в интервале до 1550^10°
Постоянная решетки, А
Плотность, г/см3
Температура плавления, °С
Температура кипения, СС
Таблица 3
ФИЗИЧЕСКИЕ СВОЙСТВА ВАН4ДИЯ
23 [22|
50,942 [22J
46. 47, 48. 49. 50, 51, 52, 53, 54. [22,23]
Кубическая объемноцентрированная [20]
3,034 [22]
6,11 [17]
1900±25
I919±2 [11J
3000 [22]
Ванадий 107
Давление пара в интервале 1393 -1609° R 1пр =-121,95.103 r~i —5,123-10-* Г+36,29
(R—газовая постоянная, кал/моль-град;
р—давление, am; Т—температура, СК) [5|
Летучесть при температуре плавления
Удельная теплоемкость при 20—100", кал/г
Скрытая теплота плавления, ккал/моль
Скрытая теплота испарения, ккал/моль
Энтальпия при 25°, ккал/моль
Энтропия при 25 , ккал/моль-грид
Коэффициент теплопроводности, кал /см -сек- град
100=
5Ш°
700°
Удельное электрическое сопротивление, мком-см
20°
30,6°
58,9°
Температурный коэффициент удельного электри-
ческого сопротивления. грид~г
0 100°
0—200'
Термо-э.д.с. по отношению к холодному спаю
<Pt, 0°), мв
100°
200п
400
700°
900"
1000"
Магнитная восприимчивость, э.м.е.
Порог сверхпроводимости, К
Коэффициент линейного расширения, град'1.
20—720° (Рентгеновский метод)
200 1000° (Дилатометрический метод)
23 500°
23—900°
2.4 -1100=
Температура рекристаллизации (для холодноката-
ного листа с обжатием на 70%), °С
Модуль упругости, кг/мм'1
Модуль сдвига, кг/мм%
Коэффициент Пуассона
Поперечное сечение захвата тепловых нейтронов,
барн/ащом
Очень низкая [13]
0.120
4
106
1.26
7,05
0,074
0,088
0.084
24,8
25,2
27,4
0,0034
0,0033
0,63
1,56
3,97
9,26
13,97
16,71
1,4-10-е
5,13
(9,7;)-0,3).10-6
8,95-10-»
8,3-10-6
9,6-10-6
10,-1-10 «
1U,9-1O-O
700 800
1,26-10» 1,33-10*
4,73-103
0,36
4,98±0,02
[13|
[16|
116]
[16]
[16]
[19]
[25]
[171
[3]
[17|
[17]
131
[22]
1261
[18]
[17]
[19]
|14, 17]
[10|
110]
[16|
холоду, предела прочности при повышенных температурах, определенного
при кратковременных испытаниях, и порог хрупкости, установленный
при ударных испытаниях надрезанных образцов. Типичные механические
свойства ванадия приводятся в табл. 4—10. О коррозионной стойкости
ванадия высокой степени чистоты можно судить по данным табл. 11. Ниже
рассматриваются отдельные характеристики нанадия, которые определяют
перспективы промышлениою применения этого металла.
108 глава 5
Кристаллическая структура
В интерваае температур от комнатной до 1550 ± 10° ванадий имеет
кубическую объемноцентрированную структуру. По наблюдениям Сейболта
и Симеона [20], при 1550° происходит полиморфное превращение метал-
ла, хотя никаких данных о структуре новой фазы эти авторы ие приводят.
Температура рекристаллизации
Как сообщил Сейболт [191, температура рекристаллизации холодноката-
ного листа ванадия, обжатого на 70%, лежит в интервале 700—800°.
Плотность и модуль упругости
Плотность ванадия составляет 6,11 г/см3, а модуль упругости равен
1,26-10*—1,33-101 кг/мм*. Величина отношения модуля упругости к плот-
ности показывает, что ванадий можно применять как конструкционный
материал.
Электрические свойства
Удельное электрическое сопротивление ванадия при комнатной темпе-
ратуре равно 24,8 мком-см; его температурный коэффициент в интервале
0—200а составляет 0,0033 мком-см/'град. Следовательно, электрическое
сопротивление ванадия значительно выше, чем у меди или алюминия.
Металлический ванадий плохо проводит магнитный поток; его удельная
магнитная восприимчивость равна 1,4- Ю~в.
Тепловые свойства
По сравиеиию с другими металлами ванадий плохой проводник тепла:
его коэффициент теплопроводности в интервале температур 100—500°
составляет 0,074—0,088 кал/см-сек-град. Коэффициент теплопроводности
железа при 20г равен 0,18, а меди 0,94 кал/см-сек-град. Удельная теплоем-
кость ванадия при 20—100° равна 0,120 кал/г-град. Коэффициент линейного
расширения ванадия мал и в интервале 200 -1000° равен 8,95- 10~в. Коэффи-
циент линейного расширения железа и меди при 20° равен соответственно
11,7-10-° и 16,5-10е.
Механические! свойства
На механические свойства технически чистого (нелегированного, вос-
становленного кальцием) ковкого ванадия существенное влияние оказывает
изменение содержания неметаллических элементов — кислорода, азота,
водорода и углерода. Более высокое содержание этих примесей в металле,
полученном восстановлением кальцием, приводит к увеличению почти
вдвое предела прочности при растяжении по сравнению с иодидным вана-
дием в отожженном состоянии. Это видно из данных о прочности и твердо-
сти, приведенных в табл. 4 для нескольких плавок горячекатаного или
холоднокатаного и затем отожженного или гомогенизированного ванадия.
Если требуется ковкий металл, то общее содержание кислорода и азота
ие должно превышать 0,259-й; однако для того, чтобы процесс обработки
Сыл выгодным с экономической точки зрения, содержание кислорода и азота
должно быть ниже 0,1596.
Ванадий почти не подвержен наклепу и способен выдерживать боль-
шое обжатие в холодном состоянии без промежуточного отжига. Холодная
Таблица 4
Предел прочности при растяжении подвергнутого горячей или холодной обработке и отожженного
металлического ванадия
с
0,024
0,08
0,05
0,07
0,09
0,06
0,06
0,10
0,047
0,045
0,13
0,17
0,П75
Содержание
О
<А0Ю
0,015
0,08
0,08
0,06
0,08
0,10
o,oq
0,07
0,(Lй
0,045
0,031
0,032
тримесей, %
11
0,001
0,006
0,008
0,004
0,006
0,004
0,005
0,007
0,0043
0,0028
0,0043
0,0021
0,0025
N
0,005
0,02
0,04
0,04
0,04
0,05
0,05
0,07
0,052
0,047
0,0072
0,026
0,0009
Условия
обработки
а
6
г
г
г
г
г
г
д
д
е
ж
а
Предел те-
кучести,
кг/мя*
9,3=
16,1"
29,4
44,1
39,2
36,4
44,8
44,8
38,8=
31),1в
33,5"
38, бп
34,0"
Предел проч-
ности при
растяжении,
кг,'мм%
20,1
26,3
38,5
48,7
44,5
42,2
46,5
52,2
47,6
58,4
39,2
43,2
40,9
Относитель-
ное удлине-
ние (на дли-
не 25 мм),
п/
38,3
33,7
32
32
36
34
38
26
34
24
41,5
37
33
Сужение
поперечного
сечения, %
95
36,7
72
66
68
69
82
68
68
50
78,5
79,0
80,5
Твердость
по Рок-
веллу
А21
А 38
В71
В 78
В 75
В 79
В81
В 77
—
Литера-
тура
11
11
2
2
2
2
2
2
4
4
10
10
10
а Переплавленный в дуговой печи слиток подидноги ванадия диаметром 19 мм после холодной ковки до диаметра 11,1 мм, выдержки при 1100г
в течение 48 час н охлаждения с печыо.
" Переплавленный в дуговой печи слиток, полученный из восстановленного кальцием ванадия, послр прокагкн при 4A0" до степени обжатия 45%,
выдержки при 900° в течение 5 час и охлаждения с печыо.
в Остаточная деформация о'2-
г Слиток квадратного сечения со стороной квадрата 50 мм, полученный из восстановленного кальцием ванадия, после горячей прокатки при 800°
п охлаждения с печью.
д Переплавленный в дуговой печк слиток квадратного сечения со стороной квадрата 50 мм, полученный из восстановленного кальцием ванадия,
после горячей прокатки прн 800° и охлаждения с печью.
е Горячепрессованный прн 1100—I ISO3, затем холоднокатаный до степени обжатия 63% н отожженный в течение 1 час при 900-450°.
ж То же, что я «е>, но холоднокатаный до степеии обжатия 50%.
3 То же, что я «м но холоднокатаный до степени обжатия 47%.
" Верхний предел текучести
no
Глава 5
Таблица 5
НЛПЯНПЬ ТЕМПЕРАТУРЫ ОТЖИГА НА ПРЕДЕЛ ПРОЧНОСТИ ПРИ РАСТЯЖЕНИИ
И КОВКОСТЬ ХОЛОДНОКАТАНОГО И ОТОЖЖЕННОГО МЕТАЛЛИЧЕСКОГО ВАНАДИЯ [2]
Толщина
полосы,
мм
1,524
0,6?5
A,356
Содержание
С
U,14
A,14
0,14
0,14
0,12
0,12
0,12
U,12
0,12
0,12
о
0,15
0,15
0,15
0,15
0,10
0,10
0,10
0,10
0,10
0,10
примесей,
Н
0.001
11,001
0,001
0,001
0,003
0,003
0,003
0,003
11,01K
0,003
%
N
0,08
0,08
0,08
0,U8
0,13
0,13
0,13
0,13
0,13
0,13
Уел odii я
обработки
а
6
в
г
6
в
г
б
в
г
Предел проч-
ности при
растяжении,
кг, лж2
79,0
72,5
53,5
50,3
71.8
55,1
52,2
77,8
49,5
47,5
Относитель-
нее удлине-
ние на дли-
не 50 мм, %
5
14,5
25
28
й
22
24
4
22
24
a В холоднокатаном состоянии до степени обжатия 75%.
Холоднокатаный и отожженный в течение 15 мин при 600° в ваиууме.
и Холоднокатаный н отожженный в течение 15 мин при 800° в вакууме.
г Холоднокатаный и отожженный в течение 15 мин при 915° в вакууме
прокатка с обжатием выше 90% без промежуточного отжига не является
необычной. В табл. 5 приводятся значения предела прочности и относитель-
ного удлинения холоднокатаного и отожженного при различных темпера-
турах ванадия из нескольких плавок.
Металлографические исследования показали, что рекристаллизация
происходит приблизительно при 800°. В зависимости от степени деформа-
ции ванадий рекристаллизуется при температуре около 800—1000°. По-
скольку ванадий имеет большое сродство к кислороду и азоту, испытания
образцов при высоких температурах проводились в инертной атмосфере.
Результаты механических испытаний при высоких температурах в атмосфере
гелия приводятся в табл. 6.
Таблица 6
МЕХАНИЧЕСКИЕ СВОЙСТВА ГОРЯЧЕКАТАНОГО МНТЛЛЛ11ЧЕСКО1 О ВАНАДИЯ
ПРИ РАЗЛИЧНЫХ ТНМ11НРАТУРЛХ
Содержание применен, %
С О
0.OG2
0,085
Н
0,0068
N
Темпера-
тура ис-
пытании а,
°С
0,11 22
400
600
800
1000
Предел проч-
ности при
растяжении,
кг/ммя
63,8
69,4
28,0
16,2
5,0
Относитель-
ное удлине-
ние на дли-
не 25 мм, %
22
19
38
36
5U
Сужение
попереч-
ного се-
чепии, %.
48
58
87
89
>99
а Испытания проводились в атмосфере гелия.
Ванадии
lit
Браун [2] отмечает, что при нагреве вплоть до 400° прочность ванадия
повышается незначительно. Он сообщает, что при 600° ванадий по своей
прочности несколько превосходит нержавеющую сталь типа 304. При тем-
пературах 600- ШОСР прочность ванадия примерно такая же, как и у не-
ржавеющей стали типа 304.
Лумис и Карлсон [11] исследовали интервал температур перехода из
хрупкого d вязкое состояние для нелегироваиного ванадия при механических
испытаниях на растяжение иодидного ванадия @.024V6 углерода, 0,005%
азота, <0,010"о кислорода, 0,001% водорода, <0,02% хрома, железа и крем-
ния) и восстановленного кальцием ванадия @,08% углерода, 0,0296 азота,
0,015°о кислорода, О,ОО6°6 водорода, <0,02% хрома, железа и кремния)
при температурах испытаний от 20 до —179°. Они сообщают, что темпера-
тура перехода для иодидного ванадия равна —110°, а для восстановленного
кальцием ванадия —65\ Полученные результаты приведены в табл. 7.
Лумис и Карлсон [11] изучали влияние намеренно вводимых приме-
сей водорода, кислорода, азота и углерода на температуру перехода вана-
Таблица 7
МСХАНИЧЕСКМЕ СВОЙСТВА ИОДИДНОГО И ВОССТАНОВЛЕННОГО КА.ЧЫЦНЕМ ВАНАДИЯ
ПРИ КОМНАТНОЙ II НИЗКИХ ТЕМПЕРАТУРАХ
Температура
11111Ы1 .1Н11Й,
-С
Относитель-
ное.1 удлине-
ние на длине
2т> мм, %
Сужение
поперечного
сечении, %
Предел те-
кучести
(с"), кг,мА№
Предел прочно-
пи при рлстн-
жении. кг/мм?
Тип разрушения
И о д и д н ы й б а н а д и fi a
2A
0
- 20
-4U
-60
-80
-1011
ПО
120
-I 111
150
-179
22
— 32
-55
- 71
-90
-1U5
-132
38,3
37,1
38.7
35,2
32,9
38,6
39,2
23,0
2,0
4,2
13.4
17,4
В а н а д и f
35,3
33,7
34,4
2,9
1,7
2.4
1,3
95,0
95,0
95,0
95,0
95,0
95.0
95,0
18,8
8,7
11,9
18,8
30,2
, a oc
51,0
36,7
26,3
1,2
1,6
3,2
0,8
9.2
11.1
14,7
11,4
14,9
13,9
17,5
27,4
21,5
27,2
39,0
40.7
становлении и
16,1
18,9
19,7
16,1
21,7
38,2
—
20,1
20,7
22,4
20,7
25,1
25,5
28,5
30,4
41,1
41,6
42.8
43.9
кальциег»
26.3
34,9
34,8
32.1
35,9
42,8
46.8
Вязкое
j,
в
7>
Л
у,
»
Полувязкое
Скалывание
»
Полувязкое
»
б
Вязкое
»
Скалывание
*
а Слнтки диаметром 19 мм, прокатанные до диаметра 11,1 мм н подвергнутые ре кристалли-
зационному отжигу при I 100° в течение 4 8 час в вакууме; твердость по Роквеллу Н 21.
б Слиткн весом 400 г, прокатанные в нагретом спстшшии D00°) до степени обжатия 45%
н подвергнутые рекристаллизационному отжигу при 900° в 1ечецне 5 час в вакуумной печи; твер-
дость по РиКвеллу R 38.
112
Глава 5
Таблица 8
ВЛИЯНИИ ПРИМЕСЕЙ ВОДОРОДА, КИСЛОРОДА, АЗОТА И УГЛЕРОДА
НЛ1ТНМПЕРЛ1УРУ ПЕРЕХОДА ИЗ ХРУПКОГО В ВЯЗКОЕ СОСТОЯНИЕ
ДЛЯ МЕТАЛЛИЧЕСКОГО ВАНАДИЯ
Сорт металла
Температура
перехода, °С
-ПО
-70
23
23
-ПО
-70
- 40
-25
105
-пи
-70
25
315
ПО
- 70
-80
-47
-45
Тип испытания
Растяжение
Изгиб
>
»
Растяжение
Изгиб
»
»
Растяжекие
Изгиб
»
Растяжение
Изгиб
Твердость
по Роквеллу
«а
21
38
21
38
45
46
55
21
38
58
68
21
38
43
44
42
Иодидный ванадий + 0,001 %
водорода
Восстановленный кальцием ва-
надий+0,006% водорода
Иодидный ванадий—0,010% во-
дорода
Иодндный ванаднй-|-0,027% во-
дорода
Иоднднын аанадий-^0,010%
кислорода
Восстановленный кальцием ва-
надий-(-0,0150о кислорода
Восстановленный кальцием ва-
наднй+0,065% кислорода
Восстановленный кальцием ва-
наднй-(-0,1159о кислорода
Восстановленный кальцием ва-
надий т-0,215% кислорода
Иодидный аанадий-(-0,005%
азота
Восстановленный кальцием аа-
надии+0,О21Чо азота
Восстановленный кальцием ва-
надий-(-0,23% азота
Восстановленный кальцием ва-
надий—0,44% азота
Иодидный ванадий-|-0,024% уг-
лерода |
Восстановленный кальцием ва-
надий-(-0,09% углерода
Восстановленный кальцием ва-
надий-|-0,10% углерода
Восстановленный кальцием ва-
надий-|-0.19°; углерода
Восстановленный кальцием ва-
надий—0,29% углерода
дня из хрупкого в вязкое состояние при испытаниях на растяжение и изгиб
(образцы 6,35 X 9,52 : 57,15 мм при базе испытаний, равной 50 мм).
Результаты испытаний приведены в табл. 8.
Клаф и Павлович 14] также сообщают результаты испытаний на растя-
жение (образцы с диаметром расчетиой части 5—6,4 мм и длиной 25 мм)
и ударную вязкость, проведенных на образцах из двух партий слитков
восстановленного кальцием ванадия (слитки диаметром 50 мм холодно-
катаного и отожженного при 800° в атмосфере аргона металла) с целью
Ванадий
113
Таблица О
ТЕМПЕРАТУРА ПЕРЕХОДА ИЗ ПЛАСТИЧНОГО СОСТОЯНИЯ В ХРМЖОЕ ДЛЯ КОВКОГО
ВАНАДИЯ, ОПРЕДЕЛЕННАЯ ПО РЕЗУЛЬТАТАМ МЕХАНИЧЕСКИХ
ИСПЫТАНИЙ НА РАСТЯЖЕНИЕ
Пруток
А
л
А
А
А
А
л
В
В
Температура
нспытзннй* СС
20
Комнатная
0
-40
-78
-140
-196
Комнатная
-78
Предел текуче-
стн «70 2).
кг/MAfi
25,9
38,8
42,0
47,3
55,3
77,0
124, G
¦30.1
49,0
Предел проч-
ности при растя-
жении, кг/ммЪ
40,0
47,6
49,8
51,0
59,9
79,8
124,6
41,7
58,4
Относительное
удлинение на
длине 25 мм, %
39
34
30
26
20
8
0
40
24
Сужение
поперечного
сечения, %
¦ 75
68
65
57
45
18
0
74
50
Таблица 10
ТЕМПЕРАТУРА ПЕРЕХОДА ИЗ ВЯЗКОГО В ХРУПКОЕ
СОСТОЯНИЕ ДЛЯ КОВКОГО ВАНАДИЯ,
ОПРЕДЕЛЕННАЯ ПРИ ИСПЫТАНИИ НА УДАР
по шарпи на Образцах прутков в
С V-ОБРАЗНЫМ НАДРЕЗОМ
Темпер.] I ура испыта-
ний, "С
Ударная иязкоегь, кгм
150
140
135
13A
125
100
30
-80
28—30
28—3U
28- 30
2,3; 2,1; 30
2,1
1,6
1,6
0,7
Химический состав
Примегь
Углерод
Азот
Кислород
Водород
Содержание примеси.
пруток А
пруток В
0,047
0,052
0,07
0,0043
0,045
0,047
0,048
0,0028
определения температуры перехода из хрупкого в вязкое состояние Эти
результаты -риведены в табл. 9 и 10.
Температура перехода для прутка А по результатам испытаний на
растяжение составляет ниже—78°, а для прутка В по результатам испытаний
на ударную вязкость по Шарпи образцов с V-образным надрезом равна 125°.
8 Заказ Us 239
114 Глава 5
ХИМИЧЕСКИЕ СВОЙСТВА
Ванадий, элемент с порядковым номером 23, находится в одной под-
группе V группы периодической таблицы с ниобием и танталом, тогда
как по своему атомному весу, равному 50,942, он помещается в горизон-
тальном ряду между титаном и хромом. Пирсон 115] утверждает, что по
реакционной способности ванадий занимает среднее положение между
титаном и хромом. Характерно, что ему присущи свойства элементов обеих
подгрупп активной V группы: он существует в различных валентных со-
стояниях и одинаково легко образует как основные, так и кислотные ради-
калы, которые могут быть центральным атомом в поликислотах совместно
с большей частью элементов IV. V, VI и VIII групп периодической таблицы.
Элементы обеих подгрупп имеют сходство, особенно по своим химическим
свойствам. Все элементы группы образуют окислы типа R2OS, обладающие
сильными кислотными свойствами в случае элементов с малым атомным
весом; по мере возрастания атомного веса кислотный характер окислов
уменьшается.
Если металл нагревать на воздухе, он окисляется с образованием окис-
лов различного цвета: коричнево-черного V2O3, сине-черного V2O4 и красно-
оранжевого V2O5. В токе хлора при 180° ванадий реагирует с ним непосред-
ственно, образуя тетрахлорид ванадия VC1-; при высокой температуре
ванадий непосредственно взаимодействует с азотом с образованием нитрида
VN, а с углеродом — с образованием карбида VC. Ванадий ие растворяется
ни в соляной, ни в разбавленной серной кислотах, но растворим в азотной,
плавиковой и концентрированной серной кислотах. Растворы щелочей
действуют на ванадий слабо, но расплавленные щелочи легко реагируют
с ним с образованием растворимых в воде ванадатов, при этом выделяется
водород.
Пятиокись ванадия, или ванадиевый ангидрид, V2O5 — наиболее
важный окисел, из которого получают почти все ванадиевые соединения.
Техническая пятиокись ванадия обычно содержит 85—94% V2Oft, 6—11%
Na2O и 2—396 прочих примесей, попадающих обычно из руды при щелочном
или кислотном выщелачивании и осаждении серной кислотой по следую-
щей реакции:
6NaVO3-| 2H2SO4 —> Na2H2V6O17 '-2Na2SO4-f H2O.
Метаьанадат Гексааакидат
натрия (раство- натрия (осаж-
рим в воде) дается при
рП 2-3)
Если осаждение проводится ступенчато [271, то вместо комплексного вана-
дата натрия осаждается пятиокись ванадия по следующей реакции:
6NaVO3+3H2SO4 - - ЗУ2О3 3Na2SO4-f ЗН2О.
Пятиокись
влнлдня
(осаждается
при рН 1 3)
Свежеосажденная V2O5 (вернее, гексаванадат натрия) легко раство-
ряется в растворах щелочей, из которых при добавлении избытка хлорида
аммония осаждается в виде метаванадата аммония NH4VO3. После филь-
трования, промывки, тщательного высушивания и прокаливания для удале-
ния аммиака получается пятиокись ванадия очень высокой степени чистоты.
Ванадий НИ
Реакция протекает по следующей схеме:
2NaVO3-f-2NlI4Cl —> (NH3J-H2O-V2O5-f2NaCl
или
2NH4VO3.
Растворимость 3% в холодной и 10% в кипящей воде.
Теоретический состав метаванадата аммония следующий: 77,74% V2O5,
14,56"о NII3, 7,70% Н2О.
Путем сплавления пятиокиси ванадия с соответствующим числом молей
едкого натра можно получить следующие водорастворимые ваиадаты натрия:
V2O5 f 2NaOH -> 2NaVO3 + нгО,
Метаванадат натрия
\'.,ОЪ I INaOH — > Na4V2O7 - - 2Н2О,
Пировападат натрия
V2O5+6NaOH —> 2Na3V'O4 + знгО-
Ортованадат натрия
При действии на раствор пятиокиси ванадия в серной кислоте сернистого
газа образуется ванадилсульфат*, который кристаллизуется из раствора
в виде красивых синих кристаллов:
V2O5 H2SO4+SO2 —> V2O2(SO4J+H2O.
Ванаднлсульфат
Эта реакция применяется для аналитического определения ванадия. При
этом в качестве восстановителя чаще всего берется двойной сульфат желе-
за^ Ij и аммония (соль Мора); избыток восстановителя разрушается затем
персульфатом аммония, а ванадилсульфат оттитровывается перманганатом
калия:
5V2O2(SO4JH 2KAlnO4-t- 22H2O —> 10H3VO4+K2SO4-|-2MnSO4-f 7H2SO4.
Ортованадневая
кислота
Пятиокись ванадия в смеси с углем при температуре красного каления
можно хлорировать:
V2O5 -ЗС+ЗС12 —> 2VOC13 -t- ЗСО.
Окситрихлорид
аииадич
(т. кип. 127,2")
Ацетат, цитрат, линолеат, олеат, оксалат, пальмитат, фенолят, рези-
нат и стеарат ванадия — примеры органических соединений ванадила,
в то время как ванадаты таких металлов, как висмут, кадмий, кальций,
хром, кобальт, медь, железо, свинец, магний, марганец, молибден, никель,
калий, серебро, натрий, олово и цинк, приготовляются для специальных
целей, главным образом для применения в качестве катализаторов или
в промежуточных процессах при очистке рудных концентратов.
Коррозионная стойкость
В табл. 11 приводится скорость коррозии металлического ванадия
в различных агрессивных средах. Кинцель [9], характеризуя общую кор-
розионную стойкость ванадия, указывает, что металл обладает высокой
• Этому сложному катиону обычно приписывают состав VO'+. Он рассматри-
вается как производное окиси четырехвалентного ванадия (VO2) и образуется при
растворении VO2 в кислотах.— Прим. ред.
8»
116
Глава
5
Таблица 11
КОРРОЗИОННАЯ СТОЙКОСТЬ МЕТАЛЛИЧЕСКОГО ВАНАДИЯ
Корродирующая среда
Соляная кислота б
Соляная кислота б
¦Соляная кислота "
Соляная кислота г
Серная кислота б
Серная кислота в
Серная кислота
Фосфорная кислота
Азотная кислота
Раствор хлорного же-
леза и поваренной
соли
Поваренная соль
Морская иода д
Промышленная атмо-
сфера
Концентра-
ция, %
10
20
20
37
10
10
10
85
Разбавлен-
ная или
концентри-
рованная
5 FeCI3
и 10 NaCl
20
—
Температура
испытаний.
"С
70
70
70
Комнатная
70
70
Соответст-
вующая
кипению
Го же
Комнатная
»
—
—
Скорость кпррпзии ванадия, мм/месяц
литой
_
0,191
—
—
—
—
0,122
—
Образец
растворяется
прокатанный
0,018
0,142
0,312
0,074
0,017
О,Ш9
0,079
Образец
растворяется
То же
1,83
—
—
Не корро-
дирует
—
—
отожжен ныйа
0,019
0,114
0,140
0,066
0,015
0,009
0,091
Образец
растворяется
То же
1.90
Не корро-
дирует
О.ОЮе
Слабо
окисляется
3 Прокатанный металл отожжен в течение 30 мин dph 900° в вакууме.
б Бгфботиров.шие воздуха через растнор.
в Барботирование азота через раствор.
г Раствор, не насыщавшийся ни воздухом, ни азотом.
л Эти данные, по-вндимому, ненадежны
с Потенциал морской воды по отношению к каломельному электроду составляет 0,2 [ в.
стойкостью к действию восстановительных кислот при умеренных концентра-
циях и разъедается в окислительных кислотах. Нелегированный ванадий
устойчив против точечной коррозии в струе солевого раствора и в мор-
ской воде.
Шлейн, Канахан и Лчерман 118) сообщили о коррозии чистого метал-
лического ванадия в имитированной океанской воде и в серной, соляной
и азотной кислотах различных концентраций. Они приводят также данные
по гальванической коррозии металлического ванадия в имитированной
океанской воде одного и в паре с такими металлами, как нержавеющая
сталь, медь, алюминий, магний и сталь SAE 4130.'Эти данные приводятся
в табл. 12 и 13. Ванадий устойчив против коррозии в имитированной океан-
ской воде, 60S6-noft серной кислоте и 20%-ной соляной кислоте при 35е.
Он устойчив против коррозии в 3°о-ной азотной кислоте, слабо корродирует
в 12So-iioii азотной кислоте и очень быстро разрушается в 17%-ной азотной
Таблица 12
КОРРОЗИОННАЯ СТОЙКОСТЬ МЕТАЛЛИЧЕСКОГО ВАНАДИЯ ПРИ 35°
Корродирующая среда
Имитированная
екая вода
Серная кислота
Соляная кислота
Азотная кислота
Концентрация
1.0 н. D,8%)
3.1 н. A3,9?о)
17,8 н. E8,8%)
17,8 н. E8,8%)
17,8 п. E8,8%)
1 н. C,6%)
2 н. G.1%)
6,1 н. B0,2%)
6,1 н. B0,2%)
6,1 н. B0,2%)
0,5 н. C.1%)
I 2 н. A1,8%)
3 н. A7,2%)
3 н. A7,2%)
3 н. A7,2%)
Продолжи-
тельность
испытаний,
сутки
30
6
6
6
6
6
Скорость коррпэии, мм/год
6
6
6
6
6
6
6
6
6
6
0,015
0,254
0,14
0,127
0.122
0,0254
0,0686
2,489;
0.518
57.65
0,279;
1.01G
природ-
ная
аэрация
0,0051 0,010
0,015
0,03
0,099
0,076
0,118
0
и,015
0,254
0,099
0,081
0,113
0,013
0,025
0,14
0,109
0,147
0,02
0,472
0.483;
113,54
51,05
34,29
Таблица 13
КОРРОЗИЯ МЕТАЛЛИЧЕСКОГО ВАНАДИЯ В ПАРЕ С ДРУГИМИ МЕТАЛЛАМИ
В ИМИТИРОВАННОЙ ОКЕАНСКОЙ ВОДЕ И В ТОКЕ ВОЗДУХА ПРИ 35°
В ТЕЧЕНИЕ 12 СУТОК
Второй металл галь-
ванической пары
Нержавеющая сталь
типа 316
Нержавеющая сталь
типа 316
Медь
Медь
Алюминий
Сталь SAE 4130
Магнии
Магний
Анодный
металл
Ванадий
Ванадий
Алюминий
Сталь
SAE4I30
Магний
Магний
1 альганиче-
ская корро-
зия (вычис-
лено по току),
мм/год
0
0
0,051
0,051
0,0076
0,076
8,97
9,60
Скорость кпррозин
ваяадня (по потере
веси), мм/год
в паре
0,020
0,0051
0,031
0,018
0
0,0013
0
0
не в паре
0,020
0,0025
0,013
0,0051
0,013
0,018
0,0076
0,023
Скорость коррозии
второго металла
плры (по по i ере
веса), мм/год
в паре
0
0
0
0
0,0025
0,241
17.46
23,4
не в паре
0
0
0,023
0,013
0
0,120
0,89
1,05
118
Глава 5
кислоте. В имитированной океанской воде ванадий является менее бла-
городным металлом, чем нержавеющая сталь и медь, но более благородным,
чем алюминий, магний и сталь SAE 4130. В паре с этими металлами ванадий
разрушается, если вторым металлом является медь, и не поддается корро-
зии в случае таких металлов, как алюминий, магний и сталь SAE 4130.
Имеющиеся данные по коррозионной стойкости ковкого ванадия в рас-
плавленных металлах приведены в табл. 14. Эти данные показывают, что
ванадий имеет большие перспективы как материал для контейнеров.
Таблица 14
КОРРОЗИОННАЯ СТОЙКОСТЬ ВЛНАДИЯ В Р\СП.П\ВЛГННЫХ МЕТАЛЛАХ
Жидкометаллнческая корро-
дирующая среда
Натрий
55,5% висмута, 44,5%
свинца
52% нисмута, 32% свинца,
1С% олова
52,3% висмута, 21,9% ин-
дия, 25,8% свинца
49,5% висмута, 11,6% оло-
ва, 17,6% свинца, 21,3%
индия
57,5% висмута, 25,2% ин-
дия, 17,3% олова
,г>5,5% висмута. 44,5%
свинца
52% висмута, 32% свинца,
16% олова
Натрии (Na2O?)
Натрий (Na,O 0,001%)
Темперл гура
испытаний,
500
619
649
619
649
649
482
649
В13
802
700
Коррозионная стойкость
Литера-
тура
Хорошая коррозионная стойкость;
скорость коррозии
0,2 мг/см'1-месяц
Хорошая коррозионная стойкость;
статические испытания в тече-
ние 500 час
То же
Обычно хорошая коррозионная
стойкость; динамические испы
тания в течение 1008 час; вес
образцов увеличился
Динамические испытания в тече-
ние 1008 нас; скорость коррозии
20 мг/см2-месяц
Тусклый атласно-серый налет;
статические испытания; скорость
коррозии 0,2 мг/см^-.месяц
Тусклый матово-серый налет; ста-
тические испытания; скорость
коррозии- 1,3 ме/см2-месяц
Не разрушается; статические ис-
пытания в течение 288 час; при-
вес 0.10%
16
16
16
16
16
16
16
16
21
21
21
СПОСОБЫ ОБРАБОТКИ
Корольки ванадия, полученные непосредственным восстановлением
окислов ванадия или путем переплавки металла, можно подвергать даль-
нейшей обработке. Исключение представляет металл, получаемый в виде
Ванадий 119
мелкой дроби .Чистый металлический ванадий поддается обработке обычными
способами ковки, прокатки, выдавливания, вытяжки, гибки, штамповки,
прессования, резания и сварки. При горячей обработке и сварке чистого
ванадия необходимо принимать меры предосторожности для предотвраще-
ния его взаимодействия с газами и их поглощения.
Переплавка
Корольки металлического ванадия после восстановления переплавляют
в слитки, из которых удобнее изготовлять бруски, трубы, проволоку,
листы или фольгу. Ванадий может быть переплавлен в дуговой печи с воль-
фрамовыми электродами в охлаждаемой водой медной изложнице в атмо-
сфере аргона или в вакууме. Можно получать слитки диаметром до 150 мм,
а в случае необходимости и большего размера.
Горячая обработка
Поскольку механические свойства ванадия изменяются в присутствии
незначительного количества кислорода и азота или одного из этих газов
при горячей обработке, металл необходимо защищать от окружающей атмо-
сферы. Для этого можно проводить нагревание в инертной атмосфере (очи-
щенный аргон или гелий) или заключать слиток в оболочку из нержавею-
щей стали толщиной 3,2 мм. Устаноапено, что оптимальный температурный
интервал ковки A100 1150е), число проходов и степень обжатия ванадия
подобны тем, которые применяются для аустенитной нержавеющей стали.
Нижний предел горячей обработки ванадия устанавливается в соответствии
с температурой рекристаллизации около 800°, но, поскольку металл не
подвержен наклепу, его можно прокатывать непрерывно вплоть до ком-
натной температуры. Однако следует иметь в виду, что при горячей обработке
в оболочке нижний предел температуры может определяться физическими
и механическими свойствами материала оболочки. Если горячая обработка
производится без оболочки, то после охлаждения до комнатной температуры
ванадий будет покрыт твердой оксиднонитридной пленкой, которую перед
дальнейшей горячей обработкой нужно удалять шлифованием или обработ-
кой резанием, описанной ниже.
Холодная обработка
Хотя ванадий имеет относительно высокую температуру рекристал-
лизации и при обработке ниже этой температуры может быть получено
некоторое преимущество, решающим фактором является то, что при темпе-
ратуре около 300" начинается окисление металла. Однако это не имеет
большого значения, так как ванадий ие подвержен заметному наклепу;
его холодную обработку можно производить даже при комнатной темпе-
ратуре.
Обработка резанием
Кинцель 191 сообщает, что чистый ванадий легко обрабатывается реза-
нием. Хорошие результаты дают резцы, которыми пользуются для обра-
ботки меди, при использовании маловязких смазочно-охлаждающих жидко-
стей, например керосина. Для грубой токарной обточки всухую рекомен-
дуется применять усиленные* резцы, а для чистовой обработки — резцы
* Тупоносые.— Прим. персе.
120 Г лаеа 5
с передним углом 30°, чтобы металл не налипал на резец. Обработку необ-
ходимо производить при умеренной скорости резания легкими резцами.
Для строгания следует применять резцы с усиленной режущей кромкой
и увеличенным передним углом. Для сверления требуются очень малый угол
заточки сверла и низкая скорость сверления. Для нарезки резьбы вручную
или па станке желательно иметь шаг винта.
Сварка
При сварке чистого ванадия, как и при его переплавке или горячей обра-
ботке, металл необходимо защищать от кислорода и азота окружающей
атмосферы. Хорошие результаты были получены при дуговой сварке в атмо-
сфере состоящей из смеси гелия и аргона.
Металлография
Образцы ванадия для металлографического исследования приготовляют
механическим или электролитическим панированием таким же способом,
как все мягкие металлы, которые легко налипают и наволакиваются. При
вырезании металлографических образцов из мягких металлов необходимо
избегать наклепа поверхности образца. При механическом полировании
в качестве смазки применяется полировочная паста в чистом виде или
с добавкой графита 19). «Наплыв» удаляется повторным полированием
или травлением. При электролитическом полировании в качестве электро-
лита рекомендуется применять ледяную уксусную кислоту с добавкой 5—10%
хлорной кислоты при плотности тока 0,155—0,233 а/см2. Хорошие резуль-
таты получены также при использовании в качестве электролита 10%-
hoio водною раствора серной кислоты.
Самым лучшим травителем является концентрированный водный рас-
твор аммиака с добавкой 5—10% перекиси водорода или 10°о соды. Цар-
ская водка и глицерин ПО], а также смесь 1 части плавиковой кислоты,
1 части азотной кислоты и 2 частей воды [16] или раствор для электроли-
тического полирования в 10%-ной соляной кислоте при комнатной темпера-
туре и напряжении 3—6 в также могут быть использованы как травители.
Известны и другие подходящие травители, например 5%-ный водный
раствор серной кислоты или 10%-ный водный раствор щавелевой кислоты,
которые применяются для электролитического травления при комнатной
температуре.
ОБЛАСТИ ПРИМЕНЕНИЯ
Чистый ковкий ванадий лишь сравнительно недавно стали получать
в количествах нескольких сот килограммов в сутки, и возможности его
применения в различных областях еще недостаточно изучены. Ванадий
представляет интерес как материал для ядерных реакторов на быстрых
нейтронах, так как он обладает малым поперечным сечением захвата ней-
тронов, малым поперечным сечением неупругого рассеяния нейтронов, боль-
шой прочностью при повышенных температурах и высокой теплопровод-
ностью. Ванадиевая фольга применяется в качестве подслоя между сталь-
ными и титановыми листами при упаковке чистого титана в стальную
оболочку. Применение ванадия благодаря его уникальным свойствам
в специальных областях вместо других металлов ограничивается его высо-
кой стоимостью, и он применяется лишь в тех случаях, когда его нечем
Ванадий 121
заменить. При существующем масштабе производства ванадия будут найдены
и другие области применения этого металла, обладающего необычным соче-
танием свойств.
ЛИТ ЕРАТУРА
1. Adenstadt Н. К.., Peqiiignot J. R.. R а у га ег J. M-, Trans. Am.
Soc. Metals, 44, 99П A952).
2. В г о w n С. М., Mechanical Properties of High Purily Vanadium, Paper Presented
at Electrochemical Society Meeting, New York, April 16, 1953.
3. С 1 e a r у Н. J., Electrical, Thermoelectric, Hardness, and Corrosion Properties
of Vanadium-Base Alloys, A. E. C, NMI-1161, 1956.
4 Clougli W. R., Pavlovic Л. S., Trans A. S. M., 52, Preprint Ki 125.
5 К d w a r d s J. W., J о h n s t о n H. L.. Blackburn P. E., J. Am. Chem
Soc, 73, 4727 4729 A951).
6. F г а п к 1 i n F. F., Vancoram Rev., 6, № 2 и 4 A947).
7 Gregory F. D., J. Electrochem. Soc, 98, 395 A951).
8. Hutchinson W- S.. Vancoram Rev., 1, 69 -72 A93П).
9. К i n 7 e 1 А. В., Metals Progr., 58, 315 A950).
10. L а с еу С. Е., В ее к С. J., Trans. A. S. M., 48, 579—594 A956).
11. Loom is В. A., Carlson O. N.. Brittle — Ductile Transition in Vana-
dium, A. E. C, ISC 1037, March 1958.
12. McKechnip R. K., Sejbolt A. U.. J. Electrochem. Soc, 97, 311 A950).
13. M а г d e n J. W., Rich M. N.. Ind. Eng. Chem., 19. 786—788 A927).
14. О r i a n i R. Л., Jones T. S.. Rev. Sci. lnstr., 25, 248—25П A954).
15. Pearson W. В., J. Iron and Steel Inst., 164, 149 A950).
16. The Reactor Handbook, Vol. 3, Sect. 1, A. E. С Pub. AECD 3647, 1955, p. 437—449.
17. Research Laboratories, Electro Metallurgical Company, 1953.
18. S с h 1 a 1 n D., К e n a h а п С. В., А с h e r m a n W. L., Corrosion, 16,
70—72 A960).
19. S e у b о 1 t A. U., General Electric Co., частное сообщение, 1953.
20. Seybolt Л. U., Sumsion 11. Т., J. Metals, 5, 292 A953).
21. Smith K- F., Van T h у п e R. J., Selected Properties of Vanadium Alloys
for Reactor Application, A. E. С Pub. ANL 5661, 1957.
22. S m i I h ej 1 s C. J., Metals Reference Book, lnterscience Publishers, Inc., New
York, 1949.
23. Strominger D., H о 1 1 e n d e r J M., S e a b о r g S. Т., Rev. Mod.
Phys., 30, 624—625 A95S).
21. Van Л г к e 1 А. П., Reine Metalle, J. Springer. Berlin, 1939, S. 220.
25. Weeks J. L., Smith K. F., J. Metals, 7, 1010 A955).
26. W e x 1 e г А., С о г а к W. S., Phys. Rev., 85, 85 A952).
27. Пат. США 2551733.
28. A 1 e x a n d e r J., J. Soc. Chem. Ind., 46, 36—37 A929).
29. Vancoram Rev., I, 3 A930).
ВИСМУТ
Г. Э ХОУ
Н. Е. Howe, American Smelling and Refining
Company, South Ptainfield, /Vea; Jersey
ВВЕДЕНИЕ
Висмут, вероятно, не был известен как самостоятельный металл жите-
лям древнего Востока, грекам или римлянам. Однако к началу средневе-
ковья в Европе уже имелись сведения о его специфических свойствах,
а в XV веке Базиль Валентин уже называл его wismul. Один из первых
минералогов Агрикола в конце XVI века называл висмут по-латыни bise-
mutttm. Однако происхождение этого слова точно не установлено. Одни
считают, что слово происходит от bleuiveiss (свинцовые белила) или wismat
(белая масса, металл), другие утверждают, что от wiesen mute — названия
рудников в окрестностях Шнееберга в Саксонии 114, 28].
Поскольку висмут всегда ассоциирован в рудах с другими металлами,
его часто путали с известными в то время металлами, а иногда принимали
за загрязненное олово или серебро, сурьму или разновидность свинца.
И только в средине XVIII века Потт, Жоффруа и Бергман получили вис-
мут в элементарном состоянии.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Содержание висмута в земной коре составляет 0,00002 вес. 96, т. е.
его содержится примерно столько же. сколько и серебра, несколько меньше
олова, но больше золота.
Самородный висмут встречается крайне редко; обычно его находят
в жильных месторождениях ассоциированным с серебром, свинцом, цин-
ком и оловом (Саксония, Боливия, Канада, Англия).
Наиболее важными рудами являются бисмит (висмутовая охра) BijOj,
бисмутинит (висмутовый блеск) Bi2S3, бисмутит и бисмутосферит (карбо-
наты). Небольшие месторождения этих руд найдены во многих странах.
Главным поставщиком висмутовых руд является Боливия. Хотя висмуто-
вые месторождения и были обнаружены в разных районах США, разработка
их ие ведется.
ПРОИЗВОДСТВО ВИСМУТА
Почти повсеместно висмут получают как побочный продукт при плавке
и очистке свинцовых, медных, оловянных, серебряных и золотых руд 116].
Ежегодное мировое производство висмута за последнее десятилетие
по примерным подсчетам составило 900 2175 т. В 1959 г. эта цифра равня-
лась 2355 т. Хотя данные о производстве висмута в США не публикуются,
можно подсчитать, что 40—50% от общего количества приходится на долю
этой страны.
Висмут У?3
Ведущими странами по производству висмута являются США, Перу,
Мексика, Южная Корея и Канада.
Почти весь чистый висмут, добываемый в США, является побочным
продуктом при рафинировании отечественного свинца и ввозимых свинцо-
вых слитков, а также при плавке и рафинировании меди. Главные постав-
щики:
1. «Америкэн смелтинг энд рифаининг компани».
2. «Серро де-Паско купер компани».
3. «Амернкэн металс клаймакс компани».
4. «Юнайтед Стейтс смелтинг, рифаннинг энд майнинг компани».
5. «Интернеишнл смелтинг энд рифаининг компани».
Необходимо отметить, что на этих заводах производится главным обра-
зом очистка свинца, а фирма «Серро де-Паско купер компани» производит
сплавы висмута в Бруклине (завод в Нью-Йорке).
В Перу фирма «Серро де-Паско купер»— самый крупный поставщик;
висмут извлекается как побочный продукт при плавке свинцовых и медных
руд в Орое.
В Мексике висмут также получают как побочный продукт при плавке
медных и свинцовых руд, как, например, на заводе Монтерри фирмы «Аме-
рикэн смелтинг энд рифаининг». Большая часть выпускаемой продукции
экспортируется в США в виде слитков висмута со свинцом.
В Южной Корее висмут добывают в больших количествах из бис-
мутинита. содержащегося в вольфрамовых рудах в рудниках юго-восточнее
Сеула.
В Канаде главным поставщиком висмута является фирма «Кинсоли-
дейтид майнинг энд смелтинг компани оф Канада». Висмут получают при
обработке свинцово-серебряных руд.
ПОТРЕБЛЕНИЕ И ЦЕНЫ |16|
Главные потребители висмута — фармацевтическая промышленность
и предприятия, выпускающие легкоплавкие сплавы.
Органические и неорганические соединения висмута идут на приготовле-
ние лекарств, употребляемых при желудочных заболеваниях, противо-
сифилитических препаратов, а также косметических средств.
До второй мировой войны ограниченное количество легкоплавких
сплавов, содержащих висмут, расходовалось для сигнальных устройств,
разбрызгивающих тушителей и прочей противопожарной арматуры. Еже-
годное потребление висмута в металлургии составляло лишь 25% общего
его количества, но в годы войны эта доля возросла примерно до 55%, после
того как легкоплавкие сплавы висмута нашли применение для различных
целей в авиационной промышленности. В послевоенный период применение
висмута распространилось и на другие отрасли промышленности, так что
к 1950 г. 60% висмута потреблялось в виде металла или сплавов.
В настоящее время цена 1 кг висмута составляет 5 долл.
СПОСОБЫ ПОЛУЧЕНИЯ ВИСМУТА 12, 12, 20]
В настоящее время из месторождений, разрабатываемых специально
для добычи висмутовых руд, поступает лишь незначительная часть потреб-
ляемого металла. Однако висмут можно извлекать из концентратов с высо-
ким содержанием сульфидных и карбонатных руд при восстановительной
плавке с углем в небольших отражательных печах, причем для разложения
124 Глав а_6
сульфидов висмута применяют железо, а дли получения легкоплавкого
шлака добавляют щелочной флюс.
Если висмут присутствует в виде окисла или карбоната в рудах (руды
Боливии и Перу) или в другом металлургическом сырье, то полнее всего
он извлекается из такого сырья выщелачиванием соляной кислотой. Отделе-
ние висмута осуществляют путем осаждения его оксихлорида из солянокис-
лых растворов при разбавлении. Оксихлорид очищают повторным раство-
рением и осаждением с применением железного скрапа для отделения меди.
Упаренный досуха фильтрат сплавляют с известью и древесным углем для
получения технического металлического висмута.
Основным источником висмута, особенно в странах западного полуша-
рия, являются побочные продукты плавки и рафинирования меди и свинца.
Висмут часто встречается в рудах этих металлов и остается вместе с ними
после плавки.
При высоких температурах медного конвертера висмут частично уле-
тучивается и собирается в виде пыли в мешочном фильтре или улавливается
в системе Коттреля вместе с такими элементами, как свинец, мышьяк,
сурьма и т. д., которые затем передаются на операции плавки и рафинирова-
ния свинца. Однако большая часть висмута остается в меди. При электроли-
тическом рафинировании меди висмут накапливается в виде анодного шлама
вместе с примесями свинца, селена, теллура, мышьяка, сурьмы и драгоцен-
ных металлов. В процессе ручной разборки шлама висмут оказывается
сконцентрированным во фракции, содержащей свинец.
Висмут встречается в большинстве свинцовых руд и остается в свинце
после плавки и рафинирования. При переработке свинцовых слитков
на рафинировочных заводах пирометаллургическими способами удаление
висмута достигается только в том случае, если его содержание составляет
выше 0,05%. Миссурийские руды, содержащие незначительные количества
висмута, не перерабатываются. Ниже описаны два наиболее эффективных
пособа отделения висмута от свинца.
Электролитический процесс Беттса
.Аноды из слиточного свинца подвергают электролитическому рафиниро-
ванию в растворе фторосиликата свинца и свободной кремнефтористоводоро-
дной кислоты. Тонкие пластинки чистого свинца служат катодами. Примеси,
содержащие висмут, накапливаются п анодном шламе, который фильтруют,
высушивают и сплавляют. Металл из этой плавки купелируется, а внемут
переходит в свипцово-сурьмяный шлак и глет. Этот шлак восстанавливают
до металла, содержащего не менее 20% висмута, и направляют на висмуто-
вый завод для рафинирования.
Процесс Беттергоиа — Кроля
Этот процесс основан на реакциях, в результате которых образуются ту-
гоплавкие соединения, например Ca3Bi2 и Mg3Biz; эти соединения ликвируют
из расплавленной ванны и снимаются в виде дросса. Обогащенный кальцием
и магнием свинец из предыдущей загрузки добавляют к размягченному
и очищенному от серебра свинцу, содержащему более 0,0596 висмута.
Образующийся при этом дросс снимают, затем смешивают с расплавлен-
ным металлом необходимое количество кальция (в виде свинцового сплава)
и металлического магния. Считок охлаждают и удаляют ликвировавшнй
висмутовый дросс. После этого в слитке остается около 0,02% висмута. Если
Висмут
125
его требуется удалить полностью, то добавляют избыток кальция и магния
и небольшое количество сурьмы.
Обогащенный висмутом дросс плавят в 25-тонных котлах и отделяют
от увлеченного свинца ликвацией. Затем дросс обрабатывают хлоридом
свинца или хлором для удаления кальция и магния. После очистки висмута
от серебра методом Паркса при дальнейшем хлорировании удаляется свинец.
В результате окончательной обработки каустической содой получается
висмут высокой степени чистоты (> 99,995%).
При производстве свинцовых белил электролизом по методу Сперри
висмут извлекается как побочный продукт из анодного шлама.
Процесс кристаллизации
Процесс кристаллизации для концентрирования висмута в свинце путем
вытеснения богатого висмутом эвтектического расплава из затвердевшей
части с высоким содержанием свинца при температурах, близких к темпера-
туре плавления, применяется редко.
ФИЗИЧЕСКИЕ СВОЙСТВА
Висмут представляет собой хрупкий кристаллический металл с силь-
ным металлическим блеском розоватого оттенка. На рис. 1 показаны ромбо-
эдрические кристаллы висмута. Висмут относится к V группе периодической
таблицы; он находится водной подгруппе с фосфорим, мышьяком и сурьмой.
*>>¦
Л
V
Рис. 1. Ромбические кристаллы
висмута.
*?
Висмут — один из немногих металлов (к числу которых относятся
также сурьма и галлий), которые увеличиваются в объеме при затвердева-
нии. Висмут расширяется на 3,32°6 (см. табл. 1).
Теплопроводность висмута меньше, чем у всех других металлов, если
ие считать ртуть.
Висмут — самый диамагнитный металл; его удельная магнитная вос-
приимчивость равна —1,35- 10е.
Под влиянием магнитного поля висмут проявляет наибольшее увеличе-
ние сопротивления по сравнению с любым из металлов (эффект Холла).
Его теплопроводность в магнитном поле уменьшается.
ФИЗИЧЕСКИЕ СВОЙСТВА ВИСМУТА
Порядковый номер
Атомный вес (стабиль-
ного природного изо-
топа)
Атомный объем,
см3/г-атом
Плотность, г/см3
20°
271" (тв.)
271 (ж)
300°
400°
600°
800°
960'
Температура плавления.
:С
Скрытая теплота плав-
ления, кал/г
Сдельная теплоемкость,
кал/г град
20°
271° (ж.)
400°
600°
800
1000°
Температура кипения, "С
Скрытая теплота испа-
рения при 1627J. кал/г
Давление пара, мм ртст.
920'
1120°
1325°
1425"
1500"
Коэффициент теплопро-
водности, кал/см-секград
20"
250°
300"
400
700
Коэффициент линейного
расширения, град'1
83
209
21,3
9,8
9,74
10,07
10.0.3
9,91
9,66
9,40
9,20
271
12,5
0,0294
0,0340
0,0354
0,0376
0,0397
0.0419
1627
204,3
1
10
100
200
400
0,020
0,018
0,041
0,037
0,037
13,310-е
1
Объемное расширение при
затвердевании, %
Поверхностное натяже-
ние, дн/см
300°
500
780°
| Удельное электрическое
сопротивление,
мкпм-см
- 100°
0°
100°
300е (ж )
400°
600°
750°
Кристаллическая решет-
ка
Поперечное сечение за-
хвата тепловых ней-
тронов, барн/атом
Модуль упругости при
растяжении, кг/мм2
Модуль сдвига, кг/мм2
Коэффициент Пуассона
Твердость по Бринеллю
A00 кг, шарик 10 мм.
30 сек)
Ударная вязкость по
Шарпи образца без над-
реза, кгм
18°
66Э
93°
149'
204°
232"
Ползучесть, кг/мм2 (на-
iрузка для скорости
изгиба0,001 мм/мм -час
66°
121"
177°
204"
Таблица I
3,32
376
363
344
75,6
106,8
160,2
128,9
134,2
145,2
153,5
Ромбическая
ао = 4,7457 А,
а = 57°14'13"
0,034±0,002
3220
1260
0,33
7
0,132
0,200
0,400
0,699
0,599
0,599
0,420
0,315
0,245-
0,210-
Висмут
Продолжение табл. 1
Устойчивость металлов по отношению к висмуту
Молибден устойчив до 1110° II Ниобий устойчив до 482°
Тантал устойчив до 900е Алюминий устойчив до 300°
Хроч устойчив до 732" | Никель и сплавы никеля устойчивы до 271°
Бериллий устойчив до 500°
Медь Эвтектика при
Марганец » з
Магний » »
Цинк » »
Платина » »
Олово » »
270°
268"
2603
254=
266°
139 =
Растворимость, %
» »
» п
» <
0,2
0,6
0,54
2,7
1,0
42,0
Примечание: В работе [13] указаны литературные источники для многих приведенных в таб-
лице данных; см. также [7, 0, 22, 23, 26, 28].
Висмут обладает высоким электрическим сопротивлением. Недавно
расплавленный висмут в кварцевой трубке был использован в качестве
нагревательного элемента печи сопротивления. Были достигнуты темпера-
туры выше 1350°. Висмут принадлежит к числу тех металлов, электриче-
ское сопротивление которых в твердом состоянии больше, чем в жидком.
Отношение величин удельного сопротивления в твердом и жидком состоя-
ниях для большинства металлов равно 0.5, тогда как для висмута оно состав-
ляет примерно 2.
Высокий термоэлектрический эффект наблюдается в том случае, когда
висмут сочетается с некоторыми другими материалами. Висмут можно
выдавливать в виде проволоки и пластин, что позволяет использовать
термоэлектрический эффект.
Благодаря малой величине поперечного сечения захвата тепловых нейт-
ронов висмут может иайти применение как теплоноситель и охлаждающая
среда в ядерных реакторах, а также для изготовления окон в медицинских
реакторах.
Висмут образует ряд двойных, тройных и более сложных сплавов с низ-
кими температурами плавления; наиболее распространенные из них часто
называют легкоплавкими сплавами [7, 8, 15, 181. В табл. 2 приведены
эвтектический состав и температура плавления этих сплавов.
Области применения легкоплавких сплавов не ограничиваются эвтек-
тическими составами, так как при изменении состава изменяются темпе-
ратура плавления и физические свойства. Например, сплав 48% Bi, 28,5%
Pb. 14,5% Sn и 9% Sb, широко применяемый для анкерного крепления
матриц, пуансонов и магнитов, удерживающих детали неправильной
формы при механической обработке, не является эвтектическим (интервал
плавления 103—263°).
Изменение температуры плавления и предела текучести, достигаемое
в случае иеэвтектических составов, позволяет применять легкоплавкие
сплавы во многих предохранительных механизмах — предохранительных
клапанах для баллонов со сжатыми газами и цистерн, автоматических
тушителях, противопожарных устройствах и т. д. В табл. 3 приведено
несколько таких сплавов.
Помимо чрезвычайно низкой температуры плавления, сплавы висмута
часто отличаются необычными расширением и сжатием. Прн отливке металла
128
Глава 6
Таблица 2
ЭВТСКТИЧЕСКИП СОСТАВ И ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ЛЕГКОПЛАВКИХ СПЛАВОВ
Система
Ag-Bi
Au_Bi
Cd -Bi
In—Bi
Li—Bi
Mg—Bi
Na—Bi
Pl>—Bi
Sb—Bi
Sri—Bi
Tl —Bi
Zn—Bi
Pb—Sn —Bi
Pb—Cd—Bi
Sn—Cd—Bi
Sn—Zn—Bi
In—Sn—Bj
11—Pb—Hi
Tl—:Sn—Bi
Pb—Sn —Cd—Bi
In—Pb—Sn —Bi
Tl—Sn Cd Bi
In—Cd—Pb—Sn—Bi
Coctjh, %
97.5B1
Я2Ш
GOBi
33,7Bi
67Bi
99Bi
59Bi
97Bi
56,5Bi
Смешивается в жидком н твердом состояниях
57Bi
76.5Bi
47,5Bi
97,3Bi
52Bi; 16Sn; 32Pb
52Bi; 8Cd; 40Pb
54Bi; 2OCd; 26Sn
56Bi; 4Zn; 40Sn
58Bi; 17In; 25Sn
55,2Bi; ЯЗ.ЯРЬ; 11.5T1
42,2Bi; 0,8Pb; 48T1
5'JBi; 35,7Sn; 14.3Г1
44Bi; 31Sn; 25T!
5HBi; lOCd; 13,3Sn; 26,7Pb
49,4Ri; ll,6Sn; 18Pb; 21 In
19.lBi; 18.2Cd; 23.4Sn; 9.2T1
44,7Bi; 5,3Cd; 8,3Sn; 22.6Ph; I9,lln
Эвтрктнчьскай
температура.
2C2
240
144
72
109
243
551
218
125
139
198
188
254
96
92
102
130
79
91
186
124
167
70
57
94,6
47
изменение объема происходит при переходе из жидкого состояния в твердое,
а также благодаря термическому сжатию.
При затвердевании сплавов висмут — свинец и особенно висмут — сви-
нец — олово происходит расширение вследствие изменения структуры
сплава при переходе в твердое состояние.
Это превращение сопровождается выделением тепла, которое легко
обнаруживается. Линейное расширение может достигать 1%. Сплав с со-
держанием около 5696 Bi, 20% Sn и 24% Pb обладает максимальным рас-
ширением, уменьшающимся при изменении содержания составных частей
или прн введении в сплав таких элементов, как кадмии, сурьма или индий.
Например, линейное расширение тройного эвтектического сплава составляет
0,8°о. Превращение в твердой фазе происходит тем быстрее, чем больше
степень расширения. При высоких степенях расширения превращение почти
заканчивается за 20—30 мин. Такое же изменение объема характерно
для системы висмут - свинец с коэффициентом линейного расширения
0,3"и, но в этом случае для достижения максимального значения требуется
несколько недель. Сжатие в процессе охлаждения компенсируется подоб-
Висмут 129
Таблица 3
ИНТЕРВАЛЫ ТЕМПЕРАТУР ЗАТВЕРДЕВАНИЯ И ТЕМПЕРАТУР ТЕКУЧЕСТИ
НЕЭВТЕКТИЧЕСКИХ СПЛАВОВ
14
21
5
48
59,4
52
42,5
48
РЬ
43
42
32
28,5
14,8
31,7
37,7
25,6
Состав, %
Sn
43
37
45
14,5
25,8
15.3
11,3
12,8
Cd
18
_
1
8,5
9,С
прочие
_
—
—
9Sb
—
—
—
4In
Температура, °С
затверде-
вания
163—143
152—120
130—132
263—103
114- 95
92—83
90—70
65—61
текучести а
154
142
135
116
100
90
72
64
а Температура, при которой поивляетси текучесть легкоплавкого сплава, согласно техниче-
ским условиям, установленным «Компрэст гэз мэньюфэкчерэрс ассошиэишн».
иым расширением, что учитывается при захвате инструментов, пуансонов
и различных деталей при механической обработке.
Поскольку висмут — один из трех металлов, которые при затвердева-
нии расширяются, вполне очевидно, что различные сплавы его со свинцом
и оловом неодинаково изменяются в объеме при переходе из жидкого состоя-
ния в твердое. При содержании около 50% висмута в сплаве Bi—Sn
и около 70 % висмута в сплаве Bi — РЬ изменения объема не происходит.
Если необходимо обеспечить точные размеры литья, то изменение
объема, обычни наблюдаемое при отливке, можно регулировать подбором
состава сплавов.
ХИМИЧЕСКИЕ СВОЙСТВА [14, 21]
Висмут, как и другие элементы V группы — мышьяк и сурьма, обра-
зует два ряда соединений, в которых он бывает трехвалентным и пятивалент-
ным. Более распространены соединения трехвалентного висмута.
Окислы] висмута
Висмут почти не окисляется при обычной температуре в сухом и влаж-
ном воздухе, длительние время сохраняя серебристо-белый блеск. При
температуре кипения окисление висмута происходит быстро с образованием
трехокиси.
Трехокись висмута В!гО3 наиболее устойчива; существование других
окислов — четырехокиси Bi2O4 и пятиокиси Bi2Os — находится под сом-
нением*. Окисный минерал бисмит представляет собой трехокись висмута.
* Оба эти окисла в действительности существуют, что, хотя и находится в проти-
воречии со сказанным, ниже признается самим автором. Верно лишь то, что четырех
окись —мало характерный для висмута окисел, н котором, как это принимается в
настоящее время, висмут находится в трех-и пятивалентном состоянии.— Прим ред.
9 Заказ № 239
130 Глава 6
Трехокись можно получить прокаливанием гидроокиси висмута или
нагреванием его основного нитрата на воздухе. На последнем способе
основано промышленное производство трехокиси висмута. Висмут раство-
ряют в горячей азотной кислоте, затем добавляют избыток едкого натра.
При продолжительном нагревании смеси осаждается тяжелый желтый
порошок трехокиси висмута*. Его применяют при эмалировании чугуна
и для росписи фарфора. Хотя трехокись висмута является основным окислом,
в горячем, очень концентрированном растворе едкого кали она проявляет
свойства слабой кислоты.
Четырехокись висмута можно получить окислением трехокиси такими
реагентами, как ферроцианид калия в концентрированном растворе едкого
кали или персульфат аммония в разбавленном растворе едкого иатра.
Пятиокись висмута является ангидридом ие выделенной кислоты НВЮ3.
соли которой в чистом виде не были получены. Эту окись можно получить
в виде пурпурно-красного осадка при окислении трехокиси висмута хлором
или при электролитическом окислении в горячем концентрированном рас-
творе щелочи.
Гидроокись висмута приготовляют так же, как и трехокись, за исключе-
нием того, что из раствора нитрата ее осаждают избытком едкого натра на
холоду.
Галогеииды висмута
Галогениды висмута имеют формулу BiXJ*. Обычно они образуются при
растворении висмута в азотной кислоте с добавлением растворимого гало-
гсннда, например KF. Поскольку соли трехвалентного висмута гидроли-
зуются водой с образованием нерастворимых основных солей, при разбавле-
нии вышеупомянутого раствора будут осаждаться основные соли; например,
ШС13+2Н2О Z?. Bi(OHJCl+2HCl.
Эта обратимая реакция показывает, что направление реакции опреде-
ляется относительным содержанием соляной кислоты и воды. При добавле-
нии воды образуется белый осадок основной соли; при добавлении соляной
кислоты осадок растворяется. При высушивании осадка основной соли легко
отщепляется молекула воды, и образуется практически нерастворимая
оксисоль — хлорид висмутила BiOCl. Большинство других галогенидов
висмута обладает такими же свойствами, что и хлорид. Хлорид висмута
употребляется в производстве пигментов и косметических средств. Бромид
висмута применяется в ветеринарии.
Нитраты висмута
Азотная кислота является лучшим растворителем висмута. При раство-
рении его в концентрированной кислоте образуется нитрат висмута, кристал-
лизующийся в виде Bi(NO3K-5H2O. Подобно другим солям висмута, при
разбавлении раствора иормальной соли будет осаждаться оксисоль состава
Bi2O.vN2O5-2H2O.
Нитрат висмута Bi(NO3K-5H2O получают путем выпаривания концен-
трированного азотнокислого раствора висмута и кристаллизации при
* Получение Bi2O3 нз гидроокиси висмута Ш(ОНK осуществляется через стадию
образования более устойчивой гидроокиси висмутила BiOOH, содержащей одновалент-
ный радикал висмутил ВЮ+; этот радикал образуется в результате реакции
Bi(OHK = BiOOH + Н2О, которая протекает при 100°.— Прим. ред.
** Имеются в виду устойчивые галогениды висмута. Висмут образует и мало-
устойчивые BiCl, BiBr и Bil.— Прим. ред.
Висмут 131
охлаждении. Основной нитрат висмута образуется в результате гидролиза
висмута в растворе азотной кислоты определенной концентрации при
30—70°. В промышленном производстве гидролиз проводится с применением
бикарбоната натрия для поддержания необходимой кислотности. При
гидролизе расходуется строго определенное количество воды; основной
иитраг образуется при перемешивании при температуре 40—50°.
Основной карбонат висмута образуется из основного нитрата. Он
осаждается при добавлении бикарбоната натрия к суспензии основного
нитрата в воде в зависимости от характера суспензии исходного вещества,
количества воды и температуры.
Обе основные соли висмута применяют в фармакологии при лечении
расстройства желудка, воспаления слизистой оболочки кишок и язвы
желудка, а также для того, чтобы сделать пищеварительный тракт непро-
зрачным при рентгеноскопии.
Соединения с серой
Сульфид висмута Ъ\^з встречается в природе в виде бисмутинита
(висмутового блеска). Его можно получить действием сероводорода иа
раствор солей висмута. Сульфид не растворим в холодных разбавленных
минеральных кислотах, но растворяется в горячей разбавленной азотной
и кипящей концентрированной соляной кислотах.
Сульфат висмута из кислиго раствора соли ие осаждается, но при выпа-
ривании этого раствора образуется кислый сульфат В1»E04)з-Нг504-611гО-
Нормальпый сульфат Bi2(SO<K можно получить нагреванием кислого
сульфата при 350°.
Органические соединения висмута
Многие органические препараты висмута применяются для лечения
сифилиса. Такие препараты, как тартрат калия и висмута, тартрат натрия
и висмута, тартрат натрия, калия и висмута и иодовисмутат натрия, раство-
римы в воде. Камфоркарбоксилат и этилкамфорат висмута растворимы
в маслах [10].
Основной галлат висмута — не растворимое в воде органическое
соединение висмута, также применяемое при лечении заболеваний пищева-
рительного тракта [10|.
СПОСОБЫ ОБРАБОТКИ
Плавку висмута осуществляют тем же способом, что и плавку свинца.
Благодаря низкой температуре плавления висмута и чрезвычайно малой
растворимости железа в нем можно применять стальные и чугунные формы.
При 300—400е скорость окисления висмута низкая, поэтому флюсы обычно
не применяют.
Поскольку висмут при обычных температурах хрупкий, его отливкам
чаще всего сразу же придают нужную форму. Расширение при затвердева-
нии отливки приводит к раздутию или вытеснению расплава у летки.
При обычных температурах висмут слишком хрупок для прокатки,
протяжки и прессования, но при температурах около 225° ои становится
более пластичным и допускает штамповку различных видов. Стержни диамет-
ром 25,4 мм можно протягивать в тонкую проволоку диаметром 0,254 мм.
9*
132 Глава 6
Такая проволока достаточно пластична, и ее можно медленно наматывать
вокруг проволоки такого же или большего диаметра.
Для нанесения защитных и декоративных висмутовых покрытий удоб-
нее всего применять электроосаждение висмута из сильнокислого раствора
перхлората. Лучшим исходным веществом для приготовления висмута
высокой степени чистоты считается хлорид.
При электролитическом осаждении висмута на железо рекомендуется
применять раствор NaBiCl4, который устойчив и дает плотный мелкокри-
сталлический осадок. Лучшие результаты были получены при плотности
тока на катоде 2—2,7 а/дм2 с раствором, содержащим 20—100 г/л соли
висмута, 200—300 мл/л соляной кислоты и небольшое^ количество животно-
го клея.
ТОКСИЧНОСТЬ [24]
Токсичность не создает затруднений при производстве висмута. Это
один из наименее токсичных тяжелых металлов; случаев отравления при
работе с висмутом не зарегистрировано.
ОБЛАСТИ ПРИМЕНЕНИЯ
Висмут находит применение в фармацевтической промышленности
(около ЗО°о), в производстве промышленных сплавов (около 60%), а также
в производстве боеприпасов, легкоплавких и алюминиевых сплавов и в ядер-
ной энергетике (около lCo).
В фармацевтической промышленности соединения висмута применяются
главным образом для приготовлении лекарств против желудочных заболева-
ний, сифилиса, а также косметических препаратов.
Промышленные сплавы, обычно легкоплавкие, позволяют регулиро-
вать объемное изменение и находят все более широкое применение для изго-
товления формовочных и вытяжных штампов в авиационной промышлен-
ности; разметочных, монтажных и контрольных приспособлений для
автомобильных и авиационных конструкций; изгибаемых тонкостенных
трубок и профилей; анкеров для штампов, пробойников, механических,
магнитных и керамических частей, а также для крепления ответственных
деталей при механической обработке; сердечников для электролитического
осаждения меди, железа, никеля и других металлов; для покрытия деревян-
ных изделий; для изготовления форм и восковых моделей при точном литье.
Один легкоплавкий сплав нашел применение в резиновой промышлен-
ности для вулканизации неопрена. Неопреновые штамповки длительное
время вулканизуются в ванне из легкоплавкого сплава D2% олова и 58%
висмута) при 205—315°.
Легкоплавкие сплавы используются также для изготовления плавких
предохранителей (предохранительные пробки, сигнальная арматура, автома-
тические головки тушителей, автоматические противопожарные выключа-
тели, а также предохранительные клапаны для цистерн и баллонов со сжа-
тыми газами).
Легкоплавкие припои висмута используются при напайке колпаков
на бронебойные снаряды, поскольку при пайке твердым припоем может
ухудшиться качество стали.
Небольшие добавки висмута к сплавам алюминия, ковким чугунам
и сталям улучшают их механические свойства. Применение висмута (~0,01\)
при отлиБке сталей улучшает их обрабатываемость и позволяет производить
Зал
управления
Скпад горючего и залы пеан
управления, устонов !
1 I пой, I
-----1,
,•-•-•••*
Соль
U.Th.Bi
BL.Th
Реактор
Рис 2. Схема энергетического ядерного реактора на жндкометаллическом топливе.
Б качестве носителя для уранпвого топлива используется висмут; охладитель реактора — жидкий металл; • соль; ¦ уран!
О висмут- , торий- Ч т — чистое топливо; И. т.— использованное топливо; пр. дел,— продукты деления: / — процесс воспро-
изводства; // — топливный прочесе.
134 Глава 6
отливку автомобильных коленчатых валов, шатунов, которые раньше
выковывались.
Легкоплавкие сплавы Bi — Sn и Bi — Cd наносят распылением на
селен с целью образования запирающего слоя в селеновых выпрямителях.
Висмут в виде довольно гибкой проволоки позволяет использовать
такие его свойства, как изменение сопротивления в магнитных полях, изме-
нение напряжения вследствие эффекта Холла, высокая электроотрицатель-
ность в термопарах (самая высокая из известных).
Интерметаллические соединения висмута с теллуром или селеном
являются ценными термоэлектрическими материалами, позволяющими
использовать эффект Пельтье в целях охлаждения Г25]. Материалы для
термопар должны обладать высокой термо-э. д. с, низкой теплопровод-
ностью и небольшим электрическим сопротивлением. Все эти свойства пре-
красно сочетаются, например, в соединениях Bi2Fe3 и Bi2Se3, применяемых
для изготовления полупроводников.
Висмут играет все более важную роль в ядерной энергетике. В реакторе,
работающем на жидком металлическом топливе [3], (см. рис. 2), скон-
струированном в США, расплавленный- висмут используется как теплоно-
ситель (горючее U236 или U233) и как охлаждающий агент. Расщепленный
уран растворяется в жидком висмуте до концентрации 15%. В реакторе
имеется регулятор из незащищенного графита. Жидкий висмут, содержащий
растворенное вещество (U-36 или U333), перекачивается через графитовый
регулятор. Запроектированные параметры таковы, что достигается крити-
ческое состояние и имеет место саморасшеплеине. Тепло, выделяющееся
в результате деления урана, передается жидкому висмуту, который пере-
качивается через раскаленные теплообменники.
Типопой силовой реактор при эксплуатации должен удовлетворять
следующим условиям:
1. Абсолютный нагрев 500 мет.
2. Электрическая мощность 200 мет.
3. Общее количество ядерного горючего @,15% урана, 99,8% висмута)
300 т.
4. Температура горючего на входе 400°,
на выходе 500°.
5. Зона воспроизводства. Дисперсия интерметаллического соединения
висмута с торием в расплавленном висмуте (примерно 10% тория).
Реакторы такого типа имеют следующие преимущества:
1. Отсутствуют элементы твердого топлива, которые требуется удалять,
подвергать какой-либо переработке или переделке.
2. Продукты деления можно удалять в непрерывном процессе.
3. Уран, использованный для деления, заменяется U233, диспергиро-
ванным в тории.
Постоянный магнит [l] (так называемый «бисманол») с высокой коэр-
цитивной силой и большой мощности был изготовлен из MnBi в Лабора-
тории военно-морского . флота США. Порошкообразный MnBi прессуют
при низких температурах C00°) и давлениях G—14 кг/см") в магнит-
ном поле, чтобы установить легкое направление намагничения. Для
этого магнита требовались энергия 4,3- 10е гаусс-эрстед, коэрцитивная сила
3400 эрстед и остаточная плотность потока 4200 гаусс.
Легкоплавкие сплавы использовались для изготовления недолговечных
штампов. Прн охлаждении сплавов в жидком азоте (—195,6°) удалось осу-
ществить чеканку на листовом металле за короткое время B4—48 час). При
охлаждении до—195,6° твердость сплава по Бринеллю возрастала с 9,2 до 45.
Висмут 135
ЛИТЕР АТУ PA
1. Adams E., Hubbard W., S у е 1 е s A., Navord Report № 2440, May 20,
1952.
2. В e t t e г t о n J. O., Lebedeii Y. E., Trans. AIME, 121, 205 A936).
3. Brookhaven National Laboratory, Nuclear Engineering Dept., Nucleonics, 12, Jis 7,
11 A954).
4. С u 1 1 i t у В. D., Trans. AIME, 175, 757 A948).
5. G о о d m a n C, The Science and Engineering of Nuclear Power, Vol. 2, Addison-
Wesley Publishing Company. Reeding, Mass., p. 158, 286.
6. Gruzensky P. M., Crawford W. J-, U. S. Bureau of Mines, Inform.
Circ. №7681, May 1954.
7. H a n s e n M., Constitution of Binary Alloys, 2nd ed., McGraw-Hill Book Company,
Inc., New York, 1958
8. H a u g h t о n J. L., Bibliography of the Literature Relating to Constitutional
Diagrams of Alloys, Institute of Metals, London, 1942.
9. lnternationai Critical Tables, McGraw-Hill Book Company, Inc., New York, 1926.
10. J e n к i n s G. L., Hart ling W. II., The Chemistry of Organic Medicinal
Products, John Wiiey and Sons, Inc., New York, 1941.
11. Л ев и и А. И., Журн. прикл. химии, 17, 613 A944).
12. Liddell D. M-, Handbook of Nonferrous Metallurgy, Recovery of the Metais,
McGraw-Hill Book Company, Inc., New York, 1945, p. 143, 193.
13. L у о n R. N.. Ed., Liquid-Metals Handbook, Atomic Energy Commission, Washing-
ton, D. C, 1952.
14. M e 1 1 о г J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry,
Vol. 9, Longmans, Green and Co., Inc., New York, 1929, p. 587.
15. Metals Handbook, American Society for Metals, Cleveland, 1948. p. 744—745.
16. Minerals Yearbook, U. S. Bureau of Mines, Government Printing Office, Washing-
ton, U. C, 1930—1957.
17. P a t t о n W. G., fron Age, 161, 84, 86 A948).
18. Peters F. P., Sci. American, 170, 16 (January 1944).
19. P i о n t e 1 1 i R., Atti congr. intern, chim., 10th Congr., Rome, 1938, 3, 609 A939).
20. P о w e 1 i A. R., The Refining of Bismuth, in Symposium, The Refining of Non-
Ferrous Metals, p. 245, 257, The Institution of Mining and Metallurgy, London, 1950.
21. Prescott А. В., Johnson С. Е., Qualitative Chemical Analysis, 7th
ed., D. Van Nostrand Company, Inc., Princeton, N. J., 1924, p. 243, 254.
22. Q u i 1 1 L. L., Chemistry and Metallurgy of Miscellaneous Materials: Thermody-
namics Nuclear Energy Series, McGraw-Hill Book Company, Inc., New York, 1950.
23. Материалы Комиссии по атомной энергии США, Ядерные реакторы. 111. Материалы
для ядерных реакторов, ИЛ, Москва, 1956.
21. Sax N. I., Dangerous Properties of Industrial Materials, Reinhold Publishing
Corp., New York, 1957.
25. S h i 1 1 i d а у Th., J. Appl. Phys., 28, 1035 A957).
26. S m i t h e 1 1 s С J., Metals Reference Book, Butlerworth and Co. (Publishers)
Ltd., London, 1949.
27. T h о m p s о n J. G., U. S. Natl. Bur. Standards. Circ. M 388, 1930.
28. Thompson J. G., U. S. Natl. Bur. Standards, Circ. J\6 382, 1950.
7.
ВОЛЬФРАМ
К- ЛИ
А'. С. Li, Wah Chang Corporation, New York, N. Y.
ВВЕДЕНИЕ
Тунгстен, как его называют в Америке, известный в Европе под назва-
нием «вольфрам»,— металл с уникальными свойствами, благодаря которым
его применяют при обработке резанием и штамповке других металлов,
а также в условиях высоких температур. Он имеет самую высокую темпера-
туру плавления C410°) и самое низкое давление пара среди остальных
металлов. Вольфрамовая проволока имеет самый высокий предел прочности
при растяжении и предел текучести до 420 кг/мм". Вольфрам — один из
наиболее коррозионностойких материалов. По плотности он уступает
лишь металлам платиновой группы и рению. После соответствующей обра-
ботки этот металл становится упругим и пластичным. Его соединение
с углеродом — самое твердое из известных веществ, содержащих металл.
Название «тунгстен» происходит от шведского tung ъ1еп (тяжелый
камень); впервые так был назван минерал шеелит примерно в 1758 г. Эле-
мент был впервые открыт в 1781 г. шведским химиком Шееле, по имени кото-
рого впоследствии шеелитом был назван природный вольфрамат кальция.
Вольфрамит железа и марганца, названный вольфрамитом, впервые был
описан примерно в 1574 г.; сначала его считали минералом олова, вместе
с которым вольфрам обычно ассоциирован в рудах. Это название немецкого
происхождения, от которого появился химический символ VV, по-видимому,
указывает на «волчью повадку» (wolflike) вольфрама; горняки, добывавшие
олово, называли его «пожирателем олова», так как в его присутствии сни-
жается количество олова, извлекаемого из руд. Наличие элемента, назван-
ного впоследствии вольфрамом, в составе минерала вольфрамита впервые
было установлено испанцами братьями Эльхиар примерно в 1783 г. Как при-
нято считать, в том же году они впервые получили металлический вольфрам.
Этот элемент не находил промышленного применения до начала наше-
го века, но с тех пор он стал одним из наиболее важных промышленных
металлов.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Вольфрам не найден в природе в самородном состоянии. За исключь-
нием тунгстенита (WS2), он всегда встречается в виде трехокиси вольфрама,
связанной с окислами железа, марганца или кальция и реже с окислами
свинца и меди. Самыми важными минералами вольфрама являются воль-
фрамит — название, которое дано целому ряду изоморфных вольфраматов
железа и марганца (Fe,Mn)WO4, — и шеелит, который представляет собой
почти чистый вольфрамат кальция CaWO4.
Минерал вольфрамит по составу изменяется от FeWO4 до MnWO4 и содер-
жит от 76,3 до 76,5% трехокиси вольфрама. Тот минерал, в котором содер-
_____ Вольфрам 137
жится меньше 20% вольфрамата марганца, назыпагот ферберитом, а минерал,
содержащий меньше 20% вольфрамата железа,— гюбнеритом. Цвет его
изменяется от черного до красновато-коричневого, удельный вес составляет
7,1— 7,5 г/см3.
В чистом виде минерал шеелит содержит 80,6% трехокиси вольфрама.
Он непрозрачен и по внешнему виду напоминает воск; цвет его изменяется
от белого или светло-желтого до черного, удельный вес составляет 5,9—
6,1 г/см3. Небольшая часть вольфрама часто замещается молибденом. Этот
минерал флуоресцирует при облучении его коротковолновым ультрафиоле-
товым светом, причем по мере увеличения содержания молибдена'окраска
изменяется от голубой через белую до желтой.
Содержание вольфрама в земной коре составляет 7-10 3 вес.%, и место-
рождения его руд сильно рассеяны. Вольфрамовые руды почти всегда
встречаются вместе с кислыми изверженными породами. Вольфрамиты
содержатся в кварцевых жилах и пегматитах обычно вместе с касситеритом,
небольшими количествами шеелита и сульфидными минералами, тогда как
шеелит почти всегда присутствует в тектите — горной породе, образовав-
шейся в результате метаморфического вытеснения в зонах контакта извест-
няков с изверженными гранитами. Содержание трехокиси вольфрама
в рудах редко превышает 2со; в США средние месторождения содержат
около 0,5% трехокиси вольфрама.
Крупные месторождения руд вольфрама найдены в Китае, США, Корее,
Боливии, Португалии, Бирме. Австралии, Таиланде, Испании, Аргентине,
Бразилии, СССР, Перу, Бельгии, Конго, Родезии и Малайе 118]. В США
разработка руд ведется главным образом в штатах Калифорния, Невада,
Северная Каролина, Айдахо и Колорадо.
Благодаря их высокому удельному весу вольфрамовые руды можно
обогащать мокрой отсадкой и промывкой на концентрационных столах.
При получении концентратов из шеелита широко применяется флотация.
Первичные концентраты подвергают очистке и дальнейшему обогащению
магнитной и электростатической сепарацией, флотацией, обжигом и выщела-
чиванием. Для того чтобы получить концентрат нужного качества, часто
приходится прибегать к химическому разложению первичных концентратов
с переосаждениём вольфрама в виде вольфрамата кальция, известного под
названием искусственного шеелита.
- ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В течение многих лет основная часть мировой добычи вольфрама падала
на Китай, который до сих пор обладает самыми большими разведанными
месторождениями. Однако в настоящее время нет такой страны, которая бы
в этой области играла доминирующую роль. Высокие цеиы, гарантирован-
ные правительством США во время военных действий в Корее, стимул провали
рост производства вольфрамсодержащих руд в этой стране до 7300 т
в год [34]. Обычно годовая производительность страны составляла около
3600 т с максимальным уровнем потребления во время второй мировой
войны, несколько превышающим 8600 т. Уровень производства вольфрама,
его потребление и цены всегда в значительной степени записят от изменений
экономических условий, в особенности от повышения спроса во время войны.
Все это отражает чрезвычайно большое значение, которое этот металл
имеет в промышленности. Развитие производства вольфрама [25], которое
совпало с двумя мировыми войнами, тремя основными депрессиями и бес-
138
Глава 7
Цена I m . долл
10 20 30 W 50 CO Ю 80 40 100
Депрессия в сталелитейной промышленности 1908 г
Начало первой мировой войны. I августа /9
начальнып уровень тюизьддепти в Hu
Конец первой миримо войны
II ноября /9/S г
1юшлиной (I долл на I иг вольфрама)
импортируемой руды, 22 сентября 1922 г
.' J?'Увеличение пошлины A.1 далп нп Iиг воль-
У^ураш) на импортируемую руду. 18 июни W3U
* г Начало второй мировой войны,
1 сентября I9J9 е
конец второй мировой войны в Европе
О мая istt г
р
О мая istt г
Ничино еиенных действий о
, 2Ь июня 1350г.
конец оагнных действий в
Морге, 21июля IS03 г
Рис. 1. Цены на вольфрамовые концентраты в США за
период 1900—1959 гг.
максимальные цены: — — — — минимальные цены.
прецедентным промышленным развитием за последние 50 лет, характери-
зуется значительными колебаниями спроса, уровня производства и цен.
Это иллюстрирует рис. 1, на котором приведена диаграмма цен на воль-
фрамовые концентраты в США за период с 1900 по 1959 г. Статистические
данные, показывающие изменение уровня производства за эти же годы,
приведены на рис. 2.
МЕТАЛЛУРГИЯ
Вольфрамовые концентраты перерабатываются на следующие три основ-
ных вида промышленной продукции: 1) ферровольфрам, 2) соединения
вольфрама и 3) металлический вольфрам.
Вольфрам
139
Уровень производства , т
isoo F
Депрессия в сталелитейное промышленности, 1SDS г
по первой мировой воины, 1 августа 19М г.
начальный уроиень производства в Китае.
1341г., 'Вт
Монец первой мировой войны,
II ноября 191В <?.
Оолонкние пошлиной (I долл. на 1 иг вольфрама)
импортируемой руды. 22 сентября 1S22 г.
Увеличение пошлины A.1 Оилл. на 1 кг воль
фримп) на импортируемую руду, IS июня 1330г.
Начало второй мирикой воины,
1сенширя ДШг.
пинсц второй мировой ооипы в
Европе, Ямин /за г.
Нинец военных действий в Порее,
27июля 1353 г.
I960
Рис, 2. Уровень мирового производства вольфрамовых
концентратов, содержащих 60% WO3.
Ферровольфрам]
Продажный ферровольфрам содержит 70—80% вольфрама и использует-
ся почти исключительно в производстве сталей и чугунов, легиронанных
вольфрамом. Его получают восстановлением какого-либо из минералов
углеродом или кремнием в электропечи либо алюминием или кремнием
по термитному процессу. Извлечение вольфрама из руд обоими методами
дает хорошие результаты, причем количество остающихся примесей можно
регулировать в широких пределах. При сравнительно небольшом весе вос-
становителя получают большое по весу количество вольфрама; трехокись
вольфрама легко восстанавливается при высоких температурах. Поскольку
ферровольфрам имеет высокую температуру плавления, его не выпускают
из печи в виде расплава, а извлекают из холодной печи в виде затвердевших
кусков, которые затем дробят и распределяют по фракциям нужных разме-
ров для добавления в расплавленную ванну стали.
НО Глава 7
Соединения вольфрама
Большинство химических соединений, имеющих промышленное значе-
ние (трехокись вольфрама, вольфрамовая кислота, вольфрамат кальция,
паралольфрамат аммония), получают в качестве промежуточных продуктов
при получении чистого металлического вольфрама, описанного ниже.
Безводный вольфрамат натрия Ыа2\УО4 можно приготовить сплавлением
трехокиси вольфрама с едким натром или содой. Дигидрат вольфрамата
натрия получают кристаллизацией из растворов при температурах
выше 6°.
Вольфрамовые бронзы применяются r качестве пигментов типа
М2О (WQs)jc-WO2, где М — щелочной металл, например натрий или калий.
Их получают несколькими методами, один из которых заключается в вос-
становлении кислых вольфраматов щелочных металлов водородом или
окисью углерода при повышенных температурах.
Гексакарбонил вольфрама W(CON — летучее твердое вещество, кото-
рое является перспективным для получения адгерентных вольфрамовых
покрытий на металлах,— может быть получен взаимодействием вольфрамо-
вого порошка и окиси, углерода при 225—300" под давлением 200 am. Это
вещество может быть получено также путем взаимодействия окиси углерода
под давлением с растворенным в эфире гексахлоридом вольфрама в при-
сутствии магния.
Металлический вольфрам
Высокая температура плавления вольфрама, его высокая реакционная
способность и отсутствие тугоплавких материалов, способных выдержи-
вать расплавленный' вольфрам, не позволяют выплавлять его обычными
методами. Поэтому для извлечения вольфрама руду подвергают химическому
разложению, затем получают очищенную трехокись и восстанавливают ее
до порошкообразного металла. Для изготовления из него изделий поль-
зуются методами порошковой металлургии.
Из множества методов, применяемых или предложенных для разложе-
ния вольфрамовых концентратов, в настоящее время лишь три метода
имеют промышленное значение: 1) разложение кислотами (обычно соляной),
2) разложение щелочами, 3) сплавление с щелочами или солями щелочных
металлов. Схемы отдельных процессов, применяемые различными изгото-
вителями, весьма разнообразны даже при использовании одинакового
сырья и получении металла для одних и тех же целей. Однако химия основ-
ных процессов, т. е. разложения и очистки, достаточно проста, что можно
видеть на рис. 3, на котором изображена общая схема процессов.
Примечательно, что физические свойства, которыми обладают готовые
вольфрамовые изделия, в значительной степени зависят от химических
и физических свойств порошка, из которого они изготовлены. Свойства
вольфрамового порошка в свою очередь зависят от физических и химических
свойств трехокисн вольфрама, из которой получен металл, и от условий
восстановления. Очевидно, контроль за свойствами конечного продукта
должен начинаться почти с первых операций разложения концентратов,
и для получения конечного продукта с нужными свойствами необходимо
следить за режимом отдельных стадий на протяжении всего процесса.
Кислотное разложение обычно применяется только в случае шеелитовых
руд, так как минералы вольфрамитового ряда сравнительно устойчивы
к действию кислот. В результате разложения образуются растворимый
хлорид кальция и нерастворимая гидратированная окись вольфрама
Вольфрам 141
(кислота). После тщательной промывки (обычно с декантацией) вольфрамо-
вую кислоту растворяют в водном растворе аммиака или в растворе едкой
щелочи. Полученный раствор вольфрамата фильтруют для удаления нерас-
творимых веществ, содержавшихся в исходной руде.
Руды, содержащие вольфрамитовые минералы, обычно разлагают путем
обработки концентрированным раствором E0"о-ным) едкой щелочи под дапле-
нием или просто кипячением со щелочью при атмосферном давлении. По дру-
гому варианту руды можно смешивать с карбонатом щелочного металла
или с едкой щелочью и спекать или полностью сплавлять с образованием
Вольфрамит Шеелит
1 Разложение HCL
Вольфрамовая иис/ююа (твС1>0ая)
Разложение NoOH (или НОН)
под давлением 1 Растворение в NoOH
Вольсррамрт натрия (раептор)
Вливание е HCL Выпаривание Осамдение с
L кристаллизация 1 помощью CaClz
дольфрамат натрия {кристапличрпкий отдои)- Вольфримат кальция
Растворение в воде. -, (осадок)
^ затем вливание е НС1 Разложение НС1
Вольфрамовая кислота tmeepdav] T
Сушка | Растворение е NfyOH
прокаливание и и Волыррамат аммония (pacntscn)
Выпаривание
Кристаллизация
Ппрапшшри/иат а/и/иония [кристаллический осадой)
' нагревание
Опись вольфрама '
Восстановление углеродом (иногда добавление ингиБитороя
J роста кристаллов)
\ Восстановление водородом
Вольфрамовый порошок Вильтримовый порошок
Р и с. 3. Схема промышленных способов переработки вольфрамовых концентратов
на порошкообразный металл.
растворимого вольфрамата щелочного металла. После выщелачивания гидро-
окиси железа и магния вместе с другими нерастворимыми веществами,
содержащимися в руде, отделяют фильтрованием и промывкой осадка.
Раствор вольфрамата аммония, получаемый в результате кислотного
разложения высокосортного шеелита и растворения вольфрамовой кислоты
в водном растворе аммиака, часто подвергают кристаллизации с целью
использования без дополнительной очистки. Однако в большинстве воль-
фрамовых концентратов содержится достаточно большое количество таких
примесей, как кремневая кислота, мышьяк, фосфор и особенно молибден,
поэтому необходима очистка первичного раствора вольфрамата. Очистку
раствора производят по существу одними и теми же методами независимо
от того, какой очищается раствор — вольфрамата аммония, калия или
натрия, а также независимо от метода, применявшегося при разложении
руды. Можно применять один из следующих методов или любое их соче-
тание.
Фосфор и мышьяк осаждают в виде арсената и фосфата магния при
энергичном перемешивании раствора с небольшим количеством хлорида
142 Глава 7 ^^^
магния. В случае обработки раствора вольфрамата натрия или калия добав-
ляют также хлорид аммония *.
Молибден можно удалять следующим образом: 1) путем добавления
сульфида натрия с последующим осаждением вольфрама хлоридом кальция;
молибден в виде сульфомолибдата остается в растворе, а осажденный воль-
фрамат кальция, как и прежде, обрабатывают кислотой; 2) подкислением
раствора вольфрамата; при добавлении H2S (лучше под давлением) или
сульфида натрия молибден осаждается в виде сульфида (MoS3); 3) подкис-
лением раствора вольфрамата с последующей кристаллизацией параволь-
фрамата аммония или щелочного металла, что приводит к концентрированию
молибдена в маточном растворе [20].
Для дальнейшего удаления примесей вольфрамат обычно подвергают
дополнительной очистке через осаждение искусственного шеелита. Шеелит
разлагают соляной кислотой, образующуюся вольфрамовую кислоту рас-
творяют в водном растворе аммиака и из полученного раствора кристалли-
зуют паравольфрамат аммония. Для этого раствор вольфрамата аммония
выпаривают до объема, составляющего одну восьмую его первоначального
объема. Маточный раствор возвращают в процесс, а кристаллический
осадок тщательно промывают и сушат. Полученное вещество представляет
собой чистый паравольфрамат аммония 5(NH4JO- 12WO3- 11Н2О, из которого
может быть получен вольфрам различных сортов.
Чтобы получить «легкую окись», кристаллы чистого паравольфрамата
натрия замачивают в кипящем растворе едкого натра, раствор фильтруют
и для осаждения вольфрамовой кислоты вливают его в кипящую соляную
кислоту. По другому способу кристаллы вольфрамата натрия можно рас-
творить в воде, а затем обработать таким же образом. Характер образую-
щихся осадков определяется концентрацией кислоты и раствора вольфрама-
та, температурой и скоростью смешения этих растворов. При слишком
быстром добавлении вольфрамата образуется хлопьевидный осадок, который
трудно промывается. При низкой температуре образуется загрязненный
коллоидальный осадок. После продолжительного промывания вольфрамо-
вую кислоту отфильтровывают и обезвоживают нагреванием примерно
до 350°.
«Тяжелую окись» получают прокаливанием кристаллов чистого пара-
вольфрамата аммония при температуре около 400° для удаления аммиака.
Эти две формы окиси обладают существенно различными физическими
свойствами и могут использоваться для получения вольфрамовых порошков,
также сильно различающихся по своим физическим свойствам. «Тяжелая
окись» имеет средний размер частиц 4—5 мк и насыпной вес 1,5—1,9 г/сма,
тогда как «легкая окись» имеет средний размер частиц 0,5—2 мк и насып-
ной вес 0,9—1,1 г/см3.
Как пи странно, лишь при изготовлении изделий из карбида воль-
фрама и в сравнительно немногих случаях применения в электронике
наилучшие результаты получаются при использовании вольфрама высокой
степени чистоты. Поэтому для целого ряда областей применения к очищен-
ной окиси перед восстановлением следует добавлять «интенсификатор»
(«допинг»). Эти добавки могут состоять из хлоридов и силикатов щелочных
металлов, окиси алюминия или двуокиси тория в количествах, составляющих
несколько сотых долей процента или достигающих 5%.
* Хлорид аммония добавляется для осаждения аммонийно-магниевых фосфата
и арсената (MgNH4PO4 • 6Н2О и MgNH4AsO4 • 6Н2О), растворимость которых при
обычной температуре составляет около 0,05 и 0,04% соответственно. Таким путем дости-
гается наиболее совершенная очистка от фосфора и мышьяка. — Прим. ред.
Вольфрам
143
Щелочные металлы и двуокись кремния летучи и почти полностью
удаляются из вольфрама на стадии спекания, которая проводится при темпе-
ратуре выше 3000°. Металл, полученный из подвергнутой такой обработке
окиси, имеет склонность к росту крупных кристаллов при спекании, что
Р и с. 4. Поперечный шлиф воль-
фрамовой проволоки диаметром
0,18 мм, травленный электролити-
чески в NaOH Х200 («Дженерал
электрик компании.)
* ":
Рис. 5. Продольный шлиф воль-
фрамовой проволоки диаметром
0,18 мм, травленный электролити-
чески в NaOH. X200 («Дженерал
электрик компании).
в свою очередь придает волокнистую структуру непровисающим нитям.
Поперечный и продольный шлифы такой проволоки'приведены на рис. 4 и 5.
Влияние некоторых нелетучих добавок, например двуокиси тория или
окиси алюминия, сказывается на росте зерна во время спекания и при после-
дующей рекристаллизации (рост замедляется) [5J.
Восстановление
Трехокись вольфрама может быть восстановлена углеродом, углерод-
содержащими газами или водородом. Наиболее чистый металл, используе-
мый в электронике и в производстве карбидов, получают восстановлением
водородом. При восстановлении углеродом в вольфраме остается некоторое
его количество; этот метод применяется для получения более дешевого
вольфрамового порошка, идущего на переплавку. Другие методы восстановле-
ния, например электролитическое восстановление, пе приобрели промыш-
ленного значения.
Восстановление водородом обычно проводится в электрических или
газовых трубчатых печах, хотя иногда для этого применяют вращающиеся
трубчатые печи и непрерывные конвейерные печи. Обычная трубчатая
печь состоит из целого ряда трубок из жаростойкого материала с внутренним
диаметром 38—76 мм и длиной 3,6—5,5 м, заключенных в раму из огнеупор-
ного материала. Печь нагревается таким образом, чтобы создавалось
несколько температурных зон, причем в первой зоне поддерживается темпе-
ратура 450—600°, а в последней зоне 750—1100° в зависимости оттого, какой
порошок требуется получить. Трехокись вольфрама помещают в лодочки
144 Глава 7
из жаростойкого сплава длиной 30—45 мм, которые вставляют в трубки
на одинаковых расстояниях друг от друга. По мере перемещении по трубке
только что загруженной лодочки происходит восстановление до металла,
и лодочка перемещается в водоохлаждаемую разгрузочную зону трубки.
С разгрузочного конца трубки противотоком по отношению к движущейся
лодочке с трехокисью подается значительное количество избыточного сухого
водорода, очищенного от кислорода. Выходящий водород сушат, очищают
от кислорода и снова используют для восстановления. Полное восстановле-
ние можно осуществить за один проход через печь или, если трехокись
i f *
•j jj^ S Рис. 6. Автоматические печи для восстановления,
i в которые загружена трехокись вольфрама
(«Бах Чсиг корпорейшн»).
восстанавливается для специальных областей применения вольфрама, необ-
ходимо проводить двухступенчатый процесс восстановления. Первую ста-
дию восстановления проводят при низкой температуре G50°), чтобы полу-
чить «коричневую окись вольфрама» (WO2), которую для окончательного
восстановления на второй стадии смешивают со свежей порцией «желтой
окиси» (WOa). С целью облегчения работы печи снабжены автоматическим
устройством для загрузки, засыпки порошка и разгрузки, что показано
на рис. 6.
Продукт восстановления, представляющий собой спеченный серый
порошок, измельчают, просеивают через сито 200 меш, смешивают в круп-
ные партии и хранят в воздухонепроницаемых контейнерах.
Размер частиц порошка, гранулометрический состав и физические
свойства конечного металла определяют следующие факторы:
1. Размер частиц порошка и метод получения окиси.
2. Примеси, вводимые намеренно или попадающие каким-либо другим
путем в трехокись.
3. Скорость, с которой трехокись достигает минимальной температуры,
при которой начинается восстановление.
4. Конечная температура, достигаемая в процессе восстановления.
5. Парциальное давление паров воды в водороде.
6. Толщина слоя трехокиси в лодочке.
7. Число стадий восстановления
Восстановление углеродом. Пригодный для переплавки сорт вольфрама,
применяемый в производстве литого карбида вольфрама и некоторых спла-
вов, можно получить восстановлением трехокиси углеродом или газообраз-
ными углеводородами. По одному из методов с трехокисью вольфрама сме-
шивают ламповую сажу в стехиометрическом соотношении, смесь утрамбо-
вывают в графитовый тигель и нагревают в газо-пламенной или в индукцион-
ной печи. Слегка спеченный продукт охлаждают с печью, измельчают
и просеивают через сито 65 меш. Обычные заводские технические условия
предусматривают минимальное содержание вольфрама 99% и максимальное
содержание углерода 0,15%.
Вольфрам 145
Карбид вольфрама
Карбид вольфрама WC получают в порошкообразном виде в результате
реакции чистого порошка металлического вольфрама и мелкодисперсной
ламповой сажи. Все то, что указано в отношении влияния степени чистоты,
размера частиц и гранулометрического состава вольфрамового порошка
на качество вольфрамовых изделий, применяемых в электронике, одинаково
справедливо и для порошка карбида вольфрама. Свойства изделий из
цементированного карбида зависят от степени чистоты и физических свойств
порошка карбида, из которого они изготовлены.
Чистый порошок вольфрама смешивают с соответствующим количеством
ламповой сажи, помещают в графитовые лодочки или тигли и нагревают
в атмосфере водорода в течение 2 час при 1450—1550°. Нагрев производят
в индукционных или графитовых трубчатых печах, после чего продукт
охлаждают в атмосфере водорода, измельчают и просеивают через сито
200 меш, В стандартном порошке общее содержание углерода колеблется
от 6,05 до 6,20%, а содержание свободного углерода составляет не более
0,1%. Размер частиц порошка карбида определяется размером частиц
исходного вольфрамового порошка и температурой, при которой становится
возможным науглероживание.
Крупнокристаллический монокарбнд вольфрама WC получают в ре-
зультате сочетания процесса восстановления руды с науглероживанием
[19, 21] и науглероживания расплавленного металла 122].
Карбиды для специальных целей или «твердые сплавы», применяемые
для механической обработки сталей, обычно содержат различные количества
карбида титана, тантала или ниобия или их комбинации. Эти добавки
вводят, добавляя порошок или окись нужного металла к смеси вольфрама
с сажей, либо получают двойные карбиды в расплавленной металлической
ванне. Двойной карбид служит для уменьшения коэффициента трения
и устранения эффекта образования кратера на кончике резца, которое
наблюдается при механической обработке стали.
Низший карбид вольфрама W2C или, что более точно, смесь WC и W2C
получают плавлением и литьем. По одному из способов смесь восстанавли-
ваемого углеродом порошка с нужным количеством углеродсодержащего
вещества утрамбовывают в графитовый тигель и нагревают выше темпера-
туры плавления W2C C000—3200°), пропуская ток большой силы через
тигель. Расплавленный карбид выливают в изложницу через небольшое
отверстие в дне тигля или закаливают его в масляной ванне, затем измель-
чают, сортируют и помещают в металлические трубки с целью использова-
ния его в качестве наплавки для электродов.
ФИЗИЧЕСКИЕ СВОЙСТВА
К самым выдающимся физическим свойствам вольфрама относятся, конеч-
но, его высокая температура плавления C410°) и высокий модуль упру-
гости, по которым он превосходит все металлы, а также низкое давление
его паров и малый коэффициент сжимаемости, которые являются самыми
низкими по сравнению со всеми остальными металлами. Его плотность,
равная 19,3 г/см3, соответствует плотности золота, но меньше, чем у пла-
тины, иридия, осмия и рения. Благодаря высокой плотности и сравнительно
большому поперечному сечению захвата тепловых нейтронов вольфрам
является эффективным защитным материалом.
10 Заказ № 23S
Таблица I
ФИЗИЧЕСКИЬ СВОЙСТВА ВОЛЬФРАМА
Порядковый номер 74
Атомный вес 183,85
Изотопы (природные) 180, 182, 183, 184, 186 Ц8|
Температура плавления, "С 3410^20 [27]
3380 [33|
Температура кипения, "С 5900 [181
Плотность при 20°, г/см* 10,3
19.26 (расчетная рентге [15[
новская плотность)
Давление пара, мм рт. ст.
1527" 1,93-10-15
2127° 7,9-10-°
2727" 6,5-10"s
32273 4,68-10-3
Г 1 П1
Удельная теплоемкость при 20е 0,032
кал/г-град
Коэффициент теплопроводности,
кал/емсек-град
20° 11,31
927° 0,275
1127' 0,268
1327° 0,26и
1527" 0,253
1727° 0,245
Кристаллическая решетка Кубическая объемноцент-
рированная .
Параметр решетки при 25". Л 3,1647
Коэффициент линейного расширения'
(среднее значение прн 0—500'), град'1 .»,.
Деформированный вольфрам 4,98-10 „
Отожженный вольфрам 4,43-10"в
\томный объем (при плотности ",53
19,3 г/см»), см3/г-атом
Теплота плавления, кал/г 44
Теплота нспврення. кал/г 1,83 ц„1
Удельное электрическое сопротивление,
мком - см
20° 5,5
227' 10,5
727' 24,3
1727 55,7
2727 SO, 4
3227' 108,5
Температурный коэффициент электрнче- 0,00482
ского сопротивления при 20—l00J
Кажущаяся работа выхода электронов, эе 1.55
Кажущаяся работа выхода ионов, эв 11,93
Коэффициент излучения 0,43
Первый потенциал ионизации 7,60
.Мап1нт1тявоспрш1мчивость,3"«.?./'-а«"ш -J-40-10-"-
Вольфрам
147
Поперечное сечение захвата тепловых
нейтронов, барн/аптм
Коэффициент всестороннего сжатия (на
мегабар) при 20°
е
Модуль упругости при 20е. кг/мм2
Продолжение табл. 1
19 2±1.0
0.28-10-6 (меньше, чем у [18|
всех известных метал-
лов)
4,1-10*
Теплопроводность вольфрама составляет менее половины теплопровод-
ности меди, но она намного выше, чем у железа или никеля. Хотя электро-
проводность вольфрама примерно втрое меньше электропроводности отож-
женной меди, она все же выше, чем у железа, никеля, ртути, платины и фос-
фористой бронзы.
Данные о некоторых физических свойствах вольфрама приведены
в табл. 1.
МЕХАНИЧЕСКИЕ СВОЙСТВА
Вольфрам обладает высокими прочностью и твердостью при комнатной
и повышенной температурах. Предел прочности при растяжении для очень
тонкой вольфрамовой проволоки выше, чем у любого из материалов, полу-
Таблица 2
МЬХЛНИШСКИЕ CBOPICTDA ВОЛЬФГАМА
ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ
Форма
Размеры,
мм
Предел гфоч-
IKK-TU при
растяжении,
кг/MM'i
Твердость
по Роквеллу
Спеченный слиток
Пруток
Проиолока
Лист
6,35
2,54
1,27
0.С35
0,254
0.127
0,025
1,016
0,508
0,254
11,2
49
105
140
157,5
175
211)
427
84
140
210
37
4(
44
44
44
45
47
чениых обычными способами. Прочность вольфрама при высоких темпера-
турах характеризуется тем, что предел прочности при растяжении после
нагревания выше температуры рекристаллизации не уменьшается резко,
как это наблюдается для других металлов. Несмотря на его большую плот-
ность, отношение прочности к весу для вольфрама при повышенной темпера-
туре является более высоким, чем у всех других испытанных металлов.
Спеченный или литой поликристаллический вольфрам имеет сравни-
тельно высокую температуру перехода из пластичного в хрупкое состоя-
ние A50—450°), тогда как температура перехода монокристалла колеблется
- К)*
148
Глава 7
от —196 до —107° [1]. Влияние предварительной холодной деформации,
содержания примесей, величины зерна и скорости деформации на изме-
нение температуры перехода пока не окончательно установлено. Обыч-
но полагают, что холодная деформация приводит к снижению, а наличие
примесей — к повышению температуры перехода поликристаллического
вольфрама. •
Таблица 3
ТИПИЧНЫЕ МЕХАНИЧЕСКИЕ СВОЙСТВА ВОЛЬФРАМА
ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ [29]
Обработка
Ковка и отжиг
Копка и рекристалли-
зация
Темпера-
тура. °С
27
326
649
871
1093
326
649
871
1093
Предел
TeKv4ecTH
(о02); кг/ям*
—
-
—
—
23,2
10,7
10,2
9,0
Предел
прочности
пр I ра(.тнже-
нии, кг/мм2
151
72,1
53,6
46,4
41,3
41,8
31,2
25.6
23,5
Относитель-
ное >дл ше-
нне, %
0,2
24,5
16,U
13,5
14,5
16,4
55,3
57.9
52,0
В табл. 2 приведены некоторые данные по механическим свойствам
вольфрама при комнатной температуре. Эти данные являются показатель-
ными, поскольку прочность спеченного и деформированного вольфрама
изменяется в зависимости от размера частиц и степени чистоты используе-
мого металла, а также технологического процесса его изготовления. В то
время как спеченный и деформированный иа холоду вольфрам характери-
зуется лишь незначительным относительным удлинением при комнатной
температуре или вообще не имеет удлинения, отожженная вольфрамовая
проволока может иметь относительное удлинение до 15% при комнатной
температуре. В табл. 3 приведены типичные данные о механических свой-
ствах вольфрама.
XHMHHFCKHE СВОЙСТВА
Вольфрам является одним из переходных элементов и расположен
в VI группе периодической таблицы. Его валентность изменяется от 2 до 6.
Соединения, в которых вольфрам обладает более высокой валентностью,
проявляют кислотные свойства, а соединения, в которых у него более
низкая валентность, имеют основные свойства.
Вольфрам образует два окисла точно установленного состава: двуокись
коричневого цвета и трехокись желтого цвета. Голубой и фиолетовый окислы
вольфрама, обычно образующиеся при восстановлении трехокиси вольфрама,
были идентифицированы рептгеноструктурным анализом как два гомо1ен-
ных окисла промежуточно! о состава, но их состав еще ие установлен.
По кристаллографическим данным наиболее вероятен для голубого окисла
состав WOJtS7b или W8O23, а для фиолетового окисла состав WO2 -5 или W4Ou
[23]. Другие окислы промежуточного состава являются лишь смесями уже
идентифицированных окислов и металлической фазы [131.
Вольфрам
149
Такие элементы, как углерод, бор, кремний и сера, непосредственно
взаимодействуют с вольфрамом при повышенных температурах с образова-
нием соответствующих соединений. Например, при 1200е1 в месте контакта
углерода и вольфрама начинает образовываться карбид вольфрама.
Вольфрам образует с углеродом два карбида: W2C и WC, некоторые
свойства которых приведены в табл. 4 [32].
Таблица 4
СВОЙСТВА КАРБИДОВ ВОЛЬФРАМА
Свойство
Содержание углерода, %
Кристаллическая решетка
Параметры решетки, Л
а
с
Теоретическая плотность, г/см3
Температура плавления, СС
W2C
3,16
Гексагональная
2,98
4,71
17,34
2730
we
6,13
Гексагональная
простая-
2,90
2.83
15,77
2630 (раэл.)
Твердость по Моосу
Карбонил вольфрама W(CO)<; может быть сублимирован и подвергнут
термическому разложению при низких температурах. Креме того, из него
может быть получен вольфрам очень высокой степени чистоты путем осажде-
иия из паровой фазы.
Вориды и силициды вольфрама характерны своей твердостью и высокой
температурой плавления.
Вольфрам сравнительно устойчив по отношению к кислотам [11].
Он начинает окисляться на воздухе при 400е. Окисление происходит быстро
при температуре красного калеиия и в кислороде с образованием трехокиси,
которая легко измельчается. Выше 750° трехокись начинает улетучиваться.
Химические свойства металлическою вольфрама описаны в табл. 5.
Вольфрам устойчив к действию многих расплавленных ме1аллов в тече-
ние длительного времени. Его можно удовлетворительно использовать
в контакте с натрием и его сплавами до 900°, с ртутью до 600°, с галлием до
800°, с висмутом до 980° и с магнием до 600° [31]. Было найдено, что он
устойчив в контакте с цинком при 700° в восстановительной атмосфере, в то
время как другие металлы и сплавы довольно быстро разрушаются [14].
СПЛАВЫ
Краткие сведения о бинарных сплавах вольфрама приведены Хансе-
ном [12]. Ниже приводятся некоторые полезные сведения из этой работы
и другие данные.
Сплавы вольфрама с молибденом, ниобием, танталом и хромом
Вольфрам образует непрерывные ряды твердых растворов лишь с молиб-
деном, ниобием и танталом, а также с хромом выше 1-400°. Тройные системы
вольфрама молибденом, ниобием и танталом также представляют собой
150
Глава 7
Таблица 5
ХИМИЧЕСКИЕ СНОПСТВА ВОЛЬФРАМА
Среда
Характер взаимодействия
Воздух или кислород
Аммиак
Вода
Водяной пар
Углерод
Окись углерода
Двуокись углерода
Водород
Азот
Фтор
Хлор
Бром
Иод
Сера
Сероводород
Соляная кислота (конц.)
Царская водка
Плавиковая кислота
Смесь плавиковой и азотной
кислот
Азотная кислота (конц.)
Серная кислота (разб.)
Серная кислота (конц.)
Смесь NaOH и КОН (водный
раствор)
Смесь NaOH и КОП (расплав)
Окисление начинается при 400°
Не действует
» »
Окисление выше 700е
Науглероживание выше 1200°
Науглероживание выше 1700"
Окисление выше 1200°
Не действует
Азотирование при 1500е
Образование фторида при 20
Образование хлоридз выше 250п
Образование бромида прн температуре
красного каления
Образование иодида при температуре
красного каления
Медленное взаимодействие с расплавлен-
ной серой
Поверхностное взаимодействие при тем
пературе красного калении
Слабое взаимодействие при 100°
Поверхностное окисление с образова-
нием WO3
Слабое действие при 100э
Быстрое растворение
Слабое действие при 100°
То же
Слзбое действие при 20"
Не действует при 20° ¦
Слабое действие, быстрое растворение
в присутствии окислителей
непрерывные ряды твердых растворов. Добавки молибдена, ниобия и тан-
тала снижают твердость и предел прочности при растяжении вольфрама
при комнатной температуре, ио они повышают его прочность при высоких
температурах. При добавлении к вольфраму примерно 40% молибдена
достигаются максимальное электросопротивление и минимальный темпера-
турный коэффициент. Сплав, содержащий 3,7% тантала, обладает прибли-
зительно па одну треть более высоким электросопротивлением, чем чистый
вольфрам 19].
Сплавы вольфрама с рением [6]'
В вольфраме растворяется до 37% рения при 3000°, а в рении — до
20% вольфрама при 2800°. В бинарной системе обнаружены две промежуточ-
ные фазы: о-фаза, образующаяся в результате перитектического рас-
Вольфрам 151
пада при 3000°, и g-фаза, образующаяся при перитектоидном распаде
при 2125°. При содержании 74°о рения между а-фазой и богатым рением
ограниченным твердым раствором образуется эвтектика. Эвтектическая
горизонталь простирается от 71 до 80?ь рения, а эвтектическая температура
равна 2825°. Имеется сообщение о том, что сплавы на основе вольфрама,
содержащие 25—35?о рения, можно прокатывать приблизительно при 1000°
в тонкую полосу. С уменьшением содержания рения наблюдается пониже-
ние пластичности, тогда как при более высоком его содержании за счет
избыточного количества о-фази образуется структура, делающая сплав
очень хрупким. Это свидетельствует о максимальной пластичности при
максимальном упрочнении твердого раствора.
Растворимость вольфрама в железе, кобальте и никеле является пред-
посылкой для образования некоторых сплавов вольфрама, полученных
методами порошковой металлургии.
Сплавы вольфрама с железом
Растворимость вольфрама в железе, составляющая 33% при 1538е,
при обычных температурах понижается примерно до 8%.
Сплавы вольфрама с кобальтом
Вольфрам легко растворяется в расплавленном кобальте. При содер-
жании вольфрама, равном 45%, и температуре приблизительно 1480е
образуется эвтектика. Растворимость в твердом] состоянии резко падает
с понижением температуры.
Сплавы вольфрама с никелем
Вольфрам легко растворяется в расплавленном никеле. При содержа-
нии вольфрама, равном 45%, и температуре 1495е образуется эвтектика.
Сплавы вольфрама с никелем и медью
Небольшие добавки меди существенно снижают температуру спекания
смеси порошков вольфрама и никеля, необходимую для достижения требуе-
мой для тяжелых сплавов плотности. При спекании смеси порошков медные
и никелевые частицы начинают сплавляться при температуре выше 1000°.
Вольфрам не растворяется в меди, но он быстро растворяется в меднонике-
левом сплаве после достижения его температуры плавления. По мере рас-
творения очень мелких вольфрамовых частиц вольфрам вторично осаж-
дается на некоторых зародышевых центрах, образуя крупные округлые
частицы. Это происходит до тех пор, пока не растворятся все очень мелкие
частицы вольфрама н в результате этого не прекратится образование
пористости в процессе получения сплава.
Вольфрамовые стали [33]
Вольфрам присутствует в стали в основном в форме карбида. В сплавах
с низким содержанием вольфрама наряду с WC присутствует карбид желе-
за Fe3C в различных количествах. Часть вольфрама может растворяться
в Fe3C, замещая железо. В сплавах с высоким содержанием вольфрама
152 Глава 7
образуются, вероятно, двойные или смешанные карбиды, состав которых
может быть выражен формулой (Fe, W)tC или (Fe, VV, Cr, V)BC. Если имеется
дополнительное количество вольфрама, то могут присутствовать вольфра
миды железа Fe2W и Fe3Wz.
V
Другие сплавы
Вольфрам хорошо растворим в алюминии, титане, ванадии, цирконии,
платине, осмии, родии и рутении, но почти не растворяется в ртути. Имеют-
ся сообщения о соединениях вольфрама с бериллием и теллуром. Вольфрам
слабо растворим в тории и уране. Он не образует сплавов с кальцием, медью,
магнием, марганцем, свинцом, цинком, серебром и оловом.
ХИМИЧЕСКИЙ И МЕТАЛЛОГРАФИЧЕСКИЙ АНАЛИЗЫ
Стандартный метод химического анализа вольфрама заключается
в осаждении его в виде цинхонинвольфрамата [35] алкалоидом ципхони-
ном из слабо подкисленных растворов вольфраматов щелочных металлов.
Осадок прокаливается при 750° до трехокиси вольфрама. Объемные методы
не дают точных результатов. У
Для металлографических исследований вольфрам можно шлифовать
вначале наждачной бумагой, полировать окисью алюминия, а затем травить
в щелочном растворе ферроциапида калия. Вольфрамовые слитки и прутки
можно полировать электролитическим методом в 496-ном растворе едкого
натра при плотности тока 3—7 а/см2. Такие же образпы могут быть под-
вергнуты также электролитическому травлению в том же растворе, но при
меньшей плотности тока.
СПОСОБЫ ОБРАБОТКИ
Вольфрамовый порошок превращается в компактный металл гидростати
ческим прессованием в разрезной пресс-форме под давлением 1,4—5,6 т/см2.
Спрессованные штабики подвергают предварительному спеканию в атмо-
сфере водорода при температуре около 1200°, чтобы сообщить им прочность
для удобства дальнейшей работы с ними. Во время окончательной термо-
обработки (сварки) предварительно спеченный штабик подвешивается вер-
тикально между неподвижным медным верхним токоподводом, охлаж-
даемым водой, и подвижным нижним токоподводом, погруженным в охлаж-
даемый водой ртутный затвор. Весь этот узел помещают под колоколообраз-
нын «колпак для термообработки», внутри которого циркулирует сухой
водород. Затем через штабик пропускают электрический ток, по силе соста-
вляющий 90—95% от тока, необходимого для расплавления штабика В ре-
зультате такой термообработки штабик получает линейную усадку на
15—20%, а плотность его достигает 17—18 г/см3. Пропускаемый ток по-
вышается ступенчато, что обеспечивает удаление летучих примесей и интен-
сификаторов, пока металл еще пористый. Например, при поперечном сече-
нии штабика, равном 6,4 см2, необходимо подвести ток в 10 000 а при напря-
жении 12 в. Размер изделий, получаемых таким образом, лимитируется
конструктивными особенностями прессового оборудования и трудностью
работы с током большой силы. Практически слитки могут иметь длину
200—760 мм н поперечное сечение 3,2—26 см2.
Вольфрам 15S
Вольфрам по сравнению с другими металлами, имеющими кубическую
объемноцентрированную кристаллическую решетку, обладает сравнительно
низкой пластичностью при комнатной температуре и чрезвычайно хрупок
в полностью отожженном (рекристаллизованном) состоянии. Однако его
можно деформировать в горячем состоянии (но ниже температуры рекри-
сталлизации), при этом он может подвергаться наклепу. Восстановление
пластических свойств деформированного вольфрама при отжиге его ниже
температуры рекристаллизации важно для последующих операций изготов-
ления изделий из вольфрама. Предельная температура рекристаллизации
зависит от микроструктуры, предыстории металла и критериев, по которым
устанавливается момент начала рекристаллизации. Степень предваритель-
ной холодной деформации, содержание примесей и продолжительность
отжига — основные факторы, определяющие минимальную температу-
ру рекристаллизации. Первоначальная ковка проводится при температу-
рах 1500—1700". Температуры деформации постепенно понижаются, и более
тонкая проволока вытягивается при 300—400°.
Пластичные прутки и проволока
Спеченный штабик, который идет на изготовление прутка или проволоки
малого диаметра, вначале подвергают ковке. Эта операция проводится
между двумя вращающимися вокруг оси прутка ковочными плашками,
которые вначале за счет центробежной сипы отбрасываются к периферии
и, ударяясь при этом задними плоскостями об окружающие их кольцом
ролики, вновь отбрасываются к центру (оси вращения), ударяя, таким
образом, по штабику несколько тысяч раз в минуту. Эти плашки можно
изготовлять из закаленной быстрорежущей стали, жаростойкого сплава,
например «стеллита» или «стейнтанга», либо из твердых сплавов. За каждый
проход площадь поперечного сечения может уменьшаться не менее чем
на 30%. По мере уменьшения площади поперечного сечения пластич-
ность металла возрастает, а плотность для прутков малого диаметра дости-
гает 19,3 г.'см3. С уменьшением диаметра изделия зерна удлиняются и обра-
зуется вязкая блокированная волокнистая структура.
При изготовлении проволоки переход от ковки к волочению опреде-
ляется главным образом ограниченными возможностями применяемого
оборудования и экономическими соображениями. Ковка часто применяется
для прутков диаметром 1 мм, а волочильный станок — для волочения прут-
ков диаметром до 6,35 мм. Проволока диаметром меньше I мм является
довольно гибкой и может быть смотана в катушки. Для изготовления про-
волоки диаметром не больше 0,25 мм протяжка производится через алмаз-
ные фильеры. Выше этого диаметра обычно применяют фильеры из карбида
вольфрама.
Вольфрамовые листы
Листы из вольфрама получают также посредством «горячен — холод-
ной» деформации. Различие имеется лишь в геометрии исходного прутка,
который прессуется не в штабики квадратного сечения, а в плоские заго-
товки. Эти заготовки нагревают до высокой температуры и подвергают
ковке, а затем прокатывают. Во время деформации вольфрама в лист опера-
цию прокатки производят с большой скоростью, чтобы предотвратить охлаж-
дение металла. Для того чтобы избежать окисления вельфрама при высо-
ких температурах прокатки, производят оболочковую прокатку или приме-
няют плакировку металлами. По мере превращения металла в очень тонкий
154 Глава 7
лист прокатку можно производить при обычных температурах. Прокатан-
ный лист имеет очень гладкую поверхность и может быть отштампован
и выдавлен в промышленные изделия различной формы.
Руководствуясь соответствующими соображениями, приведенными для
температуры перехода вольфрама из хрупкого состояния в пластичное,
компактному металлу можно придавать форму с помощью обычных техно-
логических операций, например ковки, штамповки, вырубки и гибки. По-
скольку при температурах, поддерживаемых при этих операциях, вольфрам
быстро окисляется, его следует нагревать в защитной атмосфере, лучше
в водороде, а время выдержки его в этой атмосфере должно быть сведено
к минимуму. Окисленные поверхности можно очищать от окислов промыв-
кой в горячем растворе едкого натра или прокаливанием в атмосфере водо-
рода примерно при 1000е.
Вольфрамовые детали сложной формы можно изготовлять механической
обработкой пористых Спеченных вольфрамовых заготовок, пропитанных,
медью. После механической обработки медь удаляют спеканием такого
изделия в вакууме, при этом происходит уплотнение вольфрама. Однако
достигаемая при этом методе плотность составляет лишь 90% 117]. Трубки из
вольфрама могут быть изготовлены ультразвуковой формовкой прутков.
Соединение вольфрама с вольфрамом можно осуществлять точечной
или стыковой сваркой. Однако металл шва всегда бывает рекристаллизо-
ванным и, следовательно, хрупким. Механическое соединение, например
заклепочное, по-видимому, наиболее надежно. Вольфрам легко спаивается
с медью, серебром и никелем при условии, если спаиваемые детали являют-
ся чистыми и пайка производится в неокисляющсй атмосфере. Сварка воль-
фрама с никелем методом сопротивления вполне удовлетворительна для
изготовления деталей электронных ламп.
Отливка из пасты
Вольфрамовые изделия особой формы можно отливать из пасты. Воль-
фрамовый порошок, тщательно подобранный по гранулометрическому
составу, смешивают с выгорающей добавкой, чтобы получить пасту с боль-
шой кажущейся плотностью и высокой вязкостью. Пасту отливают в фор-
мы и обжигают по керамической технологии. Эти изделия обладают механи-
ческими свойствами, близкими к свойствам ковкого вольфрама, но их
плотность лишь немного выше 90% плотности ковкого металла.
Дуговая плавка
Вольфрам может быть отлит в вакууме тем же способом, что и молиб-
ден. При этом получаются слитки более высокой степени чистоты, чем при
спекании из порошка, особенно в отношении содержания газообразных
примесей. Слиток является чрезвычайно хрупким, так как он имеет крупно-
зернистую структуру.
Электронно-лучевая плавка
Электронно-лучевая плавка проводится в вакуумной камере, в которой
ускоренные электроны фокусируются на порцию расплавленного воль-
фрама и поверхность слитка, питающего расплавленную ванну. Давление
в камере необходимо поддерживать ниже 5-10 4 мм рт. ст., чтобы предот-
вратить ионизацию газа и последующий низковольтный разряд. Темпера-
w Вольфрам 156
тура, до которой нагревается металл, зависит лишь от подводимой мощности
и потерь тепла за счет теплопроводности и излучения. Для установки дан-
ной мощности скорость плавления определяется скоростью, с которой рас-
плавляемая порция металла подается под электронный пучок. Это обеспе-
чивает основное преимущество по сравнению с другими методами плавле-
ния, так как, установив время, достаточное для испарения примесей, часто
можно получить более чистый продукт за одну плавку. Этим методом был
получен слиток диаметром около ISO мм, общее количество примесей в кото-
ром не превышало О,О15?о. При оборудовании соответствующими привод-
ными механизмами печь для плавки электронным пучком может быть
приспособлена для зонной очистки с выращиванием очищенных монокри-
сталлов вольфрама. Существенное уменьшение металлических примесей
может быть достигнуто в результате многократной зонной плавки; такие
газообразные примеси, как кислород и азот, будут повторно вноситься в рас-
плавленный металл вследствие более высокого наружного давления этих
газов III. В настоящее время метод зонной очистки нольфрама использует
ся главным образом в исследовательских целях.
Гидростатическое прессование
Вольфрамовый порошок легко уплотняется гидростатическим прессо
ваннем. Этот способ имеет преимущества при изготовлении крупных дета-
лей. Спеканием спрессованных таким образом заготовок в печи можно полу-
чить слитки, сравнимые но качеству со слитками, спеченными методом
пропускания тока.
Пламенное напыление
Вольфрам можно нанести пламенным напылением на сталь и другие
металлические основы, создавая покрытия толщиной 0,25—1,25 мм за цикл.
При этом образуется литая структура зерен и может быть достигнута плот-
ность 95%.
Спеченный карбид
Карбид вольфрама — твердый, непластичный материал, который полу-
чают цементированием или на связке с другим металлом. Для кар-
бида обычно применяется кобальт в количестве 5—30?Ь. С увеличением
содержания кобальта увеличивается ударная вязкость, но уменьшается
твердость. Характеристика конечного продукта зависит от величины зерна
материала, ею плотности и состояния поверхности, т. е. от всех факторов,
которые определяются способом производства.
В методе «холодного прессования» применяются обычные приемы по-
рошковой металлургии. Для того чтобы обеспечить равномерное распреде-
ление кобальта, порошок карбида и порошок кобальта смешивают в шаро-
вых мельницах. Затем смесь прессуют при давлении 1,4—4,2 rn.ict.C- и полу-
ченные изделия предварительно нагревают до 900е в атмосфере водорода.
После этого изделиям путем механической обработки придают окончатель-
ные размеры, упаковывают в графитовые ящики, засыпают сажей и спе-
кают при 1300—1450°. При спекании заготовки получают линейную усадку
примерно на 20% и достигают нужных размеров, плотности и твердости.
Метод «горячего прессования» отличается лишь тем, что прессование
и спекание в этом случае осуществляются одновременно. Этот метод приме-
няется для изготовления крупных и сложных деталей. Применяются графи-
Таблица
ТИПИЧНЫЕ СОРТА ЦЕМЕНТИРОВАННОГО КАРБИДА ВОЛЬФРАМА в
Область применения
Механическая обработка
резанием со снятием
стружки
Серый чугун, неже-
лсзиые и неметал-
лические материалы
Резцы для грубой
обработки
Резцы общего на-
значения
Резцы для чисто-
вой обработки
Прецизионное свер-
ление
Стали и сплавы
Резцы для грубой
обработки
Резцы оСщего на-
значения
Резцы для отделки
Резцы для полу-
фипиша и фини-
ша легированной
стали
Прецизионная об-
работка
Износостойкий
Без ударной на-
грузки
Слабая ударная на-
грузка
Тяжелая ударная
нагрузка
Стойкий по отноше-
нию к ударным
нагрузкам
Слабая ударная
нагрузка
обоз-
Условное
наченде
С-1
С-2
С-3
С-4
С-5
С-6
С-7
О70
С-8
С-9
С-10
С-11
С-12
о
91,0
94,0
96,0
97,0
74,0
82,0
76,0
77,0
80,0
94,0
91,0
87,0
87,0
Содержание, %
о
и
о
9,0
6,0
4,0
3,0
11,0
10,0
9,0
8,0
4,0
6,0
9,0
13,0
13,0
—
—
7,0
_
—
8,5
-
TiC
—
—
—
—
8,0
8,0
15.0
6,5
16,0
—
Is
?¦§
н о
90,5
91,5
92,0
92,8
91,0
90,8
91,7
92,0
92,0
Такая
же, как
у С-2
Такая
же, как
у С-1
89,0
Такая
же, как
у С-11
U
О
?*=
о at
14,60
14,95
15,10
15,15
12,25
12,45
11,20
12,75
11,25
14,20
и
i
193
168
112
112
175
158
112
154
88
228
ill
480
490
525
570
420
438
455
476
490
438
Вольфрам
157
Область применения
Средняя ударная
нагрузка
Тяжелая ударная
нагрузка
i
о
Условное
начение
С-13
С-14
85,0
75,0
Содержание, %
о
15,0
25,0
о
_
Tic
Продолжение табл.
с °
11
Е-а.
88,0
83,5
И
О
1!
с «г
14,00
13,10
« п
с
263
252
б
с « ф
S.S 5
420
350
a «Адамас кэрбайд корпорейшн».
товые пресс-формы. После спекания эти пресс-формы скалываются с гото-
вого изделия.
Свойства и общие данные о применении некоторых типичных сортов
карбида вольфрама и твердых сплавов приведены в табл. 6.
ОБЛАСТИ ПРИМЕНЕНИЯ
Существующие области применения
Первое важное применение вольфрама — изготовление из него нитей
накала для электрических ламп.
До сих пор это одна из самых важных областей применения вольфрама.
Затем следует его применение для быстрорежущих инструментальных
сталей. До 1941 г. 93% общего количества вольфрама расходовалось на
производство стали, а 5% вольфрама было использовано в виде металличе-
ского порошка, химических соединений и т. д. С того времени картина
потребления изменилась, и лишь приблизительно одна четверть вольфрама
идет на ферросплавы. Вероятное распределение вольфрама по областям
применения в процентах за последние годы, приведенное в обзоре[24)
и в справочнике 1261, указано в табл. 7.
Таблица 7
РАСПРЕДЕЛЕНИЕ ВОЛЬФРАМА ПО ОБЛАСТЯМ ПРИМЕНЕНИЯ ЗА ПЕРИОД IS49— I960 гг.
Области применения
Ферросплавы
Карбиды
Сплавы для наплавки
Сплавы Со—Сг—W—Мо
Электрооборудование
Химикалии
Другие области применения
1949
63
17
1
4
6
6
3
1955
>33
30
-
14
1
<22 6
1956
40
35
1
3,5
13
1,5
6
1957
35
40,5
2
3,5
13,5
1,5
4
1958
31,5
39
3
3
16
2,5
5
1859
32
37,5
9
5
. 13,5
1,5
1,5
1SCO3
3D
35
7
5
18
1
3,5
До конца июля i960 г.
Включая порошкообразный металл.
/5S Глава 7
Изменение потребления этого металла объясняется: 1) усиленной заме-
ной вольфрама в быстрорежущих сталях молибденовыми композициями,
главным образом из-за опасений нехватки вольфрама и правительственного
контроля, который существовал во время войны в Корее, и 2) ростом при-
менения цементированного карбида или твердых сплавов для изготовления
режущих инструментов.
Вольфрам в стали. Вольфрам, который представляет собой карбидо-
образующий элемент, соединяется с железом, углеродом и другими легирую-
щими элементами с образованием сложных комплексных карбидов, устой-
чивых при высоких температурах. Кроме того, он является упрочнителем
среднеупперодистых сталей и до некоторой степени повышает закаливаемость
стали. Измельчение зерна, сообщаемое стали при введении небольших доба-
вок вольфрама, повышает ударную вязкость. •
Основное влияние вольфрама на сталь определяется его способностью
сохранять высокую твердость при повышенных температурах, называемую
«красностойкостью». Это свойство усиливается в присутствии хрома и еще
больше в присутствии кобальта, хотя и с некоторой потерей ударной вязко-
сти. Помимо применения в производстве быстрорежущих сталей для режу-
щих инструментов, вольфрам применяется при горячей обработке сталей,
окончательной обработке (полировании) и волочении жаростойких и плохо
деформируемых сталей.
Сплавы вольфрама. Развитие реактивного самолетостроения и ракет-
ной техники со времени второй мировой войны привело к постоянно воз-
растающему спросу на сплавы, обладающие высокой прочностью и стон-
костью против окисления при высоких температурах. До сих пор высоко-
температурные сплавы разрабатывались главным образом на основании
практического опыта. При разработке таких сплавов применялись многие
композиции, содержащие вольфрам.
Сплавы кобальта, хрома и вольфрама известны с 1913 г. под названием
«стеллитов». Они сохраняют свою твердость и прочность при температурах
до 600° и применяются для изготовления литых режущих инструментов,
центров токарных станков, вставных зубьев фрез, фильер, регулирующих
планок, направляющих роликов и т. д. Очень важным применением этих
сплавов является наплавка их на изделия, подвергающиеся очень сильному
истиранию, например на пластины дробилок, зубья грейферов, седла кла-
панов и детали насосов.
Если требуется устойчивость по отношению к коррозии и эрозии или
прочность при высоких рабочих температурах, то применяют сплавы на
основе никеля, например «хастеллой».
Серебровольфрамовые сплавы, или, точнее, смеси, которые получают
методами порошковой металлургии, применяются для электрических
контактов, выключателей, стартеров двигателей, подвергающихся действию
сильного искрового разряда.
Вольфрамоникелевомедные сплавы, содержащие примерно 90% воль-
фрама, 6"о никеля и 1% меди, широко применяются в качестве материала
для защиты и контейнеров для радиоактивных материалов. Эти сплавы,
которые обычно oihocht к группе «тяжелых сплавов», нашли применение
также для роторов гироскопов, противовесов для самолетов и в других
областях, где требуется материал с высокой плотностью. Типичная микро-
структура «тяжелого сплава» («мэллори-1000») приведена на рис. 7.
Вольфрам
159-
Чистый вольфрам. Высокая температура плавления и низкое давление
пара чистого вольфрама делают его идеальным материалом для нитей ламп
накаливания и катодов электронных ламп. В виде стержней илн проволоки
чистый вольфрам применяется для изготовления термопар, измеряющих тем-
пературу до 3000°, электродов дуговых ламп, электродов для сварки в защит-
ной среде или атомно-водородной сварки и электрохимических электродов.
Из чистого вольфрама изготовляют контактные шайбы для электрических
Рис. 7. «Тяжелый сплав» метал-
лический вольфрам в матрице из
сплава W —Си — Ni («П. Р. Мэл-
лори энд компания).
;'<
:j
прерывателей и пусковых устройств. Благодаря высокой проникающей спо-
собности рентгеновых лучей, испускаемых вольфрамом, вольфрамовые
шайбы применяются в качестве мишеней для рентгеновских установок.
Высокий модуль упругости вольфрама позволяет использовать его в каче-
стве креста нитей для оптических труб, нитей для хирургических швов
и пружин для различных приборов. Пружины из вольфрама устойчивы
при температурах до 650° и не дают большой остаточной деформации.
Карбид вольфрама. За последние 10 лет применение цементированного
карбида вольфрама приобретает все большее значение. Он заменил до неко-
торой степени вольфрамовые сплавы и быстрорежущую сталь в инструмен-
тальной промышленности и производстве штампов. Чрезвычайно высокая
твердость карбида вольфрама как при обычной, так и при повышенных тем-
пературах делает его превосходным материалом для режущих инструментов.
Помимо применения его в качестве материала для режущих инструментов,
карбид вольфрама нашел широкое применение для изготовления износо-
стойких деталей, а также фильер для горячей и холодной протяжки про-
волоки, прутков и труб. Большое значение карбид вольфрама приобрел во
время второй мировой войны, когда немцы впервые изготовили из него
гильзы бронебойных пуль.
Плавленый карбид вольфрама нашел широкое применение в виде твер-
досплавных наплавок для придания износостойкости. Самым значительным
в этой области является, несомненно, применение его для изготовлепн я
160
Глава 7
инструментов глубокого бурения. Кроме того, из плавленого карбида
вольфрама можно отливать детали, стойкие к истиранию, например
сопла пескоструйных аппаратов, режущий инструмент, седла клапанов
l
ъ
Рнс. 8. Цементированный карбид воль-
фрама на основе кобальта. X 1с00
(«Адамас кэрбайд корпорейшн»).
Рис- 9. Литой карбид вольфрама и
кобальт. X1500 («Студи компании).
12% Co. 84% W. 4% с (WC/W.C).
и т. д. На рис. 8 и 9 показаны типичные структуры цементированного
и литого карбида вольфрама.
Люминофоры. Люминофоры — химические соединения, которые при
соответствующем возбуждении коротковолновым излучением, например
ультрафиолетовыми лучами, становятся источниками люминесцентного
света, более эффективного, чем все другие источники света. Вольфраматы
кальция и магния широко применяются для люминесцентного освещения.
Другие области применения. Фосфорновольфрамовая кислота, обра-
зующаяся при взаимодействии вольфрамата натрия с фосфорной кислотой,
применяется как вещество, повышающее устойчивость пигмента против
выгорания на свету. Трехокись вольфрама находит применение для приго-
товления масляных и акварельных красок. Вольфрамовые бронзы заменяют
бронзовые порошки в красках. Вольфраматы свинца являются замените-
лями свинцовых белил. Вольфрамовые соединения применяются в качестве
осветлителей стекол. Имеется сообщение о применении одного из соедине-
ний вольфрама для повышения коэффициента преломления оптических
стекол, в частности стекол, применяемых для аэрофотосъемки. Вольфрамат
натрия применяют как огнестойкий материал.
Вольфраи
161
Возможные области применения
Неуверенность в отношении снабжения вольфрамом в случае войны,
резкие колебания цен я важное значение вольфрама для американской
экономики в сочетании с периодическим контролем правительства США
за его применением стимулировали развитие металлургических исследова-
ний скорее н направлении изыскания подходящих заменителей вольфрама,
чем в направлении расширения областей его применения. В результате
этого применение вольфрама отстает по сравнению с другими металлами,
несмотря на то что иногда эти металлы имеют меньшие потенциальные
возможности. В настоящее время при наличии огромного количества воль-
фрама в американских национальных запасах и больших запасов, имею-
щихся как в США, так и за границей, по-видимому, необходимо предпри-
нять широкие исследования по изысканию областей применения вольфрама
без колебаний или опасений по поводу недостаточного снабжении этим
металлом, как это уже было сделано с молибденом.
Основным толчком для развития спроса на материалы, способные рабо-
тать при более высоких температурах и напряжениях и имеющие более
высокую коррозионную стойкость, явилось создание газовых турбин и ра-
кетных двигателей. Однако дальнейшее повышение эффективности многих
промышленных процессов, в частности в нефтяной и химической промыш-
ленности, также зависит главным образом от успехов в разработке улучшен-
ных высокотемпературных крипоустойчивых сплавов. Вольфрам, несом-
ненно, играет важную роль в производстве новых сплавов, необходимых
для каркасов самолетов и в качестве конструкционного материала для
ракет.
Сплавы, применяемые при высоких температурах, должны обладать
высокой прочностью как при комнатной, так и при высоких температурах,
хорошей устойчивостью против крипа, высокой ударной вязкостью, высо-
ким пределом усталости, а также хорошими коррозионными свойствами
и стойкостью против окисления. Кроме того, они должны обладать высо-
ким отношением прочности к плотности.
Таблица 8
СВОЙСТВА TS- ГОПЛАВКИХ МЕТАЛЛОВ
C-HoiW тна
Температура плавления, °С
Плотность, г/см3
Модуль упругости, 104 кг/.мл8
Кристаллическая решётка
Температура рекристаллизации при
выдержке 1 час, °С
Коэффициент линейного расшире-
ния, Н)-*/град
Коэффициент теплопроводности,
кал'см-сек-г рад
Давление пара при 2225',
.«к рт. ст.
Стоимость 1 кг порошьа, долл.
W
3410
19,3
3,57
КОЦ
1565
4,45
0,31
1.38-10-*
10,5
Re
3180
21,0
4,69
ГПУ
1400
6,7
0,17
1,18-10-=
1500
Т.ч
2996
16,6
1,89
КОЦ
1275
5,9
0,13
7,9-10-*
95
Мо
2610
10,2
3,29
коц
изо
л,6
0,35
0,50
7,5
S'b
2468
8,57
1.06
коц
1050
7,1
0,125
1,66-10-
220
11 Заказ № 239
162 Глава 7
Оказалось, что среди всех тугоплавких металлов вольфрам обладает
наилучшим сочетанием свойств для применения его при высоких темпера-
турах. Конечно, высокая скорость окисления недопустима для применения
ei о при высоких температурах, но этот недостаток имеют все тугоплавкие
металлы. Получены обнадеживающие результаты в улучшении стойкости
против окисления путем легирования. Возможно, более важное значение
имеет сообщение о распространении метода нанесения покрытий из дпеилн-
цида молибдена на молибден и на вольфрам [24]. До сих пор для внедрения
вольфрама в этих областях применения было приложено очень мало усилий,
но теперь этому уделяется большее внимание. В табл. 8 [30] приведены
свойства обычных тугоплавких металлов, на основании которых можно уста-
навливать пригодность этих металлов для службы при высоких темпера-
турах.
ЛИТЕРАТУРА
1. Atkinson R. H., and Staff of Metals Research Group, Westinghonse Lamp.
Division, WADD Tech. Rept. 60-37, I960.
2. Bechtold J. H., Shewmon P. G., l'rans. Am. Soc. Metals, 46, 397—
¦108 A951).
3. В г о w n С M., Fountain R. \l\, J. Metals, 10, 330 A958).
4 В u с h 1 e H., Z. Metallkunde, 37, 53—56 A946).
5. С о о 1 i d g e W. D., am л. пат. 23499, 1909; пат. США 1082933, 1913.
6. Dickinson J. M., Kichardson L., Trans. Am. Soc. Metals, 51, 1055
A959).
7. Erickson С. С, The Tool Engineer iMarch 1958).
8. F i t z e v E., Berg und lluttenmannische Monatshefte, 97, №. 5 A952).
9. G о e I /. e 1 С. С Treatise on Powder Melallurgy, lnterscience Publishers Inc.,
New York, 1950.
10. G r e g g J. L.. The Alleys cf Iron and Tungsten, McGraw-Hill Book Co.. Inc.,
New York, 1934.
11. H a m p e 1 C. A., Corrosion, 14. 557t—560t A958).
12. Hansen M., Constitution of Binary Alloys, McGraw-Hill Book Co., Inc.,
New ^ ork, 1958.
13. H eg e d u s A. J., Miller Т., Н с u g e b a u e r J., S as v ar i K-, Z. anorg.
allgem. Chem., 281, 64—82 A955).
14. Hodge W., Evans R. M., Hoskins A. F., Trails. AIME, 203, 824—
832 A955).
15. Kieffer R. 11 о t о р \V., Metal Ind., 66, 332, 354, 378 A945).
16. К о h 1 W. H., Materials Technology for Electron Tubes, Reinhold Publishing
Corp., New York, 1951.
17. Levi R., пат. США 2669008, 1954
18. L i К.. С, Wang С. \ ., Tungsten, 3rd ed., Reinhold Publishing Corp., New '
\ork, 1955.
19. Li ]\. C, Dice С. М., пат. США 2535217, 1950.
20. Loung P. Y., канад. пат. 552162, 1958
21. Me Ken na P. M., пат. США 2525778, 1950.
22. M с К e n n a P. M-, пат. США 2113355, 1938
23. M a g п е 1 i A., Anderson G., В 1 о m b e r g В., К i h 1 b о г g L., Anal.
Chem., 24, 1998 A952).
21. Materials Survey, Tungsten, U. S. Department of Commerce, December 1956.
25. Mineral Statistics, American Metal Market, New York, 195S
26. Minerals Yearbook, U. S. Bureau of Mines, 1955—1959.
Вольфрам 163
27. National Bureau of Standards, Mechanical Properties of Metals and Alloys, Circular
C447, 1943.
28. Os born R. H., J. Opt. Soc. Am., 31, 428 A911).
29. P u g h J. W., Paper Presented at Am. Soc. Testing Materials, Annual Meeting,
June 16—21, 1957.
30. P u g h J. VV., J Metals, 10. 335 A958).
31. Материалы Комиссии no атомной энергии США, Ядерные реакторы. 111. Материа-
лы для ядерных реакторов, ИЛ, Москва, 19Б6.
32. Schwartzkopf P., Kieffer R., Refractory Hard Metals, The Macmil-
lan Co., New York, "953.
33. S m i t h e I 1 s С J., Tungsten, Chapman and Hall, London, 1952.
34. U. S. Bureau of Mines, Mineral Industrial Surveys, 1956.
35. W i 1 1 a r d H. H, D i с h 1 H.. Advanced Quantitative Analysis, D. Van Nost-
rand Co., Inc , New York, 1943
8.
ГАЛЛИЙ
А П ТОМПСОН
А. Р. Thompson, The Eugle-Picher Company, Joptin,
Missouri
ВВЕДЕНИЕ
Открытие галлия предсказывалось дважды, прежде чем металл был
выделен. Менделеев в своей работе по установлению связи между свойства-
ми элементов и их атомными весами нашел доказательства, на основании
которых он предсказал существование трех элементов 122], названных им
благодаря сходству с бором, кремнием и алюминием экабором, экасилицием
и экаалюминием. В 1870 1871 гг. он предсказал свойства всех трех эка-
элсмептов.
Лекок де Буабодран в те же годы при изучении спектров сходных эле-
ментов доказал их периодичность. Эти исследования привели его к выводу,
Рис 1. Фотография кубика
твердого металла, плавящегося
в руке («Алюминум компани
оф Америка»).
что между алюминием и индием не хватает одного элемента, открытие и ос-
новные спектральные линии которого он также предсказал. Заинтересовав-
шись этим еще не открытым элементом, Лекок де Буабодран предпринял
поиски и в 1875 г. после значительных трудностей выделил его в небольшом
количестве 13] из пиринейской цинковой обманки. Позднее Лекок де Буа-
бодраи получил около 75 г нового металла и изучил его свойства. iMeime-
леео при научении нового элемента установил, что это был предсказанный
им экаалюминий 123]. Свойства нового элемента почти точно совпадали
с теми, которые он опубликовал перед его открытием. Лекок де Буабодран
также иашел, что спектральные линии галлия соответствовали предска-
занным.
Первые сведения о производстве галлия в США представлены Мак-Гут-
ченом [101, который выделил его из металлического остатка, полученного
при рафинировании технического цинка дистилляцией. Цинковая руда,
из которой был выделен галлий, добывалась из месторождения Трех шта-
тов (Миссури - - Оклахома — Канзас).
Галлий относится к III ipynne четвертого периода периодической таб-
лицы. Его порядковый номер 31, атомный вес 69,72.
Галлий 1G5
Галлий — один из трех металлов, жидких при температуре тела (два
других — цезий и ртуть); его температура плавления равна 29,75°. Низкая
температура плавления галлия иллюстрируется на рис. 1.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Галл nit широко распространен в земной коре. Вычислено [1, 9], что
в каждой тонне литосферы присутствует около 15 г галлия. Как и следовало
ожицачь на основании его сходства с алюминием, галлий найден в неболь-
ших количествах во многих глиноподобных материалах. Эйнеке 16] предста-
вил исчерпывающие материалы о содержании галлия в различных рудах,
горных породах и минералах. Лишь в немногих случаях содержание гал-
лия в различных породах превышает 0,01%. Обзор периодической таблицы
дает возможность предполагать, что в повышенных концентрациях галлий
может находиться в рудах и минералах, содержащих цинк, алюминий и гер-
маний 135].
Германит* — сложный сульфид цинка, меди, мышьяка и германия —
содержит 0,1—О,8°6 галлия. Этот минерал найден в свинцово-медных рудах
в районе Тсуыеб (Юго-Западная Африка).
Реньерит** — минерал того же характера, что и германит,— найден
в цннково-свинцово-медных рудах в бывшем Бельгийском Конго. Он со-
держит до 1П6 галлия. Эти минералы, очевидно, встречаются довольно
редко. Они являются наиболее богатыми галлием минералами, извест-
ными в настоящее время.
Уоринг нашел, что цинковые руды из месторождения Трех штатов
(Миссури — Оклахома — Канзас) содержат галлий, германий и кадмий
138]. Исследование большого числа кристаллов сфалерита*** из этого место-
рождения показало, что содержание галлия составляет 0,001—О,О2с6
(в среднем 0,005%) [35]. Известно, что другие цинковые сульфидные руды
также содержат галлий, однако лишь немногие из них были тщательно
исследованы.
Многие алюминийсодержащие минералы содержат галлий обычно
в количествах порядка 0,001—0,01 % 16]. К этой группе минералов отно-
сится боксит — основное исходное сырье для получения алюминия. Не
во всех цинковых рудах или алюминийсодержащих материалах галлий
присутствует в количествах, достаточных для экономически выгодного
извлечения. Исходным сырьем для получения галлия могут служить побоч-
ные продукты и отходы производства, в которых он содержится в опреде-
ленной минимальной концентрации, позволяющей использовать различные
методы извлечения. Германит и реньерит могут служить основными источ-
никами получения, если они доступны в достаточных количествах.
Подобно большинству других элементов, галлий найден в небольших
количествах во многих углях. Содержание галлия в различных углях
колеблется в широких пределах и зависит, по-видимому, от их происхожде-
ния. Гольдшмидт 18] показал, что некоторые древние растения избира-
тельно извлекали галлий, и поэтому концентрация его в углях значительно
выше среднего содержания в земной коре. Концентрация галлия в угле
слишком мала, чтобы иметь значение, но в продуктах сгорания угля —
* Фактически Cu4(jcS4, очень редкий.— Прим. рсд.
** (Си, Fe, Ge)S.— Прим. ред.
••• ZnS. — Прим. ред.
166 Глава 8
золах и других твердых побочных продуктах, полученных в условиях,
позволяющих сохранить галлий,— концентрация его заметно повышается.
Морган и Дэвис 1281 представили данные о содержании галлня в продуктах,
образующихся при сгорании английских углей, и сообщили, что пыль
из дымоходов содержит 0,05—1,5°о галлия. Известно также о присутствии
галлия в углях и побочных продуктах переработки углей в других странах,
в частности в СССР, Индии и некоторых скандинавских странах.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Производство галлия в США в 1959 г. составило 90 кг. Небольшие
количества были получены также в Англии и странах Европы. В США
в 1958 г. продано было 90 кг этого металла. Большая часть галлия произво-
дилась двумя фирмами — «Игл-Пичер» и «Алюминимум компани оф Аме-
рика». В настоящее время в США цена в больших партиях составляет 3 долл.
за 1 г галлия высокой степени чистоты (99,9999°и). Менее чистый металл
продается дешевле.
Предварительные подсчеты показали [2], что в США производство
галлия при соответствующем спросе может достигнуть 20 т в год. При
крупномасштабном производстве существующие цены могут быть значи-
тельно снижены.
Другим потенциальным источником получения галлия являются по-
бочные продукты переработки угля, например пыль дымоходов при сжи-
гании английских углей [28]. Сообщений об исследовании американских
углей нет. Известно, что некоторые азиатские угли содержат галлий.
ИЗВЛЕЧЕНИИ
Из-за разнообразия материалов, содержащих галлий, промышленные
методы его извлечения весьма различны.
Извлечение галлия как побочного продукта при переработке цинковых
руд месторождения Трех штатов (Миссури — Оклахома — Канзас) зави-
сит от способа переработки руды. Цинковую сульфидную руду подвергают
обжигу н выщелачивают серной кислотой с целью получения неочищенного
раствора сульфата цинка. Концентрирование галлия производят в процессе
последующей очистки раствора (описано ниже). Однако при получен ии метал-
лического цинка плавлением обожженной цинковой руды в ретортах после
отгонки цинка галлий обычно находится в ретортных остатках. В случае
применения для извлечения из этих остатков цинка вельц-процесса галлий
переходит в клинкер 1261; клинкер содержит 0,01—0,05% металла. Чтобы
извлечь галлий, клинкер растворяют. Насколько известно, этот потенциаль-
ный источник получения галлия в настоящее время не используется из-за
дороговизны процесса.
После обжига цинковой руды огарок выщелачивают серной кислотой.
Полученный раствор сульфата цинка перед поступлением на последующие
операции должен быть очищен [101. Частичная очистка достигается осто-
рожной нейтрализацией избытка кислоты; при этом получается осадок так
называемого «железного шлама». Шлам, полученный при переработке цин-
ковых руд Трех штатов, содержит около О,О7°6 галлия и используется как
исходное сырье для его извлечения. Кроме галлия, шлам содержит около
10% алюминия и 15% железа. Шлам выщелачивают кислотой или едким
Г адлий 1И7
натром. Щелочной процесс более удобен, так как кислоты оказывают кор-
розионное действие на оборудование. В щелочи растворяются соединения
алюминия и галлия, а также некоторое количество кремнезема и других
веществ. При осторожной нейтрализации кислотой осаждаются гидроокиси,
которые затем отфильтровывают. Отфильтрованный кек обезвоживают для
более полного превращения кремнезема в нерастворимую форму. Обезво-
женный остаток растворяют в соляной кислоте и получают загрязненный
раствор хлорида галлия, в котором содержится также значительное коли-
чество алюминии. В зависимости от содержания примесей в растворе хло-
рида можно проводить дополнительное осаждение и растворение гидро-
окисей.
Успешное отделение галлия от алюминия достигается при экстракции
GaCl3 эфиром из раствора в концентрированной соляной кислоте. Раствор
встряхивается с несколькими порциями эфира, который экстрагирует хло-
рид галлия, но не извлекает алюминий и некоторые другие примеси. По-
скольку эфир и солянокислый раствор не смешиваются, производится раз-
деление двух слоев. После этого эфир отгоняют и возвращают в процесс;
хлорид галлия, остающийся в перегонной колбе, содержит некоторые приме-
си, в основном железо. Раствор обрабатывают концентрированным раство-
ром едкого натра; при этом железо осаждается и затем отфильтровывается.
Чистый щелочной раствор подвергают электролизу в электролизере
с платиновым анодом и медным катодом [361. Плотность тока на аноде
составляет 0,5а'см2, на катоде—0,33 а.см", напряжение — 5,5 в. При
этих условиях температура ванны значительно выше температуры плавле-
ния галлия. Конец катода располагается над фарфоровым тиглем, помеща-
емым на дне электролизера. В процессе электролиза жидкий металл стекает
в этот тигель. Выход по току на катоде составляет около 35%, пока концен-
трация галлия в электролите не станет меньше 2 г>л, после чего выход по
току быстро падает. Расстояние между электродами составляет 3—6 см
в зависимости от размера вапиы. Благодаря интенсивному выделению газов
во время осаждения происходит циркуляция электролита, за исключением
электролита на дне ванны, так что раствор нужно периодически переме-
шивать.
Полученный таким образом технический галлий промывают последо-
вательно дистиллированной водой, разбавленной соляной кислотой и раз-
бавленной азотной кислотой. Образовавшиеся дроссы снимают и возвращают
в цикл очистки. Если при обработке азотной кислотой дроссы больше не
образуются, а жидкий галлнй под соляной кислотой имеет блестящую
зеркальную поверхность, химическая очистка считается полной.
Жидкому галлию дают переохладиться под слоем сильно разбавленной
соляной кислоты и затем вводят в качестве затравки небольшой кристалл
металла. В этих условиях почти сразу же начинают образовываться крис-
таллы галлия, которые непрерывно удаляют из жидкости до тех пор, пока
в сосуде не останется лишь небольшое количество жидкого галлия. Кристал-
лы промывают дистиллированной водой, после чего переплавляют и пере-
кристаллизовывают по методу, разработанному Бюро стандартов США
111]. Число перекристаллизации зависит от требуемой степени чистоты
металла.
Галлий получают также из щелочных растворов алюмината натрия
методом Байера. По этому методу боксит обрабатывают горячим раствором
едкого натра. Полученный алюминат натрия отфильтровывают от нераство-
римого остатка и вносят в него затравку гидроокиси алюминия. После
охлаждения начинает кристаллизоваться гидроокись алюминия, которая
168 Глава л
на определенно» стадии отделяется от раствора. Отработанная жидкость,
которая содержит основное количество галлия и значительное количество
гидроокиси алюминия, служит исходным сырьем для извлечения галлня.
Щелочной раствор обрабатывают |7] для снижения содержания алю-
миния, и оставшиеся галлий и алюминий осаждаются при подкислении
раствора. Сырой осадок гидроокисей затем вновь растворяют в концентри-
рованном растворе едкого натра и галлий выделяют электролизом с при-
менением анодов и катодов из нержавеющей стали. Электролиз проводится
при плотности тока на катоде 0,8 а/см", напряжении 10 в и температуре 80°.
Для получения металла высокой степени чистоты требуется дальнейшая
очистка. Если в исходном растворе алюмината натрия присутствует зна-
чительное количество органических веществ, то в процесс включается ста-
дия их удаления.
Другой способ извлечения галлия из растворов алюмината натрия
в процессе Байера основан на электролизе с применением ртутного катода
Ml. В эгом процессе только часть гидроокиси алюминия кристаллизуется
из раствора алюмината натрия. Обедненный раствор возвращают в произ-
водственный цикл. Галлий не осаждается с алюминием и концентрируется
по мере циркуляции алюминатных растворов. Когда концентрация галлия
становится достаточной, раствор алюмината натрия подвергают электро-
лизу с применением ртутного катода при непрерывном перемешивании.
Галлий осаждается на катоде. После электролиза раствор алюмината натрия
возвращают в цикл извлечения алюминия. Ртуть, содержащую галлий,
обрабатывают горячим раствором едкого натра. Галлий растворяется в ще-
лочном растворе, а ртуть возвращается на катод. Полученный раствор гал-
лия подвергают электролизу для выделения металла. Электролиз прово-
дится при температуре 40—50°, напряжении около 4 в, плотности тока
на катоде приблизительно 0,5 а'дм3, плотности тока на аноде 20—60 а'Ли2.
Установлено, что при этом расход электроэнергии составляет 8 вт-час
на 1 г галлия. Никаких данных нет для конечного электролиза раствора
галлата натрия, но можно предположить, что это цифры того же порядка,
что и для описанного способа.
Извлечение галлия в промышленном масштабе из пылей дымоходов
проводилось в Англии 130]. Типичные пыли дымоходов содержали обыч-
но оьоло 0,5"о германия и 0,25% галлия. По методу, принятому в Англии,
пыль сплавляют с содой, известью, окисью меди и углем (необходимо также
железо, но оно обычно находится в пылях). Таким образом получают ко-
рольки металла, содержащие большую часть германия и галлия из исходно-
го сырья. Корольки металла хлорируют в разбавленном растворе хлорного
железа, при этом галлий и германий растворяются. Образующийся тетра-
хлорид германия отгоняют из раствора, после чего раствор охлаждают для
кристаллизации солей медн, которые отделяют центрифугированием.
Затем раствор разбавляют и обрабатывают алюминием для осаждения
оставшейся меди и других металлов; одновременно железо восстанавли-
вается до двухвалентного состояния. Раствор неочищенного хлорида гал-
лия, полученный таким образом, смешивают с изопропиловым эфиром,
чтобы экстрагировать хлорид галлия (об экстракции см. выше при описании
получения галлия из цинковых руд)- После отгонки эфира хлорид галлия
перерабатывают, как это указано выше. Описан процесс 1151 получения
соединений галлия из газов, образующихся при сжигании угля. Газы под-
вергают мокрой очистке разбавленным раствором щелочи, который улавли-
вает галлий и некоторые другие металлы. Этот раствор едкого натра цирку-
лирует, пока содержание галлия не станет достаточным для экономичного
Галлий 169-
изЫ1ечения. Галлии осаждают из щелочного раствора таннином. Осадок
высушивают и озоляют. Золу растворяют в соляной кислоте и галлий экст-
рагируют из этого раствора изопропиловым эфиром. Очистку галлия на этой
стадии можно осуществлять, очевидно, одним из описанных выше
способов.
Описаны несколько методов лабораторного получения галлия из гер-
манита и первый промышленный метод получения галлия из пылей дымохо-
дов |30|. По одному методу германит измельчают до частиц размером 100 меш,
затем обрабатывают 50''о-ным раствором едкого натра и раствор выпаривают
досуха. Полученную массу выщелачивают горячей водой и получают
раствор, содержащий германий, галлий и некоторые другие вещества. Щелоч-
ной раствор нейтрализуют серной кислотой до рН 8, окисляют азотной кис-
лотой и нагревают до кипения. Затем раствор фильтруют и прн кипячении
нейтрализуют едким натром до рН 3; при этом осаждается галлий в виде
KaH2Ga (AsO4J-1",5Н2О. Осадок, содержащий галлий, отфильтровывают
и растворяют в соляной кислоте. Раствор перегоняют для удаления герма-
ния и мышьяка в виде хлоридов, остаток экстрагируют изопропиловым
эфиром и обрабатывают, как описано выше, с целью извлечения галлия.
Извлечение галлия из реньерита не описано, но, по-видимому, для этого
можно применять тот же метод, что и в случае германита.
ФИЗИЧЕСКИЕ СВОЙСТВА
Самыми уникальными свойствами галлия являются его большой интервал
жидкого состояния (один из самых больших среди других металлов) и низ-
кое давление пара даже при высоких температурах. Примечательно также,
%
Р и с. 2 Твердый металлический галлий и эластичная
упаковка для него (в центре и справа) («Игл-Пичер
компания)
что плотность жидкого галлия больше, чем твердого. Эту характеристику
необходимо принимать во внимание при упаковке галлия в контейнеры,
которые должны быть рассчитаны с учетом его расширения при затверде-
вании. Галлий можно упаковывать в эластичные и прочные мешки, как
показано на рис. 2. Для упаковки можно применять также прорезиненные
мешки и сосуды.
Физические свойства галлня приведены в таблице.
ФИЗИЧЕСКИЕ СВОЙСТВА ГАЛЛИЯ
Порядковый номер
Атомный вес
Изотопный состав, %
Массовое число 69
71
Цвет
Кристаллическая решётка
Твердость по Мопсу (тв.)
Пластичность (тв.)
Плотность, г/слз
2iP (то.)
29,65° (тв.)
29,8° (ж.)
1100° (ж.)
Удельный объем, см^/г
29" (то.)
30° (ж.)
Температура плавления, °С
Температура кипения, °С
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Давление пара, мм рт. ст.
1315=
1726°.
1983°
Вязкость, ггэ
97,7°
1100°
Поверхностное натяжение, дн/см
30е (Н2 илн СО2)
35" @,"l— 0,2 и. HCl)
Удельная теплоемкость при 29—127°,
кал/г-град
Коэффициент теплопроводности при 30°,
кал/см-сек-град
Коэффициент линейного расширения прн
0—30J, град1
Удельное электрическое сопротивление,
м ком -см
20° (tr.)
46,1" (ж.)
Электрохимический эквивалент Ga3*,
м г/к
Электродный потенциал ъСг^ (Н2=
= 0,0 в) а, в
Отражательная способность, %
4360 А
5890 А
31
64,72
61,2
38.8
Серый с
блеском
Ромбическая,
нальпая
1,5—2,5
Хрупкий
5,907
5,9037
6,0948
5,445
0,1694
0,1641
29,75
1983°
19,16
1014
1
100
760
0,01612
0,00578
735
636
0,0977
0,07—0,09
1,8-10-ь
56,8
28,4
0,24083
-0,52
75,G
71.3
B]
121
[21
|21
металлическим
[61
псевдотетраго-
[6]
[40]
[31]
[31]
[31]
[32]
[61
B|
[21
[2]
[21
[32]
[32]
[19]
1191
[17]
|21
[32]
[6]
[6]
[35]
[12|
[40]
[40J
я Номенклатура Национального бюро стандартов.
Галлий Ш
ХИМИЧЕСКИЕ СВОЙСТВА
По своим химическим свойствам галлий напоминает алюминий и явля-
ется амфотерным. На поверхности металлического галлия обычно обра-
зуется тонкая пленка окиси, так что дальнейшее окисление на воздухе
или в кислороде незначительно даже при температуре красного каления.
Предполагалось, что галлий может смачивать стекло и другие металлы, но
это следствие загрязнения окислами [12]. Свободный от окислов галлий
может смачивать некоторые поверхности, однако этот вопрос недостаточно
изучен.
Галлий не разлагает воду при 100е [2]. Он медленно растворяется
в минеральных кислотах; горячая азотная кислота окисляет металл и раство-
ряет окись. Царская водка также растворяет галлий. В растворах едкого
натра и едкого кали галлий растворяется с выделением водорода. Галлий
непосредственно соединяется с галогенами [211. Фторид галлия может быть
приготовлен растворением металла в концентрированной плавиковой кис-
лоте [14]. Обычная валентность галлия равна трем; известны соединения
одно- и двухвалентного галлия, но они, по-видимому, неустойчивы.
При качественном химическом определении хлорид галлия отделяется
от большинства других хлоридов экстракцией из раствора в 6,5 н. соляной
кислоте диэтиловым или нзопропиловым эфиром [34]. После выпаривания
эфирного экстракта может быть извлечен хлорид галлия и идентифицирован
осажчением ферроцианидом [29].
Возможно, наилучшим методом количественного определения галлия
является экстракция его из кислого раствора раствором 8-оксихиноли-
на в хлороформе с последующим спектрофотометр нческим определением
J27I.
Другие количественные определения основаны на различных принци-
пах 1241.
Галлий экстрагируют из раствора диэтиловым эфиром и реэкстрагируют
водой. Водный раствор после доведения до рН 2,8 и обработки галлоциани-
ном образует голубой лак. Лак разрушается при образовании внутриком-
плсксного соединения галлия с этилендиаминтетрауксусиой кислотой. Этот
метод дает отчетливую точку перехода и точные результаты. Для коли-
чественного анализа обычно применяются спектрографические мето-
ды. В одном нз методов [33] в качестве внутреннего стандарта приме-
няется окись бериллия, а в качестве разбавителя — порошок угля; сжи-
гание производится в дуге постоянного тока, для определения берется
линия галлия 2943,6 А.
Для определения примесей в галлии высокой степени чистоты (99,9999 °о)
применяют спектрографические методы, активационный анализ и изме-
рение остаточного сопротивления.
Подробный обзор по устойчивости ряда металлов действию галлия
представлен и справочнике [2]. Уместно привести следующее утверждение
из этого источника: «Галлий оказывает наиболее агрессивное действие на
большинство твердых металлов при данной температуре, чем какой-либо
другой исследованный расплавленный металл».
Данные по устойчивости к действию галлия некоторых металлов и дру-
гих материалов представлены ниже:
Алунд. Превосходная устойчивость до 1000°.
Вольфрам. Хорошая устойчивость до 800°.
Графит. Удовлетворительная устойчивость к действию галлия до 800*.
Двуокись циркония. Может использоваться с галлием до 500°.
172 Глава S
Другие металлы (Си, Pt, Zr, Ni, V, Мп, Ag, Аи, Се, Рг, Cd, Fe, Ge, Snr
In). Легко реагируют с галлием, образуя соединения или твердые растворы.
Другие сплавы (FeBe, Cr-50Mn, Ni-20W). Подвержены сильному воздей-
ствию галлия при 500°.
Инконель. Разрушается сильнее, чем нержавеющая сталь.
Молибден. В аначительньй мере подобен ниобию.
Нержавеющая сталь A8-8). Подвержена сильному легирующему дейст-
вию галлия при 600е.
Ниобий. Хорошая устойчивость по отношению к галлию до 400е; дейст-
вие галлия значительно усиливается при температуре выше указанной.
Окись бериллия. Полная устойчивость к действию галлия до 1000°.
Окись магния. Незначительная устойчивость при 500°; не рекомендуется.
Плавленая двуокись кремния. Не подвержена действию чистого галлия
до 1160°. Загрязнение любой окисью заметно снижает стойкость.
Свинец. Ограниченная устойчивость к действию галлия до 300 \
Сплав 92,5"о тантала. 7,5°о вольфрама. Превосходная устойчивость
к действию гачлия при 400°; умеренно устойчив до 600°.
Стекло пирекс. Галлий не оказывает заметного действия при 500 .
Тантал. Хорошая устойчивость до 450°; действие галлия усиливается
при температуре выше указанной.
Титан. Разрушается в галлии при 450".
Хром. Разрушается в галлии при 600°.
ТОКСИЧНОСТЬ
Токсичность галлии изучалась в Военно-морском медицинском иссле-
довательском институте [18]. Туман хлорида галлия оказывает слабое дей-
ствие на крыс при концентрации 0,125 мг/л и выдержке от 30 мин до 4 час.
Неизбежная едкость раствора оказывает более вредное действие. При внут-
ривенном введении смертельная доза для крыс и кроликов составляег
40 мг'кг веса. Картина отравления при введении смертельной или близкой
к смертельной дозы солей галлия — резкая потеря веса, повышенное возбуж-
дение, в некоторых случаях светобоязнь, слепота и паралич задних конеч-
ностей. При испытании нитрата галлия на людях и на кроликах приз-
наков отравления не обнаружено [20].
СПЛАВЫ
Опубликованы данные по сплавам галлия [40]. Соответствующие све-
дения приведены ниже.
Алюминий - - галлий. Галлий не растворим в металлическом алюми-
нии. Эвтектический сплав с содержанием 13"« галлия плавится при 26,3е.
Добавление 2—4"о галлия улучшает механические свойства алюминия.
Сплавы алюминия и галлия можно обогащать магнием, цинком и литием.
Висмут — галлий. Висмут не растворим в галлии при температуре
плавления C0°). При 225° в висмуте растворяется около 11% галлия.
Железо — галлий. Сплавы галлия с железом обычно содержат лишь
небольшие количества галлия. Как указывается, сплав железа, содержа-
щий 3% галлия и 14°о никеля, воспринимает закалку подобно сталям, ле-
гированным бериллием и титаном.
Золото — галлий. Максимальная растворимость галлия в золоте
достигает 4,8 вес. "о при 455f. Около 0,65"о галлия может удерживаться
золотом в твердом растворе.
Гиллип 173
Индий — галлий. Описаны легкоплавкие славы галлия с индием,
содержащие от 24 до 71 вес.% галлия. Сплавы галлий — индий прдверже-
ны постепенному действию влаги.
Кадмий галлий. Кадмий почти не растворим в галлии при 30".
Кадмий растворяет 12—13°6 галлия с образованием сплава, который зас-
тывает при 258°.
Калий — галлий. Калнй практически не растворим в галлии при 30е.
Кальций — галлий. Описан сплав CaGa2.
Лантан — галлий. Упоминается сплав LaGa?.
Литий — галлий. Описан сплав галлий — литий (91% Ga)
Магний — галлий. Галлий легко сплавляется с магнием. Твердый
раствор, содержащий 4,6% галлия, может быть получен путем закалки
и старения.
Медь — галлий. Галлий не растворяется заметно в меди при 20".
Изучены диаграммы состояния медь — галлий [13, 39]. Были исследованы
сплавы медь — цинк — галлий и медь — галлий — германий; медь — основ-
ной компонент этих сплавов.
Мышьяк — галлий. Описано соединение GaAs D8,2 вес.°6 Ga).
Натрий — галлий. Натрий практически не растворим в галлии при
30°. При более высоких температурах образуются вполне реакционноспо-
собные сплавы натрий — галлий.
Никель — галлий. Галлий легко сплавляется с никелем. Исследовался
¦сплав, содержащий 1,3% галлия.
Олово — галлий. В расплавленном состоянии галлий и олово смеши-
ваются во всех отношениях. Исследовались легкоплавкие сплавы, со!ержа-
щие до 69 °6 галлия.
Платина — галлий. Сплавы галлия и платины образуются как при
низких, так и при высоких температурах.
Ртуть — галлий. Галлий и ртуть взаимно не растворимы при комнат-
ной температуре.
Свинец — галлий. Галлий ограниченно растворим в расплавленном
•свинце (около 5% при 317J). Свинец не растворим в галлии при температуре
плавления галлия; точно так же галлий почти не растворим в твердом свинце.
Серебро — галлий. Описаны сплавы галлия и серебра, содержащие
до 30"и галлия; было исследовано 40 различных сплавов. Сплавы, содержа-
щие до 14"и галлия, по внешнему виду напоминают серебро, мягки и под-
даются обработке. Сплавы, содержащие 18—25% галлия, хрупки; хруп-
кость возрастает при содержании галлия больше 25%.
Сурьма — галлий. Известно соединение GaSb C6,4 вес.% Ga).
Теллур — галлий. Известны соединения GaTe C5,3%' Ga) и Ga2Te3
B6,7"» Ga). Другие соединения неизвестны.
Титан — галлий. Описано соединение Ga3Ti.
Церий — галлий. Описано соединение CeGa;.
Цинк — галлий. Цинк и галлий в расплавленном состоянии смешивают-
ся во всех отношениях. Описаны легкоплавкие сплавы, содержащие до
72% галлия. Эвтектический сплав 5% Zn и 94—95% Ga плавится при 25°.
Цирконий — галлий. Изучалось соединение GaZr.
СПОСОБЫ ОБРАБОТКИ
Галлий благодаря своей низкой температуре плавления доступен как
в жидком, так и в твердом состоянии. Выпуск различных изделий для про-
мышленных целей не производится.
174 Глава 8
Элсктроосаждение галлия обычно проводится из растворов галлата
натрия. Ловидимому, при электроосаждении галлия можно использовать
также и растворы галлата калия, но такой метод не описан в литературе.
Нет сведений и об успешном выделении галлия электролизом кислых
растворов.
Поскольку галлий имеет низкую температуру плавления и устойчив
против окисления, при его плавке не встречается затруднений.
ОБЛАСТИ ПРИМЕНЕНИЯ
Наиболее перспективным становится применение галлия в интерметал-
лических соединениях, которые являются полупроводниками.
Возможность сплавления галлия высокой степени чистоты с дру! ими
очень чистыми элементами (мышьяком, сурьмой, фосфором) позволяет по-
лучать эти полупроводниковые соединения со свойствами, предсказанными
Рис. 3 Поверхность стекла, равно-
мерно «увлажненная» жидким галлием.
Жидкий галлий нанесен на обычное лабо-
раторное часовое стекло. После >далення
избытка металла выпуклая поверхность
представляет собой чистое, хотя н не вполне
совершенное зеркало («Алюминум кммиани
оф Америка»),
теорией. Интерметаллические соединения с галлием применяются в высо-
котемпературных выпрямителях н транзисторах, солнечных батареях и дру-
гих приборах, где может быть использован фотоэффект в запирающем слое,
а также в инфракрасной оптике [41]. В последние годы с такими веществами
проводились интенсивные исследования- Эти соединения начинают выпу-
скаться в промышленном масштабе. Поскольку полупроводниковые соеди-
нения становятся более доступными для изучения благодаря своим уникаль-
ным свойствам, они, вероятно, найдут более широкое применение.
Возможно, что впервые галлий стали применять как наполнитель для
высокотемпературных термометров. Однако трудность изготовления поме-
шала сколько-нибудь значительному промышленному развитию выпуска
таких термометров. Из-за высокой отражательной способности галлии бы-
ло предложено применять в качестве материала для покрытия поверхности
оптических зеркал [6].
Отражательная способность галлия при нанесении его на стекло иллю-
стрируется на рис. 3.
Комиссия по атомной энергии СШЛ исследовала галлий как возможный
теплоноситель [16, 261. Большой интервал жидкого состояния галлия и низ-
кое давление пара являются весьма желательными свойствами для приме-
нении в этой области. Большое поперечное сечение захвата нейтронов не
может служить серьезным препятствием. Однако значительная реакционная
Галлий 175
способность галлия но отношению к большинству других металлов при
высокой температуре затрудняет выбор подходящего материала для кон-
тейнера.
Многие сплавы галлия не используются в различных областях приме-
нения в связи с производством более дешевых сплавов. Очень важным явля-
ется применение галлия в органических синтезах [37]. Хлорид галлия
используется как катализатор в реакциях Фриделя — Крафтса, так как
при этом снижается расход катализатора, повышаются выходы или возрас-
тает скорость реакции.
Представляет интерес применение галлия (Ga-72) при изучении рака
костей [51, так как некоторые радиоактивные соединения галлия абсорби-
руются раковой опухолью, что позволяет ее обнаружить.
Л ИТ ЕР АТУР А
1. A h г е п s L. H., S. African J. Sci., 41, 152- 160 A9-15)
2. Atomic Energy Commission, Liquid-Metals Handbook, 2nd ed.. Government
Printing Office, Washington, D. C, 1952.
3. В о i s b a u d r a n L. de, Ann. chim. et phys. E), 10. 100—141 (January 1877).
4. В г e t с q u e P. de la, Etudes sur Le Gallium, Doctoral Thesis, University of
Aix Marseille, 1955. A lengthy abstract is given in Chemical and Engineering News,
34, 4300 4301 A956).
5. D u d 1 e у H. C, The Biological Significance of Radiogallium (Ga). Project
NM011 013, Naval Medical Research Institute, National Naval Medical Center, Be-
thesda, Maryland, 1949.
6. E i n e с k e E., Das Gallium, Verlag Von Leopold Voss, Leipzig, 1937.
7. F г а г у F. С, пат. США 2582376, January 15, 1952; Brown R. W., пат. США
2582377 и 2582378, January 15, 1952.
8. G о 1 d s с h m i d t V. M., Ind. Eng. Chem., 27, 1100—1102 A935).
9. Goldschmidt V. M., Nat.-naturw. Klasse, J* 4 A937).
10. H i I d e b г a n d W. F., Scherrer J. A., J. Ind. Eng. Chem., 8, 225
A916).
11. Hoffman J. 1., Scribner B. F., J. Research Nat. Hur. Standards.
15, 205—209 A935)
12. H о p k i ii s В S., Chapters in the Chemistry of the Less Familiar Elements,
Stipes Publishing Co, Champaign. 111.. 1939, Chap. 8.
13. H u m c-R о t her у VV., Mabbott G. W., Evans K. M. C, Trans.
Roy. Soc, 233A, 1—97 A934).
14. I s а а с E., T a m m a n n G., Z. anorg. allgcm. Chem., 60, 61 A907).
15. I s a g a k i M., пат. США 2848398, August 19, 1958.
16. Jaffee R. I., Evans R. M., Fromm E. A, Gonser B. W., Gal-
lium in Nuclear Reactors: Consideration for Use as a Primary Coolant, AECD-3317,
Department of Commerce, Washington, 1949.
17. К e 1 1 e у К. К., Contributions to the Dala on Theoretical Metallurgy. X. High-
Temperature Heat-Content, Heat-Capacity and Fntropy Data for Inorganic Compounds,
II. S. Bureau of Mines Bull. 476, Government Printing Office, Washington, 1949.
18. L e v i n e M. D., D u d 1 e v H. C, Studies of the Acute Toxicity of Gallium,
Project NM Oil 013, Rept. JV» 3, Naval Medical Research Institute, National Naval
Medical Center, Bethesda, Maryland, January 13, 1949.
19. Mack G. L., Davis J. K., Bar tell F. F.. J Phys. Chem., 45,846
A941).
20. M e e k S. F., Harrold fi. C, HcCord C. P., Ind. Med., 12. 7—9 A943).
17? Глава Ь
21. Mel lor J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemi-
stry, Vnl 5, Longmans, Green and Co., Ltd., New York, 1929, Chap. 31.
22. Менделеев Д. И., Ann., Supplementband 8, Heft 2, 196—206 A871).
23. .Менделеев Д. И., С. R., 81, 969—972 (November 22, 1875).
21. M i 1 n e r G. W. C. Analyst, 80, 77—78A955)
25. Minerals Yearbook, L. S. Bureau of Mines, Government Printing Office, Washing-
ton, D. C, 1948, p. 1332.1
26. Minerals Yearbook, U b. Bureau of Mines, Government Printing Office,JWashing-
ton, D. C, 1949, p. 1310—1311.
27. Мое 11 er Т., Cohen A. J., Anal. Chem., 22, 686—690 A950).
28. Morgan G, Da vies G R.. Chem and Ind., 56, 717—721 A937).
29. N о у e s A. A., Bray W C, A System of Qualitative Analysis [or the Rare
Elements, The Macmillan Co., New York, 1927.
33. Powell A. R., Lever F. M., Wai pole R. E., J. Appl. Chem., 1,
541—551 A951).
31. Richards T. W., Boyei S.. J. Am. Chem. Sue, 43, 274 A921).
32. Spells K. E., Proc. Phys. Soc „48, 299—311 A936).
33. S t г ос к L. W., Am. Inst. Mining Met. Engrs., Tech. Pub. № 1866, 1945 (Pub-
lished in Metals Technol., April 1945).
34. Swift E. H., J. Am. Chem. Soc, 4B. 2375—2381 A924).
35. T h о m p s о п A. P., H a r n e r H. R., .1. Metals, 191, 91— 94 A951).
36. Thompson A. P., H a r n e r H. R , The Recovery, Production and Poten-
tial Uses of Gallium, Paper Presented before the Spring Meeting 1952 of the Elec-
trochemical Society, Printed in Enlarged Abstracts of Papers Presented by the Ele-
ctronics Division of the Electrochemical Society.
37. U 1 i с h H, Heyne G., Z. Elektrochem., 41, 509—514 A935) (C. A, 29,
7768—7769); U 1 i с h H., Die Chemie, 55, 37—38 A942) (C. A.. 37, 2521—2526);
U I i с h H., К с u t m a n n A., Geierhaas A, Z. Elektrochem., 49, 292—
296 A943) (C. A.. 37, 6650—6657); Ulich H., Oel und Kohle, 39, 523—527 A943)
(C A., 38, 958—964).
38. Waring W. G., Trans. A1ME, 57. 657 A917).
39. Wei bke r\, Z. anorg allgem. Chem., 220. 293—311 A934).
40. Wilkinson W. D., Properties of Gallium, ANL-1109, Argonne National
Laboratory, Chicago, 1948.
41. W i 1 1 а г d s о n R. K.., Battelle Technical Review, 6, № 8, 8—11 A957).
9.
ГАФНИЙ
Д. Р. МАРТИН, Ф. ПИЦЦОЛАТО
D. R. Martin, LibbeyOwens-Ford Glass Co., Toledo,
Ohin
Ph. J. Pizzolato, Research Division, New York
University, New York, N. Y.
ВВЕДЕНИЕ
За последние годы проявляется большой интерес к использованию
металлического гафния в качестве материала для регулирующих стержней
ядерных реакторов. Это оказалось возможным в значительной степени пото-
му, что он стал несколько более доступным металлом, так как является
побочным продуктом, получаемым при производстве реакторных сортов
металлического циркония. Высокое сечение захвата тепловых нейтронов,
хорошая коррозионная стойкость и механическая прочность делают гафний
ценным материалом для применения в органах регулирования ядерных
реакторов с водяным охлаждением.
Гафний был открыт только в 1923 г., но сообщения о получении кон-
центрата этого элемента появились на несколько лет раньше. В 1911 г.
Урбэн, работая с наиболее растворимыми фракциями раствора нитрата
иттербия, выделил небольшое количество вещества, которое, по его утвер-
ждению, обладало особыми свойствами [116]. Он сделал вывод, что это
вещество содержит какой-то новый элемент из группы редкоземельных, и дал
ему название «кельтий». Эти факты показались сомнительными Бору [18],
Костеру и Хевеши, которые убедились в том, что 72-й элемент не был редко-
земельным и что он четырехвалентен и является аналогом циркония и тория.
Костер и Хевеши заключили, что 72-й элемент скорее встречается вместе
с цирконием, чем с редкоземельными элементами, и провели тщательные
рентгеновские исследования различных цирконийсодержащих минералов
164]. Было обнаружено шесть линий, параметры которых совпадали со
значениями, вычисленными по закону Мозли для линий 72-го элемента
129]. Костер и Хевеши объявили об открытии 72-го элемента, предложив
назвать его гафнием (латин. Hafnia — Копенгаген) в честь города, в кото-
ром было сделано открытие.
В споре, возникшем в отношении приоритета, Урбэн [117] утверждал,
что он открыл кельтий G2-й элемент) на основании: 1) наблюдения линий
рентгеновского спектра; 2) факта, что открытое им вещество обладает рядом
свойств, присущих иттербию и лютецию; 3) предположения, что раствори-
мый остаток в случае редкоземельных элементов содержит обычно цирконий
и сходные с ним элементы. Костер и Хевеши [30] в ответ на это выдвинули
следующие возражения: 1) линии рентгеновского спектра, указанные Урбэ-
ном, слишком слабы, чтобы иметь уверенность в их достоверности; 2) длины
воли для приводимых им линий не совпадали с длинами волн, установлен-
ными для линий гафния; 3) указанные Урбэном свойства кельтия не совпа-
дают со свойствами, проявляемыми гафнием; 4) данные, сообщенные им для
кельтия, можно приписать смеси, состоящей главным образом из лютеция
и иттербия.
12 Заказ № 23В
178 Гл оео 9
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Гафний находится в природе в количествах от небапьших до умеренных
и сопутствует цирконию во всех его минералах. Соотношение между гафнием
и цирконием в земной коре оценивается равным примерно 0,02. Сообщается,
что в цирконах из гранитных горных пород соотношение между гафнием
и цирконием выше, чем в минералах щелочных горных пород, например
в нефелиновых сиенитах. Найдено, что в минералах гранитных пегматитов
имеется самое высокое соотношение между гафнием и цирконием, в особен-
ности в таких своеобразных разновидностях циркона*, как альвит, цирто-
лит и наэгит, а также в редком силикате скандия — тортвейтите. Торт-
вейтит — единственный минерал, в котором гафния содержится больше,
чем циркония 148]. Крупные промышленные месторождения таких минера-
лов со сравнительно высоким соотношением между гафнием и цирконием
неизвестны.
Примерами вторичных циркониевых минералов, которые могут содер-
жать до 35% гафния (от общего количества гафния и циркония), являются
162] альвит, найденный в Норвегии, Швеции и Северной Америке; мала-
кон**, который встречается в Норвегии, Франции и США; циртолит, найден-
ный в Индии, на острове Мадагаскар, в Швеции, Италии, Канаде и в США
(штате Нью-Йорк) [94]. Другие минералы, содержащие гафний,— бадде-
леит***, встречающийся в Швеции, Италии, на острове Цейлон, в Бразилии
и в США (штате Монтана) 194]; эвдиалит****, обнаруженный в Гренлан-
дии и в СССР [94]; циркелит*****, встречающийся в Бразилии [81];
пегматит******, найденный на севере Норвегии [94], и монацит (в виде
россыпей) — в Бразилии и Траванкоре (Индия) [94].
По приблизительным подсчетам в земной коре содержится 4-10 4%
гафния. Это почти столько же, сколько содержится в земной коре бериллия,
германия или урана, но больше, чем висмута, кадмия, тантала, серебра
или ртути, и меньше, чем гадолиния, празеодима или самария [66, 97].
Основные промышленные источники гафния — минералы циркон
(Zr, Hf) SiO4 и бадделеит (Zr, Hf) O2, которые вначале перерабатывались
главным образом с целью извлечения циркония. Эти минералы содержат
0,5—2% гафния по отношению к цирконию.
ИЗВЛЕЧЕНИЕ ИЗ РУД
Поскольку гафний и цирконий всегда извлекаются из руд вместе,
а отделение гафния от циркония — важная стадия в производстве реактор-
ных сортов циркония, более подробное описание целого ряда методов извле-
* Циркон — Zr[SiO4l, содержит в виде примеси до 4% НЮг, до 7% ThOz, иногда
редкоземельные элементы, иттрии и др. Альвит содержит больше Hf, Th и редкозе-
мельных элементов, а циртолит является разновидностью циркона, богатой ThO2
и UaOg. Наэгитом называют циркон, содержащий ниобий и тантал.— Прим. ¦ ред.
** Малакои также разновидность циркона.— Прим. ред.
*** Бадделеит (бразилит) — ZrOz.— Прим. ред.
*•** Эвдиалит — силикат циркония, содержащий до 15со ZrOz. Возможно, что состав
отвечает формуле (Na, Ca, FeJ^Zr (ОН, ClL[Si3 Og]2-— Прим. ред.
***•• Состав точно не установлен, предположительно — (Ca, Fe, Th. U)z(Ti,ZrJO5.—
Прим. ред.
*.»«.** Пегматит не минерал, а особая порода, часто встречающаяся в виде жил
с характерными для них крупными кристаллами. Наиболее распространены пегма-
титы гранитного типа, т. е. богатые кварцем и полевым шпатом. Многие циркониевые
минералы являются минералами пегматитовых жил.— Прим. ред.
Гафний
179
чения и разделения можно найти в исчерпывающих литературных обзорах
по цирконию [12, 83, 86, 105], а также в главе «Цирконий» настоящего
справочника.
После обогащения циркона из морского песка механическим способом,
сочетающим элсктростатистическое обогащение и обогащение по удельному
весу, его подвергают химическому разложению. Для разложения циркона
применяются следующие методы [12]:
1. Превращение циркония и гафния в карбиды или карбоннтриды
с последующим хлорированием.
2. Сплавление с щелочами.
3. Сплавление с фторосиликатом калия.
Первые два метода применяются в США для приготовления полуфабри-
ката, используемого на стадиях отделения гафния от циркония экстракцией
Ноне
Хлор
Водород
Дуговая печь
Zr(C.N)
HftC.N)
Печь для хлорирования
500°
Хлориды
лчегпил/тв
Конденсатор
100"
Конденсат
Неочищенные
ZrClL и UfCl^
Реторта дли оозгонни
со
"SiO
ил,,
¦ Т1СЦ
AJ,Gl3
ОтхсПы
т
Очищенные
ZrCU
и HfCU (Z-3%]
Рис. 1. Схема карбонитридного процесса,
из растворов. Метод сплавления с фторосиликатом калия применяется
в СССР [103] для получения сырья, используемого при отделении гафния
от циркония дробной кристаллизацией двойных фторидов (KsMF6). Схема
карбонитридного процесса [12, ПО] изображена на рис. 1.
Метод сплавления с щелочами [13] имеет то преимущество, что не тре-
бует высоких температур в электрической печи. При соотношении едкого
натра и циркона, равном 1 : 1,5, и температуре в печи 565° можно разложить
до 90% циркона и получить цирконат и гафнат натрия, которые затем отде-
ляются от растворимого в воде силиката натрия путем его выщелачивания.
12*
180
Глава 9
ОТДЕЛЕНИЕ ГАФНИЯ ОТ ЦИРКОНИЯ
Основная трудность получения гафния или реакторного сорта цирко-
ния связана с разделением этих металлов, так как не известно никакой хи-
мической реакции, в которую бы вступал только один из этих элементов
[64]. Очевидно, любой метод, применяемый для вскрытия циркониевых
ZrCl,
I NH4OH
HfCl,
Загрузка
и смешение
— ?[„0
Экстракция из раствора I
жидким энстрагентом
Цирпошлхлорид
| Цирнанилхлорид
Раствор, обогащенный
гйфнием I
НС1-
H,SCL-
NH4OH-
Швлечение
Гафнилхлорид
Промывка
Растворитель
на ииркултшю
Осаждение
Прокаливание
t
Двуокись
гафния
Р и с 2. Схема процесса разделения гафния и циркония
экстракцией из раствора тиоциапатов гексоном.
минералов, приведет к извлечению обоих элементов одновременно. Таким
образом, любой метод, применяемый для разделения этих двух металлов,
должен носить характер разделения на фракции.
Из множества методов, предложенных для разделения гафния и цирко-
ния, только три применяются в промышленном масштабе [59]:
1 Экстракция тиоцнанатов из раствора в соляной кислоте гексоном
[95, 961. •
2 Экстракция нитратов из раствора в азотной кислоте трибутилфосфа-
том [31, 50, 72].
3. Дробная кристаллизация двойных фторидов 1631.
По первому методу смесь тиоцианатов этих металлов экстрагируют
из раствора в соляной кислоте гексоном (метилизобутилкетоном). Раствори-
тель экстрагирует преимущественно гафний, при этом легко получается
продукт, содержащий менее 2% циркония. Схема процесса, основанного
на этом методе, приведена на рис. 2 [281.
Гафний . 181
Позднее был предложен метод экстракции нитратов из раствора в азот-
ной кислоте три-н-бутилфосфатом. Три-н-бутилфосфат обычно разбавляют
керосином, дибутиловым эфиром или другим растворителем, чтобы снизить
плотность и вязкость органической фазы. Поскольку в данном случае
органическим растворителем экстрагируется преимущественно цирконий,
а не гафний, получение чистого гафния затрудняется. Однако показано,
что этот метод можно применять для получения очень чистого гафния 1501.
Дробная кристаллизация двойных фторидов была первым методом,
использованным для разделения гафния и циркония в лабораторных усло-
виях, но она почти не применялась в промышленном масштабе. Этот метод
был использован в СССР в производстве двуокиси циркония высокой сте-
пени чистоты [103].
ПРОИЗВОДСТВО МЕТАЛЛИЧЕСКОГО ГАФНИЯ
Металлический гафний получают такими же способами, которые при-
меняются и в производстве циркония: способ Кроля, видоизмененный спо-
соб Кроля с применением натрия в качестве восстановителя и способ де
Бура, или иодиднын процесс.
Способ Кроля
Технология и оборудование, применяемые для получения гафния
по способу Кроля, по существу такие же, как и в производстве металличе-
ского циркония. Видоизменения по сравнениюс технологическим процессом
производства циркония определяются заменой или изменением отдельных
аппаратов, технологических операций и сорта исходных материалов. Здесь
следует иметь в виду большую чувствительность тетрахлорида гафния
к атмосферной влаге, большую устойчивость гафнилхлорида и несколько
большую пирофорностк свежеполученной металлической губки. Схема про-
цесса получения гафния по способу Кроля [54, 105] изображена на рис. 3.
Натриевый процесс
Недавно был разработан метод восстановления тетрахлоридов циркония
и гафния в промышленном масштабе с применением вместо магния метал-
лического натрия. Основным преимуществом метода восстановления нат-
рием является, по-видимому, его более низкая стоимость. Он применяется
в США, где описан как первый промышленный полунепрерывный процесс
[113]. В том случае, когда для восстановления тетрахлорида гафния при-
меняется натрий, за операцией восстановления следует выщелачивание
продукта реакции водой с целью удаления солей и избытка натрия из губ-
чатого гафния. Глассер и Темнел [55] запатентовали процесс получения
гафния из его тетрахлорида с применением вместо металлического натрия
или магния натриевой амальгамы. Были указаны некоторые преимущества,
которыми обладает амальгамный процесс: 1) большая мобильность; 2) менее
жесткие требования в отношении температуры и давления; 3) меньшее
количество загрязнений, вносимых во время процесса восстановления.
Иодидный процесс
Для получения первых компактных, образцов гафния применял-
ся процесс осаждения металла на раскаленной нити, разработанный
Ван-Аркелем и де Буром [15, 17]. В результате этого процесса образуется
182
Глава 9
кристаллический пруток компактного пластичного гафния. Для по-
лучения гафния этим способом необходима несколько более высокая тем-
пература, чем для получения циркония. Температура исходного «сырого»
Хлор _
Уголь —
Магний >.
[изБытоп 40 %)
Братающаяся
печь
Электрическая
мусрельпая
печь
еои°
нгаг
Хлора/пор*
300"
1 н«х
Печь для
очистки
Вторично
возогнанньн
Восстановительная**
печь
650°
1
Hf-^МдСЦ
Печи для
вакуумной
дистилляции
i
Гафниееая
губка
Дуговой
печь
\
Слиток
гафния
Hf {О\\)ь,кек(со стадии разделения.
I жтракииео раствори-
' телем)
¦Н,0
со
Рис. 3. Схема получения металлического гафния
способом Кроля.
* •/, НЮ,(тв.) + С(тв.) + СЫгаз) -» % ШСЦ(газ) + СО(газ)
^43 10° С54'
• %ШС1.(газ)
(;K.) -> %Hf(TB.) + МВС1,(ж.)
:=- I4 700.
металла поддерживалась при 600°, а температура нити составляла 1600°.
Иодидный процесс следует считать скорее способом очистки, чем одной из
операций основного процесса восстановления, так как в качестве исходного
материала для него требуется • металлический гафний довольно высокой
степени чистоты. Установка для получения «иодидного гафния» показана
на рис. 4.
Гафний 183
V
Рис. 4. Батарея реторт для получе-
ния иодидного гафния («Фут минерал
комлани»). *
Опера-гор держит в руках кристаллически
пруток, полученный этим способом.
\
ФИЗИЧЕСКИЕ, КОНСТРУКЦИОННЫЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА
Гафний имеет поверхность с ярким металлическим блеском. Гафний
тверже циркония и труднее обрабатывается [81]. Так же как и цирконий,
он кристаллизуется в гексагональной плотноупакованной кристаллической
решетке [94]; гафний сходен с цирконием и по многим другим физическим
свойствам.
Расхождение в имеющихся данных для многих его свойств объясняется,
по-видимому, тем, что эти свойства в значительной степени зависят от со-
держания примесей. Даже для следов примесей, содержание которых изме-
няется в довольно узких пределах, для недавно полученного гафния высо-
кой степени чистоты эта зависимость совершенно очевидна [82]. Поскольку
чистота гафния, применявшегося при измерении его свойств, до некоторой
степени определяется сортом материала, т. е. способом его получения,
предшествующими металлургическими процессами и т. д., эти сведения,
если они известны, приводятся наряду со свойствами.
Физические, конструкционные и механические свойства гафния при-
ведены в табл. 1—16*.
ХИМИЧЕСКИЕ СВОЙСТВА
По своим химическим свойствам гафний** очень сходен с цирконием,
который является его самым близким аналогом, и несколько напоминает
торий, являющийся его более далеким аналогом. В той или иной степени
это обусловлено близостью радиусов соответствующих атомов и сходством
* Наиболее полные данные о свойствах и способах получения металличе-
ского гафния, а также сведения о его применении приведены в книге Т h о m ?
D. E., H ayes Е. Т., The Metallurgy of Hafnium, U. S. Government Printinp
fice, Washington, 1960.— Прим. ред.
** Химия гафния в самом сжатом виде изложена Л. Н. Комиссаровой (г
пительную статью «Гафннй и его соединения» в сб. «Гафнин», ИЛ, 1962 г
В). — Прим. ред.
Таблица 1
ФИЗИЧЕСКИЕ СВОЙСТВА ГАФНИЯ
Плотность, г/си3 13,29 [25] Переплавленный в дуговой печи пруток
иодндпого гафния «0,01% циркония)
13,09 B0°) [1,81] Переплавленный в дуговой печи пруток
(с поправкой иодидного гафинп, подвергнутый хо-
на 1,4 ат. % лодной протяжке до степени деформа-
циркония) цни, равной 11%, с последующим от-
жигом в вакууме при 1040°; содержа-
ние циркония 0,72%
13,30 [16] Пруток иодндпого гафния, содержание
циркония не указано
13,36 [811 Вычислено
13,20 [119] »
Тепловые свойства
Температура плав- 22224^30 [33] Пруток иодидного гафния @,008% цир-
ления, °С копия)
2150 [25] Пруток иодидного гафния, переплавлен-
ный в дуговой печи «0,01% цирко-
ния)
19754-85 [1] Пруток свежеосажденного нодидного
2130±15 [81] гафнии «1,0% циркония)
Температура кипе- 5400 [97]
ння, °С
Температура аллотропического перехода из гексагональной плотноупаковашюй решетки
в кубическую объемноцептрированную
Значения, приводимые для температуры перехода, изменяются от 13104^ 10D [41]
до 19504^100° [45] — температуры, близкой к температуре плавлении гафнии. Значе-
ние, приведенное ранее Цвиккером [128], который определил температуру перехода
между 1502 и 1627°, по-видимому, подтверждает температуру 1660°, установленную
Каслманом и сотр. [27] на основании данных металлографического исследования
Тепловое расширение
Сообщается [98], что коэффициент линейного расширения для прутка иодндного
гафнии в интервале температур 0—1000° равен 5,9-10"в/град.' Коэффициент линейного
расширения иодидного гафния в интервале от 20° до различных температур в преде-
лах от - 183 до 982° был определен Аденштедтом [1]. Эти данные приведены в
табл. 2
Коэффициент теплопроводности См. табл. 3
Удельная теплоемкость См. табл. 4
Термодинамические данные См. табл. 5
Энтальпия См. табл. 6
Скрытая теплота испарения, ккал/моль 72 [127]
Теплота образования, кал/моль AW298.ie = —2fifi 06f) (±280) [71J
Электрические свойства
Удельное электрическое сопротивление
Температурный коэффициент электрического сопро-
тивления
См. табл. 7
См. табл. 7
Продолжение табл. 1
Влияние давления на электрическое сопротивле- См. табл. 8
ние
Температура перехода в сверхпроводящее состоя- См. табл. 9
пне
Термо-э. д. с. для гафпип в паре с платиной, мв
0—550* (с максимальным отклонением при 480" От 0 до 6,5±0,02 [1]
около 0,05 мв)
Коэффициент Холла при комнатной температуре, 0,16-103 [56]
в-см/а-гс
Магнитные свойства
Магнитная восприимчивость См. табл. 10
Термоионные свойства '
Темпера- Электронная эмис-
тура, =К сия, ма/см* [130]
1900 | 4,80 Значения температуры, измеренные пирометром, прнис-
2000 | 26,2 чены с поправками па лучеиспускательную способ-
2100 f 123 ность, расчетная величина которой принята равной
2200 J 485 0,37
Работа выхода электронов, эв 3,5 [10, 129]
Кристаллографические данные
Аллотропические модификации
Гафннй существует в двух аллотропических модификацнях. а-Модификацип имеет
гексагональную плотноупакованную решетку (ГПУ), а Р-модифнкацня — кубиче-
скую объемноцентрированную (КОЦ)
Параметры решетки, А
а-Модификация, а
3,188.3
3,187
3,197
5,0422
5,041
5,057
1,5814
1,582
1,582
3,50
3,078
20,2-10 ^
[811
[45]
[251
[811
[451
[25]
[41]
[901
' [92]
с/а
Р-Модификацня, а (расчетное значение при комнатной температуре)
Атомный диаметр а-гафния для координационного чнсла 8, А
Объем, свободный от атомов, см3
Текстура о гафнии
Иодидный гафний, переплавленный в дуговой печи и содержащий 3% циркония,
после холодной прокатки до степени обжатия по толщине, равней 95%, про-
являет текстуру в направлении @ 0 0 1) [10 10], повернутую под углом 25° по
отношению к направлению, перпендикулярному направлению прокаткн. Эта тек-
стура подобна текстуре, наблюдаемой у титана, циркония и, бериллия, подверг-
нутых холодной прокатке [43]. Было найдено, что текстура сжатия гафння
99,99в-ной чистоты до степени деформации, равной 78%, подобна текстуре,
возникающей при прокатке [44]
Атомные и ядерные свойства
Порядковый номер 72
Атомный вес 178.49
Атомный объем, см3/г-атом 13,37
Копалечтпыи радиус, А
Изотопный состав, %
Массовое число 170
171
172
173
174
175
176
177
178 .
179
180
Поперечное сечение захвата тепловых нейтронов (для
нейтронов со скоростью 2200 м/сек), барн1атом
Продолжение табл. 1
1,442
0,004 (макс.) ^
0,004 (макс.) I
0,005 (макс.) ( 1й/|
0,005 (макс.) J
0,18 [36, 49, 84, 85]
0,006 (макс.) [37]
5,30 \
1В,47 [
27.10 } [6,7,49,84,85]
13,84 I
35.11 J
105±5 [70]
Таблица 2
Гафини
Холодподе-
формирован-
ныйа
Отожжен-
ный при
1000° 6
КОЭФФИЦИЕНТ ЛИНЕЙНОГО РАСШИРЕНИЯ ГАФНИЯ
20—
(-183°)
-1,090
-1,14В
Коэффициент линейного р
20—
(-70»)
-0,514
-0,53о
20—
204°
1,089
1,153
20 —
3[6°
1,74„
1,844
20-
427°
2,40,
И]
асширення, 10-б град
20—
20-
538° 649°
1
3,066
3,163
3,61,
20—
760°
4,223
4,42Й
20—
871°
4,84i
5,022
20—
982°
5,473в
а Пруток диаметром 4,70 мм, холодиопрессоваиный до степени деформации 20% и отожжен-
ный при 1000°; изготовлен из прутка иодидиого гафиня.
^ Пруток диаметром 3,56 мм, холодиопрессоваииый до степени деформации 20% н отожжен-
яый при 1000°; изготовлен из прутка нодидиого гафния.
в Нолдуни [8] установил, что это значение составляет приблизительно одну треть значения
для нержавеющей стали типа 347.
Таблица 3
КОЭФФИЦИЕНТ ТЕПЛОПРОВОДНОСТИ ПРУТКА
ИОДИДНОГО ГАФНИЯ, СОДЕРЖАЩЕГО
2% ЦИРКОНИЯ [34]
Температура, °С
50а
100
200
300
400
500
Коэффициент
вт/см-град
0,223
0,220
0,215
0,210
0,207
0,205
теплопроводности
кад/см- сек- граб
0,0333
0,0526
0,0514
0,0502
0,0495
0,0490
а Экстраполировано от [00°.
УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ ГАФНИЯ
Таблица 4
Температура или темпе-
ратурный интервал
°К
1,25
1,5
2,0
3,0
4,0
5,0
6,0
8,0
10,0
12,0
14,0
16,0
18,0
20,0
20,15
50,0
75,0
100,0
150,0
200,0
250,0
298,16
29R,16 -
373,16
298—
2500
"С
-271,91
-271,66
-271,16
-270,16
-2Ь9,16
268,16
-267,16
-265,16
-263,16
-261,16
-259,16
-257,16
-255,16
-253,16
-253,01
-223,16
-198,16
— 173,1в
-123,16
-73,16
-23,16
25,00
25—100
25—2227
Уолкотт[125]
(ыодидный
гафний, со-
держащий
менее 0,1%
примесей)
0,000813
0,00100
0,00147
0,00255
0,00400
0,00600
0,0102
0,0223
0,0480
0,0770
0,130
0,207
0,308
0,434
0,441
—
—
—
—
—
—
—
Удельная теплоемкость с
Фрндберг
О1] (пруток
нодидного
гафния,
содержащий
около 2%
цирконвя)
0,0423
—
—
5,186
—
5,906
—
—
Крнстеску
и Силон [32]
(порошковый
гафний, не
аналнзиро-
налси)
3,90
11,3"
5,40
5,80
6,00
6,12
fi,24
—
кся/моль-град
Аденштед1
[1] (евеже-
осажденный
пругок иоднд-
ного гафния,
содержащий
менее 1%
циркония)
6,2,
Справочник
по ядерным
реакторам
[84]
6,00+
+ 0.524Х
< ю-з т с
а Б^рк и Дарнелл [23] нашли, что для гафния, содержащего около 2% цнрконня, кривая
Дебая удельной теплоемкости прн 40—190° К монотонно повышается. Лноуалня при 75° К полно-
стью отсутствует.
б Г —температура, °К.
Таблица 5
ТЕРМОДИНАМИЧЕСКИЕ ФУНКШШ ДЛЯ ТВЕРДОГО ГАФНИЯ [Ю7]
(ПОЛЕЧЕННЫЕ НА ОСНОВАНИИ ДАННЫХ а КРИСТЕСКУ И СИМОНА [32]
ПО ТЕПЛОЕМКОСТИ)
Темпера-
тура,
\
50,0
75,0
100,0
150,0
200,0-
250,0
298,16
с°
ки 1/моль • град
3.90
11,36
5,40
5,80
6,00
6,12
6,24
кал/моль
41
238
413
694
990
1293
1590
т ¦
0,82
3,17
4,13
4,63
4,95
5,17
5,33
кая/моль - град
1,04
4,14
6,32
8,59
10,29
11,64
12,71
—F° —И°
Г
0,22
0,97
2,19
3,96
5,34
6,47
7,41
а Уолкотт [125] считает, что образцы, применившиеся Кристеску и Симоном,
содержали главным образом НЮг.
с См. примечание в табл. 4.
Таблица 6
т,
"С
ЭНТАЛЬПИЯ
о, кал!моль
ГАФНИЯ [98]
127
645
327
1895
527
3170
727
4465
1127
7110
Таблица 7
ЭЛЕКТРОСОПРОТИВЛЕНИЕ И ТЕМПЕРАТУРНЫЙ КОЭФФИЦИЕНТ ЭЛЕКТРОСОПРОТИВЛЕНИЯ
ГАФНИЯ
Температура
или интер-
вал темпера-
тур, "С
ДИМ [34]
(пругок ио-
дидиого гаф-
ипя, ».пдержа-
щий 2%
циркония)
Бессел [122]
(пруток по-
ди аи ого гаф-
ння, выплав-
ленный в
дуговой лепи
е расходуе-
мым ЭЛектрО-
ДОМ, сорт 1)
Аденштедт
[1] (пруток
НОДИДНОГО
снежеосаж-
деиного гаф-
ния, содер-
жащий 0,7%
циркония)
де Ьур
и Фаст
[1G]
Бриджмеи
[21]
дс Хаас и
Фогт [35]
Электросопротивление, мком¦ см
269
-196
183
-56
0
20
50
100
150
200
—
—
—
34,1 а
40,6
47,1
53,6
60,1
_ I
9,42
25,9
32,8в 32,4
35,5 в
39,5в
46.5 й
53.6 в
60,Зв 61,1
7,86
30,0
32,6
— |2,80D,2а К)
29,7
29,6
Температура
илн ннтер-
иал темпера-
250
300
350
400
600
Дич [34]
(пруток ио-
дидного гаф-
ния, содержа-
щий 2%
циркония)
66,66
Вссссл [122]
(пруток ио-
дидного гаф-
ння, выплав-
ленный в
дуговой печи
г расходуе-
мым электро-
дом, сорт 1)
67,5
74.8 н
82.9 г
Адеиштедт
[1] (ПРУТПК
иодидного
свежеосаж-
денного гаф-
ния, содер-
жащий 0.7%
циркония)
84,4
106,0
Продолжение
дн Бур
и Фаст
[16]
Бриджмен
[21]
табл. 7
де Хаас н
Фогт [35]
Температурный коэффициент электросопротивления,
0
0—100
0—200
0—800
3,82-20-3
4,43-10-3
3,51-Ю-з
4,19-10-3
4,4-10-3
а Экстраполировано от 29°.
* Экстраполировано от 211°.
в Значения, полученные интерполяцией.
г Экстраполнроиано от 348,5°.
Таблица 8
ВЛИЯНИЕ
Давление,
кг/см?
0
10 000
20 000
30 000
40 000
50 000
60 000
70 000
80 000
90 000
100 000
ДАВЛЕНИЯ
Но
0,0000
0,0087
0,0163
0,0227
0,0279
0,0316
0,0348
0,0374
0,0393
0,0408
0,0419
НА ЭЛЕКТРОСОПРОТИВЛЕНИЕ ГАФНИЯ [21]
Состояние металла
Гафний в виде отожженной полосы, прокатанной
из небольших кусков свежеосажденного прут-
ка иодидного гафния @,7% циркония), полу-
чившего степень обжатия около 80% за че-
тыре прохода и отожженного в вакууме при
1050" после каждого прохода
Таблица 9
ТЕМПЕРАТУРА ПЕРЕХОДА ГАФНИЯ В СВЕРХИРОБОДЯЩРЕ СОСТОЯНИЕ
Степень чистоты
тле 1 алла
«Очень чистый»
Состояние металла
Поликристаллическнй пруток
иодидного гафния
Температура перехода, °К
по электро-
сопротивле-
нию
по чагннтным
свойствам
0,35
Литера-
тура
78
Продолжение табл. 9
Степень чистоты
металла
98,92% гафния
0,9% циркония
98,92% гафния
0,9% циркония
Состояние металла
Холоднопрессованный и отож-
женный поликристаллический
пруток иодидного гафния
Этот же образец после вторич-
ного отжига
Холоднопрессованный и отож-
женный поликристаллический
пруток иодидного гафния
Этот же образец после вторич-
ного отжига
Температура перехода, °К
по электро-
сопротивле-
нию
0,19—0,28
0,12—0,19
по магнитным
свойствам
Не наблю-
дается а до
7-„=0,15
0,37 .
Не наблю-
дается а до
rs=0,08
То же
Литера-
тура
109
109
61
61
1 Чистый гафний, по-видимому, не является сверхпроиодннком до температуры 0,08° К-
МАГНИТНАЯ
Таблица 10
ВОСПРИИМЧИВОСТЬ
ГАФНИЯ [74]
Температура,
-к
4,2
77,0
298,0
1670,0
Магнитная восприимчи-
вость, |0-вэ.м.е./г
0,46
0.40
0,42
0,57
МЕХАНИЧЕСКИЕ СВОЙСТВА ГАФНИЯ
Модуль упругости, кг/мм2
Кристаллический пруток иодидного гафния @,72%
циркония); образец отожжен в вакуу ме при 1040°
Коэффициент Пуассона для иодидного гафния, пере-
плавленного в дуговой печи
Поверхностное натяжение (при температуре плавле-
ния), эрг/см^
Механические свойства при растяжении
Отожженный иодидный гафний, переплавленный в
дуговой печи
Отожженный и горячекатаный пруток иодидного
гафния
Выдавленный иодидный гафний, переплавленный в
дуговой печи
Таблица И
1,4-101 [1, 123]
0,328 [123]
1,460±40 (93]
1,490 [127]
1,510 [112]
См. табл. 12
См. таСл. 13
См. табл. 14
Продолжение табл. И
Данные по ползучести
Иодидный гафний, переплавленный в дуговой печн См. табл. 15
Сжимаемость для давлении до 12 000 кг/смй [20]
AV
При 30° —
Прн 75° —
V C0D, I кг/си?)
AV
=9,01-I0-7p—2,37-IO-1
=8,81-10-?p—2,37-10-1
V G5°, I кг/см?) '
Твердость
Иодидный гафний и слиток, переплавленный из
кристаллического прутка
См. табл. 16
Таблица 12
МЕХАНИЧЕСКИЕ СВОЙСТВА а ПРИ РАСТЯЖЕНИИ ОТОЖЖЕННОГО
НОДИДНОГО ГАФНИЯ б, ПЕРЕПЛАВЛЕННОГО В ДУГОВОЙ ПЕЧИ [58]
Темпера-
тура.
24
149
260
371
482
593
Предел
текучести
(Со-г). кг/мм2
15,7
12,3
8,5
7,1
6,7
6,8
Предел прочно
стн при рястяже-
инн, кг/мл&
41,6
32,3
26,4
20,8
18,3
14,4
Относительное
удлинение
на длине
75 мм, %
35
43
51
56
63
56
Сужение попереч-
вого сечения, %
38
48
50
62
78
65
а Приведенные данные получены па образцах, испытанных на воздухе. Это при-
водило к некоторому загрязнению газами при более высоких температурах испыта-
ннй. Например, после испытания прн 593° образец окислился до такой степени, что
покрывался тонким слоем белого порошка. Перед испытаниями гафний был oj ож-
жен при 8©9° в течение 20 час в вакууме.
б Гафиий содержал 2,85% циркония.
Таблица 13
МЕХАНИЧЕСКИЕ СВОЙСТВА ПРИ РАСТЯЖЕНИИ ОТОЖЖЕННОГО
ГАФНИЯ И ГАФНИЕВОЙ ПОЛОСЫ [113]
Состояние металла
Гафний, отожженный
при 788° в течение
90 мин, затем ох-
лажденный на воз-
духе
Горячекатаная гафние-
вая полоса
Предел
текучести,
23,0
44,1
Предел проч-
ности при
растяжении.
40,5
55,7
Относитель-
ное удлине-
ние на длине
50 мм, %
31
15
Твердость по
Роквеллу
95
100
Таблица 14
МЕХАНИЧЕСКИЕ СВОЙСТВА ПРИ КРАТКОВРЕМЕННЫХ ИСПЫТАНИЯХ НА РАСТЯЖЕНИЕ
ВЫДАВЛЕННОГО ИОДИДНОГО ГАФНИЯ а, ПЕРЕПЛАВЛЕННОГО В ДУГОВОЙ ПЕЧИ [8]
Температура,
21
816
Предел теку-
чести, (Оо,г),
22,9—37,2
11,5—12,2
Предел прочно-
сти прн растя-
жении б, кг/мм*
65,4—73,2
14,1—14,7
Относительное
удлинение, %
22—27
43—62
Сужение попереч-
ного сечения, %
66—68
88—90
а Прутки диаметром 15,S jh.h, выдавленные из заготовки диаметром 60,3 мм.
fi При комнатной температуре н при 816° предел прочности при растяжении при кратковре-
менных испытаниях такой же, как н у нержавеющей стали 347. После испытания в течение
1U 000 час предел прочности при растяжении при 049° составляет около одной трети от предела
прочности нержавеющей стали 347 прн той же температуре.
Таблица 15
ДАННЫЕ ПО ПОЛЗУЧЕСТИ ПРИ 399° ДЛЯ
ИОДИДНОГО ГАФНИЯ, ПЕРЕПЛАВЛЕННОГО
В ДУГОНОИ ПЕЧИ [58]
Напряжение,
/М/ЛШ2
15,4
16,8
17,5
18,9
20,3 а
Пластическая
деформация, %
9,2
17,9
18,4
22,2
—¦
Скорость ползу-
чести, %/чис
з,о. ю-в
7,2-10-5
3,6-10 1
8,6-10-3
1
а Интерполировано по данным для растяжения.
Таблица 16
ТИПИЧНЫЕ ЗНАЧЕНИЯ ТВЕРДОСТИ ДЛЯ ИОДИДНОГО ГАФНИЯ
Состояние металла
Холоднопрессованный, отожжен-
ный при 10(HJ; холоднопрессо-
ванный до степени обжатия 20%
Выплавленный в дуговой печи, за-
тем отожженный в течение 20 час
при 900°
Выплавленный в дуговой печи
(<,0,01% циркония)
Слиток, выплавленный в дуговой
печи с расходуемым электродом
Измеренное значение
твердости
Ra = 43
Н„= 152
Дь = 78
Я„ = 180
Яа= 60
Яц=171а (нагрузка
3000 кг)
Нв= 147—165 (нагрузка
300 кг, диаметр ша-
рика 10 мм)
Литература
1
1 1. 81
J
81
58
25
58
39
Гафний
193
Продолжение табл. 16
Состояние металла
Измеренное значение
твердости
Литература
Горячекатаная полоса из слитка,
пыплаапенного в дуговой печи
с расходуемым электродом; по-
лоса отожжена при 927J в тече-
ние 30 мин и затем охлаждена
на воздухе
Отожженная полоса из слитка,
выплавленного в дуговой печи с
расходуемым электродом
Ra- 47—5I
НЕ = 139—150 (нагрузка
ЗОЬ кг, диаметр шари-
ка 10 мм)
58
39
«Горячая» твердость гафния [89] (слиток из кристаллического прутка)
Температура, °С 25 500
Тиердость по Бринеллю Нв A0/ЗППП/ЗО) 194 6 80
а Среднее значение.
fi Уменьшается линейно с увеличением температуры.
распределения в них электронов. Вообще говоря, с увеличением атомного
веса радиусы атомов элементов данного периода таблицы Менделеева умень-
шаются. В шестом периоде у редкоземельных элементов, вследствие того
что электроны заполняют ^-уровень, наблюдается лантаноидное сжатие.
В связи с этим радиус атома циркония почти равеи радиусу атома гафния
(см. табл. 17).
Таблица П
АТОМНЫЕ РАДИУСЫ ЭЛЕМЕНТОВ, A [UI]
lli-рнод
5
6
1
НЬ
2,16
Cs
2,35
и
Sr
1,914
Ва
1,981
Группа
111
Y
1,616
La
1,690
элементов
1\
Zr
1.454
Hf
1,142
1
I
V
Nb
,342
Та
,343
VI
Mo
1,291
W
1,299
Конфигурация внешних электронов атомов циркония — 4d2 5s2,
а гафния — Ъс1" 6s2. Поэтому следует ожидать, что химические свойства
этих двух элементов будут совершенно одинаковыми.
Первый и второй потенциалы ионизации гафния равны 5,5 и 14,9 эе
соответственно 147].
Первый потенциал ионизации, вычисленный по термоионной работе
выхода и поверхностной плотности атомов, равен 7 эе [102], что соответст-
вует ранее сообщенной величине 7,3 эе [46].
13 З.каз № 239
194 Глава 9 _
Порошкообразный гафний является пирофорным, а свежеприготовлен-
ный в вакууме металл настолько реакционноспособен, что для него не
известно ии одного раскислителя 1751.
Компактный гафний, подобно цирконию, при комнатной температуре
весьма устойчив по отношению к обычным газам и лишь при температурах
порядка нескольких сотен градусов начинает заметно реагировать с водой,
кислородом, азотом и водородом. Скорости окисления гафния в кислороде
при давлении 1 am в интервале температур 350—1200° выражаются лога-
рифмической, параболической и линейной зависимостями [1081. Соответст-
вующие значения энергии активации, нычисленные для констант скоростей
окисления, равны 11,4; 36,0 и 26,1 ккал/моль соответственно.
Реакция азота с гафнием в интервале температур 876—1034° следует
параболическому закону с энергией активации 57 ккал/моль азота [42].
Энергия активации выше, а скорость реакции ниже соответствующих зна-
чении для циркония.
Гафиий при 700° очень сильно поглощает водород и образует соедине-
ние Hf Н,,86 И21]. После многократной циклической термообработки
в атмосфере водорода при температуре до 500° с быстрым охлаждением до
комнатной температуры в водороде при 1 am достигается состав Hf H2 <0
[106, 115].
Стойкость гафиия против окисления на воздухе при повышенных темпе-
ратурах довольно хорошая и несколько выше, чем у циркония. Его ско-
рость коррозии при 750° в неподвижиом воздухе составляет 120 мг/дмг-час,
а при 950е — 385 мг/дм2-час [81]. Скорости коррозии циркония при этих
же условиях равны 108 и 737 мг/дмг-час соответственно |81]. После выдер-
живания в неподвижном воздухе при 950е в течение 2 час проницаемость
для пластин иодидного гафния составляла только 0,15 мм [81, 98[.
Гафний обладает хорошей стойкостью к действию воды под большим
давлением B45 am) при высоких температурах (до 399°) и водяного пара
до 399° [19, 38, 39, 100, 120]. Он показал также хорошую стойкость к воде
при высоких температурах (до 316°), циркулирующей со скоростью около
9 м/сек [19, 100, 120]. Коррозионная стойкость гафния по отношению к воде
при высоких температурах в меньшей степени зависит от примесей, напри-
мер азота, чем у циркония. Для гафния допустимое содержание азота в во-
де составляет примерно 0,1% [73]. Коррозионные испытания в реакторе
показали, что облучение не оказывает влияния на коррозионную стойкость
гафния по отношению к воде при высоких температурах [52].
Обычно гафний четырехвалентен, но при частичном восстановлении
тетрагалогенидов были получены неустойчивые галогениды, в которых
ои двух- и трехвалентен [79].
В водных растворах гафний всегда четырехвалентен. Гафний, при-
сутствующий в растворе в виде ионов, не так реакционноспособен, как алю-
миний, но более реакционноспособен, чем марганец. Доказательством слу-
жит тот факт, что нормальный электродный потенциал гафния при реакции
Hf + 2Н2О ~?_ НЮ2 + 4Н' + 4е равен 1,57 в. Для аналогичных реакций
нормальный электродный потенциал циркония равен 1,43 в, а тория 1,8 в.
Гафиий обладает несколько более резко выраженными основными
свойствами, чем цирконий, но менее основными, чем торий. Вообще говоря,
химия гафния более сходна с химией циркония, чем с химией тория, веро-
ятно, потому, что радиус атома гафиия ближе к радиусу атома циркония.
Например, гафний и цирконий более изоморфны, чем гафний и торий [26].
В табл. 18 приведены paci воримость и коррозионная стойкость холодно-
деформированного гафния в неподвижных; реагентах [81]. Аналогичные
Гафний
195
Таблица 18
РАСТВОРИМОСТЬ И КОРРОЗИЯ ХОЛОДНОДЕФОРМИРОВАННОГО ГАФНИЯ В НЕПОДВИЖНЫХ
РЕАГЕНТАХ ПРИ 35±1° [81]
Хлорид натрия
Едкий натр
Соляная кислота
Серная кислота
Азотная кислота
Соляная кислота
Сериая кислота
Азотная кислота
Дымящая азотная кислота
Соляная и серная кислоты
Соляная и азотная кислоты
Серная и азотная кислоты
Концентрация
раствори-
теля, %
Характер
растворителя
20
50
10
10
10
37
96,2
69,7
Соль
Щелочь
Разбавленная кис
лота
То же
э »
Концентрирован-
ная кислота
То же
Смесь кислот (I: I)
. A:1)
» » A:1)
Раствори-
мость,
мг/дм* ¦ сутки
11,80
1,59
3,17
3,17
3,19
11,9
Растворим
1,59
3,97
4,39
1143
1728
Скорость
коррозии,
мм/гсд
0,0A203
0,00457
0,00889
0,00889
A,00889
0,03302
0,00457
0,01118
0,01219
3,302
4,826
Примечание. На отдельных кристаллах гафния Б 70%-ной азотной кислоте при комнат-
ной температуре образуется анодная пленка. Толщина пленки зависит от ориентации кристаллов.
Наблюдалось образование пленок с высокой и низкой устойчивостью. При 0,025 ма/см2 напряже-
ние на элементе было менее 1,5 6, ? то время как при 1,5 ма/слР напряжение возросло до 180 в,
н пленки разрушилась прн разрядном напряжении. Вп всех случаях при анодировании более
сильное оинсленые происходило на тех гранях кристаллов металла, на который наблюдалось бо-
лее интенсивное окисление у циркония и тех же условиях [87]. Ориентации металла влияет на
рост анодной пленкн, обрвлующейся прн 0,025 ми/см% и температуре 90°, ны ее влияние оказы-
вается второстепенным в отношении образовании ыродышей [87].
исследования с цирконием показывают, что гафний несколько менее устой-
чив по отношению к этим реагентам, чем цирконий 181]. Было иайдепо,
что скорость растворения прутка иодидного гафния (99,2/оШ) в плавиковой
кислоте очень большая, даже в 1 и. кислоте; из других кислот только Цар-
ская водка реагирует почти стакойжескоростью[1111. Однако при добавле-
нии даже небольших количеств фторида аммония гафний быстро раство-
ряется и в других кислотах, за исключением йодноватой кислоты. Азотная,
серная, соляная, бромистоводородная, иодистоводородная, хлорная, фос-
форная, уксусная, хлоруксусная, дихлоруксусная, трихлоруксусная,
трифторуксусная, муравьиная и щавелевая кислоты слабо действуют или
вообще не действуют на гафннй, если не добавляется фторид аммония.
Гафинй весьма устойчив по отношению к щелочам; на него ие действуют
пары раствора едкого натра даже в присутствии перекиси натрия 1111].
ПЛАВЛЕНИЕ И ИЗГОТОВЛЕНИЕ ИЗДЕЛИИ
Поскольку гафниевая губка, полученная по способу Кроля или путем
восстановления металлическим натрием, переплавляется в слитки, пред*
ставляющие твердый хрупкий материал, перед переплавкой в слитки
и изготовлением из них изделий ее обычно подвергают дальнейшей очистке
в кристаллический пруток иодидным способом. В связи с тем что металл
13*
196 Г л ав а 9
дорог и является редким, применяют специальные способы выплавки
и изготовления изделий, чтобы обеспечить высокий выход металла, предназ-
наченного для применения в качестве материала для регулирующих стерж-
ней в ядерных реакторах [57).
Прутки нодидиого гафния могут быть переплавлены в пластичные слитки
теми же способами, что и титан и цирконий. Чаще всего в таких случаях
применяется обычный способ выплавки металла в дуговой печи с охлаждае-
мым водой медным тиглем. Самый большой выход гафния, отвечающего
техническим условиям па реакторные сорта металлов, получается после
двойной переплавки в дуговой печи [39, 57]. Качественные слитки, которые
при минимальной обработке их поверхности могут быть прокованы в ци-
линдрические болванки, получаются после вторичной переплавки в дуго-
i.ofi печи с расходуемым электродом в вакууме. Исходным материалом для
этой плавки является слиток, выплавленный из раздробленпого прутка
иодидного гафния в дуговой печи в атмосфере инертного газа с нерасходу-
емым водоохлаждаемым медным электродом с вольфрамовым иакоиечииком.
Менее длительный, одноступенчатый способ переплавки слитков заклю-
чается в сварке прихваточными швами прутков иодидного гафния в расхо-
дуемый электрод, который затем прикрепляется к медному электро-
ду 157].
Дли переплавки гафния в вакууме используются тигли из графита 177]
и цирконатов щелочноземельных металлов [118]. Считают, что при такой
очистке предотвращается загрязнение гафния примесями и он не становится
хрупким.
Для изготовлении изделий из гафния применяются по существу те же
способы, что и для выплавленных в дуговой печи циркония [86[ и титана.
Перед ковкой и прокаткой слитки металлов с высокой реакционной спо-
собностью, например гафния, выплавленные в дуговой печи с расходуемым
электродом, необходимо подвергать почерхностной обработке. Выгоднее
всего, причем без заметного влияния на качество слитка, это достигается
путем оплавления его боковой поверхности электродуговым способом
с инертной атмосфере 11261.
Поскольку гафний деформируется не так легко, как цирконий, при его
ковке и прокатке требуется поддерживать более высокие температуры.
Гафний более устойчив при нагревании на воздухе, чем цирконий, но вслед-
ствие того, что его окисел обладает лучшими защитными свойствами,
нагревание металлического гафния во время обработки, по-видимому,
лучше проводить в печи с инертной атмосферой [39]. Слитки переплаБлен-
ного в дуговой печи иодидного гафния можно легко ковать прн 927°;
максимальная температура ковки равна 1093°. Следует принимать меры
для разрушения литой структуры до того, как общая степень обжатия при
ковке станет выше 10 -15% [58]. Поковку подвергают горячей прокагке
в интервале 900—927° с конечной температурой прокатки не ниже 750г,
если необходима рекристаллизация.
Во время холодной прокатки общая степень обжатия без промежуточ-
ного отжига не должна превышать 30%, если нужно избежать сильного
растрескивания материала [57]. Можно достигнуть и более высоких степеней
обжатия, если его давать за несколько проходов с кратковременным проме-
жуточным отжигом при 800е. Общую степень обжатия в холодном состоянии
можно доводить до 50%. но при этом может происходить сильное растре-
скивание материала. При изготовлении гафниевых полос высокого качества
для ядерных реакторов горячекатаные полосы подвергают дробеструйной
обработке, протравливают и прокатывают на холоду до окончательного
Гафний 1ST
размера с максимальной степенью обжатия между отжигами в вакууме,
равной примерно 5% 139, 58].
Различные сорта гафния показаны на рис. 5.
Помимо холодной прокатки в листы, гафний можно штамповать, ко-
вать, вытягивать в проволоку или пруток, выдавливать в пруток или
в какие-либо другие изделия простой формы. При холодной вытяжке
в проволоку и при выдавливании иодидного гафния необходима соответ-
ствующая смазка. При штамповке на молотах смазки не требуется [81.
Холодную вытяжку проволоки следует осуществлять за несколько прохо-
дов со степенью обжатия 10—20% за проход с кратковременным промежу-
точным отжигом при 760' через каждые 35"о общей степени обжатия [571.
Р и с. 5. Пруток иодидного гафния (сграоа) н переплавлен-
ная из него в дуговой печи в атмосфере аргона заготовка
(слева), которую можно прокатывать о fipycOK или полосу
(«Фут минерал компании).
В процессе обычной сварки вследствие образования окислов, нитридов
и карбидов гафний становится хрупким. Сварка гафния с гафнием и гафния
с титаном, цирконием и циркониевыми сплавами (циркалой-2) производится
элсктродуговым способом с применением вольфрамового электрода в инертной
защитной атмосфере [53, 57, 65, 1141. Однако этот метод не вполне удовлет-
ворителен. Длительный контакт с электродом приводит к загрязнению гаф-
ния вольфрамом 11141. Поскольку стандартное оборудование для дуговой
сварки в атмосфере гелия не обеспечивает пластичных швов, приходится
применять специальную сварочную камеру, заполненную инертным газом -
гелием или аргоном. Для сварки в вакууме необходима на 60% большая
сила тока, поэтому сварочная камера заполняется инертным газом до атмо-
сферного давления.
Механическая обработка иодидного гафния по существу не отличается
от механической обработки иодидного циркония; эти операции осуществля-
ются с помощью высокоскоростных инструментов 1581.
Отжиг для снятия остаточных напряжений, возникших в результате
холодной обработки, обычно проводится при 700—800° — в интервале
температур, в котором происходит рекристаллизация [811. Более крупные
полосы могут быть отожжены на воздухе без какого-либо нежелательного
загрязнения, тогда как гафниевые полосы толщиной менее 1,27лш следует
отжигать в вакууме или в атмосфере инертного газа 157].
19S Глав а_9
МЕТАЛЛОГРАФИЯ
Металлографические образцы иодидного гафния могут быть успешно
приготовлены теми же методами и с применением тех же травителей, ко-
торые найдены подходящими для циркония.
Образцы, приготовленные методом химического полирования [24],
шлифуют наждачными шкурками № 3-0 или пастой из карбида кремния,
после чего погружают в полирующий расгвор или смачивают им поверх-
ность образца. Рекомендуемые полирующие растворы содержат концентри-
рованную азотную кислоту и 48%-ную плавиковую кислоту с глицерином,
водой или 30%-ной перекисью водорода.
Гафниепые шлифы можно приготовить также методом электрополиро-
вания в присутствии уксусной и хлорной кислот, описанным дли циркония
и титана 11011. Любой из растворов, рекомендуемых для циркония и мало
отличающихся друг от друга, можно с успехом применять для гафния. При
вырезании и приготовлении гафниевых образцов следует принимать те же
меры предосторожности, что и в случае циркония и титана.
ОБЛАСТИ ПРИМЕНЕНИЯ
Гафний нашел небольшое промышленное применение вследствие огра-
ниченной доступности и высокой стоимости, что обусловлено трудностью
его отделения от циркония. Однако за последние годы этот металл стал
несколько более доступным, так как он является побочным продуктом
производства реакторных сортов циркония. В связи с этим представляют
интерес потенциальные возможности его применения в качестве материала
для регулирующих стержней в ядерных реакторах с водяным охлаждением.
Помимо того что гафний имеет большое поперечное сечение захвата тепло-
вых нейтронов, он обладает превосходными механическими свойствами
и высокой коррозионной стойкостью. Пруток иодидного гафния можно
применять без оболочки для гомогенных регулирующих стержней. Одним
из самых важных критериев, определяющих выбор материалов для регули-
рующих стержней, является их устойчивость к действию излучений. Гаф-
ний считается полиостью изученным долгоживущим и сильно выгорающим
поглощающим материалом с точки зрения повреждения под действием
излучений. Регулирующие стержни из гафния успешно применяются
во время работы активной зоны реактора подводной лодки «Наутилус»
[14, 40]. Регулирующие стержни из этого материала применяются также
в экспериментальном реакторе с кипящей водой [22] и в шиппингпортском
реакторе.
Из гафния изготовляются нити ламп накаливания, катоды для рентге-
новских трубок и электроды (сплав с вольфрамом или молибденом) для
газонаполненных под высоким давлением разрядных трубок [3, 5, 68].
Порошкообразный гафний с окисью бария или стронция применяется'для
изготовления катодов высоковакуумных разрядных трубок [88]. Сплавы
гафния с титаном, не содержащие кислорода, азота, углерода и кремния,
можно применять в качестве газопоглотителей для эвакуированных и газо-
наполненных устройств, например ламп, радиоламп и телевизионных тру-
бок [76]. Кроме того, гафний используется в выпрямителях [68].
Получены сплавы гафния с марганцем, хромом, железом, кобальтом,
никелем, медью и серебром [2, 11]. Из сплава, содержащего 0,5 части гаф-
ния, примерно 80 частей никеля и 20 частей хрома, изготовляются нагре-
Гафний 199
ватели печей сопротивления [60]. При восстановлении окиси вольфрама
для регулирования скорости роста зерен и соблюдения стехиометрии можно
добавлять 0,1—3% нитрата гафния [5, 68].
Гафний применяется в производстве специальных стекол [5]. Путем
разложения галогенидов гафния при 800—1800° можно получить корро-
зионностойкую пленку гафния иа основном металле [4]. Гафний можно
электролитически осаждать из расплавленной ваниы смеси фторидов гаф-
ния и щелочных металлов на основу из таких металлов, как железо и медь
169, 104].
За последнее время гафний стал доступным в промышленном масштабе,
и его можно будет более широко применять для регулирующих стержней
ядерных реакторов.
Существующая в настоящее время цена прутков иодидного гафния
составляет около 65 долл. за 1 кг, или почти в 5 раз выше цены высокосортной
циркониевой губки с небольшим содержанием гафния [80]. В листо-
вой форме он продается по 87 долл. за 1 кг. В 1958 г. было получено
примерно 21 т гафния, а в 1960 г. его годовая производительность составила
около 32 т.
Уровень производства гафния и его стоимость находятся в прямой
зависимости от спроса на этот металл и от масштабов производства реактор-
ных сортов циркония (свободного от гафния), так как самым экономичным
источником гафния является отделение его при получении реакторного
циркония. Цирконий, предназначенный для других целей, например для
изготовления химического оборудования, не требуется освобождать от гаф-
ния. Однако если потребность в гафнии превышает количество гафния,
полученного в производстве реакторных сортов циркония, можно получить
дополнительные количества этого металла за счет увеличения количества
материала, подвергаемого разделению. При этом соответственно возрастет
и производство циркония, не содержащего гафния.
ЛИТЕР АТУР А
1. A d e n s t e d t H. K-. Trans. Am. Soc. Metals, 44, 949 A952).
2. Alloys Ltd., франц. пат. 835468, December 22, 1938.
Л Anderson W. Т., Jr.. пат. США 2477279, July 26. 1949.
4. Metalloberflache. 6A, 109 A952).
5. A r e n d A. G., Chem. Prod., II, 30 A948).
С Aston F. W., Nature, 133, 684 A934).
7. A s t о n F. W., Proc. Roy. Soc, A149, 396 A935).
«.Baldwin E. E., U. S. Atomic Energy Commission. Rept. № KAPL-M-EEB-7,
1954.
9. Baxter G. P., Guichard M., Whytla w-G ray R., J. Am. Chem.
Soc., 69, 731 A947)
10 Becker J. G., Rev. Mod. Phys., 7, 95 A935).
11 Белозерский Н. А, Фрейдлина Б. А., Резвая К. И., Авт.
свид. СССР № 54976, Май 31, 1959.
12. Benedict M., Pig ford Т. Н., Nuclear Chemical Engineering, McGraw-
Hill Book Company, Inc., New York, 1957, p. 165.
13. В е у e r G. H., Spink D. R., West J. В., Wilhelm II. A., Chem.'
Eng. Progr., Symposium Ser. № 50, A2), 67 A954).
J4. Blair C, The Atomic Submarine and Admiral Rickover, Henry Holt and Co.,
Inc., New York, 1954.
200 Глав а 9
15. Boer J. H. de, Van Arkei A. E., Z. anorg. allgem. Chem., 153, 1 A926).
16. В о e r J. H. de, F a s t J. D., Z. anorg. allgem. Chem., 187, 177 A930).
17. В о e r J. H. de, F a s t J. D , Z. anorg. allgem. Chem., 187, 193 A930).
18. Bohr N., Theory of Spectra and Atomic Constitution, 2nd ed., Cambridge Uni-
versity Press, London, 1922, p. 114.
19. В r e d e n С R., Reactor Engineering Division guarterly Report — Sec. I, Argon-
ne National Laboratory, ANL-5571, p. 119, July 1956.
20. В r i d g m a n P. W., Proc. Am. Acad. Arts Sci., 63, 347 A928).
21. В г i d g m a n P. W.. Proc. Am. Acad. Arts Sci., 82, 83 A953).
22. В u 1 1 i nger C. F., Reactor Engineering Division Quarterly Report — Sec. I,
Argonne National Laboratory, ANL-5571, p. 32, July 1956.
23. Burke D., Darnell F., Phys. Rev., 86, 628 A952).
24 С a i n F. M., Jr., Zirconium and Zirconium Alloys, p. 176, a Symposium, Ameri-
can Society lor Metals, Cleveland, 1953.
23. С a r I s о n O. N., Schmidt F Л , W i 1 h e 1 m H. A., J Electrochem.
Soc., 104, 51 A957).
26. С а г о b b i G., Atti e mem. accad. sci. lettere ed arli Modena, 7, 3 A947).
27. С a s t 1 e m a n L. S., McGeary R. K-, S h a p i г о Z. M., Simcoe
C. R., Thomas D. E., Westinghouse Atomic Power Division Report
№ VVAPD-RM-92, October 1951.
28. Coffer L. W.. Chem. Eng., 65, 107 A958).
29. Coster D., H eves у С, Nature, 111, 79 A923).
30. Coster D., Hevesy C, Nature, 111, 252 A923).
31. Cox R. P., Peterson H. C, Beyer G. H., Ind. Eng. Chem., 50, 141
A958).
32. С r i s t e s с u S., Simon F., Z. physik. Chem., B25, 273 A934).
33. D e a r d о f f D. K.-, Hayes E. Т., J. Metals, 8, 509 A956).
34. Deem H. W-, U. S. Atomic Energy Commission, Rept. № BMI-853, 1953.
35. Haas W. J. de, Voogd J., Proc. Koninkl. Ned. Akad. Wetenschap., 32, 707
A929).
.16. Dempster A. J., Phys. Rev., 55. 791 A939).
Л7. Duckworth H. E., Woodcock R. F., Stanford G. S., Coutu
A., Stearns R. L., Phys. Rev., 85, 929 A952)
38. Dunning D. N., General Electric Co., Knolls Atomic Power Lab., Quarterly
Reactor Technology Report .№ 2, KAPL-1803, p. 48, August 1957.
,!9. Dunning D. N., U. S. Atomic Energy Commission, Rept. № KAPL-M-DND-2,
1957.
40. D u n n i n g D. N.. Ray W. F... Nucleonics, 16, 88 A958).
41. Duwe-i P., J. Appl. Phys., 22, 1174A951).
12. E d w a r d s R. K-, Malloy G. Т., L. S. Atomic Energy Commission, File
№ NP-6212, December 1956.
13. Eppelsheiraer D. S., Gould D. S., J. Inst. Metals, 85, 158A956).
44. E p p e I s h e i in e r D. S., Gould D. S.. Nature, 177, 241 A956).
45. F as t J. D., J. Appl. Phys.. 23, 350 A952).
46. F i n к e 1 n b II г g W.. Z. Naturforsch., 2a, 16 A947).
47. F i n к e 1 n b u r g VV., H u m b а с h VV-, Naturwiss., 42, 35 A955).
48. Fleischer M., Geol. Survey Bull. 1021-A, Government Printing Office,
Washington, D. C, 1955.
49. F 1 u g g с S., M a t t а и с h J., Ber., 76A, 1 A943).
50. Foos R. A., Wilhelm H. A., lJ. S. Atomic Energy Commission, Rept.
№ ISC-693, 1954.
51. Fried berg S. A., U. S. Atomic Energy Commission, File № NP-5668,
1954.
60.
Cl.
62.
63.
64.
65.
66.
G
H
H
H
H
H
г i
e i
e v
e v
e v
og
1954.
H
0 1
f f
n
i t
R.
es у
e
e
e
m
s у
s у
H
e s
h s
A.
G.
G.
G.
. R
H.
Гафний 201
52. G a 1 о n i a n G. E., Call ah an E. J., Koenig R. F., U. S. Atomic
Energy Commission, Rept. № KAPL-M-GF.G-4, November 1955.
53. G e г к e n J. M., Toftegaard S. A., U. S. Atomic Energy Commissior,
Rept. № KAPL-M-JMG-6, 1956.
54. G i 1 b e r t H L., Ban M. M., J Electrochem. Soc, 102, 243 A955).
55. G 1 a s s e r J.. H a in p e 1 С. А., пат. США 2703752, March 8, 1955.
56. Goldman J. E., U S. Atomic Energy Commission, Rept J* NYO-7257,
1956.
57. G о о d w i n J. G., Hurford W. J., J. Metals, 7, 1162 A955).
58. Goodwin J G., II ur for d W. J.. L". S. Atomic Energy Commission,
Rept. № WAPD-109, 1954.
59. Googin .1. M.. in Process Chemistry (Bruce F. R., Fletcher J. M., Нушап Н. H.,
Eds.), Progress in Nuclear Energy, Scr. Ill, Vol 2, Pergamon Press, Inc., New
York, 1958, p. 194.
W Т., P f e i 1 L. В., англ. пат. 459848. January II, 1937
, Phys. Rev., 102, 1511 A956).
, Chem. and Ind., 42, 929 A923).
, Chem. Revs., 2 A926).
, Current Sci., 5, 236 A936).
., U. S. Atomic Energy Commission, Rept JY» WAPD-MDM-5,
P., Barr M. M., Gilbert H. L., Г. S. Bureau of Mines.
Rept. Invest., № 5169. 1955.
67. Honigsclimid O., Z i n t 1 E., Ber., 58. 453 A925).
f>8. Hopkins B. S., Chapters in the Chemistry of the Less Familiar Elements
Vol 2, Stipes Publishing Co., Champaign, 111., 1939, Chap. 13.
69. Horizon Titanium Corp., U. S. А., англ. пат. 775585, May 29, 1957.
70 Hughes D. J., Schwartz R. В., Neutron Cross Section, BNL-325. 2nd
ed.. Government Printing Office, Washington, D. C, July 1, 1958.
71. Humphrey G. L., .1. Am. Chem. Soc, 75, 2806 A953).
72. 11 u г e J., Saint-James R.. Proc. Intern. Conf. Peaceful Uses Atomic
Energy, Geneva, 8, 551 A956).
7.4. Kato H., Beall R. A., Holmes II. P., Ware G. C, U. S. Bureau
of Mines, Rept. № USBM-U-210, October 1956.
74. К r i es s m a n С J., M cG u i r e 1. R., Phys. Rev.. 98. 936 A955).
75. К г о 1 1 W. J., Mining and Met., 27, 262 A946).
76. К roll W. J., пат. США 2522679, September 19, 195U.
77. К г о 1 1 W. J., пат. США 2548897, April 17, 195].
7fi. К u r t i N.. Simon F., Proc. Roy. Soc., Л151, 610 A935)
79. Larscn E. M., L e d d у J. J., U. S. Atomic Energy Commission, File
№ NP-5743, August 1955.
80 Link L. E. Z i n ii \V. H., in Nuclear Engineering Handbook (Ethenngton
H., Ed.), McGraw-Hiil Book Company, Inc., New York, 1958, Sec. 12-2, p. 107.
HI L i t t on F. В., J. Electrochem. Soc, 98, 488 A951).
82 Love В., Wright Field Air Force Development Center Report ]* WADC-FR-57-
666, Part 1, 1958.
83 Ластмен С, Керз Ф., Металлургия циркония, ИЛ, Москва, 1959.
8i. Mattauch J., Ewald H., Naturwiss., 31, 487 A943).
85. Л\ at tan ch J, Ewald H., Z. physik., 122, 314 A944).
86. Miller G. L., Zirconium, 2nd ed., Academic Press, Inc., New York, 1957
p. 453.
S7. Misch R D., Fisher E. S., J. Electrochem. Soc, 103, 153 A956).
88. Phillips N. V., голланд. пат. 69486, February 15, 1952.
Ж? Глава 9
89. Northwest Electrodevelopment Laboratory, U. S. Bureau of Mines, Rept. № BM-
11-90, July 1954.
90. О 1 i v e r D. S., Culcheth Labs., U. K. Atomic Energy Authority Industrial
Group, № FRDC/P-33, May 1953.
91. Pauling L., J. Am. Chem. Soc, 69, 542 A947).
92. P e n n e r S. S., J. Chem Phys., 16. 745 A948).
93. P e t e r s о n A. W., К e d e s d у H., Keck P. H., Schwarz E., J.
Appl. Phys., 29, 213 A958).
94. R a d ее к er W., Chem. Tech. (Berlin). 2, 131 A950).
S5 R a m s а у J. W., Whitson W. K-, Jr., U. S. Atomic Energy Commission,
Rept. № Y-817, 1951.
96 Ramsay J. W-, Whitson W. K-, Jr.- U. S. Atomic Energy Commission.
Rept. № Y-824, 1951.
97. R а п к a m a K-, S a Ii a m a K-, Sahama Т. С, Geochemistry. Univer-
sity of Chicago Press, Chicago, 1950, p. 39.
98. Reactor Handbook, 1st ed.. Vol. 3, Office of Technical Services, II. S. Ainmic
Energy Commission, Washington, D. C, 1953.
99. R i с h a r d s о n D., Spectroscopy in Science and Industry, Proceedings of the
Fifth Summer Conference of Spectroscopy and Its Applications, John Wiley and
Sons, Inc.. New York, 1938, p. 65—70.
10U. Roebuck A. H., Breden С R., Greenberg S., Corrosion, 13,
87 A957).
101. R о t h H. P., Metal Progr., 63, 84 A953).
11И. S а с h t 1 e r W. M. H., Z. Elektrochem., 59, 119 A955).
103. С а ж и н Н. П., Пепеляева Е. А., Доклады советской делегации на
международной конференции по мирному использованию а-гслшой энергии. Иссле-
дования в области геологии, химии ил металлургии, АН СССР, Москва, 1955, стр.
142—150.
104. S с h 1 е с h t е n A. W.. S t г a u m а п i s М. Е., Gill С В., J Electro-
chcin. Soc, 102, 81 A955).
1U5. She It on S. M., Dill ing E. D., McClain J. H., Proc. Intern.
Conf. Peaceful Uses Atomic Energy, Geneva, 8, 505 A956).
1U6. Sidhu S. S., Acta C.ryst., 7, 447 A954).
107. S k i n n e r G. В., Beckett С W., Johnson H. L., U. S. Armed
Services Techn. Inf. Agency Dncument, JV« ATI-81814, 1950.
108. S m e It z e r W. W., S i m n a d M. Т., Acta Met., 5, 328 A957).
109. Smith T. S., Daunt J. G., Phys. Rev., 88, 1172 A952).
110. S 1 e p h e n s W. W., Morrison С Q., J. Metals, 8, 334 A956).
111. S t г а и m a n i s M. E., В alias s J. I., Z. anorg. allgem. Chem., 278, 33
A955).
112. Taylor J. W-, Metallurgia. 50, 161 (i954).
113 Technical and Application Data on Zirconium and Hafnium, Mallory-SIiaron Metals
Corporation, Niles, Ohio, 1958.
114. T h e i 1 а с k e r J. S., В a ugh E. D., К as berg A. H., S term on
R В., J. Metals, 8. 646 A956).
115. T r z e с i a k M. J.. D i 1 t h e у D. F., M a 1 1 e t t M. W., U. S. Atomic
Energy Commission, Repl. № BMI-1112, 1956.
116. U r b a i n G., С R-, 152. 141 A911).
117. V r bain G., Nature. Ill, 218 A923).
118. Urban S. F., пат. США 2684297, July 20, 1954.
119. Van A r k e 1 A. E., Z. physik. Chem.. 130, 100 A927)
120. Vaughan L. H., Ferguson К. М., Babcock and Wilcox Co.. Rept.
№ BW-5250, 1957.
Гафний
203
121. Waldo С. Т., Anderson W. К., U. S. Atomic Energy Commission,
Rept. № KAPL-M-CTW-2, January 1957.
122. W e s s e 1 E. Т., U. S. Atomic Energy Cunmission, Rept. N° AECU-3693, 1956.
123. Westinghouse Electric Corp., Atomic Power Division, Rept. № WAPD-MRP-42,
1954.
124. Wichers E., J. Am. Chem. Soc, 78, 3235 A956).
125. W о 1 с о t t N. M., Phil. Mag., 2, 1246 A957)
126. W о о d F. W.. Borg J. O.. Beall R. A., U. S. Bureau of Mines, Rept.
Invest. № 5149, 1955.
127. 3 а д у м к и н С. Н., ДАН СССР, 92. 115 A953).
12Н. Zwikker С; Pliysica. 6, 361 A926).
129. Zwikker С, Physik. Z., 30, 578 A929)
130. Z w i k k е г С, Verslag. Akad. Wetenschapen Amsterdam, 35, 336 A926); Proc
Acad. Sci. Amsterdam, 2fl, 792 A926).
10.
ГЕРМАНИЙ
Г. Р. ХАРНЕР
Н. R. Иагпсг, Chemicals and Metals Division,
The Eagle-Pichcr Company, Joplin, Missouri
ВВЕДЕНИЕ
Изучая зависимость между свойствами элементов, Пыолендс [581
установил, что, если его предположения верны, между кремнием и оловом
не хватает одного элемента. Спустя семь лет Менделеев [51] предсказал
открытие трех экаэлсментов и определил возможные свойства каждого из
них. Один из этих элементов (экасилнций) должен был принадлежать
к группе кремния. В 1886 г. Вииклеру потребовалось произвести анализ
образца аргироднта. Неоднократные анализы показывали недостачу в соста-
ве около 7"о, и в конце концов автор пришел к выводу, что недостача оГп.-
ясняется присутствием нового элемента. Наконец, Винклер [84] выделил
новый элемент и назвал его в честь свой родины германием.
В результате дальнейшего изучения свойств было окончательно опре-
делено положение германия в периодической таблице и подтверждено пред-
сказание Менделеева. Германий элемент IV группы четвертого периода
периодической таблицы. Его порядковый номер 32, атомный вес 72,59.
Несмотря на то что гермаинй известен уже много лет и свойства как
самого элемента, так и его соединений достаточно хорошо изучены, он лишь
недавно приобрел большое промышленное значение. Его промышленное
производство в США началось примерно 20 лет назад.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Содержание германия в земной коре составляет 4-10 4—7-104%
[1, 19]. Незначительные его количества были обнаружены во многих сили-
катных минералах.
Очень немногие из минералов содержат заметные количества германия
1631. Лргироднт*, из которого германий был выделен впервые, содержит
5—7% германия. Этот минерал (сульфид серебра и германия) обнаружен
лишь в небольших количествах. Канфильдит — сульфид серебра, олова
н германия**, содержащий примерно 1,8% германия,— найден в Боливии,
но тоже в небольших количествах.
В западных штатах США было найдено небольшое количество энарги-
та — сульфида медн и мышьяка***. Содержание в нем германия составляло
менее б,ОЗ°6 [62]. Вследствие малого содержания германия ни один из этих
минералов нельзя считать промышленным источником получения этого
элемента.
• AggGeS6, очень редкий.— Прим. ред.
** AgsSnSB, 'очень редкий; Ge лишь замещает олово, поэтому канфильдит сле-
дует рассматривать как сульфид серебра и олова.— Прим. ред.
*** Cu.,AsS4 или 3Cu2S • As2S5.— Прим. ред.
Германий
Германит* — сложный сульфид меди (цинка, мышьяка) н iep\ia-
ния — добывается в Тсумебе (Юго-Западная Африка); он ассоцииро-
ван со свинцово-цинково-мсдными рудами этого района. Чистый германит
содержит 109и германия [811, тогда как его среднее содержание в руде со-
ставляет только 3—4/6.
Отдельные сростки германита были найдены в виде вкраплений, диспер-
гированных в свинцово-медных рудах. Германит — единственный извест-
ный минерал, который используется в первую очередь для получения само-
го германия.
Реньерит** — сложный сульфид меди, железа, германия (и мышь-
яка) — недавно обнаружен в Республике Конго (бывшее Бельгийское
Конго) [53]. Анализ кристаллов чистого реньерита показывает, что среднее
содержание германия в нем составляет около 7% [81].
Реньерит был найден в виде неразделимой смесн в медно-цинковых ру-
дах в провинции Катанга Республики Конго (бывшее Бельгийское Конго)
14]. Он был найден также совместно с германитом в медно-евннцово-цинко-
вых рудах Тсумеба (Юго-Западная Африка) [31. Некоторые цинковые руды,
обнаруженные в США, содержат небольшое количество @,01 0,1%) гер-
мания [61; цинковые руды в других странах содержат только следы герма-
ния. Серебряные, оловянные, медные и железные руды содержат иногда
небольшое количество германия.
Значительное количество германия впервые удалось получить из
цинковых руд месторождения, расположенного в округе Трех штатов США
(Миссури — Оклахома—Канзас) [60]; впоследствии германий удалось
получить*из цинковых руд месторождения, расположенного в долине реки
Миссисипи [6].
Благодаря тому что в последние годы германий был обнаружен в рудах
месторождений Тсумеба [3] и Катанги [41, мировые запасы его значительно
возросли.
О присутствии германия в углях было известно давно [181; в последние
годы в многочисленных публикациях сообщается о нахождении германия
в углях, добываемых в различных частях света [48, 65]. Британские угли
н побочные продукты, образующиеся при их сжигании, исследовались [551
па содержание в них германия. Полученные результаты были опубликованы.
Продукты, получаемые при сжигании углей, служат одним из источников
для производства германия в Англии (см. раздел «Извлечение»). Геологи-
ческим управлением США собраны сведении о концентрации германия в не-
которых американских углях 173]. Данные о содержании германия в углях
публиковались для различных месторождений штатов Западная Виргиния
125], Иллинойс [49] и Канзас [69]. Возможность извлечения германия ил
каменных углей США широко изучалась, однако до сих пор этот метод не
нашел промышленного применения [16].
Добыча германия из цинковых и других руд экономически целесообраз-
на только потому, что в процессе извлечения основных металлов германий
концентрируется в отходах. Без такой предварительной концентрации
германия его извлечение и очистка с экономической точки зрения были бы
невозможны. Точно так же возможность извлечения германия из камен-
ного угля зависит от его концентрации в отходах, которые должны содер-
жать достаточное количество германия, чтобы его извлечение оказалось
выгодным.
* См. примечание к главе «Галлий», стр. 165.— Прим. ред.'
** То же.
206 Г л а в а 10
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В 1959 г. потребление германия (элементарного и двуокиси) в СШЛ
составило примерно 20 400 кг [161. Точные данные о его производстве не
сообщались.
Производство германия в Англии началось в 1950 г. [541; сведения об-
объеме его производства отсутствуют. Крупнейшим производителем герма-
ния в Европе является Бельгия, которая получает сырье из Тсумеба и быв-
шего Бельгийского Конго.
Основным производителем германия в США является фирма «Игл-Пп-
чер компани», которая извлекает его из цинковой руды [60]. Фирмы «Аме-
рикэн цинк компани» и «Сильвания электрик продактс, инк.» также произ-
водят германий. Впервые начала выпускать германий фирма «Америкэн
метал клаймакс, инк.». В Англии германий выпускает фирма «Джонсон.
Мэтти энд компани», использующая в качестве исходного сырья дымоходные
пыли, получаемые при сжигании каменных углей. В Бельгии германии
и двуокись германия выпускают фирмы «Сосьетэ жепераль металлюржнк
де Хобокен» в г. Олене и «Сосьетэ де ля Вьей Монтань» в г. Балсне. Опто-
вая цена германия полупроводниковой чистоты в настоящее время состав-
ляет в США 408 долл. за 1 кг. Цена двуокиси германия составляет около
243 долл. за 1 кг.
ИЗВЛЕЧЕНИЕ
В промышленном масштабе германий извлекают преимущественно н.+
цинковых и цинково-медно-свинцовых руд, германита, а также из дымо-
ходных пылей, получаемых при сжигании каменных углей.
Руду из округа Трех штатов (Миссури — Оклахома — Канзас) обога-
щают и подвергают окислительному обжигу, получая обычными методами
черновую окись цинка (вельц-окись). Обожженную руду смешивают
с поваренной солью и углем и затем спекают при высокой температуре:
при этом германий, кадмий и некоторые другие примеси испаряются. Обра-
зующиеся пары конденсируют и собирают в электростатическом фильтре.
Этот продукт разделяют путем химической обработки на черновые фракции
германия, кадмия и других примесей [601.
Германиевый концентрат обрабатывают концентрированной соляной
кислотой. Образующийся прн этом тетрахлорид германии (т. кип. 86°) отго-
няется. С целью отделения примеси мышьяка технический тетрахлорид
германия подвергают вторичной дистилляции в токе хлора. Очищенный
повторной дистилляцией тетрахлорид германия гидролизуют водой, в ре-
зультате чего образуется двуокись германия. Двуокись германия восста-
навливают при нагревании до 650° в атмосфере водорода и получают поро-
шок элементарного германия. Последний переплапляют в атмосфере инерт-
ного газа при температуре около 1100° в слитки. Такой метод получения
германия из германиевых концентратов и восстановление его до элементар-
ного состояния с различными видоизменениями применяются почти во всех
известных технологических схемах.
Цинковые руды из месторождения долины реки Миссисипи обогащают,
прокаливают и спекают так же, как и руды из месторождения, расположен-
ного в округе Трех штатов. Германий, содержащийся в этих рудах, нахо-
дится в отходящих дымах. При выщелачивании этих отходов в определен-
ных условиях серной кислотой цинк и кадмий растворяются, а свинец, гер-
маний и другие примеси переходит в шлам. При обработке шлама горячей
Германий 207
серной кислотой германий растворяется. Из этого раствора германий оса-
ждают сероводородом в виде сульфида. Полученный осадок сульфида герма-
ния затем прокаливают. Остаток после прокаливания обрабатывают кон-
центрированной соляной кислотой и проводят затем дистилляцию и очистку
так, как это описано выше 161.
В Балене (Бельгия) свинцовые и цинковые руды переплавляют по ком-
плексной схеме, в результате чего германий концентрируется в технической
окиси цинка. Выщелачивание окиси цинка в соответствующих условиях
позволяет перевести германий в раствор, из которого его осаждают. Полу-
ченный германиевый концентрат обрабатывают соляной кислотой и отго-
няют германий из раствора в виде тетрахлорида германия. Дальнейшая его
очистка производится так, как это описано для тетрахлорида германия,
получаемого из цинковых руд [81.
Присутствие германия в растворах, предназначенных для электроли-
тического получения цинка, чрезвычайно вредно. Это является одной из
причин предварительного отделения германия в применяемом в Балене
процессе, где цинк получают электролизом. Другим способом очистки цинк-
содержащих растворов является перевод германия, меди и мышьяка в шлам.
При переплавке этого шлама с избытком серы германий удаляется вместе
с дымом, из которого его в дальнейшем извлекают [47].
В Тсумебе (Юго-Западная Африка) германий встречается в виде смеси
германита и реньерита в медно-свинцово-цииковых рудах этого района.
При избнрательной флотации этих руд получают германиевый концентрат,
поставляемый в Олен (Бельгия). Там этот концентрат подвергают обжигу
в вертикальной шахтной печи в восстановительной атмосфере. Сульфид
германия отгоняют в виде дыма, который улавливают. Прокаливанием этого
конденсата в окислительной атмосфере получают техническую двуокись
германия, которую затем подвергают очистке [3].
В виде реньерита германий рассеян в медно-цинковых рудах Катанги
(Республика Конго). При получении флотационных концентратов этих руд
германий следует за медью. Образующиеся при выплавке меди дымы и пыль,
содержащие заметное количество германия, собирают, обрабатывают при
нагревании серной кислотой, выщелачивают разбавленной кислотой н полу-
чают раствор, содержащий германий. После окисления этого раствора из
него окисью магния и гидроокисью меди осаждают германиевый концен-
трат, который поступает на дальнейшую переработку [41.
Полученные из руд Тсумеба и Катанги германиевые концентраты (опи-
санные в предыдущих разделах) поставляются в Хобокен (Бельгия) для
извлечения из них германия и последующей его очистки [51. Ректификацию
тетрахлорида германия, получение из него гидролизом двуокиси, ее вос-
становление до германия и его очистку производят так, как это описано
выше.
В Тсумебе были найдены отдельные сростки германита, которые под-
вергали обработке с целью извлечения из них германия и галлия. В одном
из применявшихся для этого технологических процессов [G6] измельчен-
ный германит обрабатывали 50%-ным раствором едкого натра и получен-
ную таким образом смесь выпаривали досуха. Сухую массу выщелачивали
горячей водой, а рП полученного раствора доводили серной кислотой до 8.
В определенных условиях к кипящему раствору приливали азотную
кислоту с таким расчетом, чтобы содержание свободной кислоты в растворе
составляло 5%. После фильтрования раствора с целью осаждения галлия
рП раствора доводили едким натром до 3. Осадок гидроокиси галлия отде-
ляли фильтрованием, а фильтрат нейтрализовали аммиаком и осаждали
¦208
Глава 10
из него германий (в виде двуокиси). После этого двуокись германия отфиль-
тровывали от раствора и растворили в концентрированной соляной кислоте.
Образующийся при этом тетрахлорид германия отгоняли и подвергали
очистке. Гидролиз тетрахлорида германия с образованием двуокиси и ее
восстановление до германии, а также последующую его переплавку произ-
водили, как это описано выше.
Золу и сажу для извлечения из них германия (и галлия) сплавляют
с содой, известью, окисью меди и угольной пылью [661. В результате обра-
зуются корольки германия и шлак, которые могут быть разделены. Почти
весь германий (и галлий) концентрируется в корольках. Корольки хлори-
руют в разбавленном растворе хлорного железа. По окончании реакции
раствор сильно подкисляют и отгоняют технический тетрахлорид германия.
Полученный таким образом тетрахлорид содержит заметные количества
«t
Порошок двуокиси германия (внизу
cnpaDa), германиевые ели гки (в центре
и слева), монокристаллы германия
(два стержня вверху справа) и попс-
ррпные срезы этих типов германиевых
заготовок («Игл-Пичер компаииа).
примеси хлорида мышьяка. Для удаления этой примеси тетрахлорид гер-
мання кипятят в течение 12 час и более с обратным холодильником, снаб-
женным насадкой из медной стружки. Дальнейшие операции очистки и полу-
чения германия производят так же, как это описано для процессов пере-
работки цинковых руд и германита.
В применяемом для изготовления электронных приборов германии
допустимая концентрация примесей ничтожно мала, и чаще всего ее опре-
деляют не химическими методами, а измерением удельного электросопро-
тивления самого германия. Полученный в результате восстановления дву-
окиси германий подвергается дальнейшей очистке перекристаллизацией
[5, 61]. Самым распространенным методом очистки является зонная плав-
ка, при осуществлении которой графитовую лодочку с помещенным в нее
германием медленно перемещают в горизонтальной трубчатой печи d ат-
мосфере инертного газа или в вакууме. Материал нагревают в печи с по-
мощью нескольких индукторов, которые создают ряд зон таким образом,
что при прохождении слитка через эти индукторы образуются узкие зоны
расплавленного германия. В этом методе при многократном нагревании
до расплавления и охлаждении примеси оттесняются к концам германиево-
го слитка. Концы слитка отрезают, а используют только среднюю его
часть. Концы слитка возвращают в процесс для их очистки.
На фотографии показаны двуокись германия, германиевые слитки,
монокристаллы германия и поперечные срезы двух типов слитков.
Германии
209
ФИЗИЧЕСКИЕ СВОЙСТВА
Германий обычно относят к числу металлоидов, которые обладают про-
межуточными свойствами между истинными металлами и неметаллами.
Он принадлежит к группе материалов, известных как полупроводники.
Эти материалы, типичным представителем которых является германий,
приобрели большое значение для электронных приборов.
Физические свойства германия приведены в таблице.
[21]
[21]
[21]
[21]
[21]
ФИЗИЧЕСКИЕ СВОЙСТВА ГЕРМАНИЯ
Порядковый номер 32
Атомный вес 72,59 [76]
Изотопный состав, %
Массовое число 70
72
73
74
76
Цвет
Кристаллическая решетка
Показатель преломления
Твердость по Моосу (тв.)
Пластичность
Плотность при 25°, г/смя (тв.)
Удельный объем при 25" (тв.)
Температура плавления, °С
Температура кипения, "С
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Удельная теплоемкость при 25°, кал/г
Удельное электрическое сопротивление при 25°,
мкомем
Электрохимический эквивалент Ge4*, мПк 0,1881 ]26]
Электродный потенциал Ge4* (по отношению к во- 0,15 |34]
дородному электроду), в
20,4
27,4
7,8
36,6
7,8
Серебристый
Кубическая граие-
центрированная[50]
4,068—4,143 [9]
6,25 [50[
Хрупкий
5,32
0,188
936
-27ОП
111,5
1200
0,086
60-10«
[76|
[22|
[56[
[22]
171]
[38]
[44]
ХИМИЧЕСКИЕ СВОЙСТВА
В своих соединениях германий может быть двух- и четырехвалент-
ным; соединения четырехвалентного германия более устойчивы.
Германий при 25е вполне устойчив против действия воздуха, воды
и кислорода. При 600—700° он быстро окисляется воздухом и кислородом
150]. При нагревании с галогенами германий легко образует соответствую-
щие тетрагалогениды. Наиболее энергично взаимодействие протекает
с хлором, затем с бромом и иодом.
Соляная и серная кислоты при комнатной температуре взаимодействуют
с германием слабо; при 100° серная кислота медленно растворяет германий.
Азотная кислота и царская водка действуют на германии, особенно при
высокой температуре. Растворы едкого натра и едкого кали действуют на
14 3.1 каз № 239
210 Глава 10
германий слабо или вовсе не действуют, тогда как расплавленные щелочи
быстро его растворяют.
Германий образует два окисла — GeO и GeO2. Последний из них, дву-
окись германия, является основным промышленным продуктом.
Джонсон 1371 составил превосходный обзор опубликованных работ,
посвященных неорганическим соединениям германия. Аналогичный обзор
того же автора [36] охватывает обширные работы по металлоорганическим
соединениям германия.
Для качественного определения германия образец обычно сплавляют
с содой или едким натром. С целью отделения германия от большинства дру-
гих элементов полученный плав растворяют в концентрированной соляной
кислоте, после чего отгоняют германий в виде тстрахлорида GeCl4. Дистил-
лят анализируют соответствующим методом.
Малые количества германия лучше всего определяются качественно
с помощью фенилфлуорона. В присутствии даже следов германия появляет-
ся интенсивное розовое окрашивание 113]. Для количественного определе-
ния больших количеств германия его осаждают в виде сульфида из концен-
трированных сернокислых растворов.
Для количественного определения образец сплавляют с едким натром
или содой. Плав обрабатывают соляной кислотой и образующийся при
этом тетрахлорид германия отгоняют в токе хлора. Тетрахлорид растворяют
в 6 и. серной кислоте и осаждают германий в виде сульфида. Сульфид
окисляют перекисью водорода и взвешивают образовавшуюся дву-
окись [35].
Тетрахлорид германия можно восстановить гипофосфитом натрия,
а двухвалентный германий определить титрованием иодатом калия 130].
Очень малые количества германия рекомендуется определять не титро-
ванием или весовыми методами, а колориметрическими методами, применяя
фенилфлуорон 1131 или окисленный гематоксилин [57].
Широко применяются спектрографические методы анализа. Строк [77]
применил для разбавления угольный порошок, вводя в него в качестве
внутреннего стандарта окись бериллия. Сжигая эту смесь в кратере элек-
трода, питаемого дугой постоянного тока, он определял германий по харак-
теристической линии 2651,1 А. При видоизменении этого метода в качестве
внутреннего стандарта применяется карбонат лития, благодаря чему
полное испарение образца происходит при силе тока (постоянного) 10 а
в течение 2—3 мин [80]. В другом методе в качестве разбавителя приме-
няется пегматит без введения в него внутреннего стандарта 1201.
Критический обзор методов определения германия был опубликован
Краузе и Джонсоном [41].
Применение химических методов для определения примесей в германии
полупроводникового качества не дает удовлетворительных результатов.
Можно применять спектрографические методы, однако наиболее подходя-
щим является метод определения удельного сопротивления. Применяется
также и радиоактивационный метод определения примесей.
Германий и двуокись германия не токсичны 124]. При вдыхании тетра-
хлорид германия оказывает раздражающее действие, что происходит, по-
видимому, вследствие гидролитического разложения этого вещества на СсОг
и HCI, который, вероятно, и вызывает раздражение.
Сплавы. Ниже приводятся некоторые сведения о сплавах германия.
Алюминий — германий. В двойной системе геоманий — алюминий
имеется эвтектика E5 вес.% Ge), плавящаяся при 423° [43, 741. Раство-
Германий 2Л/
римость алюминия в германии и германия в алюминии в твердом состоянии
очень мала.
Висмут — германий. При содержании висмута, близком к 100%, обра-
зуется эвтектика с температурой плавления около 271° 168, 75].
Железо — германий. Имеются сообщения [46, 68] о существовании
двух соединений: Fe2Ge с температурой плавления 1180° и FeGe2 с темпера-
турой плавления 866е.
Золото германий. В системе золото — германий имеется эвтектика
при 12 вес.% германия с температурой плавления 356" [33]. Растворимость
германия в золоте при 350° составляет 0.8°о, при комнатной температуре
растворимость незначительна. Исследовались также тройные системы [31].
Иридий—германий. Сообщались [64] о существовании соединения IrGe.
Кобальт германий. Сообщалось [461 и сплаве германий — кобальт,
содержащем 41 вес. "о Ge.
Кремний — германий. Кремний образует с германием непрерывный;
ряд твердых растворов 175].
Магний — германий. Известно соединение Mg2Ge с температурой
плавления 1115Г, содержащее 59,9% германия 140]. В этой системе обра-
зуются две эвтектики: одна с температурой плавления 635° C,4 вес.% Ge),
другая с температурой плавления 680" (83 всс.% Ge).
Midb — германий. Эта система подробно изучена [28, 70]. В пей было
определено только одно соединение — Cu3Ge. Эвтектика содержит около
39 вес. "о германия и имеет температуру плавления 650е. В твердой а-меди
растворяется около 10% германия [27[. Исследована была также тройная
система Си — Ge — Ли [31].
Мышьяк — германий. В системе германий — мышьяк обнаружены два
соединения — GeAs и Ge.\s2 175].
Натрий — германий. Получен сплав, отвечающий составу NaGe [14],
который медленно разлагается do влажном воздухе.
Никель — германий. Эта система является сложной; в ней точно опре-
делено наличие только одного соединения — Ni2Gc — с температурой
плавления 1200е [46, 64, 68]. Упоминается и о другом соединении — NiGe,
существование которого, однако, точно не установлено. В системе обра-
зуются две эвтектики: одна с температурой плавления 1130° C3 всс.°6 Ge)
и вторая с температурой плавления 775е F6 вес."о Ge). Растворимость
германии в твердом никеле составляет приблизительно 12%.
Олово — германий. Олово с германием образуют эвтектику с темпера-
турой плавчения 232е прн содержании олова, близком к 100% 175]. Раство-
римость германия в твердом олове незначительна. Растворимость олова
в твердом германии также невелика.
Палладий — германий. Сообщалось [64] о существовании соедине-
ния PdGe.
Платина—германий. Сообщалось [64] о существовании соединения
PtGe.
Свинец — германий. Германий и свинец взаиморастворимы в расплав-
ленном состоянии, однако при охлаждении германий выделяется почти
количественно ПО].
Селен — германий. Получено два соединения — GeSc и GeSe2 [29J.
Серебро германий. В системе серебро — германий соединений не
образуется [11]. Единственная эвтектика содержит 18 вес.% германия
и имеет температуру плавления 650°.
Сурьма — германий. В системе германий — сурьма имеется эвтектика,
содержащая 28,5 вес.% германия, с температурой плавления 588° [68].
и*
212 Глава 10
Растворимость германия в твердой сурьме и сурьмы в германии очень
мала [75].
Теллур — германий. Сообщалось [39] о существовании соединения GeTe,
инконгруэнтно плавящегося при 725°.
Цинк — германий. В этой системе имеется эвтектика, содержащая
6 вес.°о германия, с температурой плавления 398°. Соединений, по-види-
мому, не образуется. Растворимость германия в твердом цинке и цинка
в германии очень мала [17].
ПРОИЗВОДСТВО ГЕРМАНИЯ
Восстановление двуокиси германия до получаемого в виде порошка
элемента и последующая переплавка этого порошка в слитки описаны
в разделе «Извлечение». Дальнейшая очистка германия перекристаллиза-
цией в вакууме или в атмосфере инертного га^а также была изложена в этом
разделе.
Германий производится в виде слитков длиной 380—660 мм, имеющих
в зависимости от промышленного спроса различное поперечное сечение.
Площадь поперечного сечения достигает 6,5 еж2. Были сделаны попытки
получать германий в виде полос, однако такой материал в продажу не
поступал. Изготовить из чистого германия проволоку, прутки и фасонные
прокатанные изделия не удается.
Германий обычно поставляют в виде монокристаллических слитков,
которые получают при медленном вытягивании на затравку из ванны рас-
плавленного германия, нагретого немного выше температуры его плавле-
ния (по так называемому методу Чохральского) [61].
Для получения германия со свойствами, необходимыми для применения
в электронике, в дальнейшем его подвергают различным видам обработки.
В некоторых случаях германий прессуют или нагревают с последующей
закалкой. Однако одним из самых лучших методов является легирование
германия незначительными количествами соответствующих металлов. Неко-
торые из пригодных для этой цели сплавов были запатентованы 145, 82].
Обычно легирование производят в атмосфере инертного газа или в вакууме.
Разработан целый ряд остроумных методов введения в германий ничтожно
малых количеств других металлов. Один из таких методов — диффузия
d германий соответствующего металла, другой метод — электрохимическое
травление.
При электролитическом выделении германия из ванны, содержащей 3 н.
раствор едкого натра, на медном катоде отлагается тонкий плотный слой.
Отложение прекращается сразу же, как только слой покрывает всю поверх-
ность катода [23]. Имеется сообщение [15], что для получения германиевых
покрытий в качестве электролита применялся раствор тетраиодида германия
в этиленгликоле. Некоторый успех достигнут при электролитическом отло-
жении германия ил раствора тетрахлорида германия в пропиленглико-
ле 178 [.
ОБЛАСТИ ПРИМЕНЕНИЯ
Открытия, сделанные в области физики твердого тела и, в частности,
относящиеся к полупроводникам, в последнем десятилетии нашли широкое
практическое применение. Первым большим шагом в использовании полу-
проводниковых свойств материалов было главным образом выявление
пригодности для этой цели высокочистого германия. Несмотря на то что
был открыт цепый ряд других полупроводниковых материалов [83], герма-
Германий 273
нин остается самым важным из них и находит в этой области наибольшее
применение *.
Благодаря полупроводниковым свойствам германий впервые стали
применять в кристаллических диодах еще во время второй мировой войны
179]. В 1948 г. была установлена возможность применения германия в три-
одах, или транзисторах [71. С тех пор продолжающиеся исследования и усо-
вершенствования открыли для германиевых полупроводниковых приборов
совершенно новые области применения. Первый германиевый диод представ-
лял собой изготовленную определенным способом тонкую пластинку гер-
мания, в которую была впрессована тонкая проволочка из соответствующе-
го металла (аналогично старинному галенитово-проволочному детектору).
Проволока и германиевая пластинка были припаяны к отдельным элек-
тродам, а все это устройство заключено в пластмассовый корпус или в сте-
клянную оболочку. Размеры такого прибора были меньше зерна [61].
Успехи d развитии технологии привели к еще большей миниатюризации
первоначально изготовленных диодов. В настоящее время диаметр герма-
ниевых диодов, предназначенных для специальных целей, значительно
меньше диаметра проволоки канцелярских скрепок, а их длина не превы-
шает 5 мм.
Германиевые диоды применяются не только как выпрямители; они могут
выполнять также функции соответствующих электронных ламп. Герма-
ниевые диоды потребляют незначительную мощность, обладают малым теп-
ловыделением, безынерционны (поскольку у них нет нити накала) и очень
прочны. Промышленность выпускает германиевые диоды различных типов.
Интересным свойством германиевых диодов является наличие у них фото-
электрического эффекта [79], позволяющего использовать их в качестве
фотодиодов.
Первые германиевые транзисторы имели почти такие же размеры, что
и германиевые диоды, и отличались от них только наличием на германиевой
пластинке двух проволочных контактов вместо одного. Это были так назы-
ваемые точечные транзисторы. Позднее был разработан прибор другого
типа. Этот прибор был изготовлен из тонкой пластинки монокристалличе-
ского германия, обработанной таким образом, что ее поверхности обладали
свойствами, отличающимися от свойств ее внутренней части. Это были так
называемые плоскостные транзисторы. Германиевые транзисторы обоих
типов при их применении имеют свои преимущества и недостатки. Уже пер-
вые из таких транзисторов имели очень небольшие размеры (около 0,3 см").
Так же как и в случае диодов, усовершенствование технологии их изго-
товления привело к уменьшению размеров и значительному улучшению
их эксплуатационных характеристик. Силовые транзисторы обычно имеют
гораздо большие размеры.
Первые германиевые транзисторы применялись в качестве усилителей
и осцилляторов. Новые открытия привели к столь Значительному расшире-
нию областей их применения, что в одном только 19Г>9 г. было выпущено
125 млн. штук полупроводниковых приборов [16]. В течение последних
4—5 лет были разработаны способы изготовления полупроводниковых
приборов в массовом масштабе, благодаря чему эти приборы нашли широкое
применение в различных областях техники. Применение полупроводни-
ковых приборов позволило усовершенствовать радиоаппаратуру, уси-
лители для глухих, оборудование для проволочной связи и уменьшить
* См. И. П. Л о м а ш о в, Германий и кремний — важнейшие полупроводни-
ковые материалы, Металлургиздат, 1960.— Прим. ред.
214 Глава 10
их габариты. Замена электронных ламп транзисторами привела к уве-
личению дальности действия телефонной связи. Устойчивость работы
всех видов связи в значительной мере зависит от применения для этой
цепи полупроводниковых приборов. Благодаря их применению были
значительно уменьшены размеры и усовершенствованы различные виды
военной аппаратуры. Эти улучшения, столь важные для военных объектов,
способствовали также их применению в бытовых и промышленных устрой-
ствах. Применение специальных германиевых приборов привело к боль-
шим успехам в технике управления ракетами и спутниками земли.
Описание теории полупроводников и механизма действия германиевых
диодов и триодов выходит за рамки этой главы. Шокли [72] разработал
превосходную теорию полупроводников, а О'Коннор [61] дал четкое опи-
сание механизма действия транзисторов.
Германиевые силовые выпрямители, применяемые в промышленности,
по сравнению с более старыми типами обладают рядом преимуществ [12].
Только в 1956 г. были установлены германиевые выпрямители на мощность,
составляющую 50 000 квот. Некоторые типы оказались прш одными для
промышленности, и их применение быстро растет.
Германий прозрачен для инфракрасного излучения. Это свойство поз-
воляет применять его для инфракрасной спектроскопии и в различных опти;
чеекпх приборах.
Специальные германиевые приборы применяются также в очень чувст-
вительных инфракрасных детекторах, используемых в радарных устройст-
вах. Благодаря высокому коэффициенту преломления и высокой дисперсии
германиевые стекла (в которых двуокись германия замещает двуокись крем-
ния) можно применять в специальных оптических устройствах. Гсрманат
магния применяется в качестве фосфора в люминесцентных лампах [42!.
Разработана конструкция германиевого термометра сопротивления, позво-
ляющего измерять температуры, близкие к абсолютному нулю. Исследова-
лась возможность применения германия в качестве катализатора, оказав-
шегося перспективным в некоторых областях применения.
Поскольку сплавы золота с германием способны расширяться при
затвердевании, рассматривалась возможность их применения для зубного
протезирования и прецизионного литья [33]. Легкоплавкую эвтектику
золота с германием можно применять в качестве золотого припоя, а также
для понижения температуры плаапения золотосодержащих сплавов.
Сопротивления, которые изготовляются путем осаждения германия
на тонкую пленку серебра, обладают интересными свойствами [321. Такие
пленки, получавшиеся осаждением серебра на стекло «пирекс» с последу-
ющим нанесением на поверхность серебра германия, имеют сопротивление
от 1000 ом до нескольких мегаом и исключительно хороший температурный
коэффициент.
Доступность германия способствовала дальнейшему изучению возмож-
ности его применения как в области электроники, так и для других целей.
.ЛИТЕРАТУР А
1. Ahrens L. H., S. African J. Sci., 41, 152—160A945).
2. Eng. and Mining J., 157, № 5. 75 A956).
3. Eng. and Mining J., 157, N° 5, 79 A956).
4. Eng. and Mining J., 157, № 5, 83 A956).
5. Eng. and Mining J., 157, № 5. 85 A956).
8.
9.
10.
И
12.
13.
14.
15.
16.
В
В
В
П
О V
г
г
г
i
i
i
Chem
В
С
D
F
F
U
1
е
i
i
r
u
n
n
s
ing
g gs
g g s
Rg s
., 33,
ton
1 e у
n i s
к С.
her
Германий 215
6. Eng. and Mining .1., 157. N> 5, 88 A956).
7. В a r d e e n J., В г a 1 t a i n W. П., Pliys. Rev.. 74, 230—231 A948); 75, 1208
A949).
Т., Andre J., J. Metals, 10, C59 A958).
H. В., Phys. Rev., 77, 297 A950).
T. R., Benedict W. S., J. Phys. Chem., 34. 173- 177 A930).
T. R., McDuffic R. O., Willis ford L. H., J. Phys.
1080—109G A929).
L. W, Thurell J R., Power, 101. № 7, 73 A957).
H. J.. Analyst, 76, 525 A951).
L. M., Skow N. A., J. Am. Chem. Soc, 52, 2369—2372 A930).
G., D о к r a s V. M., Trans. Electrodicm. Soc, 85, 80 A949).
F. L.. Germanium, in Mineral Facts and Problems, Bulletin 585, p. 341—
346, U. S. Bureau of Wines, Government Printing Office, Washington, D. С , 1960.
17. G e b h a r d t E.. Z. Metallkunde. 34, 255—257 A942).
18. П о I d s с h m i d t V. M , lnrl. Eng. Chem., 27, 1100—1102 A935)
19. G о 1 d s с h m i d t V H., Peters Cl., Nachr. Ges. Wiss. Gottingen, Math,
physik. K1-. HI; IV, 141 A933).
20. G о r d о n M., Murata К J-, Econ. Geol., 47, 170 (March April
1952).
21. Graham R. V., MacnamaraJ.. Crocker 1. H., MacFarlane
R. В., Can. J. Chem., 29, 89—102 A951).
22. Grciner E. S., J. Metals, 4. 1044 A952).
23. H a I 1 J. I.. К oen ig A E, Trans. Electrochem. Soc, 65, 215 A934)
24. Harrold G. C, Meek S. F., Ind. Med., 13, 236—238 A944).
25. H e a d 1 e e A. .1. W.. Hunter R. G.. Germanium in Coals of West Virgi-
nia, Geological and Fconomit Survey, Report of Investigations № 8, Morgantown,
West Virginia, 1951.
26. H о d g in a n C. D.. Handbook of Chemistry and Physics, Chemical Rubber
Publishing Co., Cleveland, Ohio. 1951 — 1952.
27. Hume-Rot hery W., M a b h о t t G. W., С h a n n e 1 - E v a n s К. М.,
Phil. Trans. Royal Soc, 233A, 1—97 A934).
28. Hume-Rothery W., R а у п о г С V, Reynolds P. W., Packer
H. K., J. Inst. Metals, 66, 209—239 A940).
29. Иван ов-Эми H Б. Н., ЖОХ, 10, 1813—1818 A940).
30. Иванов-Эмин Б. Н.. Заводская лаборатория, 13, 161 A947).
31. Jaffee R. I., Gonser В. W.. A1ME Tech. Pub. 1998, 1946.
32 Jaffee R. 1., McMullen E. W., Gonser B. W., Trans. Electrochem.
Soc, 89, 277—290 11946).
33. Jaffee R. 1.. Smith E. M., Gonser B. W., Trans. A1MH, 161, 366
A945).
3-t. J i r s a F., Z. anorg. allgem. Chem.. 26R, 84—88 A952).
35. J о li n s о n E. В., Dennis L. M.. J. Am. Chem. Soc, 47, 790—793 A925).
36. J ohnson О. П., Chem. Revs., 48, 259—297 A951).
37. J о h n s о п О. Н. Chem. Revs., 51. 431 A952).
38. К e 1 1 ey К. К-, Contributions to the Data on Theoretical Metallurgy. XI. En-
tropies of Inorganic Substances. Revision A948) of Data Methods of Calculation, Bureau
of Mines Bull. 477, Government Printing Office, Washington, 1950, p. 98.
39. К 1 e m m W., F r i s с h m u t h G., Z. anorg. Chem., 218, 249—251 A934).
40. К 1 с m m W., W e s t e г I i n n i n g H., Z. anorg. Chem., 245, 365—380 A941).
11. l\r a use H. H., J о h n s о п О. Н., Anal. Chem., 25, 134 A953).
42. К г о e g e r F. A., Van den В о о in g a a r d J., J. Electrochem. Soc, 97, 377—
382 A930).
9JZ Глава 10
43. К г о 1 1 W., Melajl und Erz, 23, 682—684 A926).
44. Lark-Horovitz K-. Whaley R. M., The Preparation of Pure Germa-
nium and Its Semiconducting Alloys, Paper Presented before the Ninety-Fifth Mee-
ting of The Electrochemical Society, Philadelphia, May 1949.
45. Lark-Horovitz K., Whaley R. M., пат. США 2514879, July 11,
1950.
46. Laves F., W a 1 1 b a u m H. J., Z. angew. Mineral., 4, 17—46 A942).
47. L e b e d e f f E. Y.. Welherill W. H., пат. США 2889196, June 2,
1959.
48. M с С a b e L. C, Ind. Eng. Chem., 44, 113a A952).
49. M а с h i n J. S., Witters J., 111. State Geol. Survey Circular 216, 1956.
50. M с 1 1 о r J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemi-
stry, Vol. 7, Longmans, Green and Co., New York. 1930.
51. M e н д е л е е в Д. И., Ann., Supplementband 8, Heft 2, 196—206 A871).
52. Minerals Yearbook, U. S. Bureau of Mines, Government Printing Office, Washing-
ton, D. C, 1948.
53. Minerals Yearbook, U. S. Bureau of Mines, Government Printing Office, Washing-
ton. D. C, 1949.
54. Mining J. (London), 234, 5982, 367—368 A950).
55. Morgan C, D a v i e s G. R., Chem. and Ind., 56, 717—721 A937).
56. National Research Council, International Critical Tables of Numerical Data, Physics,
Chemistry and Technology, Vol. 1, McGraw-Hill Book Co., Inc., New York, 1926.
p. 102.
57. Newcombe H. et al., Anal. Chem., 23, 1023 A951).
58. N e w I a n d s, Chem. News, 10, 59 (July 30, 1864).
59. N о у e s A. A., Bray W. C, A System of Qualitative Analysis for the Rare
Elements, The Macmillan Co., New York, 1927.
60. O'C о n п о r J. A., Chem. Eng., 59, № 4, 15R- 160 A952).
61. O'Connor J. A., Chem. Eng., 59, № 5, 154—156,370—376A952).
62. P a p i s h J., Brewer F. M., Holt D. A., J. Am. Chem. Soc., 49. 3031 —
3032 A927).
63. P e t a r A. V., Gallium, Germanium. Indium and Scandium, U. S. Bureau of
Mines Inform. Clrc. 6401, 5, November 1930.
64. P f i s t e r e r H., Schubert K- Naturwiss.. 37. 112—113 A950).
65. P i I к i ng t о n E. S., Australian J. Appl. Sci., 8, № 2,98—111 (June
1957).
66. Powell A. R., Lever F. M-, Walpole R. E.. J. Appl. Chem, 1.
541—551 A951).
67. Rossini F. D., Wagman П. D., Evans W. IL, Levine S.r
J a f f e I., Selected] Values of Chemical Thermodynamic Properties, Natl. Bur.
Standards Circ. 500, Government Printing Office, Washington, 1952, p. 151
68. R u t t с w i t K.. M a s i n g G , Z. Metallkunde, 32, 52—61 A940).
69. S с h 1 e i с h e r J. A., State Geol. Survey of Kans., Bull. 134, Part 4, U. of Kans.
Publications, Lawrence, Kansas, 1959.
70. S с h w a r z R., Elslner G:, Z. anorg. Chem., 217, 289—297 A934).
71. S e a r с у A. W., J. Am. Chem. Soc, 74, 4789 A952).
72. S h о с к 1 e у W., Electrons and Holes in Semiconductors, D. Van Nostrand Co.,
Inc., New York, 1950.
73. S t a d n i с h e n к о Т., M u r a t а К- J., Z u b о v i с P., H u f s с h m i d t
E. L., U. S. Geol. Survey, Circ. № 272, 1953.
74. Stohr H., Klemm W.. Z. anorg. Chem, 241, 305—323 A939).
75. S t о li r H., Klemm W., Z. anorg. allgem. Chem., 244, 205—223 A940).
76. S t r a u m a n i s M. E., Aka E. Z., J. Appl. Pliys., 23, 330—334 A952).
Германий 217
77. S t г ос к L. W., Am. lnst. Mining Met. Eiigrs., Tech. Publ. № 1866, 1945 (Pub-
lished in Metals Technol.. April 1945).
78. S z e к e 1 у G., J. Electrochem. Soc, 98, 318—334 A951).
79. Torrey H. C, Whitmer С A., Crystal Rectifiers, AkGraw-Hill Book
Co., New York, 1948.
80. Research Laboratories of The Eagle-Picher Company, Joplin, Missouri, неопубли-
кованные данные.
81. V aes J. F., Ann. soc. geol. Belg., T LXXII, П19—B32, October 1948.
82. W h a 1 e у R. M., пат- США 2447829, August 24, 1948.
83. W i 1 1 a r d s о n R. K-, Battelle Tech. Rev., 6, №. 8, 8 A957).
84. Winkler C, Der., 19, 210—211 (February 8, 1886).
11.
индий
Дж. Р. МИЛЛС. Р. Л. КИНГ, К. Э. УАЙТ
J. R. Mills, R. A. King, С. Е. Т. White, Re-
search and Development Division, The Consoli-
dated Mining and Smelting Company of. Canada
Ltd., Trail, British Columbia
ВВЕДЕНИЕ
Индий был открыт в 1863 г. Рейхом и Рихтером при определении таллия
в образцах цинковой обманки из Фрейберга. При спектрографическом иссле-
довании раствора хлорида цинка была обнаружена характерная линия цве-
та индиго синего, не замечавшаяся ранее. Исследователям удалось выделить
новый элемент, названный ими индий вследствие характерного синего цвета
его спектральных линий.
Индии находится в III группе периодической таблицы, в одной под-
группе с бором, алюминием, галлием и таллием. Его порядковый номер 49
и атомный вес 114,82.
В проводившихся ранее работах по изучению свойств и областей при-
менения индия встречались затруднения из-за редкости металла. В 1924 г.
во всем мире было получено всего 1 г металлического индия. Однако в настоя-
щее время запасы индия превышают его потребление, причем в случае до-
полнительного увеличения спроса его производство может быть расширено.
У. Мэррей и фирма «Индиум корпорейшн оф Америка» принимали уча-
стие в создании индиевой промышленности США. Под руководством Мэррея,
который начал свои работы с индием за десять лег до создания фирмы
в 1934 г., эта фирма занималась изучением свойств и промышленного
применения индия.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Индий не встречается в самородном состоянии. Он является широко
распространенным в природе элементом, но находится в рудах в чрезвы-
чайно малых количествах. Содержание индия в земной коре составляет
1-10 5% 169]. почти такое же, как и серебра.
Индий встречается во многих минератах (сфалерит, марматит, франкли-
нит, смитсонит, каламин, алунит, родонит, флогопит, мангантанталит,
сидерит, пирротин, касситерит, вольфрамит, гюбнерит, самарскит)*.
Большинство из них содержит его меньше 0,1% 136], хотя, по имеющимся
сведениям, пегматитовые руды штата Западная Юта содержат до 2,8% 161].
• Сфалерит ZnS; марматит — разновидность сфалерита, богатая железом (>• 1A%
FeO); франклипит (Fe, Zn, Мп) (Fe, Mn),O4; смитсонит ZnCOs; каламин Zn4(OHJ-
[Si2O7] • H2O; алунит KAl3(OH)e[SO.i]2; родонит Mn3 [SisOal; флогопит (обыкновен-
ная слюда) KMgj(OH,FJ[AlSi3Ol0]; маигантанталит — разновидность танталита
[(Мп, Fe) (Та, r-lbViO^] с большим преобладанием марганца над железом; сидерит
FeCO-,; пирротин Fe^j-S; касситерит SnO2; вольфрамит (Fe, Mn)WO4; гюбиерит
Mn\VO4 — крайний представитель минералов группы вольфрамита; самярскит (Y, Ег,
Се, U, Ca, ThL[(Nb, Та, Ti, SnJO,]3.— Прим. ред.
Индий
210
Совместно с многими наиболее редкими металлами индий концентрируется
в различных побочных продуктах в процессе получения других металлов,
главным образом цинка и свинца. Индий чаще всего ассоциирует с цинком,
поэтому в промышленных масштабах его изапекают из цинковых остатков
и плавильных шлаков. В настоящее время эти побочные продукты составляют
¦единственный промышленный источник индия.
Известно, что месторождения индия находятся ио многих странах, в том
числе вСССР, Финляндии, Швеции, Японии, Германии, Италии, Перу, Кана-
де и СШЛ.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Статистические сведения по индию весьма немногочисленны. Имеющи-
еся данные о добыче и перевозках индия приведены в табл. 1.
Основными производителями индия в США за последние годы были
только две фирмы — «Америкэн смелтинг энд рифайнииг» (Перг-Амбой,
штат Нью-Джерси), выпускающая металлический индий и его соединения,
и «Анаконда коппер майнинг» (Грейт-Фолс, штат Монтана), выпускающая
Таблица I
ДАННЫЕ О ДОБЫЧ1; И ПЕРЕВОЗКАХ ИНДИЯ
Год
1941
1942
1943
1944
1945
1946
Перевозка, с
21В «
7166
1853
2564
1787
301
кг Год
США [4|
1917
1948
1949
1950
1951
1952 В
Перевозка.а кг
413
380
17U4
3912
4765
а Включая металл и его соединения.
6 Приблизительные подсчеты.
в Пгл-ле 1951 г. сведений иет.
Год
1942
1949
1950
1951
1952
1953
Добыча, кг
Канада
13,6
21,4
154
18,1
12,6
210
Год
123|
1954
1955
1956
1957
1958 а
Добыча кг
14,8
3 259
11 297
11 955
—
а После IS57 г, сведений нет.
220
Год
1945
1946
1947
1948
1949
Глава
Добыча, кг
реру [4
41,5
126,9
561,6
1255
Продолжение табл. 1
Экспорт, кг
,5]
41,4
155,7
305
465,7
645,4
металлический индий. Помимо указанных основных поставщиков, фирма
«Серро дс-Паско» (Нью-Йорк, штат Нью-Йорк) выпускает также индиевые
сплавы, «Индиум корпорейшн оф Америка» (Ютика, штат Нью-Йорк) —
металлический индий в виде слитков, порошка, листов, проволоки, отливок
различных форм, сплавов, химикалий и растворов для электролитических
покрытий.
В прежние годы, как известно, производством индия и его соединений
занимались также фирмы «Америкэн метал компани», «Америкэн стил
эпд уайр компани» (цинковые заводы, Донора), «Америкэн цинк, леад энд
смелтинг компани», «Игл-Пичер компани», «Грасселли кемикл компани»,
«Иидиум корпорейшн оф Америка», «Пейшнл цинк компани» и «Уильяме
Шервин компани».
В США — основном потребителе индия в 1957 г. (год максимального
потребления) — использовалось почти 20 т индия своего производства
и импортного. Данные о производстве и поставках индия в США с 1951 г.
ие публикуются, однако известно, что фирма «Анаконда компани» в 1956 г.
выпустила 2,725 т индия.
Учтенные и предполагаемые запасы индия в месторождениях цинковых
руд в США составляют примерно 290 т 121].
В Перу единственным поставщиком индия является фирма «Серро
де-Паско корпорейшн» (Ороя). Эта фирма не выпускает промышленный,
индий с 1951 г., и сообщений о возобновлении выпуска не имеется [7]. Отсут-
ствуют данные за 1950 и 1951 гг.
В Канаде единственным поставщиком индия является фирма «Консо-
лидейтид майнииг энд смелтинг компани оф Канада» («Комайнко», Трейл,
провинция Британская Колумбия). «Комайнко» выпускает металлический,
индий и его сплавы в слитках и отливках различных форм, а также соли
индия и растворы. Потенциальные возможности этой фирмы составляют
примерно 35 т индия ежегодно.
Имеются также сведения о производстве индия в Бельгии («Сосьетэ
бельгошими»); ФРГ («Унтерхарцер бергунде — Хюттенверке», Окер;
«Дуисбергер Купферхюйтте», Дуисбергер) и Японии («Фурукава майнинг
компани», «Митсуй майнинг энд смелтинг компани»).
Цены на индий в США [3, 4]
В 1924 г. 1 г металлического индия со степенью чистоты 98% — общее
количество, имевшееся в то время, стоил 10 долл. Первоначальная цена
на индий со степенью чистоты 99%, как указывается в журнале «Metal and
Mineral Markets» за сентябрь 1930 г., составляла 15 долл. за 1 г. По мере
__ Индий 221
увеличения спроса и выявления новых источников сырья первоначальная
цена индия постепенно уменьшалась и в декабре 1945 г. достигла 7 центов
за 1 г металла чистотой 99,9%. В ноябре 1960 г. цена стандартного сорта
индия (степень чистоты 99,97%) колебалась от 4 до 8 центов за 1 г в зави-
симости от количества. В настоящее время основные производители индия
на основании заключенных контрактов производят поставку индия стан-
дартного сорта (степень чистоты 99,97°о) большими партиями. Сорта индия
¦более высокой степени чистоты (99,999 и 99,9999%) продаются по более
высоким ценам.
ПОЛУЧЕНИЕ ИНДИЯ
Как указано выше, индий обычно извлекается из отходов металлур-
гического или химического производства. Опубликовано очень мало сведе-
ний о промышленных способах получения индия, однако некоторые допол-
нительные данные можно получить из патентной литературы. Для иллюстра-
ции достижений в решении проблемы получения индия приводятся шесть
различных способов.
Способ фирмы «Анаконда коппер майнинг компанию
Фирмой «Анаконда коппер майнинг» запатентован способ извлечения
индия из обожженного цинкового концентрата или конденсированной окиси
цинка, получаемых в процессе переработки шлаков плавильных печей
на свинец [ 181. Цинковый огарок или конденсированную окись цинка выще-
лачивают сильно разбавленной серной кислотой, при этом основная масса
цинка растворяется, а индий остается в нерастворимом остатке. Этот индий-
содержащий остаток выщелачивают затем концентрированной кислотой
B0—25 г/л H2SO4), которая растворяет индий. К полученному после этого
выщелачивания осветленному раствору для осаждения индия добавляют
окись цинка, сульфит или бисульфит натрия. Осадок обрабатывают концен-
трированным раствором едкого натра, промывают водой и затем разбавлен-
ной серной кислотой для удаления цинка- Очищенный осадок растворяют
в серной кислоте, тяжелые металлы осаждают в виде сульфидов при про-
пускании сероводорода. Индий получают в виде губки при добавлении
к раствору металлического цинка. Индиевая губка может быть переплавле-
на и отлита в слитки технического металла. Затем производят растворение
металла в соляной кислоте и очистку полученного раствора. Для удаления
сульфат-ионов в раствор добавляют хлорид бария, а оставшиеся примеси
тяжелых металлов удаляют обработкой сероводородом. После этого раствор
фильтруют и выделяют из пего индий электролитическим путем. Получен-
ный катодный металл сплавляется под слоем едкого натра в слитки или
другие формы.
Способ фирмы «Америкэн смелтииг эид рифайнинг компанн»
Фирмой «Америкэн смелтинг энд рифаГшинг» запатентованы два спо-
соба извлечения индия. Поданным первого патента [S2], индий извлекается
из остатков выщелачиванием кислотой и затем осаждается в виде фосфата
из слабокислого раствора. Фосфат индия при обработке концентрированной
щелочью превращается в гидроокись, при прокаливании которой полу-
чается окись, восстанавливаемая водородом до металлического индия.
Полученный металл затем может быть очищен электролизом.
222 Глава И
В другом патенте, принадлежащем той же фирме [441, описан процесс
получения индия из чернового металла, содержащего в основном цинк
и снинец. Расплавленный металл обрабатывают смесью хлорида свинца
и хлорида натрия с целью получения шлака, содержащего индий в виде
хлорида. Этот хлоридный шлак выщелачивают разбавленной серной кисло-
той и индий осаждают из раствора цинковой пылью. Полученный губчатый
металл плавится, и цинк удаляется путем обработки хлором. Технический
металлический индий затем сплавляют, отливают в аноды и подвергают
очистке электролизом.
Германский способ
Этот способ, применяемый в настоящее время для извлечения индия
из руд Раммельсбергского месторождения, описан Клайнертом 142J.
Раммельсбергские руды содержат 0,0008—0,0018% индия. Основное
количество индия, содержащееся в рудах, в процессе флотации, обжига
и при восстановлении в вертикальных ретортах (метод Нью-Джерси) остает-
ся с цинком. Около 75% общего количества поступившего на переработку
индия оказывается в ретортном цинке. При очистке ретортного цинка дистил-
ляцией индий остается со свинцом; свинец содержит около 1 % индия. Свн-
нец подвергают купелированию, при этом индий переходит в глет (около
4"(> индия). Глет обрабатывают разбавленной серной кислотой, и техниче-
ский индий (около 95% индия) извлекают из раствора цементацией на цинко-
вых пластинах. Полученный технический металл растворяют в серной
кислоте, примеси удаляют из раствора сначала цементацией на индиевых
пластинах, а затем на пластинах из сплава цинка, содержащего около 1%
индии и 0,3% кадмия. Металлический индий со степенью чистоты выше
99,99"о выделяют из очищенного раствора на алюминиевых пластинах.
Полученный чистый индий сплавляют под слоем едкого натра и цианида
натрия в слитки весом около 1 кг.
Способ фирмы «Серро де-Паско»
Способ, применяемый для извлечения индия фирмой «Серро де-Паско»,
описан Райтом [81]. Лабораторная работа по извлечению индия из сложных
свинцовооловяпных сплавов описана Коули [161, экспериментальная
работа по процессу очистки ¦— Куармом [60].
Индий содержится в свинцовых концентратах, рудах, пылях и остатках
вместе с небольшими количествами цинка. Он содержится также в слитках
технического свинца и извлекается в процессе его рафинирования. При
рафинировании свинцовых слитков снимаются дроссы вначале при низкой
температуре для удаления меди, а затем при высокой температуре для уда-
ления олова и индия. Дроссы, содержащие олово и индий, восстанавливают
до металла, к расплавленному металлу добавляют смесь хлорида цинка
н хлорида свинца, в результате чего индий уходит в виде хлорида в съемы,
которые выщелачиваются затем при мокром размоле с серной или соляной
кислотой. После измельчения пульпу сливают и фильтруют, а полученный
раствор очищают цементацией на индиевых пластинах. Из очищенного рас-
твора индий извлекают в виде губки цементацией на цинковых пластинах.
Губку промывают, брикетируют и сплавляют под парафином в слитки.
Индий, получаемый этим способом, имеет степень чистоты 99,8%; основной
примесью является кадмий. По данным Куарма, путем электролиза может
быть получен индий со степенью чистоты 99,999% [60].
Индий
223
Способы фирмы «Консолидейтид маннниг эид смелтинг компани»
Фирмой «Комайнко» разработаны два способа извлечения индия из
отходов металлургического производства. В 1942 г. индий был выделен
в лабораторном масштабе из конденсированной окиси цинка, полученной
в процессе фьюмннгования свинцового шлака плавильной печи. В настоя-
щее время индий получают на опытных установках из шлаков, образующих-
ся прн переработке свинцовых отходов. Последний процесс Довочьно
подробно описан Миллсом и сотр. [511 и очень кратко—Хаитом
и сотр. [37].
Цинковые концентраты
ш
Цинковые
пбжига-
тельные
печи
Установка
для выщел<
чиеания N1
Свинцовые
кенцентррпн,
С
Установка
для еыщела
чиеания N1
Печи для
ллаеки
свинца
ОтхгЗы
Установка
для удаления
шпака
J> Шлак
— Штейн
-*¦ Шпейза
Р и с.
1. Схема получения индия на металлургических заводах
в Трейле.
Схема получения индия на металлургических заводах «Комапнко»
представлена на рис. 1. Ширина заштрихованных участков на этой диа-
грамме показывает относительные количества индия на различных стадиях
металлургического процесса в Трейле.
На завод в Трейле индий поступает с цинковыми концентратами. В про-
цессе электролитического получения цинка индий после обжига остается
в обожженном концентрате, а после его выщелачивания — в нераствори-
мом железном кске. Железный кек поступает на свинцовую плавку для
извлечения содержащегося в нем свинца и остаточного цинка. В процессе
плавки свинца индий распределяется между ишаком и свинцовым слитком
224
Глава И
примерно в равных соотношениях. Индий, содержащийся в шлаке, отго-
няется вместе с цинком и остаточным снинцом в процессе фьюминговаиия
шлаков. Окись цинка, полученная в процессе фьюмиигования, обрабаты-
вается в специальном цехе. В процессе ее выщелачивания индий снова
остается в остатке, который возвращается на плавку вместе с остатком,
поступающим состадии выщелачивания обожженного цинкового концентрата.
Шлак от переработки дроссов
Подготовительная печь
удаление меди флотацией
Обтие хвостов
й F^Z^ Медный
| концент
нитрат
Кекс-
^Электрическая печь
Известняк— 1
Пары
Шлак
Шпепза
, Катод
из сплава Pb-Sn
H,SO;
ljSO«—-?улыратизирую-\ Извлечение
| щип обжиг I | свинца
I Тпдроокисп I
1 индия и слова I
DcmamoK
ьо,5п,РЬ
¦PbSO,
Выщелачива-
кие водой
Регенерация
\ срторосиликата
ibwpac-
твор ичсиу и меди
{Цементация
J меди
индиевые
гластины
Сu **~ Смешанный раствор
сульфата и^хлорида индия
Алюминиевые'
Извлечение
рлсва it индия
(— NaCl.NadH
>NazSiFs
-NH.OH
Алюминиевые^ цемецта
или цинковые! ,.няия
пластины I ин.аия
¦ Отходы
ация
¦ Отходы
индиевая губка
Слитки
индия
Плавление
и отливка
индгевых анодов
Электрсл и ти- Катодная
чеспое ра(рини- плавка
рование
Р н с. 2. Принципиальная схема процесса извлечения индия.
В процессе, осуществляемом в настоящее время фирмой «Комайнко»,
дроссы, содержащие в качестве основных составных частей свинец, олово
и медь, а также 2,5—3% индия, измельчают, а большую часть меди удаляют
при флотации в виде флотационного концентрата. Хвосты от флотации высу-
шивают и обжигают во вращающейся печи, затем смешивают с известью
и коксом и восстанавливают в электропечи. Полученный в электропечи
слиток отливают в аноды и подвергают электролизу по способу Беттса
в свинцовом электролите (фторосиликат свинца). Свинец и олово осаждаются
на катоде, а индий остается в шламе в виде антимонида индия InSb на аиоде.
Анодный шлам подвергают сульфатизируюшему обжигу с серной кислотой,
и полученный продукт выщелачивают водой; индий при этом переходит
Индий
225
в раствор. Кислотность выщелоченного раствора поддерживают при рН 1,
затем добавляют хлорид натрия и оставшееся количество меди удаляют
из раствора цементацией на индиевых пластинах. После этого индий извле-
кают в виде губки цементацией на алюминиевых или цинковых пластинах.
Полученную губку промывают, прессуют, сплавляют и отливают в аноды
для электролитического рафинирования. Металл, поступающий на анодное
рафинирование, имеет степень чистоты 99,5%, а очищенный металл (стандарт-
ный сорт) — больше 99,97%.
Схема этого процесса получения индия представлена на рис. 2.
Помимо стандартного сорта, «Комайнко» ныпускает два сорта более
чистого индия [41]: индий высокой степени чистоты (сорт 59; 99,999°о
индия), применяемый главным образом в производстве транзисторов (полу-
чают из индия стандартного сорта путем дистилляции с последующей очист-
кой электролизом 137]), и индий высокой степени чистоты (сорт 69,
99,9999°о индия), применяемый в производстве интерметаллических
соединений (получают из индия высокой ¦ степени чистоты сорта 59).
Содержание основных примесей в трех сортах индия, выпускаемых фирмой
«Комайнко», приведено в табл. 2.
Таблица 2
СОДЕРЖАНИЕ ОСНОВНЫХ ПРИМЕСЕЙ В ИНДИИ, ВЫПУСКАЕМОМ ФИРМОЙ
¦КОМАЙ11КО>
Иидий
Стандартный
Сорт 59
Сорт 69
Си
МО"*
РЬ
8- Ю
Каждая
Содержание
Т[
2-10-*
1 ¦ Ю-*
примесь <
Cd
2-Ю-з
1 ¦ КГ«
-ыо-5 %
Sn
5-10-3
Извлечение индия из растворов для электролитических покрытии
Дайер («Индиум корпорейшн оф Америка») описал способ извлечения
индия из отработанных растворов для электролитических покрытий [19].
Раствор выпаривают досуха, и органическое вещество разрушается при
прокаливании. Прокаленный остаток растворяют в соляной кислоте; оса-
док, состоящий из хлорида серебра, некоторого количества хлорида свинца
¦1 кремнезема, отфильтровывают. Фильтрат нейтрализуют избытком аммиа-
ка, при этом индий, железо и олово осаждаются в виде гидроокисей, а медь,
кадмии, цинк и никель остаются в растворе. Осадок гидроокисей отделяют
фильтрованием и растворяют в соляной кислоте. Индий из раствора извле-
кают путем электролиза; металл очищают повторным электролизом.
ФИЗИЧЕСКИЕ СВОЙСТВА
Индий представляет собой серебристо-белый металл с ярким металли-
ческим блеском. Он мягче свинца (царапается ногтем), отличается хорошей
ковкостью и пластичностью и имеет кристаллическую структуру. Сгибание
чистого металла сопровождается характерным хрустом, как и в случае оло-
ва. Индий менее летуч, чем цинк или кадмий, но при нагревании в токе
водорода или в вакууме возгоняется. Расплавленный металл смачивает
чистое стекло. Основные свойства и константы приведены в табл. 3.
15 Заказ ,Ve 2ja
Таблица 3
ФИЗИЧЕСКИЕ СВОЙСТВА ИНДИЯ [С,75]
Порядковый номер
Атомный вес
Изотопный состав, %
Массовое число 113
115
Поперечное сечение захвата тепловых нейтронов,
барн/атом
Валентность
Кристаллическая решетка
о0, А.
с0, А
Межатомное расстояние, Л
Атомный объем, см3/г-атом
Плотность прн 203, г/см3
Температура плавления, =С
Температура кипения, 'С
Удельная теплоемкость (средняя) при 0—100',
кал/г-ерад
Скрытая теплота плавления, кал/г
Изменение объема при плавлении, %
Скрытая теплота испарения при температуре кипе-
ния, кал/г
Давление пара А
Константы для уравнения В
log p=— A I B-\-C log Т С
Применимый предел температур, = К
Коэффициент линейного расширения при
О 100'. град-*
Коэффициент теплопроводности при
О 100°, кал/см-сек-град
Поверхностное натяжение, дн/см
Удельное электрическое сопротивление, ом-см
3,38° К
4,2° К
0°С
22° С
156.6" С
3UU С
600° С
Температурный коэффициент электрического со-
противления при 0—100е, град 1
Нормальный электродный потенциал, в
Электрохимический эквивалент, мг/к
Магнетизм
49
114,82 [80]
4,23
95,77
190±10
Обычно 3, а также
2 и 1
Тетрагональная
гранецентрирован-
ная
4,583
4,936
3,24
15,7
7,31
156,6 [48]
2075
0,058
6,8
2,5
484,0
12,860
10,71
-0,7
430—2350
24,8-10-6
0,06
602—0.10 Т
Сверхпроводящий
7-Ю-") [79]
8,4-10-«
8,8-10-6 [79]
29.0-10-6
36,0-Н>-« [64]
44,0-10-6 [64]
4,7-10-3
-0,34
0,39641
Диамагнитный
Индий
227
МЕХАНИЧЕСКИЕ СВОЙСТВА
Механические свойства индия и его двойных сплавов со свинцом, оло-
вом, кадмием и висмутом изучались в институте им. Баттела [38, 39|.
Механические свойства чистых металлов приведены в табл. 4.
Таблица 4
МЕХАНИЧЕСКИ. СВОЙСТВА а
Твердость по Кринеллю
"в
Предел прочности при
растяжении, кг/мм1
Этноситильное удлине-
ние, %
Относительное сужение
поперечного сечения,%
Предел прочности при
сжатии в, кг/мм2
Модуль упругости, кг/мм2
Иидий
0,9
0,276
22
87
0,22
1101
Свинец
3,9
1,69
32
74
1,44
—
Олово
5,2
1,24
37
81
1,45
Кадмий
20,7
7,0
42
76
9,31
—
Висмут
9,6
—
—
а Испытания проводились иа металлах, отожжеииых при 100—130° в течение
1 недели.
^ Другие значения: 0,3 кг/мм2 (для иидия со степенью чистоты 99,9%) ы
0,28 кг/ммЪ (для индия со степенью чистоты QQ,D7%) [24].
в Истинный предел прочности при сжатии при остаточной деформации 10%.
Индий—чрезвычайно пластичный металл и под давлением поддается
почти любой деформации. Его относительное удлинение необычно низкое,
так как иидий не подвержен дисперсионному твердению. Почти вся деформа-
ция, получаемая при механических испытаниях, локализуется, в результа-
те чего происходит значительное сужение поперечного сечения. Значения
относительного сужения поперечного сечения, приведенные в табл. 4, были
получены при механических испытаниях листового материала. Для круглых
стандартных образцов эти значения будут значительно выше. При испыта-
ниях, проведенных Бюро стандартов США, было получено сужение попереч-
ного сечения на 99%, что более точно отражает способность индия к местной
деформации при механических испытаниях 161.
При исследовании двойных сплавов было найдено, что сплавы индия
со свинцом тверже и прочнее почти всех остальных сплавов этого металла
и имеют более высокие температуры плавления, чем другие сплавы. Среди
сплавов на основе индия самую большую твердость имеют сплавы с висму-
том, затем следуют сплавы с кадмием и свинцом. Это было обнаружено
в области твердого раствора индия. Олово, обладающее наименьшей раст-
воримостью в индии при комнатной температуре, меньше всех других метал-
лов повышает прочность и твердость. Индий оказывает наибольшее влия-
ние на повышение твердости олова. Несколько меньше индий влияет на
повышение твердости свинца, но, поскольку растворимость индия в свинце
значительно выше, максимальные твердость и прочность твердого раствора
15*
228 Глава 11
индий — свинец все же несколько выше. Индий практически не растворим
в кадмии и висмуте и поэтому не оказывает влияния на твердость этих
металлов [38].
ХИМИЧЕСКИЕ СВОЙСТВА
Индий находится в III группе периодической таблицы в одной под-
группе с бором, алюминием, галлием и таллием. Химические свойства эле-
ментов этой подгруппы в значительной степени определяются поведением
незаполненной внешней электронной оболочки, состоящей из двух s-электро-
нои и одного р-электрона. Таким образом, основные валентности индия
равны 3 и 1. Повышенная устойчивость двух s-электронов в атомах элемен-
тов этой подгруппы с большими порядковыми номерами указывает на то, что
для этих элементов устойчива низшая валентность, а для элементов с более
низкими порядковыми номерами — высшая. Так, для таллия наиболее
характерно одновалентное состояние, тогда как соединения бора устойчивы
в трехвалентном состоянии. Индий, занимая промежуточное положение,
может находиться в обоих валентных состояниях, но его обычней валент-
ность равна трем.
Потенциалы ионизации трех валентных электронов индия равны
5,76 E р); 18,79 E s) и 27,91 в E s). Приведенные значения показывают, что
трехвалентная форма индия, вероятно, имеет сравнительно неионный или
ковалентный характер связи. Этот вывод сделан на основании химических
и электрохимических свойств элемента 153].
Реакционную способность индия можно оценить по его положению
в ряду напряжений. Нормальный потенциал реакции InJ -^>- In3* + Зе
приблизительно равен —0,34 е. Таким образом, индий является несколько
более благородным металлом, чем кадмий. Однако характерная для индия
связь влияет на проявляемую реакционную способность металла. Сравни-
тельно медленное протекание химических реакций с участием индия обна-
руживает в этом элементе, так же как и у некоторых других металлов, нали-
чие более благородных свойств, чем можно было ожидать на основании его
термодинамических свойств.
Индий медленно растворяется в холодных разбавленных минеральных
кислотах и быстрее в горячих разбавленных или концентрированных
кислотах. Кипящая вода и щелочи не действуют на компактный метал т.
Топкоизмельченный индий (губка или порошок) реагирует с водой с обра-
зованием гидроокиси.
СОЕДИНЕНИЯ ИНДИЯ
Характер соединений индия, как и других металлов, зависит от валент-
ности, типа образующихся связей и размера атомов или ионов, входящих
в соединение. Индий обладает химическими свойствами, в известной степени
сходными со свойствами алюминия, железа и особенно олова, несмотря на
различие их характерных валентностей. Некоторые более распространенные
соединения индия будут рассмотрены ниже.
Сульфат индия
Сульфат индия In2 (S04b можно получить путем нейтрализации гид-
роокиси или карбоната индия серной кислотой или растворением металла
или окиси в серной кислоте при нагревании. Сульфат индия — белое, кри-
Индий 229
сталлическое, расплывающееся на воздухе твердое вещество, легко раство-
римое в воде. Кроме нормального (среднего) сульфата в зависимости от
условий реакции может быть получен кислый или основной сульфат.
Хлорид индия
Хлорид индия 1пС13 легко образуется при непосредственном взаимо-
действии элементов или при действии соляной кислоты на металл. Подобно
хлоридам железа, алюминия и других элементов с валентностями больше 2,
молекулярный характер 1пС13 проявляется в высоком давлении его паров.
Хлорид индия — белое кристаллическое вещество, сильно расплывающееся
на воздухе и растворимое в воде.
Окись индия
Окись индия 1п2О3 можно получить при нагревании металла па воздухе
или, более легко, при прокаливании гидроокиси, нитрата, карбоната или
других солей. При сравнительно низких температурах образуется бледно-
желтая аморфная окись, которая при нагревании при высоких температурах
превращается в кристаллическую форму. Лморфная окись легко растворяется
в кислотах, тогда как кристаллическая — сравнительно нерастворима.
Окись индия(Ш) изоморфна с гематитом (Fe2O3) и может замещать его
в некоторых двойных окисях или ферритах, например в магнетите. Окись
индия(Ш) может быть легко восстановлена водородом.
Сульфид индия
Сульфид индия In^ можно получить при нагревании металла с серой
или при пропускании сероводорода в слабокислый раствор соли индия. Его
цвет изменяется от желтого через красный до коричневого. Цвет и кристал-
лическая структура этого вещества, по-видимому, связаны со скоростью
образования, которая в свою очередь зависит от раствора, из которого суль-
фид индия осаждается сероводородом. Из раствора хлорида индия(Ш)
выпадает желтый осадок, который состоит из мелких частиц или имеет
неупорядоченную структуру. По-видимому, это объясняется быстрым ростом
кристаллов. Из раствора сульфата индия(Ш) образуется соль красного
цвета, обладающая определенной структурой, которая обнаруживается при
рентгеноструктурном анализе. По-видимому, в этом случае рост кристаллов
происходит с меньшей скоростью. Это может быть связано с электрохими-
ческими свойствами индия, описанными в следующем разделе.
Другие соединения
Индий образует соединения с другими металлами, например селеном,
теллуром*, сурьмой и мышьяком, а также с неметаллическими элементами —
кислородом, водородом, азотом, серой, фосфором и галогенами. Многие
из этих соединений, в том числе фосфид, арсенид, антимонид, окись,
сульфид, селенид и теллурид индия, являются полупроводниками. В по-
следние годы проведены многочисленные исследования, посвящеииые
изучению этих соединений, особенно фосфида, арсенида и антимонида индия,
* Структура внешнего электронного слоя атомов селена и теллура определяет
их преимущественно металлоидный характер.— Прим. ред.
230 Г лава И
а также областей их применения. Применение может быть основано на моду-
ляции носителей заряда и их подвижности электрическим, магнитным или
тепловым полем либо энергией фотонов или тепловой энергией [9]. Наибо-
лее важные области применения будут рассмотрены ниже.
ЭЛЕКТРОХИМИЯ
Полный обзор, посвященный вопросам электрохимии этого элемента,
опубликован Мёллером и Гопкинсом 153]. Склонность индия к образованию
ковалентных связей в своих соединениях, по-видимому, является одним
из наиболее важных свойств элемента, влияющих па его электрохимическое
поведение. Низкая проводимость растворов солей индия указывает на их
сравнительно неионный характер. Во многих электролитах электродные
реакции индия требуют сравнительно высокой энергии активации. Типич-
ными из таких электролитов являются сульфатные, фторидные и перхло-
ратные растворы в отличие от хлоридных и бромидпых растворов, а также
растворов солей некоторых органических кислот, например ацетатов
и цитратов, в которых реакции индия имеют обратимый характер.
Нормальный окислительно-восстановительный потенциал индия при-
близительно равен —0,34 в, поэтому при электрохимических процессах
выделения металла не встречается особых трудностей. Для такого процесса
предпочитают электролит, в котором протекают обратимые электродные
реакции. Подходящим является электролите высокой концентрацией хлор-
ионов. Электролитическое рафинирование в такой среде с растворимым
анодом из технического индия и индиевым катодом нашло практическое
применение [37, 511.
Во многих отношениях для изучения электрохимических свойств индия
удобен полярографический метод. Полученные таким путем данные могут
оказаться очень полезными для выяснения механизма процесса и совершен-
ствования электрохимических методов извлечения этого металла 151, 53].
Потенциал полуволны простого, некомплексного иона индия был определен
Шуфле [67] равным —0,55 в (по отношению к нормальному каломельному
электроду).
КОРРОЗИОННАЯ СТОЙКОСТЬ
Данные о коррозионной стойкости немногочисленны. Имеющиеся све-
дении обобщены Бартоном [8].
Атмосферное влияние
На воздухе при комнатной температуре чистый индий устойчив против
коррозии. На индии, подвергшемся атмосферному воздействию, образуется
тонкая вязкая окисная пленка, подобная пленке, появляющейся на алю-
минии, которая легко растворяется в разбавленной соляной кислоте.
Металл сохраняет блеск при температурах несколько выше своей темпера-
туры плавления, по при более высоких температурах легко окисляется
до 1п2Оя. Сера и сероводород на воздухе при обычных температурах на индий
не действуют.
Коррозионные испытания разбрызгиванием солей C%-ный раствор
NaCl при 35е в течение 6 недель) показали увеличение веса, соответствующее
скорости коррозии 1,93 мг!дм2-сутки для чистого индия. Полученные
образцы частично покрывались твердой желтой пленкой (цвет 1п2О3).
Индий
'231
Влияние жидких сред
Опубликованы результаты ряда испытаний, показывающие сравнитель-
ные скорости воздействия на индий различных кислот и щелочей при комнат-
нон температуре. Результаты приводятся в табл. 5.
Таблица 5
СКОРОСТЬ КОРРОЗИИ 99,9%-ПОГО ИНДИЯ В КИСЛОТАХ И ЩЕЛОЧАХ ПРИ КОМНАТНОЙ
TEMIIFPATi'PE [8]
Рчствор
Соляная кислота
Азотная кислота
Серная кислота
Уксусная кислота
Уксусная кислота
Лимонная кислота
Лимонная кислота
Щавелепая кислота
Щавелевая кислота
Молочная кислота
Янтарная кислота
Сода
Кдкий натр
Концен-
трация, %
1
I
рн
1
1
5
1
5
1
—
2,1
—
2,15
—
1,45
5 —
5 —
о
5
5
—
Потеря веса,
мг'дл&'Сутки
123
2920
176
130,3
172,9
21,8
122,2
117,6
98
151,5
122,8
0,7
(привес)
2,5
(привес)
Внешний вид
Блестящая поверхность
Блестящая поверхность.
видны протравленные
границы зерен
Блестящая поверхность
Серая тусклая поверх-
ность
То же
Блестящая поверхность
» 2
Очень легко тускнеет
Блестящая поверхность
Очень пегко тускнеет
» » »
» » »
Светло-серая пленка
По своему поведению в разбавленных кислотах индий из всех наиболее
распространенных металлов больше всего сходен с оловом. Оба металла
неустойчивы, особенно в присутствии растворенного кислорода. Однако
индий, обладающий слабоамфотерными свойствами, весьма устойчив к дей-
ствию щелочных растворов.
Смазочные масла иногда содержат органические кислоты, образующие-
ся при разложении масел в рабочих условиях. Проводились коррозионные
испытания чистого индия при воздействии на него масел SAE № 10 (на осно-
ве масел пенсильванской нефти), содержащих 5 об.% олеиновой кислоты
(концентрация кислоты значительно выше обычного содержания ее в сма-
зочных маслах). Испытания при комнатной температуре не показали изме-
нения веса через 12 суток; при 136° отмечена потеря веса, соответствующая
7,65 мг'ди'1 за 14 суток. В последнем опыте было замечено появление
коричневой тусклой пленки.
Описаны также результаты испытаний на коррозию в смазочных
маслах листового индия и свинцово-индиевых диффузионных сплавов.
Во всех случаях индий значительно повышает сопротивление подшипников
и подшипниковых сплавов коррозии. Следует отметить, что при определен-
ных температурах индиевое покрытие быстро диффундирует в поверхност-
ный слой основного металла, так что испытания в действительности показы-
вают сопротивление коррозии данного сплава, а не металлического индия.
232
Глава 11
Данные о сопротивлении коррозии индиевых сплавов сравнительно
немногочисленны. Финк и сотр. [22] сообщают, что добавка небольших
количеств олова или индия к другим металлам заметно повышает коррозион-
ную стойкость против действия 3°п-ного солевого раствора или насыщенного
раствора щавелевой кислоты. Дерг и Маркус [17] нашли, что добавка
0,1—З/о индия пассивирует олово в карбонатных растворах при рН 8,4—11,2.
6 8 ю 1г « № 18 го гг
Время, сутки
Рис. 3. Результаты коррозионных испытаний индия при погружении
в 25%-ный раствор едкого кали.
При изучении устойчивости припоев к воздействию щелочей Гримко
и Джаффи [33] получены некоторые данные о скорости коррозии металлов
в 25%-ном растворе едкого кали. Результаты испытаний чистого индия,
чистого олова, чистого свинца, сплава 50% In — 5096 Pb и сплава 5О°6
РЬ — 50% Sn показаны графически на рис. 3.Установлено, что скорость
коррозии индия в 25%-ном растворе едкого кали равна 1,5 мг1дмг-сутки
(привес) при комнатной температуре и 2,1 мг/дм2-сутки (потеря веса)
при 49°.
Из исследованных припоев наиболее устойчивым против щелочной
коррозии оказался припой, содержащий 25% индия, 37,5% свинца и 37,5%
Индий 233
олова. Сплавы, содержащие не менее 25% индия, обладают высокой устой-
чивостью к действию щелочных растворов. Были определены прочность
соединения при стандартных испытаниях и характеристики припоев, а также
сопротивление коррозии.
ТОКСИЧНОСТЬ [771
Случаи отравления людей, работающих с индием, не зарегистрированы,
однако опыты, проводимые с животными, дают основание считать, что индий
токсичен, особенно при внутривенном и подкожном введении и в меньшей
степени при приеме внутрь. В связи с этим необходимо отметить, что индий
может оказаться вредным для рабочих в определенных условиях, но соблю-
дение обычных правил гигиены обеспечивает соответствующую защиту.
Испытания над человеческим и животным организмами показали, что
индий не оказывает раздражающего действия на кожу. Случаи появления
дерматитов у производственных рабочих не зарегистрированы. Поскольку
растворимость индия в кислотах, содержащихся в пищевых продуктах,
довольно высокая, его не рекомендуется применять в производстве пищевых
продуктов.
ОПРЕДЕЛЕНИЕ ИНДИЯ
Разработано большое количество методов определения индия в рудах
и металлургических продуктах, в том числе химические, спектрографиче-
ские, спектрофотометрические и электрохимические методы. Для определе-
ния индия в горных породах и минералах применялся нейтронный актива-
ционный анализ [72]. Содержание примесей в металлическом индии легко
определяется стандартными спектрографическими, спектрофотометриче-
скнми и полярографическими методами. Спектрографические методы, при-
меняемые фирмой «Комайнко» для определения следов примесей в индии
и других металлах высокой степени чистоты, описаны Митчеллом 152].
СПЛАВЫ ИНДИЯ
Подробно исследовано большое число систем с целью изучения сплавов,
содержащих индий. Как правило, добавка небольших количеств индия
повышает твердость, прочность и сопротивление коррозии основного
металла. Опубликованы данные о следующих системах:
Двойные системы
Алюминий — индий [35, 58]
Азот — индий [35]
Арсенид индия — антимонид индия [58]
Арсенид индин — сурьма [58]
Висмут — индий [35, 58]
Галлий — индий [35, 58]
Германий — индий [35, 58]
Золото — индий [35, 58]
Иод—индий 159]
Кадмий — индий [35, 58]
234 Г лае а 11
Калий — индий [58]
Кальций — индий 135]
Кобальт — индий [35]
Кремний — индий 135, 58]
Литий — индий [35, 58]
Магний — индий [35, 58]
Марганец — индий [35, 58]
Медь — индий [35, 58]
Мышьяк — иидий [35, 58]
Натрий — индий [35, 58]
Никель — индий [35, 58]
Олово — индий [35, 58]
Палладий — индий [35, 581
Платина — индий [35, 58]
Плутоний — индий [35]
Празеодим — индий [58]
Родий — индий [35]
Ртуть —индий [35, 58]
Свинец — индий 135, 58]
Селен — индий [35, 58]
Сера — индий [35, 58]
Серебро — индий [35, 58]
Сурьма — индий [35, 58]
Таллий — индий [35, 581
Теллур — индий [35, 581
Титан — индий [35, 58]
Уран — индий [35]
Фосфор — индий [35, 58, 68]
Цезий — индий [351
Церий —индий [35, 581
Цинк — индий 135, 58]
Тройные системы
Алюминий — олово — индий [13]
Алюминий — сурьма — индий [43]
Германий — олово — индий [58]
Германий — цинк — индий 158]
Кадмий — германий — индий 158]
Кадмий — олово — индий [58]
Кадмий — цинк — индий 158]
Медь — никель — индий [58]
Медь — серебро — индий [26, 58]
Олово — цинк — индий [58]
Свинец — олово — индий [12]
Сурьма — галлий — индий 143]
Сурьма — мышьяк — индий [70]
Чстырехкомпонентные системы
Германий — олово — цинк — индий [581
Кадмий — германий — олово — индий 158]
Кадмий — германий — цинк — индий [58]
Кадмий — олово — цинк — индий [58]
Индий 235
Пятикомпоиеитные системы
Кадмий — германий — олово — цинк — индий [58]
СПОСОБЫ ОБРАБОТКИ
Выпускаемые виды изделий
Основной формой для индия является литой слиток. Из металла изго-
товляют самые разнообразные виды изделий — штампованную проволоку,
ленты, стержни, прокатанные фольгу и листы, порошкообразный индий,
диски, дробь, прокладки и кольца. Благодаря пластичности, мягкости
Рис. 4. Выпускаемые изделия из индия.
и низкой температуре плавления индий очень удобен для изготовления изде-
лий различных форм, однако его недостаточная прочность неблагоприятна
при изготовлении очень тонкой проволоки, ленты и тонкой фольги. Способы
изготовления изделий различных форм, применяемые фирмой «Комайнко»,
описаны Хаитом и сотр. [371. Некоторые стандартные формы изделий пока-
заны на рис. 4.
Сплавы индия продаются r форме слитков, а также в формах, отлитых
по образцам. Имеются также химические реактивы и растворы для электро-
литических покрытий.
Электролитическое осаждение
Смит [74] и Людвик [47] обобщили имеющиеся в литературе данные
о методах электролитического осаждения индия. Индий успешно приме-
няется в качестве покрытий для многих металлов — свинца, цинка, меди,
кадмия, олова, золота, серебра и железа. На железо предварительно реко-
мендуется наносить покрытие из цветных металлов. Для электролитического
осаждения индия применяется большое число электролитов. Наиболее
перспективны в промышленном масштабе растворы цианида, сульфата,
фторобората и сульфамата. Оптимальные условия и некоторые характери-
236 Глава П
стнки процесса электролитического осаждения индия представлены
в табл. 6 и 7.
Цианидная ванна, запатентованная для электролитического покрытия
индием 157], — одна из первых разработанных для промышленного получе-
ния металлического индия ванн, часто применяемая и в настоящее время.
Содержание индия в электролите пополняется добавкой концентрированного
раствора хлорида индия.
Фирмой «Индиум корпорейшн оф Америка» также разработана цианид-
ная ванна («Clear Cy-an-in») [47]. Это щелочная циапидная ванна, имеющая
некоторые преимущества по сравнению со старой цианидной ванной.
В продажу поступает концентрированный раствор, который требуется
лишь разбавлять определенным количеством воды. В патентах описана циа-
нидная ванна для электролитического покрытия, содержащая гидроокись
щелочного металла и соответствующие сахариды (например, декстрозу)
[29, 301. Электролит ваины этого типа для удобства хранения и транспор-
тировки можно выпаривать до твердого остатка [291. Для приготовления
нужного раствора электролита твердый остаток растворяют в воде.
Сульфатная ванна хуже цианидной по рассеивающей способности,
но она применяется вследствие своей простоты. Анодный к. п. д. этой ванны
несколько выше катодного к. п. д., поэтому для поддержания требуемых
величин рН и концентрации раствора необходимо периодически частично
заменять электролит водой или применять совместно нерастворимый анод
и растворимый индиевый анод. Применение сульфатной ванны описано
Линфордом [45].
Запатентована и находит применение фтороборатная ванна [49]. Фторо-
боратная ванна может быть приготовлена добавлением гидроокиси индия
к борофтористоводородной кислоте с последующим разбавлением водой.
Поскольку анодный к. п. д. выше, чем катодный к. п. д., этот раствор также
необходимо поддерживать при определенной концентрации разбавлением
водой или применять для этого вспомогательный нерастворимый анод.
Сульфаматная ванна описана в патенте [20]. Этот процесс еще не имеет
достаточного применения, чтобы можно было дать ему оценку. Индий может
добавляться в виде сульфамата, а также в виде хлорида или другой солн.
В последнем случае сульфамат-ион добавляется в виде сульфаминовой
кислоты.
Опубликовано много работ по осаждению сплавов индия. В патенте
[461 и статье [71] описано осаждение сплавов свинец— индий из фторобо-
ратной ванны. Имеются патенты на осаждение сплавов свинец — индий
из водных растворов или из растворов в целлозольве (моноалкиловый эфир
этилепгликоля) перхлоратов этих металлов [28]. В более позднем патенте
[78] описан метод осаждения сплавов свинца с индием из ванны, содержа-
щей соли обоих металлов с контролирующим реагентом, например этилен-
диаминтетрауксусиой кислотой и гидразином, при применении нераство-
римого анода [78].
Фирмой «Филко корпорейшн» разработаны два процесса для электро-
осаждения сплавов кадмия с индием из расплава. В одном из процессов
используется расплавленная ванна электролита, состоящего из хлоридов
кадмия, индия и цинка [65, 66], в другом процессе — ванна, состоящая
из раствора хлоридов кадмия, индия и аммония в глицерине. Электролити-
ческое осаждение эвтектического сплава G5Vo индия1 происходит при тем-
пературе, превышающей температуру плавления сплава [14].
Фирмой «Вандервелл продактс» также запатентован метод совместного
осаждения сплавов свинец — олово — индий из раствора в воде или в цел-
Таблица 6
ОПТИМАЛЬНЫЕ УСЛОВИЯ ПРОЦЕССА ЭЛЕКТРОЛИТ ИЧЕСКОГО ОСАЖДЕНИЯ ИНДИЯ [74]
Оптимальные условия
Концентрация индия,
г/ л
Добавка
Общая концентрация,
г/л
CN~(uBiueKCN)
BF,"
NH.SO;
рН
Температура, "С
Анод
Плотность тока, а/см*
Электролитическая ванна
цканидная
30
Декстроза
80
—
—
—
Комнатная
Нерастворимый
0,02
сульфатная
20
Сульфат нат-
рия
—
—
2,1—2,3
20 70
Растворимый
индиевый
П,02
фтороборатная
60—90
—
—
125—190
—
0,1 -0,4
20—35
Растворимый
индиевый
0,01—0,1
сульфаыатнаи
30
Амины
—
—
225
1,0—2,0
Комнатная
Растворимый
индиевый
0,02
Таблица 7
РАБОЧИЕ ХАРАКТЕРИСТИКИ ПРОЦЕССА ЭЛЕКТРОЛИТИЧЕСКОГО ОСАЖДЕНИЯ ИНДИЯ [47]
Рабочие характеристики
Рассеивающая способ-
ность
Качество покрытия
Анализ раствора
Максимальная темпе-
ратура
Цнет раствора
Смачиваемость
Применение
Анод
Катодный к. п. д.,%
Тенденция к точечной
коррозии
Контроль раствора
Электролитическая ванна
цнанидиая
Превосходная
Превосходное
Не очень про-
стой
Нет
Прозрачный
Легкая
Основное
Нераствори-
мый
40 50
Нет
Цианид, ме-
талл
сульфатная
П.юхая
Удовлетвори-
тельное
Простой
Проверяется
Прозрачный
Трудная
Эксперимен-
тальное
Растворимый
индиевый
30 70
Да
Металл, рН
фтороборатная
Хорошая
Хорошее
Простой
21 -32°
Прозрачный
Трудная
Эксперимен-
тальное
Растворимый
индиевый
40—50
Нет
Металл, рН
сульфаматная
Превосходная
Превосходное
Простой
Нет
Прозрачный
Довольно лег-
кая
Эксперимен-
тальное
Растворимый
индиевый
90
Нет
Металл, рН
238 Глава 11
лозольве перхлоратов этих металлов [281, сплавов цинк — индий и олово —
индий [27] и сплавов медь — индий [62] из щелочной цианидной ванны,
содержащей декстрозу, а также сплавов медь — олово — индий из щелочной
цианидной ванны, содержащей медь и индий в виде комплексных цианидов
и олово в виде станната [63]. В патенте, принадлежащем фирме «Дженерал
моторе», описан метод совместного осаждения сплава сурьма — индий
из водного раствора, содержащего цитрат аммония, среднюю натриевую
сольэтнлендиаминтетрауксусной кислоты, индий в виде растворимого соеди-
нения и сурьму в виде комплексного тартрата [73].
В патенте [40], принадлежащем фирме «Канадиен Всстингауз ком-
пани», описан новый процесс для покрытия индием и другими металлами
или сплавами, который включает применение цикла реверсивного тока для
нанесения покрытия на основной элемент. Вначале при пропускании тока
на основном элементе осаждают слой металла определенной толщины,
затем изменяют направление тока, чтобы частично удалить испорченный
и низкого качества верхний слой осадка. Этот цикл повторяется до тех пор,
пока не будет осажден слой металла требуемой толщины. Авторы патента
утверждают, что этот процесс менее продолжителен, чем обычный стандарт-
ный метод, применяемый для электролитического нанесения покрытий,
и что в этом случае образуется более гладкий и однородный осадок, состоя-
щий из большого числа очень тонких, равномерно связанных между собой
частиц доброкачественного металла.
После нанесения на основной металл индий может нродиффундировать
в металл при нагревании. Это улучшает осадок. Диффузия происходит
при нагревании покрытой части в печи или на масляной бане в течение
примерно 2 час при температуре около 175\ Индий образует при этом сплав
с основным металлом [47].
Осаждение паров
Индий может быть осажден на холодных поверхностях испарением
в вакууме. Этим способом можно изготовлять зеркала для специальных
целей. Индиевые зеркала обладают почти такой же отражательной способ-
ностью, как и серебряные зеркала, и более устойчивы против атмосферной
коррозии.
Плавление
Губчатый индий — тонкоизмельчепиый металл, который легко окис-
ляется. Чтобы предотвратить окисление, индий с губчатой или кристалли-
ческой форме плавят под защитным слоем. Обычно для защиты от воздуха
применяют едкий натр, но можно применять также парафин, очищенный
керосин и смесь едкого натра и цианида натрия. Компактный металл можно
плавить в открытых тиглях без чрезмерного окисления.
ОБЛАСТИ ПРИМЕНЕНИЯ
Существующие области применения
Подшипники скольжения. Вначале индий применялся главным образом
для изготовления подшипников. В настоящее время это применение продол-
жает оставаться важным для индия стандартного сорта (99,97°6 индия).
Добавка индия повышает прочность и твердость подшипников, увеличивает
Индий 239
коррозионную стойкость и улучшает смачиваемость, в результате чего улуч-
шаются противозадирные свойства.
Обычно индием обрабатываются серебряносвинцовые подшипники
на стальной основе. В производстве таких подшипников на стальную
наружную оболочку сначала наносится электролитический слой серебра,
иногда сверху тонкий слой («strike») меди или никеля. Серебряный слой,
имеющий высокое сопротивление усталости, является противозадирным
компонентом в подшипнике. При применении индия на серебряный слой
электролитически осаждают свинцовую оболочку и затем слой индия. После
этого подшипник нагревают для диффузии индия в свинцовый слой и полу-
чения слоя свинцовоиндиевого сплава, который богаче индием на поверх-
ности [1, 55]. Подшипники такого типа находят применение в авиационных
двигателях и двигателях для грузовых автомобилей высокой мощности
и специальных высокоскоростных автомобилей.
В Англии появились в продаже свинцовобронзовые подшипники с индие-
вым поверхностным слоем, которые изготовляются в промышленном мас-
штабе. Такие подшипники применяются в значительном количестве в англий-
ской автомобильной промышленности, а также некоторыми германскими
и итальянскими фирмами.
Полупроводники. Индий — существенная составная часть германиевого
транзистора, в котором он действует как присадка и как средство для при-
крепления свинцовой проволоки к германиевому кристачлу 161. В настоя-
щее время в различных областях техники применяются германиевые тран-
зисторы и выпрямители нескольких типов, в том числе с точечным
контактом, с поверхностным барьером и с диффузионным сплавленным
переходом. Для последнего типа германиевого транзистора, где исполь-
зуется примесный диффузионный р — п — р-переход, требуется значи-
тельно больший расход индия. Действие транзистора основано на р — п-пе-
реходе, который осуществляется, когда происходит превращение германия
р-типа в германий я-типа в твердом состоянии. Германий «-типа обра-
зуется при введении в германий высокой степени чистоты специальных
примесей, например сурьмы или мышьяка. Эти элементы, имеющие пять
электронов на своей внешней орбите (германий имеет четыре электрона),
дают избыточные электроны в решетку кристаллического германия. При
введении в германий в качестве примеси индия образуется германий р-типа.
Поскольку индий имеет на своей внешней орбите три электрона, а герма-
ний — четыре, в кристаллической решетке германия наблюдается недоста-
ток электронов. Эти недостающие электроны известны как дырки. Под
влиянием электрического поля избыточные электроны в германии «-типа
движутся к положительному источнику; в германии р-типа электроны
могут перескакивать в дырки, и дырки появляются в направлении отри-
цательной клеммы.
В нормальном транзисторе с р — п — р-нереходом индий в форме
шайбы или круга наплавляется с каждой стороны вафли (облатки) из гер-
мания «типа. При охлаждении германий в примесной области рекристалли-
зуется в р-тип, давая р— п — р-переход.
Помимо электронных свойств, индий обладает еще двумя свойствами,
благодаря которым он применяется в полупроводниковой технике: 1) легко
смачивает германий и может быть вплавлен в германий при срав-
нительно низкой температуре E00—550е); это позволяет применять
более простые способы производства и доводить содержание примесей
до минимального; 2) индий — мягкий металл, поэтому он не может
240 Глава 11
вызвать деформацию в германии вследствие усадки при твердении после
вплавлення.
Легкоплавкие сплавы. Разработано большое количество легкоплавких
сплавов, содержащих индий [61. Например, при добавлении индия к сплаву
Вуда температура плавления сплава понижается на 1,45° на каждый про-
цент добавленного индия. Самую низкую температуру плавления D7°) имеет
сплав, содержащий 19,196 индия. Эвтектический сплав, содержащий 24% ин-
дия и 76% галлия, плавится при 16° и, следовательно, при комнатной
температуре находится в жидком состоянии.
Сплавы для соединения со стеклом. Весьма полезное применение индий
нашел для соединения стекла со стеклом или с металлом 16]. Это особенно
ценно для затворов в высоком вакууме, разборных затворов и соединения
со стеклом в том случае, когда нельзя применять высокие температуры.
Фирма «Серро де-Паско» выпускает смачивающий стеклосплав «серросил-35»,
который содержит примерно равные количества олова и индия. Расплавлен-
ный сплав, способный смачивать стекло, наносится вначале ровным слоем
па предварительно нагретое стекло, после чего производится обычное соеди-
нение частей.
Припои. Индий и многие его сплавы хорошо прилипают к многим метал-
лам II неметаллам [33]. Благодаря этому широкое применение находят спе-
циальные припои, содержащие индий. Разработаны некоторые низкотем-
пературные припои, содержащие нидий, в том числе сплавы индий — медь —
серебро и индий — медь — золото. Большое количество нидийсодержащих
припоев в таблетках применяется в производстве транзисторов.
Сплавы, применяемые в зубоврачебной технике. В течение многих лет
индий используется для очистки от кислорода золотых сплавов, применяе-
мых в зубоврачебной технике [6]. При добавлении индия к сплаву повы-
шаются прочность при растяжении и ковкость и лучше сохраняется цвет
золота.
Магнитные сплавы. Разработаны некоторые ферромагнитные сплавы
Гейслера, содержащие индий. Особого внимания заслуживают сплавы
медь — марганец — индий [34], медь — магний — индий [32] и марганец—
углерод—индий [54].
Полупроводниковые интерметаллические соединения. В настоящее
время проводятся широкие исследования интерметаллических полупровод-
никовых соединений, образующихся при взаимодействии элементов 111
и V групп периодической таблицы. Из этих соединений наиболее перспектив-
ны аптимонид, арсенид и фосфид индия. Антимонид индия обладает чрез-
вычайно высокой подвижностью электронов. Подвижность электронов
антнмонида индия высокой степени чистоты при 77° К составляет
1-106 см^/в-сек. Для получения полупроводниковых соединений требуются
исходные материалы очень высокой степени чистоты. С этой целью фирма
«Комайпко» выпускает индий, содержащий менее 1 -10 SS6 каждой опреде-
ляемой примеси.
В настоящее время антимонид индия применяется в инфракрасных
детекторах и магнитосопротивлений, изготовляемых в промышленном мас-
штабе. Изучаются возможности его применения в других областях.
Индий 24J
Электрические контакты. Из индия изготовляют превосходные, с низ-
ким сопротивлением контакты с окислами, например с двуокисью титана
и титанатом бария, поэтому он может найти применение в пьезоэлектриче-
ских элементах. Представляет интерес применение индия для контактов
с низкошумовым уровнем в специальных электрических схемах и в ультра-
звуковых линиях задержки.
Атомная анергия. В индии легко вызывается искусственная радиоактив-
ность нейтронами низкой энергии, в связи с чем этот металл можно приме-
нять в качестве индикатора в ядерном реакторе. Кроме того, индиевую
фольгу можно применять для измерения потока тепловых нейтронов в реак-
торе 131]. Из сплава серебро — индий — кадмий изготовляют регулирую-
щие стержни для реакторов с водяным охлаждением.
Применение общего характера. Индий применяется как материал для
термометров сопротивления [79] и стандарта для прецизионного измерения
температуры [4Ь].
Возможные области применения [6]
Сопротивления. Окись индия 1п2О3 в виде пленки или спеченного шта-
бика обладает свойствами, благодаря которым ее можно применять в каче-
стве сопротивления. В Институте им. Баттела в соответствии с контрактом,
заключенным с Военно-воздушными силами США, проводятся исследования
по нанесению пленки окиси индия на переднее стекло самолетов в качестве
слоя, предохраняющего от обледенения и тумана. Благодаря теплоте,
выделяющейся при прохождении электрического тока через нанесенную
окисную пленку, стекло остается прозрачным и превосходно пропускает
световые лучи [2].
Термисторы. Сульфид индия In2S3 имеет высокий отрицательный коэф-
фициент удельного электросопротивления и химически и электрически
устойчив при довольно высоких температурах. Благодеря этим свойствам
его можно применять в качестве термнеторов.
Фотопроводники. Окись, сульфид, селенид и теллурид индия являются
фотопроводниками, причем селенид, по-видимому, наиболее перспективен.
Фосфоры. Многие соединения индия проявляют флуоресцирующие
свойства. В этом направлении были предприняты исследования фосфоров
на основе сульфида индия, но по другим индиевым фосфорам опубликовано
мало данных.
Смазочные материалы. Добавление индия в смазочные материалы в виде
твердых соединений или тонкой суспензии обеспечивает широкие возмож-
ности развития этой области применения. Металл обладает такими свой-
ствами, как пластичность и ковкость, которые весьма ценны для этого при-
менения 110]. Сообщается [56], что некоторые индиевые мыла, добавленные
к моторному топливу, препятствуют образованию осадка углерода и увели-
чивают коэффициент полезного действия.
Аккумуляторы. Индий и некоторые его сплавы исследуются как анод-
ные материалы в небольших аккумуляторах и микробатареях [Ш.Значи-
16 Заказ ."* 239
242 Глава 11
тельное преимущество дает применение индия в батареях, вес и объем кото-
рых строго ограничен. Устойчивость индия в щелочных электролитах
во время хранения также важно при его применении. Фирма «Элгин нейшнл
уотч» применяет микробатареи с индиевыми анодами для электронных руч-
ных часов и в ряде других случаев.
ЛИТЕР AT УРА
1. А 1 b i л J., Materials and Methods, 27, № 6, 88 A948).
2. Chem. Eng. News, 35, oYs 17, 108 A957).
3. Eng. Mining J., Metal and Mineral Markets, различные выпуски
4. Mineral Inds. J., различные выпуски.
5. Mineral Trade Notes, различные выпуски.
6. The Metal Indium and Its Uses, Pamphlet Published by The Consolidated Mining and
Smelting Company of Canada Limited, 1957.
7. П a r k e r 1. L., частное сообщение, 9 декабря 1958.
8. В a r t о n G В., in Uhlig H. H., Ed., Corrosion Handbook, John Wiley and Sons
Inc., New York, 1948, p. 119\
9 Beer A. C, J. Electrochem. Soc, 105, 743 A958).
Id. Berninger А., англ. лат. 750423, June 13, 1956.
11. Dos we 11 T. L., J. Electrochem. Soc, 105, 239 A958).
12. С a m p b с 1 1 A. N. et al.. Can. J. Chem., 33, 511 A953).
13. Campbell A. N. et al.. J. Am. Chem. Soc, 74, 1962 A952).
14 Cert a A. J., Manns T. J.. пат. США 281R374, December 31, 1957.
15. Cohen 1. et al.. Nucleonics, 16. № 8, 122 A958).
16. Coy 1 e J., Trans. Electrochem. Soc. 85, 223 A944).
17. D erg с G.. Mark us H, Trans. A1ME, 143. 198A941).
18. Doran H. M. et al., пат. США 2384610, September 11, 1945.
19 Dyer J. R., Jr., Chem. lnd., 49, 339 A941).
2U. Dyer J. R., Jr., Rowan T. J.. пат. США 2458839, January 11, 1949.
21. Eilertson D. E., Indium Chapter in Mineral Facts and Problems. 1960
Edition, U. S. Bureau of Mines Bull 585, U. S. Government Printing Office. Washing-
ton, D. C, 1960.
22. F i n k C. ,U. et al., Trans. Electrochem. Soc, 75. 463 A939).
23. F г a s e r D. В., Canadian Mineral Industry, Otlawa, Canada, Dept. of Mines and
Technical Surveys, 1957.
24. F u 1 1 m a n В., Nature, 182, 862 A958).
25. G а г d n e r A. R., Prod. Eng., 31, № 3, 66 A958).
26. G e bh а г d t E.. D r e h e г М., Z. Metallkunde, 43, 357 A952).
27. G r e e n D. F. et al., англ. пат. 637154, May 17, 1950.
28. G r e e n D. F. et al., англ. пат. 637159, May 17, 1950; пат. СЩА 2567934, Sep-
tember 18, 1951.
29. G r e e n D. F., Salmon J. E., англ. пат. 602027, May 19, 1948; канад. пат.
493416, June 2. 1953; пат. США 2538417, January 16, 1951.
30. G г е е n D. F., Sal m о п J. Е., англ. пат. 573848, December 10. 1945; канад
пат. 48785», November 4, 1952; пат. США 2497988, February 21, 1950.
31. Greenfield M. A. et al., Nucleonics, 15, № 3, 57 A957).
32. G г i n s t e a d R. R., Yost D. M., J. Am. Chem. Soc, 75, 1803A953).
33 G г у m k о S. M., J a f f e e R. I., Materials and Methods, 31, № 3, 59 A950).
34. H a m e s F. A., E p p e 1 s h e i m e r D. S., J. Metals, 185, 495 A949).
35. H a n s e n M., A n d e r k о К-. Constitution of Binary Alloys, 2nd ed., McGraw-
Hill Book Company, Inc., New York, 1958.
Индий 243
36. II op kins B. S., Chapters in the Chemistry of the Less Familiar Elements,
Slipcs Publishing Company, Champaign, 111., 1939, Chap. 8, p. 13.
37. H u n t B. G., While С. Е. Т., King R. A., Commercial Production of
Indium, C. I. M. Bulletin, 52, 359 A959).
38. J a f f e e R. I.. Weiss M. G., Paper Presented to the Electrochemical Society,
Washington, D. C, April 1951.
39. Jaffee R. I., Weiss S. M., Materials and Methods, 36, Hb 3, 113
A952).
40. J e r n s t e d t G. VV.. канад. пат. 560607, July 22, 1958.
41. К i ng R A., Metal Progr., 75, № 1. 127 A959).
42. Kleiner t R., Mining Mag. (London), 83, 146 A950).
43. Koster W-, Thorn а В., Z Metallkunde, 46, 293 A955).
41 Lebedeff Y E., пат. США 2433770, December 30, 1947.
45. Linford H. D., Trans. Electrochem. Sec. 79, 443 A941).
46. Л и пи н А. И. и др., авт. свид. СССР 103185, июль 25, 1956.
47. Ludwick М. Т., Indium, The Indium Corporation of America, New York, 1959,
P 191.
48. McLaren E. H, Can. .1. Phys., 36, 1131 A958).
49. M a r t z W. M., пат. США 2409983, October 22, 1916.
50. Me I ford D. A., Hoar T. P., J. Inst. Metals, 85, 1742 A956).
51 Mills .1. R., Hunt B. G., TurnerG. H., J. Electrochem. Soc, 1UU,
136 A953).
52. Mitchell С J., The Determination of Trace F.lemenls in High Purity Metals,
Paper Presented at the Fifth Ottawa Symposium on Applied Spectroscopy, September
15, 1958.
53. M о e 1 1 e r Th., Hopkins B. S , Trans. Electrochem. Soc., 93, 84 A948).
54. M о г g a n E. R., канад. пат. 560952, July 29, 1958.
55. Mullen U. A., Metal lnd. (London), 65, 394 A944).
56. M u г г а у W. S., Dyer J. R., Jr., пат. США 2028895, February 17, 1953.
57. M u г г а у W. S., Gray D., пат. США 1965251, July 3, 1934.
58. Peretti E. A., Constitution of Indium Alloy Systems, Pamphlet, The Indium
Corporation of America, Utica, N. Y., 1956.
59. P e r e t t i E. A.. J. Am. Chem. Soc, 78, 5745 A956).
6U. Q u a r m T. A. A., Trans. Inst. Mining and Met., 60, 77 A950).
fil. R о m e у n H., Jr., J. Am. Chem. Soc, 55, 3899 A933).
62. S a 1 m о n J. E., англ. пат 637153, May 17, 1950.
63. Salmon J. E., Perkins H. R., англ. пат. 666392. February 13,
1952.
64. S с a 1 a E.. Robertson W. D., .1 Metals, 5, 1141 0953).
65. S с h n a b 1 e G. L., пат. США 2845387, July 29, 1958.
66. Schnable G. L., J a v e s J. G., J. Electrochem. Soc, 105, 84 A958).
67. S с h u f 1 e J- А., частное сообщение, 1953.
68. Shafer M., Weiscr K., J. Phys. Chem, 61, 1424 A957).
69. Shaw D. M-, Paper Presented to American Chemical Society, New York, Sep-
tember 1951.
71). S h i h С H., P e г e I t i E. A., Trans. ASM, 48, 706 A956). •
71. Ill луге р М А. и др., Жури, прикл. химии, 31, № 1, 71 A958).
72. S in a 1 es A. A. et al.. Analyst, 82, 539 A957).
73. Smart C. F., пат. США 2750333, June 12, 1956.
74. Smith A. A., Jr.. in Kirk-Othmer Encyclopedia of Chemical Technology,
Vol. 7, The Interscience Encyclopedia, Inc., New York, 1951, p. 834.
75. S m i t h e 1 1 s C. J., Metals Reference Book, 2nd ed.. Vol. 1 and 2, Butter-
worlh and Co. (Publishers) Ltd., London, 1955.
16*
24? Глава 11
76. T h о г p e J. A., W h i t e 1 e у М. A., in Thorpe's Dictionary of Applied Che-
mistry, Vol. 6, Longmans, Green and Co., Inc., New York, 1943, p. 457
77. T u r n e r F. M., Some Notes on Indium with Special Reference to Its Toxic Pro-
perties, Pamphlet, A: E. R. E. MF.D/4 18, United Kingdom Atomic Energy Autho-
rity Research Group, 1957.
78. Waterman W. J. et al., англ. пат. 799280, August 6, 1958; канад. пат. 569059,
January 13, 1959.
79. W h i t e G. K. et al., Rev. Sci. Instr., 28, 638 A957).
80. Wichers E.. J. Am. Chem. Soc, 80, 4121 A958).
81. Wright T. R., Mining and Met., 26, 560 A945).
82. ZischkauC, L i n f о г d H. В., пат. США 2241438, May 13, 1941.
12.
ИТТРИЙ
А. ДА АН
А. И. Daanc, Ames Laboratory, Atomic Energy
Commission, Iowa State University, Ames, Iowa
ВВЕДЕНИЕ
Иттрий был открыт в 1794 г. финским химиком Гадолином. Он назвал
его в честь маленького городка Иттербю в Швеции, от которого происходят
также названия элементов тербий, эрбий и иттербий. Иттрий всегда встре-
чается вместе с редкоземельными элементами и очень напоминает их как
в химическом, так и в металлургическом отношении. Иттрий находится
в подгруппе скандия III группы периодической таблицы и напоминает редко-
земельные элементы больше, чем скандий. Несколько образцов металличе-
ского иттрия было получено еще в XIX в., однако их низкая степень чистоты
не позволяла охарактеризовать сам иттрий. Недавно разработанный метод
разделения редкоземельных элементов сделал иттрий более доступным,
и ои был получен и исследован во многих лабораториях. Интерес, проявляе-
мый к применению металлического иттрия в ядерных реакторах, обеспечил
поддержку программы его исследования со стороны Комиссии по атомной
энергии США. Промышленные способы извлечения иттрия из его руд, полу-
чения и очистки металла, а также методы анализа, относящиеся к этой
работе, опубликованы в отчете Эймсской лаборатории КАЭСША [1]. Кроме
того, много дополнительных сведений о получении, свойствах, обработке
и применении иттрия имеется в докладах симпозиума «Редкоземельные
и родственные металлы» 1959 г., изданных Американским обществом по изу-
чению металлов и КАЭ США [ 19], а также в статье Макгьюрити и Симмонса
[13]. Недавно Гшиейднсром [9] опубликован широкий критический обзор
по сплавам редкоземельных металлов. Повышенный интерес к металличе-
скому иттрию объясняется его малым поперечным сечением захвата нейтро-
нов и такими его свойствами, как температура плавления A509°), плотность
D,47 г/см'6) и поведение по отношению к другим металлам.
ХИМИЧЕСКИЕ СВОЙСТВА ИТТРИЯ
По своим химическим свойствам иттрий очень напоминает редкоземель-
ные элементы, за исключением того, что для него известна только валент-
ность 3, в то время как почти половина редкоземельных элементов, кроме
обычной валентности, равной 3, проявляет и другие валентности. Из водных
растворов иттрий осаждается в виде нерастворимых гидроокиси, оксалата
и фторида, которые могут быть использованы при весовом анализе. Хлорид,
бромид, иодид, нитрат и сульфат являются растворимыми соединениями.
Ввиду того что ион Y3+ бесцветен, его прямое колориметрическое определе-
ние невозможно. Иои Y3* и иоиы тяжелых редкоземельных элементов
имеют столь близкие размеры, что в растворах они всегда сопутствуют друг
другу. По своему поведению при различных процессах разделения и реак-
246 Глава 12
циях иттрий располагается между гадолинием и эрбием. Благодаря сов-
местному нахождению в природе и сходству в поведении иттрия и тяжелых
редкоземельных элементов, а также из-за большей распространенности
иттрия всю эту группу элементов часто называют иттриевой. Как будет
видно из дальнейшего изложения, это сходство иттрия н тяжелых редко-
земельных элементов распространяется и на металлическое состояние.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
В геохимических процессах, связанных с формированием земной коры,
иттрий и редкоземельные элементы оставались вместе. В настоящее время
они встречаются совместно в виде фосфатов в ксенотиме и монаците, силика-
тов в гадопините, ниобатов в самарските; кроме того, оии присутствуют
в таких важных минералах, как фергюсонит, апатит, бломстрандит и эвксе-
нит*. Богатые месторождения большинства этих минералов имеются в Нор-
вегии. Позднее были открыты месторождения в США (Фэр-Валли, штат
Айдахо; Блайнд-Ривер, штат Онтарио; Эйкен, штат Южная Каролина)
н в Бразилии. Содержание иттрия в земной коре составляет 4-10 J%,
в то время как содержание церия равно 4,6-10 ЗС6, неодима 2,4-10 зсо,
лантана — 1,8-10" 3%, а на долю всех остальных редкоземельных элементов
и скандия приходится 1-1СГ3%. Для сравнения укажем, что содержание
меди в земной коре составляет 4,5-10~3116. Неодинаковая доступность меди
и иттрия объясняется тем, что медные руды значительно богаче.
ПЕРЕРАБОТКА РУДЫ И ВЫДЕЛЕНИЕ
Полузаводской процесс переработки руд на иттрий и редкоземельные
элементы, разработанный Спеддингом и Поуэллом 11, 14, 15, 20], заклю-
чается в следующем. Исходный ксенотим, обогащенный на магнитном сепа-
раторе C6ио Y2OS и 24°6 RE2O3 в виде фосфатов)**, вскрывают путем обра-
ботки серной кислотой при высокой температуре. Полученный после такой
обработки раствор подают на колонки с катионообменной смолой. Для их
элюироваиия применяют раствор этилендиаминтетрауксусной кислоты,
в который для создания буфера вводят аммиак. Кроме того, в элюепте содер-
жатся ионы двухвалентной меди, препятствующие осаждению на слое
смолы в колонке нерастворимой этилендиаминтетрауксусной кислоты.
Иттрнн и редкоземельные элементы содержатся в разных фракциях элюата.
Их осаждают из этих фракций в виде оксалатов и прокаливают до окисей.
Изучались и другие комплексообразователи для этого процесса, но этилен-
диаминтетрауксусная кислота была найдена наиболее подходящей для
разделения. Процесс проводится на колонках диаметром 750 мм с высотой
слоя смолы 3 м\ производительность 12 таких колонок достигает 225 кг
99,9°6-ной Y2O3 за цикл. Продолжительность цикла составляет два месяца.
* Ксенотим и монацит YPO4 и (Се, La)PO4; гадолинит YiFe24Be? Si->O1U: самар-
скит (Y, Ег, Се, U, Ca, ThL|(Nb. Та, Ti, SnJO7]3; фсргюсонит"(У.Ег, Сс, "U, Fe) (Nb,
Та, Ti)O4; апатит Ca5(F.Cl)[PO,1]3; бломстрандит — разновидность бетафита
(L, Ca) (Nb, Та, TiKOg • пН2О, содержащая но сравнению с обычным бетафитом
больше Nb2Or, и меньше окислов титана и урана; эвксенит (Y, Се, Ca, U, Tli)(Kb,
Та, TiJO6 — Прим. ред.
** RE— сумма редкоземельных элементов.— Прим. ред.
Иттрий 247_
Описанный процесс принят на нескольких заводах, построенных различ-
ными фирмами, причем, по крайней мере в одном случае, введена предвари-
тельная стадия — экстракция растворителями.
ПОЛУЧЕНИЕ МЕТАЛЛА
Металлический иттрий был впервые получен Вёлером в 1828 г. [29]
восстановлением безводного хлорида иттрия. С тех пор метод металлотерми-
ческого восстановления галогеиидов иттрия применялся различными иссле-
дователями. Проведение реакции этого типа в крупном масштабе описано
Спеллингом, Карлсоном и Дааном 11, 211. Они восстанавливали фторид
иттрия кальцием в различных условиях (см. ниже). Галогениды — един-
ственные соединения для иттрия, которые можно восстанавливать до металла
D любом масштабе. Их получение описано ниже.
ПОЛУЧЕНИЕ ГАЛОГЕНИДОВ ИТТРИЯ
Фторид иттрия
Фторид иттрия можно получать теми же способами, которые описаны
в этой книге для фторида скандия: 1) кислый фторид аммония можно смеши-
вать с окисью иттрия и нагревать до 400е в токе сухого воздуха или гелия;
2) окись иттрия можно нагревать до 750° в токе безводного фтористого водо-
рода. При производстве в большом масштабе лучше применять второй спо-
соб. На полузаводских установках примерно 23 кг окнеи иттрия нагревают
в печи, выложенной инконелем, до 150°, после чего в печь пропускают ток
безводного фтористого водорода. Загрузку нагревают в течение 6 час при
750" без перемешивания, затем в течение 1 час печь медленно вращают.
После охлаждения полученный продукт хранят в полиэтиленовых мешках
до употребления. При проведении этого процесса требуется избыток фтори-
стого водорода 300%.
Хлорид иттрия
Вследствие сильной гигроскопичности хлорида, бромида и иодида
иттрия необходимо принимать меры, предотвращающие попадание влаги.
Для получения хлорида иттрия смешивают 9 молей хлорида аммония
и 1 моль окиси иттрия, затем добавляют 4 моля солянокислого гидроксил-
амина и нагревают полученную смесь до 400° в токе сухого воздуха или
гелии.
Бромид иттрия
Окись иттрия растворяют в бромистоводородиой кислоте и полученный
раствор выпаривают почти досуха. Затем приливают абсолютный спирт
и раствор выпаривают досуха. Эту операцию повторяют 3 раза, причем перед
последним выпариванием добавляют бромид аммония в количестве, по весу
равном количеству исходной окиси иттрия. Полученную после упарива-
ния гранулированную массу медленно нагревают до 600° в викоровой трубке
в токе сухого воздуха или гелия.
248 Глава [2
Иодид иттрия
Окись иттрия растворяют в дважды перегнанной 47%-нон йодисто-
водородной кислоте, к раствору добавляют 3 моля иодида аммония на каж-
дый моль окиси иттрия и выпаривают его досуха. После этого сухой остаток
очень медленно нагревают до 300° в течение 72 час в вакууме.
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО ИТТРИЯ
Восстановление фторида иттрия кальцием
Фторид иттрия, полученный описанными выше способами, имеет срав-
нительно большую поверхность и поэтому способен адсорбировать атмосфер-
ные газы. Для удаления некоторых адсорбированных газов перед восста-
новлением фторид иттрия рекомендуется подвергать спеканию в вакууме
или расплавлять. Это можно осуществить нагреванием YFS в танталовом,
молибденовом или титановом тигле до 1000 при 1-Ю мм рт. ст. или
в более глубоком вакууме. Указанная температура близка к температуре
плавления A152°) фторида иттрия, поэтому соль значительно уменьшается
в объеме и спекается. После этого фторид иттрия смешивают с дважды пере-
гнанным металлическим кальцием, взятым с избытком 10% по сравнению
со стехиометрическим количеством, необходимым для восстановления соли
в соответствии с уравнением реакции
2YF3-f ЗСа — * 2Y+3CaF2.
Реакционную смесь в танталовом тигле с перфорированной крышкой поме-
щают в кварцевую трубчатую индукционную печь, после чего печь откачи-
вают. Печь медленно нагревают до 600а для обсзгаживания загрузки и запол-
няют очищенным аргоном до давления 500 мм рт. ст. Затем повышают тем-
пературу; восстановление начинается примерно при 1000°, что заметно
по резкому росту температуры реакционного тигля. Температуру поднимают
до 1600° для полного отделения шлака от металла, после чего печи дают
остыть. Шлак легко откалывается, и остается иттрий в виде слитка; выход
98,5—99%. Вакуумной переплавкой слитка в тигле содержание кальция
удастся снизить меньше чем до 0,015%; тантал @,5—2%) и кислород
@,05—0,2%) остаются в виде главных примесей. В тигле диаметром 50 мм
и высотой 200 мм можно получить 150 г металла. Описанный метод восста-
новления применялся для получения 500 г металла в приборе, изображен-
ном на рис. 1. Реакционную смесь помещают в загрузочную камеру н обез-
гаживают танталовый тигель нагреванием при 1400° в вакууме. Затем в при-
бор впускают аргон и постепенно вводят загрузку в нагретый тигель до тех
пор, пока он не заполнится расплавленными металлом и шлаком при тем-
пературе 1600°. Это позволяет полиостью использовать весь объем тигля,
в то время как без загрузочного бункера используется только нижняя часть
тнгля, которая составляет одну треть общего объема.
Для работы по этому методу с загрузками 32—40 кг была разработана
печь, показанная на рис. 2. В этой печи загрузку из бункера, сделанного
из нержавеющей стали, подают в реакционную камеру с помощью шнекового
питателя. Температуру реакционной камеры поддерживают равной 1500
1550°, реакционную смесь подают периодически по мере расплавления
•предыдущей порции. Танталовая реакционная камера имеет диаметр 230 мм
н высоту 400 мм при толщине стенок 0,9 мм; она помещается, как это видно
Иттрий
249
Рис. I. Схема прибора
для получения до 500 г
иттрия.
/ — смотровое стекло; 2 —
трубка для управления за-
твором; 3 — воронка из
пнрекса; 4 — отверстия для
опечки иороикн и шихты;
5 — загрузочный затвор;
6 — линия для откачкн и
впуска аргона: 7 — танта-
ловая воронка для эагруз-
кн шихты; 8 — танталовяя
трубка, надеваемая на тн-
гель; 9 — стенкп, поддер-
живающая изоляционную
засыпку; 10 — изоляцион-
иый слой нэ гранулирован-
ного 1рафита; // — индук-
тор; 12 — танталовый ти-
гель; 13 — подставка для
тнгля.
Рис. 2. Схема печи для получения
до 40 кг иттрия.
/ — бункер; 2 — вакуумный ввод бун-
кера: 3 — трубка для управлении з.1-
грузочным затвором; 4 — загрузочный
затвор; 5 — шнек; 6 — верхний вакуум-
ный нентиль; 7 — латунная втулка; S —
крышка печн; 9 — тантал оапи трубка
для загрузки шихты; 10 — внутренняя
кварцевая трубка; // — наружная квар-
цевая трубка; 12, 13 — изоляционный
слоИ из гранулирооанного графита; 14 —
графитовый нагреватель тнгля; 15 —
тантал она и реакционная камера; 16 —
сливное отверстие; 17 — графитовый
пронедник для нагревателя сливного
отверстия; 18, 19 — огнеупорная кера-
мика; 20 — нагреватель сливиого отвер-
стия; 21 — основание печн; 22 — танта-
лоеый вкладыш вентиля; 23 — нижний
вакуумный вентиль; 24 — патрубки для
выпуска воды; 25 — часть изложницы,
в которой собирается шлак; 26 — водя-
ная рубашка; 27 — часть изложницы,
в которой собирается металл; 28 — дом-
краты для изложницы; 29 - тележка
для изложницы; 3U — вход воды.
из рис. 2, в графитовый тигель, окруженный теплоизоляционным слоем
гранулированного графита толщиной 50 мм*.
Нижнее сливное отверстие, находящееся вне нагреваемой зоны при
достаточно низкой температуре, закрывается застывшим металлом, полу-
• Графит для теплоизоляции готовится из стружек, которые получаются при
обработке очень чистого графитового стержня иа токарном стайке (например, при изго-
товлении тигля). Стружки отсеивают для отделения частиц диаметром больше 3 мм.
250 1\л ава 12
ценным в начале процесса. Сливное отверстие окружено графитовым донным
нагревателем. Для выпуска расплавленного металла индуктор опускают
так, чтобы прогреть сливное отверстие до температуры плавления иттрия,
после чего металл, а затем шлак выливают в охлаждаемую водой медную
изложницу. Вверху и внизу камеры имеются вакуумные вентили, которые
г
I
I
Рис. 3. Печь для полу- Рис. 4. Содержимое изло-
чения до 40 кг иттрия. жницы после разливки ме-
талла.
Мсмалл вместе со шлаком (сле-
ва); металлический елнток
(справа).
перекрываются при повторной загрузке бункера, заполнении его аргоном
и смене изложницы. Это позволяет сразу же начинать следующую плавку
через 1 час 20 мин.
На рис. 3 показана фотография работающей печи, на рис. 4 слева —
содержимое изложницы от одной плавки, справа — слиток иттрия после
удаления шлака. Такие слитки содержат 1% кальция, 0,5—2°о тантала,
0,1—0,2% кислорода, 0,02% углерода и 0,005°о азота. Переплавкой слитков
в вакууме в дуговой или индукционной печи может быть удален кальций,
остальные примеси остаются примерно в тех же количествах.
Процесс с использованием магниевого сплава
С целью разработки процесса получения металлического иттрия при
более низкой температуре по сравнению с температурой указанного выше
способа исследовались некоторые модификации этого основного способа
металлотермического восстановления галогенидов иттрия. Изучалось воет
становление хлорида итгрия и бромида иттрия литием и натрием. Во всех
случаях образующийся шлак плавится при более низкой температуре, чем
фторид кальция, что способствует отделению иттрия. Однако из-за высокой
температуры плавления A509s) металлический иттрий получается в виде
спеченной массы металла, заполненной расплавленным шлаком, а при
более высоких температурах, когда металл собирается в виде отдельной
фазы, в большинстве случаев получаются очень плохие выходы.
а затем с помощью воздушной классификации отделяют пыль. Полученный материал
имеет консистенцию молотого кофе. После обезгаживания в вакууме получается очень
эффективный в инертной атмосфере теплоизоляционный материал. Было найдено, что
i рафнт меньшей степени чистоты, содержащий заметное количество серы, выделяет
пары, которые чрезвычайно сильно действуют на танталовый тигель уже за время одно-
го о'пыта.
Иттрий 251
Наиболее успешным применением металлотермического восстановления
для получения иттрия является способ, разработанный Спеллингом и Карл-
соном [1, 21]. Этот процесс основан на более низкой температуре плавления
сплава магния с итгрием и на понижении температуры плавления шлака
путем добавления в реакционную смесь хлорида кальция. Ниже приводится
tk-
Рис. 5. Реторта, вставля- Рис. 6. Закрытый Оупкер на ре-
емая в печь. торте во время загрузки шихты.
Процесс для получения до
50 кг сплава с магнием.
типичная методика этого процесса. Смесь 38 кг дважды перегнанного кальция
и 16 кг дважды перегнанного магния помещают в тигановый сосуд диаметром
500 мм и высотой 1,22 м. который в свою очередь вставляют в реторту
из малоуглеродистой стали диаметром 610 мм и высотой 1,37 м с толщиной
стенок 13 мм. После откачки реторту опускают в печь, нагретую до 750"
{рис. 5). Когда смесь кальция и магния расплавится, реторту заполняют
гелием до давления 1 am. После этого к реторте присоединяют закрытую
бункерную систему (рис. 6) и при достижении температуры 800D в реактор
вводят смесь, состоящую из 81,5 кг фторида иттрия и 72,5 кг хлорида каль-
ция. Через 3 час для завершения процесса температуру поднимают до 960°.
После этого реторту охлаждают в наклонном положении, как показано
на рис. 7. Прн.таком охлаждении шлак и металл застывают в форме, в которой
могут быть легко извлечены из контейнера. В результате получается 68 кг
очень хрупкого сплава, содержащего 27 вес. со магния, который измель-
чают на куски диаметром до 13 лш, по возможности избегая действия атмо-
сферной влаги. Эти куски загружают в титановый контейнер и нагревают
в вакууме в индукционной печи или в печи сопротивления в течение 6 час
при 900°, а затем 24 час при 950°.
Индукционная печь для этой операции (называемой «обсзмагпиванием»)
показана на рис. 8. В процессе нагревания магний и остающийся кальций
медленно возгоняются из сплава. При этом получается пористая, мягкая,
слегка спеченная масса металла, называемая «губкой», которая содержит
252
Глава 12
примерно по 0,01% кальция и магния. На рис. 9 показаны куски исходного
сплава, «обезмагненный» металл в танталовом контейнере и возгон магния.
Для дуговой переплавки в слитки полученный губчатый металл измель-
чают и прессуют в стержни 300 X 38 X 38 мм, которые затем сваривают
впритык с целью изготовления из них
электрода. Весь металл переплавляют &**•
в вакууме в дуговой печи с расхо- ' {
дуемым электродом при напряжении - ¦ . ¦¦ "-* "
22—24 ей силе тока дуги 1000—1200 а. ' | "
Полученные слитки диаметром 100 лш ., . - -
\
х
Р и с. 7. Реторта, охлажда-
емая в наклонном положении.
Р и с. 8. Вакуумная индук-
ционная печь для «обезмагни-
вания» иттриевого сплава.
сваривают друг с другом в электрод длиной 1,5 м, который может быть
переплавлен в дуговой печн в вакууме со скоростью 2 кг/мин при напряже-
нии 20—24 е и силе тока дуги 2800—3200 а. Полученные слитки содержат
меньше 0.001% кальция, 0,003% магния, 0,05—0,165% кислорода
и 0,5—1% титана. На рис. 10 показаны слиток, полученный после второй
переплавки, слиток диаметром 100 мм и прессованные губчатые электроды.
Р и с. 9. Куски сплава иттрия
с магнием (в центре), «обезмагиен-
ный» иттрий в титановом контей-
нере (слева) и конденсат магния
(справа).
Денннсон [41 пытался получить металлический иттрий термическим
разложением иодида иттрия на раскаленной проволоке. Однако, несмотря
па использование различных условий, ему не удалось получить металл.
Часть опытов проводилась в условиях, в которых этим методом металличе-
ский цирконий может быть получен с очень высокими выходами. Неудача
объясняется, по-видимому, чрезвычайно высокой устойчивостью иодида
Иттрий
253
и высоким давлением пара иттрия при температурах, необходимых для
разложения иодида. Этот вывод подтверждается также Хаффином и
Уильямсом [22].
Рис. 10. Переплавленные [в ду-
говой печи слитки диаметром
150 мм (слева) и 100 мм (в центре)
к прессованные «губчатые» элек-
троды (справа).
г--.
Ё~
ОЧИСТКА МЕТАЛЛИЧЕСКОГО ИТТРИЯ
Поскольку способность иттрия поддаваться механической обработке,
го-видимому, улучшается при меньшем содержании кислорода, в несколь-
ких лабораториях в этом направлении проводились широкие исследования.
В'Энмсской лаборатории КАЭ США были разработаны три способа очистки
от кислорода: высокотемпературная перегонка металла в высоком вакууме,
очистка реагентов перегонкой их в реакционную камеру и экстракция кис-
лорода из металла в расплавленную солевую ванну, состоящую
из YF3- СаС12 или YCI3. В результате перегонки металла содержание кис-
лорода снижалось до 0,012%. При экстракции солевым расплавом полу-
чался металл, содержащий 0.01596 кислорода. Полученные образцы значи-
тельно лучше поддавались механической обработке. Хаффин и Уильяме
122] описали ряд других методов очистки металлического иттрия, которые
были испытаны в лабораториях фирмы «Дженерал электрик», Окриджской
национальной лаборатории, Горным бюро США, корпорацией «Корвис»,
фирмами «Люиекс», «Мичиган кемикл компани» и др. К этим методам отно-
сятся зонная плавка, электролиз в твердом состоянии, электроочистка
в расплавленной соленой ванне, амальгамное разделение и вакуумная
плавка. Установлено, что при электролизе в твердом состоянии из иттрия
эффективно удаляется кислород, однако этот и другие методы не совсем
пригодны для получения чистого металла. По-видимому, качество получае-
мого металла в большей степени улучшается в случае применения более
чистых реагентов и соблюдения соответствующих условий при получении
и обработке металла.
ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА ИТТРИЯ
По многим физическим свойствам иттрий весьма сходен с тяжелыми редко-
земельными металлами. При нанесении на график свойств тяжелых редко-
земельных элементов в зависимости от их порядкового номера иттрий попа-
дает между гадолинием и эрбием.
В табл. 1 приведены физические и механические свойства иттрия,
а в табл. 2—4 — данные о некоторых свойствах иттрия, полученные для
определенного интервала температур в лабораториях фирмы <Дженерал
электрик» и в Институте им. Баттела 123]. Большая часть этих данных полу-
Таблица 1
ФИЗИЧЕСКИЕ СВОЙСТВА ИТТРИЯ
Порядковый номер
Атомный вес
Температура плавления, С
Температура кипения, С
Плотность, г/е.и3
Кристаллическая решетка
комнатная температура—1490"
1490- 1509"
39
Атомный объем, см^'моль
Атомный радиус, А
Трплоемкпсть при 25°, кал/моль-град
Теплота плавления, ккцл/моль
Теплота испарения при 25J, ккал/мпль
Коэффициент теплопроводности,
кал/ач-сек-ерид
Коэффициент линейного расширения, град~1
Сжимаемость, см21кг
Модуль упругости, дн/см'1
кг/мм2
Модуль сдвига, кг/мм"
Коэффициент Пуассона
Твердость по Бринеллю
Предел прочности при растяжении, кг/мм*
Предел текучести, кг /мм*
Относительное удлинение, %
Поперечное сечение захвата тепловых нейт-
ронов, барн/шном
Удельное электрическое сопротивление,
мком-см
25°
100°
400°
700"
1000"
Гексагональная
88.9U5 A00% изотопа 89)
1509
3200
4,472
плотноупакованная
а^З.6457 А. с 5,7305 А
Кубическая пбъемнпцентрированиая
и =3,90 А
19,86
1,802
6,50
4,1
93
0,0240
10,8- Ю-6
2,09-10-е
6,63-10"
6,73-10»
2,66-Ю-ч
0,263
32
15,4 A6,8 после уменьшения попереч-
ного сечения на 10%)
6,86 A4,7 после уменьшения попереч-
ного сечения на 10%)
25 G после уменьшения поперечного
сечения на 10%)
1,31±0,08
65
83,5
133,5
169,5
190,6
Таблица 2
ЗАВИСИМОСТЬ ЭНТАЛЬПИИ И УДЕЛЬНОП ТЕПЛОЕМКОСТИ МЕТАЛЛИЧЕСКОГО
ИТТРИЯ ОТ TFMFIEPATyPbl a
Температура,
0
177,0
Энтялышм,
ка 1,'г
0
13,4
Температура,
°С
50
103
N дельная теплоемкость
кил]г-грид кал/мо it • град
0,074
0,076
6,57
6,75
Продолжение табл. 2
Температура,
•с
177,2
242,5
243,4
343,1
353,0
357,7
354,4
375,8
379,7
397,0
403.9
53fi,3
538,2
721,7
722,0
933,8
996,2
Энтальпия,
ка i/г
13,2
18.2
18,4
24,8
26,6
26,1
27,6
29,2
29,6
31,2
31,6
41,8
42,2
58,8
58,8
88,5
89,4
Температура,
°С
200
300
400
500
6Ш
700
800
900
1000
Удельная теплоемкость
кал, г-град
0,077
0,078
0,081
0,084
0,088
ки I/мо jft- граб
6,84
6,93
7,20
7,46
7.82
0,096 ' 8,54
0,105
0,115
0,124
9,33
10,22
11,22
*' Энтальпия И1 (общее теплосодержание между данной температурой и 0°) оп-
ределялась с помощью ледяного калориметра. Удельная теплоемкость находилась
графически как тангенс угла наклона крпной зависимости Ни от темпеплтуры в
данной точке. Измерения выполнены в Институте им. Баттела. Ошибка и щрренин
уделькой теплоемкости не превышает ±1%.
Таблица 3
ЗАВИСИМОСТЬ КОЭФФИЦИЕНТА ЛИНЕЙНОГО
РАСШИРЕНИЯ МРТАЛЛИЧЕСКОГО ИТТРИЯ ОТ
ТЕМПЕРАТУРЫ" [30]
Температура, "С
25—300
25—600
25 -9П0
25 -1000
Коэффициент линейного
расширения, 10 $;град
7,6
9,3
9,9
10,1
а Наиболее вероятные значения для поликрнстал-
лнческого металла с беспорядочной ориентацией зерен,
иплученные путем днлаточетрическнх измерений.
?56
ЗАВИСИМОСТЬ
Температура,
-18
п
38
9.3
N9
2U4
Глава
12
КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ИТТРИЯ
°С
Коэффициент тепло-
проводности.
кал/см • сек • град
0,0231
0,0236
0,0248
0,0260
0,0277
0,0293
Температура, °С
260
315
371
427
482
538
Таблица 4
ОТ ТЕМПЕРАТУРЫ а [31]
Коэффициент тепло-
проводности.
кал/сн-сек-град
0,0314
0,0334
0,0359
0,0392
0,0425
0,0466
а Измерения выполнены на металлическом прутке. Приведенные значения являютси
средними из определений, выполненных в лабораториях фирмы «Дженерал электрик» и Института
им. Баттеля.
чена на очень чистых образцах, особенно когда испытания проводились
на небольших образцах, так что в дальнейшем приведенные значения
вряд ли будут сильно изменены. Ненадежные результаты измерений ука-
заны в скобках. Механические и другие свойства, для определения которых
требуются большие образцы, определялись на металлическом иттрии «про-
мышленной степени чистоты», поэтому цифры, приведенные в табл. 1,
несомненно изменятся, когда более чистый металл станет доступен в коли-
чествах, с которыми можно проводить соответствующие измерения. Это
уже подтверждено при измерениях твердости, выполненных исследовате-
лями фирм «Карлсон» и «Дженерал электрик» [23]. С увеличением содер-
жания кислорода твердость повышается; имеются указания, что она изме-
няется также в зависимости от термообработки и степени деформации.
С увеличением температуры твердость заметно уменьшается. Результаты
испытаний на растяжение [23] показывают, что с увеличением содержания
кислорода прочность при растяжении возрастает, а дуктильность умень-
шается; с ростом температуры наблюдаются уменьшение прочности при
растяженнн и увеличение дуктильности.
СПЛАВЫ
Способность к образованию сплавов
Атом иттрия имеет довольно большие размеры. Лишь с некоторыми
металлами иттрий может образовывать твердые растворы замещения. Как
и следовало ожидать, с редкоземельными металлами и торием иттрий обра-
зует твердые растворы почти в любых соотношениях. Иттрий и магний
характеризуются существенной взаимной растворимостью в твердом состоя-
нии. Иттрий и другие металлы проявляют незначительную взаимную раство-
римость. Коллинз и сотр. [24] сообщили, что при добавлении иттрия
железо, хром, ванадий, ниобий и некоторые их сплавы становятся пиро-
форными.
Иттрий мало растворим в сплавах на основе железа и, по-видимому,
придает им пирофорность, улучшает их механическую обрабатываемость,
уменьшает размеры зерна, увеличивает сопротивление высокотемператур-
Иттрий 257
ной рекристаллизации, а также повышает в большинстве случаев стойкость
сплавов к окислению при высоких температурах. Характерным примером
может служить нержавеющая сталь типа 446 B5% хрома), которая противо-
стоит окислению на воздухе до 1100°; при добавлении 1% иттрия нержавею-
щая сталь этого типа устойчива к окислению при температурах до 1370°.
Сопротивление коррозии повышается в сущности так же, как и при добавле-
нии к этим сталям 5% алюминия, однако иттрий предотвращает нежела-
тельный рост зерна, вызываемый добавкой алюминия. Повышение жаростой-
кости, вероятно, является результатом образования более прочной окисной
пленки, в которой окись иттрия вместе с окисями железа и хрома способ-
ствует меньшей ее проницаемости. Добавление к сплаву, содержащему
1% иттрия, 1"о тория или 3% алюминия, приводит к образованию окисной
пленки, подобной эмали, устойчивой к нагреванию и тепловым ударам
до 1425е. Устойчивость к окислению не наблюдается у обычных аустенит-
ных нержавеющих сталей марки 18-8 и проявляется до некоторой степени
лишь у более высоколегированных аустенитных сталей, например стали
марки 310.
Иттрий и редкоземельные металлы лишь слабо растворимы в хроме,
но при добавлении этих мет&члов к хрому значительно изменяется его устой-
чивость к окислению. Коллинз и сотр. [24] сообщают, что 0,07% иттрия,
растворенного в хроме, оказывается достаточным, чтобы поверхностная
окисная пленка стала непроницаемой для азота, способной выдержать
100-часовой нагрев при 1260е. Поскольку хром при этой температуре из-за
чрезвычайно сильного проникновения азота делается хрупким, введение
добавок иттрия значительно улучшает технологию хрома. Однако следует
отметить, что при добавлении иттрия не уменьшается хрупкость хрома
при комнатной температуре, но при высоких температурах предотвращается
чрезмерный рост зерна.
Иттрий лишь слабо растворим в ванадии (меньше 0,1%), однако его
добавка способствует удалению кислорода в виде отдельного нераствори-
мого слоя. В результате получается дуктильный при комнатной температуре
ванадий, из которого холодной прокаткой можно изготовлять листы
и фольгу. Доказательством раскисляющего действия иттрия может служить
то, что сплавы ванадия, содержащие 1% иттрия, после удаления отделив-
шейся и плавающей на поверхности Y2O3 содержат только 0,5% иттрия.
Введение легирующих добавок иттрия к сплавам на основе железа,
хрома и ванадия значительно улучшает технологию этих металлов, и это,
несомненно, расширит области применения указанных сплавов. В част-
ности, Джаффи [ 12], характеризуя устойчивость к коррозии на воздухе хро-
ма с добавкой иттрия, утверждает, что такой металл можно считать одним
из самых жаростойких металлов, пригодных для работы при повышенных
температурах.
В тех случаях, когда сплавы с иттрием не изучались, но имеются све-
дения о подобных системах, содержащих другие редкоземельные металлы,
в первом приближении можно предположить, что сплавы с иттрием имеют
аналогичные свойства.
Сплавы
Ниже приводятся некоторые из наиболее важных особенностей сплавов
иттрия с другими металлами. Более подробный обзор сплавов иттрия
приводится в работе Ландина [251.
Элементы I группы (щелочные металлы). Литий, натрий и калий, при-
меняемые в качестве восстановителей при получении иттрия, не образуют
17 Заказ № 239
258 Глава 12
устойчивых интерметаллических соединений с иттрием и имеют малое срод-
ство к нему.
Элементы II группы {главная подгруппа). Система иттрий — магний
изучена Гибсоном и Карлсоном [8], которые обнаружили существование
трех перитектических соединений. Максимальная растворимость иттрия
в магнии составляет 9 вес. 9-6 при 567°. В {S-иттрии (кубическая объемноцент-
рированная решетка) растворяется 15 вес.% магния при 935°; образующаяся
фаза может быть закалена охлаждением до комнатной температуры. В работе
[8] высказывается предположение о возможности термообработки послед-
них растворов. Кальций с трудом сплавляется с иттрием; по-видимому,
образуются дна несмешнвающихся жидких слоя, как это наблюдается
в системе лантан — кальций.
Элементы III группы (редкоземельные металлы). Валлетта [28] обна-
ружил в системе иттрий — гадолиний существование почти непрерывного
ряда твердых растворов. С лантаном, церием, празеодимом и неодимом
иттрий образует ограниченные, хотя и широкие, области существования
твердых растворов, причем, по-видимому, образующиеся твердые растворы
обладают необычной структурой самария.
Элементы IV группы (Ti, Zr, Hf). В системе иттрий — титан имеется
простая эвтектика; их взаимная растворимость составляет менее 1 вес.%
иттрия в титане и около 0,59-6 титана в иттрии [2]. Система иттрий — цирко-
ний сходна с системой иттрий — титан.
Элементы V группы (V, Nb, Та). Ванадий и ниобий образуют с иттрием
эвтектики, расположенные на диаграммах состояния вблизи чистого иттрия.
Растворимость тантала в расплавленном иттрии при 1550° составляет около
296. Образование твердых растворов этих металлов друг в друге не проис-
ходит.
Элементы VI группы (Сг, Mo, W). Иттрий и хром образуют простую
эвтектическую систему. Молибден и вольфрам лишь незначительно раство-
римы в жидком иттрии, причем вольфрам менее растворим, чем тантал.
Элементы VII группы (Mn, Tc, Re). Иттрий с .марганцем образуют
фазу Лавеса YMn2 и другие соединения.
Элементы VIII группы (Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt). С железом
иттрий образует несколько интермсталлических соединений; их раствори-
мость в твердом состоянии друг в друге мала. В системе иттрий — никель
обнаружено девять ннтерметаллических соединений [3]. Подобная система
образуется и с кобальтом.
Элементы I группы (Си, Ag, Аи). С медью иттрий образует несколько
интерметаллнческих соединений; их растворимость друг в друге в твердом
состоянии мала. Образование эвтектики в этой системе является ограничи-
вающим фактором при выборе температуры нагревания плакированного
медью иттрия при его горячей обработке.
Элементы II группы (Zn, Cd, Hg). Данных нет.
Элементы III группы (В, Л1, Ga, In, TI). Иттрий образует несколько
борндов, которые являются весьма жаростойкими. При растворении иттрия
в боре последний образует новую фазу [16]. С алюминием иттрий образует
твердый раствор с концентрацией иттрия около 0,2 вес.9о и по крайнем
мере одно соединение.
Элементы IV группы (С, Si, Ge, Sri, Pb). Существуют три карбида
иттрия — Y3C, Y2C3 и YC2, причем все они гндролизуются с образованием
углеводородов [18]. Силициды иттрия являются жаростойкими.
Элементы V группы (N, P, As, Sb, Bi). Иттрий образует нитрид YN,
который разлагается парами воды.
Иттрий 259
Элементы VI группы (О, S, Se, Те). Единственным известным устойчи-
вым окислом иттрия является Y,O3. Были получены YS и YSe.
Элементы VII группы (F, C1, Вг, 1). Галогениды иттрия имеют сле-
дующие температуры плавления: YF3 1152°; YC13 709°; YBr3 913е; Yl3
964° [5].
Актиноиды. р-Фазы (кубические объемпоцентрированные) иттрия
и тория образуют непрерывный ряд твердых растворов; фазы, устойчивые
при комнатной температуре, образуют твердые растворы в широкой области
16]. С ураном иттрий не смешивается ни в расплавленном, ни в твердом
состоянии [11]. Шейнгарц [171 предложил диспергировать уран в иттрии
и использовать такой материал в качестве тепловыделяющих элементов
в ядерных реакторах, что облегчило бы проблему радиационных поврежде-
ний. Еще раньше упоминалось об использовании иттриевых контейнеров
для жидких сплавов урана.
Представляет интерес также применение иттрия в ядерных реакторах
в качестве материала, непроницаемого при высоких температурах для
водорода, который обеспечивает очень эффективное отражение и экраниро-
вание нейтронов. Андерсон [26] описал исследования, выполненные в лабо-
раториях фирмы «Дженерал электрик» и Денверского исследовательского
института, в которых изучалась зависимость между составом, давлением
и температурой в системе иттрий — водород. Было показано, что при атом-
ном отношении 1 : 1 и температуре 1300° равновесное давление водорода
составляет меньше 1 am. При 900—1200° и давлении водорода 1 am достига-
лось значительно более высокое атомное соотношение водорода и иттрия
(между 1 и 2). Образцы этих материалов сравнимы с рубашками из нержавею-
щей стали, которые позволяют подвергать образцы действию атмосферы
при высоких температурах. Они представляют собой одни из наиболее
устойчивых водородсодержащих материалов, пригодных для приме-
нения в ядерных реакторах. Необходимо дальнейшее исследование этих
материалов.
(СПОСОБЫ ОБРАБОТКИ
Иттрий можно удобно переплавлять в дуге в слитки, как это уже было
описано выше. Слитки круглого или любого другого сечения можно изготав-
ливать отливкой металла из танталового или молибденового тигля в охла-
ждаемые водой медные изложницы.
Как уже отмечалось, попытки обработки иттрия на первых полученных
образцах дали несколько обескураживающие результаты. Плохая обраба-
тываемость, наблюдавшаяся у этих образцов иттрия, объяснялась загряз-
нением кислородом, фтором и другими примесями. На удаление этих при-
месей пришлось затратить большие усилия. При снижении содержания
кислорода металл делался гораздо более дуктильным. Однако ввиду того,
что металл высокой степени чистоты был доступен лишь в небольших коли-
чествах, подробные исследования механических свойств и обрабатывае-
мости не могли быть выполнены. Как указал Болендер [27] в своей работе,
посвященной обработке редкоземельных металлов, большая часть данных
о переработке иттрия была получена на менее чистых (и хуже поддающихся
обработке) образцах металла. То, что для обработки более чистого металла
требуются менее жесткие условия, было подтверждено после того, как
в результате разработки способа очистки иттрия солевой экстракцией
стали доступны большие количества металла с низким содержанием
кислорода.
17»
260 Глава 12
Черновое обжа гие слитков
Вытяжка и ковка. Слитки, получаемые в процессе дуговой переплавки,
имеют очень крупные зерна, которые характеризуются чрезвычайно напра-
вленным ростом. Большинство неметаллических примесей в металле нахо-
дится как в виде осажденных фаз вдоль границ зерен, так и внутри зерен.
Эти обстоятельства приводят к тому, что переплавленный металл очень
плохо поддается обработке. Для устранения указанных недостатков произ-
водится предварительная обработка, в результате которой уменьшается
размер зерен и происходит выделение примесей, что улучшает обрабатывае-
мость иттрия. В качестве такой предварительной обработки можно произво-
дить процесс прессования или ковки [10, 27]. Слитки диаметром 150 мм
вставляются в герметичные медные обоймы и после соответствующего про-
грева вытягиваются в прутки диаметром 15—90 мм при 700° и скорости
вытяжки 330 мм/мин. После деплакирования вытяжку легко можно продол-
жить при 480°, применяя при этом маслографитовую смазку. Предваритель-
ной сверловкой исходных слитков можно изготовлять трубы диаметром
25 100 мм. Поскольку медь оболочки может реагировать с иттрием даже
при 510°, нагрев перед выдавливанием не должен быть продолжительным.
Гвидобони [10] сообщает, что при этих операциях требуется давление
1,4—2100 кг/См*. Болендср [27] нашел, что иттрий с низким содержанием
кислорода @,05%) можно выдавливать при 260° в профили сложной формы,
имеющие гладкие поверхности.
Для чернового обжатия полученных дуговой плавкой заготовок диа-
метром 150 мм с помощью ковки требуется выдерживание слитков при 870°
в течение 3 час в инертной атмосфере. После этого производится ковка
в пруток квадратного сечения, причем обжатие за один удар составляет
3,2 мм. Для предотвращения внутреннего растрескивания и раскрытия
заготовки через каждые 2—3 продольных удара углы поковки скругляются.
После того как поковка достигнет сечения 100 X 100 мм2, ее можно проко-
вать в 50-миллимстровый сляб для проката полосы. Если слиток подвер-
гается предварительному обжатию, как это описано выше, то допустима
его горячая штамповка или свободная ковка. Болендер [271 сообщает, что
поковка 100 X 100 мм2, полученная из слитка диаметром 150 мм. как
описано выше, была затем прокована при 700° в пруток диаметром 38 мм,
причем в промежутках между ковками заготовка по 10 мин нагревалась
в печи с температурой 870° в атмосфере аргона.
Прокатка. Иттрий может быть прокатан в холодном состоянии, причем
гораздо лучшие результаты получаются для металла с низким содержанием
кислорода. Гвидобони [101 сообщает, что легко достигается обжатие
на 4—5% за один проход, причем каждый раз после обжатия на 25% произ-
водится отжиг. При толщине меньше 0,75 мм степень обжатия увеличивают
до 50% за проход. Если металл содержит меньше 0,1% кислорода, то обжа-
тие на 50% за проход дает, по-видимому, лучшие результаты, чем обжатие
на 5°о за проход; при этом может быть получен лист толщиной 0,23 мм.
Иттрий можно прокатывать и в горячем состоянии при 760—870" на воздухе
с обжатием за проход 10—25% в лист толщиной 3,2 мм из 50-миллиметровой
заготовки.
Обжимка. Как и в случае многих других металлов, обжимка иттрия
является, по-видимому, более удовлетворительным способом изготовления
некоторых профилей, чем прокатка. В результате горячей обжимки G88°)
Иттрий 261
прутка диаметром 6 мм получается чистая гладкая проволока диаметром
0,53 мм. Болендер [271 и Гвидобони [ 101 считают, что при обжимке до 0.5 мм
следует применять обжатия за проход 5- 10% с отжигом после каждого
обжатия на 25%. В работе Болендера сравниваются способы обжатия
иттрпевой заготовки прокаткой и обжимкой. После отжига при 982° одина-
ковые образцы были подвергнуты прокатке в круглый пруток и обжимке,
причем обе операции проводились до растрескивания образцов. При круглой
прокатке была достигнута степень обжатия 15%, а при обжимке — 42%.
Протяжка. Прутки и трубки из иттрия могут быть подвергнуты про-
тяжке с использованием смазки из сульфида молибдена MoS2 и стеарата
кальция, причем каждый раз после обжатия на 25% производится отжиг.
Механическая обработка. Иттрий можно обрабатывать такими обыч-
ными способами, как распиливание, фрезерование, сверление, нарезка,
шлифование н т. п. Для всех этих операции существенное значение имеет
применение масляной интенсивно охлаждающей ванны. Охлаждающие
жидкости на основе воды не должны использоваться. При скорости резания
45—60 м.'мин должна достигаться чистота обработки поверхности
30—60 RMS. При фрезеровании на станке с головкой 30 мм ширина раз-
реза составляет обычно 3 мм, подача 25—300 мм/мин при скорости фрезы
93—153 об'мин. При сверлении угол заточки сверла составляет 90—130°,
скорость резания 60—75 м/мин при средней подаче. Стружки иттрия огне-
опасны, и при их хранении должны быть приняты меры предосторожности.
Желательно как можно быстрее пускать их на переплавку или химическую
переработку.
Соединение. Иттрий можно соединятьсплавлениемили точечной сваркой
обычными способами в инертной атмосфере. При сварке встык сплавлением
проявляется тенденция к растрескиванию; лучшие результаты получаются
при применении присадочной проволоки. Иттрий может быть сварен с боль-
шинством других металлов, однако качество соединения зависит от природы
образующегося в зоне сварки сплава.
Фишер и Фуллхарт [7] при испытании иттриевого трубопровода,
по которому циркулировал расплавленный уран (моделирование ядерного
реактора с жидким горючим), выявили необходимость проведения сварки
иттрия в чистой атмосфере. Для предотвращения пористости шва с напла-
вляемого валика необходимо удалять окисную пленку, что достигается
се «разгонкой» на соседние со швом участки металла. В противном случае
пленка вызывает пористость шва, что неблагоприятно сказывается на аппа-
ратуре.
КОРРОЗИЯ
В нормальной атмосфере иттрий весьма устойчив, он лишь слегка туск-
неет, но никогда не теряет металлический блеск. Иттрий окисляется при
более высокой температуре. С иттриевыми стружками следует обращаться
осторожно, так как при нагревании они энергично сгорают. В атмосфере
водяного пара при 750° иттрий покрывается окиспой пленкой толщиной
105 А, предохраняющей металл от дальнейшего окисления. Как упомина-
лось выше, смесь концентрированной азотной и 48?о-ной плавиковой кис-
лот A : 1) медленно действует на иттрий, другие же кислоты энергично
растворяют его.
262 Г лава 12
токсичность
О токсичности иттрия имеется мало данных. Несмотря на продолжи-
тельную работу исследователей с этим элементом, о его токсичности ничего
не сообщалось.
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ ИТТРИЯ
Иттрий, по-видимому, найдет интересное применение в будущем. Он
является наиболее распространенным из тяжелых редкоземельных элемен-
тов, и методы его производства в больших количествах достаточно разрабо-
таны. Малое поперечное сечение захвата тепловых нейтронов и устойчивость
при высокой, температуре систем иттрий — водород уже в настоящее время
вызывают интерес к его применению в ядерной энергетике. Были отмечены
сравнительно высокая температура плавления иттрия и его инертность
по отношению к расплавленному урану и большинству его сплавов. Если
дальнейшие исследования подтвердят результаты предварительных опытов,
то иттрий может стать основным материалом для некоторых ядерных реак-
торов и будет способствовать экономичному получению ядерной энергии.
Иттрий имеет слишком большой радиус атома, чтобы образовывать
твердые растворы со многими более распространенными металлами, однако
для магния в этом отношении имеются некоторые перспективы. Возможно,
наиболее замечательное применение иттрий найдет как добавка к некото-
рым более жаростойким металлам и сплавам, где уже установлена его спо-
собность образовывать прочную окисиую пленку. По-видимому, дальней-
шие исследования в этой области откроют большие возможности.
ЛИТЕР АТУ РА
1. Ames Laboratory Staff, U. S. Atomic Energy Commission Report, IS-1, 1959.
2. Bare D., Carlson O. N., Trans. Am. Soc. Metals, 1960 (будет опублико-
вано).
3. Beaudry В. J., Master of Science Thesis, Iowa State University, Ames, Iowa,
1959.
4. D e n n i s о п D. H., U. S. Atomic Energy Commission Report, ISC-617, 1955.
5. Dennison D. H., Ames Laboratory, Ames , Iowa, 1960, иеопубликооаиные
данные.
6. E a s h D. Г., Carlson O. N.. Trans. Am. Soc. Metals, 52, 1097 (I960).
7. F i s h e r R. W., Fullhart С. В., Second United Nalions Conference on
Peaceful Uses of Atomic Energy, Geneva, 7, 216 A958).
8. G i h s о n E D., Carlson O. N.. Trans. Am. Soc. Metals, 52, 1084 A9C0).
9. G s с h n e i d n e r K- A., A Critical Review of Rare Earth Alloy Systems, U. S.
Atomic Energy Commission, 1961.
10. G u i d о b о п i E. S., Huntress A. M., L о w e n s t e i n P., U. S. Ato-
mic Energy Commission Report, NMI-1223, 1959.
11. Haefling J F., D a a n e A. H., Trans. AIME, 215, 336 A959).
12. J a f f e e R . I., High Temperature Technology, McGraw-Hill Book Company,
Inc., New York, 1960. Chapter on Refractory Metals.
13. M с G u r t у J. A., Simmons C. R., Paper Presented at National Western
Mining and Engineering Conference, Dcver, 1960.
14. Powell J. E., Spedding F. H., U. S. Atomic Energy Commission Report,
ISC-617, 1955.
Иттрий ?63
15. Р о w e I 1 J. E., Sped ding F. H., Chan. Eng. Progr. Symposium Scr.,
55, 101 A939).
16. S e у Ъ о I I A. U., Trans. Am. Soc. Metals, 52, 971 (I960)
17. S h e i n h a r t ?. I., Sylvania-Cormng Nuclear Corporation, Quarterly Progress
Reports, 1959.
18. S p e d d i n g F. H., G s с h n e i d n e r K. A., D a a n e A. H., J. Am. Chcm.
Soc, 80, 4499 A958).
19. Sped ding F. H., Daane A. H., Eds., The Rare Earths and Related Metals,
American Society for Metals, Novelty, Ohio, 1960.
20. Spedding F. H., Daane A. H., Eds., The Rare Earths and Related
Metals, Chap, by P о w e I 1 J. E., The Separation of Rare Earth by Ion Exchange.
21. S p ed d i n g F. H., D a a n e A. H., Eds., The Rare Earths and Related Me-
tals, Chap, by С a r 1 s о п О. N.. Schmidt F. Л., Metallothermic Preparation
of Yttrium Metal.
22. S p e d d i n g F. H., Daane A. 11., Eds., The Rare Earths and Related Metals,
Chap, by II u f f i n e С L, W i I I i a m s J. M., Refining and Purification of
Rare Earth Metals.
23. S p e d d i n g F. H., Daane A. H., Eds., The Rare Earth and Related Me-
tals, Chap, by S i m m о n s C. R.. The Mechanical Properties of Yttrium, Scan-
dium, and the Rare Earths.
24. S p e d d i n g F. H., D a a n e A. H., Eds., The Rare Earth and Related Metals,
Chap, by С о I 1 i n s J. F., С a I к i n s V. P.. M с G u r t у J. A., Application
of Rare Earths to Ferrous and Non-Fcrrous Alloys.
25. S p e d d i n g F. H., D a a n e A. H., Eds., The Rare Earths and Related Metals,
Chap, by L u ii d i n С. Е., Rare Earth Metal Phase Diagrams.
26. S p e d d i n g F. H., D a a n e A. H., Eds., The Rare Earths and Related Me-
tals, Chap, by A n d e r s о n W. K-, Nuclear Applications of Yttrium, Scandium,
and the Lanthanons.
27. Spedding F. H., Daane A. H., Eds, The Rare Earths and Related
Metals. Chap, by Bohlender К- М., Mechanical Fabrication of Rare Earth
Metals.
28. V a 1 I e t t a R. M., Doctoral Thesis, Iowa State University, Ames, Iowa, 1959.
29. W б h I e r F., Pogg. Ann. chim. phys., 39, JMa 2, 77 A928).
30. N о I t i n g H. J., Simmons С R., К 1 i n g e n b e r g J. J., J. Inorg.
and Nucl. Chem., The Preparation and Properties of High Purity Yttrium Metal.
31. Simmons С R., M a g e e С. В., M с G u г 1 у J. A., F u n s t о n E. S.,
Calkins V. P., Chemistry and Metallurgy of Yttrium, APEX 475, Techn.
Inform. Serv. Extension, Oak Riilge National Laboratory, Oak Ridge, Tenn.
13.
КАДМИЙ
Ф. Г. МАК-ГУТЧЕН, ДЖ. Р. МАСГРАВЕ
F. С McCutchron, The Eagle-Picher Company,
Hcnryeiia, Oklahoma
J. R. Musgrave, Research Laboratories, The Eagle-
Picher Company, Joplin, Missouri
ВВЕДЕНИЕ
В 1817 г. Штромейер [69] предпринял исследование карбоната цинка
из Зальцгиттера (Германия), который использовался для приготовления
фармацевтических препаратов. Это соединение при нагревании становилось
желтым, а не белым, как это должно было бы быть с чистой окисью цинка.
Вначале считалось, что примесью является железо или мышьяк. Однако
при дальнейшем исследовании не был обнаружен ни один из этих элементов.
Штромейер установил, что примесью являлась неизвестная раньше окись
металла. Он отделил некоторое количество этой окиси от карбоната цинка
осторожным осаждением нового элемента сероводородом и затем восстано-
вил сульфид до металла. Так впервые был получен новый элемент, назван-
ный кадмием от термина «каламин» (карбонат цинка)*, потому что он был
найден ассоциированным с цинком.
Почти в то же время Герман [23] выделил аналогичный сульфид
из силезской цинковой руды и послал его Штромейеру, который идентифи-
цировал его как сульфид металла, только что открытого им. Мейснер [46]
и Карстен [33] также обнаружили новый элемент вскоре после сообщения
Штромейера.
В США кадмий впервые получен в 1906 г. [II, 25] фирмой «Грасселли
кемикл» из синего порошка побочного продукта, получаемого при плавке
цинка.
Кадмий относится к II группе пятого периода периодической таблицы.
Его порядковый номер 48, атомный вес 112,40.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Кадмий —¦ сравнительно редкий элемент, его содержание в земной коре
составляет около 0,5 г/т [2]. Гринокит CdS, который является, очевидно,
единственным известным кадмиевым минералом**, найден лишь в очень
небольших количествах (совместно со сфалеритом ZnS). Окись кадмия
в отдельных случаях присутствует в виде оболочки на поверхности кри-
сталлов гемиморфнта 157]***.
Цинк и кадмий тесно ассоциируют друг с другом; в большинстве цинко-
вых руд содержится некоторое количество кадмия. Почти весь кадмий извле-
кается из таких цинковых руд, которые содержат около 0,5% этого металла.
• Каламин ие карбонат, а водный диортоенлнкат цинка Zn4@HJ[Si207] - Н2О.
Природный карбонат цинка называется смитсонитом.— Прим. ред.
*• Известны также природная окись (монтепонит) и карбонат (отавит) кадмия,
но эти минералы очень редки-— Прим. ред.
*.*• Гемиморфнт, галмей — синонимы каламина.— Прим. ред.
Кадмий 265
Иногда встречаются небольшие месторождения цинковых минералов с боль-
шим содержанием кадмия, однако они не имеют промышленного значения.
Свинцовые и медные руды, содержащие цинк, иногда содержат кадмий
в количествах, достаточных для экономически выгодного его извлечения,
но и в таких рудах кадмий обычно ассоциирует с цинком, а не с другими
металлами.
Кадмий вначале извлекался из цинковых руд Верхней Силезии, где
он и теперь в небольшом количестве все еще добывается из этих руд.
В настоящее время 147] главные ресурсы кадмия сосредоточены в следую-
щих районах земного шара:
Австралия—цинковые руды
Тасмания—цинковые руды
Бывшее Бельгийское Коню—цинковые руды
Канада—сшшцово-цинксяые руды (Британская Колумбия) и медно-цинковые руды
(Манитоба, Саскачевак)
Мексика—цинковые и свинцово-цннковые руды
Перу—цинковые руды
Юго-Заппдная Африка—свинцово-медно-щшковые руды (Тсумеб)
США (месторождение Трех штатов, Миссури—Оклахома—Канзас)—цинковые руды.
Кадмиисодержащие цинковые руды встречаются и в других странах.
Судя по добыче, Мексика обладает, вероятно, наиболее крупными место-
рождениями руд, содержащих кадмий.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Мировое производство кадмия в 1957 г. составило 9060 т, из которых
около 4530 т приходится на долю США [511. В связи с тем что первичный
кадмий получают исключительно как побочный продукт из отходов при
восстановлении цинковых, свинцово-цинкових, медно-цинковых или ком-
плексных руд, содержащих эти металлы, производство кадмия определяется
количеством перерабатываемых руд. Получение вторичного кадмия отно-
сительно невелико.
В предыдущем разделе рассмотрены наиболее важные месторождения
кадмийсодержащих руд Однако плавка побочных продуктов для извлечения
кадмия (и последующее рафинирование) часто производится в других
местах. Только небольшая часть кадмия, содержащегося в мексиканских
рудах, извлекается и рафинируется в этой стране: основная же часть (в виде
рудного концентрата или побочного продукта) транспортируется в США
для переработки. Концентраты, получаемые из руд Юго-Западной Африки,
также переплавляются в других странах. Руды Тасмании перерабатываются
в Австралии. В частности, цифры, характеризующие производство кадмия
в США, не отражают точно количества кадмия, извлекаемого из руд, добы-
тых в этой стране.
В 1945 г. цена кадмия составляла 2,2 долл. за 1 кг, к концу 1950 г.
она поднялась до 5,5 долл. за 1 кг, а в 1959 г. снизилась до 2,9 долл. за 1 кг.
Увеличение производства кадмия, по-видимому, зависит от полноты
его извлечения из существующих источников или от открытия и промышлен-
ного использования других кадмийсодержащих руд. Вероятнее всего, эти
руды могут быть найдены в месторождениях цинка или цинксодержащих
руд [47]. Кроме того, некоторое количество кадмия можно извлекать как
вторичный металл из баббита, сплавов и, возможно, из отслуживших дета-
лей с кадмиевым покрытием.
266 _____ Глава 13
ИЗВЛЕЧЕНИЕ
Кадмий и его соединения обычно имеют более низкие температуры пла-
вления и кипения, чем аналогичные соединения цинка. Кроме того, окись
кадмия легче восстанавливается, чем окись цинка. На этом основано полу-
чение кадмия из побочных продуктов при плавке цинка *шбо при плавке
свинцовых или медных руд, в которых присутствуют цинк и кадмий
[39].
Первый промышленный способ, теперь имеющий лишь историческое
значение, заключался в грубом разделении во время восстановления цинка
в реторте. Обожженную цинковую руду, смешанную с углем или коксом,
загружали в реторту. Реторту соединяли с первичным конденсагором
и насадкой для улавливания цинковой пыли (фактически вторичный кон-
денсатор). Во время восстановления обожженной цинковой руды при внеш-
нем нагреве цинк и кадмий испарялись; основная часть цинка и некоторое
количество кадмия конденсировались в первичном конденсаторе. Из-за
более низкой температуры кипения большая часть кадмия не улавливалась
в первичном конденсаторе, а вместе с некоторым количеством цинка кон-
денсировалась в насадке в виде «синего порошка». Этот синий порошок,
содержавший 3—5% кадмия, вновь восстанавливали углем или коксом
и подвергали тщательной повторной дистилляции для получения чистого
металлического кадмия и частично окисленного порошка кадмия. Порошок
кадмия возвращали на восстановление и дистилляцию. Потери при этом
методе были высокие; извлекалось только 25% кадмия. По мере развития
металлургии цинка и кадмия этот способ был вытеснен более совершенными
способами восстановления.
В современной практике используется целый ряд разнообразных спо-
собов, но все они по существу представляют собой комбинации основных
способов, приводимых ниже.
Первичное извлечение кадмия
1. В виде конденсата, получаемого при обжиге цинковой руды, спека-
нии обожженной цинковой руды, плавке меди или плавке свинца в шахтной
печи. Концентрация кадмия в этих конденсатах иногда повышается
с помощью пирометаллургических приемов.
2.В виде шламов, получаемых при очистке растворов сульфата цинка
(из обожженной руды). Растворы сульфата цинка используются в производ-
стве литопона или для электроосаждения цинка.
Рафинирование
1. Растворение конденсатов или шламов (обычно в серной кислоте),
удаление примесей химической обработкой, осаждение кадмия (в виде
губки) при добавлении цинковой пыли. Затем кадмий плавится и дистилли-
руется; обычно для получения более чистого продукта применяется тща-
тельная повторная дистилляция.
2. После растворения конденсатов или шламов и очистки растворов
(как указано выше) проводится электролитическое осаждение кадмия
из очищенного раствора. Электролитический кадмий обычно отличается
высокой степенью чистоты.
3. Дистилляция металлического цинка, содержащего кадмий.
Кадмий 267
Извлечение кадмия
В литературе имеется полное описание* различных способов извлече-
ния [8, 25, 27, 39, 41]; ниже приводятся лишь основные способы.
При окислительном обжиге цинковых руд некоторое количество кадмия
оказывается в возгоне, особенно если не осуществляется тщательный конт-
роль за температурой. Эти возгоны можно улавливать в соответствующих
улавливающих приспособлениях (например, бегхаузах и электрофильтрах).
Часто их смешивают с другими пылями для извлечения кадмия. Обжиговые
пыли обычно содержат только 3—5°о кадмия. После обжига цинковую
руду, содержащую большую часть кадмия, подвергают дальнейшей обра-
ботке пирометаллургическими или мокрыми методами для извлечения
металла.
При обычном пирометаллургическом процессе обожженную цинковую
руду смешивают с углем или коксом и хлоридом натрия и загру-
жают в агломерационную печь. Сгорание угля обеспечивает на поде тем-
пературу, необходимую для реакции хлорида с кадмием, свинцом и некото-
рыми другими примесями. Эти примеси улетучиваются и собираются обычно
в электрофильтре. При температуре спекания хлорид, однако, заметно
не действует на цинк, и он остается в агломерате [8]. Конденсированный
цинк, полученный в качестве побочного продукта, может содержать
до 25°6 кадмия, в зависимости от содержания его в первоначальном агло-
мерате.
На некоторых предприятиях в этот процесс вводятся различные видо-
изменения. Если за один проход через агломерационную машину возго-
няется не весь кадмий, то остаток может собираться в нижних слоях агло-
мерата. Для извлечения кадмия нижнюю часть агломерата отделяют от верх-
ней части (содержащей небольшое количество кадмия) и возвращают в агло-
мерационную печь. Верхний слой передают на операцию восстановления [9].
Цинковый агломерат смешивают с углем или коксом и загружают в реторты
для восстановления и дистилляции металлов одним из обычных способов
(в горизонтальных ретортах, электротермическим способом и т. д.).
При некоторых операциях плавки свинца в шахтной печи в случае
присутствия кадмия и цинка в руде конденсат из печей содержит окислы
этих двух металлов. Подобным же образом при некоторых операциях
выплавки меди образуются пары, содержащие кадмий- В некоторых слу-
чаях конденсат по мере его образования собирают в пылеуловительных
камерах, в других случаях [27] осуществляют рециркуляцию паров для
повышения концентрации кадмия перед улавливанием. Такие конденсаты
обычно содержат не больше 5% кадмия.
В этих конденсатах перед стадией очистки необходимо повышать содер-
жание кадмия. Обычно это достигается повторным испарением пылей при
контролируемых условиях для избирательной возгонки кадмия в обжига-
тельной или в отражательной печи [27]. В некоторых случаях пыли из свин-
цовых шахтных печей взаимодействуют с кремнистым флюсом, при этом
кадмий испаряется; образовавшийся силикат свинца возвращают в шахтную
печь [72]. Дальнейшая переработка конденсатов для извлечения и очистки
кадмия описана ниже в этом разделе.
Для извлечения кадмия из обожженных цинковых руд применяется
также гидрометаллургический способ. Из раствора сульфата цинка, при-
меняемого в производстве литопона или при электроосаждении цинка.
* См. также Д. М. Ч и ж и к о в. Кадмий, Изд. АН СССР, 1962. —
Прим. ред.
268 __ Глава 13
необходимо удалять все металлы, оказывающие вредное влияние на эти
процессы. В производстве литопона присутствие металлов, дающих цветные
сульфиды или сульфаты, нежелательно; при электролизе цинка некоторые
металлы мешают электроосаждению.
При приготовлении раствора сульфата цинка обожженную цинковую
руду (неочищенную окись цинка; выщелачивают серной кислотой. Нераст-
воримую часть отфильтровывают и сульфат цинка очищают химическими
методами. На одной из стадий этой очистки для осаждения меди и кадмия
добавляется избыток цинковой пыли 139]. Этот медно-кадмиевый кек обра-
батывают далее, как описано в следующем разделе.
Рафинирование
Указанные выше конденсаты, шламы и кеки, которые могут содержать
5—50% кадмия, обычно обрабатывают серной кислотой. Если присутствуют
восстанавливающие агенты (например, SOs), то их необходимо нейтрализо-
вать окислителем. Свинец осаждается в виде сульфата свинца. Некоторые
другие примеси отделяют химическими методами, при этом в растворе
остаются главным образом медь и кадмий (иногда мышьяк). Медь и кадмий
фракционирование осаждают в виде губки цинковой пылью. Количество
используемой цинковой пыли в некоторой мере зависит от степени оконча-
тельной очистки (плавка кадмиевой губки или электроосаждепие кадмия
из раствора). Отработанный щелок возвращают в процесс для извлечения
цинка.
Видоизменение описанного выше метода концентрирования остатков,
содержащих кадмий, включает прямую обработку газообразным хлором
[381. Взвесь шлама хлорируют, при этом кадмий переходит в раствор.
Раствор фильтруют, подкисляют и осаждают кадмий цинковой пылью (как
описано выше).
Присутствие мышьяка в пыли, уносимой в дымоход, и шламах требует
чрезвычайной осторожности при работе и соответствующей вентиляции,
особенно в тех случаях, когда применяется кислота. Мышьяковистый
водород образуется легко, и при использовании цинковой пыли в кислом
растворе создаются весьма благоприятные условия для его образования.
Вдыхание даже небольших количеств этого газа может привести к смерти,
так что необходимо принимать меры для полной безопасности.
Fc-ли кадмий извлекается из осажденной губки пирометаллургическим
способом, то добавление цинковой пыли к раствору контролируют, чтобы
получить чистую кадмиевую губку. Это достигается неполным осаждением
кадмия. Остаток кадмия в растворе извлекают при повторной обработке
раствора. Кадмиевую губку брикетируют для уменьшения потерь при окисле-
нии и загружают в реторту. В случае необходимости для восстановления
окисла добавляется немного кокса. Кадмий из реторты дистиллируют
и затем повторно дистиллируют при тщательно контролируемых условиях
для получения чистого кадмия. Этот чистый кадмий переплавляют подслоем
каустической соды и отливают в соответствующие формы.
При извлечении кадмия из губки электролитическими методами допу-
скается наличие некоторого количества цинка в электролитических ваннах.
Таким образом, для осаждения всего кадмия к раствору, содержащему
кадмий, добавляют избыток цинковой пыли, а очищенную цинккадмиевую
губку используют для приготовления исходного раствора для электроли-
тических ванн. Эту губку окисляют, растворяют в разбавленной серной
кислоте и подвергают электролизу при напряжении 2,6—2,7 в и силе тока
Кадмий 269
0,0043—0,0108 а/см2 [41] с применением алюминиевых катодов и анодов
из свинца или дурайрона. В электролите необходимо поддерживать избыток
кадмия по отношению к цинку; в случае необходимости для осаждения
цинка добавляют известковое молоко. С целью уменьшения склонности
кадмия к осаждению в неправильных формах используют клей.
Частично кадмий извлекается непосредственно из содержащего кадмий
металлического цинка прямой дистилляцией. Этот процесс в сущности
основан на стандартных принципах ректификации, применяемых в химии.
Цинк кипит при 907°, кадмий — при 767°, а свинец — при 1750е [591.
Цинк, который содержит свинец и кадмий, плавят и подают в ректифика-
ционную колонну, в которой он разделяется на свинцово-цинковый сплав
(жидкий) и пары цинка и кадмия. Эти пары конденсируют и подают во вто-
рую ректификационную колонну; жидкий цинк собирается на дне колонны,
а пары кадмия— в конденсаторе. Затем кадмий рафинируют и отливают
в формы.
ФИЗИЧЕСКИЕ СВОЙСТВА
Кадмий во многих отношениях имеет сходство с цинком. Хорошее при-
липание электролитического кадмия к металлам, особенно к сплавам, содер-
жащим железо, стойкость против коррозии и физические характеристики
таких покрытий [39] привели к его широкому использованию.
Физические свойства кадмия приведены в таблице.
ХИМИЧЕСКИЕ СВОЙСТВА
Кадмий почти всегда двухвалентен; эта валентность проявляется
во всех его устойчивых соединениях.
Во влажном воздухе при комнатной температуре на металле медленно
образуется тонкая пленка окиси кадмия. При более высоких температурах
кадмий окисляется с образованием коричневого порошка CdO. Кадмий
не реагирует с водой при комнатной температуре, но пары кадмия с водяным
паром образуют окись кадмия и водород; реакция обратима.
Кадмий реагирует с галогенами с образованием соответствующих гало-
генидов, причем хлор наиболее активен. Большинство неорганических
кислот и некоторые органические кислоты растворяют кадмий; самым луч-
шим растворителем из них является азотная кислота. В отличие от цинка
кадмий нерастворим в щелочах и, следовательно, не обладает амфотерными
свойствами. Кадмий, однако, растворяется в растворе нитрата аммония,
образуя комплексное соединение кадмия и аммония.
При качественном определении кадмий вместе с другими металлами
II группы осаждается в виде сульфида ярко-желтого цвета. Если присут-
ствуют другие металлы II группы, то осадок сульфидов повторно раство-
ряют, добавляют избыток вечного раствора аммиака (появляющийся осадок
отфильтровывают), затем приливают раствор цианида калия для уничтоже-
ния окраски, обусловленной присутствием ионов меди, и сульфид кадмия
вновь осаждают сероводородом [67].
Для количественного определения кадмия анализируемый образец
растворяют, удаляют мешающие ионы и осаждают кадмий в виде сульфида.
Сульфид кадмия взаимодействием с серной кислотой превращают в сульфат,
раствор выпаривают и попученный CdSO4 взвешивают [3]. По другому
способу сульфид растворяют в соляной кислоте, раствор нейтрализуют
ФИЗИЧЕСКИЕ СВОЙСТВА КЛДМИЯ
Порядковый номер
Атомный вес
Изотопный состав, %
Массовое число 10G
108
ПО
111
112
113
114
116
Цвет
Кристаллическая решетка
Показатель преломления
4360 А (ж.)
5460 А (ж.)
5790 А (ж.)
5890 А'(тв.)
630П Л (тв.)
Твердость по Моосу (литой)
Пластичность
Плотность, г/слг3
20° (тв.)
330" (ж.)
400= (ж.)
600э (ж.)
Удельный объем, см3/г
20° (тв.)
330° (ж.)
Температура плавления, "С
Температура кипения. °С
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал'г
Давление пара, мм pin. cm.
394
484°
578е
611°
711°
767=
Вязкость, спз
350°
400°
500°
600°
Поверхнистное натяжение, дн/си
330°
370 =¦
420°
450 =¦
500=
48,0
112,4
1,4
1,0
12,8
13,0
24,2
12,3
28,0
7,3
[17]
[5]
[5]
[5]
[5]
[3]
[5|
[5|
[5|
Серебристо-белый
Гексагональная ]11]
0,39
0,546
0,82
1,13
1,31
2,0
[53]
' [53]
1531
[53]
[531
[60]
Значительная" [С9]
8,65
8,01
7,93
7,72
[17]
[5]
[5]
[5]
0,1156
0,1248
321
767
13,2
286,4
1
10
60
100
400
760
2,37
2,16
1,84
1,54
564
608
598
611
600
[17]
[59]
[17]
[5]
[70]
[70|
[70]
|70|
[70]
[70]
[5]
|5|
[5]
|5]
[5]
[5]
[5|
[5]
Кадмий 271
Удельная теплоемкость, кал/г
321—700° (ж.)
25° (тв.)
Коэффициент теплопроводности,
кил/см-сек-град
3583
435=
Коэффициент линейного расширения, град'1
25°
32U—54OD
Удельное электрическое сопротивление,
мком ¦ см
0° (тв.)
400° (ж.)
70U° (ж.)
Электрохимический эквивалент Cd2*, мг/к
Электродный потенциал Cd2* (по отноше-
нию к водородному электроду), в
Поперечное сечение захвата тепловых нейт-
ронов, барн/атпм
Продолжение таблицы
0,0632 [5]
0,055 [17|
0,105 [5]
0,119 [5]
29,8-10-е [17]
150-10-6 [53]
6,83 [17]
33,7 [5]
35,8 [5|
0,582 [41]
-0,40 [7]
2900 15]
едким натром, затем к нему добавляют цианид калия пли натрия и кадмий
выделяют из цианидного раствора путем электролиза [3, 4, стр.
431|.
Описанные выше мокрые методы определения кадмия обычно трудно
применять, и они трудоемки из-за присутствия других веществ. В случае
необходимости проведения большого числа серийных определений кадмия
быстрым и достаточно точным методом является полярографический анализ.
Потенциал полуволны кадмия (по отношению к стандартному каломельному
электроду) равен приблизительно от —0,6 до —0,8 в в зависимости от
подложки. Детали определений зависят от анализируемого образца
[34].
В рудах кадмий лучше всего определять следующим образом. Руду
растворяют обычными методами, полученный раствор выпаривают, соеди-
нения кадмия и другие растворимые вещества растворяют в соляной кис-
лоте и отфильтровывают нерастворимый остаток. После этого концентрация
раствора, содержащего кадмий, доводится до 1 н. по соляной кислоте и кад-
мий определяется обычными полярографическими методами.
Дли определения кадмия (и свинца) в металлическом цинке можно при-
менять стандартные полярографические методы [4, стр. 521].
Кадмий хорошо определяется спектрографическими методами как
в твердой пробе, так и в растворео [4, стр. 5541. Чаще используются спект-
ральные линии 2288,02 и 3261,06 А. При соблюдении достаточной аккурат-
ности и подходящих стандартах можно производить количественное опре-
деление кадмия. Точность определения зависит от прецизионности приме-
няемого спектрографа и при работе на хорошем приборе составляет
5%.
Железо и сталь хорошо противостоят действию кадмия вплоть до 700°,
однако нержавеющая сталь подвергается воздействию при температуре
плавления кадмия 15]. Многие металлы заметно растворяются в жидком
2Ц Глава 13
кадмии; к их числу относятся золото, серебро, кобальт, медь, магний, ртуть,
никель, свинец, платина, сурьма, олово и цинк. Считается, что более туго-
плавкие металлы (ниобий, хром, вольфрам и молибден) обладают некоторым
сопротивлением действию кадмия.
Коррозионная стойкость кадмия изучена чрезвычайно подробно [74].
В атмосфере сельской местности сопротивление коррозии хорошее, но в атмо-
сфере промышленных районов (особенно если присутствует SO2 или SO3)
происходит быстрая коррозия. Кадмиевое покрытие разъедается влажным
газообразным аммиаком в том случае, когда с его поверхности не удаляются
остатки из цианидных электролитических ванн. Ненасыщенные масла реа-
гируют с кадмием, особенно при наличии в них кислотных компонентов.
Сероводород (при высоких концентрациях) и влага быстро разъедают кад-
миевое покрытие; обычные атмосферные концентрации на такое покрытие
не действуют. Двуокись серы, как упоминалось выше, в присутствии влаги
оказывает сильное коррозионное действие. Большинство кислот разъедает
кадмий. Тщательное изучение рН среды па растворах НС1 и NaOH показы-
вает, что коррозия начинается сразу же, как только раствор показывает
кислую реакцию, и быстро возрастает с увеличением концентрации кислоты.
Кислород увеличивает скорость коррозии в водных растворах; при частич-
ном погружении кадмия в раствор на линии поверхности воды это действие
выражено чрезвычайно отчетливо.
токсичность
Пары кадмия и его соединений, а также растворы этих соединений ядо-
виты. Джонстон [30] подробно рассматривает токсическое действие кадмия.
Он считает, что «кадмий, вероятно, оказывает более сильное действие на
организм, чем любой другой металл. Отравление свинцом, ртутью, марган-
цем и многими чругими металлами может вызывать острые или. хрониче-
ские заболевания, но редко приводит к смертельному исходу. При недо-
оценке токсических свойств этого металла (кадмия) рабочие невольно под-
вергались действию его паров. Более того, в этих случаях предпринима-
тели включали кадмий в состав выпускаемой продукции без предупрежде-
ния о его присутствии».
Чаще всего случаи отравления наблюдались при вдыхании паров
кадмия или его соединений. Начальными симптомами отравления являются
сухость и боли в горле, кашель, головная боль, головокружение, затем
лихорадочное состояние и затрудненное дыхание. Очевидно, возникает
острое воспаление легких, вызывающее удушье. Жидкость постепенно
уменьшает объем легких до тех пор, пока кровь не перестанет получать
кислород, вследствие чего и наступает смерть. В тех случаях, когда воз-
можно присутствие паров кадмия, работать следует в защитных
масках.
Имеются сообщения об отравлении кадмием при приготовлении или
хранении пищевых продуктов и напитков в сосудах с кадмиевым покрытием.
При употреблении таких пищевых продуктов и напитков быстро возникают
резкие желудочные боли, сопровождаемые рвотой. Тот факт, что в этих
случаях не наблюдалось смертельного исхода, объясняется, вероятно,
немедленным удалением яда из желудка. Многие санитарные учреждения
в настоящее время запрещают применять для пищевых продуктов сосуды
с кадмиевым покрытием.
Симптомы отравления кадмием и его лечение подробно описаны
Принси [47].
Кадмий 273
СПЛАВЫ
Данные о двойных системах приводятся ниже. Эти сведения обобщены
Бадженом [11], и многие из приводимых ниже данных взяты из его книги.
Баджен описывает также тройные и четверные системы; по этим системам
здесь приводятся лишь краткие сведения.
Двойные системы
Алюминий — кадмий. Алюминий и кадмий взаимно не растворимы
в твердом состоянии. Твердые растворы или химические соединения не обра-
зуются [21].
Висмут — кадмий. Висмут и кадмий взаимно не растворимы в твердом
состоянии [32]. Образуется только одна эвтектика, которая содержит
40 вес.% кадмия и плавится при 140°.
Галлий—кадмий. Кадмий почти нерастворим в галлии при 30°. В кад-
мии растворяется 12—13% галлия с образованием сплава, затвердевающего
при 258° [77].
Железо — кадмий. Кадмий и железо, по-видимому, взаимно не раство-
римы в твердом состоянии [291.
Золото — кадмий. Золото и кадмий образуют два соединения: AuCd
и AuCd3 [75]. При 303° образуется эвтектика, содержащая 87 вес.% кадмия.
Индий — кадмий. Кадмий и индий полностью смешиваются в жидком
состоянии [79]. Образуется эвтектика, которая содержит 25 вес.% кадмия
и плавится при 122,5°. Индий не очень растворим в кадмии в твердом состоя-
нии, однако при 25° он растворяет 15% кадмия.
Кальций — кадмий. Образуются две эвтектики; одна из них, содержа-
щая 99 вес.% кадмия, плавится при 319°, а другая, содержащая 29 вес.%
кадмия, — при 415° [16].
Литий — кадмий. Образуется соединение LiCd; имеются сообщения
о существовании соединений LiCd3 и LigCd [19]. Литий довольно хорошо
растворим в твердом кадмии [42].
Магний — кадмий. Образуется соединение, растворимое как в магнии,
так и в кадмии в твердом состоянии. Состав соединения не установлен
[26, 64].
Медь — кадмий. Образуются два соединения: Cu2Cd и Cu2Cd3 [61, 63].
Эвтектики образуются при содержании 60 вес.% кадмия (плавится при
542°) и 99 вес.% кадмия (плавится при 314°). Кадмий слегка растворим
в твердой меди [55].
Мышьяк — кадмий. Образуются два соединения: Cd3As2 и CdAs2.
Эвтектика содержит 47% кадмия и плавится при 526° [62].
Натрий — кадмий. Сообщается, что двойная система натрий — кадмий
является сложной и характеризуется образованием многих соединений
натрия и кадмия. Сообщается также отрех эвтектиках: при 95° B8 вес. % Cd),
346° (95 вес.% Cd) и 285° (98,5 вес.% Cd) [35, 36, 43, 58].
Никель — кадмий. Никель не растворим в твердом кадмии [71, 76].
Образуется соединение NiCd. Образуется также эвтектика, которая содер-
жит 99,75?4 кадмия и плавится при 318°.
Олово — кадмий. При 29 вес.% кадмия образуется эвтектика, которая
плавится при 176°. По обе стороны эвтектики существуют твердые растворы
[221.
Ртуть — кадмий. Кадмий и ртуть полностью взаимно растворимы
в жидком состоянии, но они лишь частично растворимы в твердом состоянии
120, 45].
18 Заказ № 239
274 Глава IS
Свинец — кадмий. Свинец и кадмий практически взаимно нерастворимы
в твердом состоянии. При 249° образуется эвтектика, содержащая 17,4 вес.%
кадмия [1, 6, 14, 31, 68].
Селен—кадмий. Известно соединение CdSe [13].
Серебро — кддмий. Образуются два соединения серебра и кадмия:
AgCd nAgCdt, которые дают твердые растворы с серебром [18]. Сплав
7,596 кадмия и 92,5% серебра может осаждаться на стали электролитиче-
ским путем из циапидных растворов [28].
Сурьма — кадмий. Образуется только одно устойчивое соедине-
ние — SbCd; второе соединение (Sb2Cd3) неустойчиво. Образуются две
эвтектики; одна из них, содержащая 92 вес.% кадмия, плавится при 292°,
а другая, содержащая 40вес.% кадмия, — при 453° [1, 73]. Сурьма и кадмий
взаимно растворимы в твердом состоянии [52].
Таллий — кадмий. Образуется эвтектика, содержащая 17 вес.% кадмия
и плавящаяся при 203° [561. Таллий растворяет около 10% кадмия в твер-
дой фазе, но кадмий не растворяет таллий.
Цинк — кадмий. Цинк и кадмий слабо взаимно растворимы в твердом
состоянии. Единственная эвтектика содержит 83 вес. % кадмия и плавится
при 270" [24, 371.
Тройные системы
Висмут — олово — кадмий. Образуется тройная эвтектика, содержащая
31,2 вес.% кадмия, 27,9 вес.% олова и 40,9 вес.% висмута, которая пла-
вится при 103° [20].
Висмут — свинец— кадмий. Образуется тройная эвтектика с 8,15 вес. %
кадмия. 40.2 вес.°6 свинца и 51,65 вес.% висмута, которая плавится при
91,5° [61.
Магний — цинк— кадмий. Тройная эвтектика, содержащая 82,9 вес. %
кадмия, 16,6 вес. 9-6 цинка и 0,5 вес.% магния, плавится при 250е [10].
Свинец — олово — кадмий. Образуется тройная эвтектика, которая
содержит 18 вес.% кадмия, 32 вес.°6 свинца и 50 вес.°6 олова и плавится
при 145° [20].
Олово—цинк — кадмий. Тройная эвтектика, содержащая 24,8 вес.%
кадмия, 73,1 вес.% олова и 2,1 вес.96 цинка, плавится при 164° [40].
Многие четверные сплавы используются в качестве припоев и для низко-
температурной пайки; они рассматриваются в разделе «Области примене-
ния».
ТЕХНОЛОГИЯ ПРОИЗВОДСТВА
Кадмий используется главным образом для защитных покрытий изделий
(в основном железных и стальных); большая часть покрытий наносится
электролитическим способом. Кадмий может осаждаться из кислых ванн,
например из сульфатной или фтороборатной, но для нанесения почти всех
кадмиевых покрытий в промышленных условиях применяются цианидные
ванны [7, 66].
Кислые ванны не дают хороших покрытий без эффективных добавок
и, кроме того, характеризуются малой производительностью. Сульфатные
ванны используются при электролитическом осаждении в тех случаях, когда
получение равномерного покрытия необязательно (см. раздел «Извле-
чение»).
Цианидные ваины состоят в основном из раствора окиси кадмия и циа-
нида натрия в воде; предполагают, что в растворе присутствуют комплекс-
Кадмий 275
ный цианид кадмия — натрия и свободный едкий натр. Типичный состав
ванны: окись кадмия — 32 г/л, цианид натрия — 76 г/л. Концентрация
кадмия в промышленных ваннах может быть на 50% выше или ниже ука-
занной. При низких концентрациях в ванну для придания блеска поверх-
ности обычно добавляют фурфурол, некоторые сульфокислоты, сульфитный
щелок и т. д., а прн высоких концентрациях — никель и кобальт. Покрытия
наносят при комнатной температуре, применяя при этом аноды из кадмия
высокой степени чистоты. Плотность тока на аноде не превышает 0,021 а/см2,
плотность тока на катоде может изменяться в пределах 0,005—0,054 а/см2.
Электролитические кадмиевые покрытия для очистки и пассивации
поверхности обычно погружают в разбавленные растворы окислителей
(азотной кислоты, хромовой кислоты или перекиси водорода). Допускается
только кратковременное погружение. При более длительной выдержке
уменьшается толщина кадмиевого покрытия, в результате чего снижается
его защитное действие. В некоторых процессах для придания блеска
используются некоторые органические вещества.
В производстве сплавов кадмия, имеющих промышленное значение,
очевидно, не встречается затруднений. Особых указаний о принятии каких-
либо мер предосторожности, кроме обычных, при плавке и литье таких
сплавов нет. Легкость окисления кадмия на воздухе может вызвать необхо-
димость принятия дополнительных мер предосторожности при выпуске
таких сплавов.
Кадмий редко используется самостоятельно, поэтому производство
чистого металла здесь не рассматривается. Антифрикционные сплавы,
содержащие кадмий, отливаются обычными способами; отливка других
сплавов не связана с особыми трудностями.
ОБЛАСТИ ПРИМЕНЕНИЯ
Выпускаемый металлический кадмий используется большей частью
для нанесения защитных покрытий на железо и сталь и, в значительно мень-
шей степени, на медь 150]. Несмотря на сходство свойств цинка и кадмия,
кадмий значительно легче дает ровные и гладкие покрытия, которые обла-
дают большим сопротивлением к атмосферной и гальванической коррозии,
чем соответствующие цинковые покрытия. Кроме того, кадмий устойчив
к действию щелочей, в то время как цинк разъедается щелочными раство-
рами. Цинк и кадмий не особенно устойчивы к действию кислот.
Кадмиевые покрытия наносятся на детали малых и больших размеров,
применяемые для разнообразных целей. Однако кадмий почти никогда
не используется при изготовлении оборудования или контейнеров для
пищевых продуктов или напитков, так как ядовит (см. раздел «Токсич-
ность»).
Лишь очень редко кадмиевые покрытия наносились погружением изде-
лий в расплавленный металл. В настоящее время этот способ не приме-
няется, и его почти целиком вытеснило электролитическое осаждение.
Примерно 10% кадмия идет на изготовление сплавов. Эти сплавы
используются как антифрикционные материалы, припои, электрические
проводники и в ювелирном деле.
Антифрикционные сплавы на основе кадмия используются для высоко-
скоростных автомобильных, авиационных и судовых двигателей, работаю-
щих в условиях высоких температур. Имеется два типа таких сплавов:
один, содержащий около 1% никеля, остальное кадмий, и другой, содер-
1й*
275 Глава 13
жащий 0,7% серебра, 0,6% меди и более 98% кадмия. Из-за низкой стой-
кости кадмия к действию кислот, а следовательно, и к действию органиче-
ских ^кислот, содержащихся в смазочных материалах, кадмиевые подшип-
ники иногда покрываются индием [65]. В некоторые баббиты, содержащие
свинец, сурьму и олово, также вводятся небольшие количества кадмия для
повышения прочности.
Кадмий входит в состав многих припоев. Сплавы ципк — олово —
кадмий используются для высокотемпературных припоев. Из-за дефицит-
ности олова во время войны или по другим причинам олово частично или
полностью заменялось кадмием в мягких припоях, особенно в сплавах
свинец — олово и свинец — олово — медь.
Сплавы серебра и кадмия с различным содержанием меди и цинка,
а иногда и других металлов, широко применяются для пайки твердым
припоем. Эти сплавы можно успешно применять для удовлетворительного
соединения черных и цветных металлов. Некоторые из этих припоев с золо-
том и без него используются в ювелирном деле [48].
Легкоплавкие сплавы, содержащие различные количества висмута,
¦свинца, олова и кадмия, используются в спринклерных системах, приборах
для обнаружения пожара и т. д., а также для низкотемпературной пайки.
Некоторые из этих сплавов используются для пробных отливок в тех слу-
чаях, когда имеет значение точность литьн. При добавлении небольших
количеств кадмия к меди получается сплав, обладающий почти такой же
ысокой электропроводностью, как и чистая медь, большей прочностью
и твердостью.
Сульфид н сульфоселенид кадмия применяются в качестве красящих
пигментов. Галогениды кадмия используются в фотографии.
Кристаллический сульфид кадмия высокой степени чистоты приме-
няется в фотогальванических элементах, приборах для обнаружения излу-
чения, при изготовлении окон, пропускающих инфракрасное излучение,
и в фотоэлементах. Описано [44] получение этих кристаллов высокой сте-
пени чистоты. Представляет интерес также его применение в солнечных
батареях для преобразования солнечной радиации в электрическую энер-
гию. Изготовлены экспериментальные устройства, которые более эффек-
тивны, чем другие устройства.
Небольшое, но важное научное значение имеет применение кадмия
в нормальном элементе Вестона, который является действующим стандар-
том в США для определения величины вольта [121. Нормальный элемент
состоит из амальгамы A2,5 вес.% кадмия и 87,5 вес. % ртути) с кристаллами
сульфата кадмия и насыщенным раствором сульфата кадмия (отрицательный
полюс) и ртути и сульфата ртутиA) с кристаллами сульфата кадмия и насы-
щенным раствором сульфата кадмия (положительный полюс). Портативный
действующий нормальный элемент не имеет кристаллов сульфата кадмия;
растворы сульфата кадмия насыщаются при 4°, при этом образуется раствор,
который является ненасыщенным при комнатной температуре. Э. д. с.эле-
мента Вестона равна 1,0186 в [15].
Другое сравнительно небольшое применение кадмий находит в иике-
лево-кадмиевых аккумуляторах. В этих аккумуляторах отрицательные
пластины состоят из железных сеток с губчатым кадмием (и железом)
в качестве активного агента, а положительные пластины также состоят
из железных сеток с окисью никеля в качестве активного компонента.
Электролитом служит водный раствор едкого кали; иногда добавляется
гидроокись лития. Тщательное сравнение действия свинцовых (кислотных)
и никелево-кадмиевых (щелочных) аккумуляторов [78] показывает, что
Кадмий 277
последние имеют лишь незначительные преимущества. Однако в тяжелых
условиях работы эти аккумуляторы действуют превосходно.
Нагали применение никелево-кадмиевые аккумуляторы специального
назначения, отличающиеся по своему устройству от описанных выше,
особенно аккумуляторы малых размеров. В этих аккумуляторах отрица-
тельными пластинами являются никелевые сетки с нанесенным иа них губ-
чатым кадмием, а положительными — никелевые сетки с нанесенным
на них окислом никеля. Электролитом служит водный раствор едкого кали.
Эти аккумуляторы имеют особые преимущества и изготавливаются в каче-
стве источника питания для управляемых ракет.
Применение кадмия в ядерных реакторах не является основным, тем
не менее этот металл имеет важное значение. Кадмий обладает способ-
ностью отфильтровывать нейтроны с низкой энергией (тепловые), и когда
кадмиевые стержни помещаются в реактор, поглощение тепловых нейтронов
дает возможность управлять цепной реакцией. При соответствующем регу-
лировании кадмиевого стержня можно контролировать скорость деления
ядер и тепловыделение, что позволяет достигать желаемой мощности или
при необходимости останавливать цепную реакцию [51]. Благодаря свой-
ствам, которые указаны при описании его использования в атомных реак-
торах, кадмий можно применять также как материал, идущий на изготовле-
ние контейнеров для урановых элементов.
ЛИТЕР AT У РА
1. Abel Е., Redlich О., Adler J., Z. anorg. allgefn. Chem., 174, 269
A928).
2. A hrens L. H., S. African J. Sci., 41, 152 A945).
3. ASTM, Methods for Chemical Analysis of Metals, Philadelphia, 1950, p. 411—412.
4. ASTM, Methods for Chemical Analysis of Metals, Philadelphia, 1956.
5- Atomic Energy Commission, Liquid Metals Handbook, 2nd ed., Government Prin-
ting Office, Washington, D. C, 1952, p. 40.
6. В a r 1 о w E., J. Am. Chem. Soc, 32, 1390 A910).
7. Blum W., Hog a boom G. В., Principles of Electroplating and Electro-
forming, McGraw-Hill Book Company, Inc., New York, 1949.
8. В г а у J. L., Non-Ferrous Production Metallurgy, John Wiley and Sons, Inc.,
New Vork, 1941.
9. В r u d e r 1 i n E. J.. пат. США 2178366, October 31, 1939.
10. Bruni C, S a n d о n i n i C, Q u e г e i g h K-, Z. anorg. Chem-, 68, 7Э
A910).
11. В ii d g e n N. F., Cadmium: Its Metallurgy, Properties and Uses, Charles Griffith
and Co., Ltd., London, 1924.
12. Bur. Standards Bull., 4, 1 A907); Bur. Standards Circ. 29.
13. Chikashige-Hitosaka, Mem. Coll. Sci. Univ. Kyoto, 2, 233 A917).
14. D i С а р е г a C, Atti rcale accad. Lincei, E), 31, 1 A922)
15. Dole M-, Principles of Experimental and Theoretical Electrochemistry, McGraw-
Hill Book Company, Inc., New York, 1935.
16. Donski L-, Z. anorg. Clicm., 57, 185 A908).
17. E v e г h a r t J. L., L 1 n d 1 i e f W. E.. К a n eg i s J., W e i s s 1 er P. G.F
S i e g e 1 F., U. S. Natl. Bur. Standards, Cicr. «\° C447, p. 459, 1943.
18. G a u t h i e г Н-, Bull. soc. encour. ind. natl., 5, 1315 A896).
19. Grube G., Vosskukler H., Vogt H., Z. Elektrochem, 38, 869—
880 A932).
278 Глава 13
20. Gulliver G. H., Metallic Alloys, Charles Griffith and Co., Ltd., London, 1921.
21. G wye г Л. G. С, Z. anorg. Chem., 57, 113 A908).
22. H a n s о n D., P e 1 1- W a 1 p о 1 e W. Т., J. Inst. Metals, 56, Advance Copy
Л» 686. 449—470 A935).
23. Herman K- S. L., Gilbert's Ann., 59, 95, 113A818).
24. H i r d i с к s G., Z. anorg. Chem., 55, 415 A907).
25. H of man H. O., Metallurgy of Zinc and Cadmium, McGraw-Hill Поок Company,
Inc., New York, 1922.
26. H u m e ¦ R о t h e г у W., R о w e 1 1 S. W., J. Inst. Metals, 445, Advance Copy
A927).
27. H u t t 1 J. В., Eng. Mining J., 147, 82—85 A946).
28. I n g a 1 I s W. R-, The Metallurgy of Zinc and Cadmium, Eng. Mining J. A906).
29. I s а а с E., T a m m a n G., Z. anorg. Chem., 55, 58 A907)
30. J о h n s t о п e R Т., Occupational Medicine and Industrial Hygiene, The С V.
Mosby Company, St. Louis, 1948, p. 265—276.
31. К a p p A., Ann. phys.. 6, 754 A901).
32. К а р р A., Drudes. Ann., 6754 A901); Dissert., Konigsbcrg.
33. К а г s t e n С J. В., Archiv. Berg. Hutt., 1, 209 A819).
34. Kolthoff I M-, L i n g a n e J. J., Polarography, 2nd ed., Interscience Pub
Ushers, Inc., New York, 1952.
35. К у р н а к о в II. С, Z. anorg. Chem., 23, 439 A900).
36. Курнаков Н. С, Z.'anorg. Chem., 52, 173 A907).
37. L e В 1 а п с M., Schopel H., Z. Electrochem., 39, 695—701 A933)
38. L e v e r e t t W. H., пат. США 2138281, November 29, 1938.
39. L i d d e 1 1 D. M., Handbook of Nonferrous Metallurgy. Recovery of the Metals,
McGraw-Hill Book Company, Inc., New York, 1945.
40. Lorenz R, Plumbridge D., Z. anorg. Chem., 83, 22b A913).
41. Man tell С L., Industrial Electrochemistry, McGraw-Hill Book Company,
Inc., New York, 1940.
42. M a s i n g G., T a m m a n G., Z. anorg. Chem., 67, 183 A910).
43. M a t t h e ws о п С H., Z. anorg. Chem., 50, 180 A906).
44. Mcdcalf W. E., Fa h rig R. H., J. Electrochem. Soc, 105, 719 A958)
45. Me hi R. F., Barrett С S., Am. Inst. Mining Met. Engrs., Tecfi. Publ.
J\S 225, 1929.
46. Meissner W-, Gilbert's Ann., 5Я, 99 A818).
47. M e л t с h R. L., Lansche A. M., V. S. Bureau of Mines, Inform. Circ.
Л= 7881, 1958.
48 Minerals Yearbook, U. S Bureau of Mines, Government Printing Office, Washing-
ton, D. C, 1944.
49. Minerals Yearbook, U. S. Bureau of Mines, Government Printing Office, Washing-
Ion, D. C, 1945.
50. Minerals Yearbook, U. S. Bureau of Mines, Government Printing Office, Washing-
ton, D. C, 1950.
51. Minerals Yearbook, U. S. Bureau of Mines, Government Printing Office, Washing-
ton, D. C, 1957.
52. Murakami Т., Shinagawa Т., Kinzokuno-Kenkyu, 5, 283—296 A928).
53. National Research Council, International Critical Tables of Numerical Data, Physics,
Chemistry and Technology, Vol. V, McGraw-Hill Book Company, Inc., New York,
1926. p. 249.
54. Peirce W M., Waring R. K-. Trans. Am. Inst. Mining Met. Engrs..
121, 445- 152 A936).
65. Погодин С. А., Михеев а В. И., Каган Г. А., Труды института
анал. и физнч химии, 7, 39—47 A935).
Кадмий 279
56. П у ш и н Н. A.. Z. anorg. Chem., 30, 101 A902).
57. R а п к a m a K-. S a h a m a Th G., Geochemistry, University of Chicago
Press, Chicago, 1949, p. 712.
58. R e i n i п в h a m P., Kremmann R., Z. Metallkunde, 12. 273 A920).
59. Rossini F. D., Wag man D. D.. Evans W- H., Levine S.,
J a f f e I.. U. S. Natl. Bur. Standards, Circ. JNs 500, p. 653, 667, 670, 1952.
60. R у d b e г ц J. R., Z. physik. Chem., 33, 353 A900).
61. S a h in e n R., Z. anorg. Chem., 49, 301 A906).
62. Schemtschusehny, J Soc. Chem. lnd., 1209 A911).
63. School s J., Rev. universelle mines, 6, 278—284 A950).
64. S с h u 1 z e G. E. R . Z. Metallkunde, 32, 252 A940); Met. Abstr. (in J. fnst.
Metals), S, 326 A941).
65. Smart С F., Trans. Am. Inst. Mining Met. Engr., 128. 295—310 A938).
66. Sod er berg G., West brook L. R., Trans. Electrochcm. Soc., 80, 429
A911).
67. S t i e g I i t z J., The Elements of Qualitative Chemical Analysis, Vol. 2, Century
Company, New York, 1911.
68. S t о f f e I A., Z. anorg. Chem., S3, 137 A907)
69. Strohmeyer F., Schweigger's J., 22, 362 A818).
70. S t u 1 1 D. R., lnd. Eng. Chem., 39, 540 A947).
71. S w a r t z С E., P h i 1 1 i p s A. J.. Am. Inst. Mining Met. Engrs., lrist. Metals
Div., Contrib. J\° 55, 1933.
72. Teats R., пат. США 1727492, September 10, 1929.
73. T r e i t s с h к e W., Z. anorg. Chem., 50, 217 A906).
74. U h 1 i g H. H., The Corrosion Handbook, John Wiley and Sons, Inc., New York.
1948.
75. V og e I R., Z. anorg. Chem., 48, 333 A906).
76. V о s s G., Z. anorg. Chem., 57, 34 A908).
77. W i 1 к i n s о n W. D., Properties of Gallium, ANL-4109, Argonne National La-
boratory, Chicago, 1948.
78. W i 1 1 i h n g a n z E., Paper Presented at the Convention of the Association
of American Battery Manufacturers, Inc., Chicago, November 1948
79. W i 1 s о п С L., VV i с к О. J., lnd. Eng. Chem., 29, 1164 A937).
14.
КОБАЛЬТ
К- Р. УАЙТТМОР
С. R. Whittemore, Deloro Smelting and Refining
Company, Ltd., Deloro, Ontario
ВВЕДЕНИЕ
Гувер в своем переводе труда Агриколы «Dc Re Metallica» отмечает,
что слово «кобальт» (немецк. Kvbalt) происходит от греческого слова cobalos
(рудник). Этим словом, означающим злой дух (гном или домовой), рудокопы
Саксонии называли определенные руды, при работе с которыми они повре-
ждали свои руки и ноги; в Европе это наименование нашло широкое рас-
пространение [1]. Позднее было установлено, что это были мышьяковисто-
кобальтовые минералы.
Начало развития химии и металлургии кобальта приходится на сере-
дину XVI в., хотя кобальт применялся в керамическом производстве Египта
и Вавилонии еще в 1450 г. до н. э. Соли кобальта придают керамическим
изделиям синий цвет, а в сочетании с соединениями никеля, хрома или мар-
ганца можно получить все оттенки от синего до зеленого.
Брандт в 1735 г. получил металлический кобальт, а в 1780 г. Бергман
изучил свойства этого нового металла.
В конце XIX в. мировое производство кобальта было сосредоточено
в Германии, Венгрии и Норвегии. В 1864 г. Гарнье открыл в Новой Кале-
донии окисленные руды, которые начали разрабатывать в 1874 г. В 1903 г.
было открыто новое месторождение богатых серебряно-кобальтовых руд
в провинции Онтарио (Канада), где в 1904 г. было добыто 14,5 т кобальта [4].
ПРОИЗВОДСТВО
Страна
Австралия
Бьтшее Бельгийское
Конго
Канада
ФРГ
Марокко
Бывшая Федерация
Родезии и Ньясаленда
США
Общее количество
I0E6 а
11,8
9 087,2
1595
898
649
1 153
1 154
14 5-18
КОБАЛЬТА (В ТОННАХ)
1957 а
12,7
8113,3
1779
998
454
1 436
1496
14 279
1958 а
15,4
6 499,6
1229
1 106
92В
1626
1825
13 227
Таблица 1
[959 а
13,6
8 502
1495 В
1 469,4
1262
2 152
1057
15 951
а U. S. Bureau of Mines, Minerals Yearbook, 1959.
c Центр информации по кобальту.
Кобальт 28t
В 1920 г. было начато извлечение кобальта из медно-кобальтовых руд
в бывшем Бельгийском Конго, откуда до сих пор поступает основная масса
кобальта.
В табл. 1 приводятся данные о добыче кобальта в ряде стран.
Текущая цена кобальта составляла 3,3 долл. за 1 кг металла со степе-
нью чистоты 98—99%.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Кобальт [2] чрезвычайно рассеян в изверженных породах; содержание его
в земной коре составляет всего 0.0023% по сравнению с 0,008% для никеля.
По своей распространенности этот элемент стоит на 34-м месте. Содержание
кобальта, как это отмечалось в главе «Редкие металлы», выше содержания
свинца и составляет примерно 1,'а содержания меди. Несмотря на это, его
промышленное производство находится на одном уровне с серебром — эле-
ментом, гораздо менее распространенным. Сравнительно небольшое коли-
чество руд разрабатывают главным образом с целью извлечения кобальта,
большую же часть этого металла получают как побочный продукт при пере-
работке медных и никелевых руд.
Основными кобальтовыми минералами являются сульфиды, арсениды
и окисные соединения [2, 3, 5—7]. В табл. 2 приведены некоторые свойства
этих минералов и указаны их месторождения.
ОБОГАЩЕНИЕ
Все кобальтовые руды содержат кобальт в очень низких концентрациях
совместно с другими металлами, и поэтому их необходимо подвергать спе-
циальному обогащению с целью получения материала, пригодного для извле-
чения металла. Для обогащения различных руд, добываемых в настоящее
время, применяется несколько способов. Эти способы обогащения рассмот-
рены ниже.
Халькопирнто-кобальтиновые руды
Примером этих сульфидных руд могут служить месторождения в районе
Блэкбёрд (графство Леми, штат Айдахо), которые содержат 0,4—1% кобаль-
та[8). Кобальтин, главным образом в виде включений, ассоциируется с халь-
копиритом, пиритом и пирротитом, а также встречается на плоскостях спай-
ности хлоритово-слюдяных сланцев. Кроме кобальта, эта руда обычно
содержит 1—2% меди, 10—15% железа, 0,5—1,5% мышьяка и 3—13% серы.
В 1943 г. фирма «Калера майнинг» начала разработку месторождений
и освоила процесс извлечения меди и кобальта.
Обогащение добытой руды производится после размалывания руды
на 65% до —200 меш путем дифференциальной флотации [1, 6]. Медный
концентрат флотируется при рН 9; пульпа, содержащая железо и кобальт,
сначала активируется для отделения железа и затем флотируется для
отделения кобальта. Кобальтовый концентрат, который после очистки
содержит в среднем 17,5% Со, 20% Fe, 1,096 Ni, 0,50% Си, является сырьем
для рафинировочного завода Гарфилд фирмы «Калера майиииг».
Сульфидные руды меди, свинца, кобальта, никеля [2, 6, 11]
Смешанные сульфидные руды свинца, меди, кобальта и ииксля, ассо-
циированные с пиритом, найдены в Фредериктауне (графство Мэдисон,
282
Г л а
за 14
Таблица 2
МЕСТОРОЖДЕНИЯ И НЕКОТОРЫС СВОЙСТВА КОБАЛЬТОВЫХ МИНЕРАЛОВ
Минерал
Карролнт
Лиинеит
Смальтин
Скуттерудит
Кобальтин
Асболан
Гетерогенит а
Эритрии
Формула
CuS-Co2S3
Co3S4
CoAs2
CoAs3
CoAsS
CoO-MnO2-4H2O
2Co,O3-CoO-6H2O
3CoO-As2O5-8H2O
Состав, %
Co
Си
38,0 20,5
57,9
—
28,2
20,8
35,5
35,0
57,3
29,5
—
—
—
—
s
41.5
42,1
—
—
19,3
—
As
_
-
71,8
79,2
45,2
—
—
25,0
Удел ь-
НЫЙ
вес
4,84
4,90
6,50
6,79
6,3
1,1
3,0
Месторождение
Родезия
Содержание ко-
бальта изме-
няется от 31
до 40% в эа-
оисимости от
присутствия
железа, нике-
ля или медн.
Бывшее Бель-
гийское Конго
и шт. Миссу-
ри
Германия, Ка-
нада, бьшшсс
Французское
Марокко
Марокко, Нор-
вегия
Канада, Бирма,
Австралия
Новая Каледо-
ния, Северная
Родечия. Со-
держание ко-
бальта 4—
35%
Бывшее Бель-
гийское Кон-
Канада, Герма-
ния, Марокко
а Разновндиость очень редкого стеннернта НСоОо. — Прим. ред.
штат Миссури). Источником кобальта и никеля является зигенит (Со, NiKS4,
в котором железо и медь частично замещают кобальт. Типичный состав руды:
1,28% свинца, 2,03% меди, 1,О8°6 никеля, 0,87% кобальта, 3,57% железа.
15,4% окиси кальция, 23,9% кремния.
Ввиду близкой ассоциации и комплексности минералов логично приме-
нять флотацию, посредством которой концентрация кобальта увеличивается
в 10 раз. К измельченной в известково-цианидном цикле до —100 меш руде
добавляют флотационный агент «эйрофлоут 31» для отделения медных и свин-
цовых минералов, которые оседают во флотационных ваннах в виде едино-
го концентрата; затем производят разделение меди и свинца. Пульпа из
Кобальт 283
медно-свинцового цикла переливается в отдельную батарею ванн, куда для
извлечения зигенита добавляют «ксантат Z-8» и вспенивающий реактив. Свыше
2/з кобальта, содержащегося в руде, извлекается в виде кобальто-никеле-
вого концентрата, который обычно содержит 9,3% кобальта, 14,4% никеля
и 5,5% меди.
Медио-кобальтовые окисленные руды [3—11]
Кобальтсодержащие руды в бывшем Бельгийском Конго являются
комплексными и содержат окисленные и сульфидные минералы. Избиратель-
ное обогащение меди и кобальта пока еще не разработано.
Три типа руд перерабатываются раздельно на обогатительной фабрике
Колвези [3, Ш:
1) окиспая медная руда, содержащая небольшое количество кобальта;
2) медно-кобальтовая окисленная руда примерно с одинаковым содер-
жанием кобальта и меди:
3) смешанная руда, содержащая медно-кобальтовые окислы и медно-
кобальтовые сульфиды.
Верхние отложения содержат преимущественно минералы: малахит
Си->(ОНJСО3, псевдомалахит*, хризоколлу CuO-SiO2-H2O** и гетерогенит
СОгСОбИО
Окисленные руды, содержащие 5—6% меди и 0,2—0,3% кобальта,
размалываются в мокром состоянии до —65 меш, к ним добавляются для
флотации соединений меди сода, силикат натрия и пальмовые жирные кис-
лоты. Концентрат содержит 26—27% меди и 1% кобальта.
В нижних отложениях находятся минералы халькозин Cu2S, борнит
Cu5FeS4, халькопирит CuFeS2 и карролит CuS-Co2S3. Рудная порода
является кремне-доломитовой. Руда, содержащая 5% меди и 0,1—0,2%
кобальта, легко обогащается флотацией в щелочном цикле при использова-
ксантогепата и пенообразователя. Концентрат содержит 45—60% меди
и 0,5—2% кобальта.
Смешанные руды (сульфидные и окисные) содержат 4—6% меди
и 0,2—0,3% кобальта, обычно в форме окисла. Обогащение достигается
путем следующих операций: 1) размола до умеренной тонины G0% до
—200 меш); 2) флотирования халькозина с помощью амилксантогената и
пенообразователей; 3) флотирования малахита путем поверхностной сульфи-
дизации и последующего собирания ксантпгенатом и 4) повторного размола
и флотации промежуточного сульфидного продукта.
Сульфидный концентрат подвергают обжигу с получением сульфата
и выщелачиванию па электролитическом заводе Колвези. Окисный концен-
трат спекают и подвергают плавке в электрической печи для получения чер-
нового медно-кобальтового металла, из которого далее путем соответ-
ствующей обработки получают анодную медь и кобальтовый шлак, идущий
затем на переработку.
Медно-кобальтовые сульфидные руды
Фирма «Рокана» (Северная Родезия) получает кобальт из медных руд
Н'Кана, состоящих из таких сульфидных минералов, как халькопирит
CuFeS2, халькозин Cu2S и карролит CuCo2S4 [5].
* Cu3(OHKIPO4l.~ Прим. ред.
** Упрощенная формула. Волее точно — CuCu3(OHLlSi4Oi0] • пН2О, так как
по структуре хризоколла Слизка к минералам группы монтмориллопита — Прим.
ред.
284
Глава 14
Руда, направляемая на обогащение, содержит в среднем 3% меди,
0,14% кобальта, 2,5% железа, 1,5% серы, 45% двуокиси кремния, 12% окнси
алюминия, 7% окиси магния и 7% окиси кальция. Руду измельчают перед
флотацией на 90% до частиц величиной —200 меш. Концентраты сгущают,
фильтруют и отправляют на плавильный завод для раздельной переработки.
Типичный состав продукта обогащения следующий (вес.%):
Исходная руда
Медный концентрат
Кобальтовый концентрат
Хвосты
Си
3,2
56,8
25,0
0,4
Со
0,14
0,65
3,50
0,05
Fe
2,5
10,4
17,0
S
1,5
24,0
17,5
SiO2
45,0
4,2
21,0
AlsO»
12,0
1,2
5,0
«Чибулама майнс лимитид», расположенная в 15 км иа запад от Китве
в Северной Родезии, принадлежит «Родезией селектин траст» [91.
Запасы руд, которые содержат 5,23% меди и 0,25% кобальта, оцени-
ваются в 7 300 000 т.
В руде Чибулама минералами, имеющими экономическое значение,
являются халькопирит CuFeS2, линнеит Co3S4 и железо-кобальтовый пирит.
Пустой породой в основном является кварцит.
Таблица 3
Содержание, %
Медь
Кобальт
Железо
Сера
Нерастворимый
остаток
Влажность
Исходный
матер и it л
4,77
0,37
—
—
—
Медный
концент-
рат
34,6
0,4
25,3
31,8
6,2
6,8
Кобаль-
товый
концент-
рат
3,1
4,2
33,2
41,6
14,9
8,8
X
0
0
зосты
,14
,025
Степень
медь
93,0
4,6
извлечения,.
кобальт
13,9
80,7
Медные минералы избирательно извлекаются после депрессии кобаль-
товых минералов с помощью известкового раствора цианида иатрия.
Кобальтовые минералы извлекаются после активации сульфатом меди
и добавления серной кислоты до рН 9,0.
Состав типичных продуктов и извлеченных из них материалов приве-
ден в табл. 3.
Канадские серебряно-кобальтовые мышьяковистые руды
Обогащение серебряно-кобальтовых руд в провинции Онтарио до сих
пор еще связано с определенными трудностями, так как для различных
минералов требуется применять индивидуальные способы переработки.
Тонкое листоватое серебро, аргентит* и красная серебряная руда** легко
флотируются; однако сурьмянистое серебро***, дискразит**** и серебро
* Серебряный блеск Ag2S.— Прим. ред.
** Различаюткраснуюсветлуюсеребрянуюр?ду состава AfeAsSa (npvcTHT) и крас-
ную темную серебримую руду состава Ag3SbS3 (пираргирит). Оба минерала являют-
ся сульфидами серебра.— Прим. ред.
•*• Сурьмянистое серебро (анимикит) AgSb.— Прим. ред.
*"• Ag3Sb.— Прим. ред
Кобальт
285
в высокосортных шламах из окисленных жил, так же как и арсениты,
извлекаются с большим трудом.
Типичная схема операций гравитационного обогащения с последующей
флотацией показана на рис. 1.
Для наиболее полного извлечения из кобальтовых руд необходимы сле-
дующие условия: а) самый грубый размол, пригодный для извлечения
кобальта, и б) максимальное удаление серебра и кобальта при флотации
Руда
{0.5-г,0%Со. /,4
¦
Грубый пазмоп
Промежуточный размол
Шаровая мельнице [-80 м
Сепция первичной
\
Хвосты
Ннпссифшинюр
Т
Г
Серебряный
О.Ю7о Со \
lb,Z2/mA$ Хвосты
Мсдешщсильна»
печь
Слан
т -
Флотиционпые ест
Нинцршърит
10-/2% Со
2,8-25,5 пг/т Ад
I
Но плавильный juoud
(дли плавни Ао а Со)
Рис. 1, Схема обогащения канадских серебряно-кобальтовых руд.
Б цикле с шаровой мельницей. В качестве флотационных агентов в шаровую
мельницу добавляют соду эйрофлоут, в первое отделение флотационного
аппарата — сосновое масло и пептазолксантогенат. В случае окисленных
руд d мельницу добавляется сульфат меди.
МЕТАЛЛУРГИЯ КОБАЛЬТА
Металлический кобальт извлекается из кобальтсодсржащих материалов
главным образом двумя способами: а) термическим восстановлением и рафи-
нированием и б) электролизом. Недавно разработан третий способ извлече-
ния кобальта, который включает операции выщелачивания и восстановления
под давлением (гидрометаллургия). Главные особенности процессов извле-
чения, используемых на различных предприятиях, описаны в этом
разделе.
28Л Глава 14 __
Кобальт из окисленных руд [1, 18, 20, 30, 38]
В бывшем Бельгийском Конго кобальт получают из медных месторожде-
ний, содержащих руды с 0,5—10% кобальта. Кобальтовыми минералами
являются гстерогенит, сферокобальтин*, корнетит** и асболан.
Более богатые кобальтовые руды и спеченный кобальтовый концентрат
с обогатительной фабрики Колвези обрабатываются в трех трехфазных
печах на плавильном заводе Панда. Благодаря различию в плотностях
расплавленные металлы, разлитые в литейные ковши, разделяются на два
слоя. Первый, более легкий слой — «белый сплав» —содержит 15% меди,
44% кобальта, 1,5% кремния и 39% железа; второй — более тяжелый
«красный сплав» — содержит 89% меди и 4,596 кобальта. Эти сплавы
разливаются из ковша раздельно. Белый сплав разливается со сливного
носка.ковша в слитки нли гранулируется в воде, а затем перерабатывается
в Бельгии. Красный сплав сливается со дна и подвергается рафинированию
в печи для получения меди. Медь со степенью чистоты 98,5% рафинируется
и отливается в аноды на заводе Шитуру. Рафинировочный шлак A5% кобаль-
та) возвращается в электрическую печь. Обработка белого сплава описана
Янгом [30].
Фирма «Катанга» производит электролитический кобальт на заводе
Шитуру в Джадотвилле при выщелачивании медных концентратов из раз-
личных местных месторождений. Концентраты, которые образуют первич-
ный материал для завода по выщелачиванию меди, содержат также кобальт
в окиспой форме. Окись кобальта лишь слабо растворима в серной кислоте,
но становится растворимой под действием сульфата железа, который при-
сутствует в растворах, возвращаемых в цикл выщелачивания из цикла
электролиза меди, где поддерживается равновесие ионов Fe2+ и Fe3+.
Это дает ежемесячно растворы 200—300 т металла. Поскольку кобальт
не осаждается вместе с медью, его содержание в растворе увеличивается,
пока не достигается равновесная концентрация. Баланс достигается путем
вывода раствора, который в дальнейшем используется для растворения
бедных медно-кобальтовых руд, что позволяет контролировать количество
кобальта, добавляемого в цикл.
Содержащие кобальт растворы (раствор из отделения выщелачивания
и отработанный медный электролит, обогащенный кобальтом) обрабаты-
ваются известковым молоком для удаления железа и меди при рН 5,8.
Полное удаление меди достигается цементацией на гранулированном метал-
лическом кобальте при рН 2,5. Кобальт осаждается известковым молоком
при рН 8,0—8,2, и осадок гидроокиси кобальта, содержащий 1Б% кобальта
и 45% сульфата кальция, растворяется в отработанном электролите для
получения нейтрального раствора.
Первичный электролит содержит 70 г1л твердых веществ в виде суспен-
зии, 24 г/л кобальта и 120 г! л сульфата магния в растворе при рН 7,0.
Электролиз проводится с использованием катодов из мягкой стали и свин-
цовых (с 6% сурьмы) анодов. Катодный осадок сдирается с пластин,
а кобальт из шлама, содержащего 3—4% цинка и увлеченный основной
сульфат, извлекается магнитной сепарацией. Кобальт плавится и рафини-
руется в электрической печи на 1600 ква. Сера удаляется с сштьно известко-
вым шлаком, а цинк испаряется при дразнений. Жидкий кобальт гранули-
руют в воде, высушивают и полируют для продажи.
* Кобальтовый шпат СоСО3.— Прим. ред.
" Синоним псевдоыалахнта Cu3(OHK[POJ; очень редкий.— Прим. ред.
28?
5% никеля, 0,1% крем
0,02% марганца.
Кобальт
Конечный продукт содержит 99% кобальта, 0,5% hi
ния, 0,1% углерода, 0,15% железа, 0,02 %меди и 0,02?-
Мсдно-кобальтовые сульфидные руды [1, 18, 25]
Переработка медно-кобальтовых сульфидных руд поясняется на при-
мере технологии, принятой фирмой «Рокана» для медных руд, содержащих
карролит. Кобальтовый концентрат, содержащий 32% меди, 3,2% кобальта,
13% железа и 23% серы, подвергают сульфатизирующему обжигу для пре-
вращения кобальта в сульфат при контролируемых условиях в отношении
температуры и атмосферы печи. Сульфат кобальта выщелачивают водой
при 80—85е и получают раствор, содержащий 20—25 г/л кобальта, 7—10 г/л
меди и 0,3—0,4 г/л железа. Остаток перерабатывают в плавильной печи
для извлечения меди.
Содержание железа-и меди снижается до 0,2 и 0,02 г/л соответственно
окислением раствора на воздухе и обработкой его известковым молоком
до рН 5.5. Осветленный раствор пропускают над гранулированным и отож-
женным кобальтом (размер частиц 6,35 мм) для удаления меди цементацией
до концентрации меньше 0,001 г/л. Раствор, содержащий 15 г/л кобальта,
обрабатывают известковым молоком для осаждения кобальта в виде Со(ОНJ
при рН 8,2. Гидроокись кобальта, содержащая 40—45% твердого вещества,
добавляется в отработанный электролит.
Очищенный электролит нагревают до 70° и пропускают через, электро-
литические ванны с такой скоростью, чтобы кислотность уменьшилась
до рН 1,8. Аноды изготовляются в форме сетки из сплава свинца с сурьмой,
плотность тока на них составляет 0,021 а/см*; катоды делаются из мягкой
стали, плотность тока на катоде равна 0,016 а/см2.
Металлический кобальт, снятый с катодов, плавят в электрической
печи и гранулируют в воде. Металл содержит 99,89% кобальта, 0,041%
меди, 0,032% железа, 0,019% серы и 0,006% кальция.
Мышьяковистые кобальтовые руды
Современные методы переработки кобальтовых руд Канады и Марокко
представлены на примере фирмы «Делоро смелтинг энд рифайнинг» (про-
винция Онтарио). Ниже указан типичный состав перерабатываемых кобальт,
содержащих материалов:
Материал
Состав.
ToRbift кончен-1
трат
Руда из бывшего
Французского
Марокко
Канадский сереб-
ряно-кобальто-
вый концентрат
Aga
',83—25
0,19
70,87
,51
Сп
11,3
9,6
5,56
9,0
0,92
0,9
0,11 1,
Fe
6,0
1,8
0,8
As
31
43
11
s
10
1,7
3
SiO2
10,7
27,5
19,4
caO
3,5
4,5
9,3
a Содержание серебра выражено в кг/т.
288 Глава 14
Руду или концентрат с коксом, железным ломом (или рудой), известня-
ком или кремнеземом (по потребности) плавят в шахтной печи Трейлора.
Пары и пыль мышьяка собирают в пылеуловительной камере Коттрслля
и бегхаузе и очищают возгонкой в печи, получая при этом 99%-ную трех-
окись мышьяка, а остаток (серебро, кобальт, свинец и никель) возвра-
щают в шахтную печь. Шлак из этой печи содержит меньше 1 % ко-
бальта.
Расплавленные шпейзу, штейн и веркблей выпускают в тигли для раз-
деления на слои. После охлаждения слои разбивают н отделяют один от
другого. Веркблей обрабатывают флюсом и продувают воздухом в печи
Шварца, работающей на жидком топливе, для удаления мышьяка, серы,
свинца и меди, после чего получается серебро 998-й пробы и аи серебряно-
золотой веркблей, пригодный для электролитического разделения серебра
и золота.
Шпейзу и небольшое количество штейна измельчают до частиц вели-
чиной —100 меш и подвергают обжигу для удаления мышьяка и серы и окис-
ления железа. Обожженную шпейзу смешивают с водой и серной кислотой
для перевода кобальта, никеля, меди, серебра и железа в водораствори-
мые сульфаты. Твердый остаток возвращают в плавильную печь, а раствор
после удаления серебра передают в баки для удаления железа и мышьяка.
Железо окисляют хлоратом натрия, затем нейтрализуют известью для
осаждения арсената железа(Ш), гидроокиси жслеза(Ш) и сульфата каль-
ция, которые удаляются в процессе противоточной декантации. Медь уда-
ляется путем обработки железным ломом или электролизом. В любом слу-
чае остаток железа и меди в растворе удаляется осаждением известью.
Пульпу фильтруют, отфильтрованный кек вновь обрабатывают для извле-
чения кобальта, а раствор, содержащий кобальт и никель, подвергают обра-
ботке с цепью окончатечьного осаждения кобальта.
При действии гипохлоритом натрия осаждается сначала чистая гидро-
окись кобальта Со(ОНK, а затем смесь гидроокисей кобачьта и никеля
Со(ОНK и Ni(OHK, подаваемая на рециркуляцию. Осадок гидроокиси
кобальта отфильтровывают на фильтрпрессе; раствор передают на уста-
новку для извлечения никеля, а гидроокись кобальта при нагревании пере-
водят в окись. Промытую окись смешивают с углем и восстанавливают до
металла при 1000°. Затем металлический порошок плавят в электрической
печи и гранулируют в воде. Металл содержит 98,6% кобальта, 0,7% ии-
келя, 0.37% железа, 0,12% кремния, 0,12% марганца, 0,03% меди и.не
более 0,04% серы.
Способ выщелачивания под давлением [2, 7. 8, 14, 17, 33—35, 37]
Основы процесса переработки никелево-медно-кобальтовых руд или
концентратов выщелачиванием под давлением были разработаны в 1947 г.
Форвардом, Самисом и Кадруком в Университете бывшей Британской
Колумбии для фирмы «Шерритт Гордон майнс», владеющей большими место-
рождениями никелевых руд в Линн-Лейке (штат Манитоба). Проектирова-
ние и сооружение опытной установки были выполнены фирмой «Кемикл
констракшн», которая проводила также исследования по выщелачиванию
сернистых руд кислотными растворами под давлением и осаждению никеля
из аммиачных растворов восстановлением водородом под давлением.
Комбинирование выщелачивания аммиаком (фирма «Шерритт Гордон
майнс») с восстановлением водородом под давлением и осаждением
никеля и кобальта из раствора гидрометаллургическим способом (фирма
Кобальт 289
«Кемикл констракшн») позволило отказаться от обычных операций обжига,
плавки, электролиза и рафинирования.
Изменения, внесенные в основные стадии процесса, позволяют приме-
нять его для извлечения из бедных руд ряда металлов, например никеля,
меди, кобальта и марганца. В применении к кобальту процесс включает
стадии приготовления концентрата кобальта обычным флотационным обо-
гащением кобальтсодержащей руды и выщелачивание концентра-
ционного шлама в автоклаве при повышенных давлении и температуре
аммиаком или кислотой. Раствор затем окисляют, пропуская в
автоклав воздух или кислород. После выщелачивания и окисления
содержимое автоклава фильтруют и фильтрат очищают, удаляя медь
и железо. Кобальт и никель в полученном растворе восстанавливаются во-
дородом под давлением на отдельных стадиях. Металлы извлекаются в тон-
кодисперсной форме и поступают далее на плавку или обрабатываются
методами порошковой металлургии. В этом процессе применяется уме-
ренное давление. Выщелачивание проводится в автоклаве, снабженном
мешалкой, при температуре 77—82е и давлении 107—108 кг/см2. Гидролиз
также проводится в автоклаве при 177—246е и давлении 150 кг/см*. Вос-
становление никеля проводится при 177—204° и давлении 125—128 кг/см".
Фирма «Шеррит Гордон майнс» добывает и обогащает руды в Линн-
Лейке, штат Манитоба. Руды состоят из пирротина* в массиве и вкрапле-
ний сульфидов—пентландита**, халькопирита, пирротина, пирита и не-
больших количеств кобальтникельпирита***. Выпускаются два концен-
трата: 1) с низким сдержанней никеля и высоким содержанием меди B8—
30% меди) и 2) с низким содержанием меди и высоким содержанием никеля
A2% никеля, 0,7% кобальта, 1,5% меди, 30% железа, 28% серы и 28%
нерастворимых веществ).
Восстановленный исходный раствор содержит 48 г/л никеля и 0,8 г/л
кобальта в виде диамминосульфатов. На этой стадии восстанавливается
около 8% кобальта. Этот разбавленный раствор, содержащий никель и ко-
бальт, обрабатывают сероводородом для получения осадка двойного суль-
фида никеля и кобальта.
Сульфиды промывают и выщелачивают в окислительных условиях при
122° и давлении 107 кг/см2 для получения раствора, содержащего 50—
60 г/л кобальта и никеля. Раствор очищают, удаляя железо, иевы-
щелоченный никель и сульфиды кобальта E%) при рН 4,9—5,1, 82° и ат-
мосферном давлении.
Избирательное восстановление никеля проводится в автоклаве при
177° и давлении водорода 135 кг/см2 для получения раствора кобальта,
свободного от никеля, и никелевого металлического порошка, содержащего
20% кобальта, который возвращается в цикл рафинировочного выщелачи-
вания или продается как готовый продукт.
Восстановление кобальта проводится на аналогичном оборудовании
и при тех же условиях, если не считать присутствия 1) небольшого коли-
чества смеси сульфида натрия и цианида натрия в качестве катализатора
для образования центров кристаллизации и 2) избытка аммиака для полного
* Магнитный колчедан Ре1—Х S; обычно сера находится в избытке против FeS
до %.— Прим. ред.
** Состав отвечает формуле (Fe,Ni)t)S8. Отношение Fe к Ni обычно равно 1 : 1,
а содержвние постоянно присутствующего кобальта составляет не меньше 1,5%.—
Прим. ред.
*•* Кобальтникелышрит — разновидность пирита (FeS2), содержащая кобальт
и никель.— Прим. ред.
19 Закла № 239
Концентрат
. Kc/r CoS
- Промети раствор -
[писосы высикого давлении \
Pup оУ/и начшш процесса
Промывной раствор для первой
п'четертт ступеней I
Воздух (W пг/см!/.
Лш веек шеипш
ступеней
Г
Отстой очищен-
известиям
пятой
встоплио для онисленин |
нирлргтто^ | at
непрерывная разгрузка
[Ран для omimpnu 'шлаш\
непрерывный спив
Цапи_ для обрапотпи шлолт\
1
спЦв
В
\amocwepy
I группу \
Тала вылеживания шлама
Флоп кплхнт
Вода
^Фильтр N-l CIMC0"
Система
непрерывной
Перви
tpu/шрат
Известповыо ш/тм
'для бака №1
Воздух G м/смэ) дли
"баков низкого давления
ПарE,6 п/смг) для
Гбипов низпиго довпенш
Зотстойнина с декантацией
для очистки раствора
Лромыптй ростоор,
~~дм реггулыщаи
Оливнр^у*— Отстой —
| очищенного
Фильтрат известняпи
т/см*
ьт
|Баки для цементации меди
Очищенный
риствор
fosq,
^ для регулирования рН
-Порошок кобальта
меднш
| Рискодные бови |
Затравив
I—Пар ,31,6 кг/см1
г-Н,.!г
• «5 г/л
Ban дли*o6F.adonwti
.Со(ОН);
[Автоклавы дли I
I еосегпцновления|
Гьпп для
\ отппрпи
^~7
"^атмосферу
| Электролизеры \
u
Катидный
нобплып
По/юшиовш шлам
жктролит.
35 г/л
Вода
пг/смг
Фильтррт
Хвосты
Рис. 2. Схема получения кобальтового концентрата на рафинировочном предприятии фирмы «Калера майнииг» в Гарфилде, штат Юта
Кобальт 291
восстановления кобальта. Металлический порошок промывают и сушат
в атмосфере Еодорода. Он содержит 0,39% никеля, 0,03% железа, 0,02%
серы и 99,3% кобальта.
Фирма «Калера майнинг компани» обрабатывает (рис. 2) кобальтовый
концентрат из рудника Блэкбсрд на рафинировочном предприятии вблизи
Гарфилда, штат Юта. Отдельные партии концентрата смешивают и полу-
чают концентрат с соотношением мышьяка и железа 1,2 : 1 следующего
состава (в %):
Кобальт
Железо
Мышьяк
Сера
Никель
17,5
20,0"
24,0
29,0
1,0
Медь
Нерастворимые
примеси
Влага
0,5
5,0
12,0
Концентрат смешивают с жидкостью, участвующей в процессе, до со-
держания 25% твердого вещества. Шлам обрабатывают в автоклаве в окис-
лительных условиях при 190° и давлении 135 кг1см'г для получения рас-
твора сульфата никеля, сульфатов железа и меди и нерастворимого остатка
арсеиата железа и сульфата кальция, которые затем отфильтровывают.
Кислый шлам частично нейтрализуют известью с целью удаления
железа и затем фильтруют. Фильтрат подвергают окончательной очистке для
удаления остаточного железа, мышьяка н некоторого количества кобальта.
Шлам фильтруют, остаток подвергают повторной обработке в автоклаве,
а фильтрат обрабатывают кобальтовым порошком для цементации меди.
Часть очищенного сульфата кобальта и никеля очищается иа электро-
лизном заводе при производительности 3630 кг/сутки.
К очищенному раствору кобальта и никеля добавляют требуемое
количество безводного аммиака для получения аммиачных комплексов
кобальта, и затем восстанавливают его до металла в автоклавах объемом
1700 л, снабженных мешалками, штуцерами для ввода водорода и паровыми
рубашками. Восстановление до металла проводится при 190° водородом
в присутствии катализатора. Давление при процессе восстановления
составляет 15—16 кг!см2.
Кобальтовый металлический порошок, который содержит заметное
количество серы @,15 %), перерабатывают в печи «электромелт» в присут-
ствии шлака с высоким содержанием извести, кокса и алюминия для обез-
гаживания металла. На физические характеристики гранулированного
металла влияют-температура металла, раскисление и скорость литья.
Затем металл сушат, полируют и упаковывают.
Состав металлического кобальта (в %):
Кобальт 95,60 Мышьяк 0,03
Никель 3,90 Медь 0,02
Сера 0,03 Углерод 0,15
Железо 0,20
Кобальт нз пиритов [13, 16, 18, 28]
Извлечение кобальта, меди и цинка из пиритов, содержащих кобальт,
производится следующим образом. Пиритовую руду или концентрат вна-
чале обжигают для удаления серы, которая используется затем в произ-
водстве серной кислоты. Обожженный пирит смешивают с 6— 12% поварен-
ной соли, а в некоторых случаях с 10% пирита. Смесь подвергают хлори-
19»
292 Г лава 14
рующсму обжигу при 550—750° для перевода всех металлов, за исключе-
нием железа, в водорастворимые соединения или в соединения, растворимые
в соляной или серной кислотах. Остаток железа спекают с 1 % поваренной
соли в шахтной печи.
Раствор, содержащий железо, медь, цинк, марганец, кобальт и никель,
окисляют воздухом для перевода железа в трехвалентное состояние. Затем
железо осаждают известковым молоком вместе с медью, цинком и марган-
цем. Осадок снова обрабатывают с целью извлечения отдельных металлов.
К кобальтсодержащему раствору при определенной величине рП добавляют
соду и хлор для осаждения гидроокиси кобальта, но никель и цинк остаются
в растворе. Гидроокись кобальта высушивают и прокаливают при 750",
затем промывают водой для удаления растворимых солей и нагревают при
температуре красного каления до образования окиси кобальта. Окись
кобальта выпускается как товарный продукт или восстанавливается до метал-
ла углем в обжигательной печи при 1000е.
Кобальтовый пирит содержит 0,025—1,25% кобальта; степень извле-
чения кобальта составляет 50—60%.
Фирма «Бетлехем стил компани» получает около 375 т металла в год
из пирита, который сопровождает магнетит, добываемый в Корнуэлле
(штат Пенсильвания). Пириты перерабатываются с целью получения метал-
лического кобальта и его окиси фирмой «Пирит компани», Уилмингтон
(штат Делавэр).
ФИЗИЧЕСКИЕ СВОЙСТВА
Кобальт представляет собой твердый магнитный металл серебристо-
белого цвета на изломе, по внешнему виду напоминающий железо и никель.
Он имеет порядковый номер 27 и атомный вес 58,9332. Изотоп Со60, обра-
зующийся при облучении в ядерных реакторах, конкурирует с радием как
источник v-излучения. Встречающийся в природе кобальт состоит из 0,2%
изотопа 57 и 99,8% изотопа 59.
Наряду с железом и никелем кобальт является одним из трех ферро-
магнитных элементов. Его магнитная проницаемость составляет примерно
а/з проницаемости железа, однако при сплавлении кобальта с никелем,
железом и прочими металлами достигнуты исключительные магнитные свой-
ства (см. следующий раздел).
Свойства кобальта гораздо сильнее зависят от кристаллической струк-
туры, чем свойства большинства других элементов, так как в дополнение
к обычному влиянию примесей кобальт существует в широком интервале
температур в виде смеси двух аллотропических модификаций; при темпера-
туре ниже 400" преобладает Р-модификация, выше этой температуры —
а-модификация. Однако превращения Р ->¦ а и а-> Р происходят очень
медленно, чем, вероятно, и объясняются расхождения в опубликованных
данных о физических свойствах этого металла. В настоящее время известно,
что большинство ранних работ, посвященных точному определению свойств,
проводилось на образцах с содержанием кобальта не выше 93%.
После открытия [22] превращения Р-модификации (гексагональная
плотноупакованная решетка, а = 2,5017 1<Х, с = 4,0614 кХ) в а-кобальт
(кубическая гранецентрированная решетка, а = 3,5370 кХ) [37, 671 было
установлено, что температура превращения лежит в интервале между 360
и 500° [15, 30, 31, 41, 58, 59, 63, 65, 66, 71, 73, 75, 77]. Последующие иссле-
дования причины такого широкого температурного интервала [11, 68] пока-
зали, что превращение носит мартенситиый характер для образцов с опре-
Кобальт
293
деленной величиной зерен и происходит при 388°, если образец охлаждается,
и при 430°, если его нагревают [68]. Недавно была определена темпера-
тура превращения для деформированных образцов кобальта со степенью
чистоты выше 99,9% при 417 ± Т [16].
Существует много разногласий по поводу существования второго ал-
лотропического превращения кобальта [5, 15, 30, 41, 58, 60, 65, 66, 68,
73, 76]. Более надежные данные показывают, что изменение различных фи-
зических свойств происходит вследствие потери ферромагнетизма. Однако
в одной из последних работ [39] подтверждается представление об аллотро-
пическом превращении, вероятно, обратно в кобальт гексагональной струк-
туры выше точки Кюри (около 1120°), т. е. выше той температуры,
при которой кобальт теряет свой ферромагнетизм. Дальнейшим дока-
зательством этого явилось изучение кобальтовых сплавов, в которых точка
Кюри и начало аллотропического превращения не совпадают [38].
Непосредственное влияние примесей на свойства и их косвеииое влия-
ние, оказываемое на аллотропическое превращение, затрудняют получение
надежных данных о свойствах при комнатной температуре. По этой при-
чине чаще используются значения, полученные отдельно для гексагональ-
ной и кубической структур кобальта, а не для более обычной смеси этих
двух форм. Даже при использовании кобальта со степенью чистоты выше
99,9% выявляются значительные расхождения в данных; например, элек-
трическое сопротивление изменяется от 6,36 до 8,96 мком ¦ см.
Таблица 4
PEHTI ЬНОГРАФИЧЕСКИЕ ДАННЫЕ И ДАННЫЕ О ПЛОТНОСТИ КОБАЛЬТА
с гексагональной плотноупакованнои решеткой
Тейлор и Флойд
Институт им.
Баттела
Вычисленная
плотность а,
г/емз
Состояние образца
Закален с 400°
Очищен зонной
плавкой в
8,832
8,844
Параметры решетки, А
2,5074
2,5059
св
4,0699
4,0695
Со/СО
1,623
1,624
Присутствует значительное количест-
вов кобальта с КГЦ решеткой,
ао=3,561
Небольшое количеетвов кобальта с
КГЦ решеткой
а При расчете использовались атпмный'вес 58,94 и число Авогадро 6,0228- I 0 .
6 Отожженный материал.
в Присутствие ^-кобальта Ьп ре делено рентгенографически при использовании
Fe/C-нзл учения.
Кобальт, очищенный зонной плавкой в Институте им. Баттела [87],
имеет степень чистоты 99,95—99,98%; параметры решетки и плотность, опре-
деленные для этого материала, сравниваются с данными для кобальта, по-
лученными Тейлором и Флойдом [69] (табл. 4).. ¦
294
Г.л а в а 14
Плотность кобальта кубической и гексагональной структуры, опре-
деленная по данным рентгеноструктурного анализа, равна соответственно
8,90 и 8,94. Для кобальта со степенью чистоты выше 99,9% самые высокие
наблюдаемые значения составляют 8,92 для кованого кобальта, вероятно,
полностью гексагонального 125], и 8,87 для литого кобальта 1391. Не исклю-
чено, что кобальт имеет дефектную решетку, особенно в порошковой фор-
ме [67].
Температура плавления кобальта равна 1493е [74], температура кипе-
ния 3100°. Скрытая теплота плавления лежит в интервале между 58 и 68 кал/г.
наиболее вероятное значение составляет 62 кал/г 146, 48, 72, 73]. Скрытая
теплота испарения равна примерно 1500 кал!г.
Сообщается [62, 75, 781, что теплота превращения в точке Кюри со
ставляет 0—14,7 кал/г, однако наиболее надежным является значение
1,6 кал/г [23]. Некоторые из этих отклонений объясняются совпадением
аллотропического прекращения и точки Кюри [39]. Такие же расхождения
наблюдались при аллотропическом превращении около 400е 123, 63, 73].
но наиболее достоверным считается значение, равное 60 кал!моль, кото-
рое было определено адиабатическим методом [1].
Удельная теплоемкость при повышенных температурах определялась
адиабатическим [Пи капельным [22, 73, 78] методами. Хотя ввиду мар-
генситиого типа превращения удельную теплоемкость лучше определять
адиабатическим методом, эти значения соответствуют интервалу температур
до 800°. Результаты, полученные при определении капельным методом
[73, 78], хорошо согласуются вплоть до превращения при температуре
выше 1100°, когда наблюдается значительный разброс. Однако вследствие
Таблица б
УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ, УДЕЛЬНОЕ ЭЛЕКТРИЧЕСКОЕ СОПРОТИВЛЕНИЕ
И ТЕРМО-Э.Д.С. КОБАЛЬТА
Температура,
0
100
200
300
400
500
600
700
800
900
1000
1100
1200
1300
1400
Удельная теплоемкость,
истинная
0,099
0,106
0,113
0,120
0,125
0,126
0,136
0,147
0,159
0,172
0,187
0,204
0,166
0,167
0,168
средняи а
0,102
0,105
0,109
0,113
0,121
0,123
0,125
0,12В
0,133
0,138
0,143
0,147
0,148
0,149
V 1№ Л ТчЫ ОР
электросопротив-
ление,
мком • см
5,68
9,30
13,88
19,78
26,56
32,2
40,2
49,2
58,6
68,0
77,4
86,7
91,9
95,7
—
Температурный
коэффициент
электросопро-
тивления,
1 0-3 /град
5,31
7,36
9,63
11,0
12,6
13,8
15,0
16,6
16,6
16,6
16,6
16,6
6,7
6,7
—
Тсрмо-э. д. с.
ПО ОТИОШСНИК
к платине, ж*
0.00
2,51
5,51
9,03
12,81
16,18
18,80
21,13
22,81
23,70
23,75
23,00
21,75
а Средняя удельная теплоемиость намерена в интервале от комнатной темперптуры (пример-
но 25°) до указанной п таблице.
Кобальт
295
неодинаковой чистоты металла пользуются более поздними данными [78],
полученными для кобальта со степенью чистоты 99,9%. Значения истинной
теплоемкости приведены в табл. 5. Удельная теплоемкость жидкого кобаль-
та найдена равной 0,265 кал!г [731, но это значение, видимо, завышено.
Вычислены атомные теплоемкости [23, 78] при постоянном давлении ср
и постоянном объеме с„. Поскольку расчет теплоемкости при постоянном
объеме зависит от экстраполяции данных Бриджмена [51 для величин сжи-
маемости в широком интервале температур при 30° @,733 ¦ 10~5) и при
75° @,744 - 10~6), эти данные здесь не приводятся. Однако разница между
сг*и с,, мала. Несколько определений было сделано при температурах ниже
комнатной 110, 49, 55, 56]. Наиболее достоверными значениями следует
считать 0,0207 кал/'г для интервача от —253 до —196° [101, 0,0329 кал/г при
—201,8°, 0,0572 кал/г при —150°, 0.0810 кал/г при — 100°. 0,915 кал/г
при —50°, 0,0991 кал/г при 0° и 0,1032 кал/г при 50° [551. Эти значения очень
хорошо согласуются с определениями, проведенными при более высоких
температурах (табл. 5).
Точных данных по теплопроводности кобальта не имеется; коэффи-
циенты теплопроводности колеблются от 0,1299 до 0,172 кал/см ¦ сек ¦ град
при 30° [2, 20, 331. Кобальт становится сверхпроводящим при низких тем-
пературах [361.
Имеется несколько падежных определений теплового расширения чи-
стого кобальта [12, 30, 33, 41, 58, 61, 71, 76, 77]. Синода [611 для кобальта
с гексагональной решеткой определил этот коэффициент равным оц=
— 161 • 10~6 и cii= 12,6 ¦ 10е со средним значением 13,8- 10~с при ком-
натной температуре. Это значение выше, чем другие. Значения коэффициента
расширения приводятся в табл. 6.
Таблица С
КОЭФФИЦИЕНТ ЛИНЕПНОГО РАСШИРЕНИЯ
Температура,
°С
20—100
100 200
200
200—30U
300- 100
400
400 -500
600
750
AV/V, %
КОБАЛЬТА
Коэффициент линейного расширения, 10-й/гррд
Шульцс [58],
99,2%
12,5
13,6
—
11,4
15,1
—
14,0
—
0,30
Файн и Эллис
[12], 99,9%
A4,2)
14,2
A4,2)
A4,8)
15,7
—
16,0
16,8
0,24
Мацумото
и Нара [33]
12,55
13,57
—
14,37
15,4
—
0,27—0,36
Примечание. UV/V — расширение при переходе гексагональ-
ной модификации кобальта "в кубическую плот-
иоупакованную.
Марнк [30] и Мейер [411 получили рентгенограммы кобальта при высо-
ких температурах. Как нашел Марик, увеличение объема между 1100
и 1150° составляет 2%, что он объяснил потерей ферромагнетизма. При ди-
латометрических измерениях между 1000 и 1300° найдено, что расширение
296 Глава 14
между 1119 и 1145° равно 0,02794. Оно происходит в две стадии: в точке
Кюри и при аллотропическом превращении [38, 39].
Электрическое сопротивление измерялось многими исследователями
[7, 14, 18, 20, 23, 25, 27, 28, 30—32, 34, 47.J 52, 54, 57, 58, 60, 69], однако
в расчет следует принимать только результаты для кобальта известной
степени чистоты. Кобальт высокой степени чистоты использовали Шульце
1571, Егер, Розенбом и Цитгоф [23] н Марик [30], но результаты Марика
считаются ненадежными вследствие несоответствия рентгеновских данных
положению точки Кюри. В табл. 5 приводятся средние из этих значений
для 99,95%-ного кобальта. Найдено F9], что ниже комнатной температуры
кобальт не обнаруживает сверхпроводимости, однако Мейсснер и сотр. [34]
установили, что отлитый в вакууме чистый кобальт становится сверхпрово-
дящим при 19°К.
Точку Кюри многие исследователи определяли косвенным путем по
результатам измерений электрического сопротивления, термо-э. д. с, удель-
ной теплоемкости и рентгеноструктурного анализа [23, 30, 31, 53, 57,
62, 73, 75] и несколькими прямыми наблюдениями на чистом кобальте [14,
40, 42, 64]. Майерс и Саксмит [42] определили положение точки Кюри
при 1121 ± 3°, в то же время по измерениям Мейера и Тагланга [40] она
составляет 1131°; однако первые данные следует считать более надеж-
ными. Точка Кюрн для железа составляет 788°. Точка Кюри для кобальта
с гексагональной решеткой определена путем экстраполяции низкотемпе-
ратурных данных равной 1070° [40] и 1150° [54].
Спонтанное намагничение монокристаллов кобальта с гексагональной
решеткой при абсолютном нуле найдено равным 160,9 [14] и 162,55 [42].
Интенсивность намагничения при насыщении на единицу объема монокри-
сталлов гексагонального кобальта при абсолютном нуле составляет по оп-
ределениям 1446 [21, 26] и 1437 единиц [42]. Майерс и Саксмит [42] нашли,
что намагничение монокристаллов кобальта при переходе через точку ниж-
него аллотропического превращения возрастает с каждым циклом вплоть
до пятого цикла; кобальт с кубической решеткой намагничивается несколько
меньше, причем степень намагничения уменьшается при нагревании.
Опубликован ряд обзоров, посвященных магнитным свойствам кобальта
[19, 35].
Термоэлектрические свойства кобальта исследовались по отношению
к платине[27, 44, 47, 57, 62], никелю [8, 23, 45], железу [8] и меди [45,
47]. В табл. 7 приведены наиболее надежные значения для пары кобальт —
платина, вычисленные Егером, Розеибомом и Цитгофом [23] по экспери-
ментальным данным Шульце для температурного коэффициента при б&
лее высоких температурах. Бриджмен [3] определил эффекты Пельтье и
Томсона.
Найдено [87], что твердость по Бринеллю при комнатной температуре
изменяется от 81 до 249 в зависимости от ориентации отпечатков твердости
внутри кристалла. Твердость по Бринеллю при высоких температурах из-
меняется от 253 при комнатной температуре до 17 при 900°; такое изменение
твердости по сравнению с первоначальным значением обусловлено приме-
сями и относительными количествами присутствующих а- и Р-фаз кобальта.
Твердость по Бринеллю литого кобальта со степенью чистоты 99,9%
составляет 124 [25], а электролитического кобальта около 300 единиц [29].
На свойства кобальта сильно влияют даже самые незначительные примеси
других элементов; например, примеси углерода, серы, кремния н марганца
вредно отражаются на его пластичности. Литой кобальт имеет предел проч-
ности при растяжении 24,6 кг/мм2, который после отжига повышается т
ФИЗИЧЕСКИЕ СВОЙСТВА
Порядковый номер
Атомный вес
Изотопы
Плотность, г/сл3
Температура плавления, "С
Температура кипения при 760мм рт. ст., "С
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Постоянные решетки, А
а-Модификацня, кубическая грапецентри-
рованная
Р-Моднфнкация, гексагональная плотно-
упакованная
Температура превращения Р —*¦ а, СС
Увеличение объема при превращении гекса-
гональной плотноупаковапной фазы в ку-
бическую грансцентрнрованную
Теплота превращения, кал/моль
Точка Кюрн, "С
Удельная теплоемкость, кал,'е-град
15—100°
В жидком состоянии
Коэффициент линейного расширения при 40",
град'1
Удельное электрическое сопротивление
Объемная электропроводность прн 20° (по
отношению к электропроводности мечи), %
Скорость звука, м/сек
Коэффициент теплопроводности в интервале
0—100°, кал/см-сек-град
Твердость по Бринеллю
Литой
Электролитический
Предел прочности при растяжении, кг/мм2
Литой
Отожженный
Проволока
Предел прочности при сжатии, кг/мм2
Литой
Предел текучести, кг/ммг
Модуль нормальной упругости, кг/мм2
Модуль сдвига, кг/мм*
Таблица 7
КОБАЛЬТА
27
58, 9332
57, 59, 60 (искусственный)
8,90
1493
3100
62
1500
00=3,5370
а„=2,5017
с=4,0614
417±7
0,3% (прибл.)
60
1121
0,1056
0,141
13,36-10-»
См. табл. 5
27,6
4724
0,165
124
300
24,6
28,1
70,3
84,4
29,5
2,1-10*
7,8-10»
Высокотемпературные свойства
Предел прочности при растяжении, кг/мм2
649°
816°
Ползучесть 99,6%-ного кобальта, 100 час
при 500° 8,53 кг/мм2, относительное уд-
линение 2,7%
8,7»
2,11
Глава 14
Ползучесть при 1000° для деформации 1%
за 24 час, кг/мк2
99,97%-ньш кобальт, спеченный и кованый
Плавленный в вакууме
Продолжение табл. 7
9,78
4,71
Прочностные свойства
Плавленный в дуге, электролити-
ческий
Комнатная температура
927'
Предел проч-
ности лрн
растяжении,
кг/мм*
40,4
8,75
Предел
текучести,
кг/ил2
30,3
5,76
Уменьшение
попер*. ЧНО1-С
сечения %
3
12
28,1 кг/мм2 [9, 13]. Прочность быстро возрастает при наклепе; так, предел
прочности кобальта в виде проволоки может достигать 70,3 кг/мм2 129].
Предел прочности при сжатии литого кобальта равен 84,4 кг/мм-, предел
текучести 29,5 кг/мм2 [29]. Модуль нормальной упругости составляет
около 21 000 кг/мм2.
Самодиффузия в кобальте измерена с противоречивыми результатами
134, 43, 51, 89]. Постоянная в уравнении Аррениуса найдена равной 0,37
и 0,032, а энергия активации 67 000 и 61 900 кал соответственно.
С помощью метода, нечувствительного к предварительной обра-
ботке поверхности, Мид и Бсрченол [86] получили уравнение D =
— 0,83 ехр (—67 700/RT) см2/сек для самодиффузии в кобальте со степенью
чистоты выше 99,9% и для диффузии небольших добавок кобальта в ни-
кель — DlN°= 1,46 ехр (—68 300/ЯГ) см2/сек.
Картер и Ричардсон [81] измерили самодиффузию кобальта в окиси
кобальта и получили следующие коэффициенты диффузии:
при 1000° D = 2,6 ¦ 10° (РО2H-35 см21сек,
при 1150° D = 9,0- 10" (РО2H-30 см2/сек.
при 1350° D = 5,1 ¦ 10 я (РО2H^8 см21сек.
Турнбал [70] вычислил поверхностную энергию для границы раздела
между твердой и жидкой фазами равной 234 зрг/см2.
Скорость звука в кобальте составляет 4724 м/сек[17].
ХИМИЧЕСКИЕ СВОЙСТВА
По своим химическим свойствам кобальт очень напоминает железо
и никель, как это и следовало ожидать из-за близкого расположения этих
элементов в периодической таблице (триада железо— кобальт — никель
VIII группы). Известны соединения двух- и трехвалентного кобальта,
однако последние гораздо менее устойчивы, чем двухвалентные соедине-
ния*.
Кобальт в порошковой форме легко окисляется при комнатной темпе-
ратуре, но компактный металл не подвергается действию кислорода или
* Для комплексных соединений наблюдается обратная картина.— Прим. ред-
Кобальт 299
воды ниже примерно 300°, чем совершенно отличается в этом отношении от
железа. Порошок кобальта поглощает от 50 до 100 объемов водорода и
образует небольшое количество гидрида.
Картер и Ричардсон [7], исследуя окисление металлического кобальта
с помощью инертных меток из радиоактивной платины, пришли к заклю-
чению, что окисление происходит путем катиониой диффузии через расту-
щую окисную пленку. Скорость окисления при различных температурах
и давлениях кислорода согласуется со скоростями, вычисленными по урав-
нению Вагнера.
Выше 950° кобальт окисляется в соответствии с параболическими за-
конами, а выше 900° образует закись кобальта СоО.
При температуре около 500е кобальт разлагает аммиак, при этом азот
соединяется с металлом, образуя нитрид Co5N2; в присутствии воздуха
образуется нитрит.
Кобальт реагирует с галогенами, образуя соответствующие галогени-
ды, и легко растворяется в серной, соляной и азотной кислотах.
Хлорид кобальта СоС12 используется для получения очень мелкого
кобальтового порошка II] при восстановлении водородом в присутствии
0,1 % металлического кобальта (от веса СоСЦ) в качестве катализатора
при температурах в интервале 265—305°. Использование хлорида кобальта
в качестве индикатора влажности описано Дэвисом [3].
Кобальт медленно разъедается едким натром и водным раствором
яммиака.
Порошок кобальта и окись углерода под давлением 100 am при 200°
реагируют с образованием карбонила кобальта Со2(СО)8, который разла-
гается на воздухе при температурах выше 60° на кобальт и окись углерода.
Мак-Кивер 14] описывает производство карбонила кобальта, основанное на
приготовлении суспензии карбоната кобальта, основного карбоната ко-
бальта и гидроокиси кобальта в нейтральной органической жидкости
(спирты или кетоны), которая является растворителем карбонила кобальта.
Реакция с окисью углерода протекает в интервале температур 140—300°
под давлением 35—350 am.
Карбид кобальта Со2С образуется при 226—230° путем взаимодействия
кобальтового порошка с окисью углерода при атмосферном давлении.
Гсйдинг и Калверт [8] при исследовании соединений кобальта с мышья-
ком (до 60% мышьяка) нашли, что при комнатной температуре существуют
соединения Co2As и CoAs. Соединение Co3As2, вероятно, образуется при
реакции Co2As и CoAs при температуре выше 940°. Существует заметное
сходство между системами железо — мышьяк и кобальт — мышьяк.
Карбонат кобальта СоСО3, который получают действием карбонатов
щелочных металлов на соли кобальта(П), встречается в природе в виде ми-
нерала сферокобальтииа. Карбонат кобальта Со2(СО8K получают при окис-
лении карбоната кобальта(П).
Фторид кобальта CoF2 представляет собой твердое кристаллическое
вещество красного цвета, обычно в гидратированной форме. Свободные
энергии фторида кобальта(П) при различных температурах имеют сле-
дующие значения (ккал/моль фтора):
25°
— 147,9
227°
— 141
727°
—125
1227°
— 108,5
SOO Глава 14
Фторид кобальта CoF3 образует коричневые кристаллы в безводном со-
стоянии и красный фторид кобальта(П) при нагревании на воздухе.
Нитрат кобальта Co(NO3J-6HzO образуется при действии разбавлен
ной азотной кислоты на металлический кобальт, его окись, гидроокись или
карбонат.
Закись кобальта СоО [6] медленно образуется при нагревании метал-
лического кобальта до красного каления без свободного доступа воздуха
или при нагревании Со2О3 или Со3О4 при высокой температуре. Она яв-
ляется катализатором в процессе окисления аммиака и высыхаюших масел.
Закись кобальта — темно-серого цвета, не растворима в воде, растворяется
в кислотах и едких шелочах, слабо растворима в аммиаке. Она представ
ляет собой техническую серую окись.
Окись кобальта Со2О3 [6] получают нагреванием соединений кобальта
при низких температурах в присутствии воздуха. При нагревании до 850°
Со2О3 превращается в черную закись-окись кобальта Со3О4. Окись кобаль
та(П1) при соединении с окислами других металлов образует кобальтиты.
например ZnO-Co2O3.
Закись-окись кобальта CosO4, которая образуется при нагревании
солей до 850°, можно восстановить до металла углеродом, окисью у1лерода
или водородом.
Фосфаты кобальта образуются в нескольких формах при нагревании соли
кобальта(П) с фосфорной кислотой или фосфатом щелочного металла.
Ортосиликат кобальта CozSiOt— кристаллическое соединение фиоле-
тового цвета — входит в состав шлаков и глазурей.
Сульфат кобальта CoSOt • 7Н2О [2] получают растворением окиси
гидроокиси или карбоната кобальта в разбавленной серной кислоте; он
кристаллизуется в виде розового гидрата'.
Сульфат кобальта Co2(SO4).-i [2] можно получать электролизом обыч-
ного раствора сульфата кобальта в разбавленной серной кислоте в плати-
новой чашке, которая служит анодом; в качестве катода используется пла-
тиновая проволока в пористой чашке, содержащей разбавленную серную
кислоту. Этот сульфат является неустойчивой солью.
Сульфит кобальта CoS [2] представляет собой черный порошок, обра-
зующийся при пропускании сероводорода через щелочной раствор кобаль-
та. Он встречается в виде природногосульфидаджейпурита*, обнаруженного
в Индии.
Сульфиды кобальта Co3S4, Co2S3 и дисульфид CoS2 получают нагрева
иием соединений кобальта с серой при различных условиях. В природе
сульфиды кобальта встречаются в виде минералов карролита, линнеита
ОБЛАСТИ ПРИМЕНЕНИЯ И СПОСОБЫ ОБРАБОТКИ
В чистом виде кобальт применяется относительно мало: в виде радио
активного кобальта-60 в гамма-терапии, в промышленной гамма-дефекто-
скопии и для изготовления измерительных инструментов. 85% металличе-
ского кобальта расходуется иа жаропрочные сплавы, постоянные магниты,
инструментальные и износостойкие сплавы
* Не вполне достоверен.— Прим. ред.
** Зигенит (Со, Ni).-?S4 — сульфид с преобладанием кобальта. Полидимит Ni3S4
в сущности является минералом никеля; часть последнего может быть замещена
кобальтом.— Прим. ред.
Кобальт
301
Данные по потреблению кобальта за 1957—1959 гг., приведенные
в табл. 8, показывают изменение областей применения кобальта. -^
Таблица 8
ПОТРЕБЛЕНИЕ КОБАЛЬТА В СШДа
Область применения
Быстрорежущие и другие стали
Постоянные магниты и мягкие
магнитные материалы
Сплавы Со—Сг—W—Мо
Тнсрдые сплавы и карбиды
Прочие области применения ме-
талла
Грунтовочная фритта
Красители
Соли, реагенты для сушки
и т. д.
Прочие области применения
(в неметаллической форме)
Общее потребление, т
Год
I9S7
3,8
31,6
33,2
8,3
2,5
5,2
2,2
11.0
2,0
4157
1058
2,6
31,0
31,1
6,8
3,3
6,1
3,3
13,7
2,1
3424
1959
8,4
30,1
24,2
7,5
8,1
5,5
2,2
11.5
2,5
4494
а Данные Горного бюро США.
США являются самым крупным потребителем кобальта в мире, но для
удовлетворения всех запросов сильно зависят от ввоза кобальта из других
стран.
Области применения и способы обработки кобальта и получения его
сплавов рассматриваются в четырех разделах: железные сплавы, сплавы с
цветными металлами, порошковая металлургия кобальта и электрсюсаж-
дение.
Характеристики кобальта-60 рассматриваются в разделе «Кобальт
в биологии и биохимии».
Кобальт в железных сплавах
Диаграмма состояния системы железо— кобальт показывает, что
кобальт полностью смешивается с у-железом и образует твердые растворы
с а-железом (до 80% кобальта) [8]. Как правило, при образовании в фер-
рите твердого раствора любого элемента повышаются прочность и твердость,
но уменьшаются относительное удлинение и сужение поперечного сечения.
Способность кобальта образовывать карбиды выражена несколько
слабее, чем у железа. Кобальт является единственным легирующим эле-
ментом, снижающим способность стали принимать закалку. Его главная
роль сводится к тому, чтобы воспрепятствовать снижению жаропрочности
сплавов за счет растворения в феррите.
Быстрорежущие стали [1—7, 9]. Кобальт является важным компонен-
том группы вольфрамовых инструментальных сталей, способных к снятию
крупной стружки с большой подачей и на высоких скоростях при механи-
ческой обработке сталей и цветных металлов. Как правило, эти стали со-
держат 18% вольфрама, 4% хрома, 1% ванадия, 5—12% кобальта и 0,5—
302 Глава 14
0,896 углерода. Вообще режущая способность пропорциональна содержанию
кобальта (до 13%). В вольфраме растворяется до 30% кобальта; при по-
вторном нагреве выделяется соединение вольфрама с кобальтом, улучшаю-
щее обычные вольфрамовые инструментальные стали.
Добавки кобальта к молибденовым быстрорежущим сталям также улуч
шают их свойства.
Магниты. Критерием оценки постоянных магнитов является макси-
мальная величина произведения магнитной индукции в материале на напря-
женность магнитного поля. Он обозначается (?//)„акс, где В — магнитная
индукция (в гауссах), Н — напряженность магнитного поля (в эрстедах).
(ВЯ)„ако представляет собой меру максимального количества магнитной
энергии, которую можно накопить в единице объема магнитного материала.
Этот критерий позволяет судить о доброкачественности постоянного маг-
нита: чем больше величина (ВН)макс, тем выше эффективность магнита.
Величина остаточной магнитной индукции Д., умноженная на коэрцитив-
ную силу #.. приблизительно пропорциональна (В11)какс. Поскольку
магнитную индукцию в полностью намагниченном бруске определяет
форма магнита, величина (ВГНС) — не единственный критерий. Слишком
большая коэрцитивная сила и слишком малая остаточная индукция могут
дать приемлемую величину (B^J, но при этом, вероятно, нельзя произ-
водить замену материала без изменения конструкции магнита.
Технические кобальтовые магнитные стали содержат 6—50% кобальта
и 0,8—1,0°6 углерода с величинами (В,#с) порядка 0,9 - Ш гаусс ¦ эрстед.
В 1920 г. Хонда и Саито разработали стали марки «К. S.», содержащие
0,4 — 0,8% углерода, 30—50% кобальта, 5—9% вольфрама и 1,5—3%
хрома. Для них величина произведения (B,HJ находится в интервале от
2 ¦ 106— 2,6 • 10е гаусс ¦ эрстед. Коэрцитивная сила и величина этого
произведения, определяющие эффективность магнита, прямо пропорцио-
нальны содержанию кобальта. Мартин (пат. США 25996705, 1952) разра-
ботал магнитный сплав, содержащий 5—7% никеля, 4—6% ванадия,
43—47% кобальта, остальное железо; сплав имеет коэрцитивную силу
50—100 эрстед и Вг не менее 12 000 гаусс.
В тронной системе железо — кобальт — никель существует область
составов, для которых магнитная проницаемость имеет постоянные значе-
ния в низких полях. Эти сплавы названы «иерминварами»; типичный сплав
содержит 45% никеля, 25% кобальта и 30% железа. На магнитные свой-
ства сплава влияют закал ка^на воздухе и низкотемпературный отпуск.
Дисперсионно твердеющие магнитные сплавы содержат мало или
вообще не содержат углерода. В литом состоянии они немагнитны, но при-
обретают магнитные свойства в результате выделения при контролируемых
условиях одного или нескольких компонентов из твердого раствора. В 1931 г.
Миспма разработал ряд сплавов железо — никель — алюминий A6 —
32% никеля, 5—12% алюминия, остальное железо) с высокой коэрцитивной
силой. Установлено, что при введении добавки кобальта в количестве
0,5—40% уменьшается величина зерна, благодаря чему возрастают коэр-
цитивная сила и остаточное намагничение. Промышленные сплавы для маг-
нитов типа «алнико» содержат 14—30% никеля, 6—12% алюминия, 5—
35% кобальта, остальное железо. Некоторые сплавы содержат также медь
и титан.
Сплавы «алнико» обладают высокими коэрцитивной силой и магнит-
ной энергией. Каждый из сортов сплава имеет определенные преимуще-
ства и ограничения. Сорта V и VI имеют направленные характеристики
Кобальт 303
которые получаются при охлаждении магнита от температуры нормали-
зации (около 1300") до черного цвета в сильном магнитном поле. Все сорта
могут быть отлиты в желаемую форму, а сорта II, IV, V и VI можно полу-
чать также спеканием в вакууме или в атмосфере сухого водорода.
«Супермендюр» (фирма «Уэстерн электрик») содержит номинально 49%
железа, 49% кобальта и 2% ванадия. Его можно прокатывать от 2,31 до
0,0075 мм без промежуточных отжигов и потери пластичности. Максималь-
ная проницаемость равна 66 000 в поле 20 000 гаусс, остаточная магнитная
индукция 21 500 гаусс, коэрцитивная сила 0,26 эрстед, насыщение
24 000 гаусс, потери на гистерезис низкие.
Кобальтплатиновые магнитные сплавы, содержащие 30—72,5 ат. %
кобальта, получают спеканием металлических порошков или плавлением
и литьем. Эти сплавы обладают удовлетворительной величиной {ВН)какс.
Обычная обработка сплавов состоит в нагреве до 900—1000° для разупоря-
дочения и охлаждении до комнатной температуры с последующим изотер-
мическим упорядочивающим отжигом при 600° . Сплавы примерно с 50 ат.%
имеют наилучшие магнитные свойства. Самую высокую коэрцитивную силу.
равную 4700 эрстед, и (б#)маис 9-10" гаусс-spcmed имеет сплав, со-
держащий 49,3 ат. % кобальта, охлажденный при контролируемых усло-
виях A00°/лшн) от температуры разупорядочивающего отжига перед ста-
рением при 600°.
В табл. 9 указан состав некоторых обычных магнитных сплавов с ха-
рактеристикой их свойств.
Постоянные магниты можно изготовлять прессованием и спеканием
порошков окисей металлов с последующим намагничиванием при низкой
температуре. Из Fe3O4 и CoFe2O4 магниты изготавливают прессованием,
спеканием при 1000° и намагничиванием при 300°. При комнатной темпе-
ратуре они имеют В,= 3000—5000 гаусс и Нс = 400—600 эрстед.
Сплав «вектолит» (фирма «Дженерал электрик») получают из окиси
железа и окиси кобальта. Он имеет высокое удельное электрическое со-
противление, высокую коэрцитивную силу и низкие потери из-за вихревых
токов; его применяют в высокочастотных магнитных полях.
Ферромагнитные кристаллические окислы марганца и кобальта, имею-
щие кристаллическую структуру типа ильменита, применяются для лент
магнитной записи и в качестве материалов для сердечников в электронном
оборудовании. Химический состав описывается формулой CoMnOs, и соеди-
нение образуется при смешивании 3,35 частей тонкоизмельченного СолО4
с 3,5 частями МпО2 и водой, взятой по весу в 1,5 раза больше окислов. Эту
смесь помещают в платиновую трубку, запаивают и нагревают до 625"
при 3000 ат.
Спаи стекло—металл [1—4]. Сплавы железо—никель — кобальт,
широко применяемые для спаев стекло — металл, имеют малый коэффи-
циент расширения при температурах ниже характеристической точки
перегиба, с переходом за которую расширение возрастает. Следовательно,
подбором состава сплава можно совместить температуру перегиба с интер-
валом отжига некоторых стекол, что позволит сблизить почти или пол-
ностью коэффициенты теплового расширения сплава и стекла.
Номинальный химический состав таких сплавов: 54% железа, 28%
никеля и 18% кобальта. Температура их превращения составляет около
435", а коэффициент расширения в интервале 25—325° равен 4,0-10 е.
Выше этой температуры коэффициент расширения достигает величины
12,0-10 6.
ДАННЫЕ ДЛЯ МАГНИТНЫХ МАТЕРИАЛОВ, СОДЕРЖАЩИХ КОБАЛЬТ
Матернзлы с высокоД магнитной проницаемостью
Таблица 9
Материал
Лермендгор
2У-Пермендюр
Гиперко
Форма
Лист
»
Приблизительны В
состав, %
4,97 Fe; 50,0 Со; 0,3 Мп
4,90 Ье; 49,0 Со; 2,0 V
6,40 Fe; 35,0 Со; 1,0 Сг
Типичная
термообра-
ботка,
°С
Отжиг 800
То же
Отжиг 850
Магнитная
проницае-
мость прп
Б=20, гс
800
800
650
Макси*
мальнэя
магнитная
проницае-
мость,
гс
5 000
4 500
10 000
Индукция
насыще-
ния вв,
гс
24 500
24 000
24 200
Потери
на гисте-
резис11
эрг/смЯ
12 000
6 000
Коэрци-
тивная
сила3
ис,,
2,0
2,0
1,0
Удельное
электро-
сопротив-
ление,
мком ¦ см
7
26
25
Плотно-
сть,
г/смЗ
8,3
8,2
8,0
Сплавы для постоянных магнитов
Материал
Состав, %
(остальное Fe)
Термообработка ®
(температура, °С)
Havai ии-
чивающая
сила
"макс э
1000
1000
1000
2000
2000
2000
3000
2000
3000
3000
1000
2000
3200
Коэрци-
тивная
сила
Нс,э
150
240
250
440
550
520
700
550
750
950
300
510
660
2600
4800
Остаточ-
ная ин-
дукция
Я„, гс
Магнитная
энергия
"Н) X
Способ
обработки в
Механи-
ческие
свойства г
Плот-
кость,
г/ела
17% Со—сталь
36?i Co—сталь
Ремалой нли комол
Алнико I
Л.шико II
Алнико II, спечен-
ный
Алнико IV
Алиико V
Алнико VI
Алиико XII
Викалой 1
Впкалой II,
волока
Куиико
Платина—кобальт
Платинакс II
Тикопал'ХХХ
Тиконал G
про-
17Со; 0.75С; 2,5Сг; 8W
ЗбСо; 0.70С; 4Сг; 5W
17Мо; 12Со
12AI; 20Ni; БСо
10А1; 17Ni; 2,5Co; 6Cu
10А1; 17Ni; 2,5Co; 6Си
12А1; 28Ni; БСо
8А1; 14Ni; 24Co; ЗСи
8А1; 15Ni;24Co;3Cu;lTi
6Alj 18Ni; 35Co; 8Ti
52Со; 9,5V
52Со; 14V
50Си; 21№; 29Со
77Р(; 23Со
7С,7Р(; 23,ЗСо
34,0Со; l5Ni; 7A1; 4Си;
5Ti; 35Fe
24Co;3Cu;I4Ni;8Al;50Fe
3 950
3 1200, Пр 700
В 1200, Пр 700
В 1200, Пр 600
В 1300
3 1200, Пр 650
В,П1300,Пр600
Пр 600
ХД+Пр 600
3 1200, Пр 650 —
9 500
9 500
10 500
7 200
7 200
6 900
5 500
12500
10 000
5 800
8 800
10 000
3 400
4 500
6 40D
0,65
0,97
1,1
1,4
1,6
1,4
1,3
4,5
3,5
1,5
1,0
3,5
0,8
3,8
9,2
11,0
5,0
ГП, Т, Шт
ГП, Т, Шт
ГП, Т, Шт
Л, Ш
Л, Ш
" Ш
С, Л, Ш
Л, Ш
Л, Ш
л, ш
Л, ХП, Т, Шт
Л, ХП, Т, Шт
Л, ХП, Т, Шт
Л, ХП, Т
Тв, Пр
Тв, Пр
Тв
Тв, Хр
Тв, Хр
Тв
Тв
Тв, Хр
Тв, Хр
Тв, Хр
Пл
Пл
Пл, К
Пл
8,19
8,15
6,88
7,08
6,88
7,00
7,29
7,41
7,19
8,15
8,08
8,29
а Прн насыщении.
6 3—закалка в воду нли масло; В—охлаждение нв воздухе: Пр—прокаленный; П—охлаждевный в магнитном поле: ХД—холоднодеформированный.
в ГП—горячая прокатка влп ковка; ХП—холодная прокатка или волоченне: Л—литой; Т—обработанный на токарном ставке; Ш—подлежит шлифованию;
Шт—штампованный: С—спеченный
г Тв—твердый; Хр—хрупкий; Пр—прочвый; Пл—пласткчиыв; К—ковкий.
коГшдып
305
Сплавы, стойкие против коррпзии и окисления. Развитие газовых тур-
бин послужило стимулом для изучения влияния легирования стали на
повышение ее жаропрочности. В 1938 г. Болленрат, Корнелиус и Бунгардт
16] описали ряд сложных сплавов никель — хром — кобальт — вольфрам —
молибден, пригодных для изготовления лопаток газовых турбин. Эти сплавы
содержат 10—18% хрома, 25—40% никеля, 20—35% кобальта, 0 -8%
вольфрама, 0—8°-6 молибдена и 0,3% титана или 2—8°о ниобия.
Бардгетт и Болсовер 14] исследовали ковкий черный сплав «мульти-
элой», содержащий 0,259о углерода, 1,63% марганца, 1,03% кремния,
46,529с никеля, 20,5% хрома, 2,73"в молибдена, 3,33°о кобальта, 2,92%
ниобия, 3,52% вольфрама и 1,2% титана. При температуре 800 и напряже-
нии 3,5 кг/мм2 ползучесть за 300 час составила 0,20%. Стали, содержащие
6—7% кобальта, 0,2—0,43% углерода, 14,3% хрома, 18% никеля, 3,85%
молибдена, 3,859-6 меди и 0,75% титана, испытывались при температурах
вплоть до 750° в различных газо-воздушных смесях A:2, 1 : 4 и 1:6)
и показали удовлетворительные результаты в отношении скорости окали-
нообразования.
Концы стержней клапанов авиационных двигателей изготовляют из
сплава, содержащего 1,27— 1,43% углерода. 11,75—13,75% хрома, 2,7—
3,3% кобальта, 0,6% никеля, 0,5—0,85?о молибдена и имеющего твердость
по Роквеллу Rc - 52.
В области твердых сплавов |3, 8, 121, стойких против коррозии, исти-
рания и окисления при высоких температурах, типичными для сварочных
прутков являются следующие составы:
Номер
1,31
4,84
3,42
2,74
5,67
32,4
18,52
24,54
W
3,98
1,02
13,25
Состав, %
Мо
6,86
11,86
0,58
Со
10,2
1,36
9,36
14,81
V
Мп
№
V
ДРУШС
металлы
1,63
3,42
0,6
1,5
Тш'рдость
по Ьпккерсу
900
710
870
608
В тех случаях, когда сочетаются истирание, окисление при высоких
температурах и коррозия, требуются сварочные прутки на основе кобальта,
как это указывается ниже для литых сплавов.
В настоящее время принято напылять сплавы на основе кобальта
в форме мелкого порошка из пульверизационного пистолета на детали из
углеродистой или малолегированной стали. Разбрызгиваемый металл удер-
живается в контакте с металлической поверхностью посредством механиче-
ского сцепления, приемлемого для некоторых видов применения. В других
областях применения разбрызгиваемый металл затем расплавляется и ме-
таллургически сцепляется с основным металлом. Для осуществления такого
сцепления сплав должен находиться при температуре плавления, что опре-
деляется по особому блеску поверхности наплавляемого металла. Это свой-
ство зависит от поверхностного натяжения, широкой области пластичности
и отсутствия окисла.
Из таких сплавов изготовляют штоки насосов, рукава, плунжеры
насосов, чехлы пирометров, края лопастей вентиляторов и т. д.
20 Jana.i № 239
306 Г лава 14
Кобальт в сплавах цветных металлов
Сплавы, содержащие 20—65% кобальта, обладают превосходной из-
носостойкостью и хорошо противостоят коррозии и окислению в условиях
очень сильной коррозии и высоких температур. Эти сплавы находят при-
менение для изготовления деталей реактивных двигателей, клапанов, рабо-
тающих в условиях сильной коррозии и высоких температур. Листовой
материал идет на изготовление рефлекторов прожекторов, а из отливок
этих сплавон делают хирургические и режущие инструменты.
Такие сплавы по составу разделяются на две группы: кобальт — хром —
вольфрам и кобальт — хром — никель — вольфрам, примем вольфрам
частично или полностью можно заменять молибденом. Эти сплавы можно
модифицировать небольшими добавками ванадия, ниобия, тантала, бора,
титана и углерода.
Стеллиты. В 1899 г. Хеннс разработал сплав кобальта с хромом, обла-
давший стойкостью к действию паров химических веществ и большой твер-
достью вплоть до красного каления. Сплав не поддавался обработке на хо-
лоду, но его можно было ковать при ярко-красном калении. В 1908 г. Хейнс
разработал сплав для изготовления режущих инструментов с кромкой,
как у отпущенной стали. Путем введения добавок вольфрама, молибдена
и углерода к сплаву на основе кобальта и хрома была превзойдена в этом
отношении быстрорежущая сталь. Благодаря этому сплавы кобальт —
хром - вольфрам получили собственную область применения н были
названы стеллитами (латин. stella — звезда).
Обработка. Сплавы на основе кобальта выплавляют из первичных
металлов и лигатуры в дуговых или индукционных электропечах без шла-
ков, но с добавлением раскислителей. Их отливают при температурах раз-
ливки 1450—1600 . Лнтье обладает хорошей жаропрочностью.
Вакуумная плавка, технология которой разработана совсем недавно,
применяется для улучшения физических свойств сплавов. Механические
свойства соответственно повышаются, еслп предотвращается окисление
п удаляются газы из металла. В качестве легирующих элементов можно
использовать более эффективно легко окисляющиеся элементы: бор, алю-
миний, титан, цирконий и т. д. Таким образом могут быть значительно
улучшены температурные характеристики и физические свойства сплавов,
содержащих кобальт. Технология ковки и прокатки требует точного регу-
лирования температурь! горячей обработки, а также степени обжатия. При
прессовании или штамповке после каждой операции рекомендуется про-
водить отжиг.
Кобальтовые высокотемпературные сплавы без труда поддаются обра-
ботке, когда они термообработаны на твердый раствор, частично или
полностью состарены. Они нагартонываются подобно аустенитным нержа-
веющим сталям, и к ним применима технология обработки нержавеющих
сталей. Режущие инструменты должны иметь острые кромки и жесткую уста-
новку. Подача и скорость резания должны быть ниже, чем для аустепптн-ых
сталей, но глубина резания должна быть достаточной, чтобы можно было
избежать засаливания. Необходимо применять эффективный охладитель.
Области применения. До 1939 г. различные сплавы кобальт - хром —
вольфрам начодили применение главным образом для изготовления режу-
щих инструментов, твердых сплавов и коррозионностойких отливок. Путем
Кобальт
307
модификации этих сплавов получены подходящие жаропрочные сплавы
для реактивных двигателей и артиллерийских установок.
11иже приводятся данные о составе и твердости типичных стеллитов.
ЛИТЫЬ СПЛАВЫ
Назначение
Состав, вес.%
I W , Fe
Т"'ь
Сварочный пруток № I
Сварочный пруток № 6
Сварочный пруток № 12
Сплавы для режущ нх
инструментов
Отливки
Вкладыши клапанов
Износостойкие детали
50
64
58
42—48
50 -65
45 48
51—53
33
25,5
29
30,5 35,5
28 32
30,5
30 -32
13 2
4,75 2,5
9 1.5
15 19 1,5
5—15
12,5
10- 11
1,5
2
2
2
1
1,
1,75
0,75-
2,
1,
85
-2
1,
4
7
,7
25
1
1,
1,
1,
1
о,
0,
75
5
5
5
6
54
39
48
59
40
-56
-42
-51
68
50
55- 60
53
58
ОБРАЬОТАННЫЕ СПЛАВЫ
Обозначение
Хейнс 6В
Хеннс 6К
Хеннс 25
Состав, вес.%
Твердость
W
59
58
40
30
31
20
4,5
4,5
15
1,5
1,5
2
1,1
1,6
0,1
SI
0.
0,
0,
7
7
7
Ni
1
1
10
«с
42—45
46—49
30- 38
Сплавы, применяемые в зубоврачебной технике и для изготовления
хирургических инструментов. Сплавы па основе кобальта и хрома, приме-
няемые в зубоврачебной технике и для изготовления хирургических
инструментов, не разъедаются жидкостями, имеющимися в человеческом
организме. Следовательно, в организме не возникает э. д. с, вызывающей
раздражение тканей. Ниже приводится состав таких сплавов.
Со* тип, m.f.%
А
В
С
D
Г.
Г
0,46
0,55
0,20
0,50
0,20
0,40
62,7
61,0
57,8
63,7
27,5
67,9
Ci
29,
30,
18,
27,
27,
24.
3
0
0
5
о
0
МО
5,6
5,8
2,0
5,3
5,3
5,3
Ге
0,8
1,0
0,5
1,8
1,6
1,5
SI
0,3
0,5
0,5
0,1
0,4
0.3
Мп
0,6
0,75
0,1
0,7
0,6
м
14,0
35,7
1,4
V
2
7
Be
1,2
-
Жаропрочные сплавы. В табл. 10 -12 приводятся данные о химиче-
ском составе и физических свойствах современных кобальтсодержащизс
жаропрочных сплавов.
Упрочнение сплавов на основе кобальта с малым содержанием угле-
рода достигается путем термообработки на твердый раствор с последующим
дисперсионным твердением при температурах 538—87Г в течение 8—100 час.
Ударная вязкость сплавов на основе кобальта при комнатной темнерату-
20*
Таблица 10
ДАННЫЕ ДЛЯ ПРОМЫШЛЕННЫХ КОВАЛЬТСОДЕРЖАЩИХ СПЛАВОВ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ РАБОТЫ ПРИ ВЫСОКИХ TFMnEPATTPAX
Темпера-
тура,
Предел
прочности
при растя-
жении,
2
Относитель-
ное удлине-
ние %
10
Р
час
зрушагощее напряжение!
кг/мм*
1 1 00 час
1000 час
Данные по ползучести
S-816(NDRC 76)
¦JСо; 20Cr; 20Ni; 4W; 4Nb; 4Mo; 3Fe; l,3Mn; 0,60Si; 0.40C
6,18
43,6
26,0
16,9
10,2
7,03
3,7
33,7
20,4
12,6
7,38
4,08
2,11
20,4 a
13,4a
8,43 a
3,52 a
29,5 5
18,35
11,26
6,96
Литой хейнс стеллит № 29 (NDRC 10 или модифицированный виталлиум)
6ОС0; 27,5Cr; 5,5Mo; 2,5Ni; <2,0Fe; l.OMn; 0,60Si; <0,35C
649
732
816
871
982
49,8
48,2
46,1
29,3
23,4
18.4
9,5
17,4
19,3
35,0
49,1
—
—
—
8,8
35,7
25,3
16,9
11,7
6,6
29,5
19.3
9,96
9.28
4,56
7,03 В
10,5"
4,93"
4,93в
7,03»
0,0313г
0,03Зг
0,0022г
0,U3125p
0,0033г
0,031 Д
0,0319Д
0,031 и
0,0414Д
0,0313 п
0,048<>
0,031 е
0,0465"
0,0444е
0,0313<>
N-155 (хеПис мультимет или NDRC 21 или NDRC 66 с 0,1С«о С)
27Fe; 21Cr; 21Co; 21Ni; 3,2Mo; 2,5W; l,5Mn; l,2Nb; 0,7Si: 0.33C; 0.14N
с о о о о
с о с о о
СО *~ и го СО
-*¦ — ОО "Ч* СО
<п cj со га оэ
О О О О О
о о о о о
8^
CN — CN
- OJ —¦
! i i
О
CD
CD
CO
56
42
V
4*
—
о
CD
CD
1
1
CO
СЧ
1
21
?D
О
CD
OO
—
«SL
CD CO — OO
I CO Ю OD CO
со —
V
СО (J
см щ
OD — ОО О
со
1С
1
m
о
—
о
ОО
ОС
о
eg со О со cn
СО
fO
Ol CD Г- CN
Темпера-
тура,
°С
Предел проч-
НОС1И ПрП
растяжении,
Относитель-
ное удлине-
ние %
Разрушающее напряжение,
I 000 час
Продолжение табл 10
Данные по ползучести
Xtfwc № 27 (NDRC 60; ЛМ5 5378)
>30,UCo; 26,0Сг; б.ОМо: <2,ПГе; 0.40С; остальное Ni
Комнат-
ная
538
G49
816
927
982
62,3
44,7
44,5
38,9
30,2
23,5
12,7
16,0
14,0
21,3
23,0
24,0
_
-
40.7
20,5*
11,2
8,8
_
38,7
16,5
8,43
6,53
_
32,4
12,9
6,05
4,78
Г 8,43в
К-42-В (NDRC 77)
42Ni; 22Со; 18Сг; 13Fe; 2,6Ti; 0,7Mn; 0,7Si; 0,2—0.6AI; 0,05C
,0319г ! 0,0318Д
Состарен в течение 50 чяс при 816'
649
732
816
871
82,2
68 1
37,9
20,3
9,0"
4,0
10,0
45,0
53,3
35,2
15,5
46,0
2Ь,0
11.2
—
27,4
18,3
7,03
16,8 а
5,За
23,1 В
9,56
G-32-B
45,5Со; 18,8Сг; 12,5Ni; 2,00Mo; l,30Nb; 2,8и\ ; 0.30C; 0,40Мп; 0.40SI; остальное Fe
Обработан на твердый раствор при 1280 в течение 10 мин и закален в масло. Состарен в течение 4G час при 750Л
3d час
100 час
1000 час
чомнат-
ная
700
750
800
850
100,8
10,A
35, Я
31,3
23,8
17,9
32,8
26,8
19,4
14,9
27,6
22,3
14,9
10,4
Напряжение (скорость ползучести 10~5 0„ час)
26,8
21,6
14,9
11,2
Ннмоник 90
62Ni; 18Со; 18Сг; 1,0Ге; 0, ЮС; 2,0Ti; 1,5A1
Комнат-
ная
649
7D4
749
816
110,3
77,3
68,5
50,7
39,0
20,0
15,0
8,0
100 час
50,7
41.0
29,8
18, G
300 час-
46,9
36,4
26,1
15,6
1000 час
42,4
32,1
22,3
11,9
Данные для горячекатаного прутка в полностью термообработлнноч чк шяиии. Термообработка состоит в нагревании до 1052 — 1179 в течение
»- 12 чйс с последующим охлаждение\1 на воздухе, noBTopHosi нагревании дп 704° в течение 12 —1Ь час п. охлаждении на воздухе.
* Состарен в течение 50 час при 816°. *"
а Напряжение для скорости ползучет! [),0п0\%/час.
6 Напряжение для скорости ползучести 0,00 1%/хас.
в Напряжение для 1800—2000 чис.
г Скорость ползу 1ести (.„/час) при 500 час.
^ Скорость ползучести (%/час) при 1000 час'.
е Скорость ползучести (%/час) при 2000 час.
312
Глава
СОСТАВ ТЕХНИЧЬСКИХ ЖАРОПРОЧНЫХ
G-I8-B
S-590
И. S. 30
Рефрактал-
лой-26
Х-40
Х-50
Реие-41
J-1570
V-36
U'I-52
Co
10
20
51
20
55
40
11
37,5
42
68
Ni
13
20
15
38
10
20
Ос-
таль-
ное
28
20
1
1
Cr
13
20
26
18
25
23
19
20
25
19,5
ML\AHII4ECKHL СНОПСТВА
инлав
G-18-B
S-590
H. S. 30
Рефрактал-
лой-26
X-40
X 50
Pene-4Ja
J-1570
V-36
VVI-52
11рсдСЛ
ПРОЧНОСТИ
женин.
кг/мм2
70
112,5
67.9
105,5
71
137,1
105,3
Fc Мп
5-1
27
I
16
0,6
3
5
0,8
1,5
0.5
0,8
0,6
0,6
0,5
2
3
0,5
—
0,9
0,3
14
Таблица 11
КОБАЛЬТСОДЕРЖАЩИХ СПЛАВОВ
Состав, вес. 9,
SI
1
0,6
0,4
1
0,7
0,5
Mo
2
4
6
3,2
—
0,5 9,7
-
0,5
—
4
0,3 —
w
2.5
4
_
7
12
7
2
11
Nb
3
4
_
С
0,4
0,43
0,42
0,03
0,5
0,8
—
f
0,09
1
2
1,5
0.2
прочие
3 Ti.
0.2 AI
0,01 В,
3,15Ti,
1.6А1
4,2 Ti
0,3
0,4
0,09 В
Таблица 12
¦К4РОПРОЧНЫХ КОБАЛЬТСОДЕРЖАЩИХ СПЛАВОВ
Относи-
тельное
УД-т
Напряжение, нызыва
за 1000 час
не- 1
нпе. 1
46
10
10
75
И
_
31
—
040°
24,6
29,5
—
32,3
70,3
54,9
30,1
732°
16,9
24,6
—
23,9
36,6
17,9
"
ощее разрушение
кг/мм?
740
10,9
41,4
—
788°
Состояние
Кованый
10.5 »
15,2
12,7
16,3
15,8
29,5
16,2
Литой
Кованый
Литой
Кованый
»
12,6 Литпн
10,
5
*
а Герчообработан. 100 час под напряжением разрушения.
ре ниже, чем при 816", однако ее можно повысить ковкой. Испытания па
усталость при высоких температурах F49°) показали, что литые сплавы
несколько уступают в этом отношении кованому металлу.
Порошкообразный кобальт
Порошковый кобальт [1,8, 12, 14, 17, 23] широко применяется в про-
изводстве спеченных твердых сплавов, магнитов и предназначенных для
Кобальт 313
легирования сплавов железо — никель — кобальт «сивар». Чистый спе-
ченный кобальт почти не применяется. Его получают из тонкоизмельчепной
окиси, которая восстанавливается водородом, окисью углерода или дру-
гими восстанавливающими газами при низких температурах (800"). В ре-
зультате образуются мягкие, пластичные и губчатые частицы. Для цемен-
тирования карбидов требуется порошок кобальта крупностью не больше
325 меш и с содержанием кобальта не ниже 98%. Плотность порошкообраз-
ного кобальта равна 8,9 г''слг\ насыпной вес 1,5—3.
Один из процессов получения порошка металлического кобальта на-
чинается с растворения гидроокиси кобальта в серной кислоте, при этом
образуется сульфат кобальта. К очищенному раствору сульфата кобальта
добавляют в избытке щавелевую кислоту для осаждения оксалата кобальта,
который при 800—900° превращается в окись. Окнсь кобальта восстанавли-
вают водородом до металла, содержащего 98,8% кобальта, не больше
1% никеля, О,О59с марганца, 0,1% окиси натрия и 0,5% окиси железа.
Крупность 50—60% зерен составляет 0,1—5 мк.
Другой процесс получения порошка металлического кобальта состоит
в растворении окиси кобальта в горячей соляной кислоте. После очистки
в раствор добавляют едкий натр, для осаждения гидроокиси кобальта, кото-
рая при нагревании до 400° превращается в окись. Затем окись восстанав-
ливают сухим водородом при 700° до металлического кобальта со степенью
чистоты 99%.
Порошки сплава кобальт — хром получают гидридным процессом при
одновременном восстановлении окислов соответствующих металлов. Эти
сплавы находят применение для изготовления высокопрочных и сверх-
твердых изделий.
Порошки сплава карбида вольфрама с кобальтом [4,8,10—12, 15, 1С, 19|
размалывают, прессуют и спекают в атмосфере очищенного водорода в ин-
тервале температур 1450—1550°. При температуре несколько выше 1400°
чистый кобальт обогащается карбидом вольфрама, причем агломерат
содержит 97 -87пи карбида вольфрама нЗ—13% жидкой фазы. С повышением
температуры содержание карбида вольфрама в жидкой фазе возрастает.
При охлаждении выделяется карбид вольфрама вследствие уменьшения его
растворимости в кобальте. При комнатной температуре в кобальте остается
в растворенном виде меньше 1% карбида вольфрама.
Твердость спеченных карбидо-кобальтовых сплавов F261 изменяет-
ся в зависимости от расстояния между частицами по экспоненциальному
закону. Ударная вязкость возрастает с увеличением содержания связки,
а сопротивление разрушению в поперечном направлении достигает мак-
симума при величине среднего свободного хода 0,3—0,6 мк.
Если связующая пленка становится очень тонкой, то прочность умень-
шается за счет хрупкой фазы и неполной дисперсии зерен карбида.
Штейниц 121] описывает постоянный магнит «пермет» из цветных ме-
таллов, изготовляемый из порошков металлов, содержащих 30°п кобальта,
45% меди и 25% никеля. Сплав «фернико» (фирма «Дженерал электрик»)
151, который получают из металлических порошков железа, никеля и ко-
бальта, взятых в соотношении 50 : 30 : 15, для нужд вакуумной техники,
превосходит литой сплав. Ростокер [181, исследовавший сплавы железо —
кобальт с содержанием 30, 40 и 50% кобальта, установил, что величина маг-
нитного насыщения для этих сплавов получается на 10% выше, чем для
чистого железа.
Гётцель [8] сообщает о спекании порошка кобальта с железом, нике-
лем, хромом, вольфрамом, молибденом, алюминием, бором и цинком.
HI 4 Г л ив а 14
Описаны F28] методы порошковой металлургии, применимые для
производства жаростойких сплавов с твердеющей основой, содержащих
5—30°и хрома, до 25% железа и до 90% никеля и (или) до 70°о кобальта.
Сплав упрочняется путем диспергирования в матрице фазы, препятствую-
щей сдвигу (и возврату) и состоящей из карбидов, боридов, силицидов
и нитридов титана, циркония, ниобия, тантала и ванадия. Сплав имеет
высокое сопротивление ползучести в интервале 800—1050'.
Уоррен и Либи1 [27| изучали влияние условий прессования и спекания
на проницаемость, плотность и концентрацию пор на поверхности спечен-
ных железо-кобальтовых порошков. Установлено, что по плотности не
всегда можно надежно следить за процессом спекания, но измерения
проникновения жидкости показывают изменения в процессе спекания, не
обнаруживаемые путем измерения плотности. Восстановление порошка
водородом перед спеканием и контроль процесса позволяют приблизиться
к теоретической плотности.
Для изготовления лопаток турбин и деталей реактивных двигателей,
работающих при высоких температурах, применяется смесь тугоплавких
окислов металлов (окись алюминия, двуокись циркония) 13, 9, 22] с такими
жаропрочными металлами, как вольфрам, молибден, кобачьт, никель
и хром (керметы).
Покрытия из кобальта и его сплавов
Кобальт. Применение электролитических покрытии кобальта 111, 14,
19—21, 23, 24, 28, 30, 34, 35] до сих пор ограничивалось более высокой
стоимостью и меньшей стойкостью таких покрытий против коррозии и окис-
ления при повышенных температурах по сравнению с никелем л хромом.
Литые или катаные аноды применяются в сочетании с различными элек-
тролитами, из которых наиболее типичные имеют следующий состав:
Концентрация, г'л
Сульфат кобальта CoSO4 278
Фторид натрия NaF 14
Борная кислота НдВОз 5
Температура комнатная шш выше
Плотность тока 0,0302 — 0,0507 а/см*
Кобальтовые покрытия имеют твердость по Бринсллю 270—311, тогда
как твердость никеля составляет 180—240.
Удельное электрическое сопротивление кобальта при 18° составляет
8,96 мком-см. а температурный коэффициент сопротивления в интер-
вале 0 100' равен около 0,0036. Примеси увеличивают удельное сопротив-
ление кобальта. Стандартный электродный потенциал для Со-э-Со2* при
25J равен + 0.278 в.
Электролитическое покрытие из сплавов кобальт — никель. Совмест-
ное покрытие кобальтом и никелем 111, 18, 25, 26, 32] из сульфат но-хло-
ридных ванн получило значительное промышленное применение вследстпне
того, что такое покрытие обладает хорошей пластичностью, надежно сцеп-
ляется с основным металлом и отличается своим блеском. Широко распро-
странена ванна следующего состава:
Концен-р.щия, г'л
Сульфат никеля (кристаллический) 237
Хлорид никеля (кристаллический) 44,9
Формиат никеля 44,9
А оба 1ып 315
Борная кислота 30
Сульфат кобальта 1,5 15
Сульфат аммония * до 2,25
Формальдегид 2,25
Рабочая температура 60— 70
Плотность тока 0,0432 а/см2
Механическое перемешивание электролита
Лнод делают из сплава никеля с 1—18°» кобальта в зависимости от содер-
жания кобальта в ванне. Чем выше содержание кобальта в аноде, тем боль-
ше блеск покрытия. Формиат никеля действует как буфер, а формальдегид—
только как осветлитель.
При электроосаждении кобальта или никеля, легированного фосфо-
ром 12, 3, 5, 6, 251 в количестве до 15%, образуются твердые, коррозионно-
стойкие и блестящие покрытия. В промышленности такие покрытия нано-
сятся на калибры, стенки цилиндров, поршневые кольца и стержни кла-
панов. Электролитическая ванна состоит из хлорида или сульфата кобальта
с добавками фосфористой или фосфорной, кислоты для поддержания
постоянной концентрации ионов водорода. Рабочая температура ванны 75е,
плотность тока 0,1 а'см". Твердость по Виккерсу покрытия изменяется
от 350 до 720. В результате термообработки при 400^ покрытие становится
тверже; кобальтовое покрытие с 10% фосфора увеличивает твердость по
Виккерсу до 1100.
Электроосаждеипые сплавы кобальт — вочьфрам II, 15, 16, 181 пред-
ставляют интерес дли промышленности из-за их твердости (особенно при
повышенных температурах), приближающейся к твердости стеллита. Рас-
твор, пригонный для нанесения покрытий, имеет следующий состав:
Концентрация, г/л
Кобальт (я виде хлорнча или сульфата) 25
Вольфрам (в ииде вольфрамата натрия) 25
Сегиетова соль 4П0
Хлорид или сульфат аммония 50
Водный раствор ачмиаьа до рН 8,5
Рабочая температура 9UJ
Плотность тока 2 - 5 о 'дм2
Аноды изготовляются из вольфрама, кобальта или сплава кобальт —воль-
фрам.
Нанесение покрытий путем химического восстановления. Кобальтовое
покрытие можно нанести путем аутокаталитического химического восста-
новления [4, 7, 291. Ванна состоит из водного раствора соли кобальта,
содержащего в небольшой концентрации гипофосфит. Кобальт осаждается
по следующей реакции:
СоС12 NaH2PO2-| HoO —* Co-f-2HCI + NaH,PO3.
Восстановление иона кобальта катализируется некоторыми металлами,
в том числе и кобальтом, а так как его получают по этой реакции, действие
этого металла носит аутокаталитический характер. Таким образом, реак-
ция, вначале протекающая медленно, затем ускоряется.
316 Глава 14
КОБАЛЬТ В БИОЛОГИИ И БИОХИМИИ
Кормление животных [2 8, 10J
Скармливание скоту кобальта в виде хлорида, ацетата, сульфата или
нитрата предупреждает заболевания, обусловленные минеральной недоста-
точностью, например энзоотическим истощением, алиментарной анемией,
недостаточностью кобальта и т. д.
Добавки кобальта в почву, естественно, следует вносить в зависимости
от местности. Почва, которая содержит 2- 10~6—7-10"% кобальта,
является бедной, в то время как нормальная почва содержит 13-10 е—
30-10 6% кобальта. Добавка 0,56—11,2 кг ацетата кобальта на 1 га обес-
печивает нормальное содержание его в почве. Добавка в корм и лизунцы
6,2—8,3 г нитрата кобальта на 10 кг смеси костной муки и соли или 6,2 г
CoSO4-7H2O на 10 кг соли способствует хорошему состоянию скота.
Добавление 1 % соли кобальта в корм дает 13 мг кобальта на 10 кг зерна.
Экологические исследования показали, что неудача ранних попыток
разводить скот во Флориде объясняется тем, что в сеце отсутствовал кобальт.
Микроорганизмы, присутствующие в рубце жвачных животных, нуждаются
в кобальте для синтеза витамина Bi2.
В Австралии овцам и коровам вводят кобальтовое «драже» (гранулы
солей кобальта) для восполнения недостатка кобальта. • Гранула, кото-
рую вводят в сетку желудка, постепенно растворяясь, обогащает содер-
жимое сетки и рубца 0,1 1,0 мг кобальта ежедневно. Длительность
существования гранулы в организме может достигать нормальной продол-
жительности жизни животного.
Сообщалось, что коровы при достаточном содержании в их корме
кобальта дают в молоке витамин В^, обладающий антианемическнм дей-
ствием.
Пока еще не установлено, играет ли кобальт существенную роль для
развития растений, хотя в очень небольших количествах он обнаружен во
многих растениях. Кобальт оказался действенным при лечении многих
заболеваний животных, но сообщения о его применении прн лечении забо-
леваний человека весьма противоречивы. Многие исследователи считают
кобальт необходимым и для человека. В отношении его токсичности Гар-
динг [41 считает, что порошок металлического кобальта, попадая в орга-
низм в виде взвеси в солевых растворах или в воздухе, приводит к острому
поражению капилляров. Кобальт вызывает тяжелый отек и кровоизлияние
в легких подопытных животных, иногда даже со смертельным исходом. При
введении кобальта в брюшную полость возникает асцит * и олигемический
шок**, также иногда со смертельным исходом.
Кобальт-fiO [1]
Благодаря своей доступности и простоте получения кобальт-60 широко
применяется в качестве источника излучений для радиотерапии.
Этот изотоп излучает улучи двоякого рода вместе с р-частицами.
у-Лучи с энергией 1,17 и 1,33 Мэв образуют почти монохроматическое излуче-
ние с энергией около 1,25 Мэв, которое почти не отличается от излучения
* Брюшная водянка — скопление в брюшной полости отечной жидкости.
Прим. ред.
** Шок на псгве олигечии — уменьшение общего количества крови в организме.
Одна из форм олигемии может развиться в результате отечных процессов, например
п легких.— Прим. ред.
КеОилып 317
хорошо заэкранированного источника радия. Достаточно мягкое Р-излу-
чь-нис можно отфильтровать листом стали толщиной 0,3 мм. Такая толщина
обеспечивает прочность стенок игл и трубок и не уменьшает интенсивности
¦у-излучения. Период' полураспада этого изотопа равен 5,3 года. Интен-
сивность излучения кобапьта-60 зависит от продолжитетьности облучения и
плотности нейтронного потока в ядерном реакторе. Эти факторы кон-
тролируются, что позволяет получать источники с самой разнообразной
интенсивностью излучения.
Можно получить одиночные компактные источники с интенсивностью
излучения, эквивалентного тысячным долям грамма радия.
На растущее применение кобальта-60 указывает расширение его про-
дажи Окриджской национальной лабораторией с 25 493 кюри в 1954 г.
до 93 618 в 1956 г. и 173 235 в 1958 г. [14]. Ниже приводятся цены на
кобальт-60 по его удельной активности.
Удельная ,, Удельная
aKTHBHwih, -. i^n., активность,
кюри/г I ВШ!/1'"юРи кюри/г
1 10
11 -25
2,00 25—40
3,00 >40
Цени,
4,00
5,00
Кобальт-60 поставляется частными фирмами, а также лабораториями
Ок-Риджа, Брукхейвена и «Атомик энерджи оф Канада». Комиссия по атом-
нон энергии США с 1958 г. прекратила выпуск источников Со60, заключен-
ных в оболочку, и теперь они производятся частными фирмами.
Канадская фирма «Атомик энерджи» выпускает в массовом количестве
источники излучения в виде игл и трубок с интенсивностью 0,1—50 мкюри,
а также в виде проволоки с интенсивностью 0,1—8 мкюри на единицу
активной длины II]. Она производит также цилиндрические источники раз-
мером 9,5 X 25 мм, а также небольшие таблетки. Окриджская лабо-
ратория поставляет небольшие таблетки и слоистые источники диаметром
1 и 2 см и толщиной 1 мм. Лаборатория Брукхейвена поставляет трубки
с внешним диаметром63,5мм и длиной 330мм и листы размером 3,2 х 50 X
X 330 мм. Для применения в области радиотерапии изготовляются уста-
новки, содержащие источники Со00, снабженные радиационной защитой
и приспособлениями для фокусировки. В США на сентябрь 1959 г. была
зарегистрирована 271 установка для радиотерапии. Такие установки изго-
товляют девять фирм [14]. Первая установка была выпущена фирмой «Дже-
нерал электрик». Активный источник такой установки для кобальтовой
радиотерапии состоит из ряда таблеток в форме правильного цилиндра
диаметром и высотой, равными 1 мм, заключенных в металлический
цилиндр диаметром 31,8 мм и высотой 14,3 мм, который помещается в мас-
сивный свинцовый контейнер. Установка весит 3 т.
Помимо лучевой терапии, кобальт-60 применяется для стерилизации
и консервации пищевых продуктов, для анализов, в металлургической
технологии, для физических и химических исследований, толщинометрии,
биологических, медицинских, генетических исследований, уничтожения
насекомых и инициирования различных химических реакций. Этот полез-
ный радиоактивный изотоп с большой активностью ¦у-излучения, имеющий
низкую стоимость, открывает широкие перспективы для исследований
и имеет самые различные обпасти применения.
318 Г л а в a J?
ЛИТЕРАТУР 1
ВВЕДЕНИЕ И РЛСИРОСТРЛНЫШОСТЬ В ПРИРОДЕ
1. A g г i с о 1 a G., De Re Metallica, Translated from the First Latin Edition of 1556
by H C. Hoover and L. 11. Hoover. 1 ondon, 1912.
2. Clarke F. W., The Data of Geochemistry, II. S. Geol. Survey, Bull. 770, 192-1.
3. Dru ry С W., Rept. Ontario Bur. Mines, 27, Pt. Ill A918).
J. Harris А. С Metallurgy of the Ores from Cobalt, Ontario, Eng. Mining J.
(April 8, 1916).
5. Kraut K., Z. angew. Chem., 19, 1793 A906).
6. Voung R- S., Cobalt, Reinholri Publishing Corp., New York, 1948, p. 6—23
(Revised edition to appear in 19C1).
7. Bowie S. H., Taylor К , Mining Mag. (London). 49, 265 A958)
8. J. Metals, 191, 17 A951).
9. P e г r a u 1 t R.. Le Cobalt, Dunod, Paris, 19-16.
Ob ОI Л ЩЕМИ С
I Allen С. Г . К е n t г о D. М., ьанад. пат. 46139С, November 29, 1949.
2. С и п л i ng h a m J. R-, ьанад. пат. 46-1960, May 9, 1950.
3. Denver EquipmentlSlaff, Union Miniere du Haut-Katanga, Kohvezi Concentrating
Plant, Deco Trefoil, November — December 1952.
4. Fine M. M.. Brown W. E., Trans. AIME. 602 (July 1951).
5. H с р к е г Н. N., частное сообщение.
6. Mayer S P., пат. США 2573865, November 6, 1951.
7. S a I / m a n G., Z. Erzbergbau und Metallhiittenw., 4, 222 A951).
8. V. S. Bureau of Mines. Repl. Invest. 4279, May 1948.
9. Harper J. F., Mining World. 34 (October 1958).
Ш Sengier E., Mining World, 38 (February 1957).
11. U. S. Bureau of Mines. Rept Invest. 5388, February 1958.
МЕТАЛЛУРГИЯ
1. AIME. J. Metals, 191, 17 (January 1951).
2. AIME, J. Metals, 5, 775 A953).
,i. Brogdon H. Vas. пат США 2-100098, May 14, 1946.
4. Churchward R. E., S h e 1 t о n F. ]<-, пат. США 2476284, July 19, 1Q4.9;
2577739, December 11, 1951.
5. Combined Intelligence ObjeclivesSuh-Coramittee, Item № 21, File Xa XXI-20, Refi-
ning of Cobalt in Germany, H. M. Slationery Office, London, 1946.
6. Г. 1. А. Т., Final Rept. №829, Non-Ferrous Production Processes in the Hamburg
District, November 19-15 (Cobalt from Pyrite).
7 Forward F. А., канад. пат. 492486 н 492487, April 28, 1953; пат. США 2647820,
August 4, 1953; 2576314, November 27, 1951.
8. Forward F. A., SamisC S.Kudryk V'., Can. Mining Met. Bull., p. 3.50,
June 1918.
9. G i 1 1 A. S , Proc. Australasian Inst. .Mining and Met., .V° 152 153, 73 A949).
10 H i I g e i s L. W , Investigation of the Reduction of Cobalt Mixed Oxide and Reli
ning Crude Cobalt, Aachen, Inst. fur MelallhCittenwesen und Electrometallurgic.
ComnHinication, 1950.
11. Hills R.C.Dufour M. F., пат. США2-Ю0115, May 14, 1946; 2531336, Novem-
her 21, 1950.
12. Johnusen F., Schwartz W., Z, Erzberghau und MetallhQllenw., 3, 138
A950).
Кобальт 319
13. М а с F а г I a n e Т.. Extraction of Cobalt Oxide from tlic Iron Pyrites, near Bro-
ckville, Ontario Dept. Mines, Article 18, 1863.
14. M с G а и 1 e у P. J., naf. США 2647819, August 1, 1953.
15. M a n t e I 1 С L.. пат. США 2506159, Ma\ 2, 1950.
16. N а к a b e S., J Metals, 3. MS A951).
17. (ГСппппг J , Chem. Eng., 59. 164 A952)
18. P err a u It R.. Le Cobalt, Dunori, Paris, 1946.
19. Schaal R. В., пат США 2379659, July 3, 1915.
20. Senger E. П., Cng. Mining .I. (December 1951).
21. S h e 1 t о n F. К- пат. США 2508-127, May 23., 1950.
22. S li p I 1 о n F. 1\., С h u г с li w a r d R. E.,S 1 a 111 J.C..L i v ings t on G. F.,
U S. Bureau of Mines, Rept. Invest. 3832, November 1945.
23. Societe Generate Metallurgique de Hoboken, англ. пат. 650595, February 21, 1951;
франц. пат. 496159, October 2, 1950.
24. S I a h 1 J. C. S li e 1 1 о n F. K-. пат. США 2526707, October 21, 1950.
2i. Talbnt H. L., H e p к е г Н. N.. Bull. lust. Mining and Met., 514, October 1949.
2C. Triggs W. VV.. англ. пат. 655149, July II, 1951.
27. VV a 1 1 i s E. A., W e s I D e Witt H.. англ пат- 672993, May 28, 1952; пат.
США 2377832, June 5, 1945; 2415665, February II, 1947.
28. W a I a ii a b e Т.. On the Recovery of Cobalt in Cupriferous Pyrile, Pdper
№ 477, Mem. Coll. Sci., Kyoto Imperial University, 1939.
29. W e s t с о t t E VV., пат. США 1406595, February 14, 1922.
3). Young R. S., Cobalt, Reinhold Publishing Corp., New York, 1948.
31 Car on M..1I-, Trans. A1MF.. IKS, 91 A950); 188. 67 A950).
32. Ferrante K. J , G о о d P. С, G r u z e n s к у V. M., U. S. Bureau of Mines,
Rept. Invest. 539-1, .May 1958.
33. Forward F A., Trans. Can. lust. Mining Met., 56, 373 A953).
34. Forward F. A., M а с к i w V. N., Trans. АШЕ, 203, 457 A955).
,J5. Forward F. A., S a m i s C.S., Kudryk V., Trans. Can. lnst: Mining Met.,
51, 181 A918).
.36. \\ i t с h e 1 1 J. S., J. Metals, 343 (March 1957)
37. N as her S.. Can. Mining Met. Bull., 58, Ns 519, 396—410 A955)
ЛЧ. Sense г E. Mining World. 38 (February 1957).
ФИЗИЧЕСКИЕ CBOflC I Н.Л
I. A r m s t г о п g L. D.. G г а у s о n-S m i t h H., Can. .1. Research, 28A. 51 A950).
2 Barrett VV. F.. Chem. News, 33. 266 A876).
3. В г i d g in a n P. W.. Proc. Am. Acad. Arts Sci., 53, 269 A918).
1. В rid Km an P. VV.. Metallwirlschaft, 8. 229 A929).
5. В r i d g m a n P. W.. Proc. Am. Acad. Arts Sci., 70, 285 A933).
6. С a r d w e 1 I A. B., Pliys. Rev., 38. 2033 A931).
7 С о р а и x H., C. R , 140, 659 A905).
8. D a и г е е к е г С, Ann. phys., 42, 1504 A913).
9. D e v i 1 1 e H. St. C, Ann. chilli, et phys.. 46, 202 A85fi).
10. Dewar J., Prnc. Roy. Soc, 89A, 158 A913).
11. E d w a r d s O. S., Lipson H., J. lnst. Metals, 69, 177 A9-13).
12. F i n e M. Г... F. I 1 i s W. C, Trans. AIME, 175. 742 A918).
13. G a n t T H.. Metal lnd., 26, 131 A925).
14. G и i 1 I a u d G., R о u x M-, С R., 229, 1062 A919).
15. H e n d r i с к s . В., J e f f e r s о n M. E., SchuHz J. -E., Z. Krist., 73,
376 A930).
1С. Hess J. В., Bairell C. S., J. Metals, 4, 645 A952).
.Ш Глава 14
17. Н odgman С D., Ed., Handbook of Chemistry and Physics, Chemical Rubber
Publishing Co., Cleveland, 1952, p. 2149
18. H о 1 b о г п I... Z. Physik, 8, 58 A921).
19. Honda K., Magnetic Properties of Matter, Svokwabo and Co. Tokyo, 1928, p. 82.
2U. Honda K-, Sci. Repts. Tohoku Imp. Univ., 8, 51 A919).
21. H о п d а К. Л1 a s u in о t о Н., Sci. Repts. Tohoku Imp. Univ., 20, 323 A931).
22. H u I 1 A. W., Phys. Rev., 17. 571 A921).
23. J a e R e r F. M., R о s e n b о h m E.. Z u i t h о f f A., J. Rec. trav. chim., 59,
831 A940).
24. К a 1 m u s H. Т., H a r p e г С. П., Can. Bur eau of Mines. Rept. 309. 1914.
25 К a 1 m u s H. Т.. H a r p e г С H.. J. Ind. Eng. Chem., 7, 6 A915).
26. К а у a S., Sci. Repts. T6hoku Imp. Univ., 17, 1157 A928).
27. Knntt С G., Proc. Roy Soc. Edinburgh, 18. 310 A891).
25. McLennan J. C, Niven С D., W i I h e 1 m JO Phil. Mag., G. 672
A932).
29. M с N a u g h t о n D. J., H о I h e г s t a 1 I A. W., J. Electrodepositors' lech.
Soc. 5. 63 A950).
30. M а г i с к L., Phys. Rev.. 49, 831 A936); Z. Physik, 307 A935).
.31. Masumoto H, Sei. Repts. Tohoku Imp. Univ., 15, 449 A926).
32. Masumoto H., Sci. Repts. Tnlioku Imp. Univ., 16, 321 A927).
33 M a s u in о t о H., Kara S., Kinzoku-no-Kenkyu, 2, 1023 A926).
3!. Meissner YV., Voight В., A d e 1 s b e r g e r V., Ann. Physik, 7, 892
A930).
35 M e I 1 or J. YV., Treatise on Inorganic and Theoretical Chemistry, Vol. 14, Long-
mans, Green anri Co., Inc., New York, 1935, p. 48G.
36 .Mendelssohn K, Oben J. L., Proc. Phys. Soc. 63A, 2 A950).
37. .Metals Handbook, Cleveland, American Society for Metals, 1918, p. 1137
38. M e t с a I f e А. С, Л1МЕ, Annual Meeting, Oclober 20, 1952.
39. Me lea He A. G., Proc. World Metallurgical Congress, Detroit, 1951.
40. M e у e r A. J. P., T a g 1 a n g P., С R., 231, 612 A950).
41. Meyer YV F., Z. Krist.. 97, 145A937).
42. M у e r s H. P.. S u с к s m i t h W-, Proc. Roy. Soc, 207A, 427 A951)
C. N i x F. C. J a u m о t F. E., Jr., Phys. Rev., 82, 72 A951).
44. Noll K., Ann. Physik und Chem., S3, 874 A894).
45. Perhaux H., C. R., 147, 532 A908).
46. R a b i п о w i t s с h E.. T h i 1 о E.. Z. physik. Chem., 6B, 284 A929).
47. R e i с h a r d t G., Ann. phys., 6, 832 A901).
48. Richards J. YV.. Chem. News, 75, 278 A897).
49. R i с h a r d ь Т. YV., Jackson F. G., Z. physik. Chem., 70, 414 A910).
50. R ichardson D., Spectroscopy in Science and Industry. Proceedings of the
Fifth Summer Conference on Spectroscopy and Its Applications, John YViley and Sons,
Inc., New York, 1938, p. 64 -70.
51 R u с г R.C., Birchenall С. E., Trans. AIME, 191, 142 A951).
52. R u e r R., Kaneko K- Ferrum, 10, 257 A913).
53. R u e г R , К а п е к о К-, Metall und Erz, 9, 421 A921).
54. S e h i m а п к Н., Ann. phys., 45, 706 A914)
55. S с h i m p f f H., Z. physik. Chem., 71, 257 A910)."
56. Schinitz H. E., Proc. Roy. Soc, 72, 177 A903).
57. Schulze A., Z. Metallkunde, 23, 308 A930).
58. S с h u I z e A.. Z. tech. Physik., 8, 365 A927).
59. Sekito S.r Sci. Rept. Tohoku Imp. Univ., 16, 545 A927).
60. S e у b о ! t A. U., Mathewson С. Н-, Trans. AIME, 117, 156 A935).
61. Shinoda G., Mem. Coll. Sci. Kyoto Imp. Univ., 17A, 27 A934).
Кобальт 321
62. Жуков С, Журн. русского фиэ.-хим. общ., 40, 1748 A909).
63. S t e i n w e h г Н. von, Schulze A., Z. Metallkunde, 27, 90 (IH35).
64. S u с k s m i t h W., J. Phys. Radium, 12, 430 A951).
65. Sykes W. P-. Trans. Am. Soc. Steel Treating, 21, 385 A933).
6G. Sykes VV. P., G r a f f H- F., Trans. Am. Soc. Metals, 23, 50 A935).
67. Taylor A., J. lnst. Metals, 77, 585 A940).
68. T г о i a n о A R., Tokich J. L., Trans. AIME. 175. 728 A948).
69. T u I j n VV., О n n e s H. K., Arch, neerl., 10, 5 A927).
70. T u r n b u 1 I D., J. Chem. Phys., 18, 769 A950).
71. U Helm an F. L.. Phil. Mag., 10, 633 A930).
72. U m i n о S., Sci. Repts. Tolioku Imp. Univ., 15, 597 A925).
73. U m i n о S., Seitetsu Kenkyu, 89, 290 A925).
74. V a n D u s e n M. S., D a h 1 A. I., J. Research NBS, 39, 291. Research Paper
№ 1828 A947).
75. W a h I W.. Z. anorg. allgem. Chem., 66, 60 A910).
76. Wasserman C, Melallwirtschaft, II, 61 A932).
77 Wever F., Hashimoto V., Mill. Kaiscr-Wilhelm-Inst. Kisenforsch., Diis-
seldorf, 11, 293 A929).
78. W u s t F., M e u t h e n A., D u r r e r R., Forsch. Ver. Deut. Ing., 204 A918).
79. В i b r i n g H., Sebilleau F., Buckle Ch., J. lnst. Metals, 11, 71 A958).
80. В r i ri g e s D.W.,Baur J. P., Fassell W. M., J. Electrochem. Soc, 103,
614 A95G).
81. С a r t e r R. E., R i с h a r d s о п К D., .1. Metals, 6, 1244 A954)
82. С a r t e r R. F.., R i с h a r d s о n F D, J. Metals, 7, 336 A955).
83. F i n e M. E., G r e e n e г E. H., J. Metals, 212, 47G A958).
84. J о h n s С R., В a 1 d w i n VV. M., J. Metals, 185, 720 A949).
85. M a r t i n D. L., J. Metals, 206. 578 A956).
86. Mead H. VV., В i г с h e n a 1 I С. Е., J. Metals, 7, 994 A955).
87. M о г r a I F. R., J. Metals, 10. C62 A958)
88. N e w k i r k J. В., M a r 1 i n W. G., J. Metals, 212, 398 A958).
89. R u d er R. С, В i г с h e n a 1 I С. Е., J. Metals, 191, 142 A951).
90. S h e w m о п P., Ind. Eng. Chem., 50. 492 A958).
91. S m e 1 t z e r W.W., Everett L H., Ind. Eng. Clicm., 50. 496 A958).
92. T а у 1 or A., F 1 о у d R. W., Acta Cryst., 3, 285 A950).
ХИМИЧЕСКИЕ СВОЙСТВА
1. В e i d I e г Е. А., пат. США 2642357. June 16, 1953.
2. В о u r g о i n L., Cours de Chimie—Metaux, L'EcolePolylechnique. Montreal, 1940.
3. D a v i s V. В., пат. США 2580737, January 1, 1952.
4. M с К e e v e г С. Н., пат. США 2476263, July 12, 194У; 2477554, July 26, 1949.
5. М е I 1 о г J. VV., A Comprehensive Treatise on Inorganic and Theoretical Chemistry,
Vol. 11, Cobalt, Longmans, Green and Co., Ltd., London, 1935.
6. Weiser H. В., The Hydrous Oxides, McGraw-Hill Book Company, Inc., New
York, 1927.
7. С a r t e r R. E., Richardson F. D., J. Metals, 7. 336 A955).
8. H e у d i n g R D., С a 1 v e r t L. D., Can. J. Chem., 35, 449 A957).
9 Kellog H. H., Trans. AIME, 191, 157 A951).
10. S с li а с h n e r If.. Cobalt, 37 A959).
КОБАЛЬТ В ЖЕЛЕЗНЫХ СПЛАВАХ
1. Climax Molybdenum Co.. Molybdenum in Steel and Iron Alloys, Climax Molybdenum
Co., New York, 1948.
2. D a s D. K, R i d e о u t S. P., В е с k P. A., Trans. AIME, 194, 1071 A952).
21 Заказ № 239
32? Глава 1J_
3 Duwez P.. Martens H.. Trans. Am. Soc. Metals, 44, -184 A952).
4 Gill J. P., Tool Steels, American Society for Metals, Cleveland, 1944.
5. Grossman M. А., В a i n E. C, High Speed Steel, John Wiley and Sons, Inc.,
New York, 1931.
6 Habraken L., Coutsourads D., Cobalt, №.2, II A959).
i. Martin D. L, Ceisler A. 11., Trans. Am. Soc. Metals, 44, 161 A952).
8. Metdlb Handbook, American Society for Metals, Cleveland, 1948.
9. Vanadium Steels and Irons, Vanadium Corporation of America, New York, 1937,
p. 140—147.
МАГНИТЫ
1 A I I ее М., -Magnets, Metallurgie et Construction Mecanique, 83, 881 A951).
Bates L. F., The Magnets-Resistance of High Coercivity Alloys, Proc Phys.
Soc. 58. 153 A946).
Bates L. F., E d m о n d s о п A. S., The Adiabatic Temperature Changes
Accompanying the Magnetisation of Cobalt in Low and Moderate Fields, Proc. Pliys.
Soc, 59, 3'29 A947).
В oggs A., Magnetic Materials, Western Union Tech. Rev., 4, 79 -85 A950).
С a r r \V. J., Intrinsic Magnetization in Alloys (Co — Fc), Phys. Rev., 85, 590
A952).
Chegwidden R. A., Rectangular Hysteresis Loops of Co - Ni — Fe Alloys,
J. Metals (Tech. Sect.), 1, 570 A949).
Chegwidden R. A., A Review of Magnetic Materials for Communication
Systems, Metal Progr., 54, 705—714 (November 1948).
С Ь e 1 i n fi D. G., Method of Making Cast Alnico Magnets, пат. США 2578407,
December 11, 1951.
F a 1 1 о t M., The Magnetic Properties and the Constitutional Diagram of Iron-
Cobalt Alloys, Metaux, corrosion, usure, 18, 214 A943).
F i n к e H. E., Modern Magnetic Materials, Materials and Methods, 25, 72 A947).
G arv i n S. J., Production of Sintered Permanent Magnets, Iron Steel Inst.
(London). Spec. Rept. Mb 38, Ed. 2 (Rev.). Symposium on Powder Metallurgy, p C7—72,
December 1947.
G augler E. A., Soft Magnet Materials, Prod. F.ng., 20, fi4 A949). Composi-
tion and Heat Treatment and Properties of Magnetic Fe—Co Alloys, and Fe —Ni — Co
Alloys.
G e i s 1 e r A. H., Structure of Permanent Magnet Alloys, Trans. Am Soc. Metals,
43. 70 A951).
G e i s 1 e г А. Н-, N e w к i г к J. В., Mechanism of Precipitation in a Perma-
nent Magnet Alloy, Metals Technol., 15. 20 A948).
G e i s 1 er A. H., Structure and Properties of the Permanent Magnet Alloys, Clec
Eng., 69, 37 (I960).
Geiiler A. H., S teigert F. E., Precipitation and Diffuse Scattering in an
Fe — Mo — Co A7% Mo, \2% Co, bal. Fe) Alloy, J. Metals, 3, 259 A951).
Goldman J. E., Smoluchowski, Magnetostriction and Order — Disor-
der, J Appl. Phys, 20, 1 A94H). Alloys Fe — Co.
G о s s J. H., Permanent .Magnetic Material, Mcch. Eng., 70, *671 A948).
Harris S., The Production and Properties of Pressed Permanent Magnets,
Plastics (London), 10, 534 A946).
Hoselitz K-, Modern Hard .Magnetic Materials, Metal Treatment, 13, 213
A94C).
H о t a p W., The Particular Situation of Powder Metallurgy in the Manufacture
of Permanent Magnets (German), 4th International Mechanical Frig. Congress, June
1952.
Кобальт 323
К i t t e I С, К e s b i t t E. A., S h о с к I e у W., Theory of .Magnetic Proper-
ties of Alnico V, Phys. Rev., 77. 839 A950); Discussion, November 15, 757 A950).
К п о r r VV.. Study of the Most Suitable Chemical Composition of 4% Cr, 296 Co,
0,5% VV Permanent .Magnet Steel, Arch. Eisenhiiltenw., 23, 53 A952).
Lee F. W., Magnetostriction of Some Ferromagnelic Alloys, J. Iron Steel Inst
(London). 171, 160 A952).
Martin 1). L, Qeisler A. H., Heat Treating Cobalt-Platinum Magnets,
пат. США 2622050, December 16, 1952.
M e r i I I F. W., Performance of Ihe New Alnico Permanent Magnet Materials,
Elec. Mfg., 39, 72 A947).
Myers H. P., S u с к s m i t h H., The Spontaneous Magnetization of Cobalt,
Proc. Roy. Soc, 207, 427 A951).
N e s b i t t E. A.. Vicalloy — A Workable Alloy for Permanent Magnets, Metals
Technol., 13 (February 1946), and Trans. AIME (Metals), 415 A946).
Newkirk J. В., G e i s 1 e r A. H., Martin D. L , The Ordering Reaction"
in Co Pt E0—50 at.%) Alloys. J. Appl. Phys., 20, 816 A949).
Schneider A., VVunderlich VV., Solid Solutions in Co — Mn Systems,
Z. Metallkunde, 40, 2G0 A949).
Stanley J- K-, Metallurgical Factors Affecting the Magnetic and Mechanical
Properties of Iron-Cobalt Alloys, Trans. Am. Soc. Metals, 42, 150 A950).
Stark J. H., Low Cost Processing of Alnico Rotors anri Stators, Elec. Mfg., 48,
125 A951).
Steini tz R., Perinet, a Non-ferrous Permanent Magnet Made from Powders,
Powder Met Bull., 1. 45 A946). Permct contains 30% Co, 45% Cu, 25% Ni.
S t u d d e r s R. J-, Permanent Magnets of Sintered Oxides, Prod. Eng., 19,
120 A94Й).
Studders R. J-, Permanent Magnet Stability, Prod. Eng., 19. 129 A948).
T a g 1 a n g P., Relation Between Moments and Curie Points of 'boelectronic'
Alloys of the Fe — Co — Ni Group, С R , 229, 704 A949)
T о г г у A., The Structure of Nickel-Aluminum Magnet Alloys and the Con-
trol of Brittleness. Melallurgie, 34, 147 A946).
Turner R. S., Use of Synthetic Sand for Cast Magnels, Foundry Trade J., 85,
153 A948).
Underbill E. M., Permanent Magnet Alloys, Electronics, 21, 122 A948).
Walker J. G.. VV i I 1 i a in s J. H., Growing and Processing of Single Crystals
of Magnetic Metals. Rev. Sci. Instr., 20, 947 A949).
Weil L., Galley M., A New Method for Determination of Magnetostriction.
Application to Cobalt Territe, С R., 231, 224 A950).
Werner, J e I 1 i n fi h a u s, Permanent Magnets, Iron and Steel, 17 A944).
Quinternary alloys of Fe, Ni, Al, Co, and Cu with magnetic orientation.
Wilson M- S., VV h i t t e n t о п J. M., Influence of Improved Magnetic Alloys
on Design Trends of Electrical Instruments, Elec. Eng.. 63. 100 A944). Use of a Co —
Me — Fe alloy as a permanent magnet material.
W о h 1 f a r t li E. P., Magnetic Properties of Nickel-Cobalt and Related Alloys.
Phil. Mag., 40. 1095 A949).
II. A n s e I i n F., Permanent Magnetic Materials, Cobalt, Mb 3, 17 A959); J* 4.
29 A95Я).
Arnold H. D.Elmen G. W., Permalloy, an Alloy of Remarkable Magnetic
Properties, J. Franklin Inst., 195, 621 A923).
В а с к 1 u n d N., Electrical Resistance of Some Noble-Metal Alloys at liquid
Helium Temperatures, J. Physics Chem. Solids, 7, 94 A958).
Becker J. J., Magnetic Method for the Measurement of Precipitate Particle-
Sizes in a Cu — Co Alloy, J. Metals, 9, 59 A957).
21*
324 Глава 14
В u in а п п Н., Permanent Magnetic Alloys, Arch. Eisenliiittcnw., 15, 547 A942)
Ellis YV. C, A Study of the Physical Properties of Electrolytic Cobalt and Its
Alloys with Iron, Rensselaer Polytech. Inst. Bull., Eng. Sci. Ser. № 16 A927)
Ellis W. C, Schumacher E. E.v Magnetic A\aterials, Metals and Alloys,
269 (December 1934).
Fountain R. \V., L i b s с h J. F., Development of Mechanical and Magnetic
Hardness in a 10 Pet. V — Co — Fe Alloy, J. Metals, 5, 349 A953).
Gerstenberg D., Magnetic Investigations on Solid Solutions of Palladium
with Transition Elements (Cobalt), Ann. Physik, 2, 236 A953).
Hall R. C.,C о n r a d G. P., L i b sc h J. F., Ordering and Magnetic Treatment
ol the 50 Pet. Fe — 50 Pet Co Alloy, ,1. Metals, 7, 985 A955).
Martin U. L., Processing and Properties of Cobalt — Platinum Permanent-
Magnet Alloys, J. Metals, 212, 478 A958).
T о о I e R. C, Ferromagnetic Cobalt and Nickel Manganese Oxideb Having the
lltncnite Type Crystal Structure, канад. пат. 546593, 1957.
СПАИ СТЕКЛО — МЕТАЛЛ
1. Metal Intl., 75, 263 (September 30); 292 (October 7, 1949).
2. Mairs КН., J. Metals, 4, 460 A952).
3. Redston G. D., S t a n w о r t h J. E., J. Sci. Instr., 23, 53 A946).
4. Went J. J.. каиад. пат. 486768, Sepleraber 23, 1952.
спллвы. стойкие против коррозии и окисления
1. Metal Progr., 116 (February 1953).
2. ASTM. Symposium on Materials for Gas Turbines, Bull. Am. Soe. Testing Materials,
199 A916).
3. A v e г у Н. S., Iron Steel Engr., 26 (September 1951).
¦1. В a r d g e t t W. E-, Bolsover G.R., IronSteel Inst. (London). 135 (July 1952).
5. В i n d e r W.O., Franks R.. пат. США 2624671, January 6, 1953.
в. Bollenratli F., Cornelius H., Bungardt W, Metallwirtschaft, I,
755 A938).
7. С I a r k e W. С, пат. США '2536033, January 2, 1951.
8 Cornelius H., Arch. Eisenhuttenw., 15, 47 A941).
9. F r a n k s R., Binder YV. О., канад. пат. 460262, 460263, 460274, 460275,
October II, 1949.
10. L a r d g e H. E., Iron Steel Insl. (London), Spec. Rept. J* 43, July 1952.
11. Ocot t E. L., пат. США 2462665, February 22, 1949.
12. Riddl hough M-, Hardfacing by Welding, The Louis Casbier Co., Ltd.. Lon-
don, 1949.
13. Rose K-, Materials and Methods, 32, 54 A950).
14- Schmidt M., пат. США 2553600. May 22, 1951.
15. S k u e s C, G i f f a r d J A., S t о k e s С, англ. пат 616207, January 18, 1949.
16. S у k e s C, S h i г 1 e у Н. Т., Iron Stee! Inst. (London), Spec. Rept. № 43, 153.
July 1952.
17. W a i n d I e R. F., Metal Progr., 56. 808 A949).
КОБАЛЬТ Б СПЛАНАХ ЦВЕТНЫХ МЕТАЛЛОВ
I. ASM Staff, Approximate Strength of Important Jet Engine Alloys (Round lest
Bars), Metal Progr., 60. 80B A951).
Beattie N.J.Versnyder F. L.r Mieroconstituents in High Temperature
Alloys, Am. Soc. Metals, Preprint 1, October 1952.
Кобальт 325
В i e b e r С. С, Cast or Wrought Alloy, Age-hardenable, пат. США 2570193,
October 9, 1951.
Binder W. О., S p e n d e 1 о w H. R., New Cobalt-Base Alloy for High-Tem-
perature Sheel, .Metal Progr., 57, 321 A950).
Binder W. O., W e i s e r t E. D., Some Notes on the Oxidation-Resistance
of Boron-Containing Cr — Ni — Co — Fe Alloys, Corrosion, 9, 329 (February 1953).
В u s w e I 1 R. W., Jenkins I., P i t к i n W. R., Sintered Alloys for High
Temperature Service in Gas Turbines. Powder Met. Bull., 6, 110 A952).
Cameron J. M., Y о u d e n W- J., Statistical Analysis of Stress-Rupture
Data on S-816 Alloy B0% Co), Am. Soc. Testing Materials Proc, 50, 951 A950).
С h a s t о ii J. С. С h i 1 d F. C, Some Cobalt Rich Alloys for High Temperature
Service, Iron Steel lust. (London), Spec. Kept. № 43, 246—248, July 1952.
Clark F. 11., Metals at High Temperatures, Reinhold Publishing Corp., New
York, 1950.
Com stock G. J, Shaw J. D., Properties of Cobalt-Nickcl-Chromium
Alloys Made by Powder Metallurgy, in Physics of Powder Metallurgy, McGraw-Hill
Book Company. Inc., New York, 1951, p. 372—386.
Davis E. A., M a n j о i n e M. J., Fffect of Shape of Notch on Rupture Stren-
gth of High-Temperature Alloys, Am. Soc. Testing Materials, Preprint 78, June 1952.
Deloro Stellite, Ltd., Harrifacing with Stellite, Machinery (London), 80, 179 A952).
D у m J. В., Badger Т.. Cast Alloys Vary in Cutting Efficiency, Am. Machi-
nist, 109 (November 20, 1947).
Edwards A. R., New High Temperature Alloys, Australasian Engr., 42
(June 7, 1952).
F о 1 e у F. В., Metal Alloy for High Temperatures (Ni —Cr — Co), пат. США
2543841, March 6, 1951.
Freeman .1. W , E w i n g J. F., White A. E., Influence of Chemical
Composition op Rupture Properties at 1500°F of Forged Cr — Co — Ni Fe Base Alloys,
Natl. Advisory Comm. Aeronautics, Tech. Note 2745, July 1952.
Fr ey "D. N.. Freem an J. W., While A. E., Fundamental Effects of
Cold-Work on Some Cobalt-Chromiiim-Nickel-Iron Base Creep-Resistant Alloys. Natl.
Advisory Comm. Aeronautics, Tech. Note № 2586. July 1952.
G a d d E. R., Precision Casting Turbine Blades, High Temperature Steels and
Alloys for Gas Turbines, Iron Steel Inst. (London), Spec. Rept. № 43,"July 1952.
Grant N. J., Kales L. W., Hamilton N. E., Development and Eva-
luation of Cast Turbine Rotors, Foundry, 78, 86 A950).
Oresham H. E., D u n 1 о р A., Investment-Casting Nozzle Guide Vanes,
Iron Steel Inst. (London), Spec. Rept № 43, July 1952.
Harder О. Е., Roberts D. A., Cobalt-Chromium-Nickel Case Alloy,
капад. пат. 480487, 480488, -180489, January 22, 1952.
H a r k i n s F. G., Process Control for Resistance Welding Under Government
Specifications (Co-Base Alloys), Welding J. (N. Y), 31, 567 (July 1952).
H а у n e s E., Allovs of Cobalt with Chromium and Other Metals, lnd. Eng.
Chem.. 5, 189 A913).
11 а у n e s E., Stellite and Stainless Steel, J. Western Soc. Engrs., 35, 467 A919—
1920).
Haynes Stellite Co., Haynes Alloys for High Temperature, Booklet, Kokomo, lnd.
Henry Wiggin and Co., Ltd., The К imonic Alloys, Brochure, Birmingham, 16 England
Jessop Wm and Sons, Ltd., Alloy for High Temperature Service, англ. пат. 670560,
April 23, 1952; 674023, June 18, 1952.
К a m e n E. L., Beck P. A., Survey of Portions of the Cobalt-Chromium-
Iron-Nickel Quaternary System, Natl. Advisory Comm. Aeronautics, Tech. Notes
№ 2603, February 1952, and 2G83, April 1952.
326 Глава 14
К i n s е у Н. V., High Temperature Alloys for Gas Turbines, Can. Metals, 28
(October 1952); 20 (December 1952).
Lane J R., Grant N. J., Carbide Reactions in High Temperature Alloys,
Trans. Am. Soc. Metals, 44. 113 A952).
MacKenzie B. J., Industrial Applications of Stellite, Can. Metals, 13, 48A952).
M a n j о i n e M. J., Effect of Rate of Strain on Hie Flow Stress of Gas Turbine
Alloys at 1200- and 150U F, Am. Soc. Testing Materials Proc, 50. 931 A950).
Manly W. D., Beck P. A., Survey of the Chromium Cobalt-Nickel
Phase Diagram at 1200° C, Natl. Advisory fomra. Aeronautics, Tech. bole 2602, Februa-
ry 1952.
Martin D. L , Ocisler А. П., Constitution of C.nbalt-lron-Vanadium
Alloys, Trans. Am. Soc. Metals. 44, 161 A952)
P о р с о с к Р. L., Hardfacing — Applications (Slcllite) to Iron and Steel Indu-
stries, Iron and Steel, 24, 323 A951).
Preston D., Investigation of High Temperature Sheet Materials, Am. Soc.
Testing Materials, Preprint 85, 1952.
R e у n о 1 d s E. E., The Influence of Chemical Composition on the Rupture Prope-
rlies al 1200 F F481 (") of Wrought Criromium-Nickel-Cobalt-lron-Molybdenum-
Tunnsten-Niobiiim Alloys, University Microfilms, Publ. №2151. 1951; Trans. AIME.
Т. Р. 3344Е, p. 946.
Reynolds E. E., Freeman J. W., W h i t e A. F., Influence of Chemical
Composition on Forged Modified Low-Carbon N-1E5 Alloys in Solution-treated and Aged,
as Related to Rupture Properties at 1200' F, Natl. Advisory Comm. Aeronautics, Tech.
Note 2449, September 1951.
Rolls-Royce, Ltd., Hard Wear-Resisling Ni - Cr — Co Alloys for High Tempera-
ture, англ. пат. 666101, February 13, 1952.
Schmidt M., Weldable and High Temperature Alloy of Cobalt and Iron, цат.
США 2553609, May 22. 1951.
Schmucker R. A., P r e u s с h. Cast Alloy for Cutting Tools, канад. пат.
491130, March 10, 1953; пат. США 2551170, May 1, 1951
S e r v i S I . G r a n t N. J., Creep and Stress Rupture a= Rate Processes, J.
Inst. Metals, 80, 33 A951 — 1952).
Shaw M. C, Smith P. A., Metallurgical Considerations in Machining —
Physical Characteristics of Cast Alloys and Carbides, Am. Machinist, 130 (October 15,
1951)
VV a 1 d г о п М. В., The Stability of the Co2AlrrT ype Structure in the Alumi-
num-rich Alloys of the Al Fc — Co— Ni System, J. Inst Metals, 79, 103 A951).
Y а к е г С, Н о f f m a n C.A., Effect of Soluiion Treatment Followed by Aging
Treatment on Life of Small Cast Gas-Turbine Blades of a Cobalt-Chromium-Rase
Alloy, Natl. Advisory Cumm. Aeronautics, Tech Note № 232U, March 1951.
II. Culbertsnn P. P., How to Weld Some Wrought High Alloys, Materials and
Methods, 98 (February 1955).
D e in i r j i a n S. G., Which Alloys for Jet Hot Spots, Materials and Methods,
116 (October 1955).
Evaluation of Two High-Carbon Precision-Cast Alloys at 1700° and 1800 F by Rup-
ture Test, Natl. Advisory Comm. Aeronautics, Tech. Note K? 1130, 1946.
F о r ri h a m S., H a 1 1 p i к e M., R i d d i h о u g h M., Notes on the Techni-
que of Temporal Bone Microtomy (Stcllited Knives), Brit. Med. Cull., 12, 93 A956).
G a u 1 t J. R., Ironside D. A., 1 he Spray Fuse Hardfacing Process for 'Stel-
lite', Cobalt Base Powders, Machinery (London) (January 28, 1959).
Hoffman C. A., Gyorgak C. A., Investigation of Effects of Grain Size
Upon Engine Life of Cast A. M S. 5385 Gas Turbine Blades, Natl. Advisory Comm Aero-
nautics, Research Mem. Л° E53D06, July 6, 1953.
Кобальт 327
L a m p s » n F. K-, Tsarcff T. C, Green A. VV.. Thermal-Shock Testing
under Stress of Certain High-Temperature Alloys, Am. Soc. Testing Materials Proc,
57, 965 A957).
Я u r r a I F. R., Alloys for the Aircraft Industry, Cobalt, № 2, 23 A959).
Resistance of Six Cast High-Temperature Alloys to Cracking Caused by '1 hermal
Shock, Natl. Advisory Conim. Aeronautics, Tech. Note № 2037, 1950.
Siegfried W , Eisermann F., A Turbine-Blade Alloy Castable and Low
in Cohalt and Columbium, Metal Progr., 67, 141 A955).
U r b a i n M., High Temperature Alloys, Cobalt, № 1, 13 A959).
\V e e t о n J. W., S i g n о r e 1 1 i R. A., An Investigation of Lamellar Structu-
res and Minor Phases in Eleven Cobalt-Base Alloys Before and After Heat Treatment,
Natl. Advisory Comm Aeronautics, Tech. Note J\° 3109. 1951
порошкообразный кобальт
I.Anderson R. В., М с С a r t n с v J. Т., J. Appl. Phys., 18, 902 A947).
2. Berry В. Е., The Manufacture of Cemented Tungsten Carbide, Murex, Ltd. Rev.,
I (») A951).
3. Blackburn A. R., Shevlin T. S., Bowers H. R-, J. Am. Ceram. Soc.
32, 81 A919).
4 British Intelligence Objectives Sub-Committee, German Hard Matal Industry, Final
Kept. № 1385. Item № 21, 1945, London, H. M. Stalionery Office.
R. Bur fie г E. E., Gen. Elcc. Rev., 49, 22 A946).
G. В u s w e 1 1 R. W., P i t к e n W. R., Jenkins 1 , Sintered Alloys for High-
Temperature Service in Gas Turbines, Iron and Steel Institute, Symposium on High
Temperature Steels and Alloys for Gas Turbines, p. 258—268, 1951.
7. G a r v i n S. J., Engineering 163, 445 (May 30), 465 (June 6, 1947); Iron Steel
lnst. (London), Spec. Rept. № 38, p 67, December 1947.
8. G о e t ? e 1 C. G., Treatise on Powder Metallurgy, Vols. 1 -3, Interscience Publi-
shers. Inc., New York, 1950.
9. II a m j i a m H. J., L i d in a n W. G., Natl. Advisory Comm. Aeronautics, Tech
Note № 1918, September 1949.
10. H о о d T. A., Manufacture of Cemented Carbides, Maribyrnonfi, Victoria, Austra-
lia, Inform. Circ. № 12 (.1947) Defense Research Laboratories, Dept. of Supply and
Development.
11. J ackson W. R., Powder Metallurgy as Applied to Cemented Carbides, Can.
Mining Met. null., № 390, 393 (October 1944).
12. К i e f f e r R., Hotop ty , Pulvermetallurgie und Sinterwerkstoffe, Berlin,
J Springer, 1943; Metal lnd. (London) (June 1, 8, 15, 1945).
13. L i h 1 F., (German), Acta Phys. Anstriaca, 4, 360 A951).
14. L и m 1 e у E. J. Т., H о n e у с о m b с R. W. K-, Greenwood J. N., Proc.
Australasian lnst. Mining and Met. № 128, p. 221—226, 1942.
15. Mantle E. C, The Sintering of Tungsten Carbide with Cobalt Binder, Metal
Treatment, 14, 141 A947).
16. Месрсон Г. А., Липкес Я. М., Metal lnd. (London), 290 (November 7),
306 (November 14, 1941).
17 Mirnslav P., Hutnicke listy, 5, 105 A950).
18. К о s t о k e г W., Trans. Am. lnst. Mining Met. Engrs., 180, 672 A949).
19. S a n d f о r d E. J., T r e n t E. M., Iron Steel lnst. (London), Spec. Rcpt. № 38,
p. 84, December 1947.
20. S с h u m а с h e r E. E., S a u d e n AC, Powder Metallurgy, Metals and Alloys,
20. 1327 A944).
21. S t e i n i t i R., Powder Met. Bull., I, 45 A916).
328 Глава 14
22. Whitman M. J-, R е р к о A. J., Natl. Advisory Comm. Aeronautics, Tech.
Note № 19Ы, p. 49, July 1949.
23. VV u 1 F J., Powder Metallurgy, American Society for Metals, Cleveland, 1942.
24. В ooss J. H., Trans. A1ME, 215, 395 A959).
25. G u r 1 a n d J., J. Metals, 6, 285 A954).
26. G u r 1 a n d J., В a r d z i 1 P., J. Metals, 7, 311 A955).
27. Warren D., L i b s с h J. F., Trans. AIME. 191, 774 A951).
28. G о e t z e 1, Grant, Y о b 1 i n, кэнад. пат. 559409.
ПОКРЫТИЯ ИЗ КОСЛЛЬТА И ЕГО СПЛАВОВ
1 Brenner A., Burkhead P.Seegmiller E., U. S. Natl. Bur. Stan-
dards, Research Paper № 1834, 39, 351 A947).
2. В r e n n e г А., С h a s e С, С о u с h D. E., пат. США 2643221, June 23, 1953.
3. Brenner А., С h a s e C, R i d d e 1 1 G. E., Steel, 126, 99 A950); Iron Age,
165. 78 A950); Metal Finishing, 48, 65 A950).
4. В r e n n e г А., С h a s e C, R i d d e 1 1 G. E., пат. США 2532284, December 5,
1950.
5. В r e n n e r A., Couch D. E., Williams E. K, J. Research NBS, 44,
109 A950); U. S. Natl. Bur. Standards, Research Paper № 206 r, 1950; Metal Progr.,
114 A951).
6. Brenner A., Couch D. E., Williams E. K-, Plating, 37, 36 (January
1930); 161 (February 1950); J. Research NBS, 44, 109 A950).
7. Brenner A., R i d d e 1 1 G., J Research NBS, 39, 385 A947); Cliem. Age (Lon-
don). 57, 156 A947); Brit. Chem. Dig., 2, 322 A948); Steel Processing, 33, 67, Steel,
121, K4 A947).
8. С 1 a r k W- E.. H о 1 t M. L., J. Electrocliem. Soc., 94, 245 A948).
9. E v a n s L". R., S h о m e S. C, J. Electrodepositors1 Tech. Soc., 26, № 9A950).
lu. F a u s t C. L., Trans. Electrochem. Soc., Preprint 80—18, 181 A941).
11. Fedotov N.. Trans. Electrocliem. Soc.. «7, 547 A945).
12. Fink C.G.,Hutton J. L., Trans. Electrochem. Soc, 85. 119 A944).
13. F i n k С G., L a h K- H., Trans. Electrochem. Soc , Preprint 58—18, 241 A930).
14. G i 1 1 A. S., Proc. Australasian Inst. Mining and Met., 152- 153, 73 A949).
15. Holt №. L., Black R. E., 11 о g 1 u n d P. F., Trans. Electrochem. Soc,
Preprint 84 — 15, 139 A943).
16. H og 1 u n d P. F., H о 1 I M. L., Trans. Electrocliem. Soc, 88, 359 A945).
17. Ku Herat h A., Arch. Metallk., 2, 135 A948).
18. Led Ford R. F., Plating, 36, 560 A949).
19. О 1 d а с h С S., L a n ri a u R., Metals and Alloys, 17, 967 A943).
20. R о n t g e n P., G i e s e n K., Metall und Erz, 39, 7 A942).
21. S о d e r b e г б О., Pinner W.L., Baker E. №... Trans. Electrochem. Soc,
Preprint 80—32. 401 A941).
22. S о d e r b e r g G., P i n n e r W. L, Baker С. М., Metal Ind. (London), 67.
200 A945).
23. Verdi eck R., Ksyckji M. J., Yntema L. F., Trans. Electrochem.
Soc, Preprint 80—11, 93 A941).
24. Voung K- S., Cobalt, Reinhold Publishing Corp., New York, 1948, p. 113—120.
25. В о n n Т. Н., Wendell D. С, пат США 2644787, July 7, 1943.
26. Brown H., пат. США 2654703, October 6, 1953.
27. С u t h b e r t s on J. W-, Chem. and Ind., 48, 1152 A952).
28. Fegredo D. M., J. Indian Inst. Sci., 35B, 191 A953).
29. Hays S., пат- США 2871142, Januaiy 27, 1959.
30. KuFferath A., Arch. Metallk., 2, 135 A948).
Кобальт 329
31. Marcel de Merre, пат. США 2624702. January 6, 1953.
32. M о 1 i n e W. Е., С 1 i n с h e n s R. M., пат. США 2730491, January 10, 1956.
33. Nokin J., Rev. universelle mines, 13, 220 A957).
34. О к u п о G., Studies in Nat. Sci., 46—47 A950).
35. S a 1 in о n у A., Thews R., The Present Posilion of Cobalt Plating, Metallo-
berflache, 2,114 A9'18).
КОБАЛЬТ В БИОЛОГИИ И БИОХИМИИ
1. Atomic Energy of Canada, Ltd., частное сообщение.
2. В е с к e r D. E., S e d g vv i с к E., Loosli J. K-. Science, 110, 71 A949).
3. В о n s t e d t G., Vet. Med., 44, 451 A949).
4. Harding H. E., Brit. J Ind. Med., 7, 76 A950).
5. Schweisheimer W., Iron Age, 168, 159 A951).
6. Willis L. G., Bibliography of References to the Literature on the Minor Elements
and Their Relation to Plant and Animal Nutrition, 3rd ed., Chilean Nitrate Educa-
tional Bureau, Inc., New York, 1939; Seven Supplements, 1940—1947.
7. Andrews E. D.. New Zealand J. Sci. Technol., 35A, 301 A953).
8. В e e s о n K- C, U. S. Dept. Agr., Agr. Inform. Bull., № 7, 1 A950).
9 Ekman P., Karlsson N., Svanberg O., Acta Agr. Scand., 2, 103
A952).
10. Ferro Chemical Corporation, Cobalt Compounds for Correcting Diet Deficiencies
in Feeding Caltle and Sheep, Tech. Bull. № 24, Cleveland.
11. H a 1 e \V. H., P о p e A. L., P h i 1 1 i p s P. H., В о h s t с d t G, J. Animal
Sci., 9, 414 A950).
12. J о r ri о n K. M., Weakly H., S. Dakota State Coll. Agr. Expt. Ma., Tech.
Bull. M> 425, p 1, 1953.
13. К e e n e r H. A., Baldwin R. R., P с г с i v a 1 G. P., J. Animal Sci., 10,
428 A951).
14. К i с h in a n D. M, Henley E. J., Radioactive Cobalt, American Chemical
Society Monograph, Cobalt, 2nd ed. (Young R. S., Ed ), Reinhold Publishing Corp.,
New York, 1960.
15. S m i t h S. E.. К о с h В. A., T u г к К L., J. Nutrition, 44, 455 A951).
15.
КРЕМНИЙ
Д. У. ЛАЙОН, Дж. ФИЛД
D. II". Liicn, J. F. Field, Е. I. du Pont de Nemours
and Company, Pigments Department, Edge Moor,
Delaware
ВВЕДЕНИЕ
Истории кремния началась вскоре после того, как Дэви в 1800 г.
пришел к заключению, что кремнезем SiO3 представляет собой соединение,
а не элемент. В 1771 г. Шееле [85] получил фторид кремния SiF4 и гидро-
лизовал его до кремневой кислоты, но лишь в 1811 г. Гей-Люссак и Тенар
131] пропусканием тетрахлорида кремния над нагретым калием получили
продукт, который, по всей вероятности, представлял собой очень загряз-
ненный аморфный кремний. В 1824 г. Берцелиус [8] добился окончатель-
ного успеха в получении кремния этим методом. Он очищал кремний про-
должительным выщелачиванием фторосиликата. Кроме того, он получил
кремний взаимодействием фтороагликата калия с металлическим калием;
образовавшийся силицид разлагался водой.
Кристаллический кремнии впервые был получен Девилем [201 в 1854 г.
при электролизе загрязненной смеси хлоридов натрия и алюминия. Бле-
стящие пластинчатые кристаллы кремния были получены после растворе-
ния алюминия из гранулированного сплава, который содержал около
Юпо кремния.
Первоначальный способ, положенный в основу применяемого в на-
стоящее время промышленного способа производства, был разработан Пот-
тером 176]. Поттер изучал взаимодействие двуокиси кремния и углерода
с образованием карбида кремния в качестве промежуточного продукта на
пути получения элементарного кремния. Беккет [7] и Таккер [951 предло-
жили кислотную очистку для получения кремния высокой степени чистоты
(выше 99"и). Кремний самой высокой степени чистоты (99,97?«) был полу-
чен фирмой «Дюпон» восстановлением тетрахлорида кремния цин-
ком 161].
Кремний находится в IV группе периодической таблицы. Во многих
своих соединениях он проявляет заметное сходство с углеродом, особенно
в тех случаях, когда он является более электроположительным элементом
в соединении. Кремний по своим свойствам очень напоминает также гер-
мании, олово и свинец. С титаном, цирконием, гафнием и торием он
имеет меньшее сходство, причем сходство уменьшается с увеличением
атомного веса элемента.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Только кислород более распространен в земной коре по сравнению
с кремнием, который состаапяет около 28% веса земной коры. Кремний
всегда находится в соединении с кислородом в виде двуокиси кремния или
силикатов металлов. Содержание двуокиси кремния составляет около
Кремний.
331
78% в песчаниках, 60% в изверженных породах, 58% в глинистых слан-
цах и 5% в известняках. В среднем в земной коре содержится около
60% SiO2.
Кремний встречается в виде свободной двуокиси кремния в кварце,
большие месторождения которого найдены в горах и пустынях. Большин-
ство полудрагоценных камней состоит из различных пород кварца со сле-
дами примесей. Двуокись кремния ассимилируется некоторыми расте-
ниями и животными организмами из водных растворов. Определено также
ее присутствие на многих звездах и метеоритах.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИК^
В 1959 г. было папучсно около 14 000 т элементарного кремния со сте-
пенью чистоты 97%. В основном он выпускается в виде ферросилиция. Этот
сплав обычно содержит по 50% кремния и железа; его средняя цена в 1959 г.
составляла 292 долл. за 1 т. Количество ввозимого ферросилиция и раз-
меры его производства в США представлены в табл. 1.
Таблица 1
ВВОЗ И ПРОИЗВОДСТВО ФЕРРОСИЛИЦИЯ ЗА ПЕРИОД
IS47- I9j8 гг. (В ТОННАХ)*
Гид
1947
1948
1949
1950
1951
1952
1942
666
844
3433
9976
2027
698 075
738 567
587 719
673 363
781 888
709 306
Год
1953
1954
1955
1956
1957
1958
2001
ЗЬШ
5409
4540
3450
2175
Нроиэвоч
СТВО6
733 550
259 771
347 177
417 478
378 317
259 813
а «Minerals Yearbook», Uniled Slates Derailment оГ Interior Bure..u of Mines.
^ В пересчете на содержание кремния.
Элементарный кремний обычного сорта (97%" кремния, не более 1%
железа) продается по 0,4 долл. за 1 кг. Ферросилиций выпускается также
в виде брикетов весом около 1,1 или 2,2 кг D0% кремния) по цене 0,17—
0,22 долл. за 1 кг.
Путем очистки кремния со степенью чистоты 97% многократным выще-
лачиванием получают кремний 99,7%-ной чистоты, цена которого состав-
ляет 15,4 долл. за 1 кг. Этот сорт, однако, является еще слишком загряз-
ненным для использования его в полупроводниковой технике. Кремний
очень высокой чистоты, используемый в полупроводниковой технике, про-
дается по цене 200—1320 долл. за 1 кг. Продажа монокристаллов кремния
осуществляется по коммерческим ценам.
В табл. 2 дается перечень фирм, производящих чистый кремний. Об-
щая производительность этих фирм к концу 1958 г. составляла 74 840 кг
в год; производство кремния высокой чистоты в 1958 г., по «Ежегоднику
полезных ископаемых», составляло 22 700—27 200 кг.
332
Глава 15
Таблица 2
ФИРМЫ США, ПРОИЗВОДЯЩИЕ КРЕМНИЙ
Фирма
Географическое местоположение
«Лллсгени электроник
кемикл»
«Дау—Корнннг»
«Дюпон»
« Грейс»
«Маллинкродт»
«Мерк»
«Моисанто»
«Сильва кия»
«Техас инструменте»
«Транкоа»
«Юннон кьрбанд» (Ке-
мет днвижн)
Эре, шт. Пенсильвания
Хемлок, шт. Миннесота
Бревард, шт. Новая Каролина
Пуэрто-Рико
Сент-Луис, шт. Миссури
Денвилл, шт. Пенсильвания
Сеит-Луис, шт. Миссури
Туванда, шт. Пенсильвания
Даллас, шт. Техас
Вестфнлд, шт. Массачусетс
Кливленд, шт. Огайо
ПОЛУЧЕНИЕ КРЕМНИЯ
Кремний получают многими методами. Тетрахлорид кремния восста-
навливают водородом на раскаленной угольной нити [78] или нагретой про-
волоке [97], а также алюминием [81, ЮЗ], магнием [4] или цинком [61).
По другим процессам осуществляется восстановление трихлорсилана или
силана. Применяется также метод термического разложения тетраиодида
кремния Sil4. Фторид кремния или фторосиликаты щелочных металлов
восстанавливаются щелочными металлами [9, 20, 31, 39, 1001 или алюми-
нием [108].
Двуокись кремния может быть превращена в кремний восстановлением
углеродом или карбидом кремния в электропечи [64, 76, 86, 951 и восстанов-
лением алюминием [51, 57] или магнием [100].
Элементарный кремний можно получать электролизом двуокиси крем-
иня в расплаве окислов щелочных металлов [3], смеси хлоридов натрия
и алюминия [20] или хлорида алюминия [102].
Основным промышленным способом получения элементарного кремния
является восстановление двуокиси кремния углеродом в электропечах. При
этом применяются угольные электроды; они находятся внутри загруженной
шихты, состоящей на кокса и песка. Кремний выпускается с пода печи
и отливается в чушки весом 270—360 кг.
ФИЗИЧЕСКИЕ СВОЙСТВА
Физические свойства кремния приведены в табл. 3. Данные о дуговом
спектре опубликованы Мак-Леннаном и Эдвардсом [621. Данные об искро-
вом спектре кремния получены теми же авторами и Сале [82]. Согласно
Хаггннсу [43], кремний имеет сплошной спектр.
Кремний был получен в аморфном состоянии в виде коричневого по-
рошка [13, 105, 106], который легко может быть расплавлен или испарен
Таблица 3
ФИЗИЧГСКНЕ СВОПСТВА
Порядковый номер
Атомный радиус, А
Атомный вес
Число атомов в 1 см3
Температура кипения, °С
Катодная люминесценция (мини-
мальное напряжение для воз-
буждения)
Аморфный кремний (беловато-
желтого цвета)
Кристаллический кремний
(красного цвета)
Коэффициент теплового расшире-
ния (среднее значение), грид'1
15—1000»
25°
—157"
При температуре жидкого
воздуха
Цвет
Аморфный кремний
Графитообразный
14
11,17
28.086
4,96-10=2
2480
1600
2400
4,68-10-»
4,2-10-6
0
Отрицательный
Темно-коричневый
Черный, шестигранные
[6]
[73[
[41]
[27]
[5]
[73|
[96]
[96]
Кристаллический
Критическое чавленне, am
Критическая температура (рас-
четная), "С
Кристаллическая решетка
пластинки
Темный, серо-стальной;
небольшие кристал-
лы—прозрачные и свет-
ло-оранжеаые
1450
4920
[99|
[99]
Диэлектрическая проницаемость
Удельное электрическое сопро-
тивление, ом-см
- 190"
зин"
500°
Работа выхода электронов, эе
Кубическая (подобная [58, 68, 98]
структуре алмаза);
октаэдрические кри-
сталлы, 8 атомов в эле-
ментарной ячейке ку-
ба, ребро куба 5,42—
5.43 А
Аморфный ч кристалли- [19]
ческий кремний дают
одинаковые рентгено-
граммы
12
2-103
15
0,4
1,12
[15]
[72]
[15]
Энтропия, кал/ми.1ь- К
Твердый кремний
298" К
500' К
1000° К
1500° К
Жидкий кремний
2000° К
Газообразный кремний
298" К
500" К
1000° К
1500° К
2000° К
Свободная энергия, кал/моль-°К
Продолжение табл. 3
[79, стр. 16, 24]
7,58
11,85
15,48
23,75
40,13
42,76
46,14
48.20
49,66
[79, стр. 18,26]
Твердый кремний
29R К
500= К
ШПГГ К
1500°К
Жидкий кремний
2000"К
Газообразный кремнии
298 К
500 К
1000"К
1500 К
2000° К
Твердость
По Моосу
По Бринеллю
Теплота сгорпния до двуокиси
кремния, кал
Теплосодержание
4,50
5,46
7,70
10,56
12,29
40,13
40,63
42,55
44,12
45,31
7
240
191 000
[25]
[63[
[79, стр. 18,22]
\
\
Твердый кремний (Hj—
500° К
1000" К
1500" К
Жидкий кремний
2000° К
Газообразный кремний
ч 500° К
1000° К
1500" К
2000° К
Теплота плавления, kku.iiмоль
1,06
4,15
7,37
22.92
1,065
3,60
6,12
8,70
11,1
[41]
Теплота испарения, кал/моль
Продолжение табл. 3
71 000 [79, стр. 28]
Постоянная решетки а при 25\ Л
А1агнитная восприимчивость(крем-
ний с 0,085% железа), а. м. е.
Температура плавления, иС
Подпижность C003 К), см*/в-сек
Электроны
Дырки
Модуль упругости, кг/мм2
Предел прочности при изгибе,
кг/ .«.«2
Молекулярные силы вращения
(вычислено по данным для квар-
ца)
Число пластичности (Pt —116)
Отражательная способность (поли-
рованного технического кремния
в области видимого спектра)
Показатель преломления
5,429
0,13-Ю-о
142»
0,27
89,3
26—35°ь; самая высокая
в юлубом, быстро по-
нижается по направ-
лению к инфракрасно-
му
3,87
0,47
цк (абсолютный показатель пре-
ломления)
для инфракрасных лучей
при 1,2 мк 3,5
при 2,6 мк 3,4
Собственное электрическое сопро- 230 000
тивлекие C00° К), см-см
Плотность, г/см* 2,33
Удельная теплоемкость 99,2%-
ного кремния с, кал/г-град
0° 0,1597
0—100" 0,181
Уравнение:
с=0,165428 (в—17) +0,0001584310F—17J—0,0000003742 (С
[7.1]
[42]
[73]
1300
5U0
1,09-101
6,36
|73|
[73|
|53|
[53]
[34.88]
[201
[101]
[12]
[12]
1731
[73]
[87]
[73]
-17K
Коэффициент теплопроводности,
кал/см- сек- град
Давление пара, мм рт. ст.
1920° К
2120"К
2360° К
Частота колебаний
Красные лучи
Фиолетовые лучи
¦у-Лучи
Объемная сжимаемость, см2/дн
В работе Бреннера [10] приведена дискуссия по кремниевым усам
0,20
1
10
100
13,57-101=
3,69-1015
9,6-1012
0,98-10-1=
156]
[22]
[33]
[35]
[102]
|73|
336 Г л а eg 15
1101]. Кристаллический кремний имеет серый цвет с металлическим блес-
ком. На рис. 1 показаны различные формы кремния высокой степени
чистоты, выпускаемого в промышленном масштабе.
Рис. 1. Формы поликристаллического крем-
ния высокой степени чистоты, выпускаемого
промышленностью («Дюпон де Немур энд ком-
пани»).
ХИМИЧЕСКИЕ СВОЙСТВА
Во многих реакциях кремний ведет себя аналогично углероду. Наибо-
лее важной из этих реакций является образование силиконов и их произ-
водных. Почти во всех своих соединениях кремний четырехвалентен. Обыч-
но он образует соединения, в которых входит в состав аниона.
Кремний легко соединяется со всеми галогенами, образуя соединения
типа SiHal4. Он с трудом горит на воздухе, но реагирует с кислородом при
температуре красного каления, с серой при 600° и азотом при 1000°. При
нагревании в электрической печи кремний соединяется с бором, углеродом,
титаном и цирконием.
Кремний легко растворяется в расплавленном магнии, меди, железе
и никеле с образованием силицидов. Он растворяется также в алюминии
и серебре, выпадая при охлаждении в виде кристаллов.
Кремний взаимодействует с газообразным фтористым водородом и рас-
творяется в жидком фтористом водороде, но он совершенно инертен по от-
ношению к плавиковой кислоте. Кремний растворяется в смесях азотной
и плавиковой кислот. Кремний медленно реагирует с водяным паром при
температуре красного каления с выделением водорода.
Многие окислы восстанавливаются кремнием при высоких температу-
рах. Так, в хорошо известном процесе Пиджена [751 кремний применяется
для восстановления окиси магния до металла. Кремний реагирует с рас-
плавленными едким натром, содой, бихроматом, хлоратом и нитратом
калия.
Кремний 337
ОБЛАСТИ ПРИМЕНЕНИЯ
В настоящее время масштабы применения элементарного кремния не-
велики, однако он чрезвычайно важен для некоторых областей применения.
Наиболее известное и широкое применение кремний находит при изго-
товлении выпрямителей и триодов. Кремниевые выпрямители описаны Тор-
реем и Уитмером [94], Скаффом, Теурером и Шумахером [84], а также дру-
гими исследователями [48, 49, 55, 69, 80, 90, 109]. Этот вопрос хорошо
освещен Хантером [45].
Монокристаллы кремния могут быть использованы в полупроводни-
ковых устройствах (диодах, мощных выпрямителях, триодах, солнечных
батареях). В процессе выращивания монокристаллов или при последующей
операции вносится строго определенное количество интенсифицирующих
Рис. 2. Кремниевые полупро-
водниковые устройства («Дю-
пон де Немур энд компании).
Справа семь устройств — выпря
Мигели; слева сверху вниз —
два диода, элемент солнечной
GdT.ipen и триод.
добавок (допинг). Здесь не представляется возможным полностью осветить
этот вопрос, который подробнее рассмотрен во многих литературных
источниках* [37, 45. 89].
Некоторые полупроводниковые устройства показаны на рис. 2.
Применение кремния в триодах возрастает главным образом потому,
что максимально допустимая рабочая температура в таких триодах состав-
ляет около 250° по сравнению с 75° для германиевых триодов. Кремний
обладает высоким удельным сопротивлением даже при сравнительно высо-
ких температурах. Доступность кремния также влияет на рост применения
кремния, хотя менее распространенный германий гораздо легче очищается.
Кремний пропускает инфракрасные лучи в диапазоне длин волн 2—
8 мк [60], поэтому он нашел применение в линзах для инфракрасного
света [281. Вопрос о поглощении инфракрасной части спектра с длиной
полны более 8 мк рассмотрен Лаксом и Барстейном [60].
Кремний можно спекать с керамическими материалами с целью изго-
товления жаростойких изделий [36]. С углеродом кремний дает тугоплав-
кое соединение, в котором некоторое количество его остается в элементар-
ной форме [1]. Литые изделия, состоящие главным образом из кремния,
запатентованы для применения в качестве химической аппаратуры, труб
и тиглей [2].
Кремний, подобно бериллию и родию, может быть испарен в вакууме
в сосуде из спеченной двуокиси тория на спирали из вольфрамовой про-
волоки. Он может осаждаться из паров на подложку из поваренной соли
* См. также И. П. Л о м а ш о в, Германий и кремний — важнейшие полупро-
водниковые материалы, Металлургиздат, Москва, I960. — Прим. ред.
22 Заказ № 239
338 Глава 15
или окиси алюминия. Кремниевые покрытия наносятся на металлы вос-
становлением тетрахлорида кремния водородом; например, таким способом
можно силицировать сталь и молибден.
Кремний может действовать как катализатор при реакциях аутоокис-
ления F7). Кремний высокой степени чистоты применяется в фотоэлемен-
тах [701. Из него можно изготовлять также электроды, применяемые при
электрометрическом титровании кислот и оснований 19]. В зубоврачебном
деле и для других целей находят применение зеркала с отражательной по-
верхностью из кремния, нанесенного электролитическим способом 193].
Этот элемент широко применяется в производстве различных силици-
дов. Совсем недавно было разработано важное промышленное применение
кремния в качестве исходного материала для синтеза силиконов [4].
Описаны сплавы кремния с сурьмой, висмутом, кобальтом, золотом,
свинцом, серебром, оловом и цинком [46]. В двойных системах кремния
с указанными металлами не обнаружено никаких соединений. Получены
также сплавы с алюминием [47, 71]. Сплавы на основе железа можно по-
крывать кремнием или сплавлять с ним [59]. Отливки из сплавов железа
с высоким содержанием кремния A5%) стойки против коррозии, однако
они не поддаются обработке резанием. Эти и другие сплавы кремния и же-
леза, а также кремния, углерода и железа подробно изучались Грейнером
и сотр. [331. Те же авторы рассматривают кремнистые и кремнемаргание-
вые стали, в том числе стали, которые содержат также никель, молибден,
хром и ванадий.
Несмотря на то что кремний является наиболее распространенным
и одним из самых дешевых элементов (97%-пый ) и, кроме того, отличается
малой плотностью, стойкостью против коррозии и жаростойкостью, он не
нашел достаточно широкого применения. Основная причина ограниченного
применения кремния заключается в том, что он совершенно неппастичен
при температуре от комнатной по крайней мере до 600°. По-видимому,
в ближайшем будущем наибольший спрос на очень чистый кремний будет
наблюдаться в тех областях применения, где можно использовать его элек-
трические и оптические свойства, а также для силицирования металличе-
ских изделий с целью создания коррозионно- и жаростойких материалов.
В результате дальнейших исследований с целью получения кремния более
высокой степени чистоты наряду со снижением цен на чистый элемент, не-
сомненно, будут найдены новые области его применения.
МОНОКРИСТАЛЛЫ
Монокристаллы кремния получают несколькими" методами [11, 16,
50], причем обычно применяются метод Чохральского [16] и его модифи-
кации 191]. По этому методу затравка для монокристалла погружается
в расплавленный кремний, поддерживаемый при температуре плавления,
и затем медленно вытягивается из него. При этом обычно плавка проводится
в чистых кварцевых тиглях, а по последнему методу [17] при выращивании
небольших совершенных кристаллов применяется держатель из кремния,
к которому крепится плавильная ванна из кремния на подвижном штоке.
Типичные монокристаллы, полученные по методу Чохральского, показаны
на рис. 3.
Метод зонной плавки, разработанный Кеком [52] и описанный Пфа-
нпм [741, применяется для бестигельного плавления, очистки и выращи-
вания кристаллов. Часть кремниевого прутка нагревается в поле высокой
Кремний_
359
частоты до тех пор, пока не расплавится на всю глубину. Если при этом
оба конца прутка закреплены, то расплавленная зона может удерживаться
за счет поверхностного натяжения расплава, а также за счет совместного
действия магнитного и электриче-
ского полей. Поскольку чистый
кремний плохо проводит электри-
ческий ток при комнатной темпера-
туре, для того чтобы он мог взаимо-
действовать с полем, его предна-
рительно необходимо нагреть до
температуры около 600°. Если ис-
пользовать затравку монокристал-
ла, то пруток можно превратить в
монокристалл путем перемещения
расплавленной зоны вдоль его оси,
обычно снизу вверх, в инертной
t
Р и с. 3. Типичные кремниевые
монокристаллы, выращенные по
методу Чохральского («Дюпои
дс Немур энд компания).
Рис. 4. Установка для очистки
кремния зонной плавкой («.Пепел
хай-фрекуэнси лаборатория, инк.»).
атмосфере. Такой метод зонной плавки имеет два основных преимущества:
кремний не соприкасается с тиглем, например с кварцевым тиглем, как
в методе Чохральского, и может быть получен более однородный кристалл.
На рис. 4 приведена фотография установки для такой зонной плавки.
Выращивание совершенных кристаллов рассмотрено Доримасом [241.
ХАРАКТЕРИСТИКА И АНАЛИЗ ОСОБО ЧИСТОГО КРЕМНИЯ
Вследствие того что к чистоте полупроводниковых материалов предъ-
являются особые требования, содержание примесей в них невозможно
определить обычным химическим или спектральным анализом. Для этой1
цели применяются косвенные методы измерения, наиболее распространен-
ным из которых является измерение электросопротивления. Полупровод-
никовые сорта кремния, выпускаемые промышленностью, содержат нич-
тожные количества бора и фосфора (как правило, 10—до 10" 3%). По-
скольку фосфор в расплавленном кремнии более растворим, чем в твердом,
его можно отделить от кремния методом зонной очистки. Однако бор, кото-
рый имеет низкий коэффициент разделения, нельзя удалить этим методом.
Бор и другие элементы III группы периодической таблицы (AI, Ga
и т. д.) служат донорами электронов и делают кремний положительно1
22»
340 Глава 15
заряженным (проводимость р-типа); фосфор и элементы V группы (As, Sb
и т. д.), присутствуя в избытке, создают в кремнии проводимость п-тииа
(отр ицател ьную).
ЛИТЕРАТУРА
1. Acheson Е. G., пат. США 1014199.
2. А 1 1 е п Т. В., пат. США 1037713 и 1073560, 1912.
3. А п d r i e u х L., D о d е г о М., С. R., 198, 753—755 A934).
4. Chem. Week, 68 B4), 8 (June 30, 1951).
5. В а г a d u с - М и 1 1 с г L., Rev. met., 7, 828 A910).
€. Batuecas Т., Nature, 159, 705 A947).
7. Becket F. M., пат. США 138G227, 1921.
6. В e r z e 1 i и s J. J., Pogg. Ann., I, 121, 169, 204 A824); 2, 210 A824); 61, 10 A844).
9. Болтунов Ю. А., И с а к о в а К. Я-, ЖОХ, 7, 2838—2841, 2899—2902 A951).
10. Brenner S. S., Science, 128, 569 A958).
11. В г i d g m a n P. W-, Proc. Am. Acad. Arts Sci.. 60, 305 A925).
12. Briggs H. В., Phys. Rev., 77, 287 A950).
13. С a m b i L., Alii accad. nazl. Lincei, Sez. I, 20, 440—442 A911).
14. Coblentz W. W., J. Franklin lust., 170, 187 A910).
15. С о n w e 1 1 E. M., Proc. lnst. Radio Eng., 40, 1327—1337 A952)
16. Czochralski J., Z. physik. Chem., 92, 219 A918).
17. Dash W. С J. Appl. Phys., 29, 736 A958).
18. Davy H., Phil. Trans., 98, 333 A808); 100, 16 A810).
19. D e b у e P., Physik. Z., 17, 277 -283 A916).
20. D e v i 1 1 e H. St.-C, Ann. chim. et phys., [31, 43, 27—36 A854); 49, 62—78 A857).
21. D e v i 1 1 e H. St.-C, С а г о n H., Ann. chim. ct phys., [i], 63, 26 A861); 67,
435 A863).
22. D i t с U b и r n R. W., G i 1 m о и r J. С, Rev. Modern Phys., 13, 310—327 A941).
23. Dodero M., Bull. soc. chim.. 6. 209—218 A939).
24. D о г е га и s R. H., R о b e г t s B. W., T и r n b и 1 1 D., Growth ami Perfection
of Crystals, John Wiley and Sons, New York, 1958.
25. Fd wards C. A., J. lnst. Metals, 20. 61 A918).
26. Edwards С. А., Н е г b e г t A. M., J. lnst. Metals, 25, 175 A921).
27. Ewles J., Phil. Mag., 16]. 45. 957 A923).
28. F a n H. Y., В с с k e г M., Symposium Volume of the Reading Conference, But-
terworth Publishing Co., London, 1951
29. Фортунатов Н. С, Труды института химии АН УССР, 2, 257—259 A935).
30. F о х М, Р е а г s а 1 1 С. S., U. S. Patent Application 604013.
31. Gay-Lussac J. L., Thenard L. J., Ann. chim. et phys., [1], 69, 204 A809).
32. G о n s e г В. W., Sci. Monthly, 74, 52—57 A952).
33. Greiner E. S, M a r s h J. S, S t о u g h t о п В., Alloys of Iron and Silicon,
McGraw-Hill Book Co., New York, 1933.
34. Ha age n A., Pogg. Ann, 131, 117 A867).
35. Haber F., Ber. Phys. Ges., 13, 1122 A911).
36. И a e u b e r H., пат. США 1916836, 1933.
37. H а г п а у N. В., Semiconductors, Reinhold Publishing Corp., New York,
1959.
38. H a s s G., Z. anorg. Chem., 257, 166- 172 A918).
39. H e m p e 1 W., H a a s у Н von, Z. anorg. Chem., 23, 32—42 A900).
40. H i n о J., S t a u s s H. E., J. Metals, 4, 656 A952).
41- Hoffman F., Schulze A., Physik. Z., 38, 901—905 A937); Melallwirt-
schaft, 17, 3 A938).
Кремний 34J
42. Honda К.., The Magnetic Properties of Matter, The Macmillan Co., New York,
1928.
43. Huggins W., Proc. Roy. Soc, 18, 54C A870).
44. H u 1 1 A. W-, Phys. Rev., [2], 10, 684 A917).
45. H u n t e г L. P., Handbook of Semiconductor Electronics, McGraw-Hill Book Co.,
New York, 1956.
46. J e t t e E. R.. F о о t e F., J. Chem. Phys., 3, 605—616 A935).
47. J e t t e г L. K-, M e h 1 R. F., Am. Inst. Mining Met. Engrs., frist. Metals Div.,
Tech. Publ. № 1508, 1942.
48. Johnson V. A., Smith R. N.. Y e а г i e n H. J., J. Appl. Phys., 21, 283—
2fi9 A950).
49. Jones D. E., R a m s 1 e у С. E., R у d e J W-. W i 1 1 i a m s S V.. канад
пат. 474212, 1946.
50. Капица П. Д., Proc. Roy. Soc, 119, 358 A928).
51. К а г g e s R. A., J. Chem. Educ, 13. 593 A936).
52. К е с k P. H., G о 1 а у М. J. С, Phys. Rev., 89, 1297 A953).
53. К i n z e 1 A. N., Cunningham T. R.. Metals Technol., 6, Tech. Publ.
№ 1138 A939).
54. Kleinknccht H., Naturwiss., 39, 400 A952).
55. К о b a(y a s h i A., J. Phys. Soc. Japan, 3, 41—47 A948).
56. К о n ig s b erge r J., W e i ss J., Ann. Physik, [41, 35, 16 A911).
57. К u h n e К. А., герм. пат. 147871, 1902.
58. Kustner H., Remy H., Physik. Z., 24, 25—29 A923).
69. Lauenstein С F..U lmei P. F., пат. США 2105888, 1938.
60. L a x M., В u г s t e i n E., Phys. Rev., 97, 39—52 A955).
61. L у о n D. W, О 1 s о n С M., Lewis E. D., J. Electrochem. Soc, 96, 359—
363 A949).
62. M с L e n n a n J. C, Edwards F., Phil. Mag., [6|, 30, 482 A915).
63. Mixter W. G., Am. J. Sci., [4], 24, 130—140 A907).
64. Moissan H., Ann. chim. et phys., [7], 9, 300—301 A895); Bull. soc. chim., [3],
13. 972 A895).
65. Moissan H, Siemens F., Ber.,37, 2540 A904).
66. M о r 1 у a Y., Electrotech. J. (Japan), 2, 219 A938).
67. At о u г e u C, D u [ г a i s s e C, L a p 1 ag п е Р., С R., 187, 1266—1269 A928).
68. N e u b e r g er, Z. Krist., 92, 313—314 A935).
C9. О h 1 R. S.. пат. США 2402G63, 1946; 2415841. 1947.
70. О h 1 R. S., пат. США 2443542, 1948.
71. Pacz А., герм. пат. 632953, 1936.
72. P e а г s о n G. L., В а г d e e n J., Phys. Rev., 75, 869 A949).
73. P e a r s о n G. L, В r a t t a 1 n W. II , Proc. TRE, 43, 1804 A955).
74. P f a n n W. G., Zone Melting, John Wiley anil Sons, New York, 1958, p. 89.
75. Pi dg eon L. M., Trans. Can. Inst. Mining Met., 49, 621—635 A946).
76. Potter H. N., пат. США 875285, 1907; 875672, 1907; 908130, 1908.
77. P о t t e г J. G., пат. США 1917271, 1933.
78. P г 1 ng J. N., Fielding W, J. Chem. Soc, 95. 1497—1506 A909).
79. Q u i 1 1 L. L., The Chemistry and Metallurgy of Miscellaneous Materials, McGraw-
Hill Book Co., New York, 1950.
80. R a n s 1 e у С. E., R у d e J. W., Will iams S. V., пат. США 2419966, 1947.
81. Ranter G., LiebiR's Ann., 270, 235—266 A892).
82. S a 1 с t G., С R., 73, 1056 A870).
83. Sea [f J. H., пат. США 2402582, 1946.
81. S с а [ f J. II., T h e u r e r H. C, Schumacher E. E., J. Metals, 1, 38"—
388 A949)
'342 Глава 15
65. Scheele C. W-, Handl. Svenska Akad., 33, 120 A771).
86. S с h e i d R., англ. пат. 18659, 1907.
67. Schrauf A., Pogg. Ann., 127, 344 A866).
88. S с h i m p f f H, Z. physik. Cliein., 71, 257 A910).
89. Shockley W-, Electrons and Holes in Semiconductors, D. Van Nostrand Co.,
Princeton, N. J., 1950.
«0. Stephens W. E., Electronics, 19,G), 112—119 0946).
91. Teal G. K-, Some Recent Developments in Silicon and Germanium Materials
and Devices, Presented at National Conference on Airborne Electronics, May 10,
1954.
92. T h e u г e г Н. С, канад. пат. 452409, 1948; пат. США 2475810, 1949.
93. Tillyer E. D., пат. США 1278521, 1918.
94. Т о г г е у Н. С, VV h i t m e г С. A., Crystal Rectifiers, McGraw-Hill Book Co.,
New York, 1948, p. 301—330.
95 Tucker N. P., J. Iron Steel Inst, 15, 412—416 A927).
96. V a 1 e n t i n e r S., W a 1 1 о t J., Ann. Physik, [4], 46, 837 A915).
97. V a n Arkel A. E., Metallwirtschaft, 13, 405—408, 511—514 A934).
98. V a n Arkel A. E., Z. Kjist., 67, 235—238 A928).
99. V a n Laar J. J., Proc. Acad. Sci. Amsterdam, 18, 1220 A916).
100. V i g о г о u x E., Ann. cliim. et phys., |7J. 12, 5—74, 153- 196 A897); C. R.,
120. 94—96. 554—557 A905); Bull. soc. chim., |4], 1, 1С A907).
101. Wattcnberg H. von, Ber. Physik. Ges., 12, 105—lkO A910); Z. Eleklro-
chem., IS, 658 A912).
102. W a g s t a f i J. E. P., Phil. Mag., [6], 47, 6fi A924).
103. Weaver V. M., пат. США 1238604, 1917; 1241796, 1917; 1296575, 1919.
104. Western Flectric Co., Inc., англ. пат. 590458, 1947.
105. W i g a n d A., Ann. Phys.. 21, 95 A907).
106. Wilke-Dorfurt E., Chem. Zentr., 1909, II, 1965.
107. Winkler C, Ber., 23, 2652 A890); J. Prakt. Chem., [1J, 91, 198 A864).
108. W oilier F., Ann., 97, 266 A856); 102, 382 A857).
109. Y e а г i e n H. J, J. Appl. Phys., 21, 214—221 A950).
16.
ЛИТИЙ
П. ЛАНДОЛЬТ, М. СИТТИГ
P. E. Landolt. Consulting Engineer, New York, N. Y\
M. Sittig, Consultant, Princeton, New Jersey
ВВЕДЕНИГ
Подобно некоторым другим редким элементам, литий стал приобретать
практическое значение после первой мировой войны, когда немцы начали
применять его главным образом для производства твердого свинцового
сплава «В-металла» для железнодорожных подшипников в качестве заме-
нителя сплавов свинца с оловом и сурьмой [136—139] и изготовления лег-
ких прочных алюминиевых сплавов «склерой» [18—21].
В годы второй мировой войны интерес к литию в США быстро воз-
растал благодаря возможностям его применения для военных нужд. В
1954 г. литий н его соединения предполагалось использовать в следующих
целях:
1) безводную гидроокись лития в качестве поглотителя углекислого
газа;
2) хлорид лития для изготовления сухих батарей;
3) гидрид лития как источник водорода для морского н авиационного
¦спасательного снаряжения;
4) гидрид лития в целях производства бороводородов, применяемых
в качестве реактивного топлива;
5) металлический литий для производства новых сплавов, например
магниеволитиевых;
6) металлический литий, алюмогидрид лития и амнд лития для орга-
нического синтеза.
В 1960 г. существовали следующие основные пути использования лития
131, 124].
1) гидрид лития как реагент для производства борогидридов, приме-
няемых в качестве реактивных топлив;
2) перхлорат лития в качестве окислителя в ракетах, работающих на
твердом топливе;
3) металлический литий для новых сплавов, например сплавов с маг-
нием или алюминием;
4) литиналкилы как специфические катализаторы полимеризации;
5) металлический литий, алюмогидрид лития и амид лития в органиче-
ском синтезе;
6) литий-6 в ядерной энергетике;
7) фторид лития в качестве добавки к электролиту в производстве
алюминия.
Следует отметить, что соединения лития в течение столетия перед пер-
вой мировой войной находили применение в производстве керамики и ле-
карств, а за последние несколько лет для изготовления щелочных аккуму-
ляторов.
341 Глава 16
Элемент литий бьы открыт шведом Арфведсоном [40] в 1817 г. при изу-
чении образцов минерала петалита — алюмосиликата лития. За этим
открытием последовали' исследования многих ученых, из которых сле-
дует отметить Дэви, Гмелина, Берцелиуса, Бунзена и Маттисепа [40J.
В периодической таблице элементов литий занимает третье место вслед
за водородом и гелием. Литий — самый легкий металл. Существуют два
природных изотопа лития — Li6 и Li'. Атомный вес лития, равный 6,939,
указывает на преобладание атомов последнего изотопа.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Литий чрезвычайно рассеян в земной коре. Его содержание составляет
приблизительно 0,004%, что можно сопоставить с 0,002% для свинца и
0,0006% для олова. В природе литий встречается в виде силикатов, фто-
рида, фосфата и хлорида*. Главным источником для промышленного полу-
чения литиевых соединений являются силикатные минералы.
Несмотря на сравнительно большое содержание лития в земной коре,
обнаружено очень мало месторождений, имеющих достаточную концен-
трацию лития и рудные запасы, что необходимо для промышленной раз-
работки.
Минералы лития встречаются в большем или меньшем количестве на
всех континентах. В соответствии с существующими данными месторожде-
ния лития на континентах но их запасам можно расположить в порядке
убывающего значения следующим образом: Северная Америка, Африка,
Южная Америка, Европа, Австралия, Азия.
Если ограничиться переработкой только богатых литием минер&чов,
то невозможно будет создать сколько-нибудь значительную литиевую про-
мышленность. Раньше рудник Этта в горах Блэк-Хиллса (штат Южная
Дакота) выдавал много высококачественного сподумена, однако в то время
спрос на литиевые продукты был крайне ограничен. Высохшие соляные
озера в Калифорнии дают значительное количество лития в виде фосфата
Li2NaPO4, но только как побочный продукт при производстве поташа и
буры.
Основными минералами лития, пригодными для промышленного ис-
пользования, являются следующие:
1. Сподумен** Li2O-Al2O3-4SiO2 (или LiAl[Si2Oe]), содержащий
примерно 8% Li2O.
2. Лепидолит***—литиевая слюда состава R3Al(Si02K(+F), содержа-
щая 3—5% Li2O.
3. Амблигонит**** LiAlFPO4, содержащий 8—1096 Li2O.
4. Петалит, силикат лития и алюминия, с содержанием 2—4%
* Хлорид лития известен в природе только в растворах различного происхожде-
ния.— Прим. ред.
** Теоретически 8,1%, фактически 6,0 — 7,5%.— Прим. ред.
*•• Более точно, с учетом структуры этого алюмосиликата, состав его характе-
ризуется формулой KLip'ijAli.is [Si3AlOHJ(F,OHJ. Колебания в содержании Li2O
находятся в пределах 1,2—5,9%.— Прим. ред.
**** Вернее, LiAl[PO4](F,ОН); теоретически содержание LiO2 составляет 10,1%,
фактически 7—9,5%.— Прим. ред.
***** Петалит—алюмосиликат лития Li[AlSi4O10] с теоретическим содержанием-
4,9°6 Li2O. В петалите, как и в сподумене, литий постоянно частично замещается
натрием.— Прим. ред.
Таблица 1
МИРОВАЯ ДОБЫЧЛ МИНЕРАЛОВ ЛИТИЯ ЗА ПЕРИОД 104D-I0S8 гг. (Б
США
Запада
Южная Родезия
Ого-Западная Африка
Уганда
Южяо-Африкапская Республика
Бывшее Бельгийское Конго
Мозамбик
Португалия
Испания
Франция
Германия и Чехословакия
Австралия
Аргентина
Бразилия
1049
4389 ^
—
—
1052 в
203 6
_
—
599 6
18 6
—
—
56
—
-
—
1950
8448 а
—
182 6
8882 6
269 в
13 в
—
222 в
160
—
—
—
—
1951
11 699 а
1952
14 161 а;
— —j
1 765 6
10 743 в
196
—
—
1 342 SJ
8 891 б
—
—
279 6 [ 100 б
67 6
—
—
—
—
10 6
10 0
-
—
—
—
—
1053 !
24 710 а
—
178196
94166
166
55 6
-
57126
166
316
—
—
—
—
1
1954
34 317.»
216 б^
49 034 6
6 609 г
7.в
52 г
371 6
96
_
—
156
—
—
ТОННАХ)
1955
Нет
данных
58
24 649
8 631
—
1 515
4
127
—
4
—
112
1836
1956
Нет
данных
2 433
18 339
5 596
—
2 028
.1 123
—
58
—
—
—
168
1
1057
Нет
"данных
2611
14 767
6 307
—
2 354
385
-
7
—
—
—
22
561
1958
Нет
данных
1 991
1899
8 623
Нет
данных
98
Нет
данных
То же
—
Пет
данных
—
Нет
данных
476
а Данные Горного бюро США [144].
б Данные Лэммнша [ИЗ].
в Данные Гарного бюро США [145].
г Статистические данные [146].
346
Глава 16
Используются также отложения соляных озер, содержащие фосфат
лития и натрия Li2NaPO4*.
Обычно литиевые минералы содержатся в пегматитовых дайках, про-
мышленная разработка которых оправдывается только в том случае, если
они достаточно широкие [59]. Глубина такой жилы тем больше, чем больше
длина дайки. Обычно глубина колеблется от 60 до 150 м, доходя в отдель-
ных случаях до 300 м. Содержание лития в таких пригодных для промыш-
ленной разработки жилах составляет 1—2% Li.O.
Ранее обогащение литиевых минералов производили ручной рудораз-
боркой. По мере увеличения спроса на литий стали вводиться массовые
методы переработки. Концентрат получают Двумя методами: методом пен-
пой флотации и методом разделения в тяжелых суспензиях. Для производ-
ства концентратов с содержанием 4—6% Li2O, по-видимому, наиболее при-
годен метод пенной флотации.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В табл. 1 приведены данные по мировому производству литиевых руд
и минералов за период 1949—1958 гг., а в табл. 2 показан примерный спрос
«а литий в настоящее время и в будущем.
Таблица 2
СТАТИСТИЧЕСКИЕ ДАННЫЕ О ПРОИЗВОДСТВЕ ЛИТИЯ [74, 76]
Период
До первой мировой войны
Во время второй мировой войны
1946 1950 гг. (средние)
1951 г.
1955 г.
Предполагаемый спрос в 1960 г.
Годовой спрос в США на
соединения
лнгня в пе-
ресчете на
карбонат,
т
180
340
910
1360
500
910
>4500
>4500
обогащенный
кпнцемтрат
F% Li2O),
т
2 ООП
4D0O
10 00D
20 000
5 500
10 000
50 000
50 000
РУДУ.
т
ID 000
20 000
50 000
100 000
27 500
50 000
250000
250 UU0
До сих пор лишь очень небольшая часть всего добываемого лития
производится в виде металла. Ниже приводятся показатели мирового произ-
водства металлического лития в разные периоды:
ПРОИЗВОДСТВО ЛИТИЯ, т/год
До 1914 г.
1914—1930
1931 -1942
1942—194G
1947—1952
1952—1957
гг.
гг.
гг.
гг.
гг.
(США)
(США)
(США)
Лабораторные количеств
для исследовательских
целей
<2,3
<2,3
<45,5
<13,5
<45,5
* Неточно. Фосфат (дилитийнатрийфосфат) является продуктом переработки
рапы соляных озер, в которой литий находится в форме растворимых солей. Например,
рапа высохшего озера Ссрлс в Калифорнии содержит 0,02% LiCl наряду с большим
количеством солей натрия, калия и бора; до 0,4% LiCl содержится в богатых натрием
источниках Виши (Франция) и некоторых других.— Прим. ред.
Литий 347
Рост промышленного спроса будет зависеть в основном, если не пол-
ностью, от цен на литиевые продукты. Требования оборонной промышлен-
ности могут иметь заметное влияние на производство литиевых продуктов,
однако главным фактором, способствующим расширению областей приме-
нения лития и его соединений, все же остается снижение стоимости их про-
изводства.
Стоимость лития и его соединений
Как и в случае других металлургических продуктов, цена на метал-
лический литий зависит главным образом от стоимости исходного сырья.
Минимальная загрузка флотационной фабрики для экономичного обога-
щения руд составляет 150—200 т сырья в сутки, из которого получается
30—40 т 4—6%-ного концентрата. В 1946 г. такой концентрат на рудни
ках можно было выпускать по 4 долл. за 1 единицу окиси лития A единица
соответствует 1 % ценного вещества в 1 т). В 1952 г. цены составляли при-
мерно 7 долл. за 1 единицу окиси лития, что соответствует 38,5 центам за
1 кг карбоната лития (при выходе карбоната лития, равном 80%).
Для производства 1 т металлического лития требуется не менее 6,25 т
хлорида лития. На получение такого количества хлорида лития расхо-
дуется 5,7 т карбоната или 2,28 т окиси лития. Если выделение лития
проводить с выходом 90%, то требуется примерно 55 т исходных концен-
тратов с содержанием 5% Li2O. Стоимость сырья па 1 т металлического
лития получается следующей:
Стоимость I единицы LiaO, Стоимость I m Li, долл.
долл.
4,ПО 1100
С00 1650
В, 00 2200
10,00 2750
12,00 3300
Если принимать в расчет стоимость выделения и превращения солей
лития, электролиза при производстве металлического лития, а также капи-
тальные затраты, накладные расходы и прибыль, то металлический литий
при производстве не менее 45 m в год будет примерно в 10—15 раз дороже
исходного сырья.
Капитальные затраты, включая оборотный капитал, составляют 11—
17,6 долл. на 1 кг в год, причем сюда входят все операции от извлечения
лития из руд до получения металла.
ВЫДЕЛЕНИЕ ЛИТИЯ ИЗ РУД
При наличии рудного концентрата основной проблемой является вы-
деление из него лития [140].
Для этой цели были испытаны и нашли применение следующие методы:
1. Нагревание с бисульфатом калия с последующим выщелачива-
нием сульфата лития [116, 118, 122. 123].
2. Получение окнеи алюминия и кремнезема [109] из сподумена при
производстве портланд-цемента. Сподумен добавляют к известняку и хло-
риду кальция. При прокаливании этой смеси в обжиговой печи образуется
цементный клинкер, а литий в виде загрязненного хлорида улетучивается.
348 Глава 16
3. Нагревание концентратов сподумена до 1000° или выше, но ниже
температуры плавления, с целью превращения а-фазы сподумена в fl-фазу
[79]. Сподумен охлаждают, тонко измельчают и смешивают с серной кис-
лотой. Полученную смесь нагревают примерно до 300°, затем охлаждают
и выщелачивают, получая при этом неочищенный раствор сульфата лития.
4. Нагревание сподумена при 1038D или лепидолита при 871° с 3 ча-
стями размельченного известняка во вращающейся обжиговой печи. Спе-
ченную массу затем выщелачивают водой и получают моногидрат гидро-
окиси лития.
Первый метод применялся в Германии, однако он не имел никаких
преимуществ в отношении выходов или снижения цен. В основном этот
процесс использовался для разового производства лития.
Второй метод представляет интерес для выделения лития как побоч-
ного продукта при условии, что производство портланд-цемента осущест-
вляется в большом масштабе, не менее 170 т. в сутки. При этом процессе
может быть возогнано 98% хлорида лития, однако его дальнейшая очистка
сопряжена с очень большими трудностями.
Третий метод может быть осуществлен в виде непрерывного, достаточно
экономичного процесса, причем выход лития составляет не менее 9О°6.
Сульфатный раствор фильтруют для удаления остатка силиката алю-
миния, очищают от незначительных примесей, после чего выделяют вполне
чистый карбонат лития. Для осаждения нерастворимого карбоната лития
к сульфатному раствору добавляют кальцинированную соду; при этом
в качестве побочного продукта образуется глауберова соль Na2SO4- 10H2O.
Четвертый метод дает меньшую степень извлечения лития, чем третий
метод. При обработке сподумена стадия фазового превращения не требуется.
В табл. 3 указаны промышленные процессы, которые применяются
различными фирмами США, выпускающими соединения лития. Описанный
выше третий метод применяется фирмой «Литиум корпорейшн оф Америка»,
четвертый метоц — фирмами «Америкэн литиум кемикле» и «Фут минерал
компания.
Из чистого карбоната или гидроокиси лития можно выгодно получать
все необходимые соединения литий.
Были рассмотрены также другие методы выделения лития*. Минералы
и соединении лития являются превосходными флюсами, но они довольно
дорогие, поэтому необходимо полностью возгонять и извлекать литий
или абсорбиронать его в шлаке с последующим дорогостоящим извле-
чением металла.
ПРОИЗВОДСТВО МЕТАЛЛИЧЕСКОГО ЛИТИЯ ЭЛЕКТРОЛИЗОМ
РАСПЛАВЛЕННЫХ СОЛЕЙ
В этом разделе рассматриваются главным образом вопросы получения
металлического лития**. Для восстановления соединений лития до металла
были предложены различные методы, однако все они оказались более до-
рогостоящими, чем классический метод электролиза расплавленной смеси
* Химическая технология лития, начиная с переработки рудного сырья и вклю-
чая получение и рафинирование металлического лития, достаточно подробно освещена
в книге Ю. И. Остроушко и др. «Литий, его химия и технология», Атомнздат,
1960 — Прим. ред.
** См. также работу О. М Гуськова «Литий» (глава из книги «Основы металлур-
гии», т. 3, стр. 341—352, Металлургиздат, 1963).— Прим. ред.
Таблица 3
Промышленные процессы, применяемые различными фирмами сша для пол» чения.соединения лития
Исходный материал
Месторасположение
рудников
Месторасположение
химических заводов
Первоначальная об-
работка руды
Обогащение руды
Обжиг
Выщелачивание
Предпоследняя ст
дия очистки
Упаривание и получе-
ние готового про-
дукта
сфут минерал
компанн»
Сподумен
Кингс-Маунтин,
шт. Северная
Каролина
Санбрайт, шт.
Виргиния
Дробление и раз-
мол
Разделение в тя-
желых суспен-
зиях, затем фло-
тация
С известняком
Водой; образуется
LiOH
Нет
LiOH-H2O
«Аиерикэн поташ энд
кемикл корпорейшн»
Li2NaPO4 (рассол)
Озеро Сирлс, шт. Кали-
форния
Трона, шт. Калифорния
Упаривание
Флотация
Пет
Серной кислотой:
зуются Li2SO4
и Н3РО4
Содой; осаждается
Li2CO3
Li2CO3
обра-
«Амсрикэн литнум
кемнкле»
Лепидолит
Родезия
Сан-Лптонио,
шт. Техас
Дробление
сЛитиум корпорейшн
оф Америка»
Сподумен
Квебек а и Кингс-Ма-
уитин, шт. Север-
ная Каролина
Бессемер-Сити,
шт. Северная
ролина
Дробление и размол
Ка-
сМейвуд кемикл
уокс»
Ручная рудоразработ- Флотация
ка или мелкое руч-
ное дробление
С известняком
Водой; образуются
LiOH и КОН
Противоточная про-
мывка и сгущение
LiOH-H,O
Сподумен
Блэк-Хиллс, шт.
Южная Дакота
Мейвуд, шт. Ныо-
Джсрси
Дробление
Ручная рудораз-
борка
С серной кислотой Не опубликовано
Водой; образуется
Li2SO4
Содой, затем известью
LiOH.H2O
Покупаемая руда ввозится с 1958 г. (действительно, сКвебек литиум корпорейшн» снабжает «Лнтиум корпорейшн оф Америка»).
550 Глав а 16
хлоридов лития и калия, при котором на катоде осаждается литий, а на
аноде выделяется хлор. Во многих отношениях технология этого процесса
напоминает электролитическое восстановление хлорида магния. В табл. 4
приведены типичные рабочие характеристики промышленных электроли-
зеров.
Таблица 4
РАБОЧИЕ ХАРАКТЕРИСТИКИ ЭЛЕКТРОЛИЗЕРА ДЛЯ
ПОЛУЧЕНИЯ ЛИТИЯ [126]
Ток, а 850—900
Температура, °С 400—420
Напряжение, в 8—9
Плотность токл на аноде, а /см2 1,4
Плотность тока на катоде, а/см2 2,0
Выход по току, % 85—90
Расход электроэнергии, квт-ч/кг 40,1
Расход LiCI, кг/кг Li 7,3
Химический выход, % 83,7
Производительность электролизера, кг 100
Для получения 1 кг металлического лития из хлорида лития теорети-
чески требуется 3850 а-час при напряжении примерно 2,5 в, достаточном для
разложения хлорида с образованием металлического лития. Для преодоле-
ния электрического сопротивления ванны и подводящих проводов требуется
напряжение приблизительно 6—6,5 в. Расход электроэнергии на нагрев
ванны для получения 1 кг металлического лития составляет примерно
61,6 квт-ч. При нагреве ванны газом или нефтью расход электроэнергии
может быть снижен приблизительно до 46,2 квт-ч. 11а каждый килограмм
металлического лития выделяется примерно 5 кг хлора. При сколько-нибудь
значительном производстве лития выделяющийся хлор следует использо-
вать. Например, хлор можно абсорбировать различными растворами с целью
получения гипохлоритов и других его соединений или сжиганием водорода
в хлоре получать соляную кислоту.
Производительность одного электролизера сравнительно небольшая —
36—45 кг металлического лития в сутки; однако в случае необходимости она
может быть увеличена примерно до 225 кг в сутки. При крупном производ-
стве электролизеры можно соединять последовательно, что позволяет ис-
пользовать стандартное электрическое оборудование, дающее постоянный
ток напряжением 125—250 в.
При использовании смеси солей, близкой к эвтектическому составу
F0% LiCI и 40% КС1), достаточно поддерживать температуру 450—500е.
Этим достигается минимальный износ графитовых анодов.
Полученный таким образом металлический литий содержит некоторые
примеси, основной из которых является натрий. Практически весь натрий,
присутствующий в хлориде лнт'ня, также выделяется на катоде и остается
в металлическом литии.
Ниже приводятся результаты типичного анализа используемого хло-
рида лития (%):
LiCI 98,8
Н2О 0,6
Щелочность (в пересчете на Li2CO3) 0,06
SOf- 0.П1
CaCl2 0,10
BaCI2 0,01
.Питий
351
Na и К в виде хлоридов
Fe2O3
0,40
0,003
Результаты типичного анализа металлического лития приведены
в табл. 5.
Таблица 5
РЕЗУЛЬТАТЫ АНАЛИЗА МЕТАЛЛИЧЕСКОЮ ЛИТИЯ
Компонент
Na
Si
Al
Fe
Ca
Cu
Мб
К
N
Cl
Тяжелые метал-
лы
О
Li
Содержание, %
электролитнчьнкнй литий [СО]
фирмы «Мейвуд»
обычной степени
чистоты
0,710
0,004
0,002
0,001
0,001
0,001
0,0003
0,020
—
Нет данных
99,260
с ппннженным со-
держанием натрия
0,020
0,015
| 0,03
0,06
—
—
о,пз
0,003
0,09
Нет данных
99,750
термический про-
дукт [2Г>] фирмы
«Доминион ыа1не-
знум» обычной сте-
пени чистоты
0,01
0,04
0,03
0,03
0,02
0,001
0,5—0,2
0,5
0,1
Her данных
99,219—99,519
На рис. 1 показана схема электролизера лля получения металлического
лития.
b~12t, постоянный топ
Рис. 1. Схема электролизера для получения лития.
/ — кчмера обогревателя; 2 — жароупорный кирпич; 3 — расплавленный лектро-
лнг; 4 — поверхность выделяющегося металла; 5 — гйзопяя или нефтяная фор-
сунка; 6 —выделяющийся хлор (на пежторное использование); 7 — мотор-гене-
рнтор; 8 — графитовые электроды.
ФИЗИЧЕСКИЕ СВОЙСТВА И ОБРАБОТКА ЛИТИЯ
Физические свойства лития приведены в табл. 6. Токсикологические
свойства лития описаны Шоу [115].
ФИЗИЧЕСКИЕ СВОЙСТВА ЛИТИЯ
Порядковый номер
Атомный вес
Изотопный состав, %
Массовое число 6
7
Температура плавления, 'С
Температура кипения, °С
Плотность, г/см3
20°
200°
400'
600°
8'J0°
1000°
Теплота плавления при 179", кал/г
Теплота испарения при 1317°, кол/г
Давление пара, мм рт. ст.
745°
890°
1077°
1П84°
1156 ^
1236°
Удельная теплоемкость, кал/г-град
0°
50°
1П0°
186°
30П°
800°
Энтальпия при 25°, кал/г
Энтропия при 0°, кал/моль-град
Коэффициент теплопроводности,
кал/см -сек-' град
0»
216=
539°
Вязкость, спз
183.4°
193,2°
200°
208,1°
250.8="
283,5°
400°
000"
Удельное электрическое сопротивление, мком ¦ см
0°
100=
230°
Таблица 6
3
6,939
7,39
92,61
179
1317
0,534
0,507
0,490
0,474
0,457
0,441
103,2
4680
1
10
91
100
200
400
0,784
0,844
0,90
1,01
1,02
0,99
Г 203±0,7
[6,70±0,06
0,17
0,109
0,073
0,5918
0,5749
0,562
0,5541
0,4917
0,4548
0,402
0,317
8,55
12,7
45,25
[10]
[28]
[7]
[80]
[80]
[80]
[71
[80]
130]
|80]
180]
[801
[30]
[80]
[80]
[80]
[110[
[НО]
[301
[1101
[30]
[30]
[ПО]
[НО]
[135]
[135]
[80]
[80]
[971
[80]
[801
[80]
[97]
[97]
[52]
[52|
[80]
Литий 353
Продолжение табл. б
Поверхностное натяжение при 200- 500е, дн/см —400 [131]
Изменение объема при плавлении. % от объ- 1,5 |80]
ема твердого вещества
град-1
Коэффициент линейного расширения при 20°, 56-10—» [НО]
Поперечное сечение захвата тепловых нейтро- 71^ 1
иов, барн/атсм
Параметры решетки, А. [ПО]
а (КОД) при 20° а=3,502
Р(КГЦ)* при —196° а=4,41
* Имеются данные о том, что ниже— 1Ы5° литий кристаллизуется в гексаго-
нальной ||лотпоуПс|К!шаннои решетке с а=3,1П А и с=5,OSM А. — Прим. реС
Металлический литий не применяется как конструкционный материал
ввиду своей неустойчивости на воздухе и низкой температуры плавления.
Таким образом, чтобы сделать возможным применение лития, его необхо-
димо подвергать предварительной обработке.
Литиевые патроны
Металлический литий применяется в качестве дегазатора цветных ме-
таллов, например меди и медных сплавов. Чтобы осуществить дегазацию,
литий помещают в металлический патрон [76].
Слитки металлического литня помещают в гидравлический пресс
и выдавливают через фильеру в виде прутка подходящего диаметра (обыч-
но 12,7 мм). Полученный пруток разрезается на куски определенной дли-
ны весом 2,25; 4,5 и 9.0 г. Если такие куски добавить к 45 кг расплавленного
металла, то содержание лития составит 0,005; 0,01 и 0,02% соответственно.
Практика показала, что обычно требуются именно такие количества. Прут-
ки лития нужной длины помещают в оболочку из меди, атломиния или из
другого подходящего металла, представляющую собой тонкостенную трубку,
концы которой герметически закрываются для предохранения лития от
действия воздуха.
Литиевая проволока или лента
Литиевую проволоку (или ленту), предназначаемую главным образом
для применения в органическом синтезе, изготовляют путем выдавливания
через фильеру. Полученную проволоку (номинальный диаметр 3,2 aiai) на-
матывают на катушки и укладывают в непроницаемый для воздуха кон-
тейнер. Металлический литий хранится под сухим керосином или его заме-
нителем. 1 кг такой литиевой проволоки имеет длину 300—330 ai.
Литиевая лента наматывается на катушки, которые также помещаются
в герметичный контейнер. Лента имеет ширину 6.35 и 12,7 aiai, толщину
0,8 aiai; на катушки наматывается от 28 до 450 г ленты.
Гранулированный литий
Гранулированный- металлический литий можно получать перемешива-
нием расплавленного металла под слоем горячего парафинового масла. Он
также применяется в органическом синтезе.
23 Заказ Кв 239
354 Глава 1С __
Металлический литий, свободный от натрия
Металлический литий, полученный электролитическим путем, обычно
содержит 0,4—0,7% натрия. В некоторых случаях, например при получе-
нии сплавов лития с магнием, натрий необходимо удалять. Для этого в ап-
парате с расплавленным литием при повышенной температуре создается
глубокий вакуум (меньше 0,1 мм рт. ст.). Натрий испаряется, и литий,
который имеет гораздо более высокую температуру кипения, почти освобож-
дается от него (остаточное содержание натрия составляет 0,001—0,005%).
Расплавленный литий
Расплавленный литий находит широкое применение, в частности как
теплоноситель. Литий обладает сочетанием свойств, весьма желательным
для указанного применения: высокой удельной теплоемкостью, широким
Температура, °С
Сплавы поен»«та Ш W Ш Ш т т т
Чистое телезо
Шпоуглепадисгтя сталь цц
Низппхрошстоя сталь A/130) .
Ауапенитная Cr-Niw жавеюшав столь Illll I
Цветные мстаили
/H..Bi,Cd,Pb.Mq,Pl.Au,Aq.Si.Sn.Zn
Be.Cr.V
Zr.Ti
Nb Та Mo
Ni и сплавы на его основе _^
Сплавы на опюпе Со
Неметаллы
Нварц
Стекло и силикаты
Графит
Каучук и пластмассы
MqO
¦у^_уууу. ууууу,
ш
ИП
1—
ШИП
тт&'уул
iwwwkvy//
\\\\\УУУУУ. '. '. \ '.'У,
'УУУ У УУУУУ', " '','
гу, 'Уууу,, 'уУуу.л ',
, s, 'УУУУУ. 'У. 'УУ У
lllllllllllillMK
'УУУ,УУ. 'УУУ/
^ууу.ууу,
'У .'/'У У, У/
УУУ '' ' '//¦//'
¦уу/уух>/у,А
'УУУУУ УУУУ,
,,/,/, '////,¦
| "Г
Устойчивость
^^Ш Хороша я
ШИШИ ограниченная
U777X Плохая
I ~] Неизвестна
Р и с. 2. Устойчивость конструкционных материалов;против действия
расплавленного лития (взято из «Справочника по жидким металлам»)
Устойчивость против действия расплавленного лития оценивалась без учета
изменения механической прочности илн металлургической устойчивости мате-
риалов в яаниснмости от температуры. Дли более подробного ознакомления
с этим вопросом см. текст. Оценка устойчивости: хороший — материал может
служить сравнительно долгое время; ограниченная — материал может служить
лишь непродолжительное время; плохая — металл или сплав неприменим
в качестве конгтрукцнонного материала: неиарсстна — имеющиеся сведения
О материале недостаточны.
Литий
355
температурным интервалом существования в виде жидкой фазы, высокой
теплопроводностью, малой вязкостью и низкой плотностью. Последнее
свойство — низкая плотность — делает применение лития в охлаждающих
системах самолетов и ракет особенно желательным. Применению лития для
это» цели мешают два обстоятельства, представляющие самостоятельные
проблемы:
1. Расплавленный литий может вызывать коррозию, особенно если
не принимаются строгие меры, предотвращающие попадание в литий киспо-
рода и азота.
2. В ядерной энергетике в качестве охладителя пригоден только изо-
топ литий-7, который имеет гораздо меньшее поперечное сечение захвата
тепловых нейтронов (< 1,0 барн), чем природный литий (^- 70 барн)
и тем более изотоп литий-6, поперечное сечение захвата которого равно
912 барн.
Первая из этих проблем является предметом интенсивных исследова-
ний, предпринятых различными фирмами в целях разработки авиационных
атомных двигателей, так как применимость лития здесь очевидна. Улуч-
шается методика аналитического определения небольших примесей в ме-
таллическом литии. Широко изучаются механические способы герметизации
и фильтрования расплавленного лития.
Для решения второй проблемы необходимо проводить дальнейшие
исследования, чтобы применение лития-7 в качестве охладителя стало
экономически выгодным. В настоящее время литий-6 очень высокой чистоты
можно приобрести в Комиссии по атомной энергии США по 2—3 цента за
1 мг B0—30 тыс. долл. за 1 кг), а относительно чистый литий-7— по 15—
30 центов за I мг A50—300 тыс. долл. за 1 кг). Эти цены относятся, конечно,
лишь к небольшим экспериментальным количествам, но они дают некото-
рое представление о стоимости крупномасштабного производства чистого
изотопа лития-7.
Много сведений о работе с жидким литием имеется в «Справочнике по
жидким металлам». В качестве примера на рис. 2 показана стойкость раз-
личных материалов по отношению к жидкому литию [93].
СОЕДИНЕНИЯ. ПОЛУЧАЕМЫЕ ИЗ МЕТАЛЛИЧРСКОГО ЛИТИЯ
В табл. 7 указаны стехиометрические соотношения и количества энер-
гии, выделяющейся при взаимодействии лития и многих других элементов
с кислородом и серой.
Таблица 7
взаимодействие кислорода и серы с литием и другими элеминтами
Литий
11атрин
Калий
Руби чин
Количество
кислорода,
соединяю-
щегося с I г
элемента,
1,152
11,348
0,204
0,094
Количество теп-
ла, выделяющее-
ся при взаимо-
действии I г
элемента с
кислородом,
ккал
10,33
2,18
1.11
0,46
Кол и честно
серы, соеди-
няющейся
с 1 г эле-
мента, г
2,309
0,697
0,410
0,188
Количество теп-
ла, выдрлигоще-
ссн при взаимо-
действии I г
элемента с серой,
кка г
8,75
1,95
1,11
1,02
356
Глава 16
Продолжение табл. 7
Элемент
1 1,езнн
Бериллий
Магний
Кальций
Стронций
Барий
Алюминии
Цинк
Марганец
Кремний
Титан
Фосфор
Цирконий
Количегтпп
кислорода,
соединяю-
щегося с 1 г
элемента,
г
0,060
1,774
0.658
0,399
0,182
0,1Ю
U, 890
0,245
0,292
1,140
0,668
1,289
0,3.10
Количество теп-
ла, выделяющее-
ся при взаимо-
действии с 1 г
элемента с
киглиродом,
ккал
0,31
15,23
6,00
3,72
1,61
0,97
7,05
1,27
1.707
6,80
4,56
5,78
2,90
Количество
серы, соеди-
няющейся
с 1 г эле-
мента, г
0,120
3,554
1,320
0,800
0,366
0,234
1,783
0,491
0,583
—
—
0,351
Количество теп-
ла, выделяющее-
ся при взаимо-
действии I г
элемента с серой,
ккал
—
3,27
2,78
1,258
0,745
2,34
0,632
-1,10
—
—
—
Литий и водород
Литий легко соединяется с водородом при повышенных температурах,
образуя довольно устойчивый гидрид лития LiH. Этот гидрид имеет точно
установленную температуру плавления, равную 688°, и подобно галогени-
дам может быть расплавлен, подвергнут электролизу и т. д. Электропровод-
ность расплавленного гидрида лития сравнительно высокая [1, 2].
Гидрид лития является типичным представителем группы солеобраз-
ных гидридов, к которой относятся [4] гидриды лития, кальция, стронция,
бария, натрия, калия, рубидия и цезия (гидрид магния ие известен)*. Рас-
положение атомов в таких солеобразных гидридах напоминает расположе-
ние атомов в хлориде натрия. Их устойчивость уменьшается в том порядке,
в котором выше перечислены элементы, причем гидрид лития гораздо бо-
лее устойчив, чем остальные гидриды. Этот факт свидетельствует также
о близком сходстве свойств лития и щелочноземельных металлов.
Гидрид лития может быть получен с содержанием водорода, соответ-
ствующим составу LiH, однако другие солеобразные гидриды ввиду их
уменьшающейся устойчивости трудно получить с содержанием теоретиче-
ского количества водорода. Например, гидрид натрия NaH имеет такое
высокое давление пара, что его температуру плавления нельзя определить.
в то время как гидрид лития сравнительно устойчив и может плавиться
без разложения. Эфраим и Мишель [32] установили, что даже при темпера-
туре 640° (на 40° ниже температуры плавления) давление пара гидрида ли-
тия не превышает 70 мм рт. ст.
При электролизе гидрида лития [4] металлический литий осаждается
на катоде, а на аноде выделяется водород. Этот факт имеет большое значе-
ние, так как он вместе со сходством расположения атомов гидрида лития
* Гидрид магния MgH2 может быть получен при нагревании металла D00—500е)
в атмосфере водорода.— Прим. ред.
Литий 357
и хлорида натрия как бы указывает на принадлежность водорода к под-
группе галогенов.
Гидрид лития весьма реакционноспособен. Он легко восстанавливает
окислы, хлориды и сульфиды. Например, двуокись углерода восстанавли-
вается гидридом лития до углерода. Муассан описывает реакцию гидрида
лития с сернистым газом, которая при комнатной температуре протекает
по следующему уравнению:
2LiH+2SO2 - > Li2S2O4+H2
При температурах выше 50° образуется сульфид лития.
Известно несколько методов получения солеобразных гидридов, но
наиболее удобным до сих пор считается взаимодействие металла с водоро-
дом при повышенных температурах. 1 кг металлического лития соединяется
примерно с 1600 л водорода с образованием гидрида лития, 1 кг которого при
разложении водой дает около 2800 л водорода.
Литий и азот
Литий реагирует с азотом, образуя черный нитрид состава LisN, тем-
пература плавления которого лежит вблизи 275" [114]. Нитрид лития может
быть переплавлен в вакууме или в атмосфере азота.
При взаимодействии с водой нитрид лития, подобно другим солеобраз-
иым нитридам, например нитридам магния, кальция, стронция и бария,
образует аммиак. Получение нитридов натрия и калия связано с большими
трудностями; нитриды рубидия и цезия* неизвестны [94, 95].
Нитриды типа Li3N легко соединяются с нитридами некоторых тяжелых
металлов, например нитридом железа, а также с тяжелыми металлами в при-
сутствии азота. При этом образуются двойные нитриды вполне определен-
ного состава, которые имеют четкие температуры плавления. Франкенбур-
гер, Андрусов и Дюрр [35] описывают для лития соединение LiaN • FeN
и некоторые его химические и физические свойства.
Литий и кислород
Окись лития Li2O представляет собой устойчивое соединение пития
и кислорода, однако она очень легко реагирует с водой, двуокисью угле-
рода и многими тугоплавкими соединениями.
Известна только одна перекись лития состава Li2O2. Очень небольшие
количества этой перекиси образуются при сожжении лития в токе кислорода.
Перекись лития можно получить также с помощью перекиси водорода 1141].
Магний и кальций также имеют небольшую склонность к образованию пе-
рекисей. С другой стороны, натрий, калий, рубидий и цезий при сожжении
в кислороде очень легко образуют довольно устойчивые перекисные соеди-
нения. В табл. 8 приведены наиболее достоверные из имеющихся данных
по физическим свойствам гидрида, нитрида и окислов лития.
* Нитриды рубидия н цезия могут быть получены при взаимодействии паров
рубидия и цезия с азотом в поле тихого электрического разряда. Они не являются харак-
терными соединениями, менее устойчивы, чем иитрнд лития, и легко разлагаются
водой с образованием гидроокисей и выделением аммиака.— Прик. ред.
,?58
Глава 16
ФИЗИЧЕСКИЕ СВОЙСТВА ОКИСЛОВ
Плотность, г/смя
Температура п.швлепия,
"С
Темперлтура кипения, ^С
Теплота образования.
КК11Л/М0ЛГ1
Теплоемкость, ккил/моль
Теплота растворения,
ккал/мпяп
Теплота плавления,
ккал/моль
Теплота гидролиза,
ккая/модь
Энтропия при 25 ,
кал/моль- грид
LisO
2.U13 [61]
1427A3]
1527 [16]
142,4A08]
0,024 при 25"[б8]
2,497 при 101)'
8,892 при 200""
31,3@1]
—
—
, НИТРИДА И
Li,Os
2,297 [33]
425A32]
— 151,7A13]
—
—
—
—
Таблица S
ГИДРИДА ЛИТИЯ
Li3N
UH
1,38A6] 0,775A29]
275 [12]
47,5A2]
688 [86]
—21,34 [84]
8,2 при 0°[85]
13,5 при 527'
7| 83]
-31,76[84|
—
5,9G11]
Литий и кремний
Литий — единственный элемент своей группы, который образует
соединения и сплавы с кремнием*. Это является еще одним доказательством
сходства лития с щелочноземельными элементами. Эти сплавы получают
в эвакуированном контейнере нагреванием компонентов выше 600°. Полу-
ченный продукт представляет собой твердую прочную однородную массу,
по внешнему виду напоминающую металл. Нагревание при температурах
выше 600" даже в течение многих часов не приводит к потере сколько-ни-
будь заметного количества лития, и в литиевокремниевых сплавах литий
и кремний содержатся практически в том же соотношении, что и в исходной
смеси.
Литнепокремниевые сплавы в определенных условиях весьма реакцион-
носпособны (гораздо более реакционноснособны, чем силициды щелочно-
земельных металлов), но на воздухе довольно устойчивы и лишь покрываются
тонкой серовато-белой пленкой. Крупные куски этих сплавов полностью
разлагаются при хранении на воздухе в течение нескольких месяцев. В за-
крытых сосудах сплавы литий — кремний можно хранить длительное
время.
Муассан получил силицид лития предполагаемого состава Li,,Si2. Со-
гласно Муассану, кристаллы этого силицида имеют голубоватый оттенок.
На воздухе силицид расплывается и быстро разлагается. Удельный вес
Li0Si2 Муассан определил равным примерно 1,12.
Полученные позднее сплавы литий — кремний заметно отличаются от
описанного Муассаном силицида Li6Si2 по физическим свойствам и способу
* Та же неточность, что и с нитридами. Известны, например, силициды рубидия
и цезия, которые могут быть получены прямым синтезом из элементов.— При»,
ред.
Литий
359
получения. Муассан нагревал исходную смесь в вакууме, причем он под-
черкивал, что смесь необходимо поддерживать при температуре 400—500°,
при которой избыток лития в исходной смеси отгоняется. Муассан всегда
получал соединение Li6Si2, которое при температурах выше 500° начинало
разлагаться на литий и кремний; при температурах выше 600° это соедине-
ние полностью разлагалось. В табл. 9 приведены плотности и температур-
ные интервалы затвердевания различных литиевокремниевых сплавов,
а для сравнения — свойства Li6Si2, полученного Муассаном*.
Состав, %
L1
60
50
40
25
42,3
40
50
60
75
57,5
Таблица 9
СПЛАВЫ ЛИТИЯ И КРЕМНИЯ
Температурный
интервал затверде-
вания, °С
,0
,17
,4
,72
,12
I
500—550
-625
680—700
700—750
Разлагается выше
50U
Автор
Осборг
Муассаи
ДРУГИЕ СОЕДИНЕНИЯ ЛИТИЯ
Кроме соединений лития, получаемых обычно в безводных условиях
из металлического лития, существуют его соединения, которые получают
мокрыми способами из руд. В табл. 10 приводятся наиболее достоверные
данные по физическим свойствам наиболее важных соединений лития.
Гидроокись лития
Гидроокись лития гораздо менее гигроскопична, чем едкий натр и ед-
кое кали. Из водного раствора она кристаллизуется в виде гидрата
LiOH ¦ Н2О, который может быть топко измельчен. Растворимость гидроокиси
лития в воде примерно в 5 раз (по весу) меньше растворимости едкого натра
и едкого кали. С другой стороны, гидроокись лития примерно в 100 раз
более растворима, чем гидроокись кальция, и почти в 4 раза более раство-
рима, чем гидроокись бария. Подобно едкому натру и едкому кали, гидро-
окись лития может быть расплавлена. Склонность к разложению при нагре-
вании выражена у нее не так резко, как в случае гидроокисей щелочнозе-
мельных металлов. Температура плавления гидроокиси лития, равная 445",
намного превышает температуры плавления гидроокисей остальных щелоч-
ных металлов. Однако давление пара расплавленной гидроокиси лития зна-
чительно выше, чем давления паров гидроокисей других щелочных металлов,
и составляет 760 мм рт. ст. при температуре около 925е, в то время как
температуры кипения едкого натра и едкого кали лежат между 1300 и 1400°.
* Исследования последнего десятилетия в области химии бинарных соединений
лития дают основания для сомнений в существовании силицида лития указанного со-
става. Имеются соображения об образовании в системе литий — кремний иных соеди-
нений.— Прим. ред.
360
Глава 16
Физические свойства
LIOH
UOII НгО
Li2CO3
UF
Плотность, г/см3
Температура плаолс-
ния, СС
Температура кипения,
"С
Удельная теплоем-
кость, кал/моль ¦ град
Теплота образования,
кюхл/моль
Теплота плавления,
ккил/моль
Теплота испарения,
ккал/моль
Теплота растворения,
ккал/моль
Энтропия,
кал/моль- град
Растворимость в воде,
2,54
[103|
471,1
[120]
925 (разл.)
[42]
19.00 [5]
105,13
[70]
—2,48
[69]
4,55
[8]
12.8
[69]
10,9 [105]
1,51
[103|
188,93
[68]
—0,87
[133]
17,07
[5]
2,111
[73]
735
[65]
1200 (разл.)
[22]
23,28
[71]
—290,54
[78]
21,60
[15]
1,31 [117]
2,64
[63]
840
[И]
1681
[113]
2,59
[14]
- 145,6
[12]
-6,2
[104]
51,0
[113J
—1,04
[23]
0,133A02]
LICI
2,068
[53]
614
[134]
1380
[12]
12,2
[ИЗ]
—97,70
[12]
—3,2
[II]
36,0
[ИЗ]
—8,49
[8]
13,9
[71]
46,0 [96]
Галогениды лития
Литий легко реагирует при повышенных температурах с галогенами
образуя соответствующие галогениды. Сродство лития к галогенам выяв-
ляется геплотами образования его галогенидов. Из всех фторидов щелочных
металлов фторид лнтия имеет самую большую теплоту образования. Эта
«аномалия» исчезает с увеличением размера иона галогена. Так, теплоты
образования бромидов и иодидов щелочных металлов возрастают с увели-
чением атомного веса щелочного металла, т. е. они отражают усиление ме-
таллических свойств от лития к цезию.
Кристаплическая структура галогенидов лития напоминает структуру
хлорида натрия, а не структуру флюорита, характерную для галогенидов
щелочноземельных металлов. Тем не менее свойства галогенидов лнтия по-
зволяют предполагать близкое сходство лития с щелочноземельными эле-
ментами. Галогениды лития, подобно галогеиидам щелочноземельных ме-
Литий
361
Таблица 10
соединений лития
LiBr
3,464
[61
552
[HI
1310
[HI
—87,4
[12]
2,9
[И]
LiBOa
3,94
[57]
440
[И]
1171
[И]
72,5
[121
—1,42
[HI
2,428
[112]
236
[112]
LijSIO3 U4SiO4
—99,9
[130]
846
[67]
1200
(разл.)
[67]
2,52
[66]
1188
[113]
2,33
[91
1250
[113J
6,0
[113]
35,4
11,39
[77J
60,4 [56]
40,77
[H]
14,8
[24]
164 [64J
35.9[121]
367,7
[113]
7,2
[113]
3,5 [82] —
LfNO3
LioSO4
2,37
[54]
254
[55]
115,28
[113]
7,4 3,1
[113] [41]
0,35
[54]
- I 40 [17]
2,22
[61]
859
[113]
342,8
[113]
3,0
[113)
25 [3]
таллов, образуют продукты присоединения с аммиаком, метиламином,
этиламином и т. п., которые имеют вполне определенный состав и устой-
чивы при умеренных температурах. Хлориды натрии и калня почти неги-
гроскопичны, в то время как хлорид лития расплывается сильнее, чем хло-
рид кальция. Хлорид лития, подобно хлоридам магния и кальция, способен
образовывать с водой кристаллогидраты.
Хлорид и бромид лития обладают уникальными термодинамическими
свойствами — значительно снижают давление пара над своими растворами,
вследствие чего они представляют особый интерес для применения при
кондиционировании воздуха.
Растворимость фторида лития в воде, так же как и фторидов щелочно-
земельных металлов, сравнительно низкая*.
* При 25", по данным И. В. Тананаева, в 100 г воды растворяется 0,13 г LiF.
Еще менее растворим фосфат лития Li3PO4 — одна из наиболее трудиорастворимых
солей лития.— Прим. ред.
S62 Г лава 16
Весьма замечательны свойства галогенидов лития в расплавленном
состоянии.
Другие соединения лития
В аналитической химии и технологии используется слабая раствори-
мость фосфата, карбоната и фторида лития в воде, чем они отличаются от
соответствующих солей остальных щелочных металлов. Кроме того, рас-
творимость хлорида лития в органических растворителях, например спир-
тах, обеспечивает удобный способ отделения его от хлоридов других щелоч-
ных металлов. Фторид лития при добавлении спирта к его водному раст-
вору становится еще менее растворимым.
Сульфат лития проявляет заметное сходство с сульфатом магния. Он
образует двойные соли с сульфатами натрия и калия, например LiKSO4
и другие.
электрохимия лития
Электрохимическое поведение лития замечательно во многих отношениях,
и некоторые из них рассмотрены ниже. В водном растворе потенциал Li/Li+
равен —3,02 в A12/Н+= 0,00 в) по сравнению с потенциалами — 2,71 в для
натрия, — 2,92 в для калия и — 2,92 в для рубидия (потенциал цезия точно
не определен). Таким образом, кажется вполне вероятным, что литий яв-
ляется более электроотрицательным или менее благородным металлом, чем
другие щелочные металлы. Однако если принять во внимание гидратацию
ионов щелочных металлов, то станет ясно, что это не так. Все ионы щелоч-
ных металлов в водном растворе в большей или меньшей степени гидрати-
рованы, причем ион лития гидратирован гораздо сильнее, чем, например,
ион цезия. Этим объясняется, почему подвижность небольшого иона лития
приблизительно только вдвое меньше, чем подвижность гораздо большего
нона цезия. На явную склонность иона лития присоединять молекулы воды
указывает то, что при его гидратации выделяется большое количество
тепла. Поэтому очевидно, что большая величина потенциала Li/Li+ в вод-
ном растворе отвечает в действительности количеству энергии, выделяю-
щейся при двух следующих^реакциях:
Li — Li+, (I)
Li++nH2O —> Li+ (гидратнрованный). B)
Поведение иона лития в расплаве менее сложно, особенно в случае
расплавленных галогенидов. Электропроводность расплавленных галоге-
нидов лития очень высокая. Как это видно из табл. 11, электропроводность
фторида лития выше, чем у любого другого галогенида.
Напряжения разложения расплавленных галогенидов лития были оп-
ределены Нейманом, Рихтером и Бергве. Их результаты указывают на тот
интересный факт, что температурный коэффициент, например, для хлорида
лития равен 1,35 - 10, в то время как температурный коэффициент для
хлоридов натрия, калия, рубидия и цезия, определенный теми же авто-
рами, равен 1,5 • 10~3. Если потенциалы разложения нанести на график
в зависимости от температуры, то для хлоридов натрия, калия, рубидия
и цезия получаются прямые линии, параллельные друг другу, в то время
как прямая для хлорида лития не параллельна им. Напряжение разложе-
ния в случае хлорида лития уменьшается с повышеиием температуры более
медленно. Кроме того, в исследованном интервале температур напряжение
Литии
363
Таблица 11
ЭЛЕКТРОПРОВОДНОСТЬ НЕКОТОРЫХ РАСПЛАВЛЕННЫХ ГАЛОГЕНИДОВ
Темпера-
тура. -С
550
600
650
70И
750
800
850
900
950
1000
1050
LiF
[147]
20,3
23,4
27,2
—
LiCl
[147]
7,90
8,45
9,01
9,21
(930°)
—
[148]
—
6,0
6,2
6,4
6,6
—
—
—
N
11
3
3
3
Электрипрпнпдпшл
aCl
18]
66
77
88
KF
Г НО]
3,28
3,73
D,2)
KCl
[if.O]
—
2,19
2,30
2,40
2,50
2,61
—
ь, .«-1
MgCI2
[148]
—
—
1,09
1,18
1,26
1,38
1.44
1,54
cx-2
CaClo
[150]"
1
2
2
2
2
2
90
12
32
50
66
76
Sr
Ll
1
2
2,
2
t:l.
si]
98
14
29
43
ЕяС1.
[151]
_
_
—
—
A,71)
1,89
2,05
2.19
ArCI
U
4
4
4
4
4
5
00]
34
48
62
76
98
14
разложения хлорида лития оказывается более низким, чем у хлоридов
других щелочных металлов.
Характерная особенность лития как переходного (к щелочноземельным)
элемента выявляется также при сравнении потенциала разложения его
хлорида с потенциалами разложения хлоридов магния, кальция, стронция
3,5
600
700 800
Температура, °С
Р00
WOO
Рис. З. Напряжение разложения солей, согласно Нейману и Рихтеру.
и бария, которые также были определены Нейманом с сотрудниками. За-
висимость напряжения разложения хлоридов щелочноземельных металлов
от температуры, так же как и хлоридов щелочных металлов, представлена
рядом параллельных прямых линий. Однако угол наклона в этом случае
отличается от угла наклона прямых для хлоридов натрия, калия, рубидия
и цезия и хлорида лития. Температурный коэффициент напряжения разло-
жения хлоридов щелочноземельных элементов составляет 0,71 • 10.
На рис. 3 представлены результаты, полученные Нейманом и Рихте-
ром. Из этих результатов можно сделать вывод, что ион лития в указанных
364
Глава 16
условиях является наименее электроотрицательным или наименее основ-
ным ионом группы щелочных элементов и менее электроотрицательным,
чем ионы кальция, стронция и бария.
СПЛАВЫ
Литий, подобно другим щелочным и щелочноземельным металлам, об-
разует сплавы с многими металлами. Иногда он ведет себя как щелочной
металл, иногда же как щелочноземельный. Литий образует сплавы и интер-
металлические соединения с алюминием, цинком и другими металлами.
С кремнием литий ведет себя как щелочноземельный металл, однако с медью
он не образует иптерметаллических соединений, как это наблюдается
в случае кальция. Можно отметить, что литий, как правило, образует ин-
терметаллические соединения, отличающиеся твердостью и хрупкостью
наряду с высокой температурой плавления и мало поддающиеся действию
воздуха. Работы по сплавам лития с различными металлами проводили мно-
гие исследователи, например Асман [4], Чохральский и Рассоу [18], Френ-
кель и Хан [34], Грубе н сотр. [43—50], Генри и Кордиано [58], Масинг
и Таммап 181], Пасторелло [99—101].
В табл. 12 показано состояние знаний к 1959 г. о системах, которые
образует литий с другими элементами*.
Таблица 12
СВЕДЕНИЯ О СИСТЕМАХ, ОБРАЗУЕМЫХ ЛИТИЕМ С ДРУГИМИ ЭЛЕМЕНТАМИ
Изучены диаграммы
состояния а
Алюминий
Индий
Кадмий
Калий
Кальций
Магний
Медь
Натрии
Олово
Ртуть
Свинец
Серебро
Таллий
11инк
Имеются некоторые
сведения ^
Бериллий
Бор
Галлий
Золото
Кремний
Никель
Реиий
Рубидий
Селен
Сурьма
Теллур
Цезий
Вероятно,
нерастворим в
Вольфрам
Железо
Иридий
Молибден
Осмий
Палладий
Платина
Родий
Рутений
Уран
Хром
Данных
не имеется г
Барий
Ванадий
Гафний
Германий
Марганец
Ниобий
Стронций
Тантал
Титан
Торий
Цирконий
а Сказаны вторые компоненты систем литий—металл.—Ярил. ред.
° Указаны вторые компоненты систем, сСразованных литием с различными эле-
ментами.— Прим. ред.
в Указаны элементы, в которых лнтнй считается нерастворимым.— Пгим- ред.
г Имеется в виду, что системы L]—М (М указан в данной колонке) не изу-
чены. В действительности отдельные системы, хотя Гы частично, уже исследеганы,
например с барием, германием.— Прим- ред.
* Сплавы лития — только одна из областей его применении, которой автор уде-
ляет относительно большое внимание. В отечественной литературе применение лития,
его сплавов н соединений освещалось шире и подробнее в ряде работ. См., например,
брошюру Б. И. Когана сЛитий. Области освоенного и возможного применения»,
ВИНИТИ. 1960 — Прим. ред.
Литий
365
Таблица 13
ИНТЕРМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ ЛИТИЯ
Элемент
Магний
Алюминий
Цинк
Кадмий
Ртуть
Таллий
Свинец
Ьисмут
Серебро
Олово
Соединенне
Li2Mg6
Li2Al3
LiZn
Li2Zn3
l.iZn2
Li3C<l
LiCd
LiCd3
Li3Hg
LiHg
LiHg2
LiHg3
Li4Tl
Li3Tl
Li6Tl2
Li2Tl
LiTl
Li4Pb
Li7Pb2
LigPb
Li6Pb2
Pb
Li3Bi
LiBi
Li3Ag
LiAg
Li4Sn
Li7Sn2
L15S112
Li2Sn
LiSn
LiSn2
Устойчиво до
температуры,
—
93
272
—
370
379
232
- -42
381
-
—
381
_
648
—
658
642
415
—
720
502
326
Температура
"С
590
598
—
520
_
549
-
—
600,5
Грубе и сотр.
Чохральский и сотр.
Френкель и сотр.
1
} Грубе и сотр.
1
J
—
Зудовский
447
448
—
508
726
482
1145
450
955
765
Грубе и сотр.
У Грубе и сотр.
> Пасторелло
783 |
—
485
—
Грубе и сотр.
Диаграммы состоянии некоторых из этих систем приведены в конце
главы (см. рис. 4—14).
Сплавы лития с алюминием, цинком, свинцом и магнием имеют техни-
ческое значение [4]. При добавлении 1% лития улучшаются свойства ос-
новного металла; литий придает металлу вязкость или твердость илн од-
новременно оба свойства. Прочность на растяжение и упругие свойства
сплавов, легированных литием или содержащих его, Довольно высокие.
366 Глава 16
Сплавы лития и магния
Наблюдения Генри и других исследователей показали, что сплавы маг-
ния с содержанием лития до 10% не корродируют на воздухе. Этот случай
является единственным, так как обычно сплавы лития с другими металлами,
содержащие не менее 5% лития, при действии атмосферного воздуха в те-
чение заметного периода времени разрушаются с поверхности.
В годы второй мировой войны в Институте нм. Баттела и фирмой «Дау
кемикл» была проделана большая работа по производству и применению
сплавов лития с магнием. Эти сплавы содержат 8—12% лития, причем при-
меняемый литий должен быть свободен от натрия [38].
Уникальным свойством этих сплавов является изменение характера
кристаллической решетки вследствие сравнительно большого содержания
лития. Вместо типичной для магния гексагональной структуры литиево-
магниевые сплавы кристаллизуются в кубической объемноцентрированной
решетке. Литиевомагниевые сплавы отличаются легкой обрабатываемостью
и превосходными физическими свойствами. Однако их применение крайне
ограничивается быстрой потерей прочности при нагревании выше 150°.
Сплавы лития и алюминия
Согласно данным Асмана [41, при образовании твердых растворов рас-
творимость лития в алюминии составляет 3,5% при температуре плавления
и 2,2% при комнатной температуре. Влияние небольших количеств лития
на физические свойства алюминия или богатых им сплавов весьма сходно-
с тем, которое оказывает магний, особенно если в сплаве содержится крем-
ний. Однако ввиду более низкого эквивалентного веса лития для достиже-
ния такого же эффекта в отношении физических свойств сплава литий до-
бавляется в меньших количествах, чем магний.
Сплавы алюминия, содержащие литий, пока иашли лишь ограниченное-
промышленное применение. Среди таких литиевоалюминиевых сплавов
особый интерес представляет, по-видимому, склерон [18—21]. Типичный
состав этого сплава следующий: 83% алюминия, 12% цинка, 2% меди,
0,5—1% марганца, 0,5% железа, 0,5% кремния, 0,1% лития. По физи-
ческим свойствам склерон напоминает мягкую сталь или латунь. Сообша-
лось, что его предел прочности при растяжении, упругие свойства и твер-
дость выше, чем у дюралюминиевых сплавов.
Сплавы лигия и цинка
В области практического применения сплавов лития с цинком разрабо-
тано несколько предложений [87—92, 98. 106, 107]. Добавки лития в ко-
личестве около 0,005% заметно улучшают структуру цинковых сплавов,
уменьшая размер зерна. Очевидно, характер улучшения качества сплавов,
такой же, как и в случае магния. Вследствие низкого эквивалентного веса
литий требуется в меньшем количестве, чем магний, и часто приводит к более-
значительному улучшению качества сплавов.
Сплавы лития и свинца
Чохральский и Paccoy [18J изучали систему свинец—литий с содержа-
нием лития до 2,15%. Они полагали, что растворимость при образовании
твердого раствора лития в свинце при комнатной температуре составляет
Литий 367
0,04—0,09"о. Согласно данным Грубе [431, растворимость лития в свинце
составляет меньше 0, Ио и больше 0,03%. Грубе сообщает также о следую-
щих соединениях лития со свинцом: LiPb, Li5Pb2, Li3Pb, Li7Pb2 и Li4Pb.
При добавлении к свинцу 0,05% или меньшего количества лития зна-
чительно улучшаются литейные и физические свойства свинца, который
становится более вязким и твердым, сохраняя удовлетворительную пла-
стичность. В то же время значительно повышаются предел прочности при
растяжении и модуль упругости. Кроме того, присутствие лития в свинце
обеспечивает более мелкозернистую структуру и замедляет рекристалли-
зацию. Гарре и Мюллер [39] сравнивали влияние добавок различных эле-
ментов, например меди, сурьмы, олова, никеля, цинка и магния, с влия-
нием добавок лития на размер зерен и твердость свинца. Результаты, полу-
ченные этими исследователями, ясно показывают, что из всех испытанных
элементов литий придает свинцу наиболее мелкозернистую структуру
и наибольшую твердость. Кох [72] предложил применять сплавы лития
и свинца, особенно те, которые содержат небольшие добавки кадмия или
сурьмы, для изготовления кабельных оболочек. Он установил, что свинец,
содержащий 0,005% лития, имеет значительно более высокий предел проч-
ности при растяжении по сравнению с чистым свинцом.
Гораздо большее значение имеет применение лития в подшипниковом
сплаве на основе свинца с добавками щелочных металлов, повышающими
твердость. Этот сплав был разработан в Германии около сорока лет назац
с целью замены подшипниковых сплавов на основе олова сплавом, обладаю-
щим большей твердостью при повышенных температурах. Было найдено,
что добавка лития к свинцу весьма полезна для этой цели и делает возмож-
ным промышленное применение нового подшипникового сплава. Состав
этого нового сплава, получившего торговое название В-металл [136 — 139],
примерно следующий: 0,04% лития, 0,73% кальция, 0,66% натрия, 0,03%
калия, меньше 0,2% алюминия, остальное свинец.
Наиболее важным компонентом В-металла является литий. Его присут-
ствие придает сплаву большую твердость, особенно при повышенных тем-
пературах, высокое сопротивление деформации и удовлетворительную
износостой кость.
ПРИМЕНЕНИЕ МЕТАЛЛИЧЕСКОГО ЛИТИЯ
Литий в сплавах
Хотя выше упоминался ряд возможных полезных примеров примене-
ния лития в сплавах, фактическое его количество, идущее на эти цели,
невелико. Литий широко применяется для легирования конструкционных
сплавов алюминия и магния, а также в медных и серебряных твердых
припоях.
Литий как дегазатор и рафинирующий агент
Поскольку металлический литий химически активен, его можно ис-
пользовать для удаления газов из расплавленных металлов. Литий реаги-
рует с водородом, кислородом, серой и азотом. Соединения лития, образую-
щиеся прн его добавлении к расплавленным металлам, имеют сравнительно
низкие плотности и температуры плавления. Это особенно важно для уда-
ления твердых примесей из металла.
368 Глава 16
Во многих случаях литий нерастворим в металле или не соединяется
с ним; например, литий практически нерастворим в расплавленной меди
и в железе.
Металлический литий обычно используют для дегазации меди, в осо-
бенности при получении отливок с высокой электропроводностью [76,
127, 128].
Было найдено, что в сравнительно крупные отливки металла требуется
добавлять несколько большее количество лития. Обычно для отливок весом
до 90 кг количество добавляемого для дегазации лития составляет 0,01%
для бронз и 0,02% для меди с высокой электропроводностью. Для отли-
вок весом от 90 до 900 кг добавка лития должна быть увеличена в 2 —
3 раза.
Если масса расплавленного металла невелика, он быстро охлаждается
в изложнице и затвердевает, прежде чем может снова окислиться. В случае
больших количеств отливаемого металла избыток лития предохраняет его
от окисления во время охлаждения и затвердевания расплавленного
металла.
Литий применяется также для улучшения структуры некоторых бронз.
Он значительно увеличивает жидкотекучесть расплавленного металла.
Литий в чугуне
В течение ряда лет предпринимались попытки использовать свойства
лития, так же как и свойства магния, для улучшения качеств чугуиов.
Было найдено, что добавка к чугуну небольших количеств лития до неко-
торой степени улучшает его физические свойства. Однако за последние
пять лет в связи с развитием производства чугуна с шаровидным графитом
било получено много доказательств, что добавки лития к чугуну облегчают
получение сфероидальной структуры, причем для получения тех же свойств,
что и в случае применения магния, требуются меньшие добавки литня.
Кроме того, добавление лития не сопровождается бурной реакцией, в то
время как магний во избежание бурной реакции приходится добавлять
вместе с медью или никелем в виде сплавов 80% меди или инкеля и 20% маг-
ния [25 — 27, 111, 125].
Литий в сталях
На протяжении многих лет была проделана значительная работа по
обработке расплавленной стали литием и литиевыми сплавами. Было дока-
зано, что при добавлении к малоуглеродистым сталям незначительных коли-
честв лития несколько повышается прочность при растяжении без умень-
шения относительного удлинения. Однако до настоящего времени не най-
дено удовлетворительного метода введения добавок лития в сталь. Труд-
ность состоит в том, что температура расплавленной стали значитель-
но выше температуры кипения лития, что приводит к его быстрому испа-
рению.
По-видимому, представляет интерес возможность введения добавок
лития в стали, содержащие хром, однако и в этом случае введение лития
связано с трудностями.
Следует заметить, что при введении добавок лития в малоуглеродистые
стали в литом материале лития практически не остается. В сталях, содер-
жащих хром, оставшийся литий может быть определен, вероятно, благо-
даря образованию комплексных нитридов лития и хрома.
Литий 369
Ценность добавок лития к сталям объясняется сродством лития к водо-
роду, кислороду, сере и азоту. Необходимо дальнейшее изучение возмож-
ностей использования специфических свойств лития для удаления неко-
торых газов из стали, за счет чего достигается улучшение физических
свойств.
Литий в органической химии
Металлический литий представляет особый интерес для применения
в области органической химии. Литий и его соединения применяются для
проведения различных реакций:
1. Получение литийалкшюв и литийарилов.
2. Получение гидрида лития.
3. Реакции Гриньяра.
4. Реакции конденсации.
5. Реакции ацетилирования (синтез витамина А).
6. Получение амида лития LiNH2 для реакций аминирования.
7. Получение алюмогидрида лития LiAlH4 (из гидрида лития), кото-
рый растворим в эфире и является сильным восстановителем при низкой
температуре.
8. Полимеризация изопрена в ц«с-полнизопрен в присутствии метал-
лического лития или литийалкила в качестве катализатора.
Литий в области ядерной энергетики
Лнтий-7-был одним из первых элементов, подвергшихся делению с обра-
зованием а-частиц (Резерфорд с сотрудниками) под действием сильно уско-
ренных протонов.
В течение последних нескольких лет для получения трития Н3 исполь-
зуется важная ядерная реакция, которая заключается в действии медлен-
ных нейтронов на литий по следующему уравнению:
3U«+0ni — 2Не»+,Нз.
Изотоп литий-7 можно применять для изготовления регулирующих
стержней в реакторах на быстрых нейтронах, так как образующийся в ре-
зультате zHe4 не загрязняет реактор. Ввиду низкой температуры плавле-
ния литий необходимо для этой цели помещать в подходящую тонкостен-
ную трубку, например из бериллия.
Большое значение может иметь возможность получения атомной энер-
гии за счет таких легких элементов, как литий.
Литий в высококалорийных топливах
К сожалению, данные, относящиеся к этой области применения лития,
не публикуются, тем не менее ясно, что возможности лития в этой области
иесьма заманчивы. Термин высококалорийное топливо обычно используется
в отношении бороводородов, хотя в действительности он гораздо шире
и вьлючает любое топливо, калорийность которого выше калорийности
обычного углеводородного топлива. Таким образом, в эту категорию попа-
дают как взвеси металлов в углеводородах, так и гидриды металлов и метал-
лоорганические соединения.
Что касается бороводородов, то обычным способом получения дибо-
рана является реакция гидрида лития с эфирным раствором трифторида
бора. Имеются, однако, указания, что гидрид лития, суспендированный
'-М Заказ № 236
Таблица 14
ОЬЛЛСТИ ПРОМЫШЛЕННОГО ПРИМЕНЕНИЯ ЛИТИЯ
Сельское хозяйство [
Разведение табака
Удерживание влаги почвы
Фунгисиды
Карбонат лития
Напитки
Придание вкуса и укрепляющих
свойств
Цитрат лития
Карбонат лития
Хлорид лития
Очистка газов
Кондиционирование воздуха
Поглощение влагн
Осушение
Бромид лития
Хлорид лития
Отбеливающее средство
Производство твердых, раствори-
мых и устойчивых отбеливаю-
щих средств
Гипохлорит лития
Перекись лития
Теплопередача
Ядерная энер|етика
Получение протонов
Производство трития
Произьодство атомной энергии
Атомарный водород
Металлический литий
Гидрид лития
Керамика
Эмали для фарфора
Грунтовка и покрытия для стали
и алюминия с целью придания
им кислотоупорных свойств,
улучшения связи, понижения
температуры обжига
Глазури для керамики
Специальные стекла
Карбонат, манганит, титанат,
силикат, цирконат и кобаль-
mum лития
Минералы лития
Водород
Гальванические элементы
Первичные элементы (сухие ба-
тареи)
Аккумуляторы (щелочного типп)
Хлорид лития
Гидроокись лития
Химикалии
Производство различных соеди-
нений литкя
Катализаторы
Карбонат лития
Железо и сталь
Удаление следов примесей в гелии, Устойчивая низкая температура
аргоне и т. д. | плавления солевых смесей
Производство водорода, пригодко-
го для воздушного транспорта
Улучшение структуры сталей
Металлический литий
Удаление двуокиси углерода
Безводная гидроокись лития
Военная техника
Армия,
военно-морской флот, военно-воз-
душные силы (Информация засе-
кречена)
Пластмассы
Стабилизаторы
Катализаторы
Стеарат лития
'Тактат лития
Карбонат лития
Нитрат лития
Цветные металлы
Хромистые бронзы, медь с высо-
кой электропроводностью
Производство бронзы, никеля, се-
ребра, монель-металла, драгоцен-
ных металлов
Подшипниковые металлы
Алюминиевые отливки
Патроны с металлическим литием
Сплавы магния с литием
Металлический литий высокой
степени чистоты
Холодильная техника
Стабилизация жидкого аммиака
Нитрат лития
Гидрид лития
Нефть
Катализаторы
Удаление серы
Металлический литий
Гидрид лития
Смазочные материалы
Низкотемпературные смазки
Гидроокись лития, стеарат лития
Спасательные и сигнальные
работы
Наполнение баллонов газом
Гидрид лития
Световые сигналы
Нитрат лития
Металлический литий и его
сплавы
Десульфурация стали
Карбонат лития
Фармацевтические препараты
Реягент для получении анти-
П11.Т1ШИН0В
Амид лития
Реагент для синтеза витаминов
Металлический литий
Сварка
Флюсы для алюминия и магния
Хлорид лития
Фторид лития
Алюминии f cm
WO 90 80 10 60 50
30 ?D
—¦==:
a
I
U'fi
/X
-
1
p
N
p-n
li
4
r
i
г.
?¦•
к
яг
'-
\
11
1
1
1
700
да
500
300
200
wo
О 10 20 30 kO 50 60 70 да SO WO
Литий . am %
P и с. 4. Диаграмма состояния системы алюминий — литий [119]
Висмут, am. %
WO 90 ВО 70 SO 50 I/O 30 20 Ю
1200
&J000
1*800
гоо
/
с
/
/
' /
/
/
\
\
\
\
\
V-
С 10 W 30 W 50 60 70 ВО 30 ЮВ
Питий,am %
Рис. 5. Диаграмма состояния системы висмут— чптий [49].
Индии, aw %
100 SO 80 W 60 ЬО Ч
jo 20 io a
700
600
i.
|~ uoo
I 300 -
200
wo
л
1
§
/
/
\
\
\
\
\
\
0 10 20 SO W 50 SO 70 ' 80 SO №
Литий. am. %
Рис. 6. Диаграмма состояния системы индий — литий [51].
Кадмий, am %
IBO SO 80 70 SO 50 bO
30 20 10
600
/У
л
а
|//
1
11
\
тэ
-3
1
/
^-^
Р'Г
'—
) г
J-
i
i
¦
i
i
S
3
3
У
\
а-
I
\
ъ ~*
200
100
О 10 20 30 U0 50 ВО W 80 90 ISO
Литий , am. %
Рис. 7. Диаграмма состояния системы кадмий — литий [50]-
100 W ВО 7С 6D 5С W 3D ?0 Ю
1000
? Ш
p*r
/J
\
0 W 20 3D W 50 Б0 W BO SO WO
• Литий. a/77. %
Рис. 8. Диаграмма состояния системы кальций — литий A42J
магнии.ат. %
100 90 ЕО 70 60 SO 40 30 20 10 О
100
С00
^500
иоо
300
200
100
о ю го зо w so ее т во so too
Литий, от %
Рис. 9. Диаграмма состояния системы магний — литий 137]
а
ос* ж
и.
J
f
J
1
1
t
*
\
300 SO 80 70 60 50 1,0 30 20 10
1200
WOO
p 800
5
; 600
200
\
4
-—=-
¦™ —
-—
¦—-.
0 ID 2C 3D
Рис. 10. Диаграмма состояния системы медь — литий [99]
40 50 60 W ВО 90 100
Липши.am. %
натрий, am %
100 30 ВО 70 60 дО W 30 20 10 V
н 500
| 400
1 ЗЙО
200
100
V
J
—
\
0 10 20 30 W 50 БО 10 ВО 90 WB
Литий. am %
Рис. 11. Диаграмма состояния системы иатрий — литий 162]
Олово, am. %
100 90 SO 7!) SO 5U W 30 j#7 ID 0
800
700
Б00
300
, 200
WO
/
с
(Л
\
1
1
/
cf
/ 1
\
\
\
10 20 30 40 50 60 10 80 90 WO
Литий,o
Рис. 12 Диаграмма состояния системы олово — литий [45].
Ртуть,ат.%
¦та so w да ео so w зо 20 ю о
€00
500
; 200'
100
о
-10D
/
/
/
/
i
у
П
W
3
А
у.
/
i
—
*' %
1
1
¦
4
a
, 1
\
\
О Ш 20 30 W 50 60 10
Литий, ant.%
SO WO
Рис. 13. Диаграмма состояния системы ртуть—литш" [51].
Свинец, ст.%
100 SO SO 70 CO 50 « ЪО SO W О
100
eeo
500
wo
300
200
wo
Д <*»
—Ъм
У
/3-ж
X
f
1
7 —
p
i
rr"
К
p-r
d-r
b
°
f
f
I
1
c
•o
4
\
i
\
i
i
i
i
0 10 20 3D W 50 60 70 SO. BO 100
ПштЛ.ат.%
Рис 14. Диаграмма состояния системы свниец — литий [44].
Серебро.от. %
W0 90 80 70 ВО 50 W SO W 10 О
В 10 20 30 W 50 60 ТО 80 SO WIT
Литий,am. %
Р и с. 15. Диаграмма состояния системы серебро — литий |36].
ЮО 90 ЬО '10 a 50 W 30 20
10 20 30 W 50 60 10 SO 90 '00
Рис. 16. Диаграмма состояния системы таллий — литнй [46].
100 90 80 10 ВО SO W 30 20 10
/0 20 JO 1,0 50 GO W SO 90 100
Рис. 17. Диаграмма состояния системы циик — литий [48].
Литий 379
в некоторых растворителях, например в эфире, реагирует с трихлоридом
бора с образованием диборана. Затем диборан подвергают пиролизу с обра-
зованием пента- и декаборана. Последние соединения можно алкилировать,
в результате чего образуются соединения, применяемые как высококало-
рийное топливо.
ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ЛИТИЯ
Настоящий справочник посвящен главным образом редким элементам
в металлическом состоянии, поэтому их соединениям уделяется меньшее
внимание. Кроме того, многие из этих металлов применяются в основном
как конструкционные материалы или компоненты сплавов, а их соединения
имеют сравнительно небольшое значение.
В случае лития, однако, соединения используются гораздо шире, чем
металл, поэтому в табл. 8 были приведены основные физические свойства
ряда важных соединений лития. В табл. 14 перечислены области промыш-
ленного применения металчического лития и особенно его соединений.
ЛИТЕРАТУРА
1. Antropoff A., Germann E., Z. pbysik. Chan., 137, 209—237 A928);
Chem. Zcntr., II, 2429 A928).
2. A n t г о р о f f A., Z. Elektrochem., 38, 588—589 A932); Chem. Zentr.. II, 1878
A932); С. А., 26, 5024 A932).
3. A p p 1 e b у M. P., Crawford F.H, Cordon K., J- Chem. Soc. 1934.
1665—1671.
1. Л s s m a n n P., Z. Metallkunde, 18, 256—260 A926); С. А., 20, 1585, 3424 A926).
5. В a u e г Т. W., Johnson H.L., Kerr E. C, J. Am. Chem. Soc. 72, 5174—
5176 A951).
6. В a x I t r G. P., Am. Chem. J., 31, 558 A904).
7. В e e n S. A., Edwards H. S., Teeter С E., Jr., С a 1 k i n s V. P.,
Report NEPA-1585, September 7, 1950, Oak Ridge, Term., Fair/child Airplane and
Engine Corp.
8. Bichowsky F. R., Rossini F. D., Thermochemistry of Chemical Substan-
ces, Reinhold Publishing Corp., New York, 1936.
9. Blitz W.. L e m k e A., Z. anorg. allgcm. Chan., 203, 330—344 A932).
10 В о h m В., Klemm W., Z. anorg. allgem. Chem., 243, 69 A939).
11. Brewer L., Chemistry and Metallurgy of Misc. Mcterials: Thermodynamics,
National Nuclear Energy Series IV-19B, McGraw-Hill Book Co., New York, 1950.
12. В r e w e г L., В г о m 1 e v L. A., G i 1 1 e s P. W., L о f g r e n N. L., The Che-
mistry and Metallurgy of Misc. Materials (Quill L. L., Ed.), McGraw-Hill Book Co.,
New York, 1950.
UBrewer L., M a r g r a v e J., J. Phys. Chem., 59, 421 A955).
14. В г on s ted J. N.. Z. Eleklrocheui., 20, 554 A914).
15. В г о w n О. L., L a t i m e г W. M., J. Am. Chem. Soc, 58, 2228—2229 A936).
IB. Burton W. N.. С о f f m a n S. W., R a n d о 1 p h С L-, U. S. Office of Naval
Research Report RTM-57, 1949.
17. С a m p b e 1 1 A. N.. П a i 1 e y, Can. J. Chem., 36, 518 A958).
18. Czochralski J., Rassow E., Z. Metallkunde, 19, 111 — 112 A927).
19. С l о с h r a 1 s k i J., Welter G., пат. США 1620081, March 1927.
20. Cz ос hr a 1 s k i J., Z. Metallkunde A924).
21. С z о с h r a 1 s k i J., пат. США 1620082, March 1927.
380 Глава 16
22. D e F or с г a n d R., С. К., 146. 515 A908).
23. D е Г or с г a n d R., Ann. chim. phys., 24, 258 A911).
24. D e F or сг а п d R., С R., 152, 28, 1073 A911).
25. D e S у A. L., Am. Foundrymari, 15, 838 A949).
26. D e S у A. L., Am. Foundryraan. 15, 60 A949).
27. D e S у A. L., Metal Progress, 357 (September 1950).
28. D e v a n с у J. J., Report LA-1960, Los Alamos, New Mexico, U. S. Atomic Ener-
gv Commission.
29. Dominion Magnesium Co.. частное сообщение, 1957.
30. D о u g 1 as Т. В., Epstein L. F., Dever J.L., HowUnd W. II., J.
Am. Chem. Soc, 77, 2144—2150 A955).
31- E i g о D. P., F г a n к 1 i n J. W., С 1 e a v e г С Н.. Eng. and Mining J., 156.
X° 9, 75—89 A955).
32. E p h г a i m F., M i с h e 1, Helv. Chim. Acta, 4, 900 A921).
33. F e h e г F., Wilucki I.. D о s t G.. Chem. Ber.. 86, 1429 A953).
31. Fraenkel W., H a h n R., Metallwirtschaft, 10, 641—642 A931).
35. Frankenburger W., Andrussow L, Diirr F., Z. Elektrochem.,
34, 632—637 A928).
36. F r e e t h W. E., R а у п о г G. V., J. Inst. Metals, 82, 569—574 A954).
37. F r e e t h W. E., R а у n о г G. V., J. Inst. Metals, 82, 575—580 A954).
38. F г о s t P.D., Jackson J. H., L о о n a m A. C, L о г i g С H., J. Metals-
(September 1950).
39. G a r г е В., M u e 1 1 e г A., Z. Metallkunde, 23, 236 A931); Z. anorg. allgem. Chem.,
190, 120—122 A930).
40. Gmelin-Kraut, Handbuch der anorganischen Chemie, 8 Aufl., System № 20
41. G oo d wi n П. М., К a 1 m u s H. Т., Phys. Rev., 28, 1 A909).
42. Grimes W. R, Reactor Handbook, Z., Section 6, U.S. Government Printing
Office, Washington, D. C, May 1955.
43. G r u b e G., Z. angew. Chem., 45, 550 A932).
44. G г u b e G., К 1 a i b e r. Z. Elektrochem., 40, 745—754 A934).
45. Grub e G., Meyer, Z. Elektrochem., 40, 771—777 A934).
46. G г u b e G., Schaufler G., Z. Elektrochem., 40, 593—600 A934).
47. G г u b e G., Z e p p e 1 i n H., В u m m H., Z. Elektrochem., 40, 160—164 A934).
48. G г u b e G., VosskiihlerH.. Z. anorg. allgem. Chem.. 215. 211—224
A933).
49. Grube G., VosskChler H., Schlecht II., Z. Elektrochem., 40,270—
274 A934).
50. Orube G., Vosskuhler H, V о g t H., Z. Elektrochem., 38, 869—88u
A932).
51. G г u b e G., Wolf W., Z. Elektrochem., 41, 675—681 A935).
52 Guntz A., Broniewski W., С R-, 147, M74 A908).
53. Haigh F. L., Am. Chem. J., 34, 1142 A912).
54. Haigh F. L., J. Am. Chem. Soc, 34, 1138 A912).
55. H a r к i n s W. D., Clark G. L., J. Am. Clicm. Soc, 37, 1828 A915).
56. H e i к s J. R., G а г г e t t A. R., J. Am. Chem. Soc, 76, 2587—2590 A954).
57. Hcnglein F. A., Z. physik. Chem., 117, 285 A925).
58. H e n г у О., С о г d i a n о Н. V., Am. Inst. Mining Met. Eng., Tecli. Publ.
№ 536, 1934.
59. Hess F., The Pegmatites at Tinton, S. Dakota, U. S. Bureau of Mines, R.I. 3040,
1938.
60. H с u m a n n F. K-, S a 1 m о n O. N , KAPL Report Jv° 1667, December 1, 1956.
61. Hodgman D. C, Handbook of Chemistry and Physics, 38fli ed., Cliemical
Rubber Publishing Co., Cleveland, 195G.
Литий 381
62. II ow I and W. H., Epstein L. F., Na-Li System, Advances in Chemistry
Series, № 19, Handling and Uses of the Alkali Metals, Am. Chem. Soc, Washington,
D. C, 1957.
63. Hutchison С A., Johnston H-, J. Am. Chem. Soc, 62, 1365—1368
A940).
64. II u t t i g G. F., R e n s с h e г Г., Z. anorg. allgem. Chem., 137, 155—180A924;
65. H u t t n e г К., T a m m a n n G., Z. anorg. Chem., 43, 215—227 A905).
66. J aeger F. M., J. Wachington Acarl., 1, 49—52 A911).
67. J aeger F. M., Z. anorg. Chem., 101, 178 A917).
68. Johnston H. L., В a u e r T. W., J. Am. Chem. Soc, 73, 1119—1122 A951).
fi9. К e 1 1 e у К- К-, U. S. Bureau of Mines Bull. 393 A936).
70. К e 1 1 e у К- К-, U. S. Bureau of Mines Bull. 434 A941).
71. К e 1 1 e у К- К., U. S. Bureau of Mines Bull 477 A950).
72. Koch E., пат. США 1926545. September 1933.
73. Kremers P., Pogg. Ann., 99, 443 A857).
74. L a n ri a 1 f P. E , J. F.lectrochem. Soc, 102, № 12, 285—2R7C A955).
75. L a n d о 1 t P. E., Mining Eng., 9, 460—464 (Apiil 1957).
76. L a n d о 1 t P. E., P у n e F. R., Use of Lithium Cartridges, Foundry (March
1949).
77. L a n g e E., S с h w а г t z E., Z. physik. Chem., 133, 129—150 A928).
78. l.atimer \V. M-, The Oxidation States of the Elements and Their Potentials
in Aqueous Solutions, 2nd ed., Prentice-Hall, New York, 1953.
79. L e u t e 1\. M., E 1 1 e s t a d R. S., пат. США 2516109, 1950.
80. L у о n R. N., Liquid Metals Handbook. NAVEXOS P-733 (Rev.), 2nd ed.,
Atomic Energy Commission and Department of the Navy, Washington, June 1952.
fil. Masing G., T a m m a n n G., Z. anorg. allgem. Chem., C7, 183—199 A910).
82. Mcnzel H., Z. anorg. allgein. Chem., 166, 63—98 A927).
83. M e s s e г С. В., Damon F. В.. М а у b n г у P. C, U. S. Atomic Energy Commis-
sion Report NYO-3958, 1955.
84. M e s s e г С. E., F a s о 1 i n о L. G., T h a 1 m e у е г С. Е., J. Am. Chem. Soc,
77, 4524 A955).
85. Aicsser C. E., GitbT. R. P., Jr., U. S. Atomic Energy Commission Report
NYO-8022. 1957.
86. M e s s e г С E., Scales R. A., M e 1 1 о г J., U. S. Atomic Energy Commis-
sion Report NYO-8021, 1957.
87. Metallgesellschaft A.-G., герм. пат. 562006, 1928—1932.
88. Mctallgescllschaft A.-G., герм. пат. 569147, 1928—1932.
89. Metallgesellschaft A.-G., герм. пат. 476259, 1925.
90. Metallgesellschaft A.-G., герм. пат. 375244, 1920—1921.
91. Metallge-iellschaft A.-G., герм. пат. 413723, 1922—1923.
92. Metallgesellschaft A.-G. und W e i d m a n n H., геры. пат. 413722, 1922—1923
93. Miller E. C, Corrosion by Liquid Lithium, in Liquid Mefals Handbook,
NAVEXOS P-733 (Rev.), 2nd ed., Atomic Energy Commission jud Department
of the Navy, Washington, D. C. June 1952.
94. Moers K-, Z. anorg. allgem. Chem., 113, 179 A920).
95. Moistan H., C. R., 135. 652 A902).
9C. Мог an H. E-, J. Pliy*. Chem., B0, 1666—1667 A956).
97. Новиков И. И. н др., Атомная энергия, 4, 387- 408 A957)
98. Pack С, Fox J. С, пат. США 1767011, 1930.
99. Р as t or e 1 1 о S., Gazz. chim. ital., 60. 988 -992 A930).
100. Pas tor ell о S., Gazz. chim. ital., 60, 493—501 A930).
101. Pastorello S., Gazz. chim. ital., fil, 47—51 A931).
102. Pavne J. H., J. Am. Chem. Soc, 59, 947 1937)
382 Г л аи а 16
103. Pepinsky R., Phys. Rev., 55, 1115 A939).
104. Petit G., С r e m i e u A., C. R , 243, 360—363 A956)
105. Pickering S. V., J. Chem. Soc, 63, 890 A893).
106. Pierce Wrn. R., Anderson E. А., пат. США 1832653, 1931.
107. Pierce Wm. R., A n d e r s о п Е. А., пат. США 1832733, 1931
108. P о h 1 R-, Pringsheim P., Ber. deut. physik. Ges., 14, 49—59 A912).
109. Ralston O. C, F r a a s F, L1 S. Bureau of Mines, R. I. 3344, [937.
ПО. Материалы Комиссии по атомной энергии США. Ядерные 'реакторы. 111. Мате-
риалы для ядерных реакторов, ИЛ, Москва, 1956.
111. Reese D. J., Am. Foundryman, 16. 32 A949).
112. R i с h a r d s T. W., W i 1 1 а г d H. H., J. Am. Chem. Soc, 32, 5—49 A910).
113. R о s s i n i F. D., W a g m a n D D., Evans W. H., Levine S., J a f-
f e I., Circular 500, Natl. Bur. Stand., U. S. Government Printing Office, Washing-
ton. D. C, February 1, 1952.
114. Sato S., Sci. Papers lust. Phys. Cliem. Research (Tokyo), 35, 182—190 A939).
115. S с h о и М., Acta pharmacol. et toxlcol., 15, 70—84 A958).
116. Schumacher E. E., E I 1 i s W.C.Eckel J- F., Bell. Telephone Svslem,
Tech. Publ. Monograph B515, October 1930.
117. S e i d e 1 1 A., Solubilities of Inorganic and Metal-Organic Compounds, D. Van
Nostrand Co., New York, 1940.
118. S e v e г у n s J. H., W i 1 k i n s о n F. R., S с h u m b W. C, Ind. Eng. Chem.,
Anal. Ed., 4, 371—373 A932).
119. Ш а м р а й Ф. П., С а л ь д а у П. Я., Изв. АН СССР, ОХН, 3, 631—640 A937)
120. S h о m a t е С. Н.. С о Ь с п A. J., J. Am. Clicin. Soc., 77, 285—286 A955).
121. Simmons J. P., Ropp D. C. L., J. Am. Chem. Soc, 50, 1650—1653 A928)
122. Simon А., К i m m e r 1 e H., Z. anorg. allgem Chem., 202, 382—384 A931).
123. Sims C. E., L i 1 1 i e q u i s t G. A., Am. lnst. Mining Met. Eng,, Tech. Publ.
№ 453.
124. S i t t i g M., Brit. Chem. Eng., 3, № 3, 130—133 A958).
125. S m a 1 1 e у О.. Iron Age, 164, 68 A949).
126. S m a t k о J., Degussa Cell Opcr. Data, PB-25724, FIAT Report № 786, April
1916.
127. Smith W. С, пат. США 1923955, 1933.
128. Smith W. С, пат. США 1812992. 1931.
129. S t a r i t s k у E, Walker D. J., Anal. Chem., 28, 1055 A956).
130. S u t t 1 e J. F.. The Alkali Metals, D. Van Nostrand Co.. Princeton, N. J.,
1957. ¦
131. Taylor J. W, Mctallurgia, 50, 161 — 165 A954).
132. Tzentnershver M., Blumenthal M.. Bull. Intern, acad., polonaise.
Class sci. math, nat.. I933A, 499—522.
133. Ued a Y., J. Chem. Soc. Japan, 52, 740 A931).
134. Van L a a r J. J., Z. anorg. Chem., 149, 326 A925).
135. Webber H. A., G о 1 d s t e i n D, F e 1 1 i n g e r R. C, Trans. A. S. M. Е.„
77, 97 102 A955).
136. Welter G., Z. Metallkunde, 18, 117—120 A926).
137. Welter П., Z. Ver. deut. Ing., 70, 772—776 A926).
138. Welter С, пат. США 1625077, 1927.
139. Welter G., пат. США 1625078, 1927.
140 Williamson D. R., Mineral Industries Bull., Colorado School of Mines, I,
№ 2. 1—8 (March 1958).
141. W i n t e г n i t 7. P. F., пат. США 2488485, 1949.
142 Wolf son Д1 R., Trans. Am. Soc. Metals, 49, 794—801 A957)
113. Lamming, Mining .1. (London), 334 (September 1956)
Литий 383
144. U. S. Bureau of Mines Minerals1 Yearbook, Vol. 1, 1953.
145. U. S. Bureau of Mines Minerals' Yearbook, 1955, Lithium Preprint.
146. Statistical Summery of the Mineral Industry 1949—1954, Colonial Geological Sur-
veys, London: Her Majesty's Stationary Office, 1956.
147. Ryschkewitsch E., Z. Elektrochem., 39, 536 A933).
148. Landolt — Boernstein — Roth Tables, Suppl., Vol. I, p. 583 (Blitz, Klemm).
149. Landolt — Boernstein — Roth Tables, Vol. II, p. 1063 (Jaeger, Карта).
150. Landolt — Boernstein — Roth Tables, Vol. II, p. 1064 (Arndt, Gessler).
151. Landolt — Boernstein — Roth Tables, Vol. II, p. 1063 (Arndt).
17
МАРГАНЕЦ
Ч. Л. МЛНТЕЛЛ
Ch. L. Mantctl, Consulting Engineer, Foot Mine-
ral Company, Philadelphia, Pennsylvania
Твердый и хрупкий металл марганец, плавящийся при 1245°, впервые
был открыт как элемент шведским химиком Шселе при работе с марганце-
вой рудой пиролюзитом (МпО2). В 1774 г. Ган выделил марганец в эле-
ментарном виде. Встречающийся в природе обычно вместе с железными
рудами металл за магнитные свойства пиролюзита был назван magnes
(магнит); немецкое название металла — Mangan, а французское — man-
ganese.
В 1856 г. Муше начал вводить марганец в виде зеркального чугуна
в бессемеровскую сталь, что сразу же приобрело практическое значение.
В 1888 г. Гадфильд создал свою высокомарганцевую сталь A4% марганца).
Использование марганца при выплавке стали для регулирования содер-
жания серы имеет весьма важное значение, причем в настоящее время в США
для этих целей расходуется большая часть этого металла. На каждую
тонну выплавляемой стали идет почти 7 кг. марганца, главным образом
в виде ферромарганца. Электролитический марганец широко применяется
в полосовой стали, в целом ряде нержавеющих сталей и особенно в сталях
типов 201 и 202, в которых марганец является аустенитобразующим аген-
том и заменяет никель.
Марганец, имеющий порядковый номер 25 и атомный вес 54,9381, при-
надлежит к VII группе периодической таблицы, располагаясь по горизон-
тали между хромом и железом. Пока в 1924 г. не были открыты рений —
элемент с порядковым номером 75 — и технеций (экамарганец) — элемент
с порядковым номером 43,— марганец был единственным элементом своей
подгруппы.
Давно известный и широко распространенный в виде сплавов и соеди-
нений, марганец в чистом виде стал доступен для промышленных нужд
лишь с конца 30-х годов нашего века после освоения процесса его электро-
литического выделения. До этого выпускали сравнительно загрязненный
металл, который получали путем алюмииотермического или енликотермн-
ческого восстановления его окислов. Только с появлением очень чистого
электролитического металла стало возможным точное и обстоятельное изу-
чение свойств и путей применения марганца. Многие исследования, прове-
денные на сплавах с недостаточно чистым марганцем, требуют проверки.
Именно по этой причине марганец включен в настоящий справочник, хотя
в виде ферромарганца его применяют повсеместно. В чистом же виде мар-
ганец все еще должен рассматриваться как необычный металл, несмотря
на то что выработка 99,97%-ного металла составляет в настоящее время
100 т/сутки.
Марганец
385
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Связанный марганец широко распространен в природе и по содержанию
в земной коре занимает 12-е место среди элементов. Обычно марганец встре-
чается в ассоциации с железными рудами; однако в большинстве случаев
его концентрация в этих рудах настолько мала, что промышленное полу-
чение металла не оправдывается. Характеристика различных видов мине-
ралов марганца приведена в табл. 1.
США не имеют месторождений высококачественной марганцевой руды
[24]. Запасы известных месторождений составляют более 3,5 млрд. т руды,
содержащей около 76 млн. т Марганца. Свыше 98% этого количества мар-
ганца приходится на долю 12 крупных месторождений бедных руд, наиболее
важными из которых, как видно из табл. 2, считаются месторождения в Чем-
берлене (штат Южная Дакота), Куиуна-Рейидже (штат Миннесота), граф-
стве Арустук (штат Мэн) и Артиллери-Пик (штат Аризона).
Таблица 1
МИНЕРАЛЫ МАРГАНЦА
Минерал
Пиролюзит
Псиломеляна
Манганит
Браунпт
Гаусмаиит
Родохрозит
Диалогит
Родонит
Цвет
Светло-серый до
черного; метал-
лический блеск
Черный, матовый;
полуметалличе-
ский блеск
Темно-серый до
черного
Коричневый
Коричневый до
черного (жилы в
изперженной
руде)
"| Бледно-розовый,
1 красный, серый,
| коричневый;
J стекольный блеск
Красный, бледно-
розопый, корич-
невый
Твер-
дость
6—6,5
5—6
4
6—6,5
5,5
3—4
6—6,5
Содержа-
ние
марганца
в чистой
РУде. %
63,2
45—60
62,4
62
72
48
42
Химическая формула
МпО2
ВаМп«Мп'уО,с(ОНL
Mn2O3-H2O или
МпО(ОН)б
.¦SMibOs-MnSiCV
Мпа04
МпСОэ
MnSiCf
Плот-
ность,
г/емз
4,8
3,7—4,7
4,2—4,4
4,8
4,84
3,0
3,63
а Часто состав ненломелана изображают формулой тМпО-пМпОг-рПчС), так как состав его
неопределенный, но приближающийся к МпОг {п^т). Обычно содержит ВаО, КгО н др.—Прим.
fud.
6 Также Мп11 MnIV02 (ОНJ—Прим. ред.
в Часто просто Мп" Мп^* osi обычно содержит S1O2.—Прим. ред.
г Простейшая формула. Родонит (орлец) относится к кольцевым силикатам, и его состав вы-
ражается формулой iMn3[SigOB].— Прим. ред.
25 Заказ № 239
3X6
Глава 17
Свыше 90% потребляемой в США марганцевой руды ввозится из дру-
гих стран, а большая часть добываемой в стране руды поступает из место-
рождения Ватт (штат Монтана) в виде карбонатного минерала родохро-
зита.
В 1959 г. мощная шахта в области Амана (Бразилия) отправила в СШ V
свыше 990 тыс. т марганцевой руды. Весь ввоз в США составил около
2174 тыс. т. Бразилия, Индия, Гана и Южная Африка обеспечивают боль-
шую часть потребности США в марганцевой руде; небольшие количества
ЗАПАСЫ МАРГАНЦЕВЫХ
Общие запасы3
Артиллери-Пик, шт. Аризона
Чеыбсрлен, шт. Южная Дакота
ApvCTVK, шт. Мэн
Филлипсберг и Блтт, шт. Монтана
РУД В США
Млн.
тонн
РУДЫ
354В
203
20
2- 3
0,5
2032
79
0,2
Таблица 2
Млн.
тонн
марганца
г
76
8
1
0,3
0,6
51
10
0,1
Содержа-
ние
марганца,
%
3—48
3- 4
5
10
15
3—15
15
6 -9
48
а Пргтлтнтсльный подсчет.
руды поступают в США из Чили, Аргентины и Мексики. Большая часть
руды, ввозимой из Ганы, идет на нужды аккумуляторной и химической
отраслей промышленности. Предполагают, что Бразилия будет поставлять
в возрастающих количествах руду для металлургических целей — произ-
водства ферросплавов в электропечах, зеркального чугуна и электролити-
ческого металла.
При наличии экономичного процесса извлечения значительную долю
нужд сталеплавильной промышленности в марганце можно удовлетворить
за счет использования основного мартеновского шлака, содержащего 10 —
15% марганца. По содержанию марганца этот шлак не уступает имеющимся
бедным рудам, к тому же он находится на сталеплавильных заводах. Стра-
тегическое значение марганца стимулировало разработку в США методов
использования добываемых в стране бедных руд и основного мартеновского
шлака для получения окислов марганца. Этим вопросом занимались Гор-
ное бюро. Американский институт железа и стали, Главная администрация
по снабжению, а также частные фирмы.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Единственным способом производства чистого марганца является
электролиз. В США промышленный электролиз в целях получения мар-
ганца был осуществлен в 1939г.;в 1940г. было выработано 200 т, в 1941 г.—
600 т. В 1952 г. мощность завода фирмы «Электро манганез» в Ноксвилле
Марганец 387
составляла 3600 т/год, а в 1953 г. была пущена вторая установка. В 1956 г.
фирма «Электро манганез» объединилась с фирмой «Фут минерал», и в 1957 г.
была сооружена и пущена третья установка.
За период 1942— 1946 гг. Горным бюро на своем заводе в Боулдер-Сити
(штат Невада) было получено 680 т электролитического марганца [18].
В 1953 г. на заводе фирмы «Юнион кэрбайд металс»—филиала кор-
порации «Юнион кэрбайд»— в Мариетте (штат Огайо) действовала уста-
новка электролитического марганца, на которой перерабатывались мар-
ганцевые шлаки.
В 1960 г. производство электролитического марганца составляло при-
близительно 100 т/сутки, что соответствовало примерно 1 % потребления
марганца в форме ферросплавов, зеркального чугуна и других материалов.
Электролитический марганец используется в полосовых сталях, ста-
лях для клапанов и в нержавеющих сталях; с никелем — в ряде нержавею-
щих сталей типа 200, которые являются сплавами хрома, марганца, никеля
и железа, аустенитными по своему характеру, и в качестве легирующего
агента — в нежелезных сплавах меди (бронзах, манганине, инструмен-
тальных сплавах), алюминия, магния, никеля и в висмутовых магнитных
материалах. Он служит сырьем для производства чистых марганцевых
химикалий, влагопоглотителей и катализаторов.
Твердая, хрупкая природа а-модификации электролитического мар-
ганца, единственно устойчивой при обычных температурах, исключает вся-
кую возможность промышленной обработки чистого металла. В случае при-
садьн 2% меди и Но никеля к чистому марганцу образуется ковкий сплав.
Во многих обычных областях применения чистый марганец конку-
рирует с такими дешевыми материалами, как малоуглеродистый ферро-
марганец и ферромарганец с низким содержанием железа. Такая конку-
ренция возможна благодаря незначительному содержанию в чистом мар-
ганце углерода, фосфора, серы и кремния, что часто используется прн
выплавке сталей с низким содержанием четырех перечисленных элементов.
В табл. 3 сравниваются результаты анализа различных материалов
и цены на эти материалы.
В отношении марганцевых руд с экономической точки зрения важно
отметить, что стоимость добычи и обогащения добываемых в США бедных
руд для производства такой же продукции, на которую перерабатываются
ввозимые руды, по крайней мерс в два раза, а в отдельных случаях даже
более чем в четыре раза, превышает расходы «а ввоз руды [18, 19]. Это ска-
зывается на ценах на чистый марганец и ферромарганец.
ИЗВЛЕЧЕНИЕ
В США процесс электролиза раствора сульфата марганца в 1930 г.
был обстоятельно изучен в лабораторном масштабе и в условиях опытного
завода Шелтоном и его коллегами по работе в Горном бюро. После инженер-
ной разработки процесс в 1939 г. был внедрен в производство фирмой «Элек-
тро манганез корпорейшн» на ее Ноксвилльском заводе. В 1942 — 1946 гг.
действовала опытная установка Горного бюро в Боулдер-Сити (штат Невада).
На обоих этих заводах применялись электролизеры с диафрагмами, в кото-
рых анолитсодержал сульфат марганца, сульфат аммония и серную кислоту
для поддержания рН « 1, а постоянство католита создавалось за счет
добавления сернистого газа при рН 7,2 — 7,6. Однако многие детали про-
цессов были различными.
25*
Таблица 3
МАРГАНЕЦ И ФЕРРОСПЛАВЫ
Состав, %
Электролитический марганец
Электролитический марганец,
не содержащий водорода
Металлический марганец (тер-
мит)
Ферромарганец с низким содер-
жанием углерода
ферромарганец со средним
содержанием углерода
Стандартный ферромарганец
Стандартный ферромарганец,
брикеты
Зеркальный чугун
99
99
99
90
,98 (мин) 0,UUI (макс.)
,98 » 0,001 »
,5 » 2,0-2,5
(прибл.)
80-85
80-85
80—85
80-85
80—85
80-85
80-85
74-76
66
16-19
19-21
21-23
Остальное
»
ъ
2
2
2
»
г
»
Отпускная
цена
I кг
сплава,
центы
1,0 (мякс.)
1,0 »
1,0
1,0
1,0
1,0
1,0
5,0—7,0
1,5 (макс.)
1,0 >
1,0 »
3,0
3,0
3,0
Отпускнал
цена 1 кг
содержаще-
гося в сплаве
марганца,
центы
Не обнаружено
—
0,06 (макс.)
0,06 »
0,20 »
0,20 »
0,20 »
0,20 г
0,25 >
—
0,35 (макс.)
0,35 »
—
0,004
0,004
0,06—0,20
0,07 (чакс.)
0.U7 »
0,10 >
0,15 »
0,30 »
0,50 »
0,75 >
1,25- 1,50
7-8
7-8
6,50 (макс.)
6,50 »
6,50 »
—
100,8
—
—
—
27,0
32,6
9,9
10,1
10,3
75,0
76,5
105,7
81,8
77,3
75,7
74,0
70,7
69,6
63,0
56,1
35,9
49,3
56,4
50,2
47,0
Таблица 4
ЭЛЕКТРОЛИТИЧЕСКИЙ СПОСОБ ПРОИЗВОДСТВА МАРГАНЦА
Ванны, материал
Аноды
Количество
Материал
Размеры, мм
Катоды
Количество
Материал
Размеры, мм
Смена через (?) суток
Диафрагмы, материал
Анолит
Питание или циркуля-
ция
рН
Состав, г/л
Сульфат аммония
Мпрганец в виде MnSO4
Серная кислота
Католит
Температура, DC
рН
Состав свежего католнта,
г/л
Сульфат аммония
Марганец в виде MnSO4
Двуокись серы
Ток, Rcero ампер
Плотность тока, а/дм?
Анод
Катод
Выход по току, %
Напряжение на ванне, в
Количество марганца (кг)/ка-
тод
Расход энергии на 1 кг про-
дукта, кет-ч
Постоянный ток
Переменный ток
Степень извлечения метал-
ла, %
Степень чистоты металла, %
«Фут минерал
компани»
Бетон, облицован-
ный свинцом
21
Серебро—свинец
20
Нержавеющая
сталь
914> 457x3,2
2
Ткань
Самотек
1 1,4
120—140
10—18
25—35
35—4U
7,2- 7,6
125 135
25—40
0,10
6000
8,61
4,30
65—70
5—5,4
9—9,93
10,8-11,5
87
99,97
Эксплуатационные данные
Горное бюро,
Боулдер-Сити,
шт. Невада
Дерево, облицо-
ванное свинцом
28
Свинец-серебро
381x813x6,3
(объем пор 40%)
27
Нержавеющая
сталь
457x914x1,6
1
Хлопчатобумажно
полотно
1,5
135—140
8—10
43—50
32—36
8,25
155
25
0,10
6000
8,72- 9,63
4,81—5,32
60—65
5,0- 5,3
4,53—5,44
7,7—8,3
>78
99,9
«Юнион кэрбэйд
металс компани»
Серебро—свинец
«Хастеллой»
1067x610x1,6
2—3
Ткань
Самотек
120—140
10—12
36—44
32—40
8,5
120 140
10 000
4,81
65
5,3
74,6
99,9
Склад руВы
Запасной бу
для руды
Дробилки (с сушкой)
I
| Питательный резервуар]
Анолит
Слие
Башенный
охладитель
ш
югниевые
соли
Анслит
Анолит
Печь для еосста-
| новления руды
\Вь1Щелатватель\
Г
| Осветлитель]
—-* I
| Пульпа |
\(Рильтр Мура \
1
\Фильтр Оливера \
I ,1—
\Фильтрат\
\Сулыриды
Твердые
отходы
дые
д
Сборник католита\
JL
Фильтр
Очищенный католит\
*\ Шлам е отвал
Злея тролиэеры
\МеталЛический марганец]
Рис. 1. Схема процесса электролитического получения
марганца («Фут минерал компании).
Рис. 2.^Часть электролизного отделения на заводе
d Ноксвилле (штат Теннесси) («Фут минерал ком-
пани»).
Марганец 39/
Как отмечает Лунам [21], тот факт, что марганец гораздо электропо-
ложительнее, чем цинк, затрудняет осуществление выгодного промышлен-
ного процесса электролитического осаждения этого металла из водных
растворов. Марганец не удается осаждать из кислого раствора вследствие
Рис. 3. Электролизное i. ,ии> ¦ 4р ¦ ч ..' !?
отделение установки для & '•
получении электролитиче- Ч;.~ ', ч ' I
ского марганца в Мариетте " JW * '
(штат Огайо) («Юнион кэр- J ¦"¦, ¦; ,
байд металс компания)- '—"
повторного растворения металла при низких значениях рН, тогда как оки-
сел, отвечающий сульфату марганца, не растворяется в щелочных раство-
рах. В связи с этим электролизеры приходится снабжать диафрагмами.
Мантелл [221 описал работу установки на заводе в Ноксвилле, в том
числе схему процесса (рис. 1). Окисленные руды восстанавливают, чтобы
сделать их растворимыми в анолите, возвращаемом в процесс. После тща-
тельной очистки щелока с цепью удаления примесей железа, мышьяка,
сурьмы, олова, свинца, никеля, кобальта, молибдена, двуокиси кремния,
алюминия, кальция и магния раствор возвращают в электролизеры как
Рис 4. Чешуйки марганца, снятые
с катодных пластин при электролитическом
получении марганца.
Гладкая поверхность соприкасалась с катодом.
чешуйчатая — с раствором. Размер чешуек
38X50 мм.
католит [23]. Эксплуатационные данные приводятся в табл. 4; на рис. 2
показаня часть электролизного отделения. Бсннст [2] описал техническую
и финансовую стороны развития промышленности.
Джекобе и сотр. [18, 19] описали работу установки Горного бюро
в Боулдер-Сити (штат Невада); эксплуатационные показатели приводятся
в табл. 4. Большая часть продукции, полученной на этой установке, ис-
пользовалась для проведения опытных плавок стали в электрических печах.
На установке перерабатывались бедные руды, добываемые в США. Работа
установки была улучшена на основе опыта Ноксвилльского завода.
Кароселла и сотр. [15] и Чилтон [16] описали практику фирмы «Юнион
кэрбайд металс» в отношении использования шлаков электропечей в каче-
стве исходного сырья. Эксплуатационные показатели приводятся в табл. 4;
электролизное отделение показано на рис. 3.
На всех трех установках осевший марганец отделяют от пластин катода,
изгибая их и легко постукивая по ним молотком. Степень чистоты отделяю-
392
Глава 17
щихся мелких чешуек толщиной около 1,6 мм превышает 99,9%. Чешуйки
марганца, снятые с пластин катода, показаны на рис. 4,
В 1951 г. Шпрингер 126] дал исчерпывающий общий обзор литературы
по электролизу марганца и описал процессы, конкурирующие со спосо-
бами, успешно реализованными в промышленных масштабах.
В 1952 г. Дни [17] сообщил о раинен работе Горного бюро, но большая
часть его книги посвящена сплавам марганца.
Саали [27] выпущенную им в 1955 г. книгу разделил на следующие
части: марганцевые руды, производство ферросплавов и чистого металла,
обогащение бедных руд, свойства металла и диаграммы состояния для
сплавов.
ФИЗИЧЕСКИЕ СВОЙСТВА
Существуют четыре модификации, из которых а-марганеи устойчив
при обычных температурах, а- и В-Модификации представляют собой твер-
дые и хрупкие металлы, способные царапать стекло. Из чистого металла
1600
поо
1200
В юоо
I
i
800
GOO
Ш
200
7
1200 ПОО
woo few гот ггоо
Температура ,°С
Р и с. 5. Давление пара марганца ?20].
изделия не изготовляют. уМаргапец, который при обычных температурах
переходит в омодификацию,— пластичный и мягкий материал, который
легко сгибается и режется [25].
Физические свойства марганца указаны в табл. 5; кривая зависимости
давления пара от температуры воспроизводится на рис. 5.
Салли [271 пришел к выводу, что температуры превращения таковы,
как указано в табл. 6 [3 — 12] с соответствующими данными об аллотро-
пии марганца.
Таблица 5
ФИЗИЧЕСКИЕ СВОЙСТВА МАРГАНЦА
Порядковый номер
Атомный вес
Стабильный изотоп
Плотность, г/см3
Твердый металл при 20°
Расплав
Атомный объем, см3/г-атпм
Температура плавления, °С
Температура кипения при 760 мм рт. ст.,
°Lj
Удельная теплоемкость при 25°,
кал/г-град
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Коэффициент линейного расширения в ин-
тервале 0—100°, град1
Удельное электрическое сопротивление при
20°, мком-см
Альфа
7,44
25
54,9381
55
Бета
7,29
6,54
7,4
1244±3°
2097
Альфа
0,114
Альфа
22-10-"
Альфа
185
Бета
0,154
63,7
977,6
Бета
44
Гамма
7,18
Гамма
0,148
Гамма
14-10-е
Гамма
60
Дельта
0,191
восприимчивость при 18е,
Гамма
23
Магнитная
э. м. е.
Твердость
По Моосу
По Роквеллу
Давление пара, мм рт. ст.
12443
1327=
1527°
1727°
1927°
2027°
2127°
2227°
Теплота превращения, кал/г-атом
Альфа -»- бета G27°)
Бета -> гамма A100")
Гамма —>¦ дельта A138°)
Уравнения теплоемкости (ккал/г-атом)
Альфа ср=5,70+3,38- 10-зг-0,375- \№Т'2 B98—1000° К)
Бета ер=8,33+0,66-10-зГ A000—1374° К)
Гамма ср= 10,7 A374—1410° К)
Дельта ср=11,30 A410—1450° К)
Жидкий ср=11,0
Стандартный электродный потенциал +1,1
Мп=Мп2++2е (по отношению к во-
дородному), в
9,9
5,0
Альфа
71
0,9
2,4
18.3
89
315
541
80»
1380
535
545
430
394
Глава 17
Таблица 6
Плпт-
ность.
7,44
7,29
7,21
6,54
СВОДНЫЕ ДАННЫЕ ПО АЛЛОТРОПИИ МАРГЛНЦА
Модифика-
ция
Альфа
Бета
Гамма
Дельта
Расплав
Область устойчивости
Ниже 700°
700—1079°
1079 1143°
Кристаллическая структура
От 1143° до температуры
плавления
Выше 1244±3°
Кубическая объечноцентрированиая
решетка, 58 атомов в элементарной
ячейке, а =8,894 А
Кубическая объемноиентриропанная
решетка, 20 атомов в элементарной
ячейке, а=6,ЗША
Тетрагональнвя гранецентрироваиная
решетка, 4 атома в элементарной
ячейке, о=3,767А, с/а=0.934
Кубическая объемноцентрированшш
решетка, а=3,075А
Альфа -
Бета—>•
Бета—?-
Гамма -
Дельта
альфа
гамма
¦>• дельта
-> расплав
Температура превращения, °С
700—665
1079±3
1140±3
1244±3
При нагреианин
При охлаждении
При нагревании и охлаждении
То же
Давление пара марганца в тройной точке [1] приведено ниже.
д
0,
авлепне пара, мм
1,8
0,8
001 возгоняется
vm. cm.
при
Тройная точка, "С
1280
1244
740
ХИМИЧЕСКИЕ СВОЙСТВА
Марганец, по общей химической реакционной способности до некоторой
степени сходный с железом, образует соединения с валентностями 2, 3, 4,
6 и 7, причем наиболее устойчивы из них соли двухвалентного марганца,
а самое устойчивое кислородное соединение этого элемента — двуокись
МпО2-
Металлический марганец окисляется с поверхности на воздухе и под-
дается коррозии во влажном воздухе. Как и железо, марганец горит на
воздухе или в кислороде при нагревании. Он медленно разлагает воду на
холоду и быстро при нагревании, образуя гидрат закиси марганца Мп(ОПJ
с выделением водорода, и легко растворяется в разбавленных минеральных
кислотах, при этом выделяется водород и образуются соответствующие соли
двухвалентного марганца.
Фтор, хлор и бром реагируют с марганцем при нагревании. При нагре-
вании с азотом образуются различные нитриды, как показано на диаграмме
состояния (рис. 6), согласно Цвиккеру [28]; при нагревании с аммиаком
Марганец
395
также образуется нитрид. Марганец взаимодействует с серой [ 13] с образо-
ванием сульфидов.
Расплавленный марганец, подобно железу, растворяет углерод, обра-
зуя при этом карбид. При температурах выше 330° марганец реагирует
с окисью углерода; с двуокисью углерода взаимодействие начинается при
сильном нагревании [14].
1W0
1300
Рис. 6. Диаграмма состояния
системы марганец — азот [28].
W0.
Существования гидридов марганца не установлено, но твердый и жид-
кий марганец растворяет заметные количества водорода; электролитиче-
ский марганец обычно содержит 0,015% водорода [22].
Освобожденный от водорода, обработанный в печи металл является
промышленным продуктом, так как содержащие азот марганцевые сплавы
применяются для введения марганца и азота в специальные коррозионно-
стойкие сплавы и стали для клапанов.
Кипящие концентрированные растворы едкого кали и едкого натра
почти не действуют на марганец [14].
На реакционную способность марганца могут оказывать влияние примеси.
39$ Г лава t
СПЛАВЫ
Салли [27] обработал данные о двойных сплавах марганца с алюми-
нием, сурьмой, мышьяком, бериллием, висмутом, бором, кадмием (не сме-
шиваются в расплавденном состоянии), углеродом, церием (соединения не
образуются), хромом, кобальтом, медью, германием, золотом, водородом,
индием, железом, лантаном, магнием, ртутью, никелем, кислородом, пач-
ладисм, фосфором, платиной, кремнием, серебром, серой, танталом, тел-
луром, таллием, торием, оловом, вольфрамом, ураном, ванадием, цинком
и цирконием; о тройных сплавах марганца и алюминия с хромом, кобаль-
том, медью, железом, кремнием и цинком; марганца и меди с галлием, ин-
дием, никелем, серебром и цинком; марганца и железа с углеродом, хро-
мом, ртутью, кислородом, кремнием и серой; марганца и серы с кислоро-
дом, кремнием и ферросилицием.
ОБЛАСТИ ПРИМЕНЕНИЯ
Для особо чистых химических реактивов, фармацевтических препара-
тов (главным образом в виде солей) и целей пищевой промышленности и ката-
лиза, а также для аналитических и исследовательских работ электролити-
ческий марганец потребляется только в качестве очистителя при выплавке
некоторых обычных металлов и для легирования сплавов черных и цвет-
ных металлов.
Сталь A6% хрома, 14% марганца, 1% никеля) с низким содержанием
никеля заменяет хромоникелевую сталь марки 17-7. Эта сталь менее устой-
чива против коррозии, чем хромоникелевая сталь марки 18-8; она пригодна
для всех атмосферных условий, но ее нельзя применять для работы в усло-
виях соприкосновения с морской водой. Указанный сплав можно применять
в средах, вызывающих слабую коррозию.
Сталь, содержащая 17% хрома, 1496 марганца и 1% никеля, обла-
дает лишь умеренной устойчивостью против окисления, и ее нельзя при-
менять при температурах выше 704° при длительной работе или 760е при
кратковременной работе.
Сплавы с высоким содержанием марганца A7% хрома, 4% никеля,
6% марганца и 18% хрома, 5% никеля, 8% марганца) лишь частично заме-
няют никель.
Устойчивость этих сплавов против коррозии приближается к устой-
чивости хромоникелевой стали типа 302, за исключением жестких условий
окисления или в среде хлоридов. Они могут с успехом заменять хромони-
келевые стали марки 18-8 в большинстве областей применения, за исклю-
чением работы в очень жестких условиях в химической промышленности.
По стойкости против окисления эти два сплава превосходят сталь,
содержащую 15% хрома, 14% марганца и 1 % никеля, но они не могут срав-
ниться с хромоникелевыми сталями марки 18-8.
Ограниченность ресурсов никеля привела к разработке двух сплавов
с низким содержанием никеля и высоким содержанием марганца, доста-
точно освоенных промышленностью и признанных в качестве стандартных
сталей Американским институтом железа и стали. К таким сталям отно-
сятся сталь типа 201, содержащая 16 — 18% хрома, 5,5 — 7.5% марганца,
3,5—5,5% никеля, 0,25% (макс.) азота, 0,15% (макс.) углерода, и сталь
типа 202, содержащая 17—19% хрома, 7,5—10% марганца, 4 — 6%
никеля, 0,2596 (макс.) азота и 0,15% (макс.) углерода. Указанный выше
Марганец 397
состав с 17% хрома, 4% никеля и 6% марганца можно считать сталью типа
201, а состав с 18% хрома, 5% никеля и 8% марганца — сталью типа 202.
Стали типов 201 и 202 имеются в продаже в тех же формах, что и стали
типов 301 и 302: тип 201 — преимущественно в форме листов и полос, а тип
202 — в форме прутков и брусков.
По механическим свойствам сталь типа 201 сходна со сталью типа 301
в отношении холодной обработки и степени наклепа. Однако она имеет
более высокий предел текучести при данной степени обжатия на холоду
по сравнению со сталью типа 301 и в то же время сохраняет ковкость. Ст&пь
типа 202 сравнима по механическим свойствам со сталью типа 302. Подобно
стали типа 302, она поддается наклепу не так быстро, как стали типов 201
и 301.
Стали типов 201 и 202 обладают превосходной ударной вязкостью при
комнатной и более низкой температурах, но стали с более высоким содер-
жанием никеля благодаря большей устойчивости структуры характери-
зуются более высокой прочностью на удар. Ударная вязкость по Изоду при
температуре —183° для стали типа 201 составляет 9,68 кгм, а для стали
типа 202 — 12,44 — 16,59 кгм.
При работе со сталью типа 201 накоплен больший производственный
опыт, чем для других сплавов с высоким содержанием марганца. Эта сталь
ведет себя подобно стали типа 301. Производственный опыт показывает,
что гибку листового материала из обеих сталей можно производить в гибоч-
ных штампах одинаковых радиуса и ширины и па одних и тех же вытяжных
валках волочильного станка. При работе со сталями обоих типов получены
одинаково хорошие результаты. Меньший опыт накоплен в отношении
таких операций, как выдавливание, ковка молотом и глубокая вытяжка.
Вероятно, в некоторых случаях для таких операций формования вместо
стали типа 201 можно применять сталь типа 202.
Во всех случаях при дуговой, точечной, линейной и рельефной сварке
для стали типа 201 можно применять приемы работы, пригодные для стали
тина 301. Сварочные работы выполняются с одинаковой легкостью при
высоком качестве. Имеющиеся данные показывают, что прочность, сопро-
тивление срезу, растяжению, прочность на удар и усталость сварных швов
стали типа 201 одинаковы с аналогичными свойствами стали типа 301.
Стали типов 201 и 202 отжигаются при 1065— 1093° с охлаждением
на воздухе и при закалке в воду.
Опыт показывает, что сталь типа 201 может заменять сталь типа 301,
а сталь типа 202 — ст&чь типа 302, по крайней мере в отношении прочности
и пластичности. Точно так же можно без опасения применять стали 200-го
ряда вместо сталей 300-го ряда в условиях слабой (например, атмосферной)
или умеренной коррозии. В случае более жестких условий коррозии необ-
ходимо проводить соответствующие лабораторные или полевые опыты и при
решении вопроса о замене стали руководствоваться результатами этих
опытов.
В сталелитейном производстве марганец играет важную роль как десуль-
фуратор. Он широко применяется также в качестве раскислителя расплав-
ленной стали. Большая часть марганца при выплавке стали переходит
в шлак. Хотя для этих целей обычно применяют ферромарганец, во многих
случаях вге же идет и чистый марганец, особенно при выплавке специаль-
ных сталей или когда требуется максимально снизить содержание угле-
рода и фосфора в металле. Его добавляют для целей очистки к сталям ос-
новной мартеновской плавки, кислой и основной электроплавки, а также
к тигельной стали.
398_ Глава 17
Стали, содержащие 17— 19% хрома, 8— 10п6 марганца, 0,75— 1%
меди, 0,1% углерода и 0,2 — 0,5% кремния, обладают превосходной устой-
чивостью против атмосферной коррозии и вполне могут заменять нержа-
веющие стали. Они противостоят действию азотной кислоты любой концент-
рации при всех температурах вплоть до температуры ее кипения и многих
других промышленных химических и пищевых продуктов.
Почти все промышленные сплавы алюминия и магния содержат мар-
ганец, который повышает их коррозионную стойкость и механические свой-
ства (твердость). Содержание марганца редко превышает 1,2% для магние-
вых и 1,5% для алюминиевых сплавов. При производстве алюминиевых
сплавов электролитический марганец конкурирует с чистыми окислами,
карбонатом марганца и ферромарганцем с низким содержанием железа,
которые можно добавлять непосредственно в восстановительные тигли,
а при производстве магниевых сплавов — с чистым хлоридом марганца,
который добавляют в плавильные тигли.
Для производства манганина (инструментального сплава на основе
меди), содержащего 11 — 12% марганца и 3 — 4% никеля, а также высо-
копрочных хромоникелевых сплавов, содержащих около 2% марганца,
используется электролитический марганец. Двойные сплавы меди с мар-
ганцем характеризуются весьма высокой способностью глушить вибрации.
Марганец применяли в качестве заменителя никеля в никелевосеребряных
сплавах, а также в сплавах меди с цинком и никелем. Кроме того, его до-
бавляют к латуни и бронзе.
Многочисленные данные о свойствах и областях применения сплавов
медь — марганец, марганец — никель, медь — марганец — никель и медь-
цинк— марганец приводит Дин [17].
ЛИТЕРАТУРА
1. Baukloh W-, А 1 t I a n d С, Metallwirtschaft, IS, 651 A939).
2. В е п n e t t R. H., A Decade of Electrolytic Manganese, Mining J., ISO, № 10,
RO—85 A949).
3. B,erak J., H e u m a n n Т., Z. Metallkunde, 41, 19 A950).
4. G а у 1 e г M. L. V., J. Iron Steel Inst., MS, 393 A927).
5. G r u b e r C, Bayer K-. В u m m H., 7- Elektrochem., 42, 805 A936).
6. I sob ё М„ Science Repts. Tohoku Univ., A3, 78 A951).
7. J о h a n n s e n G.. N i t k a H., Physik. Z., 39, 440 A938).
8. N а у 1 о r B. F., J. Chem. Phys., 13, 329 A945).
9. P о t t e r E. V., Lnkcns H. C, Trans. AIME, 171, 401 A947).
10. S i e v e г t s A., M о r i t 7 H., Z. physik. Chem., ISO, 249 П937).
11. Wiechmann F., Z. anorg. Chem., 234. 130 A937).
12. Yoshisaki H., Science Repts. Tohoku Univ., 20, 182 A937); Kinzoku no
Kenkyu, 14, 91 A937).
13. В r a d 1 e у A. J., Phil. Mag., 50, 1018—1030 A925).
14. С a in p b e 1 1 A. N.. J. Chem. Soc., 123, 2323 A923).
15. С а г о s e 1 1 a M. C, F о w 1 e г R. M., J. Electrochem. Soc., 104, 352—356
A957).
16. С h i 1 t о п С. Н., Chem. Eng., 65, № 10, 136—139 A958).
17. D e я n R. S., Electrolytic Manganese and Its Alloys, The Ronald Press, New York,
1952.
18. J acobs J. H., Hunter J. W., Y a r г о 1 1 W.H., Churchward P. E.,
Knickerbocker R. G., Trans. AIME, 159, 408—428 A944).
Марганец 39
19 Jacobs J. H, Hunter J. W., Y a r г о 1 1 W. H, С h u г с h w a r d P. E.,
Knickerbocker R.G.. LewlsR. W., Heller H. A.. L i nc к J. H.,
U. S. Bureau of Mines Bull. 463, 1946.
20. К с 1 I e у К- К, N а у 1 о г В. F., Shomale C.H..U.S. Bureau of Mines
Tech. Paper 686, 194G.
21. L о о n a m A. C, J. Electrochem. Soc, 99, 295c—298c A952).
22. Mantell С L., J. Electrochem. Soc, 94, 232—243 A948).
23. M a n t e 1 1 C. L., Electrolytic Manganese Acceptance Grows, Iron Age (Septem-
ber 18, 1952).
21. Materials Survey — Manganese, National Security Resources Board, U. S. Depart-
ment of Commerce, National Production Authority, U. S. Government Printing
Office, Washington, D. C, 1952.
25. S с h 1 a i n D., Prater J. D., J. Electrochem. Soc, 94, 58—73 A948).
26. S p г i n g e г П., Die Elektrolytische Abscheidung des Mangans, Akademischc Ver-
lagsgescllschaft, Geest und Portig K-G., Leipzig, 1951.
27 Sully A. H., Manganese, Academic Press, Inc., New York, 1955.
28 Z w i с к e r U., Z.j Metallkunde, 42, 274 A951).
18. МОЛИБДЕН
Р. С. АРЧЕР
R. S. Archer, Climax Molybdenum Company,
A Division of, American Metal Climax, Inc.,
New York, N. Y.
ВВЕДЕНИЕ
Молибден — металл с плотностью 10,22, по цвету напоминает сталь
и имеет очень высокую температуру плавления (около 2610е). Молибден
является одним из наиболее известных и широко применяемых тугоплавких
металлов, а также одним из наиболее важных легирующих элементов,
добавляемых в стали, чугуны и некоторые сплавы, не содержащие железа.
Молибден — элемент с порядковым номером 42 и атомным весом 95,94 —
принадлежит к VI группе периодической таблицы и поэтому сходен с хро-
мом и вольфрамом. Нейтральный атом молибдена, помимо законченной обо-
лочки криптона с 36 электронами, содержит 5 электронов на N-оболочке
и один электрон на О-оболочке, на которых расположение электронов соот-
ветствует 4s2, 4/Л 4dB, 5s1. Некоторые характерные свойства молибдена,
например парамагнетизм, склонность ионов к образованию комплексных со-
единений и цвет его соединений, объясняются тем, что N-оболочка не закон-
чена. Существует семь природных стабильных изотопов молибдена с мас-
совыми числами (в порядке уменьшения распространенности) 98, 96, 95,
92, 100, 97, 94; известно несколько искусственно полученных радиоактив-
ных изотопов (91, 93, 99, 101, 102, 105).
В древней Греции термины tnolybdena, plumbago, graphite и galena,
по-видимому, применялись для обозначения сульфида свинца и минера-
лов, похожих на него по внешнему виду, включая графит, а также встре-
чающийся в природе дисульфид молибдена. Эта путаница, особенно в отно-
шении наименования минералов, теперь называемых графитом и молибде-
нитом, продолжалась до 1778 г., когда Шселе доказал, что молибденит
содержит серу, и получил из этого минерала молибденовую кислоту. При-
близительно в 1782 г. Хельм впервые получил ие особенно чистый метал-
лический молибден путем восстановления его окислов углеродом. Новый
элемент он назвал молибденом.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Молибден не встречается в природе в свободном состоянии. В настоя-
щее время ведутся значительные разработки только месторождений, содер-
жащих минерал молибденит (MoS2). Иногда с целью получения молибдена
обогащают повеллит [молибдат кальция, содержащий изоморфную при-
месь молибдата вольфрама — шеелита, Са (Mo, \V) OJ. В прошлом разра-
батывались месторождения, содержащие вульфенит — молибдат свинца
(РЬМоО4).
В капиталистическом мире производство молибдена сконцентрировано
в США и Чили. Рудник Клаймакс в округе Клаймакс штата Колорадо счи-
Молибден 401
тается самым большим производителем. Следующим наиболее значитель-
ным источником молибдена является медная промышленность, в которой
молибденовый концентрат выпускается в качестве побочного продукта на
нескольких рудниках США и Чили, самыми крупными из которых являются
медиые рудники в Бингеме (штат Юта). Молибден получают также как
побочный продукт при добыче вольфрама в Пайп-Крик (штат Калифорния).
По приближенному подсчету, рудные запасы США, имеющие промышлен-
ное значение, содержат более 1,36 млн. т молибдена.
ПРОИЗВОДСТВО И СТАТИСТИКА
Производство молибденитового концентрата достигло в США макси-
мального масштаба B7 900 т молибдена) во время войны, в 1943 г. В 1949 г.
его производство сократилось до 10 200 т, а в 1955 г. снова возросло до
27 900 т. В 1959 г. было получено 23 100 т молибдена. Производство молиб-
денитовых концентратов в капиталистическом мире в 1959 г. составило
31 900 т молибдена, причем 73% приходилось на долю США. С 1953 по
1957 г. потребление молибдена промышленностью в США изменилось от
10 800 до 17 700/л в год, а в других странах — от 5400 до 11300 т
в год.
Большая часть добываемого молибдена расходуется для легирования
сталей, чугуна и некоторых сплавов, не содержащих железо. Небольшое
количество перерабатывают в металлический молибден и сплавы на его
основе, еще меньшее количество в виде дисульфида молибдена применяют
в качестве смазки. Соединения молибдена находят применение в качестве
катализаторов, пигментов и аналитических реактивов. Молибден оказался
ценным микроэлементом для питания растений. Для этой цели можно при-
менять молибдат натрия и трехокись молибдена.
По сообщению Горного бюро США производство порошка молибдена
в США в 1957 г. составило приблизительно 500 т. В 1959 г. 474,9 т порошка
молибдена было израсходовано на изготовление проволоки, прутков и листов
и 526,6 т — в виде кованых заготовок и т. д.
Цены
Существовавшие в 1958 г. цены на чистый металлический молибден
составляли приблизительно 8,8 долл. за 1 кг порошка, полученного восста-
новлением водородом, и 24,2 — 35,2 долл. за 1 кг брусков, прокатанных
из слитков, которые были получены электродуговой плавкой.
ПЕРЕРАБОТКА РУДЫ
В Клаймаксе, где рудник разрабатывается в основном для получения
молибдепитового концентрата, руда содержит приблизительно 0,4% MoSE.
Молибденит отделяют от некоторых сопутствующих минералов путем дроб-
ления, тонкого измельчения и флотации. При флотации применяется реа-
гент, содержащий главным образом продукт переработки нефти, известный
как палевое днетиллатнос масло средней вязкости, и значительно меньшие
количества соснового масла и синтетического смачивающего вещества.
Концентрат молибденита обычно содержит около 80 — 95% MoS; (в перес-
чете на сухое вещество).
-Ч -liK.13 № 239
402 Г лава 18
Большую часть концентрата обжигают при большом избытке воздуха
приблизительно при 600", избегая более высоких температур, чтобы пре-
дотвратить слипание и улетучивание. При обжиге сульфид молибдена
превращается в трехокись МоО3. Пустая порода остается в концентрате —
в продукте, который после обжига называют технической окисью молиб-
дена или обожженным молибденитовым концентратом.
Последующая обработка определяется конечным назначением. Трех-
окись молибдена, как таковую, можно использовать в сталелитейной
промышленности. Трехокись обычно упаковывают в стальные банки или
бумажные мешки и перемешивают со смолой, которая служит связующим
веществом и восстановителем. Иногда трехокись молибдена смешивают
с известняком в таком соотношении, чтобы получился молибдат кальция.
Ферромолибден, содержащий около 55 — 75°6 молибдена, обычно получают
термическим восстановлением технической трехокиси. При этом в качестве
исходного сырья, помимо трехокиси молибдена, применяют ферросилиций,
алюминий и железную руду. Флюсами служат известняк и плавиковый
шпат.
Трехокись молибдена высокой степени чистоты может быть получена
путем возгонки технической окиси или при термическом разложении молиб-
дата аммония. Продукт содержит свыше 99,5°6 МоО3.
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО МОЛИБДЕНА
Металлический молибден получают из порошка молибдена, образую-
щегося при восстановлении водородом чистой трехокиси молибдена или
молибдата аммония. Восстановление проводится в трубчатых печах, ана-
логичных печам, применяемым при восстановлении вольфрама (см. главу
«Вольфрам», рис. 6). Металлическая лодочка, содержащая окись, прод-
вигается вдоль трубчатой печи со скоростью, обеспечивающей полное вос-
становление металла при максимальной температуре около 1100". Про-
цесс обычно проводится в две стадии; на первой стадии, при температуре
около 600°, образуется двуокись молибдена, которая восстанавливается до
металла при 1000—1100°. Порошок может быть превращен в компактный
металл одним из двух процессов: методом порошковой металлургии, при-
меняемой примерно с 1910 г., или электродуговой плавкой, которую нач&чи
применять примерно с 1944 г.
Метод порошковой металлургии
Молибденовый порошок в начале процесса прессуют при комнатной
температуре в болванки или брикеты в пресс-формах пои давлением 1,58 —
3,16 т/см2. Спрессованные брикеты спекают при нагревании в атмосфере
водорода или в вакууме. Спекание начинается при 1100° и происходит бы-
стрее с увеличением температуры. Для изготовления прутка и проволоки
использовались спрессованные брикеты с поперечным сечением 6,45 см3;
их нагревали в печах, подобных применяемым для спекания вольфрама,
непосредственно пропуская электрический ток при максимальной темпе-
ратуре около 2200°. При таком методе нагревания остаются неиспользован-
ными холодные концы, которые могут быть проданы как отходы. Некоторые
предприниматели предпочитают проводить спекание в печах, нагретых
молибденовым сопротивлением, при температуре около 1630°, избегая
таким образом потери концов спрессованных брикетов.
Молибден
403
Брикеты значительно большего размера прессуют под гидростатиче-
ским давлением 25 т или выше и нагревают для спекания радиационным
методом. Спеченные брикеты, имеющие диаметр до ISO мм или больше, легко
подвергаются ковке".
Электродуговая плавка
имеет очень высокую температуру плавления, вследствие
чего его невозможно расплавить и отлить в слитки высокого качества обыч-
ными способами. При электродуговой плавке расходуемым электродом
Рис. 1 ОПщии вид машины
для прессования, спекания и
плавления, применяемой в про-
цессе электродуговой плавки
молибдена («Клаймакс молиб-
дсиум компани оф Мичиган»).
служит частично спекшийся брусок; он плавится и стекает в охлаждаемую
водой изложницу, обычно сделанную из меди. Электрод может быть изго-
товлен заранее. Однако большую часть молибдена электродуговой плавки
до сих пор плавят на таком оборудовании, в котором процесс начинается
с прессования из порошка молибдена электродов; затем электроды спе-
каются до такой степени, чтобы они выдержали свой вес до внесения в дугу.
Процесс осуществляется в высоком вакууме или в атмосфере очищенных
инертных газов. Таким способом получают слитки диаметром до 305 мм
и весом до 900 кг.
На рис. 1 показан общий вид машины для прессования, спекания
и плавки, построенной в 1950 г. На этой машине выплавляют слитки диа-
метром 230 мм и весом 450 кг со скоростью расплавления 4,54 кг/мин. С фев-
раля 1958 г. работает более новая машина, которая выплавляет слитки диа-
метром 305 мм и весом до 910 кг со скоростью 7,3 — 9,1 кг'мин. Обе машины
выполняют одни и те же операции, но новая машина отличается несколько
большими размерами.
На рис. 2 показана крупным планом верхняя часть машины с бунке-
ром для порошка, расположенным вверху слева. Непосредственно под иим
расположен запасной бункер с вибрирующим питателем, который подает
порошок к питателю механизма, формующего электроды. Гидравлическая
система для прессования порошка располагается над этой камерой.
* Все рассмотренные выше вопросы, относящиеся к технологии молибдена.,
рассмотрены автором более чем бегло. Следует напомнить нашему читателю о сущест-
вовании хорошей и краткой монографии по молибдену, написанной Л. Норкоттом;.
см. сборник «Молибден», ИЛ. Москва, 1959, стр. 13—2U0.— Прим. ред. «
2fi*
404
Глава 18
Главная камера показана крупным планом на рис. 3. В этой машине
плавление осуществляется периодически, но формование электродов, спе-
кание и плавленне происходят последовательно в вакууме приблизительно
0,01 — 0,05 мм рт. cm На рис. 4 представлена схема подачи порошка
Р и с. 2 Буньср и корпус пита-
теля (слева); гидравлическая си-
стема для прессования электродов
(справа) («Клаймакс молибденум
компаии оф Мичиган»).
молибдена в механизм, формующий электроды. При давлении около
840 кг1смг порошок прессуется здесь в шестигранной пресс-форме.
Рис. 3.Главная камера(«Клай-
макс молибдсиум компани
оф Мичиган»).
Слои толщиной около 13 мм формуются со скоростью 15—20 слоев
в 1 мин. причем каждый слой образуется поверх предыдущего. Когда колон-
ка слоев опускается вниз по аппарату (рис. 5), производится спекание,
чтобы колонка приобрела достаточную прочность и поддерживала вес-
электрода длиной 305 мм, простирающегося к днищу изложницы. За счет
тепла от дуги переменного тока электрод плавится, и расплавленный металл
405
капает в охлаждаемую водой медную изложницу, в которой происходит
затвердевание.
Рис. 4. Схема подачи порошка молибдена в механизм, фор-
мующий элскгриды.
/ вертикальный цилиндр; 2 - ьлапан регулятора д.шлсиии;
3 — горичонтгии.ный цилиндр; 4 nvaHCOH; 5 — шестигранная_мат-
риц|; (J -горизонтальный рлсцепной чрхлннш.
Чтобы получить хорошо обрабатывающийся слиток, необходимо
добиться низкого содержания в нем кислорода. Поэтому для плавки приме-
няется порошок с самым низким содержанием кислорода. Для удаления
Л
Рис. 5 ААашина для спе-
кания слоев по мере их
продвижения вниз.
/ верхний ьонтактный 6.ini-
мак; А — нижний контактный
башмак
о
большей части кислорода, содержащегося в порошке, перед спеканием
и плавкой порошок можно смешивать с небольшим количеством угля. При
этом в слитке может остаться около 0.0396 углерода. При электродуговой
106 Г л а на 1Ь
плавке легирующие элементы обычно вводят, смешивая их с молибденовым
порошком, из которого изготовляется электрод. Машина, формующая и спе-
кающая электрод в вакууме непосредственно перец плавкой, особенно под-
ходит в том случае, когда вводятся легирующие присадки титана или цир-
кония, обладающие высокой реакционной способностью. Наиболее широко
применяемый до настоящего времени сплав содержит 0,5% титана. Оче-
видно, в результате дальнейших исследований появятся в продаже и другие
сплавы.
ОБРАБОТКА МОЛИБДЕНА
Горячую обработку молибдена производят путем выдавливания, ковки,
прокатки и волочения. На практике эти процессы обычно выполняются
или по крайней мере заканчиваются при температуре ниже температуры
рекристаллизации. Таким образом, металл является холоднообработан-
ным и обладает повышенной твердостью и прочностью. По мерс увеличения
деформации температура рекристаллизации понижается, поэтому часто про-
цессы обработки металла давлением производятся при более низких тем-
пературах.
Для придания спрессованным из порошка небольшим брикетам формы
прутка брикеты необходимо подвергать целому ряду ковочных операций,
известных поя названием горячей штамповки, которые начинаются при
температуре около 1300г. Ковочный штамп состоит в основном из разъемной
матрицы, которая одновременно с ударным воздействием вращается вокруг
оси обрабатываемого прутка. Ковочные штампы можно применять для
уменьшения диаметра поперечного сечения до 1,5 мм. Уменьшение диа-
метра до 0,5 мм достигается с помощью карбидных матриц; более тонкую
проволоку изготовляют путем протяжки через алмазные волоки.
В порошковой металлургии молибденовый лист получают горячей
прокаткой непосредственно из спеченных брикетов. В этом случае темпе-
ратура прокатки также постепенно снижается, и при толщине до I мм ме-
талл может быть прокатан па холоду. Молибденовый лист прокатывается
до толщины 0,025 мм.
При наличии соответствующего оборудования можно изготовлять
прутки небольшого диаметра непосредственно горячей прокаткой спечен-
ных брикетов с поперечным сечением не меньше 12,9 см2, избегая, таким
образом, операции медленной горячей штамповки со свойственной ей нерав-
номерной обработкой.
Поточный метод электродуговой плавки позволяет получать слитки
диаметром 230—305 мм. Эти слитки подвергают выдавливанию при тем-
пературах 1090—1315°. Заготовки, полученные путем выдавливания,
обычно имеют диаметр 100— 150 мм. После очистки эти заготовки прока-
тываются в прутки. Для производства полосового и листового материала
эти заготовки могут быть прокатаны или путем ковки превращены в полосы.
Выдавленные заготовки можно применить также при операциях ручной
ковки и ковки в штампах. При этих ковочных операциях металл нагре-
вается приблизительно до 1204°.
При процессах обработки металла путем прокатки и ковки рабочие
температуры и режимы обжига изменяются в зависимости от первоначаль-
ных размеров слитка или прессованной заготовки, конечных размеров
получаемого профиля и требуемых свойств. Механические свойства молиб-
дена в значительной мере зависят от степени обработки его давлением при
температуре ниже температуры рекристаллизации. Для получения хорошей
А1о.ш6ден 407
вязкости размеры заготовки должны быть уменьшены по крайней мере на
5О°о. Большую часть продукции подвергают термообработке путем нагре-
вания до температуры на 50—100° ниже температуры рекристаллизации
для снятия внутренних напряжений. Полностью рекристаллизованный
молибден имеет более низкую прочность, чем молибден, освобожденный от
ннутренних напряжений, поэтому он легче поддается обработке давлением.
Однако рекристаллизованный молибден менее пластичен при изгибе по
сравнению с молибденом со снятыми внутренними напряжениями, и обычно
из него изготовляются только детали, не имеющие изгибов, или гнутые
трубы, если последующая их обработка сопровождается термообработкой,
достаточной для достижения необходимых свойств.
Температуры рекристаллизации зависят от химического состава ме-
талла, степени холодной обработки и времени, в течение которого металл
находится при данной температуре. Нелегированный молибден в виде
прутка диаметром 15.9 мм. при уменьшении диаметра на 50—90рь путем
прокатки полностью рекристаллизуется после выдержки при 1176° в тече-
ние 1 час. Экспериментально были получены сплавы на основе молибдена,
полностью рекристаллизующиеся прн температуре около 1704°. Сплав
молибдена с 0,5% Ti рекристаллизуется после выдержки при 1342е в тече-
ние I час.
Полная рекристаллизация приводит к значительной потере твердости
и прочности, увеличение которых достигалось в результате механической
обработки. Поэтому с точки зрения применения интересно знать самую
высокую температуру, до которой молибден и его сплавы можно нагревать
с незначительной рекристаллизацией или вообще без рекристаллизации.
За температуру рекристаллизации принимается самая низкая температура,
при которой появляются новые зерна, видимые под микроскопом. Для неле-
гированного молибдена в виде тонкой проволоки дается температура рекри-
сталлизации 900°. Ниже приведены данные для круглых прутков диаметром
15,9 мм, полученных из полностью рскристаллизованных прутков диаметром
50,8 мм путем прокатки без промежуточного отжига.
Номинальный состав
Мо
Мо 0,3% N1)
Мо -0,5% "И
Мп4- 1,0% V
Me-1-2,0 W
Mo + 0.5% Ti ' 0,07% Zr
Максимальная темпе-
paxvpa (выдержка 1 час),
'С
без рекри-
сталлиза-
ции
953
1093
1215
1058
959
128G
рекриспл-
ЛИЗООИНО
1 - 3%
981
1104
1226
1A72
981
1300
ФИЗИЧЕСКИЕ СВОЙСТВА
Хотя молибден обладает многими интересными свойствами, его высо-
кая температура плавления B6101), вероятно, является самым главным
свойством, важным в промышленном отношении. Из сравнительно легко
доступных металлов только вольфрам и тантал имеют более высокие темпе-
ратуры плавления.
408
Глава 18
Вследствие высокого модуля упругости молибден может приобретать
все возрастающее значение в ракето- и самолетостроении. Сравнение зна-
чений отношения модуля упругости к плотности для нескольких промышлсн
ных сплавов показывает, что для молибдена это отношение является мак-
симальным в широком интервале температур (рис. 6). Па этом графике
зависимости отношения модуля упругости к плотности от температуры для
нескольких сплавов видно относительное преимущество сплава молибдена,
содержащего 0,5% Ti, в широком интервале температур — от комнатной
до 1315°. Высокий модуль упругости при комнатной температуре имеет
ЫЛ1 800 WOO 1200 MOO
'Л
20U 'iUU
Р и с. 6. Изменение отношения модуля jnpyioc™ к плотности
в зависимости от температуры для некоторых сплавов.
Модуль упругости, кг,лиа\ шотноиъ, г/слЭ; 1 — 0.5% Ti — Mo; 2 — 24 SAi:
J - НК 31 Mg; 4 — А110ЛТ — Ti; 5 — AISI 4i30; 6 — L-H05; 7 AIS1
3i*l; Я — хастеллой Х.
большое значение для применения молибдена в качестве оправок при расточ-
ке и сменных шпинделей, где благодаря высокой твердости инструментов
достигается большая точность при механической обработке.
В других случаях применения молибдена может быть использована
его высокая теплопроводность, которая в несколько раз превышает тепло-
проводность других жаропрочных сплавов, или его электропроводность,
приблизительно равная 1/3 электропроводности меди.
При применении молибдена при высоких температурах во многих слу-
чаях благоприятно сочетание низкого коэффициента расширения с высокой
теплопроводностью.
Поперечное сечение захвата тепловых нейтронов у молибдена сравни-
тельно низкое. Его величина несколько ниже, чем у нержавеющей стали,
и это ускорило применение молибдена в ядерной энергетике для реакторов
на медленных нейтронах и для более новых реакторов па быстрых нейтронах.
Молибден, подобно хрому, вольфраму и железу, имеет кубическую
объемноцентрированную кристаллическую решетку. Аллотропические моди-
фикации неизвестны.
Некоторые физические свойства молибдена приведены в табл. 1.
MEXAHHMCCKHF СВОЙСТВА
Молибден наряду с многими другими металлами переходит из пластич-
ного в хрупкое состояние по мерс понижения температуры деформации.
Интервал температур, в котором наблюдается этот переход, зависит от
степени чистоты металла, способов холодной обработки, внутреннего на-
Таблица I
ФИЗИЧЕСКИ!. СВОПСТЬЛ МОЛИБДЬМА15
Атомные и тепловые с н о й с т в а
Порядковый номер 42
Изотопы
Природные 92, 94, 95, 9G, 97, 9Р, 100
Искуствепиыс 91, 93, 99, 101, 102, 105
Атомный вес 95,91
Атомный радиус (координационное число 8), А 1,36
Атомный объем, смз/г-атон 9,41
Кристаллическая решетка Кубическая объемноцентрирован-
ная
Постоянная решетки при 25", кХ 3,1405
Поперечное сечение захвати нейтронов, барн/атом
Медленные нейтроны 2,7
Быстрые нейтроны
IU/250 КЭВ
1230
Потенциал ионизации, эе
Эмиссия положительных ионов, эе
Рнбота выхода электронов, je
Температура плавления, С
Скрытая теплота п топлении (вычисленная),
ккал/моль
Температура кипения, С
Скрытая теплота испарения, ккал/моль
Теплота образонания Мо(K, ккал/коль
Энтальпия при 298.16 1800 К, кил/мп.т
Теп.юемкость прн 298,16- 18И0 К, кил/моль-град
Энтропия (кристаллов) при 298,16', кал/моль-град
Л>1н.1ение пара, am
1727
26101
3227°
4727
5560'
Удельная теплоемкость, кал/г-грид
(Г
538°
10931
1М9'
2204"
2532°
Средний коэффициент линейного расширения,
град'1
20 149'
20—482°
21) fi49°
20- -9821
20- 1316°
2U--15930
9
6
7,2
8,6
4,2
-2610
6.7
-5560
117,4
180,3
Нт -Я2!18.1е--5,48Г+0,е
1С92
Ср-5,48+1,30-10-37
6,КЗ
3,9-10 1"
1,7-10-5
8,6-10-1
1,8-10-1
1,0
0.0С6
0,057
0,077
0,088
0,113
0,128
5,43-10-е
5,19- Ю-6
5,36-10 в
5,80-10 6
6,28-10-"
6,65-10-"
Продолжение табл. 1
Коэффициент теп юпроводности, кал /см -сек- град
2(>4 0,298
316 0,285
427 0,289
538 0,275
649 0,272
760° 0,268
871" 0,254
1093° 0,2.49
1649° 0,215
2204 3 0,206
Электрические и магнитные свойства
Электропроводность* при 0', % 34
Константа Вндемана 2,72
Коэффициент Точсона при 900—2200 °К с/Т=- 1,05- 10~8в/°К
.Магнитная восприимчивость, э. м. е./г-атон 53-10—6
N дельное лмектрпческое сопротивление, мкок-ем
(.) 5,2
27'1 5,78
727 23,9
927° 29,2
1127° 35,2
1327° 41,2
1527' 47,2
1727й 53,5
1927° 59,5
2127' 66,0
2227° 69,2
2327° 71,8
2527J 78,2
26223 81,4
Температурный коэффициент удельного электро-
сопротивления, град'1 0,0047
Оптические и эмиссионные свойства
Оптическая отражательная способность, %
5" «0 А 46
100 000 А 93
Полная оптическая эмиссионная способность
101») 0,13
1300 0,19
21IH" 0,24
Термоионная эмиссия в высоком вакууме, ма/см%
1600° —0,5
2A00" ~7
• По отношению к международному стандарту — «юктропроводноети образца отожжен-
ной меди, равной 100%.
Молибден 419
близителыю при 700" начинает возгоняться, он лишь слабо защищает основ-
ной металл при повышенных температурах. Однако незащищенный молиб-
ден можно применять при кратковременном воздействии высоких темпе-
ратур. Скорость окисления значительно уменьшается при низких давле-
ниях, например в разреженной атмосфере на очень больших высотах.
Идеальным решением проблемы окисления будет создание сплава на
основе молибдена, устойчивого к окислению и обладающего подходящими
механическим свойствами. Хотя возможность создания такого сплава нельзя
отрицать, в исследованиях до сих пор не найдено нужных путей, поэтому
значительная часть работ посвящается нанесению защитных покрытий
и обработке поверхностей.
При оценке покрытий следует принимать во внимание многие свой-
ства, в том числе стойкость к окислению, тепловой удар, баллистический
удар, усталость, коррозию и эрозию. В настоящее время еще нет подходя-
щего покрытия, обладающего всеми этими свойствами. В связи с этим покры-
тие нужно выбирать с учетом специфических условий, в которых оно будет
применяться.
Молибденовый лист и простые профили могут быть покрыты путем
совместной прокатки с материалом, стойким к окислению, например с инко-
нелем, а молибденовые трубы покрьшают нержавеющей сталью. Как на
простые, так и на более сложные профили покрытия можно наносить раз-
личными методами, включая электролитическое осаждение, цементацию,
осаждение из газовой фазы, осаждение в ванне расплавленного металла
или распыление факелом. Если необходимо сохранить возможно большую
прочность, в процессе нанесения покрытий не должно происходить рекри-
сталлизации молибдена или сплава на основе молибдена.
¦ Покрытия, состоящие преимущественно из MoSi2, обладают превосход-
ной стойкостью против окисления и периодического изменения температуры,
ио склонны откалываться при баллистическом ударе. Хромониьелевые
электролитические покрытия прекрасно выдерживают все испытания, кроме
циклического температурного воздействия.
В результате испытаний стойкости к окислению при температурах до
1650° экспериментально установлены следующие пределы температур для
некоторых перспектинных металлических покрытий, нанесенных распыле-
нием:
AI —Сг —Si 1430°
Ni Сг — В 1200°
Ni — Si — В 1200°
При испытаниях при 981° алюминийсодержащие покрытия устойчивы про-
тив окисления и теплового удара, имеют среднее сопротивление эрозии,
но плохо противостоят баллистическому удару.
Покрытия па основе никеля являются ковкими и служат довольно
хорошо до появления трещин. После растрескивания в результате окисле-
ния образуется молибдат никеля, ускоряющий резрушение при цикличе-
ских температурных воздействиях. При испытаниях при 981° покрытия
хорошо противостоят окислению, баллистическому удару, но слабо сопро-
тивляются эрозии и тепловому удару.
Проведены многочисленные лабораторные исследования и испытания
в крупных масштабах покрытий различных типов при температурах от
981е до температур, значительно превышающих 1650°. Приведенные выше
краткие данные составляют очень небольшую часть опубликованных дан-
ных, полученных при этих исследованиях. Можно отметить, что отдельные
27»
4Z0_ Глава 18
типы покрытий устойчивы к окислению воздухом D течение нескольких
сотен часов при 1093° и в течение более короткого времени вплоть до 1650°
или даже более высоких температур. Подробно методы нанесения покрытий
и испытаний, а также полученные результаты описаны в различных рабо-
тах, ссылки на которые приведены в конце главы.
СОЕДИНЕНИЯ МОЛИБДЕНА
Для молибдена характерны валентности 2, 3, 4, 5 и 6. Считается также,
что в карбониле Мо(СОN молибден проявляет нулевую валентность. Обычно
в природе встречаются соединения четырех- (молибденит MoS2) и шестива-
лентного (молибдаты) молибдена. В растворе молибден образует не
только простые анионы, но и большое число комплексных анионов
вследствие склонности простых ионов к агрегации и полимеризации. Это
• определяется концентрацией и величиной рН раствора. Обычно координа-
ционные числа, характерные для молибдена, равны 4, 6 и 8. Переходы от
одного координационного числа к другому происходят, когда изменяются
условия растворения. Кислород и фтор образуют наиболее устойчивые сое-
динения с шестнвалентным молибденом, хлор —¦ с пятивалентным, а бром
и сера — с четырехвалентным. Эти соединения при изменении условий
могут диспропорционировать, образуя смеси соединений, в которых молиб-
ден имеет различные валентности.
Каталитические свойства соединений молибдена обусловливают их
широкое применение в нефтяной промышленности для удаления серы, азота
и некоторых вредных металлов. Для этой цели применяется главным обра-
зом трехокись молибдена МоОз- Применение трехокиси молибдена часто
имеет большое значение для процессов получения высокооктанового бен-
зина. Кроме того, этот катализатор применяют при обработке хвостовых
фракций для улучшения качества дизельного топлива и топлива коммуналь-
ного назначения. Молибден применяют в качестве катализатора в прочес-1
сах превращения метанола, в формальдегид, бензола в малеиновый ангид-
рид и толуола в бензальдегид.
Один из главных потребителей молибдата натрия — производство
пигментов, где из него получают молибдат хрома. Этот блестящий оранже-
вый пигмент имеет высокую кроющую способность. Органические краси-
тели и пигменты огаждаются фосфорномолибденовой кислотой, давая весьма
интенсивную и прочную окраску. Соединения молибдена применяются как
протравы при крашении о:новными и кислотными красителями.
Для определения фосфора в аналитической химии применяется молиб-
дат аммония (NH4J MoO4. Из азотнокислого раствора фосфор осаждают
в виде фосфоромалибдата аммония, состав которого после высушивания при
110° отвечает формуле (NH4K PO4- 12МоО3. Некоторые фосфорномолибдено-
вые кислоты используются в аналитической химии как реактивы на алка-
лоиды и для отделения щелочных металлов. В керамике трехокись молиб-
дена действует как смачивающее вещество и флюс. При использовании
в эмалях для покрытия металлов она способствует приклеиванию, а эмали
из двуокиси титана делает непрозрачными.
В гальваностегии с помощью молибдата аммония создаются декоратив-
ные черные покрытия на металлах.
Дисульфид молибдена, который в особых условиях обладает необыч-
ными смазочными свойствами, находит возрастающее применение как при-
садка к густым смазкам. Доказано, что молибден является микроэлементом.
Молибден 421
необходимым для питания растений; он помогает бактериям фиксировать
азот в бобовых растениях. Для этого применяют оба соединения — молиб-
дат натрия и трехокись молибдена.
Молибден образует два окисла определенного состава — МоО2 и МоО3.
Описаны гидратированные формы МоО и МогО3; считается, что другие
окислы, например Мо3О4 и Мо2О5, являются смешанными. Трехокнсь молиб-
дена получают путем обжига MoS2 на воздухе. Трехокись плавится при 795°,
но вследствие высокого да&пения пара она начинает возгоняться при
650 — 700°.
Дисилицид молибдена MoSi2 является чрезвычайно тугоплавким и хоро-
шо противостоит окислению воздухом приблизительно до 1700е. Он служит
главной составной частью некоторых электронагревательных элементов,
которые должны работать па воздухе по крайней мере при 1593е.
ОБРАБОТКА МОЛИБДЕНА
Хотя мапибден на протяжении многих лет обрабатывали только путем
ковки, вытяжки, прокатки или простой формовки, было показано, что молиб-
ден можно подвергать почти всем видам обработки, применяемым в настоя-
щее время в отношении сплавов. К этим процессам относятся выдарливание
на токарно-давильном станке, ковка,
gi - ' прокатка крумых и листовых профи-
лей, глубокая вытяжка, выдавливание
И '" > и механическая обработка резанием.
I - ¦¦ -' V
Рис. 8. Кованое кольцо из мо- Рис. 9. Первоначальная опе-
либдена, полученного электро- рация штамповки направляющей
дуговой плавкой («Клаймакс лопатки из молибдена, облицо-
молибденум компани оф Мичи- ванного иикоиелем (<Вестин-
ган»). гауз электрик корпорейшн^).
На рис. 8 показано кованое кольцо с внешним диаметром 289 мм, внут-
ренним диаметром 238 мм и высотой 65 мм, изготовленное из болваикн
весом около 50 кг.
На рис. 9 показана промежуточная стадия при изготовлении путем про-
катки экспериментальною листа из облицованного инконелем молибдено-
вого сплава для направляющих лопаток реактивного двигателя. Толшина
листа составляет 1,27 мм, штамповка производилась при 315 — 426°.
На рис. 10 показана экспериментальная «сотовая» конструкция, кото-
рая изготовлена из листа молибдена толщиной 0,5л(Л(, облицованного путем
контактной электросварки листами из сплава хромалой W-12. Эта кон-
струкция в течение 5 — 10 мин была нагрета до 1538° в окислительном пла-
мени и закалена в воде. При этом нигде не было обнаружено окисления.
422
Глава 18
Рис. 11 показывает часть металлической штампованной коробки, изго-
товленной из листа сплава Мо — 0,5% Ti толщиной 1,02 мм выдавливанием
на токарно-давильном станке. Интересно отметить, что исходная болванка
Рис. 10. «Сотовая» конст-
рукция (« Т. Р. Финн энд
компани»).
Рис. II. Болванка из спла-
ва Мо — 0,5% Ti, сплавлен-
ная электродуговым способом
и затем отформованная путем
выдавлиняния на токарно-
давильном станке в коробку
(«Маркарт эйркрафт компа-
ни»).
Показана одНс половина.
была получена электродуговой свар-
кой двух кусков молибденодого листа.
Сварной шов виден в центре чаши.
В одном процессе производства
труб из нелегироваппого молибдена,
полученного электродуговой плавкой, куски металла, отрезанные от горя-
чекатаных и отожженных болванок, нагреваются до 315 — 426° и формуются
путем обратного ¦выдавливания. Матрицы предварительно нагреваются до
260°. Перед дальнейшей вытяжкой дно коробки растачивается. Отделочные
операции часто требуют промежуточного отжига.
Рис. 12. Предохрани-
тельный кожух и бугель
для клапана, работающего
в серной кислоте при вы-
соких температурах, кова-
ные из молибдена, полу-
ченного электродуговой
плавкой («Нью Инг ланд
взлв корпорейшн»).
Р и с. 13. Кованый корпус
клапана из молибдена, полу-
ченного электродуговой плав-
кой, для работы в серной
кислоте при высоких темпе-
ратурах (кНью Ингланд вэлв
корпорейшн»).
На рис. 12 показана довольно сложная с точки зрения истечения ме-
галла покопка — предохранительный кожух и бугель для специального
клапана диаметром 50 мм, предназначенного для работы при высокой тем-
пературе в серной кислоте. Деталь была изготоанена путем ковки нз бол-
ванки нслегированного молибдена в обычных штампах, применяемых для
ковки стали. На рис. 13 показан корпус для того же клапана, изготовлен-
ный машинной ковкой.
Молибден 423
СОЕДИНЕНИЕ МОЛИБДЕНА
Механические средства, например клепка и сварка, являются самыми
простыми способами соединения молибдена. Первоначальные свойства
молибдена полностью сохраняются, но соединения не всегда непроницаемы
для жидкости.
На протяжении многих лет небольшие брикеты спеченного молибдена
сваривались различными способами, но швы при этом не отличались ни пла-
стичностью при комнатной температуре, ни особой прочностью. Конечно,
они не будут отвечать требованиям, предъявляемым к соединениям ответ-
ственных частей самолетов и ракет. В результате исследований, проведен-
ных в течение последних нескольких лет, получено доказательство, что лист
беспорпстого молибдена электродуговой плавки, не имеющего трещин и уме-
ренно пластичного при комнатной температуре, можно сваривать плавле-
нием.
Сварка в атмосфере атомарного водорода илн инертного защитного газа
дает самые лучшие по качеству швы и в относительно массивных изделиях
и в листах толщиной более 0,8 мм. Таким образом можно сваривать и более
топкие листы. При сварке применяются вольфрамовые электроды с сварочной
проволокой или без нее. Можно производить и ручную дуговую сварку,
но она менее надежна, чем автоматическая. В качестве инертных газов, соз-
дающих защитную атмосферу, при электродуговой сварке используются
гелий и аргон.
Двумя важными факторами, снижающими до минимума хрупкость,
являются: 1) максимальная чистота соприкасающихся и примыкающих
к ним поверхностей и 2) тщательный контроль содержания кислорода и азота
в атмосфере, в которой ведется сварка, так как оба эти газа уменьшают пла-
стичность. Вследствие возможного содержания примесей в технических
инертных газах рекомендуется применять очищенные аргон и гелий. Нако-
нец, предварительный нагрев до температуры около 204° является благо-
приятным, хотя и не всегда необходим. Это особенно полезно при сварке
сложных деталей .
Калью и Керне наряду с описанием процесса сварки приводят резуль-
таты испытаний на растяжение и изгиб образцов сваренного листа толщи-
ной 1,6 мм из сплава Мо — 0,5% Ti. Оказалось, что прочность сварных сое-
динений сравнима с прочностью рекристаллизованного молибдена, но зна-
чительно ниже прочности кованых листов. Все образцы разрушались в зонах,
подверженных нагреву. Тем не менее прочность при 871 — 1204е была на-
много выше прочности любых существующих сплавов на основе кобальта
или никеля. Прочность шва достигала 30,58 кг'мм'1 при 981е и уменьша-
иась до 16,17 кг/ммг при 1204е. Средний радиус изгиба сварных швов при
комнатной температуре составлял 51/2Т. Было отмечено, что сварные сое-
динения при 149° обладают достаточной пластичностью, позволяющей при-
менять неглубокую штамповку. »
Молибден может быть соединен с большим количеством различных
металлов и сплавов путем пайки тугоплавким припоем. Если части впослед-
ствии будут покрываться защитным слоем при высоких температурах, то
необходима именно пайка тугоплавким припоем, который не будет пла-
виться при этих температурах.
В тех случаях, когда работа не сопряжена с высокими температурами,
н качестве твердых припоев обычно применяют сплавы меди пли серебра.
Для электронных деталей и других неконструкционных изделий при работе
с температурами выше температур плавления сплавов меди и серебра
424 Глава 18
применяемых в качестве припоев, с большим успехом использовались медио-
никелевые сплавы, содержащие 10 — 309-6 никеля. В специальных случаях
нашел применение сплав 70% никеля и 30% молибдена, плавящийся при
1328°. Для работы с более высокими температурами применяют чистые
никель и платину. Смесь порошков молибдена и бора с температурой плав
ления около 1900° пригодна для пайки в атмосфере водорода.
Хотя были проведены испытания многих сплавов, применяемых в каче
стве твердых припоев в конструкциях при высокотемпературных режимах,
лишь некоторые из них в отдельных случаях дали обнадеживающие резуль-
таты. Однако ни один из сплавов не имеет универсального применения.
ОБЛАСТИ ПРИМЕНЕНИЯ МОЛИБДЕНА
Промышленное применение металлического молибдена для опор и про
водников в лампах накаливания было начато до 1915 г. Из молибдена изго-
товляются аноды, сетки и опоры в электронных лампах. Он достаточно
устойчив и сохраняет свою форму при высоких температурах, развиваю-
щихся в процессе изготовления и применения таких ламп. Кроме того, молиб-
деновые проволока и стержни применяются для уплотнения в стекле.
Молибден в виде проволоки, стержня и ленты применяется в качестве
нагревательных элементов в лабораторных и промышленных печах, когда
необходимо работать при температурах выше температурных пределов спла-
вов с обычным сопротивлением. Рабочие температуры могут подниматься
почти до 1700°. Окисления молибдена можно избежать, если применять
инертную или восстановительную атмосферу. Обычно работают в атмосфере
водорода и диссоциированного аммиака или в вакууме. Иногда молибде-
новая трубка служит одновременно как нагревательный элемент и как
муфель. Нагретые экраны из молибдена часто используют для контроля
и определения радиации.
Молибден широко применяется для изготовления электрических кон-
тактов, работающих не в таких жестких условиях, когда требуется воль-
фрам, но где наблюдается дуговая эрозия. Он находит применение не
только в виде полуфабрикатов, но также в виде изделий порошковой метал-
лургии, содержащих примеси серебра и меди.
В ртутных переключателях молибден используется в качестве электро-
дов, с помощью которых осуществляется контакт с ртутью. Молибден не
реагирует с ртутью, по ои довольно легко смачивается ею, благодаря чему
создается хороший электрический контакт.
Важное значение имеет применение молибденовой проволоки для нане-
сения покрытий путем распыления в процессе металлизации. Для того чтобы
получить хорошее сцепление распыленного покрытия из какого-либо метал-
ла, поверхность, на которую наносится это покрытие, необходимо сделать
более шероховатой путем дробеструйной обработки или рифления. Плотно
прилипающие покрытия из молибдена на поверхности стали или алюминия
можно наносить без специальной подготовки поверхности. Такие покры-
тия создают превосходную поверхность для последующего нанесения распы-
ленных покрытий из других металлов. Молибденовое покрытие само имеет
высокую износостойкость, благодаря чему такие покрытия находят широкое
применение.
В радарных установках молибден применяется в качестве поддержи-
вающих стоек катодов и вспомогательных элементов конструкций. Его высо-
кие электро- и теплопроводность, низкий коэффициент расширения и проч
Молибден 42b
ность при высоких температурах имеют очень большое значение для дан
ного применения.
Молибден приобретает все большее значение в ракетостроении для изго-
товления некоторых деталей, работающих в условиях высоких темпера-
тур. Хотя сведения о применении молибдена в этой области засекречены,
известно, что из него изготовляют ведущие кромки контрольных поверхно-
стей, сопла ракет, вставки для сопел, лопасти турбин и другие детали, где
требуется высокое сопротивление эрозии в условиях высоких температур.
Сплавы па основе молибдена, полученного электродуговой плавкой,
подвергались тщательному испытанию в ракетных двигателях с целью уста-
новления возможности их применения для направляющих рабочих лопа-
ток и турбин, так же как и в деталях форсажных камер. В этих случаях
необходимы защитные покрытия, предотвращающие окисление. С успехом
выдержали испытание лопатки турбин, изготовленные из плакированного
молибденового листа, и лопасти винтов, откованные из правильной бол-
ванки и затем покрытые защитным слоем.
В порядке эксперимента была испытана молибденовая сблицовка ка-
меры сгорания реактивных двигателей. Облицовка с распыленным покры-
тием из сплава А1 — Сг — Si выдерживала испытания при 1315° в течение
14 мин при высокой скорости воздуха, с одной стороны, и высокой скорости
продуктов сгорания — с другой. Другое потенциальное применение мслиб-
дена — изготовление из него сопел прямоточных воздушно-реактивных
двигателей.
В стекольной промышленности из молибдена изготовляют жаростой-
кие электроды, шуровочные приспособления, насосы и детали, где необ-
ходима износостойкость. Сопротивление молибдена действию расплавлен
ного стекла, прочность при высоких температурах и хорошие электрические
свойства представляют особую ценность для стекольной промышленности.
В области ядерной энергетики предпринимаются наиболее активные
попытки применения молибдена. Хотя сведения о его применении во многих
случаях не опубликованы, молибден был использован в производстве тепло-
обменников, труб и других конструкционных деталей.
Молибден нахоаит некоторое применение в производстве инструментов
для горячей обработки металла, например наконечников для пробивания
отверстий в заготовках из нержавеющей стали в производстве бесшовных
труб, литейных стержней, пресс-форм, матриц для процессов выдавлива-
ния и зажимных приспособлений при пайке.
Молибден как легирующий элемент
В машинных конструкциях детали из сплавов обычно подвергают
закалке и отпуску с целью повышения их прочности и износостойкости.
В сталях для таких деталей молибден можно применять как основной леги-
рующий элемент или вместе с другими элементами, особенно с хромом и нике-
лем. Основная причина использования молибдена в этих случаях объясняет-
ся его способностью повышать закаливаемость стали.
Уменьшая отпускную хрупкость, молибден повышает вязкость зака-
ленной и отпущенной стали. Это свойство молибдена, а также его способ-
ность повышать закаливаемость стали необходимо учитывать при его при-
менении в тех случаях, когда наряду с большой прочностью требуются высо-
кая пластичность и вязкость, как, например, в броневых плитах и орудиях
В быстрорежущие стали вводят молибден или вольфрам или оба эти
элемента для повышения красностойкости. Молибден является легирую-
426 Глава 18
щей добавкой для целого ряда инструментальных сталей, особенно так
называемых жаропрочных сталей. Молибден добавляется также к различ-
ным типам нержавеющей стали, например к стали 316, с целью дальней-
шего улучшения их коррозионной стойкости.
Молибден увеличивает прочность стали при повышенных температу-
рах, поэтому он находит широкое применение в производстве труб, клапа-
нов, поковок и фитингов в паровых установках, работающих в условиях
высоких температур, трубок перегревателей н трубопроводов в печах для
крекинга. Молибден повышает прочность, вязкость и однородность струк-
туры серого чугуна, в котором он широко применяется в качестве присадки.
Молибден повышает также закаливаемость серого чугуна и его прочность
при высоких температурах.
Многие из сплавов па основе никеля и кобальта, созданных для работы
в условиях высоких температур, например для деталей газовых турбин,
содержат молибден, повышающий их жаропрочность. Молибден содержится
в некоторых сплавах на основе никеля, например сплавах «хастеллой», раз-
работанных главным образом с целью повышения стойкости против кор-
розии в химических растворах. Некоторые сплавы на основе титана также
содержат молибден.
ЛИТЕРАТУРА
I. American Society for Metals, The Metal Molybdenum, Cleveland, 1958. Papers
Presented at a Symposium on Technology of Molybdenum and Its Alloys Sponsored by
the Office of Naval Research, Detroit, September 18—19, 1956. The following papers
were presented*.
H e r 7. i g A. J., The Potential and Future of Molybdenum and Its Alloys, "p. 4—9.
Freeman R. R., Properties and Applications of Commercial Molybdenum and
Molybdenum Alloys, p. 10—30.
Toensing С. Н, Molybdenum Metal Powder, p. 31—50.
Scott H., T a e b e 1 W. A., Lawthers D. D., Consolidation of Molyb-
denum by Powder Metallurgy Practice, p. 51 — 75.
Gulbransen E. A., Commentary on Forging, p. 76—79.
T i m m о n s G. A., Y i n g 1 i n g R. G., Arc Melting Molybdenum, p. 80—108.
П r u с k а г t W. L.. The Working of Molybdenum and Its Alloys, p. 109—126.
T i ш in о n s G. A., Commentary, p. 127—142.
N i s h e t J. D., Fabrication at Very High Temperature Under a Controlled Atmos-
phere, p. 143—150
P 1 a t te W. N., Welding of Molybdenum, p. 151—191.
Monroe R. E., Brazing of Molybdenum, p. 192—198.
Senderoff S., Techniques for Coating Metals with Molybdenum, p. 199—213.
M a d d i n R., The Behavior of Molybdenum Single'Crystals Under Various Stress
Conditions, p. 214—240.
В е с h t о 1 d J. H., W e s s e 1 E. Т., The Ductile-To-Brittle Transition in Molyb-
denum, p. 241—261.
S p а с i 1 H. S., W u 1 f f J., Effects of Oxygen, Nitrogen, and Carbon on the
Ductilitv of Wrought Molybdenum, p. 262—278.
Baldwin W. M., Jr., Commentary, p. 279—280.
Semchyshen M., Development and Properties of Arc-Cast Molybdenum-
Base Alloys, p. 281 -329.
J af fee R I., Powder Metallurgy Molybdenum-Base Alloys, p. 330—36A.
* В этой книге, помимо указанных, помещены и другие статьи.
Молибден 427
М а 1 I e t t M. W-, Н a n s e n W. R., Determination of Gases in Molybdenum,
p. 365—393.
Coons W. C, Fractographic and Mctallographic Techniques for Molybdenum
and Molybdenum-Base Alloys, p. 394—407.
В e g 1 с у R. Т., Molybdenum for Aircraft Oas Turbine Applications, p. 408—419.
H arwood J. J., The Protection of Molybdenum Against High-Tcmpcrature
Oxidation, p. 420—459.
Safranek W.J IT-, Commentary, p. 460—4fil.
В а г г R. Q., Seinchyshen M., Perlmutter I., Effects of Hot-Cold
Work on the Properties of Molybdenum Alloys, p. 462—510.
R u s s J. J., S с h r a d e r G. E-, Forging of Molybdenum Alloy Turbine Bla-
des, p. 511—518.
Northcott L., Molybdenum Research and Development in Great Britain,
p. 519- 527.
Sims Ch. Т., Commentary, p. 52R 529.
К i e f f e r R., P i p i t z E., Sintered and Arc-Melted Molybdenum Alloys,
p. 530—553.
II. American Society for Metals, Cleveland, Ohio, Fabricalion of Molybdenum, 1959.
Papers Presented at the Molybdenum Fabrication Conference Sponsored by llic Southern
California Chapters of the ASM, May 7~ 8, 1958.
II arwood J. J., Molybdenum as a Structural Material, p. I.
T i m m о n s G. A., Development of Molybdenum-Base Alloys, p. 19.
В r u с к a r t W. L., The Production and Quality of Molybdenum Mill Products, p.J.39.
Martin D. C, Welding of Molybdenum, p. 63.
H op p i n G. S., Ill, Brazing of Molybdenum, p. 77.
Jones J. В., Ultrasonic Welding, p. 88.
Solin J. S., Fusion Welding of Molybdenum Power Plant Components, p.«103.
J a f f e e R. I., Protective Coating Systems lor Molybdenum, p. 119.
T a e b e 1 W. A., G с 1 о к J., Machining of Molybdenum and Its Alloys, p. 134.
Q u л d t R. A., Press Extrusion of Molybdenum Tubing, p. 139.
Goldberg D. C, Forming of Clad Molybdenum, p. 148.
R u s s J. J., Forging of Molybdenum and Its Alloys, p. 169
Downey R. C, Testing in the Hot Rod Engine, p. 174.
Levinstein M. A., Coating Development and Evaluation, p. 186.
Y ancey R- W., Fabrication of Electronic Tube Components, p. 205.
S i erg i e j J. M., Missile Structures and Powerplants, p. 214.
Edwards E. H., Molybdenum Requirements in the Petrochemical Industry,
p 217.
W о о I s e у С. С, Molybdenum Requirements in the Nuclear Energy Field, p. 220.
III. В 1 a n с h a r d J. R., Oxidation-Resistant Coalings for Molybdenum, WADC
Techn. Rept. 54-492, Part 1, 1954; Parl 2, 1955.
Coons W. C, Simple Electrolytic Polishing Procedures for Molybdenum Metal-
lographic Specimens, Trans. ASM, 41, 1415 1424 A949).
Couch D. E., S h a p i г о H., Taylor J. К., Brenner A., Protection
of Molybdenum from Oxidation at Elevated Iemperalure, J. Electrochem. Soc, 105,
150 A958).
D e u b 1 e N. L., H e r z i g A. J., В I a n с h a r d J. R., Arc-Casl Molybdenum,
Metal Progr. (April - - October 1955).
D о a n e D. V., Oxidation-Resistant Coatings for Molybdenum, W'ADC Techn.
Kept. 54-492, Part 3, 1957.
F i e 1 d h о u s e I. В., H e d g e J. С L a n g J. I., T а к a t a A. N., W a-
lerman Т. Е., Measurements of Thermal Properties, WADC Techn. Rcpt. 55-495,
Part t, ASTIA Document № AD 110404, September 1956.
428 Глава 18
Fieldhouse I. В., Hedge J. С, Lang J. I., Waterman Т. Е..
Measurements of Thermal Properties, WADC Techn. Repl. 55-495, Part 2, ASTIA
Document № AD 110510, November 1956.
Fieldhouse I В., H e d g e J. C, Waterman Т. Е., Measurement'
of Thermal Properties, WADC Techn. Rept. 55-495, Part 3, ASTIA Document № AD
110526, November 1956.
Freeman R. R., Briggs J. Z., Machnining Arc-Cast Molybdenum. American
Machinist, September 24, 1956.
Freeman R. R., The Properties and Applications of Commercial Arc-Cast
Molybdenum and Its Alloys, Plansee Proceedings, Metallwerk Plansee, 1958.
H a r w о о d J. J., Protecting Molybdenum at High Temperatures, Materials
and Methods, December 1956.
J a h n к e L. P., F г a n к R. G., High Temperature Metallurgy Today. Metdl
Progress, November 1958.
К u 1 j u K- M.. К e a r n s W. H-, Welding of Molybdenum-Alloy Sheet, Welding
Research Supplement, October 1958.
Lucks C. F., D e e in H. W-, Thermal Conductivities, Heat Capacities, and
Linear Thermal Expansion of Five Materials, WADC Techn. Rept. 55-496, ASTIA Docu
ment № AD 97185, August 1956.
R a s о r N. S, McClelland J. D., Thermal Properties of Materials, Part 1
Properties of Graphite, Molybdenum and Tantalum to Their Destruction Temperatures
WADC Techn. Rept. 56-400. Part I, ASTIA Document № AD 118144, March 1957.
Symposium of Molybdenum in Agriculture, Soil Science, 159—258 (March 1956)
W e а г e N. E., M о n г о e R. E., Welding and Brazing of Molybdenum, ASTIA
AD 210486, OTSPB 151063, DMIC Rept. 108, Battelle Memorial Institute, March 1, 1959
IV. Freeman R. R., Briggs J. Z., Electroplating^ onj Molybdenum Metal.
Climax Molybdenum Co. Bulletin, September 1958*.
Freeman R. R-, Briggs J. Z., A New Look at Joining Molybdenum, Cli
max Molybdenum Co. Bulletin, 1957.
Properties of Molybdic Oxide, Climax Molybdenum Co. Bulletin Cdb-1, Au-
gust 1954.
Thermodynamic Properties of Molybdenum Compounds, Climax Molybdenum Co
Bulletin Cdb-2, September 1954.
Properties of Molybdenum Pentachloride, Climax Molybdenum Co. Bulletin Cdb-3.
May 1957.
Properties of Molybdenum Disulfide, Climax Molybdenum Co. Bulletin Cdb-5
October 1956.
Refractory Molybdenum Silicides. Climax Molybdenum Co. Bulletin Cdb-6, Janu
ary 1956.
Refractory Molybdenum Carbides and Nitrides, Climax Molybdenum Co. Bulletin
Cdb-7, February 1956.
Refractory Molybdenum Borides, Climax Molybdenum Co. Bulletin Cdb-t*
March 1956.
Organic Complexes of Molybdenum, Climax Molybdenum Co. Bulletin Cdb-9.
June 1956.
Properties of Molybdenum Hexacarbonyl, Climax Molybdenum Co. Bulletin Cdb-13,
November 1958.
Symposium on Molybdenum in Agriculture, Climax Molybdenum Co. Bulletin
Ag-16, Reprinted from Soil Science, March 1956.
* Бюллетени фирмы «Клаймакс молибденум компанн» — литературные иссле-
дования, которые содержат большое количество литературных ссылок, относящихся
к данному вопросу.
19.
НИОБИЙ
Э. М. ШЕРВУД
E. M. Sherwood, Battetle Memorial Institute,
Columbus, Ohio
ВВЕДЕНИЕ
Длительное время выбору международного обозначения элемента 41
уделялось почти столько же внимания, сколько н технологии его получе-
ния. Открытый в 1801 г. английским химиком Чарльзом Хатчстом 161].
анализировавшим образцы руды, присланной в Британский музей из Кон-
нектикута, он был первоначально назван колумбием в честь Колумбии,
синонима Америки. Рудам, богатым ниобием, было дано название колум-
бит, которое стало общепринятым.
Вследствие сходства с танталом, с которым он всегда встречается в при-
роде, и трудности химической переработки не удивительно, что элемент 41
был снова открыт Розе [123] в 1844 г. и назван ниобием в честь Ниобеи.
дочери Тантала. После споров, длившихся более ста лет, это название было
принято Международным объединением чистой и прикладной химии в 1950 г.
В настоящее время оно одобрено некоторыми ведущими химическими обще-
ствами, и почти во всех публикациях Комиссии по атомной энергии США,
касающихся элемента 41, его называют ниобием. Однако большинство ме-
таллургов и ведущих металлургических технических обществ США [18],
а также все, кроме одной из важных промышленных фирм, производящих
металл, применяют название Колумбии.
Считается, что металлический ниобий впервые был получен Бломстран-
дом в 1866 г. [72] восстановлением хлорида ниобия водородом. Позже Муас-
сан [ 105] получил ниобий восстановлением его окиси углеродом в электро-
печи. Еще позже Гольдшмидт [51] восстановил окнсь порошком алюминия.
В 1905 г. и в последующие годы возрос интерес к ниобию н танталу, как
потенциальным материалам для производства нитей ламп накаливания
вместо применявшихся тогда графитовых нитей. Однако для этой цели окон-
чательно был выбран тантал. В этот же период времени Болтон [151]
получил сравнительно чистый ниобий путем восстановления фторониобата
калия натрием и определил некоторые более важные свойства металла.
Первые образцы ниобиевых прутков и листов были изготовлены Балке [8],
применившим методы порошковой металлургии; этот металл впервые был
представлен Американскому химическому обществу в 1929 г.
МЕСТОРОЖДЕНИЯ
Ниобий не найден в природе в свободном состоянии, он почти всегда
встречается совместно с танталом в минералах, содержащих как основу
кальций, железо, марганец и редкоземельные элементы. В этих минералах
могут присутствовать также олово, титан и цирконий. В отличие от многих
других металлов ниобий не образует природных сульфидных соединений.
430
Глава 19
Минерал колумбит (Fe, Mn) (Nb, TaJO6 было принято считать наиболее
важным источником ниобия, но в настоящее время постепенно приобретают
промышленное значение эвксеннт — ниоботитанат* Y, Се, Ег, U, Th, Zr
и пирохлор** (Na, CaJ (Kb, TiJ (OF)T. Содержание окисн ниобия в уга>
мянутых выше минералах различных месторождений изменяется в широ
ких пределах; в колумбите обычно содержится 30,8 — 62,3%. Хотя
точных данных о содержании пятиокиси ниобия в эвксеннте н пирохлоре
нет, известно, что общее содержание пятиокнеей тантала и ниобия состав-
ляет до 65%. В табл. 1 приведен приблизительный анализ богатой нио-
бнем разновидности пирохлора.
Таблица 1
СОСТАВ ПИРОХЛОРА [36]
Содержание,
вес. %
Содержа-
ние,
вес. %
Nb2O5
Та!1О5
CaO
FeO
55,2
3,4
13,6
2,3
МпО
Р2О5
F
Na2O
0,1
2,6
1,8
3,4
Более важны, однако, сравнительно богатые пятиокисью ниобия
залегающие повсеместно различные рудные тела, которые позволяют оце-
нить запасы руд по содержанию в них пятиокиси ниобия |64].
В Африке запасы колумбита, вероятно, превышают 70 000 т, а запасы
пирохлора — 1 200 000 т. Запасы пирохлора в Канаде и Норвегии оце-
ниваются свыше 400 000 и 500 000 т соответственно. Запасы эвксенита
и титансодержащих минералов в США, по-видимому, содержат 53 000 т
пятиокиси ниобия. Переработка всех этих минералов позволит получить
примерно 1 500 000 т ниобия, что значительно превысит спрос на этот
металл.
В настоящее время в США наблюдается тенденция к расширению произ-
водства ниобия [146]. Производство ниобия в США в 1959 г. составляло
66 т, т. е. вдвое больше, чем в 1958 г. В 1959 г. было ввезено около 1700 т
колумбнтового концентрата, в то время как местные месторождения выдали
95 т концентрата. Мировая добыча концентратов значительно уменьшилась
но сравнению с 1957 г., когда она составляла 3520 т. В Нигерии в 1957 г.
добыто 1950 т концентрата; эта страна была самым крупным в мире постав-
щиком.
Стоимость ввезенного в 1959 г. концентрата колумбита, содержащего
65% окислов, в которых соотношение ниобия и тантала составляло от 10
До 1, была равна около 2,5 долл. за 1 кг. В США цена металлического нио-
бия в конце 1960 г. составляла около 80 долл. за 1 кг металла в виде прут-
ков и 100 долл. за 1 кг листового металла.
РАЗДЕЛЕНИЕ НИОБИЯ И ТАНТАЛА
Постоянная ассоциация ниобия с танталом в природе, а также большое
химическое сродство этих двух элементов явились основной причиной,
• Точнее (Y, Се, Са, U. Th) (Nb, Та, TiJOc.— Прим. ред.
** Обычно принимается формула (Са, NaJ (Nb, TiJOe (О, ОН, F).— Прим. ред.
Ниобий Ш
мешавшей быстрому развитию эффективных способов их промышленного
производства. Поэтому важной ступенью в крупномасштабном производ-
стве ниобия является разделение ниобнеоых и танталовых соединений.
Руды, предназначенные для производства ферросплавов, обычно перера-
батываются без разделения восстановлением углеродом в электрических
печах на богатый ниобием феррониобийтантал.
Дробная кристаллизация
В течение многих лет в промышленности успешно применяется сравни-
тельно эффективный, но довольно трудоемкий процесс дробной кристал-
лизации, основанный на открытой в 1866 г. Мариньяком [92] ограниченной
растворимости фторотанталата калия K2TaF7, использованной для отделе-
ния его от более растворимого оксифторониобата K»NbOF.-,-H-.O. В на-
стоящее время дробная кристаллизация комплексных фторидов применяется
лишь в ограниченном масштабе; современная тенденция направлена на
применение методов, основанных на экстракции растворителями, или так
называемой жидкостной экстракции. При осуществлении метода Ма-
риньяка растворы, остающиеся после стадии дробной кристаллизации,
содержат растворенный оксифторопиобат, около 2% тантала, связан-
ного в растворе, и другие ирнмесн, не отделенные на предыдущих опе-
рациях, например титан и железо. Тантал может быть отделен путем добав-
ления к раствору, поддерживаемому при температуре кипения, поташа илн
аналогичного соединения, действующего как основание. В результате
этого тантал осаждается в виде основного фторотанталата Ta2Os-2K2TaF7.
Дальнейшая очистка достигается осаждением ниобия в виде ннобата нат-
рия 7Na2O-6Nb2O5-32H2O, нерастворимого в избытке едкого натра, и дроб-
ной кристаллизацией фторониобата калия 4К2О-ЗМЬ2Оь- 1GHX>. Очищен
ную пятиокись ниобия получают затем путем обработки соляной кислотой
фторониобата калня. Возможны некоторые изменения этого процесса разде-
ления, даже если ниобаты нерастворимы.
Экстракция растворителями [81]
Новый процесс отделения ниобия, основанный на экстракции раство-
рителем, привлек в настоящее время большое внимание промышленности.
Этот процесс не описан подробно, но для иллюстрации его основных прин-
ципов можно привести два метода, один нз которых разработан Горным
бюро США [141], а другой—одним из промышленных производителей
ниобия 131].
Ранние работы Горного бюро показали, что экстракция растворите-
лями в системе плавиковая кислота — соляная кислота — метнлизобутнл-
кетои [65, 153, 154] является эффективным методом разделения ннобня
н тантала. Однако представляет интерес такая система, которая позволяет
не только разделять тантал и ниобий, но и отделять примеси других эле-
ментов, обычно сопутствующих при вскрытии руды нисбию и танталу.
В дальнейшем было обнаружено, что система плавиковая кислота — сер-
ная кислота — метилизобутилкетон обладает этими необходимыми спе-
цифическими свойствами.
Первоначальную совместную экстракцню из нсходного водного раствора,
полученного путем растворения гидратированных пятнокисей тантала
н ниобия в концентрированной плавиковой кислоте и лобагления расчет-
ных количеств серной кислоты и воды, выполняют, смеширая один объем
исходного раствора с двумя объемами метилнзобутнлкетоиа. Условия
432
Глава 19
проведения этой операции следующие: исходный раствор содержит 100 г1л
гидратированиых питиокисей, концентрации плавиковой и серной кислот
составляют 5,5 н 9 н. соответственно. Для разделения органической и вод-
ной фазы применяется специальное оборудование. Одинаковые объемы
растворов плавиковой и серной кислот известной концентрации смеши-
вают с органической фазой и затем осуществляют разделение. Ниобий
Яриотицшшившя
исходный растаир,
гоёсжй гппн
шири ииодий
Рис. ,. Разделен
ниобия и тантала экстрак-
цией растворителями
[31].
Секция резкстрак
ции ниобия
Водная
L J фаза.содер-
тощая
ниибий
Отстойники
Деионизированнпя
вода
и тантал, присутствующие в каждой фазе, осаждают водным раствором
аммиака. Гидратированные пятиокиси фильтруют и прокаливают при
800°. Степень извлечения обычно превышает 90% при чистоте выше 99,9%.
Чистые ниобиевые соединения могут быть получены путем только одной
реэкстракции после первоначальной совместной экстракции.
Единственный промышленный способ экстракции растворителями,
описанный в работе [31], представлен на рис. 1. Колумбнт-танталитовую
РУДУ измельчают в шаровой мельнице до частиц величиной 100 меш или
Ниобий 433
мельче и загружают в выщелачиватель вместе с соответствующим коли-
чеством безводной плавиковой кислоты и деионизованной воды. Получен-
ную смесь перемешивают в течение 10 час при 80°, при этом происходит
растворение окислов ниобия н тантала. Большая часть примесей остается
в нерастворимом остатке. Растворенные примеси удаляют на последую-
щих стадиях процесса. Пульпу фильтруют, осадок с фильтра репульнируют
и вновь фильтруют, остаток выбрасывают. Раствор, содержащий ниобий
и тантал, помещают в емкость, в которой устанавливается рН до нужной
кислотности. Обработанную жидкость направляют затем в экстракцион-
ный каскад, где последовательно выполняются операции смешения и от-
стоя. В танталовую секцию каскада вводится метилизобутилкетон. Водную
фазу, содержащую ниобий, подкисляют и в секции экстракции ниобия
к этому раствору приливают чистый метилизобутилкетон. Наконец, экст-
ракт, содержащий ниобий, обрабатывают денопизованной водой и перели-
вают в отстойник, где ниобий осаждают аммиаком. Осадок фильтруют,
сушат, прокаливают для удаления фтора и получают пятиокись ниобия
высокой степени чистоты.
Другие методы
В работах [20, 67, 83] сообщается об эффективном разделении ниобия
и тантала в опытном масштабе методами ионного обмена. Хотя этот метод
менее перспективен, чем метод экстракции растворителями, он не связан
с аппаратурными трудностями и может обеспечить более эффективное отде-
ление примесей и необходимое разделение.
Топкое разделение ниобия и тантала может быть осуществлено хрома-
тографическими методами, но только при условии, если содержание тантала
меньше, чем ниобия [191.
Несколько лет назад английские исследователи Института атомной
энергии, столкнувшись с нехваткой ниобиевого концентрата, обсуждали
возможность применения в качестве исходного материала ферроннобия
и разработали процесс прямого хлорирования [43]. Их целью было полу-
чение трихлорнда ниобия высокой степени чистоты восстановлением пен-
тахлорида водородом или фракционированной дистилляцией смеси хлори-
дов. Таким путем можно избежать многих трудностей, связанных с отде-
лением больших количеств тантала от ниобия в исходном сырье. Сооб-
щается 126] также, что ниобий можно отделять от тантала путем обработки
смесей пентахлоридов галогенидами алюминии (хлоридом, бромидом и иоди-
дом) при повышенной температуре и уменьшенном давлении. Для разде-
ления образующихся двойных галогенидов применяют фракционирован-
ную возгонку. Для этих целей лучше всего применять нодид алюминия.
В настоящее время не может быть сделана экономическая оценка каж-
дого нз процессов, описанных в данном разделе, однако считается, что
некоторые из них найдут промышленное применение.
МЕТАЛЛУРГИЯ НИОБИЯ L103, 119, 131]
Предложено много способов получения металлического ниобия. В общем
их можно подразделить на девять основных категорий:
1) восстановление окислов и галогенидов активными металлами, неме-
таллами и электролизом (всего 6 категорий);
2) электрорафинированне;
3) реакции диспропорционировання;
28 Заказ > 239
434 Глава 19
4) термическое разложение галогенидов.
Несмотря на то, что на изучение этих различных способов было затра-
чено много усилий, промышленное применение нашли только восстановле-
ние пятиокисн ниобия карбидом ниобия или углеродом и восстановление
пентахлорида или других галогенидов металлическим натрием. Для полу-
чения порошка ниобия высокой степени чистоты в расширенном масштабе
было предложено [43] восстановление трихлорида водородом. Изучался
также способ получения ниобии путем электролитического рафипирооа-
ння в расплаве фторониобата калия [130].
Восстановление пятиокиси ниобия карбидом ниобия или углеродом
Для получения металлического ниобия в промышленном масштабе
восстановлением пятиокиси ниобия карбидом ниобия из смеси пятиокиси
и карбида прессуют штабики и нагревают их в вакууме при температуре
1600—1800°. Чтобы получить более чистый металл, продукт восстановле-
ния подвергают дополнительной обработке. Для этого первоначально полу-
ченный продукт анализируют, добавляют к нему приблизительно стсхно-
метрнческое количество карбида или пятиокиси ниобия и повторно спе-
кают. Таким путем может быть получен металл достаточно высокой степени
чистоты. Однако для ряда важных целей необходим металл с низким содер-
жанием углерода и кислорода. В этом случае требуется дополнительное
рафинирование. Связанные с ним операции описаны в других разделах
этой главы.
При восстановлении пятиокиси ниобия углеродом температура про-
цесса должна быть 2000°, а остаточное давление — не более 1 ¦ 10амм рт. ст.
Восстановление хлорида ниобия металлическим натрием
Подробные сведения о промышленном способе получения ниобия вос-
становлением металлическим натрием не опубликованы. По аналогии
с подобными способами получения титана и циркония можно осуществить
процесс взаимодействия расплавленных пентахлоридов ниобия с расплав-
ленным натрием, плавающим на поверхности расплавленного хлорида
натрия в соответствующем реакционном сосуде. Пентахлорнд ннобня вос-
станавливают до металла, получающегося в виде порошка илн гранул, кото-
рые затем опускаются на дно реакционного сосуда. Образующийся хло-
рид натрия является побочным продуктом. Полученный металл периодиче-
ски удаляют, измельчают и подвергают выщелачиванию для удаления соли:
затем металл соответствующим образом спекают.
В этом процессе либо пары пентахлорида приводятся в контакт с рас-
плавленным натрием, либо оба они взаимодействуют в парообразном состоя-
нии. Несомненно, основной задачей является замена периодических про-
цессов непрерывными, причем натриетермическое восстановление легче
поддается такой замене, чем магниетермическнй процесс. Натрий в этих
процессах имеет некоторые преимущества перед магнием. Натрий легче
очистить, так как он имеет более низкую температуру плавления и более
высокое давление пара, чем магний. Поскольку хлорид натрия менее гигро-
скопичен, чем хлорид магния, губка, полученная в результате натрис-
термического восстановления, содержит меньше влаги, чем губка, полу-
ченная при магннетермическом восстановлении.
В патенте США 150] описано восстановление пентахлорида ниобия
амальгамой натрия при перемешивании при низкой температуре.
Ниобий
435
Вода
Вода
ПОЛУЧЕНИЕ КОМПАКТНОГО МЕТАЛЛА И ЕГО ОЧИСТКА
В результате различных процессов восстановления ниобий получают
в виде мелкого порошка, небольших гранул или цилиндров. Для последую-
щей обработки до нужных размеров его необходимо превращать в компакт-
ные слитки. Обычно неоходима дополнительная очистка, поскольку металл
часто содержит очень большие количества нежелательных неметаллических
примесей (в основном углерод, азот и кисло-
род). Например, весовой анализ показывает,
что типичный образец ниобиевого порошка,
считавшегося в 1957 г. материалом высокой
степени чистоты, содержал 1,2% кислорода,
0,29% азота и 0,10% углерода. Содержа-
ние неметаллических примесей в ниобиевом
порошке, полученном от другого поставщи-
ка в тот же период времени, составляло
0,5% кислорода, 0,1% азота, 0,396 углерода
и 0,3% водорода. По анализам поставщиков
типичные ниобиевые пруткн в середине
1958 г. содержали 0.1% кислорода,
0,04% азота и 0,05% углерода. Для многих
целей требуется еще более чистый мате-
риал.
Для получения компактного рафини-
рованного ниобия применяются методы
спекания, капельной плавки в вакууме с
применением высокочастотного индукцион-
ного или электронно-лучевого нагрева,
иодидного рафинирования или дуговой
плавки с расходуемым электродом. Прутки
компактного ниобия далее могут быть очи-
щены методом зонной плавки.
Спекание [9, 35, 79, 98, 132, I57J
Этот метод получения компактного ме-
талла и его очистки применяется в про-
мышленности с 1930 г. Ннобиевый порошок
прессуют в штабики длиной 600—750 мм н
поперечным сечением 25 X 25 мм при давле-
нии 7 т/см2. В последнее время прессовали
штабики сечением 25 X 100 мм. Штабики,
предназначенные для прутков или прово-
локи, имеют квадратное сечение, а для
листов — прямоугольное сечение с шири-
ной по крайней мерс вдвое больше толщи-
ны. Спрессованные нз порошка штабики
должны быть достаточно прочными, чтобы
их концы можно было закреплять в водо-
охлаждаемых зажимах высоковакуумной
печи для спекания (рис. 2) и нагревать, пропуская через них ток.
Для этих целей можно применять также индукционный нагрев. Этот
метод нагрева имеет то преимущество, что отсутствуют нсспеченные концы,
28*
Рис. 2. Аппарат для спекания
в вакууме. (Институт им. Бат-
тела).
1 — медная трубка, охлаждаемая водой;
2 — верхний контакт; 3 водиная ру-
башка: 4 — спрессованный штабик; 5 —
вольфрамовый зажим; 6 — резервуар;
7 — желоб для ргутн; 8 — чугунное ос-
нование; 9 — к вакуум-насосу.
436
Глава 19
которые всегда остаются при спекании пропусканием тока. Однако стои-
мость оборудования для индукционного нагрева выше, чем для прямого
нагрева. В обоих случаях для уменьшения тепловых потерь необходим
точный расчет оборудования.
Плотность штабиков, спеченных пропусканием тока, после первого
периода спекания составляет около 90% теоретической. Как правило,
самая высокая температура спекания находится в интервале 1700—2300°.
Спеченные штабики подвергают холодной обработке путем прокатки или
ковки с обжатием по толщине на 20% и повторному спеканию с целью
сваривания новых контактных поверхностей, образовавшихся при механи-
ческой обработке. В результате получают компактный металл с высокой
плотностью, почти не имеющий пор.
Предполагается, что при спекании происходит процесс рафинирова-
ния. При обезгаживании в интервале температур 500—1000е быстро выде-
ляется водород. Углерод и кислород удаляются при температурах выше
1400° в результате их взаимодействия с образованием окиси углерода, кото-
рая диффундирует к поверхности металла и откачивается. При темпера-
туре около 1800° начинает удаляться кислород, по-видимому, в результате
испарения окиси ниобия. При максимальной температуре спекания эта
реакция протекает медленнее, чем образование окиси углерода. Наконец,
азот удаляется путем обычного обезгаживания при температурах выше
1900°. Этот процесс идет значительно медленнее других. Очевидно, удаление
небольших количеств таких примесей при очень высоких температурах
и низких давлениях лимитируется скоростью диффузии к поверхности
металла содержащихся в нем газов. Степень рафинировании, достигае-
мая в процессе спекания, показана в табл. 2.
Таблица 2
очистка ниогатя при спскании
Материал
Условия спекания
темпера-
тура, °С
продол-
житель-
ность,
час
Порошок высокой степени
чистоты, продажный, >& 1
Спеченный штабик
Порошок высокой степени
чистоты, продажный, № 2
Спеченный штабик, прока-
танный в лист
(Исходный материал)
2150
(Исходный материал)
23ПП
3/4
Содержанке, рее. %
С
0,16
0,02
U, 18
0,001 -
—0,02
о2
1,2
0,24
0,71
0,005-
—U,018
0,29
A,043
И,Ш
0,002
—и,013
Источ-
ник
79
157
Капельная плавка [28, 29, 40, Г.З, 90, 140]
Плавка таких химически активных металлов, как ниобий, связана
с трудностями, вызванными их сродством к углероду, кислороду и азоту.
Например, металл при контакте с многими тугоплавкими материалами, из
которых изготовляют тигли, или с окружающей атмосферой захватывает
значительные количества кислорода.
Разработано несколько методов, позволяющих избежать или умень-
шить загрязнение металла. Одним из них является процесс капельной
плавки, при которой вертикальный стержень расплавляемого материала
медленно опускается в поле индукционной катушки таким образом, что
Ниобий
437
нижний конец стержня непрерывно плавится. Расплавленные капли падают
в охлаждаемый водой медный тигель. Возможен и другой вариант, при
котором индукционная катушка может подниматься, а вертикальный стер-
жень закреплен неподвижно. Стержень можно изготовлять путем уплот-
нения илн выдавливания губкн, порошка или другого исходного материала.
Устройство для плавки ниобия, состоящее из стержня и тигля, должно
быть помещено в эвакуированную кварцевую трубку с индукционной
катушкой снаружи.
Позднее для плавки ниобия в достаточно большом масштабе стали при-
менять нагрев посредством электронной бомбардировки при остаточном дав-
лении не ниже 1 • Ю мм рт. ст. На рис. 3 показана применяемая установка.
Очищаемый слиток вводится в плавильное устройство через вакуумное
Рис 3. Электронно-лучевая
капельная плавка ниобия
(J. Metals, ГеЬгнагу 1959).
/ — входная камера; 2 — рабочая камера;
3 — исходный слитпк; 4 — высоковольт-
ный источник постоянного тока; 5 — элек-
трошмя пуйжа; в - входные камеры пуш-
ки; 7 — тигель, охлаждаемый водой; 8 —
Еытяпшатель слптка; 9— проплавленный
слиток; 10— камера для охлаждения слит-
kj; //—тарельчатый клапан; 12—диф-
фузионный иасос.
уплотнение сверху. На нижнем конце слитка электростатически фокусируют-
ся электроны высокого напряжения, эмитируемые согнутой в кольцо однови-
тковой вольфрамовой нитью.При плавке слитка капли металла падают в лужу
расплава, которая поддерживается на постоянном уровне благодаря непре-
рывному вытягиванию очищенного слптка вниз через выходное отверстие.
Во время плавки в значительной степени удаляются нежелательные при-
меси. Важной особенностью процесса является поддержание в расплавлен-
ном состоянии верхнего конца очищенного слитка (необходимая для этого
дополнительная энергия также подводится за счет электронной бомбарди-
ровки), в то время как остальная часть слитка с целью сведения до мини-
мума загрязнений поддерживается в охлаждаемом водой медном тигле. Для
получения слитка высокой степени чистоты требуется двойная переплавка;
при этом на 1 кг рафинируемого металла затрачивается 6,6—8,8 квт-ч.
Скорость очистки зависит от содержания загрязняющих примесей
в исходном слитке. При использовании слитков диаметром 75 мм скорость
первой плавки может составлять 4,5—6,8 кг/час, в то время как скорость
повторной плавки составляет около 35 кг/час. Это значение соответствует
скорости подачи слитка 107 см/час. Утверждают, что наряду со слитками
438 ' Глава 19
в качестве исходного материала с успехом можно применять порошок или
стружку. В случае применения неуплотпенного материала экран, защи-
щающий от брызг, служит анодом, подводящим ток высокого напряжения.
Наложенное электростатическое поле отклоняет электронный пучок на 90°,
направляя его на металл. Расплавленный металл разбрызгивается на экран
и
¦^! Z\
¦ "i P и с. 4. Печь для электронно-
• й лучевой капельной плавки.
и затем капает в тигель. В начале 1958 г. производительность самого мощ-
ного оборудования (печь на 120 кет) составляла 4,5 mlмесяц слитков диа-
метром 75 мм. Промышленная электронно-лучевая плавильная установка
показана на рис. 4.
Ниобий, полученный электронно-лучевой плавкой в лабораторном мас-
штабе, содержал 0,002 вес. % углерода, 0.0002 вес. % водорода, 0,001 вес.%
кислорода и 0,004 вес.% азота. Слнтки, очищаемые на промышленной
установке, диаметром до 100 мм и длиной 1067 мм содержат менее 0,01 вес. %
кислорода, менее 0,005 вес.% азота и менее 0.005 вес.% углерода.
В середине 1958 г. цена металлического ниобия высокой степени чистоты,
полученного и рафинированного электронно-лучевой плавкой, составляла
66 долл. за I кг при производительности 4,5 т/месяц. В табл. 3 показана
степень очистки, достигаемая при электрошю-лучевон плавке.
Иодидное рафинирование [32, J22, 147, 149]
Ниобий рафинируют иодидным методом, называемым иногда методом
Ван-Аркеля и дс-Вура. Исходный металл и небольшое количество иода
или иодид металла помещают в эвакуируемый сосуд, сконструированный
таким образом, что зона умеренной температуры н зона высокой темпера-
туры поддерживаются независимо. Это позволяет одновременно проводить
синтез и разложение иодида металла в той же аппаратуре. Иод служит
переносчиком металла в виде летучего иодида нз исходного материала на
поверхность, где происходит термическое разложение с образованием очи-
щенного металла и иода.
Обычно осаждение ведется на раскаленной нити, но применяют и
другие формы поверхностей. По возможности осаждение следует вести па
одноименный металл.
Ниобий 439
Этим методом получают металл в компактной форме с малым содержа-
нием неметаллических примесей, обычно в виде тонких стержней, называе-
мых «кристаллическими прутками». Хотя ночидный процесс применяется
в основном для сведения до минимума содержания неметаллических при-
месей, высококачественный рафинированный иодидный металл содержит
также мало металлических примесей.
Сообщается, что иодидный ниобий сразу после осаждения имеет твер-
дость по Виккерсу 64—80; его можно непосредственно перерабатывать на
прутки и листы путем ковки и прокатки. По данным одного исследования,
основной металлической примесью, переносимой из исходного материала
в кристаллический пруток, является тантал. Другие металлические приме-
си, присутствующие в исходном материале, например алюминий, железо,
марганец, молибден, кремний, титан и вольфрам, при соблюдении опреде-
ленных условий осаждения не были найдены в заметных количествах
в осажденном металле. В табл. 3 приведены результаты анализа ниобия,
рафинированного иодидным методом.
Дуговая плавка с расходуемым электродом [II, 87, 122, 125J
Этот метод позволяет получать главным образом ниобиевые слитки
большого диаметра, поскольку металл находится в расплавленном состоя-
нии очень короткое время и вакуум недостаточен для быстрого улетучи-
вания примесей. Однако следует учитывать дальнейшее усовершенствова-
ние этого метода. Из табл. 3 видно, что после двойной переплавки
иодидного металла в дуговой печи при пониженном давлении снижается
содержание в нем кислорода.
Бестигельное зонное рафинирование [21, 27, 70, 74—76, ПО, 127, 135]
Метод зонного рафинирования, разработанный первоначально для
очистки веществ, помещенных в лодочку, с соответствующими изменениями,
позволяющими избежать загрязнения материалом тигли, оказался эффек-
тивным для очистки компактного ниобия. Зона расплавленного металла,
создаваемая индукционным или электронно-лучевым нагревом, переме-
щается вдоль вертикально закрепленного пиобиевого стержня (мето^ «пла-
вающей зоны»), благодаря чему на одном конце происходит сегрегация при-
месей, более растворимых в жидком металле. При бестигельной зонной
плавке небольшого прутка (например, диаметром 10 мм) с применением
одного из вышеупомииутых методов нагрева обычно сохраняется первона-
чальная форма образца, что указывает на действие сил поверхностного
натяжения. Если же проводится бестигельная зонная плавка с поднимаю-
щейся зоной при индукционном нагреве, диаметр образца может быть на-
много больше, например 25 мм или более. В том случае, когда нагрев вне-
запно прекращается, расплавленный металл немедленно вытекает. Это слу-
жит доказательством, что гидростатическое давление расплавленного ме-
талла сдерживается поднимающим усилием, благодаря чему таким путем
можно рафинировать образцы большего диаметра.
Трудности, связанные с удержанием расплавленной зоны на образцах
большого диаметра, сводятся к минимуму при применении стержней ниобия
квадратного сечения или с ребристой поверхностью. Поскольку теплоотвод
с ребер лучше, чем из центра стержня, расплавленный металл оказывается
как бы заключенным в «клетку» из собственного материала. Для рафиниро-
вания ниобия в крупном масштабе этот метод не применялся.
Таблица 3
ОЧИСТКА НИОБИЯ ЭЛЕКТРОПНО-ЛУЧЫЮП ПЛАВКОЙ [] 10] И ИОДИДНЫМ РАФИНИРОВАНИЕМ Г122]
Материал
Порошок, выпускаемый промышленностью
То же после переплавки
Порошок «высокой степени чистоты»
То же после переплавки
Шихта в виде спеченных гранул
То же после рафинирования3
Листовой исходный материал
То же после рафинирования и двойной ду-
говой плавки в вакууме
Примеси, вес. %
О2
Fe
Ti
Электропн о-л ученая капельная плавка
0,25
0,01
0,02
0,0055
0,05
0,0075
0,01
0,003
0
0
0
<o
,03
,003
,005
,003
0
<o
<o
<o
,02
,01
.01
l0l
<0,0001
<0,0001
<0,0001
<0,0001
<0,U05
<0,005
<0,005
<0,005
Иодидное рафинирование
0,435
0,064
0,195
0,037
0,018
0,001
0,012
<0,001
0,05
<О,001
0,006
0,0011
—
<0,05
0
0
0
0
0021
,0008
—
0,004
0009 —
,0014
<0,005
<0,(iu5
<0,005
<0,005
<0,001
Твер-
дость
по Бри-
неллю
70—80
50—55
114
<200
63
а Другие примеси: <0,01%Мо, <0,05% W, <0,001% Си, <0,005%Sn, <0,001%
Порядковый номер
Атомный вес
Атомный диаметр, кХ
Атомный объем, см3/г-атом
Плотность, г/см3
Изотоп природный
Изотопы искусственные стабильные
Кристаллическая решетка
Постоянная решетки, А
Координационное число
Электронная конфигурация (для валентных
электронов)
Длина волны наиболее интенсивной спек-
тральной линии, Л
Поперечное сеченне захвата тепловых ней-
тронов (для нейтронов, обладающих ско-
ростью 22A0 м/сек), барн/атом
Работа выхода электронов, зв
Положительная ионная эмиссия, эв
Электрохимический эквивалент, мг/к
Магнитная восприимчивость, э.м.е.
Температура плавления, С
Температура кипения (вычисленная), °С
Теплота сгорания, кал/г
Теплота плавления3 (вычисленная),
кал/г-атом
Теплота испаренияа (при температуре кипе-
ния), кал/г-атом
Теплота возгонки, при 15°, кал/г-атом
273°
Теплоемкость твердого ниобия,
кал/г-атом ¦ град
15=
227"
727°
1227°
1727°
22273
При температуре плавленияа
Тснлосодержаниеа (при температуре плав-
ления), кал/г-атом
Энтропия, кал/г-атом-град
153
При температуре плавления"
Энтальпия при 15 , кал/г-атом
Свободная энергия при 15°, кал/г-атом¦ град
При температуре плавленияа
:тва ниобия
41
92,906
2,94
10,83
8,57
93
89, 90, 91, 92, 94, 95,
96, 97, 98, 99
Кубическая объемноцен-
триронанная
3,294
8
4d*5si
4058,94
1,15-|-0,05
4
5,52
0,1926
2,28-ID
2468±10
4927
2379
6400
166 500
172 530
171 800+490
5,95
6,14
6,62
7,10
7,58
8,06
8,25
17,05
8,73
23,51
1264
8,73
17,20
Таблица 4
[39J
[161)
[39|
[39]
[301
[162]
[39]
[39]
[391
[161]
[161]
[39]
[163]
[39]
[391
[391
[126]
[164]
[391
[164]
[164]
[1341
[1341
[1641
[164J
[1641
[164]
[164]
[1G41
[164J
[164]
[1641
[164]
[164]
[164]
[164]
а При температуре плавлении 2427°.
442
Глава 19
Продолжение табл. 4
Давление пара (при 2304 <Г< 2596), am
40 1G9
log Рат = - ~ у,—+8,872 (Т в "К)
2031 °С
2323 °С
Коэффициент теплопроиодностн.
кал/см-сек-град
0е
200°
400°
600°
Идеальное термическое сопротивление,
см- К¦ теплопроводность
15° К
90- К
Температура перехода. 'К
2,63-10-8
2,44-Ю-7
0.125
0,135
0,145
0,156
0,1
1,7
9,25
[134]
|134]
[39]
[144]
[144]
[1441
[156]
[156]
[136]
Коэффициент линейного расширения.
град '
20"
0—400° •
0—600°
0—800°
0—1000°
18°< / < 900"
L, = L0 (l-t-6,98-10-<tf+l,06-10-B?!)
Lo -длина при t=D
Удельное электрическое сопротивление,
мком ¦ см
0°
О1
18"
20 J
196°
Коэффициент электрического сопротивле-
ния, грай
18°
0—600°
7,1-10-е
7,39-10-е
7,56-10-е
7,72- Ю-"
7,88-10-6
13.5
15,22
14,8
14,6
2,7
0,00395
0,00396
[39|
[144]
[144]
[144]
[144]
[63]
[156]
[144]
[63]
[1651
[165]
[156]
[144|
ФИЗИЧЕСКИЕ СВОЙСТВА [39, 63. 93, 121. 126, 134, 144, 156]
Ниобий — металл цвета платины, мягкий и ковкий. Полированный
лист, подвергавшийся в течение длительного времени воздействию воздуха,
приобретает синеватый оттенок. Наиболее важные физические свойства
обия представлены в табл. 4.
Ниобий
443
МЕХАНИЧЕСКИЕ СВОЙСТВА [4, 64. 93. 94. 102, 112. 144, 155]
Механические свойства ниобия, как и многих других химически актив-
ных, но менее распространенных металлов, очень сильно зависят от степени
чистоты и предварительной обработки. Например, часто отмечалось влия-
ние механической обработки, термообработки, окружающей атмосферы
и облучения.
Данные, характеризующие механические свойства металлического
ниобия в различных состояниях, приведены в табл. 5.
В каждом случае была сделана попытка установить предысторию
испытуемого металла.
Таблица 5
МЕХАНИЧЕСКИЕ СВОЙСТВА НИОБИЯ
Материал: кованые прутки [Ш01
Анализ, всс.%: С 0,02; О2<0,05; N2 (J.02; Zr 0,05; Та 0,13
Свойства при комнатной температуре:
Предел текучести (о0>2), кг/мм2
Твердость по Роквеллу
Относительное удлинение (на длине 19 мм), %
Уменьшение поперечного сечения, %
При 1090' в аргоне:
Предел прочности при выдержке в течение 10A час, ке/мм^
Усталость при нагрузке 14 кг/мм1
(определялась с повышением нагрузки по 3,5 кг и затем 107 циклов
при максимальной нагрузке)
Материал: листы, выпускаемые промышленностью, толщиной 1 мм;
испытаны в направлении прокатки [63J
Предыстория: листы толщиной 3,2 лип, отожжены, прокатаны на холоду
до толщины 1 мм, отожжены в течение 30 мин при 110ии в вакууме
выше 1-Ю'6 мм рт.ст.
Атмосфера, в которой проводились испытания, не указана
47
71
16
90
9
2,6
,8
.1
¦10»
Темпера-
тура, -С
20
200
300
400
500
600
660
800
970
1030
Предел
пропорциональ-
ности,
кг/лл2
29,1
24,3
2U.6
22,4
19,7
12,5
11,1
10,3
8,2
6,9
11редел
прочности
при растяжении,
34,7
37,5
31,4
34,3
31,4
32,6
32,6
31,6
19,3
12,8
Относительное
удлинение
на длине
S 1,8 мм, %
19,2
14,2
13,2
13,3
9,6
17,5
22,4
20,7
37,5
42,5
Твердость
по Ьиккерсу
94
115
94
107
96
100
—
—
—
—
Продолжение табл. 5
Материал: прутки диаметром 3,2 мм обработаны [63] (зависимость моду-
ля нормальной упругости от температуры)
Анализ, вес. %: С 0,02; О2 0,015; N2 0,005; Та 0,35. Атмосфера, в
которой проводились испытания, не указана; предполагается,
что на вшдухе.
Температура, °С
Модуль нормальной уп- [()Ш ш 300 ш ]50 ]0 220 9 940
ругости, кг/мм2
Материал: лист 1,5 х 6,4 х 178 мм [166] (зависимость модуля нормаль-
ной упругости от температуры)
Анализ, вес. %: С 0,02; О2 0,019; N, 0,026; Та 0,07; Zr<0,03; Ti 0,014;
Fc 0,018. Слиток после электронно-лучевой плавки прокатан
на холоду в листы толщиной 1,5 мм с обжатием иа 90 %; об-
разец рекристаллизован путем вакуумного отжига при 1100°
в течение 2 час; образцы испытывались в пакууме
Температура. °С
Давление р-10~3,
мм рт. ст.
Модуль нормальной
упругости, кг/мм-
25
0,15
12 420
93
0,3
12 280
204
0,6
12 050
310
1
11900
427
2
11820
600
3
11495
800
4
11 145
900
4,5
10 935
Материал: лист, выпускаемый промышленностью [63] (влияние прокатки иа холоду
на твердость)
Уменьшение
поперечного
i-ечеиия, %
О"
10
20
30
40
50
60
Твердость па Внккерсу
в направлении,
перпендикулярном
пнпрввлению прокатки
84
104
118,5
128.5
136,5
142,5
148
в направлении,
параллельном направле-
нию прокат ки
84
104
113,5
119
123
128
132,5
u Полностью отожжен; сколов на образцах не замечено.
Материал: лист, выпускаемый промышленностью, отожжен; результаты
анализа не приведены [157] (зависимость твердости от про-
катки на холоду)
Уменьшение
толщины, %
13,5
17,5
30,4
36,3
Твердость
По Внккерсу
77
99
109
127
Уменьшение
толщины, %
48,5
75
90,6
95
Твер-
дость ПК
Внккерсу
144
157
169
173
Продолжение табл. 5
Материал: (пруткн?) [ 144] (влияние кислорода на механические свинства
при комнатной температуре)
Значения относительного удлинения измерены неравномерно вследст-
вие разрушения некоторых образцов в зажимах
Содержание
кислорода,
нес. %
0,03
0,161
0,208
0,279
0,315
0,371
0,41
Средняя
твердость
по Внккерсу
87
194
208
248
278
314
331
Предел
пропорциональ-
ности, кг/мм%
19,7
42,8
48,4
54,3
68,3
74,2
75,6
Предел
ПРОЧНОСТИ
при растяжении,
/f.-/jMAB
28,7
53,4
63,8
69,4
95,6
95,8
92,0
Относитель-
ное
удлинение,
%
29,3
1G,9
17,7
20,7
20,5
10,4
9,8
Материал: выпускаемый промышленностью [63] (результаты испытания
на ползучесть)
Темпера-
тур.,, ос
400
500
600
Напря-
же|
кг.'
6
9
12
12
6
12
12
15
6
9
Материал:
Темпер
тура, о
600 =
600 6
600в
700"
700 в
700 "
а-
С
Напря-
жение,
кг/мм*
7,8
9,4
G,3
1,6
3,2
4,7
0
1
ие.
мл2
,3
,4
,5
,5
,3
,5
,5
,7
,3
,4
Продолжительность
испыт-ший (час)
при деформации
0,05%
160
115
20
22
—
90
85
22
27
15
0,19
880
445
П,2%
2020
120 645
152
—
195
140
59
ПО
60
608
—
—
390
123
470
«чистый» [144]
Мнни-
мальнаи
скорость
ползу-
чести,
мк;мм ¦ час
0,44
0,58
0,86
0,87
0,52
0,53
0,24
5.3
1,6
0,2
Продолжительность
испытаний (час) при Продпл-
деформацнн житель-
ЫПГТ1.
.05%
5
40
50
40
80
120
0.1%
1 ,5
130
160
290
205
220
0.2%
35
315
испыта-
n ,D, ний,
о.з% час
_
1160
860 2130
15E0
550
540
1495
1115
1359
5519
2314
5008
3335
Продол-
житель-
ность
испыта-
ний, vac
1819
2700
1600
1536
362
725
1870
338
1325
2117
Общая
цеформа-
ция
ползу-
чести,
%
1,08 г
0.306
0,22
0,36
0
40
Общая
дефор-
мация
ПОЛ 1у-
чести, %
0,145
0,224
0,286
0,289
0,037
0,171
0,270
0,345
0,340
0,198
Содержа и
кислорода
до испы-
1.1 IIII»
0
0
0
0
0
0
не
%
после
шпита-
ния
015 <
04
04
04
04
01
<
<
:o,i
0.19
0,21
0,22
;o.i
:o,i
а Прессованная и отожженная пластина.
б После прокаткн.
11 Кованые прутки.
г Минимальная скорость ползучести 2,3 мк,мм-чпс.
446 Глава 19
ХИМИЧЕСКИЕ СВОЙСТВА [39]
Ниобий — металл подгруппы тантала V группы периодической табли-
цы. Наиболее устойчивый окисел ниобия (пятиокись) характеризуется
кислотными свойствами; его галогениды летучи, неполярны. В состоянии
низшей валентности ниобий проявляет основные свойства. На рис. 5 пока-
зано соотношение электродных потенциалов ниобия при различных валент-
ностях.
Как химически активный металл, ниобий легко окисляется при доволь-
но низких температурах; его обработка даже при низких температурах
должна производиться в вакууме или тщательно очищенном инертиом газе.
Обычно вследствие образования защитных окисных пленок [148]
в неактивных растворах ниобий не корродирует в широкой области зна-
чении рН. Однако активная природа ниобия проявляется в быстром рас-
творении в плавиковой кислоте, в которой не образуются защитные окисные
Nb - Nb-4+ ¦ Nb2O5
?0 = 0,65 в
Nb = Nb-4+ 1-Зе-
2Nb | 5H2O = Nb2O6+KlHi Ke~ ?« -0,65в
Р н с. 5. Изменение потенциала ниобия в кислом,
растворе при 25°.
пленки. Не вызывает сомнений, что в основном ниобий менее коррозион-
ностоек, чем тантал [56]. Ниобий медленно поддается действию тех реаген-
тов, по отношению к которым тантал инертен, и быстро реагирует с дру-
гими. Во всех случаях, когда во влагосодержащих материалах тантал кор-
родирует, ниобий также неустойчив. Можно привести несколько приме-
ров: ниобий менее пригоден, чем тантал, для применения в царской водке,
в соляной или серной кислоте. Хотя ниобий не поддается действию азотной
кислоты при температурах до 100°, в смеси азотной и плавиковой кислот
металл быстро растворяется. Горячие концентрированные соляная, сер-
чая и фосфорная кислоты действуют на металл, тогда как горячая концент-
рированная азотная кислота не действует. При комнатной температуре
металл не поддается действию серной, соляной, азотной, фосфорной, вин-
ной, молочной, уксусной и хлорной кислот, царской водки, 5"о-ного фенола,
аммиачной воды, 30%-ной перекиси водорода и 10%-ного раствора хлорно-
го железа. При действии кислот на металл медленно выделяется водо-
род, охрупчиваюший его. Например, хотя, как сообщается, скорость кор-
розии образца ниобия в 10% -ной щавелевой кислоте при 21° составляет
только 0,015 мм/год, образец становится хрупким через 82 дня. Вообще
следует избегать применения ниобия в качестве катода в гальванической
паре в электролите, поскольку водород охрупчивает его, вызывая разру-
шение.
Согласно последним исследованиям Тингли [143], ниобий значительно
менее устойчив в щелочных растворах, чем тантал. В 10%-ном растворе
едкого натра при комнатной температуре в течение 210 суток скорость кор-
розии найдена равной 0,012 мм/год: наблюдалось значительное разъедание
образцов в местах контакта раствора и погруженных резиновых упоров,
поддерживающих испытываемую проволоку. В 1%-ном растворе едкого нат-
КОРРОЗИОННАЯ СТОПКОСТЬ ПИОЬИЯ В РАЗЛИЧНЫХ СРЕДАХ
Таблица 6
Среда
HCI. раяб.
HCI, разб.
HCI, 18%
HCl, конц.
HCIt конц.
11C1, конц.
HCI, конц.
HNO3, разб.
HNO3, конц.
HNO3, конц.
lHNO-s, 2HC1
1HNO3, 2HC1
H2SO4, 20—25»,,
II2SO4, 20%
H2SO4, 20- 25%
HoSOt, конц.
H2S(L, 98%
H2SO4, 98»,,
H2SO4, 98%
H2SO4, конц.
H2SO4, конц.
H3PO4, 85%
HjPO4, 85%
HF, разб.
HF, разб.
HF, раэб.
HF, конц.
(CO2HJ 10%
Na3CO3 20%
NaOH, разб.
NaOH, разб.
NaOH, 1%
NaOH, 5%
NaOH, 5%
NaOH, 10%
NaOH, коиц.
NaOH, конц.
Температура,
20
100
19 26
19 26
20
100
ПО
20
19—26
100
19—26
50—60
20
95 100
100
19- 26
20
21
100
145
175
19 -26
100
20
100
20
100
21
100
20
100
100
100
100
Комнатная
20
100
i
I Продолжи-
тельность
испытаний,
ryiKH
—
36
36
—
67
7
—
36
-
35
1
—
4
-
36
3650
—
30
1
36
31
—
—
—
82
50
210
5
210
210
_
Скпрость
коррозии,
мм/год
0,0102
Нет
0,0000
0,0031
0,0025
0,1016
0,1016
Нет
0,0000
Нет
11,0005
0.0254
Нет
0,0005
Нет
0,0005
0,0023
0,0025
0,4826
4,5720
41,0680
0,0005
0,0838
Быстро
в
0,0152
0,0330
0,0251
0,4572
0,7366
1,1938
2,5400
0,0122
Быстро
а
Качество
образца после
испытания
—
—
—
—
Хрупкий
—
—
Частично
охрупченный
i
Хрупкий
Полностью
растворился
—
Хрупкий
—
Хрупкий
>
»
Литера-
туре
55
55
139
139
55
145
139
55
139
55
139
139
55
139
55
139
55
145
55
139
145
139
145
145
145
145
145
139
139
139
139
143
139
143
143
55
55
448
Глава 19
Среда
кон, 1"„
КОН, 5%
КОН, 5%
Н2О2, 30%
FeCl3 Ш"о
СаС12 73%
Влажный С12 (газ),
содержащий йрызги
растворов солен
Температура,
100
100
100
21
19 26
197
Кипящий на
воздухе
96
Продолжи-
тельность
испытаний.
СуТКИ
210
5
210
61
36
36
203
Продолжение
Скорость
КОрриЗИН,
мм/гад
0,6100
1,194
2,540
0,0051
0,0000
Нет
»
Качество
образца после
испытании
Хрупкий
X
»
Ковкий
-г-
табл. 6
Литера-
тура
143
139
143
139
145
49
49
ра при 100° скорость коррозии составляет 0,74 мм/год, причем проволока
становится совершенно хрупкой. В 1 %-ном растворе едкого кали при той же
температуре скорость коррозии найдена равной 0,61 мм/год; в этом слу-
чае охрупчивание было значительно меньше. В 5%-ных растворах едкого
кали и едкого натра при 100° ниобий подвергается сильной коррозии; сред-
няя скорость составляла около 2,5 мм/год, причем она возрастала к концу
испытаний. Проволока разъедалась по всей длине, становясь чрезвычайно
хрупкой. Установлено, что хрупкость появлялась вследствие образования
гидрида, который на микрофотографиях имеет вид игольчатых кристаллов.
В результате отжига в вакууме при 1000° в течение 4 час пластичность нио-
биевон проволоки восстанавливалась.
В табл. 6 представлены данные о коррозионной стойкости ниобия
в различных средах при комнатной и повышенной температурах.
Ниобий противостоит действию воды при высоких температурах, рас-
плавленных металлов (висмута, натрия и сплавов натрий — калий) и дру-
гих сред, часто при очень высоких температурах в особо неблагоприятных
условиях, создаваемых в ядерных реакторах многих типов. Ниобий не
корродирует и не охрупчивается при действии натрия или сплавов натрий —
калий даже при температурах выше 800° при условии, если эти
жидкие металлы содержат менее 4-10 3 вес. 96 кислорода [38, 95|. Несмотря
на то что опубликовано мало результатов испытаний, ниобий считает-
ся хорошим конструкционным материалом для применения в ядерных
реакторах.
Устойчивость ниобия к переносу масс в расплавленном свинце [25]
была определена с помощью небольших кварцевых контуров с конвекцией
тепла. Испытания проводились при 800°, градиент температуры контура
составлял 300°. Ниобий проявил высокую устойчивость к переносу масс
и к коррозии: прн испытаниях, длившихся до 545 час в описанных выше
условиях, не наблюдалось заметного действия. Из металлов лишь молиб-
ден ведет себя так же, как ниобий.
На рис. 6 указаны некоторые химические свойства ниобия, а в табл. 7
приведены термодинамические данные, касающиеся ниобия и некоторых его
соединений.
Ниобий
449
CCL,
(или фосген)
» Г№СЦ ¦
— NbCL3
M9 WbV,
KF (раствор)
K2Nb0F5 .
(Оксифториа)
Рис. 6. Химические реакции ниобия [36].
NbCIa — твердое вещество бледно-желтого цвета; NbCl, -твер-
дое вещество черного цвета; NbFfi — гшроскопичное твердое ве-
щество белого циста; NbH твердое вещество черного цнега;
NbC—твердое вещество желто-коричневого цвета.
Таблица 7
ТРРМОДИНАМИЧССКИЕ СВОЙСТВА3 ТВЕРДЫХ СОЕДИНЕНИЙ
НИОБИИ ПУИ 25° [ЗУ]
Соединение
NbzO?
Nb2O6
NbC
NbN
Д H°
-387,8
455,2
—30
—59
Д F°
-362,4
-422,9
—29,6
—55
B9,2)
32,8
I (—85,2)
(—108,4)
—1,4
( 20)
a Значения, приведенные в скобках, получены расчетным путем
или ненадежны.
О или Nb(>2.
Реакции ниобия с газами и углеродом; образование соединений
Физические и механические свойства ниобия в значительной степени за-
висят от примесей кислорода, азота, углерода и водорода, поэтому для глу-
бокого понимания технологии этого металла и его поведения необходимо
рассмотреть реакции ниобия с этими элементами, а также образующиеся
соединения. Заслуживают внимания также галогениды ниобия, значение
которых в промышленности возросло.
Например, в табл. 8 показана глубина проникновения кислорода в нио-
бий в течение 16 час при различных температурах. Установлены [112] сле-
дующие зависимости для скорости диффузии (в см21сек) азота и углерода
в*нио0ий при умеренных температурах (до 300е):
для азота D=0,(>072 ехр (-34800/ЙГ),
для углерода D=0,004(i exp (-33 300/RT).
Прямым следствием абсорбции водорода ниобием является сильное
охрупчиваиие его в атмосфере водорода при повышенной температуре
или в кислом растворе, когда металл служит катодом.
29 Заказ » 239
450
Глава 19
Таблица 8
ЭФФРКТИВНАЯ ГЛУБИНА ПРОНИКНОВЕНИЯ
КИСЛОРОДА В
Температу-
ра, "С
540
650
760
Глубина
проникнове-
ния кислоро-
да, мм
0,1
0,1
0,3
НИОБИИа
Темпера-
тура, °С
870
980
1090
[100]
Глубина про-
никновения
кислорода,
мм
0,8
1,0
>2,5
а Проводились испытания образцов диаметром 9,5 мм
11 длиной 12,7 мн Б течение 16 час при укцзлшои тем-
пературе.
Кислород. Окисление ниобия широко изучалось [15, 22, 53, 55, 71,
78, 129], поскольку малая стойкость его по отношению к кислороду, несом-
ненно, является одним из самых серьезных недостатков. Этот недостаток
должен быть устранен, чтобы ниобий можно было применять при высоких
температурах в тех случаях, где полезны его другие превосходные свой-
ства. В следующих разделах дано краткое описание некоторых способов
защиты ниобия.
До настоящего времени получены следующие данные. Скорость окис-
ления в интервале температур 250—375° при давлении 76 мм рт. ст. имеет
параболическую зависимость; энергия активации составляет 22 800 кал /моль.
В этих условиях образуется тонкая пленка, принимаемая за моноокись
ниобия. Реакция с влажным и сухим воздухом в интервале температур
400—1200° вначале подчиняется параболическому закону, однако после
нагревания в течение 21 час при 400° наблюдается линейная зависимость;
линейной зависимости следует также реакция окисления, при которой об-
разуется незащищающий окисиый слой [24] в интервале 600—1200°. При
1000—1200° испытуемые образцы в форме прутков окисляются быстрее,
чем листы. По сообщениям, энергия активации составляет 13 400 ксы/моль
при 600—900° и 4350 кал/моль при 900—1200°.
Исследования окисления при высоком давлении, в результате которых
была установпена линейная зависимость, показали также, что скорость
окисления очень чувствительна к давлению.
Теплота реакции, найденная экспериментально при температуре
600—1100° и нормальном давлении кислорода, составила 5410 кал/моль.
Выше 1100° скорость окисления еще больше. Окись, образовавшаяся в изу-
ченном интервале температур, состоит из двух слоев: темного нижнего слоя
ориентированных кристаллов пятиокиси и моноокиси и верхнего пористого
слоя белой пятиокиси ниобия. Теплота активации для окисления во влаж-
ном воздухе в интервале 600—1200° составляет 10 100 кал/моль. Сделан
вывод, что скорость реакции определяется диффузией кислорода через
темный нижний слой.
Из описанных окислов ниобия пятиокись имеет самое большое значе-
ние, так как при нагреваиии в нее переходят все другие окислы. Она может
образоваться также при непосредственном сжигании металла или его
соединений (например, карбида) или при дегидратации ниобиевой
Ниобий 451
кислоты*. Твердая пятиокись ниобия в зависимости от температуры существу-
ет в одной из трех аллотропических модификаций [14]. «Низшаяформа, изо-
морфная с пятиокисью тантала**, устойчива до 900 . «Средняя» форма
существует в интервале 1000—1100е и переходит в «высшую» форму при
температурах выше 1100°. Двуокись ниобия, полученная восстановлением
пятиокиси водородом, описана как темный порошок, имеющий кристал-
лическую структуру, аналогичную структуре рутила (для двуокиси ниобия:
а = 4,84 А, с — 2,99 Л, с/а = 0,618). С целью изучения окислов с мень-
шим содержанием кислорода проводилось спекание смеси двуокиси ниобия
с углеродом в различных соотношениях. Существование моноокиси ниобия
подтверждено рентгеноструктуриым анализом, однако существование
ЫЬгО3 сомнительно. Моноокись ниобия описана как порошок черного цвета.
Аяот. Азоту, как примеси в ниобии, уделялось меньше внимания, чем
кислороду. Ранее при обсуждении процессов рафинирования ниобия при
спекании указывалось, что азот можно удалять, хотя и очень медленно,
путем простого обезгаживания ниобия в вакууме при температуре 1900°
и выше.
Как следует из ранее сделанных выводов, а также судя по положению
ниобия в периодической таблице, его нитриды менее устойчивы, чем нит-
риды тугоплавких элементов IV группы. Однако существование мононитрн-
да ниобия NbN установлено вполне определенно, в то время как соединение
Nb3N6 охарактеризовано недостаточно. Нитриды образуются при непо-
средственном синтезе (выше 600°), а также при взаимодействии окиси или
галогенида ниобия с азотом в присутствии водорода. На воздухе нитриды
легко окисляются с выделением азота. Большой интерес в течение некото-
рого времени представляла сверхпроводимость мононитрида NbN при 15.2°
[34, 68, 69] — третьей из наиболее высоких температур, известных для
перехода вещества в сверхпроводящее состояние, так как в связи с этим
он может найти применение как конструкционный материал для боломет-
ров*** [5, 47, 48, 89],
Углерод. Этот элемент реагирует непосредственно с ниобием (выше
1200е) с образованием монокарбида (NbC), который устойчив до 2500е в азо-
те, ио незначительно декарбидизируется при нагревании на воздухе [ 124].
Монокарбид ниобия может быть получен путем взаимодействия металла
с углеводородами или окисла со свободным углеродом. Микрокристаллы
монокарбида ниобия были получены также методом Мак-Кенна 196] при
взаимодействии металла или его окисла с углеродом в расплавленном метал-
ле при 1800—2000°. Покрытия из монокарбида ниобия толщиной до 0,5 мм
на графите, представляющие большой интерес в ядерной технике, можно
наносить путем специально разработанного метода осаждения из газовой
фазы [13]. На рис. 7 показана микроструктура монокарбидпого покрытия
* Очевидно, имеется в виду гидратироваииая Nb2O5 ¦ *Н2О, которая может
быть осаждена из водных растворов ниобата калкя. Нио'бат калия — производное
ниобиевой кислоты, которая в свободном виде не выделена.— Прим. ред.
** Пятиокись ииобия имеет псевдогексагональную ромбическую кристалли-
ческую структуру; параметры решетки о = 6,1В;^Г>,03 А, 6=3,65^-0,02 А и
с = 3,94 + 0,02 А. Координаты атомов металла @ 0 0) и (Уг % 0).
*•* Болометры — приборы для измерения энергии излучения; принцип действия
их основан на изменении электрического сопротивления проводников при нагрева-
нии.— Прим. ред.
29*
452
Глава 19
на графите, полученного осаждением из газовой фазы, а на рис. 8 указаны
температура и давление, при которых может быть получен карбид. По внеш-
нему виду осажденный монокарбид имеет яркий металлический блеск
с розоватым оттенком.
Водород. Система ниобий — водород изучена детально [1,97]. Усло-
вия равновесия (давление — температура — состав) этой системы опреде-
лялись в интервале 100—900°, 10—
1000 мм рт. ст. и для атомных отно-
шений водород/ниобий,равных 0,01—'
0,85. Абсорбция водорода сопрово-
ждалась образованием однофазного
твердого раствора в большей части
системы. При температуре около 300"
и давлении 8 мм рт. ст. обнаружена
Рис. 7. Покрытие NbC, нане-
сенное осаждением из газовой
фазы на графите (Институт
им. Баттела).
150В 7700 1900 2100 2300
Температура графита. "С
Рис. 8. Условия образования по-
крытия NbC при осаждении из паро-
вой фазы ни графите (Институт
им. Баттела).
/—реакции не пронгходит: //—образова-
ние NbC; ///—отложение Nb if образова-
ние NbC.
двухфазная область для атомных отношений водород/ниобий 0,21 0,42.
При низком содержании водорода равновесная растворимость примерно
равна корню квадратному на величину давления. Это указывает иа то, что
водород абсорбируется в атомариом состоянии. Параметр решетки и теплота
растворения возрастают с увеличением концентрации водорода.
Галогены [2, 3, 26, 39, 44, 45, 82, 147]. Галогениды ниобия образуются
при непосредственном взаимодействии ниобия с галогенами. Они могут
быть получены также путем обработки пятиокиси ниобия галогенами
в присутствии углерода или карбида ниобия. На рис. 6 показаны некото-
рые пути получения фторидов и хлоридов. Описан способ получения три-
фторпда ниобия, имеющего высокую химическую стойкость, путем обработ-
ки гидрида ниобия при 570" плавиковой кислотой в присутствии водорода.
Бромиды получают теми же способами, что и хлориды. Реакция металла
с иодом, как известно, протекает медленно. По сообщениям, образование
иодпда происходит быстрее при взаимодействии бромида с безводным йоди-
стым водородом.
Ниобий 453
Будучи неполярными, галогениды ниобия имеют сравнительно низкие
температуры плавления и кипения. Помимо описанных в этой главе, имеются
и другие данные о свойствах галогенидов ниобия, указывающие на то,
что эти соединения, вероятно, найдут применение как исходные вещества
при получении металла.
Бориды, силициды и интерметаллические соединения [23, 39, 77,
85, 86, 108, 150]. Бориды ниобия, из которых только моноборид плавится
без разложения, неустойчивы на воздухе при температурах 1100—1200°.
Большое электрическое сопротивление, хорошая отражательная способ-
ность и низкая летучесть боридов ниобия позволяют применять их в каче-
стве нагревателей печей сопротивления и индукционных печей, а также
для теплоизоляционных экранов. Эти соединения имеют сравнительно высо-
кую твердость при повышенных температурах, в связи с чем они являются
хорошими высокотемпературными абразивными материалами.
Силициды Nb4Si, NbsSi.i и NbSi2 получают спеканием и дуговой плавкой.
Для них не характерны ни высокая твердость, ни стойкость против окисления.
Хотя сообщения об интерметаллическнх соединениях ниобия весьма
немногочисленны, все же идентифицированы соединения NbBeI2, NbGe2,
NbGeo,G-±o,o5, NbGeo,5.i+o.CG и Nb3Ge. Интерметаллическое соединение
Nb3Sn имеет самую высокую температуру перехода в сверхпроводящее
состояние, равную 18,0°К [167].
МЕТОДЫ АНАЛИЗА
Методы анализа, разработанные в многочисленных исследованиях,
касающихся ниобия, имеют несколько основных назначений, и их можно
подразделить следующим образом.
1. Количественные методы анализа ииобийсодержащих руд и мине-
ралов. Они выбираются в зависимости от характера анализируемого мате-
риала. Поскольку известно, что многие старые методы, на которые все
еще ссылаются в некоторых современных работах, не точны, необходимо
тщательно выбирать методы анализа. За границей при анализе руд и мине-
ралов применяется рентгеновский флюоресцентный метод [106].
2. Методы определения ниобия, присутствующего в качестве примеси
в других веществах. Для этих целей широко применяются спектрохимиче-
ские методы [73, 1521. Применяются также мокрые методы [84, 91]. Методы
анализа, применяемые для оценки методов разделения ниобия и тантала,
должны быть весьма чувствительными. Некоторые методы можно приме-
нять для разделения как микроколичеств, так и больших количеств ниобия
и тантала, в связи с чем они представляют ценность.
3. Методы определения различных металлических и неметаллических
примесей в ниобии, особенно при анализе металла высокой чистоты. Эти
методы имеют большое значение. В одном методе [7] применяется диф-
ференциальная спектрофотомстрия для полного анализа металла высокой
чистоты, в другом [6] определяется только ниобий.
Описаны специальные методы определения следующих металлических
примесей в ниобии: кадмия [107], меди [115], железа [16, 1181, марганца
[116], молибдена [114,117]. тантала [142], титана [30, 118], вольфрама [117]
и циркония [118].
Точное определение неметаллических примесей, в особенности газов,-
становится очень трудным при их содержании порядка 0,0004%; иеобхо-
454 Глава 19
димо разработать достаточно чувствительные методы анализа. Содержание
углерода определяется путем сожжения (при содержании до 0,0296) или
специальными кондуктометрическими методами (при содержании 0,002%).
Кислород можно определять путем вакуумной экстракции, т. е. плавки или
дистилляции. Водород определяется чаще путем вакуумной плавки, азот
микрометодом Кьельдаля, растворением с отгонкой растворителя и мето-
дами сплавления с щелочами. Подробно описаны методы определения
в ниобии кислорода, азота и водорода [52, 57, 59, 60, 101].
Поскольку технология получения ниобия постоянно совершенствуется
и приходится анализировать металл все более высокой степени чистоты,
для правильной оценки степени чистоты металла, вероятно, потребуются
специальные методы концентрирования и нейтронно-активационного ана-
лиза.
МЕТАЛЛОГРАФИЯ [17]
Разработаны соответствующие методы приготовления образцов ниобия
для металлографического исследования.
Образцы разрезают с увлажнением с помощью абразивного круга
на резиновой связке. Грубую шлифовку производят с увлажнением на
круге с помощью шкурки № 180 при окружной скорости 840 м/мин. Бо-
лее тонкую шлифовку производят на мелкозернистых карборундовых кру-
гах (№ 240, 400 и 600) со скоростью 1200 об/мин. Чтобы обеспечить
минимальное внедрение частиц абразива в поверхность шлифа, а также
для его охлаждения и смазки можно применять увлажнение водой. Перед
полировкой часто бывает полезно повторить шлифовку на мелкозернис-
том круге (№ 600).
Полировку ниобия осуществляют в две стадии. Начальную грубую
полировку производят на быстроходном круге A750 об/мии), покрытом
материалом «мираклоз»*, на поверхность которого периодически наносят
водную суспензию порошка окиси алюминия (алундового порошка) и раз-
бавленную B-59о-ную) хромовую кислоту. На этой стадии полировку
проводят при сильном или среднем нажиме до полного исчезновения
следов царапин и удаления внедренных в поверхность шлифа частиц
абразива. Если образец не содержит включений или фаз сплавов, легко
поддающихся воздействию травителя, то на этой стадии можно прово-
дить и травящую полировку.
Окончательная полировка проводится на круге, покрытом материалом
«микроклоз» со скоростью 250—500 об/мии. В качестве полирующего ма-
териала успешно применяется водная суспензия алундового порошка.
В начале окончательной полировки при удалении частиц металла, остав-
шихся после грубой шлифовки, иа поверхности шлифа могут появиться
новые царапины. Окончательную полировку ведут до полного исчезно-
вения царапин, причем заканчивают ее под слабым нажимом и при
очень малой скорости вращения круга.
Разработан весьма удовлетворительный метод травления образцов.
Смесь, состоящую из 30 мл азотной кислоты, 2 мл плавиковой кислоты
и 50 мл молочной кислоты, наносят кисточкой при комнатной температуре
иа поверхность образца на 1 мин или более. Фактически этот травитель
применяется для химического полирования образца, а не для травления
поверхности. Затем поверхность образца обрабатывают приблизительно
* «Мираклоз» и «микроклоз» — торговые наименования фирмы сБюлер» (США,
штат Иллинойс).
Ниобий 455
в течение 5 сек смесью, состоящей из 10 мл азотной кислоты, 10 мл
плавиковой кислоты и 30 мл молочной кислоты, при комнатной темпера-
туре; затем поверхность смывают, образец сушат и определяют степень
его травления. Если необходимо более глубокое травление, то процесс
повторяют еще один или несколько раз. Активной составной частью
травителя является плавиковая кислота, концентрацию которой в смеси
в случае необходимости можно изменять.
ОБРАБОТКА МЕТАЛЛА ДАВЛЕНИЕМ, ИЗГОТОВЛЕНИЕ ИЗДЕЛИЙ
И ОБРАБОТКА РЕЗАНИЕМ
Большинство сведений, касающихся применения ниобия в качестве
конструкционного материала для изготовления из него различных форм,
например пластин, прутков и проволоки, получено в результате опыта,
накопленного для металлокерамического ниобия. Вместе с тем в настоящее
время с увеличением габаритов компактного металла, получаемого дуго-
вой и электронно-лучевой плавкой в вакууме, возникла необходимость
в упрощении технологии обработки слитков. Однако, если требуется свести
к минимуму загрязнение металла атмосферными газами, все операции ков-
ки, гибки, штамповки и глубокой вытяжки приходится проводить при ком-
натной или лишь немного более высокой температуре. Кроме того, следует
принимать во внимание склонность ниобия к наволакиванию и задиранию,
до некоторой степени подобно нержавеющей стали. Однако ниобий превос-
ходит нержавеющую сталь в отношении сопротивления разрыву.
Спеченные в вакууме штабики ниобия, полученные методом порошко-
вой металлургии, пористы и, как указывалось выше, должны быть обко-
паны на холоду тяжелым молотом до степени обжатия около 20% [9].
Деформированные на холоду штабики вновь спекают, обковывают и спе-
кают еще раз с целью получения здорового беспористого металла.
Слитки ниобия, выплавленные в электроиио-лучевой печи (твердость
по Бринеллю 100 при нагрузке 500 кг), выдавливают при комнатной
температуре в заготовки [113]. Дальнейшее выа вливание труб произ-
водят также при 425° без промежуточного отжига. Общая степень дефор-
мации от слитка до трубы составляет 85%. Образец, вырезанный из внут-
ренней стенки трубы, имел следующие механические свойства: предел проч-
ности при растяжении 45,1- кг/мм2, предел текучести (ао,2) 43,5 кг/мм*,
относительное удлинение на длине 50 мм 9%. При выдавливании нио-
бия применялись стандартные смазки.
Влияние холодной обработки при ковке, штамповке или прокатке
металла становится достаточно заметным после обжатия с общим умень-
шением поперечного сечения 90%, что вызывает необходимость отжига
металла. Отжиг рекомендуется [38] проводить в течение 1 час при 1300—
1400° н вакууме (меньше 1 -10~3 мм рт. ст.).
Прокатку листов выполняют на обычных двух- или четырех-валковых
прокатных станах с валками небольших диаметров. Если конечной продук-
цией являются полированные листы, то необходимо применять соответ-
ствующие смазки. Прокатку ведут обычно с обжатием за один проход
на 5—10% и больше. Экспериментальное исследование [4] обработанного
на холоду листового ниобия показало, что его текстура аналогична текстуре
других металлов с объемноцентрированной кубической решеткой, напри-
мер а-железа. Ниобиевый лист имеет сильно волокнистую структуру, в связи
с чем его пластичность при поперечной прокатке мала. Она может быть
456 Глава 19
повышена только в результате термообработки с полной рекристаллиза-
цией.
Прутки можно изготовлять холодной вытяжкой или прокаткой, при-
меняя стандартное оборудование.
Вытягивание проволоки и труб связано с трудностями, обусловлен-
ными склонностью ниобия к наволакиванию и задиранию, поэтому особое
внимание следует уделять выбору материалов для инструмента и фильер,
а также смазки. Наиболее удовлетворительными материалами для инстру-
мента являются алюминиевые бронзы, хотя применяются также карбид
вольфрама и хромированные материалы с повышенной поверхностной
твердостью. Подходящими смазками являются обычно применяемые при
волочении воск и сульфониронянные жиры.
Очень высокое сопротивление разрыву, характерное для ниобия, пред-
ставляет собой ценное свойство при изготовлении труб [157]. Диски с отно-
шением толщины к диаметру от 1 : 48 до 1 : 60 являются исходными заго-
товками, подвергаемыми глубокой вытяжке на гидравлическом прессе.
Па этой стадии желательно обжатие от 47,5 до 51%. Полученные заготовки
формуют затем в трубы по стандартной технологии. На стадии изготов-
ления заготовок величина зерен материала имеет первостепенное зна-
чение, если должен быть сведен к минимуму так называемый эффект
«апельсиновой корки». При вытяжке труб обычно допускаются обжатия
по сечению на 35% за один проход при общей степени обжатия 60—80%,
причем для снятия внутренних напряжений необходим отжиг. Эти пределы
допустимой общей степени обжатия определяются указанными выше пре-
делами изменения отношения толщины заготовки к диаметру.
Ниобий штампуется тем же способом, что и малоуглеродистая сталь,
при этом для предотвращения наволакивания применяются особые меры
предосторожности. Можно применять стальные штампы, за исключением
тех случаев, когда происходит значительное расслаивание металла. В таких
случаях лучшие результаты получаются при работе со штампом из алюми-
ниевой или бериллиевой бронзы. При непродолжительной работе или
экспериментальных исследованиях можно применять низкотемператур-
ные сплавы (например, кирксит). Кроме того, может потребоваться
резиновая или воздушная амортизация.
При вырубке или перфорировании применяют стальные матрицы с рас-
стоянием между пробойником и матрицей, приблизительно равным 6%
толщины обрабатываемого металла. Испсльэование в качестве смазки легко-
го масла или четыреххлористого углерода уменьшает задирание матрицы.
Для придания ниобию фасонного профиля применяют выдавливание
на токарно-давильном станке. В этом случае технология обработки также
подобна применяемой для обычных металлов, ио профилирование нужно
осуществлять постепенно. Пригодны инструменты из алюминиевой бронзы,
а в качестве смазки — желтое мыло или жиры. Предварительную стадию
обработки можно выполнять с помощью деревянных оправок, для дово-
дочных операций необходимы оправки из малоуглеродистой стали. Вылав-
ливание ниобия требует продолжительных калибрований под небольшим
давлением, чтобы изделие имело однородную тслшину. Обработку рекомен-
дуется вести с окружной скоростью (по периферии детали) примерно
150 м/'мин.
Обработку ниобия резанием осуществляют обычными способами, при-
меняя резцы из быстрорежущей стали и высокие скорости резания A8—
30 м/мин), чтобы предотвратить истечение металла или наваривание его на
резец. Режущий инструмент должен быть остро заточенным и с положитель-
Ниобий
457
ным передним углом, насколько это позволяет прочность быстрорежущей
стали. На рис. 9 показаны типичные скосы и углы заточки инструмента.
Орошение детали четыреххлористым углеродом обеспечивает необходимую
защиту, но, поскольку пары этою вещества токсичны, требуется применять
соитветствующпе меры предосторожности. Для черновой обточки рекомен-
дуется скорость подачи 0.2—0,3 мм/об, для чистовой обработки — ие боль-
ше 0,125 мм /об. На практике при чистовой обработке следует избегать очень
малой глубины резания. При довольно большой глубине резания и малой
скорости подачи часто образуется поверхность лучшего качества, чем это
Направление
максимального
угла наклона
Разрез А-А
Рис. 9. Углы заточки резцов для токарной обработки
ниобия [38].
достигается при обычном сочетании режимов черновой и чистовой обработки.
Для доводки поверхности деталей, выточенных на токарном станке, можно
производить опиловку или обработку наждачным полотном; в качестве
смазки при этих операциях рекомендуется применять четыреххлористый
углерод.
Те же общие правила должны выполняться при фрезеровании, сверле-
нии, накатке и иарезке резьбы на ниобий. Рекомендуется применять фрезы
с вставными зубьями, имеющими большую боковую и заднюю поверхности.
Следует применять сверла из быстрорежущей стали с заточенным задним
углом поперечного лезвия, чтобы предотвратить истирание, и обильное
орошение четыреххлористым углеродом в качестве смазки. На ^аетглях
большого диаметра резьба нарезается чаще всего на токарном станке.
Метчики и плашки следует' очищать от стружки. В качестве доводочной
операции для ниобия шлифование применять не рекомендуется.
ТРАВЛЕНИЕ ПОВЕРХНОСТИ
Для травления ниобия межно применять различные методы и химика-
лии," за исключением горячих шелочей. Для химического травления
ниобия особенно рекомендуется насыщенный раствор трехокиси хрома
н юрячей концентрированной серной кислоте. После обработки в этом
растворе ниобий промывают горячей дистиллированной водой.
458 Глава 19
Перед нанесением электролитических покрытий [10] поверхность иио-
бия можно подвергать электролитическому травлению в плавиковой кислоте
с наложением переменного тока. Ванной служит концентрированная
D9%-ная) плавиковая кислота, поддерживаемая при комнатной темпера-
туре. Продолжительность травления составляет 1—3 мин при плотности
тока 0,2—1 а/смг. Серый налет, образующийся на подвергнутой травле-
нию поверхности, можно легко удалить смесью азотной и плавиковой
кислот перед электролитическим осаждением.
Подготовка поверхности ниобия перед сваркой рассматривается в соот-
ветствующем разделе.
НАНЕСЕНИЕ ЭЛЕКТРОЛИТИЧЕСКИХ ПОКРЫТИЙ [ 10]
На ниобии трудно получить плотно прилегающие электролитические
покрытия. Для нанесения железных покрытий разработай удовлетворитель-
ный способ, по которому железо вначале частично осаждают из сложной
ванны, состав которой приводится ниже, а затем образцы с нанесенными
покрытиями нагревают в течение 1 час при температуре около 820е в ва-
кууме 1-10~3 мм рт. ст. Для получения более хороших результатов
образец предварительно нагревают на воздухе в течение 2 час при 200°,
чтобы предотвратить образование пузырей. Слой электролитически оса-
жденного железа толщиной 0,0025 мм после такой обработки образует
диффузионно-срощенную поверхность, пригодную для последующего
осаждения, плакировки, пайки или нанесения покрытия погружением.
Состав ванны и условия нанесения железных покрытий:
FeSO4-7H2OJ
FeClr4H2O
(NH4JSO4
HCOONa
H3BO3
Увлажнитель а
Температура
Плотность тока
30U г/л
42 г/л
15 г/л
15 г/л
30 г/л
1 г/л
60°
0,032 а/см?
а «Дюпон ол ME», безводный, постав-
ляется фирмой сДюпон».
СВАРКА C7, 157, 160]
В промышленности ниобий сваривают тремя способами: сваркой сопро-
тивлением, дуговой сваркой под флюсом и дуговой сваркой в атмосфере
заднгного газа. Полуавтоматическая электронно-лучевая сварка ниобия
провинилась только экспериментально.
При сварке сопротивлением [ 159] применение даже очень высокого дав-
ления не обеспечивает достаточного контактного сопротивления между
частями, велгдетвие чего получить хорошие сварные швы трудно. При шов-
иой сварке сопрэтивлением труб кольцо из листового ниобия помещают на
большую медную оправку, которая служит одним из электродов. Другой
электрод, имеющий форму диска или кольца, обкатывает края свариваемого
металла. Последовательные электрические разряды способствуют образо-
Ниобий
459
ванию шва. Этот вид сварки обычно осуществляют автоматически под водой,
чтобы избежать окисления металла и получить более однородные сварные
швы. Точечную сварку ниобия можно производить на воздухе при неболь-
шой продолжительности контакта, порядка полупериода. В табл. 9 приве-
дены приблизительные данные, необходимые для выбора оборудования
для шовной сварки ниобия.
Таблица 9
УСЛОВИЯ ПРОВЕДЕНИЯ ШОВНОЙ СВАРКИ НИОБИЯ [38]
Толщн-
0,5
0,25
0,125
Нагрузка
на элек-
трод, кг
22,5
22,5
11,25
Шири-
коль-
ца, мм
3,2
3,2
3,2
Скп-
рость
-снар-
мм/мин
914
914
914
Циклы сварки
вклю-
чено
3
3
3
выклю-
чено
2
2
2
Напря-
жение
разом-
кнутой
цепи,в
1,6
1,3
0,8
Напряже-
ние замк-
нутой
цепи,в
1,25
1,05
0,7
Сила
сварочно-
го тока.
400П
3300
1100
Сварка в защитной среде 1159], которая является ручной операцией,
выполняется полностью в четыреххлористом углероде. Свариваемые края
располагаются параллельно. Одним из электродов служит графит, дру-
гим — свариваемое изделие. Для сварки применяется постоянный ток
20—40 а при напряжении 25—30 .в.
При дуговой сварке ниобия в защитной атмосфере 138, 159] в качестве
защитного газа применяется аргон или гелий; электродом служит воль-
фрамовый наконечник сварочной горелки. Такая сварка наиболее эффек-
тивна для соединения листов, расположенных плотно в стык (краевая или
стыковая сварка). Края свариваемых листов помещают в паз шириной
примерно 9,6 мм и глубиной 3,2 мм. Электрод вводят через крышку камеры
или экран, заполненный аргоном или гелием. За счет инертного газа должно
поддерживаться избыточное давление в экране. Защита сварного шва
достигается путем заполнения паза инертным газом со стороны, обратной
сварке. Вольфрамовый электрод делают отрицательным для получения
ковкого шва (как при сварке циркония), а дугу зажигают с помощью высоко-
частотного разряда, чтобы предотвратить загрязнение шва вольфрамом.
Дуга постоянного тока по сравнению с дугой переменного тока глубже
пронизывает металл, что способствует образованию более узкой лужи из
расплавленного металла, которую легче защитить инертным газом.Мини-
мальная толщина листа, который можно удовлетворительно сваривать этим
способом, составляет 0,33—0,38 мм.
ТИПИЧНЫЕ УСЛОВИЯ ДУГЛКОИ СЯЛРКИ ПРИ СКОРОСТИ
203 мм/мин И НАПРЯЖЕНИИ 2И — 30 я
Толщина листа
Сила сварочного
мм
тока, а
0.38
21
0,51
35
1,02
100
СВАРКИ
,.з
120
Чтобы избежать загрязнения, свариваемый металл необходимо защищать
инертным газом при его охлаждении до 300—400°.
460
Глава 19
Данные [38], необходимые для выбора оборудования аргоно-дуговой
автоматической сварки, приведены в табл. 10.
Таблица 10
1СЛОНИЯ ПРОВЕДЕНИЯ АРГОНО-ДУГОВОЙ АВТОМЛ [ИЧЕСКОП СВАРКИ
ЛИСТОВОГО НИО1ШЯ
Толщина
листа,
мм
0,3
0,51
0,76
Диаметр
вольфрамово-
го электрода,
мм
1,6
1,6
1,6
Диаметр
аргоновой
форсунки,
мм
9,6
9,6
9,6
Расход газа, л/час
прн пря-
мой пир-
ке
32
38
38
при обрат-
ной снар-
ке
14
14
14
Сила сва-
рочного
тока, а
40
60
80
Скорость
сваркн,
мм'мин
508
508
508
При сваривании листов толще 1,25 мм ток, необходимый для полного
проплавления, может оказаться настолько большим, что приведет к вы-
плескиванию расплава за пределы защитной зоны. Применяемый прутковый
электрод может окисляться и, следовательно, загрязнять сварной шов.
Сварку лучше всего выполнять в сухой камере, которую сначала про-
мывают и затем заполняют очищенным гелием или аргоном при небольшом
избыточном давлении.
Сообщается, что в некоторых случаях дуговую сварку в инертном
газе можно применять для точечной сварки ниобия, если несколько изменить
конструкцию сварочной горелки. Защищать такие сварные швы со стороны
обратной сварки не требуется.
Испытания сваренных ниобиевых образцов показали, что металл в месте
сварки по коррозионной стойкости не уступает основному металлу.
При аргоно-дуговой сварке в камере с пониженным давлением [58]
получаются более плотные и пластичные сварные швы, чем при сварке при
атмосферном или избыточном давлении. Камеру вначале откачивали до оста-
точного давления порядка 1 • 10 мм рт. ст. в течение 20 мин и затем запол-
няли очищенным аргоном до остаточного давления 250 мм рт. ст. Струю
аргона пропускали через камеру как во время сварки, так и при охлажде-
нии образца. Обезжиренные и очищенные металлической щеткой образцы
Таблица 11
УСЛОВИЯ ПРОВЕДЕНИЯ АРГОНО-ДУГОВОЯ СВАРКИ НИОВИЕБЫХ ТРУБа [58]
Толщина
стенки трубы,
мм
0,25
0,51
0,51
0,76
0,76
Внд соедине-
ния
Внахлестку
»
Краевое
В стык
?
Напряжение
в разомкну-
той цепи, в
60
60
ЦП
50
ПО
Сила свароч-
ного тока, а
27 28
45—50
45—54
40- 45
45—48
Характери-
стика тока
Постоянный
л
Переменный
Постоянный
Переменный
Диаметр
да, мм
1,6
0,8
3,2
3,2
3,2
а Расход газа: 10 л!мин очищенного (99,997%-пого) аргона.
трубок с толщиной стенок 0,25—0,75мм можно сваривать внахлестку, в стык
и в край в условиях, указанных в табл. 11. При последующих механиче-
Ниобий
461
ских испытаниях на сваренных трубках наблюдались трещины, расходя-
щиеся от сварного шва.
При подготовке ниобня к сварке 1159) подлежащие соединению поверх-
ности должны быть тщательно очищены и обезжирены четыреххлористым
углеродом, а затем зачищены тонким наждачным полотном или наждачной
Рис. 10. Схема полуавтома-
тического электронно-соароч-
ного устройства.
/ — датчик вакууыетра: 2 — элект-
род (катод); 3 — карегка; 4 — ва-
куумная камера; 5 — механический
насос: 6 — клапаны; 7 — м-ic-juinufl
диффузионный насос; 8 — мотор по-
стоянного тока.
бумагой с целью удаления инородных частиц н окисных пленок. Имею-
щиеся на сварном листе включения некоторых металлов, например медн,
попавшие с электродов при сварке сопротивлением, можно удалить трав-
лением в азотной кислоте.
Новейший метод сварки ниобиевых листов — сварка плавлением;
в этом случае применяется описанное ранее и соответствующим образом
видоизмененное оборудование для электронно-лучевой плавки [136—138,
159]. На рис. 10 показана схема опытной полуавтоматической сварочной
установки, использующей этот принцип. Свариваемое изделие заземляется,
в то время как катод электронно-лучевой пушкн поддерживается при мак-
симально отрицательном потенциале. Электроны, ускоряющиеся за счет
высокого потенциала (до 60 кв, обычно около 10—14 /се), фокусируются на
малой площади изделия (диаметром 1 —3,2 мм в зависимости от толщины
материала) и начинают расплавлять его при достижении достаточно боль-
шой плотности энергии. Этим методом можно с высокой точностью выпол-
нять как линейную, так и кольцевую сварку.
ОБЛАСТИ ПРИМЕНЕНИЯ [41, 42, 48, 62, 88, 99, 104, 120]
Появление в течение последних нескольких лет значительного количе-
ства открытой литературы, посвященной ниобию, является критерием того
значения, которое он приобрел в технике как конструкционный материал
462 Глава 19
имеющий широкие области применения. О нескольких областях приме-
нения уже упоминалось выше.
Ниобий представляет интерес для ядерной техники, поскольку он обла-
дает малым поперечным сечением захвата тепловых нейтронов, превосход-
ными свойствами при высоких температурах, стойкостью против действия
расплавленных металлов, а также совместимостью с другими конструк-
ционными материалами в виде защитного покрытия [111], легирующего
элемента или основного компонента сплава.
Хотя проблема эффективной защиты ниобия от окисления остается
нерешенной, предполагается, что он найдет применение во многих областях
благодаря хорошо изученным свойствам при повышенных температурах.
Можно надеяться, что успешным легированием или нанесением покрытий
удастся преодолеть его недостаточную стойкость к окислению. Эта проблема
особенно актуальна в случае реактивных двигателей, ракет, управляемых
снарядов и конструкционных деталей летательных аппаратов. В этом отно-
шении ниобий находится почти в таком же положении, как и молибден*,
хотя с целью разработки способов защиты молибдена проведено значительно
большее количество исследований.
Благодаря его сродству к газам, входящим в состав атмосферы, ниобий
применяется в качестве газопоглотителя в электронных лампах. Цепными
в этом отношении являются также низкая работа выхода, высокая тепло-
проводность, устойчивость к распылению, высокая механическая прочность,
способность к сварке и легкая обрабатываемость. В области электроники
ниобий также имеет потенциальное значение для применения в электро-
литических конденсаторах благодаря способности образовывать анодные
пленки, подобно танталу.
Несмотря на меньшую устойчивость ниобия по сравнению с танталом
в различных коррозионных средах, встречающихся в химической техно-
логии, его нельзя не рассматривать как потенциальный конструкционный
материал. Например, производители оборудования нефтяной промышлен-
ности [66] заинтересованы в ниобии благодаря его стойкости против кор-
розии, механическим свойствам, формуемости, а также легкости сварки,
необходимой при монтаже, ремонте и модификации.
Многие из указанных выше областей применения ниобия являются ско-
рее потенциальными, тогда как получение ферросплавов является прочно
установившейся областью его применения. В этом случае менее жесткие
требования предъявляются к степени чистоты металла и отпадает необ-
ходимость разделения.
Ниобий применяется как легирующий элемент в углеродистых и низко-
легированных сталях, в малоуглеродистых, высоколегированных, аусте-
нитных хромоникелевых сталях и в сплавах на основе железа, применяе-
мых в газовых турбинах.
В сварочные электроды с целью стабилизации нержавеющей стали
при ее сварке вводится только ниобий, поскольку титан не переходит
из электрода в изделие, свариваемое посредством дуги.
Ниже рассматриваются лишь наиболее важные примеры влияния нио-
бня в железных сплавах 1121.
Ниобий повышает прочность при повышенных температурах безугле-
родистых сталей. Он способствует заметному рафинированию зерна в угле-
родистых и малолегированных сталях, которое сохраняется при темпера-
До сих пор для мачибдена также не найден эффективный способ защиты.
Ниобий 463
турах до 1025°. Ниобневые стали проявляют превосходную устойчивость
против графитизации при 550°.
В нержавеющей стали типа 304 A8-8) ниобий применяется с целью
уменьшения межкрнсталлитной коррозии. Он связывает углерод в карбид,
препятствуя тем самым выпадению его по границам зерен. Сопротивление
разрыву и ползучести ниобийсодержащей стали 18-8, как правило, выше,
чем у той же стали, не содержащей ниобия. В сложных сплавах на основе
железа, содержащих ниобий, повышается их жаропрочность и пластичность
в горячем состоянии. Кроме того, он сообщает этим материалам устойчи-
вость против теплового удара.
Применению ннобня как основы или легирующего элемента в сплавах
цветных металлов уделялось и продолжает уделяться большое внимание.
Изучение ряда двойных и тройных сплавов на основе ниобия с добавкой
практически всех элементов периодической таблицы направлено на улуч-
шение стойкости ниобия против окисления. Например, в работе [133]
как компоненты двойных сплавов с ниобием исследовались следующие
элементы: бериллий, бор, хром, кобальт, железо, молибден, никель, крем-
ний, тантал, титан, вольфрам, ванадий и цирконий. Наилучшая устой-
чивость против окисления при 1000° была получена для сплавов, содержа-
щих около 9 вес. % хрома, 5 вес. % молибдена. 15,5 пес. % титана и 5,7вес. %
ванадия. Кинетика окисления изучалась для сплавов с хромом, молибде-
ном, титаном, вольфрамом, ванадием и цирконием [80].
Двойные, тройные и четверные сплавы на основе ниобия, содержащие
алюминий, хром, кобальт, железо, молибден, никель, кремний, тантал,
титан, вольфрам, ванадий и цирконий, являются предметом широких
исследований [100]. Наиболее устойчивый к появлению окалины сплав
содержит 20 вес. % хрома, 12 вес.% кобальта и 68 вес.°'6 ниобия.
Скорость окисления этого сплава изменяется по параболическому
закону и составляет при 1100° 7,8-10~5 г1см2-секл'*, превышая в 100 раз
скорость окисления ниобня при той же температуре.
Даже очень редкий элемент скандий исследовался как легирующий
элемент дли ниобия.
Помимо указанных выше элементов, в качестве легирующих добавок
исследовали медь, иридий, германий, рений и селен, однако без заметного
успеха [33]. Исследования ниобиевых сплавов проводили не только с целью
повышения стойкости против окисления, но и для других целей *. Техни-
чески чистый ниобий @,38 вес.% кислорода) был переплавлен в дуговой
печи с цернем с образованием сплава, содержащего 8 вес.% церия [128].
Общее содержание кислорода составляло лишь 0,004 вес.% и сплав имел
хорошую пластичность.
ЛИТЕРАТУРА
1. Albrecht W. М.. М а 1 I e t t M. W-, G о о d e W. D., J. Electrochem. Soc..
105, 219—223 A958).
2. Alexander К. М., Fairbrother F., J. Chem. Soc, Suppl. Issue № 1,
S223- S227 A949).
3. A I e x a n d e г К- М., Fairbrother F., J. Chem. Soc., 74, 2472—2476
A949).
* Подробнее о сплавах ниобия см. Г. В. Захарова, И. А. Попов,
Л. П. Жарова, Ь. В. Феди н, Ниобий н его сплавы, Металлургиздат,
19Ы — Прим ред.
464 Г л а в а 19
4. Anders F. J., Jr., Pollock W. 1., Technology of Coluinbium (Niobium)
(Gonser B. \V\, Sherwood E. M., Eds.), John Wiley and Sons, Inc.,"New York,
1958, p. GO—65.
5 Andrews D. H-, пат. США 2522153, September 12, 1950.
6. Backer R. O., G о w а г d G. W.,Wiederkehr V.R..U.S. Atomic Energy
Commission, Rept. WAPD-CTA(GLA)-471, 1957.
7. В а с к e r R. O., Coward G. W., W i e d e г к e h r V. K., U. S. Atomic
Energy Commission, Rept. WAPD-204, September 1958.
8. В a I ke С W., Ind. Eng. Chem., 27, 1166—1169 A935).
9. В a 1 к е С W., Trans. Electrochem. Soc, 85, 25—30 A914).
10. В е а с h J. G., Technology of Columbium (Niobium) (Gonser B. W., Sherwood
E. M., Fds.), John Wiley and Sons, Inc., New York, 1958, p. 81—86.
11. Benesovsky F., Sedlatchek K-, Wirth W.. Berg.-u. huttenmann.
Monatsh., 100, 219—244 A955).
12. Binder W. O., Boron, Calcium, Columbium, and Zirconium in Steel, John Wiley
and Sons, Inc., New York. 1957, p. 105—414.
13. В I о с h e r J. M., Jr., Campbell I. E.. Carbide Coatings for Graphite, Paper
Presented at the Second Int. Conf. on the Peacetime Uses of Atomic Energy, Geneva,
September 1 — 13, 1958.
14. В r a u e r G., Z. anorg. allgem. Chem., 248, 1—31 A941).
15. Bridges D. W-, Fassell W. M., Jr., J. Electrochem. Soc, 103,326-
330 A956).
16. В г ow n E. N.. R ее d D. V., U. S. Atomic Energy Commission, Rept. WAPD-
CTA(GLA)-511, January 16, 1958.
17. Buchheit R., Battelle Memorial Institute, частное сообщение, февраль
1959.
18. В urke J. J., J. Metals, 9, 1350—1351 A957).
19. В u r s t a I 1 F. H, S w a i n P., Williams A. F., Wood G. A., J. Chem.
Soc, 77, 1497 A952).
20. С a b e 1 1 M. J., 4ilner 1., Atomic Energy Research Estab. (G. Brit.) Rept.
AERE-C/R-1460, 1954.
21. С a I v er 1 e у A., D a v i s И., Lever R. F., J. Sci. Instr., 34, 142—147
A957).
22. С a r I s о п K. M., Pollock W. I., Studies of Niobium-Oxygen and Niobium-
Titanium-Oxygen Systems, Paper Presented at Am. Inst. Mining Metall. Fngrs.
High-Temperature Materials Conf., Cleveland, Ohio, April 16—17, 1957.
23. Carpenter J.H.Searcy A. W., J. Am. Chem. Soc, 78, 2079—2081 A956).
24. С a t li с a r t J. V., Campbell J.J., Smith G. P.. J. Electrochem. Soc,
103, 442—446 A958).
25. С a t h с a r t J. V., Manly W. D., Corrosion, 12. 43—47 (February 1956).
26. Chaigneau M.. С R., 244, 900—901 A957).
27. Chem. Eng. News, 35, 48—50 (October 1957).
28. Chem Eng. News, 36, 51 -52 (February 10, 1958).
29. Chem. Week, 82, 48—50 (February 1, 1958), 51—52 (April 5, 1948).
30. Ч е р и и x о d Ю. А., М е л а м е д Ш. Г., Д о б к и и а Б. М., Заоод. лаб., 24,
677—679 A958).
31. С h i I t on С. Н., Chem. Bng., 65, 104—107 (November 3, 1958).
32. Ч и ж и к о в Д. М, Г р и н ь к о А. М., ЦАН СССР, 122, 278—279 A958).
33. Clauss F, J., Barrett С. A., Technology of Columbium (Niobium) (Gonser
B. W-, Sherwood Е- М-, Eds.), John Wiley and Sons, Inc., New York, 1958.
p. 92—97.
34. Cook D. В., Z e m a n s k у M. W.. Bourse H. A., Phys. Rev., 79, 1021
A950).
Ниобий 465
35. Coolidge W. D., англ. пат. 23499, 1909; Trans. Am. Inst. Elec. Engrs., 29,
961—965 A910).
36. С о t t er M. J., Atomics and Nuclear Energy, 8, 339—342 A957).
37. Cox F. G., Steel Processing and Conversion, 43, 147 (March 1957).
38. С о x F. G., Welding and Metal Fabrication, 24, 352—358 A956).
39. D а г n e I 1 .1. R., Y n t e m a L. F., Technology of Columbium (Niobium) (Gon-
ser B. W.. Sherwood E. M., Eds.), John Wiley and Sons, Inc., New York, 1958,
p. 1—9.
40. D а у t о n S. H., Mining World, 20, 40—43 (July 1958).
41. Denny J. P., Kendall L. F., Machine Design, 30, 150 (May 29, 1958).
42. D e n n у J. P., К e n d a I 1 L. F., Metal Progr., 73, 136, 138, 140, 142. 144, 146,
148 (June 1958).
43. Dickson G. K-, Dukes J. A., Extraction and Refining of the Rarer Metals,
Paper № 14, 258—271, The Institution of Mining and Metallurgy, London, 1957.
44 E h r 1 i с b P., P 1 о g e r F., P i e t z к a G, Z. aiiorg. allgera. Chcra., 282, 19—
23 A955).
45. F a i r b г о t h e r F, F г i t h W. C, J. Chem. Soc, 76, 3051—3056 A951).
46 Fuson N.. .1. Appl. Phys., 20, 59—66 A949).
47 Fuson N.. J. Opt. Soc. Am., 38, 845—853 A948).
48. G a r d n er A. R., Prod. Eng., 29, 66—70 (March 17, 1958).
19. G e g n e r P. J., Wilson W. L., Columbia-Southern Chemical Corp., частное
сообщение, 1959.
50. G I a s s e r J., H a m p e 1 С. А., пат. США 2703752, March 8, 1955.
51. Goldschmirit 11.. V a u t i n C, J. Soc. Chem. lnd., 19, 543 A898).
52. G о w а г d G. W-, Trelcw E. F., U. S. Atomic Energy Commission, Rcpt.
WAPD-(GLA)-203, UC-4, April 24, 1956.
53. G u I b r a n s с n E. A., Andrew K- F., Trans. Am. Tnst. Mining Mel.
F.ngrs., 188, 586 A950).
54. G u 1 b r a n s e n E. A., A n d г e w K- ?., J. F.lectrochem. Soc, 105, 4—9 A958).
55. H a m p e 1 С. А-, Corrosion, 14, 87t — 911 A958).
56. H a m p e I C. A., Corrosion Properties of Tantalum, Columbium, Molybdenum,
and Tungsten, Paper Presented at Nat. Assoc. Corrosion Engrs. Meeting, San Fran-
cisco, March 17—21, 1958.
57 H a n s e n W. R, M a 1 I e t t M. W., Anal. Chem., 29, 1868—1869 A957).
58. H a r r i e s D. R., P u г с h a s J. G., Nuclear Power, 3, 219—221 (May 1958).
59. Harris W. F., U. S. Atomic Energy Commission, Rept. NP-6689, 1957.
60. H a r r i s W. F.. Technology of Columbium (Niobium) (Gonser R. W., Sherwood
E. M., Eds.), John Wiley and Sons, Inc., New York, 1958, p. 57—59.
61. H a I с h e t t C, Phil. Trans. Roy. Soc. London Ser. A, 92, 49—66 A802).
62. H a z e I t о п W. S., J. Soc. Automotive Engrs., 65. 67—69 (May 1958).
63 II e a I T. J., The Mechanical and Physical Properties of Magnesium and Niobium
Canning Materials, Second Intern. Conf. on the Peaceful Uses of Atomic Energy,
Geneva, A/Conf. 15/P/305. UK, June 3. 1958.
61 H ig b i e К- В., Technology of Columbium (Niobium) (Gorser B. W., Sherwood E. M.,
Eds.), John Wiley and Sons, Inc., New Y'ork, 1958, p. 10—15.
65 II i g b i e К. В., W e r n i n д J. R., U. S. Bureau of Mines, Rept. Invest. 5239,
1956.
66. Hooper W. H. L., Petroleum, 21. 219—224 (July 1958).
67. H u f f in a n E. H., I d d i n g s G. M., L i I I у R. С, U. S. Atomic Energy
Commission, Rept. UCRL 1165. March 1951.
68. H u 1 m J. K, M a t t h i a s В. Т., Phys. Rev., 82, 273—274 A951).
69. H u 1 m J. K., Matthias В. Т., Phys. Rev., 87, 799—806 A952).
70. lnd. Heating, 25, 924—926 A958).
30 Звказ № 239
466 Глава 19
71. 1 п о и у е П., U. S. Atomic Energy Commission, Rept. ORNLH565, September 24,
1953.
72. J о п e s R. J., Can. Dep. Mines and Tech. Surveys, Mines Branch, Mem. Ser № 135,
1957.
73 Jordan K-, P i с а г d K., Techn. Mitt. Кшрр, 15, 203—207 A957).
74. К е с k P. H., G о 1 а у M. J. E., Phys. Rev., 89, 1297 A953).
75. Keck P. H., G г e e n M., Polk M. L., J. Appl. Phys., 24, 1479—1481 A953).
76. Kelly J. С. К., Jr., The Present Status of Electromagnetic Levitation as a Higli-
Temperature Research Tool, Paper Presented at Iligh-Temperature Symposium,
Berkeley, Calif., June 25—27, 1956.
77. К i e f f e r R., В e n e s о v s k у F., Schmid H., Z. Melallkunde, 47, 247—
253 A956).
78. К 1 о p p W. D., Sims С. Т., J a f f e e R. I., Trans. Am. Soc. Metals, 50,
Preprint JN» 64 A957).
79. К 1 о p p \V. D., Sims С. Т., J a f f e e R. I.. Technology of Columbium (Nio-
bium) (GonserB. W-, Sherwood E. M., Eds.), John Wiley and Sons, Inc., New York,
1958, p. 106—120.
80. К 1 о p p W. D., S I m s С. Т., J a f f e e R. I., Effects of Alloying on the Kine-
tics of Oxidation of Niobium, Paper P712, Presented at Second Int. Conf. on the
Peacetime Uses of Atomic Energy, Geneva, September 1—13, 1958.
81. К о e г п e r E. L., S m u t z, U. S. Atomic Energy Commission, Rept. ISC-793,
August 15, 1956.
82. К о г о s у F., J. Am. Chem. Soc, 61. 838—843 A939).
83. К г a u s К. А , М о о r e G. E., J. Am. Chem. Soc, 71, 5855 A949).
84. Kriegc D. H., U. S. Atomic Energy Commission, Rept. LA-2049, May 1956.
85. Крипьякенич Р. И., Гладишевский, ДАН СССР, 104, 82—84
A955).
86. К u d i e 1 k a H., N о w о t n у , F i n d e i s e n G.. Monatsh. Chem., 88. 1048—
1055 A958).
87. К u h n W. E., High Temperature Technology (Campbell I. E., Ed.), John Wiley
and Sons, Inc., New York, 1956, p. 288—318.
88. Lazzerini R., Calore, 39, 7—15 (January 1958).
89. L e b а с q z J. V., A n d г е w s Г). Н., Proc. Natl. Electronics Conf., 4, 11—23
A948).
90. M a g e 1 Т. Т., К u 1 i n P. А., К a u f m a n n A. R.. J. Metals, 4, 1286—1288
A952).
91. M a j u m d а г А. К-, С h о w d h u г у J. В. R ay. Anal. Chim. Acta, 19, 18—
22 A958).
92. M a r i g n а с J., Ann. chim. et phys., 8, 5 A866); 9, 249 A866).
93. Materials in Design Eng., 46, 85 (September 1957).
94. M с I n t о s h А. В., J. Inst. Metals, 85, 367—372 A957).
95. M с I n t о s h А. В., В a g I e у К- Q-. J. Inst. Metals, 34, 251 A956).
96. M с К e n и а Р. М., пат. США 2124509, July 19, 1938.
97. M с К i n 1 e у Т. D., The Niobium-Hydrogen System, Paper Presented at Am-
Inst. Mining Met. Engrs. Regional High-Temperature Materials Conf., Cleveland,
Ohio, April 16—17, 1957.
98. M e r r i 1 I G. S., Trans. Am. Inst. Elec Eng., 29, 1709—1729 A910).
99. Metal Ind., 92, 527—528] A958).
100. Michael A. G., The Oxidation of Columbium-Base and Tantalum-Base Alloys,
Paper Presented at Am. Inst. Mining Met. Engrs. Reactive Met als Conf., Buffalo.
N. Y., May 27—29, 1958.
101. M i k h a i 1 о v a G. V. et al., U. S. Atomic Energy Commission, Rept. AEC-TR-
3181, 1957.
Ниобий 467
102. Miller G. L., Materials and Methods, 45, 131—135 A957).
103. Miller G. L., Metal lnd., 92, 507—509 A958).
104. Mining J., 250, 325—326 A958).
105. Moissan II., С R., 133, 20 A901).
106. H a p б у т т К- И., Беспалова И. Д., Завод. лаС, 24, 617—619 A958)
107. Н а з а р е н к о В. А., Ф л я и т и к о в а Г. В., Занод. лаб., 24, 801—802 A958).
108. N о w о t п у H.Wittmann A., Montash. Chem., 89, 220—224 A958).
109. О' D г i s с о 1 1 W. G., M i 1 1 е г G. L., J. Inst. Metals, 85, 379—384 A957).
ПО. Pf ann W. G., Trans. Am. lnst. Mining Met. Engrs., 194, 747—753 A952);
см. также P f a n n W. G., Zone Melting, John Wiley and Sons, lnc , New York,
1958.
111. Powell С F, R os en b a u m D. M., Palmer R. В., С a m p b e 1 I 1. E.,
U. S. Atomic Energy Commission, Rept. BMI-1228, October 2, 1957.
112. Powers R. W., Doyle M., J. Metals, 9, 1285—1288 A957).
113. Q u a d t R., Western Metalworking, 16, 45—47 (November 1958).
114. R eed D. V., U. S. Atomic Energy Commission, Rept. WAPD-CTA(GLA)-501,
December 31, 1957.
115. Reed D. V., U.S. Atomic Energy Commission, Rept. WAPD-CTA(GLA)-506,
January 7, 1958.
116. R e e d D V., G о w a r d G. W., U. S. Atomic Energy Commission, Rept. WAPD-
CTA(GLA)-500, UC-4, December 31, 1957.
117. R e e d D. V., W i 1 s о n H. R., G о w a r d G. W., U. S. Atomic Energy Com-
mission, Rept. WAPD-CTA(GLA)-620, July 15. 1958.
118. Reed J. F., Technology of Columbium (Niobium) (Gonser B. W., Sherwood E. M.,
Eds.), John Wiley and Sons, Inc., New York, 1958, p. 51 56.
119. R e n d a I I J. H., Metal Treatment and Drop Forging, 24, 491—494 A957)
120. R с n d a I 1 J. H., Metal Treatment and Drop Forging, 25, 7—12 A958).
121. R e s n i с k R., С a s t 1 e m a n L. S., S e i g 1 e L., U. S. Atomic Energy Com-
mission, Rept. SEP-248, June 30, 1958.
122. R о I s t с n R. F., Iodide Columbium, Paper Presented at Am. Inst. Mining Met.
Fngrs. Annual Fall Meeting, Cleveland, Ohio, 1958.
123. Rose II., Pogg. Ann. Physik Clicinie, 63, 317—341 A844).
124. R u п с k R. J, S h e i p 1 i n e V., High-Temperature Technology (Campbell I. E.,
Ed), John Wiley and Sons, Inc., New York, 1956, p. 114—130.
125. S а у r e E. D., Stoph A. J., Proc. 1956 Nat. Symp. on Vacuum Technology,
175—181
126. Schofield Т. Н., J. Inst. Metals, 85, 372—374 A957).
127. Schumacher E. E., J. Metals, 5, 1428—1429 A953).
128. S e m m e 1 J. W., Jr., Technology of Columbium (Niobium) (Gonser B. W., Sher-
wood E. M., Eds), John Wiley and Sons, Inc., New York, 1958, p. 77—80.
129. Seybolt A. U., J. Metals, 6, 774 A954).
130. SibertM. F.., U. S. Atomic Energy Commission, Rept. AECU-3798, June 15, 1958.
131. S i b e г t M. E., К о 1 k A. J., Jr., StelnbergM. A.. Technology of Colum-
bium (Niobium) (Gonser B. W-, Sherwood E. M., F.ds.), John Wiley and Sons,
Inc., New Y'ork, 1958, p. 20—34.
132. S i b e r t M. E., S t e i n b e r g M. A., Preliminary Study of Hie Equilibrium
of Carbon and Oxygen in Columbium with Carbon Monoxide Above 1600° C, Paper
Presenled at Am. Inst. Mining Met. Engrs. Reactive Metals Conf., Buffalo,
N. Y., May 27—29, 1958.
133. Sims С. Т., К 1 о p p W. D., J a f f e e R. I., Trans. Am. Soc. Metals, 5, Pre-
print № 70 A957).
134. S p с i s e r R., В I а с k b u r n P., J о h n s t о n H. L, J. Electrochem. Soc,
106. 52—53 A959).
30*
4C8 Глава 19
135. Steel, 142, 108—109 (March 24, 1958).
136. Slohr J. A., Vide, 13, ."№ 75, 163—171 (May — June 1958).
137. Stohr J. A., Nuclear Power, 3, 272—274 A958).
138. Stohr J. А., В r i о 1 a J., Soudure et Tech. Connexes, 12, 165—172 (May —
June 1958).
139. Taylor D. F., Ind. Eng. Chem., 42. 639 A950).
140. Temescal Metallurgical Corp., частное сообщение, 1958.
111. Tews J. L., M а у S. L., Technology of Columbium (Niobium) (Gonser B. W.,
Shcrwoord E. M., Eds.), John Wiley and Sons. Inc., New York, 1958, p 36—43.
142. Theodore M. L., Anal. Chem., 30, 465—467 A958).
143. T i n g 1 e у I. I., Dept. Alines and Tech. Surveys, Ottawa, Canada, частное сооб-
щение, 1959.
144. T о t t 1 e С. R., .Т. lnst. Metals. 85, 375—378 A957).
145. U h 1 i g H. H., The Corrosion Handbook, John Wiley and Sons, Inc., New York,
1948.
146. U. S. Bureau of Mines, Mineral Mkt. Rept. MMS 3188, 1958.
147. V a n Л г к e I A. E., de Boer J. H., Z. anorg. allgem. Chem.. 148, 345—350
U925).
148. Van Muylder J, deZoubov N., P о u г b a i x M-, CEBELCOR, Rapp.
Tech., Л° 53, June 1957.
149. V e i g e I N. D , S h e r w о о d E. M., С a m p b e 1 1 I. E., Tlie Metal Thorium
(Wilhclm H. A., Ed.), American Society for Metals, Cleveland, Ohio, 1958, p. 104—
113.
150. Batchelder F. W., R a e u с h 1 e R. П., Acta Cryst.. 10. 648—649 A957).
151. Bolton W., Z. Elektrochem., 13, 145—149 A907).
152. Waterbury G. R-, В r i с к е г С. Е., Anal. Chem., 30, 1007—1009 A958).
153. W e r n i n g .1. R., Higbie К. В., Ind. Eng. Chem., 46, 2491—2498 A954)
154. W e r n i ng J. R., Higbie K. B. et al., Ind. Eng. Chem., 46, 644—652 A954).
155. W e s s e I E Т.. L a w t h e r s D. D., Technology of Columbium (Niobium) (Gon-
ser B. W., Sherwood E. M., Eds), John Wiley and Sons, Inc., New York, 1958,
p. 66—76.
156. White G. K-, Woods S. В., Can. J. Phys., 35, 892—900 A957).
157. Williams L. R., J. lnst. Metals, 85, 385—392 A957).
158. Wyman W. L., Welding J., 37, 49s—53s (February 1958).
159. Y n t e m a L. F., Metal Progr., 74, 105—108 (September 1958).
IG0. Y n t e m a L. F., Western Metalworking, 16, 43 (April 1958).
161. U. S. Nat. Bur. Standards, Clrc. Ла 467, Vol. 1, 1949; Vol. 2, 1952.
162. Strominger D., Hoi lander J. M., S e a b о r g G. Т., Rev. Mod. Phys.,
30, Л» 2, 665—668 (April 1958).
163. Wright D. A., Proc. lust. Elec. Eng., 100, 125—142 A958).
164. S t u 1 1 D. R., S i n к e G. C, Thermodynamir Properties of the Elements, Am.
Chem. Soc., Washington, D. C, 1956, p. 137—138.
165. В e g 1 e у R. Т., U. S. Atomic Enerdy Commission, Rept. A-2388 (WEC), 1957.
166. В eg 1 ey R. Т., U. S. Air Force, P.cpt. WADC-TK-57-344, December 1958.
167. Scott R. В., Cryogenic Engineering, D. Van Nostrand Company, (Inc., 1959,
p. 342.
20.
ПЛАТИНОВЫЕ МЕТАЛЛЫ
Ф. Э. БИМИШ, У. А. МАК-БРАЙД. Р Р БЭЙРФУТ
F. E. Beamish, №. Л. Е. McBryde, R. R. Barefoot,
Department of, Chemistry, University ofr Toronto,
Toronto, Canada
Порядковый номер
Атомный вес
Порядковый номер
Атомный вес
Порядковый номер
Атомный вес
Железо
26
55,847
Рутений
44
101,07
Осмий
76
190,2
VIII группа
Кобальт
27
58,9332
Родий
45
102,905
Иридий
77
192,2
ВВЕДЕНИЕ
Никель
28
58,71
Палладий
46
106,4
Платина
78
195,09
I группл
(подгруппа
меди)
Медь
29
63,54
Серебро
47
107,870
Золото
79
196,967
Первые сообщения о самородной платине, т. е. об образовавшемся
в естественных условиях сплаве, который содержал главным образом пла-
тину и, кроме того, палладий, родий, иридий, осмий, рутений, медь, железо
и иногда золото, появились в 1557 г. 190]. Автором этих сообщений был
Юлий Цезарь Скалингер (или делла-Скала), итальянский поэт и ученый,
который писал о трудности расплавления металла, полученного из испан-
ских владений в Южной и Центральной Америке. Первсе научное исследо-
вание платины провел Уильям Браунригг в 1750 г. Бертслле и Пельтье 191
писали о работе М. дель-Иля. который в 1773—1774 гг. получил платину
в ковком виде. Пьер-Франсуа Шабано (или Шавано) удалось получить
ковкую платину, и в 1783 г. ему был выдан патент на этот процесс 138].
Однако при тщательном изучении литературных материалов |8| было уста-
новлено, что чистую платину впервые получил в 1803 г. Волластон. бле-
стящие работы которого завершились выделением из самородной платины
палладия и родия 199]. Полученный с помощью царской водки экстракт
из самородной платины обрабатывали хлоридом аммония для осаждения
платины, затем осаждали палладий путем добавления цианида ртутщ1)
и, наконец, выделяли родий в виде двойного хлорида натрия—родия.
Один из этих металлов Волластон назвал палладием в честь астероида
Паллас, а другой — родием из-за розово-красного цвета селей этого метал-
ла. Осмий и иридий были выделены в 1804 г. Теннантом 186]. Примерно
в то же время Колле-Декости, де Фуреруа и Вокелеи обнаружили присут-
ствие иридия в самородной платине, но их работа не была закончена 18, 59,
стр. 3]. Оба металла, осмий и иридий, были найдены в черном осадке, обра-
зовавшемся после обработки самородной платины царской водкой. Иридий
470
Глава 20
получил свое название от греческого слова iris (радуга) из-за разнообразной
окраски его солей. Последний элемент платиновой группы был открыт
Клаусом спустя сорок лет, в 1844 г., и назван им в честь России (латин.
Rutfieniu) рутением, хотя сообщение об этом появилось лишь на следующий
год 113J, когда Берцелиус подтвердил результаты опытов и признал руте-
ний как новый элемент [7, 90].
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Платиновые металлы встречаются в природе как в первичных горных
породах, так и в виде россыпей. Первичные отложения бывают двух основ-
ных типов [63, 65). Первый состоит из вкраплений или местных скоплений
металлов в богатых оливином породах, особенно в дуните, и часто ассоции-
рованы с хромитом, причем самородная платина является главной соста-
вляющей. Эрозия таких отложений приводит к образованию россыпей
металлов платиновой группы. Отложения дунита широко распространены;
наиболее важные из них в промышленном отношении находятся в СССР
и в Овервахте (Трансвааль, Южно-Африканская Республика). Ко второму-
типу месторождений относятся магматические отложения сульфидов нике-
ля — меди, которые ассоциируют главным образом с норитом. Этн место-
рождения, в которых преобладают платина и палладий, представляют собой
крупнейшие из известных запасы платиновых металлов. Наиболее обшир-
ные залежи найдены в норитовой зоне Бушвельдского вулканического
комплекса в Трансваале и в районе Садбери (провинция Онтарио, Канада).
В рудах последнего месторождения платина и палладий встречаются при-
мерно в одинаковых количествах; эти руды содержат также небольшие
примеси других платиновых металлов, серебра и золота. Драгоценные
металлы добывают в качестве побочных продуктов при выделении никеля
и меди. Южноафриканские первичные отложения содержат все металлы
платиновой группы, а также железо, никель, кобальт, медь, серебро и золо-
то. В отличие от канадских руд содержание основных металлов в южноафри-
канских рудах не оправдывает расходы по их переработке. Платиновые
металлы встречаются также в кварцевых жилах и в месторождениях меди
и угля, но эти источники имеют небольшое экономическое значение.
Россыпи или аллювиальные отложения большого экономического зна-
чения найдены в СССР, в Колумбии (Южная Америка) и в Эфиопии.
Платиновые россыпи имеются также в США, на Аляске, в Австралии
и Канаде.
Таблица 1
СОДЕРЖАНИЕ ПЛАТИНОВЫХ МЕТАЛЛОВ В ЗЕМНОЙ КОРЕ [27]
Пг.рядко-
ыи номер
78
46
77
45
7G
44
Элемент
Платина
Палладий
Иридий
Родий
Осмий
Рутений
Содержание Цпирядковый
в земной номер
коре, г т II
0,01
0,005
0,001
0,001
0,001 [83]
0,001 [83]
47
79
26
27
28
29
Элемент
Серебро
Золото
Железо
Кобальт
Никель
Медь
Содержание
коре, г'т
0,1
0,005
51 000
40
100
100
Платиновые металлы 471
Все металлы платиновой группы относятся к числу малораспростра-
ненных. В табл. 1 указано содержание этих металлов в земной коре. Осталь-
ные элементы VIII группы, а также медь, серебро и золото включены для
сравнения. Из шести элементов только платина и палладий встречаются
в самородном состоянии [641. Самородная платина представляет собой спла-
вы, содержание платины в которых составляет 50—90%. Иридий, иридосмин
(см. ниже), родий и палладий обычно сопутствуют платине. В самородной
платине присутствуют значительные примеси железа и в небольшом количе-
стве медь, никель и иногда золото. Типичный состав самородной платины
различных месторождений приведен в табл. 4. При наличии железа мине-
рал может обладать магнитными свойствами. Самородная платина встре-
чается в виде зерен, чешуек или крупных самородков. Ее месторождения
встречаются по всему земному шару, но главные из них находятся в СССР,
в Южной Африке, в Колумбии и на Аляске. Самородный палладий по внеш-
нему виду и некоторым своим свойствам имеет сходство с самородной пла-
тиной. С ним всегда ассоциируют небольшие количества платины и иридия
Самородный палладий — редкий минерал, встречающийся в Колумбии,
Бразилии, СССР и Трансваале. Палладиан (налладистая платина) — само-
родная платина*, содержащая 37% палладия. Аллопалладий, природа
которого не установлена, содержит палладий, ртуть, плагину, рутений
и медь; он встречается только в Тилкероде (Гарц).
В виде минералов соединения платиновых металлов встречаются очень
редко. Сперрилит Pt/Vsj, с которым ассоциируют иногда небольшие коли-
чества родия, встречается в провинции Садбери (Канада), Трансваале
{Южно-Африканская Республика) и СССР. Куперит PtS и браггит (Pt, Pd,
Ni) S найдены в платиноносных норитах Бушвельдского комплекса (Южная
Африка) и месторождениях Трансвааля. Из минералов, которые содержат
главным образом палладий, встречаются стибиопалладинит Pd3Sb вместе
со сперрилитом в Трансваале и потарит PdHg — в Британской Гвиане.
Лаурит RuS2, который иногда содержит осмий, относится к числу очень
редких минералов и встречается на острове Калимантан и в Трансваале.
Иридий чаще всего встречается в виде сплава с осмием в иридосмине
(Ir > Os) и сысертските (Os > Ir).
Термин «осмистый иридий» применяется почти как синоним термина
«иридосмин», но в данной главе принят последний **. Иридий ассоциирует
также с платиной и золотом в платинистом иридии*** и ауросмириде****
соответственно. Как упоминалось выше, родий наряду с другими плати-
* Другие разновидности самородной платины: иридистая (до 28% Ir), роди-
стая (до 5% Rh), медистая (до 13% Си), ферроплатина (до 20% Fe) и поликсен, наибо-
лее распространенная разновидность (до 10% Fe).— Прим. ред.
** В нашей минералогической литературе для природного сплава иридия и осмия
принято название осмистый иридий. Упомянутый авторами сысертскит является одной
из его разновидностей (темный осмистый иридий — Os, Ir), содержащей до 17% Ir,
до 68% Os, до 5% Rh и до 9% Ru.
Второй (более распространенной) разновидностью, соответствующей иридосми-
ну, является невьянскит (светлый осмистый иридий — Ir, Os), который содержит
до 77% Ir, до 49% Os, до 7.5% Ru.
Обе разновидности осмистого иридия, который в виде иевьянскита действитель-
но является синонимом нридосмина (Ir, Os), кристаллизуются в гексагональной син-
гонии, и их следует отличать от осмирида (Ir, Os), кристаллизующегося в кубической
системе.— Прим. ред.
*•* Платинистый иридий (Ir, Pt) очень редок; он обладает наибольшим уд. весом
<до 22,9).— Прим. ред.
**** Разновидность осмирида (Ir, Os), содержащая примерно 19% золота.—
Прим. ред.
Таблица 2
Страна
Канада
Платина (из россыпей и при рафиниро-
вании меди к никеля)
Прочие платиновые металлы
Южная Африка
Платиновые металлы (из руд)
Концентраты (содержание платиновых
металлов)
Осмиридий (из золотых руд)
США
Из россыпей и при рафинировании зо-
лота и меди
Колумбия
Из россыпей
СССР
Япония
Конго (с рафинировочного завода)
Эфиопия
Сьерра-Леоне (из россыпей)
Австралия
Платина (из россыпей)
Осмиридий (из россыпей)
Новая Гвинея
Новая Зеландия
Всего
в среднем за
1949—1953гг.
4302
5096
1
5935
J
208
996
884
4199»
13,7
0.65
12,1
0,25
0,15
1,43
0,1
0,1
21 448,48
1954
4800
5889
3170
7347
195
754
885
6220»
49,6
5,47
7,15
—
0,71
0,5
0,15
0,03
29023,61
Мировая добыча платиновых
1955
5302
6663
3398
8474
218
721
856
7775 а
26,4
—
10,9»
—
0,22
0,6
0,31
—
33 445,43
1956
4707
5083
3859
11211
208
665
815
7775 «
21,8
5
9,33 а
—
0,37
0,81
0,28
—
34 160,59
металлов, кг
1957
6206
6736
)
18 775
J
167
576
617
7775 а
18,3
10,1
9,33»
0,15
0,62
2,05
0,44
—
40 892.99
1958
4496
4687
9330 а
156 а
445
499
7775 а
20 а
10,1 а
5,6
0,25
0,31а
1,31
0,87
—
27 426,44
1953
1
11009а
J
11 383»
—
435
498»
7775 а
—
-
—
-
—
—
—
31 100
1 Приблизительно,
П jiatnii новые металлы
473
новыми металлами встречается в качестве незначительной примеси в само-
родной платине, причем его содержание обычно составляет менее 1 %. 11еболь-
шие количества рутения ассоциируют со сплавами платиновых металлов,
но чаще всего — с иридосминами, которые иногда содержат более 12%
рутения. Следует, однако, отметить, что некоторые разновидности ирид-
оемпнон очень устойчивы против коррозии, в результате чего ошибки ана-
лиза могут быть значительными.
ДОБЫЧА И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В первое издание этого справочника авторы включили данные о миро-
вой добыче сырой платины к концу 1916 г., а также среднегодовые данные
о добыче различными странами за период 1921—1952 гг. Эти сведения пред-
ставляют лишь исторический интерес и поэтому исключены из второго изда-
ния. Вместо этого в табл. 2 приводятся данные за период 1949—1959 гг.
[78, 79]. Интересно отметить, что за период 1950—1957 гг. мировая добыча
платиновых металлов удвоилась. Этот рост является главным образом
результатом более чем четырехкратного расширения добычи в Южной Афри-
ке; добыча в этой стране превышает половину мировой добычи. В тот же
период добыча в Канаде увеличилась примерно на 50%, а в СССР, как
предполагается, добыча возросла на 25%. В 1958 г. мировая добыча сокра-
тилась на 30%.
Несмотря на рекордную добычу платиновых металлов в 1957 г., цифры
мирового потребления показали снижение по сравнению с предыдущим
годом, а в 1958 г. произошло дальнейшее снижение примерно на 20%.
Это было связано главным образом с уменьшением спроса со стороны нефтя-
ной промышленности в США (см. стр. 504), но, несомненно, имеет отноше-
ние и к периоду экономического спада в Северной Америке в 1957—1958 гг.,
когда произошло сокращение потребления многих основных металлов.
В 1959 г. промышленный спрос повысился, в связи с чем произошло неко-
торое увеличение добычи в Южной Африке и Канаде.
Таблица 3
ЦЕНЫ НА ПЛАТИНОВЫЕ МЕТАЛЛЫ В ПЕРИОД 1955—19-".О гг. а Ц02]
Платина
Палладий
Родий
Иридий
Рутений
Осмий
2
0,
3,
1,
3,
1955
54—3,76
68—0,77
4,02
21—4,45
76—2,08
21 4 50
1956
3,12—3,76
0,74—0,77
3,79 4,02
3,21—3,53
1,44—1,76
2,57—3,21
1957
2,48
3,44
0,68—0,77
3,79
3,21
1,44
2,57
-4,02
-3.53
-1,76
3,21
1958
1,64—2,57
0,48—0,74
3,79 -4,02
2,24 -3,21
1,44 -1,76
2,24 -3,53
1959
2,41 2,57
0,48—0,77
3,91- 4.02
2,41—2,57
1,76—2,25
2,24- 2,84
1060
2,63
2,72
0,77—0,83
4,39
2,24
1,44
2,24
4,49
2,41
-1,61
2,89
а Цены в американских долларах за I г рафинированных металлов (степень чистоты не ниже
99,5%).
В табл. 3 приведены цены на платиновые металлы в 1955—1960 гг.
Примечательно, что увеличение добычи и сокращение потребления обус-
ловили снижение цен на эти металлы до заметно более низкого уровня по>
474 Глава 20
сравнению с ценами за предшествующие 6 лет. Действительно, цена на пла-
тину, существовавшая на 1 января 1959 г., была самой низкой со времени
второй мировой войны. С некоторым увеличением спроса в 1959 г. произошло
небольшое повышение цен, хотя они все еще остаются ниже среднего
уровня цен за предыдущие 5 лет.
ПОЛУЧЕНИЕ МЕТАЛЛОВ
Способы получения платиновых металлов из природного сырья и из
скрапа драгоценных металлов рассматриваются отдельно в зависимости
от источника получения сырья. Следует отметить, что по традиции фирмы,
занимающиеся рафинированием металлов, воздерживались от подробного
описания производственных процессов. В связи с этим приведенные ниже
описания процессов, которые основаны только на опубликованных мате-
риалах, могут отчасти расходиться с современной практикой промышлен-
ности.
Извлечение платиновых металлов из канадских никелевых руд
Уже упоминалось, что платиновые металлы встречаются в сульфидных
.рудах меди и никеля в Сёдбери (провинция Онтарио). Общее содержание
платиновых металлов составляет лишь около 0,5-10 4%, но, так как никеля
здесь добывается очень много, количество получаемых при этом платино-
вых металлов оказывается достаточным, чтобы считать этот источник важ-
ным.
Большая часть никелевых разработок в бассейне Сёдберн осущест-
вляется фирмой «Интернейшнл никель компани», меньшая — фирмой
«Фальконбрндж никель компани». В целях расширения добычи первая из
этих фирм организует новое предприятие в районе Мистер и Лейк-Моак
Лсйк (север провинции Манитоба, около 640 км к северу от Виннипега).
Последние данные говорят о том, что это месторождение будет выдавать
платиновые материалы также в качестве побочных продуктов и что шахта
«Томпсон» будет в Канаде вторым по величине производителем платиновых
металлов. Добычу предполагалось начать в 1960 или 1961 г.
Способ получения платиновых металлов из этих руд сочетается с про-
цессами выделения н рафинирования никеля и меди. Эти процессы описаны
в последних работах по металлургическому производству (см., например,
[18]). Основные стадии процесса, осуществляемого фирмой «Интернейшнл
никель компани», приведены на рис. 1 и 2. Большая часть платиновых
металлов отделяется от никеля и меди во время медленного охлаждения
бессемеровского штейна. При получении последнего степень окисления
серы регулируют так, чтобы получить небольшое количество металличе-
ских никеля и меди, которые действуют как коллектор для выделения пла-
тиновых металлов из сульфидов металлов. Этот сплав драгоценных метал-
лов обладает магнитными свойствами, благодаря чему его можно выделить,
пропуская молотый штейн через магнитный сепаратор. Полученный при
этом продукт расплавляют и обрабатывают таким количеством серы, которого
достаточно для превращения 80—90% никеля и меди в сульфиды; в то же
время небольшая часть этих металлов остается в свободном состоянии.
При охлаждении этого штейна выделяют значительно более богатый метал-
лический сплав, содержащий платиновые металлы; из молотого материала
его выделяют с помощью магнитной сепарации. Этот обогащенный сплав
можно затем подвергать электролитическому рафинированию, во время
которого платиновые металлы накапливаются в анодных шламах.
Пдатиновые металлы
475
Меньшее количество платиновых металлов выделяется при последую-
щем рафинировании никеля. Как показано на схеме, для получения чистого
никеля сырой никель подвергают обработке двумя способами. Па заводе
в Порт-Колборне (провинция Онтарио) осуществляется электролитическое
рафинирование, а на заводе в Клайдэче (близ Суэнси, Уэльс) применяется
Медиа-
никелевые
сулырид
ные
руды
Богатый медью штериня
[на лиивпу)
Двойной сульфид сплав
меди и нипеля драгоценных
металлов
аахмцро0ан&
способу МснЗа
медь,
Чистый I Остаток
i % глигтнпвих
метрш
Маш I
Юлись свонирЛ
соинец японца, премию
шлпм фмХ Uvw
тлим, повпнив I
содержащий плат- rnnfm пПпршпрн-
новые мгп/иялы uijiuo .ииисищсп'
ный платиной
h2so, I
Остаток остаток
Коицащхт глатлюдш пктшееые лктсл-
металлоо я", зшюто
Раствор
Ag2S0,
PdSO,
Выделение серейра
и палладия
КОНЦЕНТРАТЫ ПЛАТИНОВЫХ
МЕТАЛЛОВ
Рис. I. Схема процесса извлечения и разделения плати-
новых металлов, применяемого фирмой сИнтериейшнл иикель
компани».
Первая стадия — получение концентратов платиновых металлов.
карбонильный способ Монда. В первом случае анодные шламы, содержащие
драгоценные металлы, обжигают и сплавляют в виде вторичных анодов,
которые также подвергают электролизу. Полученные шламы содержат около
2% платиновых металлов, однако путем соответствующей кислотной обра-
¦ботки шлама концентрацию этих металлов можно довести до 50%
При рафинировании никеля по способу Монда остаток после обработки
«окисью углерода подвергают обжигу и затем выщелачивают серной кисло-
476
Глава 20
Концентраты
платиновых металлов
Нарекся
Раствор
Pt.Pd.Au
Ли(загрязненное)
[Процесс
nh ci рольвилля
ГаТП
Остаток
ФЛЮСЫ I Плпоки
Королек свинца
Раствор
Ag,Pt,Pd
Pncmoop
]
(NHjzPtCIe—|
IПрскали-
|вание
Раствор
Ihci
Pd(NH3JCI2
Pt
[
I
Раствор
Царская
вавка
(NH4JPtCI6
\прокалиеание (н2) [Прокали-
Pd
Расптор
\Проксиш-
| ваиие(н^
| Rh |
Остаток
Rh.Ir;R"jOs
khso, \Сплавление
I
Остаток
Сплав-
ление
,J
J Прокали-
вание (H)
Прокали
вание (Hj)
OSO2(NH3LCl2
|f7pDKO"-
I ванш
RuO2
\Прокали
[вание (нг)
Ru
Рис. 2. Схема процесса извлечения и разделения платиновых
металлов, применяемого фирмой «Иитериейшнл никель компани».
Вторая стадия — разделение платиновых металлов.
той для окончательного удаления меди и никеля. В остатке содержится
около 20% драгоценных металлов, как это видно из приводимого ниже
типичного анализа:
Платина 1,85% Рутений 0,Ш%
Палладий 1,91% Серебро 15,42"i
Родий 0,20% Золото 0,56%
Иридий 0,04%
Полученный на указанных выше" заводах по рафинированию нике-
ля материал транспортируется для дальнейшей переработки на Актон-
ский рафинировочный завод фирмы «Монд никель компани» (Лондон,
Англия).
Платиновые металлы 477
Па предприятиях фирмы «Фалькоибридж никель майнс, лтд.» обогащен-
ный концентрат выделяют магнитным способом, затем остаток подвергают
флотации и далее мокрой магнитной сепарации. Концентрат плавят в шахт-
ной печи на штейн, который далее обрабатывают в конверторах с основной
футеровкой, чтобы получить пригодный для транспортировки высококон-
центрированный штейн. Этот штейн, содержащий около 48% никеля, 28% ме-
ди и 22% серы, отправляется для дальнейшей переработки на рафинировоч-
ный завод фирмы в Кристиансанде па юге Норвегии. Здесь его обжигают
и из продукта обжига выделяют медь кислотным выщелачиванием и никель
путем электролиза. Анодные шламы от процесса электролиза сплавляют
и вновь подвергают электролизу с целью получения концентрата драго-
ценных металлов, который рафинируют на том же заводе в Норвегии.
Осуществляемые данной фирмой процессы подробно описаны в недавно
опубликованных материалах [11.
Извлечение платины из южноафриканских руд
Важнейшие южноафриканские месторождения располагаются па гори-
зонте Меренскай-Риф; это — огромное месторождение платины, образую-
щее часть Бушвельдского комплекса изверженных пород. Разработку
месторождений ведет фирма «Растенбург платинум майнс, лтд.». Растен-
бург находится к северо-западу от Иоганнссбурга и к западу от Претории.
Платина встречается здесь главным образом в виде сульфидных минералов
«.-перрилита, куперита и браггита вместе со стибиопалладипитом и золотом.
Кроме того, в этих месторождениях встречается некоторое количество
металлической платины. Платиновые металлы ассоциируют с такими суль-
фидными минералами, как пирротин, пентланднт и иприт. Местами эти
руды сильно выветрились и подверглись окислению. Содержание в них
платиновых металлов составляет 4-Ю4—10-10~4%. Содержание этих
металлов колеблется в широких пределах; анализ образцов из месторожде-
ния Меренскай-Риф показал следующее содержание отдельных драгоцен-
ных металлов в их сумме [56]:
Платина
Палладий
Прочие платиновые
металлы
Золото
06—77%
И—25%
1—7%
2—5%
Как уже упоминалось, низкое содержание в этих рудах основного металла
делает переработку этих руд невыгодной. Поэтому методы концентриро-
вания платиновых металлов в данном случае отличаются от методов пере-
работки канадских руд.
Руду дробят, размалывают и подвергают гравитационному обогащению
на столах и грубом холсте с целью получения продукта, содержащего в сред-,
нем 22 % платиновых металлов в самородном состоянии или в виде сульфи-
дов, и т. д. Этот металлический концентрат может содержать более двух
третей всех имеющихся в руде драгоценных металлов. Концентрат отпра-
вляют на Бримсдаунский завод фирмы «Джонсон Маттей компани, лтд.»
(Лондон, Англия) для дальнейшей переработки. Хвосты гравитационного
обогащения подвергают флотации и получают содержащий платину кон-
центрат, который состоит из смеси сульфидов меди, никеля и железа. Этот
478 Глава 20
концентрат затем плавят на штейн, который обогащают и освобождают
от большей части железа путем продувки в конвертере. Штейн содержит
около 1646 г/т платиновых металлов, половину которых доставляет пла-
тина. Концентрат и никель-медный штейн отправляют для рафинирования
в Англию или перерабатывают на близлежащем заводе фирмы «Маттей
смслтерс, лтд.».
Штейн сплавляют с коксом и бисульфатом натрия. При разливе и мед-
ленном охлаждении этого плава образуются два слоя: верхний, содержащий
сульфид меди с сульфидом натрия и некоторое количество золота или сереб-
ра, и нижний, состоящий из сульфида никеля и большей части платиновых
металлов. В этом процессе разделения меди и никеля, известном под назва-
нием процесса с разделением плава на верхний н нижний слои, исполь-
зуется принцип, применявшийся много лет при переработке руд месторо-
ждения Садбери в Канаде. Верхний слой (сульфид меди) плавят в отра-
жательной печи, затем продувают до образования черновой меди и, нако-
нец, отливают в виде анодов для рафинирования. Нижний слой (сульфид
никеля) дробят и обжигают во вращающихся печах до образования окиси
никеля. Затем окись никеля брикетируют с углем, восстанавливают до-
металла в отражательной печи и из полученного металла изготовляют аноды
для рафинирования. Анодные шламы, состоящие главным образом из чер-
нового никеля, содержат платиновые металлы. Подобно всем другим содер-
жащим платину концентратам, эти шламы экспортируют в Англию для
рафинирования.
Рафинирование концентратов платиновых металлов
Изложенное ниже базируется в основном на опубликованном описании
процессов, осуществляемых на Актонском рафинировочном заводе фирмы
«Монд никель компания [51]. Остаток при карбонильном процессе, содер-
жащий, как уже отмечалось, около 4% платиновых металлов, подвергают
четырех- или пятикратному концентрированию. Для удаления кремнезема
и основных металлов его сплавляют с свинцовым глетом, флюсами и дре-
весным углем. Сульфат свинца, который является главной составляющей
остатка карбонильного процесса, переводится в свинец. Полученный таким
путем свинцовый слиток купелируют и получают значительно обогащен-
ный сплав драгоценных металлов.
Этот сплав разделяют путем обработки кипящей концентрированной
серной кислотой, приводящей к растворению почти всего серебра и около
одной трети палладия с образованием сульфатов. Серебро выделяют и под-
вергают электролитическому рафинированию по способу Мёбиуса [II,
стр. 433], а палладий извлекают из анодных шламов.
После этого из оставшегося металла путем обрабопкн царской водкой
экстрагируют золото, платину и остаток палладия. Таким же образом обра-
батывают остатки при электролитическом рафинировании никеля и меди.
Получаемый при этом раствор хлоридов сначала обрабатывают сульфатом
железа(П) для осаждения золота в соответствии со следующей реакцией:
3FeM-+AuCIl —> 3Fe3++4Cl-+Au.
Черновое золото очищают электролитически по способу Вольвилля
[11, стр. 268). Платина осаждается из раствора в виде хлороплатинатаAУ)
аммония при добавлении хлорида аммония. Первый осадок после отделе-
ния и сушки очищают путем прокаливания до металла, который затем-
вновь растворяют в царской водке. Из этого раствора получают чистый-
П.ютинтые металлы 479
хлороплатинат аммония, который при прокаливании дает чистую губчатую
платину. Палладий выделяют из раствора в видедиаммннодихлоропалладия.
Сначала добавляют избыток аммиака, а затем соляную кислоту, в результате
чего осаждается желтая соль:
, 4NH3 —> Pd(NH3)j++4CI-,
j-2HCl - ¦* Pd<KH3JCI,+2NHt
Эту соль можно очищать растворением в избытке аммиака с повторным
осаждением соляной кислотой. При прокаливании соединения палладия
получается губчатый металл.
Нерастворимый остаток, полученный после экстракции царской водкой,
плавят со свинцовым глетом и флюсами и купелируют образующийся прн
этом свинцовый сплав. Полученный сплав драгоценных металлов разде-
ляют затем путем обработки азотной кислотой, удаляющей большую часть
палладия, платины и серебра. Нерастворимый остаток содержит родий,
иридий и рутений (и очень небольшое количество осмия) в концентрирован-
ном виде. Эта группа металлов известна иногда как побочные металлы, и по-
следующая переработка их составляет трудную часть процесса рафиниро-
вания платиновых металлов. Конечно, в этой части в опубликованных схе-
мах рафинирования различия и новшества встречаются больше, чем в части
выделения платины и палладия.
В одном из процессов родий извлекается после сплавления с бисуль-
фатом калия в виде растворимого двойного сульфата 151]. Раствор может
содержать следы других платиновых металлов, причем родин можно выде-
лить в чистом состоянии в виде осадка гсксапитритородита (ЙНЛK [Rh (NO2U
аммония (или калия). Из этого осадка родий получают путем прокаливания;
прокаливание и охлаждение осадка следует проводить в атмосфере водо-
рода. В другом процессе растворению родия в виде сульфата предшествует
обработка осадка побочного металла свинцом при умеренных температурах;
из четырех платиновых металлов только родий будет растворяться в свинце-
194]. Свинцовый сплав последовательно обрабатывают азотной кислотой
и затем горячей серной кислотой для растворения родия, в то время как
иридий, рутений и осмий остаются в виде нерастворимого остатка.
Рафинирование родия до высокой степени чистоты таким химическим
способом является трудным и утомительным. Уичерс и сотр. 1921 дали
оценку процесса, применяемого в Бюро стандартов США. Имеются сооб-
щения, что некоторые рафинировочные заводы для выделения из родия при-
месей основных металлов используют в настоящее время ионообменные
смолы [14]. В большинстве своих соединений родий входит в состав анион-
ного комплекса, так что при пропускании раствора, содержащего родий
в одном из таких комплексов наряду с основными металлами в катионной
форме, через катионообменную смолу происходит накопление в элюате-
родня в чистом виде.
Остаток после выделения родня обрабатывают для удаления платины,
золота и сульфата свинца, остающихся в сплаве после обработки его азот-
ной кислотой. Нерастворимый остаток подвергают окислительному сплав-
лению с едким кали и нитратом калия. Таким путем рутений переводят
в растворимый рутснат калия KsRuO4, а иридий окисляют в соединение,
которое нерастворимо в воде, но растворяется в царской водке. Соединение
рутения извлекают водой, а раствор обрабатывают хлором. Из этого раство-
ра при нагревании улетучивается четырехокись рутения; пары отгоняются
и поглощаются разбавленной соляной кислотой, содержащей метиловый
спирт. Таким путем рутений переводят в окспхлорид RuOCU. который выде-
¦№0 Г лава 20
ляется при выпаривании раствора. Металлический рутений папучают путем
прокаливания этого соединения в водороде.
Осмий присутствует в канадских рудах (месторождение в Садбери)
лишь в очень небольшом количестве. Его содержание составляет менее 1 %
содержания рутения. Концентраты из других источников могут содержать
¦большее количество осмия. Чтобы осмий не загрязнял получаемый только
что описанным способом рутений, его можно отделить одним из следующих
методов, подлежащих разделению. Когда преобладает рутений, дистиллат
можно улавливать горячей соляной кислотой; при этом рутений получают
в виде трихлорида. Непосредственно из этого раствора можно отогнать
четырехокись осмия, поглощая дистиллат спиртовым раствором щелочи.
Полученный раствор нагревается в автоклаве с хлоридом аммония для
осаждения осмилгетраамминохлорида OsO2(NH3LCl2- Металлический осмий
получают путем прокаливания этого соединения в водороде.
Другой метод — обработка водного экстракта из продукта окислитель-
ного сплаапения — состоит в добавлении спирта для осаждения рутения
в ннде гидратированной двуокиси. Последнюю отделяют путем фильтро-
вания, а осмий выделяют из фильтрата осаждением в виде осмата калия
при добавлении избыточного количества едкого кали.
Иридий, окисленный при сплавлении с нитратом калия, растворяют
в царской водке и полученный раствор частично упаривают. При добавлении
хлорида аммония осаждается хлороирндат (IV) аммония. Осадок можно
очищать путем повторной кристаллизации, главным образом для отцеле-
иия платины. После выделения в достаточно чистом состоянии соль про-
каливают. Полученный таким образом металл содержит некоторое количе-
ство окиси, которую восстанавливают при нагревании в токе водорода.
Следует отметить, что все фильтраты и нерастворимые остатки возвра-
щаются на соответствующие стадии процесса, так что практически потери
металлов отсутствуют. Сообщают, чго на рафинировочном заводе в Актоне
потери составляют не более 0,25/6 содержащихся в концентратах плати-
новых металлон, причем в шлаках остается 1.25%. Поскольку шлаки пере-
даются для дальнейшей обработки на никелевый рафинировочный завод,
большая часть потерь возвращается. Потери при выделении никеля и меди
также невелики. Подсчитано, что извлекается не менее 90% драгоценных
металлов, содержащихся в руде, за исключением, может быть, только осмия.
Потери осмия в виде четырехокиси в заметных количествах происходят,
вероятно, при таких операциях, как плавка и купелирование.
Переработка самородной плагины [20, 23]
До разработки канадских и южноафриканских месторождений платину
получали почти исключительно из аллювиальных отложений самородного
металла. Самородная платина встречается в виде смеси металлических
сплавов в различных районах земного шара. Как уже отмечалось, эти
сплавы состоят главным образом из платины и небольших примесей осталь-
ных металлов платиновой группы вместе с некоторым количеством железа
и следами других простых металлов. Кроме того, естественно образующийся
сплав иридосмин встречается преимущественно в виде механической смеси
с другими металлами. Типичный состав самородной платины и иридосмина
различных месторождений указан в табл. 4.
Если не считать некоторой сложности операции перевода иридосмина
в растворимое состояние, то переработка этих сплавов с целью извлечения
различных платиновых металлов производится по способу мокрой сепара-
Платиновые металлы
481
Таблица 4
Месторождение
~1латЛш
СССР
Южная Аф-
рика
Колумбия
-1ридосмин
Южная Аф-
рика
Тасмания
СССР
СОСТАВ
Pt
73—86
0
80-84
84—86
12,9
1,9
10,1
0
САМОРОДНОЙ
Pd
3—1,8
U,4
5-1
—
—
—
Os
0—2,3
32,7
45,6
27,2
ПЛАТИНЫ И ИРИДОСМИНА
Ri
?
14
7
5
1
3
9
9
Состав, %
Rh
0,3—3,5
2
Всего 0,5-
1,4
1
0,2
1,5
1г
,6—4,3
Аи
0,4
1
0,8
29,6
42,2
55,2
1
—
0,01
—
ирид-
ОСУИН
0,5
—
1
—
—
—
Fe, Си
8—17
II
5—8
—
—
—
ции, сходному с уже описанным в предыдущем разделе процессом рафини-
рования концентратов платиновых металлов канадского происхождения.
Сначала материал растворяют в царской водке. Нерастворимый остаток,
который состоит главным образом из иридосмина, иридия и, видимо, неко-
торого количества неплатиновых минералов, перерабатывают отдельно.
Из раствора в царской водке путем повторного выпаривания удаляют
азотную кислоту. Затем осаждают хлороплатииатAУ) аммония с при-
месью главным образом хлороиридата (IV) аммония. Для дополнительной
очистки исходное вещество прокаливают до металла, растворяют его в цар-
ской водке и снова осаждают. Примеси можно отделять при дробной кри-
сталлизации хлороплатипатаAУ) натрия.
Переработка фильтрата, полученного после осаждения платины, зави-
сит от содержания присутствующих в нем различных металлов. Часто
на этой стадии процесса для осаждения благородных металлов добавляют
цинк или железо. Благородные металлы можно разделить, используя уме-
ренную растворимость золота, палладия и платины в мелкодисперсном
состоянии в разбавленной царской водке, в которой родий, иридий и руте-
ний растворяются в незначительной степени. Из получаемого раствора
вначале осаждают платину, затем золото путем добавления сульфата желе-
за(П), и, наконец, окисляют в растворе палладий и осаждают его в виде
хлоропалладата (IV) аммония. Следует иметь в виду, что осажденные сое-
динения платины и палладия содержат примеси других металлов. Для полу-
чения металла в чистом виде осадки необходимо подвергать очистке.
Остаток, состоящий из родня, иридия и рутения, хлорируют на слое
хлорида натрия, сплавляют с едким натром и перекисью натрия или чере-
дуют эти операции. Первая из этих операций дает растворимый в воде хло-
рородиг, а вторая приводит к получению водорастворимого рутената
и соединения иридия, растворимого в соляной кислоте. Из полученных таким
путем растворов родий осаждается в виде гексанитритородита аммония,
а иридий — в виде хлороиридатаA\) аммония. Для выделения рутения
четырехокись рутения дистиллируют в токе хлора и поглощают ее раство-
ром разбавленном соляной кислоты. Из получаемого раствора путем добав-
ления хлорида аммония осаждают- рутений. Путем прокаливания этих
31 Заказ N. 239
482 Г лава 20
осадков d восстановительной атмосфере могут быть получены чистые метал-
лы, хотя перед прокаливанием родий лучше перевести в хлорородит
аммония.
Переработка остатка, который ие растворился при первоначальной
обработке царской водкой (иридосмина), еще недавно являлась предметом
исследований. Обычно из остатка получают сплав с цинком, который затем
обрабатывают соляной кислотой. В результате получают мелкодисперсный
материал, который сплавляют с перекисью натрия и едким натром. Такая
обработка позволяет извлекать осмий, большую часть рутения и небольшое
количество водорастворимого иридия. Водный раствор подкисляют азотной
кислотой, четырехокись осмия дистиллируют в токе воздуха. Пары улав-
ливают в растворе едкого натра, вероятно содержащем небольшое коли-
чество спирта. Из этого раствора выделяют осмилтетраамминохлорид
OsO2(NH3LCl2, который можно затем восстановить до металла. Дистилля-
цию рутения осуществляют путем хлорирования и нагревания пригото-
вленного щелочного раствора. Четырехокись отгоняют и улавливают,
как указано выше. Нерастворимый в воде остаток со стадии разложения
иридосмина сплавлением с щелочью растворяют в соляной кислоте, причем
иридий выделяется из этого раствора в виде хлороиридатаAУ) аммо
иия.
При описанном выше сплавлении с щелочами для разложения ирн-
досмипа и других содержащих платину материалов, не растворимых в цар
ской нодке, в конечный раствор попадают различные загрязняющие эле-
менты. Недавно взамен этой трудоемкой операции были предложены два
других способа. Первый из них состоит [93] в нагревании пробы в запаян-
ной трубке с концентрированной соляной кислотой и окислителем, напри-
мер хлором. Были исследованы и другие смеси, содержащие, например,
азотную кислоту и хлорат натрия или хлорную кислоту. В некоторых ел у
чаях температура достигала 300°, а давление составляло до 280 am. При этих
условиях растворялись различные сплавы металлов платиновой группы
и чистый иридий. Второй способ [301, применяемый лишь в небольшом
масштабе, заключается в сухом хлорировании сплава в присутствии избытка
хлорида натрия. Таким путем в растворимую форму можно перевести раз-
личные образцы иридосмина, в том числе и иридосмина тасманского проис
хождения, который совершенно ие поддается сплавлению с щелочами
и растворяется при мокром хлорировании в запаянной трубке лишь
частично. Этот способ применим также к пробам самородной платины,
которая полностью переводится в растворимую форму. Ни один из этих
способов, по-видимому, не применяется в промышленном масштабе, однако
предполагается, что в случае необходимости это можно будет осуществить
Следует отметить, что способы переработки самородной платины опи
саны выше лишь в самых общих чертах. На практике разделение редко дает
чистый продукт, вследствие чего каждый осадок требуется очищать для
удалении других металлов платиновой группы. Наряду с этим некоторое
количество каждого металла вследствие неполноты осаждения уносится
вместе с маточным раствором, который затем передается на последующее
разделение. Рафинирование платиновых металлов фактически представляет
собой крупномасштабную лабораторную работу в области неорганической
химии, которую нельзя проводить без основательного знания химии этих
элементов.
Подробно способы получения металлов платиновой группы в чистом
виде, применяемые Национальным бюро стандартов (США), описаны в ра-
боте [231.
Платиновые металлы
48J
Рафинирование скрапа
Значительная часть годовой продукции платиновых металлов полу-
чается за счет использования лома зубопротезных и ювелирных изделий,
лабораторного оборудования, отработанных катализаторов и т. д., а также
отходов рафинировочных и гальванотехнических цехов и заводов. Это сле-
дует из приведенных ниже данных за 1958 г. [79] о размерах производства
в США платиновых металлов: 1) из природной платины вместе с неболь-
шими количествами, выделенными из местных золотых и медных руд; 2) из
иностранных источников, главным образом из Колумбии; 3) путем рафини-
рования металлического скрапа, сметок и других отходов производства
Металл
Платина
Палладий
Иридий
Осмий
Родни
Рутений
Всего
Пронявидстпо платиновых металлов
за 1958 г., кг
природные
источники
280,7
145,9
52,4
11.4
8,4
0,7
499,5
иностранные
источники
820,5
38,0
45,4
20,1
29,8
45,5
999,3
вторичные
IIL1 ОЧИНКИ
1132,8
1209,3
38,0
10,4
82,1
62,4
2535,0
Скрап перерабатывают, как правило, теми же способами, что и кон-
центраты или самородный металл. Однако из-за более высокого содержа-
ния серебра и золота в скрапе требуется некоторое изменение технологии.
Этот вопрос весьма подробно рассмотрен в книге Хока [31], а также в обзор-
ных статьях Уайтли и Дитца [91] и ДеРла [17].
СПОСОБЫ ПОЛУЧЕНИЯ
Плавка [47, 91, 95]
Существуют два основных способа плавки платиновых металлов и их
сплавов. В одном из них металл непосредственно нагревается в тигле из
окиси кальция на пламени водородно-кислородной или кислородной горел-
ки. В другом способе применяется высокочастотный индукционный нагрев.
Второй способ наиболее широко применяется в промышленности. В послед-
нее время в исследовательских работах, когда необходимо плавить неболь-
шие количества металла, стали применять вакуумные дуговые печи.
В историческом обзоре [57J указаны три основные фазы в развитии
способа плавки платины. Первая фаза началась после изобретения Робер-
том Хэйри (Филадельфия) в 1801 г. водородно-кислородной горелки. Фирма
Бишопа, созданная в Мелверне (штат Пенсильвания), впервые стала изго-
товлять в промышленном масштабе платиновую аппаратуру, причем плавка
осуществлялась с помощью сварочной горелки. Второй исторический
31*
4Я4 Глава 20
период начался с применения Девиллем и Дебраем в 1857 г. тигля или печи
из окиси кальция, в которых можно было плавить платину в кислородном
пламени. С этого времени платина становится доступной, при этом важное
значение имело освоение в 1862 г. процесса повышения прочности пла-
тины путем добавления иридия. Третий современный период начался
в 1921 г. с применения для этого процесса высокочастотной индукционной
электропечи, изготовляемой фирмой «Аякс-Нортруп».
Тигли для плавки платины с помощью нагрева пламенем изготовляют
из сухой обожженной извести под высоким давлением. Оии состоят из верх-
ней и нижней частей, соединяемых железным кожухом. Нижняя часть
имеет вогнутую форму и желобок для выпуска расплавленного металла;
верхняя часть также вогнутой формы имеет в центре отверстия для ввода
горелки и выхода газов. Тигель необходимо предварительно нагревать
для удаления из извести окклюдированных газов, чтобы не было сильного
разбрызгивания металла. При плавке большого количества металла во
избежание его загрязнения наконечник горелки следует делать из сплава
платины с иридием.
Выбор огнеупоров для изготовления тиглей, по-видимому, ограничи-
вается окисью кальция и двуокисью циркония. Утверждают, что окись каль-
ция больше подходит для этой цели, чем двуокись циркония, так как она
способствует лучшей очистке платины путем поглощения небольших коли-
честв примесей обычных металлов пористыми стенками тигля. Кроме того,
слиток можно очищать от прилипшей к его поверхности извести путем
обработки соляной кислотой. Преимущество тигля из двуокиси циркония
состоит в том, что он не поглощает влагу. Это делает ненужным пред-
варительный нагрев тигля и допускает его повторное использование.
Тигли из глинозема, графита или двуокиси кремния загрязняют металлы
углеродом или кремнием, в результате чего металл становится хруп-
ким.
Применение тиглей из окиси кальция и нагрева пламенем для плавки
платиновых металлов связано с серьезными недостатками, в связи с чем
для этой цели широко применяется индукционный нагрев. Трудно обес-
печить надлежащее качество извести для условий работы с высокими тем-
пературами. На протяжении всего цикла плавки необходимо очень тщатель-
но регулировать состав газовой смеси. При любом восстановительном харак-
тере пламени может происходить восстановление кальция или магния из
извести и последующее загрязнение расплавленного металла. С другой сто-
роны, окислительное пламя способствует проникновению газов в металл,
что создает затруднения в последующем процессе изготовления фольги
и может даже привести к браку литья. Кроме того, некоторое количество
платины теряется в виде дыма (об окислении см. стр. 499), а при плавке
сплавов, богатых осмием или рутением, наблюдаются заметные потери этих
металлов в виде летучих окислов.
В индукционной печи достигаются высокие температуры, при которых
плавится металл, и не требуется наличия большой окружающей горячей
массы. Следовательно, для выпуска расплавленного металла можно легко
извлечь тигель, содержащий плав, если он заключен в оболочку из двуокиси
кремния. Смешение сплавов, не очень эффективное при плавке в тигле из
окиси кальция, в индукционной печи осуществляется автоматически, бла-
годаря тому что за счет электромагнитных сил, возникающих в плавке,
¦происходит энергичное перемешивание металла. Тигли изготовляют боль-
шей частью из двуокиси циркония, двуокиси кремния или окиси, алюминия
¦и футеруют двуокисью циркония или двуокисью тория. Характер иидук-
Платиновые металлы 485
ционного нагрева таков, что легко сконструировать аппаратуру, в которой
плавку металлов можно проводить в вакууме или в атмосфере инертного
газа. При плавке в вакууме слитки содержат меньше примесей газов и пу-
стот, что ведет к уменьшению брака при последующих операциях протяжки
и волочения.
Для получения очень чистых платиновых металлов, которые требуются
для научно-исследовательских работ или отдельных случаев применения
в электротехнике, необходимо предотвращать попадание в металл приме-
сей из огнеупорных материалов, в которых производится плавка, или
из атмосферы. Рауб и его сотрудники, которые провели много важных иссле-
дований сплавов платиновых металлов в Исследовательском институте
драгоценных металлов и химии металлов (Гмюнд, Швабия, ФРГ), при-
держиваются пессимистических взглядов по вопросу о степени неизбеж-
ного загрязнения этих металлов в результате реакций с огнеупорными мате-
риалами при высоких температурах. Такие реакции происходят чаще всего
в тех случаях, когда плавка проводится в восстановительной атмосфере.
Указанные выше исследователи пользовались вакуумной дуговой печью
с охлаждаемым водой медным тиглем и вольфрамовым электродом. Они
не нашли следов примесей меди или вольфрама в металле. Плавка в силу
необходимости проводилась в атмосфере аргона, так как в их печи нельзя
было создавать глубокий вакуум: для освобождения сплава от примесей
газов необходим отжиг металла в оакууме 1681.
Методы обработки [47, 95, 96]
Операции обработки платиновых металлов и их сплавов зависят от их
индивидуальных характеристик. Большую часть промышленной продукции
изготовляют из платины, палладия и их сплавов, которые выдерживают
большое обжатие. Обычно слитки этих металлов, особенно предназначаемые
для волочения, нагревают до белого каления и подвергают ковке в горя-
чем состоянии механическим молотом. После этой операции металл стано-
вится более плотным, из него устраняются пустоты и газовые пузыри. По
словам Сивнла [84], «платиновая промышленность, видимо, как никакая
другая отрасль металлообрабатывающей промышленности, испытывает труд-
ности из-за образования пузырей, так как, помимо химического сродства
этих металлов к газам, очень трудно регулировать температуру плавки».
Для некоторых зубоврачебных сплавов, особенно для тех, в которых содер-
жится золото, горячей ковки может не потребоваться. У плоских заготовок,
предназначенных для производства листового материала, принято сни-
мать вес неровности на поверхности, что позволяет производить первую
прокатку при температурах выше 800°. Затем слитки подвер! ают холодной
прокатке, ротационной ковке или протяжке до нужных размеров.
Родий и иридий тверже и хрупче платины и палладия, вследствие чего
их обработку производят иначе. При температурах выше 800° |85] родий
можно ковать и протягивать в проволоку диаметром 1 мм. В результате
горячей ротационной ковки проволока приобретает крупнозернистость.
лишающую ее гибкости. Гибкую проволоку получают, постепенно пони-
жая температуру во время обработки металла. Листовой родий можно изго-
товлять последовательной горячей прокаткой до толщины около 0,75 мм,
после чет металл становится достаточно гибким для холодной прокатки.
При холодной прокатке необходим многократный промежуточный отжиг.
Иридий совершенно не поддается прокатке в холодном состоянии, но его
486 Глава 20
можно обрабатывать в горячем состоянии так же, как и родии, при условии,
что металл имеет достаточно высокую степень чистоты.
При волочении проволоки жидкие смазочные материалы слабо сма-
чивают платину и ее сплавы, поэтому часто приходится применять сухие
мыльные порошки, которыми металл обмазывают перед пропусканием его
через фильеры. Фильеры изготовляются из стали, сапфира, карбида воль-
фрама и алмаза. Следует принимать меры для предотвращения загрязнения
металлов и их сплавов в процессе обработки; часто полосы и листы до от-
жига подвергают травлению для удаления попавшего с вальцов железа.
Все эти металлы твердеют в процессе обработки, и через соответствую-
щие промежутки времени требуется отжиг. В большинстве случаев это
осуществляется в муфельной печи со свободным доступом воздуха для обес-
печения окислительной атмосферы. Во время отжига не следует допускать
соприкосновения металла с пламенем, так как некоторые сплавы могут
загрязняться примесями, которые ведут к хрупкости или ухудшают струк-
туру металла. Некоторые сплавы приходится отжигать в атмосфере азота
или водорода, но последний иногда поглощается металлом, особенно палла-
дием, отчего металл твердеет. Температура отжига зависит от состава
металла; присутствие родия или иридия ведет к повышению этой темпе-
ратуры.
Изделия из платины и палладия и их сплавов можно изготовлять путем
выдавливания, протяжки и прокатки. Цельнотянутые трубы легко изго-
товляются при условии не слишком высокого содержания родит и иридия.
Сами по себе металлы не пригодны для штамповочных пли токарных работ,
так как их не удается чисто отрезать. Однако добавка иридия к платине
и рутения к палладию ведет к некоторому улучшению. Из платины можно
протягивать проволоку диаметром до 0,025 мм и менее. Проволока еще
меньшего диаметра (до 0,001 мм) для крестов нитей в оптических инстру-
ментах или для плавких предохранителей может быть изготовлена по спо-
coov Волластона (заделка в серебро). После окончания протяжки платино-
вую проволоку в этом случае освобождают от серебра, растворяя его в азот-
ной кислоте.
Для пайки изделий из платиновых металлов рекомендуется применять
тонкое листовое золото. Металлы можно сваривать между собой плавлением
или путем сварки ковкой при температурах ниже температуры плавления.
Путем сварки ковкой их можно сваривать также с железом, сталью и мно-
гими цветными металлами. Некоторое количество плакированных плати-
ной или палладием изделий изготовляют путем сварки этих металлов с бру-
сками или листами никеля или серебра. Затем производят протяжку или про-
катку до нужной толщины. Покрытие из платины имеет толщину не менее
0,05—0,075 мм. Совсем недавно получило развитие производство плаки-
рованных платиной электродов, являющихся незаменимыми для применения
в целях борьбы с коррозией (см. стр. 503). В этом случае платина исполь-
зуется в качестве покрытия на поверхности тантала или титана [ 15, 661;
по одному способу производства лист платипы накатывают на лист тантала
или платиновую трубу протягивают по танталовому стержню, а затем пла-
кированный материал обрабатывают в вакуумной печи для папучения хоро-
шей металлургической связи.
Обработка рутения и осмия оказалась безрезультатной. Это объяс-
няется особенностью кристаллической структуры этих металлов, отличаю-
щей их от других четырех платиновых металлов. Той же особенностью руте-
ния и осмия объясняется огромное повышение твердости сплавов при их
легировании этими двумя металлами.
Платиновые металлы 487
Электроосаждение [5, ТО, 81, 82]
Из шести металлов платиновой группы только в отношении платины,
палладия и родия применялось электролитическое осаждение как в про-
мышленном, так и в лабораторном масштабах. Известны условия ведения
процесса полного осаждения каждого из этих трех металлов для аналити-
ческих целей. Родий осаждается загрязненным окисью этого металла.
Иридии с трудом восстанавливается из растворов его хлорида и сульфата
химическим или электролитическим путем. В литературе описаны способы
отделения палладия или родия от иридия с помощью избирательного оса-
ждения. Разделение родия и иридия электролизом весьма затруднено тем,
что наряду с загрязнением осажденного родия его окисью происходит
также осаждение окиси иридия.
Путем злектроосаждеиия платины, палладия и родия в промышленном
масштабе наносят главным образом тонкие декоративные покрытия. Элект-
роосаждение родия успешно проводилось в течение длительного времени,
и при соответствующем приготовлении растворов электролита оно не пред-
ставляет трудности. Родиевые покрытия обладают высокой отражательной
способностью и твердостью; в промышленных условиях могут быть полу-
чены покрытия толщиной 2-10 6 см. Сравнительно труцно получать более
толстые непроницаемые покрытия из платины или палладия. Одной из
причин этого является склонность платины к образованию мелких тре-
щин на покрытии, вероятно, в результате уплотнения. Вследствие этого
покрытие слабо защищает от действия кислот и газов. Подобному растре-
скиванию могут подвергаться покрытия из родия толщиной свыше 5-10 4 см.
В случае электроосаждения платины и палладия выход по току составляет
менее 100%, причем одновременно выделяется значительное количество
водорода. Водород поглощается металлами, которые при этом твердеют.
Это отрицательно сказывается в том случае, когда для получения более
толстого по сравнению с декоративным покрытия приходится неодно-
кратно производить крацевание поверхности, что цля твердой и хрупкой
поверхности сопряжено с трудностями.
Родий используют для нанесения тонких покрытий па серебряные
ювелирные изделия, чтобы предотвратить их потускнение и сохранить
характерный блеск. Более толстые покрытия родия наносят на столовое
серебро, а также на высококачественные отражатели для прожекторов
и проекционных фонарей. Палладий применяется для покрытий часовых
корпусов, портсигарон и т. д. Представляет интерес применение палладие-
вого покрытия как основы при нанесении золотого покрытия на серебро,
поскольку палладий препятствует диффузии золота в серебро. Хотя и ут-
верждают, что палладий можно наносить па любой металл или припой,
на практике предпочитают предварительно наносить на металл основное
покрытие из никеля. При нанесении родия на сплавы золота или платину
подложка не нужна, но в случае сплавов олова и свинца никелевое покры-
тие совершенно необходимо, чтобы родиевое покрытие не получилось тем-
ным и полосатым. Никелевая подложка повышает стойкость родиевого
покрытия к истиранию.
Подробные сведения о составе растворов, применяемых для электро-
осаждения, сообщаются многими авторами, ссылки иа работы которых
указаны в начале данного раздела. По этому вопросу зарегистрировано
множество патентов. Платина лучше всего осаждается из аммиачного рас-
твора диаммииоплатинонитрита (платиновая Р-соль), содержащего нитрат
аммония и нитрит натрия. Можно пользоваться платиновыми или уголь-
488 Глава 20
ными анодами, причем первые из них не растворяются. Преимущество такой
ванны состоит в том, что в ней концентрация солей длительное время остает-
ся неизменной. Недавно сообщалось, что при осаждении из ванны, содер
жащей платиноD)-хлористоводородную кислоту и соляную кислоту в за-
метных концентрациях, получается утолщенное с хорошей адгезией покры
тие, не имеющее трещин [4]. Палладий можно осаждать из такого же аммиач
ного раствора, как было указано выше, но для достижения хороших резуль-
татов процесс необходимо вести при более низком напряжении и более
тщательном регулировании рН. При электроосаждении из раствора хло-
рида палладия с хлоридом аммония получаются тяжелые покрытия. В этом
случае пользуются расходуемыми палладиевыми электродами. Состав луч
ших растворов для электроосаждения родия неизвестен, но готовятся они
из выпускаемых промышленностью концентрированных растворов. Эти
растворы, по-видимому, содержат родий в виде ьислых комплексных суль-
фатов или фосфатов. Приготовленный раствор добавляют к раствору серной
или фосфорной кислоты. Для получения утолщенных покрытий без потерь
блеска предложены различные добавки. С этой целью применяют селено-
вую кислоту при концентрации 0,4—1,0 г/л. Сообщалось [70|, что при этом
из сульфатных ванн должны осаждаться покрытия, не имеющие трещин,
толщиной более 10~яси. При осаждении родия из этих растворов применяют
нерастворимые платиновые аноды. Характерной особенностью процесса
электроосаждения всех этих металлов является то, что он проводится из теп-
лых или горячих растворов и при сравнительно малой плотности тока.
Недавно в исследовательских лабораториях Джонсона Маттея был
приготовлен новый раствор для нанесения платиновых покрытий, который
позволяет получать тяжелые, прочные и блестящие покрытия на многих
основных металлах. Электролит состоит из H2Pt(NO2J SO4 E г/л), рН под
держивается ниже 2; температура ванны 50° и плотность тока 54 а/л2—
оптимальные условия для получения тяжелых блестящих покрытий ПОП
Описан способ осаждения палладия при химическом восстановлении
без затраты электрической энергии. В этом случае металл осаждают в виде
слоя толщиной 6-10~3 см па различных переходных металлах (каталитиче-
ских поверхностях) путем восстановления гидразином из аммиачного рас-
твора, к которому- добавлена этилеидиаминтетрауксусная кислота 172].
Осаждение паров металлов
Общее описание метода осаждения паров платиновых металлов в высо
ком вакууме дано Ярвудом [100] и Годлсем [26]. Этот метод не получил
широкого применения в отношении платиновых металлов и, вероятно,
в промышленном масштабе применим только для одного родия. Благодаря
малой упругости паров этих металлов для их испарения требуются очень
высокие температуры и очень глубокий вакуум. Родий обычно осаждают
электролитически на чистую вольфрамовую спираль, которую затем вводят
в аппарат и нагревают электрическим током. В Германии листовой родий
нагревают непосредственно, пропуская ток большой силы. Это дает боль-
шую площадь активной поверхности. Металл осаждают главным образом
на стекло при производстве прочных зеркальных поверхностей, обладаю-
щих высокой отражательной способностью. Платину испарить таким спо-
собом не удается, так как она собирается в каплю на нагревающей прово-
локе, отчего последняя сгорает. Однако платину можно наносить на стекло
при низких давлениях методом катодного распыления. Описание этого
специфического метода имеется в монографии Ярвуда.
Платиновые металлы 48s»
Продажные материалы
Все шесть металлов платиновой группы можно купить в виде губ-
ки или солей. Платина и палладий выпускаются в виде листов, проволоки,
фольги и ленты различной степени чистоты, а также как полуфабрикаты
ювелирных изделий, электрических контактов, стандартных сплавов и ката-
лизаторов. Катализаторы продаются в виде металлических сеток различ-
ных размеров, «черни», окислов и нанесенными на силикагель, активи-
рованный уголь и т. д. В продажу поступают также растворы для электро-
осаждепия платины, палладия и родия. Изготовляется платиновая лабо-
раторная посуда разнообразных форм и размеров (тигли, чашки, лодочки,
шпатели, электроды и т. д.). Выпускают по заказам также платиновые мунд-
штуки, обмотки для печей, цельнотянутые трубы, термоэлементы и обору-
дование для плакирования.
ФИЗИЧЕСКИЕ СВОЙСТВА
Основным требованием для получения истинных или по крайней мере
воспроизводимых значений физических свойств является возможность полу-
чения веществ в чрезвычайно чистом виде для проведения измерений. Невоз
можность достижения абсолютной чистоты, несомненно, приводит к отсут-
ствию удовлетворительного соответствия определяемых различными иссле-
дователями физических характеристик платиновых металлов. Весьма ве-
роятно, что многие из прежних данных недостаточно точны из-за отсутствия
сведений о степени чистоты использованных образцов металлов. В послед-
нее время было установлено, что даже очень небольшие следы примесей,
в том числе примеси других металлов платиновой группы, существенно
изменяют такие свойства, как твердость, электрическое сопротивление и т. д.
В связи с тем что платиновые металлы имеют явно выраженную склонность
к поглощению таких газов, как водород и кислород, нетрудно видеть,
что можно не обратить внимания на наличие примесей. В предыдущем разде-
ле отмечалась возможность образования пустот и газовых пузырей при
получении слитков компактных металлов.
Как и для других металлов, свойства часто зависят от предыстории
образца; твердость и другие механические свойства зависят от степени холод-
ной деформации и от отжига, предшествующих измерениям. Нередко
встречаются утверждения, что «термическая обработка заметно влияет на
температурный коэффициент электросопротивления чистой платины» 129].
При рассмотрении физических свойств чистых металлов последние
располагаются в следующем порядке: платина, палладий, родий и иридий,
рутений и осмий. Кратко рассматриваются также некоторые обычные спла-
вы этих металлов.
Платина
Хотя стандартные спецификации отсутствуют, рафинировочные заводы
выпускают три или четыре различных сорта металлической платины. Пер-
вый сорт, называемый термически чистым, термоэлементпым или физиче-
ски чистым, применяется для изготовления платиновых термометров соп-
ротивления идермопар. Известно, что температурный коэффициент и термо-
электрические свойства платины чрезвычайно чувствительны к присутствию
малейших следов примесей. Платина этого сорта имеет степень чистоты выше
99,99%. Второй сорт называется чистым, химически чистым или специально
490
Глава SO
чистым металлом и содержит не менее 99,9% платины. Из платины третьего
сорта обычно изготовляют тигли; она применяется также для электротех-
нических целей. Обычно ее сплавляют с 0,5% другого металла платиновой
ЬОО BOO 1200
Температура.'С
Рис 3. Термо-э. д. с. металлов по
отношению к платине [88|.
2 t в a w а
Содержание легирующей добавки,%
Р и с. 4. Термо-э. д. с. некоторых
платиновых сплавов, по отношению к
чистой платине при 1200° [88].
группы для повышения твердости и прочности и, следовательно, износо-
стойкости. Четвертый сорт платины, называемый техническим, содержит
не менее 99% металла.
Ниже приводятся опубликованные Джаиом I48J данные, характери-
зующие влияние степени чистоты металла на иекоторые физические свой-
ства.
Характеристика
Плотность при 20э, г/см3
Температура плавления, °С
Удельное электрическое со-
противление при 20°
Температурный коэффициент
электросопротивления в
пределах 0—100°,гров-1
Предел прочности при растя-
жении после отжига.
кг/мм*
Твердость по Виккерсу после
отжига
Сорта платины
первый
21,40
1769
10,5R
0,00392
12,7
42
второй
21,40
1768,5
10,6
0,0039
14,8
so
третий
21,29
1765,5
11,6
П.О035
19,7
65
Платиновые металлы
491
Более полные данные о физических и механических свойствах чистой
платины приведены в табл. 5. Сведения для этой и последующих таблиц
«имствованы из работ 13, 22, 39, 48, 54. 69, 88, 95].
Таблица о
Плотность при 20°, г/см3
Кристаллическая решетка
Постоянная решетки а0, кХ
Модификации
Температура плавления, °С
Температура кипения (вычислен-
ная), СС
Коэффициент теплопроводности п ин-
тервале 0 -100°, кал/см-сек-град
Коэффициент линейного расширения
при 0 . град'1
Зависимость теплового расширения от
температуры
Удельная теплоемкость при 0э,
кал/г-град
Зависимость удельной теплоемкости
от температуры
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Удельное электрическое сопротивле-
ние, мкпм-см
0°
20°
Температурный коэффициент электро-
сопротивления в интервале 0 ]П0",
град-1
Зависимость электросопротивления от
температуры
Поперечное сечение захвата тепловых
нейтронов, барщ'атим
Твердость по Виккерсу после отжига
Твердость по Виккерсу электроосаж-
денного металла
Предел прочности при растяжении
после отжига, кг/ммг
Предел пропорциональности после от-
жига, кг/мм2
Модуль нормальной упругости после
отжига, кг/мм2
Механические свойства зависят от состояния и истории образца, а так-
же от его степени чистоты. Электроосажденная платина гораздо тверже
ковкого металла. Путем холодной обработки с большим обжатием твер-
дость по Виккерсу можно повысить от 50 в отожженном состоянии до
120—125. В этом отношении платина почти сравнима с медью. Предел
1АТИНЫ И ПАЛ.
Платина
21,45
Кубическая
гранецентри-
рованная
3,9161
Не известны
1769
4530
0,17
8,9-10-е
См. работы
[21, 34, 62, 88]
0,0314
См. работы
[42, 88]
24,1
S40
9,81
10,6
0,003923
См. работу
[88]
8,8±0,4
40
600
ллдия
Палладий
12,02
Кубическая
гранецентри-
рованная
3,8830
Не известны
1552
398П
0,17
11.67-10-е
См. работы
[34, 36. 88]
0,0584
См. работы
[36, 46]
38,6
10.0
10.8
0,00377
См. работы
[32. 88]
80±1,5
40
190—400
12,7
2,8
1,55-10*
14.1
2,8
1,12-104
¦192 Глава 20
прочности при растяжении повышается от 14 кг/мм2 в отожженном состоя
нии до 21 кг/ми2 после холодной обработки с большой степенью обжатия
С нагревом до 1000° этот предел снижается до 2,8—4.2 кг/мм*. Предел
пропорциональности отожженной чистой платины очень низкий: для пла
тины второго сорта он составляет около 1,4—2,8 кг/мм*, но холодной обра
боткон его можно повысить до 18,2—19,7 кг/см2.
Твердость платины повышается при легировании. Никель, осмий, руте
ний, медь, золото, серебро и иридий вызывают значительное повышение
твердости; влияние легирующей добавки на единицу веса уменьшается при
мерно в том же порядке. Добавки родия и палладия дают значительно мень
шее повышение твердости, чем перечисленные выше металлы. Предел проч
ности при растяжении н предел пропорциональности при введении различ
ных легирующих элементов также повышаются.
Важное значение платины для изготовления термопар объясняет мно
гочисленность данных о величине термо-э. д. с, создаваемой платиной
с другими металлами, а также с богатыми платиной сплавами. Некоторые
из этих данных воспроизводятся на рис. 3 и 4.
Отражательная способность поверхности платины довольно высокая
и составляет в среднем около 65% для видимой части спектра, т. е. она при
мерно такого же порядка, как у никеля, выше, чем у палладия, но значи
тельно ниже, чем у родия или только что отполированного серебра.
Палладий
Из шести металлов платиновой группы палладий обладает наименьшей
плотностью и самой низкой температурой плавления. Некоторые физические
свойства палладия были приведены в табл. 5. Большинство из них, особен
но механические свойства, изменяются в зависимости от наличия примесей
и степени обжатия при холодной обработке образца. Имеются сообщения,
что в результате холодной прокатки технического палладия до 50% перво
начальной толщины твердость по Виккерсу повышается от 44 до 106. Леги
рующис элементы, особенно рутений и никель, также повышают твердость
палладия. Предел прочности при растяжении и предел пропорцнональ
ности одинаково повышаются в результате холодной обработки и леги
рования некоторыми элементами, особенно рутением и родием. Например,
предел прочности при растяжении технического палладия после отжига
при 1100° составляет около 19,7 кг/мм2, а после холодной протяжки с об-
жатием на 50% увеличивается до 33 кг/мм2; при температуре 1000е предел
прочности при растяжении уменьшается до 2,8 кг/мм2. Предел прочности
типичного ювелирного сплава, содержащего 4% рутения и 1 % родия, соста
вляет около 39,4 кг/мм2.
Родий и иридий
Эти два элемента по сравнению с двумя предыдущими отличаются боль-
шей твердостью, вязкостью и тугоплавкостью. Вследствие этого технология
их обработки разработана не так подробно, как в случае палладия. Не
которые из свойств этих элементов указаны в табл. 6.
Некоторые данные свидетельствуют о том, что родий может существо-
вать в двух аллотропических модификациях. По данным рентгеноструктур
ного анализа параметры кристаллической решетки тонкодисперсного
родия, полученного восстановлением солей или электролизом, отличаются
от параметров решетки компактного металла, полученного методом плавки
Платиновые металлы
493
ФИЗИЧЕСКИЕ СВОЙСТВА
Плотность при 20°, г /см3
Кристаллическая решетка
Постоянная решетки ас, кХ
Модификации
Температура плавления, СС
Температура кипения (вычисленная),
°С
Коэффициент теплопроводности в ин-
тервале 0- 100", кал/см-сек-град
Коэффициент линейного расширения
в интервале 0- 100°, град'1
Зависимость теплового расширения
от температуры
Удельная теплоемкость при 20°,
кал/г-грид
Зависимость удельной теплоемкости
от температуры
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Удельное электрическое сопротивле-
ние при 0°, мком-см
Температурный коэффициент электро-
сопротивления в интервале О—100°,
град-1
Зависимость электросопротивления от
температуры
Поперечное сечение захвата тепловых
нейтронов, барн/атом
Твердость по Виккерсу после отжига
Твердость но Виккерсу электроосаж-
денного металла
Предел прочности при растяжении
после отжига, кг/мм2
Модуль нормальной упругости после
отжига, кг/мм%
Aли спекания под давлением. Как сообщалось, температура перехода для
двух постулированных форм составляет 1000°. Однако наблюдалось, что
кривая зависимости э. д. с. от температуры для платина-родиевой термо-
пары не имеет скачков, наличие которых можно было бы ожидать в слу-
чае полиморфизма. Для доказательства этого недавно была исследована [6]
структура специального очень чистого образца металла, содержавшего
примеси в количестве менее 0,001%. Было установлено, что размер эле-
ментарной кристаллической решетки ас изменялся плавно и непрерывно
в интервале от комнатной температуры до 1600° и что электрическое со-
противление изменялось непрерывно и обратимо при нагревании и охлаж-
яении образца от комнатной температуры до 1450°. Это доказательство
РОДИЯ И ИРИДИЯ
Родий
12,44
Кубическая
гранецентри-
рованная
3,796
По-видимому,
отсутствуют
1960
4500
0,36
8,5-10-е
См. работы
[36, 881
0,059
См. работы
[36, 43, 88]
50,5
1341
4,7
0,00457
См. работу
[88]
156±7
110
800
43
2,9-104
Таблица 6
^Иридий
22,4
Кубическая
граиецентри-
рованная
3,8312
Не ютестны
2410
5300
0,35
6,5-10-»
См. работы
[35, 88]
0,032
См. работу
[«]
5,3
0,003925
См. работы
[33. 88]
440±20
220
22,5
5,2-104
j?4 Глава 20
исключает какое-либо полиморфное превращение в исследованном иитер
вале температур.
Упомянутое выше исследование позволило также определить значения
для некоторых механических свойств очень чистого металла. Отсюда пред-
полагалось найти ключ к разгадке необычных трудностей, встречающихся
при обработке этого металла, по сравнению с многими другими металлами,
обладающими такой же кристаллической решеткой. Твердость по Виккерсу
чистого металла после отжига составляла 110, но при прокатке до 85%
исходного поперечного сечения твердость увеличивается более чем до 300
Поэтому скорость наклепа необычно велиьа при комнатной температуре,
и автор цитируемого сообщения предполагает, что механизм его пластиче-
ского поведения несколько отличается от поведения других металлов с куби
ческой гранецентрированной кристаллической решеткой. Электроосажден
ный родий обладает значительно большей твердостью по Виккерсу, рав-
ной 800. Благодаря этой исключительно высокой твердости поверхность
не поддается механическому износу.
Родий представляет интерес с электротехнической точки зрения не
только потому, что обладает значительно более низким удельным электри-
ческим сопротивлением по сравнению с платиной или палладием, но еще
и в связи с его способностью устойчиво поддерживать низкое сопротивле
ние контакта благодаря тому, что на его поверхности не образуются окисные
пленки. Платииа-платинородиевая термопара A0% родия) служит дли
определения температур в интервале 630,5 -1063° по международной тем
пературной шкале.
Поверхность родия обладает очень высокой отражательной способ
постью, превышающей 80% для видимой части спектра. Это несколько ниже,
чем у только что отполированного серебра, отражательная способность
которого составляет при этих условиях в среднем около 90 V Однако,
поскольку серебро в нормальной атмосфере тускнеет, его отражательная
способность быстро уменьшается и становится меньше, чем у родия. По этой
причине родий широко применяют в качестве прочного материала с высо-
кой отражательной способностью.
Иридий с трудом поддается обработке, вследствие чего точно опреде-
лены лишь некоторые из его механических свойств. Приведенные в табл. Ь
значения твердости являются лишь одними из нескольких значений, опуб-
ликованных в литературе.
Рутений и осмий
Эти очень тугоплавкие металлы даже при высоких температурах отли
чаются исключительно большой твердостью и хрупкостью. Этим объяс-
няется отсутствие Достоверных данных об их свойствах. Следует отметить,
что они обладают иной кристаллической решеткой, чем остальные четырг
металла этой группы (табл. 7). Температуры плавления обоих металлов
точно определены только недавно 119]. Опубликованные в литературе
значения удельного электрического сопротивления рутения колеблются
в пределах 7,16—14,4 мком ¦ см. Точное значение трудно получить
из-за отсутствия компактных образцов металла определенных размеров.
Па основании измерений удельной теплоемкости и температурного
коэффициента электросопротивления Егер и Розенбом [44, 45] пришли
к выводу, что существует четыре, а возможно даже и пять, полиморфных
модификаций рутения. Опубликованы следующие значения температур
перехода: и-^ Мри 1035°, J5 ->- y при 1190э иу^-6 при 1500°.
Плитиноеые металлы
49b
Таблица 7
ФИЗИЧЕСКИЕ СВОЙСТВА РУТЕНИЯ И ОСМИЯ
Плотность при 20°. г/см3
Кристаллическая решетка
Параметры решетки, кХ
«о
с/а
Модификации
Температура плавления, °С
Температура кипения (вычисленная),
°С
Коэффициент линейного расширения,
РуТСНИЙ
12,4
Гексагональная
плотпоу па-
кованная
2.7003
1,5824
См. стр. 494
2250
4900
9,1-10-е
B0^)
0,057
См. работы
[36, 44, 88|
7,16—7,6
0.00449
2.56J-0.12
240
4.2-10*
Осмий
22,5
Гексагональная
плотноупако-
ванная
2,7298
1,5790
Не известны
зпоо
5500
|| осн с5,8-10-в
X оси с 410-е
Средний
4,6- Ш-о E0°)
0,0309
См. работы
[43, 88]
9,5
A,0042
15,3±0,7
350
5,6-10*
Удельная теплоемкость при 0",
кал/г - град
Зависимость удельной теплоемкости
от температуры
Удельное электрическое сопротивле-
ние при Пэ, мком-см
Температурный коэффициент электро-
сопротивления, град'1
Поперечное сечение захвата тепловых
нейтронов, барн/атом
Твердость по Виккерсу после отжига
Модуль нормальной упругости после
отжиги, кг/мм2
Сплавы платиновых металлов [25, 48, 50, 68, 97J
В данном разделе лишь в обших чертах описаны некоторые сплавы
этих металлов, имеющие промышленное или научное значение.
Основными промышленными сплавами являются сплавы платины
с медью, золотом, иридием, родием и рутением. В последнее время пооы
силось внимание к сплавам платины с кобальтом в связи с их сильными фер-
ромагнитными свойствами. Палладий даст ценные сплавы с медью, золотом,
иридием, серебром, а также с рутением и родием вместе. Свойства этих
и других сплавов платиновых металлов описаны во многих сообщениях;
большое число подробных данных содержится в работах, указанных в за-
головке этого раздела.
Перечисленные выше, а также некоторые другие сплавы платины или
палладия обычно образуют твердые растворы во всей области концентра-
ций. Сплавы, которые образует рутений с этими двумя элементами, изу-
чены недостаточно, однако известно, что их компоненты обладают ограни-
ченной растворимостью в твердом состоянии. Этот вывод согласуется с прин-
ципами1 физической металлургии в приложении к взаимной растворимости
металлов f40J Вообще благоприятные для образования твердых растворов
условия складываются, если: 1) параметры атомов растворяющего и раство-
ряемого металлов примерно равны; 2) металлы обладают одинаковой
496 Глава 20
валентностью; 3) оба металла имеют кристаллические решетки одной и той
же структуры. Если все эти условия будут обеспечены, то можно ожидать
существования непрерывного ряда твердых растворов. Из табл. 8 видно.
Таблица 8
АТОМНЫЕ РАДИУСЫ ПЕРЕХОДНЫХ ЭЛЕМЕНТОВ
Fe Co N1 Си
Атомные радиусы, А 1,27 1,25 1,245 1,275
Кристаллическая решетка КОЦ-а КГЦ КГЦ КГЦ
ГКЦ-Y
Ru Rh Pd Ag
Атомные рядиусы, А 0,001335 0,00134 0,001375 0,001442
Кристаллическая решетка ГПУ КГЦ КГЦ КГЦ
Os Ir Pt Аи
Атомные радиусы, А 0,00135 0,001354 0,001385 0,001439
Кристаллическая решетка ГПУ КГЦ КГЦ КГЦ
Примечания. КОЦ — кубическая объемноцеитрнроваииая: КГЦ — кубическая гранецентриро-
ванная; ГПУ — гексагональная плотиоупакованиан. Атомные радиусы являют.
ся радиусами по Гольдшмидту для координациоивого числа 12.
что указанные в ней двенадцать элементов имеют атомы почти одинакового
размера и, если не считать n-железа, рутения и осмия, кубическую гране-
центрированную кристаллическую решетку. Сходство валентностей наблю-
дается в случае элементов VIII группы и, возможно, меди, хотя Юм-Ро-
зери указывает [40, стр. 126], что имеется некоторое сомнение в отношении
числа электронов, участвующих в образовании связи в случае переходных
элементов в кристаллическом состоянии.
Следовательно, легко видеть, почему осмий и рутений, с их гексаго-
нальной плотноупакованной кристаллической решеткой, не показывают
полной смешиваемости с платиной или палладием. Однако имеющиеся дан-
ные свидетельствуют об умеренной растворимости рутения в этих двух
металлах, чего и следовало ожидать, судя по величине атомных радиусов
и по валентности этих элементов. Полная растворимость железа в платине
или палладии хорошо увязывается с фактом повышения температуры,
у -+• Р-перехода при введении небольшой добавки этих металлов. Сплавы,
содержащие менее 5% платины, кристаллизуются в кубической гранецен-
трированной решетке. Теория не дает объяснения, почему родий и иридий
вообще не растворяются в серебре.
Недавно было опубликовано интересное исследование Рауба [681
о структуре сплавов каждого из платиновых металлов с другим платино-
вым металлом, а также с другими металлами VIII группы, с марганцем
и некоторыми элементами IV, V и VI групп периодической таблицы. В этом
сообщении рассматривается интересное и несколько неожиданное наблю-
дение, касающееся того факта, что, хотя четыре платиновых металла с ку-
бической гранецеитрироваииой решеткой показывают полную смешивае-
мость после высокотемпературного отжига, при более низких температурах
в некоторых из этих сплавов появляются широкие разрывы в смешивае-
мости. Это ограничение во взаимной растворимости совершенно несомненно
в случае сплавов палладий — иридий (ниже 1500°), платина — иридий
(ниже 980°) и палладий — родни (ниже 850°). Структурные изменения
в этих сплавах происходят медленно; в некоторых случаях отжиг в течение
года оказывается недостаточным для достижения равновесия. Следова-
Платиновые металлы 497
тельно, пределы смешиваемости нельзя установить с достоверностью.
Автор пытается связать критическую температуру разрыва в смешивае-
мости с различиями в температурах плавления компонентов сплавов.
В тех случаях, когда разрывов в смешиваемости не наблюдалось, темпера-
туры плавления двух металлов сильно не различались.
Другое явление, связанное с образованием твердых растворов металлов,
заключается в развитии сверхструктуры при тщательном отжиге сплавов.
Это превращение типа «порядок — беспорядок» приводит к образованию
так называемых интермсталлических соединений. Некоторые примеры
перестройки кристаллической решетки подобного рода известны и среди
хорошо изученных двойных сплавов платины или палладия (наряду со спла-
вом родия с медью). Из физических основ металловедения известно, что
образование сверхструктуры может происходить в тех случаях, когда ус-
ловия благоприятствуют хорошей взаимной растворимости, но когда ра-
диусы участвующих в превращении атомов сильно разнятся, хотя и не
настолько, чтобы полностью помешать образованию растворов. Инте-
ресно отметить, что образование сверхструктуры происходит, по-види-
мому, в сплавах платины или палладия с некоторыми обычными металлами
(табл. 8), хотя сведений о том, что это явление наблюдается в двойных
системах, образованных самими платиновыми металлами, не имеется. Ясно,
что обычные металлы (см. табл. 8) отличаются по величине своих атомных
радиусов от платиновых металлов, серебра и золота. Некоторые из этих
упорядоченных структур с обычными металлами, особенно с кобальтом,
обладают интересными магнитными свойствами.
Добавление к платине или палладию элементов, упомянутых выше
в этом разделе, приводит к изменению физических свойств, которое даст
некоторые практические преимущества сплавам перед чистыми металлами.
Вообще легирующие элементы обычно повышают удельное электрическое
сопротивление, твердость и предел прочности при растяжении этих метал-
лов. Добавление других металлов платиновой группы или золота способ-
ствует повышению стойкости их против потускнения и коррозии при дей-
ствии различных химикалий.
Ниже приводятся сравнительные данные об изменении физических
свойств платины и палладия, вызываемых легированием различными
металлами.
Платина Палладий
Твердость Ni)Ru)Cu, A(i>Ii">Rh RinNi)lr)Cii>Ag>Rh)Au
Прелел прочности при растя-
жении после отжига Ru)Au)Ir)Rh Cu)Rh—Ru)Ag)Au
Удельное электрическое
сопротивление Cu>Ag)Ru>Ir, AiORh Cu>Rli)Ir
Выбор и количество вводимой легирующей добавки определяются
требованиями, предъявляемыми к сплаву. Иридий обычно добавляют к пла-
тине для повышении ее твердости и стойкости против коррозии. При
содержании иридия до20% сплавы сохраняют пластичность, а при содержа-
нии до 30% могут подвергаться горячей обработке. Рутений при добав-
лении в том же количестве обеспечивает значительно большее повышение
твердости и прочности, но для сохранения обрабатываемости металла
добавка не должна превышать 15°6. Дороговизна рутения ограничивала
н прошлом его применение для этих целей. В связи с потерями при высоких
температурах, объясняемыми образованием летучих окислов, иридий и ру-
32 Заказ № 239
498 Глава 20
тений менее пригодны по сравнению с родием для производства жаростой-
ких сплавов. Таким образом сплавы родия с платиной, несмотря на плохие
механические свойства, часто применяются для изготовления проволоки
высокого сопротивления, термопар и катализатора для окисления
аммиака.
Для повышения твердости и механической прочности палладия, исполь-
зуемого в ювелирном деле, часто добавляют рутений и родий вместе в раз-
личных соотношениях. Меднопалладиевые сплавы хорошо поддаются
обработке и являются довольно твердыми, хотя менее устойчивы против кор-
розии, чем сплавы с благородными металлами. Серебро образует с палла-
дием пластичные сплавы, которые обладают хорошей стойкостью против
коррозии; они находят применение при изготовлении ювелирных изделии,
зубных протезов, электрических контактов и проволоки высокого сопро-
тивления.
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства металлов платиновой группы удобнее рассмат-
ривать отдельно для компактных металлов, губки, порошка и «черни».
Наиболее реакциопноспособными из них являются «черни», наименее реак-
цпонноспособнымн — компактные металлы.
Компактные металлы
Палладий растворяется в горячей концентрированной азотной кислоте
и кипящей серной кислоте. Последняя оказывает слабое действие также на
платину и родий. Платина и палладий растворяются в царской водке.
Остальные металлы — осмий, рутений и иридий — устойчивы к действию
всех кислот и царской водки.
Многочисленные расплавленные окиси, гидроокиси, соли и смеси солен
оказывают корродирующее действие на платиновые металлы. Такое же дей-
ствие оказывают расплавленные перекиси, гидроокиси и нитраты элементов
1а группы nj окиси элементов Па группы; сильнее всего действуют смеси
гидроокисей и карбонатов или нитратов элементов 1а группы. Расплав-
ленные цианиды щелочных металлов также действуют на платиновые ме-
таллы.
Из неметаллов фосфор, мышьяк, кремний, сера, селен, теллур и угле-
род разъедают металлы при температуре красного каления. Из-за этой
агрессивности необходимо очень осторожно нагревать тигли и лодочку,
применяемые в лаборатории для проведения спекания или сплавления;
в противном случае появляется опасность восстановления соединений,
содержащих перечисленные выше элементы, и взаимодействия их с платиной,
что приводит к хрупкости*. Фтор и хлор разъедают все металлы в нагретом
состоянии. Палладий разъедается влажным хлором и бромом при комнат-
ной температуре; платина и палладий тускнеют под действием горячих
газов, содержащих сульфиды.
Большой интерес представляют реакции, протекающие при нагрева-
нии металлов на воздухе или в атмосфере кислорода, но еще не получившие
полного объяснения. Например, платина теряет в весе при нагревании на
воздухе или в кислороде примерно до 1000°, но этого не наблюдалось при
* Науглероживание платины при температуре красного каления не доказано,
описанное здесь явление вызвано образованием твердых растворов.
Платиновые металлы 499
нагревании в атмосфере азота или аргона. Различные исследователи объ-
ясняют это образованием летучей окиси металла. Так, Шнайдер и Эш 180]
показали, что при постоянной температуре скорость испарения зависит от
парциального давления кислорода над поверхностью металла, и сделали
вывод, что платина удаляется в форме двуокиси. Позже] Лякруа [55]
установил, что соотношение, в котором платина и кислород улетучиваются
на воздухе, составляет 2:1, в то время как в кислороде оно равно 1 :2.
После нагревания в кислороде поверхность платины приобретает значитель-
ную полосчатость, которая объясняется частично поверхностной диффузией
атомов при высокой температуре и частично травлением металла благодаря
удалению атомов металла [68]. Однако следует подчеркнуть, что известные
окислы платины обладают давлением диссоциации, равным 1 am при темпе-
ратурах, значительно более низких, чем те, при которых происходит это
явление, поэтому природа постулированных летучих окислов остается
несколько неопределенной. Палладий окисляется с поверхности при нагре-
вании до 700°. Образующаяся при этом окись палладия PdO разлагается
при температуре выше 870°. Палладий, как и платина, теряет в весе при
нагревании на воздухе или в атмосфере кислорода до высоких температур.
При этом в интервале 900—1300°, когда металл впервые нагревают в кисло-
роде, происходит поглощение кислорода, но при более высоких тем-
пературах этот первоначальный привес теряется в результате улетучи-
вания.
Родий окисляется с поверхности при нагревании на воздухе до тем-
пературы красного каления. При этом образуется окись родия Rh2O3,
которая разлагается на элементы при температуре выше 1100°. Подобное
поверхностное окисление иридия приводит к образованию окиси иридия
IrOj, которая разлагается при температурах выше 1140 . Родий и иридий,
подобно платине и палладию, теряют в весе при нагревании в кислороде,
но из всех четырех металлов самые большие потери наблюдаются в случае
иридия. Парадоксально, что ни один из известных окислов иридия не обла-
дает летучестью в условиях проводившихся опытов, чтобы этим можно было
объяснить потерю в весе. При нагревании рутения на воздухе легко обра-
зуется устойчивая двуокись рутения RuO2. Очевидно, что указанное
обстоятельство не согласуется с фактом потери в весе при сильном нагрева-
нии рутения на воздухе. Если такая потеря и происходит, то она незна-
чительна, и ее крайне трудно объяснить на основании свойств известных
окислов металла. Таким образом, хотя летучая окись металла существует,
она неустойчива при температурах выше 106е. Осмий быстро теряет в весе
при нагревании на воздухе или в кислороде вследствие образования летучей
окиси осмия Os04.
Губчатые и порошковые металлы
Два металла платиновой группы — палладий и платина — легче дру-
гих реагируют с кислотами. Палладий растворяется в серной и азотной
кислотах, а также в царской водке. При нагревании палладия в атмосфере
кислорода образуется окисел PdO. Фтор при взаимодействии с палладием
образует при 500° фторид PdF3 [74J, а хлор при температуре ьрасного
каления—хлорид PdCU [53]. Интересным является действие водорода на
палладий. В определенном интервале температур металл поглощает 800—
900 объемов водорода на единицу собственного объема. Поглощение водо-
рода примерно соответствует стсхиомстрическим соотношениям соедине-
ния Pd2H. Чтобы установить, существует ли в действительности такое
32*
500 Глава 20
соединение, было проведено много исследований. На основании многочис-
ленных литературных данных сделан вывод, что имеются две фазы раство-
рения, а не чистое вещество 183, стр. 15541; однако некоторые последние
работы подтверждают идею об упорядоченной структуре при низкой тем-
пературе [611. Дейтерий сходен с водородом по своему действию на пал-
ладий, но его растворимость в металле меньше растворимости водоро-
да. Оба газа способны диффундировать через нагретый листовой пал-
ладий.
Платина по многим химическим свойствам сходна с палладием, но зна-
чительно более коррозионноустойчива. При действии фтора на горячую
платину образуется PtF4 [601. Хлор и платина при совместном нагревании
образуют ряд хлоридов: PtCl2, PtCl3 и PtCl4. Водород поглощается платиной
значительно в меньшей степени, чем палладием. Водород диффундирует
через нагретую платину, как и через палладий.
Родий отличается тем, что почти во всех своих соединениях он является
трехвалентным. Он представляет собой менее инертный металл, чем иридий.
Горячая серная кислота растворяет родий. Расплавленный бисульфат
калия реагирует с родием с образованием Rhz(SO4K. При нагревании родия
до 600" в атмосфере воздуха или кислорода образуется ИпгОз. При 500—
600° фтор и родий образуют RhF3 вместе с небольшими количествами
RhF4 it RhF6 [731. Реакция с хлором, о которой упоминалось ранее
в спязп с процессом рафинирования металла, приводит к образова-
нию RhCl3.
Иридий — чрезвычайно инертный металл. Даже в тонкодисперсном
состоянии он слабо поддается действию какой-либо кислоты или смеси
кислот. В атмосфере воздуха или кислорода при 600° образуется окись
1гО2- При действии на металл фтора при 150° образуются IrF4 и lrFB [751.
Хлор с иридием при 600° дает 1гС13. Иридии и родий можно легко перевести
в водорастворимые двойные хлориды (в действительности хлорокомплексы)
нагреванием смеси металлов с хлоридом натрия в токе хлора при 000*.
Иридий и другие тугоплавкие материалы, содержащие платину, становятся
растворимыми после нагревания со смесью 20 объемов соляной кислоты
н ] объема азотной кислоты или эквивалентным количеством хлората
натрия, хлорной кислоты или хлора в запаянной трубке [93]. Иридий и
родий в тонкодиспереном состоянии и при нагревании сильно поглощают
водород.
При прокаливании на воздухе или в кислороде рутений легко окис-
ляется до RuO2- Металл растворяется в царской водке, щелочных раство-
рах гипохлорита и концентрированных растворах перекиси натрия или
едкого натра. Большинство расплавленных щелочей разъедает рутений,
например едкое кали в смеси с нитратом калия или хлоратом калия. Фтор
реагирует с рутением при 300° с образованием RuF5 [771, в то время как
хлор с рутением при 450" образует RuCl3 [69].
Осмий выделяется среди других металлов группы тем, что легко обра-
зует летучую окись осмия OsO4- Эта окись образуется даже при действии
холодного воздуха на топкодисперсный металл. Окислители реагируют
с осмием с образованием четырехокисн. -Растворы гипохлорита или ней-
тральные и кислые растворы хлората калия растворяют металл. На осмий
оказывают разрушающее действие многие расплавленные вещества, в том
числе едкое кали, нитрит натрия и бисульфат калия. Фтор и осмий взаимо-
действуют при 300° с образованием OsF4 и OsFfl. Хлорирование металла при
650—700° приводит к образованию хлоридов OsCl3 и OsCl4. Осмий и руте-
ний поглощают водород.
П юти новые металлы
501
«Черни» и коллоидные металлы
Платина, палладий и родий в таких тонкодиспсрспых формах, как
«черни» или коллоиды, обладают ценными каталитическими свойствами.
Платиновую чернь получают нагреванием щелочного раствора хлорида
с этиловым спиртом. Интересно отмстить, что платиновая чернь при нагре-
вании на воздухе или в атмосфере кислорода поглощает кислород, но при
высоких температурах снова теряет его. Обычно коллоидные металлы полу-
чают восстановлением растворов хлоридов таким агентом, как гпдразин-
гпдрат, в присутствии защитного коллоида. «Черни» и коллоиды широко
применяются для каталитического восстановления различных органиче-
ских соединений водородом.
Более подробно химические свойства платиновых металлов и их соеди-
нении рассмотрены в работах [25, 58, 59, 83. стр. 1454].
ОБЛАСТИ ПРИМЕНЕНИЯ
Перед детальным рассмотрением областей применения металлов пла-
тиновой группы и некоторых из их сплавов интересно ознакомиться с коли-
чественным распределением этих металлов между основными потребляю-
щими отраслями промышленности США. Эти сведения за 1958 г. приведены
в табл. 9 [79]. Из таблицы видно, что 96°-6 общего потребления приходится
Таблица 9
РАСПРЬДЕЛЕНИЕ ПЛАТИНОВЫХ МЕТ1ЛЛОВ ПО ПОТРЕБЛЯЮЩИМ ОТРАСЛЯМ
ПРОМЫШЛЕННОСТИ США В 1958 г. (кг)
Отрасли проыышлсн11с1сТ11
Химическая
Электротехническая
Зубопротезная техника и
медицина
Ювелирная и декоративная
Другие
Итого
1665,5
448.3
1318,4
178,1
1 Другие
Палладий металлы
4611,4 2899,0
8221,7
7427,1
1123,9
783,5
56,0
458,0
141,8
16,2
253,8
91,6
12 289,5
061,4
7968,4
9234,4
1588,4
2355,7
325,7
21 472,6
примерно поровну на платину и палладий. Эти данные свидетельствуют о со-
кращении сбыта по сравнению с предыдущим годом [781 при заметном
сокращении потребления платины в химической промышленности.
Приводимый ниже обзор областей применения этих металлов не
является исчерпывающим. Подробные сведения о применении платиновых
металлов часто публикуются в металлургических журналах. В 1957 г.
фирма «Джонсон Маттей энд компания (Лондон, Англия), занимающаяся
рафинированием платиновых металлов, добываемых в Южной Африке,
начала издавать выходящий раз в три месяца журнал под названием Pla-
tinum Metals Review. Этот журнал является необходимым дополнением
к литературе, посвященной этим металлам, и содержит оригинальные
статьи, сообщения о заслуживающих внимания публикациях, аннотации
текущей журнальной и патентной литературы и т. д. В нем достаточно
502 Глава 20
подробно описаны многие новейшие области применения платиновых ме-
таллов. Другие важные обзоры и монографии можно найти в работах [17,
49, 89, 95, 96, 98].
Платина
Самая чистая платина применяется для изготовления термометров
сопротивления и термопар. В интересном обзоре истории и применения пла-
тинового термометра сопротивления [67] указано, что этим прибором более
тридцати лет пользуются для определения международной шкалы темпе-
ратур. Начиная с 1948 г. с помощью термометра сопротивления был опре-
делен интервал температур между — 182,97° (температура кипения кисло-
рода) и 630,5е (температура плавления сурьмы) [28]. Для этой цели необ-
ходима платина такой степени чистоты, чтобы отношение величин ее элек-
трического сопротивления при 100 и 0° было не меньше 1,3910. Присут-
ствующие в платине примеси заметно снижают термический коэффициент
электросопротивления. Положительным элементом в термопаре является
платннородневая проволока определенного состава, обычно содержащая
10, а иногда 13% родия. Недавно появились термопары, в которых оба
элемента состоят из платинородиевых сплавов, причем один из них содер-
жит 5, а другой 20% родия; это улучшает работу прибора при высоких тем-
пературах.
В электротехнике платина применяется главным образом в виде кон-
тактов. Отсутствие поверхностной пленки обеспечивает низкое сопротив-
ление контакта и надежность в работе даже после периодов простоя. Такие
контакты находят применение в реле, сигнальных приборах и т. д. Если
контакты должны работать в цепи высокого напряжения, их делают из
сплавов с иридием A0 или 25%) или рутением E или 10?о). Очень тонкая
платиновая проволока применяется иногда для изготовления малогабарит-
ных плавких предохранителей. Благодаря отсутствию коррозии сила тока
существенно не изменяется при работе на уровне, близком к их максималь-
ной характеристике.
Электроды в запальных свечах для авиационных двигателей часто
изготовляют из платинового сплава. Помимо сильнодействующей корро-
зионной среды, в которой должны работать эти электроды, в данном случае
возникает проблема накопления свинца из топлива. По-видимому, свинец
проникает через границы зерен металла и вызывает преждевременное раз-
рушение этих электродов. Для этой цели применялись сплавы, содержащие
5—-10% рутения, 10°-о палладия и 6% рутения или 4% вольфрама. Послед-
ний из этих сплавов ввиду низкой электронной эмиссии находит примене-
ние для изготовления сеток в радиолокационных установках. Сплав с 5%
никеля используется в качестве подложки термоионных катодов, покрывае-
мых окислами металлов.
Благодаря коррозионной стойкости металлы платиновой группы нахо-
дят разнообразное применение в химической промышленности. Неболь-
шие аппараты, работающие под давлением, облицовывают листовой пла-
тиной, тогда как аппараты больших размеров можно изготовлять из плаки-
рованных платиной никеля или меди. Например, в производстве хлористого
этила применяются облицованные платиной автоклавы. Для защиты хи-
мического оборудования, работающего в условиях коррозии при повышен-
ных температурах, применяются прокладки из платиновой фольги. Аноды
из платины или с платиновыми покрытиями применяются в электролити-
ческих процессах не только в связи с их стойкостью против окисления, но
часто также благодаря высокому перенапряжению кислорода на них, что
Платиновые металлы 503
позволяет вести процесс окисления с минимальным выделением кислорода.
Для этой цели применяют главным образом сплав, содержащий 10% ири-
дия. Такие аноды находят применение в производстве пероксиборатов, пер-
хлоратов и перокенсульфатов.
Плакированные платиной электроды представляют значительный
интерес в связи с катодной защитой против коррозии. Они изучались главным
образом в связи с коррозией морских судоп. Например, корпус корабля
можно защитить в заметной степени, если сделать его катодом электроли-
тической «ячейки», в которой анодом является инертный или расходуемый
металл, и увеличить разность потенциалов между ними. Анод можно уста-
новить вдоль корпуса судна или тащить на буксире. Первыми сложными
анодами, использованными для этой цели, были плакированные платиной
медь и серебро. Медь и серебро подвергались коррозии, так как из платины
трудно получить покрытия, не имеющие пор. В случае серебра это имеет
меньшее значение, поскольку прн работе электродов в морской воде осаж-
дающийся хлорид серебра заполняет поры и трещины. Однако при исполь-
зовании платинового покрытия на тантале или титане аноды почти не под-
даются коррозии. Это происходит благодаря интересному сочетанию свойств.
Эти дна основных металла при анодировании в водном растворе покрываются
защитной окисной пленкой, которая не проводит ток к электролиту. В этом
состоит сущность «мокрого» выпрямителя. Однако эти окисные пленки
могут проводить ток, если они находятся в механическом контакте со вто-
рым металлом. Следовательно, в этих покрытых платиной электродах
основной металл не разрушается заметно благодаря защитной окисной пленке,
и для него не требуется покрытие из благородного металла, совершенно не
имеющее пор. Электроды такого типа изготовляют в настоящее время путем
плакирования (см. стр. 486), электролиза или осаждения из паровой фазы.
Чтобы избежать загрязнения оптических стекол окислами металлов,
ьоторые могут придавать стеклу окраску, плавку и отливку этих стекол
проводят в платиновых сосудах. Из платины и ее сплавов (в особенности
сплава с 1096 родия) изготовляют также фильеры и измерительные диа-
фрагмы, применяемые при обработке вязкого стекла. Сплав платины с 2%
никеля идет на изготовление мундштуков, которые применяются в произ-
водстве стеклянного волокна. Мундштуки для производства искусственного
шелка изготовляют либо из сплава с 10% родия, либо из сплава, содержа-
щего 60°6 золота и 40% платины.
Выше уже упоминалось о кобальтплатпновых сплавах, обладающих
ферромагнитными свойствами в необычно высокой степени. Так, сплав, со-
держащий около 50?ат. % кобальта, позволяет получить более мощный
постоянный магнит по сравнению с любым другим известным материалом,
н преимущество его перед многими другими новейшими постоянно магнит-
ными материалами состоит в том, что до закалки он обладает ковкостью
и гибкостью, и в таком виде его можно легко обрабатывать. Этот сплав
находит применение в электродинамических часах, в которых используется
мотор с постоянным магнитом.
В лаборатории применяются платиновые тигли, выпарные чашки,
лодочки для взвешивания и т. д. В тех случаях, когда посуда подвергается
сильному нагреванию, для снижения потерь за счет улетучивания рекомен-
дуется применять сплав, содержащий 3,5% родия. Известны многие типы
электродов для электрохимического анализа, определения проводимости
и т. д. Из сплава, содержащего 10—20% родия, изготовляют спирали для
высокотемпературных электрических печей, предназначенных для работы
в окислительной атмосфере.
504_ Глава 20
Значительное количество платины расходуется в ювелирном деле;
в целях повышения прочности к платине добавляют 5—10% иридия или
5°о рутения. В Европе некоторые платиновые ювелирные изделия изго-
товляют из сплава, содержащего 3 5% меди. Твердый сплав с 25—30%
иридия применяется для изготовления корпусов автоматических ручек,
игл для подьожного впрыскивания, деталей рентгеновской аппаратуры
и различных других мелких принадлежностей
Давно известно, что платиновые металлы обладают исключительными
каталитическими свойствами. Сама платина применяется во многих про-
мышленных процессах, наиболее важными примерами которых являются
следующие. Платина применяется в производстве серной кислоты контакт-
ным способом, хотя в настоящее время она вытесняется более дешевой
пятиокисью ванадия. Для получения окислов азота при производстве сер-
ной кислоты камерным способом н азотной кислоты из аммиака в качестве
катализатора применяются платиновые сетки (с 10% родня). Более новой
областью применения платины в качестве катализатора является так назы-
ваемый рнформинг нефти*. Этот процесс, введенный десять лет назад,
быстро развивался; в настоящее время для этой цели расходуется в хими-
ческой промышленности самое большое количество платины. Этот процесс
применяют для улучшения октанового числа бензина прямой гонки и га-
зового бензина и, кроме того, для получения больших количеств аромати-
ческих углеводородов, которые можно выделить из продукта и использо-
вать не как топливо, а для других целен. Во время риформннга нефти про-
текают следующие реакции Пб]: 1) превращение нафтеновых углеводоро-
дов в ароматические углеводороды; 2) изомеризация или крекинг алифати-
ческих углеводородов и превращение некоторых из них в ароматические
соединения; 3) превращение любых сернистых соединений в сероводород
и соответствующий углеводород; 4) насыщение этиленовых углеводородов,
за которым следуют реакции B) и C) или одна нз этих реакций. Катализа-
тор обычно приготовляют в форме небольших таблеток из окиси алюминия
или смеси двуокиси кремния и окиси алюминия, пропитанных 1 % платины.
В качестве катализатора гидрирования платина используется для некоторых
специальных реакций, например в синтезе витаминов или других фарма-
цевтических препаратов [52]. Особое преимущество применения платины
и палладия для этой цели состоит в том, что реакции восстановления можно
проводить при относительно низких давлениях водорода. Важным является
также применение платины в производстве цианистого водорода из метана,
аммиака и воздуха по так называемому способу Андрусова. Катализатор
для этой цели приготовляют в форме сетки, сходной по составу и структуре
с сеткой катализатора окисления аммиака.
Платина и палладий, нанесенные обычно в тонкодисперсной форме на
такой носитель, как окись алюминия, нашли широкое применение в про-
цессах очистки газов путем каталитического окисления или гидрирования.
Например, небольшие количества кислорода можно выделить нз водорода,
пропуская газ через патрон с катализатором, устанавливаемый непосред-
ственно на баллоне для водорода. Такие катализаторы нашли применение
во многих случаях, и есть основание предполагать, что они могут играть
все возрастающую роль в контроле загрязнения атмосферного воздуха
[37J.
* Чаще употребляют термин «платформинг» нефти, означающий крекинг в при-
сутствии платинового катализатора, направленный на получение ароматических
углеводородов из нафтеновых углеводородоп.— Прим. ред.
Платиновые металлы Я05
Палладий
Палладий часто используется вместо платины вследствие более низкой
стоимости и меньшей плотности, если это позволяют условия. Способность
не тускнеть и стойкость против коррозии делают палладий почти столь же
подходящим, как и платина, для контактен в электрических реле, например
в слаботочных телефонных аппаратах. Для этой цели обычно применяют
сплавы с 40% меди или 40% серебра. Медный сплав весьма эффективен
в цепях слабых токов, обладающих достаточной емкостью, чтобы при замы-
кании контактов вызывать значительное повышение напряжения. В обзоре,
посвященном материалам для электрических контактов, подчеркиваются
преимущества сплавов платиновых металлов, в особенности для контактов
в слаботочных цепях 141]. Автор этого обзора отмечает, что иногда преиму-
щество состоит в образовании тонкой окисной пленки на электрических
контактах, работающих в осветительных цепях. Присутствие этой пленки
может способствовать прилипанию (сварке) и образованию мельчайших
металлических мостиков в момент размыкания контактов. При нагревании
примерно до 400° сплавы палладия образуют тонкую пленку окиси, но при
более высоких температурах окись разлагается, так что поверхность остается
неповрежденной. В цитированной статье приводится важная дискуссия
по вопросу о выборе пригодного для контактов материала в соответствии
с предполагаемыми условиями его применения. Кроме того, из сплава
с 40% серебра благодаря его необычно низкому температурному коэффи-
циенту электросопротивления изготовляют спирали сопротивления. Сплав
с золотом, содержащий примерно по 50% каждого металла, идет на изго-
товление плавких предохранителей для защиты электрических печей или
загруженных в них материалов от перегрева.
Палладий широко применяется как лигатура при получении сложных
сплавов для изготовления штампованных и литых зубных протезов. Эти
сплавы могут содержать серебро, а также, по-видимому, медь, золото или
платину в различных количествах.
Новшеством является применение палладия в качестве добавки для
повышения пассивности нержавеющей стали [87] и титана [2]. Добавки
платины и палладия в количестве 0,1—1,0% заметно повышают стойкость
нержавеющей стали марки 18-9 и высокохромистой стали против коррозии
серной кислотой. Недавно Стерн [2] сообщил, что при добавлении к титану
всего 0,1% палладия или платины этот металл становится устойчивым про-
тив действия горячих растворов соляной и серной кислот. Титан весьма
устойчив против действия окислительных кислот, но он растворяется в кис-
лотах, обладающих восстановительными свойствами, например в соляной
кислоте. Благородный металл, по-видимому, действует как катод в гальва-
нической ванне и, превращая сталь или титан в анодный металл, благо-
приятствует образованию на этих металлах защитной окисной пленки.
Некоторое количество палладия требуется для ювелирного дела, при-
чем чаще всего для этих целей применяют сплавы, содержащие 4,5% руте-
ния пли 4% рутения и 1% родия. Кроме того, применяется также так на-
зываемое «белое золото», представляющее собой золото, обесцвеченное
добавкой палладия.
При описании применения платины как катализатора указывалось,
что аналогичными свойствами обладает и палладий. Он является актив-
ным катализатором для реакций гидрирования и дегидрирования, по при-
меняется в основном для первых. Особое преимущество палладия, напри-
мер, над никелем состоит в том, что в его присутствии реакции можно про
506 Глава 20 _
водить при низких и умеренных температурах в тех случаях, когда более
высокие температуры могут привести к образованию нежелательных про-
дуктов в результате побочных реакций. Катализатор гидрирования при-
меняют на практике главным образом в виде окиси палладия, приготовить
которую проще, чем «чернь»; окись быстро восстанавливается водородом
до металла. Катализатор можно также наносить в тонкодисперсном со-
стоянии на пористые материалы, например пемзу или древесный уголь,
либо на кристаллические осадки, например сульфат бария, карбонат
кальция или окись магния. Так, карбонат кальция можно пропитать рас-
твором хлорида палладия, получив таким образом тонкую пленку гидро-
окиси палладия, а затем выделить твердый материал, который при нагре-
вании в атмосфере водорода восстанавливается до металла. Иногда ката-
лизатор можно активировать воздухом или кислородом, но когда это не
удается, металл можно регенерировать для повторного использования.
Одним из важных примеров применения палладия является гидриро-
вание ацетилена в этилен газообразным водородом в присутствии палладие-
вого катализатора, нанесенного на силикагель. Другим новым примером
промышленного применения палладия является производство переьнси
водорода путем аутоокислення 2-этилантрахинола. Хинол превращают при
действии кислорода воздуха в соответствующий хннон; при этом образуется
также перекись водорода, которую отделяют противоточным поглощением
водой, а хинон восстанавливают водородом в присутствии палладиевого
катализатора на носителе. Выше уже упоминалось об использовании пал-
ладпевого катализатора для гидрирования в синтезе различных фармацев-
тических препаратов.
Упоминавшаяся в предыдущем разделе способность палладия раство-
рять водород находит практическое применение [12]. Растворимость водо-
рода в палладии в отличие от растворимости в других металлах быстро
уменьшается с повышением температуры, в то время как скорость диффу-
зии возрастает. Это используется для подвода водорода в лабораторные
вакуум-аппараты. Установленные на аппаратах палладиевые втулки дей-
ствуют как водородные «клапаны». Когда они нагреты и окружены атмо-
сферой, содержащей водород, то даже в пламени горелки через металл
диффундирует водород, а не какой-либо другой газ. *¦
Родий
Родий применяется благодаря своей твердости и блеску поверхности
не только для легирования платины, но и для нанесения покрытий. Его
можно осаждать электролитическим способом па многие металлы непосред-
ственно, хотя иногда применяют подложки из серебра или никеля. Плаки-
рованная поверхность считается идеальной для отделки высококачествен-
ных исследовательских приборов, деталей фотоаппаратов, серебряных укра-
шений и ювелирных изделий. Родиевым покрытием часто защищают метал-
лические поверхности в прецизионных приборах, применяемых для изме-
рения физических констант вызывающих коррозию жидкостей. Зер-
кала и отражатели часто покрывают родием, чтобы предотвратить их поту-
скнение.
Электрические контакты с покрытием из родия совершенно лишены
переходного сопротивления и находят применение в деталях высоко- и низ-
кочастотной аппаратуры. Скользящие электрические контакты также
обычно покрывают родием, так как осажденный электролитическим путем
металл обладает большой твердостью.
Платиновые металлы 507
С помощью недавно разработанного метода осаждения в вакууме ро-
дий можно наносить на стекло при изготовлении зеркал или (в виде более
тонких слоев) интерференционных светофильтров.
Иридий
Иридий применяется для упрочнения платины. В литературе приво-
дится мало примеров применения чистого металла, что объясняется тр\д-
ностью его обработки. Из иридия были изготовлены несколько небольших
тиглей для проведения реакций при высоких температурах, а также мунд-
штуки для выдавливания тугоплавкого стекла.
Осмий
Осмий применяется почти исключительно для производства сверхтвер-
дых сплавов, которые идут на изготовление наконечников перьев автомати-
ческих ручек, долгоиграющих патефонных иголок и штифтов для приборов.
Такие сплавы содержат около 60% осмия, некоторое количество рутения,
остальное же приходится на долю прочих металлов платиновой группы.
Эти сплавы вытеснили из указанных областей природный иридоемнн.
Рутений
Рутений применяется главным образом для упрочнения палладия
и платины. В небольших количествах рутений содержится в твердых спла-
вах осмия, используемых для изготовления наконечников перьев автомати-
ческих ручек и т. д.
Для гидрировании был рекомендован катализатор, содержащий 5°о
металлического рутения, нанесенного на окись алюминия или древесный
уголь. Как сообщают [241, в присутствии этого катализатора можно вос-
станавливать карбонильные группы в алифатических альдегидах и кето-
нах, а в некоторых случаях даже осуществлять избирательное восстанов-
ление этой функциональной группы при наличии двойной углерод-углерод-
ной связи.
ЛИТFPАТУ РА
1. Can. Milling J., 80, 105 A959).
2. Modern Metals, 15, 82 A959); Platinum Metals Rev., 3, 88 A959); Cliem. Eng. News,
37, № 15, 26 A959); Stern M., Wissenberg H.. J. riectrocliem Soc,
106, 759—764 A059).
3. Platinum Metals Rev., 1, 61 A957).
1 Atkinson R. H., Trans. Inst. Metal Finishing, 36, 7 A958).
5 Atkinson R. H., R a p e г A. R., J. Electrodepositors' Tech. Soc, 9, 77 A934);
Metal Ind. (London), 44, 191 A931).
6. В a 1 e E. S., Platinum Metals Rev., 2, 61 A958).
7. Beamish F. E., Can. Mining J., 62, 446 A941).
8-Beamisli F. E., Warren E. W., Can. Mining J.. 63, 505 A942).
9. В e г t h о 1 I e t С L., P e 1 1 e t i e г В., Ann. Chem. Liebigs, 14, 20 A792).
10. В I u m W., H о g a b о о ni G. В., Principles of Electroplating and Electroforming,
3rd ed., McGraw-Hill Book Co., Inc., New York, 1949.
11. В г а у J. L., Non-Ferrous Production Metallurgy, 2nd eri., John Wiley and Sons.
Inc., New York, 1947.
12. С h a s t о n J. C. Metallurgia, 29, 133 A944).
13. С 1 a u s C, Pogfi. Ann., 64, 192, 622 A845).
5118 Глава 20
Ы. С 1 е m e n t s F. S., R a p e r A. R.. пат. США 2552709, May 15, 1951.
15. Cotton J. В., Platinum Metals Rev., 2, 45 A958).
16. С u г г у S. W.. Plalinum Metals Rev., 1, 38 A957).
17. Dale 11. C, The Precious Metals, Inslitute of Chemistry of Great Dritain and
Ireland, London, 1941.
18. Dennis W. H., Metallurgy of the Non-Fcrrous Metals, Sir Isaac Pitman and
Sons, Ltd., London, 1954.
10. Douglass R. W-, A ri к i n s E. F.. Melting Points and Spectral Emissivities
of Osmium and Ruthenium (будет опубликовано в Metallurgical Transactions, AIME).
20. E in e 1 e u s H. J., Anderson J. S., Modern Aspects of Inorganic Chemistry,
Routlcdge and Kegan Paul, Ltd.; London, D. Van Nostrand Co., Inc., Prince-
ton. N. J., 1948, p. 378.
21. Esser H., F. u s t er b г о с k H., Arch. EisenhDttenw., 14. 341 A941)!
22. G e i b e 1 W., in Reine Metalle (Van Arkel A. F... Ed.), J. Springer, Berlin, 1939,
p. 364. 374.
23. G i 1 с h r i s t R., Chem. Revs., 32, 277 A943).
24. G i I m a n G., Culm G., Advances in Catalysis, Vol. 9, Academic Ргеьь, Inc.,
Nw York, 1957, p. 733.
25. Gnielin Handbuch der anorganischen Chemie, 8 Aufl., № 63—68, Verlag
Chemie, G. m. b. H., Berlin.
2G. G о d 1 e у Р., Iron Age, 161, 90 A948).
27. Golds с h ш i d t V. M., J. Chem. Soc, 1937, 655.
28. Hall J. A., in Temperature — Нь Measurement and Control, Vol. 2, Reinhold
Publishing Corp., New York, 1955, Chap. 8.
29. Ham W. R., S a m a n s С. Н., Science, 104, 38 A946).
30. H i 1 1 M. А., В e a m i s h F. E., Anal. Chem., 22, 590 A950).
31. H о k e С. М., Refining Precious Metal Wastes, Metallurgical Publishing Co., New
York, 1940.
.12. H о 1 b о г n L., Ann. Physik, 59, 145 A919).
33. H о 1 b о r n L., Ann. Physik. 59, 163 A919).
31. 11 о 1 b о г n L., D а у A. L., Ann. Physik, 4, 104 A901).
35. HolbornL., Valentiner S., Ann. Physik, 22, 16 A907).
36. H о I 7 m a n n H., Festschrift zum 50-jahrigen Bestehen der Platinschmeize, G. Sie-
bcrt, G. m. b. H., liana», 1931, S. 147; см. также.!, lnst. Metals, 50, 69*A932).
37. Houilry J. H., H а у e s С. Т., Platinum Metals Rev., 2, 110 A958).
38. 11 о w e .1. L., Chem. News, 109, 229 A914).
39. H » у t S. L., Metals and Alloys Data Dook, Reinhold Publishing Corp.. New, York,
1943, p. 277, 279, 280.
40 Hume-Rothery W., R а у n о r G. V., The Structure of Metals and Alloys,
3rd ed.. Institute of Metals, London, 1934.
41. Hunt L. В., Platinum Metals Kev., 1, 74 A957).
42. Jaeger F.M., Rosenbohm E., Physica, 6. 1123 A939).
43. .1 a e g e r F. M., Rosenbohm E., Proc. Acad. Sci. Amsterdam. 34. 85 A931).
11. Jaeger F. M., Rosenbohm fc., Proc. Acari. Scl. Amsterdam, 34, 808A931).
45. J a eg e r F. M, R о s с n b о h m E., Proc. Acad. Sci. Amsterdam, 44, 114A911).
4b. .1 a e fi e г F. M., V e e n s t r a W. A., Proc. Acad. Sci. Amslerdam, 37. 280 A934).
47. J a h n C. A. 11., Metal Ind. (London), 72, 18.1 A948).
48. J aim С. А. Н., Metal Ind. (London). 72, 206 A948).
49. J a h n С. А. Н., Metal Ind. (London), 72, 228, 249 A948).
50. J a h n С. Л. H., Metal Ind. (London), 72. 267 A948).
51. J о h n s о n C, Atkinson R. H., Trans, lnst. Chem. Engrs. (London), 15,
131 A937).
52. J о и e s W- H.. Plalinum Metals Rev., 2, 86 A958).
Платиновые металлы 509
51. Reiser E. Н„ Breed M В., Am. Chem. J., 16. 20 A894).
34. К е 1 1 е у! К. К-, U. S. Bureau of Mines, Bull. 1*. 383, 1935; Bull ЛЬ 391, 1936.
55. L а с г о i x R.. Rev. met., 53, 809 A956).
56. M а с D о n a 1 d D., Chem. and Inri., 50, 1031 A931).
57. M а с D о n a 1 rl D., Platinum Metals Rev.. 2, 54 A958)
58. M e I I о г J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry,
Vol. 15. I ongmans, Green and Co., London and New York, 1942.
59. Ji e I I u г J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry,
Vol. 16, Longmans, Green and Co., London and New York, 1912.
60. M о i s s a n H., Ann. chim. et pliys., 24, 282 A891).
61. N а с e D. M , A s t о n J. C, J. Am. Chem. Soc, 79, 3619 П957).
02. Nix F. С, М а с К a i r D., Phys. Rev., 61, 74 A942).
6J. O'N e i 1 1 J. J., Gunning H. C, Platinum and Allied Metal Deposits of
Canada, Department of Mines, Ottawa, Canada, 1934.
64. P a 1 а с h e С, В е г m a n H, Frondel C, Dana's System of Mineralogy,
Vol. 1, Jolin Wiley and Sons, Inc., New York, 1944.
G5. Platinum and Allied Metals, 2nd ed.. Imperial Institute, Mineral Resources Dept,
London, 1936.
66. Prtiser H. S., Platinum Metals Rev., 3, 38 A959).
G7. Price R., Platinum Metals Rev., 3. 78 A959).
68. R a u b E., J. Less Common Metals, 1, 3 A959).
69. Материалы Комиссии no атомной энергии США, Ядерные реакторы. 111. Мате-
риалы для ядерных реакторов, ИЛ, Москва, 1956.
70. R e i d F. H-. Trans, lnst. Metal Finishing, 36, 74 A959); Monri Nickel Co.. англ.
пат. 808958, February U, 1959.
71. Reray H.. W a g n e г Т., Z. anorg. allgem. Chem-. 157. 344 A926).
72. R h о d a R. N.. Trans. lnst. Metal Finishing, 36, 82 A959).
73. Ruff O.,Ascher E., Z. anorg. allgcin. Chem., 180, 42 A929).
74. RuH O., Fischer J., Z., anorg. allgem. Chem., 183, 206 A929).
75. R n f f O., F i s с h e r J., Z. anorg. allgem. Chem., 179, 161 A929).
76. R u f f O., Tschirch F. W., Ber., 46, 929 A913).
77. R u f f O., V i d i с Е-, Z. anorg. allgem. Chem., 143, 171 A925).
78. R у a n J. P., Fng. Mining J., 160, 95 A959).
7!l. К у a n J. P., M с В r e e n К. М., Minerals Yearbook, U. S. Bureau ol Mines,
Government Printing Office, Washington, D. C, 1957.
80. Sclineidcr A., E s с h U., Z. Elektroclieni.. 49. 55 A943).
81. Sc hum pelt K-, in Plating and Finishing Guide Book. (Hull N.. Hoga-
boom G. В., Eds), Metal Industry Publishing Co., New York, 1945.
82.bchumpelt K. Trans. Electrochem. Soc, 80, 489 A941).
8.5. S i d g w i с k N. V., The Chemical Elements and Their Compounds, Vol. 2, Oxford
University Press, London and New York, 1950.
84. S i v i I C, Trans. Am. lust. Mining Met. Engrs. Metals Div., 5. 24C A931).
85. Swanger W. H., J. Research NBS, 3, 1029 A929).
86. T e n n a n t S., Phil. Trans., 94, 411 A804).
87. T ом а ш on H. Д., Проблемы коррозии и защиты металлов. Труды V Всесоюз-
ного совещания по коррозии и защите металлов, Изд-во АН СССР, 1956, стр. 17.
см. также Platinum Metals Rev., 2, 117 A958).
88. V i п с s R. F., W i s e E. M., The Platinum Metals and Their Alloys, Interna-
tional Nickel Co., New York, 1941.
89. W а г w i с k B. A., Chem. Age (London), 78, 501 A957).
9A. Weeks M. E., The Discovery of the Elements. 4th ed., Journal of Chemical
Education, Easton, Pciin., p. 236.
91. W h i t e 1 у J. ()., DietzCAm lnst. Mining Met. Engrs. Tech. Publ.J\» 84, 1928.
510 Г л ае а 20
92. W i с h е г s Е., G i 1 с h r i s t R., S w a n g e r W. H., Am. Inst. Alining. Met.
Engrs. Tech. Publ. Л5 87, 1928
93. Wichers E, ScbUct W.O, Cordon С L., J. Research NBS, 33,
363 A944).
94. W i s e E. M., in Encyclopedia of Chemical Technology, Interscience Publishers,
Inc., New York, 1953.
95. W i s e E. M., in Metals Handbook (Lyman Т., Ed.), American Society for Metals,
Cleveland, 1948.
96. W i s e E. Л1.. in Modern Uses of Non-Ferrous Metals (Mathev-son С. Н., Ed.),
American Institute of Mining and Metallurgical Engineering, New York, 1935.
97. Wise E. M., E a s h J. Т., Am- Inst. Mining Met. Engrs. Tech. Publ. №. 584;
опубликовано в Metals Technol. A934).
98. Wolf H., Metall, 12, 585 A958).
99. W о 1 1 a s t о n W. H., Phil. Trans., 94, 419 A804).
100. Y а г w о о И J., High Vacuum Technique, 2nd ed., John Wiley and Sons, Inc .
New York, 1945.
101. Plalinum Metals Rev., 4, 56 A9B0).
102. Eng. MininR J., Annual Surveys, February Number.
21
ПЛУТОНИЙ
У-tH. МАЙНЕР, А. С. КОФФИНЬЕРРИ, Ф. У. ШОНФЕЛЬД,
Дж. Т. УОБЕР, Р. Н. МАЛФОРД, Р. Э. ТЕЙТ
№'. N. Miner, A. S. Coffinberry, F. W. Schonf,eld,
i. Т. Waber, ft; N. R. Mulford, R. E. Tale, Uni-
versity of, California, Los Alamos Scientific Labo-
ratory, Lvs Alamos, New Mexico
ВВЕДЕНИЕ
Открытие плутония возвестилось миру ужасающим взрывом атомной
бомбы над Нагасаки в 1945 г. Никакой другой элемент не стал известен
человечеству с такой внезапностью и при таких драматических обстоятель-
ствах. Точно так же ни один элемент не обладает рядом столь исключитель-
ных свойств, делающих плутоний уникальным металлом.
Плутоний — первый искусственно полученный человеком элемент [174].
Он имеет шесть аллотропических модификаций в относительно небольшой
области температур — от комнатной до температуры плавления, равной
640й. Металл обладает также уникальным свойством заметно сжиматься
с повышением температуры в относительно широком интервале температур
[46, стр. 355 — 357]. Плутоний — одно из наиболее токсичных из известных
веществ. Допустимые уровни загрязнения плутонием принадлежат к самым
низким для радиоактивных элементов [168]. Далее, применение в будущем
плутония для мирных целей в качестве горючего в энергетических ядерных
реакторах [174, стр. 107—108] может увеличить мировые запасы энергии
от сжигания урана более чем в 100 раз [105]. Не удивительно, что значи-
тельные усилия были направлены на научные исследования с целью луч-
шего познания этого необычного металла.
Первым был идентифицирован изотоп плутония с массовым числом
238 во время исследования Сиборгом и сотр. [174, стр. 4—10] химических
свойств индикаторных количеств нептуния. Эти исследования, проведенные
в Калифорнийском университете в 1941—1942 гг., позволили накопить зна-
чительные данные о химических свойствах плутония, и в 1942 г. было полу-
чено первое чистое соединение плутония [174, стр. 38—42]. Металл в виде
мелких корольков впервые был получен Баумбахом, а вскоре после этого —
Фридом. Хотя эти крошечные корольки плутония весили менее 50 мкг,
оказалось возможным определить их плотность, температуру плавления
и микроструктуру 146, стр. 355—357; 75].
Когда появились граммовые количества плутония, основные исследо-
вания были перенесены в Лос-Аламос [179]. С этого времени несколько
лабораторий США. Канады, Великобритании, СССР и Франции внесли зна-
чительный вклад в металлургические исследования плутония.
ИСТОЧНИКИ СЫРЬЯ
Плутоний образуется в результате радиоактивного захвата нейтрона
ураном-238 и последующего двухступенчатого Р-распада промежуточных
продуктов. В ядерных реакторах с природным ураном (содержащим 0,7%
урана-235) нейтроны, порождаемые делением урана-235, захватываются
512
Глава 21
урапом-238 и по так называемым котельным реакциям образуется iuivto-
ннй-239 [101]:
U'235 j_n _^. Продукты деления-(-2,5п+200 Мзв,
U2.i»+n -
23,5
2,33 суток
Искусственно получены изотопы плутония с массовыми числами от 232
до 216, но наиболее важным в производстве ядерного горючего и оружия
в настоящее время является плутопнй-239 ПОП с периодом полураспада
24 360 лет.
В природе встречаются весьма незначительные количества плутония,
и для практических целей его можно получать только путем синтеза. В 1912 г.
Сиборг и Перлман [175], а также Гарнер, Боннер и Сийорг 179], устано-
вили, чтов урановой смолке и других урановых минералах находится около
1-10~12 вес. % плутония. Впоследствии Пеппард и сотр. [149], а также
Левин и Сиборг [118, 173] установили наличие в природе несколько боль-
ших количеств плутония. Результаты их исследований представлены
в табл. 1 [118].
Таблица 1
СОДЕРЖАНИЕ ПЛУТОНИЯ В УРАНОВЫХ И ТОРЦЕВЫХ РУДАХ
(ПО ЛЕВИНУ И СИБОР1У)
Рудо
' Содержа-
ние ура-
на, %
Канадская урановая смолка
Урановая смолка нз бывшего Бельгий-
ского Конго
Колорадская урановая смолка
Концентрат урановой смолки нз бывше-
го Бельгийского Конго
Бразильский монацит
Монацит из шт. Северная Каролина
Фергюсонит
Карнотит
I
13,5
38
50
45,3
0,24
1,64
0.25
10
Отношение
РиМв,руда
(по весу)
Отношение
Pu23S/u
XI 012
4.8-10-12
8-10-12
10-12
1-10 "
9-10-"
1-10-1*
4-10-"
7,1
12
7,7
15
8,3
3,6
4
0,4
В природе встречается только изотоп плутоний-239. Вероятно, он
образуется в результате захвата нейтрона ураном-238 и последующего рас-
пада урана-239 и нептунин-239. Концентрация плутония определяется
вековым равновесием [101]. Поскольку Пеппард с сотрудниками смогли
выделить всего 1 мкг плутония-239 из каждых 100 т-концентрата, вполне
очевидно, что даже богатейшие месторождения урана ие могут вытеснить
методы синтеза как источник получения плутония.
В настоящее время плутоний получают в реакторах различного типа
во многих странах мира. Реакторным горючим служит уран с обычным со-
держанием урана-235 или слегка им обогащенный. Уран как ядерное горю-
чее применяется в различных видах, но чаще всего в виде металла (наиболее
плотная форма) для сведения к минимуму размера реактора [101]. Обычно
в реакторе выгорает лишь относительно небольшая доля урана-235, прежде
чем горючее извлекается из реактора для химической переработки с целью
отделения плутония от урана и продуктов деления.
Плутоний 513
ПРОИЗВОДСТВО ПЛУТОНИЯ
Данные о производстве плутония публикуются только во Франции.
В США основные производства плутония находятся в Хенфорде близ Рич-
ленда (фирма «Дженерал электрик компания) и в Саванна-Ривер (штат Юж-
ная Каролина, фирма «Дюпон де Пемур»)- В Великобритании до недавнего
времени производство плутония было сконцентрировано на заводах Уиид-
скейла [95J в Кемберленде. Однако в результате аварии, которая произошла
в 1957 г., работа двух реакторов в Уиндскейле была приостановлена [7,122].
Предполагается, что в дальнейшем производство плутония будет осущест-
влено в реакторах-конверторах типа Колдср-Холла и Чапл-Кросса 1156].
В Канаде производство плутония ведется с октября 1947 г. в реакторах
Чолк-Ривера (провинция Онтарио) [81]. В настоящее время Франция произ-
водит 20 кг плутония в год, но ожидается, что с пуском еще двух реакторов
в Маркуле будет выпускаться 100 кг металла в год [126]. В Моле (Бельгия)
Организация европейского экономического сообщества, в составе двенад-
цати членов, предполагает построить завод для выделения плутония стои-
мостью 12 млн. долларов. Пуск этого завода планировался на 1961 г. [123].
Сведений об установках, производящих плутоний в СССР, нет. Однако
публикация статей по металловедению плутония в 1955 г. в Москве и
в 1958 г. на Второй женевской конференции указывает на то, что в СССР уже
несколько лет имеются достаточные количества плутония для металлурги-
ческих исследований [9, 75, 109]. Другие отчеты из СССР доказывают, что
он обладает также большими количествами материалов, необходимых дли
полной загрузки плутонием нескольких экспериментальных реакторов
1116, 117].
Джудкинс [99] сообщает, что в настоящее время цена плутонии в слит-
ках составляет 12—45 долл. за 1 г. По современной оценке КАЭСШЛ [124],
при стоимости плутония в виде горючего для ядерных реакторов 12 долл.
за 1 г его применение будет не только технически, но и экономически
приемлемо.
Стоимость перевода нитратных растворов в металлический плутоний
доходит до 2,40 долл. за 1 г, хотя по современным рекомендациям КАЭ
СШЛ она дожна быть 1,5 долл. за 1 г. В дальнейшем па больших заводах
можно будет снизить стоимость этой переработки до 1,0 и даже 0,5 долл.
за 1 г [125].
ИЗВЛЕЧЕНИЕ ПЛУТОНИЯ
Обсуждение методов извлечения плутония будет ограничено описанием
немногих из осуществленных на практике процессов разделения и восста-
новления. Хотя производство тепловыделяющих элементов и работа реак-
тора — взаимосвязанные вопросы и их, видимо, следовало бы включить
в полное описание извлечения и металлургии плутония, производство плу-
тония в реакторах — слишком обширный вопрос, чтобы рассматривать его
здесь [81, 173].
Основная трудность в процессе извлечения плутония — это его отде-
ление от сопровождающих урана и продуктов деления. Эта проблема чрез-
вычайно осложняется присутствием сильно радиоактивных продуктов деле-
нн, из-за которых по соображениям техники безопасности многие операции
необходимо проводить при дистанционном управлении. Для того чтобы
с конечным продуктом переработки — плутонием — можно было свободно
обращаться, исходная концентрация продуктов деления в уране должна
быть уменьшена в 106—107 раз [101J.
33 jaKE3 № 239
514 Глава 21
Обычно содержание плутония в облученном уране составляет всего
несколько граммов на тонну. Кроме того, на детали процесса влияют режим
ядерной реакции получения плутония и состав окружающих его материа-
лов, неодинаковый во многих существующих типах реакторов и в реакторах
разнообразных конструкций, находящихся на различных стадиях проекти-
рования и сооружения.
Несмотря на эти очевидные затруднения, разработан ряд удовлетвори-
тельных способов отделения и извлечения плутония. По примерной клас-
сификации к этим методам относятся: 1) осаждение; 2) экстракция органи-
ческими растворителями; 3) ионный обмен и 4) пирометаллургия. Выбор ме-
тода или комбинации методов D значительной степени определяется эконо-
мическими соображениями. Так, для относительно небольших операций
может оказаться пригодным метод ионного обмена, а для экономичного
установившегося производства плутония в крупных масштабах может по-
требоваться экстракция органическими растворителями. Для переработки
сильно облученного горючего будущих реакторов с большой плотностью
энергии, вероятно, потребуются 11131 пирометаллургические методы.
Обычно химические методы разделения основаны на том, что плуто-
ний существует в нескольких степенях окисления [101]. Например, плу-
Tonnft(VI) гораздо менее устойчив, чем ypaH(VI), но плутоний(Ш) более
устойчив, чем уран(Ш). Таким образом, можно приготовить растворы,
в которых уран(У1) присутствует вместе с плутонием(Ш) или (IV). В этом
случае осуществить разделение довольно легко. Отделение продуктов деле-
ния также основано на отличии их свойств от свойств плутония в той
или иной степени окисления. Ридберг и Силлен 1166] приводят многочис-
ленные данные о выделении плутония процессами окисления — восстанов-
ления и описали ряд комбинаций отдельных операций разделения.
Первоначальная стадия извлечения плутония — это период охлажде-
ния, которое заключается в хранении облученных тепловыделяющих эле-
ментов в течение двух-четырех месяцев под водой, чтобы уменьшилась
активность продуктов деления (главным образом ксенона-133 и иода-131)
и прошло достаточное время для распада изотопа урана-237 до нептуния-237
и достаточно полного превращения нептуния-239 в плутоиий-239.
Процессы осаждения
Метод с применением фосфата висмута. Это — старейший метод извле-
чения плутония из облученного природного урана. Наиболее важный при-
мер висмутфосфатного метода — процесс, в котором плутоний осаждается
совместно с BiPO4 и LaF3. применяемыми в качестве носителей. Хотя в на-
стоящее время этот метод не применяется, к'ратко он будет рассмотрен,
поскольку он имеет историческое значение и опыт, полученный при рабо-
те этим методом, применим к другим методам осаждения. Сиборг и сотр.
[174, стр. 19—29; 188] подробно описали идею и разработку этого про-
цесса.
Облученный нейтронами уран растворяют в азотной кислоте и к полу-
ченному раствору приливают серную кислоту, которая образует комплексное
соединение с ураном, препятствующее его осаждению. Затем плутонийAУ)
осаждают совместно с BiPO4. Осадок растворяют в азотной кислоте, и плу-
тоний^) окисляется до плутония(У1), а образующийся осадок фосфата
висмута удаляют. Оставшийся в растворе плутоний(У1) восстанавливается
до плутонияA\0, который снова осаждают с BiPO4, и цикл очистки по-
Плутоний 515
вторяется. После второго осаждения в качестве носителя применяется
LaF3; дальнейшая очистка и концентрирование плутония производятся-
таким же циклом окисления—восстановления. После этого концентрация
плутония становится достаточной, и окончательную очистку проводят без
носителя. Плутоний осаждается из кислого раствора в виде перекиси.
Основной недостаток фосфатного метода заключается в трудности после-
дующего извлечения урана.
Ацетатный метод. Это другой метод осаждения [174, стр. 69]. Плутоний
осаждают совместно с натрийуранплацетатом, который повторно раство-
ряют и после восстановления плутония до четырехвалентного состояния
снова осаждают. Плутоний остается в растворе. Продукты деления уда-
ляют повторением цикла с меньшим количеством уранового носителя. Этот
метод применялся в 1943 г. для выделения нескольких миллиграммов плу-
тония примерно из 500 кг урана, облученного нейтронами на циклотроне,
и его предполагалось использовать в Ханфордс. Большой недостаток
этого метода состоит в том, что приходится перерабатывать всю массу урана
в виде осадка.
Методы экстракции органическими растворителями
Для производства плутония в большом масштабе из нескольких имею-
щихся методов разделения бьша выбрана экстракция органическими раство-
рителями [58; 101; 174, стр. 95—101; 192]. Широко использовались два
метода экстракции — пурекс- и редокс-процессы,— а также различные их
варианты. Урановое горючее растворяется в азотной кислоте с образова-
нием раствора, содержащего уран, плутоний и продукты деления. Методы
экстракции основаны на различиях в растворимости этих компонентов
в органической жидкости, практически не растворимой в воде.
Ниже описываются методы экстракции растворителями на основе
американской практики. Методы, применяемые в других странах, анало-
гичны в главном, но они отличаются некоторыми деталями, например со-
ставом органических экстрагеитов. Английские методы экстракции раство-
рителями рассмотрены Прэттом [153], Хоуэллом и сотр. [89] и Баком и сотр.
[13]. Французская практика описана Гольдшмидтом, Реньо и Прево [83]г
Реньо и сотр. [157], а также Прево, Корпелем и Репьо [1541; процессы,
применяемые в СССР, описаны Шевченко, Повицким и Соловкиным [177],
Вдовенко и Ковальской [ 193].
Пурекс-процесс. В этом процессе [71,94, 101] исходный раствор нитра-
тов урана, плутония и продуктов деления подвергается действию экстра-
гентов для отделения урана и плутония от основной массы продуктов
деления. Органическим растворителем является трибутилфосфат (ТБФ),
разбавленный керосином; экстракция ведется при различных типах
контактирования потоков. ТБФ, содержащий уран и плутоний, контакти-
рует с разбавленной азотной кислотой в колонне восстановительной
реэкстракции, в результате чего плутоний восстанавливается до трехвалент-
ного состояния. При этом плутоний полностью переходит из органической
фазы в водную. Дальнейшая очистка плутония достигается за счет окисле-
ния его снова до четырехвалентного состояния и реэкстракции ТБФ. По-
дробное описание пурекс-процесса дано Флеиери 171], а также Айришем
и Рисом [94].
33*
5/6 Глава 21
Редокс-процесс. Па протяжении ряда лет успешно применялся другой
процесс непрерывной экстракции — редокс-процесс [101, 114, 174, стр.
70—72]. Этот процесс подобен пурекс-процессу в том отношении, что вы-
полняются одинаковые функции и берутся те же исходные вещества, но
экстрагепт и высаливатель другие. Экстрагснтом служит гексоп (метил-
изобутилкетон), а высаливателем обычных ионов является нитрат алюминия.
Восстановление и окисление плутония осуществляют соответственно с по-
мощью Fe(SO3NH2J и ЫагСлчО?. Подробно редокс-процесс описан Лавров-
ским и Левенсоном 1114].
ТТА-процесс. По третьему методу экстракции плутоний экстраги-
руется из исходного водного раствора раствором теноилтрифторацетона
(ТТЛ) в бензоле, что обеспечивает отделение от урана и практически от
всех продуктов деления, за исключением циркония [58, 101, 174, стр. 70—
72]. ТТЛ представляет собой хелатпое соединение. Следы продуктов деле-
ния отмывают из органической фазы разбавленной азотной кислотой. За-
тем плутоний реэкстрагируют нз органической фазы путем промывки вос-
становителем. Поскольку нлутоний(П1) не экстрагируется в заметной
степени ТТА, он переходит в водную фазу. Цирконий не реэкстрагируется
с плутонием и удаляется из экстрагента при промывке смесью щавелевой
и азотной кислот.
Преимущество данного процесса состоит том, что в этом случае не при-
меняются высаливатели, содержащие ионы тех нлн иных металлов, поэ-
тому упрощается удаление отходов. Однако большим недостатком является
то, что экстракция происходит медленно и трудно осуществить непрерыв-
ный процесс.
Методы ионного обмена
Применение методов ионного обмена для выделения плутония изуча-
лось в лабораторном масштабе и на опытных установках, но пока не про-
двинулось дальше этой стадии [101, 113, 174, стр. 95—1011. Более важно
современное применение ионного обмена как вспомогательной операции
«месте с другими основными типами процессов разделения, где он оказался
эффективным для концентрирования растворов плутония. Достигнуто пре-
восходное удаление продуктов деления. Это приложение методов ионного
обмена подробно обсуждается Брюсом [12] и Тобером [1891.
На опытной установке в Фонтсне-о-Роз [154, 157] французские метал-
лурги использовали трехступенчатый ионний обмен па смолах для конеч-
ной очистки раствора плутония перед переводом его в сухую соль и восста-
новлением до металла. На первой ступени раствор пропускается через ка-
тионоойменную смолу, на двух последующих ступенях используется анионо-
обмепная смола, которая очищает плутоний от урана, продуктов деления
и других примесей эффективнее, чем кагионообменная смола, что упрощает
технологическую схему очистки [49]. Концентрирование и очистку плуто-
ния методами анионного обмена рассматривают Айкен 12, 189], а также
Райаи и Уилрайт [1651.
Химическое взаимодействие раствора с ионообменными смолами неве-
лико, но при действии излучения или совместном действии обоих этих фак-
торов они разрушаются довольно сильно 163]. Затраты на смолу не слиш-
ком велики, и ее замена в нестандартных процессах малого масштаба не
составляет проблемы (для извлечения не менее 45 г плутония за одну опе-
рацию расходуется 1 кг смолы стоимостью 4,3—6,5 долл. за 1 кг) 163]. Но
Плутоний 517
для продолжительных стандартных процессов, осуществляемых в большом
масштабе, методы ионного обмена пока не экономичны.
Пирометаллургические методы
В настоящее время пирометаллургические методы еще не разработаны
настолько, чтобы их можно было применять для извлечения плутония.
Однако проведены многочисленные исследования и разработки в поисках
подходящих методов, которые можно было бы использовать для извлечения
плутония из сильно облученного горючего 169; 112; 113; 132: 174, стр. 95—
101; 191J. В отличие от описанных выше химических методов разде-
ления эти процессы имеют многие преимущества. Очистка горючего
в виде расплавленного металла позволяет избежать многих операций хими-
ческой очистки и последующей стадии перевода солей плутония в металл.
Вероятно, при осуществлении пирометаллургических процессов будет встре-
чаться меньше трудностей, возникающих при химической переработке спла-
вов горючего различного состава. Кроме того, продукты деления будут
извлекаться в компактной форме, более пригодной для их применения или
захоронения [113].
Наибольшее внимание было уделено пирометаллургическим операциям
извлечения и концентрирования плутония трех типов: дистилляции,
экстракции солями и экстракции расплавленными металлами.
Дистилляция. Плутоний можно извлечь из расплавленного урана дис-
тилляцией в вакууме при 1500—1800е [3, 69, 140]. Давление пара.плутония
при 1540J в 300 раз больше, чем у урана 1128]. Может быть достигнута сте-
пень извлечения выше 99%; полученные экспериментальные данные
согласуются с теоретическими вычислениями. В настоящее время главные
проблемы состоят в выборе конструкционных материалов и разработке
приемников для плутония [113].
Более легко осуществим метод дистилляции, в котором уран перево-
дится в гексафторнд. Облученное горючее растворяют в трифториде хлора
или брома [85, 91, 194]. Гексафторид урана очищают и отделяют дистилля-
цией от фторирующих агентов и продуктов реакции. Плутоний оставляют
в аппарате для растворения в виде осадка нерастворимого тетрафторида
плутония. Этот осадок обрабатывают раствором нитрата алюминия для из-
влечения плутония экстракцией растворителем или фторируют содержа-
щийся в нем плутоний до гексафторида и затем извлекают его дистилляцией.
Основные недостатки процессов возгонки фторида заключаются в относи-
тельно высокой стоимости фтора и новизне этого метода. Однако эти недо-
статки компенсируются выгодой работы с меньшими объемами перерабаты-
ваемых материалов и отходов и простотой фторидных процессов 192, 113,
1ГM, 180, 181, 194].
Экстракция солями. Плутоний успешно экстрагировался из расплавлен-
ного урана такими галогенпдами, как UF4 и MgF2. Из расплавленной смеси
UF4 и металлического урана, взятых в одинаковых по весу количествах,
90"о плутония переходит в солевую фазу. Путем повторных операций
экстракции можно извлечь почти весь плутоний. Таким путем извлекают
фторид или хлорид плутония, которые затем восстанавливают до металла
[113, 140].
518
Глава 21
Экстракция расплавленными металлами. Серебро и магний не смеши-
ваются с расплавленным ураном и оба удовлетворительно экстрагируют
плутоний 13, 69, 129, 140, 1951. В случае применения магния следует иметь
в виду его высокое давление пара при температуре плавления урана. Маг-
ний можно отделить от плутония возгонкой. При использовании серебра
последующее отделение плутония затруднительно. В настоящее время
серебро предпочитают отделять дистилляцией [15, 113].
Церий н лантан также исследовались как возможные экстрагенты [69,
195]. Эти металлы не смешиваются с ураном в расплавленном состоянии,
и было найдено, что они хорошо экстрагируют продукты деления, особенно
редкоземельные элементы. Однако плутонии извлекается лишь частично.
Оказалось, что методы экстракции расплавленными металлами отли-
чаются невысокой избирательностью для отделения урана и плутония от
продуктов деления, но пригодны при дистанционном контроле. По-види-
мому, они окажутся перспективными, если будут допустимы сравнительно
высокие концентрации радиоактивных загрязнений в извлекаемом металле.
ПОЛУЧЕНИЕ МЕТАЛЛА
В результате экстракции органическими растворителями получается
разбавленный раствор нитрата плутония в азотной кислоте. Методы, раз-
работанные для перевода плутония из этого раствора в металл, обсуждались
Хармоном и Рисом [87].
Чтобы избежать больших потерь при осаждении и свести к минимуму
размеры применяемого оборудования, исходный раствор, полученный путем
экстракции, концентрируют до содержания плутония 10—100 г1л. Это
достигается выпариванием, экстракцией растворителями или методами
ионного обмена. Далее из концентрата можно получить металлический плуто-
нии, осаждая подходящее соединение, например трифторид плутония,
который затем непосредственно восстанавливается до металла, оксалаты плу-
тоння(Ш) или плутония(ГУ) или перекись плутония, которые перед восста-
новлением переводятся сухим методом в PuF4. Выбор процесса зависит от
степени чистоты исходного раствора, легкости извлечения из него плутония,
желаемых коэффициентов очистки и от применяемого оборудования.
Металлический плутоний может быть получен восстановлением любого гало-
генида плутония подходящим щелочным или щелочноземельным металлом
127, 35, 75, 871. Ниже приведены возможные реакции восстановления.
реакция
PuFt+4U -> Pu f 4LiF
PuF4+2Ca _*. Pu + 2CaF2
2PuF3+3Ca -» 2Pu+3CaF2
2PuCI34 3Ca -> 2Pu+3CaCI2
2PuBr3+3Ca ->- 2Pu+3CaBr2
2Pu+3CaI2
ккал/модъ Ри
- 159
-149,5
-54,8
-56,0
-55,5
59,9
плавления
шлака, °С
870
1330
1330
772
765
575
Лучшей реакцией является восстановление тетрафторида PuF4 каль-
цием, так как он не гигроскопичен, а кальций удобнее в обращении, чем
литий. Хлорид, бромид и иодид плутония сильно гигроскопичны, поэтому
нужно соблюдать особую предосторожность, чтобы в них не попала влага
Плутоний 519
до операции восстановления в бомбе. Обычно восстановление PuF4 про-
водят при нагревании в индукционной печи или в печи сопротивления реак-
тора, выложенного огнеупорным материалом и выдерживающего давление
28 am при температурах до 1600°. К PuF4 добавляется кальций (избыток
259о против стсхиометрического количества); реакция начинается около 600°.
При введении подогревающей добавки из эквивалентных количеств кальция
II иода выделяется дополнительное количество тепла и улучшаются свой-
ства шлака. Оптимальное отношение иода к PuF4 зависит от веса восстанав-
ливаемой шихты. В процессе восстановления в бомбе достигаются выходы
выше 99% [87].
Обычно получают плутоний со степенью чистоты около 99,87 вес. 96.
Металл может содержать примеси 0,05?-о железа, 0,04% углерода, 0,02%
хрома, 0,02% никеля, 0,01% сурьмы и 0,01% кремния. Однако прн соблю-
дении необходимых мер предосторожности восстановлением в бомбе можно
получить плутоний со степенью чистоты 99,97%. Джонсон [98] описал
метод получения плутония высокой чистоты, который включает очистку
исходного раствора последовательным двойным осаждением перекиси плу-
тония и очистку всех реактивов. В этом методе восстановление осущест-
вляется дважды перегнанным кальцием в тиглях из окиси кальция высокой
чистоты. Тейт и Андерсон [185] и Норе [199] исследовали очистку металли-
ческого плутония методом зонной плавки. Им удалось значительно умень-
шить содержание отдельных примесей, но степень чистоты металла оказалась
недостаточно высокой.
ИЗОТОП Ы
Известно большое количество изотопов плутония, причем все они
радиоактивны. Сиборг [173, 174, стр. 183, 295—296] обобщил данные об
изотопах трансурановых элементов. В табл. 2 приводится часть его дан-
ных, относящаяся к изотопам плутония. Абсолютные массы нуклидов вы-
числены из их энергий по отношению к абсолютной массе свинца-208. При
расчетах для нее принято значение 208, 04140 (физическая шкала).
ФИЗИЧЕСКИЕ СВОЙСТВА
Плутоний — во многих отношениях уникальный элемент. Он имеет
шесть кристаллических модификаций. а-Фаза (устойчивая при комнатной
температуре) имеет необычно высокий положительный коэффициент рас-
ширения и отрицательный температурный коэффициент электросопротив-
ления, а 6-фаза (устойчивая при нагревании в интервале 319—451°) имеет
отрицательный коэффициент расширения и положительный температур-
ный коэффициент электросопротивления. Электрическое сопротивление
всех фаз высокое, более характерное для полупроводника, чем для металла.
По-видимому, примеси сильно влияют лишь на немногие свойства
плутония. В течение нескольких лет б'-фазу* ие удавалось обнаружить
главным образом потому, что она выпадала илн подавлялась очень неболь-
шими количествами элементов, присутствовавших в качестве примесей,
и вначале у некоторых исследователей плутония имелась тенденции свя-
зывать необычные свойства плутония, а также непостоянство эксперимен-
тальных данных с наличием примесей в металле. Однако результаты более
поздних работ с металлом относительно высокой степени чистоты показы-
* В советской литературе такая фаза обозначается как rj-фаэа,—Прим. перев.
520
Глава 21
Габлица 2
МАССЫ (ФИЗИЧЕСКАЯ ШКАЛА) И РАДИОАКТИВНЫЕ СВОЙСТВА ИЗОТОПОВ ПЛУТОНИЯ
(ПО СИБОРГЬ)
топ
232
233
234
235
236
237m
237
238
239m2
239mi
239
240
241
242
243
244
245
246
a ?'
Масса
232,11343
233,11549
234,11631
235,11862
236,11969
237,12228
238.12374
—
239,12672
240,12878
241,13197
242,13423
243,13781
244,14024
245,14413"
246,14698
Период полураспада
36 мин
20 мин
9 час
26 мин
2,85 лет
0,18 сек
45,6 суток
86,4 лет
1,93-10 1 сек
1,1-Ю-э сек
24 360 лет
6580 лет
13 лет
3,73-10» лет
4,98 час
7,6-10' лет
10,1 час
10,85 суток
I — электронный захват.
ИП — изомерный
" H
переход.
мпчное значение.
Вид распада (энергия,
Мэв)
ЭЗ = «98%)
а(>2%) F,58)
ЭЗ (>99о„)
«@,1%) F,30)
Э3(94%)
а F%) F,19)
ЭЗ
аC-10-з%) E,85)
аE,763; 5,716; 5,610;
5.448)
Р(устойчив)
ИПб
ЭЗ (>99%)
а C,3-10-з%) E,65; 5,36)
аE,495; 5,452 и другие
от 5,35 до 4,61)
Р (устойчив)
ИП
ИП
аE,147; 5,134 и другие
от 5,10 до 4,66)
Р (устойчив)
«E,159; 5,115 и другие
от 5,01 до 4,85)
Р (устойчив)
Р (>99%) 0.0205
а C-10 ¦¦>%) D,893;
4,848)
аD,898; 4.854)
Р(устойчив)
Р~@,58; 0,49; 0,37)
а
Р (устойчив)
р-
P"@,3.i; 0,15)
Метод получения
U235 (а, 7п)
U233(a, 4п)
U235(a> 5п)
Cm238 а-распад
№35 (а, 4п)
U2" (а, п)
Cm240 а-распад
Cm-41 а-отдача
U238 (а. 5п)
U235(a, 2п)
Cm242 а распад
Np237 (n, ¦у)Ыр«<" в
Cm243 а-распад
Cm243 а-распад
Np239 р--распад
Pu239 (п, у)
pu240 (rii у)
Pu2" (n, у)
Pu243 (n, v)
Pu243 (n, y)
Pu=i4 (n, y)
Pu245 (n, y)
вают, что примеси влияют па свойства плутония меньше, чем предполага-
лось ранее.
В табл. 3 приведены некоторые физические свойства плутония. Атом-
ный вес плутония, как и всякого другого элемента, зависит от его изотоп-
ного состава, который для металла, полученного в реакторе, является функ-
цией характеристик и режима работы реактора [5, 173]. Образующиеся
Плутоний 521
Таблица 3
ФИЗИЧЕСКИЕ СВОЙСТВА ПЛУТОНИЯ
Порядковый номер 94
Масса изотопа плутония-239
Физическая шкала 239,13
Химическая шкала 239,00
Вычисленный атомный вес плутония, 239,11
облученного в реакторе (доза 8-Ю19
нейтр,'см°, химическая шкала)
Температура плавления, °С 639,5±^2 [23]
Температура кипения, "С 3235+^19 [151]
Давление пара при 1120—1520" 1&Рммрт.ст.= A7 587± 73)/(/+ [151]
+ 273,18) + 7,895± 0,047
Средний теплота испарении при 1120— 80,46;{-0,34 [151]
1520е, ккал/г-атпм
Поверхностное натяжение расплавлен- 437—475 11471
ного металла при 640", дн/см 490—580 [187]
Теплоты превращения, кал/г-атом [611
Теплота плавления е —> жидкость, а и = чви—ми 1148[
кал/г-атом Д И = 760J415 [1"9]
" 1291
Удельная
кал/г-атом -град 129 611
25° " "
160=
280'
350°
455"
в результате «котельных реакций», рассмотренных выше, атомы плутония-239,
оставаясь в реакторе, подвергаются дальнейшей бомбардировке нейтронами,
превращающими часть их в плутоний-240, а часть последнего в плутоний-241
или высшие изотопы. В уране, облученном нейтронами, могут быть обнару-
жены плутоний-236, плутоний-238, плутоний-239, плутоний-240. плу-
тоний-241, плутоний-242 и плутоннй-243 [1731 Практически заметно
влияют на атомный вес лишь плутоний-239, плутоний-240 и плутоний-241,
которые содержатся в получаемом в реакторе плутонии в достаточных для
этого количествах. Так, в первоначальных экспериментах по облучению
плутония в реакторе [51 было найдено, что образец, облученный интеграль-
ной дозой 8-Ю18 иейтр'см", содержит 95,37 ат.% плутония-239, 4,43 ат.%
плутония-240 и 0,20 ат.% плутония-241. Если для расчета использовать
массы изотопов, приведенные в табл. 2, то атомный вес плутония для этого
образца будет равен 239,19 по физической шкале и 239,11 по химической
шкале атомных весов.
Более новые эксперименты по облучению плутония в реакторе для
испытания материалов позволили получить лучшие данные о зависимости
изотопного состава от условий облучения [70, 96, 174, стр. 164—1681.
80,
46±0,34
437—475
490—580
&Н
Ml
Д Н
Д Н
- 95fy-IO
= 140±15
= 156±5
= 17±10
Д Н = 470J-10
Mi
&Н
Д Н
а
со.
У
6
6
8
= 480—530
= 760±115
= 94UJ-I50
8,1
9,9
11,0
10,9
' 13,2
10,4
522 Глава 21
По этим данным Триплетт [190] вычислил изотопный состав реакторного
плутония для облучений от 0 до 13 000 мет-дней!т. Изотопный состав реак-
торного плутония немного изменяется также с течением времени (т. е.
d отсутствие облучения нейтронами), но это изменение сказывается заметно
на атомном весе только в том случае, когда присутствует значительное
количество плутония-241 (период полураспада 13 лет).
В табл. 3 показано, что поверхностное натяжение расплавленного
плутония изменяется в пределах 437—475 дн/см. Эти данные вычислены по
результатам экспериментов Олсена, Санденоу и Херрика [147], которые
измеряли плотность расплавленного плутония гидростатическим взвеши-
ванием вольфрамового грузика в зависимости от температуры. Грузик был
подвешен на танталовой проволоке, и, поскольку расплавленный плутоний
смачивает тантал, необходимо было вводить поправку на поверхностное
натяжение расплавленного металла. Произведение ycos6> где Y—поверх-
ностное натяжение, а 0 — угол контакта между плутонием и танталом,
было определено как функция температуры, ио величину 0 можно было
измерить лишь при температуре затвердевания расплавленного плутония
при охлаждении. Разброс значений поверхностного натяжения от 437
до 475 дн/см вызван ошибкой измерения величины 6.
Известно, что тантал очень мало растворим в расплавленном плутонии,
так что радиус танталовой проволоки, взятый для вычисления y cos 0, мог
оказаться несколько завышенным. Если это так, то соответствующее зна-
чение поверхностного натяжения должно быть несколько выше приведен-
ного в табл. 3. Теоретический расчет поверхностного натяжения, выпол-
ненный по известным физическим постоянным плутония Тейлором [187],
показывает, что оно находится в пределах 490—580 дн/см. Теперь ясно, что
экспериментальное значение Комстока и Джибни [47], равное 100 дн/см,
ошибочно, так как на поверхности расплавленного металла в их экспери-
ментах присутствовала окисная пленка большой толщины.
Теплота плавления плутония была определена английскими [29],
французскими [148] и советскими [109] исследователями. Расхождение
между результатами различных исследователей, по-видимому, связано
с точностью измерений, которая во французской работе составила око-
ло 20%: такие же широкие пределы колебаний отмечаются в работах англий-
ских и советских исследователей. Однако все три исследования [29, 109, 148]
позволили установить, что теплота плавления плутония гораздо меньше,
чем известные значения для большинства других металлов.
Аллотропические модификации
В табл. 4 приведены данные о кристаллических структурах модифика-
ций плутония. Приведенные во второй колонке таблицы температурные
области устойчивости основьтаются на температурах превращения, уста-
новленных Крамером и сотр. [23; 46, стр. 355—357, 372—382] дилато-
метрическим методом при скорости нагревания окало 0,75 град/мин (рис. 1).
Поэтому температуры превращения не соответствуют равновесным услови-
ям, если ие считать превращений 6->-6' и 6'-»-е, которые приближенно
правильны. Три низкотемпературных превращения (и—>-р, р —*¦ у и у—*- б)
происходят при более высоких температурах, если скорости нагревания
выше [33, 199], и при значительно более низких температурах при ох-
лаждении [21; 33; 46, стр. 372—382; 143; 148; 199]. На рис. 2 показан харак-
тер гистерезиса между кривыми нагревания и охлаждения, полученными
в дилатометрических опытах с плутонием.
Плутоний
523
Таблица 4
КРИСТАЛЛИЧЕСКИЕ СТРУКТУРЫ АЛЛОТРОПИЧЕСКИХ МОДИФИКАЦИЙ ПЛУТОНИЯ
Модификация
Альфа [13, 211]
Бета [43, 210]
Гамма [209]
Дельта [64]
Дельта-
-прим [25]
Эпсилон [64]
Расплав [147]
Область
УСТОЙЧИВО-
СТИ при
нагрева-1
ини, "С
Ниже 122
122—206
Тип решетки н про-
странственная
группа
Простая моноклин-
ная, P2j/m
Моноклинная объ-
емноцентриро-
ванная, вероят-
но, I2/m
206 319 ' Ромбическая гране-
319 451
451- 476
476—640
Выше 640
центрированная,
Fddd
Кубическая гране-
центрированная,
Fm3m
Тетрагональная
объемпоцентрн-
рованная, I4/mmm
Кубическая объем-
ноцеитрирован-
ная, Im3m
—
Размеры элементарной
ячейки. А
При 25°
c = 6,182J-0,001
Ь = 4,826±0,001
с= 10,956±0,001
р= 101,74^0,01°
При 190°
а = 9,284±0,003
Ь = 10,463±0,004
с = 7,859:(-0,003
р-92,13±0,03°
При 235°
а = 3,1587±0,0004
Ь = 5,7682±0,ООО4
с= 10,162±0,002
При 320°
а = 4,6371±0,0004
При 450° а
а = 3,3261J-0,0008
с = 4,4630:(-0,0014
При 490"
а = 3,6361±0,0004
—
Число
атомов
в эле-
мен-
тарной
ячейке
16
34
8
4
2
2
—
Рентгено-
графичес-
кая плот-
ность,
г/см*
19,84
17,70
17,14
15,92
16,07
16,51
При 655°
lfi,62e
0 Размеры, приведенные для 450°, получены экстраполяцией результатов измерений, прове-
денных при более высоких температурах.
6 Плотность измерена путем гидростатического взвешивания танталового грузика.
Проводя эксперименты в условиях изотермического превращения,
Крамер и сотр. [23] пытались уменьшить расхождение между температу-
рами превращения при нагревании и охлаждении. В случае превращения
а ->- Р это им не удалось, для превращения р -»- Y они получили нижний
и верхний пределы при 174 и 199й, а равновесная температура у — 6-превра-
щения оказалась в интервале 308—31 Г. В дилатометрических опытах они
обнаружили, что эффект гистерезиса в превращениях 6 -*¦ Ь' и б'—»- е не-
значителен [23, 33, 1991, так что температуры этих превращений, наблю-
давшиеся при нагревании, можно рассматривать как приблизительно соот-
ветствующие равновесию. Однако на основании детального исследования
б'— е-превращения с помощью высокотемпературного дифрактометра
Эллиот и Ларсон [251 пришли к выводу, что во время нагревания плутония
очень высокой степени чистоты это превращение происходит при 480 + 2°.
524
Глава 21
Изучение изотермического а — ^-превращения показало, что, вероятно,
из-за сложности кристаллической решетки и низкой температуры этого
превращения при приближении к температуре превращения инкубацион-
ный период становится очень длительным. По этой причине большинство
исследователей дают расхождение между температурами превращения при
нагревании и охлаждении около 40е (от 120 до 80°). Только Ли и Мардону
[33, 199] удалось определить равновесную температуру, которая оказалась
равной 117 ± 2°. Однако, если принять во внимание наблюдения, сделан-
ные в более детальной работе Нельсона и Томаса 1143, 145], эту величину
21.0
2Ё.И
26.0
25,5
2Щ
и.
А-
—
1
100
2СП 300 1,00 500 600
Температура, °С
Рис. 1. Расширение плутония вы-
сокой степени чистоты при самона-
гревании, определенное на дилато-
метре.
Длина образца Lq = 25 мм.
юо гоо зоо wo ъоо еоо то
Температура, "С
Рис. 2. Старые дилатометрические
кривые плутония для полного цикла
нагревания и охлаждения 1174].
Длина образца Lo= 25 мм; скорость
1ыгренании и охлаждения 3 град/мин.
следует считать несколько завышенной. Нельсон и Томас изучали также
кинетику а — р"- и р" — а-превращений (рис. 3 и 4), но они применяли более
кратковременные изотермические обработки.
В первоначальных экспериментах A945 г.) по выяснению зависимости
температуры а — ^-превращения от давления Бриджмен ПО] определял
равновесные давления, вызывающие превращения при более высоких тем-
пературах. Ои нашел, что при 163 равновесное давление а — Р-превраще-
ния равно 3100 кг/см2, при 205е—7060 кг/см2. Линейная экстраполяция этих
величин к атмосферному давлению дает равновесную температуру превра-
щения, равную 129 . Поскольку ясно, что этот результат слишком высок,
Бриджмен пришел к выводу, что линейная экстраполяция ошибочна и кри-
вая зависимости температуры превращения от давления выпукла по отно-
шению к оси давления, что является нормальным для большинства твер-
дых тел.
Результаты исследования изотермических реакций р — ¦у~пРсвРаЩсиия
Нельсоном [144] (рис. 5 и 6) хорошо согласуются с данными Крамера
и сотр. [23] о разбросе температур этого превращения. Подробно работа
/50
I
120
1
\
\
\
\
о
. \
d.
\
\
_1\
%
\
\
W V
\ \
Ш
4
¦o.
r
P Конец
[|
II
/ляда
Врем», сип
/час
1С vat
Р н с. 3. Диаграмма изотермического а—Р-превращенип плутония
[[¦13, 145].
120
80
ив
-во
-по
10 1пшн Ю2 Wmuh W3 liac
Бремя, сек
Рис. 4. Диаграмма изотермического Р —а-превращения плутония
[143, 145].
260
250 —
I 730
220
2W
200
A
_
i i i I ii
Vx
\\
V
\
\
\ °
\
\
\
Г Начали \ w
превращения^^
XX
1 1
ill
о
к— у Нвнещ
\
1
10 Ю' Ю3 Ю*
Время, сек
Рис. 5. Диаграмма изотермического р—7"пРевРаше11ня плутония [144].
-100
Ю мин I vac
Время, сек
Рис. 6. Диаграмма изотермического 7 — Р—«-превращения плутония
[144
ого 7 "
, 145].
Плутоний
527
Нельсона и Томаса о кинетике превращений плутония рассматривается
ниже.
Таблица 5
РАВНОВЕСНЫЕ ТЕМПЕРАТУРЫ ПРЕВРАЩЕНИЯ
ПЛУТОНИЯ И ИЗМЕНЕНИЯ ОБЪЕМА, ВЫЧИСЛЕННЫЕ
ПО РЕНТГЕНОСТРУКТУРНЫМЩАШ1ЫМ
Превращение
P-*y
S—>¦ 6'
й'->-Е
6 —> расплав
Температура
превращения, °С
1Щ±Ю
190;?10
310±5
452Г{:2
480^4
639, Ъ±2
Изменение объ-
еыа
(~ юо) "'
9,62
2,67
6,90
—0,36а
2,16
—0,826
а Значение определено путем линейного дилатомет-
рического измерения [23].
^ Значение определено путем объемного дилатомет
рнческого измерения [I07J.
В табл. 5 приведены температуры превращения плутония в условиях
равновесия, взятые с учетом результатов всех экспериментов, описанных
ю
Время w сек
Рис. 7. Диаграмма изотермического а — р — г-препращения плутония
[1441.
выше. В ряде случаев указаны широкие пределы колебаний. В табл. 5
приведены также данные об изменении объема при всех превращениях,
включая плавление. Эти изменения объема при превращениях в твердом
528
Глава 21
состоянии, за исключением 6—б'-превращенпя, вычислены по размерам
элементарной ячейки и коэффициентам теплового расширения (рентгено-
структурные данные), приведенным в табл. 4 и 6. Изменения объема,
Таблица 6
ТЕПЛОВОЕ РАСШИРЕНИЕ ПЛУТОНИЯ
Модификация
и основной
коэффициент
Альфа, ир
Альфа, О]
%
Интгрв<1л температур
«о -^ <i>
От — 186 до + 100°
21—104=
Средний коэффи-
циент линейного
расширения,
1 О-в/град
42,3
64±О
72±5
28±5
Метод измерения
Линейный дилатомет-
рический [23, 46,
стр. 372—382]
Рснтгеноструктурный
[43, 45]
При 21° направление <1| находится под углом 10° к моноклинной оси с
и 91,7е к оси с
Бета», а,
«2- а.„
«3
При 83° направление а
Гамма, аа
%
ас
а
Дельта а
Дельта-грим, аа
«г
~аР
Эпсилон, а
Расплав, а„
V
83—252°
—
1 лежит под углом 3v
210 -310°
—
—
320- «О3
452 -480°
—
490—550°
655- 960"
85^9
15±5
13±6
Рентгеноструктурныи
[43, 45, 210]
3 к моноклинной оси а и 55, Г к оси с
—19,7±1
39,5±0,6
84,3±1,6
34,6±0,7
—8,6±0,3
444,В±12,1
—Ю63,5±18.2
—65,6±10,1
36,5±1,1
89,76
Рентгеноструктурный
[209]
То же [64]
» » [25]
» » [64)
Гидростатическое
взвешивание [ 147]
а Фаза, содержащая 2% урана.
6 Средний коэффициент пбъемного расширения.
вычисленные по рентгеноструктурным данным, обычно не согласуются с из-
менениями длины, наблюдаемыми в дилатометрических опытах, так как
последние зависят не только от изменений кристаллической структуры
П чутпний 529
и межатомных расстояний, но и от таких внешних факторов, играющих
роль при превращениях, как: 1) образование микропустот [45; 46, стр. 372—
382; 1451; 2) закрытие микропустот в процессах типа спекания [46, стр. 372—
382]; 3) пластические деформации, возникающие из-за изменения размеров
н формы образца [21, 33, 46, стр. 372—382]; 4) эффекты, обусловленные
предпочтительной ориентацией; 5) градиенты температуры внутри образца,
ьозникающие при радиоактивном самонагревании плутония [23, 46, 1671
(порядка 0,01 кал/см"-сек [167, 1831; точное значение заьисит от изотопного
состава), и 6) удержание Р-фазы (в а-фазс), что влияет на величину изме-
нения объема при а— р-прёвращении [46, стр. 372—382; 143; 1451. Однако
считается, что в случае довольно малых изменений объема при 6 — 6'-
превращении и плавлении непосредственные дилатометрические методы
дают лучшие результаты, чем вычисления на основании рентгеноструктур-
ных данных (т. е. относительно малые ошибки рентгенографических опре-
делений коэффициентов расширения будут приводить к гораздо большим
ошибкам в случае малых изменений объема при превращениях). Поэтому
данные табл. 5 не полностью согласуются с данными табл. 4 и 6. Изме-
нение объема при 6 — й'-нревращснни. которое указано в табл. 5, вычислено
по данным Крамера и сотр. [231, полученным линейной дилатометрией.
Уменьшение объема при плавлении плутония было измерено Найтом [1071
с помощью объемного дилатометра.
Из-за больших изменений объема при температуре а — р-превраще-
ния оно довольно сильно зависит от давления. Бриджмен [ 10; 46, стр. 382—
3841 получил для давлений до 7000 бар линейный наклон изменения темпе-
ратуры превращения с возрастанием давления, равный 0,0109 град/бар.
Позднее Шонфельд и Шпиндлер [46, стр. 382—3841 получили значения
0,0073 град/бар при 1000 бар и 0,0102 град /бар при 5000 бар. По этим дан-
ным определена скрытая теплота а — Р-препращення. равная 985 кал/г-атом,
что хорошо согласуется со значением 958 кал/г-атом (см. табл. 3), полу-
ченным путем калориметрического определения Дином, Кэем и Лосби [611.
Судя по этим данным, эксперименты Шонфсльда и Шпиндлера дают лучшие
значения.
Кинетика превращений
Кинетика превращений Р -* и, и—>- р\ а ->- р -j- -у и у-^Р-^к изуча-
лась Нельсоном [143, 1441 и Нельсоном и Томасом [145]. Эти исследователи
использовали метод вытеснения жидкости для получения кривых нагрева-
ния и охлаждения и кривых изотермических реакций, показывающих долю
превращенной фазы как функцию времени. По этим данным были построе-
ны С-образные кривые температура превращения — длительность превра-
щения (диаграммы изотермических превращений) и представлены для пре-
вращений a ->- р, р ->- a, p->-Y- Y^-P-"«"a->-P->YHa рис. 3—7 соот-
ветственно.
Полученные данные показывают, что р — а-превращение не идет до
конца при температурах примерно выше 0° и что количество непревращенной
при данной температуре р-фазы возрастает с увеличением содержания при-
месей. Было обнаружено также, что скорость образования а-фазы из р-фазы
довольно сильно зависит от содержания примесей, причем она тем меньше,
чем выше содержание примесей. Для образца, содержавшего 0,02% при-
месей, время превращения р -* 50%а при —21е (температура, соответствую-
щая максимальной скорости превращения) было равно 20 сек, а для образца,
содержавшего 0,15% примесей,— 70 сек.
34 3ikj3 № 239
5.30 Г лава 21
Тепловые свойства
В табл. 3 даны теплоты превращения, плавления и испарения плуто-
ния, а также теплосмкостн кристаллических фаз при постоянном давлении.
Теплоемкость расплавленного плутония ие определялась. В табл. 3 при-
ведена теплоемкость а-плутония при комнатной температуре 161J. Санде-
но [ЗС1 иашел, что изменение теплоемкости а-фазы при температурах ниже
комнатной происходит нормально, т. е. теплоемкость уменьшается с пони-
жением температуры и, видимо, приближается к нулю при 0° К. В области
очень низких температур Сандепо обнаружил, что при быстром охлаждении
(как при закалке) теплоемкость уменьшается равномерно, но если образцы
выдерживать при температуре оьоло 50е К длительное время (порядка
24 час), то на кривых удельной теплоемкости в области ниже 160" К появ-
ляются аномальные пики 136].
Теплоемкости а- и Р-фаз при постоянном объеме с„ можно вычислить
из приведенных в табл. 3 величин сг и представленных ниже данных о сжи-
маемости и коэффициентах теплового расширения этих фаз. Вычисления
дали следующие величины:
с„= 7,3 кал/г-атам при 25" (а)
с„=9,4 кал/г-атом при 160е ф)
Сандено [36J получил значения с0 по своим экспериментальным дан-
ным для ср при очень инзких температурах. Эти значения показывают, что
дебаевская характеристическая температура для «-плутония равна 127".
Однако Лакер [32] на основании данных о скорости звука при комнатной
температуре вычислил, что дебаевская характеристическая температура рав-
на 178°. В принципе характеристическую температуру следует вычислять
по скоростям звука при абсолютном нуле, по в этом случае получается
более высокое значение и расхождение со значением Сандено будет еще
больше. Результаты Сандено подтверждаются расчетами Кэя [29], который
подстановкой данных о сжимаемости и температуре плавления соответ-
ственно в формулы Эйнштейна и Линдеманна [139] приближенно определил,
что характеристическая температура плутония должна лежать в интер-
вале 92—130".
В табл. 6 даны коэффициенты линейного теплового расширения для
всех кристаллических фаз плутония и коэффициент объемного теплового
расширения для расплавленного плутония. Во второй колонке табл. 6 ука-
зан интервал температур, в котором проводились эксперименты и для кото-
рого вычислены по формуле а (/,— ЦП<М\— '«) средние коэффициенты,
помещенные в третьей колонке. Здесь tB— температура, к которой отно-
сится средний коэффициент (т. е. / = /(„ когда t = /„; для жидкой фазы
о = vu, когда t = t0). Тим, где это возможно, приведены коэффициенты,
определенные рентгенографически. Это сделано из соображений об ошиб-
ках дилатометрических измерении при определении изменений объема во
время превращений. Однако величина ошибок, обусловленных суммой
внешних факторов, будет наибольшей для кристаллических модификаций,
устойчивых при более высоких температурах, и может быть довольно малой
прн дилатометрических измерениях теплового расширения а-, р1- и ^у-фаз.
Действительно, во многих случаях коэффициенты расширения этих фаз,
определенные дилатометрически, оказываются близкими к значениям, опре-
деленным рентгенографически. Поскольку рентгенографические измерения
при температурах ниже комнатной не проводились, в табл. 6, помимо коэф-
фициента расширения, измеренного рентгенографически в интернале
Плутоний 531
21—204°, приводится средний коэффициент для а-плутонмя в интервале
от— 186 до 100°, определенный дилатометрически Крамером и сотр. [231.
Этот средний коэффициент для интервала от 186 до 100е вычислен
с использованием найденной Крамером с сотрудниками более точной зави-
симости: / = /„[1 + D6,8 j 0,05)-10" Н E5,9. 0.4I0 "**], где t~
температура, 'С. Из этого выражения можно определить точный коэффи-
циент а = dl/ldt, значительно возрастающий с повышением температуры.
\\л всех аллотропических модификаций плутония только у «-фазы прояв-
ляется столь заметное отклонение от линейности. Отсюда ясно, что из-за
этого отклонения уравнение, полученное с использованием дилатометри-
ческого метода, лучше- описывает тепловое расширение поликристал-
лпческого а-плутония, не имеющего предпочтительной ориентации, чем
усредненный по всем направлениям средний коэффициент ар= 55- 10е, полу-
ченный на основании результатов рентгенографических измерений. Опре-
деленное дилатометрически выражение для коэффициента расширения дает
в интервале 21—104' а = 53,8-10~6, что хорошо согласуется с коэффи-
циентами, полученными путем рентгенографических измерений.
В кристаллографически анизотропных а-, р-. у- и б'-фазах плутония
проявляется также анизотропное тепловое расширение. В у- и б'-фазах
нинравлеиня главных коэффициентов теплового расширения совпадают с на-
правлениями кристаллографических осей, так что в табл. 6 эти коэффи-
циенты обозначены соответственно ап, а,, и ас. Однако в моноклинных
а- и рфазах только направление главного коэффициента а2 совпадает с на-
правлением кристаллографической оси Ь, так что аа- аь. В эллипсоидах
тензора теплового расширения для двух моноклинных структур направле-
ния главных коэффициентов nt и а3, конечно, перпендикулярны друг другу
и направлению а2, поэтому они лежат в плоскости кристаллографических
осей а и с. Основное направление в оплутонии, находящееся внутри тупого
угла (Р = 101,74°) между осями а и с и образующее угол 10е с осью а, обо-
значается а,. Аналогично в Рфазе направление at находится в тупом углу
(Р = 92,13и) между осями а и с, образуя с осью а угол 37°.
Величина усредненного по направлениям коэффициента ар (т. е. коэф-
фициента для макроскопически изотропного расширения поликристалли-
ческого плутония с беспорядочно ориентированными зернами) для у-
н б'-фаз определяется из точной зависимости
а не из приближенной формулы
Применение этих формул для а- и Рфяз не дает сколько-нибудь заметного
различия в величине aJ7.
Приведенный в табл. 6 коэффициент объемного расширения расплав-
ленного плутония является средним значением, вычисленным для интервала
655—960° из выражения Олсена, Сандено и Херрика [147J, определяющего
плотность расплавленного плутония в зависимости от температуры:
р = A7,5С7—0,001451 t) г/см*,
где t — температура, ° С. Поскольку эта зависимость между плотностью
и температурой является линейной, зависимость объема от температуры
нелинейна. Поэтому изменение объема расплавленного плутония с темпера-
34*
532
Глава 21
турой удобнее всего вычислять по изменению плотности, используя приве-
денное выше уравнение.
Коэффициенты теплопроводности а- и Р-фаз в интервале температур от
— 158 до 140° были измерены Сандено и Джибни [36, 1671. Их результаты,
представленные кривой (рис. 8), показывают, что коэффициент теплопро-
водности равен приблизительно 0,020 кал/'см-сек град для а-фазы
при 25е и 0,037 кал/см-сек-град для р-плутонин при 140°. Самое низкое
значение, измеренное при — 158°, равно 0,0035 кал/см-сек-град.
Теплопроводность а-плутония измерялась также исследователями Ха-
руэлла A99J. Их измерения @,008 и 0,006 кал/см ¦ сек ¦ град для 40 и 105°
соответственно) дают значительно меньшее значение коэффициента тепло-
проводности, чем найдено Сандено и Джибни, и противоположную по знаку
температурную зависимость. Исследователи Лос-Аламоса считают, что для
Рис. 8. Изменение тепло-
проводности а- и р-плуто-
ния в зависимости от тем-
пературы 136, 167].
?00 2.40 300
Температура,,*К
ЗЬО '.00 ',50
получения правильных результатов наиболее важное значение имеет устра-
нение потерь тепла теплопроводностью по проволокам термопар. В ан-
глийской работе не указывается, уделялось ли исследователями Харуэлла
столь же большое внимание этой проблеме.
Электрические и магнитные свойства
Наилучшие данные об электропроводности плутония в зависимости от
температуры принадлежат Сандено и Джибни [36, 167). Их результаты
для двух образцов плутония высокой степеии чистоты (99,95 и 99,96 вес.%
плутония) приведены на рис. 9. На этом графике даны отношения электри-
ческого сопротивления R к абсолютному электрическому сопротивлению
R-,13 A46,45 мком-см) а-плутония при 0°. В табл. 7 приведены сред-
ние значения абсолютных электрических сопротивлений этих двух образ-
цов при различных температурах. В табл. 7 приведены также средние тем-
пературные коэффициенты электросопротивления, вычисленные из зависи-
мости ак= (R2—Rt)/Ri>(t2.— М; средний коэффициент, вычисленный для
интервала температур tt—t2, относится к 0е С; RB—абсолютное электро-
сопротивление а-плутония при 0е С.
Сандено 136] сообщил результаты, полученные Олсеном и Маттиасом
при поисках сверхпроводимости у плутония при низких температурах. При
охлаждении образца а-фазы приблизительно до 1,3°К сверхпроводимость
не обнаружена; при этой температуре металл оставался сильно парамаг-
нитным.
Плутоний
533
Термоэлектрические свойства плутония определялись Ли и Холлом
f 11 Г»1 и были сообщены Уолдроном и сотр. 1199]. Измерялась термо-э. д. с.
термопары плутоний — платина между 20 и 630° С. На основании полу-
ченных данных вычислялась абсолютная термо-э. д. с. dEldi для каждой
Рис. 9 Изменение электри-
ческого сопротивления плуто-
ния в зависимости от темпе-
ратуры и абсолютного элек-
трического сопротивления
A46,45 мком-см) при 273.15° К
[36, 1671.
200 we eca воо
Температура ш гк
из шести аллотропических модификаций плутония. Эти данные приведены
на рис. 10 и в табл. 8. Онн получены путем вычитания абсолютной термо-
Таблица 7
ЭЛЕКТРОСОПРОТИВЛЕНИЕ И TEM1IEPATN РНЫ1-" КОЭФФИЦИЕНТЫ
.•МЕКГРОСОПРОТИВЛЕПИЯ ПЛУТОНИЯ (НО СЛНДЬ'НО И ДЖИЬНИ)
Модификация
Альфа
Бегл
Гамма
Дельта
Дельта-прим
Эпсилон
Температура.
"С
-247
-223
-173
-123
0
107
147
232
352
462
501
Абсолютное
элекфшпмро-
тпвление.
МКпМ ¦ СМ
64,8
128,0
156,9
153,5
146,45
141,4
108,5
107,8
100,4
102,1
110,6
Интервал
температур
<»1 '2>. °С
От-247
до -223
От - 147
до+20
29 107
147 197
232—317
352—452
462—474
488—501
Средний темпе-
ратурный коэф-
фициен г.
10 ''град
-t 184,05
-4,18
-2,08
-0,62
-0,50
+ 0,72
+4,43
0,00
э. д. с. платины [133J из термо-э. д. с. пары плутоний — платина, вычис-
ленной по наклону кривой термо-э. д. с.— температура [115].
Первые измерения магнитной восприимчивости плутония в зависимости
от температуры были произведены Комстоком в 1952 г. Некоторые резуль-
таты этой работы были кратко сообщены Джеттом [96J в 1955 г. Позднее
они были изложены более подробно Сандсно 1361. Последующие измерения
магнитной восприимчивости плутония описаны Даусоном [60], Конобеев-
ским и сотр. [108] и Сегеном и сотр. [1761. Во всех этих исследованиях
534
Глава 21
были получены несколько более высокие значения, чем у Комстока. Однако,
поскольку Комсток применял метод Гюи, а другие исследователи — менее
точный метод Фарадея, его результаты, вероятно, до сих пор являются
наилучшими.
Ввиду того что в методе Гюи учитываются изменения длины образца
и во время нагревания и охлаждения гидравлически прессованный плутс-
Р и с. 10. Изменение термо-
з. д. с. плутония н зависи-
мости от температуры [115,
199]
юо 200 зов wo то еда wo
Температура, %
иий расширяется и сжимается иначе, чем литой плутоний, Комсток полу-
чил для литого и прессованного металла несколько различные результаты.
(Изменения длины образца должны бьпь оценены, так как они не могут быть
Таблица 8
АБСОЛЮТНЫГ ТЕРМО-Э. Д. С. ПЛУТОНИЯ
(ПО ЛИ И ХОЛЛУ)
Модификация
Лльфа
Бета
Гамма
Дельта
Дельта-прим
Эпсилон
Температура,
27
127
227
327
¦152
527
Термп-э. д. ¦¦
ЫС ttt).
10-е в,г;тд
15,51
10.00
9,20
3,72
2,32
4,24
определены непосредственно во время измерений магнитной восприимчи-
вости.) На рис. 11 показана усредненная кривая, проведенная через эк-
спериментальные точки для двух материалов, а в табл. 9 перечислены из-
бранные значения магнитной восприимчивости, а также температурные коэф-
фициенты для всех аллотропических модификаций плутония. Значения,
приведенные в табл. 9, получены путем вычислений, основанных на пер-
воначальных данных Комстока, а не на результатах измерений, приведен-
ных на рис. 11. В четвертой колонке табл. 9 указаны интервалы температур
I»— *ь Для которых были вычислены средине температурные коэффициенты
Плутоний
535
магнитной восприимчивости, отнесенные к температуре г„ [т. с. в выраже-
нии (xi— Xn)/Xo('i— <o) X = %« при t = f,,l.
В отличие от Комстока, проводившего исследования не ниже 20°,
Диусон и Сеген с сотрудниками проводили измерения до температуры жид-
кого азота. Сеген и сотр. 11761 нашли, что магнитная восприимчивость
Рис 11. Изменение маг-
нитной восприимчивости
плутония d зависимости от
температуры [36].
Д — плутонии с высокой^на-
чальной IIJIOIIiriCThKl ф — ЛИ-
ТОЙ плутоний.
200 300
Температураш%
500
600
а-плутония почти постоянна на всем протяжении до — 200е и лишь слабо
возрастает с уменьшением температуры в соответствии с наклоном d%idl =
Таблица 9
МАГНИТНАЯ ВОСПРИИМЧИВОСТЬ ПЛУТОНИЯ (ПО КОМСТОКУ)
ЛАоднфнкация
Альфа
Бета
Г.1мма
Дельта
Дельта-прим
Эпсилон
Темпера-
тура, «С
20
132
224
358
464
488
M.ii мнтпая
восприимчн-
9. м. е./г
2,23
2,31
2,23
2,13
2,12
2,15
Интервал тем-
°С
20 -118
132 -198
224 -302
358 446
464 177
488—570
Температурный
t ко-»ффпцнен|
(Х1ОВ)(Х X,
при t = ?о)
-1,8
16,4
-11,5
-12,3
36,3
-12,5
=—0,4 ¦ 10 6 в интервале от — 200 до 100 . Однако Даусон [601 наблюдал,
что магнитная восприимчивость его образца при охлаждении от комнатной
температуры до—183° увеличивается почти вдвое. Сеген и сотр. 11761
предполагают, что образец Даусона мог содержать значительное количе-
ство парамагнитной примеси.
536
Глава 21
Упругие свойства
Упругие свойства плутония изучались статическими н динамическими
методами. Поскольку а-плутонию присущи внутренние напряжения и де-
фекты (рассматриваемые ниже в связи с прочностными свойствами).
Таблица 10
>ПРОГИЕ CDOflCTBA ПРИ 30° а-ПЛ\ТОНИЯ. ИМЕЮЩЕГО ТЕОРЕТИЧЕСКОЮ
РЕНТГЕНОГРАФИЧЕСЮЮ ПЛОТНОСТЬ A0,79 г/слЗ ПРИ 30°) (ПО ЛАКЕРУ)
Свойство
Модуль упругости
Модуль сдвига-
Коэффициент Пу-
ассона
Адиабатическая
сжимаемость
Изотермическая
сжимаемость
Скорость звука в
стержне
Скорость звука в
бесконечной
среде
Скорость звука в
поперечном на-
правлении
Плотность
Обозна-
чении
Е
<;
с
%s
У.т >
Щ
VL
vT
Q
Пределы наблюда-
емых значении
8,9—10,1
3,8 -4,3
0,14 -0,20
Г 1,8 -2,2
1 1,8—2,2
2,1—2,5
2,17—2,26
2,27—2,30
1,40—1.49
19,00 19,72
Экстраполяция
до рентгеипгряфи-
ческой плотности
10,0^0.1
4,38±0,04
0,15±0,01
2,1±0,1
2,1-1-0,1
2.4J-0.2
2,25^0.01
2,31±0,01
1,49-1-0.01
19,79
Размерность
10» дн,'см*
10» дн/см"-
102 см-/дн
10-fi/am
10-»2 смУдн
106 см/сек
IDS см/сек
10й см/сек
г/смЗ
Таблица 11
ТЕМПЕРАТУРНЫЕ КОЭФФИЦИЕНТЫ М1РМИХ СЬОПСТВ
а-П1УТОНИЯ ПРИ 30° (ПО ЛAKEP^)
Температурный
коэффициент
Модуль упругости
Модуль сдвига
Коэффициент Пуассона
Сжимаемость
Скорость звука в тонком
стержне
Скорость звука в беско-
нечной среде
Скорость зв\'ка в попе-
речном направлении
dE
Tut
dG
Cdt
da_
cdi
dX_
bit
vLdt
Величина
-2O1±I4
-93J-.7
-88±11
-99±5
Плутоний
537
Таблица 12
СРЕДНИЕ КОЭФФИЦИЕНТЫ ДАВЛЕНИЯ ДО 2000 бар MIPS I ИХ
CDOflCI'B а-ПЛУТОНИЯ ПРИ 30° (ПО ЛАКЕР^)
Свойство
Коэффициент
давления
Модуль упругости
Модуль сдвига
Коэффициент Пуассона
Сжимаемость
Скорость звука в тонком
стержне
Скорость звука в беско-
нечной среде
Скорость звука в попе-
речном направлении
Е0Ар
С„Др
Да
о0Др
АХ
vo\p
vL&p
At--.
vTAp
Величина, 1 0B/6ap
+ 17,7±1,1
+ 14,4±1,3
Ь26,6±6,6
-28,4±2,9
+ 7,77+J>,55
h9,21±0,42
+ 6,12-1-0,65
вероятно, лучшие данные о таких свойствах, как модуль упругости, коэффи-
циент Пуассона и сжимаемость, получаются динамическими, а не статиче-
скими методами. Наиболее обширные исследования этих свойств проведены
Лакером [32; 46, стр. 382—384J, изучавшим упругие свойства большого
числа образцов а-плутония с помощью двух различных методов, основанных
на использовании скорости звука. В табл. 10—12 приведены результаты
его измерений для металла самой высокой степени чистоты (99,97 вес. %
плутония). Лакер обнаружил, что результаты измерений зависят от экспе-
риментально найденной объемной плотности образцов. Поэтому в табл. 10
приведены окончательные, лучшие данные теоретической (рентгенографи-
ческой) плотности для а-плутония. Температурные коэффициенты, указанные
в табл. 11, с большой степенью приближения отвечают предельным значе-
ниям при 30е. Коэффициенты давления, приведенные в табл. 12, являются
средними значениями, вычисленными для 0 — 2000 бар и отнесенными
к атмосферному давлению.
Динамические методы для измерения упругих свойств а-плутония при-
меняли также английские и советские исследователи. Эти данные наряду
с результатами, полученными английскими и американскими исследовате-
лями статистическими методами, приведены в табл. 13. Для большинства
значений, приведенных в табл. 13, плотность металла не сообщалась и по-
правки на отклонение объемной плотности от теоретической, вероятно, не
вводились.
В табл. 13 приведены данные по сжимаемости для давлений меньше
2000 бар, но измерения Бриджмена [101 проведены до болеее высоких дав-
лений. В его отчете они даны в форме Av/v0 для последовательных скачков
давления вплоть до 100 000 кг1смг. Лакер [32] пересчитал данные Бридж-
мена в виде приближенно предельных сжимаемостей AvivAp, для которых
приращения давления (Ар) изменяются от 1000 до 10 000 кг/см-. Зависи-
мость этих предельных сжимаемостей от давления представляет собой кри-
538
Г л и i
21
Таблица 13
упругие свойства а-пльтония по длнным различных исслрдокvrEjicn
Лакер |32. 46. стр. 382—384]
Ли и Ханкок [46, стр. 382—384]
Коиобеевский н сотр. [109]
Лорд [29, 46, стр. 382 -384]
Кэн н Лоутнан |29|
Брнджмен [10, 46, стр. 382—
384]
Шонфельд и Шпиндлер [46,
стр. 382 381]
Нельсон 1146|
Гарднер и Джеффрес [78]
Метод
Динамиче-
ский
То же
» 3»
Статический
Ъ »
» »
> >
» »
Модуль уп-
ругости,
103 кг/хм?
10,2
8,9
9,1
8,4
10.1
-
9,8—10,9
8,1—10,9
8- 10,5
Среднее 9,7
Модул ь
СДШ1Г.1.
юз кг/ям*
Коэффи-
циент
Плассона
1
4,4 0.15
3,8 0,21
0,13
Изотерми-
'IPCK.1U
сжимас-
MDITh,
10 « -dp
24±0,2
-2,0
2,5^0,51
а Измерена при 150°.
вую |32], которая для более низких давлений, исследованных Лаксром,
согласуется с его значениями сжимаемости и коэффициентов давления.
Экстраполяция данных Бриджмена дает сжимаемость при атмосферном дав-
лении около 2 • \0~в;бар (см. табл. 13). Предельная сжимаемость на-
дает до 1,5 ¦ 10 е,бар при 12 000 бар, примерно до 1,0 ¦ 10 ''/бар при
Г>0 000 бар и приблизительно до 0,5 ¦ 10"/бар при 100 000 бар. Таким
образом, объем ««-плутония под давлением 100 000 кг см1 составляет 89,8%
объема при атмосферном давлении [10].
По данным Шонфельда и Шпиндлера F46, стр. 382—384], изотермиче-
ская сжимаемость р-плутония при 200° в пределах от 0 до 2000 бар равна
B,3 , 1,0) ¦ 10 6 бар. Однако Бриджмен [10] пришел к выводу, что сжи-
маемость Р-плутония на 25% больше, чем у а-плутония. Изменения сжимае-
мости в зтом направлении следовало ожидать ввиду меньшей плотности
Р-плутония.
Механические свойства
По понятным причинам не предполагается, что плутоний когда-либо
приобретет значение как конструкционный материал, поэтому о его проч-
ностных свойствах имеется очень мало данных. Вполне очевидно, что при-
менение твердого нелегированного металлического плутония в виде тепло-
выделяющего элемента в ядерном реакторе невозможно из-за наличия шести
аллотропических модификаций и больших изменений объема при превра-
щениях 130, 72, 102, 184].
Кроме того, очевидно, что из-за больших изменений объема в сочетании
с анизотропией большинства кристаллических фаз в плутонии возникают
внутренние напряжения и дефекты, сильно влияющие на упругие и пласти-
ческие свойства металла. Однако, поскольку все кристаллические фазы плу-
тония, за исключением u-фазы, относительно мягки и легко деформируются,
такие напряжения п дефекты имеют большое значение в отношении проч-
Плутоний
531
ностных свойств лишь при температурах нижи 90 . Таким образом, почти
во всем интервале устойчивости а-фаза плутония имеет довольно большую
твердость и хрупкость, ее тепловое расширение анизотропно, и вследствие
моноклинной структуры она обладает очень немногими (если они вообще
имеются) хорошо выраженными плоскостями скольжения. Поэтому сле-
дует ожидать, что при комнатной температуре в «-фазе будут наблюдаться
Р и с. 12 Кривые напряже-
ние—деформация при испыта-
нии а-плутония на растяже-
ние и сжатие (Reactor Hand-
book, Vol. II, Interscience
Publishers, Inc., hew York,
1960).
/ испытании hi сжатие литого
образца при 2S°; J — испытания
и.i сжатие прессованного образцд
при 25°; 3 — испытания h.i сжатие
нрессоп iиного обр i3ii,.i при 77°; 4
испытания на растяжение литого
oOpj ii|d при y.V; Ч i(j4hii P<i-4>}~
шення.
иг
98
В.
W
56
1,2
28
п
4fr4
-/
1
-к
\-
/
/¦
/
-Л
А-
1
-н
" Г П
.—1—
г
+
1
1
1
-
0.02 в,т о,ов прь пю
Деиюрмаци*
цп
очень высокие термические напряжения, причем известно, что содержание
мнкропустот в а-плутонип неодинаково и зависит от режимов предыдущей
термообработки [45, 145].
Одна из причин, позволяющих считать, что механические свойства
плутония зависят от внутренних напряжений и дефектов, заключается
в большом различии между измеренными значениями предела прочности
при растяжении и предела прочности при сжатии. При комнатной темпера-
туре прочность при растяжении составляет менее половины прочности при
сжатии. Па рис. 12 показаны типичные кривые напряжение —деформа-
ция, полученные Шонфельдом [169]. Таким образом, было найдено, что
V литых и механически обработанных образцов прочность при сжатии со-
ставляет порядка 88—ПО кг/мм3, а прочность при растяжении, по данным
лосаламосских исследователей [169], не более 31—38 кг!мм3.
Другие данные о прочности при растяжении а-плутонин опубликованы
только металлургами Ханфорда. Нельсон [146] сообщает, что пределы проч-
ности при растяжении литых, механически не обработанных образцов рав-
ны 35,1—36,4кг/ж-и2. а предел текучести (вероятно, при ап>02) 31,6 кг/мм3.
Гарднер, Блуметер и Джеффрес [77, 78], изучая прочность при растяжении
при комнатной температуре, получили для литых и механически обработан-
ных образцов пределы прочности при растяжении 30,7—54,3 кг/мм". Неко-
торые их образцы были отожжены в течение 30—90 мин при 3A0—400 ,
540
Глава 21
и перед испытанием все они были охлаждены до —23е для перевода задер-
жанной E-фазы в а-фазу. Хотя было найдено, что отжиг не влияет на проч-
ностные свойства, наиболее очевидное объяснение более высоким значениям
прочности при растяжении (по сравнению с данными Шонфельда и Нель-
сона) состоит в том, что при охлаждении до — 23е полностью удалялась
E-фаза.
1,3
35
I"
А-
А'
У
1
Р и с. 13. Кривая напряжение
деформация для растяжения сс-плу-
тония при 32° 177, 78].
Предел прочности при растяжении
42.4 кг/мм?: предел текучести (при оо,02>
25.5 кг/мм?; ш носитсльное удлинение
0.16%: относительное сужение попереч
НОГО сечения 0%; модуль нормальной
упругости 9.8-103 кг/мм*; удельная ра-
бота yn^yroli дефоомации 1.П kclmIcm*-,
твердость по Виккерсу (нагрузка 10 кг)
2в7.
0.002
0.006
Деформации
Было найдено, что пределы текучести при а„_„« колеблются от 21,5
до 32,2 кг/мм", а модуль ударной вязкости — от 0,64 до 3,16 кгем см3.
Причина большого изменения последнего состоит в том, что он зависит от
квадрата предела пропорциональности (который довольно изменчив), со-
гласно выражению s2/2?, гдев—напряжение при пределе пропорциональ-
ности (точка А на рис. 13), a s,H—деформация. Средние прочностные
свойства плутония со степенью чистоты 99,50?о, плотностью 19,50 г смЛ
и твердостью по Виккерсу (с алмазной пирамидой) 270 следующие 178]:
предел прочности при растяжении 43,6 кг/мм2; предел текучести 26 кг/мм";
модуль упругости 9,7-103 кг,ммг и модуль ударной вязкости 0,893—
1,84 кгем/см3. Кривая напряжение — деформация типичного образца по-
казана на рис. 13. По этому графику предел пропорциональности равен
примерно 14,8 кг/мм*.
Шонфельд [1691 нашел, что предел пропорциональности равен
17,6 кг 1мм*. Его значения предела текучести при растяжении были опре-
делены при остаточной деформации 0,2%, поэтому они были одинаковы
с пределами прочности при растяжении, равными 31,6—38,7 кг/мм*. Фак-
тически при некоторых испытаниях разрушение происходило при остаточ-
ной деформации менее 0,2%. Пределы текучести при сжатии были несколько
выше: 35,2—52,8 кг,мм-. Шонфельд проводил испытания при низких тем-
пературах вплоть до температуры жидкого азота, но результаты были не-
убедительны из-за чрезвычайно высокой чувствительности плутония к над-
резу, которая становилась особенно существенной около —40° и приводила
к разрушению вне расчетной длины испытуемого образца.
Значения сужения поперечного сечения и относительного удлинения,
полученные Шонфельдом, всегда были меньше 1"о, причем обычно меньше
0,5%. При температурах ниже 20" полученные им значения по существу были
равны нулю. Гарднер, Блумстср и Джеффрес [77, 781 сообщают, что при
П липюний
541
испытаниях при комнатной температуре относительное удлинение при раз-
рушении было около 0,15%.
Прочность на сдвиг а-плутония при комнатной температуре, вычис-
ленная по результатам испытаний на сжатие, равна примерно 56,2 кг/мм11.
Однако испытания на растяжение образцов с резьбой на зажимах дают зна-
чения прочности на сдвиг, равные 24,6—31,6 кг/мм2 1169J.
ко
300
25U -
Рис. 14. Изменение твердости
плутония в зависимости от тем-
пературы (Reactor Handbook,
Vol. II, Intersciencc Publishers,
Inc.. New York, 19C0).
ZOO -
ISO
WO -
-
—
—¦
a-
•fi
r
WO IS» ZVO 250 300 SbD WO i,hO 500
Тсмпсратура'К
При испытаниях образцов с надрезом Шонфельд, Тейт и Андерсон [169]
получили ударную вязкость 0,2—2,76 кем (боек 6,9 кг, скорость 3,4—
Таблица 14
МИКРОТБЕРДОСТЬ ПРИ КОМНАТНОЙ ТЕМПЬРЛ ГУРЕ
СТАБИЛИЗИРОВАННЫХ АЛЛО! «ЭПИЧЕСКИХ
МОДИФИКАЦИЯ ПЛУТОНИЯа (ПО KPAMEPV)
Модификация
Альфа
Бета
Гамма
Дельта
Твердость по Виккерсу
при нагрузке 25 г.,
кг/мм-
295
100 =
110 =»
40—70 а
Твердость высокотемпературных фаз частично за-
висит от присутствия легирующих элементов, которые
стабилизируют нх при комнатной температуре.
4,8 м/сек). Образцы для испытаний по Шарпи (запил типа замочной сква-
жины) имели размеры 10 X 10 X 50 мм по ASTM, тип В. Механические
свойства плутония таковы, что при более низких температурах его ударная
вязкость приближается к нулю, ио при температурах выше 75° наблюдается
небольшое увеличение ударной вязкости а-фазы.
Крамер и Шонфельд [52] определили твердость нелегированного плу
тония между —100 и +220°. Их данные приведены на рис. 14. Точки, соот-
542 Глава 21
встствующис комнатной и более низкой температурам, получены на при-
боре для измерения микротвердостн Тьюкона с нагрузкой 10 кг, а при по-
вышенных температурах твердость измерялась видоизмененным прибором
Роккелла со стильным шариком диаметром 3,2 мм при нагрузке 30 кг. Все
результаты были переведены в шкалу твердости по Виккерсу 1127J, которые
могут быть выражены в кг/мм'-. Гарднер, Блумстер и Джеффрес [77, 78J
нашли, что твердость по Виккерсу их образцов а-плутония колеблется от
250 до 283 при нагрузке 10 кг и в среднем равна 265.
С помощью относительно небольших .присадок подходящих легирую-
щих элементов при комнатной температуре можно стабилизировать три
высокотемпературные модификации плутония. Крамер 150] измерил микро-
твердость при комнатной температуре таких стабилизированных фаз. Его
средние результаты даны в1 табл. 14 вместе с типичным значением микро-
твердости для нелегированной а-фазы. Необходимо иметь в виду, что твер-
дость стабилизированных фаз до некоторой степени зависит от присутствия
тегирующих элементов.
ХИМИЧЕСКИЕ СВОЙСТВА
Общая часть
Плутонии существует в четырех валентных состояниях: A11), (IV),
(V), (VI). Имеется несколько соединений, например PuS, в которых ва-
лентное состояние плутония равно A1), однако считается, что связь в этих
соединениях главным образом металлическая. Различные валентности плу-
тония возникают вследствие близости электронных энергетических уров-
ней. Электроны с внутренней оболочки 5/ легко переходят па оболочку
валентных электронов. Положение плутония в периодической таблице
спорно из-за сложности его электронной структуры, а также структур
соседних элементов. Однако общепринято, что плутоний является чле-
ном ряда элементов с Г>/-оболочкой, в известной мере аналогичного ряду
редкоземельных элементов с 4/-оболочкон, но элемент, с которого начинается
ряд с 5/-оболочкой, пока неизвестен.
В растворе п кристаллическом состоянии чаще всего встречаются
валентные состояния плутония (III) и (IV). Однако при работе с вод-
ными растворами необходимо принимать меры предосторожности, чтобы
плутоний присутствовал лишь в одном валентном состоянии, так как в рав-
новесии могут сосуществовать все четыре валентных состояния. Валентное
состояние (V) относительно нестабильно, и Pu(V) имеет тенденцию диспро-
порционпровать на Pu(lV) и Pu(Vl). Валентное состояние (VI) характерно
дли сильно окисляющих водных растворов, и ему отвечает ион плутонила
РиО,"; в твердом состоянии были получены лишь немногие соединения
Pu(VI), например PhF6. Такое соединение, как РиОз, не удалось получить,
несмотря на многочисленные попытки, и считается, что оно не существует.
Металлический плутоний легко растворяется в концентрированной соля-
ной кислоте, нодистоводородиой кислоте и хлорной кислоте с выделением
водорода и образованием иона Ри3+. Концентрированные серная и азотная
кислоты с трудом реагируют с металлом, а щелочи, например растворы ед-
кого натра, совсем не реагируют. Разбавленные кислоты растворяют металл,
но при этом остается нерастворимый осадок, который, как считают, состоит
из полимеров гидроокиси плутония или гидратированных окислов. При
повышенных температурах все обычные газы реагируют с металлическим
Плутоний
543
плутонием: окись углерода образует карбиды, двуокись углерода - кар-
биды и окислы, аммиак и азот - нитрид, галогены и галогеповодородные
кислоты — галогеннды, водород — гидрид. При избытке паров воды обра-
зуется РиО2, а при недостатке — смесь РиО2 и гидрида плутония.
Плутонии образует устойчивые соединения со всеми неметаллами, за
исключением редких газов. Большинство простых неорганических соеди-
нений плутония довольно устойчивы по сравнению с аналогичными соеди-
нениями других металлов. Так, в качестве огнеупора для расплавленного
плутония пригодны окислы лишь немногих других металлов, и восстанов-
ление соединении плутония до металла достигается с помощью ограничен-
ного числа сильных восстановителей. Почти все соединения плутония могут
быть переведены в двуокись РиО2 прокаливанием на воздухе при 1000е.
Таблица 15
X \Р \КТЕРИСТИКИ НЕКОТОРЫХ СОЕДИНЕНИИ" ПЛУТОНИЯ
Соединение
PuC
PibC3
PuCl3
PuOCl
PuF3
1'nOF
PuH2
PuN
Pu2O3
РиО»
Pu2S3
I'ub
Внешний ннд и циет
[ Серебристый. металли-
ческий, в виде порош-
ка пирофорен
Серебристый, металли-
ческий, пирофорен
Зеленый
Металлический
Серые металлические
хлопья, пирофорен
Коричневый, пирофорен
Черный, металлический,
окисляется на воздухе
Зеленый, рассыпчатый;
устойчив при высокой
температуре на возду-
хе (хорошо кристалли-
зованный довольно
инертен химически)
Черный
Золотисто-бронзовый
Кристаллическая
11руктура
Кубическая, типа NaCI
Кубическая
Гексаго! ia льная
Тетрагональная
Гексагональная
Тетрагональная
Кубическая, типа CaF2
Кубическая, типа
NaCI
Гексагональная, типа
La2O3
Кубическая, типа CaF2
Две разновидности:
кубическая, типа
Ce2S3, другая не
определена
Кубическая, типа
NaCI
Плот-
пост i.,
13,99
12,70
5,70
8,81
9,32
9,76
—
14,25
—
—
—
10,60
Температура
760
1425
>1635
Разлагается под
давлением
1 am при 870
2250
На воздухе оце-
нивается
>2500; в ва-
кууме разла-
гается при
2250
В табл. 15 дано описание некоторых наиболее известных соединений
плутония. Более полно соединения плутония описаны Кепнигемом |59|,
а также Кацем и Сиборгом [101J. Обзор интерметаллических соединений
сделан Э„иингером [24] (см. табл. 16). Сведения о кристаллической струк-
Таблица 16
КРИСТАЛЛИЧЕСКИЕ СТРУКТ» РЫ II ДАННЫЕ О МИКРОТВЕРДОСТИ ДЛЯ НЕКОТОРЫХ ДВОЙНЫХ СОЕДИПЫ1И11 ПЛЬТОНИЯ [24, 50]
PuAs
PuAu
PuBc13
PuBi
PuBij
PuC
Соединение
PuAg3
Pu3AI
PuAl
PuAl2
PuA13
PuAl4
Тип структуры
Частично упоря-
доченная SrPb3
_
Cu,Mfi
P11AI3
UA14
Кристаллическая решетка
Гексагональная
Тетраюнальпая
Кубическая
Кубическая гранецентри-
рованная
Гексагональная
Ромбическая объемпоцен-
трированная
Размеры элементарной
ичепки, Л
а=12,730
с-9,402
(Раннолс [160])
я—4,499
с=4,538
я-^10,76
(Бочвар и сотр. [9])
я = 7,838
и = 6.10
с=14,47
(Ларсон и сотр. [111])
я = 4,42
fc=6,26
Число фор-
мульных еди-
ниц в элемен-
тарной ячей-
ке
16
1
8
6
4
Простри iu-T вен-
ная группа
Р6
P4/mmm
—
Fd3m
Рбз/mmc
Imma
Вычисленная
плотность,
11,33
13,45
8,06
6,67
6,02
'[ иердлсть
по Виккер-
Су, К2/ММ*
180
125
34A
550
495
400
NaCI
NaZn13
NaCI
NaCI
(Раннолс [160])
Кубическая грапецентри- а =5,855
рованная (Горум [81])
я=10,28
я = 6,35
Кубическая гранецеитри-
рованная
Кубическая гранецен-
трированная
Кубическая гранецентри-
рованкая
4,97
Fm3m
Fm3c
Fm3m
Fm3m
10,39
4,35
11,62
13,6
155
190
565
120
600
К PujC3
u
I Pu6Co
PU3C0
Pu2Co
PuCoj
PuCo3
Pu2CoI7
PuCu2
Pu6Fe
PuFc2
ct-Pu3Ga
P-Pu3Ga
Pu5Ga3
PuGa
Pu(ia2
Pu2C3
U6Mn
Fe,P
Cu2Mg
PuNi3
Th2Ni17
L0Mn
CujMg
1 Частично упорядо-
ченная SrPb3
Частично упорядо-
ченная AuCu3
A IB.
Кубическая объемноцен-
трированная
Тетрагональная объемнп-
центрированная
Ромбическая
Гексагональная
Кубическая граиецентрн-
рооаниая
Ромбоэдрическая
Гекса! ональпая
Тетрагональная объемно-
цеитрирооаиная
Кубическая гранецентри-
рованиая
Тетрагональная
Простая кубическая
Гексагональная
(Захариасен |20G])
а=10,46
е=5,33
я = 3,47О
b= 10,939
(Эллиот, Ларсон [68])
Богатая Ри
я = 7,902
с-3,549
Богатая Со
а-7,763
с=3,648
а 7,081
а=8,325
с—8,104
а=10,404
с=5,355
а = 7,191
а = 4,471
г 4,530
а = 4,505
а = 4,246
( 4,119
I43d
I4/mcm
Cmcm
Р321
Fd3in
R3ni
P63/mmc
I4/mcm
Fd3m
P4/mmm
Pm3m
P6/mmm
12,70
17,00
14,76
14,0
13,35
10,10
17,07
12,53
14,42
14,29
9,77
805
1G5
170
245
G25
420
620
250
200
560
150
325
265
370
Лродолжение табл. 16
Соединение
PuGa3
P»3Ge
Pu2Ge3
PuGe2
PnGe3
PuH2,i,
PuH27
PuH3
PuHg3
Pu3ln
Puln3
PuMg2
PuMn2
Puts
Тип структуры
Ni3Sn
Псевдо А1В2
ThSi2
AuCu3
CaF2
PuH3
AuCu3
Частично упорядо-
ченная AuCu3
CaF,
Cu2Mg
NaCl
Кристаллическая решетка
Размеры элементарной
ячейки, V
Число фор-
мульных еди-
ниц u элемен-
тарной ячей-
Пространствен-
ная группа
Гексагональная
Гексагональная
Тетрагоиальная объемно-
центрированная
Простая кубическая
Кубическая гранецентри-
рованная
Гексагональная
Гексагональная
Кубическая пеевдообъем-
ноиентрированиая
Простая кубическая
Простая кубическая
Кубическая гранецсшрн-
ровашгая
Гексагональная
Кубическая гранецептри-
рооанная
Кубическая !рансцемтри-
рованная
а = 6,30
с --4,54
Псевдоячеика
о = 3,
с-4,
а = 4,
г= 13
^ = 4.
РиН2,„
о 'з
с=6,
,975
198'
102
1,81
,223
,78
76
0 = 3,61
а = 4,703
а=4,007
(Бочвар и сотр. [9|)
¦ 0=7,34
0=13,8
с -9,7
0 = 7,29
а=4,908
P63/mmc
P6/mmm
14/amd
Pm3m
Fm3m
Рбт/ттс
В псевдо-
ячейке
РтЗт
РтЗт
Fm3m
Fd3m
•Fm3m
Вычисленная Твердость
плотность, по Внккср-
9,18
10,06
1A,98
10,07
10,4U
9,61
13,3
9,9
4,83
11,95
14,22
360
405
150
335
145
185
470
58Э
PuNi
PuNi,
PuNi,
PuNL
PuNi,
PuO
Pu2O3
PiiO,
I Til
Cu2Mg
PuNi,
PuNif
CaZru
Th2Nl17
NaCI
La2O3
Мп2Оэ
CaF,
Ромбическая
Кубическая гранецентрп-
рованная
Ромбоэдрическая
Моноклинная
Гексагональная
Гексагональная
Кубическая гранецеитрн-
рооаннан
Гексагональная
Кубическая объемноцен
трированная
Кубическая гранецентри-
рованная
а = 3,59
Ь=Ю,21
с=4,22
(Кромер, Р\ф [57])
Богатая Ри
а = 7,141
Богатая Ni
0 = 7.115
а = 6,22
а=47,4
(Кромер, Олсен [56])
а = 4,87
b = 8,4fi
с=10,27
Р-100,0
(Кромер, Ларсон [55])
Богатая Ри
0=4,872
с=3,980
Богатая Ni
0^4,861
с=3,982
а = 8,29
с=8,01
а=4,96
0=3,841
с_5,958
Ри2О3
а-11,04
а=5,396
16
4
Cmcm
Fd3m
C2/m
PG/шгпш
РЬз/mmc
f-'тЗт
P3"ml
Ia3
Fin3m
12,9
25)
13,1 580
11,8
11,3
10,8
10,3
13,9
11,47
10,2
11,46
485
225
525
500
235
1020
105
Продолжение табл. 16
Соединение
PuOs,
PuP
PuPbg
PuRe2
Pu19Ru
P113R11
PuBRu3
PuRu
PuRu3
PuS
Pu2S3 Pu3S4
PuSi
Pu2SI3
PuSi2
Тнп структуры
MgZn2
NaCl
Вероятно, упоря-
доченная АиСиз
MgZn2
СьС1
Cu2Mg
NaCl
•
Ч13Р4
FeB
Псевдо AIB2
lhSi2
Кристаллическая решетиа
Гексагональная
Кубическая гранецентри-
рованцая
Простая кубическая
Гексагональная
—
—
Простая кубическая
Кубическая гранецентри-
ровапиая
Кубическая гранеиентри-
рованиая
Кубическая объемноцен-
трнроваииая
Ромбическая
Гексагональная
Тетрагональная объемно-
центрнрованная
Размеры 9лементарной
ячейки, А
0 = 5,44
(KoHofieencKiifi [108|)
0=5,664
(Горум [84|)
0=4,808
0=5,396
е=8,729
_
—
0-3,363
0 = 7,476
0=5,536
(Захариасен [207])
0=8,454
(Захариасеи [2081)
а-5,727
&=7,933
с=3,847
Псепдоячейка
0=3,876
c=4,09U
0 = 3,967
с-13,72
Число фор-
мульных еди-
ниц в элемен-
тарной ячей-
ке
4
4
1
4
—
—
1
8
4
10г/з"томоп
Рн,1В атомов
4
'/а
4
Пространствен-
ная группа
Рбз/гптс
Fm3m
РтЗт
Р63/ттс
—
—
—
РтЗт
Fd3m
Fm3m
—
143d
Pbmm
P6/mmm
H^'amd
Вычисленная
ПЛОТНОСТЬ,
19,2
9,87
12,86
18,45
—
—
14,87
14,06
10,60
8.41
10,15
8,77
9,08
Твердость
по Внк-
керсу^
—
235
—
—
160
200
250
210
390
500
—
PuTe
РиЛЪ
P113TI
PuTI3
T| в Pu U
B—70% U)
5 в Pu — U
B5- 7591, U)
PuZn,
Pu2Zn9
PuZn8
Pu2Zn17
Pu6Zr
PuZr2
Л11С113
NaCI
AuCu3
Раэупорядочен-
ная Мц
Cu2Mg
U2Zn17
lUZr,
Простая кубическая
Кубическая грансцептри-
роваппап
Ромбическая (?)
Простая кубическая
Гексагональная
Простая тетрагональная
Простая кубическая (при
нагревании превра-
щается а простую те-
трагональную)
Кубическая грапецентри-
ровацная
Гексагональная
Ромбическая
Гексагональная
а = 4,630
а=6,183
(Горум [84])
а=9,820
(Пул и сотр. [152])
0^4,723
(Бочвар и сотр. [9])
а 3,458
с=5,519
(Бочпар и сотр. [9])
Pu3U
а^=10,57
&=10,76
PuU
o=10,RR4
Богатая Pu
о = 7,760
Богатая Zn
а = 7,747
а= 10,39
Ь = 10,44
с-II, 18
(Бочвар и сотр. [9])
а=5,055
с=3,121
(Уолдрон исотр. [199])|
52 атома
58 атомов
РтЗт
Fm3m
РтЗт
Рбз/ттс
Fd3m
Р6ш2
9,96
10,33
14,5
12,4
17,2
18,95
10,54
16,7
10,13
180
25% U
200
65% U
450
390
410
385
350
550 Глав a Z/
туре и твердости ряда двойных соединений плутония с неметаллами и ме-
таллоидами (а также интерметаллических фаз) приведены п табл. 16. Холли
и сотр. [88] рассматривают термодинамику и диаграмму состояния окислов
плутония.
Исчерпывающее описание аналитической химии плутония дано Мст-
цем 1134J и Метцем и Уотербери 1136].
Электрохимии плутония
Нормальные окислительные потенциалы различных ионов плутония
d I M растворе НС1О4 при 25е выражаются следующим образом [48]:
2,02 —0 98111 —1,161 —0 92!)
ри0 риз+ pu4l РиОг+ PuOj+,
I.U43
-1,(J22
а в 1 М растворе HNO3 при 25—30° так:
2,02 -U,82 —[.10
рис риз+ pu4+ —
-1.04
В перхлоратных растворах ионы плутония почти совершенно не обра-
зуют комплексов. Поэтому различия в потенциалах на приведенных выше
схемах указывают на склонность плутония различных валентных состоя-
нии к образованию комплексов. Например, Ри1* сильнее координируется
с нитрат-ионами, чем плутоний в других валентных состояниях. В присут-
ствии сульфат-ионов четырехвалентное состояние стабилизируется в еще
большей степени вследствие более сильного комплексования Ри4* ионами
so; U4].
Электроосажден ие
Из водных растворов осадить металлический плутонии нельзя, так
как он разлагает воду, при этом на катоде осаждается РиСЬ и выделяется
водорот.. Плутоний был успешно осажден из растворов РиС1я в расплавлен-
ных смесях хлорида бария, хлорида калия и хлорида натрия при темпера-
туре около 800а. Этот метод исследовался как вариант технологии произ-
иодства плутония, когда он впервые появился 1179], но не был использован.
Недавно Влюменталь 181 снова'исследовал этот способ.
КОРРОЗИЯ
Хотя плутоний — реакиионноспособпыи металл, он относительно инер-
тен в сухом воздухе и может храниться в нем. Однако следы влаги сильно
ускоряют коррозию. Продажные осушающие средства эффективны в уда-
лении и задержании влаги из газов в присутствии плутония только при
относительно низких температурах (вблизи комнатной температуры и ниже).
С увеличением температуры приблизительно до 75 такие осушающие сред-
ства, каксплпкагель или окись алюминия, фактически отдают воду плутонию
И, таким образом, ускоряют его коррозию. В связи с этим важно напомнить,
Плутоний 55!
что в результате саыоразогрева плутония за счет тепла, выделяющегося
при его радиоактивном распаде, температура кусков плутония, весящих
несколько сот граммов, становится на 28—56° выше температуры окружаю-
щей среды.
Недавно в обзоре Уобера Ц971 были приведены имеющиеся сведения
о коррозии плутония и некоторых его сплавов при температурах ниже 100°.
Сушка воздуха перхлоратом магнин уменьшает скорость коррозии в интер-
вале температур 55—75" приблизительно в 65 раз.
Было найдено, что легирование плутония цирконием уменьшает ско-
рость коррозии влажным воздухом, но мало влияет на окисление сухим
воздухом. Сплав алюминия с 10 вес."о плутония практически не корроди-
рует во время недельной выдержки в чистом кислороде при 400г. Образую-
щийся слон А1«О3 обнаруживается с трудом, и средняя глубина проник-
новения оценивается равной не более 8 мк 140].
Демпси и Кэй 162], а также Уобер и Райт [40] кратко исследовали пове-
дение плутония при температурах вблизи 400'. Образцы толщиной 0,5 мм
окислялись полностью при 320" немного более чем через I час, при 343°
через 20 мин и при 400 примерно через 6 мин.
ТОКСИЧНОСТЬ И СПОСОБЫ ОБРАЩЕНИЯ С. ПЛУТОНИЕМ
Плутоний из-за своей радиоактивности весьма токсичен. Допустимая
доза плутония для организма человека ниже доз всех остальных радио-
активных элементов. Чрезвычайно большая вредность объясняется тем,
что при вдыхании или заглашвании плутоний концентрируется непосред-
ственно в кроветворных участках костей и может вызнать заболевание даже
через много лет. Плутоний может попадать в организм через раны и ссадины,
путем вдыхания или заглатывания. Однако наиболее опасный путь попада-
ния его в организм—поглощение из легких [П0|. В костях может отложиться
1 10% плутония, захваченного при вдыхании, в зависимости от таких фак-
торов, как величина его частиц и растворимость. Попавший в организм
плутонии выделяется медленно. Скорость выделения такова, что через 50 лет
после попадания в организм остается 80% усвоенного количества 11101.
Максимально допустимым содержанием в организме считается такое
количество, которое может находиться неограниченное время в организме
взрослого человека, не причиняя ему вреда. В настоящее время эта вели-
чина для плутоння-239 установлена равной 0,047 мккюри 11101, что экви-
валентно 0,75 мкг. Физиологическое действие больших доз плутония на
человека рассматривается в обзоре Лангема [НО].
Вследствие потенциальной опасности ручные операции и технологи-
ческие процессы получения плутония должны проводиться в условиях стро-
гой защиты. Обычно это достигается тем, что плутоний помещают в защит-
ные камеры с перчатками или хорошо вентилируемые химические вытяж-
ные шкафы ИЗО, 201]. Опыт показал, что общую опасность загрязнения
можно свести к минимуму, если обращать внимание на немедленную и тща-
тельную очистку от радиоактивности. Методы надзора за загрязнениями,
разработанные в лосаламосской исследовательской лаборатории, обсуж-
даются Шульте и Мейером 11711. Джетт и Коффинберри сформулировали
[971 правила проведения ручных операций в исследованиях и произ-
водстве плутония, предписываемые Отделом дозиметрии в Лос-Аламосе.
Среди исследователей различных лабораторий мира, занимающихся
металлургическими исследованиями, нет полного согласия во взглядах на
552 I\a_aea 21
то, как должна быть организована защита от вредного действии плутония.
В противоположность подходу, принятому в Лос-Аламосе, согласно кото-
рому полностью учитываются знания и большой опыт работающих с плу-
тонием, в Аргоннской национальной лаборатории, Ханфорде и в атомных
центрах Англии (Харуэлл, Олдермастон) больше всего учитывается
фактор недостаточности знаний персонала об этом элементе. Защита осу-
ществляется полным изолированием на все время и всех видов плутония
герметичными ограждениями (защишые камеры с перчатками и т. п.).
В отличие от этого в Лос-Аламосе стараются достигнуть максимальной
чистоты окружающего пространства, обеспечивая доступность плутоние-
вых материалов и оборудования при полной безопасности. Другими сло-
вами, главный принцип лосаламосскон практики состоит в сведении к ми-
нимуму всех накоплений плутония как внутри, так и вне защитных устройств
и в постоянном поддержании по возможности более чистыми от радиоактив-
ных загрязнений всех поверхностей для максимального облегчения доступа
к ним. Такая практика иногда позволяет манипулировать с кусками чистого
металла или сплава в открытом шкафу или даже в открытом виде в хорошо
вентилируемом помещении.
Эти различия рассмотрены Коффинберри и Уолдроном [46, стр. 360—
369], а опыт работы в Лос-Аламосе описан Крамером и Шонфсльдом [53].
Подробности практических приемов Аргоннской лаборатории и Ханфорда
прииедены соответственно в работах Кельмапа и сотр. [103], Уика и То-
маса [205]. Методы работы и защитные устройства, принятые в Англии,
описаны Лордом и Уолдроном J121].
Химические операции призводства плутония в Лос-Аламосе в большей
степени поддаются автоматизации, чем металлургические исследовании.
Они проводятся в герметичных камерах и управляются дистанционно Ц381.
Лосаламосские защитные устройства дли лаборатории аналитической
химии описаны Метцем 1135].
Поскольку обычно плутоний в значительной степени прояачяет только
а-активность (имеющую очень небольшую среднюю длину пробега), защиты
от излучения при работе с плутонием часто не требуется. Однако ест плу-
тоний получил большую дозу облучения в реакторе, чем необходимо для
получения Ри239, то в нем могут содержаться изотопы с высокой ^--актив-
ностью. Вообще сильно облученный плутоний нельзя обрабатывать в горя-
чих камерах, предназначенных для работы с облученным ураном, так как
такие камеры недостаточно герметичны и может происходить утечка аэро-
золей с а-акгивностью. Поэтому для работы с материалами, подобными облу-
ченному плутонию, требуются специальные горячие камеры, защищающие
от а-, р- и у-акгивности. Конструкции и применение таких горячих камер
описаны в США Лилиснталем [1191, Петерсоном, Томасом и Грином [150]
и Гертцем 1821, в Англии Броупом и Хайэмом 111] и другими исследовате-
лями 1202]. Реш обсуждает 1159] защиту от рентгеновых и -у-излучений уме-
ренной интенсивности, испускаемых плутонием, подвергнутым облучению
промежуточными дозами нейтронов. Такие дозы достаточны для значитель-
ною увеличения содержания высших изотопов плутония, но недостаточны
для образования заметных количеств продуктов деления. Сплавы, соедине-
ния и растворы, содержащие плутоний вместе с легкими элементами, на-
пример бериллием [186], могут довольно интенсивно испускать нейтроны
по реакции (а, п), создавая этим опасность для здоровья работающего пер-
сонала.
Последнее, но не менее важное соображение о безопасной работе с плу-
тонием — это предупреждение образования критической ядерной массы.
Плутоний 553
Эта опасность появляется вследствие возрастания скорости размножения
нейтронов при увеличении массы плутониевого узла или тесном сближении
с материалами, замедляющими или отражающими нейтроны. Предупрежде-
ние этап опасности лежит на обязанности ученых, занимающихся ядерной
физикой, которые должны предписывать правила надлежащего распреде-
ления в пространстве плутонийсодержащих материалов во время хранения
и работы. Швеннезен [172] и Кетцлах [104] обсуждают основы проектиро-
вания с обеспечением ядерной безопасности на заводах по извлечению плу-
тония из облученного урана, а Форд и Уолфорд 173] описывают экспери-
менты по критическим сборкам в Даунри. проведенные с целью установле-
ния совершенно безопасных условий работы на заводе, перерабатывающем
делящийся материал, и создания безопасного проекта. Очевидно, что из
соображений критической массы ограничивается размер и может опреде-
ляться форма любого куска плутония, который используется в операциях
плавления и изготовления изделий.
СПЛАВЫ
Диаграммы состояния
Большая часть исследований, проведенных с целью установления диа-
грамм состояния плутониевых сплавов, пригодна только для ориентиро-
вочных выводов. С получением дополнительных данных все диаграммы
будут изменяться и уточняться. Ниже следует перечень некоторых компо-
нентов двойных систем по сплавам плутония, для которых полностью или
частично построены диаграммы состояния.
Ртуть
Рутений
Свинец
Тантал
Тории
Уран
Хром
Церий
Цинк
Цирконии
В приложении к этой главе даны диаграммы состояния для некоторых
из этих двойных систем*.
Шопфельд и сотр. [37, 170], Уолдрон и сотр. [41, 199], а также Боч-
вар и сотр. [91 приводят сведения о сплавах плутония с барием, гафнием,
германием, золотом, индием, калием, кремнием, мышьяком, натрием, неоди-
мом, нептунием, оловом, празеодимом, рением, стронцием, таллием и тита-
ном, но они слишком незначительны, чтобы по ним можно было построить
диаграммы состояния хотя бы частично.
Перечисленные выше диаграммы состояния описаны теми же авторами,
а также Конобеевским [108]; Уэншем и Уайтом (плутоний — никель)
[2031; Малфордом и Старди ^плутоний — водород) 11411; Мардоном и сотр.
(плутоний — железо) [131]; Пулом, Уильямсоном и Марплсом (плутонии —
Алюминий
Бериллий
Ванадий
Висмут
Водород
Вольфрам
Железо
Кальций
Кислород
Кобальт
Литий
Магний
Марганец
.Vcflb
Молибден
Никель
Ниобий
Осмий
* Некоторые подробности по диаграммам состояния и кристаллическим струк-
турам см. в книге В. И. Кутанцепа «Сплавы тории, ураиа и плутония», Атомиздат,
19G2 — При к. ред.
.554 Глава 21
тории) [1521; Эллингером, Эллиотом и Крамером (плутоний уран) IC51:
Эллингером, Лендом и Крамером (плутоний — церий) IC6]; Крамером,
Эллингером и Лэндом (плутоний — цинк) 1511; Ринхаммером, Эттсром и
Джонсом (плутоний — медь) [158]. Эллиотом и Ларсеном [25] определены
фазовые равновесия в области б'-фазы для ряда двойных систем.
Сплавляемость
По сплавляемости плутоний напоминает и уран и редкоземельные ме-
таллы, хотя во 'многих отношениях она заметно отличается от обоих слу-
чаев. Можно сказать, что плутонии занимает промежуточное положение
и, кроме того, что сходство сплавов плутонии со сплавами редкоземельных
металлов больше, чем со сплавами урана. Теоретические соображения
о поведении плутония в сплавах рассматриваются Уобером 11961. Сплав-
ляемость плутония удобнее всего охарактеризовать с помощью немногих
общих положении о взаимодействии плутония с металлами различных групп
периодической таблицы элементов [9).
Прежде всего рассмотрим сплавлиемость плутония с элементами главных
подгрупп различных групп периодической таблицы. Хотя экспериментально
исследовано лишь взаимодействие с литием, натрием и калием, по-видимому,
плутоний в расплавленном и твердом состояниях полностью не смешивается
со всеми щелочными металлами. Такой же вывод можно сделать о щелочно-
земельных металлах — кальции, стронции и барии, но в расплавленном
магнии растворяется до 15 ат. 96 плутония. Если в системе плутония с бе-
риллием имеется область несмешиваемости в расплавленном состоянии (как
и в системе с ураном), то она очень узкая и лежит рядом с бога гой бериллием
областью соединения РиВе13. При реакции в твердом состоянии с магнием
плутоний образует два соединения [37, 170] (см. табл. 1С).
С редкоземельными металлами плутоний взаимодействует следующим
образом: с лантаном имеется большая область несмешиваемости в расплав-
ленном состоянии, и по аналогии с системами, образованными ураном, можно
предполагать, что он так же будет вести себя со скандием и иттрием. Однако
было найдено, что плутоний полностью смешивается в расплавленном со-
стоянии со всеми исследованными (церий, празеодим, неодим) редкоземель-
ными металлами (/-переход) и также полностью смешивается в расплавлен-
ном состоянии со всеми изученными актиноидными металлами (тории, уран,
нептунии).'Действительно, насколько известно, плутоний полностью сме-
шивается в расплавленном состоянии со всеми металлами, помимо указан-
ных выше и серебра, чю обсуждается ниже.
Найдено, что плутоний (особенно 6-фаза) образует довольно широкие
области твердых растворов с редкоземельными металлами, но между ними
не образуется соединений. Однако с актиноидами образуется одно соедине
ние (с торием) и два промежуточных твердых раствора с широкой областью
гомогенности (с ураном) [65] (см. табл. 16). к-Плутонип полностью рас-
творим в твердом состоянии в v-уране и \-нептунин [199]. Из лантаноидов
и актиноидов лишь добавки нептуния снижают температуру плавления
плутония более чем на 30°.
Переходные металлы с rf-электронами IVa, Va и Via групп образуют толь-
ко т,на известных соединения с плутонием и очень незначительно снижают
его температуру плавления в эвтектической точке или даже не снижают.
Оба соединения образуются в системе плутонии — цирконий при реакции
в твердом состоянии (см. табл. 16). Титан, цирконий и гафний, так же как
и редкоземельные металлы и металлы Пб и 1116 групп, образуют значи-
Плутонии
тельные области растворимое i и в б-плутопии. Растворимости гитана
и гафния в е-фазе порядка 30ат.пи 11991. Р-Цирконий образует непре-
рывный ряд твердых растворов с е-плутонием.
В двойных сплавах плутония с переходными элементами Va, Via, Vila
и Villa групп области растворимости в твердом состоянии очень ограниченны.
Как отмечает Конобеевский 19, 108], в этих системах существует тенден-
ция к увеличению числа соединений с увеличением числа rf-элсктроиов в пе-
реходном металле. Так. ванадий, ниобии, тантал, хром, молибден и воль-
фрам не образуют соединений с плутонием; марганец и репин образуют по
одному соединении!; железо, рутений и осмии образуют соошетственно два,
пять и че[ыре соединения, а кобальт и никель- со шесть соединений.
Другая довольно систематическая тенденция, преобладающая в этих систе-
мах,— ^то возрастающее снижение температуры эвтектики в плуюниевом
углу диаграммы состояния с увеличением числа d-электронов в переходном
металле (исключением является то обстоятельство, что минимальная тем-
пература эвтектики находится в системе плутоний — кобальт, а не плуто-
ний"— никель). Таким образом, как упоминалось выше, переходные ме-
таллы V п VI групп способствуют небольшому эвтектическому понижению
температуры или вообще не приводят к понижению температуры; марга-
нец, рутений и осмий образуют эшектики на 115 145 ниже температуры
плавления плуюния, равной 640 ; железо, кобальт и никель образуют эв-
тектики при температурах на 175—232 ниже 640°.
В системах плутоний железо и пл\ юний — кобальт встречается за-
мечательное явление — ретроградное плавление 125, 1311. Так, всовершен-
но твердом сплаве с 2 ат. % железа в состоянии е-фазы при 440 образуется
при охлаждении до 400" около ' 5 жидкости (т. е. жидкость плюс прибли-
зительно 80% по объему 6-фазы). При 400" сплав F Pu6Fe) снова стано-
вится твердым. Аналогичное положение наблюдается в системе плутоний —
кобальт, за исключением того, что в этом случае температуры несколько
ниже и при вторичном затвердевании образуются 6-фаза и Ри3Со (а не
6 +Ри,Со) [25].
Тенденция к образованию эвгекшческих видов диаграмм состояния
сохраняется, но в меньшей степени, в двойных системах плутония с ме-
таллами побочной подгруппы I группы. Так, богатая плутонием эвтекти-
ческая смесь с медью плавится при 625D |9|, а эвтектика плутоний — золото
имеет состав и температуру плавления, близкие к значениям для чистого
плуюния. Однако, как упоминалось выше, серебро не смешивается с плу-
тонием в расплавленном состоянии. Предварительные исследования систе-
мы плутонии серебро показывают, что растворимость серебра в расплав-
ленном плутонии незначительна, по максимальная растворимость плуто-
ния в расплавленном серебре составляет около 35 ат."о. Серебро образует
с плутонием одно или несколько соединении, как медь и золото (см. табл. 16).
Насколько известно, плутоний образует соединения со всеми металлами
и металлоидами побочных подгрупп. Следует отмстить также, что темпе-
ратуры плавления этих соединений значительно выше, чем температуры
плавления компонентов соответствующих двойных систем. Поэтому кривые
ликвидней имеют резкий подъем вблизи краев диаграмм состояния с малым
снижением температуры плавления в эвтектике или вообше без него. Это ха-
рактерно для всех сплавов с участием лантаноидных и актиноидных
металлов.
Растворимость в твердом состоянии в двойных сплавах плутония с ме-
таллами побочных подгрупп очень ограниченна; исключением являются
твердые растворы 6- и е-плутония с металлами По и 1116 групп (включая
556 Глава 21
алюминий). Твердые растворы, содержащие несколько атомных процентов
второго компонента, экспериментально установлены для цинка, алюминия
и большинства элементов II16 группы [9]. Большинство твердых раство-
ров fi-плутония (включая также твердые растворы с редкоземельными
металлами и металлами IVa группы) устойчивы при комнатной тем-
пературе или могут быть удержаны при комнатной температуре быстрым
охлаждением из областей их устойчивости при высоких температурах.
Однако было обнаружено, что задержать закалкой при комнатной
температуре твердые растворы r-фазы нельзя. Эллиот и Жнейднер [67]
исследовали зависимость устойчивости ряда 6-твердых растворов (и их пове-
дение при превращении) прн высоком давлении.
Области значительной растворимости в твердом состоянии a-, f>- , у-
и б'-нлу гония встречаются гораздо реже, чем у 6- и е-модификаций. Обнару-
живаемая растворимость в к-плутонии описана только для нептуния [1991.
Экспериментальные данные о возможной растноримости в твердом состоя-
нии Р- и \>-фаз трудно интерпретировать. Во многих случаях задержания E-
нли \'-фаз при комнатной температуре не ясно, является ли задержанная
фаза равновесной при высокой температуре или это пересыщенный твердый
раствор, образовавшийся в результате мартенситного превращения 6-твер-
дого раствора. Такие фазы наблюдались в сплавах плутония с алюминием,
магнием, титаном, торием, ураном и цирконием. Из твердых растворов 6'-
плутония известен лишь твердый раствор с титаном, который растворим
в количестве несколько больше 1,5 ат. 9о [25].
Интерметаллические соединения
Плутоний так же, как лантаноиды и другие актиноидные металлы, не
образует интерметаллических соединений типа фаз Юм-Розсри. Подобно
переходным металлам с /-электронами, он образует значительное число фаз
Фриауфа — Лавеса (МХ2), особенно кубических, типа MgCu2. На многих
диаграммах состояния двойных систем плутония соединения типа РиХг
наиболее устойчивы из всех промежуточных фаз в том смысле, что они имеют
наиболее высокую температуру плавления и поэтому плавятся конгруэнтно
(диаграмма с открытым максимумом). Другие промежуточные фазы перн-
тектически разлагаются при нагревании.
Плутоний с другими металлами образует также ряд структур ninaCaZns.
Кромер и сотр. [55 -57, 111] почти единственные, кто занимался рентге-
нографическим исследованием монокристаллов соединений плутония. Они
установили, что структуры многих фаз, имеющих промежуточные составы
между РиХ2 и РиХ5 (например. PuNi4), состоят из элементов этих структур,
сопранных в чередующейся последовательности. Они нашли также, что
структуры аналогичных соединений церия имеют по существу такие же
свойства [54, 561.
Несравненно большее число определений структуры интерметалличе-
скнх соединений плутония выполнено Эллингером, применявшим в своей
работе метод порошка. Данные о кристаллической структуре этих и других
двойных соединений плутония сообщались Эллингером [24], Коффинберри
и Эллингером 120], Коффинберри и Уолдроном [46, стр. 388—4031, Ран-
нолсом и Ваучером [1С0, 162], а также Бочваром и сотр. 19]. В табл. 10
приведены избранные данные о кристаллической структуре соединений плу-
тония и данные о микротвердости этих соединений, измеренной Крамером
[50]. За исключением особо оговоренных случаев, в табл. 1С даны пара-
метры элементарных ячеек, определенные Эллингером [24].
Плутоний 557
Применение в реакторах
Интерес к сплавам плутония вызван главным образом возможностью
использования их как горючего в ядерных реакторах. Такое горючее может
быть двух типов: жидкое и твердое, f 1дея горючего в виде жидкого плуто-
ниевого сплава была предложена еще в 1946 г. В первых же исследованиях
сплавов плутония пытались найти умеренно разбавленные легкоплавкие
сплавы, т. е. растворы плутония в легкоплавких металлах, которые ие были
бы настолько разбавлены, что для достижения сверхкритического размно-
жения нейтронов в реакторе потребовалась бы слишком большая масса
сплава 122]. Однако, как указывалось выше, с большинством других метал-
лов и особенное такими легкоплавкими металлами, как ртуть, галлий, олово,
свинец и другие, плутоний образует тугоплавкие соединения, поэтому рас-
творимость его в этих металлах при низких температурах очень ограниченна.
Найдено, что, по-видимому, только магний и висмут могут растворять нуж-
ные количества плутония при достаточно низких температурах [22, 7GI.
Расплавленный магний растворяет при температуре эвтектики E52^) 15 ат. %
плутония, а максимальная растворимость плутония в расплавленном
висмуте при 700 составляет почти 8 ат. %, т. е. более чем вдвое превышает
содержание урана при той же температуре. Возможности создания горю-
чего на основе плутониммагнисвых сплавов было уделено мало внимания,
но интерес к плутонию, растворенному в расплавленном висмуте, виден
из работ Туринского [28], Майлса н сотр. [1371, а также Фроста и сотр.
1761.
В качестве жидкого горючего для реактора LAMPRE в Лос-Аламосе
предусматривается применение легкоплавких эвтектических сплавов плу-
тония с железом, кобальтом и никелем [31, 45, 80, 86, 105]. Однако, по-
скольку эти двойные сплавы содержат больше плутония, чем это желатель-
но в оольшинстве случаев для реакторов, были предприняты поиски треть-
его компонента — разбавителя, который не повышал бы заметно темпера-
туру плавления. Им оказался церий. Поэтому в Лос-Аламосе и Лаборато-
рии Маунда («Монсанто кемикл компани») в Майамисберге (штат Огайо)
были проведены исследования диаграмм состояния тройных систем плуто-
ния и церия с кобальтом, никелем или медью |18, 19]. Частичное исследова-
ние системы плутоний — церий — кобальт было выполнено в Харуэлле
1200].
В предварительных исследовапиях тронных систем с добавками метал-
лов, понижающих температуру плавления (железо, кобальт, никель или
медь), было найдено, что сплавы плутоний — церим — медь могут иметь
достаточно низкую температуру плавления при не очень высоком содержа-
нии плутония 118, 451, но сплавы плутоний — церий — железо достаточно
легкоплавки только тогда, когда содержание плутония в них выше, чем
желательно для применения в реакторах. Поэтому сплавы плутоний —
церий — медь изучались, а исследование системы плутоний —церий —
железо было прекращено.
По причинам, обсуждаемым ниже, некоторые конструктиры реакторов
интересовались жидким горючим из тронных сплавов, содержащих в ка-
честве разбавителя уран (вместо церия), плутоний и металл, понижающий
температуру плавления. Был исследован ряд тройных сплавов плутония,
урана и третьего металла, однако оказалось, что они слишком тугоплавки,
и нет такого материала для контейнера, чтобы их можно было поддерживать
в нем в расплавленном состоянии [44]. По этой причине тройные сплавы
с ураном далее не исследовались.
55ti Г л два 21
Обычно считается, что жидкое горючее менее подвержено радиацион-
ному повреждению, чем твердое ядерное горючее, и из него проще удалить
продукты деления. Однако пока не доказано экспериментально, чтосплавы
жидкого горючего совершенно свободны от всех типов радиационного по-
вреждения.
Сплавы, используемые или предполагаемые к использованию в реакто-
рах как твердое горючее, классифицируются по содержанию плутонии на два
типа: 1) очень разбавленные и 2) умеренно концентрированные. Фактически
в ядерных реакторах используются, за исключением нескольких крити-
ческих сборок и экспериментальных реакторов малой мощносш 14, 81,
100, 117, 184], только сплавы алюминий — плутоний II, 39, 42, 74, 120,
161, 164, 184, 204|. Сплавы этого типа обычно содержат 2—20 вес."о @,2—
2,8 ат. %) плутония и принадлежат к классу сплавов, очень разбавленных
горючим. Они пригодны для тепловых реакторов, но непригодны для реак-
торов на быстрых нейтронах, так как из-за малого содержания плутония
требуется очень большая критическая масса. В этих сплавах плутоний
находи 1ся в виде соединения РпА14, распределенного в матрице из очень
чистого алюминия, что придает им хорошую теплопроводность 180, 86].
Такие сплавы показали превосходную устойчивость против действия облу-
чения. Было достигнуто ныгорание 60% плутония с незначительным уве^
лпчением твердости и объема (разбуханием) 1161].
Можно ожидать, что из других очень разбавленных сплавов свой-
ствами, аналогичными свойствам сплавов алюминий — плутоний, будут
обладать сплавы медь- плутонии (Pii2Cun в медной матрице) и железо —
плутоний (l'uFe2 r железной матрице). Возможность использования этих
сплаков обсуждалась Тентом [184]. В качестве горючего рассматривались
и другие разбавленные плутонием сплавы, состоящие из твердых растворов
его ви-уране, «-тории, а-цирконии и ¦у-церии (кубическая фаза при комнат-
ной температуре) |17|. Однако поскольку эти фазы могут растворять более
10 ат. % плутония, правильнее рассмотреть их ниже, в категории умеренно
концентрированных твердых сплавов.
Под «умеренно концентрированными» сплавами подразумеваются спла-
вы, содержащие 5—50 ат. % плутония. Низшие составы в этой области от-
вечают однофазным сплавам, которые можно получить, используя металлы,
образующие твердые растворы- Два таких сплава па основе твердого рас-
твора были испытаны на устойчивость против облучения со следующими
результатами: сплав, содержавший 15 всс.% плутония ва-тории, оказался
довольно устойчивым [34, 198], а все твердые растворы плутония в а-уране
(ромбическая структура) слабо сопротивлялись радиационному поврежде-
нию 134, 106, 1981. В общем в двойных сплавах при концентрациях плуто-
ния более 10—12 ат."о появляются нежелательные промежуточные фазы,
но было найдено, что однофазный сплав циркония с 40 ат. % плутония удер-
живает 6-фазу (кубической структуры) при комнатной температуре [198].
Испытание этого сплава показало его исключительно высокую устойчивость
против действия облучения [34, 1 98].
При облучении урана-238 нейтронами образуется плутоний-239 (см.
о котельных реакциях на стр. 512). Вводя в нейтронный поток реактора,
загруженного плутонием, уран-238, можно осуществить «воспроизводство»
нового плутония-239. Поэтому если к горючему, содержащему плуто-
ний, добавить уран, то скорость снижения реактивности уменьшится
вследствие воспроизводства нового плутония, замещающего часть сго-
ревшего. По этим причинам многим конструкторам энергетических реак-
торов кажется заманчивой идея создания горючего из сплава урана с илу-
Плутоний
55<>
тонием. Наибольший интерес представляют сплавы, содержащие 20—40 ат.%
плутония. Однако такие сплавы состоят целиком или большей частью из
Е-фазы системы уран - плутонии, имеющем такие неблагоприятные метал-
лургические свойства, как большая хрупкость, малая прочность, пиро-
форное гь, низкая коррозионная стойкость и, наконец, плохая устойчи-
вость против облучения 116, 30, 65, 102J. Хоти для преодоления этих вред-
ных особенностей, помимо легирования, по-видимому, существуют и другие
средства [16, 301, было предпринято широкое исследование тройных сплавов
урана, плутония и третьего элемента с иелью подавления образования ?-
фазы [30, 102, 1991. Наиболее успешно эта цель была достшнуга добав-
ками молибдена к урану и плутонию, хотя предполагается, что и другие
элементы (например, рутений) [30, 102] также эффективно помогают молиб-
дену подавить С;-фазу, увеличивая термодинамическую устончивость твер-
дых растворов \-урана/Е-илутония с кубической объемноцентрировапиой
структурой [1841. Частично фазовые равновесия в системе уран — плуто-
нии — молибден описаны Уолдроном и сотр. 1190].
В опытах с умеренным выгоранием сплавы уран — плутонии — мо-
либден показали довольно хорошую устойчивость против облучения 134,
106, 1981. Предполагается, что существенным фактором, способствующим
превосходной устойчивости к радиационным повреждениям, как и в случае
других кубических фаз, является изотропная кристаллическая структура
кубической объемноцептрированноп фазы (в отличие от анизотропного а-
урапа). Поскольку одним из основных продуктов деления плутоиия-239
является молибден, у металлургов Аргоннской национальной лаборатории
возникла идея стабилизировать фазу ¦уУРан/Е"п-лУТ0МИ11 посредством так
называемого сплава уран — плутоний - - «фиссиум», где «фиесиум»— смесь
продуктов деления, в которых преобладают молибден, рутений и другие эле-
менты, стабилизирующие эту фазу. Такой сплав имеет известные преиму-
щества в отношении работы в реакторе и регенерации горючего [26, 38, 72].
Кроме того, сплавы этого типа имеют лучшую устойчивость против облуче-
ния, чем сплавы уран — плутоний — молибден 130, 102, 106]. В табл. 17
приведен состав типичного сплава уран — плутоний — «фиссиум».
СОСТАВ ТИПИЧНОГО
шитонип -
Элемент
Рутений
Молибден
1 Ылладнй
Родий
Цирьонин
«Фиссиум»
Плутонии
Уран
Таблица 17
СШ14ВЛ УРАН-
¦ФИССИУМ»
Содержание
оес.% ,
4,3
2,8
2,5
0,7
0,5
10,8
20,0
R9.2
8,79
6,07
4,86
1,41
1,14
22,27
17,37
560^ Глав а 2?
МЕТАЛЛОГРАФИЯ
Приготовление образцов
Подробное описание методов, применяемых в металлографии плутония,
дано Крамером и Шонфельдом 153J. В основном они подобны методам, при-
меняемым для более обычных металлов. Однако из-за высокой токсичности
плутония необходимо применять сложные приемы, чтобы воспрепятство-
вать контакту оператора с образцом. Поэтому значительное внимание уде-
ляется надлежащей вентиляции, укрытию плутония в камерах и его хра-
нению. В некоторых лабораториях всю работу по приготовлению образцов
для металлографического исследования и исследование плутония и его
сплавов проводят в герметичных металлических камерах с перчатками, за-
полненными очень чистой инертной атмосферой. В других лабораториях
в относительно простых камерах с перчатками проводят только те опера-
ции, при которых получается тонкоизмельченный материал, а для более
чистых операций — монтажа шлифов, электрополировки и электротрав-
ления — используются хорошо вентилируемые вытяжные шкафы.
При приготовлении образцов для металлографического исследования
необходимы операции грубого шлифования, тонкого шлифования и меха-
нического полирования. Образцы плутония или богатых плутонием сплавов,
предназначенные для микроскопичесиого исследовании, обычно подвер-
гают электролитическим операциям полирования и травления. Фазы
и сплавы, особенно плохо поддающиеся электролитическому травлению,
недавно с превосходными результатами были подвергнуты катодному трав-
лению [931. Для многих бедных плутонием сплавов вполне применимо обыч-
ное химическое травление.
В случае чистого плутония и большинства богатых плутонием сплавов
успешные результаты дает следующий метод. Образец грубо шлифуют кар-
борундовой бумагой №№ 320 и 600, наждачной бумагой З'/О и 4/0 и затем
подвергают первому полированию бильярдным сукном с окисью алюминия
F00 зерен) или «микротканью» с алмазным порошком A5л!к). Окончатель-
ное полирование выполняют на «микротканн», ^'0КИСЬ1° алюминия или
алмазным порошком A мк). Полировальные круги вращаются со ско-
ростью 125 или 250 об, мин; для смазки и смывания абразива используется
четыреххлорпстый углерод. После этого образец подвергают электролити-
ческому травлению. Если исследуются аллотропические а- и В-моднфики-
ции или их смесь, то электролит содержит 7 частей тетрафосфорной кисло-
ты, ЗС частей воды и 57 частей 2-этоксиэтанола. Он применяется при комнат-
ной температуре и напряжении 5 — 12 в. Такой же электролит, но в соот-
ношении 12 : 33 : 55 хорошо выявляет 6-фазу, а в соотношении 2:3:5
при напряжении 12 в пригоден для продолжительного травления мягких
аллотропических модификаций с целью снятия деформированных слоев.
Если в течение 3 мин повысить напряжение до 16 в, то получается аноди-
рованная поверхность, оптически активная в поляризованном свете. Обыч-
но, за исключением специальных случаев анодирования или снятия дефор-
мированного слоя, время травления составляет 10—45 сек. После электро-
литического травления плутоний довольно пассивен по отношению к воде,
и его можно промывать дистиллированной водой и сушить теплым воздухом.
Монтирование образцов
Поскольку а-плутоний переходит при 122° в 6-фазу, применение обыч-
ных материалов, плавящихся при 120—150°, для заливки в обойму плуто-
¦>'
V-\ ¦•¦-¦'-.
¦:7*Л;
л
-V
л
Рис. 15а. Микрофото-
графия ct-плутоння зон-
иой плавки.X 100.
Электролитическое травле-
ние. Снимок сделяи в свет-
лим ноле (Э. М. Крамер).
Р и с. 15fi Микрофото-
графия а-плутоння вы-
сокой степени чистоты.
Х125.
Электролитическое травле-
ние. Снимок сделан в
поляризованном свете
(К.О. Маттьюс).
Р и с. 15в. Микрофото-
графия а-плутония зон-
нон плавки [93].X 250.
Травление катодной бом-
бардировкой. Снимок сде-
лай в светлом поле (К. Им-
лей).
P и с. 15г. Микрофото-
графия сплава (i-илуто-
ния с 2,5 ат.% алюми-
ния и примесями, час-
тично выявляющими
границы зерен. Х250.
Электролитическое травле-
ние. Снимок сдрлан в снет-
лом поле (Э. №. Крамер).
Р и с. 15д. Микрофото-
графия сплава р-плуто-
ния с 10 ат.% урана.
X 250.
Электролитическое травле-
ние Снимок сделан в по-
ляризованном свете (Э. М.
Кр-шср).
Рис. 15е. Микрофото-
графия сплана р-плуто-
ния с 5 ат.°л титана [931.
ХЗОО.
Травление катодной бом-
бардировкой. Снимок сде-
лан в светлом поле (К. Им-
лсй).
36 Заказ № 23В
V
Р и с. 15ж. Микрофото-
графия четыречкомпо-
нентного сплава плуто-
ния, содержащего смесь
а- и у-фаз и неидентифи-
цированные включения.
100.
Электролитические травле-
ние. Снимок сделан в свет-
лом ноле (У. М. Крамер).
Рис. 15з. Микрофото-
графии четырехкомно-
нентного сплава плуто-
ния, содержащего смесь
а и у-фаз и неиденти-
фицированные включе-
ния. <250.
Электролитическое Травле-
ние. Снимок сделан н по-
ляризованном свете (Э. М.
Крамер).
Рис. 15и. Микрофото-
графия сплава 6-гыуто-
Ш1Я.Х500-
Границы зерен очерчены
включениями окислов.
Электролитическое трав-
ление. Снимок с дел л н и
светлом поле (Дэк. К.
Кларк).
Рис. 15к. Микрофото-
графия ft-плутония.
Х200.
Электролитическое трипле
ннс- Снимок сделан в по-
лнрнзованном свете (К. О.
Маттьюс).
Рис. 15л. Микроавто-
радиограмма сплава алю-
миния с 1 ат. % плуто-
ния. X 25.
Светлые участки Рп АЦ;
темнля матрица — чистый
алюминии (К. I'. I и и ими.
Плутоний 563
ния и многих богатых плутонием сплавов дает неудовлетворительные
результаты. Для заливки используются смолы, полимеризующиеся при
комнатной или немного более высокой температуре.
Авторадиография
Для выяснения распределения в сплавах богатых плутонием фаз и раз-
личения промежуточных фаз по содержанию в них плутония полезно при-
менять автомнкрорадиографпю. Было найдено, что подходящую эмульсию
имеют спектрографические пластинки «кодак» типа VO. Необходимо, чтобы
при экспозиции образец соприкасался с эмульсией, которая всегда
загрязняется. Поэтому при проявлении пластинок следует учитывать, что
к их поверхности может прилипнуть значительное количество а-активного
материала. После проявления пластинки можно легко спроектировать изо-
бражение пртт заданном увеличении для получения позитива на ортохрома-
тическую пленку, а загрязненную пластинку можно уничтожить. Контакт-
ные отпечатки с позитивной пленки дают истинную репродукцию авторадио-
микрографин при подходящем увеличении.
Результаты металлографических исследовании
На рис. 15а — 15к приводятся микрофотографии шлифов плутония
и плутониевых сплавов, показывающие микроструктуру а-, |3-, у- и 6-фаз.
Сравниваются результаты электролитического и катодного травления. Эти
результаты показывают, что после электролитического травления в свет-
лом поле не выявляются границы зерен различных аллотропических моди-
фикации, если только на них не выделились значительные количества про-
межуточных фаз (или примесей) или сильно не окислилась поверхность, под-
вергнутая травлению. Однако травление катодной бомбардировкой 193]
частично выявляет границы зерен, и они четко различаются в поляризо-
ванном свете, если электролитическое травление проведено в строго опреде-
ленных условиях (см. выше).
На рис. 15л дана микроавторадиограмма плутонийалюминиевого
сплава, показывающая дендриты РиА14 в матрице из очень чнетоги
алюминия.
СПОСОБЫ ОБРАБОТКИ ПЛУТОНИЯ
Литейная практика
Плавка и отливка плутония осложняются высокой реакционной спо-
собностью расплавленного металла. Чтобы избежать реакции с воздухом,
плутоний и богатые плутонием сплавы обычно плавят в высоковакуумных
печах. Условия плавки и литья бедных плутонием сплавов определяются ха-
рактеристиками основного компонента сплава. Алюминиевые сплавы, со-
держащие до 20 вес.со плутония, были получены в тигельной печи, которая
помещалась в камеру с перчатками, заполненную аргоном. Сначала пла-
вился алюминий, а затем при интенсивном перемешивании расплава добав-
лялись небольшие куски плутония [1201. Недавно было найдено, что такую
операцию плавки можно проводить в камере с перчатками, заполненной
воздухом [2041.
36*
564 Г л ал а 21
В ряде лабораторий успешно применяется метод дуговой плавки на
охлаждаемом поду. Смесь аргона и гелия, применяемая в качестве защитной
атмосферы, обычно очищают с помощью газопоглотителя, например цир-
кония. При дуговой плавке отпадает необходимость подбора подходящего
материала для тигля. Ввиду сильной восстановительной способности плу-
тония в качестве материала контейнеров для расплавленного металла при-
годны только более устойчивые окислы, карбиды, нитриды, бориды и сили-
циды. Обычно тигли для расплавленного плутония, нагреваемого при тем-
пературах не выше 1200°, изготовляют из высокообожженных окиси маг-
ния и окиси кальция. При этом заметной реакции между тиглем н распла-
вом не наблюдается. Если время плавки ограничено и допускается значи-
тельное загрязнение углеродом, то можно использовать графитовые тигли.
Покрытие графита фторидами магния или кальция расширяет возможность
применения таких тиглей. Для более высоких температур, приближающихся
к 1500", довольно успешно использовались тигли из двуокиси тория.
В качестве материалов для тиглей применялись также некоторые туго-
плавкие металлы. Меньше всего реагирует с плутонием вольфрам, но из него
трудно изготовлять сосуды подходящей формы, имеющие настолько малую
пористость, чтобы они не впитывали плутоний. Широко исследовалось при-
менение танталовых тиглей, которые пригодны для расплавлешгого плуто-
ния, если максимальная температура равна примерно 1000°.
Относительно низкая температура плавления, большая жидкотеку-
честь и высокая плотность плутония, а также малое изменение объема при
затвердевании 1107] — весьма благоприятные литейные свойства. Однако
большие положительные и отрицательные изменения объема в твердом
состоянии вследствие аллотропических превращений целают практически
неосуществимой отливку изделий сложной формы. Отливка изделий про-
стой формы, например цилиндров и сфер, обычно не представляет затруд-
нений. В некоторых случаях для отливки более сложных изделий можно
конструировать изложницы, разбираемые при достаточно высокой темпе-
ратуре, чтобы превращения у—*¦ р и|3-»-а могли пройти без задержки, созда-
ваемой изложницей.
Чаще всего материалом литейной формы служит окись магния. Исполь-
зуется также графит, покрытый фторидом магния или фторидом кальция.
Из пего можно изготовлять изложницы с более точными размерами. Начи-
нают более широко использоваться и металлические изложницы. Они
успешно изготовляются из многих металлов. Хорошим материалом для
охлаждаемых водой изложниц или массивных изложниц, от которых должно
отводиться большое количество тепла, служит медь. При литье бедных плу-
тонием сплавов выбор материала изложницы определяется свойствами
основного компонента сплава. Для изготовления прототипов сердечников
прутковых твзл для реактора EBR-II сплав урана с 20 вес?» плутония
успешно отливался под давлением в стеклянные трубки, покрытые дву-
окисью тория |178].
Обработка давлением
В настоящее время детали технологии обработки давлением плутония
и богатых плутонием сплавов не рассекречены. Здесь могут быть сообщены
сведения для сплавов, содержащих меньше плутония, причем почти все
данные относятся к системе плутоний — алюминий.
Из сплавов, содержащих не более 20 всс.% плутония, был изготовлен
рад изделий [39, 120, 204]. В этих случаях растворимость в твердом состоя-
Плутоний 565
нии плутония в алюминии очень мала; соединение РиА14 распределено
в матрице из алюминия. В общем технология обработки таких сплавов ана-
логична обработке имеющихся в продаже сплавов на основе алюминия.
Горячая и холодная прокатка, выдавливание, ковка и волочение проволоки
производятся обычными способами при надлежащем изолировании оборудо-
вания с целью предотвращения загрязнения плутонием. Эти плутоний-
алюминиевые сплавы отличаются очень высокой стойкостью против окисле-
ния. Их поверхность может быть очищена химическими и ультразвуковыми
методами от активных загрязнений частицами плутония [39, 204|. Это зна-
чительно упрощает последующее одевание оболочки на сплав.
ОБЛАСТИ ПРИМЕНЕНИЯ
В настоящее время плутоний применяется в ядерном оружии, ядерном
горючем, источниках нейтронов, пороговых детекторах для определения
спектра нейтронов и в производстве высших изотопов плутония и трансплу-
тониевых элементов. Во всем мире самая большая доля плутония предна-
значается для производства компонентов ядерного оружия. Однако в послед-
нее время растет сознание того, что в ядерной энергетике, основанной
на уране, в виде отходов получаются большие количества плутония. Более
того, для эффективного использования мировых запасов урана широко рас-
пространенный неделящийся, но являющийся сырьем для получения горю-
чего уран-238 необходимо превращать в делящийся плутоний-239. По пред-
варительным подсчетам [105J, превращение урана-238 в плутоний-239
увеличит мировые запасы энергии, заключенной в известных и пригодных
для извлечения с экономической точки зрения запасах урана, более чем
в 100 раз. Поэтому следует ожидать, что важность разработки энергетиче-
ских ядерных реакторов, работающих на плутонии, в будущем возрастет.
Как объяснено выше, чистый металлический плутоний не может слу-
жить ядерным горючим. Применение сплавов плутония в качестве ядер-
ного горючего обсуждалось в разделах «Применение в реакторах» и «Спла-
вы». Обзор применения сплавов и соединений плутония в виде ядерного
горючего дан Тейтом 1184].
Плутоний в силу высокой и-активностн важен как компонент плутоний-
бериллиевых нейтронных источников. В отличие от механических смесей
бериллия с а-излучателями соединение РиВе,3 имеет вполне определенный
выход нейтронов на данный вес соединения [20; 46, стр. 388^403; 108].
Характеристики нейтронного источника из РиВе13 были описаны Стюартом
[182|, Раннолсом и Бучером 1163], а также Тейтом и Коффинберрн [186|.
Если используется плутоний, содержащий максимальное количество плу-
тоння-239 и минимальное количество высших изотопов, то вследствие боль-
шего периода полураспада плутония-239 получается относительно постоян-
ный по времени источник нейтронов. Такие источники хороши для калиб-
рования приборов, обнаруживающих нейтроны. Другим источником ней-
тронов может быть самопроизвольное деление пл\тония-240, получаемого
при интенсивном облучении плутония нейтронами.
В связи с тем что сечение деления плутония зависит от'энергии падаю-
щих нейтронов, он применяется как пороговый детектор для определения
нейтронного спектра. В этом методе плутониевую фольгу окружают В",
чтобы исключить деление за счет тепловых нейтронов. Определяя актив-
ность продуктов деления после экспозиции в нейтронном потоке, получают
меру интенсивности нейтронов с энергией выше пороговой, равной 4 кэв.
I BOO
two
1200
p 1000
I eoo
? em
wo
Zoo
1 1
и
г
a-i \J ^
В'
t
в
I
1
BOt
IBS
S60 i
I1
~~~
595
Tj'B
<"
Э
1
«
э
•a
12
к
1
\
920
eso
2-Я
V
-
20
80
100
чО 60
Алюмшшд, шп %
Рис 16. Диаграмма состояния системы плутоний — алюминий
[37, 170].
П 1 2 Л
1800
100
Рис. 17. Диаграмма состояния системы плутоний
железо |25, 37, 108, 131, 170].
BOO
mv>
kO SO
Кобальт, am %
Рис. 18. Диаграмма состояния системы плутоний — кобальт
[25, 37, 170].
КОС
1200
р 1000
|* sou
200
¦
t '
у™
320
206
-
b-l
rt
z
20
0 60
Марганец.ant %
Рис. 19. Диаграмма состояния системы плутоний — марганец
[37, 170].
1200
wa
Рис. 20. Диаграмма состояния системы плутоний —
медь [158].
1,0 SO
рикелъ.ат.%
во
100
V и с. 21. Диаграмма состояния системы плутоний — никель
[25, 203]
40 60
Осмий, am %
Рис 22. Диаграмма состояния системы плутоний — осмий
[108].
1W0
1200
1000
• 800
еоо
ьоо
200
ж
^ /еоо
.УХ/ 523
f) **m
-А1
41с*'
1 1
к
с
К-
1
еч
ее
1
1
ЕС
S.
1
V -
-
г «А.
3
се
с
1 i I
го
',0 60
Рутений, агп.%
/00
Р и с. 23. Диаграмма состояния системы плутоний — руте-
ний [37. 170].
300 Г
v
/
i
-
/ '
6l9
Б08
500
vs
ГСЯ5
P'll3S
r
1 /
/
__ i. i
-
\
\
\
1 _
1
1
1
t
1
1 1 1
20
w во
Торий, am %
ВО
100
Рис. 24. Диаграмма состояния системы плутоний — торий
[25, 37, 152, 170).
500
W 60
Уран, шп.%
too
Рис. 25. Диаграмма состояния системы плутоний —
уран 1651.
«PC
100
" вПО
| .500
j| <.00
300
200
ию
-
-
_ f
IIS
ISO
-~
if
s
р.Ъ
as
1 1— ¦ 1 1 1 1 ¦ T"
* \s -
ft 59? ^-^
7 ^ч ¦
\
V
I 1 1 1 1 1 1 *
п во
Церий, am. %
80
WO
Рис. 26. Диаграмма состояния системы плутоний
церий [6G]
900
800
700
SOP
400
300
200
WO
я и
/^•i ' 6S5
I wo
i
n,T 206
МО
«•г \
t .
0
Рис.
го
во
100
W 60
Цинп, am.%
27. Диаграмма состояния системы плутоний — цинк [511.
572
Глава 21
Для полного определения спектра Г901 требуются детекторы, имеющие
большие пороговые энергии, например нептуний и уран.
При захвате плутонием нейтронов образуются его высшие изотопы
н трансплутониевые элементы. Поскольку для превращения значительного
количества вещества необходимо большое количество нейтронов, наиболее
Рис. 28. Диаграмма соетоя-
ния системы плутоний — цир-
коний [199].
Диаграмм i состояния значительно
отличается от диаграммы, пред-
ложенной Бочваром и сотр. 19].
W 60
Цирпоиий,сш1%
практичный метод получения этих интересных элементов — облучение плу-
тония в реакторе. Таким путем были получены небольшие количества эле-
ментов с порядковыми номерами до ста включительно 16, 70, 142, 174,
стр. 164—168].
ЛИТЕРАТУРА*
1. "Abramson R., Boucher R., Fabre R., Monti H., Proc. 2nd
UNICPUAE, 6, 174 -183.
2. A i k e n A. At.. Chem. Eng. Progr., 53, 82 A957).
3. A i k e n A. M., McKenzie D. E., in Progress in Nuclear Energy, Vnl. 1, Ser.
Ill, Pergamon Press, Ltd., London, 1956, Chap. 7-4, p. 316—321.
4 Ball J. С Lord W. B. H.. J. Inst. Metals, S6, .469 A957—1958)
5. В a r t 1 e t t A. A., Swinehart D. F., U. S. Atomic Energy Commission,
Rept. №. LA-561, 1946.
6. «"¦"В e n t ley W.C., Diamond H., Fields P. R., Friedman A.M.,
* Proc. ICPUAE — Proceedings of the International Conference on the Peaceful
Uses of Atomic Energy, United Nations, New York, 1956; Proc. 2nd UNICPUAE — Pro-
ceedings of the Second United Nations International Conference on the Peaceful Uses
of Atomic Energy, United Nations, Geneva, 1958.
** Труды второй международной конференции по мирному использованию атомной
энергии. Доклады иностранных ученых. Ядерное горючее и реакторные металлы, Изд-во
Гл. упр. по использованию атомной энергии при Совете Министров СССР, Москва,
1959. См. также [16, 45, 82, 88, 106, 197—199].
*** Материалы Международной конференции по мирному использованию атомной
энергии, состоявшейся в Женеве 8—20 августа 1955 г. См. также ]20, 58, 71, 83, 92,
113, 140, 151, 153].
Плутоний 573
G i п d 1 е г J. E., Hess D. С, Huizenja J. R., I n g h г a m M G.,
J a f f e у A. M., Magnusson L. В., Manning W. M., M e с h J. F.,
P у I e C. L, Sjoblom R., Stevens СМ.. S t u d i с r M. H., Proc.
1CPUAE, 7. 261—27П.
7. П i s h о р Т., Metal Progr., 7B, 105 A959).
8. В 1 u m e n t h a 1 В., U. S. Atomic Energy Commission. Rept. № ANL-5975, p. 63 -
67, March 1959.
9 Б о ч в а р А. А., Конобсевский С. Т., К у т а й ц е в В. И., М е н ь ш и-
к о в а Т. С, Чеботарев Н Т., Труды Второй международной конференции
по мирному использованию атомной энергии. Доклады советских ученых. Ядерное
горючее и реакторные металлы, Изд-во Гл. упр. по использованию атомной энергии
при Совете Министров СССР, Москва, 1959. стр. 376.
10. В г i d g m a n P. W, J. Appl. Phys., 30, 214 A959).
11. В г о w n J. E., H у a m E. D., Proc. 2nd UN1CPI AE. 17, 597—651.
12. Bruce F. R., L' S. Atomic Energy Commission, Rcpt. № TID-7534, Book 1,
p. 303—331, Symposium on the Reprocessing nl Irradiated Fuels. Brussels. Belgium,
1957.
13. В u с k C, Howelis O. R., Parry T. A., Warner B. F., Willi-
ams J. A., Proc. 2nd UNICPUAE, 17, 25- <15
14. Carlson G., Proc. 2nd UNICPUAE, 17, ill —117
15. С h i о t t i P., V о i g h t A. F., Proc. 2nd UNICPUAE, 17, 368—375.
16. С h i s w i k H. M., D w i g h t A. E., Lloyd L.T., Nevilt M. V., Z e g 1 e r
S. Т., Proc. 2nd LNICPUAE, 6, 394—412.
17. С of
18. С of
19. Cof
20. Col
21. С о f
i n b e г г у A. S., пат. США 2867530, January 6, 1959.
in berry A. S., пат. США 2886504, Maj 12, 1959.
i n b e г г у A. S., пат. США 2901345, August 25, 1959.
i n b e г г у A S., Ellinger F. H., Proc. ICPUAE, 9, 138—146.
inberry A. S., Miner \V. N., Eds., The Metal Plutonium, Chap.
by Abramson R., A Diiatometric Study of Plutonium.
22. С о f f i n b e г г у A. S., M I n e r W. N.. The Metal Plutonium, Chap by Coffin-
berry A. S., Later Plutonium Metallurgical Research at Los Alamos.
23. С о f f i n Ъ е г г у A. S., Miner W N-, The Metal Plutonium, Chap, by Cramer
E. M., Hawes L. I.., Miner W. N., Schonfeld F. W., Dilatometry and Thermal
Analysis of Plutonium Metal.
24. С о f f i n b e г г у A. S., Miner \V. N., The Metal Plutonium, Chap, bv Fllinger
F. H., Review of the Internietallic Compounds of Plutonium.
25. С о f f i n b e г г у A. S, Miner W. N., The Metal Plutonium, Chap, by Elliott
R. ()., Larson A. C, Dcltaprime Plutonium.
26. С о f f i n b e г г у A. S., M i n e r W. N.. The Metal Plutonium, Chap, by Foote
F. G., Plutonium Metallurgy at the Argonne National Laboratory.
27. Cof f inberry A. S., Miner W- N.. The Metal Plutonium, Chap, by
Gribon E., Plutonium Metallurgy in France.
28. Coffinberry A. S., Miner W- N., The Metal Plutonium, Chap, by
Gurinsky D. M., A Plutonium Liquid-Metal-Fuel Reactor.
29. С о f f i n b e г г у A. S., M i n e r W. N., TheMetai Plutonium. Chap, by Kay A. E..
Some Physical and Physico-Chemical Properties of Plutonium Metal.
30. С о f f i n b с г г у A. S., Miner W. N.. The Metal Plutonium, Chap, by Kel-
man L. R., Dunworlh R. J., The Development of Plutonium-Containing Fuels
at Argonne National Laboratory.
31. С о I f i n b e г г у A. S., Miner \V. N.. The Metal Plutonium, Chap, by
Kiehn R. M., The Role of Plutonium in Nuclear Power.
32. Coffinberry A. S., Miner W. N.. The Metal Plutonium, Chap, by
Laquer H. L.. Sound Velocity Measurements on Alpha-Phase Plutonium.
674 Глава 2±
33. С о f f i n b e г г у A. S., M i n e г W. N.. The Metal Plutonium, Chap, by Lee J.,
Mardon P. G., Some Pliysicai Properties of Plutonium Metal Studied at Har-
well.
34. с: о f f i n b e г г у A. S . M i n e r W. N.. The Metal Piutonium, Chap, by
Pugh S. F., Plutonium Fuels for Power Reactors.
35. С о F f i n b e г г у A. S, Miner W. N., The Metal Plutonium, Chap, by Run-
nails O. J. C, The Preparation of Plutonium —Aluminum and Other Plutonium
Alloys; Плутоний, Сборник докладов иностранных ученых, Атомиздат, Москиа, 1964,
стр. ПО.
36. С о f f i n b e г г у A. S., Miner W. N., The Metal Plutonium, Cliap. by San-
denaw T. A., Results of Measurements of Physical Properties ol Plutonium Metal.
37. С о f f i n b e г г у A. S., M i n e r W. N.. The Metal Plutonium, Chap, by Schnn-
feid F. VV., Plutonium Phase Diagrams Studied at Los Alamos.
38. С о Г f i n be rr у A. S., Miner W. N.. The Metal Plutonium, Cliap. by
Shuck А. В., Some Concepts of Solid Fuels for Heterogeneous Fast Reactors.
39. С of f i n b e г г у A. S., .Miner W. N., The Metal Plutonium, Chap, by
Tate R. E_, Fabrication of Billets Containing Plutonium for the MTR Fuel Elements.
40. С of f i n b er г у A. S, Miner W. N.. The Metal Plutonium, Chap by
Wabcr J. Т., Wright E. S., The Corrosion of Plutonium.
-11. Colfinbeny Д, S., Miner W. N., The Metal Plutonium, Chap, by Wald-
ron M В., Phase Diagrams of Piutonium Aiioys Studied ai Harwell.
42 С о f f i n b e г г у Л S,, Miner W. N., The Metal Plutonium, Chap, by Wau-
chope K- L., The Preparation of Piutonium Aluminum Alloy Fuel Elements for
the N.R.X. Reactor.
43. С о f Г i n b er г у A. S., Miner VV. N., The Metal Piutonium, Chap, by
Zachariasen W. H., Crystal Structure Studies of Plutonium Metal; Плутонии, Сборник
докладов иностранных ученых, Атомнздаг, Москва, 1964, стр. 7.
44. С о f f i n b e г г у A. S.. Miner W N.. Los Alamos Scientific Laboratory, ие
опубликованные данные. 1957.
45. С о f f i n b e г г у A. S., S с h о n f e 1 d F. U' . С г a m e г E. M., M i п е г W. N..
El linger F. H., Elliott R. O., Struebing V. O., Proc. 2nd
UN1CPUAE. 6, 681—685.
46. С о f f i n b e г г у A. S., W a 1 d г о п М. В., in Progress in Nuciear Fnergy,
Vol. 1., Ser. V, Pergamon Press, Ltd., London, 1956, Chap. 4.
47. Comstock A. A., G i b n e у R. В., U. S. Atomic Energy Commission. Rept.
Ki LA-1348, 1952.
48. Конник Р., в книге «Актиниды» (Каи Дж., Гиборг Г., ред.), ИЛ, Москва, 1955,
гл. 8.
49. С о о р е г V R-, W а 1 1 i п g М. Т., Proc. 2nd UNICPUAE, 17, 291—323.
50. Cramer E. M. Los Alamos Scientific Laboratory, неопубликованные данные, 1958.
51. Крамер Э., Эллингер Ф., Ланд К-, в книге «Металлургия н металловеде-
ние плутония и его сплавов» (Вилькннсон У., ред.), Гос. изд-во в области атомной
науки и техники, Москва, 1902, стр. 158.
52. С г a m е г Е. М., S с h о п f е 1 Л F W., Los Aiomos Scientific Laboratory,
неппупликопаниые данные, 1956.
53. С г a in е г Е. М, S с h о п Г е 1 d F W.. Proc. 2nd UNICPUAE, 17, 668 675.
54. С г о m е г D Т., Larson А. С, Acta Cryst., 12, 855 A959).
55. С г о m с г D. Т., L arson А. С, The Crystal Slructure of PuNi4 (будет опублико-
вано в Acta Cryst.).
56. С г о m e r D. Т., О 1 s е п С. Е., Acta Cryst.. 12, 689 0959).
57. С г о rn е г D Т., Roof R. В., Acta Cryst., 12, 942 A959)
58. С u I 1 е г F. I.., Proc. ICPU4E, 9. 464—483; см. также Progress in Nuclear Energy,
Voi. i. Ser. Ill, Pergamon Press. Ltd., London, 1956, Chap. 5-2. p. 172— i94
Плутоний 575
59. Кен книг ем Б., в книге «Актиниды» (Кац Дж., Сиборг Г., ред.), ИЛ, Москва
1955, гл. 10.
60. D a ws о n J. К-, J. Chem. Soc., Part III, 3393 A954).
61. Dean D. J, Kay A. E., L о a s b у R. G., J. Inst. Metals, 86, 379 A957-19F8);
464 A957—1958).
62. D e m p s e у F., К а у A. E., J- Inst. iMelals, 86, 37S A957—1958).
63. Dietrich J. R., Zinn W. H., Solid Fueled Reactors, Addison-Wesley
Publishing Company, Reading, Mass., 1958, p. 811—812.
[6-1. F. 1 linger F П., Тгапь. Am. Inst. Mining Met. Petrol. Engn,., 206, 1256
A956).
65. tiling erF H., Elliott R. O., Cramer E. M., J. Nuclear Materials,
1, 233 A959).
66. Эллиигер Ф., Ланд К-, К'рамер Э-, в книге «Металлургия и металлове-
дение плутония и его сплавов» (Внлькинсон У., ред.). Гос. изд-во в области атом-
ной науки и техники, Москва, 1962, стр. 139.
67. Эллиот Р., Гшнейднер К., в Книге «Металлургия и четаллоиеденне плуто-
ния и его сплавов» (Внлькинсон У., ред.), Гос. изд-во в области атомной муки
и техники, Москва, 1962, стр. 227.
68. Е 1 i i о t t R- О., Larson А. С, Los Alamos Scientific Laboratory, неопубли-
кованные данные, 1957.
69. F e d e г Н. M, U. S. Atomic Energy Commission, Rept. № T1D-7534. Book 2,
p. 667—7i8, Symposium on the Reprocessing of Irradiated Fuels, Brussels, Belgium.
1957.
70. Fields P R, P у 1 e G. I... 1 n g h r a m M. G., Diamond H, S t u-
dicr M.H., Manning W M., Nuclear Sci. and Fnfi., 1, 62 A956).
71. Flanery J. R., Prnc. ICPUAE, 9, 528—531.
72. F о о t e F. G., inTlie Industrial Challenge of Nuclear Energy, II (Second Informa-
tion Conference, Amsterdam, June 24 -28. 1957); Organization for European Eco-
nomic Cooperation, Paris, 1958. Part 111, Chap. IV, p 123—132.
73. Ford G. W. K-, W a 1 f о r d J. G., Proc. 2nd UNICPUAE, 17, 545—554.
74. F г e s h 1 e у M. D., U. S. Atomic Energy Commission, Rept. .№ 1ID-7546, Book 2,
p. 789—811, Fuel Elements Conference, Paris, 1957.
75. F г i e d S, W e s t r u m E-. F , Jr., BaumbachH. I.., Kirk P. L., J.
lnorg. and Nuclear Chem., 5. 182 A958).
76. F г о s t П. R. Т., A d d i s о n С. С, С h i t t у A., G e а с h G. A., G г о s s P.,
James J. A., M e t с a 1 f e G. J, R a i n e Г, S 1 о m a n HA., Proc. 2nd
UNICPLAE, 7, 139—165.
77. G a r d n e r H. R., В 1 о о m s t с г С H., Jeffcres J. M., Proc. 2nd
UNiCPLAE. 6. 686—689.
78. G a r d n e r H. R., Jelfercs J. M., U. S. Atomic Energy Commission. Rept.
.№ HW-57130, 1958.
79. G a r n e г С. S., Bonier N. A., S e a b о г g G. Т., J. Am. Chem. Soc, 70,
3453 A948).
80 Glbney R. В., U. S. Atomic Energy Commission. Rept. J* LAMS-1080.
1950.
81. GlasstoneS., In Principles of Reactor Engineering, D. Van Nostrand Company,
Inc., Princeton, N. J., 1955, Chap. 13, p. 788—838.
82. G о e r t z R. C, Proc. 2nd UNICPUAE, 17, 585—596, 659—663.
83. G о 1 d s с h m i d t В., R e g n a u t P., P r e v о t I., Proc. ICPUAE, 0, 492—
497.
81. G or urn A. E., Acta Cryst., 10, 144 A957).
85. G u s t i s о n R. A., Barber E. J., В e n t о п S. Т.. В е г n h a r d t H. A.,
McMillan T. S., The Chlorine Trifluoride Process, in Progress in Nuclear
576 Г л аа а 21
Fncrgy, Vol. 1, Ser. Ill, Pergamon Press, Ltd., London, 1956, Chap. 6-3, p. 281—
285
86. H a I 1 D. П., Proc. 2nd UNICPUAE, 13, 300—ЗП6.
87. Harmon K- M.. R e a s W. H , I). S. Atomic Energy Commission, Rept.
As TID-7534, Book 1, p. 332—348, Symposium on the Reprocessing of Irradiated
Fuels, Brussels, Belgium, 1957.
88 H о 1 I e у С E., M u 1 f о г d R. N. R., Huber E.J., Head F. L., Ellin-
g e r F. H., В j о г к i u n d С W., Proc. 2nd UNICPUAE, 6. 215—220.
89 H о we I I s G. R.. H ug h es J. С, М а с к а у D. R. S a d d i n g t о n K.,
Proc. 2nd UNICPUAE, 17, 3- 21.
90. Hurst G. S., H ar t e r J. A., H e n s 1 e у P. N., M i 1 1 s W. A, S 1 a ter M.,
Reinhardl P. W , Rev. Sci. lnstr., 27, 153 A956).
91. H у m а п Н. Н., К a t z J. J., in Progress in Nuclear Fnergy, Vol. 1, Ser. Ill,
Pergamon Press, Ltd., London. 1956, Chap, fi-2, p. 274—280.
92 Ну man H. H., Vogel R. C, Katz J. J.. Proc. ICPUAE. 9. 613—
626.
93. 1 m I a li К . U. S. Atomic Energy Commission, Rcpt. A» LA-2287, 1959.
94. I r i s li E. R., R e a s W. H., U. S. Atomic Energy Commission, Rept. №
T1D-7531, Book 1. p. 83—106, Symposium or the Reprocessing of Irradiated
Fuels. Brussels, Belgium, i957.
95. J а у К. Е. П , Atomic Energy Research at Harwell, Rtitterworth and Co. (Pub-
lishers). Ltd., London, 1955. p. 3—5.
96. J e t t e E. R.. .1. Chem. Phys.. 23, 365 (i955).
97. .1 e t t e E. R.. С о f f i n b e г г у A. S., Материалы Комиссии по атомной
энергии США. Ядерные реакторы, ill. Материалы для ядерных реакторов, ИЛ,
Москва, 19л6; см. также Reactor Handbook: Materials, McGraw-Hill Book Co.
Inc., New York, 1955.
98. Johnson K. W. R., U. S. Atomic Energy Commission, Rept. № LA-1680, 1954
99. J u d k i ns M. F., Nucleonics, 16. 97 A958).
100. J u г и е у E T, Hali J. И., Hail D. В., G a g e A.M.,0 odbold N. H.,
S а у e r A. R., Swickard E. O., U. S. Atomic Energy Commission, Rept.
№ LA-1679. 1954.
101. С и борг Г.. в книге «Актиниды» (Кац Дж.,Сиборг Г., ред.), ИЛ, Москва, 1956,
гл. 7.
102. К е 1 m a n L. R., L. S. Atomic Energy Commission, Rept. .№ T1D-7546, Book 2,
p. 751— 777, Fuel Element Conference, Paris, 1957.
ШЗ. К e 1 m a n L. R., Wilkinson W- D., S li u с k А. В., G о e r t z R. C,
U. S. Atomic Energy Commission, Rept. A° ANL-5509, 1955; см. также Nucleonics,
14. № 3. 61 A956); № 4, 65 A956); JV 5, 77 A956).
1П4 К e t z 1 а с h N., Chem. Eng. Progr., 53, 357 A957).
105. К i e h n R. M., U. S. Atomic Energy Commission, Rept. As LA-2112, 1957.
106. К i t t e 1 J. H., P a i n e S. H., Proc. 2nd UNICPUAE, 5, 500—509.
107. Knight F. W-. Los Alamos Scientific Laboratory, неопубликованные даииые,
1958.
108. К о н о б е е в с к и й СТ., Фазовые диаграммы некоторых плутониевых систем.
Конференция отделения химических наук по мирному использованию атомной
энергии, Москва, 1955, стр. 362—375.
109. Конобеевскин С. Т., 3 а й м о в с к и й А. С , Л е d и т с к и й Б. М.,
Сокурский Ю. Н., Чеботарев Н. Т., Бобков Ю. В., Его-
ров П. П., Николаев Г. Н., Иванов А. А., Труды Второй междуна-
родной конференции по мирному использованию атомной энергии. Доклады соает-
скич ученых. Ядерное горючее и реакторные металлы, Изд-во Гл. упр. по исполь-
зованию атомной энергии при Совете Министроп СССР, Москва, 1959, стр. 396.
Плутоний 577
11П. L a n g h a m W. H., in Proceedings of the Seventh Hot Laboratories and Equip-
ment Conference, 1959 Nuclear Congress, Cleveland, Ohio; см. также Health Pliys.,
2, 172—185 A959).
111. L a r s о n A. C, Cronier D. Т., S t a m b a u g h С. К., Acta Cryst., 10,
443 A957).
112. Lawroski S., U. S. Atomic Energy Commission, Rept. № TID-7534, Book 2,
p. 479—497, Symposium on the Reprocessing of Irradiated Fuels, Brussels, Belgium,
1957.
113. Lawroski S., Proc. ICPUAE, 9, 575—582.
114 Lawroski S., Levenson M., U. S. Atomic Energy Commission, Rept.
№ ГШ-7534, Book I, p. 45—68, Symposium on Reprocessing of Irradiated Fuels,
Brussels, Belgium, 1957.
115. Lee J. A., H a I 1 R. O. A., UK.AEA Rupt. .№ AF.RE-M/R-2800, 1959.
116. Л e fi п у н с к и и А. И., Б л о х и н ц е в Д. И., А р и с т а р х о в И. Н.',
Бондаренко И. И., Казачковский О. Д., П и н х а с и к М. С,
Стависский Ю. Я-, С т у м б у р Э. А., Украинцев Ф. И., Уса-
чев Л. Н., Атомная энергия, 2, 497 A957).
117. Лейпу некий А. И., Грабин В. Г., Аристархов Н. Н., Б о и -
д а р е и к о И. И., Казачковский О. Д., Любимцев О. И., Паш-
к о в С. А., П и н х а с и к М. С, Р е н н е К- К., Стависский IO. Я.,
Украинцев Ф. И., Усачев Л. Н., Стумбур Э. А., Труды Второй
международной конференции по мирному использованию атомной энергии. Доклады
советских ученых. Ядерные реакторы и ядерная энергетика, Изд-во Гл. упр. по
использованию атомной энергии при Совете Министров СССР, Москва, 1959, стр. 215.
118. L e v i пе С. A., S e a b or g G. Т., J. Am. Chem. Soc., 73, 3278 A951).
119. L i 1 i e n t h a 1 J. R-, Los Alamos Alpha-Gamma Cells, in Proceedings of the
Seventh Hot Laboratories and Equipment Conference, 1959 Nuclear Congress,
Cleveland, Ohio.
120. Lord W. B. H., W a k e 1 i n R. J., Rev met., SS, 620 A958).
121. Lord W- B. H., Waldron M. В., J. Inst. Metals, 86, 385 A957—1958).
122. Lunlz J. D., Ed., Nucleonics, 15 № 11, 130 A957).
123. L u n t z J П., Ed., Nucleonics, 16, № 1, 22 A958).
124. L u n t z J. D., Ed., Nucleonics, 16, Л» 1, 49 A958).
125. L u n t z J. D., Ed., Nucleonics, 16, № I, 53 A958).
126. Luntz J. D., Ed., Nucleonics, 16, JVs 8, 19 A958).
127. L у m a n Т., Ed., Metals Handbook, American Society for Metals, Cleveland.
1948, p. 95. ч
128. M с К e n z i e D. E., Can. J. Chem., 34, 515 A956).
129. McKenzie D. E., Can. J. Chem., 34, 749 A956).
130. M a r a m a n W. J., Proc. 2nd UNICPIjAE, 17, 676—680.
131. Mardon P. G., H a i n e s H. R., P с а г с e J. H., Waldron M. В.,
J. Inst. Metals, 86, 166 A957 -1958).
132. Martin F. S., M i 1 e s G. I.., in Progress in Nuclear Energy, Vol. 1, Ser. Ill,
Pergamon Press, Ltd., London, 1956, Chap. 7-1. p. 291—300.
133. M a s i ng G., Handbuch der Metallphysik, B. 1, Teil 1, Akademische Verlags-
gesellschart, M. В. Н., Leipzig, 1935, S. 398.
134. M e t z C. F.. Anal. Chem., 29, 1748 A957).
135. Me tz С F., Proc. 2nd UNiCPUAE. 17, 681—690.
136. M e t z С F., W a t e r b u г у G. R., in A Treatise on Analytical Chemistry
(Kolthoff I. M., ElvingP. J., Eds.), Interscience Publishers, Inc., New York,
Chap. 52 (в печати).
137. M i 1 e s F. Т., S h e e h a n T. V., G u r i n s k у D. II., KoulsH.J.C,
Proc. 2nd UNICPUAE, 9, 180—187.
37 Заказ J* 239
578 Глава 21
138. Morgan A. N., Baker R. D., H a z e n W. С, Н e n r i с к s о п А. V.,
McNeese W. D., Thomas R. I.., Proc. 2nd UNICPUAE, 17, 537—544.
139. M о t t N.F.Jones H., The Theory of the Properties of Metais and Alloys,
Oxford University Press, London, 1936, p. 13.
140. M о t t a E. E., Proc. ICPUAE, 9, 596—603; см. также Progress in Nuclear Energy,
Vol. 1, Ser. Ill, Pergamon Press, Ltd., London, 1956, Chap. 7-3, p. 309—315.
141. M u I f о r d R. N. R., Sturdy G. E., J. Am. Chem. Soc, 77, 3449 A955);
78, 3897 A956).
142. Murphy W. J., Ed., Chem. Eng. News, 33, 1956 A955).
143- Nelson R. D., U. S. Atomic Energy Commission, Rept. ЛГ» HW-55778, 1958.
144. Nelson R. D., U. S. Atomic Rnergy Commission, Rcpt. Л5 HW-56843, 1958.
145. Nelson R. D., T h о m a s ID., Proc. 2nd UNICPUAE, 6, 170—173. "
146. Nelson T. C, U. S. Atomic Energy Commission, Rept. JVs HW-32276, 1954.
147. О 1 s с n С E., S a n d e n a w Т. Л., Herrick C. C, U. S. Atomic Energy
Commission, Rept. Jfi LA-2358, 1959.
148. P a s с а г d R., Acta Met., 7, 303 A959).
149. Peppard D. F., Studier M. H.. G erg el M. V., M a s о n G. W.,
Sullivan J.C.Mech J. F., J. Am. Chem. Soc, 73, 2529 A951).
150. Peterson P. J.. T h о m a s R. L., G r e e n J. L., Proc. 2nd UNICPUAE,
17, 664—667.
151. P h i p p s T. E., Sears G. W.. S e i Г е г t R. L., Simpson О. С, Proc.
ICPUAE, 7, 382—385.
152. P о о 1 e D. M., W i I 1 i a m s о n G. K-, Marples J A. C, J. Inst. Metals,
86, 172 A957—1958).
153. Pratt H. R. C, Proc. ICPUAE, 9, 52П—527; см. также Progress in Nuclear
Energy, Vol. I, Ser. Ill, Pergamon Press, Ltd.. London, 1956, Chap. 5-7,
p. 242—248.
154. Prevot I., Cor pel J.. Regnant P., Proc. 2nd UNICPUAE, 17, 96—106.
155. Прусаков В. Н., Симонов Н. Ф., Троиенко Н. М-, Труды
Второй международной конференции по мирному использованию атомной энергии.
Доклады советских ученых. Химия радиоэлементов и радиационных превращений,
Изд-во Гл. упр. по использованию атомной энергии при Совете Министров СССР,
Москва, 1959, стр. 49.
156. R е е с е М. С, Ed., Atomic World, 9, 367 A958).
157. Regnaut P., Faugeras P., Brut A., Helou R., Redon A.,
Proc. 2nd UNICPUAE, 17, 73—95.
158. Rhlnehammer Т. В., Е t t e r D.E., Jones L. V., The Plutonium —
Copper Phase Diagram (будет опубликовано в Proceedings of the International
Conference on Plutonium Metallurgy, Grenoble, France, April 1960); Плутоний,
Сборник докладов иностранных ученых, Атомиэдат, Москва. 1964, стр. 203.
159. R oesch W. С, Proc. 2nd UNICPUAE. 23, 339—345.
160. R и п п а 1 I s О J. С, Can. J. Chem., 34, 133 A956).
161. Runnalls О. J. С, Proc. 2nd UNICPUAE, 6, 710—717.
162. Runnalls О. J. С, В о u с h e r R. R., Acta Cryst., 8, 592 A955).
163. Runnalls O. J. С, В о u с h e r R. R., Can. J. Phys., 34, 94B A956).
164. Runnalls O.J.C., Wauchope K. L., U. S Atomic Fnergy Commission,
Rept. № TID-7516, Book 2, p. 778—788, Fuel Elements Conference, Paris, 1957.
165. Ryan J. L, Wheelwright E. J., Proc. 2nd UNICPUAE, 17. 137—144.
166. R у d b e rg J., S i 1 l ё п L. G., Acta Chem. Scand., 9, 1211 A955)
167. Sandenaw T. A., G i b n e у R. В., J. Phys. Chem. Solids, 6, 81 A958).
168. Sax N. I., Dangerous Properties of Industrial Materials, Reinhold Publishing
Corp., New York, 1957.
Плутоний 579
169. Schonfeld F. W., T a t e R. E., Anderson R. W., Los Alamos Scien-
tific Laboratory, неопубликованные данные, 1957.
170. Schonfeld F. W., С r a m e г E.M.,Miner VV. N., R i 1 i n g e г F. H.,
С о f f i n b e г г у A. S., in Progress in Nuclear Energy, Vol. 2. Scr. V, Pergamon
Press, Ltd., London, 1959, Chap. 10-10, p. 579—599.
171. S с h u 1 t e H.F., Meyer D. D., Proc. 2nd UNICPUAE, 23, 206, 210.
172. Schwennesen J. L., Proc. 2nd UNICPUAR, 17, 514—530.
173. Си борг Г., в книге «Актиниды» (Кац Дж., Сиборг Г., ред.), ИЛ, Москва, 1955,
гл. 7.
174. S e a b о г g G. Т., The Transuranium Elements, Yale University Press, New Haven.
Conn., 1958.
175. S e a b о r g G. Т., P e r 1 m a n M. L, .i. Am. Chem. Soc, 70, 1571 A948).
176. S e g u i n M., F о 1 m e r M. M.. F r i e d с 1 J., Orison F., C. R., 246,
3243 A958).
177. Шевченко В. Б., П о в и ц к и й Н. С, С о л о в к н н А. С, Труды
Второй международной конференции но мирному использованию атомной энергии.
Доклады советских ученых. Химия радиоэлементов и радиационных превращений,
Изд-во Гл. упр. по использованию атомной энергии при Совете Министров СССР,
Москва, 1959, стр. 28.
178. Shuck А. В., Argonne National Laboratory, частное сообщение, 1958.
179. Smith С. S., Metal Progr., 65, 81 A954).
180. Steunenberg R. К, Fischer J.Vogler S., Steindler M. J..
Adams M., Goring G., Vogel R. C, Rodger W. А., Ме-
си a m W J, S e e f e 1 A t W. В., Proc. 2nd UNICPUAE, 17, 452—467.
181. Steunenberg R. K., Vogel R. C, Proc. 2nd UNICPUAE, 17, 438—451.
182. Stewart L., Pliys. Rev., 98, 740 A955).
183. Stout J. W., J о n e s W. M., Phys. Rev., 71. 582 A947).
184. T a t e R. E., in Nuclear Fuel Elements (Hausner H. H., Schumar J. F., Eds.),
Reinhold Publishing Corp., New York. 1959. Chap. 8, p. 110 -143.
185. Тейт Р., Аидерсон Р., Металлургия н металловедение плутония и его спла-
вов (Уилкннсон У., ред.). Гос. изд-во в области атомной науки и техники,
Москва, 1962, стр. 215.
186. Т a t e R. Е.. С о i f i n b е г г у AS., Proc. 2nd UNICPUAE. 14, 427—431.
187. Taylor J. W., Atomic Energy Research Establishment, Harwell, частное
сообщение, 1956.
188. Thompson S. G., S e a b о r g G. Т., Progress in Nuclear Energy, Vol. I,
Ser. Ill, Pergamon Press, Ltd., London. 1956, Chap. 5-1, p. 163—171.
189. T ober F. W., Proc. 2nd UNICPUAE, 17, 574—584.
190. T r i p 1 e t t J. R., U. S. Atomic Energy Commission. Rept. № HW-33912, 1955.
191. United Nations, Proc. 2nd UNICPUAE, Серия статей, посвященных разработке
пнрометаллургических методов, Vol. 17, р. 352- 494.
192. United Nations, Proc. 2nd UNICPUAE, Серия статей, посвященных методам
экстракции растворителями, Vol. 17, р. 111 —199, 291—351.
193. Вдовенко В. М., Ковальская М. П., Труды Второй международной
конференции по мирному использованию атомной энергии, Доклады советских уче-
ных. Химия радиоэлементов и радиационных превращений, Изд-во Гл. упр. по
использованию атомной энергии при Совете Министров СССР, Москва, 1959, стр. 34.
194. Vogel R. С, Steunenberg R. K-, U. S. Atomic Fnergy Commission,
Rept- № T1D-7534, Book 2, p. 498—559, Symposium on the Reprocessing оГ Irra-
diated Fuels, Brussels, Belgium, 1957.
195. V о i g t A. F., Proc. ICPUAE, 9, 591—595; см. также Progress in Nuclear Energy,
Vol. 1, Ser. Ill, Pergamon Press, Ltd., London, 1956, Chap. 7-5, p. 322—328.
37*
580 Глава 21
196. Уобер Дж., Металлургия и металловедение плутония и его сплавов (Уилкин-
сон У., ред.), Гос. нзд-во в области атомной науки и техники. Москва, 1962,
стр. 102.
197. W a b е г J. Т., Ргос. 2nd UNICPUAE, 6, 204—214.
198. Waldron М. В., Adwick А. С, Lloyd Н , N о t 1 е у. М. J-, Р о о -
1 е D. М., Russell L. Е , S а у е г s J. В., Ргос. 2nd UNICPUAE, 6, 690—
696.
199. Waldron М. В., G а г s t о п е J., Lee J. A., War d о п P. G, Магр-
1 e s J.A.C, Poole D M., Williamson G. K-. Proc.nd UNICPUAE,
6, 162—169.
200. Waldron M. П., Р о о 1 e D. M.. Atomic Energy Research Establishment,
Harwell, неопубликованные данные, 1959.
201. Walton G. N., Ed., Glove Boxes and Shielded Cells, Part I, Academic Press,
Inc., New York, 1958.
202 Walton G. N , Ed., Glove Boxes and Shieicleri Cells, Par! 11, Academic Press,
Inc., New York, 1958.
203. Wensch G. W-, Why te D. D., L. S. Atomic Fnergy Commission. Rept.
JV° LA-I3D4, 1951.
204 Wick O. J., N с 1 s on T. C, Freshlej M. D., Proc. 2nd UNICPUAE
6, 700—709.
205. Wick O. J., Thomas ID.. Proc. 2nd UNICPUAE, 17, 531—536.
206. Z а с h а г i a s e n W. H., Acta Cryst., 5, 17 A952).
207. Zachariasen W. H., Structure Repts., 12, 139 A949).
208. Z а с h a r i a s о n W. H., Structure Repts., 12, 179 A949).
209. Zachariasen W. H., Ellinger F. II., Acta Cryst., 8. 431 A955)
210. Zachariasen W. H., Ellinger F. H., Acta Cryst., 12, 175 A959).
211. Z а с h a r i a se n W. H., Ellinger F. H., J. Chem. Phys, 27, 811 A957).
22
РЕДКОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
Г. Э. КРЕМЕРС
Н. Е.
Kremers, American Potash and Chemical
Corporation, Ncta York, N. Y.
ВВЕДЕНИЕ
К редкоземельным металлам относятся 15 элементов третьей группы
периодической таблицы с порядковыми номерами от 57 до 71 включительно.
По многим своим свойствам они похожи на элементы этой же группы —
иттрий, скандий и актиний, но все-таки больше родственны иттрию. Иногда
их называют лантаноидами.
По строению электронной оболочки редкоземельные металлы предста-
вляют собой переходные элементы, характеризующиеся последовательной
достройкой внутреннего электронного уровня 4/, начиная от двух электронов
до 14 (в трех случаях имеется по одному 5?{-электрону) с сохранением пол-
ного октета: двух 5з-электронов и шерти 5р-электронов. Поскольку после-
довательно присоединяемые электроны удалены от валентных, все редко-
Таблица I
РЬДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ И ИТТРИЙ
In оря
ряд-
, новый
номер
Атомный
вес
На-
I лент-
i нопь
Окисел (при сжигании на воздухе)
Лантан
Церий
Прачеодич
Неидим
Прометий
Самарин
Европий
Гадолиний
Тербий
Диспрозий
Гольмий
Эрбий
Тулий
Иттербий
Лютеций
Иттрий
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
39
138,91
140,12
140,907
144,24
147,00
150,35
151,96
157,25
158,924
162,50
164,93
167,21
168,934
173,04
174,97
88,908
3
3,4
3,4
3
3
2,3
2,3
3
3.4
3
3
3
3
2,3
3
3
La2O3
СеО2
Рг6Оц
Pm2O3
ТЪ4О7
Dy2O3
Но2О3
Ег2О3
Tu2O3
Yb2O3
Lu,O3
Y2O3
Цериевая
подгруппа
Тербиевая
подгруппа
Иттриеван
подгруппа
а В табл. 1 перечислены редкоземельные элементы и иттрий с их типичными
валентностью и оннслимн. согласно классической разбивке на подгруппы: цериевую,
тербиевую и иттриевую По своим свойствам итгрий обычно занимает положение
между диспрозием и гольмием.
582 Глава 22
земельные металлы и их соединения отличаются большим сходством хими-
ческих свойств, особенно их водные растворы и кристаллогидраты. По своим
химическим свойствам они различаются столь незначительно, что легко
образуют друг с другом твердые растворы.
В несольватированных системах эффект растворения отсутствует и раз-
ница свойств сказывается заметнее. Больше всего это относится к металли-
ческому состоянию и безводным солям и проявляется прежде всего в отно-
шении свойств, обусловленных строением внутренних электронных слоев,—
спектров поглощения, магнитных снойств и т. п.
Последовательная достройка внутреннего электронного уровня 4/
у редкоземельных металлов сопровождается уменьшением радиуса атомов
с увеличением порядкового номера элемента. Это уменьшение радиуса
атомов известно под названием лантаноидного сжатия.
Хотя иттрий и не является редкоземельным металлом, его часто относят
к числу элементов этой группы благодаря сходству с ними и совместному
нахождению в природе (табл. 1).
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Хотя редкоземельные металлы входят в состав очень многих минералов,
промышленное значение имеют только монацит в коренных залеганиях,
монацитовый песок, бастнезит*, фторокарбонатные минералы** и такие
минералы иттриевой подгруппы, как ксенотям, гадолинит н эвксенит.
Крупные кристаллы монацита встречаются во многих пегматитах,
но их концентрация, как правило, столь мала, что их извлечение из таких
руд является нерентабельным. Мелкие кристаллы монацита попадаются
во многих кислых гранитах и пегматизированных гнейсах. В тех случаях,
когда их концентрация была довольно высокой, выветривание таких пород
сопровождалось образованием россыпных месторождений, из которых мона-
цит извлекают в виде монацитового песка.
Наиболее значительные месторождения монацитового песка находятся
на береговых пляжах в Траванкоре (Индия), Эспириту-Санту, Рио-де-
Жанейро и Баия (Бразилия), в Джексонвилле, Флориде (США.) и Австралии.
Важные аллювиальные месторождения монацита встречаются во многих
областях мира. Из подобных месторождений редкоземельные металлы сейчас
добывают в штатах Айдахо, Северная и Южная Каролина, на Малайском
полуострове и в Корее.
Многие другие месторождения остаются потенциально важными источ-
никами снабжения этими металлами.
Монацит из жильных месторождений в районе Ванрейнсдорпа (Южно-
Африканская Республика) является сейчас основным сырьем, из которого
извлекают редкоземельные металлы и торий.
Бастнезитовыс месторождения в Сан-Бернардино (шт. Калифорния)
способны удовлетворять нужды промышленности США еще долгие годы.
По сравнению с монацитом и бастнезитом руды иттриевой подгруппы
элементов добываются в гораздо меньшем количестве. Некоторое количе-
ство ксенотима извлекается из монацитовых россыпных месторождений,
* Фторокэрбонат церия и лантана (Ce,La)F(CO3), содержащий более 70%
(Ce,LaJO3.— Прим. ред.
** Имеется в виду, например, паризит Ca(Ce,LaJF2[CO3]3, содержащий до 50%
(Се,1_аJО3.— Прим. ред.
Редкоземельные металлы
583
где он сопутствует монациту. Эвксенит добывают из аллювиальных место-
рождений в Бер-Вэлли (шт. Айдахо).
Об относительной распространенности редкоземельных металлов в при-
роде можно судить по составу монацита и бастнезита. В табл. 2 приводятся
данные типового анализа промышленных руд этих минералов*.
Таблица 2
ТИПОВОЙ АНАЛИЗ ТЕХНИЧЕСКИХ РУД РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ. %
Компоненты
La2O3
Се2О3
Рг2О3
NdA
SnbOg
Eu2O3
Cd2O3
Окислы прочих элементов тербиевой подгруппы
Окислы элементов нттриевой подгруппы
Y2O3
Окислы всех редкоземельных элементов вместе
с Y2O3
ThO,
Mgo"
CaO
BaO
AI2OS -r Fe,O3
TiO2
ZrO2
I
p2o5
SiO2
so3
Потери при прокаливании
Монацит
(шт. Айдахо)
17
29,9
3,9
11
1,3
и,001
0,5
0,2
П,1
0,9
64,8
3,5
0,1
0,3
0,6
0,2
0,1
23
1
Бапнезнт
(шт. Кали-
форния)
24,6
47,1
4,4
12,6
0,7
0,5
89,9
0,1
Наряду с другими элементами редкоземельные металлы образуются при
делении урана и плутония. Фактически единственным источником, из кото-
рого извлекают прометий, являются продукты деления, образующиеся
в ядерных реакторах.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА"
Потребление соединений редкоземельных элементов в Соединенных
Штатах остается последние несколько десятилетий на довольно постоянном
уровне, составляющем в среднем 1400—1800 т ежегодно. Основную массу
* Подробности о сырьевых ресурсах см
Б. И. Коган, Экономические очерки по ,„
1961.— Прим. ред.
** См. гл. IV—V упомянутой монографии.— Прим. ред
в гл. III недавно вышедшей монографии:
редким землям, Изд. АН СССР,
584 Глава 22
химикатов составляют технические окислы, фториды и хлориды, окись
церия, гидроокись церия и в меньшем количестве прочие соединения редко-
земельных элементов той или иной степени чистоты. Большая часть (до 25%)
хлоридов идет на производство сплавов (мишметалл).
В 1960 г. технический металлический церий 90—98%-ной степени
чистоты ценился около 30 долл. за 1 кг, а мишметалл крупными партиями
продавали по цепе около 8 долл. за 1 кг. Редкоземельные металлы и метал-
лический иттрий высокой чистоты стали поступать на рынок небольшими
партиями в конце 50-х годов по цене от 400 до 700 долл. за 1 кг для более
распространенных металлов и по 3750—7000 долл. за 1 кг таких металлов,
как европий, тербий, тулий, лютеций, которые являются самыми малорас-
пространенными среди редкоземельных металлов или которые трудно полу-
чить в виде металла. 11а первых порах такие металлы высокой чистоты
ценились чрезвычайно дорого, но по мере роста их производства наиболее
распространенные редкоземельные металлы по цене уравнялись приблизи-
тельно с цирконием и титаном.
ИЗВЛЕЧЕНИЕ И РАЗДЕЛЕНИЕ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Монацнтовые и бастнезитовые руды обычно вскрывают нагреванием
с серной кислотой. При этом образуются сульфаты редкоземельных эле-
ментов, которые выщелачиваются из продукта реакции водой. Если редко-
земельные элементы извлекают из монацитовых руд, то прежде всего стре-
мятся выделить торий. Существует несколько способов его выделения,
самым распространенным из которых является осаждение пирофосфата
тория из сернокислых растворов. Редкоземельные элементы извлекают
из раствора осаждением в виде оксалатов или двойных сульфатов редко-
земельных элементов и натрия, а уже затем эти соединения превращают
в нужную техническую соль.
В большинстве случаев редкоземельные элементы содержатся в солях
в той же пропорции, что и в рудах. Но теперь налажен выпуск в крупных
масштабах солей отдельных элементов цериевой подгруппы той или иной
технической степени чистоты.
Церий отделяют от других редкоземельных элементов путем его окисле-
ния до четырехвалентного состояния. По своим свойствам четырехвалент-
ный церий сильно отличается от прочих трехвалентных редкоземельных
элементов, причем его выделение можно осуществлять либо простым осаж-
дением основных солей этого элемента, либо кристаллизацией гексанитра-
тоцерата аммония.
Разделение остальных редкоземельных элементов затрудняется
из-за большого сходства их свойств. Для крупномасштабного разделения
элементов цериевой подгруппы раньше широко пользовались фракциониро-
ванной кристаллизацией таких солей, как двойные нитраты редкоземельных
элементов с аммонием или магнием. По этому способу было налажено про-
мышленное производство весьма чистых солей лантана. Для разделения
прочих редкоземельных элементов и иттрия прибегали к ионообменному
способу. По этому способу смесь редкоземельных элементов поглощается
в верхней части ионообменной колонки с катионитом в медной форме,
а затем производится их селективное элюирование из колонки раствором
этилендиамнптстраацетата аммония *.
* Новое о разделении редкоземельных элементов см. в статье Д. И. Рябчикова
н Е. А. Терентьевой, Успехи химии. 29 (Ю), 1285 (I960).— Прим. ред.
Редкоземельные металлы 585
СПОСОБЫ ПОЛУЧЕНИЯ
Способы получения редкоземельных металлов обобщены в табл. 3.
Промышленное производство
Хотя редкоземельные металлы можно получать калышетермическим
восстановлением хлоридов или термическим разложением амальгам, круп-
ное промышленное производство ограничивается лишь электролизом рас-
плавленных безводных хлоридов.
Во всех практических способах получения редкоземельных металлов
обычно исходным сырьем служат их безводные хлориды. При промышлен-
ном выпуске мишметалла, дидима* и металлического церия используются
гидратированные хлориды редкоземельных металлов, содержащие около
одной трети (по весу) кристаллизационной воды. В таком виде предприятия
горнорудной промышленности поставляют сырье заводам, выпускающим
редкоземельные металлы. Эти хлориды приготовляют испарением нейтраль-
ных растворов хлоридов редкоземельных металлов до тех пор, пока содер-
жание в них этих металлов, считая на окись, не достигнет уровня 44—46%.
Такие растворы начинают кипеть приблизительно при температуре 135°.
Предварительно растворы тщательно очищают от незначительных, но вред-
ных для производства примесей фосфат- и сульфат-ионов, остающихся
в них от предшествующих операций по переработке руды. Полученные
в результате испарения растворы хлоридов редкоземельных металлов охла-
ждают, при этом образуется твердая масса, которую упаковывают для
транспортировки. В типичном техническом водном хлориде редкоземельного
металла обычно содержатся следующие примесн: 0,05% SO3, 0,5% Р-=О5,
2% (CaO + MgO), 0,4% (Fe2O3 + А12О3), 0,5% Na2O и 0,5% SiO2. Для
производства весьма чистых редкоземельных металлов приготовляют хло-
риды повышенной степени чистоты.
На предприятиях, выпускающих технические редкоземельные металлы,
перед электролизом расплавленных солей приходится осуществлять дегид-
ратацию хлоридов этих металлов, как правило, путем расплавления гидра-
тированных хлоридов в чугунных, стальных или керамических контейнерах
без доступа воздуха. Нагреванием испаряют воду, пока ее содержание
не уменьшится настолько, что масса хлоридов начнет затвердевать. Нагре-
вание продолжают до тех пор, пока не испарится почти вся вода с некоторым
количеством соляной кислоты, выделяющейся при гидролизе хлпрндов
редкоземельных металлов. Образующаяся пористая твердая масса предста-
вляет собой почти полностью обезвоженный хлорид. В такой массе содер-
жится приблизительно до 10% не растворимых в воде основных хлоридов,
являющихся продуктом гидролиза хлоридов при дегидратации. Содержание
оксихлоридов в обезвоженных хлоридах существенно понижается нагре-
ванием гидратированных солей в условиях частичного вакуума при тем-
пературе 370°.
Выпускаемые промышленными предприятиями технические редко-
земельные металлы можно подразделить на следующие продукты: миш-
* Здесь под дидимом подразумевается бесцериевая смесь редкоземельных метал-
лов, получаемая в промышленных условиях из монацита или бастнезита. Классиче-
ское понятие «дидим» предполагает смесь неодима и празеодима неопределенного сос-
тава, получаемую фракционированным разделением бесцериевой смеси соединении
редкоземельных элементов. Поскольку такие смеси не имеют определенного состава,
иа производстве бытует первое определение. Иногда поставщики мишметалла назы-
вают дидимом бесцериевый мишметалл.
- Таблица 3
СПОСОБЫ ПОЛУЧЕНИЯ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Способ получения
Электролиз'расплавов хлори-
дов jj_NaCI, KC1 и т. д.
Электролиз расплавов хло-
ридов с использованием
жидкого катода магний —
кадмий
Электролиз окиси церия,
растворенной в расплаве
фторнда церия
Электролиз безводных хло-
ридов в спирте с исполь-
зованием ртутного катода
Электролиз расплавов хло-
ридов (SmCl3 и GdCl3)
с жидким кадмиевым като-
дом
Восстановление безводных
хлоридов водородом
Восстановление безводных
хлоридов, бромидов и фто-
ридов редкоземельных эле-
ментов магнием, кальцием
натрием, калием и алюми-
нием8
Восстановление безводного
бромида самария барием
Восстановление безводных
хлоридов церия, неодима
и гадолиния путем их
введения в расплавленный
магний
Восстановление окиси церия
кальцием, магнием, алю-
минием, углеродом или
кремнием
Область применения
Техническое производство ыишметалла,
церия, лантана, неодима и дидима. Лабо-
раторное получение церия, празеодима,
неодима и самария
Производство сплавов, из которых магний
и кадмий можно отогнать в атмосфере
аргона при 900 — 1200°; после отгонки
получается редкоземельный металл с со-
держанием 5% магния; вакуумная плав-
ка приводит к дополнительной очистке
всех редкоземельных металлов, кроме
самария
Маломасштабное производство церия высо-
кой степени чистоты
Производство амальгам редкоземельных
металлов, из которых ртуть нельзя уда-
лить полностью
Производство кадмиевых сплавов, из кото-
рых после Ьтгонкн кадмия получают ме-
таллические самарий и гадолиний в до-
вольно чистом состоянии
Из-за неполноты восстановления образуют-
ся только дихлориды самария, европия
и иттербия
Производство сплавов металла-восстанови-
теля или порошковых металлов сомни-
тельной чистоты (восстановление фтори-
дои натрием). При надлежащих условиях
восстановление CeF3 литием дает весьма
чистый церий. После отгонки кальция
получаются чистые металлы
Производство чистого металлического сама-
рия из его сплава с барием путем отгон-
ки последнего
Производство редкоземельных сплавов маг-
ния, из которых последний отгоняется,
что дает редкоземельные металлы
99%-ной степени чистоты
Производство пирофорных порошков, а так-
же карбида СеСг и силицида CeSig*
В атмосфере водорода или азота образу-
ются гидриды или нитриды
Литература
7, 31, 33,
34, 45, 53,
61, 92—96,
105
99
26, 58, 60
40, 55, 64
94, 95
38
1, 7, 8, 20—
22,24,26,41,
43, 44, 57,
77, 86, 88,
97, ИЗ
59
98
33, 108
Редкоземельные металлы
567
Продолжение табл. 3
Способ получения
Область применения
Термическое восстановление
соединений редкоземель-
ных металлов (окислов,
нитридов и т. п.) алюми-
нием, цирконием и т. д.
с добавкой в качестве ак-
тиватора соли хлорноватой
кислоты
Амальгамирование по реак-
ции взаимодействия нат-
риевой амальгамы с вод-,
ными растворами хлорида
или ацетата
Восстановление окислов ред-
коземельных металлов рас-
плавленным магннем при
температуре 1000°
Восстановление фторидов
редкоземельных металлов
расплавленным магнием
при температуре 800°
Восстановление окислов
(Sm2O3 или Vb2O3) метал-
лическим лантаном
Бесспорных признаков образовании чистых
металлов не имеется
Производство сложных амальгам европия,
самария и иттербия, содержащих натрий
Производство сплавов с малым содержанием
редкоземельных металлов
Введение флюсов системы КаС1 — СаС12
CaF2 приводит к образованию сплавов
с высоким содержанием редкоземельных
металлов. Это содержание повышается
с увеличением порядкового номера эле-
мента. Исключением являются церий и
самарий. Процесс применяется на практи-
ке для получения металлических празео-
дима, неодима, гадолиния
Образуются окись лантана и металлические
самарий или иттербий
Литература
41, 46, 47,
57, СО, 70
52
51
51
20
Как правило, этот способ дает более чистые металлы, чем электролиз.
металл, диднм, металлический лантан, сплав металлических неодима
и празеодима и обогащенный лантаном мишметалл. Эти редкоземельные
металлы получают из соответствующих технических хлоридов. Типовой
анализ таких хлоридов на содержание редкоземельных металлов приво-
дится в табл. 4. Получаемые из этих хлоридов редкоземельные металлы
(табл. 5) по относительному составу несколько отличаются от исходных
хлоридов, поскольку с увеличением порядкового номера редкоземельных
металлов их электролиз все более затрудняется. В большинстве случаев
чистота технических редкоземельных металлов составляег 98—99%, и они
содержат в качестве примесей кальций, магний, углерод, алюминии, мар-
ганец, фосфор и кремний в общем количестве не свыше 1% и около 1%
железа. О составе этих металлов можно судить по данным табл. 5.
Безводные хлориды можно приготовлять непосредственно в электро-
лизере нагреванием гидратированных соединений, но лучше их обезвожи-
вать отдельно и затем расплавлять в электролизере. Безводные хлориды
588
Г л цва 22
сплавляют с хлоридами натрия, калия и кальция в чугунных или облицо-
ванных огнеупорами контейнерах, выполняющих роль анода [48, 72].
Сплавление осуществляетси путем наружного нагревания контейнера газом.
СОДЕРЖАНИЕ
TFXHH4ECKHX
Металл
Церий
Лантан
Празеодим
Неодим
Самарий
Гадолиний
РЕДКОЗЕМЕЛЬНЫХ
МЕТАЛЛОВ а h
Таблица
ИХ
ХЛОРИДАХ, ПОЛУЧЕННЫХ ИЗ МОНАЦИТА
}
Содержание в хлориде (%)
мишме-
талла
46,9
24,5
6,0
19,5
2,1
0,5
Иттрий и прочие металлы
0,5
дидииа
До
44
ш
37
4
1
1
1
7
5
6
2
и
0
церия
97 99
|
ii -з
1
1
J
лаитана
0,001
99,9
0,01
ь
]
Nd Рг
1
Ш
15
65
9
а Общее содержание этих редкоземельных металлов принимается рлзиым 100%.
Опущенные в ванну графитовые аноды обычно выделяют при электролизе
такое количество тепла, которого хватает для поддержания хлоридов в рас-
плавленном состоянии.
Таблица 5
СОСТАВ ТЕХНИЧЕСКИХ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Технический метллл
Лантан
Неодим — празеодим
Церий
Мишметалл а
ЛДнншеталл, обогащен-
ный лантаном а
Содержание. %
Се
<0,1
1
97
52
47
Nd
<0,1
78*
Рг
<0,1
1б'
0,9 0,5
18 5
19
6
Sni
<Р,1
2
1,1
1
1
лантан и
прочие
редкозе-
мельные
металлы
99,9
4
1,5
24
27
а Получают из монацита и часто продают под названием «цернс-
вын металл».
Ванна при электролизе должна быть нагрета выше температуры плавле-
ния металла (около 750° для мишметалла) с таким расчетом, чтобы металл
скапливался на дне электролизера, откуда его можно слить или отлить
в виде слитков. Обычно электролиз проводят при температурах 800—900°.
По мере спуска металла в электролизер можно загружать новую партию
хлорида редкоземельного металла и продолжать электролиз до тех пор,
пока в расплаве не накопится много примесей, которые либо дадут металл
низкого качества, либо недопустимо снизят выход годного.
Редкоземельные металлы ¦ 589
Сравнительно небольшое количество основного хлорида, образующе-
гося при дегидратации хлорида редкоземельного металл'а, позволяет под
держивать расплав в жидком состоянии, тогда как высокое его содержание
мешает образованию капель металла при электролизе. Присутствие даже
следов фосфата и сульфата в сырье сказывается отрицательно, так как они
заметно увеличивают скорость коррозии готового продукта на воздухе.
Катодная плотность тока должна составлять 3—4 а,дм2, поскольку
при иных условиях металл сильно распыляется, что затрудняет электролиз.
Металлы высокой степени чистоты [1. 2, 15, 19, 50, 58, 79, 81, 88]
Электролитические способы получения редкоземельных металлов
не годятся для их производства, если требуется высокая степень чистоты
готового продукта, потому что при электролизе в металл попадают примеси
из анода, катода и расплава.
Правда, предотвращение воздействия атмосферных газов позволяет
получать весьма чистый церий, если электролиз проводят с использованием
графитовых анодов в специально сконструированном электролизере, в кото-
ром расплав прикрыт затвердевшей коркой расплавленных солей. При таком
процессе церий образуется из смеси CeF3— LiF — BaF2 при температурах,
близких к температуре плавления церия. Чтобы восполнить убыль церия
из ванны, туда непрерывно добавляют двуокись церия. В готовом продукте
высокой степени чистоты содержание примесей не превышает нескольких
сотых долей процента. По этому же способу можно получать и иттрий из
расплава KCI — YCI3 [58].
Спеддинг и сотр. [1, 77,86,88] разработали способ получения весьма
чистых редкоземельных металлов путем восстановления чистых солей этих
металлов кальцием с последующей отгонкой кальция из образующегося
сплава этого металла с редкоземельным металлом. По этому способу полу-
чают лантан, церий, неодим, празеодим, гадолиний и дидим с хорошими
показателями по выходу. Самарий таким способом получать нельзя [1, 17,
77, 88]. Этот способ пригоден для получения всех редкоземельных металлов,
кроме самария, европия и иттербия, поскольку эти металлы устойчивы
в двухвалентном состоянии. По методике указанных авторов смесь безвод-
ного хлорида редкоземельного металла тщательно перемешивается с порош-
ком чистого металлического кальция, который берется с 10%-ным избытком
сверх стехнометрического количества, необходимого для реакции 2МС13 +
+ ЗСа = ЗСаС12 + 2М. Смесь помещают в предварительно дегазирован-
ный танталовый тигель, защищенный снаружи графитовой оболочкой.
Чистые безводные хлориды редкоземельных металлов получают либо их
дегидратацией газообразным хлористым водородом [42], либо обработкой
окисла или водного хлорида хлористым аммонием с последующей отгонкой
избытка NH4C1 в вакууме [69].
Если загрязнением металла его окислами можно пренебречь, то поль-
зуются тиглями из магнезии, но если же требуется получить бескислородный
металл, то необходимо применять танталовые тигли. Эти тигли с загрузкой
помещают в защитные графитовые тигли и нагревают в индукционной печи
в атмосфере очищенного аргона до необходимой температуры E75° для лан-
тана) и после окончания реакции собирают металл путем нагрева до тем-
пературы, приблизительно на 100 200° превышающей температуру пла-
вления редкоземельного металла. Затем шлак, представляющий хлорид
кальция, выщелачивают водой. Кальций A — 5%) и магний @,1 — 1%)
590 Г лав а 22
удаляются отгонкой. Для этого редкоземельный металл выдерживают
в индукционной печи при 1400° в вакууме. В готовом продукте содержание
кальция не превышает 0,015%. Отгонку кальция и магния производят
в тиглях из магнезии, извести, окиси бериллия или тантала.
Если не требуется особой чистоты металла, осуществляют восстановле-
ние кальцием в стальных бомбах с футеровкой из окиси кальция или в доло-
митовых тиглях, заключенных в стальную бомбу. Емкость таких тиглей
берется из расчета получения 900 г редкоземельного металла за одну опера-
цию. По этому способу берут смесь порошка кальция с безводным хлоридом
редкоземельного металла, в которую добавляют иод для ускорения реакции.
Смесь заключают в бомбу, нагреваемую снаружи в газовой печи при тем-
пературе 650—700°. Когда бомба нагреется приблизительно до 400Г|, начи-
нается реакция и ее теплота повышает температуру бомбы, что сопровож-
дается восстановлением хлорида редкоземельного металла и дальнейшим
нагревом бомбы до 1400е. Высокий нагрев бомбы на заключительной стадии
реакции позволяет редкоземельному металлу слиться воедино без включе-
ний шлака. Чтобы удалить кальций из металла, последний нагревают
в хорошо эвакуированной индукционной печн. Металл рекомендуется
нагревать в танталовом тигле. Этот способ дает хороший выход церия, лан-
тана, празеодима и неодима, по не годится для получения самария и чистого
игтрия, хотя им и пользуются для получения загрязненного иттрия, содер-
жащего около 30% редкоземельных металлов [88]. Последнее обстоятельство
обусловлено тем, что иттрнй относится к числу довольно тугоплавких
металлов, что затрудняет сбор металла воедино путем слияния отдельных
капелек расплавленного металла [1].
Получение самария этим путем сопряжено с трудностями. Все редко-
земельные металлы, устойчивые в двухвалентном состоянии (самарий,
европий и иттербий), трудно восстанавливаются до металла. Восстанавли-
вать кальцием трифторид, трниодид, трихлорид и дихлорид самария
не удается. Восстановление трибромида самария барнем дает низкий выход
чистого металлического самария [62]. Металлический самарий и металли-
ческий иттербий получают нагреванием окислов этих металлов в смеси
с лантаном в вакууме с последующей отгонкой самария и иттербия. В основу
этого способа положено то, что у лантана давление пара ниже, чем у про-
чих редкоземельных металлов, и что довольно большая теплота образования
окиси лантана благоприятствует восстановлению окислов самария и иттер-
бия с образованием этой окиси [20].
Более универсальный способ получения совершенно чистых редко-
земельных металлов и иттрия (за исключением самария, европия и иттербия)
заключается в восстановлении безводных фторидов кальцием. Безводные
фториды редкоземельных металлов получают либо фторированием окислов
безводным фтористым водородом при 575е, либо прокаливанием фтори-
дов, осажденных из водных растворов плавиковой кислотой (осадок
соответствует формуле MFj-'/jHsP и обезвоживается промывкой чистым
спиртом с последующей выдержкой прн 400° и давлении 100 мм. рт. ст.
в токе гелия), либо же сплавлением окислов редкоземельных металлов
с бифторидом аммония.
Безводный фторид смешивают с порошком металлического кальция,
который берут с 10—15%-ным избытком. Танталовый тигель с загрузкой
нагревают в атмосфере аргона, пока не начнется реакция. По завершении
реакции и редкоземельный металл, и шлак (фторид кальция) должны на-
ходиться в расплавленном состоянии. Конечная температура должна
несколько превышать 1418° (температура плавления фторида кальция).
Редкоземельные металлы 591
При получении иттрия и некоторых редкоземельных металлов иногда
добавляют магний для понижения температуры плавления металлической
фазы или хлорид кальция для понижения температуры плавления шлака.
Металлотермическое восстановление галогенидов при действии паров
металла-восстановителя на эти соединения в жидкой фазе при температу-
рах ниже температуры плавления редкоземельных металлов дает продукт
в виде кристаллической губки. Благодаря сравнительно слабому нагреву,
необходимому для восстановления, загрязнение редкоземельных метал-
лов материалом тигля и слаболетучими примесями значительно ограничи-
вается. По этому способу с успехом восстанавливают иттрий, гадолиний
и диспрозий. Губку переплавляют в вакууме и отливают в слитки. Ее можно
также спрессовать в виде электродов под давлением около 70 кг/смй и исполь-
зовать в качестве расходуемых электродов при дуговой переплавке.
РАФИНИРОВАНИЕ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ 136, 50]
В металлах, полученных электролизом расплавленных хлоридов, часто
содержатся включения растворимых галогенидов. Эти включения удается
частично удалять путем промывки водой с последующей переплавкой под
слоем расплавленного хлорида натрия или эвтектического флюса.
Для отдельных редкоземельных металлов обычно пользуются тиглями
из графита, молибдена, тантала или вольфрама. Дуговую плавку проводят
в водоохлаждаемых медных тиглях. В этих случаях всегда наблюдается
загрязнение материалом тигля, степень которого зависит от природы редко-
земельного металла. Жидкий иттрий смачивает молибден и тантал, благодаря
чему извлечение его слитков из танталовых и молибденовых тиглей воз-
можно только при разрушении последних.
В металлах, полученных по методу металлотермического восстановле-
ния, всегда содержатся примеси металла-восстановителя в том или ином
количестве, которое в случае металлической губки достигает 1?'о. Если
в качестве восстановителя пользоваться кальцием или магнием, то содер-
жание их примесей можно довести до нескольких сотых долей процента
путем нагревания металла в глубоком вакууме A0 s мм рт. ст.).
Зачастую источником загрязнения редкоземельных металлов являются
тигли. Можно было бы ожидать, что такие окислы с высокой теплотой обра-
зования, как окись бериллия, магнезия, известь, двуокиси тория и цирко-
ния, должны являться хорошим материалом для изготовления тиглей,
но и в этом случае содержание их примесей в редкоземельных металлах
достигает I—2%. Это объясняется условиями равновесия реакции взаимо-
действия редкоземельных металлов с этими окислами.
Редкоземельные металлы образуют амальгамы, в то время как окислы,
карбиды и другие соединения не взаимодействуют с ртутью. Поэтому вклю-
чения, представляющие собой такие соединения, можно удалять из металла
путем его превращения в амальгаму с последующей дистилляциоппой отгон-
кой ртути. Продуктом такой переработки является пирофорный порошок,
который поддается сплавлению в инертной атмосфере. Однако завершающее
рафинирование сопряжено с большими трудностями, обусловленными при-
родой устойчивых соединений, образующихся при взаимодействии ртути
с редкоземельными металлами.
Вакуумная плавка является эффективным средством очистки от таких
сравнительно летучих примесей, как кальций и магний. Дуговая вакуумная
плавка с расходуемым электродом очищает лишь от летучих металлов.
592
Глава 22
Редкоземельные металлы с довольно высоким давлением пара (сама-
рий, европий, иттербий) поддаются рафинированию вакуумной дистилля-
цией. Последняя позволяет эффективно удалять молибден, тантал и окислы,
но необходимый для данного способа рафинирования высокий нагрев сопро-
вождается внесением примесей материала тигля.
Процесс рафинирования металлов по Ван-Аркелю для редкоземельных
металлов не годится. Если судить по сообщениям печати, то очистку зонной
плавкой применяли только по отношению к гадолинию и иттрию, причем
этот способ малоэффективен для удаления примесей кислорода и азота.
Электролиз в твердом состоянии слитков иттрия сопровождается
частичным переносом примесей кислорода и азота к аноду. Этот способ
предполагает пропускание постоянного электрического тока большой силы
через нагретый металлический пруток, подвешенный на содоохлаждаемых
электродах в неподвижной атмосфере аргона.
Известны попытки рафинировать технические редкоземельные металлы
электролитическим путем с использованием солевых ванн [58J.
Таблица 6
СТЕПЕНЬ ЧИСТОТЫ ОТДЕЛЬНЫХ РЕДКОЛЯМЕЛЬНЫХ МЕТАЛЛОВ
электролитические
Церий \
Лантан J
Лантан
Церий
Празеодим
Самарий
Европий
Гадолиний
Тербий
Диспрозий
Гольмий
Эрбий
Тулий
Иттербий
Лютеций
Иттрий
вО^о иттрия
Сплав иттрия с магнием
Приблизительный coctjh или
степень загрязнения а
<0,1% железа: <0,05% углерода
кремния
<0,1% кальция
<С0,1°1) магния
<^0,1% железа
<1% тантала 6 во всех редкоземель-
ных металлах, за исключением лю-
теция, в котором содержание тан-
тала может достигать 3%
До нескольких процентов молибдена *
До 1% кислорода
<0,025% азота
<0,02»i углерода
20% редкоземельных металлов с примесью
нескольких процентов кислорода
15 — 20% магния, 60 — 70% иттрия,
Ю — 15% других редкоземельных ме-
таллов и около 5% других примесей
а Содержание примесей редкоземельных металлов зависит в большой мере от сте-
пени чистоты исходных материалов. Обычно степень чистоты редкоземельных метал-
лов составлчет 99 п SS,S%.
^ Примеси тантала и молибдена обычно попадают из стенок тиглей. Степень за-
грязнения ими зависит от тугоплаикости редкоземельного металла: чем шше его
температура плавления, тем больше степень загрязнения материалом тж ля.
ы
Таблица 7
Металл
а-Лантан
5-Лантан
Y-Лантан
а-Церий
З-Церий
у-Церий
6-Церий
а-Празеодим
^-Празеодим
а-Неодим
Р-Пеодим
а-Самарнй
З-Самарий
Европии
а-Гадолиний
З-Гадолиний
а-Тербий
Порядко-
вый но-
мер
57
58
59
60
62
63
64
ФИЗИЧЕСКИЙ
Атомный
вес
138.91
НО,12
140,907
144,24
150,35
151,96
157,25
CTpVKTy-
ря а
Vй
ГПУ
ГПК
КОЦ
КГЦ
ГПУ
КГЦ
коц
ГПУ
коц
ГПУ
коц
р
коц
ГПУ
коц
СВОЙСТВА РЕДКОЗЬМЕЛЬНЫХ
Параметры решет-
ки, А
а
3,770
5,304
4,26
4,85
3,68
5,1604
4,11
3,6702
4,13
3,6582
4,13
8,996
4,07
4,578
3,6315
4,06
с
12,131
11,92
11,828
11,202
26,25
5,777
МЕТАЛЛОВ И ИТТРИЯ [15, 2 7]
Радиус, А
атомный
1,877
1,875
1,90
1,71
1,82
1,825
1,83
1,828
1,84
¦1,821
1,84
1,802
1,81
2,042
1,802
1,81
ИОННЫЙ
1,22
1,18
1,16
1,15
1,13
1,13
1,11
Температура,
планле-
ния
920
725
935
1024
1072
826
1312
кипения
(прнбл.)
3470
3468
3127
3027
1900
1439
3000
"С
превраще-
ния
260
868
-196
— 73
725
800
862
917
1262
1лотность,
г/емз
6,174
6,186
5,97
8,23
6,66
6,771
6,67
6,782
6,64
7,004
6,80
7,536
7,40
5,259
7,895
7,80
Поперечное
сеченне зах-
вата тепло-
вых нейтро-
нов,
барн/атом
9,3±0,3
0,73±0,08
11,6±0,6
46,0±0,6
5600±200
4300±100
46,000±
±1,000
Металл
5-Тербий
Диспрозий
Гольмий
Эрбий
Тулий
а-Иттербий
З-Иттербий
Лютеций
а-Иттрий
(S-Иттрий
Мишметалл
Порядко-
вый но-
мер
65
66
67
68
69
70
71
39
57- 71
Атомный
вес
158,924
162,50
164,93
167,26
168,934
173,04
174,97
88,905
140,00
Структу-
ра а
ГПУ
ГПУ
ГПУ
ГПУ
ГПУ
КГЦ
КОЦ
КГЦ
ГПУ
КОЦ
Параметры решет-
ки, А
а
3,599
3,5923
3,5761
3,5590
3,5372
5,481
4,44
3,5050
3,6451
4,11
с
5,696
Я,6545
5.G174
5,592
5,5619
5,5486
5,7306
Радиус, А
атомный
1,782
1,773
1,766
1,757
1,746
1,940
1,98
1,737
1,81I
1,83
ионный
1,09
1,07
1,05
1,04
1,04
1,00
0,99
1.0G
Температура,
плавле-
ния
1356
1407
1461
1497
1545
'824
1652
1509
600—650
кипения
(прибл.)
2800
2600
2600
2900
1727
1427
3327
2927
Продолжение
'С
превраще-
ния
1317
798
1459
Плотность,
г/смЗ
8,272
8,536
8,803
9,051
9,332
6,977
6,54
9,842
4,478
4,25
6,67
табл. 7
Поперечное
сечение зах-
вата тепло-
вых нейтро-
нов,
барн/атом
46±4
950J-50
65±3
173±17
127±4
37±4
112±5
1,31±О,08
а ГПУ — гексагональная плотноупакованная; КГЦ- кубическая гранецентрнрованиая; КОЦ — кубическая объемнсцептрировацная; Р — ромбоэдрнче-
Таблица 8
ТЕПЛОВЫЕ СВОЙСТВА РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ И ИТТРИЯ
[5, 18. 35, 63, 75, 76, 82, 83, 89]
Металл
Лантан
Церий
Празеодим
Неодим
Самарий
Европий
Гадолиний
Тербий
Диспрозии
Гольмии
Эрбий
Тулий
Иттербий
Лютеций
Иттрий
Удельная
теплоем-
кость а»
ка г/моль - град
(прн 0°)
6,65
6,89
6,45
7,20
6,49
6,00
11,20
6,54
6,72
6,45
6,65
6,45
6,00
6,45
6,575Со
2,4
2,2
2,4
2,6
2,6
2,3
3,7
3,9
4,1
4,1
4,1
4,4
2,2
4,6
4,1
96
95
79
69
46»
.42»
72 в
70 й
67»
67 =
67в
59»
38»
90»
93в
В
87,6
85,3
76,7
49,9
41,1
77,7
71,4
72,6
57,5
40,0
70.6
Коэффициент
линейного
расширения,
10 -в /г pud
4,9 25»
7,9 400„
В,Э 25.
6,7 4ОС„
4,8 25=
6,8 400„
6,7 25„
32 50°
С4 25°
7,0 25-
8,6 26.
9,5 400„
9,2 25°
11,6 400.
25,0 2Б.
12,5 4ОС„
10,8 400„
Коэффициент
теплопровод-
ности при
28°,
кал/см-сгкУ.
Хград
0,033
0,026
0,028
0,031
0,021
0,024
0,023
0,0244
Теплота
сгорания,
ккал/г
1,851
1,493
1,438
1,379
1,352
3 Тепловые свойства мншметалла приведены в табл. 12.
б Прн температуре 25° (кроме иттрия).
11 Приблизительная величина.
Таблица 9
УПРУГОСТЬ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ а И ИТТРИЯ [И, 74]
Металл
Лантаи
Церий
Празеодим
Неодим
Самарин
Европий
Скорость распро-
странении звука
XI о-в,
в продоль-
ном на-
прев леи ни
2,8
2,3
2,7
2,7
2,7
см/сек
в попереч-
ном на-
правлении
1,5
1,3
1,4
1,4
1,3
Модул ь
дн}
нормаль-
ной упру
гости б
3,84
3,00
3,52
3,79
3,41
XI О11,
-JW2
сдвига
1,49
1,20
1,35
1,45
1,26
Коэффи-
циент
ГТ с в
уа СОИа
0,288
0,248
0,305
0,306
0,352
Адиабатиче-
ская сжимае-
мость XI 0е
см2/кг
3,24
4,95
3,28
3,02
2,56
6,99
38*
Металл
Гадолиний
Тербий
Диспрозий
Гольмий
Эрбий
Тулий
Иттербий
Лютеций
Иттрий
Скорость распро-
странения звука
ХЮ-5, см/сек
В ПРОДОЛЬ-
НОМ на-
правлении
3,0
2,9
3,0
3,0
3,1
1,8
4,3
в попереч-
ном на-
правлении
1,7
1,7
1,7
1,7
1,8
1,0
2,4
Модуль
нормаль-
ной упру-
гости 6
5,62
5,75
6,31
6,71
7,33
1,78
6,63
Продолжение
XI0-11,
сдвига
2,23
2,28
2,54
2,67
2,96
0,70
2,62
Коэффи-
циент
Пуассона8
0,259
0,261
0,243
0,255
0,238
0,284
0,265
табл. 9
Адиабатяче-
ская сжимае-
мость вХ10",
2,52
2,45
2,39
2,14
2,11
7,12
2,09
d Данные об упругости мишметалла прииедеиы в табл. 12.
б Расчетные значения,
в При температуре 27°.
Таблица 10
МАГНИТНЫЕ И ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА РЕДКОЗЕМЕЛЬНЫХ МРТАЛЛОБ а
И ИТТРИЯ [12, 13, 18, 27, 63, 75, 76]
Металл
Лантан
Церий
Празеодим
Неодим
Самарин
Европий
Гадолиний
Тербий
Диспрозий
Гольмии
ЭрбнЛ
Тулии
Иттербии
Магнитная
восприимчи-
вость б,
3. м. е.
115
700
5470
3460
1320
224
Фсрромаг-
иитен
172 000
590
437
300
152
81
Магнитный
момент,
магнетоны
Бора
0Г
2,4
3,6
3,6
1,5
7,95
9,0
10,2
10,9
10,0
7,6
Точка Кюри,
15Д
289 Ф
230 Ф
85—175 П
20 132 П
20 Ф
51 Д
Удельное
элеклросоп-
ротиплеимс ®,
мком-см
57
75
68
64
92
81
134
116
91
94
8С
90
28
Температур-
ный коэффи-
циент в.
W-3/град
2,18
0,87
1,71
1,64
1,48
4,8026„
0,9 1,76
1,19
1,71
2,01
1,95
1,30
Продолжение табл. 10
Металл
Лютеций
^ттрнй
Магнитная
восприимчи-
вость б,
э. м. е.
17,9
Слабая
парамагнит-
ность
Магнитный
момент,
магнетоны
Бора
0
ог
Точка Кюрн,
°К
Удельное
электросоп-
ротивление ^i
мким • см
68
53
Температур-
ный коэффи-
циент Bi
10-з; г рад
2,40
2,71
а Данные о магнитных свойствах сплавов гадолиинй — лантан и гадолиний — иттрии см. б
работе [90].
6 При температуре 25°.
в При температуре 0°.
1 Приблизительная величина.
Примечании: Д — парамагнитен при температурах выше и диамагнитен при температу-
рах ниже указанной; П — парамагнитен при температурах выше наибольшего нз двух указанных
эиачеиви, диауагннтек в указанном температурном интервале и ферромагннтен прн температурах
ниже указанного интервала; Ф- ферромагннтеи прн температурах ниже указанной.
Таблица II
ДАВЛЕНИЕ ПАРА РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ [03, 84: ПО, 111]
Металл
Лаитан
Церий
Празеодим
Неодим
Самарий
Европий
Гадолиний
Тербий
Диспрозий
Гольмий
Эрбий
Тулий
Иттербий
Лютеций
1°Вр(.ммрт. ст.
а
17 185
—23 400
— 17 188
в
1,2552
ь
372
440
243
0,0045
Т ( К)
с
6,605
11,58
8,092
•
—9,1761
+ (c±d)
J
0,201
0,29
0,156
е
i
1
i
0,0457
104
Давление пара
{мм рт. ст.) при 0е
и давлении
1 мм рт, ст.
2331
1748
1850
1767
1463
I О-3 мм рт.
г т.
1535
1331
1275
1193
1005
598
Глава 22
Типичный состав и степень загрязнения различных редкоземельных
металлов и иттрия высокой степени чистоты указаны в табл. 6.
ФИЗИЧЕСКИЕ СВОЙСТВА
Неокисленная поверхность редкоземельных металлов имеет метал-
лический светло-серебристый блеск. Более активные металлы на воздухе
быстро тускнеют, покрываясь темной окисной пленкой. Потускнение идет
энергичнее во влажном воздухе. На поверхности более активных и недоста-
точно чистых металлов образуется малопрочная по сцеплению пленка
окислов, которая отслаивается, обнажая свежую поверхность, где. окисле-
ние продолжается.
Физические, тепловые, упругие, магнитные и электрические свой-
ства, а также данные о давлении пара редкоземельных металлов приве-
дены в табл. 7—11. Типичные характеристики мишметалла и ферроцерия
перечислены в табл. 12.
Таблица 12
свойства мишмсталла и ферроцерия
(по данным фирмы «Ронсои металс корпорейшн»)
Характеристика
Удельный вес
Температура плавления, °С
Твердость по Роквеллу (шкала I5T)
Твердость по Брннеллю
Модуль упругости, кг/мм2
Предел прочности при растяжении, кг/мм?
Предел текучести (предел упругости или пре-
дел пропорциональности), кг/мм2
Относительное удлинение (на длине 50 мм), %
Предел прочности при сдвиге, кг/мм*
коэффициент линейного расширения, 10~е/град
24° (реперная температура)
100°
288'
399°
593°
649°
Мишметалл
6,67
1100—1200
393—649
35
2240
80
38,5
1,3
85
0
100
1500
2500
3200
Ферроцерий
6,65
1600—1800
871—982
85
4970
104
76
0,27
94
0
700
2900
4300
9800
13000
О кристаллической структуре редкоземельных 'металлов и иттрия
[27, 54] можно судить по данным табл. 7. Наиболее распространенной струк-
турой при комнатной температуре является гексагональная плогноупако-
ваниая. Лантан, празеодим и неодим кристаллизуются в гексагональной
решетке типа лантана (A3'); скандий, иттрий и все редкоземельные металлы
от гадолиния до лютеция, кроме иттербия имеют гексагональную плотно-
А-Слпи
[Следующая
злеиентариая d
ячейки)
В -Спой
А-Сяои ?^fjS2
а
Нормальная гжогпшлыюя а Слой
решспта типа Mq,A 3 (Следующая
= злсмснтиртя
А -Слой
(Следующая
элементарная»
ячейт)
С Слой
В - Слой
А Слой
in)
Гексагональная решетка
(двуосния и шщювжнии оси с)
типа 1.а, А 3'
Нупичгпнпя ъ'ранецеит/шрпюи ¦
на я плаинюунаиоеотюя
решетка типа Си , Л 1
Гексагональная решетка
типа S/ii
600 Глава 22
упакованную структуру типа магния (ЛЗ). При комнатной температуре
церий и иттербий кристаллизуются в кубической гранецентрированной
решетке типа меди (Л 1). Самарий при комнатной температуре имеет гекса-
гональную структуру с осевым числом в 4,5 раза больше, чем у обыкновен-
ной гексагональной решетки. Европий кристаллизуется в кубической объем-
ноцептрированной решетке типа вольфрама (А2). В этом отношении он отли-
чается от всех прочих редкоземельных металлов. О структуре прометии
данных не имеется.
Вопрос о температурных модификациях церия был предметом тщатель-
ного изучения. Охлаждение обычной при комнатной температуре у-модифи-
кации с кубической объемиоцентрированной решеткой сопровождается
ее превращением в р-моднфикацию, начинающимся при температуре
— 10° и протекающим вплоть до — 178°. Ниже этой температуры ум°-
днфикяция превращается непосредственно в а-церпй. Количество обра-
зовавшегося р-церия зависит от скорости охлаждения, степени загрязнения
церия примесями и условий предшествующей деформации и обработки.
Обработка церия давлением при комнатной температуре подавляет или
полностью предотвращает превращения уцерия в р-модификацию, а обра-
ботка охлажденного церия давлением при комнатной температуре сопро-
вождается превращением р-церия в У"модиФикаЦию- Наклеп при —196
способствует образованию а-модификации. Низкотемпературные фазовые
превращения протекают с широкой петлей гистерезиса.
Церий имеет структуру гранецентрированного куба с периодом решетки
при температуре жидкого азота а = 4,85 А. Оказалось, что металл сохраняет
эту структуру даже под давлением 15 000 am. При комнатной температуре
устойчивы обе модификации — гексагональная плотноупакованная и куби-
ческая гранецентрированная. Последняя модификация образуется при
быстром охлаждении металла, а первая — при термообработке чистого
металла. В техническом церии содержится такое количество примесей
кальция и магния, которого оказывается достаточно, чтобы помешать обра-
зованию кубической гранецентрированной структуры.
Некоторые элементы стабилизируют аллотропические модификации
редкоземельных металлов. Так, магний и медь стабилизируют высокотем-
пературные модификации лантана и церия с решеткой объемноцептриро-
ванного куба, а торий, уран, плутоний и углерод стабилизируют фазу
с решеткой гранецентрированного куба. Высказывалось предположение,
что вообще элементы с валентностью ниже трех должны стабилизировать
фазу с решеткой объемноцентрированного куба, а элементы с валентностью
выше трех — кубическую гранецентрированную структуру. В литературе
попадаются сообщения и о прочих проявлениях стабилизации модифи-
каций.
Ряду редкоземельных металлов присуще аномальное изменение объема
и электрического сопротивления под высоким давлением. Подобная анома-
лия не распространяется на иттрий, неодим, самарий, европий, тулий и
лютеций.
Наличие в церии примесей железа в количестве 0,0596 изменяет вели-
чину магнитного момента. Несколько процентов железа в церии изменяют
форму кривой зависимости магнитной восприимчивости от температуры,
но сохраняют неизменным положение магнитных аномалий. Присутствие
примесей магния вместе с железом существенно отражается на магнитных
свойствах. Примесн магния и кальция понижают точку Кюри в церии
и гадолинии и видоизменяют характер аномального расширения при низких
температурах.
Редкоземельные металлы
601
МЕХАНИЧЕСКИЕ СВОЙСТВА
Редкоземельные металлы, как правило, мягки и ковки, но их ковкость
и твердость в большой степени зависят от примесей. Большое содержание
таких примесей, как кислород, сера, азот и углерод, сильно изменяет меха-
нические свойства, повышая твердость и понижая пластичность. Например,
бескислородный церий весьма ковок и легко прокатывается, тогда как
включения окислов, образующихся при переплавке, сильно снижают ков-
кость. Если степень чистоты редкоземельных металлов не очень высока,
то обычно металлы электролитического производства оказываются тверже
металлов, полученных другими способами. Твердость зависит также до неко-
торой степени от способа отливки металла и его возраста. Хранение электро-
литического церия при комнатной температуре сопровождается его посте-
пенным старением, в процессе которого он становится все тверже.
В литых редкоземельных металлах имеются включения как по границам
между зернами, так и внутри самих зерен. Зерна обычно бывают крупными,
причем их величина возрастает с уменьшением содержания включений.
Твердость редкоземельных металлов повышается с увеличением поряд-
кового номера элемента. Исключением из этого правила являются европий
и иттербий. Твердость конкретного образца зависит от предшествующей
термообработки и способа получения. Как общее правило, твердость полн-
крнсталлических образцов лантана и церия высокой степени чистоты изме-
няется в пределах от 25 до 50 единиц по Роквеллу (нагрузка 10 кг), а для
Таблица 13
MFXAHH4ECKHE СВОЙСТВА ИТТРИЯ, СКАНДИЯ И РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ а
Металл
Скандий
Иттрий
Лантан
Церии
Пралсодим
Неодим
Самарий
Европий
Гадолиний
Тербий
Диспрозии
Гольмий
Эрбий
Тулий
Иттербий
Лютеций
Твер-
„ость
"и1
кг/мм-
85
60
40
25
40
35
45
20
55
60
55
G0
70
65
25
85
Предел
проч-
HflCTH
при
расгя-
жеини.
10- 14
13
11
10
17
14
—
20
—
25
27
30
—
7
—
Пре-
дел
теку-
чести.
кг/мм%
7 10
13
9
10
15
11
—
16
—
23
22
30
—
7
—
11 ре дел
проч-
ности
при
сжа-
тии,
кг/мм?
40
80
22
30
33
25
—
—
_
—
_
78
—
—
—
Отно
ситель-
ппе
удли-
нение
%
5—10
8
24
10
11
3
—
8
_
6
7
4
—
6
—
СИ-
тел ь-
иое
тие. %
17
—
33
18
36
—
—
—
—
22
—
—
—
Мо-
дуль
упру-
ГОСТИ
X 1 0 2,
кг/мм-
63—70
39
31
36
38
35
-
57
58
64
68
74
—
18
—
Мо-
дуль
сдвига
XI0-2.
кг/ммЪ
27
15
12
14
13
13
—
22
23
26
27
30
—
7
•*~
КО9ф-
фнци-
еит
Пуас-
сона
0,27
0,29
0,25
0,31
0,31
0,35
—
0,26
U,26
0,24
0,26
0,24
0,28
—
Сжи-
мае-
мость
XI 0-е.
смЪ/кг
2,1
3,2
5,0
3,3
3,0
2,6
—
2,5
2,5
2,4
2,1
2,1
2,6
7,1
2,3
а Наиболее достоверные значения, вычисленные по опубликованным в литературе сообще-
ниям и на основе лабораторной практики [71].
E02 Глава 22
более тяжелых редкоземельных металлов этот интервал прнстираетси
от 50 до 90 единиц. В большинстве случаев редкоземельные металлы сильно
наклёпываются [71].
Механические свойства отдельных редкоземельных металлов приведены
в табл. 13.
Предел прочности и предел текучести редкоземельных металлов обычно
соответствуют нх тугоплавкости, повышаясь с увеличением порядкового
номера элемента. Исключением из этого правила является иттербий, кото-
рым в этом отношении больше подобен щелочноземельным металлам. Наклеп
повышает прочность тем значительнее, чем выше порядковый номер. Тяже-
лые редкоземельные металлы, начиная с гадолиния, обладают такой проч-
ностью, которая позволяет считать их высокопрочными легирующими при-
садками. По своей упругости иттрий сравним с алюминием и магнием.
а по прочности — с титаном [71].
Вопрос о влиянии незначительных примесей и металлических добавок
на механические свойства редкоземельных металлов мало изучен; для ит-
трия эти данные известны [14]. Обычные примеси элементов внедрения
(углерод, азот, _ кислород и водород), если они присутствуют в малом
количестве, слабо влияют на пластичность и прочность иттрия, чем послед-
ний разительно отличается от большей части прочих металлов. Твердость,
пластичность и предел текучести иттрия больше всего зависят от пред-
шествующей термообработки, ориентировки зерен и степени наклепа. Титан,
ванадий и хром дают с иттрием сходные диаграммы состояния, в которых
эвтектика смещена к богатому иттрием краю диаграммы. В концентрации
до 5% эти металлы не оказывают вредного влияния на пластичность иттрия.
Кремний, алюминий, железо н никель малорастворимы в иттрии, так что
в концентрации до 0,5% они почти не отражаются на прочности и вели-
чине предела текучести иттрия. В пределах до 5% их содержания пластич-
ность иттрия понижается.
ХИМИЧЕСКИЕ СВОЙСТВА
Редкоземельные металлы — энергичные восстановители, хотя в сухом
воздухе они обладают лишь умеренной устойчивостью. Способность металлов
взаимодействовать с влажным воздухом в большой степени зависит от их
чистоты. Следы сульфата и фосфата, попадающие в мишметалл из исходного
хлорида, вызывают преждевременное окисление «кремней» для зажигалок.
При атмосферном окислении редкоземельных металлов образуются гидра-
тнрованиые окислы с большим объемным приростом. Это приводит к разру-
шению защитной окисной пленки н обнажению металлической поверхности.
Корродирующее воздействие воздуха и воды на редкоземельные металлы
сильно зависит от природы последних. Больше всего разъедается европий,
за которым следуют лантан, церий, празеодим и неодим. На этих металлах
в атмосфере быстро образуется окисная пленка. Прочие редкоземельные
металлы и иттрий сравнительно устойчивы на воздухе. С водой европий
образует растворимое в воде соединение желтого цвета Еи(ОНJ-2Н2О,
которое затем при окислении превращается в белый продукт, являющийся,
по всей вероятности, окисью европия 185]. Вода медленно взаимодействует
с металлами, причем это взаимодействие протекает энергичнее при нагрева-
нии. Металлы легко растворяются в разбавленных кислотах, но стойки по
отношению к концентрированной серной кислоте. Некоторые данные
о скорости коррозии редкоземельных металлов на воздухе приводятся
в табл. 14.
Редкоземельные металлы
603
Таблица 14
СКОРОСТЬ КОРРОЗИИ (ивМмг-сутки) РЕДКОЗЕМЕЛЬНЫХ
МЕТАЛЛОВ НА ВОЗДУХЕ [50]
Лантан
Церий
Празеодим
Неодим
Самарий
Гадолиний
Тербий
Диспрозий
Гольмий
Эрбий
Иттербий
Иттрий
Условия коррозии (температура
и относительная влажность)
80 950
76
7
0
2
0
0
1
1
510
9U0
60
о
о
о
о
1
о
75?!
21000
5 0U0
2000
100
35
43
200°
30
—
80
70
15
0
0
11
10
—
4
400°
3 200
200 000
38000
380
17
210
1 600
350
ПО
90
170
40
600°
13000
130 000
4 800
35
16 000
40 000
6600
5 400
720
1900
Редкоземельные металлы восстанавливают окись углерода, двуокись
углерода и четыреххлористый углерод. Поэтому последний не годится для
тушения пожаров, при которых горят эти металлы. Они восстанавливают
окислы железа, кобальта, никеля, марганца, хрома, молибдена, ванадия,
титана, тантала, кремния, бора, олова, ниобия, свинца и циркония. Элек-
тродные потенциалы редкоземельных металлов указаны в табл. 15.
Редкоземельные металлы загораются на воздухе при 150—180° (лантан
воспламеняется в этих условиях при 440—460°), а наиболее загрязненные
образцы и сплавы с высоким содержанием церия пирофорны. Пирофорное
поведение металлов при напиливании, видимо, зависит в большой степени
от содержания и природы примесей. Бескислородный металлический церий
при разрезке и напяливании пепирофорен. но включения окислов вызывают
нагрев, сопровождающийся воспламенением кусочков.
При температурах выше 200° редкоземельные металлы энергично сго-
рают в атмосфере галогенов. Нагрев этих металлов в азоте до температур
выше 1000° сопровождается образованием нитридов. Они взаимодействуют
с серой при се кипении с образованием полуторных сульфидов. Путем непо-
средственного взаимодействия образуются также карбиды, силициды, фос-
фиды, антимониды и висмутиды. С водородом редкоземельные металлы
образуют гидриды внедрения. При комнатной температуре водород погло-
щается редкоземельными металлами с выделением тепла. При температуре
300° поглощение водорода происходит быстрее с образованием хрупкого
аморфного твердого продукта неопределенного состава, приблизительно
отвечающего формуле MH2i6. Этот продукт устойчив в сухом воздухе, но
воспламеняется во влажном. При нагреве гидридов в вакууме до темпе-
ратур выше 1000° происходит выделение водорода. Гидриды растворяются
в кислотах и разлагаются щелочами.
Металлические европий и иттербий растворяются в жидком аммиаке
с образованием голубых растворов [104]. Самым активным из редкоземель-
604
Глава 22
Таблица 15
ЭЛККГРОДНЫЕ ПОТЕНЦИАЛЫ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ а
(по отношению к водородному электроду)
Лантан
Церий
Празеодим
Неодим
Самарин
Европий
Гадолиний
Тербий
Диспрозий
Гольмий
Эрбий
Гулий
Иттербий
Лютеций
I я (s) = La3+ + Зе~
Сс (s) = СеЗ+ [ Зс-
Pr (s) - РгЗ+ + Зе-
Nd (s) = КсР+ 4- -Ае-
Sra (s) = Sm3+ + 3e~
Eu (s) = EU3+ + 3e-
Gd (s) = Gd^ f 3e-
Tb (s) = Tb»+ -J- 3e-
Dy (s) = Dys+ - 3e-
Ho (s) = Ho3+ + 3e-
Er (s) = Er3+ + 3e-
Tu (s) = Tl3+ 1 3e-
Yb (s) = Yb3+ -|- 3f"
Ll (s) = Lu3+ + 3e-
Э. д. с. о
+2,4
2,355
2,2
2,246
2,2
2,2
2,2
2,2
2,2
2,1
2,1
2,1
2,1
2,1
я Все значения приближенные [ЮР], кроме значений для церия и неодима,
заымствовчпных из рабиты [87J.
пых металлов является европий. Он быстро корродирует на воздухе
и по своему взаимодействию с водой напоминает кальций. Фактически
и европий и иттербий стоят ближе к щелочноземельным металлам, чем
к другим редкоземельным металлам. Это справедливо в отношении химиче-
ской активности и таких физических свойств, как кристаллическая струк-
тура, летучесть, тугоплавкость, тепловое расширение и сжимаемость.
В табл. 16 приводятся данные о разъедании огнеупоров редкоземель-
ными металлами.
ОБРАБОТКА РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ [3,9,107]
В отношении обработки иттрий изучен лучше, чем редкоземельные
металлы. Способы обработки иттрия обычно применимы и ко всем редко-
земельным металлам, кроме совершенно мягких иттербия и европия.
Литые слитки приходится обрабатывать с целью облагораживания
структуры и измельчения крупного зерна. Подобная первоначальная обра-
ботка, повышающая удлинение и вязкость, осуществляется путем выдавлива-
ния в холодном и горячем состояниях, ковки, прокатки и обработки на
ротационно-ковочной машине. Отжиг при температуре 510° с последующим
медленным охлаждением способствует размягчению более тяжелых редко-
земельных металлов, но оказывает слабое влияние на легкие металлы. Отжиг
и обработка давлением при повышенных температурах требуют защитных
контейнеров или инертной атмосферы для предотвращения коррозии. При
высоких температурах все редкоземельные металлы обладают большим
сродством к кислороду, водороду и прочим активным газам.
Таблица 16
ВЗАИМОДЕЙСТВИЕ РАСПЛАВЛЕННЫХ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
С ОГНЕУПОРАМИ [I, 26]
Огнеупор
Области применения и ограничения
Окислы
Магнезия
Известь
Окись бериллия
Глинозем \
Двуокись циркония !
Дъуокись тория (
Кремнезем J
Окислы редкоземельных ме-
таллов
Металлы
Тантал "I
Молибден /
Вольфрам
Медь
Железо
Никель
Прочие огнеупоры
Плавиковый шпат
Графит
Углерод
Стекло, фарфор и т. п.
Металлический церий разъедает тугоплавкие окислы
слабее, чем неодим, празеодим и дидим. Все окислы
слегка разъедаются с образованием окисной пленки
на поверхности металла, которая затрудняет отлияку
Лучший из тугоплавких окислоа, применимый до 1200°
Хороший огнеупор, стойкий при температурах до 1000э
Огнеупор удовлетворительного качества, применимый
в отдельных случаях для нагрева до 1250°
Разъедаются жидкими металлами
Слабо разъедаются, но применимы для нагрева до 1200-
Н00°. Все окислы смачиваются жидкими металлами
Хорошие огнеупоры. В вакууме тантал применим для
нагрева до 1700°, а молибден — до 1400°, но иа воз-
духе они оба разъедаются при температурах ьыше
500е. Хотя они и смачиваются редкоземельными ме-
таллами, в них оии не растворяются. Как огнеупор
тантал превосходит магнезию. Жидкие галогениды
редкоземельных металлов, эти металлы не разъе-
дают
Медленно разъедается расплавленными редкоземельными
металлами, но стоек по отношению к действию распла-
вов хлоридов редкоземельных металлов
Разъедаются расплавленными редкоземельными металла-
ми в разной степени в зависимости от уроьня нагрева.
Промышленные электролизеры можно отливать из
чугуна
Хороший огнеупор при низких температурах; быстро
разъедается при повышенных температ\рах с образо-
ванием сплава кальция с редкоземельным металлом
iMeдлeннo разъедаются расплавленными редкоземельны-
ми металлами, но стоики по отношению к действию
расплавов галогенидов этих металлов
В качестве огнеупоров не годятся
Примечание. Степень повреждения огнеупоров завысит от масштабов производства
и степени нагрева. Приводимые адесь сведения иосят характер обзорной сводки-
606 Глава 22
Успешность обработки редкоземельных металлов существенно зависит
от их степени чистоты. Примеси кислорода в количестве свыше нескольких
десятых долей процента обычно серьезно затрудняют обработку.
По крайней мере некоторые редкоземельные металлы поддаются выда-
вливанию при нагреве до 480—900° с использованием защитного покрытия
из окиси алюминия или меди. И хотя отдельные металлы проявляют тен-
денцию к взаимодействию с медным покрытием, это взаимодействие можно
сделать минимальным, если выдавливание производить при следующих
температурах: самарий 500е, гадолиний 650е, диспрозий 650е [3]. Мяг-
кий европий можно выдавливать через матрицы с малыми отверстиями.
Ковка измельчает зерно, но производить ее следует с предосторожно-
стями, чтобы избежать растрескивания при первоначальном деформирова-
нии. Типичная операция по ковке металлическою иттрия дуговой выплавки
начинается со слитков диаметром около 250 мм, которые нагревают до 870°
в инертной атмосфере. Прессовая ковка осуществляется с обжатием на 3 мм
за проход до диаметра около 100 мм с промежуточным отжигом при 870".
После ковки металл можно катать вгорячую или обрабатывать на ротационно-
ковочной машине при температурах выше его температуры рекристаллиза-
ции E40—650° для иттрия). Оптимальной температурой горячей прокатки
иттрия и его обработки на ротационно-ковочной машине с обжатием
на 10—25% за проход следует считать 760—870°. Эти механические операции
по обработке иттрия не требуют защитных контейнеров, поскольку неболь-
шое количество образующейся окисной пленки легко удаляется. Если
требуется более высокая степень обжатия, то без защитных контейнеров
обойтись при горячей ковке нельзя. Слитки иттрия покрывают окисью алю-
миния и заключают в оболочку из нержавеющей стали 446. Ковку ведут
с нагревом до 870°. Доброкачественный нттрий можно прокатать вгорячую
до тонкого листа за необходимое число проходов с промежуточными отжи-
гами. Небольшие добавки хрома, алюминия или ванадия улучшают обра-
батываемость иттрия в холодном состоянии.
Большая часть редкоземельных металлов поддается холодной ковке,
если содержание в них примесей кислорода, кальция и магния выдержи-
вается на достаточно низком уровне, а металлы предварительно подвер-
гаются горячей обработке давлением и при ковке еще и отжигу.
Редкоземельные металлы поддаются механической обработке подобно
мягкой стали. Исключением являются лишь более мягкие церий, европий
и иттербий. Мелкие частицы и тонкая стружка могут воспламениться, так
что обработку следует производить под маслом. Стружку н кусочки необ-
ходимо хранить в металлических контейнерах под маслом, не допуская их
скопления у оборудования, пока они не будут сожжены или переплавлены.
Чтобы уменьшить опасность возникновения пожара, при механической обра-
ботке нужно снимать как можно более массивную стружку. Масло, исполь-
зуемое при механической обработке редкоземельных металлов, и охлаждаю-
щая жидкость, применяемая при фрезеровании, должны обладать высокой
температурой воспламенения. Многие металлы, в том числе иттрий, можно
подвергать механической обработке всухую. Шлифование особых трудностей
не представляет, если пользоваться высокопроизводительным инструментом
и маслом, либо растворимым в воде, либо обладающим высокой- температу-
рой воспламенения.
Отливать из редкоземельных металлов сложные профили не удается.
Вообще литейные операции ограничиваются вакуумной плавкой при произ-
водстве слитков. Из-за способности редкоземельных металлов восстанавли-
вать кислые огнеупоры из последних нельзя делать тигли, если эти металлы
Редкоземельные металлы 607
необходимо сохранить чистыми. При использовании индукционных печей
для нагрева возможно литье в настыли.
Редкоземельные металлы, по крайней мере иттрий, сварке не поддаются,
даже если ее производить в атмосфере инертного газа. При охлаждении
сваренного места, обычно в его середине, образуются трещины, особенно
если в металле содержится свыше нескольких десятых долей процента
кислорода.
Мишметалл, являющийся исходным техническим продуктом, обычно
поставляется в видеодисков весом 18—25кг, слитков, прутков, проволоки,
токарных заготовок и порошка. Отливку производят либо в вакууме, либо
в инертной атмосфере, либо под слоем солевого флюса (хлорид бария).
ОБЛАСТИ ПРИМЕНЕНИЯ
В основных областях применения редкоземельных элементов тре-
буются скорее их соединения, чем сами металлы. В большинстве случаев
такого применения потребляется смесь соединений редкоземельных эле-
ментов такого приблизительного состава, какой характерен для руд этих
металлов. Кроме того, существует значительный спрос и на цериевые
сплавы.
Технический мишметалл выпускается с самого начала XX в. Произ-
водство электролитического церия, лантана и сплава Nd — Pr удалось
наладить в сороковых годах. Отдельные редкоземельные металлы и иттрий
высокой степени чистоты стали доступны лишь к концу пятидесятых годов.
Около одной четверти всех выпускаемых соединений редкоземельных
элементов потребляется в области электродугового освещения. Угольные
электроды в оболочке из редкоземельных металлов незаменимы в кинопро-
мышленности и применяются как при съемках в студиях, так и в кино-
театрах. Подобные же электроды используются в прожекторных установ-
ках военного назначения.
Еще около четверти производства редкоземельных металлов приходится
на смешанный металл (мишметалл) и металлический церий. Они исполь-
зуются для изготовления «кремней» для зажигалок и при производстве
магниевых и некоторых железных сплавов. В некоторых случаях примене-
ния редкоземельных металлов в качестве легирующих добавок пользуются
не самими металлами, а их солями.
Около одной четверти выпускаемых соединений редкоземельных эле-
ментов потребляется в стекловаренной промышленности Соединения
неодима и празеодима, соли церия и других элементов широко применяются
как для окрашивания, так и для обесцвечивания стекла. Окись церия и неко-
торые специальные смеси окислов редкоземельных элементов широко при-
меняются для полирования линз оптических приборов и зеркального стекла.
Остальная четверть потребления редкоземельных металлов приходится
на многие самые разнообразные области применения.
Сплавы редкоземельных металлов
Самым важным сплавом редкоземельных металлов является мишметалл.
Обычно он содержит 45—50% церия, 18% неодима, 5% празеодима, 1 % сама-
рия, 22—25% лантана и небольшое количество прочих редкоземельных
металлов. Содержание редкоземельных металлов в техническом мишметаллс
составляет около 94—99%. Остальная доля приходится на примеси алюми-
Таблица П
ДИАГРАММЫ СОСТОЯНИЯ СИСТЕМ С РЕДКОЗЕМЕЛЬНЫМИ МЕТАЛЛАМИ И ИТТРИПМ
Система
Соединения
Литература
Лантан—алюминий
Лантан—сурьма
Лантан—церий
Лантан—медь
Лантан—золото
Лантан—свинец
Лантан—магний
Лантан—марганец
Лантан—никель
Лантан—серебро
Лантан—таллий
Лантан—олово
Лантан—титан
Лантан—цинк
Лантан—цернй—серебро
Лантан—железо
LaAl, LaAl2, LaAl4
La2Sb, LaSb, LaSb2, La3Sb2
Соединений нет; твердый раствор
LaCu, LaCu2, LaCu3, LaCu4
La2Au, LaAu, LaAu2, LaAua
La2Pb. LaPb, LaPb2
LaMg, LaMg2, LaMg3, LaMge
La3Ni, LaNi. LaNi2. LaNi3, LaNi4, LaNi5
LaAg, LaAg2, LaAg3
La2Tl
La2Sn, LaSn3, La2Sn3
Соединений нет; растворимость в титане
мала
LaZrig, LaZnn
Соединений нет; растворяется в жидком
н не растворяется в твердом состоянии
Лантан—уран Растворимость лантана мала
Для систем лантана с мышьяком, висмутом, углеродом, кадмием, хро-
мом, галлнем, водородом, ртутью, азотом, кислородом, кремнием,
натрием, кислородом и серой диаграмм не имеется, но есть отдель-
ные данные
Цернй—алюминий Се3А12, СеА], СеА12, СеА14
Церий—висмут Ce3Bi, CeBi, CeBi2, Ce4Bi3
Цернй—кобальт Сс3Со, СсСо2, СсСо3, СеСо6
Цернй—медь СеСи, СеСи2, СеСи4, СеСи6
Церий—золото CeAu3, CeAu2. CeAu
Церий—ннднй Ce3ln, Ce2ln, Celn, Ce2ln3
Цернй—железо CeFe2, CeFe5
Церий—свнпец Сс2РЬ, СеРЬ. СеРЬ3
Цернй—магний CeMg, CeMg2, CeMg3
Церий—никель Ce3Ni, CeNi, CeNi2, CeNi3, CeNi4, CeNi6
Церий—кремний CeSi
Церий—серебро CeAg, CeAg2, CeAg3
Цернй -таллий Сс2Т1, CeTl, CeTlj
Цернй—сера CeS, Ce2S3, Ce2S2
Церий—торнй Соединений нет; твердый раствор
Церий—олово « Ce2Sn, Ce2Sn3, CeSn3
Цернн—тнтан Соединений нет в интервале до 50% церия
Церий- цинк CeZnB, CeZnn
Церии — уран Растворимость церия мала
Для систем церия с мышьяком, бором, бериллием углеродом, кадмием,
хромом, [аллнеы, водородом, ртутью, азотом, кислородом, плуто-
нием, теллуром диаграмм не имеется, по ecTL отдельные данные
29
103
103
29
29
29
102
65
101
29, 103
66
91
67
69
103
30
28
зо
66
29
101
29
66
103
39
66
1U2
29
29
66
66
23
106
91
67
69
28
12
I
Редкоземельные металлы
€09
Продолжение табл. 17
Система
Соединения
Празеодим—алюминий
Празеодим—мець
Празеодим—галлий
Празеоцим—золото
Празеодим -свинец
Празеодим—магний
Празеодим—никель
Празеодим—серебро
Празеодим—таллий
Празеодим—олово
Празеодим—vpaH
PrAl, РгА12, РгА14
Pi Си, РгСи2, РгСи4. РгСи6
PrGa2, PrGa, Pr3Ga2, PraGa
Рг2Аи, РгАи, РгАи2, РгЛи4
Pr2Pb. PrPb, PrPh3
PrMg, PrMg5, PrMg2
Pr3Ni, PrNi, PrNi,, PrNi5
PrAg, PrAg2. PrAg3
Pr2Tl, PrTl, PrTl3
Pr2Sn, Pr2Sn3, PrSn3
Растворимость празеодима мала
Для систем празеодима с мышьяком, висмутом, углеродом, кадмием,
железом, ртутью, азотом, кислородом, кремнием и цинком диаграмм
не имеется, но есть отдельные данные
Для систем неодима с алюминием, углеродом, кислородом, кремнием
систем не имеется, но есть отдельные данные; растворимость неодима
в уране мала
Для систем самария с кислородом, кремнием и серой диаграмм не
имеется, но есть отдельные данные; растворимость самария в уране
мала
Для систем европия с кислородом, серой, селеном и теллуром диаграмм
не имеется, по есть отдельные данные; растворимость европия в уране
мала
Для систем гадолиния с кислородом, никелем, азотом, марганцем, маг-
нием и водородом есть данные, но нет диаграмм; растворимость
гадолиния в уране мала
Растворимость тербия в уране мала
Ксть данные о двойных системах диспрозия, гольмия, тулия, лютеция
с кислородом, но нет диаграмм; растворимость этих редкоземельных
металлов в уране мала
Диспрозий—цинк
Для систем эрбия с кислородом и азотом есть данные, но нет диа-
грамм; растворимость эрбия в уране мала
Для систем иттербия с кислородом, кремнием, теллуром есть данные,
но пет диаграмм; растворимость иттербия в уране мала
Иттрий образует двойные сплавы, но диаграмм нет; растворимость
иттрия в уране мала
Иттрий—магний I Y3A\g|7. Y2Mg5, YMg
Литература
29
29
37
29
66
66
101
29
66
91
28
30
28, 30
28, 30
28, 30
28, 30
28
28, 30
3
28, 30
28, 30
28, 30
16, 25
ния, кальция, мел», марганца, кремния, никеля, свинца, железа и угле-
рода. Иногда к мишметаллу специально присаживают магний в качестве
стабилизатора, предотвращающего атмосферную коррозию.
Для специальных нужд металлургических предприятий выпускают
также мишметалл с пониженным содержанием церия C0%) и повышенным
содержанием неодима и празеодима. Ферроцернй представляет собой сплав
мишметалла с железом, содержащий обычно около 25% железа. Он состоит
главным образом из церия и его соединения с железом CeFe». Технический
39 Заказ № 239
610 Глава 22
металлический церий содержит от 95 до 99,5% церия. Содержание в нем
прочих редкоземельных металлов обычно имеет порядок от нескольких
десятых долей процента до нескольких процентов.
Изучены диаграммы состояния для многих двойных и некоторых трой-
ных систем. Наиболее важные данные о диаграммах состояния обобщены
в табл. 17. Более подробные сведения об этих диаграммах можно узнать
из указанных в этой таблице источников*.
Черные сплавы
Самым распространенным черным сплавом с редкоземельными метал-
лами является обычный «кремень» для зажигалок, содержащий около
30% железа. Остальные 7096 приходятся на долю'мишметалла с прочими
примесями. Камни для зажигалок обычно покрывают с поверхности кра-
ской для предотвращения атмосферной коррозии.
Неоднократно сообщалось о благоприятном воздействии добавок миш-
металла на многие черные сплавы. Ряд последствий легирования черных
сплавов мишметаллом хорошо изучен, тогда как некоторые другие послед-
ствия исследованы слабо и во многих случаях не воспроизводимы.
В железных сплавах мишметалл действует, видимо, преимущественно
как десульфуратор, особенно если его присаживают вместе с такими раскис-
лнтслями, как кремний, магний или алюминий. Десульфурирующее дей-
ствие объясняется, видимо, образованием сульфидов редкоземельных
металлов, которые всплывают в шлак. В случае основных шлаков, носящих
характер восстановителя, сульфиды задерживаются в них, если же шлаки
имеют кислую природу, то сера возвращается в металл в виде сульфидов
железа или марганца. При использовании мишметалла в качестве десульфу-
ратора включения серы имеют характер небольших шаровидных частиц,
случайно распределенных в массе сплава.
Если к стали присаживать добавки соединений редкоземельных метал-
лов, то последние, по-видимому, действуют не как десульфураторы, а, как
сообщалось, измельчают зерно, повышая обрабатываемость стали. Однако
соединения редкоземельных металлов не способны улучшать обрабатывае-
мость сплавов, для которых характерна красноломкость. Есть основания
полагать, что соединения редкоземельных элементов способны улучшать
свойства стали в поперечном (прокатка) направлении. Это особенно спра-
ведливо в отношении хромоиикелевомолибденовых сталей.
Мишметалл нодуляризирует *" чугун, но того же эффекта можно добить-
ся и с помощью гораздо более дешевого магния. Добавка мишметалла в ковш
в качестве только графнтизирующего агента дает чугун, по своей структуре
занимающий среднее положение между серым и ковким чугунами. Однако
мишметалл полезен в сочетании с магнием и прочими материалами, которые
способствуют нодуляризашш графита, потому что церий противодействует
влиянию следов титана, висмута, свинца, сурьмы, олова, алюминия
и мышьяка, мешающему графитизации. Для этого требуется около 0,05%
мишметалла, который часто присаживают вместе с феррокремнием в коли-
честве около 1 %. Добавки мишметалла в количестве до 1 % повышают жидко-
текучесть сталей; добавки же в большем количестве оказывают обратное
* Исчерпывающие сведения о диаграммах систем, содержащих редкоземельные
металлы, приведены в монографии Карла Гшнейднера, подготовляемой Издательст-
пом «Мир» (Karl A. Gschneinder, Rare Earlh Alloys, D. Van Nostrand Co.,
1961).— Прим. ред.
** Нодуляризация — придание зернам округлой формы.— Прим. ред.
Редкоземельные металлы 611
действие. Мишметалл добавляют к стали также для повышения твердости-
и сопротивления ударным нагрузкам, улучшения обрабатываемости и сва-
риваемости и сообщения литой стали свойств ковкой [68].
На некоторых сталелитейных заводах небольшими добавками миш-
металла пользуются для повышения качества низколегированных аусте-
нитных нержавеющих сталей. Главный выигрыш при этом — улучшение
обрабатываемости в горячем состоянии, что повышает выход годного. Высо-
колегированным нержавеющим сталям внутренне присуща краснолом-
кость. Присадка к таким сталям около 0,02% мишметалла превращает
нх в пластичные сплавы. Судя по некоторым производственным данным,,
добавки мишметалла повышают сопротивление нержавеющих сталей окис-
лению, позволяя в отдельных случаях снижать содержание никеля. К чер-
ным сплавам мишметалл присаживают обычно в небольшом количестве,
составляющем около нескольких килограммов на тонну. Сохраняются
редкоземельные металлы в сталях в весьма малых и незначительных кон-
центрациях. Их вводят чаще всего в виде ферроцерия, который является
техническим сплавом мншметалла с железом.
Из нержавеющих сталей 347 с присадкой гадолиния изготовляют упра-
вляющие стержни для ядерных реакторов [3]. Вводить гадолииин в черные
сплавы без сегрегации удается в количестве до 30%. Сплавы титана с 20%
гадолиния имеют гомогенную природу. Сплавы циркония с диспрозием,
эрбием и самарием (циркаллои) изготовляют более нли менее обычными
способами горячей н холодной обработки давлением. Попытки легировать-
эти сплавы европием оказались малоуспешными из-за его большой лету-
чести.
Добавки церия в количестве от 0,25 до 0,5% к сплавам железа с алюми-
нием способствуют измельчению зерна. Добавка 0,2% ферроцерия к литей-
ному чугуну позволяет отливать сложные отливки с хорошими механиче-
скими свойствами. Небольшие присадки церия илн лантана к техническому
ниобию придают последнему пластичность, позволяющую обрабатывать его
давлением [68].
Редкоземельные металлы и иттрий слабо растворимы в сплавах на основе
железа. Но даже этой малой растворимости бывает достаточно, чтобы
заметным образом улучшить обрабатываемость сплавов железа с хромом,
облагородить их структуру и повысить высокотемпературное сопротивление
рекристаллизации. Добавка 1% иттрия к такому сплаву железа с хромом,
как AISI-446, повышает высокотемпературное сопротивление окислению
с 1100 до 1480°, обусловленное образованием самозалечивающейся защитной
оксидной пленки. В то же время добавки иттрия к аустенитиым нержавею-
щим сталям и сплавам на основе никеля их сопротивления окислению
не повышают [16].
Цветные сплавы
Присадка около 3 % мишметалла и 1 % циркония к магниевым сплавам
повышает их высокотемпературное сопротивление ползучести. Редкозе-
мельные металлы повышают жаропрочность благодаря локальному выпаде-
нию включений вдоль межзеренных границ, вызывающему твердение
сплавов. Цирконий измельчает зерно в магниевых сплавах, позволяя
использовать их при температурах вплоть до 300—315°, главным образом
при производстве литых детален для реактивных двигателей.
Добавки мишметалла повышают жаропрочность алюминиевых сплавов
и высокотемпературное сопротивление никелевых сплавов окислению.
39*
612 Г лава 22
Мишметаллом пользуются, чтобы создать твердение медных сплавов. Церии
растворим в титане в количестве около 0,59-6 и повышает его пластичность
за счет прочности. Гадолиний же в концентрациях приблизительно до 5%
повышает прочность сплавов и предел текучести.
Введение 1,5 -2°о мишметалла в ванну жидкого алюминия для нане-
¦сепия покрытий на стали погружением в расплав улучшает внешний вид
последних и растворяет алюминиевую оксидную пленку на покрываемых
деталях. Кроме того, мишметалл способствует лучшему распределению
'частиц твердого раствора Fe - А1 в ванне.
Обработка титана церием в количестве от 0,2 до 0,7% с последующим
внутренним окислением редкоземельного металла до двуокиси церия,
частицы которой должны быть равномерно диспергированы в матрице,
повышает длительную прочность титана [321, хотя добавка 0,4С6 церия при-
водит к образованию богатой церием фазы, выпадающей по границам между
зернами, которая ухудшает механические свойства титана [4].
Церий в концентрации ниже 0,01 ?'о повышает долговечность хромо-
никелевых нагревательных элементов при их службе в интервале температур
1150 1200е, способствуя образованию защитной оксидной пленки, прочно
сцепляющейся с основным металлом. Подобным же образом цернп действует
и на кобальтовые сплавы ПО, 49].
Редкоземельные металлы растворяются в хроме ограниченно, но неболь-
шие добавки иттрия к этому металлу заметно повышают его рабочую тем-
пературу благодаря воздействию на защитную пленку из окиси хрома.
Хотя многие другие редкоземельные металлы тоже влияют на окалино-
образование и поглощение хромом азота, по своей эффективности в этом
отношении они значительно уступают иттрию. Последний очищает хром
и измельчает его зерно [16].
Присадка к ванадию от 0,5 до 2% иттрия способствует в значительной
мере очищению металла от кислорода, создавая возможности холодной обра-
ботки ванадия давлением. Его действие объясняется тем, что в области
несмешиваемости двух жидкостей расплавленный иттрий взаимодействует
с кислородом, причем образующаяся окись иттрия всплывает наверх, осво-
бождая ванадиевую фазу от кислорода.
При производстве электронных ламп мишметалл используется как гет-
тер и действует подобно барию. По некоторым сообщениям, лучшим гетте-
ром считают сплав мишметалла, алюминия и тория.
Редкоземельные металлы являются энергичными восстановителями,
соединяющимися с большей частью неметаллов и типичных металлоидов.
Поэтому они представляют интерес для непосредственного получения самых
разнообразных соединений (моносульфиды, арсениды, антимониды, висму-
тиды, теллуриды, селениды, борнды, карбиды и т. п.). За отдельными исклю-
чениями эти материалы лучше всего приготовлять непосредственно из
металлов.
Большое сродство редкоземельных металлов к кислороду и азоту
является и будет служить основой их применения в настоящем и будущем.
ЛИТЕРАТУРА
1. U. S. Atomic Energy Commission, Rept. № AECU-3800, 1958.
2 A h m a n n D. H., U. S. Atomic Energy Commission, Rept. № AECD-3205, 1950.
3. A n d e r s о n W. K-, Theilacker J. S., Neutron Absorber Materials for.
Reactor Control, Chap. 9 (будет опубликовано).
Редко-земельные металлы 613
4. Antes H. W., E d e I m а п R. E-. Foundry, 85. .\i> I A957).
5. A s р г е у L. В., Е у ring L., Heppler W., U. S. Atomic Energy Commis-
sion, Rept. № UCRL-71, 194R
6. В a rs о n et al., Pliys. Rev., 105, X° 2, 418—424 A957).
7. Billy M, T г о m b e F., С R., 193, 421 A931).
8. В о m m e г П., Hohmann E.Z. anorg. allgcm. Cheni., 241, 268—272 A939).
9. Bohlander К. M., Mechanical Fabrication of Rare Earth Metals, Paper Pre-
sented at ASM-AFC Symposium, Chicago, 111., November 1959.
10. В r e e n J. E. L а п с J. R., Effect of Rare Earth Additions on High Temperature
Properties of a Cobalt-Base Alloy, U. S. Naval Res. Lab. Rept. R-4523, April 1953.
11. Bridgman P. W-, The Physics of High Pressure, G. T. Bell and Sons, Ltd..
London, 1949, p. [60—161.
VI. В г i d R m a n P. VV-, Proc. Am. Acad. Arts and Sci., 83. 1—22 A954).
13. В г i d g in a n P. W-, Proc. Am. Acad. Arts, and Sci., S4, 111 — 129 A955).
14. Carlson O. N., В а г e D. W., Gibson E. R., Schmidt F. A., Survey
of the Mechanical. Properties of Yttrium and Yttrium Alloys, Paper Presented al
3rd Pacific Area Nat. Meeting of ASTM, San Francisco, October 11- 16, 1959,
Paper ЛЪ 116.
15. Carlson O. N., Schmidt F. A., Spedding F. H., U. S. Atomic
Energy Commission, Rept. № ISC-7-M, 1956
16. С о 1 I i n s J. F., Calkins V. P., McGurty J. A., Application of Rare
Earths to Ferrous and Non-Ferrous Alloys, Paper Presented at ASM-AEC Sympo-
sium, Chicago, III., November 1959.
17 Daane A. H., U. S. Atomic Energy Commission, Rept. № AECD-3209, 1950.
18. D a a n e A. H., Physical Properties of the Rare Earth Metals, Paper Presented at
ASM-AEC Symposium, Chicago, 111., November 1959.
19. Daane A H., S p e d d i n g F. H., U. S. Atomic Energy Commission, Rept.
№T1D-5O61, Del., 215—222, 1951.
20. D a a n e A. H., S p e d d i n g F. H., .1. Am. Chem. Soc, 75, 2272 A953).
21. IVenge G., Martin A. E., | L". S. Atomic Energy Commission, Rept.
Л"« CT-2276, 1944.
22. DocrolyC, Vanlmpe J., T у d g a t D., Rev. met., 49, 458—462 A952).
23. Eastman E. D. et al., J. Am. Chem. Soc, 72, 2248 A950).
24. E у r i n g L., С u n n i n g h a m В. В., U. S. Atomic Energy Commission, Rept-
Л° UCRI-264, 194R.
25. G i b s и n E.D., Carlson O. N., Trans. Am. Soc. .Metals, 52 A959); Preprint
¦\Ь 146 A960).
26. G г а у P. M. J., Trans. Inst. Mining Mel., 61, 141 — 170 A952).
27. G s с h n e i d п е г К. A., Crystallography of the Rarp Earth Metals, Paper Presen-
ted at ASM-AEC Symposium, Chicago, 111., November 1959.
28. H a e f 1 i n g J. F., Daane A. H. (будет опубликовано).
29. 11 ansen M., Constitution of Binary Alloys, 2nd ed., McGraw-Hill Book Co..
Inc., New York, 1958.
30. Haufihton W., Ed., Constitution of Alloys Bibliography, Inst. Metals, London,
1956.
31. H 1 1 I e b г a n d W. F., Norton Т. Н., Pogfi. Ann., 155, 633—639 AЙ75).
32. II i 1 t z R. H., Grant N. J., AIME Trans., 212, 383—387 A958).
33. Hirsch A., J. Ind. Eng. Chem., 3. 880—896 A911); 4. 65—66 A912); Trans. Am.
Electrochem. Soc, 20, 57 A911).
34. H о p k i n s B. S., Trans. Electrochem. Soc, 89, 295—300 A946).
35. H u b e г E.J., Holley С E., J. Am. Chem. Soc, 75, 5645—5647 A953).
36 Huffine С W., Williams J. M., Refining and Purification of Rare Earth
Metals, Paper Presented at ASM-AEC Symposium, Chicago, III., November 1959.
€14 Глава 22
37. I a n d e I I i A., Gazz. chira. ital.. 79, 70 A949).
38. J a n t s с h G., S к a I 1 a N.. Grubitsch H, Z. anorg. allgera Cliem.,
216, 75—79 A933).
39. J e p s о n J. O., D u w e z P., ASM Preprint № 2. 1954.
40. J u к к о 1 a F. E., A u d г i e t h L. F., Ilgpkins B. S., J. Am. Cliem. Soc.
53, IR05 A931); 56, 303 A934).
41. Karl A., Bull. soc. chim. France, 1, 871 A934).
42. К 1 e i n h e к s e 1 J. H., Kremers H. C, J. Am. Chem. Soc, 50, 959—967
П928).
43. К 1 e m W., В о m m e r H., Z. anorg. allgern. Cliem., 231, 138—171 A937).
44. Kremers H. C, Trans. Am. Electrochem. Soc, 47, 365—371 A925).
45. К г e m e г s H. С, В e u к е г H., Trans. Am. Eleclrochem. Soc, 47, 353—364
A925).
46. К u h п е К- А., герм пат 179403, 1904.
47. К u z e 1 H., англ. пат. 23215. 1909.
48. L i v i n g s t о п J., К e n t H., The Cerium Metal and Lighter Flint Industry
in Germany and Austria, Office of Military Govt. for Germapy (U. S.), Field Infor-
mation Agency, Final Report J*° 909, September 30, 1946.
49. L о h г J. M., пат. США 2687954 и 2687956, August 1954.
.50. Love В., Selection and Evaluation of Rare or Unusual Metals for Application
to Advanced Weapons Systems, Part I-A Literature Survey, WADC Technical
Report 57-666, ASTIA Doc. Л° 155685, Wright Dev. Center, U. S. Air Force,
PB-15I3I1, June 1958.
51. M a h n F., J. recherches centre natl. recherche sci. Labs. Bellevue (Paris), 1950,
№ Ю, 28—31.
52. M a r s h J. K-. J. Chem. Soc, 1942, 398, 523; 1943, 8.
.53. M a z z a L., Atti X° congr. intern, cliim., 3, 604—609 A939).
54. M с Н а г g u e С J, Y а к e 1 H. L., .Ir., .letter L. K., Acta Cryst.. 10, 832
A957).
55. M e i n t z R. E., A u d r i e t h L. F., Hopkins B. S, Z. anorg. Chem.,
211, 237 A933).
56. Metals Handbook, Am. Soc. for Metals, Cleveland, Ohio, 1948, p. 21—22.
57. M о I d e n h a u e r M., Chem. Ztg., 38, 147 A914).
58. M о г г i с e E., Knickerbocker R. G., Rare Earth Electrolytic Metals,
Paper Presented at ASM-AEC Symposium, Chicago, 111., November 1959.
59. M or r og h H., Am. Foundryman, 13, D), 91—106 A94R).
60. Л1 u t h m a n n W., Ann., 320, 116 A902); 331, 60—63 A904).
61. Muthmann VV., Holer W., Weiss L., Ann., 320, 231—269 A902).
62. О п s t a t t E. I.. J. Am. Chem. Soc, 75, 5128 A953).
63. Материалы Комиссии по атомной энергии США, Ядерные реакторы. III. Матери-
алы для ядерных реакторов, Ш1, Москва, 1956.
¦64. Неорганические синтезы, сб. 1, ИЛ, Москва, 1951, стр. 19.
65. R о 1 1 a L., I a n d e I I i A., Ber. deut. Chem. Ges., 75B, 2091 A942).
66. R о I I a L. et al., Z. Metallk., 35, 29 A943).
67. С а в и п к и и Е. М., Б у р х а и о в Г. С, ЖНХ, 2, вып. 11, стр. 2605 A957).
68. Савицкий Е. М., Редкие металлы и сплавы, Дом техники, Москва, 1959.
69. S с h г a m m J., Z. Metallk., 33, 357 A941).
70. Von Siemens E. W-, H a 1 s k e J. G., англ. пат. 10867, 1900.
71. Simmons С. R., The Mechanical Properties of Yttrium, Scandium and the Rare
Earth Metals, Paper Presented at ASM-AEC Symposium, Chicago, 111., November
1959.
72. S i n g e r R.. A i г е у H., G r i in m e t t L., L e а с h H., Bennett R.,
The Cerium Industry in German Territory, Including Reports on Radium and Meso-
Редкоземельные металлы 615
thorium. British Intelligence Sub. Committee. Final Report № 400, Item N° 21,
September 1945.
73. Смирно в-Верин С, Новости техники, № 23. 20—21 A940).
74. S m i t h J. A.. Carlson С E., Spedding F. H., AIME Trans., 1212—
1213 (October 1957).
75. Spedding F. H. et al., Progress in Low Temperature Physics, Chap. XII, ed.
by Gorter, North Holland Pub. Co., Amsterdam, 1957.
76. S p e d d i n g F. H., Progress in Nuclear Energy, Series V. Metallurgy and Fuels,
ed. by Finneston, Pergamon Press, London, 1956.
77. S p e ri d i n g F. H., D a a n e A. H, J. Am. Chem. Soc, 74, 2783—2785
A952).
78. S p e d d i n g F. H., D a a n e A. H., Hermann K. W., Acta Crystello-
graphica, 9. № 7, 559—563 A956).
79. S p e d d i n g F. H., D a a n e A. H., J. Metals, 6, 504 A954).
80. Spedding F. H., D a a n e A. H., AIME Trans., 200, 504—510 A954).
81. S p e d d i n g F. II., D a a n e A. H., Progress in Nuclear Energy, Vol. 1, Series
V, Pergamon Press. London and New York, 1956, Chap. 5.
82. S p e d d i n g F. H., D a a n e A. H., U- S Atomic Energy Commission, Rept.
№ ISC-834. 1957.
83. S p e d d i n g F. H., D a a n e A. H., U. S. Atomic Energy Commission, Rept.
№ ISC-902, 1957.
81. Spedding F. H., D а а п с А. Н., Am. Chem. Soc. Abstracts of Papers of
132nd Meeting. 1957.
85. Spedding F. H., Hanak J. J., Daane A. H., AIME Trans., 212,
379—383 A958).
86. Spedding F. H., M с G u i n i s W. J., U. S. Atomic Energy Commission,
Rept. № 1SC-I49, 1951.
87. S p e d d i n g F. H., Miller С F., J. Am. Chem. Soc, 74, 4195—4198 A952).
88. S p e d d i n g F. H., W i 1 h e 1 m H. A., Keller W. H., Ahmann
W. H., D a a n e A. H., HaclCC, Ericson R. P., U. S. Atomic Fnergy
Commission, Rept. № AECD-3208, 1950; ISC-75, 1951; Ind. Eng. Chem., 44,
553—556 A952).
89. S t u 1 1 D. R., Sinke G. C, Thermodynaniic Properties of the Elements,
Advances in Chemistry, Series M> 18, Am. Chem. Soc, Washington, D. C, 1956.
90. T h о b u г n VV. C, L eg v о 1 d S., Spedding F. II. Phys. Rev., 110,
1298—1301 A958).
91. Tin Research Institute, Equilibrium Data for Sn Alloys, Battelle Memorial Insti-
tute, 1949.
92. T г о m b e F., Trans. Electrochem. Soc, 66, 57 A934).
9.5. T г о m b e F., С R. 200, 459 A935); 201. 65G A935).
94. Trombe F., Ann. chim., [11], 6. 349—458 A936).
95. Trorabe F., Tech. mod.. 30, 855 861 A938).
96. Trorabe F., С R., 206, 1380 A938).
97. Trombe F., Mahn F., С R., 217,603A943).
98. Trombe F., Mahn F., Ann. chim., [II], 19, 345—361 A944).
99. T г о m b e F.. Mahn F., С R., 220. 778—779 A945).
100. Trombe F., Revue de Metallurgie, 52, 2—33 A956).
101. Vogel R., Z. Metallk., 37, 98 A946).
102. Vogel R., Heumann Т., Z. Metallk., 37, 1 A946).
103. Vogel R-, К lose H., Z. Metallk.. 45. C33 A954).
104. Warl J. С, К. о г s t VV., Acta Cryst., 9, 452—454 A956); J. Phys. Chem.,
69, 1590 A956).
105. VV e i b k e F., Z. Elektrochem., 45, 518—520 A939).
616 Глава 22
106. Weiner L. С. ct al., J. Inst. Metals, 86, 185 A957).
107. Williams J. M., Huffine С L., Forming and Fabrication of Yttrium
Metal, Paper Presented at ASM-AEC Symposium, Chicago, 111., November 1959.
108. Winkler С A., Ber., 23, 772 A890); 24, 873 A890).
109. Yost D. M., Russell H., Garner С S-, The Rare Earth Elements
and Their Compounds, John Wiley and Sons, New York, 1947.
110. Young R. A., Ziegler W. Т., J. Am. Chem. Soc, 74, 5251 A952).
111. Zachariasen, Acta Crysl., 2, 57 A949).
112. Ziegler W. Т., Proj. № 116—118, Navy Dept. Office Naval Research Cont-
racts» NR-ori-I92, Task Order I, Annual Rept. October 1, 1947 to September 30,
1948 A949).
113. Z i n t I E., N e u m а у г S., Z. Ele^trochem., 39, 84—86 A933).
23.
РЕНИЙ
А. Д. МЕЛАВЕН
A. D. Meiavcn, Department oft Chemistry, University
of, Tennessee, Ki'oxvitte, Tenn.
ВВЕДЕНИЕ
Приоритет открытия элемента с порядковым номером 75, гомолога
марганца, оспаривался многими авторами [21]. Честь открытия элемента
обычно приписывается Ноддаку и Такке 1651, которые в 1925 г. сделали
сообщение о присутствии этого элемента в платиновых рудах и колумбите.
Одновременно Берг н Такке 19] опубликовали сообщение о наличии этого
элемента в упомянутых рудах, основанное на рентгеновском исследовании
концентратов, полученных из платиновых и колумбитовых руд.
Поскольку открытие Ноддака, Такке* и Берга не оспаривалось**,
предложенное ими название «рений» в честь одной из областей Германии
Ринеланд сохранилось до сих пор. Ренин вместе с марганцем - элементом
с порядковым номером 25 — и технецием - элементом с порядковым номе-
ром 43 — входит в подгруппу марганца VII группы периодической таблицы.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Рений не встречается в природе в виде самостоятельных минералов,
однако он в очень незначительных количествах встречается в различных
рудах и минералах других элементов. Средняя концентрация его в земной
коре, по данным В. и И. Ноддак 163] и Гольдшмидта [33], составляет
1-1(Г'%. По данным Аартоваара [1], финский гадолинит (силикат берил-
лия, железа и редкоземельных элементов)*** содержит рений в большей
концентрации, чем указанные ниже минералы.
Помимо гадолинита, рений встречается в самых разнообразных мине-
ралах, особенно молибдените, минералах редкоземельных элементов,
колумбите, танталите, платиновых рудах, сульфидах меди и окислах мар-
ганца 121, 63].
Можно было ожидать, что в соответствии с положением в периодической
таблице рений будет ассоциировать с марганцем в марганцевых минералах.
Однако вопреки ожиданиям рений был найден лишь в очень незначитель-
ных количествах в некоторых марганцевых минералах, которые не могут
служить источником его получения.
* Ида Такке, в дальнейшем Ида Ноддак.— Прим. ред.
** Аптор противоречит сказанному выше. История открытия рения трудная
н сложная. Читатель, возможно, помнит посмертную статью И. Друце по вопросу
о приоритете открытия рения, которая была опубликована в русском переводе в моно-
графии того же автора «Рений» (ИЛ, 1951, стр. 93—95).
Следует напомнить и о том, что реиян — одни из предсказанных Д. И. Менде-
леепым элементов (двимарганеи).— Прим. ред.
*** Y2Fe"Be2Si2Oi0. Прим. ред.
618 Глава 23
Из исследованных до настоящего времени минералов молибденит MoS2
является самым богатым источником промышленного получения рения.
За исключением финского гадолинита, упомянутого выше, запасы которого,
очевидно, очень ограниченны, рений в наиболее высоких концентрациях
содержат молибдениты некоторых месторождений [21, 41]. Действительно,
именно из молибденитов был получен фактически весь рений, поступивший
в продажу. Хотя и нет прямых доказательств, кажется вполне
очевидным, что рений в молибдените присутствует в виде сульфида ReS2
или Re»S7. Поскольку оба известных молибденитовых месторождения
являются источниками промышленного получения рения, интересно также
отметить, что молибденит каждого из этих месторождений ассоциирует
с медными сульфидными рудами 124, 25, 56].
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В 1929 г. И. и В. Ноддак [64] описали получение 1 г металлического
рения из 660 кг норвежского молибденита. Это составляло единственное
и самое большое количество металла, полученное за четыре года, последо-
вавшие за опубликованием открытия элемента теми же авторами в 1925 г.
До второй мировой войны весь продажный рений был извлечен из молиб-
денита Мансфельдского месторождения медистых сланцев в Германии
[24, 25]. Сообщалось, что ежегодное производство реиия в то время соста-
вляло 120 кг по цене приблизительно 2,4 долл. за 1 г. Во время второй
мировой войны и нескольких послевоенных лет производство рения в Вос-
точной Германии было прекращено. Имеются сообщения о возобновлении
в настоящее время производства рения из мансфельдских сланцев.
В США имеются два промышленных источника получения рения.
В основе их лежит обжиг флотационных молибденитовых концентратов из
медио-молибденовых руд. В течение последних 15 лет источником получе-
ния рения служили ренийсодержащие молибденитовые концентраты, выде-
ляемые из медных сульфидных руд, добываемых в окрестностях Майами
(штат Аризона) фирмой «Майами коппер компани»*. В последнее время
основным источником получения рения стали ренийсодержащие молибде-
нитовые концентраты медных сульфидных руд штатов Юта и Нью-Мексико,
выпускаемые фирмой «Кеннекот коппер корпорейшн» (Солт-Лейк).
Пыль, получаемая при обжиге молибденитов фирмой «Майами коипер
компани», перерабатывается при Университете шт. Теннесси. За последние
15 лет при переработке примерно 25 т обжиговой пыли по принятой техно-
логии было получено около 136 кг рения в виде перрената калия. Содержание
рения в пылях колебалось от 16% (в середине 1940 г.) до 1,7—3% (в настоя-
щее время).
«Кеннекот коппер корпорейшн» снабжает своей продукцией фирму
«Чейз брас энд коппер компани» в Уотербери (штат Коннектикут), которая
недавно сообщила о своем плане выпуска металлического рения в виде
порошка и изделий из пего в количестве 45 кг в год с потенциальной воз-
можностью увеличения этой производительности [60].
Потенциальные возможности США по выпуску рения определены
от 9 до 13,6 т в год [77]. По данным недавно опубликованного материала,
мировые потенциальные запасы рения составляют примерно 50 т [19].
Эти данные кажутся сильно заниженными.
* 10 июня I960 г. «Майами коппер компани» распалась и ее пайщики слптись
с «Теннесси корпорейшн»
Рений 619
Вскоре после начала второй мировой войны цены иа оставшиеся запасы
ввезенного в США рения составляли 8 долл. за 1 г перрсната калия и 15 долл.
за 1 г металлического рения. Цены перрената калия и металлического рения,
полученных в США, составляли 6 и 10 долл. за 1 г соответственно. С тех
пор достигнуто значительное снижение цен на рений и его соединения.
Существующие цены составляют на перренат калия 113 долл. за 1 кг и на
металлический рений высокой степени чистоты 272 долл. за 1 кг. Стоимость
изделий из металла, выпускаемых фирмой «Чейз брасэидкоппер компани»,
составляет 355 долл. за 1 кг рения в виде прутка диаметром 6,35 мм, 481 долл.
за полосовой металл толщиной 2 мм и 965 долл. за фольгу толщиной
25—50 мм 196]. В США освоено производство рениевого ангидрида Re2O7,
перрената аммония и перрената натрия; цены на эти продукты являются
промежуточными между ценами на перреиат калня и металлический рений.
ПОЛУЧЕНИЕ РЕНИЯ
Процесс извлечения рения из продуктов, получаемых при переработке
мансфельдских медистых сланцев в Германии, описан Фейтом [24]. Ниже
приводится описание этого процесса, применявшегося до 1940 г.
Прн обработке мансфельдской медной руды методом восстановительной
плавки получали сульфидный шлам, содержавший соли меди, молибдена,
никеля, железа, ванадия и рения наряду с незначительными количествами
других элементов. После естественного окисления на воздухе в течение
нескольких месяцев (до года и более) шлам выщелачивали водой. Концен-
трирование раствора осуществляли самопроизвольным испарением на воз-
духе с последующим осаждением кальция, меди и никеля в виде сульфатов.
После отделения твердых сульфатов фильтрат концентрировали путем
нагревания и удаления выпадавших при охлаждении большей части суль-
фатов тяжелых металлов. Этот процесс продолжали до тех пор, пока раствор
не достигал удельного веса 2. Затем фильтрат обрабатывали раствором
сульфата аммония для осаждения нерастворимого сульфата никеля —
аммония. В результате дальнейшего выпаривания маточника и последую-
щего добавления твердого сульфата аммония при охлаждении получали
дополнительное количество сульфата никеля — аммония наряду с комплекс-
ными аммонийными солями гетерополикислот фосфора, ванадия и молиб-
дена. Обработку сульфатом аммония продолжали до тех пор, пока ие начи-
нал выпадать чистый сульфат аммония. Из бледно-желтого раствора, полу-
ченного после описанного выше ряда концентрирований и осаждений,
при обработке хлоридом калия выпадал осадок технического перреиата
калия. Осадок растворяли в горячей воде и раствор фильтровали от хлопье-
видного осадка, получая фильтрат, из которого при охлаждении осаждался
почти чистый перренат калия.
Другой, более успешно применявшийся метод представлял собой спе-
циальный окислительный процесс шлама при температуре не выше 100°
в течение нескольких месяцев. Полученный продукт окисления выщелачи-
вали водой, фильтрат концентрировали выпариванием для отделения боль-
шей части сульфатов тяжелых металлов. Раствор, содержащий рений в виде
перреиат-иона ReO^, разбавляли промывной водой от предыдущих партий
и обрабатывали насыщенным раствором хлорида калия. Полученный при
этом неочищенный перренат калия содержал небольшие количества молиб-
дена, железа, никеля и меди. Осадок растворяли в кипящей воде и обраба-
тывали щелочью для осаждения гидроокисей железа, меди и никеля.
620 Глава 23
Фильтрат от этой операции содержал перренат калия и растворимый молиб-
дат калия. Перренат калия, отделявшийся при охлаждении раствора, пере-
кристаллизовывали затем три-четыре раза из водного раствора.
Другой метод извлечения рения, принадлежащий фирме «Кеннекот
коппер корпорейшн», был сю запатентован и развит Циммерлеем и Малуфом
1103]- Источником получения рения в настоящее время является молибде-
нитовый концентрат, выделяемый из сульфидной медной руды «Кеннекот
коппер корпорейшн» или ее вспомогательных предприятий.
Как изложено в патенте, молибденит подвергают обжигу в многоподо-
вой печи при 550 650°. В этих условиях MoS2 превращается в МоО3. При
указанной температуре заметной возгонки трехокиси молибдена не происхо-
дит, рений же в процессе обжига превращается в летучий окисел. Обжиго-
вые газы, помимо окислов рения (главным образом рениевого .ангидрида
Re2O7), содержат также небольшие количества летучих соединений молиб-
дена (МоО3) и увлеченной мелкой пыли. Частицы пыли осаждаются в циклоне
и возвращаются на обжиг. Обжиговые газы поступают в орошаемый водой
скруббер, работающий по принципу противотока, для более полного рас-
творения возогнанных соединений рения, молибдена и лучшего "улавливания
мелкой пыли, не осевшей в циклоне.
При противоточной промывке газа повышается концентрация рения
в растворе. Система многократной рециркуляции включает сгуститель для
удаления из ренийсодержащего раствора твердого осадка, захваченного
обжиговыми газами, поступившими из циклона. После достижения доста-
точно высокой концентрации в нем рения раствор делится на две части
в отношении примерно 1 : 20; меньший объем поступает на фильтрацию.
К большей части раствора добавляют воду и раствор возвращают в скруббер.
Очищенный от загрязнений реиийсодержащий раствор пропускают
через анионообменную смолу, например сильноосновную алкиламинную
смолу. Анионы смолы обмениваются на анионы рения и молибдена (ReOj
и iMoOj). После насыщения анионита рением подача раствора через колонку
прекращается. Для удаления молибдена в виде молибдата натрия аниопит
обрабатывают раствором щелочи, затем рений элюируют из колонки 0,5 М
раствором хлорной кислоты. При элюировании перхлорат-ион замещает
в смоле перренат-ион, в результате чего получается ренийсодержащий
раствор высокой степени чистоты.
Элюат, содержащий рений (водный раствор рениевой кислоты HReO4),
обрабатывают аммиаком для перевода рения в перренат аммония NH4ReO4.
Путем восстановления водородом перрената аммония получают металличе-
ский рений в виде порошка высокой степени чистоты.
Метод извлечения рения, применяемый в Университете шт. Теннесси
1551, в некоторых отношениях сходен с методом, описанным Фейтом. Однако
в целом ои более прост и требует меньшей затраты времени по сравнению
с последним.
Пыли, из которых извлекается ренин, получают от фирмы «Майами
коппер» (Майами, штат Аризона). Исходная руда, добываемая в основном
для извлечения меди, содержит медь в виде сульфида наряду с небольшим
количеством молибденита. Рений ассоциирован с молибденитом, по-види-
мому, в виде сульфида. После размола и измельчения руды сульфиды кон-
центрируют флотацией. Вторая флотационная операция проводится с целью
разделения сульфидов меди и молибдена, причем рений отделяется вместе
с молибденом.
При обжиге молибденита молибден переходит в окись молибдена MoOj ,
а рений — в рениевый ангидрид Re2O7. При этом происходит частичная
Рений
621
возгонка, в результате чего образуются пыли, называемые молибденито-
выми обжиговыми пылями, которые содержат некоторое количество необож-
женного молибденита, водорастворимые комплексные соединения молибдена
неопределенного состава, рениевый ангидрид или растворимые перрснаты
вместе с незначительными количествами других соединений. На воздухе
эти пыли поглощают влагу. Влажный продукт или его водный раствор,
как и следовало ожидать, имеет кислую реакцию.
Извлечение рения
Извлечение рения из пыли проводится в большом вакуум-фильтре
кератерм-500*, снабженном пористой пластинкой «фильтрстон»*. Верхняя
Бак для водного
выщелачивании
рения из иОтигивсп
пыли
На выпаривание
Рис. 1. Аппаратурная схема процесса извлечения рения.
часть бака емкостью 380 л отделяется от нижней части бака емкостью 190 л
пористой пластинкой толщиной 5 см. В верхнюю часть бака при переме-
шивании воздухом, поступающим снизу через пористую пластинку, заливают
около 90 л воды или промывных вод от предыдущего выщелачивания и доба-
вляют примерно 90 кг пыли. Выщелачивание производится в течение 1 час
или до тех пор, пока все твердые частицы не распределятся равномерно.
Затем ток воздуха прекращают, в нижней части бака создают вакуум и рас-
тпор. содержащий рений, фильтруют от нерастворимого кека, состоящего
главным образом из молибденита. Затем фильтрат передают в запасной
отстойник, где в течение нескольких часов происходит осаждение мелких
частиц молибденита. Кек па фильтре промывают двумя порциями свежей
воды по 45 л каждая. Промывные воды используют для выщелачивания све-
жей порции пыли.
* «Юнайтед С/геитс стонуор компани», Акрон, шт. Огайо.
-j Пыль I
i i
ш
Фильт
рат
Растворе-
ние,
фильтро-
вание
неочищенный | На очистку
КРеО, I *~"*"
м- ^Выпари- ГГГ
рат всние ^^ ьушка
Остаток
\Промьт-
*>кана
урилыпре
Свежая
вода
Остаток
Промие-
ю на
фильтре
Свежая
есОа
Первая
промывка
г-Остаток- Сушка
На обжиг
Вторая
промывка
Рис. 2 Схема процесса извлечения рения из молибденитовых обжиговых пылей
Рений
623
Раствор после отстаивания и отделения от осадка передают в другой
бак с фильтром, но меньшего размера. При перемешивании воздухом загру-
жают 0,45 кг тонкоизмельченного хлорида калия на каждые 6,8 л раствора.
Перемешивание воздухом продолжается от 30 мин до I час до полного рас-
творения хлорида калия и осаждения перрената калия. При этом протекает
реакция
KCI+ReO; -» KReO4+Cl-,
по окончании которой нерастворимый осадок перрената калия отфильтро-
вывают под вакуумом.
При проведении описанных выше операций отмечены два фактора,
способствующие успешному протеканию процесса. При выщелачивании
пыли водой происходит заметное самопроизвольное разогревание раствора
и, кроме того, растворимость перрепата калия понижается в процессе его
выделения за счет охлаждения реакционной смеси при добавлении хлорида
калия.
Оборудование, применявшееся при выщелачивании пылей и опера-
циях осаждения, показано на рис. 1. На рис. 2 представлена схема про-
цесса извлечения рения.
Очистка перрената калня
Перренат калия, полученный, как указано выше, имеет обычно светло-
коричневый цвет и в пересчете на сухое вещество содержит 85—95%
KReO4. Основные примеси не растворимы в воде при 100°, однако в ие-
Всдо
Выпаривание
фильтрата.
сушка
остатка
Охлаждение |i
A"~t* фиг
tanut
[ иыа
\ ХРгС,,
Расппо-
репье.
Фильтра
вапие
Фильт-
рат
Вода
Выпаривание
фильтрате.
сушка
сстотпа
Охлаждение
до Т.филътро-
еакие
Раство-
рение,
I фильтро-
вание
Фильт-
рат
\\DcrvamoK
Вода
Выпсривснш,
фильтрата,
С\ик
до 1*.филыпро-
eanue
Раство-
J (Нилуп^\
1 ^ I
и
>ильт-
рсчп
Охлаждение
до 7' фильтра-1
венис
Facmeo-
рение,
I фильтро-
вание
Фильт-
рат
Остаток
Вода
Фильт-
рат
Ростпво
рение,
I фильтре-
дрмис
Стлып
рат
KReO*
Сушка
Р и с. 3. Схема процесса очистки перрената калия пятикратной перекристаллиза-
цией.
знач ител ьном кол ичестве п р ису тству ют и водор аствор имые соединен и я
молибдена. Такой перренат калия (растворимость KReO4 14 г на 100 г
воды при IO0D) растворяют в небольшом избытке кипяшей дистиллирован-
ной воды и полученный раствор фильтруют. Твердый остаток выбрасывают,
624 Глава 23
фильтрат охлаждают до 7°, при этом растворимость перрената снижается
примерно до 0,55 г на 100 г воды. Маточник от первой перекристаллизации
после отстаивания отфильтровывают от перекристаллизованного перрената.
Кристаллы промывают небольшим количеством холодной дистиллирован-
ной воды и вновь растворяют при 100°; раствор фильтруют и фильтрат охла-
ждают до 7° для осаждения перрената калия. Перренат калия подвергают
пятикратной перекристаллизации из дистиллированной воды. Конечный
продукт сушат при 110°. Фильтраты от первых трех операций очистки выпа-
ривают досуха, и остатки от них перерабатывают со следующей порцией
неочищенного перрената. Фильтраты от двух последних перекристаллиза-
ции используют вместо дистиллированной воды на первых двух стадиях
очистки. Схема процесса очистки перреиата калия показана на рис. 3.
Получение металлического рения
Получение металлического рения восстановлением перрената калия
или аммония в токе водорода при давлении 1 am и высокой температуре
было описано Хардом и Бриммом [42]. Методы, описанные ниже, предста-
вляют собой некоторое видоизменение этого метода и предназначены для
переработки больших количеств перрената при сокращенной продолжитель-
ности восстановления.
Получение из перрената калия. Серебряную трубку, содержащую
чистый перренат калия, помещают в бомбу, которая заполняется водородом
до давления 70 100 am. По мере повышения температуры наблюдается
постоянное возрастание давления, пока не будет достигнута температура
235\ При этой температуре наступает внезапный спад давления, указываю-
щий на начало восстаноапения. В этот момент необходимо добавлять водо-
род для обеспечения избытка восстановителя. Температура постепенно
поднимается до 350°, и затем дается выдержка в течение 30 мин. В бомбе
происходит следующая реакция:
2KReO4-f 7Н2 - > 2Re+2KOH+6H2O.
После охлаждения бомбы до комнатной температуры спускают давление
и извлекают из нее серебряную трубку. Металл тщательно промывают горя-
чен дистиллированной водой для удаления большей части щелочи. Затем
его промывают горячим разбавленным раствором соляной кислоты для
нейтрализации оставшейся щелочи и, наконец, горячей дистиллированной
водой до отрицательной реакции на хлор-ион в промывных водах. Поро-
шок металлического рения промывают 95/с-ным этиловым спиртом и сушат
в вакууме при комнатной температуре. Металлический порошок от одной
или двух партий помещают в бомбу и повторяют восстановление, промывку
и сушку. Количество загруженного на один опыт материала лимитируется
лишь емкостью имеющегося в распоряжении аппарата.
Получение из перрената аммония. В методе получения металличе-
ского рения из перрената аммонии, описанном Хардом и Бриммом 142],
исходным веществом служит перренат калия. Перренат калия в растворе
соляной кислоты обрабатывают сероводородом для осаждения сульфида
рения. Затем сульфид суспендируют в аммиачном растворе и окисляют
30°о-ноп перекисью водорода. В результате реакции образуются перренат
и сульфат аммония. Полученную смесь твердых солей восстанавливают
затем в токе водорода. Окончательное восстановление проводится при 1000°
Рений 625^
в течение 2 час. Все продукты реакции, за исключением рения, летучи,
и полученный этим способом рений обычно имеет более высокую степень
чистоты, чем металл, полученный восстановлением перрената калия.
Вследствие увеличения спроса на чистый рениевый ангидрид, чистый
перренат аммония, а также на металлический рений высокой степени
чистоты, который в свою очередь может быть получен из перрената аммония,
в Университете шт. Теннесси применяется следующий метод.
Металлический рений, полученный восстановлением перрената калия
водородом, окисляется до Re2O; при пропускании кислорода над металли-
ческим порошком при 350—5003. Вследствие своей большой летучести пары
Re-O7 пролетают в конец пирексоной реакционной трубки и конденсируются
там в виде желтых хлопьев.
С целью получения перрената аммония Re2O7 растворяют в небольшом
количестве воды и получают рениевую кислоту IIReO4- Затем в полученный
раствор медленно пропускают аммиак, проходящий через перевернутую
воронку, погружаемую на глубину 3—6 мм в раствор рениевой кислоты.
Газ следует пропускать до тех пор, пока раствор не станет слабоаммиачным.
Кристаллы перрепата аммония отделяют от раствора декантацией. Соль
растворяют, дважды перекристаллизовывают из дистиллированной воды
и сушат при 100е.
Несколько сотен граммов сухого перрената аммония переносят в кварце-
вую лодочку, которую вместе с содержимым помещают в кварцевую трубку
диаметром 75 мм и длиной около 1,2 м, средняя часть которой, примерно
450 мм, обмотана нихромовой проволокой высокого сопротивления. Через
трубку пропускают сначала азот, затем медленно равномерным током водо-
род. Температуру постепенно поднимают до 380° и поддерживают па этом
уровне до полного разложения перрената аммония. При работе с загрузкой
перрената, эквивалентной 200 г металла, па эти операции обычно затрачи-
вается около 1 час. Затем температуру поднимают до 7Ш—800° и поддержи-
вают в течение 1 час для завершения восстановления. Печь постепенно охла-
ждают в токе водорода до 100—150°, после чего водород заменяют азотом
и охлаждают печь до комнатной температуры. Полученный таким путем
из перрената аммония высокой степени чистоты металл ие нуждается в про-
мывке, так как все соединения, образующиеся при восстановлении, за исклю-
чением самого металла, летучи.
Получение из хлорида рения(У)
Получение рения высокой степени чистоты из его галогенидов описано
Симсом [84—861, Розенбаумом, Ранком и Кэмпбеллом [73]. Металлический
рений, полученный из перрепатов калия и аммония, или крупные куски
рениевого лома помещают в никоровую трубку, через которую пропускают
водород при температуре 1000° для полного восстановления окислов металла.
Затем систему охлаждают до 750° в токе гелия и выдерживают при этой тем-
пературе в течение 1 час для удаления водорода. После этого вместо гелия
пропускают хлор; при небольшом давлении хлора рений переводится
в ReCb, который возгоняется из реакционной зоны и конденсируется
в охлаждаемой воздухом ловушке. В указанных условиях образуется
примерно 150 г ReQU в 1 час.
Полученным таким путем хлорид рения(У) осторожно переносят
в холодную воду, охлаждаемую в бане со льдом. При обработке водой обра-
зуются различные продукты гидролиза, важнейшим из которых является
i идратированная окись четырехвалентного рения ReO2. Для лучшего отде-
40 Заказ № 239
Ш Глава 23
ления желатинообразного вещества через суспензию за 30 мин до фильтро-
вания пропускают ток двуокиси углерода. Отфильтрованный продукт про-
мывают дистиллированной водой и сушат в вакуум-эксикаторе.
Высушенный ReO2 помещают в молибденовую лодочку, вставленную
в трубчатую печь, и восстанавливают водородом в течение 1 час при 400°,
затем такое же время при 600°. Спеченную массу после охлаждения до ком-
натной температуры измельчают в агатовой ступке и нагревают в токе водо-
рода в течение 2 час при 800°. После этого систему охлаждают до комнатной
температуры в инертной атмосфере для удаления водорода.
Продукты гидролиза ReCI5, образующиеся наряду с ReO2, окисляют
30%-нон перекисью водорода до рениевой кислоты, которую нейтрализуют
аммиаком, а полученный в результате нейтрализации перренат аммония
очищают и восстанавливают водородом до металла. Приготовленным таким
путем металлический порошок поступает на хлорирование. Выход рения
в процессе равен 95%, общее содержание примесей в металлическом рении
составляет лишь 0,049%.
ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА
Высокие температуры, развиваемые в некоторых объектах ядерной
и ракетной техники, а также быстрое внедрение электронных и высокотем-
пературных измерительных приборов в настоящее время в значительной
степени стимулировали детальное и исчерпывающее изучение физических
и механических свойств тугоплавких металлов и их сплавов. В связи с этим
рений благодаря некоторым своим уникальным свойствам начал привлекать
все возрастающее внимание. В сериях журнала Quarterly Progress Reports
«Иивестигеншнс оф рениум», опубликованных Институтом им. Баттела 178],
дан превосходный и подробный обзор работ Симса, посвященных изучению
физических, механических и электрических свойств рения, рениевых спла-
вов, вольфрама и других жаропрочных металлов. Некоторые из наиболее
важных свойств рения, рассмотренных в этих трудах института им. Батгела,
кратко описаны ниже; специфические атомные и физические свойства при-
ведены в таблице.
По сравнению с другими элементами рений отличается высокой тем-
пературой плавления, уступающей только температуре плавления вольф-
рама и углерода [20]; по плотности он уступает только осмию, иридию
и платине [20], а по модулю нормальной упругости — осмию и иридию 179].
Кроме того, рений обладает рядом других важных положительных свойств,
которые следует принимать во внимание при оценке его роли среди туго-
плавких металлов. Например, хотя давление пара рения при температуре
2500° в 10 раз выше |80[, чем у вольфрама, характеристики его водяного цикла
при давлении 10~* мм рт. ст. и температуре 1400—1800° превосходят харак-
теристики вольфрама, вследствие чего последний металл испаряется при-
мерно в 176 раз быстрее рения [79]. Однако было установлено, что при
создании более глубокого вакуума и более полном удалении паров воды
при 1600° за время более 200 час весовая потеря рениевой нити накала
в 1,6 раз больше весовой потери вольфрамовой нити накала [еб]. Если
пренебречь влиянием водяного цикла, это можно объяснить более высоким
давлением пара рения.
От других тугоплавких металлов рений отличается тем, что он не обра-
зует карбидов [871. Однако при повышенных температурах металл раство-
ряет углерод с образованием при 2840" эвтектики, содержащей 1,3 всс.%
Порядковый номер
Атомный вес
Изотопы
Атомный радиус, А
Кристаллическая решетка
Постоянные решетки, А
ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА РЕНИЯ
75
186,2
185,187
1,3777
Гексагональная плотноупа-
кованная
Внешний вид
0=2,758^0,001
с = 4,454±0,001
с/а 1,615
Типично металлический в
слитках; черного цвета
в виде металлического по-
рошка или металла, полу-
ченного электрохимиче-
ским осаждением
[8]
[40]
[5, 61
[2, 32, ,44, 77]
[20, 34, 79]
[79, 92]
|79, S2]
[79]
Аллотропическое превращение
Температура рекристаллизации,
°С
Плотность, г/см3
Температура плавления, °С
Температура кипения (вычис-
ленная), "К
Модуль нормальной упругости,
кг/мм*
Чистый, отожженный, при
комнатной температуре
Чистый, обработанный, при
комнатной температуре
1010°
1482=
Коэффициент линейного расши-
Нет
1400 (изменяется в зависи-
мости от степени холод-
ной обработки)
21,02
3180
5900
1,69-10*
Предел прочности при ржтяжрннн,
кг/мм2
114,8
225,4
86,8
28,0
6,6-10-0—6,8-10-6
[20J
[20]
[20. 70, 81J
[20, 70, 81]
[77. 81]
[20, 70]
Относительное
удлинение, %
28
2
1
1 [20, 70, 81. 83]
[20, 70, 81|
рения B0— 1000э), град 1
Удельная теплоемкость,
кил/?.' град
0—1200'
0—20°
Коэффициент теплопроводности,
кал/см-сек-град
Удельное электрическое сопро-
тивление , мкам• см
Температурный коэффициент
электросопротивления, грод~1
0—100°
0—2700°
Сверхпроводимость
Твердость
ср=0,03256+0,6625.10-5 /
[20, 44, 77, 86]
[20, 70]
Среднее значение 0,03262
0,17
19,14 [2, 20, 7Я]
3,11-Ю-з
1,98-Ю-з [2, 79]
Становится сверхпроводящим [4]
при 0—95° К
250 (по Бринеллю)
135 (по Виккерсу) для чи-
стого слитка
40*
628
Глава 23
Твердость
Давление пара, am
2500"
2221°
272G°
Молярная энтропия при
298.16°К, кал/моль-град
Теплота возгонки (вычислен-
ная), ккал/моль
Скрытая теплота плавления,
ккал/моль
Скрытая теплота испарения,
ккал/моль
Спектральные данные
Порог фотоэффекта (длинно-
волновый предел), А
Не в вакууме
Частичный вакуум
В условиях полной дега-
зации
Работа выхода, в
Магнитный момент
Продолжение таблицы
286—325 (по Виккерсу) в за- [26, 82, 85]
висимости от степени об-
жатия и отжига
Магнитная
я. я. е.
Атомный парамагнетизм
Парахор, вычислено по
ReO2Cl3
6,11-10-« (или
4,65-10 мм рт. ст.)
1,24-10-9
7,37-10-?
8,887±0,023
152—187
7,9
152
Характерные спектральные
линии при 3000, 3425,
3452, 3462 и триплет прл
3640 А
2671—2677
2810—2830
2480 и 2662±4
4,74
4,97
5,10
4,66±0,01
3,1433 для ReiSb
3,1755 для Re1"
0,369- 10-e-j-0,uO6
68,7-10"»
78,9
68,9
76,4
[71, 80, 81]
[90]
[71, 81] •
[71, 81]
[71]
[3, 52. 53, 61, 75|
[23]
[23]
[23, 86]
[47]
|23]
[2]
[86]
[54, 74. 77, 91]
|66]
[66]
[111
восприимчивость.
ReO3Cl
углерода. Диффузия углерода в рении при высоких температурах происхо-
дит быстро, вследствие чего повышается твердость, но подвергнутые такой
обработке образцы все, же, в значительной степени сохраняют пластичность.
На основании этого можно сделать предположение, что металл в виде нити
найдет применение в углеродсодержащен атмосфере.
Расплавленные медь, серебро, олово и цинк почги не реагируют
с рением, но он легко растворяется в расплавленных железе и никеле.
Металл слабо реагирует с расплавленным алюминием [84, 86]. Металличе-
ский рений устойчив при контакте с окисью алюминия при пониженном
давлении и повышенных температурах, что наводит на мысль о возможности
применения рениевой обмотки в печах с сердечником из окиси алюминия
для работы в инертной атмосфере 120, 86].
Рений 629
Влияние рения на повышение, твердости платины исключительно
велико. Например, твердость по Виккерсу чистого литого образца платины
равна приблизительно 40, твердость чистого рения - 135, а твердость спла-
вов Re— Pt колеблется от 104 (сплав 1% Re и 99% Pt) до 229 (сплав 10%
Re и 90% Pt). Рений оказывает большее влияние на повышение твердости
платины, чем никель, осмий, иридий и родий [85].
Термопары Re — Mo и Re W имеют высокую термо-э.д.с. и весьма
чувствительны к изменению температур |86]. Другие термопары, включаю-
щие рений или его сплавы с платиной или сплавами металлов платиновой
группы, показали большие перспективы в отношении их использования для
измерения высоких температур.
Рений имеет очень высокий предел длительной прочности при повы-
шенных температурах [20, 70, 82]. Например, при 1000° длительность проч-
ности для проволоки диаметром 1,25 мм изменяется от 30 сек при нагрузке
56 кг/л(Л12до 16,5 час при нагрузке 28 кг/ммй. За время испытания полное
удлинение на образцах длиной 75 мм равно примерно 2%. При 2000° отно-
сительное удлинение увеличивается до 4°о.
Предел прочности при растяжении отожженного рениевого листа соста-
вляет 117,6 кг!мм2; в результате холодной прокатки предел прочности уве-
личивается и достигает 225,4 кг!мм2 при обжатии на 30,7% [20, 70, 81, 83].
Даже при повышенных температурах (по крайней мере до 137Г) предел
прочности при растяжении рения значительно выше, чем у других тугоплав-
ких металлов, например вольфрама, молибдена, тантала, ниобия и хрома.
При 538° предел прочности равен примерно 77,7, при 1093° — 56,7, при
1371° — 34,3, при 1649° — 21,7, при 192Г — 15,4 и при 2205° — 8,8 кг/мм*
При использовании преимуществ, обусловленных уникальными физи-
ческими и механическими свойствами рения при повышенных температурах,
следует принимать во внимание, что металл сильно и быстро разрушаетсн
D атмосфере кислорода, воздуха и в других окислительных средах, так как
в этом отношении он гораздо менее устойчив, чем ниобий, молибден, тантал
или вольфрам [70]. Металл, легко изменяющийся в окислительной атмо-
сфере, устойчив при повышенных температурах в атмосфере водорода
и в других восстановительных и нейтральных средах, устойчив к действию
соляной кислоты, не поддается коррозии при соприкосновении с морской
водой и механически устойчив при электролитической эрозии [20].
ХИМИЧЕСКИЕ СВОЙСТВА
Подробно химические свойства рения и его соединений описаны в ряде
превосходных работ [21, 37, 41, 50, 62, 76]. Большая часть приведенных
ниже данных взята из этих источников*.
Химическая активность рения в значительной степени зависит от спо-
соба его получения. В том случае, когда металл получают в тонкодисперсном
состоянии путем восстановления водородом одной из его порошкообразных
солей, он может обладать пирофорными свойствами, если не приняты меры
для удаления избытка водорода. По-видимому, тонкоизмельченный металл
оказывает каталитическое действие на окисление водорода, при этом выде-
ляется количество тепла, достаточное для воспламенения металла. С другой
стороны, полированная поверхность компактного металла с трудом тускнеет
даже при длительном соприкосновении с воздухом.
* Лучшая из этих работ — монография И. Друце «Рений» — издана в СССР
в 1951 г. под ред. проф. А. В. Лапицкого.— Прим. ред.
630 __ Глава 23
Металлический рений, нанесенный на пластинки из платины, серебра,
тантала, меди и латуни, сохраняет сильный блеск до тех пор, пока образцы
находятся в совершенно сухой атмосфере. Однако во влажном воздухе
металл постепенно окисляется, причем конечным продуктом является
рениевая кислота HReO4. В противоположность рениевому покрытию, нане-
сенному на металлическую основу, блестящее покрытие из рения на спек-
трально-чистом графитовом электроде сохраняет свой первоначальный вид
в течение нескольких лет, причем никаких попыток обеспечить сухую
окружающую среду в этом случае не делалось [89J. Леви и Эсперсен [461
нашли, что, если рениевое покрытие на вольфрамовой нити сразу же после
нанесения нагревать до 1000° в атмосфере водорода, оно будет устойчивым
во влажном воздухе при комнатной температуре в течение длительного
времени.
В соответствии с положением в периодической таблице устойчивая
валентность рения должна быть равной 7. Действительно, наиболее, рас-
пространенными являются соединения семивалентного рения. Кроме того,
известны вполне устойчивые, соединения рения с валентностью 1, 2, 3, 4, 5
и 6. Наиболее характерными являются соединения рения с валентностью
4, 6 и 7; в валентном состоянии рения от 1 до 6 существует склонность
к диспропорционированию молекул с образованием соединений рения более,
низкой и более высокой валентности (обычно 7). Реакцию диспропорциони-
ровання можно представить следующим уравнением:
Нагревание
ЗКеО3 -> ReO2+Re2O7.
Металл, нагреваемый на воздухе или в атмосфере кислорода при 350°
или более высокой температуре, легко превращается в рениевый ангидрид:
4Re+7O2 э- 2Re2O7.
Согласно наблюдениям, эта реакция протекает ступенчато, на что ука-
зывает образование, красной трехокиси рения ReC>3 в начале нагревания.
Галогены, за исключением иода, реагируют с рением весьма энергично,
причем сила взаимодействия уменьшается при переходе, от фтора к брому.
В этом случае не образуется соединений высшей валентности. Вероятно,
это объясняется тем, что даже в случае, фтора атом рения не. может удержать
семь атомов галогена. Типичные, реакции металла с галогенами предста-
влены ниже:
Re+3F2 > ReFe,
200°
ReF6-bH2 * ReF4+H2F2,
2Re + 5Cl2 > 2ReCl5,
Нагревание
ReCl5 —> ReCl34-Cl2,
2Re+3Br2->2ReBr3.
Все. галогениды рения под действием воды или влаги воздуха гидроли-
зуются и частично диспропорционируются. Природа продуктов реакции опре-
деляется типом исходного галогенида, но обычно происходит образование
оксигалогенидов металла, двуокиси рения ReO2, ренисвой кислоты HReO4,
металлического рения, галогеноводородных кислот или свободных галогенов.
Сульфиды металла могут быть получены действием паров серы на тонко-
измельченный порошок рения при повышенных температурах или действием
Рений 631
сероводорода на кислые растворы перренатов [121. Наиболее изученными
сульфидами рения являются ReS= и Re2S7.
Карбонил рения [Re (СОЫ2 получен Хибером и Фуксом [361 путем
обработки Re2O7 окисью углерода при температуре 250° и давлении 200 am.
Фосфиды [351 и арсеннды 197] рения получены прямым взаимодейст-
вием элементов с металлом. Азот не реагирует с металлическим рением
даже при повышенных температурах.
В отношении существования карбида рения высказываются противо-
речивые мнения. Тжебятовский 193] сообщает, что металл при нагревании
в атмосфере окиси углерода или метана разлагает эти соединения, в резуль-
тате чего в решетке рения появляется небольшое количество углерода.
Соляная кислота не действует на рений. -Азотная кислота и горячая
серная кислота энергично реагируют с металлом с образованием рениевой
кислоты. Перекись водорода в аммиачном растворе превращает металл, его
¦окиси и сульфиды в перренат аммония.
ОБНАРУЖЕНИЕ И АНАЛИТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ РЕНИЯ
Обнаружение рения в природных рудах даже спектральным методом
трудно осуществимо вследствие его низкой концентрации в рудах, а также
из-за мешающего действия элементов, с которыми он обычно ассоциирован.
При переработке ренийсодержащих руд получают обогащенные рением
фракции, в которых этот элемент обычно легко определяется спектральными
и химическими методами.
Колориметрический метод анализа, основанный на образовании ком-
плексного роданида, который был предложен Гельманом, Вригге и Вейбке
[27], — один из наиболее удобных химических методов определения рення.
Если к раствору, содержащему рений в виде перренат-иона, в присутствии
соляной кислоты и роданида калия добавляется некоторое количество хло-
ристого олова, то появляется окрашивание от желтого до оранжево-крас-
ного. Количественное определение присутствующего в исходном растворе
рения производится сравнением полученной окраски с окраской соот-
ветствующих стандартных растворов. Молибден мешает этому колориметри-
ческому определению, однако он может быть удален методами, предложен-
ными Гофманом и Лунделем 139], Хиски и Мелошем [381, Малоуфом
н Уайтом [49], Мелавеном и Уэтселом [57].
Вполне удовлетворительным методом определения больших количеств
рения является гравиметрический метод Вилларда и Смита [99], в котором
в качестве осадителя применяется хлорид тетрафениларсония, или видоиз-
мененный метод, предложенный Смитом и Лонгом [88], с применением
того же реагента.
СПОСОБЫ ОБРАБОТКИ РЕНИЯ
Получение металлического порошка — основного вида промышленной
продукции рения — было подробно рассмотрено выше, в разделе «Получе-
ние рения».
Из порошкового рения изготовляются прутки, проволока и листы,
несмотря на трудности его обработки, вызываемые некоторыми особенно-
стями его свойств. Как описано Кейтсом [45], порошок сначала подвергают
прессованию и затем спекают, пропуская электрический ток через пруток,
помещенный в камеру, в которой создается вакуум или атмосфера водорода.
Такая обработка позволяет получить компактный пруток с плотностью
632 Г лава 23
более 90% теоретической. По данным Кейтса, на первых стадиях деформации
изготовленные таким образом прутки пластичны как при комнатной,
так и при повышенной температуре. Однако при более глубокой деформации
рений проявляет значительное сопротивление деформации при обработке:
твердость отожженного прутка при обжатии на 10% повышается почти
вдвое. В связи с этим в процессе обработки металл необходимо подвергать
многократному промежуточному отжигу, причем температура отжига
должна быть в пределах 1480—1980°.
Несмотря на трудности, встречающиеся при обработке рения, этот
металл очень пластичен в отожженном состоянии и может быть прокован,
изогнут, скручен и прокатан на холоду.
Широко применяется нанесение электролитических рениевых покрытий
па различные металлические поверхности и графит. Как сообщают Финк
и Дерен [26], блестящие плотные покрытия можно получить из различных
ванн, содержащих перренат калия. Янг [100] описывает методы нанесения
электролитических покрытий рения и ренисвоникелевых сплавов. Нетертон
и Холт [591 приводят полуколичественные данные по осаждению рення
на катоде из сернокислой ванны. Смит, Мелавен и Клайн [891 получили
блестящие рениевые покрытия на различных металлах и графите. Хорошие
покрытия были получены из ванны, сходной с описанной Финком н Дереном
[261, но при более высокой концентрации серной кислоты. Электролит
содержал 11 г перрената калия и 12 г концентрированной серной кислоты
в 1 л. Электролиз проводился при 28—50° и плотности тока 0,10—0,27 а'.см*.
Осаждение рения из паровой фазы на нити из металлов с высокой тем-
пературой плавления, особенно на вольфрамовые нити, описано в нескольких
патентах [14, 15, 28, 29, 95]. Метод заключается в нагревании нити, пред-
назначенной для покрытия, до высокой температуры в присутствии летучих
галогенидов рения или в присутствии летучих галогенидов и инертного
газа, например азота. В результате термического разложения галогенидов
рения происходит отложение рения на металлической нити. Свойства
покрытых рением металлических нитей описаны в литературе.
ОБЛАСТИ ПРИМЕНЕНИЯ
Рений может найти применение в самых различных областях, однако
из-за высокой стоимости и редкости в настоящее время этот металл не при-
меняется в широком промышленном масштабе. По-видимому, наиболее пер-
спективно применение рения в электронике и в области измерения высоких
температур (рений-вольфрамовые термопары, работающие при температурах
выше 2000°). Другие возможные примеры применения рения, основанные на
его высокой температуре плавления, приведены в патенте фирмы «Меллорн
энд компани» [94]. Описан сплав, содержащий вольфрам, молибден и рений,
из которого изготовляются электрические контакты. Сплавы платины
и рения или платины и рения вместе с железом, родием и иридием, приме-
няемые для термопар, описаны в английских патентах [16, 17]. Аналогичные
сплавы описаны Гёдеке [31].
Беккер и Мере [7] при описании сплавов вольфрам — рений указы-
вают на существование двух интерметаллических соединений. Двойной
сплав железа и рения довольно подробно описан Эггерсом [22]. Тугоплав-
кий сплав, содержащий более 90% вольфрама, менее 10% рения и не более
1% ванадия, описан Лайзе [18]. При добавлении иридия, железа, никеля
и кобальта к платинорениевым сплавам улучшаются их механические свой-
ства и предотвращается рост зерна [17].
Рений 633
Изучались каталитические, свойства рения, а также некоторых его
соединений и сплавов. Платонов и сотр. 169] описывают получение актив-
ного рениевого катализатора из перрепата аммония и дегидрогенизацию
большого числа спиртов с образованием альдегидов и кетонов [67]. Было
найдено, что в качестве катализатора процесса гидрогенизации он менее
пригоден [68]. Получение, коллоидального репня и его применение ьак
катализатора описано Ценгелизом и Статисом [102], которые сообщают
также, о возможном применении рения как катализатора при синтезе
аммиака [101]. Кинетику процесса разложения аммиака на рениевых ката-
лизаторах исследовали Макгир и Тейлор [51]. Коллоидальный рений или
его соединения, адсорбированные из суспензии на активированном древес-
ном угле, использовались при гидрогенизации угля, каменноугольного
дегтя и минерального масла [30]. Применение рения или его сплавов с метал-
лами платиновой группы или серебром при окислении аммиака описано
Зибертом [171. Окисление SO2 в SO3 с использованием в качестве, катализа-
тора рения или смеси 90% вольфрама и 10% рения описано в патенте
И. и В. Поддак, переданном фирме «Сименс и Гальске» [13].
ЛИТЕРАТУРА
1. А а г t о v a a r a G. А., Тек. Foren. i Finland Fcirh., 52, 157 A932); С. А., 26.
5460 A932).
2 Agte С, Alterthum H, Becker K-, Heyne G., Moers K-,
Kalurwiss.. 19. 108 A931).
3. Agte C, Alterthum II., Becker K.. Heyne G., Moers K-,
Z anorg. allgem. Chem., 196, 129 A931).
¦ 4. A s с h e r m a n n G., J u s t i E., Physik. Z., 43, 207 A942).
5. A s t о n F. W., Nature, 127, 591 П931).
6. A s t о n F. W., Proc. Roy. Soc, A132, 487 A931).
7. Becker K-, Moers K-, Metallwirtschaft, 9, 1063 A930); С. А. 25, 2043 AУ31)
8. Berg O., Physik. Z., 28, 864 A927).
9. В e r g О., Т а с к е I., Naturwiss., 13, 571 A925).
10. В e u t h e H., Z. Physik, 50, 762 A928).
11. В r i scoe H. V. A., R ohinson P. L., R udge A. J., J. Chem. Soc, 1932, 2673.
12. В г i s с о e H. V. A., Robinson P. L., Sloddart E. M., J. Chem. Soc.,.
1931, 1439.
13. Англ. пат. 3466Б2, October 8, 1929.
14. Англ. пат. 351216, June 4, 1930.
15. Англ. пат. 364502, June 4, 1931.
16. Аигл. пат. 381137, June 20, 1931.
17. Англ. пат. 385859, June 8, 1931.
18. Аигл. пат. 520025, April 12, 1940.
19. Chem. and Eng. News, 60 (July 7, 1959).
20. Denny J. P., Kendall L. F., Jr., Mcch. Eng., 80, № 8, 67 (August 1958).
21. Drue e J. G. F., Renium, University Press, Cambridge, England, 1948.
22. Eggers H., Mitt. Kaiser-Wilhelm-Inst. Eisenforsch., Diisseldorf, 20, 147
A938); C. A., 32, 7879 A93B).
23. E n g e 1 m a n n A., Ann. Physik, 17, 185 A933).
24. F e i t W.. Z. angew. Chem., 43, 459 A930).
25. F e i t W-, Z. angew. Chem., 46, 216 A933).
26. Fink C. G., D e г e n P., Trans. Electrochem. Soc, 66, 381 A934).
27. G e i 1 m a n n W-, Wrigge F. W., Weibkc F., Z. anorg. allgem. Chem.»
208, 217 A932).
€34 Глава 23
28. 1ерм. пат. 527105, June 5, 1929.
29. Герм. пат. 537936, July 9, 1930.
30. Герм. пат. 693707, June 20, 1940.
31. Goedeckc W., Siebert Festscher., 72 A931); С. А., 26, 4216 A932).
32. Coldschmidt V. M., Naturwiss., 17, 134 A929).
33. G о 1 d s с h m i d t V. M.. Naturwiss., 18, 999 A930).
34. Goldschmidt V. M., Z. physik. Chem. В., 2, 241 A929).
35. H а г a I d s e n H., Z. anorg. allgem. Chem., 221, 397 A935).
36. H i e b e г W., Fuchs H., Z. anorg. Chem., 248, 256 A911).
3?. Hiskey С F, В а с о n J. A., J. Tenn. Acad. Sci., 15, 381 A940).
38. Hiskey С F., MelocheV. W., Ind. Eng. Chem., Anal. Ed., 12, 503 A940).
39. H о 11 m a n J. I., L u n d e I 1 G. E. F., J. Research Natl. Bur. Standards,
23, 497 A939).
40. H о n i g s с h in i d t O., S а с h t 1 e b e n R., Z. anorg. allgem. Chem., 191,
309 A930).
41. Hopkins B. S., Chapters in the Chemistry of the Less Familiar Elements,
Vol. 2, Stipes Publishing Co., Champaign, 111., 1939. Chap. 20.
42. Неорганические синтезы, сб. 1, ИЛ, Москва, 1951. стр. 169.
43. I n g е 1 s t a m E.. Nova Acta Regiae Sec. Sci. Upsaliensis, 10, 7 A937); Cherru
Zentr., 1, 4735 A937).
44. J a e g e г F. M., R о s e n b о h m E., Proc. Acad. Sci. Amsterdam, 36, 786
A933); С. А., 28. 1257 A934).
45. К a t e s L. W., Materials and Methods, 39, № 3, 88 A954).
46. L e v i R., E s p e r s e n G. A., Phys. Rev., 78, 231 A950).
47. Lindberg E., Z. Physik.. 50, 82 A928).
48. L i n g b e r g E., Z. Physik., 56, 402 A929).
49. M a 1 о u f E. E-, White M. G., Anal. Chem , 23. 497 A951).
50. Max ted E. В., Modern Advances in Inorganic Chemistry, Clarendon Press,
Oxford, England, 1947, Chap. 5.
51. M с G e e r J. P., Taylor H. S., J. Am. Cheni. Soc, 73, 2743 A951).
52. Meggers W. F., Bur. Stand. J. Res., 6, 1027 A931).
53. M e g g e r s W. F., Phys. Rev., 37, 219 A931).
54. Meggers W. F., King AS., В а с h e r R. F., Phys. Rev., 38, 1258 A931).
55. M e 1 a v e n A. D., Bacon J. А., пат. США 2114965. January 1947.
56. M e 1 a v e n A. D., Bacon J. A., University of Tenn. (неопубликованные
данные).
57. M e I a v e n A. D., W h e t s e I К- В., Anal. Cliein.. 20. 1209 A948).
58. M о e 1 1 e г К . Naturwiss., 19, 575 A931).
59. N e t h e r t о n L. E., Holt M. L-, J. Electrochem. Soc, 95, 324 A949).
60. New York Times, February 10, 1959.
61. N о d d а с k I.. Z. Elektrochem., 34, 629 A928).
62. Noddack I., Noddack W., Das Rhenium, Leopold Voss, Leipzig, 1933.
63. N о d d а с k I.. Noddack W., Z. Physik. Chem., 154A, 207 A931).
64. N о d d а с k W., Noddack I., Z. anorg. allgem. Chem., 183, 353 A929).
65. Noddack W., T а с k e I., Naturwiss., 13, 567 A925).
66. Per ak is N.. Capatos L., С R., 196,611A933).
67. Платонов M. С, ЖОХ. II, 683A941).
68 Платонов М. С. Анисимов СБ., Крашенинникова В. Д.,
Вег., G8B, 761 A935).
69. Платонов М. С, Т о м и л о в В. И., ЖОХ, 7, 776 A937).
70. Pugh .1. W., J. Metals, 10, № 5, 335 A958).
71. Quill L. L., Ed., The Chemistry and Megallurgy of Miscellaneous Materials,
McGraw-Hill Book Co., New York, 1950.
Рений_ 655
72. Richardson D., Spectroscopy in Science and Industry. Proceedings of the
Fifth Summer Conference (Mass. Inst. Tech.) on Spectroscopy and Applications. Boi-
ling Point Determinations by Spectroscopic Methods, John Wiley and Sons, Inc.,
New York, 1938; C. A., 32. 4080 A938).
73. R о s e n b a u m D. M-, Riinck R. J., Campbell I. E.,J. Electrochem.
Soc, 103, 518—521 A956).
74. Schmidt Т., Z. Physik., 108, 408 A938).
75. Schober H., Sitzbcr. Akad. Wiss. Wlen. Math, naturw. kl. Abt. lla., 140,
79 A931); С. А., 26, 374 A932).
76. S i d g w i с к N. V., The Chemical Elements and Tlieir Compounds, Vol. 2,
Clarendon Press, Oxford, England, 1950, p. 1291.
77. S i m s СТ., W у 1 e г E. N.. G a i n e s G. В., R о s e n b a u m D. M..
A Survey of the Literature on Rhenium, WADC Technical Report 56-319, AST1A
Document № AD 110596, June 1956, Office of Technical Services, U. S. Depart-
ment of Commerce, Washington 25, D. С
78. S i m s С. Т. et al., Investigations of Rhenium, Progress Reports to Aeronautical
Research Laboratory, Wright Air Development Center, Contract № AF-33F16)-232,
Battelle Memorial Institute, Columbus, Ohio.
79. Fifth Quarterly Progress Report, September 1953.
80. Sixth Quarterly Progress Report, December 1953.
81. Seventh Quarterly Progress Report, March 1954.
82. Ninth Quarterly Progress Report, September 1954.
83. Tenth Quarterly Progress Report, December 1954.
84. Eleventh Querterly Progress Report, March 1955.
85. Twelfth Quarterly Progress Report, June 1955.
86. Si m s С. Т. etal.. Investigations of Rhenium, WADC Technical Report 54-371,
Supplement 1, ASTIA Document J* AD 97301, p. 57, September 1956, Office of
Technical Services, U. S. Department of Commerce, Washington 25, D. C.
87. Sims C. T. et al.. Investigations of Rhenium for Electron-Tube Applications.
ASTIA Document № AD 152419, Fifth Scientific Report, June 1958, Battelle
Memorial Institute, Columbus, Ohio.
88. Smith W. Т., Jr., Long S. H., J. Am. Chem. Soc, 70, 354 A948).
89. S in i t li W. Т., Jr., M e 1 a v e n A. D., Kline J. W., University of Ten-
nessee (неопубликованные данные).
90. Smith W. Т., Jr., Oliver G. D., Cobble J. W., J. Am. Chem. Soc,
75, 5785 A953).
91. Sommer L. A., Karlson P., Naturwiss., 19, 1021 A931).
92. S t e n z e 1 W., Weerts J, Z. Krist., 84, 20 A933).
93. T г z e b i a t о w s k i W., Z. anorg. allgem. Chem., 233, 376 A937).
94. Пат. США 2234969, March 18, 1941.
Ж. Van Arkel A. E., Metallwirtschaft, 13, 405 A934); С. А., 2В. 5011
A934).
96. Wall Street Journal, February 12, 1959.
97. W e i с h m a n n F., Htimburg M., В i 1 t z W., Z. anorg. allgem. Chem.,
240, 129 A939).
98. W e n n e r 1 о f I., Z. Physik., 47, 422 A928).
99. W i 1 1 а г d H.H., Smith G. W., Ind. Eng. Chem., Anal. Ed.. 11, 305 A939).
100. Young С B. F., Matal Ind. (N. Y.). 34, 176 A936).
101 Z e n g h e 1 i s C, Slathis El., Osterr. Chem. Ztg., 40, 80 A937); С. А., 31,
4777 A937).
Л02. Zenghelis C, S t a t h i s K-, Atti X° congr. intern, chiui., 2. 821 A938);
С. А., 33, 8081 A939).
103. Z i in m e r 1 e у S. R-, M a 1 о u f E. E., пат. США 2809092, October 1957.
24.
РУБИДИЙ И ЦЕЗИЙ
К. А. ГЕМПЕЛ
С. A. Humpel, Consulting Chemical Engineer,
Skokie, Illinois
ВВЕДЕНИЕ ,
Рубидии (порядковый номер 37 и атомный вес 85,47) и цезий (поряд-
ковый номер 55 и атомный вес 132,905) являются соответственно четвертым
и пятым элементами I группы (щелочные металлы) периодической таблицы,
в которой литий, натрий и калий занимают первые места. Рубидий был
открыт при помощи спектроскопа Бунзеном A861 г.), а цезий — Кирхгоф-
фом A860 г.). Рубидий получил свое название из-за ярких красных линий
в его спектре, а цезнй — из-за ярких голубых линий.
Оба элемента представляют собой мягкие, серебристо-белые металлы
с малым удельным весом н низкой температурой плавления. Цезий пла-
вится при 25,8° и образует вместе с ртутью и галлием группу металлов,
которые при комнатной температуре находятся в жидком состоянии. Руби-
дий плавится при температуре 39°.
По физическим и химическим свойствам рубидий и цезий похожи на дру-
гие щелочные металлы. Они одновалентны в своих соединениях, обладаю-
щих весьма высоким сопротивлением окислению и восстановлению. В газо-
вой фазе (пар) эти металлы состоят почти исключительно из одноатомных
молекул. Самые активные из всех металлов цезий и рубидий занимают
к тому же соответственно первое и второе места в ряду электроположитель-
ных элементов.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
По распространенности в земной коре рубидий занимает 16-е место*,
хотя не найдено такого минерала, в котором он был бы главным компонен-
том. Чаще всего он встречается в сильно рассеянном, виде в минералах калия
в очень низких концентрациях. Подобная малая концентрация в минералах,
бесспорно, нашла отражение в недостаточности производства и ограничен-
ности применения этого довольно распространенного элемента. Между тем
рубидий обнаружен в лепндолитовых рудах Южной Африки, которые вво-
зятся в Соединенные Штаты для извлечения лития, причем в некоторых
нз них содержится до 1—1,5% рубидия и значительно меньше цезия. Уси-
ленная переработка этих литиевых руд за последние годы значительно
пополнила запасы рубидиевых и цезиевых концентратов (побочные продук-
ты), из которых сейчас производят рубидиевые и цезиевые соединения.
Один процесс переработки африканского лепидолита дает в качестве
побочного продукта смесь, содержащую 70% карбоната калия с примесью
23% карбоната рубидия и 2% карбоната цезия. Этот продукт, поставляе-
* Фактически меньше.— Прим. ред.
Рубидий и цезий 637
мый на рынок фирмой «Амсрикэн поташ ксмикл корпорейшн» под назва-
нием «алькарб», потребляется стекловаренной промышленностью как за-
менитель карбоната калия при производстве стекла для телевизионных
трубок и вакуумных ламп электронной аппаратуры. Из этого же сырья
фирма производит различные рубидиевые и цезиевые соединения.
Цезий по содержанию в земной коре, занимает среди элементов 40-е
место (почти как германий); он обнаружен в таких минералах, как поллу-
цит BCs20-2Al203-9SiO2-H20), представляющий собой гидратированный
силикат алюминия и цезия*. Крупные залежи поллуцита, содержащего
от 25 до 30% окиси цезия, недавно были открыты в районе Берник-Лейк
(шт. Манитоба). Фирма «Кэмаллой минерале» заявила о своих планах:
наладить извлечение цезия из этой руды [7]. Месторождения цезия открыты
на острове Элба (шт. Мэн) и в окрестности Блэк-Хилса (шт. Южная
Дакота).
ПРОИЗВОДСТВО И ЭКОНОМИЧРСКАЯ СТАТИСТИКА
Ежегодное производство металлического рубидия и металлического
цезия постигло уровня около 45 кг каждого. По возрастающий интерес
к возможностям этих металлов в новых областях, например цезия для
создания ионных ракетных двигателей, может коренным образом изменить
существующее положение.
Цены на оба металла колеблются в пределах от 1 до 5 долл. за 1 г
и зависят от чистоты продукта, объема поставки и упаковки. Расширение
спроса и рост производства должны привести к снижению цен на рубидий
п цезий.
Создавшаяся в отношении цен на металлический рубидий и цезий конъ-
юнктура такова, что при заключении контракта на производство пар гни
в объеме около 4,5 т эти металлы должны стоить менее 2,2 долл. за 1 г;
при производстве же на уровне около 90 т эта цена, видимо, должна сни-
зиться примерно до 5 центов.
По состоянию на январь 19(Ю г. технические рубидиевые соединения
не ниже 95%-ной степени чистоты котировались по следующей цене (дол-
лары за I кг):
Карбонат 33
Хлорид 31,9
Фторид 37,5
Сульфат . . 28,6
На технические цезиевые соединения не ниже 96%-ной степени
чистоты на то же время держались следующие цены (доллары за 1 кг):
Карбонат ... 60,5
Хлорид 76
Фторид 79
Сульфат 72
* Заимствовано из устаревших справочников. Состав поллуцита — водного алю-
мосиликата цезия —отвечает формуле (Cs, NaJlAlSUOgl ¦ пНоО, причем иода вхо-
дит в поллуцит вместе с натрием, замещающим цезий в кристаллической решетке мине-
рала.— Прим. ред.
638 Глава 24
ИЗВЛЕЧЕНИЕ
Цезиевые соединения получают из поллуцита обработкой тонкоизмель-
ченного минерала соляной кислотой с последующим дегидратированием
двуокиси кремния и отфильтровывапием нерастворимого остатка*. Цезий
выделяют из фильтрата осаждением Cs2PbCl6 или 3CsCl-2SbCl3 соответ-
ственно нитратом свинца или трихлоридом сурьмы 19, 10, 12, 13]**. Хло-
рид цезия можно выделить из этих соединений гидролизом, который дает
возможность оставить его в растворе. Для получения хлорида цезия,"совер-
шенно свободного от других щелочных элементов, можно воспользоваться
образованием и других сложных хлоридов, лучшим из которых является
хлоростаннат цезия Cs2SnCl6 [8].
Новейшим усовершенствованным технологическим способом выделения
соединений этих металлов является использование ферроцианида натрии
и цинка, который при добавлении к смешанному раствору карбонатов
щелочных элементов вызывает сначала осаждение цинкферроцианида
цезия и затем цинкферроцианида рубидия |1, 11]. Эти нерастворимые про-
дукты при нагревании на воздухе разлагаются с образованием карбонатов,
причем растворимые карбонаты рубидия и цезия можно из продуктов
разложения выщелачивать водой.
Обзор современной технологии получения рубидия и цезия составили
Лем и сотр. [11]; они останавливаются ла трудностях, с которыми сопряже-
но получение относительно чистых соединений цезия и рубидия из сырья,
главным образом из упоминавшегося «алькарба» (К2СО3+ Rb;.CO3+
+ Cs2CO3), в котором содержатся соединения двух или нескольких щелоч-
ных металлов.
Рубидий и цезий в элементарной форме можно получать следующими
способами:
1) электролизом расплавленных солей (хлорид или цианид) в инерт-
ной атмосфере;
2) термическим разложением таких соединений, как гидрид и азид,
в вакууме или инертном газе;
3) восстановлением окисей, гидроокисей, карбонатов, галогенидов,
сульфатов или хроматов такими металлами, как кальций, магний, барий,
алюминий, или кремнием при повышенных температурах.
Чаще всего практикуют нагревание карбонатов рубидия и цезия с маг-
нием при температуре около 675° в водороде или нагревание хлоридов руби-
дия и цезия с кальцием при той же температуре в вакууме. В обоих случаях
металлы конденсируются из парообразного состояния без доступа воздуха,
зачастую в нейтральном масле для предотвращения взаимодействия с атмо-
сферой.
ФИЗИЧЕСКИЕ СВОЙСТВА
Физические свойства рубидия и цезия указаны в табл. 1.
Приблизительно на 27,2% природный рубидий состоит из рубидия-87,
испускающего р-лучи с периодом полураспада 6,3- Ю10 лет***. Продук-
том его распада является стронций. Рубиднй-87 используется для опреде-
ления возраста содержащих рубидий горных пород.
* Новое в технологии цезия см. в сборнике «Цезий» (ИЛ, 1963,. стр. 9—19).—
Прим. ред.
** В солянокислой среде. — Прим. ред.
*** Вторым изотопом является рубидий-85.— Прим. ред
ФИЗИЧЕСКИЕ СВОЙСТВА РУБИДИЯ И ЦЕЗИЯ
Таблица 1
\ арактернстнка
Р>биднГ(
Порядковый номер
Атомный вес
Решетка
Период решетки при 173°, А
Атомный радиус, А
Ионный радиус, А
Плотность о твердом состоянии при 20°
Плотность в жидком состоянии, г/см3
Атомный объем при 20', см3/г-атом
Температура плавления, 'С
Температура кипения, °С
Изменение объема при плавлении, %
Скрытая теплота плавления, кал/г
Скрытая теплота испарения, кал/г
Удельная теплоемкость, кал/гград
Температура при давлении пара (СС)
1 мм рт. ст.
10 » » ъ
100 » » л
200 » » »
400 »» »
Коэффициент теплопроводности,
кал/сек-см-град
Коэффициент линейного расширения,
10-е /град
Вязьость, спз
Удельное э.лектрнческое сопротивление,
мкпм ¦ см
Температурный коэффициент сопротивле-
ния, град'1
Потенциал ионизации атомов в гаэооб^
разном состоянии, в
Работа выхода электронов, ;в
37
85,47
Объемноцентрирован-
ная кубическая
5,62
2,43
1,48
1,532
1,475 C9^
55,9
39
688
4-2,5
6,1
212
0,0913 C9—126 )
0,0907 E0г)
0,080 @°)
294
387
519
569
628
0,075 E0°)
0,07 C9 )
90 B0г)
340 D0—100 )
0,6731 C8")
0,6258 C0=)
0,4844 (99,73)
0,4133 A40,5°)
0,3234 B20,1)
11,6 @")
13,4 C5°)
19,6 D0°)
23,15 E0)
25,32 G5е)
27,47 A00')
0,006 @ )
4,16
2,09
55
132,905
Объсмноцснтрирован-
ная кубическая
6,05
2,62
1,69
1,90
1,84 B8,Бг)
69,95
28,5
705
+2,6
3,766
146
0,060 B8,5°)
0,058 E0°)
0,052 B0°)
278
387
515
570
635
0,044 B8,5°)
97 @—2G1)
0,6299 D3,4")
0,4753 @0,6-)
0,4065 A40,5е)
0,3750 AG8')
0,3430 B11е)
20 B0")
22,2 B7°)
36,6 C0°)
37,0 C7°)
3,87
1,81
640
Глава 24
Продолжение табл. I
Характеристика
Рубидий
Цезий
Электродный потенциал, я
Rb -у Rb* -e
Cs-*Cs++e
Термс-э. д. с. Q=/l—ВТ (при темпера-
туре холодного спая 0°), мкв/ерад
Поперечное сечение захвата тепловых
нейтронов, барн/атом
Основная спектральная линия, Л
Магнитная восприимчивость, я. м. е.
Твердость (по методу царапания)
Теплота образования, ккал/моль:
Rb2O
Rb2O2
Rb2O4
Cs2O
Cs2O4
2,9259
A 1 В
-8,26 | -3,02
(от -183 до 0°)
¦0,73
7800,2
0,09 A8°)
0,3
82,92
107,05
135,0
3,02
A
0,06
В-
-0,10
(от - 183 до 0°)
29
8521,1
0,10 A8")
0,2
82,20
137,
64
Единственный природный изотоп цезия — цезий-133, тогда как
цезий-137 является одним из продуктов деления урана. Последний также
испускает р-лучи с периодом полураспада 33 года*. Наряду со строн-
цпсм-90 он образует самые вредные радиоактивные отходы при использова-
нии атомной энергии.
Из наиболее интересных физических свойств рубидия и цезия нужно
отметить большую величину их ионных радиусов, низкие ионизационные
потенциалы, малый удельный вес, легкоплавкость, высокое положение
Таблица 2
ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ
Характеристика
Ашнный вес
Атомный радиус, А
Ионный радиус, А
Температура плавления, "С
Температура кипения, СС
Потенциал ионизации,в
Плотность при 20°, г,смя
Скрытая теплота плавлении.
кал! г
Скрытая теплота испарения,
кал /г
Работа выхода, зв
Литий
6,940
1,56
0,00
179,0
1317
5,363
A,534
158
4680
2,49
Натрий
22,997
1,86
0,95
97,9
883
5,12
0,97
27,05
1005
2,28
Калий
39,10
2,23
1,33
63,7
760
4,318
0,87
14,6
496
2,24
Рубидий
85,48
2,43
1,48
38,5
688
4,16
1,532
6,1
212
2,09
Цезий
132,91
2,02
1,69
28,5
705
3,87
1,90
3,706
146
1.81
* Цезнн-137 также источник у-излучеиия — Прим. ред.
Рубидий и цезий 641
в ряду напряжений и малую работу выхода электронов. Оба металла свето-
чувствительны и легко ионизируются светом как видимой, так и инфра-
красной и ультрафиолетовой областей спектра.
В табл. 2 дается интересная градация физических свойств щелочных
металлов.
ХИМИЧЕСКИЕ СВОЙСТВА
В химическом отношении рубидий и цезий очень похожи на -калий
и сколько-нибудь существенно от него не отличаются. Оба металла энер-
гично реагируют с воздухом и водой, требуют защиты от их воздействия.
Рубидий образует четыре окисла: желтую окись Rb2O, темно-коричне-
вую двуокись или перекись Rb2O2, черную трехокись КЬгОз, темно-оран-
жевую четырехокись Rb2O4*. На воздухе он быстро покрывается серо-
голубой пленкой смеси окислов Rb2O, Rb2O2 и Rb2O4. Цезий образует
такую же гамму окислов. Быстрота взаимодействия цезия с водой иллюстри-
руется хотя бы тем фактом, что этот металл реагирует со льдом при любой
температуре выше—116° с выделением водорода. Взаимодействие с холод-
ной водой сопровождается взрывом.
Гидроокись цезия является сильнейшим из известных оснований
и должна защищаться серебром или платиной от соприкосновения с воз-
духом, стеклом и двуокисью углерода, так как она способна взаимодей-
ствовать с ними. Гидроокись рубидия — тоже сильное основание.
Галогениды рубидия и цезия образуют комплексы с галогенидами таких
металлов, как сурьма, висмут, кадмий, кобальт, медь, железо, свинец,
марганец, ртуть, никель, торий и цинк. Многие из них совершенно нерас-
творимы и используются как промежуточные продукты при выделении
рубидия и цезия из смесей их с другими щелочными элементами. Кроме
двойных галоидных солей, оба элемента образуют серию полигалогени-
дов, например RblBrCl, RbBrCl2, Csl3, CsIBr2 и т. д., в которых два атома
галогена должны обладать валентностью —1, а третий—валентно-
стью + 1.
\отя щелочные металлы, в первую очередь цезий, и способны образо-
вывать комплексные соли, эта способность ослабевает с уменьшением
атомного веса.
Растворимые соединения рубидия и цезия охватывают карбонаты,
хлориды, бромиды, иодиды, гидроокиси, хлораты, нитраты, сульфаты,
сульфиды и хроматы. а нерастворимые — перхлораты, пермангаиаты, хло-
роплатинаты, фторосиликаты, периодаты**.
Цезий, подобно литию, образует самые разнообразные алкильные
и арильные производные.
Рубидий и цезий образуют сплавы со щелочными и щелочноземельны-
ми металлами, ртутью, сурьмой, висмутом и золотом. Сплавам с тремя
последними металлами присуща потеря электронов под действием света
* Здесь ряд терминологических и иных неточностей. Соединения Rb2O2 и Rb2O3
или Rb4(O2K относятся к типу перекисей, причем последнее соединение рассматривает-
ся как двойное Rb2O2 - 2RbO2. Соединение Rb2O4 — надперекись. В настоящее
время на основании рентгеноструктурных данпых установлено, что состав надпере-
киси рубидия (цезия) следует выражать формулой А1О2.— Прим. ред.
•* Свойства рубидия и цезия и нх соединений, технология соединений рубидия
и цезия, а также получение металлических рубидия и цеаия более подробно рассмот-
рены В. Е. Плющевым («Рубидий и цезий», глава из книги «Основы металлургии»,
т. 3, Металлургиздат, 1963,'стр. 381— 403).— Прим. ред.
41 Злказ № 239
642 Глава 24
эта особенность позволяет использовать их в фотоэлементах. Сплав состава,
отвечающего двойному соединению Cs3Sb, характеризуется самым высоким
фотоэлектрическим квантовым выходом.
ОБЛАСТИ ПРИМЕНЕНИЯ
В настоящее время промышленное использование рубидия и цезия
ограничивается их применением в качестве газопоглотителей (геттеров)
в вакуумных приборах, а также в фотоэлементах. Их вводят в эти приборы
в виде металлов или чаще всего в виде соли, смешанной с восстановителем
Рис. 1. Экспериментальный ионный
двигатель.
(CsCl и Са) в капсуле. Если капсулу нагреть током высокой частоты, начи-
нается реакция восстановления и металл осаждается топким слоем на вну-
тренней стеклянной поверхности прибора.
Цезий используется в сцинтилляционных счетчиках и специальных
оптических инфракрасных прицелах к винтовкам (снайперским) для веде-
ния огня в ночных условиях.
Во многих научно-исследовательских лабораториях сейчас усиленно
изучаются возможности применения рубидия и цезия еще в двух областях,
использование в которых может резко увеличить выпуск этих металлов.
Речь идет о ионных ракетных двигателях для космических кораблей и при-
борах для непосредственного превращения тепла в электрическую энергию.
Ионные двигатели основаны на ускорении ионов и их выбросе в про-
странство для создания тяги. Так как рубидий и цезий легко ионизируются
при довольно низких температурах и обладают достаточным атомным
весом, они представляются весьма перспективными в этой области. Такой
двигатель (рис. 1), разработанный Льюисской лабораторией авиационных
двигателей при Национальном управлении по астронавтике и исследованию
космического пространства, действует следующим образом: цезий подают
в бойлер, где он испаряется; затем атомы газовой фазы, нагретые приблизи-
тельно до 1650", ионизируются при прохождении над горячей вольфрамо-
вой нитью в узком пространстве, а плазма (ионизированный газ), проходя
внутри ряда колец, на которые подается высокое напряжение, чтобы создать
сильное электрическое поле, сильно разгоняется (рис. 2). Высокоскоро-
стная ионная струя, вылетающая из двигателя, и сообщает ракете тягу
[2, 5, 6].
Рубидий и цезий
643
Ввиду того что масса ионов цезия больше массы ионов более легких
элементов, это даст цезию преимущество в данной области, так как тяга
прямо пропорциональна весу ионов.
Одна из трудностей, возникающих при создании ионного ракетного
двигателя, состоит в том, что при выбросе массы положительных ионов
происходит постепенное накопление отрицательного заряда в двигателе
илн ракете. В космическом пространстве в отличие от атмосферы нет отри-
цательных ионов, что приводит к тому, что ракета увлекает за собой облако
положительных ионов, притягиваемых отрицательным зарядом ракеты.
Один из способов преодоления этого затруднения заключается в том, чтобы
«пушка» выстреливала в пространство электроны, сорванные с топливных
Р и с. 2. Смонтированный экспе-
риментальный ионный двигатель.
Круглый диск впереди — одно нэ не-
скольких ускорительных колец иысо-
кого иапрчжсиия. через которые про-
ходит пучок ионов.
.V
атомов при их превращении в положительные ионы, которые и нейтрализо-
вали бы последние.
Ионные двигатели предполагается использовать после выхода ракеты
на орбиту, причем источником энергии для двигателя должна служить
ядерная силовая установка [21. Подсчеты показывают, что нонный двига-
тель, расходующий цезий со скоростью лишь 525 г/час, должен сообщать
космическому кораблю весом 1000 т удельную тягу 90,8 кг, способную
обеспечить ему ускорение 1,1 м/сек- [6].
Одна из разновидностей термоэлектрического генератора с использо-
ванием рубидия и цезия работает на магпитогндродииачическом принципе.
Ионы цезия, образовавшиеся при нагревании, прогоняются при очень
высокой температуре через магнитное поле, но, поскольку поток ионов
представляет собой как бы электрический проводник, ионы выполняют
роль якоря в обычном генераторе, благодаря чему вырабатывается элек-
трический ток.
Другой способ превращения тепла в электричество с помощью цезия
пли рубидия имеет термоионный механизм. Если нагреть электрод или
пластинку диода, заполненного парами цезия или рубидия, электроны
вырываются из горячего электрода и летят к холодному, генерируя ток.
В данном случае к. п. д. выше, чем в случае вакуумного диода, потому что
ионизированный цезий или рубидий ускоряют образование плазмы, кото-
рая нейтрализует пространственный заряд в приборе и уменьшает потери
энергии на холодном электроде. Таким образом генерируется переменный
ток с частотой около 100 кгц [3, 4J.
41*
644 Глава 24
Цезий н рубидий играют большую роль в рассмотренных выше областях
применения, потому что они принадлежат к наиболее легко ионизируемым
элементам. Их применению в этих областях способствуют также легко-
плавкость этих двух металлов, их низкая температура кипения и высокое
давление паров.
По мере увеличения масштабов применения рубидия и цезия в этих
главных направлениях на эти еще мало используемые щелочные металлы
должен последовать рост спроса, который повлечет за собой снижение
цен на них.
ЛИТЕР АТУ РА
1. Barton G. В., II ер w о г t h J. L., M cC 1 a n a h a n CD., Jr., M o-
or e R. L., V a n T u у 1 H. H-, Fission Product Recovery from Chemical Pro-
cessing Plant Waste Solution, General Electric Co., Richland, Wash.
2. Chera. Eng. News. 38. № 5, 94 (February 1, 1960).
3. Chem. Eng. News, 38, № 3, 17 (January 18, 1960).
4. Chem. Week, 86. J* 4, 65 (January 23, 1960).
5. Chem. Week, 86, Kt 6, 44 (January 30, 1060)
6. Chem. Week, 83, № 41, 155 (October 12, 1957).
7. Chicago Daily News, February 11, 19G0 (a UPI national story).
8. Druce J. H. E., Chem. News, 117, 193—196 A918).
9 Hackspill L-, Georges Т., С. R., 230,1119A950).
10. Kennedy J. J., Chem. Revs., 23, 157—163 A938).
11. L a m Hun g-K ei H., Foster 11. R., Jr., Preparation of Cesium and Rubi-
dium Metals, Paper Presented at Div. Ind. Eng. Chem., Am. Chem. Soc, San Fran-
cisco, April 27, 1938.
12. Lebner, К е ш m e r e r, Whitlord, Ind. Eng. Chem., 16, 1280 A924).
13 Wells H. W-, Am. Chem. J., 26, 265—268 A901).
25.
СЕЛЕН
Дж. Р. СТОУН, П. Э. К.АРОН
J. R. Stone, P. E. Carnn, American Smelting
and Re[ining Company, hew York, N. Y.
ВВЕДЕНИЕ
В 1817 г. стокгольмский профессор химии и секретарь Шведской ака-
демии наук Берцелиус вместе с Гаиом занимался исследованием применяв-
шегося ранее в Грипсгольмс способа получения серной кислоты. В ходе
этого исследования при анализе самой кислоты был обнаружен осадок
с неприятным запахом, который служил признаком присутствия теллура,
установленным Клапротом. Подобный запах обнаруживался Ганом на меде-
плавильных заводах, где перерабатывались рудные концентраты из Фалуны,
а получавшаяся сера использовалась для производства серной кислоты.
Рассчитывая открыть новый источник редкого в то время элемента теллура,
Берцелиус получил этот осадок в большем количестве, но никаких следов
теллура обнаружить не удалось. Однако им было установлено присутствие
неизвестного вещества, по своим химическим свойствам похожего на теллур.
Ввиду большого сходства этих двух элементов Берцелиус решил назвать
вновь открытый элемент селеном (грсч. selen — луна), так как теллур полу-
чил свое название от латинского слова iellus — земля.
После открытия в 1817 г. селен почти пятьдесят лет оставался лабора-
торной редкостью, пока в 1873 г. Смит при исследовании электропроводно-
сти некоторых материалов совершенно случайно не обнаружил, что элек-
трическое сопротивление селена с увеличением интенсивности освещения
уменьшается, а при нагревании до 170° или более высокой температуры
несколько возрастает. Это открытие привело, в частности, к созданию
фотоэлемента, о чем подробнее говорится ниже, и явилось началом его
широкого проникновения в различные отрасли промышленности.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
По содержанию в земной коре селен занимает среди всех элементов
40-е место, между висмутом и золотом*. Селен в самородном состоянии
встречается крайне редко. Хотя селен иногда находят вместе с самородной
серой или в виде селенидов металлов в минералах клаусталите PbSe, эвкай-
рнте CuAgSe, крукезите (Си, Tl, AgJSe, науманите Ag2Se и зоргнте
PbCuSe(?), чаще всего он встречается в виде примесей в рудах свинца,
меди и никеля. Там, где получают рудные концентраты этих металлов,
селен можно извлекать в качестве побочного продукта.
Главные источники селена в США — медные рудники в штатах Юта,
Аризона и Нью-Мексико. В рудных месторождениях штата Монтана этот
* Содержание селена (элемента безусловно редкого) в земной коре оценивается
различными величинами: 1 ¦ 10~5 вес.%, 8 ¦ 10-s вес.% и другими, в общем виде -
и ¦ 10"* вес.%, и указание на 40-е место неточно и мало что говорит.— Прим. pit).
I'M Глава 25
элемент встречается в небольших количествах. Селен из этих источников
и из мексиканских медных рудников в штатах Дуранго и Сакатекас полу-
чают фирмы «Америкэн смелтинг эид рифайнинг компани», «Анаконда коп-
пср майпипг компанп», «Америкэн метал клаймакс компани» и с недавнего
времени «Кеннекот коппер корпорейшн». В Канаде «Интернейшнл никель
компанп» извлекает селен из медно-никелевых руд Садбери, а «Канадиен
коппер и файнерс» (Монреаль) получает селен из анодной меди, извлекаемой
из медно-цинковых руд Флинфлона (Манитоба). В Австралии селен про-
изводится фирмой «Электролитнк рифайнинг энд смелтинг компанп»,
в Швеции — «Болиден майпипг компани», в Бельгии — «Сосьете жепераль
оф Гобокен», в Японии — «Тайхи Бесши» и «Нипон майнннг компани»,
в Западной Германии — «Норддейтче афпнери» (Гамбург).
ПРОИЗВОДСТВО
В течение ряда лет единственным источником получения селена служили
отходы сернокислотного производства — пыль из дымоходов. В настоящее
время основной источник селена — анодные шламы, которые получаются
при электролитической очистке меди. В основном селен извлекают одним
из трех способов: нагреванием с содой, нагреванием с серной кислотой
или с-плавленнем с содой и селитрой. Эти способы можно несколько видо-
изменять в зависимости от особенностей исходного сырья.
По первому способу обезмежеппые шламы смешивают с содой и нагре-
вают ниже температуры спекания при достаточном для окисления селена
доступе воздуха. Селен получают в виде селената натрия при выпаривании
раствора со стадий выщелачивания водой продукта спекания. Сслснат
натрия восстанавливают коксом до селенида, который вновь раствиряют.
Полученный раствор продувают воздухом и затем осаждают селен дву-
окисью серы.
По второму способу шламы перед обжигом обрабатывают серной кисло-
той. Во время обжига двуокись селена возгоняется и улавливается в мок-
ром поглотителе системы Коттреля. Остальной селен в значительной степени
извлекается при последующем сплавлении с содой.
Процесс сплавления с содой протекает при высоких температурах;
обезмеженные шламы перед сплавлением смешивают с содой и кремнеземом.
После спуска первых шлаков расплавленную шихту продувают воздухом,
при этом некоторое количество селена возгоняется и улавливается в погло-
тителе системы Коттреля. Затем к шихте добавляются едкий натр и селитра.
Полученный с высоким содержанием селена и теллура шлак размалывают
п выщелачивают водой. Для осаждения теллура добавляют свежую серную
кислоту; селен* осаждают путем обработки раствора двуокисью серы.
В настоящее время ежегодный выпуск селена в США и Канаде состав-
ляет 453 635 т.
Повышенный спрос на селен, особенно для производства выпрямите-
лей, начавшийся в 1951 г., привел к острой нехватке этого элемента. Усо-
вершенствования в методах извлечения, введенные производителями селе-
на, способствовали росту производства, п к осени 1956 г. селен перестал
быть дефицитным. В настоящее время п в ближайшем будущем обеспечено
* Крайне скупые сведения го технологии селена могут быть дополнены по озна-
комлении с книгой А. А. Кудрявцева «Химия и технология селена и теллура», изд.
Высшая школа, М.. 1961 г.— Прим. ред.
Селен
647
производство селена в масштабах, достаточных для удовлетворения любых
разумных запросов. Это мнение основано на производственном потенциале
и на запасах, имеющихся у производителей.
Цены на селен изменились от 3,3 долл. за 1 кг в 1930 г. до 33 долл.
за 1 кг в 1956 г.
ФИЗИЧЕСКИЕ СВОЙСТВА
Селен — элемент с порядковым номером 34 — является третьим членом
подгруппы кислорода VI группы периодической таблицы. Свойства элемен-
тов подгруппы кислорода указаны в табл. 1.
Таблица I
СВОЙСТВА ЭЛЕМЕНТОВ ПОДГРУППЫ КИСЛОРОДА [15]
Атомный вес
Ллотность (тв.), г/ом3
Температура измерения
плотности, °С
Цвет
Температура плавления, °С
Температура кипения, 'С
Кислород
15,9994
1,426
-252,5
Синий
-218,4
182,96
Сера
32.U64
Моноклин-
ная
1,96
Желтая
аморфная
1,92
20
Желтый
119,25
444, G
Селен
78,96
Стеклообразный
4,28
Гексагональная
модификация
4,79
20
Темио-красныи,
серый
Гексагональная
модификация
217
684,9+1,0
Теллур
127,60
6,25
20
СсрсбрнстыГ
449,5+0,3
989+3,8
Селен может существовать как в твердом, так и в жидком и газообраз-
ном состояниях при температурах, легко достигаемых в любой металлурги-
ческой лаборатории.
Твердый селен
Модификации селена не так хорошо изучены, как у серы. Иногда счи-
тается, что селен имеет шесть аллотропических модификаций, хотя более
простая классификация насчитывает только три. Некоторые свойства
этих модификаций приведены в табл. 2 и 3.
Аморфный селен. Аморфный селен встречается в виде красного порош-
ка, стеклообразного и коллоидального селена.
Красный селен. Аморфный красный порошкообразный селен образуется
при обработке селенистой кислоты в растворе с рН от 7 до 3 или с еще боль-
шей кислотностью (в присутствии таких кислот, как соляная или серная)
сильными восстановителями, например двуокисью серы, гидразином или
солянокислой солью гидроксиламина. Красный порошок при выдержке
становится черным и при нагревании превращается в гексагональную
модификацию.
Таблица 2
СВОЙСТВА АЛЛОТРОПИЧЕСКИХ МОДИФИКАЦИЙ СЕЛЕНА [S, 15, 21, 25]
Свойства
Цвет
Плотность, г/см3
Температура плавле-
ния, °С
Температура кипения,
°с
Растворимость
Вода
H2SO4 (конц.)
HNO3 (конц.)
CS2
С2Н5ОН
Аморфный
порошкообраз-
ный
Красный
4,25
Размягчается
при 40—50;
переходное
состояние
684,9± 1,0
Нерастворим
Растворим
»
Слабо раство-
рим
Нерастворим
стеклообразный
Черный, крас-
ный в тол-
стых слоях
4,28
Размягчается
при 40—50
684,9±1,0
Нерастворим
Растворим
»
Слабо раство-
рим
Нерастворим
Кристалл к чей; ий
моноклиннап
модификация
Темно-красный
4,46
170—180
684,9±1,0
Нерастворим
Растворим
3)
Слабо раство-
рим
Нерастворим
геьситональная
модификация
От серого до
темно-серого
.4,79
217
684,9±1,О
Нерастворим
Растворим
Нерастворим
Таблица 3
ФИЗИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТАРНОГО СЕЛЕНА [8, 21, 25]
Порядковый номер 34
Атомный вес 78,96
Изотопы 14 изотопов с массовыми числами от 70 до 84
Плотппсть при 25°, г/сл&
Стеклообразный 4,28
Гексагональная модификация 4,79
Атомный объем, сиР/г-атом 16,4
Температура плавления, °С
Стеклообразный Неопределенная
Гексагональная модификация 2173
Температура кипения при 684,9^1,0
760 мм рт. ст., °С
Удельная теплоемкость при 0—217е, 0,081
кал/г-град
Скрытая теплота плавления, кал/г 16,5
Скрытая теплота возгонки при 79,6
760 мм рт. ст., кал/г
Коэффициент линейного расширения, 37-10
град'1
Теплопроводность
Электропроводность
Зависит от кристаллической
структуры
Зависит от кристаллической
структуры и присутствующих
примесей
Селен М9
Стекаообразный селен. Стеклообразный селей — темная хрупкая мас-
са, которая образуется при быстром охлаждении расплавленного селена,
обладает стеклянным блеском, хрупкостью и раковистым изломом и пред-
ставляет собой переохлажденную жидкость. Эта модификация селена явля-
ется диэлектриком, который электризуется трением.
Недавно полученный стекловидный селен начинает размягчаться при
нагревании до 40—50°. Примесь лишь 0,0003 вес.% теллура увеличивает
пластичность селена. Стекловидный селен, содержащий 1% хлора, весьма
пластичен после закалочной отливки, но через 24 час даже при комнатной
температуре ои большей частью переходит в гексагональную модификацию.
В отраженном свете стекловидный селен кажется зеркально-черным.
Тонкие слои в проходящем (дневном свете) кажутся кроваво-красными.
Стекловидный селен почти так же тверд, как стекло, но, возможно, более
хрупок и обладает характерным раковистым изломом. Стекловидный
селен — очень плохой проводник тепла, но при хранении в теплом месте
он постепенно кристаллизуется в гексагональной модификации, которая
обладает лучшей тепло- н электропроводностью. Помимо применения
в качестве полупроводника, в особенности для ксерографических пластинок,
стекловидный селен можно рассматривать как изолятор.
Коллоидальный селен. Коллоидальный селен получают восстановлением
разбавленных водных растворов растворимого селена такими восстанови-
телями, как двуокись серы, гидразингидрат, декстроза и трихлорид титана.
Его можно также получить, вливая раствор селена в сероуглероде в боль-
шой объем эфира или при пропускании электрического тока через раствор
селенистой кислоты между платиновым анодом и катодом, покрытым
селеном.
Цвет коллоидального селена зависит от условий осаждения и изменя-
ется от фиолетового до красного.
Кристаллический селен. Кристаллический селен существует либо
в моноклинной, либо в гексагональной модификации.
Моноклинная модификация. Получается при низкотемпературном выпа-
ривании сероуглерода, содержащего растворенный селен. При нагреве
и некоторых других условиях моноклинный селен переходит в гексагональ-
ную модификацию [7].
Гексагональная модификация. Селен гексагональной модификации счи-
тается наиболее устойчивым при обычных условиях. Он имеет серый цвет
и по внешнему виду напоминает металл, является хорошим проводником
тепла и электрического тока, довольно инертен в атмосферных условиях,
обладает высокой механической прочностью и легко образуется при нагре-
вании любой формы селена до завершения кристаллизации [16, 33, 34].
Расплавленный селен
Температура плавления селена гексагональной модификации равна
217°. При этой температуре происходит резкий переход из твердого состоя-
ния в жидкое. Аморфный селен начинает размягчаться примерно при
100"; его поведение при повышении температуры зависит от скорости нагре-
ва. При 217° он переходит в жидкое состояние.
Расплавленный чистый селен независимо от того, из какой модифика-
ции он получен, обладает небольшой текучестью, если он не нагрет на не-
сколько десятков градусов выше температуры плавления, равной 217°.
В отличие от серы жидкотекучесть селена увеличивается с повышением
650
Глава 25
температуры. Расплавленный сслеи может кипеть при атмосферном давле-
нии F84,9е) в фарфоровой или кварцевой посуде без бурления [2]. Расплав-
ленный селен, вероятно, имеет несколько молекулярных форм.
Селен в парообразном состоянии
Пары селена при температуре кипения состоят из смеси Se3 и Se2.
Давление пара определяется уравнением
lg р= — D989,5+-3,5)/Г+8,0886 ± 0,0048,
где р — давление пара, мм рт. ст.; Т — температура, °К [2J.
Рис. 1. Кривые зависимости дав-
ления пара от температуры для
селена, серы, теллура, селенистого
водорода, оксихлорида селена, тет-
рахлорида селена и двуокиси се-
лена.
-200 -ЮЗ 0 W0 200 W0 600
Температура, °с
1000
На рис. 1 приведены кривые, показывающие зависимость давления
пара от температуры для селена, двуокиси селена, тетрахлорида селена,
селенистого водорода, оксихлорида селена, серы и теллура.
Электропроводность селена
Твердый селен. Ниже температуры плавления селен гексагональной
модификации является собственным полупроводником р-типа. Галогены
увеличивают проводимость р-типа. Ширина запрещенной зоны, определен-
ная фотогальваническим методом, оценивается в 1,79 + 0,01 эе [9, стр. 430].
Детальные исследования электрических свойств кристаллического селе-
на проведены Хснкельсом [13, 14].
Селен в виде монокристалла не имеет промышленного значения, но
исследование монокристаллов Se наряду с изучением его микрокристалличе-
ских состояний дает представление о свойствах селена как полупроводника.
Селен 65/
Электрические свойства селена в твердом состоянии очень сильно зави-
сят от методов его получения, поэтому следует обращаться к оригинальным
работам.
Расплавленный селен. Исследование электропроводности расплавлен-
ного селена при 200—500е проведено Хенкельсом [12J.
Удельное электрическое сопротивление чистого расплавленного селена
определяется уравнением lgg A + BIT, где А — —3,81; В = 5850;
Т — температура, DK; (J — удельное электрическое сопротивление, ом-см.
Влияние света на электрические свойства селена
Влияние светового излучения на селен рассматривается в двух разде-
лах: 1) фотопроводимость и 2) фотогальванический эффект.
Фотопроводимость. Эффект фотопроводимости обнаружен Смитом, сооб-
щившим об уменьшении электрического сопротивления селена при его
освещении 129]. Увеличение проводимости при освещении является резуль-
татом увеличения .числа носителей, т. е. дырок и электронов, под дей-
ствием фотонов света. При прекращении освещения проводимость умень
шается до величины, имевшейся перед освещением [20].
Для работы селенового фотоэлемента, как и для вакуумного фотоэле-
мента, требуется внешний источник питания. К сожалению, в отличие
от вакуумного селеновый фотоэлемент пропускает заметный ток даже
в темноте. В некоторых фотоэлементах ток при освещении превышает темно-
вой ток в 25 раз, но чаще ток при освещении возрастает в 8— 10 раз.
Фотогальванический эффект. Фотогальваиический эффект связан с не-
посредственным преобразованием света в электрическую энергию. Примером
этого являются экспонометры, применяемые для измерения освещенности
при фотографировании. Механическое устройство экспонометра описано
на стр. 656.
Фотоны света, проходя чррез зону р — н-перехода, попадают в полу-
проводящнй слой селена с проводимостью р-типа. Полупроводником п-типа
часто является окись кадмия [28]. Условия в барьерном слое, т. е. в слое
с р — «-переходом, становятся такими, что электрон движется в направле-
нии от селена через кадмий к коллектору и обратно через внешнюю цепь
к селену.
Энергия фотона должна превосходить пороговую величину фотоэф-
фекта для данного фотоэлемента, чтобы вызвать фотогальваническип
эффект. Волновая частота света должна превышать минимальную величину
для приведения в действие фотоэлемента независимо от количества фото-
нов, попадающих на поверхность фотоэлемента в единицу времени.
ХИМИЧЕСКИЕ СВОЙСТВА [8, 15, 21, 25]
Химические свойства селена таковы, как и следовало бы ожидать
от элемента VI группы, имеющего промежуточный атомный вес между
серой и теллуром. Селен и теллур по своему химическому характеру более
металличпы, чем сера.
Во всех соединениях селен проявляет свойства неметалла; он обладает
заметной склонностью к кислотообразованию, особенно в состоянии более
высокой валентности.
052 Глава 25
Реакции с кислородом
Во многих работах сообщается, что селен горит на воздухе синим
пламенем. Его пламя синее, но он с трудом загорается и сгорает медленно.
Степень окисления селена равна —2 в селенидах, +4 в селенитах
и +6 в селснатах [27]. Значения окислительно-восстановительных потен-
циалов приведены Латимером [221.
Как сообщает Лундель [23], валентности селена в соединениях, имею-
щих значение при аналитических работах, равны 2, 4 и 6.
Двуокись селена — белое твердое кристаллическое вещество, образую-
щееся в форме четырехгранных игл, плавится при 340° в запаянной ампуле
и возгоняется при 315°. Она гигроскопична и очень хорошо растворяется
в воде с образованием селенистой кислоты H2SeO3.
Селенистая кислота напоминает сернистую кислоту H2SO3 по методу
получения, природе, типам образующихся солей и общему поведению по
отношению к окислителям и восстановителям. Восстановители, включая
двуокись серы SO2, осаждают элементарный селен. Селениты образуются
при нейтрализации селенистой кислоты гидроокисями или карбонатами.
Селениты ядовиты.
Селенистая кислота является слабой. Согласно неопубликованной
работе исследовательских лабораторий «Америкэн смелтинг энд рифайнннг
компании, количественно селенистую кислоту можно определять титрова-
нием стандартным раствором едкого кали в присутствии маннита.
Трехокнсь селена БеОз— аморфное, относительно неустойчивое, твер-
дое вещество бледно-желтого цвета, которое разлагается на двуокись селена
и кислород. Попытки получить трехокись селена с помощью методов,
применяемых для получения трехокиси серы, оказались неудачными.
Трехокись была получена при действии сухого озона на раствор селена
в селенилхлориде SeOCU-
Селеновая кислота H2Se04 образуется при окислении селенистой кисло-
ты такими реагентами, как пермапганат калия, хлор или бром. Эта кислота
по силе почти равна серной кислоте, ее соли подобны сульфатам; концентри-
рованная селеновая кислота, подобно серной кислоте, обугливает многие
органические соединения. Селеновая кислота частично восстанавливается
при комнатной температуре такими восстановителями, как сероводород,
двуокись серы, сера и селен. Для полного восстановления селеновой кисло-
ты следует применять более сильные восстановители.
Реакции с водородом
Водород непосредственно реагирует с селеном при температурах ниже
250°; с максимальным выходом реакция протекает при 575е. Выше этой
температуры реакция становится обратимой. Образующийся селенистый
водород H«Se представляет собой бесцветный газ, легко воспламеняющийся,
но относительно устойчивый в сухом кислороде. Селенистый водород обла-
дает неприятным запахом и чрезвычайно ядовит [5]. Селенистый водород
образуется также при действии разбавленных кислот на селениды металлов,
например NasSe, FeSe или Al2Se3.
Подробная методика получения селенистого водорода из селенида
алюминия приведена в сборнике «Неорганические синтезы» [17, стр. 179].
При получении селенида алюминия или любого другого селенида необхо-
димо принимать соответствующие меры предосторожности.
Селен 653
Некоторые из более реакционноспишбных селенидов при взаимодей-
ствии с водой выделяют селенистый водород [17, 19J. Поэтому с селенидами
следует обращаться с осторожностью и при их хранении не допускать
соприкосновения с водой и кислотами. Элкинс [5] считает, что селенистый
водород почти в 300 раз более токсичен, чем сероводород. Вода при 10
растворяет некоторое количество селенистого водорода и может переносить
и выделять значительное количество газа в местах, отдаленных от исходного
селенида, в результате чего опасная зона увеличивается.
Реакции с галогенами
Большинство различных галогенидов селена можно получить непосред-
ственным взаимодействием точных весовых количеств соответствующего
галогена с определенным количеством селена. Трудность состоит не в осу-
ществлении реакции между селеном и галогеном, а в получении желаемого
стехиометрического соотношения.
Фтор. Селен непосредственно реагирует с фтором при обычной тем-
пературе, образуя тетрафторид селена SeF4. Это соединение представляет
собой бесцветную жидкость с сильными раздражающими свойствами,
которая кипит несколько выше 100°, затвердевает при - -90° в белое веще-
ство. Тетрафторид селена гидролизуется водой.
Гексафторид селена SeFc, представляющий собой бесцветный газ,
образуется при—76е в результате взаимодействия фтора и селена.
Хлор. Хлор чаще других галогенов применяется при получении rajoi e-
нидов селена, особенно в производстве селеновых пластин электрических
выпрямителей.
Монохлорид селена Se2Cl2 представляет собой тяжелую маслянистую
жидкость темно-красного цвета; он образуется при непосредственном
взаимодействии элементов [25, стр. 894].
Тетрахлорид селена SeCl4 получают при действии избытка хлора
на селен или монохлорид селена. Кристаллы тетрахлорида селена от белого
до бледно-желтого цвета при нагревании возгоняются [25, стр. 8981.
Оксихлорид селена SeOCl2 представляет собой тяжелую маслянистую
едкую жидкость, которая дымит на воздухе. Вода разлагает ее на соляную
и селенистую кислоты. Оксихлорид, полученный обычным путем, представ-
ляет собой тяжелую маслянистую жидкость желтого цвета (уд. вес 2,44),
которая кипит при 179,5е и разлагается при соприкосновении с влагой.
Методика получения оксихлорида селена приводится в сборнике «Неор-
ганические синтезы» [18J. Он смешивается во всех соотношениях с бензо-
лом, хлороформом, четыреххлористым углеродом и сероуглеродом. Оксихло-
рид селена — энергичный растворитель; он растворяет серу, селен и теллур,
а также резину, бакелит, смолы, целлулоид, желатину, клей и асфальт.
Бром и иод. Монобромид селена Se2Br2 и моноиодид селена Se^b полу-
чают путем непосредственного взаимодействия элементов. Получены также
соответствующие тетрагалогениды селена — SeBr4 и Sel4-
Оксибромид селена SeOBr2, образующийся при взаимодействии двуо-
киси селена и тетрабромида селена, представляет собой кристаллическое
вещество красновато-желтого цвета, плавящееся при 41,6°. Он растворяется
в некоторых обычных органических растворителях. Оксибромид является
сильным окисляющим и бромирующим реагентом и с некоторыми металлами
реагирует со взрывом.
654
Глава 2j
Сера. Селен и сера смешиваются в расплавленном состоянии в любых
соотношениях и образуют несколько рядов твердых растворов. Диаграмма
состоянии приведена Хансеном ПО, стр. 1162].
Азот. Соединение селена и азота — нитрид селена SeN — получено
косвенным путем.
Кислоты. Многие литературные данные по растворяющему действию
различных растворителей селена нуждаются в пересмотре, так как они
были получены без учета влияния следов примесей на скорость растворе-
ния селена.
Соляная кислота не действует иа элементарный селен.
Разбавленная азотная кислота слабо растворяет неочищенный селен
и почти не действует на селен высокой степени чистоты.
Концентрированная азотная кислота на холоду быстро растворяет
неочищенный селен, тогда как селен высокой степени чистоты растворяется
в ней очень медленно. Горячая концентрированная азотная кислота бурно
реагирует с неочищенным селеном, но реакция с селеном со степенью
чистоты 99,99°6 протекает чрезвычайно медленно, и дли растворения
10—20 г селена требуется 1 час.
E н. серная кислота (холодная и горячая) действует на неочищенный
селен и селен высокой степени чистоты, но в течение 1 час не удается раство-
рить достаточное количество селена, чтобы кислота окрасилась в зеленый
цвет.
В 36 н. горячей серной кислоте за 5 мин растворяется такое количество
неочищенного селена или селена высокой степени чистоты, что кислота
становится интенсивного зеленого цвета.
Щелочи. Некоторые формы селена растворимы в разбавленных водных
растворах щелочей, водных растворах цианидов и сульфитов щелочных
металлов [24].
Растворы цианидов и сульфитов щелочных металлов широко приме-
няют для извлечения селена из селенсодсржащих пылей из дымоходов 124].
Таблица 4
НЕКОТОРЫЙ БИНАРНЫЕ СИСТЕМЫ С УЧАСТИЕМ СЕЛЕНА [10, 26]
Система
Ag—Se
Cu—Se
Те -Sc
Hg—Se
Pb—Se
Sb—Se
S—Se
Те—Se
Tl—Se
2n—Se
Эвтектический состав,
sec.% Se
26 (прибл.)
2,2
Нет эвтектики
Находится очень близко
к 100% Se
55
40
62—63
Полностью растьорим в рас-
плавленном и твердом
состоянии
23 а
—
Эвтектиче-
ская темпс-
840
1063
—
—
681
530
105
284
Образующееся
соединение
Ag2Se
Cu2Se
FeSe и FeSe2
HgSe
PbSe
Sb2Se3
ri2Se3
ZnSe
i указывают цсв других эвтектических состава.
Селен 655
Сплавлением ссленсодержащих пылей из дымоходов с едким кали
с последующим выщелачиванием водой получают растворы, содержащие
селенит калия K2Se03 и селен ид калия K«Se.
При сплавлении селена или двуокиси селена с нитратом калия образует-
ся селенат калия Кг5еО4- Сплавлением соединений селена с перекисями
щелочных металлов получают селенаты. Такие операции следует проводить
с малыми количествами и за защитными экранами.
Металлы. Селен в расплавленном состоянии частично либо полностью
смешивается с большинством металлов. Расплавленная масса обычно состо-
ит из селенида металла или смеси селенида металла и селена. В табл. 4
приводятся характеристики эвтектических точек некоторых бинарных
систем с участием селена.
С многими металлами, в том числе с металлами, указанными в табл. 4.
селен образует определенные химические соединения.
ТОКСИЧНОСТЬ [31]
Селен и его соединения весьма токсичны; предельно допустимая концен-
трация селена в воздухе составляет 1-10 ъ%.
Сведении о том, что контакт с кристаллическим или аморфным селе-
ном приводит к кожным заболеваниям, нет, тогда как соли селена вызы-
вают дерматиты.
ОБЛАСТИ ПРИМЕНЕНИЯ СЕЛЕНА
Главными потребителями селена являются электроника, производства
керамики и красителей и сталелитейная промышленность.
Электроника
Для электроники из селена изготовляют пластины электрических
выпрямителей, ксерографические пластинки, фотоэлементы, солнечные
батареи н телевизионные камеры. Во всех случаях требуется селен со сте-'
пенью чистоты 99,99—99,999%.
Селеновые выпрямители. Сухой селеновый выпрямитель состоит ил ос-
новы, подвергнутой пескоструйной обработке или протравленной железной
или алюминиевой пластины, покрытой никелем или тонким слоем висмута
и слоем селена толщиной 0,50 -0,75 мм. Слой селена наносят путем испа-
рения в вакуумной камере или вначале покрывают основу порошком селе-
на, который затем спрессовывают в течение нескольких минут под гидравли-
ческим прессом с нагретыми плитами. Полученный «сэндвич» подвергают
термообработке в течение 30 мин при температуре несколько выше 210'.
Затем создают искусственный барьер, чтобы увеличить сопротивление при-
бора при прохождении тока в обратном направлении. Наконец, устанавли-
вают уравновешивающий электрод из сплава Вуда нли другого металла
и включают селеновый выпрямитель в электрическую схему для доведения
и улучшения запирающего сопротивления. Диски собирают в промышлен-
ные приборы, которые погружают в изолирующий лак и упаковывают для
отправки.
Некоторые подробности производства селеновых выпрямителей при-
водят Эскоффери 16], Хениш 111] и Крау [3].
C56
Глава 25
Как указано в учебнике Спенке 132], со времени выпуска первого
издания «Справочника по редким металлам» в области электроники изу-
чены многие научные проблемы, касающиеся полупроводников. На рис. 2
и 3 показаны миниатюрные селеновые выпрямители двух типов.
Выпрямляющее действие сухого селенового выпрямителя, как изве-
стно, осуществляется на границе раздела между селеном с проводимостью
р-типа и барьерным слоем сульфи-
да кадмия с проводимостью /г-типа 4
136]. -,. . . -. * *
Ниже температуры плавления се- {
лен является собственным иолу провод- "
ником р-тина. Дефекты решетки на
концах цепей атомов в кристалличе-
Р и с. 2. Миниатюрные селе-
новые выпрямители капсюль-
ного типа («Интернейшил
ректифайер корп.», Эль-Сеган-
до, штат Калифорния).
Рис. 3. Миниатюрные стан-
дартные селеновые выпрямите-
ли мостикопого типа («Интер-
иейшнл ректифайер корп.», Эль-
Сегандо. штат Калифорния).
ской структуре считаются главным источником носителей. Галогены увели-
чивают проводимость р-типа. в то время как ртуть увеличивает сопротивле-
ние селена, не превращая его в проводник /г-типа 19, стр. 430].
Сульфид кадмия является полупроводником n-типа и остается им.
несмотря на значительные загрязнения, введенные случайно или предна-
меренно. Проводимость р-типа никогда не наблюдалась. Кристаллы сохра-
няют проводимость /г-типа или превращаются в изоляторы 19, стр. 585].
В селеновом выпрямителе положительный электрический ток легко
проходит в направлении через основную пластинку, затем через слой селе-
•на, через выпрямляющий слой и, наконец, через уравновешивающий элек-
трод. Направление легкого перемещения электронов противоположно
направлению перемещения положительных зарядов.
Ксерография. Ксерография — это метод воспроизведения изображений
посредством света. Этот метод особенно удобен дчя быстрого копирования
и размножения писем, чертежей, отпечатков и для размножения карт
в картографических отделах.
Пластинку с тонким слоем селена заряжают до высокого положитель-
ного потенциала. Копируемый чертеж проектируют светом на заряженную
поверхность селенового слоя. При действии света электрический заряд
селена разряжается пропорционально интенсивности света, достигающего
пластинки, при этом возникает скрытое изображение. Изображение прояв-
ляют путем напыления на пластинку порошка с отрицательно заряженными
частицами, которые прилипают к пластинке в тех местах, которые не были
Селен 657
освещены проектирующим светом. После дальнейшей обработки полученное
изображение можно использовать в качестве основной копии для получе-
ния дополнительных отпечатков. Этот процесс подробно описан Райдну-
ром [30, стр. 409].
Телевизионная камера «Видикон». Принцип действия передающей
телевизионной трубки «Видикон», разработанной «Радио корпорейшн
оф Америка», также основан на фотопроводимости аморфного селена.
Освещенные части изображения, проектируемого на слой селена, передают
световой сигнал, когда онн сканируются пучком электронов. Схема и фото-
графия «Видикона» приведены Райднуром [30, стр. 408).
Фотоэлемент (фотогальванический элемент). Рассматриваемый здесь
фотоэлемент более известен под названием фотогальванического элемента,
описанного Рейхом 129, стр. 557). Этот элемент классифицируется также
как «элемент с запирающим слоем», так как он имеет выпрямляющий слой.
Термин «пластинчатый фотоэлемент выпрямляющего типа», очевидно,
возник вследствие аналогии конструкции механических и электронных
деталей элемента с селеновым выпрямителем. Дау 14, стр. 416) приводит
схему конструкции фотоэлемента, которая показывает, каким образом
фотоны света проникают через прозрачный уравновешивающий электрод
на фотоэлектрическую поверхность, в результате чего выброшенные све-
том электроны движутся в направлении, противоположном направлению
падения света.
Солнечные батареи. Солнечные батареи следует рассматривать как
фотогальванические элементы, предназначенные для максимального пре-
образования солнечного излучения в электрическую энергию независимо
от избирательной чувствительности, необходимой для фотоэлементов, при-
меняемых в фотографии.
Стекольная и керамическая промышленность
Из всех областей применения селена самой старой, и, несомненно,
самой обширной является стекольная и керамическая промышленность.
Селен добавляют к стеклу для его обесцвечивания, чтобы устранить зеле-
ный оттенок, появляющийся в присутствии железа. Селен реагирует с кад-
мием с образованием красного селенида кадмия, применяемого в качестве
краски в производстве обычного рубинового стекла. Кроме того, селения
кадмия находит широкое применение в производстве керамики и эмалей.
Эти так называемые «стеклянные краски» широко используются в произ-
водстве бутылок для изготовления привлекательных постоянных надписей,
которые заменяют бумажные наклейки или бесцветные рельефные буквы
на бутылках из-под молока, пива и др.
Красочная промышленность
Кадмий-селеновые литопоны применяются в красочной промышленно-
сти для получения неблекнущеп краски красного цвета.
Сталелитейная промышленность
В середине 30-х годов одна нз крупных сталелитейных компании уста-
новила, что добавки селена к нержавеющей стали оказывают не только
хорошее дегазирующее действие, но и улучшают ее обрабатываемость, что
658 Глава _?5
важно для определенных марок нержавеющей стали, например стали 18-8.
Вместо селена можно добавлять и серу, но она не придает стали таких
желательных свойств, как селен, поэтому применение селена в сталелитей-
ной промышленности непрерывно возрастает.
Другие области применения
Селен находит применение в резиновой промышленности в качестве
вулканизатора в концентрациях 0,1—2% для увечичення сопротивления
нагреванию, окислению и истиранию и повышения упругости. В виде кисло-
ты селен применяют для травления стали. Двуокись селена используется
как окислитель при изготовлении одного из замечательных лекарственных
веществ — кортизона. Хотя двуокись селена давно известна как окислитель,
было найдено также, что при добавлении к смазочным маслам она действует
как антиоксидаит и поэтому может рассматриваться как ценная добавка
к ним.
Селен применяется для изготовления фотоэлементов, предназначенных
для фотографии и для окрашивания отпечатков в тоне сепия.
Селен повышает обрабатываемость не только нержавеющей стали,
но и меди. Его вводят также в качестве добавки в полировочные составы,
применяемые для полировки медных гальванических покрытий. Представ-
ляет интерес применение селена в качестве огнестойкого средства дли
оболочек кабелей коммуникационных щитов. Оксихлорид селена является
одним из самых сильных растворителей и применяется для растворения
синтетических фенольных смол, ранее считавшихся нерастворимыми.
Несмотря на то что работа по применению фосфоров из селенида кадмия
для трубок цветного телевидения вследствие эффекта старения оказались
безуспешной, исследования по преодолению этого недостатка продолжают-
ся. В области термоэлектриков селенид висмута служит заменителем тел-
луридов свинца и висмута. В настоящее время значительный интерес пред-
ставляюткомпактныетермоэлектрическиепрнборы, не имеющие движущихся
частей, с помощью которых при подводе тепла к прибору можно создавать
электрический ток (эффект Зеебека) или осуществлять охлаждение или
нагрев.
Хотя идея введения ядовитых веществ в ткани живых растений для
предохранения их от насекомых является новой, она уже общепринята.
Так, есленат натрия применяется для защиты некоторых оранжерейных
растений от красного клещика.
Оксихлорид селена находит также применение в качестве реагента
для отделения и очистки различных углеводородов. Древесный уголь
можно активировать оксихлоридом селена как поглотитель газов. Оксн-
хлорид можно применять также как растворитель для снятия красок и лака,
а также для растворения резины, смол, клея н других органических
веществ.
ЛИТЕРАТУРА
1. Неорганические синтезы, сб. I, ИЛ, .Москва, 1951.
2. В г о о k s L. S., U. S. Atomic Energy Commission AECD-2546, Technical Infor-
mation Branch, AEC, Oak Ridge, Tenn.
3. Crow L. R., Metallic Rectifiers, Howard W. Saines and Co., Inc., Indianapo-
lis, 1957.
4. Dow W. П., Fundamentals of Engineering Electronics, John Wilej and Sons.
Inc., New York, 1937.
Селен 659
5 Е I к I л я Н. В., The Chemistry of Industrial Toxicology, John Wiley and Sons,
Inc., New York, 1950.
6. E s с о f f e г у С. A., Trans. Eleclrochem. Soc, 90, 129 A946); E s с о f f e г у С. А.,
H a 1 p e r i n S., Trans. Electrochem. Soc, 90, 163 A946).
7. Gmelins Handbuch der anorganischen Chemie, 8 Aufl., System Nummer 10,
Teil A, 1950; Teil B, 1949, Verlag Chemie GMBH, Wcinhcim, Germany.
8. Handbook of Chemistry and Physics, 40th ed., Chemical Rubber Publishing Co.,
Cleveland, 1959.
9. H a n n а у В., Semiconductors, Reinhold Publishing Corp., New York. 1959.
10. H a n s e п M., Constilutioii of Binary Alloys, McGraw-Hill Book Company, Inc.,
New York, 1958.
11. H e n i s с h H K-. Metal Rectifiers, Clarendon Press, Oxford, England, 1949.
12. II en к els H. W., J. Appl. Phys., 21, 725 A950); Hcnkels H W.. M a-
czuk J., J. Appl. Phys., 24, 1056 A953).
13. H e n к e I s H. W., J. Appl. Phys., 22, 916 A951).
14. H e n к e 1 s H. W., Jlacuk J., ']. Appl. Phys., 25, 1 A954).
15. Hopkins B. S., Chemistry of the Less Familiar Elements, Stipes Publishing Co.,
Champaign, 111., 1939.
16. H u m e-R othery W., R а у л о r G. V., The Structure of Metals and Alloys,
3rd ed., Institute of Metals, London. 1954.
17. Неорганические синтезы, сб. II, ИЛ, Москва, 1951.
18. Неорганические синтезы, сб. III, ИЛ, Москва, 1952, стр. 124.
19. King A., Inorganic Preparations, D. Van Nc*trand Company, Inc., Princeton
N. J., 1936.
20. К i t t e 1 C, Solid State Physics, John Wiley and Sons, Inc., New York,
1956.
21. L ange N. A., Handbook of Chemistry, 9th ed., Handbook Publishers, Inc.,
Sandusky, Ohio, 1956.
22. L a t i m e r W. M., The Oxidation States of the Elements and Their Potentials
in Aqueous Solutions, Prentice-Hall, Inc., Englewood Cliffs, N. J., 1938.
2i. L u n d e 1 1 G. E. F., H о f f m a n J. I., Outlines of Methods of Chemical Ana-
lysis, John Wiley and Sons, Inc., New York, 1938.
24. Lunge G., The Manufacturer of Sulfuric Acid and Alkali, Vol. 1, Part 3, D
Van Nostrand Company, Inc., Princeton, N. J., 1913, p. 1468.
25. M e 1 1 о г J. W-, A Comprehensive Treatise on Inorganic and Theoretical Chemi-
stry, Vol. 10, Longmans, Green and Co., Ltd., London, 1930.
26. Metals Handbook, American Society for Metals, Cleveland, 1948.
27. Pauling L., College Chemistry, W. H. Freeman and Co., San Francisco,
1957.
28. Preston J. S., Proc. Roy. Soc, A202, 449 A950).
29. Reich H. J., Theory and Applications of Electron Tubes, McGraw-Hill Book
Company, Inc., New York, 1944.
30. R i d e n о u r L. N.. Modern Physics for the Engineer, McGraw-Hill Book Com-
pany, Inc., New York, 1954.
31 S a x N. I., Handbook of Dangerous Materials, Reinhold Publishing Corp., New
York, 1951.
32. Spenke E., Electronic Semiconductors, McGraw-Hill Book Company, Inc.,
New York, 1958.
33. H i p p e I A. R., J. Chem. Phys., 16, 372 A948).
34. H i p p e I A. R., Bloom M. C, J. Chem. Phys., 18, 1243 A950).
35. YostD. M., Russell H., Jr., Systematic Inorganic Chemistry, Prentice-Hall.
Inc., Englewood Cliffs, N. J., 1944.
36. Пат. США 2488369.
42*
26.
СКАНДИЙ
А. Г. ДААН
А. И. Duanc, Ames Laboratory, АЕС, Iowa State
University, Ames, Iowa
ВВЕДЕНИЕ
В 1871 г. Д. И. Менделеев предсказал новый элемент в периодической
таблице и в соответствии с некоторыми свойствами этого элемента, считая
его аналогом бора (экабор), поместил в"Ш группу ниже бора.
Нильсон, шведский агрохимик, открыл этот новый элемент в 1879 г.
в процессе полного анализа эвксепитовой руды и назвал его в честь своей
родины скандием*. Для изучении свойств скандия в распоряжении исследо-
вателей имелись лишь небольшие количества этого элемента, так что из-за
отсутствия подробных сведений о нем в процессе многочисленных хими-
ческих переработок его концентрировали вместе с редкоземельными эле-
ментами, поскольку он находится в 111 группе периодической таблицы.
Это было вполне допустимо, но по мерс того, как химические и физические
свойства скандия становятся более известными, его нецелесообразно рас-
сматривать вместе с редкоземельными элементами. Скандий является
первым элементом переходной группы с одним Зй-электроном и обладает
повышенной устойчивостью в металлическом состоянии, характерной для
металлов с J-электронами.
ХИМИЧЕСКИЕ СВОЙСТВА
Поскольку скандии является электроположительным металлом, его
окись имеет основной характер и растворяется в кислотах, образуя бес-
цветные растворы, содержащие трехвалентные ионы; другие валентные
состояния для этого металла не были обнаружены**. Гидроокись скандия
можно осаждать из растворов действием основания; оксалат-ионы осаждают
оксала1 скандия, хотя это соединение более растворимо, чем оксалаты ред-
коземельных элементов. Ионы фтора осаждают гидратированнын фторид
ScFj-0,,r>H2O. Покрас и Бернеис 191 описали гравиметрические методы,
которые можно применять для определения скандия, но при этом скандий
необходимо предварительно отделять от примесей. Недавно Фритц и Питр-
знк [31 предложили определять скандии титрованием чтилендиаминтетраук-
сусной кислотой. Этот метод дает хорошие результаты в присутствии боль-
шого числа ионов, обычно сопутствующих скандию.
• Общие сведения о скандии, свойства металла и его соединении, сырьепие источ-
ники, технология, а также возможные области применения скандия рассмотрены в
недавно пышедшей монографии Б. И. Когана и В. А. Названовой «Скандий», Ичд-во
АН СССР, 1963. При и. ред.
** Есть указания, что соединение дпУхватентного скандия может быть получено
в виде сульфата. См. вступ. статью Л. Н. Комиссаровой к сб. «Скандии», ИЛ,
1958 г.. стр. 5-18.— Прим. ред.
Скандий 661
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Сочержание скандия в земной коре несколько выше 5-10 uSo, и, сле-
довательно, его распространенность того же порядка, что и бериллия,
и больше, чем у некоторых редкоземельных элементов. Скандии очень
сильно рассеян; в малых концентрациях он встречается в минералах воль-
фрамите, вииките* и касситерите и может быть обнаружен во многих
золах. Хотя скандий по химическим свойствам весьма сходен с редкоземель-
ными элементами, в геохимических процессах благодаря размеру его иона
он ведет себя подобно алюминию, магнию, гафнию н цирконию, так что
руды редкоземельных элементов не являются основными концентратами
скандия. Геохимия скандия детально рассмотрена Гольдшмидтом 141.
В 1911 г. Шетелиг в Норвегии открыл новый минерал, тортвеитит**,
в котором содержалось чрезвычайно большое количество скандия C0—
40°п Sc2O3). Этот минерал впоследствии был найден также на о. Мадагас-
кар. Тортвеитит встречается в очень небольших количествах в виде высту-
пающих или остаточных призматических кристаллов, образовавшихся при
эрозии пегматитовых даек, например верного норвежского уранинита. Торт-
вейтит можно обнаружить по светлой рыжевато-коричневой окраске и приз-
матической и игольчатой форме и легко извлечь его из породы.
Возможно, из-за небольшой потребности, по главным образом вслед-
ствие крайней редкости тортвейтита со времени открытия в 1911 до 1952 г.
из карьеров в Норвегии было добыто менее 23 кг этого минерала.
Хотя скандий находится в очень малых количествах в некоторых ура-
новых рудах, переработка громадных количеств этой руды, произведенная
недавно с целью извлечения урана в соответствии с программой Комиссии
по атомной энергии США, позволит получить большое количество скандия,
имеющегося в сырье.
ПЕРЕРАБОТКА РУДЫ
Результаты детального анализа тортвейтита. который был выполнен
Марблом и Глассом [71, показали, что в минерале содержится 46% SiO2,
34% Sc2O3, 9,5°о тяжелых редкоземельных элементов, 5% AUO3, 3% ?егО3,
1,5% легких редкоземельных элементов, 0,5°« МпО, меньшие количества
CaO, MgO, ThO2 и небольшое количество гафния или циркония, хотя
Гольдшмидт допускал, что в некоторых образцах тортвейтита могут содер-
жаться определенные количества обоих этих элементов. Марбл и Гласе
разлагали тортвейтит путем многократного сплавления с содой или обработ-
кой плавиковой кислотой. В том и другом случае из полученного раствора
несколько раз осаждали оксалаты или гидроокиси, тщательно контроли-
руя условия осаждения. В результате была получена окись скандия с отно-
сительно низким выходом.
11едавно Спеддинг и сотр. [121 описали метод переработки тортвейтита,
позволяющий извлекать скандий с весьма высоким выходом. Размельчен-
ный тортвейтит смешивают с 3 весовыми частями бифторида аммония и нагре-
* Состав виикита настолько сложен, что формулу его установить не удалось.
Более того, о составе цинкита R литературе имеются самые противоречивые сведения.
По одним данным, виикит богатый ураном минерал с формулой FeTiSiO-,, no црушм—
с формулой Ca3UNb3Ol2 (ОН) и структурой бетафита (U,"Ca)(Nb, Та, TiKO9 - лН2О.
По-видимому, однако, оиикит, если таковой существует как самостоятельный минерал,
относится к сложным ниобатам.— Прим. ред.
** Диортосиликат скандия (и иттрия) (Sc, YJ|Si2O7).— Прим. ред.
662 Г лава 26
вают 12 час при 375—400° в платиновой лодочке в токе сухого воздуха.
Таким образом удаляют всю SiO2 в виде легколетучего SiF4; твердый оста-
ток содержит G5—70% ScF3 и фториды других элементов, присутствующих
в руде, которые при данных условиях опыта не улетучиваются. Такую
смесь фторидов можно растворять в концентрированной серной кислоте,
но этот процесс весьма утомителен, и растворение осуществляется другим
путем. Вначале твердый остаток смешивают с 62 вес.% металлического
кальция и нагревают в платиновом тигле при 1400° в инертной атмосфере.
При этом образуется сплав, богатый скандием G0% Sc), и шлак, представ-
ляющий собой фторид кальция. Эта металлическая фаза легко растворяется
в соляной кислоте. Полученный раствор подвергают очистке методами
родаиидной экстракции и ионного обмена. В конечном счете получают
окись скандия высокой степени чистоты.
Окись скандия, выделенная при переработке урановой руды, за счет
изотопа тория была радиоактивной, что создавало дополнительную проб-
лему при получении продукта высокой степени чистоты. В этом произвол
стве для получения чистой окиси скандия использовались методы ионного
обмена и экстракции растворителями.
ПОЛУЧЕНИЕ СКАНДИЯ
Металлический скандий впервые был получен Фишером и сотр. [2]
в 1937 г. электролизом хлорида скандия в расплавленной солевой ванне,
но продукт содержал более 50% примесей, главным образом железа и крем-
ния, так что в этой работе физические свойства элемента не были изучены.
В последующих работах получавшийся скандий содержал значительное
количество примесей или был все же недостаточно чистым [8], вследствие
чего данные о физических свойствах этого металла были до некоторой сте-
пени противоречивы и весьма' ограниченны.
В соответствии с программой изучения редкоземельных элементов
в лаборатории Университета штата Лйова Уикфилд, Спеддинг и Даан [13]
разработали метод получения скандия, а также изучили некоторые его
свойства. Этот метод описывается ниже; в качестве исходного вещества
используется фторид скандия, который можно получить следующими двумя
способами.
Получение фторида скандия
Процесс с применением бифторида аммония. Бифторид аммония смеши-
вают с окисью скандия в стехиометрических количествах (весовое отноше-
ние NH4HF2 к Sc2O3 2,5 : 1) в соответствии с уравнением
Sc2O3+6NH4HF2 —»¦ 2Sl!Fj+6NH4F-f3H2O. A)
Следует отметить, что только половина фтора в бифториде аммония прини-
мает участие в реакции; несомненно, некоторое количество фторида аммо
ния диссоциирует;
NH4F NII3+HF, B)
и выделяющийся HF, по-видимому, участвует в реакции, но, так как его
количества непостоянны, это не учитывается. Смесь помещают в платино-
вую или монелевую лодочку и нагревают 8—12 час в монелевон трубке
при 300° в токе сухого воздуха. В результате такой обработки 95% Sc2O3
превращается в ScF3. Взаимодействие бифторида аммония с оставшимися
Скандий €63
59о Sc2O3 протекает очень слабо, так как вокруг непрореагировавшей
Sc2O3 образуется корка ScF3. Если с полученного продукта снять корку,
смешать его с новой порцией бифторида аммония, взятого в таком же весо-
вом отношении B,5 : 1), и нагреть, как это описано выше, то образуется
ScF3 высокой степени чистоты, из которого получают металл восстановле-
нием, как указано ниже.
Процесс с применением фтористого водорода. Окись скандия можно
перевести в ScF3 нагреванием при 700° в токе газообразного HF, используя
монелевый противень и трубку. Реакция протекает следующим образом:
Sc2O3+6HF —*¦ 2ScF3+3HaO. C)
Поскольку эффективность действия HF уменьшается по мере его диффузии
через слой ScF3 к непрореагировавшей Sc2O3 (как указывалось выше для
случая бифторида скандия), для получения ScF3 высокого качества через
печь необходимо пропустить избыток HF приблизительно 200%.
Процесс с применением бифторида аммония используется главным
образом для работ в небольшом масштабе, преимущественно в лаборато-
риях, не оборудованных для работы с HF.
Получение металлического скандия
Прямое восстановление ScF3. Металлический скандий можно полу-
чать прямым восстановлением фторида скандия кальцием 113]. Этот метод
применялся для получения редкоземельных металлов и был описан Спед-
дннгом и Дааном [10, 111. Измельченный ScF3 смешивают с гранулирован-
ным, дважды дистиллированным кальцием, который берется в небольшом
избытке A0%) против стехиометрического количества, необходимого для
реакции
2ScF3+3Ca —> 3CaF2+2Sc. D)
Смесь загружают в танталовый или вольфрамовый тигель, который поме-
щают в индукционную печь с кварцевой трубкой. Последнюю вначале
эвакуируют, а затем заполняют очищенным аргоном до давления 1 am.
Смесь нагревают до 1600°, чтобы расплавить шлак и металл, которые хорошо
разделяются на два слоя, причем слой металла находится на дне. Такое
четкое отделение шлака в какой-то мере неожиданно, если учесть, что плот-
ности металла и фторида кальция при комнатной температуре таковы, что
можно было ожидать обратного расположения слоев (Sc 3,0 г/см3, CaF2
3,2 г/см3). Однако соли при плавлении значительно больше расширяются
в объеме, чем металлы, что в основном и определяет расположение шлака
в верхнем слое прн температуре затвердевания скандия. Избыток кальция,
взятый для реакции, концентрируется преимущественно в шлаке и тем
самым понижает плотность шлака, что способствует разделению.
После удаления шлака слиток скандия переплавляют в танталовом
тигле в вакууме, чтобы удалить 0,5—2,0% кальция, оставшегося после
восстановления. Полученный скандий содержит 3—5% тантала как основ-
ную примесь; углерод, азот, кремний, железо, кальций и другие редко-
земельные элементы присутствуют в количестве менее 3-10—*% каждый.
Такое высокое содержание тантала весьма нежелательно в процессе полу-
чения чистого металла, но, так как эта примесь тантала присутствует
в виде дендритов, совсем не связанных со скандием, она не мешает исполь-
зованию этого материала для некоторых исследований.
664 Г лае а 26
Процесс с получением цинкового сплава. Чтобы достигнуть восстанов-
ления ScF3 при более низкой температуре по сравнению с той. которая
потребуется для проведении описанного выше процесса, и таким образом
почти исключить содержание тантала в конечном продукте, можно исполь-
зовать процесс восстановления с получением цинкового сплава. Лаборатор-
ный процесс для получения тория, предложенный Вильгельмом с сотруд-
никами, описан в главе «Торий». Чтобы получить скандий, смешивают
измельченный в порошок ScF3, дважды дистиллированный металлический
кальцин, цинк и фторид лития в количествах, необходимых для протекания
следующей реакции:
2ScFH ЗСаИзСытшг 10%+8Zn |-i2UF -* 3(CaF2.4UF)-2(So4Zn)Clriai!. E)
Смесь помещают в танталовый тигель и заваривают в защитной атмосфере
гелия A50 мм рт. ст.). Затем бомбу нагревают до 1100э в инертной атмос-
фере. При такой температуре эвтектический сплав скандий — цинк и эвтек-
тическая смесь фторид кальция — фторид лития находится в расплавлен-
ном состоянии, что необходимо для четкого разделения двух фаз. Жидкий
сплав находится в контакте с танталом при более низкой температуре,
чем металлический скандий в процессе прямого восстановления, описан-
ного выше, поэтому в скандиевом сплаве растворяются значительно мень-
шие количества тантала.
После охлаждения хрупкий сплав измельчают до размера гороха
и затем нагревают в вакууме при 1200°, чтобы путем дистилляции удалить
цинк; в остатке находится пористая губка чистого металлического скандия.
Эту губку затем можно превратить в твердый металл путем обычной дуго-
вой плавки в инертной атмосфере, несмотря на то что давление пара скан-
дия довольно высокое, так что примерно 10% металла в виде тумана рас-
пыляется на внутренних стенках печи при этой операции.
Продукт, полученный этим методом, содержит лишь следы тантала
и менее 5-10 4% цинка, а также другие примеси, по существу те же, какие
имеются в металле, полученном прямым восстановлением*.
Единственным недостатком этого процесса является тот факт, что
из-за введения цинка и фторида лития, необходимых для создания надле-
жащих условии работы при более низких температурах, объем тигля увели-
чивается втрое по сравнению с тем, который требуется для получении такого
же количества скандия прямым восстановлением. Кроме того, введение
этих реагентов безусловно увеличивает содержание прнмесей в конечном
продукте.
ОЧИСТКА МЕТАЛЛИЧЕСКОГО СКАНДИЯ
Как видно из данных по давлению пара, полученных Уейкфилдом 113],
дистилляцию вполне можно применять в комбинации с другими описан-
ными выше методами для получения металла высокой степени чистоты.
При комбинации методов очистки обычно вначале проводят процесс пря-
мого восстановления, чтобы получить металлический скандий с хорошим
выходом. При этом в качестве основной примеси присутствует только
тантал, содержащийся в большом количестве. Он успешно удаляется при
дистилляции полученного металла, так же. как и большая часть других
примесей, присутствующих в небольших количествах.
* Малое количество металла не позволило выделить пробы для разработки ана-
литических методов, дающих необходимую точность определения.
Скандии
665
Дистилляцию скандия осуществляют путем нагревания металла до
1650—1700° в вакууме A • 10~6 мм рт. ст. и менее). Этот процесс проводит-
ся в приборе, изображенном на схеме.
Танталовы» тигель помещают таким образом, что его края выступают
на 50 мм выше верхней части нагревательной зоны печи. Вверху тигель
окружен конденсатором, который состоит из танталового листа толщиной
0,127 мм и закрепляется танталовой проволокой; он простирается выше
Прибор для дистилляции скандия. О
/ — кварцевая трубка; 2 — конденсироианный металл; о
3 — экран из окисн бериллия; 4 — перегородки; 5 — ин-
дуктор; € — скандий. О
С
О
О
О
нагревательной зоны. Конденсатор покрывается плотно прилегающей
крышкой с отверстием диаметром 3,2 мм в центре, которое необходимо для
быстрого эвакуирования системы в начале работы.
В процессе дистилляции температура нижней части тигля, из которой
должны поступать пары, поддерживается при 1650—1700°; верхняя часть
конденсатора имеет температуру 800—1000°. Два отражателя внутри тигля
находятся отдельно на расстоянии 25 мм друг от друга, причем нижний
расположен примерно на 50—130 мм выше уровня поверхности расплавлен-
ного скандия. Эти отражатели направляют пары на верхнюю часть секции
конденсатора, и, таким образом, основная масса конденсата собирается
на нижней поверхности крышки. Конденсат представляет собой конусооб-
разный волокнистый налет блестящего металла, который на конце по су-
ществу сплавлен. Конденсатор можно разобрать, удалить с него конденсат
и снова собрать. Эту компактную, частично сплавленную массу металла
можно сплавить в дуге, при этом регенерируемые потери за счет испарения,
как указывалось раньше, составляют более 10%.
По данным анализа в дистиллированном металле не обнаружен тантал
и он содержал следующие примеси: <0,05% железа. <0,02°Ь кальция,
<0,03% магния, <0,06% хрома и меньше чем по 110 '% углерода
и азота.
СВОЙСТВА
Металлический скандий имеет серебристый металлический блеск
со слегка желтоватым оттенком, который появляется при нахождении
металла на воздухе. Скандий — мягкий металл, который легко обрабаты-
вается в чистом состоянии. Он легко реагирует с кислотами, но длительное
время не теряет блеска на воздухе и в такой же степени не подвергается
действию воды. При высоких температурах E00—800е) скандий окисляется
666
Глава 26
на воздухе. В общем скандий по своим свойствам весьма сходен с некоторы-
ми тяжелыми редкоземельными металлами и иттрием: он не реагирует
со смесью A : 1) концентрированной азотной кислоты н 48%-ной плавиковой
кислоты, и, следовательно, эта смесь может быть использована для раство-
рения тантала и удаления его из скандия.
В таблице представлены физические свойства скандия.
ФИЗИЧЕСКИЕ СВОЙСТВА СКАНДИЯ
Порядковый номер
Атомный вес
Температура плавления, СС
Температура кипения, °С
Температура полиморфного прекра •
щения, °С
Плотность, г/см3
Кристаллическая решетка
До 1335°
Выше 1335°
Атомный объем, см3/моль
Атомный радиус, А
Удельная теплоемкость при 25°,
кал/моль- град
Теплота плавления, ккал/моль
Теплота испарения при 1630°,
ккал/моль
Коэффициент линейного расширения
при U—9ШС, град1
Удельное электрическое сопротивле-
ние при комнатной температуре,
ом-см
Температурный коэффициент электро-
сопротивления (от комнатной тем-
пературы до 100°), град'1
Предел прочности при сжатии, кг/мм2
Твердость по Роквеллу F (прокатан-
ный на холоду и неотожженный)
Поперечное сечение захвата тепло-
вых нейтронов, бирн/атом
21
44,956 A00% изотоп 45)
1539
2727
1335
2,99
Гексагональная плотиоупако-
ванная
а—3,308±0,00| А
с = 5,267±0,003 А
е/а=|,59
Вероятно, кубическая гране-
центрнрованная
15,0
1,64
6,01
3,85
78,6±0,7
12-10-е
66
5,4-10-s
40
98
24,0±1,0
ОБРАБОТКА МЕТАЛЛА
Скандий, содержащий в качестве примесеп кислород и другие неметал-
лы, очень трудно обрабатывается. Подобно нттрию его обработка значи-
тельно улучшается в чистом состоянии. Скандий доступен пока еще в край-
не ограниченных количествах, что затрудняет изучение процесса обработки
его давлением, однако известно, что скандий можно с успехом прокатывать
и ковать, сваривать в инертной атмосфере электродуговой сваркой и про-
водить точечную сварку.
Скандий 667
СПЛАВЫ
Поскольку до настоящего времени исследователи располагали неболь-
шим количеством металлического скандия, имеется всего несколько работ,
посвященных изучению систем, образованных этим и другими металлами.
Сходство скандия с иттрием и редкоземельными металлами дает возмож-
ность предсказать его поведение в сплавах в тех немногих случаях, когда
имеются данные, позволяющие делать такое сравнение. Следовательно,
при отсутствии экспериментальных данных соответствующие системы,
образованные редкоземельными металлами, могут быть использованы в пер-
вом приближении для характеристики аналогичных систем с участием
скандия. Такое предположение, вероятно, не всегда может быть правиль-
ным, так как известны случаи, когда наблюдаются заметные различия
в поведении двух редкоземельных металлов при их взаимодействии с дру-
гим элементом. Кроме того, атомные радиусы редкоземельных элементов
значительно больше A,73—1,87 А) атомного радиуса скандия A,64 А),
так что он с большей вероятностью, чем редкоземельные элементы, мог
бы образовывать твердые растворы с некоторыми металлами,,, имеющими
несколько меньший атомный радиус, например гафнием A,59 Л),о магнием
A,60 Л), плутонием A,64 Л), ураном A,56 Л) и цирконием A,60 Л).
Ниже приводятся общие сведения о взаимодействии скандия с други-
ми элементами; в них включены немногие экспериментальные данные,
но главным образом представлены предсказания, основанные на степени
сходства скандия с иттрием и редкоземельными элементами.
Группа I (щелочные металлы). Скандий проявляет очень незначитель-
ную склонность к образованию сплавов с этими металлами или вообще
не образует с ними сплавы. Вероятно, в расплавленном состоянии они
не смешиваются, доказательством чего может служить их поведение в про-
цессе восстановления.
Группа II (щелочноземельные металлы). Скандий в достаточной сте-
пени растворим в магнии и повышает его твердость. По-видимому, магний
и скандий, а также кальций и скандий не образуют интерметаллических
соединений.
Группа III (Y и редкоземельные элементы). Образуются многочислен-
ные твердые растворы без интерметаллических соединений.
Группа IV (Ti, Zr, Hf). Между высокотемпературными формами титана
и скандия вполне определенно наблюдалось образование твердых раство-
ров [1]. Лучшим доказательством образования твердых растворов может
служить то, что скандий выше 1335° имеет кубическую гранецентрированную
решетку. Это пытались подтвердить высокотемпературным рентгенографи-
ческим исследованием и закалкой образцов, но опыты оказались неудачны-
ми. Гексагональные формы титана и скандия растворяются друг в друге
в количестве примерно 10%. Образование таких твердых растворов наблю-
дали и другие авторы [5, 6].
Группа V (V, Nb, Та). По существу, твердые растворы не образуются,
но растворимость ванадия, ниобия и тантала в расплавленном скандии за-
метно повышается. Интерметаллические соединения не образуются.
068 Г л as a 26
Группа VI (Cr, Mo, W). Образование интермсталлических соединений
или твердых растворов маловероятно. Это известно на примере вольфрама^
Растворимость этих расплавленных металлов п расплавленном скандии
меньше, чем ванадия, ниобия и тантала.
Группы VII, VIII и I, II, III (побочные подгруппы). С этими элементам»
скандий может образовывать соединения, и в ряде случаен они получены
(соединения в системах Sc — Cd, Sc — Zn. Sc — Аи и др.). Некоторые
соединения легко разлагаются в вакууме или при нагревании (в системах
Sc—Zn, Sc —Cd).
Th, L.Pu. Возможно образование твердых растворов. Интерметалли-
ческпе соединения не существуют.
токсичность
До последнего времени не было никаких сведений о токсичности скан-
дия. На основании сходства скандия с иттрием и редкоземельными эле-
ментами нельзя ожидать, что он может представлять серьезную опасность
для здоровья. До тех пор пока не определены его токсические свойства,
с ним следует работать, соблюдая осторожность.
ЛИТ ЕР АТУ РА
1. В е a u d г у В. J., D a a n e А. П., Ames, Iowa (будет опубликовано).
2. Fischer W., В г u n g e г К., Grieneisen H., Z. anorg. Chera., 231.
54 A937).
3. F r i t z J. S., P i e t r l у k D. J. (в печати).
4. Goldschmidt V. M., Geochemistry, Clarendon Press, Oxford, 1954.
5. Корнилов И. И., Изв. АН СССР, ОХН, 392 A954).
6. Love В.. WADC Report RC 106, 1958.
7. Marble J. P., Glass J. J., Am. Mineralogist, 27, 696 A942).
8. Petru F., Prochazka V., H a j с к В., Czechoslov. Chem. Commun,.
22, 1534 A957).
9. Pokras L., Bern ays P. M., Anal. Chem.. 23, 757 П951).
10. S p e d fl i n g F. H., D a a n e A. H , J. Metals, fi, 504 A954).
11. Sped ding F. H., Daane A. H.. in Finniston H. M., Howe J. P., Eds.,
Progress in Nuclear Energy, Vol., 1, McGraw-Hill Book Company, New York, 1956.
12. S p e d d i n g F. H., Powell J. E., Daane A. II., H i 1 1 e r M. A..
Adams W- H., J. Electroctiem. Soc, 105. 683 A958).
13. Wakefield G. F., Sped ding F. П., D a a n e A. H., Trans. A1ME.
218. 608 A960).
27.
ТАЛЛИЙ
Г. Э. ХОУ
И. Е. Howe, Research Department, American
Smelling and Refining
Company, Svuth Pluin/ield, New Jersey
ВВЕДЕНИЕ
Впервые таллий экспонировался на международной Лондонской выстав-
ке 1862 г. За год до этого Вильяме Крукс, исследуя спектроскопическим
методом шламы одного сернокислотного завода в Германии на содержание
теллура, обнаружил в спектре характерную зеленую линию и сделал
заключение, что эта линия принадлежит новому элементу. Сравнивая цвет
спектральной линии с ярко-зелеиой окраской молодой растительности,
Крукс назвал элемент таллием (латнн. triullus — распускающаяся детка).
Ему удалось получить небольшое количество металлического таллия для
демонстрации на выставке 1862 г.
Часто то или иное открытие вызывает споры о приоритете, и открытие
таллия не явилось исключением. Независимо от Крукса профессор Ламп
обнаружил ту же спектральную линию при исследовании шламов другого
сернокислотного завода и подал заявку на свое открытие. По-видимому,
Крукс опередил открытие Ламп нсего на несколько месяцев.
Вскоре при исследовании физических и химических свойств таллия
предположение Крукса о том, что этот элемент относится к группе серы, было
опровергнуто. Исследования показали, что новый элемент по ряду своих
спойсТБ близок к CDiiHiiy, ртути, калию и алюминию. Д. И. Менделеев
при составлении периодической таблицы поместил таллнй в III группу
под индием, между ртутью и свинцом, и с тех пор положение таллия в таб-
лице не изменилось.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Содержание таллия в земной коре, по последним подсчетам А рейса
[91, составляет 0,003"о, т. е. в 10 раз превышает прежние данные. Однако
такое широкое распространение таллия еще не обеспечивает возможности
значительного промышленного получения его, поскольку основные коли-
чества элемента найдены в калиевых минералах, не имеющих в настоящее
время промышленного значения. Месторождении основных таллиевых
минералов с содержанием 16—60°с таллия * настолько мало, что они также
не имеют промышленного значения.
Основным источником получения таллия по-прежиему являются суль-
фидные руды, хотя содержание в них таллия меньше, чем в калиевых мине-
ралах. Таллии извлекается как побочный продукт при обжиге пиритов
в производстве серной кислоты и при выплавке свинца и цинка.
* Врбант AIAsoSbS5 и лорандиг TIAsS2.— Прим. ред.
670 Г лае а 27
ПОЛУЧЕНИЕ ТАЛЛИЯ
Соединения таллия, будучи летучими при температурах плавки руд,
при этом процессе конденсируются в пылях, уносимых в дымоход, обычно
в виде окиси и сульфата. Извлечение таллия из пыли основано на различ-
ной растворимости в воде солей таллия и других соединений металлов,
также содержащихся в пыли. Таллий извлекается подкисленной кипящей
водой [1, 41.
Очистка таллия от примесей тоже основана на использовании различ-
ной растворимости некоторых соединений таллия и аналогичных соедине-
ний примесей. Так, растворимость сульфата таллия в воде позволяет отде-
лять его от сульфата свинца; сульфид таллия(Ш) нерастворим в щелочных
и растворим в кислых растворах, что дает возможность отделять его от эле-
ментов Г группы; хлорид таллияA) незначительно растворим в холодной
воде, на чем основано отделение его от хлоридов кадмия, цинка, теллура
и меди.
Металлический таллий можно получить из соединений различными
путями: 1) электролизом карбоната, сульфата и перхлората; 2) оса-
ждением металлического таллия цинком и 3) восстановлением оксалата
или хлорида таллияA) [17].
В литературе описано большое число промышленных способов полу-
чения таллия. Некоторые из них основаны на извлечении таллия из дымо-
ходной пыли кипячением в подкисленной воде. Перешедший в раствор
таллий осаждают цинком. Присутствующие в незначительных количествах
металлы, например цинк, медь, свинец, кадмий и индий, удаляют "раство-
рением таллия в разбавленной серной кислоте и осаждением примесей
сероводородом. Таллий легко может быть получен электролизом насыщен-
ного раствора сульфата таллияA) при 30°. Для получения металла высокой
степени чистоты применяют нерастворимый платиновый анод. Катодом
могут служить хорошо отшлифованные для получения легко снимающегося
осадка платина, никель и нержавеющая сталь. Металл промывают, прес-
суют в бруски, плавят в атмосфере водорода и отливают в формы [171.
Таллий получают также как побочный продукт в производстве кадмия
[18, 191. Дымоходную пыль выщелачивают серной кислотой, при этом
образуются сульфаты таллия и кадмия. Перешедшие в раствор примеси
осаждают в виде сульфидов и гидроокисей, очишепный раствор подвергают
электролизу для осаждения кадмия. Когда содержание таллия и кадмия
в растворе достигнет соотношения 1 : 10, производят замену катодов новы-
ми. Электролиз продолжают; при этом происходит осаждение сплава кад-
мий — таллий E—20% TI).
Кадмиево-таллиевые катоды обрабатывают кипящей водой и паром.
Полученный раствор содержит гидроокись таллия и незначительное коли-
чество кадмия. Кадмий удаляют осаждением содой; в растворе остается
карбонат таллия. От остальных примесей, содержащихся в растворе, тал-
лий отделяют осаждением сульфидом натрия.
Сульфид таллия растворяется в серной кислоте с образованием чистого
сульфата таллия. Поскольку сульфат является основным видом промыш-
ленной продукции, дальнейшей химической обработки его не требуется.
В случае необходимости получения металлического таллия раствор сульфата
таллия применяется в качестве электролита, при электролизе которого
на алюминиевых катодах выделяется губчатый таллий. Применяют аноды
марки «Дурайрон». Полученную таллиевую губку прессуют, плавят и отли-
вают в формы.
Таблица 1
ФИЗИЧЕСКИЕ СВОПСТВА ТАЛЛИЯ
Порядковый помер 81
Атомный вес 204,37
Плотность, г/см3
20" 11,85
306,5° 11,289
326,7° 11,254
330° 11,250
Атомный объем, см3/г-апюм 17,24
Температура плавления, °С 303
Температура кипения, °С 1457
Удельная теплоемкость, кал/е-град
20° 0,031
303—500° 0,0367
Скрытая теплота плавления, кал/г 5,04
Скрытая теплота испарения, кал/г 189,9
Колффициент линейного расширения, град^1 28-10-*
Коэффициент теплопроводности, кал/см-сек-град 0,093
Удельное электрическое сопротивление, мком-см
0° 18
303» 74
Предел прочности при растяжении, кг/мм2 0,9
Относительное удлинение (на длине 125 мм), % 40
Твердость по Бринеллю (pb-5) 2
Объемное расширение при затвердевании, % 3,23
Коэффициент сжимаемости B0°, 100 — 500 Мбар) 2,83-10-°
Давление пара при 845—900" К, мм рт. ст.
log P=—^
825" 1
9835 Ю
1196° 11»
1274° 200
1364° 400
1457° 760
Кристаллическая решетка
Ниже 230= Гексагональная
плотноупакован-
ная
«=3,450 А
с=5,514 А
Выше 230° Кубическая гране-
иентрнрованная
с=3,874 А
Поверхностное натяжение при 327°, дн/см2 401
Поперечное сечение захвата тепловых нейтронов
Таллий-203
Таллин-205
Изотопный состав,
%
29,5
70,5
11.4±0,9
0,8±0,08
672
Глава 27
Производство таллия составляет около 15 т в год. Единственным круп-
ным поставщиком таллия в СШЛ является фирма «Америкой смелтинг
энд рифайнинг компания.
В течение последних тридцати лет цены на таллий значительно коле-
бались, достигая одно время 48,6 долл. за I кг. В настоящее время (данные
1960 г.) ценя на таллий составляет 16,5 долл за 1 кг.
ФИЗИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ
Свежесрезанная поверхность металлического таллия имеет металли-
ческий блеск, но на воздухе быстро тускнеет и приобретает голубовато-
серую окраску, напоминающую по внешнему ищу свинец. В отличие от свин-
ца при выдерживании таллия на воздухе в течение нссколких недель его
поверхность покрывается плотной окисной пленкой. В таблице приводятся
физические свойства таллия; при сравнении их со свойствами свинца обна-
руживается значительное сходство.
Таблица 2
¦ЖТЬКТИЧССКАЯ ТЕМПЕРА
Смете мл
Ag- Tl
Ли—Tl
Bi—Cd—Sn—Tl
Bi—Cd—Tl
Bi—Pb—Tl
Bi -Sn—Tl
Bi—Tl
Cd—Pb—Tl
Cd—Tl
Н(;ЬТ12—Tl
Hg5Tl2—Tl
In Tl
Ph—Cd—Ш—TL
Pb—Sn—Bi -Tl
Pb—Sn—Tl
Pb- Tl
Sn—Cd— Г1
Sn —Tl
Sb—11
ТУРА ДКОННЫЛ. ТРОЙНЫХ И ЧЕТ
CoiTjm, %
98.7Т1
73Т1
49.1ВГ; 18,2Cd; 23,4Sn; 9.2T1
43Bi; 4fl,8Cd; I6.2TI
38,2Bi; 36,4Cri; 25.4T1
ГВЕРНЫЛ СПЛАВОВ ТАЛЛИЯ
55,2Bi; 33,3Pl; 11.5T1
42,2Bi; O,8Pb; 48T1
50Bi; 35,7Sn; I4.3T1
44Bi; 31Sn; 2.5T1
52.ET1
83TI
40.5T1
B.5T1
Эыектики не образует, твер-
дый раствор
44,3Bi; HCd; 35,8Pb; 8.9T1
46,5Bi; 28Pb; 14Sn; 11.5T1
—
Эвтектики не образует, твер-
дый раствор
Эвтектики
Эвтектики
lOCd; 42Sn; 39TI
43.5T1
80T1
289
131
91,6
124
146,6
90,8
ШЬ,4
121
167,6
188
не образует а
203
0,6
-60
81
93
не образуетп
129,5
170
195
J В Tpoflnofl системе Pb — Cd — Tl существует инвариантная точка при 210°, кот«г;ш не
носит эвтсктпче1_ког1> характера [41].
G Псевдодвойная эвтектика сущссгнле i в области между PbTlo и Sn при 181 Bn [2t'J. но
ipoitiiiin эвтектическая точка отс>тстпует.
Таллий 673
Исследования систем таллия и других элементов [21 показали, что
таллий легко образует сплавы с большинством элементов. Исключение
составляют медь, алюминий, цинк, марганец, никель и селен, имеющие
ограниченную растворимость в расплавленном состоянии. В табл. 2 приве-
дены эвтектические температуры двойных, тройных и четверных сплавов
таллия.
Устойчивость различных металлов против действия расплавленного
таллия следующая: миргинец устойчив до lOOO3, аустснитная нержавеющая
сталь (I8Cr- 8Ni) - - до 649Г, алюминий — до 649", железо «армко» устойчи-
во при температуре плавления таллия, равной 303°; никель и монель-металл
мало устойчивы при 649е.
Брюэр 1441 расположил пригодные в качестве материала контейнеров
для расплавленного таллия металлы в порядке уменьшения их стойкости:
железо, вольфрам, тантал, молибден, ниобий, кобальт.
ХИМИЧЕСКИЕ СВОЙСТВА ТАЛЛИЯ
Таллий находится в III группе периодической таблицы в подгруппе
таллия вместе с галлием и индием. По своим химическим свойствам таллий
имеет сходство также с щелочными металлами, в связи с чем ранее возникал
вопрос, к какой группе относится этот элемент.
Таллий образует два ряди соединений, в которых он одновалентен
пли трехвалентен. Соли одновалентного таллия наиболее многочисленны
и устойчивы. Соли трехвалентного таллия легко восстанавливаются до солей
одновалентного таллия двухлористым оловом, сернистой кислотой, метал-
лическим таллием, сульфатом жслеза(П), мышьяковистокислым натрием
пли кипящей водой.
Таллий при 2СГ медленно окисляется на воздухе; с повышением темпе-
ратуры окисление протекает гораздо быстрее. При обычной температуре
на воздухе таллий за несколько недель покрывается толстым слоем окиси.
Водорастворимыми солями таллияA) являются ацетат, нитрат, ни-
трит, перхлорат, гидрат закиси, карбонат, сульфат и ферроцнанид. Сульфид
и хромит таллияA) нерастворимы, а галогениды умеренно растворяются
только в горячей воде.
Таллий легко растворяется в азотной кислоте; в разбавленной серной
кислоте растворение происходит медленно, в концентрированной — гораз-
до быстрее. В соляной кислоте растворение таллия протекает чрезвычайно
медленно.
Закись таллия Т12О образуется в результате окисления металла при
низкой температуре или при нагревании гидрата закиси таллия Т1ОН при
100'. Она плавится при 300" и разъедает стекло. Закись таллия легко окис-
ляется до окиси Т12О3 или восстанавливается до металла. Четырехокись
таллия Т1=О4 может быть получена электролитически. При растворении
в воде закиси таллия происходит образование гидрата закиси.
Гидрат закиси таллия образуется также при взаимодействии металла
с водой, содержащей кислород. Гидрат закиси таллия реагирует в воде
как сравнительно сильное основание: поглощает двуокись углерода и разъ-
едает стекло и фарфор. Гидроокись таллия Т1(ОНK образуется при дей-
ствии едких щелочей или аммиака на растворы солей трехвалентного таллия.
Галогениды одновалентного таллия сходны по своим свойствам с гало-
генидами свинца и образуются при действии соответствующих кислот
на окись, гидроокись или карбонат. Трнхлорнд таллия образуется в виде
43 .).,к;и № 239
67 4 Глава 27
моногидрата Т1С13-Н2О при пропускании хлора в воду, содержащую сус-
пензию хлорида таллия T1CI. Взаимодействие фтора с таллием происходит
настолько энергично, что металл при этом раскаляется.
Сульфат галлия T12SO4 растворяется в холодной воде D,87 г на 100 г
воды). Сульфат трехвалентного галлия с сульфатами некоторых одновалент-
ных металлов образует соединения типа квасцов. При взаимодействии
таллия с селеном и теллуром образуются селенаты и теллураты.
токсичность
При работе с таллием — во нремя плавки или при соприкосновении
с кожей — следует принимать меры против его вредного действия. На воз-
духе и с водой металл легко реагирует с образованием растворимых соеди-
нений. Такая реакция может происходить с влагой кожи, поэтому обработ-
ка таллия без применения соответствующих защитных средств должна
быть запрещена. Хотя случаи отравления таллием в промышленности
редки, все же большое число фактов тяжелого или смертельного отравления
происходит в результате введения таллия внутрь организма случайно-или
с лечебными целями, а также при его попадании на кожу. Признаками
отравления таллием являются быстрое выпадение волос, желудочно-кишеч-
ные заболевания и расстройство нервной системы [65, 69, 70, 721.
СПОСОБЫ ОБРАБОТКИ
Таллий — элемент с низкой температурой плавления, хорошей ков-
костью и невысокой прочностью. Он может быть переплавлен и подвержен
холодной обработке методами, применяемыми при обработке свинца, т. е.
отлит, прокатан или выдавлен.
Ровный плотный осадок таллия можно получить электролизом пер-
хлората таллия с применением пептона в качестве анодного деполяризато-
ра и с добавкой технического крезола [111.
ОБЛАСТИ ПРИМЕНЕНИЯ
Основное промышленное применение имеет сульфат таллия. Впервые
это соединение было применено в Германии в 1920 г. в качестве сильнодей-
ствующего средства против грызунов и с тех пор широко применяется
для уничтожения грызунов и муравьев. Сульфат таллия не имеет запаха
и вкуса, и, таким образом, при подмешивании его к пасте, состоящей из
крахмала, сахара, глицерина и воды, не может быть обнаружен [57, 66,
67, 73].
Уникальная светочувствительность некоторых соединений таллия
используется в современной военной технике. Кейс в 1917 г. нашел, что
электропроводность оксисульфида таллия (таллофидный фотоэлемент) изме-
няется под действием света. Эти фотоэлементы обладают особой чувстви-
тельностью к инфракрасным лучам. Кашман усовершенствовал талло-
фидный фотоэлемент с целью применения его в военных системах сбязи
[55, 61, 75].
Смешанные кристаллы бромида и иодида таллия применялись во вре-
мя второй мировой войны. Эти кристаллы, обладающие способностью
пропускать инфракрасные лучи очень длинных волн, нашли применение
Таллий 675
в оптических военных приборах, предназначенных для пбпаружнвания
снайперов и для сигнализации в темноте 174].
Кристаллы этого типа впервые были получены в Германии. В военно-
морской исследовательской лаборатории США получены кристаллы, содер-
жащие 42 мол. "о бромида и 58 мол.% иоднда таллия. Их свойства ана-
логичны свойствам кристаллов, полученных в Германии. Смесь приведении о
состава расплавляется в платиновых или пирексовых тиглях с коническим
дном (угол конуса 60°). Процесс выращивания кристалла регулируется
изменением температуры нечн и скоростью продвижения тигля в печи,
температура верхней части которой поддерживается равной 470°. При
Скорости продвижения, равной 25 мм за 7 час, образуются прекрасные
кристаллы диаметром 25 мм; при скорости 25 мм за 32 час образуются
кристаллы диаметром 50 мм.
Возрастающий интерес к лампам, дающим излучение эрнтемалыюго
действия, привел к исследованию материалов, способных превращать
первичное ультрафиолетовое излучение в лучи эритемального действия-
Некоторые типы силикатов и фосфатов щелочноземельных металлов,' акти-
вированных таллием, не только обеспечивают хорошее эритемалыюе изл\-
чеиие, но и сохраняют высокий процент этого излучения в течение несколь-
ких сот часов 156. 60, 62, 63, 681.
Таллий, по-видимому, можно применять как катализатор при восста-
новлении нитробензола водородом.
Применение солей таллия в медицине ограниченно вследствие неболь-
шой разницы между токсичными и терапевтическими дозами. Таллий при-
меняется при лечении стригущего лишая для удаления волос.
Применение таллия в сплавах очень ограниченно, хотя известны спла-
вы, обладающие уникальными свойствами.
Добавление свинца к таллию повышает температуру плавления сплава
выше температуры плавления компонентов. Такие сплавы получили огра-
ниченное применение в производстве специальных типов предохранителей.
Наиболее уникальным является сплав таллия с ртутью, образующий
эвтектику при содержании таллия 8,5%. Температура затвердевания
этого сплава —60', т. е. на 20° ниже температуры затвердевания ртути.
Самая низкая температура, наблюдаемая обычно в Арктике или в стра-
тосфере, составляет —60", поэтому данные сплавы можно применять для
замены ртути в жидкостных затворах и переключателях в условиях ука-
занных температур.
Флешен и Пирсон [59] при производстве низкоплавкого стекла вводили
таллий как один из компонентов (другие компоненты — мышьяк и сера).
Это стекло применялось для покрытия полупроводников, конденсаторов
и других электронных приборов с целью предохранения их от атмосфер-
ного окисления, загрязнения и действия влаги.
Несмотря на то что почти весь выпускаемый в настоящее время таллий
применяется для изготовления родентицидов и инсектицидов, с ростом его
производства легко может быть расширено промышленное использование
ценных свойств металла и его соединений.
Л ИТЕРAT У РА
1. DcMent J, Drake Н. С, Rarer Metals, Chemical Publishing Company
Inc., New York, 1946, p. 43.
2 llanstn M., Dcr Aufban (ler Zvveistofflegicrungen, VerlaR Julius Springer, Ber-
lin, 1936, S. 160, 203, 265, 4СП, 651, 1001. 1078, 1087.
43"
C7C Глава 27
3. 11 a ugh ton J. L., Bibliography of the Literature Relating to Constitulional
Diagrams of Alloys. Institute of Metals, London, 1942, p. 135. 138, 146. 157.
4. Hopkins B. S., Chapters in the Chemistrv of Less Familiar Elements, Stipes
Publishing Co. Champaign, 111-, 1910. Chap. 9.
5. L у о n R. N., Liquid Metals Handbook, Atomic Energy Commission, Department
of the Navy, June 1950.
6. M e I 1 о г J. W-, A Comprehensive Treatise on Inorganiu and Theoretical Chemistry,
Vol. 5, Longmans, Green and Co., Ltd., London, 1924, p. 406.
7. Metals Handbook, American Society fqr Metals, Cleveland, 194R, p. 20.
8. National Research Council, International Critical Tables of Numerical Data, Phy-
sics, Chemistry and Technology, Vol. 2, McGraw-Hill Book Company, Inc., New
York, 1327. p. 416, 141, 474; Vol. 6, p. 196.
9. Jhretis 1 . H., Science, 10B, 268 A947).
10 A n d r i e u x L., С R., 190, 925 A930).
11. Brown O. VV., McGlynn S. A., Trans. Electrochem. Soc, 53, 351 A928).
12. Meyer H. C, Eng. Mining J., 121. 91 A926); 123, 137 A927); 125, 136A928);
130, 135 A930).
13. Mineral Ind., 39, 661 A930).
14. Minerals Yearbook, U. S. Bureau of Mines, 1942. p. 829; 1943, p. 829—830; 1944,
p. 820—821; 1945, p. 824—825; 1946, p. 1281.
15. Munch J- С Clicm. Trade J., 93. 173, 195 A933).
16. Petar A., U. S. Bureau ofMines, lnfrom. Circ. № 6453, 1941.
17. Sanderson L., Can. Mining J., 65. 624 A944).
18. 1 e a t s R., пат. США 2011882, August 20, 1935
19. Teats R-, пат. США 2060453, Novemher 10, 1936.
211. A s a h a r a G., Sci. Papers lnst Phys. Chem Research (Tokyo). 2, 253
A925).
21. Becker h,.. Z. Physik, 42, 479 A927).
22 С о 1 e m a n F., Egerlon E.. Trans. Roy. Soc, 234A, 177 A935).
23. E i n e с к e E, Z. anorg. allgem Chem., 238, 113 A938).
24. En do H., J. lust. Metals, 30, 121 A923).
25. F a j a n s K., V о i g t A., Phys. Rev., 60, 619 A941)
26. French S. J., Metals and Alloys, 7, 61 A936).
27. Jaeger R., Physik. Z., 41, 398 A940).
28. J a n с с к е Е, Z Metallkunde, 29, 367 A937).
29. J a n e с к e E., Z. Metallkunde, 31, 170 A939); 2fi, 153 A934); см. также Z. Metall-
kunde, 27. 141 A935).
30. К i r s li n a n R., N a h u m E. A., Proc. Cambridge Phil. Soc., 36, 490 A940).
31 Rosier W,Kim K, Z. Metallkunde, 31, 84 A939).
32. Rosier W-, К am K, Z. Metallkunrie, 31, 82 A939).
33. Roster W.. Wagner E., Z. Metallkunde, 30, 338 A938).
34 К б s t e г W., Wagner F.., Z. Metallkunde, 30. 335 A938).
35. Кум маков Н. С, К о р е н е в И. И., Труды института аиалит. и физич.
химии, В. 47 A933).
36. L e v i G. R.. Z. Physik. 44, 603 A927).
37. L i p s о m H., S t о k e s A. R-, Nature, 148, 437 A941)
38. M с i s s n e r W, F r a n z H., Wester hofl H., Ann. Physik, 13, 505 A932).
39. О n n es H. K-, T u i j n W-. Arch, neerl. sci. A11). BA, 284 A923).
40. Perlman I., Goecherman R. H., Templeton R. 11., How-
land J. J., Phys. Rev., 72, 352 A947).
41. P 1 a n k J., Urmanczy А., Коггомоп u. Metallschutz, 27, 141 A941)
42. Richards T. VV., White J D., J. Am. Chem. Soc, 50, 3290 A928)
13. Bra у J., M о r r a 1 F. R., Trans. Elcctrochcm. Soc, Ь0, 55 A941).
Таллий 677
44. Brewer L., The Thermodynamics of High Vacuum—High Temperature Systems
¦ Applied to Refractories, Metallurgical Project, cc-1802, June 8, 1944.
45. Ellis O. W-, Am. Metal. Market, 35, 1, 44 A928).
46. F i п к С. С, Conard С. K-, Jr., Trans. Electrochem. Soc., 58, 457 A930);
Scott J. J., В a n a VV. P , пат. США 2236840, April 1, 1941.
47. II e n s e I F. R., Am. Inst. Mining Met. Engrs., Metals Tcchnol., 12, № 7 (Octo-
ber 1945), Tech. Puhl. 1930, p. 1—14.
18 H e n s с 1 F. R., пат. США 2180Й45, November 21, 1939; 2182381, December 5,
1939; 2375224. May 8, 1945; 2379434, July 3, 1945; 2379435, July 3, 1945; 2393905,
January 29, 1946.
49. 1. G. Farbcnindustrie. A.G., герм. пат. 494153, July 30, 1926; 496348, July 30. 1926;
пат. США 1863612, June 21, 1932.
50. McDonald J. C. Trans. Am. Inst. Mining Met. 'Engrs., 137, 430 A94A).
51. Д1 с D о n a 1 d J. С, пат. США 2233954, March 4, 1941; 230296R, November 24,
1943; 22R6866, June 16, 1942-
52. M e i s s n e r W., F r a n z H., Wester tioK H., Ann. Physik, 13, 367 A932).
53. Parks W. G., LeBaron 1. M., Trans. Electrochem. Soc., fiff, 599 A936).
54. Asiatic Petroleum Co., Ltd., E g с г t о n А. С, англ. пат. 279560, July 29, 1926
55. Case T. W-, Phys. Rev., 15, 289 A920).
56. С 1 a p p R. H., пат. США 241703В, March 4, 1947; Chpp R. H, G i n-
t h e r R. J., J. Opt. Soc. Am., 37. 355 A947).
57. D i e к e S. H., R i с h I e г С P., U. S. Public Health Kepts., 61, 672 A946)
58. F. m 1 e n T, S t о к е s A. W., Am. J. Hyg., 45, 254 A947)
59. F 1 a s с h e n S.S., Pearson A. D. J. Eleclrochem. Soc, 105, 164C A958).
Abstract 116 o[ Paper Given at Electrochemical Society Meeting, Ottawa, Canada,
September 28 — October 2. 1958.
60. F г oe I i с h H. C, Trans. Electrochem Soc, 91, 241 A947).
61. Hewlett С W., Gen. Elec Rev., 50, 22 A947).
62. К а ц М. Л., ДАН СССР, 32, 178 A941).
63. Клемент Ф. Д., ДАН СССР, 4G. 270, 295 A945).
64 Колонией Б. Т., Журн. технич. физики, 17, 195 A947).
65. М u n с h J. С, J. Am. Med. Assoc, 102, 1929 A934).
66. Munch J.C.Silver .1., U. S. Dept. Agr., Tech. Bull. N° 238, 1 A931).
67. Popence С. П., Science, fi4, 525 A92G).
68. Pringsliei m P., Rev. Modern Phys., 14, 132 A942).
69. Sessions H. K., U S. Naval Med. Bull., 47, 545 A947).
70. S t e i d 1 e H., Med. Welt, 13. 1557 A939).
71. Sullivan J. C, U. S. Bureau of Mines, Tech. Paper № 381, 1927.
72. T h i b a u t S , Ing. chim., 25. 85 A941).
73. T r a v i s B. W., J. Econ. Entomol., 36, 56 A943).
74. T u t t 1 e O. F., E g 1 i P. H., J. Chem. Phys., 14. 571 A946).
75. H i p p e 1 A , С h e s 1 e у F. G., Denmark H. S., Lin P. • В., R i t-
ter E. S., J. Chem. Phys., 14, 355 A916).
28.
ТАНТАЛ
К. А. ГЕМПЕЛ
С A. Hnmpcl. Consulting Chemical Engineer,
Skvkic, Illinois
Тантал, имеющий порядковый номер 73 н атомный вес 180,948,
элемент V группы периодической таблицы; он расположен в таблице ниже
родственного ему элемента ниобия, между гафнием (слева) и вольфрамом
(справа).
Тантал — пластичный металл, характеризующийся: 1) высокой плот-
ностью A6,6 г/см3); 2) высокой температурой плавления, равной 2996°,
причем по тугоплавкости его превосходят только два металла: рений,
имеющий температуру плавления 3180°, и вольфрам, плавящийся при 3410°;
3) способностью образовывать прочно пристающую тонкую окисную плен-
ку, что делает тантал превосходным выпрямителем и конденсатором; 4) чрез-
вычайно высокой стойкостью при обычных температурах к действию всех
кислот, кроме плавиковой и дымящей серной кислот.
ИСТОРИЧЕСКИЙ ОБЗОР
Тантал открыт в 1802 г. шведом Экебергом, давшим ему это название по
имени героя греческой мифологии Тантала вследствие трудности растворе-
ния окисла. В 1801 г. английский ученый Хатчет сообщил об открытии им
нового элемента Колумбия [40]; из-за близости свойств соединений этих
двух элементов в течение сорока лет их принимали за один и тот же элемент,
хотя еще Волластон предполагал, что это разные элементы. В 1844 г. немец-
кий химик Розе в результате тщательного исследования минерала колумбита
ил Боденманса установил, что этот минерал содержит окислы двух металлов,
один из которых — тантал, а другой, как он полагал, является новым метал-
лом, который он назвал ниобием (по имени Ниобеи, дочери Тантала) 1791.
По свидетельству американского химика Смита, сообщение которою
было опубликовано в 1877 г. [84], Розе в 1844 г. полагал, что тантал, обна-
руженный в этом минерале,— это элемент, известный как Колумбии. В свя-
зи с этим он, видимо, принял второй элемент, входящий в состав минерала,
за новый, а не просто дал другое название открытому Хатчетом Колумбию.
«Последующее исследование убедило, однако, Розе в том, что два окисла
полученные из колумбита, являются в действительности именно окислом
Колумбия, открытого Хатчетом в 1801 г.. и окислом тантала, открытого
Экебергом в 1802 г.» [84]. Учитывая вышеуказанное, не понятно, почему
в те времена, как и в более поздние годы, было принято название «ниобий»,
данное элементу Розе, а не первоначальное н более обоснованное название
«Колумбии», данное Хатчетом.
В 1866 г. Мариньяк 159] разработал классический метод разделения
этих двух родственных элементов, основанный на различии в растворимости
Тантал 179
комплексных фторидов этих элементов и калия, что позволило проводить
исследования соединений каждого из них.
Ни одному на ранних исследователей по существу не удалось выделить
ни один из этих металлов в более чистом виде, чем черновой металл. Пластич-
ный тантал впервые получил в 1903 г. Болтон на заводе СименсТальске
в Берлине. Из тантала были изготовлены первые металлические нити ламп
накаливания; до 1909 г., когда тангал в этой области применения начал
вытесняться вольфрамом, было изготовлено примерно 11 млн. ламп с танта-
ловыми нитями.
В США тантал впервые получил Балке в 1922 г., и с этого времени про-
должается его промышленное производство. Примечательно, что одной из
причин, побудивших Балке получить тантал, было стремление использовать
высокую химическую стойкость этого металла и изготовить из него анод для
электролизера с корродирующей средой хлора. Балке вскоре обнаружит,
что окисная пленка, представляющая собой Та2О5, препятствует прохожде-
нию электрического тока при погружении танталового анода в растворы.
В то же время образование такой пленки делает тантал превосходным элек-
тролитическим вентилем при использовании для выпрямления переменного
тока, в связи с чем первое существенное промышленное применение металл
нашел в зарядных выпрямителях типа «Балкит», широко применявшихся
в двадцатых годах в радиоприемных установках.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И МЕСТОРОЖДЕНИЯ
Тантал по содержанию в земной коре занимает среди других элементов
54-е место и по этому признаку, несомненно, является редким металлом. Он
всегда ассоциирован с ниобием, примерно в 11 раз более распространенным
элементом. Наиболее важным минеральным источником тантала служит таи-
талато-ниобат марганца и железа (Мп, Fe)(Ta, NbJO6. Если в минерале
содержится больше ТалО5, чем Nb2O5, то он называется танталитом, а если
меньше, то колумбитом*. Эти минералы обычно встречаются в пегматитах
в количествах, редко превышающих несколько килограммов на тонну.
Гантал содержится и в других минералах**, например в пирохлоре,
фергюсоните, самарските, эвксените и поликразе. В большинстве из них
ниобия содержится больше, чем тантала, однако, поскольку потребность
в ниобии возрастает, переработка богатых ниобием и бедных танталом руд
должна привести к увеличению количества танталовых концентратов, извле-
каемых из этих сырьевых источников. Фактически из-за относительной
дефицитности танталитовых концентратов большое количество тантала полу-
* В колумбитах преобладает железо, в танталитах — марганец. Поэтому следу-
ет различать написание формулы для танталита I(Mn, Fe)(Ta, NbJOe] и колумбита
[(Fe, Mn)(Ta, NhJO6]. Химическая природа минералов из группы тантало-ннобие-
вых соединений не вполне ясна. Наряду с прежними представлениями о принадлеж-
ности их к классу солей имеются соображения в пользу того, чтобы рассматривать
их как сложные окнелы типа R'^jOq.- Прим. ред.
** Фергюсонпт — (Y, Ег, Се. L, Fe)(Nb, Та, Ti)O4 содержит до 40% (Y, Ег),О3,
до ЛЬ% (Nb. Та),О5,до7% (UO-. i UO3); самарскит - (Y, Ег, Се, И, Са. ThL|(Nh,
Та, П, SnbO7]3 содержит до 20%~ (Y. Ег)„О3, до 37% Nb2O5, до 27% 1а-О6 и до 17%
(UO2 Ь UO3). Поликраз — (Y, Се, Са, II, Th)(Ti, Nb, TaJO0 является разновидно-
стью эвксенита (Y, Се, Са, U, Tli) (Nb, Га, TiJ O6. Состав остальных минералов ука-
яан в главе «Ниобии». Все онн, за исключением пнрохлора, интересны как рз-сырье
Y-подгруппы.— Прим. ред.
Таблица 1
ТАНТАЛОВЫЕ РУДНЫЕ КОНЦННТРАТЫ. ИМПОРТИРУЕМЫЕ
ДЛЯ ПЕРЕРАВОТКИ В ОНА
<лрана
Южняп Америка
Аргентина
Бразилия
Французская Гвиана
Европа
Белы ия—Люксембург а
ФРГ
Португалия
Шгашя
Азия
Сингапур
Африка
Бывшее Бельгийское
Конго
Мадагаскар
-Мозамбик
Нигерия
Родезия и Пьясаленд
J ганда
Южно-Африканская Рес-
публика
Австралия
Всего
Стоимость, долл. llHOIlfi . 948 638 1838 338
По-видимому, не собственнее сырье, а транзит.
СТАТИСТИКА ВЫПУСКА ТАНТАЛ'\ И НИОБИЯ В США (т)
Таблица 2
1950— [954
(в среднем
за год)
Добыча I
Ниобиево-танталоБые концен- 5,4
траты а
Импорт
Ниобпепые рудные концен-
1955 19.56
1463
траты
Танталовые рудные концен- 239
траты I
5,4
4-11
865
165
2132
595
[957
1959
168
1518
194
1159
375 470
86
1540
295
Тантал
№1
Потребление руд6
Ниобийсодержащие
Танталсодержащие
Производство металлсш
Ниобии
Тантал
I
19511 1454 I
(в среднем 1955
за |Aд]
198 в
99"=
I
354
172
Продолжение табл. 2
490 ооо
245 283
356
181
—г 3d
г 87
522
235
СО
ПО
а Содержание пятпокшек ииоСмя и тантала в энксеннте плюс общий вес колумбита —
танталита.
0 Содержание мег!ллов во всех видах исходного сырья (включая оловянные шл^ки),
использованного в любых сираслях промышленнп-ги. втом числе в производ|тве ферросплавов.
в Только ла 1052 — 1954 гг.
1 Цифры не сообщаются.
чено и-продолжают получать из концентратов с более высоким содержанием
ниобия.
Танталит добывают главным образом в западной части Австралии из
аллювиальных отложений в районе Пилбарра (теперь второстепенный
источник), на востоке Бразилии, в Нигерии и бывшем Бельгийском Конго
(теперь основной источник). Танталовыс концентраты получают как побоч-
ный продукт при обогащении россыпных оловянных (касснтеритовых) руд
в бывшем Бельгийском Конго и в небольшом количестве в Малайе. В насто-
ящее время концентраты этого типа из Конго покрывают на Х13 импорт тан-
тал итовых концентратов США.
Непосредственно в США имеются лишь второстепенные и рассеянные
месторождения танталита; промышленная добыча танталовых руд произво-
дится почти полностью за пределами этой страны. Более 999-6 танталитового
сырья США импортируют. В 1958 г. импорт на 8496 производился из восточ-
ного полушария. Такая зависимость от ввоза руд морским путем является
одним из факторов, сдерживающих более широкое применение тантала.
Руды обогащают ручной рудоразборкои, промывкой, концентрированием
на столах, электростатическим и электромагнитным способами. Концентраты,
получаемые в результате обогащения, содержат обычно не менее60.°о суммы
окислов Ta^Oj и Nb2O6; ассоциированными примесями являются железо,
олово, титан, цирконий, двуокись кремния и марганец. В концентратах,
импортируемых в эту страну, соотношение между Та2О5 и Nb2O5 колеблется
от 12 : 1 до 3 : 4, составляя для основной массы материала в среднем, види-
мо, приблизительно 1:1.
В табл. 1 представлены данные по импорту танталовых рудных концен-
тратов в 1956 1958 гг. Сведений о распределении по странам за 1959 г.
у автора не имелось, суммарный же импорт в 1959 г. снизился примерно
до 300 т, тогда как в 1958 г. было ввезено 470 т.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
Данные о тантало-ниобиевых концентратах, полученных в США, импор-
те концентратов, переработке руд и выпуске металлов сведены в табл. 2.
Из этой таблицы видно, что получены гораздо меньшие количества металлов,
682 Г лава 28
чем их содержалось в переработанных рулах. Это объясняется тем, что боль-
шая часть ниобиевых и танталовых концентратов направляется непосред-
ственно в электропечи на производство феррониобия и ферротанталоннобии.
Эти сплавы вводятся в состав некоторых аустенитных нержавеющих сталей
е целью предотвращения выпадения карбида, что достигается при содержа-
нии в сталях около 1% ниобия и тантала.
Цены на импортировавшийся танталит не публиковались; материал
с концентрацией приблизительно 60% Та2О5 продавали в 1959 г. по 7,7—
9.4 долл. за 1 кг содержавшейся в нем пятиокиси тантала. Это означает
снижение цен по сравнению с 1958 г., в начале которого цена составляла
примерно 13,3 долл. за 1 кг.
Цены на металлический тантал в последние годы снизились, так как
увеличились число производителей и общая производственная мощность
заводов. В 1960 г. порошкообразный тантал продавался по цене около
88 долл. за 1 кг, плавленые стержни — по 77 долл. за 1 кг и листы — по
120—130 долл. за 1 кг.
ИЗВЛЕЧЕНИЕ
Помимо обычных проблем, с которыми приходится сталкиваться при
отделении ценного элемента от других компонентов исходного сырья, при
извлечении тантала из руд или концентратов возникают и другие трудности,
вызываемые присутствием близкого по химическим свойствам металла —
ниобия. В отношении проблемы полного разделения тантал и ниобий очень
сходны с цирконием и гафнием.
Дробная кристаллизация
Классический метод разделения по Мариньяку, применявшийся с нача-
ла двадцатых годов, в последние годы почти полностью вытеснен методами
экстракции растворителями. Процесс дробной кристаллизации в том
виде, как он использовался в промышленности |73|, включает следующие
стадии:
1. ("плавление измельченных приблизительно до 200 меш танталовых
рудных концентратов с едким натром в печах непрерывного действия с целью
получения черновых танталатов и ниобатов натрия.
2. Выщелачивание охлажденного расслоившегося плава горячей водой
с последующей обработкой соляной кислотой для удаления больше» ча-
сти примесей железа, марганца, кремния, олова и титана. При этон обра-
ботке образуются нерастворимые гидратированпые скислы тантала и
ниобия.
3. Растворение смеси гидратированных окислов тантала и ниобия в пла-
виковой кислоте и добавление в раствор едкого кали, фторида калия или
погаша в количестве, необходимом для образования раствора фторотанта-
лата калия КзТаР, и оксифторониобата калия K^NbOF5.
4. Фильтрование горячего раствора для отделения нерастворимою
остатка и охлаждение фильтрата в кристаллизаторе. Фторотанталат калия,
растворимость которого в воде при комнатной температуре составляет
7.5 г/л, выпадает из раствора, в то время как оксифторониобат калия остает-
ся в растворе, поскольку растворимость KaNbOFVHjO в воде составляет
01,5 г/л.
5. Отделение кристаллов фторотанталата калия от маточного раствора
фильтрованием и сушка в обогреваемой паром полочной сушилке.
Тантал 683
6. Получение танталового, порошка электролизом-расплава фторотанта-
лата калия или восстановлением этом соли металлическим натрием.
Перечисленные выше стадии осуществляются главным образом периоди-
чески. Процесс дробной кристаллизации более пригоден для получения
чистого тантала, чем чистого ниобия. По этим и другим причинам этот про-
цесс в промышленности в последние годы при извлечении из руд и разделе-
нии тантала и ииобня заменен методом экстракции растворителями.
Экстракция растворителями
Широко применяемый в настоящее время метод разделения тантала
и ниобия экстракцией органическими растворителями развился из работ,
проведенных в начале пятидесятых годов рядом исследователе», главным
образом из Горного бюро (Олбэни, штат Орегон) [42, 95, 96] и Комиссии по
атомной энергии СШ4 (Эймсская лаборатория) 126, 991. В этом методе разде-
ления используется влияние концентрации кислоты на относительную
растворимость фторидов тантала, ниобия и других металлов в водной и орга-
нической (метилизобутилкетон) фазах.
Если подкисленный водный раствор фторидов тантала, ниобия и других
металлов, присутствующих в рудных концентратах, привести в контакт
с метилизобутилкетоном, то фторид тантала экстрагируется органической
фазой при низкой кислотности, а фторид ниобия — при высокой. В противо-
положность им фториды других металлов остаются преимущественно
в водной фазе. Различие в растворимости при этом столь велико, чго при
относительно небольшом числе ступеней экстракции могут быть получены
очень чистые соединения тантала и ниобия.
В промышленной практике 114] тонкоизмельченную руду
(—200 мет) обрабатывают концентрированной плавиковой кислотой, при-
готовленной растворением безводного фтористого водорода в деионизирован-
ной воде, в баках, футерованных полиэтиленом или хавегом. При этом окис-
лы тантала и ниобия растворяются, тогда как основное количество примесей
остается в виде нерастворимого остатка. Раствор, содержащий тантал и нио-
бий, отделяют от этого остатка фильтрованием и декантацией или одним из
этих способов, после чего его перекачивают в сборник, откуда он поступает
на дальнейшую переработку.
На одном из заводов [141 применяется ступенчатый процесс экстракции
тантала и ниобия. Исходный раствор, содержащий тантал и ниобий, дово-
дят до низкой кислотности и подают в расположенные каскадом полиэти-
леновые экстракторы: здесь раствор обрабатывается метилизобутилкетоном
в смесителях, затем поступает в отстойники, причем смесители и отстойники
расположены последовательно (рис. I). Тантал первым экстрагируется
в органическую фазу при низкой кислотности и затем извлекается из этой
фазы деионизированной водой. При этом получают водный раствор чрезвычай-
но чистого фторида тантала. Не содержащий тантала исходный раствор под-
кисляют до высокой кислотности серной или соляной кислотой и обрабаты-
вают в ниобиевой части расположенных каскадом экстракторов чистым
метилизобутилкеюном. Ниобий при этом экстрагируется в органическую
фалу, в тп время как по существу все имевшиеся в растворе примеси остают-
ся в водной фазе. Органическую фазу далее обрабатывают деионизирован-
ноп водой для перевода фторида ниобия из кетона в водную фазу, в которую
он переходит также в очень чистом виде.
На другом заводе осуществляют процесс одновременной экстрак-
ции тантала и ниобия. Исходный раствор, содержащий тантал и ниобии,
CR4 Глава 28
разбавляют до концентрации 20Vo по свободно!! плавиковой кислоте и пере-
качивают в расположенные каскадом полиэтиленовые экстракторы. В колон-
ках этих экстракторов раствор пропускают противотоком в метилнзобутнл-
кетон- При этом и тантал, и ниобий экстрагируются в органическую фазу.
Сильнокислый раствор, содержащий почти все имевшиеся в исходном раство-
ре примеси, выводяг из процесса. Реэкстракцию ниобия из органической
фазы осуществляют деионизированной водой. Дальнейшая обработка орга-
нической фазы деионизированной водой приводит к уменьшению ее кислот-
ности до величины, при которой из органической фазы реэкстрагируется
тантал (в виде H2TaF7).
Механизм процесса экстракции системы фторид — кетон рассматри-
вается в работах Тейлора (88], Кернера, Смутца и Уилхелма [53J, Вернинга
¦;'
Рис. I. Экстракторы, расположенные каскадом,
для разделения тантала и ниобия; смесители и от-
стонннкн (в центре) изготовлены из полиэтилена
(«Юнион кэрбайд металс компани»)
Хигби и сотр. |96] и других исследователей. Одно из предположении заклю-
чается в том, что фториды тантала и ниобия экстрагируются кетонами
с участием водородной связи.
Чистые водные растворы, содержащие тантал (наиболее вероятно
в виде HaTaF7), нагревают и осаждают в аппаратах для осаждения водным
раствором аммиака нерастворимую гидроокись тантала (или гидратиро-
ванную окись):
H,TaF7+7NH.OII -> Та (OH)s-;-7NH4F-|-2H_,O.
После фильтрования и промывки мокрый кек высушивают и прокаливают,
получая пятнокись тантала высокой степени чистоты. По другому варианту
к водному раствору, содержащему тангал, добавляют фторид калия для
получения фторотанталата калия КгТаР,:
H.,TaF7 + 2KF —> KjTaF7-t 2HF.
Осаждающийся при этом фторотанталат калия далее отфильтровывают и вы-
сушивают.
Пиобисвый водный реэкстракт также обрабатывают водным растворим
аммиака и получают чистую гидроокись ниобия, которую затем отфильтро-
вывают, высушивают и прокаливают до пятиокиеи (как описано в главе
«Ниобии», сгр. 432).
Применение экстракции растворителями для разделения и получения
чистых соединений тантала и ниобия имеет много преимуществ. Гантало-
ниобиевые руды, шлаки и рудные концентраты можно перерабатывать неза-
висимо от соотношения между танталом и ниобием в исходном сырье, сразу
с извлечением как тантала, так и ниобия, свободных друг от друга и от всех
Тантал 685
металлических примесей. Процесс протекает быстро, характеризуется очень
высоким коэффициентом извлечения; его легче проводить и контролировать,
чем другие процессы. Осуществить непрерывный процесс, хотя бы на стадии
экстракции растворителями, в этом случае гораздо легче, чем в процессе
дробной кристаллизации.
Другие методы
С целью извлечения и разделения тантала и ниобия исследовано множе-
ство других методов. К ним относятся, например, кислотные и щелочные
методы с использованием комплексообразующих реагентов, хлорирование,
ионный обмен, методы хроматографической адсорбции. Широкий обзор
предложенных до 1959 г. методов составил Миллер IG4, стр. 67—178|.
ПРОИЗВОДСТВО МЕТАЛЛИЧЕСКОГО ТАНТАЛА
Восстановить тантал из его соединений можно различными методами.
В промышленных условиях, как сообщают, применяются методы электро-
лиза, восстановления металлическим натрием и взаимодействия между пяти-
окисью тантала и карбидом тантала.
Электролиз
Электролиз расплавленного фторотанталата калия, к которому в каче-
стве деполяризатора для предотвращения анодного эффекта [88J добавляет-
ся пятиокись тантала (ТагОь.) или какая-либо другая окись, является про-
цессом восстановления, применяемым в настоящее время для получения
основного количества чистого металлического тантала. Электролиз проводят
приблизительно при 900 в открытых чугунных тиглях, которые служат като-
дами; процесс является периодическим. В качестве анодов применяются
графитовые стержни, подвешенные в тиглях. Тантал отлагается я виде
мелкокристаллических агрегатов; фторотанталат калия и пятиокись добав-
ляют в тигель периодически в течение одного цикла электролиза. Когда
осадок заполняет тигель, электролиз прекращают. Восстанавливается
только около 50% соединений тантала, введенных в электролизер [88], так
что в течение всего цикла частицы тантала окружены фторотанталатом
калия. Это защищает их от действия воздуха при температуре ванны.
В нескольких исследованиях описанного процесса, электролиза уста-
новлено, что электролиз одного только фторотаиталата калия невозможен
и что для удовлетворительного протекания процесса необходимо присут-
ствие нитиокиси тантала или какого-либо другого окисла [16, 17, 27, 671
(см. также работу Миллера) 164, стр. 179—243].
После охлаждения тигля с содержимым до комнатной температуры плав,
содержащий порошок тантала, извлекают из тигля, измельчают и промыва-
ют водой для удаления растворимых солей. Порошок очищают затем на
концентрационном столе, промывают сильными кислотами, например цар-
ской водкой, для удаления вредных примесей, сушат, просеивают, сорти-
руют и смешивают. Порошкообразный тантал, получаемый таким путем,
обычно содержит 99,85% тантала, менее 0,05?о ниобия, 0.12%" углерода,
0,015"Ь железа и менее 0,01 % титана. Его средний ситовой анализ: +200 меш
30%, от — 200 до +400 меш 40%, —400 меш 30% [88].
Глава 28
По другому варианту электролитического метода, применяемому в на-
стоящее время, расплавленный фторотанталат калия восстанавливают в гра-
фитовом тигле, которым служит анодом; тантал выделяется на металлическом
стержне—катоде, который может быть извлечен из ванны [14]. Тантал
образует дендриты (рис. 2), которые затем промывают водой и кислотами для
Р и с. '1. Отложения танталовых дендритов на катоде
* , электролизера с расплавленным фторотанталатом
^|калия («Юнион кэрбайд металс компанн»).
. * -fc Эл( .три нзер показан открытым-дли извлечения тантала.
очистки от солен и примесей. Процесс ведут в закрытом электролизере при
800—950° в вакууме или в атмосфере очищенного аргона. Электролит состоит
из фторотанталата калия, смешанного с хлоридами щелочных металлов,
однако подробно технологический процесс не описай. Среднее количество
примесей в получаемом тантале составляет около 0,05 вес. %. Дендритные
отложения тантала спрессовывают на холоду в электроды для переплавки
в дуговых или электронно-лучевых печах, в которых они превращаются
в компактные слитки.
Восстановление металлическим натрием
Натри» применяют для восстановления тантала из фторотанталата
калия но следующей реакции:
Ta+2KF
Реакцию проводят в стальной бомбе, в которую загружают оба реагента.
При наружном нагревании бомбы бурно протекает экзотермическая реакция,
в связи с чем с целью надлежащей безопасности операцию выполняют в спе-
циальной камере. После охлаждения бомбы извлекают ее содержимое
и обрабатывают его водой «другими реагентами, например метиловым спир-
том. т,ля связывания избытка натрия и растворения растворимых солей.
Порошок тантала промывают далее водой и сушат. Металл, получаемый
натристермическим методом, представляет собой очень чистый тонкий поро-
шок с размерами частиц меньше, чем при электролитическом восстановлении.
Реакция карбида тантала с пятиокисью тантала
В этом процессе используется метод, разработанный Балке [8] для
получения тантала и ниобия и основанный на взаимодействии между стехио-
метрпческими количествами чистых карбида тантала и пятиокиси тантала
Тантал
687
по следующей реакции:
5 ТаС + Та2О0 ->- 7 Та - 5 СО.
По методу, применяемому в настоящее время в промышленности,
вначале получают карбид тантала, загружая в графитовый тигель тщательно
ое
вес
¦ I
5
» i
*«"¦"
Р и с. 3. Ofiiuiiii вид печи для
производства карбида тантала,
в которой карбид получается
в результате взаимодействия
ичтнокиси тантала и углерода
при нагревании («Пах Ченг кор-
порейшн»).
Шнхта помещается в печь в графи-
товом тнгле.
Р и с. 4. Общий вид части отделения doccto-
iioDтения тантала, в котором брикеты смеси
пятиокисн н карбида тантала взаимодействуют
в вакуумных индукционных печах с получе-
нием брикетов илн кусков тантала («Вах Чеиг
корпорейшн»).
перемешанную смесь углерода (ламповой сажи) и пятпокиси тантала
и нагревая в высокочастотной печи для восстановления до карбида ТаС
Таблица 3
ТНПИЧ11ЫП СОСТАВ* ГАНТЛЛА, ПОЛУЧАЕМОГО ИЗ СМЕСИ
КАРБИДА И ПЯ1ИОКИСИ
[IpHMecL
А1
В
Сг
Си
Fe
Mg
Мп
Mo
Nb
Максимальное
содержание, вес.'
0,002
0.0001
0,003
0,004
0,010
0,002
0,002
0.0U2
0.05
Примесь
Ni
Pb
Si
Sn
Ti
V
w
Zr
Zn
Максим 1Льнс
см «ержишк', вес. „
0,002
0,002
0,005
0,002
0,015
0,002
0,010
0,010
0.002
Общее содержание С, О, N и Н гостлвлнет 0,010 вес.%.
688 Глава 28
(рис. 3). Измельченный карбид и необходимое количество пятиокиси тантала
смешивают, брикетируют и загружают в вакуумную индукционную печь,
в которой происходит восстановление металла (рис. 4). Оба процесса —
образование карбида тантала и восстановление металла — протекают при-
близительно при 2000". Извлекаемые из второй печи брикеты или небольшие
цилиндры пористого металла обычно спечены друг с другом.
Брикеты металла превращают далее в гидрид, выдерживая их в атмо-
сфере водорода при температуре около 500'. Хрупкий гидрид превращают
в порошок и дегидрируют при нагревании до температуры выше 1000°
в вакууме; охлаждается он также в вакууме.
Типичный состав металлического тантала, получаемого описанным выше
карботермическим методом, приведен в табл. 3. Степень чистоты металла
зависит от чистоты исходных карбида и пятиокиси и от загрязнения при
проведении технологических операций.
ПОЛУЧЕНИЕ И РАФИНИРОВАНИЕ КОМПАКТНОГО МЕТАЛЛА
Порошкообразный тантал, получаемый восстановлением различными
способами, можно непосредственно применять в некоторых областях, на-
пример для изготовления пористых конденсаторов, однако в большинстве
случаев его необходимо вначале превратить в компактную форму. При этом
имеется в виду еще одна цель — достичь большей чистоты металла за счет
удаления хотя бы части примесей, присутствующих в восстановленном
металле, так как даже очень небольшие количества примесей в значитель-
ной степени влияют па свойства тантала.
Вследствие чрезвычайно высокой температуры плавления тантала и его
высокой реакционной способности при нагревании для превращения метал-
ла в компактную форму приходится использовать специальные методы. Эти
методы в общем подобны применяемым для других тугоплавких и реакцион-
носпособных металлов - ниобия, гафния, молибдена, титана, вольфрама
и циркония. В промышленных масштабах применяют, спекание, дуговую
плавку в вакууме или в интертной атмосфере и электропно-лучевую плавку.
Спекание
Классическим методом превращения порошкообразного тантала в ком-
пактный металл и его рафинирования является продолжительное спекание
в вакууме при температурах порядка 2600\ Современная практика состоит
в том, что порошок тантала прессуют, обычно без связующего, при комнат-
нон температуре в штабики весом до 10 кг. Прессование производят под
удельным давлением порядка 4,0—7,7 т!см", для чего требуются очень
мощные прессы (рис. 5). Спрессованные штабики достаточно прочны, чтобы
с ними можно было осторожно манипулировать. Они имеют длину несколь-
ко футов и сечение от 19 У 19 до 17 " 51 мм- или более.
Штабики спекают в вертикальных вакуумных печах для спекания путем
пропускания через них в течение нескольких часов электрического тока
большой силы (рис. 6). Температуру штабиков повышают постепенно, делая
выдержки на различных стадиях процесса спекания, чтобы обеспечить про-
текание различных реакций рафинирования. Как установили Клопп
и сотр. [501, при 1900 2200° углерод реагируете кислородом с образованием
окиси углерода. В результате этой реакции удаляется большая часть угле-
рода, если имеется стехиометрическое количество кислорода. При 2000—
Тантал
689
2400э избыток кислорода испаряется в виде окиси тантала, а при темпера-
туре около 2600° выделяется азот в виде N2. Примеси металлов и их соеди-
нений, давлении паров которых заметно выше равновесного для области
температуры спекания, «выкипают» из тантала. С целью образования соеди-
нений, которые легче испарялись бы при температуре спекания, в металл
могут быть введены присадки, способные связывать примеси в эти соедине-
ния. Например, Балке [7] предложил до-
¦¦"-*»¦ бавлять к танталовому порошку окись маг-
нии с целью удаления углерода в резуль-
тате реакции, при которой образуются окись
углерода и магний при температуре 1800—
2000"
* л* .
Рис. 5. Общий вид пресса
мощностью 200U т для пре-
иращення порошка тантала
в штаСики для их последую-
щего спекания («Вах Ченг
корпорейшн»)
Рис. 6. Высоковакуумные аппараты для спе-
кання штабиков, спрессованных из порошка
на прессе, показанном на рис. 5, в компактный
металл («Вах Ченг корпорейшн»).
Штабикн спекают, пропуская через них* ток большой
еялы в течение нескольких часов.
Расход электроэнергии на спсканиетантала составляет несколько сотен
киловатт-часов на 1 кг металла, изменяясь в зависимости от продолжитель-
ности и числа температурных выдержек при спекании.
В результате спекания получают штабики тантала, плотность которых
составляет около 90% теоретического значения. Холодной обработкой давле-
нием устраняют имевшуюся небольшую пористость и после повторного спе-
кания получают пластичный беспористый штабик по существу с теоретиче-
ской плотностью, который можно ковать и прокатывать в лист или изготов-
лять из него проволоку волочением при комнатной температуре.
Размеры штабика, получаемого спеканием, ограничены мощностью прес-
са, который нужен для прессования порошка в штабики, и электрической
мощностью системы, требующейся для обеспечения электрическим током,
необходимым для спекания сопротивлением. Производительность установки
для спекания невелика вследствие того, что печь длительное время должна
находиться при очень высокой температуре и очень низком давлении для
спекания всего нескольких килограммов металла за один цикл.
Дуговая плавка
Дуговая плавка, широко применяемая в производстве больших слитков
титана, циркония и других подобных металлов, используется для получения
слитков тантала весом около 50 кг или бааее. Дальнейшее увеличение раз-
44 Заказ № 239
690 Глав а 28
меров печного оборудования может сделать возможным получение слитков
весом 220 кг.
Для дуговой плавки тантала применяют оборудование различных типов
н разные способы плавки. В большинстве случаев плавку ведут с расходуе-
мым электродом, изготовляемым гидростатическим прессованием порошка.
Р н с. 7. Дуговая печь с рас- Рис. R. Слиток тантала диа-
ходуемым электродом для вып- метром 200 мм, извлеченный из
лавки массивных слитков тан- дугорой печи («Нсйшнл резерч
тала ("Нейшнл резерч кор- корпорейшн»).
порейшн»)
Питатель, показанный в верхней
p°Jfl<pDHH3W вк нТжиёв"°ча'стТи ЭустИ Дендритов или брикетов, зажигая в ва-
новки виден кристаллизатор, из КууМе КОрОТКуЮ Дугу МвЖДу ЭЛеКТрО-
кошрого извлекают слиток тан- дом и танталовой затравкой „ холод.
нбм кристаллизаторе (охлаждаемый
водой медный тигель). В центре верхней поверхности танталовсго слитка
поддерживают небольшую лужицу расплавленного металла. По мере рас-
плавления нижнего конца и стекания металла в эту лужицу электрод
опускается. После заполнения кристаллизатора ему дают остыть в вакууме
приблизительно до 150D, затем печь открывают и вынимают из кристаллиза-
тора слиток.
На рис. 7 показана одна из печен, а на рис. 8 — танталовый слиток,
извлеченный из кристаллизатора. Слитки подвергают механической обра-
ботке для удаления поверхностных дефектов; такие слитки, подготовленные
для ковки, прокатки и т. п., показаны на рис. 9.
Торти 193] приводит следующие подробности одного из способов дуговой
плавки тантала. Электроды изготовляют прессованием порошка тантала вы-
сокой степени чистоты крупностью от —12 до +325 меш в короткие брикеты
диаметром 45—50 мм. Перед плавкой брикеты для упрочнения подвергают
термообработке прямым нагревом (за счет сопротивления) в вакууме в тече-
ние приблизительно 1 мин при температуре до 1500°. После этого их свари-
вают в дуге с нерасходуемым вольфрамовым электродом в атмосфере аргона
в электроды, предназначенные для переплавки в дуговой печи. Печь рабо-
тает при остаточном давлении 2-10—3—510-3лш рт. ст., поддерживас-
Тантал С91
мом механическим бустершлм вакуум-насосом производительностью
28,4 тыс. л/мин и механическим форвакуумным насосом. Охлаждаемый
кристаллизатор диаметром 100 мм облицован двойной медной трубкой, так
что внутренний диаметр кристаллизатора составляет 89 мм.
Плавку ведут при силе тока 4,5—5 тыс. а и напряжении 30 в со скоро-
стью 0,23 кг/мин. Расход электроэнергии составляет приблизительно
10 квт-ч/кг при выплавке слитков весом 30—40 кг.
I
Р и с. 9. Слиткн тантала дуговой иып
лавки («Вах Ченг корпорейшн»).
Слитки с неровной поверхностью обрабаты-
вают («обдирают») на станке, получая пока- , . _
данные справа слитки с гладкой поверх- ' Ш Ш 'S
НОСТЫО. К.1ЖДЫЙ ИЗ СЛИТКОВ. СТОМЩИХ "" ™ Ж
весах, весит примерно 32 кг.
I
По другому варианту 'этого процесса, применяемому тем же промышлен-
ником I70J, порошок тантала прессуют в брикеты диаметром и высотой по
19 мм, которые помещают в колонку электродного питателя. Затем их свари-
вают друг с другом в стержни в вакууме около 1-10 3 мм рт. ст. путем про-
пускания через них электрического тока. Изготовленный таким пугем элек-
трод плавят со скоростью 0,9- 1,1 кг/мин в слитки весом 50 кг.
Процесс дуговой плавки позволяет получать слитки тантала диаметром
200—300 мм.
Несмотря на относительно короткое время, в течение которого тантал
остается при температуре плавления или близкой температуре, при дуговой
плавке происходит существенная очистка исходного материала электрода.
В недавно проведенном исследовании Торти [93] показано, что содержание
водорода снижается на один порядок — до 1 ¦ 10~4 — 5- Ю~4%, в то время
как содержание азота не изменяется, составляя около 2,7- 10~я%. Кислород
удаляется в виде окислов тантала и окиси у!лерода. Лучше всего кислород
удаляется, если содержание углерода в электроде (присутствующего в каче-
стве примеси или намеренно вводимого при изготовлении электрода) состав-
ляет 50% теоретически необходимого дли образования окиси углерода. При
этом условии спдержание кислорода уменьшается приблизительно на один
порядок и составляет 3,4-10~3%. Содержание примесей железа, хрома,
никеля, ниобия и кремния уменьшается соответственно в 3, 6, 4, 3 и 7 раз;
конечное содержание каждого из этих элементов находится в пределах
1,4-10-3—4,0-10 3%. Указанные данные относятся к танталу высокой сте-
пени чистоты, полученному натриетермическим восстановлением тантало-
вой соли.
Электронно-лучевая плавка
Нагревание электронной бомбардировкой — один из новых способов
превращения тантала в компактный металл при его одновременном рафини-
ровании. Электронно-лучевую плавку можно проводить только в высоком
44*
692
Глава 28
вакууме, так что возможность загрязнения металла газами во время плавки
исключается. Благодаря использованию охлаждаемого водой кристаллизато-
ра, в который собирается расплавляемый металл, взаимодействие металла
с тиглем также исключается.
В производственных условиях электроны, излучающиеся с катода при
напряжении 10—20 кв, фокусируют с помощью электростатического поля
на подвергаемом плавке материале, который является анодом. Пучок
электронов фокусируют также на верхней части образующегося слитка,
чтобы поддерживать в расплавленном состоянии лужицу металла, с кото-
рой можно удалять примеси. В системе создают вакуум I ¦ 10 4 мм prn. cm.
или выше с помощью высокопроизводительных вакуум-насосов, предназна-
ченных для откачки газовых примесей, «выкипающих» из расплавленного
металла. Полученный слиток выводят в нижнюю часть печи.
Исходный металл подают в печь обычно в виде электрода, изготовлен-
ного прессованием и спеканием порошкообразного тантала, хотя можно
загружать металл и других форм. К ним относятся подлежащие рафини-
рованию слитки дуговой выплавки, порошкообразный, дендритный и че-
шуйчатый металл и скрап. При плавке всех материалов, кроме штабиков
и стержней, которые можно подавать в печь как расходуемые электроды,
необходимы изменения как конструкции печи, так и способа плавки.
Более подробные сведения об установках и способах электронно-луче-
вой плавки приведены в главе «Ниобий».
Расход электроэнергии составляет 13—18 квт-ч на 1 кг тантала. Слит-
ки диаметром до 100 мм и длиной I м получают при скорости плавки не
Таблица 4
СОСТАВ СЛИТКОВ ТАНТАЛА, ПОЛУЧЕННЫХ
ЭЛЕКТРОННО-ЛУЧЕВОЙ ПЛАВКОЙ3
Примесь
А1
С
Си
Сг
Fe
Н
Мо
N
Nb
Ni
О
Si
Ti
Содержание примеси,
партия
до плавки
<0,025
0,0036
<0,005
—
<0,01
0,01
<0,01
0,003
<0,01
<0,01
0,0082
<0,025
0,005
[13]
после плавки
<0,005
0,002
<0,0025
—
<0,001
<0,0001
<0,0025
0,001
<О,О025
<0,001
<0,0006
0,0028
<0,001
вес.%
партия 2 [1, 44]
после плавкн
_
0,003
0,003
0,0003
0,0008
0,00014
—
0,001
0,01- 0,03
0,0003
0,0016
—
—
а Слитки партий I и 2 изготовлены на разных плавильных
установках н, по-вндимому, из тантала, полученного разными тех-
нологическими методами.
Тантал Ш
менее 45 кг в сутки. Производительность данной плавильной установки
зависит от количества примесей, подлежащих удалению; этим обстоятель-
ством определяется период времени, в течение которого тантал должен нахо-
диться в расплавленном состоянии.
Что касается очистки от примесей, то примеси, давления паров которых
у поверхности расплавленного металла равны по меньшей мере 1-10 ° am,
могут легко удаляться. В случае тантала это выражается в резком сниже-
нии содержания таких металлов, как железо, никель, хром, титан и нио-
бий, и в уменьшении содержания элементов, образующих растворы
внедрения. В табл. 4 представлены результаты анализа тантала электрон-
но-лучевой выплавки.
ФИЗИЧЕСКИЕ СВОЙСТВА
Данные о физических свойствах тант&па приведены в табл. 5. Хотя
большая часть физических свойств определена точно, многие определения
проведены на металле, полученном методами порошковой металлургии
и содержащем несколько сотых долей процента примесей, влияющих на
физические свойства. Наличие металла значительно более высокой степени
чистоты, выплавленного в электронно-лучевых печах, может привести
к уточнению величии некоторых физических свойств после того, как иссле-
дования будут проведены на более чистом мет&пле.
МЕХАНИЧЕСКИЕ СВОЙСТВА
Тантал — механически прочный, пластичный, твердый металл, несколь-
ко похожий на малоуглеродистую сталь. Хотя в результате обработки дав-
лением его твердость и прочность при растяжении повышаются, тантал
нагартовывается гораздо медленнее большинства других металлов; вслед-
ствие этого могут быть допущены очень высокие степени деформации
между отжигами.
Присутствие примесей, образующих растворы внедрения,— углерода,
кислорода, азота и водорода — оказывает большое влияние на механические
свойства металла. Поскольку присутствие этих примесей определяется глав-
ным образом способом получения компактного металла и последующей тех-
нологией изготовления образца, подвергаемого испытанию, можно ожидать
существенных изменений опубликованных значений механических свойств
тантала, о чем сообщается в литературе.
Для изучения свойств применяли тантал, полученный тремя методами:
методом порошковой металлургии, или спеканием, дуговой плавкой и элек-
тронно-лучевой плавкой. Обычно мсталлокерамнческий тантал содержит
наибольшее количество примесей внедрения и металлических примесей.
Такой металл был единственным примерно до 1955—1956 гг., когда начали
получать и изучать металл дуговой плавки. Тантал, выплавленный элек-
тронно-лучевым методом, стал доступным еще позднее. Вследствие этого
большая часть сведений о механических свойствах, опубликованных в лите-
ратуре примерно до 1956 г., получена для недостаточно чистого металлокера-
мического тантала, значительное содержание примесей в котором (даже
низкое, как обычно считается для примесей) сильно сказывается на его
механических свойствах. Следует при этом отмстить, что это влияние в те
же время не является вредным для некоторых областей применения тантала.
Таблица 5
ФИЗИЧЕСКИЕ СВОЙСТВА ТАНТАЛА
Порядковый номер
Атомный вес
Атомный диаметр, А
Атомный объем, см3/г-атом
Плотность, г/см3
Природный изотоп (массовое число)
Искусственные изотопы (массовые
числа)
Поперечное сечение захвата теп-
-ловых нейтронов (при скорости
нейтронов 2200 м/сек), барн/атом
Поперечное сечение рассеяния тепло-
вых нейтронов (при скорости ней-
тронов 2200 м/сек), барн/атом
Кристаллическая решетка
Координационное число
Температура плавления, "С
Температура кипения, "С
Скрытая теплота 'плавления, кал/г
Скрытая теплота испарения, кал/г
Теплота сгорания при 30°, кал/г
Удельная теплоемкость, кал/г-атом-град
25°
127°
2273
.327°
527°
927°
1227°
1527°
1827"
2127°
2427'
2727°
Энтропия, кал/г-атом -град
25°
127°
227°
327"
527°
927°
1227°
1527°
1827°
2127°
2127°
2727°
73
180,948
2,854
10,90
16,6
181 A00%)
176, 177, 178, 179, 180,
182, 183, 184, 185,
186
2|,3±1,0
5±1
Кубическая объемноцентриро-
ьаппая
0 = 3,296 А
2996
5425
41,5
995
1346
6,08
6,27
6,38
6,46
6,57
6,76
6,90
7,02
7,15
7,28
7,40
7,53
9,90
11,71
13.13
14,30
16,17
18.87
20,40
21,66
22,76
23,72
24,58
25,37
[50, 58]
[78]
[86]
[86|
]45]
[86]
[86]
Продолжение табл. 5
Удельная теплоемкость, кил/г-град
0"
227°
727°
1227°
1727°
2227"
2727°
Давление пара, 10~e am
2351"
2.365»
2487»
2566"
2615"
2652°
2675=
Коэффициент теплопроводности, кал/см
568°
828"
ПОб'
1416°
1547°
1830'
Линейное расширение, % увеличения
0,0340
0,0350
0,0365
0,0385
0,041
0,0465
0,056
6,216
7,390
39,66
96,92
169,8
240,8
365,5
¦сек-град
0,130
0,1625
0.1715
0,1795
0,1885
0,188
0,198
длины при 24°
[77]
[19]
|201
[22]
[22]
[22]
[221
[22]
[20]
134]
(L—длина при 24°, AL—увеличение при данной тем-
пературе)
Т, °С AL/L
-М8 —0,1
24 0,0
310 0,2
593 0,4
866 0,6
1116 0,8
1360 1,0
1593 1.2
1810 1,4
2016 1,6
2204 1,8
2382 2,0
2549 2,2
2713 2.4
2866 2,6
Коэффицнент линейного расширения, град~1
20—500° 6,6-10-е D1]
20—1500° 8,0-10-6 [[8]
Удельное электрическое сопротивление, мкои-см
-183" 3,5 [80]
20=" 12,5 147]
25° 13,5 [58]
25' 13,6 |31, 82]
Продолжение табл. 5
100°
400°
700"
1000=
1500°
2000°
18,5
31,6
43,6
54,8
72,0
87,0
Для тантала, содержащего 0,00% кислорода
0°
250°
500"
750°
1000°
Температура перехода в сверхпроводящее
состояние, "К
13,6
22,8
32,0
41,2
50,4
4,38
Температурный коэффициент электросопротивления,
град-1
0—100°
0 1000°
Работа выхода электронов, эв
Для кристалла B 11) 4
Для неупорядоченных кристаллов
Электроннзя эмиссия, ма/см2
1000°
1230°
1730°
Константа электронной эмиссии, а/ск2 (°КJ
Для кристалла B 1 1)
Для неупорядоченных кристаллов
3,17-Ю-з
3,0-Ю-з
1,352^0,01
4,12
1-10-6
4,7-103
19,5
120
60
Вторичная эмиссия, 6МЯ.„.= 1,35 (первичная
]2.3]
[23]
123]
123]
|471
147]
[31]
[85]
[23[
[20]
[83[
[85[
[20]
[83]
[76]
[851
Положительная эмиссия, эв 10,0
Спектральное лучеиспускание
К, мк
9,0
5,0
3,0
1,0
0,6
0,5
0,66
0,66
0,66
0,66
0,65
0,65
0,65
0,65
0,65
0,467
0,467
Магнитная воспринмчи
25'
1870J
Т. °С
25
25
25
25
25
25
900
1100
1800
2500
2127
2327
2527
2727
2996
1100
1800
[вость, э. м. е.
0.06
0,07
0,08
0,22
0,55
0,62
0,459
0,442
0,416
0,392
0,361
0,358
0,356
0,353
0,350
0,505
0,460
0,849-10-е
0,685-10"в
[58, 851
[58, 85]
[58, 85]
[5R, К5|
[58, 85).'
|58, 85|
158, 85]
[58. 85]
[58, 85]
[58, 85]
[33]
133J
|331
[33]
[33|
[58, 85]
158, 85]
[56]
Продолжение табл. 5
Суммарное лучеиспускание
1400°
1500°
2000°
2127°
2327°
2527°
Общее излучение, вт/см2
1330°
. 1530°
1730°
Коэффициент преломления
Электрохимический эквивалент, лг/к
Стандартный электродный потенциал
для Та/Таб* ?», в
Термо-э. д. с, мв
0,20
0,21
0,25
0,292
0,300
0,308
7,3
12,8
21,2
2,05
0,3749
1,12
Тантал-платиновая пара (холодный спай при 0°)
-200°
-100°
0°
+ 100»
200°
400°
600°
800°
1000°
1200°
Тантал-вольфрамовая пара (в вакууме)
800=
101H°
1200°
1400°
1600°
1800°
2000 J
2625 ¦¦
3000°
Таитал-молнбденовая пара (в вакууме)
800°
1000°
1200°
1400°
1600°
1700="
1800°
2000=
2200=»
2400="
2500°
Тантал-ртутная пара
+0,21
-0,10
0,0
+0,33
0,93
2,91
5,95
10,05
15,20
21,41
10,65
13,72
16,65
19,05
20,90
22,25
22,90 а
20,90
18,50
12,20
14,80
16,90
18,35
19,25
19,45
19,45
18,85
17,70
15,90
14,90
э. д. с. = 1,629-Ю-* г»,бвг мв (для 100—1500°)
[85]
[85]
[85]
[33|
C3]
]33]
120]
[38]
[3]
[66]
[661
152]
а Результаты до 2000° противоречат данным, полученным при более высоких
температурах.
698
Глава 28
Таблица С
ДЛИТЕЛЬНАЯ ПРОЧНОСТЬ ТАНТАЛА ВЫСОКОЙ СТЕПЕНИ ЧИСТОТЫ,
СОДЕРЖАЩЕГО 0,0500 вес.% КИСЛОРОДА И 0,0225 вес.% АЗОТА [44]
Температура,
750
1000
Продолжи-
тельность
испытаний,
час
0,1
1,0
10
100
0,1
1,0
10
100
Предел длительной прочности,
кг/мм?
Та
11,9
11,2
10,5
9,8
5,9
4,3
3,2
2,2
Та—N 1 Та -О
17,6
15,8
13,7
11,9
7,0
5,1
3,7
2,5
15,8
12,3
10,5
9,8
6,0
3,0
2,2
Упеличенйе а
прочности, %
Та—N
47
41
30
21
19
18
16
13
Та—О
32
9
0
0
24
-4
0
а По сравнению с танталом высокой степени чистоты, состав которого привг-
ден в табл. 4 (партия 2, тантал электронно-лучевой плавки).
Например, тантал, содержащий несколько сотых долей процента азота
и кислорода, намного механически прочнее, чем металл с общим содержа-
нием азота и кислорода, не превышающим 5- 10-3%. Это видно из табл. 6,
составленной иа основании результатов испытаний на длительную прочность,
опубликованных Хольденом, Шварцбергом и Джаффи 144] в их статье
о высокотемпературных свойствах тантала.
Общая тенденция в отношении тантала, как и большинства других
подобных металлов, состоит в получении и применении возможно более
чистого металла. Для достижения желаемых свойств легче ввести известные
количества модифицирующих присадок в металл высокой степени чистоты,
чем изменять свойства металла, загрязненного примесями, сложное влия-
ние которых иа свойства точно не известно и может измениться. Более чис-
тый тантал дуговой и электронно-лучевой плавки имеет несколько практи-
ческих преимуществ перед металлом, полученным методами порошковой
металлургии: 1) могут быть получены более крупные слитки, в результате
чего увеличиваются размеры конструкционных заготовок, например'листов,
при изготовлении из которых оборудования требуется меньше сварных работ.
и т. д.; 2) при сварке чистого металла можно получить более хорошие свар-
ные швы, чем в случае металла, содержащего растворенные примеси, кото-
рые в процессе сварки испаряются или выделяются в виде соединений;
3) танталовые изделия, особенно применяемые в электронике, по-видимому,
обладают более однородными свойствами; 4) сплавы с заранее заданными
свойствами могут быть получены с более надежными результатами.
Механические свойства тантала приведены в табл. 6—15. Данные об
изменении механических свойств в зависимости от способа получения метал-
ла, температуры, отжига и т. д. включены в табл. 8—15.
Табл. 8 включает результаты многих исследований прочностных свойств
тантала. В ней приведены данные, характеризующие влияние способа
получения металла (включая содержание примесей), температуры, отжига
и холодной обработки давлением. В I и [I частях этой таблицы показано,
что соотношение между значениями прочности при растяжеиии деформиро-
ванного и рекристаллизованного (отожженного) металла электронно- чучевой
МЕХАНИЧЕСКИЕ СВОЙСТВА
Модуль упругости, кг/мм2
-180°
-73°
-50°
+ 25°
200°
350°
500°
Модуль сдвига (вычисленный), кг/мм2
Коэффициент Пуассона
Сжимаемость hVlhV0
99,95%-ный мсталлокерамический тантал;
данные почти одинаковы с результа-
тами для 99,9%-ного металла
Дашгение, кг/см 2
5 000
10 000
15000.
20 000
25 000
30 000
Температура перехода из хрупкого состояния
о пластичное
Прочностные свойства
Твердость
Предел выносливости
Ударная вязкость
Ползучесть и длительная прочность
Температура рекристаллизации
Влияние азота и кислорода
ТАНТАЛ.»
19 260
19900
18980
18 980
18280
17 920
17 430
7031
0,35
0,00243
0,00485
0.00726
0,00967
0,01208
0,01448
Таблица 7
154]
[10]
[54]
[54]
|54|
[54]
[55]
[¦¦]
При охлаждении до — 196°
не
См,
обнаружена
См. табл.
См. табл.
См. табл.
См. табл.
См. табл.
См. табл.
, табл. 6, 1
i[10, 97]
8
9
10
11
6 и 12
13
14 и 15
Таблица 8
ПРОЧНОСТНЫЕ СВОЙСТВА
1. Зависимость прочностных свойств от температуры [44]
Материал: деформированный металл, полученный электронно-лучевой плавкой
Анализ: см. табл. 4 (партия 2)
Предварительная обработка: слиток прокатан на холоду в полосу толщиной 0,89 мм
(95%-ная деформация); отжиг для снятия внутренних напряжений в аргоне в тече-
ние 15 мин при 750°
Атмосфера при испытаниях: воздух; скорость растяжения 1,27 мм/мин
Температура,
°с
27
150
245
Предел прочности
при растяжении,
кг/мм2
42,5
34,0
33,0
Предел текучести
(при (То,2). Л/МЖ2
34,5
31,6
30,9
Относительное
удлинение, %
а
66
46
Продолжение табл. 8
Температура,
'С
310
365
490
Предел прочности
при растяжении,
кг/мяЯ
34,9
38,4
32,1
Предел текучести
(при сгц.г), кг/ммЪ
33,7
35,5
31,7
Относительное
удлинение, %
56
56
56
а Образец разрушился за пределами измерительной шкалы.
^ Образец рлэрушнлея в пределах измерительна шкалы.
П. Зависимость прочностных свойстн от температуры D4J
Материал: рекристаллизованный металл, полученный электронно-лучевой плавкой
Анализ: cv. табл. 4 (партия 2)
Предварительная обработка: слиток прокатан на холоду с обжатием на 75% в полосу
толщиной 0,89 мм с промежуточным отжигом и рекристаллизован путем отжига в
течение 1 нас при 1200° ¦
Атмосфера при испытаниях: воздух; скорость растяжения 1,27 мм/чин
Температура,
-С
27
230
325
390
425
490
Предел прочности
при растяжении, кг/мм*
20,7
19,6
21,9
21,2
19,8
18,9
Предел текучести
( при Со,з), кг/мм%
18,5
6,0
4,7
—
4,5
4,5
Относительное
удлинение, %
36
23
30
25
23
20
111. Зависимость прочностных свойств от температуры а [75]
Материал: отожженная полоса металлокерамического тантала
Анализ (вес.%): 0.02С, 0,013N2, 0,0056О2, 0,1 Nb, 0,01 W, 0,015Ге
Предварительная обработка: штабик прокатан иа холоду в лист толщиной 1,27 мм
промежуточными отжигами
Атмосфера при испытаниях: вакуум; скорость растяжения 2,3 мм/мин
Температура,
"С
-195
-73
27
48
205
316
427
538
Предел прочности
при растяжении, кг!мм%
104,1
51,5
47,2
41,7
39,4
52,0
45,9
42,1
Предел текучести
(при ао,2)р кг/мм*
104,1
51,0 ,
40,4
29,9
24,9
26,6
23,5
18,4
Относительное
удлинение, %
3,7
23,1
25,3
24,6
12,7
18,0
24,3
16,2
а Данные округлены и интерполированы
Продолжение табл. 8
Температура,
°С
649
760
871
982
1093
1204
Предел прочности
при растяжении, кг/мм2
31,4
21,3
15,6
15,2
11,8
10,4
Предел текучести
(при Оо,2), кг;мм*
13,3
11,9
8,5
8,7
5,7
5,3
От н оси те л ьн ое
удлинение, %
17,.1
23,1
32,8
33,1
43,2
47,5
IV. Зависимость прочностных свойств от температуры [9|
Материал: отожженный металлокерамический пруток
Анализ (оес.%): 0,01 С, 0,01 N2, данные по О2 не приведены
Предварительная обработка: штабик обкопан на кооочной машине на холоду до диамет-
ра 7,6 мм с заключительным отжигом в течение 1 час при 1700°
Атмосфера при испытаниях: вакуум 5- ХСг^ммрт. ст.; скорость растяжения 0,43 мм/мин
Температура,
°С
— 195
— 180
— 130
—78
—30
25
200
400
Предел прочности
при растяжении,
кг/мм*
—
41,3
39,2
35,0
32,9
36,7
Предел текучести
(при 00,2), лг/ллв
87,2
73,5
58,1
42,4
39,7
27,6
18,4
15,7
Относительное
удлинение, %
12,4
13,4
15
37
34
45
31
27
Относительное
сужение. %
75
78
81
89
86
86
86
84
V. Зависимость прочностных свойств от температуры [74, 92)
Материал: отожженная, полоса металлокерамического тантала
Анализ: технический металл
Предварительная обработка: прокатан в лист толщиной 1,6 мм и отожжен
Атмосфера при испытаниях: аргон
Темпера-
1649
1927
1649
1927
2204
1649
2204
2760
Время
выдержки,
сек
10
10
90
90
90
10
10
10
Скпрщть
растиження,
MM/'MWi
0,076
0,076
0,076
0,076
0,076
152
152
152
Предел
прочности
при растяже-
нпи, кг/мм*
2,83
0,64
2,90
1,27
0,29
7,08
2,60
1,65
Предел
текучести
(прн Ои.2),
кг! мм*
2,66
0,430
2,71
0,557
0,295
5,27
1,24
0,91
Относитель-
ное удлине-
ние, %
19,0
19,3
29,7
43,5
47,8
Модуль
упругости,
кг/ммЧ
6190
5960
6890
984
Вре м я Ско рост ь
выдержки, растяжения,
сек мм/мин
90
90
90
152
152
152
Предел
прочности
при растяже-
нии, кг/мл&
7,58
¦2,77
1,46
Продолжение
Предел
текучести
(прн по,»),
кг/мм?
4,89
1,13
0,78
Относитель-
ное удлине-
ние, %
30,2
46,0
50,8
табл. 8
Модуль
упругости,
К2/ЛШ2
7520
1055
Темпера-
тура.
1649
2204
2760
VI. Зависимость прочностных свойств от температуры [33|
Материал: отожженная полоса металлокерамического тантала
Анализ (Ч-с): <0,03 С, <0,03Fe, <0,005Si, 0,24 Mo и <0,05 других примесей
Предварительная обработка: прокатан в лист толщиной 1,25/1,52 мм и отожжен
Температура,
"С
1882
2022
2180
2180
2417
2417
2467
2497
2497
2752
2767
2817
Предел проч-
ности при
растяже-
нии, кг/ммЯ
4,3.1
3,59
2,13
1,93
1,76
,86
,61
,86
,45
,31
0,87
0,687
Предел
текучести
(при Си,»),
кг 'лж2
2,25
1,79
1,06
1,30
0,87
—
0,93
0,95
0,89
U, 80
0,60
0,56
Модуль
упругости,
2530
420
490
140
773
—
280
1055
280
210
70
Скоршть
нагружения,
кг/м «2. сек
U, 188
0,138
0,044
0,011
0,044
0,046
0,045
0,038
0,040
0,047
0,007
0,005
Относительное
удлинение, %
39
46
34
32
_ 44
.38
37
34
38
25
.11
¦13
VII. Зависимость прочностных свойств от температуры [33]
Материал: отожженный лист, изготовленный из металла дуговой плавки
Анализ (%): 0,0015 С, 0,0028 Fe, 0,0062 Nb, 0,0003—0,0008 Н2, 0,002—0,003 N2, 0,0035—
0,0059О2 и 0,0173 других примесей
Предварительная обработка: прокатай в лист толщиной 1,52 мм и отожжен
Температура,
1766
2032
2057
2395
2500
2767
2782
Предел
прочности
при растяже-
нии, кг/мм%
3,07
2,67
1,95
1,67
1,22
0,494
0,82
Предел
текучести
(при Со.г),
кг/MAfl
1,37
1,09
0,88
0,42
0,45
0,25
0,25
Модуль
упругости,
кг/мм?
700
210
140
28
49
—
49
Скорость
нагружения,
кг/мл& ¦ сек
0,041
0,103
0,044
0,065
0,044
0,006
0,025
Относите
удлинен
35
47
43
47
35
26
31
Продолжение табл. 8
VIII. Зависимое il прочиостиых свойств от степени деформации на холоду [69]
Материал: металлокерамическая проволока
Анализ: для спекании штабика использован порошок «высокой степени чистоты»
Предварительная обработка: проволока диаметром 2,5 мм отожжена в течение 30 мин
при 2600° и протянута на холоду до конечного диаметра 0,23 мм с общей степенью
деформации 99%
Испытания проводились при комнатной температуре
Степень деформации
йен"! протяжке, %
О»
2A
80
90
99
Предел прочности при
растяжении, кг/мм%
23,6
34,8
46
53
74
Относительное
удлинение, %
50
—
—
Твердость пи
Внккерсу
90
130
180
190
а Исходный материал имел параметр решетки 3,296 Л
13,1 мкем-см.
н удельное электросопротивление
IX. Влияние температуры отжига на прочностные свойства [92]
Материал: лист и проволока, изготовленные из тантала дуговой плавки
Анализ (%): 0,008 О2, <0,0010С, 0,0015 N2, 0,0038 Fe,<0,0010Cr, 0,0020 Ni, 0,0025Si
Предварительная обработка: деформирован на холоду и отожжен, как указано в таб-
лице
Испытания проводились при комнатной температуре
Конечная
Внд ме- толщина
талла
Лист
Прово-
лока
или дна-
ыетр, мм
0,25
0,25
0,50
0,50
0,50
0,50
3,2
3,2
3,2
3,2
0,5
0,5
0,5
0,5
Степень
деформации
на холоду,
%
_
—
99
99
99
99
97
97
97
97
90
90
90
90
Температуре
отжига
C0 мин), °С
(После
прокатки)
1350
A час)
1150
1200
1250
1300
1300
1350
1400
1450
1150
1200
1250
1300
Срединй
размер
зерна,
мм
_
—
0,007 =
0,010
0,015
0,020
0,030
0,035
0,05
0,08
0,018
0,026
0,038
0,045
Предел
прочности
пЩж П4ГТО
прн растя-
жении,
кг/мм2
115
31
39
37
36
36
Предел
текуче»тн
(ПРИ Оо.и),
кг/мм?-
108
22
OTHqcir:
тельное"
удчине-
ние, %
1
25
24
20
17
10
* Рекрнстиллнэовая на 75%, ч других случаях —на 100%.
Таблица 9
ТВЕРДОСТЬ
I. Зависимость твердости от деформации на холоду [92]
Материал: лист тантала дуговой плавки
Анализ (%): 0,0010 О2, 0,0020 N2, 0,0020 С, 0,0016 Fe
Предварительная обработка: лист прокатан иа холоду из слитка дуговой плавки
Степень деформации при
холодной прокатке, %
0
20
40
G0
80
97
Конечная толщина, мм
3,2
2,5
1,9
1,3
0,25
3,2
Твердость поверхности по
Роквеллу I5T
70,5
82,5
86,0
89.5
90,5
92,0
а холоду [91]
С) 50
95 150
75
170
87
175
,5
94
183
II. Зивисимость твердости от деформации
Материал: металлокерамический лист
Степень деформации, %
Твердость по Внкксрсу
III. Влияние температуры отжига на твердость [76]
Материал: металлокерамический тантал, прокатан на 959о па холоду
Анализ (%): 0,0056О2, 0,013N2, 0,10Nb, 0.01 W, 0,015Fe, 0.02C
Продолжительность отжига 30 мин
Температура отжига, °С 200 600 800 1000 1100 1200 1400 1600 2500
Твердость по Кнупу 260 245 240 215 190 130 ПО 133 130*>
а Экстраполировано по графику.
i
IV. Влияние температуры отжига на твердость [44]
Материал: металл электронно-лучевой плавки
Анализ: см. табл. 4 (партия 2)
Предварительная обработка: образцы получены обжатием слитка на холоду, затем отож-
жены при указанных температурах в вакууме
Температура
отжига, °С
25
200
400
600
800
1000
1200
1400
1600
1800
Твердость по Виккерсу (нагрузка [ 0 кг)
деформация на
холоду на 50%
150
125
132
156
140
120
100
80
85
83
деформация на
холоду на 75%
150
172
175
165
135
105
80
92
88
83
деформация иа
холоду иа 85%
156
145
152
156
142
102
83
85
90
90
деформация на хо-
лоду на 75% после
промежуточного
отжига
137
130
143
140
128
111
80
86
90
86
Тантал 705
Продолжение табл. 9
V. Твердость тантала при нагревании [92]
Материал: металл дуговой плавки в виде слитка; испытан в вакууме; температура
стабилизировалась 10 мин перед измерением тверлости
Температура, °С 25 200 400 600 800 900
Твердость по Роквеллу (шкала А) 57 44 41 37 25 10
VI. Твердость тантала при нагревании [64, стр. 422]
Материал: металл очищен электронно-лучевой зонной плавкой, переплавлен в неболь-
шие слитки в дуговой печи, отшлифован и отполирован; его твердость по Виккер-
с> 89 кг/мм-; после испытания она повысчлась до 100 кг/мм2
Температура, °С 20 400 600 800 1000 1200
Твердость, кг/л и2 89 В2 73 37 29 21
плавки несколько превышает 2:1; в эти части таблицы включены результаты
исследования, проведенного Хольденом, Шварцбергом и Джаффп [44|.
Деформированный металл имеет определенные преимущества в отношении
предела текучести при более высоких температурах, но он гораздо менее
пластичен, чем металл в отожженном состоянии. Увеличение прочности при
растяжении, наблюдаемое при температуре около 300°, указывает на старе-
ние от деформации, вызванное присутствием примесей внедрения, даже при
низком содержании этих примесей в тантале электронно-лучевой плавки.
О таком же влиянии свидетельствуют приведенные в III и IV частях табли-
цы результаты исследовании Пю L75J и Бехтольда 19], выполненных на
металлокерамическом тантале, содержавшем намного большее количество
примесей внедрения.
Используя отожженный металл, полученный методами порошковой
металлургии, Пю [75J, Престон и сотр. 174] и Гласье и сотр. [33] определили
прочностные свойства при температурах до 1200, 2760 и 2818° соответственно,
что отражено в 111, V и VI частях таблицы. В VIII части таблицы приведены
данные, полученные в работе I33J для металла дуговой плавки при темпера-
туре до 2782°.
Влияние холодной обработки давлением показано в 1 и VIII частях таб-
лицы по данным Хольдена и сотр. 1441 для металла электронно-лучевой
выплавки и по данным Майсрса 169] для металлокерамического тантала.
В результате исследования Мамерс обнаружил большое влияние холодной
обработки давлением на твердость и прочностные свойства.
Изменения прочностных свойств в зависимости от отжига, показанные
в IX части таблицы, относятся к металлу высокой степени чистоты дуговой
плавки 192]. В этой части охарактеризован также рост зерен с увеличением
температуры отжига.
В табл. 9 приведены значения твердости в зависимости от температуры
(V и VI части), деформации на холоду (I и II части), температуры отжига
A11 и IV части). По возможности указаны тип металла, степень чистоты
и предыстория образца.
На рис. 10 и 11 графически показано влияние температуры отжига на
твердость металла электронно-лучевой плавки, который перед отжигом был
подвергнут обжатию на холоду с различными степенями деформации, по
данным Хольдена и сотр. 1441.
Характеристика предела выносливости при комнатной температуре
и при 73 приведена в табл. 10 по данным Борнемана и Гелы [10] для листа
и проволоки, изготовленных из металлокерамического тантала. Установлено,
45 Заказ № 23У
Таблица 10
предал выносливости
Влияние нагревания и температуры отжига [10|
I. Материал: лист толщиной 1 мм, изготовленный из металлоксрамичсского танта.ш
Анализ (%): 0.028 С, 0,015 Fe, следы Mo, Nb. SiO2, ТЮ2
Предварительная обработка: предпоследняя деформация с обжатием по сечению при-
близительно на 33% и отжиг в течение 1 час при 1400°
Испытания проводились в направлении прокатки на машине Зоннтаг SF-2
Отношение предела выносливости к пределу прочности составляет 0,63 прн 27' и 0,59
при —73°
Температура,
°С
-73
Нагрузка,
кг! »ш2
44
35
34
30
29,5
29
29
Число циклов
до разрушения
4-1A5
8-103
1-106
4-10"
1-10'
2-107
Неопределенно
велико
Телтература,
-С
27
Нигрузкл,
кг'мм*
39
30
26
25
25
25
Чигло цнк-поп
до разрушения
1,6-105
4-105
МО»
2-10«
2,5-1№
Неопределенно
велико
II. Материал: проволока диаметром [0,1 мм, изготовленная из металлокерамического
тантала
Предварительная обработка: отжиг в течение I час при 1400"
Температура,
-С
-73
Нагрузка,
кг/мм%
63
56
54
52
49
48
48
48
Число циклов
до разрушения
4-10-1
8-10*
1-105
2.105
6-Ш5
4-10°
IIP7
Неопределенно
велико
Температура,
-С
27
Нагрузка.
кг/мм%
70
58
55
49
46
45
45
45
Число циклов
до разрушения
2-101
6-Ю*
1-10=
2-10»
4,5-105
1-10«
1-10'
Неопределенно
велико
III. Материал: металлокерамическая проволока диаметром 0,1 мм
Предварительная обработка: отжиг в течение 1 vac при 1140'
Температура образцов при испытаниях 28
Нагрузка, кг/мм- 1 75
1
Число циклов до раз-
рушения а
2-10^
60
1-105
46
8-105
44
2-10"
44
5-Ю7
44
Неопределенно
велико
а Нес приведенные выше значения пзм1ы нл uupyi ленных графических данных.
Тантал
707
ПО
150
130
110
SO
10
50
\
\
\
¦
1 в
Рис 10. Изменение твердости тантала
высокой степени чистоты, прокатан-
ного на холоду из слитка, в зависи-
мости от температуры отжига в течение
I час [44].
а — слиток деформирован н.1 холоду h.i
50%; 0 — слиток деформирован hj холоду
на 75%; в — слиток деформирован нл
холоду на 55%.
400 S00 1200
Температура'С
1600 ZO0O
что отношение предела выносливости к пределу прочности при растяжении
равно 0,63 при 27° и 0,59 при —73е; предел выносливости при пониженной
г
Рис. 11. Изменение твердости тан-
тала высокой степени чистоты, про-
катанного на холоду с промежуточ-
ним отжигом, d зависимости от тем-
пературы отжига в течение 1 час [44]
Металл деформирован иа холоду после
прпмежуточищ а отжига на 75%.
О >i00 800 ПВО IG00 2000
Температура т.
температуре выше, чем при комнатной. Результаты работы [10] свидетель-
ствуют также о том, что пластичность и модуль упругости тантала не умень-
45*
\
г
708^ Глава 28
шаются при —73е; признаков хрупкости не было обнаружено; металл можно
без всяких опасений применять при низкой температуре.
В табл. 11 приведены данные об ударной вязкости отожженного метал -
локерамического тантала [10].
Таблица II
УДАРНАЯ ВЯЗКОСТЬ
Влиянне температуры ни ударную вязкогть [101
Материал: итижженнын лист толщиной 0,5 мм. изготовленный нз металлокерамнческо-
го тантала
Лспытанпя проводились на матине 4мслер РН 130 в направлении, перпендикулярном
направлению прокатки; приблизительная скорость при ударе 460 см/сек
Температура, "С
Ударная вязкость, кгм/см2
27
8240
— 57
3580
—73
3240
Данные о ползучести и длительной прочности тантала сведены в табл. 12.
Они получены Хольденом и сотр. [441 для металла электронно-лучевой
плавки в рекристаллизованном состоянии для интервала температур- 500 -
1400° и в деформированном состоянии для температур от комнатной до 750 .
Сведения о разрушающем напряжении для металла дуговой плавки при
1649° даны Торти [92]. Ползучесть и длительная прочность металлокерами-
ческого тантала определены Престоном и сотр. [74] при 1649, 2204 и 2760'.
Аллен и Кэррингтон 12] сообщили результаты испытаний на ползучесть при
сжатии при 1000°. Результаты работы [44] представлены графически на
рис. 12.
Данные о рекристаллизации тантала, выплавленного электрошю-луче-
вым способом, приведены в табл. 13 по результатам исследования 1441.
В других опубликованных по этому вопросу сообщениях описываются ана-
логичные результаты.
Влияние добавок азота и кислорода на прочностные свойства, твердость,
температуру отжига, сопротивление ползучести и длительную прочность
тантала высокой степени чистоты, выплавленного в электронно-лучевой
печи, охарактеризовано Хольденом и сотр. [44J. Были исследованы сплавы
с примесями элементов, образующих твердые растворы внедрения (Та -'-
+0,056 вес.% О2 и Та + 0,0225 вес.% N2). Хотя твердость этих сплавов
превышает твердость исходного тантала приблизительно вдвое как до отжи-
га, так и после отжига, температура рекристаллизации для нсех трех мате-
риалов остается по существу одинаковой, т. е. равной 1200—140С при выдер-
жке в течение 1 час. Влияние температуры отжига на твердость этих спла-
вов показано на рис. 13. Аналогичные сведения для исходного металла при-
ведены на рис. 10 и 11.
Прочностные свойства сплавов Та—О и Та—N для температур до 500
указаны в табл. 14. Эти свойства для тантала различной степени чистоты
представлены графически на рис. 14. График построен по данным работы
Хольдена и сотр. 144], проведенной с танталом электронно-лучевой плавки,
и работы Пю [75], выполненном с металлокерамическим танталом.
Данные о деформируемости и длительной прочности сплавов Та—О
и Та—N при 750—1200° приведены в табл. 15 [44], а о влиянии азота и кис-
10
100
umu
впглтя чпг.
Рис. 12 Ползучесть и длительная прочность рекристаллизованиого тантала высокой чистоты, дефор-
мированного на холоду после промежуточного отжига на 7596; рекристаллизован при отжиге в течение
I час при 1200° [44].
Продолжение табл. 12
Темпе-
рату-
ря.
1200
1400
На-
груз-
ка.
кг/ммг
1,8
1.8
1,3
1,1
Удли-
нение
при
нагру-
женмн,
%
0,12
0,48
0.27
0,13
Суммар-
ная де-
форма-
ция, %
0,5
1,0
2,0
5,0
2,0
5,0
1,0
2,0
5,0
0,5
1,0
2,0
5,0
Время,
4tlC
0,2
1,2
4,8
27,0
0,07
0,50
0,13
0,65
3,40
0,10
0,40
1,60
6,80
Ползу-
честь,
%
0,5
1.0
2,0
5,0
0,5
1,0
2.0
5,0
0,3
1.0
2,0
5,0
0.2
0,5
1,0
2,0
5,0
Время,
час
0,4
1,6
5,5
28,0
0,01
0,03
0,11
0,64
0,07
0,25
0,85
3,65
0,04
11,15
0,50
1.90
7,00
Мини-
мальная
скорость
ползуче-
сти,
%/чаС
0,10
2,6
1,0
0,58
Причностные
свойства
нреми,
час
141,9 а
7,3
11,0
22.4
относи-
тельное
удлине-
ние, %
16
35
26
33
а Испьлаиие прерсани до разрушения.
6 Экстраполированное значение.
II. Материал: обкованный металл электронно-лучевой плавки [44]
Анализ: см. табл. 4 (партия 2)
Прсднарительнан обработка: слиток деформирован на холоду со степенью обжатия
95°о, отожжен для снятия внутренних напряжений r течение 15 мин при 750°
в аргоне
Атмосфера при испытаниях: вакуум не ниже Ы0 * мм рт. ст.
Темпе-
рату-
ре
27
На-
гр>з-
ка,
КГ/ V W2
38,0
37,3
36,9
Удли-
нение
при
иагру-
женин,
%
0,48
0,27
0,42
Суммар-
ная де-
форма-
ция, %
1,0
2,0
1,0
2,0
5,0
0,5
1,0
Время.
0,05
A,28
0,03
0,10
3,0
0,006
0.042
Пол iy-
честь,
ч/
0,5
1,A
2,0
0,5
1,0
2,0
0,5
1.0
Время,
0,03
0,075
1,0
0,025
0,0.13
0,16
0,035
0,12
Мини-
мальная
скорость
пнлзуче-
стн.
%/.ЮС
0,29
0,69
0,86
11 рОЧ II
CBOf
нремн,
час
5,6 "
3,1
0,6
остные
ства
tiTii пен-
тел ьное
удлине-
ние, %
8
8
6,4
Таблица 12
ползучесть и длительная прочность
I. Материал: отожженный металл электронно-лучевой плавки [44]
Анализ: см. табл. 4 (партия 2)
Предварительная обработка: слнток деформирован на холоду с обжатием на 75% пос-
ле промежуточного отжига, рекристаллизован путем отжига в течение 1 час в ва-
кууме при 1200"
Атмосфера при испытаниях: вакуум не ниже 1-10 мм рт. ст.
Темпе-
рату-
ра,
"С
500
750
1000
1200
На-
груз-
ка,
кг л*л2
17,8
16,9
15,5
15,5
11,2
9,8
8,4
7,7
7,0
6,3
5.6
4,9
3,5
2,5
Удли-
нение
прн
нагру-
жен»»,
%
10,8
10,2
5,70
1,41
0,57
2,15
1,70
1,42
1,02
3,62
1,80
0,29
Суммар-
ная де-
форма-
ция, %
—
_
2,0
5,0
1,0
2,0
5,0
2,0
3,0
2,0
5,0
2,0
5,0
5,0
2.0
5,0
0,5
1,0
2,0
5,0
Bpevil,
час
— ,
_
о,ю
13,6
0,5
52,5
0,2
0,03
1,3
0,25
5,0
1.1
11,4
0,01
0,01
0,21
0,02
0,»8
0,36
2,3
Ползу-
честь,
%
_
—
1,0
2,0
5,U
1,0
2,0
5,0
0,5
1,0
2,0
2,0
5,0
0,5
1,0
2,0
5,0
0,5
1,0
2,0
5,0
0,5
1,0
2,0
5,0
2,0
5,0
2,0
5,0
0,5
1,0
2,0
5,0
Врем я,
час
_
0,06
0,14
0,44
0,7
1,0
23,7
1,5
21,5
91,56
0,1
0,fi4
0,05
0,15
0,51
2,5
0,09
0,6
2,3
8,0
0,2
1.12
4,8
14,6
0,015
0,038
0,11
0,36
0,05
0,14
0,48
2,5
Мини-
мальная
скорость
Ползуче-
сти,
%/час
0
0
9,8
0,113
0,0145
3,18
1,40
0,44
0,34
85,5
8,7
0,48
Прочностные
свойства
время,
чис
0.0
>24,7
>138,4
0,03
1,1
168,1
71,2а
4,3
12,0
30,6
55,3
0,38
4,5
55,8
относи-
тельное
удлине-
ние, %
28
а
а
29
33
33
2,2
40
43
54
58
61
60
59
Продолжение табл. 12
Темпе-
рату-
27
500
750
На-
груз-
ка.
36.9
35,0
33,0
30,2
22,8
19,3
Удли-
нение
прн
нагру-
жен инт
0,22
0,19
0,47
0,27
0,25
Суммар-
ная де-
форма-
ция, %
_
0,5
0,5
1,0
0,5
1,0
2,0
Время,
час
2,0
0,10
0,34
0.85
4,15
11.0
Ползу-
честь,
о/
0,2
0,5
1.0
0,1
0,2
0,5
1,0
2,0
Время,
час .
0,10
0,23
0,46
0,16
0,60
2,3
6,2
12,4
Мини-
мальна л
скорость
ползуче-
сти,
%/вде
Прочностные
свойства
о
о
0,0004
2,3
0,11
время,
час
>124,0
>116,0
0,0
0,60
19,4
относи-
тельное
удлине-
ние, %
5,1
6,1
7,7
а Испытание нрерпано до разрушения.
Расчетная величина; разрушение в интервале 0,3—0,8 чис.
III. Материал: металлокерамическнй тантал [2]
Метод испытаний: испытании в вакууме на ползучесть прн сжатии
Результаты: при 1000' нагрузка 4,2—5,6 кг/к.«2 дает за 24 час Jl°v деформации
ползучести
IV. Материал: лист толщиной 0,75 мм, прокатанный иа холоду из слитка дуговой
плавки |92]
Анализ (%): 0,011 О2, 0,0015 С, 0,01125 N2, 0,005 Fe,<0,001 Cr, 0,005 Ni, <0,0025 Si,
<0,001 Ti, <0,0025Mo
Результаты: время до разрыва прн 1649^ и нагрузке 2,8 кг,мм2 составляет 3 мин 6 сек,
при нагрузке 1,75 кг/мм2 18 мин 37 гск
V. Материал: отожженная ыеталлокерамическая полоса [74, 92]
Анализ: технический металл
Предварительная обработка: лист прокатан до 1,6 мм и отожжен
Атмосфера при испытаниях: aproii
ТемпРра-
тура.
1649
2204
Суммарное
удлинение.
19,5- 20
20
Длительность
нагруже-
ния а, сек
30
G0
dUO
30
60
300
Нагрузка а за указанное время.
относи
1
3.30
.1,04
2,46
0,82
0,70
0,49
тельное удлинение, %
2
3,51
3,23
2,fifi
1,02
0,96
0,03
5
3,79
3,51
' 2.99
1,32
1,12
0,82
кг "мм2
разрыв
4,07
3,79
3.23
1,41
1,19
Продолжение табл. 12
Течпера-
Суммнрное
удлинение,
%
2760 22,5- 25
Длительность
нагруже-
ния а, сек
Нагрузка а за указанное время, кг'мм*
относительное удлинение, %
30
60
300
0,36
0,30
0,21
0,43
0,38
0,27
0,54
0.47
0,35
0,42
а Данные интерполированы и экстраполированы по прямым графика 1о? (нагрузка)—log (вргчн).
Таблица 13
РГКРИС1ЛЛЛИЗЛЦИЯ ТАНТАЛА [44]
Материал: металл, полученный электронно-лучевой планкой
Анализ: см. табл. 4 (партия 2)
Условия обработки
Слиток деформирован на холоду с
обжатнем 50"ii
Слиток деформирован на холоду с
обжатием 75%
Слиток деформирован на холоду с
обжатием 95.%
Металл после промежуточного
отжига деформирован с обжати-
ем на 75%
Температура (°С), при кото-
рой рекристаллизация в те-
чение I час происходит на
50%
1100
1000
900
1050
100%
1100
1200
1300
1200
Таблица 14
ВЛИЯНИЕ АЗОТА И КИСЛОРОДА НА ПРОЧНОСТНЫЕ СВОЙСТВА ТАНТАЛА [44]
Материал: тантал высокой степени чистоты, полученный электронно-лучевой планкой
и превращенный в сплавы Та—N и Та—О
Диализ сплава Та—N(°i): 0,0006 О-г, 0,0225 N2, 0,00032 Н2, 0,002 С; сплава Та О(%):
0.05G0O2. 0,003 N2, 0,00032 Н2, 0,002 С
Содержание других элементов в обоих сплавах такое же. как прииедено в табл. 4
(партия 2)
Предварительная обработка: сплавы прокатаны на холоду с обжатнем на 70% и отож-
жены в течение 1 час при 1200" (сплав Та—N) и при 1300е (сплав Та—О)
Испытания проводились на воздухе при скорости деформации 0,05 мм/мм -мин
Та—N
Температура,
27
225
Предел прочности
при растяжении,
кг/мм.2
51,6
38,7
Предел текучести
(при Ои.г), кг-м к2
47,5
27,3
От н ос нте л ьн ое
удлинение, %
25
21
714
Глава 28
Продолжение табл. 14
Сплав
Та—N
Та—О
- 1емпература,
-С
300
3.10
375
415
500
27
135
180
225
350
500
Предел прочности
при растяжении,
кг/мл&
40,6
44,7
46.6
44,1
-12,3
42.0
4U.1
42,7
55,7
fi-4,4
35,7
Предел текучести
(при Оо,з). кг'мм?
25,2
26,2
25,7
26,0
22,1
35,1
29,5
31,4
35,7
31,1
17,2
Относительное
удлинение, %
21
20*
25 .
18
13
26
22
17
14=
27
22
а Образец разрушался за пределами измерительной шкалы; удлинение нычиглено по растя-
жению между крайними точками шкалы. Отношение между удлинением и растяжением составляет
1,2/1,0.
лорода на предел длительной прочности тантала — в табл. 6. Азот оказы-
вает на тантал резко выраженное упрочняющее влияние, однако
это влияние уменьшается со временем и с температурой. Кислород
является гораздо менее эффективным упрочнителем.
350
300
г
S 240
«О
i
200
t
о
,л
(
Л
s
V,
'\\
о
о
ч ''
ч
ISO
О WO 800 1200
Температура вттига, °С
Рис. 13. Изменение твердости спла-
пов Та—0,0225 кес.% N и Га—
0,0560 вес. % О f зависимости от
температуры отжига в течение
1 час [44]
р — Та 4- 0.051H вес. % О: X — Та+
0.0225 вес. % \: дсфпрм.и1ии на холоду
после промежуточного отжига на 70 пп.
200 1,00
Температура, X
600
Рис. 14. Предел прочности при растяжении
тантала различной чистоты [44|.
X — метал." элсктронпо-лучеепп пллпки -f O.Oftdo
вес.%О; Щ - металлокерамнческий тантал [75]:
О — метал.,. электршши-лученой пл.шки -|- 0,0225
вес.% N; Д — металл электронно-лучевой плявкн.
Таблицы 15
ВЛИЯНИЕ АЗОТА И КИСЛОРОДА НА ДЕФОРМИРУЕМОСП Ь И ДЛИТЕЛЬНУЮ ПРОЧНОСТЬ
ТАНТАЛА [11]
Материал, анализ и предварительная обработка те же, что приведены f табл. 14.
Испытания проводились в вакууме не ниже 1-1и~4 мм рт. ст.
Темпе-
рату-
ра,
°С
750
1200
750
1200
1200
На-
пря-
жение,
12,7
14,1
14,8
3,2
4,2
7.0
9,1
10,5
12.3
14,1
2,1
Удли-
нение
при
натру-
женни.
0,06
0,72
0,64
0,30
Деформируемость
суммарная
деформация
степень
де форма-
ми и °/
ЧИН, /(,
время,
час
ползучесть
степень
деформа-
ции, %
время,
час
Сплав» Та—N @.0225 вес.%
0,2
0,5
1,0
2,0
5,0
1,0
2,0
5,0
1.0
2,0
5,0
0,5 .
1,0
2,0
3,0
1,0
2,0
5,0
0,02
0,10
0,22
0,43
1,5
0,06
0,20
0,50
П,02
0,13
0,40
0,08
0,18
0.46
1,7
0,02
0,08
0,ЗЛ
0,2
0,5
1,0
2,0
5,0
0,5
1,0
2,0
5,0
0,5
1,0
2,0
5,0
0.03
0,12
0,24
0,44
1.5
0,10
0,17
0,28
0,58
0.03
0.10
0,19
0,45
1,0 . 0,04
2,0
5,0
0,10
0,36
Никаких отсчетов на тензометре не получено
0,96
2,84
4,38
6,58
0,48
СплавВ Та—О @,0560 нес.0,,)
2,0
5,0
5,0
5,0
—
0,5
1,0
2,0
1,0 0,2
47,0 0,5
1,"
»
0Д17
0.02
2,0
5,0
2,0
0,03
0,14
0,93
8,0
74,0
0,06
5,0 0,37
2,0 0,04
5,0 0,12
2.0 0,02
5,0
U,02 0,2
0,60 0,5
3,3
1,0
2,0
0,05
0,15
11,55
1,8
•1,2
Мини-
мал ьн а я
СИОрОС! Ь
ползуче-
сти,
%/час
<0,50
4,7
7,7
-
<1,0
6,7
0,03
2,5
20,4
103,0
0,39
Длите
время,
час
51,4
5,9
2,9
24,3
3,3
0,11
>313
10
10,2
0,27
>86Г
льиая
HIKTh
относи-
телен не
удлине-
ние, %
55
62
55
68
63
71
1Г|В
50
61
48
52
716
Глава 28
Продолжение табл. 15
Темпе-
рату-
ра,
На-
груз-
ка,
кг мм*
3.5
4,9
Удли-
нение
при
нагру-
же нни,
0,84
6,02
Деформируемость
суммарная
деформация
степень
деформа-
ции, %
2,0
5,0
время,
час
0,04
0,48
ползучесть
степень
деформа-
ции, %
1,0
2,0
5,0
1,0
2,0
5,11
время,
4111
0,03
0,09
0,68
0,02
0.06
0,28
Мини-
сиорость
ползуче-
сти,
%,'час
4,2
8,3
Длительная
прочность
оремя,
vac
3,6
1,7
ОТНПСН-
тельное
удлине-
38
29
а Прокатан на холоду с: «Сжатием на 70% и отожжен в течение I час прн 1300°.
^ Прокатан на холоду с обжатием на 70% и отожжен в течение I час при 1200°.
в Испытание прервано.
г Температурные циклы после Кб час; разрушение произошло приблизительно через 100 час.
ХИМИЧЕСКИЕ СВОЙСТВА
Среди других металлов тантал является одним из наиболее устойчивых
к действию различных химикалий при температурах ниже примерно" 150°.
К немногим реагентам, которые быстро действуют на тантал, относятся фтор,
плавиковая кислота, кислотные растворы, содержащие фгор-ионы, и сво-
бодный серный ангидрид. Щелочи реагируют с ним медленно, но скорость
реакции возрастает с повышением концентрации щелочи.
По мере повышения температуры тантал начинает медленно взаимодей-
ствовать с большим числом реагентов, и это взаимодействие ускоряется с тем-
пературой. Специфические условия, в которых протекают те или иные
реакции, изменяются в зависимости от реагента, как, впрочем, и в случае
любого элемента. При температурах в несколько сотен градусов тантал
становится чрезвычайно реакционноспособным в большинстве сред, в том
числе на воздухе, но за некоторыми важными исключениями, указанными
ниже. Инертность тантала обусловлена присутствием на поверхности метал-
ла тонкой прочной самозатягивающейся пленки пятиокиси тантала; хими-
ческие реагенты действуют на металл только в тех случаях, когда они всту-
пают в реакцию с этой пленкой или проникают через нее. Пленка препят-
ствует протеканию тока от тантала к электролиту, если металл служит ано-
дом, хотя ток может идти, если есть контакт металла с металлом. Это свой-
ство делает тантал ценным для применения в выпрямителях и конденсаторах.
Тантал в гальванических парах почти со всеми металлами является като-
дом. Следовательно, в ряду электроотрицательности тантал занимает верх-
нее положение, вследствие чего в гальванических парах с большинством
металлов образующийся на поверхности тантала атомарный водород быстро
им абсорбируется, что вызывает хрупкость металла. Такой же эффект
могут вызывать паразитные токи. Поэтому крайне важно, чтобы тантал,
из которого, например, изготовлено химическое оборудование, не стал
катодом; это необходимо для предотвращения изменения структуры
металла.
Тантал 717
Коррозионная стойкость
Исключительная коррозионная стойкость тантала в широких пределах
концентраций' реагентов и температур обусловила одно из его основных
применений — в качестве конструкционного материала в химическом
аппаратостроении. Устойчивость тантала к действию большого .числа реа-
гентов охарактеризована в табл. 16. Кстати, если тантал подвергается кор-
розии, то последняя происходит равномерно, без точечного травления.
Соляная кислота. Тантал устойчив к действию соляной кислоты при
любых концентрациях и при температурах по меньшей мере до 110J. Это
обстоятельство подтверждается длительным промышленным опытом. Напри-
мер, стыковые трубчатые нагреватели, толщина стенки которых равна 0,33 мм.
не корродируют при непрерывном использовании в производственных усло-
виях в дистилляционных установках в течение уже более двадцати лет.
Выше температуры кипения при нормальных условиях для данной концен-
трации кислоты достигается температура, при которой начинается точечная
коррозия, сопровождающаяся некоторымохрупчиванием. Испытания, выпол-
ненные в исследовательской лаборатории металлов фирмы «Юнион кэрбапд
металс» [5|, показали, что при 190° под давлением скорость'коррозии при
концентрации до 25% НС1 составляет менее 0,025 мм/год. В 25°о -ной соляной
кислоте в небольшой степени происходит водородное охрупчивание. Ско-
рость коррозии в 30%-ной соляной кислоте равна 0,1 мм/год, а в 37%-ной
кислоте — 0,3 мм/год, причем хрупкость увеличивается по мер'е повышения
концентрации кислоты.
Азотная кислота. Тантал устойчив к действию азотном кислоты при
всех концентрациях в широком интервале температур даже в присутствии
Н('1 или хлоридов. Это подтверждается как использованием танталового
оборудования в течение ряда лет в многочисленных промышленных уста-
новках, так и многими испытаниями в производственных условиях 132, 36].
Испытания при температуре 19СР показали, что скорость коррозии составля-
ет менее 0,025 мм'год при концентрации кислоты до 70%, при этом не про-
исходит охрупчивания 151. Другими испытаниями показано отсутствие
коррозии при температуре 250—300 и давлении 85 кг'сн2 [36).
Дымящая азотная кислота, содержащая 6,5% NO2, не действует на
тантал при температурах 121 - 149° 146].
Серная кислота. В 98%-ной серной кислоте медленная равномерная
коррозия тантала начинается приблизительно при 1753. При всех концентра-
циях ниже этой температуры коррозии не происходит. Благодаря этому
сотни танталовых нагревателей, действующих при избыточном давлении
пара 10,6—12,3 кг/см'2, в течение ряда лет применяются в промышленности
при концентрировании серной кислоты.
Установлено 187], что при увеличении температуры Ов^о-ной серной
кислоты выше 175 скорость коррозии тантала возрастает. При 200° она
составляет 0,037, при 250°—0,74 и при 300°—8,7 мм/год [35, 361. С умень-
шением концентрации кислоты скорость коррозии при данной температуре
имеет тенденцию к снижению. Испытания танталового концентратора в про-
изводственных условиях показали, что в 90%-ной серной кислоте при
250° скорость коррозии равна 0,08 ^им/год, что составляет около 1/10 скоро-
сти коррозии в 98%-ной кислоте при той же температуре [36]. Никакого
охрупчивания тантала при этом не произошло; присутствие соляной кисло-
ты или хлоридов не влияло на коррозионную стойкость.
КОРРОЗИОННАЯ СТОЙКОСТЬ
У Азот, ниже 30U (см. текст) У
У Азотистая кислота У
У Азотная кислота (см. текст) У
У Азотная кислота дымящая У
(см. текст) У
У Амилацетат У
У Амилхлорнд У
У Амины НУ
И Аммиак
У Биоло! ическис жидкости У
НУ Бисульфат натрия, расплав- НУ
ленный
У Бисульфат натрия, раствор НУ
У Бисульфит кальция
У Ьихроыат калия НУ
У Бром влажный
У Бром сухой, ниже 300" У
У Бромид натрия У
У Бромистоводородная кислота
У Бромистый водород И
И Водный раствор аммиака НУ
И Водород (см. текст)
У Воздух, ниже 30" (см. У
текст) . У
У Гидроокись барии НУ
У Гидроокись кальция У
У Гипохлорит кальция У
У Гипохлорнт натрия
У Днбромэтан У
НУ Едкий натр, концентриро- У
ванный раствор У
И Едкий натр, разбавленный У
раствор (см. текст) У
НУ Едкое кали, концентриро- У
ванный раствор У
И Едкое кали, разбавленный У
раствор (см. текст) У
У Жирные кислоты У
У Иод, ниже 300" (см. текст) У
У Иодид калия — под У
У Иодистоводородная кислота И
У Йодистый водород У
М Карбонат калия У
И Карбонат натрия У
У Кислород, ниже 300е (см. У
текст)
У Лимонная кислота
У Метнлсерная кислота У
У Молочная кислота У
У Муравьиная кислота У
Таблица 16
ТАНТАЛ\а •
Нитрат аммония
Нитрат натрия
Нитрат серебра
Нитрознлхлорнд
Окислы азота (см. текст)
Окислы хлора
Оксихлорнд фосфора
Олеум (дымящая серная
кислота)
Перекись водорода
Пиросульфат калия, рас-
плавленный
Пиросульфат натрия, рас-
плавленный
Плавиковая кислота (см.
текст)
Сера, ниже 500J (см. текст)
Серная кислота, выше 175°
(см. текст)
Серная кислота, до 175
Серная кислота дымящая
(см. текст)
Сернистая кислота
Сернистый ангидрид
Серный ангидрид
Сероводород (см. текст)
Смеси серной и азотной
кислот (см. текст)
Соли меди
Соли никеля
Соли олова
Соли ртути
Соляная кислота (см. текст)
Сульфамнновая кислота
Сульфат алюминия
Сульфат аммония
Сульфат железа(П)
Сульфат натрии
Сульфат цинка
Сульфат магния
Сульфид натрия (см. текст)
Сульфит натрия
Сульфурилхлорид
Тионилхлорид
Травитсли (за исключением
смесей азотной и плавико-
вой кислот)
Уксусная кислота
Уксусный ангидрид
Фенол
Тантал
719
У
у
У
У
и
НУ
У
У
У
У
У
У
У
У
у
У
У
У
У
У
У
У
Фосфат аммония
Фосфор, ниже 700г (см.
текст)
Фосфорная кислота, <^4-10~*
вес.% F" (см. текст)
Фталевый ангидрид
Фтор (см. текст)
Фтористый водород
Хлор влажный (см. текст)
Хлор сухой, ниже 250"
Хлорат натрия
Хлорид алюминия
Хлорид аммония
Хлорид железа(Ш)
Хлорид калия
Хлорид кальция
Хлорид магния
Хлорид натрия
Хлорид цинка
Хлориды серы
Хлориды фосфора
Хлорнронанная вода
X юрированные углеводо-
роды
Хлористый водород
Хлорная кислота
У
У
У
У
У
У
У
У
У
У
У
у
У
У
У
У
У
У
У
и
Прпдолжение табл. /6.
Х.юрноватая кислота
Хлорноватистая кислота
Хлорпроизводныр органиче-
ских соединений
Хлоруксуснаи кислота
Хромирующие растворы
Хромовая кистота
Хромовая смесь
Царская видка
Щавелевая кислота
Этилсульфат
Жидкие металлы
(см. текст)
Висмут, ди 9001
Галлий, до 450°
Калин, до 1000
Литий, до 1000
Магний, до 1150
Натрии, до 1200'
Ртуть, до 600'
Свинец, до 1000'
Сплавы натрий—калий, до
1000
Цинк, до 500^
а V — устойчив до температуры около 1о0°; НУ — неустойчив; И коррозион-
ная стойкость изменяется в занш-имостн от концентрации и температуры.
С другой стороны, сообщается 15], что испытания при температурах
кипения в 80, 85 и 95%-ной серной кислоте привели к некоторому охрупчи-
ванию образцов тантала. Соответствующие скорости коррозии составили
0,048 мм/год при 202 , 0,49 при 225"" и 4,86 при 290°. Скорость коррозии
при 190° составляет менее 0,025 мм/год для всех концентраций серной кис-
лоты, лежащих в пределах 5—90% |51.
Смесь кислот, приготовленная из 88 частей 95%-ной азотной кислоты
и 12 частей дымящей серной кислоты (содержащей 20ио SO3), разъедала
тантал при 121—149J со скоростью 0,02 мм'год 146].
Дымящая серная кислота, содержащая 15% SO3. быстро действует на
тантал- Тейлор [30, 87] установил, что, хотя при 23J скорость коррозии рав-
на 0,0076 мм/год, при 50ь она составляет 0,1, при 703—0,233 и при 130е—
100 мм1год.
Фосфорная кислота. 85"о-ная фосфорная кислота при температуре ниже
приблизительно 180° не действует на тантал, но она оказывает коррозион-
ное действие при более высоких температурах, причем скорость коррозии
Сыстро возрастает с увеличением температуры. При 225° скорость коррозии
составляет 0,09, а при 2Г>0° — 0,5 мм 'год 1361. В другой работе сообщается
15], что скорость коррозии в фосфорной кислоте при температуре кипе-
ния и при 190° составляет менее 0,025 мм/год при концентрации кислоты,
лежащей в пределах 1—85%.
720 Глава 28
Если фосфорная кислота содержит плавиковую кислоту или более
нескольких десятитысячных долей процента фтор-иона, как это часто
бывает в случае технической кислоты, то, по-видимому, такая кислота
вызывает коррозию тантала.
Влияиие фтор-иона. Плавиковая кислота (водный раствор или безвод-
ная), газообразный фтористый водород или кислотные растворы, содержащие
более 2 или 3-10 4 нес.% фтор-иона, оказывают коррозионное действие на
тантал .и охрупчивают его. Однако прн хромировании в гальванической кан-
не, содержащей фториды, коррозии, видимо, не происходит. В одном из опы-
тов скорость коррозии образца, помещенного в такую ванну на 2Ч2 месяца,
составила 0,0005 мм/год. Раствор содержал 40% СЮ3 и 0,5"о фтор-иона
(в виде фторида) и имел температуру 54—60е. В другом опыте, продолжав-
шемся 4 суток, при 54° в ванне, содержавшей 250г/л СгО3, 1,75 г/л H^S04 и
3,5 г/л фтор-иона (в виде фторида), скорость коррозии составила 0,005 мм/год.
Столь ничтожное действие может быть следствием иигибирования, вызывае-
мого комплексным ионом, образующимся между ионами хрома и фтора 136].
Другие реагенты. В пределах температур, обычно применяемых в про-
цессах, связанных с водными растворами, па тантал не действуют такие
кислоты, как царская водка, хромовая кислота, хромовая смесь (концентри-
рованная серная кислота и К2Сг2О7 или СЮ3), хлорная, хлорноватистая,
азотистая кислоты, органические кислоты, включая монохлоруксусную
и метилсерную кислоты, бромистоводородную и бромноватую кислоты и т. д.
Окислы хлора, окислы азота, хлориды серы и фосфора, РОС13, SO2CI2,
SO2, перекись водорода, фенол, сероводород и различные органические
соединения на тантал не действуют. Па него не оказывают действия соли,
образующие растворы с кислой реакцией, например ZnCl2, NaHSO4, A1C13,
FeCI3 и т. д. Он инертен во всех других растворах солей, если только отсут-
ствуют HF или концентрированные шслочи. Однако в расплавленных миро-
сульфатах натрия или калия тантал растворяется. Тантал полностью инер-
тен по отношению к жидкой среде человеческого организма, поэтому его
можно использовать в качестве хирургического имплантанта.
Щелочи. В то время как концентрированные щелочные растворы ден-
ствуют на тантал даже при комнатной температуре, и он растворяется в рас-
плавленных щелочах, металл вполне устойчив в разбавленных растворах.
В недавнем исследовании [90], пользуясь изменением электрического сопро-
тивления для учета скорости коррозии, было установлено, что скорость
коррозии танталовой проволоки, 'полностью погруженной на 210 суток
прн комнатной температуре в 10%-ный раствор едкого натра, составила
2,33-10 мм/год. В 5%-ном растворе при испытании в течение 60 суток
при 100" она составила 0,0032 мм/год. Такая же скорость коррозии была
D 10%-ном растворе едкого натра при 100". В последних случаях наблюда-
лось некоторое локальное действие в местах выхода проволоки из раствора
в погруженные в него резиновые пробки в стенках сосуда для коррозион-
ных испытаний; этим объясняется большая часть потери веса.
Галогены. Фтор действует на тантал при комнатной температуре. Тан-
тал полностью инертен к действию влажных и сухих хлора, брома и иода
при температуре до 150°; то же самое наблюдается, когда эти элементы раст-
ворены в растворах солей или кислот. Хлор начинает действовать на тан-
Тантал 721
тал при температуре приблизительно 250 ; реакция становится очень энер-
гичной через 35 мин при 450° и протекает мгновенно при 500". В присут-
ствии паров воды коррозия хлором резко замедляется, так что максимальная
температура, при которой тантал удовлетворительно стоек к действию хло-
ра, содержащего 1,5 и 30°о воды, составляет соответственно 375 и 4OO'J 194J.
Бром действует на тантал при 300°, иод — примерно при той же темпера-
туре, образуя соответственно ТаВг5 и Та15-
Сера. Тантал реагирует с серой и сероводородом при температуре крас-
ного каления с образованием дисульфида тантала TaS2. Дисульфид обра-
зуется также при нагревании пятиокиси тантала в H2S или CS^. Мало или
вообще нет данных о действии растворов сульфидов, например сульфидов
щелочных и щелочноземельных металлов, однако щелочная природа этих
соединений указывает на то, что они, видимо, в какой-то степени действуют
на тантал.
Селен и теллур. При 800° и более высокой температуре пары селена
и теллура сильно действуют на тантал. В противоположность этому мало
или лишь слегка действуют на тантал жидкие селениды и теллуриды иттрия,
редкоземельных элементов и урана в интервале температур 1300 2100°,
в связи с чем тантал считают удовлетворительным материалом, в котором
можно обрабатывать эти соединения 165]. t
Взаимодействие с газами. Как уже упоминалось, тантал становится
весьма реакционноспособным при более высоких температурах. Тантал
полностью устойчив на воздухе при 250° и более низких температурах, но
при 300*" он тускнеет за 24 час, а при более высоких температурах скорость
реакции быстро возрастает [36, 87]. Аналогичный эффект наблюдается
и с другими обычными газами.
Кислород. Имеются сообщения о нескольких окислах тантала, однако
маловероятно, что, помимо ТагО5, существуют другие стабильные окислы.
Пятнокись тантала образуется при непосредственном взаимодействии
кислорода с танталом либо в результате других химических реакций, при
которых в нее превращаются другие соединения тантала; некоторые из этих
соединений были описаны ранее.
Многочисленные исследования выполнены по кинетике и результатам
действия кислорода и воздуха на тантал. Большинство из них подробно
описаны в работе 164, стр. 486—499]. В более позднем исследовании 11],
проведенном с танталом высокой степени чистоты, полученным электронно-
лучевой плавкой, показано, что при взаимодействии тантала с воздухом
нитридов не образуется и что азот оказывает лишь небольшое влияние или
вообще не влияет на взаимодействие тантала с воздухом. На это указывается
и в работе 16]. Скорость окисления при 400—800° вначале подчиняется
параболической зависимости, затем линейной. При 800—1400° для реакции
на воздухе и при 500—1250' для реакции в кислороде отмечена только линей-
ная зависимость скорости окисления. Катастрофическое окисление в атмосфе-
ре кислорода при давлении 1 am происходит при температуре выше 1250°.
На воздухе, в котором парциальное давление кислорода равно 0,2 am, тем-
пература самовозгорания превышает 1400°. Скорость реакции в кислороде
при 1000е пропорциональна корню квадратному из давления. Окисная плен-
ка состоит из тонкого темного подслоя пятиокиси со следами трехокиси тан-
тала и наружного толстого бапого слоя пятиокиси тантала. Скорость всего
4fi Зак.тз № 239
wo
so
a
lo
so
5C.
40
30
20
W
О
J
i
I /
1-
Phc. 15. Реакция тантала с кислородом
при различных температурах [1].
¦ 12Ш> : "в— 1000°. t — S50"; С— В00°;
0—6A0°.
2003 ЬООО
Время, сек
6000
о ю 20 зо V/ so 6U w е-.о ю ши ни аи
Время, мчи
Р и с. 16. Реакция тантала с воздухом при различных темпера-
турах [1].
[_ 700 ; V — t5C°; д — 600°; ... — 550°; X — Е00°.
Тантал
723
процесса определяется диффузией ионов кислорода через прочно пристаю-
щий темный подслой.
Изменение относительной влажности воздуха, поступающего в окисли-
тельный сосуд, в пределах от 0 до 100% не оказывает влияния на характер
Рис. 17. Тантал, нагретый на поз-
духе при 1000° в течение 2,6 час
[1]. Х250.
Вндио проникновение окиси в металл по
ПЛС1СКОСТНМ (I 0 0).
окисления воздухом при 600—800°. Реакции тантала с кислородом и возду-
хом при различных температурах графически отражены на рис. 15 и 16. На
рис. 17 показано проникновение окиси в тантал по кристаллографической
Таблица 17
ВЛИЯНИЕ КИСЛОРОДА НА СВОЙСТВА ТАНТАЛА а [23. 31]
Содгржа-
' нне Оо,
ат. %
0
0,25
0,5
0,7
1,0
1,5
2,0
2,5
2,9
4,5
Электрос
ленне б,
0°
13,6
16,6
19,6
22,6
25,6
ппротив-
мком- см
1000°
37,1
40,1
43.1
46,1
49,1
Твердость
по Вик-
керсу
кг/мм2
50
250
440
583"
633
Предел
прочно-
сти при
рястмже-
НШ1,
кг/ммч
20.0
27,1
34.5°
89,6
Относи-
тельное
удлине-
ние, %
37
36
1П
8
4,5
Модуль
упругости,
кг*ммЪ
18 070
19210
19 690
19 820
Магнитная
воспрннмчи-
BGL IL, J.lM. i'
0,92
0,87
0,82
11 Отожженный и обсзгаженный металл. Вес значения получены интерполяцией округленна*
графических данных.
6 Для сопротивления d интервале температур 0—1000° наблюдается линейная зависимость
для каждой величины содержания кислорода, включая нулевое, т. е. все пять кривых являются"
пппаллельныа*н гюямыми.
[ прямыми.
в Кривая резко обрывается
46*
724
Глава 28
плоскости A0 0) при взаимодействии с воздухом в течение 2,6 час
при 1000е [1].
Рис. 18 показывает влияние взаимодействия с воздухом, кислородом
и азотом на твердость на различных расстояниях от поверхности II].
В присутствии нескольких атомных процентов кислорода увеличивают-
ся электрическое сопротивление, твердость, предел прочности при растяже-
нии и модуль упругости тантала, но снижаются относительное удлинение,
относительное сужение поперечного сечения, магнитная восприимчивость
и устойчивость против коррозии плавиковой кислотой 129, 31]. Сведения
о влиянии кислорода на физические свойства приведены в табл. 17. Если
1С00\
900
SCO
100
" 600
500
eg 4П0
^ 300:
200
100
1
1
\
\
[ \
\
tJ
\
V
\
ч
¦—.
Р и с 18. Увеличение твердости тантала
при поглощении кислорода и азота [1].
О — реакция с кислородом, 40 мин при 1200°;
д — реакция с воздухом. 6 час при 000°;
Cj — реакция с азотом. 3 час прн 1200°. "
О 0,0? (№ 006 ЦОВ 0.10 0,12 О'*
Расстояние от поверхности, мм
при этом учесть, что 1 ат.% кислорода в тантале эквивалентен лишь
0 0892 вес.%, то станет очевидным значительное влияние очень малых коли-
честв кислорода на свойства тантала. Величина B0.0 кг/мм2) предела проч-
ности при растяжении для чистого тантала, приведенная в табл. 17, при-
ближается к значению, полученному в работе 144] для тантала высокой
степени чистоты.
Азог Тантал непосредственно реагирует с азотом с образованием иитри-
чов из которых известно о существовании двух: TaN и Ta,N. Реакция начи-
нается при температуре около 300°, и скорость ее возрастает с повышением
температуры до тех пор, пока при 1100° не образуется TaN. Поглощенный
танталом азот вновь выделяется в условиях высокого вакуума при темпера-
туре приблизительно 2000 . Нитрид образуется также в результате реакции
между пятиокисью или галогенидом тантала и азотом в присутствии водорода.
Действие азота на тантал изучалось в нескольких исследованиях, по-
дробно обсуждаемых в работе |04,"стр. 466-474]. В более поздней работе [1]
изучено действие азота при 400—1475° на тантал высокой степени чистоты,
полученный электронио-лучевой плавкой. При 400—700° скорость реакции
починяется кубической, а при 800^ 1475"—параболической зависимости.
Реакция азотирования протекает намного медленнее реакции окисления.
Тантал
725
и основным продуктом реакции в виде прочно пристающей пленки на метал-
ле является нитрид TaN. На рис. 19 показана скорость увеличения веса при
нескольких температурах. Не наблюдается никакого влияния давления азо-
та на скорость реакции, указывающего на то, что происходит, взаимодей-
ствие через нитридную пленку.
Как и в случае кислорода в тантале, присутствие азота в концентрации
лишь нескольких атомных процентов увеличивает твердость, предел проч-
ности при растяжении и электрическое сопротивление и уменьшает относи-
тельное удлинение и плотность. Например, твердость по Викксрсу увеличи-
вается примерно с 75 в отсутствие азота @ ат.%) до 300 при 1,25'ат.% и до
Рис. 19. Реакция тантала с азотом при
различных 1емпсратурах [I].
#—1475°; ¦— 1000°; G—S00», О—800°-
500 WO0 1500 20QG 2500 3000 ЗЬОО
Время, сек
600 при 4 ат.°6 азота. Предел прочности при растяжении повышается
с 14 кг/мм2 в отсутствие азота приблизительно до 118 кг!им2 при содер-
жании 2 ат. , в то время как относительное удлинение снижается с 38 до
16% 181]. 1 ат. азота в тантале эквивалентен 0,0780 вес.%.
Водород. Как уже указывалось, тантал легко поглощает водород, и си-
стема Та И исследована подробно [64, стр. 445—457]. Тантал поглощает
водород при комнатной температуре при электролизе, когда используется
как катод, либо в случае нагревания металла при температуре выше 250°
в атмосфере водорода, образуя гидрид, максимальное количество водорода
в котором соответствует формуле ТаН0>Т4 или превышает 700 объемов на
1 объем металла. Поглощение водорода сопровождается расширением куби-
ческой объемноцентрированнои кристаллической решетки и увеличением
молекулярного объема, что приводит к охрупчиванию металла. При нагре-
вании такого материала в высоком вакууме при температуре приблизитель-
но 800° или выше выделяется по существу весь водород. В результате отжи-
га или обезгаживания при более высокой температуре тантал регенерируется.
11рисутствие водорода, помимо снижения пластичности, прочности
и плотности тантала, приводит к увеличению твердости и электрического
сопротивления.
726 Г лава 28 __
Водяной пар. О действии водяного пара на тантал при высоких темпе-
ратурах имеется мало данных, однако из производственной практики извест-
но, что нагревание при избыточном давлении пара до 14,2 кг.'см2, которому
соответствует температура 198°, не оказывает вредного действия на тантал.
Эндрюс I4J сообщил, что при температуре выше 1127° вода разлагается тан-
талом с поглощением кислорода металлом и выделением водорода. При 927°
и более низкой температуре эта реакция протекает очень медленно.
Двуокись углерода. Сухая двуокись углерода при давлении 8 am
и температуре 500е действует на тантал [71]; за 10 суток привес составил
6,7 мг/см*, за 60 суток — около 50 мг/см~. Тантал реагирует с двуокисью
углерода (по-видимому, при давлении 1 am) при 1100" с образованием Та2О5
и с окисью углерода при той же температуре, образуя ТаО 157]. Этот окисел
мри выдерживании в атмосфере кислорода превращается в Ta2Os.
Окись азота. При температуре ниже примерно 1125" скорость реакции
окиси азота (в виде смеси 5% КО и аргона) с танталом не может быть изме-
рена. С повышением температуры реакция протекает с возрастающей ско-
ростью, которая с 0,0065"п уменьшения поверхности в 1 сек при 1195° увели-
чивается до 0,076% при 1457° [21].
Другие газы. Хотя по этому вопросу опубликовано, по-видимому, мало
данных, можно предполагать, что тантал при повышенной температуре
реагирует с такими кислородсодержащими газообразными соединениями,
как SO2, NO2 и т. д. С углеводородами, например бензолом или нафталином,
тантал вступает в реакцию в интервале температур 1700—2500° с образо-
ванием карбида тантала 14]. Тантал используют в качестве геттера в ваку-
умные электронных лампах при температуре 650- 1000° для поглощения
газов и поддержания высокого вакуума.
Углерод, бор и кремний. При повышенных температурах тантал непо-
средственно реагируете углеродом, бором и кремнием, образуя соответствен-
но Та2С и ТаС, ТаВ и ТаВг и TaSi2; влитературе имеются сообщения и о дру-
гих бинарных соединениях этих элементов. Для этих соединений характер-
ны внешний вид и свойства металлов, высокие температуры плавления
и большая твердость.
Фосфор. Фосфиды тантала ТаР и ТаР2 образуются при нагревании тан-
таловых опилок в парах фосфора при 750—950°.
Расплавленные металлы. Тантал в отсутствие кислорода и азота исклю-
чительно устойчив к действию расплавленных металлов. На пего не действу-
ют натрии при 1200°, калий, сплавы калий — натрий, литий и свинец, при
1000 , висмут при 900J или более высокой температуре, ртуть при 600°,
галлий при 450°. Работа Аргоннской лаборатории [1001 показала, что На
него не действуют магнии и сплавы уран - магний и плутоний - магний
при 1150е.
В результате интенсивных исследований конструкционных материалов
для реакторов с расплаатенным металлическим топливом в Эймсской лабо-
ратории обнаружено [24, 25], что тантал является удовлетворительным
материалом для использования в течение нескольких тысяч часов в высоко-
температурных циркуляционных змеевиках, содержащих следующие
сплавы:
Тантал . 727
1. Расплавленный сплав магний — торий, имеющий состав, близкий
к богатому магнием эвтектическому составу F3 вес. % магния, 37 вес.% то-
рия; температура плавления 580°), при 800° в атмосфере гелия.
2. Расплавленный сплав висмут— уран E—10 вес.% урана) при 11003
в атмосфере гелия.
3. Расплавленные сплавы висмут — уран — марганец (?), содержащие
89,5- 10,0 0,5 и 94,7—5,0—0,3 вес.% компонентов соответственно, при
1160 и 1050° в атмосфере гелия.
Контейнеры из тантала в течение нескольких суток пришли в негод-
ность в случае сплавов алюминий торий — уран G6—18—6 вес.%) при
1000е, уран — железо (90—10 вес.%) при 900е и эвтектического сплава
уран — хром при таких же температурах [24, 25].
Расплавленный алюминий быстро реагирует с танталом, образуя устой-
чивое соединение танталид алюминия А13Та.
Сообщается, что цинк смачивает тантал и действует на него, если
поверхность тантала обрабатывать цинком при 440°, однако на одном заво-
де [3G], выпускающем цинк, наблюдалась превосходная коррозионная стой-
кость тантала при 500°. Это может быть обусловлено сохранением па .тантале
окисной пленки.
Интерметаллические соединения YSb, ErSb, LaSb и YBi при 1800—
2000° оказывают слабое действие на тантал, а пары сурьмы сильно действуют
при 1000° и более высоких температурах 165].
Коррозионная стойкость танталовых сплавов
Сплавы гантал — ниобий. Эти два коррозионностойких металла сплав-
ляются в любых соотношениях, образуя непрерывный ряд твердых раство-
ров. В связи с этим часто возникает вопрос, почему при переработке руд,
в которых эти родственные металлы встречаются вместе, их разделяют?
Почему их не восстанавливают совместно и пе используют образующийся
сплав для изготовления химического оборудования? Ответ состоит в том,
что присутствие даже небольшого количества ниобия, скажем 5%, резко
уменьшает коррозионную стойкость тантала. В этом направлении фирмой
Мюрскс (Англия) проведены исследования, в которых сплавы с различным
соотношением тантала и ниобия подвергали испытаниям в горячих и холод-
ных концентрированных соляной и серной кислотах. Скорость коррозии
значительно возрастала с повышением содержания ниобия в сплавах, и не-
смотря на то что сплав, содержащий 95% Та — 5% Nb, показал превосходное
сопротивление коррозии при всех испытаниях, коррозия втрое превышала
установленную для чистого тантала IG4, стр. 433—438].
Сплавы тантал — вольфрам. Некоторые данные о результатах коррози-
онных испытаний сплавов тантал — вольфрам в 50%-ном едком кали,
20%-ной плавиковой кислотен в смесях КОН с K.iFe(CN)e A : 3; концентра-
ция ие приводится) опубликованы в работе 149]. Для сплавов, содержащих
более 18%' вольфрама, скорость коррозии в 20%-ной плавиковой кислоте
оказалась равной нулю, что является их преимуществом перед танталом.
В других реагентах сплавы с вольфрамом почти не имеют преимуществ
перед танталом.
Другие сплавы. По имеющимся наблюдениям, в присутствии небольшого
количества железа или никеля, например в танталовом сварном шве, пос-
ледний подвергается почти такому же действию кислот, какого следовало
728 Г л а е а 28
ожидать для одного только железа или никеля. Помимо простого .хими-
ческою воздействия, в этом случае, несомненно, наблюдается гальваническое
действие. Относительно коррозионной стойкости других танталовых сплавов
известно очень мало, однако сомнительно, чтобы присадка к танталу метал-
лов, коррозионная стойкость которых в данной среде меньше, чем у тантала,
улучшила бы антикоррозионные свойства тантала.
Однако можно утверждать, что некоторые сплавы тантала имели бы
определенные экономические преимущества в специфических условиях
применения, требующих исключительно высокой коррозионной стойкости.
СПЛАВЫ
Тантал образует сплавы с многими другими элементами; подробные'све-
дения о них и библиографию можно найти в монографиях и справочниках
137, 62, 64, стр. 67—178]. Исследованы сплавы тантала со следующими
элементами:
Азот
Алюминий
Бериллий
Бор
Ванадий
Водород
Вольфрам
Галлий
Гафний
Германий
Железо
Иридий
Кислород
Кобальт
Кремний
Марганец
Молибден
Никель
Ниобий
Олово
Осмий
Палладий
Платина
Плутоний
Рений
Родий
Рутении
Сера
Титан
Торий
Углерод
Уран
Фосфор
Хром
Цирконий
Тантал, очевидно, не образует сплавов со щелочными и щелочноземель-
ными металлами, магнием, медью, серебром, свинцом, висмутом, кадмием,
ртутью, цинком, редкоземельными металлами и таллием.
Интерес к танталовым сплавам обусловлен главным образом расшире-
нием областей применения тантала и других тугоплавких металлов при
высоких температурах. Именное тугоплавкими металлами — ниобием, молиб-
деном, гафнием, титаном (р-фаза), вольфрамом, ванадием и цирконием —
тантал образует непрерывные ряды твердых растворов ниже линии
солндуса. Он образует сплавы и с другими металлами, имеющими высо-
кую температуру плаапения: с металлами платиновой группы, хромом
и рением.
Создание сплавов указанных выше тугоплавких металлов обусловлено,
помимо других факторов, такими свойствами, как высокая прочность, твер-
дость, пластичность при высоких температурах, благоприятное отношение
прочности к весу, и большей экономичностью сплавов. Что касается корро-
зионной стойкости в пределах температур, достигаемых при осуществлении
производственных химических процессов, то ни один танталовый сплав не
может конкурировать с чистым танталом по широте применения в различных
агрессивных средах. Однако устойчивость против действия отдельных реа-
гентов может быть улучшена. Огромный интерес в настоящее время пред-
ставляют жаропрочные сплавы с повышенной устойчивостью к окислению
в окислительной атмосфере. В этой области большое преимущество перед
танталом имеет ниобий с его вдвое меньшей плотностью по сравнению с плот-
Тантал ^ 729
ностью тантала, большей распространенностью в природе и (для
ядерных процессов) меньшим поперечным сечением захвата нейтронов. В
этом направлении проведены многочисленные исследования 164, стр.
510—5331.
Привлекает внимание работа I63J, показавшая, что окисление и окали-
иообразование в случае сплава ниобия, содержащего 20 ат."о тантала, при
выдерживании на воздухе в течение 16 час при 870 -1090 составляют около
1/s от наблюдавшихся для этого интервала температур в случае ниобия.
Эта работа показала также, что сплав, сохраняя ценные свойства ниобия
при комнатной температуре, имеет лучшие механические свойства при
высоких температурах. Значения длительной прочности, установленные
в результате 100-часовых испытаний при 1090°, равны для сплава 12 Кг/мм2
и для ниобия 9,2 кг/мм*, а значения предела выносливости составляют
3-10" циклов при 21 кг/мм2 для сплава и 2,6-10" циклов при 14 кг/мм21 для
ниобия. К сплавам на основе тантала, исследовавшимся в отношении их
стойкости против окисления при 1090е и показавшим скорость окалино-
образования п пределах от 1/10 до V7 по сравнению с нелегировапным тан-
талом, относятся следующие (ат.%): 30Ti, 30Fe, lOCr, ' 10Ni,-33Ti—18Со,
33Ti— 18Ni, 20Сг—12Ni и 20Сг—12Со.
Сплавы тантал — вольфрам
Одной из наиболее интересных систем, которая привлекает значительное
внимание, является система тантал — вольфрам. Сплавы этойсистемы всех
составов, содержащие вплоть до 30% вольфрама, были выплавлены в вакуум-
нон дутовой печи в слитки диаметром 75 мм и весом 41 кг. Полученные слит-
ки удалось распилить и подвергнуть механической обработке,, причем все
они поддавались ковке в интервале температур 1482—1927°. Их твердость
при высокой температуре повышается с увеличением содержания вольфрама.
Наибольший интерес, по мнению Торти 1921, представляет сплав с 10'о воль-
фрама. Этот сплав, полученный из порошка хорошего качества двойной
переплавкой в вакуумной дутовой печи, характеризуется высокой пластич-
ностью на холоду и прочностью при растяжении в нагретом'состоянии,
приближающейся к прочности вольфрама в интервале температур 1371 —
2482°, т. е. его прочность в несколько раз превосходит прочность тантала
и составляет около 2/3 прочности вольфрама. Слитки диаметром 89 мм были
обкованы под молотом на воздухе при 1093 в полосы, отожжены в вакууме
при 1600° и прокатаны на холоду в листы толщиной 0,25 мм.
Прочностные свойства при различных температурах сплава Та—10% W
дутовой плавки приведены в табл. 18, длительная прочность при температу-
рах выше 1650е — в табл. 19. Значения твердости при высоких температу-
рах этого сплава, а также сплавов с 20 и 30% вольфрама и неле! йрованного
тантала даны в табл. 20.
Результаты работы Майерса 169] по сплавам, полученным методами
порошковой металлургии, приводятся в табл. 21. В этой таблице приведены
предел прочности при растяжении и другие данные для различных богатых
танталом сплавов с вольфрамом при комнатной температуре.
Сведения об электрическом сопротивлении, твердости и модуле упругости
сплавов тантал вольфрам во всей области составов перечислены в табл. 22.
Сплавы, использованные для этих испытаний, были получены спеканием
порошков двух металлов 112, 48, 49]. Параметры решетки сплавов тантал —
вольфрам во всей области составов плавно увеличиваются от вольфрама
к танталу.
Таблица 18
ПРОЧНОСТНЫЕ СВОЙСТВА ЛИСТОВ СПЛЛВЛ ТАНТАЛ -10% ВОЛЬФРАМА ПРИ РАЗЛИЧНЫХ
TFMIlKPATypAX [92]
Материал: сплан вакуумной дуговой плаоки в виде листа толщиной-1,52 мм
Аналиа {%): 0.0010 С, 0,0045 О2,0,0015N2,0.0030 Fe, <0,0010 Сг, 0,0015 Ni, <0,0(J5 Мо
1. Методика испытаний: вес образцы нагревали в течение 10 сек до температуры, при
которой проводили испытание, выдерживали 30 сек в аргоне, затем испытыоали
при номинальной скорости деформации а 0,01 мм/мм-мин. Данные Южного иссле-
довательского института
Температура,
СС
Комнатная
81Ь
1371
1649
1927
2204
2482
27G0
Предел
прочности
при растяжении,
кг,'мм2
114,3
71,6
15,6
8,5
5,3
3,1
1,5
0,45
Предел текучести а
(при по,а), кг/мм*
112.8
68,8
13,9
8,3
5,1
3,0
1,5
0,45
Относительное
удлинение иа длине
25 мм. %
9,0
11,0
22,0
33,0
37,0
35,0
30,0»
20,0в
Модуль упругости ^
кг гмм2
14 480 '
14 900 -'
12020
13 01A
10 900
8 (Ш
3 515
1090
а Дсфсруацию измерили между местами зажима образца.
6 Низкие значения модуля обусловлены метдпм измерения деформации.
н Расплавился в точке разрыва.
2. Метод испытаний: кратковременные испытания на растяжение при скорости де-
формации 0.Ш1 мм/мм-сск до предела текучести и 0,01 мм/мм-сск до разрьта.
Образцы нагревали до температуры, при которой провопили испытание, за счет со-
противления и выдерживали 5 мин до приложения нагрузки. Испытания проводи-
лись в атмосфере чистого арюна
Температура,
22
9Н2
1204
1427
Предел прччно- л
сти при растя- Предел текучести
женин, кг jww2
126,6
66.1
47,1
И,8
(при оо,2), кг,мм
56,2
38,7
10,1
Относительное
удлинение иа длине
25 мм, %
4.0в
4,2
4,0
17,0
Модуль упругости
/*
18 630
13 360
9 980
7 730
а Дсфпрмацню измеряли между местаыи зажима образца.
б Низкие значения модуля обусловлены методом измерения деформации
в Удлинение иа длине 50 мм.
Таблица 19
ДЛИТЕЛЬНАЯ ПРОЧНОСТЬ СПЛАВА ТАНТАЛ— 10% ВОЛЬФРАМА [92]
Материал: холоднокатаные листы сплава толщиной 0,75 мм, изготовленные
нз слитков, выплавленных в вакуумной дуговой печи
Анализ (%): 0,0110 О2, 0,0015 С, 0,0025К2, 0,0050Fc, <0,0010Cr, 0,0050 Ni.
<0,0025Si. <U,0010Ti, <0,0023Мо
Испытания проводились d атмосфере аргона
Материал
Чистый тантал
Сплав тантал— 10%
вольфрама
Температура
испытуемого
образца, °С
1649
1G49
1092
1649
1649
1649
2371
2371
2371
Нагрузка,
кг мм%
2.fi
1,8
42,2
10,5
8,8
7,0
3,5
2,8
2,1
Время дп разрыва
мин
3
18
21
4
26
36
2
3
9
сек
6.
37
Деформирова-
ние прекраще-
но
35
15
14
13
• 50
14
Таблица 20
ТВЕРДОСТЬ ТАНТАЛА И СПЛАВА 1ЛНТ1Л— ВОЛЬФРАМ ПРИ ВЫСОКИХ
ТЕМПЕРАТУРIX [92]
Материалы: слитки дуговой плавки
Метод испытаний: вакуум; нагревание при заданной температуре в тече-
ние 10 мин
Температура,
Комнатная
200
400
600
700
800
900
1000
Твердость по Роквеллу
Та
47
44
41
37
33
25
10
—
Та-10 VV
58
57
Та-20 W
64,5
63,5
55.5 60,5
51 56
—
51,5
-
49
—
54,5
-
51
Та-30 W
70
68
64
61
58,5
—
57.5
СВОЙСТВ Л СПЛАВОВ ТАНТАЛ ВОЛЬФРАМ [CJ]
Таблица 21
Материал: проволока, изготовленная из металлсжерамических сплавов
Предварительная обработка: проволока диаметром 2,54 мм (после отжига при 2600°^
и 0,23 мм после обжатия на 99%
Содержание
вольфрама а
вес.%
5,2
10,4
26,4
ат.%
5,12
10,25
20,2
Степень tjti-
жатня по
сечению при
холодном
волочении,
%
6
20
80
90
99
б
20
80
90
99
б
Предел
ПРОЧНО-
СТИ при
растя-
жении.
41;5
60,5
78,7
87,9
126,5
58,4
«0,9
99,8
111,1
147,6
—
Относите ль-
иое удлнне-
иие, %
Твердпгть
42
12
5
—
24
10
4
3
—
150
220
270
280
210
290
340
350
335
Электро-
сопротив-
ление,
миом-см
Параметр
решетки.
А
15.G
17,4
3-,288
3,282
3,270
а Сплав, содержащий 1,18 ат.% вольфрама, очень мало отличается от иелегированного тан-
тала (см. табл. 8, часть VIII).
с Отожжен в течение 30 мин при 2600° (снижение твердости началось при 500 — 700° и по.
существу закончилось при 1и00°).
Таблица 22
СВОЙСТВА СПЛАВОВ ТАНТАЛ — ВОЛЬФРАМ а [12, -18]
Материал: металлокерампческне сплавы
Содержание
тантала,
ат.%
0
20
40
60
80
100
Электросопро-
тивление,
мком ¦ см
6,5
10,5
22,5
31
27
13,6
Твердость по
Виккерсу
375
525
560
525
405
120
Модуль упруго-
сти, хг/мл&
41340
32 690
29 530
29 530
27 420
19 120
а Нее значения получены интерполяцией кривых.
Тантал
733
Сплавы тантал — молибден
1Ма'1ибден, подобно вольфраму, образует с танталом непрерывный ряд
твердых растворов. Эти сплавы представляют интерес в связи с высокими
прочностью и температурой плавления молибдена. Температуры плавления
сплавов тантал — молибден лежат на плавной кривой, без максимума или
минимума, как показывают данные табл. 23 для материала дуговой выплав-
кн; в эту таблицу включены также параметры решетки [281.
ТЕМПЕРАТУРА ПЛАНЛЕНИЯ СПЛАВОВ ТАНТЛ. I
Материал: сплавы дуговой планки
Таблица 23
МОЛШЩЬН [2S1
Содержа-
ние тан-
тала.
О
11.2
25,2
44,1
Температура
планлення,
"С
2620
2630
27IIU
2760
Параметр
решетки,
А
3,1406
3,1541
3,1690
3,2007
Содержа- „
ние тан- Температура
тала I плавления,
S3,8
67,5
80
100
2810
2850
2880
3000
Параметр
peuiciH-ii,
¦А-
3,2150
3,2372
3,2627
3,2973
Работая с металлокерамическими сплавами, Манере [69] определил их
физические и механические своиства, представленные в табл. 24. Следует
отметить, что прочностные свойства сплава тантала с 5,2% молибдена ана-
логичны свойствам сплава с 5,2% вольфрама также изучавшегося Майерсом.
Таблица 24
СВОЙСТВА СПЛАВОВ ТАНТАЛ — МОЛИБДЕН [00]
Материал: проволока из металлокерамнческнх сплаиов
Предварительная обработка: прутки диаметром 6.35 мм попеременно ковали и спекали
при 2600" до пронолокн диаметром 2,5 мм, затем обжимали до 0,23 мм при степени
деформации 99%
Содержание
молибдена а
вес.%
вт.%
2,2
5,2
11,2
4,2
9,6
19,7
Степень
обжатия по
сечению при
холодном
волочении,
%
б
20
80
90
99
в
20
80
90
99
б
Предел
прочности
при рас-
тяжении,
кг/млР
39,4
56,2
73,8
84,4
12,1
56,2
71,3
91,4
103.4
130,1
Относи-
тельное
удлине-
ние, %
43
13
4
_
-
25
10
10
9
Твердость
по 13пк-
керсу
140
210
255
270
—
200
275
330 '
335
330
Электросо-
противление,
MKVM - СМ
16,8
_
—
20
-
—
—
—
Параметр
Л
3,288
—
3,278
—
—
3,260
а Сплав с 0,78 ат.% молибдена очень мало отличается от чистого тантала.
6 Отожжен в течение 30 мин при >00о°.
Глава 28
СПОСОБЫ ОБРАБОТКИ ТАНТАЛА
Путем обработки тантала давлением изготовляют пластины, листы,
фольгу, прутки, проволоку и бесшовные трубы небольшого диаметра.
Тантал обладает большой склонностью к наволакиванию, задиранию
и обрывам, до некоторой степени напоминая этим нержавеющую сталь, и это
необходимо иметь в виду при обработке давлением. Кроме того, тантал сле-
дует обрабатывать на холоду вследствие его высокой реакционной способ-
ности по отношению к обычным газам при нагревании; однако высокая пла-
стичность и небольшая скорость нагартовапия позволяют успешно осущест-
влять все виды холодной обработки.
Обычной практикой является обжатие на 60% и более с промежуточны-
ми отжигами в вакууме. Большие степени деформации'за проход применяют
.*»*" Ри с. 20. Прокатный стан, при-
менявшийся для изготовления
больших листов тантала («Хейнс
. стеллит компани»).
для начального обжатия штабиков и слитков при их прокатке, при дальней-
шей же прокатке обычно металл обжимают приблизительно на 10% по
толщине за проход. Листы прокатывают на стандартном оборудовании, на-
пример на двух- или четырехвалковом прокатном стане. Начетырехвалковом
стане можно прокатывать листы толщиной 0,05 мм. Для изготовления более
тонких листов можно применять также пакетную прокатку. Фольгу, приме-
няемую, например, в танталовых конденсаторах (толщиной менее 0,025 мм),
обычно прокатывают на прокатном стане Сендзимир. Прокатное оборудова-
ние, применяемое для изготовления танталовых листов, показано на рис. 20.
Размеры листа тантала определяются габаритами слитка, прокатного
стана и вакуумной печи для отжига.
Прутки и проволока
Прутки можно изготовлять холодной прокаткой и ковкой. Для воло-
чения проволоки применяют стандартное оборудование, но инструмент
и направляющие обычно изготовляются из алюминиевой бронзы, а воло-
ки — из твердого сплава для проволоки диаметром более 0,5 мм и алмазные
для проволоки меньших диаметров. Подходящей смазкой является воск,
а удержанию смазки на поверхности способствует покрытие тантала тонкой
окненой пленкой (получаемой анодным окислением). Майерс 1681 в качестве
смазки рекомендует горячий водный «раствор» 5% жидкого мыла и 5% жира.
Отожженная танталовая пронолока чрезвычайно пластична. Ее можно
сгибать на холоду на 180L с радиусом кривизны, практически равным нулю,
можно навивать на керн, диаметр которого равен диаметру проволоки. Сет-
ку и сита из проволоки можно плести обычными способами.
Тантал __^ 735
Фасонная обработка и штамповка
Из тантала можно на холоду штамповать изделия из листа, вырубать
на прессе, выдавливать на токарно-давильном станке. Его можно обрезать,
распиливать, отбортовывать, сгибать и подвер1ать глубокой вытяжке.
Рекомендуется применять пуансоны и инструмент из алюминиевом бронзы,
но если проскальзывание неслишком велико, можно применять и стальные
пуансоны. В случае необходимости применяют резиновую или воздушную
амортизацию пуансонов.
При штамповании изделии из листового тантала или вырубке на прессе
люфт должен составлять около 6% толщины металла. Для предотвращения
задирания пуансона используют масло или четыреххлористы-й углерод.
Однако поскольку четыреххлористый углерод токсичен, лучше Орименять
трихлорэтан. При выдавливании на станке рекомендуется применять инстру-
менты из алюминиевой бронзы, а в качестве смазки желтое мыло или жир.
Окружная скорость составляет 90 м'мин. Несколько мелких подач инстру-
мента предпочитают немногим крупным.
Отожженный лист можно поднергать глубокой вытяжке. Если эта опе-
рация выполняется за один прием, то глубина вытяжки может быть равна
диаметру, а если за большее число приемов, то глубина первой вытяжьи дол-
жна составлять приблизительно 40—50"о диаметра. Большая глуби
на вытяжки легче достигается для более толстого, а не для более тонкого
листа.
Необходимо применять матрицы из алюминиевой бронзы, но вытяжной
пуансон может быть стальным, если торможение не слишком велико. В каче-
стве смазки предложены сульфированный жир или парафин.
При изготовлении бесшовных труб вначале производят глубокую вытяж-
ку, получая при этом трубу небольшого диаметра. После обрезки глухого
конца трубу далее подвергают волочению через ряд волок все меньшего
размера с подвижно закрепленной оправкой, поддерживающей необходимый
внутренний диаметр. Размеры бесшовных труб ограничены габаритами
исходного диска металла, использованного при первоначальной вытяжке.
Вследствие этого трубы большей длины изготовляют продольной стыковой
дуговой сваркой толстого листа в цилиндр в атмосфере инертного газа.
Такой цилиндр подвергают затем волочению до нужных размеров. 11ри хоро-
шем качестве шва изготовляемая таким образом труба по качеству равноцен-
на бесшовной. Промежуточные отжиги производятся приблизительно через
каждые 60% обжатия.
Грубы, изготовленные из металла дуговой или электронно-лучевой
выплавки, лучше труб нз металлокерамического тантала, так как в послед-
нем случае пористость и плотность непостоянны, что при волочении приво-
дит к неравномерной толщине стенки трубы.
Обработка резаннем
Тантал можно обрабатывать резанием почти так же легко, как медь или
нержавеющую сталь, при условии применения высоких скоростей резания
пригодными для таких скоростей стальными резцами и большого количества
смазочно-охлаждающей жидкости. Для этой цели подходит четыреххлори-
стый углерод, но из-за его токсичности предпочитают пользоваться три-
хлорэтаном.
При обработке па токарном станке резцы должны быть остро заточены
и должны иметь возможно больший положительный передний угол. Обычно
756 Г лава 28
удовлетворительными оказываются такие же углы заточки резцов, какие
делают при обработке мягкой меди. Предложены скорости резания от 18,3
до 3,5 м/мин; крупную стружку прн малой скорости подачи получать лучше,
чем проводить обдирку и чистовую обработку.
При фрезеровании тантала, сверлении, нарезании наружной и внутрен-
ней резьбы выполняются одинаковые основные операции. Необходимо при-
менять фрезы с шахматным расположением зубьев с большими передним уг-
лом и углом зазора. Винты можно изготовлять путем накатки резьбы на
полностью отожженные прутки; резьбу больших диаметров предпочитают
нарезать на токарном станке, а не с помощью винторезных плашек. Сверле-
ние можно выполнять на стандартных быстрорежущих стальных, сверлах,
наконечники которых во избежание трения об обрабатываемую деталь дол-
жны иметь задний угол. Высверленные частицы необходимо часто удалять,"
а сверла - - затачивать.
Шлифовать тантал нецелесообразно отчасти из-за большой нагрузки на
шлифовальный круг и внедрения частиц абразива в поверхностный слой
металла. Полирование мелкозернистой наждачной бумагой или абразивным
полотном возможно, если их заливать четыреххлористым углеродом или
трихлорэтаном.
Отжиг
Тантал отжигают путем нагревания в течение 1 час прн 1300—1400°
в вакууме не более 1 ¦ 10 5 мм рт. ст.
Очистка поверхности
Инертность тантала по отношению к кислотам (за исключением плави-
ковой) позволяет очищать его погружением в горячую соляную кислоту,
царскую водку или смесь серной и хромовой кислот. После кислотной очистки
необходимо тщательно промывать дистиллированной водой. Для обезжири-
вания можно применять четыреххлористый углерод или трихлорэтан.
Сварка
Высокая температура плавления и высокая реакционная способность
тантала при повышенных температурах вызывают необходимость исполь-
зования для его сварки особой технологии. Лучшим способом получения
сварных швов удовлетворительного качества является дуговая сварка
в атмосфере инертного газа,— такая же, как применяемая для других туго-
плавких реакционноспособных металлов, например для титана и циркония.
Практически оборудование и технологию, используемые для этих металлов,
можно с очень небольшими изменениями применять и для сварки тантала.
Особый интерес представляет сварка тонких листов металла, из- кото-
рых изготовляется большая часть изделий. Листы толщиной 0,025—2 мм
можно с удовлетворительными результатами сваривать с помощью тантало-
вых электродов, расплавляя при этом основной металл в месте стыка для
получения шва. Более тонкие листы, толщиной менее приблизительно 0,5 мм,
загибают на расстоянии около 1,6 мм от края, образуют механическое зацеп-
ление, которое проплавляют для образования шва. Листы толщиной более
0,5 мм можно соединять в стык, проплавляя кромки двух механически сопря-
женных листов. В обоих случаях для получения хороших сварных швов
важна плотность затяжки механического сочленения. Чрезвычайно важна
Тантал 737
также тщательность очистки четыреххлористым углеродом соединяемых
поверхностей.
Обе стороны подвергаемого сварке металла должны быть защищены
атмосферой очищенных гелия или аргона. Это может быть достигнуто путем
использования продуваемой инертным газом камеры, окружающей сваривае-
мый участок, или сухого бокса, который можно откачать до глубокого ваку-
ума и затем заполнить инертным газом. Манипуляции с металлом и свароч-
ным электродом выполняют с помощью герметичных резиновых перчаток,
вмонтированных в стенку камеры.
Рис- 21. Внешний вид ка- I >-C f ' л
меры для сварки (с вольфра- _ л
човым электродом) деталей ¦ ggM
таиталооого оборудования в
атмосфере инертного газа <
(сПфаудлер компания) v • V
На рис. 21 показана такая камера (сухой бокс), применявшаяся для
изготовления из тантала химического оборудования, а на рис.. 22 изображе-
но ее внутреннее устройство (сфотографированное через открытую торцевую
Рис. 22. Внутренний вид камеры
для сварки в атмосфере инертного газа
(«Пфаудлер компани»).
Пои<|з<|на свяркп головки и боковой стенки
тпиталового вкладыша для реакторл ем-
костью 113 "
дверцу) с иллюстрацией подготовки к сварке танталового сосуда. В руках
у рабочего справа находится электродуговой сварочный пистолет. Конец
вольфрамового электрода обдувается инертным газом из этого пистолета.
Такой поток газа можно использовать и для охлаждения законченного
сварного шва.
Хотя в камерах обоих типов можно предусмотреть механическое пере-
мещение свариваемого металла или электрода, все же в большинстве случа-
ев все перемещения производят вручную.
47 Jjk ii № 2J9
738 Г л ив а 28
Правильные условия сварки зависят от многих факторов. Сотрудники
Института атомных исследований (Эймс, шгат Айова) разработали следую-
щие условия сварки с получением сварных швов такого же или лучшего
качества, чем получавшиеся до 1958 г. на материале заводского изготовле-
ния [15, 24, 25, 72J. Они применяли источник постоянного тока при напря-
жении ПО в и набор различных сопротивлений для регулирования тока
и стабилизации дуги. Для расплавления при сварке листов металла общей
толщиной 0,075 мм применялся гок 5 а, для 0,152 мм — 8 а, для 0,228 мм —
10 а, для 0,381 мм—14 а и для 1,52 мм—50—60 а. Эти данные относятся
к атмосфере гелия. Стыковую сварку металла толщиной 0,5 мм в аргоне
производили при силе тока 70—75 а, пользуясь 40-вольтной незамкнутом
цепью с понижением до 20 в в замкнутом контуре постоянного тока прямой
полярности. Для зажигания дуги с помощью ножного переключателя вклю-
чался ток между вольфрамовым электродом и танталом, находившимися
в контакте, н электрод отодвигался от тантала на несколько миллиметров.
Одним проходом вдоль стыкового соединения металл проплавляли, вторым
быстрым проходом удаляли пузырьки газа из сварного шва. После выключе-
ния дуги сварочную горелку быстро перемещали поперек сваривавшихся
поверхностей для охлаждения шва. Тантал имеет высокое поверхностное
натяжение, в связи с чем, во избежание образования блуждающего разряда,
вольфрамовым электрод должен иметь острый конец. Для сварки получали
выпрямленный с помощью селенового выпрямителя ток с 300-амперного
сварочного генератора. Свариваемые детали были отрицательным полюсом
(заземлены), а сварочная горелка — положительным.
В большинстве случаев тантал сваривают без наплавочного
прутка, однако можно использовать танталовую проволоку или пруток
в качестве наплавочного материала или расходуемого электрода либо
подпитки со стороны в дугу, зажигаемую с помощью вольфрамового
электрода.
При сварке дуговым методом металлокерамического тантала часто
появляется пористость в сварном шве или вблизи него, тогда как в случае
тантала дуговой выплавки этого не наблюдается [39].
Сварной шов и непосредственно примыкающая к нему часть металла
в процессе снарки рекристаллизуются. В других отношениях швы, сделан-
ные должным образом с применением защитной атмосферы и в отсутствие
загрязняющих материалов, неимеют изъянов. Если остальная часть изделия
нагартовывается в процессе предыдущих операций его изготовления, то она
будет иметь более высокую прочность при растяжении, чем рекристалл1ио-
ваиная часть. Отжигом, следующим за сваркой, танталовое изделие можно
целиком перевести в рекристаллизованное состояние.
Контактную сварку можно выполнять под водой, получая при этом по
существу непрерывный точечнын шов между двумя плотно прижатыми плос-
кими поверхностями. Эти поверхности прижимаются друг к другу с помо-
щью фасонных зажимов, между которыми при их контакте через тантал
проходит ток; тантал в месте касания поверхностей (т. е. в месте наиболь-
шего электрического сопротивления) разогревается и сваривается. Кроме
того, этим способом можно выполнять сварку труб внахлестку, однако при-
сутствие напуска удвоенной толщины по длине трубы ограничивает приме-
нение таких труб в химическом машиностроении.
Долгое время при изготовлении химического оборудования применя-
лась угольно-дуговая сварка, при которой свариваемое место погружается
в четыреххлористый углерод. Углерод, проникая в шов металла или на при-
легающие поверхности, сообщает им хрупкость, делая шов недоброкачест-
Тантал 739
венным [39]. Этим объясняются многие неудачи в случае применения танта-
лового оборудования в промышленности. Дуговая сварка с танталовым
электродом в инертной атмосфере не имеет такого недостатка, и сварные
швы получаются гораздо более качественными, чем при угольно-дуговой
сварке под слоем четыреххлористого углерода.
Электронно-лучевая сварка, которая выполняется в глубоком вакууме
путем фокусирования пучка электронов, летящих с высокой скоростью, на
свариваемом месте, дает применительно к танталу превосходные результаты.
Применение электронно-лучевой сварки в будущем, когда необходимое
для сварки оборудование станет более доступным, несомненно увели-
чится.
Ультразвуковая сварка эффективна в случае тонких листов тантала.
Поскольку в этом процессе металл не находится в расплавленном состояний,
устраняются его загрязнение и рекристаллизация.
Помимо сварки танталовых изделий между собой, тантал можно свари-
вать с дру |ими металлами, с которыми он образует сплавы: железом, сталью,
никелем, цирконием, титаном, ниобием, молибденом, вольфрамом и т. д.
ОБЛАСТИ ПРИМЕНЕНИЯ
Применение тантала основывается на его тугоплавкости, высокой проч-
ности и пластичности, низком давлении пара, инертности по отношению
к химическому воздействию при температурах ниже приблизительно 150%
геттерных свойствах при повышенных температурах, а также выпрямляю-
щих и диэлектрических свойствах поверхностной окисной пленки.
Конденсаторы
В настоящее время наибольшее применение тантал находит в электро-
литических конденсаторах. Танталовые электролитические конденсаторы
имеют четыре компонента: танталовый анод, диэлектрическую поверхност-
ную пленку пятиокисн тантала, электролит, играющий роль катода, и кон-
тейнер или покрытие, контактирующие с электролитом и химически с ним
не взаимодействующие. Танталовый анод может быть изготовлен из фольги,
проволоки или порошка, спеченного для придания ему прочности, но без
значительного уменьшения пористости. Аноды из спеченного порошка име-
ют наибольшую площадь поверхности на единицу объема A000—2000rjMs/cw:l)
и, следовательно, наиболее высокую удельную емкость. Диэлектрическая
окисная пленка образуется при анодном окислении поверхности тан талового
анода; она является «сердцем» конденсатора [89]. Электролит может быть
жидким (растворы серной илн фосфорной кислоты) или твердим (полупро-
нодники, например высшие окислы марганца, свинца или никеля) 160, 61,
89, 98].
Из всех конденсаторов наибольшую емкость на единицу объема имеют
твердые танталовые электролитические конденсаторы. Их малый размер
делает их весьма привлекательными для использования в транзисторных
схемах и других низковольтных схемах, требующих предельной миниатюр-
ности [89]. Эти конденсаторы действуют в интервале температур от —80
до + ISO" и имеют очень низкий ток утечки. Пористые танталовые конденса-
торы с жидким электролитом изготовляют с пределами действия от —60 до
+200° 164, стр. 45 59]. Конденсаторы всех типов имеют стабильный срок
годности при хранении н продолжительный срок службы.
471
740 Г_я ава 28
Химическое оборудование
Изготовление коррозионностойкого химического оборудования являет-
ся, по-видимому, второй по масштабу областью применения тантала. Помимо
прочности и по существу полной инертности к воздействию сильно агрес-
сивных нещелочных сред при обычных температурах (за исключением
F2, HF и свободного SO3), тантал характеризуется чрезвычайно высокими
коэффициентами теплопередачи. Последнее обстоятельство позволяет при-
менять конструкции с тонкими стенками для химического оборудования
в случае отсутствия коррозии и пленок продуктов коррозии на поверхно-
сти, пузырькового типа парообразования па поверхности при нагревании
большинства жидкостей и образования каплеобразного конденсата на паро-
вом или конденсирующей стороне теплообменника. Из всех металлов тантал
больше других напоминает по коррозионной стойкости стекло, и его часто
используют вхимическом машиностроении в сочетании со стеклом, футеро-
ванной стеклом сталью и другими неметаллическими материалами.
Типовыми элементами танталового оборудования, длительное время
применяемыми в химической промышленности, являются теплообменники,
штыковые подогреватели, конденсаторы, LJ-образные' трубки, спиральные
змеевики, гильзы для термометров, трубопроводы, диафрагмы и другие
элементы оборудования.
Тантал часто используют для устранения дефектов и повреждений обли-
цованного стеклом оборудования.
Тантал широко применяется для изготовления концентраторов серной
кислоты, нагревателей и холодильников гальванических ванн для хромиро-
вания, концентраторов для перекиси водорода, оборудования для производ-
ства и перегонки соляной кислоты, натревания и перегонки брома, нагрева
ния и концентрирования азотной кислоты, а также в производстве тонких
химических и фармацевтических препаратов [35, 36, 87|. Благодаря своей
инертности тантал не загрязняет продукты, соприкасающиеся с ним.
После того как в последнее время стали выпускать листы больших раз-
меров (примерно 750 X 1800 мм2 при толщине 0,75 мм) из металла дуговой
выплавки с использованием усовершенствованной технологии дуговой свар-
ки в инертной атмосфере, разработанной применительно к тонколистовому
металлу @,30- -0,38 мм), оказалось возможным облицовывать танталом реак-
торы, сосуды и колонки. Те же самые факторы привели также к улучшению
конструкции и прочности танталовых штыковых подогревателей, тепло-
обменников, U-образных трубок, конденсаторов и т. д., при изготовлении
которых перестали применять сварку труб внахлестку и угольно-дуговую
сварку. При больших размерах листов сократилось число сварных швов на
данной площади поверхности. В настоящее время танталом футеруют реак-
торы емкостью в несколько сотен и более литров.
Тантал применяется при конструировании оборудования для получе-
ния и обработки при повышенных температурах расплавленных металлов,
например редкоземельных металлов, и сплавов, содержащих делящиеся
материалы. В этих случаях применения тантал необходимо предохранять
от действия воздуха [23 25].
Электроника
Тантал применяется для изготовления многих деталей вакуумных
электронных ламп. Из тантала легко можно изготовить и сварить необходи-
мые образцы. Он может быть тщательно очищен в концентрированных горя-
Тантал . 741
чих кислотах. Тантал тугоплавкий, жаропрочный металл, который имеет
низкое давление пара и действует как хороший геттер. Кроме того, тантало-
вые детали, например аноды и сетки, могут быть обезгажены при темпера-
туре выше 2000° в процессе изготовления ламп.
Сплав 92,59о тантала и 7,5% вольфрама применяют в некоторых ваку-
умных электронных лампах в качестве подвесок нитей накала, сохраняю-
щих упругость при повышенных температурах. В вакуумных лампах исполь-
зуются также сплавы тантала с никелем, содержащие до j3<~)°o тантала.
Выпрямители
Диэлектрическая окисная пленка на тантале делает его пригодным
для использования в качестве выпрямителя. Это один из самых ранних при-
меров применения металла. До сих пор танталовые выпрямители многих
типов изготовляют для зарядки аккумуляторных батарей, в сигнальных при-
способлениях и т. д., где переменный ток преобразуется в постоянный.
Хирургии
Полная устойчивость тантала к действию жидкостей человеческого орга-
низма и отсутствие раздражения ткани тела при контакте с ним обусловили
его широкое применение в восстановительной хирургии. В вице пластинок
и листов металл используют для скрепления костей (особенно черепных),
в виде проволоки — для наложения швов, в виде фольги и проволоки —
для сшивания нервов, в виде пластин, листов и сетки — для возмещения
мышц брюшной полости. Современным достижением является покрытие поро-
шком тантала мест удаления опухоли мозга. В этом случае он играет роль
фокусирующего материала при последующих исследованиях и обработке,
и по изменению его пространственного расположения со временем можно
следить за тем, остановлен ли рост опухоли или она продолжает расти.
Ядерно-энергетические системы
Несмотря на то что поперечное сечение захвата тепловых нейтронов
у тантала слишком велико, чтобы его можно было использовать для внутрен-
них частей (или вблизи них) ядерных реакторов большинства типов, он
может быть использован в реакторах на быстрых нейтронах. Наибольший
интерес, однако, представляет применение тантала в теплообменниках
с жидкими металлами, например натрием или сплавами натрий — калий,
при высоких температурах и в контейнерах для таких жидкометаллических
систем, как сплав висмут — уран [24, 25].
Другие области применения
Тантал применяется для изютовления деталей высокотемпературных
печей, работающих под вакуумом или в атмосфере инертного газа. Пяти-
окись тантала является компонентом некоторых сортов оптических стекол
с высокой преломляющей способностью. Карбид тантала добавляется к кар-
биду вольфрама, из которого изготовляют режущие инструменты многих
типов. Благодаря присутствию карбида тантала такие режущие инструменты
обладают высоким сопротивлением удару и очень низким коэффициентом
трения.
742 Г\я_ао а_28^
ЛИТЕРАТУРА
1. A I b г е с h t W. М., К. 1 о р р W. D., К. о е h 1 В G., J a f f e e R I., Reac-
tion of Риге Tantalum with Air, Nitrogen, and Oxygen, Paper Presented at АШЕ
Mceling, Chicago, November 2, 1959 (будет опубликовано в Met. Soc, АШЕ).
2. A 1 I e n N. P., Carrington W. E., J. Appl. Phys., 82, 525 A952- 1954).
3. American Institute of Physics, Temperature, Its Measurement and Control in Scien-
ce and Industry, Reinhold Publishing Corporation, New York, 1941, p. 1309."
4. Andrews M. R., J. Am. Chem. Soc., 54, 1845—1854 A932).
5. Badger F. S., частное сообщение, 1959; Ind. Eng. Chem., 50, 1608—1611
A958); Union Carbide Metals Review, 18 -21 (Winter/1960).
6. Backish R.. J. Electrucliem. Sue. 105, 574—577 A958).
7. В a I k e С W., пат. США 1754453, 1929.
8. В а 1 ke С. W-, Trans. Electrochem. Soc, 85, 89—95 A944).
9. В е с h t о 1 d J. H.. Acta Met., 3, C), 249 A955).
10. Borne mann A., G e 1 а Т., Studies in the Behavior of Certain Non-ferrous
Metals at Low Temperatures, PB-111657, U. S. Dept. Commerce (OTS), Washington,
1953.
11. В г I d g m a n P. W-, Proc Am. Acad. Arts Sci., 77, 187 A949).
12. В r a u n H., К i e f f e r R., S e d 1 a t s с h e k K., Third Plansee Seminar
Proceedings 1958, p. 264 276, Pergamon Press, Inc., New York. 1Э59.
13 С a n d i d u s E.S., Simons J. C, Jr., An Electron Bombardment Furnace for
the Production of Vacuum Melted Metals, Paper Presented at Fifth National Sympo-
sium, American Vacuum Society, San Francisco, October 22—24, 1958.
14. С h i 1 t о n С H., Chem. Eng., 65, .№ 22, 1A4—107 A958).
15. D a a ne A. H., Rev. Sci. lnstr., 23, 245 A952).
16. D r i g g s F. H., пат. США 1815054, 1931.
17. D r i g g s F. II., L i 1 1 i e n d a h 1 W. C, Ind. Eng. Chem., 23, 634 A931).
18. E d w a r d s J. W., Speiser R., Johnslon H. L., J. Appl. Phys., 22,
424 A951).
19 Edwards J. W., Johnston H. L, Blackburn P. E.. J. Am. Cliem.
Soc, 74, 172 A951).
20. E s p e W , К n о I I M-, Werkstoffkunde dcr Hochvakuumtechnik, J. Springer,
Berlin, 1956.
21. H'arber M., Darnell A. J., E h r e n b e r g D. M, J. Electrochem. Soc ,
102. 44C—453 A955).
22. F i e 1 d h о u s e 1. В., H e ri g e J. C, W a t e г m а п Т. Е.. WADC Tech.
Report 55—495, 195G.
23. F i s h e r R. W., Full hart С. В., U. S. Atomic Energy Commission, Rept.
ISC-1039, 1958
24. Fisher R. W., Full hart СВ., Feasibility Studies on Molten Metal Reactor
Components, 2nd United Nations International Conference on the Peaceful Lses
of Atomic Energy, UN 1032, Geneva, 1958.J
25. Fisher R. W., Winders G. R., Chem. Eng. Progress Symp. Series, B0),
53 A957).
26. F о о s R. A., W i 1 h e 1 m H. A., U. S. Atomic Energy Commission, Rept. ISC-644.
1954.
27. F r i e d r i с li H. J., Thesis, Technischen Hochschule, Hanover, 1955.
28. G e а с h G. A., S u m m e r s-S m i t Ь D., J. lnst. Metals, 80, 143 A951 — 1952).
29. G e b h a r d t E.. P r e i s e n d a n z H., Z. Metallkundc, 46, 560 A955).
30. G e b h a r d t E., S e g h e z z i H. D., Z. Metallkunde, 48, 430—435 A957)
31. G e b h a r d t E, S e g h e z z i H. D, Z. Metallkunde, 50, 218—257, 521—527
A959)
Тантал ИЗ
32. Gegner P. J., Columbia-Southern Chemical Corp., частное сообщение, 1959.
33. G I a s i e r L. F., Jr., Allen R. D., S a 1 d i n g e r I. L., .Mechanical and
Physical Properties of the Refractory Metals, Tungsten, Tantalum and Molybdenum,
above 4000°F, Report № M1826, Aerojet-General Corp., Azusa, California, April
1959.
34. G о 1 d s m i t h A., W a t с г ш а п T. E., H i r s с h о l n H. J., WADC Tech.
Report 58-476, 1960.
35. H a m p e 1 С A., lnri. Eng. Chcm., 48, 1979—1981 A956).
36. H a m p e 1 С Л., Corrosion, 14, 557t—560t A958)
37. H a n s e n M-, Constitution of Binary Allojs, 2nd ed.r McGraw-Hill Book Company,
New York, 1958.
38. Harrison A. D. R., Thesis, London University, 1950.
39. H a s 1 i p L.H.,Payne B. S., Welding J. (N. Y), 38, 1 — 10 (December 1959).
40. H a t с h e t t С Phil. Trans. Hoy. Soc. London, Ser. A, 92, 49—66 A802).
41 H i d n e r t P., J. Res. Nat. Bur Stand., 2, 887 A929).
42. H i g b i e I\. B, W e r n i n g J. R.. Bureau of Mines Repl. of Invest. 5239, 1956.
43. Hodge W, Evans R. M., ,11 os к ins A F., J. Metals, 7, 824 A955).
44. H о I d e n F. C, Schwartzberg F. R., J a f f с e R. I., High Temperature
Mechanical Properties of Tantalum, Paper Presented at ASTM Meeting, San Francisco,
October 1959; Symposium on Newer Metals, ASTM Spec. Tech. Publ. № 272, 1960.
45. Humphrey G. L., J. Am. Chem. Soc., 70, 978 A954).
46. Kaplan N.. A n d r u s R. J., Ind. Eng. Chem., 40. 1946 A948).
17 К i e f f e г R., Benesovsky F., Planseeber. Pulvennetall., 5, 56 A957).
48. К i e f f e r R-, Sedlatschek K-, Brain H-, J. I ess Common Metals,
1, 19—33 A959).
49. К i e f f e r R., S e ri 1 a t ь с h e к К, В r a u п Н., Z. Metallkunde, 50, 18—24
A959).
50. К 1 о p p W. D., M а у к u t li D. J., О g d e n H R., J a f f e e R. I., Puri-
fication Reactions of Tantalum During Vacuum Sintering, Paper Presented at A1ME
Meeting, Chicago, November 2, 1959.
51. К 1 op p W. D., Sc h w a r 1 z b erg F. R., H о 1 d e n F. C, S i m s С. Т.,
О g d e n H. R., J a f f e e R. [., WADC Tech. Report 58-525, 1958.
52. Кос S.,Czechoslov.J. Phys., 4, 250A954)
53. Koerner E. L., Jr., Smiitz M., W i I li e 1 m H. A., Chem. Eng. Progr.,
54, № 9, 63—70 A958).
St. Koster W., Z. Metallkunde, 39, 1—9 A948).
55. Koster W., Appl. Sci. Res., Л4, 329 A954).
56. К r i e s s m a n C. J., Jr.. Rev. Mod. Phys., 25, 122—126 A95.1).
57. Л а п и ц к и й Л. В., С и и а н о в Ю. П., Артамонова Е. П., ЖИХ,
2, 80 A957).
58 М а 1 t e r L., L а п g in u i r D. В., Phys. Rev., 55, 743 A939)
59 M a r i g n а с J. С, Ann. chim. phys., S, 5 A866); 9, 249 A866).
60. Martin G. L., F i n с h a m С J. В., С h a d s e у E. F.., Jr., J. Electrocliem.
Soc, 107, 332—337 A960).
61. M с L e a n D. A., Power F. S., Proc. I. R. E., 44, 872 A956).
62. Metals Handbook. American Society for Metals, Cleveland, 1948.
63. M i с h a e 1 А В., Oxidation of Columbium-Base and Tantalum-Base Allovs,
Paper Presented at Regional AIMF Conference on Reactive Metals, Buffalo, 1958.
64. Miller G. L., Tantalum and Niobium, Academic Press, Inc., New York, 1959.
65. M i 1 1 с r J. F., R e i d F. J., H i m e s R. C, J. Electrochem. Soc, 106, 1043—
1046 A959).
66. M о rg a n F. H., D a n f or t li W. E., J. Appl. Phvs., 21, 112 A950).
C7. Myers R 11., Proc. Aust. lnst. Min. Eng.. 144. 297 A946).
744 Г л ае а 28
68. MyersR. Н., Metallnrgia, 42, 3 (Jure I950).
69. Л1 у е г s R. H., Metallurgy, 39, 7- 10 A948).
70. National Research Corp., Chem. Week, 83, № 3, 97—102 A958).
71. O'D r i s с о 1 1 W. G., T у z а с к С, R a 1 п е Т.. The Oxidation on Groups 1VA,
VA, and VIA Elemeiils in Carbon Dioxide and the Development of Oxidation Re-
sistant Zirconium Alloys, 2nd United National International Conference on the
Reaceful Lses of Atomic Energy, Geneva, 1958.
72. P e t e r s о и D., F i s h e r R. W-, D e n n i s о п D. H., D a a n e A. H..
частные сгобщения, 1958.
73. P I а с е к С, Т а у 1 о г D. F., Ind. Eng. Chem., 48, 686—695 A956).
74. P r e s t о n J. В., R о е W- P-, К a t t u s J. R., WADC Tech. Report•'57-649.
Part 1, 1958.
75. Hugh J. W., Trans. Am. Soc. Metals, 48. 677—688 A956).
76. P ug h J. W., II i b b a rd W. R-, Jr., Trans. Am. Soc. Metals. 48, 526'A956).
77. R as or N. S., McClelland J. D., WADC Tech. Report 56-400, .1957.
78. Richardson D., Speclroscopy in Science and Industry, Proceedings of the
Fiflh Summer Conference on Spectrosct>py and Its Applications, John Wiley and
Sons. Inc., New York, 1938, p. 64—70.
79. Rose H., Pogg. Ann. Physik. Chem., 63, 317—341 A844).
80. Rosenberg H. M., Phil. Trans., A247, 441 A954 — 1955).
81. Sugliezz i H. D., New Investigations into the Tantalum-Nitrogen System, 3rd
Plansee Seminar, Reutte, Austria, 1958.
82. S e r a p h i m D. P., В u d n i с к .1. 1., 1 t t n e r W. В., Ill, Trans. Melallurgv
Soc. of А1МГ, 218, 527—533 A960).
83. Shelton H., Phys. Rev., 107, № 6, 1553—1557 A957).
84. Smith J. L., Am. J. Sci., [3], 13, № 77 (May 1877).
85. S m i t h e 1 1 s C. J., Metals Reference Book, Vol. II, Butterworths Scientific
Publication, London, 1955.
86. S t u 1 1 D. R, S i п к e G. C, Thcnnodynamic Properties of the Metals, Ameri
can Chemical Society, Washington, 1956.
87- T а у 1 о r D. F , Tantalum: Its Resistance lo Corrosion, Paper Presented before
F.Iectrocheraical Society, Chicago Section, May 4. 1956; см. также [36].
88. T а у 1 о r D. F., Chem. Eng. Progr., 54, № 4, 47—50 A958).
89. T а у 1 о r R L., На ring II. Е., J. Electrochem. Soc, 103, 611—613 A956).
90. Т i п g 1 е у I. I., Department ol Mines and Technical Surveys, Mines Branch,
Oltavva, Canada, частное сообщение, 1959.
91. T i t t e r i u g l о n R., Simpson A. G., Iron and Sleel Inst. Spec. Ri-p.
K». 58, 1954.
92. Г о r t i M. L., частное сообщение, 1958.
93. T or t i M. L., J. Electrochcm. Soc, 107, 33- 35 (I960).
94. Ц е й т л и н X. Л.. Журн. прикл. химии, 29, 128Г A956).
95. W e r n i n g J. R., H i g b i e К. В., Ind. Eng. Chem., 46, 2491—2494 A954).
96. W e г n i n g J. R., H i g b i e К- В., Grace J.T.,Speecc B.F.,Cil-
b e r t H. L., Ind. Eng. Chem., 46, 644—652 A954).
97. W h i t e h e a d M., Bell Labs. Record, 28, 448 A950).
98. W i 1 h e 1 in H. А., К. е г r i g a n J. V., U. S. Atomic Energy Commission,
Rept. ISC-220, 1952.
99. W i n s с h I. O., Burris L., Jr.. Chcni- Eng. Progr., 53, E), 237—242 A957).
100. Y i h S., Wah Chang Corp., частное сообщение, 195R; Carlson С. W., N i e 1-
s о п R. H., J. Metals. 12, № 6, 472—475 A9C0).
29.
ТЕЛЛУР
Дж. Р. СТОУН, П. Э. КАРОН
J. R. Sionc, P. E. Caron, American Smelting
and Refining Company, New York, h. Y.
ВВЕДЕНИЕ
Интерес к металлоиду теллуру возрос во много раз со времени появле-
ния первого издания «Справочника по редким металлам». Теллур высоком
чистоты в качестве полупроводника является важным элементом в быстро
развивающемся теперь конструировании термоэлектрических приборов.
Теллур был открыт Мюллером фон Рихенштейном в 1782 г. Название ему
дал Клапрот от латинского слова tellus (земля) в 1798 г. По современным
сведениям распространенность теллура вдвое меньше распространенности
золота, с которым он часто встречается в природе. Таким образом, теллур
является семьдесят пятым элементом по распространенности в земной коре;
его кларк равен 2-Ю вес. %.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Теллур редко встречается в самородном состоянии, в природе обычно
он находится в виде теллуридов, особенно в виде теллурида золота.
Этими теллуридами золота являются [20, 27]:
Калаверит АнТе2
Сильванит (Аи, Ag)Te2*
Креннсрит AuTe2**
Петцит Ag3AnTe2***
Нагиагит Au2Pb|0Sb2TeGS;
также дается как Pbs(AuSbMS5(flo 8)****.
Висмутсодержащим минералом является тетрадимит
[Bi2Te2S, или BiTcS, или Bi2(Te,SK].
Теллуриды золота и серебра обнаружены в Трансильвании, Венгрии,
Мексике, Новой Зеландии, Западной Австралии и США (в штатах Колорадо,
Калифорния, Северная Каролина и Виргиния). Маленький город в графстве
Сан-Мигель (штат Колорадо) назван Теллурид. Минерал калаверит был
назван в честь графства Калаверас (центральная Калифорния).
Хотя наибольшее промышленное значение из золотых руд имеют суль-
фиды золота, меди, мышьяка и сурьмы, теллуриды золота имеют почти такое
же значение.
Приведенные выше факты указывают на сильное сродство теллура с
золотом, серебром и медью и объясняют, почему теллур является побочным
* Или AuAgTe4.— Прим. ред.
* Точнее (Аи, Ag)Te2.— Прим. ред.
* Также (Ag, Аи),Те.— Прим. ред.
* Или Au(Pb.Sb.Ke)b(S,TeI,.—Прим. ред.
746 Г л ива 29
продуктом металлургии меди. Сродство теллура с золотом настолько велико,
что анализ на содержание металла в руде методом плавки в применении
к золотым рудам должен быть совершенно изменен в случае присутствия
теллура в количестве большем, чем следы [41.
В Северной Америке основная масса теллура получается на мёдпо-
и свинцовоочистительиых заводах следующих компании: «Амерпкэн метал
клан макс», «Америкэн смелтинг энд рифайнинг компани», «Анаконда ком-
папи», «Канадиен коппер рифайнериз», «Интернепшнл никель компани»,
«Юнайтед стептс смелтинг, рифапнинг эид мамнинг компани».
ПОЛУЧЕНИЕ ТЕЛЛУРА
Теллур выделяют из анодных шламов при электролитическом рафини-
ровании загрязненной меди, часто называемой черновой медью. Поскольку
теллур не растворяется существенно в электролите, то он сопровождает дру-
гие нерастворимые материалы, включая золото, серебро и платиновые метал-
лы, которые падают с растворяющегося анода на дно ванны. Следующей
в процессе шлакования является операция, при которой золото, серебро
и платина концентрируются в сплаве, называемом сплавом дорё, а теллур
и селен собираются в шлаках в виде натриевых соединений.
При удалении шлаков из печи для получения сплава дорё, при охлажде-
нии и растворении в воде очень небольшое количество теллура или селена
остается в нерастворимом остатке. Сильнощелочной раствор тщательно
нейтрализуют кислотой (обычно серной) для осаждения теллура. Следует
совершенно избегать локальных избытков кислоты, чтобы не произошло
нежелательного осаждения селена.
Осадок двуокиси теллура собирают в фильтрпрессе. В некоторых слу-
чаях хорошо промытая и высушенная лепешка фильтрпресса может прямо
направляться в продажу. Если в таких лепешках содержатся нежелательные
или в избыточных количествах примеси, то лепешки растворяют, раствор
в случае необходимости очищают и двуокись теллура опять тщательно оса-
ждают, фильтруют, промывают и высушивают.
Восстановление двуокиси теллура до металла осуществляется при нагре-
вании с тонким порошком графита.
Электролитический процесс переработки загрязненной двуокиси теллу-
ра на металл хорошего качества описан в пат. США 2258953 (октябрь
1941 г.). Электролитом является водный раствор теллура в едком натре;
теллур выделяется на катоде, с которого его можно сдирать для последую-
щей плавки и литья.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В настоящее время теллур в США и Канаде производят шесть компаний.
В прошлом производство теллура превышало его продажу, что привело
к созданию резервного запаса на I января 1960 г. приблизительно 360 т
теллура в виде сырья и 45 т в виде очищенного материала.
Ежегодная продажа теллура в США, по сообщению Горного бюро
в период 1954—1958 гг. составляла 45—77 т. По оценке Горного бюро,
в 1959 г. продано около 160 т.
В течение последних двух лет спрос на теллур существенно возрос,
и поэтому можно предполагать, что поставщики смогут сбывать всю выпус-
каемую продукцию в виде очищенного элементарного теллура. При улуч-
Теллур
747
шении методов извлечения предполагается, что получение теллура в метал-
лургии свинца и меди может быть увеличено до максимума 230—340 пигод.
Однако прогнозы на потребление в течение следушщнх нескольких лет ука-
зывают, что теллура, получаемого в качестве побочного продукта.заводов но
очистке меди и свинца, может оказаться недостаточно для удовлетворения
требований промышленности.
В течение многих лет теллур промышленной чистоты минимум 99,5"о
d порошке или слитках расценивался в каталогах по 3,30—3,64 долл. за I кг.
Цены возросли в мае и июле 1959 г., ив январе и августе 1Р6Ог.цена состав-
ляла 8,8 долл. за 1 кг..
Для увеличения достаточной заинтересованности производящих фирм
в росте извлечения теллура безусловно необходимо побысчгть на него цепы.
Одна из американских производящих фирм «Америкэн смелтинг энд рнфап-
нинг компания продает теллур чистоты 99,99 и 99,999"п в полнкрнсталли-
ческой форме.
ФИЗИЧЕСКИЕ СВОЙСТВА 15, 8, 12, 17]
Теллур (порядковый номер 52) входит в VI группу периодической табли-
цы. Теллур является более металлическим, чем сера и селен.
Атомный вес теллура в 1916 г. считали равным 127,5, в 1925 г. также
принимали эту же величину; однако в 1956 г. значение атомного веса было
исправлено на 127,61.
По данным 1953г., насчитывалось 20 изотопов теллура. Содержание изото-
пов теллура-128 и теллура-130 в количестве 31,75°о и 34,27% соответственно
оказывается достаточным дли того, чтобы поместить более тяжелый теллур
с атомным номером 52 перед иодом с порядковым номером b'i, несмотря на
более низкий атомный вес иода 126,9044 [14].
Поскольку теллур при обычных температурах считается двухатомным,
то его молекулярный вес равен 255,20.
Теллур может быть получен в твердом, жидком и газообразном состоянии
при температурах, легко достигаемых в большинстве металлургических
лабораторий.
Таблица 1
СВОЙСТВА ЭЛЕМЕНТОВ I РУППЫ КИСЛОРОД ТЕЛЛУР [2, R, 12J
Свойства
Атомный аес A962)
Плотность (тв.), г/см3
Температура измере-
ния плотности, °С
Цвет
Температура плавле-
ния, °С
Температ\ра кипения,
"С
Кислород
15,0994
•1,426
—252,5
Синий
—218,4
— 182,96
Сера
32,064
Моноклинная мо-
дификация 1,96,
аморфная (жел-
тая) 1,92
20
Желтый
119,25
444,6
Селен
78,96
Стекловидный
4,28, гексаго-
нальная модифи-
кация 4,79
20
Темно-красный,
серый, металли-
ческий
217
684,94-1,0
Теллур
127,60
6,25
20
Серебристый
110±0,3
989,84-:!, 8
7Jfi Глава 29
Твердый теллур
Поскольку теллур обычно продается в кристаллическом состоянии,
рассмотрим эту форму первой.
Кристаллический теллур. Теллур, кристаллизующийся в гексагональной
системе, имеет металлический вид. Он хрупок и поэтому легко превращается
в порошок. Цвет теллура — серебристо-белый; более чистые сорта имеют
яркий металлический блеск. Теллур обладает некоторыми неметаллическими
свойствам» элементов его группы (серы н селена). '
Теллур легко выращивать в виде монокристаллов методом Бриджг>Тена.
Методы кристаллизации теллура для использования в качестве полупровод-
ника описаны Ханнееч [6J.
Гексагональная модификация. Теллур гексагональной модификации
устойчив ниже температуры плавления. В данной модификации атомы распо-
ложены спиральными цепями, каждый атом образует ковалентные связи
с ближайшими соседями, а поэтому каждый атом имеет восемь валентных
электронов. Эти цепи связаны с прилегающими цепями относительно слабы-
ми силами Ван-дер-Ваальса. Ось с гексагонального кристалла теллура парал-
лельна осям спиралей. Дополнительные детали структуры кристалла теллура
описаны в книге Ханнея «Полупроводники» 16].
Структура теллура гексагональной модификации показана схематичес-
ки в книге «Структура металлов и сплавов» Юм-Розсри и Рей нора [10J.
Теллур является уникальным элементом; он обладает замечательными
механическими свойствами, будучи подвержен гидростатическому давлению.
Хотя общий объем его и уменьшается, длина в направлении осп с увеличи-
вается. Это явление обсуждается в книге «Введение в химическую физику»
Слейтера 126].
Геллур легко ломается вдоль параллельных хорошо выраженных плос-
костей спайности, при этом образуются зеркально гладкие поверхности.
О влиянии присутствия следов элементов на изменение механических
свойств теллура нет никаких сведений. Многие из интерметаллических сое-
динений теллура обладают гораздо лучшими механическими свойствами.
Теплопроводность теллура при комнатной температуре составляет
около одной десятой доли величины, приведенной для олова в «Справочнике
по металлам» [19, стр. 21].
Аморфный теллур. Аморфный теллур образуется при осаждении тел-
лура из раствора теллуристой или теллуровой кислоты посредством подходя-
щего восстановительного реагента. Вопрос о том, являются ли мелкие час-
тички осадка истинно аморфными или просто мельчайшими кристалликами,
остается открытым.
Коллоидальный теллур. Коллоидальный теллур получают восстановле-
нием разбавленных водных растворов соединений теллура, например теллу-
ристой или теллуровой кислоты, при помощи таких восстановительных
реагентов, как двуокись серы, гндразингндрат и т. д. Элементарный теллур
в коллоидном состоянии можно получить, зажигая электрическую дугу
между электродами из теллура, погруженными в воду. Этот метод разрабо-
тан Бредигом в 1897 г.
Коллоиды, полученные указанными выше способами, можно стабили-
зировать, добавляя такие типичные защитные коллоиды, как желатина или
гуммиарабик.
Теллур 749
Расплавленный теллур
Температура плавления теллура гексагональной модификации равна
449,5+0,3°; при плавлении происходит резкий переход от твердого состоя-
ния к жидкому. Расплавленный теллур течет как подвижная жидкость даже
тогда, когда он нагрет только на несколько градусов выше температуры
плавления.
Расплавленный теллур оказывает сильное корродирующее действие на
железо, нержапеющую сталь и медь, но с ним можно работать, не рискуя
заметно загрязнить его, в пирексе или в кварце.
Свободная поверхность расплавленного теллура легко окисляется воз-
духом, если она не защищена восстановительными или инертными газами.
Все операции плавления должны проводиться в хорошо вентилируемом
вытяжном шкафу.
Теллур в парообразном состоянии
Температура кипения чистого теллура гораздо ниже температуры A390 ),
приводимой в учебниках в течение многих лет. Неопубликованные результа-
ты опытов, проведенных в 1951 г., показывают, что температура кипения
несколько ниже 1000°, и эта величина подтверждена обширной работой,
опубликованной Комиссией по атомной энергии США [2]. Сведения, сообщен-
ные этой Комиссией в бюллетене AECD-2546, указывают ни следующие ве-
личины:
Температура кипения при 760 мм рт. ст. 989+3,8°.
Скрытая теплота испарения 27,26±0,07 ккал/моль.
Пары теллура при температурах вблизи нормальной точки кипения счи-
тают обычно двухатомными.
Зависимость давления от температуры показана на рис. 1 в гл. 25.
Пары теллура, подобно жидкому теллуру, оказывают сильное кор-
родирующее действие на металлы.
Электропроводность
Твердый теллур. Электрические свойства теллура лучше нзччечы, чем
свойства селена, главным образом потому, что монокристаллы теллура гораз-
до легче приготовить. Значение удельного электрического сопротивления
литого в вакууме теллура, приведенное Хорном 19], равно E,27 + 0,29) >
х 10"J ом-см.
Теллур, подобно селену, обладает большей электропроводностью в нап-
равлении атомных спиралей или цепей, чем по нормали к этим цепям [26].
С электронной точки зрения теллур—полупроводник. Его проводимость лишь
слегка увеличивается под действием света.
Теллур имеет собственную проводимость р-типа. Примеси серебра, сурь-
мы, меди, золота, железа, олова, мышьяка, висмута, брома и иода являются
акцепторными. Примесей, которые являются донорными, пока не обнару-
жено.
Недавно сообщалось, что кислород, присутствующий даже в виде сле-
дов, является очень коварной примесью, что видно из следующей цитаты
в работе Хорна 19]: «...ТеО2 является в теллуре примесью р-тнпа, ее малые
концентрации чрезвычайно увеличивают термоэлектродвижущую силу и
обусловливают разнобой в ранее опубликованных величинах...».
Сообщалось, что коэффициент Холла для теллура необычно велик
и подвержен некоторым неожиданным изменениям при различных темпера-
750
Глава 29
турах. Дальнейшие исследования без доступа кислорода дадут более надеж-
ные величины, поэтому никаких ранее полученных значений здесь не при-
водится.
Расплавленный теллур. Об удельном электропроводности расплавлен-
ного теллура имеется очень мало данных. Причина этого, вероятно, заклю-
чается в сильном корродирующем действии на металлы, которые могли быть
использованы в качестве электродов..
Данные электрических измерений показывают, что полупроводниковые
свойства кристаллического теллура сохраняются выше температуры плавле-
нии и что происходит постепенный переход к металлической проводимости
с повышением температуры [6, стр. 430].
Таблица 2
НГ КОГОРЫС ФИЗИЧЕСКИЕ СВОЙСТВА ТСЛЛ^РА ГЕКСАГОНАЛЬНОП
МОДИФИКАЦИИ [5, 12, 17]
Значения
Порядкоьый номер
Лтомньш лес
Молекулярный вес (двухатомный теллур)
Изотопы: 20; веса находятся в интерьале
Изотопный состав, "о
массовое число 1-28
130
Электронные оболочки /(
L
М
N
О
Плотность гексагональной модификации при 25 , г/см3
Плотность аморфного теллура, г/ел3^
\томнын объем (гексагональная модификация), см3,'г-атом
Температура плавления, "С
1емпература кипения при 760 ли рт. ст., °С
Удельная теплоемкость при 20°, кал/г-град
Скрытая теплота плавления при температуре плавления, каг/г
Скрытая теплота испарения при температуре кипения, кал/г
Энтропия п кристаллическом состоянии при 25\ кал/град
Коэффициент теплопроводности, кал/см-сек-град
Коэффициент линейного расширения, град'1
Удельное электрическое сопротивление при комнатной темпера-
туре, мной-см
Магнитная восприимчивость при 18", э.м.е.
Твердость по Чоосу
Кристаллическая решетка
Параметры решетки, А
а
с
Поперечное сечение захвата тепловых нейтронов B200 м/сек),
барн/атсм
52
127,60
255,20
117- 135 и 137
31,75
34,27
2
8
18
18
6
6,25
6, ПО
20,45
449,5±0,3
989,8±3,8
0,047
32
107
11,88
0,014
16,75
0,G5-10-g
436600
—0,31-10-е
2,3
Гексагональная
4,4570
5.9290
4,7^0,1
Теллур 751
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства теллура соответствуют свойствам, ожидаемым от
элемента VI группы. Химически теллур — более основной элемент, чем
сера пли селен.
Степени окисления теллура следующие:
2— , в теллуридах (сильные восстановители).
О, в элементарном состоянии.
2-К окисел ТеО существует, и в холодной соляной кислоте он, по-види-
мому, образует дихлорид теллура ТеС12, но, когда раствор нагревают,
дихлорид теллура разлагается на элементарный теллур и хлорид, содержа-
щий Tclh.
4+, в двуокиси теллура ТеО; и тетрахлориде теллура ТеСЦ.
6+, в трехокиси теллура ТсОя, теллуровой кислоте Н6ТеОв* и гекса-
фториде теллура TeF6.
Степени окисления, численные величины для потенциалов, тик же
как и обширные термодинамические данные, приведены Латимером 1131.
Химические валентности, имеющие значение в аналитических методи-
ках, даны Лунделем и Гофманом [15J как шесть, четыре и минус два.
Реакции с кислородом
Достаточно горячие пары элементарного теллура при испарении в воз-
дух самопроизвольно загораются синим пламенем; при этом образуется мел-
кий порошок окисла ТеО2.
Двуокись теллура ТеОг, приготовленная в контролируемых условиях,
имеет вид белых без запаха кристаллов, содержащих 79,95 вес.°о теллура.
Для приготовления двуокиси теллура через основной нитрат Йост и Рас-
сел 130] рекомендуют действовать 6 н. азотной кислотой па элементарный
теллур. Только небольшие количества двуокиси теллура сохраняются
в растворе в воде или разбавленных кислотах.
Теллурнстая кислота П2Те03 содержит 71,84 всс.% теллура. В твер-
дом состоянии она существует в виде белых кристаллов или кристаллическо-
го порошка, слегка растворимого в воде, более растворимого в кислотах
и растворимого в щелочах. Двуокись теллура только немного растворяет-
ся в воде, а поэтому можно готовить очень разбавленные растворы, добавляя
ангидрид в воду [18].
Обширные сведения об окислах и кислотах теллура (а также серы
и селена) приведены Йостом н Расселом [30].
Трсхокись теллура ТеОз содержит 72,7 вес.% теллура. Трехокнсь тел-
лура образуется при нагревании теллуровой кислоты, достаточно сильном,
чтобы отогнать воду; окончательная температура составляет 300—360 .
Приготовленная таким образом твердая трехокись имеет оранжево-желтый
цвет, не растворяется в воде, разбавленных кислотах или разбавленных
щелочах. Горячие концентрированные растворы щелочей растворяют трех-
окнсь теллура с образованием теллуратов Г 301.
В литературе опубликовано несколько формул ортотеллуровой кисло-
ты. Ортотеллуровая кислота образует соли типа Ag6TeO6 и Ag2Te04. Кислота
НиТеОе только немного растворима в воде и имеет слабые кислотные свой-
ства. При нагревании она теряет воду с образованием Н=ТеО4 и затем ТеОз,
* Фактически Н6ТеОе является шестиосповной ортотеллуровой кислотой; обыч-
ная теллуровая кислота — Н2Те04. Однако обе кислоты являются действительно
производными Te(Vl).— Прим. ред.
752 Глава 29
как описано выше. Ортотелл\ровая кислота является хорошим окисляющим
реагентом [141.
Она может быть восстановлена до элементарного теллура двуокисью
серы.
Реакция с водородом
Химическая реакция водорода с теллуром является эндотермической.
Теллурнстый водород П2Те содержит 98,43 вес.% теллура. Его темпе-
ратура плавления —51°, температура кипения —4°. Газ бесцветен,-жид-
кость — зеленовато-желтая, кристаллы — иглы лимошю-желтого цвета.
Газ имеет очень неприятный запах и сильно токсичен.
Теллурисгый водород можно получать: Г) прямым взаимодействием
элементов; 2) электролизом серной кислоты при применении электродов из
теллура", 3) действием разбавленных кислот на теллуриды цинка, алюминия,
магния и т. д.
Газообразный теллуристый водород растворяется в воде. Полученный
раствор имеет свойства слабой кислоты, однако величины растворимости
неопределенны, поскольку растворы нестабильны н поглощают кислород,
что приводит к выделению элементарного теллура.
Растворы теллуристого водорода осаждают теллуриды металлов из
растворов металлов.
Реакции с галогенами
Галогены реагируют с теллуром с образованием многочисленных соеди-
нений. 33 галогенида и оксигалогенида с их температурами плавления и ки-
пения описаны в работе Латнмера и Гильдебранда [14, стр. 2661.
Величины энергий даны в книге Латимера [13, стр. 87]. Другие данные
о свойствах гилогенидовтеллура приведены Йостом и Расселом [30, стр. 297].
Обычно галогениды теллура гидролизуются водой с образованием соот-
ветствующего галогеноводороца и кислоты теллура. Образующиеся соеди-
нения теллура неустойчивы при многих условиях, поэтому возможен их
дальнейший распад.
Фтор. Фтор соединяется с теллуром, образуя тетрафторид или гексафто-
рнд теллура. Подробности о получении гексафторида при пропускании фтора
над гранулированным теллуром приведены Бутом в сборнике «Неоргани-
ческие синтезы» [1]. Гексафторид теллура TeF6 содержит 52,8 вес."о тел-
лура. Для температуры плавления приводится несколько различных вели-
чин около —36°.
Хлор. Хлор реагирует с теллуром даже на холоду, образуя смесь дихло-
рида ТеС12 и тетрахлорида ТеСЦ. Разделение производится фракщыннро-
ванной перегонкой, вероятно, в вакууме, так как при повышенных темпера-
турах пары разлагаются. Дихлорнд и тетрахлорид теллура в расплавлен-
ном состоянии являются хорошими проводниками электрического тока, что
указывает на их солевой характер.
Дихлорнд теллура ТеС1г содержит 64,28 вес.% теллура; он представ-
ляет собой черную массу или зеленовато-желтый порошок.
Тетрахлорид теллура ТеС14 содержит 47,36 вес.°6 теллура. Он пред-
ставляет собой белое гигроскопичное твердое вещество, разлагается водой
па окенхлорид теллура и теллуристую кислоту.
Теллур 753_
Бром. Бром непосредственно реагирует с теллуром, образуя днбромид
и тетрабромид.
Днбромид теллура ТеВг2 содержит 44,04 всс.% теллура; он существует
в виде темно-зеленой массы или черных сильно гигроскопичных кри-
сталлов.
Тетрабромид теллура ТеВг4, который содержит 28,53 весЛ'6 теллура,
существуете виде кристаллов оранжевого цвета на холоду и в виде кристал-
лов красного цвета в нагретом состоянии. Он может возгоняться в вакууме
без разложения.
Иод. Существование дииодида теллура Tel 2 твердо не установлено.
Сообщалось о получении тетраиодида в виде твердого вещества серо-сталь-
иого цвета в результате реакции двуокиси теллура с йодистым водородом.
Реакция с серой
Теллур и сера смешиваются в расплавленном состоянии в любых соот-
ношениях.
При пропускании сероводорода через теллуристую кислоту получается
осадок, являющийся, по-видимому, смесью элементарного теллура и сульфи-
да TeS2.
Сообщалось о получении моно-, ди- и трисульфидов теллура, но эти
данные не подтверждены.
Реакция с азотом
Сообщалось, что взаимодействие теллура и аммиака при —80° приводит
к образованию нитрида теллура Te3N4.
Действие кислот
Теллур нерастворим в соляной кислоте, но слабо растворяется в азот-
ной кислоте с образованием основного нитрата Tc2Os(OH)NO3. При раство-
рении теллура в концентрированной серной кислоте образуется раствор
красного цвета.
Лундель и Гофман Г15] рекомендуют растворять образцы теллура для
анализа в азотной кислоте, царской водке и концентрированной серной
кислоте.
Бромистоводородпая кислота, а также бромистоводородная кислота
в смеси с бромом используются для растворения теллура, содержащегося
в образцах редких элементов [211. Имеются методики проведения анализов.
Реакции с щелочами
Элементарный теллур растворим в растворах едкого кали и цианида
калия, в которых растворяются также многие соединения теллура. Во
избежание окисления следует предотвращать соприкосновение с воздухом.
Растворы цианида калия используются для выщелачивания теллура из
некоторых видов пыли, уносимой нз дымоходов 116].
При сплавлении теллура и ряда его соединений с содой образуется
теллурид натрия. Сплавление двуокиси теллура с нитратом калия приводит
к образованию теллуратов.
48 3jK.fj № 230
754
Глава 29
Лундель и Гофман [15] предложили использовать перекись натрия,
а также соду в смеси с нитратом калия в качестве реагентов для перевода
в растворимое состояние теллура и его соединений путем сплавления [15].
Реакция с углеродом
Карбид теллура Те2С образуется только при зажигании электринеской
дуги между электродами из теллура в парообразном или жидком сероугле-
роде. Во избежание взрывов следует не допускать соприкосновения с воз-
духом п учитывать высокое давление пара двуокиси углерода.
Реакции с металлами
Теллур, подобно сере и селену, реагирует с большинством, металлов,
в результате чего образуются теллуриды. .Методы получения теллуридов
следующие: 1) нагревание смеси теллура и нужного металла (превращать
в порошок или нагревать можно только небольшие порции смесей, потому что
при больших количествах могут произойти опасные взрывы; полезно исполь-
зовать инертную атмосферу); 2) пропускание теллуристого водорода в раст-
вор, содержащий растворимую соль избранного металла; 3) восстановление
окислов избранных металлов углеродом в присутствии элементарного тел-
лура или его окисла.
Теллуриды металлов являются твердыми веществами, имеют металли-
ческий блеск и различную окраску. Температуры их плавления располага-
ются от низких до высоких, и некоторые из теллуридов летучи. Все они
нерастворимы в воде,, некоторые растворимы в разбавленных кислотах, но
все они разлагаются азотной кислотой и царской водкой.
Некоторые теллуриды металлов разлагаются только одним нагревом
(теллурнды золота, ртути), нагревом в токе водорода (теллуриды серебра,
золота, меди, пипка) или при нагреве на воздухе, т. е. при окиелнтатыюм
обжиге
Таблица 3
ЭВТЕКТИЧЕСКИЕ ТОЧКИ НЕКОТОРЫХ ДВОЙНЫХ ТЕЛЛУРСОЛЕРЖАЩИХ
СИСТЕМ.
Система
А1 — Те
Bi—Те
Си—Те
РЬ- Те
S—Те
Se—Теа
Sb—Те
Sn—Те
Состав, % Те
3
97
1,5
85
-83
0,025
78
5,5
30
89
85
Температура,
621
414
266
413
340
326,7
405
107
540
424
405
Образующиеся
соединения
А12Те3
Bi2Te3
Cu2Te
PbTe
Sb2Te3
SnTe
а Образует непрерывный ряд твердых растворов.
Теллур 755
В расплавленном состоянии теллур либо полностью, либо частично сме-
шивается с большинством металлов при повышенных температурах. В табл. 3
приводятся эвтектические точки некоторых двойных теллурсодержаших
систем.
токсичность
Теллур менее токсичен, чем селен. Однако теллур обладает большей
склонностью, чем селен, вызывать появление характерною неприятного
запаха придыхании. У рабочих, находившихся ч атм< сфере, в которой содер-
жалось 0,001—0,01 мг теллура в 1 м:< воздуха, появлялось теллурпстое
дыхание. Неприятный запах при дыхании исчезает через несколько дней 13].
Методы определения содержания теллура в воздухе и моче описаны
Штейнбургом [29].
ОБЛАСТИ ПРИМЕНЕНИЯ ТЕЛЛУРА
Возможности применения теллура, как и селена, весьма разнообразны.
Однако теллур отличается тем, что он имеет большие потенциальные воз-
можности, но лишь немногие из них по той или иной причине реализованы.
Добавки теллура к железу, меди и свинцу
Селен и теллур, введенные в качестве добавок в нержавеющую сталь,
не только действуют как превосходные дегазаторы, но и улучшают обраба-
тываемость нержавеющей стали. По общепринятому мнению, добавки тел-
лура более эффективны, чем добавки селена, но на большинстве сталелитей-
ных предприятий теллур отказываются применять из-за неприятного запаха.
Путем введения магния и теллура в расплав можно получить ковкий
чугун, обладающий при его выплавке преимуществами серого чугуна:
жндкотекучестью, литейными качествами, обрабатываемостью.
Считается, что отливку чугуна в кокиль легче производить при добав-
лении к расплавленному металлу непосредственно перед отливкой 0.1—
0,005% теллура.
Добавка теллура к чистой меди сильно повышает ее обрабатываемость,
не оказывая существенного влияния на электропроводность. Медь с добав-
кой теллура можно подвергать холодной и горячей обработке, но она обла-
дает несколько меньшей ковкостью, чем чистая медь.
Разработаны теллуровые выпрямители, работающие при 300е, но они
недостаточно эффективны при комнатной температуре.
В Европе используется сплав свинца, содержащий меньше 0,1% тел-
лура. Добавки теллура в свинце уменьшают коррозионное действие серной
кислоты на свинец, ограничивают рост зерен, улучшают сопротивление
усталости и впбропрочность и повышают предел прочности при растяжении
(при холодной обработке).
Термоэлектрические приборы
Наиболее широкое применение теллур нашел в области термоэлект-
ричества. Он является важным компонентом термоэлектрических эле-
ментов, которые можно использовать как источники энергии и для
охлаждения.
¦18»
756 Глава 29 •
Преобразование тепла на стыке двух разнородных металлов называется
эффектом Зеебека, открытым Зеебеком в 1826 г. [24, 28]. В 1834 г. Пельтье
провел противоположный эксперимент, пропустив электрический ток от
внешнего источника через контакт, подобный использованному Зеебеком.
Если направление этого тока совпадает с направлением тока, возникающего
при нагреве спая, то последний охлаждается. Таким образом1, этот прибор
является «тепловым насосом», который не имеет движущихся частей, и его
можно использовать для охлаждения 111, 22].
К хорошему термоэлементу предъявляются следующие требования:
1) высокая термо-э. д. с; 2) низкая теплопроводность и 3) низкое электри-
ческое сопротивление. Шиллидей 125] разработал метод определения коэф-
фициента надежности приборов с учетом указанных выше факторов. К мате-
риалам, имеющим высокие коэффициенты надежности, относятся РЬТе,
ЕПгТез и Bi2Se3. Соединение В1гТея может быть получено по желанию в виде
полупроводника с проводимостью п- или /э-типа.
Теллур в керамике
Теллур находит применение в керамической промышленности для про-
изводства синих, коричневых, красных и черных глазурей и фарфоров.
Теллур как катализатор
Применение окиси теллура для каталитического превращения метиль-
ных и метиленовых групп в карбонильные группы описано в пат. США
2653138.
Теллур предложен в качестве катализатора для замены селена в реак-
циях Кьельдаля при окислении /-аскорбиновой кислоты и для ингибирова-
вания окисления полиметилсилоксанов. Предложено также использовать его
в виде тетрахлорида в синтезе кетонов по Фриделю и Крафтсу.
ЛИТЕРАТУРА
1. Неорганические синтезы, сб. I, ИЛ, Москва, 1951.
2. В г о о k s L. S., The Vapor Pressure of Tellurium and Selenium, U. S, Atomic
Energy Commission AECD-2546, Technical Information Branch, AEC, Oak Ridge,
Tenn.
3. E 1 к i n s H. В., The Chemistry of Industrial Toxicology, John Wiley and Sons,
Inc., New York, 1950.
4. F u 1 t о n C. H., S h а г w о о ri W. J., A Manual of Fire Assaying, 3rd cd.,
McGraw-Hill Book Company, Inc., New York, 1929.
5. Handbook of Chemistry and Physics, 40th en\, Chemical Rubber Publishing Co.,
Cleveland, 1958.
6. H a n n а у N. В., Semiconductors, Relnhold Publishing Corp., New York, 1959.
7. H a n s e n M., Constitution of Binary Alloys, McGraw-Hill Book Company. Inc.,
New York, 1958.
8. H о р к i n s B. S., Chemistry of the Less Familiar Elements, Stipes Publishing
Co., Champaign, 111., 1939.
9. H о r n e R. A., J. Appl. Phys.. 30, 393 A959).
10. Hume-Rothery W-, R а у n о r G. V., The Structure of Metals and Alloys,
3rd ed.. Institute of Metals, London, 1954.
11. J of f e A. F., Sci. American, 199, 31 A958).
Теллур 757
12. L ange N. A., Handbook of Chemistry, 9th cd.. Handbook Publishers, Inc.,
Sandusky, Ohio, 1956.
13. L a t i m e r W. M., The Oxidation States of the Elements and Their Potentials
in Aqueous Solutions, 2nd ed., Prentice-Hall, Inc., Englewood Cliffs, N. J., 1952.
14. L a t i m e r W. M., H i 1 d e b r a n d J. H., Reference Book of Inorganic Che-
mistry, 3rd ed., The Macmillan Company, New York, 1951.
15. L u n d e 1 1 Q. E. F., Hoffman J. I., Outlines of Methods of Chemical Ana-
lysis, John Wiley and Sons, Inc., New York, 1938.
16. Lunge Q., The Manufacture of Sulfuric Acid and Alkali, Vol. 1, Part 3, D. Van
Nostrand Company, Inc., Princeton, N. J., 1913, p. 1468.
17. M e 1 1 о r J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemist-
ry, Vol. 11, I ongmans, Green and Co., Ltd., London, 1930.
18. Merck Index of Chemicals and Drugs, Merck and Co., Inc., Railway, N. J., 1952
19. Metals Handbook, American Society for Metals, Cleveland, 1948.
20. Moses A. J., P a r s о n s C. L., Elements of Mineralogy, Crystallography, and
Blowpipe Analysis, 5th ed., D. Van Nostrand Company, Inc., Princeton, N. J., 1916.
21. N о у e s А. А., В г а у W. С, A System of Qualitative Analysis for tlje Rare
Elements, The Macmillan Company, New York, 1927.
22. O'B r i e n B. J., W a 1 1 а с e C. S., L a n d e с к e r K., J. Appl. Phys., 27,
820 A956).
23. Paul ing L., College Chemistry, 2nd ed., W. H. Freeman and Co., San Francisco,
1955.
24. P о h 1 R. W., Physical Principles of Electricity and Magnetism, D. Van Nostrand
Company, Inc., Princeton, N. J., 1930.
25. S h i 1 1 i d а у Т. S., J. Appl. Phys., 28, 1035 A957).
26. S 1 a t e r J. C, Introduction to Chemical Physics, McGraw-Hill Book Company,
Inc., New York, 1939.
27. Smith О. С, Idenlitication and Qualitative Chemical Analysis of Minerals,
2nd ed., D. Van Nostrand Company, Inc., Princeton, N. J., 1953.
28. Starling S. G., Electricity and Magnetism for Degree Students, Longmans,
Green and Co., Ltd., London, 1941.
29. S t e i n b u rg H. H. et al., I'nd. Hyg. and Toxicol., 24, 183 A942).
30. Yost D. M., R ussell H., Systematic Inorganic Chemistry, Prentice-Hall,
Inc., Englewood Cliffs, N. J., 1944.
30.
ТИТАН
Г. Р. ОГДЕН
И. R. Ogden, Battellc Memorial Institute, Columbus,
Ohio
Еще десятилетие назад титан считался редким металлом. В настоящее
же время он является основой целой отрасли промышленности. Этот элемент
был открыт в 1790 г. англичанином Грегором, однако свое наименование он
получил только после его обнаружения в 1795 г. Клапротом (Венгрия), наз-
вавшим его титаном в честь известных из мифологии первых сынов Земли
(Титанов). Грегор открыл титан в содержащих железо песках, известных
сейчас под названием ильменнтовых, тогда как Клапрот обнаружил этот
элемент в рутиле — минерале с самым высоким содержанием титана. Ни
Грегору, ни Клапроту не удалось выделить титан в элементарном состоянии,
однако ими была получена днуокись титана ТЮг.
11есмотря на попытки многих исследователей выделить титан в виде
металла, это удалось только в 1910 г. Хантеру, получившему титан восста-
новлением тетрахлорида титана натрием в стальной бомбе. Однако за этим
еще не последовало рождения современной титановой промышленности.
И после раооты Хантера титан продолжал оставаться лабораторной редко-
стью до тех пор, пока в 1946 г. Кроль (Горное бюро США) не установил, что
титан можно получать в условиях опытного завода восстановлением тетра-
хлорпда титана магнием. Это достижение явилось итогом мноюлетних иссле-
довательских работ, проведенных Кролем в своей лаборатории в Люксем-
бурге. Фирма «Дюпон» освоила промышленный способ производства титана
по этому методу и стала его выпускать для продажи с сентября 1948 г.
Титан находится в четвертом периоде IV группы периодической
таблицы; его порядковый номер 22 и атомный вес 47,90. Принадлежа
к числу переходных элементов, титан имеет не полностью достроенную
электронную d-оболочку и подобно другим переходным элементам отличает-
ся большой величиной отношения модуля упругости к плотности и высокой
температурой плавления, которая наряду с большой химической активно-
стью, особенно при повышенных температурах, создает значительные труд-
ности при получении чистого титана.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ [2]
По содержанию в земной коре титан занимает среди всех элементов
девятое место. Выше его стоят только кислород, кремний, алюминий, желе-
зо, кальций, натрий, калий и магний. Практически почти все (98%) кристал-
лические горные породы, пески, глины и прочие составляющие земной коры
содержат титан. Титан обнаружен в угле, нефти, грунтовых водах, растени-
ях, в костях и мясе животных, в вулканическом пепле, в глубоководных
пробах, метеоритах и на различных звездах. Столь широкая распространен-
Титан 759
ность титана в природе объясняет наличие многочисленных месторождений
богатых титаном минералов, легко доступных для разработки.
Среди множества титановых минералов промышленное значение имеют
только ильменит, содержащий окислы титана и железа, и рутил (ТЮг)-
Несмотря на более высокое содержание титана, значение рутила все же
меньше, так как обычно он более рассеян в других породах, россыпных место-
рождениях или в прибрежных песках, что очень мешает обогащению руд.
Рутил образует тетрагональные кристаллы. Такой же состав (ТЮ2) имеют
два других минерала— брукит, образующий ромбические кристаллы, и ана-
таз, или октаэдрит, который, подобно рутилу, образует тетрагональные
кристаллы, но более твердые и с другим осевым числом.
Особое значение имеет ильменит, поскольку он часто встречается в круп-
ных месторождениях в виде руд, почти не требующих обогащения. Место-
рождения ильменита большого промышленного значения встречаются
в кристаллических горных породах, часто совместно с гематитом или маг-
нетитом, и во вторичных отложениях песков на берегах морей и рек. До
недавнего времени песчаные отложения рутила и ильменита являлись более
важными промышленными месторождениями, чем горные породы, однако за
последнее десятилетие главным источником титанового сырья стали горные
породы. Состав ильменита бывает различным, так как окислы титана и желе-
за образуют ряд соединений. Обычно ильменит предсташшет собой титанат
железа (FeO-ТЮг), однако название «ильменит» относится к различным
соединениям титана с тем или иным количеством гематита или магнетита.
Чаще всего ильменит содержит 32% титана и 37% железа.
Вероятно, самые крупные известные месторождения титановой руды
залегают в районе Аллард-Лейк (восточный Квебек). Здесь находятся два
мощных месторождения высокосортной руды, представляющей собой смесь
ильменита и гематита, запас которой оценивается в сотни миллионов тонн.
Другие крупные месторождения титановых руд в Северной Америке распо-
ложены в штатах Нью-Йорк, Виргиния, Флорида и Северная Каролина.
Известны перспективные месторождения в штатах Миннесота, Род-Айленд,
Вайоминг, Монтана, Калифорния, Оклахома, Колорадо и Нью-Мексико.
Довольно значительные месторождения титановых руд открыты в Австра-
лии, Бразилии, Индии, Малайе, Норвегии, СССР, Швеции, Финляндии,
Португалии и Африке. Почти все месторождения включают достаточно
богатые руды, содержание ТЮг в которых составляет 40—60%.
Двуокись титана может быть получена в качестве побочного продукта
при обработке хвостов, остающихся после переработки боксита и медных
руд. Таким образом, титан является не редким, а одним из наиболее распро-
страненных металлов. Однако трудности, связанные с его получением из руд
в виде металла, заставляли в течение столь длительного периода времени
относить его к числу редких.
ПРОИЗВОДСТВО
Непрерывное увеличение объема производства титана в виде губки
в последние годы сопровождалось систематическим снижением цен. Умень-
шение спроса на титан, имевшее место в конце 1957 и в начале 1958 г.,
привело к некоторому сокращению объема его промышленного выпуска,
по не повлияло на дальнейшее падение цен. В табл. 1 приведены сведения об
объеме промышленного производства титановой губки и ценах на нее за
период 1950—1959 гг.
760
Глава 30
Таблица 1
ОБЪЕМ ПРОИЗВОДСТВА ТИТАНА И ЦЕНЫ НА НЕГО ;
Год
1S50
1951
1952
1953
1951
1955
1956
1957
1958
1959
Выпуск»титано-
вой губки, т
68
449
976
2032
4 87A
6 710
13 237
15657
4 158
3 535
Промышлен-
ное произ-
водство, т
68 г
227 г
1010
1178
1721
4685
5132
2352
2912
Цена I кг губки,
долл.0
11,02
11,02
11,02
11,02
10,42
9,33—7,62
7,62—6,07
6,07—4,96
4,96—4,02
4,02—3,53
Приблизительная цена
I кг промышленных
из дели!
слитки
19,84
19,84
19,84
19,84
19,84
17,64
15,46
13,25
9,93
9,93
, долл.
листы в
33,1
33,1
33,1
33,1
33,1
30,92
28,7
24,28
19,86
16,56
а До 1955 г. по данным «Mineral Yearbook», [956; за 1957—1959 гг. по данным «American
Metal Market».
^ Цена за сорт A-I; цена за сорт А-2 на 50—50 центов ниже.
в Технически чистыВ титан; легированные сорта дороже.
г Приблизительно.
Уменьшение спроса на титан в конце 1957 г. явилось следствием сокра-
щения объема заказов для военной авиации и реактивных двигателей. Одна-
ко падение спроса па титан не свидетельствует об отсутствии интереса к это-
му металлу и его сплавам в областях военного применения, а скорее отра-
жает изменения, происходящие в настоящее время, когда особое значение
приобретает не авиация, а управляемые снаряды. Фактически количество
титана, расходуемого на изготовление одного летательного аппарата, воз-
росло по сравнению с кризисными 1957—1958 гг. В настоящее время положе-
ние таково, что промышленный выпуск и потребление титана находятся
в состоянии устойчивого возрастания.
МЕТАЛЛУРГИЯ ТИТАНА
Реакционная способность титана при высоких температурах сильно
затрудняет его получение в чистом виде. Двуокись титана можно хотя бы
частично восстановить углеродом в электродуговой печи, однако получаю-
щийся при этом продукт представляет собой хрупкий карбид. Если процесс
восстановления проводить на воздухе, то образуется карбонитрид или
металл, настолько загрязненный углеродом, кислородом и азотом, что его
использование как конструкционного материала становится невозможным.
Из-за химической активности титана при высоких температурах возникают
трудности при работе с расплавленным металлом, так как вследствие взаимо-
действия со всеми огнеупорными материалами он сильно загрязняется при-
месями. В связи с этим были разработаны специальные способы получения
Титан 76Г
сравнительно чистого металла, а также условия его плавки и литья. По-
скольку существующие заводы производят титан в виде губчатого металла, ,
а его плавка и легирование осуществляются в основном на перерабатываю-
щих заводах, процессы плавки и литья рассматриваются ниже.
Восстановление двуокиси [2]
Попытки восстановить двуокись титана углеродом и получить достаточно
ковкий металл оказались безуспешными. При использовании в качестве вос-
становителя кальция или натрия в опытном порядке удалось получить
металл, обладающий некоторой пластичностью в нагретом состоянии. Наи-
более подходящим восстановителем двуокиси является кальций; однако он
сравнительно дорог и должен быть свободен от азота (так как азот взаимо-
действует с титаном). Недостаточная чистота металла, получающегося
в результате кальциетермии, препятствует промышленному внедрению этого
метода.
Восстановление тетрахлорида титана магнием [7, 10]
Как установлено Кролем в его экспериментальной работе, использова-
ние тетрахлорида титана в качестве исходного сырья для восстановления
может предотвратить загрязнение металла кислородом и азотом. Тетрахло-
рид титана легко подвергается очистке и удобен в обращении, поскольку
при комнатной температуре он представляет собой жидкость с температурой
кипения 136,4°. Магний является вполне пригодным металлом-восстанови-
телем. Он сравнительно дешев и допускает повторное использование,
поскольку в процессе восстановления образуется в основном хлорид магния,
который может быть электролитически восстановлен до металла. Хотя реак-
ция между расплавленным магнием и тстрахлоридом титана протекает
энергично с выделением большого количества тепла, она все же довольно
легко поддается регулированию. Па ранее существовавших опытных заво-
дах образующийся в результате реакции восстановления хлорид магния
отделяли от титанового порошка, который оказывался в нем диспергирован-
ным, путем промывки холодной соляной кислотой. Получавшийся при этом
титановый порошок превращали в пластичный металл путем прессования
и спекания, т. е. обычными методами порошковой металлургии. В промыш-
ленном производстве хлорид магния и остаток магния отгоняют в вакууме из
титановой губки, которую затем дробят на куски, пригодные по величине
для переплавки в слитки в дуговых или индукционных печах.
Общая схема производства ковкого титана по этому способу показана
на рис. 1*.
Восстановление тетрахлорида титана натрием [13]
В качестве восстановителя титана для получения титановой губки можно
применять также металлический натрий. Этот процесс подобен процессу вос-
становления магнием; он состоит из тех же основных операций, которые
• Подробное освещение процессов переработки титановых руд, производства
титановых шлаков и тетрахлорида титана, а также способов очистки последнего н полу-
чения титаиа термическим восстановлением соединений и электролизом недавно даио
советскими авторами (см. X. Л. С т р е л е ц, В. В. Ж о л о б о в, А. И. И в а и о в,
В. А. Ильичев, М. Б.Рапопорт, В. Н. Черни н. Титан, гл. 3 из книги
«Основы металлургии», том III, Металлургаздат, стр. 242—340, 1963).-— Прим. ред.
762 Г лава 30
указаны на технологической схеме (рис. 1), и отличается только тем, что
вместо магния применяется чистый натрий. Из-за меньшей валентности
натрия для получения 1 кг титана его требуется вдвое больше, чем
магния. Поскольку натрий вдвое дешевле магния, его стоимость равна
стоимости магния.
Чльменитовая руда
i
Ii1
плавка ^.Кислотная Хлсриро-
1 обработка есние
Тит'анис-
тый шлак
1BHUC- —*
Отходы с высоким Технический
г ' г содержанием железа TiCl4
Стходы с высоким т n I
Содержанием желега . z }
Очистка
Хлорирование
I ¦
I Очищенный
Процесс Кроля
»¦ (восстановление магнием)
i
Плотная '
титановая губка MgLl2
Высверливание
Дробление
Выщелачивание
Вакуумная
дистилляция
Г I
Дальнейшая очистка Плавление
исдидным методом
Титан высокой степени
чистоты в виде прутков
Р н с. I. Упрощенная схема извлечения и очистки титана.
Степень чистоты титановой губки, полученной восстановлением метал-
лическим натрием или магнием, одинакова.
Иодидный способ
Много лет назад де Бур и Ван-Аркель [13] нашли эффективный способ
получения чистого пластичного титана путем термической диссоциации
тстраиодида титана. Этот метод заключается в следующем: 1) у стенок стек-
Титан 763
лянного сосуда помещают неочищенный черновой титан, полученный путем
восстановления двуокиси или тетрахлорида титана металлическим натрием
или кальцием; 2) в системе создают вакуум и вводят небольшое количество
иода; 3) вольфрамовую нить, расположенную по оси сосуда, нагревают при
пропускании тока примерно до 1300°; 4) весь сосуд нагревают примерно до
150° для более энергичного иодирования чернового титана. С этого момента
процесс протекает автоматически, так как образующийся тетраиодид тита-
на термически диссоциирует на раскаленной вольфрамовой нити, а высво-
бождающийся при этом иод вновь взаимодействует с черновым металлом при
более низкой температуре.
В последние годы в США этот метод используется для получения титана
не только на опытных заводах, но и в небольшом промышленном масштабе.
Этот процесс проводится в металлических цилиндрических сосудах с тита-
новыми нитями накала, осторожно нагреваемыми до температуры несколько
ниже точки плавления. Этот метод рафинирования сравнительно дорог, глав-
ным образом из-за высокой стоимости исходного материала, малой произво-
дительности и небольших масштабов производства. Получаемый по этому
методу титан отличается самым высоким качеством благодаря малому содер-
жанию в нем примесей — кислорода и азота. Такой металл используется
главным образом в экспериментальных целях. Типичный анализ иодид-
ного и магниетермического металла приведен в табл. 2.
Получение титана электролизом [3, 12]
Получение титана электролизом ограничивается преимущественно
электролитическим рафинированием технического титана или его отходов
(скрапа), хотя и было исследовано много различных способов электролитиче-
ского выделения этого элемента. Во всех этих процессах в качестве электро-
лита применяют расплавленные соли. Обычно для этого в расплавленных
солях, обладающих низкой температурой плавления, растворяют низшие
хлориды титана, например дихлорид и трихлорид, или] фторотитанат.
¦С целью электролитического выделения титана в ваипу вводят соли
титана, при восстановлении которых на катоде осаждается титан.
В процессах электролитического рафинирования технический титан слу-
жит анодом, который, растворяясь в расплавленных солях, образует двух-
валентные ионы и выделяется на катоде в виде металла высокой чистоты.
Электролитический титан обладает высокой чистотой, особенно полу-
ченный электролитическим рафинированием. Титан, полученный Горным
бюро США электролитическим рафинированием из скрапа, оказался по
чистоте таким же или даже чище, нежели титан, полученный иодидным
рафинированием.
ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА
Наиболее перспективными свойствами титана являются его малый удель-
ный вес, хорошая прочность, простота обработки и превосходная коррозион-
ная стойкость. Эти свойства, особенно прочность и хорошая обрабатывае-
мость, в значительной мере зависят от степени чистоты металла. Обычно
чем чище титан, тем лучше его обрабатываемость, но вместе с тем ниже его
прочность. Следовательно, титан представляет собой хорошую основу
для легирования. Почти все металлы образуют с титаном твердые растворы,
улучшая таким образом его прочность за счет дисперсионного твердения
764
Глава 30
Способ получения
титана
Иодидный
Восстановление маг-
нием
0,01—0,03
0,01—0,03
0,005—0,01
0,005—0,15
РЕЗУЛЬТАТЫ
Содержание
Си
0,001—0,004 0,013—0,05 0,0015—0,002
0,01—0,05 <(),005 <0,03
(старения). К тому же полиморфизм титана делает возможной термическую
обработку многих сплавов па его основе.
Физические свойства титана указаны в табл. 3. Поскольку механиче-
ские свойства зависят от чистоты метачла, то промышленность выпускает
ряд сортов титана. Эти сорта титана и их обозначения (наименования).
а также их механические свойства приведены в табл. 4 и 5. Неодинаковая
прочность сортов титана может быть отнесена главнымобразом лг счет различ-
ного содержания в металле таких примесей, как кислород, азот и углерод.
Механические свойства титана, как и большинства других элементов, мож-
но значительно изменять легированием, причем многие сплавы на основе
титана уже производятся в промышленном масштабе. В табл. 6 приводятся
наименования титановых сплавов с указанием производящих их фирм.
Свойства этих сплавов приведены в табл.7. Весьма важно, что легированием
можно значительно повысить их прочность при незначительной потере пла-
стичности. Прочность многих титановых сплавов может быть дополнитель-
но увеличена путем их термообработки, которая описана в последнем раз-
деле этой главы.
ХИМИЧЕСКИЕ СВОЙСТВА
Важнейшим химическим свойством титана является его превосходная
коррозионная стойкость в различных условиях. Как и в случае нержавею-
щей стали или алюминия, эту особенность титана .можно объяснить образо-
ванием на его поверхности пассивирующей окисной пленки, благодаря чему
титан устойчив против воздействия большинства окислительных сред.
Окиспая пленка обладает защитными свойствами только при умеренном
нагреве, поскольку при температурах до 249е титан окисляется очень мед-
ленно, а при дальнейшем повышении температуры скорость его окисления
возрастает. Кроме того, титан взаимодействует с азотом, но при несколько
более высокой температуре, чем с кислородом.
Коррозия [5]
Химическая коррозия. В химических средах титан оказывается стойким
против действия влажного хлора, растворов хлоридов и таких окислителей.
как азотная кислота или царская водка. При комнатной темпера гуре он устой-
чив против действия разбавленной серной, соляной и многих органических
кислот. Плавиковая и фосфорная кислоты, а также растворы щелочей сред*
ней концентрации растворяют титан, однако в разбавленных щелочах титан
устойчив.
Титан обладает превосходной стойкостью как против общей, так и про-
тив точечной коррозии в растворах большинства солей. Он устойчив против
Титан
765
АНАЛИЗА ТИТАНА
лрнмесей, %
Fe
Mg
0,0035—0,025 0,0015—0.002 0,005—0,013
0,03- 0,2
Таблица 2
0,04 0,12
0,03—0,06
0,0015
0,003
<0,03
<0,01
<0,01
<0,03
щелевой коррозии, кавитации, эрозии, коррозионной усталости и электро-
химической коррозии. Однако он имеет такие электрохимические свойства,
которые часто могут ускорять коррозию находящегося с ним в паре металла.
Титан корродирует при действии на него плавиковой, соляной, серной,
щавелевой и муравьиной кислот. В большинстве случаев, за исключением
плавиковой кислоты, коррозия титана может быть уменьшена введением
соответствующих ингибиторов.
В табл. 8 приведены данные, характеризующие скорость коррозии тита-
на в различных средах в зависимости от температуры.
Хотя сведений о коррозионной стойкости сплавов на основе титана
опубликовано очень мало, считается, что в основном она сравнима с корро-
зионной стойкостью нелегированного титана. Разработка специальных кор-
розионностойких сплавов на основе титана была осуществлена вслед за раз-
работкой высокопрочных титановых сплавов. Разработано два типа специ-
альных коррозионностойких титановых сплавов. Сообщалось, что один из
них на основе Р-титана, содержащий 25—40% молибдена, обладает превос-
ходной коррозионной стойкостью в кипящей серной и соляной кислотах.
Другой, содержащий небольшие добавки палладия или платины, обладает
превосходной коррозионной стойкостью против действия соляной и серной
кислот.
Коррозия в морской воде. Титан обладает высокой коррозионной стой-
костью в условиях морской атмосферы и в морской воде. На титановых
образцах, выдерживавшихся в течение 18 месяцев как в стоячей, так и в пере-
мешиваемой морской воде или в атмосфере морского соленого воздуха, ника-
кой коррозии или какого-либо изменения свойств обнаружено не было.
Титан принадлежит к металлам, не обрастающим с поверхности морскими
организмами, присутствие которых вызывает точечную или щелевую
коррозию. В гальваническом ряду различных металлов и сплавов в среде
морскойводытитан располагается между сплавами инконель (пассивирован-
ный) и монель. Таким образом, титан является катодом по отношению к дру-
гим конструкционным металлам. В паре с другими металлами титан обычно
не корродирует, но резко усиливает коррозию более активных металлов.
Окисление
Скорость окисления титана в определенном интервале температур
подчиняется параболическому закону. Помимо окисления титана с поверх-
ности, происходит также диффузия в толщу металла кислорода, образующе-
го твердый раствор с титаном, в результате чего резко повышаются твердость
и хрупкость металла. Скорость диффузии кислорода в титан зависит от тем-
766 Г лава 30
Таблица 3
ФИЗИЧЕСКИЕ СВОЙСТВА НЕЛЕГИРОБАННОГО ТИТАН К [14]
Порядковый номер 22
Атомный вес 47,90
Поперечное сечение захвата тепловых нейтро- 5,8^0,4
нов, барн/атом
Кристаллическая решетка
а-Титаи Гексагональная плот-
иоупакованная
с = 4,6832±0,0004А
о=2,9504-1-0,0004А
с/а=. 1,5873
Р-Титан Кубическая оСъемно-
центриросаниая
Плотность, г/см3 4,54
Сжимаемость, ся?/кг 0,80-Ю-6
Поверхностное натяжение, дн!см 1200
Скорость звука, м/сек 4975
Коэффициент линейного расширения а-титана 8.4-10~6
при 20°, грек)'1
Коэффициент теплопроводности, кал/гм-сек-ерад 0,041
Удельная теплоемкость, кал/г-град 0,125
Температура перехода, СС ' 882.5
Скрытая теплота перехода, кал/моль 1050
Теплота плавления, ккал 5
Температура плавления, °С I6G8
Теплота испарения, кал/моль 112 5UU
Температура вдпения (вычисленная), °С 3260
Удельное электрическое сопротивление,
мком-см
Титли высокой степени чистоты 42
Технический титан 55
Критическая температура сверхпроводимости, 0.3R
"К
Коэффициент Холла,«• см /а- эрстед +1,82-J^O, 2.10~13
Коэффициент магнитной напряженности
В[, 1/эрстед* 6,6-10^1:!
Магнитная восприимчивость, з.м.е 3,17-10"li(J:0,03-10~li)
Магнитная проницаемость 1.U0005
Излучятельная способность
"а-Титан (810—870°) 0,459
р-Титан A39R,9°) 0,42
Работа выхода, эв 1,17
Ширина полосы в мягком рентгеновом излу- й,1у-A,5
чении, эв
Электронная удельная теплоемкость, 8,00-10^<
кал/моль-град
Модуль упругости, кг/мм2 10,8-1С3
пературы, поэтому при высоких температурах процессы окисления и диф-
фузии протекают одновременно. Возможность применения титана в услови-
ях повышенных температур ограничена вследствие его склонности к взаимо-
Титан
767
Таблица 4
ОБОЗНАЧЕНИЯ РАЗЛИЧНЫХ СОРТОВ НЕЛЕГИРОВАННОГО ТИТАНА
Тнтгн
Высокой степе-
ни чистоты
(99,3%) а
Технически чи-
стый (99,2%)
Технически чи-
стый (99,0%)
Технически чи-
стый (99,0%)
Фирменные обозначенуя
Cru-
cible
А-40
А-55
А-70
Mallory—
Sharer
MST-40
MST-55
MST-70
Republic
RS-40
RS-55
RS-70
TMCA
Ti-55A6
Ti-65A
Ti-75A
(Ti-IOOA)
Другие обозначения
AMS
4902
4900A
D901B)
D921)
ASTM
B-265-58T-Gr2
B-265-58T-Gr3
B-265-58T-Gr4
военные
T-9047B-1
T-9047B-1
T-9047B-1
® Сюда включены пруткн, полученные иодидным рафинированием, н металл, полученный
электролизом нз расплавленных солевых ванн.
К числу фирм, выпускающих титан, удовлетворяющий этим требованиям, относятся «Нейшнл
дистиллере». «Нью-Джерси цннк», «Фут минерал» и Горине бюро США.
* Более мягкие сорта, обозначаемые TI-35A (предел текучестн_,24,3 кг/мл&) н TI-45A (предел
текучести 31,6 ка/лш?), также удовлетворяют требованиям.
Таблица 5
МЕХАНИЧЕСКИЕ СВОЙСТВА РАЗЛИЧНЫХ СОРТОВ ЧИСТОГО ТИТАНА
Титан \ji«.ii"i«nc
Высокой степе-
ни чистоты
(99,9%)
Отожженный
Технически чн-i >
стый (99,2%)|
Технически чи-1 »
стый (99,2%)
Технически чи- »
стый (99,0%)
Механические свойства при
комнатной температуре
начальный
предел
прочности
при растя-
жении,
кг, ям
23,9
41,5
55,5
66,8
нонечный
предел
прочности
при рас-
тяжении,
14,1
28,1
44.3
56,2
относи-
тельное
удлине-
ние, %
54
28
27
25
1Механичегк-ие ев
начальный
гредел
прочности
при рас-
тяжении.
11,2
19,7
23,2
30,2
при 315°
конечные
предел
прочности
при рас-
тяжении.
9,1
13,4
19
ойства
относи-
тельное
удлине-
ние. %
52
33
28
действию с кислородом. Например, титановынлист толщиной 1 мм становит-
ся хрупким после выдержки на воздухе в течение нескольких часов при тем-
пературе 816°. Однако этот же лист можно выдерживать на воздухе при тем-
пературе 566" по меньшей мере в течение 500 час без заметного изменения
его свойств. Титановый лист толщиной 0,4 мм выдерживает в течение 15 .мин
Таблица 6
ПРОМЫШЛЕННЫЕ СПЛАВЫ ТИТАНА И ИХ ОБОЗНАЧЕНИЯ
Состав, вес?
Ti-5Al-2,5Sn
Ti-6Al-4Zr-lV
T1-8AI-IM0-IV
Ti-RAl-2Nb-lTa
Ti-8Al-8Zr—l(Nb+Ta)
Ti-7Al-12Zr
Ti-3A1-2,5V
Ti-5Cr-3Al
Ti-2Fe-2Cr-2Mo
Ti-8Mn
Ti-4Al-4Mn
Ti-4AI-3A\o-lV
Ti-4Al-4Mo-4V
Ti-5Al-2,75Cr-l,25Fe
Ti-5Al-l,5Fe-l,4t'-r-1.2Ato
Ti-6A1-4V
Ti-7Al-4Mo
Ti-16V-2,5Al
Ti-13V-llCr-3\l
Фирменные обозначения
Crucible
A-110AT
—
—
—
A-120ZA
—
C-110M
С-130АМ
C-ll5AMoV
—
—
C-120AV
C-135AMO
C-105VA
B-120VCA
Ma Могу—Sharon
Republic
Сплавы на основе t
MST-5Al-2,5Sn RS-HOC
—
—
MST-821
MST-881
—
TiMCA
i-t и т а н а
Ti-5Al-2,5Sn
Ti-6Al-4Zr-lV
T1-8AI-IM0-IV
Сплавы на основе a+fi-т нт а на
MST-3A1-2.5V
MST-3Al-5Cr
—
MST-8Mn
MST-4Al-4Mn
—
—
—
MST-6A1-4V
—
MST-16V-2,5A1
_
—
RS-110A
RS-130
Rb-115
—
RS-140
RS-120A
RS-135
Сплавы на основе
—
RS-120B
Ti-140A
—
Ti-4Al-3Mo-lV
Ti-4Al-4Mo-4V
Ti-155A
Ti-6A1-4V
Ti-7Al-4Mo
!-т и т а н а
Ti-13V-llCr-3Al
Другие обозначения
AMS
4926
4927
4923
4908A
4925A
4929
D911)
D928)
AST M
военные
B-265-58T-Gr6 (T-9047B-2)
(T-904GB-3)
—
B-265-58T-Gr7
T-9047B-3
(T-9046B-4)
(T-9047B-4)
T-9046B-1
T-9047B-6
T-9047B-7
B-265-58T-Gr5 (T-9046B-2)
(T-9047B-5)
Тшпан 769
воздействие при температуре 1093е при испытании пламенным нагревом. Ог-
раничения в отношении продолжительности и степени нагревания титана на
воздухе играют большую роль в тех случаях, когда металл подвергается тер-
мической обработке или обработке давлен нем. Использованию титана в каче-
стве жаропрочного материала препятствует прежде всего ухудшение его
механических свойств при повышенных температурах.
Нагревание титана в условиях ограниченного доступа воздуха сопро-
вождается появлением на его поверхности цветов побежалости, подобно
тому как это наблюдается при нагревании стали. Блестящая голубая поверх-
ность, возникающая, по-видимому, в результате образования окиси титана,
обладает большей коррозионной стойкостью против воздействия некоторых
кислот, чем сам металл. Растворение кислорода, азота и углерода в титане,
наблюдаемое при нагревании металла в атмосфере содержащих эти элементы
газов, служит практически способом упрочнения поверхности титана.
Химические соединения
Титан является поливалентным активным металлом, образующим раз-
личные соединения, число которых значительно больше, чем указано
в данной главе. Металлургия титана осложняется из-за образования соеди-
нений низших степеней валентности, например субгалогенидов, образую-
щихся при пиролитическом восстановлении галогенндов титана и
при их восстановлении магнием или водородом. Существуют три окисла
титана — "ПО. Ti2O3 и ТЮз — и соответствующие этим окислам соли.
Титан может образовывать комплексные титаниты. При нагревании титан
энергично взаимодействует с водородом, кислородом и азотом, из которых
только водород может быть в дальнейшем удален из металла при его нагре-
вании в вакууме при температуре выше 800°. Хлор, иод и бром взаимодей-
ствуют с титаном, образуя соответствующие галогениды.
МЕТАЛЛОВЕДЕНИЕ [7]
Па протяжении последнего десятилетия технология титана развивалась
очень быстро. Aleiiee двадцати лет назад о металловедении титана и титано-
вых сплавов практически ничего не было известно. Благодаря сосредоточе-
нию усилий многих исследовательских организаций, фирм и университетов,
направленных на выполнение субсидируемой правительством США про-
граммы, был достигнут значительный уронень знаний в области металлургии
Основы легирования
Среди нескольких возможных систем классификации сплавов на основе
титана, по-видимому, самой простой следует считать классификацию по
степени влияния легирующих элементов на температуру полиморфного
превращения титана. Некоторые легирующие добавки обладают большой
растворимостью в E-фазе (высокотемпературная кубическая объемноцентри-
ровииная модификация титана) и снижают температуру превращения по
мере увеличения их содержания в сплаве. Такие элементы называют |5-ста-
бнлизаторами. Наоборот, элементы, обладающие большой растворимостью
в низкотемпературной гексагональной нлотноупакованной с-фазс и повы-
шающие температуру превращения титана, называются а-стабилизаторими.
49 Jjkij № 230
Состав, dcc.%
Таблица 7
МЕХАНИЧЕСКИЕ СВОЙСТВА ПРОМЫШЛЕННЫХ СПЛАВОВ ТИТАНА
Условия обработки
В,гд
изделий
Механические свойства при комнат-
ной температуре
начальный
предел проч-
ности при
растяжении
кг/мм*
кпнечиын
предел проч-
ности при
растяжении,
OTHOLH-
тельное
удлине-
ние, %
Механические свойства при 315°
начальный
предел проч-
ности при
рас I нженпи,
кг/мм*
конечный
предал проч-
ности прк
растяжении,
OTHOL Н-
тельное
удлине-
ние, %
Сплавы на основе а-т итана
Ti-5Al-2,5Sn
Ti-6AI-4Zr-lV
Ti-SAI-lMo-lV
Ti-8Al-2Nb-lTa
Ti-8AI-8Zr-l(Nb-[-Ta)
Ti-7Al-12Zr
Отожжен G18°, 4 час), ОВ
Отожжен G18°, 4 час), ОП
ТО (982°,5 мин), ОВ
E93°,8 час), ОВ
Отожжен (899°, I час), ОВ
Отожжен (87Г, 8 час в ва-
кууме), ОП до 343"
Отожжен
Лист
Полоса
87,9
100,5
103,3
88,6
54,9
98,4
84,4
97,0
94,9
84,4
87,9
9,3,5
18
17
16
17
16
12
57,6
63,3
78,7
70,3
77,3
71,0
45,7
53,4
01,9
5G,9
63,3
59,8
17
20
16
25
17
13
Сплавы иа основе ее+Р-титана
Ti-3A1-2,5V
Ti-5Cr-3Al
Ti-2Fe-2Cr-2Mo
Ti-8Mn
Т1-4А1-4Мп
Отожжен
TO (805°, 1 час), ЗВ
D825,2 час), ОВ
Отожжен
Лента
Полоса
Лист
Полоса
70,3
109
96,3
125,8
97
104
59,8
101,5
87,9
129,2
87,9
93,5
15
14
18
13
15
16
80,1
66,8
95,6
72,4
77,3
61,9
45,7
78,7
58,3
63,3
15
19
1Ь
13
17
Ti-4Al-3Mo-lV
Ti-4AI-4Mo-4V
Ti-5Al-2,75Cr-l,25Fe
Ti-5AI-l,5Fc-l,4Cr-
l,2Mo
Ti-6A1-4V
Ti-7Al-4Mo
Ti-16V-2,5Al
TO G60-815°, 2 час), ЗВ
D27—538°, 24 час), OB
TO(885°, 2,5 мин), ЗВ
TO (885°, 2,5 мин), ЗВ
D96°, 12 час), ОВ
ТО(843°, 1—2 час), ЗВ
E38", 6 час), ОВ
Отожжен
ТО G88', 2 час), ЗВ
D82°, 5 час), ОВ
Отожжен
ТО (871°, 1 час), ЗВ
E38°, 24 час), ОВ
Отожжен
ТО (927°, 20 ,1ШК),ЗВ
(924°, 8 час), ОВ
Отожжен
ТО (899°, 20 мин), ЗЕ
D82°, 16 час), ОВ
ТО G49°, 20 мин), ЗВ
ТО G49°, 20 мин), ЗВ
E16°, 4 час), ОВ
Полоса
Лист
а
Полоса
Лист
Полоса
Лист
13,9
98,4
137,1
119,5
98,4
66,8
117,4
105,5
9
IS
6
6
112,5
133,6
108,3
137,1
94,9
119,5
112,5
133,6
73,8
126,5
108,3
123,0
101,9
129,4
84,4
105,5
105,5
123
31,6
116
15
6
16
9
11
7
15
12
Ih
37,9
106,9
85,8
101,2
80,8
105,5
73,8
91,4
87,9
109
98,4
70,3
79,4
71,7
82,3
70,3
87,9
G6,8
73,8
82,3
84,4
91,4
20
10
16
14
11
7
17
15
Ti-13V-HCr-3Al
Сплавы на основе Р-тнтана
ТОG60—815°, 15—30 мин),
ОВ
ТО G60°, 30 лшк),ОВ
D82°, старение), ОВ
Лист
94,9
126,5
91,4
119,5
16
6
123,0
101,9
'"* Примечание. ТО—термическая обработка; ОВ—охлажден на воздухе: ОП—охлажден с печью; ЗВ—закалка в воду.
772
Глава 30
Таблица 8
СКОРОСТЬ КОРРОЗИИ ЧИСТОГО 1ИТЛНЛ В ВОДНЫХ РЛСТВОРАХ
Среда
НС1
НС1
НС1
IIC1
НС1
HNO3
нмо'з
HNO3
IINO3
HNO3
HNOS
HNOS
H3PO4
H3PO4
H2S(L
H2SO4
II2SO4
H2SO4
H2S(L
NaOH
NaOH
NaOH
NH4OH
Л1С13
NH4CI
FeCl3
Концентрация, вес.%
Температура, DC
1
1
5
10
20
5
5
Ш
1U
20
Красная дымящая кис-
лота
Белая дымящая кислота
1U
85
1
1
10
10
40
4U
10
28
40
28
1U
10
1 -30
Насыщенный раствор
60
100
Комнатная
35
Комнатная
35
100
35
100
35
Комнатная
80
Комнатная
35
Комнатная
35
При кипении
Комнатная
80
Комнатная
100
100
100
При кипении
Скорость
коррозии,
мм/гоб
0,П
18,5
0,1
42,0
20,4
0,08
0,61
0,16
1,29
0,18
0,07
0,1
72,0
8.4
0,1
360,0
7,2
50,0
60,0
341,0
0,84
0.1
5,0
0,1
0,09
0,5
0,5
0,05
Существуют еще элементы с очень незначительной или нулевой раство-
римостью в обеих фазах, которые способны образовывать с титаном ряд
соединений.
Установлено, что. как правило, все переходные элементы стабилизи-
руют Р-фазу. Известно также, что из непереходных элементов алюминий,
олово, сурьма, углерод, кислород и азот являются а-стаСилизаторами;
водород, бериллий и кремнии стабилизируют р-фазу, а бор, фосфор и сера
образуют с титаном ряд соединений. На рис. 2 и 3 представлены диаграммы
¦состояния титана с наиболее важными легирующими элементами.
Как и у других металлов, свойства титана сильно изменяются при его
легировании. Наиболее важным механизмом упрочнения титановых сплавов
является дисперсионное твердение. Элементы из числа а-стабилизаторов при
легировании титана упрочняют его исключительно за счет дисперсионного
твердения с образованием однофазных сплавов, неподдающихся термической
обработке- В а-стабилизированных сплавах титана сохранить р-фазу
Титан
773
не удается даже с помощью закалки. Не изменяется и твердость этих сплавов
при превращении р -»-а. Легирование титана элементами, стабилизирую-
щими Р-фазу, также упрочняет металл за счет дисперсионного твердения.
Вследствие весьма малой растворимости этих элементов в р-титапе его упроч-
нение происходит преимущественно за счет Р-стабилизаторов. Элементы,
гооо
1600
1200
800
too
i
ч\
-л-
V
а-у
НС
1
Ч ¦ —т 1
/7~~i
г
1
О 25 50 75 100 0 25 SO 75 100 0 25 SO 75 100
Ванадий,°/„ Храм,"/* Морганеи,.%
гооо,
1600
1ZO0
ьоо
I-Ti,?u
0 ZS SO 7S 100 О 25 50 75 100 0 ZS SO 7S 100
Железо, % Никель, % МсЗь,7„
гвоо
моп
2ОП0
1600
1200
SOU
400
.Т1С
\
jar/3
-^
1
a
.0
25 50 75 Ш 0 25 50 75 100 0 25 SO 75 100
ШлибОен.'/е Ниобий, % иирконий,%
P и с. '2. Диаграммы состояния титана с некоторыми переходными элементами.
образующие с титаном соединения, вследствие их малой растворимости
в титане почти не оказывают влияния на свойства сплавов, кроме тех слу-
чаев, когда их избыток приводит к охрупчиванию сплава.
Наиболее универсальными являются Р-стабилизированние сплавы
титана. Малые и средние добавки к титану р-стабилизирующих элементов
веду г к образованию двухфазных (а + р)-сшшвов. Добавки свыше 10%
р-стабилизаторов делают р-фазу устойчивой до сравнительно низких темпе-
ратур и позволяют путем закалки сохранять ее до комнатнон температуры.
Однако в этих условиях р-фаза неустойчива и уже при слабом нагревании
774
Глава 30
частично превращается в переходную фазу, обозначаемую как ш-фаза,
и, наконец, в мелкодисперсную а-фазу или, возможно, в смешанную
фазу. В некоторых системах, например титан — молибден, титан —
ниобий, титан — тантал и титан — ванадий, E-фазу возможно сохранись
до комнатной или даже более низкой температуры путем добавки к титану
очень большого количества Р-стабилизатора. Таким образом, в Р-стабилн-
зированных системах существуют сплавы трех типов: двухфазные (и -)- Р),
сплавы с неустойчивой E-фазой и сплавы со стабильной Р-фазой. Если не учи-
тывать влияния термической обработки, то свойства р-стабшшзированных
О 1 2 i 4 О
Водсрод, %
гьоог
/"" Ж
1
I р
1
¦TiC
а-
_т±с
iC
А-'А-
\/ i
а
- /
\ 2 3 4 О
Углерод, %
1)
/
/
/ н
1
1A
- -
т.о
тГгс3
А
се *
Г |
У*
Т|А13'Л1
Ь> 2000
? I6OO
§- »гоо
I
цоо
О Ю 10 30 Щ О ZS 50 75 WOO ZS ЬО 75 WO
Кислород,"/*, Алюминий,"/<, Анемии.. "/„
Рис. 3. Диаграммы состояния титана с некоторыми непереходными
элементами.
1
\/
Si
а
ri.;sij
а
*
ж
\
+
ел
—V
TiSi
-•-
TlSi;
TiSiz*Si
сплавов определяются количеством легирующих добавок в твердом раство-
ре. Поскольку обычно р-стаСилизаторы обладают очень небольшой раство-
римостью в а-титане, то свойства двухфазных сплавов типа (а 4- Р), а также
сплавов с устойчивой и неустойчивой р-фазой определяются количеством
легирующих добавок, содержащихся в твердом растворе Р-фазы.
Природа р-стабилизироваиных систем делает двухфазные сплавы
(а -1- Р) легки поддающимися термической обработке. Даже обычной закал-
кон можно значительно изменить свойства сплава. Низкотемпературный
отжиг двухфазного (а , Р)-сплава позволяет получать сравнительно мягкий
материал, поскольку в этом случае в нем имеется довольно много мягкой
а-фазы. При закалке с более высокой температуры в двухфазном сплаве
у величивается колнчество более твердой Р-фазы, что сопровождается повыше-
нием его твердости и прочности. При закалке сплава, состоящего из Р-фазы,
образуется структура мартенситного типа или сохраняется р-структура,
из которых каждая является несколько более твердой и значительно менее
пластичной, чем двухфазная (и -|- Р)-структура. При высокотемпературной
Тит ан 775
закалке двухфазных снланов р-фаза в сплаве с а-фазой обычно неустойчива-
Эта неустойчивость Р-фазы приводит к хрупкости сплава в случае его при
менения при повышенных температурах. Степень неустойчивости возра-
стает с увеличением количества р-фазы в сплаве. Для предотвращения воз-
можного возникновения хрупкости двухфазные сплавы (<t + P) можно ста-
билизировать низкотемпературной термической обработкой в пределах
существования двухфазной структуры, что ведет к уменьшению количества
Р-фазы за счет образования сплошной а-фазы. С другой стороны, сплав мож-
но медленно охлаждать от температуры отжига для того, чтобы содейство-
вать превращению р-фазы в сплошную а-фазу. Оба способа уменьшают проч
ность сплава, но обеспечивают его устойчивость при повышенных темпе
ратурах.
Неустойчивость р-фазы можно использовать и для упрочнения титано-
вых сплавов. Надлежащим выбором первоначальных условий обработки
сплавов типа (а + Р) можно достигнуть некоторой неустойчивости Р-состаи
ляющей, что при последующем старении позволяет повысить прочпоси
сплава. Такая термообработка применяется для промышленных титановых
сплавов и описана более подробно в следующем разделе этой главы.
Закалка р-титана, в результате которой образуется мартенсит, по-ви-
димому, не имеет практического значения для обработки двухфазных тита-
новых сплавов. Повышение твердости и прочности, происходящее вследствие
образования мартенсита, весьма невелико по сравнению с упрочнением,
наблюдаемым в мартенситных сталях. Кроме того, термическая обработка
сплавов на основе титана с нагреванием до температуры полного перехода
сплава в Р-область должна проводиться в инертной атмосфере или в вакууме
для предотвращения охрупчивания и загрязнения сплава кислородом н
азотом.
Таблица 9
ВЗАИМОСВЯЗЬ CTPi'KTS РЫ ТИТАНОВЫХ СПЛАВОВ С ИХ СВОЙСТВАМИ
груктура
Характеристика
Универсалькость; хорошая свариваемость; хорошая проч-
ность в холодном и горячем состоянии; хорошая устой-
чивость против окисления; удовлетворительная гибкость
Наил> чшая гибкость; отличная пластичность при изгибе;
хорошая прочность в холодном и горячем состоянии; чу-
вствительность к загрязнению; невыгодность, обусловлен-
ная большим расходом стратегических металлов
Промежуточные свойства; хорошая прочность на холоду;
хорошая гибкость; отличная ковкость, умеренная под-
верженность загрязнению; плохая свариваемость
Представление о влиянии легирования титана многими элементами поз-
воляет классифицировать сплавы титана на три основных типа: а, (а р)
и р. Преимущества и недостатки каждого из этих типов сплавов указаны
в табл 9. Такая классификация обозначается в металлургии титана буквами
ABC, где А обозначает универсальные а-сплавы, В — наиболее гибкие
универсальные сплавы, а С сложные двухфазные сплавы (а+ Р), обла-
дающие промежуточными характеристиками.
776 Глава 30
Важнейшие легирующие элементы. При изучении титановых сплавов
нельзя не учитывать влияния газов — кислорода, азота и водорода. Эти
элементы, наряду с углеродом и железом, являются основными примесями
в техническом титане. По мере углубления наших знании по металлургии
титана все более выясняется необходимость предотвращать возможность
загрязнения титана газообразными примесями. Кислород, азот и водород
легко растворяются в кристаллической решетке титана. Кислород и азот,
внедряющиеся воктаэдрические пустоты гексагонально» плотноупакованиоп
решетки, обладают большей растворимостью в о-фазе, нежели в Р-титане.
Водород, внедряющийся преимущественно в тетрагональные пустоты куби-
ческой объемноцентрированноп решетки, хорошо растворяется в |5-титане.
Как уже отмечалось, кислород и азот, находящиеся в твердом растворе,
повышают прочность титана, а в слишком большой концентрации вызывают
хрупкость металла. Несмотря на то что допустимое содержание кислорода
и азота в титане весьма высоко (хрупкость возникает при содержании
около О,5°о кислорода и 0,3% азота), эти примеси, безусловно, ухудшают
прочие характеристики. Например, необходимая пластичность шва при свар-
ке титана сохраняется, пока содержание кислорода не превышает 0,15%,
а азота 0,10%. Установлено, что примеси атомов внедряющихся элементов
снижают ударную вязкость титана. Поэтому если от титана требуется, повы-
шенная ударная вязкость, то содержание таких примесей должно быть мини-
мальным.
Примесь водорода мало влияет на механические свойства нелегирован-
ного титана при растяжении, но она очень резко ухудшает ударную вязкость
металла. Хотя при повышенных температурах водород хорошо растворяется
в титане, при температурах ниже 300 его растворимость резко уменьшается.
В результате этого при комнатной температуре происходит выделение гид
ридной фазы TiH. Присутствие в структуре титана этой фазы, количество
которой зависит непосредственно от количества примеси водорода, является
причиной резкого снижения ударной вязкости. Растворимость водорода
в двухфазных титановых сплавах довольно значительна. Присутствие избы-
точного водорода в количестве 0,015- 0,020% приводит к медленному охруп-
чиванию Гюльшинства сплавов на основе ы-титана.
Углерод также растворяется в титане, внедряясь в октаэдрические пу-
стоты гексагональной плотноунакованной кристаллической решетки. Однако
его растворимость весьма ограниченна и при температуре перитектопдного
превращения не превышает 0,45%. При внедрении углерода в кристалличе-
скую решетку он образует твердый раствор и упрочняет титан. Однако если
углерод присутствует в виде карбида титана TiC, то он очень мало влияет
на все свойства титана, кроме пластичности, которую он снижает. Так же
как и другие примеси, образующие с титаном твердые растворы внедрения,
углерод вредно влияет на ударную вязкость. Для обеспечения доброкачест-
венности сварного шва содержание примеси углерода в титане не должно
превышать О,2"о.
Среди многих легирующих титан добавок наиболее важное значение
имеют следующие восемь элементов: алюминий, олово, цирконий, хром,
железо, марганец, молибден и ванадий. Из них а-стабилизаторами являются
алюминий, олово и цирконии, а остальные элементы представляют собои
Р-стабилизаторы. Упрочнение сплавов при легировании этими элементами
достигается благодаря дисперсионному твердению. Сопоставляя характери-
стики сплавов в отожженном и в стабилизированном состояниях, можно
уяснить эффект упрочнения сплавов при легировании титана каждым из
перечисленных элементов. Приведенные в табл. 10 данные для двойных
Гитан
777
Таблица 10
ППАСТИЧССКИЕ СВОЙСТВА СПЛАВОВ НЛ OCHOBF ТИТАНА
Состав сплава
Гитап i 5°ц циркония
Титаи-1-5011 олова
Титон + 5°а алюминия
Титан+5"о ванадия
Титан 4- 5% молибдена
Титан ^ 5°ц хрома
Титан ' 5ио марганца
Титан 5°м железа
Предел
текучести.
49,0
52,5
63,0
63,0
66,5
77,0
77,0
91,A
Предел
прочности
при
растяжении.
кг мм%
56,0
59,5
70.0
73,5
77,0
87,5
87,5
98.0
Oiiic.ru
тельное
удлине-
ние. %
20
20
20
20
20
20
20
10
Отщк-птель-
ное сужение,
50
50
40
50
5U
40
40
25
сплавов дают приблизительное представление, поскольку свойства титано-
вых сплавов в значительной степени зависят от количества примесей в
легируемом металле.
15-,
по
Р и с. 4. Влияние температуры
на предел прочности при растяжс-
пни некоторых штаповых сплавов.
Гр> пни Л — -цл,|ны. поддающиеся
термообработке; группа В сплавы
н^ оеиове a-TiiT.iHd. I - Ti- 13V-1 lCr-
JA1; J — Ti-lGV-2 5 \1: 3 Ti-4A1-
JMo-lV; 4 TI-8A1-1MO-1V; 5— Ti-
8AI-2Nb-lTi; в Ti-5 Al-2.5Sn; 7
пелегнрованиый титаи.
I п?
¦
~~1
7
^~ ,
'——_
\}'
100
?no mo wo
Температура. "С
500
ew
В последнее время разработка составов титановых сплавов происходила
по различным направлениям и привела к получению сплавов двух различ-
ных классов. К одному из них относятся холоднодеформируемые сплавы
на основе a-титана с однофазной гексагональной плотпоупакованно» струк-
турой, способные свариваться и предназначаемые для применения в услови-
ях, требующих хорошей высокотемпературной устойчивости против ползу-
чести. Ко второму классу относятся мягкие двухфазные сплавы, либо
сплавы на основе |5-титана, могущие быть легко полученными в мягком
состоянии и приобретающие после термообработки большую прочность.
Сплавы на основе a-титана обычно обладают средней прочностью при ком-
натной температуре, теряя ее при высоких температурах медленнее,
чем горячедеформируемые сплавы. Таким образом, ползучесть сплавов на
778
I л at
30
основе а-титана при высоких температурах обычно превосходит ползу-
честь горячедеформируемых сплавов. На рис. 4 показано влияние темпе-
ратуры на предел прочности при растяжении для образцов сплавов обоих
указанных классов.
Термообработка титановых сплавов [4, 7, 8, 11]
Термическая обработка титановых сплавов с целью повышения их проч-
ности может сопровождаться процессом дисперсионного твердения (старе-
ния), сходным с происходящим и в других легированных сплавах. Механизм
такого упрочнения основывается на взаимодействии, имеющем место во вре-
мя перехода при низкотемпературном старении Р-фазы с кубической объем-
ноцентрированной структурой решетки в а-фазу с гексагональной плотно-
упакованной структурой. Необходимые для такого перехода условия пока-
заны графически на рис. 5, где приведены типичные фазовые превращения
в Р-титане, легированном с целью его стабилизации. В таком титановом спла-
ве количество р-стабилизирующего элемента должно быть достаточным для
того, чтобы при закалке на твердый раствор (Т, на рис. 5) Р-фаза могла со-
храниться при комнатной температуре. Послезакалки сплав вновь нагревают
до температуры состаривания (Тг) и выдерживают при этоп температуре в те-
чение времени, достаточного для выделения дисперсной а-фазы, но не слиш-
ком длительно во избежание агломерации а-фазы и перестаривания сплава.
Полученные в результате термической обработки- свойства сплавов
зависят как от температуры закалки па твердый раствор, так и от температу-
ры старения. Характерные свойства титанового сплава, показывающие
влияние как температуры закалки на твердый раствор, так и темпера-
туры и продолжительности старения, приведены в табл. 11.
Таблица 11
ПЛАСТИЧЕСКИЕ СВОЙСТВА ТИТАНОВОГО СПЛАВА @% АЛЮМИНИЯ 1-1 4% ВАНАДИЯ)
В ЗАВИСИМОСТИ ОТ РАЗЛИЧНЫХ М'ЧОВИЙ ТЕРМИЧЕСКОЙ ОБРД1Ю1К.И
Термическая
закалка на твердый
раствор
ныдержка
перед
лакалкиП,
час
1
температура.
°С
816
816
816
871
871
927
927
927
927
982
982
982
обработка
старение
продолжи-
тельность
старения,
час
_
2
8
2
—
2
2
8
8
2
температура,
Ч
482
593
—
482
—
482
538
538
-
482
593
Предел
прочности
при
растяжен ни,
104,3
121,1
102,2
108,5
124,6
119,0
129,5
130,2
125,3
123,9
128,1
119,0
Предел
текучести.
Л~а'лщ2
64,4
98,0
98,0
85, Л
108,5
105,0
116,9
119,0
115,5
107,8
116.9
109,2
Относи-
тельное
удлине-
ние, °0
14
7
13
16
9
7
10
11
9
5
4
12
Титан
779
Все титановые сплавы, содержащие стабилизирующие Р-структуру до-
бавки (сплавы на основе и, -р Р- и р-титана, перечисленные в табл. 7), способ-
ны воспринимать термообработку. Некоторые из них были разработаны в ка-
честве сплавов, предназначенных для применения в отожженном состоянии,
однако из-за их состава они могут и не обладать совокупностью прочности
и пластичности, как это имеет место после термически обработки сплавов,
способных к ее восприятию. Таким образом, нет единого сплава, способного
удовлетворять всем требованиям различных отраслей промышленности.
При выборе сплава, помимо его механических свойств, исходят и из других
Рис S. Диаграмма, характеризующая
фазовое состояние в (З-стабилизнрованном
титане.
Содррнштя р c'mabwHJjatnopu •-
факторов. Поэтому разработан и разрабатывается ряд различных титановых
сплавов. Свойства листов, полученных из четырех типов промышленных тер-
мообрабатываемых сплавов, приведены в табл. 12. Титановый сплав с 6%
Таблица 12
XAPAKTFPHUC СЬОЙСТВА ЛИСТОВ ИЗ ТЕРМООБРАБАТЫВЛЕМЫХ ТИТАНОВЫХ СПЛАВОВ
Состав сплавов
Ti-CA1-4V
Ti-4Al-3Mo-lV
TM6V-2.5AI
Ti-13Y-llCr-3Al
Условия
закалкн
gg
20
15
20
30
1
с
927
889
719
788
t5-
а: ж
a- oj
t!
101,
98
73,
94
I
5
0
5
5
ЕГ
тек
J
ч
87
66
31
91
-,
5
,5
,5
,5
,0
I5!
и к
с -
p&
og
12
15
16
16
Услогия
старения
±i
S =
&5
as tq
8
12
4
96
f-
|u
|«
524
496
516
482
Щ
5 ИЗ
119
133
126
143,5
B"
>.
К
в
С! k
105
116
US
129
,9
,5
С
№
s
1
С
=
1
>
7
fi
6
алюминия и 4Vc ванадия содержит много упрочняющей добавки — алюми-
ния — и мало Р-стабилизирующей добавки — ванадия. В закаленном со-
стоянии такой сплав очень прочен и с трудом поддается деформации, причем
старение лишь незначительно повышает его прочность. Титановый сплав
с 4% алюминия, 3% молибдена и 1% ванадия содержит гораздо меньше
алюминия и поэтому в закаленном состоянии имеет больше Р-фазы (молиб-
ден явл^тся более эффективным Р-стабилизатором, нежели ванадии). Поэто-
му в закаленном состоянии его прочность меньше, чем у сплава Ti + 6% А1+
+ 4% V (Ti — 6А1 — 4V), а эффект старения у него больше. Таким образом,
780 Г л ив а 30
в частично закаленном состоянии его обрабатываемость лучше, чем у сплава
П — 6А1 - 4V. Титановый сплав с 16% ванадии и 2,5% алюминия (Ti —
lliV 2,5А1) содержит много р-стабилизирующих и мало а-стабилизирую-
щих добавок. В закаленном состоянии он очень мягок и пластичен, однако
его прочность может быть значитапьно повышена состариванием. Четвертый
сплав из этой группы — с 13% ванадия, 11% хрома и 3% алюминия (Ti —
I3V — ПСг — ЗЛО -является сплавом на основе р-титана. Вследствие
присутствия в таком сплаве большого количества Р-стабилизирующих эле-
ментов (ванадия и хрома) сплав после получения и обычного отжига одно-
фазен и имеет кубическую объемноцентрированную решетку. Распад р-фазы
происходит очень медленно, и поэтому получение достижимой для этого
сплава высокой прочности возможно только при большой продолжительности
состаривания.
Разработка технологии получения промышленной продукции из тер-
мообрабатываемых титановых сплавов производилась общими усилиями про-
изводящих фирм и правительства США 18]. Хотя способность титановых
сплавов воспринимать термообработку исследовалась раньше и подтвержде-
на лабораторными испытаниями, задачи, связанные с ее проведением в про-
мышленных условиях, затрудняли развертывание промышленного выпуска
термообрабатываемых сплавон на основе титана. Понимая необходимость
развертывания в первую очередь производства высокопрочных термообра-
батываемых сплавов. Министерство обороны США наметило трехэтапный
план ускорения разработки ряда новых титановых сплавов. Этапами этого
плана, осуществление которого началось в 1956 г., являлись следующие:
1) изготовление из новых видов титановых сплавов однородных листов с вос-
пронзнодимыми свойствами: 2) получение данных для проектирования;
3) определение самолетостроительными компаниями пригодности и свойств
титановых сплавов. К апрелю 1959 г. этот план был выполнен не полностью.
Однако первая цель выпуск термообрабатываемых сплавов — была пол-
ностью достигнута. Второй и третий этапы выполняются, и первые резуль-
таты свидетельствуют о том, что намеченные планом задания будут успешно
и полностью выполнены. Трудности, связанные с переходом от лабораторной
стадии к промышленной, заключаются в выборе способа производства ров-
ных листов, обладающих после их термической обработки воспроизводимыми
свойствами. Оказанное Министерством обороны США содействие помоиш
промышленникам преодолеть указанные трудности и приобрести необходи-
мый для решения этих задач опыт. В частности, одной из таких решенных
задач явилась закалка больших титановых листов (914,4 ' 2438,4 мм)
без существенного их деформирования. Были разработаны и в настоящее
время применяются три способа закалки титановых сплавов. После нагрева-
ния в качестве тела сопротивления зажатого в специальную оправку целого
листа его закаливают, орошая водой, либо сбрасывая в воду через окно в дне
закалочной печи, либо обрызгивая водой при выходе из печи непосредственно
на рольганге, снабженном приспособлением для выравнивания листа. Вос-
производимость качества поверхности и свопства листа улучшается по мере
совершенствования каждого из этих способов закалки, и в настоящее время
производится материал, пригодный для применения в самолетостроении.
Металлография
Шлифы для металлографического исследования титана и ег(Ясплавов
можно готовить обычными методами. Предварительно образцы шлифуют
су\им или мокрым способом посредством наждачной бумаги различных
Титан
ТРЛВИТПЛИ ДЛЯ ТИТАНА И ЕГО СПЛАВОВ
781
Таблица 13
Состав, иб.%
Плавиковая кислота (^в^о-ная)
1 —10%; остальное вода
Азотная кислота (концентрирован-
ная) 3%; плавиковая кислота
D8-]1ая) 1,5—2"i>, остальное
вода
Плавиковая кислота D8°о-ная)
1 -2%; несколько кристаллов нит-
рата железа; остальное вода
Плавиковая кислота D8%-ная) 1
часть; азотная кислота (концентри-
рованная) 1 часть; глицерин
2 части
Плавиковая кислота D8°и-ная)
1 часть, глицерин 1 часть
Характеристика
Чаще всего в качестве универсального трапи-
теля, окрашивающего u-фазу, применяется
2,5%-ный раствор HF
Наиболее распространенный травитель; приме
няется для травления сплавов па пгноие
р-, а- и (а+Р)-титана; присутствие IlNOj
ухудшает окрашивание
Хороший универсальный травитель; нитрат же-
леза применяется взамен HNO3
Хороший травитель для сплавов на основе
а-титана; взаимодействует быстро; не окра-
шивает шлиф
Применяется для двухфазных сплавов, делает
темной только а-фазу. не окрашивая Р-фазу
и карбиды
номеров (от 60 до 600). После шлифовки образцы полируют на мягком круге.
Шлифовальный станок должен быть быстроходным (около 1750 об/мии).
Для полировки применяются различные абразивные материалы в зависимо-
сти от навыков работника. Чаще всего пользуются крокусом, окисью алю-
миния, кремнеземом и карборундом. Для титана применяется также электро-
литическое полирование. В качестве электролита обычно используют смесь
хлорной кислоты и уксусного ангидрида. Поскольку электролит такого
состава взаимодействует с органическими веществами, то для закрепления
образцов не следует применять бакелит или смолы. Для электрополи-
ровки титана и некоторых его сплавов вполне удовлетворительные резуль-
таты обеспечивает плотность тока 20—30 а/дм2 при напряжении 40—60 «.
Вследствие хорошей коррозионной устойчивости титана все металлографи-
ческие травители должны содержать плавиковую кислоту. Состав чаще всего
применяемых травителс» указан в табл. 13. Некоторые типичные микростру-
ктуры титана и его сплавов воспроизводятся на рис. 6 и 7.
ТЕХНОЛОГИЯ И ПРОИЗВОДСТВО [I, 8, 8]
Плавка
Первым этапом получения титана в форме, пригодной для изготовления
промышленной продукции, является плавка титановой губки, получаемой
по способу Кроля или в процессенатриетермического восстановления. При-
менять для этого индукционную плавку нельзя, так как расплавленный
титан взаимодействует со всеми известными тигельными материалами. Обыч-
но для получения из титановой губки слитка применяют дуговую плавку.
Практически все титановые сплавы получают двукратной дуговой плавкой
\
*Ч г
P н с 6. Типичные микроструктуры
сплавов (а + р)- и р-тнтана.
Л—структура сплава (а-1-Р-)-титана, об-
работанною и отожженного при температу-
ре (а 4- (З)-сбласти. X 250: Б —структура
сплава (а | P)-thtjhh, закаленного с тем-
пературы Р-областн. X 250; В — структу-
ра сплива с неустойчивой Р-фазой, зака-
ленного с температуры fi-областн. Х 250;
Г — стр>ктура сплава с неустойчивой
Р-фазой после медленного охлаждения
с температуры Р-областЮ-, 250.
Р и с. 7. Типичные микроструктуры
сплавов сс-титана.
А — структура нелегированного титана
нли сплава а-титана, отожженных при
температуре осбласти.Х 100; Б — струк-
тура иелегированного титана или сплава
а-титаиа. закаленных с температуры ct-об-
ласти. X 250; В —структура содержаще-
го карбиды сплава а-титаиа, отожженного
прн температуре области (Офаза+карбид).
X 250; Г—структура сплава п-титаии.
содержащего водород; вндны включения
TiH в виде линий. X 100.
Титан 783
с применением расходуемых электродов. Плавку проводят в вакууме при
большой силе тока и малом напряжении. Расплавленный металл отливается
в водоохлаждаемые медные изложницы диаметром от 304,8 до 635 мм. Медь
может применяться в качестве материала изложницы потому, что титан за-
твердевает в месте контакта с медью и образует при этом изолирующую обо-
лочку (гарнисаж). Полученные после первой плавки слитки диаметром
304,8—406,4 мм соединяют по два (или больше) и повторно переплавляют
в виде расходуемых электродов в большие слитки диаметром от 508 до
635 мм, имеющие вес от 1814 до 2265 кг.
Плавка титана в дуговых печах с расходуемым электродом позволяет
производить отливку в вакууме. Такая отливка требует наличия глубоком
лужи расплавленного металла и применения изложницы из материала, не
загрязняющего металл. После расплавления загрузки печь наклоняют
и расплавленный металл выливают в изложницу. В печи диаметром 356—
381 мм получали отливки весом около 75 кг. В качестве материала для изго-
товления изложницы весьма успешно применяли графит.
Методы обработки
За исключением плавки, все процессы обработки титана могут прово-
диться обычными методами. Необходимо только при обработке давлением
или термической обработке не перегревать металл для получения желаемой
структуры во избежание его загрязнения кислородом. Температура ковки
зависит от состава сплава. Обычно максимальная температура ковки не
должна превышать 1038, а прокатки — 871". Поскольку титан склонен
к задирам и наволакиванию, то при его волочении и выдавливании необ-
ходимо применять специальные противозадирные смазки. Изготовление iHy-
тых деталей фасонных профилей не сопряжено с трудностями, если вытяжка
заготовки нь превышает 10°/0.Титан и особенно его сплавы сильно пружинят,
поэтому во многих случаях изгибания приходится подвергать их нагреву
до 260—316°, что одновременно предотвращает и растрескивание.
Склонность титана к задирам и наволакиванию оказывает влияние и на
его обрабатываемость резанием. Известно, что обрабатываемость титана и его
сплавов резанием зависит от их твердости и прочности. Чем прочнее титано-
вая заготовка, тем труднее она поддается механической обработке. Прак-
тически обработку титана резанием рекомендуется вести на малых скоростях
резаиия и с большой подачей. Рабочий инструмент следует усиленно охлаж-
дать с помощью обыкновенно применяемых масел с добавкой хлорированных
растворителей вроде четыреххлористого углерода. Шлифовку также следует
проводить на малых скоростях с весьма интенсивным охлаждением инстру-
мента.
Соединение титана с титаном можно осуществлять при помощи панки,
клепки или сварки. При клепке пользуются заклепками из нержавеющей
стали, моиель-металла или титана. Заклепки из нержавеющей стали или
монель-металла требуют меньших усилий во время клепки, чем титановые,
и, кроме того, они не образуют гальванической пары. Сварку титана можно
проводить с помощью электрической дуги в защитной атмосфере. Если при
сварке технического титана не происходит загрязнения свариваемого метал-
ла, то сварной шов обладает достаточной пластичностью и по прочности
не уступает основному металлу. Сплавы титана свариваются хуже техниче-
ского титана. При сварке существующих промышленных сплавов сварной
шов получается хрупким. Причиной возникновения хрупкости могут быть
закалочные явления, связанные с аллотропическими превращениями
784 Г лав а 30
и большой скоростью охлаждения металла после сварки, а также сегрега-
ция при затвердевании. Охрупчивание, вызванное упрочнением при превра-
щении, можно устранить послесварочной термической обработкой
с нагревом ниже температуры превращения. Предупредить же возникновение
хрупкости в результате сегрегации неудастся. Кислород, азот и углерод вре-
дят пластичности сварного шва. Поэтому содержание этих элементов долж-
но быть минимальным. В настоящее время разработаны сплавы средней
прочности, которые можно подвергать сварке, не опасаясь возникновения
хрупкости.
Прокатку титана в полосы и в прутковый материал проводят на том же
оборудовании, что и для нержавеющей стали. Практически с цельюлучшего
использовании оборудования прокатку титана чередуют с прокаткой нержа-
веющей стали. В промышленном масштабе, например, титан прокатывают
в полосу шириной 0,91 м, толщиной 0,4мм и длиной несколько сотен метров.
Для изготовления титановых труб успешно применяется выдавливание.
В настоящее время в промышленности осуществляется волочение проволоки
и тонкостенных труб, хотя обработка титана труднее, чем обработка стали.
ОБЛАСТИ ПРИМЕНРНИЯ ТИТАНА
Титан и титановые сплавы находят основное применение для военных
целей, особенно в авиации и ракетной технике, где большое значение имеет
уменьшение веса. Специальная область их применения — or цистерн с жид-
ким кислородом для ракетного топлива до деталей компрессоров ракетных
двигателей, работающих в интервале температур от —196 до ,-482°. В ука-
занном температурном интервале работает множество конструкционных
и неконструкционных деталей самолетов, такие, как обшивка, турбины реак-
тивных двигателей, крепления, лонжероны и другие детали фюзеляжа.
При выборе титанового сплава для изготовления специальных деталей
исходят из величины отношения прочности к весу и из способности этого
сплава быть использованным для изготовления данной детали. Хотя боль-
шая прочность и малый удельный вес титановых сплавов являются их основ-
ными качествами, некоторые области применения требуют наличия таких
свойств, которыми обладает сам титан. Так, например, титан применяется
с целью предотвращения растрескивания деталей в некоторых типах само-
летов. Растрескивание в титане происходит с гораздо меньшей скоростью,
нежели в других металлах, и поэтому он, как более надежный, применяется
в местах, наиболее подверженных трещинообразоианию. Благодаря плохой
теплопроводности другой областью применения титана является изготовле-
ние противопожарных перегородок. Применение титана для невоенных
целен основывается па его превосходной коррозионнойустойчивости, и хотя
объем его потреблении в этой области остается незначительным посравнению
с военной, спрос на него в качестве коррозионноустончивого материала не-
прерывно увеличивается. Насосы, фильтровальные ткани, трубы теплообмен-
ников и вей гили промышленного оборудования подвергаются воздействию
влажных хлоридов и растворов гипохлоритов. Титан обладает превосходной
устойчивостью против воздействия влажного хлора. Устойчивость титана
против окисляющего воздействия кислот позволяет применять его для изго-
товления теплообменников, работающих в присутствии 35—С0% -ной азотной
кислоты. Однако он не пригоден для работы в дымящей азотной кислоте.
Из титана изготовляют завески ванн для анодирования, поскольку он н
взаимодействует с электролитом.
Титан 785
Превосходная стойкость в морской воде позволяет широко применять
титан во флоте, где он служит для изготовления валов гребных винтов, распо-
рок, подшипников, кронбалок, оснастки и ряда других деталей, подвергаю-
щихся воздействию морском воды. Небольшой, но очень важной областью
применения титана является катодная защита обшивки кораблей. Небольшой
покрытый платиной титановый анод обеспечивает катодную защиту против
коррозии в морской воде.
ЛИТЕРАТУРА
1. Abkowitz S., Burkc J. J., H i 1 t z R. H., .Ir.. Titanium in Industry,
D. Van Nostrand Company, Inc., Princeton, N. J., 1955
2. В a r k s d a 1 e J., Titanium, Its Occurrence, Chemistry, and Technology, The
Ronald Press Company, New York, 1949.
3. Cliem. Eng., 65, 124 A958).
4. Frost P. D., Metal Progr.. 75, № 3, 99; № 4, 91 A959).
5. Harris W. J.. Jr., J. Metals, 10, 19 A958).
6. Harris W. J , Jr., S i m с о е С R., О g d e n H. R., Department of Defense
Titanium Sheet Rolling Program, Reports TML J* 46, 46A, 46В, 46С, 46D, 46E,
and 16F, Defense Metals Information Center, Battelle Memorial Institute, Colum-
bus, Ohio, 1955—1959.
7 J a f f e e R. I., Modern Metals, 14, 46 A948).
8. J a f f с e R. I., The Physical Metallurgy of Titanium Alloys, Progress in Metal
Physics, Vol. 7, Pergainon Press, New York, 1958.
9. К г о I I W. .1., Metal Ind., 343 (May 2, 1952).
10. McQuillan A. D., McQuillan M. K.., Titanium. Academic Press,
Inc. New York, 1956.
11. Nittle J.R., Baker D. H., Jr., W а г t m a n F. S., U. S. Bureau of Mines,
Rept. Invest. № 5315, 1957.
12. S i b e r t M. E., Steinberg M. A., J. Metals, 1162—1168 (September 1956).
13. V a ii A r k с 1 A. E., d e В о e r J. H., Z. anorg. Chem., 148. 345 A925).
14 L e p k о w s k i W. J., H о 1 1 a d а у J. W., TML Rep. № 73, July 25, 1957,
Titanium Metallurgical Laboratory, Battelle Memorial Institute, Columbus, Ohio.
50 Заказ № 239
31.
ТОРИЙ
Г. А. УИЛХРЛМ
И. A. Wilhelm, Institute for Atomic Research
and Ames Laboratory of, the United Stales Atomic
Energy Commission, Iowa State University Ames,
Iowa
ВВЕДЕНИЕ
Открытие тория приписывают Бсрцелиусу, который в 1828 г. сообщил
о выделении новой «земли» из минерала, найденного вблизи норвежского
города Бревика. Свое название торий получил по имени скандинавского
бога войны Тора [35].
Торий и его двуокись привлекли к себе внимание лишь в 1884 г., когда
Вельсбах запатентовал газокалильную сетку из двуокиси тория с добавкой
1% двуокиси церия [63]. Последующий рост производства калильных
сеток дал толчок поисковым работам, разведке месторождений тория и рас-
ширению производства его двуокиси. Производство газокалильных сеток
достигло наибольших масштабов в начале XX века; затем, по мере того как
газовое освещение стали заменять электрическим, спрос на тории начал со-
кращаться и к 1925 г. резко упал.
Однако редкоземельные элементы, являвшиеся побочными продуктами
переработки ториевых руд, вскоре начали находить промышленное приме-
нение, и после 1932 г. переработка руды с целью извлечения содержавшихся
в ней редкоземельных элементов превратила торий в избыточный побочный
продукт. В результате в США были созданы запасы тория, которые впослед-
ствии использовались для производства атомной энергии. До последних лет,
не считая энергетических целей, торий применялся главным образом в произ-
водстве газокалильных сеток [56]; в 1950 г. свыше 90% всего потребления
тория, за исключением расхода для энергетических целей, все еще прихо-
дилось на производство газокалильных сеток.
В последнее время потребление тория для различных целен, кроме
энергетических, значительно возросло в связи с применением его в качестве
легирующей добавки при производстве сплавов на магниевой основе; при-
садка тория к магнию в количестве нескольких процентов дает легкий сплав
с повышенной термостойкостью.
В табл. 1 приводятся данные о разрешенном Комиссией по атомной
энергии США потреблении соединений тория в США за 1952—1958 гг. для
различных промышленных целей (за исключением энергетических) |56].
Приведенные цифры не дают представления об общем потреблении то-
рия, поскольку данные об импорте и экспорте руд, концентратов, металла
и сплавов, находящихся под контролем КАЭ США, не публикуются.
Торий может служить ядерным топливом для получения атомной энер-
гии [77]. Th232 можно превратить в делящийся элемент U233, подобно тому
как изотоп U23fi превращается в делящийся Ри239. В результате захвата иен-
трона изотопом Th232 образуется Th233, что вызывает спад радиоактивности,
согласно реакции
> Ths» р2зз(j233
Торий
787
Таблица ]
РАЗРЕШЕННОЕ КАЭ США ПОТРЕБЛЕНИЕ СОЕДИНЕНИЙ ТОРИЯ В США ДЛЯ РАЗЛИЧНЫХ
ПРОМЫШЛЕННЫХ UFJlEfl, ЗА ИСКЛЮЧЕНИЕМ ЭНЕРГЕТИЧЕСКИХ (кг ThOs)
Отрасль промышлен-
ности
Магниевые сплавы
Производство газо-
калильных сеток
Огнеупоры и шлифо-
вальные составы
Химические продукты
и медикаменты
Электроника
Всего (ThO2)
1952
11533
523
5 018
125
17 199
|9.тЗ
1632
3945
106
2348
554
8585
1854
2107
4428
11
1695
914
9155
1955
[0861
20 214
455
1757
415
33 702
1956 я
22 680
18 144
91
IRI4
453
43 182
1957 а
45 359
18 144
1814
453
65 770
54J431
18 144
2 268
2 721
453
78 017
Орнентнрогтчпп
Действие U233 в цепной реакции деления ядер аналогично действию U235
или Ри239 в производстве атомной энергии. Интерес, проявляемый к торию
для указанной области применения, объясняется его большей распростра-
ненностью D земной коре по сравнению с ураном: содержание урана состав-
ляет 0,0004%, тория — 0,0012% [26]. Как показывают эти цифры, торий не
является редким элементом и распространен не менее, чем свинец и молиб-
ден. Считают, что содержащийся в земной коре торий может дать большее
количество энергии, чем уран и добываемое из недр земли топливо, вместе
взятые.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
Торий встречается в целом ряде минералов вместе с ураном и редкозе-
мельными элементами [24J. Минералы с высоким содержанием тория, напри-
мер торианит (ThO2 + UO2)* и торит ThSiO4, попадаются редко.
Главным источником получения двуокиси тория и металлического тория
является монацит, представляющий собой в основном фосфат редкоземель-
ных элементов цериевой подгруппы**. Этому минералу сопутствуют кремне-
зем и ряд других минералов, входящих в состав так называемых монацито-
вых песков. Содержание двуокиси тория в концентратах монацитовых пес-
ков достигает 10°0.
Месторождения монацита в Траванкоре (Индия) и Бразилии разраба-
тываются уже на протяжении многих лет. Монацитовые пески встречаются
также в Австралии, на Цейлоне, в Африке, Канаде и в США — в штатах
Айдахо, Флорида, Колорадо, Северная Каролина и Южная Каролина.
Наиболее значительные разведанные месторождения монацита располо-
жены на Траванкорском побережье. Концентраты из этих песков содержат
* (Th,U)O2; содержит 60—90% ThO2, а также UO2 и часто Се^О,, и ZrO2.—
Прим. ред.
** (Се, La)PO4.— Прим. ред.
50*
788 Глава 31
обычно около 9% двуокиси тория. В течение многих лет они служили глав-
ным источником получения двуокиси тория для удовлетворения спроса
в США, пока вскоре после второй мировой войны Индия не наложила эмбар-
го на экспорт этих концентратов. В 1952 г. правительство Индии заключило
с двумя французскими фирмами соглашение о переработке монацита. Эти
фирмы ежегодно выпускают 1500 т концентратов, получают торий и соедине-
ния редкоземельных элементов. По данным проведенных недавно предвари-
тельных изысканий, в Северо-Восточной Индии имеются еще более крупные
и богатые месторождения тория.
Геологические запасы бразильских месторождений оцениваются в
150 000 т монацита; содержание двуокиси тория в концентратах составляет
около С"о. С 1945 г. этот монацит перерабатывается в больших количествах
иа заводе в Сан-Пауло (Бразилия).
Концентраты, получаемые при разработке монацитовых месторождений
США, обычно содержат не более 4% двуокиси тория. В последние годы зна-
чительная часть потребности США в монаците по-прежнему удовлетворялась
за счет его импорта из Южно-Африканской Республики.
ПЕРЕРАБОТКА МОНАЦИТА
Извлечение соединений тория из монацита своцигся к отделению этого
элемента (в сравнительно небольших концентрациях) от редкоземельных
элементов. Эта проблема сопряжена с целым рядом технических трудностей.
В промышленной практике для вскрытия ториевых руд применяются два
химических способа. Сернокислотный способ применяется уже несколько
десятков лет. тогда как щелочному способу лишь недавно стали уделять зна-
чительное внимание.
В США наиболеераспростраиеннымспособом является обработка измель-
ченного монацита горячен серной кислотой, в результате которой торий
и редкоземельные элементы переходят в раствор. Отпошениедвуокиси тория
к редкоземельным элементам в растворе равно примерно 1 : 12. На заводах
Индии и Бразилии для разложения монацита используется едкий натр. Как
правило, на первой стадии щелочного процесса получают гидроокиси тория
н редкоземельных элементов и в качестве побочного продукта растворимый
средний фосфат натрия. После промывки гидроокиси растворяют в соляной
кислоте и получают раствор, содержащий торий и редкоземельные эле-
менты.
Ввиду того что растворы после обработки монацита серной кислотой
или раствором едкого натра представляют собой сложные смеси, содержащие
многие элементы, включая уран, существует несколько вариантов дальней-
шей их обработки с целью выделения тория, редкоземельных элементов
и богатых ураном фракций с последующей окончательной очисткой. Некото-
рые технологические схемы сернокислотного способа, используемые в про-
мышленной практике, предусматривают ступенчатую обработку, основанную
на различии в растворимости соединений тория и редкоземельных элементов
и па их избирательном осаждении. Для отделения тория от редкоземельных
элементов применяют сульфат, двойной сульфат, оксалат, двойной карбонат,
иодат, нитрат и другие соединения тория. Один из вариантов основан на ма-
лой растворимости Th(SOJ2-8H2Ono сравнению с сульфатами церия, неоди-
ма, празеодима и лантана. Двойной сульфат тория и натрия можно осаждать
из разбавленного раствора сульфата тория. При использовании карбонат-
ного способа торий образует растворимый двойной карбонат, а церий осаж-
Торий _ 789
дается. Путем осаждения тория из сильнокислого раствора в видеоксалата
его отделяют от незначительных количеств редкоземельных элементов
и обычных металлов. Иодатнын способ, который заключается в осаждении
иодата тория из достаточно концентрированного азотнокислого раствора,
обеспечивает полное отделение тория от редкоземельных элементен и обыч-
ных металлов. Однако осуществление этого способа в промышленном мас-
штабе обходится дорого. Одной из стадий всех указанных выше способов
является кристаллизация нитрата тория. Путем дальнейшей обработки
можно получить соединение тория более высокой степени чистоты. Готовый
продукт, получаемый в настоящее время на одном предприятии, на котором
применяется процесс, основанный на различии в растворимости и избира-
тельном осаждении, представляет собой двуокись тория с содержанием
0,002—0,01 вес.% редкоземельных элементов, достаточно чистую для произ-
водства нитрата тория надлежащего качества, предназначенного для изго-
товления газокалильных сеток. Вышеупомянутые способы подробно описаны
Леви [47], Спенсером [751, Юр и [781, а также Пилкингтопом и Уайли [621,
Гримальди и Маршем [28], Диксоном и Кауфманом [181.
В последнее время разработаны варианты [55] описанных выше процес-
сов, обеспечивающие получение соединений тория более высокой степени
чистоты в соответствии с требованиями ядерной энергетики, а также упрощен
сам процесс. Раствор после обработки руды серной кислотой или едким нат-
ром подвергают химической переработке с целью получения азотнокислого
раствора, который является обогащенной торием фракцией, свободной
от сульфатов и фосфатов. В этих процессах окончательная очистка осущест-
вляется экстракцией растворителями тория, содержащегося в азотнокислом
растворе.
По одному варианту сернокислотного процесса переработки монацита
применяют 93%-ную серную кислоту при температуре 210г. Полученные
сульфаты растворяют в воде, отделяют их от нерастворимых соединении
и затем обрабатывают водным раствором аммиака до рН 1,0. После этого
добавляют раствор щавелевой кислоты для осаждения тория и редкоземель-
ных элементов, отделяя их таким образом от сульфат-, фосфат- и урапил-
ионов. Осадок оксалатов отделяют и прокаливают, а полученные окислы
растворяют в азотной кислоте, в результате чего образуется исходный вод-
ный раствор для экстракции трибутилфосфатом. Торип и церийAУ) экстра-
гируются в органическую фазу, остальные редкоземельные элементы остают-
ся в водной фазе. Для отделения церия от трибутилфосфата и его соединений
с торием применяют 0,1 М раствор нитрита натрия, после, чего отделяют то-
рий 2%-ным водным раствором серной кислоты. Этот метод обеспечивает
эффективное разделение и получение тория высокой степени чистоты, а также
редкоземельных элементов и урана.
На рис. 1 приведен вариант щелочного процесса в комбинации с экстрак-
цией растворителями. В этом случае для вскрытия руды используется реак-
ция тонкоизмельчеппого монацита с 45%-ным раствором едкого натра при
138°. Получаемые нерастворимые в воде соединения тория, урана и редко-
земельных элементов фильтруют, промывают и затем растворяют в 37%-ной
соляной кислоте при 80". Непрореагировавшую руду или другие нераство-
римые вещества, в случае их наличия, отделяют от раствора, который затем
обрабатывают едким натром до рН 5,8 для осаждения тория и урана. Этот
осадок, который содержит также незначительное количество некоторых
редкоземельных элементов, растворяют в азотной кислоте. Затем торип и
уран отделяют от остатков редкоземельных элементов в растворе азотной кис-
лоты экстракцией трибутилфосфатом; разбавленным инертным органичес-
790
Глава 31
ким растворителем. Очищенный торий отделяют от растворителя и урана
избирательной реэкстракцией водным раствором азотной-кислоты.
Монацит
?Z$>
Измельчение
до
~37S меш
Одрайотпа I u n
|
Нристаллизо
uuv
Фильтрат
NuOH.Nu^PC,
I
Фипьтрова
ние
при 82°
Гасадоп Zuffpnmoe ,
вт/слое
!ЗЭ
Конц.
НТО
37%-шя
HGL
Фильтрат
1В отвал)
НТО,
Военныйраствор "]
нитратов \
Th,V, P33 J
Органический
растворитель
Органическая
фаза с уран
Рис I. Схема ще-
лочного процесса пе-
реработки монацита с
последующим получе-
нием соединений чи-
стого тория методом
экстракции раствори-
телями.
Водная таза г
чистым тсрисл*
Новые и более подробные описания указанных выше и других процес-
сов извлечения тория из монацита приведены в статьях Баргузена и Шмут-
ца 155] и Катберта [14]*.
ПОЛУЧЕНИЕ МЕТАЛЛИЧЕСКОГО ТОРИЯ
Металлургия тория в некотором отношении сходна с металлургией цир-
кония и титана. Подобно двуокисям циркония и титана, двуокись тория не
• См. также монографию Г. Е. Каплина, Т. А. Успенской, IO. И. Зарембо,
II В Чиркопа «Торий, его сырьевые ресурсы, химия и технология», Атомпздат,
Москва, I960.— Прим. ргд.
Торий 791
восстанавливается водородом; углерод и кремний также, мало' пригодны
для этой цели.
Влияние газов, особенно кислорода и азота, на механическую обраба-
тываемость тория слабее, чем в случае циркония и титана; по-видимому,
способность тория к образованию твердых растворов внедрения с этими газа-
ми незначительна. Кислород содержится в виде неравномерно распределен-
ной двуокиси тория. Такого рода включения не препятствуют механической
обработке, даже если их содержание, достигает 3 вес. %.
С 1829 г., когда торий был впервые получен Берцелиусом [5], металли-
ческий тории получали в небольших количествах и различной степени чисто-
ты многими методами. Берцелиус получал загрязненный порошок тория вос-
становлением тетрахлорида тория щелочным металлом (калием). При повтор-
ном проведении этого процесса рядом исследователей, в частности Болтоном
[80], Лели и Гамбергером [45] и Арсемом 11], был получен металл с содер-
жанием значительного количества двуокиси тория и, видимо, карбида
тория. Неудачные попытки получить сравнительно чистый продукт объяс-
няются главным образом наличием примесей в восстановителях и отсутствием
надлежащего оборудования, а не ошибочными металлургическими приемами.
Недавно удалось получить торий более высокой степени чистоты по но-
вым вариантам процесса восстановления тетрахлорида тория щелочным
металлом. В работе Блока [77] приведено краткое описание метода восста-
новления тетрахлорида тория металлическим натрием в атмосфере гелия.
В результате восстановления получают губчатый торий, переплавляемым
затем в слиток.
Реакция между тетрахлоридом тория и металлическим натрием иниции-
руется нагреванием реакционной смеси до температуры около 525°; обработ-
ка продолжается с последующим подогревом до 800° в течение примерно
10 час. Полученный губчатый торий освобождают от хлорида нагрия, обра-
зующегося в качестве побочного продукта, и избытка натрия из загрузки
путем нагревания в вакууме при 900" в течение 16 час. После этого губку
прессуют в заготовки, которые затем переплавляют в компактный металл.
Разработка этого метода получения металлического тория и некоторых дру-
гих методов (например, восстановление тетрахлорида тория металлическим
магнием) тормозится главным образом трудностью экономичного получения
тетрахлорида тория высокой степени чистоты.
Другим вариантом метода восстановления тетрахлорида тория щелоч-
ным металлом является процесс «металлскс», подробно описанный Дипом
177]. По этому варианту тетрахлорид тория вступает в реакцию с металличе-
ским натрием в разбавленной амальгаме натрия с образованием соединения
тория с ртутью, связанного с ртутной фазой. Это позволяет отделять дву-
окись, загрязняющую тетрахлорид тория, от металлической фазы. Полу-
ченная амальгама содержит около 1 % тория в виде суспензии соединения;
для доведения концентрации тория примерно до 1596 удаляют избыток жид-
коп ртути из твердого иитерметаллического соединения ThHg3 прессовани-
ем. Последующая вакуумная дистилляция дает губчатый торий, свободный
от ртути, который превращают в компактный металл дуговой плавкой. Этим
методом получают металлический тории высокой степени чистоты, но необ-
ходимость применения больших количеств ртути A00 частей на 1 часть
металлического тория) является большим недостатком, так как этот металл
весьма токсичен.
В промышленной практике металлический торий сравнительно высокой
степени чистоты получают следующими методами: 1) восстановлением
двуокиси тория кальцием; 2) электролизом расплавленных галогенидов
792
Глава 31
тория и 3) восстановлением ThF4 кальцием (с добавкой, хлорида цинка)
в бомбе.
Первичным продуктом первых двух процессов является порошок тория,
превращаемый в компактный металл методом порошковой. металлургии.
Ввиду пирофорпости порошка тория с ним следует обращаться осторожно.
Первичным продуктом третьего процесса является компактный сплав, при
последующей переработке которого получают губчатый торий, который затем
переплавляют в компактный металл.
Порошок тория
Получение порошка тория восстановлением двуокиси юрия кальцием.
Процесс восстановления двуокиси тория кальцием исследовали Бергер 14],
/Г вануум-
ОхлаяЗиющая
еада
Р и с. 2. Аппаратура для процесса восстановления («Электро-
кемикл сосайти»).
/ —ловушка, охлаждаемая жидким вс духом; 'J —трубка I ейслер.|;
л — линуиича для I.I*,i: 4 M,uioMCT[i; 5 внкорпвая колба; 6 — реаь-
циоиная смесь; 7 — сосуд; 1 - изолятор.
Кузел и Ведскинд [44] и Кроль 143]. Этот основной метод позволяет получать
металл сравнительно высокой степени чистоты, но он сопряжен с теми же
трудностями, что и восстановление хлорида тория.
Марден и Ренчлер [52] подробно исследовали процесс восстановления
двуокиси тория кальцием. Их метод восстановления основан на сле-
дующей реакции:
ThO, 2Со( | 2,4СаС1,) :
Торий 793
Для осуществления этой реакции требуется избыток кальция в количе-
стве 3 молей.
Реакционную смесь нагревали в закрытой стальной бомбе в печи с газо-
вым обогревом и выдерживали при 950° в течение 1 час. После охлаждения
продукт реакции выщелачивали водой, затем разбавленной азотной кисло-
той A : 10) и промывали спиртом и эфиром. Полученный, металлический
порошок высушивали в вакууме. После прессования и спекания компактный
металл содержал 99,7- 99,8?-о тория; он отличался хорошей ковкостью
и применялся для изготовления проволоки и листов.
Этот метод был усовершенствован Ренчлером и сотр. [68]: хлорид каль-
ция не вводили в реакцию, а стальная бомба была заменена тонкостенным
сосудом. Реакция проводилась при постоянном давлении в атмосфере арго-
на. Схема аппаратуры для восстановления показана на рис. 2. Подробное
описание метода приводится в работе [68]. Реакционную смесь нагревали
токами высокой частоты с помощью катушек в виде обмоток (на рисунке не
показано) на викоровом цилиндре. Воспроизводимость опытов, трудно дости-
гаемая в закрытой бомбе, при этом методе весьма хорошая; получаемый
металл содержит 99,8% тория. Процесс протекает по следующей реакции:
Т1Ю2 , 2Са 5
Для реакции требуется избыток кальция в количестве 2 молей.
Порошок тория получают после выщелачивания растворимых продуктов
реакции разбавленной уксусной кислотой, водой и промывки остатка спир-
том и диэтиловым эфиром с последующей сушкой в вакууме.
При замене двуокиси тория ТЬСЦ или Т1ЮС12 получают крупнозерни-
стый металл [49]. Эспе |21] даст обзор методов получения порошка метал-
лического тория восстановлением двуокиси кальцием. Меерсоп [53] предста-
вил доклад о проведенном им исследовании процесса восстановления дву-
окиси тория металлическим кальцием.
Получение порошка тория электролизом расплавленных солей. Элек-
тролиз безводного хлорида тория в расплавленной смеси хлоридов натрия
и калия провоцилн Муассан и Хопигшмидт [57] и Вартенберг [811. Смесь
расплавлялась в графитовом тигле, который служил катодом. Получавшийся
продукт содержал 87- 88% металлического тория.
Дрнггс и Лилиендаль [191 добились успешного получения порошкооб-
разного металлического тория электролизом расплавленных солей. Электро-
литом служила смесь хлоридов натрия и калия (взятая в соотношении 1 : 1
по весу) с двойным фторидом ThF4-KF.
Порошкообразный торий в смеси с захваченными солями осаждался
на молибденовом катоде, подвешенном в середине графитового тигля. По
окончании электролиза катод вместе с осадком медленно вынимали из элек-
тролита, который застывал, образуя покрытие, предохраняющее осадок от
окисления. Затем в ваниу снова вводили двойной фторид и возобновляли элек-
тролиз. На рис. 3 показан применявшийся для данной цели электролизер.
Одним из недостатков этого метода является непостоянное соотношение
хлорида и фторида в расплаве солей, обусловленное добавкой фторида и вы-
делением хлора в процессе электролиза; в результате приходится часто регу-
лировать состав расплава солей или изменять его. Для устранения этого
недостатка необходимо, чтобы из расплава солей при электролизе выделя-
лись только введенные в него элементы. Этого можно достигнуть добавкой
хлорида тория и электролитическим выделением тория и хлора. Однако
внедрению этой практики препятствует трудность получения безводного
794
Глава 31
тетрахлорида тория высокой степени чистоты Рейне [77] рассматривает
различные методы получения хлорида тория для последующего электролиза
и описывает способ получения металлического тория непрерывным электро-
лизом хлорида тория в расплаве хлорида натрия.
При электролитическом получении тория осадок после снятия с катода
измельчают, выщелачивают солевые массы и сушат металл, получая порошок
Молибден
——— —d
Расплав 1
П
¦: :¦"'¦'¦: .?* »*i:.
Графитовый
тигель
Порошок мргтл-
лического тория
и jameepdeeaiue
соли
Рис. 3. Схема электролизера.
в виде свободных кристаллов. Этот порошок легко превращается в ком-
пактным металл методом порошковой металлургии.
Свойства металлических порошков. Степень чистоты конечного продук-
та, получаемого методом порошковой металлургии, зависит не только от тер-
модинамики процесса на стадии восстановления, во и от активности метал-
лического порошка в процессе его получения, особенно в отношении образо-
вания двуокиси. Из-за большой общей поверхности порошков обычно обра-
зуется 0,1—0,2% окислов, загрязняющих продукт, если они не удаляются
в процессе дальнейшей обработки, например при литье. Это наблюдается
в случае таких металлов, как торий, титан и цирконий.
Порошки, получаемые кальциетермическим восстановлением двуокиси
тория, по содержанию примесей и размерам частиц отличаются от порошков,
получаемых электролизом двойного фторида в расплавленных солях. Элек-
тролитические порошки отличаются более крупнозернистой структурой;
25—30% порошков, полученных электролизом, имеют крупность +100 меш,
в то время как обычно не более 1 2% порошков кальциетермического про-
цесса имеет ту же величину частиц, а основная масса проходит через сито
—200 меш.
Все порошки содержат относительно большое количество водорода,
который может быть удален нагреванием в вакууме до 1000е.
Химическая чистота порошка тория зависит от содержания примесей
в исходных реагентах и загрязнений, вносимых при проведении процесса.
При кальциетермическом восстановлении происходит загрязнение железом
из применяемой аппаратуры, углеродом из карбида, присутствующего
в кальции, и кальцием, оставшимся после выщелачивания кислотой.
Электролитические порошки обычно содержат несколько Меньше прн-
месеп, чем порошки, полученные кальциетермическим восстановлением.
Основными примесями являются железо, углерод, кремний и молибден
(из молибденового катода). Иногда встречается также незначительная при-
месь фторидов.
Торий 795
Загрязнение порошков азотом довольно незначительно, так как нитрид
неустойчив в присутствии паров воды при сравнительно низких темпера-
турах.
Прессование порошков. Выбор метода прессования определяется раз-
мерами и формой готового изделия. Для заготовок под прокат, толщина кото-
рых после спекания не превышает 12,7 мм, можно применять пресс-формы
из закаленной стали с твердостью Rc 20—30. Прессование производится на
гидравлическом прессе под давлением 3,1—7,75 т/см2. При изготовлении
стальных пресс-форм необходимо учитывать усадку заготовок на 10—15°»
в процессе последующего спекания. Ввиду того что порошок тория прили-
пает к стальным пресс-формам, последние смазывают специальным соста-
вом стеротекс. Во избежание загрязнения спрессованного порошка углеро-
дом в процессе спекания смазка должна быть умеренной.
При получении заготовок относительно большого сечения рекомен-
дуется применять гидростатическое прессование. Порошок помещают в рези-
новую трубку, герметически закрытую с обоих концов, и затем опускают
ее в заполненный водой цилиндр пресса. При помощи соответствующего
насоси создают давление 1,5—2,3 т/см*. Этим методом прессования получают
компактный металл более однородной плотности, чем при использовании
обычных пресс-форм. Меерсон [53] исследовал процесс прессования порош-
ков тория, полученных электролизом и кальциетермическим восстановле-
нием двуокиси тория, и пришел к следующим выводам.
1. Порошок тория обладает высокой пластичностью и хорошей прес-
сусмостью.
2. 11рессуемость электролитических порошков хуже, чем кальцие-
термическнх.
3. Дли получения брикетов с плотностью 10,5—11,0 г/см" при отно-
шении длины к диаметру ~0.5 и при одностороннем прессовании или при
отношении -~1,0 и двустороннем прессовании необходимо давление 7—
11 т/см2 для кальциетермических порошков и 6—8 т/см2 для электролити-
ческих порошков.
Спекание штабикав тория. Путем спекания в вакууме 1 -10~4 мм рт.ст.
или выше при температуре 1200" достигается относительно высокая плот-
ность спрессованных штабиков тория. В случае дегазации штабиков тория
в вакууме при 1000" окончательное спекание можно проводить в атмосфере
аргона или гелия.
Для спекания применяется аппаратура различных типов. Могут быть
использованы фарфоровые или силлиманитовые трубки, но их термостой-
кость, особенно при внутреннем диаметре более 25 мм, недостаточна. При
температурах выше 1000° эти трубки проницаемы для воздуха, в результате
диффузии которого происходит частичное окисление тория. Увеличение
содержания двуокиси тория в штабиках, спеченных в течение 3 -4 час
при 1300° в тщательно подобранных трубках, не должно превышать
0,2 вес. %. При этом плотность спеченного металла составляет 11,3—11,4 г/см*,
т. е. около 98%' теоретического значения.
Согласно Меерсону Г53], при прессовании "кальциетермических порош-
ков до плотности выше 10,3 г/см3, при наличии в них примеси окиси кальция,
могут происходить вспучивание и растрескивание брикетов в процессе
их спекания в вакууме при температуре выше 1 ПH°. В результате реакции
между окисью кальция и торием в процессе спекания образуются пары каль-
ция, что создает внутреннее давление в брикете. Менее плотные брикеты,
большая пористость которых облегчает улетучивание паров кальция,
796
Глава 31
спекались вполне удовлетворительно, и конечный продукт спекания содер-
жал меньше кальция. При спекании сильно спрессованных брикетов элек-
тролитических порошков вспучивания и растрескивания не наблюдалось.
Плавка штибиКов тория и прессование. Порошок тория плавят после
прессования путем индукционного нагревания в вакууме. При выборе под-
ходящего огнеупорного материала для расплавленного металла учитывают
целый ряд факторов.Наилучшим материалом для тигля является окись берил-
лия; расплавленный металл не смачивает ее, и загрязнение бериллием обычно
Рис. 4. Вакуумная индукционная плавильная
печь небольшого размера («Электрокемикл со-
сайти»).
не превышает 0,01—0,02%. Схема печи для плавки порошка тория показана
на рис. 4. Катушка для нагрева токами высокой частоты намотана на вико-
ровый цилиндр, установленный на снабженной трубками латунной плите.
Тигель из окиси бериллия поддерживается алундовым тиглем, в котором
находится двуокись тория или другая тугоплавкая окись.
При плавке в тигле нз окиси бериллия в тории, по-видимому, растворяет-
ся некоторое количество кислорода. Томпсон [76] при определении темпе-
ратуры плавления тория установил, что расплавленный торий реагирует
с углеродом, окисью алюминия и двуокисью тория. Однако растворимость
окиси бериллия в тории незначительна. Дуговую плавку спрессованных
штабнков порошка тория в небольшом масштабе осуществил Ноланд 155],
который применял электрод с вольфрамовым наконечником н проводил
плавку с нерасходуемым электродом, и Рейне [77], использовавший в
качестве расходуемых электродов спрессованные штабики.
Порошок тория превращают в компактный металл горячим прессова-
нием. При температуре, достаточно высокой для обеспечения оптимальных
результатов, штабики металла следует защищать от действия воздуха.
Обычно для этой цели их покрывают медью или другим металлом. Согласно
Рейнсу |77], путем горячего прессования можно получить металл с плот-
ностью около 100% теоретического значения. Для получения компактных
заготовок нз порошка тория Рейне рекомендует применять горячее прессо-
вание с последующей горячей механической обработкой.
Получение компактного три я
восстановлением реакционной смеси в бомбе
В промышленности США металлический торий получают только восста-
новлением тетрафторида тория металлическим кальцием. Согласно описанию
Уилхелма [55], смесь, состоящую нз фторида тория, безводного хлорида
Торий
797
цинка и металлического кальции, смешивают, уплотняют и загружают
в бомбу с огнеупорной футеровкой, закрываемую крышкой (рис. 5). Бомбу
с загрузкой устанавливают в нагревательном колодце (печь), в котором под-
держинают температуру около 640 . Загрузку нагревают до температуры,
необходимой для инициирования реакции в течение примерно 30 мин,
Рис. 5. Поперечное сечение бомбы с
загрузкой.
/ — слепой фланец: 2 — двойной фланец;
3 — стенка тигля бомбы <ст.1льная труба);
4 огнеупорная футероскя;5 — загрузка (смесь
ТЬГ4, Са и ZnCI2>-
a *^:
<a ¦ '¦-
¦ -. ь ii-.
',. ¦ <t ¦
¦: D
.¦ i
: ¦ '¦' ' -' к ¦
. ¦>..?• :
¦ P ¦ '.'¦':".:
-13 * ¦¦*¦¦•
. ¦b.-'."vc'."T
«¦¦"¦^
-7
4.p"-1
-v:
¦.
;V
* ." • -1— '
У - ^' ^
.- i'
""¦'¦¦о ¦
"9"
¦ y'Q
_
после чего теплоты реакции становится достаточно для расплавления обра-
зующихся продуктов — сплава тория с цинком и шлака, состоящего из хло-
рида и фторида кальции. Плотный расплавленный сплав скопляется на дне
бомбы под толстым слоем жидкого шлака. Бомбу с ее содержимым выни-
мают из печи и дают ей охладиться.
Дли защиты стенок бомбы от действия расплавленного металла и шлака
а также для предотвращения загрязнения металлического тория бомбу
футеруют огнеупорным материалом. Для этой цели с успехом применяют
смесь окисей магния и кальция, получаемую из тонкоизмельченного элек-
троплавленного доломита. Футеровку производят сухим способом. Тигель
бомбы изготовлен из сварочной стали.
После затвердевания в бомбе образовавшихся продуктов получают
ториевоцннковый сплав, который охлаждают до комнатной температуры.
Сплав образуется в виде большого плотного слитка (заготовка), который
очищают от приставшего к нему шлака. Для отгонки из сплава основной
части цинка заготовку нагревают в вакууме. После отгонки цинка торий
остается в виде сплошной губки. Несколько обесцинкованных заготовок пе-
реплавляют и отливают в один слиток.
При отсутствии хлорида цинка в исходной загрузке для процесса вос-
становления продуктами реакции были бы только металлический торий
и фторид кальция, которые в применяемых условиях реакции не удалось бы
расплавить и отделить друг от друга в бомбе. Реакция хлорида цинка с каль-
798 Глава 31 ¦
цием обеспечивает три основных условия, способствующих отделению метал-
лической фазы от шлаковой.
1. Металлический цинк реагирует с металлическим торием с образова-
нием легкоплавкого сплава.
2. Хлорид кальция, образующийся в результате реакции ZnCl2 с каль-
цием, переходит в шлак, что повышает его жидкоплавкость по сравнению
со шлаком, состоящим только из фторида кальция.
3. Теплота дополнительной реакции между хлоридом цинка и каль-
цием увеличивает термичность реакции. Это значительно повышает
температуру продуктов и способствует переходу их в жидкое состояние,
что обусловливает эффективную сегрегацию металлической и- шлаковой
фаз.
Типичная загрузка для бомбы диаметром 305 мм и длиной 1,14 м состо-
ит из 80 кг фторида тория, 27 кг металлического кальция (избыток 25%)
и 7 кг безводного хлорида цинка. Эти компоненты до взвешивания измель-
чают в порошок с величиной частиц соответственно —100, —8 и —60 меш.
Перед добавлением хлорида цинка смесь фторида тория и кальция выдержн-
нают в течение некоторого времени, чтобы они хорошо перемешались.
Из этой загрузки получают заготовку торневоцинкового сплава весом около
60 кг с содержанием около 6 вес.°о цинка. При уменьшении загрузки нужно
несколько увеличивать отношение хлорида цинка к фториду тория. Следует
отметить, что хлорид цинка легко поглощает влагу из воздуха, поэтому необ-
ходимо применять безводный хлорид цинка и по возможности предотвращать
его контакт с влажным воздухом.
Отгонка цинка из ториевоцинкового сплава. Цинк отгоняют нагрева-
нием сплава в вакууме при 1100°. После нагревания в течение 1 час при ука-
занной температуре в губчатом тории остается несколько долей процента
цинка. После нагревания при этой же температуре в течение 8 час отгоняется
почти весь цинк. Быстрое нагревание допускается при температуре не выше
I000D, таи как в этом интервале возгоняется очень незначительное количе-
ство цинка. Быстрое нагревание при температуре около 1035° приводит
к такому сильному отгону цинка, что возникает опасность чрезмерного рас-
ширения и даже взрыва металлической заготовки; поэтому между 1000
и 1100° температуру сплава повышают очень медленно.
Выплавка слитков тория из заготовок, полученных восстановлением
фторида тория в бомбах. Заготовки губчатого тория, получаемые после
отгонки цинка, превращают в плотные слигки двумя способами: 1) ин-
дукционной плавкой в тигле и 2) дуговой плавкой с расходуемым элек-
тродом.
Индукционная плавка и отливка тория в промышленном масштабе опи-
саны Уилхелмом [55) и Катбертом [14]. На рис. 6 показана схема аппарату-
ры, применяемой для плавки и отливки тория этим способом. Губчатый то-
рий помещают в тигель, изготовленный из окиси- бериллия и снабженный
отверстием с пробкой для выпуска расплавленного металла снизу в графито-
ную изложницу. Тигель вставляется в графитовый нагреватель, установ-
ленный на опорном блоке из карбоцелла-60, который стоит на изолирующей
кирпичной кладке в четыре ряда. В качестве теплоизоляции применяется
графитовый порошок, засыпаемый вокруг графитового нагревателя и удер-
живаемый на месте кварцевым цилиндром. Нагревательное устройство за-
крывается кварцевым колпаком; вся установка стоит на стальной ванне,
охлаждаемой водой.
Торий
7УУ
Индуктор типа лебедки монтируют снаружи кварцевого колпака, и пос-
ле снижения давления менее чем до 1-10 мм рт. ст. ог генератора мощ-
ностью 100 кет подводят ток с частотой 3000 гц. Температура измеряется
вольфрамо-ниобиевыми термопарами. После полного расплавления загрузки
металл выпускают в графитовую изложницу. Толкая вверх стержень, кото-
рый служит для подъема изложницы, приподнимают пробку из окисп^бернл-
лия, которая всплывает на поверхность расплавленного тории, и металл
Р и с. G. Схема аппаратуры, применяемой
для вакуумной индукционной плавки и
отливки металлического тория.
/ — кварцевая трубка диаметром 48 мм;
13 - индуктор; 3 - коарцевый цилиндр;-/ — гра-
фитовый порошок; 5 — графитовый нагреватель;
6 — тигель из окиси бериллия; 7 —гуСчлгый
торий; 8 — ториевая стружка; 9 — пробка из
описи бериллия; 10 — вставка и:л окиси Гкфил-
лнл; 11 — графитовый стержень для припод-
нимания пробки и выпускное отверстие;
12 — опорный блок из карбоцелла-60; 13 — изо-
ляционный огнеупорный кирпич B8WK-30;
14 — первая термопара; 15 — вторая термопара;
16 — неопреновая прокладка; 17 ~ графитовая
изложница; 18 — опора для графитовой из-
ложницы; 19 — стальная ванна с водяным
охлаждением; 20 — стержень для подъема
изложницы.
го
стекает через отверстие в изложницу, где он затвердевает. Наличие разли-
вочного устройства с кварцевым колпаком диаметром 480 мм позволяет
отливать слитки тория весом 113 136 кг, форма которых зависит от формы
изложницы. Во время нагревания в вакууме до температуры выше 1800°
основная часть летучих примесей, включая остатки цинка и некоторые про-
дукты радиоактивного распада тория, отлагаются на внутренней стенке
кварцевого колпака.
Плавка тория в дуговых печах с расходуемыми электродами описана
Роберсоном и Биллом [55] и Катбертом [14]. Применяемый процесс анало-
гичен дуговой плавке титана и циркония. Отгонка цинка из губчатого тория
должна быть более полной, чем из губки, направляемой в 'индукционные
печи. Заготовки губчатого тория можно распиливать на «узкие пластины,
которые свариваются впритык для получения полосы, служащей первичным
расходуемым электродом.
Плавка проводится в атмосфере гелия и аргона при пониженном давле-
нии. Аргон без примеси гелия дает более устойчивую дугу, но гелий уско-
ряет процесс плавки. Первичные электроды можно переплавить в слитки
диаметром 100 мм, свариваемые вместе для использования в качестве вто-
ричных расходуемых электродов при дуговой плавке и отливке тория в слит-
кн большего диаметра. При желании эти слитки можно подвергать третьей
дуговой плавке и отливке с целью получения слитков еще большего дна-
800
Глава 31
метра. Каждая переплавка повышает степень чистоты металла, так что
металл, полученный дуговой плавкой, по качеству не уступает металлу,
выплавленному в вакуумной индукционной печи.
ОЧИСТКА МЕТАЛЛИЧЕСКОГО ТОРИЯ
Металлический торий, полученный одним из описанных выше способов,
можно очищать по методу, описанному Ван-Аркелем [79]. Этот метод,
известный под названием иодидного, основан на реакции паров иода и загряз-
ненного тория, в результате которой при заданной температуре образуются
пары Thl4, и последующем разложении иодида тория при соприкосновении
с более горячей поверхностью, в результате чего отлагается чистый метал-
лический торий. Рафинирование небольших количеств тория этим способом
подробно описано Фей гелем и сотр. Г55].
Аппаратура и процесс аналогичны разработанным и применявшимся
Ван-Лркслсм для очистки циркония и других металлов, но условия прове-
дения процесса различны вследствие неодинаковой летучести иодидов. Для
исходного (загрязненного) тория поддерживается температура около 450е,
нить накала нагревается до температуры 1300° или выше, что обеспечивает
высокую скорость осаждения.
Как правило, нодидный метод рекомендуется главным образом для
получения компактного металла с очень низким содержанием кислорода,
азота и углерода, предназначаемого для исследования основных свойств
этого металла.
Степень чистоты металлического тория
Степень чистоты конечного металла сильно зависит от степени чис-
тоты исходного сырья, тщательности ведения процесса и загрязнения
продукта в процессе получения металлического тория. В лабораторных
условиях удавалось получать металл исключительно высокой чистоты.
Основными условиями для получения металла высокой чистоты, по-види-
мому, являются высококачественное исходное сырье и применение очистки
иодидным методом.
В промышленном масштабе металлический торий достаточно высокой
степени чистоты можно получать несколькими способами при условии
Таблица 2
СОДЕРЖАНИЕ ПР1ШЕСЕГ1 В ТОРИИ, ПОЛУЧЕННОМ ПРОМЫШЛЕННЫМИ
И ИОДИЦНЫМ СПОСОБАМИ
Содержание, %
Примссн
восстановление
в бомбе и индук-
ционная плавка
в тигле из окиси
бериллия
Кислород
Углерод
Азот
Алюминий
Кремний
Железо
Цинк
Средн. 0,15
0,02—0,08
0,06—0,016
<0,003
<0,005
0.003—0,014
<0,002
Средн. 0,18
<0,03
<0,030
<J),020
<0,005
<0,050
<0,050
<0,03
0,02
0,002
<0,0U5
<0,010
<0,013
<0,002
восстановление
и бпмбс и дуговая
плавка с расходу-
емым электродом
иодндный способ
Торий
801
надлежащею контроля процесса, поэтому дорогостоящую иодидную очистку
применяют только при получении небольших количеств тория для иссле-
довательских целей. В табл. 2 приведено содержание примесей в тории,
полученном промышленными и иодпдным способами. Как видно из таблицы,
содержание углерода, азота и кислорода в нодидном тории обычно ниже,
чем в тории, полученном промышленными способами.
Порядковый номер
Атомный вес
Кристаллическая решетка
До 1400°
От 1400° до температуры плавления
ФИЗИЧЕСКИЕ, ЭЛЕКТРИЧЕСКИЕ И ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
МЕТАЛЛИЧЕСКОГО ТОРИЯ
Па ряд свойств металлического тория сильное влияние оказывают неко-
торые примеси, содержащиеся в нем в сравнительно незначительных коли-
чествах. Ввиду того что во многих исследованиях не применялся нодидный
Таблица 3
ФИЗИЧЕСКИЕ СВОЙСТВА ТОРИЯ
90
232,038
[К, 10, 17, 37, 40, 58, 76]
Кубическая гранецентрирован-
ная а0B5°)=5,О86+0,О01 А
Кубическая объемиоцентриро-
ваннан аа A450°)=4,11+
+0,001 А
Атомный диаметр (координационное число 12), А
Плотность при 25°, е/с.м3
Рентгенографические данные
Металл, полученный восстановлением в бомбе
Иодидный металл, переплавленный в дуговой
печи
Удельное электрическое сопротивление при
25°, мком-см
Металл, полученный восстановлением в бомбе
Чистый торий (ориентировочно)
Температурный коэффициент электросопротивле-
ния, град'1
Упругие свойства при 25°, кг/мм"
Модуль упругости
Модуль сдвига
Коэффициент Пуассона
Температура плавления, "С
Температура кипения, °С
Теплота испарения, ккал/моль
Теплота плавления, ккал/моль
Коэффициент линейного расширения прн 25 1000°
(среднее значение), град'1
Теплоемкость при 25е, кал/г-атсм-град
Коэффициент теплопроводности при 200°
кал!см-сек-град
Коэффициент Холла, см?!к
Коэффициент рассеяния тепла при 150=, см-,'сек
Излучательная способность прн 1000—1700°
Работа выхода электронов, эв
Период полураспада (а-распад), годы
51 Зак;13 № 239
3,596
[52, 76, 79, 83]
11,72_
11,5 11,6
11,66
[52, 54, 76J
18
13—15
3,6- 1<>-з_ 4-10-=
[42, 69,-83]
7241
2819
0,27
1750 |17, 52, 76, 79, 81]
3500—4200 [88; 90]
130 145 [55]
<4,61551
[52, 55, 76]
12,5-10-«
6,53 [27]
0,09 [55]
—10.10-5155]
0,28 [73]
0,38 прн 6670 А [82]
3,51т-0,05 [32, 66, 89]
1,39-ЮЮ
802 _ Глава 31
торий высокой степени чистоты, а иногда применялся технический торий,
между результатами различных исследований наблюдаются расхождения.
В трудах конференции «Металлический торий» [55], в главах, авторами
которых являются Смит, Берлинкур, а также Джеттер и Мак-Харг, дается
подробное описание целого ряда экспериментальных определений свойств
торня и некоторых его сплавов Ниже приводятся значения, довольно точно
характеризующие истинные свойства металлического тория. Основные зна-
чении снедены в табл. 3.
Интервал в значениях для температуры плавления тория может служить
показателем существующих расхождений в величинах, характеризующих
отдельные свойства тория. На температуру плавления, по-видимому, ока-
зывают слияние незначительные количества примесей, и точное определение
температуры плавления металлического тория несколько затрудняется воз-
можной низкой теплотой плавления и наблюдаемой склонностью к образо-
ванию оболочки на поверхности металла даже высокой степени чистоты
в глубоком вакууме. Эта оболочка затрудняет течение металла при темпе-
ратуре плавления. Для температуры плавления тория приводятся значе-
ния 1120—1850е; для иодидного тория недавно приводилось значение
около 1750°.
Кристаллическая структура и аллотропические превращения металли-
ческого тории изучались многими исследователями. Согласно Смиту JJ55J,
превращение устойчивой при комнатной температуре кубической гранецен-
трнрованной решетки в кубическую объемноцентрированную при темпера-
туре примерно НОО было установлено Чнотти в 1950 г. До этого приводи-
лись данные, свидетельствовавшие об аллотропическом превращении тория
при 225е, но новейшие исследования не подтвердили этих данных. Работая
с высокими давлениями, Брнджмен [8] получил данные, которые можно
рассматривать как слабое доказательство превращении структуры торня
в особых условиях давления.
В упомянутых выше работах 155] и в книге Катберта «Технология про-
изводства тории» [14] приведены подробные данные об исследованиях физи-
ческих свойств тория, а также литература по этому вопросу.
МЕХАНИЧЕСКИЕ СВОЙСТВА МЕТАЛЛИЧЕСКОГО ТОРИЯ
Исследования механических свойств металлического тория подробно
описаны в отчете Мил ко, Лдамса и Хармса [55]. Как правило, механичеекие
свойства тория зависят от степени чистоты металла и его предварительной
обработки. По данным Джеттера и Мак-Харга 155], режим обработки, осо-
бенно горячего прессования, влияет на механические свойства готового
продукта. Опыты горячего прессования (850*") тория, содержащего 0,12%
углерода, показали, что при скоростном прессовании предел прочности при
растяжении получаемых прутков составлял 21,4 кг/мм2, а при медленном
прессовании того же металла — 35,6 кг/мм-. Были выявлены также разли-
чия в структуре конечного металла, которые объясняются, по-видимому,
повышением температуры прутка при быстром прессовании.
Механические свойства тория при растяжении
В табл. 4 приведены некоторые типичные значения механических
свойств тория при растяжении. Следует отметить, что листовой тории, полу-
ченный восстановлением в бомбе, имеет гораздо более высокий предел проч-
Торий
803
Таблица 4
МГХАНИЧЕСКИЕ СВОЙСТВА ОЬРЛЗЦОВ ТОРИЯ ПРИ РА^ТЯЖКНИИ
Характеристика образца
Иодидный (листовой) торий, про-
катанный и отожженный
Получрнный восстановлением в
бомбе (листовой) торий
Прокатанный и отожженный
Прокатанный на холоду с об-
жатием 5U%
Полученный восстановлением в
бомбе (пруткопый) торий
Выдавленный и отожженный
Прокатанный на холоду с об-
жатнем 37,5и0
Предел
прочности
при рас-
тижении,
кг/мм2
Предел
текучести
(при сто.а),
12.16
27,84
45,98
24,18
34,45
4.85
21,30
43,32
19,40
31,92
Относи-
тельное
удлинение
на длине
60 мм. %
36
51
Отнпш-
тсльиое
сужение,
62
52
16
,73
'б!
ности при растяжении, чем иодидный листовой торий, подвергнутый такой
же обработке. Более высокое содержание углерода в металле, полученном
восстановлением в бомбе, лишь частично объясняет это повышение проч-
ности.
Р и с. 7. Влияние некоторых обыч-
ных примесей на прочностные свой-
ства при растяжении после отжига.
— предел прочности при растяже-
нии; — — — предел текучести.
i
л
/
_
s
0
N
0
" N
- —
10
0 0.1 0,2 0,3
Содержание примеси, eec.%
Прочность металлического тория, полученного восстановлением в бом-
бе и затем отожженного, при повышении его тампературы постоянно умень-
шается. Предел прочности и предел текучести отожженного металла при
температуре 500е примерно вдвое меньше, чем при комнатной температуре.
Однако относительное удлинение является минимальным при 250°, а при
температуре около 450° оно превышает относительное удлинение при ком-
натной температуре.
Па рис. 7 показано влияние примесей углерода, кислорода и азота
в иодидном тории на текучесть и прочность при растяжении отожженного
металла при комнатной температуре. Углерод повышает прочность тория
в гораздо большей степени, чем кислород или азот.
Твердость
Как показывает рис. 8, углерод оказывает значительно большее влияние
на повышение твердости тория, чем кислород или азот. Влияние углерода
на твердость тория и на его прочность при растяжении, по-видимому, свя-
51*
804
Глава 31
зано с растворимостью в твердом состоянии углерода в виде карбида торин
при комнатной температуре. Твердость по Внккерсу полностью отожженного
гго
§¦ we
<§ 11,0
е юс
с
'I 60
20
/
N
/
0
О
Рис. 8. Влияние некоторых оСыч-
ных примесей иа твердость .тория
после отжи| а.
С 0.2 0.3 0.U
Содрр»аиис примеси, вес. %
тория составляет около 38 для иодидного металла и 65 для металла, полу-
ченного восстановлением в бомбе. ,_
Сжимаемость тория
Сжимаемость тория исследовал Бриджмен [9]. При высоких давлениях
объем тория обратно пропорционален давлению. Логарифм объема изменяет-
ся линейно с логарифмом давления. Единица объема при давлении 1 кг/см-
уменьшается до 0,886 при давлении 100 пнем2.
Более подробные данные о физических и механических свойствах тория
приведены в работе «Металлический торий» [55] и в книге «Технология про-
изводства тория» 114].
МЕХАНИЧЕСКАЯ ОБРАБОТКА ТОРИЯ
Слитки металлического тория промышленных сортов легко поддаются
горячей и холодной механической обработке различными способами. Металл
с кубической гранецептрированной решеткой отличается малой твердостью,
низкой прочностью и высокой ковкостью при комнатной температуре.-Одна-
ко примесь углерода свыше 0,05% и некоторые»другие примеси ухудшают
условия механической обработки тория, особенно на холоду.
Механическую обработку тория исследовал Давенпорт [16J; в последнее
время исследования в этой области проводил Кеншшгем [55]. Большая
часть новейших исследований основана на опытах, в которых применялся
торий двух сортов: иодидный и промышленный; последний часто называют
«торием, полученным восстановлением в бомбе». Иодидньш торий содержит
незначительное количество примесей, отличается низкой прочностью и яв-
ляется самым ковким из всех получаемых сортов твердого тория.
В процессе холодной прокатки, волочения и штамповки тория без про-
межуточного отжига твердость металла увеличивается лишь незначительно,
до 40°о относительного сужения. Дальнейшая холодная прокатка до 99ии
относительного сужения сопровождается очень небольшим увеличением
твердости; однако Лоуэнстейн [50] показал, что в результате дальнейшей
холодной прокатки и штамповки прессованных прутков твердость металла,
полученного восстановлением в бомбе, уменьшается. Это свидетельствует
Торий
80S
о том, что торий можно подвергать холодной обработке неограниченное
время без отжига.
При нагревании тория для горячей обработки необходимо учитывать
его химическую активность. Нагревание можно проводить в расплаве солей
(смесь хлоридов бария, калия и натрия) [31] или торий можнп покрывать
другим металлом, например медью [72J. Горячую обработку — прессование,
ковку, прокатку, штамповку или комбинацию этих операций — обычно
производят при температуре 650—9501". Ввиду химического сродства нагре-
того тория к кислороду и азоту воздуха сварку тория необходимо произво-
дить в защитной атмосфере инертного газа.
Торий легко поддается всем стандартным видам обработки: токарной,
фрезерованию, шлифованию, сверлению и распиловке. Однако пластичность
и ковкость тория уменьшают его способность к механической обработке.
Получить хорошо отделанные поверхности резанием затруднительно, но та-
кие поверхности редко требуются при механической обработке тории. Хими-
ческий состав и предыстория металла сильно влияют на его способность
к механической обработке; холодная обработка и наличие некоторых при-
месей дают лучшие результаты. Обычно инструменты из'быстрорежущей
стали вполне пригодны для большинства процессов механической обработки
тория. Применяются также инструменты из спеченного карбида, особенно
когда торий содержит значительное количество абразивных включении.
Торий стандартных промышленных сортов можно обрабатывать в сухом
состоянии, но при этом рекомендуется применять охлаждающую среду
и хорошую вентиляцию для защиты рабочих от торцевой пыли.
ОТЖИГ И РЕКРИСТАЛЛИЗАЦИЯ
Исследования, проводившиеся в Окрнджской национальной лаборато-
рии по отжигу и рекристаллизации подвергнутых холодной обработке ноднд-
ного тория и тория, полученного восстановлением в бомбе, описаны Бойлем
Р и с. 9. Изменение твердости иодид-
него тория, холоднокатаного до 80%
относительного сужения, d зависимости
от продолжительности изотермического
отжига.
Твердость по Виккерсу при нагрузке 10 к-*
(объектнн 17 мм); цифры иа графике пока-
зывают температуру (пжщм.
I10
во \—^
50
30
\
t—.
\
-¦ ^ L-. г —-
юо-
¦—¦—_
ч
1—
GSO°,
1
W 20 30
Продолжительность
ЬО
мин
БО
[55J. На рис. 9 и 10 приведены данные по-отжигу холоднообработаиньтх
нодидного тория и тория, полученного восстановлением в бомбе. До отжига,
который проводился при различных температурах, торий подвергали холод-
ной прокатке до 80% относительного сужения. Спедует отметить, что нодид-
иын торий, по-видимому, отжигается быстрее и при более низких темпера-
турах, чем торий, полученный восстановлением в бомбе; интервал твердости
806
Глава 31
нодидного тория ниже, и оба сорта тория полностью отжигаются за несколь-
ко минут при температуре около 700. На рис. 11 показано влияние после-
дующего отжига о течение 1 час при различных температурах на твердость
образцов иодиднот тория, прокатанных на холоду до различных степеней
90
83
во.
1
-
ьзо°
son'
— -
вое
о ю 2о да ад 5о во
Продолжительность о/п/нига, мин
.ВДО 55/? С^С БЫ) 100
Температура отжига , °С
750
Р н с. 10. Изменение твердости тория,
полученного восстановлением в бомбе
и ^холоднокатаного до 80% относитель-
ного сужения, в зависимости от продол-
жительности изотермического отжига.
Тпсрдость по Виккерсу при нагрузке 10 кг
(объектив 17 мм); цифры на графике пока-
зывают температуру птжига.
Рис. 11. Изменение твердости холод-
нокатаного иодидного тория при отжиге
в течение 1 час.
Твердость по Виккерсу при нагр>зке Ю кг
(обьектив 17 мм)\ цифры на графике пока-
зывают уменьшение поперечного сечении, %
относительного сужения. Следует отметить, что при прокатке до 20% отно-
сительного сужения требуется более высокая температура отжига, чем при
прокатке до 80°и относительного сужения.
При металлографическом исследовании образцов тория, применивших-
ся для определения влияния отжига на твердость холоднокатаного металла,
были получены данные о влиянии холодной обработки на рекристаллиза-
цию тория. Эти данные приведены в табл. 5.
Таблица 5
ВЛИЯНИЕ ХОЛОДНОЙ ОБРАБОТКИ НА PL КРИСТАЛЛИЗАЦИЮ ТОРИЯ а
Относитель-
ное сужение.
Температура начала рекристлл-
-шянцнн, °С
торий, получен-
ный иесстанов-
лением в Бомбе
80
60
40
20
521)
520
540—550
550 575
нодндный торий
Температура конца рекрис-
таллизации, 'С
торнй, получен-
ный восстанов-
лением и бомбе
500
510—520
520
550—575
625
625
650
650
подидмы
торий
575
6011
600
700
Образцы выдерживались при указанных температурах в течение I час.
Торий 807
МЕТАЛЛОГРАФИЯ ТОРИЯ "
Характер микроструктуры образцов металлического тория обнаружи-
вается не легко. Ввиду большой пластичности и ковкости тория, а также его
химической активности при подготовке образцов тория для металлографи-
ческого исследования требуются соответствующая квалификация, терпение
и наличие некоторых приспособлений. Давенпорт [161 показал, что при меха-
ническом шлифовании и полировании требуется большая тщательность и что
для обнаружения микроструктуры тория весьма эффективно электролити-
ческое травление. Рот [551 и Катберт 114] дают обзор новейших работ по
металлографии тория, проведенных в разных лабораториях. В этом обзоре
широко освещены вопросы подготовки образцов тория для металлографиче-
ских исследований и определения микроструктуры.
Разработано много различных мегодов подготовки образцов тория, осо-
бенно образцов, содержащих легирующие элементы. При наличии твердых
включений в мягкой основе шлифование и полирование следует производить
очень тщательно, чтобы сохранить структуру поверхности. Из применяемых
в настоящее время методов металлографического исследования^тория, по-ви-
димому, ни один не является вполне удовлетворительным.
Шлифование
Удовлетворительного механического шлифования можно достигнуть
любым существующим стандартным способом. Заключительную стадию
шлифования можно производить шлифовальной бумагой (с карбидом крем-
ния зернистостью 600 зерен) или наждачной бумагой № 3,0, применяя в ка-
честве смазочно-охлаждающей жидкости воду или керосин. Для окончатель-
ного шлифования рекомендуется применять шлифовальный материал точною
действия для уменьшения расхода металла и предотвращения повреждения
его структуры.
Механическое полирование
Механическое полирование хорошо отшлифованных поверхностей часто
производят, применяя алмазную пасту на гладкой неворенстой ткани типа
нейлона. На практике применяют алмазные пасты различной зернистости,
но считают, что полирование пастой зернистостью 6 мк с последующим поли-
рованием пастой зернистостью 1 мк позволяет надлежащим образом обнару-
жить включения. Другие методы механического полирования предусмат-
ривают применение технического порошка окиси алюминия. Полирование
производится в две стадии: вначале окисью алюминия зернистостью 15 мк,
а затем окисью алюминия зернистостью 0,5 мк на шелке или тонком сукне.
В качестве смазочно-охлаждающей жидкости применяют воду и жидкое мыло
с добавкой щавелевой или сильно разбавленной азотной кислоты или без
добавки.
Электролитическое полирование и травление
Электролитическое полирование и травление образцов тория, подготов-
ленных надлежащим образом, явились предметом многочисленных исследова-
нии. В литературе описаны различные способы, с тлмчающиеся друг от друга
составом электролита, напряжением, продолжительностью процесса и дру-
гими показателями. Как правило, применение в качестве электролита
органических растворов дает лучшие результаты, чем применение водных
растворов, но в состав некоторых из наиболее удовлетворительных орга-
нических электролитов входит органический раствор хлорной кислоты,
808 Глава 31
который является взрывоопасным. Из электролитов, не.содержаших хлорной
кислоты, можно рекомендовать электролит следующего состава (по объему):
100 частей 98%-ной муравьиной кислоты,
2—4 части концентрированной соляной кислоты,
1—2 части 50°о-ной иодистоводородиой киелвты.
Применение этого электролита при плотности тока 0,23 а/см2 с использова-
нием образца торня в качестве анода в течение 8 сек позволяет сохранить
включения и определить границы зерен в холоднокатаном и отожженном
тории.
Включения в микроструктуре
Обычными примесями в тории являются кислород п азот; эти примеси
химически соединяются с торием, и, если их содержание превышает несколь-
ко десятитысячных долей процента, они могут быть обнаружены в виде
включений в механически отполированных образцах тория. Углерод, кото-
рый является обычной примесью, также образует соединение с торием, ни,
поскольку он растворим в этом металле в твердом состоянии, только неболь-
шое избыточное количество углерода обнаруживается в виде включения.
Цвет таких включений при яркой освещенности свежеотполированных
образцов — ярко-серый для ТЬОг, от оранжевого до желтого для ThN
п беловатый для ThC. Иногда имеется «белая фаза», которая видна на гра-
нице зерен литого тория. Эта фаза совершенно твердая и, по-видимому,
образована железом или никелем в виде соединения Th7(Fe, NiK-
ХИМИЧЕСКИЕ СВОЙСТВА ТОРИЯ
В периодической таблице торий является вторым элементом в группе
актиноидов, которая включает природный актиний, торий, протактиний
и уран, а также полученные недавно искусственно нептуний, плутоний и Дру-
гие заурановые элементы. Эта группа элементов по ряду свойств сходна
с группой лантаноидов. Торий является родоначальником радиоактивного
семейства, которое после 10 последовательных распадов (комбинация 6а-
и 4|5-распадов) заканчивается изотопом Pb2(js. Металлический торий отли-
чается высокой реакционной способностью, но в ряду напряжений он стоит
ниже магния. В большинстве соединений торий является четырехвалентным,
хотя в некоторых соединениях он проявляет валентность 2 и 3. Теплоты обра-
зования соединений тория обычно выше теплот образования соответствую-
щих соединений \рапа [25].
Свежесрезанная или свежеотполнрованная поверхность металлического
тория имеет светло-серебристый оттенок. Под действием воздуха поверхность
тория постепенно тускнеет и покрывается тонким черным слоем, предотвра-
щающим дальнейшее окисление. Скорость окисления с поверхности зависит
от содержания двуокиси .тория в металле. При очень высоком содержании
двуокиси тория в спеченных штабиках металл может полностью окислиться
и рассыпаться.
Торий отличается высокой реакционной способностью, но, как видно
из табл. 6, в кислотах он растворяется незначительно.
Все неметаллические элементы, за исключением редких газов, образуют
бинарные соединения с торием. Ниже рассматриваются некоторые из наибо-
лее важных соединений торня. Более подробное описание и список литера-
туры даны в работах Роллефсона и Хагеманна [701, Кацина [41] и Катберта
[14].
Торий 809
Таблица 6
ДЕЙСТВИЕ ОБЫЧНЫХ РЕАГЕНТОВ НЛ МЕТАЛЛИЧЕСКИЙ ТОРИП
Реагент
Уксусная кислота
Соляная кислота
Азотная кислота
Царская водка
Едкий натр
Концен-
.трация,
%
0—50
0—ЗБ
0- 68
—
0 100
Действие рсаг
Не действует
Действует
Не действует
Действует
Не действует
Металлический торий растворяется d аютной кислоте в при-
сутствии (.ледов фторида.
Окислы тория __
Двуокись тория ThO2 имеет структуру, аналогичную структуре флюо-
рита [87]; цвет двуокиси белый. Остаток сгоревшей калильной сетки газового
фонаря представляет собой в основном двуокись тория. Двуокись тория
можно получить термическим разложением оксалата, гидроокиси и нит-
рата тория, а также при нагревании тория на воздухе или в атмосфере
кислорода до высокой температуры. В литературе упоминается о существо-
вании окиси тория ThO с кристаллической решеткой, аналогичной решетке
хлорида натрия, но обнаруживаемые в микроструктуре металлического то-
рия окисные включения являются результатом выкристаллизовыван-ия дву-
окиси тория из металла. Путем добавления перекиси водорода в раствор
торцевой соли можно осадить гидрат перекиси тория Тп^От^НгО. При про-
каливании это соединение разлагается с образованием ThO2.
Карбиды гор и я
Известны два карбида тория — ThC с кубической гранецентриров^нной
решеткой [16] и ThC2 с моноклинной решеткой [38]. Карбиды тория обра-
зуются в результате взаимодействия углерода с торием; ТпСг образуется
также при реакции двуокиси тория с углеродом. Оба карбида легко разла-
гаются водой с образованием двуокиси тория и выделением газа с неприят-
ным запахом. А^онокарбид и металлический торий полностью взаимно
растворимы в твердом состоянии при высоких температурах [121.
Нитриды тория
Торий образует два нитрида — ThN и Tli2N3. Оба нитрида можно полу-
чить нагреванием металлического тория в атмосфере азота. Нитрид тория
Tli2N3 — соединение темно-красного цвета, он легко реагирует с водой или
влажным воздухом с образованием двуокиси тория. Th2N3 имеет гексагональ-
ную решетку [85], a ThN — кубическую гранецентрированную решетку
[71].
Гидриды тория
Известны два гидрида тория — ThH2 и Th4His 161]. Плотность ThIU
составляет 9,2 г/см3; этот гидрид имеет тетрагональную объемпоцентриро-
ванную решетку с параметрами at,=- 4,10 А и сс= 5,03 А. Плотность второ-
810 Глава 31
го гидрида, Th4H|5, составляет 8,33 г,'см3; он имеет кубическую решетку
с 4 молекулами в элементарной ячейке с параметром решетки ай- 9,11 А
1861. Ди гидр ид получают нагреванием металла в атмосфере водорода до тем-
пературы около 600°. Второй гидрид образуется при выдерживании ThH2
в атмосфере водорода при температуре около 250°. Образование этих гид-
ридов и их последующее термическое разложение в вакууме служат основ-
ными реакциями для превращения твердого компактного металла в порошок
[13|. При образовании высшего гидрида исходная заготовка сильно увели-
чивается в объеме и превращается в крупнозернистый порошок. Затем про-
водится полное термическое разложение обоих гидридов в вакууме при
нагревании до температуры обычно выше 700J, но намного ниже 900° с целью
уменьшения нежелательного спекания образующегося порошка металла.
Гидриды тория вступают в реакцию с кислородом, галогенами, галогено-
водородамп и водой. Оба гидрида тория пирофорны.
Гало ген иды тория
Тории легко образует тетрагалогениды. Тстрафторид и тетрахлорид
тория используются для получения металлического тория, тетраиоднд тория
является промежуточным продуктом иодидиого процесса, применяемого для
очистки металлического тория. Тетрифгорид тория обычно получают в ре-
зультате взаимодействия безводной фтористоводородной кислоты и двуокиси
тория; реакция является сильно экзотермической. Тетрахлорид тория полу-
чают, пропуская газообразный хлор над нагретой смесью двуокиси тория
и углерода или нагретым карбидом тория. Тетрахлорид в отличие от тётра-
фторнда является гигроскопичным. Тетрахлорид тория можно возгонять
в вакууме при температуре красного каления; этот процесс применяется для
очистки тория.
СПЛАВЫ ТОРИЯ
Исследования сплавов тория проводятся с 1940 г. Интерес, проявленный
к торию как потенциальному источнику ядерного топлива, привел к разра-
ботке нескольких процессов, позволяющих получать торий в сравнительно
больших количествах для различных областей применения, в гом числе
и для исследования сплавов этого металла. Высокая плотность, реакцион-
ная способность, посредственные механические свойства и высокая стоимость
чистого металлического тория исключают возможность его применения в ка-
честве основного компонента конструкционных сплавов, но улучшение
свойств тория при введении легирующих добавок может повысить его цен-
ность для ядерной техники.
Большинство полученных и исследованных до сих пор сплавов Тория
не обнаружили особо важных свойств, исключающих возможность их заме-
ны в неядерных областях применения другими, более простыми металлами
или сплавами. Все же значительная часть тория, потребляемого в неядерных
областях применения, используется в качестве присадки в сплавы на основе
магния. Впервые влияние тория на магний было исследовано Мак-Дональдом
[51], который обнаружил, что небольшая присадка тория значительно повы-
шает прочность и ковкость магниевого листового проката. Это позволило
применить к сплавам на основе магния процесс дисперсионного твердения,
что свидетельствует о растворимости в твердом состоянии.
Вопросом о влиянии добавок тория к чугуну в количестве до 1 °6 за-
нимались Баукло и Мейерлинг [31. Такие добавки способствуют очистке
Торий 8U
и десульфурацпи чугуна, что улучшает его жндкотекучесть, повышает
ковкость чугунного литья и предел прочности при растяжении, способствуя
измельчению зерен графита.
Влияние добавок 0,1 —1,0°<> тория к сплавам Сг - Ni.— Fc, Сг — Ni
и Сг — А1 исследовали Фролих и Бартел [231. Проведенные ими испытания
сплавов на выносливость при 1150—1200° показали, что срок их службы
повышается в 5—6 раз по сравнению со сплавами обычного состава. Подан-
ным Гессснбруха и Хорна I34J, добавка тория в количестве 0,015—2,0%
к сплаву 80°о Ni и 20?о Сг повышает его стойкость к окислению при повы-
шенных температурах.
Обзор сплавов тория с обычными металлами был составлен Гертлсром
[29|. Сообщается, что торий, подобно ванадию, молибдену и титану, дей-
ствует как раскислитель стали и что при добавлении тория улучшаются
механические свойства алюминия.
Были исследованы бинарные системы и диаграммы состояния, построен-
ные для целого ряда сплавов тория. Для многих из исследованных систем
характерно образование нескольких интерметаллических соединений. Никель
и кобальт образуют по пять иптерметаллическнх соединений с торием
железо и алюминий - - по четыре, а марганец, висмут, кремний и медь —
по три. Для некоторых других металлов характерно образование с торием
одного или двух интерметаллически.х соединений. Некоторые иптерметалли-
ческне соединения тория, главным образом с медью, серебром, золотом,
висмутом и свинцом, являются пирофорными.
При проведении обширных исследований образования соединений тория
с титаном, ванадием, хромом, цирконием, ниобием, гафнием и ураном не наб-
людалось. Твердые растворы в металлическом тории обнаружены в очень
ограниченном количестве систем. Компактный торий обладает некоторой
растворимостью но отношению к углероду, гафнию и урану и значительной
растворимостью по отношению к цирконию, церию и лантану.
Более подробное описание и литература по структуре сплавов торпя
приведены н отчетах Уилхелма [83], а также Рафа, Бауэра и Сэллера 155].
В недавно вышедшем переработанном издании книги Хансена [ЗЗ1] также
приведены подробные данные о многих сплавах тория.
ТЕХНИКА БЕЗОПАСНОСТИ ПРИ ПРИМЕНЕНИИ ТОРИЯ
11екоторые факторы, связанные с токсичностью тория и другими опас-
ностями, характерными для этого металла, еще недостаточно изучены. Хотя в
промышленной практике торий, по-видимому, применяется в контролируемых
условиях и это не приводит к несчастным счучаям, опыт показал, что торий
представляет вполне реальную опасность в целом ряде областей применения
и что при работе с ним необходимо принимать соответствующие меры предо-
сторожности.
Вуа [551 рассмотрел опасности, связанные с применением тория: ток-
сичность, радиоактивный распад, опасность возникновения пожара и
взрывоопасность. В своем обзоре Вуа указывает, на основании каких
данных характеризуются опасности, рекомендуемые меры предосторожности
и установление пределов. Основная вредность тория вызывается продуктами
радиоактивного распада, поэтому отходы ядерной промышленности часто
содержат потенциально опасные радиоактивные изотопы. В отчете Вуа |55]
подробно описаны меры предосторожности, необходимые при применении
тория, и приведена литература по этому вопросу.
812 Глава 31
ОБЛАСТИ ПРИМЕНЕНИЯ ТОРИЯ
Основные области применения тория (ядерная техника и производство
сплавов на основе магния и газокалильных сеток) уже рассматривались крат-
ьо в вводной части настоящей главы. Повышенный интерес к торию, наблю-
даемый за последнее время, объясняется главным образом потенциальной
возможностью его применения в ядерной технике; интерес к торнемагниевым
сплавам также быстро растет. Производство газокалильных сеток до некото-
рой степени стабилизировалось и все еще составляет значительную долю
общего потребления тория. В настоящее время газокалильные сетки приме-
няются главным образом в ручных газовых фонарях. Существует еще целый
ряд других довольно важных областей применения тория, для которых
требуются сравнительно небольшие количества двуокиси или металлическо-
го тория.
Применение тория в ядерной технике
Согласно Хоу [361, торий применяется в ядерной технике в виде метал-
ла, сплавов н различных соединений. Однако следует указать, что, хотя
в настоящее время ведется разработка метода получения U233 из тория, еще
ни один ядерный реактор не работает па U233 1771 и перспективы применения
торнн в ядерной технике еще не совсем ясны * В настоящее время изучаются
возможности применения в ядерной технике металлического тория, ториево-
урановых сплавов с покрытием из таких металлов, как цирконий или
нержавеющая сталь, а также металлических суспензий соединения торий —
висмут в жидком висмуте п водных суспензий двуокиси тория.
Для перспективного плана развития ядерной промышленности весьма
желательно добиться возможности получения новых атомов ядерного
топлини по крайней мере с той же скоростью, с которой они расходуются.
В среднем не менее двух нейтронов от каждого делящегося атома должны
находить надлежащие мишени (атом топлива для поддержания цепной реак-
ции и атом для получения вторичного ядерного топлива), иначе воспроизвод-
ство ядерного топлива не будет соответствовать его расходу.
В любом реакторе надлежащей конструкции наблюдаются различные
явления, неизбежно приводящие к потере нейтронов для желаемых реакций.
Поглощение нейтронов другими компонентами реактора, а также примеся-
ми, срыв нейтронов на экран, поглощение продуктами деления и дочерними
продуктами, а также поглощение, вызывающее побочные реакции, являются
основными причинами потерн нейтронов. Поэтому для обеспечения 100"и-
ного воспроизводства ядерного топлива количество нейтронов, выделяющих-
ся на каждый делящийся атом, должно быть намного больше двух.
Работа ядерного реактора на тепловых нейтронах с обеспечением пол-
ного воспроизводства ядерного топлива возможна, по-видимому, только
при условии применения торпя н U233. Сраннение трех видов ядерного топ-
лива в отношении количества нейтронов, выделяющихся на каждый иогло-
* Па атомной электростанции Индиан Пойнт (штат Нью-Йорк) фирмы «Коисо-
лидеитид Эдисон» с проектной мощностью 275 000 кет, пуск которой был намечен
иа 1961 г., применяется ториевын ядерный реактор. Его потребность в тории опреде-
лена равной 18 860 кг для первого года работы и 9410 кг для каждого последующего
года. 1ормерые ядерные реакторы установлены также иа атомных электростанциях
«Рурал кооператив гауэр ассошиейшн» мощностью 22 000 кет (па реке Элк. штат
Миннесота) и «Энрико Ферми» (фирмы «Пауэр риэктор дивелопмент» и «Детройт Эди-
сон») мощностью 100 000 кет (вблизи Детройта, штат Мичиган). По данным Комиссии
по атомной энергии США, в течение ближайших нескольких лет годовое потребление
металлического тория в ядерной технике составит около 10 т [cv. Chem. Week (Sep-
tember 19, 1959)].
Торий . Ш
щеннын тепловой нейтрон, показывает значения 2,38, 2,06 и 2,03 для U233,
U235 и Ри239 соответственно. Вследствие неизбежной потери нейтронов
в ядерном реакторе реакторы на тепловых нейтронах, в которых ядерным
топливом служит Pu23S, не moij't воспроизводить надлежащего количества
Ри230 п и23**.Однаьо эти данные показывают, что после пуска реактора,
работающего на тории и U333. можно достигнуть расширенного воспроизвод-
ства U23J и полного использования всего тория для производства ядерной
энергии.
Применение тория в качестве ядерного топлива связано с рядом недо-
статков, по оно имеет и преимущества [77]. По-видимому, самым большим
недостатком является образование в результате побочных ядерных реакций
материалов с высокой радиоактивностью, загрязняющих образующийся
у2з.1 „ отработавший торий. Таким материалом является главным образом
U232, который образуется непосредственно в результате реакции (п. 2п)
с U233 и побочным путем в результате реакции (п, 2п) с Th232. Интенсивная
¦у-актнвность загрязняющих изотопов и токсичность самого U23d усложняют
процесс, необходимый для периодического получения очищенного топлива
и тория и их последующей обработки. При применении тория дли производ-
ства ядерной энергии, по-видимому, требуются дистанционное управление
и герметичное оборудование.
В реакторах на быстрых нейтронах применение тория и U283 дГплжно
¦обеспечить возможность воспроизводства ядерного топлива, хотя применение
в этих реакторах и238 и Pu23s также обеспечивает это воспроизводство. Ядер-
ные установки на быстрых нейтронах пока еще нигде не работают.
Применению тория в ядерной технике в США никогда не уделяли столь-
ко внимания, сколько уделяется урану, что объясняется высоким спросом
на плутоний ввиду большого военного значения этого элемента. Некоторые
ядерные явления, происходящие с и233, снижают его ценность как ядерного
оружия по сравнению с плутонием [77].
Неядерные области применения тория
Торий имеет большое значение как легирующая добавка в производстве
сплавов на основе магния, так как он способствует повышению прочности
и сопротивления ползучести магния при высоких температурах. Несмотря
на то что плотность металлического тория соответствует плотности свинца,
для улучшения качества легких сплавов на основе магния, широко приме-
няемых в реактивной авиации и ракетной технике, достаточно небольшого
количества тория (около 3%). Подробный обзор сплавов на основе магния
с присадкой тория приведен в работе Леонтиса [46].
Другие неядерные области применения тория описаны Лилнендалем
D81. Сравнительно низкая работа выхода и высокая электронная эмиссия
тория обусловили его применение в газоразрядных трубках различного
типа. Торцевые электроды характеризуются низким пусковым напряже-
нием, постоянством рабочих характеристик и в некоторых случаях большей
долговечностью, чем оксидные электроды или электроды из торнреванного
вольфрама. В некоторых областях радиоактивность тории используется для
получения ионизированных частиц, как описано Ноттингемом [60].
Торий применяют в фотоэлементах для измерений в широкой полосе
ультрафиолетовой части спектра. Промышленные лампы такого типа приме-
нимы в пределах 2000—3750 А. Их конструкция и принцип действия описа-
ны Ренчлером и сотр. [671. Влияние газообразных примесей н металле на
фотоэлектрическую чувствительность описано Ренчлером и Генри [6Г>1.
814
Глава 31
Успешное применение металлического тория в таких газоразрядных
трубках, как ртутная лампа высокой интенсивности, описанная Фрпменом
[22], иллюстрируется табл. 7. Электроды этих ламп представляют собой
Таблица 7
СРАВНЕНИЕ ГОРИЕВЫХ ЭЛЕКТРОДОВ
И ЭЛЬКТРОДОВ С ПОКРЫТИЕМ ИЗ ОКИСИ
ЩЕЛОЧНОЗЕМЕЛЬНОГО iMr-ТАЛЛА а
Срок службы.
час
0
100
500
1000
аюо
Свето
торцевые
электроды
36H
3260
3090
3030
2620
электроды с
покрытием из
окиси щелоч-
ноземельного
металла
3450
3180
2Б80
2320
1430
3 По данныу AIEE (Американский институт инже-
неров-электриков).
торцевую проволоку, вставленную в вольфрамовую спираль. В таблице сопо-
ставляются рабочие характеристики ламп с комбинированным торцевым
электродом и ламп с электродами, покрытыми слоем окиси щелочноземель-
ного металла, после различных сроков службы. Превосходство торцевых
электродов после длительного срока службы вполне очевидно.
Металлический тории применяется при изгоювлении ламп бактерицид-
ного действия с холодными катодами. Эти лампы обычно снабжены пусто-
телыми цилиндрическими никелевыми электродами с приваренной внутри
электрода точечной сваркой ториевой пластинкой. Торий распыляется
и осаждается на никеле, образуя поверхность с меньшей работой выхода
н пониженным пусковым напряжением. Другие возможности применения
тория в электроламповой промышленности описаны Бярнсом 12], а также
Fvctiihom и Фрпменом [30].
Неядерное применение двуокиси тория
Как уже отмечалось, двуокись тория применяется главным образом для
производства газокалнльных сеток. Хотя лампы с такими сетками постепен-
но вытесняются лампами с вольфрамовыми нитями накала и неоновыми лам-
пами, производство газокалнльных сеток для ручных газовых фонарей
постоянно увеличивается.
11ри изготовлении вольфрамовых нитей накала для осветительных ламп
к металлическому вольфраму присаживают двуокись тория для регулирова-
ния роста зерна. Изготовление нитей накала из чистого вольфрама дает неудо-
влетворительные результаты, так как вследствие быстрого роста кристаллов
при высоких температурах образуются крупные равноосные зерна, по гра-
ницам которых легко происходит скольжение. Такие нити быстро перегорают.
Присадка 0,8—1,2"с двуокиси тория, добавляемой в виде нитрата к вольфра-
мовой кислоте перед ее восстановлением до металла, обеспечивает устойчи-
Торий . 815
вую мелкозернистую структуру готовой проволоки. Такие нити не перегора-
ют и лучше выдерживают вибрационные нагрузки, чем нити из чистого
вольфрама или с «летучими» присадками, например с хлоридом калия или
кремнеземом. Подробно этот вопрос рассмотрен в работе Смителса [74].
Важное значение имеют торцевые системы, особенно такие, в которых
двуокись тория распределена в вольфрамовой основе. Соответствующие им
сплавы применяются в качестве источника первичной электронной эмиссии.
Содержание двуокиси тория обычно составляет 1—2 вес.%.
Термоэлектронной эмиссии торированного вольфрама посвящено много
работ. В справочнике по электронной технике [39] этот вопрос хорошо осве-
щается с позиций промышленной практики. Термоэлектронная эмиссия
является следствием поглощения проводящими электронами тепловой энер-
гии в количестве, достаточном для преодоления работы выхода. Чем ниже
работа выхода, тем больше может быть эмиссия. Максимальная эмиссия
наблюдается тогда, когда торием покрыто около 70°'о активной поверхности.
Рабога выхода торированного вольфрама определялась несколькими иссле-
дователями. Некоторые значения приведены в табл. 8. Эти значения сопо-
ставимы со значением 3,36 в, полученным Цвикксром [88, 90"}, и 3,51 в,
приведенным в табл. 3 для термоэлектронной работы выхода чистого тория.
Таблица 8
РАБОТА ВЫХОДА ТОРИРОВАННОГО ВОЛЬФРАМА
Работа выхода,
в
2,63
42,6
2,86
2,77
Аа
3,0
3,2
6,5
Литература
2U
59
7
64
а Константа в уравнении термоэлектронной эуис-
сии Рнч;|рл1-онп—Дсшмена.
Двуокись тория применяется для изготовления электронной аппарату-
ры, в которой катод подвергается бомбардировке заряженными частицами,
например магнетронов. При одинаковой температуре термоэлектронная
эмиссия сопоставима с эмиссией торированного вольфрама [15, 84].
Значительное количество двуокиси тория расходуется на изготовление
торнрованных вольфрамовых электродов, применяемых при сварке, а также
в качестве нерасходуемых электродов при дуговой плавке переходных
металлов. Двуокись тория предназначается главным образом для стабилиза-
ции душ.
Двуокись тория, которая является самым тугоплавким окислом, в огра-
ниченном количестве идет на изготовление специальных тнглей [111. Однако
плавить переходные металлы в тиглях из двуокиси тория так, чтобы послед-
няя частично не растворялась в металле, по-видимому, невозможно.
ЛИТЕР AT УРА
1. А'г s e m W- С. пат. США 1085098, 1914.
2. Barnes L. E., Ilium. Eng., 46, 41 A951).
SJ6 Глава 31
3. В а и к I о h W., М с i e r I I n g J., Giesserei, 29, 93 A912).
4. Bcrger К., Dissertationen Basel, Gmelin Kraut Handbuch, 1907.
5. В е г z е 1 i u s J J., Pogg. Ann., 16, 385 A829).
6. П о h I i n H., Ann. Physik, 61, 421 П920).
7. В r a t t a i n W.H., Becker J. A., Phys. Rev., 43, 428 A933).
й. В r i d g m a n P. W . Phys. Rev., 4b, 825 A935).
9 В r i d g m a n P. W., Proc. Am. Acad. Arts Sci., 76, 55 A948).
10. Burgers W.C.vsn Liempl J,Z. anorg. allgem. Cherri., 193, 144 A930).
11. Calderwood W-, U. S. Atomic Energy Commission, Rept. № 2736, 1945.
12. С h i о t t i P., U. S. Atomic Energy Commission. Pert. M° AECD-3072, 1950.
13. С h i о t t i P., R о g e r s В A., Metal Progr., 60, 60 A951).
11. Cuthbert F. L., Thorium Production Technology, Reading, Mass., Addison—
Wesley Publishing Company, 1958.
15. Danforth W- E., J. Franklin Inst., 248, 449 A949).
16. Davenport E. S., АШМЕ, Tech. РнЫ. M> 226, 1929.
17. D'E у e R. W. M., U. S. Atomic Energy Commission, Rept.№ AERE-C/I^-425, 1919.
18. Die ks on B. H., Kaufman D., U. S. Atomic Energy Commission, Rept.
№ AECD-2887, 1950.
19. D r i fi g s F. H, L i 1 1 i e n d a h 1 W. С Ind. Eng. Chem., 22, 1302 A930).
20. D u s h m a n S., E w a I d I.. Phys. Rev., 29, 857 A927).
21. E s p e W-, Powder Met. Bull., 4, 17 A949).
22. Freeman G. A.. Elect. Eng., 59, 444 A940).
23. Frohlich 1\. W., В a r t h e I A., Metallwirtschaft, 21, 103 A942).
24. Fronilel C, L. S. Geological Survey, Bull. J\° 1064, 1958.
25. G 1 a s s n e r A., U. S. Atomic Energy Commission, Rept JV» ANL-575.0, 1957.
26. Glasstone S., Source Book on Atomic Energy, D. Van Nostrand Company,
Inc., Princeton, N. J., 1950
27. G r i f f e I M., Skochdopole R. E., J. Am. Chem. Soc., 75, 5250 A953).
28. G r i m a I d i F. S., M a r s h C. A., U. S. Atomic Energy Commission, Rept.
№ AECD-2818, 1947.
29. G u e r t 1 e r W., Metallwirtschaft, 19, 435 A940).
30. G u s t i n D.S., Freeman G. А., пат. США 22Н345, 2241362, 1941.
31. Hamby D. F., U. S. Atomic Energy Commission, Rept. № ORM.-1090, 1951.
32. 11 a m e r" R. J.. J. Opt. Soc. Am., 9, 251 A924).
33. H a n s e n M., Constitution of Binary Alloys, 2nd ed., McGraw-Hill Book Compa-
ny, Inc., New York, 1958.
34. Hessenbruch W., Home L., Z. Metallkunde, 36, 145 A944).
35. Hopkins B. S., Chapters in the Chemistry of the Less Familiar Elements,
Stipes Publishing Co., Champaign, III., 1939.
36. Howe J. P., Metal Progr.. 71, 97 A957).
37. H u 1 I A. W , Phys. Rev., IS, 88 A921).
ЗЯ. Hunt E. B, R u n d 1 e R- Г., J. Am. Chem. Soc, 73, 4777 A951).
39. Industrial Electronics Reference Book, John Wiley and Sons, Inc., New York, 1948.
W.James W. J-, S t r a » m a n i s M. E., Acta Cryst., 9, 376 (I95G).
41. К а и и н Л., в книге «Актиниды» (Кац Дж., Сиборг Г., ред.), ИЛ, Москва, 1956.
42. К 6 s t e r W., Z. Metallkunde, 39. 1 A948).
43. К г о 1 I W., Z. Metallkunde, 28, 30 A936).
44. К u z e I H-, W e d e k i п d E., пат. США 1088909, 1914.
¦15. L е 1 v D, H a m b e r g e r L.. Z. anorg. allgem. Chem., 87, 209 A914).
46. L с о n t i s T. E., Metal Progr., 72, 97 A957).
47. Levy S. I.. The Rare Earths, Edward Arnold and Co., London, 1924.
48. L I 1 I i e n d a h I W- C. .Metal Profir., 71. 104 A957).
49. L i I I i e n d a h 1 W. С, пат. США 2537067, 1951.
Торий _ Л/7
oft. L о vv e n s t e i п P., U. S. Atomic Energy Commission, Rept. As MIT-1102, p. 47,
1952.
51. McDonald J. C, Trans AIMME, 143, 179 A941).
52. Mardin J. W., Rentschler П. С, Ind Eng. Cheiji.. 19, 97 A927).
53. Meepcon Г А., Материалы Международной конференции по мирному исполь-
зованию атомной энергии, т. 8, Метал тергиздат, Москва, 1958, стр. 227.
54. М е i s s n e r W., V о i g t В., Ann. Physik, 7, 892 A930).
55. The Metal Thorium, Proceedtngs of] USAEC-ASM Conference on Thorium. American
Society for Metals, Cleveland, 195S.
56. Minerals Yearbook, U.S. Bureau of Alines. Government Printing Office, Washington,
D. C. 195G, 1957. 1958.
57. M о i s s a n H., Honigschmidt O., Ann. chim. et phys., 8, 182 A905).
58. N e u b e r g e r M. C, Z. Krist., 93, 1 A936).
59. N о t t i n g h a m W. В., Phys. Rev., 41, 793 AУ32).
60. Nottingham VV. В., Rev. Sci. Instr., 11, 2 A940). ^
fil. Nottorf VV-, U. S. Atomic Fnergy Commission, Rcpt. № AECD-2984, 1945.
62. Pilkington R. S., WylieA W. J. Soc. Chem. Ind. (London), 6E, 387 A947).
6.4 The Rare Earth Industry, Crosby Lockwood and Son, Ltd., London, 1918.
61. R с i in a n n A. L., Proc. Roy. Soc, A163, 499 A937).
65. R e n t s с h 1 e r H C., Henry D. E., J. Opt. Soc Am., 26, 30 A936).
66. Rentschler H.C.Henry D E., Trans. Electrochem. Soc, 87, 289 A045).
67. R e n t s с h 1 e r II. C, Hcnrj D. E., S m i t h K.. p.. Rev. Sci Instr., 3,
794 A932)
68. R с n t sc h I e r H. C, L i 1 1 iend a li 1 W. С Gray J., .пат. США 2146062,
1948.
69. Reynolds M. В., U. S. Atomic Energy Commission, Rept. № AECD-3242, 1У51.
70. R о 1 1 e f s о п О. К-, H a g e ш a n n F., U. S. Atomic Energy Commission,
Rept. Ns CB-3717, 1947.
71. R u n d 1 e R. E., Acta Cryst., 1. 180 A948).
72. Schumar J. F., Macherey R., I . S. Atomic Energy Commission, Rept.
№ CT-3731, 1946.
73. S i d I e s R H., Danitlson G. C, U. S. Atomic Energy Commission, Rept.
№ ISC-761, 1956.
71. S m i t h e I I s C. J., Tungsten, 3rd ed., Chapman and Hall, Ltd., London. 1952.
75. Spencer J., The Metals of the Rare Earth, Edward Arnold and Co, London,
1918.
76. T h о m p s о n J. G., Metals and Alloys, 4, 114 A933).
77. Thorium—U-11 Symposium, L. S. Atomic Energy Commission. Rept. Л° BNI -483
(C-26), 1958.
78. U r i e R. W , J. Soc. Chem. Ind. (London), C6. 437 A947).
79. Van A r ke 1 A. E., Reine Metalle, Edwards Bros., Inc., Ann Arbor. Mich.. 1913.
80. В о I ten W., 7. Elektrocliem., 14, 768 A908).
81. VV a r t e n b e r g H., Z Elektrochem., 15, 866 A909).
82. Whitney L. V., Phys. Rev., 48, 458 A935).
83. W i 1 h e I m H. A., Chapter on Thorium in Metallurgy and Fuels (Finneston H. M.,
Ноте J. P., Eds.), McGraw-Hill Book Company, Inc., New York, 1956.
84 Wright D. A., Nature, 160, 129 AУ47).
85 Z а с h a r i a s e n W. H., Лс1а Cryst.. 2. 288 A949).
86. Z и с h а г i a s e n VV H., Acta Cryst., 6, 393 A953).
87. /achariascn W. H., Phys. Rev., 73, 1104 A948).
88. Z w i k k e г С, Physica. 8, 240 A928).
89. Z w i k k e г С. Phys. Z., 30, 578 A929).
90. Zwikker C, Proc. Roy. Acad. Sci. Amsterdam, 29, 792 A926).
52 ,i:,Ka3 № 2 39
32.
УРАН
С. ИССЕРОУ
S. Isserow, Nuclear Metals, Inc.,
Concord, Massachusetts
ВВЕДЕНИЕ
Элемент уран открыт Клапротом в 1789 г. [83, 84]. Металлический уран
был впервые успешно получен Пелиго свыше ста лет назад. Он показал,
что вещество, открытое Клапротом, было окисью урана и что произвести
восстановление ее до металла гораздо труднее, чем думали раньше 1114,
115]. Интересная история производства металлического урана изложе-
на Уплхелмом 1141]. Однако до недавнего использования ядерных свойств
урана он и его соединении имели малое промышленное значение.
Уран — основное ядерное горючее, так как в нем содержится един-
ственный природный делящийся изотоп. Интерес к ядерным свойствам ура-
на вызван тем, что, используя их, получают энергию, продукты деления
и дополнительный делящийся материал. Уран важен не своими металли-
ческими свойствами, хотя металлический уран удобно использовать в яде_р-
ных реакторах, поскольку он обрабатывается подобно другим металлам
и привлекателен тем, что имеет большую плотность и теплопроводность.
Особые трудности производства металлического урана вызваны его большой
химической активностью, вредностью для здоровья из-за радиоактивности
и анизотропией. Тем не менее для использования урана в области ядерной
энергетики разработана передовая технология, дающая с помощью довольно
обычных операций многие тонны урана различных форм. Ни у одного метал-
ла технология не разрабатывалась столь интенсивно и за столь короткий
срок. В настоящее время в несекретной литературе имеется много сведений
о технологии урана.
Изотопы и ядерные реакции
При использовании урана в ядерной промышленности необходимо учи-
тывать, что различные изотопы дают различные ядерные реакции. Эти раз-
личия настолько существенны, что иногда необходимо разделять изотопы
в большом масштабе, главным образом концентрировать делящийся уран-235.
Изотопный состав и ядерные свойства природного урана приведены
в табл. 1.
Были приготовлены искусственные изотопы с массовыми числами
от 228 до 239. Наиболее важный из них — делящийся уран-233 (af 525) —
получен реакцией нейтронов с торием-232.
Уран-235 — единственный встречающийся в природе делящийся изотоп.
Он захватывает нейтрон, образуя уран-236, который с большой вероятностью
делится на два атома с массовыми числами приблизительно между 70 и 160.
Число выделяющихся нейтронов различно и зависит от того, какая образует-
ся пара продуктов деления. Соответствующее выделение энергии может быть
вычислено из потери массы, найденной по разности массы урана-235 плюс
масса нейтрона и массы продуктов деления плюс масса выделившихся ней-
тронов. Таким образом, если взять наиболее вероятные осколочные элемен-
Уран
819
Таблице 1
ИЗОТОПНЫЙ СОСТАВ И ЯДЕРНЫЕ СВОЙСТВА ПРИРОДНОГО УРАНА
Массовое
число
234 (UII)
235 (AdJ)
238 (IJ1)
Излучение
4,76
4,39
4,18
Содержание реакция с тепловы-
период полу- в природном м11 нейтронами
распада, лет Уране, % н ¦
2,48-105
7,13-108
4,51-10»
0,0056 |с;<0,Ь5
0,718 -Деление
af 590
99,276 Образование U'-зв,
превращающего-
ся В Ри239
ты с массовыми числами 95 и 139 [57, 69], т. е. нуклиды 42Мом и E7La"e,
то мы получим потерю массы 0,210 атомной единицы. Она легко переводится
в энергию по уравнению Е = тс2 и эквивалентна 200 Мэв,деление Пли
2-1010 кал/г B,15- Ю4 квч/г). Сравнение этих количеств энергии с теплотвор-
ной способностью угля, равной 5000 кал/г, показывает, что при полном сго-
ранин 1 г урана выделяется тепло в количестве не менее, чем при сжигании
4 т угля.
Наиболее распространенный изотоп уран-238 превращается в деля-
щийся плутоний (Ри239а; 729) по следующим реакциям:
(В выражении аХь а — атомный номер или итоговый ядерный заряд, b —
масса. По этим обозначениям нейтрон оп1, а электрон _iP°.) Первоначально
образовавшийся с захватом нейтрона тяжелый изотоп урана претерпевает
два Рраспада (испускание электрона), и получается элемент плутоний с атом-
ным номером на 2 единицы больше. Превращение тория в делящийся
уран-233 происходит по аналогичным реакциям:
оТ2.чз
Плутоний и уран-233"отделяются от своих предшественников урана и тория
химическими методами, поскольку это различные химические элементы. Для
выделения делящегося урана-235 из природного урана требуются другие
способы. Основной метод обогащения ураном-235 — газовая диффузия —
первоначальноосуществленвболыпоммасштабе в Ок-Ридже (штат Теннесси),
а в настоящее время используется также на заводах в Падьюка (штат
Кентукки) и Портсмуте (штат Огайо) [3, стр. 68; 6; 132]. Капитальные
вложения в эти три завода достигают почти 3 млрд. долл.; заводы расходуют
7% электроэнергии, производимой о США.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И МЕСТОРОЖДЕНИЯ
В результате новых открытий, стимулированных инициативой к про-
ведению большого количества разведочных работ, данные о распространен-
ности урана пересматриваются в сторону повышения. «Геологоразведочные
52*
ОСНОВНЫЕ УРАНОВЫЕ МИНЕРАЛЫ [i, ГЛ. 5]
Таблица 1
Минерал
Состав
Уранинит
Урановая смол-
ка
В основном 1!О2 с иОя, образовав-
шейся в рез\.'штате окисления
- Приблизительно U3O8
Коффшшт
Карнотит
Тюячунпт
Торбернит
U(SiO4)i- t-
K2O-2UO;,-V2Cy;!lI2O
(п обычно 1—3)
CaO-2UO3-V2O5-nH2O
(п обычно 9—10)
CuO-2UO3-P2CVnH2O
(ti обычно 8—12)
Цие
Черный (сероватый, зе-
леноватый коричне-
ватый)
Черный (сероватый,
зеленоватый)
Черный
Канареечно-желтый
Зелеповатс-желтыи
Зеленый
Примечания
Массивный или кристаллический ми-
нерал; найден в жилах, пегмати-
тах и рассеян во вторичных породах
Термин, часто употребляемый вместо
уранинита, ио обычно относимый
к массивным формам уранинита, на-
ходящимся главным образом в жи-
лах, часто с минералами других ме-
таллов и в неокнеленных вторичных
отложениях
Тонко распределен в песчаниках; час-
то тесно перемешан с уранинитом и
углистыми материалами
Встречается в рассеянных отложениях,
образующих неправильные линзы
в слоях песчаника; часто ассоции-
рован с окаменелыми деревьями и
песчаниками
Чаще всего в трещинах изисстняка
нлн доломита; находится также
с карнотитом
Вторичный минерал; образовавшийся'
с другими урановыми минера тами
в трещинах, особенно там, где про-
изошло окнс1ение первичных отло-
жений
Месторождения
Норвегия
Яхнмов (Богемия,
ЧССР); Большое
Медвежье озеро;
озеро Атабаска,
Саскачеван (Ка-
нада); округ
Гильпин (шт. Ко-
лорадп, США);
Катанга (Конго)
Шт. Колорадо
(США)
Шт. Колорадо, Юта
(США); Южная
Австралия; Ка-
танга (Конго) .
СССР
Иоганнгепрген-
штадт(Саксония)
Отеннт
Уранофан
Шрекиигернт
Давндит
Браииерит
(n обычно 8—12)
CaO-2UO3.2SiO2'6H2O
3CaO'Na2O-UO3-3CO2-SO3- 10H2Oa
(Fe, Се. U)(Ti, Fe, V, СгK(О, ОНOб
(U, Ca, Fe, V, ThK Ti5OI8
От лнмонно-желтого
до желтого цвета се-
ры, а также зеленый
Лимонно-желтый;
бледный зеленовато-
желтый
От желтого до зеле-
новато-желтого
Черный
Вторичный минерал, образовавшийся
с друшми урановыми минералами
в трещинах, особенно там, где про-
изошло окисление первичных отло-
жении
Находится в отложениях имеете с
другими вторичными урановыми ми-
нералами
Относительно второстепенный вторич-
ный минерал, находящийся в неко-
торых гнпссодержаших глинах и
окисленных участках первичных
отложении
Шт. Юта (США);
Отсн (Франция)
Катанга (Конго)
Яхимон (Богемия,
ЧССР)
Радиум-Хнлл
(Австралия)
Округ Кастер (шт.
Айдахо, США)
я Также NaCa3UO2(OH, F)[CO3]3[SO4]¦ 10Н2О. Прим. ред.
Цавиднт близок к Fc|+(Fe3+, CeJTieOu; может содержать до 8% окислов редкоземельных элементов а до 5% UO2. Это основной урановый мине-
рал высокотемпературных жильных месторождений, богатых титаном —Прим. ред. ¦ . •
822
Глава 32
Классификация некоторых
Основная
порода
Типичные ассоциации минералов
давиднт с уранинит с Си,
ильмени- Мо и Fe и
том, квар- кварц, акти-
цем и био- иолит н хло-
ТИТОМ РИТ
минералами
N1, Со, Ag и
Си с примесью
карбоната
A1 иварца)
уранинит Или
браннернт с
золотом и
сульфидами
железа(или
оба эти мине-
рала)
уранинит с . ура1шм:
галенитом. Си-мине]
пиритом и си-
ликатными
минералами
:ит с
¦рала-
мн (месторож-
дения Сц—U)
Гранит
Рнолитоные
породы
Континсн
тальиые
конгломе-
раты, пес-
чаники и
сланцы
Известняки
Конгломе-
раты
Кварцит
Гнейс
Сланцы
Вулкани-
ческие
породы
Раднум-
Хнлл
(Австра-
лия)
Райоц Ко-
пиапо (Чи-
ли)а
Карибу
(шт. Коло-
радоа.США)
Шинколоб-
ве (Конго)
Яхнмов (Бо-
гемия,
ЧССР)
Битва терс-
Ранд, Юж-
ная Африка и
Влайнд-Ри-
вер (провин-
ция Онта-
рио, Канада)
Урженрика
(Португа-
лия)
Рудник Лос-
Очос (шт.
Колорадо,
США)
. Рудник
ХэппиДжек,
Вайоминг
(США)
Колорадо,
Фронт-
Реиндж
(США)
Залежи Гун-
нар (Саска-
чеван, Ка-
нада)
Рудник
Швариваль-
цср (шт.
Колорадо,
США)
Рудник Энс
(Саскачеван,
Канада)
n Fie разрабатывается. В настоящее время законсервировано.
работы и добыча урана во всем мире находятся еще на очень ранней стадии,
несмотря на чрезвычайные усилия, затраченные на их развитие за немногие
прошлые годы» [36, стр. 7]. По содержанию в земной коре, равному 2-10 4—
-—4-10 4 вес.%, уран распространен почти так же, как бериллий, мышьяк.
Уран
823
важных месторождений урана
Таблица 3
(приведены в порядке снижения нх температур, слеьа направо)
уранинит или
коффипит с
минералами
Мо и *\s (или
оба эти мине-
рала)
Рудник Ла-
ки Ми, Вай-
оминг
(США)
уранинит it
черные мине-
ралы
Рудник Ми
Вида (шт.
Юта, США)
карнотптовые
РУДЫ (ИЛИ
тюямунит)
фосфаты н ар-
сенаты урана
Окисленные Окисленные
урано-ванадие- РУДЫ бас-
вые руды I сейна Вай-
(шт. Колорадо^, оминг(СШЛ)
США)
Хейстак, Буттс, —
шт. Нью-Мек-
сико(США)
Шт. Восточная
Пенсильванияа
(США)
отеиит. тор-
бернит с лн-
моиитоы
I урансодержа-
щне лигниты
Спокан" (Ва-
шингтон, США)
Лейквью (шт.
Орегона, США)
Приор-Маун-
тинс"(шт.
Монтана)
Шт. Север-
ная Дакота
и Южная
Дакотя
(США)
Район Кунео,
(Италия)
Рудник Энс
(Саскачеван,
Канада)
молибден и тантал [120]. Уран более распространен, чем золото, платина,
серебро, кадмий, висмут и ртуть. Он широко распределен геологически,
а также рассеян и менее сконцентрирован в рудах, чем другие столь же
распространенные элементы. Считается, что основная масса урана в земной
коре сосредоточена в узкой поверхностной зоне.
824
Глава 32 -
Имеется подробный перечень различных урановых минералов [36,
гл. 4; 51; 53; 75, гл. 3; 111]. В табл. 2 подытожены сведения об основных
по экономическому значению минералах.
Первоначально США получали уран из иностранных источников, глав-
ным образом из Конго [36, стр. 181 и Канады [36, стр. 14]. В последние
годы была настолько развернута добыча из американских источников, что
сейчас США, вероятно, стали ведущими производителями урана в западном
полушария. Другой важный источник урана — остатки шламов от добычи
золота в Южно-Африканской Республике (Витватерс-Ранд) [36, стр. 354;
46; 64].
Уран можно также извлекатьиз другого американского сырья, например
из фосфатных руд, лигнита, сланцев и монаиитового песка 136, стр. 12].
Дли этих побочных источников 136, стр. 3721 разработаны процессы извле-
чения, но они не применяются. С освоением различных мест добычи-урана,
главным образом на плато Колорадо, его производство не лимитирует соору-
жение ядерных реакторов.
ПРОИЗВОДСТВО И ЭКОНОМИЧЕСКАЯ СТАТИСТИКА
В предвоенное время, до использования урана как источника энергии
или делящегося вещества, потребление урановых соединений измерялось
килограммами. Эта мера приложима и в настоящее время для обсуждения
использования его в областях, несвязанных с ядерной энергией. Рынок для
Таблица 4
ОВЩИЕ ЗАПАСЫ УРАНОВЫХ РУД ВСЕХ КАТЕГОРИИ R США
(на 31 декабря 1959 г.)
Штаты США
11ью-Мексико
Вайоминг
Юта
Колорадо
Аризона
Вашингтон, Орегон, Нева-
да
Северная Дакота, Южная
Дакита
Другие (Техас, Калифорния,
Монтана, Айдахо, Аляска)
Всего запасов
Количество,
тыс. т
55 700
15 800
5 300
4 500
1200
1 900
600
1 100
R6100
По отношению
ко всем за-
пасам, %
64,7
18,3
e,i
5,3
1,4
2,2
0,7
1,3
100,0
ь~зО8, %
0,26
0,34
0,33
0,30
0,35
0,21
0,27
0,24
Среднее 0,28
обеспечения этой потребности слишком мал. чтобы оправдать организацию
горных разработок только для урана. В связи с потребностью урана для
ядерной промышленности производство его возросло настолько, что уже
измеряется тоннами, и разработка месторождений только для добычи урана
Уран
825
рд р р рр д р рр
ботки. Быстрая разведка и добыча поощряются правительством. Так( за ура-
новую рулу выплачиваются премии [3, стр. 61]. Известные урановые запасы
увеличиваются. Распределение этих запасов в США по состоянию на 31 декаб
ря 1959 г. приведено в табл. 4. Возрастание добычи местных руд видно из
табл. 5. Ожидаемая потребность в уране как горючем зависит от проекти-
руемой потребности во всех источниках энергии и оценки доли, падающей
на ядерную энергию. По этой оценке потребность в уране составит в 1970—
1975 гг. от 50 000 до 100 000 т.гсд 13, 1л. 5; 39; 72].
Таблица 5
ДОБЫЧА РУДЫ В США (ПОСТУПЛЕНИЕ СО ВСЕХ ЧАСТНЫХ УСТАНОВОК
И ГОСУДАРСТВЕННЫХ СТАНЦИИ СНАБЖЕНИЯ)
Полугодовой период
Июль -декабрь 1955 г.
Январь —июнь 1956 г.
Июль —декабрь 1956 г.
Январь—июнь 1957 г.
Добыча сухой
руды, тыс. т
760
1200
1510
1510
Полугодовой период
Июль—декабрь 1957 г.
Яниарь -нюнь 1958 г.
Июль—декабрь 1958 г.
Добыча сухой
РУДЫ, тыс. m
1840
2120
2650
Следует упомянуть о некоторых данных, касающихся стоимости урана.
Комиссия по атомной энергии США гарантирует оплату 17,3 долл. за 1 кг
Ь'зО8 в концентрате. Стоимость металлического урана в слитках нормального
изотопного состава @,7115% урана-235) по расценкам этой комиссии состав-
ляет 40 долл. за 1 кг. Обогащенный уран поступает в стальных баллонах
в виде сжиженного газа - гексафторида урана (UF6). Цена содержащегося
в нем общего, количества урана или урана-235 является функцией обога-
Таблици 6
UFHbl НЛ ОЬОГЛЩЕННЫП УРАН
(В ВИДЕ UFe) [3]
Уран-235,
%
0.72
1,0
10,0
50,0
90,0
Цена I кг U, долл.
40,50
75,75
1 529,00
8 379,00
15 361,00
Цеиа 1 г U i
долл.
5.62
7.58
15,29
16,76
17,07
щения, т. е. весовой доли урана-235. Несколько примеров цен даны в табл.
6 [3, стр. 14; 61. Очевидно, стоимость высокообогащеиного урана прибли-
жается к 21 000 долл. за 1 кг.
* Переработка руд с такими минералами, как карнотит с высоким содержанием
ванадия, продолжается. Они служат источником большого количества ванадия, для
которого онн первоначально главным образом и добывались.
626
Глава 32
ОБОГАЩЕНИЕ РУД
Прежде всего необходимо отделить соединения урана от основной мас-
сы сопровождающей его пустой породы. Продукт, получаемый на этой
стадии концентрирования, представляет собой технически чистое соедине-
ние урана G0—90% UaO8). Такие методы обогащения руд, как гравита-
ционное разделение или флотация, применяются мало. В основном использу-
ются гидрометаллургнческис методы, которым может предшествовать обжиг.
Кислоты и щелочи переводят уран в растворимые соединения [?6, 30].
Затем ураи извлекают из водного раствора в виде окиси или соединения
(например, соли Na2U2O;) путем осаждения или другим процессом. Ввиду
Песчаные
Подписпснный (юс квисты
твор нитратов
NH5
или
Рис. 1. Упрощенная схема
обогащения урана |3].
/ — шаровая мельница; 2 — клас-
сификатор; 3 — классификаторы
для разделения песка-шлама;
4 — 14 агрегатов (смола в пуль-
пе): 5 — фильтр; 6 — сушилка;
/ — загр>зка; // — резерв; /// —
отмывка.
Продукт
G5%
необходимости переработки больших объемов предпочитают пользоваться
недорогими реактивами. В последующих операциях предусматривается
регенерация этих реактивов.
Ввиду большого разнообразия урановых руд необходимо пользоваться
различными технологическими схемами обогащения, приспособленными к дан-
ной руде. В табл. 7 указаны главные операция н условия их выбора. На
рис. 1 представлена упрощенная технологическая схема. Подробные сведения
о различных операциях даны в специальной работе J36J. Данная книга со-
держит также исчерпывающие описания обогатительных фабрик, работаю-
щих в главных рудоносных областях США, Канады и Южной Африки:
В руде содержится малое количество урана, поэтому обогащение обыч-
но проводят вблизи источника руды, чтобы свести к минимуму транспорт-
ные расходы. Производительность фабрики колеблется от нескольких сотен
до нескольких тысяч тонн руды в сутки. Имеются табличные данные ]3,
стр. 66; 29: 30; 34] об обогатительных фабриках США; почти все фабрики
принадлежат частным лицам. (Единственная государственная обогатитель-
ная фабрика была закрыта в конце 1959 г.)
РАФИНИРОВАНИЕ
Урановые концентраты подвергают очистке для удаления оставшихся
примесей и получения чистой окиси, пригодной для последующего пере-
вода через UFj в металл для реактора или в \JF6 для завода по разделению
ОСНОВНЫЕ ОПЕРАЦИИ ОБОГАЩЕНИЯ УРАНОВЫХ РУД
Исходное сырье: урановые руды, содержащие 0,69—4,6 кг UgOg на 1 m руды
Готовый продукт: концентраты окиси или соли урана, содержащие по анализу 70—90 ве
Таблица 7
i UjO8
Типологическая операция
А, Подготовка руды
1. Измельчение
2. Обжиг
Б. Выщелачивание
1. Разложение
а) Осветление
2.
б) Разделение песка и шлама
В. Извлечение продукта
1. Извлечение
Метод
Дробление и истирание
а) Кислотное выщелачивание, обычно серной
кислотой; необходимы окислители; обычные
оборудование и приемы работы
б) Щелочное выщелачивание, обычно смесью
карбоната и бикарбоната натрия;'обычные
оборудование и приемы работы
Декантация и фильтрование, дающие прозрач-
ный раствор; иногда необходимы флоккулян-
ты. Оборудование и приемы работы обычные
Сгущение, дающее фракции песка и шлама.
Оборудование и приемы работы обычные
а) Химическое осажденне. Обычный процесс,
допускающий применение стандартного обо-
рудования для разделения системы твердое
вещество—жидкость. Реактивы и условия
осаждения меняются применительно к
способу выщелачивания (кислотному или
щелочному)
Примечания
Улучшает переход урана в раствор и облегчает
обращение с рудой; применяется не часто
Нормально показано для руд, бедных известня-
ком («*12% СаО); высокое извлечение.
Нормалыю показано для руд, богатых известью
Используется в тех случаях, когда для последу-
ющей операции извлечения необходим прозрач-
ный раствор, например для процесса осажде-
ния (см, ниже В, 1, а)
Используется вместе с процессом извлечения
«смола в пульпе» (см. ниже В, 1,6)
Ограничивается рудами, дающими прозрачный
раствор. Больший расход реактивов при оеаж-
деннм из кислых растворов (на более современ-
ных обогатительных фабриках, применяющих
кислотное выщелачивание, приняты другие ме-
тоды извлечения). Готовый продукт—обычно
окись урана, ио может быть и диуранат натрия
Продолжении табл. 7
Технологическая операция
2. Конечная обработка
б) Ионный обмен. В одном методе, требующем
прозрачного раствора, используются аиионо-
обменные смолы в обычных колоннах. В не-
давно разработанном методе, известном как
процесс «смола в пульпе» (СВП), может
использоваться пульпа. В этом процессе через
пульпу двигаются вперед и назад перфо-
рированные корзины с шариками анионной
смолы.
в) Экстракция растворителем. Применяются ор-
ганические растворители (амнны и фосфаты)
в контактном оборудовании типа смеенте-
лей-отстойинков или колони. Применяется
для прозрачных растворов
Фильтрование и сушка осадка с операции
извлечения
Примечания
С 1950 г. на многих обогатительных фабриках
используется ионный обмен. Готовый продукт—
днуранэт аммония или икись урана
Использование экстракции растворителями для
обогащения урана — недавнее усовершенстнова-
ние. В настоящее время около 1/3 урановой
руды, добываемой в США перерабатывается
экстракцией растворителем [121]
Готовый продукт содержит 70—90 вес.% урана
(в пересчете на U3O8)
Уран 829
изотопов. Концентрат отгружается на завод по изготовлению исходных
материалов, где производятся рафинирование* и получение конечного про-
дукта— металла. Рафинирование состоит из довольно обычных химических
операций, но поскольку примеси, поглощающие нейтроны, вредны даже
в концентрациях, составляющих десятитысячные доли процента, применя-
ются более жесткие стандарты качества, чем в обычной металлургической
практике.
Сначала концентрат растворяют в азотной кислоте для получения
раствора уранилнитрата UO2(NO3J- Это соединение растворимо в различных
органических растворителях [139]: диэтиловом эфире, мегилизобутилкетоне
(гексопе) и трибутилфосфате. Они могут быть использованы для экстрак-
ции уранилнитрата, который затем реэкстрагируют водой. Водный раствор
концентрируют и упаривают до гексагидрата уранилнитрата, который раз-
лагается прокаливанием до трехокиси урана UO3. Эту окись можно также
получить прокаливанием осажденного (NH4JU2OT из раствора уранил-
нитрата.
В другой возможной последовательности операций производится
непосредственное осаждение UO4 перекисью водорода. Затем LO3 или UO4
восстанавливают водородом или аммиаком до LJO2 (коричневой окиси).
Уран в виде (_Ю2 можно использовать как горючее, или же двуокись урана
можно обработать фтористым водородом для получения UF4 (зеленой соли).
В другом варианте процесса UO2 реагирует с NH4IIF2 и получается NH4LIF5,
а последний дальше разлагается на UF4 и NH4F, который можно регенери-
ровать. Соединение UF4 используют для восстановления до металла. Его
можно также перевести в UF6 обработкой фтором и передать на установку
газовой диффузии, где разделяются изотопы урана.
Заводы для производства исходных материалов по вышеизложенной
технологической схеме очистки ураннлиитрата и получения чистой UO3
в Сент-Луисе и Уэлдон-Спрингсе (штат Миссури) принадлежат фирме
«Меллиикродт кемикл уокс», а в Фернолде (штат Огайо)— фирме «Пей-
шнл лид компания. На заводе в Метрополисе (штат Иллинойс), принадле-
жащем фирме «Дженерал кемикл дивижн оф эллайд кемикл корпорейшн»,
используется разработанный Лргоннской национальной лабораторией про-
цесс более прямого приготовления UFd из концентрата, минуя получение
нитрата и UO3- Схема процесса переработки концентрата напоминает схему,
применяемую обычно к рафинированной UO3, полученном из очищенного
уранилнитрата. Она состоит из следующих операций: восстановление до
UO2, фторирование до L*F4 и затем фторирование до UF6. На каждой опе-
рации реакция между твердым веществом и газом ведется в кипящем слое-
Рафинирование достигается фракционной перегонкой UF0 173].
Можно также осаждать UF4 непосредственно из водного раствора
каталитическим восстановлением [2]. Процессы с азотной кислотой и уранил-
нитратом применяются при регенерации скрапа. Они осуществляются глав-
ным образом в Фернолде [24] при водной обработке облученного горючего
(см. стр. 852).
* Следует обратить внимание на недавно опубликованную книгу, в которой
подробно описана технология производства соединении и металлического урана,
используемых в ядерной промышленности (Г а р р и и г т о н, Р у л. Технология
проилзодства урана, переводе английского, Атомиздат, 1962). Читатель найдет в пей
более исчерпывающее изложение вопросов, рассматриваемых здесь с различной
степенью полноты В книгу включены многочисленные иллюстрации и ссылки на ори-
гмнальные работы.
830 Глава 32
ПОЛУЧЕНИЕ МЕТАЛЛА
Чистый металлический уран получить трудно из-за большого химиче-
ского сродства к другим элементам: кислороду, галогенам, азоту и угле-
роду. Для получения металла из таких устойчивых соединений, как окислы
и галогениды, необходимы сильные восстановители. Восстановление необ-
ходимо проводить в изолированной системе, чтобы избежать загрязнений
из атмосферы. Часть проблем, связанных с различными схемами восстанов-
ления, легче понять с помощью табличных данных о температурах кипения
исходных компонентов, температурах плавления продуктов реакции и из-
менениях свободной энергии и энтальпии реакций [6, 17, 56, 75. 91, .143,
стр. 21].
Двуокись урана UO2 имеет большую отрицательную свободную энер-
гию образования (— 123 ккая1г-атом кислорода при 25°). Поэтому, если
в качестве исходного вещества для получения металла используется UO2,
необходим сильный восстановитель. Водород восстанавливает при очень
большом отношении Н2/Н2О в газе и практически не может быть восстано-
вителем. Для восстановления углеродом требуется вакуум, но металл при
этом загрязняется карбидом. Термодинамически наиболее благоприятный
восстановитель — кальций, но выделяющегося тепла реакции недостаточно,
что затрудняет отделение металла от шлака — извести, поэтому получается
тонкоизмсльченный металл (глобулы или порошок). Д.тя улучшения отде-
ления извести и получения более крупнозернистого порошка можно добав-
лять какие-либо галогениды 120, 102, 122]. Для восстановления можно
использовать также гидрид кальция |1, 421. Металлические магний, натрий
и калий настолько летучи, что отгоняются из реакционной зоны. Алюми-
ний может восстанавливать окислы, но он склонен образовывать сплавы
с ураном. Сплавы урана с алюминием, используемые как ядерное горючее,
можно получать непосредственно [1271 восстановлением UO2 избытком
алюминия.
В качестве исходных веществ для получения металла наиболее пригодны
галогениды. При этом выделяется больше тепла, а шлак имеет меньшую тем-
пературу плавления. При расплавлении шлака тяжелый металлический
уран оседает и отделяется. Таким образом с малыми потерями извлекается
компактный металл (черновой слиток) относительно высокой степени чи-
стоты. Па практике в качестве исходной соли предпочитают брать UF4,
а не гигроскопичный UCI4; пригоден также NaoUCl«, поскольку это соеди-
нение менее гигроскопично, чем UCIS- В США стандартным восстановителем
служит дешевый металлический магний высокой степени чистоты. В настоя-
щее время он используется также в Англии 128]. В процессе, разработанном
в Эймсе Спеддингом, Уилхелмом и сотрудниками из колледжа штата Айова
[ 1411, необходимо пользоваться герметичной бомбой, так как при температуре,
развивающейся во время реакции, магний имеет высокое давление пара.
Стальная бомба диаметром 380 мм и высотой 1,0 — 1,14 м. вмещающая более
93 кг урана, снабжена футеровкой толщиной 25 мм. Эта футеровка доста-
точно топка, чтобы во время предшествующего реакции подогрева тепло
проникало в бомбу, и вполне достаточна для того, чтобы предотвратить
перегрев стали за счет тепла реакции [6, 140, 142]. Первоначаль-
но в качестве футеровки пользовались электроплавленым доломитом
(MgO, СаО). Затем он был заменен фторидом магния — отходом от процесса
восстановления [181. Восстановление можно проводить в большом масштабе
(например, 1,5 т) и получать большие отливки (слитки прямого восстанов-
ления), не требующие переплавки перед дальнейшей обработкой [49]. Ниже
Уран
831
приведены результаты типичного анализа металла (переплавленный чер-
новой слиток) сорта для реактора, поставляемого Комиссией по атомной
энергии США [117]:
Примесь
Азот
Бор
Железо
Кадмий
Кремний
Магний
Содержание, %
0,01 '
2,5-10-5 и
0,015
2-10-5
0,0065
2,5-10-5 I1
ПРММССЬ
Марганец
11нкель
Серебро
Углерод
Хлориды
Хром
Содержание, %
0,0025
0,01
0,0001
0,015—0.075
0.0030
0,0065
В Европе для промышленного производства урана из галогенидов
в качестве восстановителя предпочитают применять кальцин 1621. При
этом выделяется большее количество тепла, чем в случае магния, и давление
пара кальция настолько мало, что восстановление можно вести под атмос-
ферным давлением. Ранее в США (Эймс, Национальное бюро стандартов)
до магния применяли кальций. Он также используется в США вместе со
вспомогательной добавкой иода для получения обогащенного металла.
В этом случае главная цель — достижение высокого выхода. При получе-
нии впервые металлического урана Пелиго использовал калий, но можно
применять и натрий. Другие исследователи использовали эти металлы
при восстановлении в лабораторном масштабе 175], однако из-за
больших давлений пара они едва ли годятся для операций большого мас-
штаба.
Первый использованный Металлургической лабораторией металличе-
ский уран был получен фирмой «Вестингауз» электролизом расплавленных
солей [132]. (Данные о возможности электроосаждения из водных раство-
ров отсутствуют. Исследовались органические растворители, но резуль-
таты неубедительны [75].) В процессе фирмы «Вестингауз» элект-
ролизу при 900° подвергали KUF;,imh UF4, растворенные в расплавленной
смеси 80% CaClo и 20% NaCl [44, 45]. Металл осаждался в виде порошка
на молибденовом катоде и отмывался для удаления прилипшего электро-
лита. Таким способом к концу 1943 г. было получено 65 т металла. После
этого электролиз бьш вытеснен эимсским процессом [141]. Для промышлен-
ного производства предпочтение было отдано восстановлению в бомбе,
а различные виды электролитических процессов использовались только
для специальных целей. В Аргопнской национальной лаборатории бьш раз-
работан процесс, получения урана высокой степени чистоты [10] электро-
рафинированием в электролите из UC13 или UF4 в эвтектическом расплаве
LiCl — KCI при температуре около 400°.
Следует упомянуть о двух других методах получения специальных
форм урана. Для получения урана высокой степени чистоты [75] при-
менялся метод Ван-Аркеля и де Бура [137], который заключается в тер-
мическом разложении галогенида, обычно иодида, па накаленной нити
и используется для получения тугоплавких металлов. Мелкозернистый поро-
шок урана удобно получать путем обратимого разложения гидрида UH3.
Для непосредственного получения непирофорного порошка можно исполь-
зовать восстановление окиси металлическим кальцием или магнием [161.
832 Глава 32
Таблица 8
ФИЗИЧЕСКИЕ СВОПСТВА УРАНА
Плотность при 25°, г 1см3 19,07
Температура плавления, С 1132
Температура кипения (экстраполированная), СС 3813
Чапление параAС30 1970 К) 1орР„.„ гт. ,,„,. = —23 ЗОО'Г+8,583
Теплота испарения, ккал1г~атпм —- 10L)
1еплота плавления, ккал/г-атом ~4,7
Коэффициент теплопроводности, мет/см-град
25= 270
@,0645 кал/см-сек-град)
600' 380
700" (Р) 400
800" (у) 423
Удельное электросопротивление, мком-см
25 30
ЫК1 59
700 (Р) яя.я
800- (у) 54
Магнитная восприимчивость, э. м. е.
25" 1,66
600° 1,85
700° 2.05
800" 2,10
Термо-э.д.с. по отношению к платине, мв
25° -0,4
600° 13,8
700' 17,5
800° 21.4
Термоионная эмиссия
Работа выхода, в 3,27
Постоянная Ричардсона А ~6
Фотоэлектрическая эмиссия
Работа выхода, в 3.G3
Пороговая длина волны, А 3600
Коэффициент излучения (Х = С700 4) 0,51
ФИЗИЧЕСКИЕ СВОЙСТВА
В табл. 8— 11 приведены физические свойства урана. Расхождения
между значениями, представленными различными авторами, частично
объясняются изменением этих свойств в зависимости от степени чистоты и
режима получения металла. Необходимо всегда иметь в виду и анизотро-
пию урана. Приведенные значения основаны на критических оценках
Хольдена [03] и Клейна [85). У этих авторов можно найти и ссылки на ори-
гинальные работы. У них же даны графики и более подробные табличные
данные о зависимости этих свойств от температуры. Из этих компиляции
взяты также сведении для следующего раздела о поведении металла при
механической обработке.
Таблица 9
КРИ ПЛОГРАФИЧЬСКИГ ДАННЫЕ ДЛЯ УРАНД
Структ ра
Параметры
Решетки. \.
а Ромбическая (стоп-i Lmsm При 25
ка гофрнроваи-
ных слоев ато- с0—2,853
чов; связи внут- fcn = 5,fifi5
ри елчев кова- сс=4,954
лентные)
Тетрагональная Р4 mnm При 700°
ао= 10,75
го=5,65
Кубическая объем- При 8ШЬ
ноцентрировап-
ная I ис=3,534
г- 1)
О СЕ
5»
г
4
30
2
i *
г С1 "
* с г
- Е
19,07
18,14
17,91
Коэффициент расширения,
линейный
_
В интервале
0 -662°
ио+36,1-10-0
b0-R,7-10
с0 31,3-10-6
В интервале
662—772"
е,,+22,8-10-е
си 5.6-10-6
В интервале
772 100A
-21,7-10-"
1ъемпыП
_
•
+58,-8-10-6
-51,2-Ю-о
+65,2-10 «
Таблица 10
ФАЗОВЫЕ ПРЕВРАЩЕНИЯ В УРАНЕ
Превращение
¦1 котемпе-
[I. >. рнаи
фаза
а
Р
Y
высокотем-
пературная
фаза
Р
V
Жидкость
Темпера-
тур.
667
775
1132
W/V,
о/
hl.06
+0,736
~5
+0,35
+0,245
ккал>г-итом
0,7
1,15
—4,7
Таблица 11
ТЕРМОДИНАМИЧЕСКИ!: ФУНКЦИИ УРЛНЛ
300
400
500
000
700
81H
900
У И (п)
27
127
227
327
427
527
627
668
Удельная тепло-
Энтропия Л.
6,649
7,072
7,606
8,227
8,952
9,863
11,107
11,737
1,539
2,203
2,935
3,725
4,583
5,520
6,567
7,066
12,052
13,911
15,601
17,056
18,387
19,646
2Р,ЧВ2
21,436
53
42
Темпера
°К
9Н(Р)
J000
1047
1047(г)
1100
1200
1300
1375
тура
"С
668
727
774
774
827
927
1027
1102
Удельная тепло-
емкость Ср.
ка - 'г-атом ¦ град
10,147
10J47
10,147
9,147
9,147
-9,2
-9,2
-9,2
Продолжение
Энтальпия
Wt. ккал/г-атом к
7,740
8,337
8,816
9,947
10,430
11,350
12,260
13,000
табл. 11
Энтропия 5,
tA/г-атом - град
22,152
22,760
23,236
24,316 •
24,762
25,38
26,12
26,8
МЕХАНИЧЕСКИЕ И МЕТАЛЛУРГИЧЕСКИЕ СВОЙСТВА
При рассмотрении механических свойств требуется, как и в случае
физических свойств, учитывать степень чистоты, режимы обработки и ани-
зотропию металла.
Твердость
Обычно твердость урана измеряют по шкале Виккерса (испытание
с алмазной пирамидой), поскольку эта шкала применима в широком интер-
вале твердости (от а-фазы при комнатной температуре до -у-фазы при 900°).
Составленные для других металлов эмпирические таблицы для перевода
шкалы Виккерса в другие шкалы ие годятся для урана из-за различий
в наклепе при деформации и в упругих свойствах.
У литого, выдавленного Су-фаза), прокатанного (а-фаза) и отожженного
урана твердость по Виккерсу при комнатной температуре составляет около
220. С повышением температуры твердость резко надает. Скорость падения
твердости увеличивается после перелома на кривой твердость — темпера-
тура между 350 и 400°. Превращение а ->- р сопровождается резким повы-
шением твердости, поэтому твердость C-фазы при температуре превращения
663" приблизительно равна твердости а-фазы при 500е. Твердость Р-фазы
постепенно уменьшается с повышением температуры. При превращении
в у-фазу металл становится очень мягким, подобным свинцу при комнатной
температуре.
Упругие свойства
В табл. 12 приведены упругие свойства при 25° для урана различного
происхождения. При повышении температуры от 25 до 300е модуль упруго-
сти уменьшается с 19-103 до 10,4.103 кг/мм2, а коэффициент Пуассона уве-
личивается с 0,20 до 0,24. Наиболее надежные данные получают путем
измерения скорости звука, так как предел пропорциональности урана
низок, ir данные об упругости, полученные из данных о прочности при растя-
жении, неточны.
Уран
Р35
СВОЙСТВА УРАНА ПРИ 15° а
| Литой
Модуль упруго-
сти, 103
Модуль сдви-
га, 103 кг/мм2
Объемный мо-
дуль, 103
Коэффициент Пу-
20,
8,
12,
0,
8
5
4
23
18
7
10
0
Прокатанный в
ее-фазе
.«
,7
,3
,19
550°
19
7
111
0
2
6
5
20
63С
19.
8,
10,
0,
о
4
2
7
20
а-Ковка
на ковеч-
крнстал-
лияацня
20,4
7,8
0,22
Р-Термо-
обрабо-
танный
17,9 -
20,4
12,0
0.19
Таблица 12
Прокатан
Y-Выдав- ныП в зо-
ленный рячем i_ol-
20.S
8,4
11,8
0,21
17,9
7,45
10,0
0,20
а Данные последней графы получены при испытаниях на сжатие, остальные—при ультразву-
ковых измерениях.
Таблица 13
ТИПИЧНЫЕ ДАННЫЕ ИСПЫТАНИЙ НА РАСТЯЖЕНИЕ
ПРИ КОМНАТНОЙ ТЬМПЕРАТУРЕ ДЛЯ УРАНА РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ
Режим изготовления
Литой
11рокатаннын r п-области
300°
500°
С00"
Прокатанный
300"
500°
затем отожженный
Нагретый в Р-области после про-
катки r а-ойласти и
закаленный в соду
медленно охлажденный
Выдавленный при 500"
Прокатанный в Р-областн
Выдавленный в ¦у-ойласти
Предел
текучести
кг/мм
21,1
77,3
42,2
28,1
35,2
42,2
24,6
21,1
21.1
21,1
17,5
Предел
прочности
при растя-
жении.
кг'мм^
45,7
119,2
91,4
77,3
77,3
70,3
59,8
42,2
63,3
59,8
56,2
Относи-
тельное
удлинение
на длине
50 мм. %
5
7
'20
20
5
15
10
7
20
12
10
Относи-
тельное
сужение.
%
10
11
12
—
15
12
Прочность при растяжении
В табл. 13 приведены типичные данные о прочности ураиа при растя-
жении при комнатной температуре. Поскольку эти свойства зависят также
от факторов, не включенных в описание обработки материала, эти таблич-
53*
836
Глава 32
ные данные необходимо рассматривать как показательные данные, находя-
щиеся вблизи середины интервала вероятных значении. В реакторах чаше
всего применяется подвергнутый термообработке в [5-области уран, поэтому
Таблица N
ЗАВИСИМОСТЬ ПРОЧНОСТИ ПРИ РАСТЯЖЕНИИ ОТ ТЕМПЕРАТУРЫ
ДЛЯ УРАНА, ЛОДВЬРГНУТОГО ТЕРМООБРАБОТКЕ В Р-ОБЛАСТИ
смпер ура,
-73
-45
25
100
200
300
400
500
СОО
666 (о)
666 (р)
700
776(р)
776 (у)
800
Предел те-
кучести
(Оо,г). кс/мм*
29,5
28,1
24,6
21,8
18,3
15,5
12,0
8,4
4,9
2,8
4,9
4,2
3,5
<0,7
<0,7
1
Предел прочно-
сти при растя-
жении, кг/мм%
61,9
С4,7
59,8
53,4
40,8
29,5
19,7
11,2
5,6
2,8
6,3
6,3
6,3
<0,7
<0.7
Относительное
удлинение на
длине 50 jkjm,
%
4
5
10
28
31
32
33
34
34
35
35
35,5
36
36
.16
Относительное
СужСНПС, п-'"
5
Ь
12
21
34
40
50
60
72
79
79
85
94
94
99
в табл. 14 приведены данные, показывающие влияние температуры на-проч-
ность при растяжении такого урана. Имеются данные о переходе урана
wo
Ю 10'"• /В1 Юг Ю ' I
Минимальная скорость ползучести. %/час
Р и с. 2. Зависимость напряжения от
скорости ползучести при различных
температурах для урана, закаленного
из Р-области 163].
при комнатной температуре из пластичного состояния в хрупкое. Однако
ниже температуры перехода металл не становится полностью хрупким.
Десятитысячные доли процента водорода сдвигают эту температуру вверх.
Данные о разрушении образца с запилом для интервала от - 73 до
+ 1491 не дают убедительных доказательств природы перехода из хрупкого
состояния в пластичное. Ударная вязкость при комнатной температуре
составляет около 1,4 кгм, а при 149° 4,2 — 7,0 кгм [112].
Урон 817
Ползучесть
Поведение урана при испытании на ползучесть изменяется в зависи-
мости не только от указанных выше факторов, но и от эффектов циклической
термообработки и неупругости. На рис. 2 показаны данные, полученные
в Институте им. Баттела ИЗО] при точном контроле температуры. Следует
отметить резкое снижение напряжения для данной скорости ползучести
в интервале 300 — 400°; в этом интервале резко изменяются и другие меха-
нические свойства (см. «Твердость», стр. 834).
Усталость
На рис. 3 приведены данные [37] об усталости при деформациях выше
предела упругости. Они получены для урана, прокатанного при темпера-
турах верха а-области. Больший разброс значений для образцов, вырезан-
ных поперек направления прокатки, приписывается наличию строчечных
Р и с. 3. Усталостная прочность урана
при комнатной температуре в условиях
циклического нагружения [63].
/ — разброс дли поперечных образцов;
// — разброс для продольных образцов.
w jov . wud юиоо тою
Чиспо uutuiQg до /кируш/ ни»
прожилок примесей, образовавшихся в результате процесса прокатки.
Более ранние измерения [118] предела выносливости выдавленных стерж-
ней диаметром 9,5 мм на консольной машине Краузе при 10 000 об/мин
дали 17,6 кг/мм1 для 10" циклов и более и 24,6 кг/мм2 для 0,12-10е-
0,25-10° циклов.
Деформация и текстуры
Вследствие довольно необычной структуры а-урана возникают затруд-
нения при пластической деформации металла. Они имеют большое практи-
ческое значение при использовании металла в качестве горючего. Кроме
того, проблема деформации урана представляет большой интерес в связи
с волнистыми слоями атомов, ковалентной связью и анизотропией
а-фазы.
При комнатной температуре преобладает деформация двойникованием.
Сильные ковалентные связи не разрушаются, но сдвигаются и переориен-
тируются. Главным образом встречается система двойников A 3 0), но встре-
чаются также системы A 7 2) и A 7 С). Сообщается еще о двух менее важных
системах двойников— A 1 2) и A 2 1). С повышением температуры начинает
преобладать механизм деформации скольжением. Наиболее важна система
скольжения @ 10) — A0 0). Скольжение по плоскости @ 1 0) не задевает
сильных ковачентных связей. Низкий предел текучести объясняется тем,
что критическое напряжение сдвига для скольжения по @ 1 0) составляет
0,34 кг/мм2. Наблюдались также полосы излома и поперечное скольжение.
838 Глава 32
При обработке урана давлением в нем возникает предпочтительная
ориентация, отражающая стремление к достижению каждым зерном равно-
весной ориентации в его системах деформации. Предпочтительная ориента-
ция или текстура зависит от метода и температуры обработки давлением
и последующей термообработки. Текстура проявляется в анизотропии важ-
ных свойств, например коэффициента расширения и роста при облучении.
Деформация при температуре верха а-области дает текстуру с преоблада-
нием полюсов A 1 0) параллельно направлению деформации, холодная
обработка создает преобладание полюсов @ 1 0) параллельно направлению
ибработки. Полюса @ 0 1) при всех температурах ориентируются перпен-
дикулярно направлению обработки. Большая часть предпочтительной
ориентации снимается термообработкой в р-области.
Возврат, рекристаллизация и рост зериа
В отношении возврата, рекристаллизации и роста зерна после холод-
ной обработки уран в общих чертах напоминает другие металлы. Па детали
этих процессов влияет преобладание двойникования в механизме деформа-
ции. Ярко выраженное расширение линий на рентгенограммах холодно-
обработанного металла указывает на очень большие искажения решетки.
Критическая деформация при рекристаллизации составляет всего около
1%, тогда как для других металлов она ближе к 3%. Поведение при
рекристаллизации и последующий рост зерна в данном образце металла
зависят от режимов обработки и примесей (природы, объема, формы, дис-
персности). Рекристаллизация происходит в области 400 — 600°. С увели-
чением степени холодной деформации, т. е. с большими обжатиями, рекри-
сталлизация начинается и заканчивается при более низкой температуре.
Время, необходимое для полного прохождения рекристаллизации, умень-
шается с повышением температуры отжига.
РАДИАЦИОННОЕ ПОВРЕЖДЕНИЕ [63, гл. 11; 119; 143, гл. 11]
При действии излучения большой энергии на любой материал, при-
меняемый в технике, изменяются его свойства. В делящемся материале
изменения настолько заметны, что оправдывают применение термина радиа-
ционное повреждение. В акте деления образуются осколки с большой энер-
гией, которые разлетаются и при этом смещают атомы урана из их положений
в узлах решетки. (Подсчитано [63], что при облучении образца природного
урана до выгорания 0,1% каждая часть его нагревается за 10'11 сек до
3000° 15 000 раз.) Кроме того, продукты деления действуют не только
как примеси в металле, но, обладая меньшей плотностью, чем уран, значи-
тельно увеличивают его объем. Вычисления показывают, что перевод 1%
урана в осколочные элементы увеличивает объем на 3,4% [11]; особое вни-
мание необходимо уделять газообразным продуктам деления (ксенону, крип-
тону). Эги газы составляют 12?о продуктов деления; на каждые 4 атома,
претерпевшие деление, получается 1 атом газа. Диффузия этих газов идет
медленно, и влияние их незначительно, пока они изолированы. Если же
атомы газов могут диффундировать и сливаться в отдельные объемы (коа-
лесцировать), то в зависимости от объема пустот, например микротрещин,
в них могут возникать большие давления. Эти давления легко могут пре-
высить предел текучести металла или сопротивление ползучести, и соответ-
ственно образуютси трещины или пористость.
Уран
839
При облучении уран анизотропно изменяет размеры. Эти изменения
зависят от текстуры и, следовательно, режимов предыдущей обработки
металла давлением (плюс любая последующая термообработка). Монокри-
сталл растет при облучении анизотропно, сжимаясь в направлении A 0 0).
(При циклической термообработке монокристаллы не растут [63, гл. 121.)
Рост зависит от температуры, достигая максимума вблизи 250° и снижаясь
почти до нуля при 500° и выше. Рост может Сыть уменьшен за счет беспоря-
дочно ориентированной структуры или сбалансированной структуры, в кото-
рой удлинение зерен по @ 1 0) компенсируется сжатием по A 0 0)..Все же
и при малом росте остается проблема огрубления поверхности, потому что
Рис. 4. Зависимость механи-
ческих свойств облученного ура-
на при комнатной температуре
от дозы облучения [19].
0,02 Ц04 0.U6 0,08
Степень выгорании атомов. %
50
010
различные зерна ведут себя по-разному. Это затруднение можно свести к ми-
нимуму измельчением зерна, в основном за счет введения легирующих доба-
вок (хрома, кремния, циркония) 1611.
С технической точки зрения наиболее серьезная проблема в области
использования реакторного горючего — это распухание металлического
урана. Плотность при выгорании 1% металла уменьшается больше, чем на
3,4 %, вычисленных из расчета перевода урана в продукты деления. Одно
из назначений оболочки ядерных тепловыделяющих элементов — это задерж-
ка распухания. Кроме анизотропного изменения размеров и распухания,
металл испытывает дальнейшую размерную нестабильность в связи с колеб-
лющимися термическими напряжениями, которым он подвергается во время
пуска, выключения и колебаний мощности реактора. Необходимо отмстить,
что даже во время устойчивой работы реактора в горючем существуют рез-
кие градиенты температуры, зависящие от таких параметров реактора, как
геометрия сердечника горючего, температура и скорость потока охладителя
и градиент нейтронного потока.
Механические свойства урана изменяются под действием облучения,
вероятно, в результате возникновения внедренных атомов и вакансий. Они
похожи на изменения, вызываемые интенсивной холодной обработкой, и при
отжиге после облучения происходит некоторый возврат первоначальных
свойств. На рис. 4 показано действие облучения на прочностные свойства
при комнатной температуре. Исчезновение пластичности наблюдается уже
при выгорании 4-10 5 ат.%: это заметно даже на ¦у-уране. Изменение
теплопроводности при облучении незначительно.
eW0 Г лава 32
ХИМИЧЕСКОЕ ПОВЕДЕНИЕ. РЕАКЦИИ И СОЕДИНЕНИЯ
Подробный обзор химии урана дан Кацем и Рабиновичем 175]. После-
дующее краткое изложение основано главным образом на их книге, к кото-
рой надо обращаться за ссылками на оригинальные работы, включая лите-
ратуру проекта военного времени. Очень ценным источником информации
служит также более новая книга 176].
Уран — очень реакционноспособный металл, легко соединяющийся
с металлоидами и взаимодействующий с металлами. Нейтральный атом
урана состоит из ядра, окруженного 86 «внутренними электронами» н 6
валентными электронами, вероятно распределенными в состояниях 5/d7ss.
Таким образом, уран ведет себя как сильный восстановитель, и максималь-
ная валентность достигает шести. В водных системах вероятно присутствие
шестивалентного урана в виде комплексного катиона UO;*. Обычные соли
урапила и их растворы — желтые. Растворы уранаAУ) — темно-зеленые,
а растворы урана(Ш) — красно-фиолетовые. Уран образует также комп-
лексные анионы (например, U2O^"), пригодные для анионного обмена. Из
бескислородных шестивалентных соединений известны лишь гексафторид
и гексахлорид. •
Зависимость между электродвижущими силами различных окисли-
тельных состояний урана дана Латимером [90] в следующих схемах:
Кислый раствор
1,80 С BI -0,С* —0,05
U U3+ U-»h UOJ
I -П.ЯЧ4
Щелочной раствор
2,17 2,14 С.62
U U(OHK U(OH4) UO2(OHJ
Следует иметь в виду, что в последующем кратком описании реакций
урана с различными химическими веществами, главным образом газами, ско-
рости и температуры начала реакций сильно зависят от степени измельче-
ния металла. В этом свете необходимо рассматривать заключения о тем-
пературе реакции.
Реакции с металлоидами; двойные соединения
Водород. Системе уран — водород было уделено значительное вни-
мание 175, гл. 8; 125, стр. 65]. Растворимость водорода в твердом и рас-
плавленном металле зависит от модификации металла, температуры и давле-
ния. Она увеличивается при превращении низкотемпературной фазы в высо-
котемпературную, при повышении температуры и давления водорода.
Растворимость во всех трех фазах пропорциональна корню квадратному
из давления водорода. Это указывает, что растворяются атомы водорода
1100, 104]. Стехиометричеекое соединение UH3 легче всего образуется
в интервале 225 — 250°. При более высоких температурах гидрид заметно
разлагается. Давление разложения выражается уравнением
]6 Р(ли» рт. ст.)— —у (ор^ + Э.20.
выведенным на основании измерений при давлениях ниже атмосферного.
Это уравнение дает давление разложения, равное 760 мм рт. ст. при 436°.
Уравнение на основе имеющихся в настоящее время результатов измерений
до 650° имеет следующий вид [94]:
, „ 4410
Гидрид — удобное исходное вещество для получения мелкозернистого
и, следовательно, рсакционноспособного урана. Кроме того, он служит удоб-
ным источником получения чистого водорода или дейтерия.
Обычная форма гидрида P-UH3 ферромапштпа ниже 174Г-К [58,
95, 13С]. Другая форма, a-UH3, может быть получена гидрированием
при низких температурах или электролизом на урановом катоде в водном
электролите [21, 106].
Азот. Уран около 400° медленно реагирует с азотом. Ускоряясь с по-
вышением температуры, выше800г реакция идет довольно быстро, вероятно,
потому, что металл находится в состоянии у-фазы. Известны соединения
UN, LT2N3 и UN2, но между U2N3 и UN2 существуют непрерывные твер-
дые растворы. Структура U^N3 переходит непрерывно в структуру UN2.
Оба высших нитрида диссоциируют при температурах выше 700 — 800°,
образуя UN, устойчивый в вакууме до 1700е'. Мопопитрид—светло-се-
рый порошок со структурой, изоморфной UC, плавится около 2630° 1351.
Кислород. Поверхность урана начинает окисляться на воздухе уже
при комнатной температуре. Сначала образуется светло-желтая пленка
побежалости, затем темный, не имеющий защитных свойств слой окиси.
Скорость окисления зависит от температуры и формы металла. Ниже 700г
массивные куски металла окисляются медленно, но выше этой темпера-
туры окисление идет быстро. При низких температурах образуется UO2,
имеющая цвет от коричневого до черного, но при более высоких темпера-
турах возможно образование U3Oe. Примером сложных фазовых зависимо-
стей в системе уран кислород может служить возможность разложения
U3O8 до UO2 [75, гл. 11; 7С; 125, стр. 79]. Двуокись урана используется
как горючее в ядерных реакторах [5, 32, 93, 107, 116]. Она плавится
около 2800°.
Сера. Уран медленно реагирует с расплавленной серой при 250 —
300J, но при 500° загорается в парах серы. Соотношение количеств обра-
зовавшихся US2 и U2S3 зависит от условий. Моносульфид US образуется
но реакции мелкозернистого порошка урана (из гидрида) и сероводорода
или US2. Последний плавится значительно выше 2000°, довольно устой-
чив и пригоден в качестве огнеупора.
Галогены. Фтор бурно реагирует с ураном при комнатной темпера-
туре, образуя летучий гексафторид (температура возгонки 56,5°). Это
соединение используется в процессе газовой диффузии для разделения
изотопов (см. стр. 819). Тетрафторид урапа UF4 получают восстановле-
нием UFB или взаимодействием UO2 с HF или «фреонами». Это обычное
исходное сырье для получения металла (см. стр. 830—831). Фториды
также предполагается использовать в ядерных реакторах с горючим из
расплавленных солей [87].
Условия реакции урана с хлором зависят от степени измельчения
металла. Тонкоизмельченный металл загорается при 150—180°. Для
хлорирования крупных кусков металла требуется температура почти 500".
«42 Глава 32
Получаются хлориды L"C13, UC14 и UCU- Восстановление UC]4 водородом
или металлом дает LTCJ3. Чем выше валентность урана в его хлоридах, тем
они более летучи и легкоплавки.
Для температуры взаимодействия урана с бромом сообщаются раз-
личные значения (от 220 до 650°). Вероятно, этот разброс связан с различ-
ной степенью измельчения и состоянием поверхности урана. Обычным
продуктом реакции является UBr4, ио, регулируя количество брома, можно
получить UBr3. Для температуры взаимодействия иода с ураном также
сообщают различные значения. Тетраиодид урана гораздо менее устой-
чив, чем остальные галогеииды четырехвалентного урана. Для того чтобы
получить его непосредственно из элементов, необходимо значительное дав-
ление паров иода, предупреждающее разложение его до UI3. Без избытка
иода основным продуктом является трииодид.
Необходимо отметить [75. гл. 15] существование смешанных галоге-
нидов четырех- и трехвалентного урана, например UC12F2, UBrCl3, UIF3.
Реакции с простыми соединениями металлоидов
Вода. Уран довольно легко окисляется водой, образуя UO2 и водород.
Скорость его коррозии в кипящей воде равна 3 мг/см2'Час (около
0,05 мм/а/тки). В воде под давлением при температуре 200^ скорость кор-
розии составляет примерно 1 г!см2-час или выше. Аналогичные скорости
наблюдаются при коррозии в парс. Во всех случаях водород, образую-
щийся в начале реакции воды с металлом, ускоряет коррозию вследствие
образования гидрида.
В связи с значительным интересом к использованию урана в виде
горючего в реакторах, охлаждаемых водой, была проведена большая
работа по изысканию урановых сплавов с лучшей устойчивостью против
коррозии в воде. Несмотря на защиту урана материалами оболочки, необ-
ходимо считаться с поведением урана в воде ввиду возможного контакта
с водой через дефектные места в оболочке. Разработаны сплавы урана со
скоростями коррозии при 350°, близкими к коррозии нелегированного урана
в кипящей воде. Сплавы, устойчивые против коррозии, разделяются на три
категории: 1) сплавы с метастабильной у-фазой, например содержащие
около 10% ниобия или молибдена или около 50% циркония; 2) пересыщен-
ные а-фазные сплавы, полученные мартенситным превращением в менее
легированных сплавах, например с 3% ниобия или 1,5% ниобия плюс 5%
циркония (эти сплавы имеют серьезный недостаток, заключающийся в том,
что термообработки для получения устойчивости против коррозии и радиа-
ционной устойчивости несовместимы); 3) новые фазы, например U3Si 166,
67, 771 или U6Ni [381. При приготовлении таких фаз трудно получить сте-
хиометрический состав. Кроме того, их, вероятно, трудно обрабатывать.
Соединению U3Si было уделено значительное внимание. Его можно обра-
батывать при высокой температуре и успешно выдавливать совместно с цир-
калоем. Более хрупкие интерметаллические соединения, например UeNi,
можно обрабатывать в виде дисперсных включений в матрице из подходя-
щего материала, например алюминиевого сплава [431.
Уделено внимание и другому классу сплавов, хотя улучшение корро-
зионной стойкости их было менее значительным. Небольшое уменьшение
скорости коррозии достигается добавкой малых количеств циркония (напри-
мер, 2"о). Повреждение тепловыделяющего элемента в случае попадания
воды на горючее через дефектное место в оболочке соответственно умень-
шается [С8|.
Уран 843
Галогеноводороды. Фтористый и хлористый водород реагируют с метал -
личсским ураном, образуя UF4 и UC13 — гилогеннды урана промежуточ-
ной валентности. Реакция имеет тенденцию замедляться вследствие спека-
ния относительно малолетучих галогенпдов. Водород облегчает "реакцию,
образуя гидрид UH3, который легче реагирует с галогеноиодородом.
О реакциях металлического урана с бромистым и йодистым водородом
известно мало. Эти галогеноводороды реагируют с гидридом урана,- образуя
соединения трехвалентного урана.
Окись углерода и двуокись углерода. Урановые стружки реагируют при
750° с окисью и двуокисью углерода с образованием смеси окислов и кар-
бидов. Попытки приготовить карбонил урана оказались неудачными [75J.
Реакция с двуокисью углерода, используемой в качестве охладите iя
в ядерных реакторах, особенно интересна. Сообщалось, что тонкоизмельчен-
ный металл загорается самопроизвольно.
Аммиак. Уран реагирует с аммиаком, образуя нитрид. Скорость и тем-
пература нач&па реакции зависят от степени измельчения металла.
Меган и другие органические соединения. Во время реакции тонкопз-
мельченного урана с метаном при 635 — 900е образуется монокарбид урана
[96].
Можно считать, что и другие углеводороды с малым молекулярным весом
будут реагировать аналогично. Тяжелые углеводороды при подходящих
температурах могут отдать часть своего водорода металлу, образуя гидрид.
Так, декалин и тетралин образуют при 210 — 270° UH3 175]. Затем
гитрид может прореагировать с углеводородом, образуя монокарбид урана
и выделяя водород. Такой цикл реакции, начинающийся с разложения
углеводорода, представляет интерес в связи с использованием многоядерных
ароматических углеводородов (дифенил, трифенил) как охладителей для
ядерных реакторов. Предполагается, что повреждение оболочки не приво-
дит к сильному коррозионному разрушению [13, 113, 135].
При использовании хлорированных углеводородов (четыреххлористого
углерода, трихлорэтилена) для очистки металла или в других случаях
необходимо учитывать большое сродство урана к галогенам. Наиболее
вероятна реакция с парами; возможность ее протекания увеличивается
с повышением температуры и степени измельчения металла [75].
Реакции с водными растворами
Кислоты. Реакция урана с плавиковой кислотой тормозится из-за обра-
зования нерастноримой пленки тетрафторида урана. Соляная кислота
реагирует с металлом очень быстро. Степень окисления зависит от различных
факторов, таких как концентрация кислоты, температура [138]. В самом
начале растворения появляется красновато-фиолетовое окрашивание, обу-
словленное гидратированным трехвалентным ионом. Вскоре этот цвет маски-
руется появлением объемистого черного нерастворимого соединения, пред-
положительно двуокиси урана, имеющей тенденцию оставаться во взве-
шенном состоянии. Это соединение можно растворить подходящим окислите-
лем. Образование его сводится к минимуму в присутствии кремнефтористо-
водородной кислоты @,05 М). Бромистоводородная и иодистоводородная
кислоты напоминают по своему действию на уран соляную кислоту. Скорость
реакции уменьшается от хлористоводородной к иодистоводородной кислоте.
844 Г л а в а 32
Азотная кислота медленно растворяет металл, образуя уранилнитрат.
Вследствие медленной реакции азотную кислоту можно использовать для
удаления с металла окисной пленки или окалины. При растворении в азотной
кислоте некоторых сплавов, особенно урана с цирконием, оставляющих
взрывчатые осадки, необходимо соблюдать специальные меры предосторож-
ности [88, 124, 128].
Взаимодействие серной кислоты с металлическим ураном идет Медленно.
Образуются кислый сульфат ypaHa(IV) и продукты восстановления кислоты
(SOj, S, H=S). В присутствии окислителей, например перекиси водорода,
разбавленная серная кислота растворяет уран.
Теплая фосфорная кислота может быстро реагировать с металличе-
ским ураном, образуя зеленый раствор кислого фосфата уранаAУ).
Разбавленная хлорная кислота слабо действует на уран, но при концен-
трировании ее, например при уд&пении воды кипячением, можно добиться
бурной реакции. С помощью таких окислителей, как перекиси или хлораты,
можно достигнуть равномерного растворения металла в разбавленной хлор-
ной кислоте.
Органические кислоты не реагируют с металлическим ураном, но можно
получить их соли в присутствии хлористого водорода или соляной кислоты.
Щелочные раст воры. Растворы гидроокисей щелочных металлов почти
не действуют на уран, но если в них содержится окислитель, например пере-
кись водорода (или перекись натрия), они растворяют металл, образуя рас-
творимые перуранаты.
Растворы солей тяжелых металлов 1751. Вследствие большой вос-
становительной способности урана, т. е. легкости окисления, им можно
вытеснять из водных растворов такие металлы, как ртуть, серебро, медь,
олово, платина и золото. Из расплавленных солей, например галогенидов,
уран также вытесняет менее активные металлы [55, 103].
ХИМИЧЕСКИЙ АНАЛИЗ
Аналитическая химия урана хорошо разработана. Подробный обзор
ее составлен Родденом 1123], который обсуждает принципы различных мето-
дов анализа и детально описывает ход анализа. Следует упомянуть о двух
особенностях химии урана, часто используемых в целях анализа. Первая
особенность — окислительный потенциал пары U(IV) — U(VI) довольно
мал (см. стр. 840), поэтому взаимные переходы одного валентного состояния
в другое осуществляются легко. Соединения для этих двух валентных состоя-
нии урана могут сильно различаться по растворимости и способности экст-
рагироваться. Вторая особенность -- уран легко образует комплексы
с неорганическими и органическими соединениями. Их можно исполь-
зовать, чтобы удержать уран в растворе (карбонаты) или перевести в оса-
док (купферон).
Металлический уран обычно растворяется в азотной кислоте. Проце-
дура видоизменяется в зависимости от того, каким элементом он легирован.
Для отделения урана может быть использовано несколько методов. В мето-
дах осаждения чаще всего отделяют осадки: диураната аммония, четырех-
окиси (перекиси) уранаAЮ4-211^0), натрийуранилацетата, оксалата \ра-
Ha(IV) и купфероната уранаAУ). При отделении ввиде купферопата купферон
можно сначала использовать для удаления других металлов, поддерживая
Уран. Я45
уран в шестивалентном состоянии. Уран можно также удержать в растворе,
переводя его, например, в карбонатный комплекс. Он может быть отделен
экстракцией, особенно Экстракцией эфиром уранилнитрата или'купфероната
уранаAУ). Ъ'ран отделяется также возгонкой в виде LTFC.
.Л\етоды определения урана зависят от концентрации его в пробе. Когда
он преобладает, производится гравиметрическое или объемное определение.
Меньшие количества определяются колориметрическими методами. При
содержании менее микрограмма пригоден люминесцентный метод. При гра-
виметрическом определении уран взвешивается в виде окисла U3OS, полу-
чаемого прокаливанием в окислительных условиях при 800— 1050° раз-
личных осадков, включая осадки, выпадающие при действии органических
реактивов. Объемное определение обычно состоит из восстановления до
LJ(IV), титруемого далее до U(VI) стандартным окислительным раствором—
перманганатом калия, бихроматом калия, сульфатом церияAУ) или суль-
фатом трехвалентного железа. Наиболее обычный неорганический реактив
для колориметрического определения урана—перекись щелочного металла.
Имеются также различные органические реактивы. Флуоресценция следов
урана в ультрафиолетовом свете усиливается сплавлением с фторидом нат-
рия. Этим методом, разработанным до большой степени точности [23],
можно определить содержание урана до 101 г. В продаже имеются при-
боры для люминесцентного анализа [70].
Элементы, присутствующие в уране, определяют обычными методами.
Лишь иногда сначала удаляют основную массу урана, чтобы не мешать
анализу-
СПЛАВЫ УРАНА
Для изменения свойств, мешающих использованию металлического урана
в виде ядерного горючего, его можно легировать. Это легирование может
зайти настолько далеко, что вместо твердою будет использоваться жидкий
металл, в котором уран может преобладать или быть растворенным в малой
концентрации. Во всех случаях выбор легирующего элемента определяется
его ядерными свойствами. Например, легирующие элементы должны иметь
малые поперечные сечения поглощения. Одна из причин большой популяр-
ности легирования алюминием и цирконием — их малые поперечные
сечения поглощения.
Ниже приведены данные о сплавах урана. Клейн подытожил [85] све-
дения о свойствах сплавов, содержащих алюминии, бериллий, кремний,
молибден, ниобий, хром и цирконий.
Сплавы с металлоидами — углеродом, бором,
кремнием [75. гл. 9; 125; 129]
Углерод, бор и кремний ограниченно растворимы в твердом металли-
ческом уране. Они образуют соединения, структуры которых определены.
Эти соединения образуются непосредственной реакцией между элементами
(или U113 вместо урана). Известны карбиды UC и UC;. Имеются также дока-
зательства существования Ц>С3 [99, 125, стр. 23]. Вследствие большой
устойчивости этих соединений нельзя получать металл восстановлением
окиси урана углеродом [99, 129]. Карбидам урана уделяется большое
внимание как возможному ядерному горючему [126, 133]. Сообщается
[125, стр. 60; 129] о существовании трех боридов урана: L'B.., UB-,
и ив,,. Описано большое количество соединений системы ураи — кремний:
8-16 Г а ив и 32
U3Si, U3Si2, USi, a-USi2> P-USi2 и USi3 [77, 129, 144]. Особое внимание
было уделено е-фазе U3Si ввиду ее большой плотности, коррозионной
устойчивости и обрабатываемости подобно металлу [66. 67]."
СПЛАВЫ С МЕТАЛЛАМИ
Жидкие металлы
В зависимости от цели применения уран должен растворяться в расплав-
ленном металле или быть нерастворимым. Первое необходимо при разра-
ботке жидкометаллического горючего для реакторов. В этом случае для
растворения 0,1% урана служит висмут, в котором при 400° растворяется
0,21','и, а при 550° О,979о урана [87]. Па использовании растворимости
урана в расплавленных металлах основан также ряд схем регенерации горю-
чего [48]. Растворимость урана в расплавленных металлах, применяемых
в качестве охладителен или тсплопсредающей прослойки, должна быть
очень мала. Для этой области применения подходят щелочные металлы.
Диаграммы состояния
Диаграммы состояния двойных сплавов урана были предметом интен-
сивного изучения и в настоящее время имеются в нескольких справоч-
никах [60, 63, 125], где также даны сведения о структуре промежуточных
фаз. Основные черты диаграмм состояния приведены в табл. 15, где
элементы сгруппированы, согласно их положению в периодической
таблице элементов. Необходимо отметить, что из-за необычной структуры а-
и р-фаз растворимость остальных элементов в них ограниченна. В кубической
объемноцентрированной -у-фазе растворение происходит легче, но лишь
немногие элементы (молибден, ниобий, цирконий) растворимы настолько,
что могут удержать метастабильпую у"ФазУ ПРИ комнатной температуре.
Строение сплавов урана обсуждалось на основе теории сплавов [65].
МЕТАЛЛОГРАФИЯ Г63, гл. 14]
При изготовлении шлифов необходимо учитывать некоторые свойства
урана. Металл мягок и легко задерживает твердые включения. Он легко
окисляется, а поверхностный слой легко деформируется; поэтому для окон-
чательной отделки шлифа лучше пользоваться электрополировкой. Вслед-
ствие токсичности мелкого порошка урана необходимо пользоваться вытяж-
ными шкафами или мокрой шлифовкой. Окончательная подготовка поверх-
ности образца зависит от цели исследования, от того, что надо выявить:
структуру зерна, включения или диффузионные слои. Вероятно, каждый
металлограф имеет свой любимый рецепт и, можно полагать, вводит измене-
ния в опубликованные процедуры. Клейн [85] привел в табличной форме
наиболее обычные способы электролитической полировки и травления. Цен-
ным способом является катодное травление в вакууме, особенно для элек-
тронной микроскопии [7—9, ПО).
Структуру зерна можно выявить в поляризованном свете, так как уран
анизотропен. Установить размер зерна затруднительно вследствие выявления
субзерен или полигонизации. Так, группа a-зерен, получившихся из одного
и того же р-зерна, может иметь не совсем одинаковую ориентацию. Однако
Ти&яица 15
ПОВЕДЕНИЕ УРЛНЛ ПРИ ЛЕ1 ИРОВЛНИИ
Эл« |ент
Ча
Зе
Vlg
Za
\1
;е
Г|
It
ГЬ
/
ЧЬ
Га
Zi
Чо
V
Wn
Re
-с
Эвтектическая
температура,
°C
— 1100
—
640; 1105
—luoo
—
1040
/
859
716; 1035
725; 1080
Co 710; 1120
4i 740; 1100
885
Rh 885
Pd 998
Ds
r
Pt
Cu
^g
\u
in
Hg
3a
—
—
1005; 1340
950
950
852; 1105
944; Ш50
—
-II00
n _
Г1 —
3e
5n
Ph
\s
3h
Bi
Pu
—
—
Граничная
растворимость
элемента
в твердом
состоянии,
ят.%
Малая
0
-3
—
11олная
»
0,3
12
Полная
~ 3
~4
42
-0,5
-4
-6
'•—1
Чалая
-2
~9
9
5
—
-3
6,5
0
-0
6
0
—
0
—
—
—
0
0
—
—
0
Полная
Стабили-
зирован-
ная фа tii
урана
—
—
Y
(а); V
а; у
Р; у
У
Р; y
Р; y
P;y
Р; y
—
Y
Р; v
Y
Y
Р; Y
—
Р; Y
—
—
Р; v
—
—
—
—
—
—
—
—
—
—
Р; y
Соедннени*
Нет
UBc13
Нет
UAb, UAI3, UAI4
Нет"
UjsTi
fi-(UZr2)
Нет
»
LMo
Нет
UcMn, UMn,
UKe2
UeFe, UFe2
UeCo, UCo, UCo2, UCo3, UCo4. U2(.ou
UeNi, U7NiB, U5Ni7, UNi2, UNi6
U2Ru, URl, U3Ru4, U2Ru3, U3Rn3,
UK113
URh3
UPd, U5Pde, UPd3
UOs2
UIr2
UPt, UPl2, UPts, ГР13
UCu5
Нет
(U,Au3), (UAu3)
UZnB
UHg2, UHg3, UIIg4
UGag, LGa3
UIn3
UT13
UGe3
(U5S114). (UsSn3). USn3
UPb, UPb3
UAs, U3As4, UAs2
IlSb. U3Sb4, USb2
UBi, IJ3B14, UBi2
HI Г л as a 32
при облучении или механической деформации эта группа зерен ведег себя
как одно зерно. Поляризованный свет может несколько помочь при иссле-
довании включений. В противоположность урану они чаще всего изотропны,
особенно кубические изоморфные соединении UC, UN и UCK, образующие
между собой твердые растворы U(C, N) или U(O, С, N). Для их исследования,
годится нормальное светлое поле, но идентификация этих соединений затруд-
нена. Дли извлечения включений их с целью рентгеноструктурного иссле-
дования был применен ультразвуковой микромолоток [81, 82]. Эти соеди--
нения можно различать путем элекгроосаждения, основываясь на различ-
ном катодном поведении при покрытии медью [80].
СПОСОБЫ ОБРАБОТКИ
Шавка и отливка [4, 18, 22, 71]
Ввиду большей химической активности урана по отношению к воздуху
и парам воды плавку необходимо вести в замкнутой системе с инертной атмо-
сферой (или в вакууме). Исключение может быть сделано только в случае
легирования легкоплавкими элементами, например алюминием, когда тем-
пература плавки значительно снижается. Из-за большой реакционной спо-
собности затрудняется также выбор материала тигля. Основываясь на
соображениях о химической устойчивости, предпочтение отдают двуокиси
тория и окисям магния и бериллия. Их пригодность ограничена из-за пло-
хой термостойкости. Есть надежда использовать в качестве материааа тигля
иттрий, поскольку растворимость его в расплавленном уране невелика
[125, стр. 75]. В тех случаях, когда это возможно, желательно применять
графитовые тигли и графитовые стопоры. Загрязнение плавки углеродом
сводится к минимуму не только уменьшением времени нагрева, но и выдерж-
кой температуры литья металла не выше 1300 . При этой температуре рас-
творимость углерода составляет несколько сотых долей процента. Другой
подход необходим при плавке сплава, температура ликвидуса которого зна-
чтельно выше температуры плавления урана. В этом случае применяются
обмазки тиглей из стабильных окислов в отдельности или в их комбинации.
Водная суспензия окиси наносится намазыванием щеткой или распылением.
Используются обмазки из окиси бериллия, цирконата магнии, цнрконата
магния со слоем двуокиси тория и из смеси двуокисей тория и циркония.
Графит, применяемый для формы, нет необходимости защищать. Скорость
охлаждения в графитовой изложнице можно регулировать, увеличивая ее
толщину или подогревая индукционными токами. Для кокильного литья
применяются охлаждаемые водой медные изложницы. Стержни тепловыде-
ляющих элементов можно получить непосредственно центробежным
литьем [41].
Нагревание тигля и загрузки обычно производится индукционными то-
ками. Это одновременно обеспечивает и перемешивание раеппава, необхо-
димое при изготовлении сплавов. Однако при правке в графитовых тиглях,
служащих приемниками тока, перемешивание отсутствует, поскольку дей-
ствие электромагнитного поля на металл ограниченно. Перемешивание
может быть усилено выделением присутствующих в металлической шихте
липучих веществ, например магния в черновом слитке урана или цирконие-
вой губке. Такие летучие материалы можно специально вводить в шихту.
Иногда желательно использовать лигатуры. Для предварительного ставле-
ння урана с тугоплавкими металлами может примениться дуговая плав-
Уран Ш
ка |14|. Это снижает температуру последующем индукционной плавки. Ура-
новый скрап переплавляется в слиток в открытой печи под защитным слоем
соли [41].
Ковка [49, 50]
Ковке молотом предпочитают ковку на прессах, чтобы избежать раз-
брызгивания защитного соляного покрытия на металле. Соляное покрытие •
образуется при извлечении урана из соляной ванны (смесь карбонатов калия
и лития), используемой для нагревания металла. Оно служит для предохра-
нения от окисления и распыления окиси урана. Для этой операции горячей
обработки, как и для других, температура обработки выдерживается вблизи
600' — достаточно высоко в а-области и с достаточным запасом ниже темпе-
ратуры превращения в Р-фазу. К концу ковки металл охлаждают в воде,
чтобы воспрепятствовать окислению. В начале осаживанием и поперечной
ковкой разрушается грубая дендритная структура отливки. Последующие
операции ковки зависят от заданной формы откованной заготовки.
Прокатка [41, 59]
Для получения листового урана комбинируют горячую прокатку при
600° с последующей теплой прокаткой при температуре около 300е. Средой
для нагрева служат соответственно соляная (например, карбонатная) и мас-
ляная ванны. Механические свойства и структура (величина зерна, тексту-
ра) готового листа зависят от режимов прокатки, в том числе от обжатий до
отжига, а также от температуры и продолжительности отжига.
11мся валки с подходящими канавками, можно прокатать уран другого
профиля — квадратный, круглый и овальный.
Выдавливание [49, 97]
Уран можно выдавливать и получать стержни, трубы, овальные и дру-
гие профили равномерного сечения. Как и d ранее упомянутых операциях
горячей обработки, при температурах верха а-области необходимо уделять
особое внимание защите против окисления. Кроме того, ввиду более интен-
сивной деформации и склонности урана к прилипанию значительно труднее
подобрать подходящую смазку. Для смазки, а также для защиты от окисле-
ния служит тонкое покрытие из меди. Оно может быть удалено растворением
в ванне с азотной кислотой. Уран можно также выдавливать в ¦у-фазе, когда
он очень мягок. Несмотря на то что эта обработка была использована для
изготовления урановых блоков для первых реакторов, прессование в уфа-
зе разработано не так хорошо, как широко применяемое прессование
в ii-фазе (¦у-сплавы урана с ниобием и молибденом тверже, чем уран, и успеш-
но выдавливаются). Выдавливание используется для нанесения на уран обо-
лочки во время обжатия [52, 78, 105J. Тонкую и равномерную оболочку
можно нанести не только на внешний диаметр, но и на внутренний, если тре-
буется трубчатый тепловыделяющий элемент. Концы также могут быть
одновременно герметично заделаны. Для покрытия урана оболочкой осо-
бенно пригоден цирконий, так как оба эти металла имеют примерно одина-
ковое сопротивление пластической деформации и не образуют хрупких
интерметаллических соединений.
54 Заказ № 239
850 Г /ijiea 32
Круглая ковка на ковочных машинах и волочение [41, 134]
Уран можно подвергать круглой ковке на коночных машинах на хо'лоду
и в горячем состоянии. Его можно также волочить до малых диаметров,
если использовать подходящую смазку, а также то обстоятельство, чтомежду
100 и 150' он переходит в более пластичное состояние.
Механическая обработка [41]
Для урана пригодны стандартные приемы механической обработки,
с учетом его способности наклёпываться и пирофорности. Необходимо резать
на больших скоростях. Струя охлаждающей жидкости должна быть доста-
точно быстрой, чтобы смывать опилки и стружки и препятствовать и\ заго-
ранию. Очень рекомендуется вентиляция над обрабатываемым предметом.
Для уменьшения опасности самовозгорания необходимо хранить отходы от
обработки (скрап) малыми партиями под минеральным маслом.
Сварка [15]
Уран можно сваривать, пользуясь стандартной продажной аппарату-
рой, если поверхность металла достаточно хорошо очищена и над сваривае-
мым участком поддерживается среда инертного газа, препятствующая окис-
лению металла. Ввиду большой жидкотекучести расплавленного урана
необходимо держать свариваемый шов ближе к горизонтальному положе-
нию. Предварительный подогрев металла не дает никаких преимуществ.
После сварки необходим отжиг для снятия напряжений.
Другие методы соединения (пайка твердым припоем, обычная панка)
урана имеют ограниченное применение ввиду образования с припоем хруп-
ких интерметаллических соединений.
Порошковая металлургия [41, 143, 145]
Методами порошковой металлургии получается металл однородного
состава, с регулируемой пористостью @ — 40%) и величиной зерна, а также
с минимальной предпочтительной ориентацией. Можно приготовить сплавы
с тугоплавкими металлами. Безвозвратные потери металла очень малы, что
особенно выгодно при обработке таких дорогих материалов, как обогашен-
ный уран.
Порошок урана может быть получен непосредственным восстановле-
нием его окиси кальцием или магнием. Компактный уран или стружка
превращаются в порошок обычным методом — гидрированием водородом
при температуре около 225D. Затем гидрид разлагают в вакууме при 400 .
Вследствие пирофорности порошка все манипуляции с ним необходимо про-
изводить в инертной атмосфере. Поверхностная пленка окисн может мешать
спеканию. Ее необходимо разрушать во время уплотнения порошка. Поро-
шок урана прессуется на холоду (с органической смазкой) или в горячем
состоянии. Для достижения максимальной плотности спекание должно про-
водиться несколько ниже температуры плавления. Время спекания должно
быть минимальным, чтобы не происходило укрупнения зерна.
Приготовление однородных сплавов в системе уран — алюминий осо-
бенно трудно из-за большого различия плотности компонентов. Литье,
неоднородное вследствие сегрегации, можно превращать в однородный сплав,
переводя его в стружку, перемешивая и затем уплотняя, например выдав-
ливанием [891.
Уран S5?
Для приготовления дисперсионных тепловыделяющих элементов, напри-
мер ИО2 и нержавеющей стали [40, 86], используются методы порошко-
вой металлургии, подобные тем, которые применяются теперь в керамиче-
ском производстве.
ПРИМЕНЕНИЕ УРАНА
В ядерных реакторах
Илоювление металлических тепловыделяющих элементов [3, гл. 6;
G3, гл. 13; 79; 143, гл. 9 и 10J. Как конструкционный металл уран не исполь-
зуется. В реакторы элемент уран вводится в различных видах, не обяза-
тельно в виде металла. Горючеедля ядерного реактора может быть твердым
соединением (чаще всего UO2), в виде соединения, растворенного в воде, в
виде расплавленной соли или расплавленного металла (раствор урана в
другом металле). Однако преобладающим видом ядерного горючего остается
металический уран, легированный и нелегированный.
Форма тепловыделяющего элемента для данного реактора определяется
конструктором реактора. Исходя из размера и назначения реактора, он выби-
рает следующие параметры конструкции тепловыделяющего элемента:
геометрию, обогащение, охладитель и оболочку. Геометрия определяет гра-
диент температуры в горючем. Используется горючее различных форм:
пластины, стержни, трубы, проволока и ленты. Выбор охладителя реактора
(и замедлителя) и оболочки горючего взаимосвязан, так как основ-
ное назначение оболочки — защита урана от взаимодействия с охладите-
лем. Оболочка препятствует выходу продуктов деления из горючего в охла-
дитель. Д^ожст потребоваться оболочка настолько прочная при рабочей
температуре реактора, чтобы не изменилась форма горючего под дей-
ствием облучения. Выбор материала оболочки определяется несколь-
кими соображениями. В тепловом реакторе из соображений экономии ней-
тронов преимущество отдается материалам с малым поперечным сечением по-
глощения нейтронов: алюминию, цирконию (без гафння), магнию, бериллию.
Горючее и оболочка должны быть совместимы [не должно быть взаимодей-
ствия с образованием жидкости (расплава) или хрупкой интерметалличе-
ском фазы], в противном случае между ними необходима нейтральная прос-
лойка. Если нельзя осуществить непосредственное сцепление между горючим
и оболочкой, то необходимо обеспечить другими средствами теплопередачу
из горючего через оболочку к охладителю. Так, вследствие образования
легкоплавких эвтектик между ураном и железом (температура плавления
725"), а также легирующими элементами стали контакта между ними сле-
дует избегать. Термический контакт можно обеспечить прослойкой расплав-
ленного металла с большой теплопроводностью, например нагрия.
Для изготовления тепловыделяющих, элементов применяются различ-
ные упомянутые выше приемы обработки. Они могут быть видоизменены
для получения сложных тепловыделяющих элементов. Так, оболочка
из циркония может быть сцеплена с ураном в момент обжатия при сов-
местном выдавливании 152, 78, 105]. При изготовлении тепловыделяющих
элементов необходимо применять специальные приемы работы вследствие
радиоактивности горючего и большой ценности компонентов. В некоторых
случаях предпочитают проекты и процессы, пригодные для дистанционной
манипуляции и транспортировки высокоактивных материалов. Техни-
ческие условия на тепловыделяющие элементы довольно жесткие; перед
54*
832 Г лава 32
применением в реакторе они обычно подвергаются ряду строгих испыта-
нии без разрушения. {
На рис. 5 показаны некоторые типы тепловыделяющих элементов.
,1
I
Рис. 5. Тепловыделяющие элементы различных
типов.
/ — блоки урана, используемые в исследовательских
реакторах Ок-Рнджа н Ьрукхавена и промышленном хен-
фордском реакторе; 2 — брукхавенскне блоки в длинной
алюминиевой оболочке, снабженной ребрами для уско-
рения рассеяния тепла в охлаждающем воздухе; 3 —
тепловыделяющий элемент реактора для испытания ма-
териалов; 4 — аналогичный элемент аргоннского нсследо-
1ательского реактора; 5 — тепловыделяющий элемент из
пластин в алюминиевой оболочке первого эксперимен-
тального кипящего реактора в Айдахо; в—тепло выде-
ляющий элемент экгиернуентальноп» реактора с кипящей
водой, сделанный из толстых пластин в циркониевой
оболочке; 7 — одна 250-миллиметровая секции элемен-
тов зоны воспроизводства шнппннгпортского реактора
с водой под давлением, наложенная сверху на доску,
чтобы элемент был виден во всю длину; 8 — сборка уко-
роченных тепловыделяющих элементов в трубках из нер-
жавеющей стали экспериментального натриевого реактора;
9 — аналогичный элемент меньшего размера эксперимен-
тального реактора-размножителя Л? 1; 10 - сборка неболь-
ших трубок нз нержавеющей стали, содержащих урано-
вые прутки, которая представляет собой теплевндсляю-
щий элемент для экспериментального реактор а-раз-
множ ител я ¦№ 2.
Регенерация облученного горючего. Продолжительность пребывания
горючего в реакторе ограничивается радиационным повреждением и накоп-
лением продуктов деления, вызывающих соответственно нарушение цело-
стности тепловыделяющих элементов и потерю реактивности. Горючее
извлекается из реактора после того, как израсходована лишь небольшая
доля (обычно менее 1%) делящегося материала. Поэтому для экономичного
использования горючего рекомендуется извлечение из облученных тспло-
выдечяющих элементов несгоревшей части его. Кроме того, извлекается
также вновь образовавшийся плутоний.
Принятый метод переработки (регенерации) облученного горючего
состоит в растворении его в азотной кислоте. Далее раствор нитратов пере-
рабатывается, как и в рудной технологии (см. стр. 829). Горючее раст-
воряется в 55%-ной A1,7 М) азотной кислоте, и происходит реакция,
Уран 853
приближенно выражаемая уравнением
U+4,5HNO3 —> UO2(NO3J , 1.56NO+
+0,84NO2+0,0005N2O+0,043N2+2,25H2O.
Раствор уранилнитрата подвергается экстракции растворителем. Из орга-
нического растворителя извлекается раствор чистого уранилнитрата;-
полученный твердый уранилнитрат разлагается прокаливанием до 1Ю3,
а затем UO3 восстанавливается до UCb- Вследствие радиоактивности
облученного горючего необходимо вести регенерацию (по крайней мере,
начальные ее. операции) дистанционно за защитой. В итоге всего процесса
происходит полная очистка от радиоактивных загрязнении, позволяющая
вести дальнейшие манипуляции непосредственно. Чтобы получить из раз-
личных видов горючего более или менее стандартные растворы нитратов
для экстракции растворителем, применяют операции предварительной
обработки, зависящие от состава горючего и оболочки. Они могут быть
химические или механические («отрезка концов» тепловыделяющих эле-
ментов).
Изучались различные варианты неводных методов регенерации с при-
менением высоких температур. Хотя в иих достигается меньшая очистка,
чем в методах с азотной кислотой, этот недостаток компенсируется отсут-
ствием разложения при облучении органических реактивов, уменьшением
перерабатываемых объемов и упрощением проблем критической массы
из-за отсутствия воды [47]. Неводные методы основываются на различии
химических или физических свойств урана и продуктов деления (или их
соединений)- Делается попытка регенерировать горючее в металлическом
состоянии, чтобы избежать окислительно-носстановительного цикла вод-
ных процессов и, таким образом, сэкономить на стоимости повторного полу-
чения металлического горючего.
Другие области применения
Применение металлического урана, если нельзя использовать его ядер-
ные свойства, резко ограничивается неблагоприятными химическими и меха-
ническими свойствами. Изыскание других областей применения металла весь-
ма желательно ввиду наличия запасов обедненного урана (материал, обед-
ненный ураиом-235 вследствие его отделения и обогащенный ураном-238).
Для неядерных применении это изменение изотопного состава совершенно
не имеет значения. Обедненный материал считается менее опасным из-за
меньшей радиоактивности. Уран, используемый в антикатоде рентгеновской
трубки, дает рентгеновы лучи высокой энергии (очень малой длины
волиы) [101, 121] вследствие большого атомного номера. По этой же при-
чине он является выдающимся по своей эффекгивности материалом для
защиты от излучений. При использовании урана вместо свинца можно зна-
чительно снизить вес защиты. Эта экономия особенно ценна в передвижных
реакторах.
Ввиду большого сродства урана к газам он является очень действен-
ным средством для очистки благородных газов. Для этой цели его нагре-
вают приблизительно до 600° [54]. Можно использовать полированную
поверхность металла как указатель чистоты потока газа [98, 1091.
Комиссия по атомной энергии США разрешила использование гек-
сафторида обедненного урана, но выдача лицензий на продажу урановых
продуктов еще ограниченна. Стимулом для изыскания других областей
854 Глава 32
применения является очень низкая цена сильно'обедненного ураиа. Этот
материал используется в возобновленном производстве пигментов для
высокотемпературной глазури [311. Пока для обедненного урана нет доста-
точного рынка сбыта, ведутси поиски новых областей его применения
127,108].
ЛИТ ЕР АТУ Р А
1. Alexander P. P., Metals and Alloys, 8, 263 A937).
2. A I I e n R.J.,Petro» H. G, M a g'n о Р. J., Inri. Eng. Chem., 50, 1748 AЫ58).
3. Atomic Energy Facts, U. S. Atomic Energy Commission, Nuclear Technology Series,
Washington, D. C, Government Printing Office, 1957.
4. В a i r d J. C.Carson N. J., in Nuclear Metallurgy, Vol. 4, Institute of Me-
tals Division, The Metallurgical Society, American Institute of Mining, Metallurgi-
cal, and Petroleum Engineers, New York, 1957, p. 31.
5. В e I I e J., Lust in an В., Properties of Uranium Dioxide, in Fuel Elements
Conference, Paris, November 18 23, 1957, U. S. Atomic Energy Commission, Rept.
JV° T1D-7546, Book 1, p. 442, 1958; № WAPD-18-I, Westinghouse Atomic Power
Division, 1957.
6. Бенедикт М., Пигфорд Т.. Химическая технология ядерных материа-
лов. Атомнздат. М., 1960.
7. В i е г 1 е i n Т. К.., U. S. Atomic Energy Commission, Rept. № HW-32676, Han-
ford Atomic Products Operation, 1955.
8. Bier lei n T. K., U. S. Atomic Energy Commission, Rept. № HVV-34390,
Hanford Atomic Products Operation, 1955.
9. В i e r I e i n T. K, M a s t e I B., Rev. Sci. Instr., 30, 83? A959).
10. В I u in e n t h a 1 В., N о 1 a n d R. A., in Progress in Nuclear Energy, Series 5,
Metallurgy and Fuels (Finniston H.M., HoweJ. P., Eds)., McGraw-Hill Book Com-
pany, Inc., New York. 1956, p 62
11. В о w e n D., Survey of Radiation Effects on Fuel Materials, in Symposium on Ra-
diation Effects on Materials, Vol. 1, ASTM Special Technical Publication № 208,
American Society for Testing Materials, Philadelphia, 1957.
12. В reese J. С et al., U. S. Atomic Energy Commission, Rept. № CRNL-2889,
Oak Ridge National Laboratory, 1960.
13. В о у d W. К. et al., U. S. Atomic Energy Commission, Rept. № BMI-I160, Bat-
telle Memorial Institute, 1957.
14 Brit ton W H., Haynes W. V., in Nuclear Metallurgy, Vol 4. Institute
of Metals Division, The Metallurgical Society, American Institute of Mining, Metal-
lurgical, and Petroleum Engineers, New York. 1957. p. 63.
15. В г u n d i g e E L.. D о 1 I D Т., H a n k s G. S., T a u b J. M-, in Nuclear
Metallurgy, Vol. 4, Institute of Metals Division, The Metallurgical Society, American
Institute of Mining, Metallurgical, and Petroleum Engineers, New York, 1957, |i IU7.
16. В u d d e г у J. H., in Progress in Nuclear Energy, Series 5, Metallurgy and Fuels
(Finniston H. M., Howe J. P., Eds.), McGraw-Hill Book Company, Inc., New
York. 1956, p. 24.
17. Buddery J. H., H e d g e г Н. .]., in Progress in Nuclear Energy, Series 5,
Metallurgy and Fueld (Finniston H. Al., Howe J. P., Eds.), McGraw-Hill Book Com-
pany, Inc., New York, 1956, p. 3.
18 В u n t z B. J.. in Nuclear Metallurgy, Vol 4, Institute of Metals Division, TIic
Metallurgical Society, American Institute of Mining, Metallurgical, and Petroleum
Engineers, New York, 1957, p. 17.
19. Bush S. H.. U. S. Atomic Energy Commission, Rept. K° HVV-51444, Hanford
Atomic Products Operation, 1957.
Уран _ Ь55
20. Caihemallle А., англ пат 238GG3. July 7, 1924.
21. С a i I I a t R., Coriou Н., Р е г i о Р., С. R., 237, 812 A953).
22. Carson N. .1., Jr., in Nuclear Metallurgy, Vol. 4, Institute of Metals Division,
The Metallurgical Society, American Institute of Mining. Metallurgical, and Petrole-
um Engineers, New York, 1957, p. 23.
2.!. С e n t я n n i F.A., Ross A. M., D e S e s a M. A., Anal. Chem., 28, 1C51 A956).
24. Chcin. Eng., 65. .Ms 20, 50 A958).
25. Chem Eng., 67, № 14, 70 (I960).
26 Chem. Eng. News, 34, 29G8 A956).
Ti. Chem. Eng. News, 38, ЛЬ 18, 53 A960).
28. Chem. Eng. News, 37, № 6, 78 A959)
29. Chem. Week, 81. № 10, 83 A957).
30. Chem. Week, 81, № 17, 87 A957).
31 Chem. Week. 84. № 1, 24 A959).
32. Chem. Week, K4, № 13, 30 A959).
3:S. Chem. Week, 87, № 2, 4 (I960).
34 Chem. Week, 87, № 11. 95 A960).
35. С h i о t t i P., .1. Am. Сегят. Soc., 35, 123 A952).
.36. С I egg J. W.. Folcy D. D., Uranium Ore Processing, Addibon-Wesley Publi-
shing Company, Reading, Mass., 1958.
37. С о If i n L. F., Jr., Г. S. Atomic Energy Commission, Rcpt.№ KAPL-1019, Knolls
Atomic Power Laboratory, 1953.
.38. С r e s 1 i с к i M. E., Nelson B. J , пат. США 2692823, October 26, 1934;
С А.. 49. 826i A955).
39. С г о n а п С S., Chem. Eng., 65, № 11, 72 A958).
40. Cunningham J. E., Beaver R. J., W a u g li R. C, Fuel Dispersion
in Stainless-steel Components for Power Reactors, in Fuel Elements Conference,
Paris, November 18—23, 1957, U. S Atomic Energy Commission, Rcpt. № TID-7546,
Book 1. p. 243, 1958.
41. Culhber I F. L., Casting and Fabrication of Natural Uranium, in Fuel Ele-
ments Conference. Paris. November 18—23, 1957, L\ S. Atomic Energy Commission,
Rcpt. Л5> TID-7546, Book 1, p. 29, 1958.
42. D e с г о I у C, V a n 1 m p e J., Bull. tech. A. I. Br., 3, E), 1 A950).
43. D r a I ey J. E.. Argonne National Laboratory (частное сообщение).
44. D r i g g s F. H, L i I I i e n d a h I W. C, Ind. Eng. Chem., 22, 516 A930).
45. D r i g gs F. H. et al , пат. США 1821176, 1842254. 1861625, 1932
46. Eng. Mining J., 154, № 5, 72—76 A953).
47. F e d e г H. M., The Chemistry of Pyrometallurgical Processes: A Review, in Sym-
posium on the Reprocessing ol Irradiated Fuels Held at Brussels, Belgium, May 20—
25. 1957. U. S. Atomic Knergy Commission, Rept. № TID-7534, Book 2, p. 690, 1957
48 F e d e r II. M., T e i t e I R. J., Purification of Reactor Fuels and Blankets by
Crystalli/.ation from Liguid Metal Solvents, Geneva Conference Paper, P 540, 1958.
49. Fellows J. A., Bomb Reduction. Forging, and Extrusion of Uranium and Ura-
nium Alloys, in Fuel Elements Conference, Paris, November 18—23, 1957, U. S. Ato-
mic Energy Commission, Rept. № TID-7546, Book 1, p 46, 1958.
50. Fellons J A, S с h a f f с г H. J. in Nuclear Metallurgy. Vol. 4. Institute
of Melalls Division, The Metallurgical Society, American Institute of Mining, Metal-
lurgical, and Petroleum Engineers, New York, 1957, p. 67.
51 Г г о n d e I J. W. F I e i s с h e r M, U. S. Geol. Survey, Bull. K° I009-F, 1955.
52. G a r d П e r N. R., Materials in Design Eng., Л» 7, 48, 91 A958).
53. George D. R., U. S. Atomic Energy Commission, Rept. № RMO-563. 1949.
54. G i и Ьь D. S., S vec H. J., H a r r i n g t о n JR. E., Ind. Eng. (.hem., 48, 289
A956).
856 rj a e a 32
55. G i b s о n A. R., Murray P., U. K- Atomic Energy Authority, Report
AERE-M/M-72, 1954.
56. G ] a s s n e r A., U. S. Atomic Energy Commission, Rept. № ANL-5750, Argon-
nc National Laboratory, 1957.
57- Глесстон С, Атом. Атомное ядро. Атомная энергия. Развитие современных
представлений об атоме и атомной энергии, ИЛ, Москва, 1961.
58. G r u е п D. M., j. Chera. Pliys., 23, 17П8 A955).
59. Hanks G. S., T a u b J. M, Dell D. Т., in Nuclear Metallurgy, Vol. 4, Insti-
tute of Metals Division, The Metallurgical Society, American Institute of Mining,
Metallurgical, and Petroleum Engineers, New York, 1957, p. 73.
60. Хансен М., А н д е р к о K-, Структуры двойных сплавов, т. I и II, Метал-
лургиздат, Москва, 1962.
61. Н ayes E. E., Grain Refinement of Uranium by Heat-treatment and Alloying,
in Fuel Elements Conference, Paris, November 18—23, 1957, U. S. Atomic Energy
Commission, Rept. № TID-7546, Book 1, p. 75, 1958.
62. Hedger H. J., Production of Uranium Metal by the Reduction of Uiaiiium,
Tctrafluoride, in Progress in Nuclear Energy, Series 5, Metallurgy and Fuels
(Finniston H. M.. Howe J- P., Eds.). McGraw-Hill Book Company, Inc., Neu York,
1956. p. 16.
63. X о л ь де н А. Н., Физическое металловедение урана, Металлургнэдат, Москва,
1962.
61. Hull W. О., Р i n k п е у F. Т., Ind. Eng. Chem., 49, 1 A957).
65. Hume-Rothery W. et al., J. lnst. Metals, 83, 535 A955).
Rfi. Isseiow S., J. Metals, 9, 1237 A957)
67. I s s e г о w S., U. S. Atomic Energy Commission, Rept. № NMI-1145, Nuclear
Metals Inc.. 1956.
68. 1 s s e г о w S., U. S. Atomic Energy Commission, Rept. № NMI-4364, Nuclear
Metals, Inc., 1958.
69. J. Am. Chcin. Soc., 68. 2437 A946).
70 Jarrell-Ash Company, Bulletin № FL 5-58, Newtonville, Mass.
71. J aynes G. E., T a u b J. M., Doll D. Т., in Nuclear Metallurgy, Vol. 4,
Institute of Metals Division, The Metallurgical Society, American Institute of
Mining, Metallurgical, and Petroleum Engineers, New York, 1957, p. 1.
72. J о h n s о n J. C, Chem. Eng. News, 35, „\° 48, 70 A957).
73. J о п к e A. A., L e v i t z N. M, L i t t у A., L a w г о s к i S.. Ind. Eng. Chem.,
50, 1739 A958).
74. К a 1 i s h H. S.. Trans. Am. Soc. Metals, Preprint № 63 A958).
75. К а ц Дж., Рабинович Е., Химия урана, т. I, ИЛ, Москва, 1954.
76. К а ц Дж., С и б о р г Г., ред., Актиниды, ИЛ, Москва, 1956.
77. К a u f m a n n A. R., С u I I i t у В., Bilsianes G., J. Metals, a, Sec. 2,
23 A957).
78. К а и f in а п n A. R., Klein J. L. Lowenstein P., Sawyer H F.,
Zirconium Cladding of Uranium and Uranium Alloys by Cocxtrusion, in Fuel Fle-
ments Conference, Paris, November 18—23, 1957, U. S. Atomic Energy Commission.
Rept. № TID-754B, Book 1, p. 157, 1958; № NMI-TJ-8, Nuclear Metals. Inc.,
1957.
79. Kaufmann A. R., Fd., Nuclear Reactor Fuel Elements, Metallurgical Fabri-
cation, Interscience Publishers, Inc., New York, 1961.
80. К e h I G.L., Mendel E, J а г a i z F. E., Mueller M. H., Trans. Am.
Soc. Mctalb, 51, Preprint № 100 A958).
81. К e h I G. L..S t e i n m e t z H., M с G о n n a g I e W-J., Metallurgia, 4. A957).
82. К e h I G. L., S t e i n m e t z H.McGonnagle W. J-, U. S. Atomic Energv
Coininisbion, Rept. № ANL-5545, Argonne National Laboratory, 1D56.
Уран «57
83. К I а р г о t h М. Н., Chem. Ann. (Crell) II, 12, 387 A789).
84. К I а р г о t h M. H., Mem. Akad. Wiss. Berlin, 273 A789).
85. Klein J. L., Uranium and Its Alloys, in Nuclear Reactor Fuel Elements, Meta-
llurgical Fabrication (Kaufmann A. R-, Ed.), Interscience Publishers, Inc., New
York, 1961.
86. К о p e I m а п В., Recent Developments in Dispersion Type Fuel Elements,
in Fuel Elements Conference, Paris, November 18—23, 1957, U. S. Atomic Energy
Commission, Rept. N° T1D-7546, Book 1, p. 231, 1958.
87. Lane J. A.. M а с P h e r s о n H. С, М a s I a n F., Eds., Fluid Fuel Reactors,
Addison-Wesley Publishing Company, Reading, Mass., 1958.
88. L а г s e n R. P. et al., Г S. Atomic Energy Commission, Rept. № ANL-5135,
Argonne National Laboratory, 1954.
89. Larson W- L., Klein J. L., U. S. Atomic Energy Commission, Rcpt.
№NMI-1168, Nuclear Metals, Inc., 1956.
90. Лайнер В., Окислительные состояния элементов и их потенциалы в вод-
ных растворах, ИЛ, Москва, 1954.
91. L e m m о п A. W- et. al., U. S. Atomic Energy Commission, Rept. J\° BMI-550,
Battelle Memorial Institute, 1952.
92. Lewis С J., Probnick J. L., Ind. Eng. Chem., 50, № 12, 53A A958).
93. Lewis W. В., Uranium Dioxide, Atomic Energy of Canada, Ltd., Report
№ DL-31, December 1958.
94. Libowitz G. С G i b b T. R P.. Jr., J. Phys. Chem., 61, 793 A957).
95. Lin S. Т., К a u f m a n n A. R., Phys. Rev., 102, 640 A956).
96. L i t l L. M., G a r r e t t A. D , Г. г о x t о n F. C, J. Am. Chem. Soc., 70, 1718
A948).
97. Luwcnstein P., in Nuclear Metallurgy, Vol. 4, Institute of Metals Division,
The Metallurgical Society, American Institute of Mining, Metallurgical, and Petro-
leum Engineers, New York, 1957, p. 87.
98. M a 1 I e t t M. W., Ind. Eng. Chem., 42, 2095 A950).
99 M a 1 I e 11 M. W., G e г d s A. F., V а и g h a n D. A., Trans. Electiocliem. Soc.,
98, 505 A951).
100. M a 1 I e t t M. W., T r z e с i a k M. J., Trans. Am. Soc. Metals, 50. Preprint
№ 36 A957).
101. M a r d e n J. W., Trans. Elcctrochem. Soc., 66, 39 A934)
102. M а г d e n J. W., пат. США 1659209, February 14, 1928.
103. Martin F S., M i I e s G. L., The Processing of Irradiated Uranium by High-
Temperature Oxidation Reactions, in Progress in Nuclear Energy, Series 3, Procesb
Chemistry (Bruce F. R. et al., Eds.), Vol. 1, McGraw-Hill Book Company, Inc., New
York, 1956, p. 338.
104. M a t t r a w H. C, J. Phys. Chem., 59, 93 A955).
105. M о n t a g n e R., M e n e у L., Coextrusion Applied to the Fabrication of Solid
or Disperse Fuel Elements, in Fuel Elements Conference, Paris, November 18—23.
1957, U S. Atomic Energy Commission, Rept. № TID-7546, Book 1, p. 142,
1958.
106. M и I f о r d R. N. R., Ellinger F. H., Z а с h a r i a s e n W. H., J. Am.
Chem Soc. 76, 297 A954).
107. Murray P., Hugh S. E., Williams J., Uranium Dioxide аь a Reactor
Fuel, in Fuel Elements Conference, Paris, November 18—23, 1957, U. S. Atomic
Energy Commission, Rept. № TID-7546, Book 1, p. 432. 1958.
108. Nelson H. W., С a r m i с h a e 1 R. L., U. S. Atomic Energy Commission,
Rept. № TID-8203, 1960.
109. Newton A. S., U. S. Atomic Energy Commission. Rept. № MDDC-724,
January 1, 1947.
S5S Глава 32
] 10. Р a d d с п Т. R., С a i n F., U. S. Atomic Energy Commission, Rept.№ WAPD-83
(Del.), Westinghouse Atomic Power Division, 1953.
111. ПэлачЧ и др., Систрмэ минералогии, 7-е издание, т. 1 и 2, ИЛ, Москва,
1951.
112. Г а р г о с k i S. J., Sailer H. A., U. S. Atomic Energy Commission, Rept.
№ BMI-753, Battelle Memorial Institute, 1952
113. Pearlman H., Corrosion of Uranium, Thorium, anri Uranium Alloys in .Sodi-
um and Organics, in Fuel Elements Conference, Paris, November 18 23, 1957,
U. S. Atomic F.nergy Commission, Rept № TID-7546, Book 1, p. 565, 1958.
114. Peligot E.. Aim. Chem. Phys. C), 5, 5 A842).
115. P e I i g о t E.. J. prakt. Chem., 24, 442 A841).
116. P I а с е к С , N о r t h E. D., Ind. Eng Chem., 52, 458 A9C0)
117. Price H. L., Declassification of Tvpical Analyses for Normal Uranium Metal,
Director, Division of Civilian Application, U. S. Atomic Energy Commission, Memo-
randum of July 19, 1957
118. Progress Report on Metallurgy of Tuhalloy, to University of Chicago from Battelle
Memorial Institute, Rept. №CT-I795. p. 159, June I, 19-14
119 P u g h -S. F., in Progress in Nuclear Energy, Series 5, Metallurgy and Fuels (Fin-
niston H. M., Howe J P , Eds.)., McGraw-Hill Book Company, Inc., New York.
1956, p. 652.
120. R а п к a m a K-, S a h а ш a T. G., Geochemistry, University of Chicago Press,
Chicago, 1950.
121. R e n t s с h I e г Н. С M a r d e n J. W., пат. США 1625427, 1927
122. Rich M. N.. пат. США 1738669, December 10, 1929.
123. К о d d с п С. J., Ed.. Analytical Chemistry ol the Manhattan Project, National
Nuclear Energy Series, Div. 8, Vol. 1, McGraw-Hill Bonk Company, Inc., New
York, 1950.
121. R о t li H. P., U. S. Atomic Enerpy Commission, Rept. № MIT-1105, Massachu-
setts Institute of Technology, I952.J
125. Кутай цев В. И., Сплавы тория, урана и плутония, Госатомиздат, Москва,
1962.
126. Rough F. A., D i с к е г s о п R. F., Nucleonics, 18. Ns 3, 74 A960).
127. С э л л е р, Материалы Международной конференции по мирному использованию
атомной энергии, т. 9, Гос. научно-технич. изд-во хим. лит., Ленинград, 1958,
стр. 266.
128. S с h u 1 7 W. W., S с о t t F. A., V о i I a n d E. E., U. S. Atomic Energy Com-
mission, Rept. № HW-32410, Hanford Atomic Products Operation, 1954. ,
129. К и ф e p P., Ill в а р ц к о п ф П., Твердые сплавы, Металлургиздат, Москва,
1957.
130. Shober F. R., M a r s h L L., Manning G. К, U. S. Atomic Energy
Commission, Rept. № BM1-1036, Battelle Memorial Institute, 1955.
131. Smith R. В., U. S. Atomic Energv Commission, Rept. № ТШ-8ПП, 1956.
132. Смит Г. Д., Атомная энергия для военных целей, Трансжелдориздат, Москва,
19-16, стр. 104.
133. Штрассер, АТзР, 10. 21 A961).
Ш- Т a u h J. М. D о I I D. Т., II a n k s G. S., in Nuclear Metallurgy, Vol. 4,
Institute of Metals Division. The Metallurgical Society, American Institute of
Mining, Metallurgical, and Petroleum Engineers, New York, 1957, p. 95.
135. Troutncr V. H., U.S. Atomic EnerRy Commission, Rept. № HVV-58146.
Hanford Atomic Products Operation, 1958.
136. Trzebiatowski W., S I i w a A., S t a 1 i n s к i В., Roczniki Chem.,
28. 12 A954); С. А., 48, 11131a A954).
137. Van A r к e I A. E., Reine Metalle, Vcrldg J. Springer, Berlin, 1939.
Урин t>59
138. VV а г f J. С, Some Reactions of Uranium Metal, U. S. Atomic Energy Commission,
Rcpt. № MDDC-139I, Declassified October 9, 1947.
139. Warner R. K.. Australian J. Appl. Sci., 4, 581 A953).
140. У и л x ел м, Материалы Международной конференции по мирному использова-
нию атомной энергии, т. 8, Металлургиздат. Москва, 1956, стр. 227.
141. W i I h e 1 m H A., J. Chem. Ed., 37, 56 A960).
142. VV i I h e 1 m II. A., Metal Propr., 69, 81 A956).
143. Wilkinson VV. D., M u r p h у W. F., Nuclear Reactor Metallurgy. D Van
Nostranri Company, Inc., Princeton, N. J., 1958, Chap. 7.
144. Z а с h a r i a s e n W. H., Acta Cryst., 2, 94 A949).
145. Z a m b г о w J. L., in Nuclear Alctallurgy. Vol. 4, Institute of Metals Division,
The Metallurgical Society, American Institute of Mining, Metallurgical, and Petro-
leum Engineers, New York, 1957, p. 117.
33.
ХРОМ
Р. У. ФОНТЭН
R. IP'. Fountain, Aletals Research Laboratories,
Union Carbide Metals Company,
Niagara Falls, N. Y.
Элемент хром был впервые выделен в 1797 г. Вокеленом из минерала
крокоита*, который был открытПалласом в России в 1765 г. Хром получил
свое название от греческого слова «chromos», означающего цвет, по при-
чине меняющихся цветов его соединений. Хром дает зеленый переливаю-
щийся цвет изумруда, желтый цвет слюды и красный цвет рубина.
Хромовые руды были впервые использованы для производства хро-
мовых реактивов около 1800 г. и впервые применялись в качестве огнеупо-
ров в 1879 г. Хотя патент на хромистую сталь был получен в 1865 г.,
только около 1910 г. хром начал играть важную роль в металлургии.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ХАРАКТЕРИСТИКИ
Хром широко распространен в скальных породах земной коры и по
распространенности является двадцать первым элементом. Его среднее
содержание мало и составляет 0,035%.
Хотя хром широко распространен в природных месторождениях, его
никогда не находят в элементарном состоянии. Фактически flee хромовые
руды состоят из минерала хромита, который содержит главным образом
окислы железа и хрома и соответствует формуле FeO-Cr2O3, содержащей
68/оСг2Оа и 32% FcO. Лучшие сорта хромовых руд содержат 42—56% Сг2О3
и 1U—26% FeO. Добытая руда также содержит различные количества
окисей магния, алюминия и кремния. Основная добыча производится
в следующих странах: Южная Родезия. СССР, Южно-Африканская Ре-
спублика, Турция, Куба, Новая Каледония и Филиппины.
Хромит, наиболее важный источник хрома, является нерастворимым
минералом, который кристаллизуется в ромбоэдрической системе, в виде
октаэдров. Он хрупок, имеет неровный излом и твердость около 5,5 по
шкале Мооса. Его удельный вес изменяется от 4,1 до 4,9. Цвет хромита
меняется от черного как смоль до коричневато-черного, в тонких срезах —
от прозрачного до непрозрачного; образцы е высоким содержанием хрома
имеют красно-коричневый цвет, а с высоким содержанием алюминия —
кофейный. Хромит может быть слабо магнитным.
Отложения хромита ассоциируются с перидотитами и пнроксенитами
или с серпентином, являющимся продуктом изменения этих двух пород.
Хромит встречается как в виде рассеянных зерен, так и в виде линз или
пластинчатых масс. Тейер 181] устанавливает соотношение между соста-
вом хромита и ассоциированных пород и отмечает, что «хромиты с высо-
ким содержанием алюминия встречаются в массах перидотитов, содержа-
• Природный хромат свинца PhCrO4, содержащий около 70% РЬО.— Прим. ред.
Хром 861_
щих полевце шпаты, а хромиты с высоким содержанием хрома встречаются
в не содержащих полевой шпат перидотитах с низким содержанием окиси
алюминия и железа. Хромиты с высоким содержанием железа бушвельд-
ского типа, очевидно, возникли в результате кристаллизации в окружении
пироксенита с дефицитом окиси алюминия и относительно богатого железом».
Большинство руд представляют собой достаточно высокие сорта,
и их можно продавать без обогащения, если не считать ручной разборки.
Однако в случае рассеянных руд часто используют промывку руд на обога-
тительных столах для получения концентрата, содержащего около 50%
Сг2О3. Обогащение руд на практике производится редко, так как оно хотя
и увеличивает содержание Сг2О3, но обычно не улучшает соотношения
между хромом и железом. Общая добыча хромита в различных странах
с 1048 по 1958 гг. приведена в табл. 1 [56J.
Температура размягчения хромовых руд изменяется в интервале 1260—
1425е, в основном в зависимости от содержания примесей. Хромит химически
нейтрален и почти нерастворим в большинстве шлаков, но его реакционная
способность увеличивается, а огнеупорность падает с увеличением в нем
содержания железа.
ИСПОЛЬЗОВАНИЕ ХРОМОВОЙ РУДЫ
Хромовые руды и концентраты обычно подразделяются на три основ-
ные группы: 1) металлургические, 2) огнеупорные, 3) химические.
В металлургическом хромите обычно должно быть не меньше 48% Сг2О3
с соотношением хрома и железа 3:1. Обычно предпочитают твердую куско-
ватую руду, но для некоторых применений в металлургии можно исполь-
зовать мягкую руду или хромитовый концентрат.
Огнеупорные руды, используемые в производстве хромитового кирпича,
хромомагнезитового кирпича, пластичного цемента и других огнеупорных
продуктов, имеют высокое содержание Сг2Оа + А12О3 и относительно низ-
кое содержание железа и кремнезема. Огнеупорность хромитового кирпича
ограничивается в основном силикатной связкой, а не самим хромом, по-
этому количество в нем кремнезема и флюсов должно сводиться к мини-
муму. На практике ко всем хромовым рудам добавляют избыток окиси маг-
ния для соединения с кремнеземом во время обжига с образованием сили-
ката магния (форстерита).
Руда, предназначенная для химической переработки, должна иметь
наивысшее возможное содержание Сг2О3 и наименьшее содержание SiO2
и А12О3. Спецификации более разнообразны, чем для металлургических
и огнеупорных сортов, и обычно определяются для каждой руды на основе
стоимости, доступности и имеющегося опыта.
Из полного потребления хромита в США идет приблизительно 65%
для целей металлургии, около 259-6 на огнеупоры и остальное для химиче-
ской промышленности. Потребление хромита и состав руды, использовав-
шейся основными группами потребителей е 1948 по 1957 гг., представ-
лены в табл. 2 156].
МЕТАЛЛИЧЕСКИЙ ХРОМ
В промышленности используются два класса хрома — феррохром
и металлический хром. Феррохром можно получать прямым восстановле-
нием руды без удаления железа, в то время как металлический хром может
быть получен электролизом или восстановлением солей хрома, окислов
Таблица 1
МИРОВАЯ ДОБЫЧА ХРОМИТА ИА.1НЫМИ СТРАНАМИ С 194В ПО 195-1 (СРН.ДНЕГ) И С 1953 ПО 1С15« п . (и hnpoiknx тоннах)
Страна
Северная Америка
Канада
Куба
Гватемала
США
Всего
Южная Америка
Бразилия
Европа
Албания
Греция
Португалия
СССР (приблизительно)
Югославия
Всего (приблизительно)
Азия
Афганистан
Кипр (экспорт)
Индия
Иран
1448 1932
(среднее)
415
92 745
477
6 563
100 200
2 187
48 600
16612
99
580 000
108 760
765 ООП
448
14 629
24 966
6 355
1953
77 205
441
58 817
136 463
3 942
51800
40 520
6
600 000
139 950
900 000
9 115
72 543
23 657
1954
80 011
146
163 365
243 522
2 108
110 200
29 508
23
60U 000
137 216
900 000
10 080
50 968
24 406
1955
85 107
320
153 253
238 680
4 546
135 000
27 902
600 000
139 119
900 000
9 599
100 071
38 504
1956
54 248
979
207 662
267 8Й9
1536
147 000
53 581
600 000
130913
1 ООП 000
6 526
59 009
29 700
1957
127 12G
1 200
166 157
294 483
4 000
1S4 400
49 135
600 000
132 570
1 000 000
5 678
87 968
27 600
1958
82 801
143 795
227 696
2 899
221800
25 550
880 000
125 188
1 274 538
13 260
67 668
27 558
Япония
Пакистан
Филиппины
Турция
Всего
34 7G7
19 75В
359 837
566 0,38
1 026 826
Африка
ОАР
Родезия и Ньясаленд, Фе-
дерация Южной Родезии
Сьерра-Леоне
Южно-Африканская Респуб-
лика
Всего
Океания
Австралия
Нойая Каледония
Псе го
61
306149
17 159
537 593
860 462
И 75
Мировое пронзводстно (при- 2 855 000
- близителыю) I
41418
26 255
614 086
1 792 957
231
463 028
27 277
798 562
1 289 098
3 070
134 032
36 138
24 527
442 230
1005 883 619 001
1 206 350
584
442 506
21 011
706 935
1 171 036
99 263 137 102
4 300 000
5 536
93 645
29 2G9
31 808
655 882
710 253
I 575 386
426
449 202
23 231
597 368
1070 727
50 790
99 181 50 790
I
3 60A 000
3 800 000
43 947
25 487
781 598
918 308
51 050
20 000
799 744
772 368
1 864 575
281
148 965
21 900
690 851
1764 408 1564 402
654 072
18 344
722 588
1 161997
6 828
5Л 932
1 395 004
3 650
7! 100
G0 760
71750
4 400 000
4 500 000
IG078
26 935
458 903
524 000
ПО
618841
12 556
696 057
1 327 564
660
52 249
52 909
4 050 000
Таблица 2
ПОТРЕЬЛКНИСа ХРОМИТА И СОДЕРЖАНИИ. ХРОМА В РУДАХ, ИСПОЛЬЗУШЫХ ОСНОВНЫМИ ГРУППАМИ ПОТРЬБИТЕЛЕЙ В США [56]
Годы
1948—1952 (сред-
нее)
1953
1954
1955
1956
1957
1958
1959
Металлургия
485064
742 822
502 278
993 653
1 211914
1 117 073
777 682
795 971
среднее
содержание
47,8
46,3
46,3
46,5
46,8
47,1
46,9
46,7
Огне;, поры
355 643
441 155
278 324
431 407
174 562
434 922
311 911
379 300
среднее
содержание
Сг2О3. %
34,0
33,6
34,3
3.1,4
34,4
34,8
35,2
34,6
Химия
Общее
144 516
151 778
133 471
158 923
160 124
148 474
131 156
161 625
среднее
содержание
Сг2Оз, %
44,6
985 223
44,5
44,6
44,8
45,4
45,0
43,6
44.5
1 335 755
913973
I 583 983
1 846 600
1 760 469
1 220 749
1336 896
среднее
coflfpJKfiHiie
Сг2О3. "',
42,4
42,7
42,4
43,0
43,5
43,9
43,8
13,1
а В коротких тоннах.
. Хром №5
или иодида, но после предварительной химической обработки с целью уда-
ления железа и других элементов. Характеристика различных сортов фер-
рохрома не входит в задачу этой главы. Справки о феррохроме читатель
может найти в обзорах Юди [83] и Салли [79].
Металлический хром различных степеней чистоты производится путем
нескольких процессов, которые будут описаны ниже.
Алюмино- и силико термический хром
Металлический хром промышленной чистоты получается в больших
количествах с помощью процесса Гольдшмидта [29], основанного на сле-
дующей реакции:
Сг2О3 -2А1 - 2Сг А12О3-
Шихта из Сг2О3 и порошкового алюминия помещается в контейнер
с огнеупорной обмазкой и поджигается. Контейнер обычно предварительно
нагревается, а смесь поджигается перекисью бария и порошковым маг-
нием. Поскольку реакция в высокой степени экзотермична, то начавшись
она поддерживается самостоятельно. Таким образом может быть получен
металлический хром чистоты около 97—99%. Главными примесями явля-
ются алюминий, железо и кремний. Содержание углерода, серы и азота
может быть порядка 0,03, 0,02 и 0,045% соответственно.
Металлический хром промышленной чистоты получают также вос-
становлением окиси хрома кремнием. Этот процесс, проводимый в электри-
ческой дуговой печи, недостаточно экзотермичен, чтобы реакция поддер-
живалась самостоятельно. Реакция идет по уравнению
2Cr2O3+3Si —=• 4Cr+3SiO2.
Этот продукт подобен получаемому путем алюмотермического процесса,
за исключением того, что содержание алюминия в нем значительно ниже,
а кремний может присутствовать в количестве до 0,8%.
Хром, полученный восстановлением углеродом
В дополнение к указанным выше процессам металлический хром можно
также получать восстановлением его окисла углеродом-[20]. Этот процесс,
проходящий при низком давлении, основан на реакции
Сг2О3+ЗС ¦ 2О- + ЗСО. '
Смесь Cr2Oj и тонкоизмельченного угля брикетируют, помещают
в соответствующий огнеупорный контейнер и нагревают до температуры
в интервале 1275—1400". Давление, поддерживаемое в течение процесса,
зависит от температуры. Минимальное давление при температуре восста-
новления I4UU° составляет около 280 315 мк рт. ст.. Более низкие, чем
указанные выше, давлении приводят к непроизводительным расходам
хрома вследствие испарения. Содержание углерода, азота и кислорода
в этом продукте составляет 0,015, 0,001 и 0,04% соответственно, содержание
кремния около 0,02% и железа меньше 0,0396-
Электролитический хром
Электролитическое получение хрома исследовалось в течение многих
лет [2, 13, 18, 52, 53, 54, 71]. Два современных производственных процесса
основаны на электролитах: 1) хромоквасцовом [16, 17| или 2) хромо-
кислотном [33, 87|.
55 Зак.и № 239
sec
Глава 33
Хромоквасцовый процесс. Типичный хромоквасцовым электролити-
ческий процесс используется компанией «Юнион кэрбайд металс» на заводе
Мариетта, штат Огайо (США). Производительность этого завода составляет
около 2UU0 т металлического хрома в год. Технологическая схема этого
процесса для производства хрома из феррохрома показана на рис. 1 116].
Феррохром с высоким
содержанием угперида
Прпмидна осадка чидий
ПереосихШте
Кристаллизация
Фильтрование
Растворения
Опветлрнип раствора
Растворитель
Пепеугиждениг
I
Кристаллизация
фильтрование
Н->0
Двойной сульфат
железа (И) и аммония
Электролиз
Слив патолита
Храм
Регенерирован
ный анолит
Регенерации
Промыепа
Дегазация
Готовый
п/юдупм
Рис 1. Технологическая схема завода в Мяриетте (фирма «Юнион кэр-
байд металс») для производства электролитического хрома.
Феррохром с высоким содержанием углерода, крупностью, достаточной,
чтобы пройти через сито 20меш, обрабатывается смесью регенерированного
анолита, хромоквасцовым маточным раствором и подпитывается серной
кислотой при температуре вблизи температуры кипения. Посте выщелачива-
ния шлам охлаждают до 80° или ниже холодным маточным раствором от кри-
сталлизации двойного сульфата железа(П) и аммония. Нсрастворенное
твердое вещество (в большей части кремнезем) отделяют и выбрасывают.
В фильтрате хром превращают в не образующую квасцы модификацию
путем выдержки при повышенной температуре и течение нескольких часов.
Хрок
867
Этот кондиционированный раствор перекачивают в кристаллизатор
камерного типа, в котором температуру понижают до 5° для отделения
железа в форме кристаллов двойного сульфата железа(П) и аммония.
Таблица 3
ШНИЧНЫП СОСТАВ РАСТВОРОВ В ХИМИЧЕСКОМ ЦИКЛЕ
(ХРОМОКВАСЦОВЫП ПРОЦЕСС) [16]
Раствор
Состав, г/г
Фильтрат со стадии выщелачива-
ния
Остаточная промывная вода
Черновой Fc-содержащий маточ-
ный раствор
Маточный раствор после отделения
двойного сульфата желеэа(Н) и
аммония
Хромокпасцовый маточный раствор
Загрузочный раствор
72
4
73
35
20
130
NHS
19,0
2,0
4,0
7,0
5,0
0,2
75
2
80
80
64
43
:войодна
H2SO4
85
4
87
95
3
После этого маточный раствор отстаивается н направляется в^цикл старе-
ния. Старение и кристаллизация проводятся примерно при 30°,fnpH этом
t, .С".
к,<т
Ь -
- 1;
t
¦ '-^5й^*' -
i/
?'
"ч
Рис. 2 ОСвдш Ш1Д гальванического цеха заво-
да в Мариетте (фирма «Юннон кэрбайд металс»)
для производства электролитического хрома.
Катпдн m стали типа 31м. ii.i которых отложился
хром, удаляют ш плнны. Они удаляются но цикчу
черс 1 72 час; xpvnKKu осадок xpovn снимается с като-
доп с помощью пневматических молоткгш
осаждается около 80% хрома в виде амминиево-хромоилх квасцов. Кри-
сталлический шлам фильтруется и промывается. Фильтрат возвращается в
цикл выщелачивания, а промытые кристаллы хромовых квасцов растворяют
в горячен воде для получения загрузочного раствора для электролити-
55*
SfiS
Глава 33
ческой ванны. Типичный состав различных растворов и кристаллов из хи-
мического цикла приведен в табл. 3 и 4 [16].
Для успешного элсктроосаждения хрома необходимо поддерживать
рН католита в относительно узких пределах и сохранять двухвалентный
Таблица 4
ТИПИЧНЫЙ СОСТАВ КРИСТАЛЛОВ, ПОЛУЧАЕМЫХ
В ХИМИЧЕСКОМ ЦИКЛЕ (ХРОМОКВАСЦОВЫП ПРОЦЕСС) [In]
Тип кристаллов
Черновой сульфат железа
Двойной сульфат железа(П)
i аммония
Хромовые квасцы
Сг
3,4
0,4
9,1
Состав, %
Fe
6,5
10,0
0,01
NH3
6,7
7,0
3,0
Таблица 5
ТИПИЧНЫЙ СОСТЛБ РАСТВОРОВ В ЭЛЕКТРОЛИТИЧЕСКОМ ЦИК.ПР
(ХРОМОКВЛСЦОВЫП ПРОЦЕСС) [Ю]
Раст вор
Загрузочный рас-
Цнркулирующая
смесь
Католнт
Анолит
общее
количе-
ство
130
65
23
15
XpQV,
6+
0
0
0
13
г/г
3+
130,0
63
11,5
2,0
2+
0,0
2,0
12,5
0,0
Содержание, ?'л
Fe
0,200
0,100
0,035
0,023
N1I3
43
68
84
24
H2SOj
3
¦ 1
—
280
Тибмща 6
РЕЖИМ РАБОТЫ ЭЛЕКТРОЧИТИЧЕСКОЙ ВАННЫ
(ХРОМОКВАСЦОВЫП ПРОЦЕСС) [1С]
Характеристика
Катодная плотность тока, а/дм2
Потенциал ванны, в
Выход по току, %
Потребление электричества, квт-ч
РН
Температура католита, °С
Премя осаждения, час
Материал катода
Материал анода
Значение
7,5
4,2
45
18,5а
2,1—2,4
53±1
72
Сталь типа 316
Сплав серебро—свинец
A:99)
Переменный ток, подвпдимый к п-нерлтораы, па ] к* пол> цен-
ного металла.
Хроч
8Ь9
хром, образующийся на катоде. Нужно предохранять серную и хромовую
кислоты, образующиеся на аноде, от смешивания с католитом для предотвра-
щения окисления двухвалентного хрома и для возможности контроля рН.
Раствор непрерывно подается к действующим электролитическим ваннам
для поддержания концентрации хрома в оптимальных пределах. Значение
Рис. 3. Куски металлического хрома толщиной
3,2—6,35 мм, снятые с катодов (сЮннон кэрбайд
ыеталс»).
Гладка» cTi>pou«r кусков находилась около катода, шерохова-
тая соприкасалась с электролитом.
рН католита в каждой ванне контролируется подбором количества като-
лита, протекающего через диафрагмы в анолитные камеры. Типичный
состав растворов в электролитическом цикле приведен в табл. 5 и 6 [16].
Общин вид электролитического цеха на заводе Мариетта дан на рис. 2.
Хром, сдираемый с катодов, имеет толшину от 3,17 до 6,35мм. Внешний
вид металла показан на рис. 3.
Его типичный химический состав: 99,8% хрома, 0,14% железа, 0,01%
углерода, 0,025% серы, 0,001% меди, 0,002% свинца; кремний, фосфор,
алюминий, магний отсутствуют. Металл содержит около 0,5% кислорода,
0,004% водорода и < 0,01% азота.
Хромокислотный процесс. Хром получают также электролизом хро-
мовой кислоты [33, 87]. Ванна, используемая для этого процесса в Иссле-
Таблица 7
flAHHHF ИССЛЕДОВАТЕЛЬСКОП ЛАБОРАТОРИИ
АЭРОНАВТИКИ ДЛЯ ПРОЦЕССА
ЭЛЕКТРООСАЖДЕНИЯ ХРОМА
(ХРОМОКИСЛОТНЫП ПРОЦЕСС)
Характеристика
Состав ванны, г/л
Хромовая кислота
Сульфат-ноны
Температура, "С
Плотность тока, а/дм2
Выход по току, %
Время покрытия, час
Производительность, г/неделя
300
4
84-85
9,8
6-7
80—90
100A
870
Глава 33
довательской лаборатории аэронавтики в Австралии, показана на рис. 4
187]. Применяемые условия работы ванны приведены в табл. 7 [87].
Влияние режимов покрытия на электроосаждение хрома из хромокис-
ло-iHoii ванны подробно исследовано; получены следующие результаты:
1. При повышении рабочей температуры (87°) можно уменьшить
содержание кислорода в осажденном металле до 0,01%.
2. Для получения металла, не содержащего кислорода, следует под-
держивать отношение СгО3 к SOl~ ниже 100.
/f выпрямителю
постоянного тот
11
Р и с. 4. Аппарат для получения электролитического хрома путем
электролиза хромовой кислоты.
; — медный кчтод: 2 — термостат со стеклянной оболочкой. 3 — Есасы-
вающий трубопровод; 4 — гнльо.шнческаи d^iih.i. пблицив.нмии cbhhu,ov;
,5 — анод из чистого свинца: 6 — стеклянный пояс: 7. 8 — постоянные
головки; 9 - c.nt\ vmiinR выключатель; 10 — пш ружаемые кагренятелн:
// — водяная рубашк~
3. Выход по току несколько выше 8%, по-видимому, не связан с низ-
ким содержанием кислорода.
4. Лучший выход по току получается при более низких плотно-
стях тока.
Как можно видеть из табл. 8 [87], степень чистоты хрома, полученного
электролизом хромовой кислоты, значительно выше степени чистоты хрома,
полученного из хромоквасцовон ванны.
Удаление кислорода. Хотя степень чистоты хрома, полученного элек-
тролизом как хромоквасцового, так и хромокислотпого электролитов, пре-
восходит степень чистоты хрома, полученного восстановлением алюминием
или кремнием, он все же имеет высокое содержание кислорода. При изу-
чении механических свойств электролитического хрома существовала обще-
принятая гипотеза, что примесь кислорода является главной причиной
его хрупкости при комнатной температуре. В связи с этим разработаны
методы удаления кислорода, и далее будут рассмотрены три процесса:
восстановление водородом [28, 43, 50], иодиднын процесс [3, 8, 30, 86]
и рафинирование кальцием [42].
Процесс восстановления водородом. Метод восстановления водородом
Состоит в основном в нагреве электролитического хрома в потоке очищен-
Хром
871
Таблица 8
ХНМИЧЕСКИП СОСТАВ ЭЛЕКТРООСЛЖДКННОГО JCPOMA
(ПО ХРОМОКИСЛОТНОМУ ПРОЦЕССУ) [87]
Элемент
о2
No
Hs
Си
Ar
Mg
в
Si
Ca
Sb
Co
Ni
Sn
Pb, Al, Fe,
Zn, Tl
I
Концентрация, вес.% Метод анализа
0,02
0,0025
0,009
Сл. сл. @,002—0,003)
Сл. сл. «0,0005)
Сл. сл. «0,00о)
Сл. сл. «0,005)
Оч. сл. сл. «0,0005)
Оч. с.1. сл. «0,001)
Н. я. «0,0113)
Н. з. «0,01)
Н. з. «0,001)
II. з. «0,0005)
Химический и вакуумное плав-
ление
Тот же
Вакуумное плавление
Спектроскопический
»
»
»
»
*
>
»
»
Н. з. »
Примечание; Оч. сл. сл.—очень слабые следы, Сл. сл. сл^Пые следы,
Н. з.—не замечено. •
ного сухого водорода в интервале температур 1200 — 1500°. Хотя этот
процесс эффективен в отношении у меньшения содержания кислорода и азота,
он мало эффективен в отношении металлических примесей. Результаты,
полученные при водородном восстановлении электролитического хрома из
хромокислотного процесса, приведены в табл. 9 [33].
Таблица 9
ОЧИСТКА, ДОСТИГАЕМАЯ МЕТОДОМ ВОДОРОДНОГО ВОССТАНОВЛЕНИЯ
ХРОМА, ПОЛУЧЕННОГО ХРОМОКИСЛОТНЫМ СООСОБОМ [33]
Нсхидпый
Оз,
0
0
0
о
0
вес. %
п
11
12
12
05
материал
0,
0,
ес%
002
002
ОГфаботка
при 1500°, час
3:
1
3,
4.
3
,5
,0
,0
,0
.0
Конечный продукт
ОЕ, вос,%
0,020
<П,П05
0,020
<0,005
<0,005
N2, вес.%
<0,001
0,001
<0,001
<0,001
<0,001
Иодидный процесс. Иодидный процесс получения хрома высокой
чистоты из электролитического хрома основан на термическоп диссоциации
иодида хрома.
Циклический процесс. В первоначальном приборе Ван-Лркеля
и де Бура загрязненный хром и иод запаивались в эвакуированную колбу,
872
Глава 33
имеющую нагретую поверхность осаждения, обычно проволоку, нагре-
ваемую электрическим током. Колба нагревалась до температуры, при кото-
рой пары иода реагируют с хромом, образуя пары иодида хрома. Подид
диффундирует к нагретой поверхности, на которой он диссоциирует с отло-
жением хрома и выделением свободного иода. Иод затем возвращается,
снова образует иодид хрома, и таким образом процесс продолжается. В пер-
воначальном процессе вместе с хромом переносились и отлагались некото-
рые газообразные и металлические примеси. Поэтому циклический про-
цесс был видоизменен в прямоточный процесс.
Прямоточный процесс. В этом видоизмененном процессе стадии
получения иодида и отложения металла проводятся раздельно [8]. Иодид
хрома отделяют от остатка примесей и от ненрореагировавшего хрома.
Очищенный иодид хрома затем испаряют и пропускают над нагретоп по-
верхностью, где осаждается металлический хром и освобождается иод.
Иодид хрома обычно получают при температурах около 900°, в то время
как температура нити во время осаждения может меняться от 1000 до 1300'".
Эффективность прямоточного процесса очень иизка—только около 10%
используемого иодида превращается в хром за один проход над нагретой
поверхностью. В процессе Ван-Аркеля и де Бура хром получается в зна-
чительно большем количестве, но поскольку этот процесс происходит в замк-
нутой системе, существует большая вероятность переноса примесей.
Характерный состав иодидного хрома, полученного прямоточным про-
цессом, и электролитического хрома, из которого он был получен, приведен
в табл. 10 [59].
Процесс рафинирования кальцием. В методе рафинирования каль-
цием хром реагирует с парами кальция при температуре около 1000° в бом-
Таблица 10
ХАРАКТЕРНЫЙ СОСТАВ ИСХОДНОГО ЭЛЕКТРОЛИТИЧЕСКОГО
ХРОМА И ПОЛУЧЕННОГО ИЗ НЕГО ИОДИДНО1 О ХРОМА
Элемент
о
N
Н
С
S
А1
Са
Си
Fe
Mg
Mr
Mo
Ni
Si
Состав
исходный материал
0,380
0,006
0,0056 0
0,004
0,019
0,005
0,001
0,002
He замечено
0.002
He замечено
0,010
0,03
0,010
вес.%
осажденный хром я
0,0044
0,0013
0,00008
0,002
0,011
Не замечено
0,005
<0,001
0,003
0,002
0,005
Не замечено
<0,005
а Приготовлено в колбе из «викора».
^ После обезгажиЕания.
Хром
873
бе с титановой оболочкой. При этом титан действует как геттер, предупреж-
дая загрязнение азотом [42|. Металлический кальций в количестве около Зио
от веса всей шихты помещается в одном конце восстановительной бомбы,
а порошок металлического хрома помещается над кальцием и отделяется
от него сеткой 200 меш из нержавеющей стали. Закрытая бомба откачи-
вается и затем нагревается до температуры реакции. Во время нагрева
и обезгаживаиия поддержинается давление около 20 мк рт. ст. до тех пор,
пока пары кальция не проникнут в холодный конец бомбы и не сконденси-
руются. Это эффективно отключает вакуумную линию и позволяет поднима-
ться давлению паров в бомбе до тех пор, пока не будет достигнута темпе-
ратура реакции. Суммарное время реакции около 14 час. Характерный
состав хрома, полученного этим методом, следующий: 0,027% кислорода,
0,0018°и азота, 0,008"» углерода, 0,012% серы и 0.15% железа.
Современные цены на различные сорта хрома приведены в табл. 11.
Увеличение чистоты продукта отражается на его цене.
Таблица 11
ЦЕПЫ РАЗЛИЧНЫХ СОРТОВ МЕТАЛЛИЧЕСКОГО ХРОМА.
ИМЕЮЩЕГОСЯ В ПРОДАЖЕ
Сорт металла
Алюмннотермическнй хром
Электролитический хром
Вакуумный электролитический
хром
Лабораторный электролитиче-
ский хром
Хром высокой чистоты
Хром, рафинированный каль-
цием
Иодндиый хром
Ценя 1 кг, долл.
2,20 -2,82
2,54 -2,62 =
2,62—2,71 б
9,90 н
G1.81
88,30—110,37
(в зависимости от количе-
ства)
187,64 -275,93 (в зависи-
мости от количества)
а 99,8% хрома; 0,2% железа
^ С малым содержанием кислорода.
в С малым содержанием кислорода и азота; максимальное содер-
жание железа 0,03%.
ФИЗИЧЕСКИЕ СВОЙСТВА ХРОМА
Хром является одним из переходных элементов VI группы периоди-
ческой таблицы, его порядковый номер 241621 и атомный вес 51,996. Физиче-
ские свойства хрома приведены в табл. 12.
Электронная структура
В твердой и газовой фазах хром имеет следующую электронную струк-
туру [41]:
ФИЗИЧЕСКИЕ СВОЙСТВА ХРОМА
Таблица 12
Свойство
Пирядксшый номер
Атимиый вес
Кристаллическая решетка
при 20'
а0, А
Валентность
Плотность при 20°, г/см3
Удельная теплоемкость.
кал/моль -град
Температура плавления, °С
Температура кипения при
760 мм рт. ст., °С
Коэффициент линейного рас-
ширения при 20 , град-1
Удельное электрическое сопро-
тивление при 20°, мком-см
Модуль упругости, кг/мм2
Изотопный состав, %
Млссовое число -50
52
53
54
Коэффициент теплопроводности
при 20°, кал/см-сек-град
Скрытая теплота плавления,
ккал/моль
Скрытая теплота испарения,
ккал/моль
Нзлучательная способность
при 6690 А
Твердый
Жидкий
Полная нзлучательная способ-
ность при 100° (неокисляю-
щая атмосфера)
Отражательная способность
(серебро = 100%)
Показатель преломления
Сообщаемые величины
24
51,996
Кубическая объемно-
цептрнровапиая
2,8844—2,8848
2, 3, 6
7,18—7,20
5,55
(или 0,11 кал/г-град)
1845- 1903
2199 2660
6,2-10-е
12,8—12,9
29 500
4,49
83,78
9,43
2,30
0,16
3,2—3,64
76,635
0,34
0,39
0,08
X, A R.%
1 300 14
2 000 37
3 000 67
5 000 70
10 000 63
40 000 8R
ц = 1,С4 -3,28
к ^- 2570—6080
Литература
24, 64, 80
62
11
48
9, 35, 91
4, 34, 46, 77
39, 40
11, 24
58
72
61
48, 57, 85
46, 72
89
26
19, 45
26
Предпо-
читаемая
величина
2,8845
7,19
1875
2199
*
3,2
Лите-
ратура
64
11
91
34
48
Хром
875
Свойство
Электрохимические эквивален-
ты, мг/к
Валентность 6
> 3
» 2
Нормальный электродный по-
тенциал (при 25°; валент-
ность от 0 до +3). в
Сообщаемые величины
0,08983
0,17965
0,26949
0,71
Продолжение табл.
Литература
51
Предпо-
читаемая
величина
12
Лите-
Значения ионных радиусов и потенциалы ионизации для хрома также
определены 175].
Тепловые свойства
Скрытая теплота испарения при температуре кипения составляет 76 635
кал/моль [46, 72]. Температурная зависимость выражается уравнением 146]
ДЯ = 89450—4,667- (Г, °К).
Скрытая теплота возгонки при 298°К составляет 89 368 кал1моль
[46], а ее температурная зависимость определяется уравнением
ДЯ =89 400+0,207—1,48-10-ЗГ2 (Г=, К).
Давление пара хрома в зависимости от температуры следующее 1211:
Температура, °К 1350 (тв.)
1465
1600
1755
1960
2495 (ж.)
Давление пара, am
1.10-6
1-10-=
1Ш1
1¦10-»
1-10-2
Коэффициент линейного расширения в зависимости от температуры
в интервале от —100 до 700° дается следующим уравнением 139, 40J:
а, = 5,88-10-6-1 1,548-1П-Ч—1,163-1(>-«B {t .С).
Теплосодержание, энтропия и функция свободной энергии хрома для
различных температур также были определены 147, 48].
Бриджмен [12] получил следующую зависимость между сжимаемостью
и давлением (/>. кг/см'1):
при 30° AV/V0= 5,187-10-' р ' 2,19-IY)-i2 pi,
при 75° AV'/l<'n= -5,310-10-' р + 2,19-10-12 р2.
Найдено, что для различных физических свойств в зависимости от
температуры хром показывает определенные аномалии, которые не полу-
чили удовлетворительного объяснения. Наиболее поразительными из них
являются скачкообразные изменения, происходящие при почти одной
и той же температуре C7°), модуля упругости 111, 24, 67, 68], внутреннего
трения [24, 69], удельного электросопротивления [24, 661, термоэлектро-
движущей силы [24] и коэффициента линейного расширения [24] (рис. 5).
Вначале думали, что эти изменения обусловлены примесями, но теперь
их относят к свойствам самого хрома. Нет никаких указании на аллотро-
876
Глава 33
пическое превращение при температурах, при которых набпюдается ано-
мальное поведение; выше и ниже перехода кристаллическая структура
остается объемноцентрированной [24], а изменение параметра решетки
показывает только слабый излом 178]. Разница между изменением пара-
метра решетки в зависимости от температуры, и данные по линейному рас-
ширению указывают, однако, что при прохождении через точку перехода
so in"
IV9
2«
28
27
у
1
—-N
а
100 0 100
Температура, "С
гво
1010
¦гоо -wo
Гсмпература, "С
100 200
?D
s«
4?
У
/ i
/У'
1 , , 1 III
¦50 о ьо
Температура,,"С
288000
2Щ950
Рис. 5. Зависимость некоторых физи-
ческих свойств хрома от температуры.
а модуль упругости: б — внутреннее тре-
ние; а — электрическое сопротивление и
параметр решетки.
2.87S0O
юа
существует отклонение от идеальной объемноцентрированной структуры,
соответствующее более плотной упаковке выше перехода, чем ниже него.
Существует также, по-видимому, свиль между аномалией модуля упру-
гости и аномалией объемного расширения металла. Найдено, что темпера-
тура, при которой происходят эти аномалии, уменьшается в зависимости от
сжимающих напряжений и количества примесей. Если аномалия объемных
изменений наблюдается при испытаниях на сжатие, то при этом происходят
заметное увеличение деформации параллельно оси сжатия и уменьшение
перпендикулярно этой оси, а поэтому модуль упругости и коэффициент
Пуассона одновременно уменьшаются. Получено прямое экспериментальное
доказательство этого явления, показывающее, что для некоторых образцов
хрома коэффициент Пуассона может стать даже отрицательным [67].
Тщательные измерения показали, что решеточный компонент теплопро-
водности хрома удивительно высок и отвечает почти одной трети полной
Хром S77
теплопроводности [66]. В этом отношении хром отличается от всех других
переходных металлов; аналогичное поведение наблюдалось только для
бериллия [65]. Хром также показывает, в отличие от других переходных
элементов, определенные антиферромагнитные свойства, температура
Неэля равна примерно 200" [901. Антиферромагнетизм хрома обнаружен
только недавно с помощью нейтронографических исследований: он не был
установлен ранее при измерениях парамагнитном восприимчивости
[24, 55].
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства подробно рассматриваются в других работах
122, 60, 73, 82]. Общие коррозионные характеристики хрома в избранных
водных растворах приведены в табл. 13 |84J.
Хром реагирует с безводными галогенами, хлористым и фтористым
водородом. Водные растворы плавиковой и соляной кислот, бромистого
и йодистого вочорода растворяют хром, так же как и разбавленная серная
кислота. При растворении хрома в разбавленной серной кислоте выделяется
водород, в то время как при растворении в кипящей концентрирован-
ной серной кислоте выделяется двуокись серы. При комнатной тем-
пературе на хром не действуют дымящая азотная кислота и царская
водка.
Некоторые кислоты, например концентрированная азотная, фосфор-
ная, хлорноватая, хлорная, образуют на хроме окисную пленку, приводя
к его пассивации. В этом состоянии хром обладает исключительно высоким
сопротивлением коррозии, и на него не действуют разбавленные минераль-
ные кислоты. Растворенный кислород обладает достаточной окислительной
способностью, чтобы поддерживать пассивность в нейтральных растворах,
но в растворах с низкой величиной рН для сохранения пассивности должны
присутствовать более сильные окислители (а галоидные кислоты должны
отсутствовать). Обычно стойкость хрома против коррозии сходна со стойко-
стью наиболее высоколегированных нержавеющих сталей. Как правило,
хром является электроотрицательным по отношению к обычным металлам
и сплавам, и если он с ними образует гальваническую пару, то ускоряет
их коррозию.
При повышенных температурах около 600—700" на хром действуют
едкие щелочи, но на него не влияют расплавленные карбонаты щелочных
металлов. Когда хром реагирует с парами серы или сероводорода при G00—
700°, образуются сульфиды. В этом температурном интервале он также
реагирует с двуокисью серы. В окиси углерода при температуре около
1000е происходит окисление металла, при температуре около 800° на него
действует фосфор. Аммиак взаимодействует с хромом при 850° с образова-
нием нитрида, а горячая окись азота образует с хромом как нитрид, так
и окись. Пары кальция оказывают малое влияние на раскаленный докрасна
металл.
При нагревании на воздухе на хроме образуется слой окисла Сг2О-), хотя
на хром относительно не влияют при комнатной температуре ни влажный,
ни сухой воздух. При температурах выше температуры плавления хром
сгорает в кислороде.
В табл. 14 [38] приведены некоторые данные о влиянии различных
газообразных сред на литой хром при повышенных температурах.
Хром проявляет валентности от 2 до 6; только соединения шести-
и трехвалентного хрома находят пока значительное техническое примене-
Таблица 13
< ТОПКОСТЬ ЭЛЕКТРООСАЖДПННОГО ХРОМЛ К ЛЕПСТБПЮ КИСЛОТ,
СОЛЕП И РАЗЛИЧНЫХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ а [84J
Испытание погружением
Скорость
[2°
Кислоты
Азотная
Ьромистоводородиая
Азотная, 100%-нан, дымящая
Винная
Гликолевая
11одистоводородная
Лимонная
Муравьиная
Плавиковая
Серная
Ссрпан, 10и%-ная
Трпхлоруксусная
Уксусная
Уксусная, 100°о-ная, ледяная
о-Фенолсульфокнслота
Фосфорная
Фосфорная, 85%-ная
Хлорная
Щавелевая
Соли
Гнпохлорит кальция
Нитрат меди(П)
Хлорнд алюминия
Хлорнд аммония
Хлорид барии
Хлорнд железа(Ш)
Хлорид калия
Хлорнд кальция
Хлорид магния
Хлорид меди(П)
.Хлорид натрия
Хлорид-олова(II)
Хлорнд ртути(П)
Хлорид стронция
Хлорид xpoMd(III)
Хлорид цинка
Другие соед
Хлорбензол, насыщенный раствор •
Хлорбензол, 100°и-нып
Хлороформ, насыщенный растрор
Хлороформ, 100%-пый
Четыреххлористый углерод, на-
0,000
0,0254
0,000
0,000
0,000
0,000
0,000
0,000
25,400
0,2794
0,7620
0,0254
0,000
0,000
0,000
0,0254
0,000
0,0254
0,000
0,0508
0,0508
0,000
0,000
0,000
0,000
0,000
0,000
0,000
0,3810
0,000
0,000
2,0066
0,000
0,000
0,000
i н е н и я
0,000
0,000
0,000
0,000
0,000
коррозии, мм/год
58°
0,3048
4,7244
0,1270
0,1016
0,5842
0,3810
0,1778
30,4800
254,0000
1,7526.
2,6162
0,3810
0,2032
0,6604
0,8636
0,0508
1,0668
0,0254
0,8890
0,1778
0,0762
0,1016
0,0251
0,4064
0,000
0,000
0,000
0,000
0,8890
0,000
0,0762
0,0254
0,000
0,000
'0,000
0,000
0,000
сыщенньш раствор
а Концентрация для твердых растворимых вещее ih in uec.% н для жидкости»
10 об.%, если не оговпрыш особо.
Хром
879
Таблица Ы
СКОРОСТЬ КОРРОЗИИ ХРОМ1 ПРИ ДЕЙСТВИИ ГОРЯЧИХ ГАЗОВ [38]
Скорость коррозии, ме/дм2.сутки
И00°
Кислород
Пары воды
Двуокись углерода
Двуокись серы
47
5
27
16
97
37
34
39
220
117
130
320
(т
210
308
360
ние. Для хрома известно также карбонильное соединение Сг(СО)в, кото-
рое следует рассматривать как комплексное.
Первый и второй потенциалы ионизации равны соответственно 6,74
и 16,6 в. Для пятого ионизационного потенциала приводится недостоверная
величина 73 в.
ОПРЕДЕЛЕНИЕ ХРОМА
Хром может быть обнаружен в соединениях по образованию зеленого
перла буры, но желтому цвету хроматов, образующихся при плавлении
соединений хрома с нитратом калия и по красно-фиолетовому цвету, воз-
никающему при реакции шестивалентного хрома с S-дифенилкарбазидом.
Для обнаружения хрома использую1сн также методы качественного
спектрального, рентгеновского и полярографического анализов. Коли-
чественное определение хрома производят обычно путем окисления до бихро-
мата с последующим титрованием раствором соли двухвалентного железа
известной концентрации.
Анализ хрома на примеси проводится обычными аналитическими
методами. Аналитическая химия хрома детально обсуждается Серфассом
и Мюрака 174J.
ТОКСИЧНОСТЬ ХРОМА
Чистый металлический хром, хромит и трехвалентные соединения не
оказывают особенно вредного действия на ткани тела. Токсичны только
соединения шестиваленгного хрома [23]. Эти соединения оказывают раздра-
жающее, разъедающее и, возможно, токсическое действие па организм
человека. При определенных условиях шестивалентные соединения вызы-
вают перерождение и осаждение белков тканей. При тесном контакте, как
в промышленном производстве, они действуют в первую очередь на кожу
и дыхательные пути. При соприкосновении с кожей они могут вызывать
язвы и дерматиты. Вдыхание пыли хромата или хромовой кислоты может при-
вести к изъязвлению и перфорации носовой полости, а также к хроническо-
му раздражению или закупорке дыхательных путей. Появляется все больше
данных о том, что заболеваемость раком у рабочих, подвергающихся дей-
ствию пылевидных соединений шесгивалентнош хрома при рафинировании
хрома, необычно высокая. Установлено, что максимально допустимая кон-
центрация пыли и золей в расчете на СгО3 составляет 0,1 мг1мЛ воздуха при
ежедневной восьмичасовом работе в этой атмосфере.
K80 Г лава 33
ПЛАВЛЕНИЕ И ОБРАБОТКА
При плавлении хрома и сплавов на основе хрома необходимо прини-
мать специальные меры предосторожности из-за высокой температуры плав-
ления хрома и его высокой реакционном способности в расплавленном
состоянии. В расплавленном состоянии хром и его сплавы реагируют с азо-
том атмосферы, с углеродом, и поэтому во время отливки образуется неже-
лательная сетка карбидов или нитридов. Необходимо также принимать
меры для удаления кислорода, который всегда присутствует в хроме,
приготовленном обычными методами, если он не был подвергнут операции
очистки перед плавлением. Некоторые нз этих трудностей можно преодо-
леть при использовании вакуумной плавки. При подходящих условиях мож-
но уменьшить содержание азота в сплавах на основе хрома до 0,01"о или
меньше; при соответствующем контроле можно использовать углерод в каче-
стве раскислителя для получения сплавов с содержанием кислорода поряд-
ка 0,01"о или меньше [25]. Однако вакуумном плавке мешает высокое давле-
ние паров хрома и его взаимодейс!вие с большинством тигельных материалов.
Тигли для плавления хрома должны быть очень огнеупорными, и только
спеченные огнеупорные окислы имею г достаточно высокие температуры
размягчения. Используются тигли из двуокиси циркония [631 и окиси
бериллия 132!, а также корундовые тигли, покрытые двуокисью
тория 115].
Для плавки хрома, так же как и для других тугоплавких металлов,
успешно применяется дуговая плавка на водоохлаждаемом поде в инертной
атмосфере]5, 27, 36]. Этот метод имеет то основное преимущество, что в этом
случае не требуется огнеупорного тигля для расплавленного металла.
Однако для получения материала с низким содержанием кислорода хром
перед плавлением необходимо подвергать очистке от кислорода.
Методами порошковой металлургии можно преодолеть многие трудно-
сти, связанные с обычными способами плавления. Обычно порошок хрома
спрессовывают под давлением 2800—3200 кг/сж-, при этом часто употреб-
ляется связ\ ющее вещество, которое удаляется при нагреве прессован-
ных брикетов до температуры около 300° перед спеканием при более высо-
ких температурах. Спекание в вакууме часто производится в две стадии —
сначала спекают примерно при 1300° для удаления окклюдированных
и адсорбированных газов и затем смекают при 1500—1700" для получения
уплотнения. Если хром очищался перед прессованием, то спекание можно
производить в атмосфере очищенного водорода, гелин или арюна.
Достаточно чистым хром обладает достаточном пластичностью при
повышенных температурах для его горячей обработки большинством обыч-
ных методов, таких как ковка, прокатка или выдавливание. Однако при
нагреве в печи для обработки необходимо использовать инертную атмо-
сферу для предотвращения загрязнения. Для снятия напряжений, возни-
кавших при застывании слитков, переплавленных в дуге, их проковывали
и осаживали в интервале температур 800—850° после первоначального
отжига при 1200—1250 [27, 59, 70]. Первичную обработку следует про-
изводить осторожно до тех пор, пока не будет- разрушена перноначаль-
ная структура, после чего можно производить более значительные обжатия.
После первоначального разрушения структуры можно также производить
прокатку; при этом возможны такие низкие температуры прокатки, как
500". Первоначальное разрушение литом структуры можно осуществлять
также выдавливанием почти при тех же температурах, что и ковку
[10].
Хром
АЛ/
МЕХАНИЧЕСКИЕ СВОЙСТВА
За последние 15 лет усилия были направлены на разработку сплавов,
состоящих преимущественно из хрома. Этот интерес возник в первые дни
второй мировой войны, поскольку снабжение кобальтом и никелем в это
время было очень ограничено, а их запасы были очень малы. Выбор хрома
кажется очевидным по нескольким причинам. Он обладает многими свой-
ствами, которые считаются важными для применения при высоких темпера-
турах. Его температура плавления значительно превосходит температуры
плавления железа, кобальта и никеля. Его плотность несколько ниже.
Хром обладает лучшим сопротивлением деформации при повышенных тем-
пературах. Он также является одним из первых переходных металлов
с высокой температурой плавления, доступных в достаточно большом коли-
честве. Однако, хотя хром обладает достаточном пластичностью для обра-
ботки при повышенных температурах, при комнатном температуре он пока-
зывае> ограниченную пластичность или полное ее отсутствие. Этот факт
более чем другие ограничил широкое практическое использование хрома
и сплавов на его основе. Поэтому механические свойства хрома были подроб-
но исследованы; при исследовании особое внимание было обращено на
температуру перехода из пластичного в хрупкое состояние.
Механические свойства хрома зависят от многих факторов: от степени
чистоты, предварительной обработки, размеров зерен, степени деформации
и поверхностных условий. Небольшие примеси углерода, серы и азота могут
уничтожить пластичность металла. Образцы, содержащие более 0,01"и угле-
рода [59], 0,015".] серы 1591 и около 0,02"о азота [43], являются хрупкими
при комнатноп температуре. По эгой причине очень важно перед определе-
нием различных механических свойств хрома удалять из него примеси.
ПРОЧНОСТНЫЕ СВОЙСТВА
Прочностные свойства прокованных прутков иодидного хрома, изго-
товленных из переплавленного в дуге с вольфрамовым электродом слитка,
приведены в табл. 15 158]. Оба эти испытания выполнялись при использо-
вании крайне низкой скорости приложения усилия @,13 км/мий).
Наибольшие всличнны для пластичности хрома (по данным для иодид-
ного хрома) были получены в работе Иогансена и Асан [431. Эти исследова-
тели, изучавшие механические свойства кованой хромовой проволоки,
Таблаца 15
ПРОЧНОСТНЫЕ СВОЙСТВА ПРИ КОМНАТНОЙ ТЕМПЕРАТЬРЕ
КОВАНЫХ ПРУТКОВ ИОДИДНОГО ХРОМА [Г,8]
I
Образец
Обработанный (кова-
ный при 800 и
слижженнып для
снятия напряжений)
Рекристяллнзованныи
(нагретый до 816'
после ковки)
56 3.IK.13 № 239
Предел
36,6
Предел проч-
ногти при
Л.' VM-
42,1
28,8
Отночггель-
нне "в
44
П
Уменьшение
сеченнл, %
78
0
882
Глава 33
товленнон из очищенного водородным методом электролитического хрома,
получили удлинение 25ио при пределе прочности 49,9 кг/мм- при исполь-
зовании относительно высоких скоростей деформации @,51 мн/мин). Уэйн
и сотр. [881 получили удлинение 15% при пределах текучести и прочности
38,7 и 52,1 кг/мм" соответственно.
Рис. 6. Зависимость прочно-
сти и пластичности пруткив
хрома от температуры,
д—уменьшение поперечнпго сече-
ния; X—относительное удлинение;
О—предел прочности при раетя-
100 200 300 hOO 5№ SOU 100 BOO
Температура, °С
Разрывные свойства полностью рекристаллизовапного хрома при тем-
пературах до 800° были определены Иогансеном и сотр. [441. Их результа-
ты показаны на рис. 6. Ниже350° фактически не было достигнуто пластично-
сти. Выше этой температуры пластичность резко возрастала, достигая при-
мерно 50-пого удлинения при 400". При 500" удлинение падало примерно
до ЗО°о, но затем возрастало при дальнейшем увеличении температуры
испытания. Предел прочности имел тенденцию возрастать с температурой,
достигая максимума 28,2 кг/мм- при 500°.
ТЕМПЕРАТУРА ПЕРЕХОДА ИЗ ПЛАСТИЧНОГО В ХРУПКОЕ СОСТОЯНИЕ
Для хрома, подобно другим металлам с кубической объемноцентриро-
ваиной решеткой, наблюдается переход из пластичного в хрупкое состоя-
ние. В случае хрома переход от значительной пластичности к полной хруп-
кости происходит непрерывно в интервале температур, возможно, 50—
150е, в зависимости от характера испытания и других ранее упомянутых
факторов. Это свойство широко исследовано для определения влияния
примесей.
Температура перехода из хрупкого в пластичное состояние1 для
иодидного хрома определена при испытаниях на изгиб обработанного давле-
нием листового материала (толщина 0,38—0,76 мм); изгибающее усилие
прикладывалось при постоянной скорости прогиба A,26 мм/мин). Темпе-
ратура перехода найдена лежащей в интервале от 0 до —20° 18]. Иогансен
и Асан 1431 установили температуру перехода —66° для холоднодеформи-
рпванноп проволоки при изгибе со скоростью 2 ммЬиш. Эти результаты
Хром
883
определения температуры перехода по испытаниям на изгиб иодидного
и очищенного водородным методом хрома значительно ниже температуры
перехода (^200°), найденной для менее чистого хрома [80]. Салли устано-
вил, что хром чувствителен к скорости деформации — температура перехо-
да повышается примерно на 50°, когда скорость деформации увеличивается
с 0,076 до 19,5 мм!мин [801.
Найдено, что на пластичность хрома влияют поверхностные условия;
оптимальные результаты получались только после удаления электрополи-
ровкой тонкого слоя 143, 88]. Этот эффект объясняется удалением либо
поверхностных несовершенств, либо материала, очень сильно загрязнен-
ного азотом во время обработки.
300
.750
Рис. 7. Влияние содержа-
ния азота на температуру пере-
хода, определенную при изгибе
для электролитического хро-
ыа, очищенного восстановле-
нием водородом.
Содержание примесей: 0.003%
О2; 0,007% S; 0,005%С.
§ 200
I
150
I
I
1
d.001 am o,i
Содержание азота, вес %
1.0
Установлено, что кислород в количестве до 0,34% не оказывает замет-
ного влияния на переход литого хрома из хрупкого в пластичное состояние
[76]. Подобные результаты получены на кованых образцах; в интервале
концентраций от 0,006 доО,037"о кислород мало влияет на пластичность при
изгибе [8]. Было сделано предположение, что, как и в случае молибдена,
должно происходить заметное увеличение пластичности при значительно
более низких содержаниях кислорода [8].
Исследования влияния азота, по-видимому, указывают на то, что азот
может быть наиболее вредной примесью [76, 88]; его критическое содержа-
ние равно 0,002—0,003% и даже ниже (рис. 7) [761. Азот, находящийся
в твердом растворе, оказывает более вредное влияние на пластичность,
чем тогда, когда он выделяется в виде нитрида хрома. При быстром охла-
ждении наблюдается тенденция к сохранению азота в твердом -растворе
и к повышению температуры перехода, в то время как медленное охлажде-
ние позволяет получить более полное выделение нитрида. Например, при
испытаниях на изгиб температура перехода хрома, содержавшего 0,029°п
азота, найдена равной 150—200е после закалки в воду с 1200° и около 50°
после охлаждения с печыо от той же температуры [761. Кроме того, наблю-
дения показывают, чго минимальное содержание азота, вызывающее хруп-
кость, значительно ниже для рекристаллизованного материала, чем для
холоднодеформированных образцов [44]. Сделаны попытки объяснить это
влияние азога на основании представления о блокировании дислокаций
144]. Эта теория учитывает взаимодействие между дислокациями и опре-
деленными растворенными в металле атомами, которое, как было показано,
влияет па предел текучести и деформационное старение.
56*
8S4
Глава 33
Подобными же исследованиями установлен уровень вредного влияния
углерода в 0,01596 [8, 59, 76]. Эффект охрупчивания углеродом возникает
вследствие образования сетки хрупких карбидов по границам зерен. Влия-
ние серы не исследовалось достаточно детально, но сообщалось, что сера
200
но
чо
\
1
1
———._
100
Рис. 8. Влияние добавок церия на
температуру перехода, определенную-
при медленном изгибе для литого
хрома, содержащего приблизительно
0,03 и 0,07% азота.
Содержание неметаллических примесей: 0,03 —
0,07»,о N2-, n.tU % О2.
/ 2 3 4
МвОиепа церия,%
в концентрации до 0,1% не оказывает значительного влияния на пластич-
ность 1761 -
Попытки уменьшить вредное влияние этих неметаллических примесей
путем добавления рафинирующих элементов, например алюминия, танта-
ла, титана или циркония, окончились полной неудачей [28]. Частичный
Рис. 9. Влияние различных .
легирующих добавок на темпе-
ратуру перехода, определен-
ную при изгибе для кованых
и отожженных листов хрома.
-чо
О 0,05 0,10 Orlb D,PO 0,25
Содержание элемента 9 %
успех получен при добавках церия; найдено, что при содержании около 2%
этого элемента температура перехода при изгибе для хрома, содержащего
Q02—0,07%, снижается примерно на 80° [76] (рис. 8). Это улучшение
объясняется удалением азота из хрома в результате образовании нитрида
Хром
885
церия. Далее, поскольку церий имеет ограниченную растворимость в твер-
дом хроме, он оказывает малое влияние на температуру перехода.
Результаты систематических исследований о роли легирующих доба-
вок на температуру перехода из хрупкого в пластичное состояние сообща-
лись несколькими исследователями [I, 59, 801. Влияние различных леги-
рующих добавок на температуру перехода, определенную при изгибе кова-
ного и отожженного иодидного хрома, показано графически на рис. 9 1591.
Сделана попытка найти соотношение между повышением температуры
перехода и локальными дефектами решетки, вызванными заметающими
too
Рис. 10. Влияние металли-
ческих примесей на темпера-
туру перехода иодидного
хрома.
Содержание немета тлических прн-
ыссей: 0.004J- 0.014% О2; 0.003
0,005% N2; 0.001—0.007% С.
1
I
-50
0 -еко-
оо
0,т 0,08 0,12 0,1,6 0,50
Содержание метапличеспик
примесей, %
агомами. Это соотношение не полностью удовлетворительно, но наблюдается
общая корреляция между твердостью и температурой перехода — более
твердые сплавы имеют более высокую температуру перехода. Влияние
увеличения общего содержания металлических примесей на температуру
перехода при изгибе листовых образцов нодиднпго хрома изображено гра-
фически на рис. 10 [8].
В заключение раздела интересно отметить наблюдения с неожиданными
и трудными для понимания результатами. Исследователи из Горного бюро
128] нашли, что переплавленный в дуге хром, которын нельзя было обра-
батывать при температуре ниже 500°, мог быть деформирован на холоду
до 60% при прерывистом охлаждении до температуры жидкого воздуха
( -190") после каждых 5"» обжатия. Сделаны предположения для объяснения
эшго явления, которые допускают существование низкотемпературном,
пластичной модификации хрома. Однако нет доказательств о наличии како-
го-либо превращения, которое поддерживало бы эту гипотезу.
ЭЛЕКТРОЛИТИЧЕСКИЕ ПОКРЫТИЯ И ЦЕМЕНТАЦИЯ ХРОМОМ
Электролитические покрытия хромом обычно подразделяют на два
типа: 1) декоративные и 2) «твердые». Декоративные покрытия обычно
чрезвычайно тонкие, всего 0,000.25 -0,005 мм. Эти покрытия наносятся,
как правило, поверх другого электроосажденного слоя, чаще всего никеля.
«Твердые» хромовые покрытия относительно толстые (обычно 0,075 0,25 мм)
н наносятся непосредственно на основной металл (обычно сталь).
Оба типа покрытий наносятся в стандартной гальванической ванне,
состоящей из хромовой и серной кислот при отношении хрома к сере около
100 : 1. Температура и плотность тока должны быть подобраны так, чтобы
886 Глава 33
эффективность катодного тока была около 12% для блестящих покрытий
и 16% для «твердых» покрытий. Обычно плотность тока должна увеличи-
ваться при повышении температуры, и она должна быть несколько выше при
получении твердых покрытий по сравнению с декоративными.
Тонкие декоративные покрытия наносятся обычно на неблагородные
металлы для защиты их от коррозии; они придают им яркий привлекатель-
ный вид. «Твердые», относительно толстые, хромовые покрытия при-
меняются для использования преимущества высокой твердости и износо-
устойчивости или низкого коэффициента трения таких отложений. В обоих
случаях хром обычно имеет твердость 850—900 по Бринеллю. Более деталь-
ные сведения по хромовым покрытиям, включая теорию осаждения, струк-
туры хромовых покрытий и методы анализа хромовых растворов, сжато
изложены в других источниках [31].
Электропокрытия имеют определенные недостатки. Покрытия не сво-
бодны от пористости, и поэтому их коррозионная стойкость зависит от
предварительно нанесенного слоя. По причине этой пористости они непри-
годны для защиты от окисления при высоких температурах, а вследствие
резкой границы раздела покрытия с основным металлом термические напря-
жения часто приводят к отслаиванию покрытия.
Кроме электроосаждеиных хромовых слоев, хромовые поверхности
могут быть получены путем цементации хромом (хромирования). Келли
[49] описывает широко применяемый процесс. В этом процессе металл,
подлежащий обработке, помещается в смесь порошков хрома и окиси алю-
миния и нагревается в течение 3—4 час при температуре 1300—1400° для
того, чтобы хром мродиффундировал в основной металл. Толщина цементи-
рованного хромом слоя зависит от длительности процесса и температуры.
Для предохранения хрома от окисления требуется защитная атмосфера.
Использовались также другие процессы, например цементация хлори-
дом хрома [6, 7] или цементация хромом в солевой ванне [14].
СПЛАВЫ ХРОМА
Характеристика сплавов, образуемых между хромом с другими ме-
таллами, а чакже неметаллами, находится вне рамок этой 1лавы. Вели-
колепный обзор диаграмм состояния систем, включающих хром, а также
кристаллографические данные приведены Хансеном и Андерко I37J.
Свойства многих сплавов на основе хрома обсуждены Салли [79].
ОБЛАСТИ ПРИМЕНЕНИЯ
Хром, хромовые сплавы и хромовые химикалии находят широкое
применение — от простых легирующих добавок в металлургии до произ-
водства пигментов.
В металлургической промышленности хром добавляется в количестве
до 3V-o к низколегированным сталям для улучшения механических свойств
и повышения способности принимать закалку. Стали этого типа, которые
могут также содержать другие элементы, например молибден, никель,
марганец и ванадий, используются в изделиях высокой прочности — для
пружин, роликовых и шариковых подшипников, штампов и рельсов. Стали,
содержащие 5—6% хрома, имеют повышенное сопротивление коррозии
и находят применение в нефтеперерабатывающей промышленности.
Хром 887
Стали, содержащие более 10% хрома, известны под названием «нержа-
веющих» из-за их высокого сопротивления окислению и атмосферной корро-
зии. Нержавеющие стали, содержащие в качестве легирующей добавки
только хром, могут быть разделены на две основные группы: 1) мартенсит-
ные, способные принимать закалку; 2) ферритные, являющиеся однофазны-
ми при всех температурах и поэтому не подвергающиеся твердению в резуль-
тате фазовых превращений. Другим важным типом нержавеющих сталей,
также не принимающих закалку, являются аустенитные стали, которые
легируются для стабилизации высокотемпературной кубическом гране-
центрированной модификации железа до комнатных и более низких темпе-
ратур.
Высокохромистые мартенситные стали могут содержать до 2% углеро-
да; их восприимчивость к термообработке зависит от содержания углерода.
Высокоуглеродистые copra A—2% С) используются в тех случаях, когда
важны твердость и стойкость на истирание; они применяются для штампов
и инструментов. Низкоуглеродистые сорта @,3% Q используются для
производства ножевых изделии.
Превосходная коррозионная стойкость ферритных нержавеющих сталей,
содержащих около 13% хрома и 0,1% углерода, позволяет использовать
их для внутренней отделки автомобилей и в химической промышленности.
Стали, содержащие 25—3OVo хрома, обладают превосходным сопротивле-
нием коррозии и используются во многих случаях для высокотемператур-
ных печеп.
К стали можно добавлять никель и марганец в комбинации с хромом
для получения аустенитпых нержавеющих сталей, из которых наиболее
широко используется сталь с 18% хрома и 8% никеля. Эти стали показыва-
юг хорошее сочетание прочности при комнатной и повышенных температу-
рах и сопротивления коррозии и окислению. Обычно их используют в слу-
чаях, когда требуется комбинация указанных выше свойств.
Имеется много других направлений использования хрома в металлур-
гии. В высокотемпературных сплавах на основе кобальта и хрома послед-
ний добавляется в количестве до 25?о для увеличения прочности и стонко-
сти против окисления. Хром добавляется к литейному чугуну для повыше-
ния его прочности и сопротивления износу или нагреву. Режущие инстру-
менты и некоторые материалы с высоким электросопротивлением также
содержат значительное количество хрома..
Помимо положительного эффекта, который оказывает хром в качестве
легирующей добавки, достигнуты успехи в повышении чистоты хрома и, как
следствие, пластичности, что может открыть новые области его технического
применения. Возможно, что наиболее обещающей областью будущего при-
менения хрома явится разработка сплавов на основе хрома, обладающих
исключительной комбинацией сопротивления окислению и прочности при
повышенных температурах. Перснек гивы получения пластичною высоко-
температурного сплава на основе хрома, базирующиеся на последних дости-
жениях в технологии хрома, в настоящее время являются более обнадежи-
вающими, чем несколько лет тому назад.
В промышленности, производящей огнеупоры, использование хромита
основано на его высокой температуре плавления, умеренном тепловом
расширении, стабильности кристаллической модификации при повышенных
температурах и химической нейтральности. Хромитовые огнеупоры доступ-
ны в форме кирпичей и модельных форм; пластичных смесей, состоящих
из увлажненных агломератов, утрамбованных на месте; смесей, приспособ-
ленных для отливки и состоящих из сухих агломератов и связующего веще-
¦ВД? Глава 33
ства, которые после смешивания с водой могут отливаться подобно бетону;
строительных растворов и цементов для кладки кирпичей. Кирпичи, при-
готовленные цетиком из хромита, широко заменяются кирпичами, состоя-
щими из смесей хромита и окиси магния; они обладают большей огнеупор-
ностью, объемной стабильностью и сопротивлением растрескиванию.
Одним из главных потребителей хромовых химикалий является произ-
водство пигментов. Смешением хромовых химикалий с другими металлами
и их соединениями могут быть получены разнообразные композиции пигмен-
тон различных цветов. Около одной трети хромовых химикалий расходует-
ся на производство пигментов.
В текстильной промышленности хромовые химикалии используются
как закрепители при получении прочных окрасок на шерсти и для окисления
и последующих обработок красителей на хлопчатобумажных и дручих тка-
нях. Используются соединения как трех-, так и шестивалентного хрома,
например основные хромовые ацетаты и хлориды, фториды хрома, бисуль-
фаты, лактаты, броматы, оксалаты и тиоцианаты. Б настоящее время для
дубления почти всех сортов кож применяются хромовые реагенты — основ-
ные сульфаты хрома, получаемые из би.хромата.
Большое количество хромовых химикалий используется для обработки
поверхности металлов и борьбы с коррозией. Хром применяется для галь-
ванических покрытии; цементации хромом; анодирования алюминия; обра-
ботки цинка и магния; нанесения покрытия погружением железа, стали,
латуни и олова; в качестве ингибиторов для рассолов и для многих целей
в нефтеперерабатывающей и газовой промышленности.
Хромовые химикалии также находят применение в качестве окислите-
лей в производстве красителей, камфары, синтетических волокон, для
отбеливания и т. д. [82]*.
.7 ИТСРАТУРА
1. Abrahamson E. P., G г а п t N. J., Ргос. Regional Conf. on High-Temp.
Alloys. Cleveland, 1956.
2. A d с ос k F. J.. J. Iron Steel Inst.. London, 115. 369 A927).
3. Агеев П. П., Трапезников В. А., Исследования по жаропрочным спла-
вам, сб. I, HjA-aa. АН СССР, Москва, 1956, стр. \7.
4. В а и г Е., В г u n п е г R.. Helv. Cliirn. Acta, 17, 95S A934).
5. П е a I I R. Л.. А ;> л i С, Roberson А П., in Ductiic Chromium and Its
Ailoys, American Society for Metals, Cleveland, 1957, p. 110.
6. Becker G, D a e v e s K. S t e i n b e г R F, Z. physik. Them., A1S7, 354 A940).
7 Becker G., Dae ves K. et а!., пат. США 2236209. March 25, 1941; 22554S2,
September У, Ш41; 2257668, September 30, 1941; 2219004, 2219005, March 3, 1912;
2399818, May 7, 1946; 2415078, Fehruary 4, 1947.
8. В I oc h er J. .«„Campbell I. E., M а у k u I h D. J, J a f f e e R. I.,
Goodwin II. C, WADC Tech. Rept. „Yd 53/470, January 1951.
9. В I о о in D. S., GrantN. .1., Trans. A1ME, 194. 524 A952).
10. В r a n d e s F. A., S t о л e H E. N.. J. Inst. Metals, 87, 42 A958).
II Brenner A, Buck head P., Jennings G,J. Research NBS, 40, 31
A948).
12. Rridgman P. W.. Proc. Am. Acad. Sci., 68, 33 A933).
13. Bunstn W., Ann. Physik und Chemie, 1, 619 A854).
* О применении соединений хрома в химической промышленности см в книге
Т. Г$. Роде «Кислотные соединения хрома и хромовые катализаторы», Изд-во АН СССР,
Москва, 1962 г.— Прим. ред.
Хром _ 889
14. С j m р h е I 1 I. Е., В и г t h V. D., H о e с к с 1 in a n R., G о n s e г В. W.,
Trans Elcctrochem. Soc . 96, 262 П949).
15 Carlile S. J., Christian J. W, Hume-Rnthery W., J. Inst
Metals, 76. 169 A949).
16. Carosel la M. С , M e t t I e r J. D , in Ductile Chromium and Its Alloys,
American Society for Metals, Cleveland, 1957, p. 75
l7.Carosclla Я.С.МеШег J D., Metal Progr.. 69, 51 A056).
18. Carveth H. R.. Curry B. E. Trans. Am. Electrochem. Soc, 7, 115
A905). •
19. Coblenl; W. W Stair R., LI. S. Natl. Bur. Standards, Research Paper
№ 39, 352, i928.
2П Cooper H. S , пат. США 285A.378, Septemher 2, 1958.
21. Darken L. S., G u г г у R. U.. Physical Chemistry of Metals, McGraw-Hill
Rook Company, Inc., New York, 1953, p. 304.
22. E p li i i a in F., Inorganic Chemistry, 4th ed., Interscience Publishers, Inc.,
New York, 1946.
23 Fairhall L. Т., Industrial Toxicology, The Williams and Wilkins Company,
Baltimore, 1319.
21. Fine M. C, (ireinei H. S., F. 1 i [ s W. C, Trans AIME. 191, 56
A951).
25. Fountain R. W., L a m о n t J. L., in Ductile Chromium and Its Alloys,
American Society for Metals, Cleveland, 1957, p. 255.
26. F г ё e d e r i с ks l V., Ann. Pliys., 34, 780 A911).
27. G i I b e г t H. I ., Johansen H. A.. Nelson R. G., J. Metals, 5, 63
A953)
28. G i 1 b e r t H. L.. .1 о h a n s e n H. A., N e 1 s о n R. G., LI. S. Bureau of Mines,
Rept. Invest. № 1905. September 1952.
29. Goldschmidl H., герм, пат- 96317, March 3, 1895; пат. США 578686, March 16,
IH97; H9562H, August II, 1908.
30. Goodwin H. B. G i 1 b e г t R. A.. S с h w a r t z С M., G r e e n i d g e С Г.,
.1. Electrochem. Soc, 100, 152 A9531.
31. Gray A. G., Modern Electroplating, John Wiley and Sons, Inc., New York,
1952.
32. G r e e n a w а у Н. Т., Aeronaut. Res. Lah. Austral. Struc and Mat. Note № 163,
1931.
3J. Greenaway H. Т., J. Inst. Petals, 83, 121 A951).
3i. Greenwood H. C. Proc. Roy. Soc, A82, 356 A905).
35. G r u b e G., К n a b e R., J. Eleclroclieni. Sue. 42. 793 A93C).
36. Ham J. L, Siblev С. В., J. Metals, 976 (July 1957)
37. X а и с e u M., A n д е р К о К., Структуры двойных ставов, т 1 и 11. Метал-
лургиздат, Москва, 1962.
38. И a t f i e 1 d \V. H., Engineer, 134, 639 A922).
39. H i n d e r t P., J. Research NBS, 26, 81 A941).
40. H i n d e r t P., .1. Research \BS, 27, 113 A941).
41. Hum c-R о t h с г у W., The Structure of Metals and Alloys, Institute of Metals,
London, 1956, p. 14.
12. lsenberg O. F. (частное сообщение, февраль 1959)
43. J о h a n s e n H. A., A s a i G., J. Electrocliem. Soc, 101, 604 A954); 102, 362
A955).
44. Johansen H.^A.. Gilbert H L.Nclson R. G, С а г р с n t с r R. L.,
L. S. Bureau of Mines, Rept. Invest. ЛЬ 5058, May 1954.
45. J о h n s о п В. К , Proc Phys. Soc , 53, 258 A941).
46. К e I 1 e у К- К., U. S. Bureau of Mines, Bull. № 383 A936).
890 Глава 33
47. К е 1 1 с у К. К.. U. S. Bureau nf Mines, Bull. Л» 434, 38 A941).
48. Kel lev К- К-. U. S Bureau of Mines, Bull. Л» 476 A949).
49. Kelly F. С, пат. США 1365499, 1921.
50. К г о 1 1 W. J , Н е г g е г t W. F.. Y е г к е s L. A., J. Electrochem. Soc., 87.
258 A950); 98, 252 A951).
51. L a t i m er W. M., Oxidation Potentials, Prentice-Hall. Inc., Englewuod Cliffs,
N. J.. 1952
52. Lloyd R. R., R a w 1 e s W. Г., F e e n e у R. C, Trans Electrocliem. Soc.,
89, 443 A946).
53. Lloyd R. R , R о s e n b a u m J. В., Н о m m e V. E., П a v i s L. P., Trans.
Elcctrucliein. Soc., 94, 122 A948).
54. Lloyd R. R., R о s e n b a u m J. В., Н о m m e V. E., D a v i s L. P., M e r-
r I 1 1 С C, J. Electrochem. Soc, B7, 227 A950).
55. M с G u i г е Г. R., К г i e s s m a n C. J., Pliys. Rev.. 452 A952).
56. Mclnnis W-, H с i d г i с h H. V., Chrornium, Preprint, U. S. Bureau of
Mines, [Minerals Yearbook, Government [ Printing Office, Washington, D. C,
1957.
57. Maier C. G., U. S. Bureau of Mines, Bull. M> 436, 7 A942).
58. M а у к u t h D. .1., J a f f e e R. 1., Trans. ASM, 49. 948 A957).
59. Maykulh D. J., К 1 о p p W. D., J a f f e e R. I., G о о d w in H. В., J.
Electrocliem. Soc, 102, 316 A955).
60. Mellnr J. W., A Comprehensive Treatise on Inorganic and 1 henretical Chemistry,
Vol. XI, Longmans. London, 1931.
61. Metals Handbook, American Society for Metals, Cleveland, 1948, p. 1136.
62. Metal* Reference Book, Interscience Publishers, Inc., New York, 1955.
63. P a r к e R. M., Bens F. P., Symp. Materials for Aircraft Gas Turbines, 80.
ASFM, 1946.
64. Pearson W. В., H u m e-R о t her у W., J. Inst. Metals, 81, 3M A953).
65. Powell R. W., Phil. Mag., 44, 645 A953).
66. Powell R. W.Tyc R. P., J. Inst. Metals, 85, 185 A956- 1957).
67. Purse у Н., J. Inst. Metals, 86, 362 A958).
68. Purse у Н., Nature. 169, 150 A952).
69. Purse у Н., Nature, 172, 864 A953).
70. H u и с к R. J., F e a i n s i d e Т. Е., В 1 ос h e r J. M., Campbell 1. C,
in Ductile Chromium and Its Alloys, American Society for Metals, Cleveland. 1957.
p. 129.
71. Sargent G. J., Trans. Am. Eleclrochem. Soc., 37, 479 A920).
72. S e a b о г g G. Т., Р е г 1 m a n I., Rev. Mod. Pliys.. 20, 565 A948).
73. Segerblom W., Properties of Inorganic Substances, Reinhold Publishing Corp.,
New York, 1927.
74. S e r f a s s E. J., M u г а с a R. F., in Chromium (Udy M. J., Ed.), Vol. I, Rein-
hold Publishing Corp., Nc» York, 1956, p. 53.
75. S 1 a t с г J. С, Introduction to Chemical Physics, McGraw-Hill Book Company,
Inc., New York, 1939, p. 349.
76. S m i t h W. H., Seybolt A. U., J. Electrochem. Soc, 103, 347 A956).
77. S p e i s e r R., J о h n s t о n H. L, Blackburn P., J. Am. Chem. Soc,
72, 4142 A950).
78. S t г a in a u i s M. E., W e n g С. С, Acta Cryst., 8, 3G7 A955).
79. Салли А., Хрпм, Металлургиздат, Москва, 1958.
80. S u 1 1 у A. H, Brandes E. A., M i t с h e 1 1 K- W, J. Inst. Metals, 81,
585 A953).
81. T h а у e r T. P., Econ. Geol., 41, 202 A946).
82. Udy M. J , Cliromium, Vol. 1, Reinhold Publishing Corp., New York, 1956.
Хрпм ¦_ 891
83. U d у М. J., Chromium, Vol. 2, Reinhold Publishing Corp., New York, 195G.
84. U h 1 i g H. H.. The Corrosion Handbook, John Wiley and Sons, Inc., New York,
1948.
85. U m i n о S., Sci. Repts. Tohoku Univ., 15, 597 A026).
86. Van А г к e 1 A. E., К о og m a n W-. d e П о е г J. А., герм. пат. 562616,
1932; пат. США 1891132, 1923-
87. Wain H. L., in Ductile Chromium and Its Alloys, American Society fnr Metals,
Cleveland, 1957. p. 27
88. W a i n H.L., Henderson F., J о h n s t о n e S. Т. Л1-, J. lnst. Metals,
83, 133 A954—1955).
89. W а к 1 i n H. В., Phys. Rev., 73, 1458 A948).
90. Weiss R J., in Ductile Chromium and Its Alloys, American Society For Metals,
Cleveland, 1957, p. 163.
91. W у m a n L. L., S t e г 1 i n g J. Т., in Ductile Chromium and Its Alloys, Ame-
rican Society for Metals, Cleveland, 1957, p. 180.
34
ЦИРКОНИЙ
А. У ШЛЕХТЕН
Л. W. Schlcchien, Missouri Sclwcl of Mines and
Metallurgy, Rolla, .Missouri
ВВЕДЕНИЕ
Цирконий находится в подгруппе титана IV группы периодическом таб-
лицы; его атомный вес 01,22, порядковый номер 40.
В ранних работах цирконий и другие элементы это» подгруппы хара-
ктеризовались как твердые и хрупкие металлы, которые не имели большого
значения. Однако современные исследования показали, что достаточно
чистый цирконий мягок и пластичен и обладает рядом ценных свойств;
в связи с этим возросло его производство и началось интенсивное изучение
металла и его сплавов. Благодаря сочетанию коррозионной стойкости и низ-
кого поперечного сечения поглощения тепловых нейтронов циркониевые
сплавы используются как конструкционные материалы в ядерных реакто-
рах. Производство циркония в США возросло от 9,5 кг пластичного метал-
ла высокой степени чистоты в 1945 г. до 1370 т губчатого металла такой же
чистоты в 1959 г.
Присутствие до того времени неизвестного окисла металла в минерале
цирконе было обнаружено Клапротом в 1789 г. Соединение было названо
окисью циркония, что указывало на существование нового элемента. После-
дующее изучение химии этого элемента проводилось Морво, Вокеленом
и Троммсдорфом.
Первый образец металлического циркония получен в 1824 г. Верцелиу-
сом путем восстановления K2ZrFti металлическим калием. Полученный
продукт, по всей вероятности, содержал много примесей, так как Ьсрце-
лнус указывал, что металл был получен в виде черного порошка, который
не прессовался и не имел характерной для металла блестящей поверхности.
В последующие годы многими исследователями были предложены раз-
личные методы получения металлического циркония, однако все они давали
хрупкий материал из-за присутствия в металле таких примесей, как кисло-
род, углерод, азот и водород.
Лили и Гамбургер 1391 впервые получили достаточно чистый металли-
ческий цирконий, обладавший пластичностью, восстановлением в бомбе
дважды водагнанного тетрахлорида циркония металлическим натрием высо-
коп чистоты. Подобным же метод позднее был применен в США Купером
111!, Хантером и Джонсом [241.
Во время первой мировой войны появились сведения о том, что в Герма-
нии производятся циркониисодержащие стали, которые обладают ценными
свойствами и применяются для изготовления артиллерийских орудий.
В связи с этим некоторыми государственными учреждениями и частными
фирмами были предприняты исследования в области получения циркония
восстановлением его соединении и изучение свойств циркониевых сплавов.
Результаты этих работ не были особенно обнадеживающими.
В 1925 г. Ван-Аркель и де Бур 1721, а в 1926 г. де Бур и Фаст 115] опу-
бликовали первую серию работ, в которых был описан метод получения
Цирконий S'K
чистого металла, основанный па термическом разложении галогенндов метал-
ла. Путем разложения тетрампдида циркония на накаленной нити был
получен металлический цирконии, обладавший высокой пластичностью;
его можно было легко протягивать в тонкую проволоку или прокатывать
в тонкие листы. Этот метод фактически является методом очистки цирко-
ния, так как в качестве исходного материала необходим металл достаточно
высокой степени чистоты.
Спустя несколько лет фирмой «Фут минерал компани» (Филадельфия)
было начато производство тетраиодида циркония. .Тем временем фирмы
«Тайтением эллой мэньюфэкчуринг компани» и «Метал хайдридс компани»
начали выпускать хрупкий металл, пригодный для использования в каче-
стве поглотителя, легирующей добавки и воспламеняющихся порошков.
В 1944 г. Горное бюро США начало проводить в Олбэни (штат Орегон)
исследование по разработке промышленного метода получения циркония
высокой чистоты. В этой работе в качестве исходного сырья применялся
цирконовый песок, найденный на Орегонском побережье; некоторое коли-
чество цирконового концентрата получали в качестве побочного продукта
при извлечении хромита из прибрежных морских песков.
Вскоре в результате исследований, проведенных под руководством
Кроля, был разработан метод, основанный на восстановлении тетрахлорида
циркония металлическим магнием [351. Этот метод по существу является
видоизмененным процессом Кроля для производства титана. Тетрахлорид
циркония при комнатной температуре представляет собой твердое вещество;
он легко реагирует с влагой воздуха с образованием окисла и оксихлори-
да, остающихся в хлориде. Если такой хлорид добавить непосредственно
к расплавленному магнию, то при восстановлении образуется порошко-
образный металл, загрязненный кислородом, как это описано в патенте
фон Цепплина [741. Чтобы предотвратить загрязнение металла кислородом,
тетрахлорнд циркония нагревают в специально сконструированной для этой
цели части прибора для восстановления; образующиеся пары взаимодей-
ствуют с расплавленным магнием, в результате чего происходит восстанов
ление. Большая часть кислородсодержащего материала остается в остатке.
Промежуточная стадия возгонки хлорида в атмосфере водорода является
эффективным средством уменьшения содержания примесей железа.
В методе Кроля, впервые разработанном Горным бюро для промышлен-
ного получения титана, металлическая губка измельчалась и выщелачи-
валась для удаления хлорида магния и некоторого избытка металлического
магния. Такая методика процесса не подходила для получения циркония,
поэтому в случае циркония применялась дистилляция в вакууме, что исклю-
чало необходимость измельчения губки и снижало возможность загрязне-
ния металла кислородом и водородом.
Циркониевый завод Горного бюро в Олбэни (штат Орегон) расширялся
постепенно и достиг масштабов многотоннажного производства благодаря
заказам Комиссии по атомной энергии США; этот завод позднее был закрыт
и демон тирован. К 1960 г. в США цирконий производят четыре фирмы.
Фирма «Карборундум метал с» располагала заводом в Акроне (штат Нью-
Йорк) с годовой производнтельностью163т и новым заводом вблизи Паркерс-
берга (штат Западная Виргиния) с производительностью 600 т. Фирма
«Вах Ченг корпорейшн», которая некоторое время арендовала завод Горно-
го бюро, построила новый завод в Олбэни (штат Орегон) с годовой произво-
дительностью 300 т. Фирма «Мэллорн-Шарон металс» имеет завод в Аштабь-
юла (штат Огайо) мощностью 1000 т и фирма «Колумбия-Нейшпл» завод
производительностью 350 т вблизи Пенсакола (штат Флорида).
h94 Г л ае a S4
Производство циркониевой губки в 1959 г. составляло 1370 т. из них
10 га технического продукта. Около 165 т губки реакторноп чистоты в 1957—
1958 гг. импортировалось из Японии. Цена циркониевой реакторной губки
в 1959 г. составляла 13,2 долл. за 1 кг. Комиссия по атомной энергии США
покупала губку по средней цене 13,8 долл. за 1 кг.
РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ
По данным Кларка и Вашиштона [10], содержание циркония в земной
коре больше, чем меди, свинца и цинка вместе взятых. По распространен-
ности он занимает двадцатое место, являясь столь же распространенным
элементом, как хром (см. главу «Редкие металлы»). Совершенно очевидно,
что запасов циркония как в США, так и в других странах, более чем доста-
точно для удовлетворения спроса, предъявляемого предприятиями, про-
изводящими металлический цирконий.
Промышленность СШЛ использует в качестве сырья главным образом
циркон (ZrSiO4), добываемый из прибрежных песков на полуострове Флори-
да: его залежи обладают вполне достаточной мощностью и разрабатываются
главным образом с целью извлечения титановых минералов. В небольшом
количестве циркон извлекается из орегонских прибрежных песков; кроме
того, он найден в золотоносных монацитовых песках центрального Айдахо
и золотоносных песках центральной Калифорнии.
Добыча циркона в 1958 г. достигла 30 443 т.
Циркон ввозится в СШЛ главным образом из Австралии и в значитель-
но меньшем количестве из Индии. Ввоз сырья из обеих стран за последние
годы уменьшился вследствие увеличения добычи внутри США и ограниче-
ния вывоза из Индии н Австралии морских песков, содержащих в своем
составе монацит. В 1958 г. было импортировано около 17 300 т циркона.
Двуокись циркония — бадделеит — ввозится из Вразилии. В том слу-
чае, если =*та руда содержит некоторое количество циркона, она часто носит
название цнркита*. Бадделеит составляет лишь небольшую часть от общего
количества ввозимого циркона п циркона, добываемого в США. Ввоз руды
из Бразилии уменьшился вследствие введения ограничения на вывоз радио-
активных руд.
РУДНЫЕ КОНЦЕНТРАТЫ И ИХ ПЕРЕРАБОТКА
Прибрежные пески без особых затруднений обогащаются гравитацион-
ными методами; в этом случае вместо вибрационных столов используются
спиральные классификаторы, которые проще по устройству и потребляют
меньшее количество энергии. Окончательная очистка концентрата произво-
дится магнитной и электростатической сепарацией.
Цнрконовый концентрат в смеси с углем плавят в дуговой печи; при
этом образуется технический карбид циркония, а кремний в значительной
степени улетучивается в виде SiO2- В присутствии атмосферного азота или
азота, специально введенного в виде газа, образуется смесь карбида и нитри-
да (карбонитрид) циркония золотисто-желтого цвета. Полученный про-
дукт легко хлорируется с выделением тепла; при этом может быть получен
* О других минератах циркония см. в примечании к главе «Гафний». —
Прим. ред.
Цирконий ¦ в95
сравнительно чистый тетрахлорид цирконии (содержание гафния не умень-
шается).
Вышеописанный метод вскрытия применяется на заводах Горного бюро
и фирм «Карборундум» и «Вах Ченг корпорейшн»; кроме того, предлагаются
методы кислотного и щелочного вскрытия. На новом заводе фирмы «Колум-
бна-Нейшнл» циркон сплавляют с едким натром, а затем цирконий отделяют
от кремния в виде цирконата натрия.
Разделение циркония и гафния
Цпрконовыс руды обычно содержат 0,5—2,0°о гафния; вследствие
близости химических свойств .циркония и гафния их разделение не дости-
жимо описанными выше способами. Однако вследствие высокого поперечно-
го сечения захвата тепловых нейтронов гафний необходимо удалять из
реакторного циркония; его содержание не должно превышать 0,01 "о. Попе-
речное сечение захвата тепловых нейтронов для циркония составляет
всего 0,18 барн, а для гафния —115 барн, т. е. в 500 раз больше. Вследствие
этого гафний применяется для изготовления регулирующих стержней,
используемых в реакторах.
Для разделения циркония и гафния применяются методы фракцион-
ной дистилляции, ионного обмена, дробной кристаллизации, днепропор-
ционнровання и экстракции растворителями. Последний метод используется
наиболее широко. В одном из применяемых методов экстракции неочищен-
ный цирконилхлорид взаимодействует с метилизобутилкетоном, обогащен-
ным тиоцианатом, при прогивоточной подаче растворов. Растворитель
экстрагирует гафний, а цирконилхлорид смешивается с серной кислотой.
Осажденный сульфат циркония перемешивают с водным раствором аммиака
для получения гидроокиси циркония, которую затем прокаливают до чистой
двуокиси циркония. Для разделения циркония и гафния применяются и
другие растворители и методы осаждения. Очень интересен процесс раз-
деления с помощью избирательного восстановления теграхлорида цирко-
ния до трихлорнда и возгонки тетрахлорида гафния.
ПРОИЗВОДСТВО КОВКОГО МЕТАЛЛИЧЕСКОГО ЦИРКОНИЯ
Производство металлического циркония высокой степени"чистоты свя-
зано почти с теми же проблемами, которые характерны для получения тпга-
на; несмотря на большие затраты на исследования в области химии и техно-
логии до сих пор не удалось разработать каких-либо новых совершенных
методов получения этого металла. Насколько известно, в настоящее время
единственным методом промышленного получения цирьония является вос-
становление тетрахлорида циркония металлическим магнием или натрием.
Иодндный метод разложения может быть использован для дальнейшей
очистки металла.
Различные методы, пригодные для получения металлического" цирко-
ния, и пределы их применения описаны ниже.
Восстановление ZrO.,
Высокая стойкость этого соединения препятствует полному восстано-
влению даже в случае применения наиболее сильных восстановителей.
Реакции взаимодействия двуокиси циркония с кальцием 1291, алюминием
S56 Г л ава 34
145|, магнием [441 или гидридом кальция 12] приводят к попученню метал-
ла высокой степени чистоты, однако вследствие установившегося равновесия
в металле остается такое количество кислорода, которое достаточно для
снижения пластичности металла. Применение угля или карбида циркония
[33| в качестве восстановителя оказалось в одинаковой степени безуспеш-
ным при получении ковкого и легко поддающегося обработке металла.
Восстановление галогенидов циркония
Фторид, бромид и иодпд циркония не имеют значительных преимуществ
при проведении обычных процессов восстановления вследствие высокой
счонмостп этих материалов и трудностей, связанных с их получением. Из
галогенндов наиболее подходящим оказался тетрахлорид цирконии, которым
можно восстановить любым из щелочных или щелочноземельных металлов,
однако в экономическом отношении представляет интерес применение
только магния и натрия.
Восстановление тетрахлорнда магнием — метод Кроля, распространен-
ный наиболее широко, описан ниже. Восстановление натрием применяется
на одном iij новых заводов. Основным преимуществом применения натрия
является его низкая температура плавления (97,Г>"), благодаря чему можно
работать с расплавленным металлом, что облегчает его очистку, обращение
с ним и загрузку в реактор. Продукты реакции можно выщелачивать во-
дой или разбавленной кислотой, хотя следует принимать меры предосторож-
ности, чтобы не растворить цирконий.
Применение натрия имеет и существенные недостатки. Для восстано-
вления одного и того же количества циркония требуется вдвое большее
количество натрия но сравнению с магнием и соответственно следует уда-
лить большее количество побочного продукта реакции — хлорида натрия.
Кроме юго, необходимо соблюдать меры предосторожности вследствие
высокой активности натрия.
Исследовалось восстановление тетрахлорнда циркония водородом при
высоких температурах, однако металл получался в мелкодисперсном состоя-
нии, его было трудно собирать и, наконец, требовался большой расход
чистого водорода. Восстановление тстраиодида циркония водородом не дает
никаких преимуществ по сравнению с прямым термическим разложением,
так как образование иодистоводородноп кислоты сопровождается погло-
щением тепла. Восстановление фтороцирконатов натрия и калия метал-
лическим натрием или калием 111! дает очень чистый металл в коллоидаль-
ном состоянии.
Восстановление других соединений
В некоторых работах [48, 69] указано, что сульфиды циркония, по-види-
мому, реагируют с кальцием'с образованием металла, однако сообщений
о проведении подобных экспериментов не имеется.
Нитрид циркония является настолько прочным соединением, что его
использование в качестве исходного материала маловероятно.
Восстановление тетрахлорида циркония
металлическим магнием — метод Кроля
Как уже указывалось, восстановление тетрахлорнда циркония магнием
приводит к получению металла высокой степени чистоты и может при-
меняться в промышленных масштабах.
Цирконий
897
Метод, разработанный Кролем и сотр. [30, 34—36] в Горном бюро США
(Олбэни. штат Орегон), представлен на схеме (см. рис. 1). В основную
циркон
Коне —
Клер
дуговая
печь
нарбанитрид
циркония
Клоратир
Тетраююрид 'цирпоЛия ¦
(г-з% Hf i
гафния
у
гафния
Двуокись
цир/юния
Рис. I. Схема процесса Кроля.
Тетрахлорид
циркония
@,01 % ш)
L
Магний -
Магний -
Восстановление'
и
еозгонпа
Boccmui говнрние
циркониевая губка
реакторной степени
чистоты
Циркониашх у
теяни'гесмя
схему технологического процесса внесены некоторые изменения (использо-
вание печи сопротивления для получения карбидов, проведение прямого
хлорирования двуокиси циркония, использование печи сопротивлении для
плавки). Предлагались и другие изменения 1321 и усовершенствования.
Как указано выше, отличительной особенностью этого процесса является
Рис. 2. Вид циркониевой'губки после удале-
ния из реактора при процессе Кроля («Кар-
Сорундуч металс»).
Посте восстановления магнием избыток магния и
хлорид магния удалиют дистилляцией в вакууме.
в результате чего остается циркониевая губка.
нагревание тетрахлорида циркония таким образом, что в соприкосновение
с магнием, применяемым в качестве восстановителя, вступают только пары
тетрахлорида.
Вид циркониевой губки, получаемой методом Кроля, показан на рис. 2.
57 Заказ № 239
898 Глава 34
Обстоятельное изучение процесса Кроля в применении к титану может
дать возможность внести некоторые изменения и в технологическую схему
производства циркония; в частности, это касается упрощения аппаратуры,
сокращения ряда операций и увеличения размеров агрегатов.
Иодидный метод
Разложение тетранодида является чрезвычайно эффективным методом
очистки циркония, особенно от таких примесей, как кислород и азот, кото-
рые вызывают хрупкость металла. В качестве-исходного материала, жела-
тельно иметь металл высокой степени чистоты, так как в процессе перера-
ботки некоторые металлические примеси остаются в том же соотношении,
что и в исходном материале.
По существу метод заключается в следующем. Исходный материал
(«сырой» цирконий) помещают в эвакуированный сосуд для восстановления,
снабженный вольфрамовой или циркониевой нитью накала и приспособле-
нием для введения иода. Иод реагируете цирконием при умеренной темпера-
туре с образованием летучего тетранодида циркония. Тстраиодид диффунди-
рует к раскаленной нити, нагретой до 1200—1300°, и разлагается; при этом
цирконии осаждается на нити, иод освобождается и вновь используется
в описанном выше процессе. Образующиеся кристаллические прутки обычно
имеют диаметр 6,3 10,1 мм и длину 610 мм. На предприятиях фирмы
«Вестнпгауз» и в Институте им. Баттела получены прутки значительно боль-
шего размера (диаметр 4,3 мм и длина 15,25 м).
В Институте им. 13 аггел а проведен ряд опытов по изучению прямоточно-
го процесса, в котором «сырую» циркониевую губку иодировали в специаль-
ном сосуде и затем пары иодида пропускали через камеру осаждения.
Подобный метод позволял в случае необходимости производить очистку
паров и давал некоторые преимущества при проведении процесса испарения
по сравнению с методом, основанным на диффузии.
Проводились исследования и в других направлениях, в частности,
выяснялась возможность применения такого исходного соединения, ьак кар-
бид циркония, для получения металла по методу разложения иоднда или
бромида, но обнадеживающих результатов не получено.
При производстве циркония в больших количествах первое время
требовалось осуществлять иодидную очистку всего металла, закупаемого
Комиссией по атомной энергии США; однако в дальнейшем, при усовершен-
ствовании процесса Кроля, стали получать металл достаточной чистоты,
поэтому нодидной очистке стали подвергать меньшие количества металла.
Электроосаждение циркония
В работе Брандта и Линфорда 17] сообщалось об осаждении тонкого
серебристого осадка из водного раствора, содержавшего сульфат цирконила,
однако в последующих работах Холта 1231 и Зсндероффа и Бреннера [59J
совершенно определенно указывалось на бесперспективность получения
чистого циркония при электролизе водных или органических растворов.
Элсктроосаждение циркония из расплавов солей проводилось многими
исследователями. Наиболее значительной современной работой является
исследование Штейнберга, Зиберта и Вейпера 167], которые получили
наилучшие результаты при электролизе расплава, содержащего 100 частей
хлорида натрия и 25 частей фтороцирконата калия. Рабочая часть электро-
лизера была выполнена из графита, над расплавом поддерживалась атмосфера
Таблица I
ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА ЦИРКОНИЯ
Примечание
Лите-
ратура
Порядковый нпмрр
Атомный оес
Плотность при 20°, г/см3
Температура плавления,
Термодинамические
40
91,22
6,45
1852+J0
свойства
Температура кипения, °С
Температура перехода
гексагональной плотно-
упакованной структуры
в кл>бическую объемно-
центрированную, °С
Коэффициент линейного
расширения при 20°,
град1
II оси с
X оси с
п произвольном направ-
лении
Коэффициент теплопро-
водности при 25°,
кал/см-сек-град
Удельная теплоемкость
при 25°, кал/г-град
Моляльная теплоемкость
298—1135° К
1135-1400" К
Теплосодержание
298—1135° К
1135—1400° К
Энтропия при 298Г К,
кал/моль-град
Теплота плавления,
ккал/моль
Теплота испарения,
кал/моль
3580 3700
862 ±5
6,39-10 «
5,64-in-s
5,89-10-6
0,04
0,0659
Zr(a)cp-6,83+l,12x
Zr (p) ср=7,27
Zr(a) H°T-H°M
6,83^+0,56.
0,87-10Т-1 2378
= 7,277—1163
9,29±0,04
5,5
Я0 = 142 150_-t350
Оценена
Температура переходя
увеличивается о при-
сутствии О, N, С, А1,
1 If и Sn; большинство
других элементов по-
нижают температуру
перехода
Среднее значение в ин-
тервале 298 1143° К =
Среднее значение дли Р-
циркпння = 9,7 ¦ 10—°
3, 2&
8,42
49, 5U,
73
56-
58,
65
Оценена
64
12
П21
64
G3
57*
Свойство
Давление пара при
1949 -2054°К, am
Поперечное сечение зах-
вата тепловых нейтро-
нов, барн'атом
Величина
-31066
+7,3351— 2,415- 10-4Г
0,180 ±0,004
Продолжение табл
Примечание
Лнте-
рятурп
[63]
Электрические свойства
Удельное электрическое
сопротивление при 20°,
мком-см
Кристаллический
пруток высокой
степени чистоты
Хорошо образован-
ный кристалличе-
ский пруток
Переплавленный цир-
коний, полученный
восстановлением
магнием
Температурный коэффи-
циент электросопротив-
ления, град-1
0 200°
0—800"
Коэффициент зависи-
мости электросопро-
тивления от давле-
ния
Сверхпроводимость
Электрохимический экви-
валент прн валентно-
сти 4, иг /к
Термо-э. д. с. @—600°),
ме/град
Для пары Zr—кон-
стантан
Для пары Zr—алю-
мель
44,1
45
54
Дав-
43,5- 1LT<
29 3-10-4
R при давлении
R при давлении 0 am
кг/см*
0 1,000
40 000 0,9914
80 000 0,9836
Гс = 0,546 -0,68°К
0,2363
dE
~аТ
dE
(it
=0,05725 -109,4М0-в
= 0,02881—336Л1СГ'
Различия данных, пред-
ставленных в литера-
туре, объясняются
значительным влияни-
ем примесей; для ну-
левого содержания
кислорода дается ве-
личина 3,88 мком-см
[45]
Для циркония более
высокой степени чис-
тоты получены более
высокие значения
коэффициента
Цирконий
SOI
Величина
Придолжние табл. 1
Примечание
Лите-
Оптические и термоионные свойства
Коэффициенты эмиссии
при 54Ш А
6520 А
6500 А
Фотоэлектрический порог.
Л
Работа выхода, в
Магнитная восприимчи-
ьость, з. м. с.
при 2ИГ К
400" К
600J К
0,46 (а) -0,50 (р)
0,43 (а) —0,48 (Р)
0,49 (а) - 0,51 (ж.)
3200
4,1 -3,7
Фотоэлектрический по-
рог увеличивается до
3400 А при добавле-
нии кислорода
13 76
52
|4, 77
Магнитные свойства
1,28-1П"
1,32-106
1,41-10"
Цирконий парамагнитен,
магнитная восприим-
чивость увеличивает-
ся линейно при повы-
шении температуры
до температуры пере-
хода
27, 66
Чодуль
КРкг/мм*
упругости.
Коэффициент Пуассона
Механические свойства
9,00—Н,ИЯ
9,82 (для чистого отож-
женного циркония)
0,32—0,35
Твердость циркония вы- По Бриннелю 60—70, по
1, 53,
61)
53. 61
41
46
сокон степени чистоты Роквеллу (шкала D)
Предел прочности при 17,5
растяжении отожжен-
ного циркония очень
высокой степени чисто-
ты, кг,'мм2
аргона. Хлор выделялся на аноде, и в ванне оставались NaF и KF. На като-
де образовывался дендритовидньш осадок циркония, насыщенный электро-
литом; после выщелачивания и промывки получался порошок циркония.
Метод электроосаждения, по-видимому, не имеет перспектив, посколь-
ку он неэкономичен: слишком сложен электролизер, и для получения
продукта достаточной степени чистоты необходимо загружать очень чистые
исходные соли; кроме того, можно получать только порошкообразный
цирконий.
902
Глава 34
ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ СВОЙСТВА
Физические и механические свойства циркония представлены в табл. 1.
Дополнительные данные, касающиеся изменения механических свойств
О Ю 70 30 w so 60 д
Обжатие по сечению, %
гоо wo eoo wo woe
Температура оттиго, °с
Рис. 3. Влияние холодной обработки и температуры от-
жига на механические свойства переплавленного r дуговой
печн циркония, полученного способом Кроля [19|.
# твердость: Д — предел прочности при растяжении; О — предел
текучести; Д — предел пропорциональности; X — относительное
удлинение; А — обжатие по сечению, %.
в зависимости от холодной обработки, содержания кислорода и температу-
ры, по Хейесу [191, представлены на рис. 3—7.
ХИМИЧЕСКИЕ СВОЙСТВА
Взаимодействие с газами
Кислород. Цирконий легко реагирует с кислородом, причем скорость
реакции зависит от размера частиц, температуры, присутствии примесей
и состояния поверхности. Поданным Гульбрансена и Эндрюса 1171, скорость
окисления компактного циркония становится измеримой при 200° и давле-
нии кислорода 7,6 мм рт. ст. После 120 мин окисления толщина окиснон
пленки при 200° составляла 150 А, а при 425° —5000 А. Никакой простой
зависимости изменении толщины пленки от температуры не найдено.
В цирконии могут раствориться большие количества кислорода (до
СО ат. "о) с образованием твердого раствора, но при этом структура двуокиси
циркония не обнаруживается.
Равновесное давление паров насыщенного раствора кислорода в цирко-
нии настолько мало, что удаление кислорода с помощью вякуумироваиия
невозможно. Лиллиендаль и Грегори f401 удаляли 50—90"о кислорода,
содержавшегося в цирконии, нагреванием в расплавленном кальции пли
в парах кальция.
Сотрудники Горного бюро США нашли, что образцы, нагреваемые на
воздухе, быстрее увеличивают вес, чем при нагревании в чистом кислороде.
Образцы, нагретые до 1000°, самопроизвольно воспламеняются. Порошко-
образный цирконии воспламеняется при более низкой температуре, по-
. WO 700 .WO Ш 500
Темпериглуро испытаний "С
Рис. 4. Влияние температуры на меха-
нические свойства переплавленного цир-
кония, полученного способом Кроля [19].
Д — относительное удлинение; О - предел
прочности при растяжении; ? — предел те-
кучести (при Оо,2>: © — модуль упругости;
ti — предел пропорциональности. При 500°
относительное удлинение 100%.
n
I
i
J
^/
--1
I
1
t
I
I
i
к
/
*
i
7
}
1
1
—
ZBU WO BOO
Температура, °G
300
Рис. 5. Влияние температуры на
ударную вязкость циркония 119).
Д — кристаллический пруток циркония,
Мадж; О — нодиднин цирконии. ni'|jfiijiju-
тенный дуговым способом. Нельсон и сотр.;
О — иодидныи цирконий, Ш'реплавлспный
в графитовом тигле. Xeiiec и сотр.
d.i а? аз о,ч
Содержание кислорода. пес %
V и с. 6. Влияние содержания кислоро-
да на твердость и предел текучести цир-
кония [191.
Л — тоердпеть Нь (ипреде.пен.1 ни таблице);
Ш — твердость i?n; О — предел текучести
(при Со.з)-
но
1,0
\
\
\
\
"
-
4
\ —
100 - -
ED
100 200 300 100 SOU
Р н с. 7. Влияние температуры па твер-
дость переплавленного в дуговой печи
циркония, полученного способом Кроля
[19].
904 Глава 34
этому его получение и работа с ним сопряжены с опасностью взрыва и вое
пламенения.
Азот. Согласно данным Гульбрансена и Эндрюса 1171, при 400" азот
реагирует с цирконием крайне медленно, однако при 800е и выше взаимо-
действие заметно ускоряется; оно усиливается также под давлением. При
содержании азота до 20 ат. % образуются твердые растворы, выше 20 ат. "о—
ZrN. Азот не удаляется ни в процессе вакуумной обработки, ни при действии
кальция.
Водород. При температурах 300—1000° цирконий быстро адсорбирует
водород. Некоторое поглощение водорода наблюдается даже при комнатной
температуре, если образцы предварительно нагревались в вакууме для
удаления поверхностных загрязнений, которые могут препятствовать про-
никновеншо водорода.
В противоположность кислороду и азоту, водород можно полностью
удалить из циркония при продолжительном нагревании в вакууме выше
1000°. После поглощения водорода цирконий становится хрупким и его
можно легко измельчить; таким образом можно получать порошкообразный
цирконий.
С02 СО, Н2О. Цирконий легко взаимодействует с СО2 выше 800е,
с парами воды и СО — выше 1000°. При взаимодействии с СО2, СО и парами
воды образуется ZrO2, а при высокой температуре в присутствии СО и СО2
могут образовываться карбиды циркония. Недостаточное сопротивление
действию СО и С02 ограничивает применение циркония в газоохлаждаемых
реакторах (температура не должна превышать 500").
Взаимодействие с галогенами
Цирконий легко реагирует со всеми галогенами при температуре 200—
400° с образованием летучих галогенидов*.
Другие реакции циркония
При повышенных температурах цирконии реагирует с серой, углеро-
дом, кремнием, фосфором, бором и алюминием. Он взаимодействует также
со всеми окислами металлов и другими огнеупорными материалами, поэто-
му при плавке в тиглях из огнеупорных материалов в него вносятся загря-
знения.
КОРРОЗИОННАЯ.СТОЙ КОСТЬ
Коррозия в различных средах
Коррозионная стойкость циркония и титана, тантала, «стеллита № 6»
и нержаиеющей стали № 316 сравнивается в табл. 2.
* Химия цирконии и его соединений нашла в последнее время наиболее подробное
освещение в монографии.У. Б. Блюменталя «Химия циркония»,1 ИЛ, Москва, 1963.—
Прим. ред.
Таблица 2
Ю1'РОЧЦЛ11Н\Я СТППКОСГЬ ЦИРКОНИЯ И ДРУГИХ М1.ТЛЛЛОВ а
Коррозионная
Коррозионная стоПкость
Уксуснля кислота
Хлорид алюминия
Гидроокись аммо-
ния
Царская водка
Хлорид кальция
Вода, насыщенная
хлором
Хлор, насыщенный
парами воды
Лимонная кислота
цирконий
5, 99,5%; 60°, 10(Г -
очень иысокан
20, 30%; ~2СГ - тем-
пература кипения;
очень высокая
28%; ~ 20 - 100' — 28%; ~ 20° - очень
5, 10%; 20 O'if
высокая
10%; 35J, 1(Ю°
очень пысокая
очень высокая
18 —61° —слабая
20, 30, 50%; 20. 49,
100°—очень высокая
~ 20°—очень пысокая
~ 20"—слабая
10%; -20 100J —
очень высокая
пысокая
18- - 61" — очень
высокая
10, 25%; 35, 10U —
очень высокая
~ 20° — очень высо-
кая
~ 20° — очень высо-
кая
Хромовая кислота 10, 20. 30%; 20, 49, 10%; температура
100" — очень высокая
кипения — высо-
кая
' сстеллит ЛЪ 6» C0%
" , 4,5% \V,1,1°/ •
остальное Со
Все концентрации;
20 — 396 - очень
высокая
18 — 6Р — очень
высокая
Сг, 4,5% w,l,i% С,
Со)
10%; температура
кипения—высокая
~ 20 — слабая
нержавеющая сталь
типа 316
5 "л ледяная; 35-
200" — высокая
Все концентрации -
высокая
Насыщенный — 5%-ный
раствор; 35 -10П° —
слабая
35 100е — слабая
5%—концентрированный
раствор; 35 — 100" —
слабая
10 — 50%; 35 100' —
от средней до сла-
бой
Продолжение табл. 2
Кп;>рочноннэя
среда
Фосфорная кислота
Хлорид натрня
Едкий натр
Серная кислота
Четыреххлористын
углерод
Хлорид же^е-
за(Ш)
цирконии
10- 85%; ~20- 100°;
— очень высокая —
средняя
3%; 35' очень высо-
кая
10, 50%; -20- 100" —
очень высокая
10_—96%; 18 — 100° —
очень высикая в раз-
бавленной, слабая
в горячий концентри-
рованной
100%; ~20 — 49° —
очень высокая
2,5 — 30%; 20 —100г
слабая
титан
1 -85%; 20 — 100';
в разбавленных
растворах при 20'
—омеиь высокая;
в остальных слу-
чаях — слабая
3%; 35° —очень
высокая
10, 40%; 79' —тем-
пература кипения
— высокая
5 -65%; 18 -35°-
высокая в разбав-
ленной, слабая
в концентрирован-
ной
1—99%; темпера-
тура кипения —
очень высокая
1 20%; 20— 100°
— очень высикая
Коррозионная устойчив
тантал
83%; 143- 2Ш -
очень высокая
5 40%; 100, 110',
в 40%-ной — сла-
бая
20% —концентриро-
ванная, 18— 300'—
очень высокая
—
5 — 30%; 20° — тем-
пература кипения
— очень высокая
ость
встрллиг 3V ()ъ C 0n'i
Cr, 4,5,0 W, 1 ,1% С,
ос!альное Си)
38%; температура
кипения — высо-
кая
10%; температура
кипения — слабая
10%; ~ 20° — тем-
пература кнпення
— очень высокая
при ~ 20', слабая
при кипении
10, 30%; ~20° —
температура кипе-
ния — слабая
нержавеющая сталь
типа 310
10 85%; 20' темпе-
ратура кипения — сла-
бая
5%; 20° -высокая
Псе концентрации 79 -
315' — очень высокая,
за исключением ус-
тойчивости в разбав-
ленном растворе прн
кипении
25% —концентрирован-
ная- шеокая при 20°,
слабая при высокой
температуре
~ 20° — высокая
1—5%; 21°— темпе-
ратура кипения — сла-
бая
Соляная кислота В разбавленной — очень 5%—концентриро-
высокая при всех тем-
пературах, в концент-
рированном при 20° —
очень высокая, в кон-
центрированной при
кипении — слабая
Молочная кислота 5 — 85%; температура
кипения - очень вы-
сокая
Хлорид ртутн(П) | 1%—насыщенный рас-
1 35 100°
Азотная кислота
Едкое кали
Дымящая азотная
кислота
твор,
очень высокая
10% — концентрирован-
ная; 18- 100' —очень
высокая
10, 20, 30, 40%; ~ 20
— 100' — очень высо-
кая
-20 — 71° -высокая
ванная; 35 — 100°
— слабая
85%; 35' —темпе-
ратура кипения —
очень высокая
1% — насыщенный
раствор, 35— 100°
-очень высокая
5% — концентриро-
ванная; 35— 100"
высокая
20 — 71° -очень
высокая
19% — концентриро-
ванная; 18— 100°—
очень высокая
10%—копцентрпро- С>хой, влажный НС1,
ванная; 20° —тем-
пература К11ПСННЯ
— слабая
Насыщенный при
100J — очень вы-
сокая
20° — слабая
5, 10%; 35" — темпера-
тура кипения — сла-
бая
0,5 -2%; 21° -темпе-
ратура кипения — сла-
бая
Концентрированная; В разбавленной— В разбавленной -очень
18 — 85J — очень очень высокая, высокая, в концентри-
высокая в концентрирован- рованной — слабая;
ной — слабая течперат>ра кннення
ПО"; 5% —очень
высокая, 40% —
слабая
20, 30%; 20° — темпера-
тура кипения — пысо-
кая
а Данные по коррозионной устойчивости взяты из «Zirconium, Its Production and Properties», Bulletin Ч1Н, Bureau of Mines, U. S. Government Printing
Office, 1956. Концентрации растворов даны в вес.%, температура — °C коррозионная устойчивость подразделена следующим образом: очень высокая —
проникновение на глубину не более 0,01 мм/год, высокая — проникновение на 0,01 — 0,1 я*/?лЛ, средняя проникновение на 0,1 -0,25 мм/гой, елл
flan — проникновение более 0,2^ мм,'г Э; напис-нпе (для прнмерл) 5, 10% ознпчает 3L н 10%; 5 10 озна1ает от 5 до 10%,
908
Глава 34
Коррозия в газах
Результаты испытаний поведения циркония в различных газах (СО,
СОг, SO-,, Н2, C3H8J и парах воды при температурах 300—1000° 121] пред-
ставлены в табл. 3.
Данные по коррозии циркония на воздухе, в кислороде и азоте [22]
приведены в табл. 4.
Джаффи и Кемпбслл [251 сообщили, что цирконий устойчив в NH3 до
1000° и реагирует со всеми галогенами при температурах 200—400".
Таблица 3
УВЕЛИЧЕНА ВЕСА ЦИРКОНИЯ В РАЗЛИЧНЫХ ГАЗАХ [2L], мг/дмг
Темпе-
ратура,
300
400
500
600
700
750
800
900
1000
Окись угле-
рода
1 чис
30
115
150
90
60
2 1 час
200
275
600
500
120
Двуокись
углерода
I час
37
150
265
365
900
24 нас
220
864
790
740
1325
2700
Двуокись
серы
1 час
20
4000
5500
—
—
—
24 час
1,1
40
Раз-
лага-
ется
То же
—
Водород
1 час
95
95
95
93
95
—
—
-
24 час
93
95
95
2510
—
—
—
Пропан
I час
15
39
50
—
85
143
205
24 чис
—
—
—
193
—
760
420
2080
Пары
] час
—
-
73
284
385
464
1496
н2о
24 час
—
72
107
860
—
Коррозия в расплавленных металлах
Данные по коррозии циркония в расплавленных металлах и сплавах
128] приведены в табл. 5 н 10.
Коррозия в других средах
Подробные данные о поведении циркония в обычных кислотах приве-
дены в табл. 6, 7, 8 и 11.
ПЛАВКА ЦИРКОНИЯ
Слитки для последующей обработки получают из губки или пластин
методами дуговой плавки в вакууме или в атмосфере инертного газа.
Первоначально плавка циркония проводилась в графитовых тиглях,
нагреваемых в индукционных печах [47] или печах сопротивления с гра-
фитовыми элементами [311; при этом в цирконий переходило до 0,2% угле-
рода из графитовых тиглей. При плавке в тиглях из окислов также полу-
чались плохие результаты.
Позднее стали применять метод плавки в дуговых печах с вольфрамовы-
ми электродами [51] и охлаждаемыми водой медными поддонами; анало-
КОРРОЗИЯ ЦИРКОНИЯ В ГАЗАХ [22]
Таблица 4
Темпера-
тура, °С
425
500
№0
700
800
900
1000
НПО
1200
Воздух
1 час
7,6
36
95
169
326
6500
—
—
4 час
11,4
63
179
286
565
—
—
—
24 час
36
159
740
3513
5930
—
—
—
Сухой
воздух
1 нас
35
63
160
287
2170
—
—
Кислород
1 час
19
38
75
222
310
—
—
Азот
1 час 24 час
—
—
4,7
7,2
—
—
15 65
27 149
65
102
304
572
Таблица 5
КОРРОЗИЯ ЦИРКОНИЯ В РАЗЛИЧНЫХ РАСПЛАВЛЕННЫХ МЕТАЛЛАХ
И СПЛАВАХ
Коррозия
Металл
Bi
Bi—In Sn
Bi Pb
Ш—Pb- In
Bi—Pb—Sn
Ga
Hg
Те
Mg
Na,K или Na-K
Pb
300°
Неизвестна
To же
Значительная
Неизвестна
Значительная
Ограниченная
Слабая
Значительная
Слабая при тем-
пературе
плавления
F51°)
Значительная
То жеа
НПО"
Слабая
То же
Ограниченная
Слабая
Oi раниченная
Слабая
То же
Ограниченная
Значительная
Ограниченная
800°
Слабая
Неизвестна
То же
» я
» »
» »
» »
Ограниченная
То же
а При температуре плавления C27°)-
Таблица 6
КОРРОЗИОННАЯ УСТОЙЧИВОСТЬ ЦИРКОНИЯ В СОЛЯНОЙ, СЕРНОП,
фосфорной и азотноп кислотах а
Концентрация кислоты,
Скорость коррозии, мм год
в обычных условиях
Соляная кислота
менее 0,13
» 0,51
более 0,51
Серная кислота
менее 0,13
» 0,51
более 0,51
Фосфорная кислота
менее 0,13
» 0,51
более 0,51
Азотная кислота
менее 0,13
» 0,51
более 0,51
ниже
38°
0—37
0—37
0—75
0—78
78—95
0—80
0—85
0—70
0- 70
0—20
0—20
О 72
0—76
76—95
0—61
0- 63
63—80
0—70
0—70
кипения
0 -20
0—20
0—66
0—72
72—95
53
65
65—70
0—70
0—70
при высоком давлении в за-
лаяииых ампулах из стекла
пирекс в
0—37
0—37
0—70
0—70
0—60
0 -60
0—70
0—70
[21 -IC3'
0 25
0—37
0—70
0 -70
0—6A
0—60
0 -70
0—70
и -204°
0—15
0—18
18—37
0—15
0 32
32—70
0—80
0—82
82—85
0—70
0—70
а По данным нсследовательсиого отдела фирмы «Карборундум четалс компани».
б Образцы размером 51 X 12,7 X 1,1 мм обрабатывались обдувкой крошной карбида кремния
в течение 144 час при атмосферном давлении.
в Образцы размером 51 X 12,7 х 1,1 «-ai, мтделанные обдувкоп крошкоб карбида кремния,
обрабатывались 60 мл химически чистой кислоты. Запаяивые ампулы содержали воздух. Время
испытании — 4S час.
Таблица 7
РЕЗУЛЬТАТЫ ПРОДОЛЖИТЕЛЬНЫХ ИСПЫТАНИИ КОРРОЗИОННОЙ
УСТОЙЧИВОСТИ ЦИРКОНИЯ В КИПЯЩЕЙ 20%-НОП НС1 а
Обработка поверхности
Прокатка и травление
Обдувка абразивной крош-
кой
Электролитическое полиро-
вание
Продолжи-
тельность
испытаний,
час
1892
1892
1892
1892
1728
1728
Содержание
укслеза
в расТЕоре,
10-4%
5
0
5
0
5
0
Скорость коррозии,
мм 'год
обработка
144 час
0,028
0,018
0,0025
0,0015
0,025
0,025
1 обработка
2000 нас
0,076
0,051
0,051
0,025
0,010
0,018
аПо данным исследовательского отдела фирмы «КарОорундум металс компанн*.
КОНСТАНТЫ
Температура, °С
260"
287
315 а
315
360
Таблица 8
СКОРОСТИ КОРРОЗИИ ЦИРКОНИЯ В ВОДЕ
ПРИ ВЫСОКОП ТЕМПЕРАТУРЕ
Давление, кг/см?
140
73
140
109
190
К, JU2/CJH2
1,5
2,4
2,6
3,5
5,9
п
0.2R4
0.270
0,315
0,301
0,330
/Сил связаны со скоростью окисления уравнением & = Kt71
' а Под давлением.
Таблица 9
ВЛИЯНИИ ТЕМПЕРАТУРЫ ПА КОРРОЗИЮ 11ЕРГПЛАНЛЕННЫХ
В ДУГЕ КРИСТАЛЛИЧЕСКИХ ПРУТКОВ ЦИРКОНИЯ
(пар под давлением 1 am) a
*1 емпература,
'С
816
621
510
454
399
Продол жн-
тельность
воздеис1вия,
час
48
42
70
72
84
Привес,
870
2U5
67
411
2
Вид образца
Серовато-черный, бе-
лый по краям
То же
Серый, белые участк!
Серый, белые пятна
Черный
D. Е. Ttiomo», WAPD-T-I86, June 6, 1954.
Таблица 10
КОРРОЗИЯ ЦИРКОНИЯ В ЖИДКОМ НАТРИИ ПРИ ИСПЫТАНИИ В ТЕЧЕНИЕ 2 НЕДЕЛЬ
(скорость потока 1,68 м/сек) а
Темпера-
разца, °С
600
600
400
Температура
340
130
120
Содержание
в Na, 10-4%
260
23
21
Средний
мг/см
0,26
0,26
0,007
Средняя глу-
бина ПрО-
ННКИОВЁННЯ,
мк
0,71
0,74
0,02
Средняя ско-
рость корро-
зии, мг/см2Х
Хмес
3,30
3,40
0,09
Средняя ско-
рость проник-
новения.
0.001 см/мес
1,45
1,50
0.04
а С. Tyzack, Niclfar Engineering, 3 B4), 102 — 114 A958).
Таблица 11
КОРРОЗИОННАЯ СТОЙКОСТЬ ЦИРКОНИЯ В ДРУГИХ СРЕДАХ а
Среда
Минеральные кислоты
Плавиковая
Смешанные кислоты
Царская водка
Олеум F% SO2)
Хромовая кислота
Вода, насыщенная хлором
Дымящая (красная)
Азотная кислота
Хлориды металлов
Хлорид жслеза(Ш)
То же
» »
Хлорид меди(П)
Ти же
» »
» »
Хлорид ртути(П)
Хлорид олова(Н')
Хлорид марганца(И)
Хлорид никеля
Хлорид натрия
Другие хлориды
Хлорид аммония
Хлорид кальция
Хлорид магния
Хлорид бария
Хлорид цинка
Хлорид алюминия
Искусственная морская вода
То же
Органические соединения
Муравьиная кислота
То же
Уксусная кислота
То же
Концентрация,%
3 об. 1INO3 +
1 об. НС1
6 (SO2)
10
92 HNO3
1
5
10
1
5
10
1
Насыщенный
раствор
24
20
20
Насыщенный
раствор
Насыщенный
раствор
25
42
20
20
25
10—90
90
5—99,5
99,5
Температура,
Комнатная
100
Кипение
Комнатная
Температура
пения
То же
35
35
35
Температура
пения
100
100
1UU
100
100
100
100
100
1110
100
100
20
TevnepaTypa
кипения
35—100
Температура
кипения
35—100
Температура
кипения
°с
кн-
ки-
Скорость коррозии,
мм/гид
Не определялась
Слабая
0,005
Совершенно ус-
тойчив
0,015
0,00051
0,023
1,78
3,86
0,023
1,8В
8,89
0,93
Совершенно
устойчив
0,0060
0,01N0
0,0060
0,0060
0,0060
0,0060
0,0060
0,01N0
0,0060
0,0060
Совершенно
устойчив
То же
0,013
0
0,013
0
Цирконий
913
Продолжение табл. 11
Среда
Монохлоруксусная кислота
Дихлоруксусная кислота
Трихлоруксусная кислота
Молочная кислота
То же
Дубильная кислота
Щавелевая кислота
Винная кислота
Лимонная кислота
То же
Уксусный ангидрид
Четыреххлористый углерод
Хлороформ
Хлористый этилен
Трихлорэтилен
Тетрахлорэтилен
Тетрахлорэтан
Щелочные растворы и расплавы
щелочен
Ндкнй натр
Расплав едкого натра
Гидроокись аммония
Едкое кали
Расплавленный натрий
Расплав ецкого калн
Трииатрийфосфат
Сульфат уранила
Концентрация, %
100
100
100
1U—85
85
25
0,5—25
10—50
10—50
50
Температура, °С
33 100
Температура
кипения
То же
35—100
Температура
кипения
35—100
35—100
35- 100
35—100
Температура
кипения
СКОРОСТЬ Kfipp
хм/га}
0,013
0,212
11,303
0,00025
0
0,013
0,013
0,013
0,013
о
99,5
50
50
50
50
50
50
10 50
28
28—40
10—40
—
5—20
40 г/л
То же
» »
» »
» »
» »
г »
» •
35—100
35—100
35—100
35—100
600
35—100
250
0
0,0025
0,0025
0,0030
0,0030
A,0030
0,0030
Очень высокая
> >
> »
» 3»
Высокая
Слегка взаимо
действует
Очень высокая
» »
а Из работ Лейна, Голдена н Аккермана [38].
гнчные экспериментальные печи применяются для плавки других туго-
плавких металлов. При плавке в этих печах получают менее загрязненный
металл, чем они выгодно отличаются от дуговых печей с расходуемым элек-
тродом [681. Для получения сплавов, очистки и уменьшения пористости
металла применяется вторичная плавка. Вес слитков достигает 2700 кг
(см. рис. 8).
В малых масштабах в промышленности применяются и другие методы
плавки: капельная [43], бестигсльная [43] и метод всплывания 1751.
ОБРАБОТКА ЦИРКОНИЯ
Промышленный цирконий подвергается описанным ниже видам обра-
ботки.
58 j.ini.3 № М9
'Л4 Глава 34
Прокатка и ковка
Нагрузки и температуры, необходимые для первичной обработки цирко-
нии, много ниже, чем в случае нержавеющей и даже мягкой стали. Слитки
циркония нагревают до 850" в обычных печах па воздухе и затем легко
прокатывают или обжимают; сплавы циркалон II и III необходимо нагре-
вать до 1000°.
\ Рис. 8. Слиток циркония весом 3040 кг, полученный
? , при плавке циркониевой губки в дуговой печи в ат-
,_" ' ыосферс аргона (сМэллори-Шарои металс корп.»).
, ' После механической обработки поверхности слиток можно
[; ^ прокатывать в блюминге в полосы и листы.
Заготовки циркония очищают песком или травят в смеси азотной
и плавиковой кислот, а затем нагревают до 780°. В процессе передела
отжиг, сопровождаемый последующей обработкой песком, можно проводить
на воздухе, однако отжиг выпускаемых деталей следует осуществлять
в вакууме, чтобы сохранить требуемые размеры и характеристики.
Выдавливание
Изготовление цельнотянутых труб осуществляется выдавливанием заго-
товок, покрытых защитной оболочкой из стекла или меди. Применяя соле-
вые ванны, можно достигнуть температуры до 1000'. При 760е константа
экструзии больше, чем у меди, но меньше, чем у мягкой стали.
Холодная обработка
Стержни, трубы и проволоку из циркония и циркониевых сплавов
можно изготовлять холодной протяжкой, а листы — глубокой вытяжкой
иа обычном оборудовании; однако если после предыдущей операции выда-
вливания не остается медного покрытия, то поверхность циркония и спливл
цнркалой может слегка окисляться. Если применяется метод окисления,
то обжатие следует проводить осторожно, чтобы не разрушить пленку
окиси.
Механическая обработка
Цирконий можно подвергать любому способу механической обработки,
однако следует соблюдать осторожность и учитывать свойства металла.
Цирконий 915
Цирконий обладает абразивными свойствами, вызывающими большой
износ инструментов. Кроме того, при обработке цирконий быстро нагарто-
вывается. Поэтому следует применять твердосплавные инструменты и боль-
шую глубину резания.
Циркониевая стружка при нагревании может загораться, поэтому реза-
ние металла следует производить осторожно, чтобы избежать перегрева
стружки. С этой целью следует применять острые, хорошо отполирован-
ные инструменты, достаточное охлаждение и умеренную скорость резания.
Особенности гибки штамповкой
Обработка циркония и его сплавов циркалои III и циркалой II прово-
дится таким же образом, как и обработка титана. При штамповке этих
материалов вследствие упругости их в отожжепом виде получение углов
в 90е требует сгибания в матрице на угол 95—100". Материал, наклепанный
при прокатке или рихтовке, вероятно, требует гибки на 100—120°. Нагре-
вание облегчает штамповку циркония.
Обработка поверхности
Цирконий можно успешно обрабатывать различными механическими
способами. Во избежание загорания и быстрого износа шлифовального коле-
са скорость шлифовки должна быть значительно ниже, чем при обработке
других металлов.
Р и с. 9. Плавка циркония в закрытой камере,
через которую пропускается инертный газ для пре-
дотвращения загрязнения металла атмосферными
газами («Карборундум металс» и «Пфаудлср»).
Пленку двуокиси циркония невозможно удалить травлением. Поэто-
му на всех стадиях, на которых другие металлы очищаются травлением
(например, после горячей прокатки или отжига на воздухе), для очистки
циркония применяют пескоструйную обработку или обдувку металлической
крошкой. После механической очистки поверхности металл рекомендуется
погружать в раствор смеси азотной и плавиковой кислот.
58*
Ш Глава 34
Сварка
Сварку следует проводить в инертной атмосфере, чтобы избежать вред-
ного загрязнения атмосферными газами. Удобно проводить работу в закры-
том сосуде, который сначала эвакуируют, а затем заполняют аргоном (как
показано на рис. 9). Более удобна аргоно-дуговая сварка с вольфрамовым
или расходуемым электродом, при которой не требуется специальной
защиты. Стыковая сварка методом оплавления должна проводиться в атмо-
сфере аргона.
Склонность циркония к наволакиванию или наплавлению при обра-
ботке рсзанчем делает возможным применение прогрессивного способа свар-
ки давлением. Этот способ был успешно применен, например, для сварки
циркония с алюминием.
СПЛАВЫ ЦИРКОНИЯ
За последнее время было изучено много сплавов циркония, однако
не было проведено систематического изучения механических свойств таких
сплавов. По мнению Хейеса [18], в случае циркония не будет происходить
такого заметного улучшения свойств, какое было получено для сплавов
титана. Он объясняет это тем, что большинство элементов имеет весьма
ограниченную растворимость в ^-цирконии и еще меньшую в «-цирконии;
растворимость тех же элементов в титане во много раз больше.
К элементам, повышающим температуру а-^-превращения циркония,
относятся О, N, Sn и Л1. Понижают эту температуру Та, Nb, Th и U. Со
многими элементами (Н, VV, V, Ag, Be, Со, Сг, Си, Fe, Мп,Mo и Ni) полу-
чены эвтектики и эвтектоиды. В системах Zr — HF и Zr — Ti обнаружен
непрерывный ряд твердых растворов.
Механические свойства сплавов циркония
Данные по механическим свойствам отожженных сплавов а-циркония,
собранные Чаббом, представлены в табл. 12.
*
Сплавы «циркалой»
Сплавы циркалой II и циркалой III, разработанные специально для при-
менения в ядерной промышленности, обладают чрезвычайно высокой корро-
зионной стойкостью даже в присутствии небольших количеств кислорода,
азота и водорода в металле.
Состав технического циркония и сплавов циркалой представлен в табл. 13,
а сравнение механических свойств сплавов циркалой дано в табл. 14.
ОБЛАСТИ ПРИМЕНЕНИЯ
В настоящее время в США металлический цирконий применяется глав-
ным образом в области ядерной энергетики, что обусловлено его превосход-
ными антикоррозионными свойствами и низким поперечным сечением погло-
щения нейтронов. Величина поперечного сечения поглощения циркония
составляет 0,18 барн, алюминии 0,22 барн, нержавеющей стали —3 барн
и гафния 120 барн.
Цирконий применяется в активной зоне реактора для оболочек топлив-
ных элементов, в сплавах с ураном, для несущих конструкций активной
Таблица 12
MLX 1НИЧССКИЕ CDOflCTBA СОДЕРЖАЩИХ ЦИРКОНИИ СПЛАЬОВ, ОТОЖЖЕННЫХ
В п-ОБЛМ;ГИ, ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ [79]
Состав сплава,
Ипдндньш цирконий
Губка
0,841
1.4А1
l,6Nb
5,lNb
0,9Cr
0,6Со
0,4Cu
l,6Hf
0.02H
0,4Fe
0,6Mn
0,4Mo
l,3Mo
0,5Ni
0.14N
0,080
0,5Si
0,3Ag
5,9Ta
9,7Ta
5,4Th
2,5Sn
3,9Sn
5,6Sn
8,0Ti
35,0Ti
0,4W
0.5W
3.4U
9,7U
0,004V
0,8V
Предел
текучести
9,8
25,0
35,0
59,5
37,8
55,9
30,8
32,5
18,6
11,5
12,2
36,3
43,8
50,0
71,3
30,0
50,8
26,3
40,4
30,0
36,4
64,5
38,1
26,7
29,4
45,2
40,5
77,0
22,8
22,8
20,8
72,1
15,8
52,2
Предел
прочности
при
растяжении.
20,4
39,5
49,0
84,5
48,2
73,3
52,2
50,0
38,7
26,6
27,7
50,3
65,4
70,3
87,1
51,4
69,0
40,5
64,6
47,6
51,8
87,4
57,7
35,9
36,3
70,0
54,2
97,2
42,2
47,3
40,1
84,7
36,3
75,3
Относитель-
ное
удлинение
на длине
2о мм, %
34
33
33
9
38
14
20
14
1
33
47
27
16
2
17
8
17
40
30
16
22
26
9
18
39
3.4
9
6
3
23
17
35
18
26
12
Метод
плавки
и исходный
материала
Л-К
иг
и-к
иг
и-к
И-Г
иг
и-г
д-к
д-к
д-к
и-г
и-г
и-г
и-к
и-г
д-к
д-к
И-Г
и-г
и-к
и-г
и-г
д-к
д-к
и-г
И-К
д-к
д-к
д-к
д-к
д-к
д-к
И-Г
•Литера-
тура
11
12
21
22
21
22
22
22
4
4
23
22
22
22
21
22
11
4
22
22
25
22
22
4
11
22
25
26
4
26
11
27
4
22
а Д главка в дуговой печи; И—плавка в индукционной печи. Исходный материал: Г—губка
цирконии; К—кристаллический пруток циркония.
Таблица 13
химический состав циркония и спллвои циркл.юп
Содержание, %
Sn
Fe
Cr
Ni
Элемент, 10- ¦>%
Al
В
Co
I If
Pb
Mn
O2
N2
Cl2
Si
Ti
V
Cd
С
Cu
Mg
Mo
W
Na
Ca
Циркониевая
губка
0,150
0,020
0,007
75
0,5
20
100
100
50
1400
50
1300
100
50
50
0.5
500
50
600
50
50
50
30
Сплав
цмркалоН II
1,460
0,124
0,104
0,050
75
0,5
20
200
130
50
—
80
—
100
50
50
0,5
500
50
20
50
100
Сплав
цнркэлои 111
0,250
0,250
0,050
0,050
75
0,5
20
200
130
50
—
80
—
100
50
50
0,5
500
50
20
50
J00
—
Таблица 14
MfcXAHH4FCKHE СВОЙСТВА СПЛАВОВ ЦИРКАЛОЙ*
Сплав
Цирка лой II
18—20°
260э
Циркалом III
18 -20
260
Предел
прочности
при растяжении.
кг/мм*
в про-
дол 1.ном
направ-
лении
46,3
22,7
42,2
18,5
в попе-
речном
направ-
лении
45,2
22.5
43,3
18,4
Предел текучести
(при
кг1
в про-
дольном
направ-
лю н и и
31,5
13,2
25,9
9,9
Ось»),
в попе-
речном
направ-
лении
.18,8
17,0
35,9
13,5
Относительное
сужение
попереч-
ного сечения, %
в про-
дольном
iiiiiip:in-
лении
40
62
34
48
в попе-
речном
направ-
лении
40
61
39
.18
1 нерл<ить
по
Впк-
КгрСУ
156 200
144—189
по Рок-
целлу
(шка-
ла В)
90
85
Огпжжеппый.
30 кг; 2/э предельной нагрузки.
Цирконий 919
зоны*. В Дрезденском реакторе близ Чикаго нз цпркалоя II смонтировано
почти 71 км труб диаметром 14 мм.
Сравнение экономических характеристик при употреблении циркония
и нержавеющей стали для оболочек топливных элементов и постоянных
частей реактора проведено Бенедиктом 15]. Для незначительно обогащен-
ного топлива преимущество имеет цирконий, однако при увеличении сте-
пени обогащения топлива преимущество переходит к нержавеющей стали.
Рис. 10 Циркониевая губка и трубчатый Рис. 11. Вен
теплообменник, изготовленный фирмами «Пфа- тиль us циркония
удлер» и «Карборундум метался. для работы с ще-
лочами н кислота-
ми («Пауэл оэлв»
Цирконий обходится дороже, когда используется и «Карборундум
для постоянных частей, чем при использовании металс»).
для оболочек топливных элементов.
Промышленное применение циркония основано главным образом па его
высоком сопротивлении коррозии. У циркония сочетается исключительно
высокая коррозионная стойкость по отношению к минеральным и органи-
ческим кислотам и енльнощелочным растворам. При снижении стоимо-
сти и усовершенствовании методов производства цирконий сможет найти
разнообразное применение. Из него легко можно изготовлять различные
насосы, вентили, теплообменники, фильтры, трубы и другое оборудование.
Доступность подобного оборудонания, обладающего чрезвычайно высокой
коррозионной стойкостью, позволит проводить такие процессы, которые
ранее нельзя было осуществить, что, в свою очередь, увеличит спрос на этот
металл. Примером являются химические установки, для которых обору-
дование из циркония часто является незаменимым.
Для химической промышленности важно сочетание коррозионной стой-
кости циркония в щелочных и в кислых средах. Он обладает очень низкой
скоростью коррозии в азотной, соляной и серной кислотах, сухом хлоре
(до 200°), в растворах едкого натра и едкого кали, в морской воде, раство-
рах галогенидов и гипохлорита натрия. Это свойство в сочетании с высокой
механической прочностью делает цирконий весьма пригодным для изгото-
вления химического оборудования. На рнс. 10 и 11 представлены детали
оборудования, изготовленные из циркония.
* Из 18 известных ядерных энергетических установок 17 имечи актиьную зону
реактора из циркония и лишь одна — из нержавеющей стали.
920 Глава 34
Другие области применения, например изготовление электронных ламп,
ламп-вспышек для фотографин и хирургических инструментов, несом-
ненно будут расширяться при увеличении доступности металла.
ЛИТЕР АТУ Р А
1. AdenstedtH-K.. Trans. ASM, 44, 949 A952).
2. А I е х а п d e r Р. Р., пат. США 2038402. 1936.
3. Armour Research Foundation, Summarv Rept. COO-89, 1951—1952.
1. Becker J. G., Review of Modern Physics, 7, 95, 128 A935).
5. В e n e d i с t M., Metal Progr., 75, 76 A959).
6. П i n g G.. Fink F. W., T h о m p s о n H. В., Rept. BMI-65, April 16. 1951.
7. В г a d t W. E., L i n f о г d' H. В., Trans. Electrochem. Soc, 70, 431 A936).
8. В г e w e r L., in Chemistry" and Metallurgy of Miscellaneous Materials (Quill
L. L., Ed.), McGraw-Hill Book Company, New York, 1950, p. 13.
9. В r i d g e m a n P. W-, Proc- Am. Acad. Arts Sci., 81 ('!), 165 A952).
10. Clarke F. W., W a s h i n g t о п H. S, U. S. Gcol- Survey Profess. Paper, 127,
1924.
11. Coop er H. S., Trans. Electrochem. Soc, 43, 215 A923).
12. С о u g h I i n J. P., К i n g E. G-, J. Am. Cliem. Soc, 72, 2262 A950).
13. С u b i с с I о t t i D., J. Am. Chem. Soc, 73, 2032 A951).
11. d e Boer J. H-, Z. anorg. Chem., 187, 177 A930).
15. de Boer J. П., Fast J. D., Z. anorg. Chem., 153, 1 A926).
16. Golden L. В., A. S. M. Symposium on Zirconium and Zirconium Alloys, p. 305—
326, 1953.
17. G u I b r a n s e n E. A.. A n d r e w R. F., Trans. AIMME, 185, 515 A949).
18. Hayes E. Т., Metal Prngr., 63, 109 A953).
19. H а у e s F. Т., U. S. Bureau of Mines, Bull. 561 A956).
20. H ay cs E. Т., D i I 1 i ng E. D., Koberson A. H., Trans. ASM, 42, 619A950).
21. Hayes E. Т., Roberson A. H., Robertson R. H., J. Electrochem.
Soc, 97. 316—323 A950).
22. H а у e s E. Т., R о b e г s о n A. H., J. Electrochem. Soc, 96, 142—151 A949).
23. Holt M. L., J. Electrochem. Soc, 98, №. 3, 33C A951).
24. Hunter M. A., Jones A., Trans. Electrochem. Soc, 44. 23 A923).
25. Jaffee H. J., Campbell I. E., The Properties of Zirconium, Battelle Memo-
rial Institute. AEC File NP-266, June 18, ,1947.
2G. Keeler J. H., G. F.. Research Lab. Rept. SO-2512. October 5, 1953.
27. К 1 e m m W. Z.. Elektroclicm., 45, 354 A939).
28. К oe n i g R. F., Corrosion of Zirconium and Its Alloys in Liquid Melals, Knolls
Atomic Power Lab., Schenectady, New York, October 1, 1953.
29. К г о I 1 W. J-. Z. anorg. Chem., 234, 42 A937).
30. К г о I I W. J., A n d e r s о n С T. et al., J. Electrochem. Soc, 94, 1 A948).
31. К г о 1 I W. J- A n d e r s о n С. Т., G i I b e г t H. L., Am. Inst. Mining Met.
Engrs.. Tech. Publ. 2310. 1948.
32. К г о I I W. J., Hergert W. F.. Y e r k e s L. A., J. Electrochem. Soc, 97,
305 A950).
33. К г о I I W. J., S с h I e с h t e n A. W., J. Electroclieni. Soc, 93, 247 A948).
34. К г о I I W. J., S с h 1 с с h t e n A. W- et al., Trans. Electrochem. Soc, 92, 99
A947).
35. К г о I I W. J., Schlechten A. W-, Y e r k e s L. A.. Trans. Electrochem.
Soc. 89. 263 A946).
36. К г о 1 I W. J., Stephens W. W., Holmes H. P., Trans. AIMME, 188,
1445 A950).
Цирконий 921
37. К и г t i N.. S i m о n F., Prnc Roy. Soc, A151, 610 A93f>).
38. L a n e I. R.. Q о I d e n L. В., А с к e r m a n W. L., Ind. Eng Chem., 45,
1067 A953).
39. L e I у D., Hamburger L., Z. anorg. Chcm., 87, 209 A914).
10. L i I I i e n d a h I W. C, G г e g о г у Е. D., J. Electrochcm. Soc, 99, 187 A952).
41. L i I I i с n d a h ! W. C, W г о u g h t о n D. M., Gregory E. D., Trans.
Electrochem. Soc. 93, 235 A948).
42. Loft ness R. L., Rept. NAA-SR-132, July 10. 1952.
43. M a g e I Т. Т.. К u I i n S. A., Kaufman A. R., Rept. MIT 1080, AECD
3320, January 1952-
44. M a r d e n J. W., пат. США 1602542. 1926.
45. Harden J. W., R i с h M. N.. U. S. Bureau of Mines, Bull. 186 A921)
46. Mudge W. L., Rept. WAPD-T-16, June 1953.
47. National Lead Co., Steel, 128 E), 77 A951).
48. Picon M., С R., 196. 2003 A933).
49. P f e i I P. С L., Rept. AERE-M/TN-11. June 9, 1952.
50. P f e i I P. С L., Rept. AERE-M/R-960, June 27, 1952.
51. R я d t к e S. F., Scrivcr R. M., S n у d e r J. A., J. Metals, 3, 620 A951).
52. Rcntschler H.C., Henry D. E., Trans. Electrochem. Soc, 87, 289 A945).
53. R e у n о I d s M. В., Trans. ASM, 45, 839 A953).
54. R о b e r t s L. D., D a b b s J. W. Т., Phys. Rev., 86, 628 A952).
55. Roberts L. D., S a r t a i n C.C.Dabbs J. W. Т., Rept. ORNL-1365, June
20, 1952.
56. R u s s e 1 I R. В., Rept. MIT-1073. October 1951.
57. R u s s e I I R. В., Rept. M1T-1102, December 1952.
58. Russell R. В., Trans. А1ЛШЕ, 200, 1045 A954).
59. S с n d e г о f f S., Brenner A., J. Electrochem. Soc, 97, 361 A950).
60. Sch wop e A. D., Muehlenkamp G. Т., Rept. BMI-T-23, April 1950.
61. S с h w о p e A. D., Stncketl S. J., Rept. BM1-T-32, July 1, 1950.
62. Sch о ens С J., S h or t a 1 1 J. W., Rept. LRL-62, December 1953.
6.i. Skinner G. В., Edwards J. W., Johnston H. L, J. Am. Cliein.
Soc, 73, 174 A951).
64. S к i n n e г G. В., J ohnslcn H. L., J. Am. Chcm. Soc, 73, 4549 A951).
65. S к i n n e г G. В., J о li n s t о п Н. L., J. Chem. Phys., 2|, 1383 A953).
66. S q u i г е С F., К a u f m a n n A. R., J. Chem. Phys., 9, 673 A941).
67. S t e i n b e r g M. A., Sibert M. E., Wainer E., J. Electrocheni. Soc,
101, 63 A954).
68. Stephens W. W., Gilbert H. L., В e a I 1 R. A., Trans. ASM, 45, ЬС2
A953)
69 S t г о t z e r E. R., В i I t z W.,Meisel K-, Z. anorg. Chem., 242, 249 A939).
70. T г е с о R. M., Zirconium and Zirconium Alloys, American Society for Melals,
Cleveland, 1953, p. 254.
71. Udy M. C, Shaw H. L., Boulger F. W., Rept. BM1-7I1. February 20,
1952.
72. V a n A r к e I A. E., de Boer J. H., Z. anorg. Chem., 148, 345 A925).
73. Vogel R., T о n n W., Z. anorg. allgem. Chem., 202, 293 A931).
74. v о n Z e p p I i n H., пат. США 22М211, 1940.
75. Wroughton D. M. et al., J. Electrocheni. Soc, 99, 205 A952).
76. Z w i к к е г С, Proc Acad. Sci. Amsterdam, 29, 792 A926).
77. Z w i к к e r C, Physik. Z., 30. 578 A929).
78. Z w i к к e r C, Physical Properties of Solid Materials, Interscience Publishers,
New York, 1954, p. 250.
79. Л а с т м е и Б., К е р з Ф., Металлургия циркония, ИЛ, Москва, 1958.
35
ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ
КАЛЬЦИЙ, СТРОНЦИЙ, БАРИЙ
Ч. Л. МЛНТЕЛЛ
Ch. L. Manitll, Consulting Engineer, New York,
N. Y.
Щелочноземельные металлы—.кальций, стронций, барий и радий —
входят в главную подгруппу II группы периодическом таблицы. Радий
известен в форме солей и как металл до настоящего времени не применяется.
В алхимии все неметаллические вещества, не растворимые R воде ь не
изменяющиеся при прокаливании, назывались «землями». Окиси каль-
ция п магния (известь и жженая магнезия), показывающие щелочную реак-
цию, были названы «щелочными» землями . Название «кальций» происходит
от латинского слова calx (известь), стронций — от названия города Строп-
циан (Шотл<И1дия), барий —¦ от греческого слова barys, что означает тяже-
лый. Все три металла впервые были получены Дэви в 1808 г. электролизом
расплавленных хлоридов.
Из группы щелочноземельных металлов кальций имеет наибольшее
применение и производится в промышленном масштабе. По степени распро-
страненности элементов в земной коре кальций занимает пятое место (,Ч,64Л),
барий—18 место @,03"о); содержание наименее распространенного стронция
составляет лишь 0,025%.
Все три элемента — металлы белого цвета, но с различными оттенками;
они ковки, пригодны для обработки давлением и резанием и могут быть
превращены в пруткн, проволоку и листы. Они менее активны, чем натрий
и калий, и имеют более высокие температуры плавления и кипения. Наибо-
лее распространенные их минералы — это сульфаты и карбонаты. Эти
металлы образуют также перекиси, хлориды, нитраты, хлораты (в этих
соединениях они всегда двухвалентны), истинные карбиды и ацетилиды.
Типичным ацетилидом является карбид кальция СаС2, который при нзаимо-
дипствнн с водой дает ацетилен. Летучие соли металлов интенсивно окра-
шивают пламя, причем кальций окрашивает пламя в оранжево-красный,
стронций — в карминово-красный и барий — в желтовато-зеленый цвет.
Соединения стронция и бария применяются в виде нитратов, хлоридов
п хлоратов в пиротехнике для сигнальных и осветительных ракет и в
дистанционных трубках.
Кальций самый дешевый из щелочноземельных металлов, хотя он
значительно дороже натрия, стоимость которого составляет лишь неболь-
шую часть стоимости кальция. Объем производства натрия более чем
в 100 раз превышает производство кальция. В органическом синтезе натрий
играет очень важную роль, однако в металлургических процессах из-за
низкой температуры плавления и высокого давления паров он является
менее удобным раскислптелем. восстановителем, дегазатором и легирую-
щим компонентом, чем менее летучий кальций. Кроме того, конечные про-
дукты реакций с натрием более летучи и менее тугоплавки, чем соответ-
ствующие конечные продукты реакций с кальцием. В металлургических
Щелочноземельные металлы — кальций, стронций, барий 923
процессах металлический кальций конкурирует с некоторыми своими сое-
динениями, например с силицидом, борпдом и карбидом. Все эти соединения
применяются как дегазаторы, восстановители и источники кальция для
сплапов. Часто, однако, при производстве специальных сплавов, например
жароупорных сплавов никель — хром и никель — хром — железо, за счет
этих соединений могут вводиться нежелательные примеси, что исключено
при применении кальция.
Применение этих металлов в металлургии зависит от их способности
образовывать при высоких температурах чрезвычайно устойчивые нитриды,
силициды и карбиды, например Са2С (в противоположность ацетилидам,
например СаС2)*. При более низких температурах образуются устойчивые
гидриды, типичным из которых является гидрид кальция. В производстве
электронных ламп способность этих металлов поглощать остаточные газы,
связывая их в окислы, нитриды и в меньшей степени в гидриды, позволяет
использовать их в качестве геттеров.
КАЛЬЦИЙ
Свежесрезанная поверхность кальция имеет белый цвет, напоминающий
цвет серебра; поверхность излома более блестящий, чем у стали. При отно-
сительной влажности выше 30% металл тускнеет, так как на поверхности
образуется тонкая пленка окиси голубовато-серого цвета, защищающая
металл от дальнейшего окисления. Сутунки промышленного электролити-
ческого кальция толщиной 51 мм в атмосфере с нормальной влажностью
за 6 мет я цен корродируют на глубину 6,35 мм. Кинетика окисления
кальция изучена Кубиччотти [291.
Кальций нельзя отливать обычными методами, вследствие чрезвычай-
но быстрого его окисления при температуре плавления. Однако процессы
плавки и отливки с применением защитных флюсов позволяют получать
слитки кальция. Гомер и Упгейкер I58J предложили покрывать частицы
кальциевого порошка металлами, осажденными из карбонилов этих металлов.
Металлический кальцин можно обрабатывать такими же способами,
как магний и алюминий. При соприкосновении с кожей он безопасен. Fro
можно обтачивать па токарном станке, придавая ту или иную форму, свер-
лить, нарезать, распиливать, выдавливать, вытягивать в проволоку, прес-
совать и ковать из него пластины.
Технический кальций содержит 99%' металла и выпускается в виде крои,
т. е. целых необработанных кусков конденсированного металла, и в виде
лома таких кусков; игл размером 6 меш и длиной 12,7 мм; слитков разме-
ром 70 ч44 .584 мм; заготовок диаметром 279 мм и длиной 584 мм, отлитых
в атмосфере аргона; литых пластин размером 635 \ 406 63мм; выдавленных
профилей диаметром 23 мм и длиной 300мм; кусков размером 25,4 ' .. 76,2 X
Ч'2ОЗ мм; цилиндров диаметром 178 -«ж и длиной 635 мм и стружки. После
двойной дистилляции металл содержит 99,5% кальция и выпускается в виде
разломанных необработанных кусков конденсированного металла, блоков
диаметром 25,4 мм н длиной 76,2мм; крошки с частицами диаметром 9,5 мм,
т. е. размером 20 меш; игл диаметром 3 мм и игл размером С мсш. В табл. 1
приведен химический состав технического и дважды дистиллированною
кальция.
* Соединение Са2С, которое можно было бы рассматривать как продукт замеще-
ния водорода в метане на кальций, нельзя считать достоверно существующим. Карбиды
такого типа известны лишь для бериллия и алюминия.— Прим. ред.
У24 Г л два ^5 __
Кальций в виде отливок продастся партиями в несколько тонн по цене
4,52 долл. за 1 кг, в виде стружки по 6,52 долл. за 1 кг и в дистиллированном
виде (99,9%-ной чистоты) по 8,28 долл. за 1 кг.
В США в больших масштабах кальций стал использоваться срашштель-
но недавно. До 1939 г потребности внутреннего рынка удовлетворялись
Кристаллы дважды дистил-
лировашюго кальция.
материалом, импортировавшимся нз Франции в количестве 22 т/год. Одна-
ко к концу второй мировой войны ежегодное потребление уже в несколько
рая превышало эту цифру.
ПРОИЗВОДСТВО
Во время второй мировой войны в США было налажено производство
кальция вначале электролизом расплавленного хлорида, а несколькими
годами позже и методом термического восстановления окиси кальция алю-
минием в глубоком вакууме*. В производстве свинцовокальцневых сплавов
источником кальция может служить его карбид. Кремний не рекомендуется
в качестве восстанавливающего агента, так как восстановление происходит
при 1200' — предельной температуре для применяемых реторт. Эксплуата-
ционные характеристики электролитического метода производства кальция
в Европе, сообщенные Мантеллом [86J, приведены в табл. 2. На заводе кон-
церна «И. Г. Фарбениндустри» в Биттерфельде металлический кальций
производился в 10 электролизерах при максимальной силе тока 1400 а,
напряжении 25 е с выходом по току 50%; при этом производительность
каждого нз них составляла 13 кг/сутки. В качестве электролита применяли
чистый расплавленный хлорид кальция. Металл осаждался на катоде.
Применялись графитовые аноды, а для понижения температуры плавления
электролита в ванну добавляли небольшое количество хлорида калия
Начиная с 1939 г. «Электрометаллурджикл компания (Солт-Сент-Мэри,
штат Мичиган) применяла электролизеры на 2000 а, а позднее — на
10 000 а. После переплавки н очистки дистилляцией в вакууме получался
металл с содержанием кальция 99,5% и выше. В настоящее время в Север-
нон Америке метод электролиза в промышленности не применяется.
* Металлургия кальция (электролитические, термические способы получения
кальция и его сплавов, рафинирование кальция) недавно подробно рассмотрена А. Ю.
Тайцем. См. главу «Кальции» в книге «Основы металлургии», т. 3. Мета члурпидат,
Москва, 1963 г., стр. 441—170.—Прим. ред.
Таблица 1
ХИМПЧЕСКИП СОСТАВ МЕТАЛЛИЧЕСКОГО КАЛЬЦИЯ РАЗЛИЧНЫХ МАГОК
Элементы
Са
Ag
Al
В
Ва
Be
CaO
Cd
Cl2
Co
Cr
Cu
Fe
К
Li
Mg
Mn
N2
Na
Na+K
Ni
Ni+Cu+Cr
Ph
Si
Sn
Sr
Технический
KplH 1ЙЛЛП-
ческий
фирмы йшл
корпоре fliiiH»
94-97
0,0005
0,002
0,001
0,002
0,001
2—5
0,0 0,5
—
—
0.001
0,04
<0,00l
-
0,25—1,0
0,001
0,0015
0,5—0,8
—
<0,005
-
0,01
0,004
0,001
<0,001
Дэмэла,
сорт 4
98—99
-
0,35
—
—
—
Нелков
>99
—
0,03 0,30
—
— —
— 0,010
— —
—
0,5 1,5
—
1,0
—
0,2—0,5
<0,010
0,01 0,1
—
—
—
—
—
Дэмэл,
сорт 3
99 99,5
—
0,30
—
—
—
—
—
—
0,75 (макс.)
_
0,15 (макс.)
.
—
—
Дистиллированный
Нелко
99,5
0,0010
<0,0001
<0,0001
.
<0,0002
<0,(Ю02
0,0010
<0,0001
0,5000
0,0020
0,0200
-
Дэмзл,
1(.рт 2
99,9-t Mg
(Mg макс.
0,5%)
0,0007—
—0,010
11,0001J
(макс.)
—
0,00002
(макс.)
—
-
0,001—0,005
(мэьс.)
-
0,001 (макс.)
0,0005—
—0,004
(макс.)
0,01—0,025
(наьс.)
0,001 (макс]
0,001 -0,005
(макс.)
—
—
а «Дэмнннеи мэгниаисм лимитид», Хейли, провинция Онтарио. Кянадл.
«Мелко металс шжорпорсНшп», Ксйнак, Коннектикут».
92Ь
Глава 35
Таблица 2
ЭКСППУАТ АНИОННЫЕ ХАРАКТЕРИСТИКИ с)ЛЕК I РОЛИТИЧЕСКОГО
ЛРОЦНССЛ ПРОШВОДС1 НА КАЛЬЦИЯ В ЕВРОПЕ
I
Показатель
\-фаК'|ери« тика или
Электролит
Температура. °С
Сила тока на канне, а
Клтоднан плотность тока, а/см2
Выход по току, "о
Теоретическое напряжение разложе-
ния С.аС12 при 800 , в
Напряжение на ванне, в
Расход энергии, кеч/кг
Температуря плавления СаС12, С
Удельная электропроводность СаС12
при 800°, ял емз
Расход СаС12 на 1 кг кальция, кг
Теоретический
Фактический
Аноды
Катоды
Материал
Тин
Электролизер
Футеровка
Корпус
Чистый хлорид кальция
780—800
1400
100
50
3,2
25
58
780
1,9
2,76
4.5
Графитовые
Железо или графит, покрытые
кальцием
Вертикальные с контактирующей
поверхностью
Графит
Листовая сталь
Пиджен и Аткинсон 11051 нашли, что давление паров кальция при
реакции между окисью кальция и алюминием, приводящей к образованию
кальция и 2 СаО-АЬО3, в интервале температур 1150—1200' изменяется
от 1,0 до 1,3 мм рт. ст. Предполагалось, чю по механизму реакции вос-
становление окиси кальция совершается парами алюминия.
Получение металлического кальция термическим восстановлением
извести запатентовано Пиджсном и Мак-Кетти 1106]. Тонкоизмсльчепную
известь, содержащую не более 3% примесей и не более 1 % окиси магния,
брикетируют с избытком 5—20% порошкообразного алюминия, применяе-
мого в качестве восстановителя. Брикеты нагревают в вакууме 10 мк рт. ст.
или более глубоком приблизительно до 1170°. Реторту нагревают таким
образом, что пары кальция конденсируются в зоне, где температура поддер-
живаетси при 740- 680". Пары магния конденсируются в зоне с температу-
рой в пределах 350—275°. Смесь двух металлов конденсируется в промежу-
точной зоне с температурой 485—400°. В патенте описываются аппаратура
и соответствующие диаграммы и приводятся уравнения реакций, проте-
кающих при нагревании брикетов
5СаСЦ 2Л1 ЗСа + 2СаО-А12О3,
3MgO -^CaO-.-SAl — 3Mg+2CaO-Al2O3.
A)
B)
Щелочноземельные металлы — кальций, стронций, барий
927
Режимы процесса производства металлического кальция алюмотермическим
методом приведены в табл. 3 181].
Габлица 3
ХАРАКТГРИСТИКН ЛЛЮМОТЕРМИЧЬСКО! О ПРОЦЕССА
ПРОИЗВОДСТВ\ МЕТАЛЛИЧЬСКОГО КАПЫДПЯ
Показатель
Сырье
Восстановитель
Температура процесса, "С
Давление, мк рт. ст.
Материал реторты
Размеры реторты
Степень чистоты получаемого
кальция
Продолжительность одного циьла,
час
Реакция
\.ipaKi ернстик.1 ил 11 значение
Порошок чистого обожженного изие-
стняка (СаО) зернистостью 200 меш
Порошок алюминии со степенью чм
стоты 96,99% и зернистостью 20 меш
1200
20
Сплав 28% хрома, 15% никеля; ос-
тальное железо
Диаметр 254 ммТ длина 304U мм;
толщина стенок 28 мм
Магния 0,50—1,0°о, алюминия 0,01 —
U,2%, азота меньше 0,02%, хло-
риды отсутствуют, щелочные эле-
менты отсутствуют, кальция
98—99%
12
6СаО+2А1-> ЗСа+ЗСаО-А12О3
С 1959 г. в США металлический кальций производят фирмы «Нелко
металс инкорпорейшн» (Кейнан, штат Коннектикут), субсидируемая «Нью
ингланд лайм компания и «Юнион кэрбайд металс корпорейшн». Вакуумные
реторты, в которых кальций получается алюмотермическим методом, изго-
товляются фирмой «Дэминиен магнизием».
Уоррингтон и Мак-Фейл [140] приводят описание реторт для терми-
ческого восстановления щелочноземельных металлов под давлением. Это
удлиненные цилиндрические реторты со свободной от окалины внутренней
поверхностью, так как оин отливаются центробежным способом с соотно-
шением наружного диаметра к толщине стенки, равным 10,2 : 1 - 13,0 : 1.
Длина зоны восстановления реторты поддерживается равной 2286—
3048 мм. Оптимальный наружный диаметр реторты может незначи-
тельно меняться в зависимости от того, какой щелочноземельный металл
конкретно получается; так, при получении магния и бария ои равен 305 -
350 мм, а при получении кальция и стронция 317 - 106 мм. Стенки сосуда
изготовлены из нержавеющей стали, содержащей, например, 40% никеля
и 18% хрома, 20% никеля и 25% хрома или 17% никеля и 27% хрома.
Бассеро [15] приводит описание процесса восстановления кальция фер-
росилицием или алюминием с последующей дистилляцией. Процесс, описан
ный Уоррингтоном [139], отличается от процесса Пиджсна применением
брикетирования. Венер 1141J подробно описывает процесс очистки электро-
литического кальция дистилляцией. Джаффи и Парке 161] рекомендуют
процесс получения металла, основанный на разложении карбида кальция.
Миллер [92] описывает процесс получения магния с помощью ферросили-
Ш Глава 35
ция и показывает пути приспособления оборудования этого процесса для
производства кальция. Орман 1102] приводит данные по европейскому
практическому опыту производства. Андрие и Бонье [11] обсуждают метод
получения металла из кремнекальциевых и алюминиевокальциевых сплавов
дистилляцией.
Александер 18] дает описание процесса производства кальция восста-
новлением хлорида кальция натрием.
В электролизерах Дауиса для расплавленных солей [85] получают
металлический натрий, содержащий кальций. Последний кристаллизуется
из расплава и его отфильтровывают от натрия. Это — третий промышлен-
ный источник получения металлического кальция и сплавов кальция
с натрием.
Электролитический метод рассмотрен Вснсром [141].
Фудзита и сотр. [40, 41, 43] изучили различные методы получения
кальция, а также промышленные методы его очистки.
Фирма «Этил корпорейшн» получила кристаллический кальций в виде
свободного от флюса порошка с металлическим блеском путем обработки
спиртом шлама, состоящего из смеси натрия с кальцием, получающегося
при производстве натрия электролизом расплавленных солен по методу
Даунса. Получаемый продукт состоит нз темных кристаллов и имеет
чистоту 94 96?''о; прн этом вследствие того, что процесс протекает при
низкой температуре и в отсутствие газов, кальций содержит не более О,ОО15"о
азота. Предполагалось, что ежегодный сбыт составит 136 000 кг по 2,75—
3,30 долл. за 1 кг. Однако спрос на кристаллический кальций был очень
мал, и он не мог конкурировать на рынке с компактным кальцием, потен-
циальная цена которого составляла менее 2,2 долл. за 1 кг. В результа-
те производство кристаллического кальция было прекращено.
Фирма «Этил корпорейшн» разработала методику извлечения кальция
из шлама (содержащего кальций и натрий), являющегося отходом процесса
производства электролитического натрия из смеси хлорида натрия и хлори-
да кальция, при одновременном получении из низкомолекулярных высших
спиртов. Кальций, получаемый в свободном состоянии этим методом, извле-
кается, промывается и сушится [23, 56, 57].
Фирма «ОДеталс гидрид корпорейшн» запатентовала [50] метод разде-
ления шлама из кальция и натрия методом фракционной дистилляции.
Подробное описание процесса очистки кальция дистилляцией дано
Бетчерманом и Пидженом [19].
Писида [98] делится практическим опытом, имеющимся в Японии,
Барнет [22] описывает английский метод получения кальция в атмосфере
аргона при давлении 1 мм рт. ст., а Бартон [14] запатентовал двухсту-
пенчатый метод получения металла.
Александер [7] разработал метод получения кальция из смеси гидрида
кальция с окисью магния при добавлении легирующих металлических доба-
вок, из которых кальций затем дистиллируется.
ФИЗИЧЕСКИЕ СВОЙСТВ*
Прочностные свойства металлического кальция сильно зависят от при-
месей, а для чистого металла — от методов обработки. Металлический каль-
ций поддается механической обработке с улучшением свойств, как это видно
из приведенных значений предела прочности, предела текучести, относитель-
ного удлинения и обжатия как в прокатанном, так и в отожженном состоянии.
Щелочноземельные металлы — кальций, стронций, барий
929
Компактный кальций — это мягкий металл кристаллической струк-
туры, который является одновременно ковкими пластичным. Он может быть
легко подвергнут штампованию при нагревании его до 420—460°. Он имеет
две аллотропические формы, одна из которых (а) существует ниже 464°,
а другая (Р) — выше 464°. Физические свойства компактного кальция при-
ведены в табл. 4. Однако точность приведенных значений его свойств сомни-
тельна из-за влияния некоторых примесей, которые трудно удалить из ком-
пактного металла. Так, например, присутствие менее 1% связанного азота
D кальции снижает его температуру плавления с 851 до 780°. Другие свой-
ства также изменяются.
Таблица 4
ФИЗИЧЕСКИЕ СВОЙСТВА КАЛЬЦИЯ
Порядковый номер
Атомный объем, смУг-аточ
Атомный иес
Температура кипения, °С
Цвет
Сжимаемость при 30°
0 am
II 600 am
Сжимаемость при 20*
99—493 cm
100—500 Мбар/см?
Сжимаемость
Кристаллическая решетка
Плотность, г/см3
20°
450=, а-фаза в полученной вытяж-
кой проволоке
480°, р-фаза
Предел упругости, кг/мм*
Удельное электрическое сопротивление,
-ИКОИ-СЛ
0°
20°
21°, в прокатанном состоянии
21е, в отожженном состоянии
Электрохимический [эквивалент (валент-
ность 2)
ме/к
к/мг
Нормальный потенциал (по отношению
к водороду), в
Электронная структура
Энтропия, кал/г-атом-град
В твердом состоянии при 25°
В газообразном состоянии прн 25е л
Число Эриксена для листа 0,8 мм
В прокатанном состоянии
В отожженном состоянии
V* 59 Звкчз К« 239
20
25,90
40,08
1482 [131]
Белый, несколько напоминающий серебро
5,885-10—в
5,300-10-е
1
5,8-10-е
5,7-Ю
Д V (см?)
др(отл)
Кубическая гранецентрированная,
а=5,56 кХ
1,54
1,48
1,52
1,033
3,43
4,6 '
4,24—4,50
4,04—4,11
0,20762
-2,76
2-8-8.2
9,95
37,00
3,55—3,6
11,1
[131]
[129]
[68]
[65]
Твердость, литая пластина
По Бринеллю (при нагрузке 500 кг)
По Роквеллу (при нагрузке 15 кг, ша-
риком диаметром 1,588 мм)
По Моосу
Теплоемкость, кал/г-град
а-Фаза от 0 до 460°
Р-Фаза от 460 до 851°
Жидкая фаза от 851 до 1200°
Теплота сгорания, кал/г
Теплота плавления, ккал/г-атом
Теплота превращения, ккал/г-атом
Теплота испарения при 1482°,
ккал/г-атом
Стабильные изотопы (массовые числа)
Магнитная восприимчивость э.м.е.
Температура плавления, СС
Минимальное межатомное расстояние, кХ
Модуль упругости, кг/мм2
Удельная теплоемкость, кал/г-град
От—185 до 20°
0—100°
460—851°
Поверхностное натяжение, Он/см
Температурный коэффициент электросо-
противления при 20°. град'1.
Механические свойства при растяжении
Предел текучести, кг/мм-
в прокатанном состоянии
в отожженном состоянии
Предел прочности при растяжении,
кг/мм2
в прокатанном состоянии
в отожженном состоянии
Относительное удлинение на длине
25 мм,%
в прокатанном состоянии
в отожженном состоянии
Относительное сужение поперечного
сечения, %
в прокатанном состоянии
в отожженном состоянии
Коэффициент теплопроводности при 20°,
кал/см ¦ сек • град
Коэффициент теплового расширения,град~1
линейный @—300°)
объемный @—2Г)
Поперечное сечепие захвата тепловых
нейтронов, барн/атом
1 емпература «—р-перехода
Валентность
Объемная электропроводность по отно-
шению к меди, %
Продолжение табл. 4
17
42 (после прокатки)
[90]
40,
0,17
0,19
0,19
151,9
- 2,23
0,115
36,7
42, 43, 44, 46, 48
,10-10-6
851
3,93
2-103—2,8-10»
0,157
0,149
0,19
255
0,00457
Г67|
[67]
[05]
[60]
[67]
[131]
[601
[135]
[67]
[130]
8,65
1,40
11,74
4,89
7
51
35
58
0,3 (того же порядка, что для натрия и
других щелочных металлов)
0,0000220
0,001O17
0,43
464±4
2
48,7
[120|
Щелочноземельные металлы — кальций, стронций, барий 931
Теплоемкость низкотемпературной модификации кальция (а) может
быть найдена и выражена в соответствующих единицах (кал1г-атом-град)
из уравнения
где Т — температура, "К [67].
Для высокотемпературной модификации (Р) это уравнение принимает
[67] вид
Ср=6,29+1,4СЫ0-зт.
Дуглас [341 и Томлин [1321 определили давление паров кальция от 800
до 900° К. Давление паров в атмосфере может быть представлено [131]
следующими уравнениями:
а-Модификация @—460°С)
lee p (^ = 5,802Д
Р-модификация D60—851°С)
Ю8Р(«")=5,107-(/ "„ ,
жидкое состояние (851—1482°С)
Эти уравнения выведены на основании находящихся в соответствии с термо-
динамикой экспериментальных данных Пиллинга [107] по твердому каль-
цию, а также Гартмана и Шнайдера [54] по расплавленному металлу. Данные
Радберга [112] по твердому металлу не принимались во внимание как
ненадежные.
Приселков и Несмеянов [108] выразили давление паров кальция в интер-
вале от 475 до 670° уравнением
log рСа = 7,790—8524/7".
Как показывает рентгеноструктурный анализ, проведенный но методу
Дебая—Шерсра [91], кальций существует в трех модификациях: а-кальции
с кубической гранецентрированной решеткой, Р-кальций с гексагональной
плотноупакованной решеткой и ¦у~кальций с кубической объемноцентрн-
рованной решеткой, причем температуры аллотропических превращений
составляют примерно 250 и 450°. Параметры решетки, найденные для этих
трех модификаций, очень близки к параметрам решетки аналогичных моди-
фикаций стронция.
Смит и сотр. [120] показали рентгенографически, изучив образцы каль-
ция различной степени чистоты, что металлический кальций чистотой выше
99,9% имеет лишь две модификации — кубическую гранецентрированную,
существующую до 464°, и кубическую объемноцентрированную, существую-
щую от 464° до температуры плавления. Эти результаты по исследованию
аллотропии при высокой температуре отличаются от ранее известных;
в справочниках и таблицах до сих пор приводятся данные о том, что высоко-
температурная аллотропическая модификация обладает гексагональной
плотноупакованной решеткой. В дальнейшем было показано, что обнаруже-
ние ранее упомянутой промежуточной модификации со сложной структурой
является следствием влияния примесей. Температурная зависимость элек-
тросопротивления для кальция чистоты выше 99,9% —линейная как для
кубической гранецентрированной, так и для кубической объемноцентриро-
ванной модификации. Кальций отжигается при комнатной температуре.
59*
932 Глава 35
Хабер и Холли [59] провели опыт по сжиганию металлического каль-
ция в калориметре при начальной температуре 25" в атмосфере кислорода
под давлением 50 am. Т-еплота сгорания равна 15 806 дж/г. Подсчитано,
что соответствующая стандартная теплота образования окиси кальция
из элементов составляет —635,09 ± 0,89 кдж/моль. На рентгенограмме
продуктов сгорания присутствуют только линии окиси кальция.
Коллинз и сотр. [26] определили массовые числа изотопов кальция,
а Клайн и Заффарано [72] — их периоды полураспада.
Каллер и сотр. [30] изучили нейтронное рассеяние для кальция.
Тейлор [130] установил, что величины поверхностного натяжения
щелочноземельных металлов при температурах, соответствующих их темпе-
ратурам плавления (в эргах на квадратный сантиметр), равны для кальция
225, для стронция 165 и для бария 195.
Мак-Дональд и Мендельсон [82] определили электросопротивление
щелочноземельных металлов (кальция, стронция и бария) до температуры
20сК. При одинаковых геометрических размерах удельное и относительное
электросопротивление кальция по сравнению с медью, алюминием и натрием
является следующим:
Международный эталон
отожженной меди
Кальцин
Алюминий
Натрий
I одинаковых весов и
гния составляет:
Медь
Кальций
Алюминий
Натрий
Удельное
электрическое
сопритнвление
1,724
4,53
2,83
4,8
длин значение
Плотность
8,92
1,55
2,70
0,97
Относительное
электрическое
сопротивление
1,00
2,63
1,64
2,79
относительного э
Относительное
sji ектрос оп ро-
тнвление
1,00
0,46
0,50
0,30
МЕХАНИЧЕСКИЕ СВОЙСТВА
Металлический кальций намного тверже натрия, но мягче алюминия
и магния. По прочностным характеристикам он стоит гораздо ближе к алю-
минию и магнию, чем к натрию. Катодный осадок кальция в том виде,
в каком он получается из ванны, в поперечном разрезе при нагрузке 500 кг
имеет твердость по Бринеллю Нв 17. При тех же условиях металлический
натрий настолько мягок (Нв < 1), что измерения не могут быть проведены.
Твердость Нв для чистого алюминия равна 25, а для магния 30 (твердость
магния, производимого фирмой «Дау кемикл компани», составляет 32).
Твердость кальция по Роквеллу Ян равна 36—40. По склероскопу Шора
твердость нормальной поковки кальция равна 7—9, при усиленной про-
ковке она достигает 11—12 (соответствующие значения твердости для
магния равны 20 и 23).
Дистиллированный кальций имеет удлинение 53%, в то время как
вытянутый в проволоку металл дает удлинение, равное 61%, металл с содер-
жанием 98,5%—удлинение 30,5%, загрязненный металл (94—96%-ный)
Щелочноземельные металлы кальций, стронций, барий 533
не т1.ает удлинения вообще [16]. При деформации 4 мм!мин дистиллирован-
ный кальцин обладает большей ковкостью, чем алюминий чистотой 99,6%,
и меньшей ковкостью", чем свинец, однако он имеет большее удлинение, чем
каждый из них. Модуль упругости дистиллированного кальция составляет
2,24.10s — 2,C6.10s кг/мм2. При действии нагрузки менее 0,4 кг/мм2 при
домнатноп температуре явления ползучести кальция не наблюдалось. Испы-
тания на раздавливание показали, что полная рекристаллизация кальция
происходит при температуре 300° и выше в процессе деформации. Нагруз-
ка, требуемая для деформации, уменьшается с повышением температуры,
а при 440° имеет место резкий излом, соответствующий температуре не-
сколько более, низкой, чем температура аллотропического превращения
кальция. Выше 460° кальций подвергается пластической деформации при
очень малых нагрузках. Проволока из кальция легко вытягивается в интер-
вале температур 420—460°.
ОБЛАСТИ ПРИМЕНЕНИЯ
Металлический кальций применяется как легирующий компонент для
алюминия и подшипниковых сплавов свинец — кальций или свинец —
барий — кальций; как восстановитель при получении бериллия, металли-
ческих порошков хрома, редкоземельных металлов, горня, урана и циркония;
как легирующий компонент и раскислитель меди; как важнейшая легирую-
щая добавка при производстве дисперсиониотвердеющих свинцовых сплавов
для кабельных оболочек, аккумуляторных пластин и других аналогичных
применении; как модифицирующая добавка для магния и алюминия; как
девисмуторизатор свинца; как контролирующий . агент для сохранения
углерода в виде графита в чугуне; как десульфуратор и раскислитель мно-
гих сплавов (хромоникелевые, медные, железные, железоникелевые, нике-
левые, никель кобальтовые, никель хроможелезные, никелевые бронзы,
сталь и оловянные бронзы); как газопоглотитель в электровакуумных
приборах; как поглотитель азота из аргона. Кальций часто добавляют
в магниевые сплавы в количестве 0,25% для получения мелкозернистой
структуры, уменьшения тенденции к воспламенению и изменения проч-
ностных свонств при термической обработке. Другим примером при-
менения кальция являются дисперсионнотвердеющие сплавы кальция
со свинцом. Растворимость кальция в свинце при температуре плавления
последнего составляет около 0,1%, но она быстро уменьшается с пониже-
нием температуры, в результате чего происходит дисперсионное твердение
сплава, так как при обычной температуре растворимость кальция в свинце
всего лишь около 0,01 "о.
Кальций применяется также в качестве восстанови геля для получения
ряда тугоплавких металлов, например при восстановлении окиси бериллия
в присутствии меди с получением кальциевобериллиевых сплавов [122];
%пя восстановления молибдена из его окислов в бомбе (с применением окиси
магния в качестве футеровки), давление в которой достигает 84,4 кг/см**.
а температура 3000° [471; для восстановления фторидов, в особенности фтори-
дов бериллия и тория, в присутствии серысцелью получения сплавов [1241;
для восстановления галоидных соединений церия в присутствии иода [126].
Эти металлы содержат кальций и подвергаются в дальнейшем очистке
ваку у мной дистил л яцией.
Анселин и сотр. [12] при восстановлении фторида плутония кальцием
до металлического плутония, который был получен в количестве, измеряемом
граммами, добились 85—90°6-ного выхода.
60 Заказ Кг 239
234 Глава 35
Ашар,- Кар и Лорье [1J смешивали фторид скандия с равным весовым
количеством чистого кальция и добавляли фторид бария A5 г BaF2 на 10 г
фторида скандия) для улучшения расслаивания. Эту смесь нагревали в тан-
таловом тигле в аргоне при температуре 1500—1600° в течение 5 -б мин.
После охлаждения и удаления флюса слиток скандия легко вынимался
из тигля.
Для восстановления хлорида тория кальцием до металлического
тория Лилиендаль [78] применял более легкую конструкцию бомбы, чем та,
которая применялась с натрием в качестве восстановителя. Спеддинг и сотр.
[127] установили, что для благоприятного протекания реакции необходим
избыток кальция и подогреватель для сообщения дополнительного количе-
ства тепла, чтобы расплавить шлак и металл. Келлер и сотр. [04] описали
методы литья и изготовления изделий из такого тория.
Кальций применяется в качестве восстановителя при производстве
ковкого титана [74). В настоящее время практикуется получение ковкого
ванадия [83] подобным методом, т. е. восстановлением пятиокиси ванадия
порошкообразным кальцием.
Шварц и Косгер [117] сделали попытку восстановить TiS2 и Ti2S3
металлическим кальцием.
Джонстон [63] применил смесь титана и титановых сплавов со стружкой
кальция для изготовления расходуемых электродов, чтобы получить пере-
плавленные дуговым методом слитки, обладающие ковкостью.
Кубашевский и Динч [76] показали, чго гитан в равновесии с кальцием
и окисью кальция при 1000° содержит меньше 0,1% кислорода. Титан,
полученный восстановлением двуокиси титана кальцием или магнием,
содержит намного более 0,1% кислорода. Найдено, что продукты восстанов-
ления магнием или кальцием содержат не поддающиеся выщелачиванию
количества примесей магния и кальции. В том случае, когда двуокись титана
восстанавливают расплавленным магнием с последующим удалением магния
на промежуточной стадии с помощью вакуумной термообработки при 1200°
(или выше), продукт последующего кальциевого восстановления фактиче-
ски свободен от кальция; при этом достигают низкого процентного содержа-
ния кислорода, определяемого условиями равновесия. Сходный с этим
метод был еще ранее запатентован фирмой «Дэминьеи мэгпизием»133]. Титан
99,7%-ной чистоты получали восстановлением ТЮ2 до ТЮ и до Ti2O3 (или
только до Ti2O3) магнием в инертной атмосфере при 550—565°. Магний
и окись магния удаляли 5 10%-ной соляной кислотой. П2О3 и TiO вос-
станавливали до титана кальцием в инертной атмосфере при температуре,
превышающей 1000°. Восстановление до титана в две стадии устраняет
наличие кислорода, азота и водорода в металле, присутствие которых
оказывает отрицательное влияние на его свойства.
Холлэндер [32] установил, что восстановительная среда из кальция
с таким флюсом, как хлорид бария, полезна при плавлении небольших
кусков урана.
В докладе Комиссии по атомной энергии [89] сообщается, что кальций
мог быть успешно использован для получения урана как из двуокиси урана,
так и из фторида урана уже в начале 1942 г., однако «когда эти материалы
были необходимы, совсем не оказалось металлического кальция высокой
степени чистоты». Фостер и Мэгел [38] нашли, что в присутствии галоидных
соединений марганца выход по этой реакции увеличивается. Леммон н< 1тр.
[77] изучили термодинамические параметры этой реакции.
Бнрд и Крукс [17], как и Мак-Кечии и Сейболт 1831, получали ком-
пактный ковкий ванадий кусками весом но килирамму, восстанавливая
Щелочноземельные металлы — кальций, стронций, барий 935
пятиокись ванадия кальцием. Уилхслм и Лонг [143] выявили, что добавле-
ние серы оказывает на реакцию стимулирующее действие.
Келли [69] восстановил в водороде пятиокись ванадия до трехокиси
и затем превратил ее в металл путем взаимодействия с кальцием, а Лонг [80],
используя кальций, получил металлический ванадий из фторидов и суль-
фидов.
Дааи и Спеддинг [31] получили в компактном виде иттрий, тулий,
тербий, гольмий и эрбий высокой чистоты посредством восстановления
фторидов этих элементов металлическим кальцием в танталовых контейне-
рах, помещенных в инертную атмосферу, при нагревании токами высокой
частоты. Иттербий можно было восстановить лишь до двухвалентного
состояния, так как его фториды являются летучими при рабочей темпера-
туре A500—1600°).
Спеддинг и Даан [123] дали также обзор методов восстановления соеди-
нений этих редких металлов кальцием и свойств получаемых при этом
продуктов. Аманом [4] описаны результаты исследовании, проведенных
с самарием, церием и неодимом.
Лилиендаль и Ренчлер [79], Винтер [146], а также Карлсон, Шмидт
и Уилхелм [27] исследовали вопрос о применении кальция для получе-
ния циркония и гафния из фторидов этих металлов, аСпеддинг и сотр. [125]
применяли серу или иод для ускорения этой реакции. Уолш [138] получил
компактный цирконий восстановлением кальцием хлорида или фторида
циркония в присутствии серы или иода и описал методы получения чистых
исходных материалов.
Винтер [147] запатентовал метод получения таких тугоплавких метал-
лов в реакторе, как титан или цирконий, восстановлением летучих
галоидных соединений этих металлов металлом-восстановителем, особенно
магнием. Он также сделал заявку на -оригинальный метод производ-
ства ниобия, гафния, молибдена, тантала и вольфрама с применением
в качестве восстановителей кальция, бария, стронция, натрия, калия
и лития.
Гиббс, Свек и Харрингтон [46] изучили также роль щелочноземельных
металлов в очистке инертных газов. Барий, кальций, сплав кальция с 10%
магния, лантан, магний, торий и цирконий эффективно удаляют кислород
из аргона, а барий, кальций, сплав кальция с 10% магния, магний, торий
и цирконий удаляют азот из аргона. Кальций, торий и цирконий изучали
только в твердом состоянии. Сплав кальция с 10% магния эффективен лишь
тогда, когда он расплавлен. Барий настолько энергично реагирует с загряз-
нениями в аргоне, что расплавляется даже тогда, когда температура печи
ниже его температуры плавления на 350°. Как для сплава кальция с 10%
магния, так и для бария не было получено таких обширных данных, однако
имеющиеся результаты показали, что эти материалы очень эффективны
при удалении кислорода и азота из инертных газов при сравнительно
низких температурах.
Филд и Филлер [37] изучили каталитическое действие кальцин на обра-
зование твердых полимеров.
Национальный исследовательский комитет Канады запатентовал [96]
катализатор (для окисления этилена до окиси этилена), который осаждают
на металлическую основу для улучшения теплопередачи и контроля темпе-
ратуры. Температура реакции равна 240—320 , а катализатором является
сплав серебра с кальцием, магнием, барием или стронцием, из которого
щелочные металлы выщелачиваются с целью получения развитой поверх-
ности у серебра. Оптимальная концентрация щелочноземельного металла
60
936 Г лае а 35
в сплаве составляет 5—10%, а оптимальный размер ячеек на серебряной
основе сплава 220 830 мк.
Кэмброн и 4лександер [24] приготовили скелетные серебряные катали-
заторы с высокой удельной активностью удалением кальция из сплава
кальция с серебром. Катализаторы, приготовленные из сплавов кальция
с серебром, имеют более высокую удельную активность, более стабильны
и более удобны в изготовлении, чем катализаторы из других серебряных
сплавов.
гидрид кальция
Кальций соединяется с водородом с образованием гидрида кальция.
Эта реакция обратима, и водород можно снова удалить при нагревании
гидрида. Гидрид кальция устойчив при комнатной температуре и является
удобным источником водорода, так как, когда гидрид кальция реаги-
рует с водой, выделяется вдвое больше водорода по сравнению с тем
количеством, которое содержится в гидриде. Для получения водорода
в труднодоступных местах гидрид кальция создает заманчивые перспек-
тивы.
Для производства гидрида кальция во время второй мировой войны
требовалось ежедневно 10 т металлического кальция. Ежегодное потребле-
ние кальция составляло 550 т.
Do время второй мировой войны по меньшей мере 1 100 т метал-
лического кальция было превращено в гидрид кальция для использования
его в качестве источника водорода при заполнении аэростатов.
Мссрсон и Колчин [88] изучили механизм восстановления окислов
металлов гидридом кальция.
Александер [6| установил, что гидрид лития образуется при смешива-
нии галогенида лития с восстановителем, взятым из этой группы метал-
лов (магний, кальций, барий), и гидридами кальция и бария, после-
дующем нагревании смеси в атмосфере водорода до 800е с образованием
расплавленной массы и выдерживании этой массы в вице тонкой пленки
в атмосфере водорода для взаимодействия с ним.
СПЛАВЫ КАЛЬЦИЯ
Среди сплавов кальция заслуживают внимания с точки зрения про-
мышленного применения его сплавы с кремнием. Эги сплавы получают
в электропечах из извести и кремнезема при восстановлении угле-
родом.
Силикокальций нашел важное применение как раскислитель и дегаза-
тор в производстве стали. Он применяегся также в производстве высоко-
прочного серого чугуна.
При производстве стали еиликокальций добавляется как в печь, так
и в ковш. Кальций и кремний — активные раскислители и образуют легко-
плавкие шлаки, которые легко удаляются из металла, и таким образом
получается чистая сталь. Силикокальций повышает также жидкотекучесть
стали. В практике мартеновского производства стали этот сплав добавляется
в ковш, а при выплавке стали в электропечах его можно добавлять или
в печь или в ковш.
При выплавке стали в электропечах с основной футеровкой силико-
кальций находит широкое применение для быстрого раскисления как метал-
Щелочнозе цельные металлы — кальций, стронций, барий
937
личсской ванны, так и шлака. Его обычно используют в виде кусков
по 50 мм в поперечнике или меньше.
При выплавке стали в электропечах с кислой набойкой раскислитель
добавляют на конечной стадии процесса главным образом для того, чтобы
предотвратить образование газовых пузырей при затвердевании металла,
хотя можно получить и другие эффекты, например увеличение ударной
вязкости стали.
Силикокальцин обычно добавляют в количестве от 2 до 13 кг\т стали
при средних значениях от 4,4 до 8,8 кг!т.
Иногда вместо силикокальция при производстве стали используют
сплав кальция с марганцем и кремнием, так как он содержит три активных
элемента в подходящих соотношениях для образования с примесями ме!ал-
ла легкоплавких шлаков, которые легко всплывают на поверхность расплав-
ленного металла. Этот сплав обеспечивает получение стали более чистой
от окислов, газов и неметаллических включений. Помимо повышения чистоты
стали этот сплав сообщает стали жидкотекучесть, повышает ее пластичность
и способствует устранению газовых пузырен в стальном литье.
Химический состав этих сплавов приведен в табл. 5. Если сталепро-
мышленник может использовать эти сплавы, так как они не внесут в сталь
нежелательных примесей, то по сравнению с этими кальциевыми сплавами
применять чистый кальций при производстве железа, стали и связанных
с ними металлических продуктов совершенно невыгодно.
Таблица 5
ХИМИЧЕСКИЙ СОСТАВ СИЛИКОКАЛЬЦИЯ,
СПЛАНА КАЛЬЦИЯ С МАРГАНЦЕМ И КРЕМНИЕМ
И ЦЕНЫ НЛ НИХ
Кальций, %
Кремний, %
Марганец, '?0
Железо, %
Удельный вес, г/см3
Цена за тонну, долл.
Цена за 1 кг (в пе-
ресчете на каль-
цин), долл.
Ca—Si
30-33
60 65
—
1,5 3
1,76
25—30
0.U11
Ca—Мл—SI
16—2U
53—59
14—18
—
2,08
24-28
0,0044 0,0066
Диаграммы состояния сплавов кальция с алюминием, медью, водородом,
золотом, свинцом, магнием, никелем, кремнием, серебром, оловом и цинком
хорошо изучены и построены почти полностью; диаграммы состояния сплавов
кальция с сурьмой, бериллием, висмутом, бором, кадмием, литием, ртутью,
азотом, платиной, натрием и таллием изучены недостаточно и построены
лишь частично.
Асаи [131 исследовал электроконтактные свойства сплавов серебра,
меди, кадмия, олова и цинка, содержащих 1—7% кальция. Добавка кальция
улучшает контактные свойства серебра.
938 Глава 35
СТРОНЦИЙ
Металлический стронций может быть получен методами, авапогичными
применяемым для кальция и бария, например электролизом расплавлением»
хлорида, смешанного с хлоридом калия [97. 1331.
Процесс Гунтца успешно использован для восстановления окислов
других щелочноземельных металлов. Получить стронций этим методом
легче, чем барий [52].
Снайдср и Липкий [121] сделали сообщение о методе дистилляции
стронция.
Ранк [111] методами термического анализа, изучением электрического
сопротивления, дифференциальным термическим анализом и определением
теплового расширения образцов дважды дистиллированного стронция
изучил пределы существования трех аллотропических модификаций с тем-
пературами перехода 233е и 540".
Бриджмсн [21] измерил электрическое сопротивление стронция под
давлением до 7000 кг/см2 и температуре до 200". Кривые изменения электро-
сопротивления с давлением при 0, 100 и 200° параллельны друг другу;
электрическое сопротивление увеличивается с увеличением давления. Сред-
ний температурный коэффициент электросопротивления от 0 до 100° при
атмосферном давлении равен 0,00283.
Белл и сотр. [18] определили электромагнитным методом концентра-
цию для четырех изотопов стронция.
Шслдон и Кинг [118] нашли, что стронций кристаллизуется ниже
215:1 10% в гранецентрированной кубической решетке (а-фаза) [а = 6,0726 ±
± 0,0005 кХ при 25°]; от 215 до 605 ± 10°— в гексагональной, плотноупа-
кованной решетке ф-фаза) [а--4,31 ± 0,01, c = 7,05j 0,01 kX при 248°]
и выше 605° — в кубической объемноцентрированной решетке (v-фаза)
с а = 4,84 . 0,01 кХ 'при 614 .
Нотторф [99] обнаружил присутствие стронция в продуктах деления
урана, а именно: стронция-90 с периодом полураспада 17 лет (Р-излучение
с энергией 0,04 Мэв) и иттрия-90, дочернего изотопа стронция-90.
Приселков и Несмеянов [108] получили уравнение для давления паров
стронция в интервале от 400 до 600°:
7,435—7,548/7-.
Потенциальные возможности применения стронция такие же, как
у кальция и бария. Сравнительно малая распространенность стронция при-
вела к тому, что о его свойствах мало что известно*. В технике его приме-
нение не дает никаких преимуществ по сравнению с кальцием, хотя стоит
он намного дороже.
В табл. 6 приведен химический состав технического стронция и цены
для небольших партий выдавленных прутков и кристаллического металла
в виде кусков. Физические свойства стронция даны в табл. 7.
БАРИЙ
Барий плавится при 710° и кипит при 1500е [134]. Он наименее летуч
из всех щелочноземельных металлов. Давление его паров при 1200° (темпе-
ратура восстановления окиси) составляет около 50 мм. рт. ст.
* Некоторые вопросы технологии стронция и его соединений рассмотрены
Б. В. Синицыным в главе «Стронций» (см. «Основы металлургии», т. 3, Металлург-
надат, 1963, стр. 471— 482).— Прим. ред.
Таблица б
ХИМИЧЕСКИЙ СОСТАВ И ЦЕНЫ НА СТР01ШИИ
И БАРИЙ
Стронций
Барий
Азот
Магний '
Кальций
Цена за 1 кг выдавленного
прутка диаметром 23,4 мм,
долл.
Цена за 1 кг кристалличе-
ского, комкового металла,
долл.
Стронций
98 5
0,1
0,05
0,5
0,8
17,6
14,3
Барий
1,0
98,0
0,1
0,4
0,4
13,2
11,0
Таблица 7
ФИЗИЧЕСКИЕ СВОЙСТВА СТРОНЦИЯ И БАРИЯ
Порядковый номер
Атомный объем, смЗ/г-апюм
Атомный вес
Температура кипения, СС
Кристаллическая решетка
Плотность при 20°, г/см3
Удельное электрическое сопро-
тивление при 20°, мком-см
Электрохимический эквивалент,
лг/к
к/мг
Электронная структура
Теплота плаплення, кал/г
Стабильные изотопы (массовые
числа)
Скрытая теплота испарения при
температуре плавления, кал/г
Температура плавления, °С
Удельная теплоемкость при
20° С, кал/г-град
Поверхностное натяжение,
дн/см
Поперечное сечение захвата
тепловых нейтронов,
барн/атом
Валентность
Стронций
38
34
87,62
1380
Гранецеитрированиая
кубическая
2,6
23
0,45404
2,20244
2-8-18-8-2
25
84, 86, 87, 88
383
770±10
0,176
165
1,16
2
Барин
56
39
137,34
1500
Объемноцеитрирован-
иая кубическая
3,5
—
0,71171
1,40507
2-8-18.18-8-2
13,3
130, 132, 134, 135,
136, 137, 138
262
710
0,068
195
1,17
2
SJO Глава 35
Металлические магний [71], кальции [145], барий и стронции [39J
восстанавливают каждый окись другого. О восстановлении окислов щелоч-
ноземельных металлов алюминием сообщил Милле [84] в 1877 г., ио другие
исследователи показали, что конечный продукт реакции при этом пред-
ставляет сплав алюминия с щелочноземельным металлом [5, 10, 27]. Фудзи-
та и Йокомизо [42] восстановили окись бария* алюминием при температурах
1000—2000° и остаточном давлении 10 3 мм рт. ст. Восстановление иачи
нается при 1040° и выход бария составляет около 50%. Помимо бария,
образуются алюминаты бария различного состава, однако основная реак-
ция может быть описана уравнением
6ВаО+2А1 —> ЗВа+ЗВаО-А^з.
Орман и Цимбала [103] описали процесс, по которому окись бария
смешивается с алюминием в соотношении 10 : 1 по весу и порциями весом
до 715 г подвергается дистилляции в аппаратах при остаточном давлении
10 1 мм рт. ст. и температуре 1125е в течение 6—7 час. При 700° реакция
завершается:
4ВаО+2Л1 ¦ ВаО-А12О3+ЗВа-(-488ккал.
Однако для перегонки расплавленного бария требуется более высокая
температура. Побочная реакция, по которой получается промежуточный
продукт ВаАЦ, снижает выход бария. При 925" выход ахмаапяет лишь
27,4%, при 1025°—28,2%, при 1075°-32,3% и при 1125°—34%. Для
осуществления процесса необходим высокий вакуум A0 ' мм рт. ст.).
В качестве восстановителя был предложен также кремний, причем получе-
ны совершенно аналогичные результаты [148, 149].
Процесс получения бария, предложенный Гунтцем [52, 53], состоит
в нагревании при 1200е окиси бария и алюминия (взятых в соотношении
3 моля ВаО на 2 моля А1) в вакууме с последующей конденсацией паров
бария на холодном конце трубки. Позднее Матиньон [87] предложил при-
менять вместо алюминия более дешевый кремний или 90%-ный ферросили-
ций, но при этом температура восстановления должна быть на 50L выше,
чем в случае применения алюминия.
Окись бария легко восстанавливается алюминием; таким путем полу-
чены сплавы, содержащие 36% бария [5, 10]. При сжигании перекиси бария
с порошкообразным алюминием образуются сплавы, содержащие до G0?o
бария [128].
Гунтц [51] установил, что при электролизе расплавленного хлорида
бария получается не металл, а только субхлорид бария. Это подтверждено
Лгладзе и Эвелиани [2].
Барий производится в гораздо меньшем масштабе, чем кальций; объем
производства бария составляет всего лишь доли процента от производства
кальция, причем он в несколько раз дороже кальция. В табл. 6 приведен
химический состав бария, указана форма, в которой он поставляется, и стои-
мость малых партий технического бария.
1 Для производства бариевых сплавов часто применяется электролиз
расплавленных солей с катодом из тяжелого металла, который может быть
введен также в виде соли или получен из дополнительного растворимого
анода. Таким способом Корнилов [73] получил бариевоципковын сплав,
содержащий 11% бария. Аналогичным путем Фрэри [28] получил сплав
свинца, содержащий около 2% бария и некоторое количество кальция.
* Получение окиси бария и других его соединений из минерального сырья опи-
сано М. К. Барановой в главе «Барий» (см. «Основы металлургии», т. 3, Металлург-
иэдат, 1963, стр. 483—493). — Прим. рсд.
Щелочноземельные металлы — кальций, стронций, барий 941
Рэн 1110] показал, чго электролизом расплавленных солей с катодом из
тяжелого металла можно получить бариевые сплавы с 73% сурьмы,
72% олова, 84"о висмута и 97% алюминия соответственно.
Гуитц [51] и Готье [45] обнаружили, что полученный электролизом
расплавленных солей кадмиевобариевый сплав в вакууме при высокой
температуре дает совершенно чистый барий.
Кальций также является подходящим восстановителем хлорида бария.
Мутман, Вейсс и Метцгер [95], проводя эту реакцию, получили барисво-
кальциевый сплав.
Процессы получения бария и ого сплавов изучал также Кроль [75].
Савамото и Асаи [114] изучили процесс получения бария из окиси бария
и карбида кальция.
Металлический барий легко реагирует с водой и многими кислотами.
При нагревании бария в водороде приблизительно до 200е происходит
бурная реакция образован-ия гидрида бария ВаН2. Гидрид бария — твердое
соединение серого цвета, которое легко разлагается водой и кислотами. Нит-
рид бария BaNe при нагревании разлагается со взрывом*. С углеродом и азо-
том барий взаимодействует, образуя цианид бария — термически очень
устойчивое соединение. Металлический барий хорошо раскисляет медь, на
что указывают в своей работе Шумахер и Эллис [116]. Физические свойства
бария даны в табл. 7. Металлический барий не проявляет свойств сверх-
проводимости вплоть до 0,15°К [35, 49]. Массы отдельных изотопов бария:
барии-136 135, 9488J 0,0010; барий-137 136, 9502 J 0,0010; барий-138
137, 9498ц 0,009.
Сплавы бария с алюминием и магнием используются в качестве газо-
поглотителей в электронных лампах. Джеффри [62] установил, что тонкая
пленка бария на специальных стальных шариках значительно увеличивает
срок службы и уменьшает трение вращающихся анодов в высоковакуумних
рентгеновских трубках, чго дает возможность применять эти аноды при
сравнительно высоких температурах.
В патентной и другой литературе [44, 70, 101, 115, 119] упоминается
о множестве различных геттеров. Блумер [20] и Вейгнер [136] проана-
лизировали специальную область применения бария в качестве геттера
для азота, водорода, окиси углерода, углекислого газа и водяных паров.
Андерко [91 поароил линию ликвидуса для сплавов бария с магнием,
применяемых в качестве геттеров. Ода [100], а также Моррисон и Зеттер-
штром [941 изучили процесс адсорбции барием окиси углерода при низких
давлениях, а Вейгнер [137] сделал сообщение о спаде скорости поглоще-
ния для бариевых геттеров.
Дюффендек, Вольф и Рандольф [36] применяли никелевобарисвый
сплав для запальных свечей, чтобы обеспечить абсолютно точную работу
и постоянное напряжение в искровом промежутке. Имеется также сообще-
ние Рандольфа 1109] о применении сплавов Ni— Ва и Ni - Ва — Си.
Уэстрам и Эйринг 1142] получили америций в очень малых количествах
восстановлением AmF3 барием в высоковакуумной печи при 1100 .
Барин и стронций имеют изотопы с большим периодом полураспа-
да, которые содержатся в продуктах деления U3SS [144] на тепловых нейт-
ронах.
Мур и Эллисон [93] изучили адсорбцию стронция и бария на вольфра-
ме. Работа выхода для мономолекулярного слоя стронция составляет при-
* Соединение BaNB. или Ba(N3J, является азидом бария; оно, действительно,
разлагается при нагревании. Нитрид бария Ba3N., напротив, образуется при нагре-
вании бария в присутствии азота п интервале 260 -600'.— Прим. ред.
942 Глава 35
близительно 2,2 в, а для бария 1,9 в. Адсорбция осуществляется как физи-
ческий, а не химический процесс, даже несмотря на то что средняя энер-
гия активации десорбции для стронция равна 77,4, а для бария 80,7 коал!моль.
Агладзе и Эвелианн [3] получили кадмиевооариевые сплавы в расплавлен-
ной среде электролизом расплавленной смеси 40—75% хлорида бария
и 27—60% хлорида калия при 700—720° в электролизере с жидким кацмие-
вым катодом. Получены сплавы, содержащие до 40% бария. Эти сплавы
очень рыхлы и обладают очень большой активной поверхностью. Для спла-
вов, содержащих от 25 до 30% бария, выход по току колеблется от 88 до 95%.
ЛИТЕР АТУ Р А
1. Achard J С, С а г а Р., L о г i e г s .!., С. R., 243, 493 A956)
2. А г л а д з е Р. И., Эвелиани А. Ш., Труды Грузинского политехнического
института, № 5, 147 A955).
3. А г л а д з е Р. И., Эвелиани А. Ш., Труды института металлургии и гор-
НО1 с дела АН ГрузССР, 2, 89 A949). ,
4. A h m а п п П. Н., Iowa Stale Coll. J. Scl., 27, 120 A953).
5. A 1 b e r t i E, Z. Metallkunde, 26, 6 A934).
6. A I e x a n d e г Р. Р., пат. США 2606100, 1952.
7. A 1 e x a n d e г Р. Р., пат. США 2656268, 1953.
8. A I e x a n d e г Р. Р., пат. США 279-1732, 1957.
9. Anderko К- P., Trans. AIME, 209, 612 A957).
10. A n d r e s s K. R-, A I b e г t i F.., Z. Metallkunde, 27. 126 A935).
11. A n d r i e u x J. L., В о n n i e г Е., С. R., 243, 1259 A956).
12. A n s e 1 i n F., F a u g e г a s P., G г i s о n E., С R., 242, 1996 A956).
13. A s a i H., Nippon Kinznku Gakkaishi, 16, 4G4 A952).
14. Barton J., пат. США 2684898, 1954.
15. В a s s e г e a u G. J. А., франц. пат. 1004466, March 31, 1952.
16. В a s t i e n P., Rev. met., 32, 120 A935).
17. В е а г d A. P.. Crooks D. D., .1. Electrochem. Soc.. 101, 597 A954).
18. В e 1 I W. А., В u t t r a m H.J, Love L. O.. U. S. Atomic Energy Commis-
sion, Kept. № Y-692, 1950.
19. В e t с h e г m a n I. 1., P i d g e о n L. M., Trans. Can. Inst. Mining Met. Engrs.,
54. in Can. Mining Met. Bull., № 468, 253 A951).
20. В 1 о о m e r R. N.. Brit. J. Appl. Phys., 8, 40 A957).
21. В r i d g m a n P. W.. Proc. Am. Acad. Arts Sci., 84, 111 A955).
22. В u г ne t t R. L., пат США 2650085; англ. пат. 698861, 1953.
23. С а 1 i n g a e r t G.. пат. США 2543.490, 1951.
24. С a m b г on A., Alexander W. A., Can. J. Chem., 34, 665 A956).
25. С а г 1 s о п О. N.. S с h in 1 d t F. A., Wilhelm H. A., J. Electrochem. Soc,
104, 51 A957).
26. С о 1 1 i n s T. L.NIer A. O., Johnson W. H., Phys. Rev., 84, 717 A951).
27 Compagnie de produits chimiques et electrometallurgiques Alais, Froges et Camar-
gue, франц. пат. 935324, June 16, 1949.
28. Cowan W- A., Sirapkins L. D., H i e г s G. O., Trans. Electrochem. Soc,
40, 27 A921).
29. С u b i с с i о t t i D., J. Am. Chem. Soc, 74, 557 A952).
30. С u I 1 e г G., F e г п b а с h S., Sherman N., Phys. Rev., 101, 1047 A956)
31. D a a n e A. H., S p e d d i n g F. II., J. Electrochem. Soc, 100, 442 A953)
32. D e Hollander W. R, U. S. Atomic Energy Commission, Rept. № HW-38912,
1955.
Щелочноземельные метал.%ы — кальций, стронций, барий 943
33. Dominion Magnesium, Ltd., англ. пат. 664061, January 2, 1952.
34. D о u g 1 a s I. P. E.. Proc. Phys. Sec. 67B, 783 A954).
35. Duckworth H. E., К e g I e у С L.OIson J. M., Stanford G S.,
Phys. Rev., 83, 1114 A951).
36. D u f f e n b а с к О. S., Wolfe R. A., Randolph D. W., Trans. Eleclro-
chem. Soc, 59, 181 A931).
37. F i e 1 d E., Feller А, пат. США 2726234, 1955.
38. F о s t e r L. S., M a g e 1 Т. Т., пат. США 2834672, 1958.
39. Франц. пат. 366761, October 11, 1906.
40. F u j i t a E., Repts. Govt. Chem. Ind. Research Insl. Tokyo, 45, 378 A950);
49, 233 A954); J. Electrochem. Soc. Japan, 22, 528 A954).
41. Fuji t a E., Yokomizo H., J. Electrochem. Soc. Japan, 19, 148 A951);
22, 413 A954).
42. F u j i t a E., Yokomizo H., Repts. Govt. Chem. Ind. Research Inst.
Tokyo. 47, 291 A952)
43. F u j i t a E., Y о к о m i z о Н., К u г о z а к i Y., J. Eleclrochem. Soc. Japan,
19, 196 A951).
44. G a b b r i e 1 1 i E., итал. пат. 537699, January 2, 1956.
45. G a u t i e г Н., С R., 134, 1054 A902).
46. G i Ъ b s D. S., S v e с H. J., Harrington R. E., Ind Eng. Chem., 48,
289 A956).
47. G i ] b e r t H. L, Block F. E. J. Electrochem, Soc., 102, 394 A955).
48. G i r a i t i s A. P., пат. США 2756141, 1956.
¦49. Goodman В. В., Proc. NBS Semicentennial Symposium Low-Temp. Phys.,
Natl. Bur. Standards. 519, 71 A952); Nature, 167, 111 A951).
50. G r u b e r B. A., G о r d о n E., J e r m a i n R. А., пат. США 2735668, 1956.
51. G u n t z A., Chim. et ind. (Paris), Special № 461 (February 1929).
52. G un tz A., C. R., 143, 339 A906)
53. G u n t z A., G a 1 1 i о t, С R , 151, 813 A910).
54. H a r t m a n n II., Schneider R., Z. anorg. allgem. Chem., 180. 275 A929).
55. Hawkes A. S., К г о h n I. Т., пат. США 2759896, 1956.
56. H 1 1 1 Е. F., пат. США 2543406, 1951.
57. Н i I I E. F., S о г о о s H.. пат. США 2543407, 1951.
58. Homer H. J., W h i t а с г е J. R., пат. США 2839423, 1958.
59. Н и Ъ е г Е. J., Jr., Н о 1 1 е у С. Е., Jr., J. Phys. Chem., 60, 498 A956).
60. H u in e-R о t h а г у W., Atomic Theory for Students of Metallurgy, Inst. Metals,
London, 1945.
61. Jaffe S., Parks J. Al.. пат. США 2839380, 1958.
62. J e f f r i e s Z., Mining and Met., 22, 82 A941).
63. Johnston J. H., пат. США 2819158, 1958
64. Keller W. H.. L у о п W.L.Svec H. J., T h о m p s о n R., U. S. Atomic
Energy Commission, Rept. № ГШ-5223, p. 446, 1952.
?5. К e 1 1 e у К- К-, U- S. Bureau of Mines, Bull. № 383 A935).
66. К e 1 1 e у К. К-, U. S. Bureau of Mines, Bull. № 393 A936).
67. К e 1 1 e у К.- К-, U. S. Bureau of Mines, Bull. № 476 A949).
68. К e 1 I e у К- К-, U. S. Bureau of Mines, Bull № 477 A950).
€9. К e 1 1 у J. С R., Jr., пат. США 2702739, 1955.
70. К i n g A. J., пат. США 2437097, 1948.
71. К i r s e b о m G. N.. пат. США 2111367, 1938.
72. К 1 i n e R. M., Z a f f a r a n о D. J, U. S. Atomic Energy Commission, Rept.
Mb ISC-510, 1954.
73. Корнилов И. И., J. Inst. Metals, 4, 385 A939).
74. К г о 1 I W. J., Trans. Electrochem. Soc, 78. 35 A940).
944 Г л аеа 35
75 К г о 1 1 W. J., U. S. Bureau of Mines, Inform. Circ. № 7327, 194S.
76. К u b a s с h e w s к i O.,Dench W. A., Bull. Inst. Mining Met., 599, 1 A9S6).
77. L e m in о n A.W., Ward J. J.. Fischer S. M., G с a n к о p 1 i s С J.^
С 1 e g g J. W-, U. S. Atomic Energy Commission, Rcpt. № BMI-S50, I9S2.
78. L i 1 1 i e n d a li 1 W. С, пат. США 2537067, 1951.
79. L i 1 1 i e n d a h 1 W. C, R e n t s с h 1 e г Н. С, пат. США 2537068, 1951.
80. L о п g J. R.. Iowa Slate Coll. J. Sci., 27. 213 A953).
81 L о о m i s С. С, Trans. Electrochem. Soc, 89, 207 A916).
82. M а с D о n a 1 d D. K- C, Mendelssohn K.. Proc. Roy. Soc A202_
523 A950).
83. M с К е с h n i e R. K, Scybolt A. U.. J. Electrocheni. Soc, 97, 311 A950).
84. Mallet J. W , Liebig's Ann. Chem., 190, 62 A878).
85. M a n t e 1 1 С L., Industrial Electrochemistry, 3rd ed., McGraw-Hill Book Com-
pany, Inc , New York, 1950, p. 535.
86. M a n I e 1 1 C. L., H a r d у С, Calcium Metallurgy and Technology, Reinhold
Publishing Corp., New York,1945.
R7. M a t i g n о n, С R., 156, 1378 A913).
88. M e e p с о н Г. А., К о л ч и н О. П., Атомная энергия, 2, 305 A957); Сборник
научных трудов Московского ин-та тщетных металлов н золота, №25, 195 A955).
89. М е i s t e r G., U. S. Atomic Energy Commission, Rept. № MDDC-I673, 1948.
90. Mel lor J. W-, A Comprehensive Treatise on Inorganic and Theoretical Che-
mistry, Vol. 3, Longmans, Green and Co., Inc., New York, 1946.
91. M e 1 s e r t H., T i e ri e m a T. J., В u r g e r s W- G., ActaCryst., 9, 525 A956).
92. M i 1 1 e r G. L., Vacuum, 2, 19 A952).
93 Moore G. E., A 1 1 i s о n II. W-, J. Chem. Phys., 23, 1609 A955).
94. M о r r i s о n J., Zetterstrom R. В., J. Appl. Phys., 26, 437 A955).
95. M u t h m a n n W, W e i s s L, Metzger J-, Liebig's Ann. Chem., 355, 111
A907).
96. National Research Council of Canada, англ пат. 728821, April 27, 1955.
97. Neumann В., В e r g v e E., Z. Elcktrochem., 20, 187 A914).
98. Nishida К.., япон. пат. 3102, July 3, 1953.
99. N о t t о r f R. W., Iowa State Coll. J. Sci., 26, 255 A952).
100. О d a Z., Oyo Butsuri, 25, 234 A956).
101. О d a Z., A r a t a H., Yoshida S., Oyo Butsuri, 25, 240 A956).
102. О r m a n M., Prace Inst. Ministerstwa Hutnictwa, S, 129 A953).
103. О r m a n M., Z e m b a 1 a E., Prace Inst. Met., 4, 437 A952).
104. P a d g i t t F. L.. S m i t h M. В., T h о m a s W. H., пат. США 2761777, 1956.
105. P i d g e о n L M., Atkinson J. T. N.. Can. Mining Met. Bull.. № 429,
14 A948).
106. P i d g e о и L. M., M с С a t t у S. А., пат. США 2464767, 1949.
107. Pilling N. В., Phys. Rev., 18, 362 A921).
108. Приселков Ю. А., Несмеянов Аи. Н , ДАН СССР, 95, 1207 A954).
109. Randolph D. W., Trans. Electrochem. Soc, 66, 85 A934).
110. R а у К- W., Metals and Alloys, 1, 112 A929).
111. Ri nek E., C. R., 234, 845 A952).
112. R u d b erg E., Phys. Rev.. 46. 763 A934).
113. S a 1 1 e r H. A., R о ug h F. A., Chem. Eng. Progr., Symposium Ser., 50, № 11,
63 A954).
114. Sawamoto H., A s a i M., Research Repts. Fac. Eng. Nagoya Univ., 4, 41
A951).
115. S с h u 1 t i n k L., v a n Z a n t e n P. G., Philips Techn. Rev., 18, 222 A950—
1957).
116. Schumacher E. E., Ellis W. C, Trans. Electrochem. Soc, 61, 91 A932).
Щелочноземельные металлы — кальций, стронций, барий ®45
117. S с h w а г г R., Koster A.., Z. anorg. allgem. Chem., 285, 1 A956).
llrt. S h e I d о п E. A , К i n g A. J., Acta Cryst., 6, 100 A9S3).
119. Katz H., Siemens und Halske A.-G., пат. ФРГ 895478, November 2, 1953;
905517, March 4, 19S4.
120 Smith J.F, Carlson ON, Vest R. W., J. Electrochem. Soc., 103, 409
A9S6).
121. S п у d e г Т., Lipkin D., Katl. Nuclear Energy Ser., Div. V, 3, Misc. Phys.
ant! Chem. Techniques, 252, 1952.
122. Soriete anon, ties manufactures des glaces et produits chimiques de Saint-Gohain,
Chauny et Cirey, франц. пат. 973654, February 13, 1951.
123. S p e d d i n g F. H, D a a n e A. H., J. Metals, 6, 504 A954):
124. S p e d d i n g F. H., W i 1 h e 1 m H. А., К e 1 1 e r W. H., пат. США 278506S,
1957.
125. S p e d d i n g F. H., Wilhelm H. А., К e 1 1 e r W. H., пат. США 2797160,
1957.
126. S p с d d i n g F. H, W i 1 li e 1 m H. А., К e 1 1 e r W. H., A h m a n n D. H.,
D а а п е А. Н., Н а с h С. С, Ericson R. P., Ind Eng. Chem., 44, 553
A952).
127. Spedtling F. H., Wilhelm H. A., Keller W. H., I 1 i f f J. E.f
N e h e г С, U. S. Atomic Energy Commission, Rept. № TID-5232, p. 428, 1952.
128. S t a n s f i e 1 d E., Mem. Proc. Manchester Lit. and Phil. Soc, 48, Part I, Sec.
IV, 1 A901 — 1902).
129. Swisher С L., Phys. Rev., 10, 601 A917).
130. Taylor J. W., Metallurgia, SO, 161 A954).
131. Thomson G. W., G a r e 1 i s E., Ethyl Corporation, 1952.
132. Tomlin D. H., Proc. Phys. Soc, 67B, 787 A954).
133. T г а и t z M., Z. Elektroohem., 21, 130 A915).
131. Van A r к e 1 A. E., Reine Metalle, Herslelluiig-Eigenschaflen-Veiwcndung
(Appendix), J. Springer, Berlin, 1939.
135. von A n t г о р о f f A., F a 1 к E., Z. anorg. allgem. Chem., 187, 405 A930).
136. W a g e n e r S., Brit. J. Appl. Phys., 1, 225 A950); 2, 132 A951).
137. Wage пег S., Vacuum, 3, II A953); Proc Inst Elec Engrs., London, 99,
Part III, 135 A9S2).
138. Walsh K. A., U. S. Atomic Knergy Commission, Rept. № AFCD-3640, 1950.
139. Warrington 11. G., канад. пат. 534279, December 11, 1956.
140. Warrington H. G., M с P h a i 1 D. J., пат. США 2829878, 1958.
141. Wehner G., Freiberger Forschungsh., B17, 18 A956).
142. W e s t r u m E. F.. Jr., E у r i n g L., J. Am. Chein. Soc, 73, 3396 A951).
143. W
144. W
145. W
146. W
147. W
1 h e 1 m H. A., Long J. R., пат. США 2700606, 1955.
1 k i n s о n C.Crnmmiil W. E., Nucleonics, 9, 52 A951).
n k 1 e r C, Ber., 23, 2647 A890).
n t e г С H., Jr., пат. США 2586134, 1952.
n ter С. Н., Jr., пат. США 2763542, 1956.
148. Wo е li 1 е г L., Д1 u I I e r F., Z. anorp. allgem. Chem., 120, 49 AS21).
149. W о е h 1 е г L.. S с h и F F W, Z. anorg. allgem. Chem., 209, 33 A932)
Оглавление
Предисловие 5
Предисловие редактора к 1-му и'з д а н и ю. К- А. Гемпел. (Пере-
вод F. Г. Савельева) . . . . 7
Предисловие редактора ко 2-му изданию. К. А. Гемпел.
(Перевод Е. Г. Савельева) 9
1. Редкие металлы. К- А. Гемпел. (Перевод Е. Г. Савельева) . . . 11
2. Физические свойства мегиллон. К- А. Гемпел. (Перевод Е. Г. Савельева) 29
3. Бериллий. Б. Р. Кьеллгрен. (Перевод М. Б. Рейфмана) . 47
4. Бор. X. С. Купер. (Перевод Е. Г. Савельева) 81
5. Ванадий. Г. Э. Данн, Д. Л. Эдланб. (Перевод Е. Г. Савельева) 98
6. Висмут. Г. Э. Хоу. (Перевод А. Л. Любимовой) 122
7. Вольфрам. Д'. Ли. (Перевод Е. Г. Савельева) ... . 136
8. Галлий. А. П. Томпсон. (Перевод Н. А. Касаткиной) 164
9. Гафний. Д. Р. Мартин, Ф. Пшщолато. (Перевод Е. Г. Савельева) . 177
10. Германий. Г. Р. Харнер. (Перевод М. Б. Рейфмана) . . 204
11. Индий. Дж. Р. Миляс, Р. А. Кинг, К- Э. Уайт (Перевод 3 М. Никитиной) 218
12. Иприй. А. Диан. (Перевод Э. Г. Лавута) 245
13. Кадмий. Ф. Г. Мак-Гутчен, Дж. Р. Масграве. (Перевод А. А. Русакова) 264
14. Кобальт. К- Р. Уайттиор. (Перевод А. А. Русакова) ... . 280
15. Кремний. Д. У. Лайон, Д. Филд. (Перевод Е. Г. Савельева) . .' . 330
16. Литии. П. Ландольт, М Ситтиг. (Перевод Э. Г. Лавута) . . 343
17. Марганец. '/. Л. Мантелл. (Перевод А. Ф. Иванова) ... . 384
18. Молибден. Р. С. Арчер. (Перевод В. Б. Тулиновой) . . 4U0
19. Ниобий. Э. М. Шереуд. (Перевод И К. Берлин) 429
2U. Платиновые металлы. Ф. Э. Бимиш, У. А. Мак-Брайд. Р. Р. Бэйрфут.
(Перевод А. Ф. Иванова) 469
21. Плутоний. У. И. Майнер, А. С. Коффинберри, Ф. У. Шинфельд, Дж. Т. Уо-
fiep, Р. И. Малфорд, Р. Э. Тейт. (Перевод Г. Л. Зверева) 511
22. Редкоземельные металлы. Г. Э. Кремерс. (Перевод Ю. Г. Ерсмнна) . 581
23. Реннй. А. Д. Мелавен. (Перевод В. И. Бибиковой) .... 617
24. Рубидий и цезий. К- А. Гемпел. (Перевод В. И. Кривеньо) 636
25. Селен. Дж. Р. Стоун, П. Э. Карон (Перевод А. А. Русакова) 645
26. Скандий. А. Г. Даан. (Перевод Л. Н. Комиссаровой) . 660
27. Таллий. Г. Э. Хоу. (Перевод 3. А. Горновой) . 669
28. Тантал. К- А. Гемпел. (Перевод И. К. Берлин) 678
29. Теллур. Дж. Р. Стоун, П. Э. Карон. (Перевод А. А. Русакова) 745
30. Тнтан. Г. Р. Огден. (Перевод М. Б. Рейфмана) . . 758
31. Торий. /'. А. Уилхелм. (Переиод М. А. Шлосберг) 786
32. Ур.ш. С. Иссероу. (Перевод Г Л. Зверева). . . 818
33. Хром. Р. У. Фонтзн. Перевод А. А. Русакова) . 860
34. Цирконий. А. У. Шлехтен. (Перевод Л. Н. Комиссаровой) 892
35 Щелочноземельные металлы—кальцин, стронций, барий. Ч. Л. Мантелл.
(Перевод Е. Г. Савельева) 922