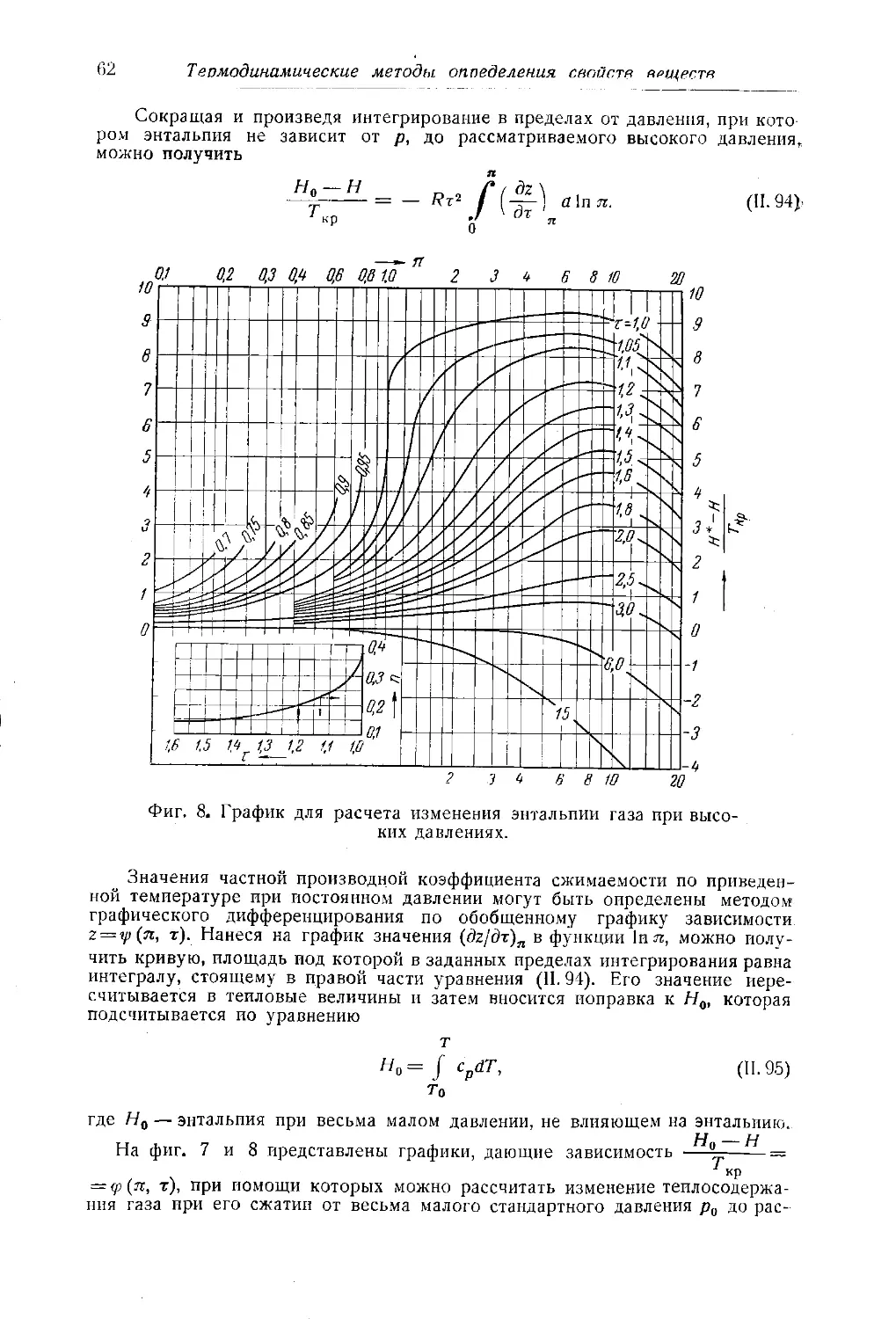
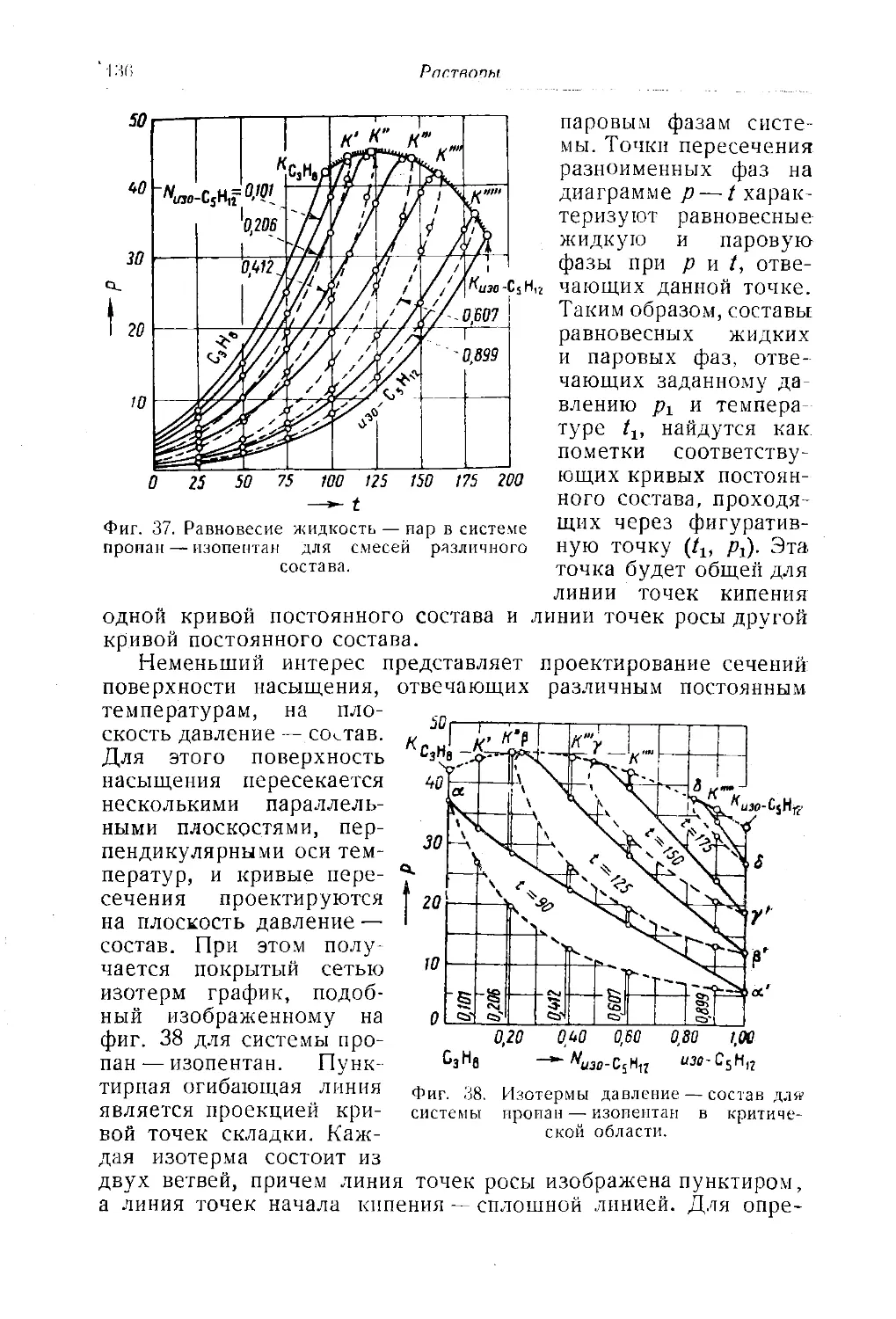
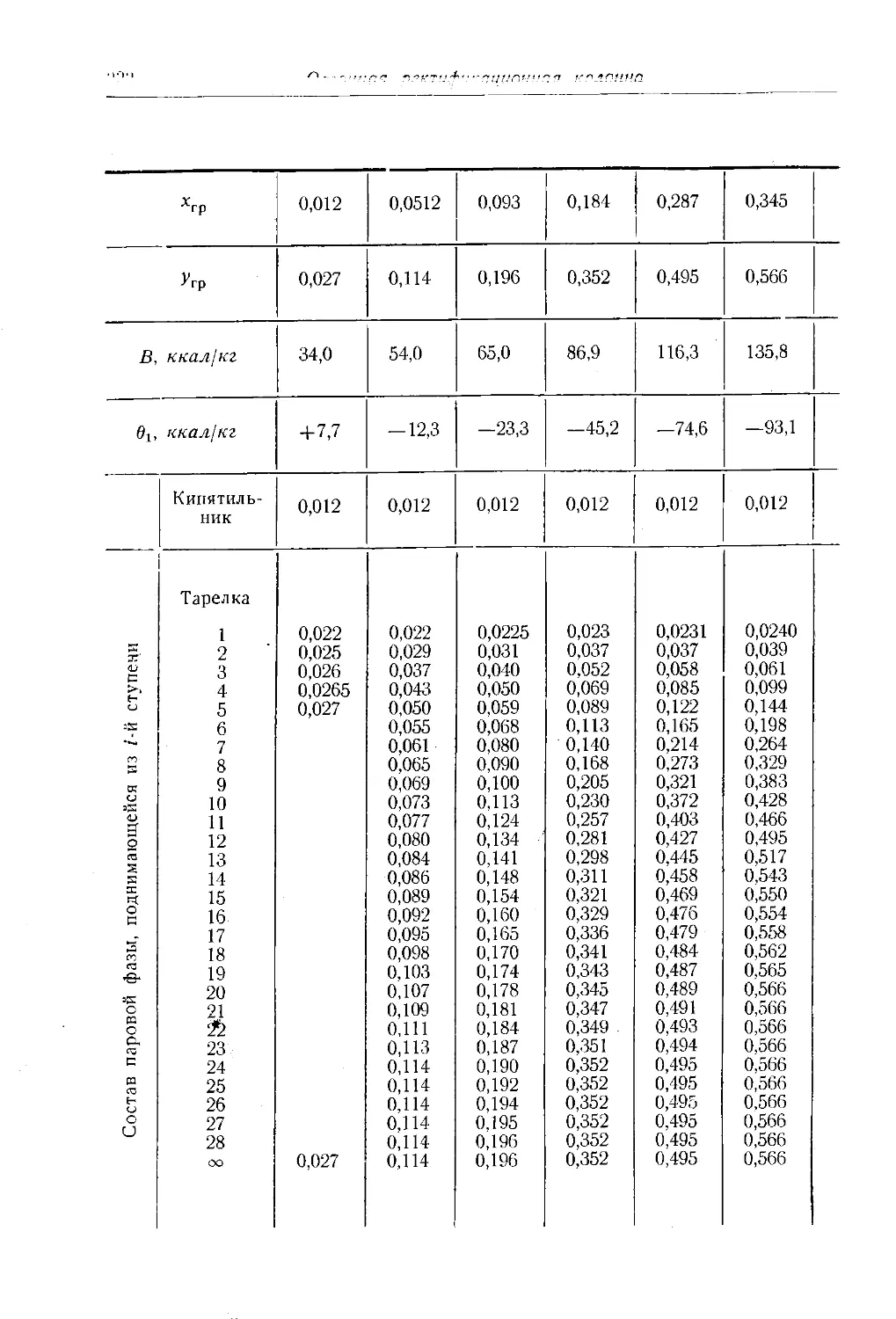
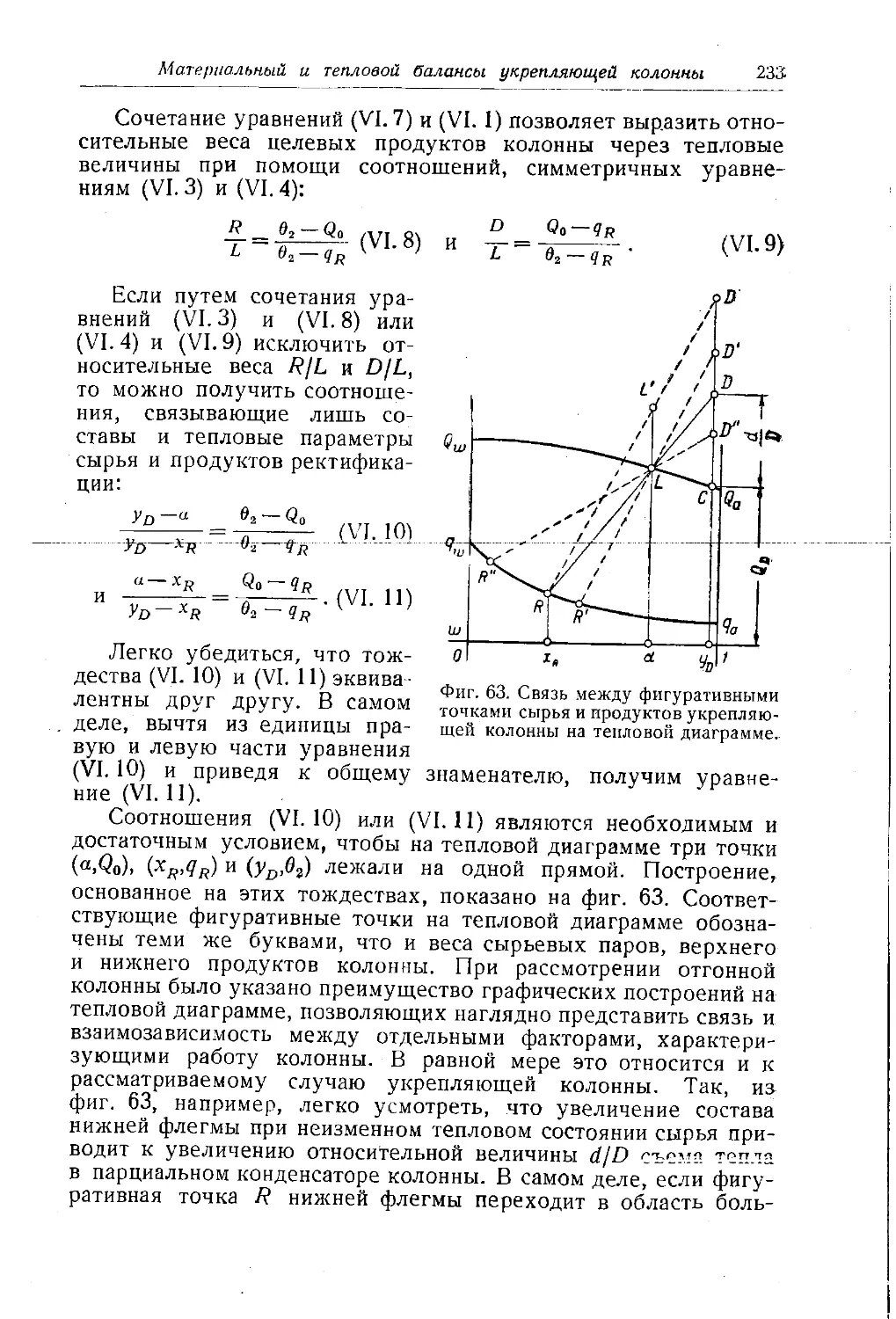
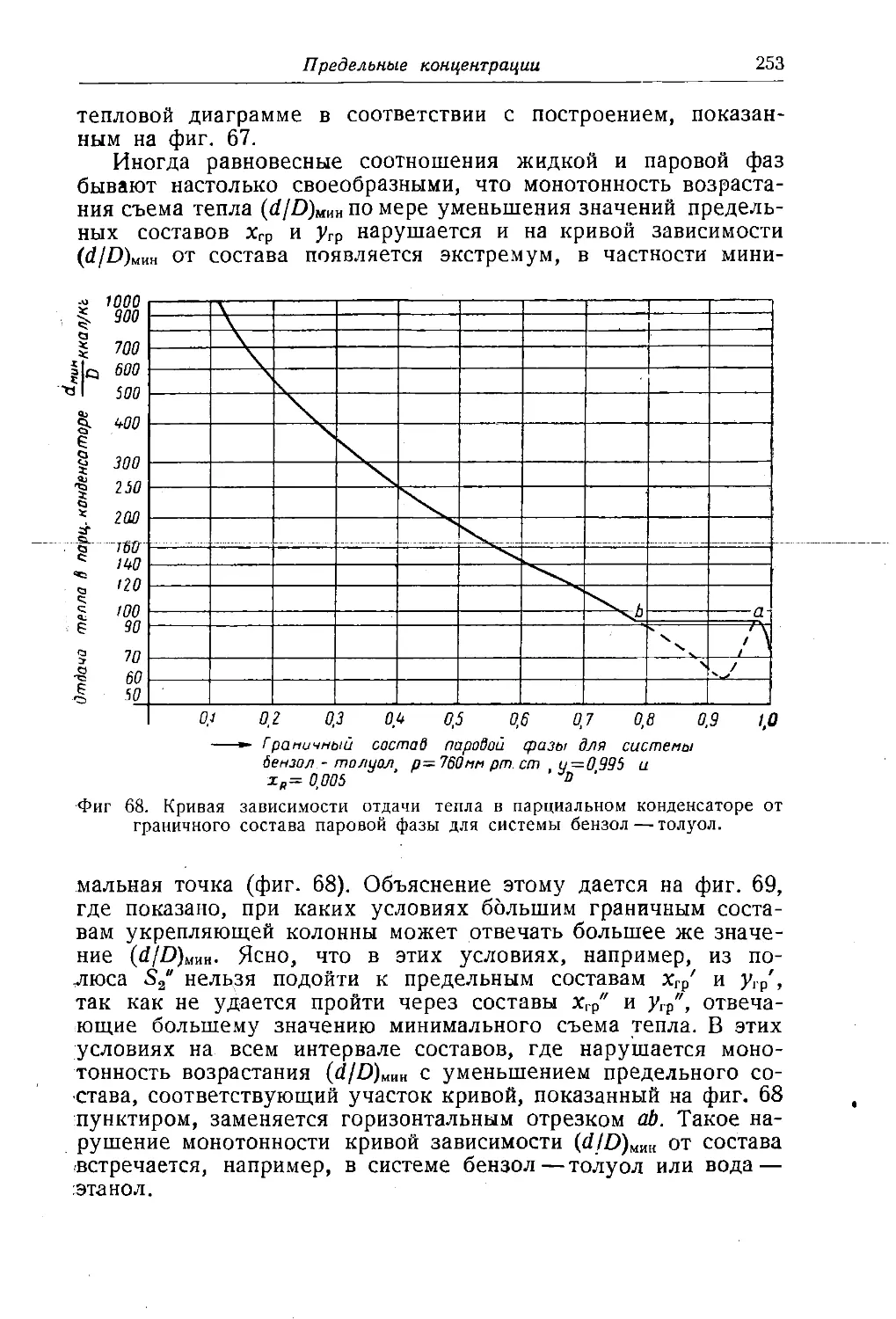
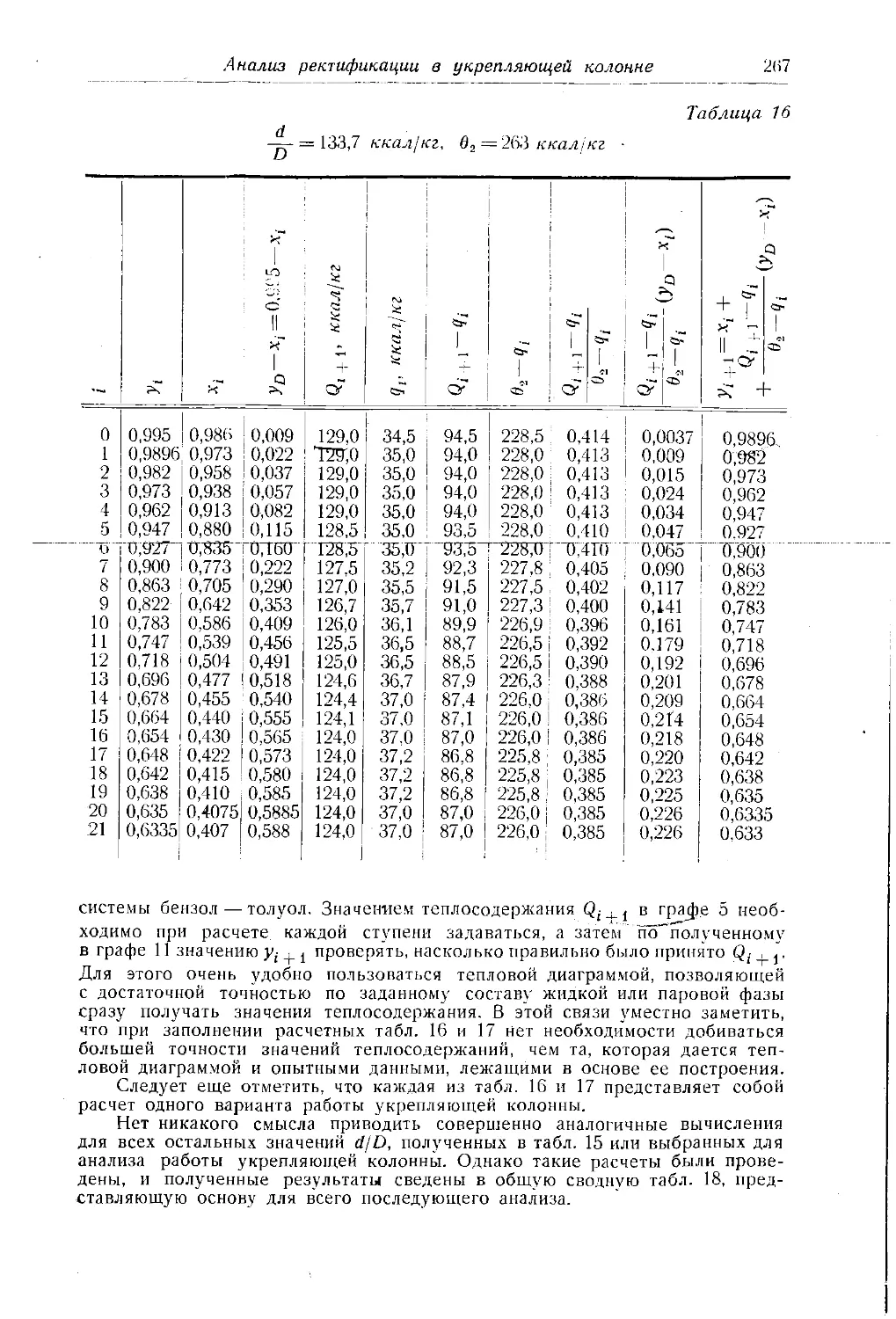
Автор: Багатуров С.А.
Теги: химия химическая промышленность нефтехимия государственное научно-техническое издательство
Год: 1954
Текст
С. А. Б АГ АТ У РОВ
КУРС
ТЕОРИИ ПЕРЕГОНКИ
И РЕКТИФИКАЦИИ
Допущено
Министерством высшего образования СССР
в качестве учебного пособия для вузов
БИБЛИОТЕКА
Ky'i^jj.e УИТК
М.,н :стеротва
Г фтян .й Пром-тти
ГОСУДАРСТВЕННОЕ НАУЧНО-ТЕХНИЧЕСКОЕ ИЗДАТЕЛЬСТВО
НЕФТЯНОЙ И ГОРНО-ТОПЛИВНОЙ ЛИТЕРАТУРЫ
Москва 1954
Книга является учебным пособием для студентов-технологов
по переработке нефти и может быть использована инженерно-
техническими работниками нефтегазовых и химических заводов.
Книга посвящена основам термодинамической теории про-
цессов перегонки и ректификации. На основе химической термо-
динамики излагается учение о равновесии и свойствах растворов
и паров, теория перегонки и ректификации, методы расчета
ректификационных колонн, вопросы азеотропной и экстракцион-
ной перегонки.
ВВЕДЕНИЕ
Переработка нефти и нефтепродуктов состоит из проводимых
в строго определенном порядке, стабильных по режиму, каче-
ственно различающихся единичных производственных процес-
сов. Последовательность этих производственных процессов
направлена на изменение свойств исходного сырья и имеет
целью получение продуктов, отвечающих техническим усло-
виям и стандарту при минимальных затратах труда, энергии и
материалов. Примерами таких единичных процессов являются
нагревание и испарение жидкостей, конденсация паров, абсорб-
---ЦИЩ.ЭКС1^акш1я...и.ректификация раствлров. отстощ фильтооаа-
ние и центрифугирование смесей и т. д. Каждый из этих единич-
ных процессов осуществляется в надлежащей типовой аппара-
туре. Так, для нагрева на нефтезаводах применяются трубчатые
печи и теплообменники, для охлаждения и конденсации — раз-
личные типы холодильников и конденсаторов, для абсорбции и
ректификации — колонные аппараты и т. д.
Основной технологический процесс переработки, предста-
вляющий в каждом конкретном случае сумму единичных про-
цессов воздействия на сырье, является предметом изучения тех-
нологии нефти и проектируется в зависимости от свойств-
исходного сырья и качеств целевых продуктов. Многообразие
целевых продуктов и качественные особенности различных видов-
нефтяного сырья вызвали необходимость деления технологии
нефти на несколько отделов, объединяющих группы родственных
технологических процессов по признаку свойств сырья и природы
конечных продуктов.
“В нашу задачу не входит классификация различных отделов,
технологии нефти, однако важно отметить, что в каждом из этих
отделов основной технологический процесс строится в опреде-
ленной системе и последовательности путем сочетания несколь-
ких единичных процессов, являющихся в значительной мере
общими для различных отделов технологии нефти.
В нефтяных вузах предметом курса «Процессы и аппараты!
технологии нефти» является изучение теории этих единичных
процессов, типовых для различных отделов технологии нефти, и-
установление режимов работы и методов расчета размеров И!
конструкций аппаратов, в которых осуществляются единичные
процессы.
I *
4
Введение
В курсе «Процессы и аппараты технологии нефти» основное
место занимает т е о р и я перегонки и ректификации,
представляющая собой наиболее глубоко и тщательно разрабо-
танную часть курса, изучение которой позволяет хорошо озна-
комиться с общими методами анализа процессов технологии
нефти. Разработка теории перегонки и ректификации требует
привлечения широкого круга основных понятий и представле-
ний, используемых в дальнейшем при исследовании других род-
ственных единичных процессов. Поэтому. в нефтяных вузах
изложение теории перегонки и ректификации предшествует дру-
гим разделам курса «Процессы и аппараты технологии нефти».
Эта традиция, заложенная еще в начале тридцатых годов
проф. А. М. Трегубовым, с тех пор укоренилась и во всех неф-
тяных вузах ныне общепризнана.
г ~ Для получения качеств целевых продуктов переработки
/нефти, удовлетворяющих техническим условиям и стандарту,
обязательным условием является их разделение при помощи
^ректификации в колонных аппаратах, составляющих неотъемле-
мую принадлежность почти каждой нефтезаводской установки.^
этой связи приобретает особую важность экономически наи-
более целесообразное их проектирование, основанное на строго
разработанной теории работы колонных аппаратов. Расчет,
проектирование, анализ работы и грамотная эксплуатация ректи-
фикационной колонны в промышленных и лабораторных усло-
виях связаны с целым рядом вопросов, относящихся к свойствам
жидких и паровых смесей, к процессам их кипения и конденса-
ции, обмена веществом и энергией при их соприкасании, глу-
бины протекания этого обмена в различных случаях и т. д. Все
эти вопросы для своего разрешения требуют привлечения раз-
личных данных и сведений из соответствующих областей физи-
ческой химии, химической технологии и термодинамики.
Рассмотрение круга вопросов, образующих научную основу
теории процессов перегонки и ректификации, в различных слу-
чаях может быть проведено с различной глубиной. Одни из этих
вопросов разработаны глубоко и тщательно, тогда как по другим
имеются лишь предварительные скудные данные, не идущие
дальше первого приближения в установлении сущности изучае-
мого явления. В одних случаях привлечение сведений из соот-
ветствующих смежных областей позволяет дать точную количе-
ственную оценку явления, в других же случаях приходится
ограничиваться первым качественным приближением ввиду
недостаточности и недоработанности имеющихся данных. Так,
например, привлечение надлежащих сведений из химической
термодинамики позволяет создать серьезное основание для по-
строения термодинамической теории процессов перегонки и
ректификации, тогда как сведения, имеющиеся по вопросам
механизма парообразования и диффузии в колоннах, еще недо-
Введение
статочны для строгой количественной оценки происходящего
процесса.
В самом деле, процесс ректификации в колонном аппарате
протекает в условиях тесного контактирования паровых и жидких
потоков и приводит к сложной картине взаимодействия фаз,
обменивающихся энергией и веществом. Качественная картина
этого сложного явления в первом приближении представляется
как двусторонний массо- и энергообмен, количественно оцени-
ваемый па основе гипотезы идеального контакта. Попытки более
глубокого исследования кинетической природы процессов обмена
веществом и энергией на контактной ступени не привели еще
к установлению достаточно обоснованных и надежных зависи-
мостей, позволяющих заменить метод теоретической тарелки,
основанный на статическом представлении процесса, кинетиче-
скими зависимостями, описывающими протекание процесса во
времени. Поэтому при проектировании ректификационной ко-
лонны следует сочетать данные теории с опытными показате-
лями, полученными при лабораторных испытаниях или снятыми
Г.действу.юпцих установок и обобщаюпщми практический опыт
работы передовиков-новаторов.
В последующих главах излагается термодинамиче-
ская теория процессов перегонки и ректификации, разви-
тием и углублением которой мы обязаны главным образом тру-
дам советских ученых: профессоров А. М. Трегубова и С. Н. Об-
рядчикова, исследованиям А. И. Скобло, Б. К. Америка и других.
Трудами этих исследователей, осветивших различные стороны
процесса ректификации и разработавших изящные и строгие
методы расчета, теория процессов перегонки и ректификации
была поднята с уровня чисто практического, можно сказать,
кустарного искусства на современный научный уровень. Труд
проф. А. М. Трегубова «Теория перегонки и ректификации»,
третье посмертное издание которого вышло в 1946 г., в течение
двух десятилетий остается настольной книгой инженеров-нефтя-
ников. Наиболее существенная его часть — оригинальная теория
ректификации сложных систем — плод многолетних исследова-
ний А. М. Трегубова. Следует также отметить исследования
А. М. Трегубова в области теории ректификации в присутствии
перегретого водяного пара, много способствовавшие выяснению
этого сложного вопроса; исследования, посвященные анализу
вариантов устройства колонн и режима их работы, и другие не
менее важные работы, уточнившие и исправившие много невер-
ных понятий и представлений. Проф. С. Н. Обрядчиковым были
выполнены важные работы по теории и методам расчета ректи-
фикационных колонн для разделения нефтяных смесей, изучалась
теория ректификации в присутствии перегретого водяного пара
в общем и частном случаях, были предложены свои оригиналь-
ные методы расчета сложных колонн. Трудами А. И. Скобло
6 Введенир
дана наиболее верная картина работы перегретого водяного
пара в отгонной колонне и исследованы вопросы четкости раз-
деления при ректификации нефтяных смесей. Из работ Б. К- Аме-
рика особо следует отметить его исследование по расчету пита-
тельной секции полной колонны, остающееся до сих пор лучшим
из всего, что в этой области было опубликовано в литературе.
Заметную роль в уточнении и развитии теории ректификации
сыграли книга Н. И. Гальперина «Дестилляция и ректификация»
(1947) и соответствующие главы учебника А. Г. Касаткина
«Основные процессы и аппараты химической технологии».
ГЛАВА I
ОСНОВЫ ТЕОРИИ ТЕРМОДИНАМИЧЕСКОГО
РАВНОВЕСИЯ
Научной основой теории процессов перегонки и ректификации
•является учение о термодинамическом равнове-
сии. Основные понятия и положения этого учения излагаются
в курсах физической химии и химической термодинамики с общей
точки зрения, не имеющей в виду специального развития вопро-
сов, непосредственно относящихся к этим частным процессам.
_ у ппттпу Агчтт п о’.т2'ттгчг»^тг ч-ттлтгпгг попттгталттп штдат
11U51UMT“" DDM/ljV UCUUUil 'DumHWlH " "у 'ICllllM XT ривимвеснн • llwlCC*'"
смысл привести изложение основных понятий этой теории и тех
ее выводов, которые имеют важное значение для развития науч-
ных основ теории процессов перегонки и ректификации.
Для строго дедуктивного термодинамического метода иссле-
дования явлений требуется точное и полное определение ряда
основных понятий и терминов, широко используемых в соб-
ственно термодинамике и во всех областях ее непосредственного
приложения. Несмотря на видимую общеизвестность этих поня-
тий и терминов, ясное и отчетливое усвоение их содержания
требует серьезного продумывания и является обязательным
условием, без которого невозможно изучение излагаемого
далее материала. Поэтому целесообразно эти основные понятия
и термины рассмотреть предварительно, определив их в соот-
ветствии с наиболее удачными из имеющихся в литературе фор-
мулировок вкладываемого в них содержания fl, 3, 10, 15].
§ 1. Тело
Определенный объем вещества, являющийся объектом термо-
динамического рассмотрения и характеризующийся рядом физи-
ческих и химических свойств, называется телом. Тело может
быть физически однородным или неоднородным
в зависимости от того, одинаковы ли во всех его частях харак-
теризующие его физические свойства. Точно так же, тело может
быть химически однородным или неоднородным, смотря
по тому, состоит ли оно из молекул одного лишь вида или
составлено из разнородных молекул. Например, естественный
нефтяной газ является химически неоднородным телом, так как
представляет смесь метана, этана, пропана и других индиви-
дуальных газов, а этанол — химически однороден, так как со-
стоит из одинаковых молекул, в которых углерод, водород и кис-
лород химически соединены друг с другом. Однако и естествен-
ный нефтяной газ и этанол являются физически однородными
телами, так как во всех частях характеризуются одними и теми
же значениями физических свойств.
§ 2. Свойства и состояние тел
Все характеризующие тело признаки, значения которых могут
быть измерены опытным путем, называются свойствами тела.
Физическими свойствами веществ являются удельные объемы,
упругости паров, температуры, содержание тех или иных соста-
вляющих в смеси и т. д. Их называют параметрами состояния
тела, так как совокупность значений физических свойств
является единственным способом характеристики состояния тел.
В самом деле, иначе никак нельзя определить состояние
тела, как указав численные значения свойств во всех его частях.
В свете этого определения ясно, что изменение хотя бы одного
из свойств влечет за собой изменение состояния всего тела.
Здесь уместно остановиться на одной важной особенности
термодинамических свойств тела. Каждая совокупность значений
свойств описывает некоторое вполне определенное состояние тела
независимо от того и без всякой связи с тем, каким путем тело
пришло именно к этому состоянию. Свойства тела являются
функциями его состояния, и если последнее так или иначе
зафиксировано, то все свойства тела сейчас же приобретают
строго определенные и единственные для данного состояния
значения. Так, например, способ получения кумола (а таких
способов известно несколько) не является его свойством, тогда
как его удельный объем или упругость пара при данной темпе-
ратуре являются в термодинамическом смысле свойствами
кумола. Совокупность значений свойств системы определяет ее
термодинамическое состояние, и, наоборот, каждому определен-
ному равновесному состоянию системы отвечает одно единствен-
ное сочетание значений ее свойств, причем важно отметить, что
установленное соответствие является взаимно однозначным.
Знание основных свойств веществ, имеющих значение в опре-
деленном, выясняемом далее смысле, — необходимое условие
всякой инженерной деятельности.
§ 3. Процесс
Любое физическое или химическое изменение состояния тела
называется процессом. Так, например, увеличение удельного
объема газа является показателем процесса его расширения,
Процесс 9
а повышение температуры тела характеризует процесс его
нагрева. Таким образом, понятие процесса связано всегда с опре-
деленным изменением свойств и соответственно состояния тела.
В термодинамике имеют важное значение некоторые специаль-
ные виды процессов, протекающих в определенных, ограничен-
ных известными требованиями условиях. Это процесс изотер-
мический, при котором температура тела сохраняется все
время неизменной, процесс изобарный, при котором не
меняется давление, оказываемое на тело, процесс изохор-
н ы й, протекающий без изменения удельного объема тела, и
процесс адиабатический, при котором к телу не подво-
дится и от тела не отводится тепло.
§ 4. Система
Одно тело или такая совокупность тел, между которыми
обеспечена возможность теплообмена, а также возможность
диффузии хотя бы одного вещества, называется системой [If.
----Систем я., нр обмрниняютпяяся энергией с. окружающей, средой,
называется изолированной системой. Понятие изолированной
системы имеет предельный характер и является такой же удоб-
ной рабочей гипотезой, как понятия совершенного газа или
идеального раствора, способствующие установлению закономер-
ностей поведения реальных газов и растворов. Удобнее всего
представлять изолированную от воздействия окружающей среды
систему, как находящуюся в бесконечном отдалении от источ-
ника воздействия или же как отделенную от него оболочкой,
обладающей бесконечно большим сопротивлением ко всякого рода
внешним воздействиям. Конечно, в реальных условиях невоз-
можно абсолютно уничтожить взаимодействие системы с окру-
жающей средой, однако в каждом конкретном случае можно
сделать его пренебрежимо малым. Это и имеется в виду в опре-
делении изолированной системы.
Представление о системе является весьма важным понятием
при исследовании поведения различных тел. При решении
каждой рассматриваемой проблемы выбор надлежащей системы
должен делаться с учетом того, чтобы количество вещества в ней
ограничивалось необходимым для исследования данной про-
блемы минимумом.
Пусть в сосуде содержится определенный газ. В данном слу-
чае термодинамической системой является сам газ, стенки же
сосуда, с которыми газ взаимодействует и от положения которых
зависит объем газа, не составляют согласно определению части
системы. Если в том же сосуде помимо газа содержится еще
жидкость, в которой газ растворим, то системой является уже
совокупность жидкости и газа.
10 Основы теории термодинамического равновесия
§ 5. Фаза
Если значения параметров состояния системы одинаковы во
всех ее точках или меняются непрерывно без скачков, то система
называется однородной или гомогенной. Определенное количе-
ство вещества, физически однородное во всей массе, назы-
вается фазой. Если каким-нибудь произвольным способом раз-
делить фазу на части, то состояние всех частей окажется одним
и тем же.
Система может состоять из одной или нескольких фаз, от-
деленных друг от друга поверхностями раздела. При этом
каждая отдельная фаза не только должна быть однородной, но
и по своим свойствам должна отличаться от других фаз системы,
ибо требование однородности фазы не предполагает ее непре-
рывности и не исключает возможности ее деления на части.
Так, если на поверхности масла плавает несколько кусков пара-
фина или в насыщенном соляном растворе распределены отдель-
ные кристаллы, то единственной твердой фазой является сово-
купность последних. Другим примером является система, состоя-
щая из практически нерастворимых воды и нефти. Если взбал-
тывать сосуд, в котором содержится эта система, то вода может
разбиться на мелкие капельки, но это не отразится на числе фаз
системы.
Таким образом, если определенные части системы обладают
тождественными свойствами, то они образуют одну фазу неза-
висимо от того, оторваны они друг от друга или нет.
Если система состоит из нескольких фаз, то последние отде-
ляются одна от другой поверхностями раздела, на которых имеет
место скачкообразное изменение значений свойств или, как
говорят, разрыв непрерывности свойств системы. Такие системы
называются неоднородными или гетерогенными.
§ 6. Экстенсивные и интенсивные свойства
Свойства системы делятся на два больших класса в зависи-
мости от того, пропорциональны они массе системы или не зави-
сят от нее. Свойства, пропорциональные количеству вещества
в системе, называются экстенсивными свойствами; свой-
ства же, полностью не зависимые от количества вещества
в системе, называются интенсивными. Примерами экстен-
сивных свойств являются вес, масса, общий объем, общее тепло-
содержание. Объем, занимаемый десятью молями газа, при про-
чих равных условиях в десять раз больше его молярного объема.
Примерами интенсивных свойств являются температура, давле-
ние, плотность, удельный объем, концентрация и т. д. Вообще
те свойства системы, значения которых остаются неизменными,
когда количества всех компонентов системы увеличиваются
Фазовое равновесие 11
или уменьшаются в одно и то же число раз, являются интен-
сивными свойствами. Некоторые интенсивные свойства могут
быть выведены из соответствующих экстенсивных свойств при-
ведением их к удельному значению.
В качестве примера можно указать такие интенсивные свой-
ства, как удельный объем или удельный вес системы.
Для характеристики состояния системы используются лишь
ее интенсивные свойства, которые и называются термодинами-
ческими параметрами состояния.
§ 7. Фазовое равновесие
Фазы системы могут взаимодействовать друг с другом, обме-
ниваясь веществом и энергией, причем их составные части будут
самопроизвольно через поверхность раздела фаз переходить из
одной фазы в другую. Этот самопроизвольный процесс массооб-
мена и энергообмена между фазами системы должен в итоге
привести к такому состоянию, когда скорость перехода из одной
фазы в другую в точности уравновесится переходом в противо-
положном направлении и в системе не будет наблюдаться "ника”'
ких видимых изменений.
В этом случае, когда во всех частях тела или системы все
параметры состояния сколько угодно долго будут оставаться не-
изменными, говорят, что система находится в равновесном со-
стоянии. В состоянии равновесия все характеризующие систему
свойства сохраняют постоянное значение, ибо действующие на
систему силы взаимно уравновешены и не могут изменить ее со-
стояния. Очень важно отличать истинное незаторможенное равно-
весие системы, при котором сбалансировано влияние действую-
щих на нее сил, от равновесия ложного; при нем в системе не
происходит изменений лишь вследствие относительно большого
сопротивления действующей силе, которого она не в состоянии
преодолеть. Критерием равновесия может служить бесконечно
малое изменение какой-нибудь действующей на систему силы,
которое должно при истинном равновесии иметь следствием
также бесконечно малое смещение положения равновесия.
Помимо требования неизменности во времени параметров со-
стояния для реализации равновесного состояния играет важную
роль второе и последнее требование — отсутствие внешних про-
цессов, поддерживающих эту неизменность параметров. Система
не находится в равновесии, если не выполняется какое-либо одно
из этих требований.
Основное значение для всех выводов, термодинамики имеет
тот экспериментально установленный факт, согласно которому
любая, изолированная от воздействия внешней среды система
с течением времени должна прийти и действительно приходит
в состояние равновесия, при котором все характеризующие
ее свойства сколько угодно долго будут оставаться неизмен-
ными.
Процессы, приближающие систему к состоянию равновесия,
называются естественными и всегда протекают самопро-
извольно.
Из состояния равновесия система может быть выведена лишь
воздействием, оказываемым извне, со стороны окружающей
среды, и поэтому во всех термодинамических рассуждениях рас-
сматриваются исключительно тепловые и механические
воздействия, оказываемые на систему извне.
Наличие поверхности раздела сосуществующих фаз является
обязательным условием фазового равновесия, так как именно че-
рез эту границу раздела происходит межфазовый обмен веще-
ством и энергией, приводящий в конечном итоге к состоянию
равновесия. Граница раздела рассматривается не как математи-
ческая поверхность, а как тонкая пленка, в которой происходит
скачкообразное изменение свойств при переходе из одной фазы
в другую. Так, например, в случае особо интересного для про-
цессов перегонки и ректификации паро-жидкого равновесия от-
деленные поверхностью раздела сосуществующие фазы характе-
ризуются значительной разностью плотностей и на границе раз-
дела фаз имеется резкий скачок этого свойства.
В однородной системе, характеризующейся так называемым
гомогенным равновесием, интенсивные свойства либо сохраняют
неизменные значения, либо меняются непрерывно от одной ее
точки к другой. В случае же гетерогенного равновесия, когда
две или больше фаз находятся в непосредственном контакте че-
рез поверхности раздела, для их равновесного сосуществования
должны быть созданы такие условия, чтобы через границы фаз
не было видимого перехода энергии.
Поэтому значения температуры и давления должны быть по-
стоянными и одинаковыми во всех фазах системы. Однако не во
всех случаях этих двух условий достаточно для определе-
ния равновесного состояния системы; хотя необходимы они
всегда.
Система может находиться в механическом и тепловом равно-
весии, но при этом в ней может и не быть химического равно-
весия, и, наоборот, при наличии химического равновесия в си-
стеме она может не удовлетворять условиям механического и
теплового равновесия.
Система, находящаяся в состоянии полного термодинамиче-
ского равновесия, должна удовлетворять условиям механического,,
теплового и химического равновесия.
Требование механического равновесия системы удовлетво-
ряется при отсутствии неуравновешенных сил, стремящихся пере-
местить части системы относительно друг друга или самую си-
стему по отношению к окружающей среде. Тепловое равновесие
Компоненты системы 13
имеется лишь в том случае, когда ни внутри самой системы
между ее частями, ни между системой и окружающей средой
нет разницы температур, вызывающей протекание процесса вы-
равнивания. Наконец, требование химического равновесия удо-
влетворяется, когда все вещества, входящие в состав системы,
представлены в наиболее устойчивых соотношениях для рассма-
триваемых условий.
В связи с последним условием необходимо ввести понятие
о компонентах системы, связанное с представлением о системе,
состоящей из двух или большего числа веществ.
§ 8. Компоненты системы
Чистые химические соединения, из которых состоят фазы си-
стемы и которые могут -обратимо переходить из одной фазы
в другую, называются компонентами системы. За число компо-
нентов принимается наименьшее число независимых
химических индивидуумов, необходимое для составления фаз си-
стемы при всех ее изменениях. Таким образом, необходимо,
чТОоегтостав кдждой"’фазы тиитетггът ъ щелотг -мог быть -выражен
через те химические индивидуумы, которые были приняты за
компоненты системы. При этом надо иметь в виду, что не все
компоненты обязательно. должны присутствовать во всех фазах
и что все взятые компоненты могут быть введены в систему
извне независимо друг от друга и в любом количестве. Каждая
фаза системы должна содержать по крайней мере один компо-
нент, который может замещаться тем же компонентом другой
фазы.
Если рассматриваемая система состоит, например, из крекинг-
бензина и полученного в процессе его производства крекинг-
газа, то согласно приведенному выше определению каждый из
входящих в систему химических индивидуумов должен рассма-
триваться как один из ее компонентов. Однако при этом число
компонентов оказывается чрезмерно большим, и это значительно
осложняет рассмотрение проблемы равновесия исследуемой си-
стемы. Для упрощения анализа можно принять за один из ком-
понентов системы стабильную часть крекинг-бензина, отвлекаясь
от того, что она, может быть, содержит около двухсот отдель-
ных, растворенных друг в друге индивидуальных углеводородов.
Это вносит известную приближенность в результаты исследова-
ния, так как приходится пользоваться усредненными значениями
свойств, например средними удельными и молекулярными ве-
сами, соответственно средней температурой кипения и т. д., но на
данном этапе развития методов исследования подобное упроще-
ние пока неизбежно.
§ 9. Степени свободы системы
Как указывалось выше, состояние системы характеризуется
совокупностью значений ее интенсивных свойств, причем обычно
за переменные принимаются давление, удельный объем, темпе-
ратура и концентрации компонентов в различных фазах системы.
Не все эти переменные являются независимыми, и это приводит
к понятию так называемой степени свободы системы.
Число независимых переменных или интенсивных свойств
равновесной системы, которое должно быть зафиксировано,
чтобы полностью определить значения всех остальных интенсив-
ных свойств во всех фазах системы, называется числом ее степе-
ней свободы.
Условия, которые должны быть соблюдены для реализации
равновесных состояний, определяются правилом фаз.
§ 10. Термодинамический метод
В отличие от статистической механики, изучающей ход непосред-
ственно доступных Наблюдению процессов при помощи представлений об
атомнодиолекулярном строении вещества, термодинамика совершенно отвле-
кается от всяких гипотез, связанных со строением вещества и механизмом:
процесса, и имеет дело лишь с макроскопическим состоянием,,
определяемым как статистическая средняя из всех отдельных микрострук-
турных состояний. Так, Например, температура и давление являются средне-
статистическими величинами, складывающимися как результат действия
микроструктурных изменений. Термодинамика рассматривает объект иссле-
дования как непрерывную, а не как дискретную среду. В этой поста-
новке вопроса ясно, что предметом изучения термодинамики могут быть
лишь объекты с достаточно большим числом частиц, допускающие средне-
статистическую трактовку.
Единственно возможными формами энергетического взаимодействия
термодинамической системы с окружающей средой является энергообмен
в форме тепла и в форме работы, и поэтому принято считать природу этого
взаимодействия отчасти тепловой и отчасти механической.
Термодинамический метод .исследования взаимодействия системы с окру-
жающей средой заключается в сопоставлении некоторого свойства системы,
изменение которого происходит вследствие особого рода внешнего воздей-
ствия окружающей среды.
§ 11. Правило фаз
Связь между числом степеней свободы системы и числом ее
фаз и компонентов называется правилом фаз и представ-
ляется следующей зависимостью:
L = n + 2 — N, (1.1)
где L — число степеней свободы; п—число компонентов; W—
число фаз.
Согласно правилу фаз число существующих в равновесной си-
стеме фаз не может превышать числа независимых компонентов
Правило фаз
больше чем на две единицы. При этом максимальное число со-
существующих фаз, отвечающее условию L = 0, возможно лишь
при вполне определенных значениях температуры, давления и
составов фаз.
Правило фаз ничего не говорит о том, какие получаются
фазы при достижении равновесия, и фиксирует лишь число фаз,
отвечающее данному числу степеней свободы при заданном числе
компонентов системы и наоборот.
Для двухкомпонентной системы, находящейся в двухфазном
состоянии, согласно правилу фаз число степеней свободы равно
двум. Это означает, что из переменных свойств системы можно
произвольно зафиксировать любые два и тем самым определить
состояние системы.
Произвол выбора значений переменных ограничен известными
пределами, которые нужно все время иметь в виду, так как
принятие значения переменного, выходящего за эти пределы, может
привести к исчезновению одной из фаз. Например, в бинарной
смеси бензол — толуол при зафиксированном внешнем давлении
в 760 мм рт. ст., если назначить в качестве второй степени сво-
боды "температуру выше 111°,~т. е. большую, чем температура
кипения толуола, то, очевидно, жидкая фаза должна исчезнуть
и полученная однофазная газовая система для своей определен-
ности потребует фиксации уже трех степеней свободы.
Таким образом, произвольность назначения в качестве сте-
пени свободы температуры двухкомпонентной двухфазной си-
стемы бензол — толуол ограничена интервалом от температуры
кипения бензола до температуры кипения толуола. Принятие
температуры, выходящей за эти пределы в ту или иную сторону,
повлечет за собой исчезновение одной из фаз.
В однокомпонентных системах согласно правилу фаз при на-
личии одной фазы существуют две степени свободы, при нали-
чии двух фаз — одна степень свободы и при наличии трех сосу-
ществующих фаз не существует ни одной степени свободы. По-
следнее означает, что равновесное сосуществование трех фаз
в однокомпонентной системе возможно лишь при одном един-
ственном сочетании свойств системы. Нарушение этого сочетания
свойств неминуемо приведет к исчезновению одной из фаз и к со-
ответствующему изменению числа критериев равновесия.
Если на рассматриваемую систему наложено какое-нибудь
ограничение, не учтенное при выводе правила фаз, то при его
применении это следует учитывать во избежание возможных
ошибок в установлении числа степеней свободы.
Так, для двухфазной паро-жидкой системы с одинаковым со-
ставом обеих фаз, т. е. в случае так называемых гомогенных
в жидкой фазе азеотропов, правило фаз принимает вид:
L = 3 — N, (1.2)
l(j Основы теории термодинамического равновесия
и такая система ведет себя как однокомпонентная независимо от
числа составляющих ее индивидуальных веществ. Соответствую-
щее теоретическое разъяснение этого можно найти в курсах хи-
мической термодинамики.
§ 12. Равновесные или квази-статические процессы
В основе понятия равновесных или квази-статических процес-
сов лежит идея о том, что любое конечное, исходящее от внеш-
него источника воздействие на равновесную систему вызывает
нарушение равновесия, сопровождающееся возникновением про-
цессов перераспределения вещества и энергии. Как показывает*^,
опыт, в ходе протекающего при этом естественного процесса уу
свойства системы изменяются таким образом, чтобы в системе
восстанавливалось равновесие. Однако при переходе системы из
одного равновесного состояния в другое возникает сложная сово-
купность промежуточных состояний, длящихся определенный от-
резок времени, в течение которого все свойства системы харак-
теризуются значениями, изменяющимися от одной точки к дру-
гой. Таким образом, изменение состояния системы, являющееся
следствием и проявлением ее неравновесности, возникшей вслед-
ствие конечного воздействия извне, нарушает условия приложи-
мости термодинамических методов исследования, которые при-
менимы лишь к равновесным состояниям. Эта трудность разре-
шается введением понятия о равновесном или квази-статическом
процессе, представляющем основной объект термоди-
намического исследования.
Согласно проекту термодинамической терминологии [1], равно-
весным или квази-статическим процессом называется непрерыв-
ная последовательность равновесных состояний, характеризую-
щаяся тем, что система, пройдя ее, выполняет наибольшую ра-
боту, которую она способна произвести, проходя данный непре-
рывный ряд состояний.
Равновесный процесс, протекающий в изолированной системе,
называется обратимым процессом.
Выяснение особенностей равновесных процессов обычно рас-
сматривают на классическом примере цилиндра с невесомым
поршнем, плотно и без трения прилегающим к его стенкам.
Пусть под поршнем содержится газ, давление которого уравно-
вешивается силой, приложенной к поршню извне. Расширение
или сжатие газа, находящегося под поршнем, можно осуществить
двумя принципиально различными способами. Если уменьшить
на конечную величину силу, действующую на поршень извне, то
при расширении газа под поршнем газ не успеет расшириться
настолько быстро, чтобы уменьшение его давления распростра-
нилось сразу по всему объему; в первое мгновение давление под
поршнем окажется меньше и слой газа, непосредственно к нему
Равновесные или квази-статические процессы
17
прилегающий, будет более разреженным, чем вся остальная
масса газа. При этом создается такое впечатление, что поршень
как бы стремится уйти от газа, а последний не успевает сразу
его догнать. В результате этого в массе газа создается отрица-
тельный градиент давления, направленный снизу вверх.
45*3.
Обратная картина наблюдается, когда путем конечного уве-
личения силы, действующей, на поршень извне, производится
сжатие содержащегося в цилиндре газа. Сжатие газа идет при
этом с конечной скоростью, однако увеличенное давление не
сразу распространяется по всему объему газа, и поэтому слой
газа, непосредственно прилегающий к поршню, оказывается бо-
лее сжатым и давление в нем делается больше, чем во всей
остальной массе газа. В этом случае в массе газа отрицатель-
ный градиент давления направлен от поршня к крышке ци-
линдра. В обоих рассмотренных случаях, идущих с конечной ско-
ростью процессов расширения и сжатия газа, нарушается равно-
весие в исследуемой системе, и поэтому процессы эти не произ-
. водят максимальной работы и не являются квази-статическими.
Уг* В самом деле, даже отвлекаясь от потерь работы на поглощение
t упругих волн, на трение и Т. ’ щ, лёгко’Та м етить,' ’ что "пр и воз в р а -
щении путем сжатия расширившегося газа в его исходное со-
стояние он не пройдет в обратном порядке через ту же последо-
вательность состояний, которую прошел при расширении, так
как давление, оказываемое на поршень в случае сжатия, больше,
чем при расширении. По этой же причине работа, затрачиваемая
на сжатие, будет больше, чем получаемая при расширении газа.
Если же расширение и сжатие проводить бесконечно мед-
ленно при непрерывном изменении давления, то можно заставить
систему пройти последовательно через бесконечно близкие равно-
весные состояния, характеризующиеся каждое в отдельности
вполне определенными значениями термодинамических свойств
системы.
Проведение подобных бесконечно медленных процессов в ре-
альной действительности практически неосуществимо, однако,
если внешние воздействия на систему достаточно малы и про-
исходят настолько медленно, что процессы выравнивания свойств
внутри системы их опережают, то состояние системы в каждый
данный момент будет неуловимо мало отличаться от состояния
равновесия.
Система, совершающая квази-статический процесс, произво-
дит максимально возможную работу, в чем легко
убедиться. Выше уже указывалось, что во всех термодинамиче-
ских рассуждениях рассматриваются исключительно воздействия.
оказываемые на систему извне. Теперь можно добавить, что
в квази-статических или равновесных процессах можно заменять
внешние параметры внутренними, и это отражается на конечных
выводах, ибо их значения совпалают. В этой связи понятно, по-
2 Зак. М» 30
БИБЛИОТЕКА
Курсов УИТК
Министерства
18 Основы теории термодинамического равновесия
чему равновесный процесс производит максимальную работу.
Так, например, при расширении в процессе, проводимом с ко-
нечной скоростью, газу приходится преодолевать давление,
меньшее, чем то, под которым находится его основная масса.
В процессе же равновесном преодолеваемое внешнее давление
равно давлению, под которым находится основная масса газа,
поэтому и совершаемая газом работа будет больше, чем в про-
цессе конечном. При этом следует иметь в виду, что в понятие
максимальной работы вкладывается алгебраический смысл и ра-
бота, совершаемая системой, считается положительной, а работа,
совершаемая над системой, — отрицательной.
В свет изложенного квази-статический процесс обычно пред-
ставляется в виде длинного ряда связанных друг с другом после-
довательных равновесных состояний, каждое из которых сме-
щено относительно соседнего на бесконечно малую величину.
Сумма этих бесконечно малых направленных смещений равно-
весия приводит к конечному изменению состояния системы, ко-
торое может быть представлено некоторой кривой на диаграмме
состояния системы. Каждая точка этой кривой отвечает некото-
рому вполне определенному равновесному состоянию системы.
Реальные же процессы, протекающие с конечной скоростью,
характеризуются состояниями, заключенными между началом и
концом процесса, не фиксированными значениями свойств си-
стемы, а полями этих величин, и поэтому их изображение на
диаграммах состояния невозможно. В этом смысле каждая ли-
ния на диаграмме состояния системы, характеризующая тот или
иной протекающий в ней квази-статический процесс, может рас-
сматриваться как линия равновесия.
Как указывалось выше, протекающий в изолированной си-
стеме равновесный процесс, единственным результатом которого
является возвращение системы из конечного состояния в исход-
ное, называется обратимым процессом. При наличии одного
лишь источника нарушения равновесия системы обратимые про-
цессы должны проводиться либо изотермически, либо адпабатно,
так как во всех других случаях конечных процессов должен
иметься теплообмен системы со средой, происходящий при конеч-
ной разности температур, влекущей за собой необратимость.
§ 13, Сумма приведенных теплот для любого равновесного
цикла
В цикле Карно тепло изотермически сообщается системе при
двух различных температурах и это приводит к уравнению
-тг+х-=°. С-З)
где Qx — тепло, полученное системой при температуре 7\
в ккал-, Qt — тепло, переданное внешнему источнику, нахо-
дящемуся при более низкой температуре Т2, в ккал.
Сумма приведенных тепло?
19
Обобщение полученного результата на любой равновесный
цикл, осуществляемый с любым рабочим веществом, не пред-
ставляет труда и приводит к существенным результатам. Для
этого необходимо рассечь замкнутую кривую произвольного
цикла (фиг. 1) бесконечно большим числом адиабат, каждая
из которых отличается от соседней на дифференциально малое
значение давления и объема. При этом части исходной кривой
процесса, соединяющие две соседние изобары, могут быть за-
менены соответствующими изо-
термами без сколько-нибудь
заметного изменения первона-
чального вида кривой цикла.
Таким образом, исходный цикл
разделяется на бесконечно боль-
шое число элементарных циклов
Карно, состоящих из двух адиа-
бат и двух изотерм. Для каждого
из этих циклов поглощенное и
отданное тепло также претста-
вляет дифференциально малое
количество dQ, и на основании
уравнения (I. 3) имеет место соот-
ношение
dQi . йКК п
Т1 "г т2 ’
Фиг. 1. Схема к определению
энтропии.
Интегрируя это выражение по всем элементарным циклам
Карно, можно получить
(1.4)
Первый интеграл представляет суммирование элементарных
приведенных теплот по всем элементам цикла на верхнем
пути АВ, а второй интеграл — то же, но по нижней ветви В А
кривой цикла. Поэтому уравнение (1.4) может быть записано
в виде
/-^- = 0. (1.5)
6
Для любого равновесного кругового процесса сумма при-
веденных теплот равна нулю.
Если криволинейный интеграл, взятый по замкнутому кон-
туру, равен нулю, то подинтегральное выражение представляет
собой полный дифференциал и, следовательно, является диф-
ференциалом некоторого свойства системы, определяемого
единственно ее состоянием и ни в коей степени предшеству-
ющими изменениями, которые система претерпела. На этом
2*
ЯП
Основы теории термодинамического равновесия
основании можно сделать заключение, что интеграл I -у-
для всех процессов, равновесных и неравновесных, является
некоторой особой функцией состояния системы, величина ко-
торой может быть найдена путем интегрирования вдоль опре-
деленного равновесного пути.
Эта функция состояния системы, представляющая собой
сумму приведенных теплот, называется энтропией и обозна-
чается S. Согласно уравнению (I. 5) дифференциал этой функ-
ции для равновесного процесса
dS==~-. (1.6)
Термодинамические функции, значения которых опреде-
ляются только состоянием системы, называются характеристи-
ческими. Энтропия, так же как и внутренняя энергия системы
или ее энтальпия, является в этом смысле характеристической
функцией.
Абсолютное значение энтропии системы не может быть оп-
ределено на базе первого и второго законов термодинамики,
так как при интегрировании дифференциального уравнения
(1.6), получается соотношение
S»/^+So, (1.7)
содержащее аддитивную константу So, представляющую собой
энтропию системы в некотором состоянии, принимаемом за
начало отсчета. Изменение энтропии при обратимом переходе
системы из одного состояния в другое
2
4S = S2-S1 = . (1.8)
Для изотермического равновесного процесса изменение
энтропии
dS = S2-S1 = 4
(1.9)
Для адиабатического же равновесного процесса, очевидно,
213 = 0. Если процесс, совершаемый системой, неравновесный,
то изменение энтропии уже не равно сумме элементарных
приведенных теплот, однако то обстоятельство, что энтропия
является функцией состояния, позволяет устанавливать ее из-
менение по начальному и конечному состояниям системы не-
зависимо от того, какой путь — равновесный или необрати-
мый— совершила система.
Принцип энтропии
21
§ 14. Принцип энтропии
Выводы, полученные в предыдущих параграфах, относились
к происходящим в системе равновесным или квази-статическим
процессам, и поэтому они не дают прямого ответа на вопрос,
как изменяется энтропия системы, когда в ней происходит
необратимый самопроизвольный процесс.
Используя свойство энтропии, что ее изменение не зависит
от пути перехода из одного состояния в другое и опреде-
ляется лишь начальным и конечным состояниями системы,
можно вычислить изменение
энтропии при необратимом про-
цессе. Для этого можно вер-
нуть систему из конечного
состояния в начальное сочета-
нием в известной мере произ-
вольных процессов, и по
количествам тепла, участву-
_____юшим в этих обратимых про-
цессах, и по температурам,
при которых эти теплоты сооб-
щаются системе или отнима-
ются от нее, рассчитать изме-
нение энтропии. Для выяснения
этого вопроса рассмотрим сле-
дующий пример.
Пусть система в результате
происходящего в ней н е р а в-
---------------------у
Уд. объем
Фиг. 2. Схема к определению
принципа энтропии.
новесного адиабатического процесса переходит из
состояния 7 в состояние 2. Начальное и конечное состояния
системы условно (для любого теплового процесса) характери-
зуются как равновесные, но для всех промежуточных состоя-
ний системы ввиду необратимости процесса нельзя устано-
вить значений ее свойств, ибо, как указывалось выше,
в неравновесном состоянии свойства системы не обладают
определенными значениями, а характеризуются полями этих
величин. Поэтому необратимый процесс, вообще говоря, не
может быть представлен на диаграмме состояния. Чтобы
подчеркнуть эту особенность необратимого процесса, на
фиг. 2 он условно представлен произвольной волнистой ли-
нией 7—2.
Изменение энтропии системы при необратимом переходе из
состояния 7 в состояние 2 может быть определено на основа-
нии того, что при совпадающих исходном и конечном состоя-
ниях системы это изменение будет одним и тем же для не-
обратимого и для обратимого переходов. Чтобы использовать
это, вернем систему из состояния 2 в состояние 1 следующим
99
'ronntiti ТРПУНгЬииЛ МЦиРГКЛРЛ ПЛ ЛtJ л Д РР И <?
равновесным путем: вначале система подвергается обратимому
адиабатическому изменению по кривой процесса 2 — 3. Входе
этого процесса энтропия S2 системы остается неизменной, ибо
для адиабаты zlS = 0, а температура приобретает некоторое
совершенно произвольное значение Т3. Из состояния 3 при
постоянной температуре Т3 система изотермически изменяется
до тех пор, пока не будет достигнута энтропия Sx начальной
системы в фигуративной точке 4. Наконец, для завершения
цикла система по адиабате 4 — 1 обратимо приводится
в исходное состояние, определяемое на диаграмме состояния
фигуративной точкой 1.
Цикл изменения состояний системы частично необратим
и состоит из одной изотермы, двух адиабат и неравновесной
ветви, по которой согласно начальному условию к системе
тепло не подводится. Единственная стадия цикла, в которой
системе обеспечен теплообмен с внешней средой, это изо-
терма 3 — 4. Пусть энергообмен системы с внешним источни-
ком по изотерме 3 — 4 выражается некоторым количеством
тепла Q. Изменение внутренней энергии системы, совершив-
шей цикл и вернувшейся .в исходное состояние, равно нулю,
и поэтому уравнение первого закона для цикла является выра-
жением принципа эквивалентности тепла и работы:
Q = W, (1.10)
где W —полная работа, совершенная циклом.
При помощи второго начала термодинамики можно судить
о том, будут ли работа цикла W и, следовательно, тепло Q
положительными, или отрицательными, иначе говоря, можно
судить о том, совершает ли работу система или работа
совершается над системой.
В самом деле, если бы тепло Q и работа W были положи-
тельны, то система, совершающая рассматриваемый цикл,
производила бы работу за счет тепла Q, заимствованного в изо-
термической стадии процесса, причем это превращение тепла
в работу оказалось бы единственным результатом кругового
процесса, т. е. происходило бы без компенсации, предусматри-
ваемой вторым началом.
Таким образом, предположение, что Q и W положительны,
противоречит второму началу термодинамики, поэтому должно
быть отброшено. В рассматриваемом случае Q отрицательно
и работа совершается над системой.
Из приведенного рассмотрения можно сделать важный для
теории термодинамического равновесия вывод, что "согласно
второму началу система, совершающая полностью или ча-
стично необратимый замкнутый круговой процесс, обяза-
тельно поглощает внешнюю работу.
Направление самопроизвольных процессов
23
На основании уравнения (I. 9) можно написать выражение для
теплоты, отдаваемой системой на изотермическойстадии процесса:
Q = T3(,S1 — S.2),
где Sx — конечное, a S2—начальное значение энтропии в изо-
термическом процессе 3 — 4. Из этого выражения, так как
Q < 0, следует, что
zjS=S2—>0. (I. II)
Необратимый адиабатический процесс всегда сопровож-
дается увеличением энтропии.
Обобщая уравнение (I. И) еще и на случай обратимых адиа-
батных изменений, можно записать его в виде
(1-12)
Знак равенства относится к обратимым состояниям системы,
а знак неравенства к необратимым.
Важно подчеркнуть, что в понятие адиабатических процессов
входят и такие внутренние процессы, которые совершаются
в системах изолированных, при водя jiqcctktqhh^
Уравнение (1.12) является одной из форм выражения вто-
рого начала термодинамики, охватывающей обратимые и не-
обратимые изменения в системе, и поэтому может быть обоб-
щено на любой процесс, протекающий в изолированной
системе, путем разделения изменения энтропии на две части.
Одна часть изменения энтропии будет характеризовать собст-
венно систему, в которой происходит процесс, обратимый или
необратимый, а другая—тепловой источник, включенный
в рассмотрение с целью изоляции системы и вместе с „рабо-
чей“ [3] частью системы образующий изучаемую изолирован-
ную систему в целом. Тогда уравнение (I. 12) напишется в виде
dS = dSpаб. сист 4“ ^*5тепл. ист 0* (I* 13)
Согласно уравнению (1. 13; энтропия изолированной системы
при необратимых или самопроизвольных процессах растет, а при
обратимых остается неизменной.
Таким образом, невозможен процесс, в результате кото-
рого общая энтропия изолированной системы уменьшается,
но, как то явствует из уравнения (I. 13), в отдельных частях
системы, иначе говоря, в неизолированной системе вполне
возможны процессы, приводящие к уменьшению ее энтропии.
§ 15. в Направление самопроизвольных процессов
В § 7$зыл установлен имеющий основное значение для
всех выводов термодинамики опытный факт, согласно кото-
рому каждая изолированная от внешнего воздействия система
сама стремится к определенному состоянию равновесия.
. я-ла ШН! TAffy/vltltJriillHinf'Vnin ПП/У11ПР^Г11^
Процессы, приводящие термодинамическую систему в со-
стояние равновесия вследствие ее изолированности от внеш-
них воздействий, являются самопроизвольными процес-
сами. Состояние равновесия является конечной точкой само-
произвольного процесса, состоящего из последовательных
неравновесных состояний, через которые в конечном итоге
система приходит к равновесию.
Поэтому самопроизвольные процессы не могут быть квази-
статическими, ибо в каждой ступени характеризуются неравно-
весностью состояния системы, приводящей к необрати-
мости. Примерами самопроизвольных процессов являются пере-
ход тепла от тела более нагретого к телу менее нагретому,
течение жидкости от высокого уровня к низкому, течение
газов от участков большего давления в участки меньшего
давления, диффузия газов, межфазовый обмен веществом при
отсутствии равновесия и т. д.
Согласно принципу энтропии протекание в изолированной
системе неравновесного процесса должно сопровождаться уве-
личением ее энтропии. Это позволяет утверждать, что все
самопроизвольные процессы могут протекать лишь в одном
направлении, определяемом энтропией.
Определяющая роль энтропии сводится к тому, что в изоли-
рованной макроструктурной системе могут самопроизвольно
протекать лишь те процессы, которые увеличивают энтропию
системы.
Система будет находиться в состоянии устойчивого равно-
весия, когда в ходе любых мыслимых в ней бесконечно ма-
лых свободных процессов, совместимых с природой системы,
ее энтропия уже не растет и dS = O.
В свете изложенного определение равновесных состояний
системы можно было бы свести к задаче отыскания максиму-
мов на кривой функциональной зависимости энтропии от неза-
висимых свойств системы.
Однако энтропия является слишком общим критерием на-
правленности процесса и состояния равновесия в системе, так
как не всегда возможно с достаточной легкостью определять
ее изменение. На практике для удобства пользуются обычна
другими составными термодинамическими функциями менее
общего характера, чем энтропия, специально введенными для
изучения некоторых часто встречающихся и наиболее важных
частных процессов. Эти функции должны быть обязательно
связаны с энтропией рассматриваемой рабочей системы,,
чтобы иметь возможность указывать направление само-
произвольных процессов и служить критерием равновесия
в системе.
Изобарный
потенциал
25
§ 16. Изобарный потенциал
Пусть рассматривается изолированная система, состоящая
из рабочей системы и из теплового источника, взаимодействие
которого с рабочей системой обратимо, поэтому температура Т
во всей изолированной системе одна и та же. Единственной
формой энергообмена рабочей системы и теплового источника
является теплообмен, приводящий, в частности, к изменению
энтропии теплового источника. Пусть в результате энерго-
обмена обратимого процесса к тепловому источнику перешло
от рабочей системы количество тепла — dQ. Тогда изменение
энтропии источника тепла согласно определению должно со-
ставить:
</5тепл,ист=--^-. (1.14)
Сочетая уравнение (1.14) с уравнением dQ = dU-]-dW пер-
вого закона, можно получить
— —-—- - —----.— dU I dW . . ___________.__.....
ИОтепл. ист = " гр •
Сопоставление с уравнением (1.13) позволяет получить
выражение для изменения энтропии рабочей системы:
„ dU + dW
иОраб, сист-^ ' у ' 1
откуда
TdSpa6. m„—dU - dW>0. (I. 15)
Поскольку в уравнении (I. 15) все величины относятся
к рабочей системе, в дальнейшем индекс у обозначения энтро-
пии опускается.
Уравнение (1.15) интегрируемо для изобарно-изотерми-
ческого процесса, примером которого может служить, в част-
ности, изменение агрегатного состояния индивидуального
вещества или химическая реакция, протекающая в гальвани-
ческом элементе. Например, работа, совершаемая системой,
в последнем случае состоит из двух видов: из работы за счет
изменения объема системы, передающейся окружению, и элек-
трической работы, совершаемой элементом. При постоянном
давлении механическая работа, совершаемая системой, равна
pAV или A(pV). Пусть электрическая работа, совершаемая
элементом, равна H-Z„H, тогда
- ЫТ'Р=Л (рУ) + 1УВН=1Урасш + 1УВИ. (1.16)
Интегрирование уравнения (1. 15) приводит (к соотношению
-WT p>AU-TAS. (1.17)
/Э/'КПЛЛ» rnooioi то пмл/b/t/fl у ti<!opro
Из сопоставления с уравнением (I. 16) может быть найдена
величина той работы, которую помимо чисто механической
работы A (pV) совершает система и которая вовсе не обяза-
тельно должна быть электрической, а может быть любым
другим видом полезной работы, совершаемой внутренними
силами системы, но только не работой расширения или сжатия:
— WBH =-Wno„e3H^AU -TAS + A(pV) (1. 18)
или
(I. 19)
Термодинамическая функция, уменьшение которой в изо-
барно-изотермических условиях измеряет работу, совершенную
системой, называется цзобарным потенциалом Ф и согласно
уравнениям (I. 18) и (I. 19) представляется соотношением
ф = и + рУ — TS = H- TS. (1.20)
Из определяющего уравнения (1.20) легко заметить, что
изобарный потенциал является термодинамической функцией,
определяемой лишь состоянием рабочей системы. Поэтому
дифференциал его является полным дифференциалом и его
изменение не зависит ни в какой мере от пути процесса,
протекающего в системе.
Уравнения (I. 18) и (I. 19) можно записать в следующем
виде:
Фх - Ф2 > IV„- (L21)
Знак равенства относится к обратимым процессам, а знак
неравенства к необратимым. Если Ф2 < Фх, то в результате
процесса уменьшается изобарный потенциал и согласно урав-
нению (1.21) система совершает работу.
Изобарный потенциал является одной из самых полезных
термодинамических функций.
§ 17. Свободная энергия
Как указывалось выше, уравнение (I. 15) можно интегри-
ровать лишь при ограничительных условиях, налагаемых на его
переменные. При постоянстве объема рабочей системы и ее
температуры механическая работа, связанная с расширением
или сжатием системы, очевидно, равна нулю и член W будет
представлять любой другой вид полезной работы, которую мо-
гут совершить внутренние силы системы. Интегрирование
уравнения (I. 15) при Т = const и V = const приводит к соотноше-
нию
— WTV^AU — TAS. (1.22)
Свободная энергия
27
Определяемая уравнением (I. 22) термодинамическая функ-
ция, уменьшение которой в изохорно-изотермических усло-
виях измеряет работу, совершенную системой, называется
свободной энергией F и представляется соотношением
F = U—TS. (1.23)
Свободная энергия F является функцией состояния системы,
ее дифференциал есть полный дифференциал, и изменение
свободной энергии не зависит от пути процесса, протекаю-
щего в системе, а определяется лишь начальным и конечным
ее состояниями.
Уравнение (1.22) можно записать в следующем виде:
Fx-F2>Wtv. (1.24)
Уменьшение свободной энергии равно работе, совершенной
системой в изохорно-изотермическом процессе.
Сопоставление уравнений (I. 19) и (1.22) для обратимых
изменений приводит к важному соотношению между макси-
мальной полезной работой 1УПп-Р-.в и максимальной работой
изохорно-изотермического процесса:
^Пояезн = ^,у-Р(^).
(I. 25)
§ 18. Условия равновесия термодинамической системы
Обязательным условием для применения соотношений
(1.21) и (1.24) является требование сохранения постоянной
температуры внешней среды и равенства температуры системы
и среды лишь в начале и в конце процесса.
Полные дифференциалы изобарного потенциала и свобод-
ной энергии могут быть получены из уравнений (I. 20) и (1.23):
йФ = dU — TdS - SdT + pdV + Vdp;
dF = dU — TdS — SdT.
Сопоставляя эти уравнения с соотношением, получающимся
из сочетания уравнений первого и второго законов
dU^TdS — pdV, (1.26)
можно получить
dФ ~ SdT + Vdp; (1.27)
dF^-SdT-pdV. (1.28)
Из этих уравнений следует, что для изобарно-изотерми-
ческих процессов
(/Ф <0, (1.29)
а для изохорно-изотермических процессов
dF<0. (1.30)
Из уравнения (1.29) можно заключить, что когда термо-
динамическая система, погруженная в среду, температура и
давление которой постоянны, переходит в результате само-
произвольного процесса из какого-нибудь начального состоя-
ния в конечное равновесное состояние, то изобарный потен-
циал системы уменьшается, если температура и давление си-
стемы в начале и в конце процесса равны температуре и
давлению внешней среды.
Равным образом из уравнения (1.30) следует, что когда
система, погруженная в среду постоянной температуры, пере-
ходит в результате самопроизвольного процесса при постоян-
ном объеме из какого-нибудь начального состояния в конеч-
ное равновесное состояние, то изохорный ее потенциал умень-
шается, если в начале и в конце процесса температура си-
стемы равна температуре внешней среды.
§ 19. Парциальные молярные величины и химический
потенциал
При термодинамическом анализе систем, не сохраняющих
постоянного состава, в которых происходят переходы веществ
из одной части в другую, особенно при определении влияния
изменения состава на свойства системы, очень полезно поль-
зоваться концепцией парциальных молярных величин. Части
системы, ее фазы, при этом рассматриваются раздельно, и, по-
скольку при наличии межфазового, обмена масса каждой фазы
и ее состав изменяются, представляет значительный интерес
выяснить влияние, оказываемое этим на свойства системы.
Пусть, например, нас интересует такое экстенсивное свойство
термодинамической системы, как ее изобарный потенциал Ф.
В качестве самой системы можно выбрать, например, раствор
бензола и толуола, представляющий наиболее обычную си-
стему при теоретическом рассмотрении процессов перегонки.
Определенный раствор этих компонентов можно получить раз-
личными путями. Так, можно к определенному количеству
бензола приливать толуол до получения заданного состава
раствора или же поступить наоборот. Можно смешивать эти
компоненты, подавая их в смеситель одновременно с различ-
ной скоростью или же это смешение проводить путем одно-
временной подачи компонентов в постоянном соотношении
так, чтобы от первой капли и до конца раствор все время
имел один и тот же желательный конечный состав. Прини-
мая во внимание, что введение дифференциально малого коли-
чества dnt молей бензола при сохранении постоянного коли-
Парциальные молярные величины и химический потенциал 29
чества второго компонента толуола и при постоянных темпе-
ратуре и давлении изменит значение изобарного потенциала
на величину (дФ/дп^т р п* dnr, можно представить полное из-
менение изобарного потенциала в виде
+ + + dn2. (1.31)
\ ип2 /т,р»П1
При постоянных Тир это уравнение примет вид:
\ дп, )Т' р П2
т, р, П1
dn2.
(I. 32)
Когда бензол и толуол подаются в сосуд одновременно
и в таком постоянном соотношении, что, начиная от первого
дифференциально малого количества и до конца смешения,
образующийся раствор все время имеет один и тот же жела-
тельный конечный состав, то изобарный потенциал конечного
раствора можно выразить так:
(ТГЗЗ)
Здесь Ф — изобарный потенциал раствора, а Фх и Ф2 — изо-
барные потенциалы на 1 моль прибавленных бензола и то-
луола, выбранные таким образом, что, будучи умноженными
на пг и п2, они в сумме дают Ф.
В уравнении (1.32) величины (-4^ могут рассматри-
\ ОП} Р1 П2
ваться как изменение изобарного потенциала бесконечно боль-
шого количества раствора, когда к нему прибавляется 1 моль
i-го компонента. Их можно иначе понимать как изменение
изобарного потенциала конечного количества раствора, когда
к нему прибавляются дифференциально малые количества бен-
зола и толуола.
Эти дифференциальные коэффициенты принято называть
парциальными молярными количествами— парциальными по-
тому, что изменяется только одна переменная, и молярными
потому, что они вычисляются на молярной основе.
По мере изменения концентрации эти частные производные
будут изменяться в широких пределах. Частные производные
по числу молей обозначают через и называют химическими
потенциалами соответствующих компонентов. Уравнение
(1.31) представится теперь так:
dФ <— SdT + Vdp + fi^dn^ /z2dn2
или
d<D< — SdT + Vdp^^p dn.. (1.34)
30
Ог.нпаы тр.ппип. тр.пмпдинпинчрекпрп ппрнорргпя
В уравнении (I. 34) член определяет изменение изо-
барного потенциала, когда при постоянных температуре и
давлении изменяется количественное содержание компонентов.
При помощи парциальных молярных количеств можно
написать аналогичные уравнения и для любых других экстен-
сивных свойств системы, например для свободной энергии F,
внутренней энергии U или энтальпии Н. Принимая во внима-
ние уравнения (1.26) и (1.28) и в соответствии с методикой
получения уравнения (L 34), можно написать
dF < — SdT -pdV + ^ p.dn.; (I. 35)
dU < TdS - pdV+'Z p.dn^ (I. 36)
В этих уравнениях знак равенства относится к обратимым
процессам, а знак неравенства к необратимым. Эти соотноше-
ния после интегрирования приводят к одному и тому же
результату:
ф (/-К + Д:.
В состоянии равновесия правые части уравнений (1.35) —
(I. 36) равны нулю, и поэтому должно соблюдаться равенство
(1.37)
Действительно, условием равновесия при постоянных Тир
является 4/Ф = 0, и поэтому из уравнения (1.34) следует усло-
вие (1.37). Аналогичным образом при постоянных Т и V усло-
вием равновесия служит dF = 0 и из уравнения (1.35) следует
условие (1.37). Другой случай, отвечающий постоянству S
и V, приводит на основании уравнения (1.36) к тому же усло-
вию (I. 37).
Химический потенциал д. является таким образом частной
производной экстенсивного свойства системы по числу молей,
т. е. парциальным молярным свойством системы, и поэтому
в растворе, например, химический потенциал р. произвольного
i-ro компонента равен парциальному значению изобарного
потенциала ОХ этого компонента в рассматриваемой фазе.
Когда рассматриваемая фаза является однокомпонентной, хими-
ческий потенциал отвечает изобарному потенциалу данного
вещества.
Пусть рассматривается двухфазная система с произвольным
числом компонентов и пусть дифференциально малое коли-
чество компонента i переходит при постоянных температуре
и давлении из первой фазы системы во вторую. Изобарный
потенциал Ф' первой фазы при этом уменьшается на величину
Кривая упругости
дФ'= р,.'dn/, а изобарный потенциал Ф" второй фазы воз-
растает на величину dФ" = pidni", общее изменение изобарного
потенциала всей системы в целом йФ будет равно сумме
изменений в обеих фазах:
dФ = dФ' + дФ” = //.' + к” dn". (I. 38)
Значения dn. равны по абсолютной величине, но противо-
положны по знаку, поэтому
£?Ф = (^'—/«/) (1.39)
При обратимом равновесном переходе изменение изобар-
ного потенциала равно нулю ЙФ = О и, следовательно, усло-
вием фазового равновесия в отношении распределения между
фазами компонента i является равенство значений химического
потенциала этого компонента в обеих фазах. Этот результат,
очевидно, может быть обобщен и распространен на любое
число фаз и компонентов системы. Таким образом, необходи-
мым условием равновесия является равенство химических
потенциалов каждого компонента системы во всех ее Фазах:
(1.40)
Если переход вещества между фазами происходит в не-
равновесных условиях, то изменение изобарного потенциала
является отрицательным, так как при любом необратимом
процессе изобарный потенциал уменьшается. В этом случае
t/Ф < 0 и (/<.’ — /т.') < 0 и, следовательно,
(1.41)
Таким образом, самопроизвольный переход компонента I
из одной фазы в другую возможен лишь в том случае, когда
его химический потенциал в исходной фазе больше, чем в той,
куда он переходит. В ходе процесса массоперехода значения
химических потенциалов обеих фаз в конечном счете
сравняются и тогда будет достигнуто состояние фазового
равновесия. Химический потенциал в свете изложенного
можно рассматривать как движущую силу межфазового
массоперехода, характеризующую способность рассматри-
ваемого компонента переходить из данной фазы, в другую
при определенных значениях температуры и давления.
§ 20. Кривая упругости
Пусть рассматривается однокомпонентная двухфазная жид-
ко-паровая система. Условие равновесия между жидкостью
и паром можно записать в виде
Т' = Т”- р'^р"
р’(Т, р) = р”(Т, р). (1.42)
32
Основы теории термодинамического равновесия
Первые два условия являются обычными условиями тепло-
вого и механического равновесия, требующими равенства зна-
чений Т и р в состоянии равновесия. На этом основании из
уравнения (I. 42) можно выразить давление в функции темпе-
ратуры или наоборот. При этом получится уравнение
Р = 9’(П (1.43)
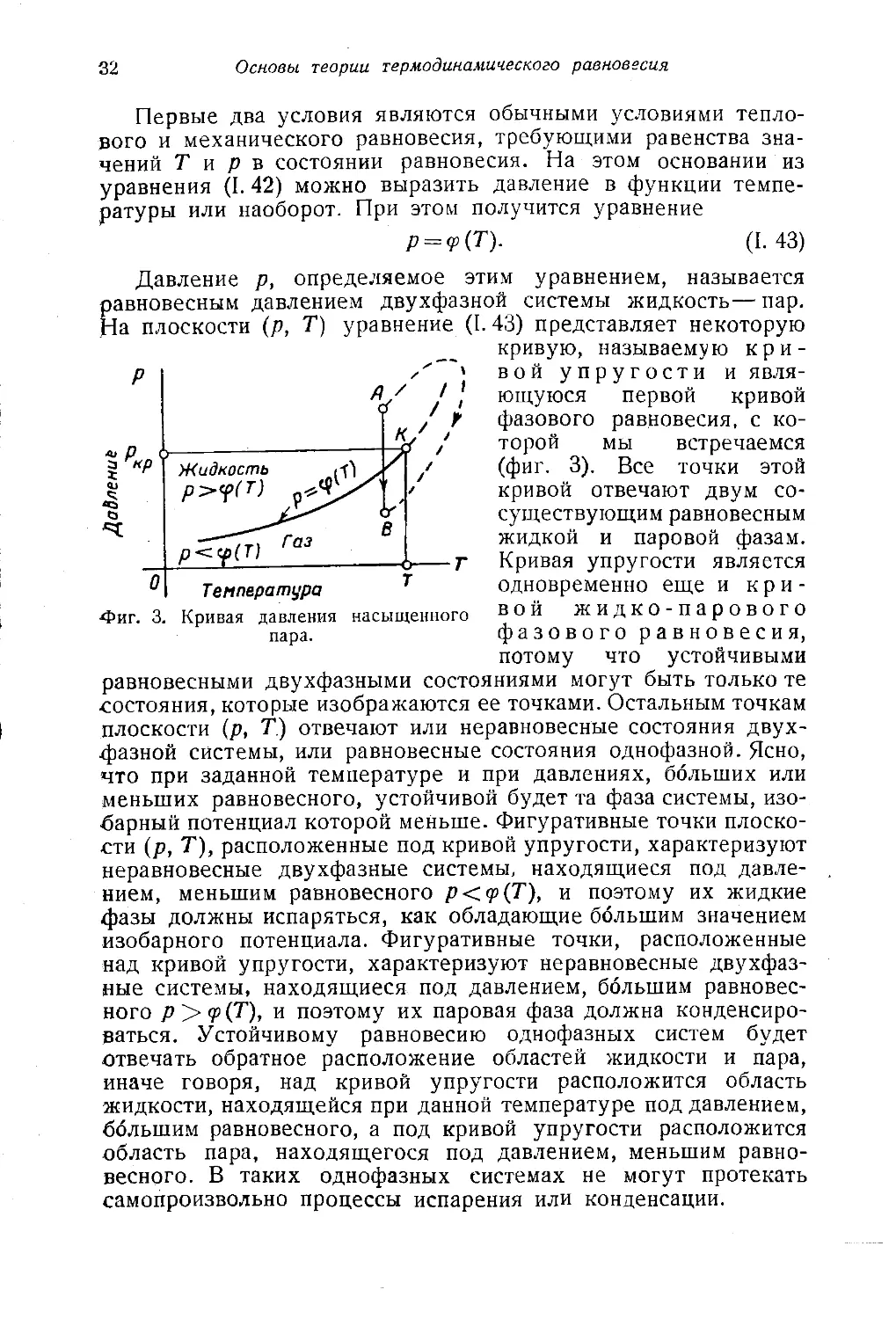
Давление р, определяемое этим уравнением, называется
равновесным давлением двухфазной системы жидкость— пар.
1а плоскости (р, Т) уравнение (I. 43) представляет некоторую
кривую, называемую кри-
вой упругости и явля-
ющуюся первой кривой
фазового равновесия, с ко-
торой мы встречаемся
(фиг. 3). Все точки этой
кривой отвечают двум со-
существующим равновесным
жидкой и паровой фазам.
Кривая упругости является
одновременно еще и кри-
вой ж и д к о - п а р о в о г о
фазового равновесия,
потому что устойчивыми
•Фиг. 3. Кривая давления насыщенного
пара.
равновесными двухфазными состояниями могут быть только те
состояния, которые изображаются ее точками. Остальным точкам
плоскости (р, Т.) отвечают или неравновесные состояния двух-
фазной системы, или равновесные состояния однофазной. Ясно,
что при заданной температуре и при давлениях, больших или
меньших равновесного, устойчивой будет та фаза системы, изо-
барный потенциал которой меньше. Фигуративные точки плоско-
сти (р, Т), расположенные под кривой упругости, характеризуют
неравновесные двухфазные системы, находящиеся под давле-
нием, меньшим равновесного p<q>(T'), и поэтому их жидкие
фазы должны испаряться, как обладающие большим значением
изобарного потенциала. Фигуративные точки, расположенные
над кривой упругости, характеризуют неравновесные двухфаз-
ные системы, находящиеся под давлением, большим равновес-
ного р><р(Т), и поэтому их паровая фаза должна конденсиро-
ваться. Устойчивому равновесию однофазных систем будет
отвечать обратное расположение областей жидкости и пара,
иначе говоря, над кривой упругости расположится область
жидкости, находящейся при данной температуре под давлением,
большим равновесного, а под кривой упругости расположится
область пара, находящегося под давлением, меньшим равно-
весного. В таких однофазных системах не могут протекать
самопроизвольно процессы испарения или конденсации.
Критическая точка
33
§ 21. Критическая точка
Еще Д. И. Менделеев установил отсутствие принципиаль-
ной разницы между жидким и газообразным состояниями ве-
щества. Очевидные внешние различия между жидкостью
и газом объясняются различным характером взаимодействия
атомов в этих двух состояниях вещества. В обоих состояниях
движение атомов имеет хаотический характер и отличается
лишь длиной свободного пробега, которая в жидкости значи-
тельно меньше вследствие ее большей плотности. Не вдаваясь
в подробности физической картины этих агрегатных состояний
вещества, заметим, что опытным путем была доказана воз-
можность непрерывного перехода из газообразного состояния
в жидкое и обратно без скачкообразного фазового перехода
на границе раздела фаз. Это обстоятельство известным обра-
зом ограничивает кривую фазового равновесия p = F(7"), обры-
вая ее в некоторой критической, точке К (фиг. 3), понятие
которой было установлено в 1860 г. Д. И. Менделеевым.
Критической точке К отвечают вполне определенные для каж-
дого вещества значения давления ркр и температуры Ткр. При
всех значениях р и Т, меньших критических, переход из од-
ной фазы в другую происходит с пересечением кривой упру-
гости или кривой фазового равновесия р(Т), на которой обе
фазы равновесно сосуществуют. Выше критической точки со-
стояние вещества может быть только однородным и иногда
называется закритическим.
На фиг. 3 показан переход системы из точки А, располо-
женной в области жидкости, в точку В, расположенную в
области газа, проведенный двумя путями. На первом пути,
пересекающем кривую фазового равновесия, происходит скачко-
образное изменение фазового состояния, сопровождающееся
положительным тепловым эффектом. На втором пути, идущем
в обход критической точки, в каждый момент свойства ве-
щества во всем объеме системы одни и те же, но в ходе
процесс! они непрерывно изменяются без скачкообразного
фазового перехода и без теплового эффекта. Так осуще-
ствляется непрерывный переход из жидкого состояния в газо-
образное. Понятие критической точки позволяет дать опреде-
ление ее параметрам. Наименьшая температура, выше кото-
рой ни при каком давлении нельзя ожижить данный газ,
называется критической температурой этого газа. Давление,
при котором газ, находящийся при критической температуре,
приходит в насыщенное состояние, называется критическим
давлением. Удельный объем вещества, находящегося под
критическим давлением и при критической температуре, назы-
вается его критическим объемом VKp. По мере приближения
вещества к критическому состоянию, отвечающему точке К
3 Зак. № 304.
34 Основы теории термодинамического равновесия
на кривой упругости р(Т), постепенно уменьшается разница
в свойствах жидкой и газообразной сосуществующих равно-
весных фаз, а в самой критической точке эта разница и вовсе
исчезает. Поэтому в критической точке скрытое тепло фазо-
вого перехода должно равняться нулю, ибо нет различия
между фазами. По той же причине и поверхностное натяже-
ние на границе жидкость — пар в критической точке тоже
обращается в нуль.
Первые систематические определения критических темпе-
ратур различных веществ были проведены в 1880—1890 гг.
киевской школой физиков М. П. Авенариусом, А. И. Надеж-
диным, В. И. Зайончевским, Б. П. Палевским и др. [6J
и А. Г. Столетовым.
В настоящее время известны критические константы для
многих веществ, определенные опытным путем и помещенные
в соответствующих справочниках. Однако представляет инте-
рес ознакомиться и с некоторыми эмпирическими формулами
расчета критических параметров.
Для определения критической температуры неполярных,
жидкостей можно воспользоваться следующим приближенным,
соотношением:
Т f м
-^=0,2831^- , (1.44)
где Ткр—критическая температура в абсолютных градусах; М—
молекулярный вес; уКип—удельный вес в нормальной точке
кипения в г)мл; Те — температура, при которой вещество
находится в равновесии с насыщенным паром, 1 г-моль кото-
рого занимает объем в 22,4 л; эта температура Те связана
с нормальной точкой кипения Ткип следующим соотношением:
In Те = 9,8 -4,2. (1.45)
‘ ют
Точность формулы (1.44) около 2%.
Для вычисления критического объема можно воспользо-
ваться уравнением
VKp = (0,377 Р+ 11,0)1-25, (1-46)
где Р — так называемый парахор, вычисляемый по формуле
р = (I.47)
Уж ~ Уп
где а — поверхностное натяжение в дн[см-, уж и уп — удельные
веса жидкости и пара в г/мл при комнатной температуре;
М — молекулярный вес.
У равнение Клаузиуса -Клапейрона
35
Для вычисления критического давления можно воспользо-
ваться уравнением
20,8 Ткп
^₽=v-^- (1-48)
* кр м
Определение критических свойств веществ и, в частности,
критических давления и температуры представляет важную
задачу, с которой часто приходится встречаться в теории про-
цессов перегонки и ректификации.
§ 22. Уравнение Клаузиуса-Клапейрона
Дана равновесная двухфазная система. Применяя к обеим
ее фазам в отдельности уравнение (I. 27), можно написать
аФг = - SrdT + Vtdp-
ЛФ2 = — S2dT + V2dp.
Л/ПгтопттСТУ пярцпРРРПлгн рг\г*утттт tjttct '~p*1ql ч
следовательно, </Ф1 = 4/Ф2- Приравнивая на этом основании правые
части написанных выше уравнений, имеем
S2 —?! _ dp_
V2 —Vi “ dT ’
(I- 49)
Применяя полученное уравнение к равновесному жидко-
паровому фазовому переходу и принимая во внимание, что
для обратимого и изотермического процесса фазового превра-
щения Z1S = Лисп/Л можно преобразовать уравнение (1.49) сле-
дующим образом:
Яисп = Т^(Уп-Уж), (1.50)
где Яисп — теплота испарения одного моля; Vn и Уж — молярные
объемы пара и жидкости. Это уравнение называется уравнением
Клаузиуса-Клапейрона и представляет изменение упругости
пара с температурой dp/dT в зависимости от теплового эффекта
процесса и удельных объемов фаз. Оно применяется для рас-
чета давления насыщенного пара веществ или для определения
их скрытой теплоты испарения.
§ 23. Методы расчета давления насыщенного пара
В дифференциальной форме уравнение (I. 50) является вполне
строгим и точным, однако для его интегрирования необходимо
пользоваться данными о молярных объемах, которые не для
всех веществ можно найти в литературе и подсчет которых
в большинстве случаев представляет значительные трудности.
з*
/"btmoi./ T/innflll TOna/yr}llLirii4’lllirl//-^/y
Обычно, в известной мере пренебрегая строгостью, в целях
упрощения вводят два допущения, позволяющие представить
уравнение Клаузиуса-Клапейрона в более простом виде. Счи-
тают, что объем жидкости пренебрежимо мал сравнительно
с объемом пара и что последний подчиняется уравнению
состояния идеального газа. Тогда уравнение (1.50) приходит
к виду
—= ^нсп /Т К 1 \
ЦТ ^Т‘ V- 31)
Для определения давления р насыщенного пара вещества
это уравнение следует проинтегрировать, что вполне осуще-
ствимо, если задана зависимость теплоты испарения от тем-
пературы. Считая в первом приближении Лисн постоянным,
можно получить
1пр=-^ + С, (1.52)
где С—постоянная. Это уравнение можно представить как
эмпирическое
= 4 + B (1-53)
и по двум опытным точкам найти значения обеих его кон-
стант А и В. Так, для углеводорода 2,2,4-триметилпентана
(изооктана) эта зависимость представляется уравнением
lg Р — t + 273>16 +4,45144,
где р выражено в am, a t — в °C.
Если допустить, что теплота испарения связана с темпера-
турой линейной зависимостью
Аисп — Яо + лТ >
то интегрирование уравнения (1.51) приводит к виду
1пр=--^ + -£-1пТ + С (1.54)
или в виде эмпирического уравнения
lgp = A + BigT + c. (1.55)
Здесь для определения констант уравнения (I. 55) необходимо
располагать уже тремя опытными точками, чтобы для каждого
вещества найти отвечающие ему значения А, В и С.
Кривые упругости веществ, близких по химическому строе-
нию и физическим свойствам, имеют известное подобие, и это
послужило основой для разработки методов сравнительного
Методы расчета давления насыщенного пара
37
расчета упругости насыщенных паров. Наиболее теоретически
обоснованным и практически точным является метод, разра-
ботанный В. А. Киреевым. Сущность этого метода состоит
в следующем. Пусть даны два вещества а и w, близкие по
химическому строению и не слишком различающиеся по точкам
кипения; применяя к ним уравнение Клаузиуса-Клапейрона,
можно написать
dlnpa _ dT а dAnpw dTw
4 и ~=Ж7‘
Сравнивая эти два уравнения при одинаковых темпера-
турах Ta = Tw, получаем
d In ра = -у— d In pw. (1.56)
Приняв с известным приближением отношение скрытых
теплот испарения AaIAw = k постоянным, можно интегрировать
уравнение (I.56):
Уравнение (1.57) связывает в линейной форме логарифмы
давлений насыщенного пара двух веществ при равных темпера-
турах. Если значения упругостей насыщенных паров обоих
веществ известны в двух точках, то подстановкой этих величин
в уравнение (I. 57) могут быть определены константы к и С и
окончательно формула В. А. Киреева примет вид:
iSPa= J~,~^>a4(lgpW-^PW') + Igpa'-’l . (I- 58)
Is /'и. й
Для практических расчетов имеет большое значение выбор
стандартного вещества, по которому ведется расчет упругости
пара. В. А. Киреев рекомендует для полярных веществ
в качестве стандартного вещества принимать воду, а для не-
полярных подбирать такое неполярное вещество, для которого
необходимые опытные данные можно найти в литературе. На
фиг. 4 приведена номограмма формулы (1.57), построенная
В. А. Киреевым в комбинированной форме для расчетов по
воде и по гексану, смотря по тому, какое из этих веществ
более подходит для стандартного. Средняя вертикальная шкала
давлений является общей для обеих частей номограммы. На
наклонных шкалах нанесены точки, каждая из которых отвечает
вполне определенному веществу. Любая прямая, проходящая
через какую-нибудь из этих точек и пересекающая шкалы
давлений и температур, связывает сопряженные значения
последних для того вещества, которому соответствует эта
точка.
38
Основы теории термодинамического равновесия
Скрытая теплота испарения
39
-Фиг. 4. Номограмма В. А. Киреева для расчета давления насыщенного пара.
7 —СН3 - СН3; 2 СН _СН; 5-Si Н3-СН3; 4 - СН3СН = СН2; 5-СН3СН2СН3;
б—СН2=С=СН2; 7—СН3С1; 8-СН2=СНС1; Р-а-С2Н5СН=СН2 (а-бутадиен);
70 —1,3-СН2 = СН — СН = СН2; 11 — и-С4Н10; 12 — £-СН3СН = СНСН3;
(^-бутадиен); 13—С2Н5С1; 14— СН2 = СН — С(СН3) = СН2; 15—(С2Н5)2 О;
16— НСООСН3; 17 — н-С5Н12; 18 — С2Н6Вг; 19 — СН2С12; 20 — НСООС2Н5;
21 — СНС13; 22 —«-С6Н14; 25-СС14; 24-С.Н.; 25 — СН3СООС2Н5;
/СИ., — СН2\
26 — СН2С1 — СН2С1; 27 — C6H5F; 28-н-С7Н13; 29— О О;
\сн2-сн/
-30— СвН5СН3; 31 — н-С8Н1а; 32 — «-СаН1а; 33 — С6Н5С1; 34 — л-СвН4 (СН3)2;
СН2 — СН2 — СН - СН2 - СН2
35 —С3Н-Вг; - и-С10Н2„; 57—C6H5NO.,;5S - | |
СН2 — СН2 — СН — СН2 —сн2
(декалин)
.СН2--СН,
39 - СвНЛ; 40— C6H5NH2; 47-о-СН3С6Н4ОН; 42 — СЙН4/ | (тетралин);
ХСН2—сн2
43 — С10Н8 (нафталин); 44—_и-СН3С6Н4ОН; 45—С6Н5 — С3Н5; 46—a-Cj0H7Br;
47 -a-C10H7OH; 48-jS-C10H,OH; 49—NH3; 50 — CH3NH2; 57 — (CH3)2CO (аце-
тон); 52 — CH3OH; 53— C2H5OH; 54— H2O; 55-CH3COOH; 56-C2H5COOH;
57 - изо-С3Н7СООН; 58— CH2OH (CHOH)2 CH2OH, 59— CH2OH — CH.OH;
60 — CH2 (ОН) CH (ОН) CH2 (ОН) (глицерин); 61 — Hg; A — В— общее давле-
ние пара растворов NH3 в воде, содержащих 5, 10, 15, 20,..., 100% вес. NH3;
Для интерполяции опытных данных рекомендуется также
пользоваться чисто эмпирическим уравнением
= (1.59)
содержащим три константы А, В а С, определяемые экспери-
ментальным путем для каждого вещества. Это уравнение легко
поддается решению относительно температуры кипения t под
заданным давлением р:
t = ----С, (1.60)
и широко используется для прямых и обратных расчетов.
§ 24. Скрытая теплота испарения
Для определения скрытой теплоты испарения веществ ис-
пользуется то же уравнение Клаузиуса-Клапейрона. Интегри-
рование уравнения (1.50) в пределах от (рх, 7\) до (р2, Т2)
приводит к выражению
‘"K’TrGr-n-b <г61>
40 Cirunnhi тргтии тррмадинпиичрскаро ппвновеспа
при помощи которого, зная две точки кривой температурной
зависимости упругости насыщенного пара, можно найти теплоту
испарения 2Исп путем прямой подстановки в уравнение (1.61)
надлежащих величин.
Для расчета величины скрытой теплоты испарения необ-
ходимо располагать надежными данными по упругостям паров
и молярным объемам веществ, так как уравнение (1.50) для
этих расчетов обычно представляется в виде
Яисп = рТ(Уп-Уж)^Д . (1.62)
Этим уравнением очень удобно пользоваться, так как из
обычных уравнений упругости насыщенного пара можно вполне
точно найти d In р/dT. При наличии данных об упругостях паров
и молярных объемах лучше всего пользоваться уравнением
(I. 62). В тех же случаях, когда этих данных нет, приходится
прибегать к другим методам расчета.
Так, для неполярных жидкостей скрытая теплота испарения
под атмосферным давлением может быть с достаточной точ-
ностью найдена по уравнению Кистяковского
^исп =8,75+ 4,571 Ig ТКИ1„ (1.63)
* кип
где Ткип —точка кипения под атмосферным давлением в абсо-
лютных градусах, а Яисп — выражено в кал!моль.
ГЛАВА II
ТЕРМОДИНАМИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
СВОЙСТВ ВЕЩЕСТВ
§ 1. Летучесть
В начальный период развития научных взглядов на термо-
динамические свойства веществ путем обобщения опытных
данных были установлены такие сравнительно простые законо-
мерности, характеризующие их поведение, как, например,
газовые законы, законы идеальных растворов или закон дей-
ствующих масс? Эти обобщения сравнительно скудных, прибли-
женных и полученных в узкой области экспериментальных
данных обладали преимуществом формальной про-
стоты, допускающей удобную математическую интерпретацию.
Однако существенный их недостаток заключался в ограничен-
ности пределов применения, не позволяющей охватить с прак-
тически приемлемой точностью все более расширяющуюся
массу опытных фактов и данных. Так, применение законов
идеального газового состояния допустимо лишь с небольшой
степенью точности в условиях, далеко отстоящих от крити-
ческих. Закон действующих масс, выраженный через обычные
концентрации, приводит к серьезным ошибкам и лишь для
весьма разбавленных растворов может считаться приемлемым.
Подавляющее большинство концентрированных растворов
весьма заметно отклоняется в своем поведении от закона Рауля,
являющегося лишь первым приближением в установлении соот-
ношений, выражающих свойства растворов.
Возникает задача установления зависимостей, позволяющих
обобщить опытные данные по системам, не подчиняющимся
упрощенным законам гипотетических концепций идеального
газа или раствора, и здесь можно итти двумя совершенно само-
стоятельными путями. Можно, например, вместо старых простых,
но недостаточно точных соотношений разработать другие, более
точные, дающие практически верный результат во всей иссле-
дуемой области температур, давлений и концентраций. Однако
при этом получаются сложные уравнения и расчеты по ним
оказываются трудными и громоздкими, так как требование
адекватного охвата всей области существования системы чрез-
42
Термодинамические методы определения свойств веществ
мерно осложняет вид аналитических соотношений. В общем
случае этот путь не может быть рекомендован. Можно исполь-
зовать и другой путь, заключающийся в том, что сохраняется
внешне простая аналитическая форма уравнения состояния
идеального газа или законов Рауля и действующих масс,
но вместо давлений и концентраций вводятся новые пере-
менные, подобранные таким образом, чтобы во всей иссле-
дуемой области изменения системы обеспечить получение
термодинамически правильного результата. Вообще этот
путь не меньше сложен, чем предыдущий, но здесь вся труд-
ность расчета переносится на вычисление вновь вводимых пере-
менных. При этом новые функции специально выбираются
главным образом для исследования практически весьма важного
случая обратимого изотермического изменения, а не всех воз-
можных изменений системы, что в некоторой степени упрощает
методику. Поэтому в термодинамике ныне принят второй путь.
Концепции термодинамических функций летучести и актив-
ности и были разработаны исключительно с целью упрощения
вычислений и удобства интерпретации термодинамических зави-
симостей. Эти функции являются интенсивными свойствами
системы и определяются исключительно ее состоянием.
Из рассмотрения практически весьма важной задачи вычи-
сления изменения изобарного потенциала в изотермическом
обратимом процессе в отсутствии химической реакции имеем
2
АФТ= fVdp. (11.1)
1
Если считать приемлемым уравнение состояния идеальных
газов, то V = RTp и
4Фт = 7?Т1п-^-. (II. 2)
Легкость, с которой определяется для идеального газа изме-
нение изобарного потенциала, может сохраняться и для реаль-
ного газа, не подчиняющегося уравнению Клапейрона-Менде-
леева, если ввести новую переменную, некоторую функцию
давления, летучесть f. Эту функцию называют еще фугетив-
ностью, обобщенной летучестью, фугасностыо или рассеивае-
мостью. Летучесть является мерой стремления вещества к выде-
лению из реальной смеси или раствора, подобно тому как стре-
мление идеального газа к рассеянию измеряется его парциальным
давлением. Летучесть должна быть выбрана таким образом,
чтобы для любого процесса, протекающего при постоянной тем-
пературе, изменение изобарного потенциала каждого компо-
нента определялось по соотношению
АФT = RTln -f{2-, (II. 3)
* h
Методы. расчета летучести для газовых систем 43
откуда
(/Фт = /?Т(/1п/. (И. 4)
В уравнении (II. 3) величины Д и /2 являются летучестями
вещества в конечном и начальном состояниях при одной и той
же температуре.
Уравнения (II. 3) и (II. 4) позволяют определять отношения
летучестей в любых двух выбранных состояниях, но недоста-
точны для определения абсолютного значения летучести, за
исключением идеального газа, у которого / = р. Для пара, под-
чиняющегося законам идеального газового состояния:
ЛФ„ = /?Г1п ^- = RT[n^~. (II. 5)
т fi Pi
Поэтому летучесть удобно определить таким образом, чтобы
она численно равнялась давлению, когда вещество находится
в условиях, допускающих применение законов идеальных газов.
Отсюда следует, что по мере приближения реального газа
к состоянию идеального газа значения летучести и давления
сближаются и в пределе совпадают, т. е. lim (//р) —1. Таким
д—>0
образом, в пределах надежности законов идеального газового
состояния летучесть численно равна давлению, имеет ту же
размерность и является поправочной функцией, применяемой
в определенных условиях, своеобразным исправленным давле-
нием, учитывающим отклонение реальных веществ от идеальных.
§ 2. Методы расчета летучести для газовых систем
Уравнение состояния идеального газа может быть представ-
лено в форме, пригодной для определения свойств реальных
газов при помощи поправочного коэффициента, учитывающего
имеющиеся отклонения:
pV = zRT. (II. б)
Поправочный множитель z, называемый коэффициентом
сжимаемости, играет важную роль не только при расчете
свойств системы, но и при вычислении летучести. Как выте-
кает из определяющего уравнения, коэффициент сжимаемости —
безразмерная величина и, как показывает опыт, зависит от
давления, температуры и природы вещества.
Ввиду недостатка необходимых данных для расчета свойств
реальных газов была сделана попытка обобщения свойств реаль-
ных газовых систем путем использования известного подобия
в поведении различных газов в областях, близких к критиче-
ским. Это натолкнуло на мысль выразить переменные пара-
метры систем р, V и Т как доли соответствующих критиче-
ских констант для каждого газа, назвав их приведенными пара-
44 Тепмадичамимеск.ие методы определения свойств веществ
метрами. Была высказана мысль, что подобие в поведении
кривых, представляющих p—V — 7-данные, является показате-
лем существования обобщенного, так называемого приведенного
уравнения состояния, годного для всех газов, в котором все
переменные, определяющие состояние газовой системы, входят
в приведенной форме. Лежащий в основе такого обобщения
принцип соответственных состояний является приближен-
ным, однако, как показывает опыт, его применение для газов,
близких по физическим свйствам и химическому строению, дает
расхождения, не превышающие 3—5%. В тех же случаях, когда
экспериментальные значения дают заметные расхождения с тео-
ретическими, для лучшего совпадения их вместо действитель-
ных значений критических температур и давлений рассматри-
ваемых веществ следует использовать надлежащим образом
подобранные псевдозначения. Использование приведенных
или псевдоприведенных координат, основанное на физико-хими-
ческом принципе соответственных состояний, позволяет на одном
графике представить коэффициент сжимаемости для всех газов
как функцию приведенного давления и приведенной темпера-
туры. Представленная на фиг. 5 зависимость z = <p (л, т) дает
достаточную практическую точность для подавляющего боль-
шинства технических расчетов.
Можно доказать, что для всех газов, свойства которых
достаточно точно характеризуются описанным выше графиком
коэффициента сжимаемости, может быть построен один обоб-
щенный график, дающий значения летучести в функции тех же
приведенных параметров. Сочетая уравнения (II. 1) и (II. 4), имеем
RTdlnf = Vdp. (II. 7)
Подставляя значение V из уравнения (II. б) и преобразовывая
RTd In f = dp,
имеем
dlnf = z-~~. (II.8;
При интегрировании этого дифференциального уравнения
нижним пределом интегралов является р — 0, что приводит
к неопределенности. Чтобы избежать этих трудностей, уравне-
ние (II. 8) преобразовываем:
dta/=[l _(1 _г)] ie- = dinp~ (1-г)^-.
/ip р
J dln-^-= — J'~Z dp. (II. 9)
1 о
Величина также характеризует степень отклонения газа
от идеального состояния и называется коэффициентом актив-
ности. Интегрирование уравнения (И.9) приводит к основному
выражению для расчета летучести:
р
In — = — / 1 dp
р J р
о
и в приведенных координатах
Рпр
(II. 10)
(П-11)
Из рассмотрения графика коэффициента сжимаемости можно
заключить, что при постоянной температуре z является функ-
цией только приведенного давления и, следовательно, коэф-
фициент активности f/p при всякой температуре должен быть
тоже функцией только приведенного давления, как то следует
из уравнения (II. 11). Обобщенный график коэффициента актив-
ности для всех газов приведен на фиг. 30. В действительности
кривые, относящиеся к различным газам, не совпадают на обоб-
щенном графике, а образуют сравнительно узкий пучок, что
объясняется приближенностью закона соответственных состоя-
ний, но на графике в целях большей простоты и наглядности
эти пучки представлены каждый одной единственной кривой.
Интегрирование уравнения (II. 10) можно провести только
графически, так как в явной форме аналитическая зависимость z
от р неизвестна. Однако, если принять, что в небольшом интер-
вале малых давлений при постоянной температуре коэффициент
сжимаемости z является линейной функцией давления, решение
уравнения (II. 10) значительно упрощается. Принимая во вни-
мание, что при р = 0 прямая z = <p(p) должна пройти через
точку с ординатой z — 1, легко установить, что постоянный
наклон этой прямой будет равен —(1 —z)/p и уравнение (II. 10)
легко интегрируется:
р
lnV = f-^-dP^-^Р = -(1-г),
О
откуда
_L = e-(i-z)
р
Принимая во внимание, что при малых значениях z вели-
чина e~z = \ —z, имеем
Методы расчета летучести для газовых систем
47
и поскольку RT/V = рид, то
Согласно уравнению (II. 13) давление, развиваемое реальным
газом, является среднегеометрическим из летучести и давления,
вычисленного для идеального газа
Расчет летучести по уравнению (II. 13) является приближен-
ным, и вести его следует лишь при отсутствии других данных
и в условиях, достаточно удаленных от критических, все время
имея в виду его приближенность и ориентировочный характер.
При отсутствии достаточных экспериментальных данных
свойства реальных газов могут быть представлены путем выра-
жения молярного объема при помощи аддитивной по-
правки к нему:
V = - — а, (11.14)
где а —поправочный член к рассчитанному по уравнению иде-
альных газов молярному объему. Сопоставляя это уравнение
с уравнением (II. 7)
RT d In / = Vdp
и имея в виду, что
Vdp = (-у-) dp — adp, (II. 15)
путем подстановки значения V из уравнения (II. 15) в уравне-
ние (II. 7) можно получить еще одно соотношение, позволя-
ющее подсчитывать летучесть газа:
RT din f = RT d In p — adp
p
RT ln-^- = RT\ny= — У adp. (11.16)
о
Интеграл в правой части уравнения (II. 16) легко получается
графическим путем по графику, дающему зависимость попра-
вочного члена а от давления р.
Наконец, следует отметить, что определяющее летучесть
уравнение (II. 7) может решаться и аналитическим методом
2
путем вычисления интеграла J Vdp для реального газа при
1
помощи одного из многочисленных уравнений состояния. Так,
например, использование уравнения Ван-дер-Ваальса приводит
к соотношению
, , , RT Ь 2а лт
1п/ = 1пу_й + у — b RTy . (11.17)
ЛЯ Тепчпдпнпм.ииески.е методы. определения свойств веществ
Даже для практических инженерных расчетов точность вы-
числений по уравнению (II. 17) не может быть признана удов-
летворительной, и поэтому летучести реальных газов реко-
мендуется рассчитывать по опытным данным при помощи
уравнений (II. 10), (II. 11) или (11.16) методом графического
интегрирования.
§ 3. Методы расчета летучести конденсированных систем
Так как объем жидкости или твердого тела обладает пре-
небрежимо малой сжимаемостью, то можно считать, что
V = const и
^УАр = УАр-, (11.18)
Р2
RT\n± = f Vdp = V(p2-P1). (11.19)
и
Летучесть конденсированной фазы, находящейся в равно-
весии с собственным паром, равна летучести ее пара, и когда
упругость пара так невелика, что могут применяться законы
идеальных газов, летучесть жидкости или твердого тела может
быть принята равной давлению равновесного пара. Равенство
летучестей равновесных сосуществующих фаз позволяет опре-
делять свойства жидкости или твердого тела, выражая их через
свойства равновесного насыщенного пара.
§ 4. Стандартные состояния
Абсолютное значение ряда термодинамических функций
(внутренней энергии, энтропии, свободной энергии, а также
изобарного потенциала) неизвестно, и поэтому на основании
уравнения (II. 7) неизвестно абсолютное значение и летучести
реального газа.
Невозможность установления абсолютной величины лету-
чести диктует необходимость выбора стандартного со-
стояния, позволяющего отсчитывать ее значения от некото-
рого условно принятого уровня. Исходя из указанного выше
равенства летучести и давления в условиях, допускающих при-
менение законов идеального газа, за стандартное состояние
чистого газа принимается его гипотетическое состояние при
некотором низком давлении, когда отклонения от идеального
состояния пренебрежимо малы. Чаще всего принимается /0 =
= р=1 ат, и хотя в некоторых случаях это состояние для
рассматриваемого реального газа может оказаться практически
не реализуемым, тем не менее соображения удобства расчета
оправдывают сделанный выбор.
Активность 49
§ 5. Активность
Отношение летучести в данном состоянии к летучести
в произвольно выбранном стандартном состоянии при той же
температуре называется активностью:
а = ~~. (П.20)
/О
На основании уравнения (II.5)
Ф — Фа= ДФТ = КТ Ina. (11.21)
Для газов летучесть в стандартном состоянии /0 всегда
равна единице, и поэтому их активность и летучесть численно
равны. Активность применяется при исследовании свойств
растворов, ибо в смешанной фазе очень трудно, а подчас и
невозможно найти числовое значение летучести, но сравни-
тельно легко определяется значение отношения летучестей —
активности. Понятие активности позволяет рассматривать /0
в уравнении (II. 20) как единицу измерения летучести. Из вы-
бора стандартного состояния для газов вытекает, что при всех
температурах, когда давление равно 1 ат, летучесть газов
также равна 1 ат. Для жидкостей и твердых тел летучесть
может равняться единице лишь при одной какой-нибудь тем-
пературе, ибо упругость равновесного пара, насыщающего
пространство, является функцией температуры и изменяется
с последней. Стандартные состояния удобно выбирать таким
образом, чтобы можно было без заметной ошибки применять
законы идеальных газов и идеальных растворов не только
к разреженным газам или разбавленным растворам, но и к ре-
альным газам и к концентрированным растворам путем под-
становки в их выражения значений летучестей и активностей.
Для газов и паров обычно принимают
(П.23)
За стандартное состояние жидкости или твердого тела, рас-
сматриваемых как растворитель, принимается обычно то их
•состояние, в котором они действительно будут находиться под
внешним давлением 1 ат. Как указывалось выше, для газов
при всех температурах условию р=1 отвечает /=1. Для кон-
денсированной фазы это равенство будет справедливо не при
всех температурах, а лишь при одной единственной, так как
давление равновесного ей насыщенного пара является функ-
цией температуры и меняется вместе с ней. Поэтому в общем
случае активность конденсированной фазы не равна летучести,
.как для паров.
4 Зан. Л» 304.
50
Термодинамические методы определения свойств веществ
Если законы идеального газового состояния применимы
к пару раствора и к пару растворителя, то активность раство-
рителя at определяется по уравнению
= (11.24)
где Pi — парциальное давление растворителя, а Рг — упругость
его насыщенных паров при той же температуре. Закон Рауля
для идеального раствора Pi = PiXi'. Легко видеть, что в пре-
делах его применимости а/х = I. Для концентрированных рас-
творов степень отклонения этого отношения от единицы слу-
жит мерой отклонения реального раствора от идеального. На
основе этого соотношения может быть написана обобщенная
форма закона Рауля, применимая и для неидеальных раство-
ров:
^7 =^1 = 71^1X1'. (11.25)
Следует помнить, что в уравнении (II. 25) пар растворителя
принят подчиняющимся законам идеальных газов.
Аналогично летучести, играющей роль исправленного дав-
ления, активность может толковаться как исправленная кон-
центрация, позволяющая сохранить в расчетах внешне простую
форму закона Рауля. Поэтому соотношение между летучестью
и давлением такое же, как между активностью и концентра-
цией:
(11.26)
Коэффициент активности у является мерой отклонения
реального раствора от закона Рауля и таким образом характе-
ризует степень его неидеальности.
Таким образом, идеальный раствор это тот, у которого актив-
ность каждого компонента равна его молярной доле. Для не-
идеального же раствора коэффициент активности у определяется
как отношение действительной активности к идеальной, иначе
говоря, к молярной доле, как то следует из уравнения (П. 26)
В условиях, когда пары подчиняются законам идеальных
газовых смесей, летучесть чистой жидкости равна ее упругости
паров и коэффициент активности определяется по уравнению
(П. 27)
где парциальная упругость первого компонента, а Рг— упру-
гость его насыщенных паров.
Различные уравнения, представляющие экстенсивные свой-
ства, могут быть написаны при помощи парциальных молярных
количеств.
Влияние температуры и др.
5 У
§ 6. Влияние температуры, давления и концентрации
на парциальные молярные величины
Наиболее полезной из парциальных молярных функций
является изобарный потенциал. Согласно уравнению (I. 33)
общий изобарный потенциал раствора
ф =^ini Ф2п2. (II. 28)
В таком выражении Ф2 и т. д. имеют характеристики
потенциалов. В свете предыдущего изложения имеет смысл
определить летучесть любого компонента раствора, смеси или
другого комплекса по уравнению
Ф^ЯПпД + Ст, (II. 29)
где ст является константой при данной температуре. Более
того, изменение парциального молярного изобарного потен-
циала любого компонента, когда система изотермически пере-
ходит из какого-нибудь начального в любое конечное состоя-
ййС,-равно
ЛФг = /?Т In . (II. 30)
Для равновесия фаз, находящихся при одной и той же температуре,,
необходимо равенство парциальных молярных изобарных потенциалов каж-
дого компонента во всех фазах. Поэтому летучесть должна быть одной и
той же для любого выбранного компонента в каждой фазе. Парциальный
молярный изобарный потенциал компонента смеси равен молярному изобар-
ному потенциалу компонента в чистом состоянии при той же температуре,
что и смесь, и под давлением, равным его равновесному давлению, под
которым он существует в смеси. Эти парциальные молярные изобарные
потенциалы, как было указано выше, являются химическими потенциалами.
Влияние давления и температуры легко находится по аналогии с общими
термодинамическими выражениями для различных важных функций. Для
изобарного потенциала
( дФЛ - / \ = _ с = Ф1 —
\ др /т 1 \ дТ /р Т
поскольку Ф3 =RT In /1 -|- с, то
/ д In /i \ Vi .
\ др )т RT
( din/Л _ Н* — Н,
\ дТ )р RT
Для системы в целом согласно уравнению (П. 28)
{ д In fi \ . / д In /, \ . Н* — И
Л11-^с)+п4т) + -- = —RT-’
(П.31)
(II. 32)
(II. 33)
(11.34)
/din/
'h '
52
Тепм.пдпчпм1шеские методы определения свойств веществ
Математическое выражение влияния изменения количества
любого из компонентов раствора легко получается из уравне-
ния, подобного уравнению (II. 28):
«1
дФ, . дФ2
дпг ‘ 2 дп,
(II. 35)
Применение уравнения (II. 35) к бинарному раствору дает
или
дФ1 п2
дФ2 ~ «1
д In /j _ n2
д In /2 п1
(11.36)
(II. 37)
Если равновесные пары подчиняются газовым законам, то
летучести могут быть заменены парциальными давлениями:
д In рг__ п2
д\п р2
(II. 38)
Если х' — молярная концентрация первого компонента,
(I—х')—молярная концентрация второго, то
д In Pi _ х' — 1
д In р2 х'
(II. 39)
Уравнения (11.38) и (11.39) называются уравнением Дюгема.
Это очень важное соотношение между парциальными давлени-
ями компонентов бинарной системы, пары которой следуют зако-
нам идеального газа. Интегрирование уравнения Дюгема часто
очень затруднительно и во всех случаях требует знания парци-
альных давлений в функции состава.
Покажем использование уравнения (11.39) на конкретном примере бинар-
ной системы хлороформ — ацетон. Найденные при 35° опытным путем парци-
альные давления компонентов этой системы при различных составах равно-
весных фаз приведены в табл. 1.
Уравнение (11.39) запишем в следующем виде:
x'd 1g Pi + (1 — х') d 1g p2 =0.
Отношение парциального давления каждого компонента к его молярной
доле в жидкой фазе обозначим соответственно через кг и к2. Тогда
р1 = к1х' и р2 = к2 (1 — х').
Подставляя эти значения в предыдущее соотношение, имеем
х' (d 1g кА + d 1g х') + (1 - х') [d 1g k2 + d 1g (1 - x')] = 0:
x'd 1g + (1 — x') d 1g k2 =0;
dlg/G = -^^dlgk2.
Влияние температуры и др.
53
Таблица 1
Молярная доля хло- роформа в равновесных фазах Парциальное давление паров, мм рт. ст.
ЖИДКОЙ паровой суммарное хлороформа ацетона
0,0000 0,0000 344,5 0,0 344,5
0,0588 0,0277 332,4 . 9,2 323,2
0,1818 0,1029 308,0 31,7 276,3
0,3568 0,2603 273,5 71,2 202,3
0,4930 0,4361 255,5 111,5 144,2
0,5516 0,5203 250,8 130,5 120,3
0,6635 0,6830 249,2 170,2 79,0
0,7997 0,8569 261,9 224,4 37,5
0,9175 0,9536 280,1 267,1 13,0
1,0000 1,0000 293,1 293,1 0,0.
Интегрируя в пределах от х'=1 до рассматриваемого значения х', полу-
чаем
х'
lg*i = Ig/3i — I
i
где Pj — упругость насыщенных паров хлороформа.
Интеграл в правой части этого уравнения может быть найден только гра-
фически. Для этого рассчитывается табл. 2. По данным этой таблицы строится
график (фиг. 6) зависимости
(1 — х'/х') от 1g к,.
График позволяет прово-
дить термодинамическую про-
верку опытных данных преды-
дущей таблицы. Пусть, на-
пример, мы задались целью
Таблица 2
х' Ч 1 /с2 1g *2
0,0000 344,5 2,537
0,0588 16,000 343,4 2,536
0,1818 4,500 337,7 2,528
0,3568 1,803 314,5 2,498
0,4930 1,028 284,5 2,454
0,5516 0,813 274,5 2,438
0,6635 0,507 235,0 2,370
0,7997 0,250 187,0 2,272
0,9175 0,089 157,0 2,197
1,0000 0,000 141,0 2,150
Г14 МЛ’Т'оЛ >./ ПППР/^Р HPUUd ГРОрГТР РРЩРСТР
выяснить, насколько правильно определены парциальные давления, отвеча-
ющие составу х'= 0,5516. Этому значению молярной доли хлороформа в жид-
кой фазе отвечает 1g к2 = 2,4385. Нанеся эту точку на ось абсцисс и про-
ведя вертикаль АВ, находим, что заштрихованная площадь под кривой
равна 0,088. Тогда
lg/q= lg Р,—0,088 = 1g 293,1—0,088 = 2,379 и ^ = 239,3.
Парциальное давление хлороформа должно равняться
Pi = Лрс'= 239,3 х 0,5516=132 мм рт. ст.
вместо определенного опытным путем значения р,— 130,5 мм рт. ст. Расхожде-
ние лишь немногим больше 1%, и поэтому опытную цифру следует рас-
сматривать как вполне удовлетворительную.
§ 7. Обобщенный метод расчета свойств однокомпонентных
систем
Расчет важнейших термодинамических свойств, теплоемко-
стей ср и су, энергии U, энтропии 8 и энтальпии И произво-
дится при помощи основных термодинамических дифферен-
циальных уравнений, связывающих эти свойства с уравнением
состояния тела, задаваемым в виде:
9>(р, У,Т) = 0. (11.40)
Установление указанных выше свойств веществ необходимо
для использования выведенных ранее уравнений, позволяющих
судить о направленности процесса. Вывод соответствующих
дифференциальных соотношений приведен ниже.
В качестве исходных уравнений примем соотношения (1.26),
(1.27), (1.28), определяющие дифференциалы термодинамиче-
ских функций U, Ф и F и уравнение dH = dU + pdV, в котором
на основании выражения (1.26) двух объединенных законов
термодинамики произведена замена dU через TdS — pdV:
dU = TdS-pdV; (1.26)
dФ^=-SdT + Vdp, (1.27)
dF = — SdT - pdV\ (I. 28)
dH = TdSA Vdp. (П. 41)
U, Ф, F и H являются функциями состояния системы,
и потому их дифференциалы являются полными дифференци-
алами, поэтому можно использовать хорошо известное свой-
ство равенства накрест взятых частных производных для нахо-
ждения четырех важных соотношений:
(Ф,—($,—($),• <"-43’
Q-«V(n-44) <П45)
Расчет свойств одноиомпонентных систем а5
Далее, положив в уравнениях (I. 26) — (I. 28) и (И. 4) попеременно то одну,
то другую переменную постоянной, можно автоматически получить еще
следующие восемь соотношений:
(Д--Р1 (11.46) 01.47)
<1Г49)
(Д- (U.50) (Sv=-Sl (" SO
(f)s-^<"-52> Ш,-Т' <,L5”
Полученных соотношений (11.42) — (11.45) вполне достаточно
.для вывода интересующих нас дифференциальных уравнений.
Выведем уравнение, определяющее внутреннюю энергию
системы в функции V и Т как независимых переменных.
Из уравнения (1.26) при постоянной температуре имеем
Vdv)T ~ Т \dViT ~ Р'
Принимая во внимание соотношение (П. 44), находим
(0-54)
При постоянном объеме на основании первого закона
/ ЗСА
= cv! поэтомУ окончательно имеем
dU = cvdT + [r^v~p]dV. (II. 55)
Аналогичным путем можно вывести уравнение для опре-
деления энтальпии Н в функции Т и р. Из уравнения (П.41)
при постоянной температуре имеем
(2^1 =Т(^) 4-V
\ др JT \ др JT
или, принимая во внимание соотношение (II. 43), находим
(<¥L\ — у_у (
\ дР)т \ дт)р
Так как при постоянном давлении (-^у) ~СР, окончательно
получаем
dH = cpdT - [Т - у] dp. (II. 56)
56 Теомодинамические методы определения свойств веществ
Уравнения (11.55) и (11.56) связывают для любой системы
внутреннюю энергию U и энтальпию Н с экспериментальными
данными р, V и Т, поэтому их иногда называют термодина-
мическими уравнениями состояния и представляют следующим
образом:
Р 'dT/v \dVIT
(П.57)
(II. 58)
„ / dU \ (дН \ '
Значения и -д-) удобнее находить по этим урав-
\ uV /'jp \ Oplrp
нениям, чем непосредственным измерением, так как значительно
проще экспериментально определить изменение давления с тем-
пературой при постоянном объеме или тепловое расширение
веществ при постоянном давлении.
Для нахождения изменения энтальпии (J/Y)T при постоян-
ной температуре между двумя значениями давления р необ-
ходимо прибегнуть к графическому интегрированию, нанеся
на график V — Т в функции р при выбранной постоян-
ной температуре. Плодцадь под кривой в заданных пре-
делах изменения р будет равна искомому изменению энталь-
пии.
Изменение энтропии системы также может быть представ-
лено при помощи свойств р, V и Т, если принять во внимание
очевидные соотношения, вытекающие из уравнений, опреде-
ляющих энтропию S и теплоемкости су и ср:
с_р_
т
(II. 60)
Принимая
написать
во внимание соотношения (11.43) и (11.44), можно
dS = ^dT-(^dp (11.61)
и
dS dT + (^\ dV. (11.62)
J \ 01 / у
Наконец, выведем уравнения, представляющие теплоем-
кости ср и cv в функции свойств р, V и Т, входящих в урав-
нение состояния (11.40). Для этого достаточно прибегнуть
к уравнениям (11.55) и (11.56), применив к ним правило равен-
ства накрест взятых производных. Так, из уравнения (II. 55)
Расчет свойств однокомпонентных систем
57
на основании указанного свойства ^удт = можно получить
Т
УдТ*)у
(II. 63)
На том же основании, применяя соотношение = dp()f
к уравнению (II. 56), можно получить
Во все полученные соотношения (11.55), (11.56), (11.61),
(II. 62), (II. 63) и (II. 64), определяющие термодинамические
свойства системы U, Н и S и теплоемкости ср и cv, входят
лишь свойства р, V и Т в виде первых и вторых производных.
Применяя соотношения, связывающие свойства р, V и Т
и калориметрические данные, можно решить эти уравнения
и рассчитать термодинамические свойства веществ. ~
Однако точное определение частных производных, вхо-
дящих в эти уравнения, практически невозможно
вследствие небольшой кривизны соответствующих кривых.
Поэтому принято частные производные от р, V и Т находить
косвенным путем, выражая их через коэффициент сжимае-
мости z или остаточный объем а.
Как указывалось в разделе, посвященном летучести, урав-
нение состояния для реальных газов может быть представлено
двумя способами:
pV = zRT (II. 6) и а=^— V. (11.14)
Из этих двух уравнений можно установить связь между
коэффициентом сжимаемости z и остаточным объемом а:
ч = ^(1-z); (11.65) 2 = -^. (11.66)
В соотношения, выведенные выше, входит ряд первых
и вторых производных. Найдем их значения по уравнениям
состояния (II. 6) и (11.14).
Дифференцируя эти уравнения, имеем первую производную
от объема по температуре при постоянном давлении:
( dV\ zR . RT f dz\ ...
(Д-7+7Ы, (ll67)
и
=--(4^ . (И.68)
\dTjp p \dT/p ' 1
Трпмпг)инами.че/:к.ие методы, оппеделения свойств веществ
Вторая производная объема по температуре при постоянном
давлении найдется дифференцированием полученных уравнений
(11.67) и (И. 68):
д2У \ _ 27? , dz \ RT / d2z \
дТ21р ~ р \ дТ1р+ р \ дТ2
(II. 69)
/ д2У \ / д2а \
ХдТ2)? \~дТ2)1
(II. 70)
Производная объема по давлению при постоянной темпера-
туре найдется дифференцированием уравнений состояния (II. 6)
и (II. 14):
фУ\ 7?г / dz \ z7?T
~ р \ др )т р2
(П-71)
др)т
RT / да
р2 \ др !т ’
(П.72)
Производная давления
• объеме получается тем же
по температуре при
путем:
постоянном
и
/ др \ _ zR . RT ( dz\
\ If I v ~ ~У ~V \ ~df} v
I dp\ _ R RT / da\
\dTJv~ V + a (Va)2 \ dT J у
(II. 73)
(II. 74)
Вторая производная давления по температуре при постоян-
ном объеме найдется дифференцированием уравнений (11.73)
и (11.74):
(д2Р \ • /и
\dT2Jv V \ дТJV \dT2)v' И1- о;
/ д2р \ _ '2RT I д2а \ 27? I да \ ...
\дТ2)у~ (У + а)Ц дТ2)у (V + a)2\dT/y-
Путем подстановки полученных первых и вторых производ-
ных в выведенные ранее основные дифференциальные уравне-
ния, определяющие свойства, можно привести их к виду,
удобному для практических расчетов при помощи графика
коэффициента сжимаемости или данных по остаточному объему.
При этом дифференцирование и интегрирование получаю-
щихся соотношений следует вести графическим путем.
Покажем, как преобразуются основные термодинамические
дифференциальные уравнения при замене производных р, V
и Т через выражения, представляющие их при помощи z и а.
Так, уравнение (11.55) при помощи уравнений (11.73) и (11.74)
может быть преобразовано в следующие два вида, в которые
Расчет свойств однокомпонентных систем
59
входят лишь производные коэффициента сжимаемости и оста-
точного объема:
dU-c^T + ^-^dV (11.77)
И
("-77а>
Значение р в этих соотношениях исключено при помощи
уравнений состояния (II. б) и (II. 14).
Равным образом могут быть получены аналогичные урав-
нения и для энтальпии путем сочетания уравнения (II. 56)
с уравнениями (11.67) и (II. 68):
dH = cpdT — dp (11.78)
и
dH = CpdT - [а — Т | dp. (II. 79)
сравнений, определяющих энтропию, будет, очевидно,
четыре в соответствии с выбранной парой независимых пере-
менных р и Т или V и Т. Так, сочетая уравнение (11.61)
с уравнениями (П. 67) и (II. 68), имеем
dS = -^-dT--^[z + T^]dp (П.80)
dS = h-dT—^-dp+^) dp. (П.81)
Сочетание же уравнения (II. 62) с уравнениями (II. 73) и (И. 74)
приводит к соотношениям
dS=^dT + -^[z+T(^)v\dV (11.82)
и
4S-^dT + ^dV-^(^dV. (П.83)
Соответствующие выражения для теплоемкостей могут
быть найдены путем сочетания уравнений (II. 63) и (11. 64) с урав-
нениями (II. 75) — (II. 76) и (II. 69) — (II. 70) соответственно:
fdcv\ 2RT / RT*( <Pz х . ш S4v
Ыт=тН+^^)’ (п-84)
( dcv А _ ‘2RT2 / дга \ 2/?7" / да \ _ щ gc\
V JT~ (V + a)A № (V + a)2 W/v; ' ’
i-n
To пмпгЬта uf/upru-ne методы оппеделемня. свойств веществ
дср\ ‘2RT I д2 \ RT2 / d2z \
~др~)т~ р \дТ1р р \ дТ2 )р ’
дср \ =т / д2а \
др JT ( дТ2 )р •
(II. 86)
(11.87)
Для интегрирования дифференциальных уравнений (П. 77) — (11.87) сле-
дует иметь в виду, что обычно коэффициент сжимаемости z и остаточный
объем а коррелируются в функции приведенных давления л и темпера-
туры т.
Эта корреляция а и z в приведенных координатах основана на том опыт-
ном факте, что все газы в соответственных состояниях характеризуются
приблизительно равными значениями коэффициента сжимаемости z и оста-
точного объема а. Поэтому в качестве вспомогательного средства привлекают
в расчетах обобщенный график z = y (л, т). Наравне с коэффициентом сжимае-
мости в расчете термодинамических свойств газов часто используется и при-
веденный остаточный объем апр, который в некоторых случаях более поле-
зен, чем. коэффициент сжимаемости.
Таким образом, имеет смысл заменить в уравнениях (П. 77) и (II. 77а)
абсолютные величины температур, давлений и остаточных объемов через их
приведенные значения, определяемые уравнениями
При этом следует пользоваться следующими выражениями для произ-
водных, получаемых дифференцированием приведенных выше соотношений:
/да\ К #г)р ' _ акр / ~ Т ' кр fdaw\ . (11.89)
д2а \ дТ2 „ = акр / " Т2 \ ' дЧР \ <Эт2 /_ ’ (П.90)
р кр '
/ dz\ 1 / dz\ (11.91)
Ркр
1 дг \ 1 I dz \ (II. 92)
н — ~т кр (Д-
Покажем на конкретном примере расчета изменения энтальпии реального
газа при постоянном давлении использование полученных выше уравнений
для определения свойств веществ. Из уравнения (II. 78)
RT21 dz \
Р \дТ>-
(П.93)
Делая подстановку из уравнения (II. 92) в уравнение (II. 93) и имеа
в виду, что dp — pKpdn., заменяя р и Т приведенными значениями, можно,
получить
(дН\ 1 = ffT2rKP2/^z\
V дп \ Р«р лРКрТкр '
Расчет свойств однокомпонентных систем
62
Термодинамические методы определения свойств веществ
Сокращая и произведя интегрирование в пределах от давления, при кото
ром энтальпия не зависит от р, до рассматриваемого высокого давления,
можно получить
Фиг, 8, График для расчета изменения энтальпии газа при высо-
ких давлениях.
Значения частной производной коэффициента сжимаемости по приведен-
ной температуре при постоянном давлении могут быть определены методом
графического дифференцирования по обобщенному графику зависимости
г = т>(л, т). Нанеся на график значения (д2/дт)п в функции 1пл, можно полу-
чить кривую, площадь иод которой в заданных пределах интегрирования равна
интегралу, стоящему в правой части уравнения (11.94). Его значение пере-
считывается в тепловые величины и затем вносится поправка к Но, которая
подсчитывается по уравнению
Т
Нв = f cpdT, (II. 9.5)
П
где Но — энтальпия при весьма малом давлении, не влияющем на энтальпию.
__j-j
На фиг. 7 и 8 представлены графики, дающие зависимость —у----------—
1 кр
= ф(л, т), при помощи которых можно рассчитать изменение теплосодержа-
ния газа при его сжатии от весьма малого стандартного давления р0 до рас-
Расчет свойств однокомпонентных систем КЗ
сматриваемого высокого давления, при котором энтальпия уже зависит от
да вления.
То же самое важное термодинамическое свойство — энтальпию Н —
можно рассчитать, использовав другую корреляционную зависимость, пред-
ставляющую остаточный объем а в функции приведенных координат. В самом
Фиг. 9. Зависимость теплоемкости газов от приведенных температуры и
давления.
деле, заменяя в уравнении (II. 79) абсолютные величины приведенными
можно получить
dH = cpdT - Ркракр [апр - т (П. 96)
Аналогичным образом можно рассчитать и другие свойства реальных
газов — внутреннюю энергию, энтропию, теплоемкости. Впрочем, значение
внутренней энергии U лучше всего рассчитывать по энтальпии при помощи
простого соотношения
U = H — pV.
(11.97)
64 Тепмодинамические методы определения свойств веществ
Расчет изменения энтальпии ио уравнению (11.96) ведется тем же мето-
дом графического дифференцирования и интегрирования, что и вычисление
по формуле (II. 94). Рекомендуется в области давлений и температур, близ-
ких к критическим, использовать корреляцию а = <р(.т, г), а в областях, уда-
ленных от критического участка, корреляцию 7 — ц>(л, т).
На основании выведенных выше формул и соотношений были построены
специальные графики, при помощи которых можно вести расчет зависимости
изменения энтальпии, энтропии и теплоемкости от приведенной температуры
и приведенного давления. На фиг. 9 представлен такой график, используемый
для расчета теплоемкости ср при высоких давлениях. Ординаты графика
дают значение ср—ср*, где ср* — теплоемкость при данной температуре
и бесконечно малом давлении, не влияющем на величину теплоемкости.
Поправки, получаемые но этому графику, иногда довольно заметно отлича-
ются от опытных значений, тем не менее при отсутствии экспериментальных
значений теплоемкости указанный метод расчета является лучшим прибли-
жением.
§ 8. Обобщенный метод расчета свойств газовых смесей
Основанный на принципе соответственных состояний обоб-
щенный метод расчета термодинамических свойств индивиду-
альных газов может быть применен и к вычислению свойств
газовых смесей. Важным положительным фактором является
то обстоятельство, что при определении свойств газовых сме-
сей можно использовать такие параметры, как коэффициент
сжимаемости, остаточный объем или соответственно уравнение
состояния в приведенной форме, сохранив неизменной обоб-
щенную методику, разработанную для чистых газов. Однако
опыт показывает, что использование истинных критических
параметров смесей приводит к значительным отклонениям
кривых, выражающих свойства газовых смесей, от кривых,
представляющих свойства чистых газов. Поэтому при вычисле-
нии свойств смесей применяются такие специально подобранные
значения исправленных критических параметров, при исполь-
зовании которых могут применяться те же соотношения, что
и для индивидуальных газов. Эти усредненные критические
параметры называются псевдокритическими. Если, например,
известны значения псевдокритической температуры и псевдо-
критического давления для сложной углеводородной смеси,
то при помощи этих параметров по обобщенному графику
коэффициента сжимаемости может быть найдено значение
последнего и простым расчетом по уравнению (П. б) вычислен
удельный объем газовой смеси.
Однако, если бы вместо псевдокритических параметров
в решении этой задачи были использованы истинные критиче-
ские температура и давление, то результат заметно отклонялся
бы от опытного. Таким образом, идея псевдокритических пара-
метров и соответственно псевдоприведенных свойств газо-
вых смесей играет важную роль в определении свойств
веществ.
Определение псевдокритических констант
65
Как показали исследования низших углеводородов, критиче-
ская температура смеси газов обладает свойством аддитивности
на базе молярной доли и может быть рассчитана по правилу
смешения, исходя из значений критических температур ком-
понентов системы. Сложнее находить значение критического
давления смеси газов, которое в ряде случаев может быть
выше, чем критическое давление любого из компонентов смеси,
и в конечном счете определяется относительным содержанием
компонентов газовой системы.
Экспериментальное определение псевдокритических пара-
метров ведется косвенным путем. Для определенной газовой
смеси устанавливаются опытные значения давления, удельного
объема и температуры и по этим данным рассчитываются те
псевдокритические параметры, которые при расчете по графику
обобщенной зависимости для коэффициента сжимаемости или
остаточного объема дают те же значения свойств системы, что
и найденные опытным путем. Если располагать найденными
подобным образом значениями псевдокритических параметров
для достаточно большого ряда газовых смесей, то можно
путем их корреляции предложить методы расчета псевдокри-
тических температур и давлений любых углеводородных систем
по их составу или разгонке.
§ 9. Определение псевдокритических констант
Естественный нефтяной газ, крекинг-газ и их фракции
состоят из низших представителей соответствующих классов
углеводородов, и для определения их псевдокритических кон-
стант исходят из установленной указанным выше опытным
путем аддитивности этих параметров на базе молярной доли:
п п
Трс. кр — 2 У‘i (крЬ (11.98) Рпс. кр — 2 Уг Р> (кр)- (11.99)
1 1
Для нефтяных фракций сложного углеводородного состава,
выкипающих в пределах кипения бензина и выше, неизвестен
точный углеводородный состав и не всегда имеются в распо-
ряжении достаточно надежные данные по истинным критиче-
ским температурам и давлениям. Однако даже при их наличии,
ввиду чрезвычайно большого числа компонентов, расчет псевдо-
приведенных констант по уравнениям (II. 98) и (II. 99) не пред-
ставляется возможным. Поэтому наиболее удобным и правиль-
ным путем корреляции опытных псевдоприведенных данных
является их представление в функции некоторых определяю-
щих свойств нефтяной фракции. Если в качестве таких свойств
принять среднюю точку кипения фракции, ее средний удель-
ный и молекулярный веса, то можно получить удобную
5 Зак. -М 304.
66 Термодинамические методы определения свойств веществ
графическую корреляцию, представленную на фиг. 10. Средняя
точка кипения нефтяной фракции связывается с удельным
весом ее при помощи характеризующего фактора К, опреде-
ляемого по формуле
1
/<= 1,216. (П. 100)
Фиг. 10. Определение псевдоприведенных параметров нефтяных фракций.
ПсеВВокритическая температура °C
На фиг. 10 характеризующий фактор К, учитывающий
химическую природу рассматриваемой нефтяной фракции, пред-
ставлен как параметр семейства кривых, дающих значения
псевдоприведенных констант в функции среднего молекуляр-
ного веса рассматриваемой фракции. Таким образом, для опре-
деления псевдоприведенных температуры и давления нефтяной
фракции достаточно знать ее разгонку и средние молекуляр-
ный и удельный веса.
При помощи псевдоприведенных констант можно исполь-
зовать обобщенную методику расчета свойств чистых газов
для вычисления свойств газовых смесей.
ГЛАВА III
РАСТВОРЫ
§ 1. Определение понятия
Раствором называется система, состоящая из двух или
большего числа индивидуальных веществ, обладающая во всех
частях одними и теми же химическими и физическими свой-
ствами.
Согласно определению понятие раствора охватывает любые
агрегатные состояния системы:—жидкие,—газообразные и твер-
дые. Примерами растворов являются нефть и нефтепродукты,
естественный нефтяной газ и воздух, жидкие и твердые сплавы
металлов и расплавленные смеси силикатов. Основной характе-
ристикой раствора является совершенно равномерное распре-
деление составляющих его веществ друг в друге. В этом
смысле необходимо отличать растворы от химических соеди-
нений и простых смесей. Химические соединения состоят из
молекул одного лишь вида и с точки зрения правила фаз
являются однокомпонентными системами, не подходящими под
определение понятия раствора. В растворе же число состав-
ляющих веществ может быть любым, ибо молекулы их в ра-
створе сохраняются химически неизменными. От простых сме-
сей растворы отличаются совершенно равномерным распреде-
лением молекул компонентов по всему объему фазы, тогда
как жидкие смеси, называемые суспензиями, эмульсиями или
коллоидными растворами, являются системами из двух или
большего числа фаз, перемешанных с различной степенью
дисперсности.
При изучении свойств раствора существенное значение
имеет способ представления его состава, определяющего, из
каких компонентов и в каком относительном количестве со-
стоит раствор.
§ 2. Состав растворов
Свойства жидкого раствора или смеси газов зависят от
свойств исходных компонентов, составляющих смесь или рас-
твор, и от относительного их содержания, называемого кон-
центрацией. Поэтому весьма важно уметь выражать составы
5*
6Я
Рагтрпт.!
смесей наиболее удобным для практических растворов образом.
Обычно составы смесей принято выражать либо в весовых до-
лях, либо в молярных долях,, представляющих относительное
содержание отдельных компонентов смеси.
§ 3. Весовая доля
Пусть рассматриваемая смесь содержит gt килограммов
первого компонента, g2 второго, g3 третьего, gn килограммов
л-го компонента. Тогда весовая концентрация z-го компонента
смеси определяется соотношением
g o . о.
1 Z Z / г т т 1 \
1 gx + ga + gs + • ’ • + g„ 2 Si G ’
где G —общий вес системы в целом.
Отношение веса данного компонента смеси к общему ее
весу называется весовой долей рассматриваемого компонента
в системе. Совокупность значений весовых долей компонентов
системы полностью характеризует ее состав. При этом в смеси,
состоящей из п компонентов, независимыми будут только
(п—1) весовых долей вследствие очевидного между ними
соотношения
xi + x2 + • • + хп = ‘ ‘ ‘ + 1’ ОН- 2)
bi bi bi
согласно которому сумма весовых долей всех компонентов
системы равна единице.
§ 4. Молярная доля
Другим широко применяющимся способом представления
состава смеси является его выражение при помощи термо-
динамической концентрации, обычно называемой молярной
долей, которая определяется аналогичным образом как отно-
шение числа молей данного компонента к общему числу
молей всей системы в целом.
Согласно определению молярная доля
z-го компонента системы, содержащей
понента, п2 молей второго, щ молей г-го,
шения
nt
х‘ ~ п, п., + пп~ % N
ИЛИ мольдробь Xi
молей первого ком-
найдется из соотно-
шу
где N — общее число молей системы.
Как и в представлении состава системы весовыми долями,
в смеси, состоящей из п компонентов, независимыми будут
Объемная доля 69
только (п — 1) молярных долей, вследствие очевидного между
ними соотношения
хг + х/+... + х„'=Д + Д+...+Д=Ь (Ш.4)
согласно которому сумма молярных долей всех компонентов
системы равна единице.
§ 5. Объемная доля
Составы систем иногда представляют еще и при помощи
так называемой объемной доли,, являющейся отношением
объема рассматриваемого компонента к общему объему смеси.
Согласно определению объемная доля у,- какого-нибудь ком-
понента системы, содержащей единиц объема первого ком-
понента, V2 единиц объема второго, \'п единиц объема п-го,
найдется из соотношения
__________________________V,________У; V,______________________
Vi = VTTVT+ • • +V„ = £У~Г
где V — общий объем системы.
Между объемными долями компонентов системы, очевидно,
имеется соотношение
vi + °2 + • • • + vn = -^у- + -^у- + • • • + у-у = 1, (1П. 6)
v i у i v п
согласно которому сумма объемных долей всех компонен-
тов системы равна единице и поэтому независимыми будут
только (п— 1) объемных долей.
Большим преимуществом весовых и молярных концентра-
ций является их независимость от давления и температуры,
а в любом процессе нефтепереработки по крайней мере один
из этих параметров является переменным. С другой стороны,
при смешении жидкостей часто изменяется объем, что при-
водит к существенным недоразумениям при использовании
объемной концентрации и, в частности, к невыполнению соот-
ношения (III. 6).
Важно отметить, что все газы, подчиняющиеся законам
идеального газового состояния, обладают равными молярными
объемами при одинаковых условиях давления и температуры
и поэтому численные значения молярной и объемной долей
для компонентов идеальной газовой смеси совпадают. В смесях
реальных газов в условиях низкой температуры и высокого
давления, когда отклонения от законов идеальных газов ста-
новятся заметными, это равенство нарушается.
70
Рлс.тяопы
§ 6. Килограммолекула и средний молекулярный вес
Как известно, килограммолекулой или молем называется
весовая единица измерения, содержащая число килограммов
вещества, равное его молекулярному весу. Обозначив молеку-
лярные веса компонентов системы соответственно через Mlt
М2, ,Мп и общий вес системы через G, можно найти общее
число N молей системы по соотношению
N== м2 +--------F^"~ = «i + n2 + -+пп = ~-, (Ш. 7)
где 7Иср — средний молекулярный вес системы.
Понятие среднего молекулярного веса системы хотя и не
имеет реального эквивалента, тем не менее служит удобным
средством упрощения вида расчетных формул. Согласно (III. 7)
можно определить средний молекулярный вес химически не-
однородного вещества как тот молекулярный вес, который был
бы у этого вещества, если бы оно было химически однородно
и состояло из молекул, имеющих такую же массу, какова сред-
няя масса фактически составляющих это вещество молекул.
§ 7. Пересчет составов
Установив понятие среднего молекулярного веса системы
или фазы, можно вывести соотношение, связывающее моляр-
ную и весовую доли компонента и служащее для их взаим-
ного пересчета. Молярная доля z-ro компонента определяется
по соотношению
x.'-nG
Xl ~ N ‘
Подставляя из (III. 7) значения nt и N и имея в виду, что
Xi=gilG, можно получить
П, £,• О gi Л1-_ Л4 ,, X,
у.' —_!_ = • ° _ Si _ ср_ _ ср 1 nil Я)
‘ N ‘ Мср G Mi Mi ’ 1 '
откуда
МсрХ1 = М^'. (Ш.9)
Соотношение (III. 9) играет важную роль при пересчете
молярных долей в весовые и обратно.
Аналогичным путем, обозначив общий объем смеси через V,
удельный вес ее через 7<;р и удельный вес г-го компонента
через у,, можно вывести соотношение, связывающее весовую
и объемную доли любого компонента системы. Вес gi компо-
Расчет среднего молекулярного и среднего удельного весов
нента равен gi = Viyi, вес всей системы G = Vycp, а весовая
доля
gi vi ?i
Xi = -7Г- = -77-----— Vi ---- ,
° V Уср У ср '
откуда
Ус₽Хг=ущь (III. 10)
Соотношение (III. 10) играет важную роль при пересчете
весовых долей в объемные и обратно.
Для определения соотношения, связывающего объемную
долю с молярной, необходимо из уравнения (III. 10) исключить
Xi при помощи уравнения (III. 9)
_ м, V
Подставляя эту величину в (III. 10), получим
AVcpV
= М-
и окончательно
Мср71щ = ЛДусрх,'. (III. И)
При помощи формулы (III. 11) производится пересчет моляр-
ных и объемных долей.
§ 8. Расчет среднего молекулярного и среднего удельного
весов
Если написать формулу (III. 9) для всех компонентов смеси
и просуммировать, то получится соотношение для определе-
ния среднего молекулярного веса системы при помощи моляр-
ных долей
М,рх1 = Л41х1'
Мсрх., = Л12х2'
— МпХп
Л1Ср (хх -Т х2 + ...-(- хп) = М^х^ -f- М2х2' -f- ...-/- Мпхп'
и окончательно /=п
Л4Ср--xxLz-г .'И,х2z . . + Мпхп' = У, MiXi' (III. 12)
i = i
Те свойства системы, числовые значения которых опреде-
ляются суммированием числовых значений свойств компонен-
тов этой системы или рассчитываются по правилу смешения, назы-
ваются аддитивными. Из рассмотрения формулы (III. 12) можно
заключить, что на базе молярной доли средний молекулярный
72
Растворы
вес системы является аддитивным свойством, иоо рассчиты-
вается по правилу смешения или как среднеарифметическая
величина.
Если ту же формулу (III. 9) написать для всех компонентов
системы в несколько преобразованном виде, а именно в виде,
решенном относительно молярной доли, и затем просумми-
ровать, то получится соотношение для определения среднего
молекулярного веса системы при помощи весовых долей
, Мср
х‘ -=^ЙГХ1
, Мер
х> =~мгх*
Средний молекулярный вес определяется через весовые
доли компонентов как среднегармоническая величина и по-
этому на базе весовых составов не является аддитивным свой-
ством. Аналогичные соотношения можно вывести и для сред-
него удельного веса смеси, используя уравнение (III. 10). Если
написать его для всех компонентов смеси и просуммировать,
то получится соотношение, связывающее средний удельный
вес системы с объемными долями компонентов:
УсрХх = m
УсрХ2 = У 2^2
УсрХп = УпУп______________
У ср (Хх + х2 + . . . + Хп) = уср = y-iV-L + y2V2 + . . . + ynVn =
= 2? у,vt. (III. 14)
Из формулы (III. 14) можно заключить, что на базе объем-
ной доли средний удельный вес является аддитивным свой-
ством, ибо определяется по правилу смешения как средне-
арифметическая величина. Здесь уместно подчеркнуть, что
принимается полное отсутствие сжатия при составлении жид-
кого раствора из исходных компонентов.
Формулы для бинарной системы 73
Если- же формулу (III. 10) написать для всех компонентов
в виде, решенном относительно объемной доли, то получится,
соотношение, связывающее средний удельный вес системы,
с весовыми долями компонентов:
4р
п3 = —— х2
?2
Ап
Vn — V Хп
У п
I it/ ^2 1 1
Vi + V-2 + • • • + Vn — I ~ Ар I н ~ г ... 4- —
\ '* 1 14 ‘ п ]
и окончательно
—= + .. (П1.15)..
Ар 71 /2 ' Vn Vi
Из формулы (III. 15) можно заключить, что на базе весовой
концентрации средний удельный вес не является аддитивным
свойством, ибо определяется как среднегармоническая вели-
чина.
§ 9. Формулы для бинарной системы
Для простейшей бинарной системы сумма концентраций
обоих ее компонентов равна единице и поэтому х2=1—xv
Для бинарной системы обычно значки опускаются и тогда
формула (III. 9) пересчета молярных долей в весовые запи-
шется так:
Mix'
Х ~ М1х' + Л12(1^7')
или в виде, более удобном для расчетов:
1
V —------------------
Mi \ х I
(III. 16)
(III. 17)
Аналогично выводимая формула для пересчета весовых
долей в молярные представится следующим образом:
Ф + ^(Ф- ')] • ("1.18)
Совершенно аналогично могут быть выведены и формулы
пересчета весовых и объемных долей для бинарной системы.
По уравнениям (III. 10) и (III. 14)
х = У1П : [ущ + у2(1 —у)] = 1 : [1 +7П'“Г~1)| • <IIL ,9>
7Z
рп/''rpr'fyi^l
Пересчет весовых долей в объемные ведется по тем же
уравнениям (III. 10) и (III. 14):
= + (111.20)
Преобразование формул пересчета составов бинарной си-
стемы к уравнениям (III. 16) — (Ill. 20) имеет целью придать им
вид, наиболее удобный для вычислений по счетной линейке.
§ 10. Другие виды концентраций
При расчете многих важных нефтезаводских процессов,
например абсорбции или некоторых случаев экстракции,
а также при расчете реакторов и отгонных колонн наряду
с рассмотренными весовыми и молярными дробями для харак-
теристики системы приходится пользоваться и другими, более
удобными способами представления состава фаз.
Так, состав системы может быть выражен числом молей
компонента или весом компонента в единице объема. Эти
.величины называются молярной (С') и весовой (С) концентра-
циями компонента и в отличие от безразмерных мольдроби
и весовой доли имеют размерности моль/м3 или к.г1м? соот-
ветственно. Есть и другие виды концентраций. Так, относи-
тельный молярный состав бинарной системы определяется
соотношением
= (Ш.21)
а относительный весовой состав бинарной системы опреде-
ляется по формуле
х= . (111.22)
Таким образом, для бинарной системы относительные мо-
лярная и весовая концентрации представляют отношение соот-
ветствующих мольдробей или весовых долей компонентов
системы соответственно. Различие этих двух способов пред-
ставления составов практически исчезает при малых значе-
ниях х’ или х, в этих пределах их можно считать взаимоза-
меняемыми. Концентрации, выражаемые соотношениями (III. 21)
и (111.22), при малых значениях составов (до 0,5 — 1%) практи-
чески совпадают с весовыми долями и мольдробями. При
больших же значениях составов в силу существующей гипер-
болической зависимости относительные составы резко откло-
няются от весовых и молярных долей, достигая уже при
х' = 0,5 значения х'=1 и далее прогрессивно увеличиваются
до бесконечности.
Пересчет относительных концентраций
Из уравнений (III. 21) и (III. 22) можно определить моляр-
ные и весовые доли по известным относительным молярным
и весовым концентрациям:
х'= С ; (III. 23) х = —(Ш. 24)
l-j-Х' 1+Х
Относительные молярные концентрации иногда называют
еще стехиометрическими.
§ 11. Пересчет относительных концентраций в другие виды
представления составов фаз
Уравнения (III. 21) и (III. 22) связывают относительные мо-
лярные концентрации с мольдробями и относительные весовые
концентрации с весовыми долями.
Требуется установить соотношение, связывающее относи-
тельную весовую концентрацию х и мольдробь того же
компонента системы.
Смысл относительной весовой концентрации х состоит в том,
что на единицу веса второго компонента системы приходится
х весовых единиц первого. Если веса измеряются, например,
в килограммах, то, следовательно, можно считать, что система
состоит из х килограммов первого и 1 кг второго компонента.
Тогда по определению мольдробь первого компонента должна
равняться числу его молей, деленному на общее число молей
системы:
М2 М2 х
х 1
где -------число молей первого, а ------число молей второго
компонента системы.
Пусть ту же мольдробь х' первого компонента системы
нужно выразить через его весовую концентрацию С. Смысл
весовой концентрации состоит в том, что в единице объема
системы содержится С весовых единиц рассматриваемого
компонента. Если веса измеряются в килограммах, а объемы
в кубических метрах, то можно считать, что в 1 м3 системы
содержится С килограммов первого компонента. Пусть удель-
ный аес системы у кг/м3. Тогда вес второго компонента в еди-
нице юбъема системы найдется как разность между весом си-
стемы у и весом первого компонента С. Зная веса компо-
нентов и их молекулярные веса, можно найти мольдробь
первого компонента по уравнению (III. 3), которое предста-
вится следующим образом:
—_______CiMl______ =_________!_______ ЛИ
+ Ч-ТйН^-1)
1 м3 системы содержится С' молей первого ком-
по весу составит С'Мг килограммов. Вес второго
Пусть в
понента, что
компонента системы определится как разность между весом
у 1 л/3 системы и весом содержащегося в этом объеме
первого компонента. Зная веса компонентов и их молекуляр-
ные веса, можно найти мольдробь х' первого компонента,
которая по определению должна быть равна:
, С = С'.м2
Х ~ , пГ y+C'C^-Ah) •
м2 +
(III. 27)
При нахождении весовой доли х через относительную
молярную концентрацию х' следует принять во внимание,
что в рассматриваемой системе согласно определению на 1 моль
второго компонента, вес которого равен его молекулярному
весу -И2 килограммов, приходится х' молей первого компо-
нента, весящих, очевидно, х'Мг килограммов. Вес всей си-
стемы, состоящей из одного моля второго и х' молей первого
компонента, составит (Л12 + x'AfJ, а весовая доля первого ком-
понента найдется из уравнения
мгх’ ___________1
м2 + м/х' ~ . м2 _1_
М, х'
(III. 28)
Та же самая весовая доля х, выраженная через молярную
концентрацию С' моль/м3, найдется следующим образом. Вес
данного компонента равен С'М±, а вес системы, взятой в объ-
еме 1 м3, равен ее удельному весу у. Следовательно, весо-
вая доля х определится как отношение этих величин:
х = СМ1:у. (III. 29)
Если же требуется определить весовую долю х через ве-
совую концентрацию С кг/м3, то, очевидно, формула пересчета
должна иметь вид:
х = у . (III. 29а)
В некоторых случаях необходимо представлять относитель-
ный молярный состав х' через весовую концентрацию С кг/м3.
Исходя из того, что в I м3 системы содержится С килограм-
Пересчет относительных концентраций
77
мов первого компонента и, следовательно, (у — С) килограм-
мов второго компонента, можно найти относительную моляр-
ную концентрацию:
Гц _ С/Mt _________1____
л2 ’"(у —С)/М2— / у__
М2 \ С
(III. 30)
Для пересчета мольдроби х' в молярную концентрацию
С моль/м3 необходимо принять во внимание, что общее
число молей, содержащихся в 1 лС системы, равно отношению
среднего удельного веса системы к ее среднему молекулярному
весу, иначе говоря, yl-Mcp моль/м3. Число же молей С первого
компонента в 1 м3 системы составит долю х' от ее общего
числа молей:
С = =______________
М л М1Х' + М2 (1 -х')
Пересчет весовой концентрации в молярную и обратно ве-
дется на__ основании очевидных соотношении"_______________
С' = С/М1 (III. 32) и С^С'ЛД, (III. 33)
Сочетание формул (III. 33) и (III. 31) позволяет выразить
весовую концентрацию С через мольдробь х':
Преобразованием формул (III. 29) и (III. 29а) можно найти
уравнения пересчета весовой доли х в молярную и весовую
концентрации С' и С:
С = (III. 35) С = ух. (III. 36)
Определяемая формулой (III. 22) относительная весовая кон-
центрация х может быть представлена через другие способы
выражения состава системы.
Так, для ее представления через мольную долю х' следует
исходить из того соображения, что вес первого компонента
в одном моле системы равен М^х’, а второго компонента
ТИ2(1 — х'). Следовательно, относительная весовая концентра-
ция х, равная по определению отношению весов обоих ком-
понентов, должна найтись из соотношения
Мгх' _ 1
М2 (1 — х') — М2 ,
М, \х'
(III. 37)
Формальный вывод уравнения (III. 37) может быть получен
простым сочетанием уравнений (III. 22) и (III. 16).
Относительная весовая концентрация х через относитель-
ную молярную х' представится на основе того соображения,
что на 1 моль второго компонента, вес которого М2, прихо-
дится х' молей первого компонента, весящих Mvx . Следова-
тельно, относительная весовая концентрация х, равная отно-
шению весов обоих компонентов, определится по уравнению
х=М^’)М2. (III. 38)
Приведенных примеров составления формул пересчета кон-
центраций вполне достаточно для выяснения методики пере-
счета в каждом конкретном случае. Единственными вспомога-
тельными величинами, которыми приходится пользоваться,
являются молекулярные веса компонентов дь средний удельный
вес системы. Для составления же формулы пересчета отправ-
ной точкой должны каждый раз служить определения понятий
искомой и заданной концентраций.
§ 12. Гипотеза идеального раствора
Для систематизации и обобщения обширного опытного
материала по растворимости различных веществ имеет боль-
шое значение гипотетическое эталонное понятие идеального
или простейшего раствора, выводимое на основе принятия
аддитивности его свойств.
Идеальным или простейшим называется раствор, общая
упругость паров которого является линейной функцией его
молярного состава в жидкой фазе и при смешении компонен-
тов которого не происходит сжатие или расширение объема
и не выделяется теплота растворения.
Поведение идеальных растворов описывается простыми
законами, но является совершенно гипотетическим, и реальные
растворы, в действительности встречающиеся в промышленных
условиях, могут только более или менее приближаться к этому
идеальному предельному эталону.
Концепция идеального раствора в применении к газовым
смесям дает те же резут^ьтаты, что и гипотеза идеального
газового состояния. Конденсированные же растворы, например
жидкие, значительно более концентрированы, чем газовые,
и здесь нарушающее влияние межмолекулярного взаимодей-
ствия обычно дает более заметные отклонения от простых
соотношений, характерных для идеального раствора. Тем не
менее концепция идеального раствора чрезвычайно полезна
для изучения свойств реальных растворов как в тех случаях,
когда недостаток опытных данных вызывает необходимость
Гипотеза идеального раствора 79
изыскания приближенных значений, так и в особенности
в случае разбавленных растворов, поведение которых вполне
точно может быть описано на основе концепции идеального
раствора.
Рассмотрение свойств идеального раствора в последующем
изложении будет вестись главным образом на примере про-
стейшей двухкомпонентной системы с дальнейшим обобще-
нием полученных результатов на растворы, состоящие из боль-
шего числа компонентов.
В разработке теории растворов выдающуюся роль играли
отечественные ученые, заложившие основы современного
понимания этого важнейшего раздела физической химии.
Д. И. Менделеев положил начало химической теории раство-
ров, развитое в дальнейшем Н. С. Курнаковым, создавшим
метод физико-химического анализа свойств растворов, являю-
щийся ныне основным способом их изучения. Д. П. Коновалов
установил два знаменитых закона в отношении давления и со-
става пара растворов, носящие его имя, и дал современную
классификацию реальных растворов. Важнейшие___особенности
поведения неидеальных растворов были исследованы
М. С. Вревским, В. Ф. Алексеевым и В. А. Киреевым.
Для изучения процессов перегонки и ректификации имеет
важное значение установление соотношений между составами
и другими свойствами растворов, в частности, упругостями
паров, температурами насыщения и теплосодержаниями их.
Эти соотношения в общем случае очень сложны и далеко
не для всех практически важных случаев установлены. Лишь
для разбавленных растворов и для гипотетического идеального
раствора разработана строгая термодинамическая теория,
позволяющая определять по составу растворов ряд их важ-
ных свойств. Не вдаваясь в более детальное рассмотрение
молекулярной природы разбавленных растворов, достаточно
ограничиться указанием на значительную разобщенность в них
разнородных молекул, благодаря чему ослабляется влияние
таких нарушающих идеальность факторов, как различающиеся
молярные объемы и силовые поля молекул.
Равным образом и в растворах веществ, сходных по физи-
ческим свойствам и химическому строению, молекулы компо-
нентов в растворах находятся практически в тех же условиях,
что и в чистом компоненте. Поэтому образование таких раство-
ров не сопровождается тепловым эффектом или изменением
объема и такие растворы по свойствам приближаются к иде-
альному.
Парциальные давления компонентов идеальной газовой
смеси пропорциональны их молярным долям. Аналогичным
образом парциальные давления компонентов жидкого идеаль-
ного раствора также пропорциональны их молярным долям
во всем интервале концентраций. Первое из этих положений
известно как закон Дальтона, второе — как закон Рауля. Рас-
смотрим эти законы подробнее.
§ 13. Закон Дальтона
Согласно классической формулировке закон Дальтона гла-
сит: общее давление смеси газов, химически не действующих
друг на друга, равно сумме тех индивидуальных давлений,
которыми обладал бы каждый отдельно взятый газ, если бы
он один находился в объеме, занимаемом всей смесью, при
той же температуре.
Для идеальных газов, составляющих смесь, эти индиви-
дуальные давления равны тем парциальным давлениям, кото-
рыми они обладают в самой смеси. В самом деле, пусть при
общем давлении р и температуре Т веса компонентов газовой
смеси будут равны G1? G2, . ..; числа их молей nlt п2,...; их
молекулярные веса Mlt М2,.. . соответственно. Если бы каж-
дый из этих газов один занимал общий объем V газовой
смеси при той же температуре Т, то оказываемое им давле-
ние pt было бы меньше общего давления газовой смеси р.
Вычислим по уравнению состояния идеального газа эти давле-
ния pt компонентов газовой смеси:
Gt
p.V = ^-RT. (Ш.39)
Для смеси газов, подчиняющихся условию идеальности,
>нмеем равенство
Gi -4- Ga -|-.. . + G
• pV =--------------- #Т = NRT, (III. 40)
‘’ср
где N—nl + n2 + ... Следовательно, из сочетания уравне-
ний (III. 39) и (III. 40) можно заключить, что
Р = Р1+Р2 + - • +Pn=2 Pi- (III. 41)
Из уравнения (III. 39) можно, преобразовав
/ъУ_ = P-У = P-N _ =
пг п,, па ' ' ' ’
получить важный вывод:
согласно которому парциальные давления компонентов идеаль-
ной газовой смеси пропорциональны их молярным долям.
Закон Дальтона
81
Написав уравнение (III. 42) для всех компонентов смеси,
можно получить
Pi_ = = = S _
У1' Уг' " ' V у/ ’
откуда
py/ = Pi. (Ш. 43)
Последнее выражение является определяющим уравнением
для парциального давления компонентов газовой смеси.
Парциальное давление компонента идеальной газовой смеси
равно произведению его молярной доли на общее давление.
Из уравнения (III. 42), выразив числа молей компонентов
через их веса и молекулярные веса, можно получить важное
соотношение
согласно которому веса компонентов идеальной газовой смеси
относятся как произведения из их парциальных давлений на
молекулярные веса.
Если составить смесь газов, занимающих под одним и тем
же давлением р и при одной и той же температуре Т раз-
личные объемы V\, V2, Е3, . . ., то для них можно написать
pV1 = nrRT, pV2 = n2RT и т. д.
Если температура и давление смеси газов остаются теми же,
что и соответствующие свойства компонентов, то, применяя
уравнение состояния идеального газа к смеси, можно написать
pV = (n1 + /72 + ..,)АТ,
откуда, сопоставляя с предыдущими равенствами, имеем
V = V1 + V2 + ... (III. 45)
Соотношение (III. 45) известно под названием закона адди-
тивности объемов; он гласит: объем, занимаемый смесью га-
зов, равен сумме тех индивидуальных объемов, которые зани-
мал бы каждый отдельно взятый газ при той же температуре
и под тем же давлением, что и смесь. Парциальный объем
можно определить аналогично парциальному давлению, как
произведение из общего объема смеси на молярную долю дан-
ного компонента:
Vi==Vy/. (III. 46)
Законы аддитивности давлений и объемов строго прило-
жимы лишь к смесям идеальных газов, а при высоких давле-
ниях и низких температурах для реальных газов дают замет-
ные отклонения. Важно отметить опытно установленный факт,
согласно которому при исследовании свойств реальных газов
6 Зак. № 304.
закон аддитивности объемов дает значительно меньшие откло-
нения, чем закон аддитивности давлений.
Из уравнения (III. 46) можно заключить, что для идеальной
газовой смеси объемная доля vj = Vi/V равна молярной доле
соответствующего компонента.
§ 14. Законы Рауля и Генри
В отличие от газов молярные объемы жидкостей не одина-
ковы п вследствие этого отношение объемов компонентов
жидкого раствора не равно отношению их чисел молей. По-
этому, если в идеальной газовой смеси парциальные давления
компонентов пропорциональны молярным или, что одно и то
же, объемным долям, то в идеальном жидком растворе пар-
циальное давление компонентов раствора пропорционально
его молярной доле в жидкой фазе, но с объемной долей
непосредственно простым соотношением не связано. Указан-
ная зависимость устанавливается законом парциальных давле-
ний Рауля, согласно которому
Р^Р^', (Ш.47)
где Pt — упругость насыщенных паров чистого компонента i
при данной температуре, а х/ — его молярная доля в жидкой
фазе.
Растворимость газов и паров в жидкостях определяется
по закону Генри, согласно которому количество газа, раство-
ренное в данном количестве раствора, прямо пропорционально
его парциальному давлению над раствором:
р^Н/у^^-х/^.х/, (III. 48)
где Н. — константа.
Коэффициент пропорциональности в уравнении (III. 48)
закона Генри изменяется с температурой и зависит от природы
газа и растворителя. Закон Генри приложим не только к чис-
тым индивидуальным газам, но и к газовым смесям, причем
в последнем случае концентрация газа в растворе пропорцио-
нальна не общему давлению газовой смеси, а парциальному
давлению в ней растворенного компонента.
Выражение закона Генри сходно с уравнением закона
Рауля, и различие между ними состоит лишь в том, что кон-
станта Kt не обязательно должна иметь значение, равное Pt, а
может быть и меньше и больше упругости насыщенных паров
растворенного компонента при данной температуре.
Законы Рауля и Генри
83
Законы Рауля и Генри, действительные лишь для идеаль-
ных растворов, во многих практических случаях выдержи-
ваются настолько удовлетворительно, что на их основе можно
проводить инженерные расчеты с вполне приемлемой точ-
ностью. Однако иногда использование этих законов приводит
к недопустимым отклонениям, и поэтому законы Рауля и Генри
рассматриваются лишь как законы идеального раствора,
выдерживающиеся для реальных растворов с тем большей
точностью, чем больше разбавлены растворы. Очень важно
отметить, что для разбавленных растворов эти законы вполне
точны, причем если закон Рауля применяют для растворителя,
то закон Генри следует прилагать к растворенному компо-
ненту и наоборот. В последующем изложении это положение
будет иллюстрировано на примере расчета условий паро-жид-
кого равновесия в системе компонентов с весьма слабой
взаимной растворимостью.
Для идеального раствора константа закона Генри
численно совпадает с упругостью насыщенных паров Рр являю-
щеися коэффициентом пропорциональности в выражении за-
кона Рауля, и поэтому оба эти закона могут быть пред-
ставлены одним соотношением
р,
= <IIL49)
На основе закона Рауля можно заключить, что для раство-
ров, близких по свойствам к идеальному, при данной темпе-
ратуре растворимость газа не зависит от растворителя и оди-
накова для всех растворителей. С повышением температуры
упругость насыщенных паров Л растет и поэтому раствори-
мость газа должна уменьшаться при постоянном рр Наконец,
чем выше точка кипения растворяемого газа, тем при одном
и том же парциальном давлении в газовой смеси его раство-
римость должна быть больше, так как с повышением точки
кипения газа понижается Л и при постоянном pt должно
увеличиваться х/.
В результате длительных испытаний были установлены гра-
ницы практической применимости закона Рауля, позволяющие
вести технические расчеты с приемлемой точностью. Изомеры
и члены одного и того же гомологического ряда, достаточно
близкие друг к другу, обычно довольно точно следуют закону
Рауля, равным образом как и некоторые другие частные си-
стемы типа четыреххлористый углерод — толуол. Кроме того,
во всех случаях, когда содержание какого-нибудь компонента
жидкого неидеального раствора приближается к 100%, к этому
компоненту может быть применен закон Рауля. Если же содер-
жание компонента близко к нулю, то к нему применяется
6*
закон Генри. Вообще закон Генри, как правило, применяется
к газам, отличающимся небольшой растворимостью, порядка
не выше одного молярного процента.
§ 15. Паро-жидкое равновесие в идеальных системах
В процессах перегонки и ректификации вопросы двухфаз-
ного паро-жидкого равновесия играют существенную роль, так
как взаимодействующие контактирующие паровые и жидкие
смеси в той или иной степени удалены от равновесного со-
стояния и стремятся к нему как к известному пределу. Из
последующего изложения выяснится основа метода анализа
этих процессов, состоящая в допущении предельного равно-
весного состояния между парами и жидкостью, что позволяет
вести количественные расчеты.
В настоящем разделе рассматриваются условия паро-жид-
кого равновесия двухфазных систем, жидкая фаза которых
подчиняется законам идеального раствора, а паровая — законам
идеального газового состояния.
В оговоренных условиях единственными необходимыми дан-
ными для количественного анализа условий паро-жидкого
равновесия являются упругости насыщенных паров компонен-
тов системы и общее давление р, под которым она находится.
Путем сочетания уравнений (III. 43) и (III. 47) законов Даль-
тона и Рауля для простейшей бинарной системы, характери-
зующейся равновесием паровой и жидкой фаз и, следовательно,
равенством значений парциальных давлений каждого компо-
нента в парах и жидкости, можно написать
Ра = РУ' = Р^\ (Ш.50)
PW = P(1 — У') = ^2(1 — (Ш.51)
где ра и pw— парциальные давления компонентов а и w,
и Р2 — упругости их насыщенных паров при данной темпе-
ратуре и / и х'—молярные доли компонента а в паровой
и жидкой равновесных фазах соответственно.
Из уравнения (III. 50) можно найти величину отношения
составов данного компонента в паровой и жидкой равновес-
ных фазах при рассматриваемых условиях температуры
и давления:
4-= Рр-=к^ <ш-52>
Определяемое уравнением (III. 52) равновесное отношение
называется обычно константой фазового равновесия
и является для идеальных и практически идеальных растворов
функцией лишь общего давления и температуры системы. При
Паро-жидк.ое равновесие в идеальных системах
85
постоянных значениях этих параметров равновесное отноше-
ние для идеальных растворов действительно представляет
собой константу. Однако для растворов, отклоняющихся в своем
поведении от идеального, равновесное отношение кх зависит
еще и от состава и поэтому при постоянных р и t уже не
является константой. В этом и заключается неточность обще-
принятого названия константы фазового равновесия, которую
уже не раз рекомендовалось заменить названием „равновесное
фазовое отношение".
Уравнение равновесия фаз (Ш. 52) может быть получено
и путем сочетания соотношений законов Дальтона и Генри,
представленного уравнением (III. 48):
=Лк. (III. 53)
Х Р Лер J Р
Уравнение равновесия фаз (III. 53) связывает константу Н
закона Генри с равновесным фазовым отношением к±.
Для жидкого раствора, находящегося в точке начала кипе-
--ящц-сум.мярняя-млпгЕпсш, паров его компонентов р^, склады-
вается из парциальных давлений ра и pw и равна внешнему
давлению р-.
P=Paw^Pa + P» = PlX' + Р2^ -*') (Ш. 54)
Уравнение (III. 54) получается простым суммированием ура-
внений (III. 50) и (III. 51). Значения Рг и Р2 упругостей насы-
щенных паров компонентов должны подставляться в уравне-
ние (III. 54) при той определенной температуре, при которой
находится равновесный раствор, и поэтому соотношение (III. 54)
называется уравнением изотермы жидкой фазы и в системе
координат paw — х' изображается прямой линией.
То же суммарное давление паров системы можно опреде-
лить и через составы паровой фазы, решив уравнения (III. 50)
и (III. 51) в отношении х' и 1—х' и сложив их:
Р = ,, (III. 55)
raw у 1 — у * v '
Л + Л
(Ш. 56)
Уравнение (III. 55) называется уравнением изотермы паро-
вой фазы и в отличие от изотермы жидкой фазы в системе
координат давление — состав представляется не прямой, а кри-
вой линией гиперболического типа.
Уравнения (III. 54) и (III. 55) позволяют по заданной темпе-
ратуре и молярному составу одной из фаз определять то
86
Растворы
давление, под которым рассматриваемая система будет нахо-
диться в равновесии.
Так, для рассматриваемой бинарной двухфазной системы
число ее степеней свободы на основании правила фаз равно
двум и, следовательно, для определенности ее состояния
достаточно зафиксировать любые два ее интенсивные свойства.
Пусть, например, заданы температура и молярный состав жид-
кой фазы. Тогда по уравнению (Ш. 54) может быть рассчитано
Состав в молярных Валят
Фиг. 11. Изотермический график
равновесия идеальной системы.
равновесное давление р, а по
уравнению (III. 50) может быть
найден состав у' равновесной
паровой фазы. Если же наряду
с температурой задан состав у'
паровой фазы, то равновесное
давление р найдется уже из
уравнения (III. 55), а неизвест-
ный состав жидкой фазы может
быть рассчитан путем реше-
ния уравнения (IIL 54) относи-
тельно х':
(Ш.57)
Если заданными интенсив-
ными свойствами системы явля-
ются температура и суммарное
давление ее паров P = Paw, то состав равновесной жидкой фазы
тоже может быть найден по уравнению (III. 57), а состав паро-
вой — по уравнению (III. 50). Эта же задача может быть решена
и графически (фиг. 11), причем в данном случае удается осо-
бенно хорошо использовать наглядность графических методов
представления. В системе координат давление — состав уравне-
ние (III. 54) представится прямой линией, проходящей через
точки А (О, Р2) и В(1, Р,). в чем легко убедиться, представив
его в виде
и дав х' значения 0 и 1. Таким образом, прямая АВ при за-
данной температуре позволяет устанавливать однозначное со-
ответствие между молярным составом жидкой фазы и общим
давлением paw паров системы. Пусть давление р, под которым
находится система, задано. Если найти на изотерме АВ точку,
ордината которой будет равна заданному давлению р, то абс-
цисса этой точки определит состав равновесной жидкой фазы.
Проведя горизонталь р = const, в точке ее пересечения С с изо-
термой АВ, определяем состав х' как абсциссу точки С. На том
же графике давление — состав оба уравнения (III. 50, 51), опре-
Изобарные кривые кипения и конденсации 87
деляющие парциальное давление первого компонента в функ-
ции молярных составов паровой и жидкой фаз, изобразятся
прямыми, выходящими из начала координат. Уравнение ра =
=Ргх' представится прямой ОВ, а уравнение ра~ РУ’— прямой ОЕ.
Найденному значению состава х' жидкой фазы отвечает по
прямой ОВ отрезок ND, пропорциональный парциальной упру-
гости ра первого компонента. Очевидно, что то же значе-
ние ра, но уже по прямой ОЕ должно отвечать равновесному
составу паровой фазы. Проведя из точки D горизонталь до ее
пересечения в точке F с прямой ОЕ, можно найти состав /
равновесной паровой фазы как абсциссу точки F. Точка F
всегда расположена правее точки D, и поэтому состав паро-
вой фазы у' по низкокипящему компоненту всегда больше
-состава х' равновесной жидкой фазы.
Уравнение (III. 55) представится на рассматриваемом графике
пунктирной кривой АНВ, абсцисса точки пересечения Н кото-
рой с линией р = const определяет состав равновесной паровой
фазы.
§16.И зобарныекривыекипения и конденсации
Построение, проведенное на фиг. II, позволило найти для
определенной совокупности значений общего давления р
и температуры системы t молярные составы х' и у' ее равно-
весных жидкой и паровой фаз. Очевидно, изменение одного
из определяющих параметров р или t вызовет в свою очередь
изменение и значений составов х' и у' фаз системы. Допустим,
что, сохраняя температуру системы постоянной, мы изменяем
давление системы р, давая ему ряд значений в интервале от
Р2 до Р}. Здесь уместно отметить, что суммарное давление
паров идеального раствора paw не может быть меньше упру-
гости насыщенных паров Р2 высококипящего компонента си-
стемы (ВКК) и не может быть больше упругости насыщенных
паров низкокипящего компонента (НКК), как то очевидно
из уравнения изотермы (III. 54). Поскольку температура си-
стемы сохраняется постоянной, остаются неизменными и упру-
гости Р± и Р2 насыщенных паров ее компонентов, а следова-
тельно, не изменяется и положение изотермы АВ на диаграмме
давление — состав (фиг. 11). Однако в связи с изменением об-
щего давления горизонталь р = const меняет свое положение,
поднимаясь или опускаясь в зависимости от того, выше или
ниже будет выбранное значение р и точка пересечения С
этой горизонтали с изотермой АВ окажется расположенной
выше или ниже начальной точки С. Соответственно и состав х'
по НКК, определяемый как абсцисса точки пересечения гори-
зонтали р = const с изотермой жидкой фазы АВ, окажется
больше при повышении давления и меньше при его понижения.
88
Растворы
Это и понятно, так как, например, если при постоянной
температуре суммарная упругость паров раствора растет, то
это показывает на увеличенное содержание в нем более лету-
чего низкокипящего компонента. Наоборот, пониженное значе-
ние общего давления паров указывает на повышение содержа-
ния менее летучего компонента, конечно, при условии неиз-
менности температуры.
Итак, при постоянной температуре, меняя значение Paw = P,
можно найти ряд сопряженных значений составов х' и у'
равновесных жидкой и паровой фаз. Предельные значения
этих составов отвечают крайним значениям paw. Так, при
Paw = ?2 точка пересечения горизонтали р = const с изотермой АВ
переходит из С в Л и составы фаз оказываются равными
х' = у' =0; при раа) = Р1 точка пересечения С переходит в поло-
жение В и составы фаз оказываются равными х' = у' = 1. Каж-
дому же промежуточному значению paw в интервале давлений
P2 < Paw < Pi отвечает некоторая определенная пара составов
х' и у', причем за исключением крайних точек имеет место
соотношение / > х'.
Значительно больший практический интерес представляют
равновесные кривые, получающиеся при сохранении постоян-
ного внешнего давления р и изменении температуры системы.
Из рассмотрения той же фиг. 11 можно видеть, что в этом
случае горизонталь р = const будет занимать неизменное поло-
жение, а изотерма АВ, наоборот, будет менять свое положе-
ние. Чем выше температура системы, тем больше упругости
насыщенных паров ее компонентов Рг и Р2, тем выше прой-
дет изотерма АВ, тем левее расположится точка ее пересече-
ния с горизонталью р = const и тем меньше окажутся составы,
равновесных фаз по низкокипящему компоненту. Это и по-
нятно, ибо чем выше температура системы, тем больше Рг
и Р2 и при тем меньшем содержании НКК достигается одно
и то же суммарное давление паров paw.
Итак, при постоянном внешнем давлении, меняя значения
температуры системы, можно найти ряд сопряженных значений
составов х' и у' равновесных жидких и паровых фаз. Анало-
гично предыдущему предельные значения этих составов отве-
чают крайним значениям температуры системы. Последние для
идеальной системы отвечают точкам кипения ta и tw чистых
компонентов системы под заданным внешним давлением. При
температуре системы, равной точке кипения ta низкокипящего
компонента, точка пересечения изотермы АВ с прямой р = const
переходит в Е и составы фаз оказываются равными х'=/ = 1.
При температуре системы, равной точке кипения tw ВКК, точка
пересечения изотермы с горизонталью р = const приходит в М
Изобарные кривые кипения и конденсации
89
вным
.зом
р = const
А
Фиг. 12. Изобарные кривые равно-
весия.
у;
Состав
а_
1
111 t
4-,—
W
0
и составы фаз оказываются равными х' — у' = 0. Каждому про-
межуточному значению температуры системы t в интервале
отвечает некоторая определенная пара составов х'
и у'. Причем за исключением крайних точек все время выдер-
живается соотношение у' > х’.
Пусть при постоянном внешнем давлении р проведен ряд
подсчетов и построена кривая АСВ на фиг. 12, дающая связь
между температурой и составом жидкой фазы раствора при
постоянном внешнем давлении. "
данным можно построить кри-
вую ADB, дающую связь между
температурой системы и соста-
вом ее паровой фазы. Обе кри-
вые сливаются в двух крайних
точках, отвечающих чистым ком-
понентам системы. Это и понятно,
ибо в однокомпонентных систе-
мах составы паровой и жидкой
фаз, очевидно, одинаковы, так
как они состоят только из одного
вещества. Во всех промежуточ-
ных точках состав паровой фазы
по НКК больше состава жидкой
и температура системы монотонно
возрастает от ia, отвечающего
х' = у' = 1, до tw, отвечающего
х' = у' = 0. Эти кривые называются изобарными кривыми равно-
весия и играют большую роль при анализе процессов пере-
гонки и ректификации, протекающих, как правило, под постоян-
ным внешним давлением.
Из определения изобарных кривых равновесия следует,
что одна из них характеризует жидкую, а другая паровую
фазу бинарной двухфазной равновесной системы. Так, некото-
рому составу х/ жидкой фазы (фиг. 12) отвечает фигуратив-
ная точка С на изобарной кривой равновесия АСВ, которая
показывает, что жидкость указанного состава будет находиться
под заданным внешним давлением при точке начала кипения,
если ее температура будет равна tr. При этом пар, равно-
весный этой жидкости, должен иметь состав у/, отвечающий
фигуративной точке D, лежащей на одной горизонтали с С.
Кривая АСВ жидкой фазы называется линией точек начала
кипения, а кривая ADB паровой фазы — линией точек начала
конденсации или точек росы.
На изобарном графике равновесия (фиг. 12) кривая точек
росы всегда расположена выше кривой точек начала кипения,
а на изотермическом графике равновесия (фиг. 11) имеется,
обратное расположение этих линий.
90
Растворы
На изобарном графике равновесия (фиг. 12)область диаграммы,
расположенная над линией точек росы насыщенных паров, харак-
теризует системы различного состава, находящиеся в состоянии
перегретого пара, а область диаграммы, расположенная под
кривой точек начала кипения, представляет различные жидкие
системы, не догретые до насыщенного состояния.
На изотермической фиг. 11 имеется обратное расположение
этих областей. Область перегретого пара расположена под
нижней кривой точек росы, а область недогретой жидкости
расположена над линией точек начала кипения.
Такое взаимно обратное расположение соответствующих
кривых и областей на изотермических и изобарных кривых
равновесия объясняется тем, что чем ниже точка кипения
компонента, тем при одной и той же температуре будет
больше его упругость паров. Поэтому, например, точке с абс-
циссой, равной единице, на диаграмме изотермической отве-
чает наибольшая ордината (давление), а на диаграмме изобар-
ной — наименьшая ордината (точка кипения).
§ 17. Кривая равновесия у — х
Для получения соотношения, связывающего составы паро-
вой и жидкой фаз, находящихся в равновесии, достаточно
сочетать уравнения (III. 50) и (III. 51), разделив одно на другое:
Т^7 = тТТД?' <ш-58)
где т = Р^у. Р2 называется коэффициентом относительной лету-
чести или по А. М. Трегубову коэффициентом обогащения.
Последний термин имеет тот смысл, что от величины т зави-
сит степень обогащения паровой фазы низкокипящим компо-
нентом. В самом деле, коэффициент обогащения т в идеальном
бинарном растворе всегда больше единицы и, следовательно,
всегда должно иметь место соотношение у' > х', что непосред-
ственно усматривается из уравнения (III. 58) и вытекает из рас-
смотренного выше первого закона Д. П. Коновалова.
Уравнение (III. 58), связывающее равновесные молярные
составы паровой и жидкой фаз бинарного раствора, обладает
одним замечательным свойством. Оно сохраняет свой вил
и в том случае, когда молярные составы заменяются весовыми
долями. Пусть средние молекулярные веса жидкой и паровой
фаз соответственно равны Мх и Му. Выразив в уравнении
<111.58) молярные составы х' и у' через весовые доли, имеем
Муу Мхх
",
Му(1-У) т Мх(1—х)
Ч? -
Кривая равновесия у—х 91
и после сокращения
Т
у * х
_у=т г—
(III. 59)
Если Pi > Р2, то, как следует из уравнений (III. 58) и (III. 59),
состав паровой фазы больше состава жидкой.
Уравнения (III. 58) и (III. 59), связывающие составы равно-
весных фаз, также называются уравнениями равновесия
и обычно представляются в нескольких видах, более удобных
для практических расчетов в различных конкретных условиях.
Так, путем простых алгебраи-
ческих преобразований уравне-
ние (III. 59) можно представить
в i виде, разрешенном относи-
тельно состава у паровой фазы:
у = (III. 60)
Л 1 + (m — 1) х ' '
Для удобства расчетов при
малых значениях состава х жид-
кой фазы проф. А. М. Трегубов
рекомендует представлять урав-
нение (III. 60) в следующем виде:
У=-------(Ш. 61)
т Н-----
х
жидкой фазы
Фиг. 13. Кривая равновесия у— х.
Решенное в отношении состава жидкой фазы уравнение
(III. 59) представится следующим образом:
У
V =-----------
т — (т — 1 j у
Уравнение равновесия (III. 63) может быть представлено
графически в системе координат у — х в виде гиперболы,
изображенной на' фиг. 13. Эта линия ОАВ называется кривой,
равновесия у — х и играет очень важную роль в расчете про-
цесса ректификации. Каждой точке кривой равновесия у — х
отвечает вполне определенное состояние рассматриваемой си-
стемы, характеризующееся определенным сочетанием значений
ее свойств — составов фаз, температуры и давления. Точка
0(0,0) является фигуративной точкой чистого ВКК, и поэтому
ей при заданном постоянном внешнем давлении отвечает
максимальная температура системы. Точка В (1,1) отвечает
чистому НКК, и поэтому ей соответствует при постоянном р
минимальная температура системы ta- Всякая другая точка
А (х, у) кривой равновесия определяет некоторое равновесное
состояние бинарной системы с температурой I, промежуточной
(III. 62)
92
Раствопы
между температурами кипения ta и tw чистых компонентов
системы.
Таким образом, вся кривая равновесия у — х помещается
внутри квадрата со стороной, пропорциональной единице изме-
рения состава. Диагональ ОВ этого квадрата концентраций
называется прямой равного состава, так как любая ее точка
имеет одинаковые абсциссу и ординату.
При построении кривой равновесия у — х, как правило,
пользуются составами НКК, и поэтому за исключением двух
крайних точек для всей остальной кривой в случае идеального
раствора имеет место соотношение у > х. Поэтому вся кривая
равновесия у - -х располагается слева от прямой равного со-
става и тем ближе к ней, чем меньше разница в составах
равновесных жидкой и паровой фаз.
§ 18. Расчет и построение кривых равновесия
Если раствор подчиняется закону Рауля, то изобарные
кривые кипения и конденсации и кривая у — х могут быть
построены для него по точкам, рассчитанным на основании
уравнений (III. 57) и (III. 52) или по одному из уравнений
(III. 58) — (III. 62).
Для идеального раствора единственными начальными дан-
ными, необходимыми для расчета, являются упругости паров
компонентов в интервале их температур кипения под задан-
ным внешним давлением.
Пусть требуется рассчитать координаты точек для построе-
ния изобарных кривых кипения и конденсации и кривой рав-
новесия у — х для системы бензол — толуол, весьма близко
следующей законам идеального раствора, при. заданном неиз-
менном внешнем давлении в 760 мм рт. ст.
Таблица 3
1, °C Pi, мм рт. ст. Л, мм рт. ст. Р~рг Р1-Рг ед -О, CL. 1 1 JI "к Ргх' у’-Р^' Р
80,2 760 300 460. 460 1,000 760 1,000
84,0 852 333 427 519 0,823 700 0,923
88,0 960 380 380 580 0,656 629 0,830
92,0 1080 432 328 648 Q.516 547 Q720
96,0 1205 492 268 713 0,376 I 453 0,597
100,0 1344 560 200 784 0,255 344 0,453
104,0 1495 625 135 870 0,155 । 232 0,305
108,0 1660 705 55 920 0,060 99,6 0,131
110,6 1750 760 0 990 0 0 0
Расчет и построение кривых равновесия
93
[Jr Рекомендуется следующая последовательность расчета,
примененная в табл. 3. Под атмосферным давлением точка
кипения бензола /а = 80,2°, а толуола tw = 110,6°. В интервале
•ta — tw задаемся несколькими промежуточными точками, напри-
мер семью равноотстоящими друг от друга температурами;
находим упругости Рг и Р2 насыщенных паров бензола и
толуола при этих температурах и заполняем графы 1, 2 и 3
таблицы. Упругости Рх и Р2 могут быть рассчитаны по форму-
лам или сняты с соответствующих графиков, но лучше каж-
дый раз пользоваться экспериментальными данными.
Фиг. 14. Графический расчет составов равновесных фаз.
Графы 4—8 представляют собой развернутый расчет по
формулам (III. 57) и (III. 52), позволяющий найти молярные
-составы жидкой и паровой равновесных фаз. В случае необ-
ходимости молярные доли легко можно пересчитать в весовые
при помощи формулы (III. 17). Полученных данных вполне
достаточно для построения равновесных кривых. При помощи
граф 1 и 6 можно нанести в системе координат температура—
молярный состав ряд точек, достаточно близко расположенных
друг к другу. Проведя через эти точки плавную кривую, по-
лучим изобарную кривую точек начала кипения жидкой фазы
изучаемой системы.
Равным образом, нанеся на тот же график данные граф 1
и 8 и проведя через полученные точки плавную кривую,
можно получить изобарную кривую точек начала конденсации
насыщенной паровой фазы. Наконец, по данным граф 6 и 8
можно построить в системе координат молярный состав паро-
вой фазы — молярный состав жидкой фазы кривую равновесия
у' — х'. Описанный аналитический метод расчета координат
94
Рлсталпы
точек равновесных кривых является наиболее надежным и
точным способом их нахождения. Менее точен, но довольно
прост и чисто графический способ расчета, описанный
ниже.
Для большей наглядности на фиг. 14 показано графическое
построение для нахождения координат только одной пары
сопряженных составов. Пусть нам известны кривые упругости
компонентов а и w, нанесенные на фиг. 14 в обычной системе
координат p — t. Проведя горизонталь р = const, отвечающую
заданному значению внешнего давления, можно определить-
температуры кипения ta и tw компонентов как абсциссы точек
И и К пересечения этой горизонтали с кривыми упругости.
Зададимся некоторой температурой промежуточной в ин-
тервале и найдем при этой температуре упругости
Рг и Р2 насыщенных паров компонентов а и w рассматривае-
мой системы. Для этого из точки на оси температур с абсцис-
сой, равной восстановим перпендикуляр до пересечения-
с кривыми упругости в точках А и В, ординаты которых
равны искомым значениям упругостей Р2 и Р1 соответственно-
В правой части графика представлена диаграмма давление —
состав, на которую переносятся точки А и В, первая в точку
А' (О, Р2), а вторая—в точку В'(1, Р^, и проводится изотерма
А'В'. Абсцисса точки ее пересечения С с горизонталью
р = const определяет молярный состав х' жидкой фазы. Прямая,
соединяющая точку 0 с точкой В', даст значения парциальных
упругостей НКК в функции молярного состава жидкой фазы.
Для найденного состава х' эта парциальная упругость рЯ1 про-
порциональна отрезку ED. Парциальная упругость рй1 в функ-
ции молярного состава паровой фазы дается прямой ОМ, от-
вечающей уравнению ра=ру'- Проведя из точки D горизонталь-
до ее пересечения с прямой ОМ, можно найти равновесный
молярный состав у' паровой фазы как абсциссу точки F, отве-
чающей тому же значению парциального давления ра1, которое
было определено по составу х' жидкой фазы. Так определяется
графическим путем одна пара сопряженных значений моляр-
ных составов х' и у' равновесных жидкой и паровой фаз рас-
сматриваемой системы компонентов а и w при заданных усло-
виях давления р и температуры представляющих собой
зафиксированные степени свободы системы. Такое построе-
ние приходится повторять и для других значений темпе-
ратуры А при том же неизменном внешнем давлении р, опре-
деляя тем самым такое число сопряженных пар молярных
составов жидкой и паровой фаз, которое позволит с достаточ-
ной точностью провести плавные изобарные кривые кипения
и конденсации и кривую равновесия у—х. В расчетах процес-
сов перегонки и ректификации чаще всего используются не
молярные, а весовые составы и поэтому полученные графи-
Тепловая диаграмма равновесия
!)5
ческим методом значения х' и у' пересчитываются из моляр-
ных в весовые доли уже аналитическим методом по уравне-
нию (III. 17).
§ 19. Тепловая диаграмма равновесия
Для анализа процессов перегонки и ректификации очень
полезна так называемая тепловая диаграмма, дающая теплосо-
держания единицы веса равновесных паровой и жидкой фаз
в функции их состава при температурах насыщения бинарных
систем.
Как известно, теплосодержание всех жидких веществ при
0° условно принимается равным нулю. Для определения теп-
лосодержания единицы веса произвольной жидкой системы
при некоторой другой температуре рассчитывается алгебраи-
ческая сумма количеств тепла, которые необходимо затратить,
чтобы перейти от нулевого уровня к состоянию системы при
данной температуре. При этом затрата тепла не зависит от
---щу1и-пропесса__елди последний ведется под постоянным давле-
нием. Для жидкой системы теплосодержание при некоторой
отличной от нуля температуре t складывается из тепла, затра-
чиваемого на то, чтобы перевести ее компоненты от нулевого
уровня к заданной температуре и произвести при этой темпе-
ратуре их смешение. Если обозначить весовую долю жидкой
системы по компоненту а через х, средние теплоемкости ком-
понентов на интервале температур от нуля до /°C через са и
сш и теплоту образования единицы веса раствора через Л, то
теплосодержание qt жидкой системы определится из соотно-
шения
qt = [сах + cw (1 — х)]/ — h ккал!кг (III. 63)
или
qt =qax + qw (1 — х) — h ккал!кг, (III. 64)
где qa и qw — теплосодержания единицы веса чистых компо-
нентов системы при заданной температуре t.
Для нефтяных и углеводородных систем теплота образова-
ния растворов Л обычно невелика и в первом приближении
ею пренебрегают, определяя теплосодержание по соотноше-
нию
qt = [CaX + cw(\ —x)]t = qax + qw (1 — х). (III. 65)
Для паровой фазы теплосодержание единицы веса смеси
складывается из тепла, которое необходимо затратить, чтобы
перевести ее компоненты в жидком состоянии от нулевого
уровня к заданной температуре и произвести при этой темпе-
ратуре их испарение. Если обозначить весовой состав паровой
фазы по компоненту а через у, скрытые теплоты испарения
96
Растворы
компонентов через 1а и lw, то теплосодержание Qt единицы
веса паров *;при температуре / определится по соотношению
Qt = [cay + Cw (1 — У)]/+ lay + lw (1 — у) ккал!кг (III. 66)
Qi = Qay + Qw (1 — у) к кал) кг,
(III. 67)
где Qa = cj + 1а и Qw =
= cwt-\-lw представляют
теплосодержание еди-
ницы веса паров чистых
компонентов системы при
заданной температуре.
Имея равновесные изо-
барные кривые кипения
и конденсации и тепло-
вые свойства компонен-
тов бинарной системы в
интервале температур ее
равновесного двухфаз-
ного существования под
заданным внешним давле-
нием, можно построить
тепловую диаграмму, ко-
торая для систем с моно-
тонными кривыми t—х,
у будет иметь вид, изо-
браженный на фиг. 15.
В функции состава па-
ровой фазы линия QwQa
определяет теплосодер-
жания единицы веса па-
ров, находящихся при
температуре конденсации,
а линия qwqa—теплосо-
находящихся при точке
ИЛИ
Фиг. 15. Тепловая диаграмма.
держания единицы веса жидкостей,
начала кипения. Прямые ab, а'Ь', соединяющие на диаграмме
фигуративные точки равновесных фаз, называются изотермами.
Сопоставление тепловой диаграммы с графиком t — х, у позво-
ляет легко установить соответствие между их эквивалентными
элементами.
Важнейшее свойство тепловой диаграммы, представляющее
главную причину ее широкого применения в анализе процессов
перегонки и ректификации, состоит в том, что фигуративная
точка смеси двух систем располагается на тепловой диаграмме
на отрезке прямой, соединяющем фигуративные точки исход-
ных систем, и делит этот отрезок на части, обратно пропорцио-
нальные весам смешиваемых систем. Это свойство тепловой
Классификация жидких растворов
97
диаграммы будет доказано в следующей главе, посвященной
теории перегонки.
При определении средних теплоемкостей жидких нефте-
продуктов желательно пользоваться опытными данными, а при
их отсутствии может быть применена следующая эмпирическая
формула, дающая отклонения до 5%:
сР =—^/0,403 + 0,000405/) ккал/кг °C. (III. 68)
]/ У15 \ /
Для определения теплосодержания паров можно применять
эмпирическую формулу
Qt = (50,2 +0,109/4-0,000 14/2)-(4 — у13) — 73,8 ккал)кг. (III. 69)
Очевидно, скрытая теплота испарения может быть опреде-
лена как разность между теплосодержаниями системы в паро-
вом и жидком состояниях.
§ 20. Классификация жидких растворов
В практике перегонки и ре1фикации ипро ищи дет ер-^
чаться с несколькими видами реальных растворов, различным
образом отклоняющихся от простейшего идеального раствора.
Целесообразно сгруппировать их по принципу общности при-
знаков, имеющих существенное значение для перегонки этих
растворов. Именно с этой точки зрения в последующем изло-
жении приведена классификация жидких растворов, построен-
ная для простоты на системах, образованных двумя компо-
нентами. Решающим признаком, образующим основу принятой
классификации растворов, является характер взаимной раство-
римости компонентов системы, охватывающий широкие пре-
делы изменения от неограниченно смешивающихся друг
с другом жидкостей до практически нерастворимых.
Растворы, образованные двумя жидкостями, можно разде-
лить на три основные группы: 1) жидкости, смешивающиеся
друг с другом во всех отношениях; 2) жидкости, смешиваю-
щиеся лишь частично; 3) жидкости, практически не раство-
римые друг в друге.
Большинство органических жидкостей, близких по химиче-
скому строению и физическим свойствам, образуют растворы,
относящиеся к первой группе, например бензол и толуол, гептан
и декан, бутан и изобутан, бензин и изооктан; другим примером
являются этанол и вода, азотная кислота и вода, бензол и этанол.
Однако весьма важное промышленное значение имеют и
многие пары жидкостей, частично растворимых друг в друге
и образующих растворы, относящиеся ко второй группе, на-
пример фенол и вода, фурфурол и вода, ацетон и вода, изо-
бутиловый спирт и вода, эфир и вода.
7 Заи. Л- 304.
98
Растворы
К третьей группе относятся такие системы пар жидкостей,
как гептан и вода, бензин и вода, толуол и вода, техника
разделения которых не вызывает особых трудностей, ибо они
легко поддаются расслоению простым механическим способом,
например отстоем.
Отклонения реальных растворов от свойств идеального
раствора являются следствием таких химических явлений, как
сольватация, ассоциация и диссоциация компонентов, а также
следствием чисто физических факторов, как влияние различ-
ных молярных объемов и силового поля молекул.
§ 21. Жидкости, смешивающиеся во всех отношениях
Двухкомпонентные растворы реальных веществ, отклоняю-
щиеся в своем поведении от идеального и относящиеся к пер-
вому виду растворов, т. е. к растворам компонентов, смеши-
вающихся во всех отношениях, различаются между собой по
характеру их отклонения (положительному или отрицатель-
ному) от идеального линейного закона, выражающего суммар-
рую упругость пара раствора в функции молярного состава
жидкой фазы.
В зависимости от степени и характера отклонения пар-
циальных давлений компонентов и суммарного давления паров
раствора от закона Рауля имеются три типа реальных раство-
ров веществ, неограниченно растворимых друг в друге.
К первому типу относятся растворы так называемого нор-
мального вида, у которых равновесные изобарные и изотер-
мические кривые кипения и конденсации, построенные по
Таблица -t
Молярные составы фаз Парциальные давления, мм рт. ст. Суммарная упругость пара, мм рт. ст.
ЖИДКОСТЬ пар СС14 С6Н6
0,000 0,000 0,0 268,0 268,0
0,051 0,068 18,5 253,4 271,9
0,177 0,213 60,0 221,7 281,7
0,295 0,336 96,9 191,4 288,3
0,396 0,438 128,7 165,2 293,9
0,559 0,586 176,4 124,7 301,1
0,677 0,696 212,3 92,7 305,0
0,766 0,778 238,8 68,1 306,9
1,000 1,000 308,0 0,0 308,0
Жидкости, смешивающиеся во всех отношениях
99
fl 0,1 0,г 0,3 (74 (7,5 0,6 0,7 0,3 0,9 /
Полярный состав жидкой (разы
Фиг. 16. Зависимость общего и парциальных
давлений пара от состава в системах с моно-
тонными кривыми равновесия.
экспериментальным данным, имеют форму, идентичную с фор-
мой этих же равновесных кривых идеального раствора.
К этому типу относится большое число неограниченно
растворимых друг в друге веществ, в особенности же ве-
ществ, близких по химическому строению и физическим свой-
ствам. В таких растворах один из компонентов, именно низко-
кипящий компонент,
всегда характеризуется
большим содержанием
в паре, чем в равно-
весной с ним жидкости.
Для иллюстрации
поведения таких си-
стем в табл. 4 приве-
дены опытные данные,
полученные путем из-
мерения парциальных
давлений компонентов
системы--четыреххло-
ристый углород — бен-
зол при постоянной
температуре 50° и при
различных составах
равновесных фаз.
Данные этой табли-
цы представлены на
фиг. 16. Опытные дан-
ные отклоняются от
значений свойств, рас-
считанных по законам
идеальных растворов,
но характерно то, что
экспериментальные кривые во всем интервале молярных соста-
вов сохраняют монотонность, не имеют экстремальных точек
и давление пара раствора и его температура кипения при
любом составе фаз являются промежуточными между упру-
гостями паров и точками кипения чистых компонентов системы.
Рассмотренный пример относится к системам, проявляющим
положительные отклонения от закона линейной зависимости.
Однако эти отклонения могут быть и в сторону меньших зна-
чений сравнительно с результатами, даваемыми законом Рауля,
и тогда системы уже будут относиться к типу, проявляющему
отрицательные отклонения. Важно лишь отметить, что и в том
и в другом случаях сохраняется монотонность изотермических
линий равновесия.
Ко второму типу неограниченно растворимых друг в друге
веществ относятся системы, характеризующиеся наличием макси-
7*
-1 ГУЛ
Pr/rrpr\nhl
Молярные составы фаз по CS2 Парциальные давления, мм рт. ст. Суммарная упругость
Таблица 5
жидкость пар cs2 i пара, СН3СОСН3 1 мм рт. ст.
0,0000 0,0000 0,0 343,8 343,8
0,0624 0,2507 110,7 331,0 441,7
0,1857 0,4666 258,4 295,4 553,8
0,3502 0,5759 358,3 263,9 622,2
0,4974 0,6254 404,1 242,1 646,2
0,6161 0,6550 428,1 225,5 653,6
0,6713 0,6678 437,3 217,5 654,8
0,7220 0,6827 446,9 207,7 654,6
0,8280 0,7207 464,9 180,2 645,1
0,9620 0,8722 500,8 73,4 574,2
1,0000 1,0000 512,3 0,0 512,3
Фиг. 17. Зависимость общего и парциальных
давлений пара от состава в системах с поло-
жительными отклонениями.
мальной точки на изо-
термической кривой
суммарного давления
паров. Типичной для
этих веществ является
система сероуглерод —
ацетон, опытные дан-
ные для которой при
температуре 35,17° при-
ведены в табл. 5.
Изотермическая кри-
вая суммарного давле-
ния паров этой системы,
приведенная на фиг. 17,
характеризуется точ-
кой максимума, отве-
чающей составу Хе =
= уё — 0,6665 и давле-
нию ре = 654,9жж]рт. ст.
Рассматриваемая кри-
вая типична для систем
с настолько большими
положительными от-
клонениями от свойств
простейшего раствора,
что нарушается монотонность кривой зависимости давления пара
раствора от его состава. Такие растворы образуются из чистых
компонентов большей частью с поглощением тепла. Согласно
Жидкости, смешивающиеся во всех отношениях
101
В. А. Кирееву [6] это тесно связано с проявляемыми системой
положительными отклонениями от идеальности. В самом деле,
поглощение тепла при образовании раствора уменьшает количе-
ство энергии, которую нужно затратить, чтобы испарить жид-
кость, и облегчает процесс ее испарения. Поэтому парциальное
давление пара каждого компонента, характеризующее его
стремление к улетучиванию из жидкой фазы или, как говорят,
к рассеянию, становится больше, чем рассчитанное по закону
идеального раствора.
Возвращаясь к графику фиг. 17 или обращаясь к табл. 5,
нетрудно заметить, что для составов, меньших хе' — уе’ 0,6665,
паровая фаза богаче сероуглеродом, чем жидкая, и когда со-
держание CS2 возрастает в жидкости, то ее давление насыще-
ния увеличивается; когда же содержание сероуглерода в па-
ровой фазе уменьшается, то и давление системы, отвечающее
ее точке росы, тоже убывает. В тех же случаях, когда со-
ставы фаз больше х/ = у/= 0,6665, паровая фаза содержит
меньше сероуглерода, чем жидкая. Здесь увеличение его со-
держания. в паровой и ж и.л ко;! фазах влечет за собой уже
понижение давления насыщения равновесных фаз. В точке
максимума суммарного давления паров составы паровой и
жидкой фаз совпадают друг с другом.
К третьему типу неограниченно растворимых друг в друге
веществ относятся системы, характеризующиеся наличием ми-
нимальной точки на изотермической кривой суммарного дав-
ления паров. Типичной для этих веществ является система аце-
тон — хлороформ, опытные данные для которой при темпера-
туре 35,17° приведены в табл. 6.
Изотермическая кривая суммарного давления паров этой
системы, представленная на фиг. 18, характеризуется точкой
Таблица 6
Молярные составы по СНС13 Парциальные давления паров, мм рт. ст. Суммарная упругость паров, мм рт. ст.
х' У’ СНС13 СН3СОСН3
0,0000 0,0000 0,0 344,5 344,5
0,0588 0,0277 9,2 323,2 332,4
0,1818 0,1029 31,7 276,3 308,0
0,3568 0,2603 71,5 202,0 273,5
0,4930 0,4361 111,5 144,2 255,7
0,5516 0,5203 130,5 120,3 250,8
0,6635 0,6830 170,2 79,0 249,2
0,7997 0,8569 224,4 37,5 261,9
0,9175 0,9536 267,1 13,0 280,1
1,0000 1,0000 293,1 0,0 293,1
102
Растяппы
минимума, отвечающей составу х/= у/--=0,625 и давлению
рс = 248 мм рт. ст. Рассматриваемая кривая является типичной
для систем, проявляющих настолько большие отрицательные
отклонения от свойств простейшего раствора, что нарушается
монотонность кривой зависимости давления пара раствора от
его состава и на ней появляется экстремальная точка, отвеча-
тельными отклонениями.
ющая минимуму давления насыщения. Такие растворы обра-
зуются из чистых компонентов большей частью с выделением
тепла. Это тесно связано с проявляемыми системой отрица-
тельными отклонениями от идеальности [6]. В самом деле,
выделение тепла при образовании раствора увеличивает ко-
личество энергии, которую нужно затратить, чтобы испарить
жидкость, и затрудняет процесс ее испарения в связи с необ-
ходимостью компенсировать энергию, выделившуюся при об-
разовании раствора. Поэтому парциальное давление пара каж-
дого компонента, характеризующее его стремление к улетучи-
ванию из жидкой фазы, меньше, чем рассчитанное по закону
простейшего раствора.
Из графика фиг. 18 или табл. 6 нетрудно видеть, что для
составов, меньших х/= у/= 0,625, жидкая фаза богаче хло-
роформом, чем равновесная ей паровая, а для составов, боль-
ших хе' = уё = 0,625, имеет место обратная картина.
Жидкости, смешивающиеся во всех отношениях
103
Наконец, во всех трех рассмотренных типичных случаях
неограниченно растворимых систем парциальные давления па-
ров компонентов растут с увеличением их состава. Эта заме-
чание не может быть отнесено к суммарной упругости паров
раствора. Системы с положительными или отрицательными
отклонениями от свойств простейшего раствора, обладающие
экстремальными, максимальными или минимальными точками
на кривых .суммарной упругости паров раствора, называются
постоянно кипящими или азео-
Фиг. 20. Изобары кипения и конден-
сации системы азотная кислота —
вода.
Фиг. 19. Изобары кипения и конден-
сации системы этанол — бензол.
На фиг. 19 и 20 представлены равновесные изобарные
кривые кипения и конденсации для обоих типов однородных
в жидкой фазе азеотропов. До настоящего времени нет до-
статочно надежного общего метода расчета данных паро-жидкого
равновесия азеотропов и наиболее верным путем остается их
экспериментальное определение. Трудность корреляции равно-
весных данных азеотропов заключается в том, что соотноше-
ния, связывающие составы сосуществующих фаз, зависят не
только от температуры и давления, как в случае идеального
раствора, но еще в заметной степени и от состава системы.
Из рассмотрения равновесных диаграмм (фиг. 19 и 20)
можно сделать заключение о взаимно обратном характере рав-
новесных изобарных и изотермических кривых кипения и кон-
денсации. Максимуму суммарной упругости пара раствора при
постоянной температуре отвечает минимум температуры кипе-
ния при постоянном давлении и наоборот.
104
Рлгтяпгы
Другое следствие, вытекающее из рассмотрения этих рав-
новесных диаграмм кривых кипения и конденсации, выра-
жается первым законом Д. П. Коновалова, согласно которому
равновесный пар содержит в относительно большем количестве
тот компонент, прибавление которого к раствору должно при-
вести к повышению его суммарной упругости паров.
В самом деле, пар в точке М (см. фиг. 17) богаче компо-
нентом w, чем равновесная ему жидкость т, и дальнейшее
прибавление к системе компонента w, как это видно из изо-
термической равновесной диаграммы, влечет за собой повы-
шение суммарной упругости паров системы. На той же фиг. 17,
но на другой ее ветви, пар М' богаче компонентом а, чем рав-
новесная ему жидкость т', и действительно прибавление к си-
стеме компонента а сопровождается увеличением суммарной
упругости паров раствора.
Одно время предполагали, что экстремальные точки на кри-
вых давления пара и точек кипения соответствуют образова-
нию определенных химических соединений обоих компонентов
системы, однако эта точка зрения уже давно опровергнута и
исправлена. Установлено, что с изменением давления или тем-
пературы состав азеотропа изменяется и если вести перегонку
системы при различных давлениях, то получаются пары раз-
личного состава. Кроме того, неидеальность этих растворов
сказывается еще и в том, что максимумы и минимумы наблю-
даются также и на кривых зависимости других свойств системы
от состава, причем экстремальные точки на кривых двух раз-
личных свойств могут отвечать различным составам.
Таким образом, в паро-жидких двухфазных системах макси-
мумы и минимумы не характеризуют какого-либо химического
соединения обоих компонентов, а являются только формой про-
явления неидеальных свойств раствора.
В табл. 7 приведены данные, характеризующие влияние дав-
ления на состав азеотропа для системы этанол—вода.
Таблица 7
Давление, мм рт. ст. Точка кипения азеотропа, °C Содержание эта- нола в азеотропе, % (мол.)
100 34,2 99,6
150 42,0 96,2
200 47,8 93,8
400 62,8 91,4
760 78,1 90,0
1100 87,8 89,3
1450 95,3 89,1
Жидкости, смешивающиеся во всех отношениях
105
На фиг. 20 приведена равновесная изобарная диаграмма
кривых кипения и конденсации для азеотропа с максимумом
температуры кипения при постоянном давлении. По оси абсцисс
отложен состав компонента w. При повышении температуры
системы от точки кипения ta чистого компонента а по мере
обогащения жидкости компонентом w координаты кривых кипе-
ния и конденсации системы возрастают, т. е. обе ветви этих
кривых восходят кверху с некоторым переменным разрывом
между ними. При этом согласно первому закону Д. П. Коно-
валова, поскольку температура кипения системы с увеличением
содержания компонента w возрастает, следует, что прибавление
компонента w уменьшает суммарную упругость паров раствора
и поэтому в паре его содержание должно быть меньше, чем
в жидкости.
Кривые кипения и конденсации касаются друг друга в экстре-
мальной точке С, отвечающей максимуму точки кипения си-
стемы, что вполне согласуется со вторым законом Д. П. Коно-
валова, требующим равенства составов жидкости и пара в точках
максимума пли минимума температуры кипения системы.________
На фиг. 19 представлена равновесная диаграмма кривых кипе-
ния и конденсации для азеотропа с минимумом температуры
кипения и соответственно с максимумом давления пара, отве-
чающим составу уе, при постоянном давлении.
От азеотропической точки, отвечающей составу уе, по мере
обогащения жидкого раствора компонентом а ординаты кривых
кипения и конденсации системы возрастают, т. е. обе эти ветви
кривых восходят кверху с некоторым переменным разрывом
между ними, исчезающим в точке слияния обеих кривых при
температуре кипения ta чистого компонента а.
Согласно первому закону Д. П. Коновалова пар, равновес-
ный жидкости, в интервале концентраций от 0 по ус богаче
компонентом w, ибо, как видно из диаграммы, прибавление его
к системе понижает ее равновесную температуру, что экви-
валентно повышению суммарной упругости паров раствора.
От азеотропической точки по мере обогащения жидкого
раствора компонентом w ординаты кривых кипения и конденса-
ции системы также возрастают, т. е. обе ветви этих кривых
восходят кверху с некоторым переменным разрывом между
ними, исчезающим в точке слияния обеих кривых при темпера-
туре кипения tw чистого компонента w. Легко заметить, что роль
низкокипящего компонента в интервале составов системы от уе
до 1 играет уже компонент а, так как увеличение его концентра-
ции ведет к понижению равновесной температуры кипения рас-
твора, что эквивалентно повышению суммарного давления паров
системы. Поэтому согласно первому закону Коновалова содержа-
ние компонента а в парах на интервале составов от уе до 1
будет больше, чем его содержание в равновесной жидкой фазе.
106
Растворы.
Кривые кипения и конденсации касаются друг друга в экс-
тремальной точке С, отвечающей минимуму точки кипения си-
стемы при постоянном давлении, что также вполне согласуется
со вторым законом Д. П. Коновалова, требующим равенства
составов фаз в экстремальных точках.
§ 22. Жидкости, смешивающиеся частично
Частично растворимыми называются системы двух или не-
скольких жидкостей, растворяющихся друг в друге для каждой
температуры в определенных пределах концентраций и вне этих
пределов образующих два или больше несмешивающихся жидких
слоя. Взаимная растворимость компонентов системы является
функцией температуры и, как показали классические исследова-
ния В. Ф. Алексеева, может увеличиваться при повышении
температуры в одних системах и при понижении ее в других.
Наиболее распространенным случаем является увеличение
взаимной растворимости компонентов при повышении темпера-
туры, как в системах фенол—вода или фурфурол — вода. При-
мером жидкостей, у которых при повышении температуры взаим-
ная растворимость понижается, может служить система эфир —
вода или триэтиламин — вода.
Обычным способом определения взаимной растворимости
двух частично смешивающихся жидкостей является определе-
ние температуры, при которой двухслойная смесь отмеренных
количеств двух жидкостей становится однородной. Изменяя
соотношение количеств компонентов и устанавливая для каждой
пропорции отвечающую ей температуру растворения, можно
определить ряд сопряженных значений составов и температур,
характеризующих взаимную растворимость частично смешиваю-
щихся жидкостей при различных температурах.
Начиная с некоторой вполне определенной для каждой
системы температуры, любая смесь ее компонентов образует
однородный жидкий раствор, т. е. жидкости смешиваются
уже во всех отношениях. Эта точка называется критической
температурой растворения и в зависимости от характера измене-
ния взаимной растворимости компонентов системы достигается
при повышении температуры системы или при понижении ее.
Так, для системы фенол—вода выше температуры 65,84° ком-
поненты смешиваются во всех отношениях и эта температура
называется верхней критической температурой растворения.
Нижняя критическая температура растворения, например, си-
стемы триэтиламин — вода 18°, ибо выше этой температуры си-
стема расслаивается на два жидких равновесных слоя.
В соответствии с этим кривые зависимости растворимости
компонентов системы от температуры имеют весьма различный
вид для разных систем, и это оказывает серьезное влияние
Жидкости, смешивающиеся частично
107
на ход процессов перегонки и конденсации систем частично
растворимых компонентов.
На фиг. 21 приведены кривые парциальных давлений одного
из компонентов бинарного неидеального раствора в функции
молярного состава жидкой фазы для различных положительных
отклонений от закона Рауля.
В случае больших откло-
нений от закона Рауля кривая
парциальных давлений может
характеризоваться двумя экс-
тремальными точками А и В—
максимальной и минимальной.
При этом растворы, составы
которых попадают в интервал
концентраций между хА и хв,
практически существовать не
могут, ибо компонент w рас-
творяется в компоненте а при
тайной температуре лишь в
пределах концентраций от О
до хА, а компонент а в ком-
поненте w— в пределах кон-
центраций компонента w от хв
до 1. Дальнейшее прибавле-
ние, например, компонента а
к раствору состава хв или
Фиг. 21. Положительные отклонения
от законов идеальных растворов,
приводящие к образованию двух
жидких фаз.
компонента w к раствору
состава хА приведет к разделению жидкой фазы на два сосущест-
вующих равновесных слоя с неизменными при данной темпера-
туре составами хА и хв, и единственным результатом разбавления
окажется изменение о гносительной пропорции весов обоих слоев.
Такая система частично растворимых компонентов может
рассматриваться как гетерогенный или неоднородный в жидкой
фазе азеотроп, ибо также в точке кипения находится в равно-
весии с паром постоянного состава и перегоняется при постоян-
ной температуре. Интервал между концентрациями хА и хв
обоих жидких слоев для различных систем может изменяться
в довольно широких пределах в зависимости от степени их
взаимной растворимости и от температуры. Для практически
весьма мало растворимых веществ концентрация хА близка
к нулю, а концентрация хв к единице.
Взаимная растворимость веществ вообще колеблется в весьма
широких пределах, изменяясь от полной растворимости до
почти полного ее отсутствия и являясь для всех известных
систем этого рода функцией температуры.
108
Раствопы
На фиг. 22 представлены кривые растворимости для двух
типов частично растворимых веществ. Линия dd' на обоих гра-
фиках дает состав пара, отвечающего при заданной темпера-
туре условию равновесия с обоими жидкими сосуществующими
слоями составов хА и хв. Примером системы второго типа,
проявляющей свойства, представленные диаграммой раствори-
мости на фиг. 22, б, является система фенол — вода.
а — первого типа; б — второго типа.
Системы фурфурол — вода, анилин — вода, изоамиловый
спирт — вода относятся к первому типу: эвтектическому классу
частично растворимых компонентов; их поведение представлено
типичной равновесной диаграммой на фиг. 22, а.
Растворы первого типа характеризуются тем, что состав
пара, равновесного обеим жидким сосуществующим фазам,
находится внутри интервала концентрации от хА до хв при
всех температурах существования трехфазной системы. Эти
жидкие растворы по аналогии с характерными идентичными
особенностями твердых сплавов называются эвтектическими.
Растворы второго типа характеризуются составом пара,
равновесного обоим жидким слоям, выходящим за пределы
интервала концентраций от хА до хв в ту или другую сторону.
Представленная на фиг. 23 диаграмма температура расслое-
ния — состав для системы фенол — вода состоит из двух гранич-
ных ветвей FK и GK, отделяющих гетерогенную в жидкой фазе
область частичного смешения от гомогенных областей полного
смешения. Все смеси, фигуративные точки которых распола-
гаются вне области, ограниченной кривой FKG, являются одно-
родными в жидкой фазе и легко реализуются практически.
Смеси же, фигуративные точки которых попадают в область,
Жидкости, смешивающиеся частично
109
Фиг. 23. Кривые растворимости
системы фенол — вода.
ограниченную этой кривой, неустойчивы, практически не реа-
лизуемы и распадаются на два слоя, составы которых при дан-
ной температуре определяются абсциссами точек пересечения
соответствующей изотермы с граничными ветвями FK и GK
кривой растворимости. Точка слияния К обеих граничных
ветвей соответствует изотерме, отвечающей критической тем-
пературе растворения компонентов системы и называется крити-
ческой точкой растворимости. Состав смеси, соответствующий
критической точке растворимости, характеризуется точкой а.
Как легко заметить из диа-
граммы растворимости, система
фенол — вода принадлежит к
группе частично растворимых
компонентов, взаимная раствори-
мость которых возрастает с уве-
личением температуры.
Пусть рассматривается бинар-
ная система частично раствори-
____мык-вешеств, находящаяся под +
заданным давлением р при своей
точке кипения и разделенная при
этом на два жидких слоя Ли В,
находящихся в состоянии равно-
весия с их общим паром £(фиг. 22).
Согласно правилу фаз такая би-
нарная трехфазная система обла-
дает одной степенью свободы,
и поэтому достаточно принять значение какого-нибудь одного
ее интенсивного свойства, чтобы все остальные параметры,
характеризующие состояние системы, определились вполне
точно. Так, принятие величины суммарной упругости паров р
компонентов раствора немедленно определяет температуру
кипения te, общую обоим равновесным жидким слоям, их составы
хА и хв и состав уе равновесного обоим слоям пара. Например,
при атмосферном давлении смеси фурфурола и воды, гетеро-
генные в жидкой фазе, кипят, каково бы ни было относитель-
ное содержание обоих жидких слоев при одной и той же тем-
пературе 97,9°. При этом обе жидкие фазы соответственно содер-
жат 18,4 и 84,1% (вес.) фурфурола и выделяют общий, равновес-
ный обоим жидким слоям пар, содержащий при обязательном
условии сильного перемешивания слоев 35% (вес.) фурфурола.
Смеси воды и бутилового спирта, гетерогенные в жидкой
фазе, кипят под атмосферным давлением при температуре 92,25°.
При этом жидкие фазы находятся в равновесии с паром состава
25,0% (мол.) алкоголя (см. фиг. 26).
Рассмотренные смеси фурфурол — вода и бутиловый спирт —
вода относятся к первому типу частично растворимых систем,
1 in
ибо состав выделяемого пара находится между составами обоих
жидких слоев. Если же два слоя А и В под заданным внешним
давлением выделяют равновесный пар Е, состав которого лежит
вне интервала составов жидких фаз, как, например, в гетеро-
генных растворах фенола в воде, у которых под давлением
150 мм рт. ст. составы жидких фаз соответственно равны 17
и 57% (вес.) фенола, а состав равновесной паровой фазы соста-
Фиг. 24. Изотермический график рав-
новесия частично растворимых си-
стем первого типа.
вляет 8,1% (вес.), то эти рас-
творы относятся ко второму
типу частично растворимых
систем.
На фиг. 24 приведены упро-
щенные изотермические равно-
весные кривые парциальных
давлений кипения и конден-
сации для бинарной системы
частично растворимых компо-
нентов а и w эвтектического
типа. Из рассмотрения равно-
весных линий этой типичной
диаграммы можно заключить,
что кривые парциальных да-
влений обоих компонентов
системы при больших и малых
концентрациях подчиняются
линейной зависимости. Так,
кривая Cfr'fl" 1 парциальных
давлений компонента а в области разбавленных.растворов ком-
понента w в а от 0 до хА довольно точно следует закону
Рауля, и на этом участке малых концентраций w проявляет
свойства идеального раствора. Та же кривая в области боль-
ших концентраций компонента w от хв до 1 также имеет
линейный характер, но здесь зависимость парциального давле-
ния от концентрации выражается не законом Рауля, а зако-
ном Генри. Аналогичные свойства проявляет и кривая 0a‘a"D
парциальных давлений компонента w, которая в области малых
концентраций или разбавленных растворов а в w на участке
концентраций от хв до 1 подчиняется закону Рауля, а в обла-
сти разбавленных растворов компонента w в а на участке кон-
центраций от 0 до хА довольно точно следует закону Генри.
Однако такие простые закономерности в ходе кривых пар-
циальных давлений наблюдаются лишь в областях разбавлен-
ных растворов обоих компонентов системы друг в друге на
интервале концентраций от 0 до хА и от хв до 1. На участке
же составов раствора от хА и до хв кривые парциальных дав-
лений обоих компонентов принимают явно выраженный криво-
Жидкости, смешивающиеся частично 111
линейный характер с двумя экстремальными, минимальной и
максимальной, точками. Соответственно кривая суммарного
давления паров раствора на участке концентраций от хА до хв
приобретает криволинейный вид с двумя экстремумами.
Линия АС является изотермической кривой точек кипения
растворов компонента w в а и точка А является фигуратив-
ной точкой насыщенного при данной температуре раствора w
в а. Линия BD является изотермической кривой точек кипения
растворов компонента а в w и точка В является фигуративной
точкой насыщенного при данной температуре раствора а в w.
Системы, совокупный состав а которых попадает в интервал
концентраций от хА до хв, распадаются на насыщенные растворы
А и В, и линия кипения для них может быть представлена
горизонталью АВ. Если изотермические кривые суммарного
давления паров представить в функции состава у паровой фазы,
т. е. нанести на диаграмму так называемые кривые точек росы
или кривые конденсации, то они для рассматриваемой системы
изобразятся кривыми СаЕ и DbE, пересекающимися в угловой
точке £, которая показывает,-что обоим-жидким равновесным
насыщенным растворам составов хА и хв отвечает один- и тот
же пар состава уе.
Области, замкнутые криволинейными треугольниками АСЕ
и BDE, являются двухфазными областями паро-жидкого равно-
весия, и для любой системы, фигуративная точка которой попа-
дает в эти области, можно найти равновесные составы паровой
и жидкой фаз путем проведения надлежащей изобары, т. е.
горизонтали, проходящей через эту точку. Абсциссы точек
пересечения изобары с линиями кипения АС или BD и конден-
сации СаЕ или DbE определяют искомые составы х и у равно-
весных жидкой и паровой фаз. Относительные количества обеих
фаз определятся известным центротяжестным построением,
вытекающим из условий материального баланса.
Если изотермические кривые кипения и конденсации рас-
сматриваемой системы построить при некоторой другой темпе-
ратуре, то в зависимости от того, будет ли она больше или
меньше, будут больше или меньше значения упругостей ком-
понентов и вся равновесная диаграмма сместится вверх или вниз.
На фиг. 24 представлен случай увеличивающейся с повы-
шением температуры взаимной растворимости компонентов. При
этом равновесные кривые кипения и конденсации принимают
вид FC'Е'D'G, изображенный пунктиром. Кривые FA и GB явля-
ются кривыми растворимости компонентов а и w и отделяют на
диаграмме гомогенные области Lx и L2 полного смешения от
заключенной между ними гетерогенной области жидких фаз.
В системах частично растворимых компонентов неэвтекти-
ческого класса изотермические кривые кипения и конденсации
112
Растворы
имеют вид, изображенный на фиг. 25. Этот случай отличается
от предыдущего тем, что оба жидких слоя А и В при опре-
деленной температуре выделяют пар Е, состав которого лежит
вне интервала концентраций от хА до хв. Кривая кипения или
изотермическая кривая суммарного давления паров раствора
в функции состава жидкой фазы претерпевает разрыв АВ на
участке концентраций от Ха до хв и представляется двумя
ветвями BD и АС, являющимися кривыми упругости жидких
Фиг. 25. Изотермический график
равновесия частично раствори-
мых систем второго типа.
растворов на интервале составов
от 0 до хв и от хА до 1. Кривая
конденсации или изотермическая
кривая суммарного давления па-
ров раствора в функции состава
сосуществующей паровой фазы
представлена линией CED. На-
сыщенные при данной темпера-
туре жидкие растворы составов
и хв, изображенные фигура-
тивными точками А и В, нахо-
дятся в равновесии с паром со-
става уе, представленным фигу-
ративной точкой Е. Кривые АС
и BD, с одной стороны, и кривая
CED, с другой, замыкают область
двухфазного паро-жидкого равно-
весия, и для любой системы, фи-
гуративная точка которой попа-
дает в эту область, можно найти равновесные составы у и х
паровой и жидкой фаз путем проведения надлежащей изобары,
отвечающей равновесному данной системе давлению. Область
диаграммы между осью ординат и ветвью BG кривой раствори-
мости представляет возможные жидкие ненасыщенные растворы
компонента а в w. Область диаграммы между ветвью АЕ кри
вой растворимости и изотермической кривой кипения АС пред-
ставляет возможные жидкие ненасыщенные растворы компо-
нента w в а. Область же равновесной диаграммы, расположенная
под кривой конденсации CED, является геометрическим местом
фигуративных точек ненасыщенных паров данного раствора.
При рассмотрении процессов перегонки и ректификации,
проводимых практически под постоянным внешним давлением,
особый интерес имеют изобарные равновесные кривые кипения
и конденсации, характеризующие зависимость температуры
кипения жидких растворов и температуры конденсации паро-
вых смесей от концентрации.
Как показали исследования паро-жидкого равновесия ча-
стично растворимых систем под постоянным давлением, изобар-
Жидкости, смешивающиеся частично
113
ные кривые кипения и конденсации имеют вид, взаимно обрат-
ный соответствующим изотермическим кривым, рассмотренным
выше.
На фиг. 26 приведена изобарная равновесная диаграмма для
эвтектического класса частично растворимых бинарных систем.
Между составами хА и хв, отвечающими обоим жидким сосу-
ществующим равновесным слоям А и В, находящимся под
заданным внешним давлением р при температуре кипения te,
изобара жидкости или линии точек кипения представляет гори-
зонталь /г = const.
Фиг. 27. Изобарные кривые равно-
весия систем второго типа.
Фиг. 26. Изобары кипения и конден-
сации системы бутанол—вода.
На фиг. 27 приведена изобарная равновесная диаграмма для
второго типа частично растворимых веществ. Этот класс рас-
творов характеризуется тем, что температура кипения трех-
фазной жидко-паровой системы является промежуточной между
точками кипения обоих чистых ее компонентов. Между соста-
вами хА и хв, отвечающими обеим жидким сосуществующим
фазам А и В, находящимся под заданным внешним давлением р
при температуре кипения te, изобара жидкости представляет
горизонталь ?е = const. Для всех систем, у которых фигуратив-
ная точка совокупного состава а обоих жидких слоев попадает
в интервал концентраций хА<а <хв, происходит их расслоение
на две жидкие сосуществующие фазы с составами хА и хв,
сохраняющие постоянную температуру выкипания te и постоян-
ную концентрацию во все время существования двухслойной
жидкости, пока слой А не выкипит полностью и не останутся
в системе только слой В состава хв и равновесный ему пар Е
состава уе.
8 Зан. № 304.
Раствооы
Смесь же состава а < хА закипит при температуре и вы-
делит пары, состав которых выражается точкой V. Эта же смесь
полностью превратится в пары при температуре /2 (точка Уа).
При температуре t образуются газовая и жидкая фазы, составы
которых составят у и х (точки
и RJ.
Так же могут быть опре-
делены температуры и соста-
вы фаз при исходной смеси
Фиг. 28. Влияние температуры на
равновесие частично растворимых
систем второго типа.
а > хв-
На фиг. 28 показано влия-
ние температуры на равно-
весие неэвтектических смесей
частично растворимых ве-
ществ для случая возраста-
ющей с температурой взаим-
ной растворимости компонен-
тов системы.
При повышении темпера-
туры длина горизонтального
участка АВ сокращается, со-
ставы обоих жидких слоев
приближаются друг к другу
и равновесное давление си-
стемы растет. С повышением
давления достигается критическая температура растворимо-
сти компонентов, жидкие фазы сливаются в одну и изо-
барные кривые кипения и конденсации принимают форму, ана-
логичную получающейся в случае идеальных растворов. При
температурах выше критической точки растворения компоненты
растворяются друг в друге неограниченно и азеотропизма, как
правило, не наблюдается.
§ 23. Системы компонентов со слабой взаимной
раствори мостью
Когда система состоит из компонентов, характеризующихся
достаточно слабой взаимной растворимостью, условия паро-
жидкого равновесия могут быть рассчитаны по законам раз-
бавленных растворов, так как при малых количествах раство-
ренных веществ эти законы выдерживаются с приемлемой для
практики точностью.
Двухкомпонентная система, образующая в жидкой фазе два
слоя, находящиеся в равновесии с одним и тем же паром опре-
деленного состава, согласно правилу фаз обладает одной сте-
пенью свободы, и, как указывалось ранее, для определенности
ее состояния достаточно принять значение какого-нибудь одного
Системы компонентов со слабой взаимной растворимостью 115
интенсивного свойства, например давления или температуры.
Как только единственная степень свободы системы будет закреп-
лена, состояние ее полностью определится и значения всех
остальных характеризующих ее интенсивных свойств станут
строго определенными и единственными.
На фиг. 29 показана изотермическая равновесная фазовая
диаграмма, представляющая условия паро-жидкого равновесия
в системах компонентов, характеризующихся слабой взаимной
растворимостью, на которой пар-
циальные упругости паров ком-
понентов системы выражены
в функции ее молярного состава.
По оси абсцисс отложены со-
ставы второго компонента си-
стемы w. Растворимость компо-
нента w в а имеется в пределах
концентраций от 0 до хА, а рас-
творимость компонента а в w—
ВПредела а (И ,‘iCi 1 . РйГе Л: И X
пределов концентраций, т. е. на
интервале совокупных составов а
системы хА < а < хр', растворы
расслаиваются на два жидких
слоя. При этом в рассматриваемом
случае, идентичном с ранее изу-
ченной системой эвтектического
Фиг. 29. Изотермы кипения и кон-
денсации слабо растворимых ве-
ществ.
типа частично растворимых ве-
ществ, состав хА весьма мал, а состав хв' очень близокТк еди-
нице, и в этом лежит достаточная причина возможности при-
менения к исследуемым системам законов разбавленных рас-
творов для изучения условий паро-жидкого равновесия.
Для приближенного аналитического определения парциаль-
ных давлений обоих компонентов системы используются законы
Рауля и Генри, причем первый из этих законов используется
для определения парциальной упругости паров растворителя,
за который условно принимается преобладающий в растворе
компонент, а второй закон - - для определения парциальной
упругости паров растворенного вещества, за которое также
условно принимается компонент, представленный в системе
в незначительном количестве.
Пусть рассматривается равновесная двухкомпонентная трех-
фазная система компонентов а и w, характеризующихся весьма
малой взаимной растворимостью, состоящая из двух жидких
слоев А и В, находящихся при определенной температуре
в равновесии с паровой фазой Е. Молярные составы хА и хв'
характеризуют оба насыщенных при данной температуре жидких
8*
слоя А и В, находящиеся в равновесии друг с другом и с об-
щей им паровой фазой Е состава у/.
Парциальное давление раА компонента а в жидком слое А,
представляющем однородный, насыщенный, разбавленный ра-
створ компонента w в а, определится согласно закону Рауля
как произведение из молярной концентрации компонента а
в жидкости на упругость Рг его насыщенных паров при данной
температуре:
PaA-P^~XA'). (III. 70)
Для определения парциального давления паров ршА компо-
нента w в том же насыщенном однородном жидком слое А
используется уже закон Генри, согласно которому при по-
стоянной температуре концентрация газа в растворе пропор-
циональна его давлению:
Ри,А= К!ха', (III. 71)
где Ki - коэффициент пропорциональности.
Аналогично, применяя те же законы ко второму жидкому
слою В, представляющему однородный, насыщенный, разбавлен-
ный раствор компонента а в iv, можно найти парциальные давле-
ния в нем обоих компонентов. Так, для компонента w, преоб-
ладающего в слое В, применение закона Рауля приводит к еле;
дующему соотношению для определения его парциального
давления пара pwB в слое В:
PwB = P^B> (HL 72)
где Р2 — упругость насыщенных паров чистого компонента w
при данной температуре.
Компонент а в слое В играет роль растворенного вещества,
и поэтому его парциальное давление раВ определяется на осно-
вании закона Генри по соотношению
РаВ = КЛ~хв')< (Ш-73)
где К2 — коэффициент пропорциональности.
Слои жидких, однородных, разбавленных растворов А и В
находятся во взаимном равновесии, и, следовательно, парциаль-
ные давления компонентов а и w в обоих слоях должны быть
одинаковыми. На этом основании, сочетая уравнения (III. 70)
с (III. 73) и (III. 71) с (III. 72), можно выразить коэффициент
закона Генри через составы слоев и летучие свойства компо-
нентов системы:
К1 = Р^ГГ -, (111-74) (III. 75)
А 1 АВ
Системы компонентов со слабой взаимной растворимостью 117
Для нахождения общей упругости паров раствора, явля-
ющейся аддитивным свойством, необходимо сложить парциаль-
ные давления его компонентов. Так, применяя законы раз-
бавленных растворов к однородным жидким системам с началь-
ным составом х', заключенным в интервале концентраций
0<х'<;хл/, можно представить упругость паров раствора
в функции молярного состава жидкой фазы уравнением
= ~х') + К1Х'- (III. 76)
Аналогично, упругость паров однородных в жидкой фазе
растворов, состав х' которых заключен в интервале концен-
траций хв' С х'< 1, представится уравнением
paw = P2x' +/<2(1 — х'). (III. 77)
Когда оба жидких слоя достигают определенных для дан-
ной температуры составов хА' и хв', они расслаиваются и урав-
нения (III. 76) и (III. 77) переходят в
--------------/\('1 — гсон«1.________________________(III. 78)
Вследствие постоянства при определенной температуре зна-
чений всех величин, входящих в правую часть уравнения (III. 78),
постоянно и значение суммарной упругости паров р, двух-
слойной жидкой системы во все время существования двух-
фазной жидкости. Когда же состав системы выходит за пределы
двухслойного участка и попадает в одну из областей разбав-
ленных однородных растворов, то, как показывают уравнения
(III. 76) и (III. 77), суммарная упругость их паров является
линейной функцией молярного состава жидкой фазы, изменя-
ющегося от 0 до хл и от хв до 1.
Для полноты представления изотермических равновесных
кривых, характеризующих случай слабой взаимной раствори-
мости компонентов системы, необходимо вывести уравнения,
устанавливающие связь между составами равновесных паровых
фаз и упругими свойствами компонентов и слоев системы.
Уравнение изотермы паровой фазы в общем виде опреде-
ляется известным соотношением
(III. 79)
где pw — парциальная упругость паров компонента w.
Для изотермы конденсации, отвечающей первой однородной
жидкости, составы х' которой заключены в интервале
О < х' < хл, это уравнение принимает вид:
(III. 80)
У' = —— ,
Paw
KjX'
118 Раствооы
Значение молярного состава х' жидкой фазы может быть
определено по уравнению
Подстановкой значения х' из уравнения (III. 81) в уравне-
ние (III. 80) можно получить уравнение изотермы паровой фазы,
отвечающей рассматриваемой однородной жидкости, представ-
ляющей разбавленный раствор компонента w в а:
= (III. 82)
Другой вид того же уравнения изотермы конденсации,
отвечающей первой однородной жидкости, получается сопо-
ставлением уравнений (III. 76) и (III. 80):
с1'-83)
Аналогичным путем можно вывести уравнение изотермы
конденсации, отвечающей второй однородной жидкой фазе,
представляющей разбавленный раствор компонентов а и w.
Исходным является соотношение
/ = (III. 84)
raw
Значение молярного состава х' второго жидкого слоя най-
дется по уравнению (III. 77) в следующем виде:
, Р ти К-9
* = • (IIL 85>
Подставляя значение х’ в уравнение (III. 84), можно полу-
чить искомое уравнение изотермы паровой фазы, отвечающей
второй однородной жидкости:
^aw 1 i}i
Другой вид того же уравнения изотермы паровой фазы
получается сопоставлением уравнений (III. 77) и (111.84):
Из рассмотрения уравнений (III. 86) и (III. 87) можно заклю-
чить, что изотермы паровых фаз, отвечающих обоим одно-
родным жидким слоям, имеют криволинейное очертание.
Состав уе' паровой фазы, отвечающий условию равновесия
с неоднородной двухслойной жидкостью, определяется на осно-
Системы компонентов со слабой взаимной растворимостью 119
вании уравнений (III. 83) или,(Ш. 87) подстановкой в них вместо х'
значений хА и хв соответственно:
y-=P.(1^+P;V. (П.,88)
в чем легко убедиться, произведя соответствующие подста-
новки значений Кх и К2 в уравнения (III. 83) и (III. 87) на осно-
вании соотношений (III. 74) и (111.75).
Пример. Использовать полученные соотношения для расчета коорди-
нат изотермических кривых кипения и конденсации р — х', у' системы вода —
анилин, находящейся при /=100°, если весовые составы равновесных жидких
слоев по анилину равны хА=0,0718 и хв = 0,897, молекулярные веса воды
и анилина Ма= 18 и 7V11V = 93 и упругости их насыщенных паров при 100°
соответственно равны Р1 = 760 мм и Р2 = 45,7 мм рт. ст.
Во все выведенные выше соотношения входят составы, выраженные
в,молярных долях. Пересчитаем заданные весовые составы в молярные доли
по уравнению (III. 18):
1- & 1----------= 0,985 и хА' = 0,015;
1 + 93 U-0,0718 — 1)
1—хн'= ----------Ц----------= 0,371 и хв' = 0,629.
В 1+21(________1_____1) В
93 \ 1—0,897 J
Найдем значения коэффициентов и К, по уравнениям (III. 74) и
(III. 75):
„ „ 0,629
/ к'-р* тр--45’7 ож~19151
Ki = Pl Г~р-=760Зг=2019-
1 “ X.Q \JjOl 1
Общее давление для трехфазного паро-жидкого равновесия может быть
рассчитано по уравнению (111.78):
Раш = Г\ (1 — хА’) + Р2хв' = 760 х 0,985 + 45,7 х 0,629 = 777,3 мм рт. ст.
Тот же результат получится, если вести расчет по уравнению (III. 76)
раа,= К1хА' + Р1 (1-хА') = 1915 x 0,015 + 760 x 0,985 = 777,3 мм рт. ст.
Состав паровой фазы, равновесной обоим жидким слоям, определяется
по уравнению (111.80):
, 1915x0,015
=---777Ж = °’°37-
Состав уе' заключен между составами хА' и хв обоих жидких слоев.
Для построения изотермической равновесной диаграммы давление пара —
состав необходимо отдельно для каждого слоя задаться рядом значений х'
в'интервале от 0 до хА и от хв до 1 и рассчитать по уравнениям (III. 83)
120
Растворы
и (III. 87) соответствующие значения составов равновесных паровых фаз.
Для первого слоя используется уравнение (III. 83), а для второго уравне-
ние (III. 87).
Расчеты сведены в табл. 8 и 9.
Таблица 8
х' Kix' 1 -х‘ Рт (1-х') Paw х' + + Р1 (1 -х') Kix'
> -Кух'+Р^-х')
0,001 1,905 0,999 759,2 761,1 0,00252
0,004 7,670 0,996 757,0 764,7 0,01000
0,005 9,575 0,995 756,0 765,6 0,01250
0,008 15,30 0,992 753,0 768,3 0,01990
0,010 19,15 0,990 752,0 771,2 0,02520
0,012 23,00 0,988 750,0 773,0 0,02970
0,015 28,70 0,985 748,6 777,3 0,03700
Для водного слоя, содержащего лишь весьма небольшое количество
растворенного анилина, этот расчет состава равновесной паровой фазы может
быть упрощен еще больше. В самом деле, положив в уравнении (III. 76)
состав х' близким к нулю, получим Paw=Pi и по уравнению (III. 80)
Сопоставляя графы 1 и 6 табл. 8, можно убедиться, что найденное
соотношение между молярными составами жидкой и паровой фаз выдержи-
вается с практически приемлемым приближением, причем тем с большей
точностью, чем меньше рассматриваемые составы.
Таблица 9
х' Р2 х' 1 — х‘ K.(l -х') Р2х" + К2 (1 - х') , РгХ'
Р2х' + К2(1 — х')
0,629 28,7 0,371 748,6 777,3 0,0370
0,650 29,7 0,350 706,0 735,7 ' 0,0404
0,700 32,0 0,300 605,0 637,0 0,0502
0,750 34,2 0,250 504,0 1 538,2 0,0636
0,800 36,5 0,200 404,0 440,5 0,0831
0,850 38,8 0,150 302,0 340,8 0,1140
0,900 41,1 0,100 201,9 243,0 0,1690
0,950 43,4 0,050 101,0 144,4 0,3000
0,990 45,2 0,010 20,2 65,4 0,6920
§ 24. Паро-жидкое равновесие при высоких давлениях
Соотношения, рассмотренные в предыдущих параграфах,
относились к тому случаю, когда жидкая фаза системы под-
чинялась законам идеального раствора, а равновесная ей паро-
Паро-жидкое равновесие при высоких давлениях 121
вая фаза — законам смесей идеальных газов. По мере увели-
чения внешнего давления паро-жидкие системы уже не под-
чиняются законам простейшего раствора в жидкой фазе
и идеального газового состояния в паровой и поэтому расчет
равновесия по уравнениям (III. 50), (III. 51), (111.57) или (III. 60)
приводит к недопустимым ошибкам.
При повышенных давлениях расчет паро-жидкого равно-
весия ведется на основании правила летучести, которое, как
показывает опыт, позволяет довольно точно описывать количе-
ственную сторону рассматриваемого явления. Сущность пра-
вила летучести состоит в следующем. Летучесть компонента
в растворе является количественной мерой его стремления
рассеяться, выделиться из смеси, и поэтому в условиях равно-
весного сосуществования фаз летучесть любого компонента
системы во всех ее фазах должна быть одной и той же, чтобы
не было перераспределения вещества между фазами. Так, для
двухфазной паро-жидкой системы условие равновесия, выра-
женное при помощи летучестей, представится соотношением
------------------------------------------------------------(III.-S9)
где /" и /Г — летучести i-ro компонента в паровой и жидкой
фазах системы соответственно.
Для использования равновесного уравнения (III. 89) необхо-
димо уметь определять летучесть компонента, находящегося
в жидком или газообразном растворе, по его летучести в чистом
виде. Рассмотрим однородную жидкую или газообразную
систему и поставим задачу определить летучесть компонента
в растворе по его летучести в чистом виде при той же темпе-
ратуре. Для неидеальных растворов эта задача решается
лишь приближенно. В идеальных же растворах летучесть
каждого компонента в растворе может быть вполне точно
определена по летучести этого же компонента, взятого в чистом
виде, но в том же фазовом состоянии, что и раствор, обяза-
тельно при температуре и общем давлении раствора.
Как указывалось ранее, по мере понижения давления отношение —L
Р
стремится к единице и при низких давлениях летучесть и давление можно
принять равными друг другу.
Изотермическое изменение изобарного потенциала, когда к смеси при-
бавляется чистый компонент, находящийся в стандартном состоянии, на осно-
вании определяющего летучесть уравнения (II. 4) в конечной форме будет
равно
ф( —ф(о = /?Т’1п7(, (III. 90)
где — парциальный молярный изобарный потенциал или, иначе говоря,
химический потенциал.
Эта запись уравнения (II. 4) объясняется тем,-что рассматриваемое веще-
ство является одним из компонентов системы и поэтому его летучесть опре-
122
Растворы
деляется не по изменению изобарного потенциала всей системы в целом,
а по парциальному молярному изобарному потенциалу данного компонента.
Изотермическое изменение изобарного потенциала с давлением дается
выведенным ранее уравнением (дФ1/др)т = Подставляя значение V( на
основании уравнения состояния идеального газа и интегрируя в пределах от
стандартного давления р° = 0 до рассматриваемого р, имеем
Ф(идеальн) i Ф(идеальн) I Р- (Ш. ^1)
Для реального газа уравнение состояния при помощи остаточного объема
можно записать следующим образом:
ai= ^идеалы. — Ареалы, = ~/ I > (Ш. 92)
где — парциальный остаточный объем.
На основании определяющего летучесть уравнения (II. 4) можно написать
выражения для дифференциала изобарного потенциала реального и идеаль-
ного газов:
$ф = V dn‘t
u реальн реальна’
б/Ф == V do
идеальн г идеальн'
Сочетая эти два уравнения с уравнением (III. 92), имеем
(^реальн ^идеальн) (^реальн ^идеальн) ^Р dp.
Интегрируя в пределах от стандартного состояния, в котором р —О, до
рассматриваемого давления р, имеем
_ Р_
фреальн - фидеальн = — f aldP- (Ш. 93)
0
Делая подстановку значения Фидеальн из уравнения (III. 91) в уравнение
(III. 93) имеем
_ . р __
Ф(реальн)> ~ Фидеальн =/?Г1п Pi~ f aidP- (Ш. 94)
0
Сочетая уравнение (III. 94) с уравнением (11.16), имеем
_ Р _
ЯТ1п lin=RTlnPi— J aidp. (III.95)
о
Для идеальных газовых смесей, подчиняющихся закон}' аддитивности
объемов, парциальное давление компонента равно ру', поэтому
7 п 1 ?
^W^RT.I °idp' (IIL96)
о
откуда
Р _
RT in fj11— RT In у’ + RT In p— J’ atdp. (III. 97)
b
Сочетая уравнения (III. 97) и (11.16), можно получить то
основное соотношение, которое носит название правила лету-
чести:
/7 = (Ш.98)
Паро-жидкое равновесие при высоких давлениях 123
Согласно этому правилу для определения летучести f° ком-
понента раствора необходимо найти летучесть этого же компо-
нента, взятого в чистом виде в том же фазовом состоянии, что
и раствор, при температуре и давлении раствора, и умножить
на молярную долю этого компонента в растворе.
Кажущееся противоречие между применением соотношений
для идеальных газовых смесей и тем, что полученное правило
летучести применяется при повышенных давлениях для реаль-
ных смесей, объясняется тем опытным фактом, что сжатая
смесь реальных газов с известным допустимым приближением
подчиняется закону аддитивности объемов.
Правило летучести применяется и к жидким растворам при
условии их подчинения закону аддитивности объемов:
7? = /.жхЛ (III. 99)
Сочетая уравнения (III. 89), (III. 98) и (III. 99), можно
написать условия паро-жидкого равновесия в следующем виде:
л" = //’У/ = 7*=/ жх/. _ (III. 100)
Уравнение (III. 100) позволяет выразить выведенное ранее
равновесное фазовое отношение через летучести;
= = (III. 101)
it
В определяющее равновесное фазовое отношение уравне-
ние (III. 101) входят летучести лишь чистых компонентов
системы, метод расчета которых по обобщенным данным при
помощи коэффициента сжимаемости или остаточного объема
был описан ранее.
Лучше всего воспользоваться графиком, дающим отноше-
ние летучести к давлению в функции приведенного давления
и приведенной температуры (фиг. 30). Чтобы найти /<", сначала
из этого графика определяют при заданных условиях Л"/р,
где р общее давление, под которым находится система, а затем,
умножив на р, находят /Д Значение же /Д определяется путем
нахождения по тому же графику значения fi/Pi с последую-
щим использованием соотношения
/ ж V (п — р.\
1g - (IIL102)
где Pi — упругость насыщенных паров данного вещества при
температуре равновесной системы; ft — летучесть чистого веще-
ства в жидкой фазе при давлении Pi и Уж — молярный объем
компонента в жидкой фазе. При давлениях ниже 35 ат Д
124
Растворы
пренебрежимо мало отличается от /1/к и нет необходимости вно-
сить поправку при помощи уравнения (III. 102), правая часть
которого ввиду небольшой разницы между р и Pt близка
к нулю.
Паро-жидкое равновесие при высоких давлениях 125
Согласно уравнению (III. 101), равновесное фазовое отноше-
ние ki определяется лишь по давлению н температуре и совер-
шенно не зависит от природы и числа других компонентов
-системы. Однако так дело обстоит только для идеальных
и практически идеальных растворов. Для растворов же реаль-
ных, отклоняющихся в своем поведении от закона Рауля,
равновесное фазовое отношение зависит еще и от состава,
и в этом приближенность и ограниченная точность определения
летучестей неидеальных растворов по уравнению (III. 100). Есть
еще и другая причина, известным образом ограничивающая
применение правила летучести. При определенной температуре
любое чистое вещество, находящееся под давлением, отличаю-
щимся от упругости его паров, может существовать лишь
в однофазном состоянии. Если, например, давление системы
больше упругости паров рассматриваемого компонента, то
в чистом виде этот компонент может существовать лишь в кон-
денсированной фазе; если же давление системы меньше его
упругости паров при данной температуре, то чистый компонент
в этих—условиях-хчтжеи-суптествовать лишь в паровой фазе.
Однако то же самое вещество, рассматриваемое как компонент
раствора, может вести себя совершенно по-другому. Так,
компонент раствора может находиться в паровой фазе, когда
упругость его паров меньше общего давления системы, и, наобо-
рот, присутствовать в конденсированной фазе, когда упругость
его насыщенных паров при данной температуре выше общего
давления системы. Между тем использование правила летучести
предполагает определение летучести f* или /,п чистого рас-
сматриваемого компонента при Т и р раствора обязательно
в том же фазовом состоянии, что и сам раствор. При этом
может оказаться (и часто так и бывает), что данный компонент
в чистом виде не может устойчиво существовать при темпера-
туре и давлении раствора в том же агрегатном состоянии,
в котором он находится в растворе. Так, например, если дав-
ление системы />=10 ата, температура / = 70° и требуется
определить летучесть /,ж пропана в жидкой фазе, то это опре-
деление приходится вести в таких условиях, при которых
чистый пропан как жидкость не может устойчиво существовать,
ибо его упругость паров при этой температуре равна 28 ата.
Решение этой задачи состоит в экстраполяции изотермических
кривых, дающих коэффициент активности в функции приве-
денного давления, в неустойчивую область.
Вместо уравнения (III. 101) для нахождения равновесного
фазового отношения можно использовать и чисто эксперимен-
тальный метод, определяя составы равновесных паровой
и жидкой фаз раствора. Из этих данных можно рассчитать
значение kt = yt /xt' цля каждого компонента системы, избегая
расчета летучестей.
Фиг. 31. Зависимость равновесного фазового
отношения от температуры и давления для
нормального октана.
равна единице, можно получить
i = п i = n
Рассчитанные или
найденные опытным пу-
тем значения равновес-
ных фазовых отноше-
ний ki для различных
углеводородов обычно
коррелируются путем
построения диаграмм
усредненных, сглажен-
ных данных или таблиц,
дающих семейства изо-
барных кривых kt в
функции температуры.
На фиг. 31 приведена
такая типичная диа-
грамма для п-С8Н18-
При высоких да
влениях вместо уравне-
ния (III. 57) для опре-
деления молярного со-
става жидкой фазы
необходимо использо-
вать уравнение
где кг и /с2 — равно-
весные фазовые отно-
шения НКК и ВКК.
Состав паровой фазы
может быть найден по
уравнению (Ш.52) как
произведение к-ух' = у'.
Уравнение изотермы
жидкой фазы много-
компонентной системы
можно найти исходя
из следующих сообра-
жений. Решив уравне-
ние (III. 52) в отноше-
нии состава паровой
фазы, написав его для
всех компонентов системы и просуммировав, принимая во вни-
мание, что сумма составов всех компонентов в паровой фазе
ktXt'.
i=l 4=1
(III. 104)
Паро-жидкое равновесие при высоких давлениях
127
Подобным же образом можно получить уравнение изотермы
паровой фазы многокомпонентной системы, решив уравне-
ние (III. 52) в отношении состава жидкой фазы и просуммиро-
вав его для всех компонентов:
1= п 1 = п
У х/ -1 = V 2' . пи.105)
i=i
При помощи этих двух уравнений рассчитываются точки
начала кипения и конденсации жидких и паровых многоком-
понентных систем. Расчет ведется следующим образом. Для
двухфазной паро-жидкой n-компонентной системы, согласно
правилу фаз число степеней свободы равно числу ее компо-
нентов п. Если задан состав одной из фаз системы, то (п—1)
степеней свободы оказываются заданными и остается одна
неиспользованная. Этой последней степенью свободы может
быть либо давление, либо температура системы. Задавшись
отним из этих парамещов, можно найти другой. _ _____________
Таким образом, для двухфазной равновесной системы доста-
точно знать составы фаз, чтобы температура и давление рас-
сматриваемой системы являлись определенными функциями
друг друга.
Если температура постоянна, то давления насыщения каж-
дой из двух фаз являются определенными функциями их соста-
вов. Точно так же если давление, испытываемое системой,
постоянно, то температуры насыщения каждой из двух фаз
являются определенными функциями их составов.
Пусть для жидкой, например, фазы заданы состав и давле-
ние, под которым она находится, и требуется найти темпера-
туру, при которой появится первый пузырек равновесного этой
жидкости пара. Задача решается методом постепенного при-
ближения по уравнению (III. 104). изотермы жидкой фазы.
Задавшись произвольным значением температуры, определяют
значения равновесных фазовых отношений kt для всех компо-
нентов системы, подставляют в уравнение (III. 104) и проверяют,
равна ли правая часть его единице. Если не равна, то требуется
подбирать новое значение температуры до тех пор, пока
уравнение (III. 104) превратится в тождество.
Равным образом в аналогичных условиях точкой начала
конденсации паровой фазы будет та температура, при которой
подстановка в уравнение (III. 105) значений kt, отвечающих
подобранной температуре, превращает его в тождество.
Уравнение (III. 103) является решением уравнения (III. 104)
для бинарной системы. По его виду легко сообразить, что оно
поддается такой же простой графической интерпретации, как
и уравнения (III. 54) или (III. 57).
12' Растворы
§ 25. Неидеальные растворы
Когда жидкие растворы не подчиняются с практически при-
емлемой точностью закону Рауля, приходится пользоваться
лабораторными данными по паро-жидкому равновесию. Эти
данные обычно представляются в виде молярных составов х'
и у' жидкости и пара в функции температуры при постоянном
давлении. В этих случаях требуется установить методы, при
пэмощи которых можно распространить имеющиеся в распо-
ряжении опытные данные на другие температуры, уменьшить
влияние экспериментальных ошибок или же с допустимым
приближением оценить условия паро-жидкого равновесия при
отсутствии достаточно полных лабораторных данных.
Отклонения от поведения простейшего раствора в жидкой
фазе принято учитывать при помощи поправочного множителя,
имеющего термодинамический смысл коэффициента активности,
который может быть либо больше, либо меньше единицы.
Так, для бинарной системы можно написать на основании
обобщенной формы закона Рауля
Л -& (111.106) и Л-$=$. (111.107)
где у — коэффициент активности.
Если продифференцировать уравнение (111.90) по составу х',
то принимая во внимание, что Ф,° не являются функциями
состава, можно получить
дФ, д In /.
-4 = /??—1*. (III. 108)
ох/ дх/ ' 7
Подстановка в уравнение (11.35) для изобарно-изотермиче-
ских условий дает
(III. 109)
и для бинарной системы
(111. НО)
Это основное уравнение Дюгема связывает коэффициенты
активности с составами и служит средством для проверки
опытных данных. Ранее это уравнение было выведено в другой
форме (II. 39).
Когда компоненты системы обладают малым сродством, то
их коэффициенты активности в растворе больше единицы,
логарифм у положителен, и в этих случаях говорят, что
система проявляет положительные отклонения от закона Рауля.
Неидеальные растворы 12V)
Эти компоненты образуют растворы с минимумом на кри-
вой точек начала кипения и конденсации, если их температуры
кипения достаточно близки друг к другу. Однако если компо-
ненты кипят в широких пределах температур, то они не будут
образовывать азеотропа.
Наоборот, когда оба компонента имеют сродство друг
к другу, то коэффициент активности у меньше единицы, его
логарифм отрицательный, и принято говорить, что такие системы
проявляют отрицательные отклонения от закона Рауля. Если
при этом точки кипения компонентов оказываются достаточно
близки, то они образуют азеотропы с максимумом точки кипения.
Вообще отклонения экспериментальных значений парциаль-
ных давлений от линейной зависимости (III. 50) могут быть
и в сторону больших и в сторону меньших значений. В первом
случае согласно уравнениям (III. 106) и (III. 107) коэффициент
активности больше единицы, разность между опытным и идеаль-
ным значениями парциальных давлений положительна, и поэтому
такие отклонения принято называть положительными. Если же
опытные значения давлений меньше рассчитанных по линейной
зависимости от молярного состава, то отклонения, очевидно,
будут отрицательными.
Из уравнений (III. 106) и (III. 107) можно получить выраже-
ние для коэффициента относительной летучести m или, иначе
говоря, коэффициента обогащения бинарной системы:
т = -.-у—= . (III. 111)
1— У' X УгР? k '
Коэффициенты активности у зависят от состава раствора
и от температуры. Изотерма неидеального жидкого бинарного
раствора запишется следующим образом:
paw = PlVix' + Р2у2(1-х'). (III. 112)
При у1 = у2 = 1 уравнение (III. 112) приходит к уравнению
<111. 54) изотермы идеальной жидкой фазы.
Уравнение Дюгема (III. 110) может быть использовано для
проверки термодинамической выдержанности опытных данных,
но оно не пригодно для прямого определения условий паро-
жидкого равновесия. Уравнение (III. ПО) связывает наклоны
кривых, дающих значения логарифма коэффициентов активности
в функции молярной доли рассматриваемого компонента
в жидкой фазе. Подобные типичные кривые в полулогарифми-
ческой сетке приведены на фиг. 32 и 33. Эти графики наглядно
показывают степень отклонения реального раствора от идеаль-
ного, так как для последнего, как известно, коэффициенты
активности равны единице и обе кривые должны представиться
соответствующей горизонталью.
Й Зак. № 304.
Раствопы
То обстоятельство, что уравнение (III. ПО) связывает наклоны
кривых на графиках Igy — х', служит основным средством про-
вода ___ , Пропиловый
Х1 Спип-'Г'
Фиг 32. Влияние состава на коэффициенты
активности системы н-пропиловый спирт —
вода. А —1,13 и /3 = 0,49.
верки правильности опыт-
ных данных. Так, из ура-
внения (III. ПО) непосреа-
ственно вытекает, что обе
кривые должны иметьпро-
тивоположные по знаку
наклоны, чтобы сумма по-
следних равнялась нулю
Когда же наклон одной
из кривых равен нулю,
то наклон другой кривой
тоже обязательно должен
быть равен нулю при тех
же значениях х'.
Для наиболее удобно-
го использования уравне-
ния Дюгема его следует
интегрировать. Известны
два наиболее удачных
решения в конечной фор-
ме уравнения (III 110),
предложенные Маргуле-
сом и Ван-Лааром. Пер-
вый получил два степенных ряда, два начальных члена которых
вполне достаточны для большинства практических приложений:
1g Y1 = (2S - А) х22 + 2 (А - В) х23;
(III. 113)
1g у2 = (2А - В) х? + 2 (В - Л) хх3.
Решение Ван-Лаара
представляется уравне-
ниями
lg7i = --^2;(Ш.115)
(1+^М
\ ьх2 )
lgr<-~---(111. 116)
В этих уравнениях А
и В являются констан-
(III. 114)
Фиг. 33. Влияние состава на коэффициент
активности системы ацетон—хлороформ.
4 = 0,44 и В = 0,34.
тами и равны логарифмам коэффициентов активности компо-
нентов I и 2 соответственно при бесконечном разбавлении.
Неидеальные растворы
131
Чтобы убедиться в этом, достаточно разрешить, например, два
последних уравнения относительно А и В:
(Ill. 117)
(Ill. 118)
При Xi'=0, очевидно, lgyi = A, a lgy2 = 0. При х2' = 0
lgy2 = B и 1g У! = 0.
Константы А и В должны быть определены опытным путем,
причем теоретически достаточно одного лишь надежного
экспериментального измерения давления, температуры и соста-
вов фаз для расчета обеих констант А и В, по которым затем
может быть вычислена вся кривая равновесия. Уравне-
ния (III. 113) — (III. 116) чрезвычайно полезны при сравнении
различных экспериментальных определений, так как позволяют
оценивать их с термодинамической точки зрения.
Таблица 10
Бинарная система Темпе- ратура, °C А В Бинарная система Темпе- ратура, °C А В
Ацетальдегид— этанол I 19-78 —0,10 -0,20 Этанол — толуол 78-110 0,763 0,763
Ацетон — бен- зол 56-80 0,176 0,176 Этиловый эфир - - этанол 34—78 0,42 0,55
Ацетон — мета- нол 56-64 0,243 0,243 Изопропа- нол — вода 82-100 1,042 | 0,492
Бензол — изо- пропанол 80—82 0,591 0,845 Метанол — бензол 56 -64 0,243 0,243
Сероуглерод — ацетон 46—56 0,566 0,778 Метилэтил- кетон — вода 73—100 1,50 0,75
Четыреххлорис- тый угле- род — бензол 76—80 0,052 i 0,046 Пропанол — вода 88—100 1,10 0,492
Этанол — бен- зол 67—80 0,845 0,699 1 Вода — фе- нол 100—181 036 1,40
9*
<ф) Растаппы
Нанеся полученные данные на график 1g у — х и экстра-
полируя до нулевого значения состава, можно найти А, таким же
путем определяется и В. Во втором приближении можно
воспользоваться полученными уже значениями у2 и и уточ-
нить значения констант А и В.
Особенно просто определяются коэффициенты активности
при наличии опытных данных по температуре, давлению
и составу азеотропической смеси, характеризующейся равен-
ством составов паровой и жидкой фаз. Если х' = у', то согласно
уравнениям (III. 106) и (III. 107)
Р Р
Vl = -fT И У2=р;.
Подставляя эти значения в уравнения (III. 117) и (III. 118),
можно определить значения А и В, а затем рассчитать всю
кривую равновесия.
Определенные этими способами значения констант А и В
для ряда бинарных систем были опубликованы многими иссле-
дователями. Некоторые из этих данных приведены в табл. 10
для различных бинарных систем под атмосферным давлением.
§ 26. Критические явления в бинарных системах
Поведение растворов и, в частности, бинарных систем в кри-
тической области значительно отличается от поведения инди-
видуальных' веществ, состоящих из молекул лишь одного вида,
и поэтому заслуживает особого рассмотрения. Согласно пра-
вилу фаз двухкомпонентная жидко-паровая система обладает
двумя степенями свободы, и если, например, задан постоянный
и неизменный состав одной ее фазы, то температура и давле-
ние насыщения этой фазы должны быть связаны функциональ-
ной зависимостью, ставящей в соответствие каждой заданной
температуре определенное давление насыщения и наоборот.
Если представить эту зависимость в системе координат
давление — температура, то получатся две кривые, отвечающие
одному и тому же заданному постоянному составу рассматри-
ваемой бинарной системы, но различным ее фазовым состоя-
ниям. Одна кривая отвечает жидкой, а другая паровой фазе
того же состава. Если принять во внимание непрерывность
состояний жидкости и пара, то обе эти кривые следует рас-
сматривать как две ветви одной и той же кривой постоян-
ного состава. Эта кривая приведена на фиг. 34 и состоит из
двух пограничных ветвей, разделяющих области, отвечающие
однородным системам того же совокупного состава, что и
постоянный состав рассматриваемой бинарной системы. Ветви
кривой постоянного состава замыкают область устойчивого
существования двухфазных паро-жидких состояний. Вся осталь-
Критические явления в бинарных системах
133
ная часть графика характеризует гомогенные состояния системы.
Обе ветви равновесной кривой постоянного состава сходятся
друг с другом в одной критической точке К, где обе фазы
становятся тождественными.
Верхняя ветвь кривой постоянного состава отвечает жидкой
фазе, нижняя — паровой. Легко заметить, что критическая
точка К бинарной системы не отвечает ни максимальной тем-
пературе, ни максимальному давлению, при которых система
может еще существовать в двухфазном состоянии. Точка М,
отвечающая максимальному давлению, и точка N, отвечающая
максимальной температуре, в общем случае не совпадают
с критической точкой К, как это имеет место в однокомпо-
нентной системе. В этом и заключается основное своеобразие
поведения растворов в критических условиях.
Кривая постоянного состава AKMNB отвечает некоторому
вполне определенному и неизменному составу рассматриваемой
системы, состоящей из двух компонентов. Если задаться дру-
гими ее составами, то каждому из них будет отвечать своя
кривая, иначе расположенная на графике р — t, с иными рас-
положением на ней критической точки К- На фиг. 35 пока-
зано, как может меняться положение критической точки К на
кривых постоянного состава в зависимости от того, какой
конкретный состав системы изучается.
Как показывает опыт, критические точки на всех кривых
постоянного состава рассматриваемой системы расположены
в точках их касания с огибающей линией, соединяющей кри-
тические точки чистых компонентов системы. Таким образом,
можно заключить, что положение критической точки на кривой
постоянного состава по отношению к точке максимума давле-
ния М или максимума температуры N определяется составом
рассматриваемой системы и расположением огибающей крити-
ческой кривой KiK2, называемой кривой точек складки.
134 Раствооы
Если рассматриваемая система является бинарной, то для
нее можно построить пространственную диаграмму в системе
координат р — I — состав, ограниченную двумя плоскостями,
перпендикулярными оси составов в двух крайних точках этой
оси, отвечающих чистым компонентам изучаемой системы.
По оси абсцисс откладываем температуру насыщения, по
вертикальной оси — соответствующее давление, а по ордина-
там— состав системы. Такая пространственная диаграмма для
системы пропан — изопентан, заимствованная из курса „Хими-
ческая термодинамика" М. X. Карапетьянца, приведена на
фиг. 36.
Здесь мы уже имеем не насыщенную кривую постоянного
состава, жидкая и паровая ветви которой сходятся в крити-
ческой точке, но поверхность насыщения, состоящую из двух
полостей, одна из которых отвечает точкам кипения насыщен-
ной жидкой фазы, а другая — точке росы насыщенной паровой
фазы. Обе части поверхности насыщения сходятся друг с дру-
гом вдоль линии критических точек А^Кг, которая и здесь
называется линией складки.
На двух упомянутых выше плоскостях, перпендикулярных
оси составов в точках 0 и 1, поверхность насыщения опирается
на кривые упругости р— I чистых компонентов, представля-
ющие собой линии слияния обеих полостей поверхности насы-
щения. Эти кривые упругостей обрываются в соответствующих
критических точках /О и /<2.
Область гетерогенных состояний, в которых система раз-
делена на две равновесные фазы, жидкую и паровую, пред-
ставляет часть пространства, заключенную между обеими по-
лостями поверхности насыщения, одной, отвечающей точкам
начала кипения жидкостей, и другой, отвечающей точкам росы
паров. Чтобы для какой-нибудь точки этой гетерогенной обла-
сти найти составы равновесных жидкой и паровой фаз, нужно
провести через нее прямую, параллельную оси составов, и
найти точки пересечения этой прямой с полостями поверхности
насыщения. Ординаты этих точек пересечения определят со-
ставы равновесных фаз, находящихся, очевидно, при постоян-
ных температуре и давлении.
Часть пространства, расположенная вне поверхности насы-
щения, отвечает гомогенным состояниям и подразделяется на
две области, из которых одна характеризует жидкие, а дру-
гая паровые однородные системы.
Изучение поверхности насыщения на пространственной диа-
грамме сопряжено со значительными трудностями. Обычно
рассматривают проекции ее сечений на какую-нибудь из коор-
динатных плоскостей, иначе говоря, закрепляют одну из опре-
деляющих состояние системы независимых переменных и иссле-
дуют связь и зависимость между двумя другими.
Критические явления в бинарных, системах
135
На фиг. 37 приведены кривые, являющиеся проекциями на
координатную плоскость р—t сечений поверхности насыщения
различными плоскостями, перпендикулярными оси составов.
Проекций „кривой критических точек''
Фиг. 3(’>. Пространственная диаграмма равновесия жидкость—пар в системе пропан — изопеи
тан (индекс „1“ относится к С3Н8, индекс „2" к С5Н12).
Проекции этих кривых постоянного состава, как и кривой
точек складки и кривых упругости компонентов на плоскость
р — t, дают полную картину равновесного существования фаз
системы. Сплошные линии отвечают жидким, а пунктирные
Рас.твопы
Фиг. 37. Равновесие жидкость — пар в системе
пропан — изопентан для смесей различного
состава.
паровым фазам систе-
мы. Точки пересечения
разноименных фаз на
диаграмме р — /харак-
теризуют равновесные
жидкую и паровую
фазы при р и /, отве-
чающих данной точке.
Таким образом,составы
равновесных жидких
и паровых фаз, отве-
чающих заданному да-
влению р± и темпера-
туре /ь найдутся как.
пометки соответству-
ющих кривых постоян-
ного состава, проходя-
щих через фигуратив-
ную точку (Л, А)- Эта
точка будет общей для
линии точек кипения
одной кривой постоянного состава и линии точек росы другой
кривой постоянного состава.
Неменьший интерес представляет проектирование сечений:
поверхности насыщения,
температурам, на пло-
скость давление — состав.
Для этого поверхность
насыщения пересекается
несколькими параллель-
ными плоскостями, пер-
пендикулярными оси тем-
ператур, и кривые пере-
сечения проектируются
на плоскость давление —
состав. При этом полу-
чается покрытый сетью
изотерм график, подоб-
ный изображенному на
фиг. 38 для системы про-
пан— изопентан. Пунк-
тирная огибающая линия
является проекцией кри-
вой точек складки. Каж-
отвечающих различным постоянным
Фиг. 38. Изотермы давление — состав для
системы пропан — изопентан в критиче-
ской области.
дая изотерма состоит из
двух ветвей, причем линия точек росы изображена пунктиром,
а линия точек начала кипения -- сплошной линией. Для опре-
Критические явления в бинарных системах
деления составов равновесных фаз, отвечающих заданному
давлению и температуре, следует найти точки пересечения
горизонтали, отвечающей данному давлению, с соответству-
ющими ветвями изотермической кривой насыщения.
На фиг. 39 слева представлен график давление — темпера-
тура с показанными на нем граничными линиями: кривыми
упругости чистых компонентов рассматриваемой бинарной
системы и А.,К2 и кривой точек складки /<^2- Последняя
может проходить по-разному, и в зависимости от ее располо-
жения и температуры равновесной системы изотермические
Фиг. 39. Расположение изотермических кривых равновесия в зави-
симости от вида кривой точек складки.
кривые кипения и конденсации приобретают ту или иную форму
в системе координат давление — состав, изображенной справа.
В самом деле, изотерме отвечает на диаграмме р — t вер-
тикаль, пересекающая кривые упругости в точхах и а2.
Проектируя эти точки в положения а\ и а'2, можно получить
в правой части графика равновесную диаграмму р—х', у’,
которая в рассматриваемом случае, когда изотерма /х = const,
пересекает только кривые упругости, но не пересекает кривой
точек складки, займет всю ширину правого графика от состава
О до 1. В точках а'1 и а!2 линии кипения и конденсации сли-
ваются друг с другом, как это и должно быть для чистых
компонентов. Верхняя изотерма характеризует жидкую, а
нижняя паровую фазы. Если же имеется другой характерный
случай, когда изотерма, например /2 = const, пересекает кривую
упругости Л,/<а одного компонента и критическую линию или,
иначе говоря, кривую точек складки КгК2, но не пересекает
другой кривой упругости, то изотермическая диаграмма равно-
весия, отвечающая температуре /2, уже будет иметь крити-
ческую точку, расположенную либо в точке максимума, либо
138
Растворы
в точке минимума давления. В этой точке сходятся линии
кипения и конденсации правой части графика, и касательная,
проведенная через нее, должна пройти горизонтально. При
этом изотермические кривые равновесия отрываются от оси,
отвечающей компоненту с меньшей критической температурой,
чем температура системы.
Если, наконец, кривая точек складки характеризуется неко-
торым максимумом температуры, отвечающим определенному
составу системы, промежуточному между 0 и 1, то изотермы,
Фиг. 40. Расположение изотермических кривых равновесия
в зависимости от вида кривой точек складки.
отвечающие температурам, более высоким, чем наибольшая из
критических температур компонентов системы, не могут пере-
сечь ни той, ни другой кривой упругости. Изотермические
равновесные кривые кипения и конденсации р — х', у' характе-
ризуются в этом случае двумя критическими точками, в кото-
рых и сходятся кривые жидкости и пара.
Так как процессы перегонки и ректификации, как правило,
протекают под постоянным давлением, то представляет особый
интерес рассмотрение паро-жидкого равновесия в изобарных
условиях. Для этого поверхность насыщения, представленную
на фиг. 36, необходимо рассечь несколькими параллельными
плоскостями, перпендикулярными оси давлений, и полученные
кривые пересечения спроектировать на плоскость темпера-
тура— состав. При этом в зависимости от вида кривых упру-
гостей компонентов системы и формы кривой точек складки
получаются различной формы изобарные кривые равновесия.
Основные случаи, аналогичные рассмотренным выше, при-
ведены на фиг. 40 и 41.
Критические явления в бинарных системах 139
Если кривая складки не имеет точки с максимумом давле-
ния, то в зависимости от того, как проходит на левой стороне
графика вертикаль, отвечающая изобаре р = const, могут встре-
титься три случая. Либо изобара, например рг = const, пересе-
кает обе кривые упругости, и тогда изобарные кривые кипения
и конденсации, изображенные справа, занимают всю ширину
правого графика от состава 0 до состава 1. Здесь уже верх-
няя кривая является линией точек росы насыщенного пара, а
нижняя кривая — линией точек начала кипения насыщенных
Фиг. 41. Расположение изобарных кривых равновесия в зависи-
мости от вида кривой точек складки.
жидких фаз. Либо изобара, например р2 = const, пересекает
одну из кривых упругостей и кривую точек складки, но не
пересекает другой кривой упругости. В этом случае изобарная
диаграмма равновесия, отвечающая этому давлению, уже будет
иметь критическую точку, расположенную либо в максимуме,
либо в минимуме температуры, и поэтому касательная к изобар-
ной кривой в этой точке будет параллельна оси абсцисс. При
этом изобарные кривые кипения и конденсации отрываются
от той оси, которая отвечает компоненту с критическим дав-
лением меньшим, чем рассматриваемое давление системы.
Если же кривая точек складки характеризуется некоторым
максимумом давления, то может представиться и такой случай,
когда изобара р = const, отвечающая давлению более высокому,
чем наибольшее из критических давлений компонентов, не
пересекает ни одной из кривых упругостей. В этом случае
изобарные кривые равновесия имеют уже две критические
точки, между которыми они и располагаются, как это пока-
зано на фиг. 41, отрываясь от обеих осей, отвечающих чистым
компонентам.
РнгтйПры
Фиг. 42. Влияние давления на вид кри-
вой равновесия у —х.
Каждая изобарная диаграмма равновесия делит график на
гетерогенную область, замкнутую кривыми кипения и конден-
сации, и гомогенные области: область паров, расположенную
выше кривой конденсации, и область жидкости, расположен-
ную ниже кривой кипения. Если на изобарной диаграмме рав-
новесия нет критических точек, то области гомогенных
состояний системы строго разграничены. Если же на диаграмме
имеются одна или две критические точки, то граница между
гомогенными областями па-
ра и жидкости не может
быть строго установлена.
Смысл рассмотрения по-
ведения систем в области
критических температур и
давлений состоит в следу-
ющем. Многие системы при
обычных условиях давления
и температуры находятся
в газообразном состоянии,,
и это препятствует их раз-
делению перегонкой или
ректификацией. Для при-
менения этих процессов
приходится сжимать газо-
образные смеси под тем или
иным давлением, достаточ-
ным для их ожижения.
Однако проведенное выше
изучение поведения систем показывает, что есть вполне опре-
деленные пределы давлений, внутри которых возможно осу-
ществить равновесие между жидкой и паровой фазами.
Так, если система находится под давлением, превосходящим
наибольшее из критических давлений компонентов, то благо-
даря наличию двух критических точек на изобарных кривых
равновесия разделение данной системы может быть осущест-
влено лишь в сравнительно узком интервале составов. Чем
ближе давление системы к максимальному давлению кривой
точек складки, тем уже интервал составов, внутри которого
могут сосуществовать равновесные фазы. Когда давление
системы совпадает с максимальным давлением кривой точек
складки, равновесное сосуществование фаз делается невоз-
можным.
На фиг. 42 представлены полученные из рассмотренных
выше изобарных кривых кипения и конденсации кривые рав-
новесия у' — х' для различных давлений, начиная от более
низкого, чем наименьшее критическое давление компонентов
системы, и кончая более высоким, чем наибольшее критиче-
Явления обратной конденсации и выкипания 141
ское давление, но меньшим, чем максимальное давление кри-
вой точек складки.
Чем больше давление, тем ближе к диагонали квадрата
составов приближаются кривые равновесия у — хи, следова-
тельно, тем меньше делается разность между составами паро-
вой и жидкой фаз. В дальнейшем будет показано, что это
играет существенную роль в процессе разделения компонентов,
которое осуществляется тем легче, чем больше разность между
составами равновесных фаз.
По мере повышения давления оно может превзойти крити-
ческое давление одного из компонентов, и тогда непрерывная
до того кривая у — х отрывается от одного из концов диаго-
нали равного состава и пересекает ее в определенной точке,
•отвечающей тому критическому составу, при котором сли-
ваются изобарные кривые кипения и конденсации. Для концен-
траций, превосходящих критический состав, отвечающий этой
точке пересечения, система может существовать лишь в одно-
фазном состоянии. Если же давление системы превосходит
критические давления обоих компонентов, то кривая равнове-
сия отрывается уже не от одного, а отоб в х концов диаго-
нали квадрата и пересекает ее в двух точках, отвечающих
обоим критическим составам. Только внутри этих двух крити-
ческих составов возможны двухфазные состояния системы. За
пределами же этих составов состояние системы может быть
лишь однофазным. Наконец, при давлении, равном максималь-
ному давлению кривой точек складки, равновесная кривая
у—х полностью сливается с диагональю квадрата составов
и уже ни при каком составе системы невозможно получить
паро-жидкого равновесия. Система может быть только одно-
фазной.
§ 27. Явления обратной конденсации и выкипания
Прй изотермическом сжимании смеси газов в условиях давле-
ния и температуры, близких к критическим, обнаруживаются
существенные отклонения от обычного поведения растворов,
заслуживающие особого рассмотрения.
На фиг. 43 представлены изобарные кривые насыщения
жидкой и паровой фаз в системе координат t—х', у' с одной
критической точкой К, которой отвечает вполне определенный
состав акр и в которой исчезает различие в свойствах фаз. Пусть
состав а рассматриваемой однородной паровой системы заключен
между критическим составом акр и составом а0, отвечающим
той точке С изобарной кривой, через которую проходит вер-
тикальная касательная к ней.
Если критическая точка К отвечает минимуму температуры
изобар насыщения, а начальное состояние рассматриваемой
14 2
Раствопы
газообразной системы представляется фигуративной точкой аг на
вертикали а = const, то при понижении температуры системы
точка должна двигаться по этой вертикали вниз. Когда в ходе
понижения температуры точка аг приходит в положение на
кривой насыщения, появляется первая микроскопическая капля
равновесной жидкости; при дальнейшем охлаждении системы
количество жидкости непрерывно растет, парового же остатка
уменьшается. Однако прогрессивное выделение жидкой фазы из
Фиг. 43. Изобарные кривые равновесия с одной критической
точкой.
массы охлаждаемого пара имеет известный предел, например <73,
так называемый максимум, после которого дальнейшее охлажде-
ние системы оказывает на нее обратное влияние и выделившаяся
жидкая фаза начинает прогрессивно выкипать. Когда фигуратив-
ная точка охлаждаемой системы приходит в положение на
изобарной кривой насыщения, она оказывается лежащей на
паровой ее ветви и, следовательно, система вновь оказывается
полностью в паровой фазе. Это своеобразное явление, выражаю-
щееся в том, что понижение температуры влечет не ожижение
двухфазной жидко-паровой системы, а выкипание ее жидкой
части, называется обратной конденсацией.
Пусть критическая точка К отвечает максимуму температуры
изобар насыщения (фиг. 43), а начальное состояние рассматри-
ваемой жидкой системы представляется фигуративной точкой
на вертикали а = const, где а—состав системы, заключенный
между критическим составом акр и составом а0, отвечающим той
точке С изобарной кривой насыщения, через которую проходит
вертикальная касательная.
Если повышать температуру системы, то ее фигуративная
точка должна двигаться по вертикали а = const кверху. Когда
Явления обратной конденсации и выкипания 14 Я
точка bk приходит в положение Ь2 на ветви жидкой фазы изобар-
ной кривой насыщения, появляется первый пузырек равновес-
ного пара. Дальнейшее повышение температуры сопровождается
непрерывным выделением паровой фазы и уменьшением жидкой.
Однако и здесь прогрессивное выделение паровой фазы из
жидкости имеет известный предел, например Ь3, так называемый
максимум, после которого дальнейший нагрев системы оказы-
вает на нее обратное влияние и выделившаяся паровая фаза
начинает постепенно конденсироваться. Когда фигуративная
точка нагреваемой системы приходит в положение Ь4 на жидкост-
ной ветви изобарной кривой насыщения, паровая фаза оказы-
вается уже полностью сконденсированной. Так, до известного
предела нагрев исходной жидкой системы сопровождается
естественным процессом ее испарения, а затем картина процесса
коренным образом изменяется и дальнейший нагрев влечет за
собой уже не выкипание, а наоборот, конденсацию образовав-
шейся в первой стадии процесса паровой фазы. Это своеобраз-
ное явление называется обратным выкипанием.
Из рассмотрения фиг. 43 легко видеть, что, если состав
исходной системы больше акр, то процессы конденсации и
выкипания ее будут протекать вполне нормально и не будет
наблюдаться обращенной картины явления. В самом деле, при
составе системы, равном ах> акр, вертикаль ах = const пересе-
кает разноименные ветви изобарной кривой насыщения, и
поэтому, исходя из начальной жидкой системы в ходе ее нагрева,
мы можем прийти лишь на линию пара и наооборот. И лишь
в тех случаях, когда состав системы заключен в интер-
вале а0<а<акр, имеют место явления обратного выкипания и
конденсации.
Эти явления широко используются в технологии нефте-
добычи для извлечения нефти из некоторых скважин, где она
находится главным образом в парообразном состоянии под давле-
нием в 100—200 ат.
ГЛАВА IV
ТЕОРИЯ ПЕРЕГОНКИ
§ 1. Основные понятия и определения
Процесс перехода вещества из жидкого состояния в газо-
образное, сопровождающийся поглощением тепла, называется
парообразованием.
Если парообразование происходит только с наружной свобод-
ной поверхности жидкости, то этот процесс называется испаре-
нием и с той или иной скоростью может иметь место при любой
температуре.
Если же образование пузырьков пара происходит не только
со свободной поверхности жидкости, но и внутри нее во всем ее
•объеме, то такое парообразование называется кипением и
в отличие от испарения имеет место лишь при вполне определен-
ной температуре, называемой температурой или точкой кипения.
Каждое индивидуальное вещество обладает вполне определен-
ной точкой кипения, являющейся однозначной функцией внеш-
него давления. Если внешнее давление равно 760 мм рт. ст., то
температура, при которой упругость паров системы достигает
внешнего давления и жидкость закипает, называется ее нормаль-
ной точкой кипения. Для процесса перегонки основное значе-
ние имеет процесс выкипания жидкости.
Процесс перехода вещества из парообразного состояния
в жидкое, сопровождающийся выделением тепла, называется
•сжижением или конденсацией.
Энергетическая природа движущей силы этих процессов
выражается в том, что, например, для парообразования тре-
буется сообщить системе определенную энергию, идущую на
преодоление межмолекулярных сил сцепления жидкости и
сопротивления, оказываемого внешним давлением. В процессе
же конденсации эта энергия выделяется обратно в том же
количестве.
Процесс частичного испарения или конденсации исход-
ной системы, представляющей собой жидкий или газообраз-
ный раствор различных по летучести веществ, имеющий
целью получение одного продукта более летучего, а дру-
Основные понятия и определения Мд
того менее летучего, чем исходный раствор, называется пере-
гонкой..
Один из продуктов перегонки, а именно более летучий,
образуется в парообразном состоянии, а другой, менее летучий,
продукт — в жидком. В подавляющем большинстве промышлен-
ных процессов перегонки целевые продукты используются
в жидком состоянии, и поэтому отгон, более летучий, чем
исходный раствор, должен быть сконденсирован в жидкость.
Таким образом, процессы выкипания и конденсации являются
составными частями процесса перегонки.
Цель перегонки может иногда состоять в получении из
исходного раствора не двух, а большего числа целевых про-
дуктов, называемых погонами и отличающихся по составу, а
следовательно, и по летучим свойствам от исходной системы.
Однако принципиальные особенности процесса перегонки сохра-
няются при этом те же, что и при делении начального раствора
на две различающиеся по летучести части.
Рассмотренные выше изобарные и изотермические кривые
равновесия позволяю'! ответитьла-шопрос какова при заданном
давлении или заданной температуре равновесная концентрация
паровой фазы, соответствующая определенному составу жидкой,
и наоборот.
При изучении процессов испарения жидкостей и конденса-
ции паров следует вполне отчетливо представлять, что в ходе,
например, испарения, протекающего с конечной скоростью,
пока еще процесс не закончился, нельзя говорить о составе
фаз, как о чем-то определенном и фиксированном, ибо, пока
идет процесс, составы сосуществующих жидкостей и паров
неопределенны.
Однако если эти же процессы проводить бесконечно мед-
ленно при непрерывном изменении давления или температуры,
то можно заставить систему пройти через последовательность
бесконечно близких равновесных состояний, фигуративные точки
которых расположатся на соответствующих изобарных или изо-
термических кривых равновесия.
Такие бесконечно медленные равновесные процессы называ-
ются обратимыми, ибо система, совершившая такой процесс,
может возвратиться в исходное состояние, пройдя в обратной
последовательности те же равновесные состояния, через кото-
рые она проходила в прямом процессе.
Смысл использования понятия идеального обратимого
процесса при изучении явлений испарения и конденсации
заключается в том, что только для обратимого процесса
параметры состояния системы, ее интенсивные свойства при
обретают определенные, фиксированные значения, однозначно
выражаемые равновесными кривыми кипения и конденса-
ции.
Ю Зак. № 304.
14Н
Теория перегонки
§ 2. Способы проведения процессов испарения
и конденсации
Испарение жидкости и конденсацию паров можно вести
различными способами: однократным, многократным и постепен-
ным — по терминологии А. М. Трегубова.
Однократный, процесс изменения фазового состояния си-
стемы состоит в том, что образовавшаяся в ходе процесса фаза
фаза
Фиг. 44. Непрерывный процесс однократ-
ного испарения.
остается в длительном
контакте с системой до
наступления в ней состоя
ния равновесия.
Постепенный процесс
изменения фазового со-
стояния системы состоит
в том, что образовавшаяся
в ходе процесса фаза не-
медленно удаляется из
системы в момент обра-
зования.
Оба способа проведе-
ния процессов испарения
и конденсации в общем
случае имеют результа-
том изменение состава
фаз системы, которое можно направлять в желательную сторону
на необходимую глубину, ^и в этом заключается практический
смысл этих процессов.
Причиной изменения состава начальной фазы системы в ходе
процессов испарения и конденсации является прогрессивное
выделение из нее новой фазы, имеющей в случае обратимого
процесса состав, равновесный с ней, но количественно отличный
от ее состава.
Многократный процесс изменения фазового состояния си-
стемы состоит в повторении однократного процесса конечное
число раз с одновременным удалением из системы образу-
ющейся в каждом однократном процессе новой фазы.
В промышленных условиях перегонка, как правило, прово-
дится под постоянным давлением, и поэтому изучение различ-
ных способов ее осуществления удобнее всего проводить по
изобарным кривым кипения и конденсации и по тепловой диа-
грамме.
Процесс однократного изменения фазового состояния, в част-
ности выкипания, осуществляется не только в виде периоди-
ческой операции, но чаще всего в промышленных условиях
непрерывным способом. Так, например, изменение фазового
состояния нефти в трубчатых печах нефтезаводских установок
Однократный процесс
воспроизводит картину непрерывного однократного выкипания,
принципиальная схема которого представлена на фиг. 44.
Сырье постоянного состава с неизменной скоростью подается
в нагреватель, где подвергается однократному испарению за
счет сообщаемого тепла В.
также непрерывно в следу-
ющем аппарате — испарителе.
Постоянство составов сырья
в образующихся из него равно
весных фаз и неизменность
скорости подачи сырья и от-
вода продуктов однократного
испарения являются основными
условиями непрерывного про-
цесса.
Рассмотрим характерные
особенности процесса одно-
кратного изменения фазового
состояния системы.
Равновесные фазы разделяются
Фиг. 45.j Диаграмма к^'анализу про-
цесса однократного испарения.
§ 3. Однократный процесс
На фиг. 45 приведены изо-
барные кривые равновесия
t — х, у и тепловая диаграмма
для бинарной системы полно-
стью растворимых друг в друге
компонентов нормального вида
с монотонными кривыми точек
начала кипения и конденсации.
Пусть фигуративная точка Lo
представляет исходную жид-
кую систему состава а и тем-
пературы/0. Начальная система
недогрета до точки кипения
4, и для начала ее перегонки необходимо поднять ее темпе-
ратуру t0 до ilt отвечающей фигуративной точке Llt лежащей
на изобарной кривой кипения жидкой фазы. В точке исход-
ная жидкость приходит в насыщенное состояние и состав
первого пузырька равновесного ей пара изобразится абсциссой
точки £\, определяемой как точка пересечения изотермы
= const с изобарной кривой точек начала конденсации.
Пусть система подвергается однократному изменению фазо-
вого состояния путем доведения ее температуры до некоторого
значения t, промежуточного между точками ее начала и t2
конца кипения.
Фигуративная точка системы придет в некоторое положе-
10*
ние L внутри двухфазного паро-жидкого участка, ограничен-
ного кривыми кипения и конденсации, и равновесные сосущест-
вующие фазы, на которые разделится система, представятся
фигуративными точками R и D с составами х и у. На фиг. 45
кривые равновесия t — х, у совмещены с тепловой диаграммой
на одном графике и соответствующие фигуративные точки на
обеих диаграммах обозначены одними и теми же буквами.
Поскольку равновесные паровая и жидкая фазы находятся
при одной и той же температуре, то их фигуративные точки R
и D на нижней диаграмме лежат на одной горизонтали, а на
верхней расположены по концам изотермы RD, проведенной
пунктиром. Здесь уместно еще раз подчеркнуть, что составы
паровой и жидкой равновесных фаз отличаются друг от друга,
причем в рассматриваемом случае содержание НКК в парах
больше, чем в жидкости. По мере увеличения температуры
однократного испарения значения составов х и у уменьшаются
и равновесные фазы обедняются компонентом а.
Рассмотрим другой случай однократного изменения фазового
состояния, когда исходная система состава а и температуры t0'
находится в состоянии перегретого пара. Чтобы довести эту
перегретую систему до насыщенного состояния, необходимо
охладить ее до температуры /2, отвечающей точке начала кон-
денсации исходной системы состава а. При этом фигуративная
точка системы перемещается из Lo' в £)2 и появляется первая
микроскопическая капля жидкости, фигуративная точка кото-
рой /?2 лежит на одной изотерме с точкой D2. Если теперь
понизить температуру насыщенных паров до некоторого значе-
ния I, промежуточного между точками начала tr и конца /2
кипения исходной системы, то ее фигуративная точка придет
в положение L и система будет состоять уже из двух равно-
весных фаз: паровой D и жидкой R, фигуративные точки кото-
рых расположатся на кривых конденсации и кипения диаграмм
равновесия. Легко заметить, что с понижением температуры
однократной конденсации составы равновесных фаз по НКК
повышаются.
Для вывода количественных соотношений, управляющих
ходом процессов однократного изменения фазового состояния
системы, нет необходимости рассматривать в отдельности испа-
рение жидкости и конденсацию паров как самостоятельные про-
цессы. Вполне достаточно исходить из следующей схемы. Дана
система веса L, начального состава а и теплосодержания Qo.
Система может быть жидкой или паровой, однофазной или двух-
фазной, недогретой до точки начала кипения или перегретой
выше точки конца кипения. Если вместо теплосодержания Qo
системы задана ее температура /0, то должно быть известно,
какая ее часть находится в жидкой и какая в паровой фазе,
чтобы можно было рассчитать теплосодержание единицы ее
Однократный процесс 149
веса. Во всяком случае считается, что состояние исходной
системы полностью определено. Требуется узнать, как изме-
нится состояние системы, если ей сообщить или от нее отнять
определенное количество тепла В.
Для решения этой задачи используется метод материальных
и тепловых балансов, подробное обоснование которого дается
в разделе теории ректификации. Здесь же можно ограничиться
лишь кратким изложением сущности его. Метод балансов исхо-
дит из того бесспорного факта, что после процесса однократ-
ного изменения фазового состояния количество вещества в си-
стеме остается тем же, что и до процесса, а количество энергии
изменяется на величину сообщенного или отведенного тепла.
Если общий вес системы до процесса однократного измене-
ния ее фазового состояния составляя L килограммов, а в резуль-
тате процесса образовалось D килограммов паровой и R кило-
граммов жидкой фазы, то, очевидно,
L=--D + R. (IV. 1)
Исходя из соображения, что веса компонентов системы до
и после процесса не изменяются, меняется лишь распределение
между фазами, можно составить уравнение материального
баланса по весу низкокипящего компонента:
La^Dy + Rx, (IV. 2)
где у и х — составы паровой и жидкой равновесных фаз, обра-
зовавшихся в результате однократного изменения фазового
состояния исходной системы.
Для определения расхода тепла В (положительного или
отрицательного) на проведение рассматриваемого процесса
составляется уравнение теплового баланса, основанное на том
соображении, что теплосодержание исходной системы плюс
подведенное (или отведенное) тепло В должны равняться тепло-
содержанию конечных продуктов процесса:
LQ0 + B = DQ + Rq, (IV. 3)
где В — количество тепла, подводимого в процессе испарения
и отводимого в процессе конденсации системы; Q(), Q и q—
теплосодержания единицы веса исходной системы, отгона и
жидкого остатка соответственно. Введя обозначение для тепло-
вого параметра
6 = Q0+ ккал/кг сырья, (IV. 4)
уравнение (IV. 3) можно представить в более удобном для рас-
четных операций, симметричном с уравнением (IV. 2) виде
L9 = DQ + Rq. (IV. 5)
150
Теория перегонки
Совместное решение уравнений (IV. 1) и (IV. 2) позволяет
вывести соотношение, связывающее конечные веса фаз с на-
чальным весом системы и составами:
—— = —?— = —(IV. 6)
у — х у — а а — х '
Сделав подстановку из уравнения (IV. 5) пропорциональных
весам величин в уравнение (IV. 6), можно получить соотношение,
связывающее лишь составы и теплосодержания фаз:
(у — х) в = (а — х) Q + (у — a) q =
= (a-x)Q + (y-x)^ — (a-x)q,
откуда
(У-x) (Q — q) = (a — x) (Q - q)
и
Как известно из аналитической геометрии, соотношение (IV. 7)
является необходимым и достаточным условием для того, чтобы
на тепловой диаграмме, дающей теплосодержание единицы веса
фаз в функции их состава, три точки (а, 0), (х, q) и (у, Q) лежали
на одной прямой. Таким образом, на основании уравнения (IV. 7)
фигуративная точка L (а, в) на тепловой диаграмме должна1
лежать на изотерме RD, связывающей фигуративные точки
7?(х, q) и D(y, Q) равновесных фаз, образовавшихся в конце одно-
кратного процесса изменения фазового состояния.
Как указывалось ранее, исходная система может быть в со-
стоянии недогретой жидкости (точка Lo), перегретого пара
(точка Lo') или даже в двухфазном жидкопаровом состоянии
(точка Lo"'). Из тепловой диаграммы на фиг. 45 и на основании
определяющего в уравнения (IV. 4) можно установить величину
расхода тепла на проведение процесса. Этот расход тепла в слу-
чае, например, недогретой до точки кипения жидкости будет
пропорционален положительному отрезку L0L на тепловой
диаграмме. Если исходная системы представляла собой пере-
гретый пар, изображенный фигуративной точкой Lo', то для
получения из нее насыщенного пара D (у, Q) и жидкости R(x, q)
от системы требуется уже отнять тепло, величина которого
будет измеряться отрицательным отрезком L0'L на тепловой
диаграмме. Вообще, смотря по тому, расположена ли фигура-
тивная точка сырья на тепловой диаграмме выше или ниже
фигуративной точки L(a, в), требуется либо отнимать тепло от
системы, либо подводить к ней тепло, чтобы получить в резуль-
тате однократного изменения ее фазового состояния конечные
равновесные продукты — жидкий R и паровой D. Если система
должна быть сконденсирована для получения целевых продук-
Однократный процесс 151
тов, тепло от нее отнимается; если же система должна выкипать,
то тепло к ней, очевидно, подводится. Отрезки, пропорциональ-
ные количеству подводимого или отводимого тепла, будут поло-
жительны или отрицательны, смотря по тому, ведется ли отсчет
кверху или книзу. Так, например, если исходная система изо-
бражена точкой Lo", расположенной в двухфазном участке, то
для получения из нее конечных продуктов /? и D ей необхо-
димо сообщить тепло, измеряемое положительным отрез-
ком L'L. Если бы точка Lo" была расположена над точкой L,
то отрезок L0"L отсчитывался бы сверху вниз, был бы отрица-
тельным и тепло не подводилось бы к системе, а отводилось
от нее.
Тепловая диаграмма позволяет разрешать ряд вопросов,
касающихся процесса однократного изменения фазового состоя-
ния, поставленных несколько по-другому. В частности, задача
может быть сформулирована следующим образом. Дана исход-
ная система, состояние которой полностью определено, и дано
количество тепла В, которое ей сообщается или от нее отни-
мается. Требуется найти, какие произойдут изменения в системе
при однократном методе ведения процесса.
При помощи тепловой диаграммы и на основании уравне-
ния (IV. 7) эта задача разрешается весьма просто. Найдя по
уравнению (IV. 4) и по заданному положительному или отрица-
тельному В тепловой параметр в, наносят на тепловую диа-
грамму точку £(а, 0), которая в общем случае может попасть
и в гомогенную и в гетерогенную области диаграммы. Если
фигуративная точка Ь(а,в) попадает в двухфазную область, то,
найдя изотерму, проходящую через эту точку в ее пересече-
ниях с линиями теплосодержаний жидкой и паровой фаз, опре-
деляем составы и теплосодержания конечных продуктов про-
цесса. Изобарные диаграммы кипения и конденсации t — х, у
в нижней части графика (фиг. 45) позволяют сразу установить
конечную температуру системы.
Относительный вес паровой фазы , называемый степенью
отгона и обозначаемый е, и относительный вес жидкой фазы
, называемый степенью конденсации и обозначаемый г, могут
быть рассчитаны по найденным составам х и у жидкого и паро-
вого конечных продуктов при помощи соотношений, представ-
ленных уравнением (IV. 6):
D а — X
-Т-- = е —--;
L у — х
JL — r = У~а
L у — х ’
(IV. 8)
(IV. 9)
152 Теория перегонки
На основании уравнения (IV. 1) легко заключить, что сумма
степени отгона е и степени конденсации г всегда равна единице:
Если в результате данного теплового воздействия на систему
ее фигуративная точка L расположится в однофазной области
диаграммы, то, очевидно, может представиться несколько слу-
чаев. Либо исходная система была однофазной и тепловое воз-
действие оказалось недостаточным, чтобы привести ее в насы-
щенное состояние, либо же это тепловое воздействие оказалось
настолько интенсивным, что система полностью перешла из
одной фазы в другую. Если же исходная система первоначально
была в двухфазном состоянии, то тепловое воздействие оказа-
лось настолько интенсивным, что система полностью испарилась
или сконденсировалась.
Так, например, если исходной системе, недогретой до точки
начала кипения, фигуративная точка которой Lo расположена
в нижней однофазной области тепловой диаграммы (фиг. 45),
сообщить тепло, меньшее, чем измеряемое отрезком то ее
фазовое состояние не изменится. Если сообщаемое тепло будет
равным L(SL1, то система придет в насыщенное состояние, так
как ее фигуративная точка перейдет на линию теплосодержаний
жидкой фазы. Если сообщаемое системе тепло будет больше
LaLx, но меньше L0D2, то фигуративная точка системы перейдет
в двухфазную область и система разделится на две равновесные
фазы. Если сообщаемое тепло еще более увеличить и довести
до L0D.2, то система придет в состояние насыщенного пара, так
как ее фигуративная точка расположится на линии теплосодер-
жаний насыщенной паровой фазы. Наконец, если системе сооб-
щить тепло, большее, чем измеряемое отрезком L0D2, например
L0Lq', то исходная жидкая система целиком перейдет в область
перегретого пара.
Обратная картина, но вполне аналогичная описанной будет
иметь место, если фигуративная точка исходной системы нахо-
дится в области перегретого пара и тепло от системы отни-
мается.
Тепловую диаграмму очень удобно совмещать с графиком
изобарных кривых кипения и конденсации t — х, у, позволяю-
щих по составу любой насыщенной фазы сразу находить ее
температуру. Кроме того, кривые t — х, у очень полезны для
прямого определения пф составу одной фазы состава другой,
равновесной с ней, и поэтому, совмещая их с тепловой диа-
граммой, можно значительно упростить методику нанесения
изотерм, соединяющих на тепловой диаграмме фигуративные
точки равновесных фаз.
Однократный процесс
153
На основании определяющих сиг уравнений (IV. 8) и (IV. 9)
можно заключить, что степень отгона е или, что то же, отно-
шение веса образовавшегося пара к первоначальному весу
системы равно отношению отрезков /?£. и RD изотермы, отве-
чающей температуре t однократного процесса изменения фазо-
вого состояния. Равным образом и степень конденсации г может
быть найдена как отношение отрезков LD и RD той же изо-
термы. Это положение, известное под названием правила рычага,
равным образом выдерживается и на тепловой диаграмме и на
диаграмме t — х, у.
Весовую степень отгона е нужно уметь пересчитывать в мо-
лярную е', показывающую, какая доля общего числа молей
исходной системы оказалась в паровой фазе в результате про-
цесса однократного изменения состояния системы. Пусть моле-
кулярный вес начальной системы равен Мй, а молекулярный вес
конечной паровой фазы равен MD- Тогда молярная степень
, , D
отгона е , определяемая как отношение числа молей -rj— конеч-
Alp
ных паров к числу молей -ту-исходной системы, найдется из
О
уравнения
, _ о м0 м0
L MD •
(IV. 10)
Аналогичным образом можно
степени конденсации, обозначив
остатка R через MR:
связать весовую и молярную
молекулярный вес жидкого
R м„ __ м0
Д MR rMR •
(IV. 11)
Зависимости (IV. 10) и (IV. 11) позволяют легко переходить
от весовой к молярной степени отгона или конденсации и
наоборот.
Расход тепла на проведение процессов однократного изме-
нения фазового состояния можно определять и чисто анали-
тическим путем, используя степени отгона или конденсации
системы и значения теплосодержаний единицы веса исходного
и конечных продуктов. Так, из уравнения (IV. 7) можно написать
для процесса однократного испарения
а — х 0 — q
У--х ~ Q~q ’
откуда расход тепла оказывается равным
= fol + <?(Q —?)•
(IV. 12)’
Теопи.я пепегонки
Обозначим съем тепла в процессе однократной конденсации
через d = — BIL, тогда тепловой параметр будет определяться
по соотношению
= (IV. 13)
а связь между составами фаз и их теплосодержаниями пред-
ставится уравнением
__ у— а _ Q — 6
у~х ~~ Q — g
Отсюда можно определить расход тепла на проведение
процесса однократной конденсации путем решения уравнения
(IV. 14) относительно d/L:
^ = (Q0-Q)+r(.Q-q).
(IV. 14)
(IV. 15)
§ 4. Построение кривой однократного испарения
бинарной системы по методу А. М. Трегубова
Фиг. 46. Построение кривой однократного
испарения по методу А. М. Трегубова.
При наличии данных по паро-жидкому равновесию рас-
сматриваемой системы, представленных в форме таблиц или
кривых равновесия, можно по уравнению (IV. 8) рассчитать
значения степеней отгона
е, отвечающих любой тем-
пературе t на интервале
между точками и t2
начала и конца кипения
данной системы. Обычно
принято эту зависимость
представлять в системе
координат t — е. Полу-
чающаяся при этом кри-
вая называется кривой
однократного испарения
системы.
Проф. А. М. Трегубов
предложил весьма изящ-
ный графический метод
построения кривой одно-
кратного испарения би-
нарной системы, сущность
которого состоит в сле-
дующем. Пусть для данной системы, начальный состав которой
равен а, даны изобарные равновесные кривые t — х, у (фиг. 46)
и требуется определить степень отгона е, отвечающую некоторой
температуре t, промежуточной между ее точками начала кипе-
ния А и конца кипения /2. Проведя изотерму / = const, в точках
Однократное изменение фазового состояния 155
ее пересечения R и D с изобарными кривыми кипения и кон-
денсации определяем фигуративные точки равновесных жидкой
и паровой фаз. Абсциссы этих точек дают значения составов х
и у.
Два луча OR и HD, проведенные через начало произвольной
горизонтали ОН длиной, равной единице, роль которой, как
в данном случае, может играть и ось абсцисс, определяют
в своем пересечении точку S. Соединим точку S прямой ли-
нией с фигуративной точкой исходной системы L (а, /) и про-
должим ее до пересечения с горизонталью ОН в точке Е.
На основании теоремы о пропорциональности отрезков па-
раллельных прямых RD и ОН, пересекающих выходящие из
вершины S лучи, можно написать
ОЕ RL а — х
^=- = - =-------= е,
ОН RD у — х
и так как отрезок ОН пропорционален единице, то е=ОЕ.
Совершенно аналогично может быть определена степень отгона
и при любой другой температуре в интервале tr < t < t2. Найдя
несколько таких сопряженных значений степени отгона е и
температуры t и принимая во внимание, что значение е=0
отвечает температуре начала кипения /ь а значению г=1 отве-
чает температура конца однократного испарения t2, можно по
точкам провести плавную кривую MPN однократного испарения
данной системы начального состава а. При другом начальном
составе, очевидно, и кривая однократного испарения будет
иметь другой вид и другое расположение.
§ 5. Однократное изменение фазового состояния в системах
частично растворимых компонентов
На фиг. 47 представлена изобарная диаграмма бинарной
эвтектической системы частично растворимых компонентов
с нанесенными на ней кривыми взаимной растворимости ком-
понентов. Как указывалось выше, растворы, состав а которых
заключен в интервалах концентраций0 < а < Ха или Хв < а < 1 при
заданном давлении в точке начала кипения представляют собой
однородную жидкую фазу. При этом возможна и начальная
неоднородность системы, если она еще не нагрета до своей
точки кипения, определяемая характером кривых растворимости,
однако важно то, что по мере повышения температуры системы
и доведения ее до точки начала кипения эта неоднородность
жидкой фазы исчезает.
Пусть фигуративная точка Lo представляет рассматриваемую
начальную гомогенную жидкую фазу состава a 41 лежит на
ветви AF кривой растворимости, и поэтому вес второй жидкой
I /!
фазы, ей равновесной, очевидно, равен нулю. Начальная система
недогрета до точки кипения /ь и для начала ее перегонки
необходимо поднять температуру 10 системы до значения, отве-
чающего фигуративной точке L, лежащей на изобарной кривой
кипения АС жидкой фазы. В точке L жидкость приходит в на-
сыщенное состояние, и состав первого пузырька равновесного
Фиг. 47. Процессы испарения и кон-
денсации в системах частично раство-
римых веществ первого типа.
ей пара изобразится абсцис-
сой точки V, представля-
ющей точку пересечения
изотермы tx начала кипения
системы с изобарной кривой
конденсации СЕ.
Пусть система подвер-
гается однократному испа-
рению при некоторой тем-
пературе t, промежуточной
между точками tx начала
и Л конца кипения ее. Фигу-
ративная точка системы при-
дет в положение Si внутри
двухфазного жидко-паро-
вого участка, и равновесные
сосуществующие фазы пред-
ставятся фигуративными
точками /?1 и с концент-
рациями х и у. Значения
концентраций х жидкой и у
паровой фаз становятся тем
меньше, чем выше темпера-
тура однократного испаре-
ния, и состав фаз обедняется
по компоненту, играющему для рассматриваемого интервала
концентраций 0<а<хА начальных жидких систем роль низко-
кипящего компонента.
Пусть к концу частичного однократного испарения началь-
ной смеси при температуре / весовая доля отгона равна е.
В момент достижения равновесия вес паров будет равен Le и
вес жидкого остатка L(1—е). Из уравнения материального
баланса по компоненту, играющему роль низкокипящего ком-
понента, можно вывести соотношение, выражающее весовую
долю отгона е в функции составов равновесных фаз и началь-
ного состава системы:
La = Ley + L (1 —е) X;
а — X
у — X '
ilV. 16)
Однократное изменение фазового состояния 1.г>7
Как и следовало ожидать, уравнение (IV. 16) тождественно
с соответствующим уравнением для определения степени отгона
в системах веществ неограниченно растворимых в жидком виде
с монотонными кривыми равновесия. На основании уравнения
(IV. 16) можно сделать заключение, что отношение веса обра-
зовавшегося пара к первоначальному весу жидкости равно
отношению отрезков R^ и изотермы, отвечающей тем-
пературе t однократного испарения. С повышением температуры
относительная величина отрезка RXS± возрастает, а отрезка S^,
наоборот, уменьшается, что объясняется прогрессивным уве-
личением веса паровой фазы и уменьшением веса фазы жидкой.
При некоторой температуре /2 однократного испарения, отве-
чающей так называемой точке конца кипения рассматриваемой
системы, жидкая фаза полностью исчезает, испаряется послед-
няя ее капля и вся система в целом оказывается в паровой
фазе. При этом состав паров в точности равен первоначальному
составу а системы. Температура /2 конца кипения ниже точки
кипения компонента системы а, играющего в данном случае
роль вьгеококипящего комнонеша. Течка является фигура-
тивной точкой состояния системы в конце ее кипения, а точка /?2
характеризует температуру и состав последней капли жидко-
сти, равновесной с образовавшимися парами. Если при одно-
кратном испарении начальной системы Lo поднять ее темпера-
туру выше /2, то фигуративная точка Llt выражающая ее состоя-
ние, перейдет в область перегретого пара, расположенную на
диаграмме равновесия выше изобарной кривой конденсации СЕ.
Пусть требуется подвергнуть однократной конденсации пар
состава а, фигуративная точка Lr которого расположена в об-
ласти перегретого пара, при некоторой температуре t'o. Про-
цесс охлаждения этого пара изобразится вертикальным отрезком
СтУ^, и в точке У2, лежащей на кривой конденсации СЕ, пар
придет в насыщенное состояние и появится первая капля рав-
новесной жидкой фазы /?2, отвечающая составу х2 Охлаждение
уже насыщенного пара до некоторой температуры I, промежу-
точной между точками начала и конца конденсации его, изоб-
разится вертикальным отрезком IZ2Slr и фигуративная точка его
придет в положение Sb отвечающее двухфазному жидко-паро-
вому состоянию системы.
Составы х и у равновесных жидкой и паровой фаз опреде-
лятся абсциссами точек R± и пересечения изотермы / =
= const с изобарами жидкой и паровой фаз. Вычтя из единицы
правую и левую части уравнения (IV. 16) и введя обозначение г
для весовой доли конденсации пара, равной г = 1—е, можно
найти ее выражение через составы фаз в следующем виде:
r=?~. (IV-17)
15Я
Tanntia rfPfippnfiKU
Соотношение (IV. 17) позволяет находить степень конден-
сации паров по метрическим свойствам равновесной диаграммы
как отношение отрезков SjVj и R1V1. С понижением темпера-
туры составы равновесных паров по компоненту w становятся
все больше, т. е. по мере конденсации в жидкую фазу пре-
имущественно переходит компонент а, играющий в данном ин-
тервале концентраций роль высококипящего компонента. Пол-
ная однократная конденсация наступает при температуре
при точке конца конденсации, совпадающей с точкой начала
кипения рассматриваемой начальной системы состава а в фи-
гуративной точке L.
Из рассмотрения процессов однократного испарения и кон-
денсации гомогенных в жидкой фазе систем частично раство-
римых компонентов эвтектического типа можно сделать заклю-
чение о полной их аналогии с соответствующими про-
цессами в системах растворов, близких по свойствам к
идеальным.
Такая же полная аналогия имеется и в процессах одно-
кратного изменения фазового состояния систем частично раство-
римых компонентов второго типа, образующих постоянно ки-
пящие двухслойные смеси с температурой кипения, промежу-
точной между точками кипения чистых компонентов.
§ 6. Многократный процесс изменения
фазового состояния
Процессы многократного испарения и конденсации, состоя-
щие в последовательном повторении процесса однократного
изменения фазового состояния системы с промежуточным раз-
делением фаз, образовавшихся в каждой ступени процесса,
были тщательно исследованы А. М. Трегубовым, выводы ко-
торого излагаются ниже.
Обратимся к изобарному графику кривых ‘Кипения и кон-
' денсации (фиг. 48). Пусть однородная жидкая система состава а,
находящаяся в точке начала кипения, подвергается процессу
однократного испарения путем нагрева до некоторой темпера-
туры t, промежуточной между точками ее начала кипения А
и .конца кипения /2. Фигуративная точка системы из поло-
жения Lt(a, 1г) перейдет в двухфазный участок, займет новое
положение L(a, /), и в соответствии с изобарными кривыми
равновесия система разделится на жидкую фазу /? и паровую D.
Вес неиспарившейся жидкости R = L(l—e1), где ег — степень,
отгона системы. Для повторения процесса однократного испа-
рения необходимо этот жидкий остаток отделить от паровой
фазы и вновь подогреть, например, до температуры /2 конца
кипения исходной системы. Фигуративная точка жидкой фазы
при этом перейдет из положения R на кривой кипения в двух-
Многократный процесс изменения фазового состояния
159’
фазный участок и займет положение L2(x, t2) на изотерме
/2 = const. Здесь уже можно сделать первый важный вывод.
В точке конца кипения исходной системы при многократном ме-
тоде ведения процесса выкипает не вся система, ибо некоторая
ее часть, определяемая фигуративной точкой /?2, остается
в жидкой фазе. Если степень отгона во второй ступени процесса
равна е2, то вес неиспарившегося остатка /?2 = /?(1— <?2) =
= L(1 — ej)(l — е2). Таким образом, можно заключить, что
при одной и той же конеч<
гона, достигаемая в однокр.
в многократном. Этот вы-
вод можно сформулировать и
по-другому: одна и та же
степень отгона при одно
кратном испарении дости-
гается при меньшей темпе-
ратуре, чем при многократ-
ном, и поэтому жидкий остаток,
полученный при однократном
испарении, должен содержать
больше ни.зкокипящего компо-
нента, ибо находится при
более низкой температуре на-
сыщения.
Обратимся к рассмотрению
процесса многократной кон-
денсации. ‘Пусть однородная
паровая система состава а,
находящаяся в насыщенном
состоянии, подвергается про-
цессу однократной конденсации путем охлаждения до неко-
торой температуры t, промежуточной между температурами
и /2 конца и начала конденсации ее. Фигуративная точка
системы из положения Z)2 (а, /2) перейдет в двухфазный участок,
займет новое положение L(a, /), и в соответствии с изобарными
кривыми равновесия система разделится на конденсат R и не-
сконденсировавшийся паровой остаток D. Вес парового остатка
£) = Е(1—ту), где д — степень конденсации исходной паровой
системы веса L. Для повторения процесса однократной кон-
денсации этот паровой остаток необходимо отделить от жидкого
конденсата R и вновь охладить, например, до температуры
конца конденсации исходной системы. Фигуративная точка ос-
таточного пара при этом перейдет из положения D на кривой
конденсации в двухфазный участок и займет положение L3(y, /Д
на изотерме = const. Если бы процесс проводился однократ-
ным способом, то/йри достижении температуры вся исход-
ная система была бы ожижена. Однако легко заметить, что при
i температуре степень от-
ном процессе, больше, чем
НИЯ.
I hi i Тропия прпррп»ки
его осуществлении в две ступени, не вся система оказывается
сконденсированной, ибо некоторая ее часть, определяемая фи-
гуративной точкой /1), остается в паровой фазе. Таким
образом, можно заключить, что при одной и той же конечной
температуре процесса степень конденсации, достигаемая,
при однократной конденсации, больше, чем при многократной.
Отсюда можно вывести, что одна и та же степень конден-
сации достигается в однократном процессе при более высокой
температуре, чем при многократном, и поэтому паровой ос-
таток, полученный при многократной конденсации, должен со-
держась больше низкокипящего компонента, ибо находится
при более низкой температуре.
В заключение следует отметить, что закономерности, уста-
новленные для многократных процессов, происходящих в си-
стемах с монотонными кривыми равновесия, в полной мере
выдерживаются и для неидеальных растворов однородных
в жидкой фазе азеотропов, как и для частично смешиваю-
щихся компонентов обоих видов в области концентраций од-
нородных в жидкой фазе систем.
й Различие, не имеющее существенного значения, здесь заклю-
чается лишь в том, что вместо низкокипящего или высококипя-
щего компонента системы нужно каждый раз иметь в виду тот из
компонентов, который в данном интервале составов играет эту
роль.
Таким образом, многократное испарение или конденсация
состоит из двух или большего числа однократных процессов
изменения фазового состояния, в каждом из которых вновь
образовавшаяся фаза отделяется от равновесного ей остатка
исходной системы, подвергающегося дальнейшему тепловому
воздействию для продолжения процесса.
Если представить себе, что в каждой однократной ступени
такого процесса система претерпевает лишь бесконечно малое
изменение фазового состояния, а число однократных ступеней
между начальным и конечным состояниями системы возрастает
до бесконечно большого, то процесс изменения фазового состо-
яния будет называться постепенным.
Иногда постепенное испарение исходной жидкой системы
называют простой перегонкой.
§ 7. Постепенное испарение систем с монотонными
кривыми равновесия
Сущность процесса постепенного испарения заключается
в том, что образующаяся паровая фаза немедленно выводится
из системы и в каждый данный момент с остаточной жидкостью
находится в равновесии лишь бесконечно м^В^ масса пара мгно-
венного состава.
Постепенное испарение систем
161
Пусть требуется рассмотреть процесс постепенного испаре-
ния системы полностью растворимых друг в друге компонентов,
изобарные кривые кипения и конденсации которой приведены
на фиг. 48.
Фигуративная точка Ljfa, представляет эту систему при
температуре L начала ее кипения. Состав равновесного ей пер-
вого микроскопического пузырька пара определяется абсциссой
точки Dlt лежащей на другом конце изотермы 2^ = const. В ходе
постепенного испарения системы ее температура будет все время
повышаться и фигуративные точки жидкого остатка и равно-
весного ему пара будут двигаться по изобарным кривым LrA
кипения и DXA конденсации вверх по направлению к точке А,
отвечающей чистому высококипящему компоненту. Установим,
как изменяются веса жидкой и паровой фаз в ходе постепенного
испарения исходной системы.
Пусть в некоторый текущий момент вес кипящей жидкости
равен L килограммов, ее весовой состав х и состав равновес-
ного ей пара у. Когда бесконечно малое количество dL началь-
ной жидкой системы пеоехопит в паровую (разу, то содержа
вие низкокипящего компонента в нем составляет ydL. При этан
вес жидкой фазы уменьшается на dL и становится равным L—aL,
а ее состав х по смыслу процесса приобретает отрицательное
приращение dx и становится равным х—dx. Принимая во вни-
мание, что первоначально содержавшийся в исходной системе
в количестве xL низкокипящий компонент после элементарного
•процесса выкипания распределился между жидкой и паровой
фазами, можно написать
xL = ydL + (х—dx) (L—dL)
или
dL _ dx
L ~ у — x
Интегрирование этого дифференциального уравнения в гтре-
делах концентраций жидкой фазы от а до некоторого значе-
ния х и в пределах весов жидкой фазы от начального Lo до
некоторого остаточного /?, отвечающего концентрации х, при-
водит к соотношению
R х
Г dL _ /' dx
Lo “
a
, 2,303 Ig-f =- (IV. 18)
x
Численное значение интеграла в правой части уравнения
определяется графическим методом как площадь под кривой,
дающей зависимость 1/(у—х) в функции х в пределах от х до оо.
И Зак. JG 304.
Анализ уравнения (IV. 18) позволяет сделать важный вывод
о теоретической невозможности получить путем постепенного
испарения жидкий остаток, представляющий собой чистый вы-
сококипящий компонент. В самом деле, при х = 0 состав равно-
весного пара у тоже равен нулю, интеграл в правой части пре-
вращается в бесконечность и, следовательно, вес остаточной
жидкости, отвечающий составу х = 0, т. е. чистому высококи-
пящему компоненту, /? = 0. Это означает, что теоретически
абсолютно чистый высококипящий компонент при постепенном
испарении исходной системы может быть получен лишь с по-
следней микроскопической каплей остаточной жидкости. Однако
следует указать, что практически чистый высококипящий компо-
нент w может быть получен при достаточно глубоком выкипа-
нии системы и без того, чтобы потребовалось полностью испа-
рить всю жидкость.
Общий расход тепла в процессе постепенного выкипания
складывается из:
1) тепла Вх, идущего на нагрев исходной жидкой системы
от начальной температуры /0 до точки начала кипения /х;
2) тепла В2, идущего на нагрев жидкого остатка перегонки
от температуры /х до конечной температуры процесса /;
3) тепла Ва, идущего на испарение из исходной системы полу-
ченного отгона и на его нагрев от /х до tD<t, где tD—средняя
температура отгона.
Потерями тепла ввиду их сравнительной незначительности
обычно пренебрегают, однако при желании их можно учесть
введением соответствующего поправочного множителя порядка
1,02—1,03 к общему расходу тепла.
Рассмотрим в отдельности каждый вид затраты тепла и да-
дим формулу для его подсчета. Вес начальной системы равен
L килограммов, отгона D килограммов и остатка перегонки R'
килограммов. Соответственно теплосодержания единицы веса
этих продуктов ’будут q\, QlD и qlR, где верхний' индекс пока
зывает ту температуру, при которой определено теплосодер-
жание. Тогда
В (ft - ft) + /? (^ - qR) + D - ^), (IV. 19}
где qR — теплосодержание единицы веса отгона в жидкой
фазе при температуре /х начала выкипания.
§ 8. Постепенная конденсация систем с монотонными
кривыми равновесия
Сущность процесса постепенной конденсации заключается
в том, что образующаяся при охлаждении паров жидкая фаза
немедленно выводится из системы и в каждый данный момент
Постепенная конденсация систем 103
с остаточным паром находится в равновесии лишь бесконечно
малая масса жидкости мгновенного состава х. При этом не-
прерывно меняется и состав у остаточного пара, обогащаю-
щегося в ходе конденсации низкокипящим компонентом.
Требуется подвергнуть постепенной конденсации насыщен-
ный пар состава а, фигуративная точка Z)2 которого располо-
жена на кривой ADB точек начала конденсации (фиг. 48).
Вследствие последовательного охлаждения этого пара появится
первая капля жидкости состава х2, определяемого фигуратив-
ной точкой /?2, лежащей на изобаре жидкой фазы и отвечаю-
щей температуре /2 начала конденсации исходных паров.
Дальнейшее постепенное понижение температуры повлечет
за собой непрерывную конденсацию пара, причем фигуратив-
ная точка выделяющейся жидкой фазы будет все время дви-
гаться по кривой Л/?2В вниз по направлению к точке В, отве-
чающей чистому низкокипящему компоненту, а фигуративная
точка пара будет двигаться к той же точке В, но по кри-
вой ADB. Установим, как изменяются веса фаз в ходе посте-
пенной концещаттии исходнсй папоной системы.__ ___ _____
Пусть в некоторый текущий момент времени вес конденси-
рующегося пара равен G килограммов, его состав у и состав
равновесной ему жидкости х. Когда бесконечно малое коли-
чество dG начального пара переходит в жидкую фазу, содер-
жание низкокипящего компонента в нем составляет xdG. При
этом вес паровой фазы уменьшается на dG и, принимая во
внимание отрицательный знак приращения dG, становится рав-
ным G + dG. Состав же паровой фазы приобретает положи-
тельное приращение dy и делается равным y + dy. В резуль-
тате бесконечно малой конденсации содержание низкокипящего
компонента в остаточном паре должно составить yG + xdG, где
попрежнему знак плюс учитывает, что приращение dG является
отрицательным. Выразим состав остаточного пара как отноше-
ние веса низкокипящего компонента, содержащегося в нем,
к общему весу пара:
откуда
dG _ dy
~G У — Х
Интегрирование этого дифференциального уравнения в пре-
делах от начальной концентрации а конденсирующегося пара
до некоторого значения у состава остаточного пара и в пре-
делах от начального Lo до некоторого конечного веса D паро-
вой фазы приводит к соотношению
D у
Г dG _ /" dy
J G ~ J y~x’
Lo a
11*
4 Д/
Толппа прпригшич/
откуда
2,303 1g = - / v2- . (IV. 20)
</ У -'
а
Как и при постененном выкипании, численное значение
интеграла в правой части уравнения (IV.20) определяется
графическим путем как площадь под кривой, дающей зави-
симости 1/(у — х) в функции у между пределами от у = а до
у = у.
Незначительное различие в способах вывода конечной фор-
мулы для постепенного выкипания и постепенной конденсации
объясняется тем, что в первом случае знаки dL и dx совпа-
дают, тогда как во втором случае dG<0, a dy>0.
Рассуждения, аналогичные приведенным в предыдущем
разделе, позволят определить величину съема тепла d в про-
цессе постепенной конденсации L килограммов паров с перво-
начальной температурой /0 при их охлаждении до темпера-
туры t с получением D килограммов остаточного пара и /?
килограммов конденсата со средней температурой
d = L _Q^ + D(Q^~ Q1d) + /? - q1*), (IV. 21)
где t2 — точка начала конденсации исходных паров.
§ 9. Процессы однократного изменения фазового состояния
в многокомпонентных системах
Выведенные выше уравнения, относящиеся к бинарной
системе, могут быть использованы для рассмотрения одно-
кратных процессов изменения фазового состояния в системах
с любым числом компонентов.
Уравнение материального баланса по общему весу исход-
ной системы, ее остатка и отгона сохранится без изменения.
Число же независимых уравнений материального баланса
по весу содержащегося в этих продуктах того или иного ком-
понента окажется на единицу меньше числа компонентов си-
стемы. Уравнение материального баланса, написанное для про-
извольного компонента системы, представится в молярных
единицах следующим образом:
Ь'а/ = £>'у/ + 7?'х/.
Исключая /?' при помощи L' = D'-\-R', имеем
D' _ ,__al'~xi' ai' — xi'
6 ~~ у/ - V ~ Г) ’
Однократный процесс в многокомпонентных системах
165
где Д— равновесное фазовое отношение для z-го компонента
при температуре и давлении равновесной системы. Решая это
соотношение относительно состава xt', получим
at ____
1+Р(А,- 1) ‘
(IV. 22)
Таких уравнений можно написать столько, сколько в си-
стеме содержится компонентов. Если их все просуммировать,
то левая сторона, представляющая сумму составов всех компо-
нентов системы в жидкой фазе, очевидно, будет равна еди-
нице и поэтому будем иметь
(IV-23)
/=1
Для систем идеальных или близких к идеальным k^PJp.
Сделав соответствующую подстановку в уравнение (IV. 23),
можно привести его к виду
Pai'
Р + е' (Pi—p)
(IV. 24)
Расчет молярной степени отгона е’ системы из п компонен-
тов при заданных давлении и температуре ведется при помощи
уравнений (IV. 23) или (IV.24) методом постепенного прибли-
жения. Задавшись произвольным значением е', подсчитывают
по уравнению (IV. 22) для каждого компонента системы значе-
ние его молярного состава в жидкой фазе, а затем, взяв
сумму всех х/ от i=l до i = n, проверяют, равна ли она еди-
нице. Если не получается равенства, то значением е' задава-
лись неправильно и требуется произвести пересчет, исходя
из другого значения е'. Обычно трех попыток достаточно для
практически точного определения степени отгона е'. При не-
больших степенях отгона удобно преобразовать расчетные
уравнения (IV. 23), разрешив каждое слагаемое в 'них относи-
тельно состава не жидкой, а паровой фазы. Для этого доста-
точно умножить обе части уравнения (IV. 22) на равновесное
фазовое отношение А, и просуммировать полученное выражение
kial'
У‘ = ktxi =П“+е' (к! — 1)
для всёх компонентов системы. Сумма составов всех компо-
нентов паровой фазы 'будет равна единице, и поэтому
i=n .
/ , 1 - е‘
(IV. 25)
(IV. 26)
= 1.
к.
Для систем идеальных или близких к идеальным =
У,' р‘ к
—_ = — и это уравнение преобразуется к виду
xi Р
l-п п >
У г>,Г7-------7Г = 1 • (IV. 27)
Pte' -\-р (1 — е ) 4 7
Расчет по уравнениям (IV. 26) и (IV. 27) ведут тем же мето-
дом постепенного приближения, задаваясь величиной е' и про-
веряя правильность ее по отклонению суммы составов равно-
весных фаз от единицы.
Если исходная система содержит нелетучий компонент,
который в результате процесса однократного изменения фазо-
вого состояния не переходит в паровую, а полностью остается
в жидкой фазе, то для него kt = yt'/xt' = 0 и его состав в жид-
кой фазе определится подстановкой этого значения kt в ура-
внение (IV. 23):
(IV. 28)
Если же исходная система содержит неконденсирующийся
газ, который в результате процесса однократного изменения
фазового состояния не переходит в жидкую, а полностью
остается в паровой фазе, то для него к^у^/х/ = оо и его со-
став в паровой фазе определится подстановкой этого значе-
ния kj в уравнение (IV. 26):
Ун/=4* (IV. 29)
Если степень отгона е' равна нулю, то конечной массы
паровой фазы не существует и температура начала кипения
насыщенной жидкой фазы может быть найдена из уравнения
(IV. 26), преобразующегося к уже известному виду уравнения
изотермы жидкой фазы:
2 А,«/ = 1. (IV. 30)
Компоненты Начальный состав а1 ki при /=5° и р = 600 мм рт. ст. /с. — 1 1 1 1 У(Ау-1) 1 + - 1)
Пропан .... я-Бутан . . . я-Пентан . . 0,100 0,650 0,250 6,34 1,37 0,32 5,34 0,37 —0,68 3,520 0,244 —0,449 4,520 1,244 0,551
Итого . . 1,000 — 1 — 1 —
Однократный процесс в многокомпонентных системах 167
Если же степень отгона е' равна единице, то не существует
конечной массы жидкой фазы и температура конца кипения
насыщенного пара может быть найдена из уравнения (IV. 23),
преобразующегося к уже известному виду уравнения изо-
термы паровой фазы:
i—n ,
2 т’1- <iv.3i)
1=1 1
Важно отметить, что исходное фазовое состояние начальной
системы не представляет никакого значения для методики
расчета, изложенной выше. Независимо от того, в жидкой или
паровой фазе была исходная система и является ли процесс
однократного изменения ее фазового состояния испарением
или конденсацией, расчет степени отгона е' и составов равно-
весных фаз ведется по одним и тем же уравнениям (IV. 23)
или (IV. 26).
Пересчет молярной степени отгона е' в весовую е ведется
но той же формулет чго и в бинарной системе...
Пример. Определить весовую степень отгона в трехкомпонентной си-
стеме, содержащей 10% (мол.) пропана, 65% н-бутана и 25% н-пентана,
которая в конце процесса однократного изменения фазового состояния
находится в равновесии при температуре / = 5° и под давлением р = 600 мм
рт. ст.
Будем вести расчет степени отгона по уравнению (IV. 23), задаваясь
различными значениями е'. После ряда попыток обнаруживаем, что е' = 0,660
. дает достаточно удовлетворительный результат, приведенный в табл. 11.
В графах 7 и 8 таблицы приведены молярные составы равновесных
жидкой и паровой фаз, а в трех следующих столбцах рассчитаны средние
молекулярные веса исходной системы Л4о = 60,1 и паровой фазы Л4О = 58,1
Весовая степень отгона определится по уравнению
г'Мд 0,660x58,1
С = --—------сгП----= Й639.
Мо 60,1
Полученные уравнения позволяют решать не только задачу
определения степени отгона, отвечающей заданным условиям
температуры и давления, но и ряд других, не менее важных
Таблица 11
, а'- 1 1+е'(А.-1) Молекуляр- ный вес М1
0,0221 0,5220 0,4540 0,140 0,715 0,145 44 58 72 4,4 37,7 18,0 6,16 41,50 10,44
0,9981 1,000 60,1 58,1
168 Теория пеоегонки
проблем. Так, например, довольно часто ставится вопрос о том,
каков будет состав паровой или жидкой фазы после испарения
из данной системы определенной ее доли однократным спосо-
бом при заданном давлении. Здесь неизвестной величиной
является уже температура, которая и определяется описанным
методом по одному из уравнений (IV. 23) или (IV. 26) путем
подбора такого ее значения, чтобы найденные при этой тем-
пературе Zrf при подстановке в уравнения (IV. 23) или (IV. 26}
превращали их в тождество.
Равным образом в несколько иной постановке задачи неиз-
вестной величиной может оказаться давление, и тогда его
значение приходится находить по тем же уравнениям тем же
методом подбора. При этом попутно определяются и составы
равновесных фаз.
§ 10. Постепенное испарение в многокомпонентных системах
Пусть исходная жидкая система содержит g±' молей пер-
вого компонента, g2' — второго и т. д., а общее число ее мо-
лей равно L':
L'= &'+&'+ ... + £/ (IV. 32)
Молярные доли компонентов в исходной жидкой системе
определятся по общему соотношению
= . (IV. 33)
Если подвергнуть исходную систему бесконечно малому
процессу выкипания, то в паровую фазу перейдет dL’ молей,
определяемых дифференцированием уравнения (IV. 32):
dL' = dgr' + dg2' + ...+dgn'.
При этом состав паровой фазы, очевидно, будет опреде-
ляться по общему соотношению
у,'"#. (IV. 34)
В качестве стандартного вещества, сравнением с которым
мы в дальнейшем будем оценивать относительную летучесть
компонентов системы, можно выбрать любой из ее компонен-
тов. Для определенности остановимся на втором и, написав
уравнение равновесия для произвольного z-го компонента
и эталонного второго, разделим их друг на друга:
У.' =
Уг' ^2 ' ’
Постепенное испарение в многокомпонентных системах 169
или, имея в виду уравнения (IV. 33) и (IV. 34), можно написать
dg,' г/ gi'
' g2' ~mi2 g2'
Подобное же дифференциальное уравнение можно написать
для любого компонента системы и для любого момента про-
цесса, ибо вследствие немедленного по мере образования
отвода паровой фазы с жидкостью в каждый момент нахо-
дится в равновесии лишь бесконечно малая масса пара и по-
этому всегда выдерживается соотношение (IV. 35).
Разделив переменные, можно переписать уравнение (IV. 35)
в следующем виде:
(IV. 35)
/о
dln^ =-£-din£2'.
Равновесные фазовые отношения kt в общем случае зависят
от давления, температуры и состава системы. Если прибли-
женно допустить, что отношение двух значений kt сохраняется
более, шли менее постоянным хотя бы в сравнительно неболь-
шом интервале температур, то это допущение позволит инте-
грировать дифференциальное уравнение (IV. 36) и получить
In -——у- = т, 2 In ,
gi о '2 g2 о
(IV. 36)
(IV. 37)
где gS и g2’— числа молей компонентов z-го и второго в оста-
точной жидкости, a gj 0' и g20' — числа молей тех же компо-
нентов в исходной жидкой системе до начала процесса ее
постепенного выкипания.
Если из начальной системы, содержащей L' молей, была
отогнана доля е', то к концу процесса перегонки остаточная
жидкая фаза должна состоять из L' (1 — е') молей. Обозначим
составы компонентов в остаточной жидкости через х/, а в ис-
ходной системе через а/. Тогда уравнение (IV. 37) можно за-
писать в следующем виде для L' = 1 молю:
, (1 — е') xt (1 — е')ха' ,,, т оо.
1g----а~,---= т,- 21g -— <IV‘ 38>
Для определения молярной доли z-ro компонента 1л' в об-
щем дестиллате достаточно составить уравнение материального
баланса
= + (IV. 39}
Уравнение (IV. 38), несмотря на свой приближенный ха-
рактер, часто применяется для углеводородных систем, со-
стоящих из родственных компонентов, для которых коэффи-
Теория прпегонки
циент относительной летучести на небольшом интервале тем-
ператур сравнительно мало изменяется. Во всяком случае
можно рекомендовать пользоваться среднеарифметическим
или среднегеометрическим из значений коэффициентов относи-
тельной летучести, взятых при температурах начала и конца
постепенной перегонки. При этом температурой в конце про-
цесса приходится задаваться и после определения состава ко-
нечных фаз проверять ее правильность по уравнению изо-
термы.
Контрольным уравнением, по которому проверяется пра-
вильность найденного по уравнению (IV. 38) состава конечной
-фазы, является очевидное требование
i=a
2 */ = i-
1=1
Уравнение (IV. 37) поддается и графическому решению, ибо
Я/
g; о'
в функции IgC^V^o) представляется прямой линией
с наклоном, равным т.
§ 11. Постепенная конденсация в многокомпонентных
системах
Пусть исходная паровая система содержит О/ молей пер-
вого компонента, G2' —второго и т. д., а общее число ее мо-
лей равно L':
L' = G1'+G2’ + ... + Gn'. (IV. 40)
Молярные доли компонентов в исходной паровой системе
определятся по общему соотношению
О/
У' = ^г- (IV. 41)
Если подвергнуть исходную систему элементарно малому
процессу конденсации, то в жидкость перейдет dL' молей,
определяемых путем дифференцирования уравнения (IV. 40):
dL' = dG/ -J- dG2' + • • • +
При этом состав жидкой фазы, очевидно, будет опреде-
ляться по общему соотношению
dG,.'
= (IV. 42)
Как и выше, выбрав в качестве стандартного второй ком-
понент системы, можно написать уравнение равновесия для
Постепенная конденсация в многокомпонентных системах
171
произвольного г-го и для второго эталонного компонентов си-
стемы и, разделив их друг на друга, получить
Д' = к,
G?’ к2 dG2'
(IV. 43)
или
d In G.' ~d In G,'.
K2 '
Интегрируя это уравнение в предположение постоянства
отношения fc(//c2 в пределах от начального веса каждого ком-
понента в исходной системе до конечного веса в остаточном
паре, можно получить
1 G-'
lg G~
u i О
или
G-^ = 1g<W •
i\ -iij
Если из начального пара, содержащего L' молей, сконденси-
рована доля г', то к концу процесса постепенной конденсации
остаточная паровая фаза должна состоять из L'(l —г') молей.
Обозначая составы компонентов в остаточном паре через у/,
а в исходной системе через а/, можно написать
, (1— r')yt’ (1 — г') у/
m/2lg-------= lg^—(IV. 4о)
Для определения молярной доли г-го компонента х/ в общем
конденсате достаточно составить уравнение материального
баланса
а/ = г'х/ + (1 — г') у/. (IV. 46)
Контрольным уравнением, по которому проверяется пра-
вильность найденного по уравнению (IV.45) состава конечной
фазы, служит очевидное соотношение
i^n
i-1
Замечания, сделанные относительно постепенного испаре-
ния, в равной мере применимы и к процессу постепенной
конденсации сложных систем.
TpnntfQ twrwmutfll
§ 12. Перегонка с насыщенным водяным паром
Использование водяного пара в процессе перегонки угле-
водородных систем вызвано стремлением понизить температуры
перегонки и тем самым предохранить от разложения недоста-
точно теплоустойчивые соединения. Той же цели можно
достигнуть, проводя перегонку под вакуумом путем поддержа-
ния пониженного давления при помощи вакуум-насоса. Однако
в ряде случаев применение водяного пара практически более
целесообразно, так как при отгонке, например, сравнительно
малолетучих веществ вакуумная перегонка трудно осущест-
вима. При перегонке с водяным паром последний непосредст-
венно вводится в массу перегоняемой жидкости, понижает
своим присутствием парциальное давление, которое должны
иметь углеводородные пары, чтобы жидкость закипела, и тем
самым позволяет вести перегонку при более низкой темпера-
туре. Вместо водяного пара может быть использован любой
химически нейтральный газ или пар. Однако при этом возни-
кают дополнительные трудности, связанные с последующим
улавливанием этого газа или пара и его отделением от дестил-
лата. Отработанный же водяной пар всегда имеется на нефте-
заводах в значительном количестве, а отделение воды от ожи-
женного дестиллата осуществляется простым отстоем.
Водяной пар может применяться для перегонки в насы-
щенном или перегретом состоянии, и это оказывает существен-
ное влияние на характер процесса перегонки.
Рассмотрим систему, состоящую из компонента а, не раство-
римого в воде, подвергающуюся перегонке при помощи насы-
щенного водяного пара. Последнее условие требует присут-
ствия в жидкой фазе, кроме компонента а, еще и не смеши-
вающейся с ним воды. Рассматриваемая система состоит из
двух компонентов и разделена на три фазы — две жидкие
и одну паровую — согласно правилу фаз обладает одной сте-
пенью свободы. Это означает, что достаточно задаться каким-
нибудь одним интенсивным свойством системы, чтобы состоя-
ние ее полностью определилось. Пусть задана температура t,
при которой ведется обратимый равновесный процесс пере-
гонки. Если упругости насыщенных паров компонента а и воды
при этой температуре соответственно равны Ра и р2', то об-
щая упругость паров системы должна равняться их сумме:
р = Ра + р/. (IV. 47)
При условии, что паровая фаза подчиняется законам идеаль-
ного газового состояния, можно написать для составов паро-
вой фазы по компоненту а и воде
РУа=Ра’ Р^-Уа^РУг =Pz-
Перегонка с насыщенным водяным паром
173
Разделив одно уравнение на другое и обозначив весовое
количество водяного пара в паровой фазе через z, имеем
У/ ^Ga/Ma = Ра
У/ 2 Рг ’
18
•откуда
z _ Mzpz' _ 18 (р — Ра)
Ga МаРа~ МаРа
(IV. 48)
По уравнению (IV. 48) можно определить относительный
расход водяного пара на перегонку, однако при условии, что
образующаяся в процессе паровая фаза находится в равнове-
сии с жидкостью. Легко заметить из уравнения (IV. 48), что
относительный расход водяного пара растет с увеличением
давления рис уменьшением температуры процесса и моле-
кулярного веса Ма отгоняемого вещества. Расход насыщенного
водяного пара, определяемый по уравнению (IV.48), отно-
сится исключительно к его_ количеству, необходимому для_
обеспечения суммарной упругости паров системы, отвечающей
данной температуре. Если задано давление р, под которым
должна вестись перегонка компонента а, то для нахождения
температуры / процесса удобнее всего прибегнуть к простому
графическому приему, показанному на фиг. 49. Нанеся кри-
вую упругости перегоняемого вещества и построив при по-
мощи таблиц свойств насыщенного водяного пара по точкам
кривую р — pz, можно найти температуру равновесия системы
как абсциссу точки пересечения этих кривых. На фиг. 49
показан такой расчет для двух веществ — бензола и толуола —
при условии, что внешнее давление равно 760 мм рт. ст.
Линия /? —р2' = 760— рг’ пересекает кривые упругости бензола
и толуола в точках М и N, абсциссы которых ta' = 69° и t'w =
— 84,5° определяют температуры, при которых упругость
насыщенных паров этих веществ будет равна 760 — pz или,
иначе говоря, в сумме с рг станет равной внешнему давле-
нию р=760 мм рт. ст. Следует обратить внимание на сниже-
ние температур кипения, вызванное присутствием насыщенного
водяного пара. Так, для бензола температура кипения пони-
жается на 11°, а для толуола на 26°. Из фиг. 49 легко видеть,
что верхним пределом температуры перегонки с насыщенным
водяным паром будет точка кипения воды при данном давле-
нии р. Теперь рассмотрим систему, состоящую из двух компо-
нентов а и w, удовлетворяющих условию полной взаимной
растворимости, но не растворимых с водой. В условиях равно-
весной перегонки с насыщенным водяным паром такая система
будет обладать согласно правилу фаз уже двумя степенями
174
Т вопия перегонки
свободы, это означает, что каждой паре заданных интенсивных
свойств ее будет отвечать некоторое вполне определенное
равновесное ее состояние. Суммарная упругость паров р этой
системы должна складываться из парциальных давлений ра, pw
и pi отдельных ее компонентов:
P = PaW + Pz=Pa + PW+Pz- (IV‘49>
Фиг. 49. Графический расчет состава равновесных фаз при перегонке с насы-
щенным водяным паром.
Подставляя значения ра и pw, на основании закона Рауля
имеем
p=p;+pa*'+pw(y-*'\ ay-50)
где Ра и Pw — упругости насыщенных паров компонентов а
и w при температуре системы, а х' — молярная доля более
летучего компонента в растворе двух взаимно растворимых
веществ а и w.
Молярная доля х' в соответствующей жидкой фазе найдется
из уравнения (IV. 50):
Определяя молярную долю у’ компонента а не во всем
объеме паровой фазы, а только в смеси компонентов а и w,
можно на основании закона Дальтона написать
РаХ' = Ра= Pawy И Р» = РЛХ — X')=Paw(l -/)•
Перегонка с насыщенным водяным паром
175
Разделив одно уравнение на другое, можно получить урав-
нение равновесия для компонентов а и w:
= щ . (IV. 52)
1 — у 1 — X ' '
Это уравнение того же вида, что и для бинарной системы
компонентов а и w в отсутствии насыщенного водяного пара,
однако то обстоятельство, что в рассматриваемом случае paw
меньше, чем давление системы р, на величину р2, имеет след-
ствием снижение температуры системы и соответственно изме-
нение величины коэффициента обогащения т.
Для расчета процесса перегонки системы компонентов а
и w с насыщенным водяным паром необходимо построить со-
ответствующую кривую равновесия или изобарные кривые
кипения и конденсации. Расчет можно вести и аналитически
по уравнениям (IV. 51) и (IV. 52), однако значительно нагляднее
графическая методика, разъясненная на фиг. 49 на конкретном
примере системы бензол — толуол.
S левой части графика в-системе -координат- р — ^тюстроенм кривые
упругости бензола и толуола и линия рац) = 760— рД Ординаты этой линии
показывают, какова должна быть при данной температуре сумма парциаль-
ных давлений ра и pw компонентов а и W, чтобы вместе с парциальным
давлением р ' насыщенного водяного пара быть равной заданному внеш-
нему давлению р = 760 мм рт. ст. Прежде всего найдем тот температурный
интервал, внутри которого может существовать рассматриваемая трехфазная
система. Граничные его температуры отвечают чистому бензолу и чистому
толуолу и определяются как абсциссы ta' и tw' точек М и N пересечения
линии Раи, = 760 — pz' с кривыми упругости бензола и толуола. Эти темпера-
туры равны: /а' = 69° и tw'= 84,5°. Таким образом, температура t равновес-
ной трехфазной системы бензол — толуол в присутствии насыщенного водя-
ного пара может изменяться в интервале 69° < t < 84,5°. Следует обратить
внимание на то, как сужается температурный интервал выкипания системы,
который в отсутствии насыщенного водяного ‘пара изменяется от 80,2 до
110,6°.
Пусть требуется определить составы равновесных фаз при некоторой
промежуточной температуре, например / = 75°. Восстановив из точки с абсцис-
сой / = 75° перпендикуляр, в точке С его пересечения с линией раи, = 760—р '
определяем суммарную упругость ра11, = 465 мм рт. ст., которую должен
иметь раствор бензола и толуола, чтобы в сумме с рг' = 295 мм рт. ст. со-
ставить общее давление паров системы, равное внешнему давлению р = 760 мм
рт. ст. В точках пересечения Е и F этого же перпендикуляра с кривыми
упругости определяются давления насыщенных паров бензола Ра = 640 мм
и толуола /J1V = 245 мм рт. ст. '
В правой части графика в системе координат давление — молярный со-
став фаз пунктиром проведена линия постоянного внешнего давления
£> = 760 мм рт. ст. и на расстоянии />2' = 295 мм рт. ст. книзу от нее гори-
зонталь paw = 46b мм рт. ст. Чтобы построить изотерму paw = Pax'4-Pw (1— х'),
необходимо найти положение ее крайних точек, спроектировав точку Е
в точку В, а точку F в точку А. Точка пересечения К изотермы АВ
с горизонталью 7^ = 465 мм определяет тот состав х'= 0,562, при котором
-17fi TpnniitJ ПОПРРГШКН
сумма парциальных давлений бензола и толуола в жидкой фазе будет равна
данному значению раи1. Прямая ОВ отвечает уравнению ра = Рах', и поэтому
ордината точки L ее пересечения с вертикалью х'= 0,562 определяет пар-
циальное давление бензола ра = 355 мм рт. ст. Очевидно, парциальное давле-
ние толуола будет пропорционально отрезку KL и составит pw=paw— Ра=
= 110 мм рт. ст. Наконец, парциальное давление бензола в функции состава
паровой фазы представится прямой OD, отвечающей уравнению Ра = Раи1у'-
Спроектировав точку L в положение Н, на прямой OD можно найти состав
бензола в равновесной паровой фазе у' = 0,775 как абсциссу точки Н.
Аналогичным образом могут быть определены составы
равновесных фаз для любой другой температуры и по найден-
ным данным построены кривые равновесия. При наличии равно-
весных данных расчет процессов перегонки ведется теми же
методами, что и при отсутствии водяного пара.
§ 13. Перегонка с перегретым водяным паром
Наиболее распространенной формой перегонки с водяным
паром является использование в процессе не насыщенного,
а перегретого водяного пара, имеющего при одной и той же
температуре меньшую упругость pzl чем давление р2 насыщен-
ного водяного пара. Важной особенностью применения пере-
гретого водяного пара является то, что в жидкой фазе вода
отсутствует и система является двухфазной, состоящей из од-
ной жидкой и одной паровой фаз.
Такая система, состоящая из компонента а и подвергаю-
щаяся равновесной перегонке при помощи перегретого водя-
ного пара, обладает согласно правилу фаз двумя степенями
свободы и в отличие от перегонки с насыщенным водяным па-
ром для определенности ее состояния недостаточно задаться
давлением или температурой, а нужно зафиксировать оба эти
параметра одновременно.
Пусть перегоняющаяся под заданным давлением р одно-
компонентная жидкость поддерживается при постоянной тем-
пературе t путем непрерывного подвода тепла в количестве,
необходимом для возмещения затрат на скрытую теплоту
испарения. Упругость перегретого водяного пара р2 будет
меньше упругости pz насыщенного водяного пара, отвечаю-
щего рассматриваемой температуре t, и поэтому общее давле-
ние р, под которым ведется перегонка, должно отвечать условию
P = Pa+Pz<Pa + PI'- GV. 53)
Принимая, что для квази-статического процесса выкипания
удаляющаяся двухкомпонентная паровая фаза находится в рав-
новесии с однокомпонентной жидкостью, можно написать
Уа Ga Z _ Ра
У г = Ч, ’• Та “ Р-Ра '
Перегонка с перегретым водяным паром
177
откуда
а Ма
Р-Ра
Ра
(IV. 54)
Следует помнить, что в данном случае р — Ра = pz < pz
Это позволяет наметить пределы, внутри которых при задан-
ном внешнем давлении р можно принимать значение второй
степени свободы системы — температуры t или упругости pz
перегретого водяного пара. Так, при заданном внешнем давле-
нии р = 760 мм рт. ст. температура кипения толуола ta= 110,6°.
Следовательно, температура равновесного выкипания толуола
в присутствии перегретого водяного пара никак не может быть
выше этой температуры. С другой стороны, при температуре
/а'=84,5° упругость паров толуола Ра = 333 мм рт. ст. и,
следовательно, для его равновесного выкипания требуется,
чтобы водяной пар имел упругость pz = 760—333 = 427 мм
рт. ст. Но эта упругость является упругостью насыщенного
водяного пара при 84,5°, которой перегретый водяной пар при
этой температуре иметь никак не может. Следовательно, темпе-
ратура /а' = 84,5° выкипания толуола в присутствии насыщен-
ного водяного пара является нижним недосягаемым пределом
температуры его выкипания в присутствии перегретого водя-
ного пара. Таким образом, при заданном внешнем давлении р
температура t однокомпонентной в жидкой фазе системы,
находящейся в равновесии со смесью собственного пара и пере-
гретого водяного пара, может изменяться в пределах от трех-
фазной точки кипения ta' до точки кипения ta рассматривае-
мого компонента при заданном давлении р, иначе говоря,
в интервале <t<ta. Понижение температуры перегонки,
достигаемое применением перегретого водяного пара, меньше,
чем при использовании насыщенного водяного пара.
Если в качестве второй степени свободы вместо темпера-
туры выбирается давление pz перегретого водяного пара
в паровой фазе, то необходимо иметь в виду, что его значе-
ние может изменяться в интервале от нуля до давления,
отвечающего упругости насыщенного водяного пара при темпе-
ратуре трехфазной точки кипения.
Перейдем к рассмотрению системы, состоящей из двух
полностью растворимых друг в друге компонентов а и w, не
смешивающихся с водой; один из компонентов можно считать
практически нелетучим. Пусть при постоянной температуре,
превышающей трехфазную точку кипения, система подвер-
гается квази-статическому постепенному выкипанию, причем
компонент w системы настолько малолетуч сравнительно с ком-
понентом а, что его упругостью паров Pw можно пренебречь.
12 Заи. № 304.
4 7Q
Раствор состоит из ga' молей компонента а, уменьшающихся
в ходе перегонки, и g^ молей компонента w, остающихся
неизменными. Парциальное давление ра летучего компонента
в паре будет равно упругости паров раствора paw^ ра + pw, так
как pw = &- На этом основании для бесконечно малого про-
цесса выкипания можно написать равновесное соотношение
в паровой фазе:
dz' _ Р — Ра
«ёа ~ Ра
(IV. 55)
Имея в виду, что для бинарной жидкой системы
На *'
(IV. 56)
где х’ — молярная доля летучего компонента в жидкой фазе,
найдем dga':
. , , dx'
^Sa Y1 — x')2
Подставляя значение dga’ в уравнение (IV. 55), получаем
откуда
ха' х2'
' 2' = J мг^т “ «•>' / <IV- ет>
Х1' Х1'
Когда имеются опытные данные, связывающие упругость
насыщенных паров раствора с его молярным составом, расход
водяного пара г' может быть определен графическим интегри-
рованием уравнения (IV. 57) при постоянных температуре и об-
щем давлении. Если же допустимо применение закона Рауля,
то, подставляя в уравнение (IV. 57) ро = Рах', можно получить
= Л , 5X/(1-X/) _ Р-Рд / 1_______1_\
Hw Jpa х2'(1— х/) Ра Н— х2' 1—Xi'/
(IV. 58)
Перейдем к рассмотрению общего случая перегонки бинар-
ной системы взаимно растворимых компонентов а и w в при-
сутствии перегретого водяного пара z. В этой трехкомпонент-
ной системе будут только две фазы — одна жидкая и одна
паровая, и число ее степеней свободы согласно правилу фаз
будет равно трем. Это означает, что, кроме температуры t и
общего давления паров р равновесной системы, для определен-
Перегонка с перегретым водяным паром
179
ности ее состояния необходимо задаться еще одним интенсив-
ным свойством, например парциальной упругостью pz перегре-
того водяного пара в паровой фазе. Тогда все остальные
свойства равновесной системы определятся однозначно и состоя-
ние ее установится. Как видим, в отличие от того, когда
в процессе перегонки участвует насыщенный водяной пар, рас-
сматриваемый случай перегретого пара характеризуется нали-
чием лишней степени свободы. Эта лишняя степень свободы
обычно используется путем задания парциальной упругости pz
перегретого водяного пара в пределах от нуля до значения
упругости pz насыщенного водяного пара при каждой рассма-
триваемой температуре. В разделе, посвященном изучению
работы перегретого водяного пара в ректификационной колонне,
детально рассмотрена методика определения составов равно-
весных фаз и построения кривой равновесия для перегонки
бинарной системы взаимно растворимых компонентов при
помощи перегретого водяного пара. Здесь же ограничимся
замечанием, что равновесные соотношения для рассматривае-
мой системы представятся теми же уравнениями, -чтои при
использовании насыщенного водяного пара, в которые вместо pz
необходимо подставить pz.
ГЛАВА V
ОТГОННАЯ РЕКТИФИКАЦИОННАЯ КОЛОННА /
§ 1. Сущность процесса ректификации
Наиболее эффективным способом разделения растворов на
те или иные фракции или практически чистые составляющие
является многоступенчатый диффузионно-контактный противо-
точный процесс ректификации.
В ректификационной колпачковой колонне на специальных
ступенях контакта, называемых тарелками, осуществляется
тесное взаимодействие между восходящим паровым и нисхо-
дящим жидким потоками. Контактирующие паровой и жидкий
потоки должны быть неравновесны друг другу, чтобы
между ними мог итти процесс обмена веществом и энергией.
Назначение каждой контактной ступени состоит в создании
условий, способствующих максимальному приближению сопри-
касающихся паровых и жидких фаз к состоянию равновесия.
В предельном случае энергообмен между соприкасающимися
в контактной ступени фазами приводит к выравниванию их
температур, обмен веществом устанавливает равновесные зна-
чения составов фаз и процесс взаимодействия фаз прекращается,
так как паро-жидкая система приходит в состояние установив-
шегося равновесия.
Дальнейшее контактирование фаз теряет всякий смысл, так
как в условиях их равновесного сосуществования невозмо-
жен никакой процесс, имеющий своим результатом изменение
свойств равновесной системы. Поэтому необходимо равновесные
фазы системы отделить друг от друга и продолжить процесс
дальше путем нового контактирования этих фаз на другой
уже контактной ступени с другими жидкими и паровыми пото-
ками, не находящимися в равновесии с ними. Такое много-
кратно повторяющееся последовательное контактирование дви-
жущихся навстречу друг другу по всей высоте колонны жидких
и паровых потоков, осуществляемое в ректификационной
колонне на тарелках, представляющих единичные ступени
контакта, в конечном счете существенно изменяет составы
контактирующих фаз.
Сущность процесса ректификации
181
Тарелка ректификационной колонны выполняет функцию
смесителя, приводя в тесный контакт паровой и жидкий
потоки, поступающие на нее, и функцию сепаратора, раз-
деляющего достигшие равновесия фазы. Вследствие значитель-
ной разности плотностей пара и жидкости равновесные фазы
легко отделяются друг от друга и свободно переходят в следую-
щую ступень контакта.
Работу единичной ступени контакта ректификационной
колонны схематично можно представить состоящей из двух
операций — смешения и
разделения фаз(фиг50).
В первой стадии кон-
тактирования жидкость
gi-i состава x,_i с вы-
шележащей ступени и
пар G/ + i состава y, + i
с нижележащей сту-
пени поступают в i-ю
контактную сту пень.
Эти потоки не нахо-
дятся в равновесий
друг с другом, и по-
этому их тесное со-
прикасание приводит Фиг. 50. Схема единичной контактной ступени,
к взаимному обмену
энергией и веществом, направленному, как и всякий самопро-
извольный процесс, в сторону достижения равновесия. В пре-
дельном случае достаточно тесного и длительного контакта на
тарелке может быть достигнуто равновесное состояние и даль-
нейший межфазовый обмен прекратится, а веса и составы фаз
приобретут новые значения, отвечающие установившемуся
состоянию равновесия.
Достигшие равновесия паровая и жидкая фазы во второй
стадии процесса отделяются друг от друга и направляются
в другие ступени контакта для возобновления процесса обмена
веществом и энергией уже с другими потоками жидкостей и
паров. Такое контактное приспособление, на котором взаимо-
действующие неравновесные друг другу фазы в результате
обмена энергией и веществом достигают равновесного состоя-
ния, называется идеальной, ступенью контакта или теорети-
ческой тарелкой.
Практическая контактная ступень отличается от теорети-
ческой тарелки тем или иным отклонением покидающих ее
фаз от состояния равновесия, и поэтому гипотеза идеальной
контактной ступени (теоретической тарелки) является тем пре-
дельным эталоном, сравнением с которым устанавливается
степень эффективности практической тарелки.
С другой стороны, при рассмотрении работы ректификацион-
ной колонны необходимо исходить из определенного представ-
ления о характере и глубине протекающего на тарелке про-
цесса межфазового обмена, без чего нельзя иметь суждения
о степени достигнутого в контактной ступени изменения составов
взаимодействующих потоков. Гипотеза теоретической тарелки,
выражающая простейший случай контакта фаз на тарелке
Фиг. 51. К объяснению процесса
ректификации.
и дающая качественно пра-
вильную картину процесса,
принимается за количествен-
ную основу при переходе от
составов фаз в одном межта-
релочном отделении к соста-
вам фаз в соседнем. Подоб-
ное допущение, называемое
методом теоретической та-
релки, не воспроизводит в точ-
ности действительной картины
явления, протекающего в кон-
тактной ступени, ибо не учи-
тывает кинетических особен-
ностей процесса массообмена
фаз на тарелке и основано на
статическом представлении
процесса. Однако метод тео-
ретической тарелки является
пока единственно возможным,
ибо кинетические зависимо-
сти, характеризующие массо-
обмен на практической та •
релке, еще недостаточно раз-
работаны и не могут быть
положены в основу расчета
процесса ректификации.
самопроизвольных процессов
отдельно взятой контактной
Для суждения о направлении
энергообмена и массообмена в
ступени уместно рассмотреть на основе метода теоретической
тарелки работу одной какой-нибудь тарелки. Пусть x,_t и у,-4-1
(фиг. 51) составы жидкой и паровой фаз, поступающих с верхней
и нижней тарелок на рассматриваемую i-ю тарелку колонны.
Нанесем на изобарные кривые кипения и конденсации фигура-
тивные точки поступающих на тарелку потоков G( + 1 и gj_i
(фиг. 51). Эти потоки находятся при различных температурах,
их фигуративные точки не лежат на одной изотерме, и поэтому
составы У1 + 1 и хг—1 не отвечают условию паро-жидкого равно-
весия. Между потоками Gi + 1 и gt_t имеется разность х фаз,
Сущность процесса ректификации
183
и при контактировании их должен иметь место межфазовый
обмен веществом и энергией, направленный на достижение
состояния равновесия.
В самом деле, по равновесным кривым легко заметить, что
состав xt_t поступающей на тарелку жидкости богаче по содер-
жанию НКК, чем состав xi + 1, отвечающий условию равнове-
сия с поднимающимся на тарелку паром Gi + l. Точно так же
пар G; + j содержит больше ВКК, чем то следует из условия
равновесия с флегмой которой отвечает равновесный
состав паровой фазы yj_1, больший чем у, + 1. Из этой раз-
ности фаз непосредственно следует, что в результате контакти-
рования на тарелке через поверхность раздела фаз будут
наблюдаться явления межфазового обмена, направленные на
достижение равновесного состояния. Для выравнивания значе-
ния химического потенциала в паровой и жидкой фазах должен
быть переход тепла от паровой фазы к жидкой путем тепло-
отдачи и перехода НКК из жидкой фазы в паровую и ВКК из
паровой фазы в жидкую путем диффузии-- .Этот-межфазовый .
обмен вследствие теплоотдачи и диффузии при достаточной
продолжительности контакта в конечном итоге приведет к
равновесию паровой и жидкой фаз.
В состоянии равновесия должна установиться некоторая
общая для обеих фаз промежуточная температура, отвечаю-
щая условию t. + t и составы х( и у; равновесных
фаз определятся по изотерме /; = const как абсциссы точек ее
пересечения с изобарными кривыми кипения и конденсации.
Таким образом, в результате контактирования неравновесных
фаз в идеальной ступени контакта путем теплоотдачи и диф-
фузии устанавливается паро-жидкое равновесие, состав пара
сдвигается в сторону обогащения низкокипящим компонентом,
а состав жидкости — в сторону обогащения высококипящим.
Уместно подчеркнуть диффузионную природу направлен-
ного обмена веществом между контактирующими фазами и
с самого начала отказаться от упрощенного толкования меха-
низма процесса ректификации как попеременных явлений ча-
стичного испарения жидкой фазы и частичной конденсации
паровой. Хорошо известно, что можно добиться заметного пере-
грева чистых жидкостей против точки начала кипения без паро-
образования или, как говорится, без фазового перехода.
С другой стороны, и чистую паровую фазу можно охладить
до температуры, несколько более низкой, чем ее точка начала
конденсации, без того, чтобы в массе пара появились капельки
образующейся жидкой фазы. Такие состояния системы называ-
ются метастабильными. Ряд экспериментальных исследований
явлений фазового перехода показал, что новая фаза не
4 QZ
может образоваться внезапно путем зарождения массы пузырь-
ков в объеме жидкости или всей массы капелек конденсата
в объеме паровой фазы, а обычно проходит через стадию мета-
стабильного состояния, выражающуюся в рассматриваемом слу-
чае в затягивании явлений конденсации пара и испарения
жидкости. Образование новой фазы начинается, как правило,,
лишь при наличии так называемых центров конденсации или
парообразования, которыми могут служить какие-нибудь не-
однородности в составе фазы. Эти центры конденсации и паро-
образования играют роль зародышей новой фазы. Возвращаясь
к рассматриванию процесса на контактной ступени, следует под-
черкнуть, что в массе жидкости на тарелке не могут образо-
ваться пузырьки паровой фазы, зародившиеся вследствие пусть
даже небольшого перегрева флегмы. Точно так же и в массе
паров не могут появиться капельки жидкой фазы, вызванные
охлаждением паров до температуры, пусть даже немного более
низкой, чем их точка насыщения. В самом деле, реальная ректи-
фикационная колонна, работающая в производственной обста-
новке, тем и характеризуется, что в результате обмена теплом
и веществом контактирующие на тарелке фазы все-таки не
достигают состояния равновесия и поэтому температуры их не
выравниваются и имеет место некоторое, хотя и небольшое
отклонение температур фаз от значений, отвечающих условиям
их насыщения. Так, температура жидкой фазы оказывается
ниже, а температура паровой фазы выше точки насыщения,
иначе говоря, флегма оказывается несколько недогретощ а
паровая фаза несколько перегретой. Таким образом, в усло-
виях взаимодействия фаз на тарелке не может иметь места
процесс кипения жидкости или конденсации пара в собствен-
ном смысле этих терминов. Имеющийся же массообмен пред-
ставляет собой явление диффузии низкокипящего компонента
из жидкости в паровую фазу и высококипящего компонента
из паровой фазы в жидкую. Такой процесс массообмена вслед-
ствие диффузии имеется при абсорбции нелетучим растворите-
лем извлекаемого компонента газовой смеси, однако в отличие
от процесса ректификации здесь явление в чистом виде имеет
лишь одностороннюю направленность.
Анализ работы ректификационной колонны ведется на основе
принятия гипотезы теоретической тарелки, и эта идеализирован-
ная картина процесса приводит к непосредственному выводу
о том, что температуры паров и флегмы, покидающих ту или
иную контактную ступень, совпадают для паровой фазы с ее
температурой начала конденсации, а для жидкой — с ее точкой
начала кипения, так как предполагается, что контактирующие
фазы достигают на тарелке состояния равновесия.
Из предыдущего можно сделать заключение о том, что объек-
тивным результатом работы теоретической тарелки является.
Методы анализа работы колонны 1 8.5
обогащение поступающего на тарелку парового потока низко-
кипящим компонентом, а жидкого потока — высококипящим
компонентом фракционируемой системы. Отсюда нетрудно
сделать вывод, согласно которому увеличение числа тарелок
должно в общем случае иметь следствием усиление этого
эффекта обогащения фаз соответствующими компонентами, так
что при некотором вполне определенном количестве контакт-
ных ступеней может оказаться уже достигнутой назначенная
наперед степень разделения компонентов системы.
Цель расчета процесса ректификации и состоит в том, чтобы
на основе количественного анализа явлений, имеющихся на
ступенях контакта, установить для каждой из них степень
обогащения паровой фазы легким компонентом, а жидкой
фазы—тяжелым компонентом системы и таким образом полу-
чить основание для суждения о том, сколько понадобится ступе-
ней контакта для предполагаемого разделения.
На основании изложенного материала можно дать определе-
ние процесса ректификации.
С КП1, U. (р) U. а 'Ц II Я. Я.в Л.ЯеП1.С Я (ЛаС^Нуу 3 L10 ЯП О /vOM/7 VO.K И ЪНЪСМ. , / ьр о —
тивоточным процессом разделения, изменяющим в жела-
тельном направлении на требуемую глубину составы много-
кратно контактирующих неравновесных жидких и паровых
потоков путем взаимного обмена веществом.
В этом определении основную роль играют слова „паровых
потоков" и „взаимного обмена", так как только они делают
формулировку приложимой единственно к процессу ректифи-
кации. Если, например, заменить их словами „газовых потоков"
и „направленного в одну сторону перехода вещества", то опре-
деление будет относиться уже к родственному процессу абсорб-
ции.
Далее в определении процесса ректификации не упоминается
о межфазовом энергообмене, так как обмен веществом всегда
связан с передачей энергии.
Процесс ректификации может осуществляться двумя принци-
пиально различающимися способами: непрерывным и периоди-
ческим. Вначале будет-.рассмотрен непрерывный процесс,
на основе теории которого построен метод расчета периоди-
ческого процесса ректификации.
§ 2. Методы анализа работы колонны
Исследование работы ректификационной колонны при усло-
вии принятия гипотезы идеальной тарелки основывается на
использовании трех основных законов, а именно: свхранения
вещества, сохранения энергии и, наконец, второго начала термо-
динамики. Применение двух первых законов находит свое
практическое выражение в составлении основанных на них
уравнений материального и теплового балансов. Второй же
закон термодинамики является той основой, которая исполь-
зуется при выводе равновесных соотношений фазового сосуще-
ствования паро-жидких систем, устанавливающих предельные
глубины самопроизвольных процессов массообмена и энерго-
обмена контактирующих неравновесных фаз.
Применение метода балансов к анализу работы ректифика-
ционной колонны основано на том постулируемом условии, что
при установившемся режиме не могут изменяться количество
тепла или количество вещества ни во всей колонне, ни в какой-
нибудь определенной выделенной части ее.
При составлении уравнений материального баланса исходят
из того соображения, что в установившемся состоянии сумма
весов потоков, поступающих в рассматриваемую ступень или
группу ступеней процесса, равна сумме весов потоков, выхо-
дящих из той же ступени или из той же группы ступеней.
Материальный баланс по общему весу потоков приравни-
вает сумму весов всех поступающих в рассматриваемый объем
веществ сумме весов всех продуктов, из этого объема выхо-
дящих.
Материальный баланс по весу одного какого-нибудь компо-
нента основан на том, что веса компонентов системы до и
после процесса в ступени или в группе ступеней остаются
неизменными, меняется же их распределение .между потоками.
Поэтому можно приравнять сумму весов данного компонента
во всех входящих потоках сумме его весов во всех выходя-
щих из рассматриваемого объема потоках.
Тепловой баланс, основанный на законе сохранения энергии
и постоянстве внешнего давления, под которым протекает
большинство нефтезаводских процессов и, в частности, процесс
ректификации, составляется исходя из того соображения, что
сумма энтальпий, входящих в рассматриваемый объем потоков,
должна равняться сумме энтальпий, выходящих из этого объ-
ема потоков, если в нем не происходят химические реакции,
сопровождающиеся поглощением или выделением тепла.
Когда рассматривается сложный технологический процесс,
то уравнения материальных и теплового балансов составляются
как для всего процесса в целом, так и для отдельных ступеней
его. При этом наиболее удобным техническим приемом, упро-
щающим составление уравнений балансов, является изображе-
ние схемы процесса с тщательным представлением на ней всех
выходящих и входящих в каждый аппарат или в каждую
ступень процесса материальных и тепловых потоков. Направ-
ление потоков изображается стрелками на подводящих и отво-
дящих линиях. Иногда имеет смысл на каждой из этих линий над-
писывать название или обозначение, вес, состав и теплосодер-
жание соответствующего материального потока. Выделяя замкну-
Изменение весов потоков
187
той линией тот или иной объем колонны, для которого необ-
ходимо составить уравнения балансов, приравнивают нулю
алгебраическую сумму весов входящих и выходящих потоков
и таким образом получают уравнения материального баланса.
Приравнивание нулю алгебраической суммы теплосодержаний
входящих и выходящих потоков позволяет легко составить
уравнение теплового баланса. При этом следует помнить, что
для каждого выделенного объема колонны можно составить
только одно уравнение теплового баланса, а число независимых
уравнений материального баланса, составленных по общему
весу потоков и по весу содержащегося в них того или иного
компонента, всегда равно числу компонентов разделяемой
системы.
Метод составления балансов ректификационной колонны
как в целом, так и по отдельным ее ступеням является мощ-
ным средством для получения важных соотношений, управляю-
щих работой колонны. На примере использования этого метода
в теории ректификационной колонны он может быть выяснен
во всех деталях и в ;альнс ипс м и-ио ,п. ~ ~
зован для анализа других важных, но
менее сложных процессов таких, напри-
мер, как абсорбция, экстракция и др.
§ 3. Изменение весов потоков
при переходе от одной контактной
ступени к другой
На примере исследования характера
изменения весов паровых и жидких пото-
ков при переходе из одного отделения
колонны в другое можно иллюстриро-
вать применение метода балансов к изу-
чению работы колонны.
Рассмотрим объем непрерывно дей-
ствующей коло’нны, включающий какую-
нибудь ее произвольную z-ю тарелку и
ограниченный сверху (z — 1)-й тарелкой, а снизу (z + 1)-й тарелкой
(фиг. 52). Пусть требуется определить изменение веса жидкого
потока при переходе из верхнего в нижнее межтарелочное
отделение колонны. В соответствии с изложенным выше поряд-
ком составления уравнений балансов прежде всего изображается
схема соответствующей части колонного аппарата и на нее
наносятся линии входящих и выходящих потоков, их веса,
составы и теплосодержания. Пунктирный прямоугольник на
фиг. 52 замыкает объем колонны, в который входят и из
которого выходят интересующие нас жидкие потоки gt-i и
Уравнения материального и теплового балансов составляются
Фиг. 52. Произвольная
секция колонны.
путем приравнивания суммы весов или теплосодержаний вхо-
дящих в замкнутый объем потоков и суммы весов или тепло-
содержаний выходящих потоков.
Материальный баланс выделенного объема колонны по
общему весу потоков представится уравнением
Gi + 1 + gi — 1 = Gi + §i- (V. 1)
Материальный баланс того же объема колонны по весу
содержащегося в этих потоках низкокипящего компонента
представится уравнением
Gi + iyi + l +gi~lxi-l =Giyi+giXi. (V.2)
Наконец, уравнение теплового баланса, выводимое тем же
путем, представится соотношением, симметричным уравнению
(V. 2), в котором составы заменены соответствующими тепло-
содержаниями:
Gi: + iQi + 1 + gi-igi-l =GiQi + giSi. (V. 3)
Полученные уравнения (V. 1)—(V.3) позволяют сделать ряд
важных выводов об особенностях работы колонны, подтвер-
ждая этим плодотворность метода балансов. Так, из уравнения
(V. 1) следует
Gi + t —gi =Gi — gi-i = const. (V.4)
Иначе говоря, разность весов встречных на одном уровне
колонны потоков паров и флегмы постоянна по всей высоте
рассматриваемой секции. Аналогичным образом можно на
основании уравнения (V.2) написать
Gi + iyl + 1 — giXi = Giyt — gi-iXi-i = const. (V. 5)
Разность весов низкокипящего компонента во встречных на
одном межтарелочном уровне колонны паровых и жидких
потоках постоянна по высоте рассматриваемой секции колонны.
В дальнейшем будет показано, что величина этой разности
изменяется скачкообразно при переходе из одной секции
колонны в другую.
Постоянна также по всей высоте рассматриваемой секции
колонны разность теплосодержаний встречных на одном уровне
паровых и жидких потоков, как то следует из уравнения (V. 3),
путем его преобразования к виду
G,+ iQi + i — gigi = GiQi — gi-tgi-i = const. (V. 6)
Из установленного выше постоянства разностей весов и
теплосодержаний встречных на одном горизонтальном уровне
паровых и жидких потоков можно сделать заключение о том,
что веса потоков и их теплосодержания могут меняться лишь
в одну сторону, либо одновременно возрастая, либо одновре-
менно убывая.
Изменение весов потоков
189
Чтобы установить, в какую сторону изменяется вес жидкого
потока при переходе из одного межтарелочного отделения
колонны в другое, необходимо из уравнений (V. 1) —(V. 3)
исключить веса паровых потоков. После простых алгебраи-
ческих преобразований получается соотношение между весами
жидких потоков в двух различных отделениях колонны:
gi-i = +1 — ?)(у, — у, +1) + (Q. +1 — Q.)(у. +1 -xi) ,v 7v
При анализе уравнения (V.7) следует иметь в виду, что на
тарелке, расположенной выше, содержание низкокипящего
компонента больше, а температура и, следовательно, тепло-
содержание единицы веса соответственно меньше, чем на
тарелке, расположенной на более низком уровне. Поэтому во
всех случаях Xi-i>Xi и второе слагаемое в числителе урав-
нения (V. 7) всегда больше второго слагаемого знаменателя.
Относительная величина первого слагаемого определяется на
том- основании , что i/i> <) г^- и - поэтому д ,ячисли 1ел я оно
меньше, чем для знаменателя.
Таким образом, можно сделать вывод о том, что в общем
случае при переходе из одного межтарелочного отделения
колонны в другое вес флегмы изменяется. На основании
уравнения (V. 4) можно утверждать, что в ту же сторону и на
ту же величину изменяется вес встречного этой флегме паро-
вого потока.
Изменение веса жидких потоков по высоте колонны зависит
от характера изменения их теплосодержаний и составов и
в конечном счете определяется тем, какой из этих факторов
оказывает большее влияние на уравнение (V. 7). Не исключена
возможность и того случая, когда влияние неравенства
нейтрализуется неравенством Xt-i>Xi и веса потоков сохра-
няются неизменными.
Однако в общем, смотря по тому, влияние какого из этих
двух неравенств перевешивает, веса потоков увеличиваются
кверху или книзу колонны.
Необходимым и достаточным условием неизменности весов
gi и gi—i явилось бы выполнение очевидного соотношения
между теплосодержаниями и составами паровых и жидких
потоков в двух рассматриваемых сечениях колонны:
Qi + i~Qi = (V 8)
Vi~ У, + 1 Х/-1— xi
Рассмотренный пример использования метода балансов
в анализе работы произвольной секции колонны выясняет особен-
ности практического его применения и характер получающихся
при его помощи выводов и заключений. В дальнейшем метод
балансов применяется систематически при решении различных
задач теории ректификации.
§ 4. Отгонная ректификационная колонна
Ректификационная колонна называется отгонной, если раз-
деляемое сырье подается в жидкой фазе на ее верхнюю тарелку.
Иногда отгонные колонны называются еще неполными колон-
нами для ректификации жидкости.
С низа отгонной колонны в жидком виде с желательной
степенью чистоты отводится высококипящий компонент исход-
ной бинарной системы, а с верхней тарелки получаются пары,,
в общем случае достаточно отличающиеся по составу от прак-
тически чистого низкокипящего компонента. Для обогаще-
ния состава верхних паров отгонной колонны легким компо-
нентом часто необходима их дополнительная ректификация,
которой отгонная колонна обычно не обеспечивает. В этом
кроется причина использования термина „неполная" при харак-
теристике ее работы.
Как будет видно из дальнейшего изложения, работу отгон-
ной колонны можно построить таким образом, чтобы с верха
ее все же получать пары, как угодно обогащенные легким
компонентом. При этом, однако, процесс оказывается неэконо-
мичным из-за чрезмерно большого расхода тепла, и задача
обогащения верхних паров обычно разрешается другими сред-
ствами. Это следует заметить, чтобы с самого начала подчер-
кнуть принципиальную возможность полного разделения в отгон-
ной колонне данной бинарной системы на ее практически
чистые составляющие.
Схематическое изображение отгонной колонны и движения
потоков в ней представлено на фиг. 53. Сырье L в жидкой
фазе подается на верхнюю тарелку колонны, с которой отво-
дятся верхние пары D состава yD, представляющие собой один
из продуктов колонны. Флегма с нижней, первой по счету,
тарелки колонны отводится в кипятильник колонны, где за
счет сообщения В ккал тепла подвергается частичному испаре-
нию, образуя поток паров GR, возвращающихся обратно
в колонну, и жидкий остаток от испарения R состава xR, отво-
димый в качестве основного целевого продукта колонны.
Из рассмотрения схемы отгонной колонны легко заметить,,
что подвод энергии для проведения процесса сосредоточен
лишь в одном месте, а именно внизу колонны, в ее кипятиль-
нике.
Жидкое сырье, перетекая по колонне сверху вниз, встре-
чается на тарелках с поднимающимся паровым потоком и,
Отгонная ректификационная колонна
191
процесс утяжеления
тем самым
Фиг. 53. Схема отгонной колонны.
последовательно контактируя с ним, все более и более обед-
няется низкокипящим компонентом, диффундирующим из
жидкости в паровую фазу. При этом обмен веществом между
жидкой и паровой фазами идет в двух направлениях и из
парового потока в жидкий тоже диффундирует высококипя-
щий компонент, усиливая
жидкой фазы. Выбрав
надлежащее число кон-
тактных ступеней и ре-
жим работы колонны,
можно добиться какого
угодно низкого содержа-
ния легкого компонента
в нижнем жидком про-
дукте колонны.
С другой стороны,
паровой поток GR, иду-
щий из кипятильника, по
мере восходяще го движ е -
ния по высоте колонны
все более обогащается
легким компонентом за
счет его диффузии из
жидкости, с которой пары
контактируют, и за счет
того, что из самого паро-
вого потока тяжелый ком-
понент диффундирует ври
этом в жидкую фазу.
Пары D, уходящие с верха
значительное количество низкокипящего компонента, продиф-
фундировавшего из жидкого потока на последовательных сту-
пенях контакта по всей высоте колонны.
отгонной колонны, содержат уже
§ 5. Материальный и тепловой балансы отгонной колонны
Для получения соотношений, связывающих веса, составы и
теплосодержания потоков сырья и продуктов отгонной колонны,
необходимо составить ряд уравнений, основанных на изложен-
ном выше методе балансов, применение которого позволяет
сразу же получить все необходимые соотношения.
Материальный баланс всего объема отгонной колонны состав-
ляется на основе того соображения, что вес поступающего
в колонну сырья L должен равняться сумме весов R и D про-
дуктов ректификации, отводимых с низа и с верха колонны:
L = D + R.
(V. 9):
Материальный баланс по содержащемуся в этих потоках
низкокипящему компоненту представится уравнением
La = DyD+ Rxr. (V. 10)
Совместное решение уравнений (V.9) и (V.10) позволяет
найти веса продуктов ректификации, отнесенные к единице
веса исходного сырья:
R уп — a D а — Хп
— ; (V. 11 — =-------- (V. 12
L yD — xR К L yD — xR V
Состав сырья а и основного целевого продукта xR обычно
^бывает наперед известен по заданию для расчета, в котором,
естественно, должно быть указано, какое сырье подвергается
ректификации и какие качества должен иметь основной целе-
вой продукт, отводимый с низа колонны. Однако этих двух
начальных данных еще недостаточно для определенности при
нахождении весов потоков, так как число неизвестных равно
пяти, а число располагаемых независимых уравнений составляет
всего два. В самом деле, если вести расчет на единицу веса
сырья, то переменными являются R/L, D/L, a, xR и yD; эти
переменные связаны двумя уравнениями (V. 11) и (V. 12). Для
определения проблемы помимо известных значений а и xR
необходимо задать еще одну какую-нибудь из остальных трех
величин. Можно принять, например, относительный вес ниж-
него продукта, или состав yD верхнего, или, наконец, относи-
тельный вес D/L верхних паров. Во всех этих случаях значе-
ния оставшихся неизвестными двух величин могут быть
определены по уравнениям (V.11) и (V. 12).
Из рассмотрения уравнения (V. 12) легко заметить, что
с увеличением состава yD верхних паров их вес D уменьшается
и, следовательно, на основании уравнения (V. 9) растет вес
нижнего продукта R. Из уравнения (V. 11) следует, что умень-
шение состава xR нижнего продукта колонны влечет за собой
понижение его веса R и соответственно увеличение веса D
верхних паров.
Других дополнительных сведений не удается извлечь из
уравнений материального баланса отгонной колонны в целом,
и поэтому уместно перейти к рассмотрению уравнения ее теп-
лового баланса.
Тепловой баланс отгонной колонны в целом составляется
на основе того соображения, что тепло, вносимое сырьем и
подаваемое в кипятильник колонны, делится на две части,
которые уходят из колонны с ее нижним и верхним продук-
тами:
Т?о + В = DQd + RqR.
(V. 13)
Материальный и тепловой балансы отгонной колонны
193
(V. 14)
Чтобы упростить методику последующих расчетных опера-
ций, уравнение (V. 13) преобразуем к более удобному виду,
симметричному с уравнением (V. 10), обозначив:
В а
Qr ft
Подстановкой из уравнения (V. 14) в уравнение (V. 13)
преобразуем последнее к желательному виду:
Lq0 = DQd + R61. (V.15)
Физический смысл теплового параметра выяснится в по-
следующем при рассмотрении теплового баланса какой-нибудь
части отгонной колонны.
Сочетание уравнений (V.9) и (V. 15) позволяет выразить
относительные веса продуктов колонны через тепловые вели-
чины при помощи соотношений,
уравнениям (V. И) и (V. 12)
R Q,,— 7,, _ __.
(V. 16)
l QD-di ' v '
совершенно симметричных
(V. 17)
L Qp '
Если исключить относительные веса продуктов колонны
путем сочетания уравнений (V. 11) и (V. 16) или (V. 12) и (V. 17),
то можно связать друг с другом составы и тепловые величины,
характеризующие сырье и продукты ректификации:
Ур а _ . /у ,о\ а XR _ Чо — #1
Уд Хд Qd 01 ’ yD XR Qd~®1
(V.19)
Тождества (V. 18) и (V. 19) эквивалентны друг другу, и каж-
дое порознь является необходимым и достаточным условием,
чтобы на тепловой диаграмме три точки (a, qQ), (xR, GJ и (yD, QD)
лежали на одной прямой. Построение, основанное на этих тож-
дествах, показано на фиг. 54. Соответствующие фигуративные
точки на тепловой диаграмме обозначены теми же буквами,
что и веса сырья верхнего и нижнего продуктов колонны.
Преимущество таких графических построений состоит в том,
что на них наглядно видны связь и взаимозависимость между
отдельными факторами, характеризующими работу колонны.
Так, из фиг. 54, например, легко видеть, что увеличение
состава верхних паров при неизменном тепловом состоянии
сырья приводит к уменьшению расхода тепла В/R в кипятиль-
нике колонны. В самом деле, если фигуративная точка D верх-
них паров переходит в область большего обогащения —
в точку D', то точка R перемещается в R' и относительное
тепло кипятильника измеряется уже не отрезком CR, а про-
порционально меньшему отрезку CR1. Из того же построения
13 Зак. № 304.
можно сделать и другой вывод, согласно которому, чем больше
теплосодержание сырья на входе в колонну, тем меньше рас-
ходуется тепла в кипятильнике при прочих равных условиях.
Действительно, если бы фигуративная точка сырья перешла из
области недогретой жидкости на линию точек начала кипения,
т. е. попала бы в положение L', то тепло кипятильника изме-
рялось бы уже меньшим
опыте подобные выводы
Фиг. 54. Связь между фигура-
тивными точками сырья и про-
дуктов колонны на тепловой
диаграмме.
отрезком. Конечно, при некотором
можно делать и без графических
построений на тепловой диаграмме,
но дело в том, что последняя не
только указывает направление того
или иного изменения, а сразу же
дает его количественную оценку,
что является неоспоримым преиму-
ществом перед аналитическими про-
цедурами, требующими определен-
ных, иногда трудоемких вычисле-
ний. Тем не менее за аналитиче-
скими методами сохраняется пре-
имущество большей точности полу-
ченных результатов.
§ 6. Уравнения концентраций
отгонной колонны
Вернемся к фиг. 53, на которой
дана схема отгонной колонны, и
попробуем установить, какие необ-
ходимы соотношения для расчета изменяющихся составов паро-
вых и жидких потоков по тарелкам колонны. За исходную точку
при анализе работы колонны принимаем обычно нижний продукт
/?, уходящий из кипятильника с составом xR и находящийся при
точке начала кипения tR, иначе говоря, отводимый в состоя-
нии насыщения как жидкий остаток процесса однократного
испарения в кипятильнике. Здесь уместно подчеркнуть, что
кипятильник отгонной колонны является единственной ступенью
во всем рассматриваемом колонном аппарате, где имеется не
диффузия, а частичное испарение в собственном смысле. Это
и понятно, ибо в кипятильнике не контактируют неравновес-
ные потоки жидкости и паров, а имеет место нагрев флегмы glt
стекающей с первой тарелки за счет сообщения ей В ккал
тепла.. Предполагая процесс однократного испарения флегмы &
протекающим обратимо, можно заключить, что она разделяется
на две равновесно сосуществующие паровую и жидкую фазы.
Нижний продукт колонны является жидкой фазой, образую-
щейся в этом процессе, и поскольку его состав xR нам изве-
Уравнения концентраций отгонной колонны
195
стен, то по равновесным соотношениям легко может быть
найден состав yR равновесного пара. В первом приближении
это определение можно сделать по изобарным кривым кипения
и конденсации (фиг. 12), а для более точного значения yR
можно рассчитать его по уравнению равновесия (III. 61). Таким
образом, устанавливаются составы равновесных потоков, поки-
дающих кипятильник.
Значительно сложнее проблема нахождения состава хх
флегмы glt поступающей с первой тарелки в кипятильник и
являющейся встречной в одном межтарелочном отделении
парам Gp. Здесь уже нельзя использовать равновесные соот-
ношения, так как встречные потоки не находятся друг с дру-
гом в равновесии, и то обстоятельство, что состав пара Gfl
известен, не помогает в определении состава флегмы gu кото-
рый, вообще говоря, может иметь любое значение на интер-
вале xR < хт < уд.
Так выявляется необходимость в соотношениях, связы-
вающих составы вс тречных на идиом уровне котжн ны паровых
и жидких фаз. В самом деле, если бы мы располагали каким-
нибудь средством для нахождения состава хх по составу уR
встречного пара, то, найдя хх, можно было бы далее по усло-
вию равновесия флегмы gx с парами Gr, поднимающимися
с той же тарелки, при помощи хотя бы изобарных кривых
кипения и конденсации рассчитать состав yt этих паров. От
паров Gx можно было бы перейти к составу встречной флегмы ga,
используя тот же способ, при помощи которого по Уд нахо-
дили хх, а затем по условию равновесия перейти к составу
паров, поднимающихся со второй тарелки. Повторяя эту про-
цедуру, можно было бы пройти всю отгонную колонну снизу
вверх. Поэтому необходимо установить соотношения между
составами встречных на одном уровне потоков колонны,
чтобы получить средство, позволяющее по известному со-
ставу одного из этих потоков определить состав встречного
потока.
Для определения соотношений, связывающих свойства
встречных на одном уровне отгонной колонны потоков флегмы
и паров, составляются уравнения материального и теплового
балансов для объема колонны, заключенного между каким-либо
ее произвольным текущим сечением и низом.
Материальный баланс по общему весу потоков составляется
на основании того соображения, что вес поступающей в выде-
ленный объем флегмы должен равняться сумме весов паро-
вого потока и нижнего продукта, отводимых из него же:
£/ + i = Gi +
(V. 20)
13*
Из этого уравнения устанавливается важное следствие:
gi + i — Gt = R = const, (V.21)
согласно которому вес флегмы в любом межтарелочном отде-
лении отгонной колонны больше веса встречного парового
потока на величину, равную весу нижнего продукта колонны.
Следовательно, разность весов встречных фаз есть величина
постоянная, и поэтому веса потоков от одного отделения
отгонной колонны к другому могут меняться лишь в одну
сторону и на одну и ту же величину. Последний вывод
был ранее получен в общем виде при выводе уравне-
ния (V. 4).
Материальный баланс того же объема отгонной колонны
по весу низкокипящего компонента системы представится урав-
нением
£i+ixi + i = Giyi + Rxr. (V.22)
В уравнение (V.22) входят веса и составы парового и
жидкого потоков колонны, встречающихся в ее отделении,
заключенном между произвольными z-й и (z + 1)-й тарелками,
и поэтому оно представляет собой одно из искомых соотноше-
ний, связывающих составы встречных на одном уровне фаз.
Все соотношения этого рода в отличие от уравнения равнове-
сия называются уравнениями концентрации. Следует все
время иметь в виду, что уравнение концентраций связывает
составы встречных на одном уровне колонны неравновес-
ных потоков.
Для отгонной колонны уравнение концентраций (V. 22)
путем сочетания с уравнением материального баланса по
общему весу потоков (V. 20) может быть решено в отноше-
нии весов парового и жидкого потоков:
; <V- 23) Т = (V- 24)
При помощи уравнений (V. 23) и (V. 24) в любом сечении
отгонной колонны по известным составам встречных фаз можно
рассчитать их относительные веса.
Обычно при расчете отгонной секции приходится по Извест-
ному составу паровой фазы искать состав встречного жидкого
потока, и поэтому уравнение концентраций принято записывать
в виде, решенном относительно состава жидкой фазы:
Xz + i =yi-^~ (y,—xR). (V. 25)
of -|- 1
Это уравнение проще всего получить решением уравне-
ния (V.24) в отношении Х/ + 1, Если же необходимо выразить
Уравнения концентраций отгонной колонны
197
состав паровой фазы через состав жидкой, то решать уже нужно
уравнение (V. 23) в отношении У/:
у,- = Xi +1 + (Xi + i - xR). (V. 26)
Таким образом, уравнения материального баланса позволяют
связать составы встречных на одном уровне отгонной колонны
фаз, и остается лишь выяснить, достаточно ли установленного
соотношения для расчета отгонной колонны.
Вернемся к поставленной ранее задаче отыскания состава
флегмы glt стекающей с нижней тарелки колонны в кипятиль-
ник. Использование уравнения (V. 25) для межтарелочного отде-
ления колонны, расположенного между первой ее тарелкой и
кипятильником, приводит при подстановке соответствующих
величин к соотношению
x1 = yR-^-(yR-Xp), (V.27)
где Xj и yR — составы встречных в рассматриваемом отделении
колонны потоков. Состав уЛ паров, поднимающихся из кипя-
тильника, известен по условию их равновесия с нижним про-
дуктом колонны, имеющим состав xR по заданию. Однако,
в уравнение (V. 27) входит неизвестная величина относитель-
ного веса флегмы g-JR, которая должна быть рассчитана
предварительно, и для этого необходимо иметь еще одно урав-
нение.
Как было доказано выше [уравнение (V. 7)], вес флегмы
в последовательных отделениях колонны, как правило, не
остается постоянным, изменяясь от одного ее уровня к другому,
и поэтому упрощенные методы расчета, построенные на допу-
щении неизменности веса gi жидкого потока по всей высоте
колонны, не отражают действительной картины процесса ректи-
фикации в отгонной колонне. Поэтому необходимо установить
соотношения, позволяющие для любого уровня колонны вполне
точно находить значения весов встречных материальных пото-
ков. Эта задача решается при помощи теплового баланса объема
колонны, ограниченного низом ее и каким-нибудь произвольным
межтарелочным отделением.
Уравнение теплового баланса рассматриваемого объема
колонны составляется на основании того соображения, что коли-
чество тепла, вносимого флегмой и подаваемого в кипятиль-
ник колонны, делится на две части, которые уходят из выде-
ленного объема колонны с потоками пара и нижнего продукта:
gi + igi + i + B~GiQi -\-RqR. (V. 28)
Сочетая уравнение (V. 28) с уравнением (V. 14), можно при-
вести его к виду, симметричному с уравнением (V. 22) мате-
риального баланса и более удобному для расчетных операций:
gl + iql + i=OiQt + l?01. (V.29)
Уравнение теплового баланса (V. 29) связывает веса и тепло-
содержания парового и жидкого потоков колонны, встречаю-
щихся на произвольном уровне по ее высоте. Сочетание урав-
нения (V. 29) с уравнением (V. 20) позволяет выразить веса
парового и жидкого потоков при помощи тепловых величин:
% = : <v- 3°) " i1 = • (V-31)
К —Qt-t-t к 4i 4i+i
Если исключить относительные веса встречных жидкого и
парового потоков путем сочетания уравнений (V. 23) и (V.30),
то можно связать друг с другом составы и тепловые величины,
характеризующие текущее сечение колонны:
*< + 1 —xr _ +1 ~ .
+ 1 Qi~ h + t ’
(V.32)
Vi—XR
У1~х1 + 1
Qi - 6i
Qi — qi + i
. (V. 33)
Полученные соотношения наравне с уравнениями (V. 22) —
(V. 26) также связывают составы встречных на одном уровне
неравновесных жидких и паровых потоков и поэтому тоже
называются уравнениями концентрации отгонной
колонны.
Уравнения (V. 32) и (V. 33) эквивалентны друг другу и каж-
дое порознь является необходимым и достаточным условием,
чтобы на тепловой диаграмме три точки (xR, 0г), (X/ + i, qi + t)
и (уь Qi) лежали на одной прямой.
Этот результат имеет существенное значение для всего рас-
чета отгонной колонны. В самом деле, уравнение концентраций
(V. 27) не могло быть решено в отношении состава Xj флегмы g1;
так как относительный вес последней был неизвестен. В урав-
нениях (V. 32) и (V. 33) веса потоков исключены путем совмест-
ного решения уравнений материального и теплового балансов,
но в них появились новые величины теплового характера.
Однако то обстоятельство, что линии тепловой диаграммы
для любого состава насыщенной паровой и жидкой фаз сразу
дают значения их теплосодержаний, позволяет весьма просто
графическим путем, находя точки пересечения прямых, опре-
деляемых уравнениями (V. 32) и (V. 33), с линиями тепловой
диаграммы, решать задачу отыскания состава одного потока
по известному составу встречного.
Соответствующее построение приведено на фиг. 55. По изве-
в
стному теплу кипятильника наносится точка /?(хр, 0^, а по
Уравнения концентраций отгонной колонны
199
составу у, и теплосодержанию Qi пара, поднимающегося в каком-
нибудь сечении колонны, его фигуративная точка Gi(yt, Qi).
Прямая, соединяющая эти точки, пересекает линию теплосо-
держаний жидкой фазы в точке gi + i (х(- + i, qt^-t), удовлетворяю-
щей условию, выражаемому уравнением (V. 32), в чем легко
убедиться хотя бы из подобия заштрихованных на фиг. 55 тре-
угольников.
Уравнение концентраций (V. 32)
приложимо к любому межтарелочному
отделению отгонной колонны, и по-
этому при помощи него, производя
указанное построение на тепловой
диаграмме, всегда можно графически
находить по составу одной из фаз
состав встречной в том же отделении
другой фазы.
Однако эти уравнения концентра--
ций поддаются решению не только
графически, шт а аналитическим пу-
тем. Решая уравнение (V. 33) в отно-
шении состава жидкой фазы, можно
получить другой вид уравнения кон-
центраций, наиболее удобный для ана-
литического решения:
х'+'(V-34)
Фиг. 55. Связь между фигу-
ративными точками встреч-
ных потоков на тепловой
диаграмме.
То же уравнение (V. 34) может быть получено простой под-
становкой значения---- из уравнения (V. 31) в выведенное
Si + 1
ранее уравнение концентраций (V. 25).
Порядок аналитического расчета по уравнению концентра-
ций (V. 34) следующий. Если по известному составу у,- паров
в каком-нибудь текущем сечении отгонной колонны необхо-
димо найти состав встречной жидкой фазы, то следует задаться
значением теплосодержания ^- + i этой жидкости, рассчитать
по уравнению (V. 34) состав х, + 1 и проверить, насколько пра-
вильно было принято значение теплосодержания qt + i. Одного-
двух пересчетов обычно достаточно для точного определения
состава x, + i жидкости по известному составу у,- паров, пере-
секающих тот же горизонтальный уровень колонны. Таким обра-
зом, аналитическое решение уравнения концентраций отгонной
колонны может вестись лишь методом постепенного приближе-
ния, и в этом отношении оно уступает графическому расчету по
тепловой диаграмме в смысле легкости и простоты. Однако ана
литический расчет обладает преимуществом большей точности,
и в некоторых случаяхэтим обстоятельством нельзя пренебрегать.
200 Отгонная пекти/Ьикаиионноя ко нонил
§ 7. Определение составов фаз на тарелках отгонной
колонны
Установленные графический и аналитический методы позво-
ляют определить составы фаз по всей высоте отгонной колонны
путем попеременного использования соотношений фазового
равновесия для нахождения составов расходящихся с тарелки
потоков и уравнения концентраций в той или иной форме для
определения составов встречных на одном уровне потоков.
Рассмотрим' порядок определения составов фаз в отгонной
колонне графическим методом по тепловой диаграмме.
По составу xR остатка и по кривой равновесия или по изобар-
ным кривым кипения и конденсации, дающим составы равно-
весных жидких и паровых фаз при заданном внешнем давле-
нии р, можно найти состав yR паров, поднимающихся из
кипятильника на первую снизу тарелку отгонной колонны. Для
определения состава хх встречной флегмы, стекающей с первой
тарелки в кипятильник, должно быть использовано графиче-
ское построение на тепловой диаграмме, основанное на урав-
нении концентрации (V. 32). Однако использование графического,
равно как и аналитического, метода расчета предполагает, что
расход тепла BjR в кипятильнике колонны известен, и хотя
его определение будет детально рассмотрено в последующем,
на данном этапе можно считать, что величина В/R уже най-
дена. Таким образом, дальнейшее изложение базируется на
предположении, что выбрана известная величина расхода тепла
в кипятильнике колонны. .
По известному значению В/R и по теплосодержанию qR
остатка, которое непосредственно снимается с тепловой диа-
граммы для состава xR, можно по уравнению (V. 14) рассчитать
и нанести на диаграмму (фиг. 56) фигуративную точку Sx(xfi, 6Х).
Фигуративная точка GR пара, поднимающегося из кипятильника
на первую тарелку, расположится на линии пара тепловой диа-
граммы в точке с абсциссой yR. Пунктирная конода соединяет
фигуративные точки остатка R и равновесного ему пара GR.
Состав хх флегмы, стекающей с первой тарелки, определится
на основании уравнения (V. 32) как абсцисса точки пересечения £х
прямой и линии теплосодержаний qwqa тепловой диа-
граммы.
Чтобы найти состав паров G1: поднимающихся с первой
тарелки колонны во второе ее отделение, необходимо вновь
обратиться к кривым равновесия и по составу хх найти состав ух.
Проведя коноду gxGx и соединив прямой линией полюс Sx с фигу-
ративной точкой Gx пара, поднимающегося с первой тарелки,
можно определить состав х2 встречной флегмы, стекающей со
Определение составов фаз на тарелках отгонной колонны
201
второй тарелки колонны, как абсциссу точки пересечения этой
прямой с линией теплосодержаний насыщенной жидкой фазы.
Продолжая описанное попеременное использование равно-
весных данных и графического построения, основанного на
уравнении (V. 32), можно, двигаясь снизу вверх по высоте отгон-
ной колонны, определять составы и температуры паровых
и жидких потоков на всех ее последовательных ступенях кон-
такта. Больше того, зная соста-
вы в любом межтарелочном от-
делении колонны, можно рас-
считать и веса потоков паров
и флегмы в каждом ее отде-
лении. Составы, веса, темпе-
ратуры и теплосодержания
потоков называются элемен-
тами ректификации и должны
определяться для каждой кон-
тактной ступени, чтобы иметь
правильное суждение о про-
цессе, протекающем в отгонной
колонне в целом.
При аналитическом расчете
составов по высоте колонны
уже не прибегают к графиче-
скому построению по тепловой
диаграмме и вычисления ведут
методом постепенного прибли-
жения по уравнению (V. 34).
Однако и здесь удобно поль-
зоваться тепловой диаграммой
как вспомогательным средством для непосредственного нахо-
ждения теплосодержаний по известным составам.
Конечной точкой расчета элементов ректификации является
достижение на верху колонны состава паров D, поднимающихся
с ее верхней тарелки навстречу сырью и отвечающих условию,
накладываемому уравнениями концентраций на встречные на
одном уровне потоки. Это последнее требование состоит в том,
что, например, прямая, соединяющая на тепловой диаграмме
фигуративную точку D верхних паров колонны с полюсом
бх), должна пройти через фигуративную точку L(a, q0)
сырья, подаваемого на верхнюю тарелку. При аналитическом
же расчете это требование выражается в том, что подстановка
соответствующих значений в уравнение (V. 34) превращает его
в тождество (V. 11):
а = Уд QD —0! Ob Xr)•
-о л л
Из этого можно сделать важный практический вывод. На
фиг. 5б рассмотрен случай, когда сырье подается в колонну недо-
гретым до точки кипения, число тарелок колонны в этом слу-
чае оказывается равным.трем. Если же сырье было бы пред-
варительно нагрето и доведено до состояния насыщения, то
его фигуративная точка перешла бы из положения L в поло-
жение L' и при неизменном расходе тепла В//? в кипятильнике
колонны число ее тарелок сократилось бы до двух, высота же
колонны и состав yD стали бы меньше. Отсюда нетрудно видеть
ту выгоду, которая получается, когда сырье подается в колонну
при точке .начала кипения, по сравнению с тем, когда оно недо-
гдето.' Однако иногда целесообразно подавать сырье на верх
отгонной колонны как раз в недогретом состоянии, но тогда
здесь преследуется уже другая цель: не изменяя значительно
расхода тепла в кипятильнике, добиться заметного облегчения
верхних паров колонны.4 В самом деле, чем ниже температура
сырья, тем меньше его теплосодержание q0 и при прочих рав-
ных условия^ т&м легче состав yD встречных верхних паров
колонны. Преобразуя уравнение (V. 19) к виду, разрешенному
относительно состава yD верхних паров, в этом легко убедиться
л» р i 4 Q гл 1 01
+ (V. 35)
Чем* . меньше q0, тем больше второе слагаемое уравнения
(V. 35) и тем больше, Очевидно, состав yD верхних паров по
содержанию низкокипящего компонента. Но чтобы добиться
наверху большего обогащения паровой фазы легким компо-
нентом, при прочих равных условиях должно понадобиться
больше обогатительных ступеней, иначе говоря, больше таре-
лок. Таким образом^... существует известная связь между теп-
ловым состоянием поступающего в колонну сырья, числом ее
тарелбк и составом ее верхнего продукта.
Из рассмотрения фиг . 56 кож но сдега ть еще заключение
о том, что по мере перехода по высоте колонны снизу вверх,
от одной контактной ступени к другой, составы паровых и
жидких потоков обогащаются низкокипящим компонентом, а
температуры их соответственно понижаются, так что флегма,
стекающая с тарелки, расположенной выше, содержит больше
НКК и имеет меньшую температуру, чем флегма с тарелки,
расположенной ниже.
Таким образом, по мере движения сверху вниз по высоте
колонны состав флегмы прогрессивно обедняется легким и обо-
гащается тяжелым компонентом системы и в самом низу ко-
лонны достигает состава, отвечающего практически чистому
высококипящему компоненту. Зададимся вопросом, можно ли
в отгонной колонне получить абсолютно чистый нижний про-
Расход тепла в кипятильнике и вес потока флегмы
20.3
дукт, состоящий из одного лишь высококипящего компонента
системы. Допустим, что остаток R, уходящий из кипятильника,
представляет собой абсолютно чистый тяжелый компонент. Но
тогда и пар GR, равновесный ему, тоже должен состоять из
абсолютно чистого ВКК, а равным образом должна состоять
из чистого ВКК и флегма glt стекающая в кипятильник, ибо
представляет собой сумму потоков остатка R и паров GR. Но
отсюда следует, что состав поднимающихся с первой тарелки
паров Gi, равновесных флегме gt, тоже должен отвечать
чистому ВКК, как и состав встречной им флегмы g2, стекающей
со второй тарелки, которая представляет собой сумму потоков
Gi и R. Продолжая намеченный ход рассуждений, нетрудно
заметить, что принятое исходное положение о том, что нижний
продукт колонны представляет собой абсолютно чистый высо-
кокипящий компонент, приводит к неизбежному заключению
о неизменяемости составов потоков по всей высоте колонны,
т. е. к заключению о том, что в колонне никакого процесса
ректификации не происходит. Очевидно, исходное допущение
было неправильным, и в отгоннби рекзф икациошГои колонне
нельзя достичь такого разделения, чтобы с низа ее уходил
абсолютно чистый высококипящий компонент. Теперь понятно,
почему во всем изложении речь идет о нижнем продукте колонны
лишь как о практически чистом высококипящем компоненте,
содержащем в лучшем случае следы легкого компонента.
Действительно, самого незначительного содержания низко-
кипящего компонента в нижнем продукте колонны вполне
достаточно, чтобы при переходе от низа колонны к последую-
щим ступеням был достигнут вполне заметный его состав
в парах и флегме.
§ 8. Связь между расходом тепла в кипятильнике и весом
потока флегмы
Определение составов фаз на тарелках отгонной колонны
графическим или аналитическим методом, описанное в преды-
дущем параграфе, требует знания величины теплового потока,
подводимого в кипятильник. Решая уравнение (V. 31) в отно-
шении теплового параметра в17 можно получить
01=Qi-8-^-(.Qi (V.36)
Сочетание уравнений (V.14) и (V.Зб) позволяет установить
связь между расходом тепла В/R в кипятильнике колонны и
весом потока флегмы в любом межтарелочном отделении
колонны:
^ = ^L(Qi.-^ + 1)-(Q/-^). (V. 37)
Уравнение (V. 37) устанавливает важное соотношение между
количеством тепла, подаваемым в кипятильник, и весом флегмы,
стекающей с какой-нибудь произвольной тарелки колонны. Чем
больше вес флегмы, тем больше тепла должно подаваться
в низ колонны. В равной мере увеличенному расходу тепла
в кипятильнике отвечает повышение веса потоков паров и
флегмы в отделениях колонны. Таким образом, регулирование
веса потоков по высоте колонны осуществляется большей или
меньшей подачей тепла в ее кипятильник.
§ 9. Минимальный вес флегмы
Установим, как влияет вес флегмы на изменение концентра-
ций потоков при переходе от одной тарелки колонны к дру-
гой. Из уравнения (V. 24), решая его в отношении разности
составов встречных потоков, можно получить
yi - Xi +1 = (у, - xR). (V. 38)
о i -|- 1
Чтобы иметь суждение о разрыве составов, например,
жидкого потока при переходе из (z’H-l)-ft в i-ю ступень кон-
такта, иначе говоря, для получения ясного представления об
обогатительном эффекте одной какой-нибудь тарелки, необхо-
димо найти разность составов одноименных потоков, стекающих
со смежных ступеней колонны. С этой целью можно в левой
части уравнения (V. 38) состав у, парового потока, поднимаю-
щегося с i-й тарелки, выразить через состав равновесной ему
жидкой флегмы, стекающей с той же тарелки, используя для
этого уравнение равновесия (III. 60):
(m — 1)х,у/ + у< — mxi = 0. (V.39)
Прибавляя и отнимая х, в левой части уравнения (V. 39),
можно преобразовать его к виду
yi — Xi~(m~ l)x/(d — yt). (V.40)
Подставляя значение у, из уравнения (V.40) в уравнение
(V. 38), можно получить искомое соотношение, связывающее
составы жидких потоков на двух смежных тарелках отгонной,
колонны:
Г>
Xi +1 - х( = х,(т— 1)(1 — у,)— --(У< -хя). (V. 41)
Si + 1
Уравнение (V. 41) показывает, что с увеличением веса флегмы
растет разность составов жидких фаз, стекающих со смежных
ступеней контакта, иначе говоря, растет обогатительный эффект
тарелки при переходе от одной нижележащей тарелки к выше-
лежащей.
Минимальный вес флегмы
205
Этот важный вывод на основании уравнения (V. 37) может
быть распространен и на величину расхода тепла в кипятиль-
нике. Действительно, с увеличением расхода тепла В/R растет
вес флегмы и согласно уравнению (V. 41) увеличивается разрыв
между составами фаз на смежных тарелках колонны. Таким
образом, изменением количества подаваемого в кипятильник
тепла можно оказывать влияние на эффект обогащения кон-
тактных ступеней отгонной колонны.
По мере уменьшения веса флегмы уменьшается и разрыв
между составами потоков в смежных отделениях колонны и
при некотором определенном минимальном значении ее веса
этот разрыв может совершенно исчезнуть. При этом со-
ставы одноименных фаз в смежных отделениях колонны сравни-
ваются, разность между ними становится равной нулю и обо-
гатительного эффекта контактных ступеней колонны уже не
будет. Этот минимальный вес флегмы может быть найден по
уравнению (V.41) для условия, когда на смежных ступенях
контакта уже не достигается обогащения фаз и разность соста-
вов Xi +t — xf =0. Тогда
£>мин __ Vi ______________
R ~ (т— IJxjO — yt)'
(V. 42)
Чем больше коэффициент обогащения т, иначе говоря,
чем дальше отстоят друг от друга по своим летучим свойствам
компоненты системы, тем меньше минимальный вес флегмы,
предельно совместимый с намеченным в колонне разделе-
нием.
Сочетание уравнения (V. 42) с уравнением (V. 40) позволяет
придать выражению для минимального веса флегмы другой
вид:
(V.43)
R у i — xl ' '
Сопоставление уравнения (V. 43) с уравнением (V. 24) пока-
зывает, что в реальной колонне, осуществляющей на каждой
своей тарелке известное обогащение паровых и жидких фаз,
влекущее за собой неравенство xi + i>Xi, вес флегмы в любом
ее межтарелочном отделении больше минимального, опреде-
ляемого уравнением (V. 43).
Для теоретического случая колонны, работающей с предель-
ным минимальным весом флегмы, составы встречных на одном
уровне фаз должны отвечать условию равновесия, как то сле-
дует из предыдущего вывода. В самом деле, состав X/ + i
жидкого потока, встречного парам, имеющим состав У/, равен
Xi, иначе говоря, равен составу жидкости, находящейся с этими
парами в равновесии.
OAfi
С)т?Г\ннс1<з npKTi / fhi t к и u I f OHH О Я. KTiint-wi
Следовательно, подстановка любой пары равновесных соста-
вов Xi и У; в уравнение (V.43) даст некоторое вполне опреде-
ленное минимальное значение веса флегмы, отвечающее
именно этой паре равновесных составов.
§ 10. Минимальное тепло кипятильника
Выше была установлена связь между расходом тепла в кипя-
тильнике колонны и весом флегмы в произвольном ее сечении,
выражаемая уравнением (V.37), согласно которому с уменьше-
нием веса флегмы тепло кипятильника тоже уменьшается.
Очевидно, минимальному весу флегмы будет отвечать неко-
торое определенное минимальное же значение расхода тепла
кипятильника, значение которого можно рассчитать подста-
новкой надлежащих величин в уравнение (V. 37):
(<?< (V. 44)
Уравнением (V. 44) устанавливается взаимно однозначное
соответствие между минимальным расходом тепла в кипятиль-
нике колонны и каждой парой равновесных составов Xi и у,
жидкой и паровой фаз разделяемой системы.
Минимальное тепло кипятильника, отвечающее данной паре
равновесных составов, особенно легко определяется графически
по тепловой диаграмме. Для этого необходимо преобразовать
уравнение (V.44) к виду
Д,ин Л л ХН т \
Qr Ъ ~ (мин) — Qi ___________ (Qi — Qi)
' У i i
и отсюда получить соотношение, связывающее составы и тепло-
вые величины:
Уравнение (V.45) является необходимым и достаточным
условием, чтобы на тепловой диаграмме три точки (Xr, 0i (мин)),
(Xi, qi) и (у,, Qi) лежали на одной прямой. Таким образом, на-
неся на тепловую диаграмму (фиг. 56) фигуративные точки
равновесных паровой и жидкой фаз сырья а0(х,, qi) и b0(yi, Qt),
необходимо продолжить проходящую через них коноду до
пересечения с вертикалью xR = const в точке S/. Ордината
этой точки согласно уравнению (V.45) равна тепловому па-
раметру 01 (мин), а отрезок R пропорционален минимальному
расходу тепла, отвечающему принятой паре равновесных со-
ставов Xi и yi. Очевидно', другой паре равновесных составов
будет отвечать другое значение минимального тепла кипятиль-
ника.
Предельные концентрации 2(П
По тепловой диаграмме легко заметить, что чем выше зна-
чения равновесных составов, тем больше отвечающее им зна-
чение минимального расхода тепла'в кипятильнике колонны,
достигающее для составов Xi = I и у; — 1 бесконечно большого
значения. Наоборот, с понижением значений равновесных кон-
центраций величина BMKH/R уменьшается и при Xi = 0 и У/ = О
тоже равняется нулю.
§ И. Предельные концентрации
Установленные в § 7 графический и аналитический методы
позволяют путем попеременного использования соотношений
фазового равновесия и уравнения концентраций последова-
тельно, двигаясь снизу вверх по высоте отгонной колонны,
определять элементы ректификации на всех ее контактных
ступенях. По мере перехода от расположенных ниже тарелок
к верхним тарелкам колонны температуры жидких и паровых
потоков уменьшаются, а составы их по низкокипящему компо-
ненту растут. Уместно задаться вопросом, есть ли предел этому
увеличению составов ф аз или его при всех условиях можно
вести как угодно далеко.
Получить ответ на этот вопрос можно из рассмотрения
тепловой диаграммы. Каждому определенному значению тепла
кипятильника от нулевого до бесконечно большого отвечает со-
гласно доказанному выше своя пара равновесных составов х< и у,
(фиг. 56). На продолжении коноды, проходящей через фигура-
тивные точки этих равновесных фаз, лежит полюс S/, опреде-
ляющий на тепловой диаграмме соответствующий минимальный
расход тепла в кипятильнике. Из того же полюса выходит
пучок оперативных линий, определяющих согласно уравнению
(V. 32) составы встречных на одном уровне колонны неравно-
весных фаз.
Исходя из некоторого наперед заданного состава xR нижнего
продукта и последовательно проводя из полюса оперативные
линии, мы до тех пор будем получать обогащение фаз при
переходе с тарелки на тарелку, пока наклон оперативной линии
будет больше наклона соответствующей коноды, выходящей из
точки ее пересечения с линией теплосодержаний жидкой фазы.
Однако по мере приближения к равновесным составам х, и у,
жидкой и паровой фаз, отвечающим условию минимума приня-
того расхода тепла в кипятильнике, наклоны оперативной линии
и коноды будут все более сближаться и в пределе при дости-
жении этих составов должны будут совпасть.
Чем ближе наклоны оперативной линии и соответствующей
коподы. тем меньше обогащение фаз, достигаемое на рассма-
триваемой ступени. Поэтому по мере приближения к рассма-
триваемой паре равновесных составов обогащение фаз при
208 Отгонная ректификационная колонии.
переходе.снизу вверх от тарелки к тарелке все более и более
уменьшается и для достижения этих составов теоретически
требуется бесконечное число тарелок. Иначе говоря,эти равно-
весные составы Xi и yi являются при данном расходе тепла
в кипятильнике колонны теоретически недостижимыми, а потому
называются предельными или. граничными составами.
Таким образом, для каждого определенного значения рас-
хода тепла В/R в кипятильнике существует своя пара значений
равновесных составов хгр и угр, достичь которых на верху
колонны ни при каком числе ее тарелок теоретически невоз-
можно. Наоборот, каждой паре равновесных составов хгр и угр
отвечает некоторое, вполне определенное, единственное и ми-
нимальное значение тепла кипятильника, при котором эти
составы теоретически достижимы лишь при бесконечно боль-
шом числе тарелок колонны. Важно подчеркнуть, что уста-
новленное соответствие между граничными составами и мини-
мальным теплом кипятильника является взаимно однозначным.
Ранее было установлено однозначное соответствие между
теплом кипятильника и минимальным весом флегмы, отвечаю-
щим той же паре равновесных составов хгр и угр. В свете пре-
дыдущего изложения можно заключить, что каждой паре равно-
весных граничных составов отвечает равным образом некоторое
вполне определенное, единственное и минимальное значение
веса флегмы, при котором достичь на верху колонны этих со-
ставов можно лишь при бесконечно большом числе ее тарелок.
В самом деле, на основании уравнения (V.41) уже был сделан
вывод, что при некотором минимальном весе флегмы составы
жидких потоков на смежных ступенях контакта не меняются
и дальнейшее обогащение фаз прекращается. По уравнению
же (V. 43) было установлено взаимно однозначное соответствие
между каждой парой равновесных составов хгр и угр и отве-
чающим им минимальным весом флегмы. Следовательно, и
каждому определенному значению веса флегмы тоже отвечает
своя пара равновесных предельных составов, достичь которых
на верху колонны нельзя с теоретической точки зрения ни
при какой высоте колонны.
Сочетанием уравнений (V.43) и (V.44) может быть получено
соотношение, связывающее минимальный расход тепла в кипя-
тильнике колонны и минимальный вес флегмы, отвечающие
каждой определенной паре равновесных предельных составов:
В е
-=• = (<?/ - qi) - (Q/ - qR). (V. 46)
Однако особый интерес для расчета отгонной колонны
представляет уравнение (V. 44), при помощи которого можно
построить график, дающий величину минимального расхода
тепла в кипятильнике в зависимости от принятых значений
Предельные концентрации
209
граничных составов на всем интервале их изменения от хгр =
= Угр = 0 до хгр = угр = 1. Такой график, рассчитанный и построен-
ный для системы бензол — толуол под давлением 760 мм рт. ст.,
показан на фиг. 57. На оси абсцисс отложены составы жидкой
фазы в весовых долях, а по оси ординат — отвечающие им
бензол - толуол, р = 7В0т рт. ст., у$= 0,935 и
1^ = 0,005
Фиг. 57. Кривая зависимости расхода тепла в кипятильнике от граничного
состава жидкой фазы для системы бензол — толуол.
значения минимального количества тепла кипятильника, кото-
рые можно либо рассчитать аналитически по уравнению (V.44),
либо найти графически по тепловой диаграмме в соответствии
с построением, показанным на фиг. 56.
Для расчета величины BJR необходимо располагать данными
по паро-жидкому равновесию и тепловым свойствам рассматри-
ваемой частной системы, для которой ведется построение гра-
фика — хГр. 11оэтому необходимо предварительно рассчитать
и построить изобарные кривые конденсации и кипения и тепло-
вую диаграмму, а затем, снимая с них необходимые данные,
вести расчеты по уравнению (V. 44) или графическим путем
непосредственно по тепловой диаграмме.
14 Зак. № 304.
1 f> flTinWHnO nPKTnshllKntl 11ПНН 09 КПИС199О
Графический расчет по тепловой диаграмме технически
прост и удобен и может быть рекомендован для определения
значений минимального тепла кипятильника, отвечающих не
очень малым значениям граничных составов. Однако свойствен-
ная всем графическим методам расчета известная неточность
становится уже недопустимой, когда определение BMmIR при-
ходится вести для очень небольших значений х, и у,, так как
даже достаточно точное снятие их значений по изобарным кри-
вым равновесия невозможно. В этом случае приходится при-
бегать к аналитическому расчету по уравнению (V.44), которое
для условий, отвечающих получению с низа колонны практи-
чески чистого тяжелого компонента состава xR 0, поддается
удобному упрощению. В самом деле, положив с небольшим
приближением
Qi Qi = Qi Qr =
где lw — скрытая теплота испарения высококипящего компо-
нента, и, принимая во внимание, что для малых сравнительно
с единицей составов равновесных фаз уравнение равновесия
приходит к виду у,- = mxi, можно путем соответствующих под-
становок в уравнение (V.44) получить
jSuuu / V: — Хр \ ( X; — Хр \
МИН j I ' ! Jx » I * Л )
--Р = \ ~7> ~ 1 / iw\ 11 — V / =
п \ У/ — J \У1Х1/
Равным образом и для больших значений граничных со-
ставов, которым отвечают относительно большие расходы тепла
в кипятильнике, не рекомендуется вести расчет графическим
путем, так как в этих случаях определяющие коноду точки
(х,, и (у,, Qi) располагаются очень далеко от искомой точки
(xR, ее пересечения с вертикалью xR = const. Поэтому и
в этих случаях следует пользоваться уравнением (V.44) и вести
расчет аналитически.
Приведенная на фиг. 57 кривая построена в функции со-
става хгр равновесной жидкой фазы, так как сырье подается
в колонну в жидкой фазе, однако ее по тем же данным можно
построить и в функции состава равновесной паровой фазы. Для
каждого значения расхода тепла в кипятильнике отгонной
колонны, изменяющегося от нуля до бесконечности, такой
график позволяет сразу указать то значение граничного состава
жидкой фазы, которого ни при каком числе тарелок нельзя
превзойти на верху колонны. Начало этой кривой расположено,
очевидно, в точке (xR, 0), и это вполне понятно/ ибо если
исходная система уже имеет состав xR, то не требуется ника-
Предельные концентрации
211
кой затраты энергии, чтобы довести ее до этого же состава,
и поэтому в данном случае обязательно ^-= 0. Чем больше
значение граничной концентрации, тем быстрее растет расход
тепла в кипятильнике, прогрессивно увеличиваясь до беско-
нечности, когда граничные составы приобретают значения хгр =
= угр = 1. Последнее также легко объяснимо. В самом деле,
если сырье, поступающее на верхнюю тарелку колонны, состоит
из чистого низкокипящего компонента, то как бы ни был велик
расход тепла в кипятильнике, все равно из этого сырья не
удается получить нижнего продукта колонны, состоящего по
условию из практически чистого высококипящего компонента,
которому неоткуда взяться. Это и представлено бесконечно
большим значением В/R при хгр = угр = 1.
График зависимости В/R от состава жидкой фазы наглядно
показывает, что чем ближе состав сырья к составу xR нижнего
продукта колонны, тем меньше тепла расходуется в кипятиль-
нике колонны на проведение процесса ректификации. По мере
_ удаления состава сырья от состава нижнего продукта колонны__
имеет место резко выраженное прогрессивное нарастание вели-
чины тепла кипятильника, расходуемого на разделение.
Итак, каждому определенному значению расхода тепла
в кипятильнике отгонной колонны отвечает вполне определен-
ный состав хгр жидкой фазы (и угр равновесной ей паровой
фазы), которого теоретически ни при каком числе тарелок
нельзя достигнуть на верху колонны. Однако, как будет пока-
зано ниже, с вполне конечным числом тарелок удается как
угодно близко подойти к этому составу, иначе говоря, практи-
чески достичь его, не увеличивая расхода тепла в кипятиль-
нике отгонной колонны против минимального. Превзойти же
этот граничный состав невозможно даже при бесконечном числе
тарелок отгонной колонны. Таким образом, каждому опреде-
ленному составу сырья, подаваемого на верхнюю тарелку
колонны, при заданной степени чистоты нижнего продукта
отвечает единственное минимальное значение тепла кипятиль-
ника, при котором практически разделительная работа колонны
еще возможна. При любом другом меньшем значении расхода
тепла в кипятильнике не удается получить в колонне намечен-
ного разделения. Любому же большему значению тепла кипя-
тильника отвечает и большее значение граничной концентра-
ции, так что желательный состав на верху колонны при расходе
тепла, большем минимального, может быть всегда достигнут.
Для этого в общем случае понадобится тем меньшее число сту-
пеней контакта, чем больше отличается В/R от минимального
значения. Однако при увеличении расхода тепла против мини-
мального необходимое число теоретических тарелок умень-
шается не пропорционально градиенту В/R, а вначале резко
14*
212
Отгонная ректификационная колонна
уменьшается и далее при последовательном увеличении B/R
достигает некоторого минимального значения для бесконечно
большого расхода тепла в кипятильнике. Эту важную особен-
ность работы колонны необходимо рассмотреть более подробно.
§ 12. Минимальное число тарелок отгонной колонны
Чем больше обогатительный эффект, достигаемый на тарел-
ках колонны, тем, очевидно, меньшее их число необходимо
для намеченного разделения. Как было установлено выше, при
Фиг. 58. Обогатительный эф-
фект тарелки как функции рас-
хода тепла в кипятильнике.
увеличении веса флегмы или, что
эквивалентно, с возрастанием тепла
кипятильника, растет и степень
обогащения фаз на каждой ступени
контакта. Из уравнения (V. 25) сле-
дует, что с увеличением веса
флегмы составы встречных в одном
отделении колонны паровых и жид-
ких фаз сближаются и при беско-
нечно большом отношении gt + tJR
эти составы должны были бы сов-
пасть. Тот же вывод можно сделать
и на основании уравнения (V. 34),
второй член правой части которого
при бесконечно большом значении
BIR, очевидно, равен нулю. Нако-
нец, и рассмотрение тепловой диа-
граммы на фиг. 58 со всей нагляд-
ностью подтверждает сделанное
заключение. В самом деле, пусть
по составу yR паров, поднима-
ющихся из кипятильника, нужно
найти состав встречной флегмы,
стекающей с первой тарелки. Для этого необходимо соединить
прямой линией фигуративную точку пара с полюсом поло-
жение которого определяется расходом тепла в кипятильнике
колонны. Абсцисса точки пересечения этой прямой с линией
теплосодержаний жидкой фазы определит искомый состав
Однако полюс может занимать различные положения в зави-
симости от количества тепла кипятильника. Так, для расхода
тепла В-jR полюс занимает положение S/ и состав встречной
флегмы определяется как абсцисса точки а; для несколько боль-
шего расхода тепла B.JR полюс расположен ниже, в положении
Si', и состав встречной флегмы определяется уже как абсцисса
точки Ь, большая, чем в первом случае. Легко заметить, что по
мере увеличения расхода тепла в кипятильнике колонны все более
растет состав флегмы gi, стекающей навстречу парам, идущим
Минимальное число тарелок отгонной колонны
213
из кипятильника. Предел этому увеличению состава жидкой
фазы наступает при бесконечно большом значении BjR, что
приводит к выравниванию составов встречных фаз yR~xlt иначе
говоря, к максимальному их отступлению от состояния равно-
весия. Чем больше разность фаз между встречными потоками,
тем эффективнее протекает обмен веществом и энергией на
тарелке, тем больше движущая сила процесса и тем меньшее
число контактных ступеней требуется для намеченного разде-
ления. Гипотетическому, предельному, практически нереали-
зуемому в промышленных условиях случаю работы колонны
с бесконечно большим расходом тепла в кипятильнике отве-
чают наибольшая разность фаз и наибольший разрыв между
составами одноименных потоков, отходящих со смежных теоре-
тических ступеней контакта. Число необходимых теоретических
тарелок в этом случае будет минимальным.
То обстоятельство, что отношение В//? может быть беско-
нечно большим и тогда, когда тепло В представляет собой
конечную величину, но зато с низа колонны целевой продукт
не отбирается, иначе говоря, когда =0, позволяет ставить
лабораторные испытания для определения минимального для
данного разделения числа тарелок и установления их эффек-
тивности. При этом пары, уходящие с верхней тарелки, должны
конденсироваться и в качестве сырья подаваться в колонну.
Уместно напомнить, что относительный вес флегмы g/R свя-
зан с расходом тепла в кипятильнике и когда последний ста-
новится бесконечно большим, то и вес флегмы приобретает
соответствующее бесконечно большое значение. Поэтому все
заключения, сделанные выше на основе рассмотрения характера
изменения составов потоков на смежных теоретических ступе-
нях при увеличении расхода тепла кипятильника до бесконеч-
ности, остаются теми же и для бесконечно большого веса
флегмы.
То обстоятельство, что при бесконечно большом расходе
тепла В/R в кипятильнике или, что то же, при бесконечно
большом весе g/R флегмы, стекающей в отделениях колонны,
составы встречных паровых и жидких фаз равны между собой,
позволяет, не прибегая ни к каким дополнительным данным,
при помощи одних лишь равновесных кривых определить ми-
нимальное число ступеней: необходимых для намеченного раз-
деления. При этом следует учесть, что, поскольку снизу ко-
лонны не отбирается нижний целевой продукт, ибо R = 0, состав
yD паров, уходящих с верхней тарелки колонны, должен быть
равен составу поступающего жидкого сырья а. На фиг. 59 по-
казано соответствующее графическое построение, проведенное
по тепловой диаграмме и по кривой равновесия у — х. На тепло-
вой диаграмме все оперативные линии параллельны и верти-
Г)т?п»ыая пркгигЬикац'Юнная колонна
кальны, ибо точка SL их пересечения расположена на беско-
нечно далеком расстоянии в соответствии с бесконечно боль-
шим значением В/R. Для проведения пунктирных конод при-
ходится, как
Фиг. 59. Определение минимального
числа тарелок в колонне.
и обычно, прибегать к равновесным данным.
На диаграмме кривой равно-
весия у — х диагональ квад-
рата составов, как известно,
является линией равных соста-
вов паровой и жидкой фаз.
В рассматриваемом случае,
когда уравнение концентраций
представляется простым соот-
ношением yi = Xt + t, выража-
ющим условие равенства со-
ставов встречных на одном
уровне фаз, линия равного
состава является графическим
представлением уравнения кон-
центраций. Определение мини-
мального числа тарелок отгон-
ной колонны на диаграмме
равновесия у — х выяснится
в ходе следующих рассужде-
ний. Условию равновесия фаз,
покидающих первую тарелку,
отвечает точка 1 (хъ г\) на
кривой равновесия. Состав х2
флегмы, встречной парам 6Х,
равен составу уг этих паров,
и поэтому, проведя горизон-
таль 7 — 7' до пересечения
с линией равного состава,
легко определить точку 7'
с абсциссой х2. Состав пара у2,
поднимающегося с первой та-
релки и равновесного флегме
состава х2, определится по кривой равновесия как ордината
точки 2, а состав встречной флегмы — как абсцисса точки 2',
которая получится проведением горизонтали 2 — 2' до пересе-
чения с линией равного состава. Так, продолжая вписывать
ступенчатую линию между кривой равновесия и линией равного
состава, можно дойти до паров GD, поднимающихся с верхней
тарелки колонны и имеющих тот же состав, что и входящее
на переработку сырье. Каждая вертикальная ступень вписанной
ломаной линии отвечает одной теоретической тарелке. Просум-
мировав общее число вертикальных отрезков ломаной, можно
установить искомое минимальное число тарелок.
Расчет числа теоретических тарелок в отгонной колонне 21. >
§ 13. Расчет числа теоретических тарелок
в отгонной колонне
Приступая к расчету отгонной колонны, проектировщик
обычно располагает составами а и xR сырья и нижнего про-
дукта колонны. Однако для определенности проблемы ректи-
фикации и установления того или иного режима работы ко-
лонны этих двух начальных данных недостаточно и необходимо
задаться еще одним дополни-
тельным параметром. Тогда
режим работы отгонной ко-
лонны становится строго опре-
деленным и единственным и
задача расчета колонны сво-
дится к определению элемен-
тов ректификации на последо-
вательных ступенях контакта
с низа до верха ее. В этом
вопросе для полного его вы-
яснения необходимо разобрать
ся глубже.
Пусть исходное сырье
веса L, состава а при темпера-
туре начала кипения подается
на верхнюю тарелку отгонной
колонны и пусть из этого
сырья необходимо получить
нижний продукт колонны со
степенью чистоты, равной xR.
Фигуративные точки нижнего
продукта /? и сырья L нане-
сены на линию теплосодержа-
ний тепловой диаграммы, пред-
ставленной на фиг. 60.
Для определения числа тарелок колонны безразлично анали-
тическим способом или же путем графического построения
необходимо принять величину тепла BJR, расходуемого в кипя-
тильнике колонны. Как известно, эта величина может изменяться
от некоторого минимального значения, отвечающего условию
равновесия встречных потоков на верху колонны, до бесконечно
большого, отвечающего условию равенства составов встречных
фаз по всей высоте колонны, иначе говоря, отвечающего усло-
вию максимального отступления встречных паровых и жидких
потоков от состояния равновесия. Последний случай в про-
мышленных условиях практически не реализуется, но работа
колонны с минимальным для заданного разделения расходом
216
Отгонная ректификационная колонна
тепла в кипятильнике с известным приближением, вообще
говоря, может быть осуществлена. Рассмотрим на тепловой
диаграмме (фиг. 60) графическое определение величины Вмт//^.
Как уже известно, для этого необходимо продолжить коноду
Ьа0 до ее пересечения в точке S/ с вертикалью xR — const и из-
мерить величину отрезка /?£/, пропорциональную минимальному
расходу тепла в кипятильнике колонны, разделяющей исходную
смесь состава а на нижний продукт состава хд и пары состава
у0, равновесные сырью и уходящие с верхней тарелки колонны.
Теоретически, как было показано выше, состав у0 недостижим
ни при каком числе тарелок колонны, практически же разница
между этим граничным составом и парами, уходящими с верх-
ней тарелки, с вполне конечным числом тарелок может быть
сделана неуловимой.
Любой другой расход тепла В//? в кипятильнике, больший
минимального, отвечает некоторому вполне определенному
режиму работы отгонной колонны. При этом в зависимости от
принятой величины расхода тепла приобретает то или иное
значение состав yD пара, поднимающегося с верхней тарелки.
Этот состав, заключенный в интервале у0 > yD а, с увеличе-
нием относительного тепла кипятильника от минимального до
бесконечно большого уменьшается от значения у0. отвечающего
Bm„/R и в пределе, при £?//?= оо, совпадает с а. Таким обра-
зом, увеличению тепла кипятильника против его минимального
значения отвечает уменьшение состава верхнего продукта,,
иначе говоря, его утяжеление, влекущее за собой попадание
большой доли высококипящего компонента в верхний продукт.
Следствием этого являются уменьшение веса нижнего целевого
продукта и увеличение веса верхнего продукта колонны. Тот
же вывод можно сделать из рассмотрения уравнения (V. 12),
согласно которому с уменьшением yD, при прочих равных
условиях вес D/L увеличивается, а /?/Ь уменьшается.
Из рассмотрения фиг. 60. легко заключить, что совершенно
безразлично, чем задаваться при выборе режима работы ко-
лонны: теплом ли кипятильника В/R или составом yD верхнего
продукта, ибо величины эти связаны простой однозначной
зависимостью, выражаемой уравнением рабочей линии (V. 34),
написанным для горизонтального уровня над верхней тарелкой.
Равным образом можно было бы задаться и желательным весом
нижнего или верхнего продукта колонны и тогда, определив у&-
по одному из уравнений (V. 11) или (V. 12), либо графически
по тепловой диаграмме, либо аналитически по уравнению (V. 37),.
найти действительный, отвечающий выбранным условиям рас-
ход тепла в кипятильнике колонны.
Таким образом, для выбора режима работы отгонной колонны
требуется помимо известных составов сырья и нижнего про-
Расчет отгонной колонны по диаграмме у—х 217
дукта задаться еще одним каким-нибудь параметром системы,
и только в этом случае режим работы колонны определяется
и решение задачи расчета элементов ректификации может
вестись по способу, изложенному в § 7.
В расчете отгонной колонны основным является нахождение
составов фаз на последовательных ступенях контакта, ибо, имея
их значение, по изобарным кривым кипения и конденсации
сейчас же могут быть определены отвечающие этим составам
равновесные температуры, а по уравнениям (V. 23) и (V.24)
рассчитаны веса потоков во всех отделениях колонны.
Расчет числа ступеней контакта и по тепловой диаграмме
и аналитически при помощи уравнения концентраций можно
вести, или двигаясь по высоте колонны снизу вверх, или же
ведя расчет от верхней тарелки к кипятильнику сверху вниз,
причем оба способа эквивалентны.
В § 7 были изложены методика графического способа опре-
деления составов на тарелках колонны и методика их аналити-
ческого расчета путем постепенного приближения по уравне-
нию концентраций (V. 34). Сочетание аналитического метода
расчета по уравнению (V. 34) с построениями на диаграмме
равновесия у — х позволяет предложить еще один, уже графо-
аналитический метод расчета отгонной колонны.
§ 14. Расчет отгонной колонны по диаграмме у — х
Уравнение концентраций (V. 34) может быть изображено
в системе координат у — х, если несколько его точек рассчитать
аналитически методом постепенного приближения, нанести их
на график у — х и провести через них плавную кривую. Эта
кривая будет устанавливать связь между составами встречных
на одном межтарелочном уровне паровых и жидких потоков.
Подстановка в уравнение (V. 34) вместо текущих координат
Xi + i_ и у, одного и того же значения xR превращает его в тож-
"дёство. Следовательно, кривая, отвечающая уравнению (V.34),
должна обязательно пройти через точку a0(xR, xR), лежащую
на линии равного состава (у = х). Эта кривая называется линией
концентраций отгонной колонны и своей выпуклостью (обычно
небольшой) обращена к оси абсцисс. Только в одной точке А.
пересекаются кривая равновесия и линия концентраций а0А
отгонной колонны. Координаты этой точки пересечения опре-
деляются теми значениями предельных составов, которые отве-
чают выбранному значению притока тепла В в кипятильник
колонны. Таким образом, две точки a0(xR, xR) и А(хгр, угр),
через которые проходит линия концентраций отгонной колонны,
всегда известны. Остается рассчитать координаты лишь несколь-
ких промежуточных точек, нанести их на график и провести
через них плавную кривую а0А. По смыслу определения любая-
2-18
Отгонная пектификационнпя колонна
точка кривой концентраций связывает составы неравновесных,
встречных на одном уровне колонны разноименных фаз, и по-
этому путем ее сочетания с кривой равновесия, дающей составы
фаз, находящихся друг с другом в равновесии, можно провести
графический расчет отгонной колонны на диаграмме у— х
(фиг. 61).
Принципиально расчет можно начинать с любого уровня
колонны, на котором известен состав хотя бы одного из пото-
ков. Начнем его, например,
с состава xR нижнего продукта
колонны. Чтобы найти состав
yR паров, равновесных остатку
и поднимающихся из кипя-
тильника на первую, считая
снизу, тарелку колонны, надо
провести из точки a0(xR, xR)
Фиг. 61. Расчет числа тарелок отгон-
ной колонны по диаграмме у—х.
вертикаль до ее пересечения
в точке 1 с кривой равновесия.
Очевидно, ордината этой точки
будет равна yR. При опреде-
лении состава хх флегмы,
стекающей с первой тарелки,
необходимо учесть, что она
пересекает тот же горизонталь-
ный уровень колонны, что и
пары состава yR, и поэтому
фигуративная точка, связы-
вающая составы этих неравновесных фаз, должна расположиться
на линии концентраций а0А и иметь ординату, равную yR. Про-
ведя из точки 1 горизонталь до ее пересечения с линией кон-
центраций в точке 2, мы найдем состав хх флегмы, стекающей
с первой тарелки, как абсциссу точки 2. Легко сообразить,
что состав ух паров, поднимающихся с первой тарелки, должен
быть найден из условия их равновесия с флегмой, стекающей
с той же тарелки. Проведя из точки 2 вертикаль до ее пере-
сечения в точке 3 с кривой равновесия, найдем ух как орди-
нату точки 3. Переходя к определению состава х2 флегмы,
стекающей со второй тарелки в то же межтарелочное отделение,
куда поднимаются пары состава ух, принимаем во внимание,
что точка, связывающая составы этих разноименных неравно-
весных потоков, должна лежать на линии концентраций а0А.
Проведя горизонталь из точки 3, находим состав х2 как абсциссу
точки пересечения 4 этой горизонтали с линией концентраций.
Так, продолжая вписывать ступенчатую линию между кривой
равновесия и линией концентраций, можно пройти снизу вверх
.по всей отгонной колонне, последовательно определяя составы
Анализ проблемы ректификации в отгонной колонне
219
паровых и жидких потоков во всех ее межтарелочных отделе-
ниях. Последним отделением колонны будет самое верхнее ее
отделение, в котором встречаются поток сырья состава а и по-
ток паров состава yD, поднимающийся с верхней тарелки.
Фигуративная точка 6 (a,yD), связывающая составы этих потоков,
расположится на линии концентраций и явится той граничной
точкой, до которой следует проводить ступенчатые построения.
Каждая вершина ломаной ступенчатой линии, лежащая на
кривой равновесия, отвечает одной контактной ступени, вклю-
чая и кипятильник. Каждая же ее вершина, лежащая на линии
концентраций, отвечает определенному межтарелочному отде-
лению. Таким образом, указанное графическое построение
позволяет вести и расчет элементов ректификации по всей
высоте отгонной колонны и определение необходимого числа
ступеней контакта.
Расчет отгонной колонны по диаграмме у—х достаточно
точен и хотя несколько уступает в отношении простоты гра-
фическому расчету по тепловой диаграмме, все же может быть
вполне рекомендован для практических инженерных расчетов
как надежное и верное средство.
§ 15. Анализ общей проблемы ректификации данной
системы в отгонной колонне
Зададимся вопросом, в какой зависимости от притока тепла
в кипятильник находится распределение составов, например
парового потока, по тарелкам отгонной колонны. Каждому дан-
ному значению В/R отвечает вполне определенная пара равно-
весных составов жидкой и паровой фаз, которая ни при каком
сколь угодно большом числе тарелок не может быть превзой-
дена на верху колонны. Однако, как уже известно, эта же
пара равновесных граничных составов практически может быть
достигнута на верху колонны с вполне конечным числом таре-
лок. При этом в зависимости от расхода тепла в кипятильнике
имеется различное распределение составов фаз по тарелкам
колонны.
Рассмотрим на конкретном примере разделения под атмо-
сферным давлением бинарной системы бензол—толуол характер
зависимости между расходом тепла в кипятильнике и распре-
делением составов фаз по тарелкам отгонной колонны.
Бинарная система бензол—толуол состоит из двух, смежных углеводо-
родов одного и того же гомологического ряда и, как показывают опытные
данные и подтверждают теоретические соображения, весьма близко следует
в своем поведении законам идеального раствора. Ранее уже были построены
изобарные кривые кипения и конденсации для рассматриваемой системы. Эти
равновесные данные положены в основу последующего расчета. Здесь сле-
дует обратить внимание на то обстоятельство, что компоненты системы
довольно близки друг к другу по точкам кипения и поэтому их разделение
9
Лттлииип notc'T'ftfhin^ntmnuufia кпилицл
требует сравнительно большого числа контактных ступеней, в связи с чем
и расчет, приводимый ниже, несколько громоздкий. Однако, как будет видно
из последующего изложения, труд, затраченный на проведение расчета,
с лихвой окупается теми многочисленными важными выводами, которые можно
сделать на основе полученных данных. Первый этап расчета состоит в по-
строении описанного в § 11 графика зависимости между притоком тепла
в кипятильник BjR и граничными составами. Получить необходимые данные
для построения графика можно либо графически, продолжая на тепловой
диаграмме ряд изотерм до их пересечения с прямой xR = const и отсчитывая
соответствующие значения В/R, либо же аналитически при помощи урав-
нения (V. 44).
В табл. 12 приведен развернутый расчет значений В/R по уравнению
(V. 44) для случая, когда с низа колонны отводится практически чистый
толуол с содержанием бензола xR = 0,005. При этом теплосодержание ниж-
него продукта, снятое с тепловой диаграммы, qR = 41,7 ккал/кг.
По данным граф 2 и 12 или 3 и 12 табл. 12 можно построить кривую-
минимального расхода тепла в кипятильнике колонны в зависимости от пре-
дельной концентрации в жидкой или паровой фазе. Приведенная на фиг. 57
в функции предельного состава жидкой фазы эта кривая имеет свое начало-
в точке (xR 0).
Перейдем к рассмотрению основной задачи— установление
хода изменения составов фаз в последовательных межтарелоч-
ных отделениях отгонной колонны. Для каждого определен-
Таблица 12
и о Q;, ккал/кг qt, ккал)кг Qi и 1 X 1 7 б7 а: 7 ф ft? X 1 К* 1 7 ф 7 ф а; и * а: 1 । 1 ~ II 2 аз|о; 1
Qi X 1 1
81 0,955 0,975 129,0 34,9 0,970 0,020 94,1 87,3 48,5 4550 4462,3
82 0,908 0,956 128,9 35,1 0,951 0,048 93,8 87,2 19,8 1860 1772,8
84 0,798 0,914 128,1 35,6 0,909 0,116 92,5 86,4 7,8 726 638,6
86 0,705 0,863 127,6 35,7 0,858 0,158 91,9 85,9 5,4 499 413,1
88 0,620 0,809 126,7 36,0 0,804 0,189 90,7 85,0 4,3 385 300,0
90 0,541 0,748 125,8 36,6 0,743 0,207 89,2 84,1 3,6 320 236,0
92 0,472 0,690 124,7 36,8 0,685 0,218 87,9 83,0 3,1 276 193,0
94 0,407 0,633 123,9 37,0 0,628 0,226 86,9 82,2 2,8 241 158,8
96 0,345 0,566 122,9 37,9 0,561 0,221 85,0 81,2 2,5 216 135,8
98 0,287 0,495 121,4 38,3 0,490 0,208 83,1 79,7 2,4 196 116,3
100 0,233 0,424 119,9 38,6 0,419 0,191 81,3 78,2 2,2 178,5 100,3
102 0,184 0,352 118,8 39,3 0,347 0,168 79,5 77,1 2,1 164 86,9
104 0,137 0,281 116,6 39,9 0,276 0,144 76,7 74,9 1,9 147 72,1
106 0,093 0,196 115,8 40,4 0,191 0,103 75,4 74,1 1,8 139 64,9
108 0,051 0,114 113,8 41,1 0,109 0,063 72,7 72,0 1,7 126 54,0
ПО 0,012 0,027 112,2 41,6 0,022 0,015 70,6 70,5 1,5 104,5 34,0
Анализ проблемы ректификации в отгонной колонне 221
«ого значения В/R имеются свое распределение составов фаз
по тарелкам и свое же число тарелок отгонной колонны, при-
водящее от состава нижнего продукта к отвечающему дан-
ному значению В/R предельному составу yD паров на верху
колонны. Задача определения составов фаз по тарелкам ко-
лонны и числа тарелок согласно изложенному ранее может
быть разрешена несколькими способами. Либо можно исполь-
зовать чисто графический способ расчета при помощи тепловой
диаграммы, определяя составы фаз на последовательных тарел-
ках попеременным проведением изотерм и оперативных линий
из полюса, отвечающего данному расходу тепла В/R в кипя-
тильнике, либо можно для этой цели воспользоваться описан-
ным в § 14 графическим методом расчета по диаграмме у—х,
проведя на ней линию концентраций, отвечающую данному
значению В/R, и вписав ступенчатую ломаную между кривой
равновесия и линией концентраций. Наконец, можно восполь-
зоваться уравнением концентраций (V. 34) совместно с данными
паро-жидкого равновесия и вести расчет числа тарелок и соста-
вов фаз на них чисто аналитическим путем. Во многих слу-
чаях графические способы расчета проще, но зато всегда они
уступают аналитическому методу в точности полученных резуль-
татов. Поэтому во всех случаях, требующих большой точности,
следует отдавать предпочтение именно аналитическому методу
расчета.
В качестве образца подобного аналитического расчета в табл. 13 приве-
дены вычисления, проведенные при значении притока тепла B/R = 34 ккал/кг
в кипятильник колонны для рассматриваемой задачи разделения системы
бензол — толуол с получением нижнего продукта, практически чистого толу-
ола со степенью чистоты xR =0,005.
r Таблица 13
хгр = 0,012, угр = 0,027, - - — 34 ккал)кг
о: и 1 >? СУ - + 7 СУ + 1 СУ СУ и т + L li 1 СУ ft; о»
+ L СУ 1 СУ“
0 0,005 0,012 0,007 112 41,5 70,5 104,3 0,676 0,00474 0,0073
1 0,0073 0,022 0,017 112,2 41,5 70,8 104,5 0,678 0,01155 0,0105
2 0,0105 0,025 0,020 112,2 41,4 70,8 104,5 0,678 0,0136 0,0114
3 0,0114 0,026 0,021 112,2 41,4 70,8 104,5 0,678 0,0142 0,0118
4 0,0118 0,0265 0,0215 112,2 41,4 7Q8 104,5 0,678 0,0146 0,0119
5 0,0119 0,027 0,022 112,2 41,4 703 1045 0,678 0,0150 0,012.0
6 0,0120 0,027 0,022 112,2 41,4 70,8 104,5 0,678 0,0150 0,0120
^гр 0,012 0,0512 0,093 0,184 0,287 0,345
Угр 0,027 0,114 0,196 0,352 0,495 0,566
В, ккал/кг 34,0 54,0 65,0 86,9 116,3 135,8
61, ккал) кг 4-7,7 — 12,3 —23,3 —45,2 —74,6 —93,1
Кипятиль- ник 0,012 0,012 0,012 0,012 0,012 0,012
Состав паровой фазы, поднимающейся из Z-й ступени
Тарелка
1 0,022 0,022 0,0225 0,023 0,0231 0,0240
2 0,025 0,029 0,031 0,037 0,037 0,039
3 0,026 0,037 0,040 0,052 0,058 0,061
4 0,0265 0,043 0,050 0,069 0,085 0,099
5 0,027 0,050 0,059 0,089 0,122 0,144
6 0,055 0,068 0,113 0,165 0,198
7 0,061 0,080 0,140 0,214 0,264
8 0,065 0,090 0,168 0,273 0,329
9 0,069 0,100 0,205 0,321 0,383
10 0,073 0,113 0,230 0,372 0,428
И 0,077 0,124 0,257 0,403 0,466
12 0,080 0,134 0,281 0,427 0,495
13 0,084 0,141 0,298 0,445 0,517
14 0,086 0,148 0,311 0,458 0,543
15 0,089 0,154 0,321 0,469 0,550
16 0,092 0,160 0,329 0,476 0,554
17 0,095 0,165 0,336 0,479 0,558
18 0,098 0,170 0,341 0,484 0,562
19 0,103 0,174 0,343 0,487 0,565
20 0,107 0,178 0,345 0,489 0,566
21 0,109 0,181 0,347 0,491 0,566
Й 0,111 0,184 0,349 - 0,493 0,566
23 0,113 0,187 0,351 0,494 0,566
24 0,114 0,190 0,352 0,495 0,566
25 0,114 0,192 0,352 0,495 0,566
26 0,114 0,194 0,352 0,495 0,566
27 0,114 0,195 0,352 0,495 0,566
28 0,114 0,196 0,352 0,495 0,566
оо 0,027 0,114 0,196 0,352 0,495 0,566
Анализ проблемы ректификации в отгонной колонне •
223
Таблица 14
0,407 0,472 0,541 0,620 1 0,705 0,798 0,908 1,000
0,633 0,690 0,748 0,809 0,863 0,914 0,956 1,000
158,8 193 236,0 300,0 413,0 638,6 1772,8 + оо
— 117,1 —151,3 —194,3 —258,3 —371,4 —597,9 — 1731,1 —ос
0,012 0,012 0,012 0,012 0,012 0,012 0012 0 012
0,0241 0,042 0,068 0,107 0,161 0,231 0,309 0,387 0,484 0,509 0,548 0,578 0,599 0,612 0,621 0,627 0,632 0,633 0,633 0,633 0,633 0,633 0,633 0,633 0,633 0,633 0,633 0,633 0,633 0,025 0,0445 0,077 0,128 0,198 0,289 0,380 0,469 0,544 0,603 0,641 0,663 0,674 0,682 0,685 0,688 0,689 0,690 0,690 0,690 0,690 0,690 0,690 0,690 0,690 0,690 0,690 0,690 0,690 0,0252 0,046 0,082 0,139 0,223 0,331 0,442 0,545 0,633 0,681 0,711 0,728 0,735 0,740 0,744 0,746 0,747 0,748 0,748 0,748 0,748 0,748 0,748 0,748 0,748 0,748 0,748 0,748 0,748 0,0255 0,050 0,096 0,168 0,277 0,404 0,153 0,642 0,712 0,752 0,775 0,788 0,797 Q 801 0,803 0,805 0,806 0,807 0,808 0,809 0,809 0,809 0,809 0,809 0,809 0,809 0,809 0,809 0,809 1 0,026 0,0513 0,099 0,180 0,305 0,454 0,556 0,681 0,764 0,812 0,837 0,850 0,857 0,860 0,861 0,862 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,863 0,0263 0,052 0,105 0,200 0,345 0,521 0,681 0,792 0,855 0,886 0,900 0,907 0,911 0,912 0,913 0,9135 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,914 0,0265 0,057 0,123 0,244 0,424 0,633 0,794 0,890 0,933 0,949 0,954 0,955 0,956 0,956 0 956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,956 0,027 0,061 0,134 0,273 0,475 0,693 0,855 0,936 0,972 0,988 0,997 0,997 0,997 0.997 0 997 0,997 0,997 0,997 0,997 0,997 0(997 0,997 0,997 0,997 0,997 0,997 0,997 0,997 0,997
Нет смысла приводить совершенно аналогичные вычисления для всех
остальных значений В/R, полученных в табл. 12. Однако такие расчеты были
проведены, и полученные результаты сведены в общую табл. 14, представ-
ляющую основу для всего нашего анализа.
В табл. 14' сделана сводка значений составов паровой фазы для ряда
значений B1R на всех контактных ступенях отгонной колонны, начиная от
кипятильника и кончая той ее тарелкой, па которой достигается с практи-
чески допустимой точностью предельная концентрация, отвечающая данному
значению притока тепла в кипятильник. В первой и второй строках табл.14
приведены пары значений равновесных составов паровой и жидкой фаз, охва-
тывающие интервал концентраций жидкой фазы от 1 до 100% и паровой
•фазы от 2 до 100% по весу. В третьей строке приведены отвечающие этим
парам равновесных составов те значения притоков тепла-в кипятильник B/R,
для которых эти составы являются предельными. Эти данные берутся из
ранее рассчитанной табл. 12 или из графика, дающего (В//?)мин в функции
угр или хгр. В четвертой строке табл. 14 приведены значения теплового пара-
метра 0], при помощи которого ведется аналитический расчет числа тарелок
и состава фаз на них по уравнению концентраций (V. 34). В остальных стро-
ках табл. 14 даются значения составов паровой фазы, покидающей данную
контактную ступень, причем кипятильник принят за нулевую тарелку.
Анализ табл. 14 вскрывает чрезвычайно важную особенность
хода изменения составов парового потока по высоте отгонной
колонны. Оказывается, что для каждого определенного значе-
ния тепла кипятильника В//? на некотором конечном и отно-
сительно небольшом числе тарелок происходит быстрое при-
ближение к граничному составу, отвечающему этому значению
притока тепла в кипятильник, а затем дальнейшее нарастание
составов на последующих ступенях контакта бесконечно замед-
ляется. Таким образом, предельная концентрация, отвечающая
рассматриваемому значению В//?, достижима теоретически лишь
при бесконечно большом числе ступеней процесса. Однако прак-
тически, как легко видеть из табл. 14, этот предельный состав
может быть достигнут с вполне допустимой степенью прибли-
жения при конечном и сравнительно небольшом числе таре-
лок.
Так, например, для рассматриваемой бинарной системы бензол — толуол,
для которой составлена табл. 14, расходу тепла в кипятильнике BR —
= 34 ккал/кг остатка отвечает предельная концентрация угр = 0,027. Хотя
с теоретической точки зрения этот состав может быть достигнут лишь при
бесконечно большом числе тарелок отгонной колонны, но из табл. 14 легко
видеть, что уже пар, поднимающийся ,с_5-й тарелки, по составу .практически
совпадает с этой граничной концентрацией. Следовательно, все остальные
тарелки, если бы они были установлены, от 6-й и до какого угодно большого
числа, были бы совершенно бесполезны, ибо их обогатительный эффект равен
нулю_и они никак не дадут возможности превзойти граничный для данного
теплового режима работы колонны состав угр = 0,027. Этим мы еще раз под-
тверждаем- сделанное ранее утверждение, согласно которому смысл вывода
о достижимости на верху колонны предельной концентрации лишь при бес-
конечном числе тарелок заключается не столько в теоретической невозмож-
ности достичь при данном В/R определенного граничного состава, сколько
в том, что ни при каком числе тарелок отгонной колонны этого состава
.превзойти нельзя, после того как он достигнут на сравнительно небольшом
•числе тарелок.
Анализ проблемы ректификации в отгонной колонне
225
Из рассмотрения табл. 14 можно далее сделать вывод, что с увеличением
притока тепла в кипятильник прогрессивно нарастает значение граничного
•состава, практически достижимого на верху отгонной колонны. Так, для
В/R = 135,8 ккал/кг предельная концентрация растет до угр = 0,566, а для
B]R = 1772,8 ккал/кг практически достижимый на верху колонны состав уже
становится равным угр = 0,956. Очевидно, дальнейшее увеличение В/R при-
ведет к возможности получения с верха отгонной колонны уже практически
чистого низкокипящего компонента — бензола. Так подтверждается сделанное
ранее утверждение о принципиальной возможности разделения в отгонной
колонне исходной бинарной системы на ее практически чистые составляющие.
Однако из той же таблицы легко видеть, как при этом должен резко воз-
растать необходимый для поддержания теплового режима колонны приток
тепла в кипятильник — обстоятельство, делающее экономически нецелесо-
образным получение двух практически чистых компонентов в отгонной
колонне.
Таблицы типа табл. 14 имеют глубокий смысл и значение для расчета
•отгонной колонны, ибо дают полную картину всех возможных вариантов ее
работы. Пусть, например, в рассматриваемой задаче разделения системы бен-
зол— толуол на практически чистый толуол состава хя = 0,005 дополнительно
требуется получать с верха отгонной колонны паровой поток состава yD — 0,495.
Это требование, конечно, должно быть согласовано со значением состава а
исходного сырья, который по условию материального баланса и по условию
подачи с ырья и отгонную-колонну; только в- жидком-состоянии может варьи-
ровать в вполне определенных пределах.
Из рассмотрения табл. 14 можно заключить, что при значениях притока
тепла в кипятильник колонны, меньших B/R = 116,3 ккал/кг, ни при каком
числе тарелок ни теоретически, ни практически нельзя достичь на верху
отгонной колонны состава паров уп = 0,495. Но уже при В//? = 116,3 ккал/кг
этот состав оказывается практически достигнутым на 24-й тарелке. Как указы-
валось выше, работа колонны при минимальном притоке тепла в кипятиль-
ник или при значениях, близких к минимальному, неустойчива и подвержена
нарушениям при самых небольших колебаниях режима питания или нагрева.
Поэтому на практике всегда работают с некоторым избытком величины при-
тока тепла в кипятильник против его минимального значения. Допустим, что
приток тепла в кипятильник доведен до В/R = 135,8 ккал/кг или, иначе
говоря, увеличен приблизительно на 17%. В этом случае число тарелок,
необходимых для получения на верху колонны желательного состава yD = 0,495,
сокращается до 12, в чем легко убедиться из рассмотрения основной таблицы.
Больше того, если продолжать увеличивать приток тепла в кипятильник, то,
как нетрудно видеть из той же таблицы, это увеличение В/R будет сопро-
вождаться уменьшением необходимого числа тарелок, но лишь до некоторого
определенного предела. Так, если довести приток тепла в кипятильник до
значения B/R = 638,6 ккал/кг, т. е. увеличить сравнительно с минимальным
значением в 5,5 раза, то желательный состав yD = 0,495 будет достигнут
между 5-й и 6-й тарелками, причем дальнейшее увеличение притока тепла,
-вплоть до бесконечно большого, не оказывает никакого влияния на необхо-
димое число тарелок. Оно остается попрежнему, где-то по середине между
5-й и 6-й тарелками. Подобный анализ можно провести и для любого другого
значения состава верхних паров, причем общий вывод, конечно, будет один и
дот же.
Обычно состав а исходного сырья бывает известен, и после
выбора того или иного режима работы колонны, определяемого
принятием конкретного значения В/R и установлением по табл. 14
числа тарелок отгонной колонны и распределения составов фаз
•по ее высоте, необходимо для завершения расчета найти тепло-
15 Зак. № 304.
226
Отгонная ректификационная колонна
содержание сырья на входе в колонну. Эта задача проще всего
решается путем сочетания уравнений (V. 11) и (V. 16):
(V. 48)
Составы в правой части уравнения (V. 48) известны, вели-
чина рассчитывается по принятому значению В/R, и поэтому
значение q0 определяется из уравнения (V.48) однозначно. При
решении подобных задач следует иметь в виду, что иногда
может потребоваться подавать сырье в колонну в состоянии»
недогретой до точки начала кипения.
Дуемсдщстал-хгырья а = О.ЗОО^щыбранндЙ. режим работы колонны опре-
деляется притоком в кипятильник b/R = 135,8 ккал!кг тепла. Для этого
режима работы отгонной колонны число ее тарелок, необходимое для дости-
жения = 0,495, равно двенадцати, а тепловой параметр 0, = —93,1 ккал/кг
остатка. Теплосодержание единицы веса паров состава yD = 0,495, находя-
щихся при своей точке начала, конденсации, QD = 121,5 ккал/кг. Подставляя
надлежащие величины в уравнение (V. 48), найдем теплосодержание q0 сырья
на входе в колонну:
. - 0,495 — 0,300 ,
Чо = 121,5 — q-495 _ qqo5-(121,5+ 93,1) = 36,0 ккал!кг.
Нанеся фигуративную точку сырья на тепловую диаграмму, нетрудно
убедиться, что она располагается ниже кривой теплосодержаний насыщенной
жидкой фазы и поэтому характеризует сырье, немного недогретое до начала
кипения.
Рассмотрим другой пример использования табл. 14. Пусть требуется
разделить в отгонной колонне исходную систему начального состава а =
= 0,407 на практически чистый толуол степени чистоты = 0,005 с относи-
тельным выходом последнего, равным R/L = 0,360. При этом пары, отходящие
с верха отгонной колонны, должны иметь состав, определяемый путем реше-
ния уравнения (V. 12) относительно yD:
yD=x* + ^(“- *r) = 0,005 + °'4°^64(у °- = 0,633.
Из табл. 14 можно заключить, что минимальный расход тепла, при кото-
ром на верху колонны получаются пары состава yD = 0,633, составляет
B/R = 158,8 ккал!кг. При этом уже на 18-й тарелке практически достигается
предельный состав парового потока yD = 0,633. Однако, если увеличить при-
близительно в полтора раза минимальный приток тепла в кипятильник и
довести его до BIR = Q2G ккал/кг, то желательный состав паров будет до-
стигнут уже на 9-й тарелке. Дальнейшее даже очень большое увеличение
расхода тепла в кипятильнике уже не вызывает столь резкого снижения
числа необходимых тарелок, которое даже для бесконечно большого значе-
ния BjR остается на уровне шести тарелок. Совершенно ясно, что и в дан-
ных случаях работы с увеличенным В/R сырье подается в колонну не в на-
сыщенном, а в недогретой до точки кипения состоянии. Здесь уместно
заметить, что вообще питание отгонной колонны несколько недогретым до
начала кипения сырьем является практически часто встречающимся способом
подвода сырья.
Может представиться и такой случай, когда фиксируются по исходному
заданию составы и верхнего и нижнего продуктов колонны и требуется
Анализ проблемы ректификации в отгонной колонне
227
выбрать такой режим работы, при котором сырье подавалось бы на верхнюю
тарелку в насыщенном состоянии. Здесь, очевидно, также можно воспользо-
ваться табл. 14 и уравнением (V. 18), которое, однако, уже решается мето-
дом постепенного приближения для каждого принятогд_,аначения BJR, Так,
если xR =0,005 и yD = 0,633, а приток тепла в кипятильник принят "равным
B]R = 236 ккал]кг, то по предыдущему число тарелок отгонной колонны
равно девяти. Состав же сырья, если оно находится при точке начала кипе-
ния, определится методом постепенного приближения из уравнения
Qn Qo
а = Уо~ -Q^OT (У° ~ Xr)‘ (V- 49)
Найдем этот состав. Теплосодержание насыщенных паров состава yD =
= 0,633 равно Qd = 124,0 ккал] кг, а тепловой параметр 0, = —194,3 ккал]кг.
Зададимся составом а = 0,461 и проверим это значение по уравнению (V. 49).
Из тепловой диаграммы этому составу сырья, находящегося в точке начала
кипения, отвечает теплосодержание </0 = 37 ккал]кг. Подставляя необходимые
данные в уравнение (V. 49), имеем
124 — 37
а = 0,633 — (0,633 - 0,005) = 0,461.
124 + 194,3 4 7
Что подтверждает правильность предварительно принятого значения.
Если сырье подается в колонну при температуре, более
низкой, чем точка его начала кипения, то, как указывалось
выше, его состав и теплосодержание связаны уравнениями
(V. 48) и (V. 49) и по одному из этих параметров может быть
однозначно определен другой. При выборе того или другого
возможного варианта работы отгонной колонны следует руко-
водствоваться соображениями экономической целесообраз-
ности, учитывая размер капитальных затрат на сооружение
колонной установки и эксплуатационные расходы, связанные
с ее непрерывной работой. То обстоятельство, что увеличение
расхода тепла в кипятильнике, начиная с некоторого зна-
чения, лишь немного уменьшает высоту колонны, а в после-
дующем и вовсе не влияет на число ее тарелок, но зато
приводит к резкому возрастанию масс циркулирующих в ко-
лонне потоков паров и жидкостей, к увеличению диаметра
колдйны и поверхностей нагрева, служит важным крите-
рием при выборе режима работы отгонной колонны. При
выборе теплового режима следует принимать тепло кипятиль-
ника, лишь немногим превосходящее минимально необходимое
для назначенного разделения.
Смысл использования основной табл. 14 состоит еще и в том,
что она позволяет путем интерполяции для любого назначен-
ного состава, например верхних паров, сразу находить сопря-
женные значения числа тарелок колонны и величины при-
тока тепла в кипятильник для самых различных режимов
работы.
15*
Так, например, если состав верхних паров колонны должен равняться
yD = 0,750, то сразу из таблицы можно сделать заключение относительно
нижней границы величины B/R, согласно которому она не может быть
меньше В/R = 236,0 ккал/кг. Далее из той же таблицы можно сразу ви-
деть, что для получения этого состава на верху 10-тарелочной колонны
нужно подавать в кипятильник около 300 ккал/кг на 1 кг нижнего продукта.
Подобные данные, сразу получаемые на основе табл. 14 для любого режима
работы отгонной колонны, используются для технико-экономического анализа
рассматриваемой проблемы разделения, и выбранный оптимальный вариант
в последующем окончательно уточняется во всех подробностях.
Табл. 14 можно построить и несколько по-другому, запол-
няя ее составами не паровой, а жидкой фазы на последователь-
ных ее ступенях контакта. Выводы при этом получаются те же.
Наконец, можно представить в табл. 14 для каждой тарелки
составы и жидкой и паровой фаз. При этом получается наи-
более полная картина всех возможных вариантов работы от-
гонной колонны по разделению данной системы на нижний
продукт определенного состава.
Компоненты рассмотренной бинарной системы бензол — то-
луол выкипают в довольно узком 30-градусном интервале тем-
ператур, равновесные составы их довольно близки, и поэтому
коэффициент обогащения m этих веществ сравнительно неве-
лик. В связи с этим разделение этой системы требует довольно
большого числа равновесных ступеней контакта. Другое дело
системы, состоящие из веществ, точки кипения которых до-
вольно далеки друг от друга, например система гептан —
эндекан, для которой разность в точках кипения компонен-
тов 96°. Здесь коэффициент обогащения относительно велик,
и разделение этой системы осуществляется сравнительно просто
и не требует большого числа ступеней.
Из предыдущего изложения можно сделать вывод, что
составление основной расчетной табл. 14, рассмотренной на
примере разделения системы бензол — толуол, важно при
анализе проблемы ректификации любой системы в отгонной
колонне. Такая таблица дает решение общей проблемы раз-
деления в отгонной колонне данной бинарной системы и поз-
воляет сразу получить ответы на многие вопросы, возникаю-
щие при выборе надлежащего режима работы колонны.
ГЛАВА VI
УКРЕПЛЯЮЩАЯ РЕКТИФИКАЦИОННАЯ КОЛОННА
§ 1. Описание колонны
Ректификационная колонна называется укрепляющей, если
разделяемое сырье подается в паровой фазе под нижнюю та-
релку. Иногда укрепляющие колонны называют еще непол-
ными колоннами для ректификации паров.
С верха укрепляющей колонны в паровой фазе с желатель-
ной степенью чистоты отводится низкокипящий компонент исход-
ной бинарной системы, а с шин ей тарелки получается флегма ,
в общем случае достаточно отличающаяся по составу от практи-
чески чистого высококипящего компонента.
Для обогащения состава нижней флегмы укрепляющей ко-
лонны высококипящим компонентом часто оказывается необхо-
димой ее дополнительная ректификация, которой укрепляющая
колонна обычно не обеспечивает. В этом и кроется причина
использования термина „неполная" при характеристике ее
работы.
Как будет видно из дальнейшего изложения, работу укреп-
ляющей колонны можно построить таким образом, чтобы с низа
ее все же получать флегму, как угодно обогащенную тяжелым
компонентом. При этом, однако, процесс оказывается неэконо-
мичным из-за необходимости перегрева сырья, циркуляции
в колонне слишком больших масс жидкостей и паров и пере-
грузки конденсатора колонны. Поэтому задача обогащения ниж-
ней флегмы укрепляющей колонны высококипящим компонен-
том обычно разрешается другими средствами. Замечание это,
как и для отгонной колонны, необходимо, чтобы с самого начала
подчеркнуть принципиальную возможность полного разделения
в укрепляющей колонне данной бинарной системы на ее практи-
чески чистые составляющие.
Схематическое изображение укрепляющей колонны и дви-
жения потоков в ней приведено на фиг. 62. Сырье L в паровой
фазе подается на нижнюю тарелку колонны, с которой отво-
дится нижняя флегма R состава xR, представляющая собой
один из целевых продуктов колонны. Паровой поток Gi с верх-
ней, первой по счету тарелки колонны отводится в парциальный
пл
конденсатор колонны, где за счет отнятия d ккал тепла
подвергается частичной конденсации, образуя поток флегмы g0',
возвращающейся в качестве орошения в колонну, и паровой
остаток конденсации, дестиллат D состава yD, отводимый в каче-
лонны можно оказывать
Фиг. 62.
Схема укрепляющей ко-
лонны.
стве основного целевого продукта колонны.
Вследствие отвода тепла в парциальном конденсаторе ко-
энергетическое воздействие на ход
процесса ректификации в укреп-
ляющей колонне.
Паровое сырье, поднимаясь
снизу вверх по колонне, встре-
чается на последовательных та-
релках со стекающим потоком
флегмы и, контактируя с ней,
все более и более обедняется
высококипящим компонентом,
диффундирующим из парового
потока в жидкий. При этом
обмен веществом между контак-
тирующими паровой и жидкой
фазами идет в двух направлениях
и из жидкости в пар тоже диф-
фундирует низкокипящий компо-
нент, усиливая тем самым процесс
облегчения паровой и утя-
желения жидкой фазы. Выбрав
надлежащее число контактных
ступеней и тепловой режим
работы укрепляющей колонны,
добиться какого угодно низкого содержания тяжелого
можно
компонента в верхних парах колонны.
С другой стороны, жидкий поток g0', идущий из парциаль-
ного конденсатора, по мере нисходящего движения по высоте
колонны все более обогащается высококипящим компонентом
за счет его диффузии из пара, с которым контактирует флегма,
и за счет того еще, что из самой жидкости низкокипящий компо-
нент диффундирует в паровой поток. Поэтому флегма 7?, ухо-
дящая с нижней тарелки укрепляющей колонны, содержит уже
значительное количество высококипящего компонента, продиф-
фундировавшего из парового потока на последовательных сту-
пенях контакта по всей высоте колонны.
§ 2. Материальный и тепловой балансы
укрепляющей колонны
Как и в отгонной колонне, для получения соотношений, свя-
зывающих веса, составы и теплосодержания паровых и жидких
потоков, входящих и выходящих из укрепляющей колонны,
Материальный и тепловой балансы укрепляющей колонны
231
необходимо составить уравнения материального и теплового
балансов.
Материальный баланс всего объема укрепляющей колонны
составляется на основе того соображения, что вес поступаю-
щего в колонну парового сырья L должен равняться сумме
весов D и /? продуктов ректификации, отводимых с верха и
с низа колонны:
L = D + R. (VI. 1)
Материальный баланс по содержащемуся в этих потоках
низкокипящему компоненту представится уравнением
La = DyD + RxR. (VI. 2)
Легко заметить полное совпадение уравнений (VI. I) и (VI. 2)
с соответствующими выражениями общих материальных балан-
сов, полученными для отгонной колонны. Это станет понятным,
если учесть, что мысль, выражаемая этими соотношениями,
в обоих случаях одна и та же, а именно, что вес исходного
сырья равен сумме весов продуктов ректификации или что вес
содержащегося в сырье компонента равен сумме весов рас-
сматриваемого компонента в верхнем и нижнем продуктах
колонны. Соответственно и относительные веса целевых про-
дуктов колонны представятся тождественными в обоих случаях
соотношениями;
/? ' Ул — a D а — Х„
= (VI-3) V7 = V---(VL4>
L XD XR L Уо XR
Состав а парового потока сырья и состав yD основного целе-
вого продукта укрепляющей колонны обычно бывают известны
по заданию для расчета, в котором, естественно, должно быть
указано, какое сырье подвергается ректификации и какие
качества должен иметь основной целевой продукт, отводимый
с верха колонны. Однако этих двух начальных данных еще
недостаточно для определенности задачи нахождения весов
потоков, так как число неизвестных равно пяти, а число рас-
полагаемых независимых уравнений составляет всего лишь два.
В самом деле, если вести расчет на единицу веса сырья, то,
как и в отгонной колонне, при рассмотрении общей задачи ректи-
фикации бинарной системы в укрепляющей колонне ’неизвест-
ными переменными величинами являются RfL, D/L, a, xR и yD.
Эти неизвестные величины связаны двумя независимыми урав-
нениями (VI. 3) и (VI. 4) или (VI. 1) и (VI. 2).
Поскольку помимо этих двух уравнений проектировщик
обычно располагает еще значениями а и yD, число неизвестных,
подлежащих определению, сокращается уже до трех. Для опре-
деленности проблемы необходимо помимо известных а и yD
232 Укпрп пatfiinno ПРКТидшкдитцОННПЯ tcnintJtjn
задаться значением еще одной какой-нибудь из остальных трех
неизвестных величин. Можно, например, задаться относитель-
ным весом D/L верхнего продукта, или составом xR нижней
флегмы, или, наконец, ее относительным весом /?/Ь. Во всех
этих случаях значения оставшихся неизвестными двух величин
могут быть определены по уравнениям (VI. 1) и (VI. 2) или по-
уравнениям (VI. 3) и (VI. 4).
Принятие той или иной неизвестной величины имеет опре-
деляющее значение для режима работы укрепляющей колонны,
и поэтому необходимо отчетливо представлять характер того
влияния, которое оказывает изменение одной из этих величин
на другие. Так, из рассмотрения уравнения (VI. 3) легко заме-
тить, что с уменьшением состава xR нижней флегмы, иначе
говоря, с утяжелением ее уменьшается при прочих равных
условиях и ее вес R/L и, следовательно, на основании уравне-
ния (VI.1) увеличивается вес D/L верхнего продукта колонны.
Отсюда ясно, что, наоборот, повышение веса дестиллата D/L
должно иметь следствием понижение состава xR нижней флегмы
укрепляющей колонны. Далее из уравнения (VI. 4) можно заклю-
чить, что увеличение состава yD верхнего продукта влечет за
собой при прочих равных условиях понижение его теса и, сле-
довательно, увеличение веса нижнего продукта. Из материаль-
ного баланса укрепляющей колонны в целом не удается извлечь
других дополнительных сведений, и поэтому уместно перейти
к рассмотрению ее уравнения теплового баланса.
Тепловой баланс укрепляющей колонны в целом состав-
ляется на основе того соображения, что количество тепла,
вносимого в аппарат сырьем, делится на три части, которые
отводятся из парциального конденсатора колонны и с ее двумя
целевыми продуктами:
LQ0 = DQd+ RqR + d, (VI. 5)
где d— тепло, отнимаемое в парциальном конденсаторе.
Чтобы упростить методику последующих расчетных опе-
раций, имеет смысл преобразовать уравнение (VI. 5) к более
удобному виду, симметричному с уравнением (VI. 2), при по-
мощи обозначения
= (VI. 6)
Подстановка из уравнения (VI. б) в уравнение (VI. 5) преобра-
зует последнее к виду
LQ0 = D62 + RqR. (VI. 7)
Физический смысл теплового параметра 02 будет выяснен
в дальнейшем при рассмотрении работы какой-нибудь отдель-
ной, выделенной части укрепляющей колонны.
Материальный и тепловой балансы укрепляющей колонны
233
Сочетание уравнений (VI. 7) и (VI. 1) позволяет выразить отно-
сительные веса целевых продуктов колонны через тепловые
величины при помощи соотношений, симметричных уравне-
ниям (VI. 3) и (VI. 4):
(VI. 8)
02 — qR
Если путем сочетания ура-
внений (VI. 3) и (VI. 8) или
(VI. 4) и (VI. 9) исключить от-
носительные веса /?/L и D/L,
то можно получить соотноше-
ния, связывающие лишь со-
ставы и тепловые параметры
сырья и продуктов ректифика-
ции:
^2 --- Qo
s l- а
yD
Уо--XR
(VI
10)
И V Х~к- = 7Г----— (VL П)
Уд XR
Легко убедиться, что тож-
дества (VI. 10) и (VI. 11) эквива-
лентны друг другу. В самом
деле, вычтя из единицы пра-
И
£> Qo—
Z. 02 — q р
(VI. 9)
Фиг. 63. Связь между фигуративными
точками сырья и продуктов укрепляю-
щей колонны на тепловой диаграмме.
вую и левую части уравнения
(VI. 10) и приведя к общему знаменателю, получим уравне-
ние (VI. 11).
Соотношения (VI. 10) или (VI. II) являются необходимым и
достаточным условием, чтобы на тепловой диаграмме три точки
(a,Qo)> (хр><7я) и (Уп’Ог) лежали на одной прямой. Построение,
основанное на этих тождествах, показано на фиг. 63. Соответ-
ствующие фигуративные точки на тепловой диаграмме обозна-
чены теми же буквами, что и веса сырьевых паров, верхнего
и нижнего продуктов колонны. При рассмотрении отгонной
колонны было указано преимущество графических построений на
тепловой диаграмме, позволяющих наглядно представить связь и
взаимозависимость между отдельными факторами, характери-
зующими работу колонны. В равной мере это относится и к
рассматриваемому случаю укрепляющей колонны. Так, из
фиг. 63, например, легко усмотреть, что увеличение состава
нижней флегмы при неизменном тепловом состоянии сырья при-
водит к увеличению относительной величины d/D съема тепла
в парциальном конденсаторе колонны. В самом деле, если фигу-
ративная точка /? нижней флегмы переходит в область боль-
шего обогащения низкокипящим компонентом — в точку R', то
точка D перемещается в D' и относительный съем тепла в кон-
денсаторе измеряется уже не отрезком CD, а пропорциона-
лен большему отрезку CD'. Очевидно, обратная картина наблю-
дается при уменьшении состава xR нижней флегмы, когда ее
фигуративная точка переходит, например, в точку R". В этом
случае точка D перемещается вниз, в положение D", и съем
тепла в конденсаторе пропорционален уже меньшему от-
резку CD". Из того же построения можно сделать и другой
вывод, согласно которому, чем выше теплосодержание сырья на
входе в укрепляющую колонну, тем большее количество
тепла d/D должно быть удалено из парциального конденсатора.
Действительно, если бы фигуративная точка L сырья перешла
с линии насыщенного пара в область перегретых паров, иначе
говоря, заняла какое-то положение L', то относительный съем
тепла в конденсаторе измерялся бы уже большим отрезком СО'".
Так тепловая диаграмма позволяет анализировать энерге-
тическую сторону процесса ректификации в укрепляющей
колонне, указывая направления того или иного изменения
и давая его количественную оценку.
§ 3. Изменение съема тепла в парциальном конденсаторе
укрепляющей колонны
При анализе уравнений (VI. 3) и (VI. 4) было показано, что
изменение состава нижней флегмы укрепляющей колонны имеет
следствием изменение весов обоих (верхнего и нижнего) целе-
вых продуктов колонны. Поэтому установление характера из-
менения величины съема тепла в парциальном конденсаторе
при варьировании качеств целевых продуктов удобно вести не
на единицу переменного в этих условиях веса верхнего про-
дукта D или нижнего R. а на единицу неизменного при всех
условиях веса исходных сырьевых паров L. В этой связи урав-
нение теплового баланса (VI.5) удобно преобразовать к сле-
дующему виду:
l(Q0-^=L6<> = dQd + R^ (VI. 12)
где
0o — Qo —- -jj- ккал/кг сырья. (VI. 13)
Если исключить из уравнений (VI. 1), (VI. 2) и (VI. 12) веса
потоков L, D и R, то получится соотношение
“ — XR °о— Ч R
yD — a Qd — ’
(VI. 14)
Изменение съема тепла в парциальном конденсаторе
235
являющееся необходимым и достаточным условием того, чтобы
три точки (а, 0О), (xR, qR) и (yD, QD) лежали на тепловой диа-
грамме на одной прямой. Соответствующее построение пока-
зано на фиг.' 64. Из подобия заштрихованных треугольников
непосредственно вытекает соотношение (VI. 14), лежащее
в основе последующего анализа.
Допустим, что режим работы укрепляющей колонны изме-
няется таким образом, что при неизменном составе верхнего
продукта yD состав нижней флегмы xR утяжеляется и фигу-
ративная точка нижнего продукта
колонны перемещается из положе-
ния R в положение R'. Если в пер-
вом случае при исходном значении
xR съем тепла в конденсаторе на
единицу веса сырья измеряется на
основании уравнения (VI.13) отрез-
ком CL, то во втором случае, когда
состав нижнего продукта делается
меньше и равен уже xR <xR, съем
тепла в парциальном конденсаторе
будет пропорционален меньшему
отрезку C'L. Таким образом, можно
сделать заключение, что по мере
утяжеления продукта, уходящего
с нижней тарелки колонны, съем
Фиг. 64. Влияние составов целе-
вых продуктов на отдачу тепла
в парциальном конденсаторе.
тепла в парциальном конденсаторе уменьшается при условии
неизменности качеств верхнего целевого продукта колонны.
Равным образом из рассмотрения той же фиг. 64 можно уста-
новить, что обратная картина будет при увеличении xR, иначе
говоря, при облегчении состава нижнего продукта колонны.
В этом случае, очевидно, съем тепла в парциальном конден-
саторе колонны должен увеличиться.
Далее представляет интерес выяснить, как влияет на вели-
чину съема тепла в конденсаторе варьирование состава yD верх-
него. продукта при неизменном составе xR флегмы, уходящей
•с ее нижней тарелки. Из графика фиг. 64 легко заметить, что
при уменьшении состава yD прямая RCD повернется влево
около точки R как вокруг центра вращения и, если, напри-
мер, новое значение состава ректификата равно yD', то эта
прямая займет положение RC'D'. При этом съем тепла в кон-
денсаторе уменьшится, так как его величина теперь будет
измеряться отрезком C'L вместо CL. Если же состав yD растет,
иначе говоря, ректификат облегчается, то съем тепла в кон-
денсаторе увеличивается, так как прямая RD поворачивается
уже вправо и точка ее пересечения с вертикалью а=const
занимает уже более низкое положение, чем начальная точка С.
Таким образом, можно сделать заключение, что по мере
облегчения продукта, уходящего с верха парциального кон-
денсатора, съем тепла в последнем увеличивается при условии
неизменности качеств нижнего продукта колонны. При утяже-
лении дестиллата имеет место обратная картина.
Наконец, из того же графика фиг. 64 вытекает, что, изме-
няя одновременно составы нижнего продукта в сторону утя-
желения, а верхнего в сторону облегчения, можно сохранить
неизменной величину съема тепла в парциальном конденса-
торе колонны. Сопряженные значения составов yD и xR продук-
тов колонны, отвечающие условию неизменности съема тепла
в конденсаторе, могут быть легко найдены путем вращения
прямой RCD вокруг точки С как центра. Абсциссы точек
пересечения этой прямой с линиями теплосодержаний паровой
и жидкой фаз определят искомые сопряженные значения yD
и xR, при которых съем тепла в парциальном конденсаторе
сохраняет постоянное значение, пропорциональное отрезку CL.
Известные ограничения, налагаемые особенностями перера-
батываемых исходных систем, будут выяснены в последующем
изложении.
Все выводы, сделанные выше на основе анализа свойств
тепловой диаграммы, могли быть получены и путем рассмо-
трения аналитических соотношений типа уравнения (VI. 14) без
графических построений на тепловой диаграмме. Однако по-
следние обладают важным преимуществом простоты и нагляд-
ности, хотя за аналитическими методами сохраняется достиже-
ние большей точности при количественной оценке конечных
результатов.
Таким образом, на основе соотношений материального и
теплового балансов укрепляющей колонны в целом возможно
сделать ряд важных выводов относительно связи и взаимоза-
висимости между составами целевых продуктов и энергетиче-
скими факторами, регулирующими режим ее работы. В даль-
нейшем эта связь будет изучена глубже.
§ 4. Уравнения концентраций укрепляющей колонны
Расчет укрепляющей колонны состоит в установлении
соотношений, позволяющих определять составы и тепловые
свойства паровых и жидких потоков на всех ее уровнях. За
исходную точку при анализе работы укрепляющей колонны
обычно принимается верхний продукт D, уходящий в паровой
фазе из парциального конденсатора. Дестиллат D должен иметь
требуемый состав yD и находиться при точке начала конден-
Уравнения концентраций укрепляющей колонны
237
сации или росы tD, иначе говоря, дестиллат отводится из пар-
•циального конденсатора как паровой остаток процесса одно-
кратной конденсации в нем. Здесь важно подчеркнуть, что
парциальный конденсатор укрепляющей колонны является
единственной ступенью во всем рассматриваемом колонном
аппарате, где имеется не диффузия контактирующих разно-
именных фаз, а частичная конденсация охлаждаемого парового
потока Glt поднимающегося в конденсатор с верхней тарелки
колонны, за счет отнятия d калорий тепла. Предполагая про-
цесс однократной конденсации паров Gi протекающим обратимо,
можно заключить, что они разделяются на две равновесно
сосуществующие фазы — паровую и жидкую. Верхний целевой
продукт колонны, дестиллат D, является паровой фазой, отде-
лившейся в процессе однократной конденсации, и поскольку
его состав yD известен, то по равновесным соотношениям легко
может быть найден состав х0' равновесной флегмы gQ', пред-
ставляющей жидкую фазу, образующуюся при однократной
конденсации паров Gx. В первом приближении это определение
можно сделать по изоиарным кривым кипения и кондснсации ,
а для более точного установления значения х0‘ можно рассчи-
тать его по уравнению равновесия. Так устанавливаются составы
равновесных потоков, покидающих парциальный конденсатор
колонны.
Значительно сложнее проблема определения состава ух паро-
вого потока Gn поступающего с верхней тарелки колонны
в парциальный конденсатор и пересекающего тот же горизон-
тальный уровень колонны, что и флегма g0', стекающая из
конденсатора. Здесь уже нельзя использовать равновесные
соотношения, так как встречные в одном межтарелочном отде-
лении потоки не находятся в равновесии друг с другом, и то
обстоятельство, что состав флегмы g0' известен, не помогает
в определении состава пара Gx, который, вообще говоря, может
иметь любое значение на интервале < У1 < Уд-
Так выявляется необходимость в соотношениях, связываю-
щих составы встречных на одном уровне колонны паровых и
жидких фаз. Если бы мы располагали каким-нибудь средством,
позволяющим по известному составу одной фазы находить
состав встречной на одном уровне другой фазы, то задача
расчета колонны в основном была бы решена. В самом деле,
попеременно используя соотношения равновесия для нахожде-
ния составов, покидающих одну и ту же контактную ступень,
и соотношение, позволяющее рассчитать составы встречных
фаз, можно было бы пройти всю укрепляющую колонну сверху
вниз, ведя счет пройденным ступеням контакта.
Для определения соотношений, связывающих свойства
встречных на одном уровне укрепляющей колонны потоков
73Я .V/ср/?л aatninoq реКТЧфнКС!Ц110!-!М(1Я ^ОННС!
флегмы и паров, составляются уравнения материального и теп-
лового балансов для объема колонны, заключенного между вер-
хом ее и каким-либо ее произвольным межтарелочным отде-
лением.
Материальный баланс по общему весу потоков составляется
на основании того, что вес поступающих в выделенный объем
паров должен равняться сумме весов жидкой флегмы и верх-
него продукта, отводимых из него же:
Gi + i=gi + D. (VI. 15)
Из этого уравнения устанавливается важное следствие:
Gi + i — gt = D= const, (VI. 16)
согласно которому вес паров в любом межтарелочном отделе-
нии укрепляющей колонны больше веса встречного потока
флегмы на величину, равную весу верхнего продукта колонны.
Следовательно, разность весов встречных фаз в укрепляющей
колонне есть величина постоянная, и поэтому веса потоков
при переходе от одного отделения колонны к другому могут
меняться лишь в одну сторону и на одну и ту же величину.
Этот вывод был ранее получен при рассмотрении отгонной
колонны, однако количественное выражение его было дру-
гим.
Материальный баланс того же объема укрепляющей колонны
по весу содержащегося в потоках низкокипящего компонента
системы представится соотношением
Gi + iVi +1 = giXi -ф DyD. (VI. 17)
Как указывалось при изучении отгонной колонны, соотно-
шения вида уравнения (VI. 17), связывающие составы встреч-
ных на одном уровне разноименных неравновесных потоков,
называются уравнениями концентраций.
Сочетание уравнения концентраций (VI.17) с уравнением
(VI. 15) материального баланса по общему весу потоков позво-
ляет установить соотношения для расчета относительных весов
потоков паров и жидкости в текущем межтарелочном отделе-
нии укрепляющей колонны:
; (vi. 18) -g-= • (VL19>
и Xi + l xi и /1+1 — xi
По уравнениям (VI. 18) и (VI. 19) в любом сечении укрепляю-
щей колонны по известным составам встречных фаз можно рас-
считать их относительные веса.
Обычно при расчете укрепляющей колонны приходится по
известному составу жидкой фазы искать состав встречного паро-
Уравнения концентраций укрепляющей колонны
239
вого потока, и поэтому уравнение концентраций принято записы-
вать в виде, разрешенном относительно состава паровой фазы:
yi + i = + ~~ (Уи-хУ). (VI. 20)
Уравнение концентраций (VI. 20) проще всего получается
решением уравнения (VI. 18) в отношении у/ +1. Если же необхо-
димо выразить состав жидкой фазы через состав паровой, то
решать уже нужно уравнение (VI. 19) в отношении х,-
Xi=yi + i—~(yD — yi + 1). (VI. 21)
Итак, при помощи уравнений материального баланса воз-
можно связать друг с другом составы потоков, встречных на
одном горизонтальном уровне укрепляющей колонны, и остается
лишь выяснить, достаточно ли установленного соотношения для
расчета колонны.
Вернемся к поставленной ранее задаче отыскания состава
---парового потока поступающего г первой верхней тарелки
укрепляющей колонны в парциальный конденсатор. Если приме-
нить уравнение концентраций (VI. 20) к межтарелочному отделе-
нию колонны, расположенному между верхней ее тарелкой
и парциальным конденсатором, то при подстановке соответствую-
щих величин оно приходит к виду
yi = x0' + -g-(yD-x0'), (VI. 22)
где х0'*и ух — составы встречных в рассматриваемом отделении
колонны жидкого и парового потоков соответственно.
Состав х0' флегмы, стекающей из парциального конденсатора,
известен по условию ее равновесия с дестиллатными парами,
имеющими назначенный по заданию состав yD. Однако в уравне-
ние (VI.22) входит неизвестная величина относительного веса
паров G-JD, которая должна быть предварительно рассчитана,
и для этого необходимо иметь еще одно уравнение.
Из анализа работы отгонной колонны уже известно, что веса
потоков паров и флегмы, как правило, не сохраняют постоян-
ного значения в последовательных отделениях колонны, изме-
няясь от одного ее уровня к другому. Задача определения весов
встречных на одном уровне укрепляющей колонны паровых
и жидких потоков, как уже известно из рассмотрения отгонной
колонны, решается при помощи уравнения теплового баланса,
составленного для объема колонны, ограниченного верхом ее
и соответствующим межтарелочным уровнем.
• Уравнение теплового баланса рассматриваемого объема
колонны составляется на том основании, что количество тепла,
240 Укпепляющая ректиЛикаиионная колонна
вносимое паровым потоком, делится на три части, которые
уходят из выдёленного объема колонны с потоками флегмы
и ректификата и в виде тепла, отводимого в парциальном кон-
денсаторе:
Gi +1 Qi +1 = giQi + DQD+d. (VI. 23)
Сочетая уравнение (VI. 23) с уравнением (VI. б), можно при-
вести его к виду, симметричному с уравнением (VI. 17) мате-
риального баланса и более удобному для последующих пре-
образований:
Gi+ i Qi +1 = gi<ji~\-D62- (VI. 24)
Уравнение теплового баланса (VI. 24) связывает веса и тепло-
содержания парового и жидкого потоков укрепляющей колонны,
встречающихся на произвольном уровне по ее высоте. Сочета-
ние уравнения (VI. 24) с уравнением (VI. J5) позволяет выразить
веса парового и жидкого потоков при помощи тепловых величин:
= (VL25) и
Если путем сочетания уравнений (VI. 18) и (VI. 25) или (VI. 19)
и (VI. 26) исключить относительные веса встречных паровых
и жидких потоков, то можно получить соотношения, содержа-
щие лишь составы и тепловые величины, характеризующие
текущее сечение колонны:
Ур — Xj = 02 —
y, + i-xi ~ Qi + t~4i
и
Ур У{ +1 Qf + i
Уг + i ~xi~ = 1 ’ Vi
Легко убедиться, что соотношения (VI. 27) и (VI. 28) экви-
валентны друг другу. В самом деле, прибавив единицу к правой
и левой частям уравнения (VI. 28) и приведя к общему знаме-
нателю, получим уравнение (VI. 27).
Соотношения (VI. 27) или (VI. 28) наравне с уравнениями
(VI. 17) —(VI. 22) также связывают составы встречных на одном
уровне неравновесных жидких и паровых потоков и поэтому
тоже называются уравнениями концентраций укрепляющей
колонны.
Уравнения концентраций (VI. 27) или (VI. 28) (каждое порознь)
являются необходимым и достаточным условием, чтобы на тепло-
вой диаграмме три точки (уD,d2), (yi + i,Qi + i) и (х,,^) лежали
на одной прямой.
Результат имеет существенное значение для всего расчета
укрепляющей колонны. Уравнение концентраций (VI. 20) не
(VI. 27)
(VI. 28)
Уравнения концентраций укрепляющей колонны
241
могло быть решено в отношении состава ух парового потока Glt
так как не был известен относительный вес последнего. Уравне-
ния же концентраций (VI. 27) или (VI. 28), хотя не содержат
весов потоков, но в них появились новые величины уже тепло-
вого характера. Однако, как указывалось выше, используя то
свойство тепловой диаграммы, согласно которому ее линии для
любого состава насыщенных паровой и жидкой фаз сразу дают
значения их теплосодержаний, можно весьма просто графи-
ческим путем, находя точки пересечения прямых, определяемых
уравнениями (VI. 27) или (VI. 28), с линиями QwQa и qwqa тепло-
вой диаграммы, решать задачу отыска-
ния состава одного из потоков по из-
вестному составу встречного в том же
•отделении колонны другого потока.
•Соответствующее построение приве-
дено на фиг. 65. По известному зна-
чению съема тепла в парциальном кон-
денсаторе d/D рассчитывается по
уравнению (VI. 6) тепловой параметр
б2 и наносится на график точка S2
(yD,0i). По составу xt и теплосодержа-
нию qt флегмы, стекающей в каком-
нибудь сечении укрепляющей колонны,
наносится на линии теплосодержаний
жидкой фазы точка gt (xt,q.). Прямая,
соединяющая эти две точки, пересе-
кает линию теплосодержаний паровой
•фазы QwQa в точке Gi + , (yi + 1Qi + 1),
удовлетворяющей условию, выражаемому уравнением (VI. 28),
в чем легко убедиться хотя бы из подобия заштрихованных на
'фиг. 65 треугольников. Таким образом, абсцисса точки G(- + 1
дает значение искомого состава паровой фазы, пересекающей
тот же горизонтальный уровень укрепляющей колонны, что
и флегма git имеющая состав х..
Уравнение концентраций (VI. 28) приложимо к любому меж-
тарелочному отделению укрепляющей колонны, и поэтому при
помощи него, производя указанное построение на тепловой
диаграмме, всегда можно графически находить по составу одной
из фаз состав встречной в том же межтарелочном отделении
другой фазы.
Однако эти уравнения концентраций поддаются не только
графическому, но и аналитическому решению. Например, из
уравнения (VI. 27) можно получить состав паровой фазы:
Л+1 - «,+ (Уо - *,) (VI. 29)
Фиг. 65. Связь между фигу-
ративными точками встреч-
ных потоков укрепляющей
колонны на тепловой диа-
грамме.
16 Зак. М 304.
рркт11<Ьик(щионная колонка
Соотношение (VI. 29) наиболее удобно для аналитического
разрешения уравнения концентраций укрепляющей колонны.
Это же уравнение (VI. 29) может быть получено простой под-
становкой значения DIGi + i из уравнения (VI. 25) в уравне-
ние (VI. 20), выведенное ранее.
Уравнение концентраций позволяет путем постепенного при-
ближения по известному составу жидкого потока найти состав
встречного на одном уровне парового потока и совместно с дан-
ными паро-жидкого равновесия образует основу аналитического
метода расчета укрепляющих колонн.
Порядок аналитического расчета по уравнению концентра-
ций (VI. 29) следующий. Если по известному составу флегмы
в каком-нибудь текущем сечении укрепляющей колонны необ-
ходимо найти состав yi + } встречной паровой фазы, то следует
задаться значением теплосодержания Q, + t этих паров, рассчи-
тать по уравнению (VI. 29) состав у|, + t и проверить, насколько
правильно было принято значение теплосодержания Q, + 1.
Одного-двух пересчетов обычно достаточно для точного опре-
деления состава у(. + j парового потока по известному составу х(
жидкой флегмы, пересекающей тот же горизонтальный уровень
колонны. Таким образом, аналитическое решение уравнения
концентраций укрепляющей колонны можно вести лишь мето-
дом постепенного приближения, и в этом отношении оно усту-
пает графическому расчету по тепловой диаграмме в смысле
легкости и простоты. Однако аналитический расчет имеет боль-
шую точность, и в некоторых случаях этим нельзя пренебрегать.
§ 5. Определение составов фаз на тарелках
укрепляющей колонны
Установленные в предыдущем параграфе графический и ана-
литический методы расчета позволяют определять составы фаз
по всей высоте укрепляющей колонны путем попеременного
использования соотношений фазового равновесия для нахожде-
ния составов расходящихся с тарелки потоков и уравнения
концентраций в той или иной форме для определения составов
встречных на одном уровне потоков.
Рассмотрим порядок определения составов фаз в укрепляю-
щей колонне графическим методом по тепловой диаграмме
(фиг. 66).
По составу yD ректификата, известному в качестве исходной
величины, и по кривой равновесия или же по изобарным кривым
кипения и конденсации можно найти состав х0' флегмы, стекаю-
щей из парциального конденсатора на первую, считая сверху,
тарелку колонны. Для определения состава встречного пара,
поднимающегося с верхней тарелки в конденсатор, необходимо-
Определение составов фаз на тарелках укрепляющей колонны 243
Фиг. 66. Определение со-
ставов фаз на таре.',
укрепляющей колонны.
использовать графическое построение на тепловой диаграмме,
основанное на уравнениях концентраций (VI. 27) или (VI. 28).
Однако использование как графического, так и аналитического ме-
тодов расчета предполагает известной величину съема тепла d/D
в конденсаторе колонны, и, хотя вопрос ее определения будет
детально рассмотрен в последующем изложении, на данном
этапе можно считать, что величина d/D каким-то образом уже
установлена. Таким образом, дальней-
шее изложение основывается на пред-
положении, что выбрана определенная
величина съема тепла в конденсаторе
колонны.
По известному значению d/D и по
теплосодержанию QD паров ректификата,
которое непосредственно снимается с теп-
ловой диаграммы для состава yD, можно
по уравнению (VI. 6) рассчитать тепловой
параметр 02 и нанести на диаграмму
фигуративную точку S2(yD,^2). Фигура-
тивная точка g0' флегмы, стекающей из
парциального конденсатора на первую
тарелку, расположится на линии насы-
щенной жидкости тепловой диаграммы
в точке с абсциссой, равной х0'. Пунк-
тирная конода соединяет фигуративные
точки ректификата D и равновесной ему
флегмы go'. Состав ух паров, поднима-
ющихся с первой тарелки, определится
на основании уравнения концентраций (VI. 28) как абсцисса точки
пересечения Gx прямой S2g0' с линией теплосодержаний QwQa
на тепловой диаграмме. Чтобы найти состав х, флегмы gu
стекающей с первой тарелки колонны во второе ее отделение,
необходимо вновь обратиться к кривым равновесия и по со-
ставу ух найти состав хх равновесной парам флегмы. Проведя
пунктирную изотерму и соединив на основании того же
уравнения концентраций (VI. 28) прямой линией полюс S2 с фигу-
ративной точкой флегмы glt стекающей с первой тарелки, можно
определить состав у2 пара G2, поднимающегося со второй тарелки
колонны, как абсциссу точки пересечения этой прямой с линией
теплосодержаний насыщенной паровой фазы.
Продолжая дальше попеременное использование равновес-
ных данных и графического построения на тепловой диаграмме,
основанного на уравнении (VI. 28), можно, двигаясь сверху вниз
по высоте укрепляющей колонны, определять составы и темпе-
ратуры паровых и жидких потоков на всех ее последовательных
ступенях контакта. Знание составов фаз позволяет при помощи
16*
244 Укрепляющая ректификационная колонна
уравнений (VI. 18) и (VI. 19) рассчитать значения весов потоков
паров и флегмы в каждом отделении колонны. Чтобы иметь
полное представление о процессе, протекающем в укрепляющей
колонне, необходимо рассчитать для каждой ее отдельной сту-
пени контакта значения всех элементов ректификации: составов,
весов, температур и теплосодержаний паровых и жидких фаз.
Хотя при аналитическом расчете укрепляющей колонны не
прибегают к графическим построениям на тепловой диаграмме
и ведут вычисления методом постепенного приближения по
уравнению (VI. 29), однако и в этом случае имеет смысл при-
бегать к тепловой диаграмме как к вспомогательному средству
для непосредственного нахождения теплосодержаний насыщен-
ных фаз по их составам.
Конечной точкой расчета элементов ректификации укрепля-
ющей колонны является достижение на нижней тарелке состава
флегмы, стекающей навстречу поднимающемуся потоку сырье-
вых паров. Состав этих потоков, нижней флегмы и сырья, также
должен отвечать условию, накладываемому уравнением концен-
траций на встречные на одном уровне потоки. Это условие
состоит в том, что, например, прямая, соединяющая на тепловой
диаграмме фигуративную точку R нижней флегмы колонны
с полюсом S2(yo, 02), должна пройти через фигуративную
точку L (a, Qo) сырьевых паров, подающихся под нижнюю
тарелку колонны. При аналитическом расчете колонны это тре-
бование выражается в том, что подстановка соответствующих
значений в уравнение (VI. 29) превращает его в тож-
дество (VI. 9):
Qrt - О п
« = ^+-02-77(Ув-хд). (VI.30)
2 з К
Из этого можно сделать важный вывод. На фиг. 63 рас-
смотрен случай, когда сырьевые пары подаются в колонну
в перегретом состоянии. Легко заметить, что если бы пары сырья
подавались в насыщенном состоянии, то при неизменном значе-
нии величины съема тепла d/D в парциальном конденсаторе
число тарелок колонны оказалось бы меньше. Однако иногда
имеет смысл подавать сырье в колонну в перегретом состоянии,
но здесь преследуется уже другая цель, а именно добиться
утяжеления нижней флегмы колонны. В самом деле, чем выше
температура сырья, тем больше его теплосодержание и при
прочих равных условиях тем меньше должен быть состав xR
встречной сырью на одном уровне нижней флегмы колонны.
Преобразуя уравнение (VI. 10) к виду, разрешенному относи-
тельно состава xR нижнего продукта колонны, можно легко
в этом убедиться:
0, — ? Р
хк~Уо 02 — Qo (Уя ~а)’ (VI. 31)
Определение составов фаз на тарелках укрепляющей колонны 245
Чем больше теплосодержание Qo единицы веса сырьевых
паров, тем больше второй член правой части уравнения (VI. 31)
и тем меньше, очевидно, состав xR нижнего продукта колонны
по содержанию низкокипящего компонента. Но чтобы добиться
внизу колонны большего обогащения жидкой фазы высококи-
пящим компонентом, при прочих равных условиях должно по-
требоваться больше контактных ступеней, иначе говоря, больше
теоретических тарелок. Поэтому можно заключить, что суще-
ствует известная связь между тепловым состоянием поступа-
ющего в укрепляющую колонну сырья, числом ее тарелок и
составами ее продуктов.
~Йз рассмотрения тепловой диаграммы можно сделать еще
заключение о том, что по мере перехода по высоте колонны
сверху вниз, от одной контактной ступени к другой, составы
паровых и жидких потоков обогащаются высококипящим ком-
понентом и температуры их соответственно повышаются, так что
флегма, стекающая с тарелки, расположенной ниже, имеет боль-
ший состав по ВКК и большую температуру, чем флегма
с тарелки, расположенной выше. В самом низу колонны состав
флегмы достигает значения, отвечающего назначенной сте-
пени чистоты тяжелого продукта колонны. С другой стороны,
по мере движения снизу вверх по высоте укрепляющей колонны
паровой поток прогрессивно обогащается легким компонентом
системы и на самом верху колонны, при выходе из парциаль-
ного конденсатора, достигает заданного состава.
Зададимся вопросом, можно ли в укрепляющей колонне
добиться получения абсолютно чистого верхнего продукта, со-
стоящего из одного лишь низкокипящего компонента системы.
Допустим, что дестиллат D, уходящий из парциального конден-
сатора, представляет собой абсолютно чистый легкий компонент
системы. Но тогда и флегма gQ', равновесная дестиллатным
парам, тоже должна была бы состоять из абсолютно чистого
НКК, а равным образом должны состоять из абсолютно чистого
НКК и пары Glt поступающие в парциальный конденсатор, ибо
эти пары представляют сумму потоков дестиллата D и оро-
шения g0', иначе говоря, пары Gx являются тем продуктом,
который в парциальном конденсаторе делится в результате
частичной конденсации на две части: D и g0'. Отсюда с очевид-
ностью следует, что и состав стекающей с первой тарелки
флегмы glt равновесной парам Glt тоже должен отвечать чистому
НКК, как и состав встречных этой флегме паров G2, поднима-
ющихся со второй тарелки и представляющих собой сумму пото-
ков g! и D. Продолжая намеченный ход рассуждений, нетрудно
заметить, что принятое исходное положение, что верхний про-
дукт колонны представляет собой абсолютно чистый низкоки-
пящий компонент разделяемой системы, приводит к неизбежному
абсурдному заключению о неизменяемости составов паровых
и жидких потоков по всей высоте колонны, иначе говоря,
к тому, что в колонне никакой ректификации не происходит.
Очевидно, исходное допущение было, неправильным, и в укреп-
ляющей ректификационной колонне нельзя достичь такой сте-
пени разделения, чтобы с верха ее уходил абсолютно чистый
низкокипящий компонент разделяемой системы. Теперь понятно,
почему во всем изложении речь может итти о верхнем про-
дукте колонны лишь как о практически чистом низкокипящем
компоненте, содержащем в лучшем случае лишь следы тяже-
лого компонента.
Действительно, самого незначительного содержания ВКК
в верхнем продукте укрепляющей колонны вполне достаточно,
чтобы при переходе от верха колонны к расположенным ниже
ступеням контакта было достигнуто заметное содержание тяже-
лого компонента в потоках флегмы и паров.
§ 6. Связь между съемом тепла в парциальном
конденсаторе и весом парового и жидкого потоков
Определение составов фаз на тарелках укрепляющей колонны
с применением графического или аналитического метода, опи-
санное в предыдущем параграфе, требует знания величины
теплового потока, отводимого из парциального конденсатора.
Решая уравнения (VI. 25) и (VI. 26) в отношении теплового
параметра 02, можно получить
+ ^-(<?< + !-?<) (VI. 32)
или
02 = Q, + 1 + -§-№ + i-^- (VI-33)
Оба эти уравнения, конечно, эквивалентны, в чем легко
убедиться, заменив, например, в уравнении (VI. 32) G, + i через
g< + D- d
Принимая-<во внимание, что 6i = QD + -&>, и сделав соответ-
ствующую подстановку в уравнение (VI. 32), можно установить
связь между съемом тепла d/D в парциальном конденсаторе
колонны и весом потока паров в любом межтарелочном отде-
лении укрепляющей колонны:
4 = -^ (Qi+i-^)-(QD -?<)• . (Vi-34)
Уравнение (VI. 34) устанавливает важное соотношение-между
количеством тепла, отнимаемым в парциальном конденсаторе, и
весом парового потока, поднимающегося в произвольном меж-
тарелочном отделении колонны. Чем больше вес паров (или,
Минимальный вес флегмы в укрепляющей колонне 247
что то же, вес флегмы, ибо они могут изменяться лишь в одну
сторону), тем большее количество тепла должно отниматься
в парциальном конденсаторе колонны. В равной мере увеличен-
ному съему тепла в парциальном конденсаторе отвечает повы-
шение веса потоков флегмы и паров в отделениях колонны.
Таким образом, регулирование веса потоков по высоте укреп-
ляющей колонны может осуществляться большей или меньшей
величиной съема тепла в ее парциальном конденсаторе.
В некоторых случаях имеет смысл связывать съем тепла
в парциальном конденсаторе колонны с составами паровых и
жидких потоков в текущем сечении колонны. Для этого доста-
точно исключить из уравнения (VI. 34) вес парового потока
О, + JD при помощи уравнения (VI. 18):
i = № +1 - Ф) - (<?т> -?)• (VI. 35)
Уравнение (VI. 35) позволяет по известным составам фаз
в каком-нибудь произвольном межтарелочном отделении ко-
лонны рассчитать величину - съема тепла в парциа.плюм кон-
денсаторе.
§ 7. Минимальный вес флегмы в укрепляющей колонне
Понятие минимального веса флегмы было установлено при
рассмотрении отгонной колонны. Вывод надлежащих соотно-
шений для укрепляющей колонны проводится аналогичным
методом. Решая уравнение концентраций (VI. 21) в отношении
разности составов встречных потоков, можно получить
у, +1 — Xi = ±(yD- yi +1). (VI 36)
bi
Чтобы иметь суждение о разрыве составов, например
жидкого потока при переходе из i-й в (1-Р1)-ю ступень кон-
такта, можно в левой части уравнения (VI. 36) состав yI + i паро-
вого потока выразить через состав Xt + t равновесной жидкости,
стекающей с той же (1 + 1)-й тарелки, используя для этого
уравнение равновесия (V.40):
yi + i — x,- + i = (m— l)x( + i(l — y,- + i). (VI.37)
Подстановка значения y, + i из этого уравнения в левую часть
уравнения (VI.36) приводит его к виду
х,— xi + l=(jn — 1)х/ + 1 (1 — yi + i) — ^ (Уо — yi + t). (VI. 38)
Уравнение (VI. 38) показывает, что с увеличением веса
флегмы gi растет разность составов жидких фаз, стекающих
2/-£ <V.*f пл*?..'* tteKTttthttK.CLttLtOHHCisi колонна
со смежных ступеней контакта, иначе говоря, растет обогати-
тельный эффект тарелки. Этот важный вывод на основании урав-
нения (VI. 34) может быть распространен и на величину съема
тепла d/D в конденсаторе колонны. Действительно, с увеличе-
нием съема тепла в парциальном конденсаторе растет вес
флегмы в отделениях колонны и согласно уравнению (VI. 38)
увеличивается разрыв между составами фаз на смежных тарел-
ках колонны. Таким образом, путем изменения величины съема
тепла в парциальном конденсаторе колонны можно оказывать
влияние на обогатительный эффект контактных ступеней укреп-
ляющей колонны, а тем самым и на число теоретических таре-
лок, необходимых для данного разделения.
С уменьшением веса флегмы gi уменьшается и разрыв
между составами потоков в смежных отделениях колонны,
и при некотором вполне определенном минимальном значении
ее веса этот разрыв исчезает. При этом составы одноименных
фаз в смежных отделениях колонны сравниваются и обогати-
тельного эффекта контактных ступеней уже больше не будет.
Этот минимальный вес флегмы может , быть найден по урав-
нению (VI. 38), если положить в нем х, — х< + 1 = 0. Тогда
----------------------с • (VI. 39)
D xi + 1(m—1)(1—yi + 1) '
Чем больше коэффициент обогащения т, тем меньше мини-
мальный вес флегмы, предельно совместимый с намеченным
в колонне разделением.
Сочетание уравнений (VI. 37) и (VI. 39) позволяет придать
выражению для минимального веса флегмы наиболее удобный
вид:
= VD~yt+1 - • (VI. 40>
Сопоставление уравнения (VI. 40) с уравнением (VI. 19) пока-
зывает, что в реальной колонне, осуществляющей на каждой
своей тарелке известное обогащение паровых и жидких фаз,
влекущее за собой неравенство x, >xl + i, вес флегмы в любом
ее межтарелочном отделении больше минимального, определя-
емого уравнением (VI. 40).
Далее из уравнения (VI. 40) следует, что в теоретическом,
предельном случае колонны, работающей при минимальных
значениях весов флегмы и паров, составы встречных на одном
уровне фаз должны отвечать условию равновесия. В самом
деле, состав х,- жидкого потока, встречного парам, имеющим
состав yi + i, равен xl + i, иначе говоря, равен составу жидкости,
находящейся в равновесии с этими парами, ибо при работе
с минимальным весом флегмы разрыв между составами фаз
в смежных отделениях колонны исчезает. Отсюда непосред-
Минимальный съем тепла в парциальном конденсаторе
24»
ственно следует, что подстановка любой пары равновесных
составов х и у в уравнение (VI. 40) определит некоторое вполне-
определенное минимальное значение веса флегмы (или паров),,
отвечающее именно этой паре равновесных составов.
§ 8. Минимальный съем тепла в парциальном конденсаторе
укрепляющей колонны
Выше была установлена связь между съемом тепла в пар-
циальном конденсаторе колонны и весом паров или флегмы
в любом произвольном ее межтарелочном отделении, выражае-
мая уравнением (VI. 34), согласно которому при понижении веса
паров или флегмы съем тепла в парциальном конденсаторе
укрепляющей колонны тоже уменьшается.
Очевидно, минимальному весу флегмы будет отвечать неко-
торое определенное минимальное же значение съема тепла
в парциальном конденсаторе, значение которого можно под-
считать непосредственной подстановкой соответствующей пары,
равновесных составов в уравнение (VI. 34):----------------
= ~~ (Q> - qt - (QD - qt =
=- qt + (Qi - Qd). (vi. 4i)
Уравнением (VI. 41) устанавливается взаимно однозначное со-
ответствие между минимальным съемом тепла в парциальном
конденсаторе колонны и каждой парой равновесных составов
Xi и у, жидкой и паровой фаз разделяемой в колонне системы.
Минимальное тепло парциального конденсатора, отвечающее
данной паре равновесных составов, особенно легко опреде-
ляется графическим способом по тепловой диаграмме. Для обо-
снования этого способа преобразуем уравнение (VI. 41) к виду
Qd + --= 02 (.мин) = qi + (Qi - qt,
откуда получается соотношение, связывающее равновесные со-
ставы с тепловыми параметрами:
Ур~Х1 .й2(мин) ~4j
Как уже известно, уравнение (VI. 42) представляет собой
необходимое и достаточное условие, чтобы на тепловой диа-
грамме три точки (yD, 02), (х/, ф) и (у/, Q/) лежали на одной
прямой. Для графического определения по тепловой диаграмме
(фиг. 67) минимального съема тепла в парциальном конденса-
торе, отвечающего данной паре равновесных составов х, и у,,
необходимо нанести на линиях QwQa и qwqa тепловой диаграммы
фигуративные точки (yzQz) и (х, qt) равновесных фаз и проходя-
щую через них изотерму продолжить до пересечения с верти-
калью yD = const в точке S2. Ордината этой точки согласно
конденсаторе.
уравнению (VI. 42) равна тепло-
вому параметру 02 (мин), а отрезок
S2'D в соответствии с уравнением
(VI. 6) пропорционален минималь-
ному съему тепла, отвечающему
принятой паре равновесных со-
ставов х, и у,. Очевидно, другой
паре равновесных составов будет
отвечать иное значение мини-
мального тепла парциального кон-
денсатора.
По тепловой диаграмме легко
заметить, что чем ниже значения
равновесных составов х, и у(,
тем больше отвечающее им зна-
чение минимального съема тепла
в парциальном конденсаторе, до-
стигающее для составов х, =
= у, = 0 бесконечно большого
значения. Наоборот, с повыше-
нием значений равновесных кон-
центраций величина dmn)D умень-
шается и при х1 = у, = 1 стано-
вится равной нулю.
Уместно заметить, что тех-
нически простой и удобный рас-
чет минимального съема тепла в парциальном конденсаторе при
помощи графического построения на тепловой диаграмме стра-
дает свойственной большинству графических методов расчета
известной неточностью, особенно сказывающейся при неболь-
ших значениях xz и yz, когда определяющие изотерму точки
располагаются очень далеко от искомой точки ее пересечения
с вертикалью yD = const. Поэтому для точных расчетов следует
рекомендовать пользоваться уравнением (VI. 41) и вести вычис-
ления аналитически.
§ 9. Предельные концентрации
Описанные графический и аналитический методы расчета
укрепляющей колонны позволяют путем попеременного использо-
вания соотношений фазового равновесия и уравнения концентра-
Предельные концентрации
251
ций, двигаясь последовательно сверху вниз по высоте колонны,
определять элементы ректификации на всех ее контактных
ступенях. По мере перехода от расположенных выше тарелок
к нижним тарелкам колонны температуры жидких и паровых
потоков повышаются, а их составы по низкокипящему компо-
ненту понижаются. Зададимся вопросом, есть ли предел этому
уменьшению состава фаз или его при всех условиях можно
вести как угодно долго.
Ответ на этот вопрос дает рассмотрение тепловой диаграммы.
Каждому определенному значению тепла парциального конден-
сатора, от нулевого до бесконечно большого, отвечает сог-
ласно установленному выше своя пара равновесных составов х и у.
Изотерма, проходящая через фигуративные точки равновес-
ных фаз, определяет в своем пересечении с вертикалью
yD = const полюс S2 (фиг. бб), из которого выходит пучок опера-
тивных линий. Абсциссы точек пересечения оперативных линий
с линиями теплосодержаний насыщенных паровой и жидкой
фаз отвечают составам встречных на одном горизонтальном
уровне паровых и жидких потоков соответственно. Исходя из
некоторого заданного состава yD верхнего продукта и после-
довательно проводя из полюса S2 оперативные линии, мы при
переходе с тарелки на тарелку сверху вниз по высоте колонны
до тех пор будем получать обогащение фаз высококипящим
компонентом, пока наклон оперативной линии будет больше
наклона соответствующей изотермы, выходящей из точки пере-
сечения этой оперативной линии с линией теплосодержаний
паровой фазы. Однако по мере приближения к равновесным
составам жидкой и паровой фаз, отвечающим условию мини-
мума принятого значения съема тепла в парциальном конден-
саторе, наклоны оперативной линии и изотермы будут все более
сближаться и в пределе при достижении этих составов должны
будут совпасть.
Из рассмотрения тепловой диаграммы (фиг. бб) легко заклю-
чить, что чем ближе наклоны оперативной линии и соответству-
ющей коноды, тем меньше обогащение фаз, достигаемое в рас-
сматриваемой ступени контакта. Поэтому по мере приближения
к той паре равновесных составов, которая своей продолженной
изотермой определяет положение полюса S2, обогащение фаз
высококипящим компонентом при переходе сверху вниз от
тарелки к тарелке все более й более уменьшается и для точ-
ного достижения этой пары равновесных составов теоретически
требуется бесконечное число тарелок. Иначе говоря, эта пара
равновесных составов является при данном съеме тепла в парци-
альном конденсаторе теоретически недостижимой. По этой при-
чине эти составы называются предельными или гранич-
ными составами для заданного значения съема тепла.
Таким образом, для каждого значения тепла парциального
конденсатора d/D существует своя пара значений равновесных
составов х0 и у0, достичь которых внизу колонны ни при каком
числе ее теоретических тарелок не представляется возможным.
Наоборот, каждой паре равновесных составов х0 и у0 отвечает
некоторое вполне определенное минимальное значение тепла
парциального конденсатора, при котором эти составы теоре-
тически достижимы лишь при бесконечно большом числе тарелок
колонны.
Ранее было установлено однозначное соответствие между
теплом парциального конденсатора и минимальным весом
флегмы, отвечающим той же паре равновесных составов паро-
вой и жидкой фаз. Поэтому можно заключить, что и каждой паре
равновесных граничных составов отвечает равным образом
некоторое вполне определенное минимальное значение веса
флегмы, при котором достичь внизу колонны этих составов
можно лишь при бесконечно большом числе тарелок.
В самом деле, на основании уравнения (VI. 38) уже был сде-
лан вывод, что при некотором минимальном весе флегмы
составы жидких потоков на смежных ступенях контакта больше
не меняются и дальнейшее обогащение фаз ВКК прекращается.
По уравнению же (VI. 40) было установлено взаимно однозначное
соответствие между каждой парой равновесных составов х и у
и отвечающим им минимальным весом флегмы. Следовательно,
и каждому определенному значению веса флегмы тоже соответ-
ствует своя пара равновесных предельных составов, достичь
которых внизу колонны с теоретической точки зрения нельзя
ни при каком числе тарелок колонны.
Путем сочетания уравнений (VI. 40) и (VI. 41) можно полу-
чить соотношение, связывающее минимальный расход тепла
в парциальном конденсаторе колонны и минимальный вес
флегмы, отвечающие каждой определенной паре равновесных
предельных составов:
тг=V (<?о - <7о)+(Qo - Qd). (VI. 43>
Однако особый интерес для расчета укрепляющей колонны
имеет уравнение (VI. 41), при помощи которого можно построить
график, дающий величину минимального съема тепла в кипя-
тильнике в зависимости от принятых значений граничных соста-
вов на всем интервале их изменения от хо = уо = О до х0 = у0= 1.
Такой график, рассчитанный и построенный для системы
бензол — толуол под давлением 760 мм рт. ст., приведен на
фиг. 68. На оси абсцисс отложены составы паровой фазы,
а по оси ординат — отвечающие им значения минимального
тепла парциального конденсатора, которые можно либо рас-
считать по уравнению (VI. 41), либо найти графически по
Предельные концентрации
253
тепловой диаграмме в соответствии с построением, показан-
ным на фиг. 67.
Иногда равновесные соотношения жидкой и паровой фаз
бывают настолько своеобразными, что монотонность возраста-
ния съема тепла (d/D)MUH по мере уменьшения значений предель-
ных составов хгр и угр нарушается и на кривой зависимости
(d/£))MHH от состава появляется экстремум, в частности мини-
---»- Грамочный состав паровой фазы для системы
бензол - толуол р=760мм рт ст у =0995 и
0,005 в '
Фиг 68. Кривая зависимости отдачи тепла в парциальном конденсаторе от
граничного состава паровой фазы для системы бензол—толуол.
ыальная точка (фиг. 68). Объяснение этому дается на фиг. 69,
где показано, при каких условиях большим граничным соста-
вам укрепляющей колонны может отвечать большее же значе-
ние (<//О)мин. Ясно, что в этих условиях, например, из по-
люса S2" нельзя подойти к предельным составам хгр' и у1р',
так как не удается пройти через составы хгр" и у,р , отвеча-
ющие большему значению минимального съема тепла. В этих
условиях на всем интервале составов, где нарушается моно-
тонность возрастания (d/D)MaH с уменьшением предельного со-
става, соответствующий участок кривой, показанный на фиг. 68
пунктиром, заменяется горизонтальным отрезком ab. Такое на-
рушение монотонности кривой зависимости (ф/£>)мин от состава
-встречается, например, в системе бензол — толуол или вода —
этанол.
254
Укреиляющая ректификационная колонна
Для расчета величины d/D необходимо располагать данными
по паро-жидкому равновесию и тепловым свойствам рассматри-
ваемой частной системы, для которой ведется построение гра-
фика ~ — у. Поэтому имеет смысл предварительно рассчитать
и построить изобарные кривые кипения и конденсации и тепло-
вую диаграмму для
ющей подстановки
рассматриваемой системы, а затем, снимая
с них необходимые данные, вести расчеты
по уравнению (VI. 41) или же графически
непосредственно по тепловой диаграмме.
Однако для больших значений составов
х0 и у0, близких к единице, их определе-
ние по изобарным кривым кипения и кон-
денсации становится недостаточно точным,
и поэтому рекомендуется находить их
расчетным путем. Для расчета же величины
съема тепла в этом случае необходимо
прибегать к уравнению (VI.41), которое
для условии, отвечающих получению с вер-
ха колонны практически чистого легкого
компонента с составом yD = 1, поддается
удобному упрощению.
В самом деле, положив с небольшим
для этого случая приближением:
Q0 Qo = Qq da = Qq <Id =
(где la — скрытая теплота испарения низко-
кипящего компонента) после соответству-
в уравнение (VI. 41) приводим его к не-
сколько более простому для расчетов виду:
f У® -^1 1 Имин
—D~ - la yi—Xi ~la D
(VI. 44}
откуда для рассматриваемого весьма небольшого интервала
близких к единице составов фаз можно получить следующее
простое соотношение между минимальным съемом тепла
в парциальном конденсаторе колонны и соответствующим ми-
нимальным же весом флегмы:
^МИН г ,
---- =4а = const.
£мин
(VI. 45)
Следует особо подчеркнуть, что линейная зависимость
(VI. 45) выдерживается лишь для значений составов, мало от-
личающихся от единицы.
П редельные концентрации
25.Т
В этих условиях и уравнение равновесия может быть запи-
сано в несколько более упрощенном виде:
1 — У 1
1 — х m '
(VI. 46)
где m — попрежнему коэффициент относительной летучести.
Из уравнения (VI. 46) легко получить соотношение
l-У 1
у — X ш—1'
подстановка которого в уравнение (VI. 44) приводит последнее
к особенно простому виду, весьма удобному для расчета съема
тепла в парциальном конденсаторе в данных условиях:
Фиин_ а
D ~ гп — 1
(VI. 47)
Кривая на фиг. 68 построена в функции состава равновес-
ной паровой фазы, так как сырье подается в колонну в паро-
образном состоянии-, однако ее, по тем же данным, можно
построить и в функции состава равновесной жидкой фазы. Для
каждого значения расхода тепла в парциальном конденсаторе
укрепляющей колонны, изменяющегося от нуля при х0 —у0=1
и до бесконечности при хо = уо--=О, такой график позволяет
сразу указать то значение граничного состава жидкой фазы,
которого ни при каком числе тарелок теоретически нельзя
достичь внизу колонны. Начало этой кривой, очевидно, распо-
ложено в точке (Уд, 0), и это вполне понятно, ибо, если ис-
ходная система уже имеет состав yD, то не требуется никакой
затраты энергии для доведения ее до этого же состава, и по-
этому в данном случае обязательно должно иметь место ра-
венство d/D = Q. Чем меньше делаются значения граничных
концентраций, тем быстрее растет относительное количество
тепла, отнимаемого в парциальном конденсаторе, прогрессивно
нарастая до бесконечности, когда граничные составы приоб-
ретают значения хо = уо = О. Последнее также легко объяснимо.
В самом деле, если пары, поступающие под нижнюю тарелку
колонны, не содержат низкокипящего компонента, то сколько
бы ни отнималось тепла в парциальном конденсаторе, сколько-
бы орошения ни подавалось в колонну, все равно не удастся
получить из этого сырья верхнего продукта колонны, состоя-
щего по условию из практически чистого низкокипящего ком-
понента. Это и представлено бесконечно большим d/D при
х0 = Уо = °-
График зависимости (d/D)mii от состава паровой фазы на-
глядно показывает, что чем ближе состав сырья к составу yD,
верхнего продукта колонны, тем меньше тепла нужно отнимать
2Ж Укрепляющая ректификационная колонна
в парциальном конденсаторе укрепляющей колонны. По мере
удаления состава парового сырья от состава верхнего продукта
колонны прогрессивно возрастает количество тепла, которое
необходимо отнимать в конденсаторе колонны для осуществле-
ния ректификации.
Итак, каждому определенному значению съема тепла в кон-
денсаторе укрепляющей колонны отвечает вполне определен-
ная концентрация х0 жидкой фазы (и у0 равновесной ей паровой
фазы), которая теоретически может быть достигнута внизу
колонны лишь при бесконечном числе ее тарелок, иначе говоря,
состав х0 по существу в данных условиях съема тепла теоре-
тически недостижим. Однако, как будет показано ниже, с вполне
конечным числом тарелок удается как угодно близко подойти
к этому составу, иначе говоря, практически достичь его, не
увеличивая расхода тепла в парциальном конденсаторе против
минимального значения, отвечающего данному составу. Перейти
же за предел этого граничного состава невозможно даже при
бесконечном числе тарелок укрепляющей колонны. Эти важные
замечания дают возможность более глубоко и точно описать
сущность понятий минимального тепла конденсатора и мини-
мальной флегмы укрепляющей колонны. Выясняется также, что
каждому определенному составу сырьевых паров, подаваемых
под нижнюю тарелку колонны, при заданной степени чистоты
верхнего продукта отвечает единственное минимальное значе-
ние съема тепла в парциальном конденсаторе, при котором
разделительная работа колонны практически еще возможна.
При любом другом меньшем значении съема тепла в конден-
саторе не удается получить в колонне намеченного разделе-
ния. Любому же большему значению тепла парциального кон-
денсатора отвечает меньшее значение граничной концентрации,
так что желательный состав внизу колонны при расходе тепла,
большем минимального, может быть всегда достигнут. Для
этого в общем случае понадобится меньше ступеней контакта,
чем при работе колонны с минимальным съемом тепла. Однако
уменьшение необходимого числа тарелок происходит не про-
порционально положительному градиенту d/D. Необходимое
число тарелок вначале падает очень резко и далее при после-
довательном увеличении djD достигает некоторого минимума,
отвечающего бесконечно большому значению d/D. Эту важную
особенность работы укрепляющей колонны необходимо рас-
смотреть подробно.
§ 10. Минимальное число тарелок укрепляющей колонны
Как уже известно из рассмотрения аналогичного вопроса
в теории отгонных колонн и как непосредственно видно из
уравнения концентраций укрепляющей колонны, например из
Минимальное число тарелок, укрепляющей колонны
257
с другом.
У, Ург
Фиг. 70. Обогатительный
эффект тарелки как функ-
ция отдачи тепла в пар-
циальном конденсаторе.
уравнения (VI. 21), при увеличении веса флегмы g, или, что
эквивалентно, при увеличении съема тепла в конденсаторе
колонны составы встречных на одном уровне укрепляющей
колонны паровых и жидких фаз сближаются и при бесконечно
большом значении относительного веса g,/D эти составы х, и
у, + 1 должны были бы сравняться, совпасть друг
Рассмотрение тепловой диаграммы на
фиг. 70 со всей наглядностью подтвер-
ждает сделанное заключение. В самом
деле, пусть по составу х0' флегмы,
стекающей из парциального конденса-
тора, нужно найти состав ух встреч-
ного парового потока, поднимающе-
гося с первой тарелки колонны. Для
этого необходимо на тепловой диа-
грамме фигуративную точку флегмы g0'
соединить с полюсом S2, положение
которого определяется расходом тепла
в парциальном конденсаторе. Абсцисса
точки пересечения этой прямой с ли-
нией теплосодержаний паровой фазы
определит искомый состав ух. Однако
полюс S2 может занимать различные
положения в зависимости от величины
съема тепла в парциальном конден-
саторе. Так, для тепла конденсатора
dJD полюс занимает положение S2'
и состав встречного пара определяется
как абсцисса точки дх; для несколько
большего съема тепла d2/D полюс расположен выше в поло-
жение S2" и состав встречного пара определяется уже как
абсцисса точки а2, меньшая, чем в первом случае. Легко заме-
тить, что по мере увеличения съема тепла в парциальном кон-
денсаторе колонны все более и более понижается состав паро-
вого потока Gx, поднимающегося навстречу орошению, стека-
ющему из конденсатора. Предел этому уменьшению состава
паровой фазы наступает при бесконечно большом значении d/D,
при котором оперативная линия занимает вертикальное поло-
жение, ибо полюс S2 удаляется в бесконечность. При этом
составы встречных фаз х0' и ух сравниваются друг с другом,
максимально отступая от состояния равновесия.
Как известно, разделительная работа теоретической тарелки
приводит к тем большему обогащению потоков,'чем больше
разность фаз между ними. Поэтому гипотетическому предель-
ному, практически нереализуемому в промышленных условиях
случаю работы колонны с бесконечно большим относительным
съемом тепла в парциальном конденсаторе отвечает наибольшая
17 Зак. № 304.
разность фаз и наибольший разрыв между составам-тг'идпо-
именных потоков, отходящих со смежных теоретических сту-
пеней контакта. Число теоретических ступеней контакта в этом
случае будет минимальным.
То, что отношение d!P может быть бесконечно большим и
когда тепло d представляет собой конечную величину,
тогда,
Фиг. 71. Определение мини-
мального числа тарелок
укрепляющей колонны.
но зато сверху колонны целевой про-
дукт не отбирается, иначе говоря,
когда 0 = 0, позволяет ставить лабора-
торные испытания для определения
минимального числа тарелок, необхо-
димых для данного разделения и для.
установления практической эффектив
ности тарелок колонны. При этом
флегма, стекающая с нижней тарелки
колонны, должна испаряться и в каче-
стве сырья подаваться в колонну.
Следует напомнить, что относи-
тельный вес флегмы или паров связан
со съемом тепла в парциальном кон-
денсаторе и когда последний стано-
вится бесконечно большим, то и отно-
сительные веса флегмы и паров тоже
приобретают бесконечно большие зна-
чения. Поэтому все заключения, сде-
ланные выше относительно характера
изменения составов потоков на смеж-
ных теоретических ступенях контакта
при увеличении d/D до бесконечности,
остаются теми же и для бесконечно
большого веса флегмы или паров.
То обстоятельство, что при беско-
нечно большом съеме тепла d/D
в конденсаторе или, что то же, при
бесконечно большом весе g/D флегмы,
стекающей в отделениях колонны, составы встречных паровых
и жидких потоков равны, позволяет, не прибегая ни к каким
дополнительным данным, при помощи одних лишь равновесных
кривых определить минимальное число ступеней контакта,
необходимых для намеченного разделения. При этом следует
учесть, что состав xR флегмы, стекающей с нижней тарелки
колонны, должен быть равен составу поступающих сырьевых
паров, ибо, во-первых, они пересекают один и тот же гори-
зонтальный уровень и, во-вторых, верхний продукт из колонны
не отбирается. На фиг. 71 показано соответствующее графиче-
ское построение на тепловой диаграмме и на диаграмме у — х.
На тепловой диаграмме все оперативные линии параллельны
Минимальное число тарелок укрепляющей колонны 2.79
друг другу и вертикальны, ибо точка S2 их пересечения
расположена в бесконечности в соответствии с бесконечно
большим значением d/D.
На диаграмме же у — х диагональ квадрата составов, являю-
щаяся линией равных составов паровой и жидкой фаз, пред-
ставляет для рассматриваемого случая линию концентраций,
связывающую составы встречных потоков. Определение мини-
мального числа тарелок укрепляющей колонны на диаграмме
равновесия у— х выяснится в ходе следующих рассуждений.
Условию равновесия фаз в парциальном конденсаторе отвечает
точка Д(х0, yD) на кривой равновесия. Состав у1 парового
потока Gi, встречного флегме g0, равен составу х0 этой флегмы,
и поэтому, проведя вертикаль АВ до пересечения с линией
равного состава, можно определить точку В(х0, уД ордината
которой равна искомому составу. Состав флегмы glt стекающей
с первой — верхней - тарелки колонны, определяется из усло-
вия ее равновесия с парами Gx как абсцисса точки С (хь ух),
а состав у2 встречного этой флегме парового потока О2 най-
дется как ордината точк1Ь'( xt. у., на линии равного состава,
играющей роль линии концентраций. Состав х2 флегмы, сте-
кающей со второй тарелки, определяется из условия равнове-
сия с парами G2, уходящими с той же тарелки, по кривой
равновесия как абсцисса точки F (х2, у2). Встречный этой флегме
пар представляет для данного конкретного случая сырьевой
паровой поток с составом а = х2, фигуративная точка которого,
очевидно, лежит на линии равного состава в положении Н (х2, а).
Из этого разъяснения следует, что минимальное число таре-
лок, необходимых для разделения данной системы, можно
найти, произведя построение ступенчатой линии, составленной
из горизонтальных и вертикальных отрезков, вписанных между
кривой равновесия и линией равного состава, начиная от точки
Д(хъ J’i) и кончая точкой Н (хк, а). Каждая вершина этой лома-
ной, лежащая на линии равновесия, отвечает одной теорети-
ческой ступени контакта. В данном конкретном случае на линии
равновесия лежат три вершины А, С и F ступенчатой линии,
и поэтому минимальное число ступеней контакта, необходимое
для разделения рассматриваемой бинарной системы, равно трем-
двум тарелкам и парциальному конденсатору, играющему роль
одной теоретической ступени контакта.
§ 11. Расчет числа теоретических тарелок в укрепляющей
колонне
Приступая к расчету укрепляющей колонны, проектиров-
щик обычно располагает составами а и yD сырья и верхнего
продукта колонны. Однако для определения проблемы ректи-
фикации и установления того или иного режима работы колонны
17*
этих двух начальных данных недостаточно и необходимо за-
даться еще одним дополнительным параметром. Тогда режим
работы укрепляющей колонны становится строго определенным
и единственным и задача расчета колонны сводится к определе-
нию всех элементов ректификации на последовательных сту-
Фиг. 72. Райчет числа тарелок укреп-
ляющей колонны по тепловой диа-
грамме.
пенях контакта с верха до
низа ее.
Пусть исходные сырьевые
пары веса L, состава а при
температуре начала конденса-
ции подаются под нижнюю
тарелку укрепляющей колонны
и пусть из этого сырья необ-
ходимо получить верхний про-
дукт колонны со степенью
чистоты, равной yD. Фигура-
тивные точки верхнего про-
дукта D и сырья L нанесены
на линию теплосодержаний
паровой фазы тепловой диа-
граммы, представленной на
фиг. 72. Для определения числа
тарелок колонны безразлично
аналитическим способом или
путем графического построе-
ния необходимо задаться вели-
чиной d/D тепла, отнимаемого
в парциальном конденсаторе.
Как известно, эта величина
может изменяться от некото-
рого минимального значения,
отвечающего условию равно-
весия встречных потоков внизу колонны, до бесконечно боль-
шого, отвечающего условию равенства составов встречных фаз
по всей высоте колонны или, иначе говоря, отвечающего условию
максимального отступления встречных паровых и жидких пото-
ков от состояния равновесия. Последний случай в промышленных
условиях практически нереализуем, но работа колонны с мини-
мальным для заданного разделения съемом тепла в парциаль-
ном конденсаторе, как указывалось выше, вообще говоря,
практически возможна. Следует, однако, иметь в виду, что
работа колонны при этом становится ненадежной и неустой-
чивой, подверженной заметным нарушениям режима при самых
незначительных колебаниях состава исходных сырьевых паров
или изменениях количества тепла, отнимаемого в парциальном
конденсаторе. Такие колебания практически вполне возможны
в промышленных условиях, и поэтому заводские установки
Расчет числа теоретических тарелок в укрепляющей колонне 261
всегда работают с некоторым избытком съема тепла в пар-
циальном конденсаторе колонны против его минимального
количества. Избыточный съем тепла в парциальном конденса-
торе имеет следствием увеличение веса флегмы и паров в отде-
лениях колонны против того значения, которое они имеют при
работе с минимальным весом орошения. Метод определения
оптимального значения съема тепла в парциальном конденса-
торе будет изложен в последующих разделах. Рассмотрим на
тепловой диаграмме (фиг. 72) графическое определение вели-
чины d.t,,K]D. Как уже известно, для этого необходимо продол-
жить коноду Lb0 до ее пересечения в точке S2' (yD, 02 (мин))
с вертикалью yD~const и измерить величину отрезка DS2',
пропорциональную минимальному съему тепла в парциальном
конденсаторе колонны, разделяющей исходную паровую смесь
состава а на верхний продукт состава yD и жидкую флегму
состава х0, равновесную сырью и отводимую с нижней тарелки
колонны. Однако ввиду указанной выше ненадежности и
неустойчивости работы колонны в условиях минимального
съема тепла приходится вести процфсаректиесжюлц*г0 с н v
повышенным значением d/D.
Любой другой съем тепла d/D в парциальном конденсаторе,
больший минимального, отвечает некоторому вполне опреде-
ленному режиму работы укрепляющей колонны. При этом
в зависимости от принятой величины съема тепла приобретает
то или иное значение состав xR флегмы, стекающей с нижней
тарелки колонны. Съем тепла в парциальном конденсаторе
колонны имеет два крайних предельных значения: минимальное
и бесконечно большое. Соответственно и состав нижней флегмы
колонны xR колеблется в пределах от х0, отвечающего dutl„ID,
до а, которое может быть лишь теоретически достигнуто при
бесконечно большом значении относительного съема тепла
в парциальном конденсаторе. Таким образом, состав xR заклю-
чен в интервале х0<хд<а, причем увеличению съема тепла
в парциальном конденсаторе против его минимального значе-
ния отвечает увеличение состава нижнего продукта колонны,
иначе говоря, его облегчение, влекущее за собой попадание
большей доли низкокипящего компонента в нижний продукт.
Следствием этого, как уже указывалось при рассмотрении
уравнений (VI. 3) и (VI. 4), являются увеличение веса нижнего
и уменьшение веса верхнего целевых продуктов.
Из рассмотрения тепловой диаграммы легко заключить, что
совершенно безразлично, чем задаваться при выборе режима
работы колонны: величиной ли съема тепла в парциальном
конденсаторе колонны йли составом xR нижнего ее продукта,
ибо величины эти связаны простой однозначной зависимостью,
262 Укрепляющая пектафикацианнпо тайна
выражаемой уравнением линии концентраций (VI. 30), написан-
ным для горизонтального уровня под нижней тарелкой:
:Qo + _ Ур-Хд,
Qo — ?R а -VR
Равным образом можно было бы задаться и желательным
весом нижнего или верхнего продукта укрепляющей колонны
и тогда, определив xR по уравнению (VI. 3), приведенному
к виду
L .
XR ~~Уо ~ft (УD аУ
можно найти действительный съем тепла, отвечающий выбран-
ным условиям, либо графическим путем по тепловой диаграмме,
либо аналитически по уравнению (VI. 34) или (VI. 41) в следу-
ющем виде:
4 = 4?? -<Qd - (VI. 48)
R
4 = 4 (Qo - - Wo - 4r)- (VI. 49)
Итак, для выбора режима работы укрепляющей колонны
требуется помимо составов а и yD сырья и верхнего продукта
задаться еще одним каким-нибудь параметром системы, и только
в этом случае режим работы колонны определяется и решение
задачи расчета элементов ректификации может быть однозначно
проведено по способам, изложенным ранее.
Основным моментом в расчете укрепляющей колонны
является определение составов фаз на последовательных сту-
пенях контакта сверху донизу, так как, имея эти значения,
можно по уравнениям (VI. 18) и (VI. 19) рассчитать веса потоков
во всех отделениях колонны. Что же касается температур и
теплосодержаний паровых и жидких потоков, то при наличии
их составов эти свойства фаз могут быть непосредственно
сняты с изобарных кривых и с тепловой диаграммы.
Расчет числа ступеней контакта укрепляющей колонны и
по тепловой диаграмме и по уравнению концентраций можно
вести, или двигаясь по высоте колонны сверху вниз, или же
ведя расчет от нижней тарелки к парциальному конденсатору.
В обоих случаях результаты будут одними и теми же.
Сочетание аналитического метода расчета укрепляющей
колонны с построениями на диаграмме равновесия у — х позво-
ляет предложить еще один — уже графо-аналитический — метод
расчета укрепляющей колонны.
Расчет укрепляющей колонны по диаграмме у — х
263
§ 12. Расчет укрепляющей колонны по диаграмме у — х
Уравнение концентраций (VI. 29) может быть изображено
в системе координат у — х, если несколько его точек рассчи-
тать аналитически методом постепенного приближения, нанести
их на график у — х и провести через них плавную кривую. Эта
кривая устанавливает связь между составами встречных на
одном уровне паровых и жидких потоков. Подстановка в урав-
нение (VI. 29) вместо теку-
щих координат у/ + 1 и Х(
одного и того же значения
yD превращает его в тожде-
ство. Следовательно, кри-
вая, отвечающая уравнению
(VI. 29), должна обязательно
пройти через точку b0(yD,
yD), лежащую на линии
равного состава (фиг. 73).
Эта кривая называется ли-
нией концентраций укрепля-
ющей колонны и своей вы
пуклостью обычно обращена
к оси абсцисс. Только
в одной точке А пересе-
каются кривая равновесия
ОАВ и линия концентра-
ций Ь0А укрепляющей ко-
Фиг. 73. Расчет числа тарелок укреп-
ляющей кЛюнны по диаграмме у — х.
лонны. Координаты этой точки пересечения определяются
теми значениями предельных составов, которые отвечают
выбранному значению отдачи тепла в парциальном кон-
денсаторе колонны. Таким образом, две точки b0(yD, yD) и
А(хгр, уГр), через которые проходит линия концентраций укреп-
ляющей колонны, всегда известны заранее. Остается рассчитать
координаты лишь нескольких промежуточных точек, нанести
их на график и провести через них плавную кривую АЬ0. По
смыслу своего определения любая точка укрепляющей линии
концентраций связывает составы неравновесных, встречных на
одном уровне колонны разноименных фаз, и поэтому путем ее
сочетания с кривой равновесия, дающей составы фаз, находя-
щихся друг с другом в равновесии, можно провести графический
расчет укрепляющей колонны на диаграмме у —х (фиг. 73).
Принципиально расчет можно начинать с любого уровня
колонны, на котором известен состав хотя бы одного из по-
токов. Начнем его, например, с состава yD верхнего продукта
колонны. Чтобы найти состав х0' флегмы, равновесной дестил-
лату и сливающейся из парциального конденсатора на первую,
264
Укрепляющая
ректификационная
ко панна
считая сверху, тарелку укрепляющей колонны, необходимо про-
вести из точки Ь0(ув, Ув) горизонталь до ее пересечения в точке 7
с кривой равновесия. Очевидно, ордината этой точки будет
равна Ув’ а абсцисса х0'. Переходя к определению состава yL
пара, поднимающегося с первой тарелки, необходимо учесть,
что этот паровой поток пересекает тот же горизонтальный
уровень колонны, что и флегма состава х0', и поэтому фигу-
ративная точка, связывающая составы этих неравновесных
встречных фаз, должна расположиться на линии концентраций Ь0А
и иметь абсциссу, равную х0'. Проведя из точки 7 верти-
каль до ее пересечения с линией концентраций в точке 2,.
мы найдем состав уг паров, поднимающихся с первой тарелки
в парциальный конденсатор, как ординату точки 2(х0', yj.
Легко сообразить, что состав хх флегмы, стекающей с первой
тарелки, должен быть найден из условия ее равновесия с па-
рами состава ylt поднимающимися с той же тарелки. Проведя
из точки 2 горизонталь до ее пересечения в точке 3 с кривой
равновесия, найдем как абсциссу точки 3. Переходя к оп-
ределению состава у2 парового потока, поднимающегося со
второй тарелки в то же межтарелочное отделение, куда сте-
кает флегма с первой тарелки, имеющая состав х1; следует
принять во внимание, что точка, связывающая составы этих
разноименных неравновесных потоков, должна лежать на линии
концентраций Ъ0А. Проведя из точки 3 (хъ ух) вертикаль до
ее пересечения с линией концентраций в точке 4, можно легко
найти состав у2 как ординату этой точки 4 (хг, у2).
Так, продолжая вписывать ступенчатую линию между кри-
вой равновесия и линией концентраций, можно пройти сверху
вниз по всей укрепляющей колонне, последовательно опре-
деляя составы жидких и паровых потоков во всех ее межтаре-
лочных отделениях. Последним отделением колонны будет
самое нижнее, в котором встречаются паровой поток сырья
состава а и жидкий поток состава xr, стекающий с нижней та-
релки укрепляющей колонны. Фигуративная точка 8 (хд, а),
связывающая составы этих потоков, расположится на линии
концентраций и будет той конечной точкой, до которой следует
проводить описанное ступенчатое построение. Каждая вершина
ступенчатой линии, лежащая на кривой равновесия, отвечает
одной контактной ступени, включая и парциальный конденсатор.
Каждая же ее вершина, лежащая на линии концентраций,
отвечает определенному межтарелочному отделению. Таким
образом, указанное графическое построение позволяет вести
и расчет элементов ректификации по всей высоте укрепляющей
колонны и определение числа ее ступеней контакта. По про-
стоте расчет укрепляющей колонны по диаграмме у—х несколько
уступает расчету по тепловой диаграмме, но тем не менее
является надежным и верным средством.
Анализ ректификации в укрепляющей колонне 265
§ 13. Анализ общей проблемы ректификации данной системы
в укрепляющей колонне
Зададимся вопросом, в какой зависимости от отдачи тепла
в парциальном конденсаторе находится распределение составов,
например жидкого потока, по тарелкам укрепляющей колонны.
Каждому данному значению d/D отвечает вполне определенная
пара равновесных составов жидкой и паровой фаз, которая
теоретически ни при каком угодно большом числе тарелок не
может быть достигнута внизу колонны. Однако мы уже знаем,
что эта же пара равновесных граничных составов практически
может быть достигнута внизу укрепляющей колонны со вполне
конечным числом тарелок. При этом в зависимости от величины
съема тепла в парциальном конденсаторе имеется различное
распределение составов фаз по тарелкам колонны.
Рассмотрим на конкретном примере разделения под атмо-
сферным давлением бинарной системы бензол — толуол характер
зависимости между величиной расхода тепла в парциальном
копдепсаторс и-раетреэдлением-соета-вов-фаа п&тарелкам-укреп-
ляющей колонны.
В основу расчета кладутся те же равновесные данные,
которые были использованы при рассмотрении соответствующей
проблемы для отгонной колонны.
Первый этап расчета состоит в построении описанного в § 9
графика зависимости между отдачей тепла d/D в парциальном
конденсаторе и граничными составами. Получить необходимые
данные для построения этого графика можно либо графически,
продолжая на тепловой диаграмме ряд изотерм до их пересе-
чения с вертикалью yD = const и отсчитывая соответствующие
значения d/D, либо же аналитически при помощи уравнения
(VI.41).
В табл. 15 приведен развернутый расчет значений d/D по
уравнению (VI. 41) для случая, когда с верха колонны отво-
дится практически чистый бензол состава уп = 0,995. При этом
теплосодержание единицы веса дестиллата в паровой фазе, сня-
тое с тепловой диаграммы, принято равным QD = 129,3 ккал/кг.
По данным граф 2 и 12 или 3 и 12 табл. 15 можно по-
строить кривую минимальной отдачи тепла в парциальном кон-
денсаторе укрепляющей колонны в зависимости от предельной
концентрации в жидкой или паровой фазе. Такая кривая, по-
строенная по данным табл. 15, представлена на фиг. 68.
Для каждого определенного значения съема тепла d/D
имеются свое распределение составов фаз по тарелкам и свое
же число тарелок укрепляющей колонны, приводящее от со-
става yD верхнего продукта к отвечающему данному значению
d/D предельному составу xR флегмы, стекающей с нижней,
Таблица 15
О о Qi , ккал/кг qt , ккал /кг .Q 1 >г _Q 1 г б7 7 о к',*" 1 i 1 q - 7 q о- t о
Q ^1 о Г? Q О 1
81 0,955 0,975 129,0 34,9 0,040 0,020 2,0 94,1 188,2 94,4 93,8
82 0,908 0,956 128,9 35,1 0,087 0,048 1,81 93,8 169,5 94,2 75,3
84 0,798 0,914 128,1 35,6 0,197 0,116 1,70 92,5 157,0 93,7 63,3
86 0,705 0,863 127,6 35,7 0,290 0,158 1,83 91,9 168,0 93,6 74,4
88 0,620 0,809 126,7 36,0 0,375 0,189 1,99 90,7 181,0 93,3 87,7
90 0,541 0,748 125,8 36,6 0,454 0,207 2,19 89,2 195,0 92,7 102,3
92 0,472 0,690 124,7 36,8 0,523 0,218 2,40 87,9 211,0 92,5 118,5
94 0,407 0,633 123,9 37,0 0,588 0,226 2,60 86,9 226,0 92,3 133,7
98 0,287 0,495 121,4 38,3 0,708 0,208 3,40 83,1 283,0 91,0 192,0
100 0,233 0,424 119,9 38,6 0,762 0,191 3,99 81,3 324,0 90,7 233,3
102 0,184 0,352 118,8 39,3 0,811 0,168 4,84 79,5 384,0 90,0 294,0
104 0,137 0,281 116,6 39,9 0,858 0,144 5,96 76,7 457,0 89,4 367,6
106 0,093 0,196 115,8 40,4 0,902 0,103 8,75 75,4 660,0 88,9 571,1
108 I 0,051 0,114' 113,8 41,1 0,944 0,063 15,00 72,7 1090,0 88,3 1001,3
110 0,012 0,027 112,2 41,6 0,983 0,015 65,50 70,6 4640,0 87,7 4552,3
тарелки колонны. Ранее были описаны методы расчета соста-
вов фаз по тарелкам укрепляющей колонны графическим спо-
собом по тепловой диаграмме, или аналитическим по уравне-
нию концентраций, или, наконец, графо-аналитически по диа-
грамме V-- х. Выбор того или иного метода расчета определяется
конкретными требованиями, предъявляемыми к точности и
быстроте расчета. Во всяком случае следует иметь в виду, что
аналитический метод расчета по уравнению концентраций и
здесь является наиболее точным.
В качестве образца подобного аналитического расчета в табл. 16 и 17
приведены вычисления, проведенные при двух различных значениях отдачи
тепла d/D в парциальном конденсаторе колонны для рассматриваемой задачи
разделения системы бензол — толуол с получением верхнего продукта, прак-
тически чистого бензола, со степенью чистоты yD = 0,995.
Точность этих вычислений зависит и определяется точностью распола-
гаемых данных по теплосодержаниям компонентов системы, которые в боль-
шинстве случаев довольно скудны и недостаточны. Тем не менее сам метод
расчета является совершенно строгим, и задача заключается лишь в расши-
рении и уточнении опытных и коррелированных данных по тепловым свой-
ствам компонентов разделяемых систем.
Вычисления в табл. 16 и 17 проведены по методу постепенного прибли-
жения на основании уравнения концентраций (УЧ.29) и равновесных данных
Анализ ректификации в укрепляющей колонне
2(57
Таблица 16
= 133,7 ккал!кг, 02 = 263 ккал!кг
1 LO 2 <3 -.1 3 ч
О 2 + т
II 2 — 1
и* 1 Н- 5 |~ т 1 1 II -_L
к _Q б7 о б7 ТУ б7 =7 +
0 0,995 0,986 0,009 129,0 34,5 94,5 228,5 0,414 0,0037 0,9896
1 0,9896 0,973 0,022 w 35,0 94,0 228,0 0,413 0,009 0,982
2 0,982 0,958 0,037 129,0 35,0 94,0 228,0 0,413 0,015 0,973
3 0,973 0,938 0,057 129,0 35,0 94,0 228,0 0,413 0,024 0,962
4 0,962 0,913 0,082 129,0 35,0 94,0 228,0 0,413 0,034 0,947
5 0,947 0,880 0,115 128,5 35,0 93,5 228,0 0,410 0,047 0.927
О О 927" 0 835 0,160 1285 350 935 228 0 0 4П ООЪа 0,900
7 0,900 0,773 0,222 127,5 35,2 92,3 227,8 0,405 0,090 0,863
8 0,863 0,705 0,290 127,0 35,5 91,5 227,5 0,402 0,117 0,822
9 0,822 0,642 0,353 126,7 35,7 91,0 227,3 0,400 0,141 0,783
10 0,783 0,586 0,409 126,0 36,1 89,9 226,9 0,396 0,161 0,747
И 0,747 0,539 0,456 125,5 36,5 88,7 226,5 0,392 0.179 0,718
12 0,718 0,504 0,491 125,0 36,5 88,5 226,5 0,390 0,192 0,696
13 0,696 0,477 0,518 124,6 36,7 87,9 226,3 0,388 0,201 0,678
14 0,678 0,455 0,540 124,4 37,0 87,4 226,0 0,386 0,209 0,664
15 0,664 0,440 0,555 124,1 37,0 87,1 226,0 0,386 0,2 Г4 0,654
16 0,654 0,430 0,565 124,0 37,0 87,0 226,0 0,386 0,218 0,648
17 0,648 0,422 0,573 124,0 37,2 86,8 225,8 0,385 0,220 0,642
18 0,642 0,415 0,580 124,0 37,2 86,8 225,8 0,385 0,223 0,638
19 0,638 0,410 0,585 124,0 37,2 86,8 225,8 0,385 0,225 0,635
20 0,635 0,4075 0,5885 124,0 37,0 87,0 226,0 0,385 0,226 0,6335
21 0,6335 0,407 0,588 124,0 37,0 87,0 226,0 0,385 0,226 0,633
системы бензол—толуол. Значением теплосодержания Qj- . j в графе 5 необ-
ходимо при расчете каждой ступени задаваться, а затем по"полученному
в графе 11 значению 4 проверять, насколько правильно было принято Q; , j.
Для этого очень удобно пользоваться тепловой диаграммой, позволяющей
с достаточной точностью по заданному составу жидкой или паровой фазы
сразу получать значения теплосодержания. В этой связи уместно заметить,
что при заполнении расчетных табл. 16 и 17 нет необходимости добиваться
большей точности значений теплосодержаний, чем та, которая дается теп-
ловой диаграммой и опытными данными, лежащими в основе ее построения.
Следует еще отметить, что каждая из табл. 16 и 17 представляет собой
расчет одного варианта работы укрепляющей колонны.
Нет никакого смысла приводить совершенно аналогичные вычисления
для всех остальных значений d/D, полученных в табл. 15 или выбранных для
анализа работы укрепляющей колонны. Однако такие расчеты были прове-
дены, и полученные результаты сведены в общую сводную табл. 18, пред-
ставляющую основу для всего последующего анализа.
В отличие от сводной табл. 14, характеризующей разделение систему
бензол — толуол в отгонной колонне, в табл. 18 приведена сводка значений
составов и паровой и жидкой фаз для ряда значений d/D на всех ступенях
контакта укрепляющей колонны, начиная от парциального конденсатора и
кончая той ее тарелкой, на которой достигается с практически приемлемой
точностью предельная концентрация, отвечающая данному значению отдачи
тепла в парциальном конденсаторе.
Для каждого определенного значения d{D в табл. 18 приведены соответ-
ствующие значения теплового параметра 62 и предельных концентраций хгр
и угр, взятые либо нз таблицы, либо из графика, дающего зависимость d/D
от состава. Далее каждая строчка таблицы отвечает определенной теорети-
ческой тарелке, для которой даются значения составов покидающих ее пото-
ков при рассматриваемом режиме работы укрепляющей колонны.
-^-=294 ккал)кг, в2 = 423,3 ккал)кг
Таблица 17
т Ю О х 1 Qi ккал/кг i !' 'g ьГ \ 1 534 4- сГ т СУ 7 г" 1 1 1 г? -Д It Ф"| q +А S Т- \ II л
0 0,995 0,986 0,009 129,0 34,5 94,5 388,8 0,243 0,002 0,988
1 0,988 0,972 0,023 129,0 34,5 94,5 388,8 0,243 0,0056 0,978
2 0,978 0,947 0,048 128,9 34,5 94,4 388,8 0,243 0,012 0,959
3 0,959 0,908 0,087 128,5 34,8 93,7 388,5 0,242 0,021 0,929
4 0,929 0,839 0,156 127,8 35,0 92,8 ; 388,3 1 0,239 0,037 | 0,876
5 0,876 0,729 0,266 126,4 35.5 90,9 387,81 0,235 । 0,062 0,791
6 0,791 0,597 0,398 125,0 36,0 89,0 387,3 0,230 0,092 । 0,689
7 0,689 0,469 0,526 123,0 36,8 86,2 386,5 0,223 0,117 0,586
8 0,586 0,363 0,632 121,5 37,5 | 84,0 385,8 0,217 0,137 0,500
9 0,500 0,290 0,705 120,0 38,1 81,9 385,2 0,212 0,150 ' 0,440
10 0,440 0,247 0,748, 119,5 38,5 81,0 384,8 0,211 0,158 0,405
11 0,405 0,218 0,777 119,0 38,7 ( 80,3 384,6 0,209 0,162 0,380
12 0,380 0,205 0,790 118,8 39,0 j 79,8 384,3 j 0,208 0,164 , 0,369
13 1 0,369 0,197 0,798 118,8 39,0 / 79,8 384,5 0,207 | 0,165 0,362
14 0,362 0,190 0,805 118,8 39,2 79,6 1 384,11 0,206 0,166 0,356
15 0,356 0,188 0,807 118,8 39,2 79,6 ) 384,1 0,206 0,166 ; 0,354
16 0,354 0,186 0,809 118,8 39,2 79,6 ) 384,1 0,206 j 0,167 0,353
17 0,353 0,184 0,811 118,8 393 79,5 384,01 0,207 0,168 / 0,352
Анализ ректификации в укрепляющей колонне 269
Анализ таблицы позволяет получить представление об осо-
бенностях хода изменения составов обоих потоков по всей
высоте укрепляющей колонны в широких пределах варьиро-
вания ее режима. Как указывалось ранее, при каждом опре-
деленном значении отдачи тепла в парциальном конденсаторе
на некотором конечном и относительно небольшом числе та-
релок происходит довольно быстрое приближение к граничному
составу, отвечающему этому значению отдачи тепла d/D. За-
тем дальнейшее изменение составов на последующих ступенях
контакта, после того как граничные составы оказываются прак-
тически достигнутыми, совершенно прекращается и все осталь-
ные тарелки оказываются бесполезными.
Так, например, отдаче тепла в парциальном конденсаторе d)D =
= 56,1 ккал/кг дестиллата отвечает предельная концентрация хгр =0,955.
Хотя этот состав теоретически может быть достигнут лишь при бесконечно
большом числе тарелок укрепляющей колонны, но, как легко видеть из
табл. 18, состав флегмы, стекающей с 6-й тарелки, уже практически совпа-
дает с этой граничной концентрацией. Здесь еще раз следует подчеркнуть
-сделанное--ранее утверждение. слглягю„1<оторому смжз выводя о достини-_
мости внизу колонны предельной концентрации лишь при бесконечном числе
ее тарелок заключается не столько в теоретической невозможности достичь
при данном d/D определенного граничного состава, сколько в том, что ни
при каком числе тарелок укрепляющей колонны за этот состав перейти
нельзя после того, как на сравнительно небольшом конечном числе тарелок
он практически достигнут.
Из табл. 18 можно далее сделать тот вывод, что с увеличением отдачи
тепла в парциальном конденсаторе значение граничного состава, практически
достижимого внизу укрепляющей колонны, прогрессивно уменьшается и тем
самым делается шире разность составов потоков между низом и верхом
колонны. Так, для d/D—118,5 ккал)кг предельная концентрация понижается
до хгр = 0,472, а для d/D = 571,l ккал!кг она доходит до хгр = 0,093. Оче-
видно, дальнейшее увеличение d/D приведет к возможности получения с низа
колонны уже практически чистого высококипящего компонента — толуола.
Так подтверждается сделанное ранее утверждение о принципиальной возмож-
ности разделения в укрепляющей колонне исходной бинарной системы на
ее практически чистые компоненты. Однако из той же табл. 18 легко видеть,
как при этом должна резко возрастать необходимая для поддержания тепло-
вого режима укрепляющей колонны отдача тепла в парциальном конденса-
торе. Это делает экономически нецелесообразным получение двух практически
чистых компонентов в укрепляющей колонне.
Табл. 18 имеет большое значение для анализа работы укрепляющей
колонны. Пусть, например, в рассматриваемой задаче разделения бинарной
системы бензол — толуол на практически чистый бензол состава уо = 0,995
дополнительно требуется получать с низа укрепляющей колонны жидкий
поток состава xR = 0,472. Это требование, конечно, должно быть согласовано
со значением а состава исходного парового сырья. Этот состав а по усло-
вию материального баланса и по условию подачи сырья в укрепляющую
колонну исключительно лишь в паровом состоянии может варьировать лишь
в вполне определенных пределах.
Из той же таблицы видно, что при значениях отдачи тепла в парциаль-
ном конденсаторе укрепляющей колонны, меньших d:D = 118,5 ккал/кг, ни
при каком числе тарелок ии теоретически, ни практически нельзя достичь
внизу колонны состава жидкости =0,472. Однако при d/D = 118,5 ккал!кг
d/D, ккал/кг 56,1 102,3 118,5
в», ккал/кг 185,4 231,6 247,8
*гр 0,955 0,541 0,472
У гр 0,980 0,748 0,690
Состав фаз Т; X; Vi Xi У< X/
Парциальный
конденсатор 0,995 0,986 0,995 0,986 0,995 0,986
Тарелка 1 0,992 0,978 0,990 0,977 0,990 0,977
2 0,989 0,972 0,986 0,966 0,985 0,965
3 0,986 0,967 0,980 0,952 0,978 0,950
4 0,984 0,963 0,973 0,938 0,970 0,933
5 0,983 0,958 0,965 0,921 0,960 0,912
6 0,981 0,956 0,956 0,902 0,949 0,885
7 0,981 0,956 0,946 0,879 0,934 0,852
8 0,981 0,956 0,934 0,852 0,912 0,798
9 0,981 0,956 0,920 0,820 0,884 0,743
10 0,981 0,956 0,903 0,781 0,852 0,689
11 0,981 0,956 0,882 0,740 0,821 0,640
12 0,981 0,956 0,860 0,700 0,792 0,600
13 0,981 0,956 0,839 0,667 0,768 0,567
14 0,981 0,956 0,821 0,640 0,748 0,541
15 0,981 0,956 0,805 0,615 0,733 0,521
16 0,981 0,956 0,791 0,597 0,721 0,507
17 0,981 0,956 0,781 0,584 0,713 0,498
18 0,981 0,956 0,774 0,574 0,707 0,493
19 0,981 0,956 0,769 0,569 0,703 0,486
20 0,981 0,956 0,766 0,565 0,698 0,479
21 0.981 0,956 0,763 0,560 0,695 0,475 [
„ 22 0,981 0,956 0,760 0,557 0,692 0,473
23 0,981 0,956 0,758 0,553 0,690 0,472 1
24 0,981 0,956 0,756 0,550 0,690 0,472
25 0,981 0,956 0,754 0,548 0,690 0,472
26 0,981 0,956 0,753 0,546 0,690 0,472
27 0,981 0,956 0,752 0,544 0,690 0,472
28 0,981 0,956 0,751 0,543 0,690 0,472
29 0,981 0,956 0,750 0,542 0,690 0,472
30 0,981 0,956 0,749 0,541 0,690 0,472
31 0,981 0,956 0,748 0,541 0,690 0,472
31 0,981 0,956 0,748 0,541 0,690 0,472
. 00 0,980 0,955 0,748 0,541 0,690 0,472
Анализ ректификации в укрепляющей колонне
271
Таблица 7S
133,7 158,6 192,0
263,0 287,9 321,3
0,407 0,345 0,287
0,633 0,566 0,495
3', A'i У, xi yt xi
0,995 0,986 0,995 0,986 0,995 0,986
0,989 0,973 0,989 0,973 0,989 0,973
0,982 0,958 0,981 0,955 0,981 0,955
0,973 0,938 0,970 0,932 0,968 0,930
0,962 0,913 0,955 0,900 0,945 0,885
0,947 0,880 0,935 0,853 0,921 0,820
0,927 0,835 0,905 0,785 0,877 0,731
0,900 0,773 0,862 0,704 0,816 Q 634
- -0,863 - — 0,/05 0,846 O-J324- - 0 748 и;эп
0,822 0,642 0,757 0,553 0,682 1 0,462
0,783 0,586 0,709 0,493 0,625 0,397
0,747 0,539 0,669 0,446 0,576 0,355
0,718 0,504 0,635 0,407 0,548 0,330
0,696 0,477 0,609 0,384 0,528 0,314
0,696 0,477 0,609 0,384 0,528 0,314
0,664 0,440 0,584 0,362 0,507 0.296
0,654 0,430 0,576 0,355 0,502 0,293
0,648 0,422 0,572 0,352 0,500 0,290
0,642 0,415 0,570 0,348 0,498 0,289
0,638 0,410 0,567 0,346 0,497 0,288
0,635 0,407 0,566 0,345 0,497 0 288
0,633 0,407 0,566 0,345 0,497 0,288
0,633 0,407 0,566 0,345 0,497 0,288
0,633 0,407 0,566 0,345 0,497 0,288-
0,633 0,407 0,566 0,345 0,497 0,288
0,633 0,407 0,566 0,345 0,497 0,288
0,633 0,407 0,566 0,345 0,497 0,288
0,633 0,407 0,566 0,345 0,497 0,28&
0,633 0,407 0,566 0,345 0,497 0,28&
0,633 0,407 0,566 0,345 0,495 • 0,287
Укрепляющая пектшЬикаиионная колонна
d/D, ккал/кг 233,3 294,0 367,6
в2, ккал/кг 362,6 423,3 496,9
X гр 0,233 0,184 0,137
Vrp 0,424 0,352 0,281
Состав фаз Уг Xi Ti Уг xi
Парциальный 0,995 0,986
конденсатор 0,995 0,986 0,995 0,986
Тарелка 1 0,989 0,973 0,988 0,972 0,988 0,972
2 0,979 0,950 0,978 0,947 0,977 0,946
3 0,961 0,912 0,959 0,908 0,956 0,907
4 0,936 0,856 0,929 0,839 0,925 0,831
5 0,895 0,764 0,876 0,729 0,863 0,705
6 0,829 0,652 0,791 0,597 0,762 0,560
7 0,746 0,539 0,689 0,469 0,742 0,415
8 0,664 0,439 0,586 0,363 0,522 0,309
9 0,587 0,364 0,500 0,290 0,432 0,241
10 0,528 0,313 0,440 0,247 0,373 0,200
и 0,488 0,282 0,405 0,218 0,338 0,174
12 0,462 0,264 0,380 0,205 0,315 0,160
13 0,449 0,253 0,369 0,197 0,302 0,151
14 0,449 0,253 0,369 0,197 0,295 0,147
15 0,435 0,242 0,356 0,188 0,292 0,145
16 0,431 0,239 0,354 0,186 0,290 0,144
, 17 0,430 0,238 0,353 0,185 0,289 0,143
18 0,429 0,237 0,352 0,184 0,288 0,142
19 0,428 0,235 0,352 0,184 0,287 0,141
„ 20 0,426 0,234 0,352 0,184 0,286 0,140
21 0,424 0,233 0,352 0,184 0,284 0,139
22 0,424 0,233 0,352 0,184 0,282 0,138
23 0,424 0,233 0,352 0,184 0,281 0,137
24 0,424 0,233 0,352 0,184 0,281 0,137
25 0,424 0,233 0,352 0,184
26 0,424 0,233 0,352 0.184
27 0,424 0,233 0,352 0,184
28 29 , 30 „ 31 . 31 0,424 0,233 0,352 0,184
ОС 0,424 0,233 0,352 0,184 0,281 0,137
Анализ ректификации в укрепляющей колонне
27,3
Продолжение табл. 18 ,
571,1 1001,3 oo
700,4 1130,6 co
0,093 0,051 0,000
0,196 0,114 0,000
Vi У Уг | Xi
0,995 0,986 0,995 0,986 0,995 0,986
0,987 i 0,969 0,987 0,969 0,986 0,968
0,971 0,932 0,971 0,932 0,968 0,927
0,941 j 0,866 0,938 0,862 0,927 0,834
0,884 0,743 0,873 0,724 0,834 0,660
0,777 1 0,579 1 0,746 0,538 0,660 0,438
0,6.34 1 i 0,408 0,574 0,353 0,438 0,244
0,482 1 0,277 0.401 0,219 0 944 0 117
' ' 0 ,304 0.195 0,275 0,134 T 0,117 0,053
0,288 0,142 0,193 0,091 0,053 0,024
0,241 0,117 0,152 0,070 1 0,024 0,010
0,217 0,104 0,132 0,059 0,010 i 0,003
0,205 0,097 0,122 0,055 0,003 0,009
0,199 0,094 0,118 0,053 0.003 0,009
0,196 0,093 0,116 0,052 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,003 0,009
0,196 0,093 0,114 0,051 0,000 0,000
13 Зак. М 304.
.этого состава практически достигает флегма, стекающая с 23-й тарелки
колонны, считая сверху. Работа колонны при минимальной отдаче тепла
в парциальном конденсаторе неустойчива и нарушается при самых неболь-
ших колебаниях режима питания или охлаждения на верху колонны. Поэтому
на практике всегда работают с некоторым избытком отдачи тепла в парциаль-
ном конденсаторе против его минимального значения.
Допустим, что отдача тепла в конденсаторе повышена до d/D=
= 133,7 ккал/кг дестиллата пли, иначе говоря, увеличена приблизительно на
11,3%. В этом случае число теоретических тарелок, необходимых для полу-
чения внизу колонны желательного состава флегмы xR = 0,472, сокращается
до четырнадцати, что видно из табл. 18. Больше того, если продолжать
увеличивать отдачу тепла в парциальном конденсаторе, то это увеличение d/D-
будет сопровождаться уменьшением необходимого числа тарелок, но лишь
до определенного предела. Так, при значении d/D — 294,0 ккал/кг, т. е. при
увеличении его на 148% против минимального, число необходимых тарелок
сокращается до семи. Минимальное же число тарелок, необходимых для
заданного разделения, определится при d/D=cc. Это минимальное число
тарелок заключено между четырьмя и пятью. Очевидно, при наличии табл. 18
подобный анализ можно провести и для любого другого значения состава
верхних паров, причем общий вывод, конечно, будет один и тот же.
Обычно состав а исходных сырьевых паров бывает известен, и после
выбора того пли иного режима работы колонны, определяемого принятием
конкретного значения d/D и установлением по табл. 18 числа тарелок укреп-
ляющей колонны и распределения составов фаз по ее высоте, необходимо
для завершения расчета принятого варианта найти теплосодержание сырья
на входе в колонну. Эта задача проще всего решается по уравнению (VI. 11)_
а— х р Г)
• Qo = ?r+ —----~— (б2— 9r) = 9r + ~F~ (Рг Яц)- (VI. 50)
Ув — XR L
Составы в правой части уравнения (VI. 50) известны по заданию, вели-
чина 02 рассчитывается по принятому значению d/D, и поэтому" значение Qe
определяется из уравнения однозначным образом. При решении задач этого
рода следует иметь в виду, что в ряде случаев может оказаться необходи-
мым подавать сырье в колонну в состоянии перегретом, а не насыщенном.
Пусть, например, состав парового сырья а = 0,720, а выбранный режим
работы укрепляющей колонны определяется отдачей тепла в парциальном
конденсаторе колонны d/D = 133,7 ккал/кг дестиллата. Для этого режима
работы укрепляющей колонны число ее тарелок, необходимое для достиже-
ния хй = 0,472, равно четырнадцати, а тепловой параметр 02 = 263 ккал/кг
дестиллата. Теплосодержание единицы веса жидкости состава xR =0,472,
находящейся при своей точке начала кипения, равно qR =36,8 ккал/кг. Под-
ставляя надлежащие величины в уравнение (VI. 50), найдем теплосодержа-
ние Qa сырьевых паров на входе в укрепляющую колонну:
Qo = 36,8 4- <263 - 36-8> =145 ккал1™-
Нанеся фигуративную точку сырья на тепловую диаграмму, нетрудно
убедиться, что она располагается выше кривой теплосодержаний насыщен-
ной паровой фазы и поэтому характеризует сырье, заметно перегретое выше
точки конца кипения.
Рассмотрим другой пример использования табл. 18. Пусть в укрепляющей
колонне требуется разделить исходную бинарную систему состава а = 0,570
на практически чистый бензол состава = 0,995 с относительным выходом
Анализ ректификации в укрепляющей колонне
275
последнего D'[L~- 0,340. Этих данных вполне достаточно, чтобы определить
состав флегмы, стекающей с нижней тарелки укрепляющей колонны и пред-
ставляющей собой ее второй целевой продукт. Решая уравнение (VI. 3) отно-
сительно xR, имеем
L / ч пппг 0,995 — 0,570 „ „,о
хР = Ув~-р(Уо-<0 = 0,995--------i _ о,34б~ =0’352'
Из табл. 18 видно, что минимальная отдача тепла, при которой
внизу колонны получается флегма состава хЛ = 0,352, немного меньше
dfD— 158,6 ккал'кг. Если положить эту цифру в основу выбранного режима
работы колонны, то флегма, стекающая с 17-й тарелки, будет иметь состав
= 0,352, а пар, поднимающийся на эту тарелку, будет иметь состав
у18 = а = 0,570. Найдем теплосодержание сырьевого потока. Имея в виду
что теплосодержание жидкого потока, стекающего с нижней тарелки, при
его составе х Г, = 0,352 составляет qR = 37,9 ккал)кг, а тепловой пара-
метр 02 = 287,9 ккал[кг, можно по уравнению (VI. 50) найти
Qo = 37,9 + 0,340 (287,9 — 37,9) = 122,9 ккал)кг.
Паровой поток сырья полается в колонну в насыщенном состоянии в точке
начала конденсации, в чем легко убедиться, нанеся его фигуративную точку
на тепловую диаграмму. Однако следует отметить, что принятое значе-
ние d/D =158,6 ккал!кг слишком мало отличается от минимального, чтобы
обеспечить устойчивую и нормальную работу укрепляющей колонны. Поэтому
выясним, как должно измениться теплосодержание поступающего в колонну
сырья, если отдача тепла в парциальном конденсаторе будет увеличена
до d/D= 192,0 ккал)кг дестиллата или, иначе говоря, будет увеличена при-
близительно на 22%. Тепловой параметр при этом б2 = 321,3 ккал)кг, и, сохра-
няя остальные условия работы колонны неизменными, мы получаем тепло-
содержание входящих сырьевых паров
Qo = 37,9 + 0,340 (321,3 — 37,9) =134,4 ккал!кг.
Сырье подается в колонну в перегретом состоянии. Здесь уместно заме-
тить, что вообще питание укрепляющей колонны несколько перегретыми
сверх точки насыщения парами является часто встречающимся способом
подачи сырья.
Для рассматриваемого случая число необходимых тарелок сокращается
до одиннадцати, что также устанавливается по табл. 18.
Может представиться и такой случай, когда по заданию фиксируются
составы верхнего и нижнего продуктов колонны и требуется выбрать такой
режим работы, при котором сырье подавалось бы под нижнюю тарелку
в насыщенном состоянии. Здесь, очевидно, также можно воспользоваться
табл. 18 и уравнением (VI. 10), которое, однако, уже решается методом
постепенного приближения для каждого принятого значения d/D. Так,
если уп = 0,995 и xR =0,352, а отдача тепла в парциальном конденсаторе
выбрана d/D= 192,0 ккал}кг дестиллата, то по предыдущему число тарелок
укрепляющей колонны будет равно одиннадцати. Состав же сырья, если оно
находится при точке конца кипения, в состоянии насыщенного пара, опре-
делится методом постепенного приближения из уравнения
а = У£>-'02_ц° <Ув~хР>- (VI. 51)
v2 i R
18*
Найдем этот состав. Теплосодержание насыщенной жидкости состава
xR = 0, 352 равно </^=37,9 ккал) кг, а тепловой параметр 02 = 321,3 ккал]кг.
Зададимся составом а = 0,548 и проверим это значение по уравнению (VI. 51).
Из тепловой диаграммы парам этого состава отвечает теплосодержание
Qo= 122,8 ккал]кг. Подставляя необходимые данные в уравнение (VI. 51),
имеем
а = 0,995 - £ (0,995 - 0,352) = 0,545.
02.1 ,о — о / ,У
Сходимость между принятым и полученным значениями а достаточно
удовлетворительная.
Если сырье подается в колонну при температуре более
высокой, чем точка его конца кипения, то, как указывалось
выше, его состав и теплосодержание связаны уравнениями (VI. 50)
и (VI. 51) и по одному из этих параметров может быть одно-
значно определен другой.
Конечно, все эти расчеты и анализ режимов работы укре-
пляющей колонны особенно наглядно могут быть представлены
на тепловой диаграмме, однако таблицы типа табл. 18 имеют
то преимущество, что сразу дают необходимое для каждого
режима число тарелок и распределение составов фаз по ним.
Так или иначе, графически или аналитически, но режим работы
колонны исследуется на основании одних и тех же основных
уравнений, и ясно, что и выводы должны быть получены в обоих
случаях одни и те же независимо от того, ведется ли рассмо-
трение работы колонны по тепловой диаграмме или же по
табл. 18.
При выборе оптимального варианта работы укрепляющей
колонны следует руководствоваться теми же соображениями
экономической целесообразности, о которых говорилось при
рассмотрении работы отгонной колонны. То обстоятельство,
что увеличение отдачи тепла в парциальном конденсаторе,
начиная с некоторого значения, лишь немного уменьшает
высоту колонны и в последующем и вовсе не влияет на
число ее тарелок, но зато приводит к резкому возраста-
нию масс циркулирующих в укрепляющей колонне потоков
паров и флегмы, к увеличению диаметра колонны и поверх-
ности охлаждения конденсатора, служит основным крите-
рием при выборе режима работы укрепляющей колонны.
Рекомендуется при установлении теплового режима работы
укрепляющей колонны принимать тепло парциального конден-
сатора лишь на 15—25% больше минимального.
Смысл использования основной табл. 18 состоит еще и в том,
что она позволяет путем интерполяции для любого назначен-
ного состава, например нижнего продукта, сразу же находить
сопряженные значения числа тарелок колонны и величины
отдачи тепла в парциальном конденсаторе для самых различ-
ных режимов работы.
Анализ ректификации в укрепляющей колонне 277
Так, например, если состав нижнего продукта колонны
xR = 0,541, то из табл. 18 сразу можно сделать заключение
относительно нижней границы величины d/D, согласно которому
она не может быть меньше 102,3 ккал/кг дестиллата. Далее
также видно, что для получения этого состава флегмы внизу
14-тарелочной колонны нужно отнимать в парциальном кон-
денсаторе 118,5 ккал/кг тепла, а в 8-тарелочной колонне
192,0 ккал/кг верхнего продукта. Подобные данные, сразу
получаемые на основе этой таблицы, для любого режима работы
укрепляющей колонны используются для технико-экономиче-
ского анализа рассматриваемой проблемы разделения, и выбран-
ный оптимальный вариант в последующем окончательно уточ-
няется во всех подробностях.
Компоненты рассматриваемой бинарной системы бензол—
толуол, как указывалось выше, выкипают в узком 30-градус-
ном интервале, и поэтому для ее разделения требуется сравни-
тельно большое число контактных ступеней. Для иллюстрации
другого варианта, когда точки кипения компонентов отстоят
довольно далеко друг от друга, в табл. 19 приведены резуль-
таты расчетов разделения системы «-гептан—эндекан в укре-
пляющей колонне.
Промежуточные и подготовительные расчеты, вполне ана-
логичные системе бензол—толуол, здесь опущены и приведена
лишь конечная таблица, дающая число тарелок и распределе-
ние составов жидких потоков по всей высоте укрепляющей
колонны для случая, когда верхний ее продукт представляет
собой практически чистый н-гептан состава yD = 0,995.
При сравнении табл. 18 и 19 бросается в глаза весьма
заметная разница в числе тарелок и в величине d/D, требуемой
для получения одних и тех же составов жидкой фазы внизу
колонны в системе бензол — толуол и системе «-гептан — эндекан.
Так, для первой системы, чтобы получить внизу колонны флегму
состава хя = 0,051, требуется отнимать в парциальном конден-
саторе по меньшей мере 1001,3 ккал/кг дестиллата, тогда как
при разделении второй системы на тот же верхний и нижний
продукты понадобится в 5 раз меньшая величина съема тепла
в конденсаторе, а именно d/D = 200 ккал/кг дестиллата.
Далее при разделении системы бензол — толуол для практи-
ческого получения указанного состава xR = 0,051 при работе
с минимальным съемом тепла в парциальном конденсаторе
понадобится 15 тарелок, а при разделении в тех же условиях
минимального d/D для системы «-гептан—эндекан возможно
практически ограничиться всего лишь б теоретическими тарел-
ками. Важно отметить, что эта разница сохраняется при реаль-
ной работе с избытком d/D против минимального. Отсюда ясно,
какое важное влияние на весь режим работы укрепляющей
ректификационной колонны оказывает характер равновесных
соотношений рассматриваемой системы. Чем ближе точки кипе-
ния компонентов системы, тем меньше разность между соста-
вами равновесных паровой и жидкой фаз и тем болшпе~дол жньГ
быть съем тепла в конденсаторе и число тарелок колонны.
Наоборот, чем дальше отстоят точки кипения разделяемых
компонентов, чем больше разнятся их летучести, тем с меньшим
числом тарелок и меньшим съемом тепла в конденсаторе можно
осуществить их ректификацию.
Таблица 19
Qd = 133 ккал1кг, уо=0,995 (система и-гептан — эндекан)
d ккал/кг Состав жидкой фазы, стекающей с 1-й ступени Гранич- ная кон- центра- ция хгр
парци- альный конден- сатор Х1 х2 х3 *4 *5 хе X,
10,0 0,935 0,750 0,665 0,645 0,625 - 0,625
15,9 0,935 0,740 0,590 0,525 0,500 — — 0,500
28,4 0,935 0,710 0,465 0,355 0,340 0,336 .— — 0,336
50,0 0,935 0,640 0,325 0,225 0,200 0,198 0,198
65,0 0,935 0,638 0,300 0,190 0,160 0,155 0,152 0,150
100,0 0,935 0,600 0,235 0,127 0,107 0,100 0,100
112,7 0,935 0,592 0,212 0,112! 0,092 0,090 0,087 0,084 0,084
200,0 0,935 0,550 0,160 0,070! 0,055 0,052 0,050 — 0,050
500,0 0,935 0,500 0,112 0,035 0,02 — — — 0,020
СО 0,935 0,450 0,075 0,008 1 0,0009 — — — 0,000
Из всего материала, изложенного выше, можно сделать вы-
вод о том, что составление основной расчетной таблицы типа
18 или 19 удобно при анализе проблемы ректификации любой
системы в укрепляющей колонне. Такая таблица дает решение
общей проблемы разделения в укрепляющей колонне данной
бинарной системы и позволяет сразу получить ответ на многие
вопросы, возникающие при выборе надлежащего режима работы
колонны.
ГЛАВА VII
ПОЛНАЯ РЕКТИФИКАЦИОННАЯ КОЛОННА
§ 1. Описание колонны
Наиболее совершенной формой осуществления ректифика-
ции является проведение ее в полной колонне, представляю-
щей собой сочетание в одном аппарате отгонной и укрепляю-
щей колонн. Ранее уже указывалось, что попытка получить
с верха отгонной колонны пары, близкие по составу к практи-
чески чистому НКК, теоретически вполне возможная, практи-
чески (в общем случае) связана с необходимостью затрачивать
чрезмерно большое количество тепла в кипятильнике колонны.
Равным образом и попытка получить с низа укрепляющей ко-
лонны флегму, близкую по составу к практически чистому ВКК,
теоретически вполне возможная, практически (в общем случае)
связана с необходимостью чрезмерно большой отдачи тепла
в парциальном конденсаторе колонны. Таким образом, получение
в одном отгонном или укрепляющем колонном аппарате двух
практически чистых целевых продуктов экономически нецелесо-
образно. Каждая из этих колонн позволяет с оптимальными
эксплуатационными расходами получать практически чистым
лишь один компонент исходной бинарной системы, отгонная —
высококипящий, а укрепляющая — низкокипящий.
В промышленности давно утвердилась практика совмещения
в одном аппарате отгонной и укрепляющей колонн, чтобы со-
здать наиболее благоприятные условия для получения обоих
целевых компонентов с любой степенью чистоты. Схема подоб-
ной, так называемой полной колонны представлена на фиг. 74.
Нижняя часть колонного аппарата представляет его отгонную
секцию, а верхняя — укрепляющую. Обе секции соединяются
друг с другом питательной секцией колонны, куда поступают
пары с верхней тарелки отгонной секции, флегма с нижней
тарелки укрепляющей секции и сырье, подаваемое извне.
В общем случае сырье входит в питательную секцию
колонны в двухфазном паро-жидком состоянии, смешивается
с потоками, идущими из нижней и верхней секций, здесь смесь
разделяется на две фазы, паровую и жидкую, и смешавшиеся
одноименные потоки направляются в соответствующие секции
280
Полная пектигЬикаиионная коппиип
колонны, паровой — в укрепляющую, а жидкий — в отгонную.
Нижняя и верхняя секции полной колонны работают точно
так же, как если бы мы имели дело с соответствующими
неполными колоннами — отгонной или укрепляющей. Соотно-
шения между весами паровых и жидких потоков на любом
Тепло | d
Тепло 1 я
Фиг. 74. Схема полной ректи-
фикационной колонны.
уровне каждой из секций, связь
между составами встречных фаз
и весами потоков или расходами
тепла представляются теми же
уравнениями, которые были выве-
дены для отгонной и укрепляющей
неполных колонн. Поэтому анализ
работы этих секций полной колонны
не даст ничего нового. Новые
результаты могут получаться лишь
из общих материальных и тепловых
балансов всей колонны в целом
и из анализа ее питательной секции,,
являющейся узловым пунктом всей
полной колонны, в котором связы-
ваются потоки сырья с потоками
флегмы и паров, идущих из ее
нижней и верхней секций.
§ 2. Материальный и тепловой
балансы полной колонны
Как и в неполных колоннах,
для получения уравнений, связы-
вающих веса, составы и теплосодер-
жания сырья и целевых продуктов
ректификации, и для вывода соот-
ношения между съемом тепла
в парциальном конденсаторе ко-
лонны и расходом тепла в кипя-
тильнике необходимо составить материальный и тепловой
балансы для всего объема полной колонны. Методика соста-
вления уравнений баланса вещества подробно разъяснена при
рассмотрении неполных колонн, и поэтому здесь эти уравне-
ния по общему весу потоков и по весу содержащегося в них
НКК пишутся сразу:
L = D + /?; (VII. 1) La = DyD + /?XR. (VII. 2)
Совпадение уравнений (VII. 1) и (VII. 2) с соответствующими
уравнениями для неполных колонн объясняется тем, что мысль,
выражаемая этими соотношениями, одна и та же, о чем было
сказано при анализе укрепляющей колонны. Из уравнений
Материальный и тепловой балансы полной колонны 281
(VII. 1) и (VII.2) могут быть найдены относительные веса целе-
вых продуктов: R __ Т- Vn CL _х \ (VII.3) XD XR
D Т = tz — X р = . (VII. 4) yD~xR V
Состав а сырья и составы yD и xR обоих целевых продуктов
полной ректификационной колонны обычно бывают известны по
заданию для расчета, в котором, естественно, должно быть ука-
зано, какое сырье подвергается ректификации и какие качества
должны иметь целевые продукты, отводимые с низа и с верха
колонны. В уравнения (VII. 1) и (VII. 2) или, что то же (VII. 3}
и (VII. 4), формально входят шесть неизвестных величин: L, D,
R, a, yD и xR. При расчете на единицу веса сырья L = l, число
неизвестных больше числа уравнений на три, а как раз три вели-
чины обычно задаются как-исходные данйые~для-
расчета. Оставшиеся две неизвестные величины D и R легко
могут быть рассчитаны по уравнениям (VII. 3) и (VII. 4). В этом
первое серьезное различие между полной колонной и неполной,,
в которой назначается состав лишь одного из продуктов ко-
лонны, а именно состав основного продукта, отбираемого как
практически чистый компонент, в отгонной — высококипящий,
а в укрепляющей — низкокипящий. Поэтому в расчете неполных
колонн при использовании тех же уравнений (VII. 3) и (VII. 4)
приходится одной из неизвестных величин задаваться, тогда как
в расчете полной колонны уже ничем задаваться ненужно и веса
целевых продуктов по уравнениям (VII. 3) и (VII. 4) опреде-
ляются однозначно.
Другое различие между работой полных и неполных колонн
состоит в том, что сырье в последние поступает только в одно-
фазном состоянии, в отгонную колонну - в жидком, а в укреп-
ляющую — в паровом. В полную же колонну сырье может
поступать как в однофазном, так и в двухфазном состояниях,
причем последний случай обычно рассматривается как общин.
Обозначая веса паровой и жидкой фаз сырья через Gc и gc, а
составы их через ус и хс соответственно, можно написать
Gc + gc = L; (VII. 5) Gcyc+gcxc = La. (VII. 6)
Совместное решение уравнений (VII. 5) и (VII. б) позволяет
найти степень отгона сырья на входе в питательную секцию
полной колонны по составам равновесных фаз:
G. а — х
~ = е =-----.
L Ус~ хс
(VII. 7}
(VII. 8)
целом не
и поэтому
Очевидно, столь же просто может быть найден и относитель-
ный вес жидкой фазы сырья:
Sc Ус~а
L Ус — хс '
Из материального баланса полной колонны в
удается извлечь других дополнительных данных,
перейдем к рассмотрению ее теплового баланса.
Тепловой баланс полной колонны составляется на основе того
соображения, что количество тепла, вносимого в колонну сырьем
и подаваемого через кипятильник, делится на три части, уноси-
мые из парциального конденсатора с верхним и нижним целе-
выми продуктами колонны:
LQ0 4* B = 4~ DQd -f-d. (VII. 9)
При определенных качествах верхнего и нижнего целевых
продуктов колонны остаются неизменными их веса и теплосо-
держания. Однако при одном и том же начальном составе а сырья
оно может подаваться в колонну при различных температурах
и с различной степенью отгона и соответственно обладать раз-
личным теплосодержанием Qo. Чем выше начальная степень
отгона сырья, тем при прочих равных условиях больше его
теплосодержание и больше поток тепла, вносимый в колонну
сырьем. Соответственно, как показывает А. М. Трегубов, с воз-
растанием теплового потока, вносимого сырьем, увеличивается
на столько же разность между съемом тепла в конденсаторе d
и приходом тепла В в кипятильник, ибо,
LQ0 — (d — В) = RqR + DQd = const. (VII. 10)
При помощи введенных при рассмотрении неполных колонн
тепловых параметров 01 и 02 можно преобразовать уравне-
ние (VII. 9) к виду, более удобному для последующих расчетных
операций:
LQo = Wi4-fl0a. (VII. 11)
Сочетание уравнений (VII. 1) и (VII. 2) и (VII. 11) позволяет
выразить относительные веса целевых продуктов колонны через
тепловые величины при помощи соотношений, симметричных
уравнениям (VII. 3) и (VII. 4):
# = 4^°; (VII. 12) 4 = (VII. 12а)
Л С/2 VJ У 2 1
Если путем сочетания уравнений (VII. 3) и (VII. 12) или (VII. 4)
и (VII. 12а) исключить веса R[L и DjL, то можно получить
Материальный и тепловой балансу полной колонны
283
соотношения, связывающие лишь составы и тепловые параметры
сырья и целевых продуктов ректификации:
Ур~а
Ур ~ XR
02 Qo
02 0!
(VII. 13)
a~xR
Ур — XR
Qo °'.. (VII. 14)
01 0 о
Тождества (VII. 13) и (VII. 14) эквивалентны друг другу, в чем
легко убедиться, вычтя, например, из единицы правую и левую
части уравнения (VII. 13) и приведя к общему знаменателю.
Получится соотношение (VII. 14).
Тождество (VII. 14) является не-
обходимым и достаточным усло-
вием того, чтобы на тепловой диа-
грамме три точки (a, Qo), (xR, 6Х) и
(yD, 02) лежали на одной прямой.
Иными словами, фигуративная точка
сырья и полюсы обеих секций пол-
ной колонны на тепловой диаграмме
лежат на одной прямой .Это важное
положение иллюстрировано построе-
нием на фиг. 75. Прямая 5\LS2 про-
ведена на основании соотношения
(VII. 14), в чем легко убедиться из
подобия треугольников и
LS2C. Из той же тепловой диа-
граммы можно сделать ряд важных
выводов о характере связи между
•отдачей тепла в конденсаторе ко-
лонны и притоком тепла через кипя-
Фиг. 7.5. Связь между фигура-
тивными точками сырья и про-
дуктов полной колонны на теп-
ловой диаграмме.
тильник при изменении теплосодер-
жания поступающего сырья. Пусть приток тепла в кипятильник
колонны остается при некотором постоянном значении, большем
минимального для каждого из рассматриваемых режимов работы
колонны. Тогда полюс отгонной секции будет все время распо-
ложен в одной и той же точке Sx. При изменении теплосодер-
жания Qo сырья его фигуративная точка будет передвигаться по
вертикали а=const. Легко заметить, что увеличение теплосо-
держания сырья приведет к возрастанию отдачи тепла в конден-
саторе, а уменьшение Qo, наоборот, вызовет понижение d/D.
Равным образом, если в тех же условиях сохранять постоян-
ным d/D или, иначе говоря, сохранить неизменным положение
полюса S2, то изменение теплосодержания сырья Qo в сторону,
например, увеличения вызовет уменьшение притока тепла через
кипятильник, а при понижении Qo тепло кипятильника будет
расти. Наконец, при одном и том же неизменном теплосодер-
жании сырья и при постоянных составах верхнего и нижнего
целевых продуктов могут изменяться лишь количества тепла d
и В, при», как показывает уравнение (VII. 9), лишь в одну
сторону и на одну и ту же величину. В самом деле, написав
уравнение (VII. 9) в виде
В — d = RqR + DQd — LQ0 = const, (VII. 15)
легко убедиться в правильности сделанного вывода. Вообще
следует иметь в виду, что тепловая диаграмма не может дать ни
одного вывода, который не содержался бы в аналитических
соотношениях, полученных при анализе работы колонны мето-
дом балансов. Преимущество графических построений заклю-
чается лишь в простоте и наглядности, с которыми эти выводы
получаются, хотя и не во всех случаях.
Прямая соединяющая на тепловой диаграмме полюсы,
верхней и нижней секций колонны, делится фигуративной
точкой сырья, через которую она обязательно проходит, на две
части, пропорциональные весам целевых продуктов разделения.
В самом деле, из рассмотрения фиг. 75 можно заключить, что
SAL а — х R D У о — я В
^1^2 У/) -Xr L ^1^2
откуда ___
8г1, D я ——
LS~2~ yD — a '
На основе соотношений материального и теплового балансов
полной колонны представилось возможным сделать ряд важных
выводов относительно связи и взаимозависимости между состав-
ными целевых продуктов и энергетическими факторами, регули-
рующими режим ее работы.
При рассмотрении неполных ректификационных колонн по-
рядок анализа их работы состоял в том, что, покончив с мате-
риальным и тепловым балансами всей колонны в целом, мы
приступали к изучению отдельных секций для выявления соот-
ношений, связывающих элементы ректификации на любом уровне
колонны. Придерживаясь того же принципиального подхода и
при изучении полной ректификационной колонны, легко заме-
тить, что основной интерес представляет анализ лишь питатель-
ной секции полной колонны, так как нижняя и верхняя секции
ее представляют собой типичные отгонную и укрепляющую
колонны, уже изученные ранее.
§ 3. Расчет питательной секции полной колонны
На фиг. 76 представлена схема питательной секции полной
ректификационной колонны, состоящей из отгонной и укрепляю-
щей секций. Пары Ол с верхней тарелки отгонной колонны и
Расчет питательной, секции полной колонны
285
Фиг. 76. Схема питательной
секции полной колонны.
флегма gK с нижней тарелки укрепляющей колонны поступают
на питательную тарелку и здесь смешиваются с сырьем, которое
в общем случае поступает в колонну в двухфазном паро-жидком
состоянии. На питательной тарелке происходят смешение и
взаимодействие всех этих потоков, и с нее отходят два потока,
паровой—кверху и жидкий—книзу. Паровой поток Gm, пред-
ставляющий смесь паровой фазы сырья Gc с парами Сл, приобре-
таёт некоторый средний состав у,п и поступает на нижнюю
тарелку укрепляющей секции, а жидкий поток gm, представляю-
щий смесь жидкой фазы сырья gc
с флегмой gK, приобретает некоторый
-средний состав хт и поступает на
верхнюю тарелку отгонной секции.
Обычно считают, что вес Gm парового
потока, поступающего на нижнюю
тарелку укрепляющей секции, склады-
вается из веса паровой фазы сырья
и веса паров Ол, поднимающихся
с верхней тарелки отгонной- сскции-х
Gm = Ос + Ол. (VII. 16)
Соответственно и состав этого
парового потока рассчитывается по
правилу смешения:
_ +
Ут Gc + °л
(VII. 17)
Вес gm жидкого потока, поступающего на верхнюю тарелку
отгонной секции, обычно определяют как сумму весов жидкой
фазы сырья и флегмы, стекающей с нижней тарелки укрепляю-
щей секции:
(VII. 18)
gm = gc + gK-
Соответственно и состав хт этого суммарного жидкого потока
рассчитывается по правилу смешения:
х = . (VII. 19)
т gc + gK
Однако смешение потоков жидкостей и паров на питатель-
ной тарелке не является простым их суммированием, а со-
провождается небольшим частичным испарением жидкости и
частичной конденсацией паров. Поэтому принятие весов Gm и gm
равными суммарным весам смешивающихся паровых и жидких
потоков не вполне точно.
В действительности, вследствие выпуклости линий, ограничи-
вающих область двухфазного состояния системы на диаграммах
типа t — х, у или тепловой фигуративная точка смеси двух одно-
именных насыщенных фаз в подавляющем большинстве случаев
попадает в гетерогенную область. Однако ввиду близости гра-
ничных кривых на небольших сравнительно участках к прямо-
линейному очертанию фигуративная точка смеси располагается
очень близко к кривой насыщения, и поэтому степень испаре-
ния или конденсации обычно незначительна. Вообще, чем ближе
друг к другу составы смешивающихся потоков, тем меньше
частичное испарение или конденсация. Тем не менее все же эти
явления происходят и оказывают известное ректифицирующее
влияние, выражающееся в облегчении состава паров сравни-
тельно с рассчитанным по уравнению (VII. 17) и в утяжелении со-
става флегмы сравнительно с рассчитанным по уравнению (VII. 19).
То обстоятельство, что наряду с частичным испарением флегмы
имеет место одновременно и в том же пространстве еще и частич-
ная конденсация смешиваемых паровых потоков, еще более уси-
ливает этот ректифицирующий эффект, увеличивая отклонения
составов ут и Хт от значений, рассчитанных по уравне-
ниям (VII. 17) и (VII. 19). Оно же, наоборот, содействует выравни-
ванию действительных значений весов Gm и gm с их расчетными
значениями, полученными по уравнениям (VII. 16) и (VII. 18), так
как конденсат паровой фазы присоединяется к жидкой фазе,
в известной мере компенсируя уменьшение ее веса, имевшееся
за счет частичного испарения, а отгон жидкой фазы присоеди-
няется к паровой, также в известной мере компенсируя убыль
ее веса за счет ее частичной конденсации.
Итак, имея в виду сравнительно весьма небольшое отклоне-
ние действительных значений весов Gm и gm от рассчитанных
по уравнениям (VII. 16) и (VII. 18), можно во всех последующих
выкладках с практически достаточной точностью пользоваться
значениями Gm и gm, полученными путем простого суммирова-
ния весов смешивающихся паровых и жидких потоков. По
той же причине и составы ут и хт принимаются равными их
значениям, рассчитанным по уравнениям (VII. 17) и (VII. 18), хотя
и с меньшим основанием, чем для весов Gm и gm, так как здесь,
наверное, будет известное отклонение. Тем не менее преиму-
щества подобного рода допущений столь велики, а получаю-
щаяся ошибка настолько мала, что с полным основанием можно
пренебречь ею и рекомендовать уравнения (VII. 16)—(VII. 19) для
расчета весов и составов паровых и жидких смесей, образую-
щихся в питательной секции полной колонны.
Приступая к расчету полной ректификационной колонны, мы
располагаем пятью исходными величинами, обычно задаваемыми
и характеризующими начальную систему и целевые продукты ее
разделения: количество L, состав а, теплосодержание сырья Qo,
составы остатка xR и дестиллат yD. Иногда дополнительно еще
задается количество тепла В, которое в данной производствен-
Расчет питательной секции полной колонны 287
ной обстановке может быть удобно затрачено в кипятильнике
колонны. Однако для общности постановки проблемы доста-
точно ограничиться первыми пятью исходными данными. Чтобы
установить режим работы колонны и полностью определить
проблему ректификации в ней, необходимо располагать не
пятью, а семью величинами: количеством L, составом а, тепло-
содержанием сырья Qo, числами тарелок отгонной и укрепляю-
щей п2 секций и значениями постоянных для каждой секции
тепловых параметров 0г и 62, представляющих собой разности
теплосодержаний встречных на одном уровне данной секции
разноименных потоков, отнесенные к разности их весов. Каж-
дому определенному режиму работы колонны отвечает вполне
определенная и единственная комбинация этих семи величин,
поэтому цель расчета колонны и заключается в их установле-
нии. Число заданных, определяющих работу ректификационной
колонны параметров, на два меньше необходимого, поэтому
задача расчета колонны становится неопределенной и может
иметь бесконечное число решений в зависимости от того, какие
произвольные (в известных-.пределах^, значения будут шина... ......
чены двум недостающим параметрам процесса. Таким образом,
при расчете колонны для определенности задачи ^.приходится
задаваться некоторым числом параметров, в дан'ном случае
двумя, и тогда может быть рассчитана вся колбнная установка
при режиме ее работы, отвечающем совокупности семи пара-
метров, положенных в основу расчета.
В качестве недостающих параметров обычно принимают
значения тех или других составов или весов фаз в питательной
секции колонны, что равносильно назначению числа тарелок
какой-нибудь из секций колонны или выбору величины притока
тепла в кипятильник и отдачи тепла в конденсаторе. В зависи-
мости от конкретных значений определяющих параметров будут
получаться различные режимы работы колонны, из которых
путем сопоставления и сравнения нескольких вариантов можно
выбрать оптимальный. На фиг. 76 показано типичное распреде-
ление потоков в питательной секции колонны для общего слу-
чая, когда сырье поступает в двухфазном паро-жидком состоя-
нии. Напишем все уравнения материального баланса, связы-
вающие веса и составы потоков, поступающих из нее. Для
потоков, пересекающих уровень питательной секции, располо-
женный над сечением ввода сырья, можно написать
(VII. 20)
(VII. 21)
(VII. 22)
Gc 4- бл = £к 4- D-,
Gcyc + Олул = gKxK 4- DyD;
GcVc 4- = (Gc 4 GAym.
Для потоков же, пересекающих уровень питательной секции,
расположенный ниже сечения ввода сырья, имеем
£с + £к = 6л + Я; (VII. 23)
gcXc + gKxK = 6лУл + Rxr; (VII. 24)
(gc + ^) хт = g.x, + g*xK. (VII. 25)
Уравнения (VII. 20) — (VII. 25) исчерпывают все возможности,
которые можно извлечь из составления материальных балансов
по общему весу потоков, по весу содержащегося в них низко-
кипящего компонента и по смешению одноименных фаз в пи-
тательной секции. Веса Gc и ge паровой и жидкой фаз сырья и
их составы ус и хс могут быть легко найдены по исходной ха-
рактеристике сырья и его теплосодержанию и поэтому в урав-
нениях (VII. 20) — (VII. 25) считаются известными. В эти шесть
уравнений таким образом входят шесть неизвестных: веса пото-
ков 6л и gK, их составы ул и хк и составы ут и хт смеси этих
потоков с одноименными фазами сырья. Казалось бы, из этих
шести уравнений можно легко найти все шесть неизвестных
величин. Однако не все уравнения в этой системе являются
независимыми, в чем легко убедиться. Так, сумма уравнений
(VII. 20) и (VII. 23) приводит к тождеству
Gc + gc = D + = L.
Равным образом и сумма уравнений (VII. 21) и (VII. 24) тйцже
приводит к очевидному тождеству
GcVc + geX. = DyD + Rxr = La.
Поэтому из каждой пары уравнений (VII. 20) и (VII. 23), а
также (VII. 21) и (VII. 24) одно из уравнений не имеет самостоя-
тельного значения, и таким образом вместо шести в нашем
распоряжении остается всего лишь четыре независимых уравне-
ния с шестью неизвестными.
Поскольку число неизвестных превосходит число независи-
мых уравнений на два, это означает, что любыми двумя из
элементов ректификации в питательной секции следует задаться,
а остальные определить по уравнениям (VII. 20)—(VII. 25). Когда
среди исходных данных фигурирует еще и величина притока
тепла в кипятильник колонны В, она играет роль одного из
параметров, которыми надо задаваться для решения системы
уравнений (VII. 20)—(VII. 25). В этих случаях для определения
режима работы колонны необходимо и достаточно принять
значение уже только одного из элементов ректификации вл»
питательной секции.
В самом деле, зная величину притока тепла в кипятильник
колонны В, можно привлечь к задаче определения элементов
Расчет питательной секции полной колонны 289
ректификации в питательной секции колонны, кроме уравнений
(VII. 20) — (VII. 25) материального баланса, еще и уравнение
концентраций (V. 34), получающееся путем совместного реше-
ния уравнений материального и теплового балансов, написанное
для уровня питательной секции, расположенного под сечением
ввода сырья. Этим число независимых уравнений увеличивается
на единицу и, понятно, число параметров, которыми нужно
задаваться, на единицу же уменьшается.
К этому же результату можно прийти и другим путем. При
наличии расхода тепла В в кипятильнике колонны можно на-
нести на тепловую диаграмму полюс (хя, отгонной ко-
лонны и, задавшись, например, составом ул, при помощи обыч-
ного графического построения найти хт. Тем самым две ве-
личины из шести неизвестных в питательной секции будут
установлены. Остальные четыре неизвестные величины уже легко
и однозначно могут быть найдены при помощи четырех неза-
висимых уравнений из системы уравнений (VII. 20)— (VII. 25).
Это показывает, что вместо одного из двух неизвестных пара-
метров, кого рым и необходимо задаваться в питател ьноТГ секции
колонны для определенности выбранного режима ректификации,
можно принять величину притока тепла в кипятильник или,
что равносильно, задаться величиной съема тепла в парциаль-
ном конденсаторе и затем при помощи уравнений (VII. 20) —
(VII. 25) и тепловой диаграммы или уравнения концентраций
(V. 34) определить все неизвестные величины.
Принятие указанных выше дополнительных условий для
определения режима работы ректификационной колонны, совер-
шенно произвольное с математической точки зрения, тем не
менее ограничено совершенно четкими пределами, которые все
время следует иметь в виду. Так, возвращаясь к рассмотрен-
ному выше примеру, когда одним из принятых параметров
процесса является величина притока тепла В в кипятильник
колонны, следует напомнить, что этому теплу отвечает вполне
определенное значение предельной концентрации ул, которое
ни при каком числе тарелок отгонной секции не может быть
превзойдено на верху ее. Поэтому принятие в качестве второго
дополнительного условия, определяющего режим ректификации,
состава ул, большего, чем его предельное значение, отвечаю-
щее выбранному значению тепла кипятильника В, явилось бы
грубой ошибкой. Так намечаются пределы, внутри которых
выбор необходимого числа дополнительных параметров уже
вполне произвольный. Однако и здесь следует иметь в виду,
что окончательный вариант должен выбираться на основе тех-
нико-экономического сравнения нескольких характерных режи-
мов, работы колонны.
19 Зак. № 304.
§ 4. Графо аналитический метод расчета
питательной секции
Можно рекомендовать довольно простой графо-аналитиче-
ский метод расчета питательной секции колонны по тепловой
диаграмме. Задача состоит в том, чтобы на тепловой диаграмме
оперативных линий отгонной и
найти расположение последних
Фиг. 77. Графо-аналитический методу
расчета питательной секции
ловой диаграмме.
укрепляющей секций колонны.
Для отгонной секции ее по-
следняя оперативная линия
должна пересечь линии тепло-
содержаний жидкой и паровой
фаз тепловой диаграммы в точ-
ках, абсциссы которых соот-
ветственно равны хт и
Точно так же последняя опе-
ративная линия укрепляющей
секции должна пересечь линии
теплосодержаний насыщенных
фаз в точках, абсциссы кото-
рых равны хк и ут. Эти линии
показаны на фиг. 77. Для от-
гонной секции последней опе-
ративной линией будет 516лцл,
для укрепляющей S2aKbK. На
тепловую диаграмму нанесена
фигуративная точка сырья L(a,
Qo), через которую обязательно
проходит прямая связы-
вающая на основании тожде-
ства (VII. 14) полюсы верхней
_ и нижней секций колонны,
по теп- и изотерма aQbQ, связывающая
фигуративные точки равновес-
ных фаз сырья. Важно отме-
тить, что составы хт и ут не могут выйти за пределы интер-
валов хс—хк и Ус —Ул и в общем случае находятся внутри
этих интервалов.
Используя метрические свойства тепловой диаграммы, при-
веденной на фиг. 77, можно обосновать расчет питательной
секции, связав друг с другом интересующие нас составы. Из
материального баланса смешения в питательной секции жидких
потоков gc и gK можно написать
gc + gK *к-хс
gc хк~хт
(VII. 26)
Графо-аналитический метод расчета питательной секции 291
Из уравнения материального баланса отгонной секции, напи-
санного для уровня, расположенного над ее верхней тарелкой,
имеем
= у^~хг_ (vn 27)
R Я У л~ хт '
Разделив
получить
уравнение (VII. 27) на уравнение (VII. 26), можно
gc Ул~ХК
Я Ул~хт
х*~хт
хк~х(
(VII. 28)
Относительный вес жидкой фазы сырья, определяемый из
уравнения материального баланса его однократного испарения,
дается уравнением (VII. 8). Разделив уравнение (VII. 8) на урав-
нение (VII. 3), можно получить
gc . 1 = gc Ус ~ а Ур ~XR
L ' R R ус — хс Ур~а '
(VII. 29)
Сочетанием уравнений (VII. 28) и (VII. 29) можно исключить
веса gc и R и получить соотношение, связывающее составы
потоков в питательной секции колонны с составами сырья и
целевых продуктов ректификации:
Уд —*R . Хк~ = Ус - ° Ур~хЯ
Ул хт хк хс Ус хс Ур а
(VII. 30)
Каждое из отношений разностей составов, входящих в выра-
жение (VII. 30), можно заменить отношением пропорциональных
отрезков, снятых с тепловой диаграммы на фиг. 77:
. ЬкЬл = a0L . S2S2
альл
(VII. 31)
Расчет по уравнению (VII.31) йедется следующим образом.
Пусть мы задались в качестве двух определяющих параметров
притоком тепла в кипятильник В и составом ул паров, подни-
мающихся с верхней тарелки отгонной секции. По величине В
можно рассчитать расположить на тепловой диаграмме
полюс Si(xR, ^1) и, проведя из него прямую, проходящую через
фигуративную точку сырья L (a, Qo), найти положение полюса
укрепляющей секции S2(yn, 02). Далее через точку L пройдет
изотерма а0Ь0, а прямая Sja,, являющаяся последней оператив-
ной линией отгонной секции, в пересечении с линией теплосо-
держаний жидкой фазы определит точку Ьл с абсциссой, рав-
ной Хт- Для проведения последней оперативной линии укреп-
ляющей секции нужно знать положение или точки ак, или
19*
$1$2
sTl
(VII. 32)
Sta
точки bK. С этой целью, подставив в соотношение (VII. 31) длины
всех известных отрезков, можно найти
Мл
&Л аоЬо
Все величины, стоящие в правой части выражения (VII. 32),
могут быть непосредственно измерены по тепловой диаграмме
и подставлены в формулу. Пусть подсчет правой части дает
некоторое ее численное значение, равное и. Считая отрезок bob,:
прямолинейным, легко сообразить, что его длина должна рав-
няться __
^Л = т~тг- (VII. 33)
Длина отрезка ЬОЬЛ снимается непосредственно с чертежа
на фиг. 77, значение и подсчитывается по выражению (VII. 32),
а длина отрезка ЬКЬО по уравнению (VII. 33). Отложив эту длину
от точки Ьо вдоль линии теплосодержаний жидкой фазы, легко
найти положение точки Ьк, абсцисса которой, очевидно, равна хк.
Соединив точку Ьк с полюсом S2 прямой, можно найти состав ут
как абсциссу точки ак пересечения этой прямой с линией
теплосодержаний паровой фазы.
§ 5. Расчет числа тарелок полной колонны
Дальнейший расчет числа теоретических тарелок колонны
ведется отдельно по каждой секции. Для отгонной секции по-
строения следует вести от ее последней оперативной линии 51ал
влево до тех пор, пока не будет достигнут состав хк остатка,
а для укрепляющей секции построения ведутся от ее послед-
ней оперативной линии S2bK вправо до тех пор, пока не будет
достигнут состав yD дестиллата.
Расчет числа тарелок секций колонны можно вести не только
по тепловой диаграмме, но и аналитически по основным урав-
нениям концентраций, выведенным при изучении неполных
колонн. 'Так, для расчета отгонной секции можно воспользо-
ваться следующим соотношением, получающимся из уравнения
(V. 32), решенного в отношении состава yt + t паровой фазы:
у,- + 1=х, + ^~--(х,-хд). (VII. 34)
Здесь счет ступеней ведется сверху вниз и верхняя тарелка
отгонной секции считается уже первой тарелкой. По составу ул
паров, поднимающихся с этой тарелки, известному из расчета
питательной секции, можно найти состав х2 равновесной флегмы,
Расчет числа тарелок полной колонны 293
стекающей с первой тарелки на вторую. Для определения
состава у2 встречных этой флегме паров, поднимающихся со
второй тарелки, используется уже уравнение концентраций
(VII. 34), при помощи которого описанным ранее методом посте-
пенного приближения и ведется аналитический расчет. Далее
путем попеременного использования соотношений равновесия и
уравнения концентраций (VII. 34) можно последовательно, дви-
гаясь с верха отгонной секции вниз до кипятильника, просчи-
тать все тарелки отгонной секции, ведя счет пройденным сту-
пеням контакта.
Расчет укрепляющей секции колонны также можно вести
аналитически, двигаясь от известных составов в питательной
секции кверху, по направлению к парциальному конденсатору.
Уравнение концентраций в этом случае представится следую-
щим образом:
(VII. 35)
В отличие от счета тарелок, принятого при изучении непол-
ной укрепляющей колонны, здесь ~ ну мерация их ведется у же
по ходу расчета снизу вверх и нижняя тарелка укрепляющей
секции будет первой тарелкой.
Приняв за исходную точку расчета известный из анализа
питательной секции состав хк флегмы, стекающей с первой
тарелки укрепляющей секции, и найдя по условию равновесия
состав ух паров, поднимающихся с этой же тарелки, можно
при помощи уравнения (VII. 35) аналитически установить состав х2
встречной' флегмы, стекающей со второй тарелки. Далее путем
попеременного использования соотношений равновесия и урав-
нения концентраций (VII. 35) можно, двигаясь последовательно
снизу вверх до парциального конденсатора укрепляющей сек-
ции, просчитать все ее тарелки, ведя счет пройденным ступе-
ням контакта.
Здесь следует подчеркнуть, что совершенно безразлично,
в каком направлении, сверху вниз или снизу вверх, вести расчет
составов фаз на последовательных тарелках секций колонны.
Важно лишь иметь какой-то отправной состав, известный для
какого-нибудь из потоков на любом произвольном уровне рас-
считываемой секции. Такими известными отправными составами,
с которых можно начинать расчет верхней и нижней секций
колонны, являются составы, найденные из расчета питательной
секции, и составы верхнего и нижнего целевых продуктов
колонны, известные по заданию. Так, приступая к расчету
отгонной, например, секции, мы располагаем составом у„ паров,
поднимающихся с верхней тарелки, и составом xR остатка,
отводимого из кипятильника. Поэтому расчет отгоцной секции
можно вести, либо исходя из состава у„, и двигаясь сверху
Полная ратификационная колонна
' —-
вниз с тарелки к тарелке, по способу, описанному выше, при
помощи уравнения (VII. 34), или же исходя из состава xR и дви-
гаясь вверх, по способу, описанному в разделе, посвященном
расчету неполной отгонной колонны. Расчет укрепляющей
секции можно вести тоже, либо исходя из состава хк и дви-
гаясь снизу вверх от тарелки к тарелке, по способу, описан-
ному выше и основанному на применении уравнения (VII. 35),
или же исходя из состава yD и двигаясь сверху вниз, по спо-
собу, описанному в главе, посвященной укрепляющей колонне.
Из соображений практического удобства рекомендуется
вести расчет секций полной колонны, двигаясь последовательно
от питательной секции колонны к нижнему ее концу при
расчете отгонной части и от питательной же секции к верх-
нему ее концу при расчете укрепляющей ее части.
§ 6. Расчет полной колонны по диаграмме у — х.
На фиг. 78 приведена обычная диаграмма у — х с нанесен-
ными на ней кривой равновесия ОНА и линиями концентраций
Kf и Мс отгонной и укрепляющей ее секций. Как и в непол-
ных колоннах, линии концентраций строятся при выбранных
значениях Bud либо по соответствующим уравнениям кон-
центраций, задаваясь несколькими значениями состава одной
фазы и находя сопряженный состав другой фазы, либо путем
проведения на тепловой диаграмме из каждого ее полюса
пучка произвольных прямых находят абсциссы точек пересе-
чения этих прямых с линиями теплосодержаний жидкой и
паровой фаз и по этим данным наносят на диаграмму у — х
ряд сопряженных точек, через которые и проводят плавные
кривые, разные для каждой секции.
Кривая концентраций отгонной секции Kf выходит из точки
K(xR, xR), лежащей на линии равного состава, и пересекает
кривую равновесия в точке / с координатами, равными тем
предельным граничным составам, которые при выбранном зна-
чении притока тепла В в кипятильник колонны ни при каком
числе тарелок отгонной секции не могут быть превзойдены
на верху ее. Поэтому точка / является той конечной точкой
кривой концентраций отгонной секции, за пределы которой
эту линию продолжать не следует.
Равным образом и кривая концентраций укрепляющей сек-
ции Мс выходит из точки М (yD, yD), лежащей на линии рав-
ного состава, и пересекает кривую равновесия ОНА в точке с
с координатами, равными тем предельным граничным составам,
которые при найденном значении отдачи тепла d в пар-
циальном конденсаторе ни при каком числе тарелок укрепляю-
щей секпии не могут быть теоретически достигнуты внизу ее.
Расчет полной колонны по диаграмме у — х 295
Поэтому точка с является той конечной точкой кривой кон-
центраций укрепляющей секции, за пределы которой эту кри-
вую продолжать не следует.
Обе кривые концентраций могут быть нанесены на диа-
грамму у—х, если в качестве одного из двух независимых
параметров, определяющих выбираемый режим работы колонны,
Фиг. 78. Расчет полной колонны по диаграмме у — х.
принимается величина притока тепла В в кипятильник ко-
лонны либо величина отдачи тепла d в парциальном ее кон-
денсаторе. По одной из этих величин при помощи уравнения
(VII. 9) теплового баланса колонны легко определяется другая,
затем рассчитываются теплорые параметры и в2 и, наконец,
по уравнениям (VII. 34) и (VII. 35) или при помощи тепловой
диаграммы путем проведения пучка прямых из ее полюсов
определяется несколько точек для каждой из линий, через
которые и проводятся на диаграмме у — х плавные кривые.
Координаты конечных точек / и с линий концентраций могут
быть определены по известным значениям Bud при помощи
рассмотренных ранее кривых В = <р(хгр) и d = y(yrp).
Итак, пусть по принятому значению В притока тепла в ки-
пятильник рассчитаны и нанесены на диаграмму у—X линии
296 Полная ректификационная колонна
концентраций Kf и Мс отгонной и укрепляющей секций.
Однако для определенности проблемы ректификации, как
известно, необходимо задаться еще одним параметром в пита-
тельной секции колонны, например составом ул, как мы это
делали выше- Только в этом случае выбранный режим работы
колонны определяется и можно приступить к нахождению
составов и других свойств потоков по всей ее высоте. Выбор
этого дополнительного определяющего параметра произволен
лишь в известных пределах. Так, для рассматриваемого случая,
когда принимается значение ул, оно, очевидно, не может быть
больше угр — граничного состава отгонной секции, отвечаю-
щего принятому теплу кипятильника, и это является факто-
ром, в известной мере ограничивающим произвольность вы-
бора величины ул. Если бы вместо ул мы задавались величи-
ной хк — составом флегмы, стекающей с последней тарелки
укрепляющей секции, то и здесь пришлось бы ограничить
свой выбор значениями хх, большими, чем состав хгр, являю-
щийся в заданных условиях отдачи тепла в парциальном кон-
денсаторе граничным для укрепляющей секции. В свете сде-
ланных замечаний можно без труда подобрать подходящее
значение второго независимого параметра и установить неко-
торый вполне определенный режим ректификации.
Для анализа работы колонны представляет большой инте
рес установить связь и зависимость между составом ул
паров, поднимающихся с верхней тарелки отгонной секции,
и составом хк флегмы, стекающей с нижней тарелки укреп
ляющей секции. Например, составу ул в указанных выше
пределах можно задавать различные значения и соответст-
венно различные значения будет при этом принимать состав
хк. Каждой комбинации значений ул и хк отвечает свое
число тарелок секций колонны, и для выбора оптимального
варианта необходимо установить, как изменяется ул с изме-
нением хк.
Искомая зависимость была уже установлена выше при
составлении материального баланса питательной секции урав-
нениями (VII. 21) и (VII. 24). Так как одно из этих уравнений
является следствием другого, то самостоятельное значение
сохраняется лишь за одним из них. Рассмотрим уравнение
(VII. 21) подробнее:
ОлУл =g«xx + (DyD — Gcyc). (VII. 36)
Второй член правой части уравнения (VII. Зб) есть величина
постоянная, ибо рассматривается ректификация сырья неизмен-
ного состава, поступающего в колонну в определенном теп-
ловом и фазовом состоянии и разделяющегося на целевые
продукты ранее назначенных неизменных свойств. Составы ул
Расчет полной колонны по диаграмме у — х. 297
и хк являются переменными величинами, и поэтому, отбросив
индексы, можно написать
G„y = gKx + (DyD- Gcyc). (VII. 37)
Если бы величины G„ и gK были постоянными, то уравне-
ние (VII. 37) в системе координат у — х представилось бы
прямой с постоянным наклоном, равным gK/G„- Однако эти
веса также являются переменными величинами, и поэтому
уравнение (VII. 37) представляется некоторой кривой.
Для фиксирования положения этой кривой на диаграмме
у — х остановимся на следующих соображениях.
Если переменный состав х„ принимает значение, равное хс,
то на основании уравнения (VII. 25) он совпадает также и с со-
ставом хт- Следовательно, кривая, представляемая уравнением
(VII. 36) или (VII. 37), обязательно пересечется с линией кон-
центраций отгонной секции К/, на которой обязательно
должна лежать точка с абсциссой хт в некоторой точке fl
имеющей абсциссу хс. Если же переменный состав у., принимает
значение ус, то, на основании уравнения (VII. 22) он совпадает
также и с составом ут. Следовательно, рассматриваемая кривая
обязательно пересечется с линией концентраций укрепляющей
колонны Мс, на которой обязательно должна лежать точка
с ординатой ут в некоторой точке Ь, имеющей ординату ус.
Таким образом, кривая, представляемая на диаграмме у — х
уравнением (VII. 36) или (VII. 37), должна пройти через точки а
и b (фиг. 78), которые легко могут быть найдены, если через
фигуративную точку сырья (хс, ус) на кривой равновесия про-
вести вертикаль и горизонталь до их пересечения с линиями
концентраций отгонной и укрепляющей секций в точке а и b
соответственно.
Линия ab, представляющая на диаграмме у—х уравнение
(VII. 36), характеризуется столь небольшой кривизной, что
часто ее изображают в виде прямой линии, проходящей через
точки а и Ь, найденные по указанному выше способу. Однако
можно указать довольно простой и вместе с тем вполне точ-
ный способ расчета координат любой из ее точек. Введем
обозначения
D — GC = A, (VII. 38)
Dyo - Ссус = Az, (VII. 39)
D62- GZQC == A6a (VII. 40)
и при помощи этих обозначений напишем уравнения мате-
риального и теплового балансов для объема колонны,
Понная пектисЬикаиионная колонна
заключенного между верхом ее и верхним уровнем питатель-
ной секции:
Сл = ^ + А; (VII. 41)
G,y = g,x+Az; (VII. 42)
Сл<?л=^к + Д0А. (VII. 43)
Исключая из этой системы уравнений веса потоков Ол, gK
и А, можно получить соотношение, связывающее лишь со-
ставы и тепловые величины:
являющиеся необходимым и достаточным условием, чтобы на
тепловой диаграмме три точки (х, qK), (у, фл) и (z, 0А) лежали на
одной прямой. Поэтому, рассчитав по уравнениям (VII. 39) и
(VII. 40) параметры z и 0А и нанеся на тепловую диаграмму
полюс (z, 6А), можно, проведя из него пучок прямых, найти
по абсциссам точек пересечения каждой из этих прямых
с линиями теплосодержаний жидкой и паровой фаз по паре
сопряженных значений хк и ул. Каждая такая пара составов
определяет на диаграмме у—х одну какую-нибудь из точек
линии ab, отвечающей уравнению (VII. 36).
Можно и аналитически рассчитать координаты точек линии
ab, преобразовав уравнение (VII. 44) к виду
‘ Q —л
Ул = хк + ^ЦМг-хк). (VII. 45)
Задаваясь значениями хк и подставляя их в уравнение
(VII. 45), можно легко и однозначно рассчитать сопряженное
значение ул. По рассчитанным координатам нескольких точек
можно, нанеся эти точки на диаграмму у—х, провести плав-
ную кривую ab, необходимую для дальнейших расчетов.
Итак, пусть на диаграмме у — х (фиг. 78) построена кривая
равновесия ОНА, проведены линии концентраций отгонной
секции Kt и укрепляющей секции Мс и по точкам построена
кривая ab, удовлетворяющая уравнению (VII. 36) или (VII. 45).
Все эти расчеты и построения можно сделать, задавшись
только одним из двух необходимых параметров, в частности,
например, задавшись величиной В притока тепла в кипятильник
колонны. Дальнейший расчет колонны, связанный с необходи-
мостью определения составов паровых и жидких притоков во
всех ее межтарелочных отделениях, возможен лишь при усло-
вии принятия второго и последнего из определяющих режим
ее работы параметров. Пусть попрежнему ул — состав паров,
поднимающихся в питательную секцию с верхней отгонной
Влияние теплового и фазового состояния сырья 299
тарелки. Отвечающий этому составу ул сопряженный с ним
состав хк флегмы, стекающей в питательную секцию с нижней
укрепляющей тарелки, определится как абсцисса точки Л,
имеющей ординату ул и лежащей на кривой ab, связывающей
составы ул и хк. По тому же составу ул определяется и состав
хт жидкого потока, поступающего на верхнюю тарелку отгон-
ной секции, как абсцисса той точки линии концентраций Kf,
ордината которой равна ул. Равным образом и состав ут смеси
паров, поступающих на нижнюю тарелку укрепляющей секции,
определяется по найденному выше составу хк как ордината той
точки линии концентраций Мс, абсцисса которой равна хк.
Теперь определены составы всех паровых и жидких пото-
ков в питательной секции колонны, и дальнейший расчет ее
нижней и верхней секций проводится, исходя из точек (хт, уя)
для отгонной и (хк, ут) для укрепляющей секций путем при-
менения обычного ступенчатого построения до тех пор, пока не
будут достигнуты составы нижнего и верхнего целевых про-
дуктов. Такое графическое построение показано на фиг. 78.
Следует обратить внимание, что для каждой секции колонны
строится своя ломаная линия, не являющаяся продолжением
ломаной линии другой секции.
На фиг. 78 показан расчет одного лишь варианта работы
колонны, отвечающего выбранной паре значений тепла кипя-
тильника В и состава ул. Другой паре этих же величин отве-
чали бы другой режим работы, другое распределение составов
фаз по тарелкам колонны и другое число тарелок в секциях.
Составы же верхнего и нижнего продуктов, конечно, остались
бы теми же.
Наконец, остается заметить, что если бы вместо ул мы
задались хк, то тогда уже ул определилось бы по точке h на
кривой ab как ее ордината, а весь остальной ход расчета со-
хранился бы неизменным. Равным образом, как легко убедиться
по диаграмме фиг. 78, можно было бы задаться и ут или хт и
остальные составы найти по линиям концентраций и кривой ab,
связывающей составы ул и хк в питательной секции колонны.
Для наглядности описанного графического, а иногда графо-
аналитического расчета полной колонны можно совместить на
одном графике диаграмму у — х стендовой диаграммой. Это
замечание, впрочем, носит чисто технический характер.
§ 7. Влияние теплового и фазового состояния сырья на
расположение линий концентраций
В предыдущем разделе нами рассмотрен наиболее общий
случай питания колонны двухфазной паро-жидкой смесью.
Однако на практике сырье может подаваться в колонну в са-
мых различных состояниях, начиная от * недогретой до точки
начала кипения однофазной жидкости до насыщенного и даже
перегретого пара. В зависимости от состояния сырья изме-
няются расположение линий концентраций на диаграмме у — х
и характер графических построений на тепловой диаграмме.
Для выяснения характера этих изменений составим материаль-
ный и тепловой баланс питательной секции полной колонны
(см. фиг. 76).
Уравнение материального баланса по общему весу входя-
щих и выходящих из питательней секции потоков предста-
вляется соотношением
L + gK + Gn = gm + Gm. (VII. 46)
Уравнение теплового баланса того же объема колонны на-
пишется в следующем виде:
LeQ(} + Ь (1 — е) q0 + gKqK -|- ОлРл = gmQm + GmQm- (VII. 47)
Для упрощения последующего вывода примем, что тепло-
содержания паров и жидкостей не претерпевают большого
изменения в питательной секции колонны, сохраняя практи-
чески постоянные значения. Иначе говоря, допустим, что
Qn — Qm = Q и qK = qm = q-
При этом условии уравнение теплового баланса (VIII. 47)
напишется в следующем виде:
beQ0 + Ь (1 — е) ?о + g«q + GnQ — gmq + GmQ
или
(Qo-^o) + + (6л-Gm)Q = (gm~gK}q. (VII. 48)
Принимая во внимание, что на основании уравнения (VII. 46)
Ол Gm = gm gK - L,
и сделав подстановку в уравнение (VII. 48), имеем
Le (Q0 — q0) — L(Q— q0) = — (gm — gK) (Q — q),
откуда
gm - gK = b (4=^- - e ) = L&> <VH• 49)
\ ч ч ч. — 4
где
& = ёт~ёк = .
L Q—q ' >
Определенная тепловым балансом питательной тарелки вели-
чина играет большую роль при выяснении взаимного распо-
ложения линий концентраций в различных случаях питания
колонны.
Влияние теплового и фазового состояния сырья
301
Рассмотрим пять основных частных случаев питания колонны
сырьем в различном фазовом состоянии и установим, какие
значения & им отвечают.
I. Сырье подается в состоянии перегретого пара
Степень отгона сырья е=1, теплосодержание сырья Qo
больше теплосодержания Q насыщенного пара и
^ = ^Оо<о
Л
где Я — скрытая теплота парообразования.
Таким образом, отрицательное значение •& показывает, что
поток флегмы в отгонной секции меньше потока флегмы
в укрепляющей за счет частичного испарения потока gK при
контрактировании с перегретыми парами сырья.
II Сырье подается в виде насыщенного пара_____
Степень отгона е также равна единице, теплосодержание
сырья Qo равно теплосодержанию Q насыщенных паров в пита-
тельной секции и #=0. При этом & = 0 и gm = gu-
ll!. Сырье подается в двухфазном паро-жидком состоянии
Q0 = Q и = ф и, следовательно, #=1 — е. Здесь положи-
тельно, но меньше единицы.
IV. Сырье подается при точке начала кипения
Степень отгона е равна нулю, теплосодержание q0 сырья
равно теплосодержанию q жидкой фазы питательной тарелки,
и поэтому #==1. Очевидно, в этом случае gc = L.
V. Сырье подается при температуре, более низкой, чем его
точка кипения
Степень отгона, как и в предыдущем случае, равна нулю,
но теплосодержание сырья q0 уже не равно, а меньше тепло-
содержания q. Поэтому •& > 1 и
gm=L& + gK. (VII. 51)
Это означает, что поток флегмы в отгонной секции равен
потоку флегмы, идущей из укрепляющей, плюс вес сырьевого
потока и дополнительно еще некоторое количество флегмы,
равное (&—1)L, образующееся, очевидно, за счет частичной
конденсации парового потока G., при его контрактировании на
питательной тарелке с холодным сырьем.
Сопоставляя уравнения (VII. 46) и (VII. 50), можно написать
G\Gm = д—1. (VII. 52>
Это уравнение вместе с уравнением (VII. 50) позволяет
вывести соотношение, представляющее собой уравнение гео-
метрического места точек пересечения на диаграмме у — х
линий концентраций отгонной и укрепляющей секций колонны.
Исходя из уравнений материального баланса верхнего и
нижнего уровней питательной секции, можно, введя обозначе-
ния Xt и у, для координат точки пересечения линий концентра-
ций, написать
Gmyi=gKXi + DyD- (VII.'53)
Олу,- = gmXi — /?xR. (VII. 54>
Вычтем уравнение (VII. 53) из уравнения (VII. 54) и сделаем
подстановку La = DyD -|- RxK:
(Ол — Ст)у1 = (£т — gK)Xi—La. (VII. 55)
Принимая во внимание уравнения (VII. 50) и (VII. 52), имеем
= (VI1-56>
Прямая, уравнением которой является (VII. 56), представляет
на диаграмме у — х геометрическое место точек пересечения
линий концентраций отгонной и укрепляющей секций колонны.
В зависимости от величины параметра •&, принимающего раз-
личные значения в рассмотренных выше пяти случаях, прямая,
выражаемая уравнением (VII. 56), располагается на диаграмме
у — х по-разному. Однако во всех случаях прямая (VII. 56)
должна пройти через точку N (а, а), лежащую на линии равного
состава (см. фиг. 79), так как подстановка ее координат в урав-
нение (VII. 56) превращает его в тождество:
& а
а ~ а — 0—1 '
Тепловой параметр & может принимать положительные и
отрицательные значения, равняться нулю, правильной дроби,
единице и, наконец, быть больше единицы. В соответствии
с этим наклон прямой (VII. 56) равный
Влияние теплового и фазового состояния сырья
303
и отрезок, отсекаемый ею на оси ординат:
к а
Ь~ 1’
(VII. 58)
принимают в каждом случае те или иные значения, определяю-
щие положение прямой (VII. 56) на диаграмме у — х.
При питании колонны перегретым паром $<0 и наклон
прямой (VII. 56) заключен в интер-
вале
Фиг. 79. Геометрические места
точек пересечения линий концент-
раций для различных случаев
питания колонны.
^-<1.
Отрезок, отсекаемый прямой
(VII. 56) на оси ординат, также
положителен, и поэтому прямая
займет на диаграмме у — х поло-
жение Na (фиг. 79).
Если сырье подается в ко-
лонну в состоянии насыщенного
пара, то & = 0, наклон прямой
(VII. 56) на основании уравнения
(VII. 57) тоже равен нулю, а отре-
зок, отсекаемый ею на оси орди-
нат, согласно уравнению (VII. 58)
равен b = а. Следовательно, в этом
случае прямая (VII. 56) займет на
диаграмме у — х горизонтальное
положение Nb.
В наиболее общем случае, когда сырье подается в двух-
фазном, паро-жидком состоянии, # = 1—е и на основании
уравнений (VII. 57) и (VII. 58) имеем
йу,-
dxi и и &—1
поэтому прямая (VII. 56) займет положение Nc.
Для питания колонны жидким сырьем, находящимся при
точке начала кипения, имеем
и л dyi А “
#=], -—= со И 0= 5—— СО.
’ dXj &— 1
Следовательно, выходящая из точки N (а, а) прямая (VII. 56)
является в данном случае вертикалью Nd.
Наконец, если сырье поступает недогретым до точки начала
кипения, то
^>1, ^L>1’ 6 = --Л-<0
и прямая (VII. 56) займет положение Ne.
О и Ь = — -^-т>0,
О Xi /
Фиг. 80. Графический
метод определения
точки пересечения ли-
ний концентраций.
Для нахождения на диаграмме у — х координат х( и у,
точки пересечения рабочих линий нижней и верхней секций
колонны можно удобно воспользоваться тепловой диаграммой.
Исходя из того бесспорного соображения, согласно которому
точка пересечения (х), у,) кривых концентраций отгонной и
укрепляющей секций должна одновременно удовлетворять соот-
ношениям материального и теплового балансов обеих секций
колонны, можно прийти к заключению, что определяющие эту
точку оперативные линии, выходящие из
полюса нижней секции и полюса S2
верхней секции, должны слиться в одну и
ту же линию, фиксирующую координаты
точки (х/, у,-). Такой единственной линией,
одновременно отвечающей условиям ба-
ланса и нижней и верхней секций колонны,
является только прямая SXS2, соединяющая
на тепловой диаграмме полюсы секций
колонны. Абсциссы точек пересечения этой
прямой с линиями теплосодержаний на
тепловой диаграмме определяют коорди-
наты точки пересечения линий концентра-
ций на диаграмме у — х (фиг. 80).
§ 8. Влияние смещения уровня ввода
сырья на общее число тарелок колонны
Представляет большой интерес выяснить,
как изменится общее число тарелок ко-
лонны, если, сохранив неизменными каче-
ства и состояние сырья и степени чистоты
целевых продуктов, опустить или поднять
на одну ступень уровень ввода питания.
Вначале исследуем два частных случая. Пусть рассматри-
вается режим работы колонны, при котором состав ул паров, под-
нимающихся с верхней тарелки отгонной секции, равен составу ус
паровой фазы сырья. Тогда на основании уравнения (VII. 17) и
смесь этих паров должна иметь тот же состав, иначе говоря,
должно иметь место равенство Ул = Ус = Ут- Для определения
состава хк флегмы, стекающей с нижней тарелки, нужно найти
на кривой ab точку с ординатой, равной ул. Проведя на фиг. 81
горизонталь НЬ, легко определить состав х,< как абсциссу
точки пересечения b этой горизонтали с линией ab, сопрягаю-
щей составы ул и хк. Дальнейший расчет числа тарелок, как
уже известно, ведется вписыванием ступенчатых линий между
соответствующими линиями концентраций и кривой равновесия.
Для укрепляющей секции исходной точкой, с которой начи-
нается построение, является точка b (хк, ут), лежащая в данном
Влияние уровня ввода сырья на число тарелок
305
случае одновременно и на линии концентраций верхней секции
и на кривой ab, так как по условию ул = ут. Для отгонной же
секции исходной точкой, с которой начинается построение,
будет уже точка т (хт, ул) на линии концентраций нижней
секции с ординатой ут — ул = Ус и с абсциссой хт. Соответствую-
щее построение показано на фиг. 81.
Зададимся вопросом, как изменится общее число тарелок
колонны, если сечение
иначе говоря, если
число тарелок отгон-
ной секции уменьшить
на единицу при прочих
равных условиях. На
расчетной диаграмме
уменьшение числа тео-
ретических тарелок от-
гонной секции должно
выразиться в том, что
состав пара с ее послел-
ней ступени будет
определяться уже не
ординатой точки т,
как вначале, а орди-
натой точки а (хс, ул),
расположенной по кри-
вой концентраций Kf
на одну ступень ниже.
При этом оказывается,
что точка а одновре-
ввода сырья опустить на одну ступень,
0 хе V, 1
Фиг. 81. Влияние смещения уровня ввода
сырья на число тарелок полной колонны
(частный случай).
менно принадлежит и
кривой концентраций Kf и линии ab, сопрягающей составы ул и хк.
Следовательно, опустив сечение ввода питания на одну ступень,
мы приходим к тому частному случаю, когда состав жидкой
фазы сырья Хс совпадает с составом хк флегмы, стекающей
с нижней тарелки.- На основании уравнения (VII. 19) в этом
случае должно соблюдаться равенство Хс = хк = хт.
Чтобы найти состав ут, с которого теперь придется начинать
построение ступенчатой линии укрепляющей секции по верхней
кривой концентраций, необходимо найти на ней точку п(хк, ут)
с абсциссой хк. Точка п, очевидно, лежит на вертикали хк =
= const, проходящей через точку а. Легко заметить, что, про-
водя графическое построение ломаной линии верхней секции,
мы ровно через одну ступень приходим в точку Ь, с которой
начиналось построение в первом случае, когда сечение ввода
питания еще не было опущено на одну ступень. Следовательно,
в рассматриваемом случае число тарелок укрепляющей секции
увеличивается на единицу, а отгонной, наоборот, уменьшается
20 Зав. № 304.
на единицу и общее число тарелок колонны остается неизмен-
ным.
Если бы мы исходили вначале из второго случая, при
котором состав хк флегмы, стекающей с нижней тарелки укреп-
ляющей секции, равен составу х- жидкой фазы сырья, то,
повысив уровень ввода питания на одну ступень, мы пришли
бы к аналогичному результату. В самом деле, в этом случае
конечная точка а(хс, ул) отгонной секции при увеличении числа
тарелок ее на единицу пришла бы в т, а конечная точка
укрепляющей секции при уменьшении числа тарелок ее на
единицу пришла бы в Ь, общее число тарелок колонны, как и
в первом случае, осталось бы неизменным и желательный
режим работы колонны оказалось бы возможным поддерживать
без увеличения или уменьшения числа ее теоретических
ступеней контакта.
На основании проведенного анализа можно сделать важное
заключение, согласно которому общее число тарелок, требуемое
для поддержания желательного режима работы колонны, одно
и то же для двух частных случаев: когда ул =у< = ут и когда
Хк = X; — Хт.
Перейдем к рассмотрению более общего случая, когда и
жидкие и паровые потоки, смешивающиеся в питательной
секции колонны, имеют различные составы (фиг. 82).
Пусть сырье подается в питательную секцию колонны
в двухфазном паро-жидком состоянии. Для установления опре-
деленного режима работы колонны зададимся некоторым про-
извольным значением состава ул или, что равносильно, состава хк
и на связывающей их кривой тп, найдем отвечающую им
фигуративную точку Л(хк, ул). Далее, проведя из точки h гори-
зонталь до ее пересечения с кривой концентраций отгонной
секции, находим точку е(хт, ул), от которой начинается графи-
ческое ступенчатое построение для нижней части колонны.
Проведя же из точки Л вертикаль до ее пересечения с кривой
концентраций укрепляющей секции в точке S (хк, ут), находим
исходную точку для расчетных графических построений верхней
части колонны. При этом определяется некоторое общее число
тарелок колонны, отвечающее выбранному режиму ее работы.
Выбор положения точки h(xK,y„) по сопрягающей линии тп
произволен в том смысле, что за предельные ее точки т и п
мы перейти не можем, так как в этом случае выбираемый
режим работы колонны не будет совместим с величиной отно-
сительного притока тепла в кипятильник или, что то же,
с величиной отдачи тепла в парциальном конденсаторе колонны.
Однако любая точка кривой тп, заключенная на ее участке,
ограниченном точками т и п, отвечает некоторому вполне
определенному режиму работы колонны. Поэтому можно до-
пустить, что, сохраняя все остальные параметры колонны неиз-
Влияние уровня, ввода сырья на число тарелок.
30
менными, мы выбираем такой режим ее работы, при котором
число тарелок отгонной секции уменьшается на единицу,
что равносильно понижению уровня ввода сырья на одну
ступень. Зададимся вопросом, сохранится ли в этом случае
общее число тарелок колонны неизменным или, иначе говоря,
увеличится ли при этом число тарелок укрепляющей секции
на одну единицу или же на большее число тарелок.
Фиг. 82. Влияние смещения уровня ввода сырья на число тарелок
полной колонны (общий случай).
Если число тарелок отгонной секции при прочих равных
условиях понизить на единицу, то фигуративная точка е (хт, ул),
связывающая составы встречных фаз над верхней ее тарелкой,
должна расположиться на одну ступень ниже и занять новое
положение ех (xml, Ул1). Чтобы найти положение, в которое теперь
должна перейти фигуративная точка S (хк, ут) верхней кривой
концентраций, связывающая составы фаз, поступающих под
нижнюю тарелку укрепляющей секции, необходимо исполь-
зовать сопрягающую линию тп. Найдя на ней точку ht (хк\ Ул1),
20*
имеющую одинаковую с точкой е± ординату, мы тем самым
заодно находим и новый состав хк‘ флегмы, стекающей в изме-
нившихся условиях с нижней тарелки укрепляющей секции.
Этот состав хк’ представляет абсциссу точки S1(xKI, у^), лежа-
щей на кривой концентраций верхней секции и связывающей
составы встречных под ее нижней тарелкой паровых и жидких
потоков. Следовательно, уже точка S1(xKI, ут1) является началь-
ной точкой для графических построений, позволяющих найти
необходимое число ступеней контакта укрепляющей секции.
Но если для перехода по-кривой концентраций отгонной секции
от точки е (хт, ул) в точку ег (хт‘, у^) достаточно уменьшить
число тарелок в нижней части колонны лишь на одну тарелку,
то для перехода по кривой концентраций укрепляющей секции
от точки S(xK, ут) в точку S1(xKI, Ут), отвечающую новым
условиям работы колонны, требуется увеличить число тарелок
верхней секции колонны уже не на одну, а на большее число
тарелок. В частности, для конкретного примера, рассмотренного
на фиг. 82, число тарелок верхней секции увеличивается на
две, когда вследствие понижения уровня ввода сырья на одну
ступень число тарелок отгонной секции уменьшается на еди-
ницу. Таким образом, изменение места ввода сырья в колонну
привело в данном случае к увеличению общего числа тарелок
колонны. Отсюда можно сделать важный вывод о наличии
известной связи между расположением уровня ввода сырья по
высоте колонны и общим числом тарелок ее.
Этот вывод можно подтвердить рассмотрением другого
случая, когда уровень подачи сырья по высоте колонны под-
нимается на одну ступень. В этом случае число тарелок укреп-
ляющей секции уменьшается на единицу и фигуративная точка
5 (хк, ут), связывающая составы фаз, встречных под нижней
тарелкой верхней секции, поднимается по кривой концентра-
ций Мс на одну ступень и занимает положение S2 (x[CI!, утп). По
значению хкп абсциссы этой точки можно найти точку Л2(хкп, ул”)
на сопрягающей линии тп и соответственно по ординате точки Л._,
тот состав у.,11, которого должны достигнуть пары, поднимаю-
щиеся с верхней тарелки отгонной части. Фигуративная точка,
связывающая составы на верху отгонной секции, найдется,
если через точку й2 провести горизонталь до ее пересечения
с линией концентраций отгонной секции Kf в точке е2(х.т\ ул11).
Легко заметить, что увеличение на единицу числа тарелок
отгонной секции передвигает в рассматриваемом случае точку
е(х.т,Ул) в новое положение е', не совпадающее с е.,. Чтобы
достичь точки е2 (Хт\ улП), требуется дополнительное обогаще-
ние фаз, которое одна тарелка не обеспечивает. Следовательно,
и в этом случае понадобится увеличение общего числа тарелок
Влияние уровня ввода сырья на число тарелок
309
колонны, что подтверждает сделанный ранее вывод о связи
между общим числом тарелок колонны и расположением
сечения ввода питания по высоте колонны.
Рассмотренные примеры позволяют сделать еще один важный
вывод, относящийся к вопросу определения минимального числа
тарелок колонны. Вспомним, что в случаях, когда сопряженные
составы хк и ул определялись точками а и b кривой тп, увели-
чение числа тарелок отгонной секции или уменьшение числа
тарелок укрепляющей не отражалось на общем числе тарелок
колонны, сохранявшемся неизменным. Когда же определяющая
режим работы колонны фигуративная точка А (хк, ул) на сопря-
женной кривой тп выбиралась не внутри, а вне отрезка ab
в ту или иную сторону, общее число тарелок колонны увели-
чивалось. Отсюда можно сделать заключение, что минимальное
число тарелок колонны, отвечающее принятому значению тепла
кипятильника и фазовому состоянию сырья, должно опре-
деляться некоторой точкой h (хк, Ул), обязательно расположен-
ной внутри отрезка ab сопряженной кривой тп. Иначе говоря,
минимальное число тарелок - колонны отвечает положению
сечения ввода питания в колонну между уровнями, отвечаю-
щими фигуративным точкам п(хс, ул) и А (хк, ус).
Вернемся к графику фиг. 82 и зададимся вопросом, на
сколько ступеней вверх или вниз по высоте колонны можно
переместить определяемое точкой А (хк, ул) сечение ввода сырья
без изменения качеств целевых продуктов и при постоянном
качестве и состоянии сырья и величины притока тепла в кипя-
тильник. Мы уже убедились, что для рассматриваемого случая
разделения, характеризуемого приведенными на графике кри-
выми равновесия и линиями концентраций верхней и нижней
секций колонны, сечение ввода можно переместить на одну
ступень вверх или вниз. Однако попытка переместить сечение
ввода, например, вниз на две ступени в данных условиях уже
невозможна. В самом деле, в этих условиях фигуративная
точка е должна была бы занять на линии концентраций отгон-
ной секции положение , расположенное на две ступени ниже
и определяемое составом ул паров, поднимающихся с верхней
тарелки нижней части колонны, и составом хт флегмы, посту-
пающей на эту тарелку. Однако если попытаться по ординате
точки е' найти соответствующую точку на сопряженной кри-
вой тп, имеющую ту же ординату, то окажется, что это не-
возможно, ибо точки сопряженной кривой, отвечающие реаль-
ным значениям ул и хк, заключены на ее отрезке от точки т
до точки п. Аналогичным образом из рассмотрения фиг. 82
можно заключить, что рассматриваемое сечение ввода, опреде-
ляемое точкой А на сопряженной кривой тп, можно пере-
местить кверху на две ступени, но попытка поднять его на
три ступени неосуществима.
310
Пп /)иЛ4
Следует давать себе ясный отчет в том, что каждый раз
при решении этого вопроса нужно исходить из летучих свойств
разделяемой системы, выражаемых кривой равновесия, и из
теплового режима работы колонны, определяемого расположе-
нием линий концентраций и сопряженной кривой тп на диа-
грамме у — х.
§ 9. Расчет питательной секции колонны при питании ее
перегретым паром
Сырье, поступающее в колонну в паровой фазе, редко
бывает при температуре точки росы. В общем случае имеется
некоторый перегрев, сравнительно небольшой, но тем не менее
секции в случае питания ко-
лонны перегретым паром сырья.
влияющий на характер графических
построений по тепловой диаграмме.
Пусть фигуративная точка сырья
L(a, Qo) и полюс S1(xR, нижней
секции колонны (фиг. 83), положе-
ние которого определяется по при-
нятому расходу тепла в кипятиль-
нике, соединены прямой линией, на
продолжении которой, как известно,
определяется полюс S2 (уд, 02) верх-
ней секции колонны. Сырье не
содержит жидкой фазы, и поэтому
состав хт флегмы, поступающей на
верхнюю тарелку отгонной секции,
будет равен составу хк флегмы,
стекающей из укрепляющей секции.
Для определенности режима работы
колонны необходимо задаться одним
из параметров в ее питательной
секции. Пусть попрежнему задается
состав ул паров бл, поднимающихся
в питательную секцию снизу. Тогда,
проведя прямую S1G.I, можно опре-
делить состав хт = хк как абсциссу точки gK пересечения
этой прямой с линией теплосодержаний жидкой фазы.
Далее, соединив полюс S2 с фигуративной точкой gK(xK, qK)
флегмы, стекающей с нижней тарелки укрепляющей секции,
и фигуративную точку сырья L(a, Qo) с точкой Ол(ул, Q.,), можно
найти в точке пересечения Qm(ym, Qm) этих прямых состав и
теплосодержание паров, поступающих под нижнюю тарелку
верхней секции колонны. Точка Gm должна одновременно при-
надлежать и прямой S2gK, поскольку последняя выражает
условие материального баланса укрепляющей секции и пря-
мой ЬОЛ, так как смесь Gm образуется из паров сырья L = GC
Расчет питательной секции колонны при питании жидкостью
311
и паров 6л, и фигуративная точка смеси должна лежать на
прямой, соединяющей фигуративные точки вступающих в смесь
систем (фиг. 83).
Дальнейший расчет числа тарелок в секциях колонны
ведется обычным способом попеременного использования усло-
вий фазового равновесия и уравнений концентраций в той или
иной форме.
§ 10. Расчет питательной
секции в случае питания ко-
лонны недогретой жидкостью.
секции колонны при питании ее
жидкостью, недогретой до точки кипения
Питание колонны жидкостью, недогретой до точки кипения,
довольно часто встречается и поэтому тоже должно быть особо
рассмотрено. Пусть через фигуративную точку сырья L (a, qQ)
и полюс Si(xR, бг) проведена прямая
общего баланса колонны SaLS2 и
определено положение полюса
S2 (yD, 02) верхней секции (фиг. 84).
Сырье не содержит паровой фазы,
и поэтому состав ут паров, посту-
пающих на нижнюю тарелку укреп-
ляющей секции, будет равен составу
ул парового потока, идущего из
нижней секции. Для определенности
режима работы колонны необходимо
задаться одним из параметров в ее
питательной секции, пусть попреж-
нему это будет состав ул—ут- Со-
единив прямой линией полюс S2
с фигуративной точкой паров Gm —
= СЛ, можно определить состав хк
как абсциссу точки пересечения gK
этой прямой с линией теплосодер-
жаний жидкой фазы. Далее, соеди-
нив полюс 8\ с фигуративной точкой
G,, (Ул, Q0 паров, поднимающихся
с верхней тарелки отгонной секции,
и фигуративную точку сырья L (а,
• q0) с точкой g,< (хк, qK), можно найти
в точке пересечения £т(хт, qm) этих прямых состав и тепло-
содержание флегмы, поступающей на верхнюю тарелку от-
гонной секции колонны. Точка (xm, </т) должна одновременно
принадлежать прямой S/L, поскольку последняя выражает
условие материального баланса отгонной секции, и прямой LgK,
так как если смесь gm образуется из жидкого сырья L=gc и
флегмы gK, то фигуративная точка смеси этих потоков должна
лежать на прямой, соединяющей точки L и gK. Построение на
312
Полная ректификационная колонна
фиг. 84 позволяет найти расположение граничных оперативных
линий для верхней и нижней секций колонны, и поэтому даль-
нейший расчет числа / тарелок уже не представляет труда и
ведется обцчными, графическим или аналитическим, методами.
§ Н. Расчет величины отдачи тепла в парциальном
конденсаторе
Определим отдачу тепла в [парциальном конденсаторе ко-
лонны (фиг. 85). Из теплового баланса верха колонны можно
написать х4
Фиг. 85. Орошение колонны
при помощи парциального кон-
денсатора.
заметное отклонение от
Заменяя Gr через g0 + D, имеем
d = ft (Qx-ft1) + D (Q^Qd). (VII. 59)
Это и есть основное соотноше-
ние для расчета величины отдачи
тепла в парциальном конденсаторе.
В некоторых курсах разность тепло-
содержаний (Qi — ifo1) принимают
равной скрытой теплоте испарения
2d ректификата и записывают
уравнение (VII. 59) в виде
d = g^D + D(^-QD).
Однако подобное допущение
иногда может повлечь за собой
истинных значений, особенно при
разделении компонентов, далеко отстоящих по точкам кипе-
ния. Для расчета отдачи тепла в парциальном конденсаторе
рекомендуется пользоваться уравнением (VII. 59).
§ 12. Холодное (острое) орошение
Наиболее распространенным на практике способом подачи
орошения является метод так называемого холодного (острого)
орошения, сущность которого состоит в следующем. Паровой
поток, поднимающийся с верхней тарелки колонны, полностью
конденсируется, и одна часть образовавшейся жидкости от-
водится как верхний целевой продукт D, а другая часть g'
возвращается на верхнюю тарелку колонны в качестве ороше-
ния. Флегма g' поступает в колонну при температуре, обычно
более низкой, чем ее точка начала кипения, так как в конден-
саторе верхние пары колонны не только ожижаются, но и
охлаждаются до температуры, при которой хранится получаю-
Холодное (острое) орошение
313
требуемый
D
Фиг. 86. Холодное (острое)
орошение.
щийся дестиллат. Таким образом, охлаждающее устройство на
верху колонны в данном случае является конденсатором-холо-
дильником.
Вследствие того, что при холодном (остром) орошении
колонны из ее схемы выпадает парциальный конденсатор,
в котором из-за частичной конденсации паров происходило их
дополнительное обогащение НКК, необходимо, чтобы пары,
поднимающиеся с верхней тарелки, уже имели
состав ректификата. Это достигается
установкой дополнительной тарелки
на верху колонны, заменяющей обо-
гатительный эффект парциального
конденсатора и позволяющей доводить
состав ух паров Gx до состава yD ректи-
фиката. Поэтому при холодном (ост-
ром) орошении флегма g0', стекающая
с верхней тарелки колонны (фиг. 86),
играет ту же роль, что и соответ-
ственно обозначенный жидкий ноток, -
стекающий из парциального конденса-
тора, когда орошение осуществляется
при помощи последнего. Отсюда
ясно, что при холодном (остром) оро-
шении колонны число ее тарелок уве-
личивается на одну, но вместо парциального конденсатора
устанавливается конденсатор-холодильник, ожижающий верх-
ний продукт и охлаждающий его до температуры хранения.
Определим отдачу тепла (Г в конденсаторе-холодильнике
при холодном (остром) орошении колонны. Составим уравнение
теплового баланса для объема колонного аппарата, заключен-
ного между верхом его и межтарелочным отделением, рас-
положенным под верхней тарелкой, заменяющей ректифицирую-
щее действие парциального конденсатора:
G1Q1 = d' + goqo' + DqD'> (VII. 60)
где qD' — теплосодержание единицы веса ожиженного верхнего
продукта колонны, обычно при температуре хранения его.
Заменим в уравнении (VII. 60) вес потока Gx через g04-£> и
преобразуем его, решив относительно d':
(VII- 61)
Из сопоставления уравнений (VII. 59) и (VII. 61) можно за-
ключить, что отдача тепла при холодном (остром) орошении
колонны больше, чем при орошении при помощи парциального
конденсатора, на величину
d'-d~D(QD-qD').
(VII. 62)
Очевидно, эта разность равна тому количеству тепла, которое
требуется затратить, чтобы насыщенные пары дестиллата скон-
денсировать и охладить до температуры, отвечающей тепло-
содержанию qD'.
Составим уравнение теплового баланса колонны по малому
кругу для определения веса холодного (острого) орошения
GiQi + gi'qD' =(D + g') Qd + goqo'.
Заменяя попрежнему через g0 + D и преобразуя, имеем
- g' (Qd -qD') = go (Qi — go') + D (Qi - Qd).
По известному весу потока g0, задаваясь температурой /
холодного орошения, можно найти его вес:
go (Qi — ?oz) + О (Qi—Qd) а
Qd Qd’ Qd—4d
(VII. 63)
Следует обратить внимание, что числитель этого выражения
равен теплу d, отнимаемому, когда орошение колонны осуще-
ствляется при помощи парциального конденсатора.
§ 13. Верхнее циркуляционное орошение
Третьей довольно распространенной системой съема тепла
на верху колонны является верхнее циркуляционное орошение
(фиг. 87). При этой системе орошения часть флегмы, стекающей
Фиг. 87. Верхнее циркуля-
ционное орошение.
с верхней тарелки колонны, отво-
дится в холодильник, где охлаждается
до желательной .температуры. Охла-
жденный жидкий поток насосом зака-
чивается обратно на верхнюю тарелку
колонны, с которой поднимаются де-
стиллатные пары D. Флегма gQ, стека-
ющая с верхней тарелки колонны,
находится в равновесии с дестиллат-
ными парами/), и поэтому в рассматри-
ваемом случае, как и в предыдущем,
верхняя тарелка играет ту же обо-
гатительную роль, что и парциальный
конденсатор в рассмотренной схеме ректификации. Отсюда ясно,
что при верхнем циркуляционном орошении число тарелок
колонны должно быть увеличено по крайней мере на одну
тарелку, чтобы возместить отсутствие парциального конденса-
тора с его ректифицирующим эффектом.
Боковое циркуляционное орошение
45
Для определения величины отдачи тепла в холодильнике
при циркуляционной системе орошения составим уравнение
теплового баланса:
GiQi = DQd-}- goqo' + rf.
Заменяя G1 чсргбз go~f-D, имеем
d=^(Qi-^o') + £»(Qi-QD). (VII. 64)
Отдача тепла в холодильнике получилась та же, что и
в колонне, снабженной парциальным конденсатором.
Для определения веса g' циркуляционного орошения состав-
ляется тепловой баланс по малому контуру:
GiQi+g'q' = dQd + g'q* + = dQd + (g'+go) q0'>
откуда, заменяя попрежнему GL через g0 + D, имеем
g'fdlo -q') = g0(Qi-q0') + O(Q1-QD)=d. (VII. 65)
Вес циркуляционного орошения можно было определить
и сразу, исходя из того соображения, что в холодильнике
отводится всего d ккал тепла, а каждый килограмм цирку-
лирующей флегмы отдает (</0'— q’) ккал1кг. Следовательно,
всего должно циркулировать флегмы
(VII. 66)
Сопоставление уравнений (VII. 63) и (VII. 66) позволило
А. М. Трегубову установить соотношение между весами
холодного (острого) и циркуляционного орошения при прочих
равных условиях:
= . (VII. 67)
В зависимости от величины теплосодержания потоков вес
циркуляционного орошения может быть больше или меньше
веса холодного (острого).
§ 14. Боковое циркуляционное орошение
В некоторых случаях для уменьшения количества холодного
а (острого) орошения, разгрузки конденсатора колонны и с целью
использования отнимаемого в колонне тепла в укрепляющей
колонне устраивается боковое циркуляционное орошение. Прак-
тически боковое циркуляционное орошение осуществляется
путем отвода с какой-нибудь тарелки всей флегмы или части
ее в расположенный снаружи теплообменник, где тепло флегмы
используется для подогрева, а сама охлажденная флегма
закачивается обратно в колонну на нижележащую тарелку. При
этом состав и количество флегмы в рассматриваемом межтаре-
лочном отделении колонны остаются неизменными, но тепло-
содержание и температура ее понижаются и на тарелку по-
ступает уже не насыщенная, а недогретая до начала кипения
жидкость. Это известным образом отражается на технике рас-
чета колонны по тепловой диаграмме или аналитическим
методом.
Фиг. 88. Боковое цирку-
ляционное орошение.
Чтобы установить и обосновать эти изменения при графи-
ческом расчете по тепловой диаграмме или при аналитическом
расчете по уравнению концентраций,
следует воспользоваться обычным мето-
дом балансов.
Материальный баланс колонны в целом
не дает ничего нового и приводит к уже
известным соотношениям. Тепловой же
баланс формально запишется по-дру-
гому:
LQ0 + B ^DQD + RqR + d1 + d2. (VII. 68)
Однако если положить, что d± -{-d2.= d,
то уравнение (VII. 68) можно записать
в его обычной форме, преобразованной для удобства расчета:
LQo = /?01-|-£)62. (VII. 69)
Таким образом, метод балансов в приложении ко всей
колонне в целом не дает существенно новых результатов и
лишь подтверждает, что и в данном случае на тепловой диа-
грамме фигуративная точка сырья L(a, Qo) и полюсы Rix^Oj)
и D(yD, 02) лежат на одной прямой.
Сечение отвода из колонны бокового циркуляционного
орошения (фиг. 88) делит ее верхнюю секцию на две части,
расположенные выше и ниже этого сечения. Обе эти части
верхней секции колонны являются обычными укрепляющими
секциями, в которых вес восходящего потока паров больше
веса встречной на одном уровне флегмы на одну и ту же
постоянную величину, равную весу D верхнего продукта
колонны. Но тепловые условия работы обеих частей укрепляю-
щей секции колонны не одинаковы. Так, для нижней части
укрепляющей секции постоянная разность теплосодержаний
встречных на одном уровне паровых и жидких потоков, от-
несенная к единице веса ректификата, равна (R, в чем легко
убедиться из уравнения теплового баланса, составленного для
объема колонны, заключенного между каким-нибудь произволь-
ным сечением этой секции и верхом колонны. Поэтому для
этой секции сохраняют силу полученные ранее расчетные
Расчет колонн по тепловым диаграммам
317
уравнения, позволяющие вести аналитический ее расчет, и
соотношения между составами встречных фаз и их теплосодер-
жаниями, позволяющие вести по тепловой диаграмме графи-
ческий расчет.
Если же составить уравнения балансов для объема колонны,
заключенного между верхом колонны и каким-нибудь произ-
вольным сечением той части укрепляющей секции, которая рас-
положена над уровнем отвода цир-
куляционного орошения, то уравне-
ния материального баланса будут
совершенно теми же, что и для
нижней части, но уравнение тепло-
вого баланса получится другим:
Gi+iQi +1 —giQi =
= DQD + d1 = De2', (VII. 70)
где
92' =Qn+ jy - (VII. 71)
Таким образом, тепловой пара-
метр в2' верхней части укрепляющей
секции отличается от теплового
параметра 02 нижней ее части на
величину
6z-62'=^-. (VII. 72)
Фиг. 89. Расчетная диаграмма
колонны с боковым циркуля-
ционным орошением.
Соответственно и полюс тепло-
вой диаграммы, из которого ведется
расчет верхней части укрепляющей
секции, не совпадет с полюсом ее нижней части. Эти два полюса
будут иметь одну и ту же абсциссу yD, но различные орди-
наты: нижний в2, а верхний в2.
Аналитический расчет обеих частей укрепляющей секции
ведется по известной форме уравнения концентраций
yi + i=xt 4- ; 1 q-1 (у - Xi) (VI. 29)
°2-
методом постепенного приближения. При этом для нижней
части укрепляющей секции в уравнение (VI. 29) подставляется
значение теплового параметра, равное в2, а для верхней —
равное 62. Расчетная диаграмма представлена на фиг. 89.
§ 15. Расчет ректификационных колонн с двойным
питанием по тепловым диаграммам
В промышленной, особенно нефтезаводской, практике часто
приходится сталкиваться со случаями, когда по технологиче-
ским соображениям необходимо ввод сырья в колонну осу-
ществлять в два различных сечения ввиду различия в составе
обоих питаний. При этом сырье более легкое, очевидно,
подается по высоте колонны на тарелку, расположенную выше.
В связи с этим ректификационная колонна (фиг. 90) двумя
сечениями ввода разделяется на три секции: одну — верхнюю,
расположенную над сечением ввода более легкого по составу
с двумя питаниями.
сырья, другую — нижнюю, расположен-
ную ниже ввода более тяжелого сырья,
и, наконец, третью — промежуточную,
занимающую среднее положение по вы-
соте колонны.
Как видно из фиг. 90, верхняя
и нижняя секции колонны с двойным
питанием представляют собой обычные
концентрационную и отгонную секции
и по соотношениям потоков в них ничем
не отличаются от соответствующих сек-
ций обычной колонны с одним пита-
нием. Разность весов встречных потоков
паров и флегмы в любом сечении верх-
ней секции постоянна по всей ее высоте
и равна весу ректификата D, а разность
весов потоков флегмы и паров нижней
секции колонны также постоянна по всей
ее высоте и равна весу нижнего про-
дукта /?.
Однако соотношения, управляющие
работой промежуточной секции колонны,
не столь просты, зависят от ряда фак-
торов и могут в различных условиях
принимать значения, существенно раз-
личающиеся, что коренным образом
отражается на характере работы рассматриваемой секции, кото-
рая может работать и как отгонная и как концентрационная^
а в одном случае и как секция, работу которой нельзя упо-
добить ни отгонной, ни концентрационной секциям обычной
колонны. В соответствии с этим существенным образом
меняется и характер графических построений на диаграмме
теплосодержание — состав, по которой ведется расчет числа
тарелок секций ректификационной колонны.
Для определения основных материальных и энергетиче-
ских соотношений, управляющих работой колонны в целом
и секций ее в отдельности, используется обычный метод мате-
риальных и тепловых балансов. В последующем изложении
постоянные по всей высоте отдельных секций колонны раз-
ности теплосодержаний встречных на одном уровне потоков
паров Gi + i и флегмы gi, отнесенные к единице веса постоян-
Расчет колонн по тепловым диаграммам
ной же разности их весов, соответственно обозначены для
отгонной секции через 61г для концентрационной секции
через 62 и для промежуточной секции через вА.
Для определения соотношения, связывающего состав а
и теплосодержание Qo единицы веса смеси L обоих питаний
L± и L2 колонны с величинами и 02 и составами xR остатка R
и yD ректификата D, составляются для всего объема колонны
уравнения материального баланса общего веса потоков и веса
содержащегося в них компонента. Совместное решение этих
уравнений с уравнением теплового баланса определит искомое
соотношение. Для колонны в целом
Lt + L2 = L = D + R
Lla1 + L2a2 = La = DyD + Rxr
^iQoi + — LQo — D62 -\-R61
(VII. I).
Полученная система соотношений (VII. I) является необхо-
димым и достаточным условием того, чтобы на диаграмме
теплосодержание — достав три заданные координатами точки
(хд, 01), (уп, 02) и (a, Qo), лежали на одной прямой, что легко
доказать путем исключения из трех уравнений системы (VII. I)'
весов R, D и L. Таким образом, для колонны с двойным пита-
нием соблюдается на тепловой диаграмме линейное соотноше-
ние, связывающее фигуративные точки целевых продуктов
верхней и нижней секций с фигуративной точкой смеси двух
подаваемых в колонну питаний.
Для определения соотношения, связывающего составы
Xi и yt + i и теплосодержания ф и Qt + i встречных потоков
gi и Gi +1 флегмы и паров в каком-нибудь текущем сечении
промежуточной секции с постоянным составом и теплосодер-
жанием гипотетического целевого продукта1 этой секции,
составляются для объема колонны, заключенного между
каким-либо сечением промежуточной секции и верхом или низом
колонны уравнения материального баланса общего веса пото-
ков и веса содержащегося в них компонента. Совместное
решение этих уравнений с уравнением теплового баланса того
же объема колонны определит искомое соотношение. Ниже
приведены уравнения, составленные для объема колонны,
выделенного замкнутой линией:
Gt .j. 1 + Li — D Д gi
Gi + 1Уг + 1 + L^ = DyD + giXi
(VII. II)
+iQz +1 Д CjQ01—D62~\~ giQt :
Постоянная по всей высоте промежуточной секции разность
весов встречных потоков паров и флегмы равна
Gt: +1 — gi’ = D — Cj = A = const.
(VII. 73)
(VII. 74)
(VII. 75)
(VII. III)
(VII. 76)
Введя обозначение хА для гипотетического состава разности
весов встречных потоков промежуточной секции и QA для ее
теплосодержания и определив хА и QA следующим образом:
OyD— £i«i
ХА D — '
п dqd ^iQoi
Уд = ’
можно притти к системе уравнений
Gt + i — gt — А
Gi + lyi + l — giXi = ЛхА
Gi + iQi + l — giqi = A6A
где-
ед = ^д + 4‘
Система уравнений (VII. III) является необходимым и доста-
точным условием того, чтобы на диаграмме теплосодержа-
ние-состав три заданные координатами точки (хА, 6А), (yj + i,
^; + 1) и (х>, qt) лежали на одной прямой. Таким образом, для
промежуточной секции колонны с двойным питанием соблю-
дается в графическом построении на тепловой диаграмме ли-
нейное соотношение, связывающее фигуративные точки встреч-
ных в текущем сечении фаз с фигуративной точкой их разности,
постоянной по всей высоте секции. Отсюда следует, что доста-
точно знать один из составов фаз в промежуточной секции и
расположение на тепловой диаграмме точки (хЛ, 0А), являю-
щейся полюсом, чтобы путем последовательного проведения
из полюса оперативных линий и при помощи конод, связываю-
щих фигуративные точки равновесных фаз, произвести расчет
числа тарелок указанной секции.
Постоянная по всей высоте промежуточной секции раз-
ность D — L1 = A весов встречных потоков паров Gl + i и
флегмы gi может быть положительной, равной нулю или отри-
цательной в зависимости от относительных количеств и составов
сырьевых потоков, ректификата и остатка, и в этом коренное
отличие промежуточной секции от двух других секций. При
заданных начальных составах а1 и а2 сырьевых потоков и L2
и конечных концентрациях у0 ректификата и xR остатка можно
вывести критическое соотношение между этими величинами,
определяющее характер процесса, протекающего в промежу-
точной секции колонны:
а2 — ХР
= (VII. 77)
Расчет колонн по тепловым диаграммам 321
Сравнение относительного веса ~ обоих сырьевых потоков
ь2
колонны с критерием Я позволяет судить о характере работы про-
межуточной секции. При этом могут представиться три случая.
Если отношение весов сырьевых потоков больше критерия
то промежуточная секция работает как отгонная, вес
флегмы в ней больше веса встречных паров и в секции, как
говорят, происходит ректификация жидкости. Если отношение
Li 1
весов сырьевых потоков меньше критерия -j— < л, то проме-
^2
жуточная секция работает как концентрационная, вес паров
в ней больше веса встречной флегмы и в секции, как говорят,
происходит ректификация паров. Если же имеет место сравни-
тельно редкий, но вполне возможный и реальный случай, когда
отношение весов сырьевых потоков равно критерию А, т. е.
-=4-== Я, то процесс в промежуточной секции нельзя уподобить
ь2
ни работе укрепляющей колонны, ни работе отгонной колонны,
ибо в этом случае веса встречных паровой и жилкой фаз равны
по всей высоте секции, а фигуративная точка разности А на
тепловой диаграмме, являющаяся полюсом для проведения опе-
ративных линий, передвигается в бесконечность.
Однако этот последний случай коренным образом отличается
от идеального случая полного орошения, при котором полюсы
колонны тоже удаляются в бесконечность. При полном оро-
шении составы встречных пара и жидкости равны, а в рас-
сматриваемом вполне реальном случае составы паров по низко-
кипящему компоненту всегда больше составов встречной
флегмы, и поэтому в первом случае оперативные линии на
тепловой диаграмме вертикальны, а здесь они наклонны.
Если промежуточная секция колонны работает как концен-
трационная, то разность А весов встречных фаз положительна
и ее гипотетический состав хА, определяемый уравнением (VII.74),
больше единицы. Если же промежуточная секция работает как
отгонная, то разность А отрицательна, так же как ее гипо-
тетический состав хА. Следует отметить, что ни величина А
разности весов встречных фаз средней секции, ни ее гипоте-
тический состав хА не имеют реального физического смысла
и играют чисто геометрическую роль вспомогательной рабочей
координаты в расчетах числа тарелок секции, и поэтому отри-
цательный вес А или концентрация хА меньше нуля или больше
-единицы не должны вызывать недоумения. С аналогичным
случаем приходится сталкиваться, например, при расчете много-
контактной противоточной экстракции масел.
Для получения аналитического соотношения, связыва-
ющего составы встречных потоков промежуточной секции с их
21 Зап. № 304.
теплосодержаниями, при помощи которого можно произвести
расчет числа тарелок, достаточно из трех уравнений системы
(VII. III) исключить веса потоков Gi и gi — 1 и вес гипотетического
целевого продукта средней секции А. Получается соотношение,
содержащее только составы и теплосодержания:
У/ = X, _ 1 + (хд - х, - 0. (VII. 78)
° A ~4i -l
Если по известному составу Х/_ i жидкой фазы в каком-либо
текущем сечении промежуточной секции необходимо найти
состав у, встречной паровой фазы, то следует задаться значе-
нием Qi теплосодержания единицы веса этих паров, рассчитать
по уравнению (VII. 78) состав у, паровой фазы и проверить,
насколько правильно было принято значение их теплосодержа-
ния Qt. Обычно одного-двух пересчетов оказывается достаточно
для практически точного определения состава у, паров по задан-
ному составу Xi-t встречной жидкости. Так следует вести ана-
литический расчет числа теоретических контактов промежуточ-
ной секции методом постепенного перехода от одного меж-
тарелочного уровня к другому.
Для обоснования чисто графического метода нахождения
положения полюса промежуточной секции на тепловой диа-
грамме следует установить соотношения, связывающие характе-
ристические для промежуточной секции величины 6А и хА с со-
ставами аг и а2 обоих сырьевых потоков и теплосодержани-
ями Q01 и Qo2 единицы их веса, с одной стороны, а также с
величинами и fl2 и составами xR остатка и yD ректификата
с другой стороны.
Материальный баланс по общему весу потоков и по весу
содержащегося в них компонента для объема колонны между
каким-либо текущим сечением промежуточной секции и низом
колонны совместно с тепловым балансом того же объема ко-
лонны приводит к следующей системе соотношений:
Е2 = R -f- A j
L2a2 = Rxr + Аха ) (VII. IV)
R2Q02= 4" ]
Система соотношений (VII. IV) является необходимым и доста-
точным условием того, чтобы на диаграмме теплосодержание —
состав три точки (хА, вА), (а2, 0О2) и (xR, 0^ лежали на одной пря-
мой. Таким образом, согласно системе соотношений (VII. IV)
полюс (хл, 0А) промежуточной секции лежит на прямой, проходя-
щей через фигуративную точку второго питания и через полюс
отгонной секции.
Расчет колонн по тепловым диаграммам
323
С другой стороны, совместное рассмотрение материального
и теплового балансов для объема колонны между каким-нибудь
текущим сечением промежуточной секции и верхом колонны
приводит к следующей системе соотношений:
D = L1 + A
DyD = Liai + AxA
О02 = ЬА1 + аоа
(VII. V)
которая является необходимым и достаточным условием того,
чтобы на тепловой диаграмме три точки (хА, 9А), (аь Q01) и (yD, 02)
лежали на одной прямой. Таким
образом, согласно системе соот-
ношений (VII. V) полюс SA(xA, 0Д)
промежуточной секции лежит на
прямой, проходящей через фигу-
ративную точку первого сырье-
вого потока и через полюс кон-
центрационной секции. Следова-
тельно, положение полюса про-
межуточной секции на тепловой
диаграмме найдется в точке
пересечения прямых StL2 и
(фиг. 91,92), определяемых систе-
мами соотношений.
Полученные системы соотно-
шений (VII. IV) и (VII. V) позво-
ляют расположить на диаграмме
теплосодержание — состав ряд
важных для расчета колонны
точек, порядок нанесения кото-
рых следующий. На отрезке LXL2
прямой, соединяющей фигуратив-
ные точки Li (аъ Qol) первого
и L2 (а2, Q02) второго питания
колонны, располагается фигура-
тивная точка L (a,Q0) их смеси,
положение которой определяется
известным центротяжестным по-
строением. Исходя из конкрет-
ных производственных условий
работы проектируемой колонны,
выбирается тепло кипятильника
Фиг. 91. Расчетная диаграмма
колонны с двойным питанием
В, несколько большее, чем минимально совместимое с желатель-
ной работой колонны, по уравнению рассчитывается величина и
на тепловую диаграмму наносится точка 51(хд,01), являющаяся
21*
S2
Фиг. 92. Расчетная диаграмма колон-
ны с двойным питанием z>-~
^2
полюсом, в котором сходятся все оперативные линии отгонной
секции колонны. Точка пересечения S2(yD, 0.2) прямой, проходя-
щей через полюс (xR, 6г) отгонной секции и фигуративную
точку L (a, Qo) смеси обоих питаний колонны, с вертикалью yD =
= const определяет на основании системы соотношений (VII. I)
положение полюса, в котором
сходятся все оперативные ли-
нии верхней — концентрацион-
ной—секции колонны. Со-
гласно указанному выше
положение полюса SA проме-
жуточной секции колонны на
тепловой диаграмме опреде-
ляется на основании систем
соотношений (VII. IV) и (VII. V)
точкой пересечения SA(xA, 0А)
двух прямых: одной, проходя-
щей через точки (аь Q01) и
S2(yD>6z)> и другой, проходя-
щей через точки S^x^O]) и
L2 (а3, Q02), как это показано
на фиг. 91 и 92 для двух слу-
чаев, 2< и Л> работы
промежуточной секции.
Расчет числа тарелок от-
дельных секций колонны
с двойным питанием осущест-
вляется последовательным про-
ведением из соответствующего
полюса оперативных линий для
каждого межтарелочного уровня и конод, связывающих фигура-
тивные точки равновесных фаз, покидающих одну иту же тарелку.
В расчете реальной колонны, работающей с избытком тепла кипятильника
против его минимального значения, совместимого с желательной работой
колонны, при котором, как известно, получается бесконечно большое число
тарелок, проектировщик лля полной определенности расчета должен задаться
значениями некоторых элементов ректификации в зависимости от располагае-
мого им числа степеней свободы, без чего вести расчет невозможно. Так,
при расчете простой колонны с одним питанием необходимо для определен-
ности проблемы помимо значения тепла кипятильника задаться еще одним из
элементов ректификации в питательной секции колонны, а именно принять
один из составов фаз или же один из весов этих фаз, поступающих в испа-
рительное пространство колонны из верхней и нижней секций колонны. Если
теплом кипятильника предварительно не задаются, то число степеней свободы
становится равным двум и для определенности проблемы необходимо зада-
ваться значениями уже двух элементов ректификации в питательной секции
простой колонны с одним питанием.
Выбор давления
325
Точно так же для полной определенности проблемы расчета колонны
с двойным питанием проектировщик должен установить 12 величин: веса Lj
и £2, составы пг и а2 и теплосодержания Q01 и Q02 исходных смесей, пода-
ваемых на разделение, числа тарелок и, отгонной, п2 укрепляющей и п3 про-
межуточной секций колонны и постоянные разности теплосодержаний 0Ь 02
и 6А встречных фаз, отнесенные в каждой секции к единице веса чистого
продукта этой секции.
Приступая же к расчету проектировщик располагает только 10 данными:
количествами LT и L2, составами at и а2, теплосодержаниями Q01 и Q02 исход-
ных смесей, теплом кипятильника В и.составами xR остатка, yD ректификата
и хА гипотетического продукта промежуточной секции колонны. Поскольку
число данных на два меньше необходимого, задача расчета колонны должна
иметь бесконечное число решений, ибо для определенности проблемы проекти-
ровщик вправе произвольно принимать различные пары значений элементов
ректификации питательных секций, доводя тем самым число неизвестных до
числа располагаемых расчетных уравнений. Однако этот произвол можно огра-
ничить, обусловив выбор одиннадцатого и двенадцатого условия требованием,
например, обеспечения наименьшего общего числа тарелок колонны, отвечаю-
щего принятому значению тепла кипятильника В. Расчет ряда вариантов
колонны с различными значениями двух дополнительных условий позволит
выбрать оптимальный вариант для практического осуществления.
Таким образом, в расчете колонны с двойным питанием число степеней
свободы^ на одну болыис- ic.'i в колонне е одшгм нита+шсм- что-рбъясняется
наличием дополнительной питательной секции и может быть доказано путем
рассмотрения соотношений материального баланса, связывающих элементы
ректификации в обеих питательных секциях колонны.
§ 16. Выбор давления
На примере выбора давления, под которым ведется процесс
ректификации, лучше всего можно проиллюстрировать, как
требования практической целесообразности сужают возмож-
ности, представляющиеся на первый взгляд безграничными.
В самом деле, с теоретической точки зрения давление, под
которым ведется процесс, может колебаться от глубокого
вакуума с незначительным остаточным давлением до почти
критического значения для рассматриваемой системы без того,
чтобы это сделало теоретически невозможным протекание про-
цесса ректификации. Однако каждая ректификационная колонна
работает в реальной производственной обстановке, в тесной
связи и во взаимодействии с остальными аппаратами установки,
и лишь конкретными возможностями, реально осуществимыми
в данных условиях, может определяться диапазон колебаний
давления, внутри которого проектировщик должен подобрать
тот или иной режим давлений. Это одна сторона вопроса
заметно сужает пределы изменения давлений, при которых
может работать колонный аппарат.
С другой стороны, выбор давления сейчас же определяет
в общем случае тот интервал температур, внутри которого дол-
жен протекать процесс разделения. Чем ниже давление, тем
ниже температуры процесса, и, очевидно, начиная с некоторого
гл лг/pi tlf ft 1 t f[<>f-t 11 П Ч KOIM'1"
значения давления, в конденсаторе колонны потребуется
уже искусственное охлаждение за счет холодильной установки,
так как температура обычного хладоагента нефтезаводских
установок (воды) окажется выше температуры насыщения верх-
него продукта колонны при выбранном давлении.
Конечно, целесообразно вести разделение под таким давле-
нием, которое позволит применять дешевый хладоагент, в част-
ности воду, однако не всегда это возможно, так как необхо-
димое для этого повышение давления может привести к таким
условиям, при которых температуры процесса окажутся выше
критических температур компонентов системы и их ожижение,
а следовательно, и ректификация уже ни при каком дальней-
шем повышении давления не смогут быть осуществлены.
При повышении давления температуры процесса растут и
в некоторых условиях они могут оказаться практически недо-
стижимыми вследствие, например, термической неустойчивости
компонентов разделяемой системы. В других условиях с повы-
шением давления температуры ректификации оказываются выше
того уровня, при котором можно в кипятильнике колонны
применить в качестве нагревательного агента насыщенный водя-
ной пар, часто использующийся на нефтезаводах. В этих слу-
чаях приходится сооружать огневой нагревательный аппарат
и выбор того или иного метода подогрева, а следовательно,
и давления процесса в конечном итоге решается соображе-
ниями технико-экономического характера.
Как указывалось ранее, давление, под которым ведется
разделение, играет большую роль и в соотношениях фазового
равновесия компонентов рассматриваемой системы, причем эта
его определяющая роль зависит в значительной мере от свойств
составляющих систему веществ. Так или иначе изменение дав-
ления оказывает влияние на соотношения паро-жидкого равно-
весия, а в случае больших давлений и на тепловые свойства
компонентов системы, что приводит к изменению числа теоре-
тических контактов, необходимых для данного разделения.
В большинстве нефтеперегонных установок давление ректи-
фикационных колонн превышает атмосферное лишь на ту вели-
чину, которая затрачивается на преодоление сопротивлений
при движении паров по высоте колонны и через конденсатор.
На мазутоперегонных установках, где в целях предохране-
ния тяжелых продуктов от разложения процесс разделения
в колонне ведется под вакуумом, остаточное давление опреде-
ляется соображениями обеспечения необходимого отгона в испа-
рительном пространстве при выбранной его температуре.
На установках, фракционирующих низшие нефтяные угле-
водороды, выбор давления должен производиться на основе
указанных выше соображений с учетом необходимости обе-
спечения легкости эксплуатации колонны и высокого технико-
Выбор количества орошения
327
экономического эффекта ее работы. Выбор окончательного
режима давлений в колонне может быть произведен на основе
расчета и сравнения нескольких вариантов.
§ 17. Выбор количества орошения
Как известно из теории ректификационной колонны, каждой
определенной паре равновесных, так называемых граничных
составов отвечает некоторый вполне определенный минимальный
расход орошения, при котором эта пара предельных составов
может быть теоретически достигнута лишь при бесконечном
числе тарелок колонны. Известно также, что эти составы практи-
чески достигаются при отвечающем им минимальном орошении
с вполне конечным числом тарелок, зато перейти за пределы
этих составов уже ни при каком числе тарелок не удается,
если не изменить количества орошения. С другой стороны, для
данных условий разделения бесконечно большому флегмовому
числу <Ра:, отвечающему той гипотетической предельной картине
работы колонны, при которой обогатительный эффект каждой
ступени контакта достигает максимума, соответствует некото-
рый минимум числа тарелок колонны.
Таким образом, имея в виду произвести разделение данной
системы на определенные фракции, проектировщик теорети-
чески может изменять количество орошения, подаваемого
в колонну, в весьма широких пределах, тем самым назначая
тот или иной режим ее работы. При этом минимальному для
данного разделения количеству орошения теоретически будет
отвечать бесконечно большое число тарелок колонны или,
иными словами, бесконечно большая ее высота, а минималь-
ному числу тарелок, отвечающему бесконечно большому флег-
мовому числу, может отвечать колонна, либо не выдающая
продуктов, либо бесконечно большого диаметра. Ни тот, ни
другой варианты не могут удовлетворить условиям производ-
ственной работы, но из этого можно сделать важный вывод
о том, что увеличение орошения уменьшает число тарелок,
необходимых для заданного разделения. Больше того, даже
самое незначительное увеличение количества орошения против
его минимального значения сразу резко делает число тарелок
колонны из бесконечно большого вполне конечным и даже
небольшим. Дальнейшее увеличение количества орошения
характеризуется уже значительно ослабленным эффектом и не
вызывает столь заметного сокращения числа тарелок, которое
в последующем вместе с ростом флегмового числа медленно,
асимптотически, приближается к минимальному.
Из этого можно заключить, что число тарелок колонны
зависит от количества орошения, определяющего в значи-
тельной степени обогатительный эффект каждой тарелки и
328
Полная ректификационная колонна
соответственно размеры колонны и ее вспомогательных уст-
ройств. В зависимости от количества орошения приобретают те
или иные размеры конденсатор колонны, расход хладоагента
в нем, кипятильник колонны и тарелки, расход энергии на подачу
орошения и хладоагента. С увеличением количества орошения
все эти факторы растут, а число тарелок и соответственно
высота колонны уменьшаются. С другой стороны, если рас-
Фиг. 93. Определение оптимального
флегмового числа.
общая стоимость; 2—эксплуатационные рас-
ходы; 3 — капитальные затраты.
по мере увеличения количества
мость колонной установки,
смотреть отдельно эксплуа-
тационные расходы, вклю-
чающие в основном стои-
мость количеств энергии,
расходуемых на насосе оро-
шения и в кипятильнике,,
и стоимость охлаждения в
конденсаторе, то они, несо-
мненно, будут расти с уве-
личением количества оро-
шения. Стоимость же затрат
на сооружение самой ко-
лонны и ее вспомогательных
устройств при минимальном
орошении должна быть бес-
конечно большой, а с уве-
личением количества ороше-
ния сначала резко снизится,
так как число тарелок ко-
лонны из бесконечного ста-
новится конечным, затем
станет минимальным и далее
будет постепенно возрастать
орошения. Общая же стои-
складывающаяся из стоимости
эксплуатационных расходов и расходов на сооружение ко-
лонны и ее вспомогательного оборудования, также при мини-
мальном орошении должна быть бесконечно велика, но при
увеличении орошения сначала падает до некоторого минимума,
а затем постепенно растет. Ясно, что оптимальными условиями
работы колонны будут те, при которых общая стоимость ее
работы будет минимальной. Сказанное иллюстрировано на
фиг. 93, графиком, заимствованным из книги А. И. Скобло [12j.
Для подобных расчетов требуется производство технико-
экономического анализа различных вариантов работы колонны,
что хотя и выглядит достаточно сложным, но для обоснования
проекта колонны должно считаться обязательным. Здесь уместно
отметить, что А. М. Трегубов считает достаточным увеличение
количества орошения на 20% против минимального, подтверж-
дая это положение ссылкой на заводские данные. Подобный.
Условия хорошего барботажа и выбор типа тарелок. 329
подход может быть рекомендован в качестве первого при-
ближения к установлению оптимального режима работы
колонны.
§ 18. Условия хорошего барботажа
и выбор типа тарелок
В нефтезаводской практике распространены в основном
лишь колпачковые тарелки, но зато конструкции их самые
разнообразные и часто довольно сложные.
Основной причиной преимущественного использования кол-
пачковых колонн при переработке нефти является их значи-
тельно большая производительность сравнительно с насадоч-
ными колоннами, используемыми главным образом в лабора-
торных условиях или для специальных случаев.
Опытные данные показывают, что производительность наса-
дочной колонны диаметром 1,5 м равна производительности
колпачковой, имеющей диаметр 1 м, и даже то, что при этом
высота колпачковой колонны увеличивается, не компенсирует
разницы в диаметре. При выборе типа ректификат; ион ной ко-
лонны для проектируемого разделения следует иметь в виду,
что колпачковые колонны с очень маленьким диаметром зна-
чительно дороже соответствующих насадочных колонн, однако
по мере увеличения диаметра стоимость насадочных колонн
растет намного быстрее, чем колпачковых, причем для прибли-
зительной грубой оценки можно считать, что стоимость наса-
дочной колонны растет пропорционально квадрату диаметра,
а колпачковой — диаметру в первой степени. Таким образом,
исходя из подобной оценки, можно считать, что имеется неко-
торое граничное значение диаметра, за пределами которого
использование колпачковых тарелок более целесообразно и
экономично.
Длительный опыт промышленной эксплуатации насадочных
колонн показал эффективность их использования при диамет-
рах, не превосходящих 0,8 м. При увеличении диаметра насадоч-
ной колонны заметно ухудшается равномерность распределения
флегмы по насадке, образуются каналы, по которым преимуще-
ственно устремляется жидкость, и работа колонны становится
неэффективной. В переработке нефти сравнительно редко встре-
чаются колонны диаметром меньше 1 м вследствие большой
производительности нефтезаводских установок, и этим между
прочим в значительной степени объясняется слабое распро-
странение насадочных колонн в нефтяной промышленности.
Падение напора при движении паров в насадочной колонне
приблизительно вдвое меньше, чем в колпачковой колонне
такой же производительности, и это делает их применение
особенно выгодным при работе под вакуумом. К недостаткам
насадочных колонн следует отнести их недостаточную гибкость
П г-t ->ггг-»г7 Г» /7 C"rt tAl I t tS f / t / <-T U И П a tSft 4 i'I (/ XJZ/
в работе, выражающуюся в необходимости использования срав-
нительно больших флегмовых чисел, и большую трудность
поддержания в них установившегося неизменного режима ра-
боты. Для большинства процессов разделения углеводородных
систем применение насадочных колонн не оправдало себя на
практике и было оставлено.
Учитывая основную роль тарелки в процессе контактирова-
ния фаз, следует в каждом конкретном случае с особым вни-
манием подходить к выбору типа тарелки и ее конструкции.
Фиг. 94. Различные типы тарелок.
Движения флегмы: а — одностороннее; 6—двухстороннее; в — радиаль-
ное; 1 — один сливной сегмент; 2 — два сливных сегмента; 3—кон-
центрический сливной борт.
Так, например, наиболее часто встречающийся тип тарелки со
сливным сегментом, схема которого приведена на фиг. 94,
обладает тем преимуществом, что расход материала на изго-
товление тарелки невелик. Однако экономия материала еще
далеко не исчерпывает всех требований, предъявляемых к та-
релке, из которых самым важным является необходимость'
обеспечения тесного контакта фаз или, как говорят, хорошего
барботажа.
Явление барботажа в колонне состоит в контактировании
паров и флегмы путем пропускания восходящего парового
потока через слой жидкости, движущейся по тарелке. Паровой
поток движется кверху вследствие отрицательного градиента
давления, направленного снизу вверх по высоте колонны, а
флегма стекает вниз с одной контактной ступени на другую
из-за напора, создаваемого ее уровнем на каждой тарелке.
Условия хорошего барботажа и выбор типа тарелок
331
Этот напор позволяет ей двигаться вниз в направлении воз-
растающего статического давления. Для возможности барбо-
тажа на тарелке устанавливаются специальные колпачки, имею-
щие различные конструкции, объединенные основной идеей,
для выяснения которой достаточно рассмотреть один какой-
нибудь тип колпачка, например простейший круглый колпачок,
показанный на фиг. 95. В круглое ; отверстие, прорезанное
в тарелке, вставляется патрубок
для прохода паров а, приваривае-
мый или иначе прикрепляемый к
корпусу тарелки и накрываемый
сверху круглым же колпачком Ь,
укрепленным так, чтобы края его
несколько возвышались над тарел-
кой. Нижние края колпачка имеют
треугольные вырезы в виде зазуб-
рин или снабжены прорезями, кото-
рые должны быть расположены
—ниже уровня жидкое и на тарелке .
Поднимающийся с нижележащей
тарелки пар проходит через патру-
бок а и, под напором разделяясь
на струйки, выходит через прорези
колпачка, попадая в жидкость, на-
ходящуюся на тарелке. Струйки
пара, а иногда и пузырьки его при-
Фиг. 95. Круглый колпачок.
ходят в контакт с жидкостью на
тарелке, обмениваются веществом и энергией и выходят в про-
странство над тарелкой, сливаясь в один общий паровой поток.
Это явление и представляет собой барботаж.
При больших скоростях движения паровой поток через
стаканы колпачков может пройти не через прорези, а, вытеснив
флегму, устремится в пространство между нижним краем кол-
пачка и уровнем тарелки. Это явление ухудшает барботаж,
так как пары не разбиваются на мелкие струйки и пузырьки,
их поверхность контакта с жидкостью становится меньше и
массообмен протекает уже менее интенсивно.
Одним из наиболее часто применяющихся типов колпачков
является представленный на фиг. 95 круглый колоколообраз-
ный колпачок, чугунный или чаще стальной., а если имеется
опасность сернистой коррозии, то его изготовляют из легиро-
ванной стали. Диаметры круглых колпачков колеблются в пре-
делах 50—180 мм. Другим распространенным типом колпачка
является прямоугольный длинный коробчатый колпачок, удоб-
ный для установки и простой по конструкции. Однако круг-
лые колпачки обеспечивают несколько большую эффективность
работы тарелки, позволяя лучше регулировать движение флегмы
по тарелке и отличаясь большей легкостью установки и закреп-
ления на тарелке, так как не имеют длинных прямых сторон,
которые должны располагаться параллельно соответствующим
сторонам соседних колпачков.
Массообмен и энергообмен; составляющие сущность барбо-
тажа, происходят через поверхность контакта фаз, и поэтому
основным условием хорошего барботажа, выражающемся в ин-
тенсивном обмене между фазами, является максимальное уве-
личение поверхности их контакта. Эта поверхность будет тем
больше, чем меньше диаметры пузырьков и размеры струек,
на которые разбивается паровой поток, проходя через прорези
колпачков. С другой стороны, наклонное направление движе-
ния струек пара в массе жидкости обеспечивает большее время
контакта фаз сравнительно с тем, когда струйки направлены
вертикально вверх, как это имеется в некоторых конструкциях
тарелок, например в ситчатых. Это же способствует уменьше-
нию так называемого явления уноса, выражающегося в захвате
движущимися струйками пара мельчайших капелек жидкости
и в переносе их в паровое пространство над тарелкой, а от-
сюда на вышележащую тарелку.
Другим условием эффективного барботажа является равно-
мерное распределение парового потока по всей площади
тарелки. В этом отношении существенную роль играет строго
горизонтальное расположение тарелки, на что следует обра-
щать самое серьезное внимание. В самом деле, даже неболь-
шой уклон тарелки создает неравномерность толщины слоя
флегмы на ней и тем самым содействует тому, чтобы па-
ровой поток устремился в те части тарелки, где толщина слоя
жидкости и соответственно сопротивление проходу паров ока-
жутся меньше. В результате этого некоторые колпачки оказы-
ваются в весьма напряженных условиях работы, тогда как
другие, расположенные в тех частях тарелки, где уровень
жидкости высок, почти не принимают участия в процессе.
Однако даже при самой точной горизонтальной установке
тарелки все равно на ней имеется известный градиент уровня
жидкости по направлению от места ввода жидкости на тарелку
до места отвода флегмы с нее, т. е. от подводящей сливной
трубы к отводящей. Когда размеры тарелки между этими двумя
точками достаточно велики или число колпачков на тарелке
настолько велико, что резко возрастает сопротивление движе-
нию флегмы на тарелке, эта разность уровней может привести
к тому, что колпачки, расположенные у входной сливной трубы,
почти не принимают участия в барботаже. В этих случаях на
тарелке устраиваются перегородки, вынуждающие жидкость
перетекать через всю тарелку, зигзагообразно проходя после-
довательные отделения ее, в каждом из которых все располо-
женные там колпачки работают в одинаковых условиях.
Условия хорошего барботажа и выбор типа тарелок
333
Механизм барботажа и действительная картина его про-
текания нц колпачковой тарелке очень сложны и до настоя-
щего времени не выяснены еще во всех деталях. Приблизи-
тельно же это можно представить следующим образом.
Можно исходить из предположения, что в каждом межта-
релочном отделении поднимающиеся пары настолько хорошо
перемешиваются, что вступают на тарелку, во все ее патрубки,
с одним и тем же составом. Этот паровой поток постоянного
количества и состава приходит в контакт с жидкостью, дви-
жущейся по тарелке. Для хорошего барботажа необходимо,
чтобы равные массы флегмы, текущей по тарелке, приходили
в контакт с одинаковыми массами паров, иначе говоря, необ-
ходимо создать условия, обеспечивающие равномерное распре-
деление всей массы паров между всеми колпачками тарелки.
При стационарном состоянии барботажа на каждом участке
рабочей тарелки устанавливаются неизменные концентрации
жидкости, непрерывно меняющей свой состав на пути движе-
ния от подводящей сливной трубы к отводящей.
Состав жидкости на тарелке не одинаков во всех ее частях,
но по мере движения по тарелке все более приближается к со-
стоянию равновесия с пересекающим ее паровым потоком,
имеющим более или менее одинаковый состав для всех кол-
пачков независимо от того, расположены ли они у места ввода
флегмы на тарелку или у отводящей сливной трубы. Очевидно,
состав флегмы в месте ее отвода с тарелки будет ближе к состоя-
нию равновесия с поступающим паровым потоком, чем состав
флегмы в момент ее поступления на тарелку, и поэтому эффект
обмена веществом и энергией по мере движения флегмы на
тарелке будет прогрессивно ослабляться. В самом деле, разность
фаз, являющаяся движущей силой процесса энергообмена и
диффузии, при приближении контактирующих потоков к состоя-
нию равновесия уменьшается и интенсивность процесса осла-
бляется.
Принято считать, что в результате направленного снизу
вверх движения паров, пересекающих подвижной слой жидкости
на ректификационной тарелке, в межтарелочных отделениях
колонны образуются четыре области, различающиеся по отно-
сительному содержанию жидкой и паровой фаз. Самая нижняя
область занимает объем от уровня поверхности тарелки до
нижнего обреза прорезей колпачков и содержит лишь жидкую
фазу, не взболтанную и не перемешанную струйками или
пузырьками пара. Следующая за ней вторая область занимает
пространство от уровня нижнего обреза прорезей колпачков
и до высоты, несколько превосходящей уровень, на котором
устанавливается на тарелке флегма в отсутствии барботажа
паров. Эта область межтарелочного объема содержит взбол-
танную барботирующим паром вспененную жидкую фазу. Третья
334- 77 О липо П Г/Аг t у П 11 lt/f Ч LI Л П •' (У ••'r
область располагается над второй и содержит крупные и мел-
кие капли жидкости и пену, захваченные и унесенные паровым
потоком из флегмы, покрывающей тарелку. В зависимости от
скорости парового потока и конструктивных особенностей
тарелки эта область занимает больший или меньший объем
по высоте межтарелочного отделения. Наконец, четвертая
область, занимающая остальную часть межтарелочного объема,
содержит постепенно по мере подъема по высоте сокращающееся
количество мельчайших частиц жидкости, образующих своеоб-
разный туман, уносимый кверху. Если скорость движения паров
выше некоторого оптимального значения, то эти частицы флегмы
переносятся через последнюю зону на вышележащую тарелку,
ухудшая ее разделительную способность.
Если в ходе движения флегмы по тарелке в массе жидкости
возникают завихрения, то следует по возможности избегать
их, так как подобные явления характеризуются понижением
эффективности работы тарелки. Причина этого в том, что часть
жидкости, уже достигшая состояния равновесия с парами,
не удаляется с тарелки, а вследствие завихрений задерживается
на ней довольно продолжительное время, и поскольку она уже
равновесна парам, то барботаж паров через нее совершенно
бесцелен.
В свете изложенного становится ясным, почему при проек-
тировании тарелки нельзя ориентироваться на свободное дви-
жение жидкости по ней, а следует это движение направлять
определенным, наиболее выгодным образом. С этой целью на
тарелке устанавливаются перегородки, которые разделяют поток
флегмы на несколько частей, вынужденных проходить опре-
деленные и равные пути по тарелке, и вследствие этого дости-
гается одинаковое время их пребывания на тарелке.
Движение флегмы на тарелке можно еще регулировать,
используя для этой цели струйки паров, выходящих из кол-
пачков. Для этого необходимо лишь увеличить число прорезей
на той стороне колпачка, которая ориентирована в направлении
желательного движения флегмы, и сократить число прорезей
на противоположной его стороне.
Уровень жидкости на тарелке обычно поддерживается на
определенной высоте путем установки на тарелке двух пере-
городок: одной, расположенной у места ввода флегмы, и дру-
гой— отводной, расположенной у сливного приспособления.
Высота и длина этих перегородок играют большую роль в обес-
печении нормальной работы тарелок и поэтому должны выби-
раться с особой тщательностью. Так, например, в зависимости
от высоты сливной перегородки устанавливается тот или иной
гидравлический затвор в сливных трубах, причем слишком
большая ее высота может вызвать захлебывание сливных труб.
Уровень сливной перегородки обычно выбирается таким обра-
Условия хорошего барботажа и выбор типа тарелок. 335
зом, чтобы даже при отсутствии движения жидкости на тарелке
прорези колпачков были затоплены. С этой целью рекомен-
дуется располагать сливную перегородку на уровне, отвечаю-
щем средней линии между верхними обрезами прорезей кол-
пачков и их стаканов. Высота входной перегородки должна
выбираться с таким расчетом, чтобы обеспечить необходимый
уровень флегмы над прорезями всех колпачков. Высота этого
гидравлического затвора не должна быть очень большой, /так
Фиг. 96. Движение флегмы ио тарелке.
а — одностороннее; б — двустороннее; в — каскадное; г — с переменой направления;
д — одностороннее; е — радиальное; 1 — сливная перегородка; 2 — промежуточная
перегородка.
как может вызвать значительную потерю напора при движении
паров. Сечение сливных труб в известной мере определяет
длину этих перегородок, однако в конечном счете этот вопрос
решается конструктивным типом тарелки. При малых расходах
жидкости для лучшего ее распределения края перегородок
иногда делаются зубчатыми в виде гребня.
На фиг. 96 схематично показаны некоторые применяемые
на нефтезаводах типы колпачковых тарелок, различающиеся
по характеру и направлению движения жидкости, по типу и
числу сливных приспособлениий. Чтобы разобраться во мно-
жестве конструктивных форм ректификационных тарелок и
умело выбрать наиболее подходящий для данного разделения
тип тарелки, необходимо отчетливо представлять описанный
выше механизм работы барботажной контактной ступени.
К сказанному ранее следует добавить несколько замечаний
практического характера. Расстояния между колпачками должны
выбираться таким образом, чтобы обеспечить возможно более
полное перемешивание жидкости на тарелке, возможно более
одинаковую скорость движения паров и минимальную потерю
напора. Опытные данные показывают, что, например, круглые
колпачки лучше располагать по вершинам равностороннего
треугольника так, чтобы расстояние между стенками соседних
колпачков не выходило за пределы 25—75 мм. Колпачки не
должны располагаться слишком близко к сливной трубе или
сливному сегменту тарелки, так как это может привести к выпле-
скиванию флегмы через сливную перегородку в сливную трубу.
Размеры стаканов и колпачков обычно выбираются таким
образом, чтобы сечение стакана равнялось сечению кольцевого
пространства между ними. Для обеспечения возможно боль-
шего постоянства скорости движения паров сечение прорезей
колпачка тоже обычно приравнивается сечению стакана или
кольцевого пространства; этим создаются наиболее благоприят-
ные условия для сохранения неизменной по величине, хотя и
переменной по направлению скорости движения паров. Расстоя-
ние между колпачками должно выбираться так, чтобы была
обеспечена достаточная площадь, занятая флегмой, через кото-
рую пробулькивают пузырьки и струйки паров. При слишком
большой тесноте расположения колпачков и относительно
малой площади, занятой флегмой, может быть явление уноса,
выражающееся в выплескивании паровыми струйками частиц
жидкости в межтарелочное пространство, а также нежелатель-
ное явление оттеснения жидкости от колпачка, резко ухудшаю-
щее эффективность барботажа.
Выбор типа тарелки определяется главным образом произ-
водительностью колонны, с увеличением которой приходится
переходить от простых конструкций типа а к все более услож-
няющимся конструкциям типа д п е, показанным на фиг. 96.
Конструкция тарелки с поперечной перегородкой и сливным
полусегментом (фиг. 96, г), обеспечивающая равномерное рас-
пределение флегмы по тарелке, особенно удобна, когда прихо-
дится иметь дело с относительно небольшими расходами
жидкости и сравнительно большой паровой нагрузкой тарелки.
Если же количество флегмы на тарелке велико, то благодаря
удлинению пути движения жидкости градиент уровня на тарелке
может чрезмерно возрасти и в этом случае рекомендуется
использовать более подходящую конструкцию тарелки, напри-
мер с встречным током жидкости, или тарелку каскадного типа
с дополнительной промежуточной перегородкой, или, наконец,
тарелку с радиальным движением флегмы на ней. Последние
типы тарелок применяются в больших колоннах с большим
расходом флегмы на тарелке. Основное их преимущество со-
Сливные трубы
.337
стоит в почти полном избавлении от незагруженных частей
рабочей поверхности тарелки, которые в других конструкциях
при увеличении диаметра колонны прогрессивно растут за счет
того, что жидкость в своем направленном движении на тарелке
обходит эти участки. Эти участки показаны двойной штрихов-
кой на фиг. 96 для различных типов тарелок.
Основное требование, предъявляемое к хорошо работающей
ректификационной тарелке, состоит в устойчивости ее режима
при различных нагрузках паров и флегмы, протекающих через
нее, в соответствии с запроектированными условиями работы
колонны.
§ 19. Сливные трубы
Сечение сливных труб должно выбираться с учетом воз-
можных колебаний режима колонны, сказывающихся главным
образом в увеличении орошения и, следовательно, количества
флегмы, протекающей в единицу времени через тарелку. Боль-
шую помощь здесь может оказать опыт работы действующих
однотипных установок позволяющий. судить, о степени удовле-
творительности выбранных размеров сливных труб. Когда
флегма на тарелке относится к категории жидкостей, склонных
к ценообразованию, чтобы избежать захлебывания сливных
труб, необходимо увеличить их сечение.
В больших ректификационных колоннах, в которых флегма
перетекает вниз с центральной части тарелки, сливные пе-
ретоки иногда конструируются в виде двух параллельных
пластин, протянутых посередине колонны вдоль ее диаметра.
Для облегчения поддержания гидравлического затвора на
тарелке нижние концы сливных труб иногда несколько сужи-
ваются. Сечение сливных труб определяют, задаваясь скоростью
течения флегмы в них 0,05—0,10 м]сек. При этом рекомен-
дуется брать сечение сливных труб с некоторым запасом, так
как это почти не отражается на стоимости тарелки, зато га-
рантирует от опасности захлебывания колонны, когда вся она
заполняется жидкостью, вследствие того, что сливные трубы
не в состоянии справиться с возросшей нагрузкой.
Помимо сливных труб на каждой тарелке необходимо иметь
небольшие отверстия, через которые в периоды остановки ко-
лонны на ремонт полностью дренируется содержащаяся на
тарелке жидкость. Размер этих отверстий должен быть таким,
чтобы они легко не забивались и не загрязнялись, но тем не
менее и не мешали нормальной работе тарелки дренированием
слишком большого количества флегмы в период функциониро-
вания колонны.
В ректификационной колонне должен быть обеспечен доступ
извне к каждой из ее тарелок для осмотра и ремонта. С этой
целью колонна по всей высоте снабжается входными лазами.
22 Зак. № 304.
Если число лазов меньше числа тарелок, то конструкция по-
следних должна обязательно предусматривать наличие у та-
релки съемных деталей, позволяющих путем их удаления до-
браться до любой другой выше или ниже расположенной
тарелки. Число лазов в колонне должно выбираться в каждом
конкретном случае на основе объективного анализа условий ра-
боты проектируемой колонны, определяющих необходимую
частоту осмотра и ремонта тарелок. В самом деле, если, исходя
из свойств веществ, разделяемых в колонне, можно опасаться
закоксования тарелок, коррозии их или загрязнения вследствие
склонности перегоняемых продуктов к полимеризации, то в этих
случаях желательно либо каждую тарелку снабдить своим лазом,
либо, если на тарелках предусмотрены упомянутые выше съем-
ные детали, на каждые 4—5 тарелок установить один входной
лаз. Если же эти вызывающие опасение моменты в работе
колонны исключены и опыт работы действующих однотипных
колонн указывает на сравнительную редкость ремонта тарелок,
работающих в проектируемых условиях, то число лазов ко-
лонны может и должно быть сокращено до минимума вслед-
ствие, во-первых, достигаемого при этом снижения стоимости
колонны, а, во-вторых, еще и потому, .что лазы требуют тща-
тельного ухода и наблюдения для предотвращения возможных
пропусков паров, представляющих пожарную опасность. Мини-
мальное число лазов для колонны определяется необходи-
мостью иметь во всяком случае по одному лазу на верху, по
середине и в низу колонны.
§ 20. Оборудование корпуса колонны патрубками
Ректификационная колонна оборудована большим числом
различных патрубков, для каждого из которых необходимо
установить место расположения и размер. Подвод сырья в ко-
лонну, отвод нижнего, а иногда и боковых продуктов колонны,
подача орошения на верх колонны и отвод паров дестиллата
и орошения в конденсатор, ввод паров из кипятильника и вся-
кого рода соединения со вспомогательной аппаратурой и конт-
рольно-измерительными приборами осуществляются при помощи
специальных патрубков, установленных на корпусе колонны.
Расположение и число патрубков, предназначенных для
выполнения определенной функции, устанавливаются в каждом
конкретном случае особенностями проектируемого разделения.
Так, например, иногда рекомендуется ввод сырья в колонну
предусматривать не только в сечение, найденное по расчету
колонны, но и по крайней мере в два другие сечения, распо-
ложенные одно выше, а другое ниже расчетного уровня. При-
чина этого кроется в известных колебаниях состава сырья и
отклонениях действительного режима колонны от режима, по-
Оборудование корпуса колонны патрубками
339
ложенного в основу расчета, отклонениях, объясняющихся
рядом допущений, которые пока еще неизбежны при проекти-
ровании колонны. Отклонения эти невелики, но для обеспе-
чения гибкости в работе колонны их следует иметь в виду,
чтобы обеспечить нормальный режим ее работы. Одним из
средств учета этих отклонений является возможность ввода
сырья на различные уровни по высоте колонны. Из практики
работы нефтезаводских установок известно, что между отдель-
ными уровнями ввода по высоте колонны могут содержаться
3—4 тарелки, а число предусмотренных возможных уровней
ввода для больших колонн с числом тарелок сто и больше
может доходить до пяти. Основное требование, которое предъ-
является к размеру сечений всех подводящих и отводящих
патрубков колонны, это обеспечение минимальной потери на-
пора при движении продуктов. Поэтому при выборе сечения
сырьевых патрубков следует руководствоваться опытом работы
действующих установок и выбирать такие размеры, которые
не вызывают чрезмерного сопротивления.
При выборе размера верхнего шлемовото патрубка и па-
трубка ввода орошения следует иметь в виду, что одним из
основных средств регулирования работы колонны является
изменение орошения, и поэтому ориентироваться не на рас-
четную величину орошения, а на приблизительно полуторное
его количество. При этом важно учесть, что размер шлемо-
вого патрубка вовсе не обязательно должен определять диа-
метр шлемовой трубы, который может быть значительно
меньше, так как шлемовый патрубок иногда используется и
как верхний лаз при ремонте колонны.
Основное требование, предъявляемое при подборе диаметра
шлемовых труб, состоит в необходимости избегать чрезмерных
потерь напора при движении паров из колонны в конденсатор.
Практика работь действующих колонн установила определен-
ные пределы оптимальных скоростей движения паров в шле-
мовых трубах. Так, для колонн, работающих под атмосферным
давлением, рекомендуется принимать скорость паров порядка
15—20 м/сек. Для вакуумных мазутоперегонных колонн, рабо-
тающих под остаточным давлением в 100—50 мм рт. ст., ско-
рость движения паров в шлемовой трубе уже может быть принята
значительно большей—порядка 30—50 м/сек. Для вакуумных
колонн, работающих под остаточным давлением меньше 50 мм
рт. ст., практика допускает скорости порядка 50—60 м/сек.
Патрубки, отводящие боковые продукты колонны, должны
устанавливаться в самой нижней части сливных приспособлений,
чтобы всегда быть покрытыми жидкостью.
Отводной патрубок для нижнего продукта колонны может
устанавливаться и на дне колонны и сбоку ее, несколько выше
места приварки днища.
22*
Колонна должна снабжаться снаружи лестницами и пло-
щадками с перилами для легкого доступа к линиям подвода
и отвода сырья, орошения и продуктов колонны, а также для
открывания лазов и удобного и безопасного производства
ремонта.
§ 21. Гидравлический расчет тарелки
Одним из существенных факторов, обеспечивающих устой-
чивую работу ректификационной тарелки и ее высокую эффек-
тивность, является правильно запроектированный гидравли-
Фиг. 97. Схема действия типичного колпачка.
ческий режим ее работы. При движении флегмы по тарелке
и паров через колпачки и жидкость имеются потери напора,
обусловливаемые сопротивлением внешнего и внутреннего тре-
ния текучих сред, а также местными сопротивлениями, которые
вызываются неизбежными изменениями направления движения,
расширением и сжатием или вообще изменением формы струи
при прохождении через патрубки и прорези колпачков, при
выходе из затопленного отверстия сливных труб, при ударах,
испытываемых текучей средой, и т. д. Таким образом потери
напора жидкости и паров при движении через тарелку опреде-
ляются в значительной степени конструкцией тарелки и ско-
ростями движения потоков. Суммарное сопротивление проходу
паров складывается из сопротивления, оказываемого сухой
тарелкой, и сопротивлений, преодолеваемых при барботаже
через жидкость. Для выяснения роли, значения и размеров
последних целесообразно рассмотреть схему действия типич-
ного колпачка, показанную на фиг. 97. Высота Асл сливной
перегородки выбирается проектировщиком, конструирующим
тарелку, или же, когда ведется расчет стандартной тарелки,
бывает задана. Обычно сливная перегородка располагается по
Гидравлический расчет тарелки
341
середине между верхним обрезом прорези колпачка и краем
парового патрубка. Высота уровня жидкости над сливной пере-
городкой йг или, как иначе ее называют, высота подпора слива
зависит от количества перетекающей жидкости, длины сливной
перегородки и ее конструкции. Прорези колпачка обычно
открыты не на свою полную высоту I, а только на некоторую
часть ее 1г. При отсутствии барботажа и движения флегмы на
тарелке статическое погружение прорезей колпачка /2 опреде-
ляется как разность между уровнем сливной перегородки и
верхним обрезом прорезей и для всех колпачков является одной
и той же. В действующей тарелке, на которой имеются дви-
жение флегмы и барботаж паров, погружение прорезей кол-
пачка Ла определяется как разность уровней между верхним
обрезом прорези и поверхностью жидкости, обтекающей рас-
сматриваемый колпачок. Величина йа не одна и та же для всех
колпачков тарелки и изменяется по пути движения жидкости,
уменьшаясь от максимальной у входа флегмы на тарелку
до минимальной у сливной перегородки. Разность уровней
жидкости на входе и выходе с тарелки zl. необходимая для
преодоления потери напора при ее движении по тарелке,
зависит от конструкции тарелки, свойств разделяемых веществ
и скоростей движения паров и флегмы по тарелке. Нижний
край колпачка возвышается над поверхностью тарелки на
высоту 8.
В промышленных колонных аппаратах применяются раз-
личные конструкции колпачков, но главным образом круглые
колоколообразные диаметром 100—180 мм и прямоугольные
шириной 75—150 мм и длиной 300 мм и больше. Прямоуголь-
ных колпачков для одного и того же сечения прорезей и стака-
нов требуется меньше, чем круглых, и поэтому монтаж их
несколько проще и легче эксплуатация, особенно в тех случаях,
когда требуется частая чистка. С другой стороны, опыт эксплуа-
тации колпачковых колонн приводит к заключению, что круг-
лые колпачки позволяют достигнуть более четкого разделения
и допускают больше гибкости при изменении конструкции
тарелки.
Для удобства расчетов принято выражать потери напора
при движении жидкостей и паров через тарелку в долях от
динамического или скоростного напора, представленного в мет-
рах столба жидкости:
h = l-^M, (VII. 79)
где £ —безразмерный коэффициент сопротивления.
Использование коэффициентов сопротивления £ позволяет
перенести трудность теоретического анализа характера влияния
различных факторов на опытное определение соответствующих
ГТ/-< хп/тнип
коэффициентов £. Для газов и паров принято измерять потерю
напора не в метрах, а в единицах давления, обычно в кг/.и2,
но в рассматриваемом случае'целесообразно все потери выра-
жать в метрах столба жидкости, так как это позволяет сразу
найти основную искомую величину высоты уровня поднятия
флегмы в сливной трубе.
Фиг. 98. Двухтарелочная секция колонны.
На фиг. 98 представлена двухтарелочная секция ректифи-
кационной колонны. Пары поднимаются с нижней тарелки на
верхнюю, и это является показателем отрицательного градиента
давления в колонне, направленного снизу вверх. Давление р2
в нижнем межтарелочном отделении больше давления рг в верх-
нем. С другой стороны, для возможности перетока жидкости
с верхней тарелки на нижнюю необходимо иметь такое превы-
шение высоты флегмы в сливной трубе над уровнем жидкости
на нижней тарелке, которое компенсировало бы разность дав-
лений (р2 — р,) и было бы достаточным для создания потока
флегмы на нижней контактной ступени. Таким образом, высота
подъема флегмы в сливной трубе или сливном сегменте тарелки,
уравновешивающая различные потери напора при движении
флегмы и паров, должна определиться как сумма всех высот
столба жидкости, отвечающих этим потерям.
В свете изложенного нетрудно написать общее выражение,
определяющее высоту поднятия жидкости Нг в сливной трубе:
Hi = (Ръ — Pi) + Лел + + л + Л6 = (р2 — pj 4- Ло + А + Л6. (VII. 80)
Гидравлический расчет тарелки
.343
Каждый из членов правой части уравнения (VII. 80) необхо-
димо разобрать в отдельности.
Высота сливной перегородки Асл, как указывалось выше,
является конструктивным фактором и обычно для принятого
типа тарелки бывает известна. Другое дело высота флегмы
над сливной перегородкой или так называемый подпор слива
величина которого зависит от периметра слива и количества
перетекающей жидкости. При этом, очевидно, с увеличением
периметра слива или, иначе говоря, длины сливной перегородки
подпор слива должен уменьшаться, а с увеличением расхода
флегмы через слив, наоборот, возрастать. Обычно в целях
обеспечения равных условий работы и небольшого градиента
уровня флегмы на тарелке не рекомендуется чрезмерно уве-
личивать подпор слива hlt оптимальные значения которого по
опытным данным должны заключаться в пределах, обеспечи-
вающих получение гидрозатвора /?2 (фиг. 97) над прорезями
колпачков в 15—40 мм высотой без учета пены. Вообще ра-
бота с небольшими значениями подпора слива предпочти-
тельнее, так как способствует предотвращению больших коле-
баний уровня флегмы на тарелке при изменении количеств
орошения и обеспечивает умеренное заполнение высоты слив-
ных труб жидкостью, образующей гидравлический затвор.
Для определения величины подпора слива рекомендуется
пользоваться обычной формулой водослива, по которой опреде-
ляется пропускная способность патрубков с незаполненным
-сечением:
9
V = -у ubf^w м2/сек, (VII. 81)
где w = |/2g/i1 — скорость жидкости в м/сек; и— коэффициент
расхода. Подстановка значений надлежащих величин в это
уравнение приводит его к виду
V = 6,645МД-5 (VII. 82)
или к виду, решенному относительно подпора слива:
|3 /" V \3 3/~ ~/ V \2
Л1 = V (w) См или = / (-66456-) М’ (VIL83)
где V — объем перетекающей по тарелке жидкости в м3/час;
Ь — периметр слива в м; Ах—подпор слива в см или м.
Расчет по формуле (VII. 83) значительно облегчается при
помощи специальной таблицы, помещенной в ряде источников
[12]. Однако следует иметь в виду, что коэффициент пропор-
циональности в этих таблицах принят равным 6,4, а не 6,645
как в уравнении (VII. 83). Очевидно данная формула может быть
использована не только для расчета величины подпора слива hr
по заданному расходу флегмы и периметру переточных труб,
344 Полная прктигЪнкационная колонна
но и для расчета длины слива b по назначенному подпору ht..
Чаще всего именно так и поступают, задаваясь оптимальным
значением йх и определяя необходимый периметр сливных труб-
или сливного сегмента.
Уравнение (VII. 83) приложимо к круглым сливным трубам
только в том случае, когда их диаметр больше учетверенного
подпора слива hy. Если же диаметр сливной трубы меньше учет-
веренного, но больше удвоенного подпора, то следует вести
расчет по формуле
V = 182,6 7)1.675^°,825 (VII. 84)
Для диаметров, меньших двойного подпора, рекомендуется
формула
V = 644£>2йх0’5. (VII. 85).
В формулах (VII. 84) и (VII. 85) диаметр принимается в ме-
трах. Используемая при расчете подпора слива формула (VII. 83)*
истечения через слив предполагает постоянство коэффициента
расхода и включает в расчет полную длину сливной перего-
родки. Эти допущения не вполне справедливы, так как стенки
колонны сжимают поток флегмы при его подходе к сливу, а
также еще и потому, что при подходе к перегородке скорость
течения флегмы заметно изменяется, что не учитывается при-
веденными выше формулами. Эффективная длина перегородки
практически меньше действительного периметра сливной пере-
городки, причем1 основными факторами, влияющими на вели-
чину этого уменьшения, являются диаметр колонны и подпор
слива hx. Для перехода от действительной длины периметра
слива b к эффективной длине Ьг или наоборот следует вводить
поправочный множитель, снимаемый с графика, приведенного
на фиг. 99.
Расчет при помощи этого графика ведется следующим обра-
зом. Вначале, считая поправочный множитель К== 1, по фор-
муле (VII. 83) рассчитывается приблизительное значение подпора
слива йг и по кривой / определяется максимальное расстояние
сливного сегмента от стенки колонны и. Если из этого расстоя-
ния вычесть подпор йх, то можно установить эффективное рас-
стояние слива от стенки колонны иг. Из отношения действитель-
ной длины перегородки b к ее эффективной длине йь по кри-
вой II может быть определен поправочный множитель К,
подстановка которого в уравнение (VII 83) позволяет рассчи-
тать новое значение подпора йх. В случае большого расхож-
дения между начальным и полученным значениями подпора йь
требуется пересчет до полного совпадения.
Итак, величина подпора йх в уравнении (VII.80) может быть
рассчитана по приведенным выше соотношениям. Перейдем
к рассмотрению методов нахождения градиента уровня жидкости
на тарелке А, величина которого зависит от типа и располо-
Гидравлический расчет тарелки
34S
жения колпачков на тарелке, скорости и длины пути флегмы,
свойств разделяемых веществ. Этот вопрос рассматривался мно-
гими авторами [11], но полученные решения проблемы явля-
ются лишь приближенными и иногда весьма громоздкими.
Фиг. 99. Определение эффективной длины сливной
перегородки.
Так, для тарелок с круглыми колпачками’ рекомендуются следующие
формулы:
при расположении колпачков по вершинам равностороннего треуголь-
ника
]/Д [3 (“2 — + 1 + о,250* ] +
3
+ зфо + .(д-1)]} = (VIL86)
L J j 1 ,т/ J Lд! 1 , i i
при расположении колпачков по вершинам квадрата
утр + ЗГ [Лв+ s («-1)]) = - (VII. 87)
По ь'очпиил
Здесь г — число рядов колиачков в направлении потока флегмы; —
сумма расстояний между колпачками в направлении, перпендикулярном ходу
жидкости, средняя для всех рядов, в м\ /2 — то же между стаканами колпач-
ков в м; b — расстояние между соседними колпачками одного ряда в м;
w — минимальное расстояние между колпачками соседних рядов в ж; V —
количество протекающей по тарелке жидкости в м3/сек', а = l,Jlt и f$ = b/w.
Остальные обозначения были даны ранее.
В уравнениях (VII. 86) и (VII. 87), кроме искомой величины 3, для дан-
ной тарелки неизвестен лишь коэффициент Са, значение которого может
быть определено путем корреляции опытных данных ио действующим тарел-
кам. Такая корреляция была проведена, и коэффициент Са в зависимости от
V!1Л и ц/у (где и — скорость паров в свободном сечении колонны в м/сек,
а у — их удельный вес в кг/м3) может быть определен из обобщенных опыт-
ных данных по графику 100, а.
Кривые на графике фиг. 100, а получены из опытных данных для значе-
ния и = |/уп =0,425 кг2 /сек м2 . Для перехода к значениям коэффициента
Са при других значениях и |Zyn следует воспользоваться графиком фиг. 100, б,
дающим значение соответствующего поправочного множителя. Эти данные
получены при шахматном расположении колпачков.
Следует все время иметь в виду, что формулы (VII. 86) и (VII. 87)
выведены и могут применяться лишь для круглых колиачков.
Расчет по этим формулам громоздок и ввиду ряда допу-
щений, принятых при их выводе, является в конечном счете
приближенным. Одни авторы, например, считают, что пары бар-
ботируют только через- массу жидкости, располагающуюся
выше нижнего обреза прорезей колпачка, и поэтому не вводят
в рассмотрение жидкость, находящуюся ниже прорезей кол-
пачка. Другие в целях упрощения получающихся соотношений
предлагают приближенно считать, что пары проходят через всю
массу жидкости на тарелке. Так, если стать на последнюю
точку зрения, то можно приближенно рассчитать градиент
уровня жидкости А по обычной формуле
Л=Я-^-J л/, (VII.88)
ЭКВ 6
подобрав надлежащее значение коэффициента трения Я и опре-
делив эквивалентный диаметр Д,кв как отношение среднего попе-
речного сечения жидкого потока к среднему смоченному
периметру. В этом уравнении Л—длина пути флегмы по
тарелке. Формула (VII. 88) в изложенной интерпретации явля-
ется, конечно, приближенной, но для всех не круглых колпач-
ков расчет приходится вести по ней.
Главная трудность заключается здесь в правильном опре-
делении величины коэффициента трения Я, значение которого
можно установить лишь обобщением опытных данных. Реко-
мендуемое значение Я = 0,005.
Потеря напора при движении флегмы через сливную трубу
определяется на основе того соображения, что при нормаль-
Гидравлический расчет тарелки
347
ных условиях сливная труба всегда на определенную высоту
заполнена флегмой и ее действие может быть вполне уподоб-
лено затопленной диафрагме. Применяя соответствующую фор-
средняя ширина потока сек м
Фиг. 100. К опреде-
лению превышения
уровня жидкости Л
на входе в тарелку.
а — колпачки без поддер-
живающих планок; b —
к ллпачки с поддержива-
ющими планками.
мулу с коэффициентом расхода, равным 0,5, можно рассчитать
потерю напора в сливной трубе по формуле
V = 0,22 ДАв0-5 или й6 = 20,65 w2, (VII. 89)
где h6 — потеря напора, выраженная в см перетекающей
жидкости; А — сечение сливной трубы в ж2; V— количество
перетекающей флегмы в мй1сек.\ w — скорость в м)сек.
PZQ ppis'rtffht fl q iffi 1()иил
Вернемся к уравнению (VII. 80). В правой его части остался;
не исследованным член (р2— рД представляющий собой ту
разность давлений, под влиянием которой паровой поток, пре-
одолевая различные сопротивления, переходит из нижнего меж-
тарелочного отделения в верхнее. Величина этой разности
давлений, очевидно, складывается из различных падений на-
пора, сопровождающих каждое преодоленное на пути движе-
ния паров сопротивление. Рассмотрение гидравлических сопро-
тивлений колпачковых тарелок паровому потоку показало, что
они складываются из сопротивления, оказываемого сухой та-
релкой, т. е. сопротивления, которое приходится преодолевать
парам при движении через собственно стаканы, колпачки и
прорези, и из сопротивления, оказываемого слоем Л2 жидкости
над прорезью колпачка. Максимальное значение высоты этого
слоя флегмы равно 1г-\-h^, (фиг. 97). Этой высотой измеряется
напор, затрачиваемый парами на преодоление статического
давления столба жидкости на тарелке. Потеря напора при дви-
жении парового потока через сухую тарелку, выраженная
в метрах столба жидкости, на основании уравнения (VII. 79)
определится из соотношения
«> (vll-90>
s ' 'Ж ' 'г
где w0 — скорость паров в прорезях колпачка в м/сек-, <р —
скоростной коэффициент, значение которого для рассматри-
ваемого случая рекомендуется принимать равным 0,5; значение
коэффициента сопротивления £ из опытных данных составляет-
в среднем 1,5. Подстановка этих значений в уравнение (VII. 90)
прёобразует его к виду
йз = 1,5 (V1L9I)
V,U А С7,О1 \ * Ж / ' ' Ж /
Напор, затрачиваемый на преодоление сил поверхностного
натяжения при прохождении паров через прорези колпачков:
Л4 = 2<г(^-4--) — (VII. 92)
где а — поверхностное натяжение жидкости на границе с па-
ром в кг/м.-, а — ширина прорези в м.
Таким образом, гидравлическое сопротивление, преодоле-
ваемое паровым потоком при переходе из одного отделения
колонны в соседнее, измеряется высотой столба перетекающей
жидкости, определяемой по соотношению (фиг. 97)
р2 — pi = Л2 + Z1 4- Л3 -f- ht + Лст, (VII. 93)
где Лет —статический напор столба паров высотой, равной
Нх—Лсл + (Л1 + Х1) м. Эта величина имеет значение лишь при
Гидравлический расчет тарелки
349
расчете колонн, работающих под большим давлением, и по-
этому в обычных случаях ввиду незначительности ею пренеб-
регают.
Определение высоты Нг (фиг. 98), на которую в сливной
трубе поднимается флегма, имеет существенное значение для
установления расстояния между соседними тарелками. При
недостаточной высоте сливной трубы уровень жидкости в ней
может чрезмерно подняться и вызвать затопление тарелки
флегмой и прекращение фракционирующей работы колонны.
Это явление носит название захлебывания и имеет своим след-
ствием обратное движение флегмы по колонне, сопровождаю-
щееся в ряде случаев уносом жидкости с верхними парами
колонны или, как говорят, перебросом. Причина переброса
состоит в том, что в захлебнувшейся колонне разность дав-
лений между тарелками в значительной степени стирается,
а давление в кипятильнике ее продолжает расти вследствие
имеющегося подогрева. В конечном счете это давление может
возрасти до такой величины, которая оказывается достаточной,
чтобы периодически выбрасывать жидкость через паровые ли-
нии на верху колонны.
Захлебывание, представляющее собой затопление флегмой
одной или ряда тарелок, прекращает переток жидкости и па-
ров и ведет к заполнению всей колонны жидкостью. Причины
захлебывания колонны могут быть самые различные, из них
главными являются следующие:
1) большая высота уровня флегмы на тарелке, вызывающая
чрезмерно большие потери напора при барботаже паров;
2) недостаточность сечения паровых патрубков и прорезей
колпачков;
3) малый диаметр колонны и малое расстояние между та-
релками;
4) малое сечение сливной трубы и малая ее высота, при-
водящие к образованию эмульсии флегмы и прорвавшегося че-
рез гидрозатвор пара.
Жидкость, поступающая в сливные трубы, содержит до-
вольно значительное количество растворенных и унесенных
с собой паров, особенно, когда жидкость склонна к ценообра-
зованию, и поэтому объем ее в сливных трубах характери-
зуется стремлением к расширению. В верхней части сливных труб,
которая иногда делается шире нижней и выделяется основная
часть растворенных во флегме паров. При этом уровень жид-
кости в сливной трубе должен быть расположен на такой вы-
соте, чтобы обеспечить вдоль стенок трубы достаточную по-
верхность для выделения растворенных во флегме паров. По
мере увеличения расхода флегмы и заполнения сливной трубы
эта поверхность уменьшается, условия для выделения раство-
ренных и унесенных с флегмой паров ухудшаются и в конечном
счете может наступить такой момент, начиная с которого пары
уже не могут высвобождаться из жидкости и вместе с ней
принудительно будут двигаться вниз по сливной трубе. По-
скольку плотность этой жидко-паровой смеси меньше плот-
ности чистой флегмы, для поддержания требуемого гидроза-
твора необходимо иметь большую высоту столба жидкости
в сливной трубе. Это приводит к еще большему заполнению
сливной трубы с последующим еще большим ухудшением
условий выделения растворенных паров из флегмы, имеющим
следствием приближение условий, способствующих захлебы-
ванию колонны. Поэтому колонна должна проектироваться
с учетом необходимого пространства для выделения паров из
жидкости, поступающей в сливную трубу. С этой целью обычно
увеличивают расстояние между тарелками, удлиняя сливную
трубу, или увеличивают диаметр тарелки. Однако последнее
мероприятие может привести к недопустимому снижению ско-
рости движения паров, при котором эффективность контакти-
рования сводится практически на нет, и поэтому, ликвидируя
условия, способствующие захлебыванию, можно упустить из
поля зрения не менее важный фактор — эффективность барбо-
тажа. Таким образом, основным средством предотвращения
захлебывания колонны является правильный выбор расстояния
между тарелками, основанный на расчетах падений напора при
движении флегмы и паров по тарелкам.
Как указывалось выше, различные потери напора при
движении флегмы и паров принято измерять соответствующими
высотами столба перетекающей жидкости. При этом не при-
нимается во внимание известное уменьшение удельного веса
флегмы вследствие присутствия в ней определенного количе-
ства растворенных и унесенных паров, так как затруднительно
установить плотность вспененной жидкости. Поэтому рассчи-
танный по чистой жидкости уровень ее поднятия в сливной
трубе несколько меньше действительной высоты подъема.
Рекомендуется расстояние между тарелками принимать по
крайней мере вдвое большим рассчитанного уровня поднятия
флегмы в сливной трубе. Обозначая расстояние между тарел-
ками через Н (фиг. 98) и высоту поднятия флегмы в сливной
трубе через Hlt можно установить связь между этими факто-
рами и гидродинамическими показателями работы тарелки:
Н>‘1Н1 - Лсл. (VII. 94)
Напор, затрачиваемый на преодоление статического давле-
ния столба жидкости на тарелке, при условии полного откры-
тия колпачка, 1г = 1, можно приблизительно представить ра-
венством
Л24" G = Лсл — s 4” ф- 0,5 4. (VII. 95)
Диаметр колонны и ее производительность 351
Уравнение (VII. 95) написано на основе того соображения,
что высота жидкости, преодолеваемая пузырьками пара при
выходе из прорезей колпачка, равна высоте сливной перего-
родки плюс подпор слива hr и половина превышения уровня
флегмы между ее входом и выходом с тарелки за вычетом
расстояния s от уровня тарелки до нижнего обреза колпачка.
Обычно s равно 10—20 мм.
Сочетание уравнений (VII. 93), (VII. 94) и (VII. 95) позволяет
выразить расстояние между тарелками колонны при помощи
рассчитанных выше потерь напора и конструктивных факторов
тарелки:
//>2 [йст4-1,5(flea + -4) + 2йх + Л3 + Л4 + Л5—s]. (VII. 96)
Величиной Лст статического напора парового столба обычно
пренебрегают ввиду его небольшой величины.
Как указывалось выше, при конструировании колпачков
исходят, как правило, из условия равенства площадей стака-
нов сечению кольцевого пространства между колпачком и стака-
ном и из приблизительного равенства этих площадей сечению_
прорезей колпачка. Эти условия могут быть записаны следую-
щим образом:
0,785JBH2 = 3,14dBHA = 0,785 (Z)2 —dH3p*)~nf, (VII. 97)
где п — число прорезей в колпачке, а / — сечение прорези.
Остальные обозначения см. фиг. 97.
§ 22. Диаметр колонны и ее производительность
Диаметр ректификационной колонны определяется скоростью
паров в ее свободном сечении и соответственно в значитель-
ной степени скоростью их барботажа через флегму на тарелке.
Как показывают многочисленные опытные данные, чем больше
скорость движения паров через флегму, тем при прочих
равных условиях эффективнее контактирование фаз на тарелке
и тем глубже протекает процесс массообмена между ними.
При пониженных скоростях движения паров уровень флегмы
на тарелке понижается вследствие увеличения его дренажа
через отводные отверстия, размеры пузырьков пара получаются
значительно большими, что приводит к снижению поверхности
их контакта с флегмой, и в конечном счете эффективность
тарелки падает. Однако при очень высоких скоростях паров
эффективность тарелки тоже падает вследствие уноса парами
частиц флегмы на вышележащую тарелку. Последний фактор
играет существенную роль при определении эффективности
ректификационной тарелки и является важнейшим определяю-
щим моментом при установлении оптимальной скорости дви-
жения паров в свободном сечении колонны. Величина уноса
зависит от скорости паров, их плотности и свойств жидкости,
через которую происходит барботаж. Оптимальная скорость
паров, при которой унос пренебрежимо мал и максимальна
эффективность тарелки, рассчитывается по полуэмпирическому
уравнению, связывающему упомянутые выше факторы, опре-
деляющие унос:
G' = 0,305с Ууп (Уж-Уп), (VII. 98)
где G' — массовая скорость парового потока в кг/час на I л<2
свободного сечения колонны; ух — плотность флегмы в кг{м3
Расстояние между тарелками м
Фиг. 101. Опытный график для определения
параметра с в уравнении (VII. 98).
1 — поверхностное натяжение 20 дн!см или выше;
2 — поверхностное натяжение 10 дн/см.
Продукт
при температуре колон-
ны; уп — плотность паров
в кг/м3 при давлении и
температуре колонны;
с — постоянная, завися-
щая от расстояния между
тарелками и поверхност-
ного натяжения флегмы.
Для определения па-
раметра с составлен опыт-
ный график, приведенный
па фиг. 101, представля-
ющий с в функции по-
верхностного натяжения
и расстояния между та-
релками. Для пользова-
ния графиком необходимо
принять значение поверх-
ностного натяжения флег-
мы по табл. 20, в которой
приведены цанные по
типичным жидкостям при
соответствующих темпе-
ратурах. Массовая ско-
рость паров часто достигает своего максимального значения
на верху колонны, и поэтому при определении параметра
Таблица 20
Поверхност-
ное натяже-
ние, дн!см
Газобензин ......................
Крекинг-бензин...................
Керосин .........................
Дизельное топливо ...............
Масла............................
9—10
13-17
20
23—25
>25
Диаметр колонны и ее производительны и> ЗьЗ
с следует брать поверхностное натяжение верхнего продукта
колонны в условиях, отвечающих верхней тарелке. Расстоя-
нием же между тарелками приходится вначале задаваться
в известной мере произвольно и затем проверять по мето-
дике, описанной в § 21.
Найдя из расчета процесса ректификации максимальную
паровую нагрузку колонны G кг[час и разделив ее на рас-
считанную по уравнению (\ II. 98) оптимальную массовую
скорость парового потока G’, можно определить сечение ко-
лонны и, следовательно, ее диаметр и линейную скорость
парового потока в свободном сечении колонны.
Полуэмпирическое уравнение (VII. 98), выведенное на основе
преобразования закона осаждения Стокса, определяет ту
скорость парового потока, при которой унос практически от-
сутствует. Однако унос является не единственным фактором,
понижающим эффективность тарелки, ибо уже при скоростях,
более низких, чем те, при которых унос становится заметным,
эффективность тарелки начинает понижаться за счет, напри-
-меда -прохода—шгреж нс чере-з —веере зи-- ктцашкое, -д-через
нижний их обрез с оттеснением флегмы и выходом в межта-
релочное пространство в виде сплошной струи. Поэтому часто
определение диаметра колонны или, что то же, выбор опти-
мальной скорости движения паров в свободном сечении
делается на основе практически оправдавшихся средних вели-
чин. Линейная скорость движения паров в колонне зависит от
ряда факторов — давления, температуры, свойств разделяемых
веществ, расстояния между тарелками, конструкции тарелок,
требуемой степени четкости ректификации и т. д. При этом,
чем меньше расстояние между тарелками и чем больше
удельный вес паров, тем меньше допустимая линейная скорость.
Поэтому в вакуумных колоннах ее значение колеблется в пре-
делах 1,5—3,5 м/сек, а в колоннах, работающих под атмо-
сферным давлением, линейная скорость движения паров колеб-
лется от 0,4 до 0,9 м/сек.
Сопоставляя опытные данные с результатами подсчетов по
уравнению (VII. 98), можно подобрать наиболее подходящую
величину допустимой линейной скорости парового потока
в свободном пространстве колонны.
Когда установлена оптимальная линейная скорость парового
потока в свободном пространстве колонны и таким образом
выбран ее диаметр, представляется возможным связать эти
факторы с производительностью колонны.
Пусть известна линейная скорость w м/сек паров на верху
колонны, где величина парового потока, как известно, чаще
всего приобретает наибольшее значение. Обозначая вес рек-
тификата через D кг/час, диаметр колонны через d метров и
флегмовое число <p=g^jDt можно выразить вес верхнего
23 Зак. № 304.
продукта колонны через линейную скорость паров w и диа-
метр колонны:
3600 х 273 х 3,14d2u»M
Л —__________________р-
4x23,1/77^+1).
ИЛИ
d2wM,.n
D = 33400 , , (VI1. 99)
р(<р+1)Т
где Мер — средний молекулярный вес верхних паров;
Т — их температура в абсолютных градусах;
р — абсолютное давление в колонне в ат.
Производительность ректификационной колонны прямо
пропорциональна квадрату ее диаметра и линейной скорости
движения паров в ее свободном сечении и обратно пропор-
циональна флегмовому числу.
Те довольно широкие пределы, внутри которых колеблется
определенная опытом допустимая линейная скорость парового
потока, позволяют подобрать такое ее значение, которое
удовлетворит условию, представляемому уравнением (VII. 99).
При известном диаметре колонны эта скорость определится из
соотношения
ш _ DpAcp^-)-L (VII ЮО)
11 33400d2Alcp • ’
При выбранной скорости w парового потока диаметр ко-
лонны найдется из уравнения
d = 0,00548 |/ (VII. 101)
§ 23. Коэффициент полезного действия тарелки
Изложенная в предыдущих разделах методика расчета
ректификационной колонны позволяет установить число теоре-
тических ступеней контакта, необходимых для рассматриваемого
разделения. Гипотеза теоретической тарелки, использованная
для создания определенности при переходе от составов фаз
в одном отделении колонны к составам фаз в смежном, вы-
ражает лишь идеализированную схему взаимодействия парового
и жидкого потоков на тарелке и хотя дает качественно пра-
вильную картину этого явления, тем не менее недостаточна
для его количественной оценки.
В самом деле, из самого понятия теоретической тарелки
непосредственно следует, что поднимающийся с нее паровой
поток находится в равновесии со стекающей с тарелки флег-
мой, а следовательно, и со всей жидкостью, покрывающей
определенным слоем тарелку. Это предполагает идеальное
перемешивание жидкости, обеспечивающее установление по
Коэффициент полезного действия тарелки 355
всей поверхности тарелки некоторого среднего состава, отве-
чающего условию равновесия с поднимающимся паровым
потоком, что возможно лишь при наличии градиента давления
на тарелке.
С другой стороны, самопроизвольный процесс установления
равновесия между контактирующими паровой и жидкой
фазами протекает во времени, а не мгновенно, и поэтому
в самом понятии теоретической тарелки содержится предпо-
ложение о том, что тарелка обеспечивает необходимое для
достижения равновесия время. Этим идеализированным пре-
дельным условиям не отвечает практическая тарелка, работаю-
щая в реальной производственной обстановке, так как,
во-первых, она характеризуется известным градиентом состава
жидкости по всей своей поверхности и флегма, с нее стекаю-
щая, не имеет того же состава, что и средний состав жидкости
на тарелке, а во-вторых, практическая тарелка не обеспечивает
ни достаточной тесноты, ни достаточной продолжительности
контакта фаз, необходимых для достижения равновесия между
ними Поэтому должен быть -указан- метод шуноляющий поре---
ходить от рассчитанного числа теоретических тарелок к числу
практических тарелок, устанавливаемых в проектируемой
колонне.
Эта задача сводится к установлению сравнительной эффек-
тивности или коэффициента полезного действия практической
тарелки, являющегося переходным фактором от теоретической
к практической ступени контакта.
Коэффициент полезного действия ректификационной та-
релки, измеряющий степень отклонения реальной тарелки от
теоретической, часто определяется по усредненному для всей
колонны значению как отношение числа теоретических таре-
лок, необходимых для назначенного разделения, к действи-
тельному числу тарелок, практически обеспечивающих полу-
чение продуктов заданной степени чистоты, »7ср=ЛгТеор/^пр.
Значения среднего к. п. д. практической тарелки колонны
могут быть получены из данных обследования действующих
колонных аппаратов путем сравнения этих данных с получен-
ным по расчету числом теоретических тарелок, необходимых
для данного разделения. При этом не только неточности,
допущенные при обследовании промышленных установок, но и
известные допущения, принимаемые иногда в том или ином
методе расчета числа теоретических тарелок, сказываются на
величине среднего к. п. д. тарелки.
Определенный таким образом средний коэффициент полез-
ного действия практической тарелки не выражает конкретных
условий работы каждой контактной ступени в отдельности,
эффективности которых в общем случае изменяются при пере-
ходе от одной тарелки к другой. В этом аспекте представляется
23*
более целесообразным связывать определение коэффициента
полезного действия тарелки с работой отдельно взятой кон
тактной ступени.
Для вывода понятия эффективности отдельно взятой прак-
тической контактной ступени достаточно рассмотреть реальные
условия работы какой-нибудь тарелки, например, отгонной
Фиг. 102. К опреде-
лению коэффициента
полезного действия
тарелки.
. Пусть состав жидкости,
колонны, представленной на фиг.
стекающей с г-й тарелки, равен Xi. Тогда при заданном рас-
ходе тепла В/R в кипятильнике колонны состав y(_i паров,
поднимающихся на эту тарелку, определится по известному
графическому построению как абсцисса точки Z»t пересечения
оперативной линии Sla1b1 с линией QwQa точек начала конден-
сации пара. Если бы /-я тарелка являлась идеальной ступенью
контакта, то состав vf поднимающегося с нее пара опреде-
лился бы из условия равновесия с жидкостью' состава х(- по
изотерме а±Ьа как абсцисса точки Ьа. Однако на реальной тарелке
вследствие недостаточной интенсивности контакта фаз и его
продолжительности, а также явлений уноса соприкасающиеся
фазы не достигают равновесия и пар, поднимающийся с та-
релки, будет иметь состав у,, промежуточный между составом
у,... 1, который он имел перед поступлением на тарелку, и
Коэффициент полезного действия тарелки
составом у,*, которого он мог бы достичь лишь в том случае,
если бы l-я тарелка была идеальной. Итак, действительный
состав у, пара для практической тарелки заключен в интервале
у,-! < Vt < yf. Фигуративные точки фаз, уходящих с одной и
гой же тарелки, соединены уже не изотермой a±ba, а прямой
а^, связывающей в данном случае неравновесные фазы.
Ясно, что чем ближе состав у, к составу у,*, тем ближе
работа реальной контактной ступени к теоретической тарелке, тем
больше ее эффективность или коэффициент полезного действия.
Аналогичный вывод можно сделать и о составах x,_li и х,
жидких потоков, поступающих на рассматриваемую тарелку и
стекающих с нее. Легко заметить из построения, приведен-
ного на фиг. 102, что состав х,- +1 жидкости, стекающей
с вышележащей практической тарелки, ближе к составу х>,
чем состав хг _j_ г*, отвечающий условиям работы теоретической
ступени контакта. Таким образом, действительный состав х,д1
флегмы, поступающей на рассматриваемую тарелку, заключен
в интервале х, <x,+i <Xi+i*, и чем он ближе к составу x,+i*>
тем эффективнее работа практической тарелки, тем большая
степень обогащения жидкой фазы достигается на ней.
Из предыдущего следует, что отклонение практической
тарелки от нормы работы теоретической ступени контакта
имеет следствием сужение разрыва между составами фаз на
смежных тарелках, приводящее неизбежно к увеличению числа
практических тарелок против теоретически необходимого для
данного разделения. Зто сужение разрыва между составами
одноименных жидких или паровых фаз может быть использо-
вано для оценки степени отклонения практической тарелки от
теоретической, иначе говоря, для установления ее эффектив-
ности. Обычно используется отклонение в составах паровых фаз,
хотя в равной мере могло быть привлечено для оценки разде-
лительной способности практической тарелки и отклонение соста-
вов жидких фаз, стекающих в смежных отделениях колонны.
Коэффициент полезного действия реальной тарелки опре-
деляется как отношение разрыва между составами паровых
фаз, поднимающихся со смежных тарелок колонны, к тому
разрыву, который имел бы место, если бы рассматриваемая
z-я тарелка была идеальной:
(У,)сР (У i — 1)ср
/L- =---------------------—
'(Vi )ср (У[ — 1) ср
(V1L 102)
Равным образом коэффициент полезного действия тарелки
колонны может быть определен и по составам жидких пото-
ков, поступающих на эту тарелку и стекающих с нее:
(Xi_|_i)cp “(Xj)cp
(X, )...,
(VII. 103)
Соотношение (VII. 103) обычно не применяется. Следует
обратить внимание, что в определяющих коэффициент полез-
ного действия тарелки уравнениях (VII. 102) и (VII. 103) составы
фаз являются для рассматриваемой тарелки усредненными
величинами, полученными в предположении, что в результате
хорошего перемешивания состав жидкой фазы один и тот же
по всей тарелке, как и состав паровой фазы для всего объема
парового потока.
В этом смысле уравнения (VII. 102) и (VII. 103) определяют
общую эффективность всей тарелки в целом. Однако их можно
приложить и к определению эффективности и какого-нибудь
участка тарелки, тем самым освобождаясь от необходимости
пренебрегать градиентом состава по тарелке и в массе паров.
В этом случае коэффициент полезного действия тарелки назы-
вается местным и определяется по соотношению
= /Ст"1 (VII. 104)
Здесь составы относятся уже не ко всей тарелке в целом,
а к определенному локализованному участку на ней, размер
которого теоретически может быть уменьшен как угодно.
В этом случае составы — i и У;—составы паров, поступающих
в данный участок тарелкн и уходящих с него.
Общий коэффициент полезного действия практической та-
релки гц представляет усредненное значение всех ее местных
эффективностей r]i„, характеризующих степень приближения
явлений массообмена в каждой точке тарелки к предельному
состоянию равновесия.
Коэффициент полезного действия тарелки зависит от ее
конструкции, размеров, от составов жидких и паровых пото-
ков, поступающих в данную ступень контакта, от свойств раз-
деляемых веществ и от количеств флегмы’и паров, контакти-
рующих на тарелке.
Увеличение расхода фаз через тарелку уменьшает время
контакта между флегмой и парами, сопровождается увеличе-
нием размеров струек и пузырьков, барботирующих через
слой жидкости на тарелке, и соответственным уменьшением
поверхности контакта фаз. В результате разделительная спо-
собность тарелки ухудшается и ее коэффициент полезного
действия падает. Уместно напомнить, что при рассмотрении
работы теоретической тарелки было установлено увеличение
обогатительного эффекта контактной ступени с увеличением
веса флегмы или паров, поступающих на нее. Эта точка зре-
ния не сохраняет целиком всего своего значения при рассмот-
рении работы практической тарелки. При прочих равных
условиях здесь увеличение веса потоков не всегда сопровож-
дается ожидаемым эффектом увеличенного обогащения фаз,
Коэффициент полезного действия тарелки
так как влияние понизившегося коэффициента полезного дей-
ствия тарелки может 'в некоторых случаях даже превысить
воздействие на необходимое число контактов со стороны уве-
личенного расхода тепла и условия разделения в колонне не
улучшатся, а наоборот, станут хуже.
Для правильного проектирования ректификационных колонн
при установлении коэффициентов полезного действия практи-
ческих тарелок необходимо принимать во внимание также
гидравлические условия работы колонны в целом и тарелок
•ее в отдельности.
В самом деле, характер движения жидкости на тарелке и
ее направление оказывают значительное влияние на коэффи-
циент полезного действия ту и только местный коэффициент
не зависит по смыслу определения от указанных факторов.
По мере движения по тарелке жидкость непрерывно меняет
свой состав, обедняясь легким компонентом вдоль всего пути
от входного до сливного сегмента, а пар, поступающий на
тарелку, в зависимости от плохого или хорошего перемеши-
вания в межтарелочном отделении поступает на тарелку либо
•одного и того же состава, либо в раз шчных участках тарелки
имеет разные составы. В обоих случаях эффективность та-
релки щ заметно варьирует, и уже давно установлено, что
этот коэффициент может иногда быть больше единицы, если
вести расчет на основе среднего состава паров и состава
жидкости, покидающей тарелку.
Таким образом, эффективность контактной ступени зависит
от ряда факторов, влияние которых на работу тарелки под-
дается установлению в основном лишь экспериментальным
путем. Однако обобщение этих опытных данных, полученных
в заводской или лабораторной обстановке, их корреляция и
обработка должны производиться на основе надлежаще обо-
снованных теоретических соотношений. Сложност^1 рассматри-
ваемой проблемы, необходимость большого количества опыт-
ных данных и трудности экспериментального характера были
причиной недостаточной разработанности методов определения
эффективности практической тарелки, являющихся пока лишь
первым приближением к решению этой трудной задачи.
Многочисленные попытки согласования данных расчета числа
теоретических тарелок с числом практических тарелок, фак-
тически необходимых для запроектированного разделения,
привели к введению ряда поправочных множителей, предста-
вляющих собой введенный ранее общий коэффициент полезного
действия тарелки. Эти переходные множители зависят от мно-
гообразных свойств разделяемых систем, типа и конструкции
погоноразделительных устройств, изменяющихся в каждом
конкретном случае, и поэтому для их нахождения при всех
условиях работы колонн и для большинства по крайней мере
Полная ректификационная колонна.
промышленных систем необходимо пользоваться коррелирован-
ными опытными данными.
Предложенные корреляции физических свойств разделяемых
систем и среднего коэффициента полезного действия тарелки
в основе своей являются эмпирическими обобщениями опытных
данных. Однако при выборе основных переменных, по которым
выводится корреляционная формула или строится график, не-
обходимо привлекать и известные теоретические соображения.
0,1 0,12 3,16 0,2 0,3 Оф 0,5 0,6 0,8 1,0 1,21ф 1,61,8 2.0 2,5 3,0 0,0 5,0 6.0 7,08,0 10,0
Отнасл'пелоная летучесть разделяемых компонентов к на вязкости сырья при сред-
них условиях в колонне (т рф
Фиг. 103. Опытный график для приближенного определения среднего коэф-
фициента полезного действия тарелок колонны.
Так, многочисленными исследованиями было показано, что
массопередача в системе соприкасающихся фаз является функ-
цией вязкости диффундирующих веществ. С другой стороны,
и коэффициент относительной летучести рассматриваемого ком-
понента приблизительно пропорционален наклону равновесной
кривой, влияет определяющим образом на характер массо-
передачи между фазами и на коэффициент полезного действия
тарелки.
Таким образом, было показано, что наиболее важными пере-
менными, определяющими диффузию между парами и флегмой,
являются вязкость жидкости и относительная летучесть компо-
нентов системы, причем другие свойства жидкостей и паров
и конструкция тарелки и колпачка оказывают сравнительно
небольшое воздействие на эффективность работы тарелки.
Попытки расчета эффективности тарелки на осноне чисто
теоретического анализа механизма образования и роста пузырь-
ков не дали положительных результатов вследствие большой
сложности рассматриваемого явления. Пришлось обратиться
к экспериментальному исследованию.
Коэффициент полезного действия тарелки ЗН1
Путем обработки опытных данных была построена зависи-
мость между коэффициентом полезного действия тарелки и про-
изведением вязкости к (сантипуазы) на коэффициент относи-
тельной летучести т, представленная на фиг. 103 в полулога-
рифмической сетке координат. Для полученной кривой не была
выведена формула, и она может рассматриваться лишь как
приближение, когда нет других более точных данных.
Определение коэффициентов полезного действия ректифи-
кационных тарелок в произвольных условиях возможно лишь
в том случае, когда известны основные принципы образования
и всплывания пузырьков пара в массе жидкости и механизм
межфазового обмена веществом.
ГЛАВА VIII
ПЕРИОДИЧЕСКАЯ РЕКТИФИКАЦИЯ
=§ 1. Характеристика процесса и способов его проведения
В процессе простой постепенйой перегонки непрерывно
выделяется паровая фаза, более богатая низкокипящим компо-
нентом, чем исходная смесь, и поэтому образующийся в кубе
жидкий остаток постепенно обогащается менее летучим компо-
нентом системы. Однако то обстоятельство, что получающиеся
при перегонке пары и остаток не имеют постоянного состава,
а непрерывно утяжеляются, позволяет отгонять лишь различ-
ные погоны, далекие по составу от практически чистых компо-
нентов системы. При теоретическом рассмотрении простой
перегонки было указано, что в этом процессе чистый низко-
кипящий компонент системы может получиться лишь с послед-
ним пузырьком конденсирующегося пара, а высококипящий —
лишь с последней каплей испаряющейся жидкости.
Совмещение процесса простой перегонки с ректификацией
выделяющихся паров позволяет обойти эти трудности и полу-
чить целевые продукты разделения в конечном количестве
и с практической чистотой, как угодно близкой к 100%. С этой
целью над перегонным кубом, в который загружается исходная
жидкая система, устанавливается укрепляющая колонна, спе-
циально предназначенная для ректификации отгоняемых паров,
поднимающихся из куба (фиг. 104). Пары с верхней тарелки
колонны отводятся в парциальный конденсатор, где образуется
поток орошения, стекающий обратно в колонну и создающий
условия для контакта фаз и барботажа на тарелках. В ходе
перегонки жидкости, загруженной в куб, ее состав и состав
паров, поступающих в колонну, непрерывно утяжеляются про-
грессивно выделяющимся низкокипящим компонентом. Тем
не менее вполне возможно в течение длительного перйода
перегонки получать с верха укрепляющей колонны дестиллат
постоянного состава, отвечающий практически чистому низко-
кипящему компоненту. Достигается этот важный результат
непрерывным изменением, в частности увеличением, коли-
чества тепла, отнимаемого в конденсаторе колонны, или, иначе
говоря, непрерывным увеличением количества орошения, пода-
Характеристика процесса и способов его проведения 363
ранее процессом непре-
Фиг. 104. Схема колонны периоди-
ческой ректификации.
ваемого на верхнюю тарелку колонны. Рассмотрим особен-
ности, характерные для процесса совмещения простой пере-
гонки с ректификацией отгоняемых паров.
Основной отличительной особенностью рассматриваемого
процесса сравнительно с изученным
рывной ректификации является
его периодичность. В самом
деле, исходная система в на-
чале операции загружается
в куб, а в конце процесса
остаточная жидкость отводится
из него, и для продолжения
работы куб должен быть еще
раз загружен новой порцией
исходного жидкого сырья. Эта
периодичность процесса накла-
дывает особый отпечаток на
характер работы укрепляющей
колонны, установленной над
кубом. То, что пары, идущие
из куба, непрерывно меняют
свой состав, постепенно в ходе
перегонки обедняясь низко-
кипящим компонентом, имеет
следствием непрерывное же
изменение составов и темпе-
ратур жидких и паровых фаз
на тарелках колонны. Эта осо-
бенность периодического про-
цесса коренным образом отли-
чает его от процесса непре-
рывной ректификации, харак-
теризующегося неизменными
во времени составами и темпе-
ратурами фаз на каждой определенной тарелке колонны. Эта
же особенность периодической ректификации является основ-
ной причиной тех трудностей, которые приходится испытывать
при обосновании теории этого процесса и разработке метода
его расчета.
Действительно, неизменность во времени составов и тем-
ператур жидких и паровых потоков, пересекающих один и тот
же горизонтальный уровень непрерывно действующей ректи-
фикационной колонны, позволяет сделать важный вывод о по-
стоянстве разности весов и теплосодержаний встречных разно-
именных потоков на любом уровне по всей высоте колонны.
Этот вывод, имеющий существенное значение для последующего
построения теории непрерывной ректификации, недействителен
36 4 Прпподичвскпя пек пк/и.и и инк
при рассмотрении периодического процесса. Если рассмо-
треть какой-нибудь произвольный, выделенный объем перио-
дически действующей колонны, то количество . вещества
и количество тепла, поступающие в течение определенного
конечного промежутка времени в рассматриваемый объем, не
будут равны количествам вещества и энергии, покидающим
этот же объем в течение того же промежутка времени. Это
и явилось основной причиной того, что при наличии строго
разработанной теории непрерывной ректификации до настоя-
щего времени не предложено такой же теории для периоди-
ческого процесса. Однако при ближайшем рассмотрении этой
проблемы можно установить некоторые особенности ее, позво-
ляющие применить к анализу периодического процесса метод
исследования, использованный при изучении непрерывной рек-
тификации. Исходным соображением при этом является сле-
дующее.
В каждый данный момент времени мгновенное значение
разностей весов фаз, пересекающих один и тот же гори-
зонтальный уровень колонны, равно как и мгновенное значе-
ние разности теплосодержаний встречных на одном уровне
, потоков, сохраняет по всей высоте колонны одно и то же
значение.
Это соображение не исключает указанной выше перемен-
ности рассматриваемых количеств веществ и энергии во вре-
мени, но подчеркивает ту особенность изменяющейся картины
процесса, согласно которой, несмотря на указанную перемен-
ность, разности весов и теплосодержаний паровых и жидких
потоков в каждый данный момент могут приниматься одними
и теми же для всех межтарелочных отделений колонны.
В каждый, следующий момент эти разности будут иметь уже
другие абсолютные значения. Такова основная рабочая гипо-
теза, используемая при построении метода расчета процесса
периодической ректификации.
Необходимым условием для практического выполнения этой
гипотезы является достаточно небольшое содержание в ко-
лонне количеств флегмы и паров сравнительно с основной
массой жидкости, залитой для перегонки в куб.
Принятие указанной выше рабочей гипотезы позволяет
наметить схему расчета процесса, основанную на той бесспор-
ной идее, согласно которой при известных для каждого мо-
мента времени значениях веса подаваемого на верх колонны
орошения и состава паров, отходящих из конденсатора, можно
к анализу периодического процесса применить методы, разра-
ботанные для расчета непрерывного процесса ректификации.
Периодическая ректификация практически осуществляется
двумя различными методами — с отбором дестиллата постоян-
ного состава и с отбором дестиллата переменного состава.
Периодическая ректификация при постоянном составе 'h•стиллати 3(>5
Обычно второй метод применяется для продолжения процесса
с отбором дестиллата постоянного состава, протекавшего до
того момента, когда дальнейший отбор целевого продукта
с неизменным составом становится практически нецелесообраз-
ным вследствие необходимости отнимать чрезмерно большое
количество тепла в конденсаторе колонны или, что то же,
необходимости подавать слишком большое количество ороше-
ния на верх колонны. В этих случаях отбор дестиллата по-
стоянного состава на известном этапе процесса заменяется
работой на получение дестиллата с меняющимся составом при
закрепленном флегмовом числе. Оба способа периодической
ректификации должны рассматриваться раздельно, так как
подчиняются различным закономерностям и исследуются по-
разному.
§ 2 Периодическая ректификация при постоянном составе
дестиллата
В ходе постепенного выкипанияГ первоначальной загрузки
перегонного куба содержание низкокипящего компонента в па-
рах, поступающих в колонну, должно уменьшаться, а высоко-
кипящего, наоборот, увеличиваться. Для получения дестил-
лата постоянного состава здесь требуется непрерывное увели-
чение количества орошения, подаваемого на верх укрепляющей
колонны. Иными словами, съем тепла djD в конденсаторе
колонны должен непрерывно возрастать.
Рассмотрим действие парциального конденсатора укрепляю-
щей колонны. Пусть изотерма а0Ь0 на тепловой диаграмме
соединяет фигуративные точки равновесных паровой и жидкой
фаз, покидающих конденсатор (фиг. 105). Эти фазы образуются
за счет частичной конденсации паров Gi, поступающих в конден-
сатор с верхней тарелки колонны (фиг. 104). Пусть в какой-то
момент времени состав этих паров равен у, и их фигуративная
точка на тепловой диаграмме расположена в на линии тепло-
содержаний насыщенной паровой фазы. Для получения из этих
паров Gj, имеющих состав ylt желательных составов х0' флегмы
и yD дестиллатных паров их необходимо охладить путем отнятия
определенного количества тепла. Количество этого тепла будет
пропорционально отрезку если вести расчет на 1 кг по-
ступающего в конденсатор пара, или отрезку , если от-
нести к единице веса верхнего продукта. Как указывалось
выше, состав jy паров, поступающих в конденсатор, все время
уменьшается по содержанию низкокипящего компонента, и по-
этому в какой-то последующий момент процесса фигуративная
точка паров Gn постепенно передвигаясь по равновесной кривой
теплосодержания, перейдет из а± в о2 и далее в а3. Легко
заметить по тепловой диаграмме фиг. 105, как требование
получения дестиллата постоянного состава приводит к необхо-
димости прогрессивно увеличивать съем тепла в конденсаторе.
Так, при составе паров Glt равном у2, расход тепла на единицу
веса этих паров составляет величину, пропорциональную от-
Фиг. 105. Действие парциального кон-
денсатора при получении дестиллата
постоянного состава.
вательно, чем ниже содержание
в парах Gx, тем большая степень
резку а2Ь2, а при составе уг
расход тепла в конденсаторе
пропорционален еще боль-
шему отрезку а3Ь3. Анало-
гичный вывод можно сде-
лать из рассмотрения отрез-
ков и a0S/, пропор-
циональных расходу тепла
в двух последних случаях,
отнесенному к единице веса
дестиллатных паров, полу-
чающихся в каждом случае.
Из тепловой диаграммы
фиг. 105 можно сделать
еще один важный вывод,
характеризующий картину
процесса при работе на
дестиллат постоянного со-
става. По мере утяжеления
состава уг паров Gx фигу-
ративная точка смеси равно-
весных паров и жидкого
орошения gQ передвигается
по изотерме а0Ь0 из поло-
жения bi в положение Ь2>
затем Ь3 и т. д. по направле-
нию к фигуративной точке
Ьо жидкой фазы. Следо-
низкокипящего компонента
их ожижения необходима,
чтобы достичь желаемого состава yD остаточного пара. В самом
деле, относительный вес жидкого орошения, определяемый
по материальному балансу процесса однократной конденсации
паров Gx состава ух, представится соотношением
g0 _ Ур-Ух
<?i yD — хо'
(VIII. 1>
В уравнении (VIII. 1) при работе на дестиллат постоянного
состава единственной переменной величиной является состав у^
изменяющийся в сторону уменьшения. Следовательно, в ходе
процесса числитель уравнения (VIII. 1) все время растет, тогда;
Периодическая ректификация при постоянном составе дестиллата 3(i7~
как знаменатель сохраняет неизменное значение, и поэтому
относительный вес также непрерывно увеличивается.
К аналогичным заключениям можно прийти и из рассмотре-
ния основного уравнения материального и теплового балансов,,
написанного для отделения колонны, расположенного над
верхней тарелкой колонны, и решенного в отношении расхода
тепла в конденсаторе:
/7 У f~t '
(VIII. 2)
и yL — л0
В ходе процесса периодической ректификации с отбором
дестиллата постоянного состава в уравнении (VIII. 2) умень-
шается состав уг паров Gr и увеличивается их теплосодержа-
ние. Легко сообразить, что при этом будет расти относитель-
ный съем тепла d/D в парциальном конденсаторе колонны.
Наконец, из уравнения материального баланса того же
объема колонны, решенного в отношении веса паров Glt отне-
сенного к единице веса целевого продукта-.
легко заключить, что уменьшение состава уг должно сопрово-
ждаться увеличением относительного веса GJD.
Таким образом, по мере протекания процесса постепенно
увеличиваются количество подаваемого в колонну орошения и
расход тепла на его проведение и уменьшается отбор дестил-
лата.
Пусть рассматривается укрепляющая ректификационная ко-
лонна с некоторым конечным числом п теоретических тарелок,
расположенная над перегонным кубом и осуществляющая ректи-
фикацию отгоняемых в кубе паров. Уместно задаться вопросом,,
при каком условии определенному мгновенному съему тепла d/D
в конденсаторе колонны или, что то же, определенному мгно-
венному значению относительного веса орошения g0/D будет
отвечать при данном числе тарелок получени еверхнего про-
дукта заданного состава.
При рассмотрении теории непрерывной ректификации уже
установлено, что и тепло d/D и орошение ga/D должны быть
обязательно больше некоторого вполне определенного мини-
мума. Условие, отвечающее минимальным мгновенным значе-
ниям d/D или g0/D, состоит в том, чтобы пар, поднимающийся
из куба на п-ю тарелку, и жидкость, с нее стекающая, нахо-
дились в равновесии друг с другом. Эта идеальная картина про-
цесса теоретически отвечает наличию в колонне бесконечно
большого числа тарелок, но, как указывалось ранее, может
бып, практически достигнута с вполне конечным числом ступе-
ней контакта. Как следствие из этих рассуждений вытекает поло-
жение, что в реальной колонне мгновенный состав хп флегмы,
стекающей с п-й тарелки колонны в куб, должен быть больше
мгновенного состава хп.-..1 жидкости в самом кубе.
Как указывалось выше, в ходе процесса периодической рек-
тификации с отбором дестиллата постоянного состава непре-
рывно увеличивается съем тепла в парциальном конденсаторе
колонны. Если колонна снабжена достаточным числом тарелок,
то необходимым условием получения из конденсатора паров
определенного состава является практическое совпадение пре-
дельных’ концентраций, отвечающих каждому мгновенному зна-
чению тепла, отнимаемого в конденсаторе, с мгновенными соста-
вами равновесных паровой и жидкой фаз куба колонны. Теоре-
тически это совпадение невозможно, но практически может быть
достигнуто с большой степенью приближения при вполне конеч-
ном числе тарелок, обычно меньшем, чем число установленных
в периодической колонне.
При рассмотрении процесса непрерывной ректификации была
установлена методика расчета сопряженных значений величины
относительного съема тепла djD в парциальном конденсаторе
колонны и предельных составов, отвечающих получению ректи-
фиката заданного состава. Та же методика может быть распро-
странена и на анализ процесса периодической ректификации.
Однако здесь следует иметь в виду, что вследствие периодич-
ности процесса в ходе его являются переменными и значения
предельных составов (хп ж1, yn + i) и значения d/D, а во многих
случаях, рассмотренных в следующем параграфе, и составы
дестиллата. Поэтому основное уравнение, связывающее все эти
величины:
-f ~ = vD~Xn^~ 1 - + <) - <), (VIII. 4)
и > п т 1 — хп + 1
следует анализировать с учетом этих важных особенностей про-
цесса периодической ректификации.
Применение формулы (VIII. 4) к расчету процесса периодической ректи-
фикации лучше всего рассмотреть на конкретном примере разделения системы
нормальных углеводородов — гептана и эндекана. диаграмма теплосодержа-
ние— состав для которой представлена на фиг. 106. Равновесные данные для
этой системы под давлением 760 мм рт. ст. были рассчитаны ранее и при-
ведены в графах 2 и 3 табл. 21.
Разделив температурные пределы (98.6 -194.5') выкипания этих углево-
дородов на достаточно узкие интервалы, можно для граничных значений' этих
интервалов определить сопряженные значения предельных составов и отве-
чающих им минимальных сьемов тепла в коиденсагоре колонны для различ-
ных закрепленных составов дестиллата. Пусть, нанрпмс-р, состав паров, ухо-
дящих в рассматриваемый момент времени с верха парциального конденсатора,
равен У[) = 0,985. Определим, как должен изменяться расход тепла в конден-
саторе, чтобы э.тот состав yD сохранялся постоянным при изменяющемся
Периодическая ректификация при постоянном составе дестиллата 369
Фиг. 106. Изобарные кривые равновесия и тепловая
диаграмма системы гептан — эндекан.
составе кубового остатка. Расчет следует вести по уравнению (VIII. 4), зада
ваясь различными температурами кубовой жидкости в интервале 98,6—194,5°
и определяя при этом равновесные составы паров и кубового остатка. При
помощи тепловой диаграммы по этим составам определяются теплосодержа-
«ия единицы веса равновесных паров и жидкости, и путем подстановки всех
24 Зак. М 304.
Таблица 2Т
°C с с ?п4-1 Qn+i + с 1 + с и 1 .Q + 1 + с о- х 05 _’г =? 1 Q О мин
+ с И 1 Q * 1 1 + +с?
кка и)кг
194,5 0 0 109,5 175,8 0 0,985 66,3 оо
191,8 0,005 0,049 108,1 174,6 0,044 0,980 66,5 1481 26,4 1454,6
189,8 0,010 0,085 106,8 173,8 0,075 0,975 67,0 871,0 27,7 843,3
185,4 0,020 0,162 104,0 171,9 0,142 0,965 67,9 461,0 30,5 430,5-
177,8 0,040 0,287 97,9 168,5 0,247 0,945 70,6 270,2 36,6 233,6
172,8 0,060 0,365 94,0 166,4 0,305 0,925 72,6 220,0 40,5 179,5
165,0 0,080 0,479 89,2 162,0 0,399 0,905 72,8 165,2 45,3 119,9
159,7 0,100 0,558 86,2 159,1 0,458 0,885 72,9 141,0 48,3 92,7
149,3 0,150 0,687 80,5 154,6 0,537 0,835 74,1 115,3 54,0 61,3
141,0 0,200 0,768 75,6 151,6 0,568 0,785 76,0 105,2 58,9 46,1
129,4 0,300 0,869 68,7 145,4 0,569 0,685 76,7 92,4 65,8 26,6
121,3 0,400 0,920 64,0 142,0 0,520 0,585 78,0 87,8 70,5 17,3
115,0 0,500 0,946 60,8 140,0 0,446 0,485 79,25 86,25 73,7 12,6
110,2 0,600 0,961 58,4 137,9 0,361 0,385 79,5 84,85 76,1 8,8
106,3 0,700 0,974 56,4 136,0 0,274 . 0,285 79,6 82,75 , 78,1 , 4.65
102,8 0,800 0,985 54,5 134,5 0,185 0,185 80,0 80,0 80,0 1 °
этих величин в уравнение (VIII. 4) определяется отвечающий заданному мгно-
венному составу кубового остатка минимальный съем тепла в конденсаторе
колонны. Так, например, температуре 141° отвечает по равновесным данным
состав xn_|_j =0,200 кубовой жидкости и состав y„^_t =0,768 равновесного ей
пара. По тепловой диаграмме находим отвечающие им теплосодержания
</п_|_1=75,6 ккал!кг и Qn + j = 151,6 ккал/кг. Теплосодержание ректификата,
имеющего состав уD = 0,985, составляет QD = 134,5 ккал!кг. Подстановка этих,
значений в уравнение (VIII. 4) дает
^МИН 0,985 --- 0,200 /1С1Й С‘, /I'll С -7- Д'. ЛС 1 /
~р~= 0 768 — 0 200 75’6)— (134,5— 7б,6) = 46,1 ккалла.
В табл. 21 приведены аналогичные расчеты, проведенные для ряда тем-
ператур и отвечающих им составов фаз в кубе колонны, выбранных внутри
интервала выкипания рассматриваемой системы н-гептан — эндекан, при
заданном постоянном составе ректификата yD = 0,985.
Из табл. 21 видно, как растет съем тепла в конденсаторе колонны при
постепенном утяжелении состава кубовой жидкости. Если состав загрузки
куба а = Хп + ( = 0,800, то в первый момент не требуется никакой ректифи-
кации для получения дестиллата с составом yD = 0,985, так как образующиеся
пары имеют именно этот состав уп + ( = yD = 0,985. Но уже в следующее
мгновение в ходе перегонки жидкость утяжеляется, состав ее равновесного
пара делается меньше (желательного состава дестиллата и для обеспечения
последнего требуется прогрессивно увеличивать съем тепла в конденсаторе.
Так, при начальном составе загрузки а = хп + 4 = 0,800 съем тепла d/D = 0, но
уже при хп_|_1 = 0,700 требуется отнимать 4,65 ккал[кг дестиллата, а при
хл+1 =0,200 этот съем . возрастает до 46,1 ккал!кг дестиллата, т. е. почти
1
Периодическая ректификация при постоянном составе дестиллата 371
в 10 раз. Дальнейшее утяжеление кубовой жидкости еще больше увеличи-
вает относительный съем тепла, который таким образом растет до бесконеч-
ности при tw= 194,5°, отвечающей точке кипения высококипящего компонента
системы — эндекана. Это вполне понятно, так как при этой температуре
хп , !=0 и, следовательно, никакими усилиями нельзя извлечь низкокипящий
компонент из кубовой жидкости, если она его не содержит.
Фиг. 107. Графический расчет минимальных
значений съемов тепла в парциальном г кон-
денсаторе.
Аналитический ра-
счет по уравнению
(VIII. 4), приведенный
в табл. 21, можно за-
менить для облегчения
вычислений менее точ-
ным, но более удобным
и наглядным расчетом
по тепловой диаграмме.
Для этого необходимо
провести на диаграмме
вертикаль yD = const и
продолжить изотермы,
отвечающие темпера-
турам, приведенным
в графе 1 табл. 21 до
пересечения с этой
вертикалью. Если из
ординат точек пересе-
чения вычитать значе-
ния Qd, то разности
дадут искомые значе-
ния съемов тепла
в конденсаторе, отве-
чающие соответствую-
щим составам кубовой
жидкости. Схема по-
добного графического
расчета представлена
на фиг. 107.
Изотермы а.А, отвечающие равновесным составам х( и'<уг,
продолжены до пересечения в точках Sx с вертикалью yD =
= const. Определяемые этим построением отрезки пропор-
циональны в выбранном масштабе съему тепла, отвечающему
надлежащей изотерме. К графическому методу следует при-
бегать лишь при ориентировочных расчетах, так как его точ-
ность уступает точности аналитического расчета по уравне-
нию (VIII. 4), приведенного в табл. 21. Следует еще указать, что
при больших значениях равновесных составов, когда разрыв
между ними делается небольшим, графический расчет становится
24*
особенно неточным. Равным образом и при малых значе-
ниях составов жидких фаз точность графического расчета неве-
лика. Однако с небольшим допущением для этого случая можно
удобно преобразовать уравнение (VIII. 4). Из фиг. 107 видно,
что без большой ошибки при малом начальном составе xn + t
ЖИДКОЙ фазы МОЖНО ПОЛОЖИТЬ Qn-f-1—<fri + l=Qu> — Qw = lw,
где lw—скрытая теплота испарения высококипящего компонента.
С несколько меньшим основанием в тех же условиях, но при
средних и особенно небольших значениях состава верхнего
продукта колонны можно положитьQd—qn + i =Qn + i—Qn + i = lw-
Это допущение выполняется в действительности лишь приблизи-
тельно, но получающееся при этом упрощение уравнения (VIII. 4)
очень удобно при ориентировочных расчетах:
rfMHH _ . Ур~Уп + 1 , Имин _ , г,
откуда
^=4^- (Уш. 6)
'-'‘id
Когда не только xn + i, но и равновесный состав пара yn + i
тоже невелик сравнительно с единицей, можно еще больше
упростить уравнение (VIII. 4), положив в уравнении равновесия
yn + i^mxn + i, (VIII. 7)
где т—коэффициент обогащения.
Сделав соответствующую подстановку в уравнение (VIII. 4),
можно привести его к виду
Ур-т*п + 1 Г Ур т 1 ох
D = l* xn + 1(m-l) -4xB+1(m-l)
Если, например, для смеси н-гептан — эндекан при малых
значениях составов, измеряемых долями процента, положить
т = 10, то уравнение (VIII. 8) придет к виду
•^-^бб,зГ-~------1,1). (VIII. 9)
Чем меньше значение yD, тем с большим основанием для
малых xx+i иу„ + 1 можно применить уравнение (VIII. 9), так как
при этом разность QD—qn+i сближается с разностью Qn + t — qni-
Состав верхнего продукта в рассматриваемом процессе пе-
риодической ректификации хотя и выдерживается постоянным,
но, вообще говоря, может иметь различные значения в разных
случаях разделения данной системы. Для полной картины
Периодическая ректификация при постоянном составе дестиллата 373
процесса периодической ректификации системы «-гептан — энде-
кан необходимо рассчитать по уравнению (VIII. 4) съем тепла не
только при одном определенном значении состава yD верхнего
продукта, как это сделано в табл. 21, но провести аналогичные
расчеты и для ряда других значений состава yD верхнего про-
дукта ректификационной колонны.
Такие подсчеты были проведены для 12 значений yD в пределах от yD =
= 0,10 до практически чистого низкокипящего компонента системы. Резуль-
таты расчетов сведены в табл. 22. Каждая графа этой таблицы дает значения
минимальных съемов тепла, которые необходимо отнимать в парциальном
конденсаторе колонны, чтобы обеспечить получение дестиллата заданного
постоянного состава, помеченного в верхней клетке соответствующей графы.
Так, например, для получения дестиллата постоянного состава yD = 0,600
жидкое сырье, загружаемое первоначально в куб, должно иметь состав, рав-
ный или меньший а = 0,114, так как именно этому составу отвечает равно-
весный пар состава уп _|_ t = 0,600. Таким образом, если бы исходная жидкость
имела состав «>0,114, то из нее в ходе перегонки выделялся бы пар, более
богатый низкокипящим компонентом, чем требуемый по условию дестиллат,
в ректификации не было бы необходимости, и только когда после постепен-
ного обеднения жидкости в кубе, ее состав достш'.бы. значения. а — Ц11 1,____
появился бы первый пузырек пара, имеющий желательный состав дестиллата
yD — 0,600. Для поддержания постоянным этого состава понадобилось бы
включить колонну и непрерывно по мере утяжеления кубовой жидкости
увеличивать съем тепла в парциальном конденсаторе.
Соответствующая графа табл. 22 показывает, что когда состав жидкости
в кубе достигнет значения хп + 1 =0,100, в конденсаторе нужно будет отни-
мать 8,2 ккал на 1 кг отбираемого дестиллата, а когда состав хп_4 дойдет
до 4% по весу, съем тепла составит уже 100,2 ккал. Наконец, когда состав
жидкого кубового остатка станет равным хп + 1 = 0,005, потребуется отнимать
849,4 ккал на 1 кг дестиллатных паров состава уо = 0,600, отводимых из
парциального конденсатора.
Для наглядности и удобства интерполяции тепловые данные таблицы
представлены графически на фиг. 108 в функции состава кубовой жидкости.
Каждая кривая на этом графике имеет пометку, показывающую, какому
составу дестиллата в весовых процентах она отвечает, и представляет графи-
ческую интерпретацию соответствующей графы табл. 22. Уместно отметить,
что каждая кривая фиг. 108 пересекает ось абсцисс в точке, отвечающей
составу жидкости, равновесной парам дестиллата, для которого эта кривая
построена. Это и понятно, ибо для жидкости такого состава в начальный
момент процесса не приходится прибегать к ректификации, так как первый
пузырек пара имеет состав, равный требуемому составу дестиллата.
Допустим, что подвергается периодической ректификации с отбором
дестиллата постоянного состава yD = 0,995 исходная жидкая система «-геп-
тан— эндекан с начальным составом а = 0,625 и пусть над перегонным кубом
установлена ректификационная колонна с восемью теоретическими тарелками.
Как показывают предварительные расчеты, приведенные в табл. 19, этого
числа тарелок вполне достаточно, чтобы при любом тепловом режиме колонны
можно было практически достигнуть в самом нижнем ее отделении (а в ряде
случаев и выше) предельных концентраций, отвечающих мгновенному значе-
нию съема тепла в парциальном конденсаторе. В каждый момент процесса
количество тепла, отнимаемого в конденсаторе или, что то же самое, коли-
чество орошения должно быть таково, чтобы обеспечить практическое равен-
ство состава флегмы, стекающей с нижней тарелки, и состава кубовой
жидкости при неизменном составе верхнего продукта колонны.
Из интерполяции по фиг. 108 выясняется, что в начальный момент съем
тепла в парциальном конденсаторе должен быть 10 ккал на 1 кг дестиллата.
Если обратиться к табл. 19, в которой приведены подсчеты составов жидких
фаз по тарелкам укрепляющей колонны, выдающей при различных значениях
съема тепла в конденсаторе дестиллат постоянного состава yD = 0,995, то
Фиг. 108. Величины съемов тепла при различных значениях состава дестиллата•
.можно установить, что уже на 5-й тарелке, считая сверху, будет достигнут
состав флегмы, отвечающий режиму работы колонны при данном мини-
муме d/D. В дальнейшем по мере утяжеления кубовой жидкости и уменьше-
ния ее состава по низкокипящему компоненту съем тепла в конденсаторе по-
степенно растет, доходя для состава кубовой жидкости Хд = 0,100 до 100 ккал
на 1 кг отбираемого дестиллата при шести тарелках, а для xR = 0,060 до
—180 ккал!кг приблизительно при восьми тарелках.
Допустим, что дальнейший отбор дестиллата постоянного состава практи-
чески нецелесообразен вследствие чрезмерно большого орошения, которое
требуется конденсировать и подавать в колонну, поэтому последующую
работу колонны решено вести при закрепленном значении съема тепла в кон-
денсаторе, равном d/D = 180 ккал!кг.
Таблица i2
1, °C Равновесные составы в ве- совых долях • " " 1 И! 1 1 Г П. | ! 1111, И | 1 1 П1 11 Г П 1 1.1. Минимальный съем тепла в парциальном конденсаторе при составе паров, выходящих из парциального конденсатора в весовых долях
194,5 *п+1 Уп+1 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 0,95 0,985 yD ~ 1,000
191,8 0,005 0,049 78,2 231,9 386,1 540,1 694,9 849,4 004,1 1159,6 1317,5 1397,9 1454,6 1479,7
189,8 0,010 0,085 13,8 105,7 197,8 290,6 383,6 476,6 574,3 663,3 758,2 807,6 843,3 859,4
188,9 0,0125 0,100 0
185,4 0,020 0,162 13,6 70,0 120,7 172,2 223,3 275,0 327,3 381,4 408,8 430,5 440,1
183,2 0,026 0,200 0
177,8 0,040 0,287 4,25 35,8 68,2 100,2 132,5 165,8 200,3 218,7 233,6 240,1
176,9 0,043 0,300 0
172,8 0,060 0,365 9,85 37,5 64,7 92,3 120,5 150,4 166,3 179,5 185,1
170,2 0,063 0,400 0
165,0 0,080 0,479 4,6 26,3 51,4 74,6 95,2 108,7 119,9 124,6
163,6 0,085 0,500 0
159,7 0,100 0,558 8,2 27,8 48,2 70,1 82,4 92,7 97,1
156,5 0,114 0,600 0
149,3 0,150 0,687 2,35 20,6 40,4 51,6 61,3 65,4
148,0 0,157 0,700 0
141,0 0,200 0,768 6,35 25,65 36,8 46,1 50,2
137,6 0,224 0,800 i 0
129,4 0,300 0,869 5,0 17,1 26,6 30,6
124,8 0,355 0,900 0
121,3 0,400 0,920 7,3 17,3 21,6
115,0 0,500 0,946 1,6 12,6 17,2
113,7 0,525 0,950 0
110,2 0,600 0,961 8,8 14,1
106,3 0,700 0,974 4,6 11,1
102,8 0,800 0,985 0 8,6
100,5 0,900 0,993 7,0
99,75 0,950 0,997 ! 5,7
98,61 1,000 81,000 0
Периодическая ректификация при постоянном составе дестиллата 375
376
П рпип^ииргкпя лек/гифцк.шш'г
Определим выходы дестиллата и кубовой жидкости, получен-
ные в первой законченной стадии процесса периодической
ректификации. Пусть первоначальная загрузка куба L килограм-
мов, а конечные веса отобранного дестиллата постоянного со-
става уо и кубового остатка с конечным составом xR соответ-
ственно равны DK и А’к. По истечении первой стадии процесса его
материальный баланс представится уравнением
La = £>KyD + (L-Z)K)xR, (VIII. 10)
откуда
Д.< a~xR
(VIII. II)
Подставляя соответствующие значения в уравнение (VIII. 11), имеем
D 0,625 — 0,060
L ' 0,995 — 0,060 = °’604-
Таким образом, относительный вес кубового остатка первой стадии про-
цесса RK)L = 0,396. Относительное количество извлеченного низкокипящего
компонента
DKyn 0,604 X 0,995
к. - —__________________— 0 962
Л кок — v.auz.
0,625
В первой стадии процесса основная масса низкокипящего компонента
оказывается извлеченной.
Пусть требуется определить расход тепла BL на проведение
процесса периодической ректификации с отбором дестиллата
постоянного состава.
Для элементарно малого промежутка времени дифферен-
циальное уравнение теплового баланса рассматриваемой колонны
напишется следующим образом:
= §Q2 + QDdD + Rdq. (VIII. 12)
Значение этого уравнения состоит в том, что элементарное
количество тепла, сообщаемое в кубе колонны, расходуется
на увеличение теплосодержания мгновенного веса кубовой
жидкости /? на dq, уходит с парами дестиллата в коли-
честве Qd$D и отводится из парциального конденсатора в коли-
честве 8Q2.
Рассмотрим отдельно каждый член правой части уравне-
ния (VIII. 12).
Количество тепла, отнимаемого в парциальном конденсаторе
колонны в ходе процесса собственно ректификации, в расчете
на единицу мгновенного веса дестиллата может быть найдено
путем определения некоторого среднего значения d/D с после-
дующим умножением этой величины на среднее же значение
веса дестиллата для рассматриваемого периода процесса.
Периодическая ректификация при постоянном составе дестиллата 3 77
Из фиг. 108 совершенно очевидно, что попытка определе-
ния среднего d/D как среднеарифметической из значений, отве-
чающих началу и концу рассматриваемого периода процесса,,
обречена на неудачу, так как в ходе процесса возрастание этой
величины далеко отклоняется от линейного характера измене-
ний, особенно при сравнительно небольших конечных составах
кубовой жидкости. Лишь в сравнительно узких пределах изме-
нения состава жидкости в кубе колонны можно приближенно
определить среднее значение съема тепла в парциальном кон-
денсаторе по уравнению
В общем же случае среднее значение d/D следует опре-
делять по соответствующей кривой графика, имеющей пометку,,
равную составу дестиллата, как среднеинтёгральную вели-
чину.
Равным образом и среднее значение веса дестиллата (D/L\ t^
изменяющегося в ходе процесса от нуля до DIC0H/L, также дол-
жно определяться как среднеинтегральная величина. Из мате-
риального баланса процесса ректификации мгновенный вес де-
стиллата определяется соотношением
(VIII. 14)
где х—мгновенный состав кубовой жидкости, изменяющийся от
а до xR. Согласно понятию среднеинтегральной величины сред-
нее значение веса дестиллата должно определиться из соотно-
шения
(VIII. 15)
Решение уравнения (VIII. 15) возможно лишь методом гра-
фического интегрирования.
Окончательное значение съема тепла в парциальном кон-
денсаторе колонны за рассматриваемый период процесса най-
дется как произведение:
d — £>ср ( D .
4 'ср
(VIII. 16)
Значение DK0H может быть использовано для нахождения ко-
нечного значения второго члена правой части уравнения (VIII. 12)
на основании того, что вследствие постоянства состава yD дестил-
лата его теплосодержание QD также сохраняет неизменное зна-
чение:
XR
f QDdD = QDDK0H. (VIII. 17)
а
При интегрировании последнего члена правой части уравне-
ния (VIII. 12) следует иметь в виду, что вес кубовой жидкости R
является величиной переменной в ходе процесса, поэтому его
необходимо увязать функциональной зависимостью с q. Из урав-
нения материального баланса установки за любой конечный про-
межуток времени можно написать
La~(L — R)yD + Rx,
откуда
R-L^-—. (VIII. 18)
Уд— x
Подставляя это значение в рассматриваемое выражение,
можно получить
qR gR
f Rdq = L(yD-a) f • (VIII. 19)
<7o *70
Величина интеграла в правой части уравнения (VIII. 19) может
быть найдена лишь графически, так как не имеется простой
аналитической зависимости между составом х кубовой жидкости
и ее теплосодержанием q в точке начала кипения; графически
же эта зависимость представляется нижней кривой обычной
тепловой диаграммы. Для вычисления интеграла необходимо
нанести на график -----— в функции теплосодержания жидкой
Уд х
фазы q и вычислить площадь под полученной кривой в преде-
лах от начального состава кубовой жидкости х = а = 0,625 до
ее состава в конце процесса x~xR = 0,060.
В табл. 23 приведены необходимые предварительные расчеты для гра-
фического интегрирования с целью нахождения интегральных выражений пра-
вой части уравнения (VIII. 12) по данным рассматриваемого примера.
Так, по данным граф 1 и 5 табл. 23 построен график зависимости D от
состава кубовой жидкости х (фиг. 109). Для определения среднеинтегрального
значения веса дестиллата необходимо вычислить площадь под этой кривой
в пределах от а = 0,625 до хд = 0,060 и затем найти высоту равновеликого
прямоугольника.
Определение площади под кривой лучше всего вести по известной фор-
муле парабол
ь
I ydxsJ^ (у0 + 4у, + 2у2 + 4у3 + ... + 2yn__2 + 4yn__i + уп). (VIII. 20)
а
Периодическая ректификация при постоянном составе дестиллата
Таблица 23
X Уд — х = = 0,995 —х 1 а - Х = = 0,625—х D = 100 9i625_x 0,995-х q, ккал)кг
0,995 — х
0,060 0,935 1,070 0,565 60,4 94,0
0,100 0,895 1,117 0,525 58,7 86,2
0,150 0,845 1,182 0,475 56,2 80,5
0,200 0,795 1,258 0,425 53,5 75,6
0,300 0,695 1,440 0,325 46,8 68,7
0,400 0,595 1,680 0,225 37,8 64,0
0,500 0,495 2,020 0,125 25,3 60,8
0,600 0,395 2,530 0,025 6,3 58,4
0,625 0,370 2,700 0,000 0,0 57,8
Для вычисления интеграла промежуток от а до Ь разделяется на п рав-
ных частей и для точек деления снимаются с графика или вычисляются зна-
, п , b — а
.с-и-.-.: функции у При этом етедует иметь и виду, что-я---------------четное- а//--=•---------
Подсчет по фиг. 109 дает для веса дестиллата среднеинтегральное значе-
= 39 кг на 100 кг исходного сырья. Аналогичным образом на фиг. 110
приведен график, дающий зависи-
мость мгновенного значения съема
тепла в конденсаторе колонны в функ-
ции состава кубовой жидкости.
Среднеинтегральное значение
съема тепла, найденное по формуле
{VIII. 20), дает значение (J =
= 40,8 ккал!кг. Таким образом, ве-
личина съема тепла в парциальном
конденсаторе колонны на основании
уравнения (VIII. 16)
d = 39 х 40,8 = 1630 ктсял/100 кг сырья.
Фиг. 109. Расчет среднеинтеграль-
ного веса дестиллата.
По данным граф 3 и 6 табл. 23
построен график фиг. 111, дающий
зависимость функции --------- от
Уп — х
теплосодержания q кубовой жидкости.
Площадь под полученной кривой пропорциональна значению интеграла в пра-
вой части уравнения (VIII. 19). Пределы интегрирования соответственно рав-
ны 90 = 57,8 и <7^ = 94 ккал)кг. Площадь под кривой / = 5100 мм2. Согласно
принятым значениям цены деления осей координат каждый квадратный мил-
лиметр пропорционален 0,5x0,02 = 0,01 ккал. Следовательно, искомое зна-
чение интеграла равно
0,060
0,625
п -------= 5100 х 0,01 = 51 ккал.
0,995 — х
Фиг. 110. Расчет среднеинтегрального значения
съема тепла в конденсаторе.
При расчете на 100 кг начальной загрузки правая часть уравнения (VIII. 19)
(*R dq
100(0,995 — 0,625) 51 = 1630 ккал/100 кг.
«о
Наконец,' количество тепла, уноси-
мое ректификатом из парциального кон-
денсатора, на основании уравнения
(VIII. 17)
QdDkoh= 134’4 х 60’4 = 8120 к«М100 кг.
Общая же затрата тепла на ведение
процесса собственно ректификации опре-
делится как сумма рассчитанных выше
величин:
— d + Q/Аон + у R dq =
Qo
= 1630 +8120 + 1630 =
=11380 к«а?/100 кг сырья (VIII .21)
Определяемое уравнением (VIII. 21}
количество тепла В/ представляет рас-
ход энергии на проведение процесса
собственно ректификации от его на-
чального момента до конечного и не
Фиг. 111. Определение интеграла в пра-
вой части уравнения (VIII. 19).
Определение поверхности теплообмена в кубе
381
включает затрат тепла в период разогрева колонны и доведения исходной
загрузки до точки начала кипения.
Количество тепла В2, затрачиваемого на нестационарный процесс нагрева
первоначальной загрузки куба от ее исходной температуры /0 = 20° до тем-
пературы начала кипения ^.определится на основании обычного уравнения
теплового баланса
В2 = Lccp (t1 — ta) = L (9l - 9о) = 100 (57.8 - 9,8) =
= 4800 ккал/100 кг сырья. (VIII. 22
Общая затрата тепла на проведение всего процесса периодической'ректи-
фикации заданной системы с отбором дестиллата постоянного состава равна
В = ВГ + В2 = 11380 4- 4800 = 16180 ккал/100 кг сырья.
§ 3. Определение поверхности теплообмена в кубе
Интересно еще разобрать вопрос об определении поверх-
ности нагрева F, необходимой для передачи тепла, затрачивае-
мого на ведение процесса.
____Уравнение теплопередачи в период ректификации для эле-
ментарного промежутка временив тх, можсб ыть написано сле-
дующим образом:
dBi = k(tn—t)Fdrlt (VIII. 23)
где к—коэффициент теплопередачи в ккал1м? час °C; tH —
температура теплоносителя в °C; t—температура кубовой
жидкости в °C; тх—время протекания процесса собственно
ректификации в часах.
В ходе ректификации и теплопередачи в кубе температура /
кубовой жидкости непрерывно меняется, увеличиваясь от зна-
чения /1( отвечающего началу кипения исходной смеси, до зна-
чения tR — точки закипания конечного продукта процесса 7?кон.
Температура /н в общем случае также должна рассматриваться
как переменная, так как в ходе процесса теплопередачи теплоно-
ситель должен охлаждаться. Лишь когда в качестве теплоно-
сителя используется насыщенный водяной пар, конденсирую-
щийся при постоянной температуре, можно считать 4 не изме-
няющейся величиной и этим в некоторой степени облегчить
решение уравнения (VIII. 23). Ввиду изменения свойств тепло-
обменивающихся сред коэффициент теплопередачи к, вообще
говоря, не сохраняет постоянного значения во весь период про-
цесса, однако изменение его относительно невелико и при поль-
зовании некоторым средним значением можно считать его по-
стоянным без заметной ошибки. В тех же сравнительно редких
случаях, когда коэффициент теплопередачи в ходе процесса
меняется в таких широких пределах, которые не разрешают
считать его постоянным, приходится это учитывать при интегри-
ровании уравнения (VIII. 23).
ЧЯ9 - -—-udiiuai.
Из уравнения (VIII. 23) по разделении переменных можно
получить
В1
(V,"'24>
о
Интеграл правой части уравнения (VIII. 24) может быть
вычислен лишь графическим путем. С этой целью необходимо
для ряда значений состава х кубовой жидкости в интервале
а>х>Хд рассчитать по уравнению (VIII. 21) значения Blt отве-
чающие этим составам х, и найти по изобарным кривым равно-
весия температуры t начала кипения кубовой жидкости того
же состава. Сопряженное значение температуры ta теплоно-
сителя найдется для каждого текущего по уравнению тепло-
вого баланса. Если при этом оказывается, что изменением коэф-
фициента теплопередачи кг пренебречь нельзя, то при рас-
сматриваемых значениях температур кубовой жидкости и тепло-
носителя обычным путем подсчитывается еще и к. Если же к
может быть принят постоянным, то его можно вынести за знак
интеграла.
Для вычисления интеграла, входящего в уравнение (VIII. 24),
необходимо рассчитать и нанести на график величину !//(:(/„ — t)
в функции Вх и определить площадь под полученной кривой
в интервале значений расхода тепла от нуля в начале процесса
собственно ректификации до Вг в конце его.
Получающаяся при этом величина произведения поверхности
нагрева на продолжительность процесса ректификации позво-
ляет, выбрав экономически целесообразную поверхность на-
грева F, установить продолжительность периода собственно рек-
тификации. При этом важно учесть производительность колонны,
чтобы интенсивный подогрев в кубе не привел к ее захлебы-
ванию, и практические данные об оптимальной продолжитель-
ности периода ректификации.
Продолжительность нагрева исходного сырья от температуры
его загрузки в куб до точки начала кипения может быть найдена
в ходе следующих рассуждений. Уравнение теплового баланса
за элементарный промежуток времени Jt2 периода нагрева может
быть написано в следующем виде:
dB2 == LtCpm dt.
Уравнение теплопередачи за тот же период
dB2 = k2F (Л, —0 dz2.
Если принять постоянными коэффициентами теплопереда-
чи к2 и температуру теплоносителя то, приравнивая правые
Периодическая ректификация при переменном составе дестиллата 383
части двух последних уравнений и решая полученное соотно-
шение в отношении т2, можно написать
(н И
Lc„m dt Lc„ — tn
J = (VW-25)
Если температура теплоносителя изменяется во время подо-
грева, то приходится прибегать к графическому интегрированию
по описанному выше методу.
§ 4. Периодическая ректификация при переменном составе
дестиллата
Как указывалось выше, в тех случаях, когда дальнейшее
получение дестиллата постоянного состава требует чрезмерного
увеличения количества подаваемого на верх колонны орошения,
обычно закрепляют съем тепла в парциальном конденсаторе на
некоторомопределенном уровне и дальнейшую работу ведут_____
при постоянном его значении. При этом состав получаемого
дестиллата непрерывно изменяется, постепенно утяжеляясь.
Возникает задача установления приемов анализа этого процесса.
В последующем изложении принимается, что число тарелок
в колонне вполне достаточно, чтобы при постоянном съеме
тепла в парциальном конденсаторе обеспечить предельные кон-
центрации, отвечающие прогрессивно обедняющимся по НКК
составам дестиллата.
Основная задача расчета периодической ректификации с отбо-
ром дестиллата переменного состава заключается в определении
соотношения, связывающего вес кубовой жидкости с ее соста-
вом. При наличии подобного соотношения легко может быть
найдено среднее значение состава дестиллата, отбираемого
в рассматриваемой второй стадии периодической ректификации.
Процесс периодической ректификации с отбором дестиллата
переменного состава можно уподобить изученному ранее про-
цессу постепенной перегонки с одним лишь существенным
различием. При рассмотрении простой перегонки предполага-
лось, что пары, отводимые из перегонного куба в каждый дан-
ный момент, находятся в равновесии с кубовой жидкостью дан-
ного мгновенного состава. Здесь же для получения нужной ана-
логии достаточно связать мгновенный состав кубовой жидкости
с мгновенным значением состава yD дестиллатных паров, неравно-
весных кубовой жидкости.
На фиг. 112 представлен график зависимости минимального
съема тепла d/D в функции состава кубового остатка в пре-
делах от 0 до 10% по весу для рассматриваемой системы
н-гептан — эндекан. Проведя на этом графике горизонталь.
отвечающую принятому, закрепленному во второй стадии про-
цесса значению dMm)D, можно получить ряд точек пересечения
этой прямой с кривыми, отвечающими различным значениям yD
состава верхнего продукта колонны. Абсцисса х каждой точки
пересечения дает состав кубовой жидкости, а пометка соответ-
ствующей кривой — сопряженный мгновенный состав дестил-
латных паров, выходящих из парциального конденсатора. Это
наиболее простой и надеж-
ный способ нахождения
связи между составами ку-
бовой жидкости и верхнего
продукта колонны.
Обозначая начальный
для второй стадии процесса
вес кубовой жидкости через
Llt а конечный через L2,
можно на основании упо-
мянутой аналогии с процес-
сом простой перегонки на-
писать
от
Фи1, 112. Зависимость съема тепла
состава кубового остатка.
, С
1П т~ =
= /y-^=“- (VIIL26)
Сопряженные значения
yD и х снимаются с графика
фиг. 112, и интеграл в пра-
вой части уравнения (VIII. 26)
вычисляется графическим
путем, описанным выше.
Найдя конечный вес L,,
xRi, уже легко по разности
остатка, отвечающий его составу
определить вес дестиллата и из материального баланса его состав.
Когда составы кубовой жидкости, уменьшаясь, доходят до
таких небольших значений, при которых условия паро-жидкого
равновесия можно представить упрощенным соотношением
<VIII. 7), связь между х и yD при заданном значении d/D может
быть определена из уравнения (VIII. 8):
Г/ d \ 1 . т 1
yD =х (т -1) [( ^T=-rJ
(VIII. 27)
Коэффициент при х может быть вычислен непосредственно
по принятому значению d/D, скрытой теплоте испарения ВКК
lw и по величине коэффициента обогащения т. Пусть его вели-
Периодическая ректификация при переменном составе дестиллата 385
чина оказалась равной Е. Тогда yD = Ex и подстановка этого
значения в уравнение (VIII. 27) приводит его в виду
'^2
L, 1 /’ dx 1 Хп,
^-T-3=~E^vJ V = T^rln^; . (VIII. 28)
откуда
1
‘г = (^Е ' =/л (VIII. 29)
ьз \ *Д2 /
Таким образом, для понижения содержания НКК в исход-
ном продукте от ах до надо уменьшить его вес в отноше-
нии
£, L, ,
— -С Л
(VIII. 30)
25 зак. «V! 304.
ГЛАВА IX
РЕКТИФИКАЦИЯ В ПРИСУТСТВИИ ПЕРЕГРЕТОГО
ВОДЯНОГО ПАРА
§ 1. Вводные замечания
Применение перегретого водяного пара или нейтрального
газа в процессе ректификации углеводородных систем вызвано
главным образом стремлением понизить температуры перегонки
и этим предохранить от разложения недостаточно термоустой-
чивые соединения. Другая причина использования перегретого
водяного пара, объясняющая его ввод в отгонные колонны
в случаях, когда вследствие невысокого интервала температур
процесса опасность разложения углеводородов исключена,
заключается в затруднительности или даже практической невоз-
можности оборудования колонны кипятильным устройством,
позволяющим обеспечить необходимый для процесса ректифи-
кации в отгонных колоннах восходящий паровой поток. Отсюда
водяной пар поступает в укрепляющую секцию. Наконец, ней-
тральный газ может содержаться и в сырьевом потоке колонны
при технологическом процессе его получения. Таким образом,
по ряду причин довольно часто приходится сталкиваться на
практике с ректификацией в присутствии перегретого водяного
пара или нейтрального газа, поэтому необходимо количественно
исследовать этот процесс и установить соотношения, позво-
ляющие вести его расчет.
Процесс перегонки с паром рассматривался многими авто-
рами, но изучению процесса ректификации в присутствии пере-
гретого водяного пара или нейтрального газа, насколько нам
известно, посвящены только работы А. М. Трегубова [13],
А. И. Скобло [12] и С. Н. Обрядчикова [8, 9].
А. М. Трегубов разработал основные моменты работы пере-
гретого водяного пара в колонне и предложил качественную
картину процесса, протекающего в колонном аппарате. Однако
нельзя согласиться с его гипотезой о возможности достижения
в испарительном пространстве идеальной колонны некоторого
минимального веса паров, поднимающихся из отгонной секции.
Как показывает внимательное рассмотрение, здесь картина зна-
чительно сложнее и задолго до достижения паровым потоком
Теоретические положения
387
отгонной секции предельного состава ее ректифицирующая
работа уже не может продолжаться.
Процесс ректификации в присутствии перегретого водя-
ного пара в отгонных колоннах глубоко проанализирован
А. И. Скобло, установившим на конкретном опытном материале
основные качественные показатели процесса, их связь и взаи-
мозависимость. Ниже предлагается аналитический метод расчета
ректификации углеводородных систем в присутствии перегре-
того водяного пара или нейтрального газа. Предлагаемый
метод основан на теоретических положениях, в значительной
части разработанных упомянутыми выше исследователями, но
облекает их в другую, более удобную форму, позволяющую
вести не только качественный, но и количественный учет явле-
ний на всех ступенях процесса и для всего аппарата в целом.
§ 2. Теоретические положения
Присутствие водяного перегретого пара в ректифицируемой
смеси накладывает определенное своеобразие на процесс ее
разделения, заметно осложняя расчетную процедуру. роме-
основных соотношений материальных и тепловых балансов,
для анализа работы колонны здесь необходимо привлечь еще
дополнительные соотношения, определяющие условия паро-
жидкого равновесия уже в трехкомпонентной системе, один из
компонентов которой присутствует только в паровой фазе.
Согласно правилу фаз трехкомпонентная двухфазная система
обладает тремя степенями свободы. Это означает, что для
определения равновесного состояния такой системы необхо-
димо принять значения любых трех ее интенсивных свойств,
тогда все остальные ее свойства в обеих фазах системы
окажутся строго определенными. Интенсивными свойствами
системы являются ее температура, общая и парциальная упру-
гость паров ее компонентов, составы фаз. Правило фаз не
накладывает никаких ограничений на выбор того или иного
интенсивного свойства в качестве степени свободы и уста-
навливает лишь число этих свойств, которое должно быть
зафиксировано для определенности состояния системы. Поэтому
из перечисленных выше свойств системы теоретически вполне
достаточно зафиксировать любые три, и равновесное состояние
системы станет строго определенным и единственным. Однако
с практической точки зрения целесообразно предоставляемый
правилом фаз известный произвол в выборе независимых пере-
менных использовать наиболее выгодным образом, выбрав
в качестве фиксированных такие свойства, которые легче
позволят рассчитать значения всех остальных свойств системы
в обеих ее фазах. При этом, выбирая значения независимых
свойств системы, необходимо строго следить за тем, чтобы не
25*
388
Ректификация. в пгшситстянн пепегп^тогп папа
перейти известных границ, за которыми изменяется число фаз
системы и, следовательно, число ее степеней свободы. Так,
например, если упругость рг перегретого водяного пара при-
нята больше упругости насыщенного водяного пара при той
же температуре, то должна обязательно появиться вторая
жидкая фаза, нерастворимый с углеводородами водный слой,
и число степеней свободы трехкомпонентной, но уже трехфаз-
ной системы, становится равным двум, а не трем.
В дальнейшем предполагается, что перегретый водяной пар
так тесно контактирует с жидкой углеводородной фазой, что
выделяемая ею и поднимающаяся с ее поверхности смесь паров
практически находится с ней в равновесии. На этом основании
относительное содержание водяного пара в смеси равновесных
жидкой фазе паров определяется согласно закону Дальтона,
распространенному на их смесь, по соотношению
2 . РгМг (Р-Ра^Мг
П G'(p-pz)My pawMy
Уравнение (IX. 1) показывает, что относительный расход
водяного пара растет с увеличением давления и уменьшением
температуры и понижается с увеличением молекулярного веса
отгоняемых из жидкости углеводородных паров. Поэтому при
постоянном расходе водяного пара с увеличением температуры
будет увеличиваться и количество отгоняемых паров. Эти
теоретические положения играют существенную роль в опре-
делении условий работы перегретого водяного пара в ректи-
фикационной колонне и поэтому приведены в качестве пред-
варительных замечаний.
§ 3. Анализ работы перегретого водяного пара
в отгонной колонне
Отгонная колонна является основным аппаратом, в котором
использование перегретого водяного пара в некоторых слу-
чаях диктуется прямой необходимостью, чего нельзя сказать
про укрепляющую колонну, работающую в присутствии пере-
гретого водяного пара большей частью лишь вследствие своей
связи с отгонной.
Пусть в отгонной колонне в присутствии перегретого водя-
ного пара требуется разделить исходную жидкую бинарную
систему, состоящую из углеводородов а и w, на практически
чистый высококипящий компонент w, уходящий с низа колонны
в жидкой фазе, и паровой.продукт определенного, ранее на-
значенного состава yD, отводимый с верхней ее тарелки (фиг. 113),
Материальные балансы всего объема отгонной колонны по
Анализ работы перегретого пара в отгонной колонне
389
общему весу потоков и по весу содержащегося в них низко-
кипящего компонента представятся уравнениями
L = D + R-, (IX. 2) La = DyD + RxR. (IX. 3)
Сочетая уравнения (IX. 2) и (IX. 3), можно определить веса
целевых продуктов колонны, отнесенные к единице веса исход-
ной жидкой системы:
D <х —
L ~ Vd — xr ’
(IX. 4)
yD — а
(IX. 5)
L yD-xR '
Для получения основных соотношений,
связывающих друг с другом веса и составы
встречных на одном уровне отгонной
колонны потоков флегмы и паров, соста-
вляются уравнения материального и тепло-
вого балансов для объема колонны, заклю-
ченного между низом ее и некоторым
текущим межтарелочным отделением
Вследствие того, что сам перегретый
водяной пар непосредственно не перерас-
пределяется между фазами, оставаясь
в одном и том же неизменном количестве
в паровом потоке, уравнения материаль-
ного баланса не содержат его, ибо его
количество сокращается в обеих частях
уравнений и в явном виде не появляется.
В связи с этим соотношения материаль-
ного баланса представятся уравнениями
(IX. 6)
gn + tXn + 1 = @пУп Д' R%R‘ (IX. 7)
Фиг. 113. Схема от-
гонной колонны, ра-
ботающей с перегре-
тым водяным паром.
Из уравнений (IX. 6) и (IX. 7) можно определить веса паро-
вого и жидкого потоков в текущем межтарелочном отделе-
нии отгонной колонны, отнесенные к единице веса ее нижнего
продукта:
(!Х-8) • (IX. 9)
Уп К Уп Хп+ 1
Уравнение теплового баланса того же объема колонны
представится следующим образом:
gn+iqn + \ + (В' + zRiR) = GnQn + #qR Д- zin. (IX. 10)
Величина B = B'-\-zrIr, стоящая в левой части уравнения
(IX. 10), обозначает количество тепла, вводимое в низ колонны
с перегретым водяным паром и каким-нибудь другим способом.
если одного перегрева водяного пара оказывается недоста-
точно для осуществления запроектированного режима работы
колонны.
Чтобы упростить методику последующих расчетных опера-
ций, уравнение (IX. 10) можно преобразовать к виду, симме-
тричному с уравнением (IX.7) материального баланса, введя
обозначения
Qn=Qn + c" in, (IX. 11)
(IX. 12)
Тогда уравнение (IX. 10) представится в следующем, более
удобном для оперирования виде:
gn + i<Jn +1 = GnQn + ROi (IX. 13)
Сочетая уравнения (IX. 13) и (IX. 6), можно выразить отно-
сительные веса парового и жидкого потоков в текущем меж-
тарелочном отделении отгонной колонны через тепловые пара-
метры:
йп +1 __ Qn
R ?«4-1 ’
(IX. 14)
Gn = 4п + 1~в1'
R Qn'~9n + i'
(IX. 15)
Сопоставление уравнений (IX. 8) и (IX. 14) или уравнений
(IX. 9) и (IX. 15) позволяет установить соотношения, связываю-
щие веса, составы и теплосодержания фаз, пересекающих один
и тот же межтарелочный уровень отгонной колонны. Поскольку
эти соотношения совершенно эквивалентны, можно ограни-
читься рассмотрением только одной их комбинации:
gn + l _ Уп~ХЯ __ Qn'-ei'
R yn~xn+i Qn' — ^n+i
(IX. 16)
Уравнения типа (IX.16) называются уравнениями концен-
траций отгонной колонны и являются основными расчетными
соотношениями, позволяющими по составу, весу и теплосодер-
жанию одного из потоков определить свойства, а следова-
тельно, и состояние встречного с ним в одном межтарелочном
отделении другого потока.
Для выяснения картины процесса ректификации в отгон-
ной колонне следует начать с рассмотрения явлений в самой
нижней ее части. Флегма с нижней тарелки колонны по-
ступает в кипятильник, где за счет ввода перегретого водя-
ного пара, а в некоторых случаях еще и подачи дополни-
тельного тепла В' подвергается однократному частичному
Анализ работы перегретого пара в отгонной колонне 391
испарению. Здесь же образовавшиеся углеводородные пары GR
отделяются от остаточной жидкой фазы А*, отводимой из
кипятильника в качестве нижнего целевого продукта. Пары GR
в смеси с перегретым водяным паром поднимаются как паро-
вое орошение на первую тарелку колонны.
Система, разделяющаяся в кипятильнике колонны на нахо-
дящиеся в равновесии пары GR и жидкий остаток А, состоит
из трех компонентов a, w и z, из которых первые два при-
сутствуют в обеих фазах, а третий только в паровой фазе.
Как указывалось выше, такая двухфазная трехкомпонентная
система для реализации равновесного состояния нуждается
в фиксировании трех интенсивных свойств. Любая совокуп-
ность любых трех интенсивных свойств рассматриваемой си-
стемы характеризует какое-то одно, вполне определенное
и единственное равновесное ее состояние. Интенсивными
свойствами этой системы, которыми может задаваться проекти-
ровщик, рассчитывающий колонну, являются температура
системы составы: жидкой и паровой yR равновесных фаз,
суммарное давление р, развиваемое компонентами системы,
парциальное давление pz перегретого водяного пара или пар-
циальное давление раи> углеводородов, относительное коли-
чество перегретого водяного пара и т. д.
Исходя из соображений практической целесообразности,
при расчете отгонной колонны рекомендуется задаваться
общим давлением р паров системы, температурой tR и соста-
вом нижнего продукта. Следует еще раз напомнить, что выбор
тех или иных независимых свойств в качестве степеней сво-
боды теоретически совершенно произволен, но каждая кон-
кретная рассматриваемая проблема может характеризоваться
своими особенностями, делающими ту или иную комбинацию
свойств особенно удобной в качестве фиксированных степеней
свободы. Так, в рассматриваемом случае отгонной колонны
при данном давлении р температура tR выбирается так, чтобы
избежать разложения углеводородов внизу колонны, а со-
став Хц принимается в соответствии с требованиями, предъяв-
ляемыми к чистоте нижнего продукта.
Как только приняты те или иные значения этих свойств,
состояние равновесной системы в кипятильнике становится
строго определенным и единственным и все остальные ее
свойства уже могут быть установлены расчетным путем.
Последовательность стадий расчета такова. При выбранной
температуре определяются тем или иным способом упру-
гости паров и Р2 компонентов системы а и w и по их
р
отношению определяется коэффициент обогащения т —
392 Ректификация в присутствии перегретого водяного пара
Состав yR паров, равновесных остатку, определяется под-
становкой состава xR остатка в уравнение равновесия
Найденный состав yR пересчитывается из весовых единиц
в молярные и по уравнению изотермы паровой фазы
<1х-18>
рассчитывается суммарная упругость paw углеводородных
паров Gr. Парциальная упругость pz перегретого водяного
пара в смеси с углеводородными парами определяется по раз-
ности
Pz~P Раи>- (IX. I9)1
По составу yR определяется молекулярный вес Му паров GRt
и по уравнению (IX. I) рассчитывается значение относитель-
ного веса водяного пара в смеси паров, поднимающихся из
кипятильника на первую тарелку колонны.
Таким образом, определяются все имеющие существенное
значение интенсивные свойства равновесной системы в кипя-
тильнике колонны. Однако установление состояния равновес-
ной системы внизу колонны еще вовсе не определяет режима
ее работы. В самом деле, для определенности работы колонны
необходимо знать еще, например, вес перегретого водяного
пара, вводимого в низ колонны, или парового орошения GR,
поднимающегося на первую тарелку, или вес флегмы glt сте-
кающей в низ колонны, а эти экстенсивные свойства не могут
быть выведены из характеристики рассматриваемой равновес-
ной системы, ибо с точки зрения правила фаз не имеют зна-
чения для ее равновесия.
Неизвестны также температура состав х1; вес флегмы gt
и относительное количество тепла В//?, вводимое в кипятиль-
ник колонны с водяным паром и через нагревательное устрой-
ство. Таким образом, довольно большое число факторов,
характеризующих режим работы колонны, все еще остается
неизвестным и из рассмотрения паро-жидкой равновесной
системы в кипятильнике их установить невозможно. Однако
перечисленные выше параметры процесса не являются неза-
висимыми, они довольно тесно связаны друг с другом, и, как
показывает более глубокое рассмотрение, принятие значений
любых двух из них позволяет сразу найти все остальные,
а тем самым и некоторый определенный режим из множества
возможных вариантов работы отгонной колонны, отвечающих
выбранным условиям в ее кипятильнике.
Анализ работы перегретого пара в отгонной колонне
393
Одним из произвольно принимаемых параметров рекомен-
дуется температура флегмы glt поступающей в кипятильник;
выбор именно этого фактора объясняется следующими сообра-
жениями. По смыслу происходящего в кипятильнике процесса
частичного испарения флегмы gx здесь должно затрачиваться
определенное количество тепла, идущее на возмещение скры-
той теплоты образующихся паров GR.
Если при этом единственным теплом, подводимым в кипя-
тильник, является тепло избыточного перегрева водяного пара,
то ввиду его сравнительной незначительности оно не покрывает
всей потребности процесса однократного испарения и последнее
не могло бы иметь места, если бы температура флегмы не
была выше температуры в кипятильнике. В результате процесса
однократного испарения флегма g± охлаждается и принимает
температуру остатка. Аналогичное рассуждение показывает, что
температура /2 на второй тарелке должна быть выше темпера-
туры tY на первой тарелке, на третьей тарелке больше, чем на
второй, на четвертой больше, чем на третьей и т. д. В этом
случае в отгонной колонне устанавливается положительный
градиент температуры по направлению снизу вверх. Как ука-
зывает А. М. Трегубов, такой обращенный по сравнению с обыч-
ным градиент температуры препятствует эффективной ректифи-
кации. Однако путем подвода в кипятильник достаточного коли-
чества тепла В' можно добиться условий, при которых флегма gY
будет иметь любую желательную температуру. Опыт показы-
вает, что оптимальные условия отвечают равенству темпера-
тур G флегмы и tR остатка. Конечно, можно подать в кипятиль-
ник больше тепла В' и снизить температуру ниже tR, но
в этом случае на первой тарелке понизится суммарная упру-
гость раиг углеводородных паров, уменьшится вес парового оро-
шения и нарушится работа колонны. Исходя из изложенного,
рекомендуется принимать температуру на первой тарелке та-
кой же, как и в кипятильнике. В обычной ректификационной
колонне, разделяющей бинарную смесь в отсутствии перегре-
того водяного пара, это равенство ti = tR могло бы не быть,
но в рассматриваемом случае оно вполне возможно вследствие
присутствия перегретого водяного пара. Поэтому в обыч-
ных колоннах поступают наоборот, задаваясь количеством
тепла В, вводимого в кипятильник, определяют режим ко-
лонны,
В качестве второго фактора, которым необходимо задаться
для определенности режима работы колонны, рекомендуется
принимать расход водяного пара, отнесенный к единице веса
нижнего целевого продукта колонны. Значения этого фактора
следует выбирать, сообразуясь с данными практики и конкрет-
ными условиями заданного разделения.
'^QZ D n tiniieiiTArntiii nflnn^nornori qn^<iun?n tinner
Как только приняты те или иные значения температуры /х
-флегмы, стекающей в кипятильник, и расхода z/R перегретого
водяного пара, вводимого в низ колонны, режим работы ко-
лонны полностью определяется и все показатели его могут быть
определены расчетным путем. Последовательность стадий рас-
чета такова.
По принятому весу z/R вводимого в низ колонны перегре-
того водяного пара и по найденному ранее по уравнению (IX. 1)
его относительному содержанию z/GR в парах, поднимающихся
на первую снизу тарелку колонны, рассчитывается вес этих
ларов согласно уравнению
gr _ £
R ~R ‘ 2
(IX. 20)
Вес встречной флегмы glt стекающей с первой тарелки в ки-
пятильник, на основании уравнения (IX.6)
Состав флегмы g1 теперь легко может быть определен по
известному составу паров GR при помощи уравнения кон-
центраций (IX. 16):
= (Г» -*„)• (IX. 21)
Зная состав флегмы glt можно по принятому значению тем-
пературы найти ее теплосодержание qy и по уравнению кон-
центраций (IX. 16) рассчитать тепловой параметр 0/, играющий
важную роль в последующих расчетах:
(IX- 22)
Сочетание уравнений (IX. 12) и (IX. 22) позволяет установить
расход тепла в кипятильнике отгонной колонны, отвечающий
выбранному режиму ее работы:
= | = (Q/ - 71) - (Qr' - qR). (IX. 23)
Когда температуры С и tR равны, учитывая близость соста-
вов Xj и xR, можно считать приблизительно равными и тепло-
содержания qx флегмы gL и qR остатка R и уравнение (IX. 23)
•приходит к виду
(IX. 24)
Анализ работы перегретого пара в отгонной колонне
395
Так устанавливаются параметры процесса для низа колонны
и ее первого межтарелочного отделения. Дальнейшие этапы
расчета состоят в последовательном переходе от одного меж-
тарелочного отделения колонны к другому снизу вверх с опре-
делением на каждом горизонтальном уровне колонны темпе-
ратур и составов встречных паровых и жидких потоков. Во вто-
ром отделении колонны, расположенном между первой и второй
тарелками, определение элементов ректификации ведется сле-
дующим образом. По составу хх флегмы g, и по ее температуре Д
при помощи уравнения равновесия (IX. 17) рассчитывается со-
став уг паров О1( поднимающихся с первой тарелки. Найденный
состав уг пересчитывается из весового в молярный и опреде-
ляются средний молекулярный вес паров Му и их парциальное
давление paw по уравнению изотермы паровой фазы (IX. 18).
Далее по уравнению (IX.1) рассчитывается относительное со-
держание водяного пара в смеси с углеводородными, а по урав-
нению (IX. 20) подстановкой соответствующих величин опре-
деляется вес паров поднимающихся с первой тарелки:
Gj. _ z О,
R - ~R ' ~ '
Вес g2fR флегмы, стекающей со второй тарелки, очевидно,
на единицу больше. Состав флегмы g2 определяется по составу yY
встречного пара при помощи уравнения концентраций (IX. 21)
с подстановкой величин, отвечающих второму отделению ко-
лонны:
х-2=Д1 —-^0'1
Остается определить теплосодержание и температуру флег-
мы g2. Для этого уравнение концентраций (IX. 16) решается
в отношении теплосодержания жидкой фазы и в него подстав-
ляются элементы ректификации, относящиеся ко второму меж-
тарелочному отделению:
-Ю- (IX. 25)
52
Температура /2 на второй тарелке определяется по найден-
ному теплосодержанию флегмы g2 при помощи соотношения
Л $2
2~ сртп ~ сах* +М1— хг)
Расчет всех остальных отделений отгонной колонны ничем
не отличается от расчета ее второго отделения и ведется по
тем же формулам, в которые лишь каждый раз необходимо
подставлять элементы ректификации, относящиеся к рассма-
триваемому межтарелочному отделению. Поднимаясь снизу
39fi PpICTIIfhnK‘/‘ii1liq ° niMiMITCTtVIl! RQfl Яь'Л “’-О
вверх по высоте отгонной колонны и последовательно опре-
деляя веса, составы и температуры паровых и жидких потоков
на ее тарелках, можно получить полное представление о харак-
тере работы колонны при условиях, которые были заданы
проектировщикам, принявшим условия существования (р, tR
и xR) равновесной системы в кипятильнике и назначившим
определенный режим (tlt в первом межтарелочном отделе-
нии колонны. Понятно, что эти пять величин теоретически
могут варьировать в весьма широких пределах, и это подчер-
кивает известную неопределенность в установлении режима
работы колонны. Очевидно, оптимальный режим отвечает наи-
более экономичным условиями работы и должен определяться
технико-экономическим сравнением ряда вариантов.
Однако из предыдущего анализа работы отгонной колонны
не выяснено, наступает ли в ходе последовательного подъема
по высоте колонны такой ее уровень, на котором прекращается
ее ректифицирующая способность. Хорошо известно, что в обыч-
ной отгонной колонне, работающей в отсутствие перегретого
водяного пара, каждому определенному расходу тепла в кипя-
тильнике отвечает вполне определенная пара равновесных, так
называемых предельных составов, превзойти которые на верху
колонны невозможно ни при каком числе тарелок. Отвечающий
предельным концентрациям расход тепла в кипятильнике
является тем минимальным значением его, которое теорети-
чески совместимо с желательной работой идеальной отгонной
колонны, на верху которой составы встречных фаз прини-
маются совпадающими с предельными. Иногда с предельными
концентрациями сопоставляются не минимальные расходы тепла
в кипятильнике, а минимальные веса идущих по колонне по-
токов паров и жидкости. Так или иначе, каждому определен-
ному назначенному режиму работы обычной отгонной колонны
отвечает вполне определенный предел обогащения фаз, пред-
ставляемый соответствующей парой равновесных составов,
который ни при какой высоте колонны при неизменности ре-
жима ее работы не может быть превзойден.
Естественно задаться вопросом, справедливо ли то же са-
мое и для отгонной колонны, работающей в присутствии пере-
гретого водяного пара или нейтрального газа. При переходе
с каждой нижележащей на следующую тарелку отгонной сек-
ции состав фаз обогащается низкокипящим компонентом и
вначале медленно, а затем все быстрее возрастает температура.
Вследствие направленного снизу вверх положительного гра-
диента температуры и состава по низкокипящему компоненту
возрастает от тарелки к тарелке суммарная упругость раи>
углеводородных паров и соответственно согласно уравнению
(IX. 19) понижается упругость pz водяного пара. Определяемое
Расчет отгонной колонны, работающей с перегретым паром 397
условиями материального и теплового баланса колонны нарас-
тание упругости паров раа> имеет предел общее давление па-
ров системы р, достичь или превзойти которое этот параметр
не должен ни при каких обстоятельствах. В самом деле, уже
при Paw~ р согласно уравнению (IX. 1) относительное коли-
чество водяного пара в смеси паров в равновесной системе
равно нулю, что противоречит исходным условиям. Так уста-
навливается тот верхний предел обогащения составов при дви-
жении по отгонной колонне снизу вверх, который для каж-
дого запроектированного режима ее работы ни при каких
условиях не может быть превзойден. Собственно этот предел
является чисто теоретическим, практически же следует оста-
навливаться на одну тарелку ниже того уровня, на котором
он достигается или на котором оказывается превзойденным.
Явления же, аналогичного бесконечно замедляющемуся
обогащению фаз при приближении к предельным равновесным
концентрациям, характерного для идеальной отгонной колонны,
работающей в отсутствии перегретого водяного пара, в рас-
сматриваемом слу'кь? Iк? наблюдается . В этом состоит корен -
ное различие этих двух случаев работы отгонной колонны.
Для иллюстрации высказанных положений необходимо рассмо-
треть конкретный пример расчета отгонной колонны.
§ 4. Пример расчета отгонной колонны, работающей
в присутствии перегретого водяного пара
Пусть требуется произвести в отгонной колонне в присутствии перегре-
того водяного пара разделение начальной жидкой системы я-гептан — энде-
кан, для которой в курсе А. М. Трегубова [13] имеются подробные данные
по упругостям насыщенных паров. Теплосодержания жидких и паровых фаз
для этой системы можно определять по таблицам, опубликованным Б. П. Вои-
новым. Теплосодержания перегретого водяного пара принимаются по соот-
ветствующим справочным данным.
Согласно доказанному выше проектировщик может принять в качестве
исходных данных значения трех степеней свободы равновесной жидко-па-
ровой системы в кипятильнике колонны. Задано общее давление паров си-
стемы р = 760 мм рт. ст., температура ее tR = 120° и состав жидкой фазы
Хд = 0,02. Принятая совокупность значений р, и xR, конечно, является
не единственно возможной, ибо любые три значения этих параметров, не
выходящие за пределы, нарушающие число фаз системы, определят некото-
рое вполне возможное ее состояние. Однако при выборе значений этих
свойств системы следует руководствоваться соображениями экономической
целесообразности и, например, произвольно не увеличивать или не умень-
шать давление р против атмосферного, когда в этом нет прямой необходи-
мости. С другой стороны, состав х^ целевого продукта тоже бывает большей
частью назначен, так что основным варьирующим фактором остается лишь
температура tR системы, задаваться которой в известных, указанных выше
пределах также следует, не упуская из поля зрения вопросов экономичности
проектируемого процесса.
Принятием значений трех ее параметров полностью определяется состо-
яние равновесной системы в кипятильнике колонны, и значения всех
ЧОЯ
Pn^'curhuKatitiя a пписцтствнп нгпггпетого водяного папа
остальных ее свойств могут быть установлены уже расчетным путем.
Прежде всего по уравнению равновесия следует найти состав паровой фазы
рассматриваемой равновесной системы, жидкая фаза которой имеет состав
хк = 0,02. При температуре системы 7^=120° упругости насыщенных паров
ее компонентов соответственно равны Рх = 1367 мм и Р, = 80 мм рт. ст.
Коэффициент обогащения т по уравнению (Ш. 58) равен: т = 1367 :80= 17,1.
Состав паровой фазы, поднимающейся с низа колонны на ее первую тарелку,
по уравнению (IX. 17)
17,1x0,02
^ = -1 +'1б~Гх W=°’2,J9-
Молекулярные веса компонентов системы соответственно равны Л4а=Ю0
и Mw= 156. Для последующих расчетов необходимо пересчитать весовой со-
став yR в молярный yR'. Пересчет ведется по известной формуле
1
“ 100 / 1______
1 + 156 \ 0,259
Средний молекулярный вес паров G^
Му = 100 X 0,353 + 156 X 0,647 = 136,3.
Парциальное давление углеводородных паров в смеси с водяным пере-
гретым паром определяется по уравнению (IX. 18)
1367
Paw- j + (1 —0,353) (17,1 — 1) 119 ММ рт‘ СТ'
Парциальное давление р2 перегретого водяного пара по уравнению
(IX. 19) равно:
рг = 760— 119 = 641 мм рт. ст.
Относительное содержание водяного пара в смеси паров, поднимающихся
из кипятильника, определяется по уравнению (IX. 1):
^18 = 0,711.
2
71 д— 119 X 136,3
На данной стадии расчета полностью определены все имеющие суще-
ственное значение для рассматриваемой проблемы свойства равновесной
системы в кипятильнике колонны, и поэтому следует перейти к выбору двух
дополнительных параметров для установления того или иного режима работы
отгонной колонны. Исходя из соображений, высказанных ранее, и задаваясь
целью хотя бы в первом отделении колонны обеспечить изотермические
условия работы, целесообразно принять температуру флегмы, стекающей
с первой тарелки, равной температуре равновесной системы в кипятильнике,
/1 = /д = 120°. В качестве второго параметра принимается расход водяного
пара, отнесенный к единице веса нижнего продукта колонны, 2/7? = 0,06.
Теперь уже режим работы колонны полностью определен и задача состоит
в определении элементов ректификации во всех ее межтарелочных отделе-
ниях.
По известному расходу г/7? перегретого водяного пара при помощи
уравнения (IX. 20) рассчитывается вес углеводородных паров, поднимающихся
из кипятильника:
G г, 0,06
_R = —_______= 0,0844.
R 0,711
Расчет отгонной колонны, работающей с перегретым паром
399
Вес встречной флегмы gi//?, очевидно, равен 1,0844. Состав хх встреч-
ной флегмы определяется по уравнению концентраций (IX. 21):
Xj= 0,259
0,259 — 0,020
1,0844
= 0,039.
Зная составы и температуру флегмы gx и нижнего продукта колонны,
можно определить их теплосодержания в жидкой фазе. Ввиду весьма незна-
чительной разницы в составах этих жидких потоков их теплосодержания-
практически одинаковы и равны ^/? = ^1 = 62,7 ккал)кг.
Для нахождения теплового параметра 0/ необходимо предварительно
рассчитать Теплосодержание перегретого водяного пара при темпера-
туре 120° 1^ = 649,5 ккал)кг. Теплосодержание единицы веса углеводород-
ных паров Gр при 120° по данным таблиц Б. П. Воинова = 138,8 ккал[кг..
Тепловой параметр QR' рассчитывается по уравнению (IX. 11):
Q R' = 138,8 + 0,711 х 649,5 = 600 ккал!кг.
Далее по уравнению (IX. 22) рассчитывается тепловой параметр 0/:
0/ = 600 — 1,0844(600 —62,7)= 17 ккал!кг.
Расход тепла в кипятильнике на основании уравнения (IX.12) опреде-
литсзг равным
— 17 = 45,7 ккал!кг остатка.
Так устанавливаются все параметры процесса для низа колонны и ее
первого межтарелочного отделения и можно перейти к расчету второго ее
отделения, расположенного между первой и второй тарелками.
Состав у1 пара, поднимающегося с первой тарелки, определяется по
уравнению (IX. 17) из условия равновесия с флегмой gx. Имея в виду, что
температура на первой тарелке та же, что и в кипятильнике, в уравне-
ние (IX. 17) подставляем ранее установленное значение коэффициента обога-
щения m = 17,1:
17,1 nni
У1~ 1 — 0,039 - 0’411-
1/3 + 0,039
Пересчет в молярную концентрацию дает значение у/= 0,522. Средний
молекулярный вес паров G1: поднимающихся с первой тарелки, Му = 127,
а их парциальное давление в смеси с перегретым водяным паром опреде-
ляется по уравнению (IX. 18):
1367 ie-7
Paw j + (1 _о,522) (17,1 — 1) — 157 ММ РТ’ СТ’
Парциальное давление водяного пара р2 = 760 — 157 = 603 мм рт. ст.
Относительное содержание водяного пара в смеси с углеводородными парами»
поднимающимися с первой тарелки, рассчитывается по уравнению (IX. 1):
г _ х I3 _ о 545
Gx “157x127 -и’й4й-
Веса паров, поднимающихся с первой тарелки, и встречной им флегмы»
стекающей со второй тарелки, соответственно равны
R 0,545 “U, i R 0,11+ 1 1,11.
Состав флегмы g2 определяется по составу у1 = 0,411 встречного пара
подстановкой надлежащих величии в уравнение (IX. 21):
0,411 —0,020
х2 = 0,411--------j-j-j-l-= 0,058.
Теплосодержание единицы веса паров G, при 120° Qi = 139,4 ккал/кг.
По уравнению (IX. 11) рассчитывается для них величина Q/:
Q/ = 139,4 + 0,545 х 649,5 = 493,4 ккал]кг,
и по уравнению (IX. 25) определяется теплосодержание единицы веса флегмы,
стекающей со второй тарелки:
493,4— 17 л
^2 = 493,4------—----=65,4 ккал)кг.
Температура С на второй тарелке рассчитывается по уравнению (IX. 26)
по значениям теплоемкостей чистых гептана и эндекана, соответственно
равных са =0,543 ккал/кг °C и сш = 0,525 ккал!кг °C:
65,4
/ —________________1222_____________=124°
2 0,543 х 0,058 + 0,525 (1 - 0,058)
Определением температуры на второй тарелке завершается расчет
второго межтарелочного отделения колонны. Уместно обратить внимание
на повышение температуры при переходе от первой ко второй тарелке.
Расчет третьего и остальных отделений колонны ведется через те же после-
довательные ступени и по тем же уравнениям, что и расчет второго отделе-
ния, и поэтому результаты последующих расчетов приведены в табл. 24.
На третьей тарелке уже достигнут уровень отгонной колонны, выше
которого не удастся подняться. Чтобы в этом убедиться, достаточно рассчи-
тать температуру, которая должна была бы быть на вышележащей тарелке,
и состав флегмы, с нее стекающей.
Пар, равновесный фдегме g4, при температуре 139° должен иметь состав у4,
определяемый уравнением равновесия. При этой температуре Рг = 2181 мм,
Р2 = 158,2 мм рт. ст. и т= 13,78, следовательно,
13,78
у4 =------—---------= 0,682.
13178 + ^ГЗ.Т~
Молярная концентрация этого пара у4'=0,771, а его молекулярный
вес Му = 112,8. Парциальное давление углеводородных паров в смеси с водя-
ными
2181
Ра'»~ 1 + (1 _ 0,771) (13,78— 1) ~'555 ММ рТ' СТ'
Относительное содержание водяного пара в смеси с углеводородными
2 : 215 х 18 —Q 062
Gi 555x 112,8 ’
Веса пара, поднимающегося с четвертой тарелки, и флегмы, на нее сте-
кающей, равны
^- = ^1 = 0,968 и А = 0,968 4-1 = 1,968.
26 Зак. № 304.
/-я ступень контакта и о к* Pi, мм рт. ст. Р2, мм рт. ст.
Кипятильник .... 120 0,020 1367 80
Тарелка 1 120 0,039 1367 80
2 124 0,058 1521,4 94
3 127 0,085 1637,2 104,5
f-я ступень контакта bi 6" Я • + ’з + •г»
Кипятильник .... 0,711 0,0844 1 1,0844 0,039
Тарелка 1 0,545 0,110 1,110 0,058
2 0,380 0,158 1,158 0,085
3 0,239 0,251 1,251 0,135
Таблица 24
£ Paw< мм рт. ст. pzi, AfM рТ. СТ.
17,1 0,259 0,353 136,3 119 641
17,1 0.411 0,522 127 157 603
16,2 0,500 0,610 120,2 215 545
15,65 0,593 0,693 117 298 462
Продолжение
ккал/кг - -- J ‘/Й <7i+1, ккал!кг и -к
138,8 649,5 600 1 62,7 120
139,4 649,5 493,4 65,4 124
142,0 651,4 389 67,0 127
143,9 653,5 299,9 73,9 139
Расчет отгонной колонны, работающей с перегретым паром
p s,VTUfhlfVfHIII <j Q nnf!Г11ТГ'ГС>111' П/1ЛРЭГ)РТЛ?Л г-пЛ(1иГ>РП y»/7’?O
Состав этой флегмы по уравнению концентраций
х6= 0,682
0,682-0,020
-----Гда— =0’346-
Фиг. II4. Линия концентра-
ций отгонной колонны, ра-
ботающей с перегретым во-
дяным паром.
Теплосодержание единицы веса паров при
/4 = 139° составляет Q4= 148,6 ккал)кг, а теп-
лосодержание водяного перегретого пара /4 —
= 659,4 ккал/кг, поэтому
Q4' = 148,6 + 0,062 х 659,4= 189,5 ккал} кг.
Теплосодержание флегмы, которая должна
была бы стекать на четвертую тарелку, опре-
деляется по уравнению (IX. 25):
?Б = 189,5 - -189.’5 ~ - = 101,8 ккал/кг.
1 ,УОо
Теплоемкости углеводородов равны са =
= 0,552 и cw = 0,572 ккал!кг °C. Температура
флегмы определится по уравнению (IX. 26):
. =_____________Ю1.8____________=]Я2=
5 0,572 х 0,346 + 0,552 (1 — 0,346)
тогда как температура насыщения жидкости,
имеющей состав х5 = 0,346, значительно ниже
и составляет — 125°.
Таким образом, четвертая тарелка рас-
сматриваемой отгонной колонны совершенно
нереальна в запроектированных условиях, и
для нормальной работы колонны необходимо
ограничиться только тремя теоретическими
тарелками, подавая на верхнюю тарелку сырье
состава а = х4 = 0,135 при температуре ti = 139°.
Веса нижнего продукта и верхних паров
колонны определятся тогда уравнениями
(IX. 4) и (IX. 5):
_D _ Q135-Q020_
L ~ 0593 —0,020 ’
и
R _ 0,593-0,135
L 0,593 -0,020 ’
Результаты расчета дают полную картину изменения составов жидких
и паровых потоков по высоте отгонной колонны при выбранном режиме ее
работы.
По данным табл. 24 может быть построена кривая равно-
весия фаз для отгонной колонны и по точкам проведена линия
концентраций для нее. Легко убедиться, что линия концентра-
ций на фиг. 114 обращена своей выпуклостью в сторону оси
ординат. Ступенчатое построение на фиг. 114 повторяет стадии
проведенного выше аналитического расчета.
Для сырья, имеющего состав, меньший а = 0,135, число
теоретических ступеней контакта может быть найдено интер-
Анализ работы перегретого пара е укрепляющей колонне
40.3
полицией данных предыдущего расчета. Для сырья, имеющего
более высокий начальный состав, необходимо выбрать другой
режим работы колонны, что не представит особого труда в свете
разъяснений, приведенных в § 3.
§ 5. Анализ работы перегретого водяного пара
в укрепляющей колонне
Присутствие перегретого водяного пара в укрепляющей
колонне в значительном большинстве случаев является неиз-
бежным следствием его ввода в низ отгонной секции, откуда
он с верхними парами подается на нижнюю тарелку укрепляю-
щей колонны. Так, например, перегретый водяной пар, подаю-
щийся в отпарные секции нефтеперегонной колонны, вместе
с отогнанными легкими фракциями направляется в укрепляю-
щие ее секции. Однако водяной пар или нейтральный газ могут
содержаться в паровом сырье укрепляющей колонны и по чисто
технологическим причинам, как, например, в колонне крекинг-
установки, где образовавшийся в процессе разложения газ
играет роль компонента, присутствующего только в паровой
фазе и лишь этим путем воздействующего на условия равно-
весия системы. Так или иначе, ректификация углеводородной
смеси в укрепляющей колонне в присутствии перегретого водя-
ного пара или нейтрального газа является довольно распро-
страненным процессом на нефтезаводах, поэтому изучение осо-
бенностей работы перегретого пара в укрепляющей колонне
существенно для нефтяников.
Влияние водяного перегретого пара на процесс ректифика-
ции в укрепляющей колонне до известной степени аналогично
его роли в отгонной колонне, но аналогия эта лишь частичная,
и для выяснения полной картины необходимо детально проана-
лизировать работу укрепляющей колонны. При этом метод ана-
лиза и основные соотношения сохраняются те же, что и при-
менявшиеся в § 3 при рассмотрении работы перегретого водя-
ного пара в отгонной колонне.
Пусть в укрепляющей колонне в присутствии перегретого
водяного пара требуется разделить исходную паровую бинар-
ную систему, состоящую из углеводородов а и w, на практи-
чески чистый низкокипящий компонент а, уходящий с верха
в паровой фазе, и жидкий продукт определенного, ранее на-
значенного состава xR, отводимый с нижней тарелки.
Материальные балансы всего объема укрепляющей колонны
по общему весу входящих и выходящих потоков и по весу
содержащегося в них низкокипящего компонента представятся
уравнениями, по виду тождественными уравнениям, получен-
ным в § 3 при анализе отгонной секции:
L—D + R; (IX. 27) La = DyD + RxR. (IX. 28)
26*
Сочетая уравнения (IX. 27) и (IX. 28), можно определить веса
целевых продуктов колонны, отнесенные к единице веса исход-
ной паровой системы:
R _ Ур~а
L Ур XR
(IX. 30)
Для получения основных соотношений, связывающих веса
и составы встречных на одном уровне укрепляющей колонны
потоков флегмы и паров, составляются уравнения материаль-
ного и теплового балансов для объема колонны, заключенного
между верхом ее и некоторым текущим межтарелочным уров-
нем. В уравнения материального баланса водяной пар не вхо-
дит, ибо его неизменное количество сокращается из приходной
и расходной частей этих уравнений, имеющих вид:
Gn + l=gn+D- (IX. 31)
Gn + iyn + t=gnXn + DyD. (IX. 32)
Номера тарелок укрепляющей колонны отсчитываются
сверху вниз. Из уравнений (IX. 31) и (IX. 32) можно определить
веса парового и жидкого потоков в любом межтарелочном
отделении укрепляющей колонны, отнесенные к единице веса
ее верхнего продукта:
4- = -°—(IX. 34)
D Уп-1--хп ' ’
Уравнение теплового баланса того же объема колонны пред-
ставится следующим образом:
Gn + iQn + i + 2z'n + i = g„qn + DQD + zl D + d. (IX. 35)
Чтобы упростить методику последующих расчетных опера-
ций, уравнение (IX.35) следует преобразовать к виду, симмет-
ричному с уравнением (IX. 32) материального баланса, введя
следующие обозначения:
Q'n + i=Qn ++д— Ч + i! (IX. 36)
ип +1
^' = Qp + -^p + i-- (ix. 37)
При помощи этих обозначений уравнение (IX. 35) предста-
вится в следующем, более удобном для последующих выводов
и расчетов виде:
Gn + lQ'n + l=gnqn + D02’. (IX. 38)
Анализ работы перегретого пара в укрепляющей колонне 405
Сочетая уравнения (IX. 31) и (IX. 38), можно выразить отно-
сительные веса парового и жидкого потока в любом межтаре-
лочном отделении укрепляющей колонны через тепловые пара-
метры:
£п _ — <?л + 1
Л ^4-1— Чп
°п4-1 °2' Чп
D Qn + t—Чп
Из уравнений (IX. 34) и (IX. 39) или уравнений (IX. 33) и (IX. 40)
можно установить соотношения, связывающие веса, составы и
теплосодержания фаз, пересекающих один и тот же межтаре-
лочный уровень укрепляющей колонны. Поскольку получаю-
щиеся соотношения эквивалентны, можно рассмотреть только
одну их комбинацию:
4?^.- а-,-у .(1X41)
U У п -Ч х п Q п ^ — <1 -----
Уравнения (IX. 41) называются уравнениями концентраций
укрепляющей колонны и являются основными расчетными соот-
ношениями, позволяющими по составу, весу и теплосодержа-
нию одного из потоков определить свойства, а следовательно,
и состояние другого потока, встречающегося с ним в одном
межтарелочном отделении. Для выяснения картины процесса
ректификации в укрепляющей колонне удобнее всего начать
с рассмотрения самой верхней ее части. При этом следует
иметь в виду, что в зависимости от свойств разделяемой си-
стемы и относительного количества перегретого водяного пара
верх колонны оборудуется или парциальным конденсатором,
или конденсационным устройством для обеспечения острого
орошения (см. фиг. 85 и 86).
Выбор того или иного способа образования жидкого оро-
шения диктуется необходимостью избежать на верху колонны
условий, при которых водяной пар может сконденсироваться и
вода вместе с орошением может попасть на тарелки колонны.
Очевидно, при малых относительных расходах водяного пара
и при сравнительно высоких температурах верха колонны при-
менение парциального конденсатора вполне возможно. Обяза-
тельное условие, которое при этом должно соблюдаться, состоит
в том, что парциальное давление водяного пара в парах ректи-
фиката должно быть меньше давления насыщения паров воды
при этой же температуре. Когда этому условию удовлетворить
не удается, необходимо отказаться от парциального конден-
сатора и оборудовать колонну конденсационно-холодильным
устройством для подачи острого орошения. Благодаря свойству
практически полной нерастворимости воды и углеводородов их
смесь после ожижения легко расслаивается и необходимое коли-
чество орошения подкачивается насосом на верхнюю тарелку
колонны.
Пусть рассматривается схема укрепляющей колонны, обо-
рудованной парциальным конденсатором. Пары Gx с верхней
тарелки колонны совместно с перегретым водяным паром по-
ступают в конденсатор, где за счет отнятия d ккал тепла под-
вергаются частичной конденсации. Здесь же жидкий конден-
сат g0 отделяется от остаточной паровой фазы D, отводимой
из конденсатора в качестве целевого продукта. Конденсат g0
подается на верхнюю тарелку колонны в качестве орошения.
Что касается перегретого водяного пара, то в конденсаторе он
лишь охлаждается от температуры tx паров Gx до темпера-
туры tD ректификата, но никоим образом не конденсируется,
так как согласно указанному выше его парциальное давление
должно оставаться ниже давления насыщения паров воды, от-
вечающего температуре tD ректификата.
Согласно правилу фаз трехкомпонентная двухфазная си-
стема, разделяющаяся в конденсаторе колонны на находящиеся
в равновесии пары ректификата в смеси с водяным паром и
на жидкий остаток — орошение, обладает тремя степенями сво-
боды. Любая совокупность любых трех интенсивных свойств
рассматриваемой системы характеризует какое-то одно, вполне
определенное и единственное ее равновесное состояние. Ин-
тенсивными свойствами этой системы, которыми может задаваться
проектировщик, рассчитывающий колонну, являются темпера-
тура /D системы, составы ее равновесных жидкой х0 и па-
ровой yD фаз, суммарное давление р, развиваемое компонентами
системы, парциальное давление pz водяного пара или парциаль-
ное давление раш углеводородов в паровой фазе, относительное
количество водяного пара и т. д.
Из перечисленных выше свойств системы теоретически
вполне достаточно зафиксировать любые три, и равновесное
состояние системы станет строго определенным и единствен-
ным. Однако каждая конкретная проблема может характери-
зоваться своими особенностями, делающими ту или иную ком-
бинацию свойств особенно удобной в качестве фиксированных
степеней свободы. В этом смысле не все интенсивные свойства
системы одинаково удобны, и поэтому рекомендуется при рас-
чете верха укрепляющей колонны как наиболее удобными за-
даваться суммарным давлением паров р, температурой tD рек-
тификата и его составом yD_
Как только приняты те или иные значения этих свойств,
состояние равновесной системы в конденсаторе становится строго
Анализ работы перегретого пара в укрепляющей колонне
407
определенным и единственным и все остальные ее свойства
уже могут быть установлены расчетным путем. Последова-
тельность стадий расчета такова. При выбранной температуре tD
определяются тем или иным способом упругости насыщен-
ных паров Рг и Р2 компонентов системы а и w и по их от-
ношению рассчитывается коэффициент обогащения tn. Со-
став х0 жидкого орошения, равновесного парам ректификата,
определяется подстановкой состава yD в уравнение равновесия:
(IX. 42)
х =____У______
m— (m— 1)у’
которое для удобства расчетов при больших значениях со-
става паровой фазы у преобразовано А. М. Трегубовым к виду
У
— У
х= ----<—
m i У
1-У
(IX. 43)
Пересчитав весовой состав ректификата в молярный, можно
по уравнению изотермы паровой фазы (IX. 18) рассчитать
упругость паров paw компонентов а и w. Парциальное давле-
ние р2 перегретого водяного пара в смеси с парами ректифи-
ката определяется по уравнению (IX. 19). Наконец, по уравне-
нию (IX. 1) рассчитывается относительное количество z/D пере-
гретого водяного пара в парах ректификата.
Таким образом определяются все имеющие существенное
значение интенсивные свойства равновесной системы в конден-
саторе колонны. Однако установление состояния равновесной
системы на верху колонны еще не определяет режима ее ра-
боты. В самом деле, для определенности работы колонны необ-
ходимо знать еще, например, веса жидкого орошения g0 или
паров поднимающихся с первой тарелки, а эти экстенсив-
ные свойства не могут быть выведены из характеристики рас-
смотренной равновесной системы, ибо с точки зрения правила
фаз являются факторами, безразличными для ее равновесия.
Неизвестны также температура и состав у± паров Glt
поднимающихся в конденсатор с первой тарелки, и относи-
тельное количество тепла d/D, отнимаемое в парциальном кон-
денсаторе. Таким образом, довольно большое число факторов,
характеризующих режим работы колонны, все еще остается
неизвестным, причем (и это самое важное) значения этих фак-
торов не могут быть установлены из рассмотрения паро-жидкой
равновесной системы в парциальном конденсаторе колонны.
Однако эти параметры процесса не являются независимыми,
а довольно тесно связаны друг с другом, и, как показывает
внимательное рассмотрение, принятие значения одного из них
408
Ректификация в присутствии перегретого водяного папа
позволяет сразу найти все остальные, а тем самым и неко-
торый определенный режим из множества возможных вариан-
тов работы укрепляющей колонны, отвечающих выбранным
условиям в ее парциальном конденсаторе.
Вследствие происходящего в конденсаторе процесса частич-
ного ожижения паров Gx, сопровождающегося образованием
паровой фазы, более богатой, и жидкой фазы, менее богатой
содержанием низкокипящего компонента, чем исходные пары,
их состав уг должен заключаться в интервале концентраций
хо<У1<Уо- этом интервале состав у± может принимать любое
значение, определяя тем самым некоторый возможный режим
работы колонны.
В указанном интервале концентраций можно задаваться
произвольным значением состава уг паров, поднимающихся
с первой тарелки укрепляющей колонны, устанавливая этим
некоторый вполне определенный режим ее работы. По приня-
тому составу уг при помощи уравнений (IX. 33) и (IX. 34) могут
быть рассчитаны веса G± паров, поступающих в конденсатор,
и флегмы g0', стекающей из него. Отсюда напрашивается вы-
вод о том, что можно было задаваться не составом ylt а на-
пример, относительными весами GJD или ggjD и использовать
уравнения (IX. 33) или (IX. 34) для нахождения отвечающего
этим весам состава ух. Таким образом доказывается полная
эквивалентность принятия любого из указанных факторов в ка-
честве параметра, определяющего режим работы колонны.
Используя так или иначе установленный вес паров G-JD,
можно определить относительное содержание перегретого водя-
ного пара 2/Gx в паровом потоке, поступающем в парциальный
конденсатор, при помощи соотношения
z г Д
G? “ D ' ‘Gx*
Уместно напомнить, что относительный вес z[D водяного
пара в ректификате был установлен при рассмотрении равно-
весной паро-жидкой системы в конденсаторе, состояние кото-
рой было определено тремя выбранными степенями свободы
A tD и yD.
Температура /х паров Gx неизвестна, но, зная их состав ух
и относительное содержание перегретого водяного пара z/G^
можно определить ее, принимая во внимание, что подстановка
найденных при этой температуре парциальных давлений раа, и
рг и параметра z/Gx в уравнение (IX. 1) должна обратить его
в тождество. Определение температуры /х ведется по необхо-
димости методом постепенного приближения. Задаваясь ее зна-
чением, находят соответствующие упругости насыщенных паров
компонентов а и w и по уравнению (IX. 18) рассчитывают их
парциальное давление раи> в смеси с перегретым водяным паром.
(IX. 44)
Анализ работы перегретого пара в укрепляющей колонне
409
Парциальное давление pz последнего определяется по уравне-
нию (IX. 19). Подстановка найденных при выбранной темпера-
туре значений paw м pz в уравнение (IX. 1) должна дать то же
самое значение относительного расхода z/Gj водяного пара,
которое было установлено расчетом по уравнению (IX. 44).
Если этого нет, то температура была выбрана неправильно
и требуется пересчет до полного совпадения значений z/Glt
определяемых уравнениями (IX. 1) и (IX. 44). Так определяется
температура паров, поступающих в парциальный конденсатор
укрепляющей колонны. Остается найти то тепло d/D, отнимае-
мое в конденсаторе, которое обеспечит сохранение выбран-
ного режима работы укрепляющей колонны. Предварительно
по уравнению концентраций (IX. 41) определяется тепловой
параметр в2', играющий важную роль в последующих расчетах:
02=qn + ^\Q'n + l-qn). (IX-45)
Полетав.Iяя в уравнение (IX. 45) вес GJD и теплосодержа-
ния q0 и Qi , относящиеся к первому межтарелочному отделе-
нию колонны, можно рассчитать значение 02', отвечающее вы-
бранному режиму ее работы.
Сочетание уравнений (IX. 37) и (IX. 45) позволяет установить
величину съема тепла в парциальном конденсаторе укрепляю-
щей колонны, отвечающую выбранному режиму ее работы:
4 = %- W - 9о) - 4 fD . (I х. 4 6)
В уравнение (IX.46) подставлены значения параметров про-
цесса, относящиеся к первому межтарелочному отделению ко-
лонны.
С определением тепла, отнимаемого к конденсаторе, уста-
навливаются все необходимые параметры процесса ректифика-
ции на верху укрепляющей колонны и в ее первом межтаре-
лочном отделении, отвечающие выбранному режиму ее работы.
Следует заметить, что другому значению состава у1г выбран-
ному в интервале концентраций х0<У1<Уо> будет отвечать
другое значение элементов ректификации и вообще другой
режим работы колонны. С другой стороны, и совокупность
определенных значений р, tD и yD, использованных в качестве
степеней свободы при установлении состояния равновесной
системы в парциальном конденсаторе, является не единственно
возможной их комбинацией и здесь, как мыслимо и множество
вариантов сочетания их различных значений. Таким образом,
устанавливается еще одна возможность варьирования режима
работы укрепляющей колонны.
Так устанавливаются параметры процесса для верха и пер-
вого межтарелочного отделения укрепляющей колонны. Даль-
нейшие этапы расчета состоят в последовательном переходе от
одного межтарелочного отделения колонны к другому сверху
вниз с определением на каждом горизонтальном уровне колонны
температур и составов встречных паровых и жидких потоков.
Во втором отделении колонны, расположенном между пер-
вой и второй тарелками, определение элементов ректификации
ведется следующим образом. По составу паров, поднимаю-
щихся с первой тарелки, и по их температуре А определяются
упругости f\ и Р2 углеводородных компонентов системы, рас-
считывается коэффициент обогащения и по уравнению равно-
весия (IX. 43) вычисляется состав хх равновесной этим парам
флегмы glt стекающей с первой тарелки на вторую. Дальней-
ший расчет ведется методом постепенного приближения. Удоб-
нее всего принимать значение относительного веса G2/D паров,
поднимающихся во втором межтарелочном отделении, и по-
следующим расчетом подтверждать его правильность. Итак,
пусть принято значение веса G2/D. Тогда состав у2 этих паров,
поднимающихся со второй тарелки, определится по уравнению
концентраций (IX. 41) с подстановкой в него величин, относя-
щихся ко второму отделению колонны:
У2=х1 + ^(уп-х1). (IX. 47)
Относительный вес z[G2 водяного пара в смеси паров, под-
нимающихся со второй тарелки, определится из очевидного
соотношения
Эта величина не сохраняет постоянного значения при пере-
ходе от одного межтарелочного отделения к другому и, как
показывает более глубокое рассмотрение, в общем случае при
переходе по колонне сверху вниз проявляет тенденцию к уве-
личению. Так как вес z перегретого водяного пара один и
тот же по всей высоте колонны, то следует заключить, что
переменный вес паров G имеет стремление понижаться по мере
перехода от выше расположенных отделений колонны к ее
отделениям, расположенным ниже. Это замечено А. М. Трегу-
бовым, отметившим, что веса жидких и паровых потоков воз-
растают к верху колонны.
Используя тепловой параметр в2, определенный по уравнению
(IX. 45) на основании данных расчета первого отделения колонны,
можно, преобразовав уравнение концентраций (IX. 41), рассчитать
приведенное теплосодержание Q2 паров G2 по соотношению
Q2' = ?1+-G7(e2'-?i). (IX. 49)
Анализ работы перегретого пара в укрепляющей колонне 411
По тепловому параметру Q2' на основании уравнения (IX. 36)
определяется температура t2 на второй тарелке колонны. Однако
эта температура еще должна быть проверена по соотношению
(IX. 1), которое и служит критерием правильности принятого
в расчете второго межтарелочного отделения веса паров G2!D.
По найденной температуре /2 определяются упругости насыщен-
ных паров чистых компонентов а и w, коэффициент обогащения,
весовая концентрация у2 пересчитывается в молярную и по урав-
нению изотермы паровой фазы (IX. 18) рассчитывается парциаль-
ная упругость paw углеводородных паров в смеси с водяным
паром. Парциальное давление pz перегретого водяного пара
определяется по уравнению (IX. 19). Если весом G^D задавались
правильно, то подстановка полученных значений pz и paw в урав-
нение (IX. I) должна дать то же значение z/G2, что и рассчитан-
ное выше по уравнению (IX. 48). Несовпадение значений z/Ga
указывает на неправильность предварительно принятого зна-
чения G2/D и на необходимость повторения расчета уже с новым
его значением. Нескольких пересчетов оказывается достаточно
— для установления практически точного значения BecaG2/£>.---
Следующие этапы расчета, состоящие в определении элемен-
тов ректификации всех остальных отделений колонны, ничем
не отличаются от методики расчета ее второго отделения и
ведутся по тем же формулам, в которые лишь каждый раз необ-
ходимо подставлять элементы ректификации, относящиеся к рас-
сматриваемому межтарелочному отделению укрепляющей ко-
лонны. Спускаясь сверху вниз по высоте колонны и последо-
вательно определяя веса, составы и температуры паровых и
жидких потоков на ее тарелках, можно получить полное пред-
ставление о характере работы колонны при условиях, которые
были заданы проектировщиком, принявшим условия существо-
вания (р, tD, yD~) равновесной системы в парциальном конден-
саторе и назначившим определенный режим (ух) в первом
межтарелочном отделении колонны. Понятно, что эти четыре
величины теоретически могут варьировать в весьма широких
пределах, и это обстоятельство подчеркивает известную неопре-
деленность в установлении режима работы укрепляющей ко-
лонны. Очевидно, оптимальный режим отвечает наиболее эконо-
мичным условиям работы и должен определяться технико-эко-
номическим сравнением ряда вариантов.
Как известно, каждому определенному назначенному режиму
работы обычной укрепляющей колонны, работающей в отсут-
ствии перегретого водяного пара, отвечает вполне определенный
предел изменения составов фаз, представляемый соответствую-
щей парой равновесных, так называемых предельных составов,
который ни при какой высоте колонны при неизменности режима
ее работы не может быть превзойден внизу ее. Естественно
задаться вопросом, имеется ли то же самое и в укрепляющей
Z1 ° r рп/Эг7//лг.~
колонне, работающей в присутствии перегретого водяного пара.
В укрепляющей колонне каждой вполне определенной равно-
весной системе в парциальном конденсаторе или, что то же
самое, каждой вполне определенной равновесной системе на
любой из ее тарелок в совокупности с определенным съемом
тепла dID на верху колонны отвечает своя пара равновесных
граничных составов, которых теоретически ни при каком числе
тарелок нельзя достичь внизу ее. Практически эти составы, как
и в обычной колонне, достигаются при вполне конечном числе
тарелок, но перейти за пределы этих концентраций уже ни
практически, ни теоретически невозможно. Поэтому часто не-
возможно, исходя из принятых на верху колонны условий,
достичь внизу ее желательного состава отводимого жидкого
продукта xR. Таким образом, эти два равновесных предельных
состава образуют как бы нижнюю теоретически недостижимую
границу изменяющихся по высоте колонны составов фаз, отвечаю-
щую данному съему тепла и принятым условиям равновесия
в парциальном конденсаторе. Чем больше тепла отнимается
в конденсаторе, тем ниже значения граничных составов, причем
бесконечно большому ръему тепла отвечают пара предельных
составов хгр = угр — 0 и минимальное число тарелок укрепляю-
щей колонны.
Установленное таким образом соответствие между каждой
парой равновесных составов паровой и жидкой фаз исходной
системы и съемом тепла в конденсаторе укрепляющей колонны
при заданных условиях равновесия на верху колонны является
взаимно однозначным.
Таким образом, понятия минимального съема тепла на верху
колонны или минимальной флегмы, совместимые с желатель-
ной работой ее, вполне применимы к условиям укрепляющей
колонны, производящей разделение в присутствии перегретого
водяного пара.
§ 6. Пример расчета укрепляющей колонны, работающей
в присутствии перегретого водяного пара
Пусть в укрепляющей колонне в присутствии перегретого водяного пара
требуется произвести разделение той же начальной системы н-гептан — энде-
кан, поступающей в колонну уже в парообразном состоянии. Условие и
некоторые данные для этого примера заимствованы из курса А. М. Трегу-
бова, но решение задачи проведено другим методом и по формулам, полу-
ченным в § 5.
Согласно доказанному выше, проектировщик располагает возможностью
принять в качестве исходных данных значения трех степеней свободы равновес-
ной паро-жидкой системы в конденсаторе колонны. Пусть для рассматриваемого
примера задано общее давление паров системы р = 760 мм рт. ст., ее темпе-
ратура tD = 87,5° и состав ее паровой фазы yD = 0,995. Как и в предыду-
щем примере, принятая совокупность значений р, tD и yD, конечно, является
не единственно возможной, ибо любые три значения этих параметров, не
Расчет укпепляющей колонны, работающей с перегретым паром 413
выходящие за пределы, нарушающие число фаз системы, определят некото-
рое вполне возможное ее состояние. Однако из соображений экономичности
процесса не следует произвольно увеличивать или уменьшать давление р
против атмосферного, когда в этом нет прямой необходимости. Состав yD
верхнего целевого продукта колонны тоже бывает большей частью задан,
так что основным варьирующим фактором остается лишь температура tD
системы, задаваться которой в известных, указанных выше пределах также
следует, не упуская из поля зрения вопросов экономичности проектируемого
процесса, так как именно значением температуры tD в конечном счете опре-
деляется расход водяного перегретого пара z/D.
Принятием значений трех ее параметров полностью определяется
состояние равновесной паро-жидкой системы в конденсаторе колонны, и зна-
чения всех остальных ее свойств могут быть установлены уже расчетным
путем.
Прежде всего по уравнению равновесия следует найти состав жидкой
фазы рассматриваемой равновесной системы, паровая фаза которой имеет
состав yD = 0,99.5. При температуре системы tD = 87,5° упругости насыщен-
ных паров ее компонентов соответственно равны Pt = 543,5 мм и Р2 =
= 20,9 мм рт. ст. Коэффициент обогащения по уравнению (Ш. 58) m = 26.
Состав жидкой фазы, стекающей из конденсатора в качестве орошения на
первую тарелку, по уравнению (IX. 43) равен
- - ----------- - _ 0.995:9,00.5--- ------------------------------
26 + 0,995:0,005 * °'
Для определения относительного содержания перегретого водяного пара
в паровой дестиллатной фазе рассматриваемой равновесной системы в кон-
денсаторе колонны следует рассчитать парциальную упругость раа) углеводо-
родных паров. Пересчет весовой концентрации yD = 0,995 в молярную дает
yD' = 0,997. Подстановкой соответствующих значений в уравнение (IX. 18)
.рассчитывается парциальная упругость раш углеводородов в паровой дестил-
латной фазе:
543,5
1 + (1 - 0,997) (26~1) = 506 ММ рт- "•
Парциальное давление перегретого водяного пара по уравнению (IX.19)
pz = 760 — 506 = 254 мм рт. ст.
Относительное содержание водяного пара в дестиллатных парах опреде-
ляется по соотношению (IX. 1):
z __ 254 х 18 _ л по
D ~ 506 х 100,2 ~ ’ ’
где 100,2 — средний молекулярный вес дестиллатных паров.
На данной стадии расчета полностью определены все имеющие суще-
ственное значение для рассматриваемой проблемы свойства рассматриваемой
системы в конденсаторе колонны, и поэтому следует перейти к выбору
дополнительного параметра для установления того или иного режима работы
укрепляющей колонны. Этим дополнительным параметром может служить
либо принятое значение веса паров, поднимающихся с первой тарелки, либо
значение их состава или относительного содержания водяного пара в них,
либо количество тепла, отнимаемого в конденсаторе колонны, или веса
флегмы, стекающей на первую тарелку из конденсатора, либо какого-нибудь
другого произвольного фактора, характеризующего режим работы колонны.
Как указывалось выше состав yL паров, поднимающихся в конденсатор, по
смыслу происходящего в нем процесса частичной конденсации должен заклю-
чаться в интервале 0,885 <yt< 0,995. Пусть принято значение у, =0,950.
414
Теперь уже режим работы колонны полностью определен и задача состоит
в определении элементов ректификации во всех ее межтарелочных отделе-
ниях.
Вес паров, поднимающихся с первой тарелки, определяется по уравне-
нию (IX. 33) подстановкой величин, относящихся к первому межтарелочному
отделению колонны:
Gj _ 0,995—0,885
D ~ 0,950-0,885 ~1’ЬУ-
Следовательно, вес встречной, стекающей из конденсатора флегмы будет
равен
-^-=1,69— 1 = 0,69.
Пересчет весовой концентрации в молярную дает значение у/= 0,969.
Средний молекулярный вес паров Gj
100x0,969+156 х 0,031 = 101,6.
Относительное содержание перегретого водяного пара в смеси паров,
поднимающихся с первой тарелки, определится по уравнению (IX. 44):
2 °’09* ППТО
оГ = Тб9= ’ 53
Температура tx паров Gj должна иметь то единственное значение, при
котором относительное содержание перегретого водяного пара в смеси
с парами Gj, рассчитанное по уравнению (IX. 1), дает величину, совпадающую
с его значением, найденным по уравнению (IX. 44). Температура tx опреде-
ляется подбором по методу постепенного приближения. Пусть ее значение
?! = 105,5°. При этой температуре упругости насыщенных паров компонентов
системы равны соответственно Р1 = 935 мм и Р2 = 46 мм рт. ст., а коэффи-
циент обогащения т = 20,3. Парциальное давление углеводородных паров
в смеси с перегретым водяным паром определится по уравнению (IX. 18):
935
Рт> 1 + (1 — 0,969) (20,3 — 1) -585 ММ рТ‘ СТ‘
Решение уравнений (IX. 1) и (IX. 19) в отношении paw приводит к урав-
нению
Раш =-----Р—м~ (1Х.50>
1 4-—------
+ G 18
Подстановка соответствующих значений в уравнение (IX. 50) позволит
судить, насколько правильно была принята температура tx— 105,5°:
760 Ж
Paw =---------ПТГ7Г = 585 мм рт' ст-
1 +0,0532-+^
1о
Проверка температуры G может быть произведена и непосредственно по
уравнению (IX. 1) подстановкой в него надлежащих параметров:
= =17-5 ^^- = 0,0532.
Gj 585x 101,6
Расы г укрепляющей колонны, работающей с перегретым паром 41.5
В обоих случаях получается полное совпадение, и, следовательно, тем-
пература /1 = 105,5° принята правильно. Следует заметить, что проверка по
уравнению (IX. 1) дает лучшие результаты, чем по уравнению (IX. 50).
Дальнейший расчет заключается в определении того съема тепла d/D
в конденсаторе колонны, который обеспечит выполнение выбранного режима
ее работы. Предварительно необходимо по уравнению (IX. 45) определить
тепловой параметр в2'.
При температуре верха колонны tD = 87,5° теплосодержание флегмы,
стекающей из конденсатора на первую тарелку, равно <?0 = 45,6 ккал/кг,
а теплосодержание дестиллатных паров QD= 127,6 ккал/кг. Теплосодержание
единицы веса перегретого водяного пара при этой же температуре iD =
= 636 ккал/кг. При температуре первой тарелки tr = 105,5° теплосодержание
единицы веса паров Gj равно Q( = 135 ккал/кг, а перегретого водяного
пара ii = 644,4 ккал/кг. Приведенное теплосодержание паров G, по уравне-
нию (IX. 36)
Q/= 135 + 0,0532 X 644,4=169,2 ккал/кг.
Тепловой параметр 6г' определится подстановкой надлежащих величин
в уравнение (IX. 45):
02' = 45,6 + 1,69(169,2 — 45,6) = 254,5 ккал/кг.
Тепло, отнимаемое в парциальном конденсаторе укрепляющей колонны.
определится по уравнению (IX. 46):---------------------------------------
-^- = 1,69 (169,2 — 45,6) — (127,6 — 45,6)—0,09 х 636 = 69,7 ккал/кг.
или по уравнению (IX. 37):
~ = 254,5 — 127,6 — 0,09 X 636 = 69,7 ккал/кг.
Расчет второго межтарелочного отделения колонны имеет целью опре-
деление веса, состава и температуры паров, поднимающихся со второй та-
релки колонны на первую. Последовательность расчета этих элементов
складывается из следующих стадий. Вначале, как указывалось выше, необ-
ходимо задаться весом парового углеводородного потока в рассматриваемом
отделении колонны, а затем последующим расчетом проверить правильность
принятой величины. Пусть G2/Z> = 1,59. Состав + флегмы gj, стекающей
с первой тарелки, найдется по условию ее равновесия с
мощи уравнения (IX. 43):
парами Gi при по-
= 0,805.
_ 0,950:0,050
20,3 + 0,950 :0,050 ~ °’
Состав встречного этой флегме парового потока G2
принятому его весу при помощи уравнения концентраций
плос , 0,995 — 0,485
У2=0,485 +.----------------------------------
Пересчет в молярную концентрацию дает значение у2' = 0,866. Относи-
тельный вес перегретого водяного пара в смеси паров, поднимающихся со
второй тарелки, на основании уравнения (IX.48) равен
= 0,0566.
G2 1,59
Средний молекулярный вес паров G2
Af2 = 0,866 х 100 + (1 —0,866) 156=107,5.
рассчитывается по
(IX. 47):
Парциальная упругость раш углеводородных паров G2 в смеси с пере-
гретым водяным паром в условиях равновесного насыщения согласно урав-
нению (IX. 50) должна составить
760 vo
Paw=------------ .=569 жл рт. ст.
1 + 0,0566
1о
Теперь необходимо подобрать такую температуру, при которой та же
парциальная упругость paw, рассчитанная по уравнению изотермы паровой
фазы (IX. 18), была бы равна найденному выше равновесному значению ра,м —
= 567 мм. Пусть температура паров G2 принимается равной /2=128°. При
этом упругости насыщенных паров компонентов системы соответственно
равны Pt = 1676 мм и Р2 = 108 мм рт. ст., а коэффициент обогащения т =
= 15,5. Подстановка этих величин в уравнение изотермы (IX. 18) дает
, (1 _ 0,866)(15,5— 1)-569 мм рт' ст'
Значения paw, рассчитанные по уравнениям (IX. 50) и (IX. 18), совпали,
что является одним из условий правильности подбора температуры /2 на
второй тарелке. Более чувствительным критерием правильности выбора
температуры /2 является уравнение (IX. 1), однако в данном случае и оно
тоже лишь подтверждает правильность подбора температуры паров, подни-
мающихся со второй тарелки:
А = Л*3 Х=0,0569.
(?2 5(э7 X 107,5
Однако проверка принятой температуры /2 по уравнению (IX. 18) является
необходимой, но не достаточной. Окончательно судить о правильности пер-
воначального выбора веса паров. G2 можно лишь на основании проверки
температуры /2 = 128° по уравнению теплового баланса (IX. 49).
Для этого рассчитывается значение приведенного теплосодержания Q2'
по уравнениям (IX.36) и (IX.49) и при совпадении этих величин или не-
большом их расхождении, не выходящем за пределы точности используемых
тепловых и упругих свойств компонентов, делается заключение о правиль-
ности выбора веса паров в рассматриваемом межтарелочном отделении. При
большом расхождении значений приведенного теплосодержания, рассчитан-
ных по уравнениям (IX. 36) и (IX. 49), очевидно, потребуется пересчет.
Теплосодержание единицы веса паров G2 при температуре /2 = 128° состав-
ляет Q2 = 144,8 к.к.ал!кг, а теплосодержание единицы веса перегретого водя-
ного пара в тех же условиях /2 = 654,6 ккал/кг. Подстановка этих величин
в уравнение (IX. 36) дает значение приведенного теплосодержания паров G2:
Q2' = 144,8 + 0,0566 х 654,6 = 181,8 ккал/кг.
Для расчета значения Q,' по уравнению (IX. 49) необходимо предвари-
тельно найти теплосодержание qT единицы веса флегмы g,, стекающей с пер-
вой тарелки, температура которой была выше установлена равной /, = 105,5°.
При этой температуре а, =55,4 ккал/кг. Подстановка соответствующих вели-
чин в уравнение (IX.49) дает значение приведенного теплосодержания па-
ров G2, равное
, ее а 254,5 55,4 ,о. _ ,
Q2Z = 55,4 4----j-=—— = 180,6 ккал/кг,
1,5У
вместо найденного по уравнению (IX. 36) значения Q2' = 181,8 ккал/кг. Рас-
хождение это хотя не превышает 0,7%, все же довольно заметно. Объяс-
няется оно известной неточностью данных по тепловым и упругим свойствам
Расчет укрепляющей колонны, работающей с перегретым паром 417
углеводородов. Для целей, преследуемых в настоящем примере, его можно
считать допустимым и перейти к расчету остальных частей колонны.
Казалось бы, нет необходимости продолжать дальше расчеты, ибо мето-
дика и техника их достаточно освещены в расчете второго отделения ко-
лонны. Однако расчета верха и первых двух отделений колонны недоста-
точно для иллюстрации одной из важнейших особенностей работы укрепляю-
щей колонны, о которой упоминалось выше. А именно речь идет о граничных
равновесных концентрациях, отвечающих каждому определенному количеству
z/D водяного пара в совокупности с каждым определенным значением съема
тепла d/D в конденсаторе колонны. Желательно продолжить расчет колонны,
двигаясь сверху вниз до тех пор, пока граничные составы не будут практи-
чески достигнуты и тем самым для выбранного режима работы колонны
будет установлена граница, за которую ни при каком числе ее тарелок не-
возможно перейти.
Расчет третьего и остальных отделений колонны ведется через те же
последовательные ступени и по тем же уравнениям, что и расчет второго
отделения, результаты последующих расчетов приведены в табл. 25.
Из приведенных расчетов следует, что состав флегмы, стекающей с пя-
той тарелки, х5 = 0,1322.
Таким образом, практически уже достигнут предел обеднения фаз при
движении сверху вниз по высоте 'колонны и значения граничных составов
для выбранного jesan iа работы колонны соответственно равны: х = 0,132
и угр =0,675. Дальнейшее увеличение числа тарелок колонны никакого прак-
тического смысла иметь не может, ибо составы на всех последующих та-
релках будут оставаться неизменными и равными граничным. В самом деле,
на каждой последующей тарелке вес паров остается равным G/D — 1,588, не
изменяется и температура t =140° и расчет повторяет все ступени после-
довательных вычислений в пятом отделении.
Так подтверждается высказанное ранее положение о приме-
нимости понятий минимального тепла конденсатора или мини-
мального веса орошения, совместимых с назначенным режимом
работы в укрепляющей колонне, производящей разделение
в присутствии перегретого водяного пара.
Решение общей задачи ректификации в укрепляющей ко-
лонне данной системы компонентов во всех возможных ва-
риантах при использовании перегретого водяного пара пред-
ставляет значительные трудности, ибо здесь режим работы
колонны определяется не только величиной съема тепла в ее
конденсаторе, как в обычной колонне, но и тем количе-
ством водяного перегретого пара, с которым ведется разде-
ление.
Однако при некотором постоянном количестве перегретого
водяного пара можно для различных количеств отнимаемого
в конденсаторе тепла находить соответствующие значения со-
пряженных им граничных составов, устанавливая тем самым
зависимость между теплом орошения и пределом обеднения
фаз по высоте колонны сверху вниз.
Так, если полученное в предыдущем расчете количество
водяного пара z/D оставить постоянным и, изменяя тепловой
параметр 02' (беря его меньше или больше), проводить расчет
последовательных отделений колонны, то каждый раз будет
27 Зак. № 304.
41«
Ректификация в присутствии перегретого водяного пара
/-ая ступень контакта \-1 Принятые значения Уг Уг' Mi 2 i Pau-i п0 ! уравне- 1 нию I (1Х.50) j
Gj D tv °С
Тарелка 1 . 0,210 1,588 137,5 0,704 0,788 111,9 0,0566 562
, 4 . 0,146 1,588 139,5 0,680 0,769 ИЗ 0,0566 560,5
5 . 0,134 1,588 140,0 0,676 0,766 113,2 0,0566 560
получаться пара сопряженных граничных составов, большая
или меньшая, чем установленные выше.
Результаты расчета сведены *в табл. 26, дающую полную
картину изменения составов жидких и паровых потоков по
высоте укрепляющей колонны при выбранном режиме работы.
Фиг. 115. Расчет укрепляющей колонны, работающей с перегретым
водяным паром.
Таблица 26
Конденсатор, /D = 87,5° Тарелка 1, tx = 105,5° Тарелка 2, /2 = 128° Тарелка 3, /3 = 137,5° Тарел- ка 4, /4 = = 139,5° Тарелка 5, /5=140°
Vd *0 У1 Уз Уз х3 У4 -И У5
0,995 0,885 0,950 0,485 0,805 0,210 0,704 0,145 0,680 0,134 0,676 0,1322
По данным табл. 26 можно построить кривую равновесия
фаз для укрепляющей колонны и по точкам провести линию
концентраций для нее. Линия концентраций оказывается при
Анализ работы колонны с перегретым паром
419
Таблица 25
Проверка по уравнениям (IX.18) и (IX.1) Проверка по тепловому балансу сопоставлением значений Q/ по уравнениям (IX.36) и (IX.49) xi
Pi Р? Pawl z G~i Qi Q/ по (IX.36) 4i-t Q/ по (IX.49)
2110 151 13,96 562 0,0566 148,7 658,9 185,9 67,95 185,15 0,146
2205 160,6 13,70 560,5 0,0567 150,2 659,8 187,5 73,4 187,4 0,134
2229 163 13,7 560 0,0567 150,65 660,1 187,85 74,9 187,9 0,1322
этом обращенной своей выпуклостью к оси абсцисс, что объяс-
няется уменьшением весов потоков по мере движения сверху
вниз по высоте укрепляющей колонны. Ступенчатое построение
на фиг. 115 повторяет стадии проведенного выше расчета.
Для сырья, имеющего состав больший а = 0,676, число тео-
ретических ступеней контакта при тех же условиях в конден-
саторе может быть найдено интерполяцией данных таблицы.
Для сырья, имеющего более низкий начальный состав, необ-
ходимо выбрать другой режим работы колонны, что не пред-
ставит затруднений в свете данных, приведенных в § 5.
§ 7. Анализ работы полной колонны
в присутствии перегретого водяного пара
Основной интерес представляет работа в присутствии пере-
гретого водяного пара полной колонны, состоящей из отгонной
и укрепляющей секций. Если в обычной отгонной колонне
можно добиться достаточно низкого содержания в верхних
парах высококипящего компонента, то в присутствии перегре-
того водяного пара или нейтрального газа пары, поднимаю-
щиеся с ее верхней тарелки, содержат в общем случае недо-
пустимо большое количество тяжелого компонента. Поэтому
возникает необходимость дополнительной ректификации верх-
них паров отгонной колонны в специальной укрепляющей сек-
ции, обеспечивающей получение практически чистого низко-
кипящего компонента. Практически эта задача полного разде-
ления исходной системы на компоненты достаточной чистоты
решается применением полных колонн.
Основным узловым пунктом в анализе работы полной ко-
лонны является исследование процесса в ее питательной секции.
Здесь связываются потоки паров и флегмы, идущие из отгонной
и укрепляющей секций, и поток сырья, поступающий в колонну
27*
i crxi 1Л1^лл'г\<л1^1лл о tip'iiCij л C'i оиы, nbc-~jjG.apixj~&, о иь» m'vcw iTupU’
Фиг. 116. Схема питатель-
ной секции полной колонны,
работающей с перегретым
водяным паром.
извне. В результате взаимодействия этих потоков на питатель-
ной тарелке устанавливается некоторое стационарное состояние,
позволяющее получить исходные данные для расчета всего
процесса по соотношениям, выведенным выше.
На фиг. 116 приведена схема питательной секции полной
ректификационной колонны, работающей в присутствии пере-
гретого водяного пара. На питательную ее тарелку входит
сырьевой поток L состава а, фазовое состояние которого не
конкретизируется и может быть вы-
яснено лишь в конце расчета по кон-
кретным условиям разделения. На ту
же тарелку из отгонной секции посту-
пают пары йл состава ул в смеси
с определенным количеством перегре-
того водяного пара z, а из укрепля-
ющей секции сливается на нее жидкая
флегма gK состава хк. Все эти потоки
взаимодействуют на питательной та
релке, и в результате их массообмена
и теплообмена на последней устана-
вливается некоторое стационарное
состояние, представляемое поднимаю-
щимися с нее парами Gm и стекаю-
щей с нее флегмой gm.
Материальный баланс питательной
тарелки по общему весу потоков и по
их потоках низкокипящего компонента
представится уравнениями
L + gx + Ол = Gm + gm', (IX. 51)
~Ь gx^x ~bGji)/ji = GmVm “Ь gmXw (IX. 52)
Уравнения (IX. 51) и (IX. 52) могут быть записаны и не-
сколько по-другому:
L = (Gm -gK)+(gm-G,) = £> + /? (IX. 53)
и
в
La = (Gmym — gKxK) + (gmXm — СлУл) = DyD + Rxr. (IX. 54)
Уравнения (IX. 53) и (IX. 54) с очевидностью вытекают из
материальных балансов укрепляющей и отгонной секций полной
колонны. С другой стороны, уравнение теплового баланса для
питательной тарелки представится соотношением
LQa "I” gagu 4“ GjiQa 4“ 21л = GmQm ~^~gmgm 4“ 21m* (IX. 55)
Преобразуя уравнение (IX. 55) при помощи вспомогательных
тепловых параметров, определяемых уравнениями (IX. 11) и
(IX. 36), можно получить более удобный его вид:
LQu £|<?к 4~ GjiQ;, =GmQm 4“ gmQmt (IX. 56)
Анализ работы колонны с перегретым паром
421
и окончательно, используя уравнения (IX. 12) и (IX. 37), имеем
LQa — (GmQm — Sk^k) + (gm<]rn — GjiQji ) = T)02 ROi . (IX. 57)
Так из анализа питательной тарелки выводятся уравнения,
характеризующие материальные и тепловые условия работы
всей колонны в целом.
Можно предложить несколько различных подходов к вопросу
увязывания в питательной секции колонны элементов ректи-
фикации ее отгонной и укрепляющей частей, однако одним из
наиболее простых способов является следующий.
Пусть принята равновесная трехкомпонентная двухфазная
система в кипятильнике отгонной секции колонны путем назна-
чения трех ее степеней свободы — давления р, температуры tR
и степени чистоты нижнего продукта колонны xR. Кроме того,
назначен еще и режим работы отгонной секции путем приня-
тия двух определяющих параметров — расхода перегретого во-
дяного пара z/R и температуры на первой, считая снизу,
тарелке. Тогда- расчет—шт методикеу-изложенной в § 3, позво-
лит определить не только число тарелок отгонной секции, но
также составы и температуры паров, поднимающихся с верхней
ее тарелки, и флегмы, на эту тарелку поступающей. Эти пары
и являются парами 0л, поступающими на питательную тарелку,
как и флегма является жидким потоком gm, стекающим в от-
гонную секцию с питательной тарелки. Таким образом, расчет
отгонной секции сразу дает температуры, веса и составы пото-
ков бл и gm, относящиеся к питательной секции, а также и
вес перегретого водяного пара, поступающего в секцию питания
с низа колонны.
Чтобы отгонная секция колонны работала в соответствии
с запроектированным режимом, необходимо иметь на пита-
тельной тарелке температуру, равную той, с которой согласно
расчету отгонной секции поступает на ее верхнюю тарелку
флегма gm. Следовательно, в результате контакта на питатель-
ной тарелке потока сырья и потоков, идущих из отгонной и
укрепляющей секций, на ней должно установиться некоторое
стационарное состояние и, в частности, температура уходящих
с нее потоков должна равняться именно той температуре, ко-
торая была получена в расчете отгонной секции. Так уста-
навливается температура на питательной тарелке.
Пусть стационарное состояние на питательной тарелке харак-
теризуется равновесием покидающих ее паров и жидкостей.
Тогда, зная температуру tm и состав хт жидкой фазы, можно
по уравнению равновесия рассчитать состав, который должна
иметь паровая фаза, поступающая с питательной тарелки
в укрепляющую секцию колонны. Таким образом, принятие
условия равновесия расходящихся с питательной секции
потоков позволяет зафиксировать состав парового питания
верхней секции колонны.
Зная состав ут и температуру tm этого парового потока,
можно рассчитать парциальную упругость паров его углево-
дородов и по уравнению (IX. 1) найти относительное содержа-
ние 2/Gm в нем сопровождающего перегретого водяного пара.
Количество паров Gm найдется по известному из расчета отгон-
ной секции расходу водяного пара при помощи уравнения (IX. 20).
§ 8. Пример расчета полной колонны, работающей
в присутствии перегретого водяного пара
На основе выведенных соотношений можно вести технологический
расчет ректификационной колонны, состоящей из отгонной и укрепляющей
секций и работающей в присутствии перегретого водяного пара, вводимого
в нижнюю ее часть.
Пусть в колонне под атмосферным давлением разделяется исходная
система, состоящая из углеводородов «-гептана и эндекана, с начальным
составом а = 0,402.
Целевыми продуктами разделения являются н-гептан, отводимый с верха
колонны, со степенью чистоты уо = 0,995, и эндекан, получаемый с низа
колонны, с составом х^ = 0,02.
Относительные веса верхнего и нижнего целевых продуктов колонны
определяются по известным формулам материального баланса колонны:
R_ 0,995 - 0,402 £>_ 0,402 — 0,020
D 0,402 — 0,020 ’ И L 0,995 — 0,020 ’ '
Таблица 27
Компоненты Сырье Остаток Ректификат
т-ра ки- пения, °C МОЛ. вес. М ai вес L/D xRi вес R/D Уо1 вес D=l,000
и-Гептан 98,61 100 0,402 1,0262 0,020 0,0312 0,995 0,995
Эндекан . . 194,5 156 0,598 1,5298 0,980 1,5248 0,005 0,005
Итого . . 1,000 2,556 1,000 1,5560 1,000 1,000
В табл. 27 приведены данные материального баланса всего колонного
аппарата в целом, отнесенные к единице веса верхнего целевого продукта D.
Для расчета питательной секции колонны можно взять данные, получен-
ные в примерном расчете отгонной колонны, проведенном по той же бинарной
системе «-гептан — эндекан. Согласно полученным при расчете отгонной
колонны данным для выбранного режима ее работы при расходе 6% водяного
пара на остаток и при условиях внизу колонны р = 760 мм рт. ст., /к=120° и
х^ = 0,02 пары, поднимающиеся с ее последней, третьей по счету тарелки,
имеют состав ул = 0,593, а жидкость, поступающая на тарелку сверху, имеет
состав хт = 0,135 и температуру /„. = 139°. Условия в питательной секции
полной колонны должны подбираться таким образом, чтобы флегма, стекаю-
щая в отгонную секцию, имела состав и температуру, отвечающие выбран-
Расчет полной колонны, работающей с перегретым паром
423
ному режиму работы отгонной секции. Конечно, если бы в отгонной секции
был выбран другой режим работы, иначе говоря, был бы принят больший
или меньший расход перегретого водяного пара или большая или меньшая
температура остатка, то и значения ул, хт и tm получились бы другими и
в других условиях работала бы питательная секция полной колонны. Однако
тот или иной режим отгонной секции все равно должен быть выбран, и
пусть этим выбранным режимом будет тот, по которому работает уже рас-
считанная отгонная колонна.
Итак, флегма, стекающая из питательной секции на верхнюю тарелку
отгонной секции, имеет состав = 0,135 и температуру /т=139°. По этим
данным можно рассчитать парциальное давление углеводородных паров
в смеси с перегретым водяным паром на питательной тарелке колонны. Пере-
счет весовой концентрации хт в молярную дает
Парциальное давление paw углеводородных паров рассчитывается по
уравнению изотермы жидкой фазы (III. 54):
рац,=2181 х 0,196 4- 158,2 х 0,804 = 555 мм рт. ст.,
где упругости насыщенных паров углеводородов при Im = 139° соответственно
равны 2Э1 = 2181 и Р2 = 158,2 мм рт. ст. Состав паров, поднимающихся с пита-
тельной тарелки в укрепляющую секцию колонны, найдется по условию их
равновесия с флегмой состава хт' = 0,196, стекающей с той же питательной
тарелки в отгонную секцию. По уравнению равновесия (IX. 17), подставляя
значение коэффициента обогащения, при температуре /т = 139° равное т =
= 13,78, получаем, что состав паров ут имеет следующее значение:
13,78 _
Ут~ 13,78 + 0,865:0,135 ~ ’
По уравнению изотермы молярный состав тех же паров
PjX ' 2181x0,196
у' = —~ =---------FFe----= 0,771,
Ут Раи, 555
что в пересчете в весовую концентрацию, очевидно, дает то же значение
ут = 0,682. Средний молекулярный вес паров, поднимающихся с питательной
тарелки, подсчитанный обычным методом, равен Му= 112,8.
Следующий этап расчета состоит в определении равновесного относи-
тельного содержания перегретого водяного пара в потоке паров Gm, подни-
мающихся с питательной тарелки. Для этого используется уравнение (IX. 1):
z _(760 — 555) х 18
Gm~ 555x 112,8 -и-иау-
Вес углеводородного потока паров Gm определяется на основании фор-
мулы (IX. 20):
Gm 2 Gm 0,060
__HL =___-1 017
R R г ~ 0,059 ’
424 Ректификация в присутствии перегретого водяного пара
Тот же вес, отнесенный к единице веса верхнего продукта колонны, на
основании очевидного соотношения будет равен
~ х = 1,017 х 1,556 = 1,582.
L) г\ U
Далее необходимо выяснить, больше ли этот вес паров того минималь-
ного веса, который совместим с желательной работой проектируемой укреп-
ляющей колонны, ибо, если он окажется меньше, то в верхней секции
колонны в данных условиях не удастся получить целевой продукт намечен-
ного состава. Для определения минимального веса паров Gm, отвечающего
их составу Ут — 0,682, необходимо считать состав встречного потока флегмы
равновесным и, следовательно, имеющим по предыдущему значение хт = 0,135.
Для такой идеальной колонны минимальный вес паров равен
(Gm\ yD-ym _ 0-995-0,682_
\ D /мин Ут-хт 0,682-0,135
и минимальный вес флегмы равен
= 1,572— 1 = 0,572.
\ 73 /мин
Вес паров Gm, полученный из условия равновесного насыщения в при-
сутствии перегретого водяного пара, оказался больше, чем минимальный
их вес, совместимый с желательной работой укрепляющей колонны,
и поэтому последняя будет работать со вполне конечным числом теорети-
ческих тарелок.
Из условия материального баланса питательной тарелки или по балансу
укрепляющей секции, что по существу одно и то же, можно определить
состав хк флегмы, стекающей на питательную тарелку из верхней секции
колонны. Для контроля вычислений рекомендуется по одному из этих, урав-
нений определять и проверять полученное значение подстановкой в Дру-
гое уравнение.
По уравнению концентраций (IX. 33) верхней секции колонны состав
Подстановка полученных значений в уравнение (IX. 52) материального
баланса питательной тарелки подтверждает правильность рассчитанного
состава и элементов ректификации питательной тарелки колонны.
2,556 х 0,402 + 0,582 х 0,144 + 1,566 х 0,251 X 0,593 =
= 1,582x 0,682+ 1,251 x 1,556 x0,135=1,343.
Уравнение (IX. 52) использовано в виде, отнесенном к единице веса
ректификата:
оа + —хк+——-Ут + —хт.
Следующий этап расчета состоит в выяснении вопроса, может ли рас-
сматриваемая укрепляющая колонна иметь наверху парциальный конден-
сатор или же, чтобы избежать конденсации водяного пара, необходимо исполь-
зовать схему острого орошения.
Расчет полной колонны, работающей с перегретым паром 425
Для этого требуется определить относительное содержание водяного
пара в дестиллатных парах, для рассматриваемого случая рассчитываемое
по соотношению
4 = -р х ~ = 0,06 х 1,556 = 0,0934.
L> i\ и
Когда на верху колонны установлен парциальный конденсатор, то выхо-
дящая из него смесь дестиллатных паров и перегретого водяного пара
находится при температуре верха в условиях равновесного насыщения. При
этом парциальное давление водяного пара не должно быть выше упругости
насыщенных паров воды при этой температуре, так как в этом случае он
обязательно будет конденсироваться, чего, очевидно, следует избегать, чтобы
предотвратить попадание воды в колонну. Для рассматриваемого случая
парциальное давление углеводородных дестиллатных паров в смеси ,с водя-
ным паром на выходе из парциального конденсатора на основании уравне-
ния (IX. 50) равно
760
Paw=-------------lT>(T9 = 500 ММ Рт- ст-
1 + 0,0934
1о
где 100,2—молекулярный вес дестиллатных паров. Парциальное давление
перегретого водяного пара pz = 760— 500 = 260 мм рт. ст. Температура,
при—которой дестиллатные па[>ы имеют—парциальную упругость
= 500 мм рт. ст., определяется подбором и проверяется по уравнению изо-
термы паровой фазы (IX. 18). Пусть температура верха колонны равна
/О = 87,1°. Упругости насыщенных паров углеводородов при этой темпера-
туре соответственно равны Рг = 537 мм и 7% = 20,5 мм, рт. ст., а коэффи-
циент обогащения т = 26,2. Пересчет весового состава ректификата в моляр-
ный дает значение yD' = 0,997. Подстановка в уравнение изотермы (IX. 18)
дает значение парциальной упругости углеводородных паров
537 _ кгю
Paw~ 1 + 0,003 (26,2- i) - 500 мм ₽т- ст-
Имеется полное совпадение с результатом, полученным по уравнению
(IX. 50), и, следовательно, температура верха /D = 87,l° выбрана правильно.
При этой температуре упругость насыщенных паров воды равна 485 леи рт. ст.,
что значительно выше найденного ранее значения рг = 260 мм рт. ст. Таким
образом, в дестиллатных парах при температуре tD = 87,1° водяной пар нахо-
дится в перегретом состоянии, не следует опасаться его конденсации и на
верху колонны может быть установлен парциальный конденсатор. Однако
рассматриваемый случай не является общим, и довольно часто относительное
содержание водяного пара в дестиллатных парах бывает настолько большим,
что температура, отвечающая условиям насыщения, падает ниже так назы-
ваемой тройной точки и водяной пар начинает конденсироваться. Чтобы
избежать этого, необходимо применять острое орошение колонны, при кото-
ром постоянное количество водяного пара на верху колонны приходится
уже не только на дестиллатные пары, но и на идущие вместе с ними пары
орошения, поэтому падает относительное содержание водяного пара и соот-
ветственно понижается его парциальное давление.
Дальнейший расчет укрепляющей секции ведется в полном соответствии
с методикой, изложенной в § 5 и иллюстрированной в § 6. Особенностью этого
расчета является большая чувствительность упругих свойств углеводородов
к самым небольшим колебаниям температуры, приводящая к большой труд-
ности расчета вследствие недостаточной точности располагаемых данных
по упругостям и главным образом по тепловым свойствам углеводородных
нпнгнтствии перегретого водяного нано
компонентов системы. Здесь уместно остановиться на причине того, почему,
определив элементы ректификации в питательной секции, рекомендуется
переходить к методике расчета колонны сверху вниз, а не с питательной
секции к верху ее. Казалось бы, этот последний порядок расчета более при-
емлем, так как здесь не пришлось бы задаваться весом паров в каждом
отделении и потом проверять его, а как и при расчете отгонной секции,
последовательно переходя от тарелки к тарелке, можно было бы этот вес
паров каждый раз определять по равновесному относительному содержанию
водяного пара в смеси паров.
В действительности это только видимая простота, не подтверждаемая
практикой расчета.
Итак, дальнейшая ступень расчета заключается в определении элементов
ректификации во всех отделениях укрепляющей секции, начиная с первого
отделения, расположенного между парциальным конденсатором и первой
тарелкой, и кончая питательной секцией колонны.
Состав флегмы g0, стекающей в виде орошения из парциального кон-
денсатора на первую тарелку колонны, определяется по уравнению равно-
весия (IX. 43):
0,995:0,05
х° ~'26,2 + 0,995:0,05
= 0,884.
Пусть вес паров, поднимающихся с первой тарелки, = 1,68. Тогда со-
став этих паров определится по уравнению концентраций (IX. 33):
а оол , 0,995-0,884
= 0,884 4-----— = 0,950.
1,00
Пересчет в молярную концентрацию дает значение >+ = 0,9693. Средний
молекулярный вес паров Gj, определенный обычным способом, Мг = 101,6.
Относительное содержание перегретого водяного пара в смеси паров, под-
нимающихся с первой тарелки, по уравнению (IX. 44) равно
z _ 0,0934
Gj ~ 1,68
= 0,0556.
Парциальное давление углеводородных паров в этой смеси по уравне-
нию (IX.50) составляет
760 Т7Й
Раш=-----------ТЛИТ = 578 ММ РТ’ СТ-
1 +0,0556 -"*’-
1о
Температура, отвечающая этой парциальной упругости, путем подбора
определяется равной fj = 105°. При этой температуре упругости паров ком-
понентов соответственно равны Pj = 922 и Р2 = 44,7 мм рт. ст., а коэффи-
i-я ступень контакта xi-i Принятые значения yt У,' ™i 2 Pawi no уравне- нию (IX.50)
o’ t(, °C
Тарелка 1 . . 0,884 1,680 105 0,950 0,9693 101,6 0,0556 578
2 . . 0,483 1,582 127,3 0,806 0,867 107,5 0,059 561
3 . . 0,210 1,582 136,9 0,706 0,790 111,8 0,059 556
Расчет полной колонны, работающей с перегретым паром
427
циент обогащения т = 20,3. Подстановка этих значений в уравнение (IX. 18)
дает совпадающее значение paw'.
922 „о
Paw- 1 + 0,0307 (20,3 -1) -578ш<Рт- ст-
При температуре верха колонны /D = 87,1 ° теплосодержание флегмы g0
составляет qa = 45,4 ккал)кг, а теплосодержание дестиллатных паров QD =
= 127,3 ккал! кг. Теплосодержание перегретого водяного пара при этой же
температуре ;D = 635,8 ккал]кг. Соответственно при температуре первой
тарелки ^ = 105° теплосодержания углеводородных паров и перегретого
водяного пара равны Qj = 134,8 ккал)кг и z'i = 644,2 ккал!кг. Приведенное
теплосодержание паров по уравнению (IX. 36) составит
Q/ = 134,8 4- 0,0556 х 644,2 = 170,6 ккал!кг.
Основной расчетный тепловой параметр определится подстановкой
надлежащих величин в уравнение (IX. 45):
Д,' = 45,4 + 1,68 (170,6 — 45,4) = 256,4 ккал!кг.
Тепло, отнимаемое в парциальном конденсаторе укрепляющей колонны
определится по уравнению (IX. 46):
_____ 1,68 (170,6 15,1)(127.3 15.1) 0.0931 х 635.8 69,6 ккал кг. ... .
или по уравнению (IX. 37) для контроля вычислений:
-^- = 256,4— 127,3 — 0,0934 х 635,8=69,6 ккал!кг.
Состав флегмы, стекающей с первой тарелки колонны во второе ее
отделение, по уравнению равновесия (IX. 43)
0,950:0,050 _
~ 20,3 + 0,950 : 0,050 ~ '
Теплосодержанце единицы веса этой флегмы при С = 105° равно =
= 55,2 ккал/кг. Дальнейший расчет приведен в табл. 28.
Третью тарелку сверху можно считать последней тарелкой, укрепляющей
секции колонны. Таким образом, число тарелок отгонной секции равно трем,
укрепляющей секции тоже трем, что вместе с питательной тарелкой дает
общее число теоретических тарелок полной колонны, равное семи. Остается
определить температуру сырья на входе в питательную секцию колонны.
По уравнению (IX. 57) общего теплового баланса питательной секции имеем
2,556 Qo = 1 х 256,4 + 1,556 х 17,
Таблица 28
Проверка по уравнениям (IX.18) и (IX.1) Проверка по тепловому балансу сопо- ставлением значений Qx по уравнениям (IX. 36) и (IX.49)
Pi Р2 m I Pawi по ' | (IX.18) Z G~i по (IX.1) Qi Q? по q. . (IX.36) 1-1 Q/ по (IX.49) xi
922 1649 2081 44,75 105,5 148,1 20,3 15,6 14,04 578 561 556 0,0566 0,059 0,059 134,8 144,4 148,6 644,2 654,3 658,6 170,6 45,4 183 155,2 187,4 67,6 170,6 182,3 187,0 0,483 0,210 0,147
откуда теплосодержание единицы веса сырья на входе в колонну составит
1 х 256,4 4-1,556 17 ..
Qo =---------4-47^--------= 110,9 ккал!кг,
2,556
чему отвечает температура /0=146°. По тепловой диаграмме легко устано-
вить, что начальная степень отгона сырья е = 0,423. Однако при вступлении
в питательную секцию сырье попадает в область пониженного парциального
давления углеводородных паров и, очевидно, подвергается дополнительному
испарению, величина которого может быть определена из материального
баланса питательной тарелки. Паровой поток Gm, поступающий в укрепляю-
щую секцию, состоит из паров, идущих с верхней тарелки отгонной секции,
и из паров, образовавшихся в результате контакта в питательной секции
потока поступающего извне сырья и потока флегмы, стекающей из верхней
секции. Разность весов паров Gm и паров Ол определит тот дополнительный
вес паров Gc, который образуется на питательной тарелке. Однако этот послед-
ний поток образуется не только за счет испарения сырья L, но и за счет ча-
стичного испарения флегмы gK, приобретающей на питательной тарелке
более высокую температуру. Таким образом, вес дополнительных паров Gc
определяется по балансу:
Gc _ Gm — G^ = 1,582 х 1 — 0,251 х 1,556 = б7
L L 2,556
Эта величина не играет существенной роли в расчете колонны и вычис-
лена с единственной целью показать известное различие между расчетами
колонны, работающей в присутствии перегретого водяного пара и когда по-
следний отсутствует.
§ 9. Расчет процесса отгонки растворителей из практически
нелетучего жидкого остатка
В производстве смазочных масел распространен процесс от-
гонки легкого растворителя типа бензина или нефти из тяже-
лого масла. В литературе [9] имеются опытные данные, ука-
зывающие на необходимость самого тщательного выделения
легкого растворителя из масла, так как даже такое, казалось
бы, незначительное количество растворителя, как 0,03% вес.,
снижает температуру вспышки остаточного масла на 45°,
а такое ничтожное его содержание, как 0,01%, понижает тем-
пературу вспышки на 8°. Таким образом, отгон растворителя
должен иметь целью практически полное выделение его из
масла. Как известно, наиболее полное удаление растворителя
из масла достигается в отгонных колоннах, в низ которых
подается отпаривающий агент — перегретый водяной пар.
Колонный аппарат для непрерывной отгонки растворителя
имеет то преимущество перед обычной перегонкой с водяным
паром, что одна и та же порция последнего, поднимающаяся
по высоте колонны, многократно используется на последова-
тельных ступенях контакта, каждый раз отпаривая дополни-
тельную часть растворителя из стекающей навстречу жидкости.
Расчет процесса отгонки растворителей
429
Этим достигаются непрерывность процесса и сокращение рас-
хода перегретого водяного пара на ведение его.
Метод расчета отгонной колонны для выделения легкого
растворителя из масел был предложен С. Н. Обрядчиковым,
а для расчета ее испарительного пространства основные соот-
ношения выведены А. М. Трегубовым. Основываясь на иссле-
дованиях указанных авторов, можно предложить метод посту-
пенчатого расчета отгонной колонны, в которой при помощи
перегретого водяного пара из тяжелого, практически нелету-
чего продукта выделяется легкий растворитель.
Особенностью рассматриваемого процесса, оказывающей
существенное влияние на методику расчета, является возмож-
ность принятия остатка за практически нелетучий компонент,
тогда как легкий растворитель при температурах процесса
характеризуется весьма значительной упругостью паров.
В самом деле, при обычных температурах работы отгонных
колонн упругость паров легкого растворителя в десятки тысяч
раз больше упругости паров масла и вследствие такого чрез-
w1ерно”большого“значгения коэфф ициентапйГогащенйя“пар~рав-
новесный жидкой фазе, практически состоит из одного лишь
легкого растворителя. Содержание тяжелого продукта в паро-
вой фазе, который теоретически должен все же быть, практи-
чески совершенно неуловимо. Таким образом, не допуская
по сути дела никакой ошибки, состав паровой фазы по всей
высоте колонны (снизу доверху) можно считать неизменным
и равным 100%-му содержанию легкого компонента. Такова
и точка зрения С. Н. Обрядчикова [9].
Основные соотношения, управляющие работой рассматривае-
мой отгонной колонны, выводятся при помощи общего метода
материальных и тепловых балансов. То обстоятельство, что
в паровую фазу по всей высоте колонны согласно показан-
ному выше переходит один лишь легколетучий компонент
системы, а с низа колонны отводится жидкий остаток, содер-
жащий лишь неуловимые следы летучего растворителя, поз-
воляет несколько упростить вид этих соотношений. В самом
деле, состав верхних паров может быть принят равным yD = l,
а состав нижнего продукта, практически полностью освобож-
денного от легкого растворителя, xR^0.
Материальный баланс всего объема колонны по общему
весу входящих и выходящих потоков и по весу содержаще-
гося в них легкого растворителя представится уравнениями
L = £) + /?; (IX. 58) La = D. (IX. 59)
Из этих уравнений может быть определен вес нижнего
продукта — тяжелого нелетучего масла:
/?=£(!—a). (IX. 60)
430
Ректификация в присутствии пере.гретого водяного пара
Материальный баланс объема колонны, заключенного между
низом ее и каким-нибудь произвольным межтарелочным отде-
лением, представится уравнениями
ёп = Оп_1 + Я-, (IX. 61) gnxn = Gn-i. (IX. 62)
Уравнение (IX. 62) получается в предположении, что состав
парового потока у по всей высоте колонны постоянен и равен
единице, а состав остатка xR практически равен нулю. Веса
потоков паров и флегмы, встречающихся на одном уровне по
высоте колонны, определяются совместным решением урав-
нений (IX. 61) и (IX. 62):
<1Х-63) ОХ-64)
Содержание легкого растворителя в жидкой фазе, стекаю-
щей с п-й тарелки рассматриваемой отгонной колонны, опре-
делится по уравнению (IX. 62):
(1х-65>
Тепловой баланс объема колонны, заключенного между
низом ее и произвольным межтарелочным уровнем, предста-
вится уравнением
gnQn + ziR = Gn — iQn — i + zin - i + (IX. 66)
Для удобства оперирования с уравнением теплового баланса
его следует преобразовать к виду, симметричному с уравне-
ниями материального баланса, введя обозначения
0/ (IX. 67) Qn-^Qn-i + ^-in-i. (IX.68)
При помощи этих обозначений уравнение теплового баланса
(IX. 66) принимает вид:
gnqn = Gn-iQ'n_i+^91'. (IX. 69)
Совместное
выразить веса
потоков через
Gn_!
R ~ п' — а ’ ~R q' _ -ОЛ. .i;
Сопоставление уравнений (IX. 63) и (IX. 71) позволяет вы-
вести основной вид уравнения концентраций рассматриваемой
отгонной колонны:
решение уравнений (IX. 61) и (IX. 69) позволяет
встречных на одном уровне паровых и жидких
тепловые величины:
Чп . /TV 7ОА Qn—1 ,JV
Расчет процесса отгонки растворителей
431
Тот же результат получится, если на основании уравнения
(IX. 65) разделить друг на друга уравнения (IX. 70) и (IX. 71).
Если известна температура, а следовательно, и теплосодер-
жание одного из потоков, например парового, то для опреде-
ления теплосодержания встречного, в данном случае жидкого
потока, следует использовать уравнение (IX. 71), преобразован-
ное к виду
(lx. уз»
Общий тепловой баланс всей отгонной колонны в целом пред-
ставится уравнением
LQ0 + ziR = DQd + ZiD + RqR. (IX. 74)
При помощи соотношений (IX. 67) и (IX. 68) уравнение (IX. 74)
можно преобразовать к виду
_____________________LQa = DQn'+R01 . (IX. 75)
Теплосодержание Qo сырья, отвечающее выбранному режиму
работы, определяется подстановкой в уравнение (IX.75) соот-
ветствующих значений из соотношений (IX. 59) и (IX. 60):
<?0 = а<?/ + (1-а)б1'. (IX. 76)
При входе сырья в питательную секцию отгонной колонны
вследствие его предварительного нагрева и наличия перегре-
того водяного пара, поднимающегося сюда же с низа колонны,
здесь происходит процесс однократного испарения, сопровож-
дающийся выделением основной массы легкого растворителя.
Содержание последнего в остаточной жидкости может ко-
лебаться в довольно широких пределах в зависимости от темпе-
ратуры процесса однократного испарения в питательной секции,
относительного содержания водяного пара в смеси паров и
летучих свойств отгоняемого растворителя. Очевидно, с пони-
жением температуры испарительного пространства и с повы-
шением точки кипения растворителя его содержание в жидкой
фазе на верху отгонной колонны будет расти.
Для анализа процесса, происходящего в питательной сек-
ции, и его количественного учета необходимо установить число
интенсивных свойств исследуемой системы, которое согласно
правилу фаз должно быть зафиксировано для определения со-
стояния всей системы в целом. Нелетучий продукт принимается
за один компонент, отгоняемый растворитель за второй, а от-
паривающий агент — перегретый водяной пар—за третий ком-
понент системы. Число же фаз системы, очевидно, равно двум —
жидкой и паровой. Такая двухфазная трехкомпонентная система
обладает согласно правилу фаз тремя степенями свободы.
432 Ректификация в присутствии перегретого воояного пари
Известный произвол, предоставляемый правилом фаз в выборе
степеней свободы, уместно использовать, задав общее давление
паров системы р, температуру ее tm и относительное содержа-
ние zjD п 'регретого водяного пара в паровой фазе системы.
Значения этих интенсивных свойств могут быть удобно подо-
браны по практически оправдавшим себя опытным показателям
работы действующих установок.
Принятие значений этих трех степеней свободы определяет
состояние системы и позволяет расчетным путем установить зна-
чения всех остальных характеризующих ее свойств и в том
числе температуры tm и состава хт ее жидкой остаточной фазы,
поступающей на верхнюю тарелку отгонной колонны.
Пары летучего растворителя, уходящие с верха отгонной
колонны, представляют смесь паров Go, выделенных сырьем
в результате его однократного испарения в испарительном про-
странстве, и паров бл, поднимающихся с верхней тарелки ко-
лонны. Вследствие того, что с нижним продуктом колонны
легкий компонент практически не отводится, общий вес этой
смеси паров должен равняться согласно уравнению (IX. 59) весу
легкого растворителя, содержащегося в исходном сырье:
G =Gc + G.t = D. (IX. 77)
Таким образом, можно считать, что веса верхнего и нижнего
продуктов колонны всегда известны, поскольку состав исход-
ного сырья является величиной заданной. В этой связи уместно
заметить, что обычно расход водяного пара на ведение про-
цесса задается в расчете на единицу веса сырья, а не верхних
паров, представляющих собой паровую фазу равновесной си-
стемы в испарительном пространстве колонны. Однако оба эти
способа задания расхода водяного пара эквивалентны, и по
принятому значению z/L расхода водяного пара на единицу
веса сырья можно рассчитать его относительное содержание
в верхних парах колонны при помощи очевидного соотношения
Z _ 2 L_____2
D L ‘ D La'
(IX. 78)
Равновесное парциальное давление паров легкого раствори-
теля в смеси с перегретым водяным паром на верху колонны
при заданном относительном содержании последнего можно
рассчитать по известному уравнению Авогадро-Дальтона
Р_ _ 4 , £ MD
Ра ° ‘ "18 ’
(IX. 79)
Очевидно, то же значение р парциального давления лету-
чий растворитель должен иметь и в жидкой фазе, находящейся
в равновесии с верхними парами колонны. Расчет парциаль-
Расчет процесса отгонки растворителей
4,33
ного давления паров легкого компонента в жидкой фазе ве-
дется по закону линейной зависимости от молярного состава:
ра = Ргхт'. (IX. 80)
Для рассматриваемого случая, когда упругость насыщенных
паров тяжелого компонента системы считается пренебрежимо
малой, уравнение (IX. 80) является уравнением изотермы жидкой
фазы.
Как указывалось выше, для определенности состояния равно-
весной системы на верху колонны помимо общего давления р
и относительного содержания z/D водяного пара в смеси паров
необходимо задаваться еще ее температурой tm. Пусть принято
некоторое определенное ее значение. Тогда, найдя при этой
температуре упругость Pt насыщенных паров чистого легкого
растворителя и рассчитав по уравнению (IX. 79) величину ра
парциального давления его, можно, подставив эти величины
в уравнение (IX. 80), найти молярный состав хт' равновесной
верхним парам жидкой фазы, поступающей на верхнюю тарелку
колонны: ____ _____ _________________
= (IX. 81)
При помощи известного соотношения между весовыми и
молярными концентрациями можно пересчитать полученный
молярный состав в весовой и по уравнениям (IX. 63) и (IX. 64)
рассчитать веса паров Ол, поднимающихся с верхней тарелки
в испарительное пространство, и жидкости gm, поступающей на
верхнюю тарелку отгонной колонны. Так устанавливаются
материальные элементы ректификации питательной секции
колонны.
Однако установление состояния равновесной системы на
верху колонны еще не определяет режима ее работы в целом, и
для выбора последнего необходимо задаться еще каким-нибудь
одним параметром процесса, например температурой на верхней
тарелке колонны или температурой остатка, уходящего с низа
колонны и т. д. Эта необходимость принятия дополнительного
параметра объясняется условиями работы реальной отгонной
колонны, у которой на верхней тарелке не может быть дости-
гнута температура испарительного пространства.
Если температура /л на верхней тарелке колонны принята,
то можно рассчитать температуру низа ее, при которой отво-
дится освобожденное от легкого растворителя тяжелое
масло.
Уравнение теплового баланса (IX. 66), написанное для объема
колонны, заключающего ее от низа до верхней тарелки, пред-
ставится в виде
gmqm + ziK = + zin + PqR.
28 Зак. № 304.
434 Ректификация в присутствии перегретого водяного пара
Исключив вес gm на основании уравнения (IX. 61) и пре-
образовав уравнение теплового баланса, можно привести его
к виду
qm -- qR (&-qm) + ~ Ця - iR). (IX. 82)
Уравнение (IX. 82) дает прирост теплосодержания жидкой
фазы Aq при переходе от нижнего продукта колонны к жидкости,
поступающей на ее верхнюю тарелку. Для определения тем-
пературы tR остатка уравнение (IX. 82) решается в отношении qR-
qR = qm-[^(Рл-?т)+4(^~//?)]- (IX. 83)
Разделив теплосодержание qR на соответствующее значение
средней теплоемкости, можно найти температуру низа колонны.
Следует иметь в виду, что теплоемкости зависят от темпера-
туры и в выражении
f' | Т (1л -/«)], (IX. 84)
cpR cpR cpR [ J
член qmlcpR не может рассматриваться как температура tm,
ибо последней отвечает теплоемкость срт, большая теплоем-
кости cpR, отвечающей температуре низа колонны.
Установлением температуры низа колонны определяется
равновесная система на нижней — первой — ступени контакта,
жидкая фаза которой отводится как целевой продукт, пред-
ставляющий собой масло, освобожденное от легкого раствори-
теля. Для этой системы известны давление, под которым она
находится, температура ее, рассчитанная по уравнению (IX. 84),
и, кроме того, известно, что она содержит лишь едва уловимые
следы легкого растворителя. Таким образом, известны значения
трех ее степеней свободы, и поэтому состояние ее вполне
определено и значения всех остальных ее свойств могут быть
установлены уже чисто расчетным путем. Установив параметры
на первой ступени контакта, можно перейти к расчету второй,
затем от второй к третьей ступени и так, двигаясь снизу вверх
от тарелки к тарелке, попеременно используя соотношения
равновесия и материального и теплового балансов, вести рас-
чет до тех пор, пока не будут достигнуты условия, предвари-
тельно назначенные для питательной секции. Не всегда удается
с одного раза получить удовлетворительный результат, но сле-
дует иметь в виду, что, во-первых, число теоретических сту-
пеней контакта, требуемое для назначенного разделения, не
обязательно должно быть целым числом и, во-вторых, от уме-
ния проектировщика в значительной степени зависит умелый
подбор определяющих факторов, влияющих на режим работы
Расчет процесса отгонки растворителей
435
колонны и на распределение температур и составов по ступеням
контакта. Рекомендуемый порядок поступенчатого расчета
следующий.
Состав хп жидкой фазы рассматриваемой n-й тарелки, извест-
ный из исходных данных, пересчитывается из весового в моляр-
ный, и по уравнению (IX. 80) рассчитывается парциальное дав-
ление легкого растворителя в парах, поднимающихся изданной
равновесной ступени контакта, иначе говоря, в паровой фазе,
находящейся в равновесии с жидкостью состава хп. Далее рас-
считывается относительное содержание перегретого водяного
пара в этой смеси паров по известному уравнению
Z (р —ра)18
О~п~ Pa'Vla
Вес паров, поднимающихся из рассматриваемой ступени кон-
такта, и вес флегмы, стекающей с вышележащей тарелки, могут
быть определены по соотношениям
G„ z G„ g„ , , z G„
------ у - p • • ’1X -------A' ;'-R - \ (IX. «0 )
Состав флегмы gn + i определяется по уравнению (IX. 65), а
ее температура по уравнению (IX. 73). Таким образом, получа-
ются исходные данные, т. е. состав жидкой фазы и температура,
для расчета вышележащей (1+1) тарелки. Здесь опять повто-
ряются те же стадии расчета, что и на предыдущей i-й тарелке,
и получаются исходные данные для расчета элементов ректи-
фикации на (г + 2) тарелки. Так, двигаясь снизу вверх, может
быть рассчитана вся отгонная колонна от низа ее, где известен
состав xR и температура tR нижнего продукта до верхней та-
релки, для которой из принятых в испарительном пространстве
условий известны состав хт и температура tm поступающей на
нее флегмы.
В заключение следует отметить, что на число равновесных
ступеней контакта, требуемых для данного разделения, большое
влияние оказывают такие факторы, как температура верха и
соответственно низа колонны и расход перегретого водяного
пара. Очевидно с увеличением значений этих важных факторов
число тарелок колонны должно уменьшаться. Выбор того или
иного температурного уровня работы колонны и расхода пере-
гретого водяного пара в конечном счете решается на основе
технико-экономических соображений путем сравнения несколь-
ких типичных вариантов, рассчитанных по изложенной выше
методике.
28*
ГЛАВА X
РЕКТИФИКАЦИЯ СЛОЖНЫХ СИСТЕМ
§ 1. Вводные замечания
Системы с числом компонентов больше двух ^называются
сложными или многокомпонентными. Ректификация подобных
систем широко распространена в промышленности, но теория
этого процесса далека от завершенности, и предстоит еще
большая работа для обоснования удобного и достаточно точного
метода расчета ректификационной колонны для разделения
сложных систем.
В этой области работали многие исследователи, однако
наиболее глубокие результаты были получены проф. А. М. Тре-
губовым [13], создавшим строго научную основу анализа слож-
ной картины процесса многокомпонентной ректификации. А. М.
Трегубов не закончил своего исследования и не довел его до
окончательной разработки практически удобного и точного
метода расчета сложной колонны. Тем не менее созданная им
основная теория является образцом научного исследования
сложнейшего из процессов химической технологии. Изложенная
в курсе А. М. Трегубова [13] эта теория здесь не приводится,
ибо читателю лучше ознакомиться с ней в превосходном
авторском изложении.
За последние годы было сделано немало попыток разработать
приближенные методы расчета ректификации многокомпонент-
ных систем, частью очень громоздких, частью недостаточно
точных. Тем не менее интересно кратко познакомиться с неко-
торыми результатами, полученными в этой области, чтобы иметь
представление об объеме проблемы, перспективах и путях ее
разрешения, постепенно намечающихся в результате усилий
многих исследователей.
§ 2. Принципиальная схема разделения сложных систем
Принципиальная схема промышленного разделения сложных
систем состоит в использовании нескольких последовательно
соединенных простых ректификационных колонн, каждая из
П ришщпиальная схема разделения сложных систем
437
Сырье
а
дар
О,и/
Жидкость
а, b
Сырье
Жидкость
Жидкость
Фиг.Д17. Способы деления
стемы.
состоящей из четырех
Ь
Пар
Жидкость
а
Пар
b
тронной си-
компонен-
w
которых разделяет поступающий продукт на легкий дестиллат
и тяжелый остаток.
Пусть требуется разделить смесь трех компонентов а, b и w
на практически чистые составляющие. Для этого необходимо
иметь две простые колонны. В первой из них система делится
на один из компонентов и на смесь двух других, а во второй
колонне эта смесь разделяется на свои практически чистые
компоненты. Для разделения четырехкомпонентной системы
понадобятся уже три простые колонны, для пятикомпонент-
ной — четыре и вообще для
«-компонентной системы
(и — 1) колонна. Это и по-
нятно, ибо каждая простая
колонна, кроме последней,
выдает лишь один целевой
продукт, а последняя — вы-
дает два целевых продукта,
что и уменьшает на еди-
ницу число потребные ко-
лонн против числа компо-
нентов.
Деление трехкомпонент-
ной системы в двух колон-
нах можно осуществить
двумя способами, схема-
тически показанными на
фиг. 117.
Ректификация системы,
тов а, Ь, с и w, может быть осуществлена пятью способами,
схематически показанными на фиг. 118. Для всех этих способов,
очевидно, число простых колонн равно трем.
Ректификация пятикомпонентной системы может быть осу-
ществлена 14 способами, шестикомпонентной — 42 способами
и т. д.
В нефтезаводской практике при ректификации такой сложной
системы, как нефть, содержащей огромное количество раство-
ренных друг в друге углеводородов различных классов, полу-
чаемые из нефти целевые продукты сами в свою очередь пред-
ставляют сложные смеси, выкипающие в пределах, установлен-
ных нормами. Вследствие этого при прямой перегонке нефти ее
обычно разделяют на 4 — 5 продуктов, иначе говоря, ведут
ректификацию в 3—4 простых колоннах. Однако эти простые
колонны не принято располагать в последовательный ряд, как
на приведенных выше схемах. На первую колонну, в которую
поступает сырая нефть, последовательно наращиваются укреп-
ляющие секции всех остальных простых колонн, отгонные
секции которых выносятся из получающегося таким образом
Г->Я
основного колонного аппарата, именуемого сложной колонной
(фиг. 119). Каждое сечение сопряжения двух укрепляющих
секций простых колонн представляет собой питательную секцию.
а, 6,с
Пар
а,Ь
Пар
——*-0
Пар
_ 6
Живность
w Живность
Живность
Сырье
Сырье
а,Ь,с 7Пар
Пар \ Ь'С
Жидкость
------w
Живность
' ~Пар Ь,с
ч 6, с, w Пар
Живность с w
Живность
~а
/ Пар *
Живность
Ь
Живность с
/
6, С, и/ 7 Пар
Живность^. Cf w / Пар С
Живность \
N------И/
Живность
Сырье
а,Ь
ПаР ’
Живность
Пар '
Живность
Живность
Фиг. 118. Способы деления системы из четырех
компонентов.
При этом надо заметить, что способ разделения здесь возможен
единственный, а именно тот, когда с верха укрепляющих сек-
ций каждой простой колонны уходит паровая смесь всех компо-
нентов, кроме одного, наименее летучего, отводимого из соот-
ветствующей отгонной секции.
Основные особенности, расчета ректификации сложных систем 439
Фиг. 119. Схема сложной нефтеперегонной колонны.
§53. Основные особенности расчета ректификации
сложных систем
Принципы и методы, на которых основана теория ректифи-
кации бинарной системы, применимы и к разделению многоком-
понентных систем, однако вследствие увеличенного числа пере-
менных здесь это сопряжено со значительно большими трудно-
стями. В самом деле, л-компонентная двухфазная жидко-паровая
система согласно правилу фаз обладает п степенями свободы.
В бинарной системе достаточно помимо давления, под которым
ведется процесс, задать содержание какого-нибудь компонента
в одной из фаз, чтобы состояние равновесной системы оказалось
полностью определенным. Не так обстоит дело в сложной
системе. Помимо постоянного внешнего давления здесь необ-
ходимо зафиксировать еще (и —1) других интенсивных факторов
для определения равновесного состояния системы. Поэтому
соотношение между составами данного компонента в жидкой и
паровой фазах сложной системы не определяется однозначно
заданием давления и состава одной из фаз по данному компо-
ненту, как в бинарной системе, а зависит от относительного
содержания других компонентов системы.
Анализ процесса ректификации в колонне, разделяющей
сложную смесь, ведется теми же методами материальных и
тепловых балансов, что и применявшиеся ранее при изучении
процессов в бинарных системах. Если при этом число незави-
симых уравнений материального баланса в бинарных системах
оказывалось равным двум, т. е. равным числу компонентов, то
в сложных системах этих уравнений будет уже п. Уравнение
теплового баланса, конечно, может быть только одно во всех
случаях.
Основной метод анализа работы сложной ректификационной
колонны состоит в аналитическом расчете числа ее теорети-
ческих тарелок, необходимых для данного разделения в опре-
деленных условиях орошения колонны. При этом, как правило,
делается допущение о постоянстве весов паровых и жидких
потоков по высоте обеих секций колонны. Нам уже известно-
из анализа ректификации бинарной системы, что подобное
допущение дает лишь приблизительную картину происходя-
щего процесса, однако учет изменяемости весов потоков чрез-
мерно осложнил бы расчеты. Тем не менее иногда приходится
прибегать и к тепловому балансу для учета весов.
Отправной точкой расчета отгонной секции колонны яв-
ляется состав ее нижнего продукта, уходящего из кипятиль-
ника. Применяя соотношения паро-жидкого равновесия и мате-
риального баланса при заданном и неизменном по всей высоте
секции весе потоков, ведут последовательный расчет соста-
вов фаз от тарелки к тарелке снизу вверх, пока не будет
достигнута питательная секция. Равным образом отправной
точкой расчета укрепляющей секции сложной колонны является
состав ее верхнего продукта, уходящего в паровой фазе из ее
парциального конденсатора. И здесь, применяя соотношения
паро-жидкого равновесия и материального баланса при задан-
ном и неизменном по всей высоте секции весе потоков, ведут
последовательный расчет составов фаз от тарелки к тарелке
сверху вниз, пока не будет достигнута питательная секция.
Таким образом, питательная тарелка колонны является тем
ее узловым пунктом, в котором должны быть увязаны резуль-
таты расчета отгонной и укрепляющей секций. При этом выяв -
ляется одно важное обстоятельство, свойственное процессу
ректификации сложных систем, с которым мы не сталкивались
при изучении разделения бинарной системы. Дело в том, что
не все компоненты исходной сложной системы присутствуют
и в верхнем и в нижнем продуктах ректификационной колонны,
как при разделении бинарной системы. В общем случае наибо-
лее легкие компоненты сырья концентрируются в дестиллате,
Понятие о ключевых компонентах
444
наиболее тяжелые — в остатке, и только компоненты проме-
жуточной летучести известным образом распределяются между
обоими целевыми продуктами колонны. Между темна пита-
тельной тарелке, куда поступает и исходное сырье, очевидно,
должны присутствовать все компоненты рассматриваемой
системы. Возникает вопрос, каким же образом, двигаясь снизу
вверх по отгонной секции или сверху вниз по укрепляющей,
можно достичь составов питательной тарелки, если отправные
точки расчета обеих секций, остаток и дестиллат, не содержат
некоторых компонентов системы. Легко сообразить, что на
нескольких тарелках отгонной секции, непосредственно при-
мыкающих к питательной, происходит полное удаление наибо-
лее летучих компонентов, а на нескольких близлежащих
к питательной секции тарелках укрепляющей колонны проис-
ходит полное удаление наиболее тяжелых компонентов.
Поэтому, ведя аналитический расчет от тарелки к тарелке,
необходимо, начиная с какой-то близлежащей к питательной,
секции тарелки отгонной колонны, подправить составы ее фаз,
введя известное количество легких компонентов, нс содержа-
щихся в остатке, и, начиная с какой-то тарелки укрепляющей
секции, расположенной недалеко от питательной тарелки, под-
править составы ее фаз, введя известное количество тяжелых
компонентов, не содержащихся в дестиллате. Однако это регу-
лирование составов на тарелках, примыкающих к питательной
секции, не может быть произвольным и должно подчиняться
тому важному требованию, чтобы обеспечить получение состава
питательной тарелки в конце расчета отгонной и укрепляющей
секций колонны. Поскольку нет объективных количественных
критериев, позволяющих устанавливать меру и уровень ввода
дополнительных компонентов в состав потоков отгонной и
укрепляющей секций, эта процедура ведется методом попыток
и весь расчет сложной колонны даже при допущении постоянства
весов потоков по высоте ее секций должен вестись методом
постепенного приближения.
§ 4. Понятие о ключевых компонентах
Пусть дана многокомпонентная смесь и производится ее
разделение на две части — более летучий дестиллат и менее
летучий остаток. Не следует думать, что разделение в ректи-
фикационной колонне происходит абсолютно четко и граница
раздела лежит между двумя определенными смежными компо-
нентами, один из которых оказывается целиком в остатке, а дру-
гой в дестиллате. На самом деле и тот и другой компоненты
появляются и в остатке и в дестиллате в пропорциях, опре-
деляемых их летучестью. В качестве примера рассмотрим
типическое разделение сложной углеводородной системы
Ректификация сложных систем
Таблица 29
Компоненты Сырье Остаток Дестиллат
ЧИСЛО молей состав а; число молей состав % ЧИСЛО молей состав У Di' %
Метан 26 0,26 0,0 0 26 42,90
Этан 9 0,09 0,0 0 9 14,9
Пропан 25 0,25 0,04 0,1 24,96 41,2
Бутан 17 0,17 16,39 41,6 0,61 1,0
Пентан .... 11 0,11 11,00 27,9 0,0 0,0
Гептан 12 0,12 12,00 30,4 0,0 0,0
Итого . . 100,0 1,00 39,43 100,0 60,57 100,0
в ректификационной колонне (табл 29), заимствованное
у В. Г. Фастовского [14].
Остаток состоит в основном из бутана, пентана и гептана,
однако очень небольшое количество пропана все же попадает
в остаток. Равным образом и дестиллат, состоящий в основном
из метана, этана и пропана, содержит небольшое количество
бутана. Эти два компонента, пропан и бутан, являются типичными
представителями тех пограничных компонентов, называемых
ключевыми, между которыми как бы проходит граница раздела
исходной системы. Один из этих пограничных компонентов,
в рассматриваемом случае пропан, называется легким ключевым
компонентом, а другой —тяжелым. Важно отметить, что легкий
и тяжелый ключевые компоненты не обязательно должны быть
смежными, непосредственно примыкающими друг к другу ком-
понентами на шкале летучести. Между ними могут располо-
житься и другие компоненты промежуточной летучести, различ-
ным образом распределяющиеся между дестиллатом и остатком.
Основное значение имеет лишь то, что все компоненты исход-
ного сырья, более летучие, чем легкий ключевой компонент, попа-
дают только в дестиллат, а все компоненты, менее летучие, чем тя-
желый ключевой компонент, попадают только в нижний продукт.
Понятие о пограничных или ключевых компонентах пред-
полагает, что самым легким из компонентов нижнего продукта
является легкий ключевой компонент, а самым тяжелым из
компонентов верхнего продукта колонны является тяжелый
ключевой компонент.
§ 5. Определение температуры паров, уходящих с верха
парциального конденсатора, и давления в колонне
Предполагается, что паровой поток, уходящий с верха пар-
циального конденсатора, находится в насыщенном состоянии.
•Следовательно, давление в колонне должно быть выбрано таким
Определение температуры и давления верха колонны
443
образом, чтобы обеспечить возможность конденсации паров
верхнего продукта за счет наиболее дешевого и доступного
хладоагента — воды. За исключением тех случаев, когда при-
ходится прибегать к искусственному снижению температур про-
цесса, чтобы перейти в область ниже критической точки, един-
ственным хладоагентом, применяемым на ректификационных
установках, является.вода.
При разделении легких углеводородов йыбор рабочего давле-
ния в колонне определяется экономическими соображениями,
о которых говорилось ранее. Во всяком случае необходимо
выбрать достаточную разность температур между хладоагентом
и точкой полного сжижения дестиллатных паров, чтобы не
получить чрезмерно большой поверхности конечного конденса-
тора. В ряде случаев, чтобы избежать значительного повыше-
ния давления в колонне, приходится итти на неполную кон-
денсацию дестиллатных паров.
Порядок расчета следующий. Приняв температуру полного
сжижения дестиллатных паров на 15—20° выше температуры
охлаждающей воды, определяют то давление, под которым
должна находиться смесь легких углеводородов. Расчет необ-
ходимого давления ведется по уравнению изотермы жидкой
фазы сложной системы:
i = и
р= v р^'- (х- о
i=i
Упругости Pz насыщенных паров чистых компонентов си-
стемы подставляются в уравнение изотермы при температуре,
выбранной в качестве точки конца конденсации дестиллатных
паров. Если вместо упругостей паров приходится пользоваться
равновесными фазовыми отношениями ki, то уравнение изотермы
записывается в виде
> = п
2Х’1 <Х.2)
1 = 1
и решается методом постепенного приближения путем подбора
такого давления, которое при температуре полной конденсации
превращает это уравнение в тождество.
Однако довольно часты и такие случаи, когда температура
полного сжижения дестиллатных паров при атмосферном давле-
нии оказывается больше температуры охлаждающей воды и
тогда, конечно, колонны работают под атмосферным давлением.
Здесь уже нет необходимости находить давление, и те же
уравнения изотермы жидкой фазы используются для нахождения
точного значения температуры полного сжижения паров, иду-
щих с верха парциального конденсатора. Расчет ведется мето-
дом постепенного приближения.
г екЛйфйКицил
Если необходимо найти температуру паров, уходящих с верха
парциального конденсатора, расчет ведется уже по изотерме
паровой фазы:
1=п , i=n (
<х-3) или <х-4>
/=1 * (=i 1
также методом постепенного приближения.
Как общее правило следует иметь в виду, что всегда, когда
ищется температура той или иной паровой фазы, необходимо
находить точку конца кипения системы данного состава, если же
ищется температура жидкой фазы, то рассчитывают точку ее
начала кипения. Это объясняется тем, что паровой и жидкие
потоки колонны принято считать находящимися в насыщенном
состоянии.
Пример. Исходная смесь и продукты ее разделения приведены в табл. 29 .
Дополнительно известно, что температура дестиллатных паров на выходе из
парциального конденсатора /п = 21°. Требуется определить давление, под ко-
торым работает колонна, если метан считается перманентным газом, не по-
являющимся в жидкой фазе.
Расчет давления насыщения, под которым находятся дестиллатные пары
на выходе из парциального конденсатора, ведется методом постепенного при-
ближения по изотерме паровой фазы путем подбора такого давления, при ко-
тором равновесные фазовые отношения Л,-для температуры 21°, будучи под-
ставлены в уравнение изотермы, превращают его в тождество. Таким давле-
нием оказывается р, = 18,1 ат. Расчет сведен в табл. 30.
Таблица 30
Компоненты дес- тиллатных паров У Di' /с,-, Pi --18,1 ат, tD = 21° , У Di Х°‘ к1
Метан 0,429 0
Этан 0,149 2,1 0,071
Пропан 0,412 0,486 0,847
Бутан 0,010 0,122 0,082
Итого ... 1,000 — 1,000
§ 6. Определение температуры низа колонны
В свете изложенного ясно, что температура насыщенной
жидкости, уходящей из кипятильника колонны, должна опре-
деляться по изотерме жидкой фазы при давлении, найденном
из расчета верха колонны. Уравнение изотермы напишется сле-
дующим образом:
1 = п
P=y*Pi*Rl’. (Х.5>
i= 1
Коэффициенты относительной летучести
445
Задаваясь температурой низа tR, определяя при этой темпе-
ратуре упругости насыщенных паров компонентов остатка Pt
и подставляя их в уравнение изотермы, подсчитываем р и
сравниваем его с действительным значением давления, под ко-
торым работает колонна. В случае их совпадения температура iR
была выбрана правильно; если же они не совпадают, то нужно
снова задаваться температурой tR и поступать так до тех пор,
пока эти значения давлений, рассчитанного и действительного,
не совпадут.
§ 7. Использование коэффициентов относительной летучести
для расчета условий равновесия в сложных системах
Вследствие известного подобия в ходе кривых упругостей
веществ, сходных по химическому строению и физическим свой-
ствам, их коэффициенты относительной летучести в небольшом
интервале температур сохраняют приблизительное постоянство.
Для ориентировочных подсчетов условий паро-жидкого равно-
весия сюжных систем это может быть использовано как фактор,
упрощающий расчеты. Дадим вывод основных формул, связы-
вающих равновесные составы жидкой и паровой фаз сложной
системы.
Уравнение равновесия, написанное для двух произвольных
компонентов системы, например первого и второго, представится
следующим образом:
РУ1 = V1P1X1 и ру2'=у2Д>х2'.
Разделив одно уравнение на другое, имеем
У/ = = m
у/ у2Р2 ‘ х2' 1 2х/ ’
где 2 — коэффициент относительной летучести первого ком-
понента по отношению ко второму. В качестве эталонного ком-
понента, с летучестью которого сравниваются летучести осталь-
ных, может быть принят любой из компонентов сложной си-
стемы, для него т, очевидно, должно равняться единице.
Для п-компонентной системы можно написать, что сумма
составов всех ее компонентов в паровой фазе равна единице:
У1 + Уг + • • • + Уп = 1. (X. 7)
Примем второй компонент системы за эталонный и, разделив
все члены уравнения (X. 7) на у2', заменим отношение составов
в паровой фазе через отношение составов тех же компонентов
в жидкой фазе при помощи уравнения равновесия (X. б):
*1' , *з' 1
1+ т32-з+ .. + тп2~7 = -г,.
л2 л2 л2 у2
(Х.б)
446
Ректификация сложных систем
Отсюда у2':
, Х„' X.,'
у 2 =---------------‘----------------— --- •
И12 х/Ц-х/ + mS2x3' -у... + mn2xn' >, тх'
откуда состав уг первого компонента в
оЛ’п
= и аналогично составы остальных
Zj тх'
Сравнивая полученное соотношение с уравнением равнове-
сия (X. 6), можем написать
X? / х2 х,'
‘ 2jmx = 77 = /Л1277'
паровой фазе yt' =
компонентов
т. д.
выраженный через
коэффициенты относительной летучести и составы равновесной
жидкой фазы, представится уравнением
, х,‘ т3 2х3
У2 = V ~ —, У3= и
Л тх Zj тх
В общем виде состав паровой фазы,
Аналогичным образом можно вывести соотношения и для
перехода от составов паровой к составам равновесной жидкой
фазы при помощи коэффициентов относительной летучести.
Исходным уравнением служит уравнение
Xi'4-x2' + x3' + -..- х„' = 1.
Разделив все члены на х2', заменим отношение составов
в жидкой фазе отношением составов тех же компонентов
в паровой фазе, использовав для этого уравнение равновесия
Х.6):
1 . 1 1 . Уз' , , 1 Уп 1
mj2 у2‘ т32 ‘ у2’ тп2 ' у2' х2 ’
Найдем отсюда х2':
„ / ______________Уг____________
2 1 , , , 1 1
+" + i^y"
Сравнивая полученное соотношение с уравнением равно-
весия, можно написать
у 221 = .Уз! = 1 . 211
т л/ ffli» Xi' ‘
Коэффициенты относительной летучести
1ДТ
Откуда состав х/ первого компонента в жидкой фазе
„ / . У/М 2
^1 х? ' /
2 У /т
В общем же виде для состава х,' любого компонента си-
стемы это уравнение представится в следующем виде:
При м е р. Требуется найти состав паровой фазы, находящейся в равно-
весии с жидкостью, содержащей 0,9% мол. пропана, 47,5% мол. бутана,
45,2% пентана и 6,4% гексана. Известно, что система находится под давле-
нием 18 ата. а коэффициенты относительной летучести ее компонентов,
взятые по отношению к бутану, сохраняют в температурном интервале
130—140° приблизительно постоянные значения, соответственно равные:
т3 4 = 1,97, т51 = 0,54 и тв4 = 0,32.
Таблица 31
TV Д'
I 7 { Хтх'
Пропан 0,009 1.97 0,0175 0,023
Бутан 0,475 1,00 0,4750 0,628
Пентан 0,452 0.54 0,2440 0,322
Гексан 0,064 0,32 0,0205 0,027
Итого . . . 1,000 Хтх' = 0,7570 1,000
Решение этой задачи приведено в табл. 31. Однако довольно часто тре-
буется помимо состава паровой фазы определить еще температуру, под
которой находится система. Для этого необходимо написать основную рас-
четную формулу для эталонного компонента, коэффициент относительной
летучести которого равен единице:
Уэ =55----7'
>, тх.'
откуда легко получить
Таким образом, равновесное [фазовое отношение для эталонного компо-
1
нента равно—------. Для рассматриваемого примера эталонным компонентом
>, тх'
является бутан, поэтому kt = - = 1,32.
Если обратиться к соответствующим справочным данным, то при задан-
ном давлении в 18 ата этому значению /:4 н-бутана отвечает температура
135°, которая и будет в то же время температурой равновесной системы.
448
Ректификация сложных систем
§ 8. Аналитический расчет сложной колонны путем
перехода от одной контактной ступени к другой
Аналитический расчет сложной колонны „от тарелки к та-
релке" аналогичен изученному ранее аналитическому методу
расчета простой колонны и основан на тех же принципах.
Он позволяет, используя попеременно условия паро-жидкого
равновесия и соотношения материального баланса, пройти всю
рассматриваемую секцию колонны от ее первой до последней
тарелки, ведя счет пройденным ступеням контакта и фиксируя
на каждой тарелке температуру и составы равновесных фаз.
Обычным допущением, значительно упрощающим расчеты,
является принятие постоянства весов потоков флегмы и паров
по всей высоте секций колонны. Поэтому, имея заданным
а
величину рабочего флегмового числа можно легко
найти веса потоков в отгонной и укрепляющей секциях ко-
лонны. Так, например, вес флегмы, стекающей в отгонной
секции, g' определится из очевидного соотношения:
g' =<pD + (\ — e')L.
(Х.11)
В отличие от метода аналитического расчета бинарной си-
стемы, где мы пользовались одним лишь уравнением опера-
тивной линии для каждой секции, здесь их число равно числу
компонентов системы, и это обстоятельство в случае много-
компонентной системы заметно осложняет расчетную про-
цедуру. Имея в виду полную аналогию метода расчета сложной
колонны „от тарелки к тарелке" и ранее изученного аналити-
ческого расчета простой колонны, покажем его практическое
применение на примерах расчета некоторых узловых точек
сложной колонны.
Пример. Исходная система, содержащая 3% мол. этана, 20% пропана,
37% н-бутана, 35% н-пентана и 5% гексана, поступает в колонну при темпе-
ратуре 107° и подвергается разделению на дестиллат, содержащий не более
1,5% н-бутана, и остаток, содержание пропана в котором не должно пре-
восходить 1%.
Расчет основных узловых точек колонного аппарата будем вести
на 100 молей исходного сырья. Ввиду незначительного допускаемого содер-
жания пропана в остатке и н-бутана в дестиллате можно с полным основа-
нием пренебречь содержанием этана в остатке и углеводородов, более тяже-
лых, чем н-бутан, в дестиллате. Распределение компонентов между остатком
и дестиллатом показано в табл. 32.
Числа молей дестиллата и остатка могут быть определены и по уравне-
ниям материального баланса. Так, например, число молей остатка по соста-
вам пропана найдется из уравнения
Число молей дестиллата, очевидно, равно 0 = 100 — 77,4 = 22,6 моля.
Уравнения материального баланса могут быть использованы и несколько
Расчет сложной колонны
449
Таблица 32
Компоненты Сырье, моли Остаток Дестиллат ..
МОЛИ состав моли состав
Этан 3,0 — 3,0 0,133
Пропан 20,0 0,7 0,009 19,3 0,854
н-Бутан 37,0 36,7 0,475 0,3 0,013
н-Пентан .... 35,0 35,0 0,451 — —
«-Гексан .... 5,0 5,0 0,065 —
Итого . . . . 100,0 77,4 1,000 22,6 1,000
по-другому. Так, по составу xRi' пропана в остатке и по числу молей де-
стиллата можно найти содержание С3 в верхнем продукте:
L . , „„„„,0,200 — 0,009 по_л
Тдз — х/?з Ь'д- (аз — А/?з ) — 0,009-1-Q226--~
И мея состав верхнего продукта, уходящего в паровой фазе с верха
парциального конденсатора, можно по изотерме паровой фазы найти давле-
ние, под которым должна работать колонна, чтобы пары дестиллата нахо-
дились в насыщенном состоянии при температуре 45—50°. Как показывает
опыт, при разделении легких углеводородных систем этот температурный
интервал является оптимальным при использовании в качестве хладоагента
воды, находящейся при температуре окружающей атмосферы. Пусть темпе-
ратура дестиллатных паров /О = 47°. Тогда методом подбора определяется
давление в колонне р=18шид. Соответствующий подсчет приведен в табл.33.
Таблица 33
Компоненты Ущ' /с., р=18ата, 1 = 47°
Этан ... Пропан Бутан 0,133 0,854 0,013 2,55 0,935 0,38 0,052 0,913 0,034
Итого . . . 1,000 — 0,999
Последняя графа табл. 33 дает значения составов орошения, стекающего
из парциального конденсатора на первую тарелку укрепляющей колонны,
считая сверху. Имея состав нижнего продукта колонны и давление, нетрудно
по уравнению изотермы жидкой фазы найти температуру остатка tR. Од-
нако мы не будем приводить этого расчета, так как он приведен выше при
помощи коэффициентов относительной летучести, где было найдено, что
t R = 135°.
29 Зак. № 304.
450
Ректификация сложных систем
Следующий этап расчета состоит в последовательном опре-
делении путем перехода от ступени к ступени температур
и составов фаз, покидающих различные тарелки колонны.
Этот расчет можно проводить, либо спускаясь вниз по высоте
колонны, исходя от известного состава орошения, стекающего
из парциального конденсатора, либо поднимаясь кверху, исходя
из известного состава нижнего продукта. В обоих случаях
в конце расчета мы должны подойти к питательной секции
колонны.
Основные уравнения материального баланса, при помощи
которых можно перейти от составов, например, жидкого по-
тока, стекающего с i-й ступени, к составу жидкой же фазы,
стекающей с (г4-1) или с (i — 1) ступени, могут быть напи-
саны сразу путем обобщения соотношений, ранее выведенных
при анализе бинарных систем. Для расчета отгонной секции
снизу вверх можно пользоваться уравнением
(X.12а)
&l oi
При расчете же от вышележащей к нижележащей ступени
можно уравнение материального баланса по содержанию про-
извольного компонента записать так:
xt =xi+i~k[ ' “ё/ хя ЦТ ' G?~‘ (X. 126)
Аналогичным образом для расчета укрепляющей секции
при переходе от нижележащей к вышележащей тарелке имеем
. . G,_, п
xt = xt-\ ki-i ' % 7Г У di (X. 13)
о I о I
и при переходе сверху вниз от тарелки к тарелке
Х1 ~~Gt g7 ' v (X- 14)
Для использования этих уравнений необходимо иметь зна-
чения чисел молей паровых или жидких потоков G и g и даже
при допущении постоянства молярных потоков по высоте
колонны нужно располагать величиной флегмового числа.
Пусть для рассматриваемой задачи рабочее флегмовое
число ?> = g!D — 5. Покажем, как оно используется для полу-
чения уравнений концентраций. Для укрепляющей секции ко-
лонны имеем
= ,,4-1 xi + ^4-1 = "б” ~*"б' = 0,834 х(. 4-0,166 уО('.
Расчет сложной колонны
451
Однако для отгонной секции число молей ее жидких и па-
ровых потоков зависит от фазового состояния сырья на входе
в колонну. Поэтому необходимо выяснить, какова степень
отгона сырья при его поступлении в питательную секцию ко-
лонны.
Расчет, проведенный по обычному методу, представлен в табл. 34 для
ё = 0,160.
Таблица 34
Компоненты + ' kit р= 18 ата\ /о = 107° 1 —е' , . 1 — г' е+ У/ , Vi X; ' = ~. 1 k<
ki
Этан . . . 0,030 5,00 0,168 0,328 0,0915 0,0183
Пропан . . 0,200 2,00 0,420 0,580 0,3450 0,1725
Бутан . . 0,370 0,97 0,865 1,025 0,3610 0,3720
Пентан . . 0,350 0,48 1,750 1,910 0,1830 0,3810
Гексан . . 0,050 0,25 3,360 3,520 0,0142 0,0568
Итого 1,000 — — — 0,9947 1,0006
Число молей жидкого потока g', стекающего с каждой тарелки отгон-
ной секции, найдется по очевидному соотношению:
g’ = <pD + (1 _ е') L’ = 5 х 22,6+(1—0,16) 100 = 197 молей.
Та же величина условно принятого постоянным молярного потока жид-
кости в отгонной секции колонны может быть найдена еще и из того со-
ображения, что она равна сумме молярного потока паров плюс вес остатка.
Молярный же поток паров в отгонной секции меньше молярного потока
паров в укрепляющей на величину отогнанных из сырья паров:
g' = G' + R = (<p + 1)D — е'А + 7? = 6 х 22,6 — 0,16 х 100 + 77.4 = 197 молей.
Число молей паров G' = g'— /? = 197 — 77,4= 119,6 моля. Теперь можно
написать общий вид уравнения концентраций для отгонной секции колонны:
119 6 77 4
xl-f-i' = ~ 197- У/ + “197 ’ Хд/ = 0,607у/ + 0,393хд/. (X. 15)
Остается показать, как используются найденные уравнения
концентраций для расчета секций колонны. Метод расчета
здесь совершенно тот же, что и для бинарной колонны. Так,
для расчета отгонной секции исходной точкой является со-
стояние нижнего продукта колонны. Найдя по уравнению
равновесия yi' = klxl' состав равновесного остатку пара, подни-
мающегося на первую^ считая снизу, тарелку, можно при
помощи уравнения концентрации (X.15) рассчитать для каж-
дого компонента его содержание во флегме, стекающей с этой
тарелки навстречу паровому потоку. Соответствующий расчет
показан в табл. 35.
29*
Таблица 35
Компоненты Кипятильник, tR = 135° Первая тарелка, /,= 128°
xRi' kv / = 135° Ут' 0,607yRi' 0,393x^7 xi' ki Ун
Пропан .... Бутан .... Пентан .... Гексан .... 0,009 0,475 0,451 0,065 2,59 1,31 0,72 0,42 0,023 0,628 0,322 0,027 0,014 0,382 0,195 0,017 0,003 0,187 0,177 0,025 0,017 0,569 0,372 0,042 2,5 1,22 0,66 0,37 0,0425 0,695 0,245 0,0155
Итого . 1,000 — 1,000 1,000 0,9980
Определение температуры тарелки ведется методом подбора таких зна-
чений А,-, которые превращают в единицу сумму составов паровой фазы у1(-_
Так, для первой тарелки эта температура оказывается равной /1=128°.
Аналогичным образом может быть рассчитан состав паров, поднимающихся
со второй, третьей и т. д. тарелок отгонной секции. Расчет следует вести
до тех пор, пока не будет достигнута питательная секция колонны. Со-
ответствующие вычисления для второй и третьей тарелок показаны в табл. 36.
Таблица 36
Компоненты Ун' Вторая тарелка, 12 = 121° Третья тарелка, Г, = 119°
0,607 х х2/ *2 Ун' 0,607х Xy2f ^3 Ун'
Пропан . . 0,0425 0,0258 0,0288 2,33 0,067 0,0406 0,0436 2,22 0,097
Бутан . . . 0,6950' 0,4220 0,6090 1Д7 0,712 0,4320 0,6190 1,14 0,706
Пентан . . 0,2450 0,1490 0,3260 0,62 0,202 0,1230 0,3000 0,60 0,180
Гексан . . 0,0155 0,0094 0,0344 0,33 0,011 0,0067 0,0317 0,31 0,010
Итого 0,9980 — 0,9982 — 0,992 — 0,9943 — 0,993
Методику постепенного приближения при расчете условий
паро-жидкого равновесия на тарелках можно упростить, при-
меняя для ориентировочных расчетов не равновесные фазовые
отношения к{, а относительные летучести mi;.. При этом ре-
зультаты получаются, конечно, приближенные, однако про-
цедура расчета заметно упрощается.
Рекомендуется пользоваться среднегеометрическими значе-
ниями коэффициентов относительной летучести, подсчитанных
по значениям температур на верху и внизу рассчитываемой
секции.
Расчет сложной колонны
453
В табл. 37 приведен расчет средних значений tntj для компонентов рас-
сматриваемой системы по значениям kt, взятым при температурах низа ко-
лонны 1^ = 135° и поступающего сырья 1о = 1О7°.
Таблица 37
Компоненты ki’ t0 = 107= t# = 135° mi4 mi4' mep = = / tn i4mi4’
Пропан 2,00 2,06 2,59 1,97 4,10 2,02
Бутан 0,97 1,00 1,31 1,00 1,00 1,00
Пентан 0,48 0,495 0,72 0,54 0,267 0,516
Гексан 0,25 0,258 0,42 0,32 0,0825 0,287
При помощи полученных средних значений относительных
летучестей компонентов можно провести расчет отгонной сек-
ции по уравнениям (X. 8) и (X. 9). Для первых двух тарелок
---рассматриваемой секции-пример, расчета, приведен в табл. 38._
Таблица 38
Компоненты
Пропан
Бутан
Пентан
Гексан
Кипятильник
2,02
1,00
0,516
0,287
0,009
0,475
0,451
0,065
0,0182
0,475
0,233
0,0187
0,0244
0,6375
0,3130
0,0251
Тарелка 1 Тарелка 2
0,0172
0,5750
0,3675
,0,0403
0,0348
0,5750
0,1900
0,0116
0,043
0,709
0,234
0,014
0,029
0,618
0,319
0,034
0,0586
0,618
0,155
0,0098
0,0697
0,7340
0,1846
0,0117
Итого
1,000 0,7449 1,0000 1,0000 0,8114 1,000 1,000 0,8414 1,0000
Сравнение полученных данных с ранее подсчитанными показывает неко-
торое различие в‘ составах покидающих тарелки потоков, однако оно неве-
лико и для ориентировочных подсчетов приемлемо. Для определения темпе-
ратуры потоков, стекающих с той или другой тарелки, удобнее исходить
из того соображения, что равновесное фазовое отношение эталонного
компонента, в данном случае н-бутана, равно
y^ = ki= 1 .
xt 2mx
(X. 16)
Найдя по этому уравнению kt и зная давление в колонне, нетрудно
определить соответствующую температуру. Так, например, для второй та-
релки ki== J = 1,19 вместо 1,17, найденного выше в табл. 36. Соответ-
0,о414
ственно и температура оказывается уже не 121°, а 123°, что представляет
заметное расхождение.
Таким образом, составы потоков еще в той или иной степени допустимо
определять в ориентировочных расчетах при помощи средних значений коэф-
фициентов относительной летучести, но находить этим способом температуры
потоков нельзя рекомендовать.
Перейдем к рассмотрению метода расчета укрепляющей
секции колонны. Исходной точкой расчета здесь является со-
стояние дестиллатных паров, покидающих парциальный кон-
денсатор. По известному из расчета температуры верха составу
равновесного дестиллатным парам орошения, стекающего на
первую, считая сверху, тарелку, можно при помощи уравне-
ния материального баланса рассчитать состав парового потока,
поднимающегося с этой тарелки навстречу орошению. Расчет
показан в табл. 39.
Таблица 39
Компоненты Дестиллат Орошение Тарелка 1, /1=52°
МОЛИ состав МОЛИ состав пары ki *1/
моли состав
Этан Пропан Бутан 3,0 19,3 0,3 0,133 0,854 0,013 5,89 103,27 3,84 0,052 0,913 0,034 8,89 122,57 4,14 0,066 0,904 0,030 2,65 1,00 0,41 0,025 0,904 0,073
Итого . . 22,6 1,000 113,00 0,999 135,6 1,000 - 1,002
Как и в расчете отгонной секции, подбор температуры тарелки ведется
методом постепенного приближения. Аналогичным образом может быть рас-
считан состав флегмы, стекающей со второй, третьей и т. д. тарелок отгон-
ной секции. Расчет следует вести до тех пор, пока не будет достигнута
питательная секция колонны. Для второй и третьей, считая сверху, тарелок
оасчеты сведены в табл. 40.
Укрепляющую секцию тоже можно рассчитать упрощенным
методом при помощи постоянных приближенных значений
коэффициентов относительной летучести. Однако здесь, как
и в отгонной секции, получающиеся результаты годны лишь
для ориентировочных целей.
Изложенная выше приближенная методика обычно доста-
точна для определения сечения ввода сырья в колонну, не-
смотря на то, что в нижней секции, например, не учтены
компоненты, более легкие, чем легкий ключевой, а в укре-
пляющей секции — более тяжелые компоненты, чем тяжелый
Изменение весов паровых и жидких потоков
4о5
Таблица 40
Компоненты хц' Тарелка 2, 12 = 57° Тарелка 3, Z3=63°
0,834 хи' 0,166 Уо/ Уи ^2/ х2/ 0,834 X Xx2f' Уз/ Лз/ *з/
Этан . . . 0,025 0,0208 0,0221 0,0430 2,83 0,015 0,0125 0,0346 3,04 0,011
Пропан . . 0,904 0,7540 0,1420 0,8960 1,07 0,838 0,6990 0,8410 1,13 0,745
Бутан . . . 0,073 0,0608 0,0022 0,0630 0,45 0,140 0,1165 0,1187 0,485 0,245
Итого 1,002 — — 1,002 0,993 0,9943 1,001
ключевой. Ошибка здесь, как правило, невелика и ею можно
пренебречь. Когда требуется определить состав потоков вблизи
питательной секции, а сырье содержит заметные количества
всех компонентов, то, как указывалось выше, приходится пу-
тем подбора вносить некоторые количества неучтенных компо-
нентов в-составы- жидких и паровых потоков, а затем прове-
рять правильность этого.
§ 9. Учет изменения веса паровых и жидких потоков
по высоте секции
Рассмотренный нами аналитический метод расчета сложной
колонны „от тарелки к тарелке" страдает тем серьезным
недостатком, что не учитывает изменяемости молярных потоков
при переходе от одного горизонтального уровня колонны
к другому. При анализе бинарной колонны было установлено,
что принятие постоянства молярных потоков находится в из-
вестном противоречии с действительной картиной процесса,
и путем использования уравнения теплового баланса оказалось
возможным каждый раз находить действительные значения
весов или молярных потоков паров и жидкости в любом меж-
тарелочном отделении колонны. Изменяемость молярных пото-
ков или весов паров и флегмы в сложной колонне также
можно учитывать путем использования уравнения теплового
баланса. Однако здесь эта задача решается значительно слож-
нее и лишь методом постепенного приближения. Расчет
действительных весов паровых и жидких фаз производится
в несколько этапов. В первой стадии расчета допускают по-
стоянство молярных потоков и на основе этого допущения
по составу одной из фаз находят состав встречной на одном
уровне фазы так, как это делалось в рассмотренном выше
примере. Затем во второй стадии расчета по уравнению изо-
термы определяют температуру встречного потока, которым
в отгонной секции является жидкий поток, а в укрепляющей
456 PpicTfffhiitrnfiffrT y CtlC^R-r^
секции паровой поток. Далее рассчитывается теплосодержание
обоих встречных потоков по уравнениям
и ?'= 2 (хп').(?„%
1=1 i=i
что составляет третью стадию расчета. В четвертой стадии
расчета определяется в первом приближении исправленное
значение молярного потока при помощи уравнения теплового
баланса:
ёп'Яп +GnQn - gn+xQn+x' + Gn^QnJ. (X. 17)
Сделав подстановку gn~Gn_{^ D или gn = Gn+i + R в зави-
симости от того, какая рассчитывается секция (укрепляющая
или отгонная), можно преобразовать уравнение теплового
баланса:
G„_i QnJ - gn qn' = GnQn' - gn+1 qn+l' = const = D62,
откуда флегмовое число в рассматриваемом сечении
g _ 02 —Q„+1'
D dn^~qn'-
Аналогичным образом и для отгонной секции
Sn Qn-l'
По полученным в четвертой стадии расчета значениям мо-
лярных потоков устанавливается первое приближенное значе-
ние флегмового числа в рассматриваемом сечении, отвечаю-
щее температуре, найденной выше во второй стадии расчета.
В дальнейшем все стадии расчета, начиная с первой, повто-
ряются до получения полного совпадения между принятым
и найденным значениями молярного потока. При этом в целях
интерполяции удобно представлять флегмовые числа в функции
температуры.
Изложенная методика учета изменяемости молярных пото-
ков по высоте колонны сложна, требует значительной затраты
труда и должна применяться лишь в тех случаях, когда тре-
буется особенная точность расчета. В большинстве же случаев
приходится ограничиваться описанной выше приближенной
методикой, пренебрегающей изменением молярных потоков
по высоте секций.
Оптимальное расположение питательной тарелки 4.57
§ 10. Оптимальное расположение питательной тарелки
в сложной колонне
Если в аналитическом расчете колонны было принято до-
статочно большое флегмовое число, то, ведя расчет, например,
с низа отгонной секции и переходя от тарелки к тарелке по
высоте колонны, мы в конечном счете должны подойти к ее
питательной секции. Уже из анализа процесса бинарной ректи-
фикации нам известно, что питательная секция может в из-
вестных пределах перемещаться по высоте колонны. Возни-
кает вопрос, какую же из последовательных тарелок отгонной
секции считать ее последней тарелкой, на каком ее уровне
прекратить использование соотношений материального баланса
отгонной секции и перейти к использованию уравнений, харак-
теризующих работу укрепляющей секции.
Ответ на этот вопрос дается на основе концепции ключе-
вых компонентов, рассмотренной ранее. Легкий ключевой ком-
понент обозначим а, а тяжелый w. Имея в виду, что веса
потоков и g паровой и жидкой ф аз не одинаковы вобе их
секциях колонны, в целях различения введем для весов от-
гонной колонны дополнительный верхний индекс — штрих.
Тогда уравнение материального баланса по весу легкого клю-
чевого компонента для отгонной секции представится в сле-
дующем виде:
5X(i+l) =°'Уа,+#ХаР
ИЛИ
Уы = g'—R Ха (1+1) — g'^R • (X. 18)
Аналогичное уравнение может быть написано и по весу
тяжелого ключевого компонента.
Уравнение материального баланса по весу компонента а
для укрепляющей секции напишется также известным образом:
GVa,==^a(1+1)+^aD
или
Уat = g + Z) Ха (i + 1) + ' (X. 19)
Если попрежнему обозначить флегмовое число 9>=~-,то
последнее уравнение можно переписать в виде
?.. = vfrW» +-^т <х-2°)
Очевидно, аналогичные уравнения могут быть написаны
и по весу тяжелого ключевого компонента w.
Возвратимся к поставленному выше вопросу об оптималь-
ном уровне перехода из отгонной секции в укрепляющую.
Очевидно, имеет смысл перейти из одной секции в другую
лишь в том единственном случае, когда обогащение, дости-
гаемое на рассматриваемой тарелке в условиях ее работы
в отгонной секции, меньше, чем при переносе ее в укрепляю-
щую секцию. В самом деле, если бы число тарелок отгонной
секции было л, то на последней л-й тарелке, являющейся по
существу питательной, мы должны были бы иметь отношение
составов XafXw, большее, чем это же отношение, рассчитанное
на основе уравнения материального баланса укрепляющей сек-
ции:
^xaft РУаР
(—') = Уа(п-1)---- G_ --- G__ (Х21)
\Xw/n RxU)R DywD V
Уш(П— 1) + Q> — (J
При расчете простой колонны было установлено, что паро-
вые и жидкие потоки на различных уровнях питательной
секции связаны следующими соотношениями:
G'=G — (1— &)L, G=g + D и G' + R=g’.
Преобразуем неравенство (X. 21), вычитая из числителя и
знаменателя правой дроби числитель и знаменатель левой,
и примем во внимание написанные выше соотношения между
весами потоков в питательной секции колонны. Тогда нера-
венство (X. 21) придет к виду
“а + -^г(1-д)’саЯ
а» + -QrG~&)xwR
(X. 22)
При выводе неравенства (X. 22) принято во внимание, что
для всех компонентов выдерживается соотношение
Lai = RxRi*DyDi. (X. 23)
Если в отгонной колонне установлено п тарелок, то (п + 1)
тарелка, считая снизу, будет первой тарелкой укрепляющей
секции и отношение составов легкого и тяжелого ключевого
компонентов на этой тарелке должно представляться при
помощи уравнения концентраций верхней секции колонны.
Основное условие нахождения первой тарелки верхней секции
состоит в следующем. Если обогащение, достигаемое на (п + 1)
тарелке в условиях ее работы в укрепляющей секции колонны,
больше, чем когда она работает в отгонной, то (»+!) тарелку
еледует принять за первую тарелку укрепляющей секции.
Оптимальное расположение питательной тарелки
459
Используя написанные выше уравнения материального баланса
укрепляющей секции, имеем
D R_
X. \ Уап п УаО Уап ’’’ a' xaR
— =------------н------>----------“------• (X. 24)
х... /1 D R ' '
Уп>п Q Уп/D Упгп 4" q> xivR
Следует все время иметь в виду, что веса потоков G и С
связаны известным соотношением и только в том частном
случае, когда сырье поступает в однофазном жидком состоя-
нии (& = 1), эти веса равны.
Вычитая из числителя и знаменателя правой части нера-
венства (X. 24) числитель и знаменатель левой и принимая во
внимание соотношения между весами потоков в питательной
секции колонны, легко видеть, что
~ /)
"и,-- У„о
(X 25)
С другой стороны, имея в виду, что G' =G—L(l —д), легко
доказать, что
aa + -§r(l-#)xaR ^a—QTG-^)yaD
&) aw (р" (1 &)УшО
Поэтому, сопоставляя соотношения (X. 22) и (X. 25), можно
написать
/ X \ аа г} О &) Уа-D / х \ / X \
Gr) < —%----------------=- (х- 2б>
4 И'У" - Q-G~&)ywD X + 1
где индекс / относится к точке пересечения оперативных
линий.
Неравенство (ХЛ26) является основным критерием опти-
мального расположения питательной тарелки, выраженным
аналитически. Рассмотрим это неравенство подробнее.
Если принять, что содержание тяжелого ключевого компо-
нента в дестиллатных парах во многих случаях пренебрежимо
мало, хШо = 0, то неравенство (X. 26) можно записать в сле-
дующем виде:
1—0
Когда сырье подается в колонну в конденсированном со-
стоянии и 0=1, это неравенство приходит к виду
IV \ XW ' П + 1
IV
(X. 28)
Иначе говоря, отношение составов ключевых компонентов
в жидкой фазе на питательной тарелке должно быть таким же,
как и сырье.
Если сырье подается в колонну в двухфазном паро-жидком
состоянии и только его жидкая фаза смешивается с жидкостью
питательной тарелки, то для этого случая имеем
/ Х„ \ / Х.\ / х„\
<(— <(— , (X. 29)
' Д ''-Xw'a 'п + х
где индекс а относится к жидкой части сырья.
Если же обеспечивается возможность тесного контакта
обеих фаз сырья с жидкостью на питательной тарелке, то кри-
терием оптимального расположения питательной тарелки
является выведенное выше основное неравенство (X. 26).
Чтобы иметь возможность пользоваться этим неравенством
и уметь определять составы ключевых компонентов на пита-
тельной тарелке, следует найти минимальный вес флегмы,
совместимый с назначенной работой колонны.
Для упрощения записи отношение составов ключевых ком-
понентов в жидкой фазе обозначается буквой у с индексом,
показывающим номер соответствующей тарелки, например
Уп < 01 + 1-
§ 11. Минимальный вес орошения
С понятием минимального флегмового числа <рМИн мы познако-
мились при рассмотрении теории ректификации бинарной си-
стемы. То же понятие применяется и в ректификации сложных
систем, однако с известным различием. Если для простой колонны,
разделяющей бинарную систему при минимальном значении
флегмового числа, участок бесконечно малого изменения со-
ставов фаз при переходе из одной ступени в другую распо-
лагался в области составов питательной секции, то в колонне,
разделяющей сложную смесь, таких участков оказывается уже
не один, а два и располагаются они не в области составов пи-
тательной секции, а по обе стороны от составов питательной
тарелки. Таким образом, один из участков бесконечно малого
изменения составов располагается в отгонной секции, а дру-
гой— в укрепляющей.
Принимая во внимание, что между ними расположено се-
чение ввода сырья, в котором происходит резкое изменение
Минимальный вес орошения
461
составов вследствие непрерывного ввода питания, содержащего
все компоненты, легко сообразить, что указанные три сечения
делят сложную колонну на несколько зон. Первая зона распо-
ложена в области от кипятильника до нижнего участка
постоянного состава и характеризуется тем, что на всем ее
протяжении снизу вверх отношение xa]xw растет. Второй зоной
является нижний участок постоянного состава, в котором
концентрации легкого ключевого компонента и менее летучих
компонентов не изменяются. В третью зону поступает сырье.
Расположенная над ней четвертая зона представляет собой
верхний участок постоянного состава, в котором концентрация
тяжелого ключевого компонента и более летучих компонентов
не изменяются. В последней — верхней — зоне отношение состава
Хи, к ха уменьшается при движении снизу вверх до достиже-
ния назначенного состава дестиллата.
Если, исходя из составов нижнего продукта отгонной секции
сложной колонны, вести последовательный расчет контактных
-ступеней при помощи данных паро-жидкого равновесия и
уравнения оперативной линии, то отношенш составов ключе-
вых компонентов Ха/Xu, на тарелках колонны по мере движения
снизу вверх будет расти до тех пор, пока не достигнет неко-
торого вполне определенного предельного значения, макси-
мального для принятых условий орошения. Равным образом
если, исходя из составов верхнего продукта укрепляющей
секции колонны, вести аналогичный последовательный расчет
контактных ступеней, то отношение составов ключевых ком-
понентов Ха/Хи, на тарелках колонны по мере движения сверху
вниз будет уменьшаться до тех пор, пока не достигнет неко-
торого вполне определенного предельного значения, минималь-
ного для принятых условий орошения. Для нормальной работы
реальной колонны необходимо, чтобы минимальное отношение
составов xafxw, отвечающее условиям работы верхней секции,
было меньше того обогащения, которое может быть достигнуто
в отгонной секции. Если же эти два отношения будут равны
друг другу или же отношение xalxw в отгонной секции
окажется меньше, чем в укрепляющей, то для разделения
потребуется бесконечно большое число тарелок или, иначе
говоря, оно будет невозможным.
Итак, случай, когда предельные отношения составов клю-
чевых компонентов при движении снизу вверх по отгонной
секции и сверху вниз по укрепляющей секции колонны равны,
отвечает условиям работы колонны с так называемым мини-
мальным весом орошения. Здесь следует ясно представлять
себе, что поступающая на питательную тарелку исходная
сложная смесь вызывает увеличение на ней тяжелых компо-
нентов сравнительно с первой тарелкой укрепляющей секции,
я поэтому абсолютные значения составов на этих тарелках
462
РектиЛикшшя сложных систем
могут и должны отличаться. Однако отношение составов клю-
чевых компонентов xalxw сохранится неизменным, ибо в усло-
виях минимального орошения колонны на последних тарелках,
расположенных по обе стороны от питательной секции, не
происходит никакого обогащения.
Для вывода формулы, позволяющей рассчитать величину
минимального флегмового числа <рМИн = , воспользуемся
тем, что в этих условиях отношение составов ключевых ком-
понентов на последней л-й тарелке отгонной секции (xa/Xu,)n
должно быть равно отношению составов этих же компонентов на
первой тарелке укрепляющей секции, считая снизу, (xa/xw')1.
Далее коэффициент относительной летучести tn, рассчитанный
по отношению к тяжелому ключевому компоненту, примем
приблизительно постоянным для тарелок, расположенных в не-
посредственной близости от питательной. Тогда можно написать
/ ха \ 1_/ У а \ / ха \ 0 + '/’мин) Уап УаО
'xwCn m\yw'n xw А О Т^мин) Ушп Уи/D
Решая это уравнение в отношении минимального флегмо-
вого числа, можно получить
m _ 1 ! тУао У»а
Тмин — J I )
4 Уап Ушп '
(X. 30)
Принимая во внимание, что на основании уравнения равно-
у
весия (X. 6) можно написать
Уинг
Ф“ИВ = М • (х- 31>
Определим на питательной тарелке состав xwn тяжелого
ключевого компонента, написав выражение для отношения
составов а и w в паровой фазе на (п—1) тарелке при помощи
уравнения материального баланса (X. 12):
7?
V , Х“п а' X°R
“ mvt =-------------------
Уи<(П-1) х______х
wn o' xwR
©МИН
R
xwnVf o' xaR
©МИН
R
Xwn о' X™R
ЯМИН
Решая это уравнение в отношении состава хшп тяжелого
ключевого компонента на питательной тарелке, можно получить
R ' mVfxwR~xaR
£>мин |
(X. 32)
Минимальный вес орошения
4(53-
Попытаемся определить на питательной тарелке составы
компонентов, менее летучих, чем тяжелый ключевой компо-
нент. Допустим, что относительная летучесть легкого ключевого
компонента а по отношению к компоненту z, менее летучему,
чем iv, равна maz. Имея в виду, что ввод питания не отразится
в отгонной секции колонны на составе компонентов, менее
летучих, чем тяжелый ключевой компонент, можно написать
— 1)=5Сап И Xz (л —1) = ^zn-
Сочетая уравнение равновесия с соотношением материаль-
ного баланса, имеем
хап __хап^мин ^xaR
Xzn “ ^лёмин'- ^z/?
Отсюда можно найти состав компонента z в жидкой фазе:
~ Последнее слагаемое в знаменателе пренебрежимо мало, и
поэтому можно написать
Составы всех компонентов, более тяжелых, чем iv, можно
представить такими же выражениями. Поэтому сумма составов
всех таких компонентов от z± до z3- будет равна
(X. 33)
Допустим, что на питательной тарелке не содержится замет-
ного количества компонентов, более летучих, чем легкий
ключевой компонент а. Тогда сумма составов компонентов
в жидкой фазе на питательной тарелке или, иначе говоря, на
последней — верхней — тарелке отгонной секции определится
путем сложения составов легкого и тяжелого ключевых ком-
понентов с суммой составов остальных, менее летучих компо-
нентов, найденной выше:
Хап “Ь 4"
£мин
Принимая во внимание, что в силу принятого ранее обозна-
чения Хап + хшп = Xwn (1 + У/) можно преобразовать предыдущее
464
Ректификация сложных систем
выражение, сделав подстановку значения xwn из уравнения (X. 32)
и решив его относительно минимального веса орошения:
2/
, D Г mVfxwR xaR /. , , X1 maixiR "I /V ЧЛЧ
£м„н =/?[--v;(Fnzzi)-~(I+^ + 24F7rj- ( -34)
21
В тех случаях, когда содержанием компонентов, более
летучих, чем легкий ключевой компонент, на питательной
тарелке нельзя пренебречь, определение минимального веса
орошения ведется несколько иным путем. Рассмотрим компо-
нент Ь, более летучий, чем легкий ключевой компонент а.
Его содержание на первой и второй, считая снизу, тарелках
укрепляющей секции позволяет написать
Уб1 m ХЫ ^мин^М + ХЬР
— Tilbw ~~~ ( •
Уиц xivl ' хи>Р
Принимая во внимание, что в зоне постоянного состава при
работе с минимальным весом орошения имеют место равенства
.Хм = Хь2 и Хия = Хи>2, можно написать
. Уьр
ХЬ2 ___ Ч’мин
xwl , Уи>Р
'Гмин
Пренебрегая вследствие незначительности вторым слагаемым
в знаменателе, получаем
. (тЬи<-1) = --------
IV1 'гмИН
откуда
хьр _____
4>мнн (mbw~ b
ХЬР
ХШ1 ’
(Х.35)
Аналогичным образом для того же компонента b в составе
парового потока, поднимающегося с л-й тарелки отгонной
секции в укрепляющую, можно написать:
m Ьп -
™bw у. —
^мин ^мин^Ы "Е ХЪР
^минХцЛ
X | wD
'/’мин
(Х.36)
__ ^мин . ХЧ1Р ^мин
^Рмин 1И ^ЧРмин = Н-Уни
Xivl.
Минимальный вес орошения
465
Отсюда определится содержание x^i тяжелого ключевого
компонента во флегме, стекающей с первой укрепляющей
тарелки:
Из ранее выведенного выражения (Х.31) для минимального
флегмового числа можно найти Уи,п:
,, __ xaD VfxwD
Заменив в выражении (X. 36) составы xbi и xwi их значениями,
можно получить
хЬп _ xaDmbvu _ (w —I) mbu>xbD
(^^минИ™ Ушп (mbw I) (xaD
___откуда _
_ Vf (m~ t) xbDXwn
Xbn~~mbw-\ xaD-VfxwD
Сумма концентраций компонентов, более легких, чем легкий
ключевой компонент, для питательной тарелки будет равна
Jj
XbnVf (т - I) \
Ь1
и окончательно минимальный
колонны может быть определен
вес орошения для сложной
по уравнению
£МИн' =9’мин£)+ (I — e')L=R
mV’fxwR~xaR
—!)
X
bJ
1 +п + п(т-1) v +
bl
(X. 37)
Если пренебречь значениями составов хаК легкого ключевого
компонента в остатке и xwD тяжелого ключевого компонента
30 Зак. № 304.
в дестиллате, можно получить несколько упрощенный вид
этого уравнения:
bj
£мин = R (’ + У/ + V/ - 1) У (miur-l)XaD +
Ь1
Y maixiR
21
(Х.38)
В качестве примера использования основной формулы рассмотрим
определение минимального флегмового числа для условий предыдущего
примера разделения углеводородной системы.
Поскольку на питательной тарелке будут компоненты, менее летучие,
чем тяжелый ключевой, и более летучие, чем легкий ключевой, расчет
минимального веса флегмы придется вести по уравнению (Х.37).
Коэффициент относительной летучести ключевых компонентов для
условий питания т = 2,00 :0,97 = 2,06. Отношение составов ключевых компо-
нентов в жидкой фазе сырья согласно табл. 34 равно = 0,1725 : 0,3720 = 0,463.
Коэффициенты относительной летучести соответственно равны: этана и
бутана т24 = 5 :0,97 = 5,16, пропана и пентана т3 5= 2 :0,48 = 4,17 и пропана
и гексана т3 6 = 2:0,25 = 8. Подставляя эти данные в уравнение (Х.37) и
имея в виду, что R = 77,4 моля на 100 молей сырья, получаем
, I 2,06 х 0,463 х 0,475—0,009
2мин-77’4| 0,463(2,06—1) Х
Х [1 + 0,463 + 0,463 (2,06—(5,16 — 1) (0,854—0,463 х 0,013) | +
Минимальное флегмовое число найдется из соотношения
Ямин' — 0 —е') L _ _ 157,5—(1-0,16) 100
D Т’мин- - 22,6
§ 12. Упрощенная методика расчета минимального веса
орошения
Из того, что в § И было сказано о зонах, на которые
делится сложная колонна при работе с минимальным весом
орошения, следует неточность обычного допущения: xa<n-v) —
^Xaw = xai и xlv(n-i) = xll,n = xwi. Однако подобное допущение
значительно упрощает расчеты и может применяться для
ориентировочных подсчетов. Приняв его, можно написать
Уап ™ Х“п <Рмипха1 + xaD <Рмиих ап + xaD
----- = т--------—------------=--------=-------------х-------
УшП Xwn ^МИН^-Wl ' XwD
(X. 39)
Расчет минимального веса орошения
467
Отсюда, решая в отношении минимального флегмового
числа, находим
„ ~ 1 / XaD m X^D
9^МИН -- i I /72 ----
xan xwn
(X. 40)
Полученное соотношение справедливо для бинарной системы,
у которой при минимальном весе орошения обе зоны постоян-
ного состава непосредственно примыкают к питательной тарелке
и сливаются в одну зону, подтверждая тем самым правильность
исходных допущений. Однако для сложной колонны это соот-
ношение остается лишь приближенным и именно вследствие
разрыва между ее зонами постоянного состава.
Подставляя в уравнение (X. 40) значения хап и xwn, выве-
денные выше, можно преобразовать его к виду
ймин xaD ~~ VfmxwD
R mVfxwR~xaR
(Х.41)
Следует иметь в виду, что флегмовое _число, найденное
этим методом, всегда больше истинного, рассчитываемого по
уравнениям (Х.37) или (X. 38) при одновременном присутствии
всех компонентов сырья по обе стороны питательной тарелки.
Для частного случая, когда первоначальная степень отгона
сырья /=0, а разделение происходит между ключевыми ком-
понентами, так что содержаниями легкого ключевого компо-
нента в остатке и тяжелого ключевого в дестиллате ввиду
незначительности можно пренебречь, предыдущее соотношение,
если принять = у>а = ап/а, приходит к следующему виду:
__________LxaPaiv_____
9’мин ~ RmXlvRaa — DxaDaw
(X. 42)
Особенно удобно применять эту формулу к трехкомпонент-
ным системам, для которых ключевыми являются первый и
третий компоненты.
§ 13. Упрощенная методика расчета составов на
питательной тарелке
Выше был установлен критерий, позволяющий правильно
определить уровень ввода питания. Согласно этому критерию
отношение составов ключевых компонентов, достигнутое на
/ ха \
уровне питания, должно подчиняться соотношению ------ < уу.
п
При аналитическом расчете колонны методом постепенного
приближения путем перехода от тарелки к тарелке опреде-
ляются составы фаз, покидающих последовательные контактные
ступени.
30*
468 г еК. {'Ц^'йпиЦ'ил Сл'ОЛСпЛл
Точный метод расчета положения питательной тарелки
состоит в последовательном переходе от кипятильника вверх
по высоте отгонной секции до тех пор, пока на некоторой
тарелке не получится отношение XajXw, близкое к vj/- В этом
случае считается, что питательная тарелка уже достигнута и
можно перейти к расчету укрепляющей секции колонны. Однако
аналитический расчет числа тарелок и составов фаз на них
для всей отгонной секции, проводимый методом постепенного
приближения, представляет значительные технические труд-
ности, и поэтому была разработана более простая, хотя и
приближенная методика этого расчета.
Из условия равновесия фаз, написанного для л-й (последней)
тарелки отгонной секции, и при помощи уравнения оператив-
ной линии укрепляющей секции, написанного для сечения
колонны, которое пересекается паровым потоком, идущим
с н-й тарелки отгонной секции, и жидким потоком, идущим
с первой тарелки укрепляющей секции, можно написать
Уап „ Хап ш <Pxal + xaD
---= ТП = m'/'n = “ -ГТ,’-•
Ушп хи>п----------------------<Pxwl + XWD
Если пренебречь малым содержанием тяжелого ключевого
компонента w в дестиллате, иначе говоря принять ^„D = 0, то
получим
~ + <х-43>
xivl
Как же изменяется отношение составов ключевых компо-
нентов в жидкой фазе на первой, считая снизу, тарелке укреп-
ляющей секции при изменении флегмового числа от минималь-
ного 9?мин до бесконечно большого срт1
На основании сделанного в § 11 допущения можно принять,
что при минимальном флегмовом числе должно соблюдаться
равенство
ХЛ хап
IV1 W71
При бесконечно большом флегмовом числе на основании
уравнения (Х.24) можно написать
Таким образом, отношение составов ключевых компонентов
в жидкости, стекающей с нижней тарелки укрепляющей ко-
лонны, является некоторой функцией флегмового числа ср,
крайние значения которой мы установили выше.
Расчет составов на питательной, тарелке
469
Обозначая xai/^u-i через 'щ можно написать rj^=f(<p). Край-
ние значения этой функции соответственно равны: при <? = <рмин
имеем »?>='¥’»> а ПРИ У — 02 функция Tj = my)n. К последнему
своему значению функция т) будет приближаться асимптоти-
чески по мере увеличения флегмового числа <р.
Были попытки заменить эту неизвестную функцию ветвью
гиперболы, определяемой точкой А (<рМИИ, трп) и имеющей асимп-
тотами ось ординат и пря-
мую г)~туп. В этом случае
зависимость т] от <р предста-
вится уравнением
= Уп[^-Умин(^-)] ,. (х 44)
Эта зависимость пред-
ставлена на фиг. 120, при-
чем часть кривой, отвеча-
ющая абсциссам, меньшим
_ 7‘«ип, как нереальная изобра-
жена пунктиром.
Подставим это выражение
что г} = ха1/ха>1:
Фиг. 120. К определению составов на
питательной тарелке.
в уравнение (Х.43), имея в виду,
— у>п (т — 1) ф = (рпт,
откуда
хаО
Xu,i ~ ’
(Х.45)
Перед нами стоит задача определения составов ключевых
компонентов на питательной тарелке. От найденного выше
состава х»! нетрудно перейти при помощи уравнения концен-
траций верхней секции к составу ywn встречного пара, под-
нимающегося с питательной тарелки. Разделив состав ywn на
равновесное фазовое отношение kwni можно найти состав Хц,п
жидкого равновесного потока, стекающего с питательной та-
релки. При этом в целях упрощения членом xwd уравнения
концентраций ввиду незначительности пренебрегают, тогда по-
лучаем
’'""“Т+Г Хи,Г
(Х-46>
Чтобы определить состав легкого ключевого компонента
на питательной тарелке, следует вспомнить, что хап = 'рпх№п-
Принимая во внимание, что коэффициент относительной лету-
чести m — kanlkwn, и сделав соответствующую подстановку
Ректификация сложных систем
хап легкого ключевого
хаР
(X. 47)
в уравнение (X. 46), можно найти состав
компонента на питательной тарелке:
v ___ 1 m гр
Хап~~^ ’ ’ '1+7
Если коэффициент относительной летучести ключевых ком-
понентов m сохраняется более или менее постоянным, то равно-
весное отношение кап во всяком случае зависит от температуры
п-й тарелки, которая в свою очередь тоже является искомой
величиной. Поэтому имеет смысл связать составы потоков п-й
и (п — 1) тарелок отгонной секции и, произведя преобразова-
ния, аналогичные предыдущим, подойти к определению составов
ключевых компонентов на n-й тарелке на этот раз снизу, а не
сверху.
Пользуясь уравнением равновесия для сочетания составов
потоков, уходящих с (п — 1) тарелки, и уравнением концентра-
ций отгонной секции для их увязывания с составом жидкого
потока, стекающего с питательной тарелки, можно написать
Уа(гс — 1) _ ха(п — 1) _ S'xan ~~ kxaR ~ g Хап__
Уш(п-1) Xw(n-t) ~ g'xWn-RxwR = g'XWn~^xWR { )
Если флегмовое число <р равно своему минимальному
значению, то согласно предыдущему
ха(п — 1) _ хап
xw(n — 1) Хрн
При бесконечно большом флегмовом числе (99=00) согласно
уравнению (Х.48) имеем
ха(п— 1) 1 хап
xw(n— 1) m xivn
(X.49)
Из этого можно сделать заключение, что отношение £ =
= xa(n-i-)lxW'n-i) является некоторой функцией флегмового
числа <р. Представляя эту зависимость в виде эмпирически по-
добранного уравнения ветви гиперболы, можно написать
' 1 МИН ' '
(X. 50)
Подставляя это соотношение в уравнение (X.48), имеем
после небольших преобразований
R р1гн,/,п[т + ?1Мин(т-1)]
g' ( Рмин^-’)
(Х.51)
Минимальное число тарелок сложной колонны
471
Сочетая это уравнение с уравнением (X. 46), определяю-
щим xwn, можно найти, разделив хап на Хит:
Полученные соотношения позволяют с известным приближе-
нием определять составы ключевых компонентов на питатель-
ной тарелке и даже ее температуру. Так, содержание легкого
ключевого компонента либо может быть рассчитано по уравне-
нию (X. 51), либо можно предварительно найти равновесное
фазовое отношение кап из уравнения (Х.52), а затем подставить
его в уравнение (X. 47) и рассчитать хап-
По значению кап равновесного фазового отношения ключе-
вых компонентов определяется и температура питательной та-
релки колонны, в общем случае отличающаяся от температуры
сырья. Для определения содержания тяжелого ключевого ком-
понента во флегме питательной тарелки можно воспользоваться
ошшидным соотношением х„, уух,..-;- ____________
В заключение следует подчеркнуть, что с уменьшением
коэффициента относительной летучести m точность упрощен-
ной методики расчета возрастает, так как при этом умень-
шается расхождение между реальной зависимостью !=/(?’) и
принятой ветвью гиперболы (X. 50).
§ 14. Минимальное число тарелок сложной колонны
В сложной колонне, как и в бинарной, число теоретических
тарелок является функцией флегмового числа, уменьшается
с увеличением последнего и достигает некоторого минимума
при бесконечно большом значении g/D. На основе концеп-
ции ключевых компонентов вывод формулы для минимально
необходимого числа тарелок при 99 = 00 ничем не отли-
чается от ранее рассмотренного вывода для бинарной си-
стемы.
В самом деле, для произвольного сечения отгонной секции
можно написать
R
Уа1 Xa(i + D g' XaR
R
Xiv(i + D g' xwR
u когда отношение g'IR = ca это уравнение принимает вид:
Уаг _ m Xai _ Xa(i + l)
У ил xuii xw(i+l)
472
Ректификация сложных систем
Равным образом, ведя счет тарелок снизу вверх, имеем
в укрепляющей секции
, хаР
Vai = + Р +~^Г
Уип , XU>D
xw(i + i) + —~~
И При <р = со
У аг Xai ха(1 — 1)
У ivi *u>i *iv(i +1)
Обобщая на всю колонну в целом, имеем
^=У> = тч ~с~ч} . (X. 53)
*u>(i—1) *u'(i — 5)
Если общее число тарелок колонны равно п, то
Хап XaR
xwn *tvR
При бесконечно большом флегмовом числе
xaD У ап т Хап
xwD У'Л'П Xwn
Подставляя в предыдущее соотношение, получаем
xaD ____щЛ + 1 xaR
*u>D *u>R
Введя принятые ранее обозначения, имеем
IgV’D-lgV’H .
п =------,--------- — 1.
1g т
(X. 54)
Формула позволяет вычислить минимальное суммарное число
тарелок сложной колонны для условий, когда коэффициент
относительной летучести т может быть принят приблизительно
постоянным.
Как уже известно, при наличии и парциального конден-
сатора и кипятильника в правой части уравнения (Х.54) вы-
читываются уже две единицы.
Пример. Для условий разделения рассмотренной выше углеводород-
ной системы С2 —Св рассчитать минимальное число теоретических тарелок.
Будем пользоваться среднегеометрическим значением коэффициента от-
носительной летучести, взятого для условий верха и низа колонны ио клю-
чевым компонентам.
Минимальное число тарелок сложной колонны
473
п . 0,935
Для верха колонны /п=47° и чя--=
VjOo
k3 2,70
И ^--^37
Для низа колонны tR = 135°
Среднее значение равно
2,46.
= 1,97.
zncp = |ZmDmK =^2,46 х 1,97 = 2,2.
Минимальное число тарелок по'уравнению (X. 54)
/1 =
/ 0,854 0,475 \
lg \ 0,013 Х 0,009'/
1g 2,2
— 2 = 8,3 тарелки.
ЛИТЕРАТУРА
1. Бюллетень комиссии технической терминологии под ред. академика
С. А. Чаплыгина и Д. С. Лотте, вып. XV. Терминология термодинамики. Изд.
АН СССР, 1937.
2. Г е л ь п е р и и Н. И. Дестилляция и ректификация,, Госхимиздат, 1947.
3. К а р а п е т ь я и ц М. X. Химическая термодинамика. Госхимиздат,
1949.
4. .Карапет ьянц М. X. Примеры и задачи по химической термо-
динамике. Госхимиздат, 1950.
5. Касаткин А. Г. Основные процессы и аппараты химической техно-
логии, изд. 5-е. Госхимиздат, 1950.
6. К и р е е в В. А. Курс физической химии. Госхимиздат, 1951.
7. К р и ч е в с к и й И. Р. Фазовые равновесия в растворах при высо-
ких давлениях. Госхимиздат, 1946 .
8. Обрядчиков С. Н. и Хохряков П. А. Расчет и конструкция
ректификационных колонн для нефтезаводских установок. ОНТИ, 1934.
9. Обрядчиков С. Н. Принципы перегонки нефти. Гостоптехиздат,
1939.
10. Путилов К. А. Курс физики, т. I, 4-е изд. Учпедгиз, 1940.
11. Р а м м В. М. Абсорбционные процессы в химической промышлен-
ности. Госхимиздат, 1951.
12. Скобло А. И. Основные элементы технологического расчета нефте-
заводских установок. Азнефтеиздат, 1939.
13. Т р е г у б о в А. М. Теория перегонки и ректификации, 3-е изд.
-Гостоптехиздат, Баку, 1946.
14. Ф а с т о в с к и й В. Г. Разделение газовых смесей, Гостехиздат, 1947.
15. X воль сон О. Д. Курс физики, т. III. ГИЗ, 1923.
О Г Л А В Л Е Н И Е '
Стр.
Введение ................................................ 3
Глава I. Основы теории термодинамического равновесия ... 7
§ 1. Тело (7). § 2. Свойства и состояние тел (8).
§ 3. Процесс (8). § 4. Система (9). § 5. Фаза (10).
§ 6. Экстенсивные и интенсивные свойства (10). §7. Фазовое
равновесие (11). § 8. Компоненты системы (13).
§ 9. Степени свободы системы (14). §10. Термодинамический
метод (14). §11. Правило фаз (14). § 12. Равновесные
или квази-статические процессы (16). § 13. Сумма при-
веденных теплот для любого___равновесного „цикла.. £18).
§ 14. Принцип энтропии (21). § 15. Направление само-
произвольных процессов (23). § 16. Изобарный потен-
циал (25). § 17. Свободная энергия (26). § 18. Условия
равновесия термодинамической системы (27). § 19. Пар-
циальные молярные величины и химический потен-
циал (28). § 20. Кривая упругости (31). § 21. Крити-
ческая точка (33). § 22. Уравнение Клаузиуса-Клапей-
рона (35). § 23. Методы расчета давления насыщенного
пара (35). § 24. Скрытая теплота испарения (39).
Глава 11. Термодинамические методы определения свойств
веществ......................................................... 41
§ 1. Летучесть (41). § 2. Методы расчета летучести для
газовых систем (43). § 3. Методы расчета летучести кон-
денсированных систем (48). § 4. Стандартные состоя-
ния (48). § 5. Активность (49). § 6. Влияние темпера-
туры, давления и концентрации на парциальные молярные
величины (51). § 7. Обобщенный метод расчета свойств
однокомпонентных систем (54). § 8. Обобщенный метод
расчета свойств газовых смесей (64). § 9. Определение
псевдокритических констант (65).
Глава Ill. Растворы ............................................. 67
§ 1. Определение понятия (67). § 2. Состав растворов (67).
§ 3. Весовая доля (68). § 4. Молярная доля (68). §5. Объем-
ная доля (69). § 6. Килограммолекула и средний моле-
кулярный вес (70). § 7. Пересчет составов (70).
§ 8. Расчет среднего молекулярного и среднего удельного ве-
сов (71). § 9. Формулы для бинарной системы (73).
§ 10. Другие виды концентраций (74). § 11. Пересчет
относительных концентраций в другие виды представления
составов фаз (75). § 12. Гипотеза идеального раствора (78).
§13. Закон Дальтона (80). §14. Законы Рауля и Генри (82).
§ 15. Паро-жидкое равновесие в идеальных системах (84).
Стр.
§ 16. Изобарные кривые кипения и конденсации (87).
§ 17. Кривая равновесия у~х (90). § 18 Расчет и построе-
ние кривых равновесия (92). § 19. Тепловая диаграмма
равновесия (95). § 20. Классификация жидких раство-
ров (97). § 21. Жидкости, смешивающиеся во всех отно-
шениях (98). § 22. Жидкости, смешивающиеся частично (106).
§ 23. Системы компонентов со слабой взаимной раствори-
мостью (114). § 24. Паро-жидкое равновесие при высоких
давлениях (120). § 25. Неидеальные растворы (128).
§ 26. Критические явления в бинарных системах (132).
§ 27. Явления обратной конденсации и выкипания (141).
Глава IV. Теория перегонки
§ 1. Основные понятия и определения (144). § 2. Способы
проведения процессов испарения и конденсации (146).
§ 3. Однократный процесс (147). § 4. Построение кривой
однократного испарения бинарной системы по методу
А. М. Трегубова (154). § 5. Однократное изменение фазо-
вого состояния в системах частично растворимых компо-
нентов (155). § 6. Многократный процесс изменения фазо-
вого состояния (158). § 7. Постепенное испарение систем
с монотонными кривыми равновесия (160). § 8. Постепен-
ная конденсация систем с монотонными кривыми равно-
весия (162). § 9. Процессы однократного изменения
фазового состояния в многокомпонентных системах (164).
§ 10. Постепенное испарение в многокомпонентных систе-
мах (168). § И. Постепенная конденсация в многокомпо-
нентных системах (170). § 12. Перегонка с насыщенным
водяным паром (172). § 13. Перегонка с перегретым водя-
ным паром (176).
Глава V. Отгонная ректификационная колонна
§ 1. Сущность процесса ректификации (180). § 2. Методы
анализа работы колонны (185). § 3. Изменение весов пото-
ков при переходе от Одной контактной ступени к другой (187).
§ 4. Отгонная ректификационная колонна (190). § 5. Ма-
териальный и тепловой балансы отгонной колонны (191).
§ 6. Уравнения концентраций отгонной колонны (194).
§ 7. Определение составов фаз на тарелках отгонной колон-
ны (200). § 8. Связь между расходом тепла в кипятильнике
и весом потока флегмы (203). § 9. Минимальный вес
флегмы (204). § 10. Минимальное тепло кипятильника (206).
§ 11. Предельные концентрации (207). § 12. Минимальное
число тарелок отгонной колонны (212). § 13. Расчет числа
теоретических тарелок в отгонной колонне (215). § 14. Рас-
чет отгонной колонны по диаграмме у -х (217). § 15. Ана-
лиз общей проблемы ректификации данной системы
в отгонной колонне (219).
Глава VI. Укрепляющая ректификационная колонна
144
180
229
§ 1. Описание колонны (229). § 2. Материальный и тепло-
вой балансы укрепляющей колонны (230). § 3. Изменение
съема тепла в парциальном конденсаторе укрепляющей
колонны (234). § 4. Уравнения концентраций укрепляющей
колонны (236). § 5. Определение составов фаз на тарелках
Оглавление
mi
Стр.
укрепляющей колонны (242). § 6. Связь между съемом
тепла в парциальном конденсаторе и весом парового
и жидкого потоков (246). § 7. Минимальный вес флегмы
в укрепляющей колонне (247). § 8. Минимальный съем тепла
в парциальном конденсаторе укрепляющей колонны (249).
§ 9. Предельные концентрации (250). § 10. Минимальное
число тарелок укрепляющей колонны (256). § 11. Расчет
числа теоретических тарелок в укрепляющей колонне (259).
§ 12. Расчет укрепляющей колонны по диаграмме у—х (263).
§ 13. Анализ общей проблемы ректификации данной системы
в укрепляющей колонне (265).
Глава VII. Полная ректификационная колонна..................... 279
§ 1. Описание колонны (279). §2. Материальный и тепловой
балансы полной колонны (280). § 3. Расчет питательной
секции полной колонны (284). § 4. Графо-аналитический
метод расчета питательной секции (290). § 5. Расчет числа
тарелок полной колонны (292). § 6. Расчет полной колонны
по диаграмме у—х (294). § 7. Влияние теплового и фазо-
вого состояния сырья на расположение линий концентра-
_________________пик (299)^ § 8. Влщщще смщпешуя^уровня ввода сырья на
общее число тарелок колонны (304).. асчётТштатёль^
ной секции колонны при питании ее перегретым паром (310).
§ 10. Расчет питательной секции колонны при питании ее
жидкостью, недогретой до точки кипения (311).
§ 11. Расчет величины отдачи тепла в парциальном кон-
денсаторе (312). § 12. Холодное (острое) орошение (312). .
§ 13. Верхнее циркуляционное орошение (314). § 14. Боко- \/
вое циркуляционное орошение (315). § 15. Расчет ректифи-
кационных колонн с двойным питанием по тепловым
диаграммам (317). § 16. Выбор давления (325). § 17. Вы-
бор количества орошения (327). § 18. Условия хорошего
барботажа и выбор типа тарелок (329). § 19. Сливные
трубы (337). § 20. Оборудование корпуса колонны патруб-
ками (338). § 21. Гидравлический расчет тарелки (340).
§ 22. Диаметр колонны и ее производительность (351).
§ 23. Коэффициент полезного действия тарелки (354).
Глава VIII. Периодическая ректификация......................... 362
§ 1. Характеристика процесса и способов его проведе-
ния (362). § 2. Периодическая ректификация при постоян-
ном составе дестиллата (365). § 3. Определение поверх-
ности теплообмена в кубе (381). § 4. Периодическая
ректификация при переменном составе дестиллата (383).
Глава IX. Ректификация в присутствии перегретого водяного
пара........................................................... 386
§ 1. Вводные замечания (386). § 2. Теоретические поло-
жения (387). § 3. Анализ работы перегретого водяного
пара в отгонной колонне (388). § 4. Пример расчета отгон-
ной колонны, работающей в присутствии перегретого во-
дяного пара (397). § 5. Анализ работы перегретого водяного
пара в укрепляющей колонне (403). § 6. Пример расчета
укрепляющей колонны, работающей в присутствии пере-
гретого водяного пара (412). § 7. Анализ работы полной
Стр.
Глава
колонны в присутствии перегретого водяного пара (419).
§ 8. Пример расчета полной колонны, работающей в при-
сутствии перегретого водяного пара (422). § 9. Расчет
процесса отгонки растворителей из практически нелетучего
жидкого остатка (428).
X. Ректификация сложных систем....................
§ 1. Вводные замечания (436). § 2. Принципиальная схема
разделения сложных систем (436). § 3. Основные особен-
ности расчета ректификации сложных систем (439). § 4. По-
нятие о ключевых компонентах (441). § 5. Определение
температуры паров, уходящих с верха парциального кон-
денсатора, и давления в колонне (442). § 6. Определение
температуры низа колонны (444). § 7. Использование коэф-
фициентов относительной летучести для расчета условий
равновесия в сложных системах (445). § 8. Аналитический
расчет сложной колонны путем перехода от одной контакт-
ной ступени к другой (448). § 9. Учет изменения веса
паровых и жидких потоков по высоте секции (455).
§ 10. Оптимальное расположение питательной тарелки
в сложной колонне (457). § 11. Минимальный вес ороше-
ния (460). § 12. Упрощенная методика расчета минималь-
ного веса орошения (466). § 13. Упрощенная методика
расчета составов на питательной тарелке (467). § 14. Мини-
мальное число тарелок сложной колонны (471).
Литература ....................................
436
474
Редактор А. И. Скобло
Ведущий редактор JJ. А. Львова
Технический редактор А. С. Полосина
Корректоры К. А. Кузьмина и Н. И. Чаброва}
Подписано к набору 15/П 1954 г.
Подписано к печати 8/V 1954 г.
Формат 60x92i/i6.
Печ-.т; гги . уч лтзхл-, it-ip -
Тираж 6000 экз. Т-03449.
Зак. № 304/495. Ц. 12 р. 70 к.
Гостоптехиздат.
Москва, Третьяковский проезд, 1/19.
Типография .Красный Печатник*.
Ленинград, проспект имени И. В. Сталина, 91.