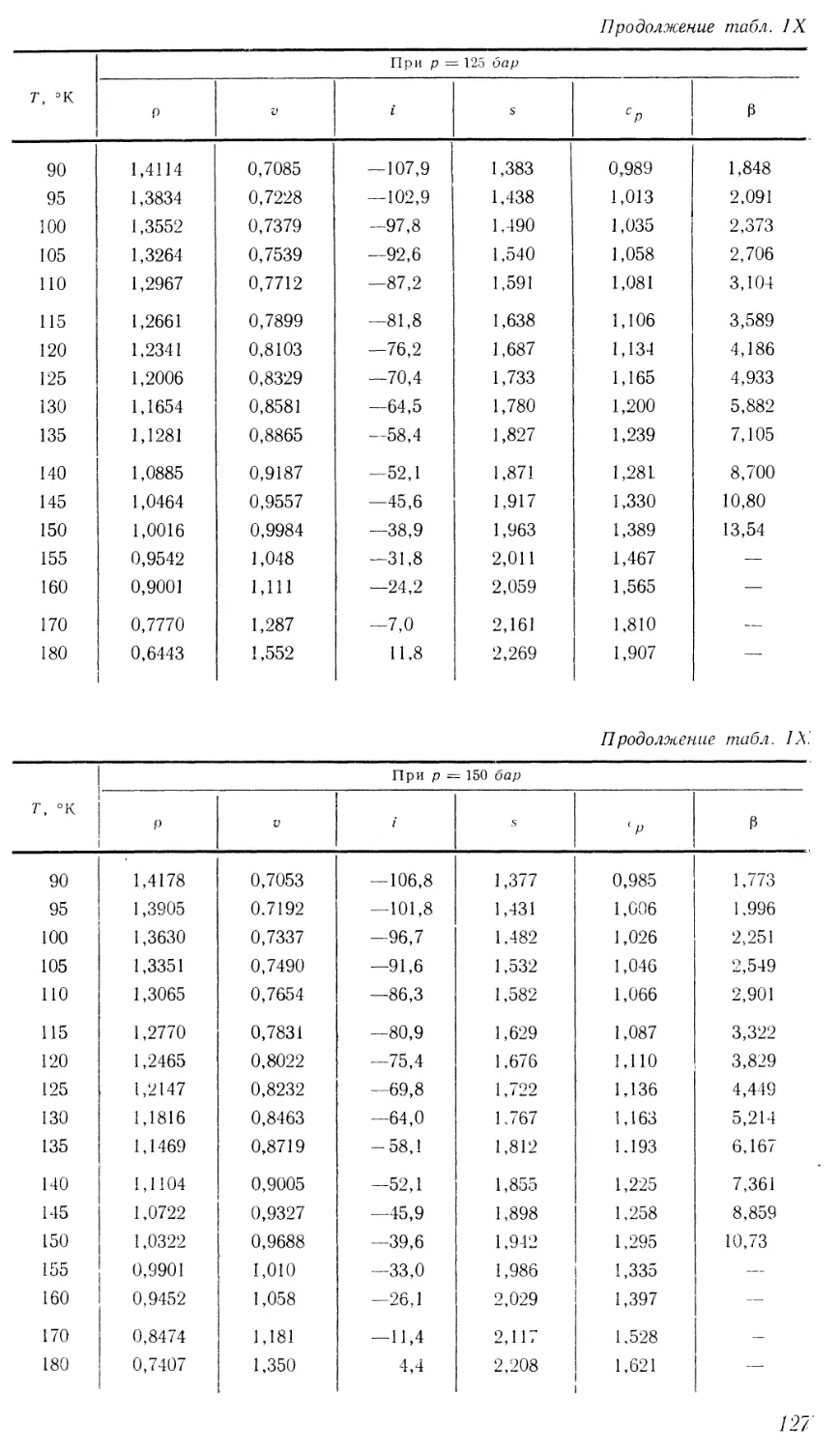
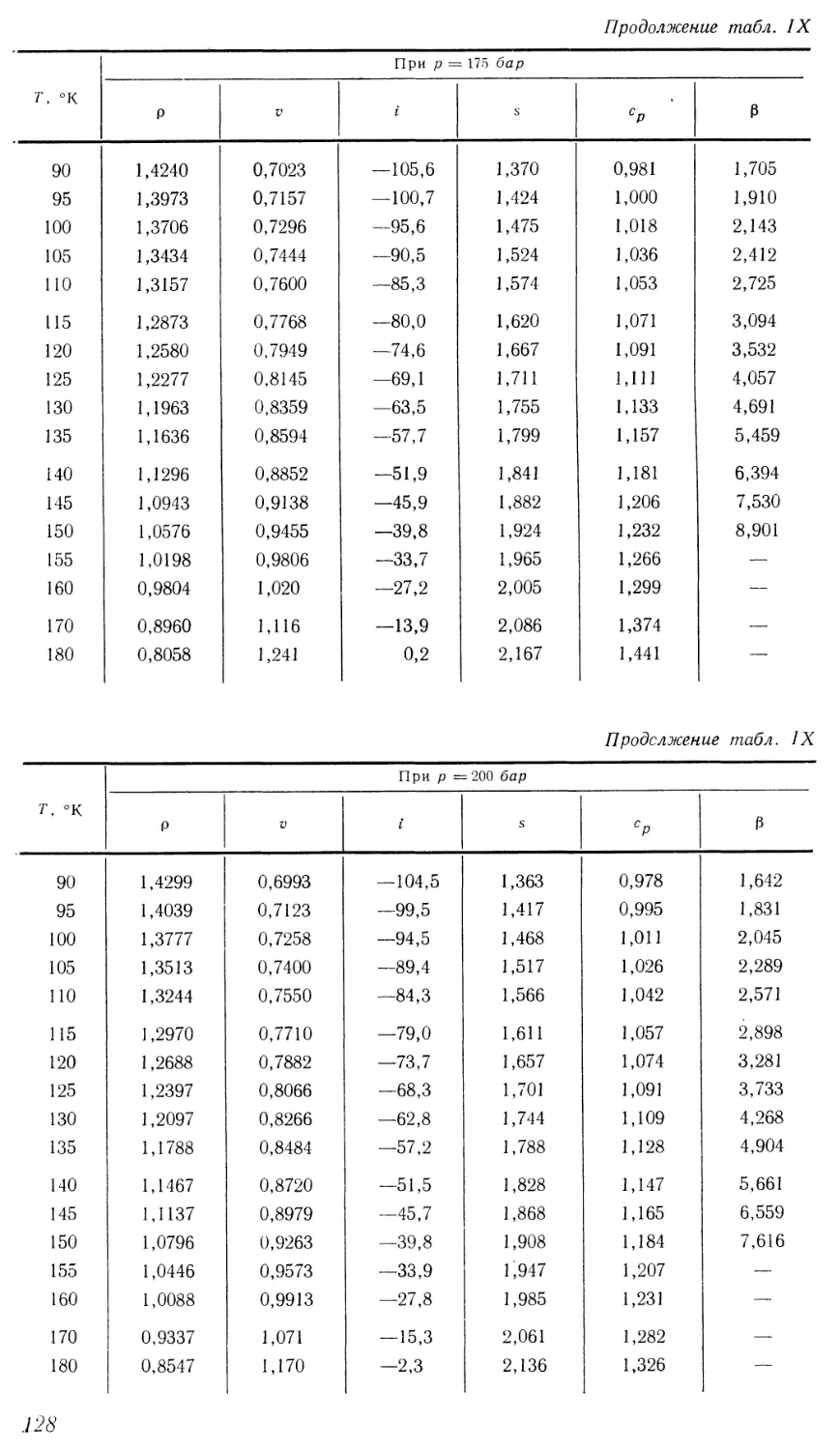
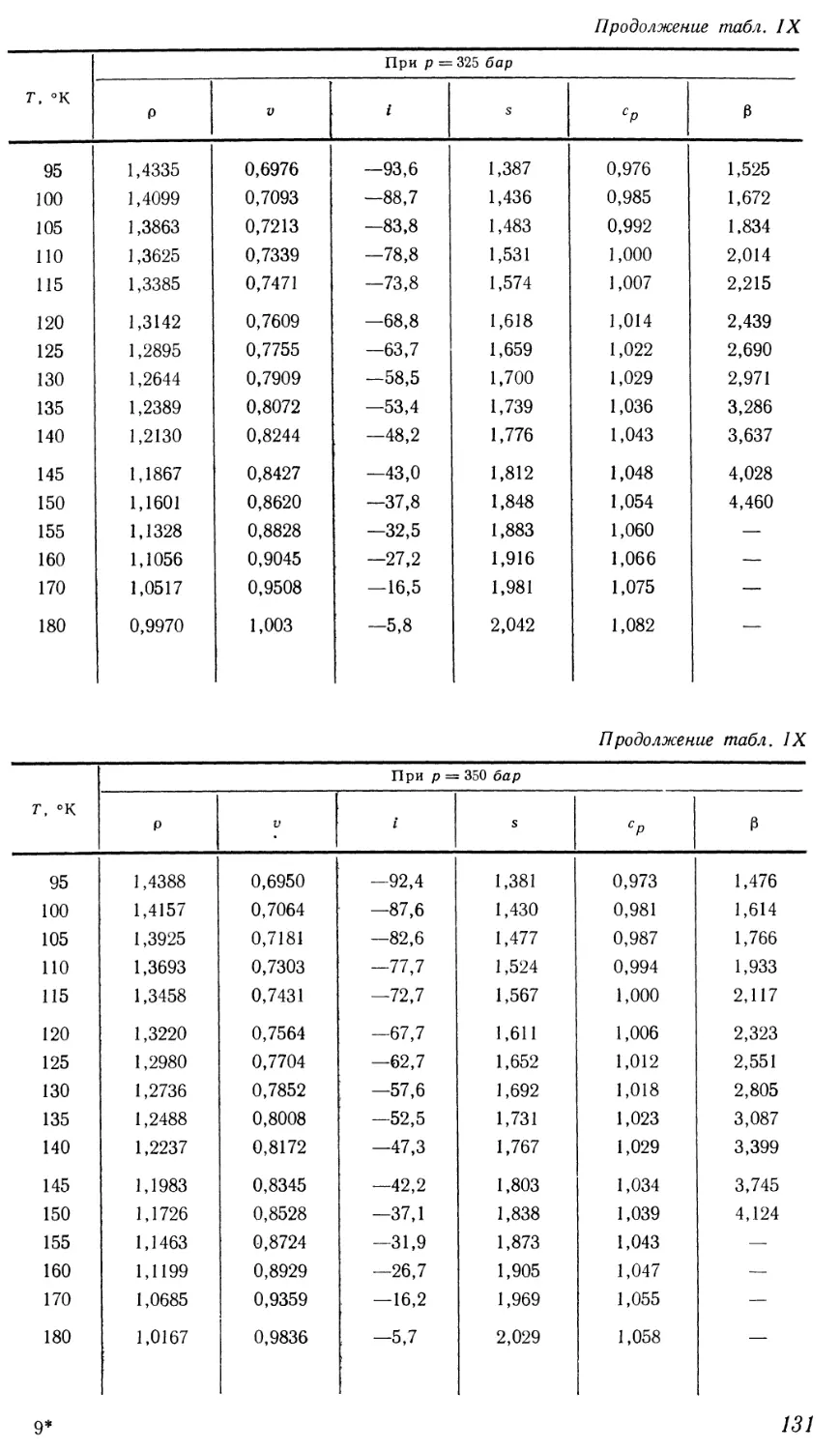
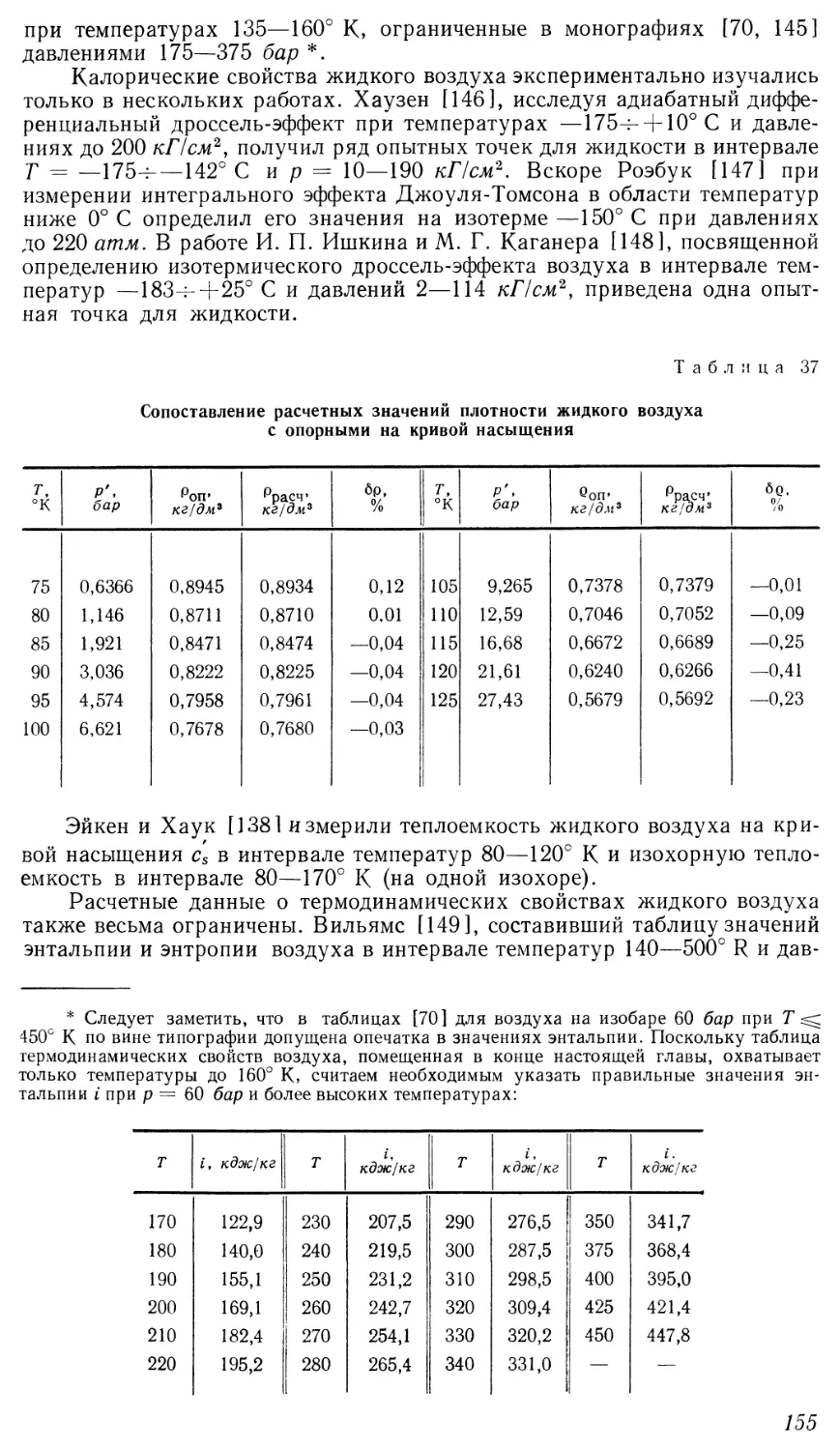
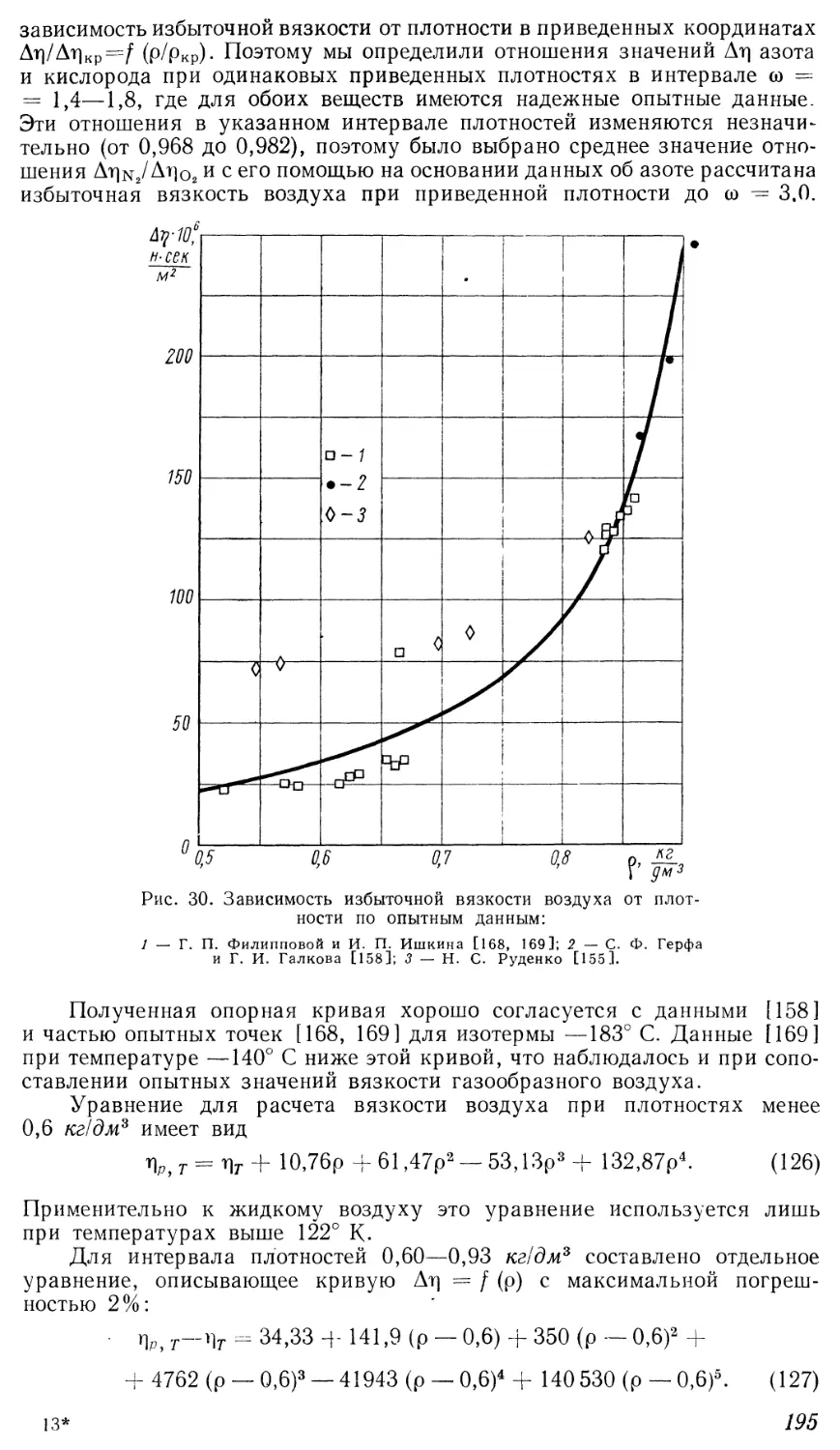
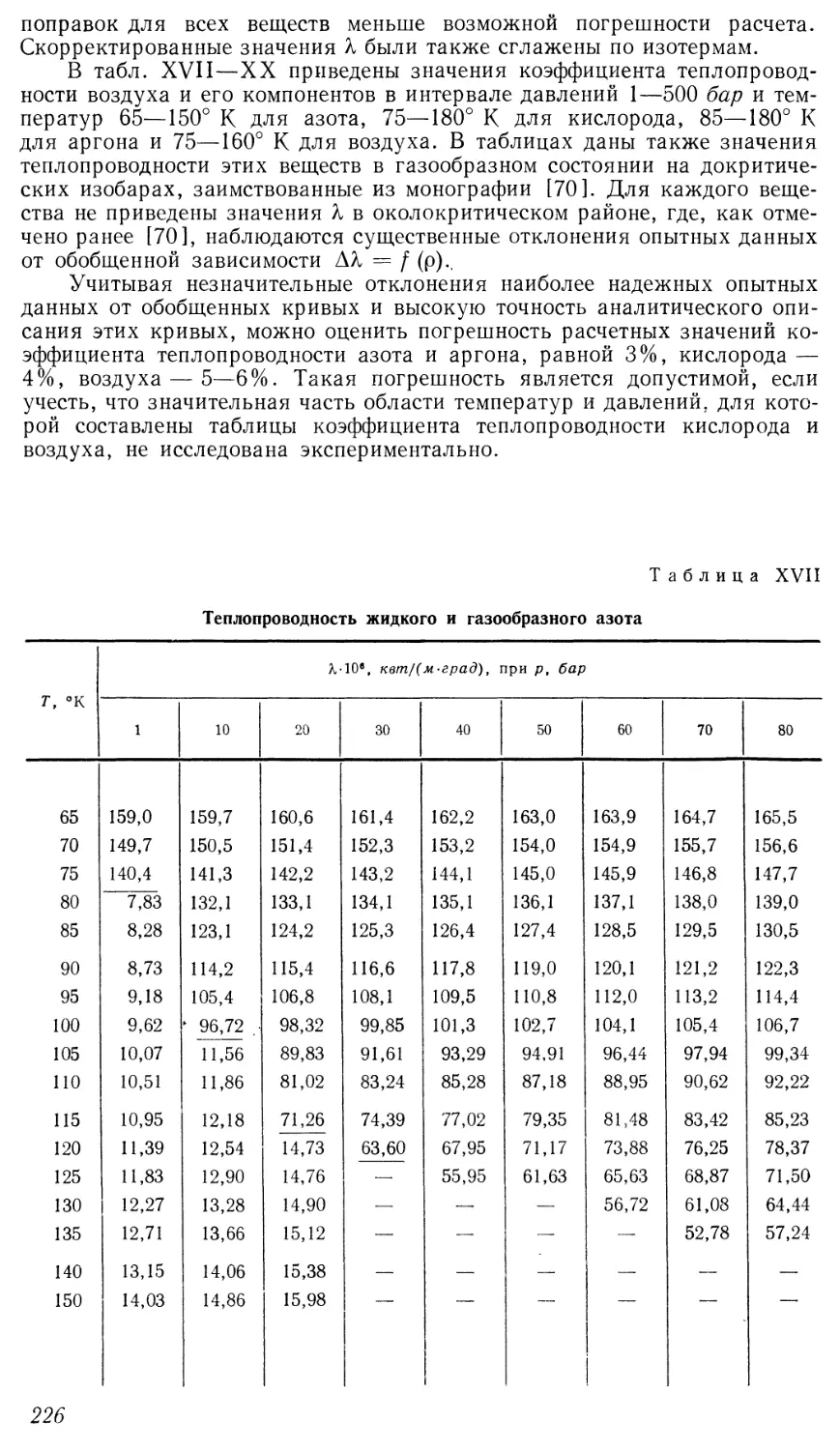
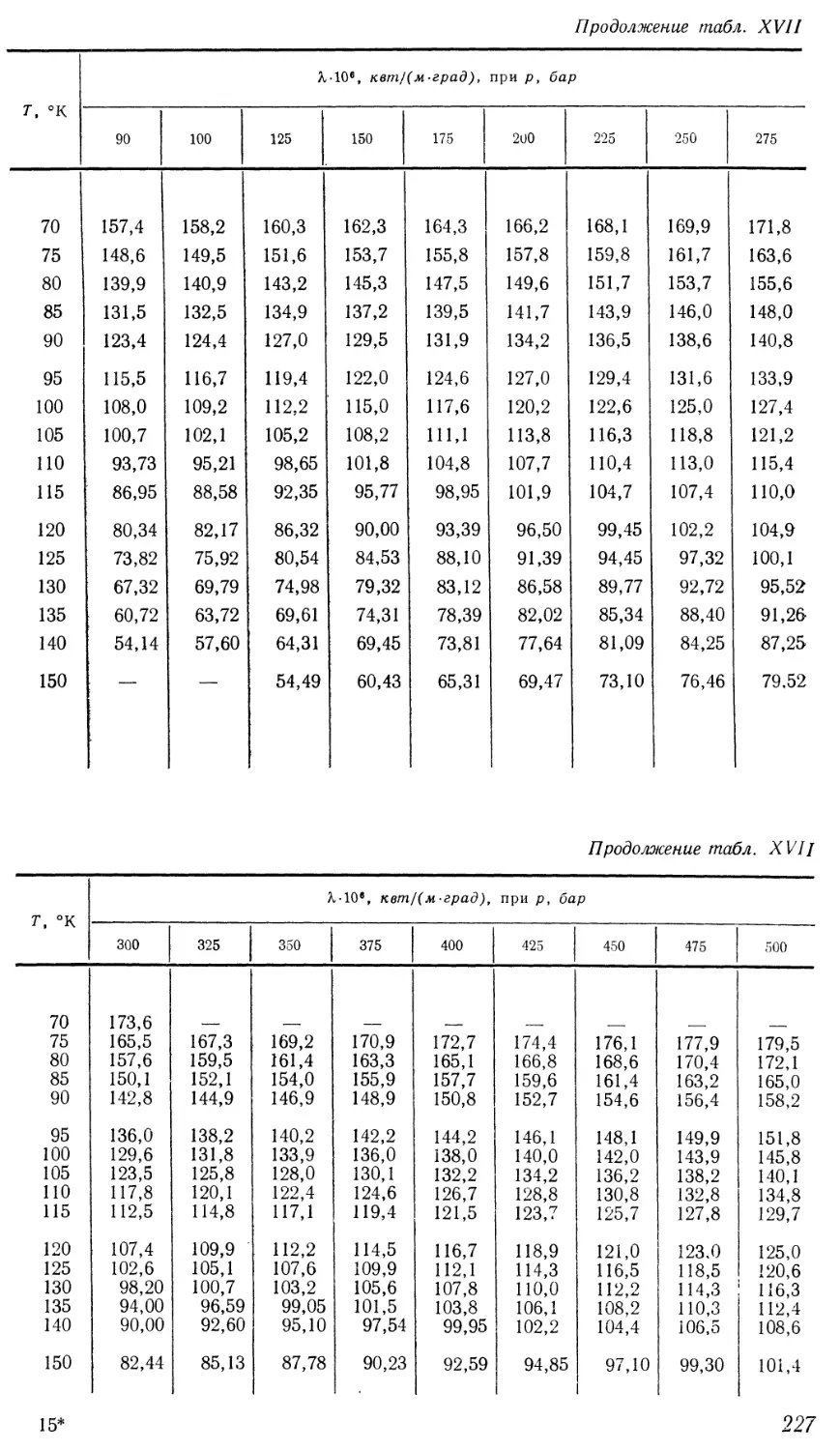
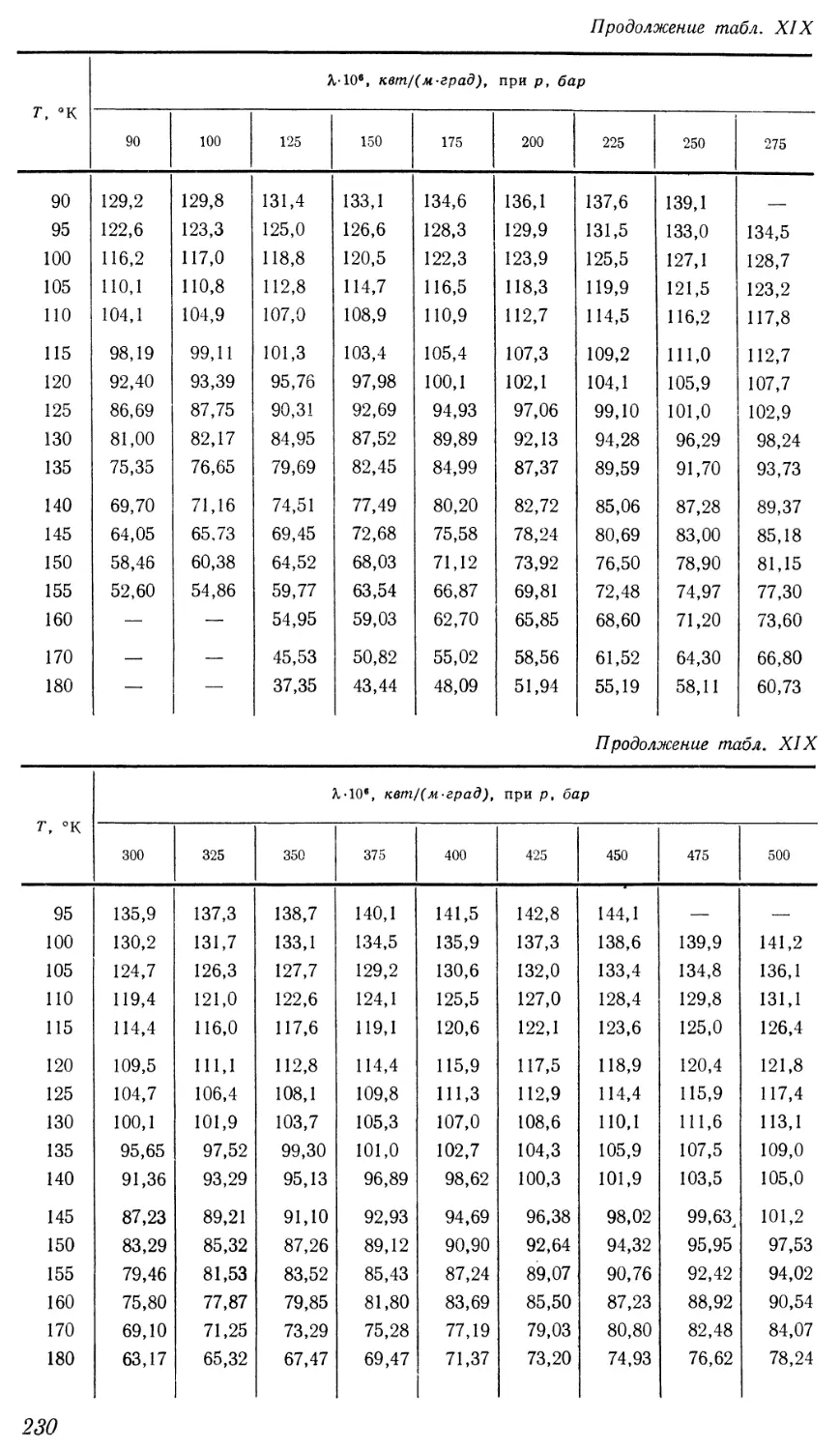
Текст
КОМИТЕТ СТАНДАРТОВ,
МЕР И ИЗМЕРИТЕЛЬНЫХ ПРИБОРОВ
при СОВЕТЕ МИНИСТРОВ СССР
Государственная служба стандартных
и справочных данных
Сер.ия: Монографии; № 3
-
Вассер
мам
,В.А
аоинович
ИЗДАТЕЛЬСТВО КОМИТЕТА СТАНДАРТОВ, МЕР И ИЗМЕРИТЕЛЬНЫХ ПРИБОРОВ
при СОВЕТЕ МИНИСТРОВ СССР
Москва
1968
УДК 546.217
Основной целью настоящей монографии являлось получение
справочных данных о теплофизических свойствах четырех
технически важных криогенных жидкостей.
В книге рассмотрены наиболее распространенные уравнения
состояния для жидкости, обоснована форма уравнения состояния*
справедливого в широком интервале температур и плотностей, и.
изложена методика его составления. Критически
проанализированы экспериментальные и расчетные данные о термических и
калорических свойствах жидких азота, кислорода, аргона и воздуха.
На основе составленных уравнений состояния для этих веществ-
получены подробные таблицы значений термодинамических свойств
от кривой насыщения до давления 500 бар и температуры 150—
180° К- По табличным данным для каждого вещества построены
диаграммы состояния: плотность — температура, энтальпия —
давление и энтропия — давление.
Проанализированы и обобщены опытные данные о вязкости и
теплопроводности жидкого воздуха и его компонентов и
составлены таблицы коэффициентов переноса в указанном интервале
параметров.
Книга рассчитана на работников научно-исследовательских и
проектно-конструкторских организаций химической и газовой
промышленности, а также на инженерно-технических работников
предприятий этих отраслей. Она может быть использована и
преподавателями, аспирантами, студентами холодильных,
химических и физических факультетов высших учебных заведений.
ПРЕДИСЛОВИЕ
Развитие ряда отраслей техники настоятельно требует получения
надежных и подробных данных о теплофизических свойствах основных
рабочих веществ в жидком состоянии. К сожалению, жидкое состояние
по сравнению с кристаллическим и газообразным менее изучено как в
теоретическом, так и в экспериментальном отношении.
Теоретическое изучение теплофизических свойств жидкости
затрудняется тем, что жидкость обладает, с одной стороны, особенностями,
характерными для твердого тела, а с другой — свойствами, присущими
газу. Хотя принципы статистической и кинетической теории жидкости
в значительной мере установлены, результаты расчетов
неудовлетворительно согласуются с экспериментальными данными.
Несмотря на большой интерес, проявляемый в последнее время
к экспериментальному исследованию теплофизических свойств жидкостей,
полученные данные сравнительно немногочисленны и для большинства
веществ охватывают узкие интервалы температур и давлений. Помимо
этого, данные различных исследователей часто недостаточно согласуются
между собой. Указанные обстоятельства не позволяют непосредственно
использовать при расчетах экспериментальные данные, а требуют их
согласования и пополнения и составления таблиц значений
термодинамических и транспортных свойств.
Такие таблицы могут быть составлены на основе либо графической
обработки опытных данных, либо расчета — с помощью уравнения
состояния. Последний способ предпочтительнее, поскольку он наиболее
точен и, при наличии современных вычислительных машин, наименее
трудоемок. Для расчета можно использовать как термическое, так и
калорическое уравнение состояния, однако в практике, как правило,
применяют термическое уравнение. Это объясняется наличием большего числа
(по сравнению с калорическими) надежных экспериментальных р, v,
Г-данных и более совершенными методами их аналитического описания.
Данные о вязкости и теплопроводности веществ могут быть описаны
аналитически с помощью различных полуэмпирических зависимостей,
однако для их использования чаще всего необходимо располагать данными
о термических свойствах. Поэтому уравнение состояния оказывается весьма
полезным и при расчете подробных таблиц коэффициентов переноса.
В настоящей монографии рассмотрены теплофизические свойства
жидких азота, кислорода, аргона и воздуха — веществ, имеющих
большое значение для техники глубокого охлаждения и ряда новых отраслей.
1*
3
Эта работа является дальнейшим развитием проводимых авторами
исследований термодинамических и транспортных свойств воздуха и его
компонентов и дополняет опубликованные ими ранее расчетные данные о тепло-
физических свойствах упомянутых веществ в газообразном состоянии.
В книге даны обзор и анализ наиболее известных уравнений
состояния для жидкости. На основании положений статистической физики
обоснована рациональная форма уравнения состояния для жидкости,
справедливого в достаточно широком интервале температур и плотностей.
Разработана методика составления этого уравнения; она применена для
аналитического описания данных о термических свойствах четырех
важнейших криогенных жидкостей.
Экспериментальные данные о термодинамических и транспортных
свойствах жидкого воздуха и его компонентов в основном получены
в последнее десятилетие и охватывают ограниченные области изменения
параметров. В настоящей работе опытные термические данные для жидких
кислорода, аргона и воздуха экстраполированы до давления 500 бар.
Это позволило составить уравнения состояния, справедливые в
интересующем технику интервале давлений, и рассчитать термические и
калорические свойства указанных веществ в ббласти изменения параметров, не
исследованной экспериментально. Полученные значения плотности были
использованы также при составлении таблиц значений вязкости и
теплопроводности четырех жидкостей на основании ограниченного
экспериментального материала, относящегося к коэффициентам переноса. Таким
образом, исследование позволило получить весь комплекс данных о
термодинамических и транспортных свойствах жидкого воздуха и его компонентов
в наиболее важном для практических целей диапазоне давлений — вплоть
до кривых насыщения и затвердевания.
С целью привлечь внимание экспериментаторов в книге указаны и те
области изменения параметров, где опытные данные отсутствуют или
недостаточно надежны. Появление новых данных, безусловно, будет
способствовать осуществлению программы составления международных таблиц
теплофизических свойств воздуха и его компонентов, намеченной
Международным союзом по теоретической и прикладной химии (ШРАС).
Настоящая монография является частью исследований
теплофизических свойств газов и жидкостей, проводимых в Одесском институте
инженеров морского флота и во Всесоюзном научно-исследовательском
институте физико-технических и радиотехнических измерений. Главы III и
V написаны А. А. Вассерманом, глава IV — В. А. Рабиновичем,
остальные — совместно.
Авторы благодарны сотрудникам кафедры термодинамики ОИИМФ
и особенно ее заведующему — профессору Я. 3. Казавчинскому, а также
сотрудникам лаборатории апробации-справочных данных ВНИИФТРИ
за ценную помощь, оказанную при выполнении настоящей работы. Авторы
глубоко признательны профессору Н. Б. Варгафтику за ценные
замечания, высказанные им при чтении рукописи книги.
Все критические замечания читателей будут приняты авторами с
большим вниманием и признательностью.
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ И РАЗМЕРНОСТИ ВЕЛИЧИН,
ВХОДЯЩИХ В ТАБЛИЦЫ I —XX
Т, °К — термодинамическая температура
(абсолютная)
Г', °К — температура начала кипения
Г", °К — температура начала конденсации
Р, бар A бар =•- 105 н/м2) —давление
Р'', бар —давление начала кипения
Р", бар—давление начала конденсации
р, кг/дм3 — плотность
v, дм3/кг — удельный объем
v', дм3/кг — удельный объем кипящей жидкости
/, кдж/кг — удельная энтальпия
V', кдж/кг — удельная энтальпия кипящей жидкости
s, кдж/(кг-град) — удельная энтропия
s', кдж/(кг-град) — удельная энтропия кипящей жидкости
г, кдж/кг — теплота парообразования
ср, кдж/(кг-град) — удельная теплоемкость при постоянном
давлении
с'р, кдж/(кг-град) — удельная теплоемкость кипящей
жидкости при постоянном давлении
Р, 10" бар'1 — изотермическая сжимаемость
Р', 10~4 бар~х — изотермическая сжимаемость кипящей
жидкости
т|, 10~6 н-сек/м2—динамическая вязкость
Я, 10~6 квт/(м-град)—теплопроводность
Глава I
О РАЦИОНАЛЬНОЙ ФОРМЕ УРАВНЕНИЯ
состояния для жидкости
Сравнительно недавно в некоторых отечественных и
зарубежных лабораториях были экспериментально исследованы термические
свойства ряда жидкостей. Получение экспериментальных р, и, Г-данных
усилило интерес к расчетным методам определения калорических свойств
с помощью уравнений состояния.
Для описания термодинамического поведения газа предложено
большое число достаточно надежных уравнений состояния, многие из которых
могут быть представлены в теоретически обоснованной вириальной форме.
К сожалению, для жидкости не существует теоретического уравнения
состояния, удовлетворительно отображающего экспериментальные
данные. Поэтому целью настоящей главы явилась разработка рационального
метода расчета термодинамических свойств жидкости на основе
уравнения состояния, описывающего опытные значения термических величин
в широком диапазоне параметров, включая кривые насыщения и
затвердевания.
1.1. Краткие сведения из теории жидкого
состояния
На термодинамической поверхности вещества жидкая фаза занимает
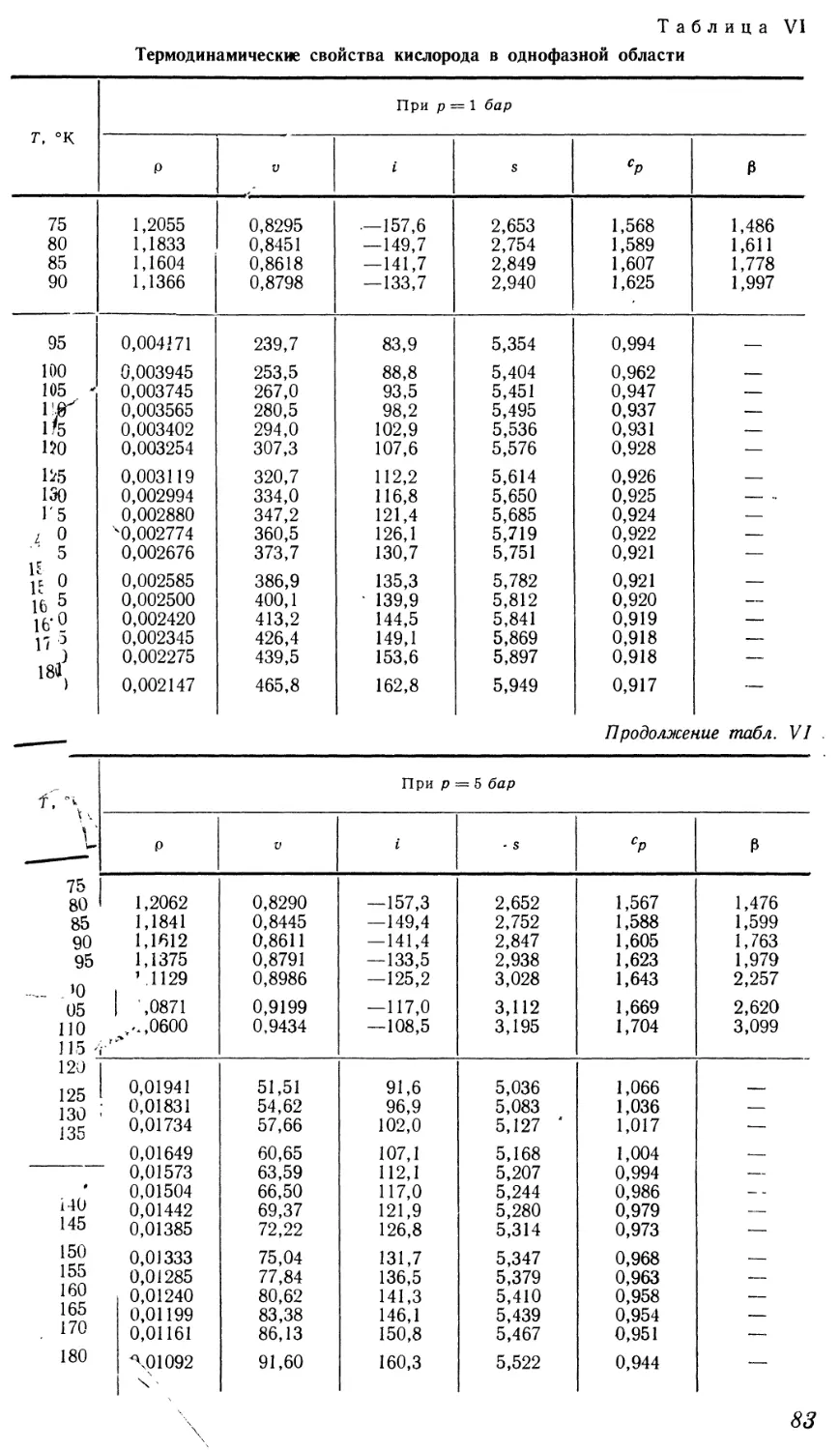
промежуточное положение между твердой и газообразной фазами. Это
может быть проиллюстрировано с помощью диаграммы давление —
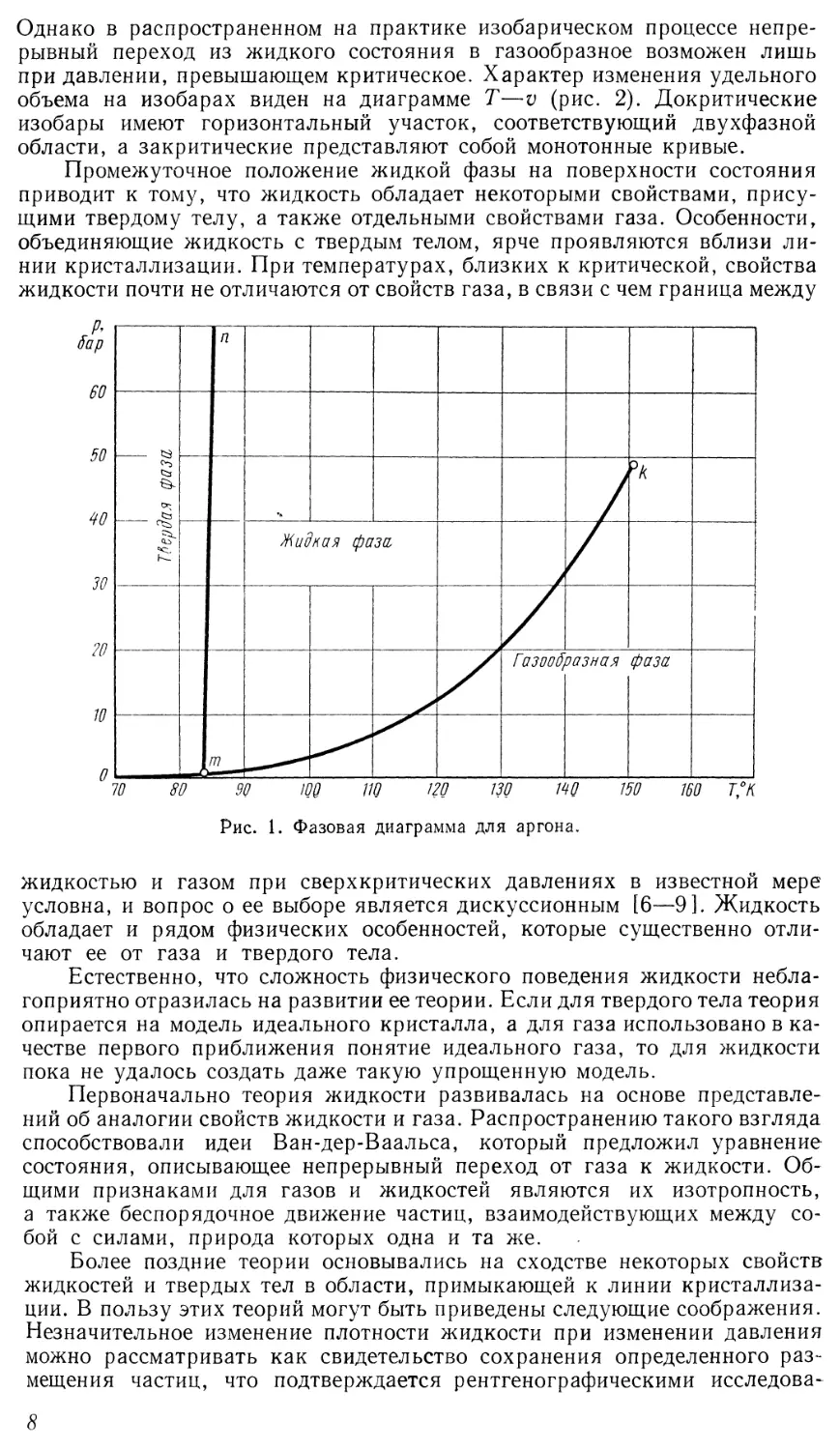
температура (так называемой фазовой диаграммы) для аргона, где нанесены
линии равновесия между фазами (рис. 1). Линии плавления или
кристаллизации (кривой тп) соответствуют значения давления и температуры,
при которых равновесно сосуществуют твердая и жидкая фазы. Кривая
упругости mk соответствует сосуществованию жидкости и газа. В точке т
(тройной точке) находятся в равновесии все три фазы. При температурах
и давлениях ниже параметров тройной точки вещество не может находиться
в жидком состоянии.
Некоторые авторы [1, 2] полагают, что на кривой плавления в
области давлений, не исследованной экспериментально, имеется
критическая точка. Однако Бриджмен [3] и Симон [4], основываясь на
полученных ими опытных данных о многих веществах при давлении до 10 000—
50 000 кГ/см2, отрицают ее существование. Это мнение подтверждается
теоретическими расчетами Джилварри [5]. По-видимому, при повышении
давления температура плавления монотонно возрастает, и невозможен
переход от жидкого состояния к твердому, минуя двухфазную область.
Непрерывный переход от жидкости к газу возможен благодаря
наличию критической точки на кривой упругости. Различные сочетания
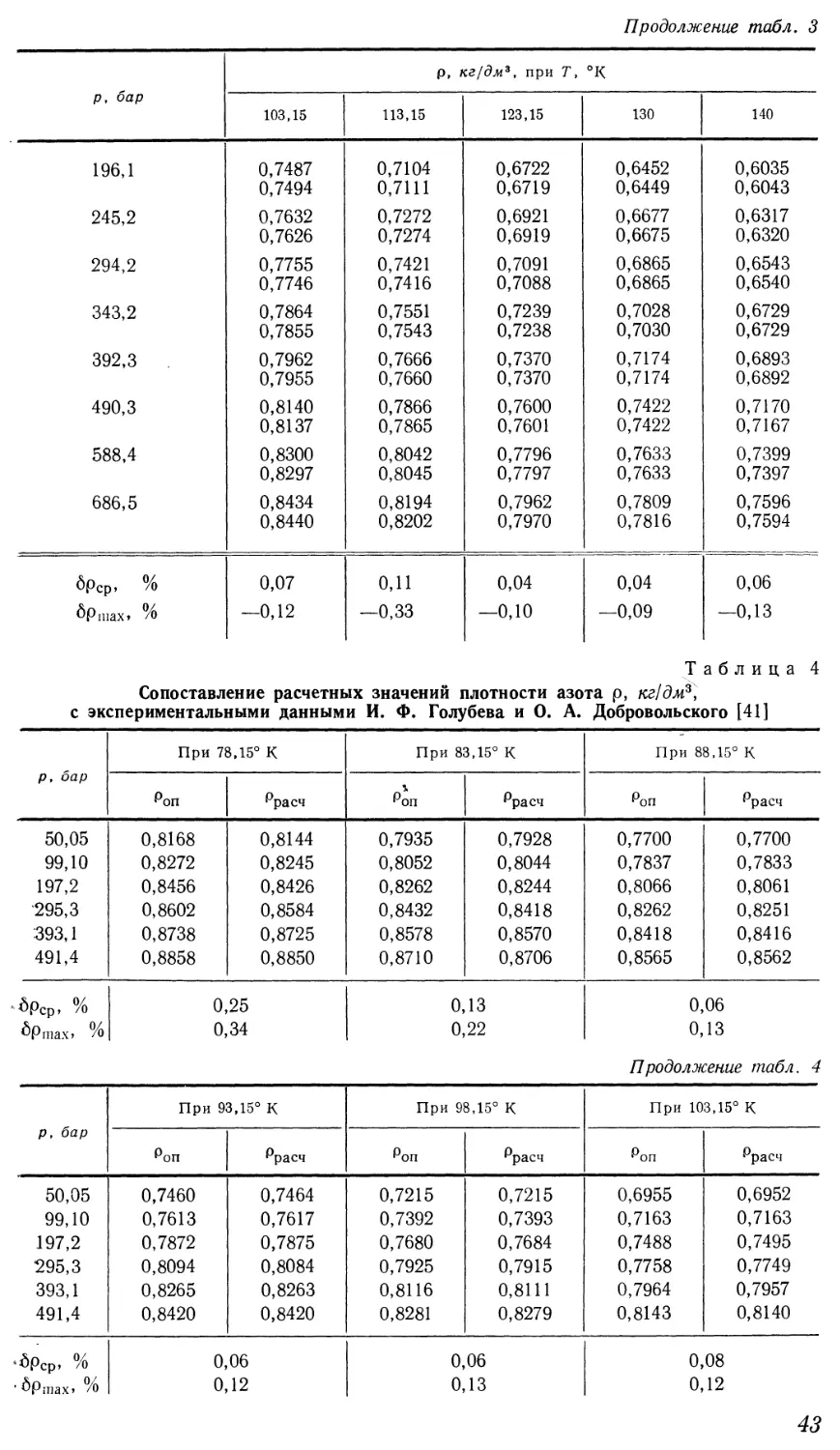
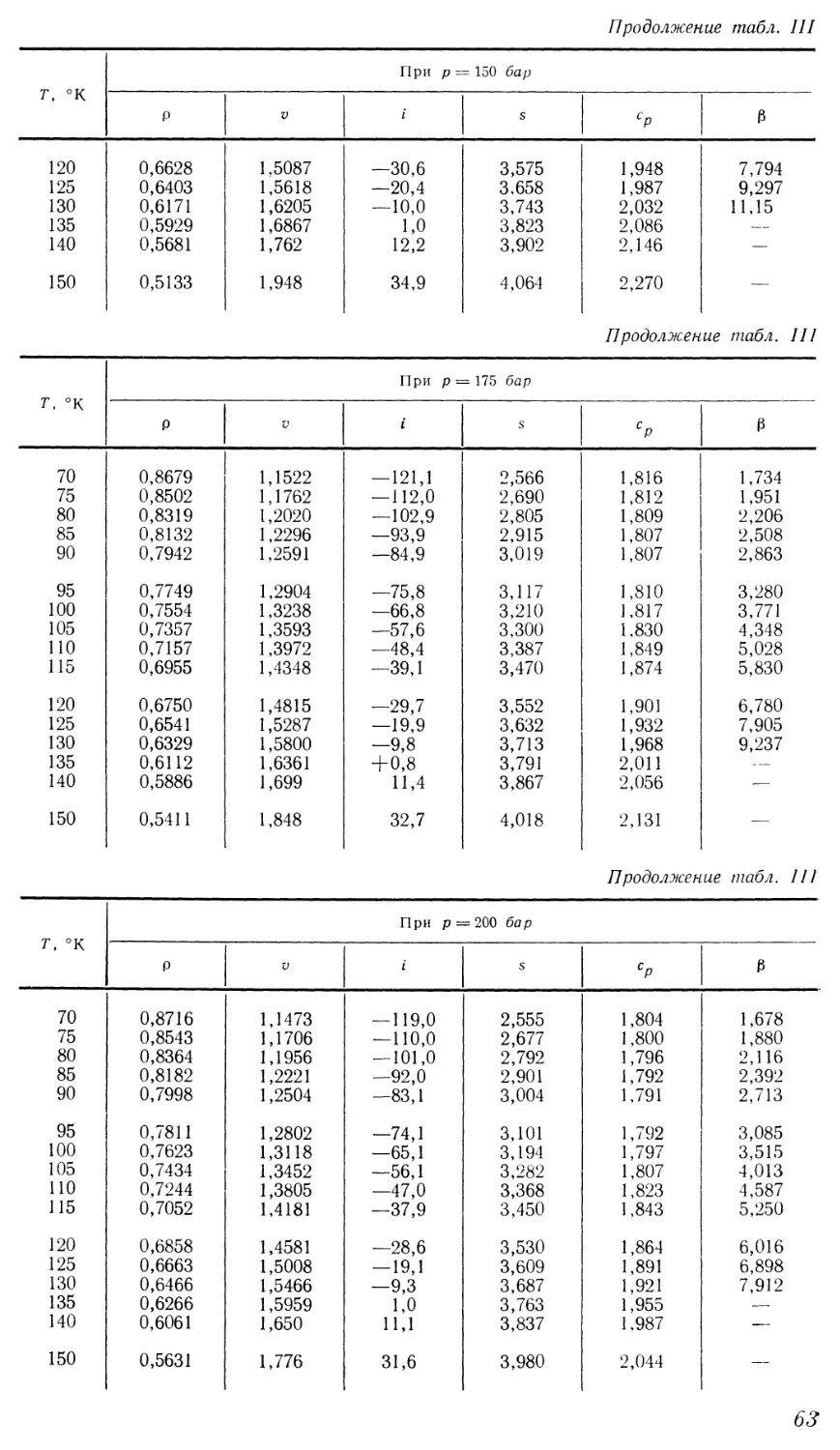
термического и механического воздействий позволяют реализовать такой
переход при любых значениях начальных и конечных параметров процессов.
7
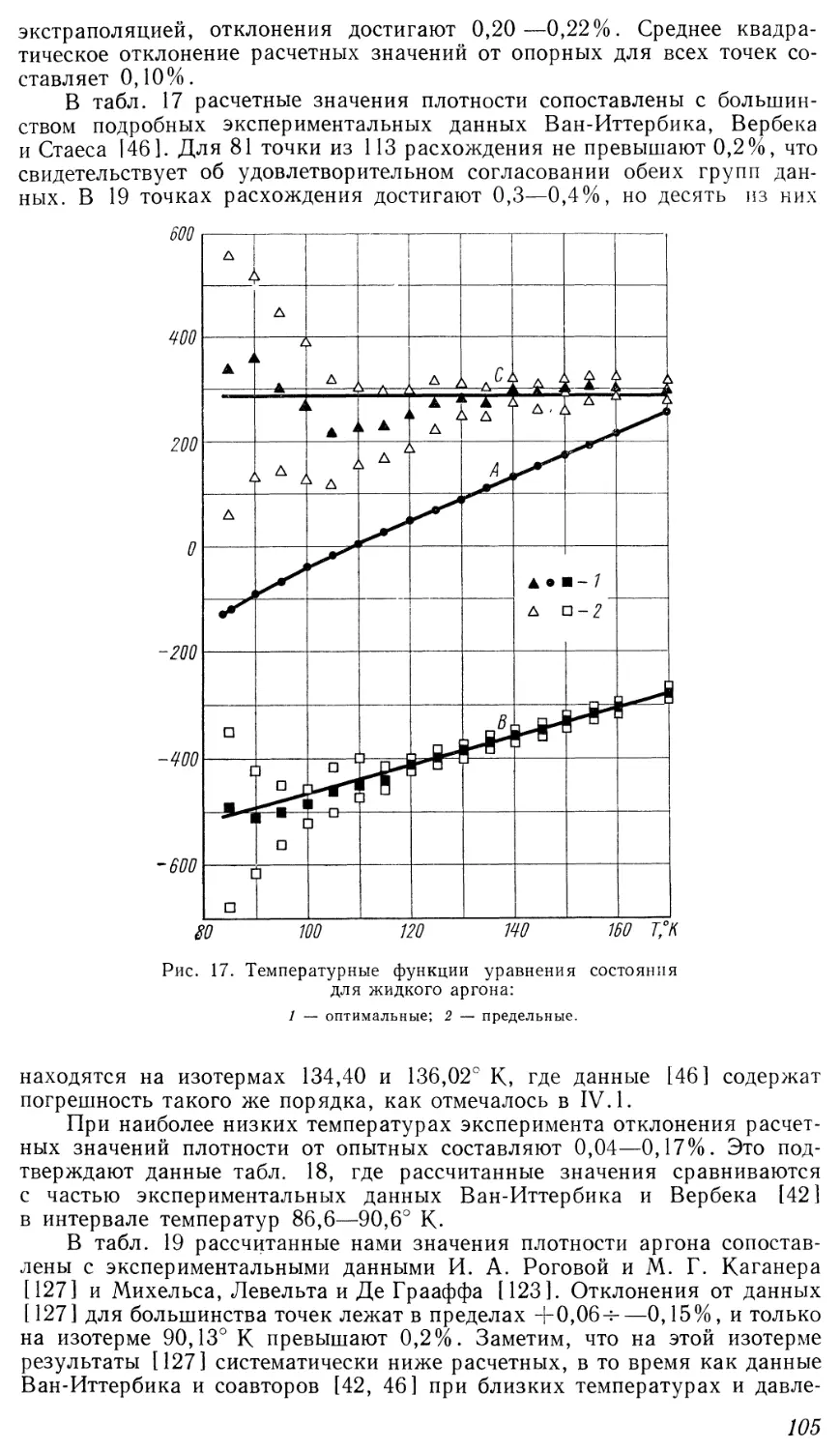
Однако в распространенном на практике изобарическом процессе
непрерывный переход из жидкого состояния в газообразное возможен лишь
при давлении, превышающем критическое. Характер изменения удельного
объема на изобарах виден на диаграмме Т—v (рис. 2). Докритические
изобары имеют горизонтальный участок, соответствующий двухфазной
области, а закритические представляют собой монотонные кривые.
Промежуточное положение жидкой фазы на поверхности состояния
приводит к тому, что жидкость обладает некоторыми свойствами,
присущими твердому телу, а также отдельными свойствами газа. Особенности,
объединяющие жидкость с твердым телом, ярче проявляются вблизи
линии кристаллизации. При температурах, близких к критической, свойства
жидкости почти не отличаются от свойств газа, в связи с чем граница между
А
дар
60
50
40 \
30
20
с§
\п
/77
Жидкая фаза
Газооб,
оазная
?к
фаза
70 80 90 Щ Щ 120 130 W
Рис. 1. Фазовая диаграмма для аргона.
150
160 L°K
жидкостью и газом при сверхкритических давлениях в известной мере
условна, и вопрос о ее выборе является дискуссионным [6—9]. Жидкость
обладает и рядом физических особенностей, которые существенно
отличают ее от газа и твердого тела.
Естественно, что сложность физического поведения жидкости
неблагоприятно отразилась на развитии ее теории. Если для твердого тела теория
опирается на модель идеального кристалла, а для газа использовано в
качестве первого приближения понятие идеального газа, то для жидкости
пока не удалось создать даже такую упрощенную модель.
Первоначально теория жидкости развивалась на основе
представлений об аналогии свойств жидкости и газа. Распространению такого взгляда
способствовали идеи Ван-дер-Ваальса, который предложил уравнение
состояния, описывающее непрерывный переход от газа к жидкости.
Общими признаками для газов и жидкостей являются их изотропность,
а также беспорядочное движение частиц, взаимодействующих между
собой с силами, природа которых одна и та же.
Более поздние теории основывались на сходстве некоторых свойств
жидкостей и твердых тел в области, примыкающей к линии
кристаллизации. В пользу этих теорий могут быть приведены следующие соображения.
Незначительное изменение плотности жидкости при изменении давления
можно рассматривать как свидетельство сохранения определенного раз-
мещения частиц, что подтверждается рентгенографическими исследова-
ниями. Жидкость, как и твердое тело, способна оказывать сопротивление
растягивающим усилиям. Для большинства веществ теплота плавления
меньше теплоты испарения при тех же давлениях (за исключением
давлений, близких к критическому). Последнее обстоятельство
свидетельствует о том, что для дисгрегации молекул твердого тела при переходе
в жидкое состояние необходимо меньше энергии, чем при фазовом
переходе жидкость—пар. Теплоемкость веществ при плавлении изменяется
незначительно, что дает основания предполагать сходство характера
теплового движения частиц в жидкости вблизи линии кристаллизации и в
твердом теле. Согласно Я. И. Френкелю [10], тепловое движение частиц
жидкости представляет собой импульсные смещения из одних временных
положений равновесия в другие и тепловые колебания вокруг этих
положений.
ои 0 2 4 6 8 10 1? г, 16 18 v,cm3/z
Рис. 2. Диаграмма v—Т для аргона.
В связи с рентгенографическими исследованиями структуры
жидкостей развились две теории их строения: псевдокристаллическая и
микрокристаллическая. Согласно первой теории расположение молекул в
жидкости в некоторой мере подобно расположению их в кристалле. Однако
по мере удаления от молекулы, принятой за исходную точку при оценке
закономерности расположения, наблюдаются все большие отклонения
от правильного чередования молекул. Вследствие непрерывного
движения молекул в псевдокристаллической решетке образуются места, не
занятые молекулами. Согласно микрокристаллической теории жидкость
состоит из комплексов, образованных несколькими десятками или сотнями
молекул. Эти комплексы непрерывно меняют положение, распадаются
и вновь образуются, и определенная молекула последовательно входит
в состав различных комплексов. *
Отметив некоторые особенности жидкостей, целесообразно рассмотреть
их термодинамическое поведение с позиций статистической физики, которая
в принципе дает все необходимое для получения уравнения состояния..
Однако вследствие неполноты знания законов межмолекулярного
взаимодействия и существенных математических трудностей невозможно решить
проблему чисто теоретическими методами. Вместе с тем теория дает сведе-
9
ния о рациональной форме уравнения состояния, и применительно к
нашей задаче это является исключительно важным.
Известно, что зависимость давления от температуры и объема можно
определить дифференцированием выражения для свободной энергии:
где N — число частиц в объеме V.
Свободная энергия системы связана со статистическим интегралом ZN
фундаментальным уравнением
Р = — kT\nZM, B)
где k — постоянная Больцмана.
Положения статистической механики приводят к выражению:
Zn=="M J ехр [~ Н% ] dTi'dT2X ••• xdTN-dpn-dp21x ••• xdp9Ni C)
здесь Н — общая энергия системы;
q и р — обобщенные координаты и импульсы частиц, составляющих
систему;
р — общее число степеней свободы одной частицы;
dx{ — элемент фазового объема, равный произведению
дифференциалов всех обобщенных координат i-и частицы,
d%t=- dqirdqu X ••• X dq9i.
Полную энергию системы можно представить в виде суммы
кинетической К (q, p) и потенциальной U (q) энергий:
H(qyp) = K(q,p) + U(q). D)
Вследствие аддитивности кинетическая энергия равна сумме энергий всех
частиц (молекул), образующих систему. В свою очередь, собственная
энергия в; /-Й молекулы зависит от импучьса и от так называехмых внутренних
координат. Потенциальная энергия взаимодействия молекул определяется
их относительным положением. Таким образом, полная энергия системы
H(q, p)=li*i(p)JrU(q). E)
Тогда статистический интеграл C) представляется произведением двух
интегралов
2* = -irQe'-Qx. <6)
где
N1
Qe= \ ехр I _ -4=— I dpn • dp21 X ¦ ¦ • X dp9N = {2nmkTf 2 ' G)
Qx=\ exp( ^•)^t1.dT2 X---X dr^, (8)
здесь m — масса частицы.
QT называют разделительной функцией или конфигурационным
интегралом системы.
Как видно из приведенных выражений, теоретическое решение задачи
сводится к вычислению Qx системы взаимодействующих частиц. К
сожалению, функция U (q) для системы реальных молекул неизвестна. К тому же
математические трудности интегрирования выражения (8) не позволяют
10
в настоящее время вычислить Qt в общем виде. Поэтому теоретическое
направление развивалось по пути разработки приближенных методов
расчета при введении упрощающих условий. В основном предполагалось,
что потенциальная энергия системы U (q) обладает аддитивностью по
отношению к парному взаимодействию частиц.
В 1937 г. Майер [11] на основании метода, предложенного ранее
Урселом [12], вычислил Qx для газа и благодаря относительно большим
расстояниям между частицами смог учесть парные, тройные и более
высокого порядка взаимодействия. Вскоре Н. Н. Боголюбов [13] на базе
теории возмущений механики совокупности молекул создал новый, более
совершенный метод определения разделительных функций. Обе теории
приводят к следующей форме уравнения состояния реального газа:
p_2_[l+J>Sl + ?gL + l!gL + ...], (9)
где В (T),C(T),D G), . . . —так называемые вириальные коэффициенты,
которые зависят только от температуры и вводятся для учета
взаимодействия двух, трех, четырех и т. д. молекул.
Вычисление вириальных коэффициентов возможно, если известна
зависимость потенциальной энергии молекул от расстояния между их
центрами и от их взаимной ориентации. Поскольку точный вид этой
зависимости неизвестен, был предложен ряд упрощенных потенциальных
функций взаимодействия. Наибольшее распространение при расчетах в теории
газов, а также в теории жидкостей [14, 15] получил потенциал
Леннарда-Джонса
<М') = -тг + -?-, 00)
в котором первым членом учитывается энергия притяжения, а вторым —
энергия отталкивания.
Несмотря на сравнительно простой вид функции A0), вычислить даже
второй и третий вириальные коэффициенты довольно затруднительно,
а последующие — для реального случая неаддитивности энергии
межмолекулярного взаимодействия — практически невозможно. Поэтому
термодинамические свойства реальных газов могут быть рассчитаны только в области
малых плотностей с помощью значений В (Т) и С (Г), полученных на
основании потенциала Леннарда-Джонса (или других моделей потенциальной
функции) и табулированных в безразмерной форме, — см., например,
монографию [16]. Для использования этих таблиц достаточно по
ограниченным опытным данным найти параметры выбранной функции
межмолекулярного взаимодействия.
Но даже в области малых и умеренных плотностей
удовлетворительное согласие экспериментальных и теоретических значений давления
получено лишь для газов простой молекулярной структуры, в первую
очередь, одноатомных и некоторых двухатомных. При более сложной
структуре попытки применить расчетные значения второго и третьего
вириальных коэффициентов, полученные на основе приближенных функций
межмолекулярного взаимодействия, не приводят к удовлетворительному
описанию термодинамических свойств. Поэтому в практике часто используют
теоретически обоснованную вириальную форму уравнения состояния (9),
а коэффициенты уравнения определяют непосредственно с помощью
опытных термических данных.
В области сильно сжатого газа или жидкости вследствие уменьшения
расстояний между частицами до величин, соизмеримых с размерами
частиц, и возрастания роли сил сцепления условия настолько изменяются,
что теоретические выводы, полученные для газа малой и умеренной
плотности, оказываются несправедливыми. С целью получения теории
термодинамических свойств жидкости, удовлетворительно согласующейся с опы-
11
том, Леннардом-Джонсом и Девоншайром [17] был предложен метод
«самосогласованного поля». В этом методе взаимодействие между частицами
заменяется взаимодействием рассматриваемой частицы со всей остальной
системой, состоящей из N—1 частиц, закрепленных в своих средних
положениях. Поскольку результаты теории Леннарда-Джонса и Девоншайра
играют большую роль для настоящей работы, рассмотрим их несколько
подробнее; будем придерживаться при этом последовательности, принятой
в монографии [10].
Предположим, что однородная система состоит из N частиц, каждая
из которых закреплена в центре сферической ячейки. Радиус а ячейки
близок к среднему расстоянию между соседними частицами, и объем ее*
V 4 3 /114
у = —= —яЛ A1)
Для одноатомных веществ в результате взаимодействия фиксированного
атома с окружающими создается сферически симметричное силовое поле,
которое можно отождествить со средним полем, соответствующим
равновероятности всех положений каждого из соседних атомов, смещающихся
из своего центрального положения в пределах сферы. Допущение не только
продиктовано желанием упростить задачу, но и оправдывается тем, что
жидкости, как и газы, изотропны, вследствие чего должны обладать
сферической симметрией.
Введем далее в конфигурационный интеграл (8) вместо координат дг
новые координаты rt, характеризующие смещение атомов из центральных
положений равновесия внутри ячеек. Тогда средняя энергия
самосогласованного поля U (г) будет зависеть от параметра г, изменяющегося в
пределах от 0 до а. Заменяя реальное взаимодействие между атомами
действием некоторой средней U (г) на каждый из них, можно рассчитать
свободную энергию F всей системы, состоящей из N атомов. При этом F, как и
для идеального газа, будет определяться произведением tyN, в котором
г|? — свободная энергия одного атома, рассчитываемая в соответствии
с F)—(8) с помощью уравнения
exp(_^J2f^jexp(_«aL,,rV, A2).
о
Интеграл, входящий в это выражение, можно записать в виде
а
Jexp(--^L*r»dr = oexp(--3M), A3}
0
где v — объем одной сферической ячейки, определяемый по
формуле A1);
X (v) — функция объема ячейки, тождественная по смыслу среднему
значению энергии самосогласованного поля.
При отсутствии взаимодействия между атомами (% = 0)
конфигурационный интеграл равен v.
На основании выражений A2) и A3) получим для свободной энергии
одного атома уравнение
" Bшп/гТK/2
•ф = — kTln
•v\+.%(p), A4)
в котором первым членом учитывается кинетическая энергия, а вторым —
влияние сил взаимодействия между атомами. Если предположить, что для
жидкости справедлива потенциальная функция взаимодействия Леннарда-
Джонса A0), то функцию % (v) можно представить выражением вида
/ ч с , d
t.lP) = --f + -r> A5)
12
где [х = га/3, v = n/3, а коэффициенты си^ должны быть подобраны
таким образом, чтобы минимум функции % (v) достигался при v = -у ла3.
С целью перехода к уравнению состояния для жидкости на основании
уравнения A) получаем [10]
кТ . Lie vd ,«-,
Р = — + ф^т-^+г- A6)
Представляет интерес анализ уравнения A6) с точки зрения его
использования для описания термодинамических свойств жидкостей и
установления интервала удельных объемов, в котором оно применимо.
При выводе уравнения состояния A6) было принято допущение о
возможности использовать для жидкости потенциальную функцию
взаимодействия A0), в которой с и d не зависят от температуры. Тогда в соответствии
с уравнением A6) изохорная теплоемкость жидкости окажется
постоянной, равной теплоемкости идеального газа, что качественно неверно.
Однако, как показано в работах [18, 19], для описания теплофизических
свойств веществ потенциал Л еннарда-Джонса F—12) можно применить
эффективнее, если принять, что его параметры зависят от температуры.
В этом случае все коэффициенты при степенях l/v в уравнении A6) будут
функциями температуры, аналогично вириальным коэффициентам
уравнения (9), и уравнение состояния для жидкости может быть записано в виде
p = 'J!f + ?ip_+CEL, A7)
Теория не дает указаний относительно вида температурных функций
уравнения состояния A7), вследствие чего их необходимо определять на
основании экспериментальных термических данных, как это часто делают,
находя коэффициенты уравнения (9). Определение вида температурных
функций для многих веществ, вероятно, поможет создать более реальную
модель силового взаимодействия между молекулами в жидком состоянии.
Необходимо оговорить область удельных объемов, в которой
применимо уравнение состояния A7). При увеличении размера сферической ячейки
средняя энергия U (г) будет уменьшаться. В случае возрастания а до 2гь
представления о самосогласованном поле, положенные в основу вывода
уравнения, становятся неоправданными, поскольку атом или молекула
могут легко выйти из ячейки, образованной соседними частицами.
Следовательно, можно предположить, что уравнение A7) справедливо при
удельных объемах, не превышающих удвоенный удельный объем вещества
в твердом состоянии (например, в тройной точке). Этот вопрос, как и
затронутый выше, будет рассмотрен в дальнейшем применительно к
опытным данным о термических свойствах жидких компонентов воздуха.
Помимо теории Леннарда-Джонса и Девоншайра [17], целесообразно
кратко рассмотреть и другие наиболее известные теории жидкого
состояния с целью получения дополнительных сведений.
По мере понижения температуры жидкости до значений, достаточно
близких к температурам кристаллизации, сила сцепления между
частицами возрастает, и жидкость становится в значительной мере похожей
на твердое тело. Однако в отличие от него жидкость пронизана множеством
поверхностей разрыва, образуемых совокупностью микрополостей. На
этом основании Я. И. Френкель [10] развил дырочную теорию жидкого
состояния, согласно которой свободный объем V—V0 может быть
представлен в виде
V — V0 = N (v — v0) = N Av. A8)
Здесь V0 — минимальный объем, отождествляемый с постоянной Ь теории
Ван-дер-Ваальса;
vQ — наименьший объем дырок;
v — средний объем при данной температуре Т и давлении р.
13
Введя ряд условий и допущений, Я. И. Френкель пришел к выводу,,
что поведение жидкостей в области умеренных давлений может быть
описано уравнением состояния
V = V0[l + nAvexp(-^+E^)}, A9)
в котором п = N/V0 — число молекул в единице объема при Т = 0 и
р = 0; и0 — значение энергии при р = 0.
Уравнение A9) качественно отражает поведение жидкостей, в
частности, объясняет их большую сжимаемость и больший коэффициент
теплового расширения по сравнению с твердыми телами. Однако применить
это уравнение для расчета термодинамических свойств жидкостей
невозможно, так как трудно достоверно определить объем микрополостей.
В последнее время в теории жидкости используют так называемые
коррелятивные функции, с помощью которых можно получить сведения
о термодинамическом поведении жидкости в неменьшем объеме, чем при
непосредственном изучении статистического интеграла [15]. Среди набора
коррелятивных функций наибольшее значение имеет радиальная функция
распределения, вероятностный смысл которой связан со взаимным
расположением частиц в жидкости. Эта функция, зависящая от температуры
и удельного объема, может быть определена, например, по
экспериментальным рентгено-срруктурным данным. В целом же при реализации метода,,
основанного на изучении коррелятивных функций и решении
интегральных уравнений для них, сталкиваются с большими математическими
трудностями, в связи с чем в настоящее время не достигается точное
аналитическое описание макроскопических равновесных свойств жидкостей,
несмотря на несомненную теоретическую ценность метода.
Невозможность определить термодинамические свойства жидкости
чисто теоретическими методами из-за трудностей вычисления
конфигурационного интеграла или коррелятивных функций вызывает появление
большого числа полуэмпирических и эмпирических уравнений состояния
для жидкости, представляющих собой модификацию уравнения Ван-дер-
Ваальса или основывающихся на других более или менее достоверных
теоретических предпосылках. Далеко не все эти уравнения могут быть
приведены к форме A7), вытекающей из теоретических соображений. Вместе
с тем данные, полученные с помощью некоторых уравнений, приемлемо
согласуются с экспериментальными в определенных областях изменения
параметров и поэтому такие уравнения рассматриваются нами ниже.
I. 2. Анализ некоторых уравнений состояния
для жидкости
Многочисленные уравнения состояния для жидкости можно
разделить на две основные группы. К первой относятся уравнения, в которых
независимыми переменными являются температура и давление, ко второй—
уравнения, выражающие давление в функции температуры и удельного
объема (или плотности).
Среди наиболее удачных эмпирических уравнений состояния первой
группы следует указать уравнение Тэйта [20]
dV К
B0)
dp ~' L+p'
где К — постоянная;
L — функция температуры.
В интегральной форме уравнение имеет вид
здесь Vо — объем жидкости, соответствующий давлению р0\
постоянная А = K/V0.
14
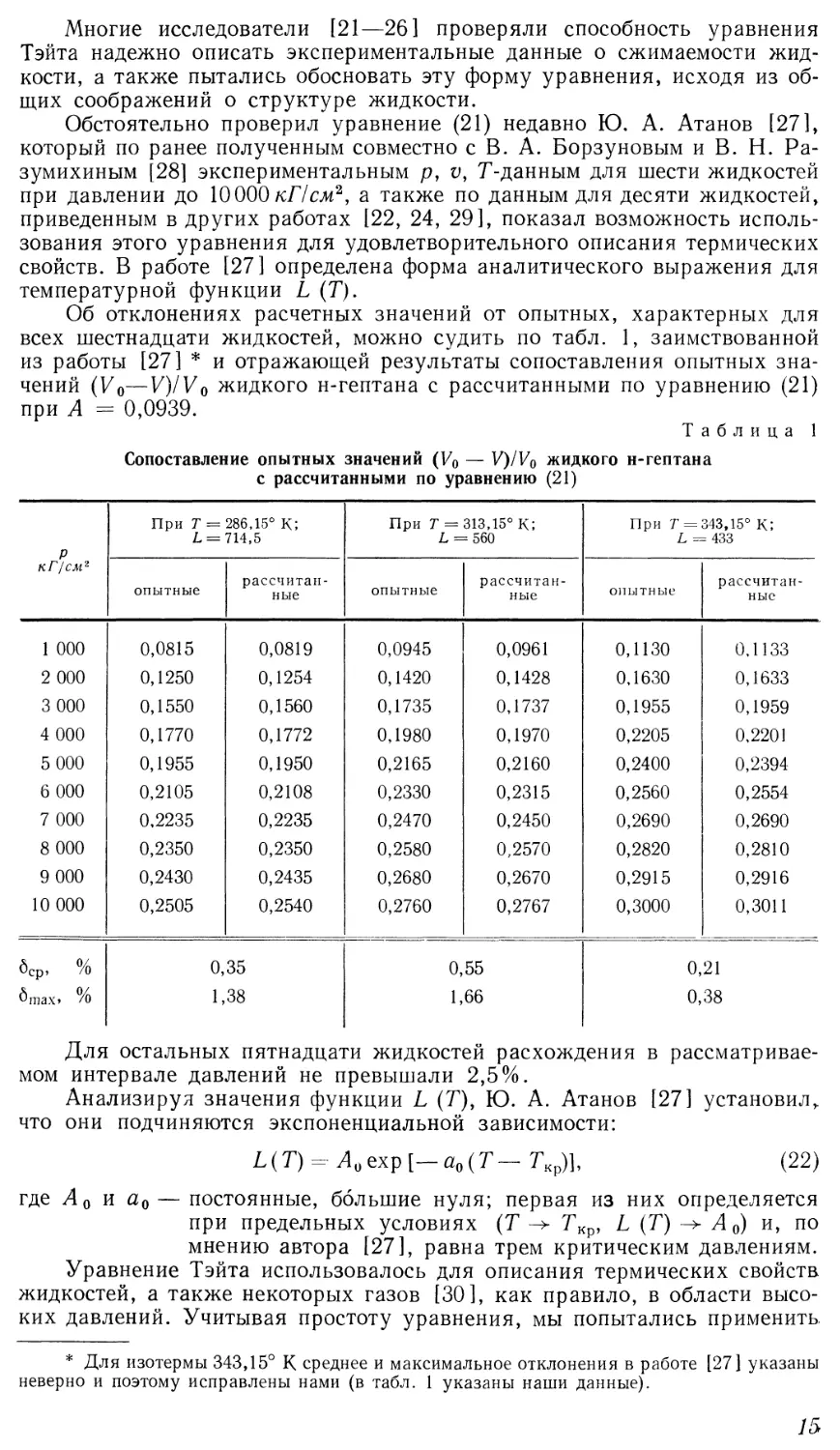
Многие исследователи [21—26] проверяли способность уравнения
Тэйта надежно описать экспериментальные данные о сжимаемости
жидкости, а также пытались обосновать эту форму уравнения, исходя из
общих соображений о структуре жидкости.
Обстоятельно проверил уравнение B1) недавно Ю. А. Атанов [27],
который по ранее полученным совместно с В. А. Борзуновым и В. Н. Ра-
зумихиным [28] экспериментальным р, v, Т-данным для шести жидкостей
при давлении до 10000 /с/7см2, а также по данным для десяти жидкостей,
приведенным в других работах [22, 24, 29], показал возможность
использования этого уравнения для удовлетворительного описания термических
свойств. В работе [27] определена форма аналитического выражения для
температурной функции L (Т).
Об отклонениях расчетных значений от опытных, характерных для
всех шестнадцати жидкостей, можно судить по табл. 1, заимствованной
из работы [27] * и отражающей результаты сопоставления опытных
значений (Уо—V)/V0 жидкого н-гептана с рассчитанными по уравнению B1)
при А = 0,0939.
Таблица 1
Сопоставление опытных значений (V0 — V)/V0 жидкого н-гептана
с рассчитанными по уравнению B1)
р
кГ/см2
1 000
2 000
3 000
4 000
5 000
6 000
7 000
8 000
9 000
10 000
бср, %
<W» %
При Т
L
опытные
0,0815
0,1250
0,1550
0,1770
0,1955
0,2105
0,2235
0,2350
0,2430
0,2505
= 286,15° К;
= 714,5
рассчитанные
0,0819
0,1254
0,1560
0,1772
0,1950
0,2108
0,2235
0,2350
0,2435
0,2540
0,35
1,
38
При Т = 313,15° К;
L = 560
опытные
0,0945
0,1420
0,1735
0,1980
0,2165
0,2330
0,2470
0,2580
0,2680
0,2760
рассчитанные
0,0961
0,1428
0,1737
0,1970
0,2160
0,2315
0,2450
0,2570
0,2670
0,2767
0,55
1,
66
При 7 = 343,15° К;
L =433
опытные
0,1130
0,1630
0,1955
0,2205
0,2400
0,2560
0,2690
0,2820
0,2915
0,3000
рассчитанные
0,1133
0,1633
0,1959
0,2201
0,2394
0,2554
0,2690
0,2810
0,2916
0,3011
0,21
0,
38
Для остальных пятнадцати жидкостей расхождения в
рассматриваемом интервале давлений не превышали 2,5%.
Анализируя значения функции L (Т), Ю. А. Атанов [27] установил,
что они подчиняются экспоненциальной зависимости:
L(T) =А0ехр[-а0(Т- ТКр)Ъ B2)
где Л 0 и а0 — постоянные, большие нуля; первая из них определяется
при предельных условиях (Т -> Гкр, L (Т) -> А0) и, по
мнению автора [27], равна трем критическим давлениям.
Уравнение Тэйта использовалось для описания термических свойств
жидкостей, а также некоторых газов [30], как правило, в области
высоких давлений. Учитывая простоту уравнения, мы попытались применить
* Для изотермы 343,15° К среднее и максимальное отклонения в работе [27] указаны
неверно и поэтому исправлены нами (в табл. 1 указаны наши данные).
15
•его для аналитического отображения данных об удельных объемах
жидких азота и аргона от кривой насыщения до давления 500 бар, однако
попытка оказалась безуспешной.
Исходя из соображений пригодности уравнения Ван-дер-Ваальса
для описания термодинамических свойств жидкости, Тамманн [31]
предложил уравнение состояния
v = umn + AtT±-j, B3)
где vmir] — объем, занимаемый жидкостью при р -> оо и Т = 0. Второй
член уравнения зависит от давления и температуры и характеризует
дополнительный объем, в котором движутся частицы. At является функцией
температуры,
273 +1
At — AQ-
273
где Л о — свободный объем при t = 0° С и р = 0. Коэффициентом k
учитывается взаимодействие молекул, обусловленное их взаимным
притяжением; он имеет тот же смысл, что и a/v2 в уравнении Ван-дер-Ваальса.
Уравнение B3) проверялось по известным опытным данным Амага
для этилового эфира на четырех изотермах: 0; 20,20; 40,45 и 49,95° С
в интервале давлений 1—3000 атм. Отклонения расчетных данных от
опытных увеличиваются по мере уменьшения давления и при р «< 1000 атм
существенно превышают допустимые пределы.
Е. В. Бирон [32], также полагая, что уравнение состояния в форме,
предложенной Ван-дер-Ваальсом, может быть применено к жидкости,
пришел к выводу о возможности описания изотермы уравнениями вида
v = A + ch> B4)
где А, В и С в общем случае — функции температуры и давления, однако
зависимость их от последнего незначительна, и ею можно пренебречь.
Уравнение Е. В. Бирона, как и уравнение Ван-дер-Ваальса,
выражает гиперболическую зависимость удельного объема от давления, и при
постоянной температуре между коэффициентами двух типов уравнений
существует очевидное соотношение: А ~ Ъ, В — RT, С — a/v2.
Отсутствие методики определения температурных функций
длительное время тормозило практическое применение уравнения B4). Наиболее
обстоятельные исследования в этом направлении были выполнены
А. М. Мамедовым, который четко указал температурные пределы приме-
лимости уравнения.
Для установления вида аналитических выражений температурных
функций А (Т), В (Т) и С (Т) А. М. Мамедов [33] рассмотрел
накопленные данные о сжимаемости воды, шести жидких углеводородов алкано-
вого ряда (пропана, н-бутана, изобутана, н-пентана, н-октана и н-декана)
и жидкой двуокиси углерода и предложил следующие выражения:
А - А0 + гТ, B5)
B = B0 + ^- + -Jb B6)
C = C0 + ^- + «gb B7)
где в = Т/100, Л0, В0, С0, г, тъ т2, пг и п2 — постоянные,
определяемые с помощью экспериментальных данных.
Результаты сопоставления расчетных и опытных значений
показывают, что с помощью уравнения B4) при температурных функциях B5)—
16
B7) сжимаемость жидкости может быть' описана с точностью
эксперимента в сравнительно узком интервале температур. Эта особенность
уравнения (:24) наглядно проявилась при описании р, v, Т-данных для воды,
которые были отображены в работе [34] тремя отдельными уравнениями
состояния, справедливыми в интервалах температур 20—140; 145—250
и 250—370° С.
В дальнейшем П. М. Кессельман [35] для описания
термодинамических свойств тяжелой воды в широком интервале температур
модифицировал уравнение Бирона. Рассматривая надежные опытные р, v, Т-данные
для тяжелой воды [36, 37] в координатах г, р, автор [35] обнару-
жил, что с ростом температуры изотермы все больше отклоняются от
прямолинейной зависимости, и ввел в уравнение B4) корректирующие
функции, которые должны возрастать по мере приближения к критической
температуре. Уравнение состояния, предложенное П. М. Кессельманом для
тяжелой воды, имеет вид
v = A +-7——+ —+ 4"> B8)
Ь + ар ' р ' р2 . '
где Л, а, п и т — экспоненциальные функции температуры;
b — функция, представленная полиномом четвертой
степени от 6 = //100.
Довольно сложный вид температурных функций уравнения B8), а
главное, отсутствие надежной методики их определения препятствуют
практическому применению уравнения.
Общим недостатком уравнения Бирона и его модификаций является
в значительной мере произвольный выбор на каждой изотерме значения
функции Л, от которой зависят последующие температурные функции.
Это обусловливает трудоемкость процесса определения температурных
функций, сложность их вида и трудность точного аналитического
описания.
В. Н. Новотельнов и Л. А. Акулов [38] предложили для описания
термических свойств жидкого кислорода эмпирическое уравнение
состояния
-р = Л0 + A±Q + Л262, B9)
здесь 9 = Г/100; Л0, Ах и Л2 — функции давления, имеющие
одинаковый вид:
Ап = ап + Ьпр~
спР~
C0)
Коэффициенты функций определялись по опытным р, v, Т-данным [39]
методом наименьших квадратов.
В статье [38] дана таблица отклонений опытных значений плотности
от расчетных, воспроизводимая нами (табл. 2) *. Примерно для половины
Таблица 2
Отклонения опытных значений плотности жидкого кислорода [39]
от рассчитанных по уравнению B9)
Т, °К
Относительная погрешность, %, при р, бар
78,45
8,07
117,68
137,3
176,52
196,13
153
143
113
93
83
2,43
-0,40
0,37
0,49
0,00
1,36
-0,18
0,35
0,44
0,08
0,94
0,02
0,38
0,37
0,11
* Значения отклонений по данным [38] округ.
Зак. 1978
0,00
0,06
0,10
0,02
-0,07
до щтщ^олей процента.
"А 17
сравниваемых точек расхождения превышают возможную погрешность
эксперимента [39], а в некоторых точках даже существенно выходят
за допустимые пределы. При постоянной температуре отклонения в
основном возрастают по мере уменьшения давления. Таким образом, уравнение
B9), по-видимому, не способно описать термодинамическое поведение
жидкости при давлениях, меньших критического.
Несколько позднее Л. А. Акулов и В. Н. Новотельнов [40]
применили уравнение состояния B9) для отображения экспериментальных
данных о плотности жидкого азота [41]. В этом случае функции давления
были представлены в несколько иной форме:
~Ап = ^ Jr К lg Р + с~п (lg pf- C1)
В кратком сообщении [40] отсутствует таблица сопоставления, однако
отмечается, что отклонения рассчитанных авторами значений плотности
от опытных [41] достигают 1%.
Ввиду невысокой точности отображения опытных данных уравнение
B9) вряд ли может быть использовано для расчета термодинамических
свойств жидкости в широкой области параметров.
Известны попытки получить уравнение состояния для жидкости
путем описания опытных данных на изотермах полиномами от давления
и последующего определения зависимости коэффициентов полиномов от
температуры. Весьма простые уравнения состояния такого вида получили
Ван-Иттербик и Вербек [42, 43] на основе своих опытных р, v, Т-данных
для жидких азота, аргона и кислорода, однако эти уравнения, как
показано в последующих главах, справедливы лишь в ограниченной области
параметров.
М. П. Вукалович, В. Н. Зубарев, Ю. А. Калинин и А. А.
Александров [44] составили для воды по надежным опытным данным [45]
уравнение состояния, справедливое в интервале температур 50—250° С
при давлениях до 1250 кГ/см2
v = Д0 @ + Вх (t) р + В2 (/) р2 4- В3 (/) р\ C2)
Это уравнение содержит 26 постоянных и описывает с высокой точностью
данные [45] в указанном интервале параметров. При более высоких
температурах отклонения расчетных значений от опытных возрастают, и
для описания изотерм 290 и 300° С, которые еще далеки от критической
температуры, потребовалось ввести в уравнение корректирующую
функцию Av, зависящую от температуры и давления. Однако и после этого
остается довольно обширная область параметров, которую не удается
описать уравнением в форме C2). Указанное обстоятельство, наряду
со сложностью структуры температурных и корректирующей функций,
ставит под сомнение целесообразность использования такого уравнения
для описания термодинамических свойств других жидкостей.
Позднее Ван-Иттербик, Вербек и Стаес [46] на основании
полученных ими экспериментальных данных о сжимаемости жидких аргона и
метана в интервалах температур 90—148° К и 115—173° К при давлениях
до 300 кГ/см2 составили уравнение состояния аналогичного вида
v = А0(Т)+ Ах(Т)р : А2(Т)р2 + А3(Т)р* 4 А,(Т)р* + Аь(Т)р\ C3)
где функции А{ (Т) представлены полиномами от температуры,
содержащими степени от нулевой по пятую включительно. Таким образом,
уравнение C3) содержит 36 постоянных, но, несмотря на это, не описывает
исходных опытных значений с точностью эксперимента. В главе IV будет
показано, что термические свойства жидкого аргона надежно описываются
в более широкой области параметров уравнением состояния сравнительно
простого вида, содержащим гораздо меньшее число постоянных.
Уравнения, отнесенные нами ко второй группе, в которых давление
представлено с помощью независимых переменных v и Т, как правило,.
18
имеют более простой вид и содержат меньшее число постоянных.
Некоторые сведения о структуре уравнения р = F (v, T) можно получить,
используя известное термодинамическое соотношение
(-tW(-34.- <34>
Дважды проинтегрировав по температуре соотношение C4) и учитывая,
что в общем случае избыточная изохорная теплоемкость Acv = ер (v, Г),
получим [47]
р = A (v) -}- B(v)T + G)(v, T). C5)
В этом выражении A (v) и В (v) — функции удельного объема,
появившиеся в результате двукратного интегрирования, а через Ф (v, T)
обозначен интеграл [J (-g^-j --f--dT, введение которого связано с
кривизной изохор реального газа.
Аналитические выражения для функций, входящих в уравнение
состояния C5), можно определить с помощью экспериментальных
термических данных. Ниже рассматриваются некоторые работы, в которых
раскрывается структура объемных и температурных функций уравнения C5).
Эйкен [48, 49] для описания термодинамических свойств твердого
тела и жидкости предложил уравнение состояния в форме
Р = Р,-$г + -?г> C6)
где рт = т(-~г) — термическое давление;
аъ а2у п и m — константы.
h
Для термического давления Эйкен предложил выражение рт = —^ Т
(здесь b — постоянная). Оно получено путем обработки опытных
данных Бриджмена о значениях \-Jf-) неполярных и слабополярных
жидкостей в широком интервале температур и давлений. Вторым членом
уравнения учитывается внутреннее давление жидкости, обусловленное
взаимодействием между молекулами; показатель степени п принят
автором равным 3. В последнем члене, которым учитываются силы
отталкивания, показатель степени m для многих жидкостей можно принять равным 6.
Таким образом, уравнение Эйкена может быть окончательно записано
в виде
р = -?-г—Э-+-3-- C7)
Это уравнение, квадратное относительно 1/и3, может быть легко
преобразовано в форму v = f (p, T), что является его достоинством.
Сопоставляя уравнения C5) и C7), легко заметить, что в последнем
функция Ф (v, T) = 0, а объемные функции соответственно равны А =
= —ajv3 + a2/v6 и В — b/v3. Следовательно, согласно уравнению C7),
изохоры должны представлять собой прямые линии, а это означает
отсутствие зависимости теплоемкости cv от удельного объема, что не
соответствует действительности. Тем не менее в некоторых случаях можно
пренебречь кривизной изохор в координатах р, Т. В частности, у жидкости
в области высоких плотностей (от двух до трех критических) зависимость
cv от удельного объема незначительна, и кривизну изохор можно выявить
только по точным экспериментальным данным.
В работе [50] на основании анализа опытных данных Кейса [51] в
координатах р, Т показано, что для определенной области параметров
уравнение состояния жидкого аммиака может быть представлено в виде
p = A(v) + B(v)T. C8)
2*
19
Объемные функции уравнения C8) записываются следующим образом:
А = а0 — ^гг-1'682; В - 60 + М'706 -f ДБ (v).
Функция ДВ (о) введена с целью обеспечения простоты аналитических
выражений для объемных функций и более точного описания данных
на кривой насыщения; ДВ (v) определяется с помощью графика,
помещенного в работе [50]. Заметим, что Р. Планк [52], анализируя те же р,
v, Т-данные для жидкого аммиака [51], пришел к выводу о возможности их
описания уравнением состояния в виде C7). Однако составленное
уравнение оказалось справедливым в значительно меньшей области температур
и давлений, чем уравнение C8).
Джонстон, Келлер и Фридман [53] исследовали сжимаемость
жидкого водорода в интервале температур 20—33° К при давлениях до 110 атм
и показали, что по результатам их измерений могут быть проведены в
координатах р, Т прямые линии в пределах точности эксперимента.
Последнее было использовано в работе [54] при получении уравнения состояния
для жидкого водорода в форме C8). Аналитические выражения для
объемных функций этого уравнения:
А = а0 + а^'1 + a2v~2 + a3v~3, В = b0 + b±v~l.
Рассматривая более точные р, и, Т-данные для воды [45], Р. Планк
[55] пришел к выводу, что термическое давление является квадратной
функцией температуры. Поэтому для описания опытных данных [45]
в интервале температур 50—250° С Р. Планк использовал уравнение
Эйкена в несколько модифицированном виде:
р = .?.7"—? + -?. C9)
Оно обеспечивает удовлетворительное согласование с опытными данными
[45] в указанном интервале температур, однако уступает по точности
уравнению C2), содержащему большее число постоянных.
Позднее А. М. Мамедов [56], построив по данным [45] изотермы
в координатах pv3, 1/у3, установил, что, хотя эти изотермы и являются
прямыми линиями,, угловые коэффициенты а2 не остаются постоянными,
а зависят от температуры. К тому же отрезки г/0, отсекаемые изотермами
на оси ординат, не равны ЬТ2 — ах и являются более сложной функцией
температуры. Определив на изотермах величины а2 и отношения у01а2,
А. М. Мамедов предложил для них следующие зависимости
сгТ — с2Т2; — -^- = d0 + d{T 4- d2T2.
Такое усложнение уравнения C9) позволило несколько улучшить
согласование расчетных и опытных значений.
Н. П. Суворов [57, 58] применительно к экспериментальным
данным о свойствах обычной и тяжелой воды использовал уравнение
состояния для жидкости, предложенное К. А. Путиловым
В этом уравнении вторым и третьим членами учитываются соответственно
притяжение и отталкивание частиц жидкости. А и В — функции
температуры — для простых неассоциированных жидкостей имеют вид
А=--а0 + а1\пТ-а2Т\
В =&0 + 61lnT — Ь2Т J' ( '
Показатель степени m принимается равным 4, а п связан с критическим
числом k = RTKp/pKpvKp зависимостью п = 3/г/C& — 4).
20
На основании критических параметров воды и данных о ее удельном
объеме в интервале температур 0—370° С и давлений 1—300 кГ/см2,
Н. П. Суворов определил значения А и В на ряде изотерм, однако ему
не удалось описать эти значения с помощью выражений D1). Поэтому
в указанные выражения были включены дополнительные члены (—а3Т~5
и —Ь3Т~5 соответственно) для учета поправки на ассоциацию молекул
воды, после чего погрешность аппроксимации функций А и В в основном
не превышала 3%.
woo
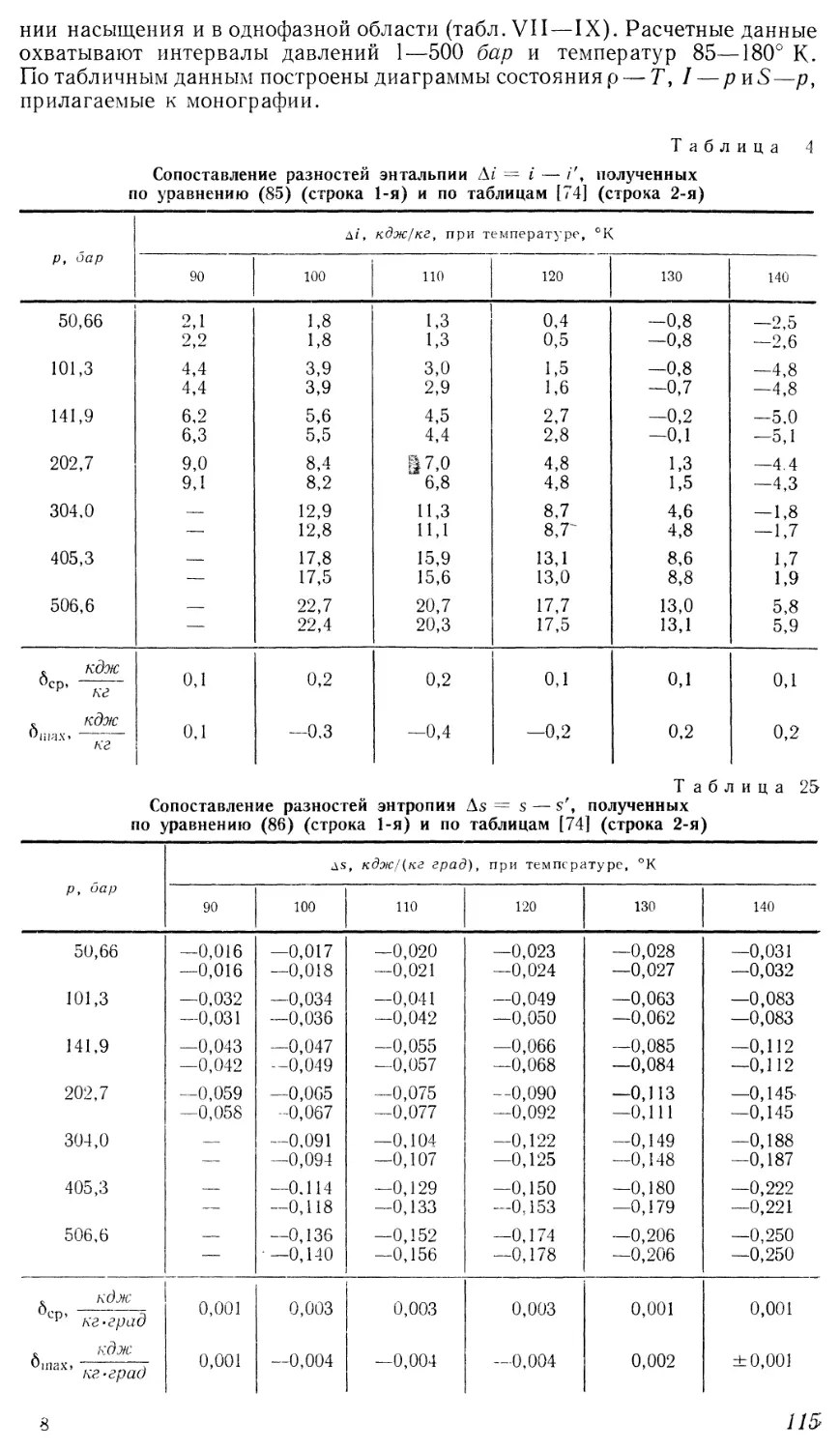
,2,307
для
Рис. 3. Зависимость комплексов ри4 — RTi? от v'
жидкого азота на изотермах по экспериментальным данным
И. Ф. Голубева и О. А. Добровольского [41 ] при 7\ °К:
1 — 83,15; 2 — 93,15; «3 — 103,15; 4 — 113,15; 5 — 123,15.
Предпринятая в работе [57] попытка расширить область, в которой
справедливо уравнение D0), до давления 12 000 кГ/см2 заставила автора
ввести в выражения D1) корректирующие функции давления (помимо
включенных ранее дополнительных членов). Вследствие этого Л и В
потеряли первоначальный смысл температурных функций. По всей
вероятности, последнее объясняется не столько зависимостью функций А и В
от давления, сколько произвольным выбором как формы аналитических
выражений для них, так и показателей степени m и п. И все же уравнение
D0) выгодно отличается от предшествующих, поскольку по форме оно
аналогично теоретически обоснованному уравнению A7) и подобно ему
предполагает зависимость коэффициентов А и В от температуры.
Отсутствие в работах [57, 58] сопоставления расчетных данных
с опытными не позволяет, к сожалению, оценить надежность уравнений
состояния, полученных Н. П. Суворовым. Поэтому нами была прове-
21
рена возможность точного описания р, v, Г-данных для жидкости с помощью
уравнения D0) на примере жидкого азота. По сглаженным
экспериментальным данным, представленным в главе II, были рассчитаны комплексы
у = pv4 — RTv3 на пяти изотермах (83,15-^123,15° К) в интервале
давлений от кривой насыщения до 490 бар и построены в зависимости от и4~я =
-_ уа,зо7# в случае справедливости уравнения D0) изотермы в указанных
координатах должны представлять собой прямые линии. Однако из рис. 3
видно, что изотермы жидкого азота не подчиняются прямолинейной
зависимости, причем их кривизна увеличивается по мере роста температуры
и понижения давления. Это свидетельствует о непригодности
рассматриваемого уравнения, в котором введены ограничения относительно первого
коэффициента и показателей степени п и т, для описания термических
свойств жидкости в широком диапазоне параметров с точностью
эксперимента.
В результате выполненного анализа можно заключить, что уравнения
состояния, относящиеся ко второй группе, обладают преимуществом перед
уравнениями первой группы, так как позволяют описать
экспериментальные данные в более широком интервале температур и давлений с помощью
сравнительно простых по форме уравнений. Причина, по-видимому,
заключается в том, что форма уравнений второй группы в той или иной мере
подобна теоретически обоснованной форме A7). Однако имеющиеся
уравнения состояния для жидкости все же не обеспечивают необходимой
точности в широкой области параметров, и поэтому требуется более детально
рассмотреть вопрос о выборе формы уравнения состояния.
I. 3. Выбор формы уравнения состояния
и методика его составления
Термическое уравнение состояния описывает геометрическую
поверхность весьма сложной конфигурации. Поэтому в термодинамике
широко распространен метод анализа не самой поверхности состояния,
а ее сечений. Это дает возможность не только исследовать особенности
конфигурации отдельных кривых или всего семейства, но и найти для них
наиболее рациональные формы аналитических выражений.
На рис. 4 показаны изотермы азота в координатах -Ш?,.Р и нанесены
кривые сосуществования жидкости и газа (кривая /) и жидкости и твердого
тела (//). Как видно из рис. 4, с понижением температуры интервал
плотностей, в котором находятся изотермы, уменьшается незначительно,
однако при температурах ниже критической реальные участки
существования гомогенной системы резко уменьшаются. При низких температурах
участкам изотерм, отражающим газовую фазу, соответствуют весьма малые
значения плотности, при которых справедливы закономерности,
характерные для разреженных газов, в то время как изотермы жидкости
заключены в интервалах плотностей, близких к плотности твердого тела.
Поскольку закритические изохоры непрерывно переходят из области
газа в область жидкости, представляется весьма заманчивым получить
единое уравнение состояния, описывающее все опытные данные с
точностью эксперимента. Использование такого уравнения для расчета
табличных значений термодинамических свойств вещества во всей однофазной
области позволило бы избежать процесса согласования данных о газе
и жидкости, рассчитанных по различным уравнениям состояния. Для
газа достаточно надежные уравнения состояния уже предложены, поэтому
целесообразно рассмотреть вопрос об описании с помощью этих
уравнений термодинамических свойств жидкости.
22
Известно, что опытные данные о термических свойствах газа могут
быть отображены с помощью вириального уравнения состояния:
Z = -g- =- 1 + В(Т)р + С(Г)р2 + 0(Г)р3 г • • • D2)
Как отмечалось выше, теоретические предпосылки вывода уравнения D2)
таковы, что оно может быть применено к газам малой и умеренной
плотности. Однако на практике полиномы от плотности успешно используются
для описания опытных изотерм в диапазоне плотностей до трех
критических. В уравнениях изотерм число членов зависит от интервала плотно-
0,2 0/4 0,6 0,8 ^ кг/дм3
Рис. 4. Изотермические сечения поверхности состояния азота в координатах -jp=r, р при т:
1 — 5,3319; 2 — 2,9556; 3 — 2,1636; 4 — 1,7675; 5 — 1,3715; 6 — 1,1735; 7 — 1,0000; 8 — 0,8962;
9 — 0,8170; 10 — 0,7378; // — 0,6586; 12 — 0,6127; / — кривая насыщения, // — кривая
затвердевания.
стей и требуемой точности, а значения коэффициентов — как от их
количества (что убедительно показано в работе [59]), так и от методов
определения. Влияние каждого из этих факторов столь существенно, что часто
одни и те же коэффициенты, особенно при высоких степенях плотности,
отличаются не только по величине, но и по знаку. При составлении
уравнений, описывающих ряд изотерм, не удается получить для всех
коэффициентов плавные кривые, которые можно описать функциями
температуры с требуемой точностью; это подтверждают уравнения, отображающие
изотермы большого числа веществ, составленные в известных работах
Михельса и соавторов. Указанное обстоятельство усложняет задачу
составления уравнения состояния, справедливого в широкой области
параметров.
На основании тщательного анализа конфигурации
термодинамической поверхности Я. 3. Казавчинский [47, 60, 61] установил, что
уравнение состояния реального газа может быть представлено в виде
Z = а0 + ^ + ро|> + ТФ + • • •, D3)
2-3
где гр, ф, ... — функции т = Т/Ткр, а а0, al9 P, у, ... — функции
приведенной плотности со = р/рКр, записываемые в виде полиномов.
Особенность уравнения заключается в том, что даже для весьма
обширной области температур и плотностей можно ограничиться
сравнительно небольшим числом элементарных функций (четырьмя объемными
и двумя температурными). Это позволило разработать методику их
определения и в дальнейшем непрерывно совершенствовать ее.
Температурные функции длительное время находили подбором
степенных \/тп или показательных е~-аХ выражений по опытным данным на
изохорах. Пытались также определить первую температурную функцию я|?
с помощью данных о втором вириальном коэффициенте [62] или о
теплоемкости cv [63]; при этом учитывали, что остальные температурные
функции могут быть представлены в виде степеней первой [62].
Объемные функции (при известных температурных) первоначально
определялись в табличном виде на изохорах, однако при высоких
плотностях, соответствующих плотностям жидкости, оказывалось крайне
затруднительным получить для объемных функций плавные кривые и
отобразить их аналитически. Метод определения объемных функций
с помощью уравнений, описывающих базисные изотермы [47], позволил
преодолеть затруднение. Поскольку этот метод не утратил своего значения
до настоящего времени, целесообразно вкратце осветить его.
Сущность метода заключается в том, что выбирают по числу объемных
функций изотермы в наиболее широком интервале плотностей и описывают
полиномами от плотности. Затем составляют систему линейных уравнений,
в левой части которой записаны значения Z, представленные с помощью
элементарных функций, а в правой — аналитические выражения для
соответствующих изотерм:
<*о + 1Г + И\ + Ш - 1 + fiiP + Ctp2 + • • • + Кгр* }
li
«о + т" + рЧ2 + W-2 = 1 + В2р + С2р2 -\ + /С2р*
| D4)
«о + Т- + Р*з + ТФз = 1 + ?зР Ч С3р2 + - • • + K3pk I
«о + т- + № + 7Ф4 = 1 + В,р + С4р2 Н + KiP*
[4 • I
Решая систему D4) при известных температурных функциях относительно
четырех объемных функций, находят для последних аналитические
выражения в виде полиномов от плотности.
По методу базисных изотерм были составлены для ряда веществ
уравнения состояния, удовлетворяющие экспериментальным р, и, Г-данным
в однофазной области и на кривой насыщения до значений плотности,
равных примерно двум критическим [64—66]. Однако такие уравнения не
могут рассматриваться как единые, поскольку они описывают лишь
небольшую часть опытных данных о жидкости. Последнее замечание
относится и к уравнению состояния для двуокиси углерода [67],
составленному недавно по этой методике с использованием шести базисных изотерм,
так как оно справедливо в области жидкости до приведенной
температуры т ^ 0,9.
Метод представления уравнения D3) через так называемые условные
элементарные функции, предложенный Я. 3. Казавчинским [68],
позволил достигнуть определенных успехов в решении проблемы составления
единого уравнения состояния. В отличие от предшествующих, новый метод
основан на предварительном определении объемных функций, с помощью
которых рассчитывают комплексы
¦f-=B-«.-^)-jr = * + Tf • D5)
24
Построив величины AZ/p в зависимости от y/j3, определяют значения
температурных функций, которые затем отображают аналитически.
По методике [68] было получено уравнение состояния для азота [69],.
которое отображает данные на кривой насыщения до со = 2,6 (т =
= 0,68). Значения плотности жидкого азота, рассчитанные по
уравнению [69], при со <2,6 согласуются с большинством экспериментальных
данных [41], опубликованных после составления уравнения, с
отклонением 0,1—0,3% [70], однако при более высоких плотностях расхождения
возрастают. При попытке повторить трудоемкий процесс определения
элементарных функций уравнения состояния и описать с точностью
эксперимента все опытные данные о термических свойствах газообразного и
жидкого азота, включая данные [2, 71] для кривой затвердевания,
оказалось, что в координатах AZ/C, у/$ докритические изотермы не являются
прямыми, и по мере понижения температуры кривизна становится все
более заметной. В связи с этим необходимо ввести дополнительные объемные
и температурные функции в уравнение состояния.
Отметим, что уравнение D3) может быть получено из теоретически
обоснованного вириального уравнения состояния только при
определенных допущениях о форме вириальных коэффициентов [70 ]. В этом нетрудно
убедиться, если в уравнении D3) сгруппировать коэффициенты при
одинаковых степенях плотности, в результате чего оно приобретает вид
Z - 1 + (аг + -^- + erf + djcp H ) р +
+ (fla + ~ + С^ + ^-Ф + ' * ' ) Р2 + ' ' ' +
+ [ак + Ц- + с$ + dk<p + • • • ) р*. D6)
Сопоставляя уравнения D6) и D2), можно заметить, что переход от одного-
к другому возможен при условии, если все вириальные коэффициенты^
представляют собой линейную комбинацию 1/т и одинаковых
температурных функций г|), ф, ... Допущение о взаимосвязи вириальных
коэффициентов упрощает методику определения элементарных функций
уравнения D3), но несколько ограничивает возможности описания им
экспериментальных данных по сравнению с уравнением D2). Если в
уравнение состояния D3) включить с целью расширения области его
применимости большее число объемных и температурных функций, то усложняется
методика их определения, что по существу лишает уравнение D3) каких-
либо преимуществ перед D2).
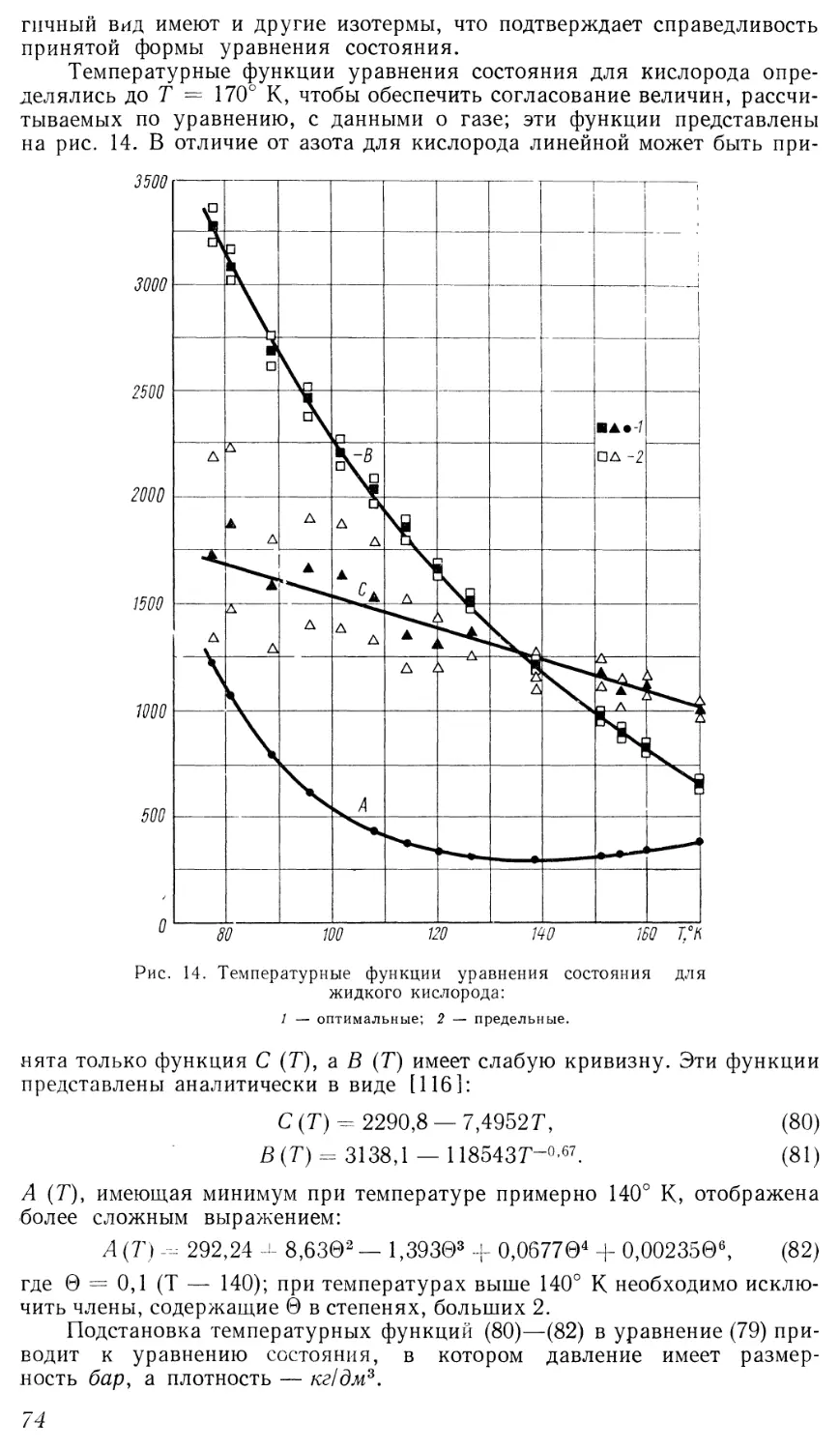
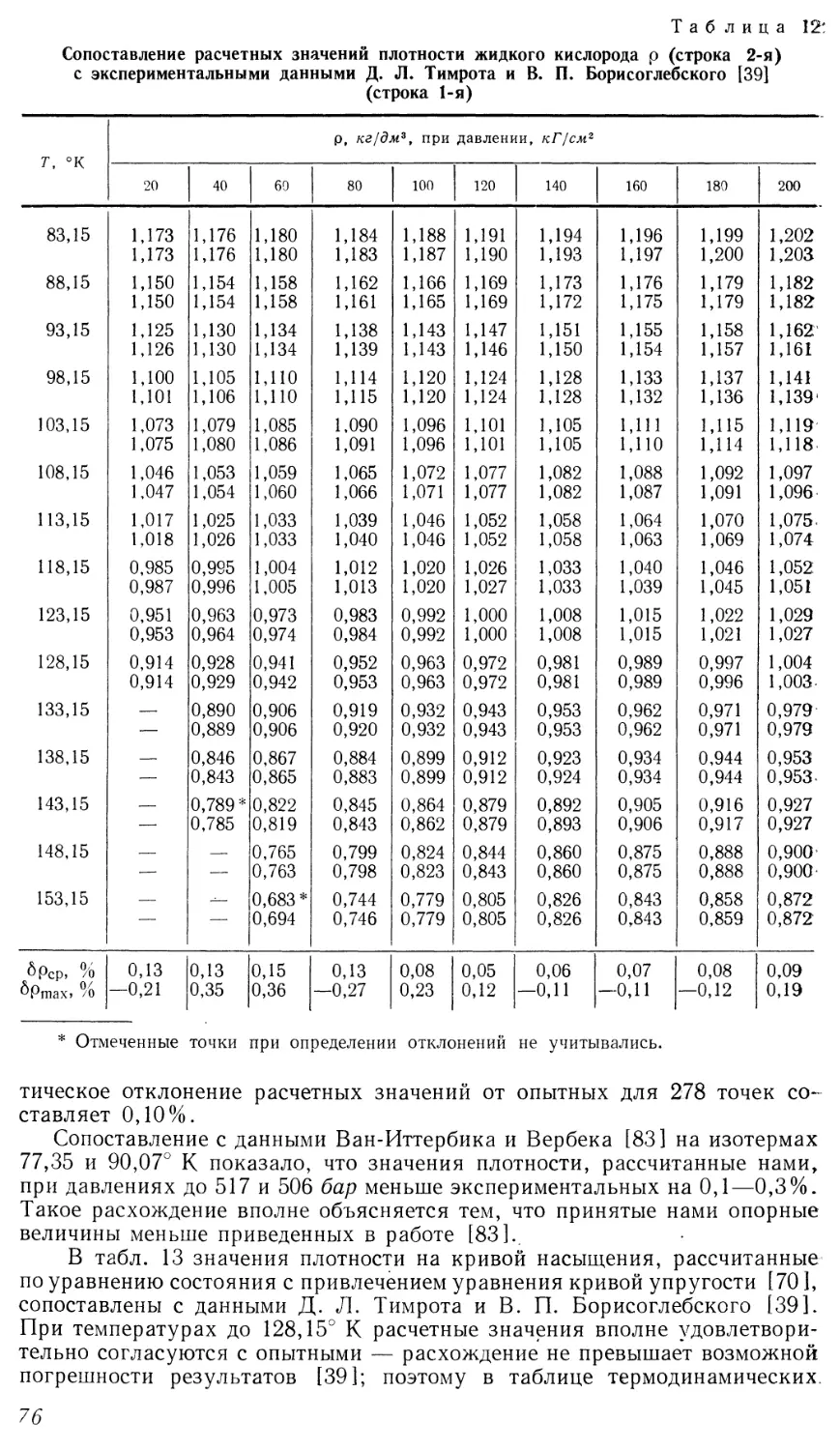
Помимо работ Я. 3. Казавчинского и его сотрудников, известны лишь
немногочисленные исследования, посвященные составлению единого
уравнения состояния. Наиболее успешные из них выполнены в криогенной
лаборатории Национального бюро эталонов (НБС) США, где получены
уравнения состояния для азота [72], кислорода [73] и аргона [74] (две
последние работы поступили в СССР лишь в конце 1966 г.). Эти уравнения
анализируются в соответствующих главах, здесь же отметим их общие
особенности.
Полученные в НБС уравнения имеют одинаковую форму,
предложенную впервые Стобриджем [72] для азота, и содержат 16 постоянных.
Уравнения состояния для азота и кислорода описывают опытные данные
до давлений 300 и 200 атм соответственно, и только уравнение для аргона
справедливо до больших давлений. Верхний предел температуры, до
которого составлялись уравнения, равен 25 — 100° С. Таким образом,
использование этих уравнений для расчета табличных значений
термодинамических свойств не исключает необходимости согласования расчетных
величин с данными для области более высоких температур и давлений.
25
По-видимому, в случае расширения интервала параметров, в котором
были бы справедливы уравнения [72—74], их форму следует существенно
усложнить, и соответственно усложнится методика составления
уравнений.
При наличии надежных уравнений состояния для газа попытки их
усложнения с целью описать свойства жидкости представляются
нецелесообразными. Достаточно составить для жидкости отдельное уравнение
состояния, которое должно описывать опытные данные вплоть до
естественных границ области существования жидкости — кривых насыщения
и затвердевания. Условной границей между газом и жидкостью с точки
зрения аналитического описания свойств целесообразно считать
критическую изотерму. При решении поставленной задачи желательно
использовать опыт, накопленный в процессе составления уравнений состояния
для реального газа.
Составление отдельного уравнения состояния для жидкости
существенно упрощает задачу отображения ее термодинамических свойств,
хотя и влечет за собой дополнительную работу по согласованию
расчетных данных о жидкости и газе на околокритических изотермах.
Учитывая, что для воздуха и его компонентов имеются надежные уравнения
состояния, описывающие свойства газа в широком диапазоне параметров,
и рассчитанные по этим уравнениям таблицы термодинамических свойств
до 1300° К и 1000 бар [70], мы сочли целесообразным ограничиться
в рамках настоящей работы составлением уравнений состояния для
жидкой фазы.
Уравнение состояния для жидкости в форме A7), полученное на основе
теоретических соображений (см. 1.1), несправедливо при сравнительно
больших удельных объемах, близких к критическому, когда неприменимы
положения теории самосогласованного поля. Поэтому нами были
предприняты поиски иных форм уравнения состояния с целью описания свойств
жидкости во всей области ее существования.
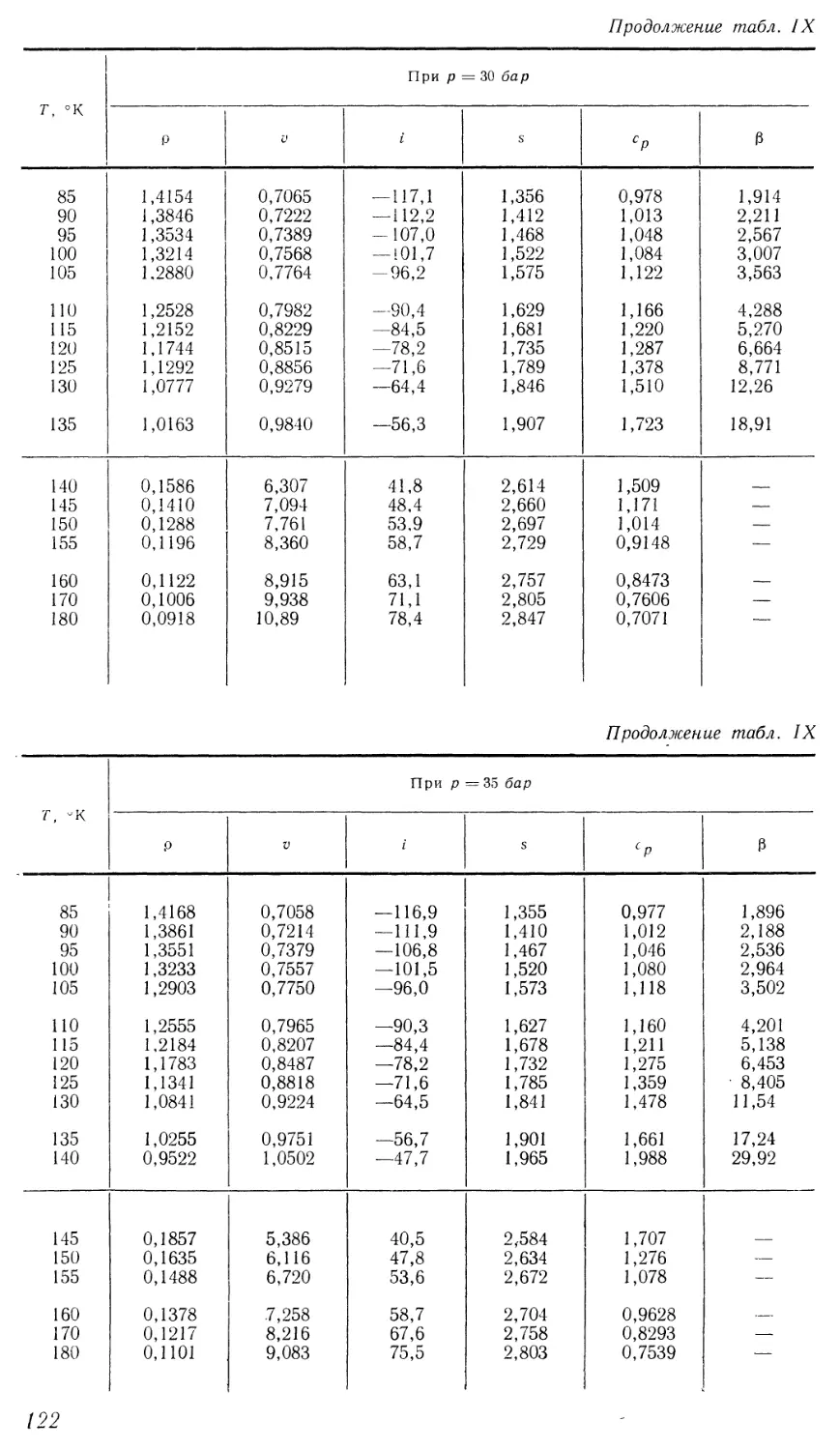
Первоначально для удобства анализа поверхности состояния
жидкости и введения условий, аналогичных предельным для газа,
рассматривались изотермы жидкости в координатах р = р — ps, р = р — ps
(индексом s обозначены свойства в состоянии насыщения). На рис. 5
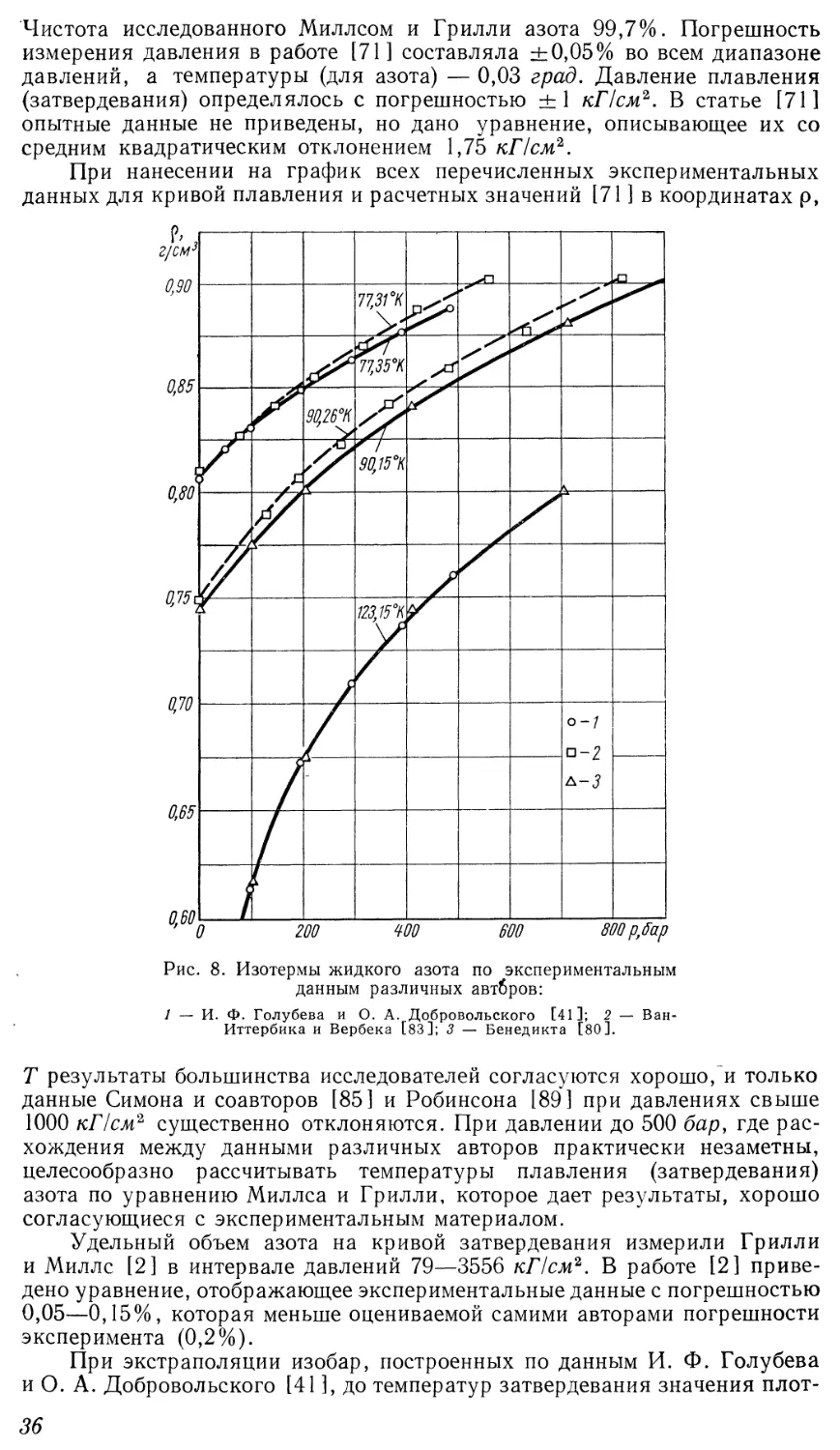
представлены в этих координатах изотермы жидкого азота по
экспериментальным данным [41 ]. Все изотермы исходят из начала координат, причем
самой низкой температуре соответствует наибольший угол наклона
(др1др)т при р ~> 0, и по мере увеличения температуры он уменьшается,
стремясь к нулю при Т -> Ткр. Простая конфигурация изотерм позволяет
предположить, что их можно описать полиномом от р. Действительно,
при температурах ниже 0,95Гкр и давлениях до 490 бар изотермы
отображаются с точностью эксперимента выражением
р = ар + Ьр2 + ср3. D7)
Как видно из рис. 5, интервал изменения р на изотермах при одина-
ковом максимальном давлении расширяется при росте температуры-
При Т <С0,95Гкр этот интервал изменяется незначительно, однако на
околокритических изотермах резко возрастает, в связи с чем указанные
изотермы трудно описать уравнением D7). В критической точке первая и
вторая производные от давления по объему обращаются в нуль, что в
нашем случае приводит к равенствам (др/др)т = 0 и (д2р/др2)т г = 0 при
р = 0. Поэтому уравнение для критической изотермы не может содержать р
в степенях ниже третьей. Если же исходить из «принципа суперпозиции»
потенциалов средних сил, то критическая точка является сингулярной
точкой изотермы [75], в которой производные всех порядков от давления
по объему равны нулю, и тогда для отображения данных на критической
26
изотерме следует искать функцию более сложного вида. Необходимость
использовать уравнения изотерм разного вида при различных приведенных
температурах усложняет форму уравнения состояния в координатах р, р
и затрудняет аналитическое представление зависимости его
коэффициентов от температуры.
В связи с изложенным возможен один из способов описания
термодинамической поверхности вещества. Уравнение состояния для газа D3),
представленное с помощью элементарных функций, отображает также
часть данных о жидкости в области приведенных температур т >> 0,9,
включая данные на линии насыщения; при этом удовлетворяются крити-
Рис. 5. Изотермы жидкого азота по экспериментальным данным
И. Ф. Голубева и О. А. Добровольского [41 ] в координатах
р = р — ps; 9 = р — ps при 7\ °К:
/ — 83,15; 2 — 93,15; 3 — 103,15; 4 — 113,15; 5 — 123,15.
ческие условия. В области температур ниже 0,95Гкр свойства жидкости
описываются уравнением состояния в форме
р = Л(Г)р + В(Г)р2 + С(Г)р3+ ... D8)
Температурные функции уравнения D8) могут быть выделены на
изотермах и затем отображены аналитически.
При расчете термодинамических свойств жидкости по уравнению
состояния D8) необходимо знать зависимости ps (T) и ps (T). Для кривой
упругости предложены разнообразные формы уравнения, подробный
анализ которых выполнен в монографии М. X. Карапетьянца [76]. Известны
также некоторые аналитические зависимости, связывающие плотность
жидкости в состоянии насыщения с температурой. Выполненные нами
расчеты показали, что наиболее удачным уравнением для ps, которое не
только описывает опытные данные с высокой точностью, но и соответствует
критической точке и производной в ней, является
Ps = Ркр + а*я + № + с®2 + dd3 + е№, D9)
где Ф = Гкр — Т\ а, 6, с, d, e — коэффициенты, определяемые на основе
опытных данных; п принимает значения от 0,25 до 0,50 в зависимости от
свойств вещества.
27
Достоинство координат р — ps, р — ps с точки зрения описания:?
кривой насыщения отмечено в монографии М. П. Вукаловича и В. В. Ал~
тунина [77]. Авторы [77] намеревались составить уравнение состояния
для жидкой двуокиси углерода в координатах v — vs, p — /?s, но
ограниченность экспериментальных данных не позволила им завершить
определение температурных функций.
Как показала проверка по опытным р, v, Г-данным жидких азота [411
и аргона [46] в области давлений до 490 и 293 бар соответственно, при*
составлении уравнения состояния в виде D8) не возникает
принципиальных затруднений, и для рассматриваемого случая в уравнении можно*
'60 70 80 90 100 110 120 130 Т,°К
Рис. 6. Изобары жидкого азота по экспериментальным данным [41 ] при
р, бар:
1 — 50,1; 2 — 99,1; 3 — 197,2; 4 — 295,3; 5 — 393,1; 6 — 491,4; /— кривая
насыщения [70], // —кривая затвердевания [2].
ограничиться первыми тремя членами. Вместе с тем, такой форме уран-
нения состояния присущи некоторые недостатки:
1) наряду с независимой переменной р используется функция
температуры ps (Г), что усложняет расчет калорических величин, особенно
теплоемкости;
2) выбор переменных ограничивает область применимости уравнения
докритическими температурами, а это затрудняет согласование расчетных
данных о жидкости и газе.
Отмеченные недостатки ставят под сомнение целесообразность
использования уравнения D8) для описания термодинамических свойств
жидкости.
Как отмечено в 1.2, в уравнения состояния для жидкости,
предложенные многими авторами, входили независимые переменные р и Т. Хотя
уравнения такого вида сложны или действуют в ограниченной области-
параметров, мы все же попытались подойти к составлению уравнения/
состояния в форме р = / (р, Т) с несколько иных позиций.
Наиболее сложную конфигурацию изобары жидкости в
координатах р, Т имеют в критической области (рис. 6). Если исключить эту
область из рассмотрения, то благодаря малой кривизне изобар окажется
возможным применить рассуждения, приведшие Я. 3. Казавчинскога>
28
ж рациональной форме уравнения для описания изохор. Расчленив
термодинамическую поверхность жидкости в координатах ру р, Т на линейную
да криволинейную части, можно предположить, что изобары описываются
уравнением состояния, представленным с помощью элементарных функций
m виде
р = Л0 + АХТ + Вг|), E0)
тде Л0, Ах и В — функции давления;
г|; — функция температуры.
В отличие от уравнения состояния D3) здесь функция т|) —
возрастающая, поскольку с повышением температуры кривизна изобар
увеличивается. Функцию г|) можно найти подбором Тп по данным для изобар
наибольшей кривизны. Затем могут быть определены функции давления:
-либо нахождением их значений на изобарах и последующим
аналитическим отображением, либо рассмотренным выше методом базисных изотерм.
Проверка по экспериментальным данным о плотности жидких азота
и аргона [41, 46 ] показала, что уравнение E0) описывает эти данные с
меньшей точностью, чем уравнение D8). Правда, по сравнению с ранее
рассмотренными работами [38, 40] нам удалось улучшить согласование
расчетных и опытных величин. По-видимому, большие расхождения в
упомянутых работах объясняются не только ограниченными возможностями
уравнения состояния E0), но и не вполне удачным выбором авторами функций
температуры и давления.
В целом можно заключить, что переход от уравнения D8) к
уравнению E0) снижает точность отображения опытных данных, хотя и
упрощает расчет термодинамических свойств. Кроме того, использование в
уравнениях состояния независимых переменных р и Т менее обосновано, чем
переменных р и Т. Это связано с тем, что в состоянии насыщения давление
зависит от температуры, и именно температура и плотность естественным
•образом входят в описание свойств фаз при использовании метода Гиббса
или метода коррелятивных функций.
Анализ результатов, полученных с помощью обеих рассмотренных
выше форм уравнения состояния, показывает, что целесообразно
рассмотреть возможность описания свойств жидкости с помощью уравнения
¦с независимыми переменными р и Т, форма которого аналогична вириаль-
t-ной. Естественно, что мы попытались использовать теоретически
обоснованную форму уравнения состояния для жидкости и сжатого газа A7),
уделив основное внимание определению зависимости коэффициентов
уравнения от температуры, а также анализу влияния свойств вещества на
значения показателей степеней удельного объема. Для такого
исследования были привлечены экспериментальные данные о термических свойствах
многих жидкостей.
Первоначально определялся вид уравнения для изотерм жидкости,
«справедливого в достаточном для практических целей интервале давлений.
В связи с отмеченными ранее особенностями термодинамического поведения
жидкости при различных приведенных температурах нами
рассматривались изотермы околокритические и близкие к тройной точке. Проверка
по опытным данным о воде, азоте, кислороде, аргоне и некоторых
углеводородных жидкостях показала, что изотермы этих веществ в широком
.диапазоне температур и в интервале приведенных плотностей со = 1,8—
3,3 (при давлениях до 500—1000 агам) описываются с точностью
эксперимента уравнением
р --= арп + Ьрп+2 + срп±\ E1)
где оптимальное значение п в зависимости от индивидуальных свойств
.жидкости оказывается равным 1; 1,5 и 2. Заметим, что показатели степени 3
и 5 во втором и третьем членах уравнения A7) получены в результате
выбора для жидкости потенциальной функции взаимодействия Леннарда-
29
Джонса F—12), а в случае справедливости других функций эти
показатели могут принимать и другие значения. Следовательно, уравнение
состояния для жидкости и сжатого газа при со > 1,8 может быть представлено
в форме [78]:
р = А (Т) р" -f В (Т) р*+2 -[- С(Т) р"+Н E2)
Располагая сеткой опорных р, v, Г-данных, выбирают я, при котором
достигается наилучшее согласование со значениями на изотермах, а затем
можно методом наименьших квадратов определить оптимальные значения
температурных функций. Однако, если учесть, что зависимость функций
от температуры должна быть плавной, то этот метод оказывается
недостаточно эффективным, поскольку на каждой изотерме получают
фиксированные значения функций. В то же время у жидкости в большей части области
ее существования малым изменениям плотности в пределах погрешности
эксперимента соответствуют значительные изменения давления, и поэтому
на ряде изотерм допустимы отклонения значений температурных функций
от оптимальных. Последнее обстоятельство позволяет получить для
температурных функций плавные кривые, которые описываются
аналитически без особых затруднений.
Учитывая, что в уравнении состояния E2) при достаточно широком
интервале давлений можно ограничиться тремя первыми членами,
целесообразно определять температурные функции методом спрямления
изотерм. Для этого по опорным данным рассчитывают комплексы
-^ = А + Яр2 + С9\ E3)
От значений р/рп на изотерме вычитают значение (р/рпH в точке на
кривой насыщения или на изобаре, хорошо исследованной экспериментально.
Затем образуется функция
При построении Ух в зависимости от р2 + р2 опорные точки группируются
вокруг прямой с разбросом, определяемым в основном погрешностью
эксперимента; это позволяет установить взаимно согласованные значения
функций В (Т) и С (Г). На рис. 7 показано такое построение для жидкого
кислорода при температуре 126,45° К; стрелками отмечены допуски для
Yl9 рассчитанные с учетом погрешности (равной ±0,1%) опытных
значений плотности. В пределах допуска проведены две пунктирные прямые,
которым соответствуют минимальное и максимальное значения С.
Сплошной прямой обозначен оптимальный вариант выбора С, при котором
достигается наилучшее соответствие опорным данным. Предельные и
оптимальные величины С определяют на всех изотермах, затем значения
функции С (Т) сглаживают и описывают аналитически.
Для определения В (Т) с помощью расчетных значений С образуют
новую функцию:
У2 = Р~У+4 = А + Яр2. E5)
Р
Построение У2 в зависимости от р2 позволяет определить Л и Я на
изотерме. При построении также учитывают допуски для Y.2; они меньше
допусков для функции Y1 (см. рис. 7), в связи с чем различие между
максимальными и минимальными значениями Я меньше, чем между
соответствующими значениями С. После сглаживания и аналитического описания
функции Я (Т) определяют А (Т) по всем опорным данным.
Последовательность нахождения температурных функций позволяет
в некоторой мере компенсировать погрешности аналитического отображе-
30
ния предыдущей функции. Наиболее сложной задачей при
последовательном определении является описание функции А (Г), для которой
допуски наименьшие; тем не менее решение и этой задачи не вызывает
особых затруднений.
С помощью уравнения E2) удалось описать с точностью
эксперимента р, vy Т-данные упомянутых выше жидкостей, включая данные
1200
1100
1000
1000
-1100
-1200 ¦
-1300
1Ш
1500
Рис. 7. Определение температурных функций уравнения состояния
E2) для жидкого кислорода на изотерме 126,45° К.
на кривых насыщения и затвердевания. По сравнению с уравнениями D8)
и E0) уравнение состояния E2) обладает преимуществами, главное из
которых — неограниченность температурного интервала.
Сверхкритические изотермы при со > 1,8 могут быть описаны уравнением E2) с высокой
точностью, что облегчает согласование расчетных данных о жидкости и газе.
Все это, а также теоретическая обоснованность и относительная простота
формы позволяют сделать вывод о перспективности уравнения состояния
E2) для описания термодинамических свойств жидкости.
I. 4. Выражения для расчета термодинамических
свойств по уравнению состояния
По отношению к давлению уравнение состояния для жидкости E2).,
как и наиболее рациональные уравнения состояния для газа D2) и D3) „
представляется в неявном виде. Поэтому при расчете табличных значений
31
термодинамических свойств некоторые затруднения вызывает
определение плотности при заданных круглых значениях давления. Задачу эту
легко решить с помощью электронных цифровых вычислительных машин,
для чего составлен алгоритм, сущность которого заключается в следующем.
На каждой изотерме рассчитываются температурные функции А (Г),
В (Г), С (Т) и затем рассматривается набор круглых значений давления р,
каждому из которых соответствует действительный корень р уравнения
состояния. Эти корни определяются методом итерации.
В качестве начального приближения корня р0 при расчете
термодинамических свойств воздуха и компонентов на докритических изотермах
принималась плотность кипящей жидкости, а для сверхкритических
температур — минимальное значение плотности, до которого справедливо
уравнение состояния. Затем корень рт+1 уточняли по методу Ньютона [79],
основанному на разложении функции / (р) = F (Г, р) — р = О при
заданных Т и р в ряд Тейлора в окрестностях точки рт по степеням поправки h.
В нашем случае достаточно было ограничиться тремя членами ряда и
определить рт+1 по формуле
Pm+1 = ?m + hm, E6)
где
и _ /(PmW(pm) /г7ч
1,11 ~~ 0,5/(pm).f (Pm)-[/'(Pm)]2 * ^П
Корень функции / (р) уточняют до тех пор, пока результаты двух
последовательных приближений рт и рт+1 не станут настолько близки, что будет
выполняться неравенство
Pm+i
<8,
где е — величина, зависящая от требуемой точности приближения;
принята нами равной 10~6.
Указанным методом на изотермах для заданных давлений
определялись значения плотности и по ним рассчитывались удельные объемы.
Для расчета изотермической сжимаемости по уравнению состояния в форме
E2) получено выражение
Р = ~~ "V \~др)т = р* [пА + (п + 2) ?р2 + (п + 4) Ср4] * E)
Калорические свойства рассчитывают с помощью уравнения состояния,
использовав основные термодинамические соотношения. Поскольку в
уравнение E2) входят независимые переменные Т и р, то для определения
энтальпии, энтропии и теплоемкостей cv и ср привлекаются следующие
^соотношения:
ds
ди
(?-),-т(#).- <6»
\ dv )т
При интегрировании первых трех уравнений следует иметь в виду,
что при Т < Ткр нижним пределом интегрирования является плотность
•32
кипящей жидкости ps, а при Т > Ткр — наименьшая плотность pmin,
при которой справедливо уравнение E2). Верхний предел является
переменным и соответствует заданным значениям давления, для которых
рассчитывают табличные значения термодинамических свойств. В качестве
постоянных интегрирования на докритических изотермах принимают
значения ^калорических свойств жидкости в состоянии насыщения, а на за-
критических — значения калорических свойств при выбранной pmln. Таким
образом, выражения для расчета энтальпии, энтропии и изобарной
теплоемкости могут быть представлены в виде
V i = i. + (пА - ТА') 1(Р) + [(га+^7ГВ'] (РП+Х ~ Р"+1) +
+ —+.4)+3~ГС,](р"+3-Р"+3)' , F3)
¦ s = Ss_A'/(p)-7rfT(p^-^+1)-^3(p''+3_ps"+3), F4)
P^U'+sV + c'p4J
с 4- Т
пА + (я + 2) ?р3 + (я + 4) Ср'
А
А"!(Р) —я^Т (Р"+1 - Р"+1) - Т^Тз- (Р"+3 - Р"+3>
F5)
/(Р)
В этих уравнениях / (р) — функция плотности, которая в
зависимости от показателя степени п имеет вид
lnp/ps при п = 1
-^.(р^-рГ1) при«^1
Расчет энтальпии и энтропии по уравнениям F3) и F4) не, вызывает
затруднений, так как величины is и ss для рассматриваемых веществ были
получены нами ранее [70]. Определение^ несколько осложняется
отсутствием значений cv , поэтому на основании уравнения F5) вычисляется
только избыточная теплоемкость Аср = ср —cVt Значения ср могут быть
сравнительно просто найдены с помощью данных об энтальпии на
основании известного соотношения ср = (dildT)p. При этом достаточно
определить указанную производную на одной изобаре во всем расчетном
интервале температур. Разнбсти между полученными таким образом
значениями ср и ранее вычисленными значениями избыточной теплоемкости
можно принять в качестве функции cv (Т), что позволяет рассчитать ср
при всех давлениях.
Изложенная методика составления уравнения состояния и расчета
термодинамических свойств жидкости применена в последующих четырех
главах, где получены уравнения состояния в форме E2) для жидк-их азота,
кислорода, аргона и воздуха и рассчитаны табличные значения
термодинамических свойств этих веществ в широком диапазоне температур и
давлений.
3 Зак. 1978
Глава II
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
ЖИДКОГО АЗОТА
1 ермбДйнамйчёскиё свойства азота наиболее исследованы по
сравнению со свойствами других компонентов воздуха как в газообразном,
так и в жидком состоянии. Помимо подробных экспериментальных данных
о плотности жидкого азота при давлении до 485 атм, полученных недавно,
имеются достаточно надежные сведения о зависимости давления и
плотности азота на кривых насыщения и затвердевания от температуры.
Поэтому при решении задачи аналитического описания термодинамических
свойств жидкого воздуха и его компонентов нами в первую очередь
рассматривался азот.
II. 1. Анализ экспериментальных данных
о плотности жидкого азота
Плотность жидкого азота впервые измерил Бенедикт [80, 811,
исследовавший термические свойства азота в обширной области изменения
параметров. В работе [80] указаны четыре экспериментальные точки при
температуре- —150° С в интервале давлений 100—700 атм и пять точек —
при —183° С и 100—1252 атм; плотность определялась взвешиванием
в пьезометре постоянного объема. В работе [81] приведены 10 точек на
изотермах —150 и —175° С при давлениях свыше 980 атм; изменение
плотности определялось по сравнению с плотностью при 0° С и 1550 атм
по известной методике Бриджмена на созданной им ранее
экспериментальной установке [82]. *
Исследованный Бенедиктом азот содержал менее 0,2 об. % примесей.
Температура в опытах измерялась термопарой медь-константан с
погрешностью 0,1 град9 однако при определении действительной температуры
пьезометра погрешность могла достигать 0,2—0,3 град. Давление ниже
1000 атм измерялось поршневым манометром с погрешностью 0,1%,
свыше 1000 атм — манганиновым манометром сопротивления с
погрешностью 0,2—0,3%. Максимальную погрешность определения плотности,
включая ошибки отнесения, автор [80] оценил равной двум единицам
Амага; для жидкого азота, плотность которого в исследованной области
изменяется от 493 до 750 Амага, это составляет 0,3—0,4%. Погрешность
измерения плотности в работе [81] оценена равной 0,3%.
Ван-Иттербик и Вербек [42] определили плотность жидкого азота
на изотермах 65,85; 72,306; 77,89; 84,99 и 90,60° К при давлениях до
150 кГ/см2. Вскоре эти же авторы [83] исследовали плотность на
изотермах 77,31 и 90,26° К при давлениях до 574 и 842 кГ/см2 соответственно.
Согласно использованной методике вначале была определена зависимость
производных (др/др)Т от давления и затем интегрированием была
рассчитана плотность.
34
Сравнительно недавно И. Ф. Голубев и О. А. Добровольский [41 ]
опубликовали опытные данные о плотности азота в интервале температур
от —195,8 до —140° С и давлений 49,4—485 атм, полученные методом
гидростатического взвешивания. В экспериментальной установке
ферромагнитный стержень, к которому подвешивается поплавок, поддерживался
электромагнитным устройством. Оно исключало трение в направляющих
поплавка и, по оценке авторов [41 ], уменьшало погрешность взвешивания
до 0,1—0,2 мг.
Использованный И. Ф. Голубевым и О. А. Добровольским азот
содержал в качестве примесей не более 0,005 об. % кислорода. Установка была
прокалибрована при температуре +25° С, где наблюдалось согласование
с данными Михельса, Лунбека и Волкерса [84] в пределах ±0,1 %.
В работе [41] результаты сопоставлены также с данными [80] и [84]
при низких температурах; расхождение не превышает 0,1%. Заметим,
что данные [84] при температурах ниже 0° С и закритических плотностях
рассчитаны по уравнению состояния, предложенному Бенедиктом [80], и
сопоставление с ними нельзя рассматривать как независимый контроль.
Авторы [41 ] не сравнили результаты своих опытов с данными Ван-Иттер-
бика и Вербека [42, 83], хотя последние частично попадают в охваченную
экспериментами [41] область температур и давлений. И. Ф- Голубев и
О. А. Добровольский оценивают погрешность получендых результатов
величиной ±0,1%.
Согласование экспериментальных данных о газе целесообразно
проводить на изотермах и изохорах, поскольку и те, и другие являются
линиями простой конфигурации. Однако для жидкости согласовывать по изо-
хорам затруднительно, так как число опытных точек чаще всего весьма
ограничено. Поэтому согласование выполнялось нами на изотермах и
изобарах. Как отмечено в главе I, изобары жидкости в координатах р, Т
в широком интервале температур и давлений (за исключением
околокритической области) являются линиями малой кривизны и, следовательно,
при согласовании вполне могут заменить изохоры.
Первоначально по данным каждого автора были построены изо'термы,
согласованы с кривой насыщения и определены значения плотности при
выбранных нами давлениях. Затем были построены изобары и согласованы:
докритические изобары с данными на кривой насыщения, а закритиче-
ские — с расчетными величинами для газа [70].
Сопоставление результатов И. Ф. Голубева и О. А. Добровольского
[41] с данными Бенедикта [80] и расчетными значениями [70]
.показывает, что расхождения составляют 0,1—0,2%, т. е. лежат в пределах
возможной погрешности эксперимента [80]. Данные Ван-Иттербика и
Вербека [42, 83], как правило, существенно завышены — до 0,7—1,3% при
высоких давлениях (рис. 8). Методика И. Ф. Голубева и О. А.
Добровольского представляется нам достаточно надежной, поэтому на большинстве
изотерм, вплоть до 123,15° К, были приняты в качестве опорных данные
[41 ]. При Т > 125° К для согласования с данными [70] опорные изобары
были проведены несколько ниже данных [70] на изотерме 130° К и выше
результатов [41] при 133,15° К.
Следует подробно остановиться на разработке сетки опорных данных
в области температур ниже 85° К. Изобары жидкости должны быть
согласованы с кривой затвердевания, для которой об азоте имеются
экспериментальные данные ряда авторов. Зависимость температуры плавления
(затвердевания) от давления исследовали Симон и соавторы [85], Вер-
шойль [86], Кеезом и Лизман [87], Бриджмен [82, 88], Робинсон [89],
Миллс и Грилли [71]. Данные [86, 87] относятся к области умеренных
давлений (до 212 и 111 кГ/см2 соответственно), результаты [85, 88, 89] —
к области высоких давлений (от 500 до 5000—9000 кГ/см2). В работе Миллса
и Грилли [71] исследованы кривые плавления ряда веществ и получены
для азота 26 опытных точек в области от низких давлений до 3600 кГ!см2~
3*
35
Чистота исследованного Миллсом и Грилли азота 99,7%. Погрешность
измерения давления в работе [71] составляла ±0,05% во всем диапазоне
давлений, а температуры (для азота) — 0,03 град. Давление плавления
(затвердевания) определялось с погрешностью ±1 кГ/см2. В статье [71]
опытные данные не приведены, но дано уравнение, описывающее их со
средним квадратическим отклонением 1,75 кПсм2.
При нанесении на график всех перечисленных экспериментальных
данных для кривой плавления и расчетных значений [71 ] в координатах р,
1' ?
2/СМ3\
0 200 400 600 800р/ар
, Рис. 8. Изотермы жидкого азота по экспериментальным
данным различных автбров:
/ — И. Ф. Голубева и О. А. Добровольского [41]; 2 — Ван-
Иттербика и Вербека [83]; 3 — Бенедикта [80].
Т результаты большинства исследователей согласуются хорошо, и только
данные Симона и соавторов [85] и Робинсона [89] при давлениях свыше
1000 кГ/см2 существенно отклоняются. При давлении до 500 бар, где
расхождения между данными различных авторов практически незаметны,
целесообразно рассчитывать температуры плавления (затвердевания)
азота по уравнению Миллса и Грилли, которое дает результаты, хорошо
согласующиеся с экспериментальным материалом.
Удельный объем азота на кривой затвердевания измерили Грилли
и Миллс [2] в интервале давлений 79—3556 кГ/см2. В работе [2]
приведено уравнение, отображающее экспериментальные данные с погрешностью
0,05—0,15%, которая меньше оцениваемой самими авторами погрешности
эксперимента @,2%).
При экстраполяции изобар, построенных по данным И. Ф. Голубева
и О. А. Добровольского [41 ], до температур затвердевания значения плот-
36
ности превышают расчетные и опытные данные Грилли и Миллса [2] на
0,2—0,6%. Для согласования с кривой затвердевания изобары опорной
сетки при температурах ниже 85° К были проведены нами между точками,
полученными экспериментально [41] и рассчитанными по уравнению
Грилли и Миллса (рис. 9), при этом отклонения от точек не превышали
0,1—0,3%. Возможно, что плотность азота в работе [41] при низких
температурах несколько завышена, поскольку с понижением температуры
расхождение с недостаточно надежными данными Ван-Иттербика и Вер-
бека [42, 83] уменьшается.
и',ибо 70 80 90 юо т;к
Рис. 9. Изобары жидкого азота вблизи кривой затверде-
% вания:
/ —данные И. Ф. Голубева и О. А. Добровольского [41];
2 — данные Грилли и Миллса [2].
В тройной точке нами принято расчетное значение р = 0,8653 кг/дм3
[2], в связи с чем потребовалось уменьшить значения плотности жидкого
азота на кривой насыщения при температурах 63,15—74° К на величину
до 0,3% по сравнению с данными [70]. Такая корректировка вполне
допустима, если учесть возможную погрешность экспериментальных данных
Матиаса и соавторов [90] о плотности азота в состоянии насыщения,
использованных в работе [70].
В итоге согласования экспериментальных данных была получена
плавная сетка изотерм и изобар; последние проходят по большинству
опытных точек [41], согласуются с данными [70] при Т = 140° К и
располагаются между точками [41 ] и [2 ] при низких температурах. Благодаря
использованию данных [2,71] для кривой затвердевания, опытных точек
Бенедикта [80] и расчетных значений [70] для газа удалось разработать
сетку опорных р9 v, 7-данных при давлении до 700 кГ/см2 F86,5 бар),
хотя эксперименты И. Ф. Голубева и О. А. Добровольского [41] ограни-
37
чены давлением 490 бар. После разработки согласованной сетки опорных
данных стало возможным перейти к следующему этапу работы —
составлению уравнения состояния для жидкого азота.
II. 2. Уравнение состояния для азота
По мере накопления экспериментальных данных о термических
свойствах азота предлагались различные уравнения состояния. Так,
Бенедикт [80] составил уравнение для интервала температур —208-f-
—45° С и плотностей 210—750 Амага:
pV = alP + а2р2 + а5р5 + T(R + blP + b2p2 + 63р3) + -f P +
+ ^_pM0-fP2, . F6)
которое соответствует опытным данным [80] со средней квадратической
погрешностью определения плотности 0,21% и максимальной 0,53%.
Примерно с такой же погрешностью оно описывает в указанной области
параметров большинство данных из второй работы Бенедикта [81 ] и работ
других исследователей, однако в околокритическом районе отклонения
расчетных значений плотности от опытных [91, 92] резко возрастают.
Данные Лейденской лаборатории [90] о плотности кипящей жидкости
уравнение F6) отображает в основном с погрешностью ±0,3%, но при
температурах выше 124° К расхождения увеличиваются до 1,7—4,4%.
В работе [81] Бенедикт предложил уравнение состояния,
описывающее полученные им экспериментальные данные в интервале температур
— 175-f-+200° С и давлений 981—5835 атм:
+ (с,+с,Т + -±- + ^у±. F7)
Оно удовлетворяет опытным данным [81] со средней квадратической
погрешностью определения объема 0,14%; погрешность определения объема
для отдельных точек не указана. При составлении уравнений F6) и F7)
в основном были использованы данные о газообразном азоте и лишь
незначительное число опытных значений для жидкости.
Ван-Иттербик и Вербек [42] по своим экспериментальным данным для
жидкого азота составили уравнение состояния, справедливое в интервале
температур 65,8—90,6° К при давлениях до 150 кГ/см2:
9^А{Т) + В(Т)р + Ср\ F8)
где А (Т) и В (Т) — линейные функции температуры,
С — постоянная.
В последующей работе [83] те же авторы составили уравнения для
изотерм 77,31 и 90,26° К при давлениях до 574 кГ/см2 и 842 кГ/см2
соответственно:
р - а + Ьр + ср2 + йръ. F9)
Ограниченность числа изотерм, естественно, не позволила авторам [83]
получить новое уравнение состояния, пригодное до более высоких
давлений, чем уравнение F8).
Одновременно Букачек и Пекк [93] предложили уравнение состояния
для газообразного и жидкого азота, справедливое, по их мнению, от кри-
38
вой насыщения до температур и плотностей, равных примерно трем
критическим:
р = - М [1 - ев {9~К)] + Х2р2?Г^р + RTpe~l9/T + /р2е\ G0)
где
^=WdT' K-ET^ + ^r; h= gt* + h; К = -К(р-ЬУ-МТ.
Уравнение G0) соответствует данным Бенедикта [80, 81] со средней ква-
дратической погрешностью определения плотности 0,7%; для жидкой
фазы в большинстве точек отклонения превышают 0,5%, а в отдельных
достигают 1%. В некоторых точках на кривой насыщения погрешность
также превышает допустимые пределы.
Вскоре Стобридж [72] составил уравнение состояния для азота,
применимое в более узкой области параметров по сравнению с
уравнением G0), но более точное. Форму уравнения Стобридж получил,
совершенствуя уравнения Бенедикта [80], Бенедикта—Вебба—Рубина [94],
Блумера и Рао [95]. В дальнейшем эта форма использовалась также для
описания термических свойств кислорода [73] и аргона [74]. Уравнение
имеет вид:
р = RTp + ( RnJT + п2 -Ь Ц- 4 - ¦? + ?) р2 +
+ (Rn6T + щ) р* + п8Гр4 + р3 (? + Щ + -^) г-^ +
+ Р5 (^ +^f + ^)е-^' + п1Ър\ G1)
Уравнение G1) описывает опытные р, и, Г-данные в интервале
температур 64—350° К при давлении до 300 ашм со средней квадратической
погрешностью определения плотности 0,39%. При составлении были
использованы в качестве опорных для области жидкости данные [80, 81, 90].
Уравнение состояния для жидкого азота, составленное недавно
Л. А. Акуловым и В. Н. Новотельновым [40], имеет сравнительно
простую форму, однако, как отмечалось в гл. I, не описывает опытных /?, v,
Т-данных в пределах точности эксперимента.
В настоящей работе преследуется цель составить точное и в то же
время достаточно простое уравнение состояния для жидкого азота. В
соответствии с методикой, изложенной в гл. I, первоначально была проверена
возможность описания изотерм жидкого азота уравнением
р = арп + Ьрп+2 + срп+\
На большинстве изотерм хорошее соответствие опорным данным
достигалось при п = 1, поэтому в дальнейшем уравнение состояния для жидкого
азота составлялось в виде]
р^Л(Г)Р4-В(Г)рЧ-СG)р5. G2)
Температурные функции А (Г), В (Т) и С (Т) определялись методом
спрямления изотерм. По опорным данным рассчитывались величины /?/р,
и на каждой изотерме из них вычиталось значение в точке на кривой
насыщения ( —) ? после чего образовывалась функция
' MT-(i),]-7^rB + cV + ^ <73)
При построении Y1 в зависимости от р2 + р\ на изотермах получались
прямые, с помощью которых определяли значения С (рис. 10). На графике
39
в пределах допусков для Yъ отмеченных стрелками, проведены две
прямые, соответствующие максимальному и минимальному значениям С.
Определенные на всех изотермах предельные и оптимальные значения С
затем сглаживались и отображались аналитически.
В дальнейшем с помощью расчетных значений С была образована
функция
Ко
Ср5
А + Вр2,
G4)
построение которой позволяет определить В (см. рис. 10). После
сглаживания и отображения В (Т) определяли А (Т). Как отмечено в гл. I, такое
зчоо
3000
2600
2200
1800
050
а 55
0,60
0,65
0,10
-^
г#
ч
NJ
*¦
ч
'Ч
ф1
Y
^ч
N
TF7
VT I
**т
Ы
5*2
^
^А
-.Ф*
&-
^
X
J*
ч
л
N
-moo
¦woo
-1800
-2000
100
105
и о
1,15
%20
Рис. 10. Определение температурных функций уравнения состояния G2) для
азота на изотерме 98,15° К-
последовательное выделение температурных функций позволяет частично
компенсировать погрешность аналитического описания С (Т) и В (Г).
Наиболее жесткие требования предъявляются к точности описания А (Т)г
отображение которой завершает процесс составления уравнения состояния.
На рис. 11 представлены температурные функции уравнения
состояния для жидкого азота; обозначения 1 относятся к предельным значениям
функций, при которых наибольшие отклонения значений плотности от
опорных данных достигают 0,1—0,2%; обозначения 2 соответствуют
оптимальным функциям. Для хорошего согласования значений
термодинамических свойств, рассчитанных по уравнению, с данными для газа
температурные функции определялись при температуре до 140° К. Функции
С (Т) и В (Т) в пределах допусков линейны и описываются выражениями
[96]:
С(Т) =. 6237,03 — 8,826Г; G5)
В (Т) - — 6405,70 + 31,6757. G6)
Функция А (Т) аппроксимируется полиномом:
А (Т) = 377,556 — 1,22038в2 — 0,09833604 + 0,000738396, G7)
где 9 = 0,1 (Т — 140).
40
5000
При подстановке выражений G5)—G7) в уравнение G2) получают
уравнение состояния для жидкого азота, в котором размерность давле-
ния — бар, плотности — кг/дм3.
При определении температурных функций уравнения состояния по
методу спрямления изотерм можно легко оценивать точность соответствия
опорным данным на каждой изотерме, принимая во внимание допуски
для Yl9 Y2 и р. Однако в процессе сглаживания и аналитического
отображения температурных функций точность описания опорных р, v,
Т-данных несколько снижается, что не может быть полностью
компенсировано последовательным
определением функций. По- 60001
этому после отображения всех
температурных функций
уравнение состояния для
жидкого азота было
проверено по опорным данным.
В табл. 3 представлены
результаты сравнения
расчетных значений плотности 4000
с опорными; в сопоставление
включены также данные на
закритических изотермах при
высоких плотностях, которые
описываются составленным
уравнением. Для 192 точек из
235 (учитывая точки, не
представленные в таблице)
отклонения не превышают 0,1 %
и лишь в двух точках
достигают 0,22 и 0,33 %.
Значительная часть точек, в которых
отклонения выше 0,1%,
лежит в интервале температур
70—83,15° К, где опорные
данные менее достоверны.
Среднее квадратическое
отклонение, определенное по
всем точкам, составляет
0,08%.
Полученное уравнение состояния было проверено также
непосредственно по экспериментальным данным И. Ф. Голубева и О. А.
Добровольского [41], Бенедикта [80] и Ван-Иттербика и Вербека [42, 83].
Большинство данных [41] в интервале температур 88,15—133,15° К
описывается уравнением с точностью эксперимента (табл. 4). На изотермах
83,15 и 78,15° К (а также на изотерме 77,35° К, не представленной в
таблице) расчетные значения систематически меньше опытных на 0,1—0,3%,
поскольку принятые нами опорные значения плотности при этих
температурах ниже данных [41].
Расчетные значения плотности на изотермах 90,15 и 123,15° К при
давлениях до 700 атм согласуются с немногочисленными опытными данными
[80] в пределах ±0,1%, что ниже погрешности эксперимента Бенедикта.
В табл. 5 плотность жидкого азота, рассчитанная по уравнению
состояния, сопоставлена с частью данных [42] и данными [83],"что позволяет
детально оценить отмеченные ранее (II. 1) расхождения между
экспериментальными значениями Ван-Иттербика и Вербека и результатами
других исследователей, принятыми нами в качестве опорных.
Представляет интерес сравнение опытных значений плотности жидкого
азота на кривых насыщения и затвердевания с расчетными, для получе-
3000
2000
1000
I—г^
*Д
АД
д
А
П
N. [
[
?
л
^ л
Д
Ал
*~t
А
4-Х
sltB
А
9
Л
1
ДПо-1
АШ9-2
ш
300
200
50
100
120
Т°К
100
Рис. 11. Температурные функции уравнения
состояния для жидкого азота.
41
4^
Ко
CO
^4
СО
О О
~0 ¦<!
СО ЬО
О CD
-4 00
оо
СП СП
00 00
~-4 ^1
СО и-
оо
СП СП
4"* Ф
СЛ ~-4
оо
ОСП
оо
^4 00
CD СО
1
CD
00
о
-ч
оо
~-4 -v|
СЛСЛ
О 00
О О
СП СП
СЛ О
-4 ^4
^4 00
ОО
сп сп
СО СО
to to
о о
слсл
-4^4
4*. Ф
1
-4
00
Ф
СЛ
ОО
^1 ^4
ОО
00 00
to to
оо
СП СП
СЛСЛ
СП СП
о to
о о
слсл
CD CD
Ф Ф.
00 СЛ
ОО
СЛСЛ
4*. Ф>
СО СО
СЛ СЛ
1
СЛ
00
00
Ф
О О
СП СП
CD CD
CD CD
Ф- СП
О О
СП СП
ф. Ф-
to to
СОСЛ
О О
Слеп
^4 ^4
О О
Ю СП
1
1
1
СО
CD
to
СО
оо
СП СП
00 CD
CD О
00 •—
ОО
СП СП
to to
СП СП
— Ф>
оо
СЛСЛ
to to
СЛ ^\
CD О
!
1
1
CD
СП
ОО
СП СП
^ ^4
00 00
сп to
оо
СП СП
о о
Ф> tO
сп сп
1
1
1
1
1
t3
с-
о
ъ
о
СЛ
00
о
140
?
съ 1
**». 1
Qb 1
*
при
о 1
Я
О О
'О "О
3 ?
О
си
р р
СЛ ¦—
•— о
СЛ CD
— О
»— СП
СП
00
СП
СЛ
1
1
1
1
1
г
о о
00 00
CD CD
Ф- Ф
CD Ф
О О
1 00 00
СП СП
00 оо
CD 00
СП
00
00
Ф
1
1
1
1
I
О О
00 00
00 00
со to
0-4
оо
00 00
СЛСЛ
спел
tO CD
Ф
CD
о
CO
1
1
1
оо
ОО 00
CD CD
Ф СО
•—00
ОО
00 00
^1 ~->
ОО
СП 4*
О О
00 00
Ф> Ф»
to ю
О н-
Со
CD
to
СО
1
|
1
ОО
00 00
00 00
to •—
О Ф-
ОО
00 00
ел ел
СП ^0
CD О
ОО
00 00
*о to
СЛ СП
0^4
СО
Ф
СО
to
1
1
1
оо
00 00
¦^ ^1
СП Ф-
ел -<i
оо
00 00
Ф* Ф
CD CD
елеп
ОО
00 00
^4 00
СП Ф-
to
CD
4^
to
1
ОО
00 00
00 00
4^ 4^
00 •—
ОО
00 00
СП СП
00 00
ело
оо
00 00
Ф* Ф>
СП CD
оо
00 00
о о
00 CD
— о
ко
Ф
СЛ
to
1
оо
00 00
--4 -Ч
00 -0
осп
оо
00 00
сп сп
to to
оо
00 00
со со
СО СО
0^4
оо
-*4 ^4
CD CD
00 00
i— сп
CD
СП
1
О О
00 00
-*4 --4
— О
О CD
О О
00 00
ел ел
СО Ф
ело
ОО
00 00
to to
4* ел
to н-
оо
^4 ^4
00 00
^4 ^4
to to
СО
-4
со
1
ОО
О0 00
СП СП
to to
О Ф
О О
00 00
Ф» ф.
СО ф.
СП СП
О О
00 00
to со
СП 00
оо
-«J -4
->4 ^4
to to
СП —
CD
ОО
О
-4
1
ОО
00 00
спел
ел сп
^4 СО
оо
00 00
со со
СП 00
00 О
ОО
00 00
ОО
ф ел
to to
оо
^4 -4
СП СП
ело
^4
00
Ф
ел
0,8706
0,8709
оо
00 00
СЛСЛ
to со
Ф —
ОО
00 00
СО СО
СО ф.
н- К)
оо
--4 00
CD О
CD О
сп -о
о о
^4 -О
спел
елсл
ел to
ел
00
00
4*
0,8680
0,8678
оо
ОО 00
Ф* Ф
CD CD
OCD
ОО
00 00
to со
CD О
со ел
оо
^4 ^4
CD CD
слеп
О CD
О О
--4 ^4
4*. Ф»
CD CD
to о
СО
CD
to
со
0,8648
0,8647
оо
00 00
Ф 4s»
ел сп
СП Ф
оо
00 00
to to
СЛ СП
со сп
оо
^4 -4
CD CD
о о
О00
оо
^4 ^4
Ф Ф
to to
^4 Ф.
>—»
CD
СЛ
0,8616
0,8615
оо
00 00
Ф- ф.
to to
о оо
оо
00 00
to to
>— ьо
tO Ф>
оо
-4 ^4
00 00
ф^сл
оо ел
оо
-О ^4
СО СО
спел
coo
ТЗ
ft
СТ5
СЛ
^4
О
^J
СЛ
со
со
СП
р
Со
"
•о
о 1
О
о
а
о
о
н
рэ
со
Sa
<ъ
а
8 «
н w
SO р
a S
а л
ф» а
11
а р»
о
'Н "о
а -
И
а о
¦
а а
а н
a w
а о\
5 ь
s
с
03
е> е>
-о р .
1 "8
X
^р
р р
— О
to о^
О О
н- О
оо сп
о о
— о
to оо
4^
CD
4^
о
00
4^
to
о
о
00
4^
to
о
о
00
ьэ
00
р
00
to
S
CD
О
00
4^
00
0,8
4^
О
СО
СО
00
^—
о
00
to
СП
ел
о
00
to
СП
00
О
00
сп
о
00
•—>
О
S
со
CTi
4^
О
S
CD
ел
s
1\5
CD
ел
СО
О
00
о
СО
4^
О
0о
о
00
4^
О
S
CD
to
ел
о
s
CD
СЛ
О
S
S
СЛ
00
0,7
s
4^
CD
li_k
CD
S
to
О
s
00
s
to
о
s
00
S
ел
о
S
о
00
о
о
S
СП
00
4*
о
S
4^
ОО
00
0,7
4^
СО
ел
со
CD
н—
о
о
s
сп
ОО
о
s
CD
S
О
S
О0
СО
to
о
S
О0
CD
00
О
S
сп
00
0,7
CD
ОО
ел
о
о
ел
о
s
4^
СП
О
О
S
4^
СП
4^
О
S
to
ел
о
s
to
ел
о
СП
CD
ел
ел
0,6
CD
ел
to
"С
Ov 1
й
"С
о
я
J0
тэ
п
•о
о
я
JP
XS
о
"О
я
т?
^
3
я
93,
ел
X
•о
я 1
СО 1
00 1
ел 1
л
3 1
*о 1
я 1
1-1 1
со 1
СЛ 1
X
S-
о
Ъ» сх>
р р
я ?
to
^9
^9
О О
оо to
4^ ел
о о
to •—
to оо
о о
•— о
00 Gi
**
CD
4*.
О
00
00
ел
00
о
00
00
ел
о
о
00
S
О
о
00
S
о
(Л
о
00
ел
СП
ел
о
00
ел
СП
to
00
CD
СО
о
00
S
СО
00
О
00
S
to
ел
о
ОО
ел
-4
00
о
оо
СЛ
S
О
о
00
4^
00
О
00
4^
О)
to
CD
ел
СО
О
Оо
а^
о
to
о
ОО
ел
ОО
4^
О
00
Ф*
СО
to
о
00
4^
00
О
00
to
СП
to
о
00
to
ел
1—
CD
S
to
О
00
4^
ел
&
о
00
4^
to
а>
о
ОО
to
СП
to
о
00
to
4^
4^
О
00
О
СП
СП
о
00
о
СП
CD
CD
О
О
00
to
S
to
О
00
to
4^
ел
о
00
о
СЛ
to
о
00
о
4^
4^
О
S
00
оо
S
о
S
оо
со
со
я
о
ел
о
00
а>
00
о
00
4^
4^
о
S
CD
СО
СЛ
О
S
CD
to
00
о
^
S
о
о
о
^
~^
о
о
с
t:
"О
о
я
•о
расч
"О
я
"О
Т)
о
•о
я
JP
хз
о
я
я
~4
р°
ел
X
я
я
со
СЛ
X
При
00
СЛ
°
X
X
о
я
я>
римент
к
0"
я
Е
S
дан
Я
ыми
5
•
е
Сопост
р
03
?а
о>
S
S
расч
я>
тных
w
X
S
<т»
X
¦ч я
о
4
о\
ева
s
О
>
У=4
Se
я
Еа
ОТН
о
о
н
я
р
W
о
н
р
&Р
TJ
о
00
о
5я
сг
о
О
о
1—I
й
CD
^ /
-«^Н
/ р
OV
5э
о о
-о -о
р р
Т— о
to -j
•— о
О 4^
о
00
СГ>
СЛ
00
00
4^
CD
О
СО
CD
to
СО
4^
СО
to
CD
4^
to
4^
ел
>—
CD
СП
рр рр рр рр рр рр рр рр
00 00 00 00 00 00 VjVj VjVj VjVq ^<| Vj "-<1^
4^4^ tOCO н—н— CDCD 0000 ^4"<I СПСП 4^4^
4^ CO CD О 00 4^ СЛ СП СЛСП 4^ СЛ tO CO CD 00
о^ so -о о сл to ц\Ф» спел сп to 4* -^
рр рр рр рр рр рр рр рр
оооо оооо Vj"-<j sVi ViVj VaVj VjVi ViVj
tO и- OO 00 00 (Л (Л СЛСЛ 4^ 4^ tO tO •— •--
О CD 4^4^ ОП СП СПСП 4^ СЛ >— ю ^ -О н— О
t04^ СЛЮ СЛСП ОСП СО»-- СП»— 4^tO •— 4^
рр рр рр рр рр рр рр рр
ss sVj ss Vj^>4 VjVi V^V) "спел ЪЬ
CDCD --4 S СПСП COCO tO tO OO CDCD -<J-J
SCn CDCD OO SS COCO 00 CD •—tO >— tO
О tO SO i— о OO 00 CD 00 ь- CD и- CD tO
pp pp pp pp pp pp pp pp
ss VjVq ss ss ~ss "спел Ъп Ъп сп on
0000 СПСП 4^4^ h— •— OO 0000 СПСП 4^4^
•—о coco to to ss eo to enen ss 4^ ел
СП CD COCO tO tO 4^4^ О СО СЛ СЛ СЛ S CD tO
pp pp pp pp pp pp pp pp
ss ss ss спел спел спЪз спел спел
ел ел coco >— •— оооо ss елел coco оо
CDCD CDCD CHS CDCD tO tO 4^4^ tO ^— 4^00
4^СП SCD SO tOCO CDCD OCO OS СОСЛ
s-
О
съ
3:
s
Co
Продолжение табл. 4
р, бар
50,05
99,10
197,2
295,3.
393,1
491,4
Spcp, %
бргаах, %
При 113,15° К
Роп
0,6352
0,6683
0,7107
0,7422
0,7670
0,7868
Ррасч
0,6350
0,6683
0,7109
0,7419
0,7663
0,7868
0,04
0,09
При 123,15° К
Роп
0,5552
0,6139
0,6728
0,7092
0,7370
0,7600
Ррасч
0,5546
0,6140
0,6724
0,7092
0,7373
0,7603
0,06
0,11
При 133,15° К
Роп
0,5528
0,6322
0,6757
0,7086
0,7338
Ррасч
0,5514
0,6825
0,6765
0,7087
0,7338
0,12
0,25
Таблица 5
Сопоставление экспериментальных данных Ван-Иттербика и Вербека [42, 83]
с расчетными значениями плотности жидкого азота р, кг/дмг
р, бар
24,98
45,87
67,01
88,61
111,13
133,86
брср, %
Spmax, %
Пр*
Роп!42]
0,8617
0,8654
0,8692
0,8724
0,8754
0,8783
65,85°
0,32
0,3
7
К
Ррасч
0,8591
0,8626
0,8660
0,8694
0,8728
0,8762
р, бар
16,08
47,16
68,09
89,67
111,78
145,98
При
Роп!42]
0,8351
0,8409
0,8446
0,8483
0,8517
0,8556
72,306° К
V
Ррасч
0,8320
0,8380
0,8418
0,8456
0,8494
0,8552
0,30
0,3
7
Продолжение табл. 5
р, оар
20,12
46,11
64,57
93,85
114,35
145,55
брср, %
йртах» %
Прр
Pon^l
0,7788
0,7865
0,7913
0,7980
0,8022
0,8078
84,99°
0,31
0,3
9
К
Ррасч
0,7764
0,7835
0,7882
0,7955
0,8003
0,8071
р, бар
22,06
45,80
62,88
89,18
116,74
145,82
Пр
Роп!42!
0,7545
0,7626
0,7679
0,7756
0,7834
0,7904
i 90,60
0,70
0,7
5
5 К
Ррасч
0,7495
0,7573
0,7626
0,7702
0,7776
0,7850
44
я
«<:
н
а>
S
я
о
о
н
^о
о
rD
я
я
я
я
Я=
я
о
я
я
го
я
СО
СИ
го
&
я
я
я
я
Со
w о
Со я
я *о со
DO У=1 43 Cd
я со со
я
я
я
;г* я
^ Й
го о
го я= н 5ь Е
Я • СГ о<^ ГО
я К
Со Я ^
«<:
3
я
-оJ
-о"
е
я
"О
Со
о
о
я
н
Со
я
я
Е
о
о
о
н
to
го
н
о
и
я
я
о _
-Я w
го к
S3
Й w
С го
я я
я -5
s R
со
-s] I
я
н
го
^
я
о
я °
Й s
о го
н н
я о
о >
о со
я w
о
сг
5
о
н
8*6 «-Q
н а
о fci
Я Со
д 2
го сг
СО с\1 Я
CD
О
со
О)
О
О
о
г»
8,15
оо
о
сг>
4^
о
Оо
ел
го
го
00
-sj
о
00
3,15
, ¦
СО
О
-4
о
00
о
_^
со
CD
со
о
-4
8,15
00
О
-4
сл
о
-4
CD
СО
СО
О
-4
О
о
со
00
ел
СО
о
сл
ел
о
^
4^
СО
о
о
3,15
о
to
ел
СО
о
о
тэ
о\
*3
Л
Е к
Яс Я
Со
О СО
2 а
S ro
о w
о
я
о
н
Я '
о
о
н
я
о
о
о
н
о а о «
2 Е&3 2
Дй
о
*"* н м
го 3 й
о хз
, о
ы я го
S 3
я
сг
го
СО со
го со
Н я
о
я
го
я
я
» СО
со
о4*4
2 го
? я
* я
н я
СО
о\ н
?з Со
• о\
м 43
о g
о\ я Р
н
го
о
я
н
о
я= § я Й
|8
Й ^
О {V)
Я о
• я
СО
-VI д п? —i , со Я
го Ъ
X
Я сг
§ я
ё я
Со Я
Я го
о го
я
о ..
Н со
я ^з
о 2
го сг ^ я=
— о
я н
чз
го
хч:тз . Е
я
я
~ сг;
я
СО
со
о
н
СО
4^ ел
сл ел
СО -s|
-J -4
-4 00
н— О
СГ) О
-vj ОО
СО О
СЛ СО
СО 00
00 СЛ
ел со
о.ооооооооо
--4 ^
й^ ел
СП СЛ
>— ел
н- СО
н- СО
-4 00
СО О
Ф» СО
^4 I—
о о
о о
оооооооо
о о
О) СО
I— О
ел со
о
СЛ
О О СО СО
со о оо ел
Ю V— _- И-
СЛ СО -<| 4^
О СО Ч Ф СД ^
сл о
елслоосл-<10ососл
ф. -Ч СО •—
СТ5 СЛ СО 00 Ю
оооооооооо
СХ> СТ5 СТ>
ю сд ч
to оо о
CD ^1
СО О
о >—
CD CD
о о о о о о о о о о
сд сд Ь Ь Ь Ь Ъ ч ч ч
tOOOOtOCD-^COO>— tO
00CH^CDOtO>--tOC0CD
СЛСОООСОСЛ^-COOCD^
00 О
to to
I I I I I I I I
о о p о о p p p
оо ел со io T— о о о
-400tO'— OCDCD4^.
о
о
a
о
н
s
Я X
р
о w
сг я
в &
В х
х я
s 5
я н
о я
Я О
я и
Я DJ
О C7V
* й
к
Со
^~ТЗ Я W ?э
•— со сг о со
о о\ я н я
° о ^ о сг
/N ГО ^ СГ
Со "
н
я
СО
о
Со
Й »
я
го со
т со
*~* п д
¦S 8 S
^ со ^
Р н я
о
СО ^CJ
о
я
н
го
я
Е "о го
я о
3.2g
2S
и 5JS-
— сг ^
^ I о
ш so
оО
• го и>
"-"я
5
о> s о ^
ол.3
о чэ
Н S
W Я
о о
?0 и со
Я ст1
со я
я -о
ТЗ со
я н ^
го ^< о
g ^я н
•=, Со
П> X
О Ja
CD Я« О Я«
о
я я
я я
я я
Я я
я
я «
д о
^?
Е
W X
я к
е|
^ со
5 о
хз to
^ я
о я
3 я
я ^
^СО
я
>г-1 СО
s я
я
о
о
о
о
я
я
я
—. я
— я
—' Н
я
^^
о я
о я
э ^
СО Я
я я
о о
-о -о
1 -8
X
"
— О
О --4
CD СЛ
СО •—
-4 СЛ
00
to
CD
О
О
СО
о
со
о
о
00
СО
to
CD
8
СО
>—
о
СО
о
со
о
о
00
СО
CD
СО
CD
СО
СЛ
00
О
00
—4
Оо
to
О
ОО
-vj
о
4*
Ю
-4
О
Оо
Оо
00
N0
О
00
¦^J
00
со
4^
0о
CD
CD
О
00
СЛ
СО
СО
О
ОО
4^
СО
CD
00
СО
о
о
0П
^
О
СЛ
о
0о
CD
СО
CD
СО
CD
-J
СО
О
00
4^
КО
СО
о
0о
со
о
со
to
to
to
-J
о
00
СЛ
ел
00
о
00
4*
СО
00
ю
-4
4^
СЛ
О
00
ко
СЛ
to
о
00
4*.
О
4^
-4
4^
О
00
4^
СО
О
Оо
СО
CD
со
со
ел
СО
О
00
о
¦-4
СО
О
-sj
со
-sj
00
ОО
о
4^
О
ОО
ю
-4
4^
О
00
tsD
4^
Ю
to
00
СЛ
о
^4
со !
О
О
^
00
to
"О
3
оо
JP
та
о
¦о
о
я
OJ
•о
та
р
"И
о' 1
"а
¦о
о
тз
Я
та
X
-j
оэ
о 1
л
та 1
s 1
to 1
0,2
а> 1
Я
1
о
С1>
по сглаженным опытным данным, и их плавного сопряжения при
критической температуре.
Результаты сравнения расчетных значений плотности на кривой
затвердевания с экспериментальными данными Грилли и Миллса [2]
представлены в табл. 7. Из таблицы видно, что рассчитанные нами значения
несколько выше опытных, и расхождения возрастают по мере
уменьшения давления, однако не выходят за пределы погрешности эксперимента
@,2%). При низких давлениях, где отсутствуют опытные точки, в таблицу
включены значения, рассчитанные по уравнению, приведенному в работе-
[2]. Полученные нами данные практически совпадают с ними, а во всем
интервале давлений, представленном в табл. 7, выше не более, чем на
0,08%. Заметим, что при разработке сетки опорных р, v, Т-данных было
допущено некоторое отклонение от точек [2], поскольку лучшее
соответствие им вызвало бы увеличение отклонений от экспериментальных
данных [41] при низких температурах (см. рис. 9). В целом значения
плотности, рассчитанные по уравнению состояния, вполне удовлетворительно»
согласуются с экспериментальными и расчетными данными Грилли и
Миллса [2].
Таблица 7
Сопоставление расчетных значений плотности азота на кривой затвердевания
с опытными данными Грилли и Миллса [2]
р, бар
19,61
58,84
98,07
137,3
166,7
196,1
245,2
т, °к
63,57
64,43
65,28
66,12
66,74
67,36
68,37
Роп
кг/дм3
0,8668 *
0,8698*
0,8715
0,8746
0,8769
0,8792
0,8828
Ррасч
кг/дм3
0,8669
0,8699
0,8730
0,8759
0,8781
0,8801
0,8837
бр, %
—0,01
—0,01
—0,17
—0,15
—0,14
—0,10
—0,10
р, бар
294,2
343,2
392,3
441,3
490,3
588,4
686,5
т, °к
69,38
70,38
71,35
72,32
73,29
75,18
77,04
Роп
кг/дм3
0,8864
0,8897
0,8930
0,8960
0,8990
0,9046
0,9099
Ррасч
кг/дм3
0,8868
0,8900
0,8931
0,8962
0,8991
0,9051
1 0,9107
бр, %
—0,05
—0,03
—0,01
—0,02
—0,01
—0,06
—0,09
* Рассчитаны нами по уравнению, приведенному в работе [2].
Выполненное сопоставление свидетельствует о том, что уравнение
состояния в форме E2) описывает с высокой точностью опытные /?, v, T-
данные жидкого азота в широкой области параметров — от кривой
насыщения до 700 бар, включая кривую затвердевания. Это дало основание-
применить уравнение для расчета подробных табличных значений
термических и калорических свойств.
II. 3. Калорические свойства жидкого азота
Калорические свойства жидкого азота исследованы
экспериментально в менее широких интервалах параметров, чем термические.
Наибольшее число работ посвящено определению теплоты испарения. Одним,
из первых эту величину измерил Альт [98] в интервале давлений 94—
713 мм рпг. ст. Фурукава и Мак-Коски [99] провели эксперименты при:
температуре от 62 до 78° К. Сравнительно недавно Мэйдж и соавторы [ 100}
получили пять опытных точек при температурах, близких к критической:
A19,2—124,3° К). При атмосферном давлении измерения выполнили;
Ширер [101], Дьюар [102], Эйкен [103], Дэйн [104], Джиок и Клай-
тон [105].
Большинство упомянутых авторов использовали статический метод,
нагревая кипящую жидкость электрическим током и измеряя затраченную?
46
энергию и количество испарившейся жидкости. Из ранних опытных
данных только результаты Альта [98] сохраняют ценность до настоящего
времени. Он тщательно определил поправку на испарение жидкости под
влиянием внешнего теплопритока и оценил погрешность опытных данных
величиной ±1%. Большая часть опытных точек [98] согласуется в
пределах указанной погрешности как между собой, так и с результатами Фуру-
кава и Мак-Коски [99], полученными с помощью более совершенной
установки, в которой использован адиабатический калориметр. В отличие от
других исследователей Дэйн [104] измерил теплоту испарения азота
(а также кислорода и смесей 02—N2) проточным методом.
Имеется несколько работ [103, 105, 106, 107, 108], посвященных
измерению теплоемкости жидкого и твердого азота. Первыми исследовали
ее Эйкен [103] в интервале температур 16,5—72,7° К и Кеезом и Камер-
линг Оннес [106] —от 15,3 до 76,5° К. В дальнейшем Клюзиус [107]
провел эксперименты в интервале 10,4—73,5° К и Джиок и Клайтон
[105] — от 15,8 до 77,7° К. Уиб и Бревурт [108] измерили теплоемкость
жидкого азота при температурах выше нормальной температуры кипения
(от 79,2 до 117° К); среднюю погрешность получения опытных данных они
оценили равной 1%. В 1959 г. Клюзиус, Сперандио и Писберген [109]
определили теплоемкость изотопов азота — 14N2 и 15N2 в твердом и жидком
состоянии в интервале температур 11—69° К. Все авторы, по существу,
измеряли cs в состоянии равновесия с насыщенным паром. Однако как для
твердого тела, так и для жидкости при низких давлениях cs практически
совпадает с ср на кривой равновесия фаз; например, для азота при р =
= 1 атм ср всего на 0,35% выше cs [14].
Мэйдж и соавторы [100] измерили изобарную теплоемкость в
интервале температур 122—274° К и давлений 10—138 бар; из полученных
ими 36 опытных точек лишь небольшая часть относится к области
жидкости. В работе [100] для большинства точек разности начальной и
конечной температур эксперимента составляли примерно 11 град, поэтому
в околокритическом районе данные [100] могут существенно отличаться
от истинных значений.
При измерениях интегрального адиабатного дроссель-эффекта азота
в интервале температур —163^- +300° С Роэбук и Остерберг [110]
получили ряд опытных точек для жидкой фазы на изотермах —163 и —151° С
при давлениях до 202 атм. В работе И. М. Гусака [111], где определен
изотермический дроссель-эффект при температурах 115,1—291,6° К,
приведены данные о жидком азоте на изотерме 115, Г К в интервале давлений
17—120 атм.
Из краткого обзора видно, что опытные калорические величины
относятся преимущественно к состоянию насыщения, а в однофазной области
они весьма немногочисленны. Поэтому таблицы термодинамических свойств
жидкого азота составлялись в основном путем обработки р, vy Г-данных.
Из приведенных в литературе расчетных значений калорических
свойств азота наиболее обширную область давлений охватывают данные
Дина [ 112], полученные графической обработкой опытных значений
термических величин. В таблицах Дина приведены значения объема, энтальпии,
энтропии и теплоемкостей с„ и cv для 1 моля. Свойства жидкости
представлены при давлениях до 1000—4000атм, но лишь на пяти изотермах (90;
100; 110; 120 и 125° К); при расчете свойств были использованы р, v, T~
данные Бенедикта [80, 81].
Более подробными являются таблицы Стобриджа [72], рассчитанные
с помощью полученного им уравнения состояния G1) —таблицы
составлены в метрической и британской системах единиц (в СССР имеются только*
последние). Таблицы содержат значения удельного объема, энтальпии,
внутренней энергии и энтропии в интервале температур 114—540° R
F3,3—300° К). Шаг таблиц по температуре 2° R, что выгодно отличает
их от таблиц Дина, но максимальное давление 3000 psia B06,8 бар).
47
В монографии Роулинсона [14] представлены таблицы
термодинамических свойств жидких азота, кислорода и аргона в состоянии насыщения,
полученные графической обработкой экспериментального материала о
термических и калорических свойствах этих веществ, накопленного до 1959 г.
Для каждого вещества таблицы охватывают диапазон температур от
тройной точки до критической, но некоторые свойства, в частности
теплоемкость, представлены лишь в интервалах температур, изученных
экспериментально. При температурах ниже 90° К данные о термодинамических
свойствах жидких азота, кислорода и аргона в состоянии насыщения
приведены также в работе Ван-Иттербика и Ван-Дэйла [113].
Мэйдж и соавторы [ 100] составили таблицу значений энтальпии азота
в интервале температур —320, 4-f-+50° F G7,37—283,15° К) и давлений
14,7—3000 psia. Таблица в значительной части основана на
экспериментальных данных самих авторов [ 100] о теплоемкости ср и Роэбука и Остер-
берга [ПО] об адиабатном дроссель-эффекте, однако при температурах
ниже —260° F A10,9° К) значения получены экстраполяцией.
Нами рассчитаны таблицы термодинамических свойств (р, и, C, i,
s, ср) жидкого и газообразного азота до температуры 140° К и
давления 500 бар с помощью уравнения состояния, представленного
выражениями G2), G5), G6), G7). Расчет выполнен на электронной цифровой
вычислительной машине. Калорические свойства определены по
уравнениям, приведенным в 1.4, причем на докритических изотермах в
качестве постоянных интегрирования приняты значения этих свойств кипящей
жидкости по данным [70], а на изотермах 130; 135 и 140° К — в точках
при давлениях 70; 90 и 125 бар соответственно [70]. Значения
термических свойств на кривой насыщения получены по уравнению состояния
с использованием уравнения для кривой упругости [70].
Полученные значения термических и калорических свойств жидкости
были затем графически согласованы с данными для газа, приведенными
в монографии [70]. В процессе согласования данных об энтальпии
потребовалось несколько изменить V (и соответственно s') по сравнению
с указанными в [70]. Поправки к значениям энтальпии лежат в пределах
от +2 кдж/кг (при температурах, близких к тройной точке) до —3 кдж1кг
(при температурах 116—123° К), т. е. в пределах возможной погрешности
расчетных данных [70]. Изменение V и sr, естественно, не нарушило
термодинамической согласованности расчетных данных. С целью
согласования изобарной теплоемкости с энтальпией была определена производная
(зуг) = ср при давлении 300 бар графо-аналитическим методом с
погрешностью 0,2%. Для определения ср в качестве значений функции cv (T)
были приняты разности Аср между полученными значениями ср и
расчетными на этой изобаре.
Заметим, что значения V, приведенные в [70], достаточно надежны.
Как показали расчеты, отклонения их от значений, полученных с помощью
экспериментальных данных о cs [105, 108], не превышают ±1,5 кдж1кг.
Тем не менее, мы сочли целесообразным внести указанные выше поправки
для облегчения согласования данных о жидкости и о газе. В итоге при
графическом согласовании данных по изобарам оказалось достаточным
несколько изменить ряд значений на околокритических изотермах
A25—135° К для у, 125—140° К для i и s, 125—150° К для ср).
Полученные графически значения были дополнительно сглажены по изотермам.
В последующих трех главах при составлении таблиц
термодинамических свойств жидких кислорода, аргона и воздуха потребовалось
выполнить аналогичную корректировку значений V и s', принятых первоначально
по данным [70]. При расчетах процессов с жидким воздухом и его
компонентами рекомендуем использовать относящиеся к состоянию насыщения
данные, приведенные в настоящей книге, поскольку они обеспечивают
лучшее согласование расчетных значений для жидкости и для газа.
48
Таблица 8
Сопоставление значений Ai — i — /', рассчитанных по данным Стобриджа [72], Дина [112] и нашим
г, °к
70
80
90
100
ПО
120
130*
140*
4*82,7- к
данным [72]
6,4
5,7
4,5
• 2,4
— 1,2
—9,4
— 137,6
— 118,3
дж/кг, по
уравнению
G2)
6,5
5,7
4,5
2,5
—0,8
—9,6
— 138,4
—118,2
6, кдж/кг
—0,1
0
0
—од
—0,4
0,2
0,8
—0,1
Д11 \, кдж/кг, по
данным [112]
'—
—
3,7
2,4
—2,9
—16,5
—145,6
— 129,4
уравнению
G2)
—
—
4,4
2,5
—0,8
—9,6
—138,1
—117,3
6, кдж/кг
—
—
—0,7
—0,1
—2,1
—6,9
—7,5
— 12,1
*Д*124,1. к
данным
[72]
9,8
8,7
7,2
4,6
0
—9,7
—141,0
—128,0
дж/кг, по
уравнению G2)
10,0
8,7
7,2
4,7
0,6
—9,7
— 143,0
—129,7
6, кдж/кг
—0,2
0
0
—0,1
—0,6
0
2,0
1,7
Д*121,6« к
данным
[112]
—
—
6,0
4,1
—1,7
—16,1
—146,5
—134,6
дж/кг, по
уравнению G2)
—
—
7,1
4,6
0,5
—9,8
— 143,0
—129,4
б
кдж/кг
—
—
— 1,1
-0,5
—2,2
—6,3
—3,5
—5,2
Продолжение табл. 8
Т, °К
70
80
90
100
ПО
120
130*
140*
Д*172,4' к
данным [72]
13,7
12,4
10,6
7,5
2,3
-8,5
—141,4
—130,8
дж/кг, по
уравнению
G2)
13,9
12,6
10,6
7,6
2,7
-8,4
— 143,5
— 132,9
6, кдж/кг
—0,2
—0,2
0
—0,1
—0,4
—0,1
2,1
2,1
Д*162,1' к
данным [112]
—
—
8,5
6,2
—0,1
— 15,1
—146,5
— 135,9
дж/кг, по
уравнению
G2)
—
—
9,8
6,9
2,3
—8,8
—143,7
— 132,6
6, кдж/кг
—
—
— 1,3
—0,7
—2,4
—6,3
—2,8
—3,3
4*206,8- к
данным
[72]
16,6
15,1
13,1
9,8
4,2
—7,1
—140,6
—130,9
дж/кг, по
уравнению G2)
16,8
15,1
13,0
9,9
4,8
—6,9
—142,8
—133,0
6, кдж/кг
—0,2
0
0,1
—0,1
—0,6
—0,2
2,2
2,1
Д*202 6' кдж/кг, по
данным
[112]
—
—
П,2
8,6
1,9
—13,5
—145,5
— 136,1
уравнению G2)
—
—
12,7
9,6
4,6
—7,1
—142,9
—133,1
5
кдж/кг
—
—
—1,5
—1,0
—2,7
—6,4
—2,6
—3,0
* На изотермах 130 и 140° К из значений i и s при повышенных давлениях вычитались значения при р = 1 ашм.
Таблица 9
Сопоставление значений As = s — s', рассчитанных по данным Стобриджа [72], Дина [112] и нашим
7\ °К
70
80
90
100
ПО
120
130*
140*
дж
oz>' кгград
данным [72]
—0,047
—0,055
—0,066
—0,081
—0,106
—0,161
—2,090
— 1,947
уравнению
G2)
—0,046
—0,055
—0,066
—0,080
—0,102
—0,162
—2,098
—1,953
. кдж
о, =-
кг-град
—0,001
0
0
—0,001
—0,004
0,001
0,008
0,006
ASoi 1 , г- , ПО
81-1 кг-град
данным [112]
—
—0,067
—0,075
—0,117
—0,227
—2,161
—2,036
уравнению
G2)
—
—0,065
—0,079
—0,101
—0,159
—2,093
—1,944
6
кдж:
кг град
—
—0,002
—0,004
—0,016
—0,068
—0,068
—0,092
Л'124,1' 7i
данным [72]
—0,068
—0,081
—0,095
—0,116
—0,149
-т-0,218
—2,172
—2,075
кдж:
г- , по
¦град
уравнению
G2)
—0,067
—0,085
—0,095
—0,115
—0,145
—0,218
—2,187
—2,190
6
кдж
кг-град
—0,001
0,004
0
—0,001
—0,004
0
0,015
0,015
As121,6> ~
п
данным
[112]
__
—
—0,097
—0,110
—0,156
—0,273
—2,219
—2,128
кдж:
кг-град
о
уравнению G2)
_
—
—0,094
—0,113
—0,143
—0,215
—2,183
—2,084
б
кдж
кг-град
—
—0,003
0,003
—0,013
—0,058
—0,036
—0,044
Продолжение табл. 9
Т, °К '
70
80
90
100
ПО
120
130*
140*
кдж
L'W кгград '
данным [72]
—0,092
—0,107
—0,126
—0,151
—0,191
—0,269
—2,235
—2,156
уравнению
G2)
—0,089
—0,107
—0,127
—0,151
—0,186
—0,267
—2,250
—2,174
. кдж
' кг град
—0,003
0
0,001
0
—0,005
—0,002
0,015
0,018
АМ62.1. ~г
данным [112]
—
—0,122
—0,140
—0,191
—0,313
—2,267
—2,188
кдж
¦град
уравнению
G2)
—
—0,120
—0,144
—0,178
—0,258
—2,238
—2,159
6
кдж:
кг -град
—
—0,002
0,004
—0,013
—0,055
—0,029
—0,029
AS2C6,8> —г
данным [72]
—0,108
—0,125
—0,146
—0,174
—0,217
—0,299
—2,270
—2,198
кдж:
¦град
уравнению
G2)
—0,105
—0,125
—0,147
—0,174
—0,212
—0,296
—2,285
—2,214
6
кг град
—0,003
0
0,001
0
—0,005
—0,003
0,015
0,016
As202,6' "
п
данным
[112]
—
—0,144
—0,166
—0,222
—0,348
—2,308
—2,237
кдж:
кг град '
о
уравнению G2)
—
—0,145
—0,171
—0,209
—0,293
—2,281
—2,210
б
кг-град
—
0,001
0,005
—0,013
—0,055
—0,027
—0,027
* На изотермах 130 и 140° К из значений I и s при повышенных давлениях вычитались значения при р = 1 атм.
Расчетные значения калорических свойств жидкого азота были
сопоставлены с данными, имеющимися в литературе. Ввиду крайней
ограниченности экспериментальных данных были привлечены табличные [72,
100, 112], охватывающие достаточно широкий диапазон давлений. При
сравнении с данными Дина [112] об энтальпии и энтропии ввиду
различия в начале отсчета сопоставлялись разности Ai = i — V и As = s — s'
на изотермах. Для температур 90; 100 и 110° К при давлении 500 атм
расхождения в значениях Ai составляют соответственно 2,1; 1,3 и
2,9 кдж/кг и As — 0,012; 0,019 и 0,003 кдж!'(кг • град). На изотермах 120
и 125° К отклонения вдвое превышают наибольшие из приведенных
значений. Для газообразного азота при температурах 130 и 140° К Ai и As
при давлениях 500 атм и 1 атм по таблицам Дина и нашим отличаются
на 2,9 кдж/кг и 0,008 кдж/(кг-град). Такие расхождения можно считать
приемлемыми. При давлениях 300 и 40t) атм Ai и As, рассчитанные по
уравнению состояния, согласуются с данными Дина примерно с такой же
точностью, как и при 500 атм. Подробное сопоставление с данными [112]
для давлений до 200 атм включительно приведено в табл 8 и 9.
Представляют интерес результаты сопоставления с расчетными
данными Стобриджа [72]. В табл. 8 и 9 приведены значения А/ и As,
рассчитанные цд ряде изотерм при давлении 82,7; 124,1; 172,4 и 206,8 бар-.
Данные хорошо согласуются как на представленных в таблице изотермах,
так и на промежуточных F5, 75; . . .; 135° К), за исключением
околокритической изотермы 125° К, где отклонения при р = 206,8 бар
достигают 5,3 кдж/кг и 0,043 кдж/(кг-град). Расхождение с данными [112],
взятыми при близких давлениях, для жидкости значительнее, чем с
величинами [72]. Это может быть объяснено недостаточным совершенством
методики, применявшейся при составлении таблиц [112]. При
температурах 130 и 140° К отклонения данных [72,112] от полученных нами в
основном близки по абсолютным величинам, но противоположны по знакам.
Сопоставление рассчитанных нами значений Ai жидкого азота с
табличными данными Мэйджа и соавторов [100] показало, что вплоть до
давления 206,8 бар (максимального для таблиц [100]) расхождения не
превышают 1—3 кдж/кг. Наибольшие наблюдаются при температурах,
близких к критической и к нормальной температуре кипения.
Расчетные значения ср сопоставлены с данными Дина в табл. 10.
При температурах, удаленных от критической, согласование хорошее.
Таблица 10
Сопоставление расчетных значений теплоемкости ср
(строка 1-я) с данными Дина [112] (строка 2-я)
р, бар
101,3
202,6
304,0
405,3
506,6
&Рср, %
&>max» %
90
1,870
1,867
1,790
1,777
1,748
1,737
1,714
1,713
1,694
1,696
0,4
—0,7
с
100
1,904
1,905
1,795
1,800
1,743
1,753
1,712
1,724
1,694
1,703
0,5
±0,7
-р, кдж/(кг град), при Т, °К
110
1,981
1,953
1,821
1,828
1,753
1,774
1,717
1,734
1,695
1,706
0,9
—1,4
120
2,101
2,035
1,860
1,863
1,774
1,793
1,733
1,745
1,699
1,707
1,5
-3,1
130
2,277
2,174
1,915
1,917
1,799
1,819
1,739
1,756
1,701
1,707
2,1
-4,5
140
2,621
2,677
1,981
2,081
1,824
1,877
1,750
1,766
1,706
1,705
2,8
5,0
4* 51
X
3
Я
о
я
О) 03
2 ч
о
я
Я
Я
кг _
о s
- оз
О О)
н н
Я О
VO
Я
Ен »Я
О) CD
со *
О
о
со
о
CN
а
о •
Е-. -—i
У О
я N.
Я —
Я fl
6 а к
pa я >=ч
й S S
я я о
Я kj л
Он О _
с Р
Я 03
Н И
О О
Я
CD
Н
Я
О
(-<
О
к я
Я
§-я
! Ю
оз s
со сн:0
Я О о
—' ^Ю
Я Он |
? Л Я
: cn
J3
н
03
н
я
5 >>
Я со
Он CD t?
Я Он S
tr - § я
?*Г CD g
л° - ft
Я >.
CD о Ч
3 со г—•
S?S я
я
я
я
<D
Я Ен
о
я
я о
Е-с Я
Я КС
Я Я
О Я
КС ^
Я со
о =я
я о
CD Я
Он О
я
Я
я
Я >—'
° я
X
я
я
о
<D
я
я
Он
о
ч
03
я
<D s
Н 43
X
03 -
CD CD
Н
О
со
я
03
см
я
<D pa
Я ^
оЗ Л
Я
я
CD
Я
03
Ен
о
я
я
я
н
о
»я
о
я
о
(D
Я
я
о
CD
Я
я -
03 CD
д Я
я ^g
кг О
о «
°- э
CD Я
. Н Я
* ни KJ
3 Я CD
03 CD
Я
о
5 ©
о ^
CD i—i
я —^
CD О
Я
КС
CD
Я
я
я
я
CD
CD
о
^ я
Я —.
Он»-н
я •—•
? ч
Е- О
У Я
03 с_<
Я
я
я
- CD
S ^
я и
S CD
я §
is
о
KJ =Я
я я
Он Я
Я CD
я Э
Он Д
и я
03 *<
я
я я
X
я
>^ Ц. CD
я
Он Я
CD
Я
Ен Я^ Я
о н о я
со *н
я CQ 5Я н
Я ^ д Я
я я « 5
н к 2 °
9 S Р
Он^
Ен 5 CD
„ Я ?
Я Я
Дом
(D Я
О Ч
CD
я
Он
CD
Я
я
До
Я
CD
CD
КГ
CD
Он Он
я ?
Он О >^ Я
О _
С ни ^
я с
, 3 Л <D
н
я -.
Он^
о
со
я
я 5/ ..
О и Я
°Я я я
? ад
Я CD
- &
Я <d
КС сз
Я
я 2
сз я >,
со К У
со
Я н
4 s
со я S
CD О Я
Он Он Я
а »—i
ss
О •
Я t-
о ю
CD сз
03
Он
я
CD сЗ О П
° ^Я •
Я ^
Он О О
е- w^r
я а> 2 ю
S »Я CD
CD О
Рн О
о
со
я
я °
я я
CD E^
Он О
03 О
Я S
о s
Я CD
X
я
я
о
CD
Я
я
я
Он 3
^ 2- Ен О
о.^^ 2 °
03 Я с^°
со Я
я я
^Н fcH |
X ^з " Я
я н ^Г • я
Я ^ S Он
ft о я о
° « 2 я
Я • Kj Он к
U53c3 g-
Ьн о ^
Я СО I О *
я я а я см
я
о
CD
я
я
к
о г^
3^
2
Sg;
S&
l|
cd О
CU С
H ^^
ЛЯ
О
CQ
s
X
s
о
COcDCJJtOCO Ю СП h- 00 CO CM 1Л CM ^r1 —• N Tf CN CD N tO О CO CD 00 О CO 05 00 —-
OOC4NCOO) Ю —' 00 tO CO ^н СЛ 00 N N О N 00 CO-^ rf 00 CM b- CO —i СП 00 О) CM
ООСЙСЛОО i-H CM CM CO ^H im^cDNOO СЛСЛОг-нГО ^inNOOO (NCOIONO
Ю i—' 00 tO CO y—i из uu c~~ с- и i^ uu oj ^ \r w ^ i^ t'J '—< uj <**j uj un
—^ CM CM CO Tf ЮЮСОМХ) O^C^O'-'OO ^lONOOO tN CO Ю N О
\Лщ/ Чр/*' Ч-/'' ^^^ V^/ * ' W^ ^-»N W-/ \J' Ub^l^.*/ 4^^ «. ^" VA/ V-/^ W*' 4V ' ¦ ^'^ "VJ »Jb«/ l "^ V^V./ \m*S 4#>f WW »-*•' «.^" 4^
—Г ^-Г —Г CM CN CM" CN СМ" СМ" СМ" СМ" СМ" СМ" СМ" СМ" СМ" СМ" СО" СО" СО" СО" СО" СО" СО" rt<" Tj^Tf ^Tf Ю
00 СЛ> О -н СМ 00ЮЬО5^ СО Ю 00 1—1 Tf ЮЬО^ОО СО 00 СО СЛ CD СО ^н <J5 00 t^
СМ СМ СО СО СО СО СО СО СО rf ^'Ф^ЮЮ Ю Ю CD CD CD t^ Ь- 00 00 О) О ^н ~-. СМ СО
CJiCT3CT5CJ)Cj3 050С5СЛСГ5 СГЗС75СЛОС75 CT>CX5CJ5CDCT) Q5<J5CT>CT5CX5 OOOOO
CM CM CM CM CM
О tO CD Ю CO
OOINCOCO
о см ю oo о
CD CO О CD CN
C0CD00-h^
О CD О CO 00
4f CD CT> r-^ CO
\*SJ t-LJ 4i^ ¦J-.' '•'J V,—' >»" l^- >¦'«' >-" V^^ «.'rf V^/* v^»/ V, 4 4^^ 4^< V / V.-^ >^4^ v. 'J Vfc^ V^^ V. N "^
lO00-.^N О CM Ю 00 О СОСООО-н^ ^f CD CD —< CO CD 00 О СО Ю
^^ЮЮЮ CD CO CO CD t-- t> t> О 00 00 00 00 00 О О OOOOO
см" см" см" см" см" см" см" см" см" см" см" см" см" см" см" см" ci см" см" см" см" см" со" со" со"
со со о см ю ооосо^аэ
СО 00 О СО Ю Ь- О СМ ^ СО
Q ^^^-^^
СО" СО" СО" СО" СО"
COI>-l^-l>b- ООГ^Ь-t^t4» сО^СО-нО COOOt^-lOCM ONCOOCO hSCSIOO)
CM '—' О О 00 NcDiO^CO
_н ^ ^ о О ООООО
CMCMCMCMCM CMCMCMCMCM
ООООО
см см см ^ —^
г^ со to -ф со —н о о оо со
ООООО ОО000000
Ю СО СМ О 00
00 00 00 00 Ь-
Ю00ООО —< —I CM CO rfi -^frf^^^
00 СО ^ СМ ^н СГ> I4- Ю СО —н
т^н^^чфтф COCOCOCOCO
СОМОСО-н
см см см см см
Mill I I I I I ММ
ООЮСОСОСО CDC^t>b-t^- О
o"o"r-"to"co" ^"o"t>"io"co" ^-Г^^Ч10.
cs, ^_ _ ^ _ г-н о о о о осомого
t-Hi-H^^H,—! ^^^н^^^-нт—I ^0H5 05 0
I М II I II II I I II I
Ю ОЮ OCD ¦ »-н t^ СО ОЮ -нЬ^ОЬ От^-нООЮ СО н О t^- Ю rf СМ -н О О
ifllOcDNN 00 00 О О О ^ -^ СМ СО О СО Th tO Ю СО N00 00 0H —' СМ СО тн т*<
^н ^н ^н -н ^н _н ^н ^н ^ CM CMCMCMCMCM CMCMCMCMCM CM CM CM CM 00 COCOCOCOCO
CO CM CO Ю CO
Ю CD rf CO CO
-и ^ — CM CM
CM Ю О N CO -и СО О rf О
ю см ю ю см
OOCOOO^t-H
CM CO CO Tf tO
ЬСЛО-"^ CO CO tO О Ю '^Ь'ФЫО О CM CM О 00
00 CO CO CO t^ —^ О CM CO CM ONNOO-h (OWOO-h
Ю CO N 00 О ООСМСОЮ СООООСМЮ N О CO CO О
ООООО ООООО ООООО
< СМ СМ СМ СМ СО СО СО СО
ю
со
—н _ t'J
СО"^ЮСОЬ~ 00 О О —'CM CO^lOCDN N00 0H- СМСО-^ЮСО Ь-00ОО —
COCOCOCOCO COCONNN N N N N l> t> N t> о© 00 00 00 00 00 00 00 00 00 О О
«Г5
СП СЛ 4* 4* 00 00 JO JO ^—^— ммррр
слослосл ослочел 1оо~-чсл1о
ОСЛО СЛОСЛОСЛ
CD CD CD CD 00 00 00 00 00 00 -4 -J -4 »-4 Q>
Cn4*»JO^—CO ^4CnpOjOO i^^^T-^
tO О ~-4 lo О CD О О CO 00 H- lo 00 00 ">—
^•-ОСЛЧ tO 4s»,00 •— СЛ 00 4s» CD tO -4
CO CO CO 00 CO 00 00 tO tO tO tO tO tO tO >—
CD -<1 О СЛ СО ЮОООЧО» СЛ 00 tO О "Ч
tO CO СП >—-4 >— 4s» О СЛ 4s» tO CD 00 4s» -~J
4W^-»-oo 00
CD О О — н- н- tO tO 00 4*»
оо оо >— оо ч^ель-о
004s»OCO tO О О 00 ^sl
N- N- М- H- N- _-_-•—»—»— >— >— tO tO tO
-v) ^J ^J -4 00 OOOOOOCDCD CDCDOOO
*~ CO О 00 *- CO О CD ^— CO СП ^4 О СО 00
oooloo*- чЬоосл"*. слоочЬЬ
CO CO CO 00 CO 00 СО СО tO tO ЬО tO tO tO tO
lololo ">—">— ">—©o!olo ooooVjVjoi
0000-400 ослочоо со^оооч
tO СЛ СЛ CO 00 *-oiOi-Ol 4* О-4 СЛ 00
to to to to to ьо^— f ~ *- ^.-^rr
О О О О О О CD CD CD CD CO CO CO CO CD
00 -4 СЛ 4=» tO >— СОООЧСЛ О СП 4s» 4» ОО
CO tO О О СЛ О' О tO СЛ 00 ^-^ЧОЮ
о сл сл ел ^ф» ^ ^ со со со со to to to jo
"*>— Vj V о Vj со о о ~4» 1о "*-* со о» V ~>—
05 CD 00 *Ч tO -Ч tO ^J 00 CD О CD -4 >— О
cdOoqicdqo оочослоо tootocooo
43
ЗЕ
о
За
9 м
Ja S
Р За
00 РЧ
5а О
<t> 2
Я О
Is
v-"' к»)
р
о
г
в
о\
J3
Р
tO tO tO tO tO tO tO tO >— и- »— »— »— и— >— >— »— »— о О О ООООО О О CD CD CD CD CD CD CD CD
О ОЭ СЛ 4* CO tO н-ОСОООЧ О» СЛ 4*. CO tO >— О CD 00 -<1 О СЛ 4* CO tO ь-OCOOOvl О СЛ 4». CO tO
to
СЛ
СЛОСЛ^Ч
4 Ul S *>¦ 4
to to to to to
О СЛ CO JO _>—
4>« ">— CD Vj СЛ
4s» СЛ tO tO 00
to >— >— — >—
© CD 00 jO ©
4* 4»ЪоЪо 4s»
СЛ 4* CO CO tO >—О © CO 00 ОО^ЧОЗСЛ СЛ СЛ 4» 4» 4>»
СЛ 00 ь— сл CD
СО СО О tO —
О О
со -ч to -<i to
to -<1 4s» 4» -4
00 СЛ 00 00 4*
00 СО CD О) tO
tO CD CD >— СЛ
4» 00 СЛ СЛ О
со to к? to to to
to о со "к— о о
00 00 tO -<l --4 О
CD -4 4» -g -4 О
СО 00 00 00 --4
4s» CD 4*. >— О
tO tO CD i— ©
—4 --4 О О О ОСЛСЛСЛСЛ
4=» >— 00 © 00 •—» CD --4 О Ф»
4s» 4s- -4 tO CD 44000^
СЛ СЛ 4s» 4* 4s»
tO i— CD 00 -J
CD 4s» CD СЛ tO
4s»4s»4s»4s»4s» 4s» CO CO CO CO
СЛ 4» CO tO >— О CD -О О СЛ
CO -4 СЛ CO >— О О CD CD CO
+ 11 I Mill Mill
00 >— СЛ tO 00 >— ь— tO tO tO CO CO CO 4s» 4» 4s»
^4s» -»4 -^ - -0 Ю Ч^Спрон- СЛ 00^-OOO
OO ~4s» © CO ~*4s» "*—¦ О CD "*>—"»— О -<I 00
Mill I I I I I Mill I II II
4^СЛСЛСЛСЛ©©©©^1 ~ ~ " " " " " "
oo^-wpoo *— оо сл j<i о
CD 4s» 00 tO О О 00 О O0 н- "со СЛ О Ъо О ">— 1о СО ~4» СЛ
со сл о-^4 oo oo cd о о >-* >— >— to to оо со оо со 4* 4=» 4s» сл сл сл сл ооооо -о ^-J-<i ^j
О tO ЬЭ jf* ^fs» JO CD сл ~ О ^— СЛ CD CO j-4 О ^4s» -4 jD JO СЛ ОООСОСЛЧ О tO 4s» О 00 О Ю 00 СЛ Ч
">— Ъо со V со 4»Vioooico оо «о оо go Vi оо!оЪосл 1о"-ч1ослоо ololoco'oo loooooco
^. 4>» ^4s» 00 00 О0 рОрОрО СО 00 СО СО СО СО СО СО рО СО СО СО СО СО СО СО СО СО СО СО 00 СО 00 00 СО СО СО
1о ">— О 01о ОО 00 00 ^>1 Vl <| -<| О О О О СЛ СЛ СЛ СЛ СЛ 4» » 4» s» "*4» Ъо СО СО СО 1о 1о 1о 1о 1о ">—
СЛ н- tO О tO 00 СЛЮСООСО н- 00 О 4^ •— СО-ЧСЛСОО 0004s»tOO 0004»tOCO -4 СЛ СО >— СО
tO 004=»004^-4 СО — tO 4s» -J >—"ЧЬОООО ОСЛ4^ЬО»— CD CD -4 О О СЛСОЬООСО ЧСЛСЛЮО
со to to to to to to to to to to to to to to to to to to to to to to to
I I I I I I I I I I I I ЬЪооч ЬслслФ'Ь ооооюЬЬ ">—~>—"»—"н-^- "н-оооо
I I I I I I I I I ' ' lO4s»C000 4s»OO4s»C0Cn>—' OOCntOCO^jChCOi—'O00--4O4»
СОСЛОО СЛООСЛ00 ОСОСЛ4»СЛ СООСЛСЛ-О >— О CO О 00
О 4s» CO CO tO tO tO ь— н- н- ь— н- »— >—>—»—
JO-00CO СО 00 СП JO СО OOOpnOOjO ^ ^ О СО CD OOOO^l-vIO ООСЛСЛСЛ
4s»"»— tO >—СЛОЮ СО 0~4s»OOo"-4 OooloOO VoCn^V] V О ~*-4 СЛ lo
сл о оо го оо о сл о cnco4s»cooo слсосососо со о сл 4s» о >— со со »— о
»—СЛ 4s» tO СО >—СО СЛ СО СЛ 00 >—
Продолжение табл. II
р
6,0
6,5
7,0
7,5
8,0
8,5
9,0
9,5
10,0
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
Т
96,40
97,48
98,52
99,48
100,41
101,30
102,15
102,97
103,76
105,25
106,64
107,96
109,20
110,38
111,51
112,59
113,62
114,61
115,57
116,48
117,37
118,23
119,07
119,88
120,66
121,43
122,17
122,89
123,60
124,29
124,97
125,63
v'
1,405
1,417
1,429
1,440
1,451
1,463
1,474
1,485
1,496
1,517
1,538
1,559
1,581
1,604
1,628
1,653
1,678
1,703
1,730
1,758
1,788
1,820
1,852
1,887
1,925
1,966
2,012
2,068
2,133
2,212
2,318
2,482
V
—82,2
—79,9
—77,7
—75,6
—73,6
—71,6
—69,7
—67,9
—66,1
—62,7
—59,5
—56,4
—53,4
—50,5
—47,6
—44,8
—42,0
—39,2
—36,4
—33,6
—30,7
—27,8
—24,8
—21,8
—18,7
—15,5
—12,1
—8,6
—4,7
—0,4
4,8
11,3
г
169,4
167,3
165,3
163,3
161,3
159,3
157,4
155,6
153,7
150,1
146,5
143,0
139,4
135,9
132,3
128,7
125,1
121,4
117,6
113,7
109,6
105,4
101,0
96,4
91,6
86,5
81,0
75,2
68,8
61,7
53,2
41,8
s'
3,287
3,310
3,331
3,351
3,372
3,392
3,409
3,426
3,443
3,474
3,503
3,530
3,557
3,583
3,607
3,631
3,655
3,678
3,700
3,723
3,746
3,770
3,794
3,818
3,842
3,867
3,893
3,920
3,950
3,983
4,022
4,072
с'р
2,107
2,125
2,144
2,164
2,185
2,207
2,229
2,252
2,276
2,327
2,382
2,443
2,513
2,595
2,689
2,791
2,899
3,014
3,135
—
—
—
—
—
—
.—
—
—
f
Э'
6,550
6,942
7,347
7,766
8,200
8,651
9,121
9,611
10,12
11,22
12,44
13,79
15,30
17,02
18,98
21,25
23,92
27,10
30,99
35,86
42,19
50,87
63,76
—
—
—
—
—
—
Таблица III
Термодинамические свойства азота в однофазной области
т, °к
65
70
75
ОООО
СЛ О
90
95
100
105
ПО
115
120
125
130
. 135
140
150
Р
0,8584
0,8385
0,8172
0,004385
0,004099
0,003851
0,003633
0,003439
0,003266
0,003111
0,002970
0,002841
0,002724
0,002616
0,002516
0,002424
0,002259
V
1,1650
1,1927
1,2237
228,0
244,0
259,7
275,3
290,8
306,2
321,5
336,8
352,0
367,2
382,3
397,4
412,5
442,6
При р
i
—144,8
—135,1
—125,4
80,0
85,6
91,1
96,5
101,8
107,2
112,5
117,8
123,1
128,4
133,7
138,9
144,2
154,7
= 1 бар
s
2,515
2,656
2,789
5,447
5,516
5,578
5,636
5,692
5,744
5,793
5,840
5,886
5,929
5,970
6,010
6,048
6,120
СР
1,929
1,936
1,948
1,151
1,107
1,086
1,075
1,070
1,066
1,063
1,061
1,058
1,057
1,055
1,053
1,052
1,050
Р
1,976
2,284
2,681
.
—
—
—
54
Продолжение табл. Ill
Т, °К
65
70
75
80
85
90
95
100
105
.110
.115
.120
125
130
.135
140
150
р
0,8591
0,8392
0,8181
0,7957
0,7719
0,7466
0,02036
0,01891
0,01769
0,01664
0,01574
0,01494
0,01423
0,01359
0,01301
0,01249
0,01157
V
1,1640
1,1916
1,2224
1,2568
1,2955
1,3394
49,11
52,89
56,53
60,08
63,54
66,94
70,28
73,58
76,84
80,07
86,45
При р -
i
— 144,5
—134,8
—125,1
—115,4
—105,5
—95,5
87,8
94,1
100,2
106,1
112,0
117,8
123,5
129,1
134,7
140,3
151,3
= 5 бар
s ч
2,513
2,654
2,786
2,911
3,030
3,145
5,097
5,161
5,221
5,276
5,328
5,377
5,424
5,468
5,511
5,551
5,627
ср
1,926
1,933
1,943
1,959
1,984
2,024
1,283
1,234
1,203
1,181
1,163
1,149
1,137
1,126
1,117
1,109
1,095
Э
1,963
2,267
2,657
3,165
3,841
' 4,770
—
—
—
—
—
—
—
Продолжение табл. III
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8599
0,8402
0,8192
0,7969
0,7734
0,7484
0,7216
0,6925
0,04040
0,03702
0,03435
0,03215
0,03028
0,02867
0,02726
0,02600
0,02387
я
-1,1629
1,1902
1,2208
1,2548
1,2930
1,3362
1,3858
1,4440
24,75
27,01
29,11
31,10
33,02
34,88
36,69
38,46
41,90
При р =
i
— 144,1
—134,4
* —124,8
—115,0
— 105,2
—95,3
—85,1
—74,5
89,5
96,8
103,7 •
110,4
116,8
123,0
129,2
135,2
146,9
= 10 бар
s
2,511
2,651
2,783
2,907
3,026
3,141
3,251
3,360
4,942
5,010
5,072
5,128
5,181
5,230
5,276
5,320
" 5,401
СР
1,922
1,928
1,938
1,953
1,976
2,012
2,070
2,164
1,516
1,417
1,350
1,304
i,267
1,237
1,213
1,192
1,160
Р
1,948
2,246
2,628
3,123
3,779
4,672
5,942
7,871
—
—
—
—
—
55
Продолжение табл. Ill
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8608
0,8411
0,8202
0,7981
0,7748
0,7501
0,7237
0,6952
0,6635
0,6266
0,05782
0,05280
0,04889
0,04569
0,04304
0,04073
0,03697
V
1,1618
1,1889
1,2192
1,2529
1,2906
1,3331
1,3817
1,4384
1,5071
1,5959
17,30
18,94
20,46
21,88
23,24
24,55
27,05
При р =
i
—143,6
—134,0
— 124,4
—114,7
— 104,9
—95,0
—84,9
—74,4
—63,4
—51,4
93,7
101,8
109,2
116,3
123,2
129,7
142,4
= 15 бар
s
2,508
2,648
2,780
2,903
3,022
3,136
3,246
3,354
3,462
3,575
4,887
4,956
5,017
5,073
5,124
5,172
5,259
СР
1,918
1,924
1,932
1,946
1,968
2,001
2,055
2,140
2,283
2,555
1,688
1,547
1,452
1,386
1,334
1,294
1,234
Р
1,933
2,226
2,600
3,083
3,718
4,578
5,788
7,593
10,55
16,33
—
—
—
—
Продолжение табл. III
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8616
0,8420
0,8213
0,7994
0,7762
0,7518
0,7258
0,6978
0,6670
0,6315
0,5869
0,07955
0,07143
0,06549
0,06086
0,05708
0,05112
V
1,1607
1,1876
1,2176
1,2510
1,2883
1,3301
1,3778
1,4331
1,4994
1,5835
1,7040
12,57
14,00
15,27
16,43
17,52
19,56
При р -
i
—143,2
—133,7
—124,0
—114,4
—104,6
—94,7
—84,7
—74,3
—63,4
—51,7
—38,2
91,1
100,5
108,8
116,5
123,6
137,5
= 20 бар
s
2,506
^,646
2,776
2,900
3,018
3,132
3,241
3,347
3,454
3,565
3,685
4,802
4,879
4,944
5,002
5,056
5,150
СР
1,914
1,919
1,927
1,940
1,960
1,991
2,040
2,117
2,245
2,476
3,029
2,021
1,752
1,598
1,496
1,422
1,322
Э
1,918
2,206
2,572
3,043
3,660
4,489
5,643.
7,337
10,04
15,05
28,00
*
—
—
—
—
56
Продолжение табл. Ill
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8624
0,8430
0,8223
0,8006
0,7777
0,7535
0,7278
0,7003
0,6702
0,6361
0,5945
0,1225
0,1011
0,08945
0,08143
0,07536
0,06636
V
1,1607
1,1876
1,2176
1,2510
1,2883
1,3272
1,3739
1,4279
1,4920
1,5720
1,6820
8,163
9,892
11,18
12,28
13,27
15,07
/ При р =
i
—142,8
—133,3
—123,7
—114,0
— 104,3
—94,5
—84,5
—74,2
—63,4
—51,9
—39,0
75,0
89,4
100,0
109,1
117,4
132,4
= 25 бар
s
2,503
2,643
2,773
2,896
3,014
3,127
3,236
3,341
3,447
3,555
3,671
4,626
4,743
4,826
4,895
4,955
5,059
СР
1,911
1,915
1,922
1,934
1,952
1,981
2,026
2,097
2,211
2,409
2,834
3,765
2,360
1,941
1,726
1,591
1,426
13
1,903
2,186
2,545
3,005
3,604
4,404
5,505
7,099
9,589
13,98
24,09
—
—
—
—
Продолжение табл. III
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8632
0,8439
0,8234
0,8018
0,7791
0,7551
0,7298
0,7028
0,6734
0,6404
0,6013
0,5462
0,1505
0,1209
0,1062
0,09625
0,08299
V
1,1584
1,1850
1,2145
1,2472
1,2836
1,3243
1,3702
1,4229
1,4850
1,5614
1,6631
1,8309
6,644
8,270
9,419
10,39
12,05
При р =
i
—142,4
—132,9
—123,3
—113,7
—104,0
—94,2
—84,3
—74,0
—63,4
—52,1
—39,6
—24,1
72,3
89,0
100,6
110,3
127,0
= 30 бар
s
2,501
2,640
2,770
2,893
3,010
3,123
3,231
3,336
3,440
3,546
3,658
3,791
4,573
4,705
4,792
4,862
4,978
СР
1,907
1,911
1,918
1,928
1,945
1,971
2,013
2,077
2,180
2,352
2,690
3,825
4,733
2,616
2,084
1,822
1,553
3
1,888
2,167
2,519
2,968
3,550
4,322
5,375
6,879
9,173
13,08
21,26
53,23
—
—
57
Продолжение табл. Ill
Т °К
65
70
75
80
85
90
95
100
105
НО
115
120
125
130
135
140
150
Р
0,8640
0,8448
0,8244
0,8030
0,7804
0,7567
0,7318
0,7052
0,6764
0,6445
0,6074
0,5587
0,4669
0,1704
0,1377
0,1209
0,1012
V
1,1574
1,1837
1,2130
1,2454
1,2814
1,3214
1,3666
1,4181
1,4784
1,5516
1,6465
1,7898
2,142
5,867
7,262
8,271
9,884
При р =
i
— 142,0
—132,5
— 122,9
— 113,3
— 103,7
—93,9
—84,0
—73,9
—63,4
—52,3
—40,1
—25,8
+0,7
71,1
90,2
102,2
121,2
= 35 бар
s
2,498
2,637
2,767
2,890
3,006
3,119
3,226
3,330
3,434
3,538
3,646
3,769
3,984
4,527
4,676
4,768
4,903
СР
1,903
1,907
1,913
1,922
1,938
1,962
2,000
2,060
2,152
2,303
2,579
2,977
3,593
4,687
2,721
i 2,162
1 1J10
Р
1,874
2,148
2,493
2,932
3,498
4,243
5,252
6,673
8,800
12,29
19,11
39,35
—
—
—
—
Продолжение табл. III
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8648
0,8457
0,8254
0,8041
0,7818
0,7583
0,7337
0,7075
0,6793
0,6484
0,6129
0,5687
0,4995
0,3047
0,1822
0,1509
0,1213
V
1,1563
1,1824
1,2115
1,2436
1,2791
1,3187
1,3630
1,4135
1,4720
1,5423
1,6315
1,7585
| 2,002
3,282
5,488
6,623
8,241
При р =
i
— 141,6
— 132,1
— 122,5
— 113,0
— 103,4
—93,7
—83,8
—73,7
—63,3
—52,4
—40,6
—27,0
-5,2
35,4
76,0
91,8
115,0
= 40 бар
s
2,495
2,634
2,764
2,886
3,002
3,114
3,221
3,325
3,427
3,530
3,636
3,752
3,932
1 4,265
4,541
I 4,667
4,832
СР
1,900
1,903
1,908
1,917
1,931
1,958
1,989
2,043
2,127
2,261
2,491
2,929
3,750
15,027
4,090
2,690
1,906
Э
1,860
2,129
2,468
2,897
3,447
4,168
5,135
6,481
8,459
11,61
17,41
31,87
—
—
—
—
.'55
Продолжение табл. Ill
Т, °К
65
70
75
80
85
90
95
100
105
110
115
120
125
130
135
140
,150
р
0,8656
0,8466
0,8265
0,8053
0,7831
0,7599
0,7355
0,7097
0,6822
0,6520
0,6181
0,5771
0,5187
0,4161
0,2521
0,1892
0,1439
V
1,1552
1,1812
1,2100
1,2418
1,2769
1,3160
1,35*96
1,4090
1,4659
1,5336
1,6180
1,7329
1,928
2,403
3,966
5,284
6,951
При р =
1
— 141,2
— 131,7
— 122,2
— 112,6
— 103,0
—93,4
—83,6
—73,6
—63,2
—52,5
—40,9
—28,0
—8,8
17,0
54,7
79,0
108,3
= 45 бар
s
2,493
2,632
2,761
2,883
2,999
3,110
3,217
3,319
3,421
3,522
3,626
3,737
3,892
4,104
4,376
4,554
4,762
СР
1,896
1,899
1,903
1,911
1,924
1,945
1,977
2,028
2,104
2,223
2,419
2,812
3,498
7,062
6,710
3,528
2,152
Р
1,846
2,111
2,443
2,862
3,398
4,095
5,024
6,302
8,147
11,01
16,02
27,07
—
—
—
Продолжение табл. III
г, °к
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
Л50
Р
0,8664
0,8475
0,8275
0,8064
0,7844
0,7615
0,7374
0,7120
0,6849
0,6556
0,6228
0,5844
0,5330
0,4585
0,3334
0,2379
0,1690
V
1,1541
1,1800
1,2085
1,2400
1,2748
1,3133
1,3562
1,4046
1,4601
1,5254
1,6055
1,7111
1,876
2,181
2,999
4,204
5,915
При р =
i
— 140,7
— 131,3
— 121,8
—112,3
— 102,7
—93,1
—83,3
—73,4
—63,1
—52,5
' —41,2
—28,7
— 11,4
* 9,7
38,4
65,8
101,1
=50 бар
s
2,491
2,629
2,758
2,879
2,995
3,106
3,212
3,314
3,415
3,515
3,616
3,723
3,862
4,046
4,260
4,447
4,692
СР
1,893
1,895
1,899
1,906
1,918
1,937
1,967
2,013
2,083
2,190
2,358
2,682
3,311
4,753
6,878
4,574
2,450
Р
1,832
2,093
2,419
2,829
3,351
4,026
4,918
6,133
7,860
10,48
14,87
23,69
—
—
—
—
59
Продолжение табл. Ill
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8680
0,8493
0,8294
0,8087
0,7870
0,7645
0,7409
0,7162
0,6901
0,6622
0,6316
0,5970
0,5546
0,5015
0,4277
0,3397
0,2274
V
1,1520
1,1775
1,2056
1,2366
1,2706
1,3081
1,3497
1,3962
1,4490
1,5102
1,5834
1,6752
1,803
1,994
2,338
s 2,944
4,397
При р =
i
— 139,9
— 130,5
— 121,0
—111,5
— 102,1
—92,5
—82,8
—73,0
—62,9
—52,5
—41,5
—29,8
— 15,0
+ 3,2
25,2
48,0
85,8
= 60 бар
s
2,486
2,624
2,752
2,873
2,988
3,098
3,203
3,304
3,403
3,501
3,599
3,701
3,820
3,970
4,124
4,296
4,556
СР
1,886
1,887
1,890
1,896
1,906
1,922
1,947
1,987
2,045
2,132
2,262
2,448
2,736
3,346
4,465
4,810
3,102
Э
1,806
2,058
2,372
2,765
3,260
3,894
4,720'
5,824
7,350
9,569
13,04 *
19,16
—
—
—
Продолжение табл. III
Т, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8696
0,8510
0,8314
0,8109
0,7896
0,7674
0,7444
0,7203
0,6951
0,6683 .
0,6394
0,6076
0,5711
0,5274
0,4733
0,4075
0,2891
V
1,1500
1,1751
1,2028
1,2332
1,2665
1,3031
1,3434
1,3883
1,4387
1,4964
1,5640
1,6459
1,7510
1,896
2,113
2.454
3,459
При р =
i
— 139,1
— 129,7
—120,3
— 110,8
— 101,4
—91,9
—82,3
—72,6
—62,6
—52,4
—41,7
—30,4
—16,9
—1,1
16,6
35,6
71,6
= 70 бар
s
2,481
2,618
2,746
2,866
2,981
3,090
, 3,194
3,294
3,392
3,488
3,584
3,681
3,792
3,916
4,052
4,191
4,436
ср
1,879
1,880
1,882
1,886
1,894
1,908
1,929
1,963
2,013
2,086
2,189
2,323
2,509
2,818
3,409
3,938
3,416
Р
1,780
2,025
2,328
2,704
3,175
3,772
4,540
5,548
6,909
8,821
11,66
16,23
24,62
—
—
—
60
Продолжение табл. Ill
7, °К
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8711
0,8527
0,8333
0,8131
0,7921
0,7703
0,7477
0,7242
0,6997
0,6740
0,6465
0,6168
0,5839
0,5460
0,5020
0,4500
0,3427
V
1,1480
1,1727
1,2000
1,2299
1,2625
1,2983
1,3375
1,3803
1,4291
1,4838
1,5467
1,6212
1,7127
1,8315
** 1,992
2,222
2,918
При р =
i
— 138,2
— 128,9
— 119,5
— 110,1
— 100,7
—91,3
—81,7
—72,1
—62,3
—52,2
—41,8
—30,9
— 18,2
—4,1
11,2
27,6
60,7
= 80 бар
s
2,476
2,613
2,740
2,860
2,974
3,083
3,186
• 3,285
3,382
3,476
3,570
3,664
3,765
3,875
3,991
4,107
4,342
СР
1,873
1,873
1,874
1,877
1,883
1,895
1,913
1,942
1,985
2,046
2,131
2,233
2,364
2,558
2,904
3,306
3,334
Р
1,755
1,993
2,285
2,646
3,095
3,658
4,374
5,299
6,524
8,194
10,57
14,15
20,01
30,95
—
Продолжение табл. III
т, °к
70
75
80
85
90
95
100
105
110
115
120
125
130
135
140
150
р
0,8544
0,8352
0,8152
0,7945
0,7730
0,7509
0,7280
0,7042
0,6793
0,6531
0,6251
0,5947
0,5611
0,5228
0,4794
0,3850
V
1,1704
1,1978
1,2267
1,2587
1,2936
1,3317
1,3737
1,4201
1,4721
1,5312
1,5997
1,6814
1,7823
1,9127
2,086
2,596
При р -
i
— 128,0
—118,7
— 109,4
—100,0
—90,6
—81,2
—71,6
+-61,9
—52,0
—41,8
-3D
—19,2
—6,2
7,8
22,5
52,9
= 90 бар
s
2,608
2,735
2,854
2,967
3,076
3,178
3,276
3,372
3,465
3,556
3,648
3,743
3,844
3,950
4,054
4,272
СР
1,866
1,867
1,869
1,873
1,882
1,898
1,923
1,960
2,013
2,083
2,164
2,262
2,397
2,612
2,910
3,125
В
1,961
2,244
2,590
3,019
3,551
4,221
5,075
6,183
7,658
9,685
12,59
16,99
24,16
—
—
—
Продолжение табл. III
т, °к
70
75
80
85
90
Р
0,8560
0,8371
0,8173
0,7969
0,7758
V
1,1682
1,1946
1,2235
1,2549
1,2891
При р =
i
— 127,2
—117,9
—108,6
—99,3
—90,0
= 100 бар
s
2,603
2,729
2,848
2,960
3,068
СР
1,860
1,859
1,860
1,864
1,871
C
1,931
2,204
2,538
2,947
3,452
61
Продолжение табл. lit
Т, °К
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,7540
0,7316
0,7084
0,6844
0,6592
0,6326
0,6042
0,5735
0,5397
0,5015
0,4184
V
1,3262
1,3668
1,4115
1,4612
1,5170
1,5807
1,6550
1,7436
1,8530
1,994
2,390
При р =
i
—80,6
—71,1
—61,5
—51,7
—41,7
—31,3
— 19,8
—7,8
5,4
19,0
47,4
= 100 бар
s
3,170
3,267
3,362
3,454
3,544
3,634
3,727
3,823
3,920
4,018
4,218
СР
1,885
1,906
1,938
1,984
2,044
2,106
2,185
2,286
2,423
2,651
2,9 Ц
Э
4,080
4,870
5,880
7,195
8,951
11,37
14,82
20,00
—
—
—
Продолжение табл. III
Т, °К
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8601
0,8416
0,8224
0,8026
0,7823
0,7614
0,7402
0,7183
0,6960
0,6729
0,6490
0,6241
0,5980
0,5704
0,5405
0,4757
V
1,1626
1,1882
1,2160
1,2460
1,2784
1,3133
1,3511
1,3921
1,4369
1,4862
1,5409
1,6024
1,6721
1,7533
1,850
2,102
При р -
i
—125,2
— 116,0
— 106,8
—97,5
—88,3
—79,1
—69,8
—60,4
—50,8
—41,1
—31,1
—20,5
—9,4
2,4
14,4
39,1
= 125 бар
s
2,590
2,715
2,833
2,944
3,051
3,151
3,247
3,340
3,429
3,516
3,603
3,690
3,778
3,866
3,952
4,126
СР
1,844
1,842
1,841
1,842
1,846
1,855
1,870
1,893
1,926
1,968
2,011
2,059
2,115
2,186
2,283
2,509
Э
1,860
2,112
2,415
2,782
3,227
3,769
4,431
5,250
6,270
7,560
9,214
11,37
14,21
—
—
—
Продолжение табл. lit
Т, °К
70
75
80
85
90
95
100
105
110
115
Р
0,8641
0,8460
0,8272
0,8080
0,7884
0,7684
0,7481
0,7274
0,7063
0,6848
V
1,1573
1,1821
1,2088
1,2376
1,2684
1,3014
1,3368
1,3748
1,4158
1,4602
При р =
1
—123,1
— 114,0
—104,9
—95,7
—86,6
—77,5
—68,3
—59,1
—49,7
—40,2
= 150 бар
2,578
2,702
2,819
2,929
3,035
3,134
3,228
3,319
3,407
3,492
СР
1,830
1,827
1,824
1,823
1,825
1,830
1,841
1,858
1,883
1,915
3
1,795
2,028
2,306
2,637
3,033
3,506
4,072
4,752
5,574
6,572.
62
Продолжение табл. Ill
Т, °К
120
125
130
135
140
150
Р
0,6628
0,6403
0,6171
0,5929
0,5681
0,5133
V
1,5087
1,5618
1,6205
1,6867
1,762
1,948
При р =
i
—30,6
—20,4
— 10,0
1,0
12,2
34,9
= 150 бар
s
3,575
3,658
3,743
3,823
3,902
4,064
СР
1,948
1,987
2,032
2,086
2,146
2,270
3
7,794
9,297
11,15
—
Продолжение табл. Ill
Т, °К
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8679
0,8502
0,8319
0,8132
0,7942
0,7749
0,7554
0,7357
0,7157
0,6955
0,6750
0,6541
0,6329
0,6112
0,5886
0,5411
V
1,1522
1,1762
1,2020
1,2296
1,2591
1,2904
1,3238
1,3593
1,3972
1,4348
1,4815
1,5287
1,5800
1,6361
1,699
1,848
При р =
i
— 121,1
— 112,0
—102,9
—93,9
—84,9
—75,8
—66,8
—57,6
—48,4
—39,1
—29,7
—19,9
—9,8
+ 0,8
11,4
32,7
= 175 бар
s
2,566
2,690
2,805
2,915
3,019
3,117
3,210
3,300
3,387
3,470
3,552
3,632
3,713
3,791
3,867
4,018
ср
1,816
1,812
1,809
1,807
1,807
1,810
1,817
1,830
1,849
1,874
1,901
1,932
1,968
2,011
2,056
2,131
Р
1,734
1,951
2,206
2,508
2,863
3,280
3,771
4,348
5,028
5,830
6,780
7,905
9,237
—
—
—
Продолжение табл. Ill
т, °к
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
р
0,8716
0,8543
0,8364
0,8182
0,7998
0,7811
0,7623
0,7434
0,7244
0,7052
0,6858
0,6663
0,6466
0,6266
0,6061
0,5631
V
1,1473
1,1706
1,1956
1,2221
1,2504
1,2802
1,3118
1,3452
1,3805
1,4181
1,4581
1,5008
1,5466
1,5959
1,650
1,776
При р =
i
— 119,0
—110,0
— 101,0
—92,0
—83,1
—74,1
—65,1
—56,1
—47,0
—37,9
—28,6
— 19,1
—9,3
1,0
11,1
31,6
= 200 бар
s
2,555
2,677
2,792
2,901
3,004
3,101
3,194
3,282
3,368
3,450
3,530
3,609
3,687
3,763
3,837
3,980
СР
1,804
1,800
1,796
1,792
1,791
1,792
1,797
1,807
1,823
1,843
1,864
1,891
1,921
1,955
1,987
2,044
0
1,678
1,880
2,116
2,392
2,713
3,085
3,515
4,013
4,587
5,250
6,016
6,898
7,912
__
—
—
63
4^
СЛ 4^ СО СО Ю tO --OOCD CD 00 00 — ) 4|
о ослосло сл о ел о ел ослосло
ооооо ооооо
41 41 V» V] Vj 00 00 00 00 00
СО 4^ О 00 CD >— СО 4^ О 00
ООС0041 СЛ tO CD СЛ tO
О CD 00 CD CD O •— О 00 •—
О ООООО ООООО ООООО
СЛ О О О О 41
CD 00 СЛ О) 00 О
-Ч 4^ •— CD 4) 4^
О •— CD СЛ ¦— 41
414141414) 00 00 00 00 00
tO СО СП 41 CD •— tO 4^ О» 4
tO CD 4) СЛ ЬО О -О СЛ tO 00
СО CD 4^ О О tO О О О 4)
со со со to to to to >— — •—
О) CO О 00 СЛ Ю О-О СЛ 00
CD00CDO00 О ' -1 СП СО
CD CD tO О tO CD 00 00 О О)
О) СЛСЛ4^4^4^ СО СО СО tO tO tO tO •— •— •—'
4 4 00 CD СП >— 00 СЛ Ю CD О) 00 0 00 0H0
СЛ 4 4^ CO СЛ CD 4^ •— О О — 4^ 00 CO О 00
0 0H0 0 СЛ О) 00 00 4 00 tO СЛ О О
Mill Mill
00 4^ СЛ СП О 4 00 CD >— •—¦
00 tO ь- CD 00 4 р> СЛ О •—
ел со"—о 4 cnloo-wi°
CD 4
00 - II I
•— •— to 4 >— to
пОО
to -jo сл-
I I
II II I
ЧООСО^ь-
СОООЧОь-
CO О О О CD 4 СЛ
00 00 00 00 00 tO tO tO tO tO
00 00 tO и- О
CD — 00 4^ СЛ
4 00 СЛ 00 00
CD.00 4 О СЛ
О О СЛ 4^ tO
00 tO O) 00 00
00 00 00 00 CO 00 CO CO CO CO CO tO tO tO tO tO
~cd о "ел 4^ Vcoto"b-o cDOoVioiCn
tO 00 и- 4^ О CD >— СО СП О) -О 4 S О) СЛ 00
н- 4 4 4^ 00 Ю 4^ 4^- О CO tO О) 4^ "О 4^ CO
4 4 4 4 4 -о -о 4 -о 4
¦О О) СЛ СЛ СЛ СЛ СП О) О) —Л
CD 00 CD 4^ 00 4^ 4 >— О >—'
43
CD 00 00 00 00 00
tO CD -О СЛ СО н—
СО •— >— >— К) СО
4 4 4 4 4 —^1 —-Л —3 —--1 —-J
CD 00 4 О) О) О О 4 4 00
4 СО СО "О 4^ СЛ 4 tO О) >—
4^ СО СО to tO tO tO н- н- »—
О О) tO CD О)
4 СЛ 4 СО tO
СО СЛ СЛ СО СП
СО •— 00 О) СЛ
СЛ О 00 CD СО
О СЛ 00 Ч| —
рСЛ^ ^СлЭООСОЬО N3NDJ— ^*^—
I ^—Cn'cD СО CD 4^*—4 V^—~CD~4Cn
1 CO tO CO CD •— 00 О О) СЛСОСПСПЧ
CD CD CO —J О О tO — 00 tO 00 4^ 4
о ооооо ооооо ооооо
сл ооооо Vi Vj "-о "-о Vj ооооЪоооЪо
00 Ю 4^ СЛ 4 CD •— СО СЛ О 00 ОЮ4^СЛЧ
— н- о 00 41 СЛ 4^ tO О 00 4 СЛ СО О 00 СЛ
О н- О 41 tO 41 •—4^ О 00 О н- О 00 tO tO
4
о
41 О СЛ СЛ 4^ 4^
tO >— О •— 41 СО
>— О tO 00 О 41
4^ tO О 4^
4^ СО СО СО tO tO tO н- »— н-
0 05W04 4^^—00 0 4^
О СЛ Ю О О tOCHCDCntO
4^ 4^ tO 41 41 — О 4^ tO О
» - Ml Mill II II I
н- н- н— 00 н- tO CO 4^ СЛ О 41 00 CD CD >— •—'
кч г л ^ гп °° ^ О СЛ 4^ СО tO ^ОСООн-
to со й^- сл» •* - >• - - v. - ~ ~ т оч
— 4^ СЛ СЛ СЛ 4^ СО Ю — О - -
OCD
СО СО СО СО СО СО СО СО СО СО СО tO tO tO tO tO
~CD 00 41О)ЪяСЛ Vcolo">— О CD 00 41 О СЛ
4^ н—СО О 00 >— CO СП О 41 00 CD 00 00 О 4^
CD н-оо^ООО "—ОО00О О 41 О СЛ 4^
CD CD 00 00 00
СО О 00 СЛ СО
СО СЛ СО 00 4^
0000414141 414L1-441
— О 00 00 4 —J 41 00 00 CD
41 н- cd >— 41 4 CD CO 4 tO
I I
ООСЛ 4^4^CO00tO tO tO tO •—' •—*
CD и- 4^
CO CO >—
00 CO 4]
^^Г^^ СЛЮО00О
00 tO tO CD •— -4 00 00 и- tO
tOCOcDCnCO CD41C04^0
Продолжение табл. Ill
Т, °К
120
125
130
135
140
150
р
0,7131
0,6963
0,6794
0,6626
0,6459
0,6105
V
1,4023
1,4362
1,4718
1,5091
1,548
1,638
При р =
1
—24,5
—15,6
—6,2
3,0
12,4
31,6
= 275 бар
s
3,475
3,550
3,624
3,696
3,765
3,896
СР
1,794
1,809
1,826
,1,841
1,855
1,883
Р
4,534
5,040
5,594
—
Продолжение табл. III
Т, °К
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8855
0,8694
0,8530
0,8364
0,8197
0,8031
0,7865
0,7699
0,7535
0,7372
0,7209
0,7047
0,6886
0,6725
0,6566
0,6230
V
1,1294
1,1502
1,1723
1,1956
1,2199
1,2452
1,2715
1,2988
1,3271
1,3565
1,3871
1,4190
1,4523
1,4870
1,523
1,605
При р =
i
—110,6
— 101,8
—93,0
—84,3
—75,5
—66,8
—58,1
—49,4
—40,6
—31,8
—23,0
— 14,0
—4,9
4,2
13,4
32,3
= 300 бар
s
2,513
2,632
2,744
2,850
2,951
3,045
3,135
3,221
3,303
3,382
3,459
3,532
3,605
3,677
3,744
3,873
СР
1,761
1,756
1,752
1,747
1,744
1,743
1,744
1,748
1,755
1,764
1,776
1,789
1,802
1,815
1,828
1,848
Р
1,488
1,645
1,823
2,025
2,251
2,503
2,783
3,090
3,428
3,797
4,199
4,636
5,108
—
—
—
Продолжение табл. III
Т, °К
1
75
80
85
90
95
100
105
НО
115
120
125
130
135
140
150
Р
0,8729
0,8568
0,8406
0,8243
0,8080
0,7918
0,7757
0,7598
0,7440
0,7283
0,7126
0,6971
0,6816
0,6662
0,6341
V
1,1456
1,1671
1,1897
1,2132
1,2376
1,2629
1,2891
1,3161
1,3441
1,3731
1г4032
1,4346
1,4671
1,501
1,577
При р =
i
—99,7
—91,0
—82,3
—73,6
—64,9
—56,3
—47,6
—38,9
—30,1
—21,4
—12,5
—3,4
5,5
14,6
33,3
= 325 бар
s
2,621
2,733
2,838
2,938
3,033
3,122
3,207
3,289
3,367
3,443
3,516
3,588
3,658
3,726
3,853
СР
1,748
1,743
1,739
1,736
1,734
1,735
1,738
1,744
1,752
1,761
1,772
1,783
1,794
1,804
1,821
Р
1,596
1,763
1,951
2,161
2,393
2,648
2,927
3,230
3,558
3,912
4,294
4,704
—
—
5 Зак
. 1978
65
о оо тн о со
ЮОООЬСП
ю t> оо о см
К «—I «^ CD Ю
СМ 00 Ю ^ СО
ICNOCOCO
^Г^н^СМСМ СМСМСОСОСО
см ем
О CD |
О СО |
° I
CD Ю *—| 00 СО t^- CD ^ ^ 0> OOt^CD^CD
СОСОСОСМСМ СМ СМ СО 'Ф ^ Ю СО h- 00 CD
с—— ir— с-— с—— t-— г— г— с^— t— г— г~— t— t— tr— t—
о
о
с:
rnC^NNO CD ^ CO CO 0> г-н 00 —« 00 ^f
i-ч CM CM CM CM О 05 l>-Ю CM ON^OCO
CO 0- 00 05 O^ -и -^ CM^ C0^ -* ID Ю^ Ф t>^ 00
см cm" cm" cm" со" со" со" со" со" со" со" со" со" со" со"
СО CD СО СО О ^N-nrt^ 05
oTodo-^co ^"ю"^"оо"о5 о^0-0^0^
O50000t^CO Ю^СОСМ^" ^-н^Ю^
Mill II I II II ~т
гнОООО^ 00 CD 00 СО CM 00 ^Г4 СМ
—1 CM tF СО О ^ 0> Ю СМ О 00 00 CD —< СМ
rfCDOOOCO Ю h- О СО СО 00 *-* ^ 00 Ю
г-н —I г-н СМ СМ СМСМСОСОСО СО ^h ^ ^ Ю
rf СО СО СО h- О СО 00 ^f CM ^-нООСМСО
tHO^OOtN N-нЮОЮ ОЮОЮ^
h- CO Tf СМ —i CD 00 СО Ю СО СМ О CD C-- ^Р
00 00 00 00^ 00^ Г-- l> t^ Г> f^ Ь- t- CO CD CO
o" o" o" o" o" o" o" o" o" o" o" o" o" o" o"
ю о ю о ю
t>- ОО 00 CD О)
Ь- Ю -н СО СМ
О Ю СМ О О
io со^ с© о^ см
—Г г-Г ^ч" см" см"
со см см см см
t—- г— t— t— t—
»—«^—' со ltd со
О т-Н ~Н -Н О
CD С^ 00^ 05 О^
см" см" см" см" со"
LO CD CO t4^ *-^
Ю" СО ОО" О" —"
С> 00 Г- СО СО
Mill
t^- СМ Ю СО Ю
СО t-- 00 О СО
СО Ю h- О СМ
—> ^н ^- СМ СМ
Ь- СМ Ю CD СО
CD ¦"* 00 CM t^.
h- CO Tfi CO —i
00^ 00^ 00^ 00^ 00
o" o" o" o" o"
ю о ю о ю
t>. 00 00 CD 05
NC0O5 1O00
—¦ rJH 05 CO TJH
см" cm" cm" со" со"
О —' CO -—< 00
см см см со со
С- h~ t-- h- t^
NtNCOOlO
CD 00 CO ^ '—i
О — CM^ C0^ tJh
CO" CO" CO" CO CO"
»D СО СМ^ CD Oi
см" со" ю" со" о-"
Ю -Ф СО СМ —'
Mill
—< СО СМ 00 —<
t^- —¦ CD —< 00
*Ф Ь- CD CM т^
CM CM CM CO CO
CD CD Ю CO 00
*-. CO —< CO ~н
00 t> t^ (>• t^
o" o" o" o" o"
оюоюо
о о —* —< см
3,750'
4,069
CO CO -н 00 CD
тф ю CD CO h-
t-, t-. ^ ^ о
t^- (>. тЧН у^ (.?)
00Ю CM CD-*
"ф Ю СО СО 00
со" со" со" со со"
СМ СО СО тр -ф
cd" о" оо" г--" ю
1 1 -"
<Ф СО 00
Ю СО CM CO CD
t^- О СО СО СМ
—1 Ю О h- О
Г- СМ 00 СО "Ф
СМ —| CD 00 Ю
"Г-t--CO CO СО^
о" о" о" о" о"
юоюоо
СМ СО СО "Ф Ю
ие табл. III
родолжен
С5
При р = 400 бар
QQ.
сх
Сз
ел
•-
а
а
»
со h- CM со оо
СО О СО СО ^
rf CO t^ C75 -н
*S ^-Г г-н" .-Г см"
'Ф —1 h- Ю СО
СМ СМ —• —< —|
05 О О О О
Ю^ h* 00 05 СП
см" см" см" см" см"
т^ СО <М^ СО^ —^
со" ^t4" со" г--" cd"
CD 00 Г^ СО Ю
М 1 II
Ю Ю CM h- CD
CM CM CO ^h CO
ONCOON
CO J> CM t^ —•
00 CD Ю CO CM
00 00^ 00 00^ 00
o" o" o" o" o"
ю о ю о ю
Ь- 00 00 СЛ О)
^-| СО Ю О Ю
СОЮЬОСЧ
см" см" см" со" со"
СО Ю 00 СО 00
—| —1 —1 СМ СМ
tr— ir— г— с— t-—
Ю О *-| Г- СМ
ооьюс^о
О -н СМ СО ^
со" СО" СО" СО" СО"
Ю^ О) -^ 00 ^
о" —^" СО" ^" СО"
Ю tJh СО СМ -н
1 II II
Ь- -н О CD CD
CD СО Ь- '—< СО
СО CD 00 —1 СО
СМ СМ СМ СО СО
h* t>- О т*« О
СО —1 I4- СМ 00
О О h- CO Tf
°ч ^ ^ ^t^-
о" о" о" о" о"
оюоюо
о о —1 -ч см
3,529
3,814
Ю —i t-- СО СО
СО Tf* Tf Ю CD
t^ t^ t-- (^ t^
CO "Ф CD Ю 0>
rt^ Ю_ CD CD t^-
CO CO CO" CO" CO"
Ю^ ^ CM CD 00
h-" —н" о" СО" СО"
| СО
CD 00 Ю
CM CD Г- СО О)
СО 00 —¦< rt< О
СО СО Tf Tf Ю
h-lOiOCON
СО CD Ю —< СМ
СО '—« О CD CD
h- t>- t>- CO^ CD^
o"o"o"o"o"
юоюоо
CM CO CO ч*1 Ю
MD
00 ~-< 00 00 О CO CO CO Ю 00 rf —«
CMCOOCOrh CM CM CO Ю 00 CO СП
^lOl^OOO CM ¦¦Ф CO 00 О CO LO
^ ^ ^ ,-Г см cm" cm" cm cm со" со" со"
i
^Ч
^
^ r^ ,-, en oo
—• — —* oo
tv, о ^ t> h-
N05C4LOO LO О LO О СП
о о —i —< см см со co ^ ^f
Г— Г— С— IT— t— t> b- t-- C~- l>
C2
^ *-ч rf CO CO 'ФОООНОО ^-hN^CO
00 СП СП СП 00 t^-LOCO'-'Cn CO CO СП CO 00
Ю CO 1^00 СП O^ —* CM^ CO^ CO ^lOLOCON
CM" CM CM CM CM" CO" CO" CO" CO" СО" СО" СО" со" со" со"
СО ОС; СО СО —^ СО^ О^ Ю^ СП СО;
-н" СМ" т? Ю !>-" ОО" О" —<" СМ" ^" ^ 1 °1Ю~ ^1
СП 00 1^ СО Ю rf Tf СО СМ —н LO СО —< О °°
¦ . . . . , , . , . ¦ ^н^со
I L.l. I I- III .1. I
^ СПСМ —< СО t>~ СО Tf —i СО СОО-нл_
00 t^-00 СП О СМ Ю 00 CM CO ^NCOOO
CM ^f СО 00 —' со Ю Г- О CM Ю t^ О СО СП
_н г-н г-н —, СМ СМ СМ СМ СО СО СО СО ^ -* ^
СМ 1—I О О О СМ СО СМ О О О СМ Г^ СО—|
СО _н со -н СО г-> СО СМ 00 Tf О СО СМ СП —•
00 t> Ю ^f СМ —' СП 00 СО Ю rf CM ^н СП (^
00^ 00 00 ОС; СО ОС; 1^- t^ t^ t> С-; «> t>; О СО
о" о" о" о" о" о" о" о" о" о о о" о" о" о"
ЮОЮОЮ ОЮОЮО ЮОЮОО
1^- ОО 00 СП СП О О —| 1—i СМ СМ СО СО ^ Ю
СМ 00 Is* Г*- СП
СП г-< Ю О СО
СО LO Ф ОС; СП
—• 00 СО "Ф СО
—< о о о о
1^ l> i> С^ 1^
СМ *ч ^ СО Ю
t-- 00 00 00 С^
Ю О (^ 00^ СП
см" см" см" см" см"
CM t^ СМ^ О «-и
сп" о" см со" ю"
00 00 Г- СО Ю
1 1 1 1 1
LO Ю СО СО СО
¦Ф СО СО СО rf
CM rf СО 00 О
^ —' Г-Н 1—1 СМ
СОЮ h- СП СМ
СП т^ СП rf О
00 t>- Ю "Ф СО
°°L °Ч. °Ч °Ч °Я
о" о" о" о" о"
юоюою
t^ 00 00 СП СП
СМЮ СП СМ СО
""Ф СМ —< СМ СО
—; ОО Ю^ t^ СП
см" см см см" см"
CM rf СО СП СМ
О О О О —'
t> t> t^ с^ t>
СО С^. О "Ф 00
°* *i ^i ^ °^
со" со" со" со" со"
СО-^Ю О Ю
со" оо" сп —" см
^ СО СМ СМ -ч
1 1 1 II
О 00 СМ О Tf
СО Ь- О СО СО
CM Tf h- СП —1
см см см см со
Г-- П< СО rf1 Ь-
LQ —< h- СО СП
гнОООМЛ
00 00 l>- t^ t^
о" о" о" о" о"
ОЮОЮО
о о -н —н см
3,160
3,394
Ю СП rf l>- СО
—I —< СО СМ СО
С-- I4- 1> О- t>
00 00 Tf t^ 00
Tf •—• 00 rf CO
-Ф Ю^ Ю^ СО^ Ь-
CO" CO" СО" СО" СО"
СП CXD Ю^ —^ Ю
со" Th со" см" сп
| —« СМ СО
о ю о со со
Tf СО СП —1 1^-
СО СО СО -* "f
г-> СО ^f СМ СП
СО СМ СП СО 00
|>. С^ t> t^ СО
о" о" о" о" о"
ЮОЮОО
СМ СО СО тр Ю
При р — 475 бар
оа
CJ
и
-
D
а
X
К
1 I4- 00 СП -н СО
1 ю г- о ю о
СО ^ СО 1>- СП
i ^СО-^ОСО
О О О О СП
t>. t> C^ C^ СО
СО —* Tf CO Ю
СО Г- I> t^ СО
ю^ со^ г^ ос; сп
см" см" см см" см"
-н СО^ ^н СО^ -н
о-" оо" о" —" со"
00 l>- t-- СО Ю
1 1 1 1 1
СО СМ Ю "* »-
О СП 00 00 00
СМ СОЮ t^ СП
Tf 00 СМ СО СМ
СМ Ь- СО О0 Th
СП С^ СО ^ СО
00 00 ОС; 00^ 00
о" о" о" о" о"
юоюою
1>- 00 00 СП СП
rf Ю Ю СО СП
СО СО —ч О СП
о. со т? со; t^
см см" см" см" см"
оо сп —ч со Th
СП СП О О О
СО СО t— t-- t^
см со со см со
Ю СО —« СП СО
О^ —1СМ^ СМ СО^
со со со" со со
Г- — СО^ —; СО
"Ф СО Ь-" СП о"
Tf" СО СМ —| -н
II 1 II
IDN^^O
СП О СМ -Ф !>¦
—* Tf СО 00 О
см см см см со
о о см со-^
о со см оо ю
СМ О СП Ь- СО
ОС; ОС; t^- t^- Ь;
о" о" о" о" о"
ОЮОЮО
00-н^!М
3,004
3,218
о —< —< —. см
Г^ С-- Г- t-- 1^
t^- CO CM rf ^
со о г- со ю
CO СО" СО" СО СО"
-;ю ^t^o
см" со" ю" со" *-<"
| т-ч CM rj4
—< оо см
О СО 00 СО h-
ГОЮЬОЮ
со со со ^ -^
00 Г^ СО 00 СО
-н 00 Ю СМ СО
Ю СО СМ -ч 00
t>- t^- J> О; СО
о" о" о" о" о"
ЮОЮОО
СО СО СО 'Ф Ю
Чо
Продолжение табл. Ill
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
Р
0,8954
0,8810
0,8666
0,8523
0,8381
0,8242
0,8104
0,7969
0,7835
0,7704
0,7574
0,7445
0,7319
0,7194
0,6935
V
1,1169
1,1351
1,1539
1,1733
1,1931
1,2134
1,2340
1,2549
1,2763
1,2981
1,3204
1,3432
1,3663
1,390
1,442
При р =
i
—85,0
—76,5
—68,0
—59,5
—51,1
—42,6
—34,1
—25,6
—17,2
—8,7
—0,2
8,3
16,8
25,4
42,6
= 500 бар
s
2,554
2,662
2,765
2,863
2,955
3,042
3,125
3,205
3,281
3,355
3,426
3,495
3,561
3,623
3,740
СР
1,699
1,697
1,696
1,695
1,695
1,695
1,695
1,695
1,697
1,699
1,701
1,703
1,706
1,708
1,715
Р
1,325
1,440
1,564
1,698
1,841
1,993
2,152
2,319
2,494
2,675
2,864
3,060
—
—
—
Глава III
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
ЖИДКОГО КИСЛОРОДА
Но сравнению с другими компонентами воздуха кислород
менее исследован как в газообразном, так и в жидком состоянии. Надежные
опытные данные о плотности жидкого кислорода ограничены давлением
200 кГ/см2. Поэтому в настоящей главе была выполнена экстраполяция
р, v, Г-данных жидкого кислорода на основании данных для азота и
приближенного термодинамического подобия этих веществ. Затем было
составлено уравнение состояния и рассчитаны термодинамические свойства
жидкого кислорода до давления 500 бар.
III. 1. Опытные р, v, Г-данные для жидкого кислорода
и их экстраполяция по давлению
В течение длительного времени отсутствовали опытные данные
о термических свойствах жидкого кислорода. В 1960 г. Ван-Иттербик и
Вербек [43] определили его плотность при температурах 64,66; 74,77;
80,18; 85,41 и 90,29° К и давлении до 150 кГ1см], а спустя год получили
данные на изотермах 77,35 и 90,07° К при давлениях до 875 и 852 кГ/см2
соответственно [83]. Как и для азота, методика заключалась в
определении производных (тр-) и расчете плотности интегрированием.
Одновременно Д. Л. Тимрот и В. П. Борисоглебский [39]
непосредственно измерили плотность жидкого кислорода в более широком
интервале температур (—120-; 190° С) при давлениях до 200 кПсм2 методом
пьезометра постоянного объема. Кислород содержал примеси — 0,5 об.%
Аг и 0,5 об. % N2, но авторы [39] отмечают, что плотность такого раствора
близка к плотности чистого кислорода. Уменьшение плотности жидкого
кислорода по мере изменения температуры и давления определялось по
количеству выпущенного из пьезометра кислорода, которое измерялось
объемным способом. Давление в пьезометре измерялось образцовым
поршневым манометром 1-го класса через систему, отделяющую кислород от
масла манометра, давление в газометре — ртутным манометром. Для
измерения температуры термостата газометра и криостата, в котором находился
пьезометр, использованы образцовые платиновые термометры
сопротивления, а для контроля равномерности температурного поля криостата — три
медно-константановые термопары. Д. Л. Тимрот и В. П. Борисоглебский
уделили большое внимание тарировке установки и определению поправки
на изменение объема пьезометра и газометра в зависимости -от
температуры и давления и поправки на влияние балластного объема. В работе [391
приведена подробная таблица плотности при круглых значениях
температуры и давления (для пятнадцати изотерм и двадцати изобар),
составленная в итоге обработки экспериментальных данных графоаналитическим
69
методом. Максимальную погрешность получения значений плотности,
включая ошибку отнесения, авторы оценили равной 0,2%.
В работах Д. Л. Тимрота и В. П. Борисоглебского получены также
данные для кривой насыщения кислорода — как экспериментальные [114],
так и сглаженные [39]. Данные [114] о давлении насыщенного пара
удовлетворительно согласуются с наиболее точными результатами опытов
Хоуджа [115], но значения ps в [39] недостаточно надежны [70].
Приведенные в работах [39, 114] значения плотности кипящей жидкости
согласуются хорошо.
Графическая обработка данных [39] показала, что по большинству
точек можно провести плавные изотермы и изобары, а отклонения некото-
Р.
г/см3
1,20
1,15
V О
ш
too
ГЦ
Ь^3
Р
Ьх
г$§
febv
S
I I
д-/
п 9
? — 1 \
1
о-3\ 1
| |
I
200кГ
/
(см2
Ш
vW
^xMxi
1 wJ\\
1 \ 1
70
80
90
WO
по
т,°к
Рис. 12. Сопоставление экспериментальных данных
о плотности жидкого кислорода:
/ — данные Ван-Иттербика и Вербека [43 ]; 2 — Ван-Иттербика
и Вербека [83]; 3 — Д. Л.
Тимрота и В. П.
[39].
Борисоглебского
рых точек от этих кривых не выходят за пределы погрешности, указанной
авторами. Величины [39] хорошо согласуются с данными для кривой
насыщения, принятыми нами по книге [70], в которой давление насыщенного
пара рассчитано на основании данных [115], а плотность кипящей
жидкости получена обработкой результатов [39, 114]. Эти величины также
вполне удовлетворительно согласуются с расчетными [70] для
газообразного кислорода, поскольку они использовались в указанной работе для
получения сетки опорных р, v, Т-данных при сверхкритических
плотностях.
При сопоставлении данных о плотности жидкого кислорода,
полученных Д. Л. Тимротом и В. П. Борисоглебским [39] и Ван-Иттербиком и
Вербеком [43, 831, обнаруживается, что значения в двух последних
работах систематически выше — на 0,3—0,5% при температурах 90,29
и 85,41° К и на 0,2—0,3% при 90,07° К (рис. 12). Эти расхождения в
значительной мере объясняются тем, что значения плотности жидкого кислорода
в состоянии насыщения, принятые в качестве постоянных интегрирования
при расчете плотности на изотермах [43, 83], выше соответствующих
70
величин [39, 114] на 0,3—0,5%. Напомним, что и для азота результаты
Ван-Иттербика и Вербека завышены. Данные Д. Л. Тимрота и В. П.
Борисоглебского получены по надежной методике и, вероятно, являются более
точными, чем [43, 83], которые трудно непосредственно использовать для
пополнения сетки опорных данных. Поэтому нами были графически
экстраполированы до температуры 75° К изобары, построенные по данным [39],
что допустимо ввиду их малой кривизны; экстраполированные участки
проведены в координатах р, Т ниже точек [43, 83] на 0,3—0,5% в связи
с отмеченными расхождениями. Задача согласования изобар с кривой
затвердевания для кислорода не ставилась, так как экспериментальные
данные о его плотности на этой кривой отсутствуют. К тому же при
давлениях до 500 бар температура затвердевания кислорода не превышает
60° К [71 ], в то время как данные [39] ограничены минимальной
температурой 83,15° К.
При давлениях свыше 200 кГ/см2 опытные данные о плотности жидкого
кислорода имеются лишь на двух изотермах и не отличаются точностью.
Поэтому для экстраполяции до давления 500 бар был использован закон
соответственных состояний и подробные р, v, Т-данные для жидкого
азота, охватывающие широкий интервал приведенных параметров.
При использовании термодинамического подобия нами
сопоставлялись плотности жидких азота и кислорода при одинаковых приведенных
температурах т и давлениях я, поскольку критическая плотность
определяется недостаточно надежно. Значения т и я в основном соответствовали
принятым в сетке опорных данных для азота. Плотность кислорода
определялась графической интерполяцией данных [39], выполняемой с высокой
точностью благодаря хорошей их согласованности.
Взамен применяемых обычно построений свойства исследуемого
вещества в зависимости от одноименного свойства базисного вещества в
соответственных состояниях нами анализировалось отношение плотностей
жидких азота и кислорода при одинаковых т и я, так как оно является
весьма чувствительным показателем термодинамического подобия. В силу
того, что закон соответственных состояний выполняется лишь
приближенно, отношения pN2/po2 изменяются на 0,5—2,0% в зависимости от
температуры и давления, причем диапазон изменения на изотермах
возрастает по мере повышения температуры (рис. 13).
Данные о плотности кислорода при т = 0,5820 получены нами во всем
рассматриваемом интервале давлений уменьшением результатов [83] на
0,004 кг/дм3, чем учитывается расхождение значений плотности на этой
изотерме в состоянии насыщения, указанных в [83] и [39, 114].
Соответствующая изотерма в опорной сетке азота отсутствует, и плотность его
рассчитана по составленному ранее (см. главу II) уравнению состояния.
Отношение р*г2/ро2 на этой изотерме имеет минимум при давлении около
300 бар, а затем незначительно увеличивается, причем в случае
использования опытных данных [83] конфигурация кривой не изменяется. Поэтому
на остальных десяти изотермах опорной сетки, охватывающих интервал
температур 80,73—150,97° К, где экспериментальные данные о кислороде
ограничены давлением 200 кГ/см2, отношения плотностей были
экстраполированы (штриховые участки на рис. 13), причем конфигурация изотерм
в координатах рм2/ро2, л принята такой же, как у исследованной изотермы.
При экстраполяции учитывалось, что в области более высоких т = 1,76—
3,05, где имеются экспериментальные р, и, Г-данные об азоте и кислороде,
форма изотерм pN2/pa2 = / (я) аналогична конфигурации кривой 1 на
рис. 13 и что отношения значений плотности этих веществ при
максимальном я ^ 10 в интервале т = 0,582—3,05 уменьшаются незначительно
(от 0,724 до 0,716).
Для уменьшения погрешности экстраполяции рк2/ро2 на изотермах
были рассчитаны экстраполированные значения плотности кислорода,
сглажены по изобарам и одновременно согласованы с расчетными дан-
71
ными [70] для газообразного кислорода. Затем повторно рассчитаны
отношения плотностей азота и кислорода и сглажены в функции давления.
Обработка экстраполированных данных в двух сечениях — изотермах
в координатах pN2/po2, я и изобарах в координатах р, Т — позволила
получить плавную поверхность состояния для жидкого кислорода при
давлении до 500 бар. Следует подчеркнуть, что для установления зависимости
pN2/po2 от давления использованы опытные данные и к тому же на большин-
?«:/?°2
)^о о
3
— —о—
-о
— -о—
"""С"-"—о.
уО О.
_2 п
_о
, о—
5—0—о
/
U о 1
-и
, I J
: 0 2 ~"~ ц 6 8 1011
Рис. 13. Отношение значений плотности жидких азота и кислорода в
функции приведенного давления и при одинаковых приведенных температурах т:
/ — 0,5820; 2 — 0,6982; 3 — 0,8170.
стве изотерм жидкости и газа, за исключением околокритических, эти
отношения изменяются в узких пределах. Поэтому можно полагать, что
погрешность экстраполирования и дополнительного сглаживания
значений плотности не превышает 0,4% при максимальном давлении.
Таким образом была получена сетка опорных р, у, Т-данных жидкого
кислорода, основанная при давлениях до 196 бар на результатах
экспериментов Д. Л. Тимрота и В. П. Борисоглебского [39], а при более высоких
давлениях (до 500 бар) — на экстраполированных величинах. Эта сетка
использована в дальнейшем при составлении уравнения состояния для
жидкого кислорода.
III. 2. Уравнение состояния для кислорода
и определение его калорических свойств
Уравнения состояния для жидкого кислорода (как и
экспериментальные данные) появились недавно и сравнительно немногочисленны.
Ван-Иттербик и Вербек [43] описали полученные ими опытные данные
в интервале температур 64,7—90,3° К при давлениях до 150 кГ/см2
уравнением состояния в форме
р - (ль + ахТ + а2Т2) + (bo + ЬгТ) р. G8)
Оно справедливо лишь в ограниченной области давлений, поскольку
предполагает линейную зависимость плотности от давления на изотермах.
72
В дальнейшем Ван-Иттербик и Вербек [83] составили уравнения для
изотерм 77,35 и 90,07° К при давлениях до 875 и 852 кГ/см2 в виде полиномов
третьей степени от давления, но не пытались использовать новые опытные
данные для корректировки уравнения G8) с целью расширения области
его применения.
В 1963 г. Стюарт, Хает и Мак-Карти [73] составили уравнение
состояния для газообразного и жидкого кислорода при температуре 55—300° К
и давлениях до 300 атм. Уравнение имеет ту же форму G1), что и
уравнение Стобриджа [72] для азота. При составлении уравнения были
использованы в области жидкости данные Д. Л. Тимрота и В. П. Борисоглебского
[39, 114] и Ван-Иттербика и Вербека [43, 83]. В работе [73] отмечается,,
что данные [39] и [43] расходятся до 0,6%; это согласуется с выводом,
полученным нами в III. 1. Авторы [73] выбрали для жидкости в качестве
опорных данные Ван-Иттербика и Вербека [43, 83] для интервала
температур 65—90° К и результаты Д. Л. Тимрота и В. П. Борисоглебского
[39, 114] для 112—148° К. Полученное Стюартом и соавторами уравнение
состояния в форме G1) хорошо соответствует опорным данным для
жидкости при температуре 85—148° К, однако по мере ее понижения
расхождения между расчетными и опорными значениями плотности существенно
возрастают, достигая 1,4% при Т = 65° К; примерно такие же отклонения
наблюдаются и в околокритическом районе. Поэтому для расчета
термодинамических свойств жидкости при температурах ниже 85° К авторы [73]
использовали уравнение состояния, предложенное Ван-Иттербиком и Вер-
беком [43].
Наиболее новым уравнением состояния для жидкого кислорода
является уравнение B9), составленное В. Н. Новотельновым и Л. А.
Акуловым [38] по опытным данным [39]. Подробный анализ, выполненный
в гл. I, показал, что погрешности расчета значений плотности с помощью
этого уравнения превышают допустимые пределы.
Как видно из приведенного обзора, только наиболее сложное
уравнение для жидкого кислорода [73] справедливо в достаточно широком
интервале температур и позволяет получить результаты с приемлемой точностью.
Однако использованные авторами [73] опорные данные ограничены, в
основном, давлением 200 кГ/см2.
В связи с хорошими результатами, достигнутыми при описании
термодинамических свойств азота уравнением состояния в форме E2), нами была
поставлена задача получить простое и удобное для расчетов уравнение
состояния для кислорода, соответствующее опорным данным при давлениях
до 500 бар. Предварительный выбор формы уравнений для изотерм
жидкого кислорода показал, что эти кривые вполне удовлетворительно
описываются уравнением E1), причем несколько лучший результат достигается,
когда показатель степени первого члена п = 2. Поэтому уравнение
состояния для кислорода составлялось в виде
р = А(Т)р* + В(Т)р* + С(Т)р\ G9).
Для определения температурных функций уравнения G9) по методу
спрямления изотерм были рассчитаны комплексы-^-, с которыми
проводились такие же операции, как и с— в главе II. Отличие состояло лишь
в том, что от значений-^- на изотерме вычиталось значение не на кривой
насыщения, а на изобаре 10 кГ/см2 (или на ближайшей к кривой
насыщения изобаре при более высоких температурах). На рис. 7 показано
построение комплексов Yх = В + С (р2 + pg) и Y2 = А + Вр2 для изотермы
126,45° К, позволяющее определить значения функций С (Т) и В (Т).
Как видно из рисунка, во всем интервале плотностей, охваченном сеткой
опорных данных, изотерма в выбранных координатах спрямляется; анало-
73
•гичный вид имеют и другие изотермы, что подтверждает справедливость
принятой формы уравнения состояния.
Температурные функции уравнения состояния для кислорода
определялись до Т = 170° К, чтобы обеспечить согласование величин,
рассчитываемых по уравнению, с данными о газе; эти функции представлены
на рис. 14. В отличие от азота для кислорода линейной может быть при-
и so юо 120 по 160 т;к
Рис. 14. Температурные функции уравнения состояния для
жидкого кислорода:
/ — оптимальные; 2 — предельные.
нята только функция С (Г), а В (Т) имеет слабую кривизну. Эти функции
представлены аналитически в виде [1161:
С (Т) = 2290,8 — 7,49527\ (80)
В(Т) = 3138,1 — 118543Г-0'67. (81)
А (Г), имеющая минимум при температуре примерно 140° К, отображена
более сложным выражением:
А (Т) = 292,24 + 8,63в2 — 1,393в3 + 0,0677в4 + 0,00235в6, (82)
где в = 0,1 (Т — 140); при температурах выше 140° К необходимо
исключить члены, содержащие в в степенях, больших 2.
Подстановка температурных функций (80)—(82) в уравнение G9)
приводит к уравнению состояния, в котором давление имеет
размерность бар, а плотность — кг/дм3.
74
Значения плотности кислорода, рассчитанные по уравнению
состояния, были сопоставлены с опорными данными и с опытными,
полученными Д. Л. Тимротом и В. П. Борисоглебским [39] и Ван-Иттербиком и
Вербеком [83]. Сравнение с частью опорных данных приведено в табл. 11,
Таблица 11
Сопоставление расчетных значений плотности кислорода р
(строка 2-я) с опорными (строка 1-я)
58,76
117,5
176,3
249,7
293,8
367,2
440,7
514,1
брср, %
вРтах. %
р, кг/дм'л, при температуре, °К
80,73
1,191
1,191
1,201
1,200
1,209
1,210
1,219
1,220
1,225
1,226
1,234
1,235
1,242
1,244
1,250
1,252
0,10
—0,16
88,64
1,155
1,155
1,167
1,166
1,177
1,176
1,188
1,188
1,195
1,195
1,204
1,205
1,213
1,214
1,222
1,223
0,07
0,09
95,80 1
1,121
1,122
1,135
1,134
1,147
1,146
1,160
1,159
1,166
1,166
1,177
1,177
1,187
1,187
1,197
1,197
0,06
±0,09
101,93
1,091
1,092
1,107
1,106
1,120
1,119
1,134
1,133
1,142
1,141
1,154
1,153
1,165
1,165
1,175
1,175
0,08
±0,09
114,19
1,026
1,027
1,047
1,047
1,064
1,064
1,083
1,082
1,093
1,092
1,107
1,106
1,120
1,120
1,133
1,132
0,07
—0,10
126,45
0,952
0,953
0,981
0,982
1,005
1,005
1,029
1,028
1,041
1,041
1,059
1,059
1,075
1,075
1,090
1,089
0,07
±0,10
138,71
0,862
0,860
0,908
0,908
0,941
0,941
0,972
0,973
0,987
0,988
1,010
1,011
1,030
1,031
1,048
1,048
0,11
0,23
150,97
0,726
0,726
0,822
0,822
0,871
0,872
0,913
0,914
0,933
0,934
0,961
0,963
0,985
0,986
1,007
1,007
0,11
—0,21
160
0,746
0,747
0,815
0,815
0,867
0,868
0,892
0,892
0,925
0,926
0,955
0,953
0,979
0,976
0,16
0,31
170
0,747
0,745
0,815
0,813
0,844
0,842
0,882
0,882
0,914
0,914
0,941
0,940
0,18
—0,27
в которой представлены также значения плотности на изотермах 160 и
170° К при сверхкритических давлениях, использованные при определении
температурных функций уравнения. Для 51 точки из 146, (включая точки,
не представленные в таблице) расчетные данные совпадают с опорными,
для 79 отклонения не превышают 0,001 кг/дм3 @,08—0,13%). Только в
отдельных точках расхождения выше 0,2%, причем большинство таких
точек относится к изотермам газа, где допустима большая погрешность
значений плотности, чем в жидкой фазе. Среднее квадратическое
отклонение расчетных данных от опорных для всех точек составляет 0,10%.
Уравнение состояния хорошо соответствует большинству
экспериментальных данных Д. Л. Тимрота и В. П. Борисоглебского. Для 122
точек из 283, представленных в работе [39], расчетные значения плотности
совпадают с опытными. Лишь в 30 точках расхождения превышают
0,001 кг/дм3 @,08—0,13%) и в 22 из них выходят за пределы возможной
погрешности получения опытных данных @,2%). Заметим, что
отклонения значений плотности, рассчитанных по уравнению состояния, от
экспериментальных наблюдаются преимущественно при давлениях до 100 бар,
а при более высоких в основном не превышают 0,12% (табл. 12). Только
в пяти крайних точках на изобарах 30—70 кГ/см2 наблюдаются
существенные расхождения с данными [39] (на 0,5—1,6%). Это свидетельствует о
¦снижении точности уравнения состояния на околокритических изотермах
вблизи кривой насыщения и подтверждает высказанное ранее (гл. I)
соображение о неприменимости уравнения в форме E2) для описания
критической области. Пять точек, для которых расхождения превышают
допустимые пределы, не были учтены при расчете отклонений. Среднее квадра-
75
Таблица 12:
Сопоставление расчетных значений плотности жидкого кислорода р (строка 2-я)
с экспериментальными данными Д. Л. Тимрота и В. П. Борисоглебского [39]
(строка 1-я)
т, °к
83,15
88,15
93,15
98,15
103,15
108,15
113,15
118,15
123,15
128,15
133,15
138,15
143,15
148,15
153,15
дРср, %
ОРтах, %
20
1,173
1,173
1,150
1,150
1,125
1,126
1,100
1,101
1,073
1,075
1,046
1,047
1,017
1,018
0,985
0,987
0,951
0,953
0,914
0,914
—
—
—
0,13
—0,21
40
1,176
1,176
1,154
1,154
1,130
1,130
1,105
1,106
1,079
1,080
1,053
1,054
1,025
1,026
0,995
0,996
0,963
0,964
0,928
0,929
0,890
0,889
0,846
0,843
0,789 *
0,785
—
0,13
0,35
60
1,180
1,180
1,158
1,158
1,134
1,134
1,110
1,110
1,085
1,086
1,059
1,060
1,033
1,033
1,004
1,005
0,973
0,974
0,941
0,942
0,906
0,906
0,867
0,865
0,822
0,819
0,765
0,763
0,683 *
0,694
0,15
0,36
р, кг/dj
80
1,184
1,183
1,162
1,161
1,138
1,139
1,114
1,115
1,090
1,091
1,065
1,066
1,039
1,040
1,012
1,013
0,983
0,984
0,952
0,953
0,919
0,920
0,884
0,883
0,845
0,843
0,799
0,798
0,744
0,746
0,13
—0,27
и3, при давлении, кГ/см2
100
1,188
1,187
1,166
1,165
1,143
1,143
1,120
1,120
1,096
1,096
1,072
1,071
1,046
1,046
1,020
1,020
0,992
0,992
0,963
0,963
0,932
0,932
0,899
0,899
0,864
0,862
0,824
0,823
0,779
0,779
0,08
0,23
120
1,191
1,190
1,169
1,169
1,147
1,146
1,124
1,124
1,101
1,101
1,077
1,077
1,052
1,052
1,026
1,027
1,000
1,000
0,972
0,972
0,943
0,943
0,912
0,912
0,879
0,879
0,844
0,843
0,805
0,805
0,05
0,12
140
1,194
1,193
1,173
1,172
1,151
1,150
1,128
1,128
1,105
1,105
1,082
1,082
1,058
1,058
1,033
1,033
1,008
1,008
0,981
0,981
0,953
0,953
0,923
0,924
0,892
0,893
0,860
0,860
0,826
0,826
0,06
—0,11
160
1,196
1,197
1,176
1,175
1,155
1,154
1,133
1,132
1,111
1,110
1,088
1,087
1,064
1,063
1,040
1,039
1,015
1,015
0,989
0,989
0,962
0,962
0,934
0,934
0,905
0,906
0,875
0,875
0,843
0,843
0,07
—0,11
180
1,199
1,200
1,179
1,179
1,158
1,157
1,137
1,136
1,115
1,114
1,092
1,091
1,070
1,069
1,046
1,045
1,022
1,021
0,997
0,996
0,971
0,971
0,944
0,944
0,916
0,917
0,888
0,888
0,858
0,859
0,08
—0,12
200
1,202
1,203
1,182
1,182
1,162
1,161
1,141
1,139'
1,119
1,118.
1,097
1,096-
1,075.
1,074
1,052
1,051
1,029
1,027
1,004
1,003
0,979
0,979
0,953
0,953-
0,927
0,927
0,900'
0,900'
0,872
0,872
0,09
0,19
Отмеченные точки при определении отклонений не учитывались.
тическое отклонение расчетных значений от опытных для 278 точек
составляет 0,10%.
Сопоставление с данными Ван-Иттербика и Вербека [83] на изотермах
77,35 и 90,07° К показало, что значения плотности, рассчитанные нами,
при давлениях до 517 и 506 бар меньше экспериментальных на 0,1—0,3%.
Такое расхождение вполне объясняется тем, что принятые нами опорные
величины меньше приведенных в работе [83]..
В табл. 13 значения плотности на кривой насыщения, рассчитанные
по уравнению состояния с привлечением уравнения кривой упругости [70 ],
сопоставлены с данными Д. Л. Тимрота и В. П. Борисоглебского [39].
При температурах до 128,15° К расчетные значения вполне
удовлетворительно согласуются с опытными — расхождение не превышает возможной
погрешности результатов [39]; поэтому в таблице термодинамических.
76
Таблица 13
Сопоставление расчетных значений плотности р жидкого кислорода
на кривой насыщения с опытными данными [39]
т, °к
83,15
88,15
93,15
98,15
103,15
108,15
113,15
р, бар
0,4529
0,8146
1,369
2,173
3,289
4,782
6,717
Роп
кг/дм3
1,169
1,145
1,121
1,095
1,068
1,041
1,011
ррасч
кг/дм3
1,169
1,146
1,121
1,096
1,070
1,042
1,013
6р, %
0
—0,09
0
—0,09
—0,19
—0,10
—0,20
т, °к
118,15
j 123,15
128,15
133,15
138,15
143,15
148,15
i
р, бар
9,165
12,20
15,89
20,33
25,62
31,87
39,20
кг/дм3
0,981
0,948
0,912
0,873
0,828
0,775
0,705
ррасч
кг/дм3
0,982
0,948
0,911
0,870
0,822
0,767
0,703
бр, %
—0,10
0
0,11
0,34
0,73
1,04
0,28
свойств жидкого кислорода в состоянии насыщения для интервала
температур 75—130° К приняты расчетные значения плотности. При более
высоких температурах отклонения расчетных величин от опытных возрастают,
достигая 1%, в связи с чем значения плотности при температурах 138—
—152° К приняты нами поданным [70], а в интервале 131 —137° К получены
графическим согласованием этих данных и расчетных. Величина ркр,
а также значения р' при температурах 153 и 154° К были уточнены путем
.построения комплексов р ^ р и Ур'р" в зависимости от температуры.
Значения плотности жидкого кислорода, полученные по уравнению
состояния G9), были также сопоставлены с рассчитанными Стюартом,
Хастом и Мак-Карта [73]. В интервале температур ПО—160° К при
давлении до 304 бар (максимального для таблиц [73]) обе группы данных
согласуются в основном с отклонением 0,1—0,2%, и только в околокритическом
районе расхождения достигают 0,5—1,5%. Удовлетворительное
согласование при давлениях свыше 196 бар можно рассматривать как
свидетельство надежности экстраполяции по давлениям, выполненной авторами
работы [73] и нами. При температурах ниже 110° К значения плотности
в [73] оказываются систематически более высокими. Расхождения
достигают 0,4—0,5%, что объясняется различием опорных данных, принятых
в настоящей работе и в [73].
Переходя к рассмотрению калорических свойств жидкого кислорода,
можно отметить, что значительное число экспериментальных работ
посвящено определению его теплоты испарения при атмосферном давлении.
Наиболее точными являются исследования Дэйна [104]*, Джиока и Джон-
стона [117], Франка и Клюзиуса [118], Клюзиуса и Коннертца [119];
несколько более ранних работ упомянуто в обзоре М. П. Орловой [120].
Альт [98] первым получил опытные данные о теплоте испарения
кислорода в достаточно широком интервале температур F8—90° К). В
дальнейшем Фурукава и Мак-Коски [99] измерили ее примерно в том же
диапазоне температур и Алиханов [121] провел эксперименты в интервале
•80—106° К. Результаты этих трех работ согласуются вполне
удовлетворительно.
Теплоемкость жидкого и твердого кислорода в состоянии равновесия
с газом впервые измерил Эйкен [103] при температурах 17—73° К. В
дальнейшем Клюзиус [107] и Джиок и Джонстон [117] получили аналогичные
данные в интервалах Т — 10,2—72,8 и 13,0—90,3° К соответственно.
М. П. Орлова [120] отмечает, что при температурах выше 44° К данные
1107] и [117] расходятся примерно на 5—8%, хотя сами авторы оценивают
погрешность получения экспериментальных данных в этой области
величиной 0,1%; более надежными являются результаты [117], полученные
с помощью адиабатического калориметра.
77
Изобарная теплоемкость жидкого кислорода исследована
экспериментально Э. Э. Шпильрайном в интервале температур —120-^—190° С
и давлений 10—90 кГ/см2; полученные им данные приведены в
справочнике [122]. Имеются также немногочисленные опытные данные Хоуджа
[115] об изохорной теплоемкости кислорода в интервале температур
125—160° К и приведенных плотностей со = 0,56—1,52, которые частично
относятся к области жидкости.
Расчетные данные о термодинамических свойствах жидкого кислорода
до недавнего времени отсутствовали. В упомянутых ранее (гл. II) работах
Роулинсона [14] и Ван-Иттербика и Ван-Дэйла [113] приведены только
данные для кривой насыщения жидкости. В 1960 г. Ван-Иттербик и Вер-
бек [43] с помощью составленного ими уравнения состояния получили
значения ср в интервале температур 65—90° К при давлении до 150 кГ/см2.
Стюарт и соавторы [73] рассчитали подробные таблицы
термодинамических свойств кислорода, где наряду с данными о плотности представлены
калорические величины (энтальпия, внутренняя энергия и энтропия) при
давлениях до 300 атм для температур 86—300° К и до 140 атм для 56—
85° К.
С помощью уравнения состояния, представленного выражениями G9),
(80), (81) и (82), нами рассчитаны термодинамические свойства кислорода
(р, v, |3, /, s, Ср) при давлениях до 500 бар и температурах 75—170° К.
Для определения калорических свойств использовались выражения,
приведенные в 1.4/, на закритических изотермах A55—170° К) в качестве
начальных выбирались точки при давлениях 80—150 бар. Расчетные
значения термодинамических свойств были графически согласованы с
данными [70] о газе. Для облегчения согласования оказалось целесообразным
изменить значения Г, принятые нами первоначально по таблицам [70];
поправки лежат в пределах от +1,7 кдж/кг при температуре 75° К до
—3,3 кдж/кг при 154° К. Соответственно скорректированы г и s'. Значения
ср были определены, как и для азота, с помощью производной \~gf-) на
изобаре 300 бар.
В процессе согласования данных о жидкости и газе на изобарах был
также изменен ряд значений термодинамических свойств при
околокритических температурах (v при 155—160° К; i при 155—165° К; s при 155—
170° К и ср при 140—180° К), в связи с чем данные на этих изотермах были
дополнительно сглажены графически.
Полученные нами значения ср были сопоставлены с опытными данными
Э. Э. Шпильрайна [122]. В интервале температур —150 -^ 120° С
сравниваемые величины согласуются удовлетворительно (в пределах
2—3%); при более низких температурах расхождения возрастают примерно
вдвое.
Расчетные значения энтальпии и энтропии жидкого кислорода были
сопоставлены с данными Стюарта и соавторов [73]. Ввиду различия в
начале отсчета сравнивались hi = i — V и As = s — s' на изотермах.
Из табл. 14 видно, что на большинстве изотерм, включая изотермы 80—
100° К, где имеются расхождения р, и, Г-данных, разности энтальпии
отличаются не более чем на ±0,4 кдж/кг при всех давлениях. Только при
температуре 150° К, близкой к критической, в большинстве точек имеются
систематические расхождения на 1,4—1,6 кдж/кг. Аналогичная картина
наблюдается при сопоставлении данных об энтропии (табл. 15):
расхождения As, как правило, лежат в пределах ±0,004 кдж/(кг-град) и только
на изотерме 150° К достигают 0,01 кдж/(кг-град).
При давлениях свыше 304 бар опытные или расчетные данные о
калорических свойствах жидкого кислорода до настоящего времени не
опубликованы, что исключает возможность проверки полученных нами значений.
Тем не менее удовлетворительное согласование с данными [73] и
отсутствие тенденции увеличения отклонений по мере повышения давления
78
о
и
а
о
&
СО
W
а
о
к«
о
о\
?а
со
о
н
К
9 °
ж со
сооо
н4 Ж SQ
* * а
I н 8J
СО
н
сг
§<
г— td
О ,
я 2
<ъ >_, в
>=" 5 о
о к •
Й? S
со чз о
fc» со о
CD СО j*
« & к
СГ О) Н
nag
> Ca й
5 43 &>
go ?
g со к
К >э н
Л О со
§s|
^ Ох д
ой Е
СО 43 гВ
о
о
н
со
СО
К
о
о
43
о
: РО
СО
СО
д
К
О
о
н
со
о
3
3
го
43
Qb
р?
о
N
О
О
о
1
о
о
о
to
I
о
о
о
4^
1
о
о
о
4-*
1
о
о
о
to
о
о
о
to
о
о
о
СЛ
о
о
о
о
г?
гра
<Oj
?!
С1>
8
о
о
о
*""*
о
о
о
to
о
о
о
00
о
о
о
to
о
о
о
'"-*
о
о
о
to
о
о
о
4^
о
о
о
со
о
4^
о
1 1
1 1
1 1
оо
о о
CD CD
CD ^1
1 1
оо
Н—i 1—'
— о
tO CD
1 1
о о
to to
^1 СО
1 1
о о
4^ 4*
О) 4^
1 !
о о
<l -vl
Ю СО
1 1
ОО
to to
i— Сл
1 1
о о
to to
00 ^J
CD CD
to
ст
CO
4^
1 1
1 1
oo
о о
00 00
00 О)
( 1
о о
>— о
OCD
ОСТ
1 1
оо
СО О
1 1
О О
со to
>— CD
1 1
о о
СЛСЛ
СЛ СТ
1 1
о о
CD СО
to о>
1 1
о о
to to
СТ СЛ
00 ОО
to
to
to
CD
I 1
I 1
о о
о о
-J ~vj
О) 4^
1 1
оо
о о
00 00
СТ СО
1 1
о о
о о
CD CD
00 О)
1 1
О О
4^ СО
I I
О О
Со со
О) 00
1 [
О О
-^ ^-1
— О)
1 1
о о
to to
4^ СО
4* 45*
>__
00
to
ф.
1 1
1 1
о о
о о
Оэ СТ
СО >—
1 1
оо
о о
-vl СТ
tO CD
1 1
оо
оо
00 0о
СО ¦—
1 1
о о
о о
CD CD
¦О О)
1 1
оо
^J 00
1 1
оо
4^ СЛ
оо to
1 1
оо
to to
— о
СТ СТ
>__.
4*
*—
CD
1 1
О О
ОО
4^ 41*
to со
1 1
оо
о о
СЛ 4^
ооо
1 1
о о
о о
СЛ СЛ
00 СЛ
1 1
оо
оо
О) О)
СТ СЛ
1 1
оо
о о
-J ->1
00 00
1 1
оо
оо
CD CD
4*. СТ
II
О О
to to
— 4*
I 1
О О
00 --J
to to
,„.,
о
со
1 1
о о
о о
СО СО
о —
1 1
оо
оо
со со
¦<! СЛ
1 1
оо
о о
4^ 4*
to о
1 1
о о
о о
4^ 4^
CD 00
1 1
О О
о о
СЛ СЛ
<1 ~vj
1 1
о о
о о
О) ^J
CD •—
I 1
о о
о о
CD CD
О 4^
1 1
О О
СО tO
О 00
СТ)
о
00
о
1 1
о о
о о
00 CD
1 1
О О
оо
to to
to •—
I 1
о о
оо
to to
СТ4*
1 1
о о
о о
to to
CD 00
1 1
о о
о о
СО СО
4* СО
1 1
О О
оо
4^ 4^
О —
! 1
ОО
о о
4^ СЛ
00 —
1 1
О О
О О
-ч ст
оо
"а
¦сз
о
о
о
to
со
о
_»
о
о
>
II
1
1/1
*
&
*
?!
Со
•град
э
к
о
Я
\
О
о
н
"О
о
р
to
&
S
00
5я
CD
SB
к
о
¦о
р
ш
X
о
о
н
Г&
s«
ф
X
н
•о
зт>
¦8-
Б I
— сл
i ~»
о
р
X
е
"И
СО ?>
OV
о о
I -s
X
"^ ^
S Oj
?t Го
го
оо
СО СО
1
о о
>?. СО
1
оо
4^ СО
1
1
о о
со to
1
1
о о
to •—
о о
со to
о о
^J СТ
1
СТ СЛ
СО
о
4^
о
1 1
СТ -<!
CD СО
сл ст
СТ О
СО 4^
00 —
1—1 Н—'
1—' 1—'
^ со
-о -а
н- О
о о
^ н-
1 1
to^—
-^"to
to
ст
OD
4^
1 l
1 1
4^ 4^
СТ CD
СО СО
4^ 00
•— to
чо
CD CD
to со
СЛ СЛ
4^ tO
1 1
Он-
00 СЛ
1 1
со to
00 >?>
to
ю
to
CD
1 1
to to
to сл
to сл
CD CD
CT CD
^0 ^J
CO 4^
CO CO
^ сл
1 1
to to
— 00
1 1
4^ CO
О to
>—'
00
to
4^
1 1
CD О
CD tO
CD CD
О СО
^] ^
CT 00
СЛ СЛ
СЛ СТ
to to
со о
1 1
CO CO
tO 00
1 1
СП СО
— СЛ
>—i
>^
CD
00 00
-<1 4^
^4 ^1
CT CD
CT <l
CD H-
сл сл
^4 00
CO CO
00 00
•— О
о оо
i i
CO 4^
00 СЛ
1 1
45». СО
-vj tO
|_—
о
со
СТ СТ
со о
СЛСЛ
4* СТ
4*» СЛ
00 О
СО СО
00 CD
to to
4». 4^
+ |
О О
н- tO
1 1
СО 4^
00 4*
1 1
СО к-
>— сл
СТ
о
00
О
со со
CD CT
со со
to to
to to
00 00
to to
H-i h—»
1 I
о о
45- CT
1 1
to со
¦o >—
1 1
¦^ CT
00 4^
¦ta
о J
to
о
о
t-^
о
)—'
о
(—'
о
о
о
>
1 1
"л" 1
(\1 1
при Т
л
5 CD CO СО СО СО СО ХО CDCDCOCOOO OOOOOOOOOO 00 00 00 00 4 4 4 4 4 4 4 4 4 4 05 0> 0> 05 СГ5 05 05 О» О) 05 СП СЛ
5 CD 00 4 05 Ol 4^ 00 Ю •— О О CO 00 4 05 'СП 4* CO ЬО »— О СО GO 4 05 Ql *U 00 Ю •— О CO 00 -4 0> &l 4*> CO bO •— О CO 00
4 05 Cn;?
4^ 4^ CO CO 00 CObObObObO
*О О OOOOO
> о о о о coooo ooooo ooooo ooooo ooooo
4^ О 4 СП ЬО О 4 СЛ CO — СОЧО^СО ЬО >— о CD 00 00 4 05 Cn Cn 4^ 00 00 00 bO Ю^-^-h-b- •— OOOO OOOOO OOOOO OOOOO
О CO CO >— СП 0054^004^ 05 CD CO 00 4^ NO О ь-CO CD О ^ 00 СП О 4^ CD 4^ О 05 ЬО CD 05 4^ ЬО О OO 4 G2 СЛ 4^ 00 ЬО ЬО ^ _- н- о О О OOOOO
ЮО^СЛ>- ЬО 4 4 CO СП CO CO 4^ 05 CO •¦— CO 00 4^ 00 •— 05 00 4 00 ^«-WO»- 4 05 CD >?* CO 4^004^bO>— ЬОСЛООСООО СП *- CO 4 СП 4^ CO ЬО >— •—
" " ------ - "-""-~'~^C0<?00O5CO05CnC0CX00tO4004OCD00C0O5C0b04^00Cn
CO 4 05 05 00 00 4 00 CO bO tO 4 >— СП COOOOiCOO
00 4 00 4^ 4 4 »— О
00 4 tO CO 05 4 >— СЛ^СЛСОСП
о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о о
СО СО СО СО 02 СО СО COCO СО СОСО|00 00 00 OOOOOOOOOO 00 Ъо 00 00 00 00 00 00 Ъо 00 ОоЪоОООООО ОоЪоЪоОоЪо 00 00 00 00 ~4 ~4 4 Vj Vj ~4 4 ~4 4 4
СЛ4^4^СОСО ЬО ЬО Ю <— •— О O^CD COCO 00 00 00 4 4 4 05 05 0H1 Oi Cn 4^ 4^ 4^ CO CO 00 ЬО ЬО to Ю *- ^- »— >— О О О СО СОСОСООООО 00 О0 00 4 4
00 00 00 00 4^ С04^005ь— 4 СО СО СП •— 4WOCDO) ЬО 00 СП .— 00 СПн-ооСПЮ 00СПЬОС0О5 СО >— 00 СП ЬО О Ч *> N2 СО 44^tOCOS >?». ЬО О 4 05
05 05 4 СО ЬО СП СО 4^ О О) 4^ СО СО ЬО СО 4^ 05 СП 00 ^- 4*. 00 GO 00 4^ OS^NDO 00 vj С7) О) Ч ОООЬОСПОО >— СП СО СО 4 •— СП >— 05 ЬО 00 4^ О 4 ЬО
111-11 Mill Mill
II I II I II IIII I IIII I II I II II II I II I II I IIII
—'"—bO bObObObObO COCOCOCOCO 00004^4^4^ 4^4^4^4^СП СП СП СП СП СП 0505050505 Q4444 S Ч Ч 00 00 OOOOOOOOOO
^4 00 0 рООСЛЧОО OtOWOOOl рООО^СО ^ОзООСО*- KJ^CDvlCD OtO^Ol4 00O^W4^ 0H0 0^10 ^СЛЧООр
ЬОСОО5С0 О Vl ^ ^- 00 ^ ^OO^O-nI Vo'^VjW ~CO СЛ ">— CO 00 СП "н— Vj 00 bVobb 00^ OOl"^- 05То~40оЪо ~4^ ОСл'ь- 05 ЬО 00 COCO 00
* и- >— и- bO bO I
^ _ _ _- _ i^iNjbObObO bO bO bO tO bO bObObObObO bObObObObO bO bO bO tO bO bObObObObO bObObObObO bObObObObO bObObObObO bObObObObO
COCOCDCOCD OOOOO OOOOO »— >— •— •— •— •— .— >—>— ^- н-ь-н-ю Ю bObObObObO bObObObObO bOOOOOOOOO OOOOOOCOCO 00O0O0COCO
4^Cnj4 00CO ,p ^— bO 00 4^ S11?^ Т^$°?р ,P J""* I4"* i° .P0 ^f^ ^^ ^C-1 ^5~5 j-~4 ?0 00 CO О •— bO tO CO 4^ СП СП О) 4 4 00 COOO^-bO jOOO^^Ot 05 4 j4 00 GO
4 CO I- 00 СП 05 ^OD CD CO 00 CO 00 4 4 4О5 00СЛ00 tO 0 00 05 4^ ^— "CO " СП СО ОЧ^к) О 4O5tO~C0O5 иОЧ^'н- 00СЛЬОСОО5 СОО^
)Чй^Ч
СО СО CO 00 00 СО 0Л00 00СО COOOOOOObO ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО tO ЬО ЬО ЬО bObObObObO ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО ЬО bObObObObO bObObObObO
bO bO>— •— >— — >
ЬО — CD 4 05 4^ С
4 ЬО 05 CO ЬО 05 С
•!>— OO ООООСО COCDCOCDCD CDOOOOOOOO 004444 405О5О505О5СПСПСЛСП СП 4^ 4^ 4^ 4^ COOOCOCOtO bO tO tO >— >—
Ль— C04 054^4^ь-сО 4СП4^4^ЬО О 00 05 4^ GO >— CO 4 СП 00 >— CD 4 СП CO >-* 00 05 4^ tO О 4 СП СО О ООСПСОООО СПЬ004СП
>»CO 05CO ЬО СП СПЬО 4^ ОзОООООЬО 000500С0О Ь04^4^4^4^ 4^ СП СП СО >— 0004СПСО 00005tOCD 4^ СО 4^ 00 00 O5000b005
40505 0505050505 05О5О505О5 0505050505 О50505О5О5 05 СП СП СП СП СПСПСПСП
OCOCO 0044O5O5 СП СП 4^ 4^ СО COtObOtOtO •— *- »— О О ОСОСООООО 00444 ' I
05CDtO СПООЬ0050 СПОСП1—4 О0СОО5СПн- 44^0400 005ЬОСОСП Ь0004^О
II II II I II II I I I II II I
,00 со 00 00 to ьоююьою jobobototo botobo^—e>— ~^T*T*?~ ^!Г*!Г!Г!Г ГТТ-^
0o"to">—OCO '00 4O CnV VoobObO^ ">— OOCOCO CD 00 004*4 405О5О5СЛ CnCnCnV MM
^Ю"-СО ^-ЮООСДОО н-^41-СЛ O^OCO^ OO^-OO^ О44^ь-00 OlCxX-OOi ' ' ' I
bO4^0044 004i-COCD00 »— bO 4 СП 05 04054CD COOCOOCO 004^00COCn С04^^-СО
Mill II I I I II I I I
g
s
X
p
2
И
s
CO
^ Ъ
U XJ la
CO ЯЭ О
•-J OV W
Co о "О
f4 H S
S E н
s
,—, л
О
o\
0^
CO
» S
О
•— д
о чз
^ со
Д
к
Co
f S w
^,J OB
^^ 22 Я
, . к о й р
й^3 р»
Со
о
л «
ГО S
н я
Д О)
rt н ^
> *< iH
СО 43 ^3
Д со О»
д х .-*
0й
к д
н Е ^
rD П) Д
о а
Я
В ~ S д
о>
~ it/ я о w
g ^ F ¦ ^ —
w Co
о s S 00 g0 д
Д Д
О Д
g E «S
и fa н
CO S
^ S n
Co Д
po rD
CO ^ S О P»«
^ й C*D t<H о
0
S3
s
s
p
ыщенн
so
H
p
o\
fcl
s
я
p
<
43
Fs
^ я
Й О
о
*о
" я
^я
1 я
•в ?
ь—
W
to
Я
О
н
и
о
и
СО
я
Е
я
W
° 5 ^
ю Е я
о ~ s
Д° ю ^
<^ ^ ?
н Д w
идо
w н н
ТЗ 43
-, и 2
Со Оэ я
w й д
со г& <т>
екая
дав-
при
1
§
CO CD CO CO CM LOh-ODLOt> 00 —.—.—. 00
CO О О —i Tt" 00 Tf CM CO CD CM CM ID CM CO
со" со" со" со" ¦* ThT^^Tf ю ю" ю" ю" cd" cd" cd" t*-T t^T oo" oo" cd" cd" о"-н" см" со" ^" id" cd" oo"
00 '—i CO ^ ID
Ю0^05Ю
^CDNOOO
00 00
OCO^MO) cDCD-HCOlD
CMOOLDOO'— ^OJlDOiiD
О CM Ю t^- —<
CM CM CM CM CO
ID ODlO *-* 00
CO CO Tf" LD ID
CM CM CM CO ID
ОО^ЮСОЬ
t^ t^ f-, t-» h-
Г--О rf CD "Ф ONCDlOiC Ь- О rf О h-
00O—<CM^ CO h- CD —i CO urjOOOCOiD
l>-00 00 00 00 00 00 00 CD CD 0 0H00
CD CD 00 CM 00 CD t^ —< 00 CD
00—< -Ф 00—< ID O) -Tt4 00 CO
0 _ —. ~, см см см со со ^
Ю 00 CDO CM
CD ID CM —¦ О
^ICCONOO
Tf h- —i CD CM CD h-
О —< *Ф h- CM t— "Ф
<Л О —• CM ^ ION
III II I
< CM CM CM CMCMCMCMCM CMCMCMCMCM CMCMCMCMCM CMCOCOCOCO COCO
s
3
CO О CD —< h- COO^OO -и N ^ 00 00 ООЮОСО-н t~- CO 00 ^t< CD 'tONCOO Ю —< 00 ^F CM СП CO CO-н 00 COCOOOCOCO N CO О
^CONCflO WCOlONOO О -—> CO 'Ф CO b- CD —• CM "Ф lONQOO-^ CO Ю CO 00 О —< CO -"Ф CD 00 О-нСОЮСО 00 О CM Ю 00 *-1 CO —•
CM CM CM CM CO CO CO CO CO CO ^J< ^ <ф •ф ^ 'Ф^ЮЮЮ ID ID ID CO Ю CO^ CO CO^ CO^ «>- t^ t^ t^ t^C^ t^ 00^ 00^ 00^ C5Q 00 05 0H5 CD^ 0_0_ CM
CO" CO" CO" CO" CO" СО" СО" СО" СО" СО" со" со" со" со" со" со" со" со" со" со" со" со" со" со" со" со" со" со" СО" со" со" со" со" со" со" со" СО со" со" со" СО СО СО СО СО *<? *Ф "*?
'twh^O Ю О Ю CD СО Г-ОСМ-ФСО h- Ь- Ь- Ь- Ю СО —^ 00 Ю-^ СО О CM rt< LD CD LD CO CD СО СО 00 00 СО —• СО CD CD О CD СО —«
СО СМ О О) 00
CD CD CD 00 00
СО ID СО —< О
00 00 00 00 00
00 Г— Ю СО —«
С^. !>• t^ Ь- t^.
OD t^ ID CO —'
СО СО СО СО СО
О) h- ^h CM О
Ю Ю ID ID ID
h- LD CM CD CO
Tf Tf rf CO CO
CO О h- CO О
CO CO CM CM CM
CO CM 00 'Ф О
—i -нООО
"Ф Г- I
- ^ OSs CM rf CO t^- CD О CM ^LDCDt^OO 00 00 00 00 l>- CO CO LD ^ CO ^' O) CO CO_ О Г^-_ CO OD "Ф 00 CM CO_ О) CM "Ф Ю_ CO 00
о о cd" оо" со" ^h см" о" ел" ь-"
—" ~< CD;CD CD О) CD СП 00 00
I I
I I
LO СО -ч CD h-
СО СО СО LD LD
II I I I
CO -и 00 CD CO
rf Th CO CO CO
I I I I I
—" 00 LD CO О I>-^0
COCMCMCMCM —.*-«.—. CD CM
00 CM CM CO CM
I I
1 I
s к
в x
о «в
U CQ
О cd
к о
cd
NOiOOO
оо^спюо
LD CO CD h» 00
CD CD OD CD CD
^CO^ '¦ rt ¦ 1
COCMOOLOLO ОО'Ф—'00Ю CO-hOOON CD CO CO CO CD
00 0HH О ~-« CM CO CO ^ Ю CO !>¦ b- 00 CD О —< CM CO
CD CD 0H0 OOOOO OOOOO О —i —¦ —« —i
00 CM t-- CO —'.
О CM CO LD Г^-
CM CM CM CM CM
OOCMCOCO COt-~r^LOLO СМЮ'Ф
О) —< CO ID 00 —« -Ф 00 CO CD t1^ CD CO
CMCOCOCOCO "Ф "Ф Tf LD ID CO Г- СО
OOOOO OOO*
-и 00 CO CD O) CM LD O) LD 00
COI^^CMCM Ю CD ID -Ф Ю
h- О Tf 00 CM CO О ID О Ю
CO h-
00 CO —' CM «f О 00 00 CM 00
О CO CM 00 'Ф —'N^<MO
t>- CD rf CO "Ф CD t> CD -Ф CO
l>- LD ^f CO CM —i —• —i CM CO
Tf ID ID ID CO CO t>- !>• 00 00 О) О) О О —¦ CM CM CO ^f ^ LD CD t» 00 O)
O'-'CMCO^» iDCOt^-OO
CMCMCMCMCM CMCMCMCMCO
l>- rt- ID —« *-<
CO О ^ О) "Ф
—Г со" "ф" lo" t^-"
со со со со со
NNCOC0 05 r-ц O) t^
C0)LO^CMO)CO LDCO00
oo" о" см" со" id" t^T O) o"
CO^^^1^ ^rfLD
COtlOCON 00 CD О —• CM CO Tf LD CD t^- 00 CD О —« CM CO^lOCON 00 CD О —i CM CO ^ LD CO t^ 00 CD О <—• CM CO ^f -*
^_-н^н^н^-4 ^h^,cmcNCM CMCMCMCMOJ CMCMCOCOCO COCOCOCOCO СОСО'Ф'Ф'Ф Tf ^ rt< ^ ¦* ^^ЮЮЮ LDLDLfD
j aa
1 - Ct-
1 ^
-
1 **¦
-
1 Ъ
^
CL
CO — N О CO
t^ Tf h- О *—
1 ^„ьооо^
! -Г ~-T —Г см" oj
Tf CO LD Ю CO
00 О —< CM CO
LD CO CO CO CO
t^. OD CO — '—
CM CM CD tt CO
N00 00O5O)
См" cm" cm" cm c-3
LO Ю CO rf rf
—Г с^Г tjT см" o"
CM "-Ч -^ ^ ^н
CM CM CM CM СI
oo Ф oq_coo
—Г со" ь." со" о"
LD "Ф СО СО СО
ттттт
CD CM СО О СМ
ОООООСО
тг LD h* 00 ОС-
00 00 00 00 00
о" о" о" о" о"
00 Ю "-< LD СО
СО CD -Ф О^ СМ
оо" со" ь-" о" см
I-- 00 00 CD CD
ЮО!ООЮ
СМ^ LD Г- О CM
о" о" о"—Г-Г
Продолжение табл. V
V
1,50
1,75
2,00
2,5
3,0
3,5
4,0
4,5
5,0
5,5
6,0
6,5
7,0
7,5
8,0
8,5
9,0
9,5
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25 .
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48 |
49 |
50 1
Т
94,10
95,74
97,21
99,78
101,99
103,94
105,70
107,30
108,78
110,15
111,44
112,65
113,79
114,87
115,91
116,90
117,85
118,76
119,63
121,30
122,85
124,32
125,71
127,03
128,28
129,48
130,63
131,74
132,80
133,83
134,82
135,78
136,70
137,60
138,48
139,32
140,15
140,95
141,74
142,50
143,25
143,97
144,69
145,38
146,06
146,73
147,38
148,02
148,65
149,26
149,86
150,46
151,04
151,61
152,17 ]
152,72
153,26
153,79
154,32
v'
0,8956
0,9023
0,9084
0,9194
0,9294
0,9386
0,9470
0,9551
0,9628
0,9703
0,9775
0,9844
0,9911
0,9976
1,004
1,011
1,017
1,023
1,029
1,040
1,052
1,063
1,075
1,087
1,099
1,111
1,122
1,133.
.. 1,145"
1,156
1,168
1,179
1,191
1,203
1,215
1,227
1,240
1,253
1,267
1,280
1,295
1,310 1
1,325
1,340
1,357
1,376
1,395
1,414
1,434
1,456
1,481
1,508
1,537
1,569
1,606
1,648
1,696
1,759
1,873
i'
—126,9
—124,2
—121,8
—117,4
—113,7
—110,4
—107,4
— 104,6
—102,0
—99,6
—97,4
—95,2
—93,1
—91,2
—89,3
—87,5
—85,8
—84,0
—82,3 ,
—79,1
—76,1
—73,2
—70,3
—67,6
—65,1
—62,6
—60,2
—57,8
—55,3
—53,2
—51,0
—48,8
—46,7
—44,6
—42,6
—40,5
—38,5
—36,4
—34,4
—32,5
—30,6
—28,7
- —26,7
—24,8 1
—23,0
—21,2
—19,3
— 17,4 |
—15,4 1
—13*5
—11,3
—9,0
—6,6
—4,0
— 1,3
1,6
4,7
8,6
14,9
г
208,7
207,2
205,7
203,0
200,6
198,4
196,2
194,2
192,3
190,5
188,8
187,0
185,3
183,8
182,2
180,6
179,1
177,5
175,9
172,9
170,0
167,1
164,2
161,4
158,7
156,0
153,4
150,7
148, Г
145,4
142,7
140,0
137,4
134,8
132,2
129,4
126,7
123,9
121,2
118,5
115,7
112,9
110,0
107,1
Ю4,3|
101,4
98,3
95,2
91,9
88,4
84,8
80,9
76,7
72,2
67,'4
62,2
56,6
49,6
35,8
s'
3,012
3,040
3,066
3,110
3,146
3,178
3,208
3,233
3,256
3,278
3,298
3,318
3,336
3,357
3,367
3,383
3,398
3,412
3,426
3,453
3,476
3,499
3,521
3,541
3,562
3,581
3,598
3,614
3,631 •*
3,648
3,664
3,680
3,695
'3,709
3,722
3,736
3,750
3,764
3,777
3,789
3,802-
3,815
3,828
3,840
3,852
3,863
3,875
3,887
3,899
3,911
3,925
3,939
3,954
3,970
3,988
4,007
4;027
4,049
4,095 |
с'р
1,641
1,649
1 1,656
1,670
1,684
1,698
1,712
1,726
1,740
1,754
1,768
1,782
1,797
1,812
1,827
1,842
1,857
1,873
1,889
1,921
1,954
1,988
2,023
2,059
2,095
2,132
2,170
2,209
2,24$
2,290
2,332
2,375
2,421
2,470
2,523
2,580
2,641
2,706
2,776
2,850
2,930
3,015
злоз
3,194
3,288
3,385
3,485 I
3,586
3,687 I
3,789
3,892
. —
—
—
—
— i
— j
—
Р-
2,221
2,325
2,425
2,621
2,812
3,001
3,190
3,380
3,571
3,765
3,963
4,164
4,370
4,580
4,796
5,018
5,246
5,481
5,723
6,231
6,774
7,355
7,980'
8,653
9,380
10,17
11,02у
11,95 <
12,96*
14,06
15,27
16,59
18,04
19,63
21,38.
23,31
25,43
27,77
30,34
33,17
36,29
39,71
43,45*
47,52
51,91
56,62
61,60^
66,79
72,09
77,39
82,53-
—
—
—
—
—
—
—
82
о.
а
VO
II
К
а
С
с
са
^
со
-
?>
а
<
1,486
1,611
1,778
1,997
00 О h- Ю
со ооо см
ЮЮСОСО '
СО т»* О) О
QDt^OOOi
см см см" см
СО Ь-С^-t^-
tC стГ —Г со"
Ю ^f Tf CO
тттт
0,8295
0,8451
0,8618
0,8798
Ю СО ^Р СО
Ю СОО СО
О 00 СО СО
см —* —« —
ю ою о
t>- 00 00 05
1
0,994
5,354
83,9
239,7
о
о
о"
ю
ел
Mill
CMl^ h 1 00
СО rf СО СО CM
о* о о о> о>
о" о" о" о" о"
Тр -н Ю СО СО
OIOQCON
ю ю ю ю ю
00 Ю СМ О* СО
оо" со оо" см" t^."
00 0H500
ю о^ю о со
со" t^" о" ^f Is-"
Ю СО 00 05 О
см см см см со
LQ Ю Ю CM "f
05 «^ Ю rf CM
со со со со со
ооооо
ооооо
о" о" о" о" о"
V
оюамо
i i м i
СОЮ ^ СМ-н
см см см см см
05 05 05 05 05
о" о" о" о" о"
^ОЮО)-ч
.—¦ ю оо ~<лп
СО СО О t^ h»
ююююю
смоо тр»-*^
см" со" ^-Г со" о"
—1 —< СМ СМ СО
h- О CM lO t>
о" ^ф о-" о" со
см со ^ со г-
СО СО СО СО СО
05 rf О rh СО
—¦ 05 00 t^- h-
—i 05 00 С-- СО
со см см см см
ооооо
о со о о о^
о" о" о" о" о"
ММ 1
*-« О О500 00 t^
СМ СМ —< —1 ~< —<
О) О) 05 0> О) О)
о" о" о" о" о" о"
СМ СМ —« 0> t- О
00 ~ч rf CO 05 rf
Г^ CXD 00^ 00^ 00^ 05^
ююююю ю"
CO^O^lO'-^CO 00
ю" оГ т^4 стГ со" см"
СО СО -* тМО CO
О 1-ч СМ^ тр иСЭ 00
СО" О" СО" СО" 05" Ю
00 О —^ СМ СО СО
СО "f rp Tf Tf rf<
Ю О О LO LO t^
OOOW^N rp
Ю Ю 4f CO CM —h
CM CM CM CM CM CM
о о о о о о
соооо^о о^
о" о" о" о" о" о"
ЮОЮОЮ OiOO «О,^^
.—н ^ *-, ..о ЧО I'- °°
а
VO
ю
II
о.
я
а
G
са
^
со
-
a
а
/л
1 СО О СО 05 Ь-
Г-- 05 СО h- LO
тр lO ^ 05 CM
t^ ооюсо со
С000О СМ тр
lO lO cO^co CO
СМ СМ Ь- 00 00
LOLO ^Р СО СМ
о t^ сад ел со
см" см" см" см" со"
ьГоГ^со"ю"
LO *Ф Tf CO CM
1 1 1 1 1
ОЮ—• —1 СО
О) Tf —< 05 00
CM ^P CO t^ О)
00 00 00 00 С©
о" о" о" о" о"
1,2062
1,1841
1,1612
1,1375
М129
?§?°>® с
2,620
3,099
1,669
1,704
3,112
3,195
—117,0
—108,5
0,9199
0,9434
1 1 1
со cot^
СО СО -н
ОО^
со со t^
СО00 СМ
°. р, *~1
ю"ю"ю"
СО 05 О
—Г со" см"
05 05 О
51,51
54,62
57,66
N-r^ тр COCO
g g О 00 Г-
°.°. ( ооо
^ о"о"о"
5 Ю О Ю О Ю О LO
о *-• ~ см см со оо
!
Mil
rf "Ф СО 05 СО
O05 00NN
О 05 05 О) 05
—"о" о" о" о"
OONtO ^
сОО^оо^н
—^ СМ СМ СМ СО
ifiioioioio
i>." см" г--" —Г со"
О н —< СМ СМ
Ю 050 t^ СМ
СО^ Ю^ Ю^ СО^ СМ
О" СО" СО" 05" CN
со со со СО Г-
05 СО ТР СМ Ю
¦^N0^00
СО Ю Ю rf СО
ООООО
о" о" о" о" о"
* ою
Mill
00 СО 00 ^ -н
СО СОЮ Ю Ю
О 05 О 05 05
о" о" о" о" о"
1^ 0H 05 Г^
TJ* Г>- —1 СО СО
СО СО 'Ф 't Tf
ю ю юШю
Ь- Ю^СО ^00
-Г со" —Г со" о"
СО СО "Ф тр Ю
Tf гр СМ 00 СО
qoqcDco -^
ю" h-" о" со" со"
t-- t^. оо оо оо
СОЮОО)^
СО 00 тр О) СО
со см см —^ —<
оооо^о
о" о о" о" о"
о ю о ю о
Ю Ю СО СО 1>
!
0,944
5,522
60,3
91,60
см
05
о
180
со
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2071
1,1850
1,1623
1,1387
1,1141
1,0885
1,0617
1,0332
1,0027
0,03832
0,03587
0,03380
0,03201
0,03044
0,02904
0,02780
0,02667
0,02565
0,02472 -
0,02385
0,02232
V
0,8284
0,8439
0,8604
0,8782
0,8976
0,9187
0,9419
0,9678
0,9973
26,09
27,88
29,59
31,24
32,86
34,43
35,97
37,49
38,99
40,46
41,92
44,80
i
—157,0
—149,1
—141,2
—133,2
—125,0
—116,7
—108,3
—99,7
—90,8~
94,0
99,8
105,5
111,0
116,3
121,6
126,9
•132,0
137,1
142,2
147,2
157,1
= 10 бар
s ч
2,650
2,751
2,846
2,937
3,026
3,110
3,193
3,273
3,352
4,900
4,948
4,992
5,034
5,073
5,110
5,145
5,179
' 5,211
5,242
5,272
5,329
СР
1,566
1,586
1,603
1,620
1,640
1,6A5
1,69$
1,74S\.
Р
1,462
1,584
1,745
1,956
| 2,229
2,582
3,046
3,673
1,809 "*]ч A54fe
1,186
1,143
1,112
1,088
1,069
1,052
1,038
1,026
1,015
1,005
0,997
0,982
^>W—
^
i.
>
*
— К*
1 ?\
_1
)
)'
5
__)*
~4 v.
Продолжение шаб
т, °к
75
80 .
85
90
95
100
105
ПО
115
120
125
шг
130
135
140
145
150
155
160
165
170
180
р
1,2080
1,1860
1,1633
1,1398
1,1154
1,0899
1,0633
1,0351
1,0050
0,9723
0,9359
ш
0.05549
0,05174
0,04864
0,04600
0,04370
0,04168
0,03990
0,03828
0,03683
0,03429
V
0,8278
0,8432
0,8596
0,8774
0,8966
0,9175
0,9405
0,9661
0,9950
1,0285
1,0685
h№
18,02
19.33
20,56
21,74
22,88
23,99
25,07
26,12
27,15
29,16
При р -
i
— 156,7
—148,8
—140,9
—132,9
—124,7
—116,5
—108,1
-99,6
—90,7
—81,5
—71,8
97,7
104,1
110,1
116,0
121,7
127,3
132,7
138,1
143,4
153,8
= 15 бар
s
2,649
2,749
2,844
2,935
3,024
3,107
3,191
3,271
3,349
3,428
3,509
4,844
4,892
4,936
4,977
5,016
5,052
5,087
5,120
5,151
5,210
ср
1,565
1,584
1,601
1,618
1,637
1,661 v
1,693
1,738
1,799
1,881
1,997
1,296
1,238
i,191
1,155
1,126
1,102
1,081
1,064
1,049
1,024
• >
J4
:бз
_ ,38.
,31
Мз
1,77
134
Л17
>6,29
\ '39,71
43,45
47,52
•4,91
'6,62
П.60
.6,79
'9 0Q
^7,39
82 53
—
, ,.
i
84
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
по 4
115
120
125
130
135
140
145
150
155
160
•165
170
180
При р = 20 бар
Р
1,2089
1,1869
1,1643
1,1409
1,1166
1,0913
1,0649
1,0370
1,0072
0,9750
0,9393
0,8987
0,07595
0,07005
0,06536
0,06149
0,05820
0,05536
0,05285
0,05063
0,04682
V
0,8272
0,8425
0,8589
0,8765
0,8956
0,9163
0,9405
0,9661 .
0,9950 ,!
1,0285 -
1,0685
1,1128
VIM
13,17
14,28
15,30
16,26
17,18
18,06
18,92
19,75
21,36
i
— 156,4
—148,5
—140,6
—132,7
—124,4
—116,3
—107,9
—99,4
—90,6
—81,4
—71,8 •
—61,6
-ЫN
95,9
103,0
109,7
116,0
122,1
128,0
133,8
139,4
150,3
s
2,647
2,748
2,842
2,933
3,022
3,105
3,188
3,268
3,346
3,425
3,504
3,585
4,772
4,824
4,871
4,914
4,954
4,991
5,026
5,060
5,122
СР
1,563
1,582
1,599
1,615
1,633
1,657
l,68flL
1773Г
1,788
1,866
1,973
2,127
1,493
1,377
1,299
1,241
1,197
1,162
1,133
1,109
1,071
Р
1,437
1,554
1,711
1,913
2,174
2,509
2,946 A
3,528 '
4,328 ?К
5,4?8 '
7,241 1)
10,22
—
Продолжение табл. VI
Т, °К
75
80
' 85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2097
1,1878
1,1653
1,1419
1,1178
1,0927
1,0664
1,0388
1,0094
0,9776
0,9427
0,9031
0,8665
0,09679
0,08829
0,08184
0,07665
0,07233
0,06863
0,06540
0,06006
V
0,8266
0,8419
0,8582
0,8757
0,8946
0,9152
0,9377
0,9627
0,9907
1,0229
1,0608
1,1072
1,1675
10,33
11,32
• 12.22
13,05
13.83
14,57
15,29
16,65
При р-
i
—156,1
— 148,2
—140,3
• -132,4
— 124,2
—116,0
—107,7
—99,2
—90,4
—81,4
—71,8
—61,7
—50,8
94,4
102,4
109,7
116,5
123,0
129,2
135,2
146,7
= 25 бар
s
2,646
2,746
2,841
2,931
3,020
3,103
3,186
3,265
3,343
3,421
3,500 -<
3,580
3,663
4,719
4,775
4,825
4,869
4,910
4,948
4,984
5;05П
СР
1,562
1,581
1,596
1,613
1,630
1,653
1,683
1 1,724
1,779
1,852
1,952
2,091
2,305
1,710
1,520
1,403
1,323
1,263
1,217
1,179
1,123
Р
1,424
1,540
1,694
1,893
2,147
2,474
2,899
3,461
4,227
5,316
6,958
9,656
14,75.
—
—
— .
--
—
:
85
оо -jcDCDCnел
о ослосло
4^ 4^ 00 00 tO tO >——* О О СО СО 00 00 *vj
СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
г3
о ррррр
о о *- ">— *— *-
00 СО О •— tO 00
00 00 4^ СЛ tO СУ)
00 ~vl CO tO CD 4*
ооррр Р.ГЧТЧ'"- ГТ^ГЧТ-
"¦ч оо оо со "со сооооо ">— ~>—">— I- "to
4^ >— CD >— 4* 00 >— 4^ CD CO tO 4^ CD 00 •—
CD CD 00 >— СО tO 00 tO СО СЛ О 4*. -О СО •—
to^-оосло -^слоослоо to >— to CD 4^
^- Op00 00j4
to ь- ел оо "i— oo
ел оо to -ч сл оо
оо *чсо о
!Г!Г!Г!Г~!Г f^PPf* РРРРР
Сою"—ОО ОСОСОСОСО 0000000000
4^юелсосл >~*оослсо>— со^сл4^ьо
О СЛ — -Ч 00 -<1СГ>СОСЛ00 tO 4* CD О СЛ
to 4^ -4 n- -4 CD CD 4* О О —4 н- ^J CD СЛ
О — •— СЛ >— CD
I II I I I I I II I II II
tO00CnCn*<l 00 СО СО — — н- к- •— н- —
Q5 c?j _. и- >— >— О 00 О •— tO 00 00 rf* СЛ
-bVcooo lo-oo^P1 ."ГР^?
to сл cd оо -ч -о ел
я
к
"О
II
4^ 4* 4^ 4^ 4* 4*
СО 00 00 ~-n) —4 CD
оо ел >— CD *— ел
to -ч сл со cd со
со со со со со со оо со со со ¦ со to to to to
00 Vj CD СЛ V V CO tO ^— О О СО Ъо -4 CD
00 О0 СЛ "Ч СО •— 00 CD 00 СО >— tO СО 4* 4^
|-^ООЮ СЛ-Ч О ¦—СО CD 00 -Ч СО СО
tO СО 4^ СЛ "Ч •—
СЛ CD СЛ "Ч СЛ О
>— CD — tO СО СЛ
I Mill
со to to to >—
>— 4^ н- О СО 00 -Ч -Ч CD CD CD CD СЛ СЛ СЛ
COCncOtO"— tO CD 1— -4 4s» tO О CO ^4 CD
OCDOOOCO -4 >— ^- CO СЛ 4^ 00 tO -J О
CO CD CD -4 4^ 0 0 00 00 4^ О 00 CD СЛ 4*
О СЛ СО •— CD tO 4^. CO О О СО СЛ CD —* О
CD tO СО О 4^ СО 00 -Ч СО — СО О
^
родолжеь
ше табл. VI
180
0,07402
13,51
142,9
4,988
1,183
1
•ч cd сг> сл ел
ослосло
0,1060
0,09775
0,09122
0,08591
0,08137
top pop
tO CD О tO 4>»
СО 4^ CD 00 00
¦Ч
СйЮ"-мО
О 4* "Ч О ЬО
V| СО СЛ СО СЛ
4^ 4^ 4*- 4*- 4*.
СО 00 00 Vj Vj
>— -<l CO CO 4s»
00 СО 00 tO О
tO СО 00 4^ CD
CD tO СО СО СЛ
4^ О 4^ "Ч tO
1 1 1 1 1
145
0,1173
8,528
93,6
4,680
1,927
1
4^ 00 со to
ослосл
рррр
00 00 СО СО
О CD О 4»
•ч to -ч сл
>— CD 4^ СО
1,0572
1,1021
1,1593
1,2389
II 1 1
со сл cd -ч
р »—*- >—
tO К) 00 00
СО СО СО СО
~-Ч CD СЛ V
4^ СЛ -Ч СО
4^ CD СЛ CD
to to to •—
сл to 0 со
CD 4^ СЛ CO
4^ СО 00 tO
6,700
9,159
13,60
23,49
to •— •— 00
осло ело
Ьоооо
00 •— 4* CD СО
О ¦— О00 4^
to слеп о о
~рррр
о со "со со со
to 00 cd 00 >—
О00 >— CD 4>-
MvIO^h-
Mill
— осо о •—
соЪоГ4^
СЛ 00
со со со со со
4^ СО tO ^— ">—
|— 4^ CD OO О
00 О СО СО н-
00 -4 "Ч CD CD
СО -Ч >— -Ч 4*
СО О -4 00 СО
СЛ 4^ СО tO tO
и- и- СО 00*4^
CD 00 СО СЛ 42»
СЛ — CD СО •—
СО СО 00 00 -q
сл 0 ел 0 сл
>— 4^ CD 00 •—
СО СО CD 00 О
ОО Ю ^1 CD
ррррр
00 00 00 00 00
со *ч ел 4». to
СО 4^ -J •— CD
-g СО СЛ tO О
II 1 1 1
tO CO 4^ 4^ СЛ
СО to ООор
со'^-ооч
со to to to to
О CO 00 -4 CD
>—> tO 00 4^ 4s»
00 CO CO СЛ 4^
CD CD СЛ СЛ СП
tO ь— СО -4 CD
|— оо cd ел V
to -j -4to к—
tO 00 00 CD tO
0
¦0
C2
"
СЛ
xT
¦oo
r» I
s
-0
CO I
0 1
0\ I
R 1
о
Со
00 -4 ОЗ Оз СП
О О СЛ О СП
р poop
ЬО СО СЛ СП CD
О 00 О ^ CD
tO 00 CD CD tO
oo грелся
to to оз со О
tO О tO СП CD
О OiQOlO)
CO •— О CD 00
О СП О О CO
Vj WTcnoo
ф* ф» ф* ф. ф.
00 Vj Ъ> 05 СП
00 Ф* СО 00 ф.
tO Ф» tO О ОЭ
Г-4 Г- Г-1° 5*3
V OJ 00 tO tO
tO СП ОЗ ф> Ф-
to Ф* ф* ф* ф>
Mil!
150
0,6927
1,4436
— 13,0
3,911
3,596
67,10
ф. Ф- 00 00 tO
СП О СП О СП
0,9549
0,9191
0,8786
0,8314
0,7731
to to н- о о
СО О СО 00 Ф»
00 tO 00 00 ^
СП 00 tO О Ю
II II 1
tO ф. СП ОЗ -4
00 *- н- tO *-
bocobVi
СО 00 00 00 00
00 Vj ОЗ СЛ ф.
О •— 00 ОЗ 00
СП 00 00 ¦— Ф»
-Ч 00 н— CD 00
СО •— О -Ч 00
Ф*- О СО ОЗ О
to ¦— >—
CD СЗ ^— -Ч р
toViocob
to со со оз со
•— со
о ел о сл о
CD О О О О
00 ¦—' Ф» ^ СО
•Ч -vl СЛ tO -4
СП С73 ^4 Ф- СО
^оооо
о со со со "со
>— 00 СЛ 00 •—
to to оз to о
•— "О 00 СЛ 00
1 1 1 1 1
ОСООООь-
со о
СО 00 00 00 00
V 00 tO ~— о
О 00 tO -^4 СО
00 tO СП CJ3 СЛ
00 ~<1 ОЗ О ОЗ
О Ф» СО Оз СО
Ф* СЛ СО Ф* 00
Ф» CO CO tO tO
V) 00 tO "-Ч 00
Оз Ы n- tO Ф*
Ф- О ^1 СП ОЗ
СО СО 00 00 ^0
СЛ О СП О СЛ
tO Ф^ ОЗ СО •—
tO ОЗ СО •— 00
СП tO >— Ф- н-
орооо
00 00 ОоЪоЪо
СО СЛ СО tO
О tO СЛ СО 4^
СО СО 00 00 СО
1 1 1 II
tO 00 00 4s» СЛ
00 <— CO^J Ф»
~— to to ^— со
со to to to to
О СО 00 Vj оз
>— tO 00 Ф> Ф*
N3 Ф- Ф* О О
Оз Оз СП СП СЛ
1-ОСОЧСЛ
00 СО 00 Ф» -Ч
О 00 ОЗ Ф» 00
Ф* ь— ОО 00 -vj
СОСЛОСПЧ
ч
я
"О
с
-
СЛ
Г5
¦Q
¦со
д.'
хз
К
= 45 бар
*
?
^
00
О
0,1047
9,549
134,9
4,880
1,330
1
^J ОЗ ОЗ СП СП
ОСП О СП О
ррррр
>— tO 00 СЛ 00
NJ03SWO
^J 4^ ОЗ СЛ ОЗ
.Р0 Г41 .Г41 Р5 571
Ф» СО tO СП СП
СО >— ОЗ •— СО
-vj 00 ОЗ ОЗ -vj
to — О со 00
со *—Слоз Ф»
^ rfi. ^ 4^ >*»¦
оо V] Vj оз сл
о сл осо сл
осооч^
Г- Г- Г- i42 ~°°
V оз Ъо to со
со to оо >— о
со ф* о. со со
1 1 1 1 1
4^ ф^ СО 00 tO
СП О СП О СП
ррррр
Vj 00 00 СО СО
оз to ^i •— сл
О Ф- 00 СЛ tO
СО — ОЗ СО О
СО То н- О О
ь— н- ф. СО СП
Ф* СО Ф* tO О
00 СЛ -О СЛ 45*.
1 1 1 1 1
tO 4^ СП ОЗ -^1
•о о — to ь—
VbNibs
00 00 СО 00 00
00 Vj ОЗ СП Ф>
— to ф* оз оо
*v) ОЗ Ф» СЛ Оз
1,896
2,001
2,144
2,377
2,918
6,243
8,319
11,80
18,49
34,92
to 1— •— о о
О СП О СЛ О
со bob о
00 >— Ф. -Ч СО
СЛ СЛ ф. •— ОЗ
»— оз о о -ч
^оооо
о со со со со
•— оо сл со >—
СЛ Ф- -vl СО »—
— -vj 00 ^4 СО
1 1 1 1 1
•— СО 00 О »—
о to
00 00 00 00 СО
ф> со to ^— о
•— 00 СП ^] СО
— Ф- 00 СО -Ч
00 ~-4 --sj ОЗ ОЗ
•— Сл О Оз Ф.
сл оо сл оо >—
ф. СО СО tO tO
оо со to Vj со
со сл *vj оз -ч
О 00 Ф> ОЗ -v|
со СО Оо 00 -ч
сл о сл о а»
to ф> оз со -—
ь— СЛ 00 О tO
00 ь— tO СЛ СО
ррррр
00 00 00 Ъо 00
СО ¦<! СП ф. tO
>— оо о) о- ф»
00 00 О OCD
1 1. 1 1 1
Ю СО 00 Ф. СЛ
СО ^- СО ^1 СЛ
ф> Ьз Ьп Фь to
со to to to to
О СО 00 Vl ОЗ
>— to оо ф. ф»
Ф> ОЗ Оз |— —
оз оз сл сл сл
to о со -*vi сл
•— сл о оз оо
О 00 ОЗ Ф> СО
¦^4 СО Ф* СО 00
СО ф» ОЗ СО 00
•о
ci
-.
«
"О
¦00
При р — 40 бар
^
Хз
«2
ex
t5
При р — 50 бар
CO.
J*
и
-
»
a
tf
CD rf LO b- CD
CO h- —< СП CM
CO^CDN O^
. —<" —Г —? *-ч" см"
со см г- —< со
ЮЬООО-н
LO LO LO CO CD
00 00 CM CM О
CO CO CO CM *-h
CO h- 00 СП О
см" см см" см со"
Ю h* ОП O^ С©
'Ф CD" ОО —<" CM"
LO Tf CO CO CM
77777
00NCDNO
CO 00 Tf —н О
CM CO LO t4^ СП
00^ 00^ 00^ 00^ 00^
o"o"o"o"o"
О CO -и CM CO
^CSONOO
—< СП Г- ^f CM
Ю О LO О Ю
t^- 00 00 СП СП
со ю см см со
—н 00 CO СП rf
CO CO *-* t^ CD
cm" cm со" со" ^
LO СП СО Ь- СО
СО LO СП СО СП
CD CO CO l>- t^
СО 'Ф СО СП LO
СП t>. Ю СМ О
О ~н СМ^ СО т?
СО" СО" СО" СО" СО"
с-- со
^^емсооо
-н О 00 СП О
"-и —< СП 00 00
ММ!
h- CM Ь- СП СО
Q-h^OO
О СОЮ 00 —
СП СП СП^ СП^ О^
о" о" о" о" —<"
СМ СП "* Ю 00
СП СО h» СП (Л
СП h- rf —. 00
О^ О^ О^ О^ СП
о ю о ю о
OlO
LO СО СО СП rf
00^ СО^ ч* ГО СМ^
LOt>. о"ю"ю"
~н _н CM
Tf -"tfi h- CO CO
СО LO СО LO СП
00 СП О CM LO
—« со СМ — LO
00 Ю СО —| СП
^lOCONN
СО" СО" СО" СО" СО"
СО -« *-н СО^ -*
—Г см" см" —Г сп"
h- COLO Th CM
М М 1
г-н 00 -ч СМ —1
¦^ го см го со
'Ф 00 СО СП h~
о о^ —^ *-* см^
00 h- СО -ч t-
Г- СМ СО 00 СО
LO CM 00 СО 00
СП О^ 00 СХЭ Г-
о" о" о" о" о"
Ю О Ю О LO
см со со ^ ^
49,83
3,251
3,892
— 15,0
1,4026
0,7129
150
II 1 1
СОЮ LO LO
Tf СМ — СО
00^ О^ СМ^ 00^
о^> со" см" <-<"
— —• спел
О LO СМ 00
Tf Ю СО^ СО^
Tf Tf Tf Tt4
—* LO^ CO Tt*
со" со" сп" сп"
со оо сп о
г^ см о ю
Ю СМ СОЮ
lO 00 Ю^ »-н
СО" ^" Ю" СО"
CM rf 00Ю
—• t"- СП СМ
OOONCO
СМ СМ^ -и —.
о" о" о" о"
ю о ю о
Ю CD CD h-
J
,530
4,785
126,2
7,150
0,1399
180
При р— 60 бар
со.
J*
-
...
»
Q.
X
к
Tf СП СО —| СМ
•^f Tf 00 СО 00
СО "ФЮ Г^СП
Tf СП СО СО О
Ю СО 00 СП —<
Ю_ Ю^ Ю^ LO СО
Ю Ю СП СП СО
СО СО СМ —« О
СО 1^ 00 СП О^
см" см" см" см" со"
СП СМ^ ГО^ Ю^ тН
СО" СО" ОО" О" СМ"
ю ^ со со см
7777-7
СОЮ СО *-н СМ
СМ Г^ СО О 00
см со ю ь- оо
oq^ oq^ сю оо^ оо
о" о" о" о" о"
СО О О СО СП
Ю ^ СМ СП Ю
—ч СП h~ Tf CN
ю о ю о ю
О- 00 00 СП СП
СП О СП rf 00
Ю —| Ю Tt« CM
СМ СО О^ СО^ "*
см см со" со" ^
00 —| СМ СМ СО
емю оо см t^
со <о со^ г- г^
СП О 00 СО СП
00 t>. ^ СМ СП
О —1 СМ^ ГО^ ГО^
СО" СО" СО СО" СО"
СО —
^^ооемю
-hONCOO
—н —< СП 00 00
М М 1
h- h~ 00 CM t^
h- 00 —" t*- Ю
OMiONO
СП СП СП СП О
о" о" о" о" -н"
t^ t^ t^ CO CO
—| СО О СО Tf
О t— Ю СМ СП
-н О О^ О СП
о ю о ю о
о о —< —| см
СП СО СО
О СО СМЮ —|
ю^ о ^ см^ о^
ю" !>¦" СП со" о"
—* см
h- CO CD СП rf
СО —| ОЮО
00^ СП О^ —^ ^
Th оо см оо г-
t^ Tf CM G^ l>.
^ЮСОСО t^
со" со" со" СО" CO
Ю^ ^ СО^ О^ 00^
—Тем" см" см" о"
NCOLO ^С0
М М 1
СМ СП СП СО 00
ООЮОСОЬ
СО h- СМ Г- -Ф
о о^ —^ —^ см^
СМЮ СМ —1 rf
СО СП СМ О —н
СО СМ СПЮ О
СП СП 00 00 00
о" о" о" о" о"
Ю CD Ю <^> Ю
см со со ^f тг
33,45
Ю -н О СМ СО
см сп t-- t^- ю
со о^ ^ о. ю^
CM" rf —с со" СМ"
Ю СП О ^f Ю
СО О СП 00 t^
00 О СМ ^ Ю
СО ^ ^ ^f ^f
00 LO LO ~н СО
t>." см" оо" о" ю"
—1 Tf 00 СП
1
О О О
t^ СО —< СО О
^h со оо см см
СО Ю Ю 00 Ю
"Ф СО rf CO CM
CM CM h 1 -н
¦^ ю оо со см
Is*- СО ГО СМ^ СМ^
о" о" о" о" о"
о ю о ю о
Ю Ю CD CO h-.
1
1
,809
4,696
116,4
5,531
0,1808
о
оо
00
00
о
о.
C5
C5-
<=>
II
C5.
К
О,
aa
^
00
-
D
a
1 ^
CM Ю CO t^ О
CM CMLO CM Tf
—• h- СП CM Ю
lOCDNCOO
Ю Ю Ю LO CD
CM CM СОЮ CM
CO CO CM —' О
CO h- ОС; СП О^
см" см" см" см" со"
*Ф Ю N СП 00
со" ю" h-Г of —"
Ю -Ф СО СМ СМ
ттттт
Ю СО СП СОЮ
—1 CD —< 00 CD
СМ СО Ю СО 00
00^ 00^ 0C3 00_ 00^
о" о" о" о" о"
СМ СО 00 СО *-<
Г-- Ю СО —< 00
—1 СП С^ Ю СМ
ЮОЮОЮ
h- 00 00 СП 0>
Ю СТ> СМ СП —'
О СО CD О СО
см" см" см" со" ^"
CM CO CM О) Ю
CD CD CD t4» t>-
Ю Ю CO 00 CO
00 CD ^f —« СП
O^ —* CM CO CO
CO" CO" CO" CO" СО"
00 CD
^^соспсм
^ONOOO
—i — СП 00 00
Mill
CD rf О) h- rf
Ю CD 00 СО -ч
СП^О^ОЭ Oi О
о" о" о" о" -н"
СМЮ 00О CD
rf 05 СО h- 00
О h- Ю СМ СП
-^q 0^0^05
ОЮОЮО
о о —н —| см
О СО СМ
—> 00 О) О- 00
СМЮ Ю СО СО
ю" со" ОО" —Г со"
СМ СП Ю СО ^
—I h» Ю t>- t^-
00 00 СП О СМ
1^ О СО СО ^
СО ^ "н 00 СО
^lOCOcDN
СО" СО" СО" СО" СО"
cocoiqiqt^
—Г см" см" см" —Г
О- СО Ю ^ СО
1 1 1 1 1
СО СО 00 00 СО
СМ 00 О — Ю
со со ^-| со см
О О^ *-* ~н СМ^
^f 00 СМ I4- СМ
00 Ю О О СО
СО СО О СО —1
СП О) О) 00 00
о" о" о" о" о"
ЮОЮОЮ
СМ СО СО Tf Tf
25,41
—• Oi CM О СО
CO^COOOO
ю см ю со oo
см со ю со со
CO CO CO Th CD
00 СП ^ CM "Ф
со" со" т? ^" ^"
со со ю см
cn°°oo"~"t-"
-(СО-нЮЬ
1 1
^ Tt CM
00 Ю 00 О 00
ОП-HiON
CO ^ t^ rf CM
CO C^ О CM —<
rf CO CM 00 Ю
CO СП 00 О О
l>.^ CD^ Ю ^ CO
o" o" o" o" o"
ОЮОЮО
Ю Ю CD CD O-
1
203
CM
4,608
105,4
4,360
0,2294
О
oo
О
»
При р = 80 bap
oa.
<0
СЛ
...
P
O.
4
-4
CM CM —^ Ю СП
о о со en o>
Со^ЮООО
^tCDNOOO
ю ю юю со
О 05 CO CM 0>
CO CM CM —< CT>
CO b- CO СП СП
см" см" см" см" см"
со о -^ со со
см" ю" г-" сп" —н
Ю rf СО СМ СМ
ттттт
Ю ~н СО —' 00
О Ю О ^ ^
СМ СОЮ СО 00
00 00 00 00 00^
о" о" о" о" о"
00 Ю СО СМ СО
00 N Ю СО О
—< 05 Г4- Ю СО
ЮОЮОЮ
h- 00 00 О) Оэ
Tf СМ СО Ю СО
Ю t*- h- 00 Ю
—^ rf 00^ СО^ СО
см" см" см" со" -*
СО СО СМ N СП
—< СО СО СП СО
СО CD CO CO t^
-h-hOOCON
00 СО СО—¦ 00
о —« о^ со^ со^
СО" СО" СО" СО" СО"
СО -н
^^спюсп
-н О СО 00 СП
^ -н СП 00 ^
till
N. О CM rf СМ
CO^CDON
О СМ -^ N СП
О) СТ) С?) (J) СГ)
о" о" о" о" о"
СО СМ СП Ю 00
СО СМ СО О СМ
О 00 Ю СО О
*1 °. °~ °. °.
'о ю о ю о
о о ~ ~ см
Ю СП Ю
-*# со о со со
СП — СП ^Г СО
^" СО" о" О" ^
О СО СМ Ь- ^
СП т^ —( ^-н t^-
Is- 00 СП О —¦
О СМ ч* Ю 00
COCOONS
rf ю Ф со h-
CO" CO" CO" CO" СО"
—; О^ СО СП Ю^
—Г см" см" см" см"
С- СОЮ ч* СО
1 1 1 II
^OOt^OlO
N -н —1 СП СО
СМ СО О 'Ф О
cqo^-^<N
СО 00 N- СО СП
СО '-i Г- О 00
СП СП СП 00 00
о" о" о" о" о"
ЮОЮОЮ
СМ СО СО ^ г^
20,60
СМ Г*- 00 —| О
-<Ь^Ю00
'tNcDCON
CM CM CO 4f Tf
СО — "# О —1
СМ СМ СО N —н
00 СП О^ —* СО^
СО" СО" ^ гр т^"
—21,0
—7,2
10,1
31,9
57,0
СП О О
СО Ю СО —< СО
Г^ h- ч^ t^, ^-н
СМ^ СО Ю^ 00 TfH
05 СО —* Ю rf
—1 С^- 00 ^ чнн
00 CM Tf СО —'
t^ Nqiq чф
о" о" о" о" о"
ОЮОЮО
ю ю со со с^
1
2,716
СП
93,3
3,481
0,2873
о
¦ 00
ОС
СМ О Ю Tt* —i lOCDCDO —1
ОООООСОСО ОО00-н05
СМ СО Ю СО 00 ~ч ^ t^- CM 00
00 00 О —«
ООСОСО"*
t> 00 СО ^ СО
I I
CM CM CM CO CO ^flOt—C75CM
N^CN^lO О CD СО Ю rf
Tt« CO Г- 00 CD ^ СМ Ю 00 CM
ЮЮЮЮЮ СО СО СО СО Г-
О —1 СО Ю "«*
Г- CM h- CO CD
t-- 00 00 CD О
СОЮ 00 СО СО
00 СО 00 Ю 00
СМЮ CD t> *-н
< СМ СМ СМ СМ СО ^ СО
СМ СМ '—| О CD - _. -.
СО t-- 00 CD CD О -ч -СМ СО СО
h- h- Tt4 00 ^ ^ЮЮЮСО
NlOCOOOO Ю CM CD CO CO
СМ СМ СМ СМ СМ СОСОСОСОСО
СО" СО*" СО" СО" СО
—ч СТ) СТ) О *-« СО
СО СО СТ) ~н СМ^ ^f
СО" СО" СО" ^" -Ф ^"
см^ооо^
см"^"со"оо"о"
LO "* СО СМ СМ
ь- со
^Г * Ю —^ СО
CM Tf « ~ ~
-^ О СО 00 СТ)
—I ~ СТ) 00 t>-
00 00 СО —' — —|
О —< СМ СО СО
t^ COLO rh CO
^ _ц ^н __ _ ^н — 0)ООС^ Г^СОНО^ГСО CNCT
Mill Mill II I II II
^ со co^ io t^.
см ел" ю" см" cm"
CM Tf
rf CT) CO h- —"
CD CO CD Ю CO
-и CO Tf CD 00
00 00 00 00 00
^ 00Ю CM CO
—i —i CO t^ CO
О CM Tf CO CD
CD CD CD CD CD
(NlOCONO
CM Ю CD CO CD
О О О — —•
CD Tt* CM
^f Г^- 00 CO t^- CM
m co\r>int>- со
CM CO tF CD CD 00
ooooo ooooo
rt« —i Tf CM Tt< О CD CD CD 00
О CD t^ Ю CM CD rf CD CO CO
CM CD l^ Ю CO ОООЮСОО
CS| _¦ _ —< —< -и О О О О
О Ю СО О —< CD Ь-00 CD 00 «-н
00 t4- "^f CD О CD t^ Ю СО Ю СО
N^'hN'* CD Tf 00 О О Ю
CD CD CD CX> 00^ ^- t^ CO^ CO^ ID СО
o"o"o"o"o" o"o"o"o"o" o"
X
^
юоюою оюоюо юоюою оюоюо о
C^OOOOCDCD О О —' —< CM CM CO CO Tf rf Ю Ю CO CD !>¦ 00
COOOO't't
СОЮ 00 CO CM __ . _ .
CM CO ^ CO 00 OCON'-'N
CD CD О ч* CO ^f —' CD CD
lO^^CD^t CD CD CO CD r-,
CM CM CM CO CO ^ Ю CO 00 —• Ю
5 M M
Ю 00 CD О —< Tt< CM Ю ^f О
rf Ю CO 00 CD OCS^N-h
ЮЮЮЮЮ CO CO CO CD h-
Ю CD^h CM CM
NN00 05O
NlOOJ^O CD
t^ CO CD CD CO CD
-и СОЮОЮ CM
< CM CM CM CM CO CO CO
VO
тН СО СО Ю CM CO CO CD CO CO
CM CM "—< О CD NiCNON
CO h- 00 CD CD О —• CM CO CO
00 00 Г— СО Ю
-3* —< 00Ю CM
CD ^f -4 Ю CM
coNtoimo
NOOCOO-H
CM CM CM CM CM СОСОСОСОСО СОСОСОСОСО CO CO CO «^ rf ^
co^ ociq смл см^ см см
—Tco"cd"oo"o"
Ю ^ CO CM CM
77777
M
-sq ^ O^ t^ CO СОЬСОСОЮ CD —« CO -и O^
—н О CD" Is-" СТ)" О" -^ CM" CO CO" CM" —<" CM" Г--Г r^T
rH^GH0N NCOlOtCO CM —< —< CO
Mill I II II II
Tt« 00 —i CM Ю CD CD CD -и Ю 00 Ю h- тр CM 0001*
00 CM 00 тр —• CD CD О Tt^ CD NOilONtD rf b- тр ю CD 00
—| CO ^ CO 00 CD —i Tf CD 00 -H^tOOWN CO О О ^ Ю 00
00^ 00^ CO 00 Ф OOCDCDCDCD О О О ^ *-CjCO^tlON CO
o"o"o"o"o" o"o"o"o"o" ~~"—<" —<"—Г ^-Г^-Г—Г^^ см"
CD 00 CM —' Ю CO ^ 00 CO CO
—• О CD l^ ^ —' Г-- СМ Г- О
CM О Is-Ю СО —| 00 CD CO —¦
СМ СМ —< —• -н -чОООО
СО 00 — О СМ
см см *-< t^ о
00 Ю СМ 00 Ю
CD CD CD 00 00
00 ~н О СМ Ю 00
CD Ю CM h- 00 00
О СО —н ^t4 CD -н
00 h- Г- CD Ю тр
ООООО ООООО
о
к."
юоюою оюоюо юоюою оюоюо о
t^OOOOCDCD О О —' -н СМ СМСОСО^^ ЮЮСОСОГ- 00
Оь
^
00 ^СПСПСЛСЛ 4*4^000010 Юн-н-оО СО СО 00 00 ^J
о о сл о сл о слоелоел о сл о сл о слоелоел
© ррррр рррр~ !Г^ГТ*^ ГТТТ'Г"
сп Vj^Vjoooo оо со о со о оооо^— ">— "^- Т— То То
•— »—СЛ00ЮСЛ (DtO^sJO tOUl-qcOtO 4* СП 00 О tO
СО О •— 00 4* 00 ОООООЮ 00 N3 О СО Ю 4* СП -vj 00 СО
СП tO 00 ^| СП 00 О О 00 СО <д *— О) 4^ О tO ^tOQOi^
Г* ГТТЧТ1 Г^ТЧ^Р РРРРР РРРРР
05 4s* со То То ^— ь-оЬЬЬ соЬсоЬЬо
•— о оо сп •—сп tooocntoco ^слюоео ,_ .
4* 00 •—00 to СЛ 00^4 4*4^-4 tO О СО СО •— СО -v) tO -4 СО
О ^ ь- О О О СО СО *Ч О О СЛ |— 00 СЛ О 4* 4*
* - III I II I I I I I I I Mill
— -Ч СП 4* >—tO 004*СЛСПСП ~vl 00 СО ^- •— •— •— — ^- >—
". .:«^СЛ*. 4* 00 tO О СО -^СЛСООО •— Ю 00 4* 4*
4^ -4 Ю О -
н-to оо4*слспсп ~-4 оо со •— — •— •— — ^- >—
СЛ 4^ 4^ СО tO О СО -^СЛОООО •— tO СО 4* 4*
^ V, го го "^ >п V* V %s "Li ~• fO ^4 СЛ СО О 00
О 00 СО СО О СЛ О V О Vj ~ Р
о о
;<i сл со о оо
V со t— оо сл
4^ 4^ СО СО СО СО СО СО СО СО СО СО СО СО СО СО tO tO tO tO JO
~— о со оо оо "-Ч bboi^V ооЬю^о со oo oo Vj о
4* O^slO^ 00 —^ СЛ 00 tO СЛ 00 О СО СЛ ЧОООО^-
O 00 О Ю 00 4^ 04W40 >— О 00 CO О 4* CO >— CO О
to to to to *
4* tO >— О СО 00 00ЧЧЧО5
CO >— о >— CO -41 —-4 CO О 00
CO О СП 4* 00 •— -J tO -4 "Ч О
О О О СЛ СЛ СЛ СЛ СЛ СЛ СЛ
СЛ СО О СО 00 ^СПСЛ4*00
4* О СО СО ^- >—00 СЛ СП СП
СО -vl СП СЛ 4* 00 СО tO tO tO -
I I s;
СЛ tO >— CO О >— 00 O 00 О СЛ CO tO »—
>¦— О СП 4* 00 СЛ Ю 00 СО СП СП О ОП СП
00 00 -О •— СО СЛСО — СЛСО СО I— СО •— -vl
<0
00 ^J СП СП СЛ СЛ 4* 4*. СО СО tO tO >— >— О С
о ослосло слоелоел ослосле
со со оо оо ^
слоелоел
р
сл
to
со
ООООО ООООО и-^-м-^-1— т~~*~Р~*~
СП -О -J ¦<! 00
СЛ н- СЛ СО СО
СО — *<1 00 СП
to to ^а -4 -g
00 СО СО СО СО
¦О О 00 СП СО
.— 4* СЛ СЛ 00
со ^ оо to •—
оооо •—
н- 4* СП СО »—
СО СЛ СО СО СП
*ч to оо-о со
>-* — .— to to
00 СП 00 О tO
СО •— 00 4* СЛ
сл -ч сл оо -ч
00 Gn4*OOtO>— •— •— О О О
4^ •— о •— СЛ СО 4* О СП 00 О
to -4 сп со to сл -челоосп-ч
00 n— tO О 00 СП >— О
РРРРР РРРРР
СО СО О "сО 00 00 00 00 00 00
00 СЛ 00 ь- СО -<1 СП 4* СО •—
О СП 4* 4* СЛ -Ч О СП О СЛ
—J 00 00 4* 4* СЛ 00 О О 00
сл ьо III I I I I I I I I I I I
»— to со to •— to со 4* сл сп сп ~vj oo со >— >-;, >¦—
I I I
JM
'родолжеь
ше табл.
о
4,223
2,895
1
оооосоУГ*
сп to
4* CO CO 00 СО
О СО СО 00 Vj
СП 00 О 00 СП
tO СЛ 00 -Ч 00
NO ND N3 tO ~
"#*¦ СО ">— О СО
СО tO 00 00 СО
tO ^1 00 00 О
11,37
">— 4^ 4^ tO 00
00 00 СО 00 00
Vl СП СЛ СЛ V
О СО СП О СО
О СЛ СО tO 00
со оо Vj Vj Vj
О СО 00 4^ —
-ч -ч сп -ч to
СО -Ч СП ^ 4^
О tO 00 00 О
О tO -41 4^ 4^
00 00 СП tO 4*.
VVjbl°P
со со
00 СО СО СО 00
00 to Ю 'J— О
СП СО ^— 4^ СП
00 >— 00 СО 4^
оп Ъп сп сп сл
^ сл to осо
СО О СП СП tO
О0 ЬО Ю N3 ^*
V СО СЛ "tO О
to ьо со — сл
.— 00 4-* 4^ СО
00 О 4^ tO О
00 00 СЛ 00 О
to to ]о to to
СО 00 00 Vj ОП
00 CO О — —
00 -Ч 00 СП -<I
СЛ СП СП Ъ\ СЛ
00 ^vl СП СЛ 4^
о — to to о
Vj СЛ V00 tO
со сп to о >—
СО СЛ tO 00 СО
о
^3
О
C0J
о
a
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
р
1,2330
1,2124
1,1916
1,1705
1,1491
1,1278
1,1052
1,0826
1,0596
1,0359
1,0116
0,9864
0,9604
0,9335
0,9056
0,8765
0,8459
0,8135
0,7806
0,7457
0,6707
V
0,8110
0,8248
0,8392
0,8543
0,8703
0,8871
0,9048
0,9237
0,9438
0,9653
0,9885
1,0137
1,0412
1,0713
1,1042
1,1409
1,1822
1,2292
1,281
1,341
1,491
При р =
i
—147,0
—139,3
— 131,6
— 123,9
—116,1
— 108,3
—100,4
—92,4
—84,4
—76,3
—68,1
—59,7
—51,4
—42,9
—34,2
—25,0
— 15,5
—5,7
4,5
14,9
36,0
175 бар
s
2,603
2,702
2,793
2,881
2,966
3,046
3,124
3,198
3,269
3,339
3,408
3,474
3,538
3,600
3,661
'3,723
3,785
3,845
3,908
3,970
4,095
СР
1,532
1,541
1,548
1,555
1,562
1,570
1,581
1,595
1,612
1,632
1,653
1,674
1,696
1,722
1,755
1,793
1,836
1,885
1,940
2,010
2,216
3
1,139
1,219
1,320
1,444
1,594
1,774
1,989
2,247
2,557
2,931
3,386
3,941
4,621
5,454
6,471
7,71&
—
—
—
—
—
Продолжение табл. VI
Т, СК
*75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2364
1,2160
1,1955
1,1746
1,1536
1,1322
1,1106
1,0886
1,0662
1,0433
1,0199
0,9958
0,9710
0,9456
0,9194
0,8924
0,8641
0,8343
0,8038
0,7734
0,7077
V
0,8088
0,8223
0,8365
0,8513
0,8669
0,8832
0,9005
0,9186
0,9379
0,9585
0,9805
1,0042
1,0298
1,0576
1,0876
1,1206
1,1573
1,1985
1,244
1,293
1,413
При р =
i
—145,5
. —137,8
—130,1
—122,5
—114,7
—106,9
—99,1
—91,2
—83,2
—75,2
—67,1
—58,9
—50,6
—42,3
—33,9
—25,0
—15,6
—6,2
3,7
13,3
32,8
200 бар
s
2,597
2,695
2,786
2,873
2,958
3,037
3,115
3,189
3,259
3,329
3,396
3,461
3,524
3,585
3,645
3,705
3,764
3,823
3,881
3,940
4,056
СР
1,529
1,536
1,542
1,548 .
1,554
1,561
1,570"
1,582
1,596
1,613
1,631
1,647
1,664
1,684
1,708
1,736
1,767
1,802
1,844
1,895
2,032
Э
1,070
1,142
1,232
1,342
1,473
1,627
1,810
2,024
2,408
2,739
3,137
3,613
4,186
4,873
5,692
6,672.
—
—
—.
—
—
92
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2398
1,2196
1,1992
1,1787
1,1579
1,1369
1,1157
1,0942
1,0724
1,0502
1,0276
1,0045
0,9808
0,9566
0,9319
0,9064
0,8800
0,8524
0,8237
0,7955
0,7369
V
0,8066
0,8200
0,8339
0,8484
0,8636
0,8796
0,8963
0,9139
0,9325
0,9522
0,9731
0,9956
1,0196
1,0454
1,0731
1,1032
1,1364
1,1732
1,214
1,257
1,357
При р —
i
—143,9
— 136,3
— 128,6
—121,1
— 113,2
—105,5
—97,7
—89,9
—82,1
—74,1
—66,0
—57,9
—49,8
—41,6
—33,3
—24,7
—15,4
—6,1
3,1
12,3
30,7
225 бар
s
2,590
2,688
2,779
2,866
2,950
3,029
3,106
3,179
3,250
3,318
3,385
3,449
3,511
3,571
3,630
3,688
3,746
3,803
3,859
3,915
4,026
СР
1,526
1,531
1,537
1,542
1,547
1,553
1,560
1,570
1,583
1,597
1,611
1,624
1,637
1,652
1,671
1,691
1,714
1,742
1,776
1,816
1,908
Р
1,070
1,142
1,232
1,342
1,473
1,627
1,810
2,024
2,276
2,575
2,924
3,340
3,831
4,410
5,087
5,884
—
—
—
—
—
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
р
1,2431
1,2230
1,2028
1,1825
1,1621
1,1415
1,1207
1,0996
1,0784
1,0568
1,0349
1,0126
0,9898
0,9667
0,9432
0,9191
0,8942
0,8683
0,8418
0,8150
0,7610
V
0,8045
0,8177
0,8314
0,8456
0,8605
0,8761
0,8923
0,9094
0,9273
0,9462
0,9663
0,9876
1,0103
1,0344
1,0602
1,0880
1,1183
1,1517
1,188
1,227
1,314
При р =
*•
i
— 142,4
— 134,8
— 127,2
—119,6
— 111,8
—104,1
—96,4
—88,6
—80,8
—72,9
—64,9
—56,9
—48,9
—40,9
—32,6
—24,2
—15,0
—5,9
2,9
11,8
29,5
250 бар
s
2,583
2,681
2,772
2,858
2,942
3,021
3,098
3,171
3,240
3,308
3,374
3,438
3,499
3,558
3,616
3,673
3,730
3,785
3,840
3,894
4,000
СР
1,523
1,527
1,532
1,536
1,540
1,546
1,552
1,560
1,571
1,582
1,594
1,605
1,615
1,626
1,641
1,656
1,674
1,697
1,725
1,757
1,827
Р
1,039
1,108
1,194
1,297
1,419
1,564
1,733
1,930
2,159
2,427
2,741
3,107
3,535
4,032
4,605
5,268
— ¦
—
—
—
—
93
Продолжение табл. Vf
т, °к
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
р
1,2463
1,2263
1,2064
1,1863
1,1661
1,1458
1,1254
1,1048
1,0841
1,0631
1,0418
1,0202
0,9983
0,9761
0,9536
0,9307
0,9071
0,8826
0,8569
0,8319
0,7819
V
0,8024
0,8154
0,8289
0,8429
0,8575
0,8727
0,8886
0,9051
0,9224
0,9407
0,9599
0,9802
1,0017
1,0245
1,0486
1,0744
1,1024
1,1330
1,167
1,202
1,279
При р =
i
—140,9
— 133,3
—125,7
—118,1
—110,4
—102,7
—95,0
—87,3
—79,5
—71,7
—63,8
—55,8
—47,9
—40,0
—31,9
—23,6
—14,5
—5,6
3,1
11,6
28,7
= 275 бар
s
2,577
2,674
2,765
2,851
2,935
3,013
3,089
3,162
3,231
3,299
3,364
3,427
3,488
3,546
3,603
3,659
3,71.5
3,769
3,823
3,876
3,978
СР
1,520
1,523
1,527
1,531
1,534
1,539
1,544
1,551
1,560
1,569
1,580
1,588
1,596
1,605
1,616
1,628
1,642
1,661
1,684
1,711
1,770
Э
1,010
1,076
1,157
1,255
1,370
1,505
1,662
1,844
2,055
2,299
2,581
2,907
3,284
3,716
4,209
4,773
—
—
—
—
—
Продолжение табл. Vf
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2494
1,2296
1,2098
1,1900
1,1701
1,1501
1,1300
1,1098
1,0895
1,С691
1,0484
1,0274
1,0063
0,9849
0,9633
0,9414
0,9188
0,8956
0,8711
0,8474
0,7994
V
0,8004
0,8133
0,8266
0,8403
0,8546
0,8695
0,8849
0,9010
0,9178
0,9354
0,9539
0,9733
0,9938
1,0153
/1,0381
1,0623
1,0883
1,1166
1,148
1,180
1,251
При р =
i
—139,4
—131,8
—124,2
—116,6
—108,9
—101,3
—93,6
—86,0
—78,2
—70,4
—62,6
—54,7
—46,9
—39,0
—31,0
—22,8
— 13,9
—5,1
3,4
11,7
28,3
300 бар
_
s
2,571
2,668
2,758
2,844
2,927
3,005
3,05Г
3,154
3,222
3,290
3,354
3,417
3,477
3,535
3,591
3,646
3,701
3,754
3,807
3,859
3,958
СР
1,518
1,520
1,523
1,526
1,529
1,533
1,537
1,543
1,550
1,558
1,567
1,574
1,580
1,587
1,596
1,605
1,616
1,632
1,651
, 1,674
1,725
Р
0,983
1,046
1,123
1,216
1,325
1,452
1,598
1,767
1,961
2,184
2,440
2,733
3,06&
3,449
3,879
4,366
—.
—
—
—
—
94
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2524
1,2328
1,2132
1,1936
1,1739
1,1542
1,1345
1,1147
1,0948
1,0748
1,0546
1,0343
1,0138
0,9931
0,9724
0,9513
0,9297
0,9075
0,8842
0,8613
0,8157
V
0,7985
0,8112
0,8243
0,8378
0,8519
0,8664
0,8815
0,8971
0,9134
0,9304
0,9482
0,9669
0,9864
1,0069
1,0284
1,0512
1,0756
1,1019
1,131
1,161
1,226
При р =
i
— 137,8
—130,3
—122,7
—115,2
— 107,5
—99,9
—92,3
—84,6
—76,9
—69,2
—61,4
—53,6
—45,8
—38,0
—30,1
—22,0
— 13,3
—4,6
3,7
11,9
28,2
: 325 бар
s
2,564
2,661
2,751
2,837
2,920
2,998
3,074
3,146
3,214
3,281
3,345
3,407
3,466
3,524
3,580
3,634
3,688
3,740
3,792
3,843
3,941
СР
1,515
1,516
1,519
1,522
1,524
1,527
1,531
1,536
1,542
1,548
1,555
1,561
1,566
1,571
1,577
1,585
1,594
1,607
1,623
1,643
1,687
3
0,957
1,018
1,092
1,180
1,283
1,402
1,539
1,697
1,876
2,081
2,314
2,580
2,881
3,220
3,599
4,025
—
—
—
—
—
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
110
115
120
125
130
135
140
145
150
155
160
165
170
180
р
1,2554
1,2359
1,2165
1,1970
1,1776
1,1582
1,1388
1,1193
1,0998
1,0802
1,0606
1,0408
1,0209
1,0009
0,9808
0,9606
0,9399
0,9185
0,8960
0,8741
0,8306
4
V
0,7966
0,8091
0,8221
0,8354
0,8492
0,8634
0,8782
0,8934
0,9092
0,9257
0,9429
0,9608
0,9795
0,9991
1,0195
1,0410
1,0640
1,0887
1,116-
1,144
- 1,204
При р —
i
—136,3
—128,8
—121,2
— 113,7
—106,0
—98,5
—90,9
—83,2
—75,5
—67,9
—60,1
—52,4
—44,7
—36,9
—29,1
—21,1
—12,6
—4,1
4,2
12,2
28,3
350 бар
s
2,558
2,655
2,745
2,830
2,913
2,991
3,066
3,138
3,206
3,272
3,336
3,398
3,457
3,514
3,569
3,622
3,675
3,727
3,778
3,828
3,924
СР
1,513
1,513
1,515
1,517
1,519
1,522
1,525
1,529
1,534
1,539
1,545
1,550
1,553
1,557
1,562
1,568
1,576
1,586
1,600
1,617
1,656
Р
0,933
0,991
1,062
1,146
1,243
1,356
1,485
1,632
1,799
1,988-
2,202
2,444
2,716-
3,020
3,358
3J3S
—
—
—
—
—
95
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
р
1,2583
1,2389
1,2196
1,2004
1,1812
1,1621
1,1429
1,1238
1,1047
1,0855
1,0663
1,0470
1,0277
1,0083
0,9889
0,9693
0,9493
0,9289
0,9074
0,8857
0,8432
V
0,7947
0,8072
0,8199
0,8330
0,8466
0,8605
0,8750
0,8898
0,9053
0,9212
0,9378
0,9551
0,9731
0,9918
1,0113
1,0317
1,0534
1,0765
1,102
1,129
1,186
При р =
i
— 134,8
—127,2
—119,7
—112,2
—104,6
—97,0
—89,4
—81,8
—74,2
—66,6
—58,8
—51,1
—43,5
—35,8
—28,0
—20,2
—11,8
—3,5
4,7
12,7
28,5
375 бар
s
2,552
2,649
2,738
2,824
2,906
2,983
3,059
3,130
3,198
3,264
3,328
3,389
3,447
3,504
3,559
3,612
3,663
3,715
3,765
3,814
3,909
СР
1,511
1,511
1,512
1,514
1,515
1,517
1,519
1,523
1,527
1,531
1,536
1,540
1,543
1,546
1,550
1,554
1,561
1,570
1,581
1,597
1,630
Р
0,910
0,966
1,034
1,114
1,207
1,313
1,435
1,572
1,728
1,903
2,101
2,323
2,570
2,845
3,149
3,485
—
—
—
—
—
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2611
1,2419
1,2228
1,2037
1,1847
1,1658
1,1469
1,1281
1,1094
1,0906
1,0718
1,0530
1,0341
1,0153
0,9964
0,9775
0,9584
0,9388
0,9183
0,8969
0,8562
V
0,7930
0,8052
0,8178
0,8308
0,8441
0,8578
0,8719
0,8864
0,9014
0,9169
0,9330
0,9497
0,9670
0,9850
1,0036
1,0230
1,0434
1,0652
1,089
1,115
1,168
При р =
i
—133,3
— 125,7
—118,2
— 110,8
— 103,1
—95,6
—88,0
—80,4
—72,8
—65,2
—57,6
—49,9
—42,3
—34,6
—26,9
— 19,1
— 10,9
—2,8
5,8
13,2
28,9
= 400 бар
s
2,546
2,642
2,732
2,817
2,899
2,976
3,051
3,122
3,190
3,256
3,319
3,380
3,438
3,495
3,549
3,601
3,652
3,703
3,753
3,801
3,895
СР
1,510
1,508
1,508
1,510
1,511
1,513
1,515
1,517
1,521
1,524
1,528
1,531
1,533
1,536
1,539
1,543
1,548
1,557
1,567
1,580
1,609
3
0,889
0,942
1,007
1,084
1,172
1,273
1,388
1,517
1,663
1,826
2,009
2,213
2,440
2,691
2,965
3,268
—
—
—
—¦
'
96
Продолжение табл7 VI
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Р
1,2639
1,2448
1,2258
1,2069
1,1882
1,1695
1,1509
1,1324
1,1139
1,0955
1,0771
1,0587
1,0403
1,0219
1,0036
0,9853
0,9670
0,9480
0,9276
0,9074
0,8680
V
0,7912
0,8034
0,8158
0,8285
0,8416
0,8551
0,8689
0,8831
0,8978
0,9128
0,9284
0,9446
0,9613
0,9785
0,9964
-1,0150
1,0341
1,0548
1,078
1,102
1,152
При р =s
i
— 131,7
—124,2
—116,6
— 109,3
—101,6
—94,1
—86,6
—79,0
—71,4
—63,9
—56,2
—48,6
—41,0
—33,4
—25,7
—18,0
—9,9
—1,9
6,0
13,9
29,4
425 бар
s
2,540
2,636
2,726
2,810
2,893
2,969
3,044
3,115
3,183
3,248
3,311
3,372
3,430
3,486
3,540
3,592
3,642
3,692
3,741
3,788
3,882
СР
1,509
1,506
1,506
1,507
1,508
1,509
1,510
1,513
1,515
1,518
1,521
1,523
1,525
1,527
1,529
1,534
1,538
1,546
1,555
1,567
1,594
Э
0,868
0,920
0,982
1,055
1,140
1,236
1,344
1,466
1,603
1,756
1,926
2,115
2,323
2,553
2,803
3,077
—
—
—
—
—
Продолжение табл. VI
Т, °К
75
80
85
90
95
100
105
110
115
120
125
130
135
140
145
150
155
160
165
170
180
р
1,2666
1,2476
1,2288
1,2101
1,1915
1,1730
1,1547
1,1364
1,1183
1,1002
1,0822
1,0642
1,0462
1,0283
1,0105
0,9927
0,9752
0,9568
0,9372
0,9174
0,8787
V
0,7895
0,8015
0,8138
0,8264
0,8393
0,8525
0,8660
0,8799
0,8942
0,9089
0,9241
0,9397
0,9558
0,9725
0,9896
1,0074
1,0254
1,0451
1,067
1,090
1,138
При р =
i
—130,2
—122,7
— 115,2
—107,8
—100,2
—92,7
—85,1
—77,6
—70,0
—62,5
—54,9
—47,3
—39,8
—32,2
—24,6
—16,9
—8,9
— 1,0
6,8
14,6
29,9
450 бар
s
2,534
2,630
2,719
2,804
2,886-
2,963
3,037
3,108
3,175
3,240
3,303
3,364
3,421
3,477
3,531
3,582
3,632
3,682
3,730
3,776
3,868
ср
1,507
1,504
1,503
1,504
1,505
1,505
1,506
1,508
1,510
1,512
1,515
1,516
1,517
1,519
1,522
1,526
1,531
1,538
1,546
1,557
1,581
Р
0,849
0,899
0,959
1,029
1,109
1,201
1,304
1,419
1,548
1,691
1,849
2,025
2,218
2,429
2,658
2,908
—
—
—
—
—
7 Зак.
. 1978
97
«2
о
= 475 бар
О.
ОС
«л
D
а
о
Е^
ООСО^^
СО t^- COO 00
со оо о>©ж©
CD CM О -н CM
ооооо
LO LO LO LO LO
00 Tf« CO oo О
CM CM «-и O) 00
lOCONN OO
см cm" cm" cm" cm"
—128,6
—121,2
—113,7
—106,3
—98,7
O) 00 O)C0 О
h- O) —« rf Г-
00 CD —i CM CO
I> O.^ 00 00^ 00
o"o"o"o"o"
CM ^ h- CM 00
О) О *-* CO "tf
COLO CO —' CD
CM CM CM^ CM^ ^
I LO О Ю О LO
I NOOOOQCn
00 CD LO CO ^
CO CO h- O) CO
-^CM CO^TfCD^
CM CO rt< CO h»
oo ooo
ЮЮЮЮЮ
со —i —i oo CO
LO CO О CO CO
см" со" со" со" со"
CM t^ CM CO^ .-и
»-* СО" СО" oo" —J"
О) 00 !>- СО СО
ММ!
о со о> оо см
О СО COO LO
Ю СО t^- О) О
00 00 00 00 С75
о" о" о" о" о"
LO "sf Tf CO 00
СО 00 О CM rf
О LOOLOO
о о —• — см
О)С0 СМ Ь~ t^
t^ tJ* CM —< CM
t4» С5-^00Ю
О) О -ч COLO
О 1-. i-H r-H —.
Ю Ю LO Ю LO
со со со о> см
0)LO —< СО СМ
CM OO r^T^UO
со со со со со
ЮОЮ05С0
со" со" оо" о" со"
Ю Tf СО СО СМ
М М 1
CD —1 Г- f- CM
Oi Ю О СО СО
—" СОЮ СО 00
CD CD CD CD CD
о" о" о" о" о"
*-ч ^ О) ^ -н
N05^^N
00 CD LO СО *-«
o^o^qo^q
ю о ю о ю
CM CO CO Tf« тИ
2,757
О *Ф —« О) О
CM CM CO CO Tf
LO LO LO LO Ю
со со см о ю
h- CM Is- CM CO
ICCOCONN
CO" CO" CO" CO" CO"
"GO t^CO
-HhONlO
1 1
COLO О
ONCDCDO)
О —i СОЮ h»
со со сэо^со
t^ 00 COO 00
o> см lo t^ со
O) 00 CO -^ CM
cd cd cd cd cd
o"o"o"o"o"
OLOOLOO
LO LO CD CO t4-,
1
1,571
3,856
30,6
1,125
0,8889
о
00
I
a;
C3
cOO)LOOcO t^O^fOiiO lOc^^HlOO *-*
гнЩ'-'ООЮ СОСОСО^С^ _ cO CO *-< '-' CMj I I j I
oq ехэ 0^05 0^ -^ см ^ "* ^ ls^°®cJ>cvi'* *Я I I I I i
o"o"o"o"~Г ^^-Г—Г .-Г—7 ^^см"см*сч cm
Ю О 00 00 CD CD О —> CM CO
0005 0H5 0H000
LOLO^rfTt1 Tf Ю LO LO Ю
Tf Ю CO 00 —< LOOCOr^CO
О О О О ~-< — CM CM CO ^
LO LO LO LO Ю Ю LO LO Ю Ю
(N^OOiN
LO CO h- l> 00
LO CM CD CO CM
0H О г-н CM
00 00 CD -и Tf LO LO CO О LO Ю
ОО^ОСО^н CD —* CO —« LO "^f
CM CO "^ ^ Ю IOCOCONN 00
CM CM CM CM CM CM CO CO CO CO CO CO CO CO CO CO CO CO CO CO CO
CM t^ CM 00
fM-Г^Г^СМ NCNNCNN CM CO — CO—< LO
CSj _ _ О h- OiCM^t^-O) CM ^ t- O) CM Tf * * « • tJ.
_н ^н ^ г-н Oi 00001>-СОЮ LO т^ CO CM CM ^hCO-<00CO —«
M I II II M I II II I M - m
CO О О CM h- LO CD CD CO LO CD CD 00 CO CM CD CM О
CD 00 О CM rf NOC^N^ LO О LO —н h- CO О 00 h- 00 CM
00 O) —i CM CO ^CONOOO —i CO Tf CO C^- CD —i CM ^И CD —<
b- l>- 00 00 00 00 00 00 00 CD CD CD CD CD CD 0H000 *-.
t^ l>- 00_ 00^ 00^ 00 00^ 00 00 О)
о" о" о" о" о" о" о" о" о" о"
О) О) О) О) О)
о" о" о" о" о"
0H^0^0^0^
О)*—«ЮСМО О) О СО Is» СМ 00 СО rf CO ^f Th О) ОО <—• СО СО
г-н со ^ СО 00 О) CM rf СО О) ^^N000 СО О) CM LO CD О)
MOCO^Oi Ь-СО'Ф СМ О О) h- tO rf СМ О 00 N LO CO CD
CM CM CM CM «-и ^н ^н —< ^н ^ ООООО 0 0HHH) 00
—.oooo
о
bPQ^Q10 О LO О LO О LO О LO О LO OLOOLOO О
Г"» 00 00 CD CD 00--i(M CM CO CO ^ Tt* Ю Ю CO CD Г- 00
Глава IV
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
ЖИДКОГО АРГОНА
¦ 'есмотря на то, что аргон является инертным газом и
экспериментальное исследование его термодинамических свойств в принципе не
вызывает затруднений, опытные р, v, Т-данные для аргона при
температурах ниже 0° С до 1958 г. оставались немногочисленными и не охватывали
области жидкости. За последнее время ряд авторов исследовали
термические свойства жидкого аргона, однако опытные данные получены в
меньшем интервале давлений, чем аналогичные данные об азоте. В настоящей
работе значения плотности жидкого аргона согласованы и
экстраполированы до давления 500 бар, и затем составлены подробные таблицы его
термических и калорических свойств.
IV. 1. Анализ экспериментальных термических
данных для жидкого аргона и их пополнение
Опытные р, и, Т-данные для жидкого аргона впервые получили
Михельс, Левельт и Де Граафф [123], исследовавшие сжимаемость аргона
в интервале температур—155-^—25° С и плотностей 8—653 Амага. Эти
авторы использовали установку [124], созданную специально для
исследования в области температур ниже 0° С и впервые примененную для
воздуха [125]. В установке используется пьезометр постоянного объема,
находящийся в криостате и соединенный капилляром с
дифференциальным манометром, в котором диафрагма отделяет исследуемый газ от масла
поршневого манометра. Для расчета количества газа, заполняющего
пьезометр, необходимы р, v, Г-данные при нормальных температурах, и авторы
[123] использовали результаты измерений на изотермах 0 и 25° С [126],
выполненных в той же лаборатории. При охлаждении криостата часть
газа перетекает из дифференциального манометра в пьезометр, поэтому
плотность газа в последнем во время опыта рассчитывалась на основе
давления и отношения объемов обоих узлов.
Михельс, Левельт и Де Граафф исследовали весьма чистый аргон,
содержавший в качестве примесей лишь сотые доли процента метана. Было
проведено 27 серий измерений для разных заполнений пьезометра,
каждая серия начиналась при 25° С и заканчивалась при низких температурах.
Для жидкого аргона получены данные на изотермах —122,5; —125; —130;
—135 и —140° С (от 11 до 3 точек на каждой); помимо этого, получено
11 опытных точек при 10 различных температурах в интервале —124 -г-
—155° С. Максимальное давление на изотермах уменьшалось по мере
понижения температуры (от 301 атм при —122,5° С до 157 атм при
— 140° С).
В работе [123] получены опытные данные о термических свойствах
газообразного и жидкого аргона в состоянии насыщения при
температурах до —156° С. Эти данные были использованы в работе [70] при состав-
7*
99
лении таблиц термодинамических свойств аргона. Михельс и соавторы
привели также таблицу значений pv при круглых значениях температур
и плотностей, включая область жидкости до —140° С и 640 Амага, и
подробную таблицу сглаженных значений ортобарических плотностей в
интервале температур от —153° С до критической.
Вскоре И. А. Роговая и М. Г. Каганер [127] исследовали сжимаемость
аргона в интервале температур —183-^0° С при давлениях до 200 атм.
Экспериментальная установка, описанная авторами ранее [128], работала
по методу пьезометра постоянного объема. Количество вещества в
пьезометре определялось объемным способом с .помощью трех калиброванных
сосудов, помещенных в термостат. Температуру измеряли образцовым
платиновым термометром сопротивления, погруженным в криостат, а
равномерность распределения температур в последнем контролировали с
помощью дифференциальных термопар. Во время опытов температура крио-
стата поддерживалась постоянной с погрешностью ±0,01 град при помощи
фотоэлектронного терморегулятора. Температура в термостате
регулировалась с погрешностью ±0,05 град; при этом использовался контактный
ртутный термометр. Для измерения давления газа служил поршневой
манометр. Масло, заполняющее манометр, отделялось от исследуемого
газа с помощью мембранного дифференциального манометра и ртутного
уравнителя; благодаря последнему снижалась погрешность измерений
разности давлений до 0,01 % абсолютного давления. Давление газа в
калиброванных сосудах измерялось ртутным манометром с погрешностью
0,05 мм рт. ст.
Авторы [128] использовали четыре пьезометра емкостью от 7 до
400 смг, что позволило проводить опыты в широком диапазоне изменения
удельного объема. Калибровку пьезометров проводили многократно, и
погрешность определения объемов составляла 0,02%. Поправка на
влияние балластного объема определялась с погрешностью 0,05% (по
отношению к объему наименьшего пьезометра). Экспериментаторы учитывали
также поправки на изменение объема пьезометра при изменениях
температуры и давления. Объем газометра был определен с погрешностью
±0,03%.
Для проверки установки проведены опыты с воздухом, очищенным
от двуокиси углерода и паров воды. Полученные данные о сжимаемости
воздуха при температурах 0; —50 и —100° С и давлениях от 20 до
НО кГ/см2 согласуются с экспериментальными [125, 129] с погрешностью
О—0,07%. Авторы [128] считали, что установка позволяет измерить
удельные объемы в области температур от 20 до —200° С и давлений до
200 кГ/см2 с погрешностью ±0,05%. Указанная оценка представляется
заниженной, поскольку при суммировании погрешностей определения
объемов ошибка могла достигать 0,1 %, а погрешность измерения давления
поршневым манометром в работе не указана.
Исследованный И. А. Роговой и М. Г. Каганером аргон содержал
менее 0,02% примесей — азота и кислорода. В работе [127] получены
экспериментальные данные на 11 изотермах, из которых три (—135,03;
—150,08 и —183,02° С) относятся к области жидкости. На указанных
изотермах приведено от 6 до 8 опытных точек. Авторы отмечают, что
отдельные точки в газовой фазе отклоняются на 0,5% от результатов Гольборна
и Отто [91 ] и Михельса, Левельта и Де Грааффа [123]. Такие,расхождения
подтверждают справедливость высказанного выше сомнения в высокой
точности данных [127].
Ван-Иттербик и Вербек [42] первоначально определили плотность
жидкого аргона в узком интервале температур на четырех изотермах
(86,637; 87,915; 89,13 и 90,55° К) при давлениях до 150 кГ/см2 по методике,
принятой в их лаборатории. Позднее Ван-Иттербик, Вербек и Стаес [46]
опубликовали данные о плотности жидкого аргона в более широкой
области температур и давлений. Эти исследователи использовали ту же экспе-
100
риментальную установку, что и в предыдущих работах, внеся в нее ряд
усовершенствований. Применявшийся ранее пружинный манометр был
заменен поршневым; для отделения масла, заполняющего последний, от
исследуемого вещества был использован мембранный дифференциальный
манометр. Разность давлений определялась с погрешностью 0,013 кГ/см2,
при давлениях до 300 кГ/см2. Температура измерялась с погрешностью
менее 0,01 град платиновым термометром сопротивления, калиброванным
в Лейдене. Постоянство температуры обеспечивалось электронным
устройством с отклонением 0,01 град. Чистота исследованных веществ (аргона
и метана) в работе [46] не указана. Ван-Иттербик, Вербек и Стаес получили
р, v, Т-данные для жидкого аргона на 11 изотермах в интервале 90,13—
148,25° К. Число опытных точек на отдельных изотермах составляло от 7
до 16. Максимальное давление достигало 251—299 кГ/см2.
Из краткого обзора видно, что экспериментальные р, v, Т-данные
различных авторов получены при разных температурах и давлениях. Поэтому
при графическом согласований данные были предварительно сглажены по
изотермам и приведены к одинаковым давлениям. Сопоставление по
изобарам показало, что хотя разброс данных, полученных отдельными
авторами, в основном незначителен, расхождения превышают
указываемую исследователями погрешность эксперимента.
Наиболее подробными являются данные Ван-Иттербика и соавторов
[42, 46], в совокупности охватывающие почти всю область температур от
тройной точки до критической. Результаты [42] и [46] при температуре
90° К согласуются между собой с погрешностью 0,05—0,10?^. При
сравнении с данными других авторов в широком интервале температур не
обнаруживается систематических расхождений в отличие от аналогичного
сопоставления данных Ван-Иттербика и Вербека [42, 43, 83] об азоте и
кислороде. Только на изотермах 134,40 и 136,02° К значения плотности [46]
в ряде точек занижены на 0,3—0,4%.
Значения плотности, полученные Михельсом, Левельтом и Де Грааф-
фом [123], на изотермах 133,15 и 148,15° К выше данных [46] на 0,2%,
а при температурах 138,15 и 143,15° К расхождения между ними в
основном не превышают ±0,1 %: лишь две точки [123] при 143,15° К и давлениях
до 70 бар расположены нижена0,4—0,5%. ДанныеИ. А.Роговой иМ.Г. Ка-
ганера [127] на изотерме 138,12° К практически совпадают с указанными
в [46], но в области более низких температур систематически меньше их
(на 0,2% при 123,07° К и на 0,3—0,4% при 90,13° К). Результаты [127]
для жидкости вполне удовлетворительно согласуются с данными [123],
хотя в околокритическом районе между обеими группами данных имеются
расхождения, отмеченные в работе [127].
Выбор опорных значений плотности жидкого аргона первоначально
проводился до максимально достигнутого в опытах давления —300 бар.
В основу сетки опорных величин были положены данные Ван-Иттербика
и соавторов [42, 46], а в области температур, охваченной экспериментом
Михельса, Левельта и Де Грааффа [123], —также и результаты этих
исследователей. Сверхкритические изобары опорной сетки были
согласованы с расчетными данными [70] о газе, что не представляло
затруднений, так как последние получены на основании результатов [123]. В
области низких температур изобары жидкости были незначительно
экстраполированы до кривой затвердевания. В связи с этим целесообразно
рассмотреть имеющиеся для нее данные.
Зависимость температуры плавления (затвердевания) аргона от
давления изучена рядом авторов. Симон, Руэман и Эдварде [85, 130] и Брид-
жмен [82, 88] исследовали кривую плавления при высоких давлениях
(от 1000 до 6000 кПсм2). Позднее Клюзиус и Вейганд [131 ] провели
эксперименты в интересующей нас области умеренных давлений (до 200 атм).
Сравнительно недавно Михельс и Принс [132] получили опытные данные
для кривой плавления аргона (а также для кривых плавления криптона
101
и ксенона) при давлениях от 0,68 до 1497 атм. Результаты [131 ] и [132]
хорошо согласуются: расхождения не превышают 0,08 град A атм);
указанные данные были использованы нами для определения зависимости
температуры затвердевания аргона от давления.
В литературе приведены лишь четыре опытных значения удельного
объема аргона на кривой затвердевания при давлениях 1; 2000; 4000 и
6000 кГ/см2 [82]; значение 0,702 дм3/кг при р = 1 кГ/см2
неудовлетворительно согласуется с удельным объемом жидкости в тройной точке v' =
= 0,7067 дм3/кг, полученным в [70] на основании экспериментальных
данных Матиаса, Кроммелина и Камерлинг Оннеса [133]. Поэтому для
аргона, в отличие от азота, нельзя надежно определить плотность на кри-
от
0,58
ом
°^os
ч>^~
!
!
1
3
-О <
-о
0.58
0,60
2 \ I I I
0,58
л ?
о- -.
-о
-о
о
?
Юп
Рис. 15. Отношение значений плотности жидких азота и аргона в функции
приведенного давления и при одинаковых приведенных температурах т:
/ — 0,6586; 2 — 0,7378; 3 — 0,8170.
вой затвердевания при заданном давлении, и изобары опорной сетки были
экстраполированы до температур затвердевания таким образом, чтобы
получилась плавная кривая затвердевания в координатах плотность —
температура.
С целью экстраполяции опорных данных в область более высоких
давлений (до 500 бар) использована та же методика, что и для кислорода.
Были проанализированы отношения значений плотности жидких азота
и аргона при одинаковых приведенных температурах и давлениях. На
девяти рассмотренных нами изотермах в интервале т = 0,5727—0,9755
и я = 0,408—6,125 эти отношения изменяются в зависимости от давления
на 1—2%, причем по мере роста температуры интервал изменения на
изотермах увеличивается (рис. 15).
Отношения pN,/pAr на изотермах были экстраполированы до давления
500 бар; экстраполированные участки кривых показаны на рис. 15
пунктиром. Рассчитанные затем значения плотности аргона были сглажены по
изобарам, согласованы с данными [70] о газе и экстраполированы до
кривой затвердевания. После сглаживания по изобарам снова проверена
плавность отношений pN2/pAr на изотермах. В итоге обработки данных по
двум сечениям обеспечена плавность экстраполированной части
поверхности состояния жидкого аргона. Поскольку Pn2/Paf на большинстве
изотерм изменяются в узких пределах и экстраполяция их по давлениям не
102
столь широка, как для кислорода, можно полагать, что погрешность
экстраполирования и сглаживания значений плотности жидкого аргона
лежит в пределах 0,2—0,3% и эти данные могут быть использованы
совместно с экспериментальными для составления уравнения состояния.
IV. 2. Уравнение состояния для аргона
Большинство авторов, получивших экспериментальные р, v,
Г-данные для жидкого аргона, описали их аналитически. Так, Михельс,
Левельт и Де Граафф [123] отобразили опытные данные на пяти
изотермах жидкости в интервале температур —140 -г- —122,5° С уравнениями
вида
pv = А -г Bq + Ср3 + Dp5. (83)
Оно соответствует экспериментальным данным с максимальной
погрешностью, равной 0,1%. Коэффициенты уравнений изотерм не
обнаруживают плавной зависимости от температуры, что не позволяет получить
уравнение состояния для жидкого аргона путем аналитического описания
этих коэффициентов.
Ван-Иттербик и соавторы [42, 46] предложили два уравнения
состояния для жидкого аргона. Первое из них, представленное в форме F8),
описывает опытные данные в весьма узком интервале температур 86,6—
90,6° К при давлениях, не превышающих 150 кГ/см2. Второе, имеющее
вид C3), справедливо, судя по результатам расчетов [46], в интервале
температур 90—130° К при давлениях до 300 кГ/см2. Это уравнение
содержит 36 постоянных, что при использовании его в указанной сравнительно
небольшой области параметров может привести к погрешности
определения производных. Точность уравнений в работах [42, 46] не оценена.
В 1964 г. Госман, Хает и Мак-Карта [74] составили уравнение
состояния для жидкого и газообразного аргона в интервале температур 86—
300° К при давлениях до 1000 атм в форме [71]. При составлении
уравнения были использованы экспериментальные р, v, Г-данные Михельса и
соавторов [123, 126], Роговой и Каганера [127], Ван-Иттербика и Вербека
[42] и наиболее известные данные о термических свойствах аргона в
состоянии насыщения [123, 133—135]. Уравнение соответствует опытным
данным в однофазной области со средней квадратической погрешностью
0,11%. Авторы [74] располагали также неопубликованными р, v, Т-дан-
ными Волкера для интервала температур 90—200° К и давлений 20—
500 атм, но не смогли использовать их при определении коэффициентов
уравнения из-за существенных расхождений с результатами [123] (до 2%
для значений плотности). Опытные данные Ван-Иттербика и соавторов
[46] при составлении уравнения состояния не учитывались; последующая
проверка, выполненная в работе [74], показала, что среднее отклонение
расчетных значений плотности от данных [46] составляет 0,14%, а
максимальное — 0,63%.
В отличие от авторов упомянутых работ, мы располагали сеткой
опорных термических данных для жидкого аргона при давлениях до 500 атм.
Уравнение состояния для аргона составлялось в той же форме G9), что
и для кислорода, поскольку изотермы аргона при давлениях до 500 бар
хорошо описываются полиномами, содержащими вторую, четвертую и
шестую степени плотности. Температурные функции уравнения
определялись методом спрямления изотерм. Для этого были рассчитаны комплексы
р/р2 и выполнены преобразования, описанные в главе I. Как и для
кислорода, от значений р/р2 на большинстве изотерм вычиталось значение при
давлении 10 бар, а для околокритических изотерм — на ближайшей к
кривой насыщения изобаре. Построение комплексов Yг = В + С (р2 + р2)
и Y2 = А + Вр2 показано на рис. 16 для изотермы 130° К- Допуски для
комплексов Y1 и самих величин С довольно велики, особенно при темпе-
¦&
103
ратурах ниже 120° К, если учесть, что абсолютные значения Yг и С для
аргона сравнительно невелики.
После определения С для всех изотерм опорной сетки (от 85 до 17(Г К)
оказалось, что в пределах допусков можно принять С для аргона
постоянной (рис. 17). Хотя составляемое уравнение состояния является
эмпирическим, не исключено, что постоянство С является следствием большей
простоты термодинамического поведения одноатомного аргона по
сравнению с поведением двухатомных азота и кислорода, у которых С зависит
от температуры.
, Температурные функции уравнения состояния для аргона,
представленные на рис. 17, определялись до Т = 170° К, причем на закритиче-
Рис. 16. Определение температурных функций уравнения состояния для
аргона на изотерме 130° К.
ских изотермах использовались только данные при со > 1,8, которые хмо-
гут быть описаны уравнением состояния в форме E2). При сравнении с
температурными функциями для основных компонентов воздуха (см. рис. 11
и 14) видно, что не только С, но и А для аргона имеет более простую
конфигурацию. Функция А (Т) для аргона напоминает изохору реального газа
и может быть с высокой точностью описана выражением, которым обычно
описываются изохоры. После аналитического описания А (Т) и В (Т) и
подстановки полученных выражений в уравнение G9) уравнение
состояния для аргона приобрело вид [136]
р = (— 465,6 + 4,1577 + 4274-102- Т — 360 553• 104- Г) р2 —
— G33,5 — 2,67Г) р4 + 287р6, (84)
здесь размерность давления — бар, плотности — кг/дм3.
Надежность этого уравнения проверена сопоставлением расчетных
значений плотности с опорными и экспериментальными. Табл. 16 содержит
результаты сравнения расчетных величин с частью опорных. В 62 точках
из 181 (включая точки, не представленные в таблице) значения совпадают,
в 76 точках отклонения расчетных данных от опорных не превышают
0,001 кг/дм3 @,07—0,10%). Только в 17 точках, почти все из которых
лежат в области давлений выше 300 бар, где опорные данные получены
104
%
экстраполяцией, отклонения достигают 0,20—0,22%. Среднее квадра-
тическое отклонение расчетных значений от опорных для всех точек
составляет 0,10%.
В табл. 17 расчетные значения плотности сопоставлены с
большинством подробных экспериментальных данных Ван-Иттербика, Вербека
и Стаеса [46]. Для 81 точки из 113 расхождения не превышают 0,2%, что
свидетельствует об удовлетворительном согласовании обеих групп
данных. В 19 точках расхождения достигают 0,3—0,4%, но десять из них
во юо 120 то 160 т;к
Рис. 17. Температурные функции уравнения состояния
для жидкого аргона:
/ — оптимальные; 2 — предельные.
находятся на изотермах 134,40 и 136,02° К, где данные [46] содержат
погрешность такого же порядка, как отмечалось в IV. 1.
При наиболее низких температурах эксперимента отклонения
расчетных значений плотности от опытных составляют 0,04—0,17%. Это
подтверждают данные табл. 18, где рассчитанные значения сравниваются
с частью экспериментальных данных Ван-Иттербика и Вербека [42]
в интервале температур 86,6—90,6° К.
В табл. 19 рассчитанные нами значения плотности аргона
сопоставлены с экспериментальными данными И. А. Роговой и М. Г. Каганера
[127] и Михельса, Левельта и Де Грааффа [123]. Отклонения от данных
[127] для большинства точек лежат в пределах +0,06-;—0,15%, и только
на изотерме 90,13° К превышают 0,2%. Заметим, что на этой изотерме
результаты [127] систематически ниже расчетных, в то время как данные
Ван-Иттербика и соавторов [42, 46] при близких температурах и давле-
105
Таблица 16
Сопоставление расчетных значений плотности аргона р
(строка 2-я) с опорными (строка 1-я)
р
бар
20
40
60
80
100
120
140
170
200
250
300
350
400
450
500
брср, %
ортах»
%
90
1,382
1,382
1,389
1,388
1,395
1,394
1,400
1,399
1,406
1,405
1,411
1,410
1,416
1,415
1,425
1,423
1,432
1,430
1,443
1,441
—
—
=
0,09
0,14
100
1,317
1,317
1,325
1,325
1,333
1,333
1,340
1,340
1,348
1,347
1,354
1,354
1,361
1,360
1,370
1,369
1,379
1,378
1,393
1,391
1,406
1,404
1,419
1,416
1,430
1,427
1,440
1,437
1,450
1,447
0,13
0,21
по
1,247
1,247
1,258
1,258
1,267
1,268
1,277
1,278
1,285
1,286
1,294
1,295
,1,302
1,303
1,315
1,314
1,326
1,324
1,343
1,341
1,358
1,356
1,372
1,369
1,384
1,382
1,397
1,394
1,408
1,405
0,13
0,22
р, кг/дм3, прр
120
1,167
1,166
1,182
1,182
1,196
1,196
1,208
1,209
1,219
1,221
1,230
1,231
1,241
1,241
1,255
1,256
1,269
1,269
1,289
1,288
1,307
1,306
1,324
1,322
1,338
1,337
1,352
1,351
1,365
1,363
0,09
—0,16
130
—
1,092
1,090
1,113
1,112
1,131
1,131
1,147
1,147
1,161
1,162
1,174
1,175
1,192
1,193
1,209
1,210
1,233
1,234
1,255
1,255
1,274
1,274
1,291
1,291
1,306
1,306
1,321
1,321
0,07
0,18
[ Г, °К
140
—
0,967
0,965
1,009
1,007
1,039
1,038
1,064
1,063
1,084
1,084
1,102
1,102
1,125
1,126
1,146
1,147
1,175
1,176
1,202
1,202
1,223
1,224
1,243
1,243
1,261
1,261
1,277
1,278
0,10
0,21
150
—
—
—
—
0,963
0,963
0,995
0,995
1,021
1,021
1,053
1,053
1,079
1,080
1,116
1,116
1,146
1,147
1,172
1,173
1,195
1,195
1,215
1,216
1,234
1,234
0,05
—0,09
160
—
—
—
—
—
—
0,973
0,974
1,009
1,009
1,054
1,054
1,090
1,090
1,120
1,121
1,146
1,147
1,170
1,170
1,190
1,190
0,06
—0,10
170
—
—
—
—
—
—
—
0,991
0,992
1,034
1,034
1,069
1,069
1,098
1,098
1,124
1,124
1,147
1,147
0,04
—0,10
ниях выше (см. табл. 17 и 18). Расчетные значения плотности согласуются
с подавляющим большинством экспериментальных [123] с расхождением
±0,2%, и лишь в двух точках на изотерме 143,15° К наблюдаются более
существенные отклонения.
Уравнение состояния (84) с высокой точностью описывает кривую
насыщения аргона в широком диапазоне температур. Значения плотности
жидкого аргона на кривой насыщения, рассчитанные по уравнению
состояния (с привлечением уравнения для кривой упругости [137]) в
интервале 85—140° К согласуются с опорными данными в пределах ±0,2%,
причем при большинстве температур отклонения не превышают 0,1%
(табл. 20). В качестве опорных приняты величины, полученные в работе
[70] графическим согласованием результатов экспериментов Михельса и
соавторов [123] и лейденских исследователей [133]. При температурах
выше 140° К расхождения существенно возрастают, поэтому в таблицах
термодинамических свойств аргона в состоянии насыщения (см. табл. VII
106
Таблица 17
Сопоставление расчетных значений плотности жидкого аргона р
с опытными данными Ван-Иттербика, Вербека и Стаеса [46]
Р, бар
10,58
31,90
63,49
96,13
131,07
168,24
205,78
245,87
11,59
53,74
100,13
123,76
169,36
219,28
245,36
283,90
19,22
58,15
101,30
144,55
167,99
215,65
239,28
264,09
Роп
кг/дм9
При Т =
1,3788
1,3860
1,3953
1,4043
1,4131
1,4217
1,4304
1,4391
Spcp =
0 Ртах =
При Т =
1,3344
1,3505
1,3656
1,3733
1,3882
1,4030
1,4106
1,4179
брср =
"Ртах =
При Т =
1,2600
1,2790
1,2969
1,3148
1,3240
1,3409
1,3490
1,3577
брср =
"Ртах =
Ррасч
кг/дм3
-- 90,15° К
1,3776
1,3844
1,3937
1,4028
1,4122
1,4216
1,4305
1,4392
= 0,09%
= 0,12%
96,998° К
1,3339
1,3492
1,3646
1,3720
1,3852
1,3987
1,4052
1,4145
= 0,22%
= 0,38%
108,18°К
1,2613
1,2794
1,2983
1,3150
1,3235
1,3393
1,3467
1,3542
= 0,13%
= 0,26%
р, бар
16,93
58,48
106,69
163,31
208,43
232,70
258,81
288,35
31,38
65,90
107,28
1 155,24
210,65
268,70
293,32
21,38
46,29
79,83
119,15
163,77
214,86
269,39
Роп
кг/дм*
При Т =
1,1881
1,2170
1,2457
1,2709
1,2889
1,2982
1,3071
1,3161
бРср =
О Ртах ~
При Т =
1,1123
1,1445
1,1755
1,2042
1,2321
1,2589
1,2688
бРср =
"Ртах =
При Т =
1,0585
1,0919
1,1246
1,1548
1,1839
1,2110
1,2379
бРср =
бртах =
Ррасч
кг/дм3
117,10° К
1,1890
1,2170
1,2439
1,2701
1,2885
1,2975
1,3067
1,3168
- 0,07%
= 0,14%
127,05° К
1,1102
1,1435
1,1748
1,2045
1,2325
1,2580
1,2675
= 0,10%
= 0,19%
130,85° К
1,0559
1,0893
1,1231
1,1550
1,1845
1,2123
1,2377
= 0,15%
= 0,25%
107
to *
оь
оя
со S
> ID
к
о
н
О)
X
о
DO
ко
СО
о
?5
S
"D О"
э Р
II И
1 °
Lb
4*-
¦v©
©^
КО
СО
ко
го
00
4^
00
Т—i
СП
ю
о
ко
4^
00
*<|
СО
1_
ю
00
СО
^1
О
to
-X-
о
По
-*]
to
о
оо
СО
СП
СД
СО
СП
00
о
СП
СП
о
о
СП
оо
с*
"О
н
X
II
1
1
р
СО
©^
ю
00
4^
ОО
о
to
to
о
to
ко
о
"О
II
о
,11%
о оо
СО 4^
-4 О
— 4^
р р
СО СО
00 СП
-о о
о to
о о
"сО "СО
00 СП
^л to
"Ч СП
to
00
СО
со
о
to
о
оо
to
о
to
о
д
43
к
•S
II
4^
00
to
СП
о
я
КО
СОО
СО
со
СО
to
СО
to
го
4^
00
-vl
о
^1
со
СО
оо
СЛ
to
со
о
СЛ
СП
•^
о
со
-ч
СП
ко
о
4-
СЛ
СО
4^
СОО
о
СП
о
"О
ч
Со
11
1
1
о
4^
о
с -
СО
4^
4^
--4
4^
00
оо
4^
СО
00
о
"О
•о
II
о"
to
-3
©^
-vl
оо
4^
00
СО
ОО
О
СО
СО
ю
СЛ
О
^1
00
со
СО
о
т_
СО
^]
СЛ
00
со
СО
ОО
ко
-vl
КЗ
00
оо
ко
4^
•vl
оо
о
о
^_
со
СО
4^
00
00
•ч
оо
-^
ко
СО
СО
ел
о
о
со
00
оо
^
о
ко
ко
4^
^1
¦ч
о
00
оо
СО
о
00
^1
оо
СО
СО
"о
^1
СЛ
СП
о
-.1
^1
00
¦ч
СО
о
СЛ
ОО
4>
О
СЛ
¦ч
4^
4^
СО
"-Л
ОО
о
СЛ
ко
ко
о
СЛ
со
ст>
4^
4^
^
CD
ко
^1
о
ю
оо
СП
о
СЛ
СЛ
-vl
о
о
СЛ
ко
о
С Э
ОО
СЛ
4-
оо
СО
-v)
о
со
СО
ОО
КО
о
СО
со
4^
СЛ
^1
00
О
СЛ
0,9
СЛ
00
->1
Г")
СО
оо
о
о
СО
СО
о
•ч
о
СО
оо
сп
о
о
СО
оо
4^
СЛ
СЛ
СО
4^
КО
0,9
о
СП
о
О
45-
О
Д
тз
К
II
,__
СО
00
со
00
я
д
К
¦н
II
ф-
оо
оо
00
о
я
ко to ко ко 1— •—
004^К0ОС000СОСПС0
— М О ^ СЛ4^0000
(D^StOSCOO'-S
ф-оослоооокооо^со
.?* -моюооспыюо)^
ТО 0° СП СО КО >— ООСЛСОЮСП
3 ^рК0СО004^СООК0С0К0
II II
II "
0,22
—0
ji, \0 Ю Ю »- >— — >— >— О О
То-«о(ОСвО)^005Ю
3 4^СП^СОКООК04^СЛ
©^ слокосооокоосл
КО КО КО КО >— >—
004^^-О0000С0СП4^
н-ОСО>— 4^K0O-vlO
•— соооокоспоооооо
слоооосоооооосоко
Оо to >- *- |— н- »— о О О
Х> 0>ос000004^К0004^КО
3 "Роокооооспкоспоосо
?= ? ^|ь-00С000О000000
II II
1 °
ск ь
о^*о>— — ^- — — ооо
<р OC000-vJ4^K0004^K0
©^ СЛ4^СОООСОООООСОКО
Ю01ь-ОЧСЛ-ч1С0Ч
д
43
II
>—»
34,4
о
я^
д
43
К
ч
II
СО
оо
о
ко
о
я
1 й
"О
*
-St "о
?°
^'
а-8
ts
й
t3
^?
^я
? -о
2*
Ох
Таблица 18
Сопоставление расчетных значений плотности жидкого аргона р
с опытными данными Ван Иттербика и Вербека [42]
р, бар
17,24
27,46
37,83
48,23 i
58,40
68,48
78,82
89,17
13,44
33,64
53,91
74,15
94,20
114,56
134,24
144,33
Роп
кг /дм3
При Т =
1,4030
1,4059
1,4086
1,4114
1,4141
1,4167
1,4192
1,4219
^Рср =
Ортах =
При Т =
1,3942
1,4000
1,4060
1,4117
1,4174
1,4225
1,4277
1,4302
6Рср =
ОРтах =
Ррасч
кг/дм3
86,637° К
1,4020
1,4047
1,4076
1,4104
1,4132
1,4159
1,4186
1,4213
= 0,06%
= 0,09%
87,915° К
1,3926
1,3986
1,4042
1,4098
1,4165
1,4204
1,4254
1,4278
= 0,13%
= 0,17%
р, бар
22,21
41,30
60,61
79,73
99,04
118,51
137,49
147,17
18,37
| 36,93
56,11
75,32
94,65
114,02
133,77
143,72
Роп
кг/дм3
При Т =
1,3887
1,3943
1,4003
1,4051
1,4107
1,4161
1,4210
1,4236
6рср =
дртах =
При Т =
1,3795
1,3851
1,3911
1,3965
1,4021
1,4075
1,4128
1,4156
6рср =
Spmax =
Ррасч
кг /дм3
89,130° К.
1,3875
1,3933
1,3989
1,4043
1,4094
1,4146
1,4194
1,4219
= 0,10%
- 0,12%
90,55° К
1,3778
1,3836
1,3892
1,3949
1,4002
1,4056
1,4108
1,4133
-= 0,13%
= 0,16%
и VIII), начиная со 144° К, значения плотности кипящей жидкости
приняты по данным [70], а в интервале 136—143° К получены графическим
согласованием расчетных величин и данных [70].
Значения плотности аргона на кривой затвердевания, рассчитанные
по уравнению состояния, хорошо согласуются с опорными данными,
полученными экстраполяцией изобар до температур затвердевания. При
давлениях до 250 бар расхождения обеих групп данных не превышают
0,07%, а при давлениях до 500 бар — 0,21% (табл. 21).
Представляет интерес сопоставление значений плотности жидкого
аргона, рассчитанных нами и авторами работы [74], поскольку обе группы
данных получены независимо и охватывают область давлений свыше
300 кГ/см2, не исследованную экспериментально. Сопоставление было
выполнено на семи изотермах в интервале температур 90—150° К и
давлений 50—500 атм. Не приводя соответствующей таблицы, укажем, что
среднее отклонение данных [74] от рассчитанных по уравнению состояния
(84) составляет 0,12%, а максимальные отклонения на изотермах не
превышают 0,15—25% во всем диапазоне давлений. Только в
непосредственной близости от критической точки (при Т = 150° К и р = 50 атм)
расхождение достигает 0,77%, причем наши данные ниже величин [74].
Вполне удовлетворительное согласование рассчитанных значений
плотности как с экспериментальными данными, так и с результатами [74]
109
Os 4^ tO —
с» ел 4^ 4^
ч ю ч ч
to со ел оо
*—¦ •— о О
О О СО СО
^ о, tO О Ч СЛ
Р О" 00 О О Оэ
3 р о о ел оо
II II
II "
1 -°
о 3 Г Г- Я Я
>— ^ О О СО СО
м оХ Ю О Ч СЛ
ч? -ч о н- ел
©^ 05 Ф Ol Ч
00 tO >— н-
о >-» ел •— оо
^ 00 »- о О)
со to ел ел оо
СО 4^ СО СО -^
•— *- н- о о
н- О О СО СО
О» 4^ 00 tO ~>J tO
-о о ф. ел оо 4^ -ч
3 р to to оо оо о
II II
II 11
1 -°
iSrr Г Я Я
и- ^ — О О СО СО
со ° *• оо ю ч w
-.о ел ел оо оо оо
О4- СЛ СЛ СЛ Ч N3
д
тз
К
н 1
II
ел
00
со
о
я
д
43
К
¦S
II
СЛ
0,6
ел
о
>^
СО
00
00
СО
S? л- СЛ
Р 5° О»
3 р со
СО д
II II
II II
1 °
1 т-
h- NO М
ел ^ ел
^р ОО
©^ о
о
"О О
1 У
II II-
1 Я
о S
^
Os
СО
СЛ
00
СО
"Ч
OS
СО
С»
OS
ко
00
4=*
4^
~*J
t .
4^
OS
-ч
-
4^
00
оо
4^
СЛ
СЛ
4^
to
о
to
to
о
со
со
СЛ
о
OS
о
00
-vl
00
~
о
00
00
00
to
Oi
о
CD
00
СЛ
о
о
to
со
СЛ
СЛ
о
со
СО
-
О
СО
о
со
СО
OS
СО
о
^1
4^
СО
О
¦ч
OS
4*
СО
ел
ОО
OS
О
со
-vj
as
ел
о
со
¦ч
OI
со
^J
со
00
о
4*
00
OS
о
4^
00
OS
•ч
со
to
СО
О
СО
to
СО
о
о
со
с:>
о
о
д
-О
К
II
СО
о°
to
о
Я
Д
тз
к
ч
II
4^
00
СЛ
о
/Ъ
О
"О
пах
II
1
1
О
OS
О
"©
max
II
1
1
я
4^
о
^
О
"О
о
"О
II -
о
to
^
о
оСр
II-
о
,24
\0
00
00
ю
4*
КО
4^
00
00
to
4^
СЛ
ОО
N3
4^
СО
to
t .
сл
to
о
-
СЛ
СЛ
ю
О)
СО
О)
4^
ко
СО
СЛ
to
to
со
OS
СО
СЛ
00
о
4^
( .
О
СО
00
to
-
О
со
СЛ
to
4^
СО
OS
OS
to
го
to
00
to
to
CO
00
о
-vl
CO
t ,
о
00
OS
CO
-
О
CO
*vl
to
Ю
о
CO
to
to
о
о
to
Co
OS
OS
CO
о
CO
OO
to
о
CO
00
K')
to
со
-vl
о
Co
CO
СЛ
to
CO
^-1
о
4^
OS
Os
00
о
CO
CO
to
00
о
CO
CO
Os
СЛ
^.1
00
СЛ
CO
00
о
4*.
00
ел
д
*o
к
н
II
4^
3,1
сл
о
ж:
*«. to
СО СЛ
to to
OS 4^
to >—
СЛ СЛ
OS 4^
со to
СЛ 00
о
"О
max
II
1
1
о
•<!
©^
д
тз
К
•S
II
to
3,0
-ч
о
я
to
о
со
to
л- СЛ
о* ^,
"О
II
о
со Г-
\0 _-
0х СЛ
СО
00
OS 4^
^4 ^
со ^
со со
3 о оо со
to
•—1
СО
Оэ
4^
о
OS
g р 4^ СЛ ОЭ
II *°
|! II
1 "
1 о
1,416
1,421
,28%
0,34%
СЛ 4=»
tO OS СО
о *ч сл
^ Ь "со
OS OS •—
г г я д
О. О СО -О
со 4*. оо a
00 ь- СЛ
ф ел ч цч
II
СО
о -00
О О СО СЛ
СО 4^ 00 о
СО О 4^ ,.
о о to Я
ф-
о
со
00
о
~о
max
II
о
СО
^9
о4-
СО
00
4^
00
со
СО
СО
со
4^
о
со
OS
о
II-
о
00
"Ч
СЛ
о
со
со
ко
OS
CO
СО
^J
о
СЛ
00
СЛ
СО
, ,
OS
4^
—
OS
СЛ
4^
4^
00
OS
-ч
со
оо
4^
¦ч
С^й
00
СО
4^
00
со
о
t_k
о
4^
00
-
о
4^
ю
Os
4^
о
со
*ч
Оо
со
00
to
OS
со
to
^J
OS
__,
о
4^
Os
00
-
о
4ь.
4^
CO
д
"U
s
¦s
II
90,13
я
д
*o
s
II
CO
3,1
СЛ
о
я
to
•о
Co
о
л
ета
to
•о
Со
о
н
» 1
й
"О
р
Л)
Qu
^
я
о
Со
2
?
о
¦сз
р
я
о
3=1
СО
S
Таблица 20
Сопоставление расчетных значений плотности жидкого аргона
на кривой насыщения с опорными [70]
т
°к
85
90
95
100
105
ПО
115
р
бар
0,7898
1,337
2,134
3,242
4,727
6,653
9,088
р, кг/дм3
опорное
1,407
1,374
1,342
1,309
1,276
1,239
1,201
расчетное
1,407
1,376
1,343
1,310
1,276
1,240
1,201
бр
%
0
—0,15
—0,07
—0,08
0
—0,08
0
т
°к
120
125
130
135
140
145
р
бар
12,11
15,78
20,20
25,45
31,64
38,90
р, кг/дм3
опорное
1,160
1,115
1,066
1,009
0,942
0,853
расчетное
1,160
1,114
1,064
1,007
0,942
0,869
бр
%
0
0,09
0,19
0,20
0
—1,84
Т а б л и ц а 21
Сопоставление расчетных значений плотности аргона
на кривой затвердевания с опорными
р
бар
10
20
40
60
80
100
120
140
Т
°К
84,04
84,28
84,78
85,27
85,76
86,25
86,75
87,24
р, кг/дм3
опорное
1,416
1,417
1,419
1,422
1,424
1,426
1,429
1,432
расчетное
1,416
1,417
1,420
1,422
1,424
1,426
1,429
1,431
бр
%
0
0
—0,07
0
0
0
0
0,07
р
бар
170
200
250
300
350
400
450
500
т
°к
87,95
88,69
89,88
91,09
92,23
93,40
94,54
95,71
р, кг/дм3
опорное
! 1,435
1,438
1,443
1,449
1,454
1,459
1,464
1,468 |
расчетное
1,434
1,437
1,442
1,447
1,452
1,457
1,461 |
1,465
бр
%
0,07
0,07
0,07
0,14
0,14
0,14
0,21
0,20
свидетельствует о том, что полученное уравнение состояния для жидкого
аргона (84) является достаточно надежным в широком интервале
температур при давлениях до 500 бар.
IV. 3. Калорические свойства жидкого аргона
Экспериментальные данные о калорических свойствах жидкого
аргона крайне ограничены. Так, теплота испарения аргона, в отличие от
теплоты испарения азота и кислорода, измерена только при нормальной
температуре кипения. Из работ, посвященных определению этой величины,
наиболее точными являются исследования Франка и Клюзиуса [118] и
Флюбахера с сотрудниками [135].
Теплоемкость c's жидкого аргона на кривой насыщения впервые
исследовал Эйкен [103] в интервале температур 87—93° К. Позднее Эйкен и
Хаук [138], несколько усовершенствовав установку [103], определили
с в интервале Т = 90—140° К- В работах [103, 138] получены также
немногочисленные данные об изохорной теплоемкости в несколько более
широких интервалах температур, чем данные о c's.
Роэбук и Остерберг [139], исследовавшие интегральный адиабатный
дроссель-эффект аргона при температурах —150-^+300° С и давлениях
до 200 ашму получили ряд опытных точек и для жидкой фазы.
111
Перечисленными работами исчерпываются все известные нам
экспериментальные исследования калорических свойств жидкого аргона.
Таблицы термодинамических свойств аргона, содержащие частично
данные о жидкой фазе, впервые составил Дин [140]. В этой монографии
приведены значения удельного объема, энтальпии, энтропии и теплоемко-
стей ср и cv в широком интервале температур (от кривой насыщения до
600° К) при давлениях до 5000 атм. Таблицы Дина составлялись до
появления надежных экспериментальных р, v, Т-данных Михельса и соавторов
[123] в области температур ниже 0° С, поэтому при температуре 120-—
270° К и давлении 60—200 атм табличные данные получены обработкой
результатов экспериментов [139]. При более высоких давлениях и
температурах ниже 270° К таблицы [140] составлены на основе экстраполяции
изобар до кривой затвердевания и последующей обработки
экстраполированных р, v, Г-данных и менее подробны, нежели в области, охваченной
экспериментом. Для давлений менее 200 атм и температур ниже 120° К
данные о свойствах жидкости в таблицах Дина практически отсутствуют
(за исключением точки с параметрами 100 атм и 110° К).
Ван-Иттербик и соавторы [46 ] по уравнению состояния C3) рассчитали
термодинамические свойства жидкого аргона в интервале температур
90—130° К при давлениях 2—300 кГ/см2. В таблице [46] даны ср ис0, их
отношение, скорость звука, дифференциальный дроссель-эффект,
производные — (Г") и —\~дТ~) и Разности энтропии As = sj— s' на пяти
изотермах и семи изобарах.
Более подробными являются таблицы термодинамических свойств
аргона, рассчитанные Госманом, Хастом и Мак-Карти [74] по
составленному ими уравнению состояния. В таблицы включены значения
плотности, энтальпии, внутренней энергии и энтропии; шаг по температуре Г К.
Расчетные данные Госмана и соавторов охватывают более широкую
область давлений (до 1000 атм), чем аналогичные данные НБС (США) для
азота [72] и кислорода [73]. Однако в работе [74] не указано, каким
образом было экстраполировано уравнение состояния до значений плотности,
равных примерно 2,8 критической, при которых отсутствуют
экспериментальные данные о термодинамических свойствах аргона в однофазной
области.
В настоящей главе по уравнению состояния (84) рассчитаны
термические и калорические свойства аргона в интервале температур 85—170° К
при давлениях до 500 бар. Поскольку это уравнение имеет более простой
вид, чем уравнения состояния для основных компонентов воздуха,
выражения для расчета калорических свойств аргона также упрощаются и
могут быть окончательно представлены в виде
/ = *' —0,1[(— 931,2 + 41,570+ 17096О-2 — 21633Ш~4)(р — ps) —
- (978 - 26,70) (р3_рз)+ 344,4 (рб—рЭД, (85)
s = s' — 0,1 [D,157 — 854,8#-3+ 144221,2«) (р — р8) +
+ 0,89 (p3-Ps)L (86)
Ср = Cv + О X
, { [D,157 — 854,8ft-3 + 144221,2ft-5) p + 2,67р3]2
Х I (— 931,2 + 83,14ft + 85480-2 — 721106ft-4) p — B934 — 106,8ft) p3 + 1722р5
— B56,44*-4 — 72210,6#-6) (р — ps)}, (87)
где О =0,17\
При расчете энтальпии и энтропии на закритических изотермах
A55; 160 и 170° К) в качестве нижнего предела интегрирования приняты
значения плотности при давлениях 125; 150 и 200 бар соответственно;
112
значения i и s для этих начальных точек приведены в таблицах
[70].
Расчетные значения термодинамических свойств жидкого аргона были
графически согласованы с данными [70] о газе, при этом несколько
изменены V и sf. Поправки к значениям энтальпии в интервале температур
85—145° К лежат в пределах +1,7-5- —1,5 кдж/кг. Постоянные
интегрирования для ср на изотермах выбраны после определения производной
( ~дТ) ПРИ Давлении 300 баР- В процессе согласования данных о жидкости
и газе изменены значения v, i, s при 150—160° К а ср при 145—180° К;
скорректированные данные дополнительно сглажены по изотермам.
Полученные по уравнениям (85)—(87) значения калорических свойств
аргона сопоставлены с указанными выше табличными данными. При
сопоставлении с результатами Дина (как и в главе II) сравнивались значения
At = i — V и As = s — s' на изотермах; результаты приведены в табл. 22.
Таблица 22
Сопоставление разностей энтальпии и энтропии, полученных по данным
Дина [140] и по уравнениям (85) и (86)
Ai, кдж/кг
по таблицам
[140]
по
уравнению (85)
кдж/кг
AS, кдж/(кг. град)
по таблицам
[140]
по
уравнению (86)
6s
кдж
кг. град
При р = 202,6 бар
90
100
ПО
120
130
140
150
9,8
9,2
7,3
4,5
0,4
-6,4
-23,5
9,0
8,3
6,9
4,8
1,3
4,3
-21,5
0,8
0,9
0,4
—0,3
—0,9
—2,1
—2,0
—0,057
—0,061
—0,078
—0,099
—0,126
—0,166
—0,276
0,062
0,065
0,075
0,090
0,113
-0,145
-0,250
0,005
0,004
—0,003
—0,009
—0,013
—0,021
—0,026
При р = 304,0 бар
100
по
120
130
140
150
12,6
9,9
6,3
1,3
—6,6
—24,9
13,0
11,4
8,8
4,6
-1,8
-20,0
-0,4
-1,5
-2,5
-3,3
-4,8
-4,9
-0,088
-0,112
-0,141
-0,174
-0,223
-0,341
0,091
-0,104
-0,122
-0,149
-0,188
-0,301
0,003
—0,008
—0,019
—0,025
—0,035
—0,040
При р = 506,6 бар
100
по
120
130
140
150
21,1
15,1
10,8
4,9
—4,0
—23,5
22,7
20,7
17,7
13,0
5,8
-13,4
— 1,6
—5,6
—6,9
—8,1
—9,8
—10,1
—0,142
—0,173
—0,208
—0,249
—0,305
—0,432
0,135
0,151
0,174
0,206
0,250
0,368
—0,007
—0,022
—0,034
—0,043
—0,055
—0,064
При давлении 202,6 бар обе группы данных согласуются
удовлетворительно: расхождения не превышают 2,1 кдж/кг и 0,026 кдж I{кг-град).
На изобаре 101,3 бар, не представленной в таблице, максимальные
отклонения вдвое меньше, чем при р == 202,6 бар. Большее расхождение
8 Зак. 1978
из
при давлениях 304,0 и 506,6 бар, вероятнее всего, объясняется
уменьшением точности получения Дином результатов в области, где он не
располагал экспериментальными данными.
Сопоставление значений ср с данными Дина показало, что
расхождения в основном не превышают 4% (табл. 23). При давлениях 101,3 и
202,6 бар в ряде точек наблюдаются более значительные отклонения,
однако часть этих точек относится к области температур ниже 120° К,
где данные [140] получены экстраполяцией.
Таблица 23
Сопоставление значений ср, кдж/(кг-град), рассчитанных
по уравнению (87), с данными Дина [140]
т
°к
90
100
ПО
120
130
140
150
160
170
180
При р —
ср [140]
—
1,244
1,264
1,317
1,407
1,592
2,153
2,228
2,028
12
101,3 бар
СР (87)
—
1,097
1,161
1,244
1,357
1,534
1,934
2,425
2,087
,1
,4
При р =
СР [НО]
1,104
1,107
1,109
1,117
1,142
1,177
1,227
1,274
1,304
1,309
6
12
202,6 бар
СР (87)
0,978
1,010
1,041
1,072
1,107
1,144
1,180
1,226
1,275
1,316
1
,9
При р= 304,0 бар
ср [140]
—
1,026
1,029
1,034
1,044
1,059
1,082
1,104
1,127
1,142
2,
3,
СР (87)
—
0,988
1,006
1,022
1,039
1,056
1,070
1,083
1,095
1,105
3
8
При р —
ср [140]
0,951
0,951
0,951
0,954
0,954
0,956
0,966
0,979
0,991
506,6 бар
СР (87)
0,962
0,964
0,965
0,967
0,969
0,971
0,971
0,968
0,966
1,5
2,6
В таблицах термодинамических свойств жидкого аргона,
рассчитанных Ван-Иттербиком и соавторами [46], из интересующих нас
калорических свойств приведены ср и As = s — sf. Величины As по данным [461
и нашим согласуются в пределах —0,004ч-+0,011 кдж/(кг-град) во всем
диапазоне температур и давлений *. Значения ср по обоим источникам при
температурах 110 и 120° К согласуются в пределах ±5%, но при 100 и
130° К максимальные отклонения возрастают примерно вдвое. Заметим,
что на изотермах 120 и 130° К рассчитанные нами значения ср являются
промежуточными между указанными в [46] и [140]. При температуре
90° К расхождения с данными [46] достигают 17—30%. На этой изотерме
значения ср [46 ] возрастают по мере повышения давления, что качественна
противоречит поведению изобарной теплоемкости жидкости и
подтверждает справедливость высказанного выше (см. IV.2) сомнения в точности
расчета производных по уравнению состояния C3).
Подробное сопоставление рассчитанных по уравнениям (85) и (86)
разностей энтальпии и энтропии с величинами, определенными по
таблицам [74], показало, что обе группы данных хорошо согласуются. Значения
А/ отличаются не более чем на +0,2-= 0,4 кдж/кг даже в области высоких
давлений (табл. 24); наибольшее отклонение для As не превышает
—0,004 кдж1(кг-град) (табл. 25). К сожалению, аналогичное
сопоставление на изотерме 150° К не удалось выполнить, поскольку в таблицах [74]
данные для кривой насыщения ограничены температурой 149° К.
Таким образом, можно сделать вывод о достоверности полученных
нами значений термических и калорических свойств жидкого аргона.
Ниже представлены таблицы термодинамических свойств аргона в состоя-
* В таблице [46] у As ошибочно не указан знак минус.
114
нии насыщения и в однофазной области (табл. VII—IX). Расчетные данные
охватывают интервалы давлений 1—500 бар и температур 85—180° К.
По табличным данным построены диаграммы состояния р — 7\ / — р и 5—р,
прилагаемые к монографии.
Таблица 4
Сопоставление разностей энтальпии А/ = i — /', полученных
по уравнению (85) (строка 1-я) и по таблицам [74] (строка 2-я)
р, оар
50,66
101,3
141,9
202,7
304,0
405,3
506,6
л КОЖ
ь кдж
б„их, —
90
2,1
2,2
4,4
4,4
6,2
6,3
9,0
9,1
—
—
—
—
—
—
0,1
0,1
д*\
100
1,8
1,8
3,9
3,9
5,6
5,5
8,4
8,2
12,9
12,8
17,8
17,5
22,7
22,4
0,2
—0,3
кдж/кг, при температуре, °К
ПО
1,3
1,3
3,0
2,9
4,5
4,4
17,0
6,8
11,3
11,1
15,9
15,6
20,7
20,3
0,2
—0,4
120
0,4
0,5
1,5
1,6
2,7
2,8
4,8
4,8
8,7
8,7^
13,1
13,0
17,7
17,5
0,1
—0,2
130
—0,8
—0,8
—0,8
—0,7
—0,2
—0,1
1,3
1,5
4,6
4,8
8,6
8,8
13,0
13,1
0,1
0,2
140
—2,5
—2,6
—4,8
—4,8
—5,0
—5,1
—4.4
—4,3
—1,8
—1,7
1,7
1,9
5,8
5,9
0,1
0,2
Таблица 25
Сопоставление разностей энтропии As = s — s\ полученных
по уравнению (86) (строка 1-я) и по таблицам [74] (строка 2-я)
р, оар
50,66
101,3
141,9
202,7
304,0
405,3
506,6
« кдж
ср' кг-град
Л кдж
дгаах' 1^7ра~д
90
—0,016
—0,016
—0,032
—0,031
—0,043
—0,042
—0,059
—0,058
—
—
0,001
0,001
AS
100
—0,017
—0,018
—0,034
—0,036
—0,047
—0,049
—0,065
—0,067
—0,091
—0,094
—0,114
—0,118
—0,136
—0,140
0,003
—0,004
, кдж/(кг град), при температуре, °К
110
—0,020
—0,021
—0,041
—0,042
—0,055
—0,057
—0,075
—0,077
—0,104
—0,107
—0,129
—0,133
—0,152
—0,156
0,003
—0,004
120
—0,023
—0,024
—0,049
—0,050
—0,066
—0,068
—0,090
—0,092
—0,122
—0,125
—0,150
—0,153
—0,174
—0,178
0,003
—0,004
130
—0,028
—0,027
—0,063
—0,062
—0,085
—0,084
—0,113
—0,111
—0,149
—0,148
—0,180
—0,179
—0,206
—0,206
0,001
0,002
140
—0,031
—0,032
—0,083
—0,083
—0,112
—0,П2
—0,145
—0,145
—0,188
—0,187
—0,222
—0,221
—0,250
—0,250
0,001
±0,001
115
Таблица VII
Термодинамические свойства жидкого аргона в состоянии насыщения
(по температурам)
т
83,78
84
85
86
87
87,29
88
89
90 1
91
¦92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
.107
108
109
ПО
111
112
113
114
115
116
117
118
119
120
121
Р
0,6875
0,7052
0,7898
0,8821
0,9825
1,013
1,091 \
1,210
1,337
1,474
1,622
1,781
1,952
2,134
2,329
2,537
2,758
2,993
3,243
3,507
3,787
4,084
4,397
4,727
5,074
5,440
5,825
6,229
6,652
7,097
7,562
8,048
8,557
9,088
9,643
10,22
10,82
11,45
12,11
12,79
V'
0,7068
0,7075
0,7106
0,7138
0,7171
0,7180
0,7204 |
0,7237
0,7270
0,7303
0,7337
0,7372
0,7408
0,7444
0,7480
0,7517
0,7555
0,7593
0,7632
0,7672
0,7713
0,7754
0,7796
0,7838
0,7881
0,7925
0,7970
0,8017
0,8066
| 0,8116
0,8166
0,8217
j 0,8270
0,8325
0,8382
0,8440
0,8499
0,8560
0,8624
0,8690
*"
—119,6
—119,4
—118,4
—117,4
—116,4
—116,1
—115,4 |
—114,4 !
—113,4
—112,4
—111,3
—110,3
—109,2
—108,1
—107,0
—106,0
—104,9
—103,8
—102,7
—101,6
—100,4
—99,3
| —98,2
—97,0
[ —95,8
| —94,7
—93,5
I —92,3
—91,1
—89,9
—88,7
—87,4
—86,2
—84,9
—83,6
—82,3
—81,0
—79,7
—78,4
—77,1
г
161,8
161,7
161,1
160,4
159,8
159,6
159,2
158,5
157,9
157,2
156,4
155,7
154,9
154,1
153,3
152,5
151,7
150,9
150,0
149,4
148,1
147,2
146,3
1 145,2
. 144,2
| 143,2
142,1
141,0
139,9
138,8
137,6
136,4
135,2
133,9
132,6
131,3
129,8
128,5
127,0
[ 125,6
s'
1,352
1,354
1,366
1,377 1
1,388
1,392
1,399
1,411 j
1,422 1
1,433
1,444
1,455
1,466
1,478
1,489
1,500
1,510
1,521
1,532
1,543
1,554
1,565
1,575
1,586
1,597
1,608
1,618
1,629
1,640
1,651
1,661
1,672
' 1,682
1,693
1,704
1J14
1,725
I 1,735
1,746
S 1,757
c'p I
0,975
0,977
0,984
0,991
0,999
1,001 '
1,007
1,015
1,023
1,031
1,039
1,047
1,055
1,063
1,071
1,079
1,087
1,095
1,103
1,111
1,120
1,129
1,138
1,147
1,157
1,167
1,177
1,188
1,199
1,210
1,222
1,235
1,248
1,261
1,275
1,290
1,306
1,323
1,340
1,358
0'
1,949
1,962
2,022
2,083
2,147
2,166
2,213
2,282
2,354
2,428
2,505
2,586
2,670
2,757
2,849
2,945
3,045
3,150
3,261
3,377
3,499
3,627
3,762
3,905
4,056
4,216
4,385
4,565
4,755
4,958
5,174
5,405
5,652
5,916
6,199
1 6,503
6,831
7,184
7,566
1 7,980
116
Продолжение табл. VII
Т
122
123
124
125
126
127
128
129
130
131
132
133
134
135
136
137
138
139
140
141
142
143
144
145
146
147
148
149
150
150,86
Р |
13,49
14,23
14,99 |
15,78
16,60
17,45
18,33
19,25
20,20
21,18
22,19
23,24
24,32
25,45
26,61
27,80
29,04
30,32
31,64
33,00
' 34,41
35,86
37,36
38,90
40,49
42,14
43,83
45,58
47,39
1 48,98
v'
0,8758
0,8828
0,8900
0,8975
0,9053
0,9134
0,9218
0,9306
0,9399
0,9495
0,9595
0,9701
0,9812
0,9929
1,005
1,017
1,031
1,046
1,062
1,080
1,099
1,121
1,145
1,173
1,205
1,245
1,293
1,358
1,464
1,867
i'
—75,7
—74,3
—72,9
—71,4
—70,0
—68,5
—67,0 |
—65,5
—64,0
—62,4
—60,9
—59,3
—57,6
—55,9
—54,2
—52,5
—50,8
—49,0
—47,1
—45,3
—43,5
—41,7
—39,8
—37,6
—35,2
—32,4
—29,0
—24,7
1 —18,3
—2,4
г
124,0
122,4
120,8
119,1
117,4
115,6
113,7
111,8
109,9 !
107,8
105,8
103,6
101,3
98,9
96,5
94,0
91,4
88,6
85,6
82,7
79,5
76,3
72,7
68,8
64,1
58,7
52,1
43,6
| 31,1
1 0
s'
1,768
1,779 1
1,790
1,800
1,811
1,823
1,834
1,845
1,856
1,867
1,878
1,889
1,901
1,913
1,924
1,936
1,948
[ 1,960
1,972
1,983
1,994
2,006
2,019
2,033
2,049
2,067
2,088
2,115
2,157
1 2,261
с'р
1,377
1,398
1,420
1,444
1,469
1,495
1,523
1,554
1,587
1,622
1,659
1,700
1,7'44
1,792
1,844
1,900
1,960
2,022
2,086
2,153
2,222
2,294
2,368
2,445
—
—
—
—
—
J —
Э'
8,429
8,919
9,453
10,04
10,68
11,38
12,16
13,02
13,98
15,04
16,24
17,57
19,08
20,77
22,70
24,88
27,36
30,19
33,41
37,06
41,18
45,79
50,87
56,34
62,05
67,77
73,20
~~
—
1 —
Таблица VIII
Термодинамические свойства жидкого аргона в состоянии насыщения
(по давлениям)
р
0,75
1,0
2,0
3,0
4,0
5,0
6,0
7,0
8,0 •
9,0
т
84,54
87,17
94,27
99,03
102,72
105,79
108,44
110,79
112,90
114,84
и'
0,7092
0,7176
0,7416
0,7594
0,7742
0,7872
0,7991
0,8104
0,8211
0,8315
V
— 118,9
— 116,2
— 108,9
— 103,7
—99,6
—96,1
—93,0
—90,2
—87,6
—85,1
г
161,4
159,7
154,7
150,8
147,5
144,5
141,7
139,1
136,6
134,1
s'
1,360
1,390
1,469
1,522
1,561
1,594
1,622
1,647
1,670
1,691
с'р
0,981
1,000
1,057
1,095
1,127
1,155
1,182
1,208
1,234
1,259
Э'
1,994
2,158
2,693
3,154
3,591
4,024
4,463
4,914
5,382
5,871
117
Продолжение табл. VIII
р
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
Т
116,62
118,28
119,84
121,31
122,70
124,01
125,27
126,47
127,62
128,73
129,80
130,82
131,82
132,78
133,71
134,61
135,48
136,33
137,16
137,97
138,75
139,52
140,27
141,00
141,71
142,41
143,10
143,77
144,42
145,06
145,69
146,31
146,92
147,51
148,10
148,67
149,26
149,80
150,33
v'
0,8417
0,8517
0,8615
0,8711
0,8806
0,8900
0,8995
0,9090
0,9186
0,9282
0,9379
0,9476
0,9575
0,9676
0,9778
0,9881
0,9986
1,009
1,020
1,031
1,042
1,054
1,067
1,080
1,094
1,109
1,124
1,140
1,156
1,174
1,195
1,218
1,243
1,270
1,299
1,336
1,380
1,435
1,525
i'
—82,8
—80,6
—78,6
—76,7
—74,7
—72,8
—71,0
—69,3
—67,6
—65,9
—64,3
—62,7
—61,1
—59,6
—58,1
—56,6
—55,1
—53,6
—52,2
—50,8
—49,4
—43,0
—46,6
—45,3
—44,0
—42,7
—41,5
—40,2
—38,8
—37,4
—35,9
—34,3
—32,5
—30,6
—28,5
—26,1
—23,3
—19,9
— 15,0
г
131,8
129,5
127,3
125,2
122,9
120,7
118,6
116,5
114,4
112,3
110,3
108,2
106,1
104,0
102,0
99,9
97,8
95,6
93,5
91,5
89,2
87,0
84,8
82,7
80,3
78,1
75,9
73,5
71,0
68,4
65,6
62,5
59,0
55,3
51,2
46,4
40,9
34,2
24,9
s'
1,710
1,728
1,745
1,760
1,775
1,790
1,804
1,817
1,830
1,842
1,853
1,865
1,876
1,887
1,898
1,908
1,918
1,928
1,938
1,947
1,957
1,966
1,975
1,984
1,993
2,001
2,009
2,017
2,025
2,034
2,044
2,055
2,066
2,078
2,091
2,107
2,125
2,146
2,174
СР
1,285
1,311
1,337
1,364
1,392
1,421
1,451
1,482
1,513
1,546
1,580
1,615
1,652
1,691
1,732
1,774
1,818
1,864
1,911
1,959
2,008
2,057
2,106
2,154
2,203
2,252
2,301
2,350
2,399
2,449
2,498
—
—
—
—
—
—
—
0'
6,385
6,928
7,503
8,114
8,766
9,461
10,20
11,00
11,86
-12,78
13,78
14,85
16,01
17,26
18,61
20,08
21,67
23,39
25,26
27,28
29,46
31,81
34,34
37,06
39,95
43,02
46,26
49,64
53,13
56,69
60,28
63,84
67,30
70,61
73,70
76,52
—
—
118
Таблица IX
Термодинамические свойства аргона в однофазной области
т, °к
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4074
0,005512
0,005196
0,004917
0,004668
0,004444
0,004242
0,004058
0,003890
0,003735
0,003593
0,003461
0,003339
0,003225
0,003119
0,003020
0,002839
0,002681
V
0,7105
181,4
192,4
203,4
214,2
225,0
235,7
246,4
257,1
267,7
278,3
288,9
299,5
310,1
320,6
331,1
352,2
373,2
При р
i
—118,4
45,1
47,4
50,6
53,4
56,1
58,8
61,5
64,1
66,8
69,5
72,1
74,8
77,4
80,0
82,7
88,0
93,2
= 1 бар
s
1,365
3,240
3,271
3,299
3,326
a,35i
3,375
3,398
3,420
3,441
3,461
3,480
3,498
3,516
3,534
3,551
3,582
3,612
СР
0,984
0,5624
0,5551
0,5494
0,5449
0,5413
0,5384
0,5361
0,5341
0,5325
0,5311
0,5300
0,5290
0,5281
0,5274
0,5268
0,5257
0,5249
Р
2,021
—
—
—
—
Продолжение табл. IX
т, °к
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4085
1,3768
1,3445
1,3111
1,2761
0,02404
0,02270
0,02152
0,02048
0,01955
0,01871
0,01794
0,01724
0,01660
0,01601
0,01546
0,01447
0,01362
V
0,7100
0,7263
0,7438
0,7627
0,7837
41,59
44,05
46,46
48,83
51,16
53,46
55,74
58,00
60,24
- 62,46
64,67
69,07
73,42
При р
1
— 118,2
—113,2
— 108,0
— 102,6
—97,0
51,1
54,3
57,4
60,4
63,3
66,2
69,1
72,0
74,8
77,6
80,4
85,9
91,4
= 5 бар
s
1,364
1,420
1,477
1,532
1,586
2,986
3,014
3,040
3,065
3,088
3,110
3,131
3,151
3,170
3,188
3,206
3,239
3,270
СР
0,983
1,022
1,061
1,102
1,147
0,6439
0,6243
0,6090
0,5969
0,5870
0,5789
0,5721
0,5664
0,5616
0,5575
0,5540
0,5482
0,5438
3
2,005
2,334
2,736
3,243
3,901
—
—
—
—
—
—
—
—
—
119
Продолжение табл. IX
Т, °К
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4099
1,3784
1,3463
1,3132
1,2785
1,2417
1,2018
0,04713
0,04423
0,04175
0,03962
0,03774
I 0,03605
I 0,03454
0,03317
0,03192
0,02972
0,02782
V
0,7093
0,7255
0,7428
0,7615
0,7822
0,8054
0,8321
21,22
22,61
23,95
25,24
26,50
27,74
28,95
30,15
31,33
33,65
| 35,94
При р
i
— 118,0
— 113,0
— 107,8
— 102,4
—96,8
—91,0
—84,9
51,5
55,1
58,5
61,9
65,1
68,2
71,3
74,3
77,3
83,2
88,9
= 10 бар
s
1,363
1,419
1,475
1,530
1,584
1,639
1,692
2,862
2,891
2,918
2,941
2,967
2,989
3,010
3,030
3,049
3,084
3,117
СР
0,982
1,020
1,058
1,098
1,142
1,194
1,259
0,7412
0,7039
0,6758
0,6539
0,6365
0,6223
0,6106
0,6008
0,5925
0,5794
0,5696
Р
1.986
2,308
2,701
3,192
3,828
4,681
5,884
х
—
—
—
—
—
—
—
Продолжение табл. IX
Т, °К
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4113
1,3799
1,3481
1,3153
1,2809
1,2445
1,2053 '
1,1621
0,07324
0,06796
0,06364
0,06000
0,05687
0,05413
0,05171
i 0,04954
t 0,04579
0,04268
V
0,7085
0,7247
0,7418
0,7603
0,7807
0,8035
0,8297
0,8605
13,65
14,71
15,71
16,67
17,58
18,47
19,34
20,19
21,84
23,43
При р
i
—117,8
— 112,8
— 107,6
—102,3
—96,7
—90,9
—84,8
—78,4
49,2
53,0
57,0
60,7
64,2
67,6
70,9
74,1
80,3
86,3
= 15 бар
s
1,361
1,417
1,474
1,528
1,581
1,636
1,689
1,745
2,770
2,803
2,833
, 2,860
2,884
! 2,907
2,928
1 2,948
2,986
3,021
СР
0,981
1,019
1,056
1,094
1,137
1,186
1,248
1,330
0,8838
0,8088
0,7589
0,7221
0,6932
0,6710
0,6528
0,6370
0,6144
0,5981
Р
1,967
2,283
2,666
3,143
3,757
4,576
5,716
7,402
—
—
—
—
—
—
—
120
Продолжение табл. IX
т, °к
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4127
1,3815
1,3499
1,3173
1,2833
1,2474
1,2087
1,1664
1,1189
0,1009
0,09234
0,08569
0,08032
0,07582
0,07194
0,06859
0,06289
0,05824
V
0,7079
0,7238
0,7408
0,7591
0,7792
0,8017
0,8273
0,8574
0,8937
9,906
10,83
11,67
12,45
13,19
13,90
14,58
15,90
17,17
При р
i
—117,6
—112,6
—107,4
—102,1
—96,5
—90,7
—84,7
—78,3
—71,5
46,2
51,2
55,6
59,7
63,5
67,2
70,7
77,4
83,8
= 20 бар
$
1,359
1,415
1,472
1,526
1,579
1,634
1,686
1,741
1,797
2,705
2,742
2,774
2,803
2,829
2,853
2,875
, 2,916
2,953
СР
0,977
1,017
1,053
1,090
1,132
1,179
1,238
1,315
1,423
1,060
0,9286
0,8468
0,7905
0,7492
0,7176
0,6954
0,6558
0,6301
3
1,949
2,258
2,632
3,096
3,890
4,475
5,558
7,136
9,620
—
—
—
__
—
—
Продолжение табл. IX
Т, °К
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4141
1,3831
1,3517
1,3194
1,2857
1,2501
1,2120
1,1705
1,1242
1,0709
0,1298
0,1169
0,1077
0,1004
0,09434
0,08929
0,08110
0,07463
V
0,7072
0,7230
0,7398
0,7579
0,7778
0,7999
0,8251
0,8544
0,8896
0,9338
7,707
8,551
9,290
9,965
10,60
11,20
12,33
13,40
При р
i
— 117,4
—112,4
—107,2
—101,9
—96,3
—90,6
—84,6
—78,3
—71,6
—64,2
43,8
49,6
54,5
59,0
63,1
67,0
74,3
81,2
= 25 бар
s
1,358
1,413
1,470
1,524
1,577
1,631
1,684
1,738
1,793
1,851
2,654
2,696
2,731
2,761
2,788
2,813
2,857
2,896
ср
0,979
1,015
1,051
1,087
1,127
1,173
1,229
1,301
1,400
1,547
1,276
1,055
0,9340
0,8560
0,8012
0,7605
0,7037
0,6662
Р
1,931
2,234
2,599
3,051
3,625
4,379
5,410
6,891
9,173
13,07
—
—
—
—
~^-
—
12 Р
Продолжение табл. IX
Т, °К
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4154
1,3846
1,3534
1,3214
1,2880
1,2528
1,2152
1,1744
1,1292
1,0777
1,0163
0,1586
0,1410
0,1288
0,1196
0,1122
0,1006
0,0918
V
0,7065
0,7222
0,7389
0,7568
0,7764
0,7982
0,8229
0,8515
0,8856
0,9279
0,9840
6,307
7,094
7,761
8,360
8,915
9,938
10,89
При р
i
— 117,1
— 112,2
— 107,0
— 101,7
—96,2
—90,4
—84,5
—78,2
—71,6
—64,4
—56,3
41,8
48,4
53,9
58,7
63,1
71,1
78,4
= 30 бар
s
1,356
1,412
1,468
1,522
1,575
1,629
1,681
1,735
1,789
1,846
1,907
2,614
2,660
2,697
2,729
2,757
2,805
2,847
СР
0,978
1,013
1,048
1,084
1,122
1,166
1,220
1,287
1,378
1,510
1,723
1,509
1,171
1,014
0,9148
0,8473
0,7606
0,7071
3
1,914
2,211
2,567
3,007
3,563
4,288
5,270
6,664
8,771
12,26
18,91
—
—
—
—
Продолжение табл. IX
Т, ¦'К
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4168
1,3861
1,3551
1,3233
1,2903
1,2555
1,2184
1,1783
1,1341
1,0841
1,0255
0,9522
0,1857
0,1635
0,1488
0,1378
0,1217
0,1101
V
0,7058
0,7214
0,7379
0,7557
0,7750
0,7965
0,8207
0,8487
0,8818
0,9224
0,9751
1,0502
5,386
6,116
6,720
.7,258
8,216
9,083
При р
<•
— 116,9
—111,9
— 106,8
— 101,5
—96,0
—90,3
—84,4
—78,2
—71,6
—64,5
—56,7
—47,7
40,5
47,8
53,6
58,7
67,6
75,5
= 35 бар
s
1,355
1,410
1,467
1,520
1,573
1,627
1,678
1,732
1,785
1,841
1,901
1,965
2,-584
2,634
2,672
2,704
2,758
2,803
СР
0,977
1,012
1,046
1,080
1,118
1,160
1,211
1,275
1,359
1,478
1,661
1,988
1,707
1,276
1,078
0,9628
0,8293
0,7539
3
1,896
2,188
2,536
2,964
3,502
4,201
5,138
6,453
• 8,405
11,54
17,24
29,92
—
—
—
122
Продолжение табл. IX
Т, °К
85
90
95
100
105
НО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4181
1,3876
1,3568
1,3253
1,2925
1,2581
1,2215
1,1820
1,1388
1,0902
1,0340
0,9655
0,8745
0,2093
0,1838
0,1671
0,1446
0,1295
V
0,7052
0,7206
0,7370
0,7546
0,7737
0,7948
0,8187
0,8460
0,8782
0,9173
0,9671
1,0357
1,1436
4,777
5,440
5,985
6,913
7,724
При р
i
— 116,7
—111,7
— 106,6
— 101,3
—95,8
—90,2
—84,3
—78,1
—71,6
—64,7
—57,0
—48,4
—37,9
40,1
47,8
53,9
63,9
72,4
=40 бар
s
1,353
1,409
1,465
1,518
1,571
1,625
1,676
1,729
1,782
1,837
1,895
1,957
2,030
2,564
2,615
2,653
2,714
2,763
СР
0,976
1,010
1,043
1,077
1,113
1,154
1,203
1,263
1,341
1,449
1,609
1,872
2,380
1,812
1,339
1,124
0,9135
0,8078
Э
1,880
2,165
2,506
2,923
3,445
4,117
5,014
6,256
8,072
10,92
15,87
25,96
53,12
—
—
Продолжение табл. IX
т, °к
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
0
1,4195
1,3891
1,3585
1,3272
1,2947
1,2607
1,2245
1,1857
1,1433
1,0960
1,0419
0,9774
0,8954
0,2844
0,2286
0,2015
0,1698
0,1501
V
0,7045
0,7199
0,7361
0,7535
0,7724
0,7932
0,8166
0,8434
0,8747
0,9124
0,9598
1,0231
1,1169
3,516
4,374
4,962
5,888
6,663
При р
i
—116,5
— 111,5
— 106,4
— 101,1
—95,7
—90,0
—84,2
—78,0
—71,6
—64,7
—57,3
—49,0
—39,2
28,3
40,5
48,3
59,9
69,3
= 45 бар
s
1,352
1,407
1,463
1,516
1,569
1,622
1,673
1,726
1,778
1,832
1,889
1,949
2,017
2,472
2,552
2,602
2,672
2,726
СР
0,975
1,009
1,041
1,074
1,109
1,148
1,195
1,252
1,325
1,423
1,564
1,782
2,153
3,738
1,813
1,362
1,019
0,8702
Р
1,863
2,143
2,477
2,882
3,389
4,038
4,895
6,072
7,766
10,36
14,72
23,02
42,32
—
—
123
Продолжение табл. IX'
Т, °К
90
95
100
105
НО
115
120
125
130
135
140
145
150
155
160
170
* 180
р
1,3906
1,3602
1,3291
1,2969
1,2632
1,2275
1,1892
1,1476
1,1016
1,0494
0,9881
0,9128
0,7602
0,2933
0,2437
0,1978
0,1721
V
0,7191
0,7352
0,7524
0,7711
0,7916
0,8147
0,8409
0,8714
0,9078
0,9530
1,0120
1,0955
1,3155
3,410
4,103
5,056
5,810
При р
i
— 111,3
—106,2
—100,9
—95,5
—89,8
—84,0
—78,0
—71,6
—64,8
—57,5
—49,5
--40,3
—20,0
30,8
41,6
55,6
66,0
= 50 бар
s
1,406
1,462
1,515
1,567
1,620
1,671
1,723
1,774
1,828
1,884
1,941
2,006
2,292
2,477
2,547
2,631
2,690
СР
1,007
1,039
1,071
1,105
1,143
1,187
1,241
1,310
1,400
1,525
1,709
1 1,992
2,390
2,957
1,745
1,152
0,9426
0
2,122
2,448
2,843
3,335
3,961
4,783
5,900
7,485-
9,868.
13,73
20,71
35,31
—
—
_
1
Продолжение табл. IX
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,3935
1,3635
1,3328
1,3012
1,2681
1,2333
1,1961
1,1560
1,1120
1,0630
1,0070
0,9412
0,8435
0,6609
0,3771
0,2647
0,2211
V
0,7176
0,7334
0,7503
0,7685
0,7886
0,8109
0,8361
0,8651
0,8993
0,9407
0,9931
1,0625
1,1855
1,513
2,652
3,778
4,522
При р
t
—110,9
—105,8
—100,5
—95,1
—89,5
—83,8
—77,8
—71,5
—64,9
—57,9
—50,3
—41,8
—30,2
—10,8
23,1
45,8
58,8
= 60 бар
s
1,403
1,458
1,511
1,563
1,616
1,666
1,718
1,769
1,820
1,874
1,929
1,988
2,069
2,193
2,410
2,548
2,622
СР
1,004
1,035
1,065
1,097
1,133
1,174
1,222
1,282
1,359
1,461
1,599
1,794
2,134
6,742
3,803
1,546
1,125
Р
2,080
2,393
2,769
3,233
3,818
4,575
5,586
6,986
9,017
12,14
17,32
26,71
—
—
—
—
—
124
Продолжение табл. IX
т, °к
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,3964
1,3667
1,3365
1,3053
1,2729
1,2388
1,2026
1,1638
1,1217
1,0753
1,0233
0,9640
0,8902
0,7843
0,6064
0,3522
0,2780
V
0,7161
0,7317
0,7482
0,7661
0,7855
0,8072
0,8315
0,8592
0,8915
0,9300
0,9772
1,0373
1,1235
1,275
1,649
2,839
3,597
При р
i
—110,4
—105,3
—100,1
—94,7
—89,2
—83,5
—77,6
—71,4
—65,0
—58,2
—50,9
—42,9
—33,7
—20,8
—0,4
34,2
51,0
= 70 бар
s
1,399
1,455
1,508
1,559
1,612
1,661
1,712
1,762
1,818
1,865
1,918
1,973
2,035
2,118
2,242
2,459
2,556
СР
1,002
1,031
1,060
1,090
1,123
1,161
1,205
1,258
1,325
1,409
1,517
1,663
1,900
2,929
4,926
2,182
1,366
0
2,040
2,340
2,699
3,137
3,685
4,385
5,306
6,554
8,312
10,90
14,94
21,59
—
—
—
—
—
Продолжение табл. IX
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
Л 80
Р
1,3992
1,3699
1,3400
1,3094
1,2775
1,2441
1,2089
1,1712
1,1307
1,0865
1,0377
0,9833
0,9219
0,8418
0,7278
0,4627
0,3436
V
0,7147
0,7300
0,7462
0,7637
0,7828
0,8038
0,8272
0,8538
0,8844
0,9204
0,9636
1,0170
1,0847
1,188
1,374
2,161
2,910
При р -
i
—110,0
—104,9
—99,7
—94,4
—88,9
—83,2
—77,4
—71,3
—65,0
—58,3
—51,3
—43,8
—35,4
—25,3
—12,0
21,2
42,6
= 80 бар
s
1,396
1,452
1,504
1,556
1,608
1,657
1,707
1,757
1,806
1,857
1,907
1,960
2,017
2,085
2,166
2,368
2,492
СР
0,999
1,027
1,055
1,083
1,144
1,149
1,189
1,237
1,295
1,366
1,454
1,572
1,746
2,216
2,975
2,851
1,658
Р
1,966
2,242
2,569
2,964
3,448
4,054
5,055
6,177
7,717
9,912
13,17
18,18
26,06
—
—
_____
_____
125
Продолжение табл. IX
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4020
1,3730
1,3435
1,3133
1,2820
1,2493
1,2148
1,1783
1,1392
1,0969
1,0508
1,0000
0,9440
0,8780
0,7899
0,5724
0,4167
V
0,7133
0,7283
0,7443
0,7614
0,7800
0,8005
0,8232
0,8487
0,8778
0,9117
0,9517
1,0000
1,0593
1,139
1,266
1,747
2,400
При р
1
—109,5
—104,5
—99,3
—94,0
—88,5
—82,9
—77,1
—71,1
—64,9
—58,4
—51,6
—44,4
—36,6
—27,6
—17,0
9,9
34,0
= 90 бар
s
1,398
1,449
1,501
1,552
1,604
1,653
1,702
1,751
1,800
1,850
1,898
1,949
2,002
2,062
2,128
2,291
2,429
СР
0,997
1,024
1,050
1,077
1,106
1,138
1,175
1,218
1,269
1,330
1,403
1,500
1,643
1,893
2,288
2,852
2,940
Р
1,966
2,242
2,569
2,964
3,448
4,054
4,829
5,844
7,208-
9,097
11,79
15,74
21,57
—
—
—
—
Продолжение табл. 1X1
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4047
1,3761
1,3470
1,3171
1,2863
1,2543
1,2206
1,1850
1,1471
1,1065
1,0626
1,0149
0,9630
0,9033
0,8319
0,6553
0,4914
V
0,7119
0,7267
0,7424
0,7592
0,7774
0,7973
0,8193
0,8439
0,8717
0,9037
0,9411
0,9853
1,0384
1,107
1,202
1,526
2,035
При р =
1
—109,1
— 104,0
—98,9
—93,6
—88,2
—82,6
—76,9
—71,0
—64,8
—58,5
—51,8
—44,9
—37,4
—29,1
— 19,9
2,4
26,0
= 100 бар
s
1,391
1,446
1,498
1,549
1,600
1,648
1,698
1,746
1,794
1,843
1,890
1,939
1,989
2,044
2,102
2,237
2,372
СР
0,995
1,020
1,046
1,071
1,098
1,128
1,162
1,201
1,246
1,300
1,361
1,438
1,542
1,708
1,954
2,459
2,097
3
1,930
2,196
2,510
2,885
3,342
3,908
4,624
5,548
6,767
8,413
10,69
13,90
18,42
—
—
—
—
126
Продолжение табл. IX
Т, °К
_________
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
______________
1,4114
1,3834
1,3552
1,3264
1,2967
1,2661
1,2341
1,2006
1,1654
1,1281
1,0885
1,0464
1,0016
0,9542
0,9001
0,7770
0,6443
V
0,7085
0,7228
0,7379
0,7539
0,7712
0,7899
0,8103
0,8329
0,8581
0,8865
0,9187
0,9557
0,9984
1,048
1,111
1,287
1,552
При р =
i
— 107,9
—102,9
—97,8
—92,6
—87,2
—81,8
—76,2
—70,4
—64,5
—58,4
—52,1
—45,6
—38,9
—31,8
—24,2
—7,0
11,8
= 125 бар
s
1,383
1,438
1,490
1,540
1,591
1,638
1,687
1,733
1,780
1,827
1,871
1,917
1,963
2,011
2,059
2,161
2,269
Ср
0,989
1,013
1,035
1,058
1,081
1,106
1,134
1,165
1,200
1,239
1,281
1,330
1,389
1,467
1,565
1,810
1,907
1,848
2,091
2,373
2,706
3,104
3,589
4,186
4,933
5,882
7,105
8,700
10,80
13,54
—
—
—
—
Продолжение табл. IX,
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4178
1,3905
1,3630
1,3351
1,3065
1,2770
1,2465
1,2147
1,1816
1,1469
1,1104
1,0722
1,0322
0,9901
0,9452
0,8474
0,7407
V
0,7053
0,7192
0,7337
0,7490
0,7654
0,7831
0,8022
0,8232
0,8463
0,8719
0,9005
0,9327
0,9688
1,010
1,058
1,181
1,350
При р =
i
— 106,8
—101,8
—96,7
—91,6
—86,3
—80,9
—75,4
—69,8
—64,0
—58,1
—52,1
—45,9
—39,6
—33,0
—26,1
—11,4
4,4
- 150 бар
s
1,377
1,431
1,482
1,532
1,582
1,629
1,676
1,722
1,767
1,812
1,855
1,898
1,942
1,986
2,029
2,117
2,208
ср
0,985
1,006
1,026
1,046
1,066
1,087
1,110
1,136
1,163
1Л93
1,225
1,258
1,295
1,335
1,397
1,528
1,621
Р
1,773
1,996
2,251
2,549
2,901
3,322
3,829
4,449
5,214
6,167
7,361
8,859
10,73
—-
—
„__
—
127
Продолжение табл. IX
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4240
1,3973
1,3706
1,3434
1,3157
1,2873
1,2580
1,2277
1,1963
1,1636
1,1296
1,0943
1,0576
1,0198
0,9804
0,8960
0,8058
V
0,7023
0,7157
0,7296
0,7444
0,7600
0,7768
0,7949
0,8145
0,8359
0,8594
0,8852
0,9138
0,9455
0,9806
1,020
1,116
1,241
При р =
i
—105,6
—100,7
—95,6
—90,5
—85,3
—80,0
—74,6
—69,1
—63,5
—57,7
—51,9
—45,9
—39,8
—33,7
—27,2
1 —13,9
0,2
= 175 бар
s
1,370
1,424
1,475
1,524
1,574
1,620
1,667
1,711
1,755
1,799
1,841
1,882
1,924
1,965
2,005
2,086
2,167
ср
0,981
1,000
1,018
1,036
1,053
1,071
1,091
1,111
1,133
1,157
1,181
1,206
1,232
1,266
1,299
1,374
1,441
Р
1,705
1,910
2,143
2,412
2,725
3,094
3,532
4,057
4,691
5,459
6,394
7,530
8,901
—
—
—
—
Продолжение табл. IX
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4299
1,4039
1,3777
1,3513
1,3244
1,2970.
1,2688
1,2397
1,2097
1,1788
1,1467
1,1137
1,0796
1,0446
1,0088
0,9337
0,8547
V
0,6993
0,7123
0,7258
0,7400
0,7550
0,7710
0,7882
0,8066
0,8266
0,8484
0,8720
0,8979
0,9263
0,9573
0,9913
1,071
1,170
При р -
i
—104,5
—99,5
—94,5
—89,4
—84,3
—79,0
—73,7
—68,3
—62,8
—57,2
—51,5
—45,7
—39,8
—33,9
—27,8
— 15,3
—2,3
= 200 бар
s
1,363
1,417
1,468
1,517
1,566
1,611
1,657
1,701
1,744
1,788
1,828
1,868
1,908
1,947
1,985
2,061
2,136
СР
0,978
0,995
1,011
1,026
1,042
1,057
1,074
1,091
1,109
1,128
1,147
1,165
1,184
1,207
1,231
1,282
1,326
3
1,642
1,831
2,045
2,289
2,571
2,898
3,281
3,733
4,268
4,904
5,661
6,559
7,616
—
—
—
—
J 28
Продолжение табл. IX
г, °к
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4357
1,4102
1,3846
1,3589
1,3328
1,3061
1,2789
1,2509
1,2222
1,1926
1,1622
1,1310
1,0990
1,0661
1,0330
0,9643
0,8928
V
0,6965
0,7091
0,7222
0,7359
0,7503
0,7656
0,7820
0,7994
0,8182
0,8385
0,8604
0,8842
0,9099
0,9380
0,9681
1,037
1,120
При р =
i
—103,3
—98,4
—93,4
—88,3
—83,2
—78,0
—72,8
—67,4
—62,0
—56,5
—51,0
—45,4
—39,7
—33,9
—28,1
— 16,2
—3,9
= 225 бар
s
1,357
1,411
1,461
1,510
1,558
1,603
1,649
1,692
1,734
1,777
1,816
1,855
1,894
1,931
1,969
2,041
2,111
СР
0,975
0,990
1,005
1,018
1,031
1,045
1,059
1,073
1,083
1,103
1,119
1,133
1,146
1,163
1,181
1,216
1,246
Р
1,584
1,760
1,957
2,180
2,434
2,727
3,066
3,460
3,919
4,457
5,085
5,816
6,662
—
—
—
—
Продолжение табл. IX
т, °к
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4413
1,4163
1,3913
1,3661
1,3407
1,3148
1,2884
1,2614
1,2337
1,2054
1,1764
1,1467
1,1164
1,0854
1,0540
0,9901
0,9251
V
0,6938
0,7061
0,7188
0,7320
0,7459
0,7606
0,7762
0,7928
0,8106
0,8296
0,8501
0,8721
0,8958
0,9213
0,9487
1,010
1,081
При р =
i
—102,1
—97,2
—92,2
—87,2
—82,1
—77,0
—71,8
—66,5
—61,2
—55,8
—50,4
—44,9
—39,3
—33,7
—28,1
—66,1
—4,9
= 250 бар
s
1,351
1,404
1,454
1,503
1,551
1,595
1,640
1,683
1,725
1,766
1,805
1,843
1,881
1,917
1,954
2,023
2,090
СР
0,972
0,986
0,999
1,011
1,022
1,034
1,046
1,058
1,070
1,083
1,095
1,107
1,117
1,129
1,142
1,167
1,188
0
1,530
1,694
1,876
2,081
2,312
2,576
2,878
3,226
3,626
4,088
4,620
5,230
5,925
—
—
—
—
9 Зак
. 1978
129
Продолжение табл. IX
Т, °К
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4222
1,3977
1,3731
1,3483
1,3231
1,2974
1,2713
1,2446
1,2173
1,1895
1,1611
1,1322
1,1027
1,0730
1,0132
0,9524
V
0,7031
0,7155
0,7283
0,7417
0,7558
0,7708
0,7866
. 0,8035
0,8215
0,8407
0,8613
0,8833
0,9069
0,9320
0,9870
1,050
При р =
i
—96,0
—91,1
—86,1
—81,1
—76,0
—70,8
—65,6
—60,4
—55,1
—49,7
—44,3
—38,9
—33,4
—28,0
—16,8
-5,5
= 275 бар
s
1,398
1,448
1,496
1,544
1,588
1,633
1,675
1,716
1,757
1,795
1,832
1,869
1,905
1,940
2,008
2,072
ср
0,982
0,994
1,004
1,014
1,024
1,034
1,044
1,055
1,065
1,075
1,084
1,094
1,103
1,112
1,130
1,144
Э
1,633
1,802
1,991
2,203
2,442
2,714
3,023
3,376
3,778
4,235
4,754
5,337
—
—
—
—
Продолжение табл. IX
Т, °К
95
100
105
110
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4279
1,4039
1,3798
1,3555
1,3310
1,3060
1,2806
.1,2548
1,2284
1,2016
1,1743
1,1467
1,1183
1,0900
1,0335
0,9766
V
0,7003
0,7123
0,7247
0,7377
0,7513
0,7657
0,7808
0,7970
0,8140
0,8322
0,8515
0,8721
0,8942
0,9174
0,9676
1,024
При р =
'
—94,8
—89,9
—85,0
—79,9
—74,9
—69,8
—64,7
—59,5
—54,2
—49,0
—43,7
—38,4
—33,0
—27,7
—16,7
—5,8
= 300 бар
s
1,392
1,442
1,490
1,537
1,581
1,625
1,667
1,708
1,748
1,785
1,822
1,858
1,893
1,928
1,994 |
2,056
1 Ср
0,979
0,989
! 0,998
1,007
1,015
1,024
1,032
1,041
1,049
- 1,058
1,065
1,073
1,080
1,080
1,099 j
1,109
0
1,577
1,735
1,909
2,104
2,323
2,569
2,846
3,160
3,514
3,913
4,360
4,859
—
—
—
—
Продолжение табл. IX
Т, °К
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4335
1,4099
1,3863
1,3625
1,3385
1,3142
1,2895
1,2644
1,2389
1,2130
1,1867
1,1601
1,1328
1,1056
1,0517
0,9970
V
0,6976
0,7093
0,7213
0,7339
0,7471
0,7609
0,7755
0,7909
0,8072
0,8244
0,8427
0,8620
0,8828
0,9045
0,9508
1,003
При р =
i
—93,6
—88,7
—83,8
—78,8
—73,8
—68,8
—63,7
—58,5
—53,4
—48,2
—43,0
—37,8
—32,5
; —27,2
—16,5
[ —5,8
325 бар
s
1,387
1,436
1,483
1,531
1,574
1,618
1,659
1,700
1,739
1,776
1,812
1,848
1,883
1,916
1,981
2,042
ср
0,976
0,985
0,992
1,000
1,007
1,014
1,022
1,029
1,036
1,043
1,048
1,054
1,060
1,066
1,075
1,082
Э
1,525
1,672
1,834
2,014
2,215
2,439
2,690
2,971
3,286
3,637
4,028
4,460
—
—
| —
—
Продолжение табл. IX
Т, °К
95
100
105
110
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4388
1,4157
1,3925
1,3693
1,3458
1,3220
1,2980
1,2736
1,2488
1,2237
1,1983
1,1726
1,1463
1,1199
1,0685
1,0167
V
0,6950
0,7064
0,7181
0,7303
0,7431
0,7564
0,7704
0,7852
0,8008
0,8172
0,8345
0,8528
0,8724
0,8929
0,9359
0,9836
При р =
/
—92,4
—87,6
—82,6
—77,7
—72,7
—67,7
—62,7
—57,6
—52,5
—47,3
—42,2
—37,1
—31,9
—26,7
—16,2
—5,7
: 350 бар
S
1,381
1,430
1,477
1,524
1,567
1,611
1,652
1,692
1,731
1,767
1,803
1,838
1,873
1,905
1,969
2,029
ср
0,973
0,981
0,987
0,994
1,000
1,006
1,012
1,018
1,023
1,029
1,034
1,039
1,043
1,047
1,055
1,058
Р
1,476
1,614
1,766
1,933
2,117
2,323
2,551
2,805
3,087
3,399
3,745
4,124
—
—
—
—
9*
Продолжение табл. IX
Т, °К
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4441
1,4213
1,3986
1,3758
1,3528
1,3296
1,3061
1,2823
1,2582
1,2338
1,2092
1,1843
1,1590
1,1338
1,0838
1,0342
V
0,6925
0,7036
0,7150
0,7269
0,7392
0,7521
0,7657
0,7799
0,7948
0,8105
0,8270
0,8440
0,8628
0,8820
0,9227
0,9669
При р =
i
—91,2
—86,4
—81,5
—76,5
—71,6
—66,6
—61,6
—56,6
—51,5
—46,5
—41,4
—36,3
—31,3
—26,0
— 15,7
—5,4
= 375 бар
s
1,375
1,424
1,472
1,518
1,561
1,604
1,645
1,684
1,723
1,759
1,794
1,829
1,863
1,895
1,958
2,017
СР
0,970
0,977
0,983
0,988
0,993
0,998
1,003
1,008
1,012
1,017
1,021
1,024
1,028
1,031
1,037
1,038
Э
1,431
1,561
1,702
1,858
2,029
2,217
2,426
2,657
2,911
3,192
3,500
3,835
—
—
—
—
Продолжение табл. IX
т, °к
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4492
1,4268
1,4045
1,3821
1,3595
1,3368
1,3138
1,2906
1,2671
1,2434
1,2195
1,1958
1,1707
1,1464
1,0980
1,0504
V
0,6900
0,7009
0,7120
0,7236
0,7356
0,7481
0,7611
0,7748
0,7892
0,8042
0,8200
0,8366
0,8542
0,8723
0,9107
0,9520
При р =
i
—90,0
—85,2
—80,3
—75,4
—70,5
—65,5
—60,6
—55,6
—50,6
—45,6
—40,5
—35,5
—30,5
—25,3
—15,1
—5,1
= 400 бар
s
1,370
1,419
1,466
1,512
1,555
1,598
1,638
1,677
1,716
1,751
1,786
1,821
1,854
1,886
1,948
2,005
СР
0,968
0,974
0,978
0,983
0,987
0,991
0,995
0,999
1,002
1,006
1,009
1,012
1,015
1,017
1,021
1,020
3
1,389
1,511
1,644
1,789
1,947
2,122
2,314
2,524
2,756
3,009
3,286
3,585
—
—
—
132
Продолжение табл. IX
Т, °К
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Р
1,4541
1,4321
1,4101
1,3881
1,3660
1,3438
1,3213
1,2986
1,2757
1,2525
1,2292
1,2058
1,1822
1,1585
1,1114
1,0655
V
0,6877
0,6983
0,7092
0,7204
0,7320
0,7442
0,7568
0,7701
0,7839
0,7984
0,8135
0,8294
0,8459
0,8632
0,8998
0,9385
При р =
i
—88,8
—84,0
—79,1
—74,2
—69,3
—64,4
—59,5
—54,5
—49,6
—44,6
—39,6
—34,6
—29,6
—24,5
—14,5
—4,6
= 425 бар
s
1,365
1,413
1,460
1,506
1,549
1,591
1,631
1,670
1,709
1,744
1,778
1,812
1,846
1,878
1,938
1,995
СР
0,966
0,971
0,974
0,978
0,981
0,984
0,988
0,990
0,993
0,996
0,999
1,001
1,003
1,004
1,007
1,007
Р
1,349
1,464
1,589
1,725
1,873
2,035
2,212
2,405
2,617
2,847
3,097
3,367
—
—
—
—
Продолжение табл. IX
Т, °К
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4590
1,4373
1,4157
1,3940
1,3723
1,3505
1,3285
1,3062
1,2838
1,2613
1,2385
1,2157
1,1927
1,1697
1,1238
1,0793
V
0,6854
0,6958
0,7064
0,7173
0,7287
0,7405
0,7528
0,7656
0,7789
0,7929
0,8074
0,8226
0,8384
0,8549
0,8898
0,9265
При р =
L
—87,6
—82,7
—77,9
—73,0
—68,2
—63,3
—58,4
—53,5
—48,6
—43,6
—38,7
—33,8
—28,8
—23,7
—13,8
—4,0
= 450 бар
s
1,359
1,408
1,455
1,501
1,543
1,585
1,625
1,664
1,702
1,736
1,771
1,804
1,838
1,869
1,929
1,985
ср
0,964
0,968
0,971
0,973
0,976
0,978
0,981
0,983
0,985
0,987
0,989
0,990
0,992
0,992
0,993
0,992
Р
1,312
1,421
1,538
1,666
1,804
1,955
2,119
2,297
2,492
2,702
2,929
3,174
—
—
—
—
133
Продолжение табл. IX
Т, °К
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4423
1,4210
1,3998
1,3784
1,3570
1,3354
1,3136
1,2917
1,2696
1,2474
1,2251
1,2027
1,1803
1,1357
1,0923
V
0,6933
0,7037
0,7144
0,7255
0,7369
0,7489
0,7613
0,7742
0,7876
0,8017
0,8163
0,8315
0,8473
0,8805
0,9155
При р =
i
—81,5
—76,7
—71,9
—67,0
—62,2
—57,3
—52,4
—47,5
—42,6
—37,7
—32,8
—27,9
—22,9
—13,1
—3,4
= 475 бар
s
1,403
1,449
1,495
1,537
1,579
1,619
1,657
1,695
1,729
1,763
1,797
1,830
1,861
1,921
1,976
СР
0,965
0,967
0,969
0,971
0,973
0,974
0,976
0,978
0,979
0,980
0,981
0,982
0,982
0,981
0,980
0
1,380
1,491
1,611
1,741
1,881
2,034
2,199
2,378
2,572
2,780
3,002
—
—
—
Продолжение табл. IX
Т, °К
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
р
1,4472
1,4263
1,4053
1,3843
1,3632
1,3420
1,3207
1,2992
1,2776
1,2559
1,2341
1,2122
1,1903
1,1468
1,1048
V
0,6910
0,7011
0,7116
0,7224
0,7335
0,7451
0,7572
0,7697
0,7827
0,7963
0,8103
0,8249
0,8401
0,8720
0,9051
При р =
i
—80,3
—75,5
—70,7
—65,8
—61,0
—56,2
—51,3
—46,5
—41,6
—36,7
—31,9
—27,0
—22,1
—12,3
—2,7
500 бар
s
1,398
1,444
1,490
1,532
1,573
1,613
1,651
1,688
1,723
1,756
1,790
1,822
1,853
| 1,912
1,967
ср
0,963
0,964
0,965
0,966
0,967
0,969
0,969
0,970
0,971
0,972
0,973
0,973
0,973
I 0,971
0,969
Р
1,341
1,447
1,560
1,682
1,813
1,956
2,109
2,275
2,454
2,645
2,849
, —
—
—
Глава V
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА
ЖИДКОГО ВОЗДУХА
d кспериментальные данные о термодинамических свойствах
жидкого воздуха весьма немногочисленны; плотность его определена
лишь Михельсом и соавторами [125] при исследовании термических
свойств в области низких температур. В работе [125] для жидкости
получены 8 экспериментальных точек на изотермах 118,15—132,15° К при
плотностях, не превышающих 2,4 критической. Приведены также данные
о плотности жидкого воздуха на кривой насыщения при температурах
выше 118° К; ненадежность этих данных отмечена ранее [70]. В связи
с этим наиболее ответственным этапом настоящего исследования явилась
разработка сетки опорных ру vy Т-данных, необходимых для составления
уравнения состояния и расчета термодинамических свойств жидкого
воздуха.
V. 1. Способ определения термических
свойств малоисследованной жидкости
Сетку опорных термических величин для жидкого воздуха
невозможно получить на основании соответствующих данных для жидких
азота, кислорода и аргона, поскольку опытные данные об изменении объема
при смешении этих жидкостей имеются только в узком интервале
температур при давлениях, близких к атмосферному. К тому же
экспериментальные данные о плотности жидких кислорода и аргона при давлениях свыше
200 и 300 бар практически отсутствуют. Поэтому было признано
целесообразным применить закон соответственных состояний и
экспериментальные данные о термических свойствах азота [41], использованные в
предыдущих главах при экстраполяции опытных данных о плотности
компонентов воздуха.
Справедливость закона соответственных состояний для воздуха и
азота проверена сопоставлением безразмерных комплексов о = pv/RTKp
в газообразном состоянии при одинаковых значениях приведенных
температуры т — Т/Ткр и плотности со = р/ркр- Комплексы о рассчитывались
по уравнениям состояния, представленным в форме о = f (со, т) в
монографии [70]; координаты шит для воздуха были образованы с помощью
параметров критической точки контакта: Гкр = 132,55° К, vKp =
- 3,1963 дмУкг.
В табл. 26 представлены значения а для азота и воздуха при
одинаковых т и со в интервале т = 1,2071—2,6405 GВ = 160—350° К) и
со = 0,2—2,2, в котором для обоих веществ имеются достоверные
экспериментальные данные. Из таблицы видно, что при докритических плотностях
отклонения от закона соответственных состояний незначительны, однако по
мере увеличения плотности отклонения систематически возрастают,
достигая 3—5% при со Э5 2. Дополнительная проверка по восьми опытным
135
Таблица 26
Сопоставление комплексов а = -=— в соответственных
Ai кр
состояниях азота и воздуха (опорная точка — критическая)
0)
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1,8
2,0
2,2
При т = 1,2071; Гв = 160° К
aN2
1,0462
0,9121
0,8042
0,7251
0,6764
0,6591
0,6772
0,7444
0,8884
1,1487
1,5695
<?в
1,0474
0,9156
0,8113
0,7338
0,6832
0,6620
0,6769
0,7409
0,8755
1,1120
1,4934
бег, %
—0,11
—0,38
—0,88
—1,19
—1,00
—0,44
0,04
0,47
1,47
3,30
5,10
При т = 1,3580; Тв = 180° К
aN2
1,2218
1,1ПЗ
1,0265
0,9705
0,9471
0,9603
1,0179
1,1361
1,3435
1,6782
2,1810
Ов
1,2221
1,1130
1,0305
0,9750
0,9488
0,9569
1,0087
1,1194
1,3115
1,6160
2,0733
6а, %
—0,02
—0,15
—0,39
—0,46
—0,18
0,36
0,91
1,49
2,44
3,85
5,19
При X = 1,5089; Тв = 200° К
aN2
1,3947
1,3062
1,2438
1,2107
1,2150
1,2601
1,3569
1,5237
1,7894
2,1913
2,7684
ав
1,3945
1,3066
1,2456
1,2131
1,2128
1,2516
1,3405
1,4963
1,7425
2,1101
2,6385
6<J, %
0,01
—0,03
—0,14
—0,20
0,18
0,68
1,22
1,83
2,69
3,85
4,92
Продолжение табл. 26
СО
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1,8
2,0
2,2
При t = 1,8861; Гв = 250° К
<*N2
1,8209
1,7832
1,7752
1,8027
1,8739
1,9985
2,1900
2,4690
2,8656
3,4163
4,1581
^в
1,8200
1,7815
1,7731
1,7987
1,8646
1,9806
2,1603
2,4228
2,7932
3,3029
3,9899
бет, о/0
0,05
0,10
0,12
0,22
0,50
0,90
1,37
1,91
2,59
3,43
4,22
При Т=2,2633; ГВ = 300°К
a,V2
2,2428
2,2530
2,2975
2,3839
2,5222
2,7244
3,0057
3,3883
3,9029
4,5864
5,4765
ав
2,2416
2,2502
2,2928
2,3753
2,5060
2,6966
2,9629
3,3254
3,8096
4,4465
5,2714
ба, %
0,05
0,12
0,20
0,36
0,65
1,03
1,44
1,89
2,45
3,15
3,89
При Т = 2,6405; TQ = 350° К
GN2
2,6626
2,7192
2,8150
2,9591
3,1634
3,4410
3,8085
4,2890
4,9137
5,7207
6,7495
°в
2,6612
2,7160
2,8087
2,9464
3,1394
3,4017
3,7510
4,2088
4,8004
5,5548
6,5033
ба, %
0,05
0,12
0,22
0,43
0,76
1,16
1,53
1,91
2,36
2,99
3,79
точкам [125] показала, что для жидкого воздуха отклонения лежат в
пределах —6ч-+ 15%. Это свидетельствует о невозможности использования
закона соответственных состояний в обычной формулировке для
разработки интересующих нас опорных р, v, Г-данных.
При исследовании термодинамического подобия газовых смесей и их
компонентов в принципе нельзя выбирать критическую точку в качестве
опорной, так как критические состояния смеси и чистого вещества не
являются соответственными. Поэтому Я. 3. Казавчинский [141, 142]
предложил использовать в качестве опорных другие точки, имеющиеся
у чистых веществ и смесей постоянного состава и пригодные для
образования безразмерных координат. Эти точки можно определить из условий
равенства для различных газов двух безразмерных комплексов разного
наименования.
В качестве одного из таких комплексов желательно выбрать
коэффициент сжимаемости Z = pv/RT, который характеризует отклонение тер-
136
мических свойств реального газа от свойств идеального; вторым
комплексом может служить любая надежно определяемая величина. В частности,
целесообразно использовать точки на кривой Бойля с одинаковым
значением Z, которые удовлетворяют следующим условиям:
Z=idem; р.(^)г = 0. (88)
Эффективность выбора опорной точки на кривой Бойля при исследовании
термодинамического подобия газовых смесей показана в работе В. И.
Недоступа [143].
Нами были определены для воздуха и азота кривые Бойля в
координатах Z—р и Z—Т на основании экспериментальных р, v, Г-данных.
В качестве опорных приняты точки со значением Z0 = 0,3, расположенные
достаточно близко к области жидкости и характеризуемые параметрами:
для воздуха р0 = 0,4522 кг/дм*, Т0 = 137,55° К и для азота р0 =
- 0,4214 кг1дм\ Т0 - 131,62° К.
При использовании закона соответственных состояний в обычной
трактовке сопоставлялись комплексы а, которые совпадают в идеально-
газовом состоянии у разных газов при одинаковой приведенной
температуре. В случае выбора новой опорной точки подобия следует сравнивать
коэффициенты сжимаемости Z в соответственных состояниях, что при
Z0 = idem эквивалентно сопоставлению приведенных давлений. Для
воздуха значения Z были рассчитаны с использованием о (см. табл. 26).
Для азота после определения координат новых опорных точек уравнение
состояния преобразовано к виду Z = ср (со, т), где со = р/р0 ит = Г/Го*,
и рассчитаны величины Z для значений со и т, соответствующих
температурам и плотностям воздуха, указанным в табл. 26.
В табл. 27 сопоставлены значения Z для азота и воздуха при
одинаковых т и со. Сравнение данных табл. 26 и 27 показывает, что использование
новой опорной точки подобия в области докритических плотностей лишь
незначительно уменьшает максимальные отклонения от закона
соответственных состояний, но в 2—3 раза снижает отклонения при со = 1,8—2,2.
При наибольшей плотности отклонения на отдельных изотермах
составляют 1,5—2% вместо 3—5%, как показано в табл. 26. Хотя проверка была
выполнена только в области газа, но, поскольку при высоких плотностях
не обнаруживается тенденции к возрастанию отклонений на изохорах
по мере понижения температуры, можно полагать, что и для жидкости
расхождения между значениями Z азота и воздуха в соответственных
состояниях останутся примерно такими же, как указанные в табл. 27.
Результаты сопоставления подтверждают целесообразность выбора
опорной точки подобия на кривой Бойля для воздуха и азота. Однако
термодинамическое подобие этих веществ в координатах Z, со, т все же
является приближенным. Поэтому нельзя рассчитать с приемлемой
точностью р, v, 7*-данные для жидкого воздуха по составленному в главе II
уравнению состояния для жидкого азота, преобразовав его к приведенным
координатам. Для решения задачи потребовалось разработать более
сложную методику, основанную на использовании новой опорной точки.
Одним из возможных способов получения данных о термических
свойствах малоисследованной жидкости является построение закрити-
ческих изохор с использованием р, v, 7-данных жидкости в состоянии
насыщения и газа при соответствующих плотностях. Однако свойства
большинства газов при высоких плотностях не исследованы
экспериментально. К тому же, несмотря на малую кривизну изохор жидкости, их
построение при отсутствии данных в широком интервале температур
не может быть выполнено вполне надежно.
* Коэффициенты преобразованного уравнения состояния для азота приведены ниже.
137
Таблица 27
,_ „ „ pv
Сопоставление значении Z = -?tft в соответственных
состояниях азота и воздуха (опорная точка — на кривой
Бойля при Z0 = 0,3)
to
0,1384
0,2767
0,4151
0,5535
0,6919
0,8302
0,9686
1,1070
1,2454
1,3837
1,5221
При % = 1,1632; Гв = 160° К
ZN2
0,8697
0,7608
0,6729
0,6073
0,5678
0,5527
0,5661
0,6180
0,7292
0,9305
1,2569
ZB
0,8677
0,7585
0,6721
0,6079
0,5660
0,5484
0,5607
0,6138
0,7253
0,9213
1,2372
bz, %
0,23
0,30
0,12
—0,10
0,32
0,78
0,96
0,68
0,54
1,00
1,59
При т = 1,3086; ГВ = 180°К
ZN2
0,9020
0,8223
0,7610
0,7195
0,7027
0,7111
0,7512
0,8334
0,9773
1,2092
1,5580
ZB
0,8999
0,8196
0,7588
0,7180
0,6987
0,7047
0,7428
0,8243
0,9657
1,1900
1,5268
bZ, %
0,23
0,33
0,29
0,21
0,57
0,91
1,13
1,10
1,20
1,61
2,04
При Т= 1,4540; Т в = 200° К
ZN2
0,9261
0,8688
0,8283
0,8065
0,8088
0,8370
0,8983
1,0035
1,1704
1,4224
1,7844
ZB
0,9242
0,8659
0,8255
0,8040
0,8038
0,8295
0,8885
0,9917
1,1548
1,3985
1,7487
bZ, %
0,21
0,33
0,34
0,31
0,62
0,90
1,10
1,19
1,35
1,71
2,04
Продолжение табл. 27
to
0,1384
0,2767
0,4151
0,5535
0,6919
0,8302
0,9686
1,1070
1,2454
1,3837
1,5221
При т = 1,8175; Гн = 250° К
ZN2
0,9665
0,9471
0,9431
0,9567
0,9937
1,0574
1,1552
1,2970
1,4978
1,7759
2,1504
ZB
0,9650
0,9446
0,9401
0,9537
0,9886
1,0501
1,1454
1,2846
1,4809
1,7512
2,1155
•
bZ, %
0,16
0,26
0,32
0,31
0,52
0,70
0,86
0,97
1,14
1,41
1,65
При х = 2,1810; Тв = 300° К
ZN2
0,9915
0,9963
1,0157
1,0526
1,1125
1,1990
1,3193
1,4820
1,7000
1,9888
2,3646
Zr
0,9904
0,9942
1,0131
1,0495
1,1072
1,1915
1 1,3091
1,4693
1,6832
1,9646
2,3291
bZ, %
0,11
0,21
0,26
0,30
0,48
0,63
0,78
0,86
1,00
1,23
1,52
При т = 2,5445; 7В = 350° К
ZN2
1,0087
1,0300
1,0658
1,1189
1,1947
1,2968
1,4317
1,6073
1,8349
2,1280
2,5010
Zb I
1,0078
1,0286
1,0637
1,1158
1,1890
1,2883
1,4206
1,5939
1,8180
2,1037
2,4629
bZ, %
0,09
0,14
0,20
0,28
0,48
0,66
0,78
0,84
0,93
1,16
1,55
Для преодоления затруднений целесообразно использовать данные
о хорошо исследованном базисном веществе и закон соответственных
состояний (после выбора опорной точки подобия на кривой Бойля можно
эффективно применить этот закон при сверхкритических плотностях).
На основании данных о базисном веществе можно надежно
экстраполировать изотермы исследуемого газа в область высоких плотностей, если учесть
сравнительно небольшие и, как правило, регулярные отклонения от
термодинамического подобия. В дальнейшем, основываясь на данных,
полученных вследствие экстраполяции изотерм, строят изохоры исследуемого
вещества; при этом необходимо также использовать данные о базисном
веществе с целью получения достоверной конфигурации изохор.
Предлагаемая методика была проверена на примере азота и аргона.
В качестве базисного вещества выбран азот, для которого имеются
опытные данные до значений плотности, равных примерно трем критическим,
138
описанные уравнениями состояния [70] и G2). Экспериментальные данные
о газообразном аргоне охватывают плотности до 2,1 критической и также
отображены уравнением состояния [70]. Для жидкого аргона опытные
данные ограничены давлением 300 бар, однако они были экстраполированы
до давления 500 бар (см. гл. IV). Проверка методики на примере указанных
веществ позволяет также дополнительно оценить надежность опорных
данных для жидкого аргона в области, не охваченной экспериментом.
Для экстраполяции по плотности изотерм газообразного аргона
необходимо располагать данными о термических свойствах азота и аргона
при одинаковых приведенных температурах и плотностях. Поэтому
уравнения состояния для азота и аргона [70] были преобразованы в
используемые нами координаты Z, со, т с помощью параметров опорных точек
подобия, выбранных на кривой Бойля при Z0 = 0,3. Параметры опорной
точки для азота указаны выше, а для аргона они были определены на
основании опытных данных и составляют: Т0 = 157,55° К, р0 = 0,7149 кг/дм3.
Преобразованные уравнения состояния записываются в форме
Z = а0 + -^ + р-ф 4- 7ф,
т
где объемные функции имеют вид:
7 _ 9 _ / 7 _
а0 = 1 + J] апы)п] ах = ^j Ьпып для аргона $] Ьпып
П=\ /1=1 \ /1=1
п=1 л=1
(89)
(90)
Коэффициенты объемных функций для обоих газов приведены в табл. 28.
Т а б п п ц а 28
Коэффициенты объемных функций уравнения состояния (89)
для азота и аргона
1
2
3
4
5
6
7
8
9
1
2
3
4
5
6
7
0,45192
1,05495
-2,52035
2,96513
-2,03887
0,67665
-0,06303
0,66548
—0,21031
3,44536
—9,03870
10,40805
—5,42459
1,05700
Для азота
0,55393
-6,73224
21,88907
-23,02526
19,32145
-12,93116
6,77075
-2,30860
0,32361
Для арго
-1,60827
2,35651
-18,67227
51,26459
-58,77124
30,56294
-5,93397
—2,59025
0
6,11843
40,46730
—67,23575
36,83974
—6,97412
—
—
н а
—0,20455
—3,70382
32,36348
—90,83549
104,75075
—54,27920
10,50116
о
6,89599
-26,94950
-19,49229
53,07037
-31,94459-
6,46732
-0,24977
2,19319
-17,14721
49,58534
-58,28372
30,38953
-5,87818
139
Рис. 18. Зависимость
отношения приведенных давлений
азота и аргона в
соответственных состояниях от
приведенного давления азота.
Температурные функции для азота представлены в виде полиномов
от 1/т:
яр - 3,015590т-2—5,218746т-М 5,161472т-4 — 2,480260т-5 + I
+ 0,461955т-6
_ _ _ (91)
Ф -3,402947т-2 —6,312844т-3 + 6,671846т-4 —3,587400т-5+
+ 0,771947т-6 ]
Для аргона функции яр и ф имеют вид
ф = 1/т2, ф = 1/т3. (92)
По преобразованным уравнениям состояния были рассчитаны для
аргона и азота приведенные давления л = — на десяти изотермах в ин-
Ро
тервале приведенных параметров: т = 1,0—2,5 и со = 0,1 —1,6, в котором
имеются опытные данные для обоих газов. При сопоставлении расчетных
величин наблюдаются отклонения от термодинамического подобия:
приведенные давления для азота и аргона в соответственных состояниях
отличаются до 7,3%. Из рис. 18 видно, что на шести изотермах в интервале
т = 1,0—1,5 отношения :rtN2/jtAr при одинаковых nNs оказываются
практически одинаковыми, но при дальнейшем увеличении температуры они
систематически уменьшаются. Для построения изохор жидкости достаточно
располагать данными на нескольких околокритических изотермах при
высоких плотностях, поэтому нами не учитывалось влияние температуры
на отношение nNJnAr и построена обобщенная кривая по данным в
интервале т = 1,0—1,5. Кривая экстраполирована графически до п^2 = 30
с учетом формы кривых отношений п^2/пАг при более высоких
температурах, где имеются данные во всем интервале давлений. Обобщенная
кривая описана уравнением
4^- = 1 + 1,09Ы0~2як2 —6,229-10nN2 +
+ 1,709-10~5n3N2— 1,804-10kn2. (93)
Затем были рассчитаны значения я для азота на шести изотермах
в интервале ~% = 1,0—1,5 и со = 1,7—2,0 и определены по уравнению (93)
приведенные давления газообразного аргона в указанном интервале
плотностей.
Получив в результате экстраполяции изотерм данные о сжимаемости
газа до со = 2, приступили к построению изохор жидкости. С этой целью
при выбранных значениях плотности были определены термические
свойства жидкого аргона на кривой насыщения по сглаженным опытным
данным, приведенным в [70], а при со = 2 — на кривой затвердевания по
опорным данным, полученным в главе IV. Также был определен
коэффициент сжимаемости жидкого азота на изохорах при со = 1,7—2,0 и при
тех значениях приведенных температур, при которых представлены
опорные данные для жидкого аргона. Величины Z азота определяли
графической интерполяцией опорных данных, полученных в главе II.
Использование в этих целях уравнения состояния для жидкого азота G2), несмотря
на его хорошую точность по плотности, могло бы привести к заметным
погрешностям определения Z в связи с малой зависимостью сжимаемости
жидкости от плотности.
141
Затем были совместно построены изохоры для азота и аргона (рис. 19).
При этом соблюдалось подобие их конфигурации и обеспечивалось плавное
изменение отношений Z обоих веществ в соответственных состояниях в
зависимости от плотности и температуры. В табл. 29 представлены значения
коэффициента сжимаемости жидкого аргона.
и 0,6 0,8 1,0 1,2 0 Т
Рис. 19. Изохоры аргона (У) и азота B) в ' безразмерных
координатах:
/ — кривая затвердевания аргона; // — кривая насыщения.
На основании полученных значений Z были рассчитаны давления
для жидкого аргона при температурах 90—150° К. Затем построены
изотермы в координатах р, р, определена плотность при круглых значениях
давлений и данные сопоставлены с опорными для жидкого аргона. Из
табл. 30 видно, что более половины полученных значений плотности
согласуется с этими данными в пределах ±0,1% и только в 16 точках из 91
расхождения составляют 0,2—0,3%. Следует подчеркнуть, что в интервале
давлений 350—500 бар, где опорные данные получены экстраполяцией
изотерм, отклонения такие же, как и в диапазоне давлений, охваченном
экспериментом. Это можно рассматривать как дополнительное
свидетельство достоверности величин, полученных экстраполяцией.
Вполне удовлетворительное согласование полученных значений
плотности жидкого аргона с опорными подтверждает надежность
предложенного способа определения термических свойств малоисследованной
жидкости, что позволяет применить этот способ для жидкого воздуха.
142
ч
\о
03
Н
Cj
X
о
U
O.Q.
об
о
U
§
ВС
S
М
S
н
о
о
S
CU
ей
ЖИМ
CJ
ей
н
я
<L>
К
=г
s
•в-
•&
коэ
о
X
о
m
S
0?
X
<У
о
о.
и
а
о
с
тате
л
п
>>
со
cu
О.
СО
ные
'чен
5
X
СП
«
0
а>
>>
f-
СЧ
а
0)
2
а>
н
К
а
с
N
1
г2
140
со
о
?ч
О
о
о
о
з*
^
ГО
3
00
00
см
о
1
1
1
1
1
1
*Ф
ОЗ
см
0,9
со
ю
СП
СО
о
00
ОС)
о
1
1
1
1
1
аз
о
о
о
Tf«
со
N
Ю
о
СО
^
СО
о
СО
00
о
о
1
1
1
1
ч*
см
N
о
ю
CD
о1:
00
о
N
СП
ю
о
СО
СО
о
1
1
1
1
00
со
ч*
со
N
аз
ч^
ю
Оз
о
CD
СО
СО
о
00
со
о
1
1
1
со
ю
см
N
о
N
СО
СМ
CN
¦ф
СО
CN
—'
а)
а)
N
о
ю
ю
0,3
1
1
оо
СО
оо
см
00
СО
ОС)
см
см
<ф
^
о
см
см
Ю
N
—•
00
Tf
»—<
ю
CD
0,9
0,483
I
со
а;
ю
со
аз
00
<ф
СО
см
00
аз
СО
см
Ю
о
см
ю
N
n
»—1
00
со
0,886
0,235
.,
Tf
ОЗ
СО
LO
аз
со
00
о
со
со
со
00
см
СО
"ф
Ю
см
оо
см
см
см
см
оо
1,315
0,697
00
аз
см
*ф
2,0
СИ
X
О
о ,
si
с х
»Х еС
X S
з °
5
О
Б
О
о
ю
о
§
120
о
100
COCO LOCO —i CO СО *Ф СП СО СОЮ СО'* CMO ЮСО LOCO ф CN
| | | | | | | | (?>CD QQ CNC^l ЮЮ N00 ^|-н тф^ ht> 0H) -н-н COCO
| | I I | | I | qoi ао) оо оо^ оо ^-н ^^ ^^ гн^ (Mq cscn
о"о" coco ^^ ^r-S _Т^-Т ,-Г,-Т ^_Г _Г^ _н'^ч" ^-Г_' ^^
N00 азо азо -^ю -*гю смем ю •**> со *ф юсо смоо соо со—' ^ аз n со
COCO O —< СО -ф COCO 0000 ОО СМСМ ^frf О-О- О О) (МСМ *Ф ^ cOiO NN
а> аз оо оо оо оо —« —> —« —¦ —< —< —• —• см ^ см см см см см см см см
о" о" —<~ ,-г^-г ^г^-г _г^-г _г^-г *-Г_г _7^; _г^ ,-г^; _г_г ^г^: _;_г _г_г
СМ -н СО СМ —' О N Ю -н О "Ф СМ СМ О ОЗ СО СО О Ю СМ -ф —< —• ОЗ COLO — О
аз аз 1—< —< со со *ф rf coco nn аз аз оо coco lolo nn аз оо оо см см
ОО —• —i *-н *-ч —i — ^н —• —i —< —• -^ CN СМ (МСМ СМСМ СМ (М СМСМ СО СО COCO
n со см о coco оо со аз n о оо —< ос ю см аз ю азю n^ rf о colo см о ю -ф
COCO 00 00 ОЗ ОЗ ОО »-* —¦> СО СМ <ф СО ЮЮ COCO ОО ОО OO CM CM COCO Ю LO COCO
^ _^ _н ^ _ч _н СМСМ СМСМ СМСМ СМСМ СМСМ СМСМ СМСМ COCO COCO COCO COCO COCO
NN 00N NN NCO LO Ю Tf CO CM'—1 ЮС0 CO ^ COO OOCD CMO "Ф rf NCO 0000
Tf Tf ЮЮ COCO NN 0000 CDOi CO О —н^-t СМСМ тГ 'Ф LOiO NN 0000 ОзОЗ ОО
СМСМ СМСМ СМСМ СМСМ СМСМ СМСМ COCO COCO COCO COCO COCO COCO COCO COCO -Ф^ф
NCO Ю-Ф COCM 003 00CO rf CO —« О OCJ3 O300 COCM COCO ОЗОЗ О CN
—' —• СМСМ COCO -ФСО <ф Tf ЮЮ COCO NCO Г- N ОЗОЗ ОО —^ —< COCO i
COCO COCO COCO COCO COCO COCO COCO COCO COCO COCO 'ф ф "Ф rf rh -ф
I I
см о аз n lo 'Ф
оо оо оо оо аз аз
СО СО СО СО СО СО
о о
оо
ф1 -ф
СО СО -н ^
оо —.—I
"ф -ф "ф "ф
СО N LO LO СМ СО
—1 —н СМ СМ СО СО I.
Tf "Ф ^Ф "Ф ^Ф 'ф I J
I I I
1111
о
о
о
о
см
о
ю
см
о
о
со
о
ю
со
о
о
<ф
о
LO
-ф
о
о
LO
о. В
V. 2. Разработка сетки опорных ру v, Г-данных
для жидкого воздуха
В соответствии с изложенной методикой в целях получения
опорных р, v, Г-данных для жидкого воздуха требовалось экстраполировать
изотермы газа в область высоких плотностей и затем провести изохоры
вплоть до кривой насыщения.
Для решения первой части задачи были рассчитаны по уравнению
состояния воздуха [70] значения приведенного давления на восьми
изотермах в интервале температур Тв = 150—300° К (т = 1,0905—2,1810)
и приведенных плотностей сов = 0,2—2,2 (со = 0,1384—1,5221). Затем
были определены значения п азота при тех же значениях т и со по
уравнению состояния, преобразованному в форму Z = ср (со, т) — см. V.I.
На рис. 20 представлены отношения п^2/пв в соответственных
состояниях как функция приведенного давления азота. Эти отношения меньше
отличаются от единицы, чем аналогичные отношения для азота и аргона
(см. рис. 18), и в рассматриваемой области изменения параметров не
превышают 1,021. В интервале т= 1,0905—1,4540 (Тв = 150—200° К) эти
отношения не обнаруживают существенной зависимости от температуры
(она наблюдается только при более высоких температурах).
По данным в указанном интервале температур проведена обобщающая
кривая, с которой на шести изотермах значения nNJnB согласуются в
пределах 0,2—0,5%. Кривая экстраполирована графически до л^2 = 30,
при этом учитывался характер зависимости nNJnB = / (kn2) на
изотермах Тв = 250 и 300° К, охватывающих большую часть рассматриваемого
интервала давлений. Построенная кривая описана уравнением
i = 1 + 2,45- 10SN2 — 6,75- 10^n2 -I- 7,5- 10~7Sn9- (94)
яв
В дальнейшем были рассчитаны приведенные давления азота на шести
изотермах в интервале т = 1,0905—1,4540 и со = 1,5913—1,9372 (сов =
= 2,3—2,8) и затем по уравнению (94) найдены соответствующие значения
приведенного давления воздуха. В табл. 31 представлены значения
приведенного давления азота и воздуха для исследуемой области высоких
плотностей, где экспериментальные данные о воздухе отсутствуют.
После экстраполяции изотерм воздуха следовало перейти к
построению изохор. Однако плотность жидкого воздуха в состоянии насыщения р'
плохо исследована экспериментально, в связи с чем потребовалось
предварительно уточнить ее значения.
Т а б л и ц а 31
Приведенные давления азота и воздуха в соответственных
состояниях для области высоких плотностей
WB
2,3
2,4
2,5
2,6
2,7
2,8
со
1,5913
1,6605
1,7297
1,7988
1,8680
1,9372
При Тв
х —
nN2
7,449
9,349
11,70
14,59
18,12
22,46
= 150° К;
1,0905
^в
7,340
9,186
11,46
14,25
17,64
21,82
При Тв
х =
^N2
9,117
11,22
13,78
16,89
20,67
25,28
= 160° к;
1,1632
*в
8,962
11,00
13,47
16,47
20,10
24,50
пРи_гв
х =
KN2
10,76
13,05
15,81
19,14
23,14
28,02
= 170° К;
1,2359
^в
10,55
12,77
15,43
18,63
22,47
27,15
144
Продолжение табл. 81
сов
2,3
2,4
2,5
2,6
2,7
2,8
со
1,5913
1,6605
1,7297
1,7988
1,8680
1,9372
При Гв = 180° К;
X = 1,3086
^N2
12,39
14,86
17,82
21,35
25,58
30,71
в
12,13
14,51
17,36
20,75
24,81
29,72
пРи_гв
х =
%2
13,98
16,62
19,77
23,50
27,95
33,31
= 190° К;
1,3813
^в
13,66
16,21
19,23
22,82
27,08
—
При Тв
х —
^Na •
15,53
18,35
21,68
25,61
30,26
35,86
= 200° К;
1,4540
*в
15,16
17,87
21,07
24,84
29,29
—
В работе [70] получены расчетные значения ортобарической
плотности воздуха. При температурах ниже 90° К р' определена по
соответствующим величинам для компонентов воздуха с учетом экспериментальных
данных об изменении объема при смешении; выше 100° К для расчета
использована обобщенная зависимость р7ркр = / (TJTKp), полученная
в [70] обработкой опытных данных об азоте и кислороде (в качестве
величин рКр и Ткг> для воздуха приняты параметры критической точки
контакта).
Выше показано, что закон соответственных состояний соблюдается
точнее в области высоких плотностей при использовании опорной точки
подобия на кривой Бойля, выбранной при Z0 = 0,3. Поскольку эта точка
близка к пограничной кривой жидкости, интересно проверить, совпадают
ли для азота и кислорода зависимости плотности кипящей жидкости от
температуры в приведенных координатах при образовании последних
с помощью параметров новой опорной точки. С этой целью была определена
кривая Бойля кислорода и найдена на ней точка со значением Z0 = 0,3,
параметры которой составляют: Т0 = 161,00° К, р0 = 0,5808 кг/дм3.
Затем по сглаженным опытным значениям плотности жидких азота и
кислорода в состоянии насыщения [70] определены величины со' для обоих
веществ при одинаковых ts (табл. 32).
Из табл. 32 видно, что в интервале т = 0,48—0,88 значения со' азота
и кислорода при равных ts согласуются в пределах +0,10-= 0,22%,
и лишь по мере приближения к критической температуре наблюдаются
более существенные расхождения. Справедливость обобщенной
зависимости со' — / (ts) для азота и кислорода позволяет полагать, что она
соблюдается также и для воздуха. Поэтому нами рассчитана плотность жидкого
воздуха в состоянии насыщения на основании параметров его опорной
точки Z0 = 0,3 по зависимости со' = / (xs) для азота.
Полученные значения р' воздуха несколько отличаются от
данных [70], однако при температурах до 128° К расхождения в основном
не превышают ±0,5%. В околокритическом районе новые данные были
з
сглажены графически в координатах р', ]/l — ts для согласования с
критической плотностью воздуха ркр = 0,3129 кг/дм3; в итоге расхождения
с величинами [70] при Т = 130—132° К превысили 1%, однако
улучшилось согласование с экспериментальными данными [125, 144]. При
температурах ниже 82° К нами приняты преимущественно полученные ранее
значения р' воздуха, опирающиеся в этой области, как отмечено выше, на
экспериментальные данные о его компонентах и практически совпадающие
с новыми данными в интервале 76—83° К.
10 Зак. 1978
145
Рис. 20. Зависимость отношения приведенных давлений азота и воздуха в соответственных состояниях от приведенного
давления азота.
Таблица 32
Приведенные плотности азота и кислорода в состоянии
насыщения о' по данным G0)
Xs
0,48
0,50
0,52
0,54
0,56
0,58
0,60
0,62
а
N2
2,059
2,034
2,008
1,982
1,955
1,927
1,899
1,870
>'
о2
2,057
2,033
2,007
1,981
1,954
1,927
1,899
1,870
ts
0,64
0,66
0,68
0,70
0,72
0,74
0,76
0,78
@
N2
1,840
1,809
1,778
1,745
1,710
1,675
1,638
1,599
'
о2
1,840
1,809
1,778
1,745
1,710
1,675
1,639
1,600
xs
0,80
0,82
1 0,84
0,86
0,88
! 0,90
0,92
0,94
а)
N2
1,558
1,514
1,467
1,415
1,358
1,290
1,208
1,099
о2
1,559
1,516
1,469
1,418
1,361
1,295
1,215
1,108
Ha рис. 21 (аналогичном приведенному в монографии [70])
сопоставлены принятые в настоящей работе значения плотности жидкого воздуха
в состоянии насыщения с приведенными в таблицах [70] для воздуха и его
основных компонентов. Новые данные удовлетворительно согласуются
с частью экспериментальных величин, а расхождения с результатами [70]
гораздо меньше разброса опытных [125, 144] и расчетных [140, 145]
данных.
?!
г/см3
0,8
0,7
0,6
0,5
ол
V
/
А
0,3)
0 - 1
Д- 2
° - 3
а - Ч-
М
°гу
X
А
-/-
7
Ьу
м
и^
^Г
1L
Л
0J
0,2
о,з
0А
0,5
0,6
0,7
0,99
_1_
п-т
0,97 095
0,90 0,85 0,80
0,70
060
Рис. 21. Сопоставление принятых значений плотности жидкого воздуха в состоянии
насыщения с опытными и расчетными данными:
/ — принятые в настоящей работе; //— взятые из таблиц [70]; 1
2 — Михельса и соавторов [125]; 3 — Дина [140]; 4
данные Куэнена и Кларка [144];
Баера и Швиера [145].
10*
147
о ~ 2 й- °
щ к к g ^
« s ^ 2- к
<я к ? Pj s
8 ? e^g
n й Г) И Л
сз д g О Я
н СО м нн Д
Я 5 О X ?
н S д s г"
2 к S к л
I s s I °
я о о 5 Г/
* ??l| 5
о ^ н си
н 9^ ^ о
к ^^ *
d) CJ н—г CD
IT s s Я
-&ао д ^
(Т) « 3 ^ ^
- о tR w
g g О ^ С
f s g о S
<L> H S ю S
со н У * и
^ 5 о, о
>^ Я Я
к д я 4
е (D s 2
Я д л С
I 3 ° в§ то
^ се ТО
К (L» ? аз
8 х S н
о
CD Л
О Н
хо
о
Я W
t? CD
*g
о,*-
о
CJ се
о „
ю
<L>
CD
я
се
2 5 ч н й
> 2" о о *
о с с ч ^
о о о о
PQ Я X Я й
S ~ ? R
&° § Я
се я <d Г>
н я с й
° к о 5/
? S w а*
<* Ч ст> С
О СС X к
0 ? s *
§ Й я к
?- Я я <ь>
1 « ? 2
Я се ± Я
? ^5 си
о о о s
о ? >я я
s ° 8 к
CD ^ Я CD
Cv3 CJ Я" КГ
s 2 я Е-?
s 5 ч 5
? се q О
Я Он
*- ?: <d ^
Я се н Zj
CD Ю Я
В Я s e
я с^ ^
5 со sS f- ,
J=L Л ° И
*§" к> ° х
f ce t-r
о о. &
w и и
се
х
со
>,s
^ №
Я
cd я
О cd
Он V
Н я
о
с
О
СО Он rv
S VO о
ь^ ° ^
s се со
«?«
со л
о я
к
CD
о я
X
о
со
а
S
к
CD
ч ^
CD Ю
я «а
s ^^ s
^ g се s
3 а 5 35 се
к
S
о
о
S
а
СО
CD О
О
о
см
о ^
CD
О
_ S а
„ о о =s
II О О CD
^ CD DC
нем я S
CJ S
О А
К Я
О
s w
Он ^
Ю
О
Й QfT K ^ CD
С^ 9-VOQ л
2.-2 s
cd и ч к
с И vo я
н
ев
13|
X м
К О
X СИ
су о;
т ч
ев е<
w X
* X
ев <
Sa
ев х
*§¦
н с
IS
ев н
S ^
I "
? со
•е-
о
IK
о.
N
Tf
г^
t-*
О
о
t^-
о
t^.
05
СО
о
00
654
о
о
00
СО
о
5816
о"
S
0,5
13
и
О)
со
1—<
о
1
1
1
1
1
1
!
1
1
1
Ю
О
CD
СО
П<
CN
О^
ю
rJH
о
1Л
t^
т-Н
о
1
1
1
1
1
1
1
1
1
1^
а>
CN
Ь-
1Л
CN
00
^
00
О
00
ю
о
СО
CD
CN
О
1
1
1
J
I
1
00
00
о>
0-
CD
см
00
о
со
ю
о
Ю
1^
о
00
О)
со
о
1
1
1
1
о
00
CD
00
h-
см
00
а>
00
~
СО
СМ
CD
СО
СО
СО
СО
О
о
,~w
0,593
СО
сч
У—*
о
1
1
CN
Г^
СО
О)
00
СМ
СМ
CN
Ю
h-
СТ>
г^.
h»
CD
О
ю
СО
1—4
0,963 ;
05
^
о
1
1
00
г>-
а>
00
см
см
00 |
ю |
см
—< 00
^ ^
СО h-
CM CN
<Х> *Ф
ю ь-
о ^
CM CN
CD Ю
СО CD
IS. —«
—i CN
1,366 |
1,811
CX> Tt<
CJ) -^
О —н
a> ^
О) О
CO О
о о
rf О
со —
О rt*
о о
CN CM
05 СГ5
см см
«2
сх
^
h-
LQ
СО
СО
г—,
г^
СО
С)
Ю
00
-Ф
СО
h-
CN
Г^-
СО
^^
Tf
^
CD
г^.
h-
Th
'Ф
аз
«D
LO
СО
'Ф
CD
CD
^
а>
ю
00
Г^
СО
о
^
CN
СО
СО 00 О N.
СО О Ю N
cD^ O^ "^ CD
о' о" о" о о сГ о" о" о" »-Т —Г —Г сч <м см
IO
о
N
см
о
см
N.
СО
см
о
00
см
N
см
о
см
о
СП
см
о
о
^
см
со
о
^г
о
а)
со
о
см
ю
CD
^
о
о
N.
00
ю
о
N
со
ч*1
N
о
LO
ю
CD
о
см
см
'—<
ю
см
ю
•—<
CD
CD
00
*—<
LO
СО
СО
CN
СО
00
CN
—• CM О N —<
CD О CO N LO
—< CM CM CM CO
<Э О" О" О О CD О О" —~ ^ ^ CN CN
СО
CD
тН
СО
СО
СО
СМ
00
СО
N
О
СО
CD
СО
О
N.
N
N
О
СМ
00
со
N.
СО —< Ю Ю 00 '--* 00^*-чО0
I г | | iCOCOCONNCO^fCNcOO
I | I I I ^ Cj CO ^ CD О) CN CD О CD
о" о <э о~ о" о ~ -Г см ем
I I I I I I 2
COCMCMOOCONCNLOrf
OCDCM—hNOOCOOcO
СО LO N О rf CD П
О О О О О ^ ~
МММ
N
I -.
О
СО Ю CD СМ
О0
о
СО
о о о -< —* см
СМ О СО ^ CD CM
I | | | -* 00 О N СМ -н
I I | | -* СО N О LO —^
о о" о ^ г~: сч
СО
00
СО
CD
О
ч^
00
N
СО
о
ю
о
N.
о
СО
CN
СО
N
«—'
N
"^
LO
-Ф
ем
00
Ю
ч^
СО
CD
N
СО
а)
со
о
CD
СМ
ю
ч^
_
см
см
ю
ем
СО
CD
Ю
СО
Ю
Г")
CD
СО
ч^
N
CD
CN
N
LO
00
00
CD
N
CO
О
ОС)
CO
00
1^
CN
N
CO
CD
00
CMCNCMCMCMCMCNCNCN 0q
была идентичной (рис. 22) и чтобы отношения значений Z обоих веществ
в соответственных состояниях изменялись плавно по изотермам и изохо-
рам. Полученные значения коэффициента сжимаемости воздуха
приведены в табл. 34.
Рис. 22. Взаимное расположение изохор воздуха и данных для азотатв соответственных
состояниях:
/ — воздух; 2 — азот.
Поскольку при разработке опорных р, v, Т-данных для воздуха
учитывались индивидуальные особенности его термодинамического поведения,
проявляющиеся в- отклонениях от закона соответственных состояний,
можно полагать, что погрешность полученных данных не превышает 0,3—
0,5% по плотности. Это подтверждается сопоставлением опорных
значений плотности с немногочисленными опытными данными Михельса и
соавторов [125], выполненным в табл. 35.
Таблица 34
Опорные значения коэффициента сжимаемости воздуха
СО
2,4
2,5
2,6
2,7
2,8
2,85
2,9
2,95
Z при температуре, °К
75
0,408
0,916
80
0,126
0,512
0,938
1,424
85
0,604
0,970
1,368
1,804
90
0,403
1,002
1,344
1,725
2,149
95
0,268
0,748
1,326
1,663
2,038
2,447
100
0,179
0,573
1,040
1,610
1,950
2,310
2,710
105
0,142
0,453
0,835
1,288
1,860
2,177
2,540
149
ы
01
о.
>>
а>
с
1 s
<и
н
S
о.
с
о
т!"
1—1
1Л
го
,_
<м
<м
LO
о
Ю
СО
СО
О
ю
LO
СО
CN
О
1
1
I
1
1
1
!
1
^
cd
со
СО
СО
О
ю
СМ
СО
СМ
о
1
!
1
1
|
!
1
1
ю
t^.
СО
a
о
^
CD
СО
см
о"
о
CD
-—и
О
!
!
I
!
!
i
!
со
00
СМ
С-
СО
о
CD
00
ОО
СМ
о
о
СМ
о
1
1
!
;
:
!
t^
СО
LO
Th
О
00
^
см
СО
о
CD
СМ
см
о
1
1
1
!
!
00
TF
о
f^
^г
о'
со
00
со
о
00
h-
СМ
о
00
СО
О
1
!
;
1
1
С7>
LO
CD
СО
ю
о
см
Ю
СО
^
о
^
LO
со
о
СО
со
см
о
Ю
о
о
;
I
1
о
см
4f
см
CD
со
о
CD
см
00
Ю
о
см
СО
"*
о
со
СО
со
о
tF
CD
о
!
1
!
см
СО
^
ю
00
о
о
СО
СО
h-
о
CD
о
СО
О
О
ь*
^г
О
см
см
СО
О
0,160
!
1
см
см
^
ю
О
LO
СО
CD
О
t^
О
00
О
ю
со
СО
О
00
О
Ю
О
0,339 |
LO
^
0,1
со
см
со
о
со
Tf
О0
см
LO
о
т-Ч
У—*
CD
о
?
t^.
о
0,580
СО
г-
со
о
т*«
см
со
о
со
CD
00
«ф
CD
LO
со
»—'
о
см
см
т—4
см
со
о
0,889 |
м
Ю
см
СО
СО
CD
см
LO
00
LO
см
ь-
—*
см
00
LO
•—1
г-
см
4f
1,258 |
h-.
\П.
-
СО
см
CD
со
см
ю
ь~
см
см
СО
LO
1—-1
см
см
о
см
1—1
со
00
1,690
см
о
ю
^
см
t^
CD
00
CM
ь-
oo
ь-
см'
F^
со
CM
- -
СО
Tf
Ю
CM
00
о
тН
см
2,253
1
см
h-
2,0
00
CM
га
Cf
к
ч
VO
ra
H
is
H 5
B5 g
« я
s S
x 2
? *
X tf
M н
X
*1
л s
X d
ex и
о с
§8
о
о0"-
ье
о.
0)
о
a
сх
о
с
о
CN
о.
Q
v°
с?
К
1>.
LO
^
О
О
00
CD
СО
О
см
СО
CD
СО
О
LO
LO
h-
СО
LO
2,1
со
00
О
1
CD
1^
О
LO
о
00
00
О
ю
о
О'
CD
СО
-ф
о
см
о
со
о
LO
о
СО
CD
о
ю
о
о
h-
СО
LO
о~
СО
LO
о
о
CD
а)
00
LO
О
СО
00
а>
ю
О
см
CD
ч*
Ю
оо'
CM
со
о
о
СО
СО
о
CD
О
СО
СО
О
СО
Tf
О
h-
О
I
со
см
см
г^
О
LO
СО
см
t-
о
со
со
о
см
см
о
1
о
г^
со
СО
о
Tt<
оо
СО
СО
о
о
го
CD
СО
ю
об'
СО
СО
о
1
LO
00
см
*"-
о
CD
о
со
t^
о
CD
ю
см
9 i
я &
t=f оз
3 Я
со
оЗ
X w
>>
t< оз
- М
Оч а
о к
со
о ь
Я <D
Я
CQ
Cv3
03
Н
СУ 0) 05
сз О
к с
О)
t< S
Ю S
S Л
Он Я
° S
• ^ о
сз ^
о
S С
я х
03 СЗ
н
S
а
CJ
са
н
о
S X
S
я
<D
:г
сз
Я
со
я
я
« О
СЗ «
л гя
с я
U Я
Я *я
Я я
5 ч
о ^
я
Он Я
<Р Он
я
я я
н
и
с
я
н
о
я О
я
о
о
я
_ о
я я
5 <u
Я tr
« оз
о д
Н со
я
я я
я ся
к о
CJ Я
я о
я
аз S
Он S
>> я
О)
« я
я я
я ^
О) О.
t: о .
я о
oj Я Я
о с си
я
К ^ 03
'--? Я О.
(Ч Я >»
§
V. 3. Уравнение состояния для воздуха
и расчет калорических свойств
Как показано в предыдущих главах, термические данные для
жидких компонентов воздуха при давлениях до 500 бар с высокой точностью
описываются уравнениями состояния, имеющими форму E2) и
содержащими три температурные функции. Проверка по опорным р, v, Т-данным
для жидкого воздуха на отдельных изотермах показала, что наилучшее
удовлетворение достигается при выборе в уравнении E2) значения п = 1.
Затем были определены температурные функции уравнения состояния
методом спрямления изотерм. В качестве иллюстрации на рис. 23 показано
определение функций В (Т) и С (Т) для изотермы 100° К. Величины Y1
и Y2 определяли по тем же формулам G3) и G4), что и для азота;
спрямление большинства изотерм достигалось назначением для этих величин
допусков, соответствующих погрешности опорных данных, равной 0,1%
при определении плотности.
На рис. 24 представлены температурные функции уравнения
состояния для жидкого воздуха. При предельных значениях функций
наибольшие отклонения от опорных данных достигают 0,1—0,2% по
плотности. Для лучшего согласования величин, рассчитываемых по уравнению
состояния, с данными для газа температурные функции определялись до
140° К.
Для воздуха, как и для азота, функции С (Т) и В (Т) в пределах
допусков линейны и описываются выражениями
С(Т) = 5270— 12,4 Г, (95)
В(Т) = — 5910 + 30,27. (96)
Функция А (Т) для воздуха во многом напоминает по своей конфигурации
аналогичную функцию для азота и, подобно ей, апроксимируется
полиномом
А (Т) = 344,5—1,379 + 4,04362 + 1,9936» + 0,094204, (97)
где
9 = 0,1G—140).
После подстановки аналитических выражений для температурных
функций в уравнение E2) при п = 1 получается уравнение состояния
для жидкого воздуха, в котором давление имеет размерность бар, а
плотность — кг/дм3.
Значения плотности, рассчитанные по уравнению состояния,
сопоставлены с опорными в табл. 36. Расхождения между обеими группами
величин для большинства точек A46 из 186) не превышают 0,1 % и только
в семи точках при температурах 120 и 125° К составляют 0,2—0,3%.
Среднее квадратическое отклонение расчетных данных от опорных равно
0,09%. Опытным точкам Михельса и соавторов [125], попадающим в
область применимости уравнения состояния (при со >> 1,8), оно соответствует
с погрешностью определения плотности 0,1—0,5%.
Ввиду ограниченной точности опорных данных возможно, что
действительная погрешность расчетных значений плотности выше отклонений,
указанных в табл. 36. Если в дальнейшем появятся подробные опытные
р, v, Т-данные для жидкого воздуха и потребуется уточнить температурные
функции уравнения, это можно будет выполнить без принципиальных
затруднений благодаря достаточно надежной и простой методике
определения указанных функций.
Уравнение состояния описывает кривую насыщения жидкого воздуха
с высокой точностью. В интервале температур 75—110° К расчетные и
151
5000 г-
0,50 0,55 010 0,75 0,80
2800
ZbOU
Z400
2200
2000
WOO
\\
f
V
w
f
I
ti&r
V
'
?Tv
\>
V*
\j
\
Y
^
Г
>
\
>
/s~
#
^J
-WO
-1500
¦WOO
-J 700
WOO
WOO
120
125
1,30
135
1,40
Рис. 23. Определение температурных функций уравнения
состояния для жидкого воздуха на изотерме 100° К-
4000
3000
2000
1000
Рис, 24. Температурные функции уравнения состояния для
жидкого воздуха:
/ — оптимальные; 2 — предельные.
в У
0,06
—0,10
0,06
—0,12
0,04
—0,06
0,07
—0,11
0,07
—0,12
0,05
0,09
0,06
0,11
Crc4^4^COCOtOtO- — — —
ОСЛОСЛОСЛО^44^ЮО000^4^Ю
ООООООООООООООО
ОО ОО ОО ОО ОО ОО ОО ОО
II || || || || || || CDCDCDCDCDCDCDCDCDCDCDCDCDCD0000
|| || |] || || || || юю _- _ н_^ ^^ 00 00 00 с^ю
tO — ЧО) 4^ СО и- о --J 4^4*. О — *<! ¦<»
tOOO СЛОО 4^ 00 — CD "Ч 4^ СООО Ч i- — ^4
О О О О О О О О О О О О О О О О О О О О О О
|| |" | || || CDCD COCO CDCD CD CD 00 00 00 00 00 00 00 00 00 00 00 00 00 00
tO tO — — CDCD ОО CDCD CDCD CDCD 00 OO 00 00 --J -<» -<l
CO tO CD СЛ 00 -4 CO tO 00 -J 4^4^ i— О «4^4 COCO CDCD СЛ СЛ
CD 00 4^4*. СЛ ^4 4^ CD CO CD 4^ О 00 tO О W^ CO tO — О
OO OO ©O CDCD pp ©O ©© O© ©© ©© ©© © © °°
II II CDCD CDCD CDCD 00 00 00 00 00 00 00 00 ОЭ00 00 00 00 00 00 00 00 00 00 OO
tO tO — и- ОО ЮСО 0000 0000 ЧЧ ЧЧ SOI OiO) 05CJ3 СЛСЛ СЛСЛ
tO — 4s» 4^ CD СП 00 00 CDCD 4^00 00 00 4^4^ О CD СЛСЛ — — CD CD — —
O00 CD -4 00 О CD tO O0CO tOCD 4^0 4^ — tOCD CD CD ?* CD 00 ^ CDCD
oo pp P© P© P© °° P° PP PP PP PP PP PP PP PP
CDCD CDCD CDCD 00 00 0000 00 00 00 00 00 00 00 00 0000 00 00 00 00 0000 00 00 0000
tOtO — — OO CDCD OOCD 0000 -<1 -O CD CD СЛСЛ СЛСЛ 4^-4^ 4^4^ CO00 CO CO tOtO
О — COCO CD CD 0000 COO CD CD ' CD CD >?>. Ф* -<|-vj CO bO 00 -vl CO tO 00 -<l COtO ~vj CD
CDO ^-4 ~-4 — CD CD CD Ox CD 4^СЛ 44^ 4^0 CDCO 4^ CD CD 00 -vj CO СЛ CD tOCO СЛСО
op pp pp pp pp pp pp pp pp pp pp pp pp pp pp
CDCD 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00 00
OO CDCD CDCD 0000 О -vl CD CD СЛСЛ 4^4^ COCO COCO tOtO tO — — — OO OO
CDCD 00 00 CDCD "—tO tO tO tO tO — »— 4^4^ ^4 О — — CD СЛ О CD 4^ CO 00 -4 — О
tO СЛ 4^ CD tO -v] СЛь— — 00 — 4^ CO— 4^ — О СЛ 00 tO CO CD CD O0 ^4*4 W4^ CD 00
P P ' P P P P P P P P P P P P P P P P P P P P P P P P P P P P
0000 0000 0000 0000 O000 00 00 00 00 00 00 0000 0000 0000 VjVj Vl^J ^J^J ^4 Vj
CDCD 0000 -4^4 CDCD СЛСЛ ?* 4^ COCO tOtO — — CD CD CD CD CDCD ОООО ОоОО -g ~-4
— tO CO 4*- 4^СЛ 4^СЛ 4^ СЛ CO 4^ —' — CO 4^ СЛСЛ CDCD COCO CD CD CDCD tOtO COCO
CD— COO 4^tO CDCD 00 ^ OOtO -4 CO 00 О СЛ 4^ CDCD CO— -<1 СЛ CD СЛ OtO CDOO
pp pp pp pp pp pp pp pp pp pp pp pp pp pp pp
0000 0000 0000 0000 0000 00 00 O00O 00 00 Vl^J V] Vj ^J V] Vl Vj Vj^j VjVj -4 V)
--4^4 CDCD СЛСЛ 4^4^- COCO tOtO — — OO COCO 0000 ^4-^ --4 --4 CDCD СЛСЛ 4^4^
~-J 00 OOCD 00CO OOCD --4O0 СЛСЛ — tO COCO COCO CDCD COCO — tO COCO 4^4^> CO 4^
COO CO— 00-J СЛ 4^ ^ CD СО-Ч CO— tOCO CD ^4 0000 СЛСЛ --1 О О^СЛ — CO COCO
¦a-
СЛ
oo
о
00
СЛ
CD
о
CD
СЛ
о
о
о
СЛ
р
?!
Л)
съ
, при температуре, °К
п
о
я
о
О
Н
-~ р
"О 08
2 =
toS
w3
о Е
о *
я w
О X
"О р
X ?
"О О
° Й
ж х
Р О
О
о
W
ОЛ
О
CD
Я
н
О Ф
S
о
н о
а>
X
о
О
п°
о s
оэ s s
9 » ^
4з^°
2 I сло> ^
й сг> ° я s
а ел о
1^^з
н
CD
Я
о
ест
л в*
п_
» «?
Я л>
я
03
^ <^
S24 я
я
О)
Я§
° я
>тн Я
5 |»
о S
С5\ Я
03 Л
тз <^
оз G
^ Я
о х
о
о
43
43
ГО
Я
43
О
03
Я
Як.*
о
я
о
сг
со
о
я
03
я
о
я
я н
S я
° а
«4з
я s
н >•
3 й
я 2
я я
я
я
03 ><
СО
о
н
43 тз
00 00
я
о
43
пз
— о
ю я
СЛ О
/^ сг;
43 ™
Оз со
о я
X 03
о л
ГО О)
я ^ о
Я g 43
- д s
о
03 Я!
° Э
сг о
я я
Л <^
О) Я
я н
s 2
SQ Я
" я
я о
о
о
я
о
о
» 3
я
ГР
я й w я
^ ^ 43 43
К И Я 03
43
S ?
CD S
Н Я
Я (V
43
я я
СО 43
Я Я
о ь
Я н^
3 я
СО Я
о -
я
о
ГР
3^
о
н
я
^ (Т)
h-j С^
я
? w
(Т> о
' со
д^
43 X
Я 03
я
и
°00
го
о н
о ^
Я 4э
я
Н ^4 Я Я
—» я
со Е
о я
-• а
si
н- Я
о я '
я
я
о
я
О)
о
я
о я
43
43
о
Р^Я
я
S2E
о
о
43
>4^ О 43
я
со «^
s *
S 43
E я
a> н
я
43 g
s«
<т> 2
я "
н
нн sx CD ГО ^-J СГ
z^N н^ i i i i
с
я 5
я н
Я о
о я
о w
3 43
sS
о S
я 5
я ^
я 14-
° л
Я н—
я -
?я К
я
1 у1
я I
я
о
я
о
2=3
я
я
н
Я
СО
со
fcl
(Г
я
я
а ел ?
Gv I ^>
Е >—
я ^Я
§^ Йс
я * 3
к Q »
Я Я
чэ о
Я Q
СО
И
& *
S ^
я *
к я
я о
О) I
^ I
о СО
8*2 ^^
» Е gs
go
Со 43
О со
о ^з
о ¦
о о •— о
¦ ¦ ел о
.*5 со
«а
> .-
со я ъ "
- * 3
Я w
О со
к s
со со Я
я
я
Е
Со
ьо о
9 «
I 2=1
°чз
Со ^ _ Я
° ь 3
2=1 "
я<чз
3 g
со 3
я.о
о
о
43
СО
со
я
о
"I
о
я
со
4э
Я ^"Т
я ^<
о >
*< о
X О
со я
ч? я
Я О
Я ЧЗ
S ?
? Со
? X
133
со
Я
я
СО
я
я
Е
X
я
о
н
4Э
CD
о
я
Со
2=3
О
о
я
я
со
?
я
я
н
я
я
«
о
н
о
0\
Е
я
я
о
я
о
2=1
сг
со
о
я
Со
я
Е
со
я
СО
¦ л
я
я
я
я
чэ
о
я
со
я
§,
я
о
я=
о}
Eg
*|
" О
w я
н х
&> ^
ov 2
«ц Я
г о
Яс
к> О
Я со
X
• я
2=1 О
Я *1
о
о -
я 55
43
1 ?
~° я
^я
« я
Со
со
я я
со со
Л О
а> о
Я Со
я 4з
Я СО
SS х
О) СО
я ю
я о
о
я °
о о
<^а
Со Я
43 Я
я я
Л СО
ft) Е
SJ3
ел
ч О
cm ^
¦ft "
•g со
я
чэ
Я ° '
я
Ч|
н
$+
о о
1,3 о
О) Я
ft) 4Э
й Со
я
н
ГО
я
я
S
я
я
я
я
о
я
43
Со
я
о
я
>
со
„ч >
i
^ н
43
О)
н
я
43
я 5.
Со ^—
в?
Е съ
CD ЧЗ
> ci
Со ^*
я
я я
Е "°
П) Я
00 w
>=1
S ^
^ X
^СО
о
Я —'
43 "Г^
я
ел 2
о Я
^Й
я
о я
о
43
S
я
я
я
н
я
A5
43
Со
н
43
Со
"О °"
в?
^^
РР
t—о
4^ 00
ОО
о> о
РР
1о^-
С?> СЛ
РР
to^—
00 00
1
РР
"— о
СДС?>
1
ОО
со О
1
РР
00 •—
СЛ
о
' О
ОО
00 00
С7> С75
00 00
to оо
ОО
00 00
rfb ^
CD CD
4^ CD
О О
00 00
OO 00
СЛ О)
CD Ф>
О О
00 00
to to
to to
-vj H-
PP
00 00
OO
CD 00
O0 h-
PP
^^
CD CD
C75 rfx
О СЛ
PP
V^Vj
00 00
to 1—
4^0
ф.
СЛ
О
OO
00 00
СЛ СЛ
00 4^
^J СЛ
ОО
00 00
ОО 4^
СО О
to 0
ОО
00 00
to to
22
ОО
00 00
н- О
и- ^J
ОО
^1 -^
СО СО
—1 О
to to
РР
VjVi
00 00
00 to
to 0
РР
VjVj
C7> C7>
00 --J
CO 00
4^
О
О
OO
00 00
4^ 4^
00 4^
4^ 00
OO
00 00
to to
00 CD
00 О
a><o>
00 00
00 00
00 <j>
0 0
^4 ^
CD CO
00 00
О ^
О О
-^ -q
00 00
00 00
CO О
PP
Vj^j
C7> <J>
CO 00
OO
-<l -J
СЛ СЛ
4* 00
OO
00
8
PP
00 00
00 00
Ю 00
00 to
OO
00 00
cr> o>
00 CD
О О
00 00
О О
OO
СЛ СЛ
О О
^4 ^J
00 00
4^ 4^
CO 4^
OO
-4 ^4
05 О
CO 00
00 -~4
О О
^4 -0
СЛ СЛ
00 to
СДСО
OO
^0 ^4
00 00
^4 CT5
4* CD
OO
О
О
PP
00 00
to to
0 —
00 0
00
00 00
О О
00 00
tO 4=*
О О
-<l ^4
00 00
CD CD
4^ 4^
OO
^4 ^
CD CD
CO CO
CD 4^
OO
-sj ^4
СЛ СЛ
to to
00 CD
OO
^4 -vl
00 00
СЛ СЛ
00 —
OO
^4 ^1
00 ^4
4^ ~-4
to
СЛ
0
PP
00 O0
О О
CD ^4
со —
OO
^4 ^4
00 00
00 00
CD -4
OO
^4 ^4
^4 ^4
OO
4^ СЛ
О О
^4 -J
СЛСЛ
to to
tO 4*
О О
-v4 -vl
CO 00
00 00
CO CD
О О
-<l --4
СЛ 4^
00 CO
О О
CD CD
CO CO
CDOl
»— 4^
to
О
О
О О
-4 -~4
CO CO
to to
•— to
0 0
^4 ^4
~-4 --4
to to
и- СЛ
00
^4 -J
СЛ СЛ
to to
— CD
OO
-vl ^4
OO 00
и- Ю
со СЛ
00
~-4 -O
СЛ--4
OO
CD CD
CO CO
OO
CD —
PP
"Oi'bi
CD CD
00 00
^4 >—
^4
О
О О
^4 -4
00 00
to to
— to
00
*-4 ^4
CD CD
O —
CO СЛ
OO
^4 ^4
00 4^
CO О
СЛОТ
OO
^4 ^4
-vl 00
CD 00
CDCD
CD CD
CO CO
СЛ CD
CDO
О О
CD CD
-4 ^4
to to
•— to
OO
CD CD
4^ 4^
^4 00
CO О
4^
О
PP
V) V4
^4 ^4
00 to
О О
^4 ^4
4^ 4^
00 CO
СЛ 00
OO
-J ^4
to to
СЛ CD
00 00
OO
--4 ^4
О О
— to
сл со
00
CD CD
-s4 -^
CD ^4
СОСЛ
О О
CTJ CD
СЛСЛ
OO
C73 СЛ
О О
CD CD
to to
to to
^4 CD
to
О
О О
¦O ^4
CD CD
00 00
4* CD
CDCD
-4 -J
00 4^
CO О
00 00
О О
^4 ^4
4^ CD
CD Ф»
OO
CD CD
00 CO
CO О
О CD
О О
CD CD
Oi CD
to to
О CD
OO
CD CD
00 CO
00 CO
.— О
OO
CD CD
О О
СЛО0
О
О
О О
^4 --4
СЛСЛ
4^ СЛ
CO 4^
О О
-4 ^4
tO 00
CD О
00 tO
О О
--4 ^4
О О
tO 4*
^4 CD
О О
CD CD
^ ^4
4^ CD
CD О
О О
CD CD
4^ 4^
4^ СЛ
CD tO
OO
CD CD
>— О
CD 00
О О
СЛСЛ
^4 ^4
4^ 00
00 4^
00
О
О О
-4 ^4
4^ 4^-
СЛ CD
CD CD
О О
¦<! "-4
00 CD
to to
00
CD CD
00 CO
CO —
OO
О О
CD CD
СЛ СЛ
"-4 OO
СЛ CD
О О
CDCD
to to
to —
СЛСО
OO
СЛСЛ
00 00
00 4*
1 1
1 1
CD
О
О О
--4 -J
00 00
СЛ CD
4* 4*
OO
^4 ^
О О
СЛ CD
СЛ CD
CDCD
CDCD
^1 -4
to 00
00 00
О О
CD CD
CO CO
СЛ CD
CO О
CDCD
СЛСЛ
COCO
CO СЛ
1 1
I 1
1 I
| 1
4*
О
PP
*-<Г-ч
to to
CO 4^
CO CD
OO
CD CD
CO CO
°>r
¦^4 4^
О О
CD CD
СЛСЛ
to to
СЛ 4^
OO
CD CD
О О
4^ CO
^4 CO
I |
1 1
1 1
I |
1 1
1 1
to
О
О О
-4 <l
OO
--4 4^
OO
CD CD
-si ^J
to >— ,..
4^ -4
1 1
1 |
1 1
1 1
1 1
1 1
1 1
1 1
| 1
1 1
Ox
R
t3
,__,
О
H-1
ND
^
to
CO
0
H>
CO
1—I
?
"O
x
**
n>
мпе]
эату
"О
Л
^3
Си
а
;=>
ее
при температурах 135—160° К, ограниченные в монографиях [70, 145]
давлениями 175—375 бар *.
Калорические свойства жидкого воздуха экспериментально изучались
только в нескольких работах. Хаузен [146], исследуя адиабатный
дифференциальный дроссель-эффект при температурах —175-^ + 10° С и
давлениях до 200 кГ/см2, получил ряд опытных точек для жидкости в интервале
Г = —175ч—142° С ир = 10—190 кГ/см2. Вскоре Роэбук [147] при
измерении интегрального эффекта Джоуля-Томсона в области температур
ниже 0° С определил его значения на изотерме —150° С при давлениях
до 220 атм. В работе И. П. Ишкина и М. Г. Каганера [148], посвященной
определению изотермического дроссель-эффекта воздуха в интервале
температур —183ч-+25° С и давлений 2—114 кГ/см2, приведена одна
опытная точка для жидкости.
Таблица 37
Сопоставление расчетных значений плотности жидкого воздуха
с опорными на кривой насыщения
°к
75
80
85
90
95
100
р\
бар
0,6366
1,146
1,921
3,036
4,574
6,621
кг/дм3
0,8945
0,8711
0,8471
0,8222
0,7958
0,7678
Ррасч»
кг/дм3
0,8934
0,8710
0,8474
0,8225
0,7961
0,7680
6р,
%
0,12
0,01
—0,04
—0,04
—0,04
—0,03
т,
°к
105
ПО
115
120
125
р',
бар
9,265
12,59
16,68
21,61
27,43
Qow
кг /дм3
0,7378
0,7046
0,6672
0,6240
0,5679
ррасч'
кг/дм3
0,7379
0,7052
0,6689
0,6266
0,5692
Sq.
0/
/0
—0,01
—0,09
—0,25
—0,41
—0,23
Эйкен и Хаук [1381 измерили теплоемкость жидкого воздуха на
кривой насыщения cs в интервале температур 80—120° К и изохорную
теплоемкость в интервале 80—170° К (на одной изохоре).
Расчетные данные о термодинамических свойствах жидкого воздуха
также весьма ограничены. Вильяме [149], составивший таблицу значений
энтальпии и энтропии воздуха в интервале температур 140—500° R и дав-
* Следует заметить, что в таблицах [70] для воздуха на изобаре 60 бар при Т ^
450° К по вине типографии допущена опечатка в значениях энтальпии. Поскольку таблица
термодинамических свойств воздуха, помещенная в конце настоящей главы, охватывает
только температуры до 160° К, считаем необходимым указать правильные значения
энтальпии i при р = 60 бар и более высоких температурах:
т
170
180
190
200
210
220
i, кдж/кг
122,9
140,0
155,1
169,1
182,4
195,2
т
230
240
250
260
270
280
кдж/кг
207,5
219,5
231,2
242,7
254,1
265,4
т
290
300
310
320
330
340
i,
кдж/кг
276,5
287,5 J
298,5 1
309,4
320,2
331,0
т
350
375
400
425
450
—
i.
кдж/кг
341,7
368,4
395,0
421,4
447,8
—
155
лений 1—220 атм на основании опытных данных Роэбука [147], приводит
в ней данные о жидкости на шести изотермах и шести изобарах. Дин [140]
на основании графической обработки опытных р, и, Т-данных [125,
129, 150] составил таблицы значений термодинамических свойств
воздуха A/, /, 5, Сру Cv) в интервале температур 90—450° К при давлениях
до 1200 атм. К сожалению, для жидкости в таблицах [140] имеются
данные только на трех изотермах A20; 125 и 130° К) при давлениях до
300 атм. Помимо этого, некоторые авторы [145, 146, 149, 151] при
построении диаграмм состояния для газообразного воздуха охватывали
и область жидкости, правда, на этих диаграммах она занимает лишь
небольшие участки.
Нами сопоставлены значения термодинамических свойств жидкого
воздуха, рассчитанные по уравнению состояния, с табличными данными
Вильямса [149] и Дина [140]. В табл. 38 и 39 приведены разности
энтальпии Ai — i — V и энтропии As = s — s' на пяти изотермах по
данным [149] и нашим. На изотерме 140° R G7,78° К) сравнение не
проводилось ввиду отсутствия для нее в таблицах [149] значений V и s . С учетом
того, что Вильяме при составлении таблиц располагал в области жидкости
только ограниченным числом опытных точек [147], согласование его
данных с рассчитанными по уравнению состояния является вполне
приемлемым .
Т а б л и ц а 38
Сопоставление разностей энтальпии At = i — i\ рассчитанных по данным
[149] (строка 2-я) и нашим (строка 1-я)
р, бар
60,80
101,3
141,9
182,4
222,9
6Ср, кдж/кг
Ojflax» КиЭЮ/КЗ
д/, кдж/кг, при Т, °К
88,89
3,4
1,1
6,0
3,4
9,6
6,6
11,4
10,3
14,2
13,2
2,2
—3,0
100,00
1,9
0,7
4,0
2»7
6.2
5,3
8,5
8,2
11,2
11,2
0,9
— 1,3
ш,11
—0,2
0
0,9
0
2,5
1,9
4,5
3,7
6,7
7,0
0,6
—0,9
122,22
—4,6
—3,7
—5,6
—5,9
—4,8
—6,0
—3,4
—4,7
— 1,4
— 1,9
0,9
— 1,3
127,78
— 11,4
—10,8
—14,3
— 14,5
— 14,3
—16,3
—13,5
— 15,4
— 11,7
—13,0
1,4
—2,0
Сравнение с данными Дина показало, что значения удельного объема
жидкого воздуха, приведенные в таблицах [140], в интервале давлений
120—300 атм согласуются с рассчитанными нами в пределах 0,1—0,7%.
Однако при давлении 100 атм и ниже во многих точках расхождения
превышают 1%, достигая 3—4% на изотерме 130° К вблизи кривой
насыщения. Это объясняется различием принятых нами и Дином значений
плотности жидкого воздуха на кривой насыщения в околокритическом районе
(см. рис. 21) и, по-видимому, погрешностями, допущенными в работе [140]
при графической обработке весьма немногочисленных опытных данных
о жидкости [125].
Значения Д/ и As на изотермах 120; 125 и 130° К, рассчитанные по
данным Дина и нашим, отличаются до 15—19 кдж/кг и 0,11—0,14 кдж/(кг-град)
соответственно, причем абсолютные величины Д* и As, по [140],
систематически выше. Расхождение во многом объясняется тем, что при
составлении таблиц Дина энтальпия и энтропия жидкости определялись
156
с помощью расчетных значений ср независимо от V и s'. Характерно, что
при вычитании из текущих значений энтальпии и энтропии
соответствующих величин при давлении 40 атм разности i — /40 и s — s40 на
изотермах 120—130° К по таблицам Дина и нашим отличаются не так
существенно: до 5—8 кдж/кг и 0,03—0,05 кдж1(кг-град). Заметим, что
данные [140] об энтальпии и энтропии воздуха недостаточно надежны также
и в газовой фазе при температурах, близких к критической, о чем
свидетельствует сравнение разностей энтальпии и энтропии при повышенном и
атмосферном давлениях на изотермах 135 и 140° К по таблицам Дина [140],
Баера и Швиера [145] и нашим.
Таблица 39
Сопоставление разностей энтропии As = s — s'f рассчитанных по данным
[149] (строка 2-я) и нашим (строка 1-я)
Р, бар
60,80
101,3
141,9
182,4
222,9
6ср, кдж/(кг-град)
$тах> кдж/(кг*град)
as, кдж/(кг-град), при Г, °К
88,89
—0,039
—0,082
—0,065
—0,118
—0,087
—0,138
—0,111
—0,157
—0,130
—0,191
0,051
—0,061
100,00
—0,050
—0,082
—0,081
—0,120
—0,109
—0,146
—0,134
—0,173
—0,157
—0,201
0,038
—0,044
111,11
—0,061
—0,064
—0,100
—0,122
—0,135
—0,156
—0,163
—0,193
—0,190
—0,218
0,023
—0,030
122,22
—0,088
—0,083
—0,145
—0,160
—0,186
—0,210
—0,220
—0,251
—0,249
—0,280
0,023
—0,031
127,78
—0,131
—0,120
—0,203
—0,208
—0,252
—0,272
—0,289
—0,316
—0,320
—0,348
0,020
—0,028
Полученные Дином значения изобарной теплоемкости жидкого
воздуха в интервале давлений 100—300 атм систематически выше
рассчитанных по уравнению состояния на 24—36%. Для газообразного воздуха
при температурах 135—150° К и указанных давлениях значения ср по
таблицам [140] также завышены на 11—29%. В то же время значения ср,
рассчитанные Баером и Швиером [145], согласуются с нашими данными
на изотермах 140 и 150° К в пределах —1,6-4-4-5,5% при давлениях до
250 бар, включая район максимумов ср.
Выполненное сопоставление свидетельствует о вполне
удовлетворительном согласовании данных, полученных нами и Вильямсом [149],
и о ненадежности данных, приведенных в таблицах Дина [140].
В табл. X—XII приведены значения термодинамических свойств
воздуха в состоянии насыщения и в однофазной области. На кривой
насыщения представлены данные для жидкости в зависимости от температуры
(в интервале 64—132,55° К) и от давления (в интервале 0,25—36 бар).
Данные для однофазной области охватывают интервал температур 75—
160° К и давлений 1—500 бар. По расчетным данным построены диаграммы
состояния р — Ту I — р и S — р, прилагаемые к монографии. Для
области температур ниже 118° К и давлений свыше 223 бар
термодинамические свойства воздуха определены впервые.
157
I II I I I I I I I I
LO lO CD N
СООМЛ
—• CN CN CO
CO CN —< —• —¦
rf LO CD t*- CO
N CD N CO cO
—н CN rt* t^ О
050 —• CM Tf
CO oO 00 oo CD
rt« CDLO CN О
Ю CO 00 О CN
CO О CN OCD
О —< CO l>- CN
r^ CD 00 О CO
CNCnOO)S
О CD CN CD ^
CD CO CN Ю CD
CD CD —- CO О _^
lC О О "Ф xf О "Ф CO CD cO CO О CD CO 00 COOcO
CO 00 CO CO -ф ^-н СО СО Ю СО 00 CN N CD CO Ю CD t-<
CNCNCNCN CNCNCNCNCN CNCOCOCOCO CO CO CO -Ф <=f ^rj-^fLOLO LOlOCDCDCD N N 00 CO CD О О —• CN cO
I I II I II I I I
N CO CD Ю —«
CD t-~ Is- 00 CD
COLOCN CD N
CN CN CO LO h»
00 CD О г-1 CN
OCONCNOD N N CD CN N
tJ* LO CD 00 CD гнСОЮООО
CO CDLO —i
.TfTfLOCD — . , «._ - , =.. , _ -- - - - - ..__.._ ... - _ _- _ -
I CO CO CO CO 00 CO CO CO CO CO CD CD CD CD CD CD CD CD CD COC^OOO^ СЭО^СЭО^О^ —^ —^ —^ —^ CN^ CN^ CN^ CN^ CO^ CO^ ^^lO^CC^CD^ N^O
^^*-Z^ r-S,-Tr-ZЛ^ ,—T^-T-^—Г,—Г,—Г ^Л-1Г^Гг-1 т-Гт-TcicNCN csTcsTcn'cn'cn" csTcsTcn cncn cn^cncncncsT cn"cn*cn"cn*cn* cncnco
8 &
oa
is
*i
2g
&*
OS flj
u a
S3
5-
fret о
О О
S о
С1- м
н
—« CD CD CN Is- CN N- CN N- —<
^f CD CD CN Tf N CD CN rf N
CD CD CD h- N N N- CO CO CO
LO 00^ ^ CO
CD —i ^f CD 00
00 CD CD CD CD
гч-rfCDCD'—i CO Ю N 00 CD
гнСОЮЬО CN Tf" CD 00 О
О О О О—• ^ч^^^нСЧ
О —| CN CO ^
СО LO IN- CD —i
CN CN CN CN CO
LO CD CD CD CD
CO LO N- CD —и
CO CO CO CO ^f
CD CD LO LO ^f
CO LO it» CD т-н
Tf CO CN —. —<
CO lO IN CD 1-й
LO LO LO LO CD
OCTOOOON
CO tF CO 00 О
Ю CO CO CO N
NNNN00 CD О CN
CN rf CO 00 О CN LO N
N NNN00 00 00 00
CNCNCNCNCN CNCNCNCNCN CNCNCNCNCN COCOCOCOCO COCOCOCOCO СОСОСОСОСС COCOCOCOCO CO CO ',CO CO CO COCOCOCOCO CO CO CO CO CO CO CO CO CO CO CO CO CO
xf CD CO О CN rf CD CO —• CO LO N CD-и CO ^ CO N 00 СП О -ч CN CO rf
—н CD N CD rt<
LO "Ф ^f rf *sf
CN О CON LO
"^ Tf CO CO CO
I I I II Mill Mill Mill Mill
rf LO Ю
О О О CD N
II II I
LO LO LO LO Ю ^^^CN^^-h O^OO^N^CD^^ ^О^СО^СО СЭ CO^ CO^ 0\ ^ CO (NiON
^f CO CO
I I I
N CD С
IT
OLOOiOO LO О LO —н N CO CD Ю —< CO (MOO^ON COON-^-h 00 CD CO —«CD N CO Ю xf CO CNCNCNCNcO ^lONCO^ rf CO CN N CN OOlOCOCNCN COCDCN
COCONN00 OOCDCDOO ^r-*cSCOCO *Ф Tf LO CO CO N0000CDO О —< CN CO CO xf LO CO N CO CD О ^ CN CO ^ Ю О N О) О *—< CO ^ CO N CD .-н СО Ю NCDCN
OOOOO 000^-<-ч _н ,—. ,-н r-< r-> _<_<,-« ,-н ^ __ _ ^ _ ^ CNCNCNCNCN CNCNCNCNCN CNCOCOCOCO COCOCOCOCO ^^ф^г^г^ гг^ЮЮЮ ЮЮСО
LO CO
*—i y-« CD CD -ф
—< CO CO CO N
N COO CN rf
OO-h — .-.
^ CN CO —i О
Tf Ю О О Ю
N О т^ СО CN
—• CN CN CN СО
Ю -н СО СОЮ
LO CN LO LO СО
N СО CD CD ^f
CO Tf Tf LO CO
СОЮ CD
CD Tf 00 CO 00
CN CN CN ^ CO
N CO CD О ^ч
LO CO ^f 00 CO
ОЮ *-< 00 N
CO Tf CO N CD
CD N CN Tf CO
N CD CO 00 LO
гнСОСОООгн
-и CO LO CO CN
Tf CD CD rf Tt1
00 CTi CO О CD
i-H LO О LO CD
^-н CO CD ^ CO
-и LO CN CO CO
LO О CO CN CO
CO CN LO 1—i ^-н
LO CN CD N LO
OOOOO CD О <0> CD CO CD CD CD CD CD ООО^^^н ^-ч^-н^н,—,^ CNCNCNCNCO cOCOt -^^ lOlOCOcDCO NCO00CDCD O^-^^CO ^lOCONoO
¦^ 00 N lO "^
— CO CD CO rt< CD
iCN^NOCO
Ж — — —* CN CN
CD rf ^ CN CO CO CO N —' LO
00COCOCD'-' OCDOOO^ LOCONO^ ^O^^^ CN CD N- CO CO CD^fOlNCO
N- CN N- CN CD cO CO CN —' —< CN ^f N CN N ^Ф CN —¦ CN rf 00 CO О CD О CN N- x^ CN CO
CN CO CO tjH rf LO CO N- 00 CD О *—' CN "Ф Ю N CD—^ CO LO N О CO LO CD CN Ю CD CO IN-
N —н О CN О ^ LO CO
COCNOOCO 00 CO N —' N
.-. CO —< CO—< CO CN CO LO —¦
OOOOO CD CD CD CD CD CD CD CD CD CD
iCNCNCN CNCOCOCOCO "ФтГ^ЮЮ COCONNOO OOCDCDO-и ^СМсО'Ф'Ф LOCON-OOCD
rf lO CO N 00
00 00 00 00 00
-* Ю CO N 00
CD CD CD CD CD
CD О —< CN CO
CD О О О О
•Ф LO CO N 00
OOOOO
CTi О — CN CO Tf* LO CO t -
— О CD CD 00 00 4 4 О О СЛ СЛ 4* 4^ 00 00 К) Ю ^— ^— — ^— О О О
о ело сл ЪЬЪсло слослосл о ел о "^ ел toocnto
ОСЛО СЛОСЛОСЛ
to tO tO >¦— >— >— н— >— н-^-н-h—о ООООО OOOCDCD О О О О О OOOOOOOOOO 00 4 4 4 Сл
to >— О О 00 4 О СЛ 4^00h-ocD 4 О СЛ 4^ СО tO >— О CD 00 j<J Сл &> СО >-* IQ J<J СЛ ^ ?0 O^OOO^COjX
^— N3 СО ^ W *4> СО ЬО О 00 СЛ 1— То СО СП О ^4 00 Ъо Vj "о 4*> *- Vj СО 05 00 00 4^ О СП 00 СО ^- То
СЛ 4 О tO О О Ю СП СО О) СО СЛ СО 4^ О О СП 4 ООО^Ю СО Сл СО О 00 Сл *— Ю СЛ СО О00С0С000
О CD 00 О О СЛ 4^ СО to >—
О О О СЛСЛСЛСЛСП 4^4^4^4^4^ OOOOOOOOOO COOOOOOOtO tOtOtOtOtO tO tO >— >— >— н— ц— н— >— о
СЛ tO О 00 О 4^ tO О 00 О 4^ tO О 00СЛСГ)СЛ4^ WtO>-000 <Ю)СЛ^Ю ¦—' О 00 ЧО) СЛ 4^ (О О 00
СЛ CD СЛ Ю •—' »— i— •— tO 00 СЛ О -J 00 CD О О О О О О О CD 00 О 4^ tO CD СЛ О ОО 45- 4^ 00 *- О 4 >—
III Mill I I I II I II I I II I I I I III I I Mill II I I I
000000 004^4^.4^4^ СП СП СП О О О 4 4 4 4 Ч Ч 00 00 00 00 О О О >—' »— н— н- >— ь— >_-»—*—>— ¦—i
•—COO СО*— 4^ О CD ЮСЛОО00 О О tO 00 СП 4 0^—000 ^^5°^° О О »—*- *- Ю tO tO СО 4^
сососл ^—4 сососл toooo 4 со со о Ъо "-о оэ о 4 со "to о to со "со-0 5° .Г*1 i43 •!** Г** .Г"* ^ 5° 5я 5°
tO 4 00 00 О 00 н-СОООн-ч
00 00 00 00 00 00 00 00 OOOOOOOOOO OOOOOOOOOO CO 00 CO 00 CO COCOCOCOCO COCOCOCOCO CO CO tO tO tO
00 00 00 Ъо 00 ~4 Vj ~4 О О О СЛ СЛ СП СП СП СЛ ^ V ^ 4*- V СО СО СО Ю То N0 >— >— о О О СО 00 Vj
О 4 СП СО •— О 4 СЛ 00000000 О 4 О 4^ tO н— О 4 СЛ tO О 4 СЛ tO 00 4*. О СЛ tO СО СЛ О 4^ Ч СЛ
000000 00 4 v)(J5^ i-ООСЛО*- О О О 4^ 4 О >— •— О 00 СЛ О *— О СЛ 00СЛ4^4^О •— О СО 4^ 4^
со со to to to to to to to to to to to to to to to to to to to to to to to >
OOh— CD 00ЧС75СЛ^
О •— О 4^ CO 4^ О О
О 00 4 OOOOOOCDCO
4^ 00 00 tO tO
00 4 tO 00 00
О CD 4 О 00
Ю •—и-и-и- OOOOO
OOi^tOb- О 4 О 4^ CO
О 4^ О CO tO СЛ CO 4^ CO 4^.
О О CO CO CD
to о со ^ сл
О СЛ О СЛ СО
CD CD CO 00 00 00 00 00 00
4^ tO О СО 00 4 О СЛ 00
СО О 00 00 00 ЧСЛн-^
СО 00 tO
00 СО СО
СП V СО
со о о
СЛ 00 tO •— О СО 00 4 4 4 ОООСЛСЛ СЛ4^4^4^СО COOOOOtOtO tOtOtOtO
@00H14 >-* -^ 4^ Ю tO
О СЛ 00 СЛ 00 00 О 00 00 СО
tO 4^ СО О tO
00 О СО О tO
•— 4 О — О
00 4^ •— 00 4^ >—00 СЛ tO СО
СЛ СО СЛ н— СО 4 О О О 4
ЬО 4 СО О 4^ 00 О О 4 •—'
О 00 О О 4
4 00 4 tO О
4 О 00 tO tO
СП 4^ tO О
О tO tO О
О О СО 4
to to to to to
00 4 О СП 4^
to to
00 tO
I
CO 00 00 00
4 СЛ 4^ tO
00 ОО Ю tO tO tO tO
"- О 00 4 О 4s- ОО
и— о *- 4 WOvJ^m CD 00
to to о 4^ o>- о со со о со
CO 00 CO CO 00
4ЭФ>СОь-
co ю to to to
O00 4 О 4^
О
CO
со о
5a rj
ft О
is
в
tO tO tO j— j—j—j—^-j— J—J-*
V К) О О О 00 00 "*4 О О
СЛ О 4 00 •— СЛ О СП >— 00 СЛ
О О СЛ 00 >— ю tO 4 4 —о
СО 4 О СЛ О ¦—' — tO Ю tOOO
tO CO О СЛ 4 00
4^f^4i-4^ 4^4^000000 0000
"to"—"н-о ЪЪЪЪЪ СО 00
оо О 00 О Ot0004^ •—О
О *— О О 0 4 4 0 00 004^
р
о
Е
Я
X
Н
ол
S
X
ф* СО СО СО
сл "о сл "to
00 О СП 4
СП СЛ СП СП
СО — 4^ 4
О tO СП СО
§
3:
о
ОО.
4 а
%
•-
*Ь
к
^
CL
45,51
54,88
3,557
3,885
3,918
3,939
—28,7
—26,0
см —•
00 —
CD t>-
124,12
124,90
123,01
123,84
LO CD
CM CM
68,87
4,350
0-"tN-H
CO 00 О CM ID
°l °l0- °~ °„
со" СО" *Ф ^" V
CO ^ ^f CO -и
CO О t> ^f —i
CM CM —¦ —< —'
1 1 1 II
CM CD CO CM ^
^NrHLOCO
t^ C-- CO 00 00
CO 05 О О 05
CO CO -^ 00^ «tf
ю" CD" Г-* !>-" 00"
CM CM CM CM CM
СО Ю CO Oi CO
CD т? CM СЭ Г^
Tf LO" CO" CD" О-"
CM CM CM CM CM
t-~ 00 CT5 О —
CM CM CM CO CO
1 1 1 1
1 1 1 1 1
NOCOCD^
O^ г-н ,—. -и CM
^ ^f "^f ^t4 ^f
t^ —- CM CO O^
O-" Tf o" tjT o"
III"
CM 00 LO LO CO
Tf 05 CO ^P LO
05 05 О —( CM
CD —« ^P CO h-
-H 00^ "^ 0_ CO^
О55"о"-н"'-Г
см см со со со
CO 00 05 00 CD
<Ф -и CO Ю^ CM
oo" 05" 05" 0" —*
CM CM CM CO CO
CM CO ^ LO CO
со со со со со
X
* X
cd
ё
О
sS
О
EC
со
cd
•в-
О
X
5
о4
Mil I I I I I Mill II
СМ тр h- СМ00ЮСМО OOCOLO^fCO CMO
I LO ^ CO CO CM CM CM CM —1 —< _ г-н —< ^« ^
000 ООООО ООООО 00
ex
C5
^OCO Oi О 00 CO CD 00 00 CD CO O) CO 00
05100 Ю'-'ЮО'Ф 00 CM CD О СО Ь- CO
Ю CO t^ h» CO 0C) Ol Oi 05 0 0-н-н "l^
ЮЮЮ lo"lo"lo"lo"lo" lo"cd"cd"cd"co" Cd"co"
t^OS'-H CO-^ CD t— 00 О) О О 1—i CM CM CO
O^CNCM CM—^O^COCO ONQOO^ 0^0^
cd"—<"cd" ^-*~co"o"lo"o" lo"o5^"oo"co" 00" t^-"
CO LO CO 00 Oi —• CM "*P LO CD 00 O) —< CM Ю
CM CM CM CM CM CO CO CO CO CO CO CO ^f Tf 4*
t^- —« f— CD Г-- CD —• Oi t- LO CM Г- Oi COCO
С000Ю iON-hNCO ^OOO —1 COCO
CM 05 t-- LO CO CM О 05 COh-СОЮтР CO —1
rt^COCO CO CO CO CO CM CM CM CM CM CM CM CM
000 00000 00000 00
©oo cocoo©^© ©©©©© ©л©
o"o"o" o"o"o"o"o" o"o"o"o"o" o"o"
ОЮОЮ ОЮОЮО ЮОЮОЮ OO
0000O5O5 © © -^ —'CM CM CO CO ^P ^P ЮСО
C3
VD
Ю
II
s
Си
ca
00
D
Q.
0
Еч
05 Tp LO 1С CM
*-« О О l>- О
-и lo © CD^ CO^
CM" CM" CO" CO" тр"
Tf CD О ^f Oi
00 00 Oi Oi Oi
CO —н СО О CD
—1 CO Th LO LO
o> 0 —^ см со
CM" CO" CO" CO" CO"
тр СО 05^ СО
—н" см" см" со"*Я
СО СМ -н О СО
7777?
СОО О О 05
00 h~ 05 LO LO
*-* *Ф Г- — LO
—< 1-н — СМ СМ
СМ 00 СМ О СМ
"Ф —1 00 СО СО
05 t~- тр СМ 05
СО 00^ 00^ 00^ 1>
о" о" о" о" о"
ЮОЮОЮ
Г- 00 00 05 05
II II 1
СМ -Ф LO тр Г^
СО ^ 00 00 Ю
-^ О LO О LO
СМ СО СО ^ гр
lo" lo" lo" lo" lo"
CD CO^ rp О CO
0" со" cm" со" со"
05 Oi О О -и
CO 00 CM 00 b-
05 TP 05 CM Ю
O" ^" !>¦" —Г тр"
LO LO LO CO CO
CO CO t-- CM 05
со со см со ^f
05 00 t>- CDlO
0^ 0^ 0^ 0^ 0^
o"o"o"o"o"
О LO О LO О
о о —• —• см
Mill
CO CM CO LO 05
05 00 h- LO LO
00000
О СО тР СО О
0 ^h со см cd
¦10Ю1Л COCO
lo" lo" lo" lo" lo"
-h LO C7> CO CD
05" rp 05" lo" 0"
—h CM CM CO ^f
CO Ol т-н^ CM CO^
t^-" 0" ^p" t>." 0"
CD t>- t- t>- 00
Ю 05 05 Tf Tf
l>- О ^ 05 Tf»
^ ^ CO CM CM
00 0^0^ 0^
o"o'o"o"o"
ЮОЮОЮ
CM CO CO tJ< ^
1 I
сою
Ю 'Ф
о о
5,696
5,763
45,9
56,4
83,44
89,54
0,01198
0,01117
о о
Ю СО
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
110
115
120
125
130
135
140
145
150
160
р
0,8952
0,8729
0,8494
0,8245
0,7980
0,7695
0,7383
0,03879
0,03588
0,03352
0,03155
0,02984
0,02835
0,02703
0,02586
0,02480
0,02295
V
1,1171
1,1456
1,1773
1,2128
1,2531
1,2995
1,3544
25,78
27,87
29,83
31,70
33,51
35,27
36,99
38,67
40,33
43,58
При р -
i
—131,1
—122,0
— 112,6
— 103,1
—93,3
—83,2
—72,8
92,9
99,7
106,2
112,5
118,5
124,4
130,2
135,9
141,5
152,5
= 10 бар
s
2,913
3,028
3,139
3,246
3,351
3,452
3,552
5,097
5,158
5,214
5,264
5,311
5,356
5,398
5,438
5,476
5,548
ср
1,836
1,863
1,894
1,932
1,979
2,041
2,133
1,422
1,332
1,270
1,226
1,193
1,167
1,146
1,129
1,115
1,093
Р
2,101
2,478
2,967
3,618
4,511
5,795
7,767
—
—
—
—
—
..._
—
—
—
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
110
115
120
125
130
135
140
145
150
160
р
0,8961
0,8740
0,8507
0,8260
0,7998
0,7717
0,7411
0,7071
0,06150
0,05571
0,05136
0,04792
0,04500
0,04257
0,04045
0,03858
—
V
1,1159
1,1442
1,1755
1,2106
1,2503
1,2958
1,3493
1,4143
16,26
17,95
19,47
20,87
22,22
23,49
24,72
25,92
—
При р =
i
—130,7
—121,6
—112,3
—102,8
—93,1
—83,1
—72,8
—61,9
89,0
97,2
104,8
111,7
118,3
124,6
130,8
136,8
—
= 15 бар
s
2,910
3,025
3,136
3,243
3,347
3,447
3,546
3,646
4,972
5,042
5,103
5,158
5,207
5,254
5,296
5,338
—
ср
1,832
1,858
1,887
1,924
1,968
2,025
2,109
2,244
1,767
1,560
1,436
1,353
1,294
1,250
1,216
1,189
1,150
Э
2,083
2,453
2,931
3,563
4,424
5,647
7,495
10,57
—
—
—
—
—
—
—
—
—
П Зак. 1978 161
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
р
0,8971
0,8751
0,8519
0,8275
0,8016
0,7739
0,7439
0,7107
0,6724
0,08628
0,07622
0,06935
0,06414
0,05999
0,05650
0,05350
0,04864
V
1,1148
1,1428
1,1738
1,2085
1,2475
1,2922
1,3443
1,4071
1,4871
11,59
13,12
14,42
15,59
16,67
17,70
18,69 *
20,56
i
—130,4
— 121,3
—112,0
—102,5
—92,8
—82,9
—72,7
—62,0
—50,5
85,2
95,2
103,7
111,4
118,5
125,3
131,8
144,3
= 20 бар
s
2,907
3,022
3,138
3,239
3,343
3,442
3,540
3,639
3,741
4,882
4,963
5,030
5,088
5,140
5,187
5,232
5,312
ср
1,828
1,853
1,881
1,916
1,957
2,010
2,086
2,205
2,425
2,237
1,813
1,604
1,476
1,390
1,328
1,281
1,215
и
2,065
2,428
2,896
3,509
4,340
5,509
7,244
10,05
15,34
—
—
—
—
—
—
—
—
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
! Р
0,8980
0,8761
0,8532
0,8289
0,8033
0,7760 .
0,7465
0,7142
0,6774
0,6323
0,1118
0,09653
0,08688
0,07987
0,07435
0,06983
0,06274
V
1,1136
1,1414
1,1721
1,2064
1,2449
1,2887
1,3395
1,4002
1,4762
1,5816
8,944
10,36
11,51
12,52
13,45
14,32
15,94
При р =
/
—130,0
—121,0
—111,7
—102,2
—92,6
—82,7
—72,6
—62,1
—50,8
—38,1
82,2
93,9
103,4
Ш,7
119,3
126,5
139,9
= 25 бар
s
2,905
3,019
3,130
3,236
3,339
3,438
3,535
3,632
3,732
3,841
4,815
4,908
4,979
5,040
5,093
5,142
5,288
ср
1,824
1,849
1,875
1,908
1,947
1,996
2,065
2,170
2,357
2,784
2,772
2,057
1,755
1,584
1,473
1,395
1,292
Э
2,048
2,404
2,861
3,458
4,260
5,377
7,012
9,590
14,22
25,12
—
—
—
—
—
—
—
162
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
Р
0,8989
0,8772
0,8544
0,8304
0,8050
0,7780
0,7491
0,7176
0,6821
0,6398
0,5791
0,1357
0,1154
0,1033
0,09461
0,08787
0,07788
V
1,1125
1,1400
1,1705
1,2043
1,2422
1,2853
1,3349
1,3936
1,4661
1,5631
1,7267
7,367
8,662
9,682
10,57
11,38
12,84
При р =
i
—129,7
—120,6
—111,4
—102,0
—92,4
—82,6
—72,5
—62,1
—51,0
—38,8
—23,4
80,7
93,9
104,0
112,8
| 120,8
135,3
= 30 бар
s
2,902 •
3,016
3,126
3,232
3,335
3,433
3,529
3,625
3,723
3,829
3,954
4,772
4,871
4,945
5,007
5,061
5,155
СР
1,820
1,844
1,870
1,900
1,937
1,983
2,045
2,139
2,300
2,634
3,910
3,197
2,271
1,871
| 1,668
1,538
1,381
Э
2,031
2,381
2,827
3,408
4,184
5,253
6,796
9,175
13,27
22,02
58,81
—
—
—
—
—
—
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
р
0,8998
0,8782
0,8556
0,8318
0,8067
0,7801
0,7516
0,7208
0,6865
0,6464
0,5936
0,5013
0,1554
0,1321
0,1180
0,1080
| 0,0941
V
1,1113
1,1387
1,1688
1,2023
1,2397
1,2819
1,3304
1,3874
1,4567
1,5469
1,6847
1,995
6,435
7,572
8,472
9,255
10,63
При р =
ь
—129,3
— 120,3
— 111,1
—101,7
—92,1
—82,4
—72,4
—62,1
—52,2
—39,4
—25,3
—0,9
81,2
94,8
105,4
114,5
! 130,4
=35 бар
s
2,900
3,014
3,123
3,228
3,330
3,428
3,524
3,619
3,715
3,817
3,933
4,127
4,749
4,849
4,923
4,985
5,088
СР
1,816
1,839
1,864
1,893
1,928
1,970
2,027
2,111
2,251
2,521
3,285
—
3,325
2,324
1,941
1,728
1,486
Р
2,015
2,353
2,794
3,360
4,110
5,135
6,594
8,799
12,46
19,70
41,94
—
—
—
—
—
—
11*
СЛ СЛ
ОО
0,1879
0,1512
5,321
6,612
91,9
114,4
4,764
4,909
2,721
1,927
1 1
4^ 4^ СО СО tO
СЛ О СЛ О СЛ
о о о о о
to со V сл сл
tO >— 00 СЛ tO
4^ СО СЛ СО tO
СЛ СЛ СО tO tO
^ со !° Г* ~
4^ ~ О -4 СП
СЛ ^ СЛ СЛ О
СО ^ 4^ О *>1
о оо
1 1
^3 4^ >— tO
СЛ -J СО СО 00
00 О tO СЛ СО
4*. 4^ 4*- 4*. СО
СЛ V ~>— О 00
СЛ СЛ -О •— 00
4* tO 00 Ю СО
СО 00 СЛ СО tO
СО О О tO СЛ
СО СО Ю О —
.— 4^ СО 4^ 4^
24,46
to — — о о
О СЛ О СЛ О
РРРРР
"сл ел Vi "-ч "-ч
ел со to сл оо
СО 00 СО 00 СЛ
4^ 4^ 00 00 СО
СП V СО СО fo
-J — О -4 Ю
СЛ 00 tO СО 4^
Mill
4^ СЛ СЛ ^J 00
о *- to to *-
Сл"сл О О 00
со со со оо оо
"-4 сл "сл Ъ\ 4*
СО 4* >— СО СЛ
СО н— О СО СО
О СО 4^ 00 СО
О 00 tO О СО
СЛ О -О 05 4^
^— СЛ 00 О 00
00 СО СЛ СЛ >—
Сл 4^ 4*
со со со оо -ч
СЛ О СЛ О СЛ
ооооо
00 00 00 00 "со
>— СО СЛ 00 О
•— сл со — to
сл со •— со сл
СО СО СЛ СО О
to СЛ 4^ 4^ 00
tO СО О ~-4 О
— 128,2
—119,3
— 110,1
— 100,8
—91,4
со со со со to
со to ">— о оо
•— >— >— ОСО
СО 00 4*- СЛ tO
0D 00 00 00 00
О *vj 4^ tO О
tO СО 00 СЛ CD
СО СО to KD —
СО tO Vj tO CO
о to о со о
СЛ 4^ >— tO ^J
^
.?S
"О
С2
I *
Га
1 "°
"CD
"С
"а
- 50 бар
СЛ СЛ 4^4^COC0tO Ю^-"-00 СО СО 00 00 -Ч
ОО СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
рр ррррр ррррр ррррр
"— ^— ^-Ьф»слЬ о> о> Vi Vj Vj ooooooooco
С0СЛ 00 tO CO СЛ >— СЛ CD tO СЛ 00 ОСОСЛООО
О ~-sJ О СЛ --4 СО 4^ 00 4^- СЛ СЛ 4^ СО 4^ ^1 О •—'
СЛ tO 4^ СО >— ^J >— •— СЛ СО СЛ О СОСЛСОСОСЛ
J<J СЛ СЛ 4^ tO ~ И- М- Н- и- н- и- ь- К— V- h— I—
сл со "сл V to оо а> "сл ^ "со со to to ">— ^- ^— ">—
СЛСЛ ^ь-00ОЮ >— СО ~-4 tO "Ч СОСОСЛСОО
ело со оо оо сл оо со со сл >— сл 4^. оо сл сл со
СЛ 4s- СЛ -Ч СО СЛ ^4 СО СЛ О —
~5 II I I I II I II II
toO 00 СЛ »-* ¦— tO 4^ СЛ СЛ -Ч 00 фи-ммм
оР ч оо ч о ч р^-to ю to _ о — *— to
о *° со V ^ "сл "сл "to "сл "о"— о сл Г- Р Р 9°
•—* 4^ СЛ СЛ
Ф* 4* Ф. 4*. 4^. ^ 00 СО 00 СО СО СО 00 00 СО 00 tO
СО 00 "-ч"сл1о ОСО ЧЧЬ СЛ й^ СОЮ*"»—О00
СЛСО СЛ >— 4^ 4^ О СО О О >— tO tO tO ¦— О СО
СЛ00 >— 00 СЛ tO tO 00 >— -Ч^О СО •— «*4 00 4*.
><
•—tO ЬОСЛООСОЬО tON3 |Оь- н- м-н-м-^-^-
"-4tO СО "*-* СЛ V) "-Ч СО "н—О СО СО СО 00 00 00 00
СЛСО СЛ -Ч -Ч >- СЛ СЛ -Ч СЛ СО 4*. >— ¦<! СЛ СО О
СЛО OOOtOCOOO О О СО 4^ СЛ ОСОСООСО
II Mils
•и- Ю СО СО tO -О СО СО
со о 4^ 4^ to •— -ч сл со .-* оо
4^ СО Сл >— 00 н- СО tO
о
о
о
СЛСЛ 4^4^COC0tO tO — — О О СО СО 00 00 -Ч
ОО СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
о о ооооо ррррр оооо о
">— "— ">—"н-"to "сл "сл "сл "сл "-а "-ч "-g оооо оооо "со
ь—СО 4^ ^4 СО СО О СЛ СО tO СЛ 00 ОСОСЛЧО
*— О СЛО*— 4^4^ tOOC04^tO ООСОСЛСОО
СЛСО СО О 00 СЛ "Ч СЛ^СО»—О СО tO 00 СО «Ч
00 j4 рСЛфкн-н- ^— _- н- _- *— ^-н-^»—^—н-
СО СЛ 00 00 СО 00 СЛ СЛ V 00 00 Ю "tO "tO ">— ">— ">—
СЛСО СЛ 00 •— ->4 СЛ 00 4^ 00 tO -vj СООСЛСО^—
сооо to со 4^ •— со to -ч •— сл оо чочмо
СЛ СЛ СО 4^ — -4 — СО tO CO tO
ю5 сооосл II Mill ММ!
СЛ-4 *<1СОСОСЛЮ СОелСЛ-ЧОО СО •— •— >— ь—
~гл - , >, >>. -!л -^ СЛ СО — tO tO ЬО — О •— tO tO
СО^ЛОСЛСООО- - - - - - - ^-0000
СЛОО^ — СОЮ CO. - - -
4^ 00 ОСО
СЛ 4^ ^4^ 4^ 4^ 00 СО СО СО 00 СО СО 00 СО СО tO
"осо оо"-чсло"со оо"-ч"сл"сл^ coto^-ooo
to»— ОО^-ЧСО— О О »— *— tO tO tO tO ¦— CO
CntO СОСЛЬООСЛ -40000CO4^ Ч СЛ О >-4
и- >— tOC0004^tO tO tO tO tO >—
СЛСО СО — СЛ00СО 4^tOOOCD COOOOOOOOO
»—СЛ 4^.СО00ЮСЛ СООООн-СЛ <—' 00 СЛ СО н-
ОСЛ —004^ — tO ЬОООСЛООО СОСЛ004^СО
СО — н—
Р ^IT'PPP ^Р$° *°!T*
I I V 00 "-О ^ 4^ О О 00 Vj CO CD
1 ' N2 ЧСПСЛОЮ СОн- СЛСОСО
-JCDCO COOOtOCnCn
I I
§
21
><
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
р
0,9043
0,8833
0,8614
0,8385
0,8147
0,7896
0,7633
0,7354
0,7055
0,6728
0,6359
0,5913
0,5333
0,4507
0,3415
0,2650
0,1979
V
1,1059
1,1321
1,1609
1,1925
1,2275
1,2607
1,3028
1,3502
1,4044
1,4678
1,5726
1,6913
1,875
2,219
2,928
3,773
5,054
При р =
i
—127,5
. —118,6
— 109,5
—100,3
—90,9
—81,4
—71,7
—61,8
—51,6
—40,8
—29,4
—16,4
0,7
22,8
49,9
73,1
90,0
= 60 бар
s
2,887
3,000
3,108
3,211
3,311
3,407
3,499
3,590
3,681
3,773
3,867
3,971
4,097
4,260
4,450
4,608
4,798
СР
1,799
1,818
1,838
1,860
1,886
1,915
1,953
2,005
2,081
2,205
2,422
2,824
3,482
4,808
5,485
3,837
2,338
0
1,936
2,250
2,642
3,140
3,781
4,624
5,760
7,343
9,654
13,27
19,64
33,66
—
—
—
—
—
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
Р !
0,9060
0,8853
0,8637
0,8411
0,8177
0,7932
0,7676
0,7406
0,7121
0,6813
0,6475
0,6086
0,5612
0,5015
0,4274
0,3494
0,2509
V
1,1038
1,1296
1,1579
1,1889
1,2230
1,2607
1,3028
1,3502
1,4044
1,4678
1,5445
1,6431
1,782
1,994
2,340
2,862
3,986
При р =
i
—126,8
—117,9
—108,8
—99,6
—90,3
—80,9
; —71,3
—61,6
—51,6
—41,2
—30,2
—18,0
—3,7
13,7
34,5
55,6
| 90,0
= 70 бар
s
2,882
2,994
3,102
3,205
3,304
3,399
3,490
3,580
3,669
3,758
3,849
3,945
4,056
4,184
4,325
4,470
4,692
СР
1,792
1,810
1,828
1,849
1,872
1,897
1,930
1,973
2,035
2,134
2,296
2,557
2,942
3,518
4,187
4,168
2,770
Р
1,906
2,210
2,587
3,061
3,666
4,450
5,489
6,901
8,889
11,84
16,56
25,17
—
—
—
—
—
Продолжение табл. XII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
р
0,9077
0,8872
0,8659
0,8437
0,8206
0,7967
0,7717
0,7456
0,7182
0,6890
0,6575
0,6225
0,5814
0,5328
0,4757
0,4129
0,3058
V
1,1017
1,1271
1,1549
1,1853
1,2186
1,2552
1,2958
1,3412
1,3924
1,4513
1,5209
1,6064
1,720
1,877
2,102
2,422
3,270
При р =
i
—126,0
—117,2
—108,2
—99,1
—89,9
—80,4
—70,9
—61,3
—51,5
—41,3
—30,7
—19,1
—6,1
9,0
26,3
44,2
78,4
= 80 бар
s
2,877
2,989
3,096
3,198
3,297
3,391
3,482
3,570
3,657
3,745
3,833
3,924
4,025
4,138
4,257
4,378
4,597
СР
1,786
1,802
1,819
1,838
1,858
1,881
1,909
1,945
1,997
2,078
2,200
2,395
2,649
2,992
3,373
3,622
3,029
3
1,878
2,171
2,533
2,986
3,558
4,290
5,245
6,514
8,249
10,71
14,39
20,38
31,56
—
—
—
—
О © 4^4^0000tO tO >— .—¦ о О © © ОС GO --J
ОО СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
ОО О©О©О ©©©О© © © © О ©
4^ СЛ СЛО> ©О) О) ^"-^VlVlOo OOOOOOOOCD
©СО ^J©CO©CD >— 4^ © GO — СО ©^4 СО >—
00© 4^ -J -<! © tO -4 >— СЛ 00 ^- С04^СЛСЛСЛ
C75^J 4^tO00©CO 4^ --J 4^ ©>— ь- СЛ 4* © tO
— 00 vH5 0lCn^ СОСОСОЮЮ tO •¦— •— •— ©
СОСЛ 4^ 4^ © © 4^ © 4^ © © © О -4 4^ »~ ©
4^00 — --J 00 — 4^ СООООООЮ © © tO © tO
СЛ© © tO © tO © 4^KD4^©^J
III Mill I I I I I
СЛЮ »— >—tOOO 4*. © ©© -4 00 © >— >— •—>
p© еонрр^ ©©©oooo j<i©©b-to
loco ©ел ©oo о © 4^ Vj cd 1— to toF^i0
to •— ^4
4v 4* 4^4^000000 COCOCOCOCO © © © tO tO
СЛ© >— Ю^СЛЧ © >—© 4*- © © ~vj -J © _
4^ © •— © >— -*4 © © 4* >— ©00 -4 >— >— О) О
to to to to to to *- ~f~~~ Г*ГТ*Г*Г~
V*4^ ooto^— ob ©00000000 ooVjViVjVi
00© Юь-н-ЮО) и- 00 СЛ CO to ©© 00 -O ©
СЛ00 ^-©4^0000 OOCO©-^tO © © 4^ tO ¦—
00 ^ J— © -v3 © СЛ 4^ CO 00 tO tO ЬО ^
I I WVco © to to 00 Vi "н-ЬЬоч
I I h— O© >— tO © CO © © 4» © tO *— ©
*- 4^ © © © © 00 4* >— 4* ©
СПСЛ 4» 4^ © © tO tO •— — © © © © © 00 -4
©© сл©сл©сл ©сл©сл© слослосл
о© ©©©©© ©©©©© © © о© ©
СО V ©© ©©© Vj Vj Vj Vj 00 00 00 00 00©
CDC0 CO -О >-- 4^ -v) О tO © -<1 О ND*."vlcD-
O^J >— CO — 4^ 4* tO © 4^ © © ОH0С-н-
Ч>- © 4* tO © © -4 © © © © © © Ю О -—
СЛ© © -4 © © 4^ 4* © © tO tO (О — >— — ©
tO © 004^СОСЛ00 tO "Ч tO © 4* •— -04^tO©
— СО ©4^©н-Ю СО — 4^ tO 4s. ©00©tO~-4
4* © н- >— -vl 00 00 tO 4^ tO © ©
III Mill
-a 00 © © > _
CO
OOtOOO 4^ ©© -«4 *4 00 CD *— — >—
O- h-h-000 ООЧО^-ЬО
- 00-V4T-V ©ooPF1^
© 00 СЛ
о
о
I
*
J± #*. 4^ 4* CO CO 00 CO CO 00 CO CO CO 00 CO to tO
4^ tO ">—©CDOOOO VjCT>CnVco tO "^-©©00
сл-g ^^oo©o to © © © -ч 00000040
-ч •— © © to >— © *- -a to ©© сооелоо-ч
to to юьо toto to „TTTT"* 'ТЧТТ*
00 00 ©СЛ СО~н-о ©©©ЪоОО 00 00 00 Vj Vj
-400 00©tO-sJ© © © О -4 © CO 1— OOC'-s)
4* tO tO © О О tO tO -4 © © tO 4^00COCO4^
to •— •—
© СЛ >— © j^j СЛ 4* 4* 00 tO tO tO i—
I I СООСЛ ©ToOOOOO 00004* ©00
I I ^-COt0 4^00-4tO©©4^COCDtO
© 4* О © © tO004^00CO
0)СЛ 4^4^COCOND tO >— >— © © ©©0000-^1
©© СЛ©СЛ©СЛ ©СЛОСЛО СЛОСЛО©
oo ©poop о о op© р>а>р><э<э
coV елслел©© ©ViVjVjoo 00000000©
СЛСЛ © © © © © © tO © -<1 © tO 4* © © О
© © -4 © -a 4* © о © о © © © © © © ©
СЛ© © © -4 © © >-сО^ЧО СЛ tO © >— 4*
© *- ©00©©© 4^COCOtOtO tO^-h-MO
>— © ©©-O^J© 000000004^ •— 00 © tO ©
© © © © W © © © >— tO © © 4* *- tO 4* ©
СП 4* ©4^-4tO© WOOO^O)
cw^ Ml Mill Mill
00--J ь— СЛ -<1 >— W 4^©©-^I^ 00 © >— ^— H-
, © •—' и- м- •— O© © 00 © >— tO
^1 © ©
CDCO©©-<l-- . . . .^
00© 4^©©©© Ю4^--
© ©CO
©CO To^-* O©00 ViQ5 СЛ Vco tot—OCD00
©© tototototo to^
0>— ©©4^tO>— ©©©00© ©©©^1-<1
KD4^ 4^©©©tO W©tO©© 4^ tO >— © ©
©-J 4^00004^00 ©©h-o© © © >— СЛО
tO •— >—
4*" j4 tO © <J © СЛ 4^ CO tO tO tO J—
ЬЬч ^^x— оt—. VcoVt-oo
oo©oo соочю^ ел •— oo © ©
CD4^©4^© ЧСЛОЗ^О
05 СЛ 4^ 4^ СО СО tO tO — — О О СО СО 00 00 -<1
ОО СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
ро ррррр ррррр ррррр
СЛ05 05 0»05^<1~^ ^vJ^J^300 00 00 00 00 СО СО
ЧЮ 4^ 05 00 — СО СЛ -О СО — СО СЛ-vlOOOtO
СЛ Ю СЛ 00 СО — — tO tO tO •— — — О СО 00 О»
¦^J-Ч О>О^)СЛС0 — — н- СО <1 СО -^ 00 СЛ --J
-vJOJ СЛ 4^ 4*- 4* СО WtOtOt-OtO — — — >— о
WO 4^ СО СЛ 0 05 tO СО СЛСО О Ч4^ЮОЧ
ЧО СОЧОСЛС5 СО СЛ tO — tO 4ь. 00 'СО О СО
СЛСО СЛ Ю СЛ 05 СО "Ч СЛ СО 00 —
^ю~ I I I I I I I I I I I I I
ОО ООСО^ю С04^СЛО><1 00 СО СО •—' •—'
к>Ь ЬЬООЯРО 00^СЛ4-СО Ю-СОО-
СЛСО OOCOOOOi-4^tOCO- -
ело
4». 4*. 4*. со со со со со со со со со coeocototo
— О О СО 00 <1 V] 0> СЛ V CO CO Ю — О СО 00
СО ^ ОСОСЛООО СО СЛ -<1 СО — tOCOCOCOtO
00 — — »— 00 4^ СО 4*- 05 -<1 05 tO 4^ О 00 О CO
COCO СОСООООООО 00 -О -О -<| ~^ ~^ -<1 -vl -J -<|
ООСЛ Ю О 00 СЛ СО 0 0040H) СЛ ^ 4^ W Ю
00»— 00 СЛ — 05 — СО СО СЛ -Ч — CO--JOC003
СО J-J О) СЛ СЛ Ф- 4* СО СО tO tO ЬО — н-
to со со о to "ел oV о о со о оосл
tO 00 СЛ СЛ ЧСОООО*>. СЛ tO 4*. О СО
— СО О 05 ~-JO>toOiO СЛ СЛ СО tO СЛ
^3
•^5
а
><
C75 СЛ 4^ 4^ СО СО tO tO |— — О О СО СО 00 00 -<1
ОО СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
ОО ООООО ООООО ООООО
СЛО» 05 05 05 Оэ"--1 VjVl^ooOO 00 00 00 "со СО
4^ О ЮСЛ-ОСОЮ 4^02000tO 4*. 05 00 О to
Ю>- ~v) >— СЛ 00 О — tO СО 4^ СЛ СЛ СЛ СЛ 4^ СО
— СО ОСДЮ^СО *<1 СО 00 О) tO СЛ СЛ — СО О
00 СЛ елСЛ4^4^СО COCOtOtOtO — — — — О
tOO» СОСОООСООО 4^ — -J 4*. — 00 СЛ Ю О 00
— со ел ел — оо оо оо о ел to — to ел со ел со
4^4^ СО00000000 -4 4*> 00 00 4*.
20,9
42,1
4,104
4,238
о о
СО 4^
— ^J
1 1
1 1 1
— >— to to
о о о о со
Ъ> "tO tO СО "со
4^ СО СО СО СО
О СО 00 00 V)
СО СЛ 00 О tO
— ^4 — СЛСО
О СО СО 00 00
— -J СО СО О)
г* р т^ р
1 O СО СО 00
1 о со -^ со
СО — н-
Mill
СО 4^ СЛ О» *vl
СО 00 -v| р ОЛ
"to "со "со со "to
со со со со со
О» СЛ ^. *. СО
ел ~-а со — to
Ю 4^ 4^ tO -J
00 00 ~^l -^ -O
CO — CO 00 -J
05 CO -J 05 00
СЛ СЛ 4*. CO CO
00 "o CO "-<! tO
CT5 4^ CO CO CO
сл^-чсоо
— 118,9
—110,4
—101,7
—92,9
—84,1
со со со to to
"to — о "со "оо
00 4^ 4^ 4^. CO
00 СО СЛЮ 4*.
-О -^ -q -Ч -<1
О» О) СЛ 4*. СО
СО — СО СЛ -^ |
to to to — —
"¦<! V —' 00 СЛ
СО СО tO О» 4^
со ел ^ -^ ~-д
~.
СЛ
"CD
С5 ел 4^ 4^ со со to to — I—оо со со оо оо -о
ОО СЛОСЛОСЛ ОСЛОСЛО СЛОСЛОСЛ
рр ррррр ооооо ооооо
"слел "о> "о> "о> о» "-g VjVjVjVa оо "оо "оо "оо "со со
— -4 ОСОСЛООО СО СЛ -*1 СО — 00 05 000-
ил ^ со — оо со -^ о to ел ел оо соооосо
tO-<l СО^СОСЛЮ Ю00ОЮФ. СЛ — СО О —
CO^sJ О» СЛ СЛ 4^ 4* COCOtOtOtO — — >— н— о
4^4^ СЛ 00 — СЛ — СЛ tO СО СЛ tO СО СЛ СО •— 00
— О 05 СО СО СО 4^ СО 00 О 4^ tO н- tO СЛ — 00
— о 4^ со coco о to ел со — о
IN I I I I I I I I I I
4*. Ю — — tO СО 4^ф.СЛО)Ч 00 СО — — —
СЛ ЬС ^— О О О О О СО 00 ^ О) СЛ ^ О — tO
to оо "ел"ел"со"-чЪ> —^"слсл ел о> сл-^]0^0
4^. tO 00
4^ 4^. 4^ СО СО СО СО СО СО СО СО СО СО СО СО KD tO
"to— "о"со"со"оо"-<j "ел"ел"елV"со "to — "о"со"оо
оо4^ слоооюел -о со — to 4^. слелслсл4^
44^ -vJOOCOCO- COCOtOOOtO Ю-4004^СЛ
to to to to >
P5
><
tO— H-OCOCOCO 00000000-O -J^4-4^-<I
4^.00 ЮСЛСО^О ЧФ.ЮОСО 00-<lO5Cn4^
COCO O>CO00-^14=- OCOCOCOOO ^1^4-<I00CO
CO — CO -q pi СЛ 4^.^ CO ND tO tO — —
"•<i"to"co"oo bVsoV "со"ел"to"со"-<j
— 000005 — CO 4*. CO 4^. СЛСЛЮСОО
слю оо to — ел со ючооон-
2
ex
225 бар
II
к
a
QQ.
ЬО
-
а
Q.
0
b^
CO CD CD CD CO
^f CD CO CO N
—Г —Г со" со" со
СО 00 ^f О CD
СО СО СО тр "Ф
N n nn n
Q) _н 00 *-l 00
«—' СО —1 —| СП
CD О г— CS СО
СМ СО СО СО СО"
CD
О 00 CD О СО
—| CD 00 00 Ь-
Mill
CD СО О ~ч Ю
Ю 00 СО N СО
CD г-* Tf CD CD
Ю СО N 00 CD
CN^lOCON
—i CD N Ю CO
CD 00 00 00 00
o" o" o" o" o"
О Ю О Ю О
00 00 CD CD О
00 CD О -Ф CD
CD —< CO О ^
CN N CM 00 т?
CO CO т^^Ю
CO CD О CD Ю
ЮЮЬООО
NN NN 00
^(NON^
00 CD Tf —i CD
CO^f Ю CD CD
CO CO CO CO" CO"
COlONOOlO
со" ^ф" ю" со" n"
CD Ю *Ф CO CO
1 1 1 1 1
CO rf О О 00
-нО^СОСО
СОЮ 00 -н ^
со со со coco
00 NN СО Ю
00 CDO —i СО
—< CD 00 CD Tf
СХ) Ь-l> l>^ t^
о" о" о" о" о"
ю о ю о ю
О ~ —1 СО СО
6,175
7,002
7,960
СО СО -н N CO
СО Tt« CD N CD
00 00 00 00 00
^Ф N 00 CD CO
COCOONS
N 00^ CJ5 CD^ O^
CO CO CO CO t?
CD
—< CDOO О
1 1 -w
N
CO С0Ю —' --<
00 CO CD —* CD
CO CO N 00 О
CO CO CO —' О
CO О 00 CD Tf
^ ^ Ю ^ ^
o"o"o"o"o"
о ю о ю о
СО СО rf 'Ф Ю
1
1,912
4,166
39,3
674
0,5974
о
CD
с*.
CD Ю Ю О "Ф
00 CD СО —< СО
CD 00 —i "Ф N
OON-ЮО
N N CO —• CD
О Tf CD Tf CD
—< —i CO CO CO CO CO CO *Ф "Ф
Ю CO CD
LO"cd"n"
со n со оо со ою^ьсо
—< т-ч CO CO CO CO^IO^OO
|>~ t~— t— С— t— C^-b-t^-t^l>-
CD r-л CO CO "Ф Ю
N 00 00 00 00 00
CD О CD 00 Ю 00 00 Ю ^ "Ф
О —< О CD 00 CD^CMON
CD N CD ^f CD OO
тр i-h 00Ю —' CO
N 00 00 CDO —'
CO CO CO CO CO C0COCOCOC0 CO CO CO 00 'Ф Tf
* CO COi CD t* CD
00
^ CO <D 0_ CO N O^ CO ^ ID
О СО" N CD О" 1—" СО" ^f" ю" CD , . .. .
—< CD 00 N N СОЮ^ООСО —ЮО^ОО 00
Mill Mill II "«эт
CO CD 00 CD CO CD CO О О rf CDO
-МЮФЮ —< CD 00 OQ CD CO 00 00 О 'Ф rf
CD r~> CO Ю 00 —< CO CD CD CO CD CD CO 00 CO CO
О ,-н r-, —. ,-н CO CO CO CO CO СОСО-^^Ю CD
Tf CD ^ —¦ 00
CD CD О CO CO
»-< CD 00 CD 'Ф
CD 00 00 00 00
CO CD CD 'Ф CO
Ю CD 00 О CO
CO О 00 N Ю
00 oo N N N
CD CO Tf N CO
CO Ю Ю Ю CD
N N CD CD CD
OOOOO OOOOO OOOOO
оюоюо юоюою оюоюо о
00 00 CD CD О О—'—'CO CI COCO^ThlO CD
><
Tf CD CO Ю —• г-" CD 00 00 CD —< О —i
COCOlOOCD -н(?IЛ00 1Л N^00
соооосою о>сч:соою cdcd^co
—h" *S со" со" со" со" со" со" "* -ф ю" ю" о"
СО N СО N СО 00 rf СО СО "Ф CD Ю ^—н Ю О
О О -н —' СО СОСО'ФЮСО N00OOO -н
N N N N N NNNNN NNN 00 00 00
00 CD Tf CD СО Ю "^t1 «—i CD CD О CD N CO N CO
CD CD CD 00 N Ю CO *-< 00 Ю CO CD CD CO CD —«
00 05 О »-H CM СО^ЮЮСО l>- N 00^ CD^CD^ *~*
co"cJcococo co"cococo"co coco"co"coco ^"
CD
CO
O^lONOO О^СО^Ю СО^^Ю.°1 °1
—^ CD 00 N CD СОЮ^СОСО —' N CO —' О GO
II II I II I II II -CT °
t^t^-CD—^CO OOO'-hCON
CDt^CDCOC^ С000СО-ФС0
00 О CO Ю t4- О CO Ю 00 —*
О —. i—' —< ^н CO CO CO CO CO
CD Tf CO
'Ф N CO CO CO CO
^N^lOO) 00
COCO^^^t Ю
CON—'CO^f ЮОО—'СОСО
О СО Ю N CD —i CO CD 00 —<
СООООСО-Ф СО *—' CD N CD
CD CD 00 00 00 QOOOhNN
N О CD CO 00 -и
CO CO N 00 CD CO
Tf CO О 00 CD CO
N NN CD CD CD
OOOOO OOOOO OOOOO О
ОЮОЮО ^-O CD\^a>lT^ ОЮОЮО О
00 00 CD CD О O-^-'CMCN CO CO ^f "Ф Ю CD
4D
300 бар
II
о.
к
о.
оо.
о.
ьо
.-
»
О.
Ч<
К
Ю 00 СО О СМ
00 СО Г"- —' t-
to t>- о см ^
^Г^-Г^-Гсм см
^ 00 СО СО 00
Ф0H0-н
со со г^ с^- о-
00 00 СО ^О
00 00 00 Ь- СО
MQO^h CM_
см см" со со" со
о
о см ^*ioV
-н 05 00 h- со
1 1 1 1 1
СО 00 СМ СО ОЗ
CM CM rf СО ОЗ
ооо см ^ со
О3 00Ю —| 00
COCO 0> CM rf
СМ О 00 Г-~ Ю
ОЗ О) 00 00 00
о" о" о" о" о"
оюоюо
00 00 ОЗ ОЗО
СМ СМ -<05 00
СО 00 СО О ^
Г- О^ ^ СЮ СМ
см" со" со со" ^"
00 ^ СМ О 00
—• СМ СО П« tjh
t^ о t^ t^ с-.
CM —' \>- CM ^
со" со" со" со" со"
^1 ОЭ — ^ t^
оо" о" —<" см" со"
Ю Tf rf СО СМ
1 1 1 1 1
^ ОЗ Ю r-i Oi
О) ^н rf t-~ аз
—« см см см см
Tf CO CM Tf СО
h- о со со аз
СО СМ О 00 СО
00^ 00 00 t> Г-
о" о" о" о" о"
ю о ю о ю
О г-« г-, СМ СМ
4,662
5,148
5,691
t^. со аз Tf <o
Ю со со t^ h-
с— г— t— с— t-—
rf см аз со со
r-t 00 ^ -Н t^
t> О; оо аз^ аз^
со" со" со" со" со"
—14,9
—6,0
3,1
12,3
21,5
tj«0 —'Ю
оо аз см оо со
см ю аз см со
00 СО СО ^ ^f
00 00 ^ О —
см ю оо о см
Ю СО —| О 00
о" о" о" о" о"
оюоюо
СО СО "* Tf Ю
I
ILL']
4,090
39,2
,547
0,6464
о
СО
аз см со со Tf аз оо —• оо аз non
со -< о см со см —' оо со см —н^о
ю^ t^ аз ^ со со ел см io аз^ со_ t^ см
—Г —Г —^ см" см" см" см" со" оо" со" тр ^" ю"
i i i
со о ю о ю о со см аз ю -н ю оо —• см
оо аз аз о о —н —н см см со -^ ^t4 ^ ю ю
СО СО СО h-Г- Ь- t-~ Г- h- t— Ь- О- t>- О- h-
оооосмсоаз о оо ^ аз —< о Is- со со г-- о
t^t^o-co^f сооооюсо t^ со со аз ю ь-
оо аз о ^н см со ^ ^ ю со r^ t^ оо осз аз^ о^
см" см" со" со" со" со" со" со" со" со" оо" оо" со" со" оо" "*
^t^cMt^cM ^-^юазсм ю
сооо"аз"о"см" ео^0!^00- °°
_ ю^сососм —h^tjhcocm аз
; | | | | | | || -««
—i о со -ф аз -н о i>- о см ю со со ю см
оо оо оо о см соо-^ою со см со i>- см оо
t^ аз —• ^ со оо —< оо со оо -h^no^ r-i
о о —< —| —• —и см см см см со со со ^ ^ ю
^ оо аз аз аз —-^азсою соосмю^ оо
t^-о со со аз со со аз со h* ^юооосо оо
см^аз^ю ^cnocon со п< см -ч оэ ю
азаз^оооооо^ oq^oq^oo^t^t^ t^t^t^t^co co^
о" о" о" о" о" о" о" о" о" о" о" о" о" о" о" о"
аз ^ со со аз со со оо о со ^ см
ю^^соо моюоосм аз о i i i
CD СЮ О CN Ю l^ CD СО_ О О^ С000 | | |
—Г —Г см" см" см" см" со" оо" со" т? т^ ^
см t^- со оо со аз^азсо^ азо^^о^
ооооазазо о —< —' см см смоооососм
СО СО СО СО h- t-~ h- Ь- t-. Ь- С^ t^ t-- Г- l>-
00 CM CM t-- 00
CO СОЮ СО —'
030 i—i CM CO
CO CM !>¦ 00 CO
аз t^ ti« —< oo
со -^ ю со со
см ir^ аз оз —.
о оо оо азо
см" со" со" со" со" со" со" со" со" со" со" со" со" оо" т?
оо^азг^аз Tf оо см со о
оо" о" —Г со" -* со" о-" аз" о" см"
OOOOh-СОЮ ^f СО СМ СМ -н
I I I I I Mill
сою со см со
rf ir^tO СМ Ю Ю О СМ г-1 аз »-н СМ ОО 00
со со -"Ф со оо *-н ю аз rf аз nconoo
о^союь о см ^ t-- аз смюоосмоз
О —« —• г-, г-4 СМ СМ СМ СМ СМ 00 00 00"^^
сооюазю сосоюазсо ю^со*-*—<
т^ оо —^ -^ оо см со о ^f аз со t^ о ¦«*< —м
1—< аз оо со ^f со "-• о со со ю со см о t>
СЛ 00^ СО 00^ 00^ 00^ 00 00^ t>- t^ h- h- Г^ О-^ СО
о" о" о" о" о" о" о" о" о" о" о" о" о" о" о"
юоюою оюоюо юоюоо
оо аз аз о о —< »-^ см см со со^^юсо
Q5 СЛ 4^ 4^ СО 00 tO Ю — >— OOCDCOOO
о о ел о ел оелоело елоелосл
о о о о о о о о о о о о о о о
Vj V] V) <J Vj Vj 00 00 00 00 00 00 00 "CD CD
О 00 4^ 05 -4 CO О •— 00 4^ 05-vl СО О tO
н_ ,— (j> к— G5 ОСЛСООООО 00 00 4^ СО СЛ
00 СО "^ 05 00 "^1 О 00 СО 05 0>С04^С005
4^ 00 00 00 tO tO tO tO >— — >—>—>— о О
tO 05 00 >— 00 O54^t0C0-<l СП CO •— CO 00
4^ 05 CO CO 00 4^ tO О CO 00 4 ^ 00 CO О
CO 00 N0 О >— -^ CO СЛ tO 4^ СОООН-ОФ-
4^tO~ I I I I I I I I I I
O0 05 00 CO •— <1 •— tO 00 4^ 4^ СЛ 05-v| 00
слЬ-Vato Ь^РГ Р^Я^^
Q5 и- 05 >— ел со со -<i о
4^00 00 0000 OO 00 00 00 00 00 CO CO 00 tO
о oo oo "-о Vj 05 ел ел ~4^ со To to T— о со
О СО ОО -Ч >— 4^ 00 •— 00 05 00 О tO O0 00
ОООСЛСЛОО СО tO tO СО 4^ 05 05 tO tO СО
0505050505 0505050505 0505050505
^1 00 00 СО СО СО СО СО СО СО 00 00 -«О 05 05
>—¦ 4^ 00 tO 05 00 00 00-sj CO 00ь-слСО4^
00 00 00 00 tO tO ЬО ND К) *-* ^— *-
| I СоЪ 00000054^ ЮО00О5СЛ
• ' О »— 4^ CD 05 00 •— »— •— 00 -V] tO
4*. СЛ СО СО О СО -4 >— 00 00 tO О
съ
I
С75СЛ4^4^СО 00 tO tO •— >— OOCDCOOO
о о ел о ел оспосло слослоел
о о о о о о о о о о о о о о о
05 Vj Vj Vj Vj Vj Vj oo oo oo oo oo oo со "со
CD Ю СО СЛ 05 00 CO •— tO 4^. СП--4 CO О tO
tO CO 00 4^ CO 00 00 00 00 00 00 4^ О 05 tO
>—ОСЛО»— CD 05 CO 00 4^ 00 4^ tO >— О
4^00000000 tOtOtOtO— >-*>—>—>— О
4^ 00 СЛ tO О -vl СЛ tO О 00 05 4^ tO О 00
споо4^050 ел to со-<» ел 4^0000004^
OtO>— 00 tO 05tOCn4^-vl 4^ 05 4^. -<l 05
4>ю~ I Mill I I I I I
tO СП 05 00 О 00 >— tO CO 4^ СП СЛ 05 -<1 00
-<1 СЛ 4^- tO •—' CO 00 05 СП
4^. 4*> 00 00 00 00-
4^. CO 4^-CD 4^ 00 tO 05 О
4^ CO 00 00 00 00 CO 00 00 00 00 00 00 00 tO
o^oooVjVi bcnoiVw юю"*—oco
>— О 4^ 00 tO O5C0tOCn-^ CD •— 00 4^ 4^
05 ^4 CO 00 СП и-00 00 О 4^ 05 05 tO tO CD
СТH5ЧЧЧ *-J-^^^405 0505050505
00 CO О О О ООООСО СО00 00ЧСП
СЛ050Ю4^ O5CH4^tO00 tO 05 О 4^ СО
4^ СО СО 00 00 tO ЬО JO tO н- н- >—
I I I "—оо слюо^сл оо осовел
I I I 05 4^ 4^ 05 О СЛ tO OCOOtOO)
•— н- 05 СО 00 СО 4^ tO 4^ н- СЛ СО
ооооо ооооо ррррр
05 "¦<! Vj "-О "-О "-О "-<1 00 00 00 00 00 00 СО СО
СО — tO 4^ 05 ЧСООЮСО СПО500О —
•— СО СО СП I— 05 »— *-4 tO 00 СО СО СП tO 00
-О -Ч ^ CD 05 00 СО >— 4^ О 00 -4 СО •—' 4^
4^4^.00 00 00 to tO tO tO •— >— — *- >— о
ООЧ^ь- 00 О 00 — СО Ч4^ЮО00
Ч>-0000 ^4 tO СО СЛ 00 I—СО 00 00 00
tOCn05>— 0000ОС04^ ООООООСЛСО
*ю~ I I I I I I Mill
н- 4^ СЛ 05 "—' н-н-IOW^ СП О "<i ^1 00
слЬслЬоо РЯ^Р^ S^-PPF
4^005ь-С5 >— 05 >— СЛ СО
4^00 00 00 00 ОО 00 00 00 00 00 00 00 00 tO
О СО 00 00 -О
oo to о о оо
4^ tO 00 tO 00
05 05 СЛ 4^ СО
¦<| ОСО 05 00
оо ел ел н- сл
СО tO — О СО
о to 4^ ел ел
^4 О) tO tO 00
¦<| -sj -vj -4 -vl -О ^J -<1 -<J -<J 05 05 05 05 05
О и- и- и- >— >— h— >— О О CO CO 00 00 -vl
oo h—ф. сп сл ел со н— оо оо -vi to 05 о ел
4^ 4^ 00 00 00 tO tO tO tO и- >— »—
I 4^ О Vj^^-00O5 "^^"СОЧЬ
I СП CO 05 05 -41 CO 4^ О -О 05 00 i—
00 00 00 tO 00 CO tO i— 05 CO >— О
0\
><
Продолжение табл. XII
Т, °К
90
95
100
105
НО
115
120
125
130
135
140
145
150
160
р
0,9137
0,8984
0,8833
0,8683
0,8537
0,8392
0,8251
0,8111
0,7972
0,7832
0,7689
0,7547
0,7403
0,7110
V
1,0945
1,1131
1,1322
1,1516
1,1714
1,1916
1,2120
1,2329
1,2544
1,2768
1,3006
1,3250
1,3508
1,4066
При р =
i
—72,8
—64,5
—56,1
—47,7
—39,3
—30,8
—22,3
—13,9
—5,5
2,8
11,2
19,5
27,9
44,7
= 450 бар
s
3,023
3,112
3,196
3,276
3,353
3,428
3,501
3,571
3,638
3,702
3,763
3,823
3,880
3,987
СР
1,664
1,670
1,677
1,684
1,689
1,693
1,693
1,693
1,691
1,688
1,683
1,678
1,673
1,658
Э
1,623
1,779
1,948
2,128
2,319
2,519
2,728
2,946
3,174
3,416
3,677
—
—
Продолжение табл. XII
Т, °1\
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
Р
0,9174
0,9024
0,8875
0,8729
0,8585
0,8444
0,8306
0,8169
0,8034
0,7897
0,7758
0,7620
0,7478
0,7194
V
1,0901
1,082
1,1267
1,1456
1,1648
1,1842
1,2040
1,2241
1,2448
1,2663
1,2890
1,3123
1,3373
1,3900
При р —
i
—70,9
—62,6
—54,2
—45,8
—37,4
—29,0
—20,5
—12,1
—3,8
4,4
12,8
21,1
29,4
46,0
475 бар
s
3,014
3,108
3,186
3,266
3,343
3,418
3,491
3,561
3,627
3,691
3,752
3,812
3,869
3,976
ср
1,659
1,666
1,673
1,681
1,686
1,689
1,689
1,688
1,685
1,680
1,675
1,669
1,662
1,646
Р
1,577
1,725
1,883
2,051
2,229
2,414
2,607
2,808
3,017
3,239
3,476
—
—
Продолжение табл. XII
г, °к
90
95
100
105
110
115
120
125
130
135
140
145
150
160
р
0,9209
0,9062
0,8916
0,8773
0,8632
0,8494
0,8359
0,8227
0,8093
0,7960
0,7824
0,7685
0,7547
0,7273
V
1,0859
1,1035
1,1215
1,1399
1,1584
1,1772
1,1963
1,2157
1,2356
1,2563
1,2781
1,3012
1,3250
1,3750
При р =
i
—69,0
—60,7
—52,3
—48,9
—35,5
—27,1
—18,7
—10,3
—2,0
6,2
14,4
22,7
30,9
47,4
= 500 бар
s
3,005
3,094
3,177
3,257
3,334
3,409
3,482
3,551
3,617
3,681
3,743
3,802
3,860
3,966
СР
1,655
1,663
1,670
1,678
1,683
1,686
1,686
1,683
1,679
1,673
1,667
1,660
1,651
1,684
0
1,534
1,673
1,822
1,980
2,146
2,319
2,498
2,683
2,876
3,079
3,297
—
—
Глава VI
вязкость жидкого воздуха
И ЕГО КОМПОНЕНТОВ
/Динамическая вязкость криогенных жидкостей является
одной из основных характеристик, необходимых для расчетов установок
глубокого охлаждения. Тем не менее до сих пор не были составлены
подробные таблицы значений вязкости жидкого воздуха и его компонентов
в интервале температур от тройной точки до критической при достаточно
высоких давлениях. Полученные разными авторами немногочисленные
экспериментальные данные часто существенно расходятся между собой,
и поэтому не все опытные величины могут быть положены в основу
таблиц. В настоящей работе на основании ограниченного числа наиболее
надежных опытных данных установлены некоторые закономерности
поведения коэффициента динамической вязкости и составлены таблицы значений
вязкости жидких азота, кислорода, ар^\"- 1: воздуха, которые могут
быть использованы при инженерных расчетах.
VI. 1. Экспериментальные данные о вяз:/.ости
жидких азота, кислорода, аргона и воздуха
Количество работ, в которых приведены опытные данные о вязкости
жидкого воздуха и его компонентов, весьма ограничено. К тому же
большинство экспериментаторов исследовали вязкость рассматриваемых
жидкостей лишь в со^^янии насыщения.
Первую попытку измерить вязкость жидкого воздуха предпринял
Форш [152], который методом Пуазейля получил значение ц = 33 X
X 10~4 г/(см -сек) при нормальной температуре кипения. Позднее Фершаф-
фельт и Никез [153] методом колеблющегося шара получили существенно
отличающийся результат — г\ = 16,78-Ю-4 г/(см-сек) при температуре
79,57° К для состава: 63% N2, 35% 02 и 2% Аг. В работе [153]
приведены также значения вязкости технических азота и кислорода, но только
при одной температуре для каждого вещества.
Более обширные исследования вязкости компонентов воздуха в
жидком состоянии выполнили Н. С. Руденко и Л. В. Шубников [154]. Ими
получены значения коэффициентов вязкости жидких азота, кислорода
и аргона, а также окиси углерода в интервале температур от нормальной
точки кипения до тройной точки. Был применен метод Пуазейля,
позволяющий получить абсолютные значения вязкости и не требующий знания
других свойств вещества (за исключением плотности). Вискозиметр системы
Убеллоде находился в цилиндрическом сосуде Дьюара, закрытом
герметичной крышкой; необходимая температура достигалась откачкой паров
охлаждающих жидкостей (технических азота и кислорода). Для
облегчения регулирования температуры сосуд с вискозиметром был погружен
во второй сосуд Дьюара, заполненный жидким воздухом. Для измерения
температуры использован кислородный конденсационный термометр,
помещенный вблизи вискозиметра.
172
Жидкость в вискозиметре находилась под давлением, превышающим
давление насыщения примерно на 150 мм рт. ст., что предотвращало ее
кипение. Давление создавалось с помощью газообразного водорода,
содержащегося в двух баллонах. Авторы [154] указывают, что
растворимость водорода в исследуемых жидкостях незначительна и его присутствие
не влияет на точность измерений.
В опытах были использованы три вискозиметра с капиллярами
диаметром 0,0786; 0,0774 и 0,0718 мм и длиной 30,7; 32,4 и 34,2 мм
соответственно. Вязкость определялась при различных перепадах давления, при
этом длительность перетекания жидкости изменялась от 6 до 30 мин,
а погрешность измерения составила 0,2 сек. Каждое значение вязкости,
приведенное в работе [154], представляет собой осредненный результат
трех — пяти измерений.
При использовании метода Пуазейля надежность опытных данных
существенно зависит от точности измерения диаметра капилляра. Эта
величина входит в формулу для расчета вязкости в четвертой степени.
Поэтому Н. С. Руденко и Л. В. Шубников с целью контроля точности
определения геометрических размеров вискозиметров дополнительно измеряли
вязкость жидкости, хорошо исследованной экспериментально. Один из
вискозиметров был прокалиброван с помощью этилового эфира при
температуре 20° С, причем опытное значение его постоянной, принятое
авторами [154] в качестве истинного, отличалось от рассчитанного на
основании геометрических размеров всего на 0,25%. С помощью этого
вискозиметра была тщательно определена вязкость жидкого кислорода при
нормальной температуре кипения (с учетом термического расширения
прибора); остальные вискозиметры калибровались с помощью жидкого
кислорода.
В работе Н. С. Руденко и Л. В. Шубникова экспериментальные
данные представлены в таблицах и на графике, построенном в координатах
вязкость-температура. Для азота приведено восемь опытных точек в
интервале температур 63,9—77,3° К, для кислорода — 16 точек в интервале
54,4—90,1° К и для аргона — четыре точки при 84,2—87,3° К.
Погрешность своих данных авторы [154] оценили равной 1,4%, однако указали,
что при наиболее низких температурах погрешность могла возрастать
в связи с неточным измерением температуры кислородным термометром
(в тот период отсутствовали надежные сведения о зависимости давления
паров кислорода ниже 10 мм рт. ст. от температуры).
В дальнейшем Н. С. Руденко [155] измерил вязкость жидких азота,
кислорода и воздуха, а также метана и этилена в состоянии насыщения
при более высоких температурах — вплоть до близких к критическим.
Примененный в работе [155] вискозиметр был спроектирован с
использованием метода колеблющегося цилиндра. Исследуемое вещество
находилось в медном баллоне, рассчитанном на давление 60 кГ/см2\ в этом же
баллоне был помещен алюминиевый цилиндр, подвешенный на стальной
нити диаметром 0,2 мм. Первоначально цилиндр отклонялся от
положения равновесия с помощью магнита, для чего в цилиндр был запрессован
железный крестик. Колебания системы наблюдалисьус помощью
закрепленного на нити зеркальца и шкалы.
Прибор был помещен в сосуд Дьюара, заполненный пентаном. В
сосуде был также размещен змеевик, через который продувался холодный
воздух с целью регулирования температуры. Некоторые температурные
точки были получены с помощью сжиженных азота, кислорода и
водорода. В интервале 9i—169° К температура измерялась с помощью
метанового и этиленового конденсационных термометров, погрешность
измерения составляла 0,2 град.
Метод колеблющегося цилиндра использован в работе Н. С. Руденко
как относительный. Вискозиметр калибровали с помощью сжиженных
азота, кислорода, метана и водорода при атмосферном давлении, а также
173
с помощью кислорода при пониженном давлении, которому
соответствовала температура 77,35° К. Значения вязкости первых трех веществ
были определены ранее Н. С. Руденко и Л. В. Шубниковым [154, 156]
абсолютным методом; для водорода использованы данные других авторов.
Исследованные в работе [155] вещества получены из технически
чистых газов конденсацией в ловушку с последующей разгонкой; воздух
предварительно очищался от влаги и двуокиси углерода. Количество
примесей в полученных жидкостях не превышало 0,1%.
Во всех опытах давление поддерживалось примерно на 0,5 кГ/см2
выше равновесного давления пара с целью исключения возможности
кипения жидкости при небольших отклонениях температуры. В процессе
измерений время, в течение которого амплитуда колебаний уменьшалась вдвое,
изменялось от 17 до 240 сек; амплитуды составляли 4;6 и 8°. Период
колебаний был равен 3,4 сек и оставался постоянным для всех исследованиях
жидкостей.
В результате экспериментов были получены пять опытных точек для
азота в интервале температур 90,1 —111,7° К, шесть для кислорода при
111,0—154,2° К и пять для воздуха при 90,1 —126,4° К.
Экспериментальные данные представлены авторами в таблицах и на графике, построенном
в координатах т), Т. В таблицах для азота и кислорода приведены также
значения вязкости при нормальной температуре кипения, полученные
ранее в работе [154] и использованные автором [155] при калибровке
вискозиметра. Как и при использовании большинства относительных
методов, точность определения вязкости в работе [155] в значительной
мере зависела от надежности опытных данных о веществах,
применявшихся при калибровке. Поэтому, по мнению Н. С. Руденко, вероятная
погрешность полученных им данных составляет 2%.
С. Ф. Герф и Г. И. Галков [157, 158] измерили вязкость некоторых
сжиженных газов и их смесей в интервале температур от тройной точки
до нормальной точки кипения. В работе [157] получены данные об азоте,
а в [158] — о кислороде и смеси азот — кислород двух составов. При этом
был использован метод Пуазейля, который, как отмечают авторы [157],
имеет строгую математическую теорию, прост в конструктивном
отношении и не требует больших количеств исследуемых жидкостей.
Применявшийся в опытах вискозиметр не мог быть использован для абсолютных
измерений, так как длину капилляра нельзя было определить с
необходимой точностью. Поэтому С. Ф. Герф и Г. И. Галков проводили измерения
относительным методом, прокалибровав вискозиметр с помощью воды
при температурах 18—22° С.
Вискозиметр Убеллоде был помещен в герметически закрытый сосуд
Дьюара, заполненный охлаждающей жидкостью (при температурах ниже
90,1° К — жидким кислородом). Температура регулировалась откачкой
паров охлаждающей жидкости и могла поддерживаться постоянной с
погрешностью ±0,2 град. С такой же точностью измерялась температура;
при экспериментах с азотом, кислородом и их смесями для этой цели
использовали кислородный конденсационный термометр.
Исследуемые вещества подвергали осушке и многократной разгонке
под вакуумом. Чистоту их проверяли химическим анализом, она
составляла 99,8%. В процессе эксперимента измеряли разность давлений Ар
и продолжительность перетекания жидкости т. Коэффициент вязкости
исследуемой жидкости ц рассчитывали по формуле
где т]0 — принятое значение коэффициента вязкости воды;
(ДртH — произведение разности давлений на продолжительность
перетекания при калибровочных экспериментах для воды.
174
Результаты экспериментов представлены [157, 158] в таблицах и на
графиках; для азота приведено семь опытных точек в интервале
температур 66,2—77,3° К, для кислорода — шесть при 64,4—90,1° К. В
работе [158] получены также три значения вязкости для смеси 80,4% N2 —
19,6% 02 в интервале температур 68,1—77,7° К и четыре значения для
смеси 40% N2—60% 02 в интервале 68,4—76,8° К. С. Ф. Герф и Г. И. Гал-
ков сопоставили полученные значения вязкости азота с результатами
Н. С. Руденко и Л. В. Шубникова. Из приведенного в работе [157]
графика видно, что при температуре 77° К обе группы данных согласуются
вполне удовлетворительно, однако при Т ^ 66° К расхождение достигает
примерно 8%, причем результаты [154] завышены. Погрешность своих
опытных данных авторы [157] оценили равной 1%, но действительная
погрешность, по-видимому, выше, так как использованные в работах [157,
158] при калибровке вискозиметра значения коэффициента вязкости воды
ниже новых справочных данных [122] на 2,5%.
Одновременно с авторами рассмотренной работы [158] Ван
Иттербик и Ван Пэмел [159] также измерили вязкость жидкого кислорода в
состоянии насыщения в интервале температур 69—90° К. Был использован
метод колеблющегося диска (относительный вариант); вискозиметр
калибровали с помощью кислорода при нормальной температуре кипения на
основании опытных данных Н. С. Руденко и Л. В. Шубникова [154].
Позднее Ван Иттербик, Цинк и Ван Пэмел [160] определили вязкость
жидких азота, кислорода, аргона и водорода методом колеблющегося
диска, использовав метод как абсолютный. Диск диаметром 17,5 мм и
толщиной 1,94 мм был подвешен на платиновой проволоке диаметром 0,12 мм\
колебания системы наблюдались при помощи зеркала и шкалы. Данные
об азоте и аргоне получены в интервале температур от тройной точки до
нормальной точки кипения и о кислороде — при 70—90° К; к сожалению,
они представлены только в виде графиков. Оценка точности опытных
данных в работе [160] отсутствует, однако Ван Иттербик и соавторы
сопоставили их с ранее полученными данными [154, 159] и отмечают, что для
кислорода и азота большинство опытных значений согласуется в
пределах 1%, а для аргона новые данные выше результатов Н. С. Руденко
и Л. В. Шубникова на 1,5—3,5%.
Метод колеблющегося диска был использован также Форстером [161,
162], измерившим вязкость жидких неона, аргона и азота в состоянии
насыщения. Автор указывает [161, 162], что эксперименты для азота
проведены в интервале температур от тройной точки до критической, а для
аргона — от тройной точки до 116° К; чистота этих веществ составляла
99,8%. Основной целью работы являлось, по-видимому, исследование
вязкости неона, поэтому Форстер привел в таблице лишь часть опытных
данных о двух других веществах A0 точек для азота в интервале
температур 66,55—121,1° К и 8 — для аргона при 85,38—113,8° К). Погрешность
опытных данных оценена равной ±2%. Форстер отмечает, что полученные
им значения вязкости азота при температурах выше 95° К отличаются от
данных Н. С. Руденко [155], которые существенно завышены (до 18%).
Выполненное нами (см. VI.2) сопоставление подтверждает это и в то же
время дополнительно показывает, что мнение автора об
удовлетворительном согласовании полученных им данных об аргоне с результатами
[154, 160] не вполне обоснованно, так как расхождения
достигают 8%.
Одновременно с работами Форстера опубликована статья Буна и
Томаса [163], посвященная исследованию вязкости жидких кислорода,
аргона, криптона и метана. Вязкость определялась методом Пуазейля;
диаметр капилляра 0,3 мм, длина 150 мм. Вискозиметр был помещен
в криостат, в котором поддерживалась постоянная температура с
погрешностью 0,01 град. Жидкость в вискозиметре находилась при
давлении насыщения. Чистота исследованных веществ составляла 99,98%;
175
она определена с помощью масс-спектрометра, а также измерением
давления паров в тройной точке.
При экспериментах измерялось время протекания определенного
объема жидкости и определялась относительная величина кинематической
вязкости, причем в качестве единицы измерения принята вязкость аргона
при температуре 88,98° К. К сожалению, абсолютное значение вязкости
аргона в работе [163] не указано, что несколько затрудняет использование
полученных данных. Значения вязкости кислорода получены в интервале
температур 75,35—91,57° К (8 точек), аргона — 83,94—88,98° К F
точек); погрешность опытных данных Бун и Томас оценили равной 1%.
Несколько позднее Сайи и Кобаяши [164] разработали оригинальную
методику одновременного измерения вязкости, плотности и
поверхностного натяжения жидкости и применили ее для исследования свойств
аргона и кислорода. Принципиальная особенность сконструированной ими
установки заключается в использовании чувствительной электрической
схемы с индуктивным датчиком. С помощью этой схемы при измерении
плотности методом гидростатического взвешивания определялась
выталкивающая сила, а при измерении поверхностного натяжения — сила
взаимодействия жидкости с платиновым кольцом. Вязкость в установке
измерялась методом капилляра, при этом жидкость вытекала из
измерительной камеры под действием собственного веса через капилляр
диаметром 0,1 мм и длиной 40 мм. Уровень жидкости последовательно проходил
через два узла, находящиеся на расстоянии 3 мм друг от друга на медной
проволоке диаметром 0,08 мм, которая соединяет индуктивный датчик
с кварцевым поплавком (используемым для определения плотности).
Благодаря поверхностному натяжению жидкости в момент прохождения
узлов изменялась сила, действующая на проволоку, что регистрировалось
датчиком; таким образом измерялось время истечения определенного
объема жидкости.
Этот метод измерений является относительным. Авторы калибровали
установку с помощью жидкого кислорода, данные о свойствах которого
опубликованы другими исследователями; в частности, при измерениях
вязкости были использованы данные Н. С. Руденко и Л. В. Шубни-
кова [154].
В работе [164] приведены данные о плотности, поверхностном
натяжении и коэффициенте динамической вязкости аргона в интервале
температур 84,10—86,85° К и кислорода в интервале 80,07—87,50° К (по пять
опытных точек для каждой жидкости). Точность полученных данных
в статье не оговорена. Заметим, что значения плотности жидких кислорода
и аргона, приведенные в рассматриваемой работе, систематически выше
рассчитанных нами по уравнениям состояния (на 0,55—0,65%). Это
объясняется, по-видимому, тем, что Сайи и Кобаяши при калибровке
установки использовали завышенные значения плотности кислорода.
Рассмотренные выше работы посвящены определению вязкости
жидкого воздуха и его компонентов при давлениях насыщения или весьма
близких к ним. Гораздо больший теоретический и практический интерес
представляют исследования вязкости этих жидкостей в более широкой
области параметров; к сожалению, число таких работ незначительно.
Первое исследование в указанном направлении выполнили Б. И. Вер-
кин и Н. С. Руденко [165], изучавшие вязкость азота и аргона при
постоянных плотностях и различных температурах методом падающего
груза. При проведении экспериментов в широком интервале температур
и постоянной плотности давление достигало нескольких тысяч атмосфер,
поэтому измерительная трубка была помещена внутри толстостенной
бомбы. Трубка, бомба и падающий цилиндрический груз были
изготовлены из бериллиевой бронзы; внутри груза был запрессован столбик
из магнитного сплава. Прибор помещен в сосуд Дьюара; в качестве
охлаждающих жидкостей применяли азот и кислород.
176
Падающий груз приводился в движение поворотом сосуда Дьюара
на 180° вокруг горизонтальной оси; прохождение груза между двумя
фиксированными сечениями измерительной трубки регистрировалось с
помощью двух индукционных катушек, присоединенных к зеркальному
гальванометру. Груз имел длину 12 мм и наружный диаметр 3,970 мм,
радиальный зазор между ним и трубкой был равен 0,015 мм.
Продолжительность падения груза измерялась секундомером с погрешностью
0,2 сек и составляла от 20 до 100 сек. Исследуемые вещества до поступления
в вискозиметр подвергались дистилляции с последующей разгонкой.
В работе [165] вязкость измерялась относительным методом.
Первоначально определялось время падения груза т0 при температуре
насыщения вещества, т. е. для условий, когда известен коэффициент
вязкости г] 0 по данным [154]. Затем температуру повышали и снова измеряли
время падения груза xt. Значение коэффициента вязкости на изохоре при
температуре опыта рассчитывали по формуле
% = *]oVTo- (99)
Полученные Б. И. Веркиным и Н. С. Руденко экспериментальные
данные представлены на графике в координатах текучесть—температура.
Для азота, помимо кривой насыщения, нанесены четыре изохоры:
р = 0,861; 0,832; 0,798 и 0,753 г! см3, для аргона — только изохора
р= 1,41 г/см3. Максимальная температура в опытах составляла
примерно 290° К. Погрешность определения коэффициента вязкости, по
утверждению авторов, не превышала 2,5%.
Дальнейшие исследования в этой области были выполнены Н. Ф.
Ждановой [166], которая измерила вязкость жидкого и газообразного азота
в интервале плотностей 0,38—0,746 г/см3 и широком диапазоне
температур (от кривой насыщения до 290° К). В работе [166] использован
вискозиметр Б. И. Веркина и Н. С. Руденко; для регистрации
продолжительности падения груза применялись поочередно гальванометр и усилитель
с осциллографом. Как и в исследовании [165], азот перед опытами
подвергался многократной дистилляции для удаления примесей. Плотность
азота при его конденсации в вискозиметре определялась на основании
табличных данных о зависимости р' = / (Ts) *; погрешность определения
температуры конденсации, по мнению автора, не превышала 0,5 град.
Н. Ф. Жданова проводила эксперименты в более широком интервале
плотностей, чем предыдущие исследователи [165], и для части
исследованных ею изохор не была известна вязкость азота в состоянии насыщения.
Вероятно, по этой причине в работе [166] значения коэффициента
вязкости на изохоре при температуре опыта вычислялись по формуле
% = Ло^ (Р — Р/У^о (Р — Ро), A00)
где т]0 и ро — вязкость и плотность азота при температуре 18° С и
атмосферном давлении;
т0 — продолжительность падения груза при этих условиях;
к]0 pt, xt — аналогичные величины при параметрах опыта;
р — плотность материала груза.
Так как р0 <g p, то формула для расчета вязкости несколько
упрощается:
4t = Ло^(Р — РД/тоР- (Ю1)
Экспериментальные данные [166] представлены на трех графиках
в координатах 1/т), Т\ г], P и In г], IIТ. Масштаб графиков мал, и по ним
нельзя надежно определять значения вязкости. Правда, точность опытных
данных невысока( максимальная погрешность оценена автором равной 6%),
и это в какой-то мере оправдывает графическую форму их представления.
* В работе [166] не указано, какие литературные данные использовались при этом.
12 Зак. 1978.
177
На графике в координатах 1/т), Т из одиннадцати представленных
изохор четыре заимствованы Н. Ф. Ждановой из работы Б. И. Веркина
и Н. С. Руденко, в которой имеется аналогичный график. Однако при
сопоставлении наблюдаются существенные расхождения на этих изохо-
рах, заметные даже при малом масштабе. Например, при р = 0,798 г/см3
и критической температуре значение 1/rj в работе [165] равно
800 см-сек/г, а в [166] — 990 см-сек/г; при р = 0,832 г/смг и Т = 100° К
эти значения соответственно равны 630 и 760 см-сек/г и т. д. В работе [166]
не указывается, что при построении графика данные Б. И. Веркина
и Н. С. Руденко были скорректированы, поэтому причины расхождений
неясны.
В результате анализа экспериментальных данных [165, 166]
Н. Ф. Жданова заключила, что при плотности менее двух критических
вязкость увеличивается по мере повышения температуры, а при более
высоких плотностях — уменьшается. Построенные в работе [166]
изотермы вязкости азота в зависимости от плотности при р > 2ркр все
заметнее отклоняются друг от друга, причем более низким температурам
соответствуют большие значения (дг\/др)т. Этот вывод представляет
некоторый интерес, однако невысокая точность опытных данных [166] и
обнаруженное на графиках несоответствие заставляют критически относиться
к нему. В дальнейшем мы вернемся к рассмотрению этого вопроса при
сопоставлении экспериментальных данных о вязкости азота, полученных
разными авторами.
Метод падающего груза был применен также Робинсоном [167],
исследовавшим вязкость азота, аргона и гелия при низких температурах
и высоких давлениях. В отличие от исследований [165, 166] в
рассматриваемой работе опыты проводились при постоянной температуре, а
давление создавалось с помощью ручного масляного насоса. Вискозиметр был
калиброван как при низких температурах, так и при высоких давлениях.
Об азоте и аргоне получены данные при температуре 90° К и давлениях
до 1400 и 280 атм соответственно, а также на изотермах 195 и 298° К
при давлении до 2000 атм. Экспериментальные данные, погрешнбсть
которых оценена равной 10%, представлены на графиках в координатах rj, p;
масштаб графиков чрезвычайно мал.
Некоторые данные о вязкости жидких азота, аргона и воздуха
получили Г. П. Филиппова и И. П. Ишкин [168, 169], экспериментировавшие
в интервале температур —183-^-0° С при давлении до 150 атм. Эти авторы
применили сравнительный метод определения вязкости. Сущность его
состоит в том, что вещество последовательно протекает по двум
капиллярам. В рабочем капилляре вещество движется при заданных параметрах,
в сравнительном — при комнатной температуре и давлении, близком к
атмосферному. Кинематическая вязкость vt определяется на основании
известной вязкости v2 в сравнительном капилляре по уравнению
vx = F v2Apx/Ap2, A02)
где Дрь Ар2 — перепады давлений в капиллярах;
F — постоянная прибора, найденная авторами [169] в
результате проведения многих калибровочных опытов;
таким образом, был сделан переход к относительному
методу измерений.
В кратком сообщении [168] приведены сглаженные значения
коэффициента динамической вязкости воздуха и аргона в указанной выше
области параметров; для жидкой фазы каждого вещества имеются лишь
несколько значений вязкости при давлениях 50; 100 и 150 кГ/см2. В более
подробной статье [169] представлены графики зависимости динамической
вязкости от температуры при различных давлениях, а также
экспериментальные значения коэффициента кинематической вязкости трех веществ.
Для жидкого аргона приведено в общем 16 опытных точек на изотермах
178
—183 и —140° С в интервалах давлений 50—141,2 атм и 35,8—150,7 атм
соответственно. Для азота при температуре —183° С и давлениях 34,5—
149,2 атм дано 10 значений v, для воздуха при той же температуре и
давлениях 42,9—120,9 атм — 4 значения (данные, полученные для этих
веществ при —140° С и более высоких температурах, относятся к газовой
фазе). Максимальная погрешность определения кинематической вязкости,
по оценке авторов [169], составляет 3%. Однако при построении изотерм
вязкости в зависимости от давления по данным [169] отклонения
некоторых опытных точек от кривых, проведенных по большинству точек, в 2—
3 раза превышают указанную величину.
И. Ф. Голубев и сотрудники [170] выполнили обширное
исследование вязкости азота в интервале температур —195,8-^0° С при давлениях
до 500 атм\ при этом получен ряд опытных данных о жидкой фазе.
Измерения проведены методом капилляра с помощью стеклянного
вискозиметра, помещенного в сосуд высокого давления. Продолжительность
протекания определенного объема вещества через капилляр определялась
по длительности перемещения равновеликого объема ртути между двумя
электрическими контактами. Исследованный азот содержал лишь
незначительную примесь кислорода (менее 0,01%). Авторы [170] обработали
экспериментальные данные в координатах цРу Т — %, р; опытные точки
сгруппировались вокруг обобщающей кривой'с разбросом ±2%, не
превышающим возможной погрешности измерений. Используя полученную
обобщенную зависимость «избыточной» вязкости от плотности, И. Ф.
Голубев и соавторы составили таблицу значений коэффициента вязкости азота
при круглых температурах и давлениях для исследованной ими области
изменения параметров.
Недавно Ван Иттербик, Цинк и Хеллеманс [170а] измерили вязкость
жидких азота и кислорода при давлениях до 25 кГ/см2 методом
колеблющегося диска, использованным как абсолютный. Аппаратура, примененная
в этой работе, подобна описанной ранее Ван Иттербиком и
соавторами [160], но несколько усовершенствована применительно к
экспериментам в области повышенных давлений. Диаметр и толщина
колеблющегося диска были такими же, как в работе [160], но диаметр платиновой
проволоки уменьшен до 0,05 мм. Для азота получены данные на изотермах
70,10; 77,25; 83,97 и 90,16° К, для кислорода — 77,26 и 90,14° К.
Результаты экспериментов представлены в таблице C4 точки для N2 и 14
для О2) и на графиках в зависимости от давления.
Рассмотренными работами исчерпываются известные нам
экспериментальные исследования, в которых получены данные о вязкости жидкого
воздуха и его компонентов. Гораздо больше работ посвящено измерению
вязкости рассматриваемых веществ в газообразном состоянии.
Некоторыми авторами получены опытные данные о газе при высоких
давлениях; они могут быть использованы при построении обобщенной кривой
Дг] = / (р) в интервале плотностей, соответствующих плотностям
жидкости. Вязкость газообразного азота довольно подробно исследована
при высоких плотностях (до 2,4 критической) в работах Михельса и Гиб-
сона [171], И. Ф. Голубева и В. А. Петрова [172], Макита [173], Росса
и Броуна [174], Лазара и Водара [175], Вермесса, Джоанн и Во-
дара [176]. Опытные данные о кислороде при плотностях до 1,7
критической получили И. Ф. Голубев и В. А. Петров [172] и Кияма и
Макита [177]. Вязкость аргона при сверхкритических плотностях измерили
И. Ф. Голубев и В. А. Петров [172] и Михельс, Ботцен и Шурман [178],
вязкость аргона и воздуха — Макита [173]. Перечисленные работы
проанализированы в монографии [70].
Результаты большинства экспериментальных работ использованы при
проверке различных уравнений, характеризующих вязкость жидкости,
и составлении таблиц значений вязкости жидкого воздуха и его
компонентов.
12*
179
VI. 2. Обзор методов расчета вязкости
жидкости и уравнения для определения
вязкости рассматриваемых веществ
Ввиду отсутствия общей теории жидкого состояния до настоящего
времени не разработаны строго обоснованные методы расчета вязкости
жидкости.
Первую попытку создать теорию вязкости жидкости предпринял
Егер [179, 180], который ввел понятие «идеальной жидкости» (состоящей
из абсолютно твердых шарообразных молекул) и для объяснения
внутреннего трения в ней воспользовался теми же представлениями, что и для
газа. Согласно теории Егера вязкость жидкости должна увеличиваться
по мере возрастания температуры. Но этот вывод противоречит опытным
данным, он является следствием механического перенесения
представлений, характеризующих газ, на жидкость, которой присущ иной
механизм передачи количества движения от слоя к слою.
В отличие от вязкости газов, в которых энергия передается при
столкновениях хаотически движущихся молекул, вязкость жидкостей
обусловлена существованием сил межмолекулярного взаимодействия. В газах
при повышении температуры увеличивается энергия молекул, а
следовательно, и внутреннее трение; в жидкостях же при этом условии
уменьшаются силы взаимного притяжения молекул, что приводит к уменьшению
вязкости.
Бриллуэн [181] и М. Ф. Широков [182] попытались вывести
зависимость вязкости от температуры, рассматривая течение вязкой жидкости
как волновой процесс и используя представления, разработанные Дебаем
для объяснения свойств твердого тела. Однако предложенная ими
волновая теория вязкости жидкостей не позволяет достичь
удовлетворительного согласия данных расчета и эксперимента.
Многие авторы на основании общих теоретических соображений или
в результате обработки экспериментальных данных предлагали
экспоненциальную зависимость вязкости жидкости от температуры:
т) = Аев/Т, A03)
где А и В — постоянные, определяемые по опытным значениям вязкости.
Это уравнение, часто приписываемое Андраде [183], отображает с
точностью эксперимента данные о многих жидкостях при низких давлениях
и температурах, не превышающих нормальную температуру кипения.
Андраде [184] рассмотрел проблему расчета вязкости жидкости
исходя из того, что при температурах, близких к температурам
кристаллизации, многие свойства жидкости мало отличаются от свойств твердого
тела. Андраде предложил несколько более сложную зависимость
1
т) = Ср 3eDp/Ty A04)
где С и D — постоянные.
По теории Андраде коэффициент С пропорционален частоте
колебаний частиц жидкости. При проверке уравнения A04) по
экспериментальным данным отклонения в большинстве случаев не превышали 2%.
В монографии Рида и Шервуда [185], в которой рассмотрены наиболее
распространенные методы расчета термодинамических и транспортных
свойств веществ, отмечается, что для описания зависимости вязкости
от температуры предложено много соотношений, но ни одно из них не
обладает заметными преимуществами по сравнению с уравнением A03).
Однако Г. М. Панченков [186] справедливо подчеркнул, что это
уравнение при постоянных Л и В не может отобразить экспериментальные
данные на кривой насыщения в широком интервале температур, так как
180
зависимость lg ц — / (-f-j для состояния насыщения не является
линейной.
Пользуясь методами статистической механики, Эйринг [187] развил
теорию абсолютных скоростей реакций, получившую название теории
активного комплекса. Теория была положена Эйрингом и
сотрудниками [188, 189] в основу расчета коэффициента вязкости жидкостей.
По мнению этих авторов, элементарным процессом течения жидкости
является переход молекул из одного положения равновесия в другое,
при этом преодолевается потенциальный барьер между положениями.
Энергия активации, характеризующая взаимодействие частиц жидкости,
затрачивается на увеличение пространства между соседними молекулами,
куда может поместиться движущаяся молекула. Уравнение для расчета
вязкости, полученное на основании теории активного комплекса, имеет
вид
±Н - TaS
ц^Ае *т , A05)
где А — постоянная величина;
R — газовая постоянная;
АН и А5 — энтальпия и энтропия активации.
Исходя из связи между энергией активации вязкого потока и энергией
испарения жидкости и введя ряд допущений, Эйринг получил
окончательное уравнение для вязкости жидкости:
1 3 дР
~о" ~о~ исп
г] = 1,090-103 м2 т е п*т , A06)
где М — масса молекул;
V — мольный объем;
п — коэффициент, равный 3 для сферически симметричных
молекул и —4 для полярных молекул;
А?исп — внутренняя энергия испарения жидкости, АЕИСП = LHCn —
— pAV (здесь LHcn — теплота испарения; AV — изменение
объема).
Проверка уравнения A06) по опытным данным показала [190], что
с его помощью можно достаточно надежно определить коэффициент,
характеризующий зависимость вязкости от температуры, но расчетные
значения вязкости имеют существенную погрешность (до 300%).
Некоторые положения теории Эйринга близки к положениям,
выдвинутым Я. И. Френкелем [10, 191], который, основываясь на сходстве
теплового движения частиц твердого тела и жидкости при температурах,
близких к температурам кристаллизации, вывел уравнение, определяющее
вязкость жидкости,
ц-^Аеи/кт, A07)
где А — постоянная, характеризующая период колебаний частиц около
положения равновесия;
U — энергия активации;
k — постоянная Больцмана.
Общим для теорий Эйринга и Я. И. Френкеля является
предположение о механизме вязкого течения как о перемещении молекулы в «дырку»,
связанном с преодолением потенциального барьера. Однако методы
расчета различны, поэтому множитель А в уравнениях A05) и A07) имеет
разный физический смысл.
Я. И. Френкель предложил ряд зависимостей для определения А
и U, что позволило получить правильный порядок величины вязкости,
но не ее достоверное значение [186]. В дальнейшем Н. Ф. Жданова [166]
181
проверила справедливость уравнения A07) в широкой области
параметров, используя экспериментальные данные о вязкости азота [165, 166].
Из приведенного в статье [166] графика видно, что при плотностях свыше
двух критических и докритических температурах соблюдается линейный
характер зависимости In ц =/A/Т) на изохорах, проведенных по опытным
точкам. При температурах, превышающих критическую, изохоры
искривляются, что свидетельствует о неприменимости уравнения A07) к газу.
Угол наклона изохор в координатах In r), 1/T, численно равный энергии
активации, уменьшается по мере уменьшения плотности; величина
отрезка, отсекаемого на оси ординат при линейной экстраполяции изохоры,
также зависит от плотности. Следовательно, при использовании
уравнения в форме A07) для расчета вязкости жидкости в широкой области
параметров нельзя принимать А и U постоянными; они являются функциями
плотности. Для нахождения этих функций и установления пределов
применимости уравнения A07) необходимо располагать достаточным
количеством экспериментальных данных, более надежных, чем указанные
в [166].
Довольно простое эмпирическое уравнение, связывающее текучесть
сжиженных газов ф = 1/т) с приведенной температурой т = Т/Ткр,
получено в работе Н. С. Руденко [192]:
Ф=-?(Зт-1), A08)
где а — постоянная.
Это уравнение соответствует опытным значениям [154—158], но после
появления данных на кривой насыщения при температурах, близких
к критической, установлено, что оно справедливо лишь в ограниченном
интервале температур [166].
Рассмотренные выше теоретические и эмпирические уравнения,
отражающие зависимость вязкости жидкости от температуры, не могут
быть использованы для расчета вязкости в обширной области параметров.
Более перспективным является представление экспериментальных
данных в зависимости от удельного объема или плотности, что позволяет
описать эти данные в достаточно широкой области температур и давлений
сравнительно простыми аналитическими выражениями.
Связь вязкости с удельным объемом была впервые установлена
в работах А. И. Бачинского [193, 194], который нашел, что между
значениями удельного объема и текучести жидкости существует зависимость
v = b + C<p9 A09)
где b и С — постоянные.
Заменив текучесть вязкостью, можно преобразовать формулу A09)
к виду
ч = т=ь- <110>
Качественное обоснование уравнения А. И. Бачинского состоит в том,
что вязкость жидкости, обусловленная взаимодействием молекул, должна
зависеть от удельного объема. По мере его возрастания увеличивается
расстояние между молекулами, следовательно, уменьшаются силы
сцепления и вязкость.
Проверка уравнения A09), выполненная автором с помощью опытных
данных Торпа и Роджера [195] для 66 жидкостей, показала хорошие
результаты. В дальнейшем многие исследователи проверяли
уравнение А. И. Бачинского и установили, что оно плохо соответствует опытным
данным при температурах, близких к тройной точке, а также данным для
ассоциированных жидкостей [186]. Исследуя применимость уравнения
при высоких давлениях (порядка нескольких тысяч атмосфер), Г. М. Пан-
ченков обнаружил, что для отображения опытных данных Бриджмена
182
[196] значение С должно существенно изменяться по мере изменения
давления.
В своей монографии [186] Г. М. Панченков проанализировал работы
многих исследователей, пытавшихся теоретически доказать зависимость,
установленную А. И. Бачинским (работы М. Ф. Широкова [197],
А. С. Предводителева [198], Герцога и Кудара [199], А. Д. Гольдгам-
мера [200] и Б. М. Гугеля [201]). Г. М. Панченков отметил, что эти
авторы не опирались на предварительно высказанные предположения
о механизме течения и структуре жидкостей, а подбирали механизм
течения с целью получить в итоге уравнение А. И. Бачинского. Ни одному из
исследователей не удалось теоретически строго вывести уравнение A09),
хотя они использовали различные исходные положения и методы решения
задачи.
Несмотря на теоретическую необоснованность уравнения A09), мы
намеревались применить его для расчета вязкости жидкого воздуха и его
компонентов, учитывая, что оно удовлетворяет экспериментальным
данным для многих жидкостей и к тому же имеет простой вид. С этой целью
первоначально были определены значения удельного объема жидкого
азота по уравнению состояния G2) при всех температурах и давлениях,
при которых представлены опытные данные в работах [154, 155, 157,
162, 169, 170], и графически построена зависимость между значениями
текучести и удельного объема. Из рис. 25 (верхняя кривая) видно, что
при удельном объеме выше 1,27 дм3/кг (со <2,7) опытные точки И. Ф. Го-
лубева и соавторов [170] и часть точек Г. П. Филипповой и И. П. Иш-
кина [169] группируются вокруг прямой с разбросом, не превышающим
3%, но при меньших значениях v данные отклоняются от линейной
зависимости. По данным Н. С. Руденко [155] и Форстера [162], которые
существенно расходятся как между собой, так и с результатами работ
[169, 170], могут быть проведены отдельные прямые, не соответствующие
большинству опытных данных, представленных на графике. Для
интервалов v = 1,12 + 1,21 дм3/кг и 1,21 -*¦ 1,27 дм31кг можно составить отдельные
уравнения в форме A09), однако на границах интервалов не будет сохранен
плавный характер изменения вязкости в зависимости от удельного
объема. Таким образом, с помощью уравнения А. И. Бачинского можно
описать значения вязкости жидкого азота далеко не во всей области
параметров, исследованной экспериментально.
А. С. Предводителев опубликовал ряд работ [202—204],
посвященных выводу уравнений для расчета вязкости и теплопроводности
жидкостей, где на основании различных предпосылок получены некоторые
модификации формулы A09). В статье [202] был использован метод
адиабатических инвариантов и критерии механического подобия;
полученное таким путем уравнение для расчета вязкости аналогично
уравнению (ПО). В работе [203] выведены формулы для коэффициентов
переноса жидкостей и сжатых газов на основании предположения, что эти
коэффициенты можно представить как сумму, в которой первое слагаемое
вычисляется в соответствии с кинетической теорией газов, а второе —
на основе модели жидкости как упругого континуума. Полученное в [203]
уравнение для расчета вязкости имеет вид
где Ъ и С — постоянные.
Позднее В. А. Соловьев [205] обнаружил в работе [203] ряд спорных
физических предпосылок и математических неточностей. По мнению
автора [205], хорошее согласование величин, рассчитанных по
уравнениям А. С. Предводителева, с опытными не свидетельствует о
теоретической обоснованности уравнений, а лишь является следствием того, что
они содержат постоянные, определяемые с помощью экспериментальных
183
3~
<5а
_Q \
V
!
J
Ч> I
с\
1
0
\р
-О г
°\ 1
-0
л°
^ INj С^ ^- Ц^ ^О
1 1 I I I I
о > a • о <
О
io
*0
н>
top
о
\
>
а D Ч>
Р D
\
>
о
о
о
о
^ ^
\
\
\
N
0
>
о
N 1
%
о
[ °
>
а
N
\
\
\
\
1с
&
"ho 1
О
о
^
CD
СЗ
« Ч
н 2
л о
н &
о л
о
S к
S
о
Я Р"
гз ^
Sets
\с
о
>=* со
со с<
Q. Я
л О) 'S . . „ д
и о. о | ю S
\о
е1
I §l|1-So
данных, и к тому же близки по форме к эмпирическим зависимостям
А. И. Бачинского и Вебера (для теплопроводности).
В дальнейшем А. С. Предводителев [204 ] рассмотрел вопрос о
тепловом движении в жидкости, исходя из идей Дебая о спектре собственных
колебаний ограниченного тела. В статье [204, № 8] на основании
концепции блуждающих волновых пакетов (сумм волн сжатия) выведена формула,
названная автором обобщенной формулой А. И. Бачинского,
С
(v — b) vr
ч = - I ,v. • <112)
Уравнение A12) в работе [204] не проверялось, вероятно, потому, что
оно отличается от ранее полученного и проверенного уравнения A11)
только отсутствием слагаемого r\t.
Нами проверена применимость уравнения A12) для описания опытных
данных о вязкости жидкого азота. С этой целью были построены (см.
I ±
рис. 25) величины —гг- = фр 3 в зависимости от удельного объема.
Из нижней кривой видно, что уравнение A12) не имеет преимуществ
перед уравнением А. И. Бачинского с точки зрения охвата широкой
области параметров одним уравнением.
В упомянутой ранее монографии Г. М. Панченкова [186], помимо
критического анализа различных теорий вязкости жидкости, развита
собственная теория, основанная на сравнительно простой
квазикристаллической модели строения жидкости. Г. М. Панченков вывел уравнение,
выражающее зависимость вязкости от температуры и плотности:
ц = зущу^ м Vt^*4i
4 18/ __ 8 \2
RT
A13)
где R — универсальная газовая постоянная;
vM — собственный объем молекул;
М — их масса в расчете на одну грамм-молекулу;
N 0 — число Авогадро;
е — энергия связи молекул жидкости, рассчитанная по теплоте
испарения в вакууме.
Расчеты, выполненные по уравнению A13), давали правильную
картину зависимости вязкости жидкости от температуры, однако
расчетные значения rj в ряде случаев отличались от опытных на 10—20%.
Впоследствии Г. М. Панченков для повышения точности
уравнения A13) ввел в него вероятностный множитель /s [206], а в работе [207]
получил уточненное уравнение для расчета вязкости жидкости
ЗА 2~ 5_ _4_ J_ Sp / __ 8о \
12 VR 1 / Vm яд 6 Зт2г Л«Г 1 RT \ /11/14
11 = V"^ V ~W 9 Т fse [1-е J. A14)
Уравнение A14) отличается от A13) не только наличием множителя /s
и величиной коэффициента перед ]/7? ( /— я^ 3)^5,09 вместо 3 ]/б ),
V V я
но и тем, что 1 — е~?о/^т фигурирует в первой степени, а энергия связи е0
выражается через теплоту испарения жидкости при абсолютном нуле.
Вероятностный коэффициент /s определяется по формуле
fs = eAS/R, A15)
где As — изменение энтропии при образовании одной связи (в расчете
на 1 моль).
В работе [207] предложена зависимость, позволяющая определить As
на основании значений энтропии идеального газа и насыщенного пара,
теплоты испарения и общего числа связей в грамм-молекуле жидкости.
185
Для практического использования уравнения A14) Г. М. Панчен-
ков [207] представил его в виде
_± _!
г) = Л'р 3 Т 2e*JRT (l - e*'/RT), A16)
где через А' обозначены остальные сомножители. Предполагая, что /'
и, следовательно, А' практически не зависят от температуры, Г. М. Пан-
ченков на основании двух опытных значений вязкости, выбранных при
различных температурах, рассчитывал А' и е0, а затем определил
значения коэффициента вязкости для остальных опытных точек. При этом
условии погрешность расчетных значений вязкости не превышала
нескольких процентов.
Позднее А. П. Торопов и Г. А. Бродская [208] высказали сомнения
в справедливости допущения о независимости Л' и е0 от температуры.
Отвечая им, Г. М. Панченков [209] подчеркнул, что найти зависимость А'
от температуры затруднительно; при расчетах в узком интервале
температур А' принималась постоянной, поэтому отклонения от
экспериментальных данных достигали нескольких процентов. В то же время Г. М.
Панченков не согласился с методами, примененными авторами [208] для
доказательства зависимости энергии связи г0 от температуры.
Переходя к общей оценке уравнения A14), можно вполне согласиться
с мнением Бретшнайдера [210] о том, что не все величины,-входящие
в это уравнение, могут быть легко и достоверно определены. Это
ограничивает применение уравнения Г. М. Панченкова.
Наиболее строгие теоретические методы исследования явлений
переноса проанализированы в известной монографии Гиршфельдера, Кер-
тисса и Берда [16]. Из рассмотренных в ней теорий явлений переноса
в плотных газах и жидкостях наиболее пригодна для практического
использования теория, предложенная Энскогом [211]. Хотя она развита
для газов, состоящих из твердых сферических молекул, ее можно
применить и для реальных газов. Вязкость сжатых газов можно рассчитать
с помощью уравнения Энскога:
f=w (f L ЬЬ-+°'800+°'7614 И» о 17>
если вычислять комплекс Ьрх по выражению [211]:
*P*=-H-5r).-h (И8)
Михельс и Гибсон [171] еще в 1931 г. сопоставили вязкость,
рассчитанную по уравнению A17), со своими экспериментальными данными об азоте
при температуре 50° С и давлениях до 1000 агам. Они обнаружили, что
наименьшие расхождения наблюдаются при высоких плотностях, т. е.
в районе минимума отношений ( — ], а наибольшие — в области малых
плотностей. Выполненная позднее [70] проверка уравнения A17) в более
широком интервале температур подтвердила этот вывод и дополнительно
показала, что по мере понижения температуры погрешность расчетных
значений вязкости азота возрастает как в области малых, так и в области
высоких плотностей, и на изотерме 150° К при со = 2,0 превышает 7%.
Это заставляет сделать вывод о непригодности уравнения Энскога для
расчета вязкости жидкости.
Помимо рассмотренных аналитических зависимостей для определения
коэффициента вязкости, следует отметить работы, опубликованные
А. Г. Усмановым и соавторами [212—215], в которых обобщаются
экспериментальные данные о коэффициентах переноса в зависимости от
изменения энтропии. Задача обобщения опытных данных методами подобия весьма
важна, так как эти методы позволяют экстраполировать данные в область,
186
не изученную экспериментально. Для разреженных газов метод [212]
позволяет обобщать данные о коэффициентах переноса различных веществ,
что важно с точки зрения экстраполяции данных в область высоких
температур. Однако для этого случая, как отмечают Э. Э. Шпильрайн
и В. А. Фомин [216], зависимость, предложенная А. Г. Усмановым,
не имеет преимуществ перед методом обобщения данных с помощью при-
веденной температуры Т* = , вытекающим из теории коэффициентов
переноса в разреженных газах [16]. Применительно к сжатым газам по
методу [212] обобщаются данные об одном веществе, взятые при разных
давлениях [213]. Поскольку энтропия газа существенно зависит от
давления, требование об одинаковом начальном значении энтропии для
всех изобар не может быть выполнено, и изобары группируют в серии,
охватывающие различные интервалы давлений, что снижает ценность
обобщения. Тем не менее для области высоких давлений метод А. Г. Усма-
нова позволяет достигнуть более высокой точности, чем многие другие
методы, в которых используется подобие. Не касаясь теоретической
обоснованности метода [212], являющейся дискуссионной [215, 216], отметим,
что при использовании подобия с практической точки зрения
предпочтительнее выбирать в качестве независимых переменных термические
величины, а не энтропию, вычислить которую для малоисследованных веществ
затруднительно.
Известно много приближенных способов расчета вязкости жидкости,
однако они не рассматриваются в настоящей главе ввиду сравнительно
низкой точности. Достаточно подробные сведения об этих способах
приведены в монографиях Рида и Шервуда [185] и Бретшнайдера [210].
Учитывая отсутствие надежных теоретически обоснованных
уравнений для расчета вязкости жидкостей и недостатки рассмотренных выше
эмпирических формул, мы сочли целесообразным проверить применимость
зависимостей, наиболее оправдавших себя при обобщении опытных
данных о вязкости сжатых газов. Первоначально было рассмотрено
уравнение И. Ф. Голубева [217]
Цр,т = Цт-\-а{^)\ A19)
где а и п — постоянные, определяемые по экспериментальным данным;
pt — термическое давление.
При выводе уравнения A19) приближенно учтены основные факторы,
определяющие поведение реальных газов — силы межмолекулярного
взаимодействия и размеры молекул. И. Ф. Голубев отмечал, что он
ограничился простыми молекулярно-кинетическими соображениями, так как
более строгое рассмотрение зависимости вязкости реальных газов и
жидкостей от температуры и давления приводило лишь к более сложным
уравнениям, но не увеличивало существенно точности отображения опытных
данных.
В соответствии с уравнением A19) избыточная вязкость Ат] = r\PfT —
— г\т зависит от плотности и температуры, поскольку pt является функцией
тех же переменных. Эта особенность уравнения И. Ф. Голубева
представляет интерес, так как по данным некоторых авторов наблюдается
существенное влияние температуры на избыточную вязкость.
Уравнение A19) проверено в монографии [217] с помощью опытных
данных для восьми веществ; приведенные графики подтверждают
линейную зависимость между Ат] и ~- в логарифмических координатах. Однако
представленные на графиках данные относятся в основном к газообразной
фазе, и только для двуокиси углерода показана справедливость
зависимости и в жидкой фазе при температурах, близких к критической. И. Ф.
Голубев осторожно подходит к оценке возможности применения
уравнения A19) для описания вязкости жидкости, оговаривая, что оно может
187
быть использовано в области, где жидкость с известным приближением
можно рассматривать как сильно сжатый газ.
Вопрос о применимости уравнения A19) для жидкости представляет
определенный интерес, поэтому нами, несмотря на сделанное замечание,
выполнена соответствующая проверка на основании наиболее подробных
опытных данных И. Ф. Голубева и соавторов [170] о вязкости жидкого
азота, полученных по надежной методике в широком интервале
температур и давлений. Производная (-=?-) = -Ц- для всех опытных точек была
рассчитана по уравнению состояния G2) для жидкого азота. Чтобы полу-
0J 0,8 0,3 1,0 V U U ig?i
Рис. 26. Данные о вязкости жидкого азота [170] в координатах lg Дг), \gptIT.
чить значения Аг], от значений вязкости при заданных температурах
и давлениях вычитали значения % газа при атмосферном давлении,
определенные по сглаженным опытным данным, приведенным в [70].
Следует заметить, что использование в уравнении для расчета вязкости
жидкости слагаемого %, определяемого по данным для газа, позволяет
получить единое уравнение для расчета вязкости жидкости и газа и
оправдано с точки зрения некоторых теорий жидкости, например, в случае
применения теории существенных структур для расчета коэффициентов
переноса [218].
На рис. 26 представлена зависимость между Ат] и ptIT для азота
в логарифмических координатах. Здесь же нанесена прямая,
соответствующая уравнению И. Ф. Голубева [217] для расчета вязкости
газообразного азота, полученному на основании данных при температурах выше
273° К. При построении прямой постоянная а принята равной 5,587
(вместо 567 по [217]), так как pt выражено, в барах, а вязкость —
в 10~6 н-сек/м2. Из рис. 26 видно, что данные для околокритической
изотермы 123,15° К располагаются довольно близко к этой прямой, однако
по мере понижения температуры изотермы смещаются вправо и
искривляются, а угол их пересечения с прямой возрастает. Это свидетельствует
о неприменимости уравнения A19) для описания вязкости жидкости
в широкой области параметров.
188
Для расчета вязкости сжатых газов весьма эффективно может быть
использована зависимость избыточной вязкости от плотности,
предложенная Н. Б. Варгафтиком [219]. Эта зависимость успешно применялась
с целью обобщения экспериментальных данных о многих веществах,
в частности, газообразного воздуха и его компонентов [70], двуокиси
углерода, аммиака и азота [217, 170] в газообразном и жидком
состояниях. Поэтому нами были обработаны в координатах Лг], р опытные
данные о вязкости жидкого воздуха и его компонентов. Большинство этих
данных относится к состоянию насыщения, вследствие чего по
отклонениям их от обобщенной кривой, построенной в указанных координатах,
можно судить о согласованности данных (даже при влиянии температуры
на избыточную вязкость).
С целью построения зависимости Дт) = / (р) были рассчитаны
значения плотности для всех опытных точек в однофазной области по
уравнениям состояния, приведенным в главах II—V; для данных на кривой
насыщения плотность определялась интерполяцией по таблицам
термодинамических свойств (табл. I, IV, VII и X). Как и в случае проверки
уравнения И. Ф. Голубева, при расчете Ат] из значений вязкости жидкости
вычитались значения т]г, найденные по данным [70] при давлении 1 бар.
При температуре ниже нормальной температуры кипения значения цт
были получены экстраполяцией кривой, построенной по данным [70].
При этом учитывалось, что вязкость газа при атмосферном и более низких
давлениях практически одинакова, кривая цт имеет незначительную
кривизну и, наконец, вязкость исследуемых жидкостей при температурах,
не превышающих ^рмальную температуру кипения, и давлениях до
500 бар в 30—100 раз превышает вязкость газа и, следовательно,
погрешность экстраполяции не может сказаться на достоверности значений Аг].
При нанесении на график наиболее надежных экспериментальных
данных о вязкости жидкого азота в координатах Дг), р (рис. 27) не
обнаруживается влияния температуры на избыточную вязкость. Данные
И. Ф. Голубева и сотрудников [170], относящиеся к интервалу
температур 77,35—123,15° К при давлениях до 500 агпм, удовлетворительно
согласуются с результатами опытов С. Ф. Герфа и Г. И. Галкова [157]
и Н. С. Руденко и Л. В. Шубникова [154], полученными для кривой
насыщения. Экспериментальные данные Г. П. Филипповой и И. П. Иш-
кина [169] на изотерме —183° С отличаются разбросом, однако часть их
согласуется с перечисленными выше данными. По опытным точкам [154,
157, 169, 170] можно провести кривую, плавно сопрягающуюся при
р = 0,68 кг/дм3 с кривой, рассчитанной по уравнению Дг) = / (р) [70],
которое обобщает опытные данные о вязкости сжатого газа [169—176],
не представленные на графике. Данные [170] для жидкости при
плотностях менее 0,68 кг/дм3 попадают на кривую для газа, в то время как
результаты опытов Форстера [162] и Н. С. Руденко [155] существенно
выше и не согласуются с этой кривой.
На рис. 27 не нанесены данные Ван Иттербика и соавторов [160,
170а], Б. И. Веркина и Н. С. Руденко [165] и Н. Ф. Ждановой [166],
так как эти данные представлены в работах только на графиках*. Как
отмечалось в VI. 1, данные [160] об азоте согласуются с результатами
опытов [154] в основном в пределах 1%, а данные [165] изменены в
работе [166] примерно на 20%. Помимо этого следует подчеркнуть, что при
плотностях 0,832 и 0,861 кг/дм3 данные [165, 166] резко занижены по
сравнению с результатами других исследователей и не согласуются с ними
даже при низких температурах. По данным [165, 366] обнаруживается
существенное влияние температуры на вязкость при плотностях,
превышающих удвоенную критическую, однако из-за низкой точности данных
* С работой [170а] авторы ознакомились после окончания подготовки
иллюстративных материалов рукописи.
189
н-сек
250
Рис. 27. Обобщение
экспериментальных данных о
вязкости жидкого азота:
/ — И. Ф. Голубева и
соавторов [170]; 2 — Форстера [162];
3 — Г. П. Филипповой и И. П.
Ишкина [169]; 4 — С. Ф. Герфа
и Г. И. Галкова [157]; 5 —Н. С.
Руденко [155]; 6 —Н. С. Руден-
ко и Л. В. Шубникова [154].
200
150
100
50
V
-D
о- /
V- 2
о-З
• -4
0-5
л- ?
V
?
00
7
0 0
V
0,50
0.55'
0,60
065
L-
V
V
0
V D
? >
хК
с
оУ
о
SD
о
д/
v 7
п/
й 7G
ft7J
/?<?(/
005 р. •—
такое влияние представляется сомнительным. Так, по графику,
приведенному в работе [166], значения вязкости азота при максимальной
плотности р = 0,861 кг/дм3 и температурах 85; 150; 273° К равны 163; 114
и 83 [10~6 н-сек/м2]. Последнему значению соответствует значение Дг} =
= 67-10~6 н-сек/м2, которое, как видно, из рис. 27, не согласуется с
общим ходом кривой Дт] = / (р) в области газа, полученной на основании
надежных экспериментальных данных. По-видимому, при получении
опытных данных [165, 166] были допущены значительные погрешности.
В работе [166] одной из причин погрешности могла явиться неточность
определения продолжительности падения груза т0 в газообразном азоте
при р = 1 атм, которая используется при расчете вязкости по
формуле A01).
Опорную кривую Дт] = / (р) для жидкого азота первоначально
предполагалось провести непосредственно по данным [170], однако тогда
участок кривой при плотностях выше 0,8 кг/дм3 оказывался почти
прямолинейным, и его плавное сопряжение с кривой вызывало некоторые
затруднения. Контрольное построение изобар вязкости по данным [170]
обнаружило перегибы на изобарах 300—500 атм при температурах
ниже 100° К- Чтобы достичь достоверной конфигурации изобар и хорошего
согласования данных о жидкости и газе, потребовалось провести опорную
кривую в интервале р = 0,70—0,81 кг/дм3 несколько выше точек [170].
При более высоких плотностях кривая проведена между опытными
точками [154, 170] и [157]. При плотностях менее 0,68 кг/дм3 в качестве
опорных приняты значения Дт], рассчитанные по уравнению для газа [70],
которые, как указано выше, хорошо согласуются с данными [170].
Интересно отметить, что данные Ван Иттербика и соавторов [170а]
при нанесении их на построенный нами график Ац = / (р) располагаются
в интервале р = 0,746—0,842 кг/дм3 выше опорной кривой, что
подтверждает правомерность некоторого отклонения этой кривой вверх от
данных [170].
Уравнение для расчета избыточной вязкости газообразного азота
составлено в монографии [70] при р = 0—0,72 кг/дм3. При экстраполяции
по этому уравнению до р = 0,9 кг/дм3 расчетные значения Дт] оказываются
гораздо ниже принятых нами опорных данных. Попытка описать
аналитически кривую Дт] = / (р) азота в интервале р = 0—0,9 кг/дм3 показала,
что для достижения требуемой точности уравнение должно содержать
большое число членов (по-видимому, в связи с резким возрастанием Дт]
при плотностях выше 0,75 кг/дм3). Поэтому было признано
целесообразным описать участок кривой в интервале р = 0,65—0,90 кг/дм3 с помощью
отдельного уравнения, а при плотностях менее 0,65 кг/дм3 рассчитывать
вязкость азота по ранее полученному уравнению [70]
Лр, т = Пт + 13>83р 4- 23,83р2 4- 160,75р3 — 328,88р4 -f 410,21р5, A20)
в котором вязкость выражена в Ю-6 н-сек/м2 и плотность — в кг/дм3.
Уравнение A20) мы применили лишь при температуре 107° К и выше, так
как при более низких температурах плотность жидкого азота превышает
0,65 кг/дм3.
В интервале р = 0,65—0,90 кг/дм3 опорная кривая описана с
погрешностью менее 1 % уравнением
Ат1 = Лр, т — Пт = 52,09 -4- 253,4 (р — 0,65) + 1638 (р -- 0,65J —
— 29 438 (р — 0,65K + 283 350 (р — 0,65L — 471 070 (р — 0,65M, A21)
в котором г] и р выражены в тех же единицах, что и в предыдущем
уравнении. При р = 0,65 кг/дм3 значения Ац и производной d (Ar\)/dp по обоим
уравнениям совпадают. Заметим, что точность аналитического описания
кривой выше точности опорных данных, однако возрастание отклонений
расчетных Ац от опорных нежелательно, так как может повлечь за собой
191
искажение конфигурации расчетных изобар вязкости и увеличение работы
по графическому согласованию данных о жидкости и газе.
Экспериментальные данные о вязкости остальных компонентов
воздуха не столь многочисленны, как данные о вязкости азота. Для
кислорода нами были обработаны данные Н. С. Руденко и Л. В. Шубникова
[154], Н. С. Руденко [155], С. Ф. Герфа и Г. И. Галкова [158], Буна
и Томаса [163], Сайи и Кобаяши [164]. Для пересчета данных Буна
и Томаса из относительных величин в абсолютные было предварительно
найдено по опытным данным значение вязкости аргона в состоянии
насыщу-/0/
и-сек
м2
500
400
300
200
100
0
о -1
ш-2
• -3
0-4
а-5
д
V
•
• у
* IP
1
•/
• /
> I
0,8
0,9
Ю
V
и
Рис. 28. Зависимость избыточной вязкости жидкого кислорода
от плотности по опытным данным:
/ — Сайи и Кобаяши [164]; 2 — Буна и Томаса [163]; 3 — С. Ф.
Герфа и Г. И. Галкова [158]: 4 — Н. С. Руденко [155]; 5 — Н. С.
Руденко и Л. В. Шубникова [154].
щения при температуре 89,98° К, использованное авторами [163] в
качестве единицы измерения вязкости. На рис. 28 представлены в
координатах Дт), р данные из перечисленных работ, за исключением части опытных
точек [154] при температуре ниже 60° К (поскольку температура этих
точек, как отмечают сами авторы, определена недостаточно надежно).
На рисунке не нанесены данные Ван Иттербика и соавторов [159, 160],
которые представлены в графической форме и согласуются с результатами
опытов Н. С. Руденко и Л. В. Шубникова [154] в пределах 1% (VI.1).
Из рис. 28 видно, что данные [154] и [163] хорошо согласуются между
собой и занимают промежуточное положение по отношению к [158] и
[164], расхождение между которыми достигает 19%. Опорная кривая Лт] =
= / (р) проведена нами по опытным точкам [154, 163 ] и при р = 0,92 кг/дм3
плавно сопряжена с кривой, рассчитанной по уравнению для вязкости
газообразного кислорода [70]. Экспериментальные точки Ван Иттербика,
Цинка и Хеллеманс [170а] представлены в интервале плотностей р =
= 1,14—1,20 кг/дм3 и при нанесении их на рис. 28 располагаются выше
опорной кривой. В ¦ этом интервале плотностей кривая наиболее точно
описывает данные [163] и осредняет результаты измерений [158, 170а]
и [164].
192
Данные Н. С. Руденко [155] о кислороде, как и об азоте (см. рис. 27),
завышены по сравнению с опорными величинами и не могут быть
согласованы в координатах Ат], р с данными о газе, поскольку их отклонения
от опорной кривой увеличиваются по мере уменьшения плотности,
достигая 67% при р = 0,824 кг/дм3 (Т = 138,4° К). По-видимому, в опытах
Н. С. Руденко была допущена погрешность, которая сказывается все
заметнее по мере удаления от нормальных температур кипения азота
и кислорода, при которых калибровался вискозиметр.
Функция Ац = f (p) для кислорода при плотностях выше 1,05 кг/дм3
резко возрастает и не может быть отображена с помощью экстраполяции
по плотностям уравнения, составленного в работе [70]. Учитывая
трудности, встретившиеся при попытке описать одним уравнением кривую
избыточной вязкости азота при плотности от нуля до трех критических,
мы не пытались составить такое уравнение для кислорода. Вязкость
кислорода при плотностях менее 0,92 кг/дм3 можно рассчитывать по
уравнению [70]
ПР,т=Чт+ 11,99р Ч 52,01р2 — 58,11р3-!- 89,14р4. A22)
Оно используется нами лишь при Т > 127° К, поскольку при более
низких температурах плотность жидкого кислорода даже на кривой
насыщения превышает 0,92 кг/дм3.
Для интервала р = 0,92—1,26 кг/дм3 получено уравнение,
описывающее опорную кривую кислорода с погрешностью до 1,5%
Чр, т — % = 73>66 + 237>8 (Р — °>92) + 486 (Р — °,92J +
+ 10 695 (р — 0,92K — 79 367(р — 0,92L + 208570 (р — 0,92M. A23)
В уравнениях A22) и A23), а также в приведенных ниже уравнениях
для расчета вязкости аргона и воздуха, т] ир выражены в 10_6 н-сек/м2
и кг/дм3. Поскольку аналитическое описание кривой Дт|. = / (р) для
каждого вещества выполнялось с помощью двух уравнений, было обеспечено
совпадение значений функции Ат] и производной d (Ar\)/dp в точке перехода
от одного уравнения к другому.
Зависимость избыточной вязкости жидкого аргона от плотности
определялась в настоящей работе на основании экспериментальных
данных Н. С. Руденко и Л. В. Шубникова [154], Форстера [162], Буна
и Томаса [163], Сайи и Кобаяши [164], Г. П. Филипповой и И. П. Иш-
кина [168, 169]. Данные [154, 162, 164] охватывают узкий интервал
плотностей A,38—1,42 кг/дм3), и только в работах [162, 168, 169]
представлены значения вязкости в более широком диапазоне плотностей.
Из рис. 29 видно, что данные [168, 169] характеризуются большим
разбросом, а расхождения между ними и результатами [164] достигают 14%.
Данные [154] и [163], как и для кислорода, хорошо согласуются между
собой. При построении опорной кривой по опытным точкам [162, 169]
нельзя добиться ее согласования с кривой Дг) = / (р), рассчитанной по
уравнению для определения вязкости газообразного аргона [70], которое
описывает данные Михельса и соавторов [178] в интервале плотностей
0—1,13 кг/дм3. Учитывая невысокую точность данных [162],
обнаруженную при сопоставлении экспериментальных величин для азота, мы
провели кривую Дт] = / (р) по данным [154, 163] и плавно сопрягли ее при
р = 1,08 кг/дм3 с кривой, рассчитанной по уравнению для газа. В
интервале р = 1,05—1,16 кг/дм3 опытные точки [169] для изотермы —140° С
располагаются ниже опорной кривой, что наблюдалось и при построении
кривой для газообразного аргона [70].
Для расчета вязкости жидкого аргона при плотностях менее
1,05 кг/дм3 (т. е. в ряде точек при Т > 132° К) можно рекомендовать
ранее составленное уравнение
Лр, т = Лг + 11 >50р + 42,90р2 — 33,45р3 + 36,83р4. A24)
13 Зак. 1978
193
При плотности от 1,05 до 1,45 кг/дм3 опорные значения избыточной вязкости
аргона отображены с погрешностью менее 1 % уравнением
т,р> т — г\т = 65,42 + 161,5 (р — 1,05) + 225 (р — 1,05J +
+ 7503 (р — 1,05)8 — 33 918 (р — 1,05L + 56 905 (р — 1,05MJ A25)
Вязкость жидкого воздуха исследована гораздо хуже вязкости его
компонентов. Для воздуха имеются данные Г. П. Филипповой и И. П. Иш-
кина [168, 169] при температуре —183° С и давлении до 150 кГ/см2,
несколько опытных точек Н. С. Руденко [154] на кривой насыщения
1,0 1,1 1,2 13 l^Qr—,
' ' ' ' * у дм3
Рис. 29. Зависимость избыточной вязкости жидкого аргона
от плотности по опытным данным:
/ — Сайи и Кобаяши [164]; 2 — Буна и Томаса [163 ]; ?— Форстера
[162]; 4 — Г. П. Филипповой и И. П. Ишкина [168, 169]; 5 — Н. С.
Руденко и Л. В. Шубникова [154].
и результаты ранних исследований [152, 153], представляющие лишь
историческую ценность. С некоторым приближением можно рассматривать
в качестве данных о воздухе значения вязкости, полученные С. Ф. Герфом
и Г. И. Галковым [158] для смеси 80,4% N2 — 19,6% 02 при
температурах 68,1; 72,6 и 77,7° К. Перечисленные данные, а также результаты [168,
169] для околокритической изотермы —140° С в интервале р = 0,52—
0,67 кг/дм3 представлены в координатах Дг), р на рис. 30. Для данных [158 ]
плотность определена по значениям плотности жидких азота и кислорода
в состоянии насыщения, приведенным в табл. I и IV, с учетом уменьшения
объема на 0,6% при смешении [70].
Опорные значения избыточной вязкости воздуха при плотностях
менее 0,6 кг/дм3 рассчитаны нами по уравнению для газа [70]. Для
нахождения этих значений в области более высоких плотностей ввиду
ограниченности экспериментальных данных о жидком воздухе потребовалось
использовать закон соответственных состояний. В монографии [217]
отмечено, что для воздуха и двухатомных газов справедлива обобщенная
194
зависимость избыточной вязкости от плотности в приведенных координатах
Аг]/Аг|Кр=/ (р/Ркр)- Поэтому мы определили отношения значений Ац азота
и кислорода при одинаковых приведенных плотностях в интервале со =
= 1,4—1,8, где для обоих веществ имеются надежные опытные данные.
Эти отношения в указанном интервале плотностей изменяются
незначительно (от 0,968 до 0,982), поэтому было выбрано среднее значение
отношения At]N2/At]o2 и с его помощью на основании данных об азоте рассчитана
избыточная вязкость воздуха при приведенной плотности до со — 3.0.
A7f10c,
н-сек
200
150
100
50
С
V
D-/
.-2
0-3
cf*2
а <
ЧР
.
0
л FP
V гГ
I
J
/
?
0,5
0}д
0,1
о, М.
Г дм*
Рис. 30. Зависимость избыточной вязкости воздуха от
плотности по опытным данным:
/ — Г. П. Филипповой и И. П. Ишкина [168, 169]; 2 — С. Ф. Герфа
и Г. И. Галкова [158]; 3 — Н. С. Руденко [155].
Полученная опорная кривая хорошо согласуется с данными [158]
и частью опытных точек [168, 169] для изотермы —183° С. Данные [169]
при температуре —140° С ниже этой кривой, что наблюдалось и при
сопоставлении опытных значений вязкости газообразного воздуха.
Уравнение для расчета вязкости воздуха при плотностях менее
0,6 кг/дм3 имеет вид
%, т = % + Ю,76р + 61,47р2 — 53,13р3 + 132,87р4.
A26)
Применительно к жидкому воздуху это уравнение используется лишь
при температурах выше 122° К.
Для интервала плотностей 0,60—0,93 кг/дм3 составлено отдельное
уравнение, описывающее кривую Ат] = / (р) с максимальной
погрешностью 2%:
ЛР, т—Лг = 34>33 + 141>9 (Р — °>6) + 350 (Р — W +
f 4762 (р — 0,6K — 41943 (р — 0,6L + 140 530 (р — 0,6M.
A27)
13*
195
По уравнениям A20)—A27) рассчитана вязкость жидкого воздуха
и его компонентов при давлениях до 500 бар. Необходимые для расчетов
значения плотности взяты из таблиц термодинамических свойств,
приведенных в главах II—V, а г\т приняты по данным [70] (для температур
ниже нормальной температуры кипения, как отмечено выше, данные [70]
экстраполированы графически).
Расчетные значения вязкости были графически согласованы по
изобарам с данными о рассматриваемых веществах в газообразном
состоянии. Благодаря хорошей согласованности значений плотности,
использованных для расчетов, при построении изобар почти не потребовалось
корректировать величины вязкости. Так, для кислорода и воздуха
значения вязкости жидкости и газа не были изменены, и только при давлении
до 500 бар были пополнены данные на изотермах 170 и 180° К для
кислорода и 160° К для воздуха, ограниченные в таблицах [70] давлениями
250—300 бар. Для азота были незначительно скорректированы (на 0,2—
0,4%) значения вязкости на изотермах 135—150° К при давлениях 300—
500 бар. Данные об аргоне были изменены на изотермах 170 и 180° К
при давлениях 300—500 бар на 0,3—1,6% и при температурах 155 и 160° К
и давлениях 100—250 бар в пределах 0,5%. Скорректированные величины
вязкости были дополнительно сглажены по изотермам.
В табл. XIII—XVI приведены значения коэффициента динамической
вязкости четырех веществ в жидком и газообразном состояниях в
диапазоне давлений 1—500 бар и температур 65—150° К для N2, 75—180° К
для 02, 85—180° К для Аг и 75—160° К для воздуха. Погрешность
расчетных данных может быть оценена равной 3% для азота и 5% для
остальных веществ, что является приемлемым для инженерных расчетов.
Таблица XIII
Динамическая вязкость жидкого и газообразного азота
т
°к
65
70
75
?0
$5
90
95
100
105
110
115
120
125
130
135
140
150
1
263,3
211,3
167,7
5,52
5,86
6,20
6,54
6,88
7,22
7,56
7,89
8,21
8,52
8,83
9,14
9,45
10,06
10
267,7
215,4
171,3
136,6
111,1
93,26
80,93
71,30
7,83
8,11
8,40
8,68
8,96
9,25
9,54
9,83
10,41
20
272,8
219,7
175,3
140,0
113,6
95,28
82,60
72,97
63,97
55,17
46,26
9,53
9,68
9,88
10,10
10,28
10,85
ti-10\ н
30
277,7
224,4
179,3
143,3
116,4
97,37
84,29
74,59
65,84
57,28
49,02
39,74
11,55
11,07
11,03
11,12
11,45
•сек/м2, п
40
282,6
229,0
183,2
146,7
119,2
99,51
86,02
76,16
67,60
59,25
51,40
43,35
33,69
18,05
13,14
12,50
12,32
ри р, бар
50
287,6
233,6
187,5
150,1
121,9
101,8
87,77
77,72
69,29
61,12
53,54
46,12
38,10.
29,45
19,98
15,51
13,65
60
292,7
238,3
191,4
153,7
124,8
104,0
89,51
79,22
70,89
62,94
55,53
48,49
41,35
34,24
26,86
20,68
15,70
70
297,8
242,9
195,7
157,3
127,8
106,3
91,35
80,76/
72,42
64,69
57,37
50,41
44,07
37,63
31,31
25,44
18,47
80
302,7
247,5
199,8
160,9
130,8
108,7
J93,19
82,29
73,92
66,36
59,10
52,55
46,33
40,33
34,62
29,23
21,47
196
Продолжение табл. XIII
Т
°К |
70
75
80
85
90
95
100
105
110
115
120
125
130
135
140
150
90
252,3
204,1
164,5
133,8
111,1
95,07
83,86
75,39
67,94
60,78
54,37
48,36
42,70
37,30
32,29
24,34
100
256,8
208,4
168,2
13f\0
113,6
97,00
85,42
76,81
69,48
62,43
56,08
50,23
44,79
39,70
34,87
26,96
125
268,7
219,1
177,7
144,8
120,0
102,0
89,49
80,34
73,08
66,36
60,05
54,45
49,31
| 44,27
40,12
1 32,48
•Л-10е, н
150
280,8
230,1
187,2
153,0
126,7
107,5
93,76
83,95
76,44
69,93
63,76
58,21
53,23
48,63
44,38
36,94
сек/м2, при р, бар
175
292,7
241,1
197,1
161,4
133,8
113,1
98,25
87,63
79,72
73,25
67,30
61,67
56,77
52,29
48,11
40,82
200
304,7
252,3
207,1
170,2
141,2
119,1
103,0
91,50
83,05
76,40
70,56
65,07
60,07
55,63
51,54
44,25
225
316,8
263,5
217,5
179,2
148,8
125,5
108,1
95,58
86,45
79,47
73,63
68,27
63,23
58,76
54,72
! 47,35
250
328,8
274,7
227,9
188,4
156,8
132,1
113,5
99,92
90,02
82,55
76,55
71,27
66,31
61,72
57,65
50,32
275
340,9
286,4
238,3
197,9
164,9
138,9
119,3
104,5
93,76
85,72
79,44
74,13
69,24
64,63
60,50
53,06
Продолжение табл. XIII
Т
°к
70
75
80
85
90
95
100
105
ПО
115
120
125
130 .
135
140
150
300
353,3
297,9
249,1
207,5
173,3
146,2
125,3
109,4
97,70
89,02
82,32
76,86
72,04
67,48
63,25
55,76
325
—
309,4
259,8
217,4
182,1
153,6
131,5
114,5
101,9
92,49
85,32
79,57
74,70
70,12
65,85
58,21
350
—
321,2
270,9
227,2
190,8
161,3
138,1
120,0
106,4
96,12
88,39
.82,33
77,27
72,59
68,28
60,64
ri-10e, н-сек/мг, пр
375
—
332,7
281,8
237,3
200,0
169,3
144,8
125,7
111,1
100,1
91,64
85,12
79,84
75,02
70,68
63,03
400
—
344,5
292,8
247,5
209,2
177,4
152,0
131,7
116,1
104,1
95,03
88,00
82,41
77,50
73,11
65,44
и р, бар
425
—
356,2
303,8
257,8
218,7
185,8
159,1
137,9
121,3
108,5
98,67
91,03
85,06
80,04
75,51
67,75
450
—
367,8
315,1
268,5
228,3
194,5
166,8
144,5
126,8
113,1
102,5
94,27
87,82
82,64
77,94
70,00
475
—
379,7
326,4
279,1
237,9
203,2
174,5
151,2
132,6
118,0
106,5
97,60
90,69
85,20
80,31
72,21
500
—
391,4
337,6
289,6
247,8
212,1
182,6
158,1
138,6
123,0
110,8
101,2
93,70
87,74
82,67
74,30
197
Таблица XIV
Динамическая вязкость жидкого и газообразного кислорода
т
°к
75
80
85
90
95
100
105
НО
115
120
125
130
135
140
145
150
155
160
165
170
180
1
303,8
253,6
216,2
188,2
7,21
7,64
8,05
8,46
8,86
9,26
9,65
10,03
10,40
10,77
11,13
11,48
11,82
12,16
12,49
12,82
13,47
10
308,1
256,9
218,9
190,3
168,4
157,7
135,5
121,6
108,6
9,79
10,14
10,49
10,83
11,18
11,52
11,85
12,18
12,50
12,82
13,14
13,76
20
313,1
260,7
221,8
192,7
170,4
152,5
137,2
§123,4
110,5
98,63
88,15
7$, 78
11,59
11,85
12,12
12,40
12,68
12,97
13,26
13,55
14,14
*П10в, н
30
317,9
264,4
224,7
195,0
172,3
154,2
138,9
125,2
112,3
100,4
89,95
80,75
71,50
61,60
13,17
13,28
13,44
13,65
13,87
14,11
14,62
сек/м2, при р, бар
40
322,9
268,2
227,7
197,3
174,3
156,0
140,6
126,8
114,1
102,2
91,69
82,58
73,74
64,56
54,65
15,09
14,72
14,67
14,05
14,24
14,73
50
327,9
272,1
230,7
199,8
176,3
157,8
142,3
128,5
115,8
104,0
93,43
84,34
75,78
67,12
58,13
48,43
18,57
16,53
16,84
15,95
16,04
60
332,8
275,9
233,8
20?. 2
178,3
159,5
143,9
130,2
.117,5
105,7
95,11
86,00
77,71
69,40
61,00
52,35
41,78
23,24
19,20
17,60
17,09
70
337,8
280,1
236,8
204,7
180,3
161,3
145,6
131,8
119,1
107,4
96,79
87,61
79,49
71,49
63,53
55,50
46,77
35,53
26,39
20,44
18,50
80
343,0
284,1
239,9
207,1
182,4
163,0
147,2
133,4
120,8
109,1
98,43
89,20
81,19
73,43
65,79
58,19
50,64
41,68
32,40
25,22
20,44
Продолжение табл. XIV
Т
°к
75
80
85
90
95
100
105
110
115
120
125
130
135
140
145
150
155
160
165
170
180
90
348,2
287,9
243,1
209,6
184,4
164,8
148,8
135,0
122,3
110,7
100,1
90,78
82,79
75,24
67,86
60,61
53,43
45,82
37,72
30,51
23,02
100
353,2
292,1
246,3
212,1
186,2
166,6
150,4
136,5
124,0
112,3
101,7
92,31
84,32
76,95
69,78
62,77
55,96
49,00
41,72
35,08
26,08
125
366,4
302,4
254,4
218,5
191,6
171,0
154,5
140,4
127,8
116,3
105,6
96,13
87,98
80,87
74,12
67,57
61,24
55,21
49,22
43,51
33,75
rj-106, н-сек/м2, прр
150
380,0
312,7
262,6
225,1
197,0
175,5
158,4
144,1
131,5
120,1
109,4
99,85
91,52
84,43
77,96
71,72
65,70
59,95
54,50
49,43
40,18
175
393,9
323,6
271,1
231,8
202,4
180,0
162,4
147,8
135,2
123,7
113,1
103,5
94,98
87,75
81,44
75,43
69,65
64,09
58,90
54,15
45,41
р, бар
200
407,7
334,5
279,8
238,6
208,0
184,6
166,5
151,6
138,8
127,3
116,8
107,1
98,41
90,98
84,65
78,84
73,22
67,81
62,81
58,21
49,77
225
422,1
346,0
288,6
245,8
213,7
189,3
170,5
155,2
142,2
130,7
120,2
110,6
101,8
94,18
87,70
81,97
76,50
71,24
66,30
61,72
53,58
250
436,8
357,4
297,6
252,9
219,5
194,2
174,6
158,9
145,7
134,1
123,6
114,0
105,1
97,35
90,68
84,93
79,57
74,41
69,53
65,01
57,01
275
451,7
369,0
307,1
260,4
225,4
199,0
178,7
162,6
149,2
137,5
126,9
117,3
108,4
100,5
93,64
87,75
82,47
77,40
72,58
68,12
60,18
198
Продолжение табл. XIV
Т
°к
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
300
466,8
381,2
316,5
268,1
231,6
204,1
183,0
166,3
152,5
140,8
130,2
120,5
111,7
103,7
96,62
90,54
85,20
80,22
75,48
70,99
63,00
325
482,0
393,6
326,1
275,9
237,9
209,2
187,3
170,1
156,0
144,0
133,4
123,7
114,8
106,8
99,61
93,32
87,84
82,90
78,13
73,68
65,73
350
497,9
406,1
336,5
283,8
244,3
214,5
191,7
173,8
159,4
147,2
136,5
126,8
117,9
109,8
102,5
96,12
90,48
85,47
80,70
76,20
68,28
Л-106, н-сек/мг, пр
375
513,9
418,7
346,5
292,1
250,9
219,9
196,1
177,7
162,9
150,4
139,6
129,9
121,0
112,9
105,5
98,92
93,08
87,98
83,15
78,72
70,78
400
529,9
432,0
357,2
300,4
257,6
225,4
200,7
181,6
166,4
153,6
143,7
132,9
124,0
115,9
108,4
101,7
95,78
90,52
85,75
81,27
73,34
и р, бар
425
445,2
367,7
308,9
264,7
231,1
205,5
185,7
169,8
156,9
145,8
135,9
127,0
118,8
111,3
104,5
98,50
93,05
88,18
83,67
75,70
450
458,5
378,7
317,8
271,7
236,8
210,3
189,6
173,4
.160,1
•148,8
138,8
129,9
121,7
114,2
107,3
101,3
95,63
90,63
86,06
77,98
475
472,3
389,7
326,9
279,1
242,8
215,2
193,8
177,1
163,3
151,8
141,7
132,7
124,5
117,0
110,1
104,0
98,29
93,10
88,34
80,10
500
486,2
400,8
336,0
286,6
248,9
220,2
198,1
180,7
166,6
154,8
144,7
135,6
127,3
119,8
112,8
106,6
100,8
95,40
90,61
82,22
Динамическая вязкость жидкого и газообразного аргона
Таблица XV
т
°к
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
1
279,8
7,45
7,88
8,30
8,72
9,13
9,54
9,94
10,34
10,74
11,14
11,53
11,92
12,31
12,69
13,07
13,81
14,54
10
284,0
238,8
204,6
177,7
155,3
135,6
117,5
10,57
10,94
11,29
11,66
12,02
12,39
12,76
13,12
13,48
14,19
14,89
20
288,8
242,7
208,0
180,8
158,2
138,5
120,5
104,0
89,73
12,31
12,54
12,81
13,10
.13,41
13,73
14,05
14,69
15,35
Т).Ю6, н-
30
293,6
246,7
211,5
183,9
161,1
141,3
123,4
107,0
92,53
80,95
71,31
14,32
14,31
14,44
14,63
14,86
15,37
15,94
сек/м2, пр
40
298,5
250,7
214,9
186,9
163,9
144,1
126,2
109,8
95,33
83,42
74,02
64,52
53,95
16,36
16,09
16,06
16,29
16,68
и р, бар
50
254,8
218,4
190,0
166,8
146,9
129,0
112,7
98,06
85,90
76,46
67,62
58,29
43,45
19,18
18,07
17,56
17,65
60
258,9
221,9
193,1
169,7
149,6
131,8
115,1
100,8
88,38
78,71
70,33
61,76
51,10
36,02
22,46
19,42
18,91
70
263,1
225,4
196,2
172,5
152,4
134,5
118,2
103,5
90,87
80,90
72,76
64,71
56,08
45,52
33,34
22,29
20,55
80
267,3
229,1
199,3
175,4
155,1
137,2
120,9
106,2
93,36
83,06
74,99
67,34
59,77
50,93
41,60
26,69
22,71
199
Продолжение табл. XV
Т
°к
90
95
100
105
НО
115
120
125
130
135
140
145
150
155
160
170
180
90
271,6
232,6
202,4
178,2
157,8
139,9
123,6
108,8
95,85
85,25
77,08
69,70
62,50
54,72
46,77
32,13
25,47
100
275,9
236,4
205,7
181,0
160,4
142,5
126,2
111,4
98,30
87,44
79,03
71,89
64,97
57,90
50,71
37,15
28,73
125
287,0
245,6
213,7
188,2
167,1
148,9
132,6
117,8
104,5
93,02
83,86
76,76
70,32
64,00
57,96
46,38
37,16
Л-Ю6, «•
150
298,3
255,1
221,8
195,4
173,8
155,2
138,8
123,9
110,5
98,65
88,77
81,11
74,70
68,83
63,42
52,93
44,09
сек/м2, пр
175
310,0
264,9
230,3
202,8
180,4
161,5
144,9
129,9
116,4
104,2
93,83
85,47
78,97
73,01
67,80
58,24
49,69
и р, бар
200
321,9
275,1
238,7
210,2
187,1
167,7
150,9
135,8
122,1
109,8
98,97
89,98
82,88
76,86
72,00
62,71
54,48
225
334,3
285,4
247,5
217,9
193,9
173,9
156,7
141,5
127,7
115,3
104,1
94,62
86,89
80,80
1 75,80
| 66,65
58,61
250
346,9
296,0
256,6
225,6
200,7
180,1
162,6
147,1
133,2
120,6
109,3
99,36
91,06
84,39
79,18
70,18
1 62,38
!
275
—
307,0
265,9
233,6
207,7
186,4
168,4
152,7
138,6
125,9
114,4
104,1
95,36
88,10
82,41
73,52
1 65,81
Продолжение табл. XV
Т
°к
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
300
318,2
275,5
241,8
214,8
192,8
174,2
158,2
144,0
131,0
119,4
109,0
99,75
91,93
85,71
76,54
69,03
325
329,9
285,3
250,2
222,1
199,2
180,1
163,7
149,2
136,2
124,4
113,7
104,2
95,91
89,16
79,62
71,88
350
341,6
295,4
258,8
229,6
205,8
186,0
169,2
154,4
141,2
129,2
118,4
108,7
100,0
92,73
82,50
74,70
тИ0«, «•
375
353,9
305,7
267,7
237,2
212,5
192,1
174,7
159,6
146,2
134,0
123,0
113,1
104,2
96,58
85,60
77,50
сек/м2, пр
400
366,5
316,4
276,8
245,1
219,3
198,1
180,2
164,8
151,1
138,8
127,7
117,5
108,3
100,4
88,75
80,23
и р, бар
425
379,1
327,3
286,1
253,0
226,3
204,4
185,9
170,0
156,0
143,5
132,2
122,0
112,7
104,4
91,89
82,90
450
392,5
338,6
295,8
261,3
233,5
210,7
191,6
175,2
160,9
148,3
136,7
126,3
116,8
108,4
95,02
85,50
475
350,1
305,5
269,9
240,9
217,1
197,3
180,4
165,9
152,9
141,3
130,7
121,0
112,3
98,30
88,19
500
361,9
315,8
278,5
248,4
223,7
203,1
185,8
170,8
157,6
145,7
135,0
125,2
116,2
101,6
90,80
200
Таблица XVI
Динамическая вязкость жидкого и газообразного воздуха
т
°к
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
1
226,6
—
6,04
6,41
6,76
7,11
7,45
7,79
8,12
8,45
8,77
9,09
9,41
9,72
10,03
10,34
10,94
10
231,0
181,6
144,7
117,7
98,17
83,78
72,46
8,30
8,58
8У88
9,17
9,46
9,76
10,05
10,35
10,64
11,22
20
236,0
185,9
148,1
120,5
100,5
85,74
74,32 .
64,61
55,49
9,81
9,93
10,12
10,34
10,58
10,83
11,08
11,61
ri-lO6, н
30
240,9
190,1
151,6
123,3
102,7
87,65
76,13
66,53
57,71
49,19
41,69
11,59
11,41
11,44
11,56
11,73
12,13
¦ сек/м2, п
40
246,0
194,3
153,6
126,1
105,0
89,61
77,94
68,35
59,78
51,62
43,77
35,97
14,93
13,18
12,80
12,72
12,85
ри р, бар
50
251,1
198,5
158,5
129,0
107,4
91,62
79,73
70,12
61,70
53,86
46,46
40,50
30,56
19,08
15,28
14,34
13,86
60
256,4
202,8
162,1
131,8
109,8
93,61
81,52
71,87
63,55
55,91
48,80
43,74
35,32
27,67
20,56
17,17
15,27
70
261,5
207,3
165,8
134,8
112,2
95,65
83,30
73,56
65,33
57,86
50,96
44,67
38,60
32,28
26,14
21,32
17,20
80
266,8
211,7
169,5
137,9
114,6
97,73
85,08
75,24
67,03
59,69
52,95
46,83
41,18
35,57
30,14
25,38
19,38
т
°к
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
90
272,1
216,1
173,1
141,0
117,2
99,78
86,90
76,93
68,68
61,45
54,85
48,84
43,41
38,22
33,23
28,74
22,27
100
277,6
220,7
177,0
144,0
119,7
101,9
88,71
78,58
70,30
63,14
56,64
50,73
45,38
40,45
35,78
31,52
24,85
125
291,4
232,4
186,8
152,1
126,4
107,4
93,35
82,72
74,25
67,13
60,82
55,06
49,79
45,09
40,69
36,50
29,56
Ti-10e, н
150
305,3
244,4
196,8
160,4
133,3
113,1
98,19
86,92
78,13
70,90
64,65
59,01
53,76
49,01
44,92
41,23
34,90
сек/м2, п
175
319,9
256,8
207,2
169,2
140,4
119,0
103,1
91,20
82,02
74,58
68,28
62,67
57,41
52,69
48,52
44,85
38,67
ри р, бар
200
334,6
269,7
218,2
178,3
148,0
125,3
108,3
95,70
85,93
78,21
71,75
66,13
60,82
56,12
51,86
48,12
41,97
Продолжение табл. XVI
225
282,7
229,2
187,8
155,8
131,9
113,8
100,3
89,97
81,83
75,17
69,44
64,23
59,45
55,10
51,23
44,92
250
.
296,0
240,9
197,3
164,0
138,7
119,5
105,1
94,07
85,51
78,57
72,69
67,50
62,54
58,14
54,26
47,55
275
309,8
252,5
207,6
172,4
145,8
125,4
110,1
98,37
89,28
81,99
75,89
70,59
65,71
6Г,08
57,14
50,30
20!
Продолжение табл. XVI
Т
°к
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
300
323,8
264,7
217,8
181,2
153,2
131,6
115,4
102,9
93,22
85,48
79,10
73,62
68,69
64,02
59,93
52,92
325
339,0
277,4
228,8
190,5
160,8
138,2
120,8
107,5
97,22
89,07
82,35
76,66
71,56
66,80
62,66
55,50
350
290,1
239,6
200,0
168,9
145,0
126,6
112,4
101,4
92,75
85,67
79,68
74,44
69,63
65,40
58,14
Т]-10в, н-сек/м2, при р, бар
375
303,5
251,1
209,8
177,2
152,1
132,7
117,6
105,9
96,56
89,06
82,79
77,28
72,33
67,99
60,70
400
316,9
263,0
219,9
185,9
159,5
138,9
123,0
110,4
100,6
92,56
85,91
80,18
75,11
70,64
63,13
425
330,9
274,9
230,4
194,9
167,1
145,4
128,6
115,2
104,7
96,21
89,14
83,10
77,92
73,32
65,48
450
—
287,4
241,1
204,3
175,0
152,3
134,3
120,3
109,1
100,0
92,52
86,13
80,75
76,01
67,67
475
—
300,3
252,6
213,8
183,4
159,4
140,4
125,5
113,6
104,0
95,97
89,22
83,57
78,56
69,80
500
—
313,1
263,6
223,7
192,0
166,8
146,8
131,0
118,5
108,1
99,60
92,42
86,27
81,06
71,95
Глава VII
ТЕПЛОПРОВОДНОСТЬ ЖИДКОГО ВОЗДУХА
И ЕГО КОМПОНЕНТОВ
Вс
возросшие требования к точности расчета теплообменных
аппаратов обусловили необходимость получения данных о
теплопроводности технически важных жидкостей и газов при различных температурах
и давлениях. Несмотря на появление в последние годы двух работ,
посвященных измерению теплопроводности жидких азота и аргона при
давлениях до 500 атм, в целом теплопроводность рассматриваемых нами
жидкостей недостаточно исследована экспериментально, к тому же далеко не
все опытные данные имеют высокую точность. В связи с этим в настоящей
главе кратко рассмотрены методы измерения теплопроводности жидкостей
и указаны основные причины, приводящие к погрешностям. Затем в
результате анализа экспериментальных данных о теплопроводности выбраны
наиболее достоверные значения. На основании принятых опорных данных
получены аналитические зависимости, с помощью которых рассчитаны
табличные значения коэффициентов теплопроводности жидкого воздуха
и его компонентов для той же примерно области параметров, что и
табличные значения термодинамических свойств.
VII. 1. Методы измерения теплопроводности
жидкостей
Все методы измерения коэффициента теплопроводности основаны
на использовании закона Фурье. Для плоской однородной стенки
толщиной б, на наружных поверхностях которой поддерживаются постоянные
температуры t1 и /2, коэффициент теплопроводности X определяется по
уравнению
Я = ^, A28)
где q — количество тепла, переданное через единицу площади за
единицу времени.
Обеспечив в установке стационарный режим, можно после измерения
теплового потока, толщины слоя вещества и температур t± и t2 рассчитать
коэффициент теплопроводности. Значение коэффициента будет относиться
к давлению, при котором находится вещество, и к средней температуре
-——-. Если измеряются все величины, входящие в формулу A28),
метод называется абсолютным методом плоского горизонтального слоя.
Созданы установки, в которых тепловой поток последовательно
проходит через два плоских слоя различных веществ. В слоях возникают
градиенты температур, обратно пропорциональные коэффициентам тепло-
203
проводности. В этом случае можно записать следующее равенство для
теплового потока:
q=-\{t[-Q = ^{fx-f2). A29)
Здесь индексы при К и б и штрихи при t относятся соответственно к
первому и второму веществам. Из уравнения A29) получим
- л U — tc,
К = hf--?—;>¦ A30)
По уравнению A30) можно определить kl9 зная Х2, измерив толщины
слоев и перепады температур в них, не измеряя теплового потока. Такой
метод называется относительным методом плоского горизонтального слоя.
Рассматриваемый метод является одним из наиболее надежных
и получил широкое распространение при исследовании коэффициента
теплопроводности жидкостей. Впервые метод плоского горизонтального
слоя был использован Вебером [220], в дальнейшем его применяли Тодд
[221 ], Геркус и Лэйби [222], Бэйтс [223], Е. П. Боровик [224] и другие
исследователи. Подробное описание конструкций наиболее интересных
экспериментальных установок, созданных на основании этого, а также
и других методов, дано в известной монографии Н. В. Цедерберга [225].
Автор [225] отмечает, что при реализации метода плоского
горизонтального слоя встречаются с определенными трудностями в связи с
необходимостью устранить утечки тепла. Поэтому вокруг измерительной камеры
устанавливаются охранные кольца и защитные плиты, и предусматривается
тщательный контроль за температурным полем. Однако далеко не во
всех экспериментальных установках удавалось устранить утечки тепла,
а также предотвратить возникновение конвективного теплообмена,
искажающего результаты опытов, в слое исследуемого вещества. Так, в
установке Гаммана [226], предназначенной для измерения теплопроводности
жидких азота, кислорода и их смесей, вокруг измерительной камеры
имелась только вакуумная рубашка, а толщина слоя исследуемой жидкости
составила 12 мм; избежать утечек тепла и появления конвективного
теплообмена не удалось. Значения коэффициентов теплопроводности жидких
азота и кислорода, полученные Гамманом, завышены по сравнению с
данными других исследователей до 40%.
Относительный метод плоского горизонтального слоя, предложенный
Христиансеном еще в конце прошлого века [227, 228], в дальнейшем
неоднократно применялся для определения теплопроводности. В частности,
Л. П. Филиппов [229] создал установку для измерения теплопроводности
газов и жидкостей в интервале температур 0—300° С при давлениях до
100 кГ/см2. Толщина слоя исследуемого вещества в установке составляла
0,4 мм у что препятствовало возникновению конвективного теплообмена.
Для уменьшения утечек тепла с боковых поверхностей измерительной
камеры были применены охранные кольцевые нагреватели. В качестве
образцового вещества использовалось стекло толщиной 5 мм.
Максимальная погрешность измерения теплопроводности оценивается автором [229]
равной 3%.
Оригинальным является оптический вариант метода плоского
горизонтального слоя, заключающийся в том, что градиент температур в слое
исследуемой жидкости определяется непосредственно, оптическим путем,
на основании зависимости показателя преломления жидкости от
температуры. Количество тепла, прошедшее через слой жидкости, измеряется
калориметрическим способом. Этот метод был развит в работах В. П. Фрон-
тасьева [230—232] для измерения теплопроводности как отдельных
жидкостей, так и жидких бинарных смесей. Результаты, полученные в работах
[231, 232] для воды и многих органических жидкостей, достаточно
надежны.
204
Другим весьма распространенным методом измерения
теплопроводности является метод коаксиальных цилиндров, сущность которого состоит
в следующем. Если имеется цилиндрическая труба из материала с
коэффициентом теплопроводности Я и ее внутренняя и наружная поверхности
поддерживаются при температурах tx и t2 соответственно (tx > t2), то
согласно закону Фурье количество тепла, проходящее при установившемся
режиме через стенку трубы за единицу времени,
Q = -?5r-(*i-a A31)
где гг — внутренний радиус трубы;
г2 — внешний радиус;
/ — длина.
Поместив между двумя коаксиальными цилиндрами исследуемое
вещество, через которое проходит установившийся тепловой поток из
внутреннего цилиндра, можно определить коэффициент теплопроводности
по формуле
<?1п-^-
Х= 2л/(*!-*,) ' A32)
Метод коаксиальных цилиндров, аналогично методу плоского
горизонтального слоя, называется абсолютным, если в опыте измеряются все
величины, входящие в формулу, по которой рассчитывается
теплопроводность.
Формула A32) может быть представлена и в виде
k^Aj-2-f-, A33)
где А — постоянная установки, определяемая при помощи вещества
с известной теплопроводностью. Использование найденного таким
образом значения А является отличительной чертой относительного метода.
Метод коаксиальных цилиндров был впервые применен Стефаном [233]
и Винкельманом [234]. Недостатком метода является утечка тепла с
торцов измерительных цилиндров. Для предотвращения этого
устанавливаются охранные нагреватели и вводится контроль за температурными
полями. При создании установок, работающих по этому методу, вызывает
также затруднения обеспечение соосности цилиндров. Кроме того,
необходимы такие условия эксперимента, при которых в слое исследуемого
вещества не возникает конвективного теплообмена (что особенно
существенно при проведении опытов в критической области).
Установки, в которых использован метод коаксиальных цилиндров,
успешно применяются в практике теплофизического эксперимента. Так,
Н. Б. Варгафтик и С. В. Смирнова [235] построили установку для
измерения теплопроводности азота и водяного пара абсолютным методом.
Для жидкостей обыкновенно применялась относительная модификация
метода, развитая в работах Л. П. Филиппова [236], Н. В. Цедерберга
и Д. Л. Тимрота [237], Риделя [238] и др. Погрешность измерения
теплопроводности в работах [236, 237] оценивается равной 2—3%.
Принципиальные основы метода коаксиальных цилиндров
используются и в методе нагретой проволоки. В установках внутренний цилиндр
заменен проволокой небольшого диаметра, которая используется
одновременно как нагреватель и как термометр сопротивления. Исследуемое
вещество помещается между проволокой и наружным цилиндром,
диаметр которого уменьшен с целью исключения конвективного теплообмена.
Метод нагретой проволоки, аналогично предыдущим, также может быть
205
абсолютным или относительным, при этом коэффициент теплопроводности
рассчитывается по формуле A32) или A33).
Метод нагретой проволоки, предложенный Шлеермахером [239],
в настоящее время стал одним из наиболее апробированных методов
измерения теплопроводности жидкостей и газов. Для жидкостей его применили
в своих работах Д. Л. Тимрот и Н. Б. Варгафтик [240], Е. П. Боровик
и соавторы [241 ], А. К. Абас-заде [242], Н. В. Цедерберг и Д. Л.
Тимрот [243] и ряд других отечественных и зарубежных исследователей.
При использовании этого метода необходимо тщательно калибровать
капилляр измерительной трубки, обеспечивать соосность проволоки и
трубки, а в экспериментах под давлением уделять особое внимание
предотвращению конвективного теплообмена.
Значительно позднее упомянутых выше стационарных методов
определения коэффициента теплопроводности был предложен метод
регулярного режима, являющийся нестационарным. Г. М. Кондратьев [244,
245] создал теорию регулярного режима, основанную на том, что в
процессе охлаждения тела относительная скорость изменения температуры
в единицу времени при таком режиме является постоянной и одинаковой
во всех точках. Первоначально Г. М. Кондратьев на основании этой
теории предложил методы измерения коэффициента теплопроводности
твердых тел, а в дальнейшем [246] и жидкостей.
Основным узлом экспериментальной установки, работающей по
методу регулярного режима, является так называемый бикалориметр,
который чаще всего представляет собой шар, состоящий из ядра и
оболочки. Между ними находится слой исследуемой жидкости.
Математическое описание режима регулярного охлаждения бикалориметра позволяет
определить коэффициент теплопроводности жидкости. При отсутствии
скачка температуры между наружной поверхностью бикалориметра и
окружающей средой и при малом градиенте температур в ядре коэффициент
теплопроводности жидкости и относительная скорость изменения
температуры в единицу времени т связаны уравнением [245, 246]
Х = 8^-т, A34)
где б — толщина слоя жидкости;
К и Ф — постоянные прибора;
Б — критериальная величина, характеризующая режим
охлаждения.
Шаровые бикалориметры использованы в установке 3. И. Геллера
и Ю. Л. Расторгуева [247], с помощью которой исследована
теплопроводность толуола, некоторых масел и продуктов крекинга при
атмосферном давлении. Ядра и оболочки были изготовлены из меди — ее высокая
теплопроводность обеспечивала равномерное распределение температур.
Концентрическое расположение ядра и оболочки достигалось при помощи
фарфоровых распорок.
Получили распространение также цилиндрические бикалориметры,
которые использовали, в частности, Р. А. Мустафаев [248] при
определении теплопроводности различных сортов нефтяных масел и И. Ф. Голубев
и Я. М. Назиев [249] при измерении теплопроводности некоторых
газообразных и жидких углеводородов в интервале температур 0—360° С
и давлений 1—500 кГ/см*. Максимальная погрешность опытных данных
оценивается авторами [249] равной 2,5%. И. Ф. Голубев предложил
удачную конструкцию цилиндрического бикалориметра, что позволило
в дальнейшем исследовать теплопроводность газообразных воздуха и
метана [250], а также газообразного и жидкого азота [251] в широком
диапазоне параметров.
При использовании метода регулярного режима даже при отсутствии
конвекции могут быть допущены систематические ошибки в связи с отво-
206
дом тепла по дистанционным распоркам и по проводам термопар. На
степени достоверности опытных данных сказывается также скачок
температуры между наружной поверхностью бикалориметра и окружающей
средой, обусловленный конечным значением коэффициента теплоотдачи а
на поверхности бикалориметра. Для обеспечения высокого значения а
необходимо интенсивно перемешивать жидкость в термостате в ходе
эксперимента.
Итак, все методы, предложенные для измерения теплопроводности,
достаточно сложны и трудоемки. При создании установок на основании
каждого из рассмотренных методов необходимо строго соблюдать ряд
условий, иначе будет допущены значительные погрешности. Вместе с тем
полное исключение побочных эффектов при измерении теплопроводности,
по-видимому, невозможно, вследствие чего во многих случаях необходимо
критически оценивать точность полученных опытных данных. Можно
сказать, что теплопроводность является одной из наименее надежно
определяемых теплофизических характеристик. Отмеченные обстоятельства
учитывались в дальнейшем при анализе экспериментальных данных
о теплопроводности исследуемых нами криогенных жидкостей.
VII.2- Анализ экспериментальных данных
о теплопроводности компонентов воздуха
в жидком состоянии
Теплопроводность жидких азота, кислорода и аргона, в отличие от
вязкости, исследовалась преимущественно при давлениях, отличающихся
от давления насыщения. Наибольшее число экспериментальных работ
посвящено определению коэффициента теплопроводности азота.
Первым измерил теплопроводность жидкого азота Гамман [226]
в интервале температур —208,5-^ 199,7° С при давлениях насыщения.
И хотя данные Гаммана оказались существенно завышенными из-за
конвективного теплообмена (что отмечалось в VII. 1), однако в целом его работа
сыграла положительную роль в развитии методики теплофизического
эксперимента со сжиженными газами.
В дальнейшем Е. Боровик, А. Матвеев и Е. Панина [241 ] методом
нагретой проволоки получили более надежные данные о теплопроводности
жидкого азота при давлениях, близких к давлениям насыщения.
Диаметр платиновой проволоки составлял 0,048 мм, внутренний диаметр
медных измерительных трубок — 1,73 мм. Чтобы исключить влияние
концевых эффектов, в установке применены две измерительные трубки рабочей
длиной 141 и 67 мм. Авторы полагали, что при достаточно большом
отношении длины трубки к диаметру концевые эффекты не зависят от длины,
и поэтому определяли сопротивление средней части длинной нити как
разность сопротивлений обеих нитей. При изготовлении установки было
обращено внимание на достижение соосности нитей и трубок; чтобы нити
при нагреве не провисали, осуществлялось постоянное натяжение их
с помощью пружин. Прибор был помещен в герметически закрытый сосуд
Дьюара, заполненный охлаждающей жидкостью, которая
перемешивалась мешалкой. В приборе поддерживалось давление, несколько
превышавшее давление насыщенных паров исследуемого вещества при
температуре опыта, для того чтобы предотвратить появление пузырьков газа при
нагревании платиновой проволоки.
Чистота исследованных в работе [241 ] веществ (азота, окиси
углерода, метана и этилена), определенная химическим анализом, составила
99,8%. Полученные опытные данные представлены в таблице и на
графиках. Для азота приведены четыре опытные точки в интервале температур
—195,3-;—161,4° С. Погрешность опытных данных, по мнению авторов
[241 ], не превышала 2%.
207
Позднее Пауэре, Мэттокс и Джонстон [252] измерили
теплопроводность жидкого азота в состоянии насыщения методом плоского
горизонтального слоя. Измерительная камера экспериментальной установки
была образована двумя никелированными дисками и припаянной к ним
трубой из нержавеющей стали; внутренний диаметр камеры 76,2 мм,
расстояние между верхней и нижней пластинами 24,5 мм. На внутренних
поверхностях пластин закреплены спаи дифференциальной термопары
медь—константан, с помощью которой измерялась разность температур
в слое жидкости, составлявшая примерно 5 град. На наружной стороне
верхней пластины имелась спиральная канавка, в которой размещен
манганиновый нагреватель. Измерительная камера со всех сторон, за
исключением нижнего торца, окружена вакуумной рубашкой. Прибор
был погружен в криостат, в котором поддерживалась более низкая
температура, чем температура исследуемой жидкости.
В работе [252] получены 12 опытных точек в интервале температур
68,7—88,1° К. Экспериментальные данные представлены в таблице и на
графике; погрешность их оценена равной 1,5%. Пауэре и соавторы
сопоставили свои данные с полученными ранее и отмечают, что результаты [241 ]
выше данных [252] примерно на 3% при температуре 90° К и на 8%
при 80° К, а опытные величины [226] резко завышены. Авторы [252]
объясняют расхождение с данными [241 ] в основном ошибками,
допущенными Е. Боровиком и сотрудниками при калибровке экспериментальной
установки.
Теплопроводность жидкого азота при давлениях, существенно
отличающихся от давлений насыщения, впервые измерил Е. Боровик [224],
который провел эксперименты в интервале температур —182,8-;—102,5° С
и давлений 11,2—99,0 атм. Исследование охватывало наиболее трудную
для измерений околокритическую область и имело большое значение для
выяснения различия в механизме теплопроводности жидкости и газа.
В работе [224] использован метод плоского горизонтального слоя,
который, по мнению Е. Боровика, позволяет создать наилучшие условия для
исключения конвекции. Эффективный диаметр измерительной пластины
40,3 мм, расстояние между пластинами 2,09 мм. Для предохранения от
потерь тепла вокруг верхней пластины было размещено охранное кольцо,
а над ней — защитный диск. Температуры в приборе измерялись
платиновыми термометрами сопротивления; разность температур пластин
составляла 0,3—3 град и определялась с погрешностью 0,01 град. Прибор
помещался в ванну, заполненную жидким кислородом либо жидким
этиленом.
При обработке результатов измерений [224] были введены поправки
на утечку тепла через охранное кольцо A—2%) и на передачу тепла
излучением (от 0,05 до 2,3%). Помимо этого, была введена поправка на
конвекцию, так как полученные в опытах данные зависели от разности температур
пластин At. Для исключения влияния конвекции проводилась серия
измерений при фиксированных значениях температуры и давления и
различных At. Из графика, помещенного в работе [224], видно, что опытные
значения к линейно зависят от разности температур. Поэтому Е. Боровик
графически экстраполировал прямые, проведенные по опытным точкам,
до At = 0 и принял соответствующие значения коэффициента
теплопроводности в качестве «истинных».
Исследованный в работе [224] азот содержал менее 0,2% примесей.
В итоге экспериментов получено 21 значение коэффициента
теплопроводности для указанной выше области температур и давлений; данные
представлены в таблице и на графиках, построенных в координатах А,, р; X, t
и Я, р. При проведении исследований основное внимание было обращено
на измерения в области перехода от газа к жидкости. Поэтому на трех
докритических изотермах получено только четыре опытные точки при
давлениях до 43,6 атм, а на критической изотерме и ближайшей сверх-
208
критической (—140,5° С)—девять точек при давлениях до 93,9 атм.
Максимальная погрешность опытных данных оценена автором [224]
равной 3%, но, по нашему мнению, может превышать эту величину из-за
неточной графической экстраполяции, примененной, чтобы исключить
влияние конвекции на результаты опытов.
Значительно меньшую область изменения параметров по сравнению
с работой [224] исследовал Просад [253], который получил данные о
теплопроводности жидкого азота в интервале температур —181,6-^—179,1° С
и давлений 4—б атм. Данные [253] выше результатов [224] примерно
на 50% и близки к получаемым при экстраполяции ненадежных данных
Гаммана.
Юлир [254] определил теплопроводность азота при температурах
76,4—184,3° К и давлениях 5,8—67,6 атм; в этой же работе получены
данные о теплопроводности аргона. Измерения проводились методом
коаксиальных цилиндров; наружный диаметр внутреннего цилиндра—31,5 мм,
радиальный зазор между цилиндрами — 0,25 мм, а длина зазора —
141,7 мм.
Цилиндры были изготовлены из меди и центрированы с помощью
бакелитовых колец. Оба цилиндра составные; в них имелись полости
объемом 41,3 и 49,3 см3, заполненные гелием, с помощью которого
измерялась разность температур. Использование гелиевого газового
термометра является интересной особенностью установки Юлира. Как отмечает
автор [254], термометр устойчив к вибрациям, чувствителен и позволяет
регистрировать малые разности температур, благодаря чему можно свести
к минимуму конвективные токи. Ввиду малых перепадов температур
в рассматриваемой установке не требовалось применять точные
компенсирующие устройства или вносить существенные поправки в результаты
опытов. Прибор был заключен в алюминиевый корпус и погружен в сосуд
Дьюара, для охлаждения использован жидкий азот.
В работе [254] получены 22 опытные точки для азота, причем большая
часть их относится к давлениям ~33,5 и ~67 атм (я = 1 и 2). Данные
представлены в таблице и на графике, на котором нанесены также точки,
полученные интерполяцией данных Е. Боровика [224]. Результаты [224]
при давлении 67 атм в интервале температур 126—146° К значительно
ниже данных [254]; Юлир полагает, что причиной расхождения является
завышенная поправка на конвекцию, определенная Е. Боровиком по
методике, описанной выше. Максимальную погрешность своих опытных
данных Юлир оценил равной 2,5%. Для околокритической области эта
величина представляется нам заниженной, поскольку погрешность
определения абсолютной температуры в опытах могла достигать 0,5 град.
Теплопроводность жидкого и газообразного азота и аргона
исследовали также Цибланд и Бартон [255]; данные об азоте получены примерно
в том же интервале температур (80,7—202,5° К), что и в работе Юлира,
но в более широком интервале давлений A —134 атм). В работе [255]
использована экспериментальная установка, созданная по методу
коаксиальных цилиндров и подробно описанная авторами ранее [256].
Внутренний цилиндр изготовлен из серебра, длина его 100 мм и наружный
диаметр 32,84 мм; внешний цилиндр выполнен из меди, внутренний
диаметр его 33,33 мм. Центровка их осуществлялась с помощью шести
стеклянных штифтов. По торцам внутреннего цилиндра расположены
охранные нагреватели, имеющие тот же диаметр и длину 43 мм каждый.
Постоянная установки определена при температуре 20° С, а для других
температур пересчитывалась с помощью известных коэффициентов
термического расширения материалов цилиндров; погрешность определения
постоянной не превышала 0,5%. Разность температур между цилиндрами
измерялась термопарами медь—константан и составляла в опытах с азотом
0,48—6,0 град. В работе [255] установка была снабжена системой
автоматического регулирования температуры, что позволило поддерживать тем-
И Зак. 1978
209
пературу измерительной камеры постоянной в течение длительного
времени с погрешностью, не превышающей нескольких сотых градуса.
Чистота азота, исследованного Цибландом и Бартоном, составляла
99,5%. Для восьми изобар получено 86 опытных точек, из которых
примерно треть относится к жидкой фазе; данные представлены в таблице и
на графике. Значения коэффициента теплопроводности, включенные
в таблицу, получены осреднением результатов нескольких измерений;
каждый из результатов отличался от среднего значения не более чем на 1 %.
В работе [255 ] проанализированы причины, вызывающие конвекцию; ее
отсутствие проверялось измерением теплопроводности при неизменных
температурах и давлениях и различных At, при этом расхождения между
данными не превышали ±1%. Благодаря малому перепаду температур
конвекция практически не возникала даже на критической изотерме, и
только при давлениях, близких к рКр, в интервале температур ±3 град
от критической нельзя было выполнить надежные измерения. Авторы [255]
полагают, что в их установке конвекция могла появиться при
температурах, превышающих критическую на 5—15 град в интервале приведенных
давлений я = 1 — 2; при более высоких давлениях она не возникала.
Сравнительно недавно И. Ф. Голубев и М. В. Кальсина [251 ]
измерили теплопроводность жидкого и газообразного азота в интервале
температур — 195,6 -s- + 20,6° С и давлений от 1 до 485—600 атм методом
регулярного теплового режима. Бикалориметр И. Ф. Голубева, конструкция
которого описана в статье [250], имеет цилиндрическую форму.
Внутренний и внешний цилиндры изготовлены из меди, а их поверхности,
ограничивающие слой исследуемого вещества, полированы и никелированы.
Внутренний цилиндр диаметром 12 мм состоял из средней (измерительной)
части длиной 140 мм и двух торцовых компенсационных цилиндров
длиной по 50 мм. Толщина слоя исследуемого вещества в опытах с азотом
составляла 0,3 мм. По оси внутреннего цилиндра размещен нихромовый
электронагреватель. Температура внешнего цилиндра измерялась
платиновым термометром сопротивления с погрешностью 0,1 град, а разность
температур цилиндров — трехспайной дифференциальной термопарой
медь—константан. Давление измерялось образцовыми манометрами
класса 0,2. Для проведения опытов при температурах ниже комнатной
бикалориметр помещался в криостат. Азот, исследованный в работе [251 ],
содержал в качестве примесей только 0,005% кислорода.
Опытные данные, полученные И. Ф. Голубевым и М. В. Кальсиной,
представлены только на графике в координатах КРуТ — Яг; р. Обработка
данных в указанных координатах позволила установить обобщенную
зависимость избыточной теплопроводности от плотности, справедливую
при большинстве температур и давлений, за исключением
околокритических. С помощью этой зависимости в работе [251 ] определены значения
коэффициента теплопроводности газообразного и жидкого азота при
круглых температурах и давлениях (для 23 изотерм в интервале —195,8-г-
-?-0о С и 14 изобар в интервале 1—500 атм). Авторы [251 ] не оценили
точности данных, но отметили их удовлетворительное согласование
с результатами [255].
Нами сопоставлены в координатах X, Т и X, р экспериментальные
значения теплопроводности азота, полученные в большинстве
рассмотренных работ (за исключением ненадежных данных [226], [253]). Сравнение
показало, что данные И. Ф. Голубева и М. В. Кальсиной [251 ] и Цибланда
и Бартона [255] чаще всего являются промежуточными по отношению
к результатам более ранних исследований. Данные [251, 255] для жидкой
фазы согласуются в пределах 1—2%, а результаты других авторов [224,
254] отличаются от них не более чем на 4%, за исключением двух опытных
значений [224] при температуре —182,8° С, завышенных на 8%, При
экстраполяции изотерм, построенных по данным [251, 255], до кривой
насыщения значения коэффициента теплопроводности оказываются ниже
210
опытных данных Пауэрса, Мэттокса и Джонстона [252], однако
отклонения в основном не превышают 2—3% и только при температуре —185° С
достигают 6%. Данные Е. Боровика, А. Матвеева и Е. Паниной [241 ] для
кривой насыщения не согласуются с данными в однофазной области и,
по-видимому, завышены в среднем на 10%. Следует заметить, что в
околокритическом районе между данными о температуропроводности газообраз-
0 70 110 150 190 • 230 270 Т,°К
Рис. 31. Зависимость теплопроводности азота от температуры и
давления по данным:
/ — И. Ф. Голубева и М. В. Кальсиной [251]; 2 — Цибланда и Бартона [255];
3 — Юлира [254].
ного азота наблюдаются существенные расхождения. Так, в интервале
температур 130—150° К при давлениях 33,5—134 апгм опытные данные[255]
выше результатов [2513 на 5—10%, а расхождение между данными [224]
и [254] достигает 14%. Но в области жидкости, как отмечено выше,
данные И. Ф. Голубева и М. В. Кальсиной [251 ] и Цибланда и Бартона [255]
согласуются вполне удовлетворительно и поэтому могут быть приняты
в качестве опорных при расчете коэффициента теплопроводности жидкого
азота.
На рис. 31 показана зависимость теплопроводности жидкого и
газообразного азота от температуры и давления. При построении графика
использованы в основном данные [251 ] в более широкой области
параметров, чем результаты остальных исследователей. Для изобар 33,5; 67
14*
211
и 134 атм значения X получены нами графической интерполяцией данных
[251 ] с целью сопоставления их с результатами других авторов. При
этих же давлениях на график нанесены опытные точки [254, 255]. Из
рисунка видно, что теплопроводность жидкости значительно выше
теплопроводности газа при той же температуре. По мере ее повышения
теплопроводность жидкости, как и вязкость, понижается. При докритических
давлениях фазовый переход от жидкости к газу связан с резким
уменьшением теплопроводности, которое аналогично изменению
термодинамических свойств и вязкости на этих изобарах. При сверхкритических
давлениях теплопроводность изменяется непрерывно с изменением температуры.
Сверхкритические изобары, а также некоторые докритические в
координатах к, Т имеют минимум, после которого теплопроводность газа
монотонно возрастает с повышением температуры. Этот минимум по мере роста
давления смещается в область более высоких температур. Рис. 31 не
только отражает поведение коэффициента теплопроводности, но и позволяет
оценить согласованность опытных данных [251, 254, 255] в области газа
и жидкости.
Помимо графического отображения экспериментальных данных о
жидком азоте в обычных координатах, в дальнейшем эти данные обработаны
в других системах координат с целью получения уравнения для расчета
теплопроводности (см. VII.3).
Теплопроводность жидкого кислорода, несмотря на его широкое
применение в технике, исследована хуже, чем теплопроводность азота.
Первым это свойство жидкого кислорода измерил Гамман [226] в
состоянии насыщения при температурах —207,2-^—191,1° С. Полученные им
семь опытных значений завышены и возрастают по мере повышения
температуры, иначе говоря, данные [226] даже качественно не передают
зависимости теплопроводности от температуры.
В 1955 г. Цибланд и Бартон [256] определили теплопроводность
жидкого и газообразного кислорода в интервале температур 79,2—199,8° К
и давлений 1 —135,8 атм методом коаксиальных цилиндров. Особенности
использованной ими экспериментальной установки отмечены выше при
рассмотрении опытных данных об азоте. При проведении опытов с
кислородом в установке еще не было устройства для автоматического
регулирования температуры в измерительной камере, что несколько увеличивало
продолжительность измерений. Разность температур между цилиндрами
составляла от 0,39 до 8,07 град в зависимости от температуры и давления.
Исследованный кислород содержал до 0,2% примесей.
Из приведенных в работе [256] 65 значений коэффициента
теплопроводности кислорода подавляющее большинство получено осреднением
результатов трех—шести измерений; отклонения от средних значений не
превышали 1%. На основании опытных данных в работе построена
диаграмма теплопроводность — температура для интервала 80—
200° К и нанесены 16 изобар от 1 до 140 атм, а также кривая
насыщения.
Почти одновременно с авторами [256] Н. В. Цедерберг и Д. Л. Тим-
рот [243] измерили теплопроводность кислорода при давлениях 60 и
100 кГ/см2 в интервале температур —190-^+25° С методом нагретой
проволоки. В экспериментальной установке [243] диаметр платиновой
проволоки-нагревателя составил 0,1 мм, внутренний диаметр стеклянной
измерительной трубки — 0,52 мм (в окончательной серии опытов [225])
и длина измерительного участка — 98 мм. На стеклянную трубку был
навит наружный термометр сопротивления, изготовленный из платиновой
проволоки диаметром 0,05 мм. Для натяжения нагревателя установлена
вольфрамовая пружина. Измерительное устройство помещено в
обогреваемый медный блок, окруженный вакуумной рубашкой, а весь прибор
погружен в сосуд Дьюара с жидким азотом; температуры выше —190° С
создавались обогревом медного блока.
212
При изготовлении измерительной части прибора было чрезвычайно
трудно достичь соосности трубки и нагревательной нити. Постоянная
прибора, вычисленная по геометрическим размерам, составила 2,67, однако
после контрольных опытов с воздухом принята равной 2,50, что
свидетельствовало об эксцентриситете в расположении нагревателя. Перепад
температур в слое кислорода Л^, величина которого в рассматриваемой работе
не указана, по-видимому, поддерживался в допустимых пределах,
поскольку авторы [243] специально исследовали вопрос о его влиянии на
возникновение конвекции. Значение At. находили как разность между
общим перепадом температур, определяемым с помощью термометров
сопротивления, и перепадом в стенке измерительной трубки, при расчете
которого принималась во внимание зависимость теплопроводности стекла
от температуры. При обработке данных учитывалось влияние натяжения
нагревателя на его электрическое сопротивление, но поправки на
лучистый теплообмен и на отвод тепла с концов проволоки не вводились,
поскольку они, как показал расчет, не превышали 0,12 и 0,60%
соответственно и лежали в пределах погрешности измерений.
В работе [243] не приведена таблица экспериментальных данных,
а имеется только график, на котором представлена зависимость
теплопроводности от температуры при давлениях 60 и 100 кГ/см2.
Максимальная погрешность измерений при температурах ниже —130° С не превышала
2,8%, но при более высоких температурах возрастала до 4—5% из-за
трудности поддержания стационарного режима при нагреве медного
блока. Н. В. Цедерберг и Д. Л. Тимрот обработали экспериментальные
данные в логарифмических координатах и описали их уравнениями
К.т = К + 4>зо- ю~8р2,11, A35
Хр9 Т = ХТ+ 1,246.10~У'2\ A36)
первое из которых справедливо при плотностях свыше 825 /сг/ж3, а второе —
в интервале 50—535 кг/м3. Размерность коэффициента теплопроводности
в этих уравнениях — ккал/(м-ч-град). По уравнениям A35) и A36) авторы
[243] рассчитали теплопроводность жидкого и газообразного кислорода
в интервале температур —200-^+40° С и давлений 1 —100 кГ/см2 (с шагом
20 град и 20 кГ/см2).
Н. В. Цедерберг и Д. Л. Тимрот сопоставили значения А,, полученные
интерполяцией своих опытных данных, с результатами Е. Боровика [224],
который измерил теплопроводность газообразного кислорода на
изотерме —117° С, близкой к критической, в интервале давлений 25,2—
96,8 атм. По мнению авторов [243], расхождения не превышают 3,5%,
т. е. лежат в пределах суммарной погрешности сравниваемых величин.
Однако интерполяция данных Н. В. Цедерберга и Д. Л. Тимрота в
околокритической области не могла быть выполнена достаточно надежно из-за
сложной конфигурации изобар и малочисленности опытных точек. Поэтому
сопоставлением данных [224] и [243] нельзя строго оценить их
согласованность.
Имеются работы, в которых приведены лишь отдельные значения
теплопроводности жидкого кислорода. Так, в работе Просада [257]
измерена теплопроводность в состоянии насыщения при температуре
—180,9° С. Кейс [258], наряду с данными о газообразном кислороде,
получил две опытные точки для жидкости при температурах — 187,5
и —162,8° С и давлениях 7,4 и 10,5 атм соответственно. В работе [259],
посвященной исследованию теплопроводности жидкого озона в интервале
температур —195,8 -^ —128,0° С, определено значение X для жидкого
кислорода в состоянии насыщения при t = —195,8° С.
Наиболее подробными являются результаты Цибланда и Бартона
[256]. Они были обработаны нами графически по двум сечениям —
изотермам и изобарам, что позволило получить сглаженные табличные зна-
3
i
чения коэффициента теплопроводности при круглых температурах и
давлениях. Сопоставление полученных значений X с рассчитанными по
уравнениям Н. В. Цедерберга и Д. Л. Тимрота [243] показало, что они
согласуются преимущественно в пределах 1—2%, и только в околокритическом
районе расхождения достигают 4—5%. Результаты опытов Е. Боровика
на изотерме —117° С оказались ниже сглаженных величин [256] на 8%
при давлении 67,8 атм и на 13% при р = 96,8 атм. Опытные данные
Кейса [258] согласуются с результатами [256] в пределах 1%, а
величины X в работах [257] и [259] оказываются выше на 40 и 8%
соответственно. В дальнейшем в качестве опорных данных для расчета
теплопроводности жидкого кислорода были использованы результаты работ
[243, 256].
Довольно подробные экспериментальные данные о
теплопроводности жидкого аргона получены в работах Юлира [254] и Цибланда и Бар-
тона [255], рассмотренных ранее при анализе данных о жидком азоте.
Юлир измерил теплопроводность аргона в интервале температур 86,6—
193,8° К и давлений 0,98—96,1 атм. Исследованный аргон содержал
в качестве примесей до 0,4% азота. Опытные данные Юлира представлены
на девяти изобарах в виде таблицы и графика, построенного в
координатах А,, Г; из приведенных 66 опытных точек к жидкой фазе относятся 37.
В работе [254] перепады температур были небольшими, однако в
околокритической области не исключена возможность влияния конвекции на
результаты эксперимента, и погрешность опытных данных в этой области
могла превысить указанную автором величину 2,5%.
Цибланд и Бартон [255] определили теплопроводность аргона в
диапазоне температур 93,3—196,1° К и давлений 1—120 атм. Чистота
исследованного аргона составляла 99,95%. Экспериментальные данные
представлены для 11 изобар в таблице и на графике. В работе [255] приведено
для аргона 120 значений А, из которых примерно половина относится
к области жидкости; подавляющее большинство значений X, приведенных
в таблице, получено осреднением данных 2—7 измерений, отличающихся
от среднего значения в пределах ± 1 %. Разность температур между
цилиндрами лежала в пределах 0,54—6,7 град. Опыты при различных At
показали, что при критическом давлении и температурах ниже 148° К
конвекция не возникала. При давлении л = 1,5 в интервале температур 158—
165° К некоторые опытные значения X оказались завышенными вследствие
влияния конвективного теплообмена, но в области более высоких
давлений изменение перепада температур не влияло на коэффициент
теплопроводности.
В упомянутой выше работе Кейса [258], где измерена
теплопроводность семи газов и жидкостей методом коаксиальных цилиндров, получено
пять значений X жидкого аргона в интервале температур —186,3-^
¦*-—161,3° С и давлений 2,2—10,2 атм.
В 1963 г. Икенберри и Райе [260] методом коаксиальных цилиндров
исследовали теплопроводность аргона в обширной области параметров
(91,1—234,6° К; 1—500 атм); ими получены также данные о криптоне,
ксеноне и метане. Авторы [260] подчеркивают, что этот метод позволяет
использовать измерительную камеру небольшого диаметра, которую
легко поместить в корпус, выдерживающий высокое давление, и вместе
с корпусом погрузить в сосуд Дьюара. Установка Икенберри и Раиса
имела меньшие размеры, чем рассмотренные ранее установки, созданные
по методу коаксиальных цилиндров. Наружный диаметр внутреннего
цилиндра был равен 9,83 мм, длина цилиндров 76,2 мм и радиальный зазор
между ними 0,38 мм. Цилиндры изготовлены из меди; по оси внутреннего
цилиндра просверлено отверстие, в котором размещен нихромовый
электронагреватель. Температура наружного цилиндра и разность температур
цилиндров измерялись с помощью термопар медь—константан;
погрешности измерения составляли 0,1 и 0,01 град соответственно. В процессе
214
эксперимента разность температур составляла примерно 0,4 град; авторы
[260] полагают, что при такой незначительной разности температур
и зазоре 0,38 мм в установке не могла возникнуть конвекция, за
исключением опытов в критической области.
Аргон, исследованный в работе [260], имел весьма высокую чистоту
(99,99%). Для этого вещества Икенберри и Райе получили 68 опытных
точек, из которых 40 — в области жидкости. Данные представлены в виде
таблицы и на графике для восьми изотерм при давлениях, близких к
круглым значениям; максимальное давление на изотермах, как правило,
составляет 498,1—501,5 атм, а при Т = 149,5° К достигает 532,1 атм. Авторы
[260] отмечают, что их опытные данные хорошо согласуются с
полученными Юлиром [254] и Цибландом и Бартоном [255], за исключением
данных на изобаре 96 атм при температурах несколько выше критической;
однако числовые результаты сопоставления в работе не приведены.
Максимальную погрешность своих экспериментальных данных Икенберри и
Райе оценили равной 2%, однако из приведенных выше сведений о
точности измерения разности температур видно, что погрешность могла
превышать указанное значение.
Выполненная нами обработка данных [260] показала, что по ним
могут быть проведены плавные изотермы и изобары и большинство точек
согласуется с этими кривыми в пределах 1—2%; отклонения некоторых
точек достигают 3%, что несколько превышает погрешность, указанную
экспериментаторами. Данные Икенберри и Раиса согласуются с
большинством точек Цибланда и Бартона в пределах 2%, однако между
отдельными точками при температурах выше 135° К имеются расхождения до 5—
6%; как правило, эти точки отклоняются от плавной поверхности X, р, Г,
построенной по опытным данным каждой группы авторов. Данные Юлира
[254], полученные при тех же давлениях, что и результаты Цибланда и
Бартона [255], в интервале Т = 100—130° К согласуются с ними в
пределах ±2%, однако при Т = 90° К ниже на 3—4%, а на
околокритических изотермах 140—150° К выше на 3—5%. Значения к, полученные
Кейсом [258], ниже данных [255] на 2—4%. При тех температурах и
давлениях, при которых наблюдаются наибольшие расхождения между
экспериментальными данными, результаты [260] часто занимают
промежуточное положение по отношению к опытным величинам других авторов.
Сопоставление показывает, что в качестве опорных данных о
теплопроводности жидкого аргона могут быть приняты результаты Икенберри и Раиса,
а при давлениях до 120 атм — также и подробные данные Цибланда и
Бартона.
Теплопроводность воздуха при температурах ниже 0° С и повышенных
давлениях в течение длительного времени не была исследована
экспериментально. Только в 1963 г. И. Ф. Голубев [250] при измерении
теплопроводности газообразного воздуха в широком интервале температур при
давлении до 500 атм методом регулярного режима получил данные для
изотермы —77° С, которая еще достаточно удалена от области жидкости.
Из анализа экспериментальных данных о теплопроводности
компонентов воздуха в жидком состоянии видно, что только данные об азоте
и аргоне относятся ко всему диапазону давлений, для которого в
настоящей работе составляются таблицы теплофизических свойств. Для
кислорода данные ограничены давлением 136 атм, а для воздуха вообще
отсутствуют, что существенно усложняет расчет значений X этих жидкостей.
Поэтому в VI 1.3 рассматриваются методы расчета теплопроводности
жидкостей на основании ограниченного числа экспериментальных данных
с целью получения соответствующих уравнений и расчета
теплопроводности исследуемых веществ в широкой области температур и давлений.
215
VII.3. Расчет теплопроводности жидких
азота, кислорода, аргона и воздуха
Как отмечалось в предыдущих главах, в силу специфических
особенностей жидкого состояния — интенсивного взаимодействия частиц при
их большой неупорядоченности, затрудняющих теоретический анализ
проблемы, а также ввиду отсутствия надежных данных об истинной
структуре жидкостей, в настоящее время не имеется теории, которую можно
использовать для точного определения теплофизических свойств
жидкостей, в частности, для вычисления коэффициента теплопроводности.
Большинство теоретических выражений, используемых для расчета
теплопроводности жидкостей, основано на модели явления переноса
энергии в жидкости, предложенной Бриджменом [261]. При этом
предполагается, что энергия молекул, равная RT/2 на одну степень свободы,
передается от слоя с высокой температурой к слою с более низкой
температурой, а скорость процесса переноса равна скорости распространения
звука в жидкости. Общая энергия, передаваемая молекулами, принимается
равной градиенту энергии, умноженному на время, а коэффициент
теплопроводности определяется с помощью уравнения Фурье
Х = ^г, A37)
где R — газовая постоянная;
а — скорость звука;
/ — среднее расстояние между центрами молекул.
Допуская, что молекулы располагаются рядами в кубической решетке,
можно записать
/ = у WF0,
где V — объем 1 моля, iV0 — число Авогадро. Следовательно,
теплопроводность жидкости в соответствии с теорией Бриджмена может быть
представлена в виде
X = 2Ra(-^Y . A38)
Кардос [262] и Сакиадис и Котес [263], основываясь на теории
Бриджмена и предполагая, что энергия, перенесенная 1 молем, равна удельной
теплоемкости вещества, а расстояние между молекулами меньше
расстояния между их центрами, получили следующую зависимость для расчета
теплопроводности жидкости:
А, == cppaL, A39)
где L — среднее расстояние между поверхностями молекул в смежных
изотермических слоях, которое меньше расстояния / между центрами
молекул на диаметр молекулы. Итак, из теории Бриджмена следует, что
количество энергии, передаваемое через слой жидкости, пропорционально
теплоемкости и плотности.
Несмотря на то, что уравнения A38) и A39) в некоторой мере
обоснованы теоретически, средняя погрешность значений теплопроводности,
рассчитанных по ним, составляет 25 и 16% соответственно [185, 210], что
не позволяет использовать эти уравнения для точных расчетов.
Второе направление в развитии теории теплопроводности жидкостей
основано на попытках связать рассматриваемое явление с теорией свобод-
216
ного объема жидкости. Основываясь на этой теории, Фурье [264] вывел
уравнение для теплопроводности
с\12Т
^ = Т^> A40)
где cv — удельная теплоемкость при постоянном объеме;
/ — среднее расстояние между центрами молекул;
г] — коэффициент динамической вязкости.
Теоретические предпосылки, использованные при выводе
уравнения A40), не являются более строгими, чем положения теории Бриджмена.
В случае практического использования этого уравнения требуется больше
исходных данных, чем при расчетах по уравнениям A38) и A39), и не
достигается существенного повышения точности. Поэтому уравнение
Фурье не получило широкого распространения.
Одно из первых эмпирических уравнений для теплопроводности
жидкостей было предложено еще в 1880 г. Вебером [220]:
_4_ 1_
к=А-срр3М \ A41)
где А —постоянная, среднее значение которой 3,59-10~3 [при
размерности X — кал/(см-сек-град), ср — кал/'(г• град) и р — г/см3];
М — молекулярная масса.
Уравнение A41) составлено на основании экспериментальных данных
примерно для пятидесяти жидкостей; данные получены методом плоского
горизонтального слоя. Для некоторых углеводородных жидкостей А
принимает значения от 3,18-10 до 4,63-Ю-3, и если при расчете не учесть
этого, а пользоваться средним значением А, то можно допустить ошибку
от 13 до 22%.
Для лучшего согласования расчетных данных с экспериментальными
Смит [265] предложил принять в уравнении A41) А = 4,3• 10~3. Оно
весьма близко к полученному позднее Н. Б. Варгафтиком [266] на
основании своих экспериментальных данных о коэффициентах
теплопроводности двенадцати жидкостей при температуре 30° С (А =4,28*10~3).
Однако Пальмер [267] полагает, что нельзя выбирать одинаковое
значение А для нормальных и ассоциированных жидкостей. Он предложил
уравнение аналогичного вида, в котором фигурирует энтропия
парообразования при нормальной температуре кипения как фактор,
характеризующий полярность.
В работе [265] Смит предложил новое эмпирическое уравнение,
связывающее теплопроводность с плотностью, теплоемкостью и вязкостью,
А,-106 = 11 + 6450(ср — 0,45K 4- 1250 (^)°'ЗЗЭ + 100 ^_1!_\0'ш. A42)
В уравнении A42) размерности X, ср и р такие же, как и в уравнении
A41), размерность вязкости — спз.
В монографии Рида и Шервуда [185] приведена подробная таблица,
где сравниваются значения теплопроводности, рассчитанные по
уравнениям Вебера [220], Пальмера [267] и обоим уравнениям Смита [265],
с экспериментальными данными для многих жидкостей. Наименьшее
среднее отклонение достигается по уравнению Вебера, но это отклонение
A3%) существенно превышает погрешность эксперимента.
А. С. Предводителев [268] показал, что А в уравнении Вебера не
является постоянной, а зависит от температуры и давления. В
дальнейшем, пользуясь теорией адиабатических инвариантов, А. С.
Предводителев [202] установил, что для конденсированных газов, в которых суще-
217
-ственно проявляются силы Ван-дер-Ваальса, произведение А (р, Т)-ср
не зависит от состояния вещества. Обозначив А (р, Т)-ср-М 3 через В,
можно записать уравнение A41) в виде
Я-Вр3, A43)
где значение постоянной В определяется только природой вещества.
Проверка уравнения A43), выполненная А. К. Абас-заде [242] по
экспериментальным данным о теплопроводности бензола, толуола и ксилола
в жидком и газообразном состояниях, показала, что В в уравнении [143]
действительно не зависит от температуры и давления. Л. П. Филиппов
[269] на основании экспериментальных данных о 50 органических
жидкостях получил выражение, связывающее отношения коэффициентов
теплопроводности при различных температурах и фиксированных давлениях
с отношениями плотностей в этих состояниях,
?-(?)'¦ <144>
чем также подтвердил справедливость уравнения A43).
Уравнение A43) применимо только для жидкостей, но А. С. Предводи-
телев [203] обобщил его для всей однофазной области, представив
уравнение для расчета теплопроводности в виде
_4_
Я = Яг + Вр~, A45)
где кт — коэффициент теплопроводности разреженных газов. Неточности,
обнаруженные В. А. Соловьевым [205] в работе [203], не снижают,
однако, практической ценности уравнения A45), проверенного на
обширном экспериментальном материале.
Н. Б. Варгафтик [270] предложил более общий вид уравнения для
теплопроводности реальных газов:
Л = Хг + /(р), A46)
где вид функции / (р) устанавливается на основании экспериментальных
данных. По опытным данным о теплопроводности двуокиси углерода,
азота и водяного пара Н. Б. Варгафтик определил вид этой функции и
получил уравнение в форме
к = Ьт+Врп. A47)
Как отмечено в монографии [225], уравнение A47) хорошо описывает
теплопроводность сжатых газов до значений плотности, равных полутора
критическим, поэтому многие исследователи использовали его для
обобщения экспериментальных данных.
Имеется еще ряд уравнений, позволяющих рассчитать
теплопроводность жидкости на основании данных о термодинамических свойствах и
вязкости, однако эти уравнения не рассматриваются нами из-за их низкой
точности. Сведения об этих уравнениях имеются в недавно изданной
монографии Бретшнайдера [210].
Из краткого обзора уравнений для расчета теплопроводности
жидкости видно, что в большинстве выражается зависимость теплопроводности
от двух переменных ,и только уравнение A43) представляет X как
функцию плотности. Из уравнений в форме А, = / (Г, р) наиболее удачными
являются уравнения А. С. Предводителева A45) и Н. Б. Варгафтика
.218
#{146), в которых теплопроводность выражена в виде суммы функций
температуры и плотности, причем в качестве температурной функции
принимается теплопроводность газа при атмосферном давлении. Такая
зависимость теплопроводности жидкости от двух переменных является более
общей, чем зависимость только от плотности, противоречащая, кроме
того, общей тенденции поведения теплофизических свойств реального газа
в широком диапазоне изменения параметров. Однако, учитывая хорошее
«соответствие опытным данным, показанное при проверке уравнения A43)
в работах [203, 242, 269], мы сочли целесообразным обработать наиболее
-подробные экспериментальные данные об азоте и аргоне в координатах
как X, р, так и АХ, р. Значения плотности исследуемых жидкостей при
температурах и давлениях эксперимента определялись по их уравнениям
состояния, полученным в главах II—IV. Для расчета избыточной
теплопроводности XPt т — Хт использованы значения Хт газа при давлении 1 бар
;по соображениям, аналогичным изложенным в главе VI при расчете
избыточной вязкости. При температурах ниже нормальной температуры
кипения значения Хт, как и%, получены экстраполяцией соответствующих
:кривых, построенных по данным [70].
На рис. 32 представлены экспериментальные данные о
теплопроводности жидкого азота [224, 251, 254, 255] в координатах X, р и АХ, р.
В обеих системах координат опытные данные группируются вокруг
обобщенных кривых примерно с одинаковым разбросом. Отклонения опытных
точек И. Ф. Голубева и М. В. Кальсиной [251] и Цибланда и Бартона
[255] от кривых X = / (р) и АХ = f (p), как правило, находятся в пределах
±2%, и только для некоторых точек [251 ] на изотермах — 160 и —170° С
незначительно превышают указанную величину. Данные Юлира [254],
как и в обычной системе координат X, р, Т, отличаются большим
разбросом, достигающим 4%, однако не обнаруживают каких-либо регулярных
отклонений от обобщенных кривых. Опытные точки Е. Боровика [224]
на изотерме —182,8° С существенно выше, что отмечалось и ранее при
сопоставлении данных на изотермах и изобарах. На график не нанесены
экспериментальные данные [241, 252] для кривой насыщения, которые
выше данных [251, 255] и при обработке в координатах X, р и АХ, р,
естественно, располагались бы выше обобщенных кривых. Из рис. 32
видно, что расстояние между кривыми X — f (р) и АХ = f (p) в
направлении оси ординат несколько уменьшается по мере роста плотности. Это
объясняется тем, что для фиксированного интервала давлений более
высоким значениям плотности жидкости на изотермах соответствуют более
низкие температуры и, следовательно, меньшие значения Хт.
При обработке экспериментальных значений теплопроводности
аргона в тех же системах координат (рис. 33) разброс точек оказывается
более заметным, чем для азота. Это частично объясняется тем, что данные
И. Ф. Голубева и М. В. Кальсиной об азоте [251 ] сглажены самими
экспериментаторами в координатах АХ, р. Наиболее существенным для
нас является то обстоятельство, что и для аргона обе системы координат
позволяют достигнуть примерно одинаковой точности при построении
обобщенной кривой по опытным точкам. Большинство экспериментальных
данных Икенберри и Раиса [260] и Цибланда и Бартона [255] отклоняется
от кривых X = / (р) и АХ = f (p) не более чем на 3%, и лишь для отдельных
точек отклонения превышают указанную величину. Часть опытных точек
Юлира [254] и Кейса [258] несколько больше отклоняется от
обобщенных кривых, однако отклонения лежат в тех же пределах, что и при
сопоставлении всех опытных данных в обычных координатах X, р, Т, и не
свидетельствуют о непригодности зависимостей X = f (р) и АХ = f (p).
Обработка экспериментальных данных о теплопроводности аргона
в координатах lg X, lg р (рис. 34) показывает, что при этом не
соблюдается линейная зависимость, т. е. уравнение A43) даже в случае выбора
на основании опытных данных не только постоянной В, но и показателя
219
§
1 ^ч
N
S
^2^
Щ&
^Чь
ш9
<*
«
а\
1A1
? о О «
<
<
V
с^ч
Щл
< ^
dQ
о\
о
3
X OD
D
<\
V1
р
\я
'14
С5к
со»
1с*
CD
О О
m 3 s
CD ffi
К Я5
О
-с,,
О
vo ^ о
о з я :^-
О я о
>а рр
• 3 °
см 2 сх
со ? с
я Й §
S S CD
а Он н
аз
Н
О
та о cs»
о h^n
S Я ВДрЦ
Si л1
я я ==?
I . 2 *
Х-10е
м-град
120
W0
80
SO
Рис. 33. Обобщение опытных
данных о теплопроводности жидкого
аргона:
/ — данные Икенберри и Раиса [260];
2 — Цибланда и Бартона [255]; 3 —
Кейса [258]; 4 — Юлира [254].
40
*л-
D-/
о-2
• ~3
д-4
л
kS^?
А
jM
А&рР
^^ °
>^l
D^rf
по
и
а
П JT
УЪ&
Jfid
а 4W^
A jp*°
о.
D new
oj
OJ0J
n6gP*
Q
n/u
D 5^4 D/
ж4 J?
7
№.
D>^ ^л
0,8
ax-10;
кВт
мград
WO
0,5
Ю
V
U
1,3
120
WO
80
60
1Л
кг
дм
40
степени при величине плотности не может описать эти данные в широком"
диапазоне параметров. В то же время из рис. 34 видно, что в узком
интервале плотностей, т. е. для группы близко расположенных изотерм, можно
провести прямую по опытным точкам в пределах их разброса, чем и
объясняется хорошее согласование расчетных значений X с экспериментальными
в работах [203, 242, 269]. Аналогичный результат получается при
обработке опытных данных в координатах lg AX, lg p.
-0,10 -0,05 0 0,05 0,10 0,15 lgp
Рис. 34. Экспериментальные данные о теплопроводности жидкого аргона в координатах
lgMgp:
/ — данные Икенберри и Раиса [260]; 2 — Цибланда и Бартона [255]; 3 — Кейса [258]; 4 — Юлира
[254].
Поскольку кривые А, = / (р) и АХ = / (р) с одинаково хорошей
точностью соответствуют экспериментальным данным о наиболее изученных
компонентах воздуха, нами было использовано для расчета
теплопроводности исследуемых жидкостей уравнение Н. Б. Варгафтика A46),
имеющее наиболее общий вид и позволяющее в принципе получить единое
уравнение для расчета теплопроводности газа и жидкости.
В монографии [70] опытные данные о теплопроводности
газообразного воздуха и его компонентов в широком интервале температур и
плотностей обобщены в координатах ДА, р, и полученные кривые с высокой
точностью описаны полиномами 4-й или 5-й степени от плотности. В отличие
от уравнений для расчета вязкости, уравнения для определения
избыточной теплопроводности газообразных азота и аргона даже при условии
экстраполяции по плотностям хорошо согласуются с данными о жидкости.
222
во всем рассмотренном нами интервале плотностей. Так, для жидкого
азота при построении кривой ДА, = / (р) до р = 0,76 кг/дм3 могут быть
приняты в качестве опорных значения ДА,,- рассчитанные по уравнению
[70], и только при более высоких плотностях расчетная кривая,
показанная на рис. 32 штриховой линией, располагается несколько выше
принятой нами опорной кривой (сплошная линия), однако расхождения не
превышают 1%. Для жидкого аргона опорная кривая ДА, = / (р)
совпадает с рассчитанной по уравнению [70] при плотностях менее 0,9 кг/дм3,
а при более высоких она проведена нами несколько выше расчетной (на
1,0—1,8%). Такое хорошее согласование объясняется тем, что при
составлении уравнений для расчета теплопроводности газообразных азота
и аргона в интервалах плотностей 0—0,7 и 0—1,4 кг/дм3 соответственно
были также использованы в качестве опорных данные И. Ф. Голубева
и М. В. Кальсиной [251 ] и Цибланда и Бартона [255]. К тому же
производная d (АХ)! dp в отличие от d (Ay\)ldp не начинает резко возрастать
при плотностях выше 2,5 критической, и поэтому экстраполяция ранее
составленных уравнений по плотностям не вызывает существенного
расхождения с опытными данными.
Отсутствие на опорных кривых ДА, = / (р) для азота и аргона
участков с резким изменением кривизны позволило описать кривые в
широком интервале плотностей, включая докритические плотности,
уравнениями, содержащими всего пять членов. Эти уравнения имеют вид:
для азота
Кт — Ат = 29,46р + 175,67р2 — 305,78р3 -\ 420,06р4 — 79,16р5; A48)
для аргона
Кт — К = 18,52р + 57,98р2 — 71,53р3 + 57,18р4 — 7,52р5, A49)
где А, выражена в 10~6 кет/(м-град), р — в кг/дм3. Уравнения A48) и
A49) описывают опорные кривые в интервалах плотностей 0,15—0,9 и
0,20—1,45 кг/дм3 с погрешностями менее 0,20 и 0,35% соответственно.
При меньших значениях р относительные отклонения расчетных ДА, от
опорных, естественно, возрастают, однако абсолютные отклонения не
превышают 3-Ю кет/(м-град). Необходимо заметить, что на
околокритических изотермах наблюдаются существенные отклонения опытных точек
от обобщенной кривой в интервале плотностей 0,10—0,45 кг/дм3 для
азота и 0,15—0,85 кг/дм3 для аргона [70] — это следует учитывать при
расчете теплопроводности по уравнениям A48) и A49).
Данные о теплопроводности жидкого кислорода были обработаны
нами только в координатах ДА,, р; при этом, наряду с опытными данными
Цибланда и Бартона [256] и Кейса [258], были использованы также ДА,,
рассчитанные для выбранных значений плотности по уравнениям
Н. В. Цедерберга и Д. Л. Тимрота [243]. На рис. 35 представлены
перечисленные данные, а также кривая ДА, = / (р), рассчитанная с помощью
составленного ранее [70] уравнения для определения теплопроводности
кислорода:
Кр9 Т = кТ+ 25,45р + 192,76р2 - 433,23р3 + 477,84р4— 156,30р5. A50)
В этом уравнении Я и р выражены в тех же единицах, что и в уравнениях
A48) и A49).
Из рис. 35 видно, что опытные данные о жидком кислороде
располагаются по разные стороны от расчетной кривой, при этом отклонения
их от нее не превышают 3%. Расхождения между опытными данными
[256] и [243] в координатах ДА,, р лежат в тех же пределах, что и при
сопоставлении А, на изотермах и изобарах. Хорошее согласование
расчетной кривой с опытными данными объясняется тем, что данные Цибланда
223
и Бартона [256] о газообразном кислороде и рассчитанные ДА по
уравнениям Н. В. Цедерберга и Д. Л. Тимрота [243] были использованы
в монографии [70] при составлении уравнения [150].
Уравнение A50) справедливо в интервале плотностей 0—1,2 кг/дм3.
Использование зависимости ДА = / (р) имеет то преимущество, что уже
при температурах 95° К и выше можно рассчитать по уравнению A50)
теплопроводность кислорода при давлении до 500 бар, поскольку
плотность жидкости при фиксированном давлении уменьшается по мере роста
температуры. Для расчета теплопроводности на изотермах 75—90° К при
давлении до 500 бар уравнение A50) использовано нами до р = 1,27 кг1дм3\
погрешность экстраполяции вряд ли могла оказаться существенной, если
учесть хорошие результаты, полученные при экстраполяции
аналогичных уравнений для азота и аргона *.
Теплопроводность жидкого воздуха, как отмечено выше, не
исследована экспериментально. Методы расчета теплопроводности жидких
смесей на основании данных о компонентах, рассмотренные в монографиях
[185, 210], не обеспечивают приемлемой точности. Поэтому было признано
целесообразным использовать для расчета теплопроводности жидкого
воздуха уравнение, полученное ранее [70] на основании данных о газе
в интервале р = 0—0,7 кг/дм3. Это уравнение имеет вид
Ар, Т = ХТ + 42,16р + 56,65р2 + 4,30р3 + 95,98р4; A51)
здесь А выражена в 10~6 квт/(м-град).
Уравнение [151] использовано нами для расчетов при плотности до
0,93 кг/дм3. При этом учитывалось, что для компонентов воздуха данные
о жидкости и газе в координатах ДА,, р образуют единую обобщенную
кривую, которая с удовлетворительной точностью описывается уравнением,
составленным для газа (даже в случае экстраполяции уравнения по
плотностям).
* Спустя девять месяцев после окончания работы над рукописью появилась статья,
3. А. Ивановой, Н. В. Цедерберга и В. Н. Попова («Теплоэнергетика», № 10, 1967), в
которой авторы представили полученные ими экспериментальные данные о теплопроводности
жидкого и газообразного кислорода в интервале температур —190 -.—Ь70° G при
давлениях до 500 кГ/см2. Поэтому значительный интерес представляет сопоставление этих
данных с расчетными величинами теплопроводности кислорода, полученными по уравнению
A50).
Т, °К
93,15
113,15
133,15
153,15
173,15
Л.-106, кет/(м-град), при р, кГ/см2
60
150,6
150
125,2
126
97,9
97,2
100
153,0
152
128,6
129
103,4
103
77,3
74,9
2С0
158,3
157
135,7
136
113,9
114
93,1
92,0
74,6
73,4
300
162,9
162
141,8
143
122,0
123
103,7
104
86,8
87,6
400
167,1
166
147,1
147
128,6
129
111,9
114
96,4
96,9
500
170,9
168
151,9
153
134,5
137
119,0
122
104,5
105
Как видно из этой таблицы, в области жидкости наблюдается хорошее согласование
наших данных (строка 1-я) с результатами последних экспериментов.
Аналогичная проверка была выполнена и при более высоких температурах. Не
приводя таблицы сопоставления, укажем, что расхождения сравниваемых величин не
превышают суммы погрешностей эксперимента и расчета по уравнению A51). Таким
образом, дополнительно подтверждена достоверность полученных нами значений
теплопроводности жидкого и газообразного кислорода.
224
По уравнениям A48)—A51) рассчитана теплопроводность жидкого
воздуха и его компонентов при давлениях до 500 бар. Как и при расчете
вязкости, значения плотности исследуемых веществ при заданных
температурах и давлениях были приняты по таблицам, приведенным в главах
II—V, а Хт — по данным [70].
Поскольку значения плотности воздуха и его компонентов в
газообразной и жидкой фазах рассчитаны по различным уравнениям состояния,
м-град
160
то
120
100
SO
60
\о
Oyffp
К>
0-1
о-2
•~3
ъ
JnP
/о
°fv
/С)
/V
0,7
0,8
0,9
W
U
12 о Ш-
9 ?'9м*
Рис. 35. Зависимость избыточной теплопроводности жидкого
кислорода от плотности:
1 — поданным Н. В. Цедерберга и Д . Л. Тимрота [243]; 2 — Цибланда и
Бартона [256]; 3 — Кейса [258].
а для азота и аргона к тому же использованы разные уравнения для
определения теплопроводности газа и жидкости, была проверена
согласованность расчетных значений теплопроводности газа [70] и жидкости путем
построения сверхкритических изобар. При проведении изобар значения К
были подвергнуты лишь незначительной корректировке на
околокритических изотермах. Для азота изменены на 0,1% пять значений К при
температурах 140 и 150° К- Для кислорода — в пределах 0,5% ряд значений
на изотермах 155—170° К. Для аргона на изотермах 160 и 170° К в
интервале давлений 125—500 бар были приняты значения X, которые выше
данных [70] о газе на 0,2—0,7% и несколько ниже рассчитанных по
уравнению A49). Для воздуха данные на изотермах 145; 150 и 160° К при
давлениях выше 200 бар скорректированы на 0,1—0,3%. Указанные значения
15 Зак. 1978.
225
поправок для всех веществ меньше возможной погрешности расчета.
Скорректированные значения X были также сглажены по изотермам.
В табл. XVII—XX приведены значения коэффициента
теплопроводности воздуха и его компонентов в интервале давлений 1—500 бар и
температур 65—150° К для азота, 75—180° К для кислорода, 85—180° К.
для аргона и 75—160° К для воздуха. В таблицах даны также значения
теплопроводности этих веществ в газообразном состоянии на докритиче-
ских изобарах, заимствованные из монографии [70]. Для каждого
вещества не приведены значения X в околокритическом районе, где, как
отмечено ранее [70], наблюдаются существенные отклонения опытных данных
от обобщенной зависимости АХ = f (p).,
Учитывая незначительные отклонения наиболее надежных опытных
данных от обобщенных кривых и высокую точность аналитического
описания этих кривых, можно оценить погрешность расчетных значений
коэффициента теплопроводности азота и аргона, равной 3%, кислорода —
4%, воздуха — 5—6%. Такая погрешность является допустимой, если
учесть, что значительная часть области температур и давлений, для
которой составлены таблицы коэффициента теплопроводности кислорода и
воздуха, не исследована экспериментально.
Таблица XVII
Теплопроводность жидкого и газообразного азота
т, °к
65
70
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
150
1
159,0
149,7
140,4
7J&
8,28
8,73
9,18
9,62
10,07
10,51
10,95
11,39
11,83
12,27
12,71
13,15
14,03
10
159,7
150,5
141,3
132,1
123,1
114,2
105,4
' 96,72 .•
11,56
11,86
12,18
12,54
12,90
13,28
13,66
| 14,06
14,86
Я-10е, квт/(
20
160,6
151,4
142,2
133,1
124,2
115,4
106,8
98,32
89,83
81,02
71,26
14,73
14,76
14,90
15,12
15,38
15,98
30
161,4
152,3
143,2
134,1
125,3
116,6
108,1
99,85
91,61
83,24
74,39
63,60
—
—
—
—
м-град), при р, бар
40
162,2
153,2
144,1
135,1
126,4
117,8
109,5
101,3
93,29
85,28
77,02
67,95
55,95
—
—
—
50
163,0
154,0
145,0
136,1
127,4
119,0
110,8
102,7
94,91
87,18
79,35
71,17
61,63
—
—
—
60
163,9
154,9
145,9
137,1
128,5
120,1
112,0
104,1
96,44
88,95
81548
73,88
65,63
56,72
—
—
70
164,7
155,7
146,8
138,0
129,5
121,2
113,2
105,4
97,94
90,62
83,42
76,25
68,87
61,08
52,78
—
80
165,5
156,6
147,7
139,0
130,5
122,3
114,4
106,7
99,34
92,22
85,23
78,37
71,50
64,44
57,24
—
226
Продолжение табл. XVII
Tt °К
70
75
80
85
90
95
100
105
110
115
120
125
130
135
140
150
90
157,4
148,6
139,9
131,5
123,4
115,5
108,0
100,7
93,73
[ 86,95
80,34
73,82
67,32
60,72
54,14
100
158,2
149,5
140,9 |
132,5
124,4
116,7
109,2
102,1
95,21
88,58
82,17
75,92
69,79
63,72
57,60
К
125
160,3
151,6
143,2
134,9
127,0
119,4
112,2
105,2
98,65
92,35
86,32
80,54
1 74,98
| 69,61
64,31
54,49
•10е, квт/(м-град),
150
162,3
153,7
145,3
137,2
129,5
122,0
115,0
108,2
101,8
95,77
|; 90,00
84,53
79,32
74,31
69,45
60,43
175
164,3
155,8
147,5
139,5
131,9
124,6
117,6
111,1
104,8
98,95
93,39
! 88,10
83,12
78,39
73,81
65,31
при р, бар
200
166,2
157,8
149,6
141,7
134,2
127,0
120,2
113,8
107,7
101,9
96,50
91,39
| 86,58
82,02
77,64
69,47
225
168,1
159,8
151,7
143,9
136,5
129,4
122,6
116,3
110,4
104,7
99,45
| 94,45
89,77
85,34
81,09
73,10
250
169,9
161,7
153,7
146,0
138,6
131,6
125,0
118,8
113,0
107,4
102,2
1 97,32
92,72
88,40
84,25
76,46
275
171,8
163,6
155,6
148,0
140,8
133,9
127,4
121,2
115,4
110,0
104,9
100,1
95,52
91,26
1 87,25
79,52
Продолжение табл. XVII
Т, °К
70
75
80
85
90
95
100
105
НО
115
120
125
130
135
140
150
300
173,6
165,5
157,6
150,1
142,8
136,0
129,6
123,5
117,8
112,5
107,4
102,6
98,20
94,00
90,00
82,44
325
167,3
159,5
152,1
144,9
138,2
131,8
125,8
120,1
114,8
109,9 '
105,1
100,7
96,59
92,60
85,13
г
350
169,2
161,4
154,0
146,9
140,2
133,9
128,0
122,4
117,1
112,2
107,6
103,2
99,05
95,10
87,78
«•10е, квт/(м-град),
375
170,9
163,3
155,9
148,9
142,2
136,0
130,1
124,6
119,4
1 114,5
| 109,9
105,6
101,5
97,54
90,23
400
172,7
165,1
157,7
150,8
144,2
138,0
132,2
126,7
121,5
116,7
112,1
107,8
103,8
99,95
92,59
при р, бар
425
174,4
166,8
159,6
152,7
146,1
140,0
134,2
128,8
123,7
118,9
114,3
110,0
106,1
| 102,2
| 94,85
'450
176,1
168,6
161,4
154,6
148,1
142,0
136,2
130,8
125,7
121,0
116,5
112,2
108,2
104,4
97,10
475
177,9
170,4
163,2
156,4
149,9
143,9
138,2
132,8
127,8
123,0
118,5
1 П4,3
110,3
106,5
99,30
500
179,5
172,1
165,0
158,2
151,8
145,8
140,1
134,8
129,7
125,0
120,6
116,3
112,4
108,6
101,4
15*
227
Таблица XVIII
Теплопроводность жидкого и газообразного кислорода
т, °к
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
1
169,8
163,7
157,4
151,0
8,69
9,17
9,65
10,13
10,61
11,08
11,55
12,02
12,48
12,94
13,40
13,85
14,30
14,75
15,20
15,65
16,54
10
170,3
164,2
158,0
151,6
145,1
138,5
131,6
124,9
117,8
12,32
12,70
13,08
13,48
13,88
14,29
14,70
15,11
15,53
15,95 j
16,36
17,20
20
170,8
164,7
158,6
152,3
145,8
139,3
132,6
125,8
118,9
111,7
104,2
96,19
15,35
15,53
15,77
16,05
16,35
16,68
17,03
17,38
18,11
\,-10в, квпг,
30
171,4
165,3
159,1
152,8
146,5
140,0
133,4
126,8
119,9
112,9
105,6
97,96
89,71
80,51
18,43
18,26
18,27
18,38
18,56
18,78
19,32
'(м-град),
40
171,8
165,8
159,7
153,5
147,1
140,8
134,2
127,6
120,9
114,0
107,0
99,56
91,76
83,33
73,82
22,66
21,43
20,94
20,77
20,70
20,88
при р, бар
50
172,3
166,4
160,2
154,1
147,8
141,4
135,0
128,5
121,9
115,2
108,2
101,1
93,63
85,76
77,26
67,64
)
—
60
172,8
166,8
160,8
154,7
148,4
142,1
135,8
129,4
122,9
116,2
109,5
102,6
95,37
87,89
80,05
71,62
—
70
173,3
167,4
161,4
155,3
149,1
142,8
136,5
130,2
123,8
117,3
110,7
103,9
96,95
89,82
82,46
74,77
66,00
—
80
173,7
167,9
161,9
155,8
149,7
143,5
137,3
131,0
124,7
118,3
111,8
105,2
98,47
91,60
84,63
77,42
69,99
—
Продолжение табл. XVIII
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
165
170
180
Я-10*, квт/(м-град), при р, бар
90
174,3
168,4
162,4
156,4
150,3
144,2
138,0
131,8
125,5
119,2
112,9
106,4
99,88
93,25
86,56
79,77
72,81
100
174,8
168,9
162,9
157,0
150,9
144,8
138,7
132,6
126,4
120,2
113,9
107,6
101,2
94,80
88,37
81,86
75,34
68,42
125
175,8
170,0
164,2
158,3
152,3
146,4
140,4
134,4
128,4
122,4
116,4
110,4
104,3
98,32
92,36
86,42
80,52
74,40
68,40
62,52
51,99
150
177,0
171,2
165,4
159,6
153,7
147,9
142,0
136,2
130,3
124,5
118,7
112,9
107,2
101,5
95,86
90,27
84,79
79,33
73,98
68,74
59,41
175
178,1
172,4
166,6
160,9
155,1
149,3
143,6
137,8
132,2
126,5
120,9
115,3
109,8
104,3
98,96
93,70
88,49
83,40
78,49
73,75
65,09
200
179,1
173,4
167,8
162,1
156,4
150,7
145,1
139,5
133,9
128,4
122,9
117,5
112,2
106,9
101,8
96,78
91,81
86,94
82,44
77,95
69,65
225
180,1
174,6
168,9
163,3
157,7
152,1
146,5
141,0
135,6
130,2
124,9
119,6
114,4
109,4
104,4
99,57
94,82
90,11
85,70
81,39
73,55
250
181,1
175,6
169,9
164,4
158,9
153,4
147,9
142,5
137,2
131,9
126,7
121,6
116,6
111,9
106,9
102,2
97,57
93,10
88,70
84,45
76,91
• 275
182,1
176,5
171,1
165,5
160,1
154,6
149,3
144,0
138,8
133,6
128,5
123,5
118,6
113,8
109,2
104,6
100,2
95,70
91,45
87,32
80,11
228
00
О
>—*
4^
СО
СО
to
-v]
О
со
ел
00
1
1
1
1
1
1
1
-4
о
о
00
UI
4^
-vl
ю
to
05
со
(О
^1
1
1
1
1
1
1
аз
о
о
to
00
о
СО
а»
оо
4^
со
о
to
1
1
1
1
1
1
ел
ел
о
о
о
о
^
о
ОЗ
ф»
to
со
СТ>
1
1
1
1
1
1
1
1
СЛ
о
СО
-^
о
4*>
4^
4*>
ел
ю
со
ел
1
1
1
1
1
1
ел
со
со
со
СЛ
CD
со
4^
ел
со
4^
to
О
со
го
оо
со
о
со
1
1
ел
ел
»—^
Оз
ел
^i
00
со
аз
о
со
ОЗ
to
to
со
4^
о
СО
(—•
СО
со
со
СО
СО
СО
ю
со
Оз
о
о
Оз
ОЗ
to
4^
СЛ
С7Э
4^
СЛ
4^
Оз
Оз
4*-
Оз
00
~
СО
ел
со
00
4^
СО
аз
СО
СЭ
СО
Оз
СЛ
со
Оз
^4
со
00
ОЗ
СО
to
со
~vl
о
СО
со
^1
to
СЛ
о
^1
со
со
Оз
СО
о
00
СЛ
4^
СО
4*
4^
О
СО
ОЗ
^4
to
Сл
^.1
4^
i—>
СЛ
^4
СЛ
Оз
00
-vl
^1
~
^J
00
4^
оо
^i
СО
^4
^4
to
СЛ
00
to
4^
СО
to
о
-vl
^1
-vl
00
-vl
СО
to
СЛ
00
о
аз
аз
оо
СО
СП
00
СО
N0
to
00
4^
4^
00
ел
СЛ
аз
N5
о
¦<1
СО
4^
ОО
СО
аз
00
4^
ел
00
СЛ
•^1
^1
00
аз
СО
00
00
00
1 ^
со
00
СО
to
аз
СО
о
со
4^
СО
4^
О
н—
СЛ
-v)
аз
4^-
оо
СО
СО
со
о
аз
со
ю
^4
СО
СО
to
ОТ
со
4^
СО
о
СО
СЛ
СО
to
СО
аз
СО
о
СО
^4
to
Сл
1—>
о
-<!
СО
4^
СО
аз
СЛ
to
СО
^4
СЛ
СЛ
СО
00
СЛ
4^
СО
СО
СЛ
to
о
о
СЛ
о
4^
о
to
СО
о
СО
to
о
ел
-j
о
4*
О
СО
О
О
О
4^
СО
О
СЛ
оо
о
оз
-4
О
--4
аз
О
00
4^
О
СО
to
О
О
аз
^1
4^
О
СО
^1
1 ,
о
аз
>—»
4^
ГО
СО
СО
I—1
СО
СО
4^
^4
СЛ
4^
СО
СЛ
аз
4*
4^
аз
СЛ
^1
со
1—-1
00
00
со
СО
аз
ю
о
4^
to
to
00
СО
о
аз
1—•
4^
Ю
Со
Сл
to
4*.
to
to
4^
СО
КО
СЛ
-^
N3
аз
4^
Ю
^J
ко
--4
00
ко
00
4^
ОО
СЛ
СО
о
to
СО
о
00
СО
СЛ
СО
to
СО
to
00
1
1
.
1
.
1
ч
я
о
о
о
о
ё
о
о
о
^
о
"
й
2
о
сх>
я
К
•сз
-vl ОЗ ОЗ СЛ СЛ
о слосл о
to и- •— о о
о сл о сл о
СО СО 00 00 --J
сл о сл о сл
о
о о to сл со
СЛ СЛ О
со со сл со to
СО 4^ 4^ СЛ СЛ
СЛОСЛОСЛ
То То со аз со
ЮЧООЗк-
я
Ь)
о
я
тз
о
ю
S
00
00
со со о о о
N0 ОЗ О^ СО
оз сл сл оо ь—
СО 00
н- н- to Ю СО
V 00 V О 00
СО 4^ 4^ СЛ СЛ
ОЗ н- ОЗ н— -q
4^ -О >— СЛ СО
•— со оо о to
ооо
4* ^4 »— ^4 4^
_ >— О н- tO
4*» ^4 н- СЛ 00
СО
о
--4
со ел оо со со
СО 4^ 4*. СЛ СЛ
СО 4^ СО 4^ СО
аз V со То V
Оз ОЗ -<1 00 00
4*. СО СЛОСЛ
СЛ 00^-CO^vJ
о
о
о\
-о
р
4^ •— О О О
о
О tO 4^ 00 45.
О -О СЛ 4^ 4^
Оз -vl OtO Оз
ооо — •—
^ ело to аз
оз То "о ооо
to to to со со
О 4^ СО COj-4
00 00 О СО Ъо
4^ 4^ ел сл аз
,tOj<I^— ОЗ^-д
со о ^Ъ ел
аз -vico n- со
н
СО
о\
сл н- со -о аз
tO tO СО СО СО
JO ОЗ О^ СО
ел^ сл оо^—
аз to со ^4 аз
оз аз оо о to
00н-ь- tO
слео to оз о
сл >—Vj сл со
tO tO СО СО 4^
4^ ро to аз о
ь-* о о То сл
со 4^ о оо аз
ОЗ -v) -vl 00 00
00 СО 00 СО СО
оз аз "-vi оо о
р и-
о
X Я
кн 00
X
4^ со ел to со
-ч сл сл аз оо
4-. сл сл сл аз
ОЗ О СЛ CD 4s»
1— оз То оо оз
СЛ 4^ 4^ ОЗ 00
Продолжение табл. XIX
Т, °К
90
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
А,-10е, квт/(м-град), при р, бар
90
129,2
122,6
116,2
110,1
104,1
98,19
92,40
86,69
81,00
75,35
69,70
64,05
58,46
52,60
100
129,8
123,3
117,0
110,8
104,9
99,11
93,39
87,75
82,17
76,65
71,16
65,73
60,38
54,86
125
131,4
125,0
118,8
112,8
107,0
101,3
95,76
90,31
84,95
79,69
74,51
69,45
64,52
59,77
54,95
45,53
37,35
150
133,1
126,6
120,5
114,7
108,9
103,4
97,98
92,69
87,52
| 82,45
! 77,49
72,68
68,03
63,54
59,03
50,82
43,44
175
134,6
128,3
122,3
116,5
110,9
105,4
100,1
94,93
89,89
84,99
80,20
75,58
71,12
66,87
62,70
55,02
48,09
200
136,1
129,9
123,9
118,3
112,7
107,3
102,1
97,06
92,13
87,37
82,72
78,24
73,92
1 69,81
65,85
58,56
51,94
1
225
137,6
131,5
125,5
119,9
114,5
109,2
104,1
99,10
94,28
89,59
85,06
80,69
76,50
72,48
1 68,60
61,52
55,19
250
139,1
133,0
127,1
121,5
116,2
111,0
105,9
101,0
96,29
91,70
87,28
83,00
78,90
74,97
71,20
64,30
58,11
275
134,5
128,7
123,2
117,8
112,7
107,7
102,9
98,24
93,73
89,37
85,18
81,15
77,30
73,60
66,80
60,73
Продолжение табл. XIX
Т, °К
95
100
105
ПО
115
120
125
130
135
140
145
150
155
160
170
180
Я,-10е, квпг/(м-град), при р, бар
300
135,9
130,2
124,7
119,4
114,4
109,5
104,7
100,1
95,65
91,36
87,23
83,29
79,46
75,80
69,10
63,17
325
137,3
131,7
126,3
121,0
116,0
111,1
106,4
101,9
97,52
93,29
89,21
85,32
81,53
77,87
71,25
65,32
350
138,7
133,1
127,7
122,6
117,6
112,8
108,1
103,7
99,30
95,13
91,10
1 87,26
83,52
79,85
73,29
67,47
375
140,1
134,5
129,2
124,1
119,1
114,4
109,8
105,3
101,0
96,89
92,93
89,12
85,43
81,80
75,28
69,47
400
141,5
135,9
130,6
125,5
120,6
115,9
111,3
107,0
102,7
98,62
94,69
90,90
87,24
83,69
77,19
71,37
425
142,8
137,3
132,0
127,0
122,1
117,5
112,9
108,6
104,3
100,3
96,38
92,64
89,07
85,50
79,03
73,20
450
144,1
138,6
133,4
128,4
123,6
118,9
114,4
110,1
105,9
101,9
98,02
94,32
90,76
87,23
80,80
74,93
475
139,9
134,8
129,8
125,0
120,4
115,9
111,6
107,5
103,5
99,63^
95,95
92,42
88,92
82,48
76,62
500
141,2
136,1
131,1
126,4
121,8
117,4
113,1
109,0
105,0
101,2
97,53
94,02
90,54
84,07
| 78,24
230
Таблица XX
Теплопроводность жидкого и газообразного воздуха
т, °к
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
1
154,1
—
7,93
8,41
8,88
9,34
9,80
10,25
10,70
11,15
11,60
12,04
12,48
12,92
13,36
13,79
14,66
10
154,8
146,0
137,2
128,4
119,7
110,9
102,1
11,97
12,29
12,63
12,94
13,35
13,72
14,10
14,49
14,87
15,66
>
20
155,6
146,9
138,2
129,5
120,9
112,3
103,7
94,86
85,59
15,22
15,15
15,24
15,42
15,66
15,92
16,21
16,85
«•10е, кет 1 (м-град),
30
156,4
147,7
139,1
130,6
122,1
113,6
105,2
96,72
87,96
78,52
66,64
18,85
18,12
17,89
17,87
17,94
18,29
40
157,2
148,6
140,1
131,6
123,2
114,9
106,7
98,14
90,11
81,37
71,59
59,25
—
—
—
—
—
при р, бар
50
158,0
149,5
141,0
132,6
124,3
116,2
108,1
100,1
92,08
83,90
75,18
65,26
52,33
—
—
—
—
60
158,8
150,3
141,9
133,6
125,4
117,4
109,5
101,7
93,93
86,13
78,12
69,40
59,49
—
—
—
—
70
159,5
151,1
142,8
134,5
126,5
118,6
110,8
103,2
95,68
88,21
80,69
72,82
64,26
54,93
—
—
—
80
160,3
151,9
143,7
135,5
127,5
119,7
112,1
104,6
97,33
90,13
82,97
75,69
67,95
59,85
—
—
—
Продолжение табл. XX
Т, °К
75
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
90
161,0
152,7
144,5
136,5
128,6
120,8
113,3
106,0
98,89
91,93
85,08
78,21
71,08
63,72
56,34
—
—
100
161,8
153,5
145,4
137,4
129,6
122,0
114,6
107,4
100,4
93,64
87,02
80,48
73,79
66,91
60,14
—
—
Я-106, квт/(м-град),
125
'163,6
155,5
147,5
139,7
132,1
124,6
117,5
110,6
103,9
97,56
91,41
85,40
79,41
73,42
67,53
—
—
150
165,4
157,4
149,5
141,8
134,4
127,2
120,3
113,6
107,2
101,1
95,28
89,64
84,04
78,53
73,19
68,02
58,77
175
167,2
159,3
151,5
144,0
136,7
129,6
122,9
116,4
110,3
104,4
98,80
93,42
88,05
82,91
77,96
73,11
64,34
при р, бар
200
168,9
161,1
153,5
146,1
138,9 ,
132,0
125,4
119,1
113,1
107,4
102,0
96,86
91,64
86,76
82,02
77,50
69,07
225
—
162,9
155,4
148,1
141,0
134,3
127,8
121,6
115,8
110,3
105,1
100,0
95,10
90,32
85,73
81,34
73,20
250
—
164,7
157,3
150,0
143,1
136,5
130,1
124,1
118,4
113,0
107,9
103,0
98,32
93,52
89,17
84,90
76,90
275
—
166,4
159,0
152,0
145,1
138,6
132,4
126,5
120,9
115,6
110,6
105,9
101,3
96,70
92,41
88,24
80,46
231
Продолжение табл. XX
Т, °К
80
85
90
95
100
105
ПО
115
120
125
130
135
140
145
150
160
300
168,1
160,8
153,8
147,1
140,7
134,6
128,8
123,3
118,1
113,2
108,5
104,0
99,60
95,38
91,24
83,57
325
169,8
162,6
155,7
149,1
142,7
136,7
131,0
125,6
120,5
115,7
111,1
106,7
102,3
98,19
94,10
86,50
)
350
—
164,3
157,5
151,0
144,7
138,7
133,1
127,8
122,8
118,1
113,6
109,2
104,9
100,9
96,90
89,40
.-10е, квт/(м-град),
375
—
166,0
159,3
152,8
146,6
140,8
135,2
130,0
125,1
120,4
115,9
111,6
107,4
103,4
99,48
92,05
400
—
167,7
161,0
154,6
148,5
142,7
137,2
132,1
127,2
122,6
118,2
113,9
109,8
105,8
101,9
94,56
при р, бар
425
—
169,3
162,7
156,4
150,3
144,6
139,2
134,2
129,3
124,8
120,4
116,2
112,1
108,2
104,3
97,00
450
—
—
164,4
158,1
152,2
146,5
141,2
136,1
131,4
126,9
122,6
118,4
114,3
110,4
106,6
99,30
475
—
—
166,1
159,9
153,9
148,3
143,1
138,1
133,4
128,9
124,7
120,5
116,5
112,5
108,7
101,6
500
—
—
167,7
161,5
155,7
150,2
144,9
140,0
135,4
131,0
126,7
122,6
118,6
114,7
110,9
103,9
ЛИТЕРАТУРА
1. Ebert L., «Osterr. Chem. Ztg.», 1/2, 1, 1954.
2. Grilly E. R., Mills R. L. «Phys. Rev.», 105, 4, 1140, 1957.
3. Bridgman P. W. «Revs. Modern Phys.», 18, 1, 1946.
4. Simon F..E. «Proc. Amer. Acad. Arts Sci.», p. 319, 1954.
5. Gilvarry J. J. «Phys. Rev.», 102, 317, 1956.
6. J а ко b M. «Physik. Z.», 11, 413, 1935.
7. Шейндлин А. Е. «Теплоэнергетика», 3, 26, 1954.
8. К а г а н е р М. Г. ЖФХ, 32, 332, 1958.
9. Семенченко В. К-, Мартынюк М. М. В сб.: «Применение
ультраакустики к исследованию вещества», вып. 15, 129. М., изд-во Моск. обл. пед. ин-та, 1961.
10. Френкель Я- И. Кинетическая теория жидкостей. М., Изд-во АН СССР, 1945.
11. Ма у er J. E. «J. Chem. Phys.», 5, 67, 1937.
12. U г sell H. D. «Proc. Cambr. Phil. Soc», 23, 685, 1927.
13. Боголюбов Н.Н. Проблемы динамической теории в статистической физике.
М., Гостехиздат, 1946.
14. R о w 1 i n s о n J. S. Liquids and liquid mixtures. London, Butterworths, 1959.
15. Ф и ш е р И. З. Статистическая теория жидкостей. М., Физматгиз, 1961.
16. Гиршфельдер Д., Кертисс Ч., Берд Р. Молекулярная теория
газов и жидкостей. М., ИИ Л, 1961.
17. Lennard-Jones J. E., Devonshire A. F. «Proc. Rov. Soc», 163,
53, 1937.
18. К а з а в ч и н с к и й Я- 3., К е с с е л ь м а н П. М., Р а б и н о в и ч В. А.,
ИФЖ, 4, № 12, 16, 1961.
19. Кессельман П. М. «Теплофизика высоких температур», 2, № 6, 1964.
20. Т a i t P. G. Voyage of Challenger Report. London, H. M. Stationary Office, 1888.
21. W h о 1 A. «Z. Phys. Chem.», 99, 234, 1921.
22. Carl H. «Z. Phys. Chem.», 101, 238, 1922.
23. Gibson R. E. «J. Amer. Chem. Soc», 56, 4, 1934.
24. G i b s о n R. E., L о e f f 1 e г О. Н. «J. Am. Chem. Soc», 61, 2515, 1939.
25. G i b s о n R. E., L о e f f 1 e г О. Н. «Ann. NY Acad. Sci.», 51, 727, 1949.
26. G i n n e 1 R. «J. Chem. Phys.», 34, 2174, 1961.
27. At ан ob Ю. А. ЖФХ, 40, № 6, 1216, 1966.
28. А т а н о в Ю. А., Борзунов В. А., Р а з у м и х и н В. Н. «Труды
институтов Комитета», вып. 75 A35). М., Изд-во стандартов, 1964, стр. 143.
29. American Institute of Physics Handbook. New York—London, 1957.
30. Ц и к л и с Д. С. ДАН СССР, 79, 289, 1951.
31. Tammann Т. A. Nachrichten v. d. k. Gesellschaften der Wissenschaften zu
Gottingen, 1911.
32. Б и р о н Е. В. Учение о газах и жидкостях. М., Госиздат, 1923.
33. Мамедов A.M. «Доклады АН АзССР», 5, 55, 1949.
34. Мамедов А. М. «Теплоэнергетика», 9, 1960.
35. Кессельман П. М. «Теплоэнергетика», 4, 1960.
36. К и р и л л и н В. А., У л ы б и н С. А. «Теплоэнергетика», 4, 1959.
37. Р и в к и н С. Л. «Атомная энергия», 7, № 5, 1959.
38. Н о в о т е л ь н о в В. Н., Акулов Л. А. ИФЖ, 9, № 6, 802, 1965.
39. Тимрот Д. Л., Борисоглебский В. П. ИФЖ, 4, № 1, 1961.
40. Акулов Л. А., Новотельное В. Н. ЖФХ, 40, № 3, 708, 1966.
41. Голубев Иг Ф., Добровольский О. А. «Газовая
промышленность», 5, 43, 1964.
42. Van Itterbeek A., Verbeke О. «Physica», 26, No 11, 931, 1960.
43. Van Itterbeek A., Verbeke O. «Cryogenics», 1, No 2, 77, 1960.
44. В у к а л о в и ч М. П., Зубарев В. Н., Калинин Ю. Я-,
Александров А. А. «Теплоэнергетика», 4, 76, 1961.
45. Вукалович М. П., Зубарев В.Н., Александров А. А.,
Калинин К). Я- «Теплоэнергетика», 10, 1959.
233
46. V a n I t t e r b е е к A., Verbeke О., S t a e s К- «Physica», 29, 742, 1963.
47. К а з а в ч и н с к и й Я- 3. «Теплоэнергетика», 7, 44, 1958.
48. Eucken A. «Gettinger Nachr. Math. Phys.», S. 340, 1933.
49. E u с k e n A. «Forch. Geb. Ingenieurwesens», 12, 113, 1941.
50. P а би н о в и ч В. А., Цойман Г. И. ИФЖ, 4, № 1, 31, 1961.
51. Keyes F. G. «J. Amer. Chem. Soc», 53, 965, 1931.
52. Plank R. Kaltetechnik, 12, № 10, 282, 1960.
53. Johnston H. L., Keller W. E., F г i e d m a n A. S. «J. Amer. Chern.
Soc», 76, 1482, 1954.
54. P а б и н о в и ч В. А. «Нефть и газ», 9, 97, 1961.
55. Plank R. «Brennstoff—Warme— Kraft», 12, N 7, 1960.
56. Ma медов A.M. «Теплоэнергетика», 9, 77, 1962.
57. Суворов Н. П. ЖФХ, 34, вып. 3, 1938, 1960.
58. С у в о р о в Н. П. ЖФХ, 36, вып. 1, 216, 1962.
59. М i с h е 1 s A., AbelsJ.C, TenSeldam С A. De Graaff W. «Physica»,
26, 381, 1960.
60. К а з а в ч и н с к и й Я- 3. ДАН СССР, 95, 1005, 1954.
61. Казавчи некий Я- 3. «Теплоэнергетика», 11, 59, 1960.
62. К е с с е л ь м а н П. М. ИФЖ, 2, № 1, 68, 1959.
63. Р а б и н о в и ч В. А. ИФЖ, 3, № 6, 107, 1960.
64. 3 а г о р у ч е н к о В. А. ЖФХ, № 3, 607, 1959.
65. Вассерман А. А., К а з а в ч и н с к и й Я- 3. ИФЖ, 3, № 4, 81, 1960.
66. Ж У Р а в л е в A.M. ИФЖ, 6, № 8, 106, 1963.
67. Кессельман П. М., Котляревский П. А., Афанасьев М. М.
ИФЖ, 9, № 4, 1965.
68. К а з а в ч и н с к и й Я- 3. ИФЖ, 7, № 6, 129, 1964.
69. Вассерман А. А. ЖФХ, 38, № 10, 2386, 1964.
70. В а с с е р м а н А. А., Казавчинский Я- 3., Рабинович В. А.
Теплофизические свойства воздуха и его компонентов. М., «Наука», 1966.
71. Mills R. L., Grilly E. R. «Phys. Rev.», 99, No 2, 480, 1955.
72. St о bridge T. R. «Nat. Bur. Stand. Tech. Note», No 129A, 1963.
73. S t e w a r t R. В., H u s t J.G,Mc. С a r t у R. D. «NBS Report», No 7922,
1963.
74. G о s m a n A. L., H u s t J. G., M с. С a r t у R. D. «NBS Report», No 8293,
1964.
75. Zimm В. Н. «J. Chem. Phys.», 19, 1019, 1951.
76. Карапетьянц М. X. Методы сравнительного расчета физико-химических
свойств. М., «Наука», 1965.
77. Вукалович М. П., Алтунин В. В. Теплофизические свойства
двуокиси углерода. М-, Атомиздат, 1965.
78. Вассерман А. А., Рабинович В. А. В сб.: «Теплофизические
характеристики веществ», вып. 1. М., Изд-во стандартов, 1968.
79. Л а н ц о ш К- Практические методы прикладного анализа. М., Физматгиз, 1961.
80. В е n e d i с t M. «J. Am. Chem. Soc», 59, 2224, 1937.
81. В e n e d i с t M. «J. Am. Chem. Soc», 59, 2233, 1937.
82. В r i d g m a n P. W. «Proc Am. Acad. Arts. Sci.», 70, 1, 1935.
83. Van Itterbeek A., Verbeke O. «Cryogenics», 2, No 2, 79, 1961.
84. M i с h e 1 s A., L u n b e с k R. J., W о 1 k e r s G. J. «Physica», 17, No 9,
801, 1951.
85. Simon F. E., Ruhemann M., Edwards W. A. M. «Z. Phys. Chem.»,
B6, 331, 1930.
86. Ver sc ho у 1 e Т. Т. Н. «Trans. Roy Soc», (London), A230, 189, 1931.
87. Keesom W. H., Lisman J. H. C. «Physica», 1, 735, 1934.
88. В r i d g m a n P. W. «Phys. Rev.», 46, 930, 1934.
89. Robinson D. W. «Proc. Roy. Soc», (London), A225, 393, 1954.
90. Matias E-, Kamerlingh Onnes H., Crommelin C. A. «Comm.
Leiden», No 145c, 1914.
91. Hoi born L., Otto J. «Z. Phys.», 30, 320, 1924.
92. Kamerlingh Onnes H., Van Urk A. T h. «Comm. Leiden», No 169d,
1924.
93. В u k а с e k R. F., Peck R. E. «A. I. Ch. E. J.», 7, No 3, 453, 1961.
94. В e n e d i с t M-, Webb G. В., R u b i n L. С «J. Chem. Phys.», 8, No 4,
334, 1940.
95. Bloomer О. Т., R а о К- N. «Inst. Gas. Technol. Res. Bull.», No 18.
Chicago, 1952.
96. В а с с е р м а н А. А., Рабинович В. А. ИФЖ, 12, № 3, 342, 1967.
97. Казавчинский Я- 3., Кудашев В. И. ИФЖ, 5, № 4, 31, 1962.
98. А 1 t H., Ann. Phys. Lpz.», 19, 739, 1906.
99. F u r u k a w a G. Т., McCoskey R. E. «Techn. Note U. S. Comm. Aero.»,
No 2969, 1953.
100. Mage D. Т., Jones M. L., Katz D. L., Roebuck J. R. «Chem.
Eng. Progr. Sympos. Ser.», 59, No 44, 61, 1963.
234
101. Sc hearer «Phys. Rev»., 15, 190, 1902; 17, 124, 471, 1903.
102. Dewar J. «Proc. Roy. Soc», London, 76A, 325, 1906.
103. E u с к е n A. «Verhandlungen der deutschen Phys. Ges.», 18, 4, 1916.
104. Dana L. I. «Proc. Amer. Acad. Arts and Sci.», 60, 241, 1925.
105. G i a u q u e W. F., С 1 а у t о n J. O. «J. Amer. Chem. Soc», 55, 4875, 1933.
106. К e e s о m W. H., Kamerlingh Onnes H. «Proc. Roy. Acad.»,
Amsterdam, 18, 1247, 1916.
107. CI us i us K- «Z. Phys. Chem.», B3, 41, 1929.
108. Wiebe R., Brevoort M. «J. Amer. Chem. Soc», 52, 622, 1930.
109. С 1 u s i u s K-, S p e r a n d i о A., P i e s b e r g e n U. «Z. Naturforsch»,
142 9 793 1959.
110. Roebuck J., Osterberg H. «Phys. Rev.», 48, 450, 1935.
111. Гусак И. М. ЖТФ, 7, № 8, 796, 1937.
112. D i n F. Thermodynamic Functions of Gases. V. 3. London, Butterworths, 1961.
113. V a n I t t e r b e e k A., Van D a e 1 W. «Adv. Cryog. Eng.», 9, 207, 1964.
114. Тимрот Д. Л-, Борисоглебский В. П. ЖЭТФ, 38, № 6, 1729,
1960.
115. Hoge H. J. «J. Res. Nat. Bur. Stand.», 44, 321, 1950.
116. В а с с е р м а н А. А., Рабинович В. А. ЖФХ 42, № 7, 1968.
117. Giauque W., Johnston H. «J. Amer. Chem. Soc», 51, 2300, 1929.
118. F r a n k А., С 1 u s i u s K- «Z. phys. Chem.», B42, 395, 1939.
119. Clusius K-, Konnertz F. «Z. Naturforsch.», 4a, 117,1949.
120. Орлова М. П. ЖФХ, 40, № 12, 2986, 1966.
121. А л и х а н о в Р. А. ЖЭТФ, 29, № 6, 902, 1955.
122. Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и
жидкостей. М., Физматгиз, 1963.
123. Michels A., Levelt J.M., De Graaff W. «Physica», 24, 659, 1958.
124. Michels A., Wassenaar Т., Zwietering Th. N. «Physica»,
18, 67, 1952.
125. Michels A., Wassenaar Т., Levelt J. M., De Graaff W.
«Appl. Sci. Res.», A-4, 381, 1954.
126. Michels A., W i j k e r Hub., W i j k e r H k. «Physica», 15, 627, 1949-
127. Роговая И. А., Каган ер М. Г. ЖФХ, 35, № 9, 2135, 1961.
128. Роговая И. А., Каганер М. Г. ЖФХ, 34, № 9, 1933, 1960.
129. М i с h е 1 s A., Wassenaar Т., Van Seventer W. «Appl. Sci.
Res.», A-4, 52, 1953.
130. Simon F.E, Ruhemann M., Edwards W. A. M. «Z. Phys. Chem.»,
B7, 80, 1930.
131. С 1 u s i u s K-, W e i g a n d К- «Z. Phys. Chem.», B46, 1, 1940.
132. Michels A., P r i n s C. «Physica», 28, No 2, 1962.
133. Mathias E., Crommelin C, Kamerlingh Onnes H. «Comm.
Leiden», No 131a, 1912.
134. Clark A., Din F., Robb J., Michels A., Wassenaar Т.,
Zweitering Th.N. «Physica», 17, 876, 1951.
135. Flubacher P., Leadbetter A., Morrison J. «Proc. Phys. Soc.»
(London), 78, 1449, 1961.
136. В а с сер ман А. А., Рабинович В. А. ИФЖ, 13, № 2, 190, 1967.
137. Лурий Л. И., Рабинович В. А. ЖФХ, 40, № 3, 706, 1966.
138. Eucken A., Hauck F. «Z. phys. Chem.», 134, 161, 1928.
139. Roebuck J., Osterberg H. «Phys. Rev.», 46, 785, 1934.
140. D i n F. Thermodynamic Functions of Gases. V. 2. Butterworths, London, 1956.
141. Казавчинский Я- З. ДАН СССР, 161, № 5, 1127, 1965.
142. Казавчинский Я- 3. ИФЖ, 9, № 3, 1965.
143. Недоступ В. И. ИФЖ, 10, № 6, 783, 1966.
144. Kuenen J. P., Clark A. L. «Comm. Leiden», No 150b, 1917.
145. Baehr H. D., Schwier K- Die thermodynamischen Eigenschaften der
Luft im Temperaturbereich zwischen —210° С und +1250° С bis zu Driicken von 4500 bar.
Berlin /Gottingen/ Heidelberg, Springer-Verlag, 1961.
146. Hausen H. For sen. Geb. Ingenieurwes., H. 274, 1926.
147. Roebuck J.R. «Proc Amer. Acad. Arts and Sci.», 64, 287, 1930.
148. И ш к и н И. П., Каганер М. Г. ЖТФ, 26, № 10, 2329, 1956.
149. Williams V. С. «Trans. Amer. Inst. Chem. Engrs.», 39, 93, 1943.
150. Holborn L., Schultze H. «Ann. Phys.», 47, D) 1089, 1915.
151. Епифанова В. И., Дксельрод Л-С, Мороз А. И., Нарин-
с к и й Г. Б. и др. Разделение воздуха методом глубокого охлаждения, т. 1. М.,
«Машиностроение», 1964.
152. Forsch С «Z. Phys.», 1, 177, 1900.
153. Verscha-f felt J. E., Nicaise C «Comm. Leid.», 149b.
154. Rudenko N. S., Schubnikow L. W. «Phys. Zeit. der Sovjetunion»,
6, No 5, 470, 1934.
155. Руденко Н. С ЖЭТФ, 9, вып. 9, 1078, 1939.
235
156. Rudenko N. S., Schubnikow L. W. «Phys. Zeit. der Sovjetunion»,,
8, No 2, 179, 1935.
157. Г е р ф С Ф., Г а л к о в Г. И. ЖТФ, 10, № 9, 725, 1940.
158. Г е р ф С. Ф., Г а л к о в Г. И. ЖТФ, 11, № 7, 613, 1941.
159. Van Itterbeek A., Van Paemel О. «Physica», 8, 133,1941.
160. Van Itterbeek A., Zink H., Van Paemel O. «Gryogenics»,
2, No 4, 210, 1962.
161. Forster S., «Monatsber. Deut. Akad. Wiss.» (Berlin), 5, No 10, 659, 1963.
162. Forster S. «Cryogenics», 3, No 3, 176, 1963.
163. Boon J. P., Thomaes G. «Physica», 29, No 3, 208, 1963.
164. Saji J., Kobayashi S. «Gryogenics», 4, No 3, 136, 1964.
165. В е р к и н Б. И., Руденко Н. С ЖЭТФ, 20, вып. 6, 523, 1950.
166. Жданова Н. Ф. ЖЭТФ, 31, вып. 1G), 14, 1956.
167. Robinson D. W. «Bull. SSR Annexe», 329, 1955.
168. Филиппова Г. П., Ишкин И. П. «Кислород», № 2, 38, 1959.
169. Филиппова Г. П., Ишкин И. П. ИФЖ, 4, № 3, 105, 1961.
170. Голубев И. Ф., Шепелева Р. И., Коновалова Л. В. Труды
ГИАП, вып. 13, 45, 1963.
170а. Van Itterbeek A., Zink H., Hellemans J. «Physica», 32,
№ 2, 489, 1966.
171. Mi che Is A., Gibson R. «Proc. Roy. Soc», A-134, 288, 1931.
4 172. Голубев И. Ф., Петров В. А. Труды ГИАП, вып. 2, 5, 1953.
173. Makita Т. «Rev. Phys. Chem. Japan», 27, 16, 1957.
174. Ross J., Brown G. «Ind. Eng. Chem.», 49, 2026, 1957.
175. L a z a r r e F., V о d a r В. «С. r. Acad. Sci. Paris», 243, 487, 1956.
176. V e r m e s s e J., J о h a n n i n P., V о d a r В. «С. r. Acad. Sci. Paris»,
256, 3016, 1963.
177. К i j a m a R., Makita T. «Rev. Phys. Chem. Japan», 26, No 2, 70,
1956.
178. Michels A., Botzen A., Schuurman W. «Physica», 20, 1141, 1954.
179. Jager G. «Wien. Ber.», 105, 15, 1896.
180. Jager G. «Wien. Ber.», Ill, 697, 1902.
181. В r i 1 1 о u i n L. «Journ. d. Phys.», 3, 326, 362, 1922.
182. Ш и р о к о в М. Ф. Труды совещания по вязкости жидкостей и коллоидных
растворов. Т. И. М., Изд-во АН СССР, 1944, стр. 35.
183. Andrade E. «Nature», 125, 489, 1930.
184. Andrade E. «Phil. Mag.», 17, 497, 698, 1934.
185. Рид Р., Шервуд Т. Свойства газов и жидкостей. М., Гостоптехиздат, 1964.
186. Панченков Г. М. Теория вязкости жидкостей. М., Гостоптехиздат, 1947.
187. Eyring H. «J. Chem. Phys.», 3, 107, 1935.
188. Eyring H. «J. Chem. Phys.», 4, 283, 1936.
189. Глесстон С, Лейдер К-, Э й р и н г Г. Теория абсолютных
скоростей реакции. М., ИИЛ, 1948.
190. Е w е 1 1 R., Е у г i n g H. «J. Chem. Phys.», 5, 726, 1937.
191. Френкель Я- И. Теория твердых и жидких тел. М., Гостехтеоретиздат, 1934.
192. Руденко Н. С ЖТФ, 18, № 9, 1123, 1948.
193. Batschinski A. «Phys. Z.», 13, 1157, 1912.
194. Batschinski A. «Z. Phys. Chem.», 84, 643, 1913.
195. Thorpe Т.Е., Rodger J.W. «Phys. Trans. Roy. Soc. London», A-185,
397, 1894.
196. Бриджмен П. В. Физика высоких давлений. ОНТИ, 1935.
197. Широков М. Ф. ЖФХ, 3, № 2—3, 175, 1932; ЖЭТФ, 3, вып. 3, 237, 1933.
198. Предводителев А. С ЖЭТФ, 3, вып. 3, 217, 1933.
199. Herzog R. О., Kudar H. С «Z. Phys.», 80, 217, 1933; 83, 28, 1933.
200. Гольдгаммер А. Д. ДАН СССР, 3, № 7, 484, 1934.
201. Г у гель Б. М. ЖЭТФ, 7, 1409, 1937.
202. Предводителев А. С ЖФХ, 22, вып. 3, 339, 1948.
203. Предводителев А. С. В кн.: «Сборник, посвященный памяти акаде- .
мика П. П. Лазарева». М., Изд-во АН СССР, 1956, стр. 84.
204. Предводителев А. С ИФЖ, 4, № 6, 3, 1961; № 7, 3, 1961; № 8, 3, 1961.
205. Соловьев В. А. ЖТФ, 29, № б, 791, 1959.
206. Панченков Г. М. ДАН СССР, 63, 701, 1948.
207. Панченков Г. М. ЖФХ, 24, вып. 11, 1390, 1950.
208. Торопов А. П., Бродская Г. А. ЖФХ, 34, вып. 8, 1879, 1960.
209. Панченков Г. М. ЖФХ, 34, вып. 8, 188а, 1960.
210. Бретшнайдер С Свойства газов и жидкостей. М-, «Химия», 1966.
211. Чепмен С, К а у л и н г Т. Математическая теория неоднородных газов.
М., ИИЛ, 1960.
212. Усманов А. Г. В сб.: «Теплопередача и тепловое моделирование». М., изд-во
АН СССР, 1959, стр. 298.
213. Усманов А. Г., Большов В. П. В сб.: «Теплопередача и тепловое
моделирование». М., изд-во АН СССР, 1959, стр. 313.
236
214. Усманов А. Г. В сб.: «Конвективный и лучистый теплообмен». М., изл-во
АН СССР, 1960, стр. 97.
215. Бакиров Н. У., Усманов А. Г. «Труды Казанского
химико-технологического института», вып. 32, 3, 1964.
216. Шпильрай'н Э. Э., Фомин В. А. «Теплоэнергетика», № 9, 71, 1962.
217. Голубев И. Ф. Вязкость газов и газовых смесей. М., Физматгиз, 1959.
218. Lin S. Н., Е у г i n g H., Davis W. J. «J. Phys. Chem.», 68, No 10, 3017,
1964.
219. Варгафтик Н. Б. «Известия ВТИ», № 1, 13, 1952.
220. Weber H. F. «Annalen der Physik und Chemie», 10, 5, 103, 1880.
221. Todd G. W. «Proc. Royal Soc», A-83, 190, 1909.
222. Hercus E. O., Lab у Т. Н. «Proc. Royal Soc», A-95, 190, 1919.
223. Bates О. К- «Ind. Eng. Chem.», 25, No 12, 1933.
224. Боровик Е. ЖЭТФ, 17, № 4, 328, 1947.
225. Цедерберг Н. В. Теплопроводность газов и жидкостей. М., Госэнерго-
издат, 1963.
226. Н a m m a n G. «Ann. der Physik», 32, 5, 594, 1938.
227. Christiansen С, Widemann. «Ann. der Phys. und Chem.», 114,
14, 1881.
228. Christiansen С «Ann. der Phys. und Chem.», 119, 257, 1883.
229. Филиппов Л. П. «Вестник МГУ», Физика, серия физико-математических
и естественных наук, № 9, 1953.
230. Фронтасьев В. П. ЖФХ, 20, № 1, 1946.
231. Фронтасьев В. П. ЖТФ, 28, № 8, 1958.
232. Фронтасьев В. П., Гусаков М. Я- ЖТФ, 29, № 10, 1959.
233. Stefan J. «Wien. Ber.», 47, 81, 1863; 65, 45, 1872.
234. Winkelmann A. «Annalen der Physik und Chemie», 3, 512, 1874.
235. Варгафтик Н. Б., Смирнова СВ. ЖТФ, 26, 1251, 1956.
236. Филиппов Л. П., «Вестник МГУ», Физика, Серия физико-математических
и естественных наук, № 6, 1954; № 8, 1955.
237. Цедерберг Н. В., Тимрот Д. Л. ЖТФ, 25, № 14, 1955.
238. R i e d е 1 L. «Kaltetechnik», Heft 4, 1950.
239. Schleiermacher A. «Annalen der Physik und Chemie», Heft 6, 623, 1888.
240. Тимрот Д. Л., Варгафтик Н. Б. ЖТФ, 10, № 13, 1063, 1940.
241. Б о р о в и к Е., Матвеев А., Панина Е. ЖТФ, 10, № 12, 988, 1940.
242. Абас-Заде А. К- ЖТФ, 22, № 1, 7, 1952.
243. Цедерберг Н. В., Тимрот Д. Л. ЖТФ, 26, № 8, 1849, 1956.
244. Кондратьев Г. М. Испытание на теплопроводность по методам
регулярного режима. М., Стандартгиз, 1936.
245. Кондратьев Г. М. Регулярный тепловой режим. М. Гостехиздат, 1954.
246. Кондратьев Г. М. «Известия АН СССР», ОТН, № 4, 1950.
247. Геллер 3. И., Расторгуев Ю. Л- «Химия и технология топлив и
масел», № 10, 1958.
248. МустафаевР. А. «Изв. высш. учебн. завед.», Приборостроение, № 1, 1959.
249. Голубев И- Ф., Назиев Я-М. «Труды энергетического института АН
Азербайджанской ССР», т. 15, 1961.
250. Голубев И. Ф. «Теплоэнергетика», № 12, 78, 1963.
251. Голубев И- Ф., Кальсина М- В. «Газовая промышленность», № 8,
41, 1964.
252. Powers R. W., Mattox R. W., Johnston H. L. «J. Amer. Chem.
Soc», 76, 5968, 1954.
253. Pro sad S. «Current Science», 20, No 10, 164, 1951.
254. U h 1 i r A. «J. Chem. Phys.», 20, No 3, 463, 1952.
255. Ziebland H., Burton J. «Brit. J. Appl. Phys.», 9, 52, 1958.
256. Ziebland H., Burton J. «Brit. J. Appl. Phys.», 6, 416, 1955.
257. P г о s a d S. «Brit. J. Appl. Phys.», 3, 58. 1952.
258. Keyes F. G. «Trans. ASME», 77, 1395, 1955.
259. Waterman T h. E., К i r s h D. P., В r a b e t s R. I. «J. Chem.Phys.»,
29, No 4, 905, 1958.
260. I k e n b e г г у L. D., R i с e S. A. «J. Chem. Phys.», 39, No 6, 1561, 1963.
261. B'ridgman P. W. «Proc. Amer. Acad. Arts. Sci.», 59, 154, 1923.
262. Kardos A. «Forsch. Geb. Ingenieurwes.», 5B, 14, 1934.
263. S a k i a d i s B. C, Coates J. «Amer. Inst. Chem. Eng. J», 1, 275, 1955.
264. Fourier A. «Compt. rend.», 221, 234, 1945.
265. Smith J. F. «Trans. ASME», 58, 719, 1936.
266. Варгафтик Н. Б. «Известия ВТИ». № 8, 6, 1949.
267. Palmer G. «Ind. Eng. Chem.», 40, 89, 1948.
268. Предводителев А. С ЖТФ, 4, №8, 1, 1934.
269. Филиппов Л. П. «Вестник МГУ», № 12, 1954.
270. Варгафтик Н. Б. «Известия ВТИ», № 7, 13, 1951.
ОГЛАВЛЕНИЕ
Предисловие 3
Условные обозначения и размерности величин, входящих в таблицы I—XX .... 5
Глава I
О рациональной форме уравнения состояния для жидкости
1.1. Краткие сведения из теории жидкого состояния 7
1.2. Анализ некоторых уравнений состояния для жидкости 14
1.3. Выбор формы уравнения состояния и методика его составления 22
1.4. Выражения для расчета термодинамических свойств по уравнению состояния 31
Глава II
Термодинамические свойства жидкого азота
II. 1. Анализ экспериментальных данных о плотности жидкого азота 34
II.2. Уравнение состояния для азота 38
И.З. Калорические свойства жидкого азота 46
Таблица I. Термодинамические свойства жидкого азота в состоянии насыщения
(по температурам) 52
Таблица II. Термодинамические свойства жидкого азота в состоянии
насыщения (по давлениям) 53
Таблица III. Термодинамические свойства азота в однофазной области . ... 54
Глава III
Термодинамические свойства жидкого кислорода
III.1. Опытные р, v, Г-данные для жидкого кислорода и их экстраполяция по
давлению 69
II 1.2. Уравнение состояния для кислорода и определение его калорических свойств 72
Таблица IV. Термодинамические свойства жидкого кислорода в состоянии
насыщения (по температурам) 80
Таблица V. Термодинамические свойства жидкого кислорода в состоянии
насыщения (по давлениям) 81
Таблица VI. Термодинамические свойства кислорода в однофазной области 83
Глав а IV
Термодинамические свойства жидкого аргона
IV. 1. Анализ экспериментальных термических данных для жидкого аргона и их
пополнение 99
IV.2. Уравнение состояния для аргона 103
IV.3. Калорические свойства жидкого аргона 111
Таблица VII. Термодинамические свойства жидкого аргона в состоянии
насыщения (по температурам) 116
Таблица VIII. Термодинамические свойства жидкого аргона в состоянии
насыщения (по давлениям) * 117
Таблица IX. Термодинамические свойства аргона в однофазной области ... 119
238
Г лава V
Термодинамические свойства жидкого воздуха
V.I. Способ определения термических свойств малоисследованной жидкости . ... 135
V.2. Разработка сетки опорных р, у, Т-данных для жидкого воздуха 144
V.3. Уравнение состояния для воздуха и расчет калорических свойств 151
Таблица X. Термодинамические свойства жидкого воздуха в состоянии
насыщения (по температурам) 158
Таблица XI. Термодинамические свойства жидкого воздуха в состоянии
насыщения (по давлениям) 159
Таблица XII. Термодинамические свойства воздуха в однофазной области . . . 160
Глава VI
Вязкость жидкого воздуха и его компонентов
VI. 1. Экспериментальные данные о вязкости жидких азота, кислорода, аргона и
воздуха 172
VI.2. Обзор методов расчета вязкости жидкости и уравнения для определения
вязкости рассматриваемых веществ 180
Таблица XIII. Динамическая вязкость жидкого и газообразного азота . . . 196
Таблица XIV. Динамическая вязкость жидкого и газообразного кислорода 198
Таблица XV. Динамическая вязкость жидкого и газообразного аргона ... 199
Таблица XVI. Динамическая вязкость жидкого и газообразного воздуха . . 201
Глава VII
Теплопроводность жидкого воздуха и его компонентов
VI 1.1. Методы измерения теплопроводности жидкостей 203
VI 1.2. Анализ экспериментальных данных о теплопроводности компонентов воздуха
в жидком состоянии 207
VII.3. Расчет теплопроводности жидких азота, кислорода, аргона и воздуха .... 216
Таблица XVII. Теплопроводность жидкого и газообразного азота 226
Таблица XVIII. Теплопроводность жидкого и газообразного кислорода 228
Таблица XIX. Теплопроводность жидкого и газообразного аргона .... 229
Таблица XX. Теплопроводность жидкого и газообразного воздуха .... 231
Литература 233
Александр Анатольевич Вассерман
Виктор Абрамович Рабинович
ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ЖИДКОГО ВОЗДУХА
И ЕГО КОМПОНЕНТОВ
Редактор издательства С. Я- Рыско
Суперобложка и переплет художника Я. А. Савенко
Технический редактор Н. М. Ильичева
Корректор А. Г. Старостин
Т-04881 Сдано в набор 12/1 1968 г. Подписано к печати 21/VI 1968 г. Формат 70X108Vie
Бумага типографская № 1 21,0 усл. п. л. + 6 вкл. 8,4 усл. п. л. 20,0 уч.-изд. л. -f- 6 вкл.
12,31 уч.-изд. л. Тираж 10 000 Изд. № 566/7. Заказ № 1978. Цена в переплете № 7
с суперобложкой 3 р. 28 коп. Цена в переплете № 7 без суперобложки 3 р. 24 коп.
Издательство стандартов. Москва, К-1, ул. Щусева, 4
Ленинградская типография № 6 Главполиграфпрома Комитета по печати
при Совете Министров СССР. Ленинград, ул. Моисеенко, 10.