Текст
Больше химической литературы на
vk.com/chemzone
More chemistry books you can find on
vk.com/chemzone
vk.com/chemzone
GRAPHITE AND ITS CRYSTAL
COMPOUNDS
by A. R. UBBELOHDE, F.R.S.
Professor of Thermodynamics
Imperial College of Science and Technology,
London
and F. A. LEWIS
Lecturer in Inorganic Chemistry
Queen’s University,
Belfast
OXFORD
AT THE CLARENDON PRESS
1960
A. P. Уббелоде, Ф. А. Льюис
ГРАФИТ И ЕГО
КРИСТАЛЛИЧЕСКИЕ
СОЕДИНЕНИЯ
Перевод с английского
Под редакцией:
канд. техн, наук Е. С. Головиной
и канд. физ.-мат. наук О. А. Цу ха но в ой.
ИЗДАТЕЛЬСТВО • « М И Р >
Москва-1965
УДК 546.26-162
Книга представляет собой систематизированный об-
зор исследований, относящихся к перспективному
жаропрочному материалу — графиту. С большим зна-
нием дела показано современное состояние проблемы,
собраны разнообразные данные о графите. Рассмотрены
вопросы строения кристаллической решетки и процессы,
происходящие в ней при графитизации; механические,
тепловые и электрические свойства графита; влияние
облучения на различные свойства графита; структура
связей в графите; магнитная восприимчивость; окислы
графита, их структура и физико-химические свойства;
реакции графита с газами и др. В большом количестве
таблиц и графиков приведен справочный материал.
Книга является ценным пособием для научных работ-
ников и инженеров, работающих в области создания
новых жаропрочных материалов на основе графита, а
также для профессорско-преподавательского состава и
студентов химико-технологических вузов.
! гззю 1871 г.
Редакция литературы по вопросам новой техники
ПРЕДИСЛОВИЕ РЕДАКТОРОВ
Вряд ли можно назвать вещество, которое имело бы более
разнообразное и широкое применение, чем углерод. Наряду с
тем что углерод является основной составляющей частью раз-
личных природных углей и используется как топливо и для
химической переработки, он получил широкое применение в
различных областях техники. Благодаря особому сочетанию
физико-химических свойств углерод незаменим в атомной
энергетике, имеет разнообразное применение в электротехни-
ке, используется как теплоизоляционный и смазочный матери-
ал. В настоящее время графит и углерод начинают широко при-
меняться как конструкционный материал, особенно в различ-
ных областях новой техники. Благодаря этому бурно разви-
ваются многочисленные исследования, направленные на
создание материалов на основе графита, обладающих задан-
ными механическими, физическими и химическими свой-
ствами.
Не удивительно, что изучению. свойств, и структурных осо-
бенностей углерода и графита уделяется.все бол.ьшеё внима-
ние и возникает потребность4 в обобщении .и систематизации
исследований, выполненных* в различных аспектах.
Одной из таких работ является книга А. Р. Уббелоде и
Ф. А. Льюиса, в которой излагается состояние проблемы с
рассмотрением очень широкого круга вопросов. Результаты
исследований структуры углерода и методов получения
углеродов различных структур рассматриваются в связи с его
теплофизическими, механическими, магнитными, электриче-
скими и химическими свойствами; описаны кристаллические
соединения графита, причем особое внимание уделено окиси
графита, ее образованию и свойствам; приведен обзор работ
по химическому взаимодействию графита с газами.
Широкий диапазон вопросов, освещенный в книге, не
позволил авторам изложить материал в полном объеме;
изложение сделано в краткой описательной форме без при-
влечения математического аппарата и иногда носит библио-
графический характер. Однако хорошая систематизация ма-
6
Предисловие редакторов
териала и большая библиография, приложенная к книге,
значительное количество таблиц и графиков -с ценными спра-
вочными данными дают в руки читателя систематизированное
руководство, позволяющее получить сведения не только из
области, которой непосредственно занимается читатель, но
и из ряда смежных самостоятельных областей.
В представленном обзоре почти отсутствуют ссылки на
работы советских ученых, даже когда эти работы занимают
ведущее положение. Например, работы школы акад. М. М. Ду-
бинина по адсорбционным характеристикам углерода, работы
по исследованию физико-химического механизма процесса
взаимодействия углерода с газами, обобщенные в следующих
монографиях: Франк-Каменецкий Д. А., Диффузия
и теплопередача в химической кинетике, Изд-во АН СССР,
1947; П р е д в о д и т е л е в А. С., X и т р и н Л. Н., Цу х а н о -
в а О. А., Колодцев X. И., Гродзовский М. К., Горение
углерода, Изд-во АН СССР, 1949; Канторович Б. В., Вве-
дение в теорию горения и газификации твердого топлива,
Изд-во АН СССР, 1961, а также исследования П. А. Теснера
с сотрудниками по получению сажистого углерода и т. д.
Книга А. Р. У'ббелоде и Ф. А. Льюиса является ценным
пособием для широкого круга научных работников и инже-
неров, занятых исследованиями физико-химических и струк-
турных свойств углерода, разработкой методов получения
различных сортов графитов и углеродов и-их использованием
в промышленности, и может служить справочным настоль-
ным руководством.
Перевод на русский язык выполнен В. В. Краснопевцевым
(гл. IV—VIII), канд. физ.-мат. наук А. А. Предводителевым
(гл. I, II), инж. Б. Б. Смирновым (гл. Ill, .IX). Гл. I, II,
IV—VII отредактированы канд. физ.-мат. наук О. А. Цухано-
вой, гл. Ill, VIII и IX — канд. техн, наук Е. С. Головиной.
Е. С. Головина,
О. А. Цуханова
ПРЕДИСЛОВИЕ АВТОРОВ
При исследовании графита и его кристаллических соеди-
нений затрагивается много разнообразных научных и техни-
ческих вопросов. Так как структура графита представляет
собой предельный случай структуры различных ароматиче-
ских рядов, то его химические свойства могут представлять
большой интерес для химиков-органиков. С точки зрения фи-
зики, графит благодаря специфической структуре его энерге-
тических зон (одна заполненная зона, отделенная от пустой
зоны запрещенной зоной практически нулевой толщины)
занимает промежуточное положение между металлическими
проводниками,-у которых зоны проводимости частично запол-
нены, и хорошо известными полупроводниками, в которых
ближайшая пустая зона расположена на один-два электроно-
вольта выше заполненной зоны.
Известно, что благодаря слоистой структуре графит обла-
дает ценными смазывающими свойствами. Очень высокая
температура плавления углерода способствует все большему
использованию его в качестве конструкционного материала в
высокотемпературных технологических процессах. Благодаря
некоторым физическим свойствам графит получил широкое
применение в ядерных реакторах.
Существует большое многообразие каменных и древесных
углей и коксов. Графит является основной составляющей
частью всех углей, которые также содержат разные количе-
ства других элементов. Наряду с преобладающими арома-
тическими связями в этих углеродных полимерах имеются
группы с тетраэдрическими связями, соответствующие
<$р3-симметрии углеродной связи.
Образование многочисленных кристаллических соединений
путем внедрения различных добавок связано с характерной
слоистой структурой графита. Перенос зарядов в этих кри-
сталлических соединениях резко изменяет л-электронные
полосы графита, приводя во многих случаях к образованию
новых типов твердого вещества с проводимостью, не уступаю-
щей проводимости металлов.
8
Предисловие авторов
При изложении материала, представленного в этой книге,
возникли трудности в связи с очень неоднородным характе-
ром имеющихся сведений по физике и химии любого из ука-
занных явлений. Часто приходилось рассматривать совместно
данные, весьма различные по степени научной достоверности.
Теоретики часто не учитывают важного значения различ-
ных структурных и химических дефектов в графите и относят
имеющийся экспериментальный материал к гипотетическому
графиту, не отличающемуся от идеального в кристаллогра-
фическом отношении. С другой стороны, технологи склонны
не придавать должного значения ценным сведениям о свой-
ствах коксов и углей, которые можно получить из более
академических исследований, справедливых для почти иде-
ального графита.
Учитывая эти трудности, авторы старались дать в книге
обзор различных направлений исследования, не делая попыт-
ки обобщить результаты в тех случаях, когда это представ-
лялось преждевременным. Цель настоящей книги — дать
всестороннюю информацию о состоянии вопроса, что может
способствовать более тесному сотрудничеству лиц, изучающих
разные стороны проблемы углерода.
А. А Уббелоде,
Ф. А. Льюис
ГЛАВА I
НЕКОТОРЫЕ КРИСТАЛЛОГРАФИЧЕСКИЕ
МОДЕЛИ ГРАФИТА
В монографии, посвященной графиту, во избежание не-
доразумений необходимо прежде всего тщательно установить
терминологию. Это лучше всего сделать, если начать рас-
смотрение с идеальных моделей, а затем описать те отклоне-
ния, которые наблюдаются в реальных образцах.
I. 1. ГЕКСАГОНАЛЬНАЯ ПОЧТИ ИДЕАЛЬНАЯ РЕШЕТКА
Как будет описано ниже в I. 2, в естественных условиях
графит встречается в отложениях, из которых можно выде-
лить частички, представляющие собой почти совершенные
кристаллы. Микроскопические исследования показывают, что
они представляют собой плоские пластинки, у которых углы
между боковыми гранями составляют 60° [767]. Структура
кристаллического графита одна из первых изучалась с по-
мощью рентгеновских лучей [223, 277, 478], причем впослед-
ствии исследования были повторены с большей точностью
(см., например, [68, 397, 678, 759, 1036]). Из этих исследова-
ний следовало, что атомы углерода в графите располагаются
в параллельных слоях. Расстояние между слоями в элемен-
тарной ячейке в направлении оси с при комнатной темпера-
туре равно 3,3538 А [296]. Несколько отличное значе-
ние с получено для цейлонского естественного графита.
(с = 3,3544 А), что обусловлено, по-видимому, различиями
геологического происхождения, а, возможно, является резуль-
татом влияния ромбоэдрической формы (см. ниже) [1088].
Тщательные рентгеновские исследования многих образцов
при 15°С указывают на то, что даже в результате нагревания
до 3600°С при давлении аргона до 10 атм расстояние между
слоями в искусственном графите не становится меньше
3,3569±0,0001 А. Весьма показательно, что графит, кристал-
лизующийся из расплавленного железа в виде спелевого гра-
10
Глава I
фита или киш-графита (содержание в золе железа и крем-
ния 48,4%), находится в сжатом состоянии [1088]. Расстояние
между слоями в таком графите составляет 3,3528 ±0,0002 А
(см., например, работу [677]). Если удалить железо путем
обработки концентрированной соляной кислотой, расстояние
между слоями увеличивается и достигает значения, характер,-
ного для цейлонского графита (ср. также 1.5. 1).
Фиг. 1. Структура графита гексагональной модификации.
В каждом слое атомы углерода образуют сетку правиль-
ных гексагонов с расстоянием С—С 1,415 А [1036]. Отсюда
теоретическое значение плотности получается равным
2,265 г!см\ Плотность встречающегося в природе графита
имеет тот же порядок. Согласно идеализированной кристал-
лической структуре, предложенной Берналом [68], эти слои
плоские; атомы углерода в каждом слое располагаются точно
под центром правильных гексагонов в соседнем верхнем слое
(фиг. 1), причем порядок упаковки выражается чередованием
слоев ababab. Эта последовательность означает, что по отно-
шению к некоторой фиксированной оси с третий слой будет
иметь точно такое же расположение атомов, что и первый,
и т. д. Подобная идеализированная структура соответствует
гексагональной структуре с четырьмя атомами в элементар-
ной ячейке и принадлежит к пространственной группе
РЪ^ттс.
Как показала практика, при изучении возможных струк-
турных вариантов углерода очень важно использовать моно-
хроматическое излучение [731, 869].
Кристаллографические модели графита
11
I. 2. РОМБОЭДРИЧЕСКАЯ ПОЧТИ ИДЕАЛЬНАЯ РЕШЕТКА
В другой идеализированной ромбоэдрической решетке бы-
ли обнаружены такие же слои плоских шестигранных сеток
[580, 597, 598]. Однако каждый третий слой находится в таком
отношении ко второму, в каком второй относится к первому.
Поэтому вдоль оси с получается следующая последователь-
ность: abcabc. Слабые линии на порошковых рентгенограммах,
соответствующие второй структуре, указывают на то, что
естественные графиты, например цейлонский, баварский, ко-
рейский и траванкорский, могут содержать оба типа упаковок
(ср. данные Финча и Уилмана [286]). Возможно, что и пиро-
литический графит также обнаруживает слабые дифракцион-
ные линии, соответствующие этой структуре [140].
Относительное содержание второй модификации графита
может изменяться при механической и химической обработ-
ках, указывая на то, что эти изменения получаются за счет
смещения слоев углеродной сетки друг относительно друга.
Например, растирание в порошок кристаллического графита
может увеличить процент ромбоэдрической структуры с
4 -5 до 151%* [35]. В результате детальных исследований
Бёмом и Гофманном [94] соотношения между гексагональной
и ромбоэдрической упаковками найдено, что доля ромбо-
эдрической модификации в естественных графитах может'
достигать 30%. По-видимому, следует считать установлен-
ным, что размол увеличивает процент ромбоэдрической упа-
ковки; механизм этого перехода, аналогичный «механиче-
скому двойникованию», был выдвинут Лавесом и Баскином
[585].
Почти полное отсутствие ромбоэдрической упаковки в
искусственном графите и переход ромбоэдрической структуры
в гексагональную при нагревании до 2000—3000°С свидетель-
ствуют о большей стабильности последней модификации [94,
585].
Обработка горячими крепкими кислотами также приводит
к перестройке атомных слоев и подавлению структуры, соот-
ветствующей последовательности abc, с образованием гекса-
гональной модификации. При этом исчезают дополнитель-
ные резкие линии на рентгенограмме [580]. Поскольку при
обработке не происходит заметных потерь углерода, то мож-
но предположить, что под воздействием крепкой кислоты
слои в углеродных сетках становятся подвижными и сме-
щаются в новые по отношению к соседним слоям положе-
ния. Это может возникнуть при временном и локальном
образовании соли кислоты (см. V. 1. 1) и при последующем ее
12
Глава I
разложении. Такое предположение находится в соответствии
с тем фактом, что скольжение соседних слоев также имеет
место при анодировании графита в концентрированном вод-
ном растворе бромистого калия. Вероятно, это связано с
образованием и распадом соединения графита с бромом
(см. разд. V. 3). В отличие от действия сильной кислоты
анодирование в присутствии брома увеличивает долю ром-
боэдрической упаковки в восстанавливаемом углероде
[617].
Относительное смещение слоев может происходить при
образовании соединения, когда расстояние между слоями в
направлении оси с несколько увеличивается, а затем сокра-
щается в процессе восстановления. Внедрение и удаление
дополнительных атомов может привести к движению дисло-
каций между соседними слоями. Скольжение сеток наблю-
дается также, когда графит, состоящий из совокупности
ромбоэдрических и гексагональных областей, вступает сна-
чала в соединение с кристаллическим хлористым железом
(см. разд. V. 5), а затем FeCl3 удаляется при нагреве в
потоке хлора при температуре 100—600°С. Подобная обра-
ботка позволяет получить графит с чисто гексагональной
структурой [928], содержащий всего около 1,4% остаточного
хлора.
Более детально было исследовано распределение элек-
тронной плотности в решетке графита. Если каким-либо
способом зафиксировать фигуры Кекуле или другие фигуры,
то можно исследовать влияние расположения валентных
связей на электронную плотность. Например, по электронной
дифракции можно установить, что вокруг атома углерода
имеется неравномерное распределение наружных валентных
электронов [1107]. Однако рентгеновские исследования и ней-
тронная дифракция [35] показывают, что распределение
плотности валентных электронов имеет максимум около
центральных точек С — С-связей.
Наблюдая пятна-сателлиты на фотографиях «монокри-
сталла», Лукеш [615] высказал предположение, что не все
составленные из атомов углерода гексагоны правильные. Воз-
можно, что угловое расхождение составляет 40'. Сейчас еще
преждевременно пытаться отнести это расхождение за счет
возможных структурных дефектов, которые могут даже вклю-
чать небольшие количества инородных атомов.
В соответствии с этим находятся данные Пулмана по
изменению распределения электронной плотности для неболь-
ших конденсированных ядер углеводородов [834] (см.
раз. IV. 2).
Кристаллографические модели графита
13
I. 3. ОСНОВНЫЕ ТИПЫ ГРАФИТОВ И УГЛЕРОДОВ
Много недоразумений происходит в связи с тем, что в ли-
тературе для углерода разного происхождения встречаются
различные наименования: графит, кокс, ретортный уголь,
сажа, ламповая сажа, древесный уголь, животный уголь
и т. д.
В настоящей монографии слово «графит» означает угле-
род, в котором атомы располагаются слоями, ориентирован-
ными друг по отношению к другу по типам упаковок ab
нлн аЬс. В случае углерода с неправильной «турбостратной»
структурой, в котором слои не находятся в определенном
кристаллографическом соответствии друг с другом [35, 294-—
296], или углерода с заметным количеством других дефектов
необходимо эти дефекты особо оговаривать и каким-то обра-
зом классифицировать. Имеются три основных типа графитов
с почти идеальной структурой:
1) естественный графит;
2) выделения графита, кристаллизующиеся в процессе
выплавки чугуна (спелевый, или киш-графит);
3) искусственный графит, который обычно образуется
при дегидрогенизации и полимеризации углеводородов из
конденсированной или газовой фазы.
I. 4. ДЕФЕКТЫ СТРУКТУРЫ В ГРАФИТЕ
Любой структурной характеристике идеализированной
трехмерной решетки графита может соответствовать некото-
рый дефект. Многие из этих дефектов встречаются в образцах
частично графитизированных углеродов, рассматриваемых
ниже. Разнообразие и устойчивость различных дефектов
структуры в графите имеет первостепенное • значение при
объяснении многих свойств твердого углерода. Некоторые из
них будут описаны при рассмотрении отдельных физических
свойств в следующем разделе. Наиболее подходящими мето-*
дами при исследовании дефектов в почти идеальной струк-
туре графита (см. ниже) являются рентгеновские и другие
дифракционные методы. Если концентрация дефектов очень
мала, рентгеновские методы оказываются недостаточно чув-
ствительными. В этом случае для оценок можно воспользо-
ваться методами, основанными на изучении электрических
или химических свойств. Для исследования грубых дефек-
тов лучшие результаты могут дать другие методы.
14
Глава I
В идеальном графите взаимодействие между слоями ато-
мов углерода мало по сравнению с более тесными связями
двух соседних атомов в углеродной сетке за счет более близ-
кого их расположения. Расстояние между атомами С — С
в слое составляет 1,415 А. Поэтому структурные дефекты
удобно разделять на две группы: дефекты, относящиеся к
нарушениям между слоями, и дефекты связи в сетках. В со-
ответствии с этим рассмотрение дефектов также удобно вести
раздельно по установленным типам. Однако необходимо*
иметь в виду, что в действительности между ними может
иметься определенная взаимосвязь.
' I. 4. 1. ДЕФЕКТЫ УПАКОВКИ СЛОЕВ
Совершенные плоские гексагональные сетки из атомон
углерода (наименьшее расстояние между атомами 1,415 А)
могут быть смещены так, что будет нарушено чередование
слоев, характерное для гексагональной или ромбоэдрической
структуры. Такой углерод, состоящий из совершенных гекса-
гональных сеток, в котором сохраняется параллельность
слоев, но нарушен порядок в последовательности укладки
слоев, будем называть углеродом с неправильной упаковкой,
или турбостратным (turbostratic). Первоначальное значение
термина «турбостратный» относилось к углероду, который
еще не был нагрет до достаточно высокой температуры, обес-
печивающей получение упаковки, характерной для графита.
В настоящем понимании этот термин характеризует только
геометрию, а не способ получения материала.
Турбостратное разупорядочение наблюдается довольно-
часто*при рентгеновском изучении углерода [75, 1094, 1119]
и может быть измерено по интенсивности линий (002) [295,
803, 804] (см. ниже). Турбостратное разупорядочение вызы-
вает очень слабые изменения в расстояниях между слоями,
которые можно обнаружить только в некоторых случаях пре-
цизионными методами. При определении расстояния между
слоями (сетками) в различных сортах углерода и кокса
(ср. данные работ [204, 295, 296]) было установлено суще-
ствование двух типов сильно разупорядоченных структур.
В «неграфитизирующихся» видах углерода не наблю-
дается полного трехмерного порядка даже при нагревании
в течение длительного времени до 2000°С. Расстояние между
слоями в таком углероде равно 3,7 А. По-видимому, в этом
случае имеются некоторые структурные препятствия для
диффузии углеродных атомов [284], которые предотвращают
графитизацию при нагревании. При нагревании «графитизи-
Кристаллографические модели графита
15
рующихся» углей уменьшение дефектности наблюдается уже
при температуре около 1200°С и очень отчетливо выражена
при 2200°С. Кинетически это различие может возникать за
счет присутствия большого количества атомов водорода в
графитизирующихся углях. До начала процесса кажущееся
расстояние между слоями в графитизирующихся углях со-
ставляет 3,44 А.
При нагревании выше 1600°С, по-видимому, возникает
смешанная структура: некоторые слои имеют упаковку гра-
фита с расстоянием
между слоями ^3,35 А,
а другие обнаружива-
ют турбостратную
структуру со средним
расстоянием 3,44 А.
В таких смешанных
структурах определяет-
ся среднее расстояние
d между слоями, для
вычисления которого
были предложены раз-
личные эмпирические
соотношения. Наибо-
лее обоснованное урав-
нение было предложе-
но Бэконом; оно име-
Доля неправильно упакованных слиеа р
Фиг. 2. Изменение межплоскостного рас-
стояния при возрастании степени разупо-
ет следующий вид: рядоченности р в упаковке слоев.
d - 3,440-0,086(1-р)-
—0,064р(1— р) [36]. С возрастанием упорядочения р изме-
няется от 1 до 0 (фиг. 2). Слоистая структура с высокой
степенью упорядоченности образуется при отложении пиро-
графита, получаемого при разложении различных аромати-
ческих и алифатических углеводородов в парообразной фазе
[140, 724]. Было обнаружено, что частичное окисление пони-
жает степень разупорядоченности [1099, 1100].
При анализе различных нарушений в порядке упаковки
слоев было принято, что размеры гексагональных сеток
углеродных атомов весьма большие. Однако, как это будет
видно из следующего раздела, в реальном углероде
этого не должно быть. Если размеры сеток составляют ме-
нее 50 А или около того, то считается, что расстояние
между слоями возрастает более или менее непрерывным
образом [71, 442, 858, 1119]. Это возрастание не всегда воз-
можно отделить от турбостратного разупорядочения
больших макромолекул, поскольку разупорядочение слоев-
16
Глава I
часто сопровождается обрывом гексагональных сеток. Даль-
нейшее усложнение получается за счет того, что обычно
гексагональная сетка рассматривается как плоскостная и по
своему характеру преимущественно ароматическая. Можно
предположить, что в графитах с сильными структурными на-
рушениями имеются включения алициклических решеток,
как, например, в структурах со складчатыми слоями окиси
графита [674] (ср. гл. VIII).
Интерпретация рентгенограмм, полученных для дефект-
ных структур углерода, основывается на ряде данных, полу-
ченных более точными методами. При этом пытаются рас-
считать постоянные решетки а и с, приняв, что сама решетка
является совершенной. В настоящее время в выводах отдель-
ных авторов имеются противоречия (ср. результаты работ
[76, 465, 803, 804]). Строго говоря, рентгеновские методы
должны быть использованы скорее для определения распре-
деления молекулярных размеров, а не для определения сред-
него размера [234, 235]. В настоящее время предложены дру-
гие методы измерения размеров кристаллитов, основанные
на изучении теплопроводности [964].
1.4.2. ДЕФЕКТЫ В СВЯЗЯХ УГЛЕРОДНОЙ РЕШЕТКИ
Кристаллографически обе структуры идеального графита
должны рассматриваться как бесконечные сетки, состоящие
из углеродных гексагонов, расположенных в параллельных
слоях. Однако практически эти сетки всегда имеют конечные
размеры, хотя некоторые почти совершенные графиты долж-
ны обладать сетками достаточно больших размеров. Сетку
конечного размера удобно рассматривать как большую
макромолекулу углерода, которая в случае графита с почти
идеальной структурой является ароматической по своему
характеру и плоской.
Как видно из табл. 1, можно заметить близкое соответ-
ствие значений межплоскостных • и межатомных расстояний,
даже если сравнивать совсем небольшую ароматическую мо-
лекулу с графитом. В этом смысле графит можно рассматри-
вать как предельное образование из органических ароматиче-
ских соединений различных гомологических рядов. Это
позволяет сделать ряд важных выводов, которые будут об-
суждены ниже. В четвертой колонке табл. 1 приведены зна-
чения возможных наикратчайших расстояний между парами
молекул, симметрично расположенных относительно центра
в кристалле. Во всех случаях эти пары наклонены по отно-
шению к соседним парам под углом от 40 до -- 60°.
Кристаллографические модели графита
17
Таблица 1
Молекулярные параметры ароматических углеводородов,
аналогичных графиту
Наименование Модель Число конден- сированных гексагонов Расстояние между парал- лельными мо- о лекулами, А Длина С—С- связей.А (опытные дан- ные) Источник
Бензол 1 1,397 [988]
Пирен 4 3,52 1,39 —1,45 [866]
Перилен 5 3,47 1,37 —1,54 [244]
1 Коронен 7 3,40 1,385—1,430 [865]
? * ,
Овален 10 3,45 1,345—1,435 [243]
Т урбострат- Около 600 3,44 (1315)
ный угле-
род
Графит 1,000 3,35 1,415
Алмаз 1,555 [609]
Этилен 1,353 [348]
Такое отклонение от слоистой упаковки графита, вероятно,
отсутствует в углеводородах с достаточно большим количе-
ством атомов. Интересно знать, при каких размерах молекул
это имеет место, однако в настоящий момент мы не распо-
лагаем соответствующими данными. Наклон молекул, по-ви-
2 А. Р. Уббелоде
18
Глава I
димому, обусловлен взаимодействием между ароматическими
—СН-группами одной молекулы с л-электронами соседних
молекул, и это подтверждается тем фактом, что гексаметил-
бензол подобно графиту имеет плоскую упаковку. Другой ха-
рактерной чертой является то, что углеводороды с меньшим
числом атомов обычно имеют диапазон длин С—С-связей
в решетке. Длина С—С-связи в алмазе определяет верхний
предел, а двойная связь в этилене практически устанавли-
вает нижний предел диапазона длин связей, хотя в некото-
рых конденсированных гексагональных сетках наблюдаются
еще более короткие связи, приближающиеся по своему ха-
рактеру к С—С-связям в ацетилене. В углероде с сеточными
дефектами можно ожидать наличия подобного же диапазона
длин связей, но существующие методы не позволяют его об-
наружить. Данные табл. 1 дают представление о типах
дефектов связей в графите. Рассмотрим основные типы де-
фектов.
I. Краевые дефекты. Когда С—С-связь не может образо-
ваться (например, в случае, если одна макромолекула не
находится в плоскости своих ближайших соседей), все же в
таком краевом дефекте обычно всегда находятся другие пути
насыщения электронных валентных связей атомов углерода.
а. Весьма часто инородные атомы, как, например, Н или
группы типа —ОН, =0, —О—, вступают во взаимодействие
с краевыми дефектами (см. гл. IX). Такие макромолекулы
в некотором роде подобны замещенным ароматическим мо-
лекулам с меньшим числом атомов. Таким образом, полному
упорядочению атомов углерода при сильном нагревании
должно предшествовать выделение связанных с углеродом -
инородных атомов. В ряде других случаев атомы металлов
или галогенов могут быть связаны таким же образом с крае-
выми дефектами. Как будет показано ниже, они могут оказы-
вать существенное влияние на электронные и химические
свойства углерода.
б. Подобно слабым центральным С—С-связям в гекса-
арилэтане, атомы углерода на краевых дефектах могут обра-
зовывать слабые парные спиновые связи с атомами соседних
макромолекул. Такие слабые связи обычно распадаются при
повышении температуры и могут обусловливать электронные
свойства, которые рассматриваются в гл. IV.
в. «Дырочные» и «клещевидные» дефекты [1058, 1060]
возникают в том случае, когда разрушение связей приводит
к образованию пустот или разрывов в гексагональной сетке
углеродных атомов. На фиг. 3 приведены некоторые типич-
ные примеры дырочных дефектов.
Кристаллографические модели графита
19
У разрывов сетки ограниченность пространства мешает
насыщению углеродных валентных связей путем присоедине-
ния инородных атомов или какой-либо группы. Так, напри-
мер, вандерваальсовское отталкивание даже для С—Н-груп-
пы имеет радиус действия порядка 1,29 А при отсчете от
углеродного атома как от центра [777]. При образовании свя-
зей с углеродом группы, содержащие вместо Н другой эле-
мент, должны занимать еще большие объемы, в которых
Ф и г. 3. Характерные «дырочные» дефекты
в гексагональной углеродной сетке.
действуют силы отталкивания. Это имеет одно из следующих
последствий:
1. Гексагональная сетка значительно вытягивается и из-
гибается, чтобы разместить группы инородных атомов. Этот
процесс может свести к минимуму искажение, особенно если
оно возникло за счет клещевидных дефектов (фиг. 4), однако
отклонение от плоскости всегда приводит к потерям резо-
нансной энергии [18]. В результате этого подобные инород-
ные атомы или группы будут связаны значительно слабее,
чем при нормальной связи таких групп с краевыми атомами
плоской ароматической молекулы.
2. Для одного йли более атомов электроны оказываются
неспаренными около дефекта. Вероятно, это особенно харак-
терно для дырочного дефекта. У таких атомов оказывается
захваченным спин неспаренного электрона. Неспаренные
электроны не могут перемещаться в решетке без изменения
всех пространственных соотношений. В гл. IV будут рас-
смотрены некоторые последствия подобных дефектов. Инте-
ресно отметить, что во многих случаях концентрация захва-
ченных неспаренных электронов достигает максимума, равно-
го приблизительно одному спину на 2000 атомов углерода при
содержании инородных групп атомов около 6% (ср. IV. 7).
г. У клещевидных дефектов могут возникать винтовые
дислокации или другие искривления гексагональной сетки.
2*
20
Глава I
На маленьких частицах газовой сажи, подвергшейся графи-
тизации при 2500°С, были замечены, ступени роста (фиг. 5)
Ф и г. 4. Изгибание гексагональной углеродной сетки у клещевидных
дефектов за счет отталкивания угловых атомов.
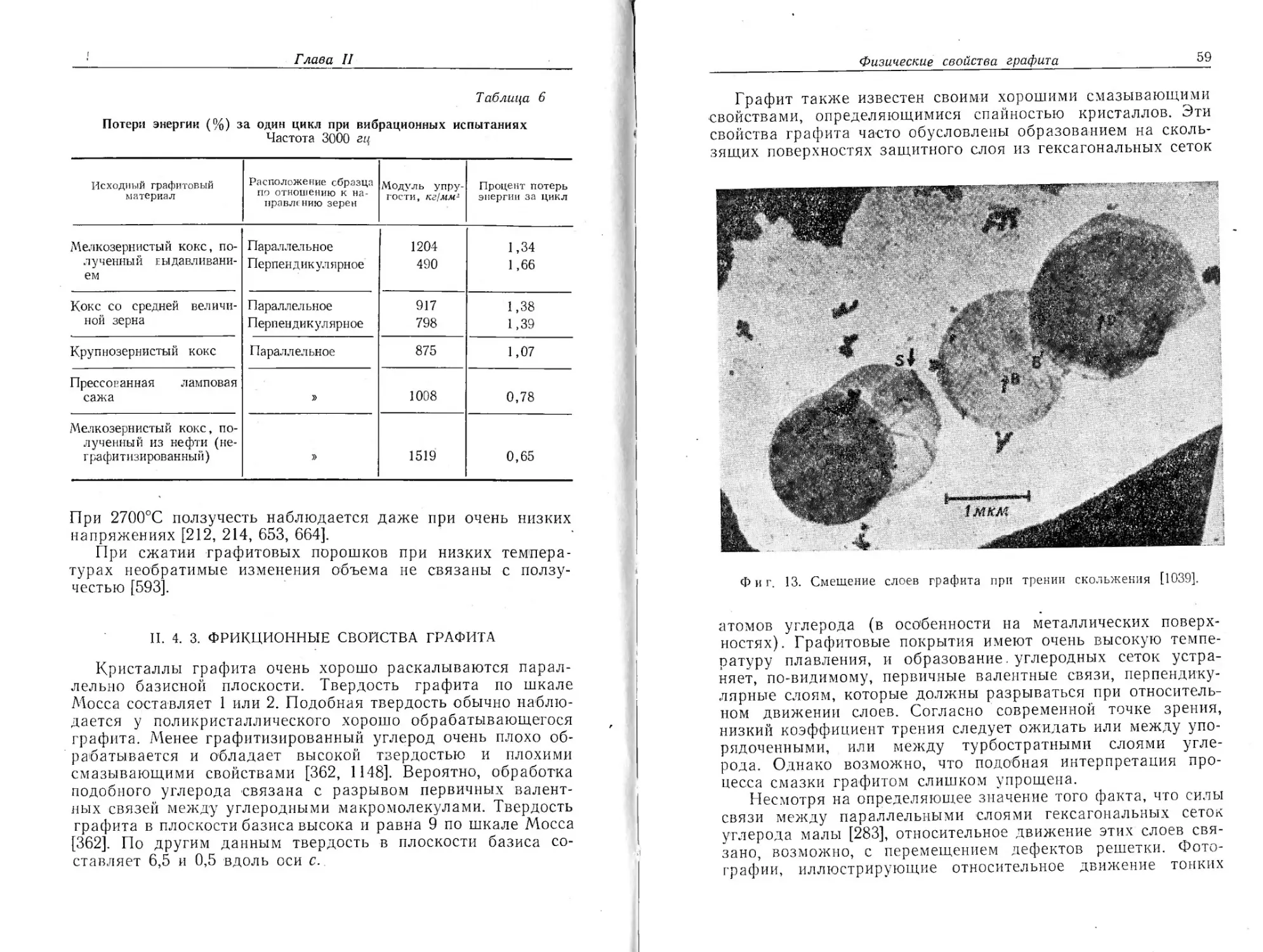
Фиг. 5. Гексагональные слои роста [1038—1040].
[1038—1040]. Примечательно, что ступени роста на искус-
ственном графите имеют высоту порядка 150—350 А. Боль-
шое значение диамагнитной характеристики Ландау для
Кристаллографические модели графита
21
графита [806, 1156] (см. разд. IV. 5) обычно утрачивается
v кристаллитов, меньших 150 А. Несмотря на существенную,
по-видимому, роль подобных дислокаций в различных хими-
ческих реакциях графита, в настоящее время пока теорети-
чески не ясно, почему ступеньки
столь велики, если они возникают
в процессе роста.
д. Плоскости двойникования кри-
сталлов графита исследовались раз-
личными авторами [ср. 813]. В обла-
сти соединения материнского и двой-
никового кристаллов должна возни-
кать дефектная сетка, что может
осуществляться различными путя-
ми. Согласно одному из предполо-
жений, на линии двойникования об-
разуются чередующиеся кольца, со-
стоящие из четырех и восьми ато-
мов (фиг. 6).
е. Физические свойства графита
при температуре выше 2500сК по-
зволяют предположить, что в этих
условиях начинают образовываться
термические дефекты в заметных
равновесных концентрациях. При
температуре 2400°С кратковремен-
Ф и г. 6. Гексагональная
сетка углерода, содержа-
щая группы ячеек из 8, 4 и
8 звеньев в плоскости двой-
никования.
На фигуре показано также на-
правление движения атомов при
перемещении плоскости двойни-
кования. Плоскость двоинико-
вания рассекает данную фигуру
вдоль пунктирной ’ линии."
ная прочность на разрыв -резко па-'
дает [653] (фиг. 7), тогда как на
кривой теплоемкости обнаружива-
ется крутой подъем при температу-
ре около 3250°С (фиг. 8а), подоб-
ный подъему перед плавлением
[470]. Как видно из фиг. 86, тепло-
проводность при температуре около
2800°С начинает падать более резко
[275, 823]. Эти изменения могут
быть связаны с процессом образования вакансий, энергия
образования которых составляет 7 эв,
1*. Дефекты изомерных связей. В случае приведенных
выше сеточных дефектов предполагалось, что атомы углерода
сохраняют хр2л-гпбрпдизацию в сетке, так что углеродная
макромолекула в слое остается истинно ароматической.
Однако эго не всегда так. Например, атомы или группы
атомов могут быть присоединены к атомам углерода, гибри-
дизация которых в сетке соответствует sp3. Подобные атомы
22
Глава I
будут стремиться располагаться в изогнутой сетке, а не в
плоской — ароматической. Такое искривление может иметь
место при образовании производных графита с ковалентными
связями (см. разд. V. 3 и VII. 8), например окиси графита
или фтористых соединений. Наличие складчатых сеток можно
установить по слабым, но вполне определенным рефлексам
в некоторых естественных графитах [397, 1037]. Даже если
углеродные макромолекулы остаются плоскими, аналогия с
ароматическими соединениями с меньшим числом атомов
(см. табл. 1) указывает на то, что все С—С-связи в каждой
плоскости не обязательно
должны быть эквивалент-
ными. Это относится в
первую очередь к очень
малым кристаллитам, у
которых доля краевых
дефектов велика. Хотя
рентгеновские исследова-
ния различных графитов
[615, 616, 618] позволяют
предположить подобные
неравномерности связей
в плоскостях, их наличие
установить трудно [37],
даже используя прецизи-
онные рентгеновские ме-
тоды [39, 642] и точное
значение коэффициентов
рассеивания [252]. Как и
Фиг. 7. Прочность графита и других предполагается, растира-
высокотемпературных материалов [653]. ние графита В порошок
вызывает обрыв связей и
возрастание числа дефек-
тов [38]. Помещение графита с краевыми дефектами в среду
различных газов приводит к возникновению связей с разными
группами.
Необходимо отметить, что ромбоэдрический графит, по-
видимому, представляет собой промежуточное состояние при
переходе графита в турбостратное состояние при измельче-
нии [94]. Дефекты изомерных связей скорее всего следует
ожидать вблизи дислокационных линий [414]. Слабые связи
могут образовываться в области плоскостей двойникования
графита [813] (см. выше).
III. Химические дефекты (включение инородных атомов
в углеродную сетку). В' ионных кристаллах изучено большое
Кристаллографические модели графита
23
количество «химических» дефектов за счет захвата инород-
ных ионов. Если валентность инородного иона отличается от
материнского кристалла, то, может возникнуть смыкание ва-
лентных связей. В кристаллах типа алмаза инородные атомы
Фиг. 8а. Теплоемкость графита [470].
Различные обозначения относятся к разным образцам графита.
Фиг. 86. Теплопроводность графита [275, 823].
Различные обозначения относятся к разным способам определе-
ния температуры.
могут удерживаться ковалентными связями. В этом случае
при условии разных валентностей внедренного атома и мате-
ринского кристалла материал приобретает явно выраженные
полупроводниковые свойства.
В графите встраивание инородного атома в ароматиче-
скую углеродную сетку, по-видимому, вполне возможно, хотя
на этот счет пока не имеется достаточных данных. Давно
24
Глава I
известно, что внедрение небольшого количества атомов бора
приводит к понижению электрического сопротивления и к
положительному температурному коэффициенту проводи-
мости [16, 362, 1108], как это имеет место для металлов. Как
будет показано в подразд. IV. 11.1, атомы бора, вероятно,
увеличивают число акцепторов и соответственно изменяют
полосу проводимости. Из аналогии с захватом инородных
атомов молекулами с меньшим числом атомов следует, что-
в решетку графита могут встраиваться О, S, Se, As, N, Р
и т. д. При этом можно ожидать, что атомы, находящиеся
в периодической системе левее углерода, будут служить
электронными акцепторами, а лежащие правее атомы ока-
жутся донорами (см. также разд. VI. 4).
Если в решетку встраивается гетероатом, то часть связей,
вероятно, обрывается. Таутомеризм связей в решетке с де-
фектами может объяснить, почему бор облегчает графити-
зацию углерода [16], способствуя миграции связей.
По аналогии между гексагональной углеродной сеткой,
рассматриваемой как одна ароматическая макромолекула, и
меньшими ароматическими молекулами, химия которых изу-
чена значительно лучше, можно сказать, что «функциональ-
ное» исследование химических свойств захваченных гетеро-
атомов представляет большой интерес. Образование различ-
ных химических производных описано только для углерода
с большим количеством дефектов [326], и поэтому особый
интерес вызывает проведение подобных исследований на
графите со структурой, более близкой к идеальной.
IV. Дефекты, вызванные излучением. Дефекты, образуе-
мые в почти идеальном графите и частично графитизирован-
ном углероде бомбардировкой нейтронами или другим излу-
чением высокой энергии, отличаются по структуре от опи-
санных выше дефектов. Под действием радиации атомы
углерода сначала смещаются со своих нормальных положе-
ний в решетке. При этом они могут образовать замыкающие
цепи между углеродными макромолекулами, подобно замы-
кающим цепям в облученных полимерах. Однако при обыч-
ных температурах значительная часть таких смещенных
атомов, по-видимому, остается на месте, с той лишь разни-
цей, что они обладают менее прочными связями по сравне-
нию с нормальными. Можно ожидать, что присутствие
«возбужденных» атомов углерода будет влиять как на физи-
ческие свойства [414, 535], так и на химическую активность.
В сильно облученных кристаллах графита внедрение про-
межуточных атомов углерода может привести к увеличению
межплоскостного расстояния с на 81% [40, 525]. Эти наруше-
Кристаллографические модели графита
25
ния снимаются при отжиге при 1500°С. При анализе хода
перегруппировки атомов углерода, смещенных при бомбар-
дировке частицами высокой энергии, необходимо учитывать
миграцию вакансий к краям частицы при нагревании ниже
1700°С [700].
В других систематических исследованиях влияния радиа-
ционных дефектов, возникших при нейтронном облучении,
рассматриваются электро- и теплопроводность, энергия и
константы упругости [152, 537, 947, 1148]. Эти исследования
относятся к поликристаллическому прессованному графиту,
в котором на месте смещенных атомов углерода образуются
поры. Было бы значительно легче объяснить соответствую-
щие данные, полученные на облученных монокристаллах,
однако такими данными мы пока не располагаем. Накопле-
ние энергии при деформации, возникающей при облучении
[679], имеет большое практическое значение, например в
связи с инцидентом на реакторе в Уиндскейле [430, 723].
V. Грубые дефекты (частично графитизированные
углероды). Представление об углероде как о полимере,
содержащем макромолекулы, вытекает из рассмотрения про-
цесса графитизации (см. 1.7). Дефекты типов I—IV рассма-
тривались на примере «почти графитовой» структуры. Значи-
тельно более грубые дефекты по отношению к идеальному
графиту можно найти в широком ассортименте частично
графитизированного углерода. В последнем только малые
области «кристаллитов» углеродного полимера приближают-
ся к структуре графита. Они связаны вместе посредством
различных видов углеродных структур, которые по сравне-
нию с решеткой графита должны рассматриваться как
«аморфные». Если в кристалле присутствуют подобные
крупномасштабные дефекты, то соответствующий способ опи-
сания реальной структуры должен быть выбран в зависи-
мости от происхождения полимера. Одна из гипотез, которую
можно проверить экспериментально, состоит в том, что поры,
присутствующие в углероде, существенно зависят от того,
каким образом «кристаллиты» связаны между собой. Объем-
ная плотность частично графитизированного углерода может
быть на 25—30% ниже плотности идеального графита. В та-
ком углероде расположение атомов на внутренних поверх-
ностях пор может оказать существенное влияние на физико-
химические свойства.
Вполне вероятно, что в некоторые поры проникает газ
или жидкость, например газообразный гелий. Пропитка кри-
сталла метанолом*или н-гексаном при кипячении с обратным
холодильником является другим методом определения объ-
26
Глава I
ема доступных пор; возможно также использование изотермы
адсорбции азота [48]. В некоторых случаях объем неучиты-
ваемых пор может достигать 2,0%. Возможно, что атомы
углерода, «блокирующие» подобные поры, более реакционно-
способны, чем атомы в областях с более правильной графи-
товой структурой [249], так как окисление в воздухе при тем-
пературе 430—500° практически полностью уничтожало
блокаду (потери углерода составляли при этом меньше 31%).
Растирание углерода в очень мелкий порошок увеличивает
количество проницаемых пор.
Ввиду большого практического значения свойства вну-
тренней поверхности и распределение пор в углероде и гра-
фите с большим количеством дефектов были исследованы
во многих работах. Подобные вопросы, относящиеся к хи-
мии поверхностей, не будут подробно обсуждаться в настоя-
щей книге. Обзор соответствующих работ был выполнен
Киплингом [542]. В последнее время большое количество
исследований проведено на поликристаллическом графите,
получаемом выдавливанием и последующей графитизацией.
В этом направлении достигнуты определенные успехи и
получен графит для ядерных реакторов с большей плот-
ностью и пониженной пористостью [17]. В связи с этим был
разработан специальный рентгеновский метод для исследова-
ния распределения кристаллитов по отношению к некоторой
выбранной оси.
Другим важным параметром, характеризующим сильно
деформированный графит, является «размер зерна». Это
понятие обычно относится к размеру областей с почти
идеальной графитовой структурой, которые связаны между
собой связями неграфитового типа и не обнаруживают по
отношению к соседним зёрнам упорядоченности. Например,
в некоторых искусственных графитах размеры зерна могут
составлять около 150 А. Если углерод подвергается отжигу,
размер зерна может достигнуть постоянного значения, зави-
сящего от температуры отжига [803]. Чувствительность рент-
геновских методов падает с уменьшением размеров зерна.
Последнее всегда необходимо иметь в виду при определении
размеров связей почти идеальных графитов с крупными де-
фектами, а также во всех видах углеродов и коксов [235, 900].
I. 5. ЕСТЕСТВЕННЫЙ ГРАФИТ
В различных частях земного шара естественный графит
имеется в количествах, обеспечивающих рентабельность
горных разработок. Графитовые отложения, находящиеся в
Кристаллографические модели графита 27
эксплуатации, имеются на Цейлоне, в Корее, Австрии, Чехо-
словакии, Баварии, Канаде, США, на Мадагаскаре, в Мек-
сике и Италии. Даже при удалении глины и других пород
естественные графиты, как правило, содержат заметное ко-
личество примесей [654]: кремния (присутствует в виде крем-
незема), железа .(в виде окиси), кислорода, водорода и сле-
дов целого ряда элементов. Кристаллы углерода в таких
естественных графитах обычно бывают различной степени
совершенства и упорядоченности. Хорошие трехмерные кри-
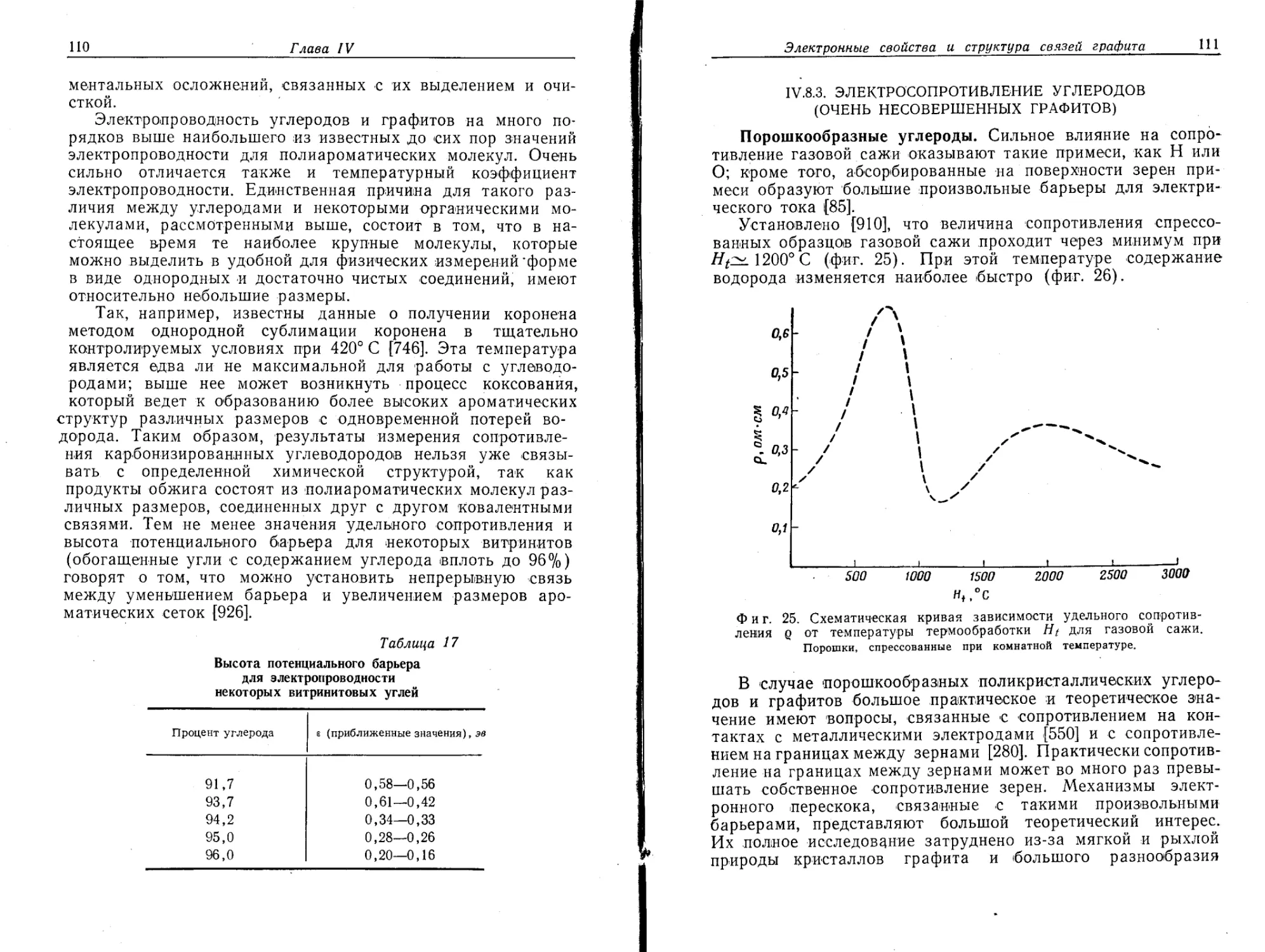
сталлы достаточно больших размеров встречаются очень
редко. Даже наиболее богатые углеродом отложения обычно
обладают столбчатой упаковкой кристаллитов. При этом
ось с направлена приблизительно перпендикулярно оси* стол-
биков.
Внешний вид естественных графитов различен. В отложе-
ниях, относительно свободных от других минералов, и после
промывки графит часто получается в форме маленьких че-
шуек с металлическим блеском. Маленькие прозрачные и
полупрозрачные гексагональные чешуйки были описаны
Пилипенко и Орешкиным [798]. Химический анализ и физиче-
ские измерения показывают, что эти кристаллы обладают
высоким содержанием углерода. Тонкие слои других естест-
венных кристаллов также оказываются прозрачными [907].
После удаления крупных частиц примеси для получения
наивысшей чистоты естественный графит обычно подвергает-
ся многократной обработке концентрированной соляной кис-
лотой и промывке концентрированной плавиковой кислотой
до тех пор, пока содержание золы не уменьшится до требуе-
мой величины.
В литературе также описано использование для экстрак-
ции четырехфтористого углерода и шестифтористой серы
[329—331]. При нагревании в атмосфере хлора и углекис-
лого натрия содержание золы может быть уменьшено до
0,041% [1142]. С целью удаления остатков галогенов обрабо-
танные таким образом графиты желательно прокалить в
вакууме при температуре 2000°С и выше. Для получения
графита наивысшей чистоты необходимо прокаливание при
температуре 3000°С (см. подразд. 1.6.2).
Несмотря на значительный интерес, проблема геологиче-
ского происхождения естественных графитов не решена.
Можно предполагать, что графиты образовались при тех же
процессах, что и алмазы — при кристаллизации углерода из
расплавленной магмы, как и породы вулканического проис-
хождения. Однако измерение растворимости углерода в
магме не говорит в пользу этой гипотезы.
28
Глава I
Согласно другой точке зрения, графит представляет собой
«последний остаток» в процессе карбонизации и коксования
углеводородов растительного происхождения. Водород, ко-
торый можно обнаружить при нагревании некоторых есте-
ственных графитов, говорит в пользу этой гипотезы [1105].
Значительное давление, а также высокая температура, по-
видимому, оказывали воздействие только на конечные стадии
графитизации естественных графитов. Наблюдаемое иногда
столбчатое строение естественных графитов, по-видимому,
является результатом геофизических срезывающих усилий,
вызывающих преимущественную ориентацию поликристал-
лических образцов.
I. 5. 1. ГРАФИТОВЫЕ ВЫДЕЛЕНИЯ В ЧУГУНЕ (КИШ-ГРАФИТ)
При производстве чугуна избыточный углерод выделяется
в виде чешуек из расплава или из твердого раствора в про-
цессе дальнейшего охлаждения. Эти выделения известны под
названием спелевого графита, или киш-графита. В зависи-
мости от внешней формы вкрапленного в твердый металл
углерода, его называют пластинчатым (чешуйчатым) углеро-
дом отжига, зернистым или сфероидальным. Образцы гра-
фита обычно получаются путем растворения железа в НС1
и промывания в HF. По имеющимся данным такая обработ-
ка уменьшает зольность в графитовых вкраплениях до 2%
[1088].
Графитовые выделения в чугуне по своему внешнему виду
обычно подобны тонким чешуйкам естественного графита.
Как и в высококачественном естественном графите, включе-
ния в чугуне обычно состоят из одного или нескольких кри-
сталлитов, хорошо пригнанных друг к другу.
Рентгеновские исследования спелевого графита и углерода
отжига показывают, что их структуры почти идентичны
структуре естественного графита [497]. Эти выводы подтверж-
дают также результаты более поздних исследований [677,
1088]. Однако пластинчатый и зернистый графит, а также
углерод отжига обладают, по-видимому, менее совершенной
структурой, чем спелевый грдфит. Это различие можно объяс-
нить, если предположить, что первоначально образуется
соединение со слоистой структурой, в состав которого входит
железо [365]. Эти соображения интересны в связи с ранними
работами, в которых также высказывается предположение
о возможности образования слоистого соединения графита
с железом [560, 859] (см. разд. V. 2). При окислении наруж-
ных слоев в «углероде отжига» в центре гранулы получается
Кристаллографические модели графита 29
более совершенное кристаллическое состояние [673]. Из чугу-
на выделяются различные относительные количества ромбо-
эдрического и гексагонального графита [762].
Несмотря на то что выделение графита из металлического
раствора представляет собой один из механизмов образова-
ния естественного графита, физико-химическое состояние
растворенного углерода точно неизвестно даже в железе.
Понижение точки замерзания [172] дает некоторые сведения
об этом. Углерод, по-видимому, преимущественно находится
в атомарном состоянии, причем он может быть связан с
атомами железа псевдометаллическими связями (—F = C)
[1051]. При более низких температурах возможно образова-
ние углерода, находящегося в полиатомарном состоянии в
форме гексагональных колец. Способность насыщенного угле-
родом железа «растворять» графитовый стержень [581] ука-
зывает на разрушение графита при образовании соединения
со слоистой структурой.
I. 6. ИСКУССТВЕННЫЙ ГРАФИТ
Существуют две теории образования графита: теория по-
следнего остатка и теория образования графита путем кри-
сталлизации из расплавленной магмы. В пользу первой гово-
рят различные способы получения искусственного графита, в
которых используется пиролиз органических соединений. Де-
тальная структура конечных продуктов до некоторой степени
зависит от исходного материала и температуры пиролиза.
I. 6. 1. ПЛОТНЫЙ ПИРОЛИТИЧЕСКИЙ ГРАФИТ
Если соединение довольно простой структуры разлагается
при высокой температуре, примером чего является термиче-
ское разложение метана или этана [138—140, 362], то полу-
чающийся графит имеет блестящую серебристую поверхность
[349].
Мейер [691] исследовал в 1958 г. механизм обмена энер-
гией между газовыми молекулами и твердым углеродом
при крекинге. Была обнаружена интересная зависимость
между плотностью и рентгеновскими данными для углерода,
отложившегося при все возрастающих температурах
(табл. 2). Это указывает на влияние различных кинетиче-
ских факторов, относительное значение которых изменяется
с повышением температуры. Во всех образцах пиролитиче-
ского графита углеродные гексагональные сетки параллель-
30
Глава /
Таблица 2
Характеристика кристаллических дефектов в пиролитическом углероде [140]
Температура осаждения, °C Исходные данные После отжига в течение 3 час при 2500аС После отжига в течение 2 час при 2в00 С
ПЛОТНОСТЬ, г! см1 характер дебае- граммы плотность характер дсбае- граммы л о ь? С характер дебас- грамм ы
2103 2,21 Несколько ли- ний hkl 2,23 Несколько ли- ний hkl 2,24 Четкие линии
1900 1,70 Линии hkl от- сутствуют 1,89 Линии hkl от- сутствуют 1,73 Линии hkl от- сутствуют
1800 1,14 То же 1,37 То же 1,73 Размытые линии
1703 1,12 » » 1,50 » » 1,52 То же
1630 1,35 Сильно размы- тые линии 2,06 Несколько ли- ний hkl 2,14 Линии h&l выра- жены менее четко, чем при 2100'С
ны, но имеют турбостратный характер. Тот факт, что
наиболее совершенно графитизированные образцы были по-
лучены при наиболее высоких температурах, представляется
естественным следствием повышения скорости диффузии ато-
мов углерода. Однако весьма примечательно, что при сред-
них температурах разупорядоченная структура углерод-
ного полимера, по-видимому, становится замкнутой; это об-
условлено, вероятно, большей скоростью поступления новых
атомов по сравнению со скоростью перераспределения де-
фектов решетки. В отложениях, полученных при самых низ-
ких температурах, такое явление выражено слабее, вероятно,
вследствие задержки атомов водорода у —СН-связей. Это
может облегчить процесс кристаллизации при высокой тем-
пературе за счет предотвращения преждевременного замыка-
ния в разупрочненных структурах полимера. Интересно
также отметить, что пиролиз различных алифатических угле-
водородов приводит к углероду со структурой графита. Не-
смотря на их алифатическое происхождение, в литературе
отсутствуют указания на существование в таких твердых
телах связей типа алмаза [362].
Кристаллографические модели графита 31
Нанесение тонких пленок плотного углерода на изоля-
торы для производства сопротивлений требует тщательного
контроля за процессом пиролиза в печах [362], нагретых до
температуры 975—1300°С, с атмосферой азота (не содержа-
щего кислорода). При использовании метана в продуктах
реакции содержатся ацетилен, этан, этилен, бензол, нафта-
лин, антрацен и т. д. Присутствие примесей в виде тяжелых
атомов металла или их окислов приводит к образованию
мягкой рыхлой сажи. Соли мешают отложению углерода.
При использовании ароматических углеводородов отложения
углерода образуются значительно быстрее, чем при разло-
жении метана. Это позволяет предположить, что гексагоны
могут встраиваться в твердую фазу целыми группами вместо
отдельных атомов углерода.
Структура углерода, получающегося при неполном сго-
рании топлива в двигателях внутреннего сгорания или при
детонации газов (например, ацетилена), представляет боль-
шой технический и научный интерес. Имеющихся в настоя-
щее время данных пока еще совершенно недостаточно для
подробного обсуждения этого вопроса. Однако можно сде-
лать предположение, что образование углерода в паро-
образной фазе происходит путем возникновения полицикли-
ческой ароматической молекулы, которая затем конденси-
руется и теряет инородные атомы [363,. 772]. Хотя в некото-
рых случаях подобные промежуточные продукты и могут
образоваться, гексагональные сетки из атомов углерода
могут также получаться при последовательном расщеплении
более простых органических молекул.
I. 6. 2. КУСКОВОЙ ИСКУССТВЕННЫЙ ГРАФИТ
Для обычного технического употребления графит полу-
чают в виде больших блоков путем нагревания органического
кокса до высокой температуры без доступа воздуха. Нагрев
антрацита производится в электрических печах, кокс нагре-
вают с добавкой смолы. Соответствующие связующие из
смол описаны в работе Блэкли и Ирпа [84] и Мартина и
Нельсона [667]. Поскольку органический кокс представляет
собой частично пиролизованное органическое соединение с
меньшим молекулярным весом, совершенно очевидно, что
процесс графитизации включает постепенно развивающуюся
полимеризацию, в ходе которой теряются инородные атомы,
например кислород и в особенности водород. Последователь-
ность этих процессов можно изобразить в виде следующей
схемы:
32
Глава I
Органические молекулы,
содержащие С, Й, О
и т. д.
Полициклический ароматический кокс или поли-
меры, содержащие меньшее количество С,
Н, О и т. д., 4- Продукты крекинг-процесса
с меньшим молекулярным весом и Н2О, СО,
СО2
4
Графит + продукты последующего крекинга
При электрическом нагреве в местах плохого контакта
или повышенного сопротивления возникает местное разогре-
вание. Это может способствовать росту кристаллических
агрегатов. Хотя описываемый ниже метод основан на посте-
пенном исключении неграфитовых связей между атомами
углерода, все же он может благоприятствовать сохранению
различных уже описанных дефектов.
Выбор графита в качестве замедлителя цепной реакции
ядерного деления обусловлен различными соображениями.
Материал замедлителя должен обладать следующими свой-
ствами: 1) обеспечивать быстрое замедление нейтронов, об-
разующихся при ядерном делении, до равновесных тепловых
скоростей и 2) иметь малое эффективное сечение захвата
нейтронов. Эффективное сечение графита принимается рав-
ным 0,0040 барн\ его теоретический предел для углерода в
графите составляет 0,0035 барн.
Для осуществления наилучшего замедления нейтронов
потеря энергии при столкновении должна быть велика, а рас-
стояние между двумя последовательными столкновениями
мало. В этом отношении наилучшим материалом является
D2O, за которым следует бериллий. Графит менее эффекти-
вен, но имеет важное преимущество вследствие его доступ-
ности, дешевизны, высоким механическим свойствам, легкости
механической обработки и хорошим тепловым свойствам.
Недостатком его является пористость (см. ниже). Газ,
используемый в реакторе в качестве теплоносителя, также
должен обладать малым поперечным сечением захвата ней-
тронов. Применяемый для этих целей СО2 не обладает доста-
точно удовлетворительными тепловыми свойствами и может
при определенных условиях реагировать с графитом с обра-
зованием СО [185]. При облучении в ядерном реакторе
графит получает повреждения, поэтому время от времени
элементы должны выниматься и подвергаться отжигу при
температуре выше 1500°С. Интересно отметить, что при уве-
личении эффективной плотности реакторного графита на
0,1 г!см3 количество отводимого тепла на единицу массы
углерода возрастает на 6%.
Кристаллографические модели графита
33
Экспериментальный графитовый завод в Харуэлле описан
Прайсом и Йейтсом [827]. Основные технические характе-
ристики процесса производства плотного поликристалличе-
ского искусственного графита высокой чистоты, предназна-
ченного для ядерных реакторов, можно проиллюстрировать
на следующем примере метода его получения в США [206].
При этом мы не будем рассматривать детали технологиче-
ских вариантов, которые могут быть использованы на раз-
личных производствах на разных стадиях.
Исходным материалом является нефтяной кокс, обычно
приготовляемый из рафинированного тяжелого масла путем
полимеризации и дистилляции летучих фракций при 450°.
Если произвести химическую и высокотемпературную очист-
ки, можно также в качестве исходного материала использо-
вать некоторые сорта антрацита с низкой концентрацией
серы [105]. Сырой нефтяной кокс содержит около 95% С.
При последующем нагревании выделяется значительное коли-
чество углеводородов. Количество выделившихся при 1000°С
летучих газов может достигать 7—16%. Содержание золы
составляет обычно 0,1—2,2%', а содержание серы 0,1—4,3%.
Получающийся продукт прокаливается при 1300°С, что при-
водит к некоторой усадке. Содержание металлических при-
месей оказалось следующим (в частях на миллион1 * 3):
Кремний ... . . . 50—1300 Марганец .... 0—180
Железо .... . . . 270—2000 Никель 0—85
Ванадий .... . . . 5-270 Кальций 130—5200
Титан . . . 2—55 Магний 10—230
Алюминий . . . . . . 15—430 Бор 0,2—0,9
Прокаленный кокс дробится, просеивается и разделяется по
фракциям от 0,4 до 13 мм. Различные фракции дробленого
кокса смешиваются в определенном отношении и к 100 ча-
стям кокса добавляется 30 частей смолы (каменноугольного
дегтя). Смола имеет примерно следующий состав:
Углерод .........
Водород .........
Азот.............
91,3—92,9 Сера.................‘ 0,42—0,53
4,47—4,80 Зола............... . 0,05—0,10
0,81—1,07 Кислород .... 1,16—2,28
Вязкость смолы сильно зависит от температуры:
13 000 сантипуаз при 130°С
2200 »» 150°С
540 » » 170°С
1 В дальнейшем будет
ч. н. млн. — Прим, ред.
применяться сокращенное обозначение: •
3 А. Р. Уббелоде
34
Глава I
Смесь приготовляется при температуре 165°, при которой
смола становится достаточно жидкой. Для облегчения выдав-
ливания можно добавить минеральное масло.
Эффект преимущественной ориентации. При выдавлива-
нии обычно используется давление 140 кг!см?. При этом полу-
чаются заготовки размерами 115X115 мм. В процессе выдав-
ливания частицы углерода стремятся расположиться так,
чтобы их наибольший размер был параллелен оси формы.
Поэтому поликристаллический графитовый блок в этом, на-
правлении прочнее и имеет большие электро- и теплопровод-
ность. Наоборот, при прессовании частицы стремятся рас-
положиться так, чтобы их наибольшие размеры были перпен-
дикулярны действующей силе. Поэтому направление дей-
ствующей силы будет соответствовать минимуму прочности,
электро- и теплопроводности (ср. [17]).
Заготовки охлаждаются, а затем их отжигают при тем-
пературе около 750°С. Чтобы предотвратить усадку при плав-
лении битума, используется коксовый порошок. При 300—
500°С из смеси выделяются углеводороды, а при 450°С она
становится твердой. Если связующее затвердевает выше этой
температуры, наблюдается очень сильная усадка. После про-
грева при 1000°С остается около 65% связующего. В боль-
ших печах весь цикл отжига может занимать шесть недель.
Графит, уплотненный пропиткой битумом. Графитизация
на этой стадии позволяет получить продукт с плотностью
1,55 г/см3. Чтобы повысить плотность реакторного графита,
применяется пропитка битумом. Сначала стержень, нагретый
на газовом пламени до 250°С, эвакуируется при давлении
менее 0,1 атм, а затем подвергается пропитке горячим биту-
мом. Эту операцию проводят под давлением 7 атм, чтобы
обеспечить уплотнение в центре стержня. После снятия дав-
ления излишки битума стекают. Другой способ уплотнения
полукристаллического графита заключается в уменьшении
газовой проницаемости, что имеет большое техническое зна-
чение. Фуриловый спирт в присутствии катализатора
полимеризуется до смолы, которая обжигается до неграфити-
зированного углерода с плотностью 1,3 г)смг. Последний
может быть использован для указанных выше целей [1103].
Если не требуется особенно высокой степени чистоты, то
уплотненные стержни затем нагреваются в печах Ачесона
[2], под которых выложен огнеупорными плитками, уложен-
ными на бетонное основание. Графитовые электроды, которые
служат проводниками, зацементированы на двух концах
печи, а графитовые стержни, подвергающиеся пропитке,
укладываются крест-накрест. Все свободное пространство
Кристаллографические модели графита 35
между ними заполняется гранулированным коксом. Чтобы
обеспечить теплоизоляцию, стержни со всех сторон засыпают
гонким карборундом, коксом и песком. Гранулированный
кокс между стержнями играет роль электрического сипро-
тивления; кокс нагревается током мощностью 600—4000 кет.
Мощность зависит от размеров печи и желаемой степени
графитизации. В зависимости от типа печи и требуемого
сорта графита расход энергии составляет 4—7,5 кет на 1 кг
конечного продукта. Продолжительность нагревания состав-
ляет от трех до четырех дней, а охлаждение — две недели.
Максимальная температура достигает 2600—3000°С.
Химический анализ конечных продуктов показывает, что
при графитизации происходит интенсивная очистка. В состав
конечных продуктов входят 0,04—0,8% золы, а также следую-
щие вещества (ч. н. млн.): 0,4—0,8 В; 8—160V; 5—20 Ti;
11—70 Fe и 150—260 Са.
Для получения графита высшей чистоты стержни промы-
ваются газом, содержащим хлор или фто^ и нагреваются до
2500°С [752]. Эта операция удаляет примеси, например редкие
земли, ванадий и бор, и уменьшает общую зольность до
20 ч. н. млн. Свойства конечного продукта представлены в.
табл. 9.
I. 6. 3. ЭЛЕКТРОЛИТИЧЕСКИЙ ГРАФИТ
При электролизе геля окиси графита образуются кристал-
лы графита [614, 1029]. Рентгенограммы полученного материа-
ла в виде длинных дендритов аналогичны рентгенограммам
для естественного графита. Дефекты в таких кристаллах в
настоящее время полностью не изучены.
I. 6. 4. ПРОЧИЕ ВИДЫ ИСКУССТВЕННЫХ ГРАФИТОВ
Многие специальные типы графитов приготовляются из
особых органических соединений. Способ их приготовления,
подобно реакторному графиту, включает дегидрогенизацию
углеводородов. В некоторых случаях дегидрогенизация может
протекать практически до конца. В итоге получается угле-
род, который можно рассматривать как ароматическую
макромолекулу, в которой отношение Н/С весьма мало.
Остаточные дефекты в конечном продукте, помимо других
факторов, зависят от температуры прокаливания.
Промышленный углерод (ср. данные работ [1, 400, 654]) со
средней степенью упорядоченности удобно разделить на две
основные группы.
3*
36
Глава I
1. Углерод, образующийся преимущественно при реакции
в газовой фазе, например при горении или крекинге газооб-
разных углеводородов при высоких температурах (газовая
сажа) или жидких углеводородов (пламенная сажа).
2. Углерод, образующийся при последовательной дегидро-
генизации жидких или твердых углеводородов. В результате
получается продукт, частично сохраняющий форму исходных
веществ. К этому классу относятся кокс, древесный и костя-
ной уголь.
Обычно в первом случае получаются порошкообразные
продукты, а во втором — образуются куски. Физические свой-
ства таких веществ изменяются в зависимости от исходного
материала и способа приготовления. По своей структуре по-
лучающийся графит сильно отличается от идеального (в осо-
бенности вторая группа). Причиной этого могут явиться два
обстоятельства:
1. В исходном продукте имеется значительное количество
минеральных примесей. Например, в костяном угле содер-
жание фосфатов превышает содержание углерода.
2. Имеется заметная тенденция к сохранению морфологии
исходной молекулы углеводорода. Это можно наблюдать на
примере растительного угля, получающегося из больших мо-
лекул целлюлозы, имеющейся в древесине. Во всех случаях
можно повысить упорядоченность атомов углерода, а также
подвергнуть углерод графитизации путем соответствующего
нагревания [803, 804]. В связи с особыми требованиями про-
мышленности и вследствие подходящих физических свойств
частично графитизированный углерод может иметь большое
практическое значение.
Большое количество работ посвящено изучению кристал-
лической структуры и активных полярных групп на поверх-
ности частиц [97, 383] (см. также гл. VIII).
Изменение электронных свойств этих сортов углерода
при последовательной графитизации будет обсуждено в
разд. IV. 8.
I. 6. 5. попытки СОЗДАНИЯ крупных монокристаллов
ИСКУССТВЕННОГО ГРАФИТА
Вследствие большой анизотропии крупные монокристаллы
представляют интерес с точки зрения их электронных свойств.
Попытки получения таких кристаллов имели лишь частичный
успех. Хорошо сформированные кристаллы графита удалось
выделить из расплава в атмосфере аргона при давлении
150 атм, но при этом столкнулись с большими технологиче-
Кристаллографические модели графита 37
скими трудностями [206]. Если маленькие пластинки, состоя-
щие из небольших монокристаллов, подвесить в жидкости,
например в жидком желатине, и приложить для их ориента-
ции сильное магнитное поле, то при затвердевании жидкости
получается «столбчатая» структура с плоскостью базиса, па-
раллельной направлению магнитного поля. Несмотря на то
что анизотропия такого «упорядоченного твердого тела» ве-
лика, она все же значительно меньше анизотропии истинного
монокристалла [567].
Углерод, образующийся при разложении метана, имеет
ярко выраженную ориентацию; плоскость базиса оказывает-
ся параллельной поверхности, на которой происходит выделе-
ние. Однако в направлении, перпендикулярном этой плоско-
сти, полного упорядочения не происходит. Если отложение
происходит на плоской поверхности, то можно получить кри-
сталлы графита, упорядоченные в двух направлениях [139].
Монокристаллы графита длиной до 6 мм можно получить
при нагревании больших монокристаллов карбида алюминия
при 2500°С. В этом случае алюминий улетучивается и кон-
центрируется в более холодных участках печи. Несмотря на
то что подобные кристаллы графита морфологически плохо
изучены, можно сказать, что размеры межплоскостного рас-
стояния при 25°С в направлении оси с составляют
3,3545±0,0005 А, что указывает на хорошо выраженное упо-
рядочение в таких кристаллах [290].
I. 1. СТРУКТУРНЫЕ И МОЛЕКУЛЯРНЫЕ ИЗМЕНЕНИЯ
В ПРОЦЕССЕ ГРАФИТИЗАЦИИ
В последующих разделах будут даны некоторые техниче-
ские характеристики производства плотного поликристалли-
ческого графита высокой чистоты. Многие из них были уста-
новлены опытным путем. Для выяснения причин образования
грубых дефектов были проведены также и микроскопические
исследования [668].
Структурные и молекулярные изменения, обнаруженные
при исследовании процесса графитизации, в настоящее время
составляют важный раздел химии полимеров и твердого те-
ла. Однако в наших знаниях все еще имеется большой про-
бел, что сказалось также на последующем описании процесса
графитизации, тесно связанного с различными дефектами в
графите. Для простоты будем рассматривать образование
графита из чистых углеводоров в отсутствие окисляющей
атмосферы.
38
Глава I
При нагревании углеводородов выше 400°С начинается
процесс полимеризации. Вещество начинает темнеть и даже
чернеть. Иногда пользуются термином «обугливание», одна-
ко в технике более употребителен термин «коксование».
Сетки с конденсированными кольцами, образующиеся даже
при использовании алифатических углеводородов, постепен-
но увеличиваются в размерах. Относительная легкость нача-
ла процесса полимеризации зависит от молекулярной струк-
туры исходного вещества. При давлении, соответствующем
давлению собственного пара, антрацен, нагретый до темпе-
ратуры около 500°С, начинает превращаться в уголь [538],
но многие другие углеводороды могут выдержать на-
гревание до более высокой температуры, в особенности если
в соединении отсутствуют . антраценовые группировки или
замещенные боковые группы [645].
Дегидрогенизация развивается до тех пор, пока темпера-
тура не достигнет — 1600°С. Влияние температуры обработки
на электросопротивление показано на фиг. 9. На этой стадии
получающийся продукт можно назвать углеродом, так как
почти все атомы водорода удалены. Рентгенограммы [75] по-
казали наличие очень больших сеток гексагональных колец.
Однако эти сетки не располагаются одна над другой в опре-
деленном кристаллрграфическом порядке в направлении, пер-
пендикулярном слоям. Полимер углерода содержит макро-
ароматические молекулы, но на этой стадии не образуется
правильной структуры графита.
Если графитизация легко протекает в результате более
интенсивного нагрева при соответствующей температуре, то
получающийся на этой стадии продукт обычно называют
«мягким» коксом («soft» coke) [710]. С другой стороны, при
полимеризации некоторых веществ образуется «неграфитизи-
рующийся» углерод [295], который может графитизироваться
только при более длительном нагревании при более высокой
температуре [599, 986]. Причина такого различия будет рас-
смотрена ниже.
При описании следующей стадии будем предполагать, что
углерод легко графитизируется. При нагреве до температу-
ры выше 1600°С наблюдаются дальнейшие структурные изме-
нения. Как показали рентгеновские исследования, при этом
становятся различимыми линии, соответствующие отражению
от /^/-плоскостей, которые полностью соответствуют подоб-
ным линиям естественного графита [803]. Если максимальная
температура термообработки повышается (для удобства
будем ее обозначать через Я/), интенсивность и резкость
«графитизированных» линий hkl увеличивается. Резкость
Кристаллографические модели графита
39
рентгеновских линий возрастает примерно до Я/ 3000°С; в
большинстве случаев максимальное разрешение получается
при Я/^ 2800°С. Эти наблюдения показывают, что процесс
графитизации развивается в интервале 1600—2800°С; в поли-
мерном углероде постепенно развивается трехмерная упоря-
доченность.
Фиг. 9. Зависимость удельного электросопротивления
мягкого углерода от температуры предшест-
вовавшей термообработки ///[805].
Измерения выполнены при комнатной температуре.
Количественными рентгеновскими исследованиями уста-
новлено, что по мере развития рекристаллизации при термо-
обработке имеют место следующие три процесса, способст-
вующие устранению различных дефектов:
1) рост размеров гексагональной сетки атомов углерода.
Этот процесс можно характеризовать «диаметром» аромати-
ческой макромолекулы;
2) упаковка гексагональной углеродной сетки в парал-
лельные слои с образованием пакетов различной толщины;
3) взаимная ориентация углеродных гексагонов в парал-
лельных слоях с образованием графита с более или менее
«идеальной структурой».
40
Глава I
С целью определения количественных характеристик «сте-
пени графитизации» графита с грубыми дефектами были
разработаны различные рентгеновские методы исследования
[530]. Несмотря на то что таким способом можно установить
некоторые полезные эмпирические закономерности, истинная
количественная оценка дефектов может быть произведена
только на основе учета интенсивности рентгеновских отраже-
ний, когда структура не слишком отличается от почти иде-
ального графита. Например, все виды кристаллического угле-
рода имеют некоторые характерные черты структуры графи-
та [295]. В большинстве случаев на рентгенограммах углеро-
да с весьма неупорядоченной структурой наблюдаются диф-
фузные кольца, приблизительно соответствующие линиям
графита (002) и (100). Это указывает на присутствие гекса-
гональной сетки углерода в параллельных слоях, но не везде
правильным образом ориентированной. Помимо этих отра-
жений (002), в таком неупорядоченном углероде обнаружи-
ваются Лй-линии и отсутствуют линии hkl f/=/=0). Если имеет
место процесс графитизации при нагревании, то его можно
обнаружить по появлению и усилению отражений hkl (7 ^0)
(см. также данные Касаточкина и Каверова [521]).
Когда мягкий кокс постепенно подвергается графитизации
при температурах до 3000°С, отражение (101) начинает появ-
ляться только для диаметра сетки больше 150 А. Это указы-
вает на то, что межплоскостные силы между ароматическими
макромолекулами (для сеток указанного размера или боль-
шего) становятся достачно большими по сравнению с дез-
ориентирующими факторами и обеспечивают параллелизм
слоев [803, 804]. С другой стороны, интересно отметить,
что в то время как кокс и ретортный графит при на-
гревании до температуры, несколько большей 1500°С, очень
быстро превращаются в крупнокристаллический графит, при
нагревании сажи или активированного углерода процесс
графитизации за счет увеличения диаметра углеродной гек-
сагональной сетки и числа параллельных слоев оказы-
вается застопоренным на очень ранней стадии. Сопоставле-
ние адсорбционных и каталитических свойств различных
сортов углерода показывает, что активность углерода
уменьшается в следующей последовательности: активирован-
ный древесный уголь, сажа, кокс или ретортный гра-
фит. Экспериментальные данные, иллюстрирующие это раз-
личие (табл. 3), относятся к аморфному углероду, образую-
щемуся из газовой фазы [450]. Как уже указывалось, при
рентгенографическом изучении структуры пиролитического
углерода различного происхождения, нагретого до высокой
Кристаллографические модели графита
41
Таблица 3
Торможение процесса рекристаллизации аморфного углерода
Данные анализа, % Размеры рекрис- таллизовавшейся гексагональной сетки, А Свободная по- верхность ад- сорбции1), я2/г
С Н зола высота | диаметр
Газовая сажа непосредственно после образования 9,57 1,7 0,08 15 20 63
после прокаливания в течение 10 час при 1300°С в атмосфере СО 99 — 0,14 20 35 53
после прокаливания в течение 24 час при 3000эС 99 — 0,20 100 200 53
Ацетиленовая сажа непосредственно после образования 99,0 0,6 0,05 60 200 35
после прокаливания в течение 10 час при 1300°С 99,0 — 0,27 60 200 37
после прокаливания в течение 24 час при 3000°С 99 — 0,27 300 400 36
х) Данные основаны на адсорбционной способности метилен блау.
температуры, наблюдалось аналогичное различие между
«графитизирующимся» и «неграфитизирующимся» углеродом
[294, 295].
Это позволило предположить структурную модель негра1
фитизирующегося углерода, согласно которой в углероде пред-
полагается наличие сильных поперечных связей, соединяю-
щих небольшие пакеты параллельных слоев гексагональных
сеток углерода. Считается, что в графитизирующемся угле-
роде взаимная ориентация подобных пакетов, по-видимому,
более близка к почти идеальной графитовой структуре.
Процесс рекристаллизации при нагревании заключается в
постепенном смещении целого слоя плоскостей или даже це-
лых групп плоскостей. В графитизирующемся углероде это
может происходить более легко путем мелких переходов.
42
Глава I
Одним из возможных механизмов перестройки является скач-
кообразный переход в положение, соответствующее локаль-
ной ab- или айс-упаковке в графите. В других кристаллогра-
фических структурах близкой аналогией является движение
дислокаций, однако очень сильная анизотропия графита вно-
сит некоторую специфику в это явление.
Вследствие сильных поперечных связей полимеризация
различных органических молекул может привести к образо-
ванию углеродов с совершенно различной структурой. Конеч-
ный результат в сильной степени зависит от условий, дейст-
вующих на ранних стадиях процесса роста молекул (ср. дан-
ные работы [184]). Например, из многих органических соеди-
нений (типа антрацена или фенантрена) при нагревании в
жидком состоянии при 500°С образуется углерод, который
легко графитизируется при температурах 2500—3000°С.
С другой стороны, если пары подобных соединений соприка-
саются с сильно нагретой поверхностью, легкость последую-
щей графитизации зависит от природы первоначально обра-
зовавшегося отложения углерода. Например, если бензол до-
бавляется в поток гелия при низком парциальном давлении,
то на нагретой до 900—1400°С поверхности образуются твер-
дые серые отложения, которые легко графитизируются при
температуре выше 2500°С. Однако при больших концентра-
циях бензола или меньшей температуре поверхности обра-
зуется пористый углерод, который не графитизируется даже
при 3000°С. Вероятно, это происходит за счет того, что на
ранних стадиях полимеризации неграфитовые сетки углерода
оказываются фиксированными поперечными связями.
К веществам, при пиролизе которых образуется графити-
зирующийся углерод, относятся тощие богатые кислородом
угли, поливинилхлорид (С2Н3С1)„, смоляной и нефтяной кок-
сы. Неграфитизирующийся углерод образуется при карбони-
зации поливинилиденхлорида (С2Н2С12)п и сахара [1141].
Заторможенный рост при рекристаллизации неграфити-
зирующегося углерода приводит к образованию продукта с
низкой плотностью. Например, плотность углерода из поли-
винилиденхлорида составляет 1,59 г/см3, тогда как уголь, по-
лученный из сахара при нагревании до 3000°С, имеет плот-
ность 1,79 г!см3. Если процесс графитизации может протекать
таким образом, что будет исключено образование пор, то
плотность может возрасти почти до значения плотности иде-
ального графита. Например, при коксовании поливинилхло-
рида при 1000°С образуется углерод с плотностью 1,99 г)см3,
а при 3000°С в атмосфере N2— углерод с плотностью
2,25 г! см3 [295].
Кристаллографические модели графита 43
Избыточный водород в исходном соединении благопри-
ятствует рекристаллизации за счет усиления внутренней ми-
грации углерода преимущественно в местах, где имеется
меньше занятых валентных связей у соседних атомов угле-
рода. При повышении температуры избыточный водород за-
тормаживает процесс «отвердевания» полимерной структуры
углерода. Так, например, в (С2Н2С12)П количество водорода
достаточно только для того, чтобы вывести из соединения
хлор в виде НС1 с образованием неграфитизирующегося
угля, в.то время как в (С2НзС1)п имеется избыточный водо-
род. При пиролизе такого вещества образуется большое ко-
личество смолы и других остатков, которые продолжают
быть вязкими до температуры 450°С. Это позволяет получить
плотный легко графитизирующийся углерод.
Имеющиеся данные указывают, что при температурах
ниже 1000°С не происходит перехода углерода в графит даже
при благоприятных химических условиях; например, при
реакции
3Ni + C6CI6 — 3Ni С12 + 6СТВ
(никель Ренея)
при 230°С и давлениях до 6000 кг!см? практически образует-
ся аморфный углерод. Для подобного углерода линии (002)
появляются только после тщательной его очистки [814]; при
этом расстояние между сетками оказывается равным 3,40 А.
L 7. 1. ГРАФИТИЗАЦИЯ НА ВИНТОВЫХ ДИСЛОКАЦИЯХ
Как уже указывалось в подразд. 1.4.2, в естественных
и искусственных кристаллах графита часто наблюдаются
спирали роста [463]. Аналогичные спирали также были обна-
ружены на частицах графитизированной газовой сажи
[1038—1040]. Возможно, что эти спирали образуются в ре-
зультате роста кристалла на винтовой дислокации (механизм
Франка) [293]. Однако пока не ясно, каким образом могли
образоваться большие ступени высотой 150—300 А. По-ви-
димому, это объясняется наличием в центре кристалла боль-
шого количества дислокаций одного знака. Рекристаллиза-
ция частично графитизированного углерода с помощью этого
механизма могла происходить только в определенных местах,
например около клещевидных дефектов [1058—1061], причем
этот механизм во многих отношениях аналогичен рекристал-
лизации металлических кристаллов при отжиге. При воз-
растании температуры будут вступать в действие другие
44
Глава I
области, для которых энергия активации имеет большое зна-
чение.
Как уже отмечалось ранее, рентгеновские данные ука-
зывают на ограниченную протяженность областей с правиль-
ным расположением атомов углерода. Дислокационный
механизм упорядочения может помочь ответить на вопрос,
почему полная графитизация невозможна при температуре
1600°С. Причины заторможенного роста в модели Франклина
менее ясны, если не принять во внимание изменение проч-
ности связей между рассматриваемыми слоями. При этом
для объяснения отсутствия перескока плоскостей в новое по-
ложение при одной и той же температуре необходимо учесть
изменение прочности связи между другими областями упо-
рядочения. В работе [41] рассмотрен механизм роста ните-
видных кристаллов графита на винтовых дислокациях
(см. подразд. 1.7.2); образование спиралей при росте гра-
фита из парообразной фазы изучалось в [932].
Если торможение процесса роста связано с винтовыми
дислокациями, то на поверхности графитизированной газо-
вой сажи можно ожидать появления ступенек роста. В ли-
тературе известны упоминания о наличии поверхностной не-
однородности [826]. До сих пор подобные поверхности счи-
тались однородными [910] даже при фундаментальных иссле-
дованиях процесса адсорбции [93, 219, 455, 766]. В связи с
вышеизложенным результаты работ по адсорбции должны
быть пересмотрены (ср. данные [356].
I. 7. 2. МИГРАЦИЯ АТОМОВ УГЛЕРОДА ПУТЕМ ДИФФУЗИИ
Аналогично процессу отжига металлов при различной
термообработке графита миграция атомов углерода может
привести к устранению, а в некоторых случаях к образова-
нию различных дефектов решетки. Используя изотоп С14,
измерили диффузию графита [284], причем процесс диф-
фузии рассматривался как комбинация процессов на границе
зерен и внутри решетки. Для внутрикристаллической
диффузии значение энергии активации найдено равным
90 кал!моль [237], однако здесь необходимы, по-видимому,
дополнительные исследования в связи со сложностью воз-
можного механизма процесса миграции (ср. [520]).
Необходимо иметь в виду, что те атомы углерода, кото-
рые не находятся в гексагональной углеродной сетке, зна-
чительно менее жестко связаны и потому более подвижны.
Например, при крекинге углеводородов на нагретой нити
наблюдается отложение углерода в виде нитевидных кристал-
Кристаллографические модели графита
45
лов графита (фиг. 10), гексагональная сетка которых парал-
лельна оси кристалла. Скорость роста таких кристаллов легче
всего объяснить, сделав предположение, что атомы углерода
или свободные радикалы, например —СН2, при попадании
на поверхность движутся более или менее свободно к верши-
нам кристалла, где и встраиваются в решетку [690, 691].
Фиг. 10. Графитовые отложения в виде нитевидных кристаллов на
углеродной нити, нагретой до 2000°С в ацетилене [692].
46
Глава I
I. 7. 3. ИЗМЕНЕНИЕ ДРУГИХ ФИЗИЧЕСКИХ СВОЙСТВ
’при графитизации
Была установлена тесная связь между теплопроводностью,
электропроводностью и дефектностью кристаллов [114]. '
Многие физические и химические свойства подтверждают
различие между разупорядочением в графитизирующемся и
неграфитизирующемся . углероде. Неграфитизирующийся
углерод значительно более тверд и обладает вдвое меньшим
тепловым расширением; в отличие от графитизирующегося
углерода он не превращается с легкостью в окись графита
при воздействии реактива Броди (концентрированная HNO3 +
+KCIO3) [651]. Необходимо заметить, что при воздействии
реактива Броди и графит и углерод в итоге превращаются в
меллитовую кислоту. Различие состоит лишь в том, что на
промежуточной стадии окись графита образуется только при
воздействии реактива на графит (см. гл. VIII).
Параллельно с изменением рентгеновских данных в тем-
пературном интервале Ht от 1600 до 2400°С наблюдается
изменение магнитных и электронных свойств (см. гл. IV).
Некоторые данные о постепенном упорядочении углерод-
ных полимеров при графитизации можно получить, исходя
из данных по электропроводности [13]. Тщательно очищен-
ный й подвергшийся нейтронному облучению естественный
графит сохраняет положительный «металлический» коэффи-
циент проводимости [829] даже при очень высоких степенях
разупорядочения. Распространение этих данных на графит с
грубыми дефектами в настоящее время не кажется оправ-
данным.
При термообработке в температурном интервале 1600—
2400°С магнитная восприимчивость углерода резко умень-
шается (фиг. 11) (см. также гл. IV). Диамагнитные свой-
ства небольших ароматических сеток, присутствующих в
углеродном полимере, при низких температурах термообра-
ботки можно объяснить, например, с точки, зрения правила
Паскаля для таких молекул. Резкий скачок в районе 1600°С
еще не получил полного объяснения [804, 806].
Систематическое изучение изменений свойств при гра-
фитизации углерода, полученного из различных органических
молекул известной структуры, позволило сделать более опре-
деленные выводы [4]. В графите с грубыми дефектами общая
магнитная восприимчивость складывается из диамагнитной
и парамагнитной компонент структуры. Инородные атомы,
как, например, кислород, могут оказывать существенное
влияние на промежуточных стадиях образования графита
Кристаллографические модели графита
47
с идеальной структурой. Поэтому к выводам относитель-
но структуры графита, полученным на основе магнитных
измерений, необходимо относиться с большой осторожно-
стью.
Из данных, полученных при изучении изменения элек-
тронного магнитного резонанса при графитизации, следует,
Фиг. И. Магнитная восприимчивость углерода в зави-
симости от температуры термообработки Я/ [804, 806].
что максимальное количество захваченных свободных элек-
тронов наблюдается при 94% С. На этой стадии структура
углерода по сравнению с графитом должна обладать боль-
шим количеством дефектов. По-видимому, это обусловлено
наличием дырочных и клещевидных дефектов [1058—1061]
или слабыми связями между соседними макромолекулами за
счет спаренных спинов (см. разд. IV.7).
I. 8. РАЗЛИЧНЫЕ ФОРМЫ ИСКУССТВЕННОГО УГЛЕРОДА
Другие формы искусственного углерода, не упоминавшие-
ся в предыдущих разделах, не представляют особого инте-
реса для целей настоящей монографии. Поскольку все они
являются полимерами углерода с грубыми дефектами, кри-
сталлическая структура идеального графита может оказать-
ся неподходящей моделью для их описания. Как уже
указывалось ранее, при использовании твердого или жидкого
48
Глава I
исходного продукта из ароматических молекул получается
высокополимерный кокс за счет образования большого ко-
личества С—С-связей. Однако такая структура может содер-
жать значительное количество инородных атомов. Подобные
полимеры при сильном нагревании обычно не плавятся, а
обугливаются.
Углерод, получаемый при неполном сгорании в двига-
телях внутреннего сгорания. Возможно, что он образуется
при реакциях, аналогичных реакциям образования сажи.
Большое экономическое значение этих вопросов возникает
в связи с загрязнением воздуха городов. Проведено много
исследований для изыскания методов подавления дымообра-
зования. Некоторые данные [431] указывают на то, что аро-
матические углеводородные топлива легче образуют углерод,
чем алифатические.
Коллоидный «графит». В промышленности используются
коллоидные растворы, в которых графит диспергирован в
разных растворителях, как, например, в воде, ацетоне и т. д.
Несмотря на то что процесс стабилизации графитовых частиц
физически неясен, он, по-видимому, зависит от природы
используемого растворителя. Тот факт, что отложения гра-
фита являются довольно хорошими электрическими провод-
никами, свидетельствует о наличии весьма совершенной гек-
сагональной сетки углерода значительных размеров. Имеется
несколько опубликованных обзоров работ, посвященных
коллоидному графиту [965, 1010] (ср. данные работы [671]).
Сажа. Она получается при полимеризации газообразных
углеводородов, обычно проводимой в присутствии кислорода
с целью удаления части атомов водорода, представляющих
собой препятствия для образования поперечных связей. Сажа
имеет низкую объемную плотность и низкие тепло- и элек-
тропроводность. Ее часто используют в качестве теплоизо-
ляции при высоких температурах.
Газовая сажа, часто используемая в качестве пигмента
или добавки к резине, содержит продукты менее полной деги-
дрогенизации по сравнению с обычной сажей. Подобные ча-
стицы «углерода» обладают способностью прилипать к другим
материалам. Группы атомов, расположенных на краях гекса-
гональной сетки, имеют, вероятно, сложную структуру, и их
природа может определять свойства материала [1001].
В принципе способы дегидрогенизации при производстве
газовой сажи должны включать в себя удаление хотя бы
некоторой доли водорода, например, путем использования
хлора или фтора. Однако подобные способы, по-видимому,
пока еще не описаны.
Кристаллографические модели графита 49
Углеродные пленки, полученные испарением углерода в
вольтовой дуге. Возможно, что неотожженные пленки пред-
ставляют собой твердый углерод с наименее упорядоченной
структурой, причем в них содержится довольно небольшое
количество примесей [89, 1035].
«Открытые» углеродные полимеры. Если молекулы тща-
тельно подобранной структуры полимеризуются при доста-
точно низких температурах, между определенными атомами
в исходных структурах образуются полимерные связи С—С.
«Открытые» структуры могут возникать, когда наблюдаются
сильные отклонения от графитовой структуры, хотя и обра-
зуется твердая фаза. Наличие атомов водорода или других
атомов, а также и самих атомов углерода может способство-
вать сохранению открытой структуры. Одна группа таких
твердых веществ включает углерод с большим содержанием
кислорода и образуется при пиролизе поликарбоновой кисло-
ты, например меллитовой кислоты и меллитатов ртути и
бария, бензолпентакарбоновой кислоты, инозита и различ-
ных производных гуминовой кислоты [966]. Рентгеновские
данные указывают, что все эти углеродные остатки имеют
практически постоянную величину периода решетки с (в ин-
тервале 8—10 А), в то время как период а гексагональной
углеродной сетки изменяется от 20 А (в случае образования
отложения при 400°С) до 32 А (при 1000°С). Измерения
адсорбционной способности, проведенные на азоте, указы-
вают на высокую удельную поверхность (до 2125 лг2/г); это
говорит в пользу наличия у аморфного углерода открытой
структуры с поперечными связями, подобной о-тетрафенилену
[731]. Подобным же образом в углероде, образованном при
дегидрогенизации ацетилена при низкой температуре, не об-
наруживается заметной графитовой структуры.
«Красный углерод». Этот углерод, получающийся при
полимеризации недокиси углерода С3О2 [916—918], имеет
некоторые характерные черты ароматических молекул, одна-
ко его структура все же очень далека от структуры графита.
Гетероатомы кислорода расположены по краям структуры, а
также, вероятно, входят в состав сетки. Предполагаемая стру-
ктура представлена на фиг. 12.
Каменные угли. Структуре различных углей посвящены
обширные обзоры [464, 472, 1071]. В угле всегда содержится
заметное количество кислорода. На основании данных рент-
геноструктурного анализа можно сказать, что при содержа-
нии 89% углерода средний размер ароматической сетки
примерно соответствует 4 или 5 кольцам [732]. При этом на
кривой распределения по размерам имеется резкий пик [429].
4 А. Р. Уббелоде
50
Глава I
Согласно данным химического анализа, степень ароматиза-
ции угля возрастает при увеличении содержания углерода
Фиг. 12. Предполагаемая структура сетки
«красного» углерода.
[339]. Одна-ко предположение Фриделя [308] о том, что основ-
ная часть многоядерных ароматических молекул имеет не-
большие размеры, встречает возражения других исследова-
телей [937, 1072]. Имеются попытки связать структуру угля
со структурами продуктов пиролиза [226], хотя описание
структуры угля следовало бы базировать на статистических
принципах, поскольку в угле, как можно предполагать, при-
сутствуют различные молекулярные структуры (ср. [235]).
ГЛАВА И
ФИЗИЧЕСКИЕ СВОЙСТВА ГРАФИТА
Из сказанного в гл. I ясно, что дефекты в графите могут
оказывать существенное влияние на различные физические,
свойства. Как уже отмечалось, графит может находиться в
поликристаллическом состоянии, характерном для большин-
ства твердых тел. В 'плотных кусках графита имеются об-
ласти достаточных размеров, состоящие из вполне совершен-
ных монокристаллов. Однако даже в этих областях в силу
природы углеродных связей гексагональные углеродные сетки
могут располагаться совершенно беспорядочно. Поэтому мно-
гие образцы графита по своей структуре ближе к структуре
частично закристаллизовавшегося высшего полимера с попе-
речными связями, а не к структуре идеализированного гра-
фита. При описании различных физических и химических
свойств графита полезно рассмотреть, где это возможно, на-
сколько они зависят от взаимной ориентации гексагональных
углеродных сеток. Приводимые ниже данные по свойствам
углерода получены, как правило, при таких температурах,
когда дефектная структура может рассматриваться как ста-
бильная. При больших температурах могут наблюдаться такие
изменения, которые связаны с обратимым процессом образо-
вания термических дефектов. Полезный обзор по различным
физическим свойствам графита сделан Хоу [473]. Однако в
этом обзоре автор не рассматривает дефектные структуры.
II. 1. ПЛОТНОСТЬ
Рассчитанная на основании данных рентгеноструктурного
анализа плотность идеального графита структуры ababab
имеет величину 2,265 г/сж3 [443]. Однако .практически даже
естественный «хорошо упакованный» графит* редко имеет
плотность, превышающую 2 е/см3. Искусственные графиты
4*
52
Глава //
часто обладают плотностью 1,6 г/см3 и ниже, что, по-видимо-
му, связано с наличием областей с сильным нарушением упа-
ковки. Поэтому плотность можно принять за некоторую
характеристику совершенства кристаллической структуры
графита [27]. В соответствии с различными данными в угле-
роде имеются закрытые и открытые поры. Размеры некоторых
из них могут быть молекулярными.
Характерные значения плотности приведены в табл. 4а и
46 [206].
И. 2. РАЗМЕРЫ ДОСТУПНЫХ ПОР
Размеры пор можно определить с помощью ртутного поро-
мера [862]. При использовании других жидкостей, напри-
мер керосина (который, по-видимому, удобно принять в ка-
честве стандарта), плотность хороших кристаллов естествен-
ного графита, измеренная методом погружения, оказывается
близкой к теоретическому значению (2,265 г/см3) (табл. 4а).
Таблица 4а
Плотность почти идеального графита, определенная методом
погружения в различные среды
Материал Плотность, г/слг1 Среда Источник
Искусственный графит Окисленный графит Порошок Естественный цейлонский графит (99,5 %) Пиролитический углерод » » 2,091 2,093 2,224 2,220 2,253 2,251 2,07 До 2,2 л-Гексан Гелий Метанол Г елий Метанол Гелий [362] [НО]
Это указывает на то, что для подобных жидкостей остаются
недоступными только немногие поры и трещины [249]. Опре-
деленную таким методом плотность некоторые авторы назы-
вают «истинной» плотностью [206].
Значения плотности, приближающиеся к плотности идеаль-
ного графита, были также получены при погружении в керо-
син искусственного графита, приготовленного из нефтяного
кокса, прокаленного при 3000°С. Это указывает на почти
Физические свойства графита 53
идеальную структуру таких материалов. Как видно из
табл. 46, действительная плотность углерода, полученного
Таблица 46
Плотность углерода, определенная методом погружения в керосин
(приблизительные значения)
Материал Плотность, г! см? Материал Плотность, г1см?
Активированный уголь 1,46 Ацетиленовая сажа 2,04
Сахарный уголь 1,50—1,58 Битуминозный уголь 2,09
Кокосовый уголь 1,51 Антрацит 2,09
Уголь из древесины хвой- 1,60
ных пород Каменноугольный вар 2,09
Уголь из целлюлозы 1,60 Пол у биту минозны й уголь 2,11
Пековый кокс из древес- 1,70 Пековый кокс из ка-
ной смолы менноугольного дегтя 2,14
Уголь из древесины твер- 1,87 Лигнит 2,18
дых пород
Костяной уголь 1,94 Печная сажа Ретортный уголь 2,18 2,23
Углерод, получаемый из крови 2,01 Нефтяной кокс 2,23
из различных исходных материалов, сильно отличается от
теоретической даже после прокаливания при 3000°С. Это сви-
детельствует о наличии в подобных структурах значительного
объема пор, недоступного для жидкости, и в свою очередь
говорит о сопротивлении изменению упорядочения отдельных
кристаллитов [295], включающих такие поры.
Если имеются блокированные поры, то большую плотность
материала можно получить при использовании гелия [275, см.
также 220]. Тем не менее для многих сортов углерода и даже
для поликристаллического графита плотности, определенные
с помощью гелиевого метода, все же ниже теоретического зна-
чения [249, 973, 1086]. Это говорит о наличии значительного
объема пор радиусом менее 30 А. Анализ показывает, что
поры большого размера также могут быть блокированы.
Можно сделать поры более доступными для проникновения
гелия, используя частичное окисление углерода или его из-
мельчение. С помощью изотерм десорбции азота также можно
определить распределение и размеры пор [48, 157, 796].
54
Глава II
При облучении, в особенности нейтронами, имеет место
расширение в направлении оси с в кристаллах графита. При
определении распределения пор по размерам было установ-
лено, что некоторые атомы путем диффузии мигрируют в
поры. Интересно отметить, что при облучении наблюдается
уменьшение размеров пор и даже их полное «залечивание»
[974]. Этим можно объяснить расхождение между величиной
расширения, вычисленной на основе рентгеновских данных, и
непосредственно наблюдаемым макрорасширением [1096,
1148], которое имеет несколько меньшее значение.
II. 3. ПЛОЩАДЬ ПОВЕРХНОСТИ
Площадь поверхности графита при определении по изо-
термам адсорбции и десорбции азота [147] была найдена
равной 0,47—0,87 ж2/г. Кроме того, площадь поверхности
определяли также по проницаемости [482]. Установлено, что
в результате окисления площадь поверхности может увели-
читься до 2 л^/г за счет раскрытия внутренних пустот [206].
При облучении она уменьшается, но вновь увеличивается
при нагревании [1096]. Нагревание выше 500°С оказывается
достаточным для удаления с поверхности графита большей
части блокирующих частиц [973].
II. 4. МЕХАНИЧЕСКИЕ СВОЙСТВА ГРАФИТА
Для практических целей механические свойства обычно
исследовались на достаточно больших поликристаллических
образцах. Имеется несколько обзоров, посвященных этому
вопросу [170, 206, 212—214, 1148]. Монокристаллы обычно
слишком малы, чтобы можно было применять для их иссле-
дования ту же методику.
Аналогично другим физическим свойствам механические
свойства, как, например, модули упругости и сдвига, будут
изменяться в зависимости от направления формовки или
выдавливания. Это связано с ориентировкой отдельных кри'
сталлитов в направлении выдавливания или перпендикулярно
• направлению обжимающей силы при формовке. При этом
наблюдается только частичная преимущественная ориента-
ция в зернах. Анизотропия свойств в монокристаллах, по-
видимому, будет выражена более отчетливо.
- Прочность графита изменяется в широких пределах в
зависимости от способа его получения; при этом определенное
влияние оказывает плотность образца.
Физические свойства графита 55
II. 4. 1. СЖИМАЕМОСТЬ
Сжимаемость графита измерялась различными исследова-
телями [51, 128, 852]. Для такой сильно анизотропной струк-
туры, как графит, величины сжимаемости параллельно и
перпендикулярно плоскостям слоев сильно различаются.
Однако точно измерить эти значения довольно трудно. При
комнатной температуре сжимаемость в направлении оси а,
вероятно, ничтожна по сравнению с сжимаемостью в направ-
лении оси с.
Сжимаемость графита можно также рассчитать по вели-
чине теплового расширения, измеренного в различных на-
правлениях, и при использовании уравнения состояния Грю-
найзена. Релей [855] приводит следующие значения упругих
констант при 18°С (в 10“13 см2/дин):
4“ ^12= 1»8,
S13=-4,3,
S33=58,5.
Тогда линейные сжимаемости (в 10~13 см2/дин) оказываются
равными К±= —2,5 и Kw =50. Это приводит к среднему зна-
чению полной сжимаемости К=2А±+Л'ц=45, согласующемуся
с экспериментальным значением 44,9 [51].
Сжимаемость графита можно сравнить с сжимаемостью
алмаза, которая по данным [3, 1131] равна 5,8- 10-12 см2/дин.
Однако акустические измерения показали, что это значение
может быть завышенным [640, 1150].
Если предположить, что связи между углеродными макро-
молекулами слабы и имеют преимущественно характер сил
Ван-дер-Ваальса, то теоретические вычисления, произведен-
ные на основе учета взаимодействия между макромолекула-
ми, находятся в хорошем согласии с измеренными значениями
сжимаемости [124]. Некоторые поправки к этим расчетам
были сделаны Комацу [557].
Для слоев из полубесконечной гексагональной сетки из
углеродных атомов, находящихся на расстоянии d, была пред-
ложена простая потенциальная функция [202]. Исходя из дан-
ных по сжимаемости, можно сказать, что для атомов угле-
рода в различных сетках потенциальная функция сил при-
тяжения— отталкивания имеет степень 6—12 либо 6 [202].
Тогда энергия притяжения Е полубесконечной решетки по
отношению к другой, находящейся на расстоянии d = 3,35 А,
оказывается равной —334 эрг/см2 для функции 6-й—12-й сте-
пени и —351 эрг/см2 для функции 6-й степени.
56
Глава II
Величину Е можно рассматривать как поверхностную
энергию графита. Суммарная поверхностная энергия системы
графит — воздух для базисной плоскости, оцененная по
экспериментальным значениям теплоты смачивания графита
неполярными и полярными жидкостями, равна 119 эрг/см2
[350]. Плотность кристаллов естественного графита близ-
ка к теоретическому значению, равному 2,265 г/см\
Для поликристаллического графита с меньшей плотностью
при сжатии наблюдается необратимое уменьшение объема
[26, 128], которое, по-видимому, связано с нарушением меж-
кристаллитных связей и увеличением его плотности, стремя-
щейся к теоретическому значению плотности для монокри-
сталла. Только после этого происходит сжатие собственно
кристаллической решетки. Сжатие поликристаллического по-
рошка также приводит к необратимым изменениям объема
[593]. При исследовании углерода с большим количеством
дефектов часто наблюдаются гистерезисные явления при сжа-
тии [718, 719]. Это, по-видимому, связано с различными про-
цессами накопления энергии деформации в поликристалли-
ческом графите, имеющем малый объемный вес. Малая вели-
чина модуля сжимаемости графита способствует его сопро-
тивлению термическим ударам.
II. 4. 2. МОДУЛЬ УПРУГОСТИ, МОДУЛЬ СДВИГА
И КОЭФФИЦИЕНТ ПУАССОНА
В большинстве случаев эти данные, полученные из зави-
симости между напряжением и деформацией, относятся к
поликристаллическим образцам [206]. Модули, определяемые
по измерениям скорости звука, находятся в хорошем соот-
ветствии со значениями, вычисленными по кривой напряже-
ние— деформация при малых напряжениях [Ы48].
В отличие от сжимаемости упругие модули графита срав-
нимы с этими характеристиками для других плотноупакован-
ных кристаллов. Значения модулей для стержней из поли-
кристаллического графита, полученных выдавливанием,
должны быть определены в различных направлениях по отно-
шению к оси выдавливания [206, 537] (см. также [213]).
Приблизительные значения модулей для железа и свинца
внесены в табл. 5 для сравнения.
Кратковременная прочность на разрыв поликристалличе-
ского графита может быть определена стандартным методом
при резком приложении растягивающих напряжений. Инте-
ресно отметить, что при увеличении температуры до 2500°С
прочность сначала возрастает на 50—100%, а затем падает
Физические свойства графита
57
Таблица 5
Механические свойства поликристаллического графита
Поликристаллический графит Железо Свинец
параллельно ориентации зерен перпендику- лярно ориен- тации зерен
Модуль упругости, 1010 дин/см2 8,9 6,2 . 90 15
Модуль сдвига, 1010 дин/см2 3,2 5,4
Коэффициент Пуассо- на 0, ,1
вплоть до точки кипения или сублимации [213, 653], по-ви-
димому, вследствие влияния обратимых термических дефек-
тов (ср. фиг. 7). Значительный интерес представляют изме-
нения модуля упругости в зависимости от термообработки
[460]; они связаны, вероятно, с образованием винтовых дисло-
каций. При возрастании температуры термообработки Нt в
интервале от 1200 до 2000°С модуль упругости уменьшается,
затем при Hf = 2400° проходит через максимум, а при даль-
нейшем повышении температуры термообработки снова па-
дает. Были исследованы также изменения величин модуля
упругости, модуля сдвига и характеристик ползучести для
графита, полученного из различных исходных материалов
[212, 214]. Обнаруженные различия, по-видимому, надо отно-
сить за счет дефектов, присутствующих в кристалле.
Как уже указывалось, графит не является вполне упругим
телом. После приложения даже весьма незначительных на-
грузок еще задолго до предела текучести или разрушающей
нагрузки наблюдается остаточная деформация [206]. Эта
остаточная деформация сопровождается значительным вязко-
упругим затуханием. Потери энергии (за цикл в %) были
измерены на частоте 3000 гц\ соответствующие данные при-
водятся в табл. 6.
Были получены также кривые ползучести при высоких
температурах. Испытания проводились при нагрузке, состав-
ляющей 85% от разрушающего напряжения при комнатной
температуре. Результаты показали, что при 2300°С по истече-
нии 2 час удлинение в момент разрушения составляет 7%.
Глава II
Таблица 6
Потери энергии (%) за один цикл при вибрационных испытаниях
Частота 3000 гц
Исходный графитовый материал Расположение образца по отношению к на- правлению зерен Модуль упру- гости, кг! мм1 Процент потерь энергии за цикл
Мелкозернистый кокс, по- лученный выдавливани- ем Параллельное Перпендикулярное 1204 490 1,34 1,66
Кокс со средней величи- ной зерна Параллельное Перпендикулярное 917 798 1,38 1,39
Крупнозернистый кокс Параллельное 875 1,07
Прессованная ламповая сажа » 1008 0,78
^Мелкозернистый кокс, по- лученный из нефти (не- гра фит изи ров энный) » 1519 0,65
При 2700°С ползучесть наблюдается даже при очень низких
напряжениях [212, 214, 653, 664].
При сжатии графитовых порошков при низких темпера-
турах необратимые изменения объема не связаны с ползу-
честью [593].
II. 4. 3. ФРИКЦИОННЫЕ СВОЙСТВА ГРАФИТА
Кристаллы графита очень хорошо раскалываются парал-
лельно базисной плоскости. Твердость графита по шкале
Мосса составляет 1 или 2. Подобная твердость обычно наблю-
дается у поликристаллического хорошо обрабатывающегося
графита. Менее графитизированный углерод очень плохо об-
рабатывается и обладает высокой твердостью и плохими
смазывающими свойствами [362, 1148]. Вероятно, обработка
подобного углерода связана с разрывом первичных валент-
ных связей между углеродными макромолекулами. Твердость
графита в плоскости базиса высока и равна 9 по шкале Мосса
[362]. По другим данным твердость в плоскости базиса со-
ставляет 6,5 и 0,5 вдоль оси с.
Физические свойства графита
59
Графит также известен своими хорошими смазывающими
свойствами, определяющимися спайностью кристаллов. Эти
свойства графита часто обусловлены образованием на сколь-
зящих поверхностях защитного слоя из гексагональных сеток
Фиг. 13. Смещение слоев графита при трении скольжения [1039].
атомов углерода (в особенности на металлических поверх-
ностях). Графитовые покрытия имеют очень высокую темпе-
ратуру плавления, и образование, углеродных сеток устра-
няет, по-видимому, первичные валентные связи, перпендику-
лярные слоям, которые должны разрываться при относитель-
ном движении слоев. Согласно современной точке зрения,
низкий коэффициент трения следует ожидать или между упо-
рядоченными, или между турбостратнымп слоями угле-
рода. Однако возможно, что подобная интерпретация про-
цесса смазки графитом слишком упрощена.
Несмотря на определяющее значение того факта, что силы
связи между параллельными слоями гексагональных сеток
углерода малы [283], относительное движение этих слоев свя-
зано, возможно, с перемещением дефектов решетки. Фото-
графии, иллюстрирующие относительное движение тонких
ГЛАВА. HI
ТЕПЛОВЫЕ СВОЙСТВА ГРАФИТА
III. 1. ТЕПЛОЕМКОСТЬ
Этот важный термодинамический параметр графита изу-
чался в разных диапазонах температур. Хорошее совпадение
многочисленных данных, полученных к настоящему времени,.
tooo гооо зооо
Температура ° К
Фиг. 15. Схематическое изображение зависи-
мости теплоемкости графита от температуры.
позволяет считать, что теплоемкость не зависит от мелких
дефектов в кристалле, за исключением, возможно, области
очень низких температур. Характерная кривая для всего диа-
пазона температур представлена на фиг. 15 (см. также
фиг. 8,а).
Тепловые свойства графита 63
Тщательные определения теплоемкости естественного гра-
фита были проделаны Вебером [1105] в интервале температур
от комнатной до 1000°С. Теплоемкость древесного угля, по-
видимому, не отличается от теплоемкости графита. Вебер по-
казал, что эта характеристика увеличивается с повышением
температуры, но даже максимальная величина меньше зна-
чения 6 кал) г-атом, вытекающего из закона Дюлонга и Пти.
Более точные измерения выполнены Магнусом [647]. Они
охватывают температуры до 1100°С. При этом для тепло-
емкостей выше 5,5 кал)г-атом • °C горизонтального участка на
кривой не наблюдалось, тогда как Хоув [470] получил такой
участок, измеряя теплоемкость при высоких температурах.
Измерения при температурах ниже 0°С были выполнены
Корефом [562] и Нернстом [734]. Позднее было проведено мно-
го дополнительных измерений в интервале 0—300°К- Почти
всегда использовался поли-кристаллический искусственный
графит главным образом потому, что для точных измерений
при низких температурах требуется большое количество ве-
щества. Якобс и Паркс [499] провели опыты при температурах
от 60 до 300°К и сделали оценку значения энтропии графита
при 298°К. Значение энтропии Якобса и Паркса было под-
тверждено более поздними измерениями [59], выполненными
при температурах вплоть до 2°К. Небольшое отличие зна-
чений, полученных Де Сорбо и Тейлором [229], приписывалось
Кисомом и Перлманом [527] наличию адсорбированных га-
зов и структурным дефектам графита [230].
Основываясь на весьма грубых предположениях, Магнус-
[647] нашел в 1923 г., что характеристические температуры
Дебая для тепловых колебаний параллельно и перпендику-
лярно плоской сетке углеродных гексагонов имеют значения.
0Х=228О°К и би =760°К. Темплоемкость графита с упоря-
доченной решеткой при низких температурах представляет-
особый теоретический интерес ввиду явной анизотропности
структуры решетки. Колебания вдоль сеток обычно приводят
к совсем другим значениям упругих констант, чем колебания
в перпендикулярном направлении, так что спектр даже зву-
ковых колебаний сильно отличается от непрерывного дебаев-
ского спектра. Было высказано предположение [59, 229, 527,
573], что при низких температурах колебания только в двух
измерениях вносят вклад в колебательную теплоемкость. Если
бы это было достаточным приближением к спектру звуковых,
колебаний при низких температурах, то теплоемкость графита
при понижении температуры до 0°К должна была бы изме-
няться по закону Т2 вместо Г3. Однако существование такой
зависимости практикой окончательно не подтверждено.
64
Глава Ш
Для теоретического объяснения полученных результатов в
ряде работ было рассмотрено влияние размера частиц [371]
и других факторов [545, 556, 557, 573, 740, 742, 870], Вполне
вероятно, что отклонения обусловлены дефектами в кристал-
лах, которые всегда встречаются в разных образцах графита.
Необходимо отметить, что вкладом электронов в теплоем-
кость при очень низких температурах, по-видимому, часто
пренебрегали. Комацу [557] предполагает, что этот вклад
может быть значительным при температуре ниже 2°К (ср.
также работу [570]).
Более поздние исследования Де Сорбо и Николса [233]
были проведены калориметрическим методом в интервале
температур 1—20°К на графите с кристаллитами различных
размеров. Они нашли, что для естественного канадского гра-
фита (кристаллы шириной порядка 100 мкм) зависимость Т3
наблюдается при температуре жидкого гелия. Как колеба-
тельная составляющая теплоемкости, так и небольшая
(линейно зависящая от температуры) электронная теплоем-
кость оказываются нормальными. В ламповой саже кристал-
лы графита значительно мельче, и они сильно повреждены.
Ее теплоемкость вплоть до самых низких температур остается
примерно пропорциональной Т2. Образец естественного гра-
фита, в котором 0,04% атомов было замещено бором с целью
увеличения доли дырок в полосе проводимости, незначительно
отличался от исходного материала.
Влияние размера кристаллитов и дефектов решетки на
теплоемкость при низких температурах рассматривалось с
точки зрения теории, согласно которой беспорядочная упаков-
ка углеродных сеток приводит к увеличению с44, характери-
зующему межплоскостное сопротивление сдвигу. Это увели-
чение заметнее в более мелких кристаллитах, для которых
межплоскостное расстояние приближается к турбостратному
значению 3,44 А [113, 558]. Несмотря на противоречи-
вые данные по теплоемкости графита при низких температу-
рах, расчеты энтропии S0 при стандартных условиях нахо-
дятся в хорошем согласии. Например, для естественного цей-
лонского графита S2°98J6= 1,29±0,01 энтроп.ед., а для искус-
ственного графита получено значение 1,372±0,005 энтроп.ед.
Де Сорбо и Тейлор [232] заинтересовались теплоемкостью
графита, степень неупорядоченности .которого увеличилась
под действием облучения. Экспериментально было найдено,
что облучение увеличивает теплоемкость (фиг. 16) при низ-
ких температурах, но что разница в теплоемкостях до и после
облучения асимптотически стремится к постоянному значе-
*кал]г-атом-
Фиг. 16. Теплоемкость Ср облученного и необлученного
графита при низких температурах [232].
х необлученный графит; о облученный графи?*.
Таблица 7
Среднее значение Ср и связанных с ней функций
для графита
Т, °к с , р ’ кал!град'Моль о о WT“H298,16, кал1моль кал1град’Моль
298,16 2,06 0 1,37
300 2,08 3 1,38
500 3,50 569 2,79
700 4,43 1371 4,13
1000 5,14 2842 5,85
1300 5,57 4429 7,25
1600 5,83 6142 8,44
2000 6,05 8521 9,76
2500 6,26 11601 11,14
3000 6,42 14773 12,29
5 А. Р. Уббелоде
66
Глава III
нию при температуре порядка 300° К. При 298,16° К энтропия
такого облученного углерода S^98 16= 1,492 ±0,009 энтроп. ед.
Одно из объяснений увеличения удельной теплоемкости за-
ключается в том, что смещенный углерод рассматривается как
отдельная фаза со значительно большей степенью свободы
колебаний и температурой Дебая ’порядка 180° К.
Средние значения теплоемкости Ср и связанных с ней
функций приведены в табл. 7 по данным [874].
Как уже было отмечено, при температурах выше 3500° К
наблюдается резкое увеличение теплоемкости, объясняемое,
по-видимому, обратимым образованием вакансий или дру-
гих дефектов, обусловленных тепловым движением [470]
(см. фиг. 8,а).
III. 2. ТЕПЛОВОЕ РАСШИРЕНИЕ ГРАФИТА
Для монокристаллов графита с упорядоченной решеткой
коэффициент теплового расширения а обнаруживает значи-
тельную анизотропию, как и следовало ожидать из анизотро-
пии упругих констант. Опыты с монокристаллами цейлонского
графита в интервале температур 15—800° С дали те же зна-
чения а и и ах, которые можно получить из данных табл. 8
[730]. Величины коэффициентов теплового расширения для
Таблица 8
Периоды элементарной ячейки гексагонального
графита (в А)
Температура, °C с а
14,6 6,6943 2,45622
150,0 6,7185 2,45570
300 6,7474 2,45567
450 6,7752 , 2,45574
600 6,8046 .2,45574
700 6,8240 2,45605
800 6,8445 2,45616
температур вплоть до'1700°С приведены в работах Матуяма
[675, 676]. Эти монокристаллы содержали около 4% золы, ко-
торую не удаляли, чтобы не нарушить правильности кристал-
лической решетки. Удаление абсорбированных газов нагре-
Тепловые свойства графита 67
ванием до 850°С в вакууме заметно не изменяло размеры
кристаллической решетки.
Рассчитанные коэффициенты линейного расширения a(i
(по оси а) и а± (по оси с) имеют следующие значения:
Температурный интервал, °C а-107
0—150 .............' 15
40Э.................. 0
60Э—800 .................. 9
а±: Среднее в интервале 15—800°С............. 283
Как уже указывалось, заметное увеличение расстояния
между гексагональными углеродными сетками, перпендику-
лярными оси с, свидетельствует лишь о слабых силах взаи-
модействия в этом направлении, что подтверждается данными
для коэффициентов расширения.
Ничего определенного- неизвестно о каком-либо отличии
коэффициента расширения ромбоэдрического графита, кото-
рое можно ожидать, вероятно, в направлении оси с. Предпо-
лагалось, что сокращение периода решетки а при повышении
температуры до 150° С обусловлено эффектом Пуассона,,
хотя это можно объяснить также изменением сил, обеспечи-
вающих перенос зарядов (см. IV.2) с увеличением расстояния
между гексагональными сетками.
Неупорядоченный графитизированный ' углерод имеет
средние коэффициенты расширения, которые остаются доста-
точно анизотропными, если существует предпочтительная
ориентация макромолекул. Это может привести к растрески-
ванию блоков графита при внезапном изменении температуры.
Реакторный графит обладает свойствами, указанными
в табл. 9, которые можно сопоставить с другими физическими
свойствами, рассматриваемыми в данном разделе. Колебания
значений отдельных характеристик зависят от совершенства
графитизации и -различной ориентации кристаллитов. Данные
о графитизированной ламповой саже включены в таблицу
для сравнения, поскольку она близка к изотропному веществу.
Из сравнения среднего коэффициента теплового расширен
ния некоторых неупорядоченных углеродов (см. табл. 9) со
средним коэффициентом теплового расширения графита с
упорядоченной решеткой (получен на основе данных табл. 8)
следует, что когда области с неупорядоченными углеродными
атомами, связывающими гексагональные сетки, занимают
значительную часть всего объема, то величина среднего ко-
эффициента теплового расширения оказывается меньше. Этого
следует ожидать, если атомы соединены ковалентными.
5*
68
Глава III
Таблица 9
Физические свойства углеродов
Свойства, измеренные при комнатной температуре Графитизиро- ванная лампо- вая сажа Кусковой графит для реакторов
параллельно зернам перпендику- лярно зернам
Удельное сопротивление, мом • см 4,6—5,1 : 0,6—0,9 1,20
Теплопроводность, кал)см • °C • сек — 0,40—0,56 0;30
Коэффициент теплового расши-
рения при 60°С, 10—7/°С 41—42 11-24 27—38
Модуль упругости, кг) мм2 742—875 980—1400 560—770
Предел прочности на изгиб,
кг!мм2 1,98—2,478 1,484 1,487
Предел прочности при растяжении,
кг/мм2 .—. ! 0,308 0,91
Предел прочности при сжатии П,
кг!мм2 — 4,165 4,494
Общая плотность, г!см? 1,67 . 1,6—1,75 —
1 См. также [633].
С—С-связями, что характерно для единичных связей в алма-
зе. Однако при наличии трещин и пор тепловое расширение
вызывает напряжения сжатия и растяжения, и изменения раз-
меров с температурой, полученные при измерениях, могут не
соответствовать изменениям размеров кристаллов, свободных
от напряжений. Соображения по механизму объемного тепло-
вого расширения графита с сильно нарушенной структурой
были рассмотрены Мрозовским [717]. Следует отметить, что
для графита с частично нарушенной структурой, полученного
из нефтяного кокса, в интервале температур от —196 до
1118° С равнялось 286-10~7/°С [1085] (ср. [675]). На коксах
с размерами кристаллов 160—600 А измерения с помощью
рентгеновских лучей в интервале 20—200° С обнаружили оди-
наковые значения (с точностью до 1,2%) для коэффициента
теплового расширения в направлении оси с.
Из-за наличия пор объемное расширение, однако, значи-
тельно меньше. Например, объемный коэффициент теплового
расширения Х107, определяемый как сумма линейных коэф-
фициентов по трем взаимно перпендикулярным направлениям,
Тепловые свойства графита 69
оказался равным 87 и 56 для двух разных коксов [54,
273, 1085].
До 700°С измерения производились интерференционным
методом, до 2500° С — путем наблюдения за отделением
вольфрамового зонда на 300-миллиметровом образце [206].
При еще более высоких температурах вплоть до 3500° С
наблюдается плавное увеличение коэффициента расширения
[470]. Несмотря на то что коэффициенты теплового расшире-
ния при комнатной температуре для графитов разной струк-
туры принимают самые различные значения, изменение -сред-
него коэффициента с увеличением температуры почти одина-
ково. В случае _ надобности это позволяет производить
экстраполяцию до высоких температур [206].
III. 3. ПЛАВЛЕНИЕ ГРАФИТА
Четкие опыты по плавлению графита выполнить трудно
из-за очень высокой температуры плавления и узкого темпе-
ратурного интервала существования жидкой фазы при обыч-
ных давлениях. Согласно ранним обобщениям [19, 419, 901,
902], температура плавления графита 3800° К близка -к точке
кипения, которая по данным более поздней работы Глоклера
[341] равна примерно 4200° К. В одном из способов плавления
графита используют дугу в атмосфере аргона при давлении
150 атм [206]. Имеются данные [52], что тройная точка отве-
чает Давлению 105 кг/см2 и температуре 4000° К. Это уста-
навливает нижний предел давления, необходимого для пред-
отвращения непосредственного испарения углерода, минуя
плавление.
Некоторые косвенные сведения о плавлении графита
можно получить из общих соображений о плавлении и струк-
туре кристалла. Структура расплавленного графита точно не
известна, но кристаллическая структура твердого графита
позволяет предположить, что неупорядоченный квазикристал-
лический расплавленный графит, способный к течению в трех
различных направлениях, образуется с интенсивным обрывом
С—С-связей в гексагональной углеродной сетке. Некоторые
участки этой сетки могут, по-видимому, сохраниться, но их
удлинение, вероятно, значительно меньше, чем в кристаллах.
Плавление такой кристаллической сетки было тщательно
исследовано для двуокиси кремния SiOs и силикатов. Скры-
тая теплота плавления на 1 атом углерода оценивается энер-
гией, необходимой для разрыва, например, полоёины валент-
ностей С—С, т. е. порядка 80 кал)г-атом углерода [341]. Для
70
Глава III
рассчитанного значения точки плавления энтропия плавле-
ния составит около 20,0 энтроп. ед. Для более мелких поли-
циклических ароматических молекул для энтропии плавления
можно привести значение (в той мере, в какой производи-
лись соответствующие расчеты), близкое к 3—6 энтроп. ед.
[636] на каждое углеродное кольцо, однако здесь преобла-
дает другой механизм плавления.
III. 4. ИСПАРЕНИЕ УГЛЕРОДА
Было проведено весьма обширное изучение испарения гра-
фита с целью определения основного параметра, позволяю-
щего установить абсолютные энергии разрыва связи, исходя
из теплот образования органических молекул [341]. Работы,
проводившиеся в разных направлениях, указывают, что теп-
лота испарения атомов углерода в их основном состоянии
составляет
ДЯИсП = 170,4 ккал/г-атомС.
Однако другие исследователи приводят для этой величины
весьма противоречивые значения [126, 174, 432, 606]. Непо-
средственное калориметрическое определение, по-видимому,
не выполнимо. Можно установить эту величину косвенно,
комбинируя спектроскопическое определение теплоты диссо-
циации с определением термохимической теплоты горения
[578] и используя уравнения
СОГаз * Сгаз —Н Огаз Д/7р
СТв + -у- О2 (газ) •—► СОгаз — АЯ2,
~2~ О2 (газ) * Огаз ^7/3,
Ств * ► Сгаз Д//4.
Величины ДН2 и ДНг известны точно. Если будет получено
надежное значение Д/Л, то это обеспечит получение надеж-
ного значения ДЯ4.
Однако анализ спектров поглощения СО показывает, что
нелегко выбрать из трех наиболее вероятных значений энер-
гию диссоциации ДН^ этой молекулы. Эти три значения дают
при суммировании следующие наиболее вероятные значения
теплоты сублимации углерода ДН$: 170,4; 141,1 и
124,7 ккал)моль [328]. Прямое определение теплоты субли-
Тепловые свойства графита
71
мации углерода можно произвести, подставляя значение дав-
ления паров р в уравнение
d In р ДЯ4
Нанося на график 1пр в зависимости от 1/Т, получим величи-
ну ДЯ4. Однако такие измерения трудно выполнить экспери-
ментально, так как диапазон температур, необходимых для
получения измеримых давлений пара, лежит выше 2400° С.
По данным Келли [528], давления в области температур по-
рядка 2200—3000° С составляют от 10~5 до 10-1 мм рт. ст.
соответственно.
Метод, основанный на достижении равновесия, предусмат-
ривает во избежание некоторых теоретических и практиче-
ских трудностей нагрев образца в замкнутом сосуде; таким
образом может установиться равновесие между твердой и
парообразной фазами. В замкнутом сосуде делается неболь-
шое отверстие; учитывая площадь отверстия а и скорость
истечения G (г/сек) из сосуда в вакуум, получаем давление
пара р из уравнения
G 1 /
р=-у 7Г’
где pi — плотность при температуре Т и давлении 1 дин[см2.
Более простой метод состоит в измерении скорости испа-
рения твердого углерода в газообразный при разных темпе-
ратурах в условиях, когда ни один атом не возвращается
на поверхность твердого углерода. Как хорошо известно, ско-
рость испарения с 1 см2 поверхности связана с давлением
пара следующей зависимостью:
Число молекул, покидающих поверхность a Np
см2-сек ~ *
Здесь р — равновесное давление пара; М — молекулярный
вес. Основная неточность этого метода заключается в неопре-
деленности значения коэффициента аккомодации а. В пре-
дельном случае, когда каждый атом или молекула углерода
из газовой фазы, ударяясь о твердое тело, остается на его
поверхности, а=1. Опыты, проводимые с другими твердыми
телами, в особенности металлами при высоких температурах,
показали, что значение а часто колеблется в интервале
0,2—0,8. Величина а может быть даже еще меньше, если кри-
сталлическая структура сложная или если поверхность
72
Глава III
загрязнена. Для графита коэффициент аккомодации молекул,
ударяющихся о поверхность из паровой фазы, принято -счи-
тать достаточно высоким; если это предположение -справед-
ливо, то давление пара, измеряемое по истечению, может
быть надежно определено [242, 1032].
В принципе считается возможным, что в образующемся из
твердого графита паре содержатся различного рода молеку-
лы. Хотя, по общему мнению, преобладающая часть пара
состоит из атомов углерода в основном состоянии, некоторая
доля атомов может быть в электронновозбужденном состоя-
нии. С помощью масс-спектрометрического изучения паров
углерода было установлено наличие заметных концентраций
многоатомных молекул, таких, как С2, С3, и молекул с боль-
шим числом атомов, например конденсированных колец
[174, 176, 461, 1032].
Было высказано предположение, что теплоты испарения
последовательных атомов углерода А и В с краев гексаго-
нального кольца в макромолекулярной сетке углеродных
атомов
А_В
колеблются в отношении 2:1, однако здесь не учитывались
происходящие при этом электронные изменения. Разница в
затрате энергии при последовательном удалении атомов угле-
рода А и В с гексагона может оказать влияние на скорость
некоторых процессов, например окисления [578], поскольку
освобождение атома А происходит при разрыве двух связей,
а последующий отрыв атома В — при разрыве только одной
связи.
Несмотря на первоначальные разногласия, в данное время
разные экспериментальные работы, проводившиеся как по
методу измерения давления пара, так и по определению энер-
гии связи бомбардировкой электронами^ дают для теплоты
испарения графита значение Д//Исп = 170,4 ккал/г-моль • °C
[127, 174, 344, 377, 549, 708, 1032]. Весьма полезная обзорная
работа была выполнена Керном [529].
III. 4. 1. ТОЧКА КИПЕНИЯ УГЛЕРОДА
Точка кипения углерода при давлении 1 атм, определен-
ная из данных по давлению пара’ [341], отвечает температуре
4200° К. Это противоречит значениям для тройной точки, по-
лученным Бассе [52]. Во всяком случае, точка кипения опре-
Тепловые свойства графита
73
деляет максимальную температуру кратера, которую можно
достигнуть в электрической дуге с гладкими угольными элек-
тродами; при обычных условиях температура кратера не бу-
дет заметно превышать точку кипения или сублимации неза-
висимо от того, какая из этих температур ниже [170, 638]. Если
создать углеродную дугу при более высоком давлении газа,
можно получить некоторое повышение температуры кратера
[206].
III. 4. 2. ОСАЖДЕНИЕ УГЛЕРОДА ИЗ ПАРОВОЙ ФАЗЫ
Прямое осаждение углерода из пара может быть неже-
лательным для некоторых процессов, например в лампах с
углеродной нитью, где стенки лампы постепенно покрываются
пленкой углерода. Осаждение углерода используется для
приготовления образцов для электронной микроскопии [115].
Процессы, протекающие при осаждении углерода, по-ви-
димому, значительно усложняются, если исходным материа-
лом является углеводород. Они рассматривались в разд. 1.6.1.
III. 4. 3. ТЕПЛОТА СГОРАНИЯ
По данным работы [1083], теплота сгорания &НС идеаль-
ного графита для реакции
Ств “И О2 (р- 1 атм) * СО2 1 атм)
составляет 393 447 ±45 дж]моль.
Из данных Просена и Россини [832] следует,' что величина
\Нс для очищенного естественного графита может быть не-
сколько меньше, чем для искусственного графита. Этого и
следует ожидать, .если структура естественного графита при-
ближается к идеальной и имеет меньше дефектов с высокой
энергией. Однако авторы считают, что наблюдаемый разброс
данных лежит в пределах точности опытов (ср. Ш.8).
III. 5. ТЕПЛОПРОВОДНОСТЬ ГРАФИТА
Эта величина представляет большой практический инте-
рес в связи с использованием графита в качестве высокотем-
пературного материала. Она представляет также большой тео-
ретический интерес (см. разд. IV.8.7), поскольку графит обна-
руживает значительную электронную проводимость. Об изме-
рении теплопроводности монокристаллов сообщалось многими
авторами (ср. [962]). При температуре 298° К теплопровод-
74
Глава III
ность (в вт/сж*°С) по оси а превышает 4,0, а по оси с равна
около 0,8. Значение 4,0 можно сравнить с теплопроводностью
меди (3,88 в тех же единицах).
Интересно отметить, что отношение коэффициентов тепло-
проводности в двух взаимно перпендикулярных направлениях
для графита значительно ближе к единице, чем отношение
электропроводностей по тем же направлениям (см. ниже
[318, 362, 829]).
Много измерений было проведено на искусственном гра-
фите (ер. [823]). Теплопроводность поли-кристаллического
графита на связующем материале составляет от 0,5 до
0,2 вт/см-°С. При этом теплопроводность выше в направле-
нии, параллельном преобладающим направлениям плоско-
стей углеродных гексагональных сеток, и может быть сравни-
ма с величиной теплопроводности алюминия, тогда как в пер-
пендикулярном направлении эта характеристика сравнима с
теплопроводностью латуни. Однако в отличие от этих метал-
лов в трафите тепло передается в основном благодаря коле-
баниям решетки (ср. [67]). Так же как и в монокристаллах,
упорядоченный в двух направлениях графит может обладать
высокой теплопроводностью в направлении, параллельном
основным плоскостям, содержащим сетки углеродных гекса-
гонов. Соответствующие значения оказались выше, чем »для
меди [139]. В этом отношении для графита подтверждается
общее соотношение между высокой характеристической тем-
пературой Дебая и высокой проводимостью неметаллов [67].
В противоположность этому прокаленный углерод, у которо-
го размеры кристаллитов не отличаются по величине более чем
в 100 раз от размеров образцов, обнаруживает более чем в
1000 раз меньшие теплопроводности. Как будет показано ни-
же, это приписывается замедленному перемещению теплового
фронта от одной молекулы, состоящей из углеродных гекса-
гональных сеток, к соседней ввиду слабой валентной связи
между ними [710, 717].
Имеются данные по теплопроводности графитов с разной
степенью дефектности решетки; такие данные существуют как
для температур ниже комнатных (почти до 0° К) [67], так и
для очень высоких температур [823]. В тех случаях, когда
удается установить связь между измерениями теплопровод-
ности и теплоемкости, в особенности при низких температу-
рах, это проливает дополнительный свет на дефекты струк-
туры.
На фиг. 17 показана зависимость теплопроводности от
температуры для естественного графита при низких темпе-
ратурах [963]. Согласно данным [469] (ср. [471]), теплообмен
Тепловые свойства графита
75
при низких температурах в основном определяется колеба-
ниями в плоскости, что приводит к квадратичной зависимости
удельной теплоемкости от температуры. Когда теплопровод-
ность в неметаллических кристаллах лимитируется рассеи-
ванием решеточных волн на границах кристаллитов (в слу-
чае графита в интервале около 15—50° К), теплопроводность
Фиг. 17. Теплопроводность канадского естественного
графита [962].
должна зависеть от температуры так же, как теплоемкость.
Однако искусственный графит не следует этому правилу, что
приписывается наличию связующего, вводимого в углерод до
графитизации. В этом случае теплопроводность зависит от
температуры в степени 2,2—2,8, а теплоемкость — в значи-
тельно меньшей степени. Если неупорядоченные области
имеют слабо выраженную кристаллическую алмазоподобную
структуру и поведение их можно описать дебаевской моделью
изотропного твердого тела, то полная теплопроводность может
совпадать с наблюдаемыми значениями. Подтверждением этой
гипотезы является изменение теплопроводности с температу-
рой пропорционально Т2, установленное для зерен
76
Глава III
чистого естественного графита при низких температурах
[962, 964].
Начиная с низких температур, теплопроводность растет с
температурой, пока не достигнет максимального значения.
Этот максимум на кривой является характерной особенностью
всех неметаллических кристаллов (ср. [67, 823]). Температу-
ра максимума зависит от размера кристаллитов и степени
совершенства кристаллов. Для искусственного графита мак-
симальная теплопроводность наблюдается при температуре
10 ’
со
о
j •'—
V I
® -1 I "——
I 10 - / '"х
I 1
i»" У
Л , /
10 ----1----1—---1---------1---1----1--
О ' ЮОО 2000 3000
Температура, ° К
Фиг. 18. Схематическое изображение зависимости
теплопроводности поликристаллического графита от
температуры.
около 200° С и равна примерно 0,8 вт/см*°С, а при очень вы-
соких температурах теплопроводность резко падает [275, 470]
(фиг. 18). Наличие максимума обусловлено появлением но-
вого фактора, уменьшающего теплопроводность, роль кото-
рого возрастает с повышением температуры. Таким фактором
является взаимодействие решеточных волн друг’ с другом
(фонон-фононное рассеивание).
Для углеродов с небольшими кристаллитами и с высо-
ким содержанием неупорядоченного материала рассеивание
на границах, по-видимому, является определяющим вплоть до
температуры 1500° С, выше которой происходит рост кристал-
лов и графитизация (ср. [503]).
Поскольку многие процессы получения графита со связу-
ющим ведут к предпочтительной ориентировке кристаллов,
теплопроводность такого графита редко изотропна. Это может
Тепловые свойства графита 77
иметь важные последствия для механической прочности де-
талей, изготовленных из графита, в случае наличия в них
температурных градиентов.
III. 5. 1. СВЯЗЬ МЕЖДУ ТЕПЛО- И ЭЛЕКТРОПРОВОДНОСТЬЮ
УГЛЕРОДОВ И ГРАФИТОВ
В противоположность почти идеальным графитам в угле-
родах с сильно нарушенной структурой, большая часть тепло-
проводности при высокой температуре может быть обуслов-
лена электронами. Поэтому теплопроводность таких углеродов
может увеличиваться с температурой в отличие от. тепло-
проводности графита, близкого к идеальному (см. фиг. 18), у
которого вплоть до весьма высоких температур преобладает
проводимость, обусловленная решеточными волнами [823].
Мизушима [696] находит заметное изменение теплопроводно-
сти углеродов при температуре Hf около 1200—1400° С, хотя
соответствующего изменения электропроводности не наблю-
дается.
Боумен, Крумхансл и Мирс [114] приводят данные по
влиянию добавок бора в количестве до 0,1%. В то время как
электропроводность возросла на 20% за счет увеличения чис-
ла носителей тока (ср. гл. VII), теплопроводность не измени-
лась. Это снова указывает на то, что рассеивание, опре-
деляющее тепловое сопротивление, можно считать не за-
висящим от концентрации электронов. Подтверждением этого
является сравнение электро- и теплопроводности углеродов и
графитов. При комнатной температуре теплопроводность уг-
леродов составляет около 0,01 теплопроводности графита,
тогда как величина электропроводности углеродов может из-
меняться в пределах 0,1—0,05 от электропроводности графита
[823].
Для разных образцов поликристаллических графитов вы-
сокая теплопроводность сочетается с низким удельным элек-
тросопротивлением. Произведение сопротивления (ож-слт) на
теплопроводность (кал/см- сек *°С) равно $k [206, 820, 821];
qk 0,000307. Для разных графитов среднее значение Qk при
комнатной температуре равное 0,00031,' хотя величина q мо-
жет изменяться в 2 раза. Такое постоянство произведения не
означает, что здесь справедлив закон Видемана—Франца, по-
скольку теплопроводность графита не определяется движе-
нием электронов [466, 469, 962, 964, 1045]. Тем не менее это
эмпирическое соотношение позволяет определять теплопро-
водность по электропроводности, измерить которую гораздо
легче.
78
Глава III
III. 5. 2. ВЛИЯНИЕ НЕЙТРОННОГО ОБЛУЧЕНИЯ
Как и в случае электропроводности, в результате нейтрон*
него облучения, вызывающего, образование дефектов в кри-
сталлах, происходит уменьшение теплопроводности как при-
родного, так и поликристаллического искусственного графита
[152, 964].
III. 6. ПРЕВРАЩЕНИЕ АЛМАЗА В ГРАФИТ
III. 6. 1. КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА АЛМАЗА
Второй аллотропической модификацией углерода с устано-
вившейся кристаллической решеткой является алмаз. До не-
давнего времени алмаз можно было получить только из при-
родных источников. В настоящее время достижения* в обла-
сти высокого давления при высоких температурах позволяют
осуществить контролируемый синтез алмаза [148, 382,
998].
Однако пока что не вполне ясно, сможет ли полученный таким
способом алмаз экономически конкурировать с природным.
Интерес к полупроводниковым свойствам алмазов [207, 709,
1106] может способствовать развитию производства алмазов
с заданными свойствами. Как и в случае искусственного гра-
фита, эти источники искусственных и природных алмазов,,
вероятно, будут дополнять друг друга. Усовершенствование
технологии, возможно, позволит получить монокристаллы
графита, которые подтвердят очень большое различие в ве-
личине физических свойств, измеренных параллельно и пер-
пендикулярно углеродным слоям; до сих пор измерения про-
водились на наилучших из имеющихся природных кристал-
лах [184].
Несмотря на относительную редкость, природные алмазы
в кристаллографическом отношении обычно более совершен-
ны, чем природный графит. Это не так уж неожиданно ввиду
кубической симметрии алмаза и мягкости графита. Общие’
особенности структуры кристалла алмаза хорошо установле-
ны. В твердом состоянии атомы углерода расположены сим-
метрично и имеют четыре связи с ближайшими соседями,,
расположенными по углам тетраэдра. Пространственная
группа алмаза представляет собой Fd3m [116, 266]; точное
определение длины С—С-связи дает значение 1,5445 А [243,
609]. С точки зрения валентности углерод в алмазе пред-
ставляет дегидрогенизированный предел алифатического ря-
да, так же как графит представляет собой дегидрогенизиро-
ванный предел ароматического ряда. Плотность алмаза при:
Тепловые свойства графита 79
комнатной температуре для совершенного кристалла состав-
ляет 3,5154 г/см3 [53], а для графита она равна 2,626 г/см3.
Алмаз является, таким образом, гораздо более плотноупако-
ванной структурой, чем графит. Существуют обзорные статьи
Чемпиона [168, 169] по алмазам (см. также симпозиум о
структуре и свойствах алмаза [1009]).
Ввиду отсутствия остаточных валентностей в алифатиче-
ской структуре углерод в алмазе в химическом отношении
гораздо более насыщен, чем в графите. В некотором отноше-
нии лучшие алмазы представляют собой наиболее совершен-
ную кристаллическую решетку, -созданную природой. Изуче-
ние ультрафиолетового и инфракрасного поглощения алма-
зом [868] и рентгеновские измерения на разных кристаллах, в
особенности методом расходящегося пучка [608, 609], показа-
ли, что природные алмазы делятся на два общих типа.
Алмаз I. Этот тип, по-видимому, более однороден и дает
исключительно резкое рентгеновское изображение, характер-
ное для почти совершенных кристаллов.
Алмаз II. Структура алмазов типа II более мозаична;
некоторые кристаллы отражают рентгеновские лучи в широ-
ком диапазоне углов. Исследование процесса, раскалывания
кристаллов указывает на большую долю примесей [1129].
Полупроводниковые свойства изучали главным образом у
алмазов типа II [136, 137].
Разделение на два самостоятельных типа, по-видимому,
является не столь резким, как это предполагалось первона-
чально [224, 435, 1005]. В связи с различными включениями
в алмазах [366] и несовершенных черных алмазах [285] воз-
никают интересные структурные проблемы. Воздействие ядер-
ных излучений приводит к изменению цвета и люминесценции
[251, 1154] и может вызвать местное превращение в графит.
Было проведено теоретическое изучение несовершенств ре-
шетки [544], и полоса поглощения при 2,0 эв объяснялась
наличием вакансий в решетке [189].
III. 7. ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА АЛМАЗА
Теплоемкость алмаза ниже 300° К была измерена многими
учеными [227, 228, 809]. Для температур выше 300° К имеются
данные Магнуса и Ходлера [648]. Данные, полученные Де
Сорбо и Деснойерсом и Моррисоном, совпадают вплоть до
75° К и дают близкие значения термодинамических функций.
Например, для 100° К эти авторы приводят следующие зна-
чения:
80
Глава III
Де Сорбо (1953 г.) ........
Деснойерс и Моррисон (1958 г.)
S0 , кал1г-апголг°С Ну—Н®
0,0192 1,3095
0,0172 1,3211
Однако расчетные значения © сильно отличаются друг от
друга. В табл. 10 приведены данные Деснойерса и Моррисо-
на. Предельное значение © = 2219±20°К совпадает с величи-
ной © = 2240±5°К, полученной расчетным путем по упругим
свойствам [640].
При низких температурах дебаевское приближение соот-
ветствует опытным данным при значениях 0, приводимых
в табл. 10.
Таблица 10
Наблюдаемые значения 0 для алмаза
Температура, °К ©, °к
70,2 1930
81,6 1900
96,17 1920
153,7 1845
276,6 1855
Не известно, имеется ли заметная разница в температуре
0 для двух типов алмаза, но, поскольку основное различие
заключается в микроскопической структуре, не следует ожи-
дать больших расхождений. Значительно большая величина©
Таблица 11
Коэффициент теплового расширения алмаза
Диапазон температур, °К Коэффициент объемного рас- ширения а,10“6/°С
298—378 4,50
378—478 6,70
478—573 8,58
573—673 9,81
673—773 10,70
773—873 11,55
873—923 12,30
Тепловые свойства графита 81
1850°) для алмазов по сравнению с величиной 0х для
графита (ср. III.1) обусловлено более прочными связями по
всем направлениям в. кристалле алмаза.
Тепловое расширение алмаза изотропно и соответствует
его кристаллической симметрии. В табл. 11 приведены зна-
чения коэффициента теплового расширения алмаза для раз-
ных температур [571].
III. 8. ПРЕВРАЩЕНИЕ ГРАФИТА
Согласно имеющимся данным, плавление алмаза при ат-
мосферном давлении не было осуществлено. Не известны
также случаи непосредственного испарения алмаза при вы-
соких температурах или осаждение углерода со структурой
алмазной решетки, а также алмазных слоев или алмазных
ячеек, хотя в принципе это следует считать возможным.
Напротив, при атмосферном давлении и температурах выше
1000° С алмаз начинает самопроизвольно превращаться в гра-
фит, причем, при температуре порядка 1750°С этот процесс
протекает очень быстро [794, 1031]. Полученный графит был
подвергнут тщательному изучению с помощью рентгеновских
лучей [360]. При нагревании до 2000° алмаз полностью пре-
вращается в графит, но при нагреве до температуры порядка
1600° образуется, по-видимому,’ промежуточная структура уг-
лерода [931]. Это может быть кристаллический «гибрид» из
кубической (алмаз) и гексагональной (графит) структур
(ср. [1056—1061] для других примеров гибридов кристаллов).
Облучение алмаза нейтронами вызывает нарушение в рас-
пределении углеродных атомов в алмазной решетке вследст-
вие их смещения. Если такие неупорядоченные кристаллы
прокалить, то атомы в местах дефектов рекристаллизируются
в графитовую структуру. Это указывает на то, что даже в
таких маленьких объемах графит представляет собой более
устойчивую структуру углерода при обычных давлениях и
температурах [175].
Об относительной стабильности форм углерода можно су-
дить также по результатам исследований алмаза при шли-
фовке. Как было описано раньше (11.4.3), при шлифовании
алмаза алмазом образуется черная графитовая пленка. Это
объясняется, по-видимому, тем, что в результате нагрева по-
верхности достигается температура, достаточная для превра-
щения алмаза в графит с заметной скоростью [108].
Когда шлифовка происходит при обычных температурах,
рентгеновские исследования указывают на то, что получен-
6 А. Р. Уббелоде
82
Глава Ill
ный углерод является аморфным [109, ПО]. По-видимому, для
графитизации было слишком мало времени.
Термодинамически превращение можно оценить по дан-
ным о теплотах сгорания алмаза и графита (ср. разд. Ш.4.3 ).
По результатам Джесапа [506], которые немного изменены
Прозеном и Россини [832], теплоты сгорания ДЯ с при
298,16° К составляют:
Сграфит 4“ О2 —* СО2—94 051 ± Ю,8 кал\
Салмаз + °2 —► СО2—94 505 ±22,9 кал\
что дает
^графит * СаЛмаз4~453,2 ± 20,3 К(1Л/2-С11Т1ОЛ1.
Те же самые опыты показали, что в пределах точности
эксперимента не было разницы в теплоте сгорания естествен-
ного и искусственного графитов, полученных разными мето-
дами. Действительно, графит всех типов можно было рас-
сматривать как термодинамически стандартный материал.
Энтропию твердого углерода в двух кристаллических фор-
мах можно определить по теплоемкости при разных темпе-
ратурах.
Таблица 12
Энтропия алмаза и графита
Температура, °К ° графит со алмаз AS0, кал,/г-атом-°С
0 0 0 0
100 0,2184 0,0221 0,1963
200 0,7238 0,1915 0,5323
300 1,3737 0,5918 0,7819
400 2,081 1,14 0,941
600 3,474 2,39 1,084
800 4,127 3,01 1 ,117
1000 5,846 4,70 1,146
1200 6,807 5,63 1,177
Данные табл. 12 получены расчетным путем в 1945 г.
[1083] по теплоемкостям при температурах выше 25° К. Дру-
гие измерения в том же диапазоне температур и ниже 25° К
полностью подтверждают эти значения и результаты экстра-
поляции до температур ниже 25° К. Согласно данным Дес-
нойерса и Моррисона [227], значения для алмаза, вероятно,
требуют проверки.
Тепловые свойства графита 83
Если тепловая теорема Нернста применима к твердому
углероду, что, по-видимому, весьма вероятно, исходя из кри-
сталлической структуры его двух форм и последних измере-
ний теплоемкости до очень низких температур ([59, 527], а
также см. разд. III.1), то изменение энтропии с температурой
можно получить непосредственно по разности величин в ко-
лонках 2 и 3 табл. 12. Эти результаты показывают, что раз-
ность свободных энергий AG° алмаза и графита (AG° =
= АН°—TAS0) мала по абсолютному значению и что темпера-
турный коэффициент ее низок. Это указывает на то, что изме-
нение давления может играть существенную роль при опре-
делении наиболее устойчивой формы кристалла при любой
температуре благодаря выражению Р СУграфит—V алмаз), по-
скольку
\ дР
Начиная с опытов Муассана, предпринимались попытки
превратить графит в алмаз путем кристаллизации при высо-
ких давлениях и температурах. Муассан охлаждал раствор уг-
лерода в железе, для того чтобы углерод выпадал из раствора
и одновременно подвергался действию высокого давления
вследствие сжатия металла [699]. Затем он растворял железо
охлажденной болванки кислотами. Он утверждал, что полу-
чал маленькие твердые кусочки алмаза. Это утверждение вре-
мя от времени подвергалось критической проверке, но ни разу
оно не было безоговорочно подтверждено [224, 683]. Утвержде-
ния Хеннея в этом отношении также вызвали безрезультат-
ные споры [278, 391, 682]. Для углерода можно было испро-
бовать также и другие растворители [683].
В связи с отсутствием опытных данных было сделано пред-
положение, что величины сжимаемости алмаза и графита
Г fdv\ ]
I (1/V) ( дР L постоянны и не зависят от температуры и
давления. Используя наиболее надежные из имеющихся зна-
чений коэффициентов теплового расширения и плотности гра-
фита и алмаза; Россини и сотр. [872—874] построили графики
предполагаемого изменения AG с температурой. По этим
расчетам при давлениях выше-- 20 000 атм и температурах
ниже 1000° С устойчивой формой углерода должен быть
алмаз. На фиг. 19 изображена схематическая диаграмма со-
стояний углерода [148].
При еще более высоких давлениях область температур, в
которой алмаз является термодинамически устойчивой фор-
мой углерода, должна еще больше расшириться.
6*
84
Глава HI
Пересчет имеющихся термодинамических данных привел
к уравнению [65, 66] для определения равновесного давления
при температурах выше 1200° К:
Р(в атм) = 7000+27Т[Т (в °К) > 1200°К].
Следует подчеркнуть влияние скорости реакции на пере-
ход. При обычных температурах и давлениях алмаз в термо-
динамическом отношении неустойчив. Однако скорость изме-
Ф и г. 19. Схематическое изображение диаграммы состоя-
ния углерода.
нения кристаллической формы в графитовую становится за-
метной только при температурах выше 1000° С. Можно пред-
положить, что подобные же кинетические факторы действуют
и при обратном превращении, а именно графит —► алмаз.
По-видимому, полезно рассмотреть использование катализа-
торов.
В 1947 г. Бриджмен создал прибор, позволяющий сжимать
графит до давления порядка 40 00'0 атм при температурах до
'2000° С. Однако такие экспериментальные условия можно
было поддерживать лишь в течение нескольких секунд; в этих
Тепловые свойства графита 85
опытах алмазов получить не удалось. Возможно, что скорость
реакции можно увеличить даже при низких температурах,
если с помощью потока нейтронов -создать в теле высокую
концентрацию подвижных атомов углерода. Первоначально
такие опыты были неудачными [66]. С тех пор удалось путем
преодоления невероятных технологических трудностей под-
держивать в течение продолжительного времени высокие дав-
ления и температуры. В результате рентгенографического
анализа полученных алмазов было установлено наличие в
них некоторого количества никеля [361]. По литературным
сведениям эта работа достигла в настоящее время полупро-
мышленного уровня.
III. 9. КРИСТАЛЛЫ, ПОДОБНЫЕ ГРАФИТУ
III. 9. 1. ПОЛИМОРФНЫЕ ФОРМЫ КРЕМНИЯ И КАРБИДА КРЕМНИЯ
Подобно алмазу, обычные формы твердого кремния, гер-
мания и серого олова имеют структуру цинковой обманки
[991], характерную для полупроводниковых соединений с тет-
раэдральными 5/?3-связями [703, 704], но при температуре
выше 900°С появляется некубическая форма кремния [424].
С момента установления кристаллической структуры кар-
бида кремния SiC было проведено большое количество иссле-
дований. Было обнаружено много фазовых модификаций
[619, 841, 842, 1171], но во всех случаях структура оказалась
типа обычной цинковой обманки с одним атомом Si, окру-
женным тетраэдрически четырьмя атомами углерода, и наобо-
рот. В связи с различными внешними формами крйсталлов
были предложены различные механизмы их роста [1077]. Кар-
бид кремния используется в качестве сопротивления; по сво-
ему высокому удельному сопротивлению, равному примерно
1010 ом, он напоминает алмаз [697]. В этом отношении SiC
занимает промежуточное место между алмазом и кремнием
и отличается от карбидов, например карбида Zr и карбида Ti,
которые являются хорошими проводниками. В связи с отсут-
ствием сведений о существовании гидридов кремния (силанов),
аналогичных бензолу СбНб, а также поскольку разло-
жение силанов происходит с образованием кремния со струк-
турой цинковой обманки, элементы IV группы (кроме угле-
рода) , по-видимому, не способны образовывать кристаллы
со слоистой структурой, подобные графиту; аналогичные би-
нарные структуры также не образуются из атомов элементов
этой группы.
86
Глава III
III. 9. 2. НИТРИД БОРА
В отличие от элементов IV группы кристаллическая
решетка нитрида бора почти идентична графитовой и к
тому же она изоэлектронна с ним, обнаруживая такое же
сходство с графитом, как окись углерода с азотом или закись
азота с углекислотой. Расстояние, отделяющее плоскости
(3,30А), и расстояние между атомами В—N (1,45А) прак-
тически такие же, как у графита.
Кристаллическая структура [122, 398] нитрида бора отли-
чается от структуры графита abab тем, что кольца чередую-
щихся атомов бора и азота расположены точно друг над
другом [780, 781], причем в соседних слоях над атомом бора
находится атом азота. Каждый атом азота расположен, та-
ким образом, между двумя атомами бора, и наоборот.
В отличие от графита у нитрида бора очень высокое элек-
трическое сопротивление, которое возрастает с увеличением
чистоты [817]. Это мягкое вещество (твердость 1—2); оно хо-
рошо раскалывается по плоскостям, параллельным плоско-
стям кристаллических решеток [346]. Хотя нитрид бора иног-
да добавляется в смеси, его смазывающие свойства, по-ви-
димому, уступают свойствам графита [775]. Значение тепло-
емкости, соответствующее закону Дюлонга и Пти, не дости-
гается даже при 900° С [649]. Попытки выяснить тип связи в
нитриде бора предпринимались многими исследователями
[123, 131, 780, 781]. Ввиду слоистой структуры нитрида бора
интересно отметить, что он так же, как и графит, образует
слоистые соединения [199, 200]. Добавки, которые удавалось
ввести £0 настоящего времени, представляют собой молеку-
лярные образования; молекулы, внедряющиеся между сет-
ками нитрида бора, отличаются от молекул, внедряющихся
в графит (гл. V).
Аналогия между нитридом бора и углеродом усиливается
в связи с существованием «боразона», представляющего со-
бой нитрид бора со структурой цинковой обманки. Боразон
образуется при высоком давлении и высокой температуре, с
успехом используемых при изготовлении искусственных алма-
зов [1115]. У этой формы нитрида бора очень перспективные
технические свойства; в нем сочетается твердость алмаза со
значительно более высокой рабочей температурой и с боль-
шей сопротивляемостью к окислению.
Еще одним соединением типа Аш—Bv,y которого можно
ожидать слоистую структуру, является фосфид бора; соглас-
но имеющимся сведениям, это соединение имеет структуру
цинковой обманки [819].
ГЛАВА IV
ЭЛЕКТРОННЫЕ СВОЙСТВА И СТРУКТУРА
СВЯЗЕЙ ГРАФИТА
Кристаллические структуры графита и некоторые из ос-
новных типов дефектов этих структур уже обсуждались с точ-
ки зрения их топологии в гл. I (1.4 и 1.4.1). В гл. IV приведен
обзор электронных свойств графита и структур связей. В нем
последовательно рассматриваются магнитная восприимчи-
вость и электропроводность, а также термоэлектродвижущая
сила, эффект Холла и оптические свойства.
IV. 1. ВЛИЯНИЕ ГРАНИЦ МЕЖДУ КРИСТАЛЛИТАМИ
В случае графита некоторые магнитные свойства углеро-
да поддаются более отчетливой интерпретации, чем такие
электрические свойства, как удельное сопротивление и его
температурный коэффициент. Это обстоятельство объясняется
тем, что такая величина, как магнитная восприимчивость по-
ликристаллического тела, является лишь суммой восприимчи-
востей всех электронных орбит, которые содержатся в его
структуре. Разница между многоядерными ароматическими
углеводородами, обособленными друг от друга в кристалле
(подобно многоядерным сеткам, связанным вместе в углеро-
дах) силами отталкивания, и более крупными плоскими
многоядерными сетками в почти идеальном графите заклю-
чается только в том, что различным членам при суммиро-
вании магнитных свойств приписывается неодинаковая отно-
сительная роль и вместе с тем не требуется добавления
многочисленных членов, учитывающих влияние границ.
Однако магнитные характеристики являются более труд-
ным объектом’ для измерений, и в настоящее время они
имеют гораздо меньшее значение для техники, чем электро-
сопротивление, для которого влияние границ может оказаться
преобладающим. Поэтому по удельному сопротивлению почти
88
Глава IV
идеальных графитов и углеродов опубликовано подавляющее
количество данных.
Электропроводность почти идеальных графитов уже рас-
сматривалась весьма успешно с точки зрения представлении,
развитых для зонной теории кристаллов. В случае чрезвы-
чайно несовершенных графитов, которые находятся в середи-
не ряда ароматических макромолекул и рассматриваются
обычно как углероды, применение зонной теории может быть
только качественным, так как слияние дискретных электрон-
ных уровней в почти непрерывную зону в сильной степени
нарушается на основных дефектах и границах кристаллитов.
Наконец, для многоядерных ароматических углеводородов
небольших размеров, обособленных друг от друга в кристалле
силами отталкивания, электропроводность связана с очень
ощутимой активацией, электронов в зону проводимости. При
теоретических описаниях их поведения в качестве полупро-
водников снова используются хорошо известные приемы. Не-
обходимо подчеркнуть, однако, что переплетение различных
механизмов проводимости, которое можно встретить в весьма
несовершенных графитах (углеродах), приводит к теоретиче-
ским осложнениям, в настоящее
время в значительной степени
неразрешимым.
Фиг. 20. Расстояние между
атомами С—С (в А) в зависи-
мости от порядка полной связи.
IV. 2. ВАЛЕНТНЫЕ СВЯЗИ
В МОЛЕКУЛАХ
АРОМАТИЧЕСКОГО РЯДА
И В ГРАФИТЕ
В многоядерных * ароматиче-
ских молекулах линейные разме-
ры связи углерод — углерод ме-
няются в соответствии с распо-
ложением связи относительно
краевых атомов в молекуле. Тео-
рия показывает, что эти рассто-
яния лежат между значением
1,541 А для чистой одиночной С—
С-связи и значением 1,325 А для
чистой двойной С = C-СВЯЗИ. МО-
ЖНО! определить также порядок
связи [784], который является плавной функцией длины связи,
как это показано на фиг. 20. Некоторые расчетные зна-
чения порядка связи приведены на фиг. 21 [834]. Если
Электронные свойства и структура связей графита
число конденсированных ядер в молекуле велико, то рас-
чет, выполненный с помощью резонансной теории, оказы-
вается менее удовлетворительным по> сравнению с молеку-
лярным орбитальным методом, который дает для линейных
размеров С—С-связи хорошее совпадение с экспериментом.
Фиг. 21. Вычисленные значения порядка подвижной связи [834],
а — овален; б — циклический антрацен.
Этот результат не является неожиданным, так как метод мо-
лекулярных орбит позволяет вычислить длину связи для
электронов, которые принадлежат всем атомам молекулы, а
вместе с тем известно, что для ароматических молекул дело-
кализация играет особенно важную роль (ср. также [188]).
IV. 2. 1. ЭНЕРГИЯ СВЯЗИ МЕЖДУ СЛОЯМИ
В плоскости ароматической молекулы, которая практиче-
ски во всех случаях удерживается неподвижно в горизонталь-
ном положении с помощью ароматического резонанса, мини-
мальное расстояние между центрами краевых атомов углеро-
да, не связанных друг с другом, составляет приблизительно
3,4—3,6 А. Это расстояние обычно определяется СН-связями
и представляет собой для этих СН-групп так называемую
оболочку отталкивания Ван-дер-Ваальса.
Известны отдельные случаи, когда, несмотря на более
сильное резонансное перекрытие для плоской конфигурации,
отталкивание между ближайшими С—Ц'-группами для мно-
гоядерной ароматической молекулы приводит к равновесной
конфигурации за пределами плоскости. Так, например, во
многих полифениловых молекулах, таких, как /7-трифенил,
объединенных с помощью С—С-связей, кольца не являются
компланарными и образуют между собой углы в 30—90°
(соответствующую литературу см. в [22, 646]).
90
Глава IV
Как уже отмечалось, аналогичные «складки» в графите
должны сопутствовать в принципе некоторым типам дефектов
решетки, таких, как, например, дырочные и клещевидные де-
фекты [593, 957, 1058, 1060] (ср. 1.4.4 и 1.4.1).
Это обстоятельство могло бы иметь важные последствия
как для реакционной способности разупорядоченных атомов
углерода вблизи области образования складок, так и для
электронных свойств кристалла. Вообще говоря, смещение
атомов углерода из плоской гексагональной сетки вызывает
ослабление ароматического резонанса и снижение насыщен-
ности связанных атомов углерода. При отсутствии усложняю-
щих явлений это должно привести к улучшению их электрон-
но-акцепторных свойств. Кроме того, возможно, что простран-
ственные требования, связанные с такими дефектами, будут
препятствовать спариванию спинов 'всех валентных электронов
вследствие присоединения к этим дефектам инородных атомов
или вследствие образования связей С—-С. Такие узлы в ды-
рочных и клещевидных дефектах, соответствующие «вмерз-
шим» свободным радикалам, будут влиять (подобно другим
дефектам сетки) на электронные свойства кристалла, такие,
как сопротивление и термо-э.д.с., и видоизменять в результа-
те своего парамагнетизма магнитные свойства кристалла.
Дефекты решетки других типов, обсуждавшиеся в гл. I,
точно так же могут воздействовать на электронные свойства
в большей или меньшей степени. В этой главе они рассматри-
ваются в тех случаях, когда имеются соответствующие дан-
ные, хотя систематических исследований этого вопроса для
почти идеального графита не существует.
Силы, действующие между слоями углеродных гексаго-
нальных сеток, были рассмотрены ранее. Обычно их считают
силами типа Ван-дер-Ваальса, однако если сетки становятся
достаточно крупными, то нельзя забывать о возможном
вкладе таких сил, которые обусловлены связями, возникаю-
щими вследствие переноса зарядов [721, 722], или поляриза-
ционными связями (ср. [355, 456, 957]). Различными путями
было показано, что многоядерные ароматические молекулы
и углеродные гексагональные сетки в графите обнаруживают
амфотерные свойства, поскольку они образуют кристалличе-
ские соединения, содержащие как электронные доноры (на-
пример, щелочные металлы), так и акцепторы (А1С13).
В случае отсутствия таких внедренных групп может сде-
латься ощутимой вероятность самополяризационных эффек-
тов, для которых донорные и акцепторные свойства сеток
чередуются. Интенсивное окрашивание некоторых соедине-
ний с более мелкими многоядерными ароматическими моле-
Электронные свойства и структура связей графита 91
кулами, обладающих способностью к переносу зарядов,
показывает, что в графите, если его рассматривать в каче-
стве предельного члена различных ароматических рядов, мо-
жет возникнуть сильное оптическое поглощение, обусловлен-
ное процессами, сходными с электронными.
Величина энергии связи между слоями до сих пор
остается предметом дискуссии. Полученные рядом авторов
оценочные значения лежат в интервале 10—20 ккал/г-атомС
[124, 899] (ср. II. 4.1 и II. 4.3). С другой стороны, из зависи-
мости между энергией и длиной связи [283] следует, что
значение энергии 7,9 ккал/г-атом С должно соответствовать
расстоянию 3,41 А (ср. II. 4).
IV. 3. МОЛЕКУЛЯРНЫЙ МАГНЕТИЗМ УГЛЕВОДОРОДОВ
АРОМАТИЧЕСКОГО РЯДА
В электронной модели графит должен рассматриваться
как предельный случай для различных рядов многоядерных
ароматических углеводородов, в которых число конденсиро-
ванных ядер в любой «молекуле» становится очень большим
и, кроме того, предполагается трехмерный порядок [1047].
За исключением некоторых совершенно аномальных слу-
чаев, в обычно встречающемся графите такие островки 'кон-
денсированных ядер не простираются неограниченно по все-
му массиву, а разрываются дефектами различных типов
(см. гл. I). Промежуток или скачок от одного «островка» к
другому в графите имеет некоторую произвольную протя-
женность. Кроме того, может нарушиться параллельное рас-
положение гексагональных сеток. Для такой модели диамаг-
нетизм кристаллического графита, как следует ожидать,
приводит к результатам, которые характерны для более низ-
ких ароматических углеводородов.
В этой связи необходимо подчеркнуть, что молекулярная
магнитная восприимчивость хм определяется как %лт = /CAf/р,
где . К — магнитная восприимчивость единицы объема, М —
молекулярный вес, а р — плотность [936]. Молекулярный
магнетизм ароматических углеводородов складывается при-
близительно аддитивно из элементарного магнетизма электрон-
ных орбит, связанных с атомами водорода и углерода [1075].
Паскаль эмпирически показал, что “ SAr + B, где ЕАг
характеризует аддитивный вклад индивидуальных атомов в
молекулах, а В есть некоторая «конститутивная» константа,
зависящая от молекулярной структуры. Для ароматических
молекул величина В содержит большой диамагнитный член,
92
Глава IV
который обычно растет с увеличением числа конденсирован-
ных ядер. Величина В зависит также от взаимного располо-
жения этих ядер, как это следует из табл. 13.
Таблица 13
Магнитная восприимчивость ароматических
углеводородов (в Ю”6 CGSM)
Число конденсиро- ванных ядер п 55,6-п
Бензол 1 55,6 55,6
Нафталин 2 91,9 111,2
Антрацен 3 129,4 166,8
Фенантрен 3 127,9 166,8
Пирен 4 , 147,9 222,4
Хризен 4 166,7 222,4
Перилен 5 166,8 278,0
Антантрен 6 204,2 333,6
Овален 10 353,8 556
Средняя молекулярная диамагнитная восприимчивость,
взятая по всем направлениям, с учетом добавочного члена,
обусловленного бензольным кольцом, не вполне подчиняется
формуле Паскаля. Как общее правило, наблюдаемый в мно-
гоядерных соединениях диамагнетизм оказывается ниже ве-
личины, предсказываемой на основе аддитивности, причем
это отклонение тем значительнее, чем больше число ядер
[271]. В связи с этим по возрастающей величине разности
(Паскаль) —Хднэкеп) ВСе СОвДИНеНИЯ МОЖНО рЭСПОЛОЖИТЬ В ТЭ-
кой последовательности: бензол 0,‘ нафталин 48, антра-
цен 106, нафтацен 142, тетрафенилнафтацен 140, дибензан-
трацен 289.
Результаты, приведенные в табл. 13, относятся к порош-
кообразным поликристаллическим образцам, которые можно
считать изотропными (см. литературу, приведенную в рабо-
тах [8, 11, 458]).
Магнитная восприимчивость ароматических углеводоро-
дов заметно анизотропна [643, 840, 952]. Диамагнитная вос-
приимчивость монокристаллов этих соединений, измеренная
в каком-нибудь направлении, не зависит от температуры.
Вдоль оси, перпендикулярной плоскости конденсированных
ядер, диамагнетизм очень велик, в то время как вдоль на-
правлений, параллельных, плоскости ядер, он мало отличает-
Электронные свойства и структура связей графита 93
ся от диамагнетизма для многих неароматических углеводо-
родов.
Приведенные ниже данные иллюстрируют эту анизотро-
пию. Для типичного кристалла графита магнитная воспри-
имчивость в единицах 10“6 CGSM составляет: = —22,0;
X п =—0,5[319], а их отношение равно44. Для меньших моле-
кул величина анизотропии, выраженная отношением
по сравнению с молекулой бензола характеризуется следую-
щими значениями: нафталин 2,11; антрацен 3,38; фенантра-
цен 3,07; пирен 4,31; дифенил 2,20 [134].
Количественные теории анизотропии были предложены
Полингом [776] и Лондоном [602]. В модели Полинга много-
ядерная молекула рассматривается как сверхпроводящая
электрическая цепочка. Лондон разработал квантовомеха-
нический подход, соответствующий блоховскому приближе-
нию для случая сильной связи в теории металлов. Обе тео-
рии находятся в удовлетворительном согласии с эксперимен-
том, что объясняется, по мнению Лондона, преобладающим
влиянием геометрических факторов. Как та, так и другая
теория не учитывает кулоновского взаимодействия электро-
нов, если только его нельзя описать с помощью поля Хартри.
Брукс [134], который модифицировал эти теории, включив
ионные члены, пришел к выводу, что для ароматических мо-
лекул приближение Хунда — Мулликена имеет преимущество
перед теорией ГайтлераЛондона. Это означает, что для
расчета анизотропии следует предполагать, что резонирую-
щая двойная связь носит не только ковалентный, но и ча-
стично ионный характер того же порядка величины.
Вычисления Полинга можно сравнить с эксперименталь-
ными данными Кришнана и его сотрудников. В* табл. 14 хн
представляет диамагнитную молекулярную восприимчивость
вдоль оси, параллельной плоскости молекулы, а —в на-
правлении, перпендикулярном к сеткам углеродных текса-
гонов.
Высокий диамагнетизм ароматических соединений и его
анизотропию можно понять в самом общем смысле с точки
зрения классической теории молекулярного' магнетизма Лан-
жевена. Согласно этой теории, диамагнетизм связан с замк-
нутыми электронными оболочками, представляющими собой
контуры электрического тока, которые прецессируют в маг-
нитном поле. Полная молекулярная восприимчивость полу-
чается при суммировании по всем орбитам замкнутых обо-
лочек
№ УНо
1м втс2 / '
94
Глава IV
Таблица 14
Диамагнитная молекулярная восприимчивость (в IO“6CGSM)
Молекула Эксперименталь- ные данные По Полингу
ZJ. Z и
Бензол С6Н6 37 91 39 88
Нафталин С10Н8 39 187 61 165-
Дурол С10Н14 77 141 79 128<
Гексаметил бензол С]2Н18 101 164 99 148
Флюорен С13Н10 73 194 80 178.
Антрацен СиН10 46 273 83 242:
Фенантрен СнН]0 74 240 83 242
Пирен С1бН10 81 303 92 329
Хризен С18Н12 88 306 105 319<
n-Трифенил С18Н14 98 260 109 256>
Гексаэтилбензол С18Н30 165 231 159 208.
1:2;5:6-Дибензантрацен С22Н14 ИО 358 127 395
n-Кватерфенил С34Н18 129 345 144 340
1:3:5-Трифенилбензол С24Н18 131 347 144 340
В этом выражении наиболее существенную роль играет
член, учитывающий проекции площадей электронных орбит
на плоскость, перпендикулярную направлению магнит-
ного поля. Исключительно высокий диамагнетизм аромати-
ческих молекул вытекает из того факта, что в этих молеку-
лах некоторые электроны (ароматические или л-электроны)
размазаны по всему ароматическому каркасу, обусловливая,
таким образом, гораздо большие значения г2, чем обычно
принятые значения г СД1—2 А. Вычисление диамагнитной
восприимчивости методами квантовой механики [1075]’
приводит к выражению типа формулы Ланжевена, с той
только разницей, что вследствие наличия возбужденных уров-
ней появляются дополнительные члены, которые могут сде-
латься существенными, если эти уровни лежат близко к ос-
новному энергетическому уровню молекулы
__ Ne2 Vb2 2 VI \т<> (п',п)\* .
г 3 2j » п)
___________
1) Более подробное описание состояний электронов в молекулах, в
частности л-состояния, см., например, в кн. Г. Эйринга, Дж. Уолтера,.
Дж. Кимбалла «Квантовая химия», М., Г948. — Прим, перев.
Электронные свойства и структура связей графита
95
В этом соотношении m°(n/,n) представляет собой недиаго-
нальный матричный элемент для углового момента системы,
а у(п'.п)—частота перехода п. Кроме диамагнетизма,
обусловленного замкнутыми электронными оболочками, за-
метный вклад в молекулярную магнитную восприимчивость
ароматических структур могут давать структуры «свободных
радикалов», если энергия их образования близка к энергии
основного состояния. Каждый нескомпенсированный спин
электрона вызывает увеличение парамагнитного члена
в соотношении Ван-Флека (ср. [1075])
__
— 3kT
+ Ж
В этом выражении первый член, который содержит квад-
рат низкочастотной части магнитного момента ц2, усред-
ненный по всем ориентациям, соответствует, как сказано
выше, ланжевеновской парамагнитной восприимчивости. Вто-
рой член представляет собой не зависящий от температуры
весь высокочастотный вклад в восприимчивость В отли-
чие от диамагнитных членов первый .парамагнитный член,
несомненно, зависит от температуры, так как статистическая
вероятность ориентации магнитных диполей в молекуле в
направлении поля зависит от тепловой энергии. Из этих
соображений при исследовании парамагнитных членов всегда
целесообразно измерять молекулярную магнитную восприим-
чивость при нескольких температурах. Из приведенного выше
соотношения Ван-Флека следует, что с падением температу-
ры парамагнитный член растет, очевидно, даже тогда, когда
концентрация нескомпенсированных спинов остается посто-
янной. Однако даже более мелкие ароматические молекулы
способны к заметной диссоциации на свободные радикалы с
нескомпенсированными спинами, причем эта диссоциация
зависит от температуры. Хорошо известным примером явля~«
ются производные триарилметила с общей формулой
Ari Аг4
Аг2—С —- С—Аг5
Аг3 Аг6
В этих соединениях энергия диссоциации С—С-связи может
лежать близко к значению kT, так что в соответствии с при-
родой' ароматических групп Ari,Ar2, . . . и т. д. происходит
более или менее далеко идущая диссоциация на свободные
96
Глава IV
радикалы:
Ari
Дг2—С-----
Аг3
Это подтверждают некоторые параметры диссоциации,
приведенные в табл. 15 (данные [825]).
Таблица 15
Параметры диссоциации некоторых арилэтанов
Указанную- диссоциацию на свободные радикалы можно
описать с помощью обычной константы равновесия. Из тем-
пературной зависимости этой константы можно найти значе-
ния теплоты диссоциации, такой, как ДЯ2о. Важно отметить,
что парамагнитный член восприимчивости, отнесенный к
1 моль любого свободного радикала, выражается соотноше-
нием
л'|4г!Ф+1)
3kT
где цв=^12тс — магнетон Бора; N — число неспаренных
электронов в 1 моль; g — фактор спектроскопического рас-
Электронные свойства и структура связей графита 97
щепления, равный 2 для электронных спинов; s —квантовое
число для полного спинового момента неспаренного электро-
на (s=r/2)- Для отдельного неспаренного электрона при 293°К
Xm=1270*10-6CGSjW. Для диссоциированной на свободные
радикалы доли х одного моля, растворенной в V литрах
растворителя, в случае равновесия можно написать
(Аг)2^±2Аг,
(1—х) 2х.
Согласно уравнению изохоры равновесия Вант-Гоффа,
диссоциация зависит от температуры. Константа равнове-
сия К равна
4х2 = ЛЯ
(1 — х) V И dT RT2 *
Так как и концентрация неспаренных спинов и парамаг-
нитный вклад, отнесенный к спину, меняются с температу-
рой, то температурная зависимость полной магнитной вос-
приимчивости может иметь сложный характер с наличием
максимума. Если свободные радикалы возникают внутри
отдельной молекулы, то для процесса образования диради-
кала под действием теплового возбуждения слабосвязанных
валентных электронов используется аналогичное описа-
ние [802].
IV. 4. МАГНИТНАЯ ВОСПРИИМЧИВОСТЬ ГРАФИТА
Как и в случае не очень больших ароматических молекул,
диамагнетизм графита достигает большой величины и обла-
дает высокой анизотропией. Диамагнитная восприимчивость
в некоторой мере зависит от степени совершенства иссле-
дуемых кристаллов. По данным Гангули и Кришнана [319],
для типичного монокристалла характерны следующие зна-
чения восприимчивости (в единицах 10~6 CGSM):
Zi=-22,0,
Хн =—0,5.
Необходимо отметить, что эти авторы используют для
Хл. и Хн обратные обозначения.
Диамагнитная восприимчивость, измеренная в направле-
нии, перпендикулярном сеткам углерода, сильно зависит от
температуры, в то время как для направлений, параллель-
ных основной плоскости сеток, ее значение практически не
зависит от температуры. Фиг. 22 дает представление о сте-
пени этого различия [568].
7 А. Р. Уббелоде
98
Глава IV
Магнитная восприимчивость пол икриста ллического гр а-
фита должна представлять собой результат геометрическо-
го суммирования по различным ориентациям. Эксперимен-
тальное значение восприимчивости для хаотически ориенти-
рованных кристаллитов, равное приблизительно— 7,0-10—6,
не противоречит такому заключению [804]. Несмотря на от-
сутствие серьезных различий, возникающих вследствие влия-
ния границ между кристаллитами, ошибка измерений при та-
ких экспериментах составляет примерно ±10% [61, 806].
Фиг. 22. Магнитная анизотропия кристаллов графита [568].
Чтобы объяснить огромное расхождение между величи-
ной магнитной восприимчивости —7,0 • 10~6 для углерода в
виде графита и значением восприимчивости —0,5*10-6, кото-
рое следует ожидать из формулы Паскаля после суммирования
средних вкладов в расчете на бензольное кольцо, Гангули
и Кришнан 1319] предположили, что л-электроны в графите
ведут себя как двумерный электронный газ. При этом каж-
дый атом углерода дает один электрон, поэтому электрон-
ный газ имеет очень низкую температуру вырождения.
В усовершенствованном варианте теории, предложенном
Мрозовским [710], учитываются эффективные массы дырок
и электронов и их средние концентрации, что устраняет
трудности, вызванные расхождением между теоретическими
и экспериментальными значениями удельной теплоемкости
и магнитной восприимчивости. Однако при этом возникают
новые осложнения, связанные с уменьшением диамагнитной
Электронные свойства и структура связей графита
99
восприимчивости кристаллических соединений графита [411].
Предложенная модель, по-видимому, не соответствует рас-
четам, основанным на двумерных -структурах зон [466, 624].
Недостаточность формулы Ландау — Пайерлса для диамаг-
нитной восприимчивости электронов проводимости обсуж-
далась Макклуром (ср. [624, 256, 257]). Некоторые исследо-
ватели, изучающие графит, не уделяют, вероятно, необходи-
мого внимания влиянию различных сеточных дефектов,
особенно влиянию на температурный коэффициент воспри-
имчивости/
По-видимому, немаловажную роль, и в первую очередь
для графита, играет образование дирадикалов, которое на-
блюдается в некоторых углеводородах, например в полиа-
ценах. Это обстоятельство иллюстрируется следующей
формулой:
/\/\/\/\/\
,|S I 1'1 ]
\/\/\/\/\/
Попытки создать очень большие кристаллы графита
(см. 1.6.5) из суспензии маленьких монокристаллических
пластинок в желатине, осажденных в сильном магнитном
поле, кончались образованием лишь некоторой ориентиро-
ванной структуры с цилиндрической симметрией, в которой
все с-оси этих пластинок оказывались направленными пер-
пендикулярно приложенному магнитному полю, а основные
плоскости располагались параллельно полю. Отношение, ха-
рактеризующее анизотропию для такой структуры [567], оп-
ределяется выражением V2 (Х±+Хц)/Х — 22,5 вместоx±/x;j2i44.
IV.5. МАГНИТНАЯ ВОСПРИИМЧИВОСТЬ УГЛЕРОДОВ
Очень полезно рассмотреть возможные изменения маг-
нитных свойств внутри некоторого гипотетического ряда
ароматических соединений, заключенных между бензолом и
графитом. По мере того как в процессе образования более
высоких углеводородов размеры молекулы при последова-
тельном присоединении новых колец к бензолу увеличивают-
ся, в эмпирическую формулу Паскаля вводятся добавочные
диамагнитные члены. При увеличении молекулярных разме-
ров восприимчивость, рассчитанная на 1 г-атом углерода в
соединении, на бензольном конце ряда в рамках правил Па-
7*
100
Г лапа IV
скаля должна оставаться приблизительно постоянной.
С другой стороны, на противоположном конце ряда, в гра-
фите, высокий диамагнетизм, зависящий от температуры,
можно истолковывать с точки зрения свободного электрон-
ного газа. В промежуточном случае коксов и углеродов наб-
людается сложная картина. Восприимчивость этих материа-
лов и ее температурная зависимость исследовались различ-
ными авторами [4, 656, 657, 804, 806, 1156].
Фиг. 23. Магнитная восприимчивость углеродов % в зависимости
от температуры термической обработки Ht .
На фиг. 23 представлена зависимость магнитной воспри-
имчивости, измеренной при температурах 78 и 300°К, от
максимальной температуры термической обработки
углерода [532].
Начальное падение диамагнитной восприимчивости до не-
которого минимума (вплоть до появления парамагнетизма)
объясняется наличием захваченных кристаллом свободных
радикалов с неспаренными спинами (ср. 1.4.2). Это объяс-
нение подтверждается известными экспериментами по пара-
магнитному резонансу [164, 459, 1066].
Электронные свойства и структура связей гпафита 101
При более высоких значениях Ht имеется критическая
область (1600—2400°), в которой наблюдается крутой подъ-
ем диамагнитной восприимчивости с ее характерной темпе-
ратурной зависимостью. Если при построении графика
вместо Нt в качестве переменной взять эффективный раз-
мер кристаллитов [803], измеренный стандартными метода-
ми [295, 296], то быстрое увеличение диамагнитной воспри-
имчивости будет наблюдаться в области, где диаметр кри-
сталлитов, расположенных в перпендикулярном к гексаго-
нальной оси направлении, достигает критических значений
Фиг. 24. Магнитная восприимчивость % в зависи-
мости от диаметра кристаллитов для углеродных
стержней и порошков газовой сажи [933].
между 50 и 150А (фиг. 24.) Причина, по которой восприимчи-
вость должна достигать некоторого предельного значения
при размерах кристаллитов примерно 150А, остается неяс-
ной, так как значительного роста кристаллов при этом еще
не происходит.
Если рост кристаллов графита осуществляется с помощью
механизма винтовых дислокаций, то такое резкое увеличение
восприимчивости можно было бы объяснить непрерывным
«ядрообразованием» кристаллитов, которые становятся до-
статочно большими для проявления «графитового» диамаг-
нетизма на протяжении всей критической температурной об-
ласти Ht .
Более детальные данные об энергетических уровнях элек-
тронных зон в графите способствовали бы устранению этой
неясности. Возможно, что для получения лучшего теоретиче-
ского приближения нужно учитывать как электронные зоны
102
Глава IV
макромолекулярных областей, так и влияние неспаренных и
слабо спаренных 'спинов электронов, захваченных в углеро-
дах некоторыми дефектами.
Если сравнивать углероды, изготовленные коксованием
определенных молекул, то можно установить корреляцию
между магнитной восприимчивостью и долей (относительно
почти идеального графита) структурных дефектов, постоян-
но .присутствующих в углероде. Однако рентгенографиче-
ские методы не позволяют надежно выявить отчетливой свя-
зи [5] между магнитной восприимчивостью и относительной
интенсивностью рассеяния в кристаллографически разупо-
рядоченном углероде. Как уже говорилось, более опреде-
ленная связь появляется тогда, когда у таких углеродов в
области почти идеального графита объем или толщина кри-
сталлитов связана с магнитной восприимчивостью (ср. фиг. 24).
Пако и Маршан [763] использовали для описания гипоте-
тического двумерного газа в графите статистику Ферми—
Дирака и пришли к заключению, что диамагнетизм газовой
сажи и графита сводится, во-первых, к независящей от тем-
пературы диамагнитной восприимчивости и, во-вторых, к
зависящей от температуры диамагнитной восприимчивости,
которая анизотропна и направлена перпендикулярно плоско-
сти слоев графита. Изменение этой характеристики с темпе-
ратурой выражается соотношением Ах/Ахо = 1 —ехр(—То/Т),
где Ах— диамагнитная анизотропия углерода при темпера-
туре Т (°К), Ахо — значение Ах при 0°К, а То—температу-
ра вырождения гипотетического электронного газа в углеро-
де. Предельная анизотропия Ахо, зависящая от температу-
ры, и температура вырождения TQ являются константами,
характеризующими углерод. Пако и Маршан предполагают,
что не зависящая от температуры хй представляет собой ми-
нимальную удельную восприимчивость, которой обладает
углерод при уменьшении диаметра слоя. С помощью соот-
ветствующих значений То они описали поведение газовой
сажи и кристаллического графита в температурной области
от—196 до + 1000° С; по их данным, для газовых саж ха=
= 0,8-КМ CGSM/г. Критические размеры кристаллитов в
газовых сажах составляют около 40А [764].
IV.5.1. ВЛИЯНИЕ ИЗМЕЛЬЧЕНИЯ НА МАГНИТНУЮ
ВОСПРИИМЧИВОСТЬ
Параллельно с изучением влияния роста кристаллитов,
наблюдаемого при повышении , интересные сведения
можно получить также из экспериментов по измельчению, в
Электронные свойства и структура связей графита 103
процессе которого кристаллиты разрушаются (316]. В частно-
сти, установлено, что диамагнетизм в значительной мере
теряется при измельчении кристаллитов до размеров ни-
же 200А.
Вместе с уменьшением размеров кристаллитов измельче-
ние может сопровождаться разрывом связей С—С. Если та-
кие разорванные связи представляют собой свободные ва-
лентности, которые в конечном счете могут быть заняты с
помощью одного из обсуждавшихся механизмов (ср. 1.4),
то вклад полученного таким образом парамагнетизма только
нейтрализует обычный диамагнетизм незатронутых частей
макромолекулы. С другой стороны, присоединение кислорода
или водяного пара к свежеразорванным С—С-связям может
привести к возникновению более сложных эффектов. Это об-
стоятельство показывает, насколько важно проводить экспе-
рименты по уменьшению кристаллического объема в контро-
лируемой атмосфере.
В процессе графитизации очень несовершенного углерода
наблюдались ступеньки скольжения размером порядка 300А
(463, 1039, 1040]. В связи с этим результаты опытов по из-
мельчению могут, вероятно, означать, что размер в 300А яв-
ляется некоторой критической величиной, выше которой сле-
дует учитывать поведение электронного газа. В более мел-
ких кристаллитах, даже трехмерных, число л-электронов,
по-видимому, совершенно недостаточно для обеспечения ана-
логичного эффекта. Возможно также, что для кристалличе-
ского объема ниже указанного предела уменьшение диамаг-
нетизма вызвано винтовыми дислокациями; кроме того, в
гексагональных сетках могут встречаться значительные от-
клонения линейных размеров С—С-связи от определенной
величины.
IV. 6. ИСЧЕЗНОВЕНИЕ ДИАМАГНЕТИЗМА ЭЛЕКТРОННОГО ГАЗА
ПРИ ОБРАЗОВАНИИ КРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
Как подробнее показано ниже (ср. гл. VII), высокая диа-
магнитная восприимчивость графита падает также в резуль-
тате образования слоистых соединений. Ряд исследователей
считает, что смещение электронов с уровней, расположенных
вблизи потолка заполненной зоны, вызвано образова-
нием соединений. С точки зрения других, это смещение
связано с механическими процессами. Хотя изменение диа-
магнетизма, обусловленное образованием кристаллического
соединения, еще не может быть однозначно интерпретирова-
104
Глава IV
но, тем не менее наиболее вероятное объяснение заключается,
по-видимому, в отклонении электронного газа от состояния
равновесия [629]. Диамагнетизм электронного газа обычно
не исчезает после внедрения нескольких первых атомов
[516, 848, 887], как это, вероятно, происходило бы в том слу-
чае, если бы электроны вытеснялись с уровней, расположен-
ных у потолка заполненной зоны. Однако это обстоятельство
можно объяснить тем, что в процессе внедрения в первую
очередь оказываются занятыми различные дефекты сетки
(1.4.2).
IV.6.1. МАГНИТНАЯ ВОСПРИИМЧИВОСТЬ УГЛЕЙ
Как известно, существует довольно сложное эмпириче-
ское соотношение между числами ядер на «молекулу» в
углях (включая ароматические и алициклические ядра)
и молярной диамагнитной восприимчивостью. В связи с этим
были выполнены косвенные расчеты, причем применимость
упомянутого соотношения к углеродам, содержащим даже
менее 4% водорода, до сих пор окончательно не выяснена
[925]. Однако для углей этот эмпирический подход представ-
ляется полезным. Надо сказать, что при использовании не-
скольких методов оценки все они дают приблизительно оди-
наковую величину размера «молекулы» (ср. [459]).
IV.7. ИССЛЕДОВАНИЕ ЭЛЕКТРОННОГО ПАРАМАГНИТНОГО
РЕЗОНАНСА В УГЛЕРОДАХ Й ГРАФИТЕ
Измерения статической магнитной восприимчивости угле-
родов и графита, даже будучи выполненными для некоторой
области температур, вызывают при их истолковании ряд
сомнений. Дополнительные данные были получены в резуль-
тате применения метода электронного парамагнитного резо-
нанса [42], причем некоторые результаты не могут быть
объяснены до сих пор. Методы электронного парамагнитного
резонанса описаны в работах [58, 163, 933] и в настоящей
книге не рассматриваются.
Основная идея электронного парамагнитного резонанса
заключается в том, что любые неспаренные электронные спи-
ны в таком твердом теле, как очень несовершенный графит,
можно охарактеризовать временем их релаксации. Таким об-
разом, в результате различной обработки можно получить
экспериментальные кривые для концентрации неспаренных
спинов, которые характеризуются соответствующими време-
нами релаксации. Для различных видов углеродов, подверг-
Электронные свойства и структура связей графита 105
шихся термической обработке до температур выше 1400° С,
можно таким путем связать молярную долю спинов свобод-
ных электронов с сохранившимся в кристалле водородом,
причем максимальное значение этой доли соответствует кон-
центрации атомов углерода в пределах между 80 и 94% и со-
ставляет 64О-4 на 1 г-атом. При карбонизации же различ-
ных исходных материалов в вакууме может сохраниться
более высокий процент неспаренных спинов, чем при карбо-
низации на воздухе (ср. [498]).
Влияние примесей и дефектов кристаллической решетки
в случае графита остается неясным [164, 410]. В первых гла-
вах описывались различные способы возникновения неспа-
ренных спинов в углеродах. Систематическое применение
резонансных методов должно способствовать их распознава-
нию. Ингрэм [492] нашел, что электронный парамагнитный
резонанс позволяет обнаружить совместное воздействие из-
мельчения углеродов и их перемалывания с различными ма-
териалами.
Все углероды и угли органического происхождения, в ко-
торых обнаружен заметный электронный спиновый резонанс,
по-видимому, представляют собой очень несовершенные гра-
фиты (ср. [15, 145, 492, 951, 1066]). Из исследований Ингрэ-
ма вытекает, что наблюдаемые эффекты быстро убывают до
нуля, когда содержание гетероатомов в углероде или в дру-
гих углях падает ниже 6%. Это указывает на то, что релак-
сационные явления определяются дефектами, присутствую-
щими в кристалле. Для почти идеального графита следует
ожидать гораздо более коротких времен релаксации.
В настоящее время эта совершенная методика позволяет
получать данные, выходящие далеко за рамки обычных тео-
ретических и экспериментальных представлений, что отчасти
объясняется сложностью исследуемых систем. Ряд неразре-
шенных вопросов возникает также в связи с дефектами в
углеродах, полученных путем обжига различных органиче-
ских соединений, и в особенности металлических солей орга-
нических кислот [58].
IV.8, ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ГРАФИТА
КАК ПРЕДЕЛЬНОГО ЧЛЕНА РЯДА
АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
В свете недавних исследований нельзя, по-видимому, го-
ворить об электрических свойствах графита без предвари-
тельного рассмотрения свойств ароматических молекул и
углеродов, которые, вероятно, представляют собой последе-
106
Глава IV
вательные стадии в процессе образования графита «из естест-
венных продуктов. Как ранее указывалось, углероды можно
рассматривать в качестве графитов с крупными дефектами,
внедренными в почти идеальный графит со сравнительно не-
большими дефектами кристаллической решетки.
IV.8.1. ПРОВОДИМОСТЬ ТВЕРДЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ,
СВЯЗАННАЯ С л-ЭЛЕКТРОНАМИ
Результаты измерений сопротивления отдельных арома-
тических молекул были опубликованы рядом авторов [8, 182,
267,493,621,746]. Эти данные проливают некоторый свет ина
сопротивление графитов. Основные трудности подобных из-
мерений заключаются в сложности разделения межмолеку-
лярного и внутримолекулярного сопротивлений углеродов
промежуточной структуры. Если «молекулы» с конденсиро-
ванными ядрами очень велики, как это бывает в ароматиче-
ских сетках почти идеального графита, то внутримолекуляр-
ное сопротивление, возникающее в любой такой сетке
вследствие различных процессов электронного рассеяния, со-
ставляет заметную часть от общего сопротивления. А если «мо-
лекулы» слишком малы, для того чтобы при измерениях
сопротивления любую сетку ковалентных связей можно было
бы рассматривать как одну сетку, простирающуюся от одно-
го электрода к другому, то большая часть полного сопротив-
ления будет обусловливаться межмолекулярными электрон-
ными процессами. Именно эти процессы определяют основ-
ную часть сопротивления многоядерных углеводородов, об-
ладающих лишь немногими ядрами.
Вместе с тем в обзоре экспериментальных данных полез-
но напомнить о том, что перескоки электронов от молекулы
к молекуле могут определяться межмолекулярными расстоя-
ниями, которые связаны со структурой самого кристалла,
как, например, в монокристаллах с небольшими ароматиче-
скими молекулами. Кроме того, межмолекулярные расстоя-
ния могут зависеть также и от таких условий, как упаковка
поликристаллических порошков. В связи с этим для любых
порошков на экспериментальные результаты может оказывать
влияние степень уплотнения и преимущественной ориентации;
следовательно, всякий раз, когда это возможно, необходимо
исследовать зависимость сопротивления от уплотнения.
Хотя ряд ранних экспериментов с ароматическими соеди-
нениями был выполнен на порошках, спрессованных при низ-
ких давлениях порядка 100 атм [8, 268], тем не менее усовер-
шенствования в экспериментальной технике позволяют
Электронные свойства и структура связей графита 107
использовать для измерений более плотные поликристалли-
чеокие образцы, полученные либо методом сублимации [746],
либо изготовленные из 'спрессованных порошков с одновре-
менным нагреванием, стимулирующим пластическое течение
(неопубликованные сообщения Паркинса и Уббелоде). Ис-
следовались также и монокристаллы [183, 686]. Почти во
всех случаях кристаллы или кристаллиты были ориентиро-
ваны хаотически, в связи с чем измеренные значения элект-
ропроводности являются усредненными по всем кристалло-
графическим направлениям. Как известно, и в графите [318,
829], и в слоистых углеводородах [183, 686] наблюдается
большая анизотропия электропроводности. Несмотря на то
что эта анизотропия влияет на абсолютную величину элект-
ропроводности, она не должна менять последовательности
ее значений для отдельного ряда углеводородов. Действитель-
но, как измерения Инокучи [493] на порошкообразных угле-
водородах, так и измерения Нортрупа и Симпсона [746] на
сублимированном сплошном материале дают почти одина-
ковую последовательность значений электропроводности в
ряду полиароматических углеводородов.
По аналогии с зонной теорией твердого тела в примене-
нии к собственным полупроводникам потенциальный барьер
в твердых углеводородах ассоциируется иногда с переходом
из заполненной валентной зоны в зону проводимости [746].
Механизм электрической проводимости в полупроводни-
ках часто рассматривается с точки зрения теории зон Брил-
люэна в твердом теле [1137]. В простейшей модели для соб-
ственных полупроводников электрическая проводимость есть
результат термического и оптического возбуждений элект-
ронов из заполненной зоны кристалла в первоначально
пустую зону проводимости. Эти две энергетические зоны раз-
делены запрещенной зоной, ширину которой можно оценить,
например, по порогу фотоэффекта. С другой стороны, были
предприняты попытки [702—704] описать проводимость тако-
го типа исходя из концепции «резонирующих связей» Полин-
га в металлах и вводя гипотезу о некоторой «полупроводя-
щей связи».
При комнатной температуре величина электропроводно-
сти твердых углеводородов о-бычно возрастает с увеличением
числа бензольных колец и размера молекул. В табл. 16 (ср.
также [14] и [834]) представлены значения электропроводно-
сти Изо при обычной температуре и энергии термической ак-
тивации, входящей в выражение
<5 = Со ехр
108
Глава IV
Таблица 16
Значения электропроводности и энергии активации
для многоядерных углеводородов
Молекула а10, ом г*см 1 6, эв
Хризен 2.10—19 2,20
Антрацен 1-ю—18 1,93
Пирен 1-10“18 2,02
Антантрен 3-10—18 1,60
Перил ен 1 • 10“16 1,95
Нафтацен 8-10-15 1,70
Пентацен 3-10— 1,50
Коронен — 1,13
Нафтодиантрен — 1,2
Виолантрен — 0,85
Углерод (Я^<600°С) 10“5 0,3
Углерод (Я/^500—700°С) от 10“7 до 1,0 от 0,5 до 0,2
Углерод {//^ > 900—1700°С) 200 от 0,15 до 0,00
Графит 2200°С) > 1000 <0,01
Для молекулярных кристаллов процесс возбуждения, управ-
ляющий проводимостью, можно описать с помощью одного
из по крайней мере двух возможных механизмов.
1. Индивидуальные молекулы в кристалле переходят из
своего основного состояния в возбужденное при тепловом,
фотохимическом или других способах поглощения энергии.
Энергия возбуждения после этого может быть передана от
каждой возбужденной молекулы к соседним с вероятностью,
которая определяется структурой кристалла. В случае элект-
рической проводимости это возбуждение должно быть до-
статочным для осуществления ионизации. Затем электроны
могут перескакивать от одной молекулы кристалла к дру-
гой; для такого перескока им может потребоваться добавоч-
ная энергия активации. Под действием внешнего поля элект-
роны дрейфуют в направлении этого поля, а смежные
ароматические молекулы попеременно ведут себя то как источ-
ники электронов, то как их ловушки. Этот дрейф электронов
от одной ионизованной молекулы кристалла к другой под
действием приложенного поля можно представить схемати-
чески следующим образом:
Электронные свойства и структура связей графита
109
e^r(Ar)+ © (Аг) ' (Аг)-_______©
Из-за ограниченного взаимодействия между молекулами
в молекулярных кристаллах энергия возбуждения, необходи-
мая для ионизации в кристалле, почти равна энергии воз-
буждения для изолированных частиц с поправкой на энер-
гию поляризации. Если можно пренебречь дальнейшей акти-
вацией для перескока электрона от заряженной молекулы
к соседней незаряженной, то энергия активации полупрово-
дящего кристалла будет близка к энергии ионизации изоли-
рованной ароматической молекулы.
2. Для мелкоизмельченных поликристаллических порош-
ков потенциальный барьер выше энергии активации для
проводимости монокристалла; это можно объяснить более
или менее произвольными границами между кристаллитами.
На таких границах молекулы могут отстоять друг от друга
значительно дальше, а их взаимная ориентация может быть
менее благоприятной для переноса электронов, чем в моно-
кристаллах.
Наиболее современные методы изготовления образцов
сводят к минимуму ошибки, обусловленные вторым механиз-
мом, однако вопрос о влиянии первого механизма на про-
цесс проводимости в молекулярных кристаллах до сих пор
остается трудноразрешимым. Полностью удовлетворитель-
ной модели проводимости для молекулярных кристаллов
в настоящее время, по-видимому, не существует. Модель,
рассматривающая перескок электронов, была выдвинута для
твердых комплексов некоторых ароматических молекул с
щелочными металлами и галогенами [355, 456, 957]. С незна-
чительными изменениями эту модель можно использовать
для чистых соединений. Полупроводниковый характер прово-
димости твердых органических материалов, по-видимому,
часто связан с наличием л-электронных конфигураций в
молекулах [7, 9, 269, 1076]; к таким материалам относятся
фталоцианины, красители и многие ароматические структу-
ры, содержащие кислород, азот и другие элементы, а также
углерод и водород.
IV.8.2. ЭЛЕКТРОПРОВОДНОСТЬ БОЛЬШИХ МНОГОЯДЕРНЫХ
МОЛЕКУЛ
Полупроводниковые свойства больших плоских аромати-
ческих молекул с трудом поддаются описанию из-за экспери-
по
Глава IV
ментальных осложнений, связанных с их выделением и очи-
сткой.
Электропроводность углеродов и графитов на много по-
рядков выше наибольшего из известных до сих пор значений
электропроводности для полиароматических молекул. Очень
сильно отличается также и температурный коэффициент
электропроводности. Единственная причина для такого раз-
личия между углеродами и некоторыми органическими мо-
лекулами, рассмотренными выше, состоит в том, что в на-
стоящее время те наиболее крупные молекулы, которые
можно выделить в удобной для физических измерений’форме
в виде однородных и достаточно чистых соединений, имеют
относительно небольшие размеры.
Так, например, известны данные о получении коронена
методом однородной сублимации коронена в тщательно
контролируемых условиях при 420° С [746]. Эта температура
является едва ли не максимальной для работы с углеводо-
родами; выше нее может возникнуть процесс коксования,
который ведет к образованию более высоких ароматических
структур различных размеров с одновременной потерей во-
дорода. Таким образом, результаты измерения сопротивле-
ния карбонизированнных углеводородов нельзя уже связы-
вать с определенной химической структурой, так как
продукты обжига состоят из полиароматических молекул раз-
личных размеров, соединенных друг с другом ковалентными
связями. Тем не менее значения удельного сопротивления и
высота потенциального барьера для некоторых витринитов
(обогащенные угли с содержанием углерода вплоть до 96%)
говорят о том, что можно установить непрерывную -связь
между уменьшением барьера и увеличением размеров аро-
матических сеток [926].
Таблица 17
Высота потенциального барьера
для электропроводности
некоторых витринитовых углей
Процент углерода е (приближенные значения), эв
91,7 0,58—0,56
93,7 0,61—0,42
94,2 0,34—0,33
95,0 0,28—0,26
96,0 0,20—0,16
Электронные свойства и структура связей графита
111
IV.8.3. ЭЛЕКТРОСОПРОТИВЛЕНИЕ УГЛЕРОДОВ
(ОЧЕНЬ НЕСОВЕРШЕННЫХ ГРАФИТОВ)
Порошкообразные углероды. Сильное влияние на сопро-
тивление газовой сажи оказывают такие примеси, как Н или
О; кроме того, абсорбированные на поверхности зерен при-
меси образуют большие произвольные барьеры для электри-
ческого тока [85].
Установлено [910], что величина сопротивления спрессо-
ванных образцов газовой сажи проходит через минимум при
1200° С (фиг. 25). При этой температуре содержание
водорода изменяется наиболее быстро (фиг. 26).
Фиг. 25. Схематическая кривая зависимости удельного сопротив-
ления Q от температуры термообработки для газовой сажи.
Порошки, спрессованные при комнатной температуре.
В елучае порошкообразных поликристаллических углеро-
дов и графитов большое практическое и теоретическое зна-
чение имеют вопросы, связанные с сопротивлением на кон-
тактах с металлическими электродами [550] и с сопротивле-
нием на границах между зернами [280]. Практически сопротив-
ление на границах между зернами может во много раз превы-
шать собственное ‘Сопротивление зерен. Механизмы элект-
ронного перескока, связанные с такими произвольными
барьерами, представляют большой теоретический интерес.
Их .полное исследование затруднено из-за мягкой и рыхлой
природы кристаллов графита и большого разнообразия
112
Глава IV
кристаллических дефектов, присутствие которых ’усложняет
интерпретацию экспериментальных результатов. Как прави-
ло, приложенное к порошкообразным образцам давление
понижает их сопротивление, а при циклических измерениях
наблюдается гистерезис. . Давления, используемые в таких
экспериментах, достигают 9000 атм; если зерна графита име-
ют почти идеальную структуру, то при высоких давлениях
электросопротивление границ между зернами, по-видимому,
Фиг. 26. Газы, выделяемые при высоко-
температурной откачке, из газовой сажи
«сферон 6» [910].
не играет существенной роли {593], тогда как для менее со-
вершенных углеродов влияние границ будет гораздо более
сложным.
Твердые углероды. Образцы из очень сильно разупоря-
доченных углеродов можно было бы, по-видимому, получить
при дуговом испарении углеродных нитей в атмосфере
инертного газа. Однако остается не ясным, относятся ли
известные значения сопротивления, полученные для таких
углеродов [89, 1035], к образцам, свободным от инородных
атомов, приобретаемых во время пребывания в инертном газе.
Для очень 'несовершенных углеродов представляется це-
лесообразным не связывать проводимость с определенной
химической структурой, а искать эмпирическую зависимость
между электропроводностью и максимальной температурой
Электронные свойства и структура связей графита 113
термической обработки кристалла Hf. Можно оценить коли-
чественное отношение между углеродом й водородом, при-
сутствующими на любой последовательной стадии обработ-
ки, однако было бы неправильным считать, что это отноше-
ние связано с наличием определенных углеводородов с
молекулами больших размеров и одинакового состава.
Из фиг. 9 следует, что очень быстрое падение сопротив-
ления' происходит на начальных стадиях полимеризации и
дегидрогенизации, т. е. во время так называемого процесса
Фиг. 27. Относительное сопротивление р/ро стержней
из мягкого углерода в зависимости от температуры
термической обработки Ht [599].
На кривых указаны средние температуры, при которых были
получены углеродные стержни.
коксования. Участки кривой, где она начинает выравнивать-
ся, совпадают с конечными стадиями дегидрогенизации, для
которых продукт реакции может быть назван собственно
углеродом.
На фиг. 27 представлена более подробная зависимость
удельного сопротивления от Hf (при значениях Ht от
1000° С и выше) [599]. При дальнейшем нагревании углерода
примерно выше 2400° С на кривой наблюдается второй уча-
сток с уменьшающимся сопротивлением. Это вторичное па-
дение связано с возникновением в углероде трехмерного
порядка, т. е. с графитизацией.
При карбонизации «неграфитизированного» исходного
материала [295] получаются кривые сопротивления, слегка
отличающиеся от прежних [599].
8 А. Р. Уббелоде
114
Глава IV
IV.9. МЕХАНИЗМ ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИ
В УГЛЕРОДАХ
До настоящего времени лишь немногие исследователи
пытались изучить механизм проводимости в «коксах, т. е. в
соединениях, которые были подвергнуты термической обра-
ботке при максимальных И* в пределах 400—900° С. Гораз-
до больше внимания было уделено электропроводности
углеродов, т. е. тем участкам кривых фиг. 9 и 27, где Ht ме-
няется от 900 до 2000° С, а сопротивление начинает выравни-
ваться. Структурные изменения на этой стадии последова-
тельной карбонизации самым подробным образом обсужда-
лись в разд. I. 1. 7. Признаки возникновения упорядочен-
ных микрографитовых трехмерных областей начинают появ-
ляться около /Д = 1600°С. Механизм электропроводности для
материалов этого типа был описан Мрозовским с точки зре-
ния формального распространения на них зонной модели
для графита (см. [710] и более поздние работы этого автора).
В случае идеального графита зона проводимости, в кото-
рой при 0° К нет ни одного электрона, отделена от л-элект-
ронной зоны пренебрежимо малой запрещенной зоной; более
подробно это обстоятельство обсуждается в IV. 10 и ниже.
В результате перекрытия зон или теплового возбуждения
при температуре выше абсолютного нуля в зоне проводимо-
сти идеального графита оказывается достаточное количество
электронов, вследствие чего графит ведет себя как металли-
ческий проводник. Мрозовский и его сотрудники считают,
что различные стадии перехода от ароматических углеводо-
родов (через очень несовершенные графиты-коксы) к почти
идеальному графиту можно представить в виде последова-
тельного сокращения конечной ширины запрещенной зоны
(фиг. 28). Хотя такая интерпретация электронных процессов
для последовательной карбонизации является сугубо каче-
ственной, тем не менее она позволяет связать между собой
значительную часть экспериментальных данных.
Энергия активации (ширина запрещенной зоны на
фиг. 28), найденная по логарифмической зависимости о от
1/Т, уменьшается с увеличением Hf. Кроме того, этим дан-
ным соответствуют известные результаты по исследованию
края инфракрасного поглощения [637].
Теоретическое положение энергетических уровней в гомо-
логическом ряду бензол—графит рассмотрено также в рабо-
те [190].
Как предполагает Мрозовский, в результате поперечной
связи сеток и карбонизации в области /7,2x1000° С, а также
Электронные свойства и структура связей графита
115
вследствие выделения водорода в л-зоне образуются дырки;
это предположение позволяет объяснить сравнительно высо-
кую электропроводность и положительный коэффициент Хол-
ла для указанных углеродов. Можно считать, что в результа-
те последовательных потерь водорода освобождаются свобод-
ные валентности, которые играют роль электронных ловушек,
локализованных, вероятно, на дырочных и клещевидных де-
фектах [593, 957, 1058, -1060]. Несмотря на то что частично
заполненные электронные зоны графита имеют с точки зре-
ния механизма проводимости «металлический» характер, на-
личие положительного температурного коэффициента электро-
проводности для этой категории углеродов приписывается
Зона
проводимости
Запрещенная
зона
Валентная (я)
зона
Твердые Сырой Обожженный Частичная Поликристалла -
углеводороды кокс углерод графитизация ческий графит
Выделение летучих Рост кристаллов
Фиг. 28. Представление зонной модели углеродов с помощью схемьп
одномерных энергетических зон [599].
Запрещенная зона сокращается с увеличением размеров кристаллитов (и тем-
пературы термической обработки). Истощение уровня Ферми зависит от кон-
центрации периферийных валентных связей углерода, которая увеличивается;
с возрастанием хемосорбции газов и уменьшается с повышением диаметра
кристаллитов.
рассеянию на границах между сетками, которое уменьшается
с -повышением температуры.
Наряду с удельным сопротивлением на поведение носите-
лей электричества в значительной мере проливают свет изме-
нения коэффициента Холла и величины сопротивления в маг-
нитном поле (магнитосопротивления), которые наблюдаются
при последовательной термической обработке. Зависимость
коэффициента Холла от Ht для низкотемпературных углеро-
дов объясняется изменением концентрации дырок в нижней
л-зоне графита, поскольку переход электронов в результате
теплового возбуждения в верхнюю зону проводимости невоз-
можен из-за слишком широкой запрещенной зоны (фиг.. 29).
По мере увеличения концентрации дырок нижняя зона по-
степенно истощается; изменение знака коэффициента Холла
связано с прохождением энергетической кривой зоны через
точку перегиба, так что d2zldk2, вторая производная от энер-
гии 8 по волновому числу k, становится теперь положительной.
При Hf выше 1400° С процесс образования дырок вследствие
S*
116
Глава IV
выведения водорода, по-видимому, в основном завершается.
Связывание разорванных сеток, происходящее во время роста
кристалла, приводит к уменьшению количества дырочных де-
фектов, играющих роль электронных ловушек. л-Зона начи-
нает снова заполняться. Однако когда сетки соединяются,
ширина запрещенной зоны Де тоже уменьшается. При
Ht— 2000° С эту зону можно считать достаточно малой для
Фиг. 29. Схематическая кривая зависимости коэффици-
ентов Холла /у и термо-э.д.с. О от температуры терми-
ческой обработки Hf.
перехода электронов в зону проводимости под действием теп-
лового возбуждения.
Несмотря на то что в процессе проводимости принимают
участие как дырки, так и электроны, в почти идеальном гра-
фите преобладающее влияние имеют в конечном счете элек-
троны из-за более высокой подвижности. Тот факт, что после-
довательная графитизация углеродов сопровождается изме-
нением электропроводности и коэффициента Холла, позволяет
сделать аналогичные выводы и для углеродов [401]. Пред-
ставляется весьма вероятным, что в коксах и углеродах па-
дение сопротивления вызвано, с одной стороны, уменьшением
рассеяния носителей вследствие повышения порядка, а с дру-
гой стороны, связано с уменьшением количества эффективных
Электронные свойства и структура связей графика П7
носителей в результате обеднения решетки электронными ло-
вушками.
Эта формальная интерпретация Мрозовским [710] общего
сопротивления коксов и углеродов с точки зрения характери-
стических зон была сохранена в основном и в измененном
Диаметр кристаллов^'
Фиг. 30. Зависимость коэффициента Холла и относи-
тельного магнитного сопротивления («магнитосопротив-
ления») Apm/pm от температуры термической обработки
углерода Hf при двух значениях температуры [715].
Пунктирные кривые в области = 1650 — 1900°С соответствуют
хлорированным образцам. Напряженность магнитного поля со-
ставляет 6500 э.
варианте этой теории [715]. Усовершенствованная теория поз-
воляет связать большое количество экспериментальных дан-
ных [805, 806, 933], но она сопряжена с некоторыми осложне-
118
Глава IV
пнями. В соответствии -с другой возможной теорией электро-
проводности [111, 903] основная часть сопротивления обуслов-
лена процессами на произвольных границах кристаллитов,
размеры которых приближаются к молекулярным. Так как
проводящие каналы в графите располагаются преимуществен-
но вдоль плоскостей слоев, то нет ничего удивительного в том,
что (в отличие от металлов с кубической решеткой) удельное
Фиг. 31. Термо-э.д.-с. О стержней мягкого углерода в зависи-
мости от температуры термической обработки [599].
В качестве эталона используется платина. На кривых указаны средние тем-
пературы, при которых были получены стержни.
сопротивление графитовых пленок, осажденных пиролитиче-
ски, остается независимым от толщины вплоть до нескольких
ангстремов [362].
На фиг. 30 и 31 показана температурная зависимость не-
которых электрических характеристик углеродов после того,
как они были подвергнуты термической обработке при после-
довательно увеличивающихся температурах. Объяснение этих
кривых зависит от окончательной интерпретации величин для
почти идеального графита (см. ниже) и более подробно здесь
излагаться не будет.
Электронные свойства и структура связей графита
1 19
IV.10. ЭЛЕКТРОСОПРОТИВЛЕНИЕ ПОЛИКРИСТАЛЛИЧЕСКОГО
ГРАФИТА
Расположенный в одном ряду с углеводородами и угле-
родами поликристаллический связанный материал, описывае-
мый здесь под названием искусственного графита, обладает
удельным сопротивлением около 800 • 10-6. ом- см. Было бы
желательно, конечно, при обсуждении сопротивления «графи-
та» использовать результаты, полученные на образцах, для
которых можно определить происхождение каждого из откло-
нений структуры. Полный трехмерный порядок, наличие ко-
торого часто считается установленным для материала, в дей-
ствительности можно подтвердить лишь в первом приближе-
нии с помощью рентгеноструктурного анализа поликристал-
лического графита. Различие в полученных результатах мож-
но объяснить значительными отклонениями от трехмер-
ного порядка, если материал недостаточно графитизирован,
или присутствием других кристаллических дефектов, описан-
ных в гл. I.
Если предположить, что отдельные кристаллиты обладают
почти идеальной структурой, то вследствие наличия в поли-
кристаллическом графите огромного количества пор или боль-
ших пустот его сопротивление будет зависеть от кажущейся
плотности. С этим обстоятельством можно связать тот факт,
что траектории электрического тока располагаются между
кристаллитами [713].
Влияние давления. Учитывая особенности структуры поли-
кристаллического графита, следует ожидать, что сжатие гра-
фита будет заметно изменять его сопротивление. Действи-
тельно, это явление наблюдалось при давлениях вплоть до
105 атм [130]; при снятии давления первоначальное значение
сопротивления не восстанавливается, что указывает на неко-
торые изменения в упаковке кристаллитов и, возможно, в рас-
положении связей на боковых поверхностях этих кристаллитов
вследствие их соприкосновения под влиянием сжатия. За-
служивает внимания сообщение Минца [695] о том, что сжа-
тый до 350 атм графит имеет более низкий температурный
коэффициент удельного сопротивления (//q)d^jdT, чем при
обычных давлениях. По-видимому, можно считать, что в ре-
зультате более тесного взаимного расположения кристаллитов
при сжатии различные барьеры между -ними, включая и эле-
ктронные переходы, понижаются.
В поликристаллических материалах, в которых отдельные
кристаллиты ориентированы более или менее хаотично, любая
остаточная анизотропия сопротивления появляется вследст-
120
Глава IV
вие. преимущественной ориентации кристаллитов, возникаю-
щей в процессе спрессовывания и формовки смеси кокса и
связующего вещества перед ее обжигом и окончательной
графитизацией. Так, например, удельное сопротивление бру-
скового графита при 20° в направлении, параллельном оси
выдавливания, может меняться от 570 до 840 (в 106 ом-см),
а в перпендикулярном направлении оно достигает 1200.
' Влияние температуры. Величину сопротивления намеряют,
как правило, вдоль направления максимальной проводимости.
Очевидно, для более полной информации необходимо знать
температурные коэффициенты, измеренные как в параллель-
ном, так и в перпендикулярном к указанному направлениях.
Анизотропия сопротивления монокристаллов, по-видимому,
так велика (см. следующий раздел), что в поликристалличе-
ском графите весь ток практически течет, вероятно, в направ-
лении, параллельном осям а кристаллитов. Измеряемое со-
противление определяется, очевидно, длиной зигзагообразных
траекторий, расположенных параллельно a-осям; эту точку
зрения можно было бы подтвердить с помощью измерений
температурного коэффициента для различных направлений.
Многочисленные исследования температурной зависимости
сопротивления были проведены в связи с их огромным зна-
чением для техники. Как правило, величина сопротивления в
двух направлениях известна довольно редко, и, кроме того,
материал одного и того же происхождения, к сожалению, ни-
когда, по-видимому, не исследовался во всей области темпера-
тур. Схематический график, иллюстрирующий основные осо-
бенности поведения удельного сопротивления выше и ниже
комнатной температуры, представлен на фиг. 32.
Особое внимание следует обратить на максимум при 5° К
и форму кривой от 20° К до комнатной температуры [849,
1045]. В различных работах приведены данные о сопротивле-
нии для температур от комнатной до самых высоких
(ср., например, [182, 470]). Положение минимума на фиг. 32
меняется для различных образцов и зависит от абсолютных
значений сопротивления на других участках кривой.
Как и в случае электропроводности очень несовершенных
графитов, обсуждавшейся в связи с углеродами, поведение
поликристаллического графита по сравнению с поведением
почти идеальных монокристаллов графита объясняется не-
сколько более широкой запрещенной зоной. Может быть, бо-
лее простой является другая точка зрения, по которой кри-
сталлиты в поликристаллическом графите представляют собой
почти идеальные монокристаллы, отделенные потенциальны-
ми барьерами [111]. В порошкообразном графите такие барье-
Электронные свойства и структура связей графита 121
ры, по-видимому, невелики [593], однако если на границах
кристаллитов поликристаллического материала удерживаются
атомы водорода, высота барьеров может возрасти. Стимулом
для проведения исследований в этой области является тот
факт, что элементы сопротивления, изготовленные из грану-
лированного углерода [280, 363, 755, 1021], заняли прочное
место в технике воспроизведения звука.
Нейтронная бомбардировка. По имеющимся данным ней-
тронная бомбардировка повышает сопротивление поликри-
сталлического графита [32, 152, 265]. Этот результат аналоги-
чен эффекту нейтронного облучения в других кристаллах [536]
/,5
\
\
\
\
\
\
\
\
\
0.5
Q L—1----1-----J----1-----1-----1---1
5 500 1500 2500
Температура ,°К
Фиг. 32. Схематическая кривая зависимости
удельного сопротивления р поликристаллического
графита от температуры.
и может обусловливаться возросшим рассеянием электронов
проводимости. Вследствие особой природы электронных зон
графита следует с осторожностью рассматривать любые со-
ображения о связи смещенных атомов углерода с изменением
заселения зон [964]. Кроме того, необходимо принять меры к
устранению тазов, которые могут собираться на дефектных
местах, образованных в результате облучения нейтронами.
Вполне возможно, что в отличие от дефектов, остающихся
после неполной термической графитизации коксов, имеются
другие характерные особенности радиационных дефектов, ко-
торые также нуждаются в дальнейшем разъяснении.
122
Глава IV
IV.11. ЭЛЕКТРОСОПРОТИВЛЕНИЕ МОНОКРИСТАЛЛОВ
ПОЧТИ ИДЕАЛЬНОГО ЕСТЕСТВЕННОГО ГРАФИТА
Исследованию сопротивления кристаллов почти идеаль-
ного естественного графита посвящены многочисленные рабо-
ты. При этом большинство измерений было выполнено вдоль
оси, параллельной плоскости углеродных сеток, т. е. в на-
правлении, перпендикулярном оси с. Определение сопротив-
ления вдоль с-оси оказалось не столь простым, так как его
величина во много раз выше величины сопротивления в на-
правлении, перпендикулярном оси с; это обстоятельство объ-
ясняется, по-видимому, тем, что различные несовершенства
кристаллитов накоротко замыкают участки с высоким сопро-
тивлением.
Даже лучшие «монокристаллы» графита сплошь и рядом
состоят из большого количества кристаллитов, хотя их ориен-
тация, как установлено рентгенографическими исследования-
ми, гораздо ближе к совершенной, чем для «искусственного»
поликристаллического 'графита. Однако с помощью рентгено-
структурного анализа нельзя обнаружить все дефекты, при-
сутствующие в кристаллической решетке. • Для того чтобы
сделать однозначное заключение об анизотропии электронных
свойств графита, необходимо иметь более совершенные мето-
ды наблюдения дефектов кристаллической структуры.
При отсутствии точной информации об остаточных дефек-
тах, которые могут присутствовать даже в монокристаллах
почти идеального графита, отношение удельных сопротивле-
ний ( /ра), измеренных в направлениях, перпендикулярном
и параллельном оси а гексагональных сеток углеродных ато-
мов, указывает лишь на предельные значения величины, ожи-
даемой для кристаллов без дефектов. Даже в пиролитическом
графите, полученном с помощью крекинга метана на нагретой
поверхности углерода с последующей термообработкой при
2100° С, отношение удельных сопротивлений для осей с и а,
характеризующее анизотропию, достигает приблизительно 104
[140]. Такие образцы отличаются хорошим параллельным рас-
положением гексагональных сеток, однако и они в общем
далеки от монокристаллов, и, кроме того, на дефектах ре-
шетки этих кристаллов может удерживаться незначительное
количество водорода. Самая высокая величина этого отноше-
ния для небольших монокристаллов естественного графита
[318] составляет точно так же около 104 (ср. [254, 255]).
Вызывает недоумение тот факт, что по другим известным
измерениям, выполненным на тщательно приготовленных мо-
нокристаллах, отношение рс/ра не превосходит 200 [829, 831];
Электронные свойства и структура связей графита 123
низкие значения зарегистрированы, по-видимому, также для
других пиролитических пленок углерода [362]. Представляется
вероятным, что присутствие или отсутствие характерных де-
фектов (1.4.2, 1.7.1), таких, как винтовые дислокации, а так-
же дырочные и клещевидные дефекты, имеет решающее влия-
ние на электропроводность в направлении оси с, так что для
отношения, характеризующего анизотропию, может оказаться
существенным как наличие, так и отсутствие дефектов. Оси
винтовых дислокаций направлены примерно перпендикулярно
углеродным гексагональным сеткам. Электропроводность вдоль
винтовой линии соответствовала бы, очевидно, электропро-
водности в направлении, параллельном плоскости углеродных
гексагональных сеток, вследствие чего каждая винтовая дис-
локация в любом образце шунтировала бы на значительной
площади поперечного сечения вокруг винтовой оси участки с
более высоким сопротивлением, соответствующим электропро-
водности по оси с. В связи с этим большое значение могли
бы иметь измерения, выполненные на нитевидных кристаллах
графита (ср. 1.7).
Результаты измерений удельного сопротивления по дан-
ным различных авторов приводятся в табл. 18.
Таблица 18
Удельное сопротивление (в ом см) хорошо ориентированного графита
при комнатной температуре .
Тип графита Ptz Рс Рс/Ра
Гангули и Кришнан [318] Естественный —10“4 — Ю4
Примак и Фукс [829, 830] » 3,8-10"5 —0,01 ^200
Дутта [254] » 9,9-10“5 1,00 1,0-104
Браун н Уотт [140] Пиролитический 6-10”5 0,5 0,8-104
Температурные коэффициенты. Как и в случае самого
удельного сопротивления, в приведенных различными авторами
значениях температурного коэффициента сопротивления поч-
ти идеальных монокристаллов графита существует расхожде-
ние.
Результаты различных исследователей согласуются друг с
другом в том, что температурный коэффициент сопротивления
положителен (как в случае металлов) для направления, па-
раллельного плоскости углеродных гексагональных сеток
5
Температура^
।_
280
Фиг. 33. Удельное сопротивление графита в направлении,
параллельном оси а.
Ф и г. 34. Зависимость логарифма электропроводности сг
от обратной температуры [254].
—электропроводность вдоль основной плоскости;а Ц (а )~ электропровод-
ность в направлении, перпендикулярном основной, плоскости.
Электронные свойства и структура связей графита 125
(фиг. 33) [829, 971]. Для направления, параллельного оси с,
некоторые авторы находят, что этот коэффициент является
отрицательным [318]; другие исследователи [829, 830] получили
для температурного коэффициента при температурах жидко-
го азота положительную величину. На фиг. 34 в полулога-
рифмических координатах представлены некоторые результа-
ты, полученные Дутта [254].
Результаты измерений сопротивления монокристаллов при
температурах около 0°К [829] недостаточно полны для срав-
нения их с данными для поликристаллического графита [849]
и свидетельствуют о дальнейшем резком уменьшении
сопротивления при очень низких температурах. Однако в гра-
фите и его кристаллических соединениях сверхпроводимости
еще не наблюдалось вплоть до 1,25°К [409]. Установлено, что
под действием нейтронной бомбардировки температурный
коэффициент сопротивления монокристаллов становится от-
рицательным, как и у большинства поликристаллических
искусственных графитов. При этом предполагается, что обра-
зовавшиеся дефекты кристаллической решетки увеличивают
количество дырок в валентной зоне [830]. Однако для про-
верки этого предположения необходимы более детальные
исследования.
IV. 11.1. СТРУКТУРА ЭЛЕКТРОННЫХ ЗОН В ИДЕАЛЬНОМ ГРАФИТЕ
Если графит рассматривать как идеальный трехмерный мо-
нокристалл, то электронные уровни можно было бы описывать
с точки зрения резонанса валентных связей [188]. Однако
гораздо более широкое применение получили методы
молекулярных орбит. Сравнительно давно было до-
казано [187, 1091], что л-зону графита можно рассматривать
как зону, расщепленную на заполненную валентную зону и
пустую зону проводимости, которые или только касаются
друг друга, или слегка перекрываются [188]. Точка соедине-
ния этих двух зон показана на фиг. 35 [627]. Расчет энергети-
ческих зон для двумерной модели с сильной связью, проде-
ланный Корбато [186], свидетельствует о том, что взаимодей-
ствия на расстоянии вплоть до девятого соседнего атома все
еще оказывают влияние на конечные результаты вычислений;
это обстоятельство проливает некоторый свет на степень влия-
ния дефектов сетки на физические и химические свойства
графита (ср. [167]).
Все зонные модели для монокристаллов графита в основ-
ном можно использовать для описания электропроводности
вдоль плоскостей углеродных гексагональных сеток. В на-
126
Глава IV
правлении, перпендикулярном указанному, пригодность зон-
ной модели для электропроводности менее очевидна. Опре-
деленные трудности возникают вблизи углов зоны Бриллюэна
[627], Некоторые расчеты [1091] предсказывают тот же поря-
док анизотропии сопротивления, который был получен экспе-
риментально Примаком и Фуксом [829]; из других расчетов
[376] следует гораздо более высокая анизотропия, как это бы-
Фиг. 35. ПЛОТНОСТЬ СОСТОЯНИЙ ДЛЯ ЧИСТОГО ГрЗ-
фита, случай у0=2 эв [627].
Пунктирная линия изображает двумерную плотность
состояний с той же величиной и тем же значением
средней энергии от края зоны.
структуру предпринимались рядом авторов [509, 510, 601]. Их
результаты согласуются с данными по исследованию других
электромагнитных свойств графита (см. ниже).
Различия между зонными структурами гексагонального и
ромбоэдрического графитов [375] носят сложный характер,
однако с помощью указанных выше исследований они должны
отчетливо обнаруживаться. Слончевский [955] предложил ис-
пользовать для описания зонной структуры графита другую
теорию, впервые введенную Уоллесом для случая сильной
связи (ср. [1161]). Для получения «топологии» зон Слончев-
ский произвел подробное исследование теории групп для кри-
сталлов. Вследствие большого расстояния между слоями
взаимодействие между ними трактуется с помощью теории
возмущений; такой подход приводит к модели энергетических
Электронные свойства и структура связей графита 127
зон, включающей лишь небольшое число параметров, которые
должны определяться из опыта. Однако никакой удовлетвори'
тельной корреляции между этой моделью и эксперименталь-
ными значениями абсолютной магнитной восприимчивости
[627] найдено не было. В пределах этой модели, используемой
для объяснения результатов по циклотронному резонансу в
графите [749], рассматривается обширный экспериментальный
материал.
IV. 11.2. ДРУГИЕ ЭЛЕКТРОМАГНИТНЫЕ ПАРАМЕТРЫ ГРАФИТА
Дополнительные сведения о зонной структуре можно по-
лучить из измерений большого количества других электромаг-
нитных параметров графита, которые будут рассмотрены
здесь сравнительно кратко. Основная трудность заключается
в том, что на некоторые свойства могут весьма заметно вли-
ять различного рода дефекты кристаллической структуры, так
как заполненная зона графита практически или касается пу-
стой зоны, или слегка перекрывается с ней. На фиг. 36 [971]
показан один из способов закрепления монокристаллов гра-
фита в экспериментах по измерению гальваномагнитных
характеристик, позволяющий избежать искривления этого
мягкого кристаллического соединения.
Эффект Холла. Исследования эффекта Холла были выпол-
нены на поликристаллическом графите [534] и на тщательна
отобранных и очищенных естественных кристаллах [61, 971,,
972] при температурах, достигающих 1,6°К, и при величине маг-
нитного поля вплоть до 25 000 гс. При низких температурах
для коэффициента Холла были обнаружены зависящие от
магнитного поля осцилляции де Хааза—ван Альфена.
Таблица 1$
Периоды де Хааза — ван Альфена в графите, вычисленные
по данным различных измерений
Pit 10 5/гс Р,2, Ю 5/гс Температура, °К Источник
Восприимчивость 2,20 1,65 1,27 [920, 921]:
. 2,15 1,61 1,367
Магнитосопротивление 2,15 — 1,37 [61]
Коэффициент Холла 2,15 — 1,371
Магнитосопротивление 2,12±0,01 1,59±0,01. 4,2 |
Коэффициент Холла 2,10±0,01 1,57±0,01 4,2 / [971]
128
Глава IV
Ф и г. 36. Один из способов закрепления монокристаллов
графита при гальвавометрических измерениях [271].
Каждое деление линейки у нижнего края фотографии соответствует
1 мм.
Магнитосопротивление. Магнитосопротивление при низких
температурах достигает очень больших значений [971]. Были
обнаружены также осцилляции де Хааза—ван Альфена; кро-
ме того, эффект, подобный эффекту де Хааза—ван Альфена,
наблюдался при низких температурах и для магнитной вос-
приимчивости [61, 920, 921]. Во всех этих экспериментах были
найдены точно такие же осцилляции де Хааза—ван Альфена.
Степень совпадения значений периода Р между последова-
Электронные свойства и структура связей графита
129
магнитного поля Н для графита при 298, 77 и 4,2°К [271].
Точки, соответствующие низким полям, не приведены, чтобы не перегру-
жать графики. Пунктирные кривые представляют собой эмпирические
средние линии.
X кристалл ЕР-7; • кристалл ЕР-14.
тельными пиками (ср. фиг. 37 и 38), подсчитанных из разных
измерений, показана в табл. 19 [971]. Получены два различ-
ных периода PY и Р2.
9 А. Р. Уббелоде
130
Глава IV
Фиг. ,38. Зависимость относительного магнитосопротивления от
величины магнитного поля Н для графита при 77 и 4,2°К [271].
Пунктирные кривые представляют собой эмпирические линии.
х кристалл ЕР-7; О кристалл ЕР-14; V кристалл ЕР-5.
Сопоставление приведенных в этой таблице результатов
с экспериментальными данными по исследованию циклотрон-
ного резонанса в графите [314, 315] позволяет сделать сле-
дующие заключения:
Электронные свойства и структура связей графита 131
1. Электроны и дырки являются собственными носителя-
ми приблизительно в равных количествах: пе^ nh =2,5-Ю18 в
1 см3. Аналогичные значения найдены из измерений сопротив-
ления при нулевом поле [971].
2. Подвижности электронов и дырок имеют значения,
представленные в табл. 20 [971].
3. Эффективные массы т* примерно равны: т£^0,03 т0
(для электронов) и т*^0,06 (для дырок); /и0 — масса по-
коя свободного электрона. Значения т*, полученные из экспе-
риментов по циклотронному резонансу, также согласуются с
указанными величинами [314, 586, 587, 749, 750].
4. И циклотронный резонанс, и эффект де Хааза—ван
Альфена указывают, кроме того, на присутствие в графите
гораздо меньших концентраций других носителей — как элект-
ронов, так и дырок [586, 971, 972] — с более низкими эффек-
тивными массами [749, 750].
Таблица 20
Подвижности основных носителей электричества
в графите
Температура, °К 104 см2/в'сек 104 см2/в-сек Отношение
298 1,6 1,5 1,10
77 9,0 10 0,90
4,2 100 130 0,77
Вследствие различной природы дефектов структуры, при-
сутствующих в разных образцах, при объяснении экспери-
ментальных результатов могут возникнуть осложнения. Де-
фекты могут играть роль или электронных доноров, или ло-
вушек. Преднамеренное создание дефектов при нейтронной
бомбардировке поликристаллического графита приводит к
образованию электронных ловушек, которые можно описать
с помощью теории электронных зон [509]. Однако до сих пор
не установлено никакой связи между изменением коэффициен-
та Холла и концентрацией дефектов, введенных иными путя-
ми в другие образцы графита. Поэтому пока результаты экс-
периментов не получат более определенного истолкования.^
подробное обсуждение теории является преждевременный
(см. [626, 1067]).
9*
132
Глава IV
IV.11.3. ТЕРМОЭЛЕКТРОДВИЖУЩАЯ СИЛА
Величина термоэлектродвижущей силы (термо-э. д.с.) гра-
фитов и углеродов может заметно зависеть от того, присутст-
вуют ли в кристалле крупные дефекты. Уже первые исследо-
вания на различных коксах и углеродах [599] обнаружили
Фиг. 39. Зависимость термо-э.д.с. в для
системы поликристаллический графит — гра-
фит, ориентированный по оси а, от температу-
ры [470].
связь между термо-э. д.с. и последовательной графитизацией,
которую можно объяснить в полном соответствии с измене-
ниями других параметров (ср. фиг. 30).
Отдельные исследователи предпринимали попытки изме-
рить анизотропию термо-э. д. с. графита. Величина термо-э. д.с.
была определена Уббелоде и Орром [1057] для превосходно
ориентированных естественных кристаллов, содержащих зна-
чительные количества примесей. Для монокристаллических
образцов графита и хороню ориентированного пиролити-
ческого графита, полученного с помощью крекинга метана,
Электронные свойства и структура связей графита 133
термо-э.д.с. составляет приблизительно —9 мкв/°С в образ-
цах, ориентированных по оси а, и + 6 л*юз/оС по оси с. Зна-
чение абсолютной термо-э. д. с. для меди при 20°С по отноше-
нию к тому же эталону равно 1,9 мкв/°С. Положительный
знак для термо-э. д.с. соответствует случаю, когда термоэлек-
трический ток в холодном спае течет от образца к эталонно-
му металлу. Напряжение Зеебека на холодном спае при этом
будет положительным для 'положительной термо-э. д.с. [1138].
Указанные выше значения близки, вероятно, к значениям тер-
мо-э. д. с. для идеальных монокристаллов графита (неопубли-
кованные сообщения Блэкмена, Дандеса и Уббелоде). На
фиг. 39 показана величина э. д. с. термопары, изготовленной
из ориентированного по оси а монокристалла и поликристал-
лического графита [1064].
.IV. 11.4. ТЕРМОИОННЫЕ КОНСТАНТЫ
Что касается термоионных констант графита, то работа
выхода ф равна 4,62 ±0,02 эв при постоянной истечения А =
= 60±2 см~2-град~2. Спектральная удельная эмиссия неод-
нократно определялась в интервале температур от 1200 до
1700°К [П9, 501].
IV. 11.5. ОПТИЧЕСКИЕ И ДИЭЛЕКТРИЧЕСКИЕ
СВОЙСТВА ГРАФИТА
Следует особо коснуться вопроса о том, почему углерод
часто бывает черным, вместо того чтобы иметь серебристый
металлический отблеск, подобно большинству настоящих ме-
таллов. Внешний вид графита в значительной мере зависит
от степени совершенства его кристаллической решетки. Гра-
фит, осаждаемый при высоких температурах из газовой фазы
(например, при нагревании углеродных нитей в метане), мо-
жет иметь серебристый отлив. Естественный кристаллический
графит блестит почти так же, как металлы, в то время как
плотно связанный поликристаллический графит имеет черный
цвет (см. фиг. 36). В этом состоянии поверхность твердого
тела не обладает способностью отражать падающий на нее
свет. Вероятно, присутствующие в твердом теле электроны,
которые приходят в движение под действием электромагнит-
ного поля падающей световой волны, имеют чрезвычайно
благоприятные возможности для рассеяния передаваемой
кристаллу энергии без заметного отражения ее. Это сообра-
жение позволяет сделать предположение о наличии корреля-
ции между долей крупных дефектов графита и его отража-
134
Глава IV
тельной способностью. В этой связи ранее уже упоминалось
о прозрачности некоторых разновидностей графита (разд. I. 5).
В результате предварительных исследований отражатель-
ной способности различных почти идеальных графитов около
2600 А был обнаружен пик с резким спадом со стороны длин-
новолновой части спектра до более или менее постоянной ве-
личины. Этот эффект приписывался резонансу, который, воз-
можно, связан с известным переходом при 2600 А для бензо-
ла и с пиком вблизи этого значения длины волны,
найденным во' многих многоядерных соединениях. Фото-
электрическая работа выхода, равная 4,70 эв, соответствует
пороговой длине волны 2600 А; ее связь с пиком отражатель-
ной способности в этой области до настоящего времени яв-
ляется предметом обсуждения [480].
Из микроскопических измерений отражательной способно-
сти монокристаллов графита в воздухе, воде и кедровом мас-
ле для направлений, параллельного и перпендикулярного
плоскостям слоев, были определены показатели преломления
и поглощения. Найденные максимальное и минимальное зна-
чения показателя преломления графита равны 2,15±0,04 и
2,04±0,04 [622]. Эти значения соответствуют значениям отра-
жательной способности в воздухе, составляющим около 28%
для основной грани и около 12% для грани’ 1012). Если
максимальная величина показателя преломления почти не
отличается от минимальной, то разница между значениями
показателя поглощения оказывается гораздо более заметной.
Для основной плоскости показатель поглощения равен 0,65±
±0,03, а минимальная величина составляет лишь 0,01. Такое
низкое значение присуще обычно диэлектрикам (непровод-
никам). Эта разница лучше согласуется с высоким отноше-
нием сопротивлений рс/ра, имеющим порядок 104—105,чем с
низким (ср. разд. IV. 11).
IV.11.6. ОПТИЧЕСКИЕ И ДИЭЛЕКТРИЧЕСКИЕ СВОЙСТВА
УГЛЕЙ
Измерения диэлектрической постоянной и молярной реф-
ракции углей [926] показывают, что их приращение на 1 атом
углерода падает с увеличением содержания углерода при зна-
чениях последнего примерно выше 89%. Оказывается, что в
таких углеродах, по-видимому, возможен перенос зарядов
между двумя или более параллельными слоями. Однако экс-
траполяция подобных данных на почти идеальный графит
представляется рискованной.
Электронные свойства и структура связей графита 135
IV.12. СТРУКТУРА ЭЛЕКТРОННЫХ ЗОН В АНАЛОГАХ ГРАФИТА
Аналогами графита в отношении зонной структуры явля-
ются соединения, полученные в результате внедрения в графи-
товые сетки других атомов, и соединения с полностью заме-
щенной структурой графита, как, например, нитрид бора.
О внедрении инородных атомов, таких, как Н, О и, возмож-
но, N, неоднократно упоминалось выше в связи с углеродами,
полученными с помощью пиролиза более мелких органиче-
ских молекул. Вся совокупность известных данных показы-
вает, что при этом имеют место значительные изменения. Тем
не менее систематических исследований электронных свойств
графита с точки зрения особого влияния на них внедренных
атомов было проведено мало. По-видимому, те атомы, кото-
рые расположены в периодической системе справа от угле-
рода, играют роль электронных доноров и инжектируют
электроны в верхнюю (почти пустую) зону проводимости гра-
фита. Таким образом, вследствие присутствия этих атомов
углерод должен был бы стать более электроположительным
«металлом» с более высоким отрицательным температурным
коэффициентом электропроводности. Однако другие структур-
ные эффекты, которые связаны с внедрением таких дефектов,
могли бы нарушить любую несложную корреляцию, особенно
в том случае, когда присутствие инородных атомов вызывает
заметное уменьшение размеров углеродных сеток.
До настоящего времени не получены углероды, содержа-
щие гетероатомы кислорода, азота или серы [44] (ср. [918])
и одновременно настолько свободные от крупных дефектов,
что можно было бы с уверенностью сказать, являются ли эти
инородные атомы частью ароматических углеродных гексаго-
нальных сеток или они удерживаются неграфитовыми связя-
ми. Оба типа связи хорошо известны в химии сравнительно
небольших ароматических молекул.
Для л-электронйых зон оба случая должны приводить к
весьма различным следствиям; это обстоятельство могло бы
способствовать успешному изучению электронных свойств не
очень несовершенных графитов.
В результате внедрения атомов бора [362] электросопро-
тивление углеродных элементов сопротивления понижается,
а его отрицательный температурный коэффициент умень-
шается по абсолютной величине, если только количество ато-
мов не превышает примерно 4%. Вообще говоря, атомы бора,
каждый из которых лишен электрона, по-видимому, получают
электроны из заполненной зоны. Однако законченного теоре-
тического исследования этого процесса не проводилось.
136 Глава IV
В хорошо известном кристаллическом аналоге графита,
твердом нитриде бора (см. гл. III, разд. 9.2) благодаря более
высокой электроотрицательности по сравнению с бором
такое перераспределение электронов придает сеткам ча-
стично ионный характер. Локализованные связи соединяют,
вероятно, атомы азота и бора в какой-нибудь одной плоско-
сти, причем электроны остаются на орбитах, простирающихся
по всей сетке (ср. [188]). Интервал между заполненной и
пустой л-подзонами в нитриде бора составляет приблизитель-
но 4,6 эв в противоположность совсем небольшому значению
в случае графита. Это обстоятельство ставит нитрид бора,
несмотря на его структурную аналогию с графитом, в один
ряд с диэлектриками.
ГЛАВА V
КРИСТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ ГРАФИТА
Как следует из гл. IX, графит претерпевает ряд окисли-
тельных процессов, которые приводят к образованию газооб-
разных продуктов, особенно при высоких температурах, где
необходимая для этого перестановка связей протекает с до-
статочно высокой скоростью. При обычных температурах гра-
фит реагирует гораздо слабее и образует кристаллические
соединения, в которых, однако, сохраняется слоистый каркас
углеродных ядер. Это обстоятельство позволяет считать такие
материалы кристаллическими соединениями графита; это со-
ображение подтверждается еще и тем, что при восстановле-
нии указанных соединений, как правило, опять получается,
графит с почти неизменившимся каркасом.
Кристаллические соединения графита, по-видимому, удоб-
но представлять в качестве твердых производных графита, в
которых слои углеродных макромолекул сохраняют прису-
щую им структуру и ароматический характер. Хорошо изве-
стно, что более мелкие ароматические системы образуют про-
дукты присоединения и поляризации [456, 957]. В этих про-
дуктах, как и в большинстве обычных ароматических заме-
щенных соединений, каркас атомов углерода во всех
отношениях остается неизменным. Не останавливаясь на бо-
лее детальном обсуждении структуры, которое приводится
ниже, следует сказать, что в кристаллических соединениях
графита предполагается аналогичная неизменность углерод-
ного каркаса.
Кристаллические соединения графита, образованные при
внедрении добавок, легко отличить от окиси графита. Окись
графита, которую называют иногда графитовой кислотой,,
представляет собой предельный случай, характеризующийся
радикальным изменением углеродного каркаса графита под
действием длительных процессов окисления и гидратации. Так
как сетка углеродных атомов в окиси имеет, вероятно, изо-
гнутую форму и не обладает ароматической структурой, а
138
Глава V
сама окись не может снова перейти в графит -без сравнитель-
но интенсивного химического превращения, эту стадию окис-
ления удобнее обсуждать отдельно (гл. VIII). Ряд фторидов
углерода [884] и других аналогичных соединений отличается,
по-видимому, подобным же образом от соединений внедрения
(см. ниже).
По способу образования среди кристаллических соедине-
ний внедрения естественно различать соединения, полученные
электрохимическими методами, в которых углерод ведет себя,
по-видимому, как макрокатион, и соединения, полученные в
результате простого присоединения добавок. Продукты пря-
мого присоединения удобно в свою очередь разделить на две
группы: в соединениях первой группы добавки (например,
атомы щелочных металлов) играют роль электронных доно-
ров, в соединениях второй группы — роль электронных ак-
цепторов (А1С1з). Поскольку это различие основано на опре-
деленном истолковании структуры, которое не всегда является
окончательным, то ниже для удобства предлагается следую-
щая классификация соединений:
1) соединения, полученные электрохимическими методами;
2) продукты присоединения атомов металла;
3) многоатомные соединения внедрения.
Для рассмотренных ниже соединений внедрения различ-
ных типов предполагается внедрение добавки между
углеродными гексагональными сетками, для которых, по-ви-
димому, сохраняется как ароматический характер, так и пло-
ская форма. Практически образцы графита содержат различ-
ные дефекты, на которых тоже могут происходить реакции с
добавками, протекающие в условиях совершенно другой ва-
лентности. Это обстоятельство особенно справедливо для де-
фектов сетки, которые, вероятно, являются причиной образо-
вания «остаточных соединений» графита. Закрепление доба-
вок на таких дефектах происходит, по всей вероятности,
одновременно с их внедрением между слоями и может даже
предшествовать ему. Хотя подобными факторами часто пре-
небрегают, их всегда необходимо учитывать, например, при
обсуждении ранних стадий процесса электрохимического
окисления графита.
VI. СТЕХИОМЕТРИЯ КРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
В случае кристаллических соединений графита нет необ-
ходимости добиваться такой строгой стехиометрии, как для
других кристаллических соединений [20, 847]. Даже если тео-
Кристаллические соединения графита 139
ретйчески все места в кристаллической решетке эквивалент’
ны для внедрения атомов, то и тогда можно ожидать возник-
новения разнообразных соединений, структура которых будет
зависеть от температуры. Кроме того, дефекты сетки и де-
фекты упаковки в графите могут оказывать влияние на состав
образующихся соединений. В ряде случаев при образовании
соединений наблюдались явления гистерезиса, так что во мно-
гих опытах по их приготовлению трудно гарантировать усло-
вия истинного термоцинамического равновесия.
V.I.I. ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ГРАФИТА
ЭЛЕКТРОХИМИЧЕСКИМИ МЕТОДАМИ
Бисульфат графита. Реакция образования бисульфата гра-
фита, по-видимому, сопровождается слабым электрохимиче-
ским окислением. Впервые она была описана в 1841 г. Шауф-
хейтлем [911] и довольно подробно исследована Броди [133].
Если упорядоченный углерод в виде графита нагреть с кон-
центрированной серной кислотой, к которой добавлена в ка-
честве окислителя достаточно крепкая азотная кислота, то
твердая фаза набухает и превращается из черной в голу-
бую. К другим окисляющим агентам, успешно использовав-
шимся для получения бисульфата графита, относятся: СгО3,
KMnO4, (NH4)2S2O8, MnO2, PbO2, As2O5 [1026], йодноватая и
иодная кислоты, а также соли трех- и четырехвалентного
марганца [445, 879]. Эти вещества могут функционировать в
качестве окисляющих агентов при наличии радикалов ОН
[1048]. Такие галогены, как хлор и бром, значительно менее
эффективны по сравнению с растворами в концентрированной
серной кислоте; это объясняется, вероятно, тем, что они могут
непосредственно сами образовывать продукты присоединения.
Как известно, бисульфат графита образует суспензии в
кислой среде, способные подавлять гидролиз (например, в
пирофосфорной кислоте) [305]. С различными предосторож-
ностями бисульфат графита можно выделить после промывки
и очистки пирофосфорной кислотой [881]; его состав близок к
C+24(HSO4)^2H2SO4.
Промывка этого кристаллического соединения водой, раз-
бавленной кислотой или щелочью (NaOH), вызывает потерю
серной кислоты и ведет к возникновению дискретного ряда
промежуточных продуктов. При этом может образоваться не-
сколько форм окиси графита, однако до сих пор тщательных
исследований такого разложения не проводилось. Разложение
бисульфата легко осуществить также с помощью кислотно-
140
Глава V
восстанавливающего агента, каким, например, является сер-
нокислое железо [305].
Установлено, что в ряде случаев маточный трафит в про-
цессе приготовления бисульфата графита после образования
соединения становится «рассыпающимся»; это объясняется,
по-видимому, тем, что вследствие расширения, обусловленного
процессами электрохимического окисления, и включения от-
рицательных ионов внутри твердого тела возникают силы,
превосходящие его предел прочности. Это явление можно-
легко понять на примере поликристаллического графита, в.
котором заметное расширение в направлении оси с происхо-
дит настолько неравномерно, что приводит к образованию
внутренних напряжений. В случае монокристаллов или хоро-
шо ориентированного графита можно предположить замет-
ное уменьшение тенденции к разрушению кристалла при об-
ратимой реакции образования бисульфата.
Несмотря на наличие экспериментальных доказательств
обратимого электрохимического окисления и восстановления
графита в серной кислоте [305], ни о каком детальном изме-
рении потенциала этого электрохимического окисления для
вполне образовавшегося слоистого соединения, по-видимому,
не известно (тем не менее см. [413]). Из опубликованных ра-
бот следует упомянуть лишь о результатах предварительных
измерений электродного потенциала «остаточных» соединений
[407]. Бисульфат графита можно получить также с помощью
реакций на электроде, в процессе которых упорядоченный уг-
лерод в виде графита, погруженный в концентрированную
серную кислоту, используется в качестве анода [1028]. Этим
путем можно изготовить множество других производных кис-
лоты. Анодное окисление имеет значительные преимущества
как с точки зрения осуществления довольно точного контроля
над количеством включенного вещества, так и проведения
одновременных измерений физических свойств [407]. Если при
этом используются не монокристаллы, то для предотвраще-
ния растрескивания электрода, вызванного разбуханием твер-
дого вещества, требуются особые предосторожности. В слу-
чае поликристаллического графита такое растрескивание
обычно ограничивает диапазон измерений тех или иных ха-
рактеристик небольшими начальными дозами включения. До-
полнительные трудности могут возникнуть из-за неоднород-
ности образца, обусловленной неравновесным распределе-
нием добавок в процессе диффузии.
Электрохимическую природу бисульфата графита можно
продемонстрировать, погружая частицы 'графитового спеля и
бисульфата графита в концентрированную H2SO4. До соеди-
Кристаллические соединения графита 141
нения двух частиц платиновой проволокой реакции не проис-
ходит, тогда как при их соединении спель превращается в
не полностью окислившийся бисульфат, а бисульфат графита
восстанавливается до более низкой стадии окисления (ср.
[445, 879]).
К химическим реакциям бисульфата графита следует так-
же отнести:
1. Двойное разложение, которое наблюдалось также меж-
ду другими солями графита. Равновесие реакции
Фосфат графита + H2SO4 X Сульфат графита + Н3РО4,
по-видимому, смещено далеко вправо;, таким образом, ор-
тофосфорная кислота легко замещается серной, однако об-
ратная замена затруднена [855].
2. Сильное взаимодействие с щелочами и водой с выделе-
нием небольшого количества двуокиси углерода.
3. Мгновенное разложение под действием органических со-,
единений, таких, как простые эфиры, спирты, ледяная уксус-
ная кислота или сложные эфиры. Алифатические углеводоро-
ды, СС14, СНС1з и CS2 с бисульфатом не реагируют. Осушен-
ные бензол и толуол вступают в реакцию, вероятно, с
образованием соответствующих сульфокислот.
Все попытки использовать для приготовления бисульфата
графита менее упорядоченный графитизированный углерод
оканчивались тем, что превращение углерода в бисульфат в
зависимости от структуры используемого твердого вещества
либо совершенно не имело места, либо происходило только
частично. В свете известных структур, содержащих дефекты
(см. разд. 1.4, 1.4.1 и 1.4.2), можно ожидать, что основным
препятствием для электрохимического окисления при получе-
нии бисульфата графита будут неароматические С—С-связи,
соединяющие углеродные гексагональные сетки. Эти связи
будут мешать разделению слоев, которое необходимо для
включения добавки при образовании слоистых соединений
графита. В известном смысле действие таких поперечных де-
фектов в углеродах можно сравнить с действием поперечных
звеньев в вулканизированной резине, которые затрудняют ее
разбухание в растворителях и возможное образование дис-
персии, аналогичной коллоидному раствору. Если количество
поперечных звеньев на единицу объема кристалла очень мало,
они замедляют разбухание/ не предотвращая образования
дисперсии; если же количество звеньев велико, то дисперсии
не происходит.
При изучении электронных свойств графита были пред-
приняты попытки связать действие нейтронного облучения
на графит с образованием кристаллических соединений.
142
Глава V
Полученные результаты оказались слишком сложными для
интерпретации, поэтому за дальнейшей информацией следует
обратиться к оригинальной литературе [418].
Продолжительное окисление графита в несколько менее
сильном растворе кислоты приводит к образованию окиси гра-
фита и в конечном счете к образованию меллитовой кислоты
Сб(ОН)б, которая еще сохраняет ароматическую структуру.
В результате дальнейшего окисления эта кислота превра-
щается в двуокись углерода.
Другие кислые соли графита. Кроме кислого бисульфата,
с помощью аналогичных методов было получено большое
количество самых различных кислых солей графита, в том
числе нитрат, перхлорат, биселенат, пирофосфат, фосфат
и арсенат [855]. Большая часть кислых солей разлагается
даже под действием малейших следов воды, присутству-
ющей в сильных кислотах, используемых для их приготовле-
ния [441].
Значительный интерес представляют изменения различных
состояний электронов, сопровождающие реакцию разложе-
ния, однако природа этих изменений еще не ясна. Нитрат
графита является единственной кислой солью, которая, по-
видимому, была выделена в виде твердого соединения. Не-
смотря на то что нитрат графита разлагается даже при про-
мывке концентрированной азотной кислотой с удельным
весом 1,48, в герметически запаянных трубках его можно хра-
нить, вероятно, в течение нескольких дней [839], не опасаясь
разложения. Не исключена возможность того, что в действи-
тельности нитрат графита является одной из форм окиси
графита (гл. VIII).
Кислые соли относительно сильных органических кислот
можно получить в процессе реакции на аноде или при ис-
пользовании достаточно сильных окисляющих агентов, раст-
воренных в этих кислотах. Их можно приготовить также с
помощью реакции двойного разложения в процессе промывки
бисульфата графита кислотой [894]. Среди уже исследован-
ных кислот следует отметить трифторуксусную CF3*COOH и
борфторуксусную BF3(CH3COOH) кислоты. Соли таких кис-
лот были получены как с заполнением всех слоев, так и с
меньшим числом внедренных атомов.
C+24HF“22H2F2 и аналогичные соединения с более низ-
ким содержанием фтора очень похожи на другие кислые соли
графита [886]. Они образуются в результате сходных процес-
сов, в том числе при анодном окислении графита в жидком
безводном HF. После пропускания газообразного фтора через
безводную HF, в которую помещен трафит, при комнатной
Кристаллические соединения графита 143-
температуре в течение нескольких минут образуется голубое
твердое вещество. Если к соединению, полностью насыщен-
ному фтором, добавить избыток графита, то получаются бо-
лее низкие состояния окисления. Такие соединения являются
окисляющими агентами, выделяющими иод из HJ.
• Рентгеноструктурные исследования показывают, что внед-
рение добавок в пространство между углеродными гексаго-
нальными сетками увеличивает расстояние между ними при-
близительно до 8,08А. При этом ароматический плоскостной
характер углеродных сеток, очевидно, сохраняется (ср.
табл. 24, разд. VI. 3. 2).
V.2. КРИСТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ ГРАФИТА
С МЕТАЛЛАМИ
Для щелочных металлов были разработаны различные
способы прямого и надежного введения атомов в решетку
графита.
Общепринятый метод получения соединений графита с ще-
лочными металлами (такими, как калий) основан на том, что
при любой температуре кристаллическому соединению, со-
держащему добавку типа калия, соответствует определенное
давление паров металла. Для приготовления нужного соедине-
ния необходимо подвергнуть графит действию достаточно вы-
сокого давления паров калия, которое создается в результате
нагревания чистого металла до соответствующей температу-
ры в том же эвакуированном объеме, в который помещен гра-
фит. По-видимому, существует дискретный ряд кристалличе-
ских соединений графита, которые могут образовываться при
добавлении определенного количества второго компонента.
Фиг. 40 иллюстрирует такое ступенчатое образование соеди-
нений графита с калием. Таким образом, для получения кри-
сталлического соединения требуется, чтобы давление паров,
необходимое для введения атомов металла с помощью сорб-
ции, превышало давление, соответствующее разложению это-
го соединения. Однако это значение должно лежать ниже
давления, при котором происходит разложение следующего
соединения, более богатого металлом. Однако не для всех
случаев имеются достаточно полные кривые давления паров
[422]. Соответствующие пары значений температуры для про-
цесса ступенчатого образования были найдены для большого
количества кристаллических соединений [300, 301, 421, 422,
629]. В качестве примера такого ступенчатого процесса мож-
но указать на образование С8К при температуре графи-
144
Глава V
та 400°С и температуре калия 360°С и С24К при температурах
графита и калия 400°С и около 285°С соответственно.
С точки зрения вероятной структуры связей в соединениях
графита с металлом важно иметь данные о влиянии различ-
ного рода дефектов кристалла на образование этих соеди-
нений. Согласно опубликованным данным, чрезвычайно несо-
вершенные графиты, такие, как сажа, поглощают калий в тех
Ф и г. 40. Изобара соединения графита с калием [422].
Графит поддерживается при температуре i2°C; температура
паров калия Л=250°С.
же количествах, что и более совершенные графиты. Однако
сопоставление результатов для углеродов, способных и неспо-
собных к графитизации при нагревании, показывает, что при-
соединение калия происходит наиболее легко в графитовой
области углеродного полимера [844, 815]. В то же время про-
цесс внедрения натрия в графит, как показано ниже, проте-
кает, по-:видимому, с затруднениями, хотя с сажей он соеди-
няется в значительных количествах [30Г]. Возможно, что тип
связи между атомами щелочного металла и углеродными гек-
сагональными сетками сажи аналогичен типу связи для бо-
лее мелких ароматических молекул ([456], а также см. ниже).
Если это так, то атомы водорода, закрепленные на краях
углеродных гексагональных сеток сажи, вследствие изменения
электронных энергетических уровней могут облегчать процес-
сы переноса электронов по сравнению с идеальным графитом.
Кристаллические соединения графита 145
Во время приготовления кристаллического соединения гра-
фит сначала обезгаживается в высоком вакууме при самой
высокой температуре, а затем, как описывалось выше, под-
вергается воздействию паров второй компоненты. Через не-
сколько часов после завершения сорбции образец герметиче-
ски запаивается, что обычно осуществляется с помощью не-
большой вспомогательной спирали, через которую
пропускается электрический ток.
Эта методика использовалась при изготовлении соедине-
ний калия, рубидия и цезия, однако для соединений лития и
натрия она до сих пор не давала положительных результатов.
Тщательные рентгенографические исследования порошкооб-'
разных кристаллических соединений калия и рубидия [887]
показывают, что последовательный ряд этих соединений
имеет разрыв. Идеальными формами для кристаллических
соединений обоих щелочных металлов являются: С8М, С24М,
С36М, С48М и -СбоМ. Вследствие образования дефектов для
реального состава кристаллического соединения могут по-
явиться отклонения в любом из двух направлений, так что в
случае С24М действительный состав при неизменной структуре
колеблется между C2iM и С27М. С уменьшением содержания
металла цвет соединения постепенно становится более насы-
щенным: С8М имеет оранжевый цвет, соединения между Ci6M
и С30М темно-голубые, а начиная с С40М и далее соединения
имеют черный цвет. Следует заметить, что с помощью срав-
нительно слабой обработки в кипящей воде нельзя удалить
более 10% щелочного металла.
Соединения графита с щелочными металлами вполне ста-
бильны при обычных температурах и в вакууме, хотя (как
это следует из самих методов получения) при более высоких
температурах щелочной металл теряется вследствие испаре-
ния. В воздухе эти порошки легко окисляются, а при свобод-
ном доступе кислорода могут самопроизвольно воспламе-
няться.
Образование соединения графита с калием и аммиаком
(см. ниже) наблюдалось в том случае, когда на графит воз-
действовали растворами калия в жидком аммиаке.
V.2.I. СТЕХИОМЕТРИЧЕСКОЕ ПРИСОЕДИНЕНИЕ
ЩЕЛОЧНЫХ МЕТАЛЛОВ
В том случае, когда взвешивание металла, присоединяе-
мого к графиту, можно осуществить без разложения соеди-
нения для непосредственного образования некоторых соеди-
10 А. Р. Уббелоде
146
Глава V
нений графита [887], очень удобно использовать нагрев пред-
варительно обезгаженного, почти идеального графита в при-
сутствии строго определенного количества второго компонента.
Таким путем были получены соединения калия, рубидия
и цезия [889]. Этот способ облегчается при использовании
метода взвешивания точных количеств чистого калия, описан-
ного Льюисом [594].
В соответствующих условиях можно ввести небольшие
количества и таких атомов, как натрий [422]; известны также
данные о соединениях графита с литием. С .помощью рентге-
ноструктурного анализа и при исследовании магнитных
свойств было обнаружено образование соединения графита с
натрием примерного состава Ce4Na, получавшегося при на-
гревании металла с порошкообразным графитом в течение
1 час при температурах около 400°С [30, 31]. Это соединение,
как уже сообщалось, имеет темно-фиолетовый оттенок.
Из данных рентгенографических исследований следует,
что в этом кристаллическом соединении каждый восьмой слой
расширяется примерно до 3,35—4,6 А. Если это действительно
так, то не ясно, почему натрий не входит в другие слои. Для
приготовления смешанных соединений графита с натрием и
калием применялись также жидкие смеси и жидкие сплавы.
[422]; в этом случае на внешней поверхности использованных
зерен графита может оставаться избыточный натрий (неопуб-
ликованные данные Уббелоде, Льюиса и Орра).
Данные о получении кристаллических соединений с желе-
зом [560] или с щелочноземельными металлами [409, 960}
нуждаются в проверке, так как эти продукты могли содер-
жать и другие молекулы, как это наблюдается в случае со-
единений графита с щелочнььм металлом и аммонием (см.
ниже).
Приготовление соединений с помощью электролиза. Элек-
тролиз расплавов представляет собой еще один метод при-
готовления соединений графита с щелочным металлом. Одна-
ко этот метод наталкивается на трудности, связанные с извле-
чением из расплава готового материала. Тем не менее в ре-
зультате электролиза смешанных расплавов КС1—LiCl было
получено соединение, которое оказалось производным лития
[422].
Кристаллические соединения с металлом и аммиаком. Со-
единения графита с щелочными и щелочноземельными метал-
лами были приготовлены путем электролиза растворов солей
этих металлов в жидком аммиаке [261, 409, 889, 960]. В ре-
зультате сопоставления аминов различных щелочных метал-
лов [889] установлено:
Кристаллические соединения графита 147
1. Для всех пяти щелочных металлов при непосредствен-
ном взаимодействии графита с аминами, а в случае К, Rb и
Cs при воздействии на С8М жидкого NH3 образуется кристал-
лическое соединение темно-голубого цвета с примерным со-
ставом Ci2M(NH3)2.
2. Стабильность соединений графита с металлами К, Rb,
Cs и аммиаком не отличается от стабильности кристалличе-
ских соединений, не содержащих аммиака. Атомы Li или Na
при обработке соединения избыточным жидким NH3 могут
вымываться, тогда как остальные щелочные металлы обра-
зуют более устойчивые производные. Это зависит, по-видимо-
му, от энергии ионизации и поляризуемости атомов щелочных
металлов (ср. разд. VI. 4.).
3. Во всех случаях решетка расширяется, так что расстоя-
ние между слоями, если не учитывать присутствия щелочно-
го металла, становится равным 6,6А.
4. Можно выделить также кристаллические соединения се-
рого или черного цвета с примерным составом C24M(NH3)2»
5. Данные рентгеноструктурного анализа показывают, что
углеродные сетки по обеим сторонам слоя, содержащего1
M(NH3)2, лежат непосредственно одна над другой. Углерод-
ные сетки слоев, не содержащих M(NH3)2, располагаются в
шахматном порядке, как в гексагональном графите (ср. так-
же разд. VI. 3 для сопоставления различных свойств в ряду
соединений графита с щелочными металлами).
6. Если в пространство между углеродными гексагональ-
ными сетками графита входят метиламиновые растворы ли-
тия, то образуется кристалл голубого цвета с примерным со-
ставом Ci2Li(CH3NH2)2. При этом расстояние между углерод-
ными слоями увеличивается приблизительно до 6,9 А.
V.3. СЛОИСТЫЕ СОЕДИНЕНИЯ ГРАФИТА С ГАЛОГЕНАМИ
С8Вг. При непосредственном соприкосновении паров бро-
ма с почти идеальным графитом легко образуются слоистые
соединения определенного состава. В случае монокристаллов
графита внешняя форма соединения, несмотря на его расши-
рение вдоль оси с, может остаться неизменной, поскольку
включение брома, по-видимому, не вызывает разрушения аро-
матических сеток. Явление расширения графита в присутст-
вии паров брома впервые было установлено в 1933 г. [304].
При достижении определенного значения химического потен-
циала брома соединение графита с бромом можно осущест-
вить или с помощью электролиза расплавленных солей [883],.
10*
148
Глава V
или лри медленном внедрении атомов брома из растворов в
серной кислоте. Для получения соединений заданного соста-
ва удобно использовать раствор брома различной концент-
рации в ряде органических растворителей (неопубликованные
результаты Орра и Уббелоде). В случае поликристаллическо-
гр графита «блокирование» части материала уменьшает пре-
дельную абсорбцию (см. разд. V. 4).
C5JCI. Однохлористый иод легко образует соединение,
которое характеризуется полным включением галогенов [200,
408, 890]. Следует отметить, что при комнатных температурах
ни хлор, ни иод сами по себе, по-видимому, почти не обра-
зуют соединений с графитом.
С8С1. Небольшие количества хлора можно внедрить только
в особых случаях [408] при комнатных температурах. С по-
мощью специальной методики оказывается возможным полу-
чить соединение с внедрением хлора до предела [517, 518] да-
же при —789С, которое, по-видимому, очень похоже на соот-
ветствующее соединение графита с бромом. Заметный
диамагнетизм графита исчезает при образовании кристалли-
ческого соединения, являющегося лишь слабым диамагнети-
KOiM.B присутствии НС1 или при использовании вместо чистого
графита остаточного соединения брома скорость проникнове-
ния хлора значительно увеличивается, а количество внедрен-
ного хлора, вероятно, достигает более высоких конечных зна-
чений [518]. Как показывают измерения плотности, при обра-
зовании С8С1 из графита происходит увеличение объема
приблизительно на 42%.
C8JxBry. В остаточные соединения брома может быть так-
же внедрено некоторое количество иода. После введения до-
бавки отрицательная магнитная восприимчивость (ср. разд.
VII. 3) по абсолютной величине уменьшается; при этом пра-
вильной стехиометрии не наблюдается.
Йодистый бром легко абсорбируется графитом вплоть до
некоторого предельного состава C8JxBry, где (х+у) = 1. Что
касается процесса удаления атомов галогена, то бром те-
ряется гораздо быстрее, чем иод, вследствие чего оставшееся
соединение оказывается обогащенным иодом [180].
CF. Соединения графита с фтором образуются при нагре-
вании в присутствии газа до температуры около 400°С [898].
Эти соединения по своим свойствам совершенно не похожи
на кристаллические соединения внедрения в случае осталь-
ных галогенов. CF, так же как. и C4F, прочно удерживает
фтор. CF представляет собой серое гидрофобное твердое со-
единение, которое не смачивается такими органическими жид-
костями, как бензол, ацетон, спирт и уксусная кислота.
Кристаллические соединения графита 149
Кристаллохимические свойства твердого CF подробно еще
не изучены. Это соединение 'практически является изолятором
(неопубликованные данные Орра и Уббелоде). Можно пред-
полагать, что связи между фтором и углеродом носят кова-
лентный характер с наличием заметной поляризации, вслед-
ствие которой фтор становится отрицательно заряженным
[768]. Эта структура предполагает наличие углеродной макро-
молекулы, в которой сетка является алифатической, а не аро-
матической; вероятно, существующие углеродные сетки обла-
дают з/Агибридизацией. Рентгенограммы [884] показывают,
что длина С—С-связи в сетке увеличивается до величины,
равной расстоянию между слоями 8,17А. При тщательном
контроле процесса взаимодействия между графитом и газо-
образным фтором при температурах 400—500°С были полу-
чены твердые соединения с составом между CF0,676 и CF0,998-
По мере приближения к составу CFi,0 цвет соединения стано-
вится более светлым, а сам кристалл более прозрачным. Хотя
эти твердые соединения являются инертными и не проводят
электричества, тем не менее при длительном воздействии на
них ксилола между ним и соединениями наблюдается медлен-
ная реакция (ср. также данные [891]).
Полученное соединение по многим своим свойствам ана-
логично окиси графита, в частности его структура также ха-
рактеризуется наличием изогнутой сетки. В результате очень
быстрого нагревания оно бурно возгоняется и переходит в
CF4, C2F6 и более высокие фториды. Однако в отличие от
окиси графита это соединение графита с фтором не разбухает
под действием полярных растворителей.
C4F. Наиболее удобный способ получения C4F сводится к
пропусканию над графитом при комнатной температуре смеси
газообразных HF и F2. Фтор так прочно закрепляется в гра-
фите, что его нельзя удалить даже при обработке теплым
водным' раствором щелочи. Однако при сильном нагревании
C4F, аналогично CF, бурно разлагается с выделением смеси
летучих фторидов, таких, как CF4, C2F6 и твердых продуктов.
В отличие от других кристаллических соединений графита
(см. разд. VII.1), величина электропроводности C4F составля-
ет всего лишь около одной сотой от значения электропровод-
ности маточного графита. При его образовании происходит
расширение углеродных гексагональных сеток; при этом рас-
стояние между углеродными сетками увеличивается примерно
до 5,4 А. По некоторым предположениям [885] углеродные гек-
сагональные сетки в этом соединении остаются «ароматически-
ми» без серьезного искажения плоской формы сетки и заметно-
го изменения длины С—С-связи. Атомы фтора, по-видимому,
150
Глава V
лежат в чередующихся слоях, как показано на фиг. 41. Такое
расположение характерно для многих соединений, содержа-
щих между слоями внедренные атомы или группы, как, на-
пример, для С8К, C8Rb, C8Cs, С+HSO72H2SO4, С8Вг и т. д.
Фиг. 41. Вероятное 'расположение атомов
фтора над углеродной гексагональной сет-
кой С<Р(ООО)и под этой сеткой(•••)
[878]. .
Кислые фториды графита. Эти соединения уже обсужда-
лись в разд. V.I.I.
V.4. ОСТАТОЧНЫЕ СОЕДИНЕНИЯ ГРАФИТА С ГАЛОГЕНАМИ
Кристаллические соединения графита с внедренными моле-
кулами брома и однохлористого иода при пребывании на воз-
духе и в вакууме легко теряют большую часть внедренных
молекул. Подобное явление можно ожидать и для других
внедренных добавок, однако детальных исследований здесь
не проводилось. В случае соединений графита с галогенами
часть добавки прочно удерживается, в результате чего обра-
зуются так называемые «остаточные» соединения. Оставшееся
количество добавки зависит от первоначальной структуры
графита [407, 546, 547]. Способность удерживать добавку на-
блюдалась и при исследовании падения величины магнитной
восприимчивости графита при абсорбировании им брома [848].
До известной степени это удерживание имеет сходство с ги-
стерезисом, найденным для других явлений сорбции.
Существует мнение, что связь углерода с галогенами, ко-
торые удерживаются в остаточных соединениях после удале-
ния основной массы внедренного вещества, и связь углерода
с другими добавками остаточных соединений имеют различ-
ную природу. Весьма вероятно, что галогены закрепляются на
существующих дефектах сетки с помощью какой-нибудь ва-
лентной связи, аналогичной той, которая соединяет бром с
Кристаллические соединения графита
151
менее крупными ароматическими молекулами.
Не исключено также, что при первоначальном введении
брома С—С-связи неграфитового происхождения между угле-
родными гексагональными сетками разрушаются, вследст-
вие чего появляются сетки, прочно удерживающие атомы
брома в местах разрывов этих связей. Один из аргументов в
пользу такого наблюдаемого на опыте разрыва связей сво-
дится к тому, что после образования остаточных соединений
графит сравнительно легко абсорбирует другие группы, как
если бы первичная обработка способствовала отделению слоев
друг от друга [407, 408, 518]. Однако до сих пор неизвестно,
происходит ли это из-за видоизменения дислокаций вследст-
вие присутствия добавки или от того, что в результате пер-
вичного внедрения добавки действительно разрываются все
несовершенные С—С-связи, соединяющие параллельные сетки.
Образование остаточных соединений наблюдалось также
в процессе приготовления слоистых соединений при анодном
окислении графита. Если одновременно с приготовлением сло-
истого соединения исследуется изменение его физических
свойств и, в частности, электрического сопротивления, то пос-
ле замены полярности электродов на обратную, как правило,
сравнительно легко удаляется только часть сорбированного
материала. Количество оставшегося в графите вещества со-
ставляет более или менее постоянную долю первоначально
внедренного количества, которая зависит от природы исполь-
зуемого графита. Как показывает химический анализ, даже
продолжительная промывка водой не приводит ни к дальней-
шему изменению физических свойств, ни к дополнительному
удалению материала, внедренного в самом начале [408].
В этом случае для выяснения природы связи добавки в оста-
точном соединении необходимо установить, происходит ли
внедрение добавки между углеродными гексагональными сет-
ками остаточных соединений или она удерживается с по-
мощью иного механизма.
Новый свет на эти проблемы проливают рентгенографиче-
ские исследования в комбинации с определением изотерм
сорбции брома для углеродов различной степени разупорядо-
ченности [652]. Эти исследования подтверждают известное
мнение о том, что по изменению положения электронных уров-
ней Ферми в л-зонах графита вследствие увеличения разупо-
рядоченности сеток можно установить, является ли внедрение
брома термодинамически осуществимым или нет. Из них так-
же следует, что для некоторых почти идеальных графитов
(таких, например, как поликристаллический графит Ачесона)
отсутствие сорбции брома вплоть до предельной концентрации
152
Глава V
CgBr объясняется главным образом блокированием части
графитовых слоев. Что касается десорбции, то, как показы-
вают данные рентгеноструктурного анализа, удаление всего
брома весьма затруднено из-за образования слоев, насыщен-
ных бромом, в которых присоединенный металл является ки-
нетически изолированным, хотя он и удерживается с помощью
нормальной связи слоистого соединения.
Примеры кристаллических соединений, в которых включе-
ния изолированы кинетически, были описаны в связи
с другими вопросами (ср. [519]). Вследствие разнообразия
дефектов, присутствующих обычно в графите, очень трудно
решить, какие именно дефекты служат местами свя-
зи. Существует конкретное указание на то, что группы, кото-
рые прочно удерживаются в остаточных соединениях, оказы-
ваются химически связанными на дырочных и клещевидных
дефектах, однако это предположение нуждается в подтвер-
ждении. До некоторой степени ему противоречит тот факт, что
остаточные соединения, полученные из углеродов (последние
чрезвычайно несовершенны), не столь стабильны, как соеди-
нения, полученные из графита [806].
Другое предположение заключается в том, что многоатом-
ные добавки могут удерживаться на дефектах остаточных
соединений с помощью углеродкислородных связей, первона-
чально представляющих собой группы — С= О или —С—ОН.
Так, например, в связи с известным химическим взаимодейст-
вием А1С1з и FeCla с фенольной группой — ОН и другими аро-
матическими соединениями, содержащими кислород, пред-
ставляется весьма вероятным, что в графите многоатомные
добавки удерживаются на аналогичных дефектах в виде
—ОА1С12 и т. д. Извлечь весь А1С13 из кристаллического соеди-
нения графита с хлористым алюминием не удается даже при
прокаливании; в качестве конечного продукта получается
некоторое количество окиси алюминия (неопубликованные
данные Орра и Уббелоде).
Для объяснения электронных свойств остаточных соеди-
нений, по-видимому, необходимы новые методы исследования
связей. Ввиду ограниченного количества известных данных в
настоящее время представляется рискованным рассматривать
эти соединения в качестве кристаллов, содержащих опреде-
ленное число электронных дефектов, вносящих в случае ре-
шетки графита совместный вклад в электронные энергетиче-
ские уровни [715, 806, 964]. К упрощенному распространению
на поликристаллический графит молекулярно-орбитальной
или блоховской теории твердого состояния следует относиться
с известной осторожностью, так как эффекты, обусловленные
Кристаллические соединения графита 153
сильно связанными группами, могут быть полностью локали-
зованы в дефектах сетки. Тем не менее линейное изменение
электронных характеристик с увеличением концентрации
остаточных примесей, если только оно имеет место до образо-
вания кристаллического соединения, явилось бы некоторым
подтверждением модели объединенных электронных уровней.
В связи с этим остаточные соединения могли бы быть истол-
кованы точно таким же образом, как и твердые растворы с
замещенными сетками, к которым относятся соединения гра-
фита с бором [362, 413]. Роль инородных атомов, присутству-
ющих в этих двумерных углеродных сетках, с точки зрения
электронных свойств аналогична роли инородных атомов в
трехмерных сетках таких полупроводников, как германий
(ср. также [748]).
V.5. СЛОИСТЫЕ СОЕДИНЕНИЯ ГРАФИТА С ДРУГИМИ
МОЛЕКУЛАМИ
Галогениды металлов. Как было обнаружено' Тилем [1026],
графит, кроме образования кислотно-ионных соединений, со-
единений с металлами и соединений с галогенами, абсорби-
рует хлористое железо, вследствие чего увеличивается рас-
стояние между слоями. В течение некоторого времени пред-
принимались безуспешные попытки получить другие соеди-
нения графита, молекулы которых изоморфны хлористому
железу [882]. Лишь сравнительно недавно были приготовлены
соединения с самыми разнообразными молекулярными груп-
пами [197—199]. В настоящее время существует мнение,
что в решетку графита могут быть внедрены молекулы мно-
гих веществ. Неудачи ранних попыток можно, по-видимому,
объяснить тем, что для разделения углеродных макромолекул
и внедрения между ними молекул другого вида необходимо
сначала разорвать неграфитовые связи [888]. С другой сторо-
ны, для внедрения некоторых добавок может потребоваться
избыток атомов галогена. Методы приготовления кристалли-
ческих соединений, как правило, предполагают нагревание
графита вместе с внедряющимися молекулами. Однако в ряде
случаев (и в том числе для А1С1з) сообщалось [262] о необхо-
димости присутствия такого элемента^ как хлор, который
участвует в процессе переноса зарядов, обязательном для
образования этих соединений [629]. Как показывают рентге-
нограммы порошков, соединение графита с А1С1з [888] по мере
постепенного повышения температуры от 265 до 440° С при
его приготовлении проходит три стадии:
154
Глава V
1) заполнен каждый слой, примерный состав C9AICI3,
окраска темно-голубая;
2) заполнен каждый второй слой, примерный состав
С18А1-С13, окраска бледновато-черная;
3) заполнен каждый четвертый слой, по виду вещество
напоминает графит, примерный состав С36А1С13.
Хотя доля активного хлора, внедренного в решетку вместе
с А1С1з, с трудом поддается точному определению аналити-
ческими методами [892], из самых общих соображений сле-
дует, что активно внедряющейся группой является [А1С14]“
в комбинации с переменным количеством А1С13 в качестве
-«распорок». Таким образом, кристаллическое соединение
С+[А1С14]“ А1С13 должно иметь сходство с кислыми сульфа-
тами, которые тоже включают, по-видимому, неизмененную
H2SO4 и, кроме того, HSO~4 (ср. стр. 139). Во всех этихслу- '
чаях наблюдается ряд возможных составов.
Кроме перечисленных, было получено соединение с одно-
временным внедрением FeCl3 в два слоя и А1С13 — в третий
1892]. Для внедрения в графит хлористого галлия необходимо
(как и для внедрения хлористого аммония) присутствие хло-
ра [892]. В этом случае в графит внедряется, вероятно, груп-
па [GaCl4]“. Эти соединения, как установлено рентгенострук-
турным анализом, имеют приблизительно следующий состав:
GaCl3: С = 1 : 9, заполнен каждый слой;
GaCl3:C=l : 18, заполнен каждый второй слой; I
GaCl3: С= 1 : 35, заполнен каждый четвертый слой. j
Хлористый индий проявляет себя аналогичным образом, j
однако в этом случае внедрения активного хлора практиче- ;
ски не происходит. В соединении, идентифицированном с по-
мощью рентгеноструктурного анализа, заполнен каждый вто-
рой слой, и по виду оно напоминает графит.
Многие из соединений, о приготовлении которых уже сооб-
щалось, до сих пор были изучены лишь поверхностно, причем •
полученные данные часто оказываются противоречивыми.
В случае А1С13 большинство доказательств, указывающих на
одновременное связывание галогена и молекулы-акцептора
при образовании таких внедренных групп, как [А1С14]~,
[А1С13Вг]_ и т. п., относится к кристаллическим соединениям,
содержащим лишь совсем небольшие количества добавки
[262]. При таких низких общих концентрациях добавок в кри-
сталлах становится особенно заметной вредная роль тех до- 5
бавок, которые удерживаются на дефектах сетки.
В случае хлоридов редкоземельных металлов степень вне-
дрения, вероятно, также зависит от одновременного присутст-
вия других молекул, таких, как С12, НС1 или Н2О, однако эта
Кристаллические соединения графита 155
закономерность пока еще не совсем понятна. В заметном ко-
личестве могут внедряться, по-видимому, только YCI3 и
GdCl3, причем это происходит в том случае, когда их гидра-
тированные хлориды нагреваются в трубках Кариуса вместе
с естественным графитом [1079]. Введенные молекулы, очевид-
но, играют роль электронных акцепторов, как это следует из
предварительных данных по измерению коэффициента Холла.
Соединения с внедренными молекулами галогенидов дру-
гих металлов были изучены Крофтом [199—201] полуколиче-
ственным методом для следующих материалов: CuCl2, СиВг2,
АиС13; трихлориды: В, Fe, Cr, Со, Ru, Al, Ga, In и Tl; А1Вг3,
ZrCl4, CoCl4, RuCl4, HfCl4, SbCl5, TaCl5, M0CI5, WC16,
UC14, ReCl4, CrO2Cl2, CrO2F2, UO2C12.
В некоторых случаях (например, для Си и Со) внедряться
могут только атомы с более высокой валентностью. Следует
отметить, что сжимаемость соединения графита с хлористым
железом оказалась выше, чем для маточного графита [920].
Окислы и сульфиды металлов. Как установлено, среди
окислов и сульфидов, способных к заметному внедрению в
графит при нагревании в запаянных трубках [199], находится
и T12S, причем если нагрев производится при 200° С в присутст-
вии графита и серы, то внедряющейся группой является T1S2.
Группа Sb2S5 входит в неизменном виде. В состав других со-
единений внедрения входят CuSi.3, FeS2, WS2,4 и CrO3.
Окислы и сульфиды остальных металлов внедряются в го-
раздо меньшей степени, а полученные кристаллические соеди-
нения имеют, по-видимому, неопределенный состав.
Соединения внедрения для аналогов графита. В случае
нитрида бора [199, 201] соединения внедрения образуются с
SbCl3, AsCl3, CuCl, FeCl3 и A1C13.
Увеличение расстояний между слоями, обусловленное вне-
дрением хлоридов, описано Крофтом [199—201]. В том случае,
когда для эксперимента используются добавки переменной
валентности, в слои нитрида бора внедряются хлориды более
низкой валентности, чем в графит. В качестве примера сле-
дует упомянуть Sb111 и Си1 . В нитрид бора внедряется также
N2H4. Кристаллы СгС13 и А1В2 тоже образуют соединения
внедрения с пятихлористым молибденом и аммиаком соответ-
ственно.
В слоистые силикаты, такие, как бентонит, внедряются
различные полярные молекулы; расстояние между слоями
при этом увеличивается.
Путем использования растворов в жидком аммиаке в не-
которые сульфиды, например в MoS2, WS2 и SnS2, с ярко вы-
раженной слоистой структурой кристаллов можно внедрять
156
Глава V
атомы щелочных и щелочноземельных металлов [893, 895].
Увеличение расстояния между слоями и некоторые химиче-
ские свойства этих кристаллических соединений говорят о на-
личии поляризации; для соединения калия ее можно выра-
зить с помощью формулы Кб+ (MS2)?>~. Однако до сих пор нет
количественных методов для оценки степени развития про-
цесса переноса зарядов.
V.6. ХИМИЧЕСКИЕ РЕАКЦИИ КРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
ГРАФИТА
Химические реакции кристаллических соединений графита
полностью не изучены. Некоторые из приводимых ниже дан-
ных были рассмотрены раньше в связи с другими вопросами.
В случае электрохимических соединений, таких, как бисуль-
фат графита, реакция восстановления, протекающая на като-
де или под действием химических реагентов, дает графит,
содержащий небольшое количество «остаточных» молекул,
как это отмечалось выше для остаточных соединений. Это об-
стоятельство необходимо иметь в виду при разработке мето-
дов химического анализа. Все галогены, за исключением
фтора, можно удалить путем нагревания или даже при до-
статочно продолжительном пребывании при комнатной тем-
пературе, однако «остаточные» молекулы удерживаются и в
этом случае. Для удаления основной массы внедренного ве-
щества из кристаллических соединений с некоторыми много-
атомными молекулами требуется интенсивное нагревание. Так,
в некоторых специальных образцах углерода удерживается
до 5% FeCl'3 [882].
Механизм физического превращения кристаллического
графита во время такого удаления остается неизвестным. Во
многих случаях наблюдается заметное вздутие или расслое-
ние материала [200, 888]. Можно предположить, что сразу
после удаления некоторого количества внедренных частиц из
пространства между двумя углеродными макромолекулами
смежные углеродные гексагональные сетки обрушиваются и
увлекают за собой остальные слои. Не исключено, однако, что
будет захвачена только часть сеток (ср. [652]). Точно так же
при образовании кристаллических соединений графита в ре-
зультате сорбции внутрь слоев процесс «раскрытия» (расслаи-
вания) последних, который, по-видимому, является автоката-
литическим, сильно облегчается, как только определенное
количество молекул произведет деформацию слоя. Краевые
дырочные и клещевидные дефекты углеродных макромолекул
могут способствовать этому первоначальному расслаиванию.
Кристаллические соединения графита
157
Фиг. 42. Расслаивание и разрушение соединения графита с хлори-
стым алюминием при нагревании [200. 813].
так что при обсуждении различных форм кристаллических
соединений графита никогда не следует отказываться от по-
пытки учесть его дефекты. Наконец, значительный интерес
представляли бы исследования кинетики скоростей сорбции
(фиг. 42).
158
Глава V
Необходимо отметить, что кристаллические соединения
графита могут соединяться также с другими группами. Так,
соединение графита с хлористым железом в результате не-
прерывного набухания в жидком аммиаке образует, по-види-
мо му, уротропин. Некоторые добавки, например А1С1з, па
крайней мере частично подвергаются гидролизу, тогда как
другие добавки, например FeCl3, более стабильны, пока они
удерживаются в кристаллических соединениях [199]. Это раз-
личие, очевидно, связано с природой взаимодействия между
углеродными гексагональными сетками и добавками, однака
достаточно полной информации об этом в настоящее время
не существует.
Применение кристаллических соединений графита. Учиты-
вая химические свойства соединений графита, Крафт [200]
указал на ряд возможных областей их применения. Раздель-
ное выделение хлористого железа и хлористого алюминия в
процессе разложения соединений можно было бы использо-
вать для удаления из алюминия небольших количеств желе-
за [197]. Кислотно-ионные соединения можно использовать во
вторичных элементах с той же целью, с которой используются
твердые электролитические окисляющие агенты; практиче-
скому применению этих соединений препятствуют их разло-
жение и низкий электрохимический потенциал [413, 879, 881].
Порошкообразное соединение графита с калием можно ис-
пользовать как удобный газопоглотитель небольших количеств
кислорода (неопубликованные данные Уббелоде, Льюиса и
Орра). Применение соединения антрацена с натрием в ка-
честве стимулятора для полимеризации показывает, что со-
единения графита -с щелочными металлами могут обладать
ценными каталитическими свойствами; так, например, соеди-
нение графита с калием представляет интерес в качестве ка-
тализатора для полимеризации этилена [816].
Было высказано предположение [143], что окись графита
благодаря наличию в ней кислорода можно было бы исполь-
зовать как деполяризатор элемента Лекланше.
V .6.I. СТОЙКОСТЬ УГЛЕРОДА К ХИМИЧЕСКИМ ВОЗДЕЙСТВИЯМ
Причина разрушения углеродов, используемых в качестве
стенок контейнеров для реагирующих систем, очевидна из
рассмотрения известных слоистых соединений графита и дру-
гих возможных соединений этого типа. Всякий раз,
когда условия благоприятствуют образованию слоистого
соединения, вследствие местного расширения возникают мощ-
ные раскалывающие усилия и происходит растрескивание,.
Кристаллические соединения графита 159s
которое может вызвать гораздо более глубоко расположен-
ные повреждения, чем поверхностная эрозия. Этому процессу
может благоприятствовать образование остаточных соедине-
ний [408]. Для того чтобы углероды сопротивлялись разруше-
нию, их подвергают дегазации без изменения основных пара-
метров, существенных для электропроводности. Это возможно
потому, что развитые поперечные связи между углеродными
гексагональными сетками препятствуют разбуханию, которое
должно происходить даже при местном образовании слои-
стых соединений. Кроме того, в стабильных углеродах дефек-
ты, на которых может начаться разбухание материала при
образовании слоистого соединения, устойчиво связаны с проч-
но удерживаемыми атомами и вследствие этого недоступны
при существующих условиях. По аналогии с вулканизацией
серы и современными методами полимеризации, которые ис-
пользуются для увеличения стабильности высокомолекуляр-
ных полимеров, а также для предотвращения их разбухания не-
обходимо упомянуть о возможности сцепления сеток с по-
мощью поперечных связей групп, отличных от атомов угле-
рода, как об одном из способов повышения сопротивления
разрушению углеродов.
Когда углерод нужно использовать в качестве электрода,
на котором могут выделяться различные атомы и радикалы,
тщательная обработка поперечных связей и дефектов может
оказаться более важной для улучшения сопротивления раз-
рушению, чем обработка при высоких температурах. Так, на-
пример, взрыв углеродных электродов при чрезмерно кислом
электролизе и высоких плотностях тока объяснялся образо-
ванием окиси графита [195]. Авторы редко сообщают подроб-
ности о способе изготовления удачных углеродных электродов.
ГЛАВА VI
ХИМИЧЕСКАЯ ФИЗИКА КРИСТАЛЛИЧЕСКИХ
СОЕДИНЕНИЙ ГРАФИТА
В настоящее время исследования химико-физических
свойств кристаллических соединений графита находятся го-
раздо дальше от завершения, чем исследования маточных
углеродов.
Как уже говорилось, такое положение вызвано тем об-
стоятельством, что плотный поликристаллический углерод при
образовании кристаллического соединения часто превра-
щается в поликристаллический порошок. В этих условиях та-
кие свойства соединений, как тепловое расширение, сжимае-
мость, твердость и электропроводность, могут определяться
скорее границами между кристаллитами, чем свойствами
собственно кристаллической решетки. Исследования межкри-
сталлических границ указывают на то, что в некоторых
случаях их влияние сводится, по-видимому, лишь к допол-
нительному эффекту [593]. К счастью, картина рентгеновской
дифракции и величина магнитной восприимчивости вряд ли
сильно меняются в результате превращения графита в поли-
кристаллические порошки при образовании кристаллических
соединений. Другая сложность заключается в том, что неко-
торая часть добавок может закрепиться в графите на дефек-
тах структуры; их вклад в количественные характеристики
кристалла зависит от природы этих дефектов, которая может
быть весьма различной и в любом случае с трудом поддается
изучению. Эта неопределенность осложняет детальную ин-
терпретацию ряда результатов [261, 407, 408, 411].
VI .1. ТЕРМОХИМИЯ СЛОИСТЫХ СОЕДИНЕНИЙ ГРАФИТА
Измерения силы связи, ее длины и других свойств имеют
большое значение как для классификации, так и для объяс-
нения природы -связи в слоистых кристаллических соедине-
ниях графита. Большое значение могли бы иметь данные по
Химическая физика кристаллических соединений графита 161
теплотам образования соединений. К сожалению, состояние
исследований по физической химии этих веществ, охаракте-
ризованное <выше, не позволяет сделать достаточно простых
и точных калориметрических измерений. Так, например, если
графитизированный углерод бросить в расплавленный калий,
выделяется некоторое количество тепла, которое можно изме-
рить с помощью более или менее обычных калориметриче-
ских методов. Тепловыделение, как правило, оказывается не-
большим, а уравнение химической реакции точно не известно.
В соответствии с химическим анализом происходящую реак-
цию можно записать в следующем виде:
Ств+Кж —> С4КТВ (увлажнен избыточной жидкостью) 4“ &Н.
Для этой реакции Фреденхаген и Каденбах [300] получили
ДЯ =—1500 кал/г-атом углерода, тогда как Квартермен и
Примак [835] нашли, что Д/7 =—972 ±24 кал!г-атом углерода.
Такое расхождение можно объяснить ошибками эксперимента
или разным исходным материалом. Природа химико-физиче-
ского состояния связанного углерода в избыточном жидком
калии остается неясной. Другие прямые методы калоримет-
рических измерений, по-видимо му, не известны. В то же вре-
мя можно предложить ряд косвенных методов, аналогичных,
например, измерению разности теплот реакции:
^8КТвЧ ^2(галоген, газ) —>СТВ+КХ
ТВ»
Ктв Н 2”-^2 (галоген, газ) * ^КХ^.
При этом необходимо внимательно следить за тем, чтобы эти
реакции прошли до конца и чтобы полученный твердый угле-
род представлял собой почти идеальный графит, который
можно успешно применять для термохимических целей.
В этой области никаких экспериментов, по-видимому, не про-
водилось.
VI.2. ДАВЛЕНИЕ ПАРОВ СЛОИСТЫХ СОЕДИНЕНИЙ
Косвенные методы определения теплот реакции и измене-
ния свободной энергии включают измерение давления паров
диссоциации слоистых соединений. Однако необходимо отчет-
ливо представлять себе, что соответствующая термохимиче-
ская реакция, которая определяет процесс выделения неболь-
шой массы второго компонента из большого количества слои-
11 А. Р. Уббелоде
162
Глаза VI
сто го соединения, не всегда будет иметь такой простой вид,
как реакция
С пМкристаллич. соед.' “►Спочти идеальный графитЧ“Мпар.
В результате частичного выделения металла М кристалличе-
ская решетка почти идеального графита вряд ли остается в
Фиг. 43а. Абсорбция брома в графите
при 28,8°С [848].
1 — начальная сорбция; 2 — десорбция; 3 — ресорб-
ция.
большое сходство с потерей паров твердым раствором или с
изотермой десорбции, когда поглощающая среда обладает
рядом участков с различными сорбционными потенциалами
(ср. [413, 422]). На фиг. 43а и 43 6 представлены изотермы
сорбции для соединения графита с бромом. Как уже отмеча-
лось при обсуждении некоторых других свойств, анализ экс-
периментальных данных по измерению давления паров при
абсорбции (в особенности для начальной стадии) сильно
усложняется вследствие образования остаточных соединений
несовершенными графитами (см., например, [411]).
Химическая физика кристаллических соединений графита 163
Теплоты реакции, подсчитанные из косвенных определений
давления паров, составляют следующие значения [422]:
С24Ктв+2Кж—>ЗС&КТВ—3,4 ккал/г-amo'M К;
С24КЬТВ+2НЬЖ —^3C8RbTB—5,5 ккал/г-атом^',
С34Сзтв+2Сзж—>3C8CsTB —10,4 ккал/г-атом Cs.
Фиг. 436. Изотермы графитизированной газовой сажи с бромом
[462].
О прямой ход (повышение давления); Ф обратный ход (понижение давления).
VI.3. РЕНТГЕНОСТРУКТУРНЫЕ ИССЛЕДОВАНИЯ СОЕДИНЕНИЙ
ГРАФИТА
По термохимии кристаллических соединений графита
имеются лишь немногочисленные данные, тогда как структур-
ных исследований по кристаллохимии проведено значитель-
но- больше. Частично это объясняется более простой методи-
кой эксперимента; даже рентгенография порошков дает об-
ширную информацию о кристаллической решетке. Основным
недостатком многих рентгенограмм порошков является отсут-
ствие точных данных о возможных изменениях длины связей
углерод—углерод в гексагональных сетках. При проведении
таких экспериментов необходимо обращать внимание на то„
11*
164
Глава VI
чтобы расположение кристаллитов в' образцах было изо-
тропным.
При образовании всех изученных соединений графита
происходит увеличение расстояния между углеродными гек-
сагональными сетками. Принимая во внимание структуру свя-
зей этих кристаллических соединений, следует одновременно
ожидать небольших изменений длины С—С-связи внутри сет-
ки (ср. гл. I); эти изменения могут быть незаметными до тех
пор, пока не будет в значительной степени разрушена аро-
матическая структура углеродных макромолекул (в качестве
возможных примеров см. работы [55, 674]). Главные измене-
ния структуры при образовании этих кристаллических со-
единений рассматриваются обычно с точки зрения увеличе-
ния расстояния между углеродными сетками в направлении
оси с [305, 879]. Это расширение часто приводит к разруше-
нию. Однако в благоприятных случаях (например, для соеди-
нения графита с бромом) удается сохранить монокристаллы
([883], а также неопубликованные данные Блэкмена, Мэтьюса
и Уббелоде).
VI.3.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ СЛОЯМИ
Характерная структурная особенность кристаллических
соединений состоит, по-видимому, в том, что они образуются
при внедрении второго компонента либо в каждый из следу-
ющих друг за другом слоев углеродных колец, либо в каждый
слой, чередующийся в строго определенном порядке через не-
сколько слоев [422, 914]. Таким образом, последовательности
слоев выглядят или как ааааа, или как ababab, или имеют
еще меньшую частоту повторения. При этом а представляет
собой увеличенное расстояние между углеродными сетками
для слоя, содержащего второй компонент, а b — нормальное
расстояние между соседними сетками пустого слоя графита.
Вследствие взаимодействия между соседними слоями рас-
сматриваемое расстояние в случае «пустого» слоя, располо-
женного между двумя заполненными, изменяется по сравне-
нию с расстоянием между углеродными сетками чистого гра-
фита. Однако в настоящее время точность измерений-не
позволяет сделать окончательных выводов. По аналогии с
другими слоистыми структурами кристаллов в не полностью
сформировавшихся кристаллических соединениях графита
можно предположить наряду с регулярными последователь-
ностями слоев существование нерегулярных последовательно-
стей, таких, как abbbaabaaabab. Однако до сих пор такие
Химическая физика кристаллических соединений графита 165
нерегулярности не были обнаружены, хотя имеющиеся дан-
ные не позволяют сделать окончательных выводов.
В качестве иллюстрации можно указать на внедрение в
слои графита хлорной кислоты [881] и на образование при
этом пяти «идеализированных» соединений (табл. 21).
Таблица 21
Расстояния между углеродными сетками в графите
с внедренными молекулами хлорной кислоты
Общее число слоев Период элементарной О ячейки1)» А о Расстояние между сетками, А
заполненный слой 'незаполненный слой
1 7,94 7,94
2 11,12 7,77 Ь 1x3,35
3 14,30 7,60 h 2x3,35
4 17,65 7,60 Ь 3x3,35
5 21,00 7,60 1- 4X3,35
х) Элементарная ячейка содержит один заполненный и один или не-
сколько незаполненных слоев.
При составлении таблицы исходили из того, что для каж-
дого незаполненного слоя сохраняется нормальное расстоя-
ние между сетками, характерное для маточного графита. Од-
нако это представляется маловероятным, если происходит
перенос заряда от добавки к углеродным гексагональным
сеткам или в противоположном направлении. Область, на ко-
торую распространяется влияние слоя, не известна, однако
(особенно в случае электростатических полей) она, по-види-
мому, превышает расстояние до ближайшего соседнего слоя.
Можно ожидать, что смежные углеродные сетки сильнее при-
тягиваются друг к другу вследствие поляризации: это обстоя-
тельство должно привести к некоторому уменьшению (б) рас-
стояния между сетками, как это показано в табл. 22.
Предположение о том, что слои, расположенные от слоя с
добавкой дальше, чем ближайшие соседи, приблизительно
сохраняют «нормальное» для графита расстояние между сет-
рами, приводит к другому представлению о структуре
(табл. 23).
166
Глава VI
Таблица 22
Предполагаемая величина расстояния между
ближайшими соседними сетками графита 0
с внедренными молекулами хлорной кислоты (в А)
Нормальный графит Графит с внедренными молекулами
о А слой
3,35 7,94 Заполненный
3,35 3,35— Ь Следующий
3,35 7,94 Заполненный
3,35 3,35—& 7,94 Следующий
Величина д (характеризует уменьшение расстояния меж-
ду сетками), подсчитанная на основании этого предположе-
ния, равна 0,17 А, что находится в соответствии с известны-
ми свойствами графита.
Таблица 23
Предполагаемая величина расстояний между сетками
в графите с внедренными молекулами хлорной кислоты
Общее число слоев Период элементарной О ячейки, А О Расстояние между сетками, А
заполненный слой незаполненный слой
1 7,94 7,94 j 1
2 11,12 7,94 I- 1X3,18
3 14,30 7,94 Ь 2x3,18
4 17,65 7,94 Ь 2x3,184-3,35
5 21,00 7,94 f- 2x3,184-2X3,35
VI.3.2. ОТНОСИТЕЛЬНОЕ УВЕЛИЧЕНИЕ РАССТОЯНИЯ
МЕЖДУ СЕТКАМИ
Поскольку установлено, что при образовании кристалли-
ческого соединения происходит внедрение молекул между уг-
леродными гексагональными сетками без значительного из-
Таблица 24
Расстояния между углеродными сетками различных
кристаллических соединений
Приближенная эмпирическая формула кристаллического соединения Расстояние между О сетками, А Источник
с8к ) С24к с36к J 5,40 [887]
C64Na 4,6 [31]
C8Rb i Ca^Rb CggRb j 5,65 [887]
C8Cs 5,94 19141
C12M(NH3)2 > M=Li, Na, K, Rb или Cs j 6,6 [889]
C12Li (CH3NH2)2 6,9 [889]
C9 (Ga Cl4) Ga Cl3 9,5 [892]
C9 (Al Cl4)~ Al Cl3 9,52 [888]
C§Br C16Br 7,05 [883]
C6IC1 7,24 [890]
C„FeCl3 9,37—9,45 [882]; ср. [193]
C2+4HSO7(H2SO4)2 7,98 [881]
168
Глава VI
менения межатомных расстояний С—С внутри отдельной сет-
ки, все результаты рентгенографических исследований струк-
туры соединений графита можно представить в виде данных
по увеличению расстояния по оси с, периодичности расширя-
ющихся слоев и распределению атомов или молекул в каж-
дом отдельном слое, содержащем внедренный компонент.
Эти параметры пока еще не определены для всех полученных
кристаллических соединений. В табл. 24 приведены имею-
щиеся* сведения о расширении кристаллических соединений.
Увеличение расстояния между сетками при внедрении доба-
вок, обусловленное, по-видимому, значительными ван-дер-
ваальсовыми силами отталкивания, составляет характерный
признак, общий для всех слоистых решеток. Аналогичным
образом с увеличением количества воды в окиси графита уве-
личивается суммарное разбухание; предельное расширение
может достигать И А, после чего наступает разрушение оки-
си с образованием коллоидного раствора [441].
VI.3.3. РАСПОЛОЖЕНИЕ ДОБАВОК В СЛОЕ
Для многих кристаллических соединений рентгенографи-
ческие исследования проводились на порошкообразных образ-
цах с недостаточно четко определенной структурой, вследст-
Грабит 2-я стадия ** 3-л стадия
ч: cq •♦-•А 3 со
с = c=2*5,75 кХ нш Хь Оз За Ь* 1^7?
4-я стадия — -- - А
•• V • д
—
ж Л
• ~ в
-Д
ч• в
Csj
tl
“•-м-м в
»♦ »• Л
5~я стадия
* с 0( - V — iUt ии 1ХЛ f Т 1 о I II » X О ( о X Г о 1 О 1 X 1 и 00 S» Со Ь >
•» ♦ Спой атомов С
-----С/юй атомов К
Д
Фиг, 44. Последовательное расположение углеродных гексагональных
сеток и атомов калия в различных соединениях графита с калием
[882, 887].
Ось с лежит в плоскости чертежа.
Химическая физика кристаллических соединений графита 169
О к
. 45. Соединение графита
с калием С8К [882, 887].
вне чего до сих пор не получено достоверных данных о рас-
положении добавок в каждом отдельном слое. Тем не менее
эти результаты были тщательно сопоставлены для ряда про-
изводных графита с ще-
лочным металлом: С8М,
С24М, С36М и Сб0М [887]
(фиг. 44 и 45). При этом
были установлены наибо-
лее важные характерные
черты расположения до-
*бавок.
1. Углеродные гекса-
гональные сетки, непо-
средственно прилегающие
с двух сторон к слою ато-
мов щелочного металла,
располагаются идентично.
Фиг. 44 иллюстрирует эту
особенность для послед-
них четырех случаев (ста-
дий) в противоположность
ш ахм атному р а спо ложе-
нию сеток гексагонального
графита. Такое же иден-
тичное расположение се-
ток возникает, по-видимо-
му, при образовании кис-
лых солей [894].
2. Наиболее вероятным
р аспр еделением атомов
щелочного металла яв-
ляется р а спр еделение их
по центрам углеродных
гексагонов. В соединении
С8М наблюдается более
тесная по сравнению с
другими кристаллически-
ми соединениями упаков-
ка, как это видно из рас-
смотрения фиг. 46.
При комнатной темпе-
ратуре атомы щелочных
металлов совершают колебания _со значительными амплиту-
дами х, достигающими величины х = 0,05А.
170
Глава VI
В противоположность соединениям с присоединением ще-
лочных металлов в кристаллических соединениях графита с
внедрением таких молекул, как А1С13, углеродные гексаго-
нальные сетки с обеих сторон внедренных групп сохраняют,
по-видимому, то же шахматное расположение, что и в ма-
точном графите. Эти данные согласуются с предположением
о более слабом взаимодействии в подобных кристаллических
соединениях.
Фиг. 46. Расположение атомов щелочного
металла в соединении графита с калием
относительно углеродных гексагональных
сеток [882, 887].
Атомы калия располагаются по углам треуголь-
ника. Центральный атом К присутствует только
в соединении СзК.
Для установления области распространения электронного
взаимодействия полезно иметь точные сведения о кажущемся
объеме, требуемом для добавки. К сожалению, этот объем
не всегда известен с достаточной точностью.
Сохранение йй/-линий в кристаллических соединениях и
в графите после удаления ранее введенной добавки озна-
чает, что при внедрении отдельных групп слои углеродных
макромолекул не смещаются относительно друг друга. Одна-
ко изменение соотношения гексагонального и орторомбиче-
ского графитов при кипячении твердого вещества в умеренно
крепких азотной и серной кислотах объяснялось образовани-
ем электрохимического соединения, которое предполагает
перескакивание плоскостей в одинаковые для всех положе-
ния, за которым следует скачкообразный переход к шахмат-
Химическая физика кристаллических соединений графита 171
ному расположению -сеток при повторном разложении. Необ-
ходимы дальнейшие доказательства возможности такого
скольжения целых углеродных гексагональных сеток относи-
тельно друг друга при образовании и разложении кристалли-
ческих соединений графита или при отжиге -графита.
VI.4. СТРУКТУРА СВЯЗЕЙ В СОЕДИНЕНИЯХ ГРАФИТА
Вопрос о связи добавок в остаточных соединениях, если
это не оговаривается специально, не обсуждается в настоя-
щем разделе. Осложнения, возникающие из-за любых связей
неслоистого происхождения, играют, вероятно, более важную
роль в начальных -стадиях введения примеси, когда количе-
ство добавки не превышает нескольких молярных процентов.
В кристаллических соединениях графита слои по существу
обладают амфотерными свойствами, а тип -связи внедренных
молекул не всегда является очевидным. Для любого -слоисто-
го кристалла с поляризующимися амфотерными слоями мож-
но понизить его потенциальную энергию посредством внедре-
ния сильно полярных групп, не вызывая глубокого изменения
положения электронных орбит. Так, например, вода и другие
полярные соединения, внедренные в монтмориллониты и бен-
тонит [359], удерживаются, вероятно, с помощью простого
электростатического взаимодействия. Однако ряд данных для
графита свидетельствует (по крайней мере в некоторых слу-
чаях) о более глубоком электронном взаимодействии между
внедренными группами и углеродными макромолекулами.
При рассмотрении различных свойств кристаллических
соединений графита с точки зрения типа связи очень полезно
выделить следующие группы:
1. Структуры, в которых добавка очень прочно связана с
углеродной сеткой, вероятно, с помощью ковалентных связей.
В таких случаях нарушается даже строгий ароматический
характер каркаса с его плоскими гексагональными кольцами.
Есть основания думать, что углеродные сетки окиси графита,
фторидов й, может быть, сульфидов графита в значительной
степени теряют такие типичные «графитовые» свойства [1047],
как электрическая проводимость. Это происходит в результате
различной гибридизации электронных орбит в углеродно-се-
точном каркасе, сопровождающейся понижением роли элек-
тронов, определяющих большую часть специфических особен-
ностей графита. Более того, предполагалось, что между неко-
торыми молекулярными добавками и углеродной сеткой су-
ществует прямая ковалентная связь [413]. Данные, свидетель-
ствующие о наличии перераспределения связей в этих случа-
172
Глава VI
ях, в ‘настоящее время не являются достаточно убедитель-
ными.
2. Соединения, в которых, как в кислых солях, в резуль-
тате электролитического окисления углеродных макромолекул
образуются макрокатионы. Например, бисульфат графита
можно уподоблять, вероятно, другим кислым солям более
мелких катионов. То обстоятельство, что при образовании
макрокатиона, содержащего примерно 24 атома углерода,
удаляется только один электрон, объясняется природой за-
полненных электронных уровней сетки. Эти уровни рассмат-
риваются в разд. IV.11.1 и гл. VII. Исследования электриче-
ских свойств, которые чувствительны к числу незанятых
электронных уровней (см. гл. VII), подтверждают предполо-
жение о том, что для образования макрокатионов в кислых
солях электроны удаляются из ароматических сеток графита.
Значения постоянной решетки для кислых солей, измеренные
с помощью рентгенографических методов (ср. табл. 24), со-
гласуются в общих чертах с этой точкой зрения, хотя данные
о радиусах соприкасающихся ионов для кислых сульфатов
и аналогичных кислотных групп в неорганических солях яв-
ляются недостаточно полными, чтобы считать ионные кристал-
лы с макрокатионами окончательной и детальной моделью
кислых солей графита. Попытки вычислить значения энергии
образования солей не имели успеха из-за слишком большого
количества неопределенных параметров [413].
3. Соединения, в которых углеродные макромолекулы гра-
фита образуют макроанионы в результате Перехода электро-
нов от щелочных металлов, внедренных между слоями, к ма-
кромолекулам. По сравнению с кислыми солями электронные
структуры внедренных атомов металла более просты, что поз-
воляет провести достаточно полный анализ модели, по кото-
рой эти кристаллические соединения рассматриваются в -каче-
стве солей с углеродными макроанионами [1062]. В этих
кристаллических соединениях исчезает магнитная восприим-
чивость, связанная с внешними орбитами [629, 887], а электро-
проводность сильно возрастает вследствие перехода электро-
нов' в незаполненную зону макроаниона. При этом, совсем не
учитывается изменение в л-зонах вследствие увеличения рас-
стояния между углеродными гексагональными сетками. Такое
предположение, по-видимому, оправдывается благодаря сла-
бому взаимодействию между параллельными сетками грдфита
[629]. Исследования эффекта Холла подтверждают эти сооб-
ражения [261]. По расчету радиусов соприкасающихся орбит
в случае соединений графита с калием и рубидием попереч-
ный размер области, в которой действуют силы отталкивания
Химическая физика кристаллических соединений графита 173
для макроаниона Сп, составляет ~ 2,74 А, что согласуется с
диаметро'м этих орбит 2,72 А для аниона фтора [1062]. Такой
же расчет для C8Cs дает близкое значение диаметра области,
равное примерно 2,56 А. Тот же автор подсчитывает теплоту
образования ионной кристаллической решетки, состоящей из
углеродных макроанионов и катионов щелочных металлов.
Выражение для энергии решетки содержит следующие
члены:
1) теплота испарения £исп твердого щелочного металла;
2) энергия ионизации I, необходимая для удаления элек-
трона из атома металла в газообразном состоянии;
3) работа Н, необходимая для отделения друг от друга
плоских углеродных макромолекул на расстояние, на котором
их взаимодействие между собой становится пренебрежимо
малым;
4) электронное сродство Е удаленных друг от друга
макромолекул, которое определяет их способность к приобре-
тению свободных электронов в процессе образования таких
макроанионов, как Сл;
5) потенциальная энергия решетки Ереш, освобождающаяся
при образовании кристаллической решетки из свободных уг-
леродных макроанионов и щелочных катионов.
Полная теплота Q для реакции
Мтв+8СТВ —> С8МТВ+Q
равна
Q == ^исп + ^ +^Г4"£+£реш-
Из упомянутых ранее калориметрических измерений известно,
что Q является малой или пренебрежимо малой величиной.
Данные по исследованию электронных свойств кристалли-
ческих соединений (см. гл. VII) показывают, что величина
Е близка к нулю. Для Н не получено определенного зна-
чения, хотя и были сделаны попытки оценить эту величину.
Например, предельное значение Н, подсчитанное из теплот
испарения ряда многоядерных ароматических углеводородов
с увеличивающимися молекулярными весами [495], оказалось
равным 18 ккал1г-атом углерода. По другим оценкам
(см. разд. IV.2.1) это значение составляет примерно
10 ккал/г~ атом.
В целом, сумма двух членов Е + Н будет оставаться по-
стоянной для всего ряда щелочных металлов; наиболее веро-
ятное значение равно примерно +144 ккал на группу из
8 г-атом углерода.
174
Глава VI
Сумма членов (ЛисП+7) (в ккал/моль) дает следующие
значения: Li=162,4; Na = 144,2; К = 121,2; Rb = 116,4.
Однако на основании этих данных невозможно оконча-
тельно определить значение £реш, так как неизвестен вклад
энергии поляризации углеродного макроаниона, который,,
по-видимому, имеет значительную величину. Некоторое пред-
ставление о влиянии радиуса соприкосновения и поляризуе-
мости можно получить из рассмотрения родственной группы
солей LiF, NaF, KF и RbF. По данным [777], энергия решетки
для указанных солей равна следующим значениям
(в ккал/моль): LiF = 240,1; NaF-213,8; KF= 190,4; RbF = 181,8.
Интересно сопоставить фториды щелочных металлов и со-
единения графита с щелочными металлами. Электронное
сродство фтора достаточно велико, чтобы обеспечить образо-
вание фторидов всех щелочных металлов. В случае углерод-
ных макромолекул и для обсуждаемой модели различные
энергетические уровни находятся гораздо ближе к равнове-
сию друг с другом. Этим обстоятельством можно было бы
объяснить тот факт, что кристаллические соединения легко
образуются между графитом и атомами К, Rb и Cs и с тру-
дом в случае Na и Li, если они вообще образуются. Анало-
гичные соображения можно привести для соединения графита
с хлором (ср. V.3). К этому можно добавить, что вклад в
термодинамическую устойчивость кристаллического соедине-
ния со стороны дефектных структур может привести к неко-
торым критическим условиям для температуры Тс, выше ко-
торой эти структуры не образуются, а также к критическим
концентрациям, за пределами которых они не существуют.
Для данного соединения значение Тс может оказаться слиш-
ком низким для его свободного образования, как в случае
хлорида.
Исследования магнитных свойств [887] последовательного
ряда соединений с щелочными металлами CsM, С24М, СзеМ
и СеоМ (М означает К или Rb) показывают, что заметный
диамагнетизм графита исчезает даже для кристаллического
соединения С6оМ, которое имеет четыре углеродных слоя, не
содержащих никаких включений (ср. фиг. 44). Это обстоя-
тельство можно истолковать с точки зрения дальнодействую-
щих ионных сил в квазисолеподобной модели. Эти силы до-
статочны, чтобы видоизменить верхнюю Часть заполненной
л-зоны, которая обусловливает высокий диамагнетизм графи-
та. Однако вследствие того что полученные эксперименталь-
ные данные относятся к различным полям, а удаление сильно
парамагнитных окислов щелочных металлов наталкивается на
серьезные трудности, для надежной интерпретации дальне-
Химическая физика кристаллических соединений графита 175
действующих сил между отдаленными заполненными слоями
необходимы новые исследования. Следует также иметь в виду
возможное переплетение между собой эффектов внедрения
и эффектов, связанных с добавками, которые удерживаются
на дефектах графита.
Всякое представление кристаллических соединений графи-
та с щелочными металлами в виде квазиионных кристаллов
должно объяснять их металлический характер [629]. Так как
связи между М и углеродной сеткой, вероятно, -не влекут за
собой полной передачи электронов, то в этом случае кристалл
можно представить в виде резонансной структуры со связями
между М и С, лишенными электрона, как это принято в мо-
дели Полинга для металлических кристаллов. Легкая смачива-
емость соединений избыточным щелочным металлом (ср. [835])
и, кроме того, некоторое сходство между низким значением Q
и низкими теплотами образования многих сплавов в значи-
тельной мере подтверждают квазиметаллическую модель свя-
зи для этих кристаллических соединений. Их высокая элек-
тропроводность согласуется либо с солеподобной, либо с
металлической связью, поскольку любая из этих связей пред-
полагает увеличение числа электронов в результате их пере-
хода на пустые уровни л-зоны углеродных 'макромолекул.
Однако увеличение электропроводности в направлении,
нормальном к плоскостям макромолекул, было бы легче объ-
яснить с помощью металлической модели. Экспериментальные
результаты для хорошо ориентированного графита указывают
на сильное увеличение проводимости в этом направлении,
если только калий внедряется между углеродными гексаго-
нальными сетками (ср. гл. VII). На самом же деле эти две
модели могут представлять собой два возможных рабочих
приближения. Как в той, так и в другой модели необходимо
учитывать расположение добавки внутри любого слоя. В слу-
чае присоединения щелочных металлов к углеводородам с
меньшими молекулами в результате переноса зарядов доба-
вочные атомы, как правило, располагаются на особых местах
ароматических молекул, так как такое расположение допус-
кает энергетически выгодную перестройку орбит. Аналогич-
ные факторы могут играть роль в таких соединениях, как со-
единение графита с калием, однако для подробного обсужде-
ния требуется большее количество данных. Фиг. 45 и 46
иллюстрируют действительное расположение атомов в соеди-
нении С8К.
Приведенные опыты не позволяют проверить (ср. [347])
предположение о том, что в соединении графита с бромом
бром может существовать не в виде молекул, а в виде ионов
176
Глава VI
[629]. По-видимому, часть внедренного брома должна пред-
ставлять собой анионы, которые соответствуют углеродным
макрокатионам, а другая часть присутствует -в виде молекул,
играющих роль распорок, аналогичных H2SO4 в кислых суль-
фатах графита. Некоторым подтверждением этого предполо-
жения служит свободный обмен, наблюдаемый между ато-
мами галогенов в том случае, когда в графит вводится одно-
хлористый или однобромистый иод [180].
4. Для четвертой и в настоящее время самой большой
группы кристаллических соединений графита, по-видимому,
характерны процессы, связанные с переносом заряда между
углеродными макромолекулами и внедренными комплексами,
которые могут представлять собой либо донорные, либо ак-
цепторные образования. Как правило, внедренные группы
являются, по-видимому, акцепторами. Электронная структура
этих соединений до сих пор недостаточно объяснена. Тща-
тельные исследования позволяют во многих случаях предпо-
лагать, что объединяются во время образования подобных
кристаллических соединений отрицательные атомы. В таком
случае структура связи должна содержать в себе углеродные
макрокатионы и сложные анионы вместе с молекулами,
играющими роль распорок, например Сп (А1С14)т А1С1з;
С* (FeCl4) mFeCl3; С + (FeCl4)m А1С13 и т. д. (ср. [262]). С дру-
гой стороны, по, аналогии с соединениями более мелких аро-
матических молекул, характеризующимися наличием переноса
зарядов [399] (см. также ссылки, цитируемые в [1062]), аро-
матические углеродные сетки графита могут образовывать
сходные поляризационные связи, особенно с такими электрон-
ными акцепторными группами, как Br2, FeCl3 и т. д. В соеди-
нениях графита с бромом обнаружена проводимость, повы-
шенная по сравнению с маточным графитом [629].
В этом отношении такие соединения графита напоминают
соединения более мелких ароматических молекул с присоеди-
нением брома [957].
Такое поведение соединения графита с бромом можно
объяснить, если предположить, что некоторые электроны по-
кидают заполненную л-зону углеродных гексагональных се-
ток, в результате чего появляется дырочная проводимость.
Хотя нет полной ясности, какие атомы добавок следует отне-
сти к прочно связанным в остаточных соединениях, а какие
к внедренным в слоистые соединения, измерения коэффици-
ента Холла подтверждают образование электронных дырок
(см. гл. VII).
ГЛАВА VII
МАГНИТНЫЕ И ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА
КРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ ГРАФИТА
VII.1. ИЗМЕНЕНИЕ ЗАПОЛНЕНИЯ ЭНЕРГЕТИЧЕСКИХ ЗОН
ПРИ ОБРАЗОВАНИИ КРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
Некоторые дополнительные сведения об электронных зо-
нах графита можно получить из данных по изучению соответ-
ствующих свойств кристаллических соединений. Одна из при-
чин, затрудняющих развитие таких исследований, заклю-
чается в том, что сильное расширение пространства между
слоями в процессе образования кристаллических соединений
вызывает, как правило, дробление поликристаллического гра-
фита, так что имеющиеся экспериментальные данные получе-
ны главным образом на поликристаллических порошках. К на-
стоящему времени эта трудность преодолена [1065], и сейчас
имеются данные по анизотропии электрических и магнитных
свойств кристаллических соединений графита. При рассмот-
рении соединений с более высокой по сравнению с графитом
электропроводностью (например, в случае соединений графи-
та с щелочными металлами и бромом) следует использовать
наиболее реальную модель графита, по которой графит имеет
бесконечную кристаллическую решетку с электронными энер-
гетическими зонами, соответствующими его квазиметалличе-
ской природе. Вследствие упрощенного представления элек-
тронных зон для бесконечных гексагональных сеток (т. е. в
случае двумерного приближения для идеального графита)
функция распределения электронов N (е) по энергиям 8 при-
обретает вид, показанный на фиг. 35. При этом одну зону
можно считать почти совершенно пустой, а другую — почти
целиком заполненной.
Для установления связи между зонной картиной и харак-
теристиками, чувствительными к точному расположению этих
зон в случае их перекрытия или разделения, требуется^ по-ви-
димому, дальнейшее развитие приведенной картины энерге-
тических зон. Такими характеристиками являются, например,
температурный коэффициент электросопротивления в направ-
лении оси а и температурный коэффициент весьма высокой
диамагнитности в перпендикулярном к этой оси направлении.
12 А. Р. Уббелоде
178
Глава VII
Вероятно, в идеальных монокристаллах графита зоны незна-
чительно перекрываются, тогда как в поликристаллическом
графите они разделены небольшим промежутком (разд. IV. 10
и IV.11.1).
Несмотря на то что в этой упрощенной квазиметалличе-
ской модели графита совершенно не учитывается присутствие
дефектов, особенно дефектов сетки и винтовых дислокаций,
она позволяет объяснить некоторые явления, связанные с
электрическими и магнитными свойствами многих кристалли-
ческих соединений графита. Если полученные данные отно-
сятся к поликристаллической текстуре этих соединений, то
результаты по определению изменения электропроводности по-
с-равнению с электропроводностью маточного графита следует
интерпретировать с осторожностью, так как образование со-
единения может повлиять на электронные барьеры между
кристаллитами.
VII.2. ИЗМЕНЕНИЕ ЭЛЕКТРОСОПРОТИВЛЕНИЯ
ПРИ ОБРАЗОВАНИИ СОЕДИНЕНИЙ
Уменьшение электросопротивления при образовании со-
единений в общих чертах объяснено Макдоннелом, Пинком
и Уббелоде [629]. Что касается зонной структуры графита, то
электроположительная добавка, включенная между углерод-
ными гексагональными сетками, будет снабжать электронами
пустую л-зону, а электроотрицательная получать их из за-
полненной л-зоны. Вследствие этого в твердом соединении
увеличивается либо число электронов проводимости, либо
число положительных дырок. Фиг. 47 иллюстрирует влияние
на сопротивление небольших последовательных добавок при-
месей к поликристаллическому графиту. Если есть основание
предполагать, что вместо процесса переноса электронов про-
исходит образование основных ковалентных связей добавок
с определенными атомами углерода, как в случае твердого
фтористого углерода, ароматический характер структуры на-
рушается и электропроводность графита падает.
Это объяснение является, очевидно, слишком упрощенным,
так как основано на двумерной модели энергетических зон
графита. По-видимому, следует принимать во внимание влия-
ние взаимодействия между соседними углеродными гексаго-
нальными сетками, а также другие вторичные эффекты. Со-
поставление совокупности данных позволяет в настоящее вре-
мя предполагать, что в маточном графите, если он только не
содержит дефектов, вклад такого взаимодействия в электрон-
ную проводимость весьма невелик. Однако полностью нельзя
Магнитные и электрические свойства соединений графита
179
пренебрегать взаимодействием между слоями, так как опыт
показывает, что проводимость монокристаллов графита в на-
правлении, перпендикулярном углеродным гексагональным
сеткам, имеет конечное значение (IV.11).
В кристаллических соединениях взаимодействие между со-
седними слоями может быть в значительной мере видоизме-
нено. Если процесс переноса электронов между углеродными
гексагональными сетками и добавками является достаточно
Концентрация примесей, /0 $атомов донора/атом G
Фиг. 47. Относительное сопротивление (R/Ro) соединений
графита, образованных примесями л- и р-типов [261].
Положительные значения соответствуют донорной примеси (п), от-
рицательные значения — акцепторной примеси (р).
интенсивным, то для большинства полярных соединений с
включением слои оказываются сильно поляризованными.
Одно из доказательств этого утверждения можно получить
из исследования анизотропии электропроводности. Для по-
ликристаллических порошков получены данные по изменению
электропроводности в направлении оси а, которое характери-
зуется наиболее -высокой проводимостью. Однако для хорошо
ориентированных образцов возможны измерения и в направ-
лении оси с. Из фиг. 48 [1065] видно, что для соединения гра-
фита с калием заметное повышение электропроводности (при-
близительно -в 200 раз) наблюдается для нормального к слоям
направления. Это указывает на существенное по сравнению
12*
80
Глава VII
с маточным графитом увеличение взаимодействия между со-
седними слоями.
На основании существующих данных по рентгеноструктур-
ному анализу кристаллических соединений графита нельзя
/,о
ю'1-
Осъ с, графит
Ось с, соединение графита с Вг
-
§ <о~г-
—Си с, JC1
Ось С, Вг
Ось a, JC1
Ось а, Вг
Ось а, К
Си -Ч
§ 10
Е
Ось с, соединение графита с К
си
g to -
Ю
з
/о'5-
ю'6-
- Ось а, грасрит
- Ось at соединение графита с Вг
- Fe
- Ni
- Ось а.соединение графита с К
- А1
Фиг. 48.
а — относительное изменение сопротивления в направлениях осей а и с при
образовании кристаллических соединений графита.
б — сравнение удельного сопротивления хорошо ориентированного графита и его
кристаллических соединений с удельным сопротивлением некоторых металлов.
с достаточной уверенностью утверждать, является ли любое за-
метное изменение длины связи С—С углеродных сеток ре-
зультатом взаимодействия с добавками.
Изменение электрических свойств, связанное с образова-
нием «остаточных» соединений (ср. V.4), можно, вероятно,
интерпретировать, исходя из того, что в таких соединениях
Магнитные и электрические свойства соединений графита 181
небольшие количества добавки прочно удерживаются на де-
фектах сетки. Как уже говорилось, это объяснение не яв-
ляется единственным. Какой бы ни была природа связи,
электронные доноры должны, очевидно, отдавать электроны
в пустую зону, а электронные акцепторы — получать элек-
троны из заполненной зоны, что приводит в любых случаях
к повышению электропроводности.
Между кристаллическими соединениями графита и соеди-
нениями тех же добавок с более мелкими ароматическими
молекулами наблюдается некоторый параллелизм. Так, на-
пример, при образовании кристаллических соединений элек-
тропроводность более мелких ароматических молекул возра-
стает. Заметное увеличение электропроводности можно на-
блюдать в соединениях, содержащих электронные акцепторы,
такие, как бром, хотя эти вещества являются не очень ста-
бильными из-за дальнейшего замещения брома при С—Н-свя-
зи [12]. Более устойчивые кристаллические соединения могут
быть получены с электронными донорами, например с щелоч-
ными металлами. Для приближенного объяснения электриче-
ских и других свойств соединений с более мелкими молеку-
лами можно снова воспользоваться солеподобной моделью
[355, 456, 957].
VI1.3. МАГНИТНЫЕ СВОЙСТВА КРИСТАЛЛИЧЕСКИХ СОЕДИНЕНИЙ
Из ряда экспериментов следует, что образование всех
кристаллических соединений с электропроводностью, большей
чем у маточного графита, сопровождается, как правило, сни-
жением заметного диамагнетизма графита. Соответствующее
снижение найдено для соединения графита с калием [629].
В общем это изменение магнитных свойств можно объяснить
тем, что . электронные акцепторы опустошают верхнюю часть
почти заполненной л-зоны, а электронные доноры наполняют
самую нижнюю часть почти пустой зоны проводимости. Для
количественной интерпретации явления необходимы более
точные теории магнетизма маточного графита. Понижение
значительного диамагнетизма маточного графита при образо-
вании «остаточных» соединений наблюдалось во многих слу-
чаях [518]. Этот эффект можно объяснить переходом электро-
нов из заполненной зоны графита в электронные ловушки,
которыми являются дефекты. -Однако детальное обсуждение
механизма изменения магнитной восприимчивости представ-
ляется преждевременным из-за неопределенностей в интер-
претации природы связи в остаточных соединениях.
182
Г лава VII
Результаты исследований других электронных свойств
кристаллических соединений графита, отличающихся высокой
электропроводностью, подтверждают простую модель Мак-
доннела, Пинка и Уббелоде.
VII.3.1, ТЁРМО-Э.Д.С., КОЭФФИЦИЕНТ ХОЛЛА,
МАГНИТОСОПРОТИВЛЕНИЕ
Фиг. 49. Зависимость коэффициента Холла графита
от количества введенных примесей [206].
Магнитные и электрические свойства соединений графита 183
ческой зоны или на дне пустой зоны. В случае поликристал-
лических порошков при измерениях удобно использовать от-
прессованные столбики из проводящего порошка, зажатые
между двумя медными электродами. Такие электроды под-
держиваются при различных температурах, измеряемых с
помощью небольших термопар, вмонтированных в электроды.
В том случае, когда соединения графита содержат компонен-
ты, которые могут реагировать с медью, как, например, гало-
гены, очень удобно защищать электроды тонким слоем пла-
тиновой фольги. Как показывают экспериментальные данные,
Концентрация примесей, Коатомов донора/атом С
Фиг. 50. Магнитосопротивление графита с при-
месями и- и р-типов [261].
1 — слоистое соединение при 300°К; 2 — остаточное соединение при
300°К; 3 — остаточное соединение при 77°К; 4 — остаточное соеди-
нение при 300°К; 5 — слоистое соединение при 77°К.
термо-э. д. с. слоистых соединений графита меняется как раз
в том направлении, в котором, по-видимому, изменяется ко-
личество электронов и дырок в л-зонах в результате введения
в графит добавки.
Кроме того, в сильно разупорядоченных углеродах абсо-
лютная величина термо-э. д.с. постепенно падает по мере по-
следовательного повышения упорядоченности под действием
отжига [89]; это обстоятельство, вероятно, частично обуслов-
лено присутствием в таких образцах инородных атомов. Для
некоторых кристаллических соединений были измерены так-
же коэффициент Холла и магнитосопротивление. На фиг. 49
и 50 представлены кривые, иллюстрирующие изменение элек-
184 Глава VII
тронных свойств после внедрения донорных и акцепторных
групп (ср. [261]). Эти кривые относятся лишь к начальным
стадиям введения примесей. В этой области данные экспе-
римента находятся в согласии с результатами, полученными
из простой модели Макдоннела, Пинка и Уббелоде [629]. Не-
которые детали, как, например, отсутствие симметрии, не со-
гласуются с этой моделью. Однако необходимо помнить, что
в любом случае результаты, полученные для идеального' гра-
фита, могут быть искажены вследствие присутствия разно-
образных дефектов кристаллической структуры, а также из-за
использования поликристаллического материала.
ГЛАВА VIII
ОКИСЬ ГРАФИТА (ГРАФИТОВАЯ КИСЛОТА)
VIII.1. связь С ДРУГИМИ кристаллическими
СОЕДИНЕНИЯМИ ГРАФИТА
В связи с отсутствием общепринятого термина для обозна-
чения самого высокого продукта окисления графита, еще со-
храняющего развитую сеточную структуру, представляется
целесообразным использовать общее название «окись графи-
та», пока не будут полностью установлены различные формы
продукта (для полноты обзора ср. [221, 222]). Включение это-
го вещества в последовательный ряд кристаллических соеди-
нений графита вытекает из следующих соображений.
1. Окись графита образуется при окислении графита в
присутствии воды при прочих равных условиях, необходимых
для образования кислых солей графита (ср. V.1). Это подроб-
но иллюстрируется на примере удобного метода получения
окиси, описанного Хаммерсом и Офменом [479].
2. Окись графита может образоваться в процессе электро-
лиза, когда используются угольные электроды, в присутст-
вии, например, слабой HNO3 и какого-нибудь окисляющего
агента [143, 502]. При этом может произойти вспышка
[194, 195].
3. Расширение графита при образовании его окиси напо-
минает расширение кристалла при образовании других слои-
стых соединений. Однако здесь имеется одно существенное
отличие, заключающееся в том, что углеродные гексаго-
нальные сетки окиси графита, по-видимому, изгибаются
(см. ниже).
4. Химический состав окиси графита можно представить
в виде С + (ОН)^(Н2О)2. По сравнению с бисульфатом
(ср. V.1) на первый взгляд может показаться, что это соеди-
нение являётся основанием; однако его реакция с лакмусом
имеет кислый характер [133]. Окись графита наиболее целе-
сообразно рассматривать как амфотерное соединение. Чтобы
не предрешать заранее его поведение, предпочтительнее,,
по-видимому, называть его не «графитовой кислотой», а
186
Глава VIII
«окисью графита». Степень основности можно связать с не-
прерывным разбуханием твердого соединения в воде. В том
случае, когда оно ведет себя, как кислота, происходит, веро-
ятно, сорбция некоторого количества ОН~ и освобождение
протонов.
Существует предположение, не проверенное, правда, на
опыте, что структуры, аналогичные структуре окиси графита,
могут образовываться как промежуточные стадии при окис-
лении графита газообразным кислородом, особенно в присут-
ствии молекул воды. По химическим свойствам окись графи-
та при комнатной температуре является вполне устойчивой.
При нагревании до температуры выше 150° С она разлагается
с выделением различных продуктов в зависимости от скоро-
сти нагрева [69, 441, 554]. Если окись графита нагреть до
200°, она вспыхивает и превращается в СО2 и СО [437].
Различные структуры окиси графита могут образоваться
также в качестве промежуточных продуктов окисления гра-
фита паром. Этот вопрос имеет непосредственное отношение
к гл. ГХ.
Многие авторы пытались по-разному представить эмпири-
ческую формулу окиси графита: Тиле [1024] изобразил ее
в виде [С6(ОН)з]п, в то время как Франклин [298] предложил
формулу [СйС^Щп. Гофман [448] указал на то, что состав оки-
си не является постоянным и зависит как от типа графита,
используемого в качестве исходного материала, так и от про-
должительности процессов окисления и восстановления. Эту
связь легче всего понять, если представить, что в графите
происходит последовательное разрушение углеродных сеток.
Предельная формула [C7H2O4L относится к продукту, полу-
ченному как из естественного, так и из синтетического графи-
тов [218]. 1 г этого соединения окисляет 32,7 ±0,2 миллиэкви-
валента T1CI3 и, по-видимому, лишь 28,0 миллиэквивалентов
Ш, что объясняется закреплением иода в окиси графита.
Состав восстановленной окиси графита, как оказалось, пред-
ставляет собой [С7ОН]П.
Согласно исследованиям, выполненным на различных гра-
фитах ([177]; ср. также [178]), не существует единственной
формулы для окиси графита, близкой к идеальной
С8О2(ОН)2, поскольку состав окиси зависит от метода полу-
чения и структуры исходного графйта.
5. После пиролиза окись графита снова превращается в
углерод и в продукты более низкого молекулярного веса.
Рентгенограммы полученного углерода показывают, что пос-
ле нагревания до 1800°С окись графита переходит в почти
идеальный графит [674].
Окись графита
187
VIII.2. ОБРАЗОВАНИЕ ОКИСИ ГРАФИТА
Окись графита является одним из первых исследованных
слоистых соединений [133, 354]. Штауденмайер [978—980] и
Хамди [385] показали, что в том случае, когда азотная и сер-
ная кислоты нагреваются с графитом в присутствии неболь-
шого количества окисляющего агента, например в присутст-
вии хлорноватокислого калия, графит набухает и претерпе-
вает последовательное изменение окраски; в конце концов
реакция завершается образованием окиси графита. На первый
взгляд кажется странным, что образование бисульфата и
других кислых соединений графита происходит аналогичным
путем. Однако бисульфат графита образуется лишь в тех слу-
чаях, когда концентрированная серная кислота добавляется
к графиту в присутствии различных окисляющих агентов.
Подобно другим слоистым кислым соединениям, бисульфат
графита образуется достаточно быстро, а при добавлении
воды к раствору — также быстро разлагается [855].
С другой стороны, для полного превращения графита в
окйсь может потребоваться пять дней [133] или более [372];
при этом необходимо затратить некоторое количество воды.
Кислые соли, по-видимому, можно рассматривать в качестве
некоторых промежуточных продуктов, возникающих при об-
разовании окиси графита. Подтверждением этой точки зре-
ния является то, что смесь Броди образует окись графита
только с графитизирующимися углеродами [651], содержа-
щими участки графитовой структуры.
Процесс образования окиси графита проходит через раз-
личные стадии в зависимости от времени, которое требуется
для реакции; эти стадии сопровождаются изменением окраски
[479] от голубой через различные оттенки зеленой и до желтой
[133]. Остается неизвестным, имеет ли зеленая окись графита
действительно такой цвет или она состоит из желтых и черных
слоев. После просушки конечный продукт приобретает корич-
невую окраску [316]. Признаком завершения этих стадий слу-
жит появление при интенсивной промывке более или менее
коллоидной взвеси, прородящей электрический ток. Сухой ма-
териал тока не проводит (см. ниже) [437].
Более высокая по сравнению с окисью графита степень
окисления предполагает распад графита до меллитовой кис-
лоты
ОН___ОН
ОН/ /ОН
он он
*88 Глава VIII
То обстоятельство, что меллитовая кислота образуется,
как правило, без участия окиси графита, когда неграфитизи-
рованные углероды подвергаются окисляющему воздействию
разбавленных азотной и серной кислот, согласуется с извест-
ной точкой зрения, по которой окись графита содержит поли-
гексагональные сетки атомов углерода. Еще до появления
рентгенографических методов исследования для установления
«графитовой» природы углерода требовалось определить,
можно ли с помощью реактива Броди получить из этого уг-
лерода окись графита. Значение этих методов, по-видимому,
выявлено недостаточно. Дальнейшие эксперименты необхо-
димо проводить на углеродах различной структуры, дефекты
которой достаточно изучены, причем последовательные хими-
ческие превращения должны сопровождаться физическими
исследованиями с применением рентгеноструктурного анали-
за и метода электропроводности.
VIII.3. СТРУКТУРА ОКИСИ ГРАФИТА
Рентгенографические исследования [441, 447, 896, 897J
показывают, что расстояние между слоями углеродных ма-
кромолекул в графите увеличивается при образовании окиси
графита. Окись графита в некоторых отношениях отличается
от других слоистых соединений. В зависимости от /количества
введенной воды расстояние между слоями макромолекул ме-
няется от 6 до 11 А.
Расстояние между сетками в направлении оси с для сухой
окиси графита то же, что и после сорбции 4% Н2О; дальней-
шее введение воды приводит к расширению, которое после
поглощения 16% Н2О становится пропорциональным количе-
ству сорбированной воды [437]. Некоторая часть адсорбиро-
ванной воды «запрятывается», очевидно, в сетки, поскольку
указанное пропорциональное расширение не настолько вели-
ко, чтобы вся введенная вода поместилась в этом объеме.
Обнаружено [218], что в полярных жидкостях удельный объем
окиси графита ниже, чем в неполярных, однако значение этого
факта остается неясным.
С помощью рентгенографических методов [23, 160, 161,
177] наблюдалась также межслойная сорбция органических
молекул, таких, как (C2Hs)2 или диоксан.
До сих пор не вполне ясно, происходит ли последователь-
ное введение О и Н или же отдельные слои полностью
заполняются группами ОН, как в случае других соединений
графита. Низкая скорость образования окиси графита по
сравнению с более высокой скоростью для других слоистых
Окись графита
соединений означает, что образование окиси сопровождается
многочисленными разрывами С—С-связей внутри каждой уг-
леродной гексагональной сетки, вследствие чего размеры
сетки в конечном счете уменьшаются. Эти разрывы могут
вызвать дальнейшее разбухание уже полностью окисленного
соединения.
Существует мнение, по которому атомы кислорода, по-
добно фтору (ср. V.3), образуют с углеродной гексагональ-
ной сеткой ковалентные связи [413, 415]. Для проверки этой
гипотезы было бы полезно сравнить по порядку величины
значения сопротивления окиси графита и фтористого графи-
та, так как в последнем случае образование ковалентных
связей сопровождается очень сильным увеличением сопротив-
ления [629]. Образование ковалентных связей с валентными
электронами атомов углерода в гексагональных сетках мо-
жет произойти лишь в том случае, когда эти сетки теряют
свою «макроароматическую» природу, которая характери-
зуется зр2л-гибридизацией и плоской структурой. Так, напри-
мер, гексагональные сетки могли бы стать «гидроароматиче-
скими», что соответствует увеличению длины С—С-связи и
появлению зр3-гибридизации. Из-за взаимного влияния в та-
ких сетках соседних гексагонов невозможно предугадать,
будет ли увеличиваться длина С—С-связи вплоть до значения
1,54 А, характерного для алифатических соединений, которое
было найдено также для небольших алициклических молекул.
Степень такого взаимного влияния должна зависеть от раз-
мера и близости замещающего атома. Механические напря-
жения в таких гидроароматических гексагональных сетках
могут уменьшаться вследствие их «перекашивания».
В противоположность изложенной точке зрения Вейсс
[1110] и Франклин [298] нашли, что структуру окиси графита
можно считать аналогичной структуре бисульфата графита.
Это означает, что в том случае, когда количество внедренной
(до предела) соли не превышает стехиометрически возмож-
ного, не будет наблюдаться перекашивания углеродных се-
ток, аналогичного перекашиванию при образовании ковалент-
ных связей. Данные, свидетельствующие о наличии перека-
шивания сеток, кажутся противоречивыми. Образование
складок и перекашивание плоскостей слоев наблюдались
электронографическими методами [55], причем предполага-
лось, что они возникают благодаря эпоксидным связям меж-
ду плоскостями слоев (см. ниже). Эта модель подтверждается
экспериментами по инфракрасному поглощению [372].
Положение линий (1010) и (1120) на рентгенограммах по-
рошков окиси графита [447] указывает на увеличение длины
190
Глава VIII
С—С-связи в слоях до 1,44А по сравнению с 1,415 А для гра-
фита [674]. Следует отметить, что проекция связи на плос-
кость изогнутого слоя в алициклической углеродной гексаго-
нальной сетке с расстоянием С—С = 1,53 А приводит к кажу-
щейся длине С—.С-связи, равной 1,45 А. Предполагалось
также, что некоторое количество кислорода соединяется с уг-
леродными гексагональными сетками связями типа окиси
этилена. С этой точки зрения вода, которая разделяет слои,,
удерживается, подобно молекулам Н2О, благодаря полярному
притяжению. Кроме того, должно присутствовать небольшое
количество гидроксильных групп. Другое предположение
[345] сделано по аналогии с перекисью фенантрена, которая
диссоциирует на соответствующие фенантроксильные груп-
пы, и состоит в том, что некоторая часть кислорода может
присоединяться к углероду только поодиночке. Измерения
магнитных параметров должны подтвердить это соображение.
По аналогии с более мелкими углеродными циклическими
молекулами вторая модель для окиси графита с ковалент-
ными связями между кислородом и углеродом включает ги-
дроперекисные группы [218, 327].
Для оценки количества связанного кислорода использо-
валась реакция химического восстановления окиси под дейст-
вием сульфата железа и гидразина. Процесс восстановления
осуществлялся также с помощью окислов олова и меди и
электролиза [1024, 934]. Поскольку таким путем весь кисло-
род не восстанавливается [441], некоторое его’ количество
оказывается связанным с молекулами воды (ср. [479, 855,
856, 896, 897]).
Одновременно с восстановлением можно произвести аце-
тилирование окиси графита [896, 897]. В этом процессе одна
из ОН-групп не поддается ацетилированию, однако при вос-
становлении с одновременным ацетилированием окиси графи-
та получается меньшее количество иода, чем при прямом
восстановлении. Это обстоятельство, возможно, указывает на
наличие в окиси графита кетоенольной таутомерии [218, 221],
хотя исследование инфракрасного поглощения [372] не выяв-
ляет наиболее эффективных связей кислорода с углеродом.
Необходимо отметить, что замещение водорода дейтерием
в окиси графита наталкивается на серьезные трудности. Это
нелегко согласовать с присутствием в окиси графита спирто-
вых и фенольных групп.
В результате промывки продукта водным раствором
СЮ2 + НС1 в темноте получается твердое соединение, которое
сохраняет бледную окраску даже после просушки в присутст-
вии Р2О5. Под действием слабой щелочи оно сразу темнеет,
Окись графита
191
причем светлый и темный продукты имеют, по существу, оди-
наковый состав и, вероятно, связаны с превращением
кето-форма (бледный) енол (темный).
Количество связанных ОН-групп можно определить либо
с помощью удаления вместе -с диоксаном «физически удер-
живаемой» воды, либо, наоборот, с помощью обработки твер-
дого соединения этилатом натрия. Оба метода дают около
НО миллиэквивалентов на 100 г. Лишь некоторую часть этих
ОН-групп можно нейтрализовать водным и спиртовым раство-
рами NaOH или метилировать диазометаном. Кислотные
свойства этих ОН-групп, которые приписываются окиси гра-
фита, несмотря на гидроароматический каркас, обусловлены,
по-видимому, их близостью к двойным связям.
Присутствие некоторого количества групп ОН и СООН
подтверждается данными по инфракрасному поглощению.
Разбухание окиси графита,-которое наблюдалось при различ-
ных способах первичного метилирования этих групп, можно
объяснить лишь в том случае, если карбоксильные группы
лежат на краях углеродных гексагональных сеток, а группы
ОН находятся около атомов углерода, расположенных ближе
к центру.
VI1I.4. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОКИСИ ГРАФИТА
Физические свойства окиси графита, за исключением ее
структуры, которая исследовалась рентгенографическими ме-
тодами, были изучены чрезвычайно поверхностно. Измерения
электросопротивления спрессованных порошков показали, что
окись графита является плохим проводником электричества
[437], хотя никаких систематических исследований зависимо-
сти сопротивления от содержания воды не проводилось. Изме-
рения магнитных характеристик, выполненные на одном об-
разце, а также на образце, который, по-видимому, был недо-
статочно окисленным [316], не обнаружили высокого диамаг-
нетизма, свойственного графиту. Окись графита представляет
собой одноосный кристалл, обладающий отрицательным двой-
ным лучепреломлением [327].
Электропроводность коллоидов, образующихся перед ко-
нечной стадией разложения до окиси графита, была исполь-
зована для получения с помощью электролиза зеркальных
поверхностей графита. Под действием кислот эти коллоиды
флоккулируют; при этом роль пептизатора играет аммиак.
Аморфный углерод образует суспензии окиси графита. Кри-
сталлический графит после окисления образует очень вязкие
растворы, в которых мицеллы заряжаются отрицательно при
192
Глава VIII
всех значениях pH [1025] (ср. также [386]). Желтая и корич-
невая формы окиси графита пептизируются в гидрофильные
отрицательно заряженные коллоидные растворы с флуорес-
ценцией, цвет которой меняется от ярко-желтого до темно-
красного. Тот факт, что более низкие формы окиси графита
(голубая или зеленая) под действием красного света перехо-
дят в желтую или коричневую [1024], вместе с упомянутыми
выше оптическими эффектами представляет интересный
объект для дальнейших исследований.
Фиг. 51. Включение в окись графита органических молекул
и Н2О [160, 161].
В более тщательном изучении нуждается также вопрос о
сходстве окиси графита с другими слоистыми структурами,
такими, как, например, бентонит. Для объяснения давления,
развиваемого при разбухании окиси графита в воде, были
выдвинуты различные соображения [73, 146], основанные на
рассмотрении взаимодействия между молекулами раствори-
теля и углеродными сетками. Однако никакого оконча-
тельного согласия, по-видимому, достигнуто не было; измере-
ния макроскопических параметров системы желательно до-
полнить дальнейшими исследованиями структуры.
Рентгенографические и другие исследования сорбции
окисью графита широкого класса молекул [161] показывают,
что нормальные алифатические спирты могут располагаться
между сетками окиси графита или перпендикулярно или
вдоль их плоскости. Величина расстояния между сетками, по-
лученная из оценки этого эффекта, оказалась равной при-
мерно 4,8 А.
На фиг. 51 показана возможная структура для случая
перпендикулярного расположения.
ГЛАВА IX
ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ ГРАФИТА
В ГАЗООБРАЗНЫЕ ПРОДУКТЫ
Превращению углерода в газообразные продукты посред-
ством химической реакции посвящено большое количество
исследований. В общем виде это можно записать так:
Ств+Х—► Газообразный продукт.
Многие исследования были предприняты в связи с большим
значением для технологических процессов реакций с участи-
ем твердого углерода, особенно реакций, в которых участвуют
кислород «и водород. При этом имеют место следующие три
главные реакции:
а) экзотермическая реакция
Ств+О2—>СО2,
(1)
основное назначение которой заключается в выделении теп-
лоты горения;
б) эндотермическая реакция
СТВ+СО2—+2СО,
(2)
цель которой заключается в производстве газового топлива, и
в) реакция
ств+н2о—>со+н2,
(3)
которую можно использовать самостоятельно или в термоди-
намической комбинации с реакцией (2) в качестве важного
источника производства промышленного водорода, т. е.
Ств+2Н2О—>СО2+2Н2. (4)
При реакции в присутствии водорода вполне возможны обра-
зования газообразных водородных соединений:
Ств+/?н2-—>СН4, С2Н6 и т. д. (5)
13 А. Р. Уббелоде
194
Глава IX
Таблица 25
Равновесие графита с газообразными продуктами
К — Продукты
р Исходные вещества
С02 (газ) СГрафит+О2 ,газ) ( 1)
Н2Огаз^з±Н2 (Га3) — О2 (газ) (3)
£ОгазЧ“П2 (газ) СГрафИТ4~Н2Огаз (5)
СН4 (га3) qjzt Сграфит4-2Н2 (газ) (7)
1g Кр для
СОгаз СГрафцТ-|-— ^2 (газ) (2)
со2 (газ) ^графит 2СОгаз (4>
С02 (газ) + Н2 (газ) СОгаз+
+Н3Огаз (6)
реакций
Темпера- тура, °C (1) (2) (3) (4) (5) (6) (7)
25 —69,09 —24,05 —40,05 —20,99 + 16,00 —4,99 —8,90
26,84 —68,67 —23,93 —39,79 —20,81 + 15,86 —4,95 —8,82
126,84 —51,54 — 19,13 —29,24 —13,28 + 10,11 —3,17 —5,49
226,84 —41,26 —16,28 —22,89 —8,74 +6,63 —2,11 —3,43
.326,84 —34,40 —14,34 —18,63 —5,72 +4,29 — 1,43 —2,00
426,84 —29,50 —12,96 —15,58 —3,58 +2,62 —0,96 —0,95
526,84 —25,83 —11,93 — 13,29 — 1,97 + 1,36 —0,61 —0,15
626,84 —22,97 —11,13 —11,50 —0,71 + 0,37 —0,34 + 0,49
726,84 —20,68 —10,48 —10,06 +0,28 —0,42 —0,14 + 1,01
826,84 • —18,80 —9,94 —8,88 + 1,08 —1,06 + 0,02 + 1,43
926,84 —17,24 —9,50 —7,90 + 1,76 —1,60 +0,16 + U9
1026,84 —15,92 —9,12 —7,06 +2,32 —2,06 + 0,26 +2,10
1126,84 —14,78 —8,79 —6,35 +2,80 —2,44 + 0,36 +2,36
В табл. 25 представлены константы равновесия для обычных
реакций с участием С, О и Н. Эта таблица заимствована из
работы Гульбрансена и Эндрью [367], но если требуется вы-
сокая точность, то для термодинамических величин следует
использовать оригинальные данные [1083].
Другими важными в технологическом отношении реакция-
ми, которые ведут к образованию газообразных продуктов, яв-
ляются реакции хлорирования
Ств+пС12—>СС14, С2С16 и т. д.
и соединения с серой
Ств+$2
CS2.
Химическое превращение графита в газообразные продукты 195
Эти общие уравнения не охватывают, естественно, все воз-
можные продукты. Как будет видно из дальнейшего, уравне-
ния, описывающие комбинации углерода с кислородом, на-
пример, должны также включать и образование более слож-
ных окислов.
В преобладающем большинстве опытов в качестве исход-
ного материала использовался углерод, отличающийся от гра-
фита как по структуре, так и в химическом отношении. В дан-
ной монографии не предполагается излагать технологию
процесса, по которому практически осуществляются подобные
реакции. Из экономических соображений многие из этих
реакций исследовались на углеродах, которые в лучшем слу-
чае можно рассматривать как весьма несовершенную форму
графита. Однако даже такие исследования прикладного ха-
рактера выявили некоторые важные закономерности механиз-
ма реакций, характерных для твердого состояния. Весьма
полный перечень литературных работ с описанием отдельных
экспериментальных методик можно получить в других обзо-
рах по этому вопросу, как, например, у Блэквуда [80].
Более специфический технологический интерес к окисле-
нию именно графита, а не углерода,’который по сравнению с
графитом обладает крупными дефектами, объясняется расту-
щим применением графита как тугоплавкого материала, а
также материала, используемого в ядерных реакторах. В по-
следнем случае существенно то, что окисление может значи-
тельно измениться после облучения* графита [563, 700].
Для уменьшения воздействия окислителя на графит, ис-
пользуемый в качестве конструкционного материала, следует
удалить любой способствующий окислению катализатор (см.,
например, работу [307]). Наиболее распространенные примеси
способствуют окислению; фосфаты и бораты являются инги-
биторами [263]. Другой метод, предохраняющий углерод от
окисления, состоит в применении стойких покрытий, в том
числе и покрытий из пиролитического углерода [357, 633]. Бла-
годаря значительной пористости искусственного графита мож-
но покрывать его внутренние поверхности слоями некоторой
толщины. Для этой цели в графит вводились фенольные смолы.
Получаемое вещество стойко к окислению газами и к другим
химическим воздействиям при температурах не выше 200° С.
В противоположность сплошной поверхности металлов, кото-
рая при окислении трескается и откалывается, окисление гра-
фита может ограничиться, кристаллитами, немедленно оголяю-
щимися в результате разрушения предохранительного покры-
тия каждого кристаллита, хотя соединения между кристалли-
тами сохраняются [329]. Предотвратить окисление при более
13*
196
Глава IX
высоких температурах можно при помощи других химических
покрытий, например карбидами металлов [331], или путем
пропитки [633].
IX.1. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ИЗУЧЕНИЯ ОБРАЗОВАНИЯ
ГАЗООБРАЗНЫХ ПРОДУКТОВ
Общепринятым методом изучения кинетики реакции яв-
ляется наблюдение за изменением давления во времени (см.,
например, [996]). Так как продукты летучи, то другим обще-
принятым способом измерения скорости реакции является
определение изменения веса образца графита. Если при обыч-
ном или пониженном давлении используются чувствительные
микровесы, то вес может регистрироваться непрерывно [263,
367, 844]. Кроме того, с успехом можно следить за протека-
нием реакции с помощью меченых атомов [101, 307]. При вы-
соких температурах опыты проводятся на углеродных нитях,
которые нагреваются пропусканием через них электрического
тока. Температура может быть измерена оптическим пиромет-
ром (библиографию по экспериментальным работам см. в
[91]).
При таком изучении скорости реакции наряду с аналити-
ческим определением газообразных продуктов и исходных ве-
ществ одновременно проводятся другие наблюдения. При
этом часто интересуются отношением СО2/СО, при помощи
которого можно сделать заключение о последовательности
окисления углеродных сеток.
Экспериментальными параметрами являются температура
и давление. Результаты опытов опубликованы для интервала
температур от 0° С (хемосорбция) до примерно 2500° С
[217, 357].
Большая часть исследований проводилась при давлениях
1 ат и ниже (часто из соображения удобства). Однако сле-
дует отметить, что газификация углерода при высоком давле-
нии имеет определенные технологические преимущества.
Были опубликованы теоретические расчеты равновесных со-
ставов исходных газообразных веществ и продуктов реакции
при увеличении давления [368, 369]. Как и следовало ожидать,
больше всего экспериментов было проведено по реакции уг-
лерод — водяной пар при повышенном давлении; получены
данные вплоть до давлений 500 ат [81, 352, 595].
Наиболее прецизионное изучение реакции углерод — кис-
лород выполнялось с чистым кислородом; воздух чаще ис-
Химическое превращение графита в газообразные продукты, 197
пользовался в опытах технологического характера. Азот обыч-
но считается лишь разбавителем. Однако было высказано
предположение [154], что при определенных условиях возмож-
но химическое взаимодействие азота с углеродом. Азот может
сильно хемосорбироваться на графите. Для охлаждения реак-
торного графита после обработки его галогенами при 3000°
используется инертная газовая среда [752]. В том случае, когда
возникает сомнение, для проверки следует использовать смесь
кислорода с аргоном или другой инертный газ [217, 680]. Кро-
ме того, важно точно знать влажность используемого газа,
особенно в точных экспериментах по изучению механизма
реакции. При образовании газообразных продуктов окисления
состав газа по мере окисления изменяется, в особенности если
опыт проводится в статических условиях. Метод потока не-
сколько улучшает условия, но если образец более или менее
порист, то можно обеспечить лишь конечную скорость подво-
да и отвода газов от поверхности. По-видимому, невозможно
избежать некоторой доли вторичных продуктов окисления, и
это препятствует четкому определению первичных и вторич-
ных стадий окисления графита и углеродов.
При изучении механизма образования газообразных про-
дуктов из твердого углерода необходимо знать точные харак-
теристики твердого тела, чтобы сделать надежные физико-
химические заключения. Даже в исследованиях прикладного
порядка обычно измеряют размер частиц, который опреде-
ляет внешнюю поверхность, доступную для свободного потока
газа. Очень важно также знать пористость углерода, хотя ее
изучают реже. В графите, близком к совершенному, или в
углероде с большим количеством дефектов, кажущаяся плот-
ность которых значительно ниже плотности идеального в кри-
сталлографическом отношении графита (т. е. ниже 2,26 г/мл),
происходит диффузия реагирующих газов к внутренним по-
верхностям (см., например, [1084]). Если внутренняя поверх-
ность во всем куске велика, то значительная часть пор стано-
вится доступной лишь после того, как сгорит та часть угле-
рода, которая преграждает доступ к ним [249, 973, 1086].
Совершенно очевидно, что соответствующие изменения в рас-
пределении пор по размеру (фиг. 52), эффективной поверхно-
сти’ (фиг. 53а) и плотности, определяемой иммерсионным ме-
тодом в гелии (фиг. 536), имеют большое значение. Инертная
зола в углероде может влиять на пористость, даже если
она не оказывает никакого влияния на механизм реакции
[589].
При достаточно высоком отношении поверхности к массе
можно применить методы сорбции для определения доступной
198
Глава IX
поверхности. Некоторые из этих методов упоминаются в
разд. II.2. Обычные углероды по своей структуре весьма не-
совершенны по сравнению с идеальным графитом, и рассмот-
Ф и г. 52. Изменение распределения пор по размеру
в графите CSF при частичном его окислении [973].
По оси ординат отложен общий объем пор, радиус
которых лежит в интервале от 7? до R -Г A R.
О образец окислен на 2,4%; • образец окислен
на 6,0%.
Кроме макроскопических факторов, определяющих доступ-
ность углеродной поверхности для газов, каждый из много-
численных дефектов структуры, уже рассмотренных в гл. I,
может в большей или меньшей степени влиять на механизм
окисления. В проводимых в настоящее время исследованиях
процесса окисления влиянию разных дефектов уделяется не-
одинаковое внимание. Как будет показано ниже, практиче-
ски наиболее тщательно изучалось, по-видимому, каталитиче-
ское влияние атомов разных .металлов на окисление. Посколь-
Химическое превращение графита в газообразные продукты 199
ку в настоящее время в исследованиях по переходу графита
в газообразные продукты имеется много неясностей, пред-
ставляется наиболее целесообразным рассмотреть в данной
Фиг. 53а. Изменение величины поверхности с
возрастанием окисления типичной пробы графита
и соответствующего ему порошка кокса [973].
AS Изменение величины поверхности.
~ Первоначальная поверхность
о графит; • порошок кокса.
°/о окисления по потере веса
Ф и г. 536. Влияние окисления на плотность
графита CSF [973].
монографии прежде всего явление окисления графита, близ-
кого к идеальному (в той мере, в какой мы располагаем дан-
ными), а затем установить роль дефектов, о которых мы
имеем сведения.
200
Глава IX
IX.2. ОКИСЛЕНИЕ ПОЧТИ ИДЕАЛЬНОГО ГРАФИТА
Как показали измерения [284, 520], скорость миграции
атомов углерода в твердом теле при всех температурах, при
которых изучалась реакция с кислородом, практически слиш-
ком мала, чтобы непосредственно влиять на механизм реак-
ции. В обычном диапазоне температур вплоть до 600° С все
вероятные механизмы включают первичный акт цепной реак-
ции. Реагирующие вещества, например молекулярный О2, за-
крепляются в некоторых местах углеродной сетки (обычно на
дефектах). В благоприятных случаях неустойчивые продукты,
которые образуются в результате взаимодействия молекул на
начальной стадии, можно определить как «поверхностные
окислы». Если температура достаточно высока, эти продукты
распадаются. Газообразная молекула отделяется от решетки
обычно таким образом, что оставляет некоторый дефект в
макромолекуле углерода, от которой она отделилась. Это
часто дает возможность свежей молекуле реагирующего ве-
щества снова присоединиться, так что повторные стадии мо-
гут следовать за первичным актом в известном смысле ана-
логично цепным реакциям свободных радикалов.
При практическом использовании этой простой схемы
осложнение заключается в том, что в графите, имеющем де-
фекты, быстрее будет окисляться та его часть, в которой
дефектов больше. Было исследовано окисление природного
графита [404] и искусственного графита высокой чистоты [90,
367]. В ряде случаев при помощи рентгеноструктурного ана-
лиза было установлено преимущественное окисление участ-
ков с наибольшим количеством дефектов [1099, 1100].
В большинстве случаев при изучении окисления углерода
в газообразные продукты углеродный скелет можно было
считать «замороженным». Однако облучение, например в
атомных реакторах, может постепенно вызывать радиацион-
ное повреждение, которое ослабляет связь углеродных ато-
мов. Поскольку закрытая литература рассекречивается весь-
ма медленно, в настоящее время не представляется возмож-
ным дать полный обзор. Однако -можно привести следующие
важные сведения о реакции в интервале 250—450° С: если
образец был облучен и получил повреждения, то энергия
активации снижается с 48,8 до 37 ккал) моль [563], что указы-
вает на отмеченное выше «ослабление» связи.
IX.2.1. ПЕРВИЧНЫЙ АКТ
Разрушение края. Теоретически углеродную гексагональ-
ную сетку близкого к идеальному графита следует рассматри-
Химическое превращение графита в газообразные продукты 201
вать как макромолекулу ароматического ряда. Если графит
специально не обрабатывался в вакууме при очень высокой
температуре, краевые места обычно имеют такие валентно-
сти, которые используются не в системе сетки, а идут на
связь с инородными атомами. При этом образуются связи
—С = О, —С-ОН или —СН. Если окисление происходит у
края, то первичный акт, по-видимому, будет заключаться в
отрыве газообразной молекулы, такой, как СО, прежде чем по-
ступит новая молекула кислорода и начнется следующая сту-
пень реакции. Это рассуждение справедливо и для инородных
атомов, присоединенных к внутренним краям дырочных или
клещевидных дефектов в сетках [1058]. Оптическое изучение
изменения формы отдельных кристаллов, нагреваемых в окис-
лительной атмосфере, могло бы пролить некоторый свет на
то, взаимодействуют ли края или поверхности сеток, и в сущ-
ности пролить свет на механизм окисления. Однако таких
опытов, по-видимому, не проводилось. Если измельчать гра-
фит в атмосфере различных газов, например в кислороде или
водороде, то при равных условиях число присоединенных
молекул кислорода окажется гораздо больше [904]. Это объ-
ясняется присоединением кислорода к краям сеток, вновь
образующимся при ломке, однако имеющиеся данные не
исключают других объяснений.
"В менее совершенном графите дефекты в местах соприкос-
новения хорошо графитизированных углеродных сеток с об-
ластями неупорядоченного расположения атомов могут
явиться участками, в которых происходит первичный акт,
аналогично реакциям по краям сетки. Здесь также инород-
ные атомы, уже присоединенные к таким местам дефектов,
могут быть удалены тем же способом, что и в первичном ак-
те, прежде чем последующее взаимодействие приведет к не-
прерывному окислению.
1Х.2.2. РАЗРУШЕНИЕ ПОВЕРХНОСТИ; ВЛИЯНИЕ ХИМИЧЕСКИХ
ПРИМЕСЕЙ
По аналогии с механизмом реакции более мелких молекул
ароматического ряда первичный акт окисления может про-
изойти не на краю сетки. Например, молекула кислорода мо-
жет быть присоединена некоторыми углеродными атомами
сетки. При этом идеальное ароматическое расположение
sp2rt преобразуется в другой ряд, близкий к алициклическому
или алифатическому ряду sp3. При таком распределении мест
кислород может образовать поверхностные соединения в ви-
де перекиси или эпокси-колец.
202
Глава IX
Экспериментальное и теоретическое развитие этой идеи
весьма затруднено в.связи с влиянием разных осложняющих
факторов. Одним из наиболее важных факторов является то,
что любой переход электрона, необходимый для присоедине-
ния кислородной молекулы к поверхности углеродной сетки,
по-видимому, очень сильно зависит от наличия дефектов в ре-
шетке. Это приводит к необходимости различать (что вооб-
ще не делается) механизм окисления, преобладающий в
сильно поврежденном графите или углероде, от механизма
окисления графита, близкого к идеальному. Кроме того, так
же как и при рассмотрении краевого окисления, первичный
акт окисления часто тормозится инородными атомами или
их группами, присоединенными к решетке тем же путем. Сре-
ди этих химических присадок, захваченных в сетки углерода
и графита, могущих влиять на окисление, следует различать
влияние таких атомов, как О, Н, N, которые могут быть не-
посредственно присоединены к атомам углерода, и влияние
атомов металлов, например Na, К, Fe, Си и т. д., которые, по
всей вероятности, присоединяются к сеткам посредством
кислородных групп вида —С—ОН.
Даже в спектрально чистом углероде можно особыми
средствами обнаружить такие атомы, как, например, В, Ti,
Са, Na, Si, Fe, Mg и Си. Если они включены в сетку, то
электронная плотность смежных с ними углеродных атомов
будет нарушена, что может способствовать или препятство-
вать воздействию кислорода. Опыты, иллюстрирующие ката-
литическое влияние подобных присадок, обычно не устанав-
ливают, каким образом эти присадки связываются с углеро-
дом (см., например, [590]). Предназначаемый для атомных
реакторов графит (ср. разд. 1.6.2) содержит даже меньше
металлических присадок, чем спектрально чистый материал,
и его механизм окисления, по всей вероятности, не нару-
шается атомами, являющимися «источниками» и «стоками»
электронов.
В графите с большим количеством дефектов и в меньшей
степени в графите, близком к идеальному, часто обнаружи-
вается водород в качестве примеси в сетках. Как установле-
но в работе [910], даже нагрев до П00°С не обеспечивает
удаления всего водорода из саж (ср. I. 7), и первичный акт,
принятый в некоторых механизмах окисления для низких
температур, подтверждает присутствие водорода [91]. Кисло-
род, включенный каким-нибудь образом в сетку, оказывает,
по-видимому, еще более сильное влияние на первичный акт,
чем наличие С—Н-связи, и, следовательно, на легкость окис-
ления углеродов. Хемосорбция кислорода на углеродах, ве-
Химическое превращение графита в газообразные продукты 203
роятно, более прочная, чем водорода [910], и последующая
роль радикалов —С—ОН и —С=О, образующихся на поверх-
ности углерода [322, 383, 1000], может -быть определена по
поведению таких радикалов 'при окислении более мелких мо-
лекул ароматического ряда. Между прочим, можно отметить,
что наличие таких поверхностных радикалов влияет также
на активность угольных электродов, на ионный обмен и ката-
литическую активность активированного углерода [325]. На
фиг. 54 схематически показано изображение частицы сажи.
н
rfbo
I 11 li
- п II и
000
Фиг. 54. Модель частицы сажи [383],
а — вид кристаллитов сбоку; б — вид кристаллитов
сверху в увеличенном виде.
Влияние подобных радикалов на окисление углеродов и
графита рассматривалось различными авторами (см. [81]).
Наличие их может объяснить, почему обработка соляной кис-
лотой сильно влияет на окисление графита со значительным
количеством дефектов [307]. Однако действие кислоты может
также изменить долю различных неорганических примесей,
присоединенных к сетке, по всей вероятности, при помощи
таких радикалов. Так, например, соли железа и меди сильно
влияют на механизм окисления графита [590]. С другой сто-
роны, явное влияние атомов щелочных металлов на процесс
окисления, по-видимому, имеет большое значение для активи-
рованных углеродов [1155]. В графите со значительным коли-
204
Глава IX
чеством дефектов строение кислотных радикалов, с помощью
которых атомы неорганических примесей удерживаются в
сетке, по-видимому, является другим, и электронная передача
каталитического влияния к удаленным атомам углерода, ве-
роятно, менее эффективна, чем в сетках макроароматическо-
го строения, близких к совершенным. Такие атомы щелочных
металлов также оказывают каталитическое действие на реак-
ции серы с углеродом [661], тогда как другие неорганические
атомы, иногда встречающиеся в золе углеродов, могут спо-
собствовать окислению [1015] (ср. [80, 263]).
Если каталитическая примесь добавляется в монокристал-
лы графита, то при благоприятных условиях обнаруживается
ускоряющееся окисление вследствие образования шестигран-
ных углублений [417]. Эти углубления и другие непосредст-
венные результаты окисления, вызванные такими катализа-
торами, как железо, золото или серебро, можно обнаружить
с помощью микроскопа. Объяснение подобных исследований
в данное время затруднено из-за несовершенства многих
«монокристаллов» графита, поскольку кристаллические де-
фекты влияют на окисление аналогичным образом
Кислород может удерживаться более сложными путями в
углеродах, полученных при низкой температуре (700—800° С),
что помогает объяснить их активность в атмосфере кисло-
рода [1022] и при взаимодействии с водородом при высоких
давлениях [82].
Несмотря на наличие большого количества эксперимен-
тальных данных о влиянии примесей (в виде атомов или ра-
дикалов) на окисление графита, близкого к идеальному или
со значительным количеством дефектов, все же к предпола-
гаемым структурным характеристикам радикалов по выше-
изложенным причинам следует подходить с некоторой осто-
рожностью.
1Х.2.3. ОБРАЗОВАНИЕ ПОВЕРХНОСТНЫХ ОКИСЛОВ
И СЛОИСТЫХ СОЕДИНЕНИЙ ПРИ ОКИСЛЕНИИ
В первичном акте при воздействии на край или поверх-
ность (описано в предыдущем разделе) часто предполагается,
что молекулы кислорода действуют независимо друг от дру-
га. Существуют некоторые различия между подобными пред-
положениями и механизмами, в которых допускается образо-
вание слоистых соединений или по крайней мере допускается
полное преобразование наружной углеродной сетки в окислен-
ные производные, называемые обычно «поверхностными окис-
лами». Предполагалось, что подобные двумерные произ-вод-
Химическое превращение графита в газообразные продукты 205
ные углерода образуются раньше, чем наступает заметное
разрушение с образованием газообразных продуктов (послед-
ний процесс протекает в ряд стадий).
Слоистые соединения, полученные при помощи электро-
литического окисления, могут разрушиться и образовать га-
зообразные продукты, похожие на продукты окисления угле-
рода. Это справедливо также и для окислов графита
(ср. гл. VIII). По-видимому, не имеется более прямых дан-
ных, чем эти, подтверждающих участие слоистых окислов в
окислении углеродов и близкого к идеальному графита при
нормальных условиях с помощью молекулярного кислорода.
Для поликристаллического графита рентгеновский анализ
не установил разницы при нагреве графита в кислороде до
450° С или в СО2 до 750° С. При таких условиях .любое увели-
чение расстояния между параллельными, гексагональными
сетками, вызванное, образованием слоистых соединений, дол-
жно быть заметно, если оно сопровождает окисление [1085].
Образование слоистых соединений в слоях, близких к поверх-
ности, может не обнаруживаться при помощи рентгеновских
лучей.
Благодаря использованию обогащенного озоном кислорода
[1100] удалось поглотить гораздо больше атомов кислорода
даже при комнатной температуре, а именно до 40% по весу.
Изучение продуктов с помощью рентгеновских лучей показы-
вает, что в обуглившемся куске наиболее уязвимыми местами
являются те, в которых присутствуют отдельные гексаго-
нальные сетки, а наименее уязвимыми — те области, в кото-
рых имеются параллельные сетки. Авторы приходят к выво-
ду, что если сорбция кислорода происходит с одной стороны
сетки, то образуется весьма устойчивый поверхностный оки-
сел в виде твердого соединения, если же сорбция возможна
с обеих сторон, то соединение значительно менее устойчиво
и свободно распадается на окислы углерода.
В ряде работ [312, 603, 604] были высказаны предположе-
ния, что наиболее близкие к поверхности сетки углеродных
атомов, а возможно, и более удаленные преобразуются в
«поверхностный окисел». Впервые эго мнение было высказа-
но еще в работах [24, 850, 851]. Лоури и Хьюлетт [612] счи-
тают поверхностные окислы устойчивыми твердыми комплек-
сами, которые разрушаются при нагреве и образуют опре-
деленные смеси СО и СОг и которые можно рассматривать
как ангидриды окислов графита [476]. Как указывалось вы-
ше, такие рассуждения не всегда учитывают возможную раз-
ницу при реагировании графита, близкого к идеальному, и
углерода с большим или меньшим количеством дефектов.
206
Глава IX
Таким образом, кислый или основной характер поверхност-
ных окислов [323, 325, 392] присущ главным образом углеро-
дам со значительным количеством дефектов. В работе [997]
вновь было сделано предположение, что первичным актом
окисления является образование молекул СО, которые силь-
но хемосорбируются на поверхности (ср. [367]) и защищают
ее от последующих воздействий, пока молекулы СО не будут
удалены.
В настоящее время теория валентности не дает однознач-
ного ответа, справедлива ли подобная схема или происходит
процесс образования хинона из макроароматических молекул.
Полезно вспомнить, что нагретый в глубоком вакууме графит
«активируется» благодаря потере удерживаемых хемосорб-
цией молекул (ср. [104]). При продолжительном нагреве эта
активация пропадает, что приписывается «самовосстановле-
нию» поврежденной части углеродных, сеток [102, 103]
(ср. [106]). Нормальная самодиффузия углеродных атомов в
графите [284, 520], конечно, слишком медленна, чтобы объяс-
нить такую самодезактивацию, однако не следует забывать,
что атомы углерода в поврежденных местах сетки более по-
движны (например, после повреждений, вызванных облуче-
нием [700]). При попытках дать объяснения этому явлению
нельзя полностью исключать повторную сорбцию газообраз-
ных примесей, присутствующих в вакуумной системе. Пред-
положение, что С3О2, а возможно, и еще более низшие окислы
играют роль при окислении углерода [99,- 225, 396], в настоя-
щее время звучит неубедительно.
Если принять существование поверхностных окислов, что
предполагает возможность присоединения гетероатомов
к поверхностям углеродных макромолекул, то более полные
сведения можно получить, приготовляя ряд производных
«поверхностных соединений». Таким образом на поверхности
чистого углерода были приготовлены основные поверхностные
окислы, кислые поверхностные окислы и сульфиды; кислый
окисел можно дополнить метиловыми группами с помощью
диазометана. С аммиаком они частично ведут себя как кар-
боксильные группы, образуя аммиачные соли и амиды [98].
Углеродо-водородные связи могут быть замещены хлором,
а большую часть хлора можно заменить группами—ОН, —CN
или — NH2. Эти особенности поведения углеродов в виде мак-
роароматических молекул на одном конце гомологического
ряда с идеальным графитом на другом его конце весьма важ-
ны при рассмотрении каталитического действия углеродов,
включая самокатализ при окислении. Практические предло-
жения (например, [403]) относительно торможения процесса
Химическое превращение графита, в газообразные продукт ' 7
окисления углерода должны учитывать аналогию в х '
ском поведении ароматических микро- и макромолеку
Харкер, Меш и Уин-Джоунс [392] изучали образова,
поверхностных окислов при взаимодействии СО2 с углеродом.
В заключение можно добавить, что многие из этих инте-
ресных предположений предопределили развитие современных
взглядов на природу дефектов в твердых телах и на меха-
низм закрепления инородных атомов в твердых телах. Вви-
ду этого и в связи с недостаточной точностью в определении
дефектов в углероде или графите, использованных в ряде
упомянутых опытов, поставленные вопросы могут быть выяс-
нены только при дальнейшем глубоком исследовании пер-
вичного акта окисления твердого углерода.
IX.2.4. ПОСЛЕДУЮЩИЕ СТАДИИ
После соединения кислорода с углеродным атомом в сет-
ке в первичном акте какого-либо рода (в виде отдельных
молекул или поверхностного окисла, распространяющегося по
многим местам сетки) при достаточно высокой температуре
произойдет перераспределение связей и отделение газообраз-
ных продуктов. За этим может последовать дальнейшее пере-
распределение связей, и 'если кислород снова соединится с
твердым остатком таким же образом, как и раньше, может
установиться последовательный цикл окисления.
Все замечания, сделанные раньше относительно влияния
разных дефектов в решетке и инородных атомов на первич-
ный акт взаимодействия, тем более справедливы по отноше-
нию к последующим стадиям механизма. Существующие в
этом отношении противоречия не всегда могут быть разре-
шены на основании имеющихся сведений, и прежде всего
потому, что влияние этих факторов еще недостаточно опреде-
лено. Достаточно напомнить о большом различии в термиче-
ской стойкости более мелких органических молекул в зависи-
мости от того, являются ли они ненасыщенными или содер-
жат атомы справа или слева от углерода в периодической
системе, чтобы понять, почему некоторые из основных пред-
положений, сделанных относительно последующих стадий
окисления углеродов или графита, близкого к совершенному,
следует в настоящее время рассматривать как интересные,
но не полностью доказанные. Можно также ожидать, что
основной механизм будет меняться с изменением температу-
ры; если дефекты изменяют скорость окисления, то косвенно-
они могут влиять на механизм реакции.
208
Глава IX
IX.2.5,. СОСТАВ ГАЗООБРАЗНЫХ ОКИСЛОВ
Значительные разногласия возникли при обсуждении со-
става первичных газообразных окислов. Большинство авто-
ров считало, что сначала выделяется окисел СО, который в
присутствии избыточного кислорода частично или полностью
может перейти в СО2 на поверхности углерода или при после-
дующей реакции в газовой среде. Например, вторичное окис-
ление первично образовавшейся СО объясняет наблюдаемый
голубой ореол вокруг горящей частицы углерода [29, 1124].
Хорошо известно влияние водорода и молекул воды на
окисление СО, и поэтому представляет особый интерес тот
факт, что ореол ослабляется в 20—130 раз при горении ча-
стиц твердого графита по сравнению с углеродом, имеющим
значительное число дефектов. Это подтверждает весьма рас-
пространенное мнение о первичности образования СО и ука-
зывает также на влияние дефектов углеродной сетки и, воз-
можно, количества удерживаемого водорода на механизм
взаимодействия.
В результате использования метода нити, предложенного
в свое время Лэнгмюром [584], было показано, что основным
продуктом взаимодействия является СО при условии, что
возвращение его на углеродную поверхность сведено до мини-
мума [996]. При изучении горения углерода в слое в различ-
ных экспериментальных условиях [28], как и в опытах в цик-
лонных камерах [1073], подтверждено мнение, что СО пред-
ставляет собой основной первичный газообразный продукт.
Опыты при больших скоростях потока кислорода, омываю-
щего поверхность поликристаллического графита, с целью
сведения к минимуму возможности возвращения газа на
углеродную поверхность [90] также показали, что СО преоб-
ладает в первичных газообразных продуктах, хотя даже в
этом случае газовый анализ обнаруживал не более 90% окиси
углерода.
Самостоятельное изучение взаимодействия углекислоты с
углеродом может внести ясность в понимание роли вторич-
ных реакций, которые усложняют экспериментальное опре-
деление первичных газообразных продуктов. С точки зрения
равновесия, большое значение имеет то обстоятельство, что
по закону действующих масс в реакции
Ств+СО2^2СО
при температурах ниже 600°С преимущественно образуется
углекислота. Изучению окисления в этом диапазоне темпера-
тур было посвящено много работ (ср. табл. 25). Это значит,
Химическое превращение графита в газообразные продукты 209
что если даже СО является первичным продуктом по кинети-
ке реакции, то существуют благоприятные условия для пре-
вращения его в СО2 за счет вторичных реакций. К сожале-
нию, изучение вторичной реакции обычно проводилось не на
тех же образцах углерода и графита, которые использова-
лись при изучении кинетики прямой реакции окисления этих
веществ молекулярным кислородом, и поэтому в настоящее
время мы редко располагаем достаточно полными сведениями.
Некоторую поддержку получила также точка зрения, со-
гласно которой первичным продуктом окисления твердого
тела молекулярным кислородом может быть СО2 [596]. При
изучении прямой реакции взаимодействия атомов кислорода
с углеродом [83, 994] были получены противоречивые сведе-
ния относительно первичных продуктов. Данные об образо-
вании «в качестве 'первичных продуктов некоторого количест-
ва С3О2 [225] относятся к графиту с сильно поврежденной
облучением решеткой и касаются углеродных сеток со значи-
тельным количеством дефектов (ср. также работу [99]). При
исследовании механизма окисления углерода было высказано
предположение о существовании окисла С2О, особенно при
низких температурах [396].
IX.2.6. ПАРАМЕТРЫ, ОПРЕДЕЛЯЮЩИЕ СКОРОСТЬ
ОКИСЛЕНИЯ ГРАФИТА
Многочисленные попытки были предприняты для обосно-
вания величины энергии активации, соответствующей наблю-
даемой скорости процесса при различных температурах. Вви-
ду сложности явления и многочисленности стадий, которые
могут участвовать в процессе окисления, предложенные схе-
мы, хотя и представляют интерес, но часто недостаточно убе-
дительны. В дальнейшем будут рассмотрены только наиболее
характерные примеры.
Скорость окисления углеродных нитей возрастает с темпе-
ратурой примерно до 750—1000° С. В интервале 1000—1700° С
скорость, сохраняя первый порядок, падает при повышении
температуры. На фиг. 55 приведены данные по окислению
углеродных нитей, полученные разными авторами. При более
высоких температурах скорость снова возрастает, но поря-
док реакции становится нулевым. По-видимому, в разных диа-
пазонах температур определяющими являются различные про-
цессы. Из уравнения скорости реакции
Скорость = Д4-Вро2,
где А и В — постоянные, было получено значение энергии
14 А, Р. Уббелоде
210
Глава IX
активации, равное 37,5 ккал!моль [367]. Это значение опреде-
ляется, возможно, энергией десорбции молекул СО, хемосор-
бированных углеродом, без чего не могут протекать после-
дующие стадии, или же оно отвечает энергии разрыва
углеродных связей при отделении СО от углеродной сетки.
Фиг. 55. Реакция углерода с кислородом
(углеродная нить); р —10~2 мм рт. ст. [91].
Кривые воспроизводят результаты работ раз-
личных авторов: 1 — Эйкена; 2 — Дюваля;
3 — Мейера; 4~ Сивонена; 5 — Стриклэнда —
Констебла; 6 — Мейера.
Для описания тех же и некоторых других эксперименталь-
ных данных была предложена следующая форма уравнения
скорости [90]: ___
Скорость = С j/poT*
При этом энергия активации принимает значение, равное
42 ккал!молъ. Появление такого выражения для скорости
реакции обусловлено тем, что определяющим процессом ока-
зывается диффузия кислорода в трещины и поры тела
(ср. также [1117]). ‘Во избежание усложнений, связанных с
наличием пор, были сделаны попытки использовать для опы-
тов природный графит высокой плотности (2,26 г/<ш3), однако
Химическое превращение графита в газообразные продукты 211
избежать влияния размера частиц и «величины полной по-
верхности не удалось [404]. Было показано, что, когда ско-
рость «окисления определяется диффузией кислорода внутрь
графита, порядок реакции равен n + V2, где п — истинный
порядок поверхностной реакции [90]. При таких условиях
наблюдаемая энергия активации должна равняться половине
энергии активации истинного поверхностного процесса. При
окислении очень тонких графитовых пЛастинок для избежания
Атомы 0, хемосорбированные поверхностью
Ф и г, 56. Энергетическая схема реакции кислорода
с поверхностью [90].
s 1 — энергия активации хемосорбции кислорода (величина не
. известна).
г2 — теплота адсорбирования кислорода. Расчет по энергии
связи дает значение 183 ккал/моль, оценка по калориметри-
рованию 97 ккал/моль. е3— энергия активации десорбции СО;
по данным кинетических измерений (90] она составляет
80 ккал/моль. — теплота образования СО из твердого угле-
рода и газообразного кислорода, равная 26,8 ккал/моль.
влияния диффузии внутрь куска 'был получен нулевой поря-
док скорости реакции по давлению, а энергия активации
оказалась равной 80 ккал/моль. Это значение было также
получено для температур выше 1700° С для скорости окисле-
ния графитовых нитей при нулевом порядке реакции. < Эта
энергия активации, видимо, относится к основной стадии
окисления, т. е. к разрыву С—С-связей на поверхности.
14*
212
Глава IX
На фиг. 56 изображено соотношение между энергией акти-
вации для разных стадий процесса и другими энергетически-
ми величинами. Хотя отдельные детали могут нуждаться в
коррективах, соотношения такого рода, если они будут осу-
ществлены, имеют большое значение для окисления углеро-
дов и графита.
Рассмотренные выше схемы первичных актов и вторичных
процессов позволяют предположить, что некоторые газообраз-
ные молекулы препятствуют процессу окисления углеродов
и графита, поскольку они могут занимать места, способные
вступать в реакцию, преграждая к ним доступ кислорода.
Отчетливо выраженных случаев такого поведения не уста-
новлено, по-видимому, из-за исключительно сильной хемо-
сорбции кислорода. Можно подобрать ингибиторы для вто-
ричных реакций в газовой фазе вблизи поверхности твердого
тела [29, 1127].
IX.2.7. РЕАКЦИЯ С СО2
Эта реакция протекает с измеримой скоростью на многих
углеродах при температурах выше 600° С. Методы изучения
аналогичны методам, используемым при окислении молеку-
лами кислорода [313, 582, 590, 687, 944].
Общепринято считать, что первым актом в реакции
с+со2—>со
является абсорбция СО2 активными местами углерода. За этим
следует образование молекулы окиси углерода и графито-
кислородного комплекса, который после абсорбции свежей
молекулы СО2 может перестроиться и выделить СО. Избы-
ток СО в газовой фазе над углеродной поверхностью конку-
рирует с СО2 за активные места и тем самым в некоторой
степени мешает окислению. Некоторое подтверждение этой
модели реакции получено из опытов с радиоактивным угле-
родом [101]. Однако опыты с пористым искусственным графи-
том показывают, что определяющей стадией процесса яв-
ляется диффузия во внутренние поры, что приводит к друго-
му объяснению тормозящего действия [844].
IX.2.8. РЕАКЦИЯ с ВОДОРОДОМ
Известно лишь очень немного физико-химических иссле-
дований прямого взаимодействия водорода с углеродом и
графитом. Метан, по-видимому, является главным первич-
Химическое превращение графита в газообразные продукты. 213
ным продуктом, но образуется он в значительном количестве
только при высоком давлении [46, 60]. Из термодинамических
соображений следует, что высокое давление способствует об-
разованию метана (ср. [81, 352, 481]). Эта реакция играет не-
которую роль как вторичная при окислении углерода водя-
ным паром. Утверждается также, что при воздействии Н2О
на гидрогенизированную углеродную поверхность [81] обра-
зуется метан.
IX.2.9. РЕАКЦИЯ С ВОДЯНЫМ ПАРОМ
Было проведено много технических и научных исследова-
ний по взаимодействию углерода с Н2О. Общепринятым ме-
тодом приготовления активированного углерода для абсорб-
ции газов является воздействие пара на- пиролитический
углерод [400, 1146]. Уравнение реакции часто пишется в виде
Н 2О -f- Ств—> СО Н~Н2
или
2Н2О+СТВ-—>СО2+2Н2.
Здесь возможны различные термодинамические варианты
благодаря комбинации с некоторыми другими реакциями,
приведенными на стр. 194. Некоторую роль, особенно при
низких температурах, может играть прямое образование во-
дородных соединений, таких, как метан [81, 352]. По анало-
гии с действием СО2 на углерод первичным актом после хе-
мосорбции Н2О твердым телом является десорбция Н2, со-
провождающаяся перестройкой углеродно-кислородного ком-
плекса. Избыток Н2 в газе сильно замедляет реакцию [603],
по-видимому, за счет конкуренции с Н2О за активные места
на углеродной сетке.
Последующая десорбция углеродно-кислородного комплек-
са может происходить таким же‘образом, как и в других
окислительных реакциях углерода с образованием СО, а воз-
можно, и СО2, и новых дефектных мест, на которых могут
протекать последующие стадии. Однако участие Н2О в этом
процессе также, вероятно, имеет место. При реакции Н2О с
углеродом [488, 489] могут играть некоторую роль катализа-
торы, которые действуют либо на поверхности^ либо при окис-
лении СО в газовой среде. Как и для других реакций углеро-
да с газами, значение дефектов в твердом теле изучено не-
достаточно, чтобы можно было сделать исчерпывающий вы-
вод из результатов опыта.
214
Глава IX
Удовлетворительная схема реакции [92] включает следую-
щие этапы:
^2^газЧ~2Ств >ОНсорб+Нсорб, ккал/моль, (1)
ОН с ор(Г—►Ocopg+Нсорб, (2)
К;1
2Нсорб—>Н2 газ, г3--75 ккал/моль, (3)
Осорб—»СОгаз. (4)
Если принять, что скорость общей реакции определяется реак-
циями (1) и (3), то можно пренебречь скоростью диффузии
во внутренние поры, и тогда легко объяснить кинетику реак-
ции, установленную экспериментально. Энергия активации ез,
подсчитанная для реакции (3), совпадает с измерениями по
хемосорбции водорода на графите [47]. Полученные резуль-
таты не указывают на заметную подвижность сорбированных
частиц на поверхности.
При высокой температуре мелкие частички графита, близ-
кого к идеальному, проходя через водяной пар, реагируют с
ним гораздо быстрее, чем углерод со значительными дефек-
тами [246]. Поскольку на графите слоистые соединения могут
образовываться значительно легче, чем на дефектном угле-
роде, то это позволяет предположить, что при окислении Н2О
образует слоистые соединения (по меньшей мере на внешних
поверхностях).
IX.3. ОБРАЗОВАНИЕ УГЛЕРОДНЫХ ОТЛОЖЕНИЙ
ПРИ КРЕКИНГЕ ГАЗООБРАЗНЫХ МОЛЕКУЛ
Для многих исследований процесса окисления, рассмот-
ренных в предыдущих разделах, термодинамически возмож-
но отложение углерода в результате «крекинга». Боль-
шое внимание уделяется выяснению точной структуры дефек-
тов углей и графита, и, по-видимому, в этой области имеется
широкое поле деятельности (ср. [1090]).
IX.4. ОБРАЗОВАНИЕ ДРУГИХ ГАЗООБРАЗНЫХ ПРОДУКТОВ
ИЗ УГЛЕРОДОВ
За исключением упомянутых выше примеров, лишь в не-
большом числе случаев исследование проводилось по такой
методике, которая позволяла установить отдельные стадии
механизма реакции. Например, при воздействии фтора на
Химическое превращение графита в газообразные продукты 215
графит, по-видимому, происходит увеличение расстояний меж-
ду слоями решетки (по всей вероятности, благодаря образо-
ванию пленочных соединений), прежде чем начинают выде-
ляться газообразные продукты [884, 885]. Однако количество
данных, подтверждающих это явление, весьма ограничено.
Действие серы изучалось главным образом на древесном уг-
ле, содержащем значительное количество алифатических
С—С-связей [392]. Не ясно, образуются ли газообразные сер-
ные соединения преимущественно на таких связях или на
ароматической части углеродной структуры.
В ряде исследований углей предполагалось [1125], что при
низкой температуре образуются углеродно-серные комплексы,
которые при более высоких температурах распадаются с вы-
делением CS2. Однако в случае графита таких реакций не
обнаружено [1126]. Изучение влияния каталитических доба-
вок на скорость взаимодействия показывает, что только кри-
тические количества солей натрия и калия оказались полез-
ными для этой цели [661].
ЛИТЕРАТУРА
1. Abbott Н. W., Encyclopaedia of Chemical Technology, ed.
R. E. Kirk & B. F. Othmer, Interscience, N. Y., vol. 3, 1949,
pp. 1—34.
2. Ac h eson E. G.,/. Franklin Inst., 147, 475 (1900).
3. Adams L. H., /. Washington Acad. Sci., 11, 45 (1921).
4. A d a m s о n A. F., В 1 a у d e n H. E., Industrial Carbon & Graphite,
Soc. Chem. Ind., Lnd., 1958, p. 28.
5. Adamson A. F., В lay den H. E., Proc, 3rd Carbon Conference,
Buffalo, N. Y., Pergamon Press, 1959, p. 147.
6. А к a E. Z., cm. [991].
7. Akamatu H., Inokuchi H., J. Chem. Phys., 18, 810 (1950).
8. Akamatu H., Inokuchi H., Han da T., Nature, 168, 520 (1951).
9. Akamatu H., Inokuchi H., J. Chem. Phys., 20, 1481 (1952).
10. Akamatu H., cm. [495].
11. Akamatu H., Matsunaga Y., Bull. Chem. Soc. Japan, 26, 364
(1953).
12. Akamatu H., Inokuchi H., Matsunaga Y., Nature, 173, Г68
(1954).
13. Akamatu H., Inokuchi H., Takahashi H., Matsuna-
ga Y., Bull. Chem. Soc. Japan, 29, 574 (1956).
14. Akamatu H., Inokuchi H., Proc. 3rd Carbon Conference, Buffa-
lo, N. Y., Pergamon Press, 1959, p. 51.
15. A к a m a t u H., Mr о z о wski S., W о b s c h a 11 D., Proc. 3rd Car-
bon Conference, Buffalo, N. Y., Pergamon Press, 1959, p. 135.
16. Albert P., Pari sot J., Proc. 3rd Carbon Conference, Buffalo, N. Y.,
Pergamon Press, 1959, <p. 467.
17. Ali D., Fitzer E., Ragoss A., Industrial Carbon & Graphite,
Soc. Chem. Ind. Lnd., 1958, p. 135.
18. Ali M. A., Coulson C. A., J. Chem. Soc., 1558 (1959).
19. Alterthum H., Fehse W., Pirani M., Z. Elektrochem., 31, 313
(1925).
20. Anderson J. S., Ann. Rep. Chem. Soc., 43, 104 (1946).
21. Andrew K- F., см. [367].
22. A n d r e w s J. N., U b b e 1 о h d e A. R., Proc. Roy. Soc., 228A, 435
(1955).
23. Aragon F., Cano Ruiz J., MacEwan D. M. C., Nature, 183,
740 (1959).
Литература
217
24. Armstrong Н. Е., J. Soc. Chem. Ind., 24, 475 (1905).
25. Arnott R. L., cm. [874].
26. Ar r a gon Ph. P., Berthier R. M., Industrial Carbon & Gra-
phite, Soc. Chem. Ind. Lnd., 1958, p. 565.
27. A r s e m W. C., Trans. Electrochem. Soc., 20, 105 (1911).
28. Arthur J. R., Bangham D. H., Th ring M. W., J. Soc. Chem.
Ind., 68, 1 (1949).
29. Arthur J. R., Bleach J. A., Ind. Eng. Chem., 44, 1029 (1952).
30. A s h e r R. C., W i 1 s о n S. A., Nature, 181, 409 (1958).
31. Asher R. С., I. Inorg. NucL Chem., 10, 238 (1959).
32. At tree R. W., Dahl in ger O., Canad. J. Phys., 35, 462 (1957).
33. Aub г ey К. V., cm. [464].
34. Austin A. E., Harrison R. J., Proc. 3rd Carbon Conference,
Buffalo, N. Y., Pergamon Press, 1959, p. 585.
35. В а с о n G. E., Nature, 166, 794 (1950).
36. В a co n G. E., Acta Cryst., 4, 558 (1951).
37. Bacon G. E., Franklin R. E., Acta Cryst., 4, 561 (1951).
38. Bacon G. E., Acta Cryst., 5,.392 (1952).
39. Bacon G. E., Acta Cryst., 5, 492 (1952).
40. В а с о n G. E., W a r r e n В. E., Acta Cryst., 9, 1029 (1956).
41. Bacon R., Growth & Perfection of Crystals, John Wiley, N. Y., 1958,
p. 197.
42. В a g g u 1 e у D.-M. S., Owen J., Rep. Progr. Phys., 20, 304 (1957).
43. В a n g h a m D. H., cm. [28].
44. В a r a n i e с к i C., Riley H. L., Streeter E., Industrial Carbon
& Graphite, Soc. Chem. Ind. Lnd., 1958, p. 283.
45. В a r b e r E. F., cm. [348].
46. Barrer R. M., Rideal E. K., Proc. Roy. Soc., 149A, 231, 253
(1935).
47. В arrer R. M., J. Chem. Soc., 1256 (1936).
48. Barrett E. P., J о у n e r L. G., Halen da P. P., J. Am. Chem.
Soc., 73, 373 (1951).
49. Barrett P., cm. [590].
50. В a s к in Y., cm. [585].
51. В a s s e 4 J., C. R. Acad. Sci. Paris, 213, 829 (1941).
52. В a s s e t J., Brennstoff Chem., 22, 127 (1942).
53. Bearden J. A., Phys. Rev., 54, 198 (1938).
54. В e с к h u r s t L, Proc. Roy. Soc., 102A, 340 (1923).
55. Beckett R. J., Croft R. С., I. Phys. Chem., 56, 929 (1952).
56. В e e b e R. A., cm. [455].
57. Bennett J. E., Ingram D. J. E., Phil. Mag., 45, 545 (1954).
58. Bennett J. E., Ingram D. J. E., Tapley J. G., J. Chem. Phys.,
23, 215 (1955).
59. В e r g e n 1 i d U., Hill R. W, Webb E. J, Wilks J., Phil. Mag.,
45, 851 (1954).
218
Литература
60. Berl Е., В emm an R., Z. phys. Chem., 162A, 71 (1932).
61. Berlincourt T. C., Steele M. C., Phys. Rev., 98, 956 (1955).
62. В e m m a n R., cm. [60].
63. Berman R., Proc. Phys. Soc., 65A, 1029 (1952).
64. Berman R., Advances in Physics, 2, 103 (1953).
65. В e r ma n R., The wl is J., Nature, 176, 834 (1955).
66. Berman R., Simon F., Z. Elektrochem., 59, 333 (1955).
67. В e r m a n R., Industrial Carbon & Graphite, Soc. Chem. Ind. Lnd.,
1958, p. 42.
68. Bernal J. D., Proc. Roy. Soc., 106A, 749 (1924).
69. Berthelot M., Petit P., Ann. Chim. Phys., 19, 401 (1870).
70. В e r t h i e r R. M., cm. [26].
71. Biastock K., Hofmann U., Angew. Chem., 53, 327 (1940).
72. В i с к e r d i к e R. L., cm. [1103].
73. Bikerm an J. J., Z. phys. Chem., 151A, 129 (1930).
74. В i n f о r d J. S., cm. [91].
75. Biscoe J., Warren В. E., /. Appt. Phys., 13, 364 (1942).
76. В i z z а к A., M a r i с i с S., Int. Conference on Peaceful Uses of Ato-
mic Energy, United Nations, N. Y., vol. 8, 1956, p. 491.
77. '^lackburn P. E., cm. [432].
78. В 1 а с к m a n L. C. F”, cm. [1064, 1065].
79. В 1 а с к w e 11 D. E., cm. [1005].
80. Blackwood J. D., Rev. Pure Appt. Chem., 4, 251 (1954).
81. Blackwood J. D., McGrory F., Aust. J. Chem., 11, 63 (1958).
82. Blackwood J. D., Aust. J. Chem., 12, 14 (1959).
83. Blackwood J. D., McTaggart F. K., Aust. J. Chem., 12, 114
(1959).
84. Blakeley T. H., Earp F. K., Industrial Carbon & Graphite, Soc.
Chem. Ind. Lnd., 1958, p. 173.
85. Blanchard A, F., Industrial Carbon & Graphite, Soc. Chem. Ind.
Lnd., 1958, p. 434.
86. В 1 a у d e n H. E., см. [1155, 1456].
87. В 1 a у d e n H. E., cm. [4, 5].
88. В 1 e a c h J. A., cm. [29].
89. Blue M. D., Danielson G. C., J. Appt. Phys., 28, 583 (1957).
90. В 1 у h о 1 d e r G., E у r i n g H., J. Phys. Chem., 61, 682 . (1957).
91. Bly ho Ider G., Binford J. S., Eyring H., J. Phys. Chem., 62,
263 (1958).
92. Bly ho Ider G., Eyring H., J. Phys. Chem., 63, 693 (1959).
93. В о b к a R. J., Dininny R. E., Siebert A. R., Pace E. L.,
/. Phys. Chem., 61, 1646 (1957).
94. Boehm H. P., Hofmann U., Z. anorg, Chem., 278, 58 (1955).
95. Boehm H. P., cm. [916—918].
96. В о e h m H. P., cm. [177].
97. В о e h m H. P., Z. anorg. Chem., 297, 315 (1958).
Литература
219
98. Boehm Н. Р., Hofmann U., Clauss A., Proc. 3rd Carbon Com
ference, Buffalo, N. Y., Pergamon Press, 1959, p. 241.
99. Bond R. L, Pinchin F. J., Nature, 182, 129 (1958).
100. Bond W. L., cm. [640].
101. Bonner E., Turkevich J., J, Am. Chem. Soc., 73, 561 (1951).
102. Bo n n e t a i n L., Duval X., L e t о r t M., C. R. Acad. Sei. Paris,
245, 1728 (1957).
103. Bonne tain L., Duval X., L etort M., C. R. Acai. Sci. Paris,
246, 105 (1958). •
104. В on net a i n L., J. Chim. Phys., 56, 266 (1959).
105. Boobar M. G., Wright С. C., Kinney C. R., Ind. Eng. Chem.,
50, 27 (1958).
106. Boulanger F., Duval X., Letort M., Proc. 3rd Carbon Con-
ference, Buffalo, N. Y., Pergamon Press, 1959, p. 257.
107. Bourdeau R. G., cm. [693].
108. Bowden F. P., Young J. E., Proc. Roy. Soc., 208A, 444 (1951).
109. Bowden F. P., Freitag E. H., Proc. Roy. Soc., 248A, 350 (1958).
110. Bowden F. P., Scott H. G., Proc. Roy. Soc., 248A, 368 (1958).
111. Bowen D„ Phys. Rev., 76, 1878 (1949).
112. В о w m a n J. C., cm. [752].
113. Bowman J. C., Krumhansl J. A., J. Phys. Chem. Solids, 6, 367
(1958).
114. Bowman J. C., Krumhansl J. A., Meers J. T., Industrial Car-
bon & Graphite, Soc. Chem. Ind. Lnd., 1958, p. 551.
115. Bradley D. E., Brit. J. Appl. Phys., 5, 65 (1954).
116. Bragg W. H., Bragg W. L., Proc. Roy. Soc., 89A, 277 (1913).
117. Bragg W. L., cm. [116].
118. Braithwaite E. R., J. Nucl. Eng., 2, 107 (1957).
119. Braun A., Busch G., Helv. Phys. Acta, 20, 33 (1947).
120. Braun R. M., cm. [874].
121. В r e e A., cm. [621].
122. Брегер A. X., Acta Physicochim. (URSS), 10, 902 (1939).
123. Бр erep A. X., Жданов Г. С, Изв. АН СССР, 28, 629 (1940).
124. Brennan R. О.,/. Chem. Phys., 20, 40 (1952).
125. Brettschnei d е г О., см. [898].
126. Brewer L., Gilles Р., Jenkins F., J. Chem. Phys., 16, 797
(1948).
127. В r e w e r L., I. Chem. Phys., 20, 758 (1952).
128. Bridgman P. W., Proc. Am. Ac. Arts Sci., 76, 9 (1945).
129. Bridgman P. W., J. Chem. Phys., 15, 92 (1947).
130. Bridgman P. W., Proc. Am. Ac. Arts Sci., 81, 165 (1952).
131. Brill R., Hermann C., Peters A., Naturwiss., 29, 784 (1941).
132. В г о d e r s e п K., cm. [891].
133. Brodie В. C., Phil. Trans. Roy. Soc., 149, 249 (1859).
134. Brooks H., J. Chem. Phys., 8, 939 (1940).
220
Литература
135. Brooks Н., см. [573].
136. Brophy J. J, Phys. Rev., 99, 1336 (1955).
137. Brophy J. J., Physica, 22, 156 (1956).
138. Brown A. R. G., Hall A. R., Watt W., Nature, 172, 1145 (1953).
139. Brown A. R. G., Watt W., Powell R. W., T у e R. R., Brit. J.
Appl. Phys., 7, 73 (1956).
140. Brown A. R. G., Watt W., Industrial Carbon & Graphite, Soc.
Chem. Ind. Lnd., 1958, p. 86.
141. В г о w n A. R. G., cm. [357].
142. В г о w n A. R. G., cm. [1103].
143. Brown В. K., Storey O. W., Trans. Electrochem. Soc., 53,129 (1928).
144. Brown C., cm. [904].
145. Brown T. H., Turkevich J., Proc. 3rd Carbon Conference, Buffalo,
N. Y., Pergamon Press, 1959, p. 113.
146. Bruins E. M., Rec. Trav. Chitn. Pays-Bas, 54, 317 (1935).
147. Brun auer S., Emmett P. H., Teller E., J. An. Chem. Soc.,
60, 309 (1938).
148. Bundy F. P., Hall T. P., Strong H. M., Wentorf R. H., Na-
ture, 176, 151 (1955).
149. Bupp L. P., см. [1148].
150. Bupp L. P„ см. [974].
151. Bu rnelle L., cm. [190].
152. Burton M. G., Neubert T. J., J. Appl. Phys., 27, 568 (1956).
153. В u s c h G., cm. [119].
154. Busso R. H., C. R. Acad. Sci. Paris, 228, 1946 (1949).
155. Бутягян П. Ю., см. [671].
156. Cadenbach G., cm. [300].
157. C a d e n h e a d D. A., Everett D. H., Industrial Carbon & Gra-
phite, Soc. Chem. Ind. Lnd., 1958, p. 272.
158. C a g 1 e F. W., cm. [278].
159. Campbell N. L., cm. [1079].
160. Cano Ruiz J., MacEwan D. M. C., Nature, 176, 1222 (1955).
161. Cano Ruiz J., MacEwan D. M. C., Tercera Reunion Internacio-
nal sobre Reactividad de los Solidos, Madrid, 1956, p. 227.
162. Cano Ruiz J., cm. [23].
163. Castle J. G., Phys. Rev., 92, 1063 (1953).
164. Castle J. G., Phys. Rev., 94, 1410 (1954).
165. Castle J. G., Wobschall D. C., Proc. 3rd Carbon Conference,
Buffalo, N. Y., Pergamon Press, 1959, p. 129.
166. Chaberski A., cm. [715].
167. Chalklin F. C., Proc. Roy. Soc., 194A, 42 (1948).
168. Champion F. C., Advances in Physics, 5, 383 (1957).
169. Champion F. C., Science Progress, 45, 447 (1957).
170. Chaney N. К., Ha mis ter V. C., Glass S. W., Trans. Electro-
chem. Soc., 47, 201 (1935).
Литература
221
171. С h i р m a n D. R., см. [1096].
172. Chi pm an J., Discuss. Faraday Soc., 4, 23 (1948).
173. Chowdhury A., cm. [255].
174. Chupka W. A., Inghram M. G., J. Phys. Chem., 59, 100 (1955).
175. Clark C. D., Ditchburn R. W., Dyer H. B., Proc. Roy. Soc.,
234A, 363 (1956).
176. Clausius K., Douglas A. E., Canad. J. Phys., 32, 319 (1954).
177. Clauss A., Pl ass R., Boehm H. P., Hofmann U., Z. anorg.
Chem., 291, 205 (1957). .
178. Clauss A., Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon
Press, 1959, p. 321.
179. Clauss A., cm. [98].
180. Colin G., Herold A., C. R. Acad. Sci. Paris, 245, 2294 (1957).
181. С о 11 a rt F., cm. [590].
182. Collier L. J., Stiles W. S., T а у 1 о r W. G. A., Proc. Phys. Soc.,
51, 147 (1939).
183. Compton D. M. J., Schneider W. G., Waddington T. C.,
J. Chem. Phys., 27, 160 (1957).
184. Conroy J. S., Slysh R. S., Murphy D. B., Kinney C. R.,
Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon Press, 1959,
p. 395.
185. Cope stake T. B., Davidson H. W., Tonge B. L., /. Appl.
Chem., 9, 74 (1959).
186. С о r b a t о F. J., Proc. 3rd Carbon Conference, Buffalo, N. Y., Perga-
mon Press, 1959, p. 173.
187. Coulson C.A., Nature, 159, 265 (1947).
188. Coulson C. A., Valence, Clarendon Press, Oxford, 1952, p. 266.
189. Coulson С. A., К e a r s 1 e у M. J., Proc. Roy. 'Soc., 241A, 433
(1957).
190. Coulson C. A., S ch a ad L. J., В urn ell e L., Proc. 3rd Carbon
Conference, Buffalo, N. Y., Pergamon Press, 1959, p. 27.
191. Coulson C. A., cm. [18].
192. Cowan A., cm. [633].
193. Cowley J. M., Ibers J. A., Acta Cryst., 9, 421 (1956).
194. Creighton H. J. M., J. Franklin Inst., 193, 89 (1922).
195. Creighton H. J. M., Ogden W. H., Trans. Electrochem. Soc., 48,
21 (1925).
196. Croft R. C., cm. [55].
197. Croft R. С., /. Appl. Chem., 2, 557 (1952).
198. Croft R. C, Nature, 172, 725 (1953).
199. Croft R. C., Austr. J. Chem., 9, 184 (1956).
200. Croft R. C., Research, 10, 23 (1957).
201. Croft R. C., Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon
Press, 1959, p. 315.
202. Crowell A. D., J. Chem. Phys., 29, 446 (1958).
222
Литература
203. С s а 1 а п Е., см. [441, 443].
204. С u 11 i s С. F., М a n t о n J. Е., Thomas G. В., W i 1 m a n Н.
Ada Cryst., 12, 382 (1959).
205. Curran G. P., см. [352].
206. Currie L. M., Ha mi st er V. C., McPherson H. G., InL
Conference on Peaceful Uses of Atomic Energy, United Nations,
N. Y., vol. 8, 1956, p. 451.
207. Custers J. F. H., Physica, 18, 489 (1952).
208. D a h 1 i n g e r O., cm. [32].
209. Dail H. W, cm. [314].
210. Danielson G. C., cm. [89].
211. D anz H., cm. [649].
212. Davidson H. W., Losty H. H. W., Nature, 181, 1057 (1958).
213. Davidson H. W., Losty#. H. W., Ross A. M., Industrial Car-
bon & Graphite, Soc. Chem. Ind. Lnd., 1958, p. 551.
214. Davidson H. W., Losty H. H. W., Mechanical Properties of Non-
Metal lie Brittle Materials, Butterworth, Lnd., 1958, p. 219.
215. Davidson H. W., cm. [986].
216. Davidson H. W., cm. [185].
217. Day R. J., Walker P. L., Wright С. C., Industrial Carbon &
Graphite, Soc. Chem. Ind. Lnd., 1958, p. 348.
218. De В о e r J. H., Van Doorn А. В. C., Proc. K. Ned. Akad. Wet.r
57B, 181 (1954).
219. De Boer J. H., Kruyer S., Trans. Faraday Soc., 54, 540 (1958).
220. De Boer J. H., S t e g g e r d a J. J., Proc. K. Ned. Akad. Wet.,
61B, 317 (1958).
221. De В о e r J. H., V a n D о о r n А. В. C., Industrial Carbon & Gra-
phite, Soc' Chem. Ind. Lnd., 1958, p. 302.
222. De Boer J. H., V a n D о о r n А. В. C., Proc. К. Ned. Akad. Wet.,
61B, 169, 242 (1958).
223. Debye P., Scherrer P., Phys. Z., 18, 291 (1917).
224, De itch С. H., Nature, 152, 148 (1943).
225. Deitz V. R., Prosen E. J., Nature, 181, 109 (1958).
226. Depp E. A., Stevens С. M., N e u w о r t h M. B., Fuel, 35, 437
(1956).
227. Desnoyers J. E., Morrison J. A., Phil. Mag., 3, 42 (1958).
228. De Sorb о W., J. Chem. Phys., 21, 876 (1953).
229. De Sorbo W., Tyler W. W., J. Chem. Phys., 21, 1660 (1953).
230. De Sorbo W., J. Chem. Phys., 23, 1970 (1955).
231. De Sorbo W, J. Am. Chem. Soc., 77, 4713 (1955).
232. De Sorbo W., Tyler W. W., J. Chem. Phys., 26, 244 (1957).
233. De Sorbo W., N i c h о 1 s G. E., J. Phys. Chem. Solids, 6, 352
(1958).
234. Diamond R., Acta Cryst., 10, 359 (1957).
Литература
223
235. Diamond R., Acta Cryst., 11, 129 (1958).
236. Dienes G. J., cm. [284].
237. Dienes G. J., J. Appl. Phys., 23, 1194 (1952).
238. Dienes G. J., cm. [563].
239. D i n g 1 e d у D. P., cm. [432].
240. D i n i n n у R. E., cm. [93].
241. Ditchburn R. W., cm. [175].
242. D о e r h a a r d Th., Gold finger P., Waelbroeck F., Bull.
Soc. Chem. Belg., 62, 498 (1953).
243. Donaldson D. M., Robertson J. M., Proc. Roy. Soc., 220A
157 (1953).
244. Donaldson D. M., Robertson J. M., White J. G., Proc. Roy.
Soc., 220A, 311 (1953).
245. D о n d e s S., cm. [396].
246. Dotson J. A., Koehler W. A., Holden J. H., Ind. Eng. Chem.,
49, 148 (1957).
247. Douglas A. E., cm. [176].
248. Drake L. C., cm. [862].
249. Dresel E. M., Roberts L. E. J., Nature, 171, 170 (1953).
250. D r u s h e 1 H. V., cm. [383].
251. Dug dale R. A., Brit. J. Appl. Phys., A, 334 (1953).
252. D u n c a n s о n W. E., Coulson C. A., Proc. Roy. Soc. Edinburgh.
62A, 37 (1944).
253. Dundas P. H., см. [1064].
254. Dutt a A. K-, Phys. Rev., 90, 187 (1953).
255. Dutt a A. K., Chow d bury A., Indian J. Phys., 28, 312 (1954).
256. Dutt a A. K., Indian I. Phys., 32, 397 (1958).
257. Dutta A. K-, Physica, 24, 343 (1958).
258. Duval X., cm. [102, 103].
259. Duval X., cm. [106].
260. Dyer H. B., cm. [175].
261. Dzurus M. L., Hennig G. R., I. Chem. Phys., 27, 275 (1957).
262. Dzurus M. L., Hennig G. R., J. Am. Chem. Soc., 79, 1051 (1957).
263. Earp F. K., Hill M. W., Industrial Carbon & Graphite, Soc. Chem.
Ind. Lnd., 1958, p. 326.
264. Earp F. K-, cm. [84].
265. Eatherley W. P., Phys. Rev., 98, 1531 (1955).
266. Ehrenberg W., Z. Krist., 63, 620 (1926).
267. Eley D. D., Parfitt G. D., P er г у M. J., T a у s u m D. H., Trans.
Faraday Soc., 49, 79 (1953).
268. Eley D. D., Parfitt G. D., Trans. Faraday Soc., 51, 1529 (1955).
269. E 1 e у D. D., Research, 12, 293 (1.959).
270. Emmett P. H., см. [147].
271. Enderlin L., Ann. Chim., 10, 5 (1938).
272. Erb E., cm. [1066].
224
Литература
273. Erf ling H. D„ Ann. Phys., 34, 136 (1939).
274. E r g u n S., cm. [622].
275. Euler J., Ann. Phys. Lpz., 18 (6), 344 (1956).
276. Everett D. H., cm. [157].
277, Ewald P. P., Sitzungsber. Munch. Akad., 4, 7 (1914).
278. E у r i n g H., Cagle F. W., Z. Elektrochem., 56, 480 (1952).
279. E у r in g H., cm. [90—92].
280. F a i r w e at he r A., Frost E. J., Shirley D. G. M., Industrial
Carbon & Graphite, Soc. Chem. Ind. Lnd., 1958, p 409.
281. Fehse W., см. [807].
282. Fehse W., cm. [19].
283. Feilchenfeld H., J. Phys. Chem., 61, 1133 (1957).
284. Feldman M. H., G о e d d e 1 W. V., Dienes G. J:, G о s s e n W.,
J. Appl. Phys., 23, 1200 (1952).
285. Fettke C. R., Sturges F. C., Am. Mineral, 18, 172 (1933).
286. Finch G. I., Wilma n H., Proc. Roy. Soc., 155A, 345 (1936).
287. F i t z e r E., cm. [17].
288. Fletcher J. F., cm. [1148].
289. Fo rest i R. J., cm. [1084].
290. Foster L. M., Long G., Stumpf H. C., Am. Mineral, 43, 285
(1958).•
291. Foster W. E„ cm. [816].
292. F о x J. J., cm. [868].
293. F r a n к F. C., Advances in Physics, 1, 91 (1952).
294. Franklin R. E., Acta Cryst., 3, 107 (1950).
295. Franklin R. E., Proc. Roy. Soc., 209A, 196 (1951).
296. Franklin R. E., Acta Cryst., 4, 253 (1951).
297. Franklin R. E., cm. [37].
298. Franklin R. E., J. Chim. Phys., 50, C 26 (1953).
299. Franklin R. E., cm. [1099, 1100].
300. Fredenhagen K-, Cadenbach G., Z. anorg. Chem., 158, 249
(1926).
301. Fredenhagen K., Suck H., Z. anorg. Chem., 178, 333 (1929).
302. Freitag E. H., cm. [109].
303. F r e n z e 1 A., cm. [437, 438].
304. Frenzel A., Tech. Hochschule Berlin (диссертация), 1933.
305. Frenzel A., Hofmann U., Z. Elektrochem., 40, 511 (1934).
306. Frenzel A., cm. [440, 441].
307. Frey H. M., Proc. Roy. Soc., 228A, 510 (1955).
308. Friedel R. A., Nature, 179, 1237 (1957).
309. Frohlich P. K., cm. [1031].
310. Frost E. J., cm. [280].
311. Fuchs L. H., cm. [829, 830].
312. Gadsby J., Hinshelwood C. N., Sykes K. W., Proc. Roy.
Soc., 187A, 129 (1946).
Литература
225
313. G a d s b у J., Long F. J., Sleight holme B., Sykes K. W.,
Proc. Roy. Soc., 193A, 357 (1948).
314. Galt J. K-, Yager W. A., Dail H. W., Phys. Rev., 103, 1586 (1956).
315. Galt J. K-, Yager W. A., Merritt F. R„ Proc. 3rd Carbon Con-
ference, Buffalo, N. Y., Pergamon Press, 1959, p. 193.
316. G a n g u 1 i N., Phil. Mag., 21, 355 (1936).
317. G a n g u 1 i N., cm. [568].
318. Ganguli N., Krishnan K- S., Nature, 144, 667 (1939).
319. Ganguli N., Krishnan K. S., Proc. Roy. Soc., 177A, 168
(1941).
320. Garlick G. F. J., cm. [1154].
321. Garner L. H., cm. [1119].
322. Garten V. A., Weiss D. E., Austr. J. Chem., 8, 68 (1955).
323. Garten V. A., Weiss D. E., Willis J. B., Austr. J, Chem.,
10, 298 (1957).
324. Garten V. A., Weiss D. E., Austr. J. Chem., 10, 309 (1957).
325. Garten V. A., Weiss D. E., Rev. Pure & Appl. Chem., 7, 69
(1957).
326. Garten V. A., Weiss D. E., Proc. 3rd Carbon Conference, Buf-
falo, N. Y., Pergamon Press, 1959, p. 295.
327. G a u b e r t P., C. R. Acad. Sci. Paris, 177, 1123 (1923).
328. G a у d о n A. G., Dissociation Energies & Spectra of Diatomic Mo-
lecules, Chapman & Hall, Lnd., 2nd ed., 1953.
329. Gaylord W. M, Ind. Eng. Chem., 45, 2182 (1953).
330. Gaylord W. M., Ind. Eng. Chem. 47, 1953 (1955).
331. Gaylord W. M., Ind. Eng. Chem., 49, 1584 (1957).
332. Gilbert E. С., см. [974].
333. Gilbert L. A., cm. [480].
334. Gilles P„ cm. [126].
335. Gilliland E. R., cm. [595, 596].
336. Gillson J. L., cm. [1031].
337. Giraitis A. P., cm. [816].
338. G i r i f a 1 с о L. A., cm. [350].
339. Given P. H., Lupton V., P e о v e r M. E., Nature, 181, 1059
(1958).
340. Glass S. W., cm. [170].
341. Glockler G., J. Chem. Phys., 22, 159 (1954).
342. G о e d d e 1 W. V., cm. [284].
343. G о 1 d f i n g e r P., cm. [242].
344. Gold finger P., Mem. Soc. Roy. Sci. Liege, 15, 378 (1955).
345. Goldschmidt S., Steigerwald C., Annalen, 438, 202 (1924).
346. Goldschmidt V. M., Norsk. Geol. Tids., 1926, p. 226.
347. Goldsmith M., /. Chem. Phys., 18, 524 (1950).
348. Go How ay W. S., Barber E. F., J. Chem. Phys., 10, 88 (1942).
349. Gomer R., Meyer L., J. Chem. Phys., 23, 1370 (1955).
15 A. P. Уббелоде
226
Литература
350. Good R. J., Girifalco L. A., Kraus G., J. Phys. Chem.,
62, 1418 (1958).
351. Gorin E., cm. [352].
352. G о rd n g С. E., Curran G. P., Tarbox R. P., Gorin E.,
Ind. Eng. Chem., 45, 2586 (1951).
353. G os sen W.} cm. [284].
354. Gottschalk J., I. prakt. Chem., 95, 321 (1865).
355. Gracey J. P. V., Ubbelohde A. R., J. Chem. Soc., 4089
(1955).
356. Graham D., J. Phys. Chem., 61, 1310 (1957).
357. Graham J. A., Brown A. R. G., Watt W., Industrial Car-
bon & Graphite, Soc. Chem. Ind. Lnd., 1958, p. 309.
358. Green L., cm. [653].
359. Greene-Kelly R., Trans. Faraday Soc., 57, 412 (1955).
360. Grenville Wells H. J., Mineral Mag., 29, 803 (1952).
361. G r e n v i 11 e Wells H. J., Lonsdale K-, Nature, 181, 758
(1958).
362. Grisdale R. O., Pfister A. C., van Roosbroek W., Bell
System Tech. J., 30, 271 (1951).
363. Grisdale R. O., J. Appl. Physics, 24, 1082 (1953).
364. Groenewege M. P., cm. [1072].
365. Gruhl W., Gunter N’i с к e I F., Giesserei, 41, 453 (1954).
366. Gukelin E., Schweiz. Mineral Mitt., 28, 146 (1948).
367. Gul bransen E. A., Andrew K. F., Ind. Eng. Chem., 44,
1034, 1039, 1048 (1952).
368. G u m z W., Gas Producers & Blast Furnaces. Theory & Method of
Calculation, John Wiley, N. Y., 1950.
369. Gumz W„ Ind. Eng. Chem., 44, 1071 (1952).
370. Gunter Nickel F., cm. [365].
371. Gurney R. W., Phys. Rev., 88, 465 (1952).
372. Hadzi D., Novak A., Trans. Faraday Soc., 51, 1614 (1955).
373. H a e n n i P., cm. [554].
374. H a e r i n g R. R., Wallace P. R., J. Phys. & Chem. Solids, 3,
253 (1957).
375. H a e r i n g R. R., Canad. J. Phys., 36, 352 (1958).
376. H a e r i n g R. R., Wallace P. R., Proc. 3rd Carbon Conference,
Buffalo, N. Y., Pergamon Press, 1959, p. 163.
377. Hagstrum H. D., J. Chem. Phys., 23, 1178 (1955).
378. H a 1 e n d a P. P., cm. [48].
379. Hall A. R„ cm. [138].
380. Hall A. R., см. [357].
381. Hall H. T., см. [148].
382. Hall H. T., Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon
Press, 1959, p. 163.
383. HallumJ. V., Drushel H. V., J. Phys. Chem., 62, 110 (1958).
Литература 227
384. Halsey G. D., см. [826].
385. H a m d i H„ Kolloid Beiheft, 54, 554 (1943).
386. H a m d i H., Kolloid Z., 128, 22 (1952).
387. Ha mister V. C., cm. [170].
388. Ha mis ter V. C„ cm. [206].
389. H a n d a T., cm. [8].
390. H a n d a T., cm. [495].
391. Hann ay J. B., Proc. Roy. Soc., 30A, 450 (1880).
392. Harker H., Marsh H., W у n n e - J о n e s W. F. K-, Sympo-
sium on Properties of Carbon, Newcastle on Tyne, 1956, p. 22.
393. Harker H., Marsh H., Wynne-Jones W. F. K., Industrial
Carbon & Graphite, Soc. Chem. Ind. Lnd., 1958, p. 291.
394. Harker H., cm. [498].
395. Harrison R. J., cm. [34].
396. Hart eck P., Don des S., Л Chem. Phys., 27, 1419 (1957).
397. Hassel O., Mark H.. Z. Phy^., 25, 317 (1924).
398. Hassel O., Norsk. Geol. Tids., 1926, p. 226.
399. Hassel O., Proc. Chem. Soc., 1, 250 (1957).
400. Hassler J. W., Active Carbon, Chemical Publishing Co., N. Y, 1951,
401. Hauser O., Z. phys. Chem. (Lpz.), 210, 151 (1959).
402. Heal T. J., cm. [633].
403. Hedden K., W i с к e E., Proc. 3rd Carbon Conference, Buffalo;
N. Y., Pergamon Press, 1959, p. 249.
404. H e i n d 1 e R. A., Mohler N. F., J. Am. Ceramic Soc., 38, 89 (1955>-
405. Heinlein L., cm. [516].
406. Hemstreet H. W., cm. [849].
407. Hennig G. R., J. Chem. Phys., 19, 922 (1951).
408. Hennig G. R., J. Chem. Phys., 20, 1438, 1443 (1952).
409. Hennig G. R., Meyer L., Phys. Rev., 87, 439 (1952).
410. Hennig G. R., Smaller B., Yas ait is E. L., Phys. Rev., 95r
1088 (1954).
411. Hennig G. R., McClelland J. D., J. Chem. Phys., 23, 1434
(1955).
412. H e n n i g G. R., cm. [960].
413. Hennig G. *R., Proc. 1st and 2nd Conf, on Carbons, Univ. Buf-
falo, N. Y., 1956, p. 103.
414. Hennig G. R., Hove J. E., Int. Conference on Peaceful Uses of
Atomic Energy, United Nations, N. Y., vol. 7, 1956, p. 666; имеется
русский перевод: Материалы Международной конференции по мир-
ному использованию атомной энергии в Женеве в 1955 г., т. 7, М.,.
1958, стр. 809.
415. Hennig G. R., см. [700].
416. Hennig G. R., см. [261, 262].
417. Hennig G. R., Proc. 3rd Carbon Conference, Buffalo, N. Y., Per-
gamon Press, 1959, p. 625.
15*
228
Литература
418. Hennig G. R., Montet G. L., Proc. 3rd Carbon Conference,
Buffalo, N. Y., Pergamon Press, 1959, p. 349.
419. Herbst H, Phys. Z., 27, 366- (1926).
420. Hermann C., cm. [131].
421. Herold A., C. R. Acad. Sci. Paris, 232, 838, 1484 (1951).
422. Herold A., Bull. Soc. Chim., 999 (1955).
423. Herold A., cm. [180].
424. Heyd F., Kohl F., К о с h a n о v s к a A., Collection Czechoslov.
Chem. Commun., 12, 502 (1947).
425. Hill M. W., cm. [263].
426. Hill R. W., cm. [59].
427. H i n s h e 1 w о о d C. N., cm. [312].
428. H i p к e n H., cm. [595].
429. Hirsch P. B., Proc. Roy. Soc., 226A, 143 (1954).
430. H.M.S.O., Accident at Windscale Pile, Oct. 10th, 1957, Cmd. 302, 1957.
431. Hobson P. D., Ind. Eng. Chem., 50, 337 (1958).
432. Hoch M., Blackburn P. E., D i n g 1 e d у D. P., J о h n -
st on H. L., J. Phys. Chem., 59, 97 (1955).
433. Hodler A., cm. [648].
434. Hoerni J., cm. [1107].
435. Hoerni J. A., Wooster W. A., Acta Cryst., 8, 187 (1955).
436. Hofmann H., cm. [1022].
437. H о f m a n n U., Frenzel A., Z. Elektrochem., 37, 613 (1931).
438. H о f m a n n U., Frenzel A., Kolloid Z., 58, 8 (1932).
439. Hofmann U.,. cm. [305].
440. Hofmann U., Frenzel A., Kolloid Z., 68, 149 (1934).
441. Hofmann U., Frenzel A., Csalan E., Annalen, 510, 1 (1934).
442. Hofmann U., Wilm D., Z. Elektrochem., 42, 504 (1936).
443. Hofmann U., Wilm D., Csalan E., Z. Elektrochem., 42, 506
(1936).
444. Hofmann U., Elektrotech. Z., 58, 111 (1937).
445. Hofmann U., Riidorff W., Trans. Faraday Soc., 34, 1017 (1938).
446. Hofmann U., cm. [879].
447. Hofmann U., Holst R., Ber., 72, 754 (1939).
448. Hofmann U., Erg. d. exakt. Naturwiss., 18, 229 (1939).
449. Hofmann U., cm. [71].
450. Hofmann U., Ragoss A., Sinkel F., Kolloid Z., 96, 231
(1941).
451. Hofmann U., cm. [94].
452. Hofmann U, cm. [916—918].
453. Hofmann U, cm. [177, 178].
454. Holden J. H., cm. [246].
455. Holmes J. M., Beebe R. A, Canad. J. Chem., 35, 1542 (1957).
456. Holmes W a 1 к e r W. A., Ubbelohde A. R., J. Chem. Soc,,
720 (1954).
Литература
229
457. Holst R., см. [447].
458. Honda H., Ouichi К., Bull. Chem. Soc. Japan, 24, 181 (1951).
459. Honda H., Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon
Press, 1959, p. 159.
460. Hong K., Mrozowski S., Phys. Rev., 98, 1564 (1955).
461. Honig R. E„ J. Chem. Phys., 22, 126 (1954).
462. Ho ole у J. G., Can. J. Chem., 37, 899 (1959).
463. Horn F. H., Nature, 170, 581 (1952).
464. Horton L., Randall R. B., Aubrey К. V., Fuel, 23, 65,
100 (1944).
465. Hou ska C. R., Warren В. E., J. Appl. Phys., 25, 1503 (1954).
466. Hove J. E., Phys. Rev., 98, 1563 (1955).
467. Hove J. E., Phys. Rev., 100, 645 (1955).
468. Hove J. E., см. [414].
469. Hove J. E., Smith A. W., Phys. Rev., 104, 892 (1956).
470. Hove J. E., Industrial Carbon & Graphite, Soc. Chem. Ind. Lnd.,
1958, p. 501.
471. Hove J. E., Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon
Press, 1959, p. 515.
472. Howard H. C., Ind. Eng. Chem., 44, 1083 (1952).
473. Howe J. P., I. Arn. Ceram. Soc., 35, 275 (1952).
474. Huffman E. W. D., cm. [1000].
475. Hughes G., см. [1103].
476. Hulett G. A., Nelson O. A., Trans. Electrochem. Soc., 37,
103 (1920).
477. Hulett G. A., cm. [612].
478. Hull A. W., Phys. Rev., 10, 661 (1917).
479. Hummers W. S., Off eman R. E., J. Am. Chem. Soc., 80, 1339
(1958).
480. Humph reys-О wen S. P. F., Gilbert L. A., Industrial Car-
bon & Graphite, Soc. Chem. Ind. Lnd., .1958, p. 37.
481. Hunt В. E., Mori S., Katz S., Peck R. E., Ind. Eng. Chem.,
45,677(1953).
482. Hutch eon J. M., Longs taff B., Warner R. K., Industrial
Carbon & Graphite, Soc. Chem. lnd. Lnd., 1958, p. 259.
483. I b er s J. А., см. [193].
484. Iley R_, cm. [1156].
485. Imperial G. R., cm. [1088, 1090].
486. Inghram M. G., cm. [174].
487. Ingles J. A., cm. [819].
488. Ingles O. G., Trans. Faraday Soc., 48, 706 (1952).
489. Ingles O. G., Austr. J. Appl. Sci., 4, 451 (1953).
490. Ingram D. J. E., cm. [57, 58].
491. Ingram D. J. E., Austen D. E. G., Industrial Carbon & Gra-
phite, Soc. Chem. Ind. Lnd., 1958, p. 19.
230
Литература
492. I ngra m D. J. E., Proc. 3rd Carbon Conference, Buffalo, N. Y.,
Pergamon Press, 1959, p. 93.
493. Inokuchi H., Bull, Chem. Soc. Japan, 24, 222 (1951).
494. Inokuchi H., cm. [7—9, 12—14].
495. Inokuchi H., Shi ba S., Han da T., A kamatu H., Bull.
Chem. Soc. Japan, 25, 299 (1952).
496. Inoue M., cm. [1067].
497. lokibe K., Sci. Rep. Tohoku Imp. University, 9, 275 (1920).
498. Jackson C., Harker H., Wynne-Jones W. K. F., Nature,
182, 1154 (1958).
499. Jacobs G. J., Parks C. S., J. Am. Chem. Soc., 56, 1913 (1934).
500. J a f f e L. D., cm. [664].
501. Jain S. C., Krishnan K. S., Proc. Roy. Soc., 213A, 143 (1952).
502. James M., Johnston N. J., Pilcher E. В., J. Electrochem.
Soc., 102, 474 (1955).
503. Jamieson С. P., Mrozowski S., Proc. 1st and 2nd Conf, on
Carbons, Univ. Buffalo, N. Y., 1956, p. 155.
504. J e n к i n s F., cm. [126].
505. Jepson J. E., cm. [664].
506. Jessup R. S., J. Res. Nat. Bur. Stands., 21, 475 (1938).
507. Joel N., cm. [1150].
508. Johnson W., см. [1103].
509. Johnston D. F„ Proc. Roy. Soc., 227A, 349, 359 (1955).
510. Johnston D. F., Proc. Roy. Soc., 237A, 48 (1956).
511. Johnston H. L., cm. [432].
512. J о h n s t о n N. J., cm. [502].
513. Johnston R. L., cm. [775].
514. J о n с к P., cm. [517].
515. Joyner L. G., cm. [48].
516. Juz a R., Lubbe H., Heinlein L., Z. anorg. Chem., 258, 105 (1949).
517. Juza R., J о nek P., Schmeckenberger A., Z. anorg. Chem.,
292, 34 (1957).
518. Ju z a R., Schmeckenberger A., Z. anorg. Chem., 292, 46
(1957).
519. Kacser H., Ubbelohde A. R., Nature, 164, 445 (1949).
520. К a nt er M. A., Phys. Rev., 107, 655 (1957).
521. Касаточкин В. И., Каверов А. Т., ДАН СССР, 120, 1007 (1958).
522. Katz S., см. [481].
523. Каверов А. Т., см. [521].
524. К е а г s 1 е у М. J., см. [189].
525, К eating D. Т., Phys. Rev., 98, 1859 (1955).
526. keen R., см. [653].
527. Keesom P. H., Perlman N., Phys. Rev., 99, 1119 (1955).
528. Kelley К- K., U.S. Bur. Mines Bull., 383 (1935).
529. Kern D. M., J. Chem. Educ., 33, 272 (1956).
Литература
231
530. К е s s 1 е г F. М., V е s е г i к о v а V., Brennstoff Chem., 38, 297 (1957).
531. Kiive Р., см. [806].
532. Kiive Р., М г о z о w s к i S., Proc. 3rd Carbon Conference, Buffa-
lo, N. Y., Pergamon Press, 1959, p. 165.
533. Kilpatrick J. E., cm. [1083].
534. Kinchin G. H., Proc. Roy. Soc., 217A, 9 (1953).
535. Kinchin G. H., A Nuclear Energy, 1, 124 (1954).
536. Kinchin G. H., Pease R. S., Rep. Progr. Phys., 18, 2 (1955).
537. Kinchin G. H., Int. Conference on Peaceful Uses of Atomic Ener-
gy, United Nations, N. Y., vol. 7, 1956, p. 472; имеется русский пе-
ревод: Материалы Международной конференции по мирному ис-
пользованию атомной энергии в Женеве в 1955 г., т. 7, М., 1958,
стр. 574.
538. Kinney С. R., Nunn R. С., Walker Р. L., Ind. Eng. Chem.,
49,880 (1957).
539. Kinney C. R., см. [724].
540. Kinney C. R., см. [105].
541. Kinney C. R., см. [184].
542. Kipling J. J., Quart. Rev. Chem. Soc., 10, 1 (1956).
543. К i rm reut her K., cm. [928].
544. KI erne ns P. G., Phys. Rev., 86, 1055 (1952).
545. К 1 e m e n s P. G., Austr. J. Phys., 6, 405 (1953).
546. Kmetko E. A., Phys. Rev., 82, 456 (1951).
547. Kmetko E. A., J. Chem. Phys., 21, 2152 (1953).
548. Kmetko E. A., cm. [637].
549. Knight H. T., Rink J. P., J. Chem. Phys., 29, 449 (1958).
550. Knowles A. D., Industrial Carbon & Graphite, Soc. Chem. Ind.
Lnd., 1958, p. 388.
551. К о c h a n о v s k a A., cm. [424].
552. К о e h 1 e r W. A., cm. [246].
553. Kohl F., cm. [424].
554. К о h 1 s c h u tt t e г V., Haenni P., Z anorg. Chem., 105, 121 (1919).
555. Kohn J. A., cm. [842].
556. Komatsu K., Nagayima T., J. Phys. Soc. Japan, 6, 438 (1951).
557. Komatsu К., J. Phys. Soc. Japan, 10, 346 (1955).
558, Komatsu K., /. Phys. Chem. Solids, 6, 380 (1958).
559. К о m о d a T., cm. [1038].
560. К о n о b e j e w s k i S., Z. Rrist., 72, 381 (1929).
561. К о no b e j e v s k у S. T., Pravdynk N. F., Kutaitsev V. I.,
Int. Conference on Peaceful Uses of Atomic Energy, United Nations,
N. Y., vol. 7, 1956, p. 472; имеется русский перевод: Кон об e ев -
с к ий С. Т., Ку тайцев В. И., Правдюк Н. Ф., Мате-
риалы Международной конференции по мирному использованию
атомной энергии в Женеве в 1955 г., т. 7, М., 1958, стр. 582.
562. К о г е f F., Ann, Physik, 36, 49 (1911).
232
Литература
563. Kosika W. L., Dienes G. J., Advances in Catalysis, Academic
Press, N. Y., vol. 9', 1957, p. 398.
564. Kovacs S., cm. [1022].
565. Kraus G., cm. [350].
566. К r i s h n a n K. S., cm. [840].
567. Krishnan K. S., Phys. Rev., 45, 115 (1934).
568. Krishnan K. S., Ganguli N., Z. Krist., 100A, 530 (1939).
569. Krishna n K. S., см. [318, 319].
570. К r i s h n a n K. S., Nature, 145, 388 (1940).
571. К r i s h n a n K. S., Nature, 154, 486 (1944).
572. Krishnan K. S., cm. [501].
573. Krumhansi J. A., Brooks H., J. Chem. Phys., 21, 1663 (1953)
574. К r u m h a n s 1 J. А., см. [113, 114].
575. Kruyer S., cm. [219].
576. К u r s A., cm. [700].
577. Кутайцев В. И., ем. [561].
578. Kynch G. J., Penney W. G., Proc, Roy. Soc., 179A, 214 (1941).
579. L ab a eye P., см. [590].
580. La i d 1 e r D., Т а у 1 о r A., Nature, 146, 130 (1940).
581. Lakin J. R., Mackenzie J., Industrial Carbon & Graphite, Soc.
Chem. Ind. Lnd., 1958, p. 625.
582. Lambert J. D., Trans. Faraday Soc., 32, 452, 1584 (1936).
583. L a n d e 1 A., cm. [892].
584. Langmuir J. Am. Chem. Soc., 37, 1154 (1915).
585. Laves F., Baskin Y., Z. Rrist., 107, 22 (1956).
586. Lax B., Z e i g e г H. J., Phys. Rev., 105, 1466 (1957).
587. L a x B., Rev. Mod. Phys., 30, 122 (1958).
588. L e i n h a r d t T. E., cm. [849].
589. Letort M., Magrone R„ J. Chim. Phys., 47, 576 (1950).
590. Letort M., Petry J., Barrett P., Collart F., Labaeye P.,
Martin J., J. Chim. Phys., 47, 548 (1950).
591. Letort M., cm. [102, 103].
592. Letort M., cm. [106]..
593. Lewis F. A., Orr J., Ubbelohde A. R., Proc. Phys. Soc., 70B,
928 (1957).
594. Lewis F. A., J. Soc. Chem. Ind., 1504 (1957).
595. Lewis H. K., Gilliland E. R., H i p k e n H., Ind. Eng. Chem.,
45, 1697 (1953).
596. Lewis H. K., Gilliland E. R., Paxton R. R., Ind. Eng. Chem.»
46, 1327 (1954).
597. Lipson H., Stokes A. R., Nature, 146, 130 (1942).
598. Lipson H., Stokes A. R., Proc. Roy, Soc., 181A, 101 (1942).
599. Loebner E. E., Phys. Rev., 102, 46 (1956).
600. L о h r O., cm. [1022].
601. Lomer W. M., Proc. Roy. Soc., 227A, 230 (1954).
Литература
233*
602. London F., J. Phys. Radium, 8, 397 (1937).
603. Long F. J., Sykes K. W., Proc. Roy. Soc., 193A, 377 (1948).
604. LongF. J, SykesK. W, /. Chim. Phys., 47, 361 (1950).
605. Long G., cm. [290].
606. Long L. H„ Norrish R. G. W., Proc. Roy. Soc., 187A, 337 (1946).
607. L о n g s t a f f B., cm. [482].
608. Lonsdale K-, Proc. Roy. Soc., 179A, 315 (1942).
609. Lonsdale K-, Phil. Trans. Roy. Soc., 240A, 219 (1947).
610. Lonsdale K., cm. [361].
611. L о s t у H. H. W„ cm. [212].
612. Lowry H. H., Hulett G. А., Л Am. Chem. Soc., 42, 1408 (1920}.-
613. Lubbe H., cm. [516].
614. Luke K., Madgin W. M., Riley H. L, Nature, 138, 161 (1936).
615. L u к e s h J. S., Phys. Rev., 80, 226 (1950).
616. Lukesh J. S., J. Chem. Phys., 19, 383 (1951).
617. Lukesh J. S., J. Chem. Phys., 19, 1203 (1951).
618. Lukesh J. S., Phys. Rev., 84, 1068 (1951).
619. Lundqvist D., Acta Chem. Scand., 2, 177 (1948).
620. L u p t о n V., cm. [339].
621. Lyons L. E., Bree A., Morris G. C., Proc. 3rd Carbon Confe-
rence, Buffalo, N. Y., Pergamon Press, 1959, p. 87.
622. McCartney J. T., Er gun S., Proc. 3rd Carbon Conference, Bu-
ffalo, N. Y., Pergamon Press, 1959, p. 223.
623. McClelland J. D., ем. [411].
624. M с С 1 u r e J. W., Phys. Rev., 104, 666 (1956).
625. McClure J. W., Phys. Rev., 108, 612 (1957).
626. McClure J. W., Phys. Rev., 112, 715 (1958).
627. McClure J. W., Proc. 3rd Carbon Conference, Buffalo, N. Y., Per-
gamon Press, 1959, p. 179.
628. McDonald D. К- C., cm. [1021].
629. McDonnell F. R. M., Pink R. C., U b b e 1 о h d e A. R., J. Chem.
Soc., 191 (1951).
630. MacEwan D. M. C., cm. [160, 161].
631. MacEwan D. M. С., см. [23].
632. Me Gr ory F., cm. [81].
633. McIntosh A. B., Heal T. J., Cowan A., Industrial Carbon &
Graphite, Soc. Chem. Ind. Lnd., 1958, p. 560.
634. Mackenzie J., cm. [581].
635. McKinstry H. A., cm. [1085].
636. McLaughlin E., Zainal H. A., J. Chem. Soc,, 863 (1959).
637. M с M i c h a e 1 B. D., К met ко E. A., Mrozowski S., J. Opt.
Soc., 44, 26 (1954).
638. McPherson H. G., J. Opt. Soc., 30, 189 (1940).
639. McPherson H. G., cm. [206].
640. McSkimin H. J., Bond W. L., Phys. Rev., 105, 116 (1957).
234
Литература
641. McTaggart F. К., см. [83].
642. McWeenyR., Acta Cryst., 4, 513 (1951).
643. McWeeny R., Proc. Phys. Soc., 66A, 714 (1953).
644. M a d g i n W., M., cm. [614].
645. Madison J. J., Roberts R. M., Ind. Eng. Chem., 50, 237 (1958).
646. Magill J. N., U b b e 1 о h d e A. R., Trans. Faraday Soc., 54,1811 (1958).
647. M a g n u s A., Ann. Physik, 70, 203 (1923).
648. Magnus A., Hodler A., Ann. Physik, 80, 808 (1926).
649. Magnus A., Danz H., Ann. Physik, 81, 407 (1926).
650. M a g г о n e R., cm. [589].
651. Ma ire J., C. R. Acad. Sci. Paris, 232, 61 (1951).
652. Ma ire J., Mering J., Proc. 3rd Carbon Conference, Buffalo, N. Y.,
Pergamon Press, 1959, p. 337.
653. Ma Ims'trom C., Keen R., Green L., J. Appl. Phys., 22, 593
(1951).
654. Ma nt ell C. L., Industrial Carbon, Van Nostrand, N. Y., 2nd ed.,
1946.
655. M a n t о n J. E., cm. [204].
656. Marchand A., C. R. Acad. Sci. Paris, 238, 460 (1954).
657. M a r c h a n d A., C. R. Acad. Sci. Paris, 239, 1609 (1954).
658. Marchand A., cm. [763, 764].
659. M a r i c i c S., cm. [76].
660. Mark H., см. [397].
661. Марковский Л. Я., Изв. АН СССР, 31, 350 [1941].
662. Marsh Н., см. [1155].
663. М а г s h Н., см. [392, 393].
664. Martens Н. Е., Jaffe L. D., Jepson J. Е., Proc. 3rd Carbon
Conference, Buffalo, N. Y., Pergamon Press, 1959, p. 529.
665. Martin A. E., cm. [868].
666. Martin J., cm. [590].
667. Martin S. W., Nelson H. W., Ind. Eng. Chem., 50, 33 (1958).
668. Martin S. W., Shea F. L., Ind. Eng. Chem., 50, 41 (1958).
669. Mathews J., cm. [1065].
670. Matreyek W., cm. [1141].
67 h Матцкевич E. Б., БутягинП. Ю., Коллоидн. журн., 30, 665 [1958].
672. M a t s u n a g a Y., cm. [11—13].
673, Matuyama E., Nature, 170, 1123 (1952).
674. M a ‘t u у a m а /Е., J. Phys. Chem., 58, 215 (1954).
675. M a t u у a m a E., J. Sci. Inst., 32, 229 (1955).
676. Ma tu ya ma E., Carbon, 7, 12 (1958).
677. Matuyama E., Nature, 183, 670 (1959).
678. M a u g u i n C., Bull. Soc. Franq. Min., 49, 32 (1926).
679. Maurer R., Ru der R., J. Appl. Phys., 27, 571 (1956).
680. May W. G., Mueller R. H., Sweetser S. B.} Ind. Eng. Chem.,
50, 1289 (1958).
Литература
235
681. Meers J. T., см. [114].
682. Mellor D. Р, Research, 2, 314 (1949).
683. Mellor J. W., Comprehensive Treatise on Inorganic & Theoretical
Chemistry, Longmans Green, Lnd., vol. 5, 1924.
684. M e r i n g J., cm. [652].
685. Merritt F. R., см. [315].
686. Mette H., P ick H., Z. Phys., 134, 556 (1953).
687. Me у er L., Trans. Faraday Soc., 34, 1056 (1938).
688. Meyer L., cm. [409].
689. M.e у e r L., cm. [349].
690. Mey e r L, Z. Krist., 109, 61 (1957).
691. Meyer L., J. Chem. Phys., 28, 617 (1958).
692. Meyer L., Proc. 3rd Carbon Conference, Buffalo, N. Y., Pergamon
Press, 1959, p. 451.
693. Meyer R. A., Bourdeau R. G., Proc. 3rd Carbon Conference,
Buffalo, N. Y., Pergamon Press, 1959, p. 569.
694. M и н e p о и н a 3. В., см. [1171].
695. МинцБ. В., Цветные металлы, 12, 65 (1940).
696. Mizushima S., Phys. Rev., 86, 251, 1040 (1952).
697. Moe rs К., Z. anorg. Chem., 198, 262 (1931).
698. M о h 1 e r N. F., см. [404].
699. Moissan H., Ann. Chim. Phys., 8 (7), 306 (1896).
700. Mon tet G. L., Hennig G. R., К u r s A., Nuclear Sci. Eng., 1,
33 (1956).
701. Mon tet G. L., cm. [418].
702. M о о s e r E., Pearson W. B., J. Electronics, 1, 629 (1956).
703. Mooser E., Pearson W. B., J. Chem. Phys., 26, 893 (1957).
704. Mooser E., Pearson W. B., Proc, of Conference on Semi-Con-
ductors, Ashorne Hill, Physical Soc., Lnd., 1957, p. 65.
705. Mori S., см. [481].
706. Morris G. C., cm. [621].
707. Morrison J. A., cm. [227].
708. Morrison J. D., Stanton H. E. J. Chem. Phys., 28, 9 (1958).
709. Moss T. S., Photoconductivity in the Elements, Butterworth, Lnd.,
1952, p. 95.
710. Mrozowski S., Phys. Rev., 85, 609 (1952).
711. Mrozowski S., I. Chem. Phys., 21, 492 (1953).
712. Mrozowski S., cm. [637].
713. Mrozowski S., Phys. Rev., 98, 1564 (1955).
714. M г о z о w s к i S., cm. [460].
715. M г о z о w s к i S., Chaberski A., Phys. Rev., 104, 74 (1956).
716. Mrozowski S., cm. [503].
717. M ro z о w s ki S., Industrial Carbon & Graphite, Soc. Chem. Ind.
Lnd., 1958, p. 7.
718. Mrozowski S., cm. [532].
236
Литература
719. Mrozowski S., см. [15].
720. М u е 11 е г R. Н„ см. [680].
721. М u 11 i ке n R. S., /. Am. Chem. Soc., 74, 811 (1952).
722. Mulliken R. S., J. Phys. Chem., 56, 801 (1952).
723. Mur gatroy d W„ Nature, 180, 1093 (1957).
724. Murphy D. B., Palmer H. B., Kinney C. R., Industrial Carbon
& Graphite, Soc. Chem. Ind. Lnd., 1953, p. 77.
725. Murphy D, B., cm. [184].
726. Nabors L. G., cm. [1000].
727. Nagashima M„ cm. [1035].
728. N a g а у i m a T., cm. [556].
729. Nelson H. W., cm. [667].
730. Nelson J. B, Riley D. P., Proc. Phys. Soc., 57, 477 (1945).
731. Nelson J. B., Riley D. P., Nature, 159, 637 (1947).
732. Nelson J. B., Fuel, 32, 153, 795 (1954).
733. Ne 1 s о n O. A., cm. [476].
734. N e r n s t W., Ann. Physik, 36, 395 (1911).
735. N e u b e r t T. J., cm. [152].
736. N e u b e r t T. J., cm. [748].
737. Neuhaus A., Angew Chem., 66, 525 (1954).
738. Neuworth M. B., cm. [226].
739. Neville H. A., cm. [1015].
740. Ne we 1 1 G. F, J. Chem. Phys., 23, 2431 (1955).
741. Newell G. F., J. Chem. Phys., 24, 1049 (1956).
742. Newell G. F., J. Chem. Phys., 27, 240 (1957).
743. N i с h о 1 s G. E., cm. [233].
744. Nightingale R. E., Snyder W. A;, Proc. 3rd Carbon Conferen-
ce, Buffalo, N. Y., Pergamon Press, 1959, p. 579.
745. N о r r i s h R. G. W., cm. [606].
746. Northrup D. C., S i m p s о n O., Proc. Roy. Soc., 234A, 124, 136 (1956).
747. N о v a к A., cm. [372].
748. Novick A., Neubert T. J., J. Appl. Phys., 27, 572 (1956).
749. Nozieres P., Phys. Rev., 109, 1510 (1958).
750. Nozieres P., Proc. 3rd Carbon Conference, Buffalo, N. Y., Perga-
mon Press, 1959, p. 197.
751. Nunn R. C., cm. [538].
752. О deni ng C. A., Bowman J. C., Industrial Carbon & Graphite,
Soc. Chem. Ind. Lnd., 1958, p. 537.
753. О f f em an R. E„ см. [479].
754. Ogden W. H., cm. [195].
755. О 1 m s t e a d P. S., J. Phys. Chem., 33, 69 (1929).
756. Орешкин И. И., см. [798].
757. О г г J. С., см. [593].
758. О г г J. С., см. [1057].
759. О 11 Н., Ann. Physik, 85 (4), 81 (1928).
Литература
237
760. Ouichi К., см. [458].
761. Owen J., см. [42].
762. Owen W. S., Street B. G., J. Iron & Steel Inst., 167, 113 (1951).
763. Pa can It A., Marchand A., C. R. Acad. Sci. Paris, 241, 489
(1955).
764. Pa cault A., M a r c h a n d A., Proc. 3rd Carbon Conference, Buffa-
lo N. Y., Pergamon Press, 1959, p. 37.
765. Pace E. L., cm. [93].
766. Pace E. L„ J. Chem. Phys., 27, 1341 (1957).
767. Pal ache C., Am. Mineral, 26, 709 (1941).
768. Pa bin D. E., Wadsworth K. D., Nature, 162, 925 (1948).
769. P al mer H. B., cm. [724].
770. Parfitt G. D., cm. [267, 268].
771. P a r i s о t J., cm. [16].
772. Parker W. G., Wolf hard H. G., J. Chem. Soc., 2038 (1950).
773. Parks G. S., cm. [499].
774. P a t s c h e к e G., cm. [1022].
775. Patterson M. B., Johnson R. L., National Advisory Committee
on Aeronautics Tech. Note № 3334, 1954.
776. Pauling L, /. Chem. Phys., 6, 673 (1936).
777. Pauling L., Nature of the Chemical Bond, Cornell Univ. Press,
1948, ipp. 191, 341.
778. Paxton R. R., cm. [596]:
,779., Pearson W. B., cm. [702—704].
780. Pease R. S., Acta Cryst., 5, 356 (1952).
781. Pease R. S„ Acta Cryst., 7, 633 (1954).
782. Pease R. S., cm. [536].
783. Peck R. E., cm. [481].
784. Penney W. G., Proc. Roy. Soc., 158A, 306 (1937).
785. Penney W. G., cm. [578].
786. P e о v e r M. E., cm. [339].
787. Perlman N., cm. [527].
788. Perry M. J., см. [267].
789. Peters A., cm. [131].
790. Petersen E. E., cm. [844].
791. Petit P., cm. [69].
792. Petry J., cm. [590].
793. Pfister A. C., cm. [362].
794. Phinney F. S., Science, 120, 393 (1954).
795. Pick H., cm. [686].
*796. Pierce C., J. Phys. Chem., 60, 1480 (1953).
797. Pilcher E. B., cm. [502].
798. П и л и п e н к о П. П„ Орешкин И. И., Юбилей Вернадского
АН СССР, 2, 723 (1936).
799. Р i m е n t а 1 G. С., см. [874].
238
Литература
800. P i n c h i n F. J., cm. [99].
801. Pink R. C., cm. [629].
802. Pink R. C., Ubbelohde A. R., Trans. Faraday Soc., 54, 1811
(1948).
803. Pinnick H. T., J. Chem. Phys., 20, 756 (1952).
804. Pin nick H. T., Phys. Rev., 94, 319 (1954).
805. Pinnick H. T., Proc. 1st and 2nd Conf, on Carbons, Univ. Buf-
falo, N. Y., 1956, p. 3.
806. Pin nick H. T., Kiive P., Phys. Rev., 102, 58 (1956).
807. Pirani M., Fehse W., Z. Elektrochem., 29, 168 (1923).
808. Pirani M., cm. [19].
809. Pitzer K. S., J. Chem. Phys., 22, 159 (1938).
810. Pitzer K. S., cm. [1083].
811. Pitzer K. S., cm. [874].
812. Pl ass R., cm. [177].
813. Platt J. R., Z. Krist., 109, 226 (1957).
814. P 1 a t z e r N.,.C. R. Acad. Sci. Paris, 244, 2932 (1957).
815. P 1 a t z e r N., C. R. Acad. Sci. Paris, 245, 1925 (1957).
816. Pod all H., Foster W. E., Giraitis A. P.} J. Org. Chem.,
23, 82 (1958).
817. P о d s z u s E., Z. Elektrochem., 39, 75 (1933).
818. Polley M. H., cm. [910].
819. Popper P., Ingles J. A., Nature, 179, 1075 (1957).
820. Powell R. W., Proc. Phys. Soc., 49, 419 (1937).
821. Powell R. W., Schofield F. H„ Proc. Phys. Soc., 51, 153
(1939).
822. Powell R. W., см. [139].
823. Powell R. W., Industrial Carbon & Graphite, Soc. Chem. Ind. Lnd.,
1958, p. 46.
824. Pravdynk N. F., cm. 1561].
825. Preckel R., Sei wood P. W., J. Am. Chem. Soc., 63, 3397
(1941).
826. Prenzlow C. F., Halsey G. D., J. Phys. Chem., 61, 1158
(1957).
827. Price M. S. T., Yeats F. W., Industrial Carbon & Graphite,
Soc. Chem. Ind. Lnd., 1958, p. 111.
828. P r i m a к W., см. [835].
829. Primak W., Fuchs L. H., Phys, Rev., 95, 22 (1954).
830. Primak W., Fuchs L. H., Phys. Rev., 103, 541 (1956).
831. Primak W., Phys. Rev., 103, 544 (1956).
832. Pro sen E. J., Rossini F. D., J. Res. Nat. Bur. Stand., 33,
439, 447 (1944).
833. Pro sen E. J., cm. [225].
834. Pullman B., Proc. 3rd Conf. Carbon, Buffalo, N. Y., Pergamon.
Press, 1959, p. 9.
Литература
23$
835. Q u a r t е г m a n L., Primak W., J. Am, Chem. Soc,, 74, 805
(1952).
836. Raats E., cm. [1086].
837. Ragcss A., cm. [450].
838. Ragoss A., cm. [17].
839. Rakszawski J. F., cm. [1090].
840. Raman С. V., Krishnan K. S., Proc. Roy. Soc., 113A, 511
(1927).
841. Ramsdell L. S., Am. Mineral, 29, 431 (1944).
842. Ramsdell L. S., Kohn J. A., Acta Cryst., 4, 75 (1951).
843. R a n d a 11 R, B„ cm. [464].
844. Rao P. V. N. R., Petersen E. E., Ind. Eng. Chem., 50, 331
(1958).
845. Ras or N. S., cm. [964].
846. Ratcliff W. C., cm. [934].
847. Rees A. L. G., Chemistry of the Defect Solid State, Methuen,
Lnd., 1954.
848. Reyerson H. L., Wertz J. E., Weltner W., White-
hurst L., I. Phys. Chem., 61, 1334 (1957).
849. Reynolds J. M., Hem street H. W., Leinhardt T. E.,
Phys. Rev., 91, 1152 (1953).
850. Rhead T. F. E., W h e e 1 e r R. V., J. Chem. Soc., 831, 846 (1912).
851. Rhead T. F. E., Wheeler R. V., J. Chem. Soc,, 461, 1210
(1913).
852. Richards T. W., J. Am. Chem. Soc., 37, 1934 (1915).
853. Ride al E. К., см. [46].
854. Riet veld B. J., см. [1072].
855. Riley D. P., Proc. Phys. Soc., 57, 486 (1945).
856. Riley D. P., cm. [730, 731].
857. Riley H. L., cm. [614].
858. Riley H. L, J. Roy. Coll. Sci., 10, 10 (1940).
859. Riley H. L., Fuel, 24, 8, 43 (1945).
860. Riley H. L., cm. [44].
861. Rink J. P., cm. [549].
862. Ritter R. L., Drake L. C., Ind. Eng. Chem. Anal., 17, 782
(1945).
863. Roberts L. E. J., cm. [249].
864. Roberts R. M., cm. [645].
865. Robertson J. M., White J. G., I. Chem. Soc., 607 (1945).
866. Robertson J. M., .White J. G., J. Chem. Soc., 358 (1947).
867. Robertson J. M., cm. [243, 244].
868. Robertson Sir R., Fox J. J., Martin A. E., Proc. Roy.
Soc., 157A, 579 (1936).
869. Ro ok sb у H. P., Steward E. G., Nature, 159, 639 (1947).
870. Rosenstock H. В., J. Chem. Phys., 21, 2064 (1953).
240
Литература
871. Ross А. М., см. [213].
872. Rossini F. D., см. [832].
873. Rossini F. D., см. [1083].
874. Rossini F. D., Pitzer К- S., Arnott R. L., Braun R. M.,
Pi mental G. C., Selected Values of Physical & Thermodynamic
Properties of Hydrocarbons, Petroleum Project 44, Carnegie Inst.,
Pittsburgh, Penn. USA, 1953.
875. Rossman R. P., Smith W. R., Ind. Eng. Chem., 35, 972 (1943).
876. R u b i s c h O., cm. [889].
877. Ruder R., см. [679].
878. R u d о r f f G., cm. [884, 885].
879. Rudorff W., Hofmann U., Z. anorg. Chem., 238, 1 (1938).
880. Rudorff W., см. [445].
881. Rudorff W., Z. phys. Chem., 45B, 42, 174 (1939).
882. Rudorff W., Schulze H., Z. anorg. Chem., 245, 121 (1940).
883. Rudorff W., Z. anorg. Chem., 245, 383 (1941).
884. Rudorff W., Rudorff G., Z. anorg. Chem., 253, 281 (1947).
885. Rudorff W., Rudorff G., Chem. Ber., 80, 417 (1947).
886. Rudorff W., Z. anorg. Chem., 254, 319 (1947).
887. Rudorff W., Schulze E., Z. anorg. Chem., 277, 156 (1954).
888. Rudorff W., Zeller R., Z. anorg. Chem., 279, 182 (1955).
889. Rudorff W., Schulze E., R u b i s c h O., Z. anorg. Chem.,
282, 232 (1955).
890. Rudorff W., Sils V., Zeller R., Z. anorg. Chem., 283, 299 (1956).
891. Rudorff W., Brodersen K., Z. Naturforsch., 12B, 595 (1957).
892. Rudorff W.} L a n d e 1 A., Z. anorg. Chem., 293, 327 (1958).
893. Rudorff W., Sick H. H., Angew. Chem., 71, 127 (1958).
894. Rudorff W„ Siecke W. F., Ber., 91, 1348 (1958).
895. Rudorff W., Angew. Chem., 71, 487 (1959).
896. Ruess G. L., Kolloid Z., 110, 17 (1945).
897. Ruess G. L., Monatsh., 76, 381 (1946).
898. Ruff О., Brettschneider O., Z. anorg. Chem., 217, 1 (1934).
899. Ruff 0., Trans. Faraday Soc., 34, 1022 (1938).
900. Ruston W. R., Fuel, 32, 52 (1953).
901. Ryschkewitsch E., Z. Elektrochem., 31,* 54 (1925).
902. Ryschkewitsch E., Z. Elektrochem., 32, 42 (1926).
903. Sandor J., Proc. Ultrafine Structure of Coals & Cokes, Lnd., 1944,
p. 342.
904. Savage R. H., Brown C., J. Am. Chem. Soc., 70, 2362 (1948).
905. Savage R. H., Ann. N. У. Acad. Sci., 53, 862 (1951).
906. Savage R. H„ Schaefer D. L., J. Appl. Phys., 27, 136
(1956).
907. Savage R. H., Nature, 183, 315, 454 (1959).
908. Schaad L. J., cm. [190].
909. Schaefer D. L., cm. [906].
Литература
241
910. Schaeffer W. D., SmithW. R., Polley M. H., Ind. Eng.
Chem., 45, 1721 (1953).
911. Schaufhaiitl P., /. prakt. Chem., 21, 155 (1841).
9Г2. Scherrer P., ем. [223].
913. S c h e u e r m a n R. F., cm. [929].
914. S c h 1 e e d e A., Wei 1 m a n n M., Z. phys. Chem., 18B, 1 (1932).
915. Schmeckenb 916. Schmidt L., e r g e г А., см. [517, 518]. Boehm H. P., Hofmann U., Z. anorg. Chem.,
282, 241 (1955). 917. Schmidt L., Boehm H. P„ Hofmann U., Z. anorg. Chem.,
296, 246 (1958) 918. Schmidt L., Boehm H. P., Hofmann U., Proc. 3rd Carbon
Conference, Buffalo, N. Y., Pergamon Press, 1959, p. 235.
919. Schneider W. G., cm. [183].
920. Schoenberg D., Phil. Trans. Roy. Soc., 245, 1 (1952).
921. S с h о e n b e r g D., Physica, 19, 791 (1953).
922. Schofield F. H., cm. [821].
923. Schulze E., см. [887, 889].
924. Schulze H., cm. [882].
925. Schuyer J., Naturwiss., 13, 388 (1955).
926. Schuyer J., van Krevelen D. W., Fuel, 34, 213, 339 (1955).
927. Schuyer J., см. [1071].
928. Schwab G. M., Ki rmreuther K-, Angew. Chem., 71, 220 (1959).
929. Scott A. F., Scheuerman R. F., J. Phys. Chem., 61, 97 (1957).
930. Scott H. G., cm. [110].
931. Seal M., Nature, 182, 1264 (1958).
932. Sears G. W., J. Chem. Phys., 31, 358 (1959).
933. Seldin E. J., Proc. 1st and 2nd Conf, on Carbons, Univ. Buffalo,
N. Y., 1956, p. 117.
934. Selvig W. A., Ratcliff W. C., Trans. Electrochem. Soc., 37,
121 (1920).
935. Sei wood P. W, cm. [825].
936. Sei wood P. W., Magnetochemistry, 2nd ed., Interscience, N. Y., 1956.
937. Shannon J. S., Fuel, 37, 353 (1958).
938. Shea F. L., cm. [668].
939. S h i b a S., cm. [495].
940. Shirley D. G. M., cm. [280].
941. Sick H. H., cm. [893].
942. Siebert A. R., cm. [93].
943. S i e с к e W. F., cm. [894].
944. Sih von en V., Trans. Faraday Soc., 34, 1062 (1938).
945. Sils V., cm. [890].
946. Simival W. G., cm. [1005].
947. Simmons J. H. W., Industrial Carbon & Graphite, Soc. Chem.
Ind. Lnd., 1958, -p. 511.
16 A. P. Уббелоде
242
Литература
948. Simmons J. H. W., Proc. 3rd Carbon Conference, Buffalo, N. Y./
Pergamon Press, 1959, p. 559.
949. Simon F., cm. [66].
950. Simpson O., cm. [746].
951. Singer L. S., Spry W. J., Smith W. H., Proc. 3rd Carbon
Conference, Buffalo, N. Y., Pergamon Press, 1959, p. 121.
952. Singh L., Trans. Faraday Soc., 54, 1117 (1958).
953. S i n к e 1 F., cm. [450].
954. Sleightholme B., cm. [313].
955. Slonczewski J. C., Weiss P. R., Phys. Rev., 99, 636 (1955).
956. Slonczewski J. C., Weiss P. R., Phys. Rev., 109, 272 (1958).
957. Slough W., Ubbelohde A. R., J. Chem. Soc.,' 782, 911, 982
(1957).
958. Slysh R. S., cm. [184].
959. Smaller B., cm. [410].
96O. 'Smaller B., Hennig G. R., Yas a it is E. L., Phys. Rev., 97,
239 (1955).
961. S meet s H. H., cm. [1073].
962. Smith A. W., Phys. Rev., 95, 1095 (1954).
963. Smith A. W., cm. [469].
964. Smith A. W., Rasor N. S., Phys. Rev., 104, 885 (1956).
965. Smith E. A., J. Inst. Petroleum, 37, 255 (1951). 966. Smith T. D., J. Chem. Soc., 923 (1952). 967. Smith W. H., cm. [951]. 968. Smith W. R., cm. [875]. 969. Smi th W. R., cm. [910]. 970. Snyder W. A., cm. [744]. 971. S ou 1 e D. E, Phys. Rev., 112, 698, 708 (1958). 972. Soule D. E., Proc. 3rd Carbon Conference, Buffalo, N. Y., Perga-
mon Press, 1959, p. 2035.
973. S p a 1 a r i s C. N., J. Phys. Chem., 60, 1480 (1956).
974. S p a 1 a r i s C. N., Bupp L. P., G i 1 b e r t E. C., J. Phys. Chem.,
61, 350 (1957).
975. S p a 1 a r i s C. N., Proc. 3rd Carbon Conference, Buffalo, N. Y.,
Pergamon Press, 1959, p. 575.
976. Spry W. J., cm. [951].
977. Stanton H. E., cm. [708].
978. Staudenmaier L., Ber., 31, 1481 (1898).
979. Staudenmaier L., Ber., 32, 1394 (1899).
980. Staudenmaier L., Ber., 33, 2824 (1900).
981. Steele M. C., cm. [61].
982. Steggerda J. J., cm. [220].
983. S t e i g e r w a 1 d C., cm. [345].
984. Stevens С. M., cm. [226].
985. Steward E. G., cm. [869].
Литература
243
986. Steward Е. G., Davidson H. W., Industrial Carbon & Gra-
phite, Soc. Chem. Ind. Lnd., 1958, p. 206.
987. Stiles W. S., cm. [182].
988, 5 t о i c h e f f В. P., Canad. J. Phys., 32, 329 (1954).
989. Stokes A. R., cm. [597, 598].
990. Storey O. W., cm [143].
991. Straumanis M. E., Aka E. Z., J. Appl. Phys., 23, 330 (1952).
992. Street B. G., cm. [762].
993. Streeter E., cm. [44].
994. Streznewski J., Turkevich J., Proc. 3rd Carbon Conferen-
ce, Buffalo, N. Y., Pergamon Press, 1959, p. 273.
995. Strickland-Constable R. F., Trans. Faraday Soc., 34, 1374 (1938).
996. Strickland-Constable R. F., Trans. Faraday Soc., 40, 333 (1944).
997. S t r i с к 1 a n d - С о n s t a b 1 e R. F., Proc. Roy. Soc., 189A, 1 (1947).
998. Strong H. M., см. [148].
999. Strong H. M., Man-made Diamonds, Research Information Servi-
ces, G. E. C. Schenectady, N. Y., 1955, p. 18.
1000. Studebaker M. L., Huffman E. W. D., Wolfe A. C., Na-
bors L. G., Ind. Eng. Chem., 48, Г62 (1956).
1001. Studebaker M. L., Rubber Chemistry & Technology, 30, P4TO
(1957).
1002. Stumpf H. C., cm. [290].
1003. Sturges F. C., cm. [285].
1004. Suck H., cm. [301].
1005. Sutherland G. - В. В. M., В 1 а с к w e 11 D. E., S i m i v a 1 W. G.„
Nature, 174, 901 (1954).
1006. Sweetser S. B., cm. [680].
1007. Sykes K. W., cm. [312, 313].
1008. Sykes K. W., cm. [603, 604].
1009. Symposium on the Structure & Properties of Diamond, Proc. Indian
Acad. Sci., 1944.
1010. Szymanovitz R., Colloid Chemistry, 6, 436 (1946).
1011. Takahashi H., см. [13].
1012. Tapley J. G., cm. [58].
1013. Tarbox R. P., cm. [352].
1014. Taylor A., cm. [580].
1015. Taylor H. S., Neville H. A., I. Am. Chem. Soc., 43, 2055
(1921).
1016. Taylor R., cm. [188].
1017. Taylor W. G. A., cm. [182].
1018. Taylor W. J., cm. [1083].
1019. T a у s u m D. . H., cm. [267].
1020. Teller E., cm. [147].
1021. Templeton I. M., MacDonald D. К. C., Proc. Phys. Soc^
66 B, 680 (1953).
16*
244
Литература
1022. Terre s E., Patscheke G., Hofmann H., Kovacs S,
Lohr O., Gasu. Wasserfach., 77, 585 (1943).
1023. T h e w 1 i s J., cm. [65].
1024. Thiele H., Z. anorg. Chem., 190, 145 (1930).
1025. Thiele H., Kolloid Z., 56, 129 (1931).
1026. Thiele H., Z. anorg. Chem., 206, 407 (1932).
1027. Thiele H., Z. anorg. Chem., 207, 340 (1932).
1028. Thiele H., Z. Elektrochem., 40, 26 (1934).
1029. Thiele H., Tech. Ind. Schweiz. Chem. Ztg., 18, 47 (1935).
1030. Thomas G. B., cm. [204].
1031. T h о m p s о n M. de F., Frohlich P. K., Gill son J. L.,
Trans. Electrochem. Soc., 43, 161 (1923).
1032. Thorn R. J., Winslow G. H., I. Chem. Phys., 26, 186 (1957).
1033. T h r i n g M. W., cm. [28].
1034. Tonge B. L., cm. [185].
1035. Toy о da H., Na gas hi ma M., J. Phys. Soc. Japan, 14, 274
(1959).
1036. Trezbiatowski W., Roczniki Chem., 17, 73 (1937).
1037. Ts uz uku T., Kagaku, 23, 32 (1953).
1038. Tsuzuku T., Ko mo da T., J. Phys. Soc. Japan, 10, 81 (1955).
1039. Tsuzuku T., J. Phys. Soc. Japan, 12, 778 (1957).
1040. Tsuzuku T., Proc. 3rd Carbon Conference, Buffalo, N. Y., Perga-
mon Press, 1959, p. 433.
1041. T u г к e v i ch J., cm. [101].
1042. Turkevich J., cm. [145].
1043. Turkevich J., см. [994].
1044. Tye R. R., см. [139].
1045. Tyler W. W., Wilson A. C., Phys. Rev., 89, 870 (1953).
1046. Tyler W. W., см. [229, 232].
1047. Ubbelohde A. R., Nature, 132, 1002 (1933).
1048. Ubbelohde A. R., J. Chem. Soc., 1605 (1935).
1049. Ubbelohde A. R., cm. [802].
1050. Ubbelohde A. R„ cm. [519].
1051. U b b e 1 о h d e A. R., J. Chem. Soc., 1143 (1950).
1052. Ubbelohde A. R., cm. [629].
1053. Ubbelohde A. R„ cm. [456].
1054. Ubbelohde A. R., cm. [22].
1055. Ubbelohde A. R., cm. [355].
1056. Ubbelohde A. R., British J. Appl. Phys., 7, 313 (1956).
1057. Ubbelohde A. R., Orr J. C., Nature, 179, 193 (1957).
1058. Ubbelohde A. R., Nature, 180, 380 (1957).
1059. Ubbelohde A. R., cm. [957].
1060. Ubbelohde A. R., Quart. Rev. Chem. Soc., 11, 246 (1957).
1061. Ubbelohde A. R., cm. [593].
1062. Ubbelohde A. R., cm. [646].
Литература
245
1063. Ubbelohde A. R., Proc. 3rd Carbon Conference, Buffalo, N. Y.,
Pergamon Press, 1959, pp. 63, 329.
1064. U b be 1 о h d e A. R., Blackman L. C. F., Dundas P. H.,
J. Soc. Chem. Ind., 595 (1959).
1065. Ubbelohde A. R., Blackman L. C. F., Mathews J.,
Nature, 183, 454 (1959).
1066. Uebersfeld J., Erb E., Proc. 3rd. Carbon Conference, Buffalo,
N. Y., Pergamon Press, 1959, p. 103.
1067. Uemura Y., Inoue M., J. Phys. Soc. Japan, 13, 382 (1958).
1068. V a n der К a m E. J., cm. [1126].
1069. Van Doorn А. В. C., cm. [218, 221, 222].
1070. Van KrevelenD. W., cm. [926].
1071. Van Krevelen D. W., Schuyer L., Coal Science, Elsevier,
Amsterdam, 1957.
1072. Van Krevelen D. W., Groenewege M. P., Rietveld B. J.,
Nature, 181, 640 (1958).
1073. Van Loon W., Smeets H. H., Fuel, 29, 119 (1950).
1074. Van Roosbroek W., см. [362].
1075. Van Vleck J. H., Theory of Electric & Magnetic Susceptibilities,
Clarendon Press, Oxford, 1932.
1076. Vartanyan A. T., Acta Physicochim. URSS, 22, 201 (1947).
1077. Verma A. R., Nature, 168, 783 (1951).
1078. V e s e r i к о v a V., см. [530].
1079. Vickery H. C., Campbell N. L., J. Am. Chem. Soc., 79, 5897
(1957).
1080. W a d d i n g t о n T. C., cm. [183].
1081. W a d s wo r t h K. D., cm. [768].
1082. Waelbroeck F., cm. [242].
1083. Wagman D. D., Kilpatrick J. Ei, Taylor W. J., Pit-
zer K. S„ Rossini F. D., J. Res. Nat. Bur. Stand., 34, 143 (1945).
1084. Walker P. L., Foresti R. J., Wright С. C., Ind. Eng.
Chem., 45, 1703 (1953).
1085. Walker P. L., McKinstry H. A., Wright C. C„ Ind. Eng.
Chem., 45, 1711 (1953).
1086. Walker P. L., Raats E., J. Phys. Chem., 60, 364, 370 (1956).
1087. Walker P. L., см. [538].
1088. Walker P. L., Imperial G„ Nature, 180, 1184, 1185 (1957).
1089. Walker P. L., cm. [217].
1090. W a 1 кer P. L., R aksz a wski J. F., I m p e r i a 1 G. R., J. Phys.
Chem., 63, 133, 140 (1959).
1091. Wallace P. R., Phys. Rev., 71, 622 (1947).
1092. Wallace P. R., cm. [374, 376].
1093. Warner R. K., cm. [482].
1094. Warren В. E., J. Chem. Phys., 2, 551 (1934).
1095. Warren В. E., cm. [75].
246 Литература
1096. Warren В. Е., Chip man D. R., Knolls Atomic Power Report
KA PL-938, 1953.
1097. Warren В. E., ем. [465].
1098. Warren В. E., см. [40].
1099. Watt J. D., Franklin R. E„ Nature, 180, 1190 (1957).
1100. Watt J. D., Franklin R. E., Industrial Carbon & Graphite,
Soc. Chem. Ind. Lnd., 1958, p. 321.
1101. Watt W., см. [138—140].
1102. Watt W., cm. [357].
1103. Watt W., Bi eke rd ike R. L., Brown A. R. G., John-
son W., Hughes G., Nuclear Power, 4, 86 (1959).
1104. Webb E. J., cm. [59].
1105. Weber H. F., Phil. Mag., 49, 131, 276 (1875).
1106. W e d e p о h 1 P. T., Proc. Phys. Soc., 70B, 177 (1957).
1107. Weigle J., Hoerni J., Nature, 164, 1088 (1949).
1108. W e i n t r a u b E., Trans. Electrochem. Soc., 16, 182 (1909).
1109. Weiss D. E., cm. [322—326].
1110. Weiss J., Nature, 75, 744 (1940).
1111. Weiss P. R., cm. [955].
1112. Well ma nn M., cm. [914].
1113. Wei tner W., cm. [848].
1114. Wen to rf R. H„ cm. [148]. ...
1115. Wen tor f R. H., J. Chem. Phys., 26, 956 (1957).
4116. Wertz J. E., cm. [848].
1117. Wheeler A., Advances in Catalysis, Academic Press, N. Y., vol. 2,
1951, p. 250.
1118. Wheeler R. V., см. [850, 851].
1119. White A. H., Garner L. H., J. Chem. Phys., 9, 492 (1941).
1120. White J. G, см. [865].
1121. White J. G., cm. [866].
1122. White J. G., cm. [244].
1123. Whitehurst L., cm. [848].
1124. Whittingham G., Fuel, Lnd., 29, 244 (1950).
1125. Wibaut G., Z. angew. Chem., 40, 1136 (1927).
1126. Wibaut G., Van der Kam E. J., Proc. Acad. Sci. Amster-
dam, 32, 501 (1929).
1127. Wicke E., Fifth Symposium on Combustion, Reinhold, N. Y., 1955,
p. 245.
1128. Wicke E., см. [403].
11,29 . Wilks E. M, Phil. Mag. 34, 1074 (1958).
1130. Wilks J., cm. [59].
1131. W i 11 i a m s о n E. D., J. Franklin Inst., 193, 491 (1922).
1132. Willis J. B., cm. [323].
1133. Wilm D„ CM. [442, 443].
1134. Wilm an H., cm. [286].
Литература
247
1135. Wilman И., см. [204].
1136. Wilson А. С., см. [1045].
1137. Wilson А. Н., Proc. Roy. Soc., 134А, 277 (1932).
1138. Wilson A. H., The Theory of Metals, 2nd ed., Cambridge Univ.
Press, 1953.
1139. Wilson S. A., cm. [30].
1140. Winslow G. H., cm. [1032].
1141. Winslow G. H., Ma trey e к W., Yager W. A., Industrial
Carbon & Graphite, Soc. Chem. Ind. Lnd., 1958, p. 190.
1142. Wirtz Ж., Int. Conference on Peaceful Uses of Atomic Energy,
United Nations, N. Y., vol. 8, 1956, p. 496.
1143, Wobschall D. С., см. [15].
1144. Wobschall D, C., cm. [165].
1145. Wolfe A. C., cm. [1000].
1146. Wolff W. F., J. Phys. Chem., 63, 653 (1959).
1147. Wo If hard H. G., cm. [772].
1148. W о о d s W. K., Bupp L. P., Fletcher J. F., Int. Confe-
rence on Peaceful Uses of Atomic. Energy, : United Nations, N. Y.,
vol. 7, 1956, p. 665.
1149. Wooster W. A., cm. [435].
1150. Wo о st e r W. A., Joel N., Nature, \ 82, 1149 (1958).
1151. Wright С. C, cm. [1084, 1085].
1152. Wright С. C., cm. [105].
1153. Wright С. C., cm. [217].
1154. W r i g h t G. T„ G a r 1 i с к G. F. J., Brit. J. Appl. Phys., 5, 13 (1954).
U55..Wynne-Jones W. F. K., Bl ay den H. E., Marsh H.,
Brennstoff Chem., 33, 238 (1952).
1156. W у n n e - J о n e s W. F. К., В lay den H. E., Г1е у R., Brenn-
stoffChem., 33, 268 (1952).
1157. Wynne- jQnes W. F. K„ cm. [392, 393].
1158. W у n n e - J о n e s W. F. K., cm. [498].
1159. Yager W. A., cm. [314, 315].
1160. Yager W. A., cm. [1141].
1161. Yamazaki M., J. Chem. Phys., 26, 930 (1957).
1162. Y a s a i t i s E. L., cm. [410].
1163. Y a s a i t i s E. L., cm. [960].
1164. Yeats F. W., cm. [827].
1165. Young J. E„ cm. [108].
1166. Zainal H. A., cm. [636].
1167. Z eiger H. J„ cm. [586].
1168. Zeller R., cm. [888].
1169. Zeller R., cm. [890].
1170. Жданов Г. С., см. [123].
1171. Жданов Г. С., Минер о ина 3. В., Журн. эксп. и теор. физики,
17,3 (1947).
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Активированный углерод 40, 203,
213
Алмаз; см. Дефекты; Кристалли-
ческая структура; Полупровод-
никовые свойства; Связь; Темпе-
ратура Дебая; Теплосодержа-
ние; Фрикционные свойства; Эн-
тропия; Ядерное облучение
Анизотропия 54
диамагнетизма в графите 92—
94, 174
----углеводородах 92—94
константы упругости графита;
см. Сжимаемость 55, 57
магнитной восприимчивости
ароматических углеводоро-
дов 92
----графита 97—99
механических свойств 54
низкотемпературной удельной
теплоемкости 63, 64
преимущественной ориентации
в поликристаллическом гра-
фите 34
теплового расширения графи-
та 61, 66—69
теплопроводности графита 74,
75, 77
электропроводности 107
электросопротивления графи-
та 122
— монокристаллов естествен-
ного графита 122—125
— углеродов 122, 123
Ароматические углеводороды; см.
Анизотропия; Полимеризация;
Связь
внедрение атомов бора 23, 24
смазка из графита 58
соединения с щелочными ме-
таллами и галогенами 109,
137, 143—145, 152, 174
электронные свойства 88, 89,
91—97
Бентонит, внедрение 155, 171, 192
Бисульфат графита 139—142, 156
Бор
влияние на графитизацию 86
-----удельную теплоемкость
графита 86
----- электросопротивление
графита 86
Боразон 86
Взаимодействие между слоями в.
кристаллических соединениях
164—168
Винтовая дислокация 43, 44; см.
Дислокации
Вязкоупругие свойства 57, 58
Газовая сажа 48; см. Активиро-
ванный углерод; Древесный
уголь; Кокс; Полимеры откры-
тые углеродные; Сажа
винтовые дислокации 20,.
43, 44
магнитная восприимчивость
102
содержание водорода 144, 202
тепловое расширение 67
химическая природа поверх-
ности 48, 203
электросопротивление 111
Гексагональная решетка 9, 10
графита 1; см. Ромбоэдриче-
ская решетка; Слои
Геологическое происхождение
алмаза 27
графита 28
Германий
кристаллическая структура 85
Гидроксильные группы
в активированных углеродах
202—206
— графите 18, 152
— окиси графита 191
Гистерезис
в процессе сжатия углеродов
56, 112
при абсорбции брома 162, 16$
Предметный указатель
249
Графит искусственный
кусковой 31—35
плотный пиролитический 29—
31
уплотненный пропиткой биту-
мом 34
электролитический 35
Графитизация 38—42; см. Дегид-
рогенизация; Температура тер-
мической обработки
влияние бора 86
— водорода 43
изменение магнитных свойств
46, 47, 100
— размеров кристаллитов 40,
41
— электронных свойств 38, 39
— электросопротивления 113
на винтовых дислокациях 43, .
44.
Давление паров
кристаллических соединений
143, 144
слоистых соединений 161—163
Двойникование 11
плоскости двойникования в
кристаллах графита 21
Дегидрогенизация углеводородов
35, 36, 38; см. Коксование; Об-
угливание; Полимеризация
влияние на электросопротив-
ление 38
Дефекты
в алмазе 79
вызванные излучением 24
грубые 25
дырочные и клещевидные
18—20, 152
изомерных связей 16, 21, 22
краевые 18, 22
решетки (сетки) 16, 21, 139
термические при высоких тем-
пературах 21
упаковки 14—16
химические 22, 23
Диамагнетизм
графита 97, 101—103
кристаллических соединений
181
Дислокации 22, 123; см. Винтовая
дислокация; Графитизация; Ни-
тевидные кристаллы; Рост кри-
сталлов
Дисульфид вольфрама, соедине-
ния внедрения 155
Дисульфид молибдена
смазочные свойства 61
соединения внедрения 155'
Диффузия в графите 44—45
Диэлектрические свойства
графита 133, 134
углей 134
Древесный уголь 13, 36
Естественный графит 26—28
внешний вид 27
длина связи 9, 10
окисление 200
очистка 27
плоскости двойникования 11
происхождение 27, 28
содержание ромбоэдрической
формы 11
Железо; см. Кристаллические сое-
динения
возможные слоистые соедине-
ния с графитом 28
растворимость графита в же-
лезе 28, 29
Затухание; см. Вязкоупругие свой-
ства
Защитные покрытия на графите
195
Измельчение графита; см. Поры
изменение кристаллической
структуры 11, 22
— магнитных свойств 98—104
обрыв связей 22
окисление 201, 202
Изотермы сорбции
для графита 54
— соединений графита с бро-
мом 151, 162, 163
Инородные атомы 18, 19, 22—24,
135, 168—171, 201; см. Дефекты
сетки; Примеси
Испарение углерода 70—73
Каменный уголь 49, 50
Карбид кремния 85
Катализаторы
для окисления углерода 195г
200—204, 215
— полимеризации 158
Кислые соли графита 139—142
Кокс
графитизация 33
250
Предметный указатель
мягкий 38
электронные свойства 116, 117
Коксование 38, 48; см. Обуглива-
ние
Коллоидные дисперсии
графита 48
окиси графита 191, 192
Коэффициент Пуассона 56, 57
Красный углерод 49
Кратковременная прочность кри-
сталлического графита 56, 57
Крекинг углеводородов'29, 214
Кремний, кристаллическая струк-
тура 85
Кристаллические соединения гра-
фита 137—159
Кристаллическая структура; Ни-
трид бора; Окись графита; Оста-
точные соединения; Слои; Слои-
стые соединения
в качестве гальванических
элементов 158
с аммиаком и атомами ме-
талла 146, 147
— аммиаком и FeCl3 и А1С13
146
— бромом 147, 148, 150—152,
176
— водой 154, 155
— дисульфидом вольфрама
155
— дисульфидом молибдена 155
— железом 146, 152—155
— иодом 142,( 143, 148, 149
— калием 143—145, 174, 175
— кислородом 22, 152
— кислотами (солями) 139—
143
— литием . 145—147, 174
— натрием 145, 146, 174, 175
— однобромистым иодом 148
— однохлористым иодом 148,
150
— - органическими кислотами
142, 143
— рубидием 145, 146, 174
— серой 155, 156
— смешанными окислами,
сульфидами, хлоридами
154—156
— треххлористым хромом 155
— фтором 22, 142, 143, 148,
149
— хлористым галлием 154,
155
— хлористым железом 154—
156, 158
— хлором 148, 174
— цезием 145, 146
электрохимические соединения
139—141
Кристаллическая структура
алмазов 78, 79
графита 9, 10, 28
каменных углей 49
окиси графита 137
соединений графита 164—166
углеводородов 30
углеродов 10
Ламповая сажа 48; см. Газовая
сажа
тепловое расширение 67
теплоемкость 64
Магнитная восприимчивость; см.
Анизотропия
влияние размеров кристалли-
тов 98—102, 103, 104
графита 97—99
и инородные атомы 46, 47
каменных углей 104
кристаллических соединений
103, 160, 181
температурная зависимость 46
углеводородов 94, 104
углеродов 46, 47, 99—102
Магнитный резонанс
графита 47, 104, 105
кристаллических соединений
104, 105
углеродов 104, 105
Магнитосопротивление; см. Эф-
фект де Хааза — Ван-Альфена
графита 182—184
кристаллических соединений
182—184
углеродов 182—184
Методы приготовления кристалли-
ческих соединений 153, 154
Механические свойства графита
54; см. Вязкоупругие свойства;
Модуль упругости; Ползучесть;
Твердость; Фрикционные свой-
ства; Ядерное облучение
Модуль сдвига 54, 56, 57
Модуль упругости
влияние ядерного облучения
61
графита 54, 56—58
Предметный указатель
251
^Монокристаллы графита
приготовление 36, 37
Накопленная энергия; см. Работа
деформации
Недокись углерода 49
Нитевидные кристаллы (усы) 44
Нитрид бора
кристаллическая структура 86
связь и электронная структу-
ра 86, 135, 136
смазочные свойства 86
соединения внедрения 86, 155
Обугливание 38; см. Полимери-
зация
Окисление идеального графита
200, 201
механизм окисления 200—204
скорость окисления 209—212
.Окись графита (графитовая кис-
лота); см. Коллоидные диспер-
сии; Слои изогнутые
в качестве деполяризатора в
элементе Лекланше 158
внутрислойная сорбция 192
коллоидальные свойства 191
образование 185, 187, 188
пиролиз 186
структура 21, 22, 137, 185—191
электропроводность 191, 192
Олово
серое, кристаллическая струк-
, тура 85
Оптические свойства
графита 133, 134
углей 134
Осаждение углерода в двигателях
внутреннего* сгорания 31, 48
из газовой фазы 31, 36
— паровой фазы 73
«Остаточные соединения» графита
с галогенами 150—153
Отражательная способность гра-
фита 134
Отслаивание; см. Разбухание
Очистка графита 48
Парамагнитный резонанс в угле-
родах и графите 104, 105
Перенос заряда
в кристаллических соединени-
ях углеводородов 176
действие на тепловое расши-
рение в кристаллических
соединениях графита 176
между слоями графита 176
Превращение
алмаза в графит 77—79, 81
графита в газообразные про-
дукты 193—196
Пиролитический графит* 29—31,
122
Плотность 51, 52
алмаза 78, 79
графита и углерода 25, 42, 51,
52, 56, 78, 79
измеренная иммерсионным
методом в гелии 53, 197
—, -----керосине 52
электронная 12
Поверхность
влияние частичного окисления
198
окисление графита 197, 198
площадь поверхности углеро-
да и графита 54
поверхностная энергия графи-
< та 56
поверхностные пленки на гра-
фите 59
Подвижность носителей зарядов в
графите 115—117, 131
Показатели преломления графита
134
Ползучесть графита 57
Полимеризация углеводородов 38,
42, 158; см. Коксование; Обуг-
ливание
Полимеры
открытые углеродные 49
Полупроводниковые свойства 78,
79, 109
Поры в углеродах и графите 25,
26, 52—54
влияние облучения 53, 54
закрытые 53
открытые 25, 26
Преимущественная ориентация 34;
см. Анизотропия
Примеси в углеродах и графите
18, 19, 202—204; см. Инородные
атомы; Очистка
Прочность графита 22, 54
Пустоты межкристаллические в
графите; см. Поры
Работа выхода графита 133
Работа деформации в графите 57,
78
Разбухание кристаллических со-
единений 156
252
Предметный указатель
Размер зерен (кристаллитов) 25,
26, 64
влияние на магнитную вос-
приимчивость 101—103
----г- теплопроводность 76
---удельную теплоемкость
графита 63, 64
Распределение электронов
в графите 12, 21
— углеводородах 17, 18
Реактив Броди 46, 187
Реакторный графит 32
тепловое расширение 67
Ромбоэдрический графит 11, 12,
22, 67
Рост кристаллов 43, 44
Сажа 48
Сверхпроводимость 125
Свободные валентности в углеро-
дах и графите 12, 88
Связь; см. Электронные зоны
валентная 12, 88
в алмазе 18
— графите 9, 10, 122, 151
— многоядерных ароматиче-
ских углеводородах 88—89
— неполностью графитизиро-
ванных углеродах 90—91
— остаточных соединениях 171
— слоистых соединениях гра-
фита 164—166
между, слоями 179
слабо спаренного спина 90
Сера; см. Кристаллические соеди-
нения; Примеси; Химические
реакции
Сжимаемость 55—57
Слои изогнутые 19
Слои, смещение
в графите 11, 12, 59
— процессе образования кри-
сталлических соединений
12, 166—168
Слоистые соединения 147, 153, 205
Соединения брома; см. Аромати-
ческие углеводороды; Кристал-
лические соединения
Спелевый графит 10, 13
процесс образования 28—29
разновидности 28
Спектр поглощения графита 134
Способность к механической об-
работке графита 32
Степень упорядоченности 15
Стойкость углерода к химическим
воздействиям 158, 159
Структура
смешанная 15
турбостратная 14
Ступеньки роста 20, 21, 44; см.
Рост кристаллов
Твердость
графита 58, 61
углеродов 58
Температура Дебая
алмаза 80, 81
графита 63
Температура термической обра-
ботки 57
Тепловое расширение 66—69
алмаза 67, 68, 81
графита 66—68
углеродов 67—69
Т еплопроводность
влияние нейтронного облуче-
ния 78
графита 23, 73—77
связь с электропроводно-
стью 77
углеродов 75, 77
Теплосодержание; см. Удельная
теплоемкость
алмаза 79—81
графита 79—81
Теплота
сгорания графита 73, 82
испарения 70—72
образования кристаллических
соединений графита 161—163
перехода графита в алмаз
83—85
плавления графита 69, 70
Термоионные константы графита
133
Термохимия слоистых соединений
графита 160, 161
Термо-э.д.с.
графита 132, 133, 182—184
кристаллических соединений
графита 182—184
углеродов во В(ремя графити-
зации 183 •
Точка кипения углерода 72, 73
Точка плавления углерода 69
Углероды
образующиеся путем осажде-
ния из метана 37
полученные путем испарения
в электрической дуге 49
Предметный указатель
253
электрическое сопротивление
49
Удельная теплоемкость
алмаза 79, 80
влияние бора 64
— дефектов 66 •
— облучения 64, 65
— размеров кристаллитов 64
графита 23, 63, 64
древесного угля 63
ламповой сажи 64
нитрида бора 86
Фосфид бора 86
Фрикционные свойства; см. Слои
алмаза 60, 61
графита 58—60
дисульфида молибдена 61
нитрида бора 86
углеродов 59
Фтор; см. Кристаллические соеди-
нения
Химические реакции графита; см.
Кристаллические соединения
с водой 213, 214
— водородом 212, 213
— двуокисью углерода 132,
212
с серой 215
— фтором 214
Хлор; см. Кристаллические соеди-
нения
Циклотронный резонанс в графи-
те 131
Электроды углеродные 159
Электролитическое образование
графита 35
кристаллических соединений
графита 156
Электронная дифракция в графите
12
Электронные* зоны
аналогов графита 135, 136
графита 125—127
кристаллических соединений
графита 177
нитрида бора 135, 136
теория 107, 114—117
углеводородов 88, 107
углеродов 88
Электропроводность; см. Электро-
сопротивление
Электросопротивление; см. Анизо-
тропия
влияние бора 135
— давления 119, 120
— нейтронной бомбардировки
78, 121
— температуры 38, 39, 120,
121
ароматических соединений 106,
107
графита 38, НО
кристаллических соединений
графита 178—181
монокристаллов графита 122—
125
нитрида бора 86
поликристаллического графи-
та 119—121
углеводородов 108, ПО
углеродов и коксов 77, 108,
112, 113
частиц газовой сажи 111
Энергия
активации 107—109, 209—211
диссоциации ароматических
углеводородов 95—97
решетки кристаллических со-
единений 173, 174
связи между слоями 89—91
Энтропия
алмаза 81—85
графита 63, 64, 81—85
плавления графита 69, 70,
81—85
Эффект де Хааза — Ван-Альфена
128, 131
Эффект Холла
в графите 131, 182—184
— кристаллических соедине-
ниях графита 127, 182—184
— углеродах во время гра-
фитизации 182—184
Ядерное облучение
влияние на алмаз 79
----- механические свойства
61
----- образование кристалли-
ческих соединений 141
-----окисление 195, 200
— — расширение 61
-----теплопроводность 25, 78
-----удельную теплоемкость
64—66
----- физические свойства и
структуру 24, 25
----- электросопротивление
25, 121
ОГЛАВЛЕНИЕ
Предисловие редакторов ........................................ 5
Предисловие авторов....................................... . , 7
Глава I. Некоторые кристаллографические модели графита . . . 9
1.1. ’Гексагональная почти идеальная решетка................ О'
1.2. Ромбоэдрическая почти идеальная решетка ...... 11
1.3. Основные типы графитов и углеродов..................... 13
1.4. Дефекты структуры в графите............:............... 13
1.5. Естественный графит................................... 26-
1.6. Искусственный графит................................... 29
1.7. Структурные и молекулярные изменения в процессе гра-
фитизации . ................................................ 37
1,8. Различные формы искусственного углерода................ 47
Глава II. Физические свойства графита........................... 51
II.1 . Плотность . . ...................................... 51.
II.2 . Размеры доступных пор................................ 52
II.3 . Площадь поверхности.................................. 54
II.4 . Механические свойства графита........................ 54
Глава III. Тепловые свойства графита............................ 62
III . 1. Теплоемкость....................................... 62
III. 2. Тепловое расширение графита......................... 66
II 1.3. Плавление графита ................................. 69
III. 4. Испарение углерода.................................. 70
III. 5. Теплопроводность графита............................ 73
III. 6. Превращение алмаза в графит......................... 73
III. 7. Термодинамические свойства алмаза.............. . 79
III. 8. Превращение графита............................... 81
III. 9. Кристаллы, подобные графиту......................... 85
Оглавление
255
Глава IV. Электронные свойства и структура связей графита . . 87
IV . 1. Влияние границ между кристаллитами.................. 87
I V.2. Валентные связи в молекулах ароматического ряда и в
графите . . . ....................................... 88
IV .3. Молекулярный магнетизм углеводородов ароматического
ряда.......................................................... 91
IV. 4. Магнитная восприимчивость графита.......... 97
IV.5 . Магнитная восприимчивость углеродов ........ 99
IV .6. Уничтожение диамагнетизма электронного газа при обра-
зовании кристаллических соединений...........................103-
I V.7. Исследование электронного парамагнитного резонанса в
углеродах и графите......................................... 104
IV .8. Электрические свойства графита как предельного члена
ряда ароматических соединений................................ 105
IV. 9. Механизм электрической проводимости в углеродах . . 114
IV.1 0. Электросопротивление поликристаллического графита . 119
IV. 11. Электросопротивление монокристаллов почти идеального
естественного графита.........................................122
IV .12. Структура электронных зон в аналогах графита .... 135
Глава V. Кристаллические соединения графита......................137
V.I . Стехиометрия кристаллических соединений ...... 138
V.2. Кристаллические соединения графита с металлами . . . 143
V.3. Слоистые соединения графита с галогенами............... 147
V.4 . Остаточные соединения графита с галогенами........... 150
V. 5. Слоистые соединения графита с другими молекулами . . 153
V.6 . Химические реакции кристаллических соединений графита 156
Глава VI. Химическая физика кристаллических соединений графита 160
VI. 1. Термохимия слоистых соединений графита.............. 160
VI.2. Давление паров слоистых соединений.................... 161
VI.3 . Рентгеноструктурные исследования соединений графита ., 163
VI. 4. Структура связей в соединениях графита.............. 171
Глава VII. Магнитные и электрические свойства кристаллических
соединений графита.............................................. 177
VII. 1. Изменение заполнения энергетических зон при образова-
нии кристаллических соединений................................177
VII.2 . Изменение электросопротивления при образовании со-
единений .................................................... 178
VII.3. Магнитные свойства кристаллических соединений. . . . 181
256
Оглавление
Глава VIII. Окись графита (графитовая кислота).............. 185
VIII .1. Связь с другими кристаллическими соединениями гра-
фита ................................................... 185
VII 1.2. Образование окиси графита.............. 187
VIII .3. Структура окиси графита....................... 188
VIII. 4. Физико-химические свойства окиси графита........191
Глава IX. Химическое превращение графита в газообразные про-
дукты .......................................................193
IX. 1. Экспериментальные методы изучения образования газооб-
разных продуктов........................................ 196
IX.2. Окисление почти идеального графита.................200
IX.3 . Образование углеродных отложений при крекинге газооб-
разных молекул...........................................214
IX.4. Образование других газообразных продуктов из углеро-
дов ........................................... , . . . 214
.Литература ..........................................: : : 216
Предметный указатель.........................................249
А. Р. Уббелоде, Ф. А. Льюис
ГРАФИТ И ЕГО КРИСТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
Редактор В. С. Хангулова
Художник И, А. Литвишко
Художественный редактор Н. А. Фильчагина
Технический редактор Л. П. Кондюкова
Корректор И. М. Максимова
Сдано в производство 2fy)X 1964 г. Подписано к печати 9/II 1965 г.
бумага 60Х901/1в=8,0 бум. л., 16,0 печ. л. Уч.-изд. л. 14,66. Изд. Xs 20/2336
Цена 1 р. 18 к. Зак. 595
(Темплан 1965 г. Изд.-ва «Мир», пор. л. 186)
ИЗДАТЕЛЬСТВО «МИР»
Москва, 1-й Рижский пер., 2
Московская типография № 20
Главполиграфпрома Государственного комитета
Совета Министров СССР по печати
Москва, 1-й Рижский пер., 2