Автор: Парфенов В.А. Яхно Н.Н.
Теги: нервная система невропатология неврология алкоголизм как болезнь нейрохирургия психиатрия медицина диагностика учебное пособие патогенез этиология клиника частная неврология
ISBN: 5-89481-337-9
Год: 2006
Н.Н. Яхно В.А. Парфенов
ЧЙСТНШ
на® шаги
МЕДИЦИНСКОЕ ИНФОРМАЦИОННОЕ АГЕНТСТВО
Н.Н. Яхно В.А. Парфенов
ЧАСТНАЯ НЕВРОЛОГИЯ
Учебное пособие для студентов медицинских вузов
Рекомендовано Учебно-методическим объединением по медицинскому и фармацевтическому образованию вузов России в качестве учебного пособия для студентов медицинских вузов
МЕДИЦИНСКОЕ ИНФОРМАЦИОННОЕ АГЕНТСТВО МОСКВА
2006
УДК 616.8
ББК 56.1
Я90
Яхно Н.Н., Парфенов В.А.
Я90 Частная неврология: Учебное пособие для студентов медицинских вузов. — М.: ООО «Медицинское информационное агентство», 2006. 192 с.
ISBN 5-89481-337-9
В книге изложены современные представления об этиологии, патогенезе, клинике, диагностике, лечении и профилактике основных заболеваний нервной системы.
Для студентов медицинских вузов, также может быть использовано при обучении неврологов и врачей общей практики.
УДК 616.8
ББК 56.1
ISBN 5-89481-337-9
© Яхно Н.Н., Парфенов В.А., 2006
© Оформление. ООО «Медицинское информационное агентство», 2006
Содержание
Тема 1
Острое нарушение мозгового кровообращения.
Дисциркуляторная энцефалопатия. Сосудистая деменция.............................5
Тема 2 Заболевания периферической нервной системы.....44
ТемаЗ
Нервно-мышечные заболевания. Боковой амиотрофический склероз................61
Тема 4
Рассеянный склероз. Острый рассеянный энцефаломиелит...............73
Тема 5
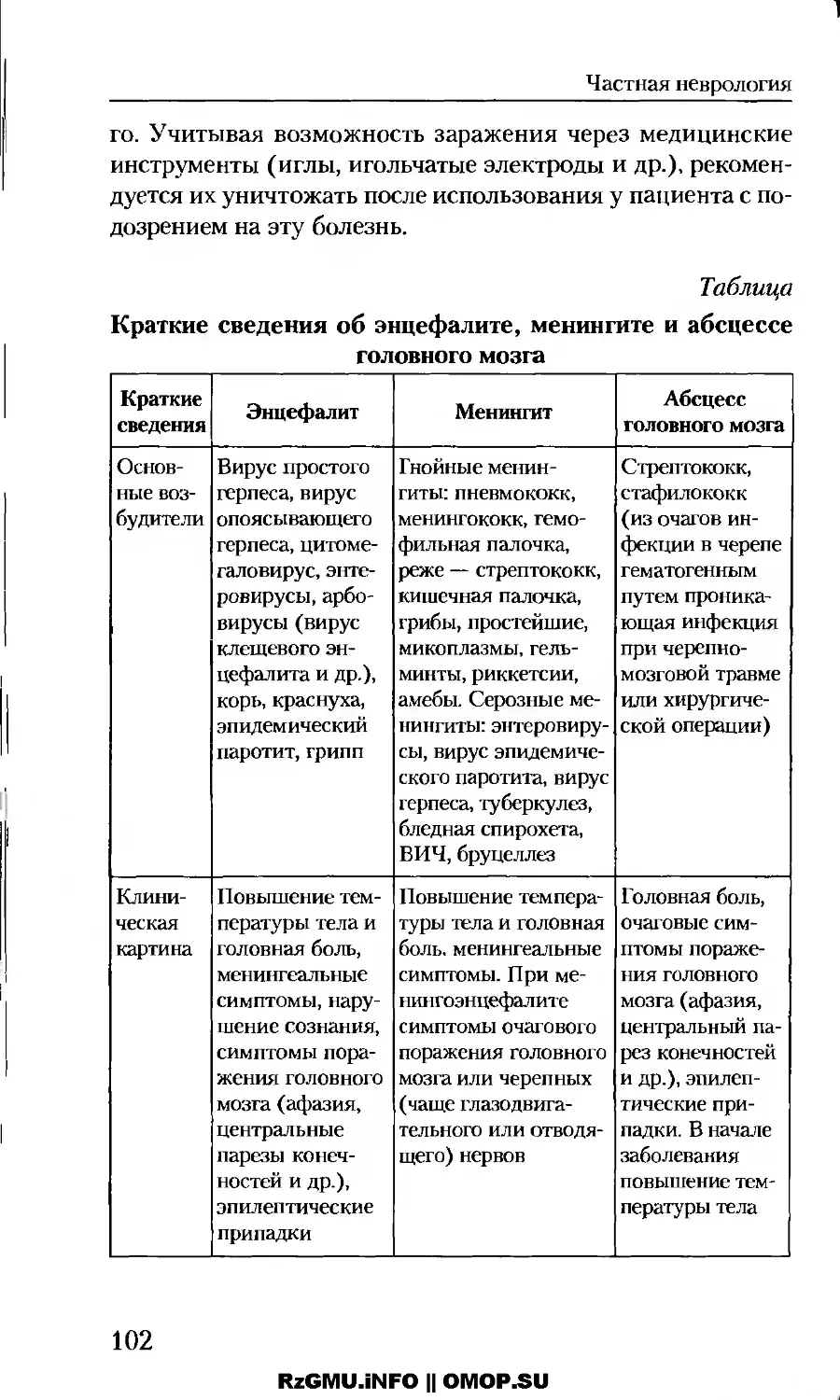
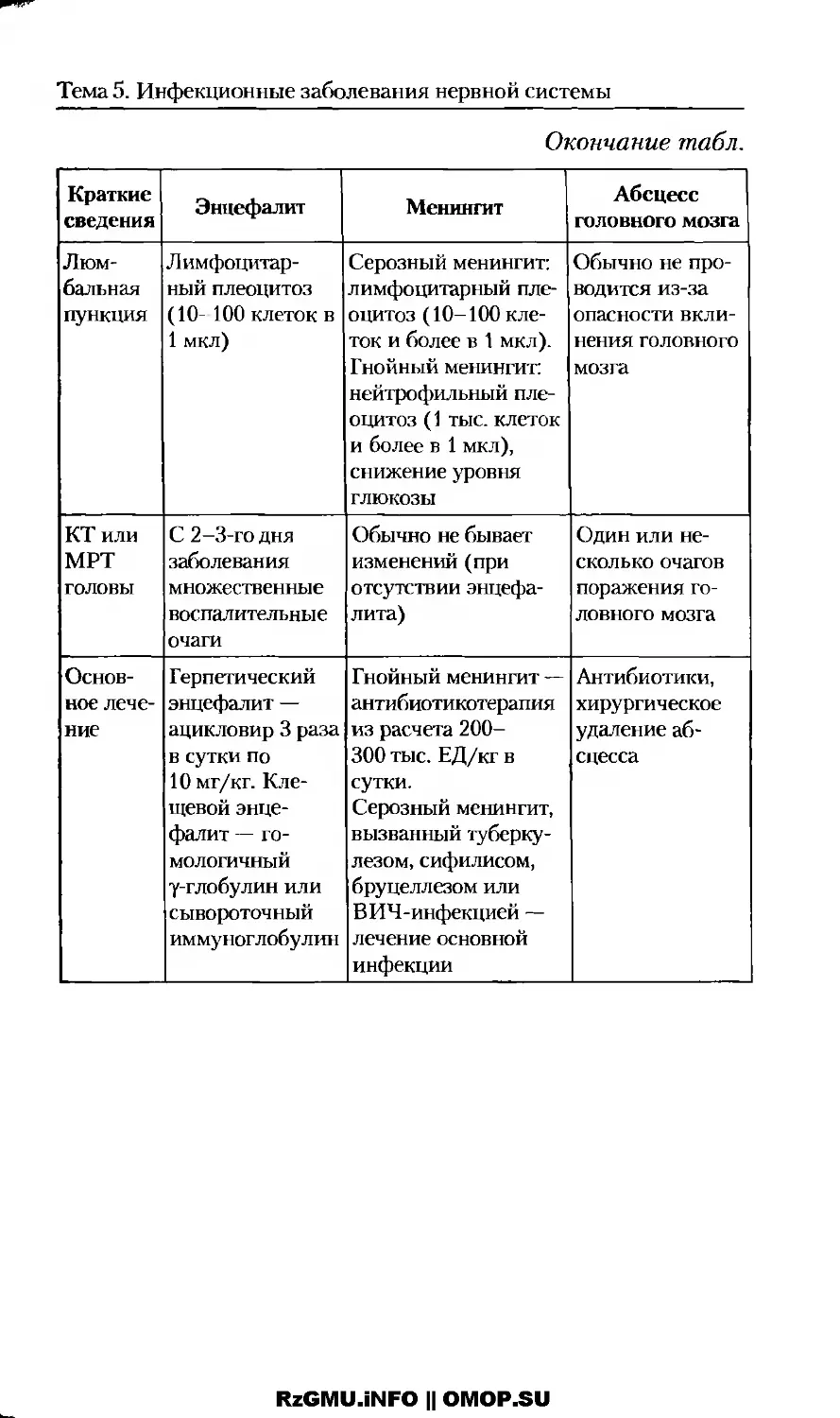
Инфекционные заболевания нервной системы......81
Тема 6
Опухоли нервной системы.......................104
Тема 7
Черепно-мозговая и позвоночно-спинномозговая травма........................................108
Тема 8
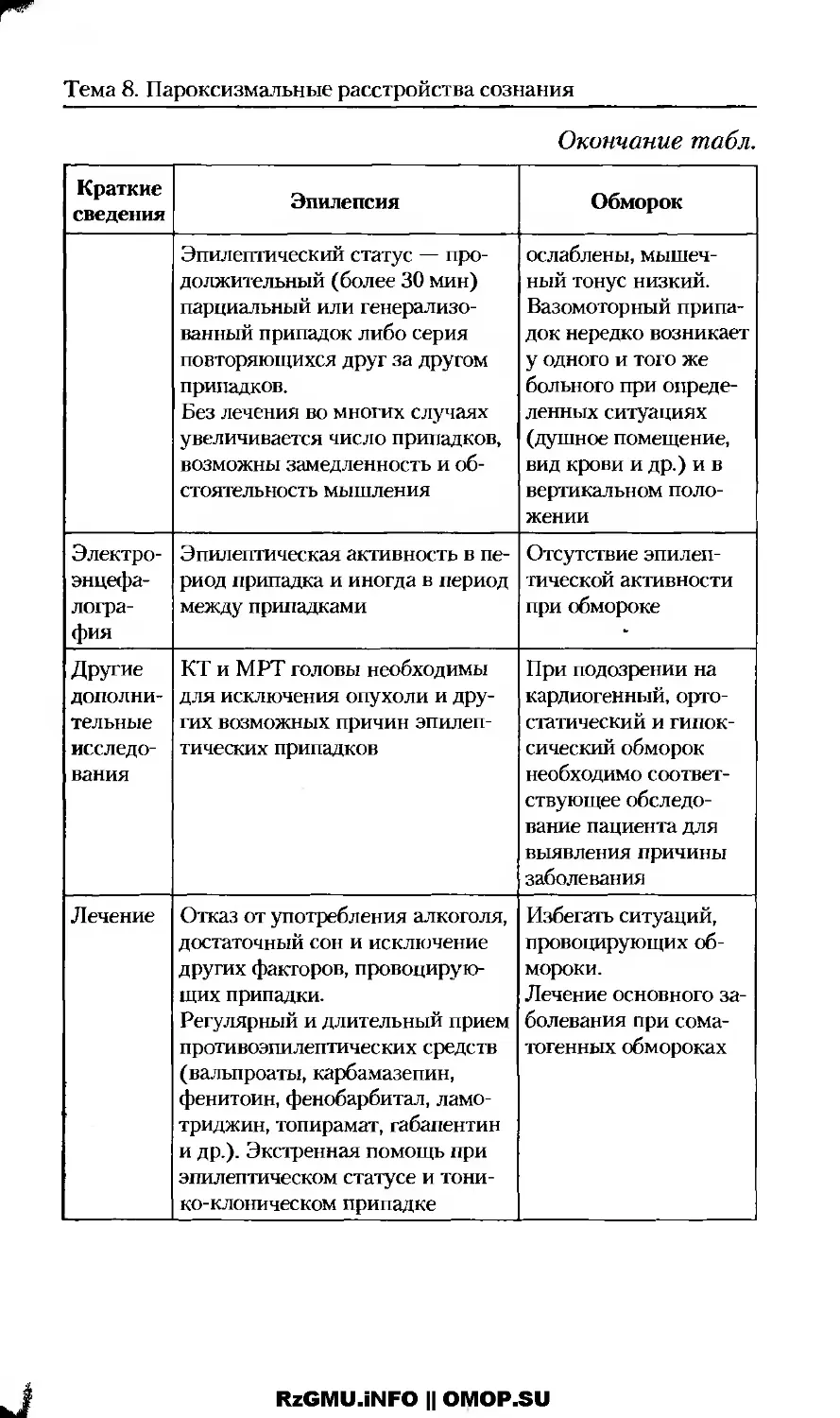
Пароксизмальные расстройства сознания: эпилепсия и обмороки.....................................121
Тема 9
Боль в спине. Вертеброгенные неврологические нарушения и другие скелетно-мышечные расстройства ...134
Тема 10 Головная и лицевая боль........................150
Тема 11
Поражение нервной системы при некоторых соматических заболеваниях, метаболических нарушениях и интоксикациях.....................163
Тема 12
Вегетативная дистония и невротические расстройства ....177
Список литературы..............................186
Тема 1
Острое нарушение мозгового кровообращения. Дисциркуляторная энцефалопатия.
Сосудистая деменция
Кровоснабжение головного мозга
Кровоснабжение головного мозга осуществляется по двум основным системам: каротидной (передней) и вертебробазилярной (задней). Внутренние сонные артерии исходят из общей сонной артерии, берущей начало справа от плечеголовного ствола, слева от дуги аорты. Позвоночные артерии исходят из подключичных артерий и при слиянии образуют основную (базилярную) артерию, кровоснабжающую ствол мозга и мозжечок. Внутренние сонные и позвоночные (пре-церебральные) артерии после вхождения в полость черепа образуют анастомотическую сеть, состоящую из виллизи-ева круга и основной артерии. Парные передние, средние и задние мозговые артерии осуществляют кровоснабжение полушарий головного мозга. Отток крови от головного мозга осуществляется по наружным и внутренним мозговым венам, дренирующимся в большие синусы твердой мозговой оболочки, из которых кровь через внутренние яремные вены, плечеголовные вены и верхнюю полую вену возвращается в сердце.
Прекращение кровотока по одной или даже нескольким прецеребральным артериям может не вызвать локальную ишемию мозга, благодаря включению анастомозов вилли-зиева круга и других менее значимых путей коллатераль
ного кровообращения. Напротив, прекращение кровотока по мозговым артериям или их ветвям обычно приводит к локальной ишемии мозга, поскольку система анастомозов между ними не компенсирует выключение кровотока по одной из артерий.
Острые нарушение мозгового кровообращения
Острое нарушение мозгового кровообращения (ОНМК) определяется клинически как быстро возникающее очаговое и/или диффузное (общемозговое) нарушение функции головного мозга сосудистого генеза. ОНМК представляют собой наиболее распространенные заболевания головного мо^га в зрелом и ц^жилом возрасте. Среди ОНМК выделяют ишемический и геморрагический инсульт/транзиторную ишемическую атаку (ТИА), а также острую гипертоническую энцефалопатию (гипертензивную энцефалопатию). Ишемический инсульт (инфаркт мозга) и ТИА вызваны прекращением или значительным уменьшением кровоснабжения участка мозга — локальной ишемией. Среди геморрагических нарушений мозгового кровообращения выделяют кровоизлияние в мозг (паренхиматозное кровоизлияние) и субарахноидальное (подоболочечное) кровоизлияние. Инсульт проявляется стойкими (более суток) очаговыми и/или общемозговыми нарушениями функции головного мозга или приводят к быстрому (в течение первых суток) летальному исходу. Этим он отличается от ТИА, при которой наблюдаются только кратковременные (менее 24 ч) симптомы локальной ишемии мозга. В тех случаях, когда клинические симптомы исчезают полностью в пределах от 2 сут до 3 нед., диагностируют малый инсульт (или инсульт с обратимым неврологическим дефицитом).
Частота инсультов колеблется в различных регионах мира от 1 до 4 случаев на 1 тыс. населения в год, значительно нарастая с увеличением возраста. Среди инсультов ишемические составляют 70-85%, кровоизлияние в мозг — 20-25%, субарахноидальное кровоизлияние — 3-5%. В последние
годы в России ежегодно регистрируется более 400 тыс. инсультов, в стране проживает более миллиона людей, перенесших инсульт, 60-80% из них — инвалиды.
Ишемический инсульт и транзиторная ишемическая атака
Выделяют инсульт в стадии прогрессирования (или инсульт в развитии), когда клинически регистрируется нарастание степени неврологических нарушений, и завершенный инсульт, когда неврологические нарушения стабильны или постепенно регрессируют. Причины ТИА и ишемического инсульта не имеют качественных различий. Клинический исход ишемического нарушения мозгового кровообращения (ТИА или инсульт) определяется в основном калибром артерии, в котором нарушен кровоток, локализацией и скоростью закупорки мозговой артерии, состоянием коллатерального кровообращения и реологическими свойствами крови.
Этиология и патогенез. К основным факторам риска ишемического ОНМК относят пожилой и старческий возраст, артериальную гипертонию, гиперхолестеринемию, атеросклероз церебральных и прецеребральных (сонных и позвоночных) артерий, курение, заболевания сердца (мерцательная аритмия, инфаркт миокарда, аневризма левого желудочка, искусственный клапан сердца, ревматическое поражение клапанов сердца, миокардиопатии, бактериальный эндокардит), сахарный диабет. Ишемические ОНМК примерно в 90-95 % случаев вызваны атеросклерозом церебральных и прецеребральных артерий, поражением мелких церебральных артерий вследствие артериальной гипертонии, сахарного диабета или кардиогенной эмболией. В более редких случаях они обусловлены васкулитом, гематологическими заболеваниями (эритремия, серповидноклеточная анемия, тромбоцитемия, лейкозы), иммунологическими нарушениями (антифосфолипидный синдром), венозным тромбозом, расслоением прецеребральных или церебральных артерий, мигренью, у женщин — приемом оральных контрацептивов. Среди ишемических инсультов выделяют атеротромботи-
ческий (атеротромбоз или артериоартериальная эмболия), кардиоэмболический, лакунарный (поражение мелких церебральных артерий) и инсульт, вызванный другими (более редкими) причинами.
Атеросклероз представляет наиболее частое заболевание церебральных и прецеребральных артерий, вызывающее ишемическое ОНМК. Атероматозные бляшки поражают прецеребральные (сонные, позвоночные), крупные и средние церебральные артерии, преимущественно в местах их деления, извитости и слияния. Рост атеросклеротической бляшки осложняется ее изъязвлением и тромбообразова-нием с полной закупоркой артерии. Фрагменты тромба и атеросклеротической бляшки могут быть источником эмболии более дистального отдела артерии (артериоартериальная эмболия). Атеротромбоз и эмболия составляют причину примерно половины ишемических ОНМК.
Кардиогенная эмболия является причиной около 20% ишемических инсультов и ТИА. Она обычно возникает вследствие формирования эмболических фрагментов на клапанах сердца или образования внутрисердечного тромба. К доказанным кардиогенным факторам риска эмболии мозга относят фибрилляцию предсердий (мерцательная аритмия), искусственный клапан сердца, ревматическое поражение клапанов сердца, недавний (до 1 мес.) инфаркт миокарда, внутрисердечный тромб, внутрисердечное объемное образование (миксома). Возможными кардиогенными факторами риска эмболии мозга считают синдром слабости синусового узла, незаросшее овальное отверстие, атеросклеротические отложения в грудной аорте, инфаркт миокарда давностью 2—6 мес., гипо- или акинетический сегмент левого желудочка, кальцификацию митрального или аортального клапана. Неревматическая мерцательная аритмия вызывает большинство случаев кардиальной эмболии в мозг. Парадоксальная эмболия в мозг может возникать вследствие попадания эмболов из венозной системы или правого предсердия в случаях незаращения овального окна, дефекта межпредсердной или межжелудочковой перегородки.
Лакунарный инсульт составляет 15-30% случаев ишемического инсульта. Лакунарный инсульт — небольшой по величине (до 15 мм в диаметре) инфаркт мозга, который локализуются в белом веществе полушарий головного мозга, в стволе мозга и мозжечке. В процессе организации этого инфаркта образуется маленькая полость — лакуна, что и дает название «лакунарный инсульт». Их развитие связывается с поражением мелких (40—80 мкм в диаметре) перфорирующих ветвей средней мозговой артерии, задней мозговой артерии и основной артерии преимущественно вследствие артериальной гипертонии и сахарного диабета.
Артериальная гипертония представляет один из главных факторов риска ишемического ОНМК. Чем выше уровень артериального давления, тем вероятнее развитие инсульта. Артериальная гипертония приводит к развитию ишемической ОНМК напрямую, вызывая в перфорирующих артериях мозга липогиалиноз и фибриноидный некроз, а также опосредованно через стимулирование атеросклероза преце-ребральных, крупных и средних церебральных артерий и развитие сердечных заболеваний, например инфаркта миокарда и мерцательной аритмии, осложняющихся кардиогенной эмболией.
Независимо от причины, вызвавшей локальную ишемию мозга, развивается каскад патобиохимических изменений, приводящих к необратимому повреждению нервной ткани по механизмам некроза и апоптоза.
Оптимальный объем мозгового кровотока составляет 50-60 мл/100 г/мин. Падение мозгового кровотока ниже 20 мл/100 г/мин вызывает нарушение функционального состояния нейронов коры головного мозга, а снижение до 10-15 мл/100 г/мин приводит к быстрым в течение нескольких минут необратимым изменениям в тканях головного мозга. В течение 6—8 мин нейроны остаются жизнеспособными и могут восстановить свои функции при нормализации кровоснабжения. При локальной ишемии мозга вокруг участка с необратимыми изменениями формируется зона, кровоснабжение которой ниже уровня, необходимого для нормального функционирования, но выше 10—15 мл/100 г/мин (критиче
ский порог необратимых изменений) — «ишемическая полутень». Гибель клеток в области «ишемической полутени» приводит к увеличению размеров инфаркта. Однако эти клетки в течение определенного времени могут сохранять свою жизнеспособность, поэтому развитие необратимых изменений в них можно предотвратить при восстановлении кровотока.
Отек головного мозга возникает через несколько минут после развития локальной ишемии вследствие повреждения клеточной мембраны и накопления воды в клетке (цитотоксический отек) и нарастает спустя несколько дней из-за повреждения гематоэнцефалического барьера и попадания плазмы во внеклеточное пространство мозга (вазогенный отек). Выраженность отека мозга находится в прямой зависимости от размеров инфаркта мозга, поэтому он максимален при обширном атеротромботическом или кардиоэмболическом инсульте и практически отсутствует при лакунарном инсульте. Отек мозга вызывает повышение внутричерепного давления, что может привести к геморрагической трансформации инфаркта и дислокации ствола мозга. Смещение промежуточного и среднего мозга в рострокаудальном направлении и их сдавление в намете мозжечка представляет наиболее частую причину смерти в первую неделю обширного ишемического полушарного инсульта.
Если летального исхода не наступает, отек мозга достигает максимума на 2-4 день заболевания, а затем постепенно спадает на протяжении 1-2 нед., некротическая ткань мозга подвергается разжижению или резорбции. В дальнейшем на месте инфаркта формируется соединительная ткань (глио-мезодермальный рубец), при этом может образоваться кистообразная полость.
Клиническая картина ишемического инсульта. Ишемический инсульт обычно развивается в течение нескольких секунд или минут (реже на протяжении часов или дней) и проявляется двигательными, чувствительными, речевыми и другими очаговыми неврологическими нарушениями. Расстройства сознания, рвоты, интенсивной головной боли в большинстве случаев не наблюдается, за исключением ин-
Тема 1. Острое нарушение мозгового кровообращения фарктов в стволе мозга, мозжечке или обширных полушарных инфарктов.
Прогрессирующее течение инсульта (постепенное или ступенеобразное нарастание неврологических нарушений в течение нескольких часов или дней) наблюдается у 20 % больных ишемическим инсультом в каротидном бассейне и у 40 % больных ишемическим инсультом в вертебробазилярном бассейне.
Инсульт в каротидной системе встречается в 5—6 раз Чаще, чем в вертебробазилярном бассейне. Синдром тотального поражения в каротидном бассейне состоит из контралатеральной гемиплегии, гемианестезии, гемианопсии и афазии при поражении доминантного полушария или анозогнозии, нарушений схемы тела при поражении субдоминантного полушария. Развитие этого синдрома обычно вызвано закупоркой основного ствола средней мозговой артерии, что приводит к обширному поражению лобной, теменной и височных долей полушария головного мозга. Синдромы частичного поражения в каротидной системе проявляются геми- или монопарезом конечностей, парезом мышц лица и языка по центральному типу, геми- или моногипестезией конечностей, верхнеквадрантной гемианопсией, расстройством высших психических функций и другими нарушениями. Они вызваны закупоркой ветвей средней мозговой артерии, передней мозговой или внутренней сонной артерии либо их сужением, что приводит к более ограниченному инфаркту в полушарии головного мозга,
Сочетание слепоты на один глаз и симптомов ишемии полушарий мозга на той же стороне (например, гемипарез на противоположной стороне) — окулопирамидный синдром — патогномоничен для грубого стеноза или закупорки внутренней сонной артерии.
Инфаркт при закупорке передней мозговой артерии проявляется контралатеральным гемипарезом с преобладанием в проксимальном отделе руки и дистальном отделе ноги или монопарезом ноги, при этом могут наблюдаться легкие чувствительные нарушения в паретичных конечностях, задержка или недержание мочи.
Инфаркт в бассейне средней мозговой артерии возникает значительно чаще, чем в передней мозговой артерии. Закупорка основного ствола средней мозговой артерии вызывает синдром тотального поражения в каротидной системе, который нередко приводит к смерти больного. Инфаркт в бассейне корковых ветвей средней мозговой артерии проявляется центральным параличом лица и языка на противоположной стороне, а при поражении доминантного полушария — моторной афазией (закупорка прероландовой артерии), брахи-офациальным гемипарезом (закупорка роландовой артерии), сенсорной афазией и другими нарушениями.
Инсульт в вертебробазилярной системе может проявляться гомонимной гемианопсией, глазодвигательными нарушениями, двусторонними нарушениями движений или чувствительности в конечностях, мозжечковой атаксией и нистагмом, классическим альтернирующим синдромом — поражение одного или нескольких черепных нервов с одной стороны в сочетании с двигательными и/или чувствительными нарушениями в конечностях с другой. При поражении зрительного бугра, височной и затылочной доли мозга возможны нарушения высших мозговых функций.
Закупорка позвоночной артерии (или задней нижней мозжечковой артерии) может привести и к обширному инфаркту дорсолатерального отдела продолговатого мозга и нижней поверхности полушария мозжечка. Такой инфаркт проявляется синдромом Валленберга—Захарченко, который в классическом варианте включает головокружение, тошноту, рвоту, на стороне очага — болевую и температурную гипестезию лица, мозжечковую атаксию, синдром Горнера, паралич глотки, гортани и неба, приводящих к дисфагии, дисфонии, дизартрии, на противоположной стороне — болевую и температурную гипестезию конечностей и туловища. Однако чаще наблюдаются варианты синдрома с отсутствием или незначительным поражением продолговатого мозга, которые проявляются преимущественно головокружением, нистагмом и мозжечковой атаксией.
Закупорка основной артерии может привести к значительному поражению среднего мозга и моста — развиваются
глазодвигательные нарушения, тетраплегия, расстройство сознания, нарушение витальных функций, что в большинстве случаев вызывает быстрый летальный исход. Различные синдромы могут возникать при закупорке ветвей основной артерии, кровоснабжающих мост и средний мозг: периферический парез мимических мышц на стороне очага, гемиплегия на противоположной стороне (синдром Мийяра—Гю-блера), периферический парез мимических мышц и наружной прямой мышцы глаза на стороне очага, гемиплегия на противоположной стороне (синдром Фовилля), на стороне очага паралич глазодвигательного нерва, на противоположной стороне гемиплегия (синдром Вебера) или гемиатаксия и атетоидные движения в конечностях (синдром Бенедикта), паралич взора вверх, нарушение конвергенции и частичный двусторонний птоз век (синдром Парино) и др.
Закупорка задней мозговой артерии обычно проявляется контралатеральной гомонимной гемианопсией. Двусторонние поражения могут приводить к корковой слепоте.
Изложенные синдромы возможны при атеротромбо-тическом и кардиоэмболическом подтипах ишемического инсульта. Атеротромботический инсульт часто развивается ночью или утром, неврологические нарушения могут постепенно или ступенеобразно нарастать в течение нескольких часов или даже дней. В анамнезе больных чаще, чем при других типах инсульта, отмечаются ТИА или ишемические инсульты в одном и том же сосудистом бассейне. Для эмболического инсульта характерно внезапное развитие симптоматики нередко на фоне физического или эмоционального напряжения, кардиальной аритмии. Неврологические нарушения обычно максимальны сразу после развития инсульта, реже они нарастают в течение времени.
Лакунарный инсульт наиболее часто возникает одномоментно, реже проявляется постепенным нарастанием неврологических нарушений. Расстройства сознания, эпилептические припадки, нарушения высших психических функций и полей зрения не бывают при лакунарном инсульте. Наиболее часто при лакунарном инсульте возникают следующие синдромы: парез руки, ноги, лица и языка по центральному типу
с одной стороны («чисто двигательный инсульт»), сочетание умеренного или легкого центрального гемипареза и геми-гипестезии («сенсомоторный инсульт»), ощущение онемения и/или расстройство чувствительности (чаще болевой и температурной) по гемитипу («чисто сенсорный инсульт»), сочетание легкой слабости и неловкости руки и дизартрии («дизартрия и неловкая рука»), центральный гемипарез в сочетании с атаксией в паретичных конечностях («атактический гемипарез»).
Диагностика ишемического инсульта основывается на остром развитии очаговых неврологических нарушений, характерных для поражения одного из сосудистых бассейнов мозга (нейроваскулярный синдром), и наличии факторов риска его развития (возраст старше 50 лет, ТИА или ишемический инсульт в анамнезе, артериальная гипертония, сахарный диабет, курение сигарет, заболевания сердца) и требует подтверждения методами рентгеновской компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) головы. Без применения КТ или МРТ головы ошибка в дифференциальной диагностике ишемического и геморрагического инсульта даже в случаях типичной клинической картины составляет 5-10%.
Если нет возможности выполнить КТ или МРТ головы, то проводят люмбальную пункцию и эхоэнцефалоскопию. При ишемическом инсульте цереброспинальная жидкость обычно прозрачная с нормальным содержанием белка и клеточных элементов, хотя в некоторых случаях определяется небольшое увеличение лимфоцитов и белка. Эхоэнцефалоскопия у больных ишемическим инсультом в первые часы в большинстве случаев не выявляет смещения срединных структур головного мозга.
Для выяснения причины ишемического инсульта используются ультразвуковые методы исследования сосудов, среди которых наиболее информативны дуплексное и триплексное (цветное дуплексное) сканирование прецеребральных артерий головы (в последние годы и церебральных артерий) и транскраниальная допплерография церебральных артерий. Дуплексное сканирование позволяет обнаружить не только
закупорку, но даже небольшой стеноз артерий. Транскраниальная допплерография может выявить гемодинамически значимый стеноз или окклюзию церебральной артерии.
Для выявления патологии прецеребральных и церебральных артерий наиболее информативна церебральная ангиография. Она позволяет обнаружить стеноз, окклюзию, изъязвление, аневризму и другие патологические изменения в артериях, однако риск осложнений при ее проведении достигает 4 %. Поэтому ангиография проводится только в тех случаях, когда планируется хирургическое лечение либо у больных молодого возраста в случаях неясной причины ишемического инсульта. В последние годы все большее развитие для диагностики поражения прецеребральных и церебральных артерий получают магнитно-резонансная ангиография и спиральная компьютерная ангиография.
У всех больных ишемическим инсультом записывают ЭКГ, позволяющую выявить нарушения ритма, ишемию и другие изменения миокарда. Холтеровское мониторирование ЭКГ используется в тех случаях, когда предполагается эмболический генез инсульта вследствие пароксизмального нарушения сердечного ритма. ЭхоКГ (трансторакальная или чреспищеводная) проводится при подозрении на поражение клапанного аппарата сердца, кардиомиопатию, внутрисердечный тромб или опухоль, аневризму желудочков.
В план обследования больного инсультом входят: клинический анализ крови с определением числа тромбоцитов (выявление эритремии, тромбоцитемии, тромбоцитопенической пурпуры, серповидноклеточной анемии, лейкоза); анализ крови на ВИЧ и реакция Вассермана; биохимический анализ крови; анализ мочи клинический; при необходимости рентгенография грудной клетки с целью диагностики заболеваний легких (пневмония, туберкулез, опухоли и др.).
Кардиоэмболический подтип инсульта устанавливается при выявлении кардиального источника эмболии и отсутствии данных за другой тип ишемического инсульта. Ате-ротромботический подтип инсульта диагностируется при выявлении окклюзии или значительного (более 50% диаметра) атеросклеротического сужения прецеребральной и
церебральной артерии и отсутствии данных за другой тип ишемического инсульта. Лакунарный инсульт диагностируется на основании характерного неврологического синдрома («чисто двигательный инсульт», «сенсомоторный инсульт», «чисто чувствительный инсульт», «атактический гемипарез», «дизартрия и неловкая кисть») и данных КТ или МРТ о наличии небольшого (до 15 мм в диаметре) инфаркта.
Дифференциальную диагностику ишемического инсульта проводят с другими заболеваниями, проявляющимися быстрым развитием очаговых и/или общемозговых неврологических нарушений. Результаты КТ или МРТ головы позволяют исключить многие заболевания (опухоль, внутримозговое кровоизлияние, черепно-мозговая травма, энцефалит и другие), которые иногда клинически неотличимы от ишемического инсульта.
Течение и исход ишемического инсульта определяется локализацией и объемом инфаркта, выраженностью отека мозга, а также наличием сопутствующих заболеваний и/или развитием осложнений в течении инсульта (пневмония, пролежни, уросепсис и др.). В первые 30 дней умирает около 15-25% больных. Летальность выше при атеротромботиче-ском и кардиоэмболическом инсультах и составляет всего 2 % при лакунарном инсульте. Причина смерти в половине случаев — отек мозга и сдавление его ствола, в остальных случаях — пневмония, сердечные заболевания, эмболия легочной артерии, почечная недостаточность или септицемия. Значительная часть (40%) летальных исходов возникает в первые 2 суток с момента заболевания. Из оставшихся в живых около 60-70% больных имеют инвалидизирующие неврологические расстройства к концу месяца. Чем более значителен неврологический дефицит к концу первого месяца заболевания, тем менее вероятно полное восстановление. Спустя год с момента инсульта дальнейшее восстановление неврологических функций мало вероятно, хотя улучшение речи у больных афазией может продолжаться в течение нескольких лет после инсульта. У больных лакунарным инсультом отмечается лучшее восстановление, чем при других типах ишемического инсульта.
Лечение. При ишемическом инсульте проводятся как общие терапевтические мероприятия (базисная терапия), применяемые при других инсультах, так и специфическая (дифференцированная) терапия.
Общие терапевтические мероприятия (базисная терапия). Большое значение имеют общие мероприятия: коррекция нарушенных витальных функций сердечно-сосудистой и дыхательной систем, профилактика и лечение возможных соматических осложнений — эмболии легочной артерии, тромбоза вен нижних конечностей, пневмонии, пролежней, нарушения функции тазовых органов, кардиальных и др.
. В первые сутки гипотензивные препараты назначают только при очень высоком артериальном давлении (систолическое артериальное давление 200 мм рт. ст. и выше, диастолическое артериальное давление 120 мм рт. ст. и выше), что обусловлено риском значительного падения артериального давления и вследствие этого усиления ишемии головного мозга. В дальнейшем рекомендуется постепенное и умеренное снижение артериального давления до уровня, немного превышающего (на 10-20 мм рт. ст.) обычные значения артериального давления у больного или до 160— 170/95—100 мм рт. ст. в случае впервые выявленной артериальной гипертонии. Спустя 7-10 дней с момента инсульта риск осложнений от гипотензивной терапии уменьшается, и рекомендуется длительная гипотензивная терапия для профилактики инсульта и других сердечно-сосудистых заболеваний.
Лечение отека мозга и повышенного внутричерепного давления показано больным ишемическим инсультом при прогрессировании неврологических нарушений, обусловленном нарастающим отеком мозга, и развитии нарушений сознания, дыхания. В этих случаях рекомендуется поднять головной конец кровати, ограничить введение жидкости, использовать глицерол (внутрь 10%-й раствор в дозе 0,25-1 г/кг каждые 4-6 ч или в/в капельно 10 % на физиологическом растворе из расчета 1-2 мл/кг за 2 ч) или маннитол (в/в 20%-й раствор в первоначальной дозе 1 г/кг, а затем в дозе 0,25-1 г/кг/сут каждые 2-6 ч) либо дексазон (в/в в
первоначальной дозе 10 мг, а затем в дозе 4 мг каждые 6 ч). При неэффективности терапии возможна комбинация этих препаратов с мочегонными средствами (например, 20-80 мг фуросемида в/в каждые 4-12 ч) или перевод больного на управляемое дыхание с целью гипервентиляции легких, что снижает внутричерепное давление. Если эти меры не помогают и по данным КТ или МРТ головы отмечаются нарастание отека мозга и дислокация ствола, то возможно хирургическое лечение с целью декомпрессии мозга и спасения жизни больного.
При проведении интенсивной терапии необходимо обеспечить нормальный водно-электролитный обмен, что требует контроля влажности кожных покровов и языка, тургора кожи, гематокрита и электролитов в сыворотке крови, а при нарушениях — корригирующей терапии. Ограничение жидкости или нерациональное использование диуретиков приводит к дегидратации, способствующей повышению гематокрита, свертываемости крови и снижению ее текучести. Избыточное введение жидкости при инфузионной терапии может увеличить отек головного мозга, вызвать сердечную недостаточность.
Больные в коматозном состоянии требуют адекватного питания, контроля функций тазовых органов, ухода за кожей, глазами и ротовой полостью. Желательно использовать кровать с гидромассажным матрасом и боковыми бортиками, предупреждающими падение больного. При невозможности самостоятельного глотания осуществляется зондовое питание. Для профилактики повреждений кожи и пролежней необходимо периодически поворачивать больного, проводить ежедневную гигиеническую обработку кожи, обеспечить сухость кожных покровов, своевременно менять постельное белье, расправлять его складки и предупрждать недержание мочи и кала.
С целью предупреждения тромбозов глубоких вен конечностей рекомендуют бинтование ног эластичным бинтом или применение специальных (пневматических компрессионных) чулок, подъем ног на 6-10°, пассивную гимнастику, возможно профилактическое применение малых доз
(5 тыс. ЕД 2 раза в день) гепарина. Для профилактики пневмонии рекомендуются дыхательные упражнения (глубокое дыхание) и ранняя активизация больного.
Длительность постельного режима определяется общим состоянием больного, стабильностью неврологических нарушений и жизненно важных функций. В случаях удовлетворительного общего состояния, при непрогрессирующих -неврологических нарушениях и стабильной гемодинамике он может ограничиваться 3-5 днями, в остальных случаях не должен превышать 2-х нед. при отсутствии соматических противопоказаний. При активизации больного необходимо постепенно увеличивать физические нагрузки.
45 Большое значение имеют лечебная гимнастика (при наличии двигательных расстройств) и логопедические занятия (у больных с речевыми нарушениями). Ранняя активизация больного целесообразна не только для улучшения двигательных функций конечностей, но и для предупреждения тромбоза глубоких вен.
Специфическая (дифференцированная) терапия. При поступлении больного в стационар в срок до 3-6 ч с момента заболевания и подтверждении ишемического характера инсульта (исключения кровоизлияния в мозг) при КТ или МРТ головы обсуждается вопрос о тромболитической терапии с целью лизиса тромба или эмбола и восстановления кровотока в ишемизированной ткани мозга. Для тромболитической терапии чаще используют тканевый активатор плазминогена (актилизе) в/в в дозе 0,9 мг/кг однократно (10%-й раствор препарата струйно, а остальная часть — капельно в течение часа). Возможно также в/a введение препарата при ангиографии (локальный тромболизис). Лучшие результаты лечения отмечаются при тромболитической терапии в первые 3 ч заболевания. К сожалению, тромболитическая терапия используется редко в связи с поздней госпитализацией больных в стационар, недостаточной оснащенностью неврологических отделений.
Для предупреждения дальнейшего тромбообразования в случае ишемического инсульта и повторной эмболии церебральных артерий используются прямые антикоагулян
ты — гепарин или низкомолекулярные гепарины (например, фраксипарин). Они снижают также риск тромбоза глубоких вен голени и эмболии легочной артерии. Лечение антикоагулянтами целесообразно при кардиоэмболическом инсульте и нарастании неврологических нарушений (инсульт в ходу) при атеротромботическом инсульте. Гепарин вводят под кожу живота по 5 тыс. ЕД каждые 4-6 ч в течение 7-14 дней под контролем свертываемости крови (увеличение активированного тромбопластинового времени в 2-3 раза в сравнении с первоначальным). В условиях отделения интенсивной терапии можно ввести гепарин в/в первоначально в дозе 5 тыс. ЕД, а затем по 1 тыс. ЕД/ч в/в капельно, корректируя дозу в зависимости от показателей свертываемости крови. Фраксипарин используют в дозе 0,5-1 мл под кожу живота 2 раза в сутки. В тех случаях, когда планируется длительная антикоагулянтная терапия, в последние 2 дня применения гепарина назначают непрямые антикоагулянты (варфарин).
С целью предупредить тромбообразование и эмболию церебральных артерий широко используются антиагреган-ты, которые назначают в сочетании с антикоагулянтами или изолированно: ацетилсалициловая кислота (аспирин) по 100-300 мг/сут или тиклопидин (тикло) по 250 мг 2 раза в день либо клопидогрель (плавике) по 75 мг/сут. Их применение уменьшает также вероятность тромбоза глубоких вен голени и эмболии легочной артерии.
Для уменьшения поражения мозга и обратного развития возникших в нем изменений используются различные нейропротекторные средства, но их эффективность еще не доказана полностью. Аплегин (карнитина хлорид) вводят по 500-1000 мг на 250-500 мл физиологического раствора в/в капельно на протяжении 7-10 дней, глиатилин по 0,5-1 г в/в или в/м 3-4 раза в сутки в течение 3-5 дней, а затем внутрь по 0,4—1,2 г 2 раза в сутки. Глицин используется сублингвально в суточной дозе 1-2 г в первые 5 дней инсульта, пирацетам (ноотропил) в дозе 4-12 г/сут в/в капельно в течение 10-15 дней, затем (или с начала лечения) внутрь по 3,6-4,8 г/сут. Семаке применяется эндоназально в дозе 12-24 мг (по 2-4 капли раствора) в течение 5 дней. Цере-
Тема 1. Острое нарушение мозгового кровообращения бролизин рекомендуется в больших дозах (20-50 мл/сут), вводимых в один или два приема на 100-200 мл физиологического раствора в/в капельно (в течение 60-90 мин) на протяжении 10-15 дней.
Применение вазоактивных препаратов направлено на увеличение кровоснабжения в ишемизированной ткани, хотя их эффективность также не доказана. Нимодипин (ни-мотоп) вводят в дозе 4-10 мг в/в капельно через инфузомат медленно (со скоростью 1-2 мг/ч) 2 раза в сутки в течение 7-10 дней, после этого (или с начала лечения) назначают внутрь по 30-60 мг 3-4 раза в сутки. Винпоцетин (кавинтон) применяется по 10-20 мг/сут в/в капельно (в течение 90 мин) на 500 мл физиологического раствора в течение недели, затем (или с начала лечения) внутрь по 5 мг 3 раза в день. Ницерголин (сермион) используется по 4-8 мг в/в капельно на 100 мл физиологического раствора 2 раза в день в течение 4-6 дней, затем (или с начала лечения) внутрь по 5 мг 3-4 раза в день. Циннаризин (стугерон) назначают внутрь по 25-75 мг 3-4 раза в сутки. Инстенон применяется по 2-4 мл в/в капельно (в течение 3 ч) на протяжении 3-5 сут.
С целью улучшения реологических характеристик крови для гемодилюции могут быть использованы реополиглюкин или реомакродекс по 200-400 мл в/в капельно 1-2 раза в день в течение 5-7 дней, пентоксифиллин (вазонит, трентал) по 200 мг в/в капельно 2 раза в сутки в течение 5-7 дней, а затем (или с начала лечения) внутрь по 600-1200 мг в сутки. Эффективность этой терапии дискутабельна.
При инфаркте мозжечка с выраженным стволовым синдромом и обструктивной гидроцефалией, выявляемой при КТ или МРТ головы, нейрохирургически накладывают наружный дренаж или вентрикулярный шунт.
Транзиторная ишемическая атака (ТИА). Клинические симптомы заболевания обычно возникают внезапно и достигают максимальной степени в течение нескольких секунд или 1-2 мин, они обычно сохраняются на протяжении 10-15 мин, значительно реже — нескольких часов (до суток). Очаговые симптомы поражения головного мозга разнообразны и
определяются локализацией ишемии мозга в каротидном или вертебробазилярном бассейне, общемозговые симптомы наблюдаются редко. Клиническая картина в дебюте ТИА соответствует ишемическому инсульту. Часто ТИА проявляется легкими неврологическими нарушениями (онемение лица и руки, легкий гемипарез или монопарез руки), хотя возможны и выраженные расстройства (гемиплегия, тотальная афазия). Нередко наблюдается кратковременное снижение зрения на один глаз («amavrosis fugas»), что обусловлено нарушением кровообращения в глазничной артерии.
ТИА могут часто повторяться или возникают всего один-два раза. Почти у 30-40% больных, перенесших ТИА, в течение последующих 5 лет развивается инсульт. Более 20% этих инсультов происходит в течение первого месяца, а почти половина — в период первого года после ТИА.
Диагноз ТИА чаще всего устанавливается лишь ретроспективно на основании анамнеза: развитие преходящих симптомов очагового поражения головного мозга у больного, имеющего факторы риска ишемического ОНМК. Дифференциальную диагностику проводят с заболеваниями, проявляющимися преходящими неврологическими нарушениями: мигренью, парциальным эпилептическим припадком, болезнью Меньера и др.
Пациенты, перенесшие ТИА, требуют обследования для выяснения причины преходящей ишемии мозга с целью предупредить ишемический инсульт и другие заболевания сердечно-сосудистой системы. В план обследования входят ангиологическое исследование (пальпация и аускультация сосудов шеи и конечностей, измерение артериального давления на обеих руках), общий и биохимический анализ крови с определением холестерина и его фракций, исследование гемостаза, ЭКГ, неинвазивные ультразвуковые методы исследования прецеребральных и церебральных артерий (предпочтительнее дуплексное сканирование прецеребральных артерий и транскраниальная допплерография церебральных), магнитно-резонансная ангиография. При подозрении на кардиоэмболический генез транзиторной ишемической атаки показана консультация кардиолога и более углублен-
нйе исследование состояния и функции сердца (ЭхоКГ, холтеровское мониторирование). В тех случаях, когда выявляется гемодинамически значимый стеноз внутренней сонной артерии (75 % диаметра и более), необходимо рассматривать показания к хирургическому лечению — эндартерэктомии, стентированию.
КТ или МРТ головы желательна во всех случаях перенесенной ТИА, но она необходима в диагностически неясных случаях для исключения других возможных причин преходящих неврологических нарушений (опухоль мозга, небольшое внутримозговое кровоизлияние, травматическая субдуральная гематома и др.). У большинства пациентов с ТИА в анамнезе КТ и МРТ головы не выявляет очаговых изменений, однако в 10-25% случаев (чаще в тех случаях, когда неврологические нарушения сохранялись на протяжении нескольких часов) выявляется изменения, характерные для инфаркта мозга, что указывает на определенную условность термина ТИА.
В большинстве случаев ТИА лечение не проводится вследствие кратковременного характера неврологических нарушений и обращения к врачу после их регресса. В случаях длительного эпизода неврологических нарушений, при повторяющихся ТИА осуществляется лечение как при ишемическом инсульте.
Профилактика ишемического инсульта направлена на коррекцию факторов его риска. К наиболее значимым корригируемым факторам относят артериальную гипертонию, заболевания сердца, курение сигарет, злоупотребление алкоголем, сахарный диабет, атеросклеротический стеноз сонных артерий.
Артериальная гипертония — наиболее важный корригируемый фактор риска инсульта. Повышение диастолического АД всего на 7,5 мм рт. ст. сопровождается увеличением риска инсульта в 2 раза. Снижение диастолического АД на 8-10 мм рт. ст. в условиях длительной гипотензивной терапии уменьшает на 30-55 % частоту инсульта. Больным артериальной гипертонией рекомендуется достигать идеальной Массы тела и поддерживать ее, что в большинстве случаев
требует снижения общей калорийности пищи и при отсутствии противопоказаний регулярных физических нагрузок.
Отказ от курения сопровождается постепенным существенным снижением риска инсульта, и после 5 лет воздержания от курения риск инсульта у бывшего курильщика мало отличается от такового у никогда не курившего человека.
Для профилактики повторного инсульта больным, перенесшим ТИА или ишемический инсульт, рекомендуется в течение 2-3-х лет или постоянно прием ангиагрегантов: ацетилсалициловой кислоты (аспирин) по 100-300 мг/сут, дипиридамола (курантил) по 400 мг/сут в комбинации с 50 мг аспирина, тиклопидина (тикло) по 500 мг/сут или клопи-дрогеля (плавике) по 75 мг/сут.
У больных с мерцательной аритмией и другой патологией, опасной повторением кардиоэмболического инсульта, при отсутствии противопоказаний более эффективно использовать непрямые антикоагулянты (варфарин по 2,5-10 мг/сут), чем антиагреганты, однако это требует регулярного контроля протромбина (повышение международного нормализующего отношения — МНО — до 2-4 или снижение протромбинового индекса до 50-60%).
Для устранения выраженного стеноза (сужение 70-99 % диаметра) внутренней сонной артерии у больных, перенесших транзиторную ишемическую атаку или малый инсульт, рекомендуется хирургическое лечение — каротидная эндартерэктомия. При решении вопроса о хирургическом лечении следует учитывать не только степень стеноза сонной артерии, но и распространенность атеросклеротического поражения прецеребральных и церебральных артерий, выраженность патологии коронарных артерий, наличие сопутствующих соматических заболеваний.
Большое значение в профилактике инсульта и других сердечно-сосудистых заболеваний имеет диета с низшим содержанием жира (уменьшение потребления жира до 30 % от общей калорийности пищи и холестерина до 300 мг в сутки). В последние годы показана эффективность статинов (симвастатина, правастатина и др.) в профилактике инсульта и инфаркта миокарда.
Кровоизлияние в мозг
Этиология и патогенез. Нетравматическое кровоизлияние в мозг наиболее часто (60% случаев) возникает как осложнение артериальной гипертонии. Развитие дегенеративных изменений (липогиалиноз, фибриноидный некроз) в небольших перфорирующих артериях мозга и образование микроаневризм на фоне артериальной гипертонии рассматриваются как наиболее важные предпосылки гипертонического внутримозгового кровоизлияния. Кровоизлияние возникает вследствие разрыва измененной перфорирующей артерии (в большинстве случаев лентикулостриарной или короково-медуллярных артерий) или микроаневризмы либо геморрагического пропитывания. При разрыве артерии или микроаневризмы кровотечение продолжается от нескольких минут до часов, пока в месте разрыва не образуется тромб. Гипертензивное внутримозговое кровоизлияние локализуется преимущественно в бассейнах перфорирующих артерий мозга— в области базальных ганглиев (50%), зрительного бугра (15%), белого вещества полушарий (15 %), моста мозга (10%) и мозжечка (10%).
Другими причинами кровоизлияния в мозг являются разрыв артериовенозной мальформации, мешотчатой аневризмы или другой сосудистой мальформации. В пожилом возрасте нередкая причина кровоизлияния в мозг — амилоидная ангиопатия, возникающая вследствие отложения амилоидного белка в среднем слое и адвентиции мелких корковых артерий и артериол. Внутримозговым кровоизлиянием может осложниться терапия антикоагулянтами и тромболитиками (при остром инфаркте миокарда или ишемическом инсульте). Кровоизлияние в мозг может быть вызвано тромбоцитопенией, гемофилией, лейкозом, геморрагическим диатезом, артериитом, расслоением артерии, тромбозом внутричерепных вен. При алкоголизме, приводящем к нарушению функции печени и гипокоагуляции, возможны массивные внутримозговые кровоизлияния. Прием кокаина, амфетамина или метамфетамина может привести к кровоизлиянию в мозг.
Морфологически различают кровоизлияния по типу гематомы и геморрагического пропитывания. Гематома хорошо отграничена от окружающих тканей и представляет полость, заполненную жидкой кровью и ее «устками. Выделяют гематомы латеральные (снаружи внутренней капсулы), медиальные (кнутри от внутренней капсулы), смешанные (занимающие всю область базальных ганглиев и внутренней капсулы), а также лобарные (долевые). Кровоизлияние типа геморрагического пропитывания бывает вызвано диапедезным кровоизлиянием из мелких артерий, вен и сосудов микроцирку-ляторного русла. Оно формируется за счет множественных мелких сливающихся или рядом расположенных кровоизлияний, имеет неровные контуры без четких границ.
Кровоизлияние приводит к гибели нервной ткани в месте гематомы. Поражение вещества мозга также происходит вследствие его сдавления гематомой и резкого повышения внутричерепного давления. Кровоизлияние в большинстве случаев приводит к прорыву крови в субарахноидальное пространство (паренхиматозно-субарахноидальное кровоизлияние), а у части больных и/или в желудочки мозга (паренхиматозно-вентрикулярное кровоизлияние). При кровоизлиянии обычно развивается и ишемия мозга из-за механического сдавления и некоторой вазоконстрикции, вызванной излитием крови в субарахноидальное пространство и вещество мозга. Выраженность этих изменений (ишемии мозга, отека и повышения внутричерепного давления) находится в прямой зависимости от размера образовавшейся гематомы. При большом количестве излившейся крови возникает смещение структур мозга и сдавление его ствола (среднего мозга в намете мозжечка в большинстве случаев), что обычно приводит к летальному исходу. Если этого не происходит, через 1-2 нед. отек и ишемия мозга постепенно уменьшаются, излившаяся кровь образует фибриновый «усток, превращающийся затем в жидкую массу, которая постепенно подвергается резорбции. С течением времени на месте гематомы образуется киста.
Клиническая картина. Для кровоизлияния в мозг характерно быстрое (одномоментное или в течение минут, редко
часов) развитие неврологической симптоматики. Кровоизлияние чаще возникает в период бодрствования, нередко на фоне физического или эмоционального напряжения. Общемозговые симптомы во многих случаях преобладают над очаговыми или сходны с ними по тяжести. Внезапная головная боль, рвота, гиперемия лица, психомоторное возбуждение, нарушение сознания с одновременным появлением очаговых симптомов — типичная картина обширного кровоизлияния в полушарие или ствол мозга. В 10% случаев развиваются генерализованные эпилептические припадки. Сразу или через несколько часов выявляются менингеальные симптомы. Как и при ишемическом инсульте, у большинства больных отмечается повышение артериального давления. Наиболее частый очаговый симптом кровоизлияния — центральный гемипарез, который может сопровождаться разнообразными изменениями мышечного тонуса — понижением или повышением, нередко пароксизмальным повышением с гормето-ническими судорогами. При массивных полушарных гематомах нередко происходит смещение медиальных отделов височной доли в вырезку мозжечкового намета со сдавлением среднего мозга, ранний признак которого — расширение зрачка на стороне пораженного полушария. Исключение составляют небольшие по размерам гематомы или ограниченные диапедезные кровоизлияния, которые проявляются только очаговыми неврологическими симптомами и по течению напоминают ишемический инсульт.
Кровоизлияние в базальные ганглии и внутреннюю капсулу обычно проявляется контралатеральной гемиплегией, гемианестезией, парезом мимических мышц и языка ио центральному типу, гомонимной гемианопсией, афазией (при поражении доминантного полушария) или анозогно-зией (при поражении субдоминантного полушария). При небольших размерах гематомы неврологические нарушения могут быть менее выражены (например, умеренный гемипарез и гемигипестезия) и не сопровождаться выраженными общемозговыми симптомами.
При кровоизлиянии в зрительный бугор возникают контралатеральная гемианестезия и гемиатаксия (при пора
жении переднебоковых отделов), гемианопсия (при поражении заднебоковых отделов), иногда преходящий гемипарез (вследствие поражения внутренней капсулы) и глазодвигательные расстройства (миоз, парез взора вверх или сходящееся косоглазие). Возможны пространственная дезориентация, амнезия, сонливость, апатия и речевые нарушения (при поражении доминантного полушария). Через несколько дней или недель после инсульта могут развиться гиперпатия, дизестезия и спонтанная боль на стороне, противоположной кровоизлиянию (центральная постинсультная боль).
Кровоизлияние в мозжечок обычно сопровождается головокружением, тошнотой и повторной рвотой при сохранении сознания. Больных часто беспокоит головная боль в затылочной области, они не могут стоять или ходить, у них обычно выявляются нистагм и атаксия в конечностях. В дальнейшем возможно сдавление ствола мозга с развитием геми- или тетрапареза, расстройством глотания и фонации, поражением лицевого и отводящего нервов, нарушением сознания.
При кровоизлиянии в мост мозга может развиться кома или (при ограниченном поражении) контралатеральный гемипарез и гомолатеральный парез мимических мышц и отводящего нерва (или межъядерная офтальмоплегия). Для кровоизлияния в средний мозг характерны двусторонние глазодвигательные расстройства, а при поражении ножки мозга — гомолатеральный паралич глазодвигательного нерва и контралатеральная гемиплегия (синдром Вебера) или гемиатаксия (синдром Бенедикта); при прогрессировании кровоизлияния нарушается сознание и возникает тетрапле-гия. В случаях кровоизлияния в ствол мозга часто наблюдаются тахипноэ и нарушения ритма дыхания, гипертермия, гипергидроз, децеребрационная ригидность.
При кровоизлиянии в белое вещество полушарий мозга (лобарная гематома) неврологические нарушения менее выражены, менингеальные симптомы часто отсутствуют в начале заболевания, сознание сохранено примерно у 50% больных, головная боль нередко бывает локальной и соответствует месту образовавшейся гематомы. Кровоизлияние в
лобную долю обычно проявляется контралатеральным парезом руки, лица и языка по центральному типу, возможна моторная афазия (при поражении доминантного полушария). Кровоизлияние в теменную долю сопровождается контралатеральной гемигипестезией, в затылочную долю — контралатеральной гомонимной гемианопсией, в височную долю доминантного полушария — сенсорной афазией. ( V
Диагноз кровоизлияния в мозг основывается на остром развитии общемозговых, очаговых неврологических нарушений, менингеальных симптомов и наличии факторов риска внутримозгового кровоизлияния. Длительно существующая артериальная гипертония позволяет предположить гипертензивное кровоизлияние.
Ведущий метод дополнительного обследования в острейшем периоде — КТ головы, позволяющая определить локализацию и размер гематомы, смещение структур мозга, гидроцефалию и прорыв крови в желудочки, а также исключить другие заболевания (например, инфаркт мозга или опухоль).
• Если нет возможности выполнить КТ или МРТ головы, то проводят люмбальную пункцию и эхоэнцефалоскопию. При массивном кровоизлиянии примесь крови в цереброспинальной жидкости обнаруживается уже через несколько часов с момента заболевания. При ограниченных лобарных гематомах примесь крови в ликворе иногда отмечается только спустя 2-3 сут с момента кровоизлияния в мозг. В случаях локализации гематомы в полушарии мозга при эхоэнцефалоскопии обычно выявляется смещение срединных структур в сторону непораженного полушария.
В тех случаях, когда у молодых больных не обнаружено факторов риска кровоизлияния и КТ, МРТ, магнитно-резонансная ангиография не выявляют его причину (или нет возможности провести магнитно-резонансную ангиографию), целесообразна церебральная ангиография для исключения мешотчатой аневризмы, артериовенозной мальформации, опухоли мозга или васкулита. Церебральная ангиография также рекомендуется в случаях планируемого хирургического лечения при внутримозговом кровоизлиянии.
Как и при ишемическом инсульте, проводят клинический и биохимический анализ крови, общий анализ мочи, рентгенографию легких и ЭКГ.
Течение и исход. Смертельный исход в первые 30 дней заболевания развивается у 40-60 % больных как вследствие поражения мозга (большая гематома, отек, сдавление ствола мозга), так и из-за присоединяющихся осложнений (пневмония, инфаркт миокарда, эмболия легочной артерии). Наиболее высока летальность при кровоизлиянии в ствол мозга. Она значительно ниже при небольших кровоизлияниях в мозжечок, хвостатое ядро или при лобарной гематоме.
Из оставшихся в живых большинство больных имеют стойкие неврологические нарушения, однако восстановление обычно лучше, чем при ишемическом инсульте потому, что кровоизлияние оказывает менее разрушительное действие на ткань мозга, чем инфаркт.
Лечение включает общие мероприятия, как и при ишемическом инсульте. Для уменьшения головной боли применяют ненаркотические анальгетики. При повышении артериального давления используют гипотензивные средства, поскольку риск ишемии мозга вследствие его снижения значительно ниже при кровоизлиянии в мозг, чем при ишемическом инсульте. Целесообразно снижение артериального давления до обычных для больного значений или, если они не известны, до уровня 150/90 мм рт. ст.; более значительное снижение может привести к гипоперфузии головного мозга. Лечение отека мозга и повышенного внутричерепного давления проводят так же, как и при ишемическом инсульте. Предполагается, что предпочтительнее использовать манни-тол (0,7-1 г/кг первоначально, а затем 0,25-0,5 r/кг каждые 3—5 ч). При нарушении сознания рекомендуется эндотрахе-альная интубация и гипервентиляция легких с целью уменьшить отек мозга.
Хирургическое лечение (удаление или дренирование гематомы) рекомендуется при больших по объему гематомах (более 40 мл) при кровоизлиянии в мозжечок. При небольших гематомах в мозжечок и ясном сознании больного или в случаях, когда с момента кровоизлияния прошло бо
лее недели, проводится консервативное лечение в условиях отделения интенсивной терапии. При другой локализации внутримозгового кровоизлияния эффективность хирургического лечения дискутабельна, но оно обсуждается во всех случаях латерального расположения полушарной гематомы. При обструктивной гидроцефалии для спасения жизни больного можно использовать наложение наружного дренажа или вентрикулярного шунта.
В случае артериальной аневризмы или сосудистой мальформации возможны раннее (в первые 3 дня заболевания) хирургическое удаление гематомы и клипирование аневризмы. У больных с нарушенным сознанием операция обычно откладывается до улучшения состояния на фоне консервативной терапии.
При кровоизлиянии, вызванном лечением антикоагулянтами, используется протамина сульфат при применении гепарина и введение только свежезамороженной плазмы либо в комбинации с витамином К (25 мг п/к) при применении непрямых антикоагулянтов.
По миновании острого периода, как и при ишемическом инсульте, ведущее значение имеют лечебная гимнастика (при двигательных расстройствах), логопедические занятия (при нарушениях речи), бытовая и социальная реабилитация больного.
Профилактика повторного кровоизлияния у больных е артериальной гипертонией основывается на длительной гипотензивной терапии, обеспечивающей достижение оптимального уровня артериального давления.
Субарахноидальное кровоизлияние
Этиология и патогенез. Спонтанное (нетравматическое) субарахноидальное кровоизлияние (САК) в большинстве (70-85%) случаев бывает вызвано разрывом мешотчатой аневризмы с излитием крови в субарахноидальное пространство головного и спинного мозга. Мешотчатые аневризмы наиболее часто локализуются в артериях виллизиева круга, их образование обусловлено врожденным дефектом сосу-
диетой стенки обычно в месте бифуркации или ветвления артерии. Факторами риска разрыва мешотчатой аневризмы считаются артериальная гипертония, курение и злоупотребление алкоголем.
Значительно реже САК бывает вызвано разрывом артериовенозной мальформации или другой сосудистой мальформации. К редким причинам САК относятся расслоение мозговых артерий, гематологические расстройства (серповидноклеточная анемия, лейкоз, тромбоцитопения, синдром диссеминированного внутрисосудистого свертывания), антикоагулянтная терапия, амилоидная ангиопатия (в пожилом возрасте), церебральный васкулит, употребление кокаина, использование симпатомиметиков. В большинстве (примерно 2/з) случаев неаневризматического САК не удается выявить его причину.
САК может сопровождаться кровоизлиянием в вещество мозга (субарахноидально-паренхиматозное кровоизлияние), окклюзионной или сообщающейся гидроцефалией. Через 3-5 дней в 30 % случаев возникает выраженный спазм церебральных артерий, максимальный на 5—14-й день, сопровождается ишемией мозга и почти у 50 % больных инфарктом мозга. Спазм церебральных артерий обычно регрессирует в течение 2-3 нед. с момента заболевания, но в 20 % случаев выраженный ангиоспазм приводит к смерти больного. В течение 4-6 нед. (особенно часто в первые несколько дней) возможно повторное кровоизлияние, которое более чем у 50 % больных приводит к смертельному исходу.
Клиническая картина. САК обычно развивается внезапно, без каких-либо предвестников. Внезапная интенсивная головная боль — первый и наиболее частый симптом. САК возникает в состоянии бодрствования, нередко на фоне физического или эмоционального напряжения. Вместе с головной болью нередки тошнота и рвота, светобоязнь. Нарушение сознания возникает у 50-60 % больных, и у части из них достигает степени комы. Примерно у 10% больных развиваются эпилептические припадки, чаще в первые сутки заболевания. Через 3-12 ч после начала заболевания у большинства больных выявляется ригидность шейных мышц,
Тема 1. Острое нарушение мозгового кровообращения реже обнаруживаются другие менингеальные симптомы (симптомы Кернига и Брудзинского).
В первые дни у большинства больных отсутствуют очаговые неврологические симптомы. Поражение глазодвигательного нерва может возникать вследствие его сдавления аневризмой задней соединительной артерии или излившейся кровью. Поражение отводящего нерва (часто двустороннее) развивается вследствие повышения внутричерепного давления или его компрессии аневризмой. Возможны умеренное повышение температуры (обычно до 37-38 °C) и артериальная гипертония.
На 2-3-й нед. у части больных возникают очаговые симптомы поражения головного мозга вследствие спазма церебральных артерий. Клиническая картина соответствует ишемическому инсульту в бассейне артерий, где возникает ангиоспазм.
Повторное САК проявляется интенсивной головной болью и в большинстве случаев приводит к коме и/или новым неврологическим нарушениям.
Диагноз. В типичных случаях диагностика не вызывает серьезных затруднений на основании клинических данных — внезапная выраженная головная боль, появление менингеальных симптомов, нарушение сознания. Однако небольшие по объему кровоизлияния могут проявляться лишь умеренной головной болью с поздним (на 2-3-й день заболевания) присоединением менингеальных симптомов, что иногда приводит к ошибкам в диагностике и неправильной тактике ведения больного. Поэтому при подозрении на субарахноидальное кровоизлияние необходима экстренная госпитализация больного и проведение КТ или МРТ головы, а при их недоступности — люмбальная пункция.
При обширном кровоизлиянии КТ головы выявляет кровь в подоболочечном пространстве у большинства (95 %) больных в первые сутки заболевания. В последующие дни вероятность обнаружения крови при КТ головы резко падает, составляя около 50 % к 7-му дню, 20 % — к 9-му дню, и почти отсутствует после 10-го дня с момента заболевания. МРТ головы также выявляет САК в первые сутки у боль
шинства больных, а в последующие дни часто более информативна, чем КТ, в выявлении сгустков излившейся крови (вследствие хорошего определения продуктов распада гемоглобина). Цереброспинальная жидкость более или менее интенсивно окрашена кровью в первые дни. Ксантохромия после центрифугирования цереброспинальной жидкости отмечается уже через 12 ч после САК и остается на протяжении 2-6 нед. Через сутки в цереброспинальной жидкости могут быть макрофаги и увеличение количества лимфоцитов.
Во всех случаях САК, при которых планируется хирургическое лечение, показана церебральная ангиография для выявления возможной аневризмы. В настоящее время это самый информативный метод исследования, который позволяет обнаружить даже небольшие мешотчатые аневризмы и получить представление об индивидуальных анатомических особенностях кровоснабжения мозга.
При ухудшении состояния больного необходимо повторная КТ головы (для исключения повторного субарахноидального или внутримозгового кровоизлияния, инфаркта мозга, его отека, острой гидроцефалии), а также ЭКГ (возможность инфаркта миокарда и аритмии) и биохимический анализ крови (выявление электролитных нарушений).
В план обследования больного с САК, как и при других инсультах, входят клинический анализ крови и мочи, биохимический анализ крови, ЭКГ, рентгенография грудной клетки. В случаях неясного генеза субарахноидального кровоизлияния необходимо тщательное гематологическое исследование.
Летальность при субарахноидальном кровоизлиянии составляет в первые 30 дней 30-50 %. Внезапная смерть (в течение нескольких минут) наступает у 15 % больных до того, как они получат какую-либо медицинскую помощь. В случае комы вероятность летального исхода достигает 80 %. Однако у большинства оставшихся в живых стойкой инвалидизации не бывает.
Лечение. При субарахноидальном кровоизлиянии лечение направлено на предупреждение повторного кровоизлияния, церебрального вазоспазма (с последующей ишемией моз
га), гидроцефалии. Большое значение имеет также профилактика электролитных нарушений (гипонатриемия), аритмии сердца, нейрогенного отека легких и других соматических осложнений. Необходима госпитализация больного в нейрохирургическое отделение, чтобы иметь возможность (при выявлении аневризмы) выполнить хирургическое лечение.
Чтобы предупредить повторное кровоизлияние, необходимо соблюдение постельного режима в течение 4-6 нед., устранение запора (при необходимости прием слабительных средств). Целесообразно приподнять головную часть кровати на 30° для снижения внутричерепного давления. Уменьшают головную боль ненаркотическими анальгетиками (500 мг парацетамола каждые 4-6 ч), при выраженной боли возможно применение кодеина (60 мг в/м или внутрь каждые 3-4 ч).
При мешотчатой аневризме обсуждается раннее (24-48 ч после разрыва аневризмы) хирургическое лечение — клипирование шейки аневризмы и удаление сгустков крови из субарахноидального пространства. Раннее хирургическое лечение сводит к минимуму риск повторного кровоизлияния и снижает вероятность ангиоспазма и ишемии мозга. Оно позволяет также провести профилактику церебральной ишемии после операции у больного путем гиперволемии и артериальной гипертензии без опасности повторного кровоизлияния. Однако операция противопоказана больным в коме и не рекомендуется при выраженных неврологических нарушениях из-за высокой летальности и низкой вероятности восстановления.
При артериовенозной мальформации хирургическое лечение обычно проводят через 1-2 нед. после субарахноидального кровоизлияния. В случаях кавернозной и венозной мальформации или артериовенозной фистулы возможно их хирургическое удаление, если они находятся в доступном для оперативного вмешательства месте. В остальных случаях иногда используется лучевая терапия или эндоваскулярная окклюзия.
Антифибринолитические средства можно использовать до операции или в течение 4-6 нед., если она не проводится. Эпсилон-аминокапроновую кислоту применяют
по 30-36 г/сут в/в или по 3-4,5 г внутрь каждые 3 ч, тра-нексамовую кислоту (трансамча) — по 1 г в/в или 1,5 г внутрь каждые 4-6 ч. Применение антифибринолитических средств уменьшает вероятность повторного кровоизлияния, но существенно увеличивает риск ишемического инсульта, тромбоза глубоких вен нижних конечностей и эмболии легочной артерии. В настоящее время антифибринолитиче-ские средства применяют только в случаях повторного или продолжающегося субарахноидального кровоизлияния.
Для профилактики спазма мозговых артерий с первых часов заболевания применяют нимодипин в/в капельно из расчета 15—30 мкг/кг/ч в течение 5-7 дней, а затем (или с начала лечения) 30-60 мг нимодипина 6 раз в сутки в течение 14-21-го дня. Для достижения гиперволемии и гемо-дилюции вводят не менее 3 л жидкости (физиологический раствор) в сутки и 250 мл 5%-го раствора альбумина 4-6 раз в сутки.
Для уменьшения отека мозга применяют в/в дексаметазон по 4 мг каждые 6 ч, маннитол 0,5-1 мг/кг каждые 4 ч или 10%-й глицерол 400-600 мл/сут. При гипонатриемии обычно достаточно уменьшить количество вводимой изотонической жидкости. Если имеется гиповолемия, то для коррекции гипонатриемии вводят изотонический солевой раствор или раствор Рингера. Когда выявляется неадекватная продукция антидиуретического гормона, то для коррекции гипонатриемии показано ограничивать объем вводимой жидкости до 1 л в день и применять фуросемид 40 мг в день. Уменьшить неокклюзионную гидроцефалию возможно повторной люмбальной пункцией.
Общие мероприятия проводятся как при ишемическом инсульте. Постельный режим более строгий, чем при других инсультах.
Острая гипертоническая энцефалопатия (гипертензивная энцефалопатия)
Острая гипертоническая энцефалопатия представляет редкое осложнение тяжелой хронической артериальной гипер-
Тема 1. Острое нарушение мозгового кровообращения тонии или быстрого значительного подъема артериального давления. В 50 % случаев она приводит к смерти больного из-за тяжелого отека мозга.
Этиология и патогенез. Острая гипертоническая энцефалопатия развивается при злокачественном течении артериальной гипертонии, при отмене гипотензивных препаратов, приеме симпатомиметических средств, заболевании почек, феохромоцитоме, синдроме Кушинга, токсикозе беременных, расслоении аорты, узелковом периартериите. Заболевание возникает на фоне очень высокого артериального давления (диастолическое артериальное давление выше 120 мм рт. ст.) вследствие срыва ауторегуляции мозгового кровообращения. Предполагается, что срыв ауторегуляции приводит к расширению церебральных артерий, гиперперфузии и отеку мозга со сдавлением капилляров, замедлением внутримозгового кровотока.
Клиническая картина и диагноз. Острая гипертоническая энцефалопатия обычно развивается в течение нескольких часов и проявляется диффузной умеренной или выраженной головной болью, тошнотой, рвотой, нарушением сознания на фоне высокого артериального давления (диастолическое артериальное давление более 120 мм рт. ст., чаще 140— 150 мм рт. ст. и выше). Часто отмечаются зрительные нарушения в виде мерцания или затуманивания зрения, мерцающей скотомы, иногда ярких зрительных галлюцинаций. У части больных развиваются генерализованные или парциальные эпилептические припадки, возможно психомоторное возбуждение. Степень нарушения сознания варьирует от легкой спутанности до комы. Очаговые неврологические симптомы нехарактерны, их появление позволяет предположить внутримозговое кровоизлияние или инфаркт мозга как осложнение острой гипертонической энцефалопатии. Заболевание может также осложниться застойной сердечной недостаточностью, отеком легких, острой анурией или гемолитической анемией.
Диагноз подтверждает выявлени отека мозга при КТ или МРТ головы, а также отек дисков зрительного нерва, кровоизлияние в сетчатку глаз или выраженный спазм артериол сетчатки при офтальмоскопии.
Лечение. Основные направления терапии — нормализация артериального давления и устранение отека мозга. Рекомендуется снизить среднее гемодинамическое артериальное давление в течение часа приблизительно на 20 % от исходного уровня, а в последующие 24 ч добиться обычных для данного больного значений (диастолическое артериальное давление обычно не ниже 90 мм рт. ст.). Первоначальное быстрое снижение артериального давления можно достигнуть в/в введением нитропруссида натрия (начиная с дозы 0,3-0,5 мкг/кг/мин) или лабетолола (в дозе 2 мг/мин) либо диазоксида (в дозе 15-30 мг/мин).
Таблица
Краткие данные об основных типах инсульта
Краткие сведения Ишемический инсульт Кровоизлияние в мозг Субарахноидальное кровоизлияние
Частота, % 70-85 20-25 3-5
Основное заболевание Атеросклероз, артериальная гипертония, заболевания сердца (мерцательная аритмия, ревматическое поражение клапанов сердца и др.) сахарный диабет и др. Артериальная гипертония, артериовенозная или другая сосудистая мальформация, амилоидная ангиопатия, осложнение терапии антикоагулянтами и др. Врожденная мешотчатая аневризма, артериовенозная или другая сосудистая мальформация и др.
Основные механизмы развития Церебральный атеротромбоз или артерио-артери-альная эмболия, кардиальная эмболия, поражение мелких (перфорирующих) артерий мозга с развитием лакунарного инфаркта, гемодинамические нарушения; отек головного мозга Разрыв измененной артерии мозга или сосудистой мальформации, геморрагическое пропитывание; отек головного мозга, часто со смещением его структур и компрессией ствола Разрыв мешотчатой аневризмы или другой сосудистой мальформации; спазм церебральных артерий с ишемией мозга через 3-5 дней с момента субарахноидального кровоизлияния; отек головного мозга
Продолжение табл.
Краткие сведения Ишемический инсульт Кровоизлияние в мозг Субарахноидальное кровоизлияние
Нарушение сознания Нехарактерно (только при инфаркте ствола, мозжечка или обширном инфаркте в полушарии) Характерно для больших кровоизлияний; часто головная боль Характерно для больших кровоизлияний, почти всегда в начале заболевания головная боль
Менингеальные симптомы Нехарактерны В большинстве случаев В большинстве случаев
Симптомы очагового поражения головного мозга Соответствуют бассейну пораженной мозговой артерии (нейроваскулярные синдромы) Соответствуют месту кровоизлияния Могут отсутствовать, обычно возникают при спазме церебральных артерий
Летальность в течение месяца 15-25% 40-60% 30- 50%
Дополнительные методы КТ или МРТ головы, при их недоступности — люмбальная пункция, дуплексное сканирование церебральных и прецеребральных артерий, ЭКГ, гематологические и биохимические исследования и др. КТ или МРТ головы, при их недоступности — люмбальная пункция, ЭКГ, гематологические и биохимические исследования и др. КТ или МРТ головы, люмбальная пункция, ЭКГ, церебральная ангиография, гематологические и биохимические исследования и др.
Лечение Тромболизис (первые 4 6 ч), антикоагулянты (при кардиоэмболическом типе или прогрессирующем течении Хирургическое удаление гематомы (при кровоизлиянии в мозжечок, латеральной локализации гематомы Хирургическое выключение аневризмы, для профилактики спазма церебральных артерий —
Окончание табл.
Краткие сведения Ишемический инсульт Кровоизлияние в мозг Субарахноидальное кровоизлияние
инсульта), анти-агреганты, ней-ропротективная терапия; профилактика и лечение соматических осложнений; лечебная гимнастика, логопедические занятия и др.), лечение отека мозга; профилактика и лечение соматических осложнений; лечебная гимнастика, логопедические занятия гемодилюция, гиперволемия, артериальная гипертензия, нимодипин; профилактика и лечение соматических осложнений
Профилактика повторного инсульта Антиагреган-ты (аспирин, дипиридамол, клопидогрель, тиклопидин), вар-фарин (при кардиоэмболическом инсульте), антигипертензивная терапия, каротидная эндартерэктомия (при стенозе ВСА* более 75 %), статины (симвастатин, правастатин) Антигипертензивная терапия Хирургическое выключение аневризмы, антигипертензивная терапия
* ВСА — внутренняя сонная артерия.
Дисциркуляторная энцефалопатия. Сосудистая деменция
Дисциркуляторная энцефалопатия — хронически текущее сосудистое заболевание головного мозга с расстройством его функций. Сосудистая деменция характеризуется снижением памяти и других когнитивных функций, вызванным хроническим (или реже одним острым) сосудистым заболеванием головного мозга и приводящим к нарушению профессио-
Тема 1. Острое нарушение мозгового кровообращения нальной, общественной и/или бытовой адаптации. Сосудистая деменция соответствует III стадии дисциркуляторной энцефалопатии.
Дисциркуляторная энцефалопатия и сосудистая деменция встречаются преимущественно у лиц пожилого и старческого возраста. По мере старения существенно увеличивается их частота. Сосудистая деменция составляет 10-15% всех деменций, а ее сочетание с болезнью Альцгеймера (смешанная деменция) еще Ю-20'% всех деменций.
Этиология и патогенез дисциркуляторной энцефалопатии и сосудистой деменции те же, что и при остром нарушении мозгового кровообращения. Наиболее часто основными заболеваниями являются артериальная гипертония, церебральный атеросклероз и сахарный диабет. Прогрессирование расстройств функций мозга может быть вызвано как острым нарушением мозгового кровообращения, так и хронической ишемией головного мозга (недостаточностью церебрального кровообращения). Острое нарушение мозгового кровообращения может протекать с явной клинической симптоматикой (ТИА или инсульт) и бессимптомно («немой» инсульт, определяемый при рентгеновской компьютерной или магнитно-резонансной томографии). Характерным проявлением хронической ишемии головного мозга считается разрежение белого вещества головного мозга (лейкоареоз), наблюдаемое при КТ или МРТ вокруг желудочков (пери-вентрикулярно) и под корой больших полушарий головного мозга (субкортикально).
Сосудистая деменция чаще возникает вследствие повторных инсультов, выраженного лейкоареоза или сочетания этих изменений, значительно реже после одного инсульта с поражением стратегических для когнитивных функций областей мозга (лобная доля левого полушария, область те-менно-височно-затылочного стыка левого полушария, обеих зрительных бугров и др.).
Клиническая картина и диагноз. В I стадии дисциркуляторной энцефалопатии отмечается легкое снижение памяти и внимания, пациентов нередко беспокоят головная боль, общая слабость, повышенная утомляемость, эмоциональная
лабильность, несистемное головокружение, нарушение сна. При нейропсихологическом обследовании выявляются легкое снижение памяти, концентрации внимания и других когнитивных (познавательных) функций. В неврологическом статусе могут обнаруживаться асимметрия сухожильных рефлексов, легкие симптомы орального автоматизма и нарушения координации.
Во II стадии дисциркуляторной энцефалопатии отмечается умеренное снижение памяти и внимания, у пациентов возможны головная боль и другие симпттомы I стадии заболевания. При нейропсихологическом исследовании выявляются умеренные изменения памяти и других когнитивных функций. В неврологическом статусе обнаруживаются умеренные симптомы орального автоматизма, нарушения координации, возможны парезы мимических мышц по центральному типу, патологические кистевые и стопные симптомы, легкие проявления акинезии с повышением мышечного тонуса по типу ригидности.
В III стадии дисциркуляторной энцефалопатии значительно снижены память и внимание, у пациентов возможны головная боль и другие симптомы, отмечаемые на I—II стадии. При нейропсихологическом исследовании выявляются значительные изменения памяти и других когнитивных функций. Имеющиеся мнестико-интеллектуальные нарушения затрудняют профессиональную, общественную и/или бытовую жизнь пациентов и приводят к сосудистой деменции. В неврологическом статусе — центральный парез конечностей, выраженный псевдобульбарный синдром с симптомами орального автоматизма, парез мышц лица по центральному типу, проявления акинезии с повышением мышечного тонуса по типу ригидности (чаще в нижних конечностях), нарушения походки по типу лобной атаксии и апраксии, нередко нарушается контроль функции тазовых органов.
Течение дисциркуляторной энцефалопатии вариабельно, смерть наступает от повторного инсульта или инфарктов миокарда либо интеркуррентных заболеваний (пневмония, эмболия легочной артерии, уросепсис и др.).
При рентгеновской компьютерной и магнитно-резонансной томографии выявляются последствия ранее перенесенных инсультов в виде кист или изменений по типу глиоза, субкортикальный и перивентрикулярный лейкоареоз, при этом выраженность изменений нарастает от I к III стадии дисциркуляторной энцефалопатии. При ультразвуковом дуплексном сканировании могут быть обнаружены стеноз или закупорка вне- и внутричерепных мозговых артерий.
Диагноз дисциркуляторной энцефалопатии основывается на клинической картине, наличии перенесенных ТИА и инсультов, факторов риска нарушения мозгового кровообращения (артериальная гипертония, атеросклероз, сахарный диабет, мерцательная аритмия и др.) и исключении других заболеваний (болезнь Альцгеймера, тревожный невроз, депрессия и др.), которые могут проявляться сходными симптомами.
Лечение направлено на профилактику повторного нарушения мозгового кровообращения, поэтому соответствует изложенной ранее профилактике ишемического инсульта и кровоизлияния в мозг. Большая роль отводится адекватному лечению основных заболеваний, вызвавших дисциркуляторную энцефалопатию, — артериальной гипертонии, сахарного диабета, мерцательной аритмии и др.
Для улучшения памяти и других когнитивных функций рекомендуют достаточную умственную нагрузку, тренировку памяти, а также лекарственные препараты. Церебролизин рекомендуется по 20-50 мл в/в в 1 или 2 приема на физиологическом растворе ежедневно в течение 3—4 нед. В виде курсов (1 или 2 мес.) или постоянно используются пирацетам (ноотропил) по 1,6-4,8 мг/сут, винпоцетин (кавинтон) по 15-30 мг/сут, танакан по 120-160 мг/сут, пентоксифиллин по 1200 мг/сут, глиатилин по 1200 мг/сут, мемантин (акати-нола мемантин) по 10-20 мг/сут, ривастигмин (экселон) по 2-6 мг/сут и др.
Тема 2
Заболевания периферической нервной системы
Поражения периферических нервов проявляются нарушениями чувствительности (невропатический тип расстройств чувствительности), движений (периферические парезы) и вегетативно-трофических функций. Нарушение функции периферических нервов возможно как вследствие поражения аксона (аксональная невропатия), так и его миелиновой оболочки (демиелинизирующая невропатия).
Поражение одного нерва определяется как мононевропатия, одновременное поражение двух соматических или периферических нервов или более — как полиневропатия. Плексопатия — поражение нервных сплетений (шейного, плечевого или пояснично-крестцового) вследствие травмы или других причин (хроническая компрессия, сахарный диабет, инфильтрация злокачественной опухолью, лучевая терапия и др.).
Невралгия проявляется болью в зоне иннервации нерва без нарушений его функции. Радикулопатия — поражение спинномозгового корешка — рассматривается в теме Верте-брогенные неврологические нарушения.
Мононевропатия
Мононевропатия проявляется периферическим парезом мышц, иннервируемых пораженным нервом, мононевропа-тическим типом расстройства чувствительности и вегетативными нарушениями в зоне иннервации. Мононевропатия
Тема 2. Заболевания периферической нервной системы наиболее часто бывает вызвана травмой нерва или его сдавлением в костно-фиброзно-мышечном канале (туннельная невропатия). Она возможна также вследствие нарушения микроциркуляции и ишемии нерва при сахарном диабете, ревматоидном артрите, узелковом периартериите, амилоидозе, акромегалии, а также по причине непосредственного инфицирования при проказе. Из черепных нервов чаще поражается лицевой нерв, из спинномозговых нервов — срединный нерв в области запястного канала.
Невропатия лицевого нерва (паралич Белла)
Этиология и патогенез. Невропатия лицевого нерва в большинстве случаев вызвана ишемией, отеком и компрессией нерва в узком костном канале, имеет идиопатический и предположительно инфекционный (вирусный, возможно, герпетический) или инфекционно-аллергический генез. Частота заболевания составляет около 20 случаев на 100 тыс. населения. Симптоматические формы невропатии развиваются при травме височной кости, опухоли мосто-мозжечкового угла, отите, опоясывающем герпесе и др.
Клиническая картина. Паралич Белла часто провоцируется переохлаждением. Вначале нередко отмечается боль в области сосцевидного отростка, на фоне которой остро развивается односторонний парез или паралич мимических мышц. Лицо больного перекашивается, на стороне поражения сглаживаются кожные складки, опускается угол рта. Больной не может поднять бровь, закрыть глаз, при оскаливании рот смещается в здоровую сторону. При еде нередко пища застревает между щекой и десной, жидкость выливается из угла рта. В зависимости от уровня поражения лицевого нерва возможны сухость глаза или слезотечение, нарушение вкуса на передних 2/3 языка, гиперакузия на стороне паралича. Полное восстановление при параличе Белла наблюдается у 70-80% больных обычно в течение 1 мес. (реже 2-3), у остальных больных остается парез или, реже (3 %), паралич мимической мускулатуры. Прогноз хуже у пожилых, при сопутствующем сахарном диабете и/или артериальной гипертонии.
Диагноз основывается на клинических симптомах и обычно не вызывает трудностей. Если поражение мимических мышц сочетается со снижением слуха, нарушением чувствительности на лице (поражение тройничного нерва), центральным парезом конечностей, мозжечковой атаксией или другими симптомами, которые не характерны для невропатии лицевого нерва, показана МРТ головы для исключения опухоли мосто-мозжечкового угла и других заболеваний головного мозга.
Лечение. Более быстрое восстановление отмечается при приеме преднизолона по 60 80 мг/сут в течение первых 5-7 дней с последующей постепенной отменой в течение 10-14 дней. Возможно вводить метилпреднизолон (250-500 мг в/в 2 раза в день в течение 3-5 дней с последующим применением преднизолона) в сочетании с реополиглюкином (400 мл в/в 2 раза в день в течение 3 дней, а затем 1 раз в день в течение недели) и пентоксифиллином (300 мг/сут в/в в течение 10 дней) для улучшения микроциркуляции. Учитывая предполагаемую роль вируса простого герпеса в развитии заболевания, предложено применять ацикловир (по 200 мг 5 раз в день внутрь в течение 2—3 нед. или первые 7 дней парентерально из расчета 5 мг/кг 3 раза в день, а затем внутрь). С первых дней рекомендуется гимнастика мимических мышц, наклейки из лейкопластыря, чтобы предотвратить перерастяжение пораженных мышц. К поздним осложнениям относится контрактура денервированных мимических мышц, которая плохо поддается лечению (рефлексотерапия, массаж, карбамазепин).
Мононевропатии периферических нервов конечностей
Клинические проявления поражения периферических нервов конечностей изложены в разделе «Общая неврология. Симптомы поражения спинного мозга, его корешков и периферических нервов».
Невропатия срединного нерва. Синдром запястного канала составляет до 2/3 всех туннельных невропатий. Он
возникает вследствие компрессии срединного нерва в запястном канале, образованном костями запястья и поперечной ладонной связкой, что вызвано чаще всего утолщением мышц и связок, определенную роль играет врожденная узость запястного канала. Синдром запястного канала может быть при микседеме, акромегалии, сахарном диабете, менопаузе, беременности, приеме пероральных контрацептивов, ревматоидном артрите, а также вследствие перегрузки лучезапястного сустава (частое сгибание-разгибание кисти). Женщины болеют в 2 раза чаще.
Диагноз основывается на клинических данных и подтверждается результатами электронейромиографии (замедление скорости проведения возбуждения по срединному нерву в области запястного канала) и электромиографии (наличие денервационных изменений в иннервируемых срединным нервом мышцах).
Лечение направлено на уменьшение нагрузки на лучезапястный сустав, во многих случаях помогает бинтование запястья на ночь, а при выраженности симптомов — иммобилизация сустава в течение 2-4 нед. с помощью шины. Используют нестероидные противовоспалительные средства, анальгетики, противоотечные средства, компрессы с димек-сидом. Эффективно введение кортикостероидов (с новокаином или без него) в запястный канал. При отсутствии эффекта и нарастании атрофии мышц показана хирургическая декомпрессия нерва в области запястного канала.
Невропатия локтевого нерва возникает вследствие его травмы или компрессии в области локтевого или, реже, лучезапястного сустава. При травме накладывают шину, проводят лечебную гимнастику и массаж; при туннельной невропатии лечение такое же, как и при синдроме запястного канала, эффективна хирургическая декомпрессия нерва.
Невропатия лучевого нерва обычно возникает вследствие его травмы (при переломе плечевой кости) или компрессии на уровне нижних отделов плечевой кости. На уровне плечеподмышечного угла компрессия нерва может быть вызвана неправильным пользованием костылем. Поражение нерва нередко развивается остро вследствие компрессии
руки головой во время сна в неудобной позе (при алкогольном опьянении). Восстановление при травме происходит спонтанно в течение 2 мес., применяют массаж и лечебную гимнастику. Если через 2 мес. после травмы восстановление не происходит, а также при туннельной невропатии рекомендуют хирургическое лечение.
Невропатия седалищного нерва чаще возникает в месте его прохождения через грушевидную мышцу по механизму туннельного синдрома и проявляется болью и парестезия-ми в<шд£да'и<от)Г1£, возможно нарушение функции нерйй. Пальпация грушевидной мышцы болезненна с распространением боли по ходу седалищного нерва.
Синдром грушевидной мышцы может быть вызван травмой крестцово-подвздошной или ягодичной области с последующим спазмом мышцы, а также рефлекторным напряже
нием мышцы при компрессии измененным межпозвонковым
диском нижних поясничных и первого крестцового корешков. При травматическом поражении возможно спонтанное восстановление в течение 2 мес., при спазме грушевидной мышцы применяют ее новокаиновую блокаду.
Невропатия бедренного нерва возникает обычно в области паховой складки, позади нее вследствие травмы (с образованием гематомы) или спонтанной гематомы, например, при приеме антикоагулянтов. Поражение нерва проявляется болью в паховой области, которая может распространяться на переднюю и внутреннюю поверхность бедра, внутреннюю поверхность голени и стопы. При длительном заболевании возникает нарушение функции нерва. Возможно спонтанное восстановление в течение 2 мес., применяют лечебную
гимнастику и массаж.
Невропатия латерального кожного нерва бедра (болезнь Рота) возникает при его компрессии в области пупар
товой связки, что чаще вызвано травмой, ношением корсета, бандажа или тугого ремня либо избыточным отложением жира в нижнем отделе передней брюшной стенки и в области бедер, реже — опухолью, асцитом, беременностью. Необходимо выяснить причину компрессии нерва и, если
возможно, то устранить ее. В большинстве случаев болезнь не причиняет серьезных страданий больному. В случае ожирения симптомы ослабевают при снижении массы тела. При выраженной боли может помочь введение местных анестетиков и кортикостероидов в область прохождения нерва на уровне передней верхней подвздошной ости, в редких случаях требуется хирургическое лечение.
Невропатия малоберцового нерва наиболее часто возникает при его компрессии у головки малоберцовой кости, что может быть вызвано резким подошвенным сгибанием и супинацией стопы, длительным пребыванием в положении на корточках или сидя, закинув ногу на ногу, ношением гипсовой повязки. Возможно спонтанное восстановление в течение нескольких недель. С целью предупредить контрактуру голеностопного сустава проводят лечебную гимнастику, фиксируют стопу. При длительном поражении развивается атрофия мышц передней и наружной групп голени. Если восстановление не происходит, рекомендуют хирургическую декомпрессию нерва.
Невропатия большеберцового нерва возникает при его компрессии кзади и ниже медиальной лодыжки в области тарзального канала, что может быть вызвано отеком или гематомой вследствие травмы голеностопного сустава. В этих случаях наблюдаются боль и онемение в подошвенной части стопы и пальцев, боль усиливается в положении стоя и при ходьбе, а также при перкуссии и пальпации места компрессии. Эффективна хирургическая декомпрессия нерва.
Полиневропатии
Полиневропатия представляет множественное поражение периферических нервов, чаще проявляющееся симметричным вялым (периферическим) парезом (обычно в дистальных отделах конечностей и/или чувствительными нарушениями по полиневропатическому типу, вегетативными расстройствами преимущественно в дистальных отделах конечностей и иногда сочетающееся с поражением черепных нервов.
Этиология и патогенез. Полиневропатии могут быть наследственными (наследственные соматосенсорные и вегетативные, амилоидная, порфирийная и др.), инфекционными (дифтерийная, лепрозная), токсическими (мышьяковая, свинцовая, отравление фосфорорганическими соединениями и др.), дисметаболическими (при соматических заболеваниях — сахарном диабете, уремии, печеночной недостаточности, гипотиреозе, гиповитаминозах В,, В6, В12 и др.); они возникают при злокачественных новообразованиях, болезнях соединительной ткани и васкулитах (узелковый периартериит, ревматоидный артрит, системная красная волчанка, склеродермия), беременности, заболеваниях крови, после вакцинаций (против бешества, тифа, ветряной оспы и др.) и как ятрогенные вследствие осложнений лекарственной терапии (изониазидом, пиридоксином, дифенином и др.). Чаще всего (примерно в ’/3 случаев) встречается диабетическая полиневропатия.
Клиническая картина. Полиневропатия обычно развивается постепенно. Характерны боль и парестезии, чувствительные нарушения по типу «носков» и «перчаток», снижение или утрата сухожильных рефлексов, особенно ахилловых, вялые атрофические парезы в дистальных отделах конечностей. Как правило, симптомы появляются и доминируют в ногах. Нарушение глубокой чувствительности может привести к сенситивной атаксии. Парез стоп вызывает характерные изменения походки (степпаж), в редких случаях из-за грубых проксимальных и дистальных парезов больные утрачивают способность к передвижению. Вегетативные нарушения могут проявляться ортостатической гипотензией, потливостью или сухостью кожных покровов, ломкостью ногтей, тазовыми расстройствами.
Диагноз полиневропатии основывается на клинических данных и обычно не вызывает трудностей. Электромиография (ЭМГ) и электронейромиография (ЭНМГ) подтверждают поражение периферических нервов (симметричное замедление скорости проведения возбуждения по периферическим нервам, снижение амплитуды мышечного ответа, денервационная активность в иннервируемых мышцах) и 50 ,
позволяют дифференцировать аксональную дегенерацию (снижение амплитуды мышечного ответа при легком снижении скорости проведения возбуждения по нервам) и демиелинизацию (выраженное снижение скорости проведения возбуждения по нерву, полифазный характер мышечного ответа). В неясных случаях диагностическое значение может иметь биопсия нерва.
Выявив полиневропатию, необходимо установить ее причину, что требует тщательного соматического обследования больного. Чаще всего встречается диабетическая и алкогольная полиневропатия. В части случаев не удается установить причину полиневропатии; у больных пожилого возраста следует учитывать возможность паранеопласти-ческого синдрома, который может предшествовать клиническим проявлениям злокачественного новообразования.
При полиневропатии в молодом возрасте и наличии случаев заболевания в одной семье вероятна наследственная невропатия (невральная амиотрофия Шарко—Мари—Тута). Она наследуется по аутосомно-доминантному, реже аутосомно-рецессивному типу. Симптомы обычно появляются в возрасте до 30 лет в виде медленно нарастающей симметричной слабости в дистальных отделах ног с развитием выраженной амиотрофии и характерной деформации стоп («полая стопа), через 5-10 лет присоединяется слабость и в дистальных отделах рук. При обследовании выявляются периферические парезы, снижение или утрата сухожильных рефлексов, легкие чувствительные нарушения, в ряде случаев трофические нарушения — отек и цианоз кожных покровов конечностей. Постепенно парез может достигать значительной степени (до плегии в стопах), однако в большинстве случаев не приводит к обездвиженности больного.
Лечение полиневропатии зависит от ее этиологии. При экзогенных причинах (интоксикация, гиповитаминоз) необходимо их устранить. В случаях соматического заболевания ведущее значение имеет их лечение. При двигательных нарушениях рекомендуют лечебную гимнастику, массаж, физиотерапевтические процедуры, в случаях грубого пареза стоп — ношение ортопедической обуви.
Острая воспалительная демиелинизирующая пол иради кулоневропатия (синдром Гийена—Барре)
Этиология заболевания неизвестна, предполагают иммунологические нарушения, приводящие к сегментарной демиелинизации в передних корешках, проксимальных отделах периферических нервов, сплетениях и вегетативных узлах. Частота заболевания составляет 1-2 случая на 100 тыс. населения. Мужчины болеют чаще женщин. Заболевание возможно в любом возрасте, но встречается несколько чаще в 50-75 лет.
Клиническая картина. У 50% больных за 1-3 нед. до появления неврологических симптомов отмечаются заболевания верхних дыхательных путей, кишечные расстройства или ангина. Первые неврологические нарушения — боль и парестезии в ногах и/или парез в них. В дальнейшем двигательные расстройства в ногах прогрессируют и присоединяются нарушения в руках. Симптомы нарастают в течение 1-4 нед. Ведущее проявление заболевания — вялый паралич, который часто распространяется в восходящем направлении, захватывая мышцы ног и тазового пояса, туловища, шеи и иногда дыхательную мускулатуры. Обследование обычно выявляет мышечную гипотонию, снижение или отсутствие рефлексов, легкие чувствительные нарушения в виде гипалгезии и гиперестезии в дистальных отделах конечностей, симптомы натяжения. В части случаев развиваются опасные для жизни дыхательные нарушения и расстройство глотания. Черепные нервы поражаются в 75 % случаев, в половине из них страдает лицевой нерв. У многих больных с выраженными двигательными нарушениями развиваются вегетативные расстройства в виде ортостатической гипотензии, тахикардии и пароксизмальной аритмии.
Возможны осложнения, обусловленные в значительной степени обездвиженностью больного: пролежни, пневмонии, тромбоэмболия легочной артерии, тромбоз вен. Летальность
в настоящее время не превышает 5%. У большинства больных восстановление начинается спустя 10-12 дней после прекращения прогрессирования заболевания и продолжается от 6 мес. до 3 лет. Полное восстановление наблюдается в половине случаев, у большинства остальных больных сохраняются только легкие неврологические расстройства и лишь у 10-15% больных остаются грубые парезы, приводящие к инвалидности.
Диагноз основывается на клинических данных. При люмбальной пункции повышено содержание белка при незначительном увеличении числа клеток в цереброспинальной жидкости (белково-клеточная диссоциация). ЭНМГ обнаруживает снижение скорости проведения возбуждения по периферическим нервам в 90 % случаев.
Лечение направлено главным образом на профилактику возможных осложнений. Большое значение имеют общий уход за больным, искусственная вентиляция легких (ИВЛ) при дыхательной недостаточности, парентеральное питание при нарушении глотания. Восстановление ускоряет плазмаферез, проведенный в первые 7 дней заболевания; рекомендуется 3-5 сеансов плазмафереза через день с обменом 1,5-2 л плазмы за сеанс. Эффективно в/в медленное (в течение 6-8 ч) введение иммуноглобулина из расчета 0,4 г/кг в 1л 0,9%-го раствора натрия хлорида (физиологический раствор) в течение 5 дней. Для профилактики тромботических осложнений целесообразно использовать гепарин по 5 тыс. ЕД под кожу живота 2 раза в сутки. Рекомендуют также массаж па-ретичных мышц и лечебную гимнастику. Ранее применяемые кортикостероиды в настоящее время не рекомендуются.
Хроническая воспалительная демиелинизирующая полирадикулоневропатия — редкое неврологическое заболевание, сходное с острой воспалительной демиелинизирующей полирадикулоневропатией Гийена—Барре, но имеет хроническое ремиттирующее или непрерывно прогрессирующее (не менее 2 мес.) течение. Первые атаки заболевания обычно более легки и менее продолжительны, чем последующие. Заболевание может иметь как идиопатический генез, так и возникать при ВИЧ-инфекции, системной красной
волчанке, злокачественных и других заболеваниях. В основе заболевания лежат дизиммунные расстройства. При идиопатической форме для лечения используют преднизолон по 100 мг/сут в течение 2-4 нед. с последующим постепенным уменьшением дозы до поддерживающей (5-20 мг/сут). При отсутствии эффекта рекомендуется плазмаферез (по 2 сеанса в неделю в течение 3 нед.) или азатиоприн по 50 мг 3 раза в день либо в/в введение иммуноглобулина. Примерно 33% больных выздоравливают, у остальных сохраняются различные двигательные нарушения.
Плексопатии
Плексопатия — поражение нервных сплетений: шейного, плечевого или пояснично-крестцового.
Этиология и патогенез. Плексопатия возникает вследствие травмы или других причин (хроническая компрессия, инфильтрация злокачественной опухолью, лучевая терапия). Значительно чаще встречается плечевая плексопатия, которая обычно вызвана травмой: травматические роды, вывих плечевого сустава, автомобильная авария, сдавление сплетения во время наркоза, длительное ношение тяжести на плече («рюкзачный паралич»), ножевое ранение, костные аномалии (шейное ребро — гипертрофированный поперечный отросток CVII), сдавление опухолью верхушки легкого. Пояснично-крестцовая плексопатия возникает вследствие объемного образования в забрюшинном пространстве (опухоль, абсцесс, аневризма аорты или подвздошной артерии), кровоизлияния в подвздошно-поясничную мышцу (при гемофилии или передозировке антикоагулянтов), перелома костей таза, оперативных вмешательствах на тазобедренном суставе. Возможна идиопатическая плексопатия.
Клиническая картина. Выделяют 3 вида плечевой плексопатии. В случае преимущественного вовлечения верхних отделов плечевого сплетения (корешки С5-С6) развивается синдром Эрба: парез в проксимальных отделах руки (в области плечевого и локтевого суставов) с постепенным развитием атрофии, расстройство чувствительности на наружной
поверхности плеча. При поражении нижних отделов плечевого сплетения (корешки CR-Th() возникает синдром Дежерин—Клюмпке: вялый парез кисти и пальцев, расстройство чувствительности по внутренней поверхности плеча и предплечья, а также синдром Горнера (возникающий обычно при травматическом отрыве корешков С8 и Tht от спинного мозга). При тотальном поражении плечевого сплетения развивается паралич всей руки и мышц плечевого пояса, утрата чувствительности в этих же зонах.
Одним из вариантов идиопатической плексопатии является синдром Персонейджа—Тернера (невралгическая амиотрофия): вслед за интенсивной болью в плече развивается парез в проксимальных отделах руки с последующей грубой атрофией без чувствительных нарушений; в течение нескольких месяцев наблюдается полное спонтанное восстановление в 90% случаев. Возможны редкие семейные идиопатические формы плечевой плексопатии.
Диагноз плексопатии основывается на клинико-анамнестических данных. ЭМГ и ЭНМГ уточняют локализацию и степень поражения. При отсутствии травмы необходимо исключить компрессию сплетения (опухоль, гематома, шейное ребро и др.). При травме прогноз определяется ее тяжестью, в большинстве случаев наблюдается полное (или частичное) восстановление в течение нескольких месяцев.
Лечение зависит от причины плексопатии. При травме с полным разрывом (например, при ножевом ранении) показано экстренное микрохирургическое сшивание нервов. В остальных случаях хирургическое лечение рекомендуется только при отсутствии восстановления в течение 3-5 мес. и признаках аксональной дегенерации (по данным ЭНМГ). Во всех случаях целесообразны лечебная гимнастика, массаж паретичных мышц, при боли — анальгетики, физиотерапия, иглорефлексотерапия.
Невралгии
Невралгия проявляется болью в зоне иннервации нерва без нарушения его функции. Она может быть первичной
(идиопатическая) или вторичной (симптоматическая), вызванной опухолью или другими заболеваниями. Наиболее часто встречается невралгия тройничного нерва.
Невралгия тройничного нерва. Этиология. Заболевание в большинстве случаев имеет идиопатический генез, предполагается компрессия тройничного нерва в области его выхода из моста крупной артерией (чаще верхней мозжечковой артерией). Идиопатическая форма возникает преимущественно в возрасте старше 40 лет, заболеваемость составляет 6 случаев в год на 100 тыс. населения, 60-70% больных — женщины. Симптоматическая форма невралгии тройничного нерва может быть вызвана рассеянным склерозом (образование склеротической бляшки в области чувствительного ядра тройничного нерва), опухолью мозга и основания черепа, аневризмой, локальным процессом в области синусов, зубов, челюсти или глотки.
Клиническая картина. Невралгия тройничного нерва проявляется кратковременными (несколько секунд или 1-2 мин) приступами односторонней колющей или режущей боли (ощущение жжения или «прохождения электрического тока») в области второй или третьей, реже первой ветви нерва. Во время приступа больной часто замирает, боясь шелохнуться и усилить боль, реже он потирает щеку или сдавливает висок, стараясь ослабить боль. Приступ боли может вызвать рефлекторное сокращение мимической и жевательной мускулатуры на стороне боли (болевой тик). Характерны внезапные начало и окончание приступа, свободные от боли — «светлые» промежутки. Приступы возникают спонтанно или провоцируются разговором, глотанием, жеванием, чисткой зубов, бритьем. Многие больные отмечают развитие приступов при умывании холодной водой. Из-за страха вызвать приступ больные иногда перестают чистить зубы, редко умываются, бреются. Нередко вначале приступы боли имеют локальный характер, проецируясь в область того или иного зуба либо десны, в связи с чем больные обращаются за консультацией к стоматологу. Вскоре область боли увеличивается, захватывая зону одной или не-
Тема 2. Заболевания периферической нервной системы скольких ветвей тройничного нерва. Боль никогда не переходит на другую сторону, однако в редких случаях (3-5%) она двусторонняя. У многих больных приступы могут исчезать на месяцы и годы, повторные приступы обычно возникают в тех же зонах лица. У некоторых больных никогда не бывает спонтанных ремиссий. С течением времени у части больных начинается тупая боль или жжение вне приступа. Эмоциональное и физическое напряжение может увеличивать частоту приступов. Обследование не выявляет неврологических нарушений, иногда отмечается болезненность в зонах выхода ветвей нерва и легкая гипер- или гипестезия в области заинтересованной ветви, обнаруживаются курковые зоны, раздражение которых провоцирует приступ боли.
Диагноз невралгии тройничного нерва основывается на характерных приступах и исключении ее симптоматического генеза. При подозрении на опухоль мозга показана МРТ головы.
Лечение. Основу лечения составляет лекарственная терапия. Карбамазепин (финлепсин) — наиболее эффективный препарат, который дает положительный результат в 2/з случаев. Начинают лечение с 100 мг в сутки и каждые 2 дня увеличивают дозу на 100 мг до положительного результата или до 600 мг в 3 приема. Если в течение недели суточная доза в 600 мг не дает положительного эффекта, постепенно увеличивают дозу до 1200-1600 мг, и в тех случаях, когда и при этих дозах нет положительного результата, препарат отменяют. Возможно применение и других проти-воэпилептических средств: фенитоина по 300-900 мг/сут, клоназепама по 2-6 мг/сут или габапентина (нейронтин) по 1200 мг/сут. При длительном течении заболевания, как и при любом хроническом болевом синдроме, можно использовать антидепрессанты, например амитриптилин по 25-100 мг/сут. Если наблюдается тяжелое течение заболевания и не помогают лекарственные средства, рекомендуют хирургическое лечение. В настоящее время наиболее часто используется репозиция кровеносного сосуда, сдавливающего тройничный нерв.
Таблица 2.1
Краткие сведения о мононевропатиях конечностей
Этиология Травма нерва или его сдавление в костно-фиброзно-мышечном канале (компрессионно-ишемическая, или туннельная, невропатия), сахарный диабет, ревматоидный артрит, узелковый периартериит, амилоидоз, акромегалия, проказа
Клинические проявления Периферический парез мышц, иннервируемых пораженным нервом, мононевропатический тип расстройства чувствительности и вегетативные нарушения
Электро-нейромиография Замедление скорости проведения возбуждения по нерву, снижение амплитуды мышечного ответа
Лечение При туннельной невропатии — профилактика дальнейшей компрессии нерва, при отсутствии эффекта консервативной терапии возможна хирургическая декомпрессия
Таблица 2.2
Краткие сведения о невропатии лицевого нерва
Этиология Идиопатические формы — ишемия, отек и компрессия нерва в узком костном канале (конституциональная особенность), возможна роль вирусной (герпетической) инфекции и переохлаждения. Симптоматические формы — травма височной кости, опухоль мостомозжечкового угла, опоясывающий герпес
Клинические проявления Односторонний парез или паралич мимических мышц, нередко боль в области сосцевидного отростка, возможны сухость глаза или слезотечение, нарушение вкуса на передних 2/3 языка, гиперакузия на стороне паралича
Течение Полное восстановление у 70-80% больных обычно в течение 1 2 мес., прогноз хуже у пожилых, при сопутствующем сахарном диабете л/или артериальной гипертонии
Лечение Преднизолон внутрь (1 мг/кг в сутки), ацикловир (1000 мг в сутки), лечебная гимнастика мимических мышц
Таблица 2.3
Краткие сведения о полиневропатиях
Этиология Диабет, хронический алкоголизм, реже — наследственные, инфекционные (дифтерия, проказа), токсические, при уремии, печеночной недостаточности, гипотиреозе, гиповитаминозах, злокачественных новообразованиях, болезнях соединительной ткани и васкулитах, заболеваниях крови, после вакцинаций и как осложнение от приема лекарственных средств
Клинические проявления Симметричный периферический парез конечностей, чувствительные нарушения по полиневропатиче-скому типу, вегетативные расстройства преимущественно в дистальных отделах конечностей, иногда поражение черепных нервов
Электронейромиография Замедление скорости проведения возбуждения по периферическим нервам, снижение амплитуды мышечных и сенсорных потенциалов
Лечение Терапия основного заболевания или устранение токсического действия, тиамин при алкогольной по-линевропатии и препараты сс-липоевой кислоты при сахарном диабете
Таблица 2.4
Краткие сведения об острой воспалительной демиелинизирующей полирадикулоневропатии
Этиология Дизиммунные нарушения, приводящие к демиелинизации в передних корешках, проксимальных отделах периферических нервов, сплетениях и вегетативных узлах
Клинические проявления Начало обычно с боли и парестезии в ногах. В дальнейшем постепенное (1-4 нед.) нарастание периферического пареза конечностей, часто парез мимических мышц. Возможны расстройства дыхания и глотания, вегетативные нарушения в виде ортостатической гипотензии и тахикардии
Электронейромиография Замедление скорости распространения возбуждения по нервам конечностей
Люмбальная пункция Повышенное содержание белка в цереброспинальной жидкости
Окончание табл. 2.4
Лечение Профилактика возможных осложнений у обездвиженных больных, 3-5 сеансов плазмафереза через день (с обменом 1,5-2 л плазмы за сеанс), в/в иммуноглобулин (0,4 г/кг) в течение 5 дней, лечебная гимнастика
Таблица 2.5
Краткие сведения о невралгии тройничного нерва
Этиология В большинстве случаев идиопатический генез, возможна компрессия тройничного нерва в области его выхода из моста артерией. Симптоматические формы — рассеянный склероз, опухоль мозга и основания черепа, аневризма
Клинические проявления Кратковременные (несколько секунд или 1-2 мин) приступы односторонней колющей или режущей боли в области второй или третьей, реже первой ветви нерва. Приступы возникают спонтанно или провоцируются разговором, глотанием, жеванием, чисткой зубов, бритьем. Возможна болезненность в зонах выхода ветвей нерва и легкая гипер- или ги-пестезия в областа^заинтересов^нной ветви
Лечение 6g* (Л U Карбамазепин по 600 мг/сут или другие противо-эпилептические средства (фенитоин, габапентин, антелепсин), антидепрессанты. При отсутствии эффекта от консервативной терапии хирургическое лечение (репозиция кровеносного сосуда, сдавливающего тройничный нерв и др.)
Тема 3
Нервно-мышечные заболевания. Боковой амиотрофический склероз
Миастения
Миастения — заболевание, вызванное поражением нервно-мышечного синапса и проявляющееся патологической мышечной утомляемостью и мышечной слабостью. Распространенность — 4 случая на 100 тыс. населения.
Этиология и патогенез. Миастения представляет собой аутоиммунное заболевание с образованием антител к постсинаптической мембране нервно-мышечного синапса, что приводит к нарушению проводимости в нем. У 60% больных миастенией выявляется гиперплазия вилочковой железы, у 10% больных — ее опухоль (тимома).
Миастеноподобные синдромы наблюдаются при бронхогенном раке (синдром Ламберта—Итона), при приеме пенициламина, аминогликозидов (неомицин, гентамицин, канамицин и др.), стрептомицина, полипептидных антибиотиков.
Клиническая картина. Характерные проявления болезни — слабость мышц и их патологическая утомляемость. Во многих случаях заболевание начинается с глазодвигательных нарушений, вызванных поражением глазных мышц и проявляющихся двоением и опущением век (глазная форма миастении). Утром нарушения могут отсутствовать, а к вечеру и при нагрузке (длительном чтении) значительно нарасти. Реже заболевание начинается с нарушений глотания (дисфагия), речи (дизартрия) и голоса (дисфония) либо со
слабости в конечностях (периферический парез). У небольшой части (15%) больных проявления миастении остаются локальными, а у остальных постепенно прогрессируют, приводя к генерализованной форме заболевания. При распространении слабости на мышцы конечностей, как правило, больше страдают мышцы проксимальных отделов конечностей, нередко поражаются мышцы шеи. Один из наиболее тяжелых симптомов миастении — слабость дыхательных мышц, сопровождающаяся удушьем.
При миастении может наблюдаться быстрое ухудшение состояния — миастенический криз с генерализованной мышечной слабостью, выраженной дисфагией, дисфонией, дизартрией и дыхательными нарушениями. Сходное по клиническим проявлениям состояние — холинергический криз — возникает при передозировке применяющихся для лечения антихолинэстеразных препаратов и обычно сопровождается гиперсаливацией, ознобоподобным тремором, повышенным потоотделением, диареей, бледностью, узкими зрачками, брадикардией.
Диагноз миастении основывается на клинических данных и подтверждается пробами с двигательными нагрузками, позволяющими выявить патологическую мышечную утомляемость. Важное диагностическое значение имеет про-зериновая проба — введение п/к 1-3 мл 0,05%-го раствора прозерина (в сочетании с 0,5 мл 0,1%-го раствора атропина), после которой через 20-40 мин обычно уменьшаются мышечная слабость и утомляемость в течение 2-3 ч. При электронейромиографии отмечается снижение амплитуды мышечных потенциалов при стимуляции нерва с частотой 3-10 в секунду у 75% больных. Высокой информативностью также обладает электромиография с исследованием потенциалов отдельных мышечных волокон. Серологические исследования позволяют обнаружить антитела к синаптическим холинорецепторам у 70% больных с глазной формой миастении и у 80-90 % больных с генерализованной формой. Полное обследование, включающее серологические исследования, электронейромиографию и электромиографию, обеспечивает 100% диагностику. Всем больным с миастенией
показана рентгеновская КТ грудной клетки для выявления тимомы или гиперплазии вилочковой железы.
Лечение. В качестве патогенетического лечения используют антихолинэстеразные средства. Прозерин применяют периодически, в основном для кратковременного повышения мышечной силы перед физической нагрузкой или едой, по 2-3 мл п/к или 1 мл в/в 0,05%-го раствора или по 15 мг внутрь. Калимин используют для длительного приема по 30-60 мг 3-6 раз в день. У небольшой части больных, преимущественно с локальной формой миастении, применение антихолинэстеразных средств позволяет на длительное время улучшить состояние и стабилизировать течение заболевания.
При обострениях болезни, вызывающих значительные нарушения и неподдающихся лечению антихолинэстеразны-ми средствами, проводят курсовое лечение преднизолоном по 60-100 мг/сут в течение 1-2 нед. до достижения положительного эффекта, а затем постепенно снижают дозу до поддерживающей (5-15 мг ежедневно или 10-30 мг через день). При отсутствии положительного результата или побочных эффектах от преднизолона, а также с целью снижения его дозы можно использовать цитостатики: азатиоприн по 50-150 мг/сут или циклоспорин до 5 мг/кг в сутки на протяжении нескольких лет. Улучшение состояния больных миастенией может быть также достигнуто несколькими сеансами плазмафереза или введением иммуноглобулина в/в из расчета 0,4 г/кг/сут в течение 5 дней.
При наличии тимомы, а также всем больным с генерализованной формой миастении в возрасте до 70 лет, показано удаление вилочковой железы (тимэктомия), которую проводят в специализированных центрах. В среднем улучшение состояния и стойкая ремиссия (обычно до 5 лет) наблюдаются у 70% оперированных.
Для купирования миастенического криза применяют в/в прозерин, при дыхательных нарушениях — искусственную вентиляцию легких: в течение 2-3 нед. используют преднизолон по 60-100 мг с постепенным уменьшением дозы. При холинергическом кризе необходима временная отмена ан-
тихолинэстеразных средств под постоянным наблюдением, при дыхательных нарушениях — искусственная вентиляция легких с последующим подбором адекватной дозы средств.
Прогрессирующие мышечные дистрофии
Прогрессирующие мышечные дистрофии — группа наследственных заболеваний, проявляющихся нарастающей мышечной слабостью и атрофией. Мышечные дистрофии вызваны первичным наследственно обусловленным поражением мышц (миопатия), при этом сохранными остаются двигательные нейроны, их аксоны и нервно-мышечные окончания. Они представляют наиболее частую причину миопатии, которая также бывает воспалительной, врожденной и метаболической на фоне тиреотоксикоза, гипотиреоза, гиперпаратиреоза, гиперкортицизма или акромегалии. Различные типы прогрессирующих мышечных дистрофий отличаются друг от друга генетическим дефектом, типом наследования, сроком начала заболевания, локализацией и быстротой развития мышечных атрофий, парезов и других сопутствующих симптомов.
Миодистрофия Дюшена встречается чаще других форм — 63 случая на 1 млн населения.
Патогенез. При миодистрофии Дюшена патологический ген (дистрофин) локализован в коротком плече Х-хромосо-мы, заболевание передается по рецессивному, сцепленному с Х-хромосомой типу, поэтому болеют мальчики.
Клиническая картина. Большинство типов прогрессирующих мышечных дистрофий проявляются в детском или юношеском возрасте. Типично постепенное нарастание симметричной слабости и атрофии мышц проксимальных отделов конечностей, тазового и плечевого пояса. При значительной степени поражения мышц тазового пояса у больных наблюдается «утиная» походка: они ходят переваливаясь к боку на бок. Поднимаясь из горизонтального положения, больной из-за мышечной слабости с трудом переворачивается на живот, затем, упираясь руками в пол, становится на
Тема 3. Нервно-мышечные заболевания четвереньки и после этого, упираясь руками в голени, затем в бедра, постепенно выпрямляется. Поражение мышц плечевого пояса проявляется их слабостью и атрофией, характерны «крыловидные лопатки», особенно при поднятии руки вверх, деформация грудной клетки. Чувствительных нарушений нет, рефлексы обычно снижаются умеренно.
Миодистрофия Дюшена уже в раннем детском возрасте проявляется отставанием физического развития: больные дети позднее начинают ходить, обычно плохо бегают и прыгают. Мышечная слабость преобладает в проксимальных отделах ног и тазовом поясе, изменения походки обычно обнаруживаются в возрасте 2-5 лет. Икроножные мышцы, иногда четырехглавые мышцы бедра и дельтовидные, как правило, увеличены в размере и уплотнены за счет разрастания соединительной ткани (псевдогипертрофия), однако их сила снижена. Другие мышцы бедер, тазового и плечевого пояса атрофируются на ранних стадиях заболевания. Постепенно процесс принимает восходящее направление и распространяется на плечевой пояс, мышцы спины, а затем и на проксимальные отделы рук. Часто страдает сердечная мышца по типу кардиомиопатии. У многих больных снижен интеллект. К 10 годам дети уже ходят с трудом, а к 15 годам они, как правило, полностью обездвижены. Больные умирают на 2-3-м десятилетии жизни вследствие сердечной недостаточности или легочных осложнений.
Диагноз основывается на клинических данных и подтверждается повышением (в 10-100 раз) активности креатинфосфокиназы в сыворотке крови и изменениями при электромиографии, характерными для миопатии (снижение длительности и амплитуды потенциалов двигательных единиц, отсутствие признаков поражения периферических нервов или мотонейронов передних рогов спинного мозга). В неясных случаях проводят биопсию мышц, которая выявляет диффузную гибель мышечных волокон и их замещение жировыми и фиброзными клетками. Большое значение имеет лабораторно-генетическое обследование.
У матерей больных детей (носительниц патологического гена) обычно слегка снижена мышечная сила, увеличены
икроножные мышцы и повышена активность креатинфосфокиназы в сыворотке крови.
Лечение. Эффективного лечения нет. Ведение больного направлено на предотвращение развития контрактур, поддержание мышечной силы и продление периода самостоятельного передвижения. Рекомендуются регулярные занятия лечебной гимнастикой (но без значительной нагрузки), массаж и при необходимости ортопедические мероприятия.
Медико-генетическое консультирование имеет большое значение для предупреждения рождения больных детей. Пренатальное определение пола и диагностика заболевания плода в пораженных семьях позволяют рассматривать вопрос о прекращении беременности.
Полиомиозит
Полиомиозит — наиболее частая форма приобретенных миопатий в целом. Частота заболевания составляет около 1 случая на 100 тыс. населения.
Патогенез. Предполагается аутоиммунный характер по-лиомиозита с Т-клеточной агрессией, направленной на мышечные волокна. В 30-50% случаев полимиозит развивается на фоне системных заболеваний (системной красной волчанки, узелкового периартериита, ревматоидного артрита, склеродермии). В 10-30% случаев полимиозит сочетается со злокачественным новообразованием (обычно рак легкого или толстой кишки у мужчин, рак молочной железы и яичников у женщин) и расценивается как паранеопластический синдром.
Клиническая картина. Полиомиозит чаще возникает в среднем и пожилом возрасте. Характерно постепенное, в течение недель, нарастание слабости в проксимальных отделах конечностей, мышцах плечевого и тазового пояса. Слабость ног проявляется затруднением подъема по лестнице, вставания из глубокого кресла, с колен или корточек. При поражении мышц плеч и проксимальных отделов рук больному сложно поднять руки выше головы: причесать волосы или положить какой-либо предмет на верхнюю полку.
Из-за слабости задних мышц шеи больным бывает трудно удерживать голову, возможно присоединение дисфагии и дисфонии. Сухожильные рефлексы в паретичных конечностях лишь слегка ослаблены, атрофия обычно не выражена. Иногда отмечаются боль в мышцах и их болезненность при пальпации. Нередко сочетается с поражением кожи — дерматомиозитом.
Диагноз. Диагноз основывается на клинических данных и подтверждается результатами электромиографии. Характерно повышение активности креатинфосфокиназы, аминотрансфераз и альдолазы в сыворотке крови, а также увеличение СОЭ. Гистологическое исследование биоптата мышц обнаруживает воспалительный характер изменений. При обследовании больного с полиомиозитом необходим тщательный онкологический поиск.
Лечение. Длительно (обычно не менее 4-8 нед.) используют преднизолон из расчета 1 мг/кг (обычно 60-80 мг/сут) до достижения клинического эффекта, оцениваемого по уменьшению степени пареза и снижению активности креатинфосфокиназы. В дальнейшем постепенно уменьшают дозу на 5 мг каждую неделю до 20 мг/сут, которую сохраняют в течение 6-12 мес.; при обострении заболевания дозу вновь увеличивают. При отсутствии эффекта от перорального приема преднизолона можно его сочетать с цитостатиками — азатиоприном (150-300 мг/сут) или метотрексатом (25-30 мг/нед. в/в), а также использовать пульс-терапию метилпреднизолоном по 1000 мг/сут в/в в течение 3-5 дней с последующим переходом на пероральный прием преднизолона и цитостатика.
В большинстве случаев через 1-2 мес. лечения наблюдается нарастание мышечной силы, уменьшение степени пареза. Примерно в 20% случаев отмечается полный регресс неврологических нарушений, в большинстве остальных случаев — значительное улучшение состояния. Прогноз при идиопатических формах в целом относительно благоприятный — в течение 10 лет умирают только 10% больных, прогноз хуже при наличии злокачественного новообразования или тяжелого системного заболевания.
Таблица 3.1
Краткие сведения о некоторых нервно-мышечных заболеваниях
Краткие сведения Миастения Полиомиозит Миодистрофия Дюшена
Патогенез Аутоиммунное заболевание с образованием антител к постсинаптической мембране нервно-мышечного синапса Аутоиммунное заболевание с образованием антител к мышечным волокнам Заболевание наследуется по рецессивному сцепленному с Х-хромосомой типу
Клиническая картина Слабость мышц и их патологическая утомляемость часто возникают вначале в глазных мышцах (двоение, опущение век), а затем у большинства (85 % больных) распространяются на другие мышцы, приводя к парезам конечностей, дисфагии, дизартрии, дис-фонии и нарушениям дыхания. Возможны резкие ухудшения состояния — миастенические кризы Заболевание чаще возникает в среднем и пожилом возрасте. Характерно постепенное нарастание слабости в проксимальных отделах конечностей, мышцах плечевого и тазового пояса. В 30-50% случаев полиомиозит возникает на фоне системных заболеваний (системная красная волчанка и др.), в 10-30% случаев сочетается со злокачественным новообразованием Заболевание проявляется у мальчиков в раннем детском возрасте: дети плохо бегают и прыгают. мышечная слабость преобладает в проксимальных отделах ног и тазовом поясе. Постепенно парезы распространяются на плечевой пояс, мышцы спины, а затем и на проксимальные отделы рук. Часто выявляется кардиомиопатия. Больные дети к 15 годам, как правило, полностью обездвижены и умирают на 2-3-м десятилетии жизни
Электромиография Снижение амплитуды и длительности двигательных единиц Снижение амплитуды и длительности двигательных единиц, их полифазия, денервационная активность Снижение амплитуды и длительности двигательных единиц
Окончание табл. 3.1
Краткие сведения Миастения Полиомиозит Миодистрофия Дюшена
Элек-троней-ромио-графия Снижение амплитуды повторных мышечных ответов при ритмической стимуляции 3-10 имп./с Изменения отсутствуют Изменения отсутствуют
Креа-тинфос-фоки-наза в сыворотке крови Обычно в норме Умеренное повышение Значительное повышение
Другие исследования Положительная прозериновая проба, в сыворотке крови — антитела к постсинаптической мембране, КТ средостения для выявления тимомы Онкологический поиск, при биопсии мышц — воспалительные изменения При биопсии мышц — диффузная гибель мышечных волокон, лабораторно-генетические исследования
Лечение Антихолинэсте-разные средства (калимин, про-зерин), кортикостероиды (преднизолон), цитостатики, плазмаферез, иммуноглобулин, удаление тимомы Кортикостероиды (преднизолон), цитостатики. Хороший эффект при лечении идиопатических форм заболевания Лечебная гимнастика, симптоматическое лечение
Спинальные амиотрофии
Спинальные амиотрофии — наследственные заболевания с прогрессирующим вялым парезом и атрофией мышц вслед
ствие поражения нейронов передних рогов спинного мозга. В мышцах могут наблюдаться фасцикуляции, чувствительных расстройств не бывает. Разные типы спинальных амио-трофий отличаются главным образом возрастом пациентов, в котором они начинаются, скоростью прогрессирования и типом наследования. Диагноз подтверждается ЭМГ, биопсией мышц и данными лабораторного генетического исследования. Эффективного лечения нет, большое значение имеет лечебная гимнастика.
Спинальная амиотрофия I типа (болезнь Верднига— Гоффмануа) — аутосомно-рецессивное заболевание с частотой 4-10 случаев на 100 тыс. новорожденных. Начинается в первые полгода жизни, быстро прогрессирует, 95 % больных умирают в возрасте до 1 года.
Спинальная амиотрофия II типа — более редкое аутосомно-рецессивное заболевание, возникает между 3 и 15-м мес. с момента рождения. Прогрессирование менее быстрое, большинство больных умирают до 4-5 лет.
Спинальная амиотрофия III типа (болезнь Кугельберга-Веландер) — аутосомно-рецессивное или аутосомно-до-минантное заболевание, возникает в возрасте от 15 мес. до 10 лет. Заболевание медленно прогрессирует, больные длительно сохраняют способность самообслуживания и даже иногда работоспособность. Смерть наступает обычно в зрелом возрасте от присоединяющихся инфекционных, чаще легочных, заболеваний.
Спинальная амиотрофия IV типа (спинальные ами-отрофии взрослых) — редкие формы заболевания, имеющие аухрсомно-рецессивный, аутосомно-доминантный или Х-сцепленный рецессивный тип наследования. Проявляются чаще в возрасте 30-40 лет, медленно прогрессируют, существенно не влияют на продолжительность жизни.
Боковой амиотрофический склероз
Боковой амиотрофический склероз (болезнь двигательного нейрона) — быстро прогрессирующее заболевание нервной системы, вызванное избирательной дегенерацией двигате ть-
ных нейронов спинного мозга, коры и ствола головного мозга. Частота заболевания 1-5 случаев на 100 тыс. населения. Примерно 5 % случаев заболевания наследуются по аутосомно-доминантному типу, в некоторых из них обнаруживается недостаточность фермента супероксиддисмутазы. Болезнь чаще возникает в 50-70 лет.
Клиническая картина. Заболевание развивается постепенно, проявляясь слабостью мышц конечностей, мышечными подергиваниями (фасцикуляции) и локальной атрофией мышц или нарушением глотания (дисфагия) и речи (дизартрия). Первыми симптомами часто являются слабость и похудание мышц кисти в сочетании со спазмом и фасци-куляцией мышц руки или слабость в одной ноге в виде свисающей стопы. На ранних стадиях нередко отмечаются преимущественно периферические (вялые) парезы или реже центральные (спастические) парезы конечностей. Однако при прогрессировании болезни у большинства больных наблюдается сочетание периферического и центрального пареза: грубая атрофия мышц верхних и нижних конечностей и фасцикуляции в них при высоких сухожильных рефлексах и патологических симптомах (Бабинского, Россолимо и других). Также характерно сочетание бульбарного и псев-добульбарного синдромов: дизартрия, дисфония, дисфагия, атрофия и фибрилляции языка при оживлении нижнечелюстного и глоточного рефлексов, симптомах орального автоматизма. Снижения интеллекта, нарушений чувствительности и функции тазовых органов не наблюдается даже на поздних стадиях заболевания.
Большинство (90%) больных умирают в среднем через 3 года после начала заболевания, как правило, от дыхательных нарушений и присоединяющейся, часто аспирационной, пневмонии. У остальных наблюдается более медленное течение болезни.
Диагноз основывается на клинических данных и подтверждается электромиографией, при которой выявляются денервационная активность (потенциалы фибрилляций, положительные острые волны, фасцикуляции), значительное увеличение амплитуды и длительности двигательных еди
ниц. КТ или МРТ головного и спинного мозга проводят для исключения других заболеваний нервной системы.
Лечение. Эффективного лечения нет. Применение ри-лузола (рилутека) по 100 мг в сутки несколько задерживает прогрессирование болезни и продлевает жизнь больных на несколько месяцев. В качестве симптоматической терапии при спастичности можно использовать миорелаксанты (10-30 мг баклофена, 6-18 мг сирдалуда в сутки), при болезненных мышечных спазмах ног (крампи) — 300 мг дифенина или 10—20 мг реланиума в сутки, при депрессии и насильственном плаче — 25-50 мг амитриптилина на ночь, при нарушении глотания — 90-180 мг калимина в сутки.
Таблица 3.2
Краткие сведения о боковом амиотрофическом склерозе
Краткие сведения Боковой амиотрофический склероз
Патогенез Гибель двигательных нейронов спинного мозга, ствола мозга и коры больших полушарий
Клиническая картина Сочетание периферического (с фасцикуляциями, выраженной атрофией) и центрального пареза конечностей, сочетание бульбарного и псевдо-бульбарного синдромов, быстро прогрессирующее течение
Диагноз Основывается на клинической картине, данных электромиографии, отсутствии других заболеваний спинного и головного мозга по данным КТ и МРТ
Лечение Симптоматическое
Тема 4
Рассеянный склероз. Острый рассеянный энцефаломиелит
Рассеянный склероз
Рассеянный склероз — заболевание центральной нервной системы, с нарушением функций головного, спинного мозга и зрительного нерва, возникающее чаще в молодом возрасте и проявляющееся повторными обострениями и/или хроническим прогрессирующим течением. При заболевании поражается преимущественно миелин, нейроны и их аксоны остаются относительно сохранными на ранних стадиях патологического процесса (демиелинизирующее заболевание).
В России рассеянным склерозом страдают более 100 тыс. человек, заболеваемость увеличивается в направлении с юга на север и в меньшей степени с востока на запад.
Патогенез. Этиология неизвестна, у больных рассеянным склерозом определенные антигены гистосовместимости обнаруживаются чаще, чем в популяции в целом. В патогенезе важная роль отводится иммунологическим нарушениям. Предполагается, что начальным этапом может стать перенесенная в раннем детстве вирусная инфекция (до сих пор не установлена точная роль какого-либо вируса). Согласно другой теории, имеет место первичная аутоиммунная патология. Развертывающийся аутоиммунный процесс вызывает клеточно-опосредованный воспалительный процесс в миелине и приводит к его разрушению, которое может быть как обратимым вследствие последующего восстановления миелина (ремиелинизация), так и приводить к образованию
склеротических бляшек (развитие глиальной ткани) в зонах пораженного миелина. Страдают и аксоны нервных проводников, с чем в большей степени связан устойчивый неврологический дефицит — парезы, атаксия, чувствительные и тазовые расстройства.
В головном и спинном мозге при рассеянном склерозе имеются множественные, различные по величине (от нескольких миллиметров до нескольких сантиметров) очаги разрушения миелина. Очаги поражения возникают преимущественно вокруг желудочков головного мозга, в белом веществе спинного мозга, мозжечка, ствола головного мозга, а также в зрительных нервах. Нейроны не повреждаются. На месте одного или нескольких старых поражений иногда возникают полости вследствие полного разрушения миелина, аксонов и кровеносных сосудов.
Клиническая картина. Симптомы заболевания появляются обычно в возрасте 16-50 лет (чаще в 20-35 лет), редко в детском возрасте или после 50 лет. Женщины болеют чаще чем мужчины (1,7:1). Для заболевания характерно волнообразное течение с периодами обострений и ремиссий.
Обострение рассеянного склероза проявляется чаще постепенным (в течение нескольких дней) развитием очаговых неврологических нарушений с нарастанием их степени, но изредка (примерно в каждом пятом случае) возможно быстрое, в течение нескольких часов, возникновение выраженных неврологических расстройств. При первом обострении нередко отмечается одно неврологическое нарушение, но может быть и сочетание этих нарушений. Чаще всего это центральный парез одной или обеих ног, нарушение чувствительности по проводниковому типу, мозжечковая атаксия, двоение или ретробульбарный неврит зрительного нерва. После первого обострения обычно следует ремиссия. Повторное обострение проявляется прежними симптомами или новыми нарушениями.
Примерно у 25 % больных первое обострение проявляется ретробульбарным невритом зрительного нерва. В течение нескольких часов или дней развиваются снижение зрения или слепота на один глаз и боль при движении глазного
яблока. Затем у большинства больных зрение полностью или частично восстанавливается. Многие больные наблюдаются только офтальмологом с диагнозом ретробульбарный неврит зрительного нерва, диагноз рассеянного склероза обычно ставят только через несколько лет, когда у больного возникают обострения с другими неврологическими нарушениями.
У больных возможны различные неврологические нарушения, но чаще наблюдаются центральный парез в конечностях (обычно с преобладанием в ногах), атаксия (чаще мозжечковая), глазодвигательные расстройства, нистагм, снижение остроты зрения, нарушение функции тазовых органов (императивные позывы на мочеиспускание, недержание или задержка мочи, запор, импотенция), расстройство чувствительности по проводниковому типу. Парез на ранней стадии часто проявляется только преходящей слабостью и повышенной утомляемостью в ногах, изменениями в рефлекторной сфере (оживление сухожильных рефлексов, клонус стоп, отсутствие брюшных рефлексов, патологические кистевые и стопные рефлексы). Характерно колебание состояния, мерцание симптомов в течение одного дня, ухудшение состояния после физической нагрузки и в жаркую погоду или после приема горячей ванны.
Течение рассеянного склероза может быть не только волнообразным с периодами ремиссий и обострений (около 80 % случаев в начале заболевания), но и первично прогрессирующим (около 20% случаев). При волнообразном течении после обострения может наблюдаться полный или частичный регресс неврологических нарушений, и затем следует ремиссия различной длительности (до нескольких лет). Первые обострения обычно сопровождаются лучшим восстановлением, а последующие приводят к более стойким нарушениям. Прогрессирующее течение может быть изначально или со временем сменить волнообразное течение либо сочетаться с ним (вторично прогрессирующее течение). Во многих случаях чередование обострений и ремиссий незаметно сменяется вторично прогрессирующим течением. При развитии заболевания в зрелом возрасте чаще встре
чается первично прогрессирующее течение заболевания без явных обострений и ремиссий.
У 20% больных наблюдается доброкачественное течение и может длительно (10-20 лет и более) сохраняться трудоспособность. Однако у большинства больных постепенно нарастают неврологические расстройства, приводя к инвалидности. В среднем через 10 лет от начала заболевания только 50% больных сохраняет способность к самостоятельному передвижению, остальные полностью «прикованы» к инвалидной коляске или могут передвигаться на ограниченные расстояния. Инвалидизация больных может быть вызвана не только центральным парезом конечностей, но и атаксией, недержанием мочи, потерей зрения вследствие атрофии зрительного нерва и различным сочетанием этих нарушений. На поздних стадиях заболевания (в среднем через 20-25 лет) у значительной части больных отмечаются снижение памяти и внимания, депрессия или эйфория, снижение критики к своему состоянию. Рассеянный склероз сокращает жизнь в среднем на 10 лет, смерть чаще наступает от присоединяющихся сочетанных заболеваний (пневмония, воспалительные заболевания почек с почечной недостаточностью и др.), связанных с обездвиженностью пациента.
Сравнительно редко наблюдаются злокачественные формы заболевания (обычно при поражении ствола мозга), при которых смертельный исход наступает в течение нескольких месяцев или лет. В редких случаях болезнь протекает бессимптомно и изменения в головном (или спинном) мозге обнаруживаются случайно при МРТ.
Диагноз рассеянного склероза основывается на наличии симптомов нескольких очагов поражении головного, спинного мозга и зрительных нервов, волнообразного (с периодами обострений и ремиссий) или хронического прогрессирующего течения заболевания, а также на отсутствии других заболеваний (инфекционных, опухолевых и др.), которые могут проявляться сходной клинической картиной. Диагноз нередко вызывает сложности в дебюте заболевания при наличии одного очага поражения в спинном или головном мозге. Большое значение в диагностике заболевания
имеет МРТ, которая выявляет многофокусное поражение белого вещества головного и спинного мозга и позволяет исключить другие заболевания центральной нервной системы. Поражения белого вещества лучше видны при МРТ в определенных режимах (Т2 и Flair изображения). КТ во многих случаях не выявляет поражения головного и спинного мозга у больных рассеянным склерозом, поэтому не рекомендуется при подозрении на рассеянный склероз. Использование контрастного вещества (гадолиний) при МРТ позволяет отличить свежие очаги поражения по накоплению в них контраста.
Исследование вызванных потенциалов мозга (зрительных, слуховых, соматосенсорных) может выявить замедленное проведение возбуждения в различных отделах головного и спинного мозга, что подтверждает действительно многофокусное поражение центральной нервной системы. В цереброспинальной жидкости у многих (около 80%) больных обнаруживают небольшой плеоцитоз (увеличение числа лимфоцитов более 5 клеток в 1 мкл) и/или повышение уровня у-глобулинов. С помощью электрофореза цереброспинальной жидкости можно выявить олигоклональные фракции иммуноглобулина, что имеет большое значение в диагностике неясных случаев и в определенной степени позволяет судить об активности патологического процесса.
Лечение. В период обострения рассеянного склероза используют кортикостероиды (преднизолон, метилпреднизолон). Наиболее эффективно в/в введение метилпреднизолона в суточной дозе 500-1000 мг в течение 3-7 дней, после которого можно принимать препарат внутрь по 60-80 мг/сут в течение 5-7 дней с последующим уменьшением дозы на 5 мг каждые 2 дня до полной отмены. Возможно использование преднизолона по 60-80 мг/сут в течение 10-14 дней с последующим снижением дозы на 5 мг каждые 2 дня до полной отмены. В период тяжелых обострений можно сочетать кортикостероиды с плазмафёрезом/а при неэффективности лечения использоватЬ(Щ1ТГОстатикйГ(азатиоприн, метоксан-трон и др.). Применение кортикостероидов снижает продолжительность обострения, но, к сожалению, не уменьшает
степень неврологических расстройств и не предупреждает дальнейшие обострения.
Для возможной профилактики обострений и связанного с этим уменьшения неврологического дефицита показан p-интерферон 1b (бетаферон п/к через день) или 1а (авонекс в/м раз в неделю или ребиф п/к три раза в неделю) либо кополимер-1 (копаксон п/к ежедневно). Применение этих иммуномодулирующих препаратов снижает частоту обострений на ’/3, уменьшает их тяжесть, а также количество новых очагов поражения головного мозга по данным МРТ, но высокая стоимость этих препаратов ограничивает их широкое использование. При неуклонно прогрессирующем течении заболевания, кроме бетаферона, можно использовать цитостатики (азатиоприн, метоксантрон и др.) или 5-7 сеансов плазмафереза.
В качестве симптоматической терапии у болвных рассеянным склерозом со значительными спастическими парезами или параличами может быть эффективно применение антиспастических средств — баклофена, мидокалма и сир-далуда, начиная с небольших доз (10 мг баклофена, 300 мг мидокалма, 4-6 мг сирдалуда в сутки), индивидуально подбирая оптимальную суточную дозу. Лечебная гимнастика способствует профилактике контрактур паретичных конечностей и может улучшить двигательную активность больных, однако целесообразны только легкие, не вызывающие переутомления физические нагрузки. Тремор иногда уменьшается при приеме пропранолола (40-60 мг/сут), клоназепама (0,5-6 мг/сут) или диазепама (5-15 мг/сут). Частая утомляемость снижается при рациональной организации физических нагрузок и приеме амантадина (миданатан) по 100 мг 2 раза в день. При нарушении мочеиспускания больным рекомендуется регулировать употребление жидкости и стараться опорожнять мочевой пузырь в определенное время; при задержке мочи может понадобиться катетеризация мочевого пузыря. В случаях недержания мочи применяют средства, снижающие гиперрефлексию детрузора мочевого пузыря — детрузитол по 2-4 мг/сут или дриптан (оксибу-тинин) по 5-10 мг/сут.
Для профилактики обострений больным рекомендуется избегать инфекционных заболеваний (при их развитии пройти полный курс лечения желательно на постельном режиме), физической перегрузки, инсоляции. Больным не показаны тепловые процедуры, бальнеотерапия. Обострения в период беременности возникают сравнительно редко, но в течение года после ее разрешения их вероятность существенно возрастает, о чем должны быть информированы женщины детородного возраста, страдающие рассеянным склерозом.
Острый рассеянный энцефаломиелит
Острый рассеянный энцефаломиелит относится к группе демиелинизирующих заболеваний центральной нервной системы. Это заболевание по патогенезу, морфологии поражения центральной нервной системы и клинической картине напоминает обострение рассеянного склероза, но встречается значительно реже последнего. Предполагается аутоиммунная природа острого рассеянного энцефаломиелита.
Симптомы обычно развиваются в течение нескольких часов или дней после вирусной (корь, краснуха, ветряная оспа) или, значительно реже, бактериальной инфекции либо применения определенных вакцин. Выделяют формы с преимущественным поражением полушарий или ствола головного мозга (церебральная), мозжечка (мозжечковая) либо спинного мозга (спинальная). При МРТ выявляют изменения, сходные с рассеянным склерозом. В цереброспинальной жидкости в большинстве случаев бывает плеоцитоз.
Большинство больных выживают, у них хорошо восстанавливаются утраченные неврологические функции. В редких случаях при обширном поражении головного мозга наступает смерть в течение нескольких дней.
Как и при обострении рассеянного склероза, наиболее часто в лечении используют кортикостероиды, реже плазмаферез. Метилпреднизолон вводят в/в капельно в суточной дозе 500-1000 мг в течение 3-7 дней, после которого назначают пероральный прием препарата по 60-80 мг/сут в
течение 5-7 дней с последующим уменьшением дозы на 5 мг каждые 2 дня до полной отмены.
Повторные обострения после перенесенного острого рассеянного энцефаломиелита не возникают, что принципиально отличает это заболевание от рассеянного склероза.
Таблица
Краткие сведения о рассеянном склерозе
Патогенез Аутоиммунное заболевание с поражением миелина центральной нервной системы
Клиническая картина Дебют заболевания обычно в молодом возрасте (16-50 лет, чаще 20-35 лет). Течение заболевания волнообразное с периодами обострений и ремиссий и/или хроническое прогрессирующее
Очаговые неврологические нарушения: центральный парез в конечностях (обычно с преобладанием в ногах), атаксия (чаще мозжечковая), глазодвигательные расстройства, снижение остроты зрения (ретробульбарный неврит зрительного нерва), нарушение функции тазовых органов, расстройство чувствительности по проводниковому типу
МРТ Многофокусное поражение белого вещества головного и спинного мозга, которое лучше определяется в режимах Т2 и Flair-изображения
Вызванные потенциалы головного мозга Замедленное проведение возбуждения в различных отделах головного и спинного мозга
Цереброспинальная жидкость Небольшой лимфоцитарный плеоцитоз и/или повышение уровня у-глобулинов, при электрофорезе оли-гоклональные фракции иммуноглобулина
Лечение В период обострения — кортикостероиды (метилпреднизолон по 500-1000 мг/сут в течение 3-7 дней). Для профилактики обострений — иммуномодулирующие средства: бетаферон п/к через день, авонекс в/м 1 раз в неделю, ребиф п/к 3 раза в неделю или копак-сон п/к ежедневно. Симптоматическая терапия
Тема 5
Инфекционные заболевания нервной системы
Поражение нервной системы возможно бактериями и вирусами, а также спирохетами, грибами и паразитами. Инфекционные возбудители могут проникать в головной мозг гематогенным (при септицемии или инфекционной эмболии) или контактным путем (из инфицированных отделов черепа, ушей, синусов), а также при открытых травмах черепа или хирургическом вмешательстве.
Энцефалит
Энцефалит — заболевание головного мозга, вызванное инфекционным (преимущественно вирусным) поражением. Выделяют первичный и параинфекционный энцефалит. При первичном энцефалите инфекционный агент (нейротропный вирус) проникает через гематоэнцефалический барьер и непосредственно поражает головной мозг. При параинфекци-онном энцефалите на фоне системной инфекции возникают микрососудистые поражения и диффузная демиелинизация головного мозга вследствие аутоиммунных реакций.
Этиология. Первичные энцефалиты вызываются вирусом простого герпеса, опоясывающего герпеса, цитомегаловирусом, энтеровирусами, арбовирусами (вирус клещевого энцефалита, вирус комариного энцефалита и др.), микоплазмой и др. Параинфекционный энцефалит может возникать при кори, краснухе, эпидемическом паротите, гриппе и других инфекционных заболеваниях. Вне эндемических
областей и периода эпидемий энцефалит наиболее часто бывает вызван вирусом простого герпеса. Ежегодно отмечается 2-4 случая герпетического энцефалита на 1 млн человек.
Клиническая картина. Первыми симптомами энцефалита обычно являются повышение температуры тела и головная боль. В дальнейшем быстро (в течение нескольких дней) присоединяются менингеальные симптомы, нарушается сознание от легкой оглушенности до комы, могут возникать различные неврологические нарушения (афазия, центральный парез конечностей, атаксия и др.) и/или эпилептические припадки.
Продолжительность заболевания от 2-х нед. до нескольких месяцев. Летальность в острой стадии более 10%. У части выживших больных остаются стойкие неврологические нарушения (деменция, афазия, центральный парез конечностей и др.) и/или формируется симптоматическая эпилепсия.
Диагноз основывается на клинико-анамнестических данных и подтверждается люмбальной пункцией: повышенное давление цереброспинальной жидкости и лимфоцитарный плеоцитоз (чаще 10-100 клеток в 1 мкл). КТ и МРТ головы позволяют исключить такое поражение головного мозга, как опухоль, абсцесс, и спустя 2-3 дня с начала заболевания обычно выявляют множественные воспалительные очаги в головном мозге. Определяют возбудителя болезни бактериологическим и серологическим исследованием. Экспресс-диагностика с помощью полимеразной цепной реакции позволяет установить возбудителя уже в первые дни заболевания. Однако в части случаев выявить возбудителя не удается, и диагноз основывается на данных клиники, ликворологического исследования, КТ или МРТ головы.
Для герпетического энцефалита характерны эпилептические припадки, поведенческие нарушения, обонятельные и вкусовые галлюцинации, расстройства памяти, афазия, центральный парез конечностей. Во многих случаях быстро развивается сопор, а затем и кома. При электроэнцефалографии часто наблюдаются периодические высокоамплитудные острые волны и медленно-волновые комплексы 2-3 кол./с
в височных отведениях. Летальность достигает 40 %, а при отсутствии лечения — 50-70%. У большинства из выживших больных остаются стойкие неврологические нарушения и/или развивается симптоматическая эпилепсия.
Клещевой весенне-летний энцефалит регистрируется преимущественно на Дальнем Востоке и в Сибири, реже в Европейской части страны. Заболевание возникает после укуса клеща или при употреблении сырого козьего молока, содержащего вирус клещевого энцефалита. Оно чаще регистрируется в весенне-летний период. Инкубационный период составляет 8-20 дней. Заболевание обычно начинается с подъема температуры тела до 39-40 °C, озноба, сильной головной боли, тошноты и рвоты. На 2-4-й день присоединяются менингеальные симптомы, а затем наиболее часто возникает периферический парез в мышцах шеи, плечевого пояса и проксимальных отделах рук. Из-за слабости мышц развивается «свисающая» голова. Возможны и другие неврологические нарушения: бульбарный синдром с дизартрией и атрофией языка, центральный парез конечностей, гиперкинезы, полирадикулоневритический синдром. На Дальнем Востоке нередко отмечается тяжелое течение заболевания, которое почти в 30 % случаев приводит к летальному исходу. Однако у большинства больных температура тела обычно снижается на 5-7-й день заболевания. В конце 2-й нед. начинается постепенное восстановление, которое приводит к полному или частичному регрессу двигательных нарушений. Наиболее часто остаются слабость и атрофия в мышцах шеи и плечевого пояса. У некоторых больных развивается ко-жевниковская эпилепсия: миоклонические подергивания в определенных группах мышц, на фоне которых периодически возникают большие судорожные (тонико-клонические) припадки.
Лечение. При герпетическом энцефалите и любом энцефалите, в развитии которого можно предположить роль вируса простого герпеса, используется в/в медленное введение ацикловира 3 раза в сутки по 10 мг/кг. Продолжительность лечения составляет 10-14 сут. Раннее начало лечения (до развития нарушений сознания) значительно снижает
летальность и выраженность остаточных неврологических нарушений.
При клещевом энцефалите применяют гомологичный у-глобулин (титрованный против вируса клещевого энцефалита) или сывороточный иммуноглобулин (получаемый из плазмы доноров). Для профилактики заболевания используют тканевую инактивированную вакцину. При укусе клеща вводят противоклещевой у-глобулин.
При всех энцефалитах проводится также симптоматическая терапия (анальгетики при головной боли), а при развитии эпилептических припадков назначаются противо-эпилептические средства.
Абсцесс головного мозга
Абсцесс головного мозга представляет очаговое скопление гноя в веществе головного мозга. Он возникает в тех редких случаях, когда некроз ткани головного мозга одновременно сочетается с ее бактериальным инфицированием.
Этиология. В 40 % случаев абсцесс головного мозга развивается вследствие распространения инфекции из гнойных очагов в среднем ухе, околоносовых пазухах или сосцевидном отростке. В 1 /3 случаев он возникает гематогенным путем у больных с гнойными заболеваниями легких, врожденными пороками сердца, острым инфекционным эндокардитом или другими внечерепными очагами инфекции вследствие заноса инфицированного эмбола в мозг. В небольшой части случаев абсцесс головного мозга представляет осложнение проникающей черепно-мозговой травмы или хирургической операции. Почти в 20 % случаев заболевания не удается выявить первичный очаг инфекции. Наиболее частые возбудители заболевания — стрептококк и стафилококк.
Клиническая картина. Головная боль — первый и наиболее частый симптом заболевания. В тяжелых случаях к ней присоединяются тошнота, рвота и спутанность сознания. В начале заболевания температура тела повышается у большинства больных, спустя 1-2 нед. она постепенно нормализуется. Очаговые симптомы поражения головного моз
га (афазия, центральный парез конечностей, атаксия и др.) возникают у многих больных, они нарастают постепенно и соответствуют локализации абсцесса. У части больных возникают парциальные или генерализованные эпилептические припадки. Во многих случаях инфекционные проявления (повышение температуры тела, лихорадка) не выражены, поэтому заболевание в большей степени напоминает опухоль, чем инфекционное поражение мозга. Летальность составляет 15-25%, однако при множественных абсцессах умирает почти 50% больных. Почти у 50% выживших сохраняются неврологические нарушения и/или развивается симптоматическая эпилепсия.
Диагноз основывается на клинико-анамнестических данных и результатах КТ или МРТ головы, которые выявляют один или несколько очагов поражения головного мозга. Люмбальная пункция не рекомендуется из-за высокого риска вклинения головного мозга при ее проведении. Для установления первичного очага инфекции проводят соматическое обследование (рентгеногорафия грудной клетки, эхокардиография, посев крови и др.).
Лечение. Используются антибиотики широкого спектра действия в больших дозах, например пенициллин из расчета 300 тыс. ЕД/кг в сутки внутривенно через каждые 2-4 ч. Для устранения отека мозга в острой стадии применяют маннитол или дексазон внутривенно. На ранней стадии заболевания лечение может быть консервативным, однако в большинстве случаев требуется хирургическая операция. При поверхностной локализации абсцесса его удаляют, при глубокой локализации дренируют его содержимое и вводят местно антибиотики.
Менингит
Менингит — острое инфекционное заболевание с преимущественным поражением паутинной и мягкой оболочек головного и спинного мозга.
Этиология. В зависимости от характера воспалительного процесса в оболочках мозга и вызванного им изме
нения цереброспинальной жидкости выделяют гнойный и серозный менингит. Наиболее частый возбудитель гнойного менингита у взрослых — пневмококк, менингококк, гемофильная палочка, у детей до 4 лет — гемофильная палочка, менингококк. В качестве редких возбудителей гнойного менингита могут обнаруживаться стрептококки, кишечная палочка, грибы, простейшие, микоплазмы, гельминты, риккетсии, амебы и другие возбудители. Серозный менингит вызывают чаще энтеровирусы (вирусы Коксаки и ECHO), реже — вирус эпидемического паротита, вирус герпеса и другие возбудители. Причиной серозного менингита могут быть также туберкулез, сифилис, ВИЧ-инфекция, бруцеллез.
Клиническая картина. Первый и наиболее частый симптом заболевания — головная боль, постоянная и распирающая, часто ощущается во всей голове и сочетается с рвотой. Вместе с головной болью появляются другие инфекционные проявления: повышение температуры тела, гиперемия лица, общее недомогание, учащение дыхание, тахикардия или брадикардия. При обследовании выявляются менигеальные симптомы. Очаговые неврологические симптомы возникают только при поражении вещества мозга (менингоэнцефалит) или черепных (чаще глазодвигательного или отводящего) нервов.
Течение гнойного менингита может осложниться повышением внутричерепного давления, эпилептическими припадками, артериальным и венозным тромбозом, субдуральным выпотом, гидроцефалией, нейросенсорной глухотой. Общая летальность при бактериальном менингите составляет около 10%. После перенесенного менингоэнцефалита могут остаться неврологические нарушения (деменция, афазия, центральный парез конечностей) и развиться симптоматическая эпилепсия.
Диагноз. В диагностике менингита, помимо клиникоанамнестических данных, решающее значение имеет исследование цереброспинальной жидкости. При серозном менингите жидкость прозрачная или слегка мутноватая, лимфоцитарный плеоцитоз — до 100 клеток в 1 мкл и более. При
Тема 5. Инфекционные заболевания нервной системы гнойном менингите цереброспинальная жидкость мутная, желто-зеленого цвета, нейтрофильный плеоцитоз до 1 тыс. клеток в 1 мкл и более. При остром менингите характерно повышение ликворного давления, плеоцитоз при умеренном повышении белка (клеточно-белковая диссоциация). Резкое снижение уровня глюкозы в цереброспинальной жидкости типично для гнойного бактериального менингита, а также туберкулезного и грибкового. Изменения в ликворе позволяют установить диагноз серозного или гнойного менингита, окончательный этиологический диагноз определяется только при помощи бактериологических, вирусологических и серологических исследований. У 10-30% больных не удается выявить возбудителя менингита.
Менингококковый менингит вызывают грамотри-цательные диплококки. Заболевание передается воздушно-капельным путем от больного человека или здорового носителя, бывает спорадическим, но иногда наблюдаются небольшие эпидемии; чаще болеют дети, особенно раннего детского возраста. Инкубационный период заболевания колеблется от 2 до 10 дней. Клиническая картина и изменения цереброспинальной жидкости при менингококковом менингите типичны для гнойного менингита. В тяжелых случаях на коже появляется геморрагическая сыпь, обычно в виде звездочек различной величины и формы, плотных на ощупь. Длительность заболевания при адекватном лечении составляет 2-6 нед. Тяжелые формы заболевания могут осложняться пневмонией, артритом, отеком мозга, эпилептическими припадками, синдромом диссеминированного внутрисосудистого свертывания и быстро приводить к летальному исходу.
Менингит, вызываемый гемофильной палочкой, — наиболее частый гнойный менингит у детей. У взрослых встречается реже и обычно как осложнение перелома костей черепа, острого синусита, среднего отита. Клиника и изменения цереброспинальной жидкости типичны для гнойного менингита. При отсутствии лечения у новорожденных летальность достигает 90 %. Длительность заболевания при адекватном лечении — 10-20 дней.
Пневмококковый менингит нередко возникает как осложнение при среднем отите, мастоидите, синусите, инфекционных заболеваниях верхних дыхательных путей. Клиника и изменения цереброспинальной жидкости типичны для гнойного менингита. На 3-4-й день заболевания на слизистой оболочке рта, реже на руках и туловище могут появиться герпетические высыпания, мелкая геморрагическая сыпь. Без лечения больные умирают на 5-6-й день заболевания, летальность при адекватном лечении составляет 20-30 %, она особенно высока, когда менингит развивается на фоне тяжелой пневмонии, абсцесса легкого или эмпиемы плевры.
Вирусный менингит в большинстве (90 %) случаев бывает вызван энтеровирусами. Чаще болеют дети, предполагается воздушно-капельный способ передачи инфекции. Инкубационный период составляет от 2 до 7 дней. Головная боль и общие инфекционные проявления менее выражены, чем при гнойном менингите. Менингеальные симптомы появляются на 2-3-й день заболевания. Изменения в цереброспинальной жидкости типичны для серозного менингита. Заболевание продолжается в 90% случаев 10-14 дней. Оно более длительно при возникновении рецидивов, однако и при них исход благоприятный.
Туберкулезный менингит чаще возникает при гематогенно-диссеминированном туберкулезе. Первичный очаг обычно локализуется в легких или бронхиальных лимфатических узлах. В большинстве случаев наблюдается медленное течение заболевания. В течение 2-3-х нед. постепенно нарастают головная боль, утомляемость, отмечается субфебрилитет. В дальнейшем появляются менингеальные симптомы, нередко возникает поражение глазодвигательных нервов. При менингоэнцефалите возможны афазия, центральный парез конечностей, эпилептические припадки и нарушение сознания. В цереброспинальной жидкости обнаруживаются лимфоцитарный плеоцитоз до 100-300 клеток в 1 мкл, низкое содержания глюкозы и высокое содержание белка. Микобактерии туберкулеза возможно выявлять в мазке из ликвора, окрашенном по Цилю—Нильсену. Летальность достигает
10 %, у 20-30 % выживших остаются стойкие неврологические нарушения в виде афазии, центрального пареза конечностей и симптомов поражения глазодвигательных нервов.
Лечение. Гнойный менингит требует неотложного лечения, каждый час задержки повышает риск осложнений и увеличивает вероятность смертельного исхода. Лечение основывается на антибиотикотерапии и должно быть начато после подтверждения диагноза результатами люмбальной пункции даже в тех случаях, когда возбудитель еще не установлен. Если возбудитель менингита не выявлен, то лечение обычно начинают с пенициллина, вводимого парентерально (в/в или в/м) через 3-4 ч в суточной дозе 18—24 млн ЕД из расчета 200-300 тыс. ЕД/кг (грудным детям — 300-400 тыс. ЕД/кг). В случае отсутствия эффекта и при исходно тяжелых формах суточная доза повышается до 48 млн ЕД в/в, при коматозном состоянии больного — до 64-80 млн ЕД в/в. При выявлении менингококка или пнево-мококка препараты выбора — пенициллин или ампициллин по 12-15 г/сут, при обнаружении гемофильной палочки — ампициллин по 12-15 г/сут или левомицетин по 4 г/сут. При отсутствии эффекта от этих антибиотиков или их непереносимости используют ванкомицин, цефалоридин и др. Продолжительность антибиотикотерапии не менее 10 дней или 7 дней после нормализации температуры. Улучшение состояния больного обычно наблюдается уже через 1-2 дня лечения. Большое значение имеют тщательная коррекция водно-электролитного дисбаланса, лечение синдрома диссеминированного внутрисосудистого свертывания при его развитии, применение маннитола или дексаметозона в случае отека головного мозга и повышения внутричерепного давления, использование противоэпилептических средств при эпилептических припадках, а также общий уход за больным. При выявлении очагов первичной инфекции показано их хирургическое лечение.
Лечение вирусного менингита симптоматическое; если выявлен вирус герпеса, показано лечение ацикловиром, как и при энцефалите. Лечение серозного менингита, вызванного сифилисом, бруцеллезом, ВИЧ-инфекцией, основывается
на лечении основной инфекции и проводится в специализированных больницах. При лечении туберкулезного менингита используют комбинацию: изониазид по 15 мг/кг в сутки (в сочетании с 25-30 мг пиридоксина для профилактики полиневропатии), рифампицин по 600 мг/сут и пиразина-мид по 30 мг/кг в сутки в течение 2-3 мес., а последующие 7 мес. — изониазид и рифампицин. При недостаточном эффекте добавляют стрептомицин по 1 г/сут в течение 1-3 мес. или этамбутол по 25 мг/кг в сутки в течение месяца, а затем по 15 мг/кг в стуки еще 1-3 мес.
Полиомиелит
Полиомиелит (эпидемический детский паралич) — острое вирусное заболевание с поражением двигательных нейронов спинного мозга и ствола головного мозга и периферическим параличом конечностей. Наиболее часто болеют дети в возрасте от 6 мес. до 10 лет.
Этиология. Заболевание вызывает вирус полиомиелита, реже — другие вирусы (ЕСНО-вирусы, вирус Коксаки, возбудитель паротита), что расценивается как полиомиелитоподобный синдром. Заражение обычно происходит алиментарным путем.
Клиническая картина. Инкубационный период колеблется от 3 до 35 дней, в среднем составляет 17 дней. Вначале обычно возникают общее недомогание, повышение температуры тела, желудочно-кишечные или катаральные дыхательные расстройства. Вслед за этим появляется головная боль, возможны менингеальные симптомы, а через 2-5 дней развиваются двигательные нарушения, которые нарастают в течение суток или нескольких дней. Нередко отмечаются фасцикуляции в мышцах. Периферический парез наиболее часто возникает в нижних конечностях, но может захватывать и мышцы туловища, шеи и рук. Больных часто беспокоят боль и спазмы в паретичных мышцах. При исследовании выявляются мышечная гипотония и арефлексия в конечностях. Степень двигательных нарушений варьирует от легкого пареза в одной конечности (чаще в ноге) до тетраплегии.
Постепенное восстановление двигательных функций обычно начинается уже к концу 1-й нед. с момента развития пареза. В 10-15% случаев возникают дыхательные нарушения и/ или расстройства глотания (бульбарный синдром). Летальность составляет 5-10% и обычно вызвана нарушениями дыхания, глотания. У многих больных, перенесших полиомиелит, остается парез разной выраженности, развивается атрофия в паретичных мышцах, в пораженных конечностях замедляется рост костей.
Диагноз. В период эпидемической вспышки диагноз основывается на клинических данных и обычно не вызывает сложностей. При спорадических случаях диагноз полиомиелита подтверждается вирусологическими исследованиями в крови и цереброспинальной жидкости, выделением вируса из зева, кала. В цереброспинальной жидкости обнаруживается умеренное повышение числа клеток, преимущественно лимфоцитов, и белка.
Лечение и профилактика. Лечение симптоматическое. Для уменьшения боли применяют ацетилсалициловую кислоту или другие анальгетики, для снятия мышечных спазмов — диазепам (седуксен), тизанидин (сирдалуд). При дыхательной недостаточности проводят искусственную вентиляцию легких. Для предупреждения контрактур мышц проводят лечебную гимнастику, массаж.
Профилактические прививки против полиомиелита привели к полному исчезновению заболевания во многих странах мира. Вакцину Сейбина, содержащую ослабленные живые вирусы, назначают внутрь новорожденным дважды с перерывом в 8 нед., с последующей ревакцинацией в возрасте 1 год и 4 года. Вероятность развития полиомиелита после прививки крайне мала (0,02—0.04 случая на миллион вакцинаций).
Спинальный эпидуральный абсцесс
Спинальный эпидуральный абсцесс (эпидурит) представляет очаговое гнойное воспаление эпидуральной клетчатки спинного мозга.
Этиология. Большинство случаев заболевания вызывается гематогенным путем из очагов гнойной инфекции в коже, глотке, легких, сердце, почках или органах малого таза. Возможно распространение инфекции контактным путем при остеомиелите позвоночника, ретроперитонеальном абсцессе, нагноении после хирургических вмешательств, абсцессе поясничной мышцы. В половине случаев эпидурит возникает на фоне иммунодепрессивных состояний различного генеза. В 20-30 % случаев заболеванию предшествует травма спины с образованием небольшой гематомы. Возбудители заболевания — стафилококк, реже грамотрицательные бактерии. Эпидуральный абсцесс чаще развивается в среднегрудном и нижнепоясничном отделах, где эпидуральное пространство лучше всего выражено. Абсцесс приводит к сдавлению спинномозговых корешков, а затем и спинного мозга.
Клиническая картина. Первые симптомы — повышение температуры тела, боль в спине на уровне поражения и местное напряжение мышц. Затем через 2-3 дня боль становится корешковой, опоясывающей при грудной локализации и иррадиирует в ногу при поясничной локализации абсцесса. Далее нарушается чувствительность по проводниковому типу ниже уровня поражения, возникают тазовые расстройства и центральный парез в ногах.
Диагноз основывается на клинических данных и требует подтверждения МРТ позвоночника. Если нет возможности ее провести, используют контрастную миелографию. При рентгенографии позвоночника иногда можно выявить остеомиелит. В крови отмечаются высокий лейкоцитоз и увеличение СОЭ.
Лечение. Требуется неотложное хирургическое лечение: ламинэктомия, удаление гнойника и дренирование. В течение 4-6 нед. антибиотики вводят в/в, затем 2-3 мес. перорально. Антибиотик должен соответствовать чувствительности высеянного возбудителя. Если он не известен, то терапия проводится с учетом наиболее вероятных возбудителей (стафилококк и грамотрицательные бактерии). Без операции болезнь заканчивается тяжелой инвалидностью или смертью. При своевременной комбинированной терапии
Тема 5. Инфекционные заболевания нервной системы (хирургическое лечение + антибиотики) прогноз хороший: большинство больных полностью выздоравливают.
Ботулизм
Ботулизм — заболевание нервной системы с нарушением нервно-мышечной передачи (нарушением высвобождения ацетилхолина из пресинаптической мембраны) вследствие действия токсина, продуцируемого Clostridium botulinum. Заболевание связано с употреблением в пищу продуктов, содержащих токсин (в большинстве случаев домашних консервов). При раневом ботулизме токсин образуется в некротических тканях. При ботулизме у грудных детей токсино-образование происходит в кишечнике, обусловливая почти 5% случаев внезапной смерти у новорожденных. Экзотоксин блокирует высвобождение ацетилхолина из пресинаптической мембраны и нарушает функционирование нервно-мышечных и вегетативных синапсов.
Клиническая картина. Симптомы появляются обычно через 8-36 ч после употребления пищи, содержащий токсин. У многих больных возникают тошнота, боль в животе, рвота и понос. Характерны глазодвигательные расстройства, мидриаз с отсутствием реакции зрачков на свет, нарушение глотания и дизартрия. Через 2-3 дня может появиться периферический парез мышц шеи и конечностей. В тяжелых случаях развиваются сердечная и дыхательная недостаточность, судороги и кома. Без лечения на 4-8-й день болезни погибают 70% больных. У детей до 6 мес. заболевание проявляется запором, мышечной слабостью и гипотонией с последующим нарушением сознания.
Диагноз основывается на клинико-анамнестических данных и подтверждается обнаружением токсина в крови, рвотных массах или испражнениях больного либо в использованных пищевых продуктах.
Лечение. Применяют промывание желудка, клизмы, вводят антиботулиническую трехвалентную сыворотку в дозах 20-40 тыс. ME 2-3 раза в сутки. При необходимости осуществляют искусственную вентиляцию легких, зондовое
кормление. Полное восстановление у выживших наблюдается в течение нескольких недель.
Поражение нервной системы при ВИЧ-инфекции
Вирус иммунодефицита человека (ВИЧ-инфекция) вызывает неврологические осложнения более чем у 50% больных. Примерно в 10% случаев неврологические нарушения представляют первые клинические признаки синдрома приобретенного иммунодефицита (СПИДа), оставаясь в некоторых случаях единственным проявлением заболевания до летального исхода. Приблизительно в */3 случаев у больных СПИДом возникают клинические признаки поражения центральной или периферической нервной системы, а при патологоанатомическом исследовании практически у всех больных обнаруживается повреждение ЦНС.
Из неврологических осложнений СПИДа наиболее часто встречаются энцефалопатия, миелопатия, энцефалит и менингит вследствие оппортунистической инфекции (токсоплазмоз, герпес, цитомегаловирус, криптококк и др.), поражения периферической нервной системы, лимфома и другие опухоли головного мозга, связанные со СПИДом. В раннюю фазу ВИЧ-инфекции (2-4 нед. после инфицирования) неврологические осложнения (менингит, менингоэнцефалит, миелопатия, невропатия) нередко полностью регрессируют в течение нескольких дней и недель. В период развернутой картины СПИДа они бывают стойкими, обычно прогрессируя и приводя к смерти больного.
Энцефалопатия (комплекс СПИД-деменция) возникает более чем у 50 % больных на фоне развернутой клинической картины СПИДа. Она проявляется нарастающими расстройствами памяти и внимания, апатией, заторможенностью и замедленностью мышления, приводящими к деменции. Возможны двигательные нарушения (атаксия, нижний центральный парапарез), изменения поведения с развитием психозов и эпилептические припадки. КТ и МРТ
Тема 5. Инфекционные заболевания нервной системы головы выявляет диффузные изменения белого вещества и атрофию, серологические исследования обнаруживают антитела к ВИЧ. Смерть наступает в среднем через полгода после развития деменции.
Миелопатия возникает изолированно или сочетается с энцефалопатией. Она проявляется центральным нижним парапарезом, утратой глубокой чувствительности в нижних конечностях, недержанием мочи.
Среди оппортунистических инфекций чаще встречается токсоплазмозный энцефалит, который проявляется головной болью и нарастающей неврологической симптоматикой (афазия, центральный гемипарез, атаксия и др.), эпилептическими припадками. КТ и МРТ головы выявляет один или несколько очагов, которые накапливают контрастное вещество по периферии в виде кольца. Церебральный токсоплазмоз обнаруживается при аутопсии у 15-30 % больных СПИДом. Цитомегаловирусный и герпетический энцефалит обычно проявляется эпилептическими припадками, спутанностью сознания, иногда психическими расстройствами. КТ и МРТ может обнаружить диффузное мелкоочаговое поражение головного мозга. Криптококковый менингит развивается остро или подостро с головной болью, тошнотой и лихорадкой, приводя постепенно к нарушению сознания. Диагноз оппортунистических инфекций при СПИДе подтверждают соответствующие исследования цереброспинальной жидкости и сыворотки крови. Их диагностика крайне важна, поскольку они, особенно церебральный токсоплазмоз, представляют наиболее излечимые неврологические осложнения при СПИДе.
Среди поражений периферической нервной системы чаще встречается сенсорная полиневропатия. Она возникает почти у */3 больных на поздней стадии СПИДа, проявляясь болью и парестезией в дистальных отделах конечностей. У 5-10% больных ВИЧ-инфекцией развивается опоясывающий герпес вследствие поражения спинномозговых корешков и ганлиев вирусом опоясывающего герпеса. Из других поражений периферической нервной системы при СПИДе
возможны невропатия лицевого нерва, острая и хроническая воспалительная демиелинизирующая полирадикулоневро-патия, вегетативная полиневропатия.
Лечение основывается на терапии ВИЧ-инфекции. Комбинация блокаторов транскриптазы (зидовудин и лами-вудин) с новыми ингибиторами протеаз такими, как индинавир, значительно уменьшает количество активных вирусов и удлиняет продолжительность жизни многих пациентов, однако не влияет на неврологические расстройства, за исключением прогрессирующей мультифокальной лейкоэнцефалопатии.
Во многих случаях более эффективно в отношении неврологических нарушений лечение сочетанных инфекционных поражений. При токсоплазмозе применяют пириметамин (хлоридин) (25 мг/сут) и сульфадимезин (4 г/сут), при обнаружении цитомегаловируса — ганцикловир, вируса герпеса — ацикловир, при выявлении криптококка — флуконазол. При воспалительной демиелинизирующей полира-дикулоневропатии используют плазмаферез и кортикостероиды, при боли и парестезиях в случае сенсорной полиневропатии — карбамазепин (200-600 мг/сут) или габапентин (1200 мг/сут) и амитриптилин (25-75 мг/сут).
Нейросифилис
Нейросифилис — поражение нервной системы при сифилисе. Бледная трепонема, проникая через гематоэнцефалический барьер, может вызвать воспалительные изменения в сосудах и оболочках головного и спинного мозга, а также дегенеративное поражение вещества мозга, образование гумм. Неврологические расстройства возникают преимущественно во вторичном и третичном периодах сифилиса, хотя уже в раннюю стадию после инфицирования почти у 30% больных в цереброспинальной жидкости выявляются признаки асептического менингита. Большинство классических форм поражения нервной систем (спинная сухотка, прогрессирующий паралич, атрофия зрительных нервов, гумма) почти полностью исчезли из повседневной практики после вне
дрения антибиотиков, хотя без лечения они развиваются не менее чем у 7 % больных сифилисом. В настоящее время наиболее часто (у 1—2% больных вторичным сифилисом) встречаются менинговаскулярный сифилис и сифилитический менингит.
Клиническая картина и диагноз. Латентный (бессимптомный) нейросифилис диагностируется на основании изменений в цереброспинальной жидкости (лимфоцитарный плеоцитоз, увеличение количества белка, положительная реакция Вассермана) у больного сифилисом. В большинстве случаев изменения цереброспинальной жидкости спонтанно регрессируют, однако у части (20%) больных развиваются неврологические осложнения, поэтому при выявлении латентного нейросифилиса рекомендуют такой же курс лечения, как и при его клинических формах. Клинически явный сифилитический менингит возникает через несколько месяцев или лет, в среднем через год, после заражения и проявляется типичной клиникой острого серозного менингита. Нередко отсутствует лихорадка, наблюдается поражение черепных нервов.
Менинговаскулярный сифилис, вызывая церебральный и спинальный эндартериит, может служить причиной ишемического инсульта головного и спинного мозга. Инсульт развивается обычно через 5-30 лет от момента заражения. Развитию инсульта иногда предшествуют головная боль, головокружение, нарушение сна и эмоциональные расстройства.
Классические формы нейросифилиса обычно развиваются через 5-50 лет после инфицирования. Для спинной сухотки характерны пронзающая боль, сенситивная атаксия, снижение или полное выпадение глубоких видов чувствительности, утрата ахилловых и коленных рефлексов, вялость или отсутствие реакции зрачков на свет при сохранении реакции на конвергенцию и аккомодацию (симптом Аргайла Робертсона), изменение формы зрачков и анизокория. Прогрессирующий паралич проявляется нарастающей деменцией, эмоциональной лабильностью с последующим присоединением пареза рук и ног, иногда эпилептических припадков.
Сифилитическая гумма по своим клиническим проявлениям напоминает опухоль головного мозга.
Диагноз нейросифилиса основывается на серологических реакциях и результатах исследования цереброспинальной жидкости. Используются реакция Вассермана и в неясных случаях высокочувствительная реакция иммунофлюоресценции (РИФ) и реакция иммобилизации трепонем (РИТ). Необходимо учитывать возможность ложноположительных и ложноотрицательных результатов. При активном инфекционном процессе в цереброспинальной жидкости обнаруживается лимфоцитарный плеоцитоз (200-300 клеток в 1 мкл), увеличение содержания белка и у-глобулинов.
Лечение основывается на применении бензилпенициллина по 12-24 млн ЕД/сут в течение 14 дней. При аллергии к пенициллинам возможно применение тетрациклина по 500 мг 4 раза в сутки, эритромицина по 500 мг 4 раза в сутки или цефалоспоринов (цефтриаксона) в течение месяца. Прогноз хороший в случаях бессимптомного нейросифилиса и сифилитического менингита. Изменения, обусловленные инфарктом при менинговаскулярном сифилисе, часто бывают стойкими и приводят к инвалидизации больного.
Опоясывающий лишай
Опоясывающий лишай (опоясывающий герпес, Herpes zoster) возникает при реактивации латентного вируса варицелла-зостер (varicella-zoster) и проявляется болью и кожными высыпаниями на уровне поражения. Вирус варицелла-зо-стер у детей вызывает преимущественно ветряную оспу, а у взрослых — опоясывающий лишай. Реактивация вируса, персистирующего в спинномозговых и черепных ганглиях, возникает по неясным причинам (идиопатическая форма) или на фоне иммунодефицита (злокачественная опухоль, ВИЧ-инфекция, химиотерапия и др.), кортикостероидной терапии, хирургических вмешательств, травм и др. Частота заболевания составляет 3-5 случаев в год на 1 тыс. населения и возрастает с увеличением возраста.
Клиническая картина и диагноз. Заболевание начинается с одностороннией боли, гиперестезии или чувства жжения в зоне нескольких дерматомов, которым иногда предшествуют легкие общие инфекционные проявления (повышение температуры тела, общее недомогание, утомляемость). Более чем в половине случаев страдают грудные сегменты (чаще Th5-Th6), в 20% случаев — глазничная ветвь тройничного нерва, в 20 % случаев — пояснично-крестцовые сегменты. Спустя несколько дней в зоне боли появляются высыпания, которые вначале представляют эритематозные пятна и папулы, а затем превращаются в везикулы. В части случаев, помимо сегментарных высыпаний, возникают рассеянные везикулы. При отсутствии осложнений в течение нескольких недель прекращается боль, и исчезают кожные высыпания, оставляя после себя диспигментацию или рубцы. Редкие осложнения опоясывающего герпеса — периферический парез конечностей, поражение черепных нервов, воспалительная демиелинизирующая полирадикулоневро-патия, церебральный васкулит, энцефаломиелит, менингит и миозит. Глазничный герпес иногда осложняется язвой роговицы, увеитом, васкулитом сетчатки и некротическим ретинитом.
Сравнительно часто (10-15% случаев), особенно в пожилом возрасте, боль не проходит после регресса кожных высыпаний и развивается постгерпетическая невралгия. Возможны как приступы острой прокалывающей, режущей боли, так и постоянная жгучая, сверлящая боль. Прикосновение к пораженному участку кожи обычно усиливает боль. У некоторых больных развивается нестерпимый зуд с расчесами. В пораженных участках кожи могут быть участки гипо- или гиперестезии.
Диагноз основывается на клинических данных и в большинстве случаев не вызывает сложностей. При исследовании цереброспинальной жидкости обнаруживается увеличение числа клеток (10-100 клеток в 1 мкл), преимущественно лимфоцитов, незначительно повышается содержание белка.
Лечение. Во многих случаях опоясывающего лишая, когда нет осложнений, интенсивных высыпаний и боли,
лечение можно ограничить анальгетиками, местными антисептиками (бриллиантовый зеленый) для предупреждения гнойных осложнений и анестезирующим кремом. При глазничном и осложненном герпесе, а также в случае интенсивной боли и высыпаний рекомендуют ацикловир по 600-800 мг/сут в 4-5 приемов или по 5 мг/кг в/в 3 раза в день в течение 7-10 суток.
При постгерпетической невралгии используют антидепрессанты (амитриптилин по 50-75 мг/сут и др.). В случае пароксизмальной боли эффективно применение карбамазепина (финлепсин) по 200-600 мг/сут или дифенина по 100-300 мг/сут либо габапентина (нейронтин) по 1200-3600 мг/сут. Возможно использование капсаицина (настойки красного перца), наносимого на кожу в области боли, физиотерапии и рефлексотерапии.
Болезнь Крейтцфельдта—Якоба
Болезнь Крейтцфельдта—Якоба вызвана образованием патологического белка-приона, которое приводит к отложению амилоида в нейронах головного мозга и их гибели с развитием глиоза и вакуолизации (спонгиоформная энцефалопатия). Частота заболевания 1 случай на 1 млн человек, и в последние годы она увеличивается.
Этиология. Выделяют спорадические, наследственные, ятрогенные и новые формы заболевания. Спорадическая форма встречается наиболее часто (почти 90 % случаев) и обусловлена до конца неясным (но ни экзогенным, ни вирусным) превращением нормального белка в патологический — прион. Наследственная форма составляет около 10 % случаев заболевания, имеет аутосомно-доминантное наследование с определенными генными нарушениями. Известно более 200 случаев передачи заболевания от больного человека при трансплантации роговицы, введении электродов в головной мозг (при нейрохирургических операциях) или использовании человеческого гормона роста (ятрогенная форма). В 1996 г. описано несколько случаев заболевания в Великобритании (новая форма) вследствие, как предпола-
Тема 5. Инфекционные заболевания нервной системы гается, употребления мяса коров, страдавших спонгиоформ-ной энцефалопатией (болезнью «бешеных коров»).
Инкубационный период при ятрогенных и новых формах колеблется от 2 до 20 лет. Возраст больных при спорадической форме чаще от 55 до 70 лет, при наследственной форме — от 40 до 55 лет, все больные новой формой болезни были моложе 50 лет.
Клиническая картина. Развитие заболевания в большинстве (почти 90%) случаев постепенное. Первые симптомы в У3 трети случаев — снижение памяти, нарушение поведения и высших психических функций, в другой У3 случаев — мозжечковая атаксия, глазодвигательные нарушения, снижение зрения, головокружение, головная боль, в остальных случаях — их сочетание. В развернутой стадии болезни всегда наблюдаются психические расстройства (часто до выраженной деменции), в большинстве случаев — миоклонические подергивания в разных группах мышц и отдельных пальцах, а также мозжечковая атаксия, глазодвигательные и зрительные нарушения. Прогрессирование заболевания приводит постепенно к сопору и коме. В развернутой стадии болезни на электроэнцефалограмме (ЭЭГ) часто (за исключением новой формы) определяются трехфазные острые волны с частотой 1-2 Гц или вспышки высокоамлитудных волн на фоне плоской кривой. В цереброспинальной жидкости характерны изменения качественного состава белков при электрофорезе.
Большинство больных спорадической формой умирают в течение полугода, а наследственной формой — в течение 1-2 лет с начала заболевания.
Диагноз основывается на клинической картине, изменениях ЭЭГ и цереброспинальной жидкости. МРТ и КТ головы не выявляют специфических изменений, но позволяют исключить другие неврологические заболевания. Во многих случаях окончательный диагноз устанавливается только при патологоанатомическом исследовании или прижизненной биопсии мозга.
Эффективного лечения нет. Заболевание не передается контактным путем, поэтому не требуется изоляции больно
го. Учитывая возможность заражения через медицинские инструменты (иглы, игольчатые электроды и др.), рекомендуется их уничтожать после использования у пациента с подозрением на эту болезнь.
Таблица
Краткие сведения об энцефалите, менингите и абсцессе головного мозга
Краткие сведения Энцефалит Менингит Абсцесс головного мозга
Основные возбудители Вирус простого герпеса, вирус опоясывающего герпеса, цитомегаловирус, энтеровирусы, арбовирусы (вирус клещевого энцефалита и др.), корь, краснуха, эпидемический паротит, грипп Гнойные менингиты: пневмококк, менингококк, гемофильная палочка, реже — стрептококк, кишечная палочка, грибы, простейшие, микоплазмы, гельминты, риккетсии, амебы. Серозные менингиты: энтеровирусы, вирус эпидемического паротита, вирус герпеса, туберкулез, бледная спирохета, ВИЧ, бруцеллез Стрептококк, стафилококк (из очагов инфекции в черепе гематогенным путем проникающая инфекция при черепномозговой травме или хирургической операции)
Клини- ческая картина Повышение температуры тела и головная боль, менингеальные симптомы, нарушение сознания, симптомы поражения головного мозга (афазия, центральные парезы конечностей и др.), эпилептические припадки Повышение температуры тела и головная боль, менингеальные симптомы. При менингоэнцефалите симптомы очагового поражения головного мозга или черепных (чаще глазодвигательного или отводящего) нервов Головная боль, очаговые симптомы поражения головного мозга (афазия, центральный парез конечностей и др.), эпилептические припадки. В начале заболевания повышение температуры тела
Окончание табл.
Краткие сведения Энцефалит Менингит Абсцесс головного мозга
Люмбальная пункция Лимфоцитарный плеоцитоз (10- 100 клеток в 1 мкл) Серозный менингит: лимфоцитарный плеоцитоз (10-100 клеток и более в 1 мкл). Гнойный менингит: нейтрофильный плеоцитоз (1 тыс. клеток и более в 1 мкл), снижение уровня глюкозы Обычно не проводится из-за опасности вклинения головного мозга
КТ или МРТ головы С 2-3-го дня заболевания множественные воспалительны е очаги Обычно не бывает изменений (при отсутствии энцефалита) Один или несколько очагов поражения головного мозга
Основное лечение Герпетический энцефалит — ацикловир 3 раза в сутки по 10 мг/кг. Клещевой энцефалит — гомологичный у-глобулин или сывороточный иммуноглобулин Гнойный менингит — антибиотикотерапия из расчета 200-300 тыс. ЕД/кг в сутки. Серозный менингит, вызванный туберкулезом, сифилисом, бруцеллезом или ВИЧ-инфекцией — лечение основной инфекции Антибиотики, хирургическое удаление абсцесса
Тема 6
Опухоли нервной системы
Опухоли головного мозга
Частота первичных опухолей мозга составляет около 15 случаев на 100 тыс. населения в год. Смертность от опухолей мозга составляет около 1 % от общей смертности и 3 % смертности вследствие злокачественных новообразований. По данным патологоанатомического исследования, почти в 20 % случаев смертности от злокачественных опухолей внемоз-говой локализации выявляется метастатическое поражение головного мозга. Метастазы в мозг чаще возникают при раке легкого, молочной и щитовидной железы и при меланоме.
Клиническая картина определяется локализацией, размером, темпом роста опухоли и выраженностью отека головного мозга. Чаще наблюдается постепенное нарастание неврологических нарушений, реже — быстрое (инсультообразное), что обычно вызывает кровоизлияние в опухоль мозга.
Первыми проявлениями опухоли мозга могут быть головная боль (иногда с тошнотой и рвотой) вследствие повышения внутричерепного давления, очаговые неврологические симптомы, зависящие от локализации опухоли (гемипарез, афазия, нарушение зрения, атаксия и др.), изменения поведения, эпилептические припадки.
Головная боль отмечается более чем у 50% больных с опухолью мозга, почти у */3 больных она представляет один из первых симптомов заболевания. Вначале головная боль
обычно легкая и эпизодическая, в дальнейшем увеличиваются ее частота, длительность и интенсивность. Она нередко возникает утром или ночью, может сопровождаться тошнотой и рвотой, ослабевает в течение дня. При острой окклюзии IV желудочка мозга наблюдаются резкая головная боль, рвота, нарушение дыхания и вынужденное положение головы, при котором улучшается отток ликвора (синдром Брунса).
Генерализованные и парциальные эпилептические припадки встречаются примерно у 30% больных, чаще при медленно растущих поверхностных опухолях. В течение длительного времени (несколько лет) они могут быть единственным клиническим проявлением опухоли мозга, например менингиомы.
Скрытое малосимптомное течение характерно для опухоли передней части лобной доли, височной доли недоминантного полушария, мозолистого тела.
Диагноз. При подозрении на опухоль головного мозга необходимы КТ или МРТ головы, чувствительность которых существенно возрастает при контрастировании. Рентгенография черепа, ЭЭГ, ЭхоЭС, исследование глазного дна, люмбальная пункция (при отсутствии признаков внутричерепной гипертензии) в настоящее время используются только как методы предварительной диагностики, а отсутствие изменений при этих исследованиях не исключает возможности опухоли мозга. При подозрении на метастатическое поражение головного мозга, которое может быть первым клиническим проявлением злокачественной опухоли различной локализации, показано тщательное соматическое обследование.
Опухоли спинного мозга
Опухоли спинного мозга составляют около 10-12% всех опухолей ЦНС. Метастазы в спинной мозг чаще возникают при миеломной болезни, лимфомах, раке легкого, молочной железы, предстательной железы и почки.
Клиническая картина. Характерно постепенное нарастание неврологических нарушений в течение недель, месяцев
или даже лет. Клиническая картина определяется локализацией опухоли по длиннику спинного мозга, ее величиной, внутримозговым или внемозговым ростом, сдавлением окружающих тканей; она складывается из сегментарно-корешко-вых и проводниковых расстройств.
Корешковая боль часто является одним из первых симптомов, она может сопровождаться различными чувствительными нарушениями (гипералгезия, парестезии, гипестезия) по ходу корешка, усиливаться в положении лежа и при кашле, сопровождаться болезненностью при перкуссии остистого отростка позвонка в области опухоли. Нередко боль в спине неправильно трактуется как «банальный радикулит». Сегментарные нарушения проявляются периферическим парезом, чувствительными и вегетативными нарушениями; они вызваны поражением вещества мозга на уровне опухоли и поэтому соответствуют ее локализации. Проводниковые расстройства проявляются центральным парезом, тазовыми расстройствами и чувствительными нарушениями книзу от уровня поражения.
При шейной локализации опухоли проводниковые расстройства возможны в руках и ногах, при грудной — в ногах, при поясничной — в дистальных отделах ног. При латераль-но расположенной опухоли может развиться синдром Броун—Секара (поражение половины спинного мозга), который проявляется сегментарно-корешковыми расстройствами, центральным парезом, проводниковым нарушением глубокой чувствительности на стороне опухоли и проводниковым расстройством болевой и температурной чувствительности на противоположной стороне. Опухоли в области конуса спинного мозга (сегменты S2-S5) проявляются болью, и анестезией в аногенитальной области, тазовыми расстройствами. При опухоли конского хвоста возможны корешковая боль и расстройство чувствительности в ногах, периферический парез стоп, тазовые расстройства.
Диагноз. МРТ — ведущий метод диагностики опухоли спинного мозга, который позволяет дифференцировать вне- и внутримозговое расположение опухоли, исключить другие заболевания спинного мозга. Рентгенограмма по
звоночника может выявить эрозии дужек позвонков и расширение межпозвонковых отверстий (при невриномах) или деструкцию позвонка (при метастазах). Если отсутствует возможность выполнить МРТ или КТ, то производят люмбальную пункцию. В цереброспинальной жидкости можно выявить повышение содержания белка и опухолевые клетки. В дальнейшем выполняют рентгеноконтрастное исследование спинного мозга — миелографию, определяющую локализацию опухоли.
Лечение опухолей нервной системы. Лечение опухолей головного и спинного мозга преимущественно хирургическое и нередко в сочетании с лучевой и химиотерапией. При многих внемозговых церебральных и спинальных опухолях удается полностью удалить опухоль. При внутримозговых опухолях чаще удается удалить только часть опухоли, уменьшив сдавление вещества мозга. При интенсивной головной боли используются ненаркотические анальгетики в сочетании с дексаметазоном. Основу лечения неоперабельных и метастических опухолей составляет лучевая терапия и противоопухолевые средства.
Тема 7
Черепно-мозговая и позвоночно-спинномозговая травма
Черепно-мозговая травма
Распространенность черепно-мозговой травмы составляет более 200 случаев на 100 тыс. населения в год. Выделяют закрытую черепно-мозговую травму и открытую, при которой полость черепа сообщается с внешней средой и возрастает вероятность инфекционных осложнений. В мирное время чаще встречается закрытая черепно-мозговая травма. Ведение больных с открытой черепно-мозговой травмой относится к компетенции нейрохирургов и травматологов. В настоящем разделе обсуждаются преимущественно вопросы, связанные с закрытой черепно-мозговой травмой.
Классификация и патогенез. Повреждение головного мозга может быть обусловлено непосредственно травматическим воздействием в области удара и на противоположной стороне в месте противоудара, диффузным аксональным повреждением, а также внутричерепными осложнениями (гематома, инфекция, отек мозга) или возникающими при травме соматическими нарушениями (артериальная гипотония, нарушение дыхания и др.), приводящими к гипоксии мозга.
В зависимости от морфологии повреждения головного мозга выделяют сотрясение головного мозга, ушиб, диффузное аксональное повреждение и внутричерепную гематому. Ушиб (контузия) мозга — некротическое размозжение участков коры и белого вещества, обычно сочетаюшееся с
Тема 7. Черепно-мозговая и позвоночно-спинномозговая травма небольшими кровоизлияниями и отеком головного мозга. Сотрясение головного мозга представляет резкую его встряску при травме головы без макроскопических изменений с обратимым нарушением функций, которое связывают с легкой степенью диффузного аксонального повреждения. Среди внутричерепных травматических кровоизлияний по локализации выделяют эпидуральные, субдуральные и внутримозговые гематомы.
Для понимания механизма травмы важно знать тот факт, что полушария головного мозга, окруженные цереброспинальной жидкостью, способны двигаться в полости черепа отдельно от костных структур. Если возникает резкий удар, приводящий голову в движение, полушария головного мозга отстают от движения костных структур, напротив, если голова ударяется о неподвижный предмет, движение полушарий головного мозга опережает движение костных структур. В обоих случаях вследствие вращательного движения полушарий возникает их деформация (скручивание) относительно жестко фиксированного ствола головного мозга, которая максимально выражена на уровне верхних отделов ретикулярной формации ствола мозга, что вызывает утрату сознания. Силы вращения разделяют или разрывают аксоны нервных клеток в белом веществе и стволе головного мозга (диффузное аксональное повреждение). Кроме того, при вращательном движении полушарий их поверхностные образования повреждаются от соприкосновения с костями черепа и складками твердой мозговой оболочки, что приводит к развитию размягчения (ушиба головного мозга) и кровоизлияний как в месте удара, так и на противоположной стороне в месте противоудара. Диффузное аксональное повреждение объясняет утрату сознания после травмы при отсутствии анатомических повреждений мозга по данным КТ или МРТ головы.
По степени нарушения сознания после травмы выделяют легкую, среднюю и тяжелую черепно-мозговую травму. Легкая черепно-мозговая травма, в основе которой обычно лежит сотрясение или легкий ушиб мозга, составляет большинство (80%) всех случаев черепно-мозговой травмы. Она
обычно не представляет угрозы для жизни пострадавшего, но нередко вызывает последствия, снижающие качество его жизни.
Перелом костей черепа чаще имеет место при тяжелой черепно-мозговой травме, но возможен и при легкой ее степени. Наличие перелома костей черепа существенно повышает вероятность внутричерепного кровоизлияния. Перелом костей основания черепа связан с риском повреждения сонной артерии, зрительного нерва и других черепных нервов, попадания в полость черепа воздуха (пневмоцеле) и инфекции (менингит, энцефалит), а также с риском постоянного истечения цереброспинальной жидкости в придаточные пазухи носа (ринорея) или ухо (оторея).
Эпидуральная гематома возникает вследствие кровотечения из поврежденной оболочечной артерии (a. meningia media) или реже вены, при переломе височной или теменной кости. Субдуральное кровоизлияние возникает вследствие поражения вен, соединяющих венозную систему головного мозга и синусы твердой мозговой оболочки. Повышение внутричерепного давления при венозном кровотечении может привести к его остановке и формированию хронической субдуральной гематомы. Чаще субдуральная гематома образуется над поверхностью полушария, нередко с обеих сторон. В большинстве случаев ушиба мозга возникает субарахноидальное, а нередко и субдуральное кровоизлияние.
Клиническая картина. Черепно-мозговая травма вызывает нарушение сознания, степень и длительность которого определяют ее прогноз. Быстрое восстановление сознания после травмы свидетельствует в пользу ее легкой степени. Чем более длительна потеря сознания, тем вероятнее ушиб мозга или внутричерепное кровоизлияние. При нарушении сознания тяжесть травмы удобно определять по шкале комы Глазго (табл. 7.1). Если общая сумма баллов составляет 13-15, то черепно-мозговую травму расценивают как легкую, если 8-12 — как средней тяжести, если 3-7 — как тяжелую. Средняя и тяжелая степень черепно-мозговой травмы указывает на высокую вероятность ушиба мозга и/или внутричерепной гематомы; например, субдуральная гематома выяв
ляется у 20 % больных с тяжелой черепно-мозговой травмой. Напротив, легкая черепно-мозговая травма в большинстве случаев вызвана сотрясением головного мозга, вероятность эпидуральной и субдуральной гематомы составляет соответственно 0,5 и 1 %. При тяжелой черепно-мозговой травме быстрая смерть может наступить вследствие нарушения функции дыхательного центра продолговатого мозга.
Таблица 7.1
Шкала комы Глазго
Показатель Баллы
Открывание глаз:
спонтанное 4
на речь 3
на боль 2
отсутствует 1
Речь:
полностью сохранена 5
спутанная 4
непонятные слова 3
нечленораздельные звуки 2
отсутствует 1
Двигательная реакция:
выполнение инструкций 6
целенаправленная реакция на болевое раздражение 5
отдергивание конечности на болевое раздражение 4
сгибательная реакция на болевое раздражение 3
разгибательная реакция на болевое раздражение 2
отсутствует 1
При обследовании больного важно исключить наличие перелома костей черепа, а также перелома позвоночника и конечностей, повреждений внутренних органов. Перелом костей свода черепа можно обнаружить при внешнем осмотре и пальпации. Кровотечение из носа и наружного слухового прохода, гематома в области виска или сосцевидного отростка за ухом (симптом Бэттла), двусторонний кровоподтек в орбитальной области («симптом очков») указывают на возможность перелома костей основания черепа, хотя могут быть следствием местной травмы. Истечение цереброспи-
нальной жидкости из носа (ринорея) и уха (оторея) свидетельствует о переломе костей основания черепа. Перелом костей черепа при легкой черепно-мозговой травме увеличивает вероятность внутричерепной патологии (гематома, инфекция) в 4 раза.
При неврологическом обследовании выясняют наличие симптомов очагового поражения головного мозга: слабость в конечностях, расстройства чувствительности, нарушение координации и др. Они свидетельствуют о структурном поражении мозга: ушибе и/или гематоме. Обнаружение менингеальных симптомов указывает на вероятность травматического субарахноидального кровоизлияния, а их появление спустя несколько дней после травмы позволяет предположить инфекционный процесс (менингит, энцефалит). Поражение обонятельного нерва указывает на перелом решетчатой кости, поражение лицевого — на перелом пирамиды височной кости.
При обследовании в больнице необходимо исключить повреждение других органов, в особенности брюшной полости, грудной клетки, позвоночника и трубчатых костей, что наиболее вероятно в случае стойкой артериальной гипотонии (снижение систолического артериального давления ниже 90 мм рт. ст.).
Диагноз. В случаях легкой черепно-мозговой травмы, когда нет признаков перелома костей черепа и изменений при неврологическом обследовании, а также отсутствуют факторы риска гематомы при травме головы (прием антикоагулянтов или патология свертываемости крови), можно ограничить первичное обследование рентгенографией черепа и, если она не обнаружит изменений, то не проводить КТ головы. Этих пациентов необходимо наблюдать в течение нескольких недель и при ухудшении состояния произвести КТ или МРТ головы.
В остальных случаях необходима экстренная КТ головы. Если нет возможности провести КТ или МРТ головы, то выполняют рентгенографию черепа, эхоэнцефалоскопию, осмотр глазного дна и при подозрении на гематому (нарастающее ухудшение состояния, перелом костей черепа при
рентгенографии, смещение срединных структур мозга при эхоэнцефалоскопии, застойные диски и кровоизлияние в сетчатку на глазном дне) могут быть наложены диагностические фрезевые отверстия. Люмбальная пункция не рекомендуется из-за опасности вклинения мозга и может быть произведена при подозрении на менингит после того, как по данным КТ или МРТ исключено объемное повреждение мозга. При признаках повреждения шеи необходима рентгенография шейного отдела позвоночника. В план обследования больного с черепно-мозговой травмой входят клинический и биохимический анализ крови (электролиты, глюкоза, коагулограмма, показатели функции печени и почек), общий анализ мочи.
Диагноз сотрясения головного мозга основывается на кратковременной (секунды или минуты) утрате сознания после травмы, отсутствии неврологических нарушений и изменений при рентгенографии черепа и/или КТ головы. При сотрясении головного мозга возможны головная боль, головокружение, тошнота, рвота и амнезия на события травмы. Обычно в течение нескольких часов или дней состояние нормализуется, однако у части лиц, перенесших сотрясение головного мозга, развивается посткоммоционый синдром, который может быть причиной более длительной нетрудоспособности. Больные с легкой черепно-мозговой травмой должны наблюдаться в стационаре в течение 5—7 дней.
Диагноз ушиба (контузии) головного мозга основывается на длительном (минуты, часы или реже дни) нарушении сознания после травмы, наличии очаговых неврологических нарушений (афазия, центральный гемипарез и другие) и подтверждается результатами КТ или МРТ головы. Ушиб мозга нередко сочетается с внутричерепной гематомой, которая может развиться постепенно, поэтому при ухудшении состояния больного с ушибом мозга требуется повторная КТ или МРТ головы для выявления возможной гематомы.
Диагноз эпидуральной и острой субдуральной гематомы основывается на прогрессирующем ухудшении состояния пострадавшего сразу после травмы или через небольшой (минуты или часы) «светлый промежуток», возникающий вслед за первоначальной потерей сознания, и подтвержда
ется результатами КТ или МРТ головы. При эпидуральной гематоме у больных часто возникают контралатеральный гемипарез и гомолатеральное (реже контралатеральное) поражение глазодвигательного нерва с мидриазом, а также эпилептические припадки. Сходные клинические симптомы могут наблюдаться и при острой субдуральной гематоме. В случаях подострого (развитие симптомов в течение от 2 до 14 сут) или хронического (возникновение симптомов после 14 сут) течения субдуральной гематомы наблюдается длительный «светлый промежуток» после травмы, а затем обычно появляются головная боль, очаговые неврологические нарушения (афазия, центральный гемипарез и др.), эпилептические припадки и расстройство сознания.
Хроническая субдуральная гематома часто вызывает сложности в диагностике, потому что может развиться через длительный период (месяцы и даже годы) после легкой черепно-мозговой травмы, о наличии которой больные часто забывают. Такая ситуация характерна для пожилых людей, а также для больных, принимающих антикоагулянты. Во всех случаях подозрения на травматическую субдуральную гематому необходима экстренная КТ или МРТ головы, которая позволяет поставить диагноз. При отсутствии своевременного лечения большинство больных с травматическим внутричерепным кровоизлиянием умирают вследствие отека мозга и сдавления его ствола. Небольшие субдуральные гематомы могут редуцироваться самостоятельно, но эти пациенты требуют постоянного наблюдения у нейрохирурга и повторной КТ или МРТ головы для подтверждения благоприятного течения заболевания.
Всех больных с черепно-мозговой травмой необходимо госпитализировать в нейрохирургический стационар, чтобы в случае необходимости провести экстренную операцию, которая способна спасти жизнь пострадавшего.
Прогноз, течение и осложнения черепно-мозговой травмы. Прогноз черепно-мозговой травмы определяется ее тяжестью, наличием сочетанных травм и заболеваний, возрастом больного, своевременностью оказания медицинской помощи. Течение тяжелой и средней тяжести черепно-мозго-
Тема 7. Черепно-мозговая и позвоночно-спинномозговая травма вой травмы может осложниться артериальной гипертонией или гипотонией, аритмией сердца, отеком легких, аспирационной пневмонией, эмболией легочной артерии, синдромом диссеминированного внутрисосудистого свертывания и др. При тяжелой черепно-мозговой травме около 50 % больных погибают, а у 20 % больных развивается хроническое вегетативное состояние или сохраняется грубый неврологический дефект.
При ушибе головного мозга тяжелой степени часто в первые часы или дни после травмы наступает смерть. У некоторых больных после длительного периода нарушения сознания нормализуются жизненно важные функции, больные открывают глаза, у них восстанавливается цикл «сон-бодрствование», но они лишаются когнитивных функций и нормального реагирования (хроническое вегетативное состояние). У части больных восстановление лучше, чем у больных с хроническим вегетативным состоянием, но сохраняются стойкие неврологические нарушения (центральный гемипарез, афазия и др.). У большинства больных с ушибом головного наблюдается постепенное восстановление неврологические функций, обычно наиболее значительное в течение первых 6 мес. с момента травмы. У некоторых больных после ушиба мозга возникают изменения личности и снижение интеллекта, что влечет за собой серьезные проблемы в их социальной и бытовой адаптации. В этих случаях требуется наблюдение и лечение у психиатра.
Посттравматическая эпилепсия возникает в среднем у 5% больных, чаще у больных с ушибом мозга и/или гематомой, в большинстве случаев наблюдаются большие судорожные припадки.
Посткоммоционный синдром проявляется головной болью, головокружением, нарушением сна, раздражительностью, снижением концентрации внимания, ухудшением памяти, повышенной утомляемостью и уменьшением работоспособности после перенесенной черепно-мозговой травмы. Он чаще возникает после легкой черепно-мозговой травмы (сотрясения или легкого ушиба мозга), его происхождение неясно, предполагается роль легкого диффузного аксональ
ного повреждения и психогенного фактора. Чем больше времени прошло после травмы, тем более вероятна роль психосоциальных факторов или рентных отношений в генезе предъявляемых больным жалоб (судебное разбирательство, оформление инвалидности). Через год после легкой черепно-мозговой травмы проявления посткоммоционного синдрома (чаще всего головная боль, головокружение, повышенная утомляемость) сохраняются у 10-15% больных. При прогрессирующем ухудшении состояния больного следует помнить о возможности хронической субдуральной гематомы и других осложнений, диагностика которых требует повторной КТ или МРТ головы.
Лечение. Оказание экстренной помощи больному с острой черепно-мозговой травмой направлено на обеспечение проходимости дыхательных путей, стабилизацию артериального давления и борьбу с шоком при его развитии. Необходима экстренная госпитализация больного в нейрохирургическое отделение. При транспортировке больного в бессознательном состоянии требуется иммобилизация шейного отдела и осторожность при перемещении больного в связи с вероятностью повреждения шейного отдела позвоночника, которое нередко возникает, особенно при тяжелой черепно-мозговой травме.
При выявлении эпидуральной или субдуральной гематомы производят ее хирургическое удаление. При внутримозговом кровоизлиянии операция показана при больших, доступных для хирургического вмешательства гематомах, вызывающих смещение мозговых структур или тяжелые неврологические нарушения, а также в случаях неэффективности консервативной терапии.
При ушибе мозга, а также у больных с внутричерепным кровоизлиянием (если не осуществляется хирургическое лечение) проводится консервативная терапия, направленная на обеспечение нормального дыхания, стабильного артериального давления и профилактику осложнений. Большое значение имеет общий уход за больным. При повышении внутричерепного давления и отеке мозга используют гипервентиляцию, в/в введение 100-200 мл 20%-го раствора маннитола (при
Тема 7. Черепно-мозговая и позвоночно-спинномозговая травма необходимости каждые 4-6 ч), а при отсутствии эффекта возможно в/в введение барбитуратов. Для улучшения метаболических процессов в головном мозге и его кровоснабжения можно использовать кавинтон (15-30 мг/сут внутрь или в/в), нимодипин (120 мг/сут внутрь или в/в), пирацетам (4-12 г/сут внутрь или в/в), церебролизин (10-50 мл/сут в/в капельно) и другие нейропротективные средства (однако их эффективность не доказана).
При развитии менингита назначают антибиотики. Их применяют также с профилактической целью при открытой черепно-мозговой травме, особенно при истечении ликвора (ринорея или оторея).
При сотрясении головного мозга рекомендуют постельный режим, длительность которого (от суток до нескольких дней) определяют индивидуально, и проводят симптоматическое лечение (анальгетики, седативные средства и др.). Важно динамическое наблюдение за больным, поскольку после «светлого промежутка» возможно развитие гематомы. Многие пациенты, у которых после травмы нет каких-либо объективных расстройств, жалуются на головную боль, головокружение, нарушение сна и плохое самочувствие, что в большинстве случаев связано с. повышенной тревожностью или депрессией как реакцией на травму и с особенностью личности (преморбидный невротический или депрессивный тип личности). В этих случаях могут помочь транквилизаторы или антидепрессанты.
При развитии эпилептических припадков рекомендуют постоянный прием противосудорожных средств. Более чем у 50 % больных припадки прекращаются и возможна постепенная отмена противосудорожных средств под контролем ээг.
При посткоммоционном синдроме целесообразна рациональная психотерапия, постепенное увеличение нагрузки, при повышенной тревожности эффективны транквилизаторы, при депрессивном состоянии — антидепрессанты в индивидуально подобранной дозе. Следует сказать больному о высокой вероятности постепенного улучшения состояния, рекомендовать как можно скорее вернуться к работе
и обычному образу жизни. При выраженных эмоциональных расстройствах целесообразна консультация психиатра. Посткоммоционный синдром встречается чаще и сохраняется дольше в тех случаях, когда в связи с травмой головы возникает судебное разбирательство, и/или возможна компенсация за причиненное больному повреждение. Поэтому урегулирование юридических проблем, связанных с травмой, относится к важным компонентам реабилитации пациента с посткоммоционным синдромом. Напротив, длительное течение судебного процесса, повторные многочисленные исследования только усиливают страх пациента и уменьшают его мотивацию вернуться к работе.
Позвоночно-спинномозговая (спинальная)травма
Патогенез. В мирное время травма спинного мозга обычно возникает вследствие падения, неудачного ныряния в воду, автомобильной катастрофы и происходит за счет компрессии позвонков в вертикальной плоскости в сочетании с быстрым чрезмерным сгибанием или разгибанием головы (антеро- или ретрогиперрефлексии). В результате разрыва связок позвоночника происходит смещение верхнего позвонка кпереди по отношению к нижележащему, что обычно вызывает перелом тела или дужек позвонков и вследствие этого раздавливание спинного мозга. Тяжесть травмы усиливается при наличии сопутствующих дегенеративно-дистрофических изменений позвоночника или врожденного узкого позвоночного канала.
Клиническая картина. В целом, травма спинного мозга проявляется параплегией или тетраплегией с параличом сфинктеров и потерей чувствительности ниже уровня поражения. Симптомы зависят от уровня поражения.
Повреждение спинного мозга на уровне верхних шейных сегментов (С,-С3) вызывает остановку дыхания и немедленную смерть, если не проводится искусственная вентиляция легких. При более низком уровне поражения наблюдается тетраплегия либо нижняя параплегия, утрата
Тема 7. Черепно-мозговая и позвоночно-спинномозговая травма чувствительности по проводниковому типу ниже уровня поражения и тазовые расстройства. В первые часы после травмы симптоматика может нарастать, например, с умеренного тетрапареза до тетраплегии в связи с нарастанием отека спинного мозга.
В стадии спинального шока, возникающего сразу после травмы, исчезают все виды рефлексов ниже уровня повреждения, появляется недержание мочи из-за атонии мочевого пузыря, возможна паралитическая кишечная непроходимость вследствие атонии кишечника. В дальнейшем (через 1-2 нед., иногда позже) стадия спинального шока начинает постепенно сменяться стадией повышенного рефлекторного возбуждения в частях тела, которые иннервируются нейронами ниже уровня повреждения. У больного появляются патологические сгибательные рефлексы (симптом Бабинского, защитные рефлексы), а затем повышаются сухожильные рефлексы, повышается тонус мочевого пузыря и кишечника. Гиперрефлексия мочевого пузыря выражается частыми и императивными позывами к мочеиспусканию, его автоматическим опорожнением при небольшом наполнении. При полном повреждении спинного мозга парализованные нижние конечности согнуты. При поражении шейного утолщения мышцы парализованной руки или кисти атрофируются и исчезают рефлексы.
Степень восстановления определяется распространенностью поражения по поперечнику спинного мозга. При его частичном повреждении обычно наблюдается постепенное, наиболее значительное в первые 6 мес., восстановление двигательных, чувствительных и тазовых функций.
Диагноз основывается на клинико-анамнестических данных. Большое значение имеют рентгенография позвоночника, КТ и МРТ, которые позволяют определить перелом и смещение позвонков, объем поражения спинного мозга.
Лечение. Больные должны находиться в травматологических или нейрохирургических отделениях, специализирующихся на спинальной травме.
Лечение переломов и смещений позвоночника относится к компетенции травматологов и заключается в ортопеди
ческом устранении подвывиха и фиксации позвоночника. Эффективность ламинэктомии, а также высоких доз кортикостероидов с целью декомпрессии спинного мозга при травме полностью не доказаны. У больных, перенесших спинальную травму, большое значение имеет лечебная гимнастика и постепенная социальная и бытовая адаптация.
Таблица 7.2
Краткие сведения о закрытой черепно-мозговой травме
Краткие сведения Сотрясение головного мозга Ушиб головного мозга Внутричерепная гематома
Патогенез Диффузное аксональное повреждение Некротическое размягчение вещества головного мозга Кровотечение из поврежденной артерии или вены с образованием гематомы
Клиническая картина Кратковременное нарушение сознания Длительное нарушение сознания, очаговые неврологические нарушения Менингеальные симптомы, очаговые неврологические нарушения, постепенное ухудшение состояния
Рентгенография черепа Отсутствие изменений Чаще отсутствие изменений Чаще перелом костей черепа
КТ головы Отсутствие изменений Очаг (очаги) пониженной плотности (размягчение) Область (области) повышенной плотности (гематома)
Лечение Симптоматическая терапия Лечение отека мозга, симптоматическая терапия Хирургическое удаление гематомы
Тема 8
Пароксизмальные расстройства сознания: эпилепсия
и обмороки
Эпилепсия
Эпилепсия — хроническое заболевание головного мозга, проявляющееся повторными эпилептическими припадками. Заболеваемость эпилепсией составляет 6-7 случаев на 1 тыс. населения.
Этиология, патогенез и классификация. Эпилептический припадок развивается вследствие распространения чрезмерных нейронных разрядов из очага эпилептической активности на весь мозг (генерализованный припадок) или его часть (парциальный припадок). Он может быть следствием различных заболеваний и патологических состояний:
1) пре- и перинатальных нарушений (инфекционных заболеваний в период беременности, родовой травмы, асфиксии новорожденных и др.);
2) инфекционных заболеваний ЦНС;
3) токсического поражения ЦНС (этанолом, угарным газом, свинцом, ртутью, лекарственными средствами и др.);
4) черепно-мозговой травмы;
5) цереброваскулярных заболеваний;
6) дисметаболических энцефалопатий;
7) опухоли головного мозга;
8) наследственных заболеваний;
9) лихорадки;
10) дегенеративных заболеваний головного мозга.
В этих случаях заболевание расценивается как симптоматическая эпилепсия. Однако у большинства (2/3) больных эпилепсией не удается установить этиологию заболевания, что расценивается как генуинная, или идиопатическая, эпилепсия.
В генезе идиопатической эпилепсии обсуждается роль наследственных факторов, потому что 3-6 % больных имеют семейный анамнез заболевания. При МРТ у многих больных идиопатической эпилепсией выявляют уменьшение нижнемедиальных отделов височных долей и изменение интенсивности сигнала от них, что указывает на вероятность перинатального повреждения головного мозга.
Выделяют два основных типа эпилептических припадков: генерализованные и парциальные. Генерализованные припадки проявляются утратой сознания с судорогами или без них. К генерализованным припадкам относят большие судорожные припадки и малые припадки или абсансы (простые и сложные). Генерализованные припадки могут начинаться сразу с потери сознания (первично генерализованные припадки) или же ей предшествуют признаки очаговой дисфункции мозга (ауры) в виде обонятельных, слуховых, зрительных ощущений, а также пароксизмальных изменений психического состояния Парциальные припадки начинаются с симптомов очагового поражения головного мозга. При простых парциальных припадках сознание не нарушается, а при сложных возникает нарушение или изменение сознания. Парциальные припадки вызваны локальными участками перевозбуждения в головном мозге, поэтому их называют также фокальными припадками. Первично генерализованные припадки чаще наблюдаются при идиопатической эпилепсии, парциальные припадки — при симптоматической эпилепсии.
Клиническая картина. Заболевание может развиться в любом возрасте в виде эпилептического припадка. У многих больных наблюдается только один тип припадков.
Большой судорожный припадок проявляется потерей сознания и непроизвольной двигательной активностью. В начале припадка больной иногда издает крик, все его тело на
прягается, затем он теряет сознание и падает, его челюсти сжимаются, часто вызывая прикус языка, дыхание останавливается и нередко происходит непроизвольное мочеиспускание. Двигательные нарушения могут проявиться только тоническим напряжением мышц (тонические судороги) или повторяющимися клоническими подергиваниями мышц лица, туловища и конечностей (клонические судороги), но чаще всего вначале наблюдаются тонические судороги, а затем клонические, либо отмечается их чередование. Во время падения и судорог больной может получить серьезные повреждения головы и тела. По завершению тонико-клонических судорог дыхание восстанавливается, но больной остается в бессознательном состоянии, его мышцы расслаблены, дыхание поверхностное. Через несколько минут сознание восстанавливается, но больной остается оглушенным, сонливым и не помнит, что с ним произошло. Многих больных после приступа беспокоит боль в мышцах, перенапряженных во время судорог, боль в местах ушибов и в языке в случае его прикуса, а также головная боль. Длительность припадка различна, но чаще составляет всего несколько минут.
В возрасте от 3 до 60 лет большие судорожные припадки чаще обусловлены идиопатической эпилепсией, хотя при их дебюте в возрасте старше 30 лет существенно возрастает вероятность интоксикации этанолом и опухоли головного мозга. После 60 лет впервые появившиеся большие судорожные припадки часто бывают обусловлены цереброваскулярным заболеванием. На фоне высокой температуры тела у 3—4% детей развиваются кратковременные (до 10 мин) судорожные припадки (фебрильные припадки), которые могут повторяться при возникновении лихорадки в детском возрасте, однако только у 3% детей с фебрильными припадками в дальнейшем развивается эпилепсия.
Абсансы представляют кратковременную (обычно 2-10 с, редко более 30 с) потерю сознания. В период припадка больной продолжает сидеть или стоять, нередко наблюдаются подергивания век и ритмичные (3 раза в секунду) движения рук или пальцев. Абсансы начинаются в детстве, чаще в возрасте 4-12 лет. Они обычно становятся менее частыми (но
редко исчезают полностью) в подростковом возрасте, когда впервые может развиться большой судорожный припадок. Чаще всего наблюдаются простые абсансы, при которых мышечный тонус не утрачивается и больной не падает. Во время приступа он прекращает совершаемые им действия, а после продолжает их, не помня о приступе. При сложных абсансах возникают непроизвольные движения или резкое снижение постурального тонуса (атонические абсансы), приводящее к падению больного в период приступа. Простые абсансы обычно появляются в возрасте 4-8 лет и часто самостоятельно проходят к 20 годам, хотя в тех случаях, когда они сочетаются с большими судорожными припадками, они могут сохраняться и после 20 лет. Сложные абсансы чаще сочетаются с другими типами припадков и имеют худший прогноз.
Простые парциальные припадки протекают при сохранении сознания и проявляются повторяющимися движениями в одной из частей тела, жевательными движениями, вращательными и позно-тоническими движениями (парциальный моторный припадок) или зрительными, вкусовыми, слуховыми ощущениями, онемением и парестезиями в половине тела, конечности (парциальный сенсорный припадок) либо тошнотой, рвотой и профузным потоотделением (парциальный вегетативный припадок). Припадок продолжается от 10 с до 3 мин. Наиболее демонстративен джексоновский моторный припадок, при котором на фоне полного сознания развиваются клонические судороги в отдельных мышечных группах, иногда распространяющиеся на всю половину тела (джексоновсий марш). Сложные парциальные припадки происходят при измененном сознании и проявляются внешне координированными и целесообразными движениями (причмокивание губами, жевательные или глотательные движения, беспорядочная ходьба и другие автоматизированные движения) или галлюцинаторными феноменами, явлениями деперсонализации и дереализации (состояния «уже виденного» или «никогда не виденного»), ощущением отчуждения внешнего мира, собственного тела. Парциальный припадок может перейти в большой судорожный припадок (вторично генерализованный припадок), и если это проис
ходит быстро и не замечается первоначальная симптоматика, то парциальный припадок сложно отличить от первично генерализованного большого судорожного припадка.
Парциальный припадок часто бывает вызван опухолью, инсультом, черепно-мозговой травмой или другим заболеванием с очаговым поражением головного мозга. Развившиеся в возрасте 10-30 лет сложные парциальные припадки чаще обусловливаются идиопатической эпилепсией.
Миоклонические эпилептические припадки проявляются одиночными или повторяющимися непроизвольными подергиваниями различных групп мышц (миоклония), эпилептический генез которых подтверждают при электроэнцефалографии.
Эпилептический статус — состояние, при котором развивается один продолжительный (более 30 мин) парциальный или генерализованный припадок либо серия повторяющихся друг за другом, через небольшие интервалы времени припадков. В перерывах между припадками больной может реагировать на раздражители и даже выполнять простейшие Инструкции, однако полностью сознание не восстанавливается. Развитие статуса часто связано с резким прекращением приема противоэпилептических средств. Иногда статус может быть первым проявлением эпилепсии. Летальность при эпилептическом статусе в настоящее время не превышает 5% при своевременной квалифицированной помощи.
Течение эпилепсии в значительной степени зависит от ее этиологии и типа припадков. Так, у детей существуют благоприятные (простые абсансы, фебрильные судороги и др.) формы эпилепсии. У взрослых течение эпилепсии без лечения нередко прогредиентное, что проявляется постепенным учащением припадков, склонностью к развитию серий припадков или эпилептического статуса. У многих больных эпилепсией, особенно при неадекватном лечении, могут развиться замедленность и патологическая обстоятельность мышления, многословность, чрезмерная пунктуальность, вздорность, эгоцентризм и в то же время угодливость, преувеличенная почтительность; может сужаться круг интересов, ухудшаться память и снижаться интеллект.
Диагностика эпилепсии основывается на факте наличия припадков и результатах электроэнцефалографии, которая выявляет эпилептическую активность в период припадка. При тонико-клонических судорогах на электроэнцефалограмме (ЭЭГ) регистрируется постоянный ряд ритмичных спайков или острых волн, подавляющих нормальный основной ритм. Во время абсанса на ЭЭГ наблюдаются ритмичные комплексы пик-волна, частотой 3 Гц. В межприступный период эпилептическую активность обнаруживают только у 2/з больных с припадками, выявляемость эпилептической активности повышается при использовании различных методов провокации (ритмическая световая стимуляция, гипервентиляция, суточная депривация сна, регистрация во время сна и др.). Отсутствие эпилептической активности при электроэнцефалографии в межприступный период не исключает диагноз эпилепсии, хотя указывает на необходимость тщательной дифференциальной диагностики с другими заболеваниями (обморок, мигрень, истерия и др.). И наоборот, эпилептическая активность на ЭЭГ при отсутствии припадков не служит основанием для диагностики эпилепсии.
Установив диагноз эпилепсии, необходимо постараться выяснить ее причину. Нередко большие судорожные припадки вызывает алкоголизм; большинство их развивается в период 7-46 ч после прекращения приема алкоголя лицами, страдающими хроническим алкоголизмом. Если у больного развиваются парциальные припадки, высока вероятность текущего неврологического заболевания, например опухоли головного мозга. Ведущее значение в установлении причины эпилепсии имеют КТ или МРТ головы, которые следует проводить всем больным, страдающим эпилептическими припадками.
Лечение эпилепсии включает помощь при эпилептическом припадке, что особенно важно при эпилептическом статусе и большом судорожном припадке, и профилактику повторных эпилептических припадков. При симптоматической эпилепсии необходимо лечение основного заболевания (например, удаление опухоли головного мозга) или
Тема 8. Пароксизмальные расстройства сознания устранение токсического фактора (прекратить употребление алкоголя).
Во время большого судорожного припадка необходимо максимально оградить больного от возможных повреждений. Его укладывают на кровать или на пол, по возможности на бок (предупредить аспирацию рвотных масс), и удаляют предметы, способные причинить травму; не следует оказывать насильственных действий, например пытаться вставлять в рот между зубами различные предметы для предупреждения травм языка. При эпилептическом статусе для купирования судорог в/в медленно, при необходимости повторно, вводят диазепам (сибазон, реланиум, седуксен) в дозе 0,25-0,4 мг/кг (до 20 мг), и если статус не купируется, пациента направляют в реанимационное отделение, где обеспечивают Проходимость дыхательных путей (введение воздуховода или интубация трахеи), дают кислород через маску. В случае продолжения припадков в/в вводят барбитураты (тиопентал натрия или гексенал), раствор фенитоина или вальпроата натрия, проводят мониторинг кислотно-основного состояния, гемостаза и при необходимости корригируют их.
В предупреждении повторных эпилептических припадков ведущее значение имеют рациональный режим труда и отдыха, исключение приема алкоголя, обеспечение нормального ночного сна, исключение других факторов, провоцирующих припадки, и регулярный прием противоэпилептиче-ских препаратов. Работа больного не должна быть связана с пребыванием на высоте, огнем, обслуживанием движущихся механизмов, вождением автомобиля. Лечение начинают с приема одного препарата, постепенно повышая дозу от начальной до средней, а при отсутствии эффекта — до максимальной. Если частота припадков не снижается или возникают побочные эффекты, то назначают другой препарат и постепенно отменяют первый. Резкая отмена препарата даже при его низкой эффективности опасна развитием эпилептического статуса. При частичном эффекте обычно используют комбинацию с другим препаратом, при этом схема приема должна быть предельно упрощена. При отсутствии эффекта от лекарственного препарата можно исследовать
его концентрацию в крови; высокая концентрация препарата свидетельствует об отсутствии его эффективности, низкая его концентрация указывает на целесообразность увеличения дозы для получения клинического эффекта.
Выбор противоэпилептического средства зависит от припадков. При больших судорожных и парциальных припадках препараты выбора — карбамазепин (финлепсин) по 8-20 мг/ кг/сут, вальпроаты (депакин) по 10-50 мг/кг/сут или дифенин (фенитоин) по 5-10 мг/кг/сут, препараты резерва — фенобарбитал (люминал) по 2-4 мг/кг/сут у взрослых и по 3-8 мг/кг/сут у детей, а также ламотриджин (ламиктал) по 50-200 мг/сут, габапентин (нейронтин) по 1200 мг/сут, топирамат (топомакс) по 200-600 мг/сут. При абсансах препараты выбора — этосуксимид (суксилеп) по 10-25 мг/кг/сут и вальпроаты (депакин), препараты резерва — ламотриджин (ламиктал), клоназепам по 2-6 мг/сут. При миоклонических припадках препараты выбора — вальпроаты (депакин) и бензодиазепины, клоназепам, препарат резерва — ламотриджин (ламиктал). Прием препаратов должен быть непрерывным и длительным. Если на протяжении 3 лет припадки отсутствуют на фоне лечения, то возможно постепенно (в течение 1-2 лет) под контролем электроэнцефалографии уменьшить дозы препаратов до полной отмены. Прекращать лечение не рекомендуется в пубертатном периоде. Низкая эффективность противоэпилептической терапии чаще отмечается при парциальных припадках, выраженных психических изменениях, задержке психомоторного развития у детей.
При отсутствии эффекта от консервативного лечения обсуждается возможность хирургического удаления эпилептического очага, которое чаще используется при выявлении в коре головного мозга эпилептического очага по данным электроэнцефалографии, МРТ и позитронно-эмиссионной томографии головы.
Обмороки
Обморок (синкопе) — кратковременная потеря сознания, вызванная преходящим значительным снижением мозгового
кровотока. Предобморочное или липотимическое (пресин-копальное) состояние — ощущение потери сознания — представляет более легкую степень этого состояния. В течение жизни обмороки возникают почти у 73 людей, чаще у женщин.
Этиология, патогенез и классификация. В зависимости от механизма развития обморока их можно с определенной степенью условности разделить на неврогенные, соматогенные и психогенные (истерия, тревожные расстройства).
Неврогенные обмороки возникают в результате неоптимальных вегетативных и сосудистых рефлекторных реакций и обусловливаются резким снижением артериального давления вследствие расширения периферических сосудов (вазомоторный обморок) и/или брадикардии (вазовагальный обморок). Вазомоторный обморок встречается наиболее часто (до 90 % всех обмороков), он возникает, как правило, у молодых людей в период стрессовых ситуаций (вид крови, неожиданное известие, испуг), при интенсивной боли или провоцирующих физических факторах (жара, душное помещение, выраженная усталость, длительное стояние); с возрастом обмороки возникают реже или исчезают совсем. К неврогенным относят также синокаротидный обморок (синдром гиперчувствительности каротидного синуса), который наблюдается преимущественно у мужчин пожилого и старческого возраста и может возникать при движении головой и наклонах головы назад, ношении жестких воротничков и тугом завязывании галстука. Кашлевой обморок (беттолепсия) обычно развивается на фоне выраженного кашля при бронхолегочных заболеваниях. Никтурический обморок наблюдается преимущественно у мужчин среднего и пожилого возраста после или (реже) во время мочеиспускания в ночное время. Возможны обмороки при дефекации, которые чаще возникают в пожилом и старческом возрасте на фоне запора при натуживании. Ортостатический обморок обусловлен недостаточностью рефлекторных симпатических механизмов, поддерживающих тонус периферических артерий, и вследствие этого резким падением артериального давления при резком переходе в вертикальное положение или длительном пребывании в нем. Обморок может возни
кать при вегетативной периферической недостаточности у больных с полиневропатией на фоне идиопатической ортостатической гипотензии, сахарного диабета, амилоидоза, алкоголизма, а также вследствие гиповолемии (кровопотеря, рвота и др.), длительного постельного режима или приема некоторых лекарственных средств (нитраты, гипотензивные и сосудорасширяющие средства и др.).
Среди соматогенных обмороков наиболее часто встречается кардиогенный обморок, обусловленный снижением мозгового кровотока вследствие резкого уменьшения сердечного выброса. Он может быть вызван аритмией (желудочковая тахикардия, атриовентрикулярная блокада, синдром слабости синусового узла и др.) или препятствием кровотоку в сердце (миксома предсердия, тампонада сердца, гипертрофическая кардиомиопатия и др.).
Клиническая картина. Для всех типов обмороков характерно быстрое развитие. Потере сознания нередко предшествуют ощущение тошноты и дурноты, пелена перед глазами, головокружение, утрата ясности мышления. Человек ощущает слабость, чувство приближающейся потери сознания (предобморочное состояния) и стремится лечь. Если такой возможности нет, он теряет сознание и медленно падает («оседает»). В период обморока дыхание и пульс ослаблены, мышечный тонус низкий, зрачки часто расширены и ослаблена их реакция на свет. После нескольких секунд или 1-2 мин горизонтального положения человек открывает глаза и быстро приходит в себя. Сразу после обморока кожные покровы остаются бледными, пульс слабый, артериальное давление низкое. Некоторое время сохраняется общая слабость, может быть тошнота.
Вазомоторный обморок нередко у одного и того же больного развивается под влиянием определенного фактора (например, жара, душное помещение), он возникает только в вертикальном положении, и больной обычно не теряет сознания, если при появлении первых симптомов имеет возможность лечь. Во время обморока при длительной и глубокой потере сознания возможны тонические (но не клонические) судороги. Развитие обморока в положении лежа
Тема 8. Пароксизмальные расстройства сознания указывает на соматическую, чаще кардиогенную (аритмия) его природу.
Диагноз вазомоторного обморока основывается на данных анамнеза и требует исключения других типов обмороков, гипогликемии и эпилепсии. При подозрении на кардиогенный обморок, который часто проявляется внезапной потерей сознания без предшествующих симптомов, показана консультация кардиолога, ЭКГ-исследование, холтеровское мониторирование, эхокардиография и другие исследования. Ортостатический и синокаротидный обмороки подтверждаются соответственно результатом ортостатической и синокаротидной пробы. Психогенные обмороки часто вызваны гипервентиляцией и обычно проявляются длительным (несколько минут) предобморочным состоянием в виде не только дурноты, общей слабости, но и чувства страха, тревоги, нехватки воздуха, в виде парестезий, тетании; нередко наблюдается чередование периодов возврата и потери сознания. В неясных случаях для дифференциальной диагностики с эпилепсией проводят электроэнцефалографическое исследование с провоцирующими эпилептический припадок пробами (при обмороке не обнаруживают эпилептической активности). При нарушении сознания, вызванном гипогликемией, определяется снижение уровня сахара в крови и характерен регресс симптомов при внутривенном введении глюкозы. Клинический анализ крови позволяет исключить анемию.
Лечение. Во время вазомоторного обморока необходимо уложить больного на спину и приподнять ноги, освободить шею и грудь от стесняющей одежды. Для более быстрого возвращения сознания можно обрызгать лицо холодной водой, приложить холодное полотенце, дать для вдыхания нашатырный спирт. При необходимости в случаях значительного снижения артериального давления можно использовать симпатомиметические средства (1%-й раствор мезатона, 5%-й раствор эфедрина), в случаях сердечной аритмии — противо-аритмические средства. При развитии предобморочного состояния в связи с медицинской процедурой (взятие крови для анализа, стоматологические процедуры) необходимо
быстро уложить пациента или резко наклонить его туловище вниз. Для профилактики неврогенных обмороков нередко достаточно избегать провоцирующих факторов или устранить их. При ортостатическом обмороке не следует быстро вставать, основное лечение направлено на устранение причины ортостатической гипотензии. При других типах обмороков (кардиогенный, психогенный и др.) необходимо лечение основного заболевания.
Таблица
Краткие сведения об эпилепсии и обмороках
Краткие сведения Эпилепсия Обморок
Причины Распространение чрезмерных нейронных разрядов из очага эпилептической активности на весь мозг (генерализованный припадок) или его часть (парциальный припадок). Идиопатическая эпилепсия. Симптоматическая эпилепсия: пре- и перинатальные нарушения, инфекционные заболевания ЦНС; токсическое поражение ЦНС (этанолом и др.); черепно-мозговая травма; цереброваскулярные заболевания; дис-метаболические энцефалопатии; опухоли головного мозга; наследственные заболевания, лихорадка, дегенеративные заболевания головного мозга Преходящее значительное снижение мозгового кровотока. Неврогенные (рефлекторные) обмороки: вазомоторный (90 % всех обмороков), вазовагальный, синокаротидный, кашлевой и никтурический. Кардиогенный (вследствие аритмии или препятствия кровотоку в сердце), ортостатический, гипоксический и психогенный обмороки
Клини- ческая картина Первично генерализованные припадки (с нарушением сознания с начала припадка): большие судорожные (тонико-клонические) припадки и абсансы (потеря сознания до 2-10 с). Парциальные (фокальные) припадки: простые (моторные, сенсорные, вегетативные) и сложные (с вторичным нарушением сознания). Быстрая и кратковременная (секунды — 1-2 мин) потеря сознания, которой нередко предшествуют ощущение дурноты, пелена перед глазами, головокружение. В период обморока дыхание и пульс значительно
Окончание табл.
Краткие сведения Эпилепсия Обморок
Эпилептический статус — продолжительный (более 30 мин) парциальный или генерализованный припадок либо серия повторяющихся друг за другом припадков. Без лечения во многих случаях увеличивается число припадков, возможны замедленность и обстоятельность мышления ослаблены, мышечный тонус низкий. Вазомоторный припадок нередко возникает у одного и того же больного при определенных ситуациях (душное помещение, вид крови и др.) и в вертикальном положении
Электро-энцефа-логра-фия Эпилептическая активность в период припадка и иногда в период между припадками Отсутствие эпилептической активности при обмороке
Другие дополнительные исследования КТ и МРТ головы необходимы для исключения опухоли и других возможных причин эпилептических припадков При подозрении на кардиогенный, ортостатический и гипоксический обморок необходимо соответствующее обследование пациента для выявления причины заболевания
Лечение Отказ от употребления алкоголя, достаточный сон и исключение других факторов, провоцирующих припадки. Регулярный и длительный прием противоэпилептических средств (вальпроаты, карбамазепин, фенитоин, фенобарбитал, ламотриджин, топирамат, габапентин и др.). Экстренная помощь при эпилептическом статусе и тонико-клоническом припадке Избегать ситуаций, провоцирующих обмороки. Лечение основного заболевания при соматогенных обмороках
Тема 9
Боль в спине. Вертеброгенные неврологические нарушения и другие скелетно-мышечные расстройства
Боли в спине — одна из наиболее частых жалоб пациентов в общемедицинской практике и одно из ведущих (по некоторым данным второе по частоте после респираторных заболеваний) обращений за медицинской помощью. В нашей стране пациенты с болью в спине чаще обращаются к неврологам или специалистам мануальной медицины, однако с развитием семейной медицины увеличивается число пациентов, которые по поводу боли в спине обследуются и лечатся у врачей общей практики.
Основные причины боли в спине. Боль в спине примерно в 90 % случаев вызвана дегенеративно-дистрофическими изменениями позвоночника (остеохондроз, спондилез, спон-дилоартроз), врожденными или приобретенными деформациями позвоночника, миофасциальными синдромами или фибромиалгией.
Дегенеративно-дистрофические изменения позвоночника проявляются остеохондрозом — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями тел смежных позвонков. Поражение межпозвонкового диска возникает вследствие его повторных травм (подъем тяжести, избыточная статическая и динамическая нагрузка, падения и др.) и возрастных дегенеративных изменений. Студенистое ядро, центральная часть диска, высыхает и частично утрачивает амортизирующую функцию.
Тема 9. Боль в спине. Вертеброгенные неврологические нарушения Фиброзное кольцо, расположенное по периферии диска, истончается, в нем образуются трещины, к которым смещается студенистое ядро, образуя выпячивание (пролапс), а при разрыве фиброзного кольца — грыжу (протрузию). Грыжи межпозвонковых дисков наиболее часто возникают в нижних поясничных дисках, реже — в нижнешейных и верхнепоясничных, крайне редко — в грудных. Грыжи диска в теле позвонка (грыжи Шморля) клинически не значимы, грыжи диска в заднем и задне-боковом направлении могут вызвать сдавление спинномозгового корешка (радикулопатия), спинного мозга (миелопатия), чаще на шейном уровне, или его сосудов. В пораженном позвоночном сегменте возникает относительная нестабильность позвоночника, развиваются костные разрастания тел позвонков — остеофиты, повреждаются связки (спондилез) и межпозвонковые суставы (спондилоартроз). Образование задних остеофитов может привести к сужению позвоночного канала, образование боковых остеофитов — к компрессии спинномозгового корешка в межпозвонковом канале. Кроме компрессионных синдромов возможны рефлекторные (мышечно-тонические), которые обусловлены патологической импульсацией от болевых рецепторов измененных дисков, связок и суставов позвоночника. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако в дальнейшем становится фактором, поддерживающим боль. Рефлекторные синдромы остеохондроза позвоночника возникают в течение жизни почти у каждого второго человека, компрессионные — значительно реже. Остеохондроз поясничного отдела часто сочетается с патологией крестцово-подвздошных сочленений.
Частой причиной боли в спине могут быть врожденные или приобретенные деформации позвоночника (сколиоз — искривление позвоночника в боковой плоскости, кифоз — искривление позвоночника назад), смещения тел позвонков — спондилолистез (обычно Lv смещается вперед относительно S, или LIV относительно Lv), сужение просвета позвоночного канала (позвоночный стеноз) и вызванное уменьшением содержания кальция в костях снижение плот
ности костной ткани — остеопороз, который осложняется компрессионным переломом позвоночника. Эти изменения обычно сочетаются с дегенеративно-дистрофическими изменениями позвоночника.
Миофасциальная боль вызвана формированием так называемых триггерных точек (зон) в мышцах и/или связанных с ними фасциях. Триггерные точки возникают под влиянием хронического мышечного напряжения при тяжелой физической работе, длительном пребывании в неудобной позе, резком движении и других состояниях. Эти точки могут находиться в активном или пассивном состоянии. Активная триггерная точка представляет зону повышенной возбудимости мышцы или ее фасции, она вызывает боль в покое и при движении, сопровождающимся напряжением мышцы. Пассивная триггерная точка выявляется только при пальпации мышцы, что и позволяет ее определить.
Фибромиалгия характеризуется диффузной и обычно симметричной болью в мышцах туловища и конечностей. Она чаще выявляется у женщин среднего и пожилого возраста, сочетается с депрессией, расстройством сна, астенией и другими психическими нарушениями, что указывает на ее вероятное психогенное происхождение.
Боль в спине может быть единственным симптомом при опухоли спинного мозга, сирингомиелии и других заболеваниях спинного мозга. Она возникает при деструкции позвонков и поражении нервных корешков вследствие инфекционных процессов (туберкулезный спондилит, спинальный эпидуральный абсцесс), новообразования (первичные и метастатические опухоли позвоночника, миеломная болезнь), дисметаболических нарушений (гиперпаратиреоз, болезнь Педжета). Боль в спине возможна вследствие перелома позвоночника, стеноза позвоночного канала и анкилозирующего спондилоартрита (болезнь Бехтерева).
Боль в спине возникает при различных соматических заболеваниях (сердца, желудка, поджелудочной железы, почек, органов малого таза и др.) по механизму отраженной боли, что необходимо иметь в виду при дифференциальной диагностике.
I
Распространенность различных причин боли в спине существенно меняется с возрастом. Изменения осанки (сколиоз, кифоз), миофасциальные синдромы, врожденные деформации позвоночника и остеохондропатия (болезнь Шейермана) являются наиболее частыми причинами боли в спине в детском и подростковом возрасте. Миофасциальные синдромы и травмы служат ведущими причинами боли в спине в молодом и среднем возрасте. Кроме этих причин в пожилом возрасте боль в спине часто вызвана спондилезом, спондилоартрозом, остеопорозом, метастазами опухолей. У женщин частой причиной боли является фибромиалгия.
Обследование пациента с болью в спине. При расспросе жалоб и анамнеза выясняют: локализацию и иррадиацию боли, ее длительность и обстоятельства возникновения, зависимость боли от положения тела и движения в позвоночнике, перенесенные травмы и заболевания. Появление боли после неловкого движения, длительного пребывания в неудобной позе, тяжелой физической работы, а также усиление боли при изменениях положения тела и движениях характерны для неврологических проявлений дегенеративно-дистрофических изменений позвоночника и миофасциальных синдромов. Оценка эмоционального состояния пациента (выявление депрессии и повышенной тревожности) имеет большое значение при хроническом болевом синдроме, который во многих случаях вызван и поддерживается психогенными факторами.
При обследовании пациента с болью в спине следует провести внешний осмотр, определить подвижность различных отделов позвоночника, наличие локальной болезненности в спине и конечностях, напряжение мышц и болезненность при их пальпации (нейроортопедическое обследование). При внешнем осмотре можно выявить искривление позвоночника в боковую сторону (сколиоз), усиление физиологических изгибов позвоночника (лордоз или кифоз), ограничение подвижности в некоторых отделах позвоночника при поворотах в постели, вставании, ходьбе или движении, вызывающем напряжение пораженной мышцы. При неврологическом обследовании определяют наличие парезов, расстройств чув
ствительности, выпадения рефлексов, симптомов натяжения нервных корешков и других неврологических нарушений. Соматическое обследование направлено на выявление злокачественных новообразований, инфекционных процессов и соматических заболеваний, которые могут проявляться болью в спине.
У пациентов с болью в спине диагноз часто устанавливается на основании неврологического и нейроортопедическо-го обследования, если оно выявляет типичную клиническую картину дегенеративно-дистрофических изменений позвоночника, миофасциального синдрома или фибромиалгии и при этом нет признаков онкологического или воспалительного заболевания, а также травмы позвоночника.
При боли в спине в части случаев необходимы дополнительные исследования, которые позволяют выявить другие заболевания, иногда скрывающиеся под маской доброкачественных, в основном, болевых синдромов. К таким случаям относятся: (1) нетипичная картина болевого синдрома (отсутствие связи боли с движениями позвоночника; необычная локализация боли); (2) травма спины в анамнезе; (3) лихорадка, симптомы интоксикации, онкологическое заболевание; (4) нарушение функции тазовых органов, признаки поражения спинного мозга.
В таких случаях необходимы дополнительные исследования, среди которых наиболее часто используются: (1) рентгенография позвоночника в нескольких проекциях, (2) общий и биохимический анализ крови, (3) КТ или МРТ позвоночника, (4) денситометрия (оценка костной плотности) и сцинтиграфия позвоночника и костей таза и конечностей.
Рентгенография позвоночника позволяет, в основном, исключить врожденные аномалии и деформации, перелом позвонков, смещение тел позвонков (спондилолистез), воспалительные заболевания (спондилит), первичные и метастатические опухоли. Рентгенография позвоночника не позволяет точно определить грыжу межпозвонкового диска, косвенно на ее наличие указывает уменьшение высоты межпознкового диска. Признаки дегенеративно-дистрофических изменений (остеохондроз, спондилез или спондилоартроз) обнаружива-
Тема 9. Боль в спине. Вертеброгенные неврологические нарушения ются почти у 50 % лиц среднего возраста и у большинства пожилых пациентов, нет прямой зависимости между наличием и выраженностью их и болью в спине. Поэтому выявление дегенеративно-дистрофических изменений при рентгенографии не исключает наличия других причин боли в спине и не может быть основой клинического диагноза.
Рентгеновская КТ или МРТ позволяет выявить грыжу диска, определить ее размеры и локализацию, а также обнаружить стеноз позвоночного канала, опухоль спинного мозга или другие неврологические заболевания. Важно отметить, что при КТ и МРТ позвоночника часто выявляются дистрофические изменения, особенно в старших возрастных группах. Эти изменения обнаруживаются почти у 90% пожилых пациентов с болями в спине. Наличие грыжи межпозвонковых дисков по данным КТ или МРТ, особенно небольших размеров, не исключает другой причины боли в спине и не может быть основой клинического диагноза.
Денситометрия костей используется для диагностики снижения костной плотности (остеопороза), сцинтиграфия костей — для определения их метастатического поражения.
Дегенеративно-дистрофические изменения позвоночника (остеохондроз, спондилез, спондилоартроз) чаще проявляются в виде поясничных рефлекторных синдромов: люмбаго, люмбалгии, люмбоишиалгии.
Люмбаго (поясничный прострел) — резкая, простреливающая боль в пояснице, которая обычно развивается при физической нагрузке (подъем тяжести) или неловком движении. Больной нередко застывает в неудобном положении, попытка движения приводит к усилению боли. При обследовании выявляют напряжение мышц спины, обычно сколиоз, уплощение поясничного лордоза или кифоз, значительное ограничение подвижности в поясничном отделе из-за усиления боли. Симптомы поражения периферической нервной системы не определяются.
Люмбалгия — боль в спине и люмбоишиалгия — боль в спине и по задней поверхности ноги развиваются чаще после физической нагрузки, неловкого движения или переохлаждения, реже — без каких-либо причин. Боль ноющая,
усиливается при движениях в позвоночнике, определенных позах, ходьбе. Для люмбоишиалгии характерна боль в ягодице и по задненаружной поверхности ноги, но в отличие от поражения нервного корешка (радикулопатии) при рефлекторных синдромах боль не достигает пальцев стопы. При обследовании выявляют болезненность, напряжение мышц спины и задней группы мышц ноги, ограничение подвижности позвоночника, часто сколиоз, симптомы натяжения (Ласега, Вассермана и др.).
Радикулопатия поясничных и первого крестцового корешков проявляется острой простреливающей болью в вжище w ноте. При обследовании больного кроме мышечно-тонического синдрома (напряжения мышц спины и ноги), наблюдаемого при рефлекторной люмбоишиалгии, выявляются чувствительные, рефлекторные и/или двигательные нарушения в зоне пораженного корешка. Радикулярная или корешковая боль более интенсивная, чем боль при мышечно-тоническом синдроме, для нее характерна иррадиация в проксимально-дистальном направлении по ходу корешка. Корешковая боль острая, иногда «кинжальная», обычно уси-ливается при движении, кашле и движении.
Характерны усиление боли после чиханья, приведения подбородка к грудине, симптомы натяжения нервных корешков. Чаще поражаются пятый поясничный (L5) и первый крестцовый (S,) корешки, реже — четвертый поясничный корешок (L4) и очень редко верхние поясничные корешки.
При радикулопатии S( боль и парестезии распространяются от поясницы и ягодицы по задней поверхности бедра, задненаружной поверхности голени к наружному краю стопы и последним пальцам. Зона болевой и тактильной гипестезии выявляется на наружной поверхности голени и последних пальцах стопы, реже — на задней поверхности бедра; выпадает ахиллов рефлекс, при вовлечении двигательной части корешка определяется слабость икроножной мышцы, иногда — пронаторов стопы.
При радикулопатии L5 боль и парестезии распространяются от поясницы и ягодицы по наружной поверхности бедра и голени к внутреннему краю стопы и большому паль-
Тема 9. Боль в спине. Вертеброгенные неврологические нарушения цу. Зона гипестезии выявляется на наружной поверхности голени и большом пальце, рефлексы сохранены; при вовлечении двигательной части корешка определяется слабость длинного разгибателя большого пальца, реже — тыльных сгибателей и пронаторов стопы.
При радикулопатии L4 боль и парестезии распространяются по передневнутренней поверхности бедра, иногда и по внутренней поверхности голени. Зона гипестезии выявляется в этой же области, выпадает коленный рефлекс, может определяться слабость четырехглавой мышцы бедра.
Важными для диагностики являются методы нейровизуализации (КТ или МРТ), выявляющие повреждение корешка грыжей диска или остеофитом.
Цервикалгия и цервикобрахиалгия — рефлекторные синдромы на шейном уровне, которые чаще развиваются после физической нагрузки или неловкого движения шеи. Цервикалгия — боль в шейной области, которая нередко распространяется в затылок (цервикокраниалгия).
Цервикобрахиалгия — боль в шейной области с распространением в руку. Характерно усиление боли при движениях в шее или, наоборот, при длительном однообразном положении (в кино, после сна на плотной высокой подушке и др.). При обследовании выявляют напряжение шейных мышц, ограничение движений в шейном отделе, болезненность при пальпации остистых отростков и межпозвонковых суставов на стороне боли.
Радикулопатия нижних шейных корешков встречается значительно реже, чем рефлекторные синдромы, и проявляется помимо мышечно-тонического синдрома чувствительными, рефлекторными и/или двигательными нарушениями в зоне иннервации пораженного корешка. При радикулопатии С6 отмечается боль по краю трапециевидной мышцы, в верхних отделах плеча с иррадиацией по его передней поверхности, лучевой поверхности предплечья и часто в большой и указательный пальцы кисти, возможны чувствительные нарушения в этих областях, снижение рефлекса с двуглавой мышцы и карпорадиального рефлекса, легкий парез мышц, обеспечивающих сгибание предплечья и наружную ротацию
плеча. При радикулопатии С7 отмечается боль в лопатке с иррадиацией в область грудных мышц, подмышечную впадину, заднебоковую поверхность плеча, заднюю поверхность предплечья, указательный и средний пальцы; возможны чувствительные нарушения в этих областях, снижение рефлекса с трехглавой мышцы, слабость мышц, разгибающих предплечье. Информативно КТ- или MPT-исследование шейного отдела позвоночника.
В грудном отделе рефлекторные и компрессионые синдромы дегенеративно-дистрофических изменений позвоночника встречаются значительно реже, чем в поясничном и шейном отделах. Они проявляются рефлекторными мышечно-тоническими синдромами, при радикулопатии — нарушением чувствительности в зоне пораженных корешков.
Течение рефлекторных и компрессионных осложнений дегенеративно-дистрофических изменений позвоночника различно. В большинстве случаев в возрасте 20-60 лет наблюдаются периодические обострения заболевания, чаще после физических нагрузок, неловкого движения или переохлаждения. Рефлекторные синдромы обычно проходят в течение нескольких дней или 2-4 нед., радикулопатии — в течение месяцев, но в части случаев они принимают хроническое течение на годы. После 60 лет обострения заболевания часто становятся редкими или совсем прекращаются.
Спондилолистез (чаще всего смещение Lv вперед относительно S( или LIV относительно L(v) обычно возникает в детском или подростковом возрасте, но проявляется клинически в среднем и пожилом возрасте. Характерны боль в нижних отделах спины, ограничение подвижности в поясничном отделе, пальпируемая «ступенька» с одного остистого отростка на нижележащий (с Lv на S, или с L1V на Lv), выраженный поясничный лордоз. Боль усиливается в положении стоя и при ходьбе. В некоторых случаях вследствие компрессии спинномозговых корешков возникают периферический парез конечностей, расстройства чувствительности по сегментарно-корешковому типу или нарушение функции тазовых органов.
Поясничный стеноз (сужение позвоночного канала в поясничном отделе) проявляется болью в нижних отделах спины обычно с иррадиацией в бедро и голень. Как правило, боль усиливается в положении стоя и при ходьбе и может напоминать перемежающуюся хромоту, связанную с поражением сосудов. В некоторых случаях возникают периферические парезы стоп и чувствительные нарушения в них. В положении сидя, при наклоне вперед и сгибании туловища симптомы уменьшаются или исчезают.
Вертеброгенная шейная миелопатия относится к редким осложнениям дегенеративно-дистрофических изменений позвоночника, проявляющихся сужением позвоночного канала на шейном уровне и компрессией спинного мозга. Она возникает преимущественно в среднем и пожилом возрасте и обычно развивается постепенно. Вначале отмечаются боль и ограничение движений в шейном отделе позвоночника. В дальнейшем к ним присоединяется слабость в конечностях, у больных в руках выявляют периферический парез, в ногах — спастический парез и нарушение глубокой чувствительности. В редких случаях нарушается функция тазовых органов.
Сдавление корешков конского хвоста представляет другое редкое осложнение остеохондроза, вызванное большими срединными грыжами дисков L5-S1 и L4-L5. Оно проявляется острой болью в обеих ногах, онемением в них и аногенитальной области, нарушением функции тазовых органов. Также возможно сдавление корешково-спинномозговой артерии L5 и S,, проявляющееся развитием на фоне боли в спине и ноге слабости в стопе (парализующий ишиас) с последующим ослаблением боли. Крайне редко сдавливается артерия, кровоснабжающая спинной мозг (спинальный инсульт), что проявляется параличом ног, проводниковым типом расстройств чувствительности и тазовыми нарушениями.
Диагноз рефлекторных и компрессионных осложнений дегенеративно-дистрофических изменений позвоночника основывается на клинических данных и требует исключения других возможных причин боли в спине. Рентгеногра
фию позвоночника используют, в основном, для исключения врожденных аномалий и деформаций, спондилолистеза, воспалительных заболеваний (спондилит), первичных и метастатических опухолей. Рентгеновская КТ или МРТ позволяет выявить грыжу диска, определить ее размеры и локализацию, а также обнаружить стеноз позвоночного канала, спондилолистез, опухоль и другие заболевания спинного мозга.
Миофасциальная боль проявляется напряжением мышц и наличием в них триггерных точек, которые обнаруживаются путем мануального исследования мышц. Активная триггерная точка — постоянный источник боли, усиливающейся при пальпации точки в мышце; латентная триггерная точка вызывает боль только при ее пальпации. У каждой мышцы возникает самостоятельный миофасциальный синдром, с характерной локализацией боли при раздражении триггерной зоны, распространяющейся за пределы проекции мышцы на кожную поверхность. При миофасциальных синдромах симптомы поражения периферической нервной системы отсутствуют, за исключением тех случаев, когда напряженные мышцы сдавливают нервный ствол.
Среди миофасциальных болей часто встречаются синдромы лестничной мышцы и квадратной мышцы поясницы. При поражении лестничной мышцы почти вдвое ограничен поворот головы из-за боли, которая может распространяться вокруг плечевого сустава и вдоль руки. При миофасциальном синдроме квадратной мышцы — боль в пояснице и болезненность при пальпации мышцы — боль часто распространяется в область ягодицы, подвздошного гребня и большого вертела бедра.
Диагноз миофасциальных синдромов основывается на клинических данных и исключении других возможных причин боли; дифференциальный диагноз с рефлекторными синдромами (мышечно-тонические синдромы) вследствие дегенеративно-дистрофических изменений позвоночника часто бывает сложным, возможно сочетание этих заболеваний.
При отсутствии поддерживающих факторов миофасциальная боль может пройти самопроизвольно, если предоста-
Тема 9. Боль в спине. Вертеброгенные неврологические нарушения вить мышце покой на несколько дней. Напротив, физическая нагрузка, стрессовая ситуация и другие негативные влияния могут способствовать хроническому течению миофасциального синдрома, что сопровождается развитием дистрофических процессов в пораженных мышцах.
Фибромиалгия встречается преимущественно у женщин. Характерна диффузная и симметричная боль в туловище и конечностях. Отмечаются болезненные зоны, легкая пальпация которых усиливает боль. При фибромиалгии, в отличие от миофасциальной боли, давление на болезненные точки не вызывает мышечного напряжения и распространения боли в другие области. Болевые зоны обычно располагаются в затылочной области, шее, межлопаточной области, пояснице, ягодицах, внутренней поверхности коленных суставов. Поражения периферической нервной системы не отмечается. У больных с фибромиалгией часты депрессия, астения, нарушение сна, головная боль напряжения и болевые синдромы другой локализации. Диагноз основывается на клинических данных. Преобладает хроническое течение заболевания с частыми обострениями, нередко вызванными психогенными факторами.
Другие заболевания, проявляющиеся болью в спине. При опухоли спинного мозга, сирингомиелии и других заболеваниях спинного мозга боль в спине часто сочетается с другими неврологическими расстройствами, обычно отсутствует мышечно-тонический синдром. Диагноз устанавливают с помощью КТ или МРТ позвоночника.
При деструктивном поражении позвоночника (туберкулезный спондилит, первичная опухоль или метастаз в позвоночник, остеопороз, гиперпаратиреоз) часто наблюдается локальная болезненность, диагноз устанавливают на основании результатов рентгенограммы и/или КТ или МРТ позвоночника.
Перелом позвоночника, врожденные или приобретенные деформации позвоночника (сколиоз), деформирующий спондилоартрит, ревматоидный артрит, болезнь Педжета также проявляются болью в спине. В их диагностике большое значение имеют рентгенологические методы исследования.
При соматических заболеваниях отраженная боль в спине обычно сочетается с другими проявлениями заболевания, она не сопровождается напряжением мышц спины и обычно не усиливается при движениях в позвоночнике. Отраженная боль обычно диффузная и ноющая, но временами бывает более острой и поверхностной.
Лечение боли в спине основывается на терапии основного заболевания. В дальнейшем изложено лечение при наиболее частых причинах боли в спине — неврологических осложнениях дегенеративно-дистрофических изменений позвоночника, миофасциальной боли и фибромиалгии.
Лечение рефлекторного синдрома и радикулопатий вследствие дегенеративно-дистрофических изменений позвоночника основывается в остром периоде на покое, избегании резких наклонов и болезненных поз. Рекомендуют постельный режим в течение нескольких дней до стихания резкой боли, жесткую постель (щит под матрац), прием анальгетиков, нестероидных противовоспалительных препаратов (диклофенак, индометацин, мовалис, целебрекс и др.) и миорелаксантов (мидокалм, сирдалуд). После этого рекомендуется постепенное увеличение физической нагрузки, пациенту следует оберегаться от чрезмерного мышечного напряжения (длительное сидячее положение, ношение тяжестей и т.п.). При ослаблении боли рекомендуют постепенное увеличение двигательной активности, упражнения на укрепление мышц. Ранняя и более быстрая активизация больных и постепенное возвращение их к труду снижает вероятность хронического течения болевого синдрома.
При острой боли в нижней части спины можно использовать фиксирующий пояс, при боли в шее — шейный воротник. Однако длительная фиксация шейного или поясничного отдела не рекомендуется, за исключением некоторых случаев, например, травматического перелома позвонков или их смещения (спондилолистез). Поясничный фиксирующий пояс можно использовать также периодически при необходимости передвижения в случае острой боли, а также подъема тяжести после стихания боли.
Можно использовать физиотерапевтические обезболивающие процедуры, втирание мази, компрессы с 30—50% раствором димексида и новокаином, новокаиновые и гидрокортизоновые блокады.
При радикулопатии, особенно парализующем ишиасе с корешковой болью и парезом стопы, используются средства для улучшения кровообращения в сосудах спинномозгового корешка, например пентоксифиллин (трентал, вазонит).
Если рефлекторные синдромы дегенеративно-дистрофических изменений позвоночника обычно проходят в течение 1-4-х нед., то при радикулопатии сроки восстановления удлиняются до 6—8 нед. При хроническом течении рефлекторных синдромов и радикулопатий могут быть эффективны физиотерапевтическое лечение, нестероидные противовоспалительные средства, миорелаксанты, мануальная терапия, рефлексотерапия и санаторно-курортное лечение. У многих больных с длительным течением болевого синдрома выявляется депрессивное расстройство и значительный эффект можно получить от применения антидепрессантов (амитриптилин, флуоксетин и др.) в комбинации с другими методами Терапии, и особенно лечебной гимнастикой.
Хирургическое лечение (удаление грыжи диска) необходимо в тех редких случаях, когда возникает сдавление спинного мозга или спинномозговых корешков. Хирургическое лечение в оптимальные сроки показано при поясничном стенозе, спондилолистезе и вертеброгенной шейной миелопатии.
Для профилактики обострений остеохондроза рекомендуют избегать провоцирующих факторов (подъем больших грузов, ношение тяжелой сумки в одной руке, переохлаждение и др.), регулярно заниматься лечебной гимнастикой.
При миофасциальной боли необходимо предоставить мышце покой на несколько дней. Можно использовать упражнения на растяжение мышц (постизометрическая релаксация), прием миорелаксантов (мидокалм, сирдалуд), физиотерапию (ультразвук), рефлексотерапию или местное введение анестетиков в триггерные зоны, компрессы с ди-мексидом и анестетиками.
При фибромиалгии наиболее эффективны антидепрессанты (амитриптилин, флуоксетин и др.). Для уменьшения боли используют нестероидные противовоспалительные средства, физиотерапию, лечебную гимнастику и рефлексотерапию. У многих пациентов наблюдается только частичное ослабление боли после курса лечения, часто возникают обострения, что требует повторных курсов лечения.
Таблица
Краткие сведения о неврологических проявлениях дегенеративно-дистрофических изменений позвоночника, миофасциальном синдроме и фибромиалгии
Основные характеристики Дегенеративнодистрофические изменения позвоночника Миофасциальный синдром Фибромиалгия
Причина боли Рефлекторные (мышечно-тонические) синдромы и радикулопатии Формирование активных и пассивных триггерных зон в мышце На фоне депрессии и астении возникает диффузная боль (психогенная боль)
Клиническая картина Появление боли после физической нагрузки, усиление боли при изменении положения позвоночника, движениях, мышечно-тонический синдром и при радикулопатии симптомы поражения корешка Появление боли после физической нагрузки, усиление боли при движении, вызывающем напряжение мышцы, наличие болезненных зон при пальпации мышцы Появление диффузной боли на фоне депрессии, болезненность при пальпации мышц в шее, спине и конечностях, движения в позвоночнике часто не ограничены
Рентгенография позвоночника Признаки остеохондроза, спондилеза, спондилоар-троза Специфические изменения отсутствуют Специф ические изменения отсутствуют
Окончание табл.
Основные характеристики Дегенеративнодистрофические изменения позвоночника Миофасциальный синдром Фибромиалгия
КТ или МРТ позвоночника Часто грыжи межпозвонковых дисков Специфические изменения отсутствуют Специфические изменения отсутствуют
Диагноз Характерные изменения при неврологическом и нейро-ортопедическом обследовании, отсутствие данных по клиническим признакам и дополнительным исследованиям (рентгенография позвоночника, КТ или МРТ) за другую причину боли в спине
Лечение В остром периоде — покой, анальгетики, нестероидные противовоспалительные средства, миорелаксанты, при ослаблении боли — лечебная гимнастика Не допускать нагрузки на мышцу, постизометрическая релаксация, введение анестетиков в триггерные точки, миорелаксанты, при ослаблении боли — лечебная гимнастика Антидепрессанты, нестероидные противовоспалительные средства, лечебная гимнастика
Тема 10
Головная и лицевая боль
Головная боль (цефалалгия) — одна из наиболее частых жалоб пациентов в медицинской практике. Она может быть ведущим, а иногда и единственным, симптомом почти при 50 различных заболеваниях. Головная боль возникает вследствие возбуждения болевых рецепторов, которые локализуются в твердой мозговой оболочке, артериях основания мозга и внечерепных артериях, покрывающих череп тканях (кожа, мышцы, сухожилия, слизистые оболочки), а также при заинтересованности тройничного, языкоглоточного и блуждающего нервов, двух верхних шейных спинномозговых корешков. Основная часть паренхимы мозга не имеет болевых рецепторов, поэтому обширные поражения вещества мозга часто не приводят к боли, хотя и сопровождаются значительными неврологическими нарушениями.
Выделяют первичную головную боль, когда она и связанные с ней симптомы составляют ядро клинической картины, и вторичную, когда она представляет симптом другого заболевания. К первичной головной боли относят мигрень, головную боль напряжения, пучковую головную боль и некоторые другие ее типы, не связанные со структурными повреждениями. Вторичная головная боль может быть проявлением черепно-мозговой травмы, опухоли, инфекционных заболеваний, приема или отмены некоторых веществ, дис-метаболических нарушений, краниальной невралгии, заболеваний глаз, носа, уха и зубов, синусита.
Обследование пациента с головной болью. Тщательно собранный анамнез составляет основу обследования пациента с головной болью. Необходимо выяснить темп развития головной боли, ее интенсивность, локализацию и длительность, сопутствующие симптомы, клиническое течение, провоцирующие, усиливающие и облегчающие факторы.
Первостепенное значение имеет темп развития головной боли. Впервые возникшая острая или нарастающая по интенсивности подострая головная боль значительно чаще указывает на серьезное и даже потенциально опасное для жизни заболевание (субарахноидальное кровоизлияние, менингит, опухоль мозга и др.), чем постоянная или периодически повторяющаяся (хроническая) головная боль, которая чаще представляет собой мигрень или головную боль напряжения.
На вероятность опасного заболевания у пациента с головной болью могут указывать следующие признаки: 1) впервые возникшая интенсивная или постепенно (дни или недели) нарастающая головная боль; 2) изменения при неврологическом обследовании; 3) лихорадка или другие проявления инфекционного заболевания; 4) наличие злокачественной опухоли.
Острая интенсивная головная боль в сочетании с менингеальными симптомами и лихорадкой позволяет предположить внутричерепной инфекционный процесс, без лихорадки — субарахноидальное кровоизлияние. При подозрении на инфекционное поражение головного мозга и его оболочек или субарахноидальное кровоизлияние ведущее значение в диагностике имеет исследование цереброспинальной жидкости. Однако в тех случаях, когда нельзя исключить объемный процесс в головном мозге (опухоль, травматическая гематома, абсцесс), необходимо сначала провести КТ или МРТ головы, а затем (при отсутствии объемного процесса) — люмбальную пункцию.
При обследовании пациента с подострой или хронической головной болью для исключения объемного процесса в головном мозге (опухоль, субдуральная гематома, абсцесс) ведушее значение имеют КТ или МРТ головы. Если у па
циента с хронической головной болью предполагается заболевание глаз, ротовой полости, уха, носа или глотки, то показана консультация соответствующих специалистов. При психических нарушениях необходима консультация психиатра. В тех случаях, когда предполагается связь головной боли с дисфункцией шейного отдела позвоночника, необходимо нейроортопедическое обследование.
Мигрень
Мигрень — одна из наиболее распространенных форм первичной головной боли, которая обусловлена дисфункцией нейрогенной вазомоторной регуляции. Мигренью страдает 10-12% взрослого населения, женщины в 1,5-2 раза чаще мужчин, однако в детском возрасте приступы мигрени встречаются у мальчиков не реже, чем у девочек. Выделяют мигрень с аурой и мигрень без ауры. Мигрень с аурой более чем в половине случаев возникает у членов одной семьи, что указывает на важную роль наследственного фактора в ее развитии. Несколько реже наследственной может быть мигрень без ауры.
Патогенез. Патогенез мигрени не совсем ясен и представляется в виде взаимодействия невральных, сосудистых и нейрохимических компонентов. Одна из наиболее ранних гипотез объясняет развитие неврологической симптоматики при мигрени спазмом сосудов (преимущественно внутричерепных), а головную боль — их расширением (преимущественно внечерепных). Более поздние гипотезы предполагают повышенную чувствительность окончаний тройничного нерва в кровеносных сосудах у пациентов с мигренью. Снижение мозгового кровотока, возникающее перед головной болью, приводит к деполяризации нервных окончаний в кровеносных сосудах, что вызывает их расширение и вследствие этого пульсирующую и одностороннюю боль. В патогенезе мигрени также отводится важная роль снижению содержания серотонина в сыворотке крови в период головной боли.
К основным факторам, провоцирующим приступ мигрени, относят: эмоциональный стресс, период менструации и
Тема 10. Головная и лицевая боль овуляции, недосыпание, физические нагрузки, некоторые продукты питания (какао, шоколад, сыр и др.), алкоголь, сильный свет, шум, неприятные запахи, обострение сопутствующих заболеваний, перемену погоды.
Клиническая картина. Первые приступы мигрени обычно возникают в юношеском или молодом возрасте, реже — в зрелом и крайне редко — в пожилом. Наибольшая распространенность заболевания в возрастной группе 20- 40 лет.
Основное клиническое проявление болезни — приступообразная головная боль, которая наиболее часто локализуется в половине головы (гемикрания) в лобно-височной области, бывает интенсивной и часто пульсирующей, нередко сопровождается тошнотой, рвотой, свето- и звукобоязнью, усиливается при физической, эмоциональной и умственной нагрузке. Приступ мигрени может возникнуть в любое время суток, он часто начинается во время ночного сна, под утро или после пробуждения. В большинстве случаев боль, по крайней мере, вначале — односторонняя, но позднее может распространиться на обе стороны головы, хотя нередко на протяжении всего приступа сохраняется на одной стороне. Другими характерными симптомами приступа мигрени служат тошнота и рвота. Как правило, они возникают к концу болевой фазы, но иногда бывают с самого начала и тогда могут досаждать пациенту больше. В период приступа мигрени многие больные стараются при возможности уединиться, затемнить помещение, лечь в постель и укутаться одеялом.
Частота приступов колеблется от нескольких за всю жизнь до нескольких в неделю. У большинства больных мигренью возникает один или два приступа в течение месяца.
Примерно у 50 % женщин, страдающих мигренью, приступы возникают непосредственно перед менструацией, в некоторых случаях только в определенные дни менструального цикла. В период беременности почти в половине случаев приступы мигрени не беспокоят. Прием пероральных контрацептивов может увеличить частоту приступов мигрени. В пожилом возрасте приступы мигрени обычно возникают реже или вообще проходят. Длительность приступа от 4 ч до 3 сут, чаще всего 8-12 ч. Неврологическое обследование
больных мигренью в межприступном периоде не выявляет очаговых неврологических нарушений.
Мигрень без ауры (простая мигрень) — наиболее частая форма мигрени, наблюдающаяся почти в 2/3 случаев заболевания.
Приступ головной боли при мигрени может сочетаться с аурой — неврологическими нарушениями, которые нарастают на протяжении 5-20 мин и полностью исчезают в течение одного часа. Мигрень с типичной аурой (классическая мигрень) — самая частая форма мигрени с аурой и составляет почти Уз всех случаев заболевания. Аура проявляется зрительными расстройствами (в виде сверкающих зигзагов, точек, шаров, вспышек или выпадения участка поля зрения), односторонними парестезиями (или онемением), реже — гемипарезом или речевыми нарушениями. Зрительные нарушения могут сочетаться с онемением половины тела, лица и языка, в более редких случаях — со слабостью в конечностях и нарушением речи. Если неврологические нарушения возникают на правой стороне, то головная боль локализуется чаще слева, и наоборот; лишь в 10-15% случаев боль возникает на той же стороне, что и неврологические нарушения. В конце ауры возникает пульсирующая боль в лобновисочно-глазничной области, которая нарастает в течение 0,5-1,5 ч, сопровождается тошнотой, иногда рвотой.
Редко встречаются осложненные формы мигрени. Мигренозный статус — это серия тяжелых, следующих друг за другом приступов (с интервалом менее 4 ч), сопровождающихся многократной рвотой, либо один необычно тяжелый и продолжительный (более 72 ч) приступ. Мигренозный инсульт характеризуется стойкими очаговыми неврологическими расстройствами (обычно в течение 1-3 нед.) в период мигренозного приступа; при КТ или МРТ выявляются небольшие ишемические очаги.
Диагноз мигрени основывается на клинико-анамнестических данных. Он может быть поставлен при наличии следующих характеристик: 1)5 приступов и более в анамнезе; 2) длительность каждого из них 4-72 ч (без адекватного лечения); 3) головная боль соответствует как минимум двум
из следующих четырех характеристик — односторонняя локализация, пульсирующий характер, средняя или тяжелая интенсивность (препятствующая выполнению привычной деятельности), усиление при обычной физической нагрузке или ходьбе; 4) во время головной боли бывает рвота (или тошнота) или светобоязнь либо звукобоязнь; 5) отсутствуют данные за наличие заболеваний, проявляющихся вторичной головной болью.
В тех случаях, когда нет типичной клинической картины мигрени и нельзя исключить заболевание, проявляющееся симптоматической головной болью, необходимы дополнительные обследования. Среди них ведущее значение имеет КТ или МРТ головы, которые позволяют исключить опухоль и другие заболевания головного мозга.
Лечение может быть направлено на купирование приступа мигрени и профилактику часто возникающих мигренозных атака.
Части больных приступ мигрени помогают снять простые анальгетики: парацетамол, ацетилсалициловая кислота и другие средства. Ацетилсалициловую кислоту можно использовать в самом начале приступа мигрени в дозе 500-1000 мг. Парацетамол применяется как в таблетках, так и в ректальных свечах по 500 мг (максимальная суточная доза 4 г). Можно использовать комплексные препараты, содержащие парацетамол или ацетилсалициловую кислоту и кофеин: аскофен, каффетин, цитрамон, седалгин и др. Из группы нестероидных противовоспалительных средств иногда эффективен напроксен по 500-1000 мг или диклофенак по 50-100 мг, лучше в форме ректальных свечей. В качестве противорвотного средства помогает метоклопрамид (церу-кал, реглан) внутрь по 10 мг или в виде ректальных свечей.
Для купирования приступа мигрени более эффективны препараты, содержащие эрготамин и дигидроэрготамин, и агонисты серотониновых рецепторов (суматриптан, на-ратриптан, золмитриптан и др.). Эрготамин используется в виде 0,1%-го раствора по 15—20 капель или 1-2 мг в таблетках (кофетамин); если боль не стихает, прием этой дозы можно повторить через 1 ч. Дигидроэрготамин применяют по
10—20 капель в 1/2 стакана воды, а также вводят внутривенно или внутримышечно в начальной дозе 0,5 мг либо в виде назального спрея (дигидергот). Агонисты серотониновых рецепторов представляют наиболее эффективные средства для снятия приступа мигрени, но они более дорогостоящие, чем анальгетики. Суматриптан (имигран) назначают внутрь по 25-100 мг или 6 мг п/к с помощью специального шприца, повторный прием возможен через час. Золмитриптан (зо-миг) применяется по 2,5 мг, повторный прием рекомендуется только через 2 ч. Наратриптан (нарамиг) используется по 2,5 мг в виде таблеток или 1,5 мг п/к.
Профилактика основывается на устранении (если это возможно) или ослаблении факторов, провоцирующих приступы мигрени. Применение лекарственных средств показано при частых (два и более в месяц) и тяжелых приступах мигрени, и поэтому оно необходимо только небольшой (не более 10%) группе больных. Длительность лечения составляет в большинстве случаев один или несколько месяцев. Наиболее эффективен пропранолол по 40—120 мг/сут. Также можно использовать трициклические антидепрессанты (амитриптилин по 25-100 мг/сут и др.), блокаторы кальциевых каналов (верапамил по 120-240 мг/сут и др.), противо-эпилептические средства (карбамазепин по 600-800 мг/сут и др.), нестероидные противовоспалительные средства (напроксен по 750 мг/сут и др.). Выбор одного из этих средств решается индивидуально с учетом имеющихся сочетанных заболеваний, например при наличии депрессивного состояния у больного мигренью целесообразно применение антидепрессантов.
Пучковая головная боль
Пучковая головная боль (кластерная головная боль, мигренозная невралгия) встречается у 0,1-0,4 % населения, у мужчин в 5-6 раз чаще, чем у женщин (см. табл. 10.1). Патогенез заболевания неясен. Заболевание обычно возникает в возрасте 20-40 лет и беспокоит мужчин молодого и среднего возраста.
Клиническая картина. Название головной боли («пучковая», или «кластерная») отражает патогномоничную особенность ее течения — наличие серий приступов боли («пучка» или «кластера») в ограниченный период времени с последующей длительной ремиссией (от нескольких месяцев до нескольких лет). Приступ пучковой головной боли характеризуется быстрым началом с достижением максимальной интенсивности уже через несколько (обычно 10) мин и бывает относительно (чаще 20-40 мин) непродолжительным. Боль сверлящая или жгучая, почти всегда односторонняя, чаще в области глаза или за глазом, но может локализоваться вокруг глаза или в височной области, распространяться на щеку, мягкое небо, нижнюю челюсть, ухо или шею. В период приступа пациент из-за сильной, подчас нестерпимой боли не может лежать, он обычно ходит или сидит, может вести себя причудливым образом: стонать, плакать, кричать, бегать на месте, угрожать самоубийством. Боль настолько мучительная, что после приступа пациент остается изможденным в течение еще 30-60 мин. На стороне боли часто отмечаются вегетативные проявления: слезотечение, покраснение глаза, заложенность носа, ринорея, птоз, сужение зрачка, потливость лба или лица, отек век. Более половины всех приступов возникает ночью или утром, в одно и то же время, поэтому иногда пучковую головную боль называют «будильниковой головной болью».
У большинства пациентов ежедневные серии приступов (пучки) возникают в течение 2-8 нед., а затем следует ремиссия от нескольких месяцев до нескольких лет. Чаще наблюдается одно или два обострения за весь год. У некоторых больных обострение провоцируется приемом алкоголя. Реже встречается хроническая форма пучковой головной боли, при которой в течение многих лет возникают ежедневные приступы без ремиссии.
При обследовании пациентов с пучковой головной болью не выявляется неврологических нарушений, за исключением синдрома Горнера в период обострения.
Диагноз пучковой головной боли основывается на клинико-анамнестических данных. Он может быть поставлен при наличии следующих характеристик: 5 приступов и бо-
лее сильной односторонней глазнично-височной боли, продолжающейся без лечения от 15 до 180 мин и возникающей 1-8 раз в день, при этом на стороне головной боли наблюдается, по крайней мере, один из следующих симптомов: покраснение глаза, слезотечение, заложенность носа, ринорея, потливость лба и лица, сужение зрачка (миоз), птоз, отек века. В тех случаях, когда типичной клинической картины пучковой головной боли не бывает и нельзя исключить заболевание с симптоматической головной болью, необходимы дополнительные исследования. Среди них ведущее значение имеют КТ или МРТ головы, которые позволяют исключить опухоль и другие заболевания головного мозга.
Лечение. В начале приступа пучковой головной боли эффективны ингаляция кислорода со скоростью 7 л в минуту, суматриптан в виде подкожной инъекции в дозе 6 мг, дигидроэрготамин в форме инъекций и интраназального аэрозоля (дигидергот). Некоторым пациентам помогает закапывание в нос 4%-го раствора лидокаина. С целью снижения частоты и интенсивности приступов пучковой боли в период обострения можно использовать 40—60 мг преднизолона в день в течение 7—14 дней с последующим постепенным уменьшением дозы, а также карбонат лития по 300-900 мг/сут. При хроническом течении пучковой головной боли может быть эффективным прием карбоната лития по 300-900 мг/сут или индометацина по 50-150 мг/сут.
Головная боль напряжения
Головная боль напряжения (ГБН) составляет почти 2/3 всех случаев хронической головной боли. ГБН периодически беспокоит почти половину населения, однако только 5-10% пациентов обращаются за медицинской консультацией (см. табл. 10.1).
Патогенез. Развитию ГБН способствуют тревожность, депрессия, стрессовые и конфликтные ситуации, монотонный труд или перегрузки на работе либо в учебе, недостаток отдыха, нарушения сна, сексуальные проблемы, нарушение рефракции, сколиоз позвоночника, травма головы, врожденная предрасположенность к мышечному напряжению. В ча-158
Тема 10. Головная и лицевая боль сти случаев отмечается напряжение, избыточное сокращение перикраниальных мышц, что и вызывает головную боль. В остальных случаях основное значение имеют эмоциональные нарушения — повышенная тревожность и депрессия, поэтому головная боль может быть расценена как психогенная.
Клиническая картина. Для ГБН характерна двусторонняя локализация боли, умеренная интенсивность, не меняющаяся при выполнении физической работы. Боль обычно тупая, непульсирующая; пациенты часто жалуются не столько на боль, сколько на ощущение сдавления, стягивания или сжимания головы в виде «шлема» или «каски». ГБН обычно не сопровождается тошнотой или рвотой. У части пациентов ГБН возникает сравнительно редко, например в период стрессовой ситуации или напряженной умственной работы, продолжается несколько часов и проходит самостоятельно или после приема простых анальгетиков (эпизодическая ГБН). У других пациентов ГБН более частая (более 15 приступов в месяц), ее длительность варьирует от часов до нескольких дней (хроническая ГБН), но возможны «светлые», без боли промежутки разной длительности. Некоторых пациентов боль беспокоит почти ежедневно и во многих случаях на протяжении многих лет. Она может возникать в любом возрасте, течение ее различное. При неврологическом обследовании, за исключением напряжения и болезненности перикраниальных и шейных мышц, других нарушений обычно не выявляется. Психологическое обследование часто обнаруживает депрессию и/или повышенную тревожность.
Диагноз ГБН основывается на клинико-анамнестических данных. Он может быть поставлен при наличии как минимум двух характеристик боли: 1) сжимающая или сдавливающая (непульсирующая) боль; 2) легкая или умеренная интенсивность (боль может снижать эффективность труда, но не ограничивает деятельность); 3) двусторонняя локализация; 4) боль не усиливается при хождении по лестнице или аналогичной физической деятельности; при этом отсутствуют тошнота и рвота (может наблюдаться анорексия), свето- и звукобоязнь (может наблюдаться только светоз- или звукобоязнь). В тех случаях, когда не бывает типичной клинической картины головной боли напряжения и нельзя ис-
ключить заболевание, проявляющееся симптоматической головной болью, необходимы дополнительные исследования: КТ или МРТ головы, которые имеют основное значение и позволяют исключить опухоль и другие заболевания головного мозга.
Лечение. Значительная часть больных, страдающих ГБН и обращающихся за консультацией к врачу, подозревают у себя серьезное и опасное для жизни заболевание. Поэтому внимательная беседа с пациентом, тщательный осмотр и последующее разъяснение врачом сути заболевания часто позволяет развеять страхи пациента, способствует улучшению его состояния. При ГБН можно использовать лекарственные средства, физиотерапию и аутогенную тренировку, психотерапию. При редкой эпизодической боли рекомендуется устранить по возможности факторы, провоцирующие боль, а также нужна рациональная организация режима труда и отдыха, прием при необходимости анальгетиков — ацетилсалициловой кислоты, парацетамола. В случаях частой эпизодической или хронической ГБН важно комплексное лечение; при этом во всех случаях целесообразно уменьшить прием анальгетиков, которые у отдельных пациентов достигают токсической дозы и могут стать самостоятельной причиной боли («абузусная головная боль»). Из лекарственных средств наиболее эффективны антидепрессанты и транквилизаторы. При выборе лечения важно выяснить, что преобладает у пациента — тревожность или депрессия. Во всех случаях можно использовать антидепрессанты, однако транквилизаторы показаны только при повышенной тревожности, а при депрессии они могут даже ухудшить состояние пациента. Амитриптилин принимают с 12,5—25 мг на ночь и постепенно повышают дозу до 50-100 мг/день. Пароксетин (рексетин) используют по 20 мг/сут. Флуоксетин (прозак) принимают с 10 мг/сут до 40 мг/сут. Тианептин (коаксил) используют по 12,5-25 мг 2-3 раза в день. В резистентных случаях к антидепрессантам добавляют Р-адреноблокаторы и нестероидные противовоспалительные средства (индометацин, ибупрофен, кетопрофен, напроксен) и миорелаксанты, например, тизанидин (сирда-луд) по 4-12 мг/сут.
Таблица
Краткие сведения об основных типах первичной головной боли
Краткие сведения Мигрень Пучковая головная боль Головная боль напряжения
Распространенность 10-12 % населения 0,1-0,4 % населения Почти половина населения
Провоцирующие факторы Эмоциональный стресс, период менструации, недосыпание, физическая нагрузка, некоторые продукты питания, алкоголь Употребление алкоголя Тревожность, депрессия, эмоциональный стресс, физические нагрузки, нарушения сна, врожденная предрасположенность к мышечному напряжению
Пол и возраст больных Молодой возраст, чаще у женщин Преимущественно у мужчин молодого и среднего возраста В различном возрасте у лиц мужского и женского пола
Приступ головной боли:
Интенсивность Характер Локализация Физическая нагрузка Длительность Сильная Пульсирующий Половина головы Усиление боли 4-72 ч без лечения Сильная Режущий, колющий Глазнично-височная область Обычно без усиления боли 20-40 мин Средняя Давящий, сжимающий Диффузная или локальная Обычно без усиления боли Большая вариабельность, может быть постоянной
Сочетанные симптомы Тошнота, рвота, свето- и звукобо-язнь. При мигрени с аурой: Покраснение глаза, слезотечение, заложенность носа, Депрессия, повышенная тревожность, болезненность
Тема 10. Головная и лицевая боль
RzGMU.iNFO || OMOP.SU
Окончание табл.
Краткие сведения Мигрень Пучковая головная боль Головная боль напряжения
Период возникновения зрительные расстройства, односторонние парестезии, реже — гемипарез или речевые нарушения У женщин часто перед менструацией ринорея, потливость лба и лица, сужение зрачка (миоз), птоз, отек века Часто ночью при пальпации перикраниальных мышц Нет существенной зависимости
Течение Чаще 1-2 приступа в месяц, уменьшение частоты приступов в пожилом возрасте Приступы чаще беспокоят в течение нескольких недель один или два раза в год Эпизодическая или хроническая (15 дней в месяц и больше) головная боль напряжения
Дополнительные исследования КТ и МРТ головы позволяют исключить опухоль и другие заболевания головного мозга при нетипичной клинической картине головной боли
Лечение В период приступа: анальгетики (парацетамол, ацетилсалициловая кислота), препараты эрготамина и дигидроэрготамина, агонисты серотониновых рецепторов (суматриптан, золмитриптан, наратрип-тан). Для профилактики пропранолол, а также антидепрессанты, нестероидные противовоспалительные средства, противоэпилеп-тические средства В период приступа ингаляция кислорода, препараты эрготамина и дигидроэрготамина, агонисты серотониновых рецепторов (суматриптан, золмитриптан, наратриптан). Для профилактики приступов преднизолон, карбонат лития, нестероидные противовоспалительные средства При эпизодической головной боли — анальгетики (парацетамол, ацетилсалициловая кислота). При хронической головной боли — антидепрессанты, транквилизаторы, миорелаксанты, нестероидные противовоспалительные средства; психотерапия
Общая неврология
Тема 11
Поражение нервной системы при некоторых соматических заболеваниях, метаболических нарушениях и интоксикациях
Неврологические осложнения при заболеваниях сердца
Неврологические осложнения при различных заболеваниях сердца и аритмиях наиболее часто обусловлены: (1) карди-оцеребральной эмболией, вызывающей развитие инсульта, (2) снижением сердечного выброса, проявляющимся обморочными состояниями.
Кардиоцеребральная эмболия бывает причиной примерно 20% инфарктов мозга. В зависимости от потенциального риска выделяют заболевания сердца с высоким и средним риском тромботических осложнений и эмболии. К высокому риску относят: механический протез клапана сердца, митральный стеноз с фибрилляцией предсердий, мерцательную аритмию (за исключением изолированной формы фибрилляции предсердий), тромб левого предсердия или левого ушка предсердия, синдром слабости синусового узла, инфаркт миокарда в течение первых 4-х нед., тромб левого желудочка, дилатационную кардиомиопатию, акинетический сегмент левого желудочка, миксому левого предсердия, инфекционный эндокардит. К среднему риску относят: пролапс митрального клапана, митральный стеноз без фибрилляций предсердий, аневризму предсердия, неза-ращение овального окна, трепетание предсердий, изолированную форму фибрилляции предсердий, биопротез клапана
сердца, врожденную сердечную недостаточность, гипокинезию сегмента левого желудочка, инфаркт миокарда в сроки от 4-х нед. до 6 мес.
Мерцательная аритмия (фибрилляция предсердий) — наиболее частая причина кардиоэмболического инсульта (до 45% всех случаев). Риск инсульта значительно выше при мерцательной аритмии на фоне поражения клапанов сердца (вследствие ревматизма или других причин), а также у больных пожилого и старческого возраста. Частота инсульта снижается у больных мерцательной аритмией при использовании непрямых антикоагулянтов (варфарин по 2,5-10 мг в сутки) или аспирина в суточной дозе 100-325 мг.
Инфаркт миокарда осложняется инсультом в 0,9%-2,4% случаев. Инсульт чаще возникает при инфаркте в области верхушки и переднебоковой области, чем в задней стенке левого желудочка. Более чем в половине всех случаев он возникает в первые 4 дня с момента развития инфаркта миокарда. В дальнейшем риск инсульта снижается, он более высок при формировании акинетического сегмента левого желудочка сердца.
При ревматическом поражении сердца в 20% случаев возникают тромботические осложнения, из которых почти половина — эмболия мозговых сосудов с развитием инсульта. При митральном стенозе вероятность эмболии значительно выше, чем при изолированном поражении аортальных клапанов. Риск инсульта существенно возрастает при формировании тромба в предсердии или развитии фибрилляции предсердий. Повторная эмболия возникает в 60% случаев, поэтому при эмболических осложнениях или возникновении мерцательной аритмии больным ревматизмом рекомендуется длительный профилактический прием непрямых антикоагулянтов.
Пролапс митрального клапана встречается у 5% населения. Хотя вероятность риска инсульта при нем повышена, она мала у лиц молодого возраста. В среднем инсульт возникает в течение года всего у одного из 6 тыс. молодых людей с пролапсом митрального клапана. Профилактический прием антиагрегантов или непрямых антикоагулянтов
Тема 11. Метаболические нарушения и интоксикации рекомендуется только при эмболических осложнениях или фибрилляции предсердий.
Когда кардиальная патология сопровождается снижением сердечного выброса и вследствие этого диффузной преходящей ишемией мозга, возможны различные неврологические нарушения от головокружения, парестезий, изменений зрения до обмороков. Кардиальная патология — причина 8-50 % всех обмороков, по данным разных авторов, ее роль значительно выше в структуре обморочных состояний у лиц пожилого и старческого возраста. Развитие кардиогенного обморока возможно вследствие двух основных причин: (1) нарушений сердечного ритма (слабость синусового узла, атриовентрикулярная блокада, желудочковая тахикардия или фибрилляция, пароксизмальная тахикардия); (2) формировании аортального стеноза или закрытия просвета левого предсердия подвижным тромбом либо миксомой.
Нарушение сознания может возникнуть уже через несколько секунд после развития желудочковой аритмии (фибрилляции или тахикардии). Перед потерей сознания обычно ощущается головокружение или затуманивание зрения. После нормализации сердечного ритма в течение 30 с и более у пациентов остается спутанность сознания или головокружение.
Для диагностики нарушений сердечного ритма как причины обморока большое значение имеет ЭКГ и особенно длительное холтеровское мониторирование, позволяющее выявить эпизодические пароксизмальные нарушения сердечного ритма. Профилактика неврологических осложнений основывается на лечении кардиального заболевания.
Неврологические осложнения при артериальной гипертензии
Артериальная гипертензия — второй по значимости (после возраста) фактор риска инсульта, и что особенно важно, — потенциально обратимый этиологический фактор. Между степенью повышения как систолического, так и диастоличе
ского артериального давления и риском инсульта установлена прямая связь во всех возрастных группах.
Артериальная гипертензия способствует развитию трех форм ишемического инсульта: атеротромботического, кардиоэмболического и лакунарного. С ней связаны кардиальная патология и нарушения сердечного ритма, осложняющиеся эмболией мозговых артерий (кардиоэмболический инсульт). Артериальная гипертензия ускоряет развитие атеросклероза — причины атеротромботического инсульта. Она приводит к морфологическим изменениям сосудистой стенки — гиалинозу, микроатероматозу и фибриноидным изменениям в мелких прободающих артериях мозга, что может вызвать развитие лакунарного инсульта.
Артериальная гипертензия рассматривается как ведущий этиологический фактор почти 60 % всех кровоизлияний в мозг. Она способствует развитию микроаневризм сосудов головного мозга и изменений перфорирующих артерий мозга, разрыв которых осложняется кровоизлиянием в мозг. Наиболее часто поражаются перфорирующие артерии базальных ганглиев, моста, мозжечка, что объясняет локализацию кровоизлияния в этих отделах мозга.
Повышение артериального давления выше верхней границы ауторегуляции мозгового кровообращения может привести к острой гипертонической энцефалопатии: отеку головного мозга, застойным явлениям на глазном дне на фоне высокого артериального давления (систолическое обычно более 250 мм рт. ст., диастолическое до 150 мм рт. ст. и выше).
Артериальная гипертензия в первые сутки инсульта отмечается не только у страдающих гипертензией, но и у лиц с нормальным АД, и в большинстве случаев, видимо, не является непосредственным провоцирующим фактором инсульта. Повышение артериального давления может быть обусловлено стрессовой ситуацией, связанной с болезнью и госпитализацией, а также реакцией на повышение внутричерепного давления или поражение определенных отделов головного мозга. Большинство неврологов не рекомендует снижать умеренно повышенное АД (систолическое до 200 мм рт. ст., диастолическое до 120 мм рт. ст.) в острейшем
периоде инфаркта мозга и субарахноидального кровоизлияния из-за опасности снижения мозгового кровотока и усиления ишемии мозга.
Длительное лечение артериальной гипертензии — одно из наиболее эффективных направлений первичной профилактики инсульта. Популяционные исследования показывают, что снижение повышенного артериального давления всего на 5 мм рт. ст. приводит к уменьшению риска инсульта на 30-40%. В качестве немедикаментозных методов снижения повышенного артериального давления установлена эффективность снижения избыточной массы тела, уменьшения потребления поваренной соли, а также увеличения физической нагрузки. В качестве эффективных антигипертензивных средств в настоящее время рассматриваются ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина II, p-адреноблокаторы, диуретики, блокаторы кальциевых каналов длительного действия.
Дисметаболическая энцефалопатия
При различных соматических заболеваниях возможно нарушение функций головного мозга вследствие метаболических нарушений, что определяется как дисметаболическая энцефалопатия. К развитию энцефалопатии значительно чаще приводят остро возникающие изменения метаболизма, чем хронические. Далее изложены наиболее распространенные дисметаболические энцефалопатии.
Гипоксическая энцефалопатия возникает вследствие неадекватного снабжения головного мозга кислородом, вызванного сердечно-сосудистой или дыхательной недостаточностью. Наиболее частыми причинами церебральной гипоксии служат остановка сердца (инфаркт миокарда, желудочковая аритмия и др.), удушье (утопление, удушение дымом и др.), отравление окисью углерода и сосудистый коллапс, вызванный кровотечением, септическим шоком или тяжелой травмой.
При остро развивающейся выраженной гипоксии быстро возникает глубокая кома, которая способна вызвать не
обратимую смерть головного мозга, а затем и смерть больного или хроническое вегетативное состояние. При более легкой гипоксии после восстановления сознания может наблюдаться снижение памяти (из-за избирательной гибели нейронов гиппокампа) и других когнитивных функций, вплоть до тяжелой деменции и различных экстрапирамид-ных синдромов. Даже при минимальной гипоксии нередко развивается преходящее нарушение внимания, мышления и координации.
При острой гипоксии необходимы реанимационные мероприятия: восстановление проходимости дыхательных путей, искусственная вентиляция легких, восстановление сердечной деятельности и др.
Печеночная энцефалопатия часто осложняет течение цирроза печени. Она обычно развивается сравнительно медленно на фоне хронического течения болезни, сопровождающегося портальной гипертензией, и рассматривается как портальная печеночная энцефалопатия. В случаях молниеносной печеночной недостаточности возможно быстрое развитие энцефалопатии.
Больные циррозом печени и их родственники часто не придают существенного значения начальным проявлениям энцефалопатии в виде нарушений памяти, внимания, неадекватности суждений и поведения, эмоциональных и когнитивных нарушений, что нередко приводит к обращению за медицинской помощью только на ее выраженной стадиии, для которой характерны расстройства сознания в виде феномена «включения-выключения»: резкие колебания сознания от ясного до спутанного в течение одного дня. У больных с портальной печеночной энцефалопатией могут отмечаться сужение зрачков, ослабление их реакций на свет, астериксис («порхающий» тремор рук), повышение тонуса мышц, гиперрефлексия, двусторонний симптом Бабинского. Если портальная энцефалопатия представляет потенциально обратимое заболевание, то энцефалопатия при молниеносной печеночной недостаточности в большинстве (85%) случаев приводит к смерти вследствие отека головного мозга.
Диагноз печеночной энцефалопатии при циррозе печени основывается на результатах клинического обследования. Печеночные пробы обычно существенно изменены, но не отмечается их корреляции со степенью энцефалопатии. При длительном заболевании нередко наблюдается умеренная гипербилирубинемия, в этих случаях тяжесть болезни больше отражает степень гипоальбуминемии, гипокоагуляции, тромбоцитопении. КТ и МРТ головы используются для исключения других заболеваний у больных циррозом печени, например субдуральной гематомы.
При портальной печеночной энцефалопатии рекомендуется строгая безбелковая диета, вне обострения должно быть ограничено количество потребляемого белка, предпочтителен растительный белок. Положительный результат дает применение лактулозы по 20-30 г 4 раза в день, гепа-мерц по 3—6 г/сут внутрь или 2-4 г в/м или в/в. Коматозным больным лактулозу вводят парентерально по 20-30 мг каждый час до выхода из комы. Эффективно также применение неомицина в суточной дозе 4-12 г в острой стадии и 2-3 г в хронической стадии заболевания. Терапия молниеносной печеночной энцефалопатии мало эффективна, за исключением пересадки печени, если она возможна.
Уремическая энцефалопатия. Клинические проявления уремической энцефалопатии не коррелируют ни с одним показателем почечной недостаточности, но у многих больных связаны со скоростью ее развития. При острой почечной недостаточности возможно коматозное состояние, а при хронической могут наблюдаться легкие неврологические нарушения даже при высокой азотемии.
Заболевание обычно развивается медленно с повышенной тревожности и утомляемости, апатии и снижения концентрации внимания. При прогрессировании заболевания могут наблюдаться неадекватное поведение, зрительные галлюцинации, эпилептические припадки. Неврологическое обследование наиболее часто выявляет дизартрию, гиперкинез, атаксию при ходьбе, нарушение чувствительности, диффузную мышечную слабость. Возможен гемипарез, который проходит после диализа. Эпилептические припадки
чаще бывают при острой почечной недостаточности или в терминальной стадии заболевания. Диагноз уремической энцефалопатии основывается на клинических данных.
Основу лечения больных уремической энцефалопатией составляет терапия почечной недостаточности: диализ и трансплантация почки.
Церебральные осложнения при сахарном диабете могут быть обусловлены метаболическими нарушениями, вызванными как заболеванием (кетоацидоз, высокая гипергликемия), так и его лечением (гипогликемия). Лечение осложнений основывается на терапии основного заболевания и проводится эндокринологом.
При кетоацидозе в большинстве случаев возникают расстройства сознания, но не характерны очаговые неврологические нарушения и эпилептические припадки. Лечение кетоацидоза может привести к развитию выраженного отека головного мозга вследствие нарушения осмотического равновесия (резкое и значительное снижение гиперосмолярности крови).
Высокая гипергликемия с гиперосмолярностью может возникать при диабете без существенного кетоацидоза и приводить к постепенному нарушению сознания (некето-немическая гиперосмолярная кома). Помимо нарушений сознания могут развиться эпилептические припадки, очаговые неврологические нарушения в виде гемипареза, гемианопсии и др. Лечение некетонемической гиперосмолярной комы в отличие от кетоацидоза обычно не приводит к отеку мозга.
При гипогликемии возможны нарушение сознания, очаговые неврологические нарушения (инсультоподобные эпизоды), эпилептические припадки, делирий, гиперсомния и др. Неврологические нарушения обычно развиваются при уровне глюкозы в крови ниже 2 ммоль/л. При дальнейшем нарастании гипогликемии нарушается сознание, а при уровне ниже 1 ммоль/л развивается кома. Введение глюкозы обычно вызывает быстрый регресс неврологических нарушений.
Неврологические осложнения алкоголизма
Острая алкогольная интоксикация. Симптомы алкогольной интоксикации возникают у лиц, которые не имеют длительного опыта употребления алкоголя, при достижении концентрации этанола в крови приблизительно в 1,5 г/л. Симптомы интоксикации проявляются психомоторной рас-торможенностью, легкой атаксией, нистагмом, мидриазом, дизартрией, гиперемией лица и тахикардией. При превышении этой концентрации возможна кома со снижением артериального давления и угнетением сознания. У алкоголиков, не имеющих нарушения функции печени, симптомы интоксикации возникают при значительно более высоких концентрациях алкоголя в крови, кома и летальный исход развиваются при концентрации этанола в крови 5-5,5 г/л.
Диагноз алкогольной комы или интоксикации устанавливается на основании анамнестических данных, запаха алкоголя изо рта, наличия высокой концентрации этанола в крови. Следует отметить, что прием алкоголя может привести к развитию различных заболеваний, например инсульта, поэтому больные с неврологической симптоматикой, которая возникла на фоне употребления алкоголя, требует тщательного обследования для исключения других возможных причин нарушения сознания и неврологических нарушений.
Больной с алкогольной комой требует наблюдения и лечения в условиях реанимационного отделения, показаны внутривенное введение тиамина (до 100 мг), обеспечение электролитного баланса.
Алкогольная полиневропатия — наиболее частое осложнение хронического алкоголизма, обусловлена недостаточностью витаминов группы В, преимущественно тиамина (витамина В,). Большинство больных алкоголизмом имеют субклинические проявления полиневропатии в виде нарушений чувствительности на стопах, снижения или отсутствия ахилловых рефлексов, болезненности при пальпации икроножных мышц. У части больных алкоголизмом
отмечается развернутая клиническая картина симметричной дистальной полиневропатии с преобладанием в нижних конечностях: боль и парестезии в голенях и стопах, крампи (судорога, спазм), жгучая боль в подошвах, нарушение чувствительности по типу «носков» и «перчаток», атрофические парезы с преобладанием в дистальных отделах конечностей, вегетативно-трофические нарушения.
Терапия состоит в полном отказе от алкоголя, богатом витаминами питании, парентеральном применении тиамина по 100 мг в сутки в течение 2-3-х нед. При выраженной боли эффективны антидепрессанты (амитриптилин по 25-50 мг на ночь) и противоэпилептические средства (карбамазепин по 100—200 мг 3 раза в день, габапентин по 1200-3600 мг в сутки). При отказе от алкоголя в большинстве случаев отмечается полный или значительный регресс симптомов в течение нескольких недель.
Эпилептические припадки возникают преимущественно при длительном употреблении алкоголя. После запоя они развиваются в 3-4 % случаев. Большинство (90 %) припадков бывает в период от 7 до 48 ч после прекращения приема алкоголя. Возможен один генерализованный тоникоклонический припадок, но чаще их несколько, в 2 % случаев развивается эпилептический статус. Почти у 30% больных эпилептические припадки сопровождаются алкогольным психозом (белая горячка), у остальных состояние полностью нормализуется в течение нескольких часов или суток. ЭЭГ у больных с алкогольными эпилептическими припадками не выявляет в межприступном периоде эпилептической активности. Купируют припадок внутривенным введением 10-20 мг диазепама (седуксен, реланиум). Профилактика припадков состоит в отказе от алкоголя, не требуется назначения противоэпилептических препаратов.
Алкогольная мозжечковая дегенерация развивается при длительном алкоголизме, в ее генезе предполагается недостаточность витаминов группы В, преимущественно тиамина. Симптомы заболевания обычно нарастают постепенно в течение нескольких недель или месяцев, после этого состояние стабилизируется на многие годы. Характерны наруше-
Тема 11. Метаболические нарушения и интоксикации ния походки и равновесия от легкой степени до невозможности самостоятельно стоять (астазия) и ходить (абазия), интенционный тремор в нижних конечностях.
Для лечения используются витамины группы В, тиамин по 100 мг в течение 2-3-х нед., богатая витаминами пища. Даже при полном отказе от алкоголя в большинстве случаев наблюдается только частичный регресс неврологических нарушений.
Энцефалопатия Вернике встречается в 2 раза реже, чем мозжечковая дегенерация, и также связывается с недостаточностью тиамина. Заболевание возникает в течение нескольких дней, часто после продромального периода в виде общей астении, анорексии, боли в животе, повторной рвоты и поноса. Проявляется глазодвигательными расстройствами (горизонтальным и вертикальным нистагмом, сходящимся косоглазием, парезом наружных глазных мышц, горизонтальным парезом взора), атаксией при стоянии и ходьбе, нарушением памяти и сознания. МРТ головы выявляет мелкоочаговые симметричные поражения в области ствола мозга, таламуса и гипоталамуса. Летальность составляет около 20% чаще вследствие пневмонии, обострения туберкулеза легких или цирроза печени. В остальных случаях при адекватном лечении наблюдается регресс глазодвигательных нарушений и атаксии, однако нередко остаются существенные нарушения памяти и психики, приводя к деменции. В части случаев возникает корсаковский амнестический синдром, при котором грубо нарушена память на текущие события.
Основу лечения составляет парентеральное введение тиамина по 100 мг в сутки в течение 6-8 нед., богатое витаминами питание.
Алкогольная деменция. У многих больных хроническим алкоголизмом развиваются когнитивные нарушения вплоть до степени деменции. Они могут быть вызваны прямым действием этанола на центральную нервную систему с дегенерацией нейронов. Причинами деменции у больных алкоголизмом могут быть энцефалопатия Вернике с развитием корсаковского амнестического синдрома, повторные
эпилептические припадки, повторные черепно-мозговые травмы, а также печеночная энцефалопатия и другие неврологические заболевания, вызывающие деменцию, например болезнь Альцгеймера. Большое значение в установлении причины когнитивных нарушений имеет КТ или МРТ головы, что позволяет исключить многие заболевания, например травматическую субдуральную гематому.
Больным с когнитивными нарушениями, вызванными алкоголизмом, рекомендуется категорический отказ от употребления алкоголя, прием тиамина по 100 мг в сутки, богатое витаминами питание, прием ноотропных препаратов.
Поражение нервной системы при приеме некоторых наркотиков (героина и кокаина)
Диацетилморфин, или героин, представляет наиболее распространенный наркотик. Он вызывает чувство блаженства, эйфории. За эйфорией вскоре следует ухудшение состояния, возникают слабость и тошнота, которые проходят после повторного применения наркотика, что и обусловливает привыкание к нему (наркоманию) с сильной зависимостью.
Отравление происходит обычно в результате передозировки героина. При отравлении возникают нарушение сознания, поверхностное дыхание, сужение зрачков, брадикардия и гипотермия. При нарастании нарушения сознания расширяются зрачки, наблюдается цианоз кожи и слизистых оболочек; смерть может наступить вследствие угнетения дыхания и асфиксии. Употребление героина может также вызвать гипоксическую энцефалопатию, инфаркт мозга, экс-трапирамидные расстройства.
Лечение острой интоксикации проводят в реанимационном отделении, используют специфический антидот — налоксон, который вводят в/в из расчета 0,01 мг/кг.
Кокаин вдыхают через нос («нюхают») или курят («крек»). Кокаин вызывает состояние блаженства, эйфории и расслабленности, при его регулярном использовании быстро развивается наркотическая зависимость.
Передозировка кокаина может вызвать эпилептические припадки, значительное повышение артериального давления, нарушение сердечного ритма, угнетение дыхания, кому и смерть. Регулярное использование кокаина, обладающего адренергическим действием, существенно повышает риск субарахноидального и внутримозгового кровоизлияния, а также инфаркта головного и спинного мозга.
При коме требуется неотложное лечение в реанимационном отделении, блокируют дофаминергические рецепторы галоперидолом до 15 мг в сутки.
Отравление тяжелыми металлами
Краткие сведения о неврологических симптомах, вызванных отравлением тяжелыми металлами, приведены в таблице.
Таблица
Краткие сведения об отравлении некоторыми тяжелыми металлами
Металл Источник отравления Неврологические симптомы Диагностика отравления
Свинец Краска, содержащая свинец; вода из свинцовых емкостей; горящий или плавящийся свинец; аккумуляторы Эп и лептические припадки, полиневропатия, при тяжелых отравлениях — нарушение сознания (сонливость, сопор, кома) Повышенная концентрация свинца в крови и копропорфирина в моче; в ликворе повышение содержания белка и клеток
Мышьяк Гербициды, родентициды, инсектициды, кожные кремы для лечения псориаза Энцефалопатия, сенсомоторная полиневропатия Повышение концентрации мышьяка в крови, моче, волосах и ногтях
Ртуть Производство термометров, зеркал, ламп накаливания, рентгеновских аппаратов, латексных красок Тремор, атаксия походки, сенсорная невропатия Повышение концентрации ртути в крови и моче
Окончание табл.
Металл Источник отравления Неврологические симптомы Диагностика отравления
Марганец Марганцевая руда Паркинсонизм, сонливость, астения Наличие марганца в крови и моче
Таллий Родентициды, инсектициды, кремы для удаления волос Острая полиневропатия Наличие таллия в моче
Висмут Применение препаратов висмута при заболеваниях желудочно-кишечного тракта Сонливость, мышечный спазм, эпилептические припадки, атаксия Наличие висмута в моче
Тема 12
Вегетативная дистония и невротические расстройства
Вегетативная дистония
Вегетативная дистония — это состояния, обусловленные нарушением центральной вегетативной регуляции внутренних органов и висцеральных систем. Жалобы, предъявляемые пациентом, подобны тем, которые возникают при повреждении органа или системы органов.
Вегетативная дистония чаще всего бывает вызвана невротическим расстройством или острым либо хроническим стрессом, эмоциональным перенапряжением. Тревога, страх, депрессия повышают активность симпатической и парасимпатической нервной системы, что проявляется функциональными изменениями в сердечно-сосудистой, дыхательной и других системах. Почти 40% населения периодически, а 5% людей постоянно испытывают чувство тревожности, часто сопровождающееся вегетативной дистонией, что во многих случаях служит основанием для обращения к врачу. Вегетативная дистония может быть обусловлена также конституциональными факторами (конституциональная вегетативная дистония), эндокринными изменениями (пубертатный период, климакс). В редких случаях она представляет первое проявление эндогенного психического заболевания. На амбулаторном приеме врачей различных специальностей до 10-20% составляют пациенты с симптомами вегетативной дистонии.
Характерны сердцебиения, боль в сердце, тахикардия или брадикардия, лабильность артериального давления,
ощущение нехватки воздуха, удушье, боль в животе, ощущение его вздутия, учащенное и обильное мочеиспускание или другие симптомы без объективных признаков поражения сердечно-сосудистой, дыхательной системы, желудочно-кишечного тракта и мочеполовой сферы или при наличии изменений в этих системах, не соответствующих жалобам пациента. В части случаев жалобы основаны на объективных признаках вегетативной дисфункции, таких, как сердцебиение, покраснение лица, потливость и др. В остальных случаях это субъективные жалобы неспецифического или системного характера, такие, как быстропроходящая боль по всему телу, ощущение жара, тяжести или вздутия живота, которые пациент соотносит с каким-либо органом или системой. Часто вегетативная дистония проявляется приступообразными состояниями — вегетативно-сосудистыми кризами (см. панические атаки). У пациентов с вегетативной дистонией почти всегда отмечаются эмоциональные расстройства — повышенная тревожность, нарушение сна, связь соматических жалоб с эмоциональным состоянием. Пациенты обычно фиксированы на своих ощущениях, часто обращаются к врачу и настойчиво требуют медицинского обследования, несмотря на его отрицательные результаты при предыдущих осмотрах.
Диагноз вегетативной дистонии основывается на исключении соматического заболевания и поэтому в зависимости от жалоб требуется участие кардиолога, пульмонолога, гастроэнтеролога или уролога (нередко нескольких специалистов). Под видом вегетативной дистонии могут скрываться первые симптомы соматического заболевания, что требует тщательного обследования больного, особенно при первом обращении.
Лечение вегетативной дистонии базируется на лечении основного заболевания, которым в большинстве случаев является невроз. При конституциональной вегетативной дистонии большое значение имеет рациональная организация труда и отдыха, в случаях гиперактивности симпатической нервной системы эффективны Р-адреноблокаторы (пропранолол по 20-80 мг/сут, атенолол по 25-100 мг/сут и др.),
Тема 12. Вегетативная дистония и невротические расстройства при тревожных состояниях — седативные средства и транквилизаторы, при депрессии — антидепрессанты.
Невротические расстройства
К невротическим расстройствам относят: (1) тревожные расстройства (панические атаки, тревожный, фобический и обсессивно-компульсивный неврозы) и (2) соматоформные расстройства (конверсионное расстройство или истерия). Невротические расстройства тягостны для пациента и существенно снижают качество его жизни, они отличаются стойкостью и не представляют кратковременную реакцию на стресс, которая периодически в течение жизни возникает у большинства людей.
Невротические расстройства рассматриваются как психогенные заболевания. При этом отмечается важная роль не только психологической травмы, вызвавшей заболевание, например конфликтной ситуации на работе, но и психотравмирующих событий в детском возрасте. В развитии невротических расстройств несомненное значение имеют особенности личности, которые формируются при взаимодействии наследственно-конституциональных факторов и условий жизни и воспитания. У части пациентов заболевание бывает семейным.
Невротическое расстройство представляет одно из наиболее распространенных заболеваний в современном обществе, они встречаются у 5-10% населения.
Тревожные расстройства
Наиболее часто тревожное расстройство проявляется повышенной раздражительностью и тревожностью, приступами тревоги (панические атаки) и вегетативными расстройствами. У многих пациентов отмечаются симптомы депрессии. Почти у 50% пациентов отмечается семейный характер заболевания. Тревожное расстройство наиболее часто возникает в молодом возрасте, у женщин оно встречается в 2 раза чаще, чем у мужчин.
Тревожный невроз представляет собой хроническое заболевание с периодическими обострениями, которые могут продолжаться в течение недель, месяцев или даже нескольких лет. Пациентов часто беспокоят головокружение, сердцебиения, боль в области сердца, затруднение дыхания, что заставляет их чаще обращаться к терапевту или кардиологу, чем к неврологу или психиатру. В период приступа тревоги (панической атаки) усиливается сердцебиение, появляется боль в сердце, возникают затруднение дыхания, ощущение приближающегося несчастья и смерти, слабости, дурноты, волн жара или холода. У многих пациентов учащается дыхание (гипервентиляция), что вызывает снижение концентрации углекислого газа в крови и приводит к сужению церебральных артерий с головокружением, онемением (парестезии) области губ и пальцев рук, иногда кратковременной потерей сознания. Приступ тревоги обычно продолжается 15-30 мин, затем его проявления ослабевают, но сохраняется чувство внутреннего напряжения и страха нового приступа. Панические атаки могут возникать редко (раз в месяц) или повторяться по несколько раз в день либо ночью. Вследствие этих приступов у многих пациентов возникает страх открытого пространства (агорафобия) и склонность к домашнему затворничеству из-за опасения оказаться в месте, где возникнет приступ и трудно будет получить медицинскую помощь.
При фобическом неврозе имеется страх определенных ситуаций, болезней, животных или предметов. Пациенты понимают необоснованность собственных страхов, но не могут преодолеть их, испытывают панику и становятся беспомощными в период приступа страха. У большинства пациентов имеются панические атаки и агорафобия. Части пациентам удается приспособиться к своим страхам, они нередко устраиваются на работу поблизости к дому или работают дома, что позволяет им избегать ситуаций, провоцирующих приступы страха и панические атаки (например, поездки в метро, участие в собраниях большого числа людей и др.), и сохранить хорошую работоспособность.
Многие пациенты с тревожным и фобическим неврозом испытывают повышенную физическую и психическую
утомляемость, у них снижена работоспособность. Они часто предъявляют жалобы на нарушение памяти, концентрации внимания, повышенную чувствительность к внешним раздражителям, перемене погоды. При их обследовании часто выявляются легкая тахикардия, иногда повышенная вариабельность артериального давления при повторных исследованиях, учащенное дыхание, тремор пальцев рук и оживление сухожильных рефлексов. При этом отсутствуют признаки соматических или неврологических заболеваний. Инструментальные обследования пациентов (электрокардиография, эхокардиография, электроэнцефалография, компьютерная томография головы и др.), нередко по их настоятельному требованию, также не выявляют признаков органического поражения внутренних органов и нервной системы.
Течение тревожного и фобического невроза вариабельно, но более чем у 50 % больных невроз сохраняется на протяжении всей жизни, проявляясь периодическими обострениями. Стойкая инвалидизация возникает в относительно небольшой (10-20%) части случаев.
Диагноз основывается на наличии повышенной тревожности, страхов, панических атак и исключении соматических, неврологических и других психических заболеваний. При обследовании пациентов особенно важно исключить заболевания щитовидной железы и надпочечников, при которых часто возникают приступы выраженных вегетативных расстройств, напоминающие проявления тревожного невроза. Следует учитывать, что прием некоторых лекарственных средств (психостимуляторы, симпатомиметики и др.), вызывает симптомы, напоминающие тревожное расстройство.
Лечение основывается на психотерапии, включающей рациональную психотерапию — разъяснение пациенту доброкачественного характера симптомов заболевания (отсутствие данных за опасное для жизни заболевание) и высокой вероятности ремиссии. Широко используются другие методы психотерапии, при этом преимущество одних методов над другими остается предметом многочисленных дискуссий. Пациентам с фобическим неврозом часто помогают различные модификации поведенческой психотерапии. При
ступ панической атаки обычно снимает прием диазепама (5-10 мг) или других транквилизаторов. Для уменьшения симптомов тревоги и частоты и выраженности панических атак эффективны транквилизаторы (альпразолам по 2-3 мг/сут, атаракс по 25-100 мг/сут, клоназепам по 1-4 мг/сут и др.), а при депрессивных симптомах — антидепрессанты (амитриптилин по 50-75 мг/сут, пароксетин по 20 мг/сут, сертралин по 50 мг/сут, флуоксетин по 20 мг/сут и др.). Длительность курса лечения составляет несколько недель, а нередко и месяцев при динамическом наблюдении за состоянием пациента.
Обсессивно-компульсивное расстройство
Обсессивно-компульсивное расстройство (невроз навязчивых состояний) обычно проявляется в подростковом или молодом возрасте. У части пациентов оно бывает семейным.
Основные проявления представляют насильственные мысли и побуждения (обсессии) и навязчивые действия (компульсии), которые насильственно вторгаются в сознание пациента вопреки его желанию противостоять им или избавиться от них. Пациентов часто беспокоит навязчивый страх причинить вред своим ближайшим родственникам. В качестве навязчивых движений часто отмечаются мытье рук, повторная проверка дверных замков или газовых кранов. У многих пациентов наблюдаются также тревожное расстройство и/или депрессия.
Диагноз основывается на тех же принципах, что и диагноз тревожного невроза.
Лечение основывается на тех же принципах, что и лечение тревожного невроза. Эффективны антидепрессанты, в частности флуоксетин (прозак) по 20 мг/сут и пароксетин (рексетин) по 20 мг/сут.
Истерический невроз
Истерический невроз (конверсионное расстройство). Классический тип истерического невроза дебютирует преиму-
Тема 12. Вегетативная дистония и невротические расстройства щественно у девушки или молодой женщины, имеет хроническое течение с периодическими обострениями. В зрелом возрасте частота и выраженность обострений обычно снижается.
Заболевание часто проявляется симптомами, напоминающими таковые неврологического заболевания — паралич конечностей, припадки, головокружение и расстройство походки, нарушение речи или потеря зрения. Истерический паралич конечностей представляет одно из наиболее частых проявлений заболевания. При нем не обнаруживается изменений мышечного тонуса и рефлексов, характерных для центрального или периферического пареза. Внимательное наблюдение за двигательными возможностями пациента показывает, что полное отсутствие движений в парализованной конечности (или ее части) не соответствует периодическому ее участию в отдельных двигательных актах. Истерические припадки проявляются обычно хаотическими движениями конечностей с различными патологическими позами кистей и стоп, извивающимися движениями в туловище. Голова нередко запрокидывается назад, глаза закатываются вверх, туловище выгибается в виде «истерической дуги». При истерическом припадке не наблюдается типичных проявлений и последовательности тонических и клонических судорог, характерных для судорожного эпилептического припадка; попытка врача во время припадка открыть глаза пациента обычно вызывает его зажмуривание. При записи электроэнцефалограммы во время истерического припадка не регистрируется эпилептической активности, характерной для эпилептического припадка. При других истерических симптомах (нарушения стояния и ходьбы, расстройства зрения, речи и др.) также отмечается несоответствие этих изменений неврологическим нарушениям.
Пациентов часто беспокоит боль различной локализации — в области живота, спины и конечностей. В связи с подозрением на острое хирургическое заболевание, например аппендицит, пациенты нередко подвергаются хирургической
операции. Обострения заболевания существенно затрудняют учебу, работу, общественную деятельность и семейную жизнь, потому что часто приводят к госпитализации или длительному наблюдению и лечению в поликлинике. Во многих случаях симптомы истерии копируют проявления недавней болезни у кого-либо из родственников или знакомых, например паралич левых конечностей возникает после общения с больным инсультом, имеющим левосторонний гемипарез. У пациентов часто отмечаются тревожные расстройства и повышенная внушаемость. Следует отметить, что пациент не осознает природу своего заболевания.
Диагноз основывается на наличии симптомов истерии, истерическом типе личности (эгоцентричность, эмоциональная лабильность, склонность к театральному и привлекающему внимание поведению) и исключении соматических и неврологических заболеваний. В пользу истерического характера симптомов указывает их несоответствие неврологическим нарушениям. Повторение подобных эпизодов, которые не соответствуют обычным проявлением неврологического или соматического заболевания, подтверждает диагноз истерического невроза. Инструментальные методы обследования, также не выявляют изменений, например магнитно-резонансная томография не обнаруживает признаков поражения головного мозга при стойкой «парализации» конечностей.
Лечение истерического невроза направлено на купирование симптомов болезни и ослабление имеющихся в большинстве случаев невротических расстройств. Широко используются различные виды психотерапии, включая гипноз и психоанализ, но их эффективность остается предметом дискуссий. Рациональное объяснение пациенту природы заболевания как невроза либо как симптомов, вызванных собственным внушением, как правило, не помогает. Целесообразно убеждать пациента в том, что он поправится, отмечать имеющееся улучшение состояния. При двигательных нарушениях рекомендуется лечебная гимнастика. Если имеется тревожное расстройство, эффективны транквилизаторы, если депрессия — антидепрессанты.
Таблица
Краткие сведения о неврозах
Краткие сведения Тревожный и фобический невроз Обсессивно-компульсивный невроз Истерический невроз
Причины развития Психотравмирующая ситуация, психогении детского возраста, особенности личности, наследственная предрасположенность
Симптомы Повышенная раздражительность и тревожность, приступы тревоги (панические атаки), агорафобия и вегетативная дистония, нередко депрессия. При фобическом неврозе страх определенных ситуации, болезней, животных или предметов Насильственные мысли и побуждения (обсессии) и навязчивые действия (компульсии), часто тревожное расстройство и/или депрессия Истерический паралич конечностей, припадки, головокружение, расстройство походки, нарушение речи, потеря зрения и демонстрация других симптомов, несоответствующих проявлениям неврологических или соматических заболеваний. Нередко тревожное расстройство
Течение Дебют чаще в молодом возрасте, периодические обострения возможны в течение всей жизни на фоне психотравмирующих ситуаций
Диагноз Наличие симптомов невроза и отсутствие данных за неврологическое, соматическое или другое психическое заболевание
Лечение Психотерапия, при тревожных расстройствах — транквилизаторы, при депрессии — антидепрессанты
Список литературы
1. Болезни нервной системы. Руководство для врачей. Под ред. Н.Н. Яхно, Д.Р. Штульмана. — М., 2004.
2. Вейнер Г., Левитт Л. Неврология. — М., 1998.
3. Виберс Д„ Фейгин В., Браун Р. Руководство по цереброваскулярным заболеваниям. — М., 1999.
4. Гусев Е.И., Коновалов А.Н., Бурд Г.С. Неврология и нейрохирургия. — М., 2000.
5. Зенков Л.Р. Клиническая эпилептология. — М., 2002.
6. Карлов В.А. Судорожный эпилептический статус. — М., 2003.
7. Наследственные заболевания нервной системы. Руководство для врачей. Под ред. Ю.Е. Вельтищева, П.А. Темина. — М., 1998.
8. Неврология. Под ред. М. Самуэльса. — М., 1997.
9. Нейротравматология. Под ред. А.Н. Коновалова. — М., 2004.
10. Руководство по детской неврологии. Под ред. В.И. Гузевой. — СПб., 1998.
И. Шмидт Т.Е., Яхно Н.Н. Рассеянный склероз. — М., 2003.
12. Яхно Н.Н., Парфенов В.А., Алексеев В.В. Головная боль. — М., 2000.
МЕДИЦИНСКОЕ ИНФОРМАЦИОННОЕ АГЕНТСТВО
119048 Москва»
М Трубецкая ул., д.8 (ММА им И М.Сеченова), комн 733
Телефакс 245-8620
Тел. 242-9110
E-mail: miapubl@mail.ni http:// www.medagency.nj
of 733,
(Moscow Medical Academy), M Trubetskaya 8.
Moscow, 1)9048
Tel /fax 245-8620
Tel. 242-9110
E-mail miapubl@mail ru hvcp-J/ wwwmedagency ru
MEDICAL INFORMATIONAL AGENCY
Издател ьство «Медицинское информационное агентство» — одно из ведущих российских медицинских издательств, обладающее большим опытом работы и популярностью на рынке медицинской литературы. За годы своего существования мы выпустили около ста медицинских изданий: учебники и учебные пособия, руководства и справочники, атласы и словари, научные труды и монографии, а также другую медицинскую литературу ведущих отечественных ученых-медиков и врачей, обладающих большим практическим опытом.
Наше издательство приглашает к сотрудничеству авторов и авторские коллективы. Издательство поможет вам подготовить к изданию ваши труды (научное и литературное редактирование, технически грамотное и профессиональное художественное оформление, наглядное и корректное выполнение иллюстрационного материала и др.), а также разместить заказ в типографии и распространить тираж.
Учебное издание
Яхно Николай Николаевич Парфенов Владимир Анатольевич
ЧАСТНАЯ НЕВРОЛОГИЯ
Учебное пособие для студентов медицинских вузов
Руководитель научно-информационного отдела канд. мед. наук А. С. Макарян Главный редактор А.С. Петров
Зам. главного редактора С.А. Зайцева Ответственный за выпуск О.В. Жукова Корректор О.И. Белова
Компьютерная верстка МП Трубачев Препресс-обработка А.Н. Дубок
Санитарно-эпидемиологическое заключение № 77.99.02.953.Д.001179.03.05 от 15.03.2005 г. Подписано в печать 17.10.05. Формат 84х1081/32. Бумага офсетная. Печать офсетная. Гаршпура Petersburg. Объем 6 печ. л. Тираж 4000 экз. Заказ № 3093
ООО «Медицинское информационное агентство» 119435, Москва, М. Трубецкая, д. 8 (ММА им. И.М. Сеченова), тел./факс: 242-91-10, 245-86-20;
E-mail: miapubl@mail.ru http://www.medagency.ru Интернет-магазин: www.medkniga.ru
Книга почтой на Украине: а/я 4539, г. Винница, 21037 E-mail: maxbooks@svitonline.com
Отпечатано в ОАО «Типография “Новости”» 105005, Москва, ул. Ф. Энгельса, 46
ISBN 5-89481-337-9