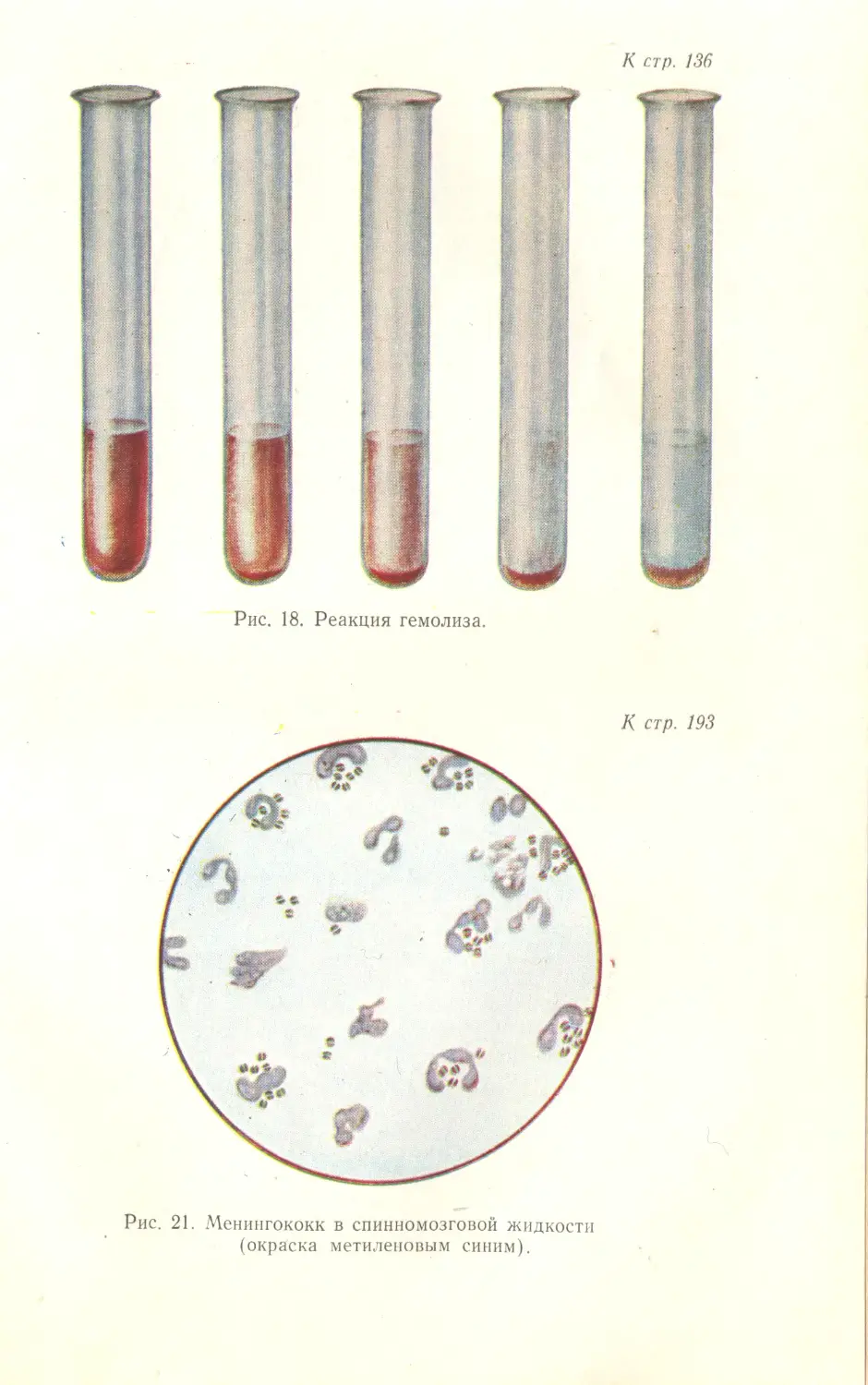
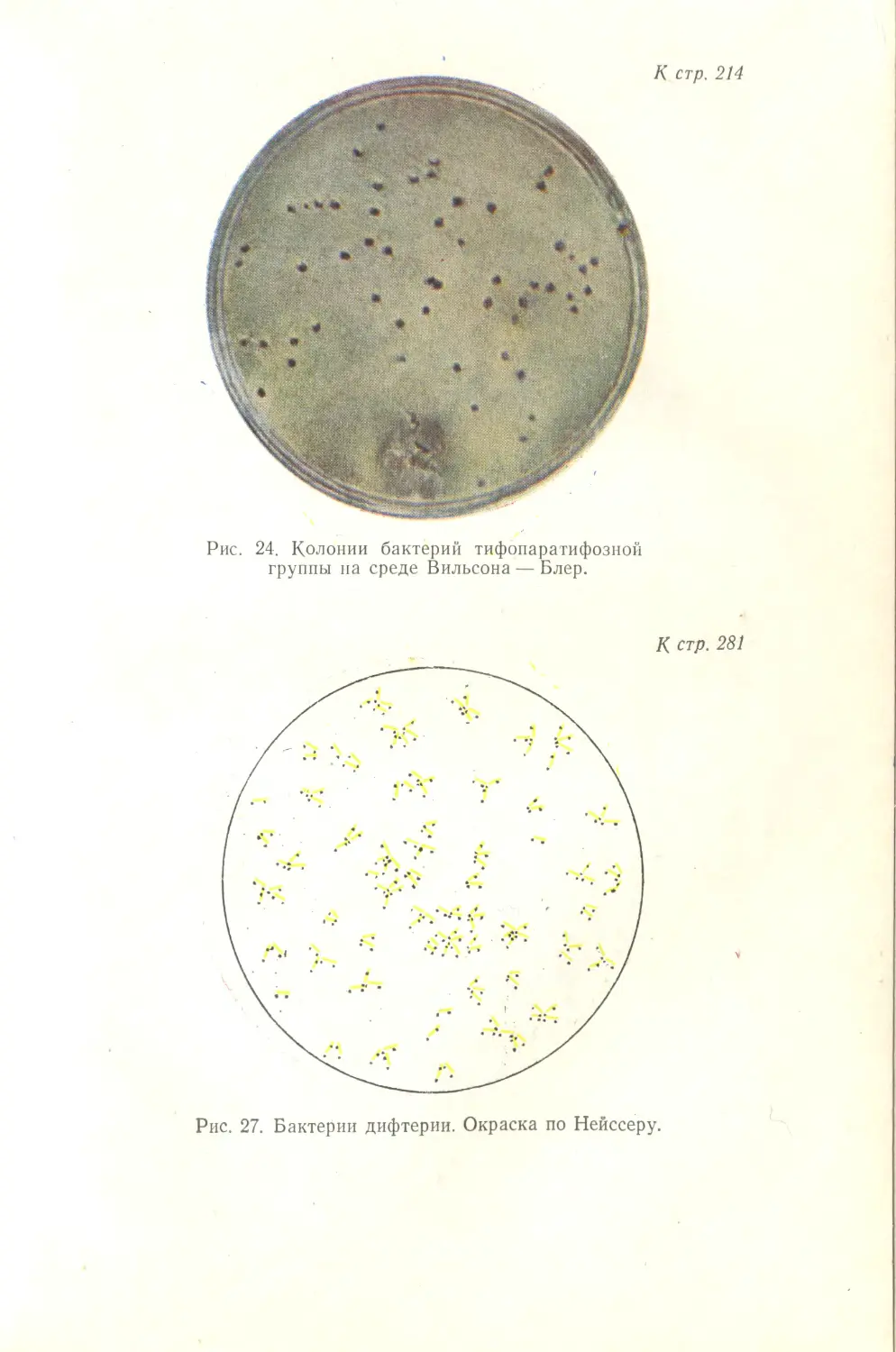
Автор: Лабинская А.С.
Теги: биология клетки и субклеточных частиц цитология медицина микробиология биотехнологии
Год: 1978
Текст
УДК 576.8(024) : 61] (075.8)
ЛАБИНСКАЯ А. С. Микробиология с техникой микро-
биологических исследований. Изд. 4-е, перераб. и доп. М.,
«Медицина», 1978, 394 с., нл.
В учебнике три части: общая микробиология, специальная
часть и санитарная микробиология. В первой части дается опи-
сание бактериологической лаборатории, излагаются микроско-
пические методы исследования и основы приготовления пита-
тельных сред. Во второй части дается характеристика различ-
ных патогенных микроорганизмов и методика бактериологиче-
ских исследований. В третьей части изложены методы санитар-
но-бактериологического исследования воды, почвы населенных
мест, воздуха и продуктов питания.
В приложении приведены наиболее употребительные дез-
инфицирующие средства н прописи приготовления из них ра-
бочих растворов, рецепты приготовления красок и реактивов,
индикаторов, питательных сред и консервантов.
Учебник написан в соответствии с программой, утвержден-
ной Министерством здравоохранения СССР, и предназначен для
фельдшерско-лаборантских отделений медицинских училищ.
В учебнике 34 рис., 65 табл.
Рецензенты:
Преподаватели микробиологии Харьковского медицинского
училища № 1 кандидат медицинских наук, доцент Н. Ф. Го-
ловина и Ф. М. Кагановская
Л
51000—008
----------33—78
039(01)—78
© Издательство «Медицина», Москва, 1978
ЧАСТЬ ПЕРВАЯ
ОБЩАЯ МИКРОБИОЛОГИЯ
БАКТЕРИОЛОГИЧЕСКАЯ ЛАБОРАТОРИЯ
Бактериологические лаборатории как самостоятельные
структурные единицы организуются при санитарно-эпидемио-
логических станциях (СЭС), в инфекционных больницах,
больницах общего типа, некоторых специализированных ста-
ционарах (например, в туберкулезных, ревматологических,
кожно-венерологических) и в поликлиниках.
Бактериологические лаборатории при СЭС исследуют на
общую бактериальную загрязненность, а также на заражен-
ность условно патогенной и патогенной микрофлорой объекты
внешней среды: воздух, воду, почву, продукты питания; про-
водят обследование организованных коллективов и отдельных
лиц на носительство патогенных бактерий кишечной группы,
коринебактерий дифтерии, коклюша, паракоклюша, менинго-
кокка.
Работа бактериологической лаборатории в комплексе с
другими отделами СЭС имеет определенную задачу — оздо-
ровление внешней среды и снижение заболеваемости населе-
ния.
Бактериологические лаборатории при лечебно-профилакти-
ческих учреждениях выполняют анализы, необходимые для
постановки и уточнения диагноза инфекционного заболева-
ния, способствуя правильному выбору специфического лече-
ния и определению сроков выписки больного из инфекцион-
ной больницы.
Предметом для исследования в бактериологических лабо-
раториях являются:
1. Выделения из организма человека: моча, кал, мокрота,
гной, а также кровь, спинномозговая жидкость и трупный
материал.
2. Объекты внешней среды: вода, воздух, почва, продукты
питания, смывы с предметов инвентаря, рук и т. п.
ПОМЕЩЕНИЕ БАКТЕРИОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
И ОБОРУДОВАНИЕ РАБОЧЕГО МЕСТА
Специфика микробиологических работ требует, чтобы по-
мещение, отведенное под лабораторию, было изолировано от
больничных палат, жилых комнат, пищевых блоков.
з
В состав бактериологической лаборатории входят: лабо-
раторные комнаты для бактериологических исследований и
подсобные помещения; автоклавная или стерилизационная
для обеззараживания отработанного материала и заражен-
ной посуды; моечная, оборудованная для мытья посуды; сре-
доварочная для приготовления, розлива, стерилизации и хра-
нения питательных сред; виварий для содержания подопыт-
ных животных; материальная для хранения запасных реакти-
вов, посуды, аппаратуры и хозяйственного инвентаря.
Перечисленные подсобные помещения как самостоятель-
ные структурные единицы входят в состав крупных бактерио-
логических лабораторий. В небольших лабораториях средова-
рочную и стерилизационную объединяют в одной комнате;
специальное помещение для содержания подопытных живот-
ных отсутствует.
Под лабораторные комнаты, в которых производят все
бактериологические исследования, отводят наиболее светлые,
просторные помещения. Стены в этих комнатах на высоту
170 см от пола окрашивают в светлые тона масляной краской.
Пол покрывают релином или линолеумом. Такого рода отдел-
ка позволяет пользоваться при уборке помещения дезинфи-
цирующими растворами.
В каждой комнате должна быть раковина с водопровод-
ной подводкой и полкой для бутыли с дезинфицирующим рас-
твором.
В одной из комнат оборудуют застекленный бокс с пред-
боксником для выполнения работ в асептических условиях.
В боксе ставят стол для посевов, табурет, над рабочим
местом монтируют бактерицидные лампы. В предбоксник по-
мещают шкаф для хранения стерильного материала.
Лабораторное помещение оборудуется столами лаборатор-
ного типа, шкафами и полками для хранения необходимой
при работе аппаратуры, посуды, красок, реактивов.
Очень большое значение для работы имеет правильная
организация рабочего места врача-бактериолога и лаборан-
та. Лабораторные столы устанавливают около окон. При раз-
мещении их нужно стремиться к тому, чтобы свет падал спе-
реди или сбоку от работающего, лучше с левой стороны, но
ни в коем случае не сзади. Желательно, чтобы комнаты для
проведения анализов, особенно для микроскопирования, име-
ли ориентацию окон на север или северо-запад, так как для
работы необходим ровный рассеянный свет. Освещенность
поверхности столов для работы должна быть 500 лк. Для
удобства дезинфекции поверхность лабораторных столов по-
крывают пластиком, а каждое рабочее место на нем — зер-
кальным стеклом.
За каждым сотрудником лаборатории закрепляют отдель-
ное рабочее место площадью 150X60 см. Все рабочие места
Таблица 1
Необходимые предметы для бактериологической работы
№ п/п Наименование предмета Примерное количество
1 Набор красок и реактивов для окраски препара- 1
тов
2 Стекла предметные 25—50
3 Стекла покровные 25—50
4 Стекла с лунками 5—10
5 Штатив под пробирки 2
6 Петля бактериальная 1
7 Шпатели стеклянные 10
8 Шпатели металлические 1
9 Банка с ватой 1
10 Пипетки градуированные на 1, 2, 5, 10 мл По 25 каждой
емкости
11 Пипетки пастеровские 25—50
12 Пинцет, ножницы, скальпель По 1
13 Банка с дезинфицирующим раствором для отра- 1
ботанных предметных стекол
14 Микроскоп с осветителем 1
15 Лупа X 5 1
16 Масленка с иммерсионным маслом 1
17 Фильтровальная бумага 3—5 листов
18 Банка с дезинфицирующим раствором для пипе- 1
ТОК
19 Спиртовая или газовая горелка 1
20 Установка для окраски препаратов:
промывалка, лоток с мостиком По 1
21 Песочные часы на 1 и 2 мин По 1
22 Шприцы с набором нгл 5
23 Стерильные пробирки 100
24 Баллоны резиновые 3
25 Карандаш по стеклу 1
оборудуют предметами, необходимыми для повседневной бак-
териологической работы, перечень которых дан в табл. 1.
ПРАВИЛА РАБОТЫ И ПОВЕДЕНИЯ В ЛАБОРАТОРИИ
Особенностью бактериологических работ является посто-
янное соприкосновение сотрудников лаборатории с заразным
материалом, культурами патогенных микробов, зараженными
животными, кровью и выделениями больного. Поэтому все
сотрудники бактериологической лаборатории обязаны соблю-
дать следующие правила работы, которые обеспечивают сте-
рильность в работе и предупреждают возможность возник-
новения внутрилабораторных заражений.
1. В помещение бактериологической лаборатории нельзя
входить без специальной одежды — халата и белой шапочки
или косынки.
2. Нельзя вносить в лабораторию посторонние вещи.
5
3. Запрещается выходить за пределы лаборатории в ха-
латах или надевать верхнее платье на халат.
4. .В помещении бактериологической лаборатории катего-
рически запрещается курить, принимать пищу, хранить про-
дукты питания.
5. Весь материал, поступающий в бактериологическую ла-
бораторию, должен рассматриваться как инфицированный.
6. При распаковке присланного заразного материала необ-
ходимо соблюдать осторожность: банки, содержащие мате-
риал для исследования, при получении обтирают снаружи
дезинфицирующим раствором и ставят не прямо на стол, а на
подносы или в кюветы.
7. Переливание жидкостей, содержащих патогенных мик-
робов, производят над сосудом, наполненным дезинфицирую-
щим раствором.
8. О случаях аварии с посудой, содержащей заразный ма-
териал, или проливания жидкого заразного материала надо
немедленно сообщать заведующему лабораторией или его за-
местителю. Мероприятия по обеззараживанию загрязненных
патогенным материалом платья, частей тела, предметов ра-
бочего места осуществляются немедленно.
9. При исследовании зараженного материала и работе
с патогенными культурами микробов необходимо строго со-
блюдать общепринятые в бактериологической практике тех-
нические приемы, исключающие возможность соприкоснове-
ния рук с заразным материалом.
10. Зараженный материал и ненужные культуры подле-
жат обязательному уничтожению, по возможности в тот же
день. Инструменты, использованные в работе с заразным
материалом, тотчас после их употребления дезинфицируют,
как и поверхность рабочего места.
11. При выполнении бактериологических работ нужно
строго следить за чистотой рук: по окончании работы с за-
разным материалом их дезинфицируют. Рабочее место в кон-
це дня приводят в порядок и тщательно дезинфицируют, а за-
разный материал и культуры микробов, необходимые для
дальнейшей работы, ставят на хранение в запирающийся реф-
рижератор или сейф.
12. Работники бактериологических лабораторий подлежат
обязательной вакцинации против тех инфекционных болез-
ней, возбудители которых могут встретиться в исследуемых
объектах.
ПОРЯДОК ХРАНЕНИЯ, ОБРАЩЕНИЯ И ОТПУСК
КУЛЬТУР ПАТОГЕННЫХ МИКРОБОВ
Возбудители заразных болезней в соответствии со сте-
пенью опасности заражения для работающих с ними лиц, уче-
том клиники вызываемых заболеваний, а также наличием
6
эффективных приемов охраны труда и техники Оезопасности
при работе подразделяются на следующие пять групп:
Группа 1. Возбудитель чумы.
Группа II. Возбудитель холеры, натуральной оспы, бру-
целлеза, туляремии, сибирской язвы, сапа, мелиоидоза, эпи-
демического сыпного тифа, эпидемических энцефалитов, ге-
моррагических лихорадок, желтой лихорадки, лихорадки Ку,
лихорадки цуцугамуши, лихорадки 'Скалистых гор, орнито-
зов, гистоплазмоза, кокцидиозов, токсин ботулиновый.
Группа III. Возбудители бактерийных (брюшной тиф, ди-
зентерия, дифтерия, туберкулез и др.), вирусных (бешенство,
полиомиелит, корь, грипп и др.), риккетсиозных ( (болезнь
Брилля, клещевые тифы и др.), простейших (малярия, лей-
шманиоз, возвратный тиф, сифилис и др.), грибковых (акти-
номикоз, бластомикоз, дерматомикозы и др.), инфекционных
заболеваний, выделенных в самостоятельные нозологические
формы.
Группа IV. Возбудители токсикоинфекций и острых бак-
териальных отравлений (сальмонеллы, стафилококки, виб-
рионы, клостридии и др.), энтеритов (эшерихии, энтеро- и
аденовирусы и др.), септццемий и пневмоний (стафилококки,
стрептококки, синегнойная палочка и др.).
Группа V. Облигатная непатогепная микрофлора, насе-
ляющая слизистые и кожные покровы человека, а также мик-
роорганизмы— показатели санитарного состояния внешней
среды (эшерихии, энтерококки, перфрингепс и др.).
Представленная схема распределения возбудителей по
группам определяет режим работы, порядок хранения и вы-
дачи микроорганизмов различных групп.
Работу с культурами микробов I и II групп можно прово-
дить только с разрешения Центральной режимной комиссии
Главного управления карантинных инфекций Министерства
здравоохранения СССР или Главного санитарно-эпидемиоло-
гического управления Министерства здравоохранения союзной
республики, в специально оборудованных лабораторных по-
мещениях, работа которых регламентируется действующими
инструкциями по режиму работы с материалом, зараженным
или подозрительным *па зараженность возбудителями чумы,
холеры, сибирской язвы, туляремии и бруцеллеза.
Работа с возбудителями, отнесенными в III группу, про-
водится в соответствии с правилами устройства, техники без-
опасности, производственной санитарии и личной гигиены при
работе в лабораториях санитарно-эпидемиологических уч-
реждений.
Работа с возбудителями IV и V групп требует соблюдения
обычного режима работы бактериологической лаборатории,
обеспечивающего надежную защиту персонала лаборатории
от виутрилабораторпых заражений в процессе исследований
7
и надлежащее обеззараживание материала, исключающее
возможность распространения инфекции за пределы лабора-
тории.
Порядок хранения культур 1—V групп. Культуры микро-
бов хранят в пробирках на плотных питательных средах и в
ампулах в лиофилизированном состоянии. На пробирки и ам-
пулы с культурами наклеивают этикетки с номером штамма
по инвентарной книге, названием возбудителя и датой пере-
сева.
Культуры хранят в холодильниках или сейфах. Холодиль-
ники и несгораемые шкафы с культурами I, II и III групп
по окончании рабочего дня закрывают на ключ, пломбируют
или опечатывают. Места хранения культур IV и V групп за-
пирают. Ключи от замков, пломбиры и печати хранятся у за-
ведующего лабораторией или выделенного им лица. В поме-
щениях, где хранят культуры I и II групп, входные двери
закрывают на замок и пломбируют или опечатывают сургуч-
ной печатью.
Учет культур и материалов, подозрительных на заражен-
ность возбудителями I—V групп. Культуры возбудителей I—
V групп, выделяемые при диагностических исследованиях и
находящиеся в работе бактериологической лаборатории, под-
лежат обязательной регистрации в журналах с пронумеро-
ванными страницами, прошнурованных и скрепленных сур-
гучной печатью учреждения.
Министерством здравоохранения СССР для лабораторий,
работающих с живыми культурами микробов, утверждены
следующие формы журналов
Форма 1. Журнал регистрации материалов (культур),
поступивших для исследования.
Форма 2. Журнал учета выделенных культур и их унич-
тожения.
Форма 3. Журнал, ведение которого предусмотрено для
лабораторий, работающих с возбудителями I и II групп,
отражает движение микробных культур и материалов, подо-
зрительных на зараженность.
Микробные культуры, отнесенные к I и II группам, и за-
раженные животные учитываются по каждому виду возбуди-
теля отдельно, микробы III—IV групп — суммарно по каж-
дому роду возбудителя. Микроорганизмы V группы специаль-
ному учету не подлежат. Регистрация их ведется в рабочих
журналах и дневниках.
Порядок передачи культур микробов внутри учреждения
и за его пределы (внутри страны). Из лаборатории в лабора-
1 Положение о порядке хранения, обращения, отпуска и пересылки
культур бактерий, вирусов, риккетсий, грибов, простейших, микоплазм, бак-
терийных токсинов и ядов животного происхождения, передаче их в зару-
бежные страны и получении из зарубежных стран от 30 января 1974 г.
8
Журнал (форма 1) регистрации материалов (культур),
поступивших для исследования
№ п/п Дата Наименование материала Откуда поступил Цель исследования Результат исследования Приме- чание
1 2 3 4 5 6 7
х.
Журнал (форма 2) учета выделенных культур и их уничтожения
Хе п/п № штамма Наименование культуры Дата выделения Источник выде- ления Адрес и дата взятия материала Способ выделения Типичность штамма1 Судьба штамма Примечание
1 2 3 4 Б 6 7 8 9 10
1 При культуре — указать эти признаки.
торию в пределах одного учреждения музейные культуры
микробов III—V групп передаются по письменному разре-
шению заведующего музеем культуры микробов, возбудите-
ли I—II групп — с разрешения руководителя учреждения.
В пределах одной и той же лаборатории штаммы обозначен-
ных групп бактерий могут быть переданы по письменному
разрешению заведующего лабораторией.
Для выдачи культур за пределы лаборатории необходимо
официальное требование за подписью руководителя учреж-
дения, скрепленное гербовой печатью.
Разрешение на выдачу культур возбудителей I—V групп
дает руководитель учреждения. Культуры микробов I и
II групп выдаются лишь в те учреждения, которые имеют
разрешение Министерства здравоохранения СССР на работу
с этими микроорганизмами. Учреждения, запрашивающие
культуры возбудителей III группы, одновременно с требова-
нием должны представить заключение местной (районной, го-
родской) СЭС о наличии условий для работы с возбудите-
лями этой группы.
Культуры микробов I—V групп в высушенном виде (в ам-
пулах) или в пробирках на плотных питательных средах при
выдаче завертываются в лигнин или гигроскопическую вату
и помещаются в металлический (для культур III—V групп
9
Журнал (форма 3) движения заразного материала (бактерий, вирусов и других куль тур, токсинов, ядов, образцов,
подозрительных на зараженность)
Количество сухих культур (ампул) BHtf ХВпоя и (онаи-эина) ОНЭЖО1НИиХ OHShXlTOU кшг Хевьвн и 20 21 22 23
ичество зара- 1ных органов (проб) инк ХНпоя и онэжохьинХ ОНЭЖВЙВВ 17 18 19 |
5 £ ВИЯ XlCBhBH и ю ИМ
Количество зараженных эктопаразитов (проб) BHtf Хйноя я онэжохьинХ онэжвйвв BHff XlTBhBH и 12 13 14 15 |
Количество зара- женных живот- ных (по вндам) BHtf Хвиоя и онэжохьинХ ига oirgajou онэжвйвв BHV XlCBhBH и | II 01 6 8
оличествоЗ посевов внЯ ХТтноя я онэжохьинХ ОНВЭЭО11 5 6 7 |
ВН1Г XlTBhBH я
Количество поступивших^ объектов (культур) СО
Вид исследования (наименование культуры) сч
Дата i
можно пластмассовый) плот-
но закрывающийся опеча-
тываемый пенал.
Культуры бактерий I и
II групп пересылают со спе-
циальной связью. При этом
пенал с отправляемыми
культурами укладывают в
деревянный прочный ящик,
обшивают его материалом,
пломбируют или опечатыва-
ют сургучной печатью. На
адресной стороне посылки
прикрепляется особый яр-
лык с отметкой «Опасно.
Не открывать во время пе-
ресылки».
Культуры возбудителя
чумы пересылаются в сопро-
вождении 2 лиц, одним из
которых должен быть врач.
Микробные культуры,,
отнесенные в III группу, пе-
ресылаются обычной поч-
товой посылкой в такой же
упаковке, как культуры I и
II групп, или выдаются
через нарочного по предъ-
явлении им официального
требования, доверенности и
паспорта.
УБОРКА ЛАБОРАТОРНОГО
ПОМЕЩЕНИЯ
Помещение лаборатории
ежедневно до начала рабо-
ты следует убирать влаж-
ным способом. Пыль с по-
верхности столов, приборов^
оборудования, а также под-
оконников стирают чистой
тряпкой, увлажненной дез-
инфицирующим раствором.
Полы очищают от пыли
пылесосом и после этого
протирают тряпкой, смочен-
ной в 3—5% растворе кар-
боловой кислоты.
10
После окончания работы стены, покрытые метлахскими
плитками или окрашенные масляной краской, моют горячей
«одой с мылом или стиральным порошком. Потолки, карнизы,
верхняя часть стен, окрашенные клеевой краской, не реже од-
ного раза в неделю очищают от пыли пылесосом.
Подготовка бокса к работе. Помещение бокса обрабаты-
вают следующим образом: ежедневно п^ред началом работы
полы протирают дезинфицирующим веществом (2% раствор
хлорамина или 3% раствор фенола); воздух обеззараживают
бактерицидными лампами, установленными на высоте 2—
2,5 м от поверхности пола, из расчета одна лампа БУВ-30
(1,5—2,5 Вт) на 1 м3 помещения. При указанных условиях
бокс облучают 2—3 ч. Перед началом работы лампы выклю-
чают. При отсутствии бактерицидных ламп непосредственно
перед работой производят дезинфекцию бокса, протирая по-
мещение 5% раствором хлорамина.
Для того чтобы предотвратить заражение бокса, образцы
материалов, подлежащие исследованию, вносят в бокс после
предварительного тщательного протирания их 3% раствором
фенола. По этим же соображениям работа в боксе проводится
в стерильных халатах, защитных масках и тапочках, специ-
ально предназначенных для бокса.
Воздух в боксе следует регулярно, не менее 2 раз в неде-
лю, проверять на бактериальную обсеменепность. Чашки с
мясо-пептонным агаром (рец. 38, с. 352) и средой Сабуро
(рец. 149, с. 389) оставляют открытыми на 15 мин. Посев на
мясо-пептонпом агаре выдерживают в термостате 48 ч при
37°С, чашки со средой Сабуро — 96 ч при 22°С. Допустимым
ростом считается 5 колоний на чашках. Количество колоний
больше 5 при 15-минутпой экспозиции является показателем
высокой обсеменепности воздуха бокса. В этих случаях по-
мещение бокса нуждается в дополнительной, более тщатель-
ной обработке. Не менее одного раза в неделю помещение бок-
са моют горячей водой с мылом, дезинфицирующими средст-
вами и протирают досуха.
Уборка рабочего места. По окончании работы бе-
рут пинцетом кусок ваты, смачивают его в 5% растворе хлор-
амина (см. с. 339) или в 5% растворе карболовой кислоты
(см. с. 340) и протирают им поверхность стекла на рабочем
месте. Такого рода повседневная дезинфекция носит профи-
лактический характер.
МЫТЬЕ И ОБРАБОТКА ЛАБОРАТОРНОЙ ПОСУДЫ
Посуда для бактериологических работ должна быть чистой,
а для многих исследований — и стерильной, так как исполь-
зование загрязненной, плохо вымытой посуды может приве-
сти к получению неправильных результатов.
И
Для мытья лабораторной посуды в микробиологических
лабораториях отводится отдельное помещение — моечная
или специальное рабочее место, которое обеспечивается боль-
шой раковиной с подводкой горячей и холодной воды, нагре-
вательными приборами: газовой или электрической плитой..
В моечной необходимо иметь кастрюли, тазы, ведра, ерши,
щетки и доски с колышками для сушки чистой посуды. На
дно раковины кладут густую металлическую сетку, чтобы пре-
дупредить засорение канализационной сети частицами агара,
ватой, бумагой, попадающими в воду при мытье посуды.
.В процессе мытья на посуду воздействуют механическими
и химическими факторами. К числу первых относится удале-
ние грязи с помощью щеток и ершей. При отсутствии ершей
или невозможности их использования, например в случае не-
соответствия ерша размеру сосуда, посуду моют с помощью
мелко нарезанных кусочков бумаги, соломы или сена. При
этом загрязнение, имеющееся на внутренних стенках, удаля-
ется механически. Наилучшие результаты мытья посуды от-
мечаются в том случае, когда воздействие механических фак-
торов сочетается с действием химических веществ. Поэтому
ерши, Которыми моют посуду, предварительно погружают в
соду, полужидкое мыло, мыльный раствор или стиральный
порошок.
Надписи, сделанные на стекле восковым карандашом, лег-
ко снимаются щеткой либо кусочком влажной марли с ме-
ловым порошком или содой.
Для устранения налета белого цвета, нередко появляю-
щегося на стекле, посуду помещают на 30—40 мин в 5—
10% раствор хлористоводородной кислоты.
Сильно загрязненную посуду со следами жира обрабаты-
вают в хромовой смеси (см. с. 340). Хромовая смесь, будучи
сильным окислителем, разрушает органические вещества с об-
разованием растворимых или газообразных продуктов. Перед
употреблением хромовую смесь подогревают до температуры
45—50°С, а затем заливают ею грязную посуду.
Мытье новой лабораторной посуды. В ведре с теплой во-
дой растворяют хозяйственное мыло, чтобы образовалось
небольшое количество пены, погружают в нее посуду н ста-
вят на слабый огонь. После 15-минутного кипячения посуду
вынимают, ополаскивают чистой водой, погружают в теплый
1—2% раствор хлористоводородной кислоты, доводят до ки-
пения и вываривают 10—15 мин, чтобы нейтрализовать избы-
ток щелочи, который мог остаться при изготовлении стекла.
После кипячения в кислоте посуду прополаскивают водопро-
водной водой и дважды дистиллированной.
При мытье посуды, служащей для постановки серологиче-
ских реакций, кислоты и щелочи использовать не рекоменду-
ется, так как даже следы этих веществ, оставшиеся на стен-
12
ках, могут исказить результат реакции. Такую посуду моют
горячей водой, кладут на сетки, чтобы с нее стекла вода, за-
тем несколько раз ополаскивают дистиллированной водой и
сушат в сушильном шкафу. /
Мытье лабораторной посуды, бывшей в употреблении. По-
суда, в которой содержался зараженный материал, поступает
в мойку после предварительной дезинфекции, гарантирующей
гибель находящихся в ней патогенных микробов. Перед
мытьем из пробирок, чашек и матрацев обеззараженную жид-
кость выливают в канализацию. Не очень загрязненную посу-
ду моют ершом в горячей воде с мылом, содой или в растворе
горчицы. Посуду со следами агара, желатина или другой
питательной среды за сутки перед мытьем заливают 2—5%
раствором едкого натра или едкого кали. Очень загрязнен-
ную жирную посуду, не поддающуюся мытью обычным спо-
собом, заливают на 30—40 мин хромовой смесью, а затем
в течение продолжительного времени промывают проточной
водопроводной водой.
Простой и надежный способ мытья и обеззараживания ла-
бораторной посуды предложен Г. П. Кирсановым (1972). От-
работанную лабораторную посуду (пробирки, чашки Петри,
предметные стекла с мазками после иммерсионной микроско-
пии и пр.) стерилизуют в автоклаве в течение 2 ч при 2 атм.
После стерилизации посуду загружают в бак и заливают рас-
твором, содержащим на 100 мл дистиллированной воды 5 мл
нашатырного спирта и 3 г порошка для стирки хлопчатобу-
мажного и льняного белья в механизированных прачечных
(изготовитель — Казанский химкомбинат имени Вахитова,
ВТУ 1'8/37-64). Лабораторная посуда хорошо отмывается и
обезжиривается в течение 30 мин кипячения в указанном
растворе, затем ее прополаскивают водопроводной водой и
дважды дистиллированной. После этого посуду высушивают
в сушильном шкафу.
Для обработки посуды, применявшейся для выращивания
микобактерий туберкулеза на яичных питательных средах,
А. В. Ивановым и соавт. (1974) предложен простой и эконо-
мичный способ. Использованные пробирки со средами авто-
клавируют при 1,5 атм в течение 30 мин, затем по 250—
300 пробирок укладывают в бачки или эмалированные ведра
с плотной крышкой, заливают 4 % раствором едкого натра и
кипятят 2 ч. Во время кипячения остатки питательной среды
растворяются и образуется однородная жидкая мыльно-ще-
лочная смесь, способствующая освобождению пробирок от
плотных остатков среды. После 2 ч кипячения мыльно-щелоч-
ной раствор переливают в другое ведро для повторного ис-
пользования (раствор может быть использован 3—4 раза).
Прокипяченные отмытые пробирки несколько раз прополас-
кивают водопроводной водой и высушивают.
13
Посуду, используемую для приготовления и хранения пи-
тательных сред и культивирования микробов, нельзя обраба-
тывать дезинфицирующими веществами, так как даже следы
их делают питательную среду непригодной для размножения
микроорганизмов.
Мытье градуированных пипеток. Пипетки и другая граду-
ированная посуда, поступающие для работы, должны быть
абсолютно чистыми и хорошо обезжиренными. На стенках
плохо обезжиренной посуды при вливании жидкости остается
большое количество капель, вследствие чего слитый объем
жидкости не будет соответствовать той величине, которая ука-
зана на шкале деления.
Новые градуированные пипетки, не бывшие в употребле-
нии, моют следующим образом. С помощью резинового бал-
лончика, надетого па пипетку, насасывают в нее горячую
мыльную воду и погружают затем в сосуд с такой же водой.
Чтобы вода из пипеток не вытекала, уровень жидкости в со-
суде должен соответствовать высоте пипеток. Выдержав 20—
30 мин в мыльном растворе, пипетки прополаскивают водо-
проводной водой и переносят в 1—2% раствор хлористоводо-
родной кислоты, который постепенно доводят до кипения.
Далее пипетки обрабатывают так же, как и остальную стек-
лянную посуду.
Пипетки, бывшие в употреблении, тщательно протирают
тонкой упругой проволокой, на конец которой плотно накручи-
вают кусочек ваты или марли в виде сливы. Для того чтобы
загрязнения снимались быстрее и легче, пользуются горячей
мыльной водой, раствором питьевой соды или стирального
порошка.
Закупорившийся канал пипетки прочищают мандреном
от тонких игл шприцев. Промытые пипетки складывают
в таз, заливают теплым раствором горчицы или мыль-
ной водой и ставят на слабый огонь. После 20—30-минутного
кипячения пипетки вынимают и ополаскивают сначала теплой
проточной водой, а затем дистиллированной.
Сильно загрязненные пипетки также очищают вначале
ершом с мылом или содой, а затем погружают в хромовую
смесь, налитую в ванночку или банку, по высоте соответству-
ющую длине обрабатываемых пипеток. В хромовой смеси
пипетки выдерживают 20—30 мин, затем в течение несколь-
ких минут промывают проточной и дважды ополаскивают ди-
стиллированной водой.
Мытье предметных и покровных стекол. Предметные и по-
кровные стекла должны иметь абсолютно чистую поверхность
и быть хорошо обезжиренными. Капля воды, нанесенная на
обезжиренное стекло, растекается равномерно, а на плохо
обезжиренном стекле распадается на мелкие капельки. Пред-
метные и покровные стекла рекомендуется мыть и ополаски-
14
вать в резиновых перчатках, чтобы не загрязнять и^ жиром,
находящимся на поверхности кожи.
Стекла предметные и покровные, не бывшие в употребле-
нии, моют в теплой мыльной воде и после ополаскивания за-
ливают смесью Никифорова (см. с. 29). Если стекла, выну-
тые через 2—3 дня из смеси Никифорова, сохраняют следы
жира, их складывают в фарфоровую чашечку, заливают 2—
5% раствором гидрокарбоната натрия или едкого натра, ста-
вят на слабый огонь и кипятят, считая от момента закипания
воды, в течение 20—30 мин. После кипячения в щелочном
растворе стекла ополаскивают проточной водопроводной во-
дой, опускают на 10—15 мин в 5—10% раствор хлористово-
дородной кислоты и затем промывают проточной водой.
Предметные и покровные стекла, бывшие в употреблении,
загрязненные краской и иммерсионным маслом, обрабатыва-
ют следующим способом: 1) опускают на 2 ч в концентриро-
ванную серную кислоту или хромовую смесь, затем тщатель-
но промывают проточной водопроводной водой; 2) заливают
5% раствором гидрокарбоната натрия или щелочи (едкое ка-
ли или едкий натр), ставят на слабый огонь и кипятит в те-
чение 30—40 мин.
Силиконирование лабораторной посуды. Тщательно вымы-
тую и обезжиренную посуду высушивают и заливают на не-
сколько минут при комнатной температуре 3% раствором по-
лиметилсилоксановой жидкости (марка ПМС-200 или
ПМС-300) в хлороформе. При этом на поверхности стекла
образуется тончайшая оргапосиликоновая пленка с хороши-
ми гидрофобными и адгезивными свойствами. Жидкость мож-
но использовать многократно. Обработанную таким образом
посуду помещают на '2 ч в сушильный шкаф при температуре
180—210°С. После этого посуда готова к употреблению. Плен-
ка не смывается водой и не разрушается кислотами. Для ее
удаления посуду следует в течение 2 ч кипятить в 10% рас-
творе щелочи.
Сушка и хранение чистой лабораторной посуды. Высушен-
ную посуду просматривают на свет. Стекло ее должно быть
совершенно прозрачным, без матового налета и пятен.
Вымытую посуду не вытирают, а сушат при комнатной
температуре (холодная сушка) или горячим воздухом в су-
шильном шкафу при температуре 100—105°С.
Чисто вымытую и высушенную посуду, закрытую пробками
с бумажными колпачками или без них, хранят в местах, на-
дежно защищенных от пыли, лучше всего в плотно закрыва-
ющемся шкафу.
ДЕЗИНФЕКЦИЯ
Уничтожение патогенных микробов в объектах внешней
среды называется дезинфекцией.
1S
В микробиологических лабораториях дезинфекционные ме-
роприятия используются очень широко. Оканчивая работу с
заразным материалом, сотрудники бактериологических лабо-
раторий производят профилактическую дезинфекцию рук и
рабочего места.
Дезинфекции подвергают отработанный патологический
материал (кал, моча, мокрота, спинномозговая жидкость,
кровь) перед выбрасыванием его в’канализацию.
Загрязненные патологическим материалом или культурой
микробов градуированные и пастеровские пипетки, стеклян-
ные шпатели и металлические инструменты тотчас после их
употребления опускают в стеклянные банки с дезинфицирую-
щим раствором, находящиеся на столе у каждого рабочего
места.
Обязательной дезинфекции подлежат также использован-
ные в работе предметные и покровные стекла, так как даже
в фиксированном и окрашенном мазке иногда сохраняются
жизнеспособные микроорганизмы, которые могут явиться ис-
точником внутрилабораторного заражения. Не обрабатывает-
ся дезинфицирующими средствами только та посуда, в кото-
рой выращивались микроорганизмы. Ес складывают в метал-
лические бачки или биксы, пломбируют и сдают в стерилиза-
цию.
Выбор дезинфицирующего вещества, концентрация его
раствора, соотношение между количеством дезинфицирующе-
го вещества и обеззараживаемым материалом, а также про-
должительность срока дезинфекции устанавливаются в зави-
симости от конкретных условий, учитывающих в первую оче-
редь устойчивость обеззараживаемых микробов, степень пред-
полагаемого загрязнения, состав и консистенцию материала,
в котором они находятся.
Дезинфекция рук после работы с заразным материалом и
при попадании его на кожу. По окончании работы с заразным
материалом руки профилактически дезинфицируют. Ватный
шарик или марлевую салфетку смачивают 1 % раствором
хлорамина или 3% раствором лизола, протирают сначала
левую, затем правую кисть руки в такой последовательности:
тыл кисти, ладонная поверхность, межпальцевые пространст-
ва, ногтевые ложа. Таким образом, сначала обрабатывают
места, наименее загрязненные, затем переходят к участкам
кожи, загрязненным наиболее сильно. Протирают руки в те-
чение 2 мин двумя тампонами последовательно. При загряз-
нении рук культурой патогенного микроба или патологиче-
ским материалом в первую очередь дезинфицируют загряз-
ненные участки кожи. С этой целью их покрывают на
3—5 мин ватой, увлажненной 1% раствором хлорамина, за-
тем вату сбрасывают в бачок или ведро с отработанным ма-
териалом, а руки обрабатывают вторым тампоном так же,
16
как и при профилактической дезинфекции. (После обработки
хлорамином руки моют теплой водой с мылом. При работе
с бактериями, образующими споры, обработка рук произво-
дится 1% активированным хлорамином. При попадании на
руки заразного материала экспозицию дезинфицирующего ве-
щества увеличивают до б мин.
СТЕРИЛИЗАЦИЯ
Стерилизация в отличие от дезинфекции предусматривает
в стерилизуемом объекте уничтожение всех вегетатив-
ных и споровых, патогенных и непатогенных микроорганиз-
мов. Стерилизацию производят различными способами: па-
ром, сухим горячим воздухом, кипячением, фильтрацией
и т. д. .Выбор того или иного способа стерилизации опреде-
ляется качеством и свойствами микрофлоры стерилизуемого
объекта.
Подготовка и стерилизация лабораторной посуды. Перед
стерилизацией лабораторную посуду моют и сушат. Пробир-
ки, флаконы, бутыли, матрицы и колбы закрывают ватно-мар-
левыми пробками. Поверх пробок на каждый сосуд (кроме
пробирок) надевают бумажные колпачки.
Резиновые, корковые и стеклянные пробки стерилизуют
в отдельном пакете, привязанном к горлышку посуды.
Чашки Петри стерилизуют завернутыми в бумагу по 1 —
5 шт. Пастеровские пипетки по 3—15 шт. заворачивают в
плотную оберточную бумагу. В верхнюю часть каждой пипет-
ки вкладывают кусочек ваты, предупреждающий попадание
материала в рот. При завертывании пипеток нужно соблю-
дать большую осторожность, чтобы не обломать запаянные
концы капилляров. Во время работы пипетки из пакета вы-
нимают за верхний конец.
В верхнюю часть градуированных пипеток, как й в пасте-
ровские пипетки, вставляют предохранительную вату и затем
заворачивают в плотную бумагу, нарезанную предварительно
полосками шириной 2—2,5 см и длиной 50—70 см. Полоску
бумаги кладут на стол, левый конец ее загибают и заверты-
вают им кончик пипетки, затем, вращая пипетку, наверты-
вают на нее ленту бумаги. Для того чтобы бумага не разво-
рачивалась, противоположный конец ее закручивают или при-
клеивают. На бумаге надписывают объем завернутой пипет-
ки. При наличии пеналов градуированные пипетки стерили-
зуют в них.
Лабораторную посуду стерилизуют: а) сухим жаром при
температуре 150, 160 и 180°С соответственно 2 ч, 1 ч и
30 мин; б) в автоклаве при давлении 1 атм в течение 20—
30 мин^
Стерилизация шприцев. Шприцы стерилизуют в разобран-
ном виде: отдельно цилиндр и поршень в 2% растворе гидро-
2 Лабинская А. С.
17
карбоната натрия 30 мин. При работе со спороносной микро-
флорой стерилизацию производят в автоклаве при 132±2°С
(давл. 2 атм) в течение 20 мин, при 126±2°С (давл. 1,5 атм) —
30 мин.
Простерилизованный шприц собирают после того, как он
остынет, в цилиндр вставляют поршень, надевают иглу, пред-
варительно вынув из нее мандрен. Иглу, цилиндр и поршень
берут пинцетом, который стерилизуют вместе со шприцем.
Стерилизация металлических инструментов. Металличе-
ские инструменты (ножницы, скальпели, пинцеты и пр.) сте-
рилизуют в 2% растворе гидрокарбоната натрия, который
предупреждает появление ржавчины и потерю остроты. Лез-
вия скальпелей и ножниц перед погружением в воду рекомен-
дуется обертывать ватой.
Стерилизация бактериальных петель. Бактериальные пет-
ли, сделанные из платиновой или нихромовой проволоки, сте-
рилизуют в пламени спиртовой или газовой горелки. Такой
способ стерилизации получил название прокаливания или
фламбирования.
Петлю в горизонтальном положении вносят в нижнюю,,
наиболее холодную, часть пламени горелки, чтобы не про-
изошло разбрызгивания сжигаемого патогенного материала.
После того как он сгорит, петлю переводят в вертикальное
положение, накаливают докрасна вначале нижнюю, затем
верхнюю часть проволоки и прожигают петледержатель. Про-
каливание в целом занимает 5—7 с.
Подготовка к стерилизации и стерилизация бумаги, марли
и ваты. Вату, марлю, фильтровальную бумагу стерилизуют
в сухожаровой печи при температуре 160°С в течение часа от
момента показания термометром данной температуры или в
автоклаве при давлении 1 атм в течение 30 мин.
Перед стерилизацией бумагу и марлю нарезают кусочка-
ми, а вату сворачивают в виде шариков или тампонов нуж-
ной величины. После этого каждый вид материала в отдель-
ности по одной или несколько штук заворачивают в плотную
бумагу. При разрыве пакета простерилизованный материал
следует стерилизовать повторно, так как стерильность его
нарушается.
Стерилизация перчаток и других резиновых изделий. Из-
делия из резины (перчатки, трубки и т. д.), загрязненные ве-
гетативной формой микробов, стерилизуют кипячением в 2%
растворе гидрокарбоната натрия или текучим паром в те-
чение 30 мин; при загрязнении спороносной микрофло-
рой— в автоклаве при давлении 1,5—2 атм в течение 30 или
20 мин.
Резиновые перчатки перед стерилизацией внутри и сна-
ружи пересыпают тальком для предохранения их от склеива-
ния. Между перчатками прокладывают марлю. Каждую пару
18
перчаток завертывают отдельно в марлю и в таком виде по-
мешают в биксы.
Стерилизация патогенных культур микробов. Пробирки и
чашки4, содержащие культуры микробов, не нужные для даль-
нейшей работы, складывают в металлический бак, пломбиру-
ют крышку и сдают на стерилизацию. Культуры патогенных
микробов убивают в автоклаве в течение 30 мин при давле-
нии 1 атм. Вегетативные формы микробных культур разреша-
ется уничтожать кипячением. Стерилизуемый материал зали-
вают холодной водой (лучше 2—5% щелочным раствором) и
ставят на огонь, предварительно запломбировав крышку
бака. Крышка должна иметь несколько маленьких отверстий
для выхода пара. Культуры микробов кипятят Р/2—2 ч с мо-
мента закипания воды.
Сдача баков для стерилизации в автоклавную производит-
ся специально выделенным лицом под расписку. Режим сте-
рилизации регистрируется в специальном журнале.
При уничтожении культур микробов I и II групп, а также
материала, зараженного или подозрительного на заражен-
ность возбудителями, отнесенными к этим группам, баки с от-
работанным материалом переносят на металлических под-
носах с высокими бортами в присутствии сопровождающего
лица, допущенного к работе с заразным материалом.
ВИДЫ СТЕРИЛИЗАЦИИ
Стерилизация кипячением. Стерилизацию кипячением про-
изводят в стерилизаторе. В стерилизатор наливают дистилли-
рованную воду, так как водопроводная образует накипь.
Стеклянные предметы погружают в холодную, металлические
предметы—в горячую воду с добавлением гидрокарбоната
натрия. Стерилизуемые предметы кипятят на слабом огне.
Началом стерилизации считается момент закипания воды в
стерилизаторе. По окончании кипячения инструменты берут
стерильным пинцетом, который кипятят вместе с остальными
предметами.
2
1»
Стерилизация сухим жаром. Стерилизация сухим жаром
производится в печи Пастера. Подготовленный к стерилиза-
ции материал кладут на полки так, чтобы он не соприкасался
со стенками. Шкаф закрывают и после этого включают обо-
грев. Продолжительность стерилизации при температуре
150°С 2 ч, при 165°С—1 ч, при 180°С — 40 мин, при
200°С —10—15 мин (при 170°С бумага и вата желтеют,
а при более высокой температуре обугливаются).
Началом стерилизации считается тот момент, когда тем-
пература в печи достигнет нужной высоты. По окончании сро-
ка стерилизации печь выключают, но дверцы шкафа не от-
крывают до полного охлаждения, так как холодный воздух,
поступающий внутрь шкафа, может вызвать образование тре-
щин на горячей посуде.
Стерилизация паром под давлением. Стерилизацию паром
под давлением производят в автоклаве. Автоклав состоит из
двух котлов, вставленных один в другой, кожуха и крышки.
Наружный котел называют водопаровой камерой, внутрен-
ний— стерилизационной камерой. В водопаровом котле про-
исходит образование пара. Во внутренний котел помещают
стерилизуемый материал. В верхней части стерилизационного
котла имеются небольшие отверстия, через которые прохо-
дит пар из водопаровой камеры. Крышка автоклава гермети-
чески привинчивается к кожуху.
Кроме перечисленных основных частей, автоклав имеет
ряд деталей, регулирующих его работу: манометр, водомер-
ное стекло, предохранительный клапан, выпускной, воздуш-
ный и конденсационный краны. Манометр служит для опре-
Таблица 2
Соотношения показаний
манометра и температуры
кипения воды
Показания манометра, атм Температура ки- , пения воды по Цельсию
0 100э
0,2 105°
0,4 110°
0,5 112°
0,6 114°
0,7 116°
0,8 117°
0,9 1193
1 121°
1,5 127°
2 134°
деления давления, создающегося
в стерилизованной камере. Нор-
мальное атмосферное давление
(760 мм рт. ст.) принимается за
нуль, поэтому в неработающем
автоклаве стрелка манометра
стоит на нуле. Между показания-
ми манометра и температурой
имеется определенная зависи-
мость (табл. 2).
Красная черта на шкале ма-
нометра определяет максималь-
ное рабочее давление, которое
допускается в автоклаве. Пре-
дохранительный клапан служит
для предохранения от чрезмерно-
го повышения давления. Его уста-
навливают на заданное давление,
т. е. давление, при котором нуж-
но производить стерилизацию,
20
при переходе стрелки манометра за черту клапан автоклава
автоматически открывается и выпускает лишний пар, замед-
ляя тем самым дальнейший подъем давления.
На боковой стенке автоклава имеется водомерное стекло,
показывающее уровень воды в водопаровом котле. На трубке
водомерного стекла нанесены две горизонтальные черты —
нижняя и верхняя, обозначающие соответственно допускае-
мый нижний и верхний уровень воды в водопаровой ка-
мере.
Воздушный кран предназначен для удаления воздуха из
стерилизационной и водопаровой камер в начале стерилиза-
ции, так как воздух, являясь плохим проводником тепла, на-
рушает режим стерилизации. На дне автоклава находится
конденсационный кран для освобождения стерилизационной
камеры от конденсата, образующегося в период нагревания
стерилизуемого материала.
Правила работы с автоклавом. Перед нача-
лом работы осматривают автоклав и контрольно-измеритель-
ную аппаратуру.
В автоклавах с автоматическим регулированием пара на
электровакуумном манометре водопаровой камеры стрелки
устанавливают в соответствии с режимом стерилизации: ниж-
нюю стрелку ставят на 0,1 атм ниже, верхнюю — на 0,1 атм
выше рабочего давления.
Водопаровую камеру заполняют водой до верхней отметки
водомерного стекла. В период заполнения водой вентиль на
трубе, по которой пар поступает в камеру, держат открытым
для свободного выхода воздуха из котла.
Стерилизационную камеру автоклава загружают стери-
лизуемым материалом. После этого крышку (или дверь) ав-
токлава закрывают, закрепляя плотно центральным затвором
или болтами; чтобы избежать перекоса болты завинчивают
крест-накрест (по диаметру). Затем включают источник по-
догрева (электрический ток, пар), закрывая вентиль на тру-
бе, соединяющей источник пара со стерилизационной каме-
рой. С началом парообразования и создания давления в во-
допаровой камере производят продувку (удаление воздуха
из стерилизационного котла). Способ удаления воздуха опре-
деляется конструкцией автоклава. Вначале воздух выходит
отдельными порциями, затем появляется ровная непрерывная
струя пара, указывающая, что из стерилизационной камеры
воздух полностью вытеснен. После удаления воздуха кран
закрывают и в стерилизационной камере начинается посте-
пенное повышение давления.
Началом стерилизации считается тот момент, когда стрел-
ка манометра показывает заданное давление. После этого
интенсивность подогрева уменьшают, чтобы давление в авто-
клаве в течение нужного времени оставалось на одном уровне.
21
По окончании времени стерилизации подогревание пре-
кращают. Закрывают вентиль в трубопроводе, подающем пар
в стерилизационную камеру, и открывают вентиль на конден-
сационной (нисходящей) трубе для снижения давления пара
в камере. После падения стрелки манометра до нуля медлен-
но ослабляют прижимные приспособления и открывают крыш-
ку (дверь) автоклава.
Температура и продолжительность стерилизации опреде-
ляются качеством стерилизуемого материала и свойствами
тех микроорганизмов, которыми он заражен.
Контроль температуры в стерилизационной камере осуще-
ствляется периодически с помощью бактериологических тес-
тов. Биотесты изготовляются бактериологическими лабора-
ториями СЭС или лабораториями дезинфицирующих станций
из образцов почвы, содержащей споры сапрофитов, выдержи-
вающей в течение 3—5 мин воздействие пара с температурой
120°С. Не менее трех образцов почвы, завернутых в пергамент-
ную, а затем фильтровальную бумагу, вместе с максималь-
ным термометром закладывают в коробки со стерилизуемым
материалом. Вне коробок в верхнюю и нижнюю части стери-
лизационной камеры кладут еще две биопробы.
По окончании работы автоклава пробы земли вместе с
контрольными (непрогретыми)' образцами направляют в бак-
териологическую лабораторию СЭС па исследование. При
соблюдении правил асептики каждую пробу засевают в 20 мл
питательных сред (мясо-пептонный сахарный бульон и полу-
жидкий мясо-пептонный агар). При посеве наружную обертку
развертывают, стерильными ножницами срезают угол пакета
и содержащуюся в нем землю высыпают над пламенем горел-
ки в пробирки с питательными средами. Посевы инкубируют
в термостате 7 сут при 37°С.
При появлении микробного роста из первичного посева
производят высев па мясо-пептонный агар для выявления спо-
ровой микрофлоры. Рост вегетативных форм (сарцины, кок-
ки) расценивается как загрязнение питательной среды в мо-
мент посева вследствие нарушения правил асептики. При
наличии в питательных средах роста спорообразующих мик-
роорганизмов бактериологический контроль повторяют и
производят проверку технического состояния автоклава.
Стерилизация текучим паром. Стерилизация текучим па-
ром производится в текучепаровом аппарате Коха или в авто-
клаве при незавинченной крышке и открытом выпускном кра-
не. Аппарат Коха представляет собой металлический полый
цилиндр с двойным дном. Пространство между верхней и
нижней пластинками дна заполняют на 2/з водой (для спуска
оставшейся после стерилизации воды есть кран). Крышка
аппарата имеет в це нтре отверстие для термометра и несколь-
ко небольших отверстий для выхода пара.
22
Стерилизуемый материал загружают в камеру аппарата
неплотно, чтобы обеспечить возможность наибольшего кон-
такта его с паром. Началом стерилизации считается время
с момента закипания воды и поступления пара в стерилиза-
ционную камеру. В текучепаровом аппарате стерилизуют
главным образом питательные среды, свойства которых из-
меняются при температуре выше 100°С.
Стерилизацию текучим паром следует проводить повтор-
но, так как однократное прогревание при температуре 100°С
не обеспечивает полного обеспложивания. Такой метод полу-
чил название дробной стерилизации: обработку сте-
рилизуемого материала текучим паром проводят по 30 мин
ежедневно в течение 3 дней. В промежутках между стери-
лизациями материал выдерживают при комнатной темпера-
туре для прорастания спор в вегетативные формы, которые
погибают при последующих прогреваниях.
Тиндализация. Тиндализация — дробная стерилизация с применением
температуры ниже 100°С, предложенная Тиндалем. Прогревание стерили-
зуемого материала производят в водяной бане, снабженной терморегуля-
тором, по часу при температуре 60—65°С в течение 5 дней или при 70—
80°С в течение 3 дней. В промежутках между прогреваниями обрабатывае-
мый материал выдерживают при температуре 25°С для прорастания
спор в вегетативные формы, которые погибают при последующих прогрева-
ниях. Тиидализацией пользуются для обеспложивания питательных сред,
содержащих белок.
Механическая стерилизация с помощью бактериальных
ультрафильтров. Бактериальные фильтры применяют для
освобождения жидкости от находящихся в пей бактерий,
а также для отделения бактерий от вирусов, фагов и экзоток-
синов. Вирусы бактериальными фильтрами не задерживаются,
и поэтому ультрафильтрацию нельзя рассматривать как сте-
рилизацию в принятом значении этого слова.
Для изготовления ультрафильтров применяют мелкопори-
стые материалы (каолин, асбест, нитроцеллюлоза и Др.), спо-
собные задерживать бактерий.
Асбестовые фильтры (фильтры Зейтца).
Фильтры Зейтца представляют собой асбестовые пластинки
толщиной 3—5 мм и диаметром 35 и 140 мм для фильтрации
малых и больших объемов жидкости. В СССР асбестовые
фильтры изготовляют двух марок: «Ф» (фильтрующие), за-
держивающие взвешенные частицы, но пропускающие бакте-
рий, и «СФ» (стерилизующие), более плотные, задерживаю-
щие бактерий.
Перед употреблением асбестовые фильтры монтируют в
фильтровальные аппараты и вместе с ними стерилизуют в ав-
токлаве. Асбестовые фильтры используются однократно.
Мембранные ультрафильтры. Мембранные
ультрафильтры из органического вещества нитроклетчатки
23
Рис. 1. Прибор Зейтца с во-
ронкой.
представляют собой диски белого
цвета диаметром 35 мм и толщиной
0,1 мм.
Бактериальные фильтры разли-
чаются по величине пор и обозна-
чаются порядковыми номерами
(табл. 3).
Непосредственно перед употреб-
лением мембранные фильтры сте-
рилизуют кипячением. Фильтры по-
мещают в дистиллированную воду,
подогретую до температуры 50—
50°С, чтобы предупредить их скру-
чивание, кипятят на слабом огне
в течение 30 мин, меняя 2—3 раза
воду. Простерилизованные фильтры
во избежание их повреждения вы-
нимают из стерилизатора фламби-
рованным и остуженным пинцетом
с гладкими кончиками.
Асбестовые и мембранные фильт-
ры для фильтрации жидкостей
монтируют в специальные фильтро-
вальные приборы: Зейтца или Руб-
левской водопроводной станции
(рис. 1). Каждый из указанных выше приборов состоит из
двух частей: верхней, имеющей форму цилиндра или воронки,
и нижней—опорной части аппарата, с так называемым
фильтровальным столиком из металлической сетки или
пористой керамической пластинки, на которую помещают
мембранный или асбестовый фильтр. Опорная часть аппара-
та имеет форму воронки, суживающаяся часть которой
укрепляется в резиновой пробке горлышка колбы Бунзена.
В рабочем состоянии верхнюю часть прибора фиксируют на
нижней с помощью винтов (в приборе Зейтца) или специ-
ального металлического кольца
с двумя пазами, надетого на
шейку воронки (в приборе Руб-
левской водопроводной станции).
Перед началом фильтрации
места соединения различных'
частей установки для создания
герметичности заливают парафи-
ном. Отводную трубку колбы
присоединяют толстостенной ре-
зиновой трубкой к ^водоструйно-
му, масляному или велосипед-
ному насосу. После этого в ци-
Таблица 3
Бактериальные фильтры
№ фильтра Средний диаметр пор, мкм
1 0,3
2 0,5
3 0,7
4 0,9
5 1,2
24
линдр или воронку аппарата наливают фильтруемую жид-
кость и включают в действие насос, создающий вакуум в
приемном сосуде.
В результате образующейся разности давлений фильтруе-
мая жидкость проходит через поры фильтра в приемник.
Микробы остаются на поверхности фильтра.
МИКРОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Микроскопический метод исследования предусматривает
наблюдение за живыми и убитыми микробами в окрашенном
и неокрашенном состоянии.
Различают простые и сложные способы окраски.
Первые основаны на применении какой-либо одной краски,
например метиленового синего или фуксина. Вторые преду-
сматривают воздействие на один и тот же препарат двух
красок. Сложные методы окраски позволяют обнаруживать
в теле микробной клетки различные структурные элементы
(капсулы, споры, включения), помогают дифференцировать
сходные по величине и форме бактерии, принадлежащие к
различным видам.
МИКРОСКОПИЯ МИКРООРГАНИЗМОВ в живом состоянии
Для изучения формы и выявления подвижности бактерии
изучают в живом состоянии в препаратах раздавленной или
висячей капли.
Раздавленная капля. На предметное стекло нано-
сят каплю бульонной культуры. При обильном росте микро-
бов культуру предварительно разводят стерильным изотони-
ческим раствором хлорида натрия (рец. 20, с. 347). Нанесен-
ную на предметное стекло каплю раздавливают. Для этого
покровное стекло ставят на ребро у края капли и опускают,
постепенно вытесняя воздух, находящийся между предмет-
ным и покровным стеклами, чтобы избежать образования в
ней пузырьков воздуха. В правильно приготовленном препа-
рате раздавленной капли стекла плотно склеиваются и жид-
кость тончайшим слоем заполняет пространство между ними,
не выступая за края покровного стекла.
Висячая капля (рис. 2). На середину необезжирен-
ного покровного стекла наносят небольшую, с четкими края-
ми каплю бульонной культуры. Каплю материала покрывают
предметным стеклом с лункой, края которой предварительно
смазывают вазелином. Предметное стекло с прилипшим к
нему покровным стеклом перевертывают. Капля оказывается
висячей в герметически закрытой влажной камере, из кото-
рой жидкость испаряется очень медленно и поэтому препа-
рат долгое время остается пригодным для наблюдения.
25
Рис. 2. Препарат висячей капли.
Висячую каплю микроскопируют с плоским зеркалом и
суженной диафрагмой. При малом увеличении (8Х) на-
ходят край капли, отчетливо видный в затемненном поле зре-
ния. По одну сторону линии (края) видно множество мель-
чайших капелек конденсата, осевших на внутренней поверх-
ности покровного стекла, по другую сторону линии фон рав-
номерно серого цвета — искомая капля. Найденный край
капли устанавливают в центре поля зрения микроскопа при
малом увеличении и, не сдвигая препарата, переходят на бо-
лее сильную (40 X) или иммерсионную систему, слегка рас-
ширив диафрагму микроскопа.
Подвижные бактерии проходят с одинаковой скоростью
большие пространства, иногда через все поле зрения микро-
скопа, вращаясь вокруг своей оси.
Живые микробы, находящиеся в препарате раздавленной
капли, можно изучать и в темном поле зрения. При
этом методе микроскопирования толщина предметных стекол
не должна превышать 1,2 мм, покровных — 0,2 мм. Принцип
исследования микробов в темном поле зрения заключается
в том, что в объектив и, следовательно, в глаз наблюдателя
попадают не прямые лучи света, а отраженные исследуемым
объектом. Вследствие этого неосвещенное поле зрения оста-
ется совершенно темным, а микробные тела, отражающие лу-
чи света, освещены очень ярко.
Для создания темного поля конденсор Аббе заменяют
темпопольным конденсором, имеющим затемнение централь-
ной части. При отсутствии специального берут обычный кон-
денсор Аббе, развинчивают и вкладывают между его линза-
ми кружок черной фотобумаги так, чтобы незначительная
периферическая часть линзы оставалась свободной.
При микроскопировании препаратов в темном поле зре-
ния на верхнюю поверхность конденсора наносят каплю кед-
рового или вазелинового масла, поверх которой очень осто-
рожно, чтобы пе образовалось пузырьков воздуха, наклады-
26
вают препарат. На покровное стекло наносится вторая капля
масла. Наносить масло на обе поверхности препарата не-
обходимо для того, чтобы при микроскопировании с иммер-
сионной системой проходящие лучи света не преломлялись.
МИКРОСКОПИЯ МИКРООРГАНИЗМОВ В ОКРАШЕННОМ ВИДЕ
Для изучения микроорганизмов в окрашенном виде на
предметном стекле делают мазок, высушивают, фиксируют
его и после этого окрашивают.
Приготовление мазков. Исследуемый материал распределя-
ют тонким слоем по поверхности предметного хорошо обез-
жиренного стекла.
Мазки готовят из культур микробов, патологического ма-
териала (мокрота, гиой, моча, кровь и др.) и из органов
трупов. .
Техника приготовления мазков определяется характером
исследуемого материала.
1. Приготовление мазков из микробных
культур с жидкой питательной среды и из жид-
кого патологического материала (моча, лик-
вор и др.). Маленькую каплю исследуемой жидкости на-
носят бактериальной петлей на предметное стекло и круго-
выми движениями петли распределяют равномерным слоем
в виде кружка диаметром в копеечную монету.
2. Приготовление мазков из крови. На пред-
метное стекло, ближе к одному из его концов, наносят кап-
лю крови. Второе — шлифованное — стекло, которое должно
быть уже предметного, ставят на первое под углом 45° и
подводят к капле крови до соприкосновения с ней. После
того как кровь растечется по шлифованному краю, стеклом
делают скользящее движение справа налево, равномерно рас-
пределяя кровь тонким слоем по всей поверхности стекла
(рис. 3). Толщин-a мазка зависит от величины угла между
стеклами: чем острее угол, тем тоньше мазок. Правильно-
приготовленный мазок имеет светло-розовую окраску и оди-
наковую толщину на всем протяжении.
3. Приготовление толстой капли. На середину
предметного стекла пастеровской пипеткой наносят каплю
крови или прикладывают стекло непосредственно к капле
крови, выступающей из пальца. Нанесенную на стекло кровь
размазывают бактериальной петлей так, чтобы диаметр об-
разующегося мазка соответствовал величине копеечной мо-
неты. Стекло оставляют в горизонтальном положении до под-
сыхания крови. Кровь в «толстой капле» распределяется не-
равномерно, образуя неровный край.
4. Приготовление мазка из вязкого мате-
риала (мокрота, гной). Мокроту или гной, нанесенные
27
Рис. 3. Приготовление мазков из крови.
на предметное стекло ближе к узкому краю, накрывают дру-
гим предметным стеклом. Стекла слегка придавливают друг
к другу. .
После этого свободные концы стекол захватывают I и
II пальцами обеих рук и разводят в противоположные
стороны так, чтобы при движении оба стекла плотно приле-
гали друг к другу. Получаются мазки с равномерно распре-
деленным материалом, занимающим большую часть.
5. Приготовление мазка из культур с плот-
ных питательных сред. На середину чистого, хорошо
обезжиренного стекла наносят каплю водопроводной воды,
в нее вносят бактериальную петлю с небольшим количеством
исследуемой микробной культуры так, чтобы капля жидко-
сти стала слегка мутноватой. После этого излишек микроб-
ного материала на петле сжигают в пламени горелки и при-
ступают к приготовлению мазка по описанному выше спо-
собу (1).
6. П р и готов л е н и е мазков из органов и тка-
ней. Поверхность органа с целью обеззараживания прижи-
гают накаленными браншами пинцета, делают по этому ме-
сту надрез и из глубины остроконечными ножницами выре-
зают небольшой кусочек ткани, который помещают между
двумя предметными стеклами. Далее поступают так же, как
при приготовлении мазка из гноя и мокроты. Если ткань ор-
гана плотная, то из глубины разреза делают скальпелем со-
скоб. Полученный при соскабливании материал распределя-
ют тонким слоем по поверхности стекла скальпелем или бак-
териальной петлей.
Для изучения взаимного расположения элементов ткани
и находящихся в ней микроорганизмов делают мазки-отпе-
чатки. Для этого вырезанный из середины органа небольшой
кусочек ткани захватывают пинцетом и прикладывают по-
верхностью среза к предметному стеклу несколько раз по-
следовательно, получая таким образом ряд мазков-отпе-
чатков.
Высушивание и фиксирование мазков. Приготовленный на
предметном стекле мазок высушивают на воздухе и после
полного высыхания фиксируют. При фиксировании мазок
закрепляется на поверхности предметного стекла, и поэтому
при последующей окраске препарата микробные клетки не
28
смываются. Кроме того, убитые микробные клетки окраши-
ваются лучше, чем живые.
Различают физический способ фиксации, в основу которо-
го положено воздействие высокой температуры на микробную
клетку, и химические способы, предусматривающие примене-
ние химических средств, вызывающих коагуляцию белков
цитоплазмы.
Физический способ фиксации. Предметное стек-
ло с препаратом берут пинцетом или I и II пальцами правой
руки за ребра мазком кверху и плавным движением прово-
дят 2—3 раза над верхней частью пламени горелки. Весь
процесс фиксации должен занимать не более 2 с. Надеж-
ность фиксации Цроверяют следующим простым приемом:
свободную от мазка поверхность предметного стекла прикла-
дывают к тыльной поверхности левой кисти. При правиль-
ном фиксировании мазка стекло должно быть горячим, но не
вызывать ощущения ожога.
Химический способ фиксации. Для фиксации
мазков применяют также химические вещества и соединения
(табл. 4).
Таблица 4
Вещества для химической фиксации
Фиксирующее вещество
Время
фиксации,
мин
Безводный метиловый спирт
Этиловый (винный) спирт 96%
Жидкость Никифорова (смесь спирта и нар-
козного эфира в соотношении 1:1)
Жидкость Карнуа (спирта 96% 60 мл, хло-
роформа 30 мл, уксусной кислоты ледя-
ной 10 мл)
5 ,
10—15
10—15
10—15
Предметное стекло с высушенным мазком погружают в
склянку с фиксирующим веществом и затем высушивают на
воздухе.
Техника окраски мазков. Для окраски мазков пользуются
растворами красок или красящей бумагой, предложенной
А. И. Синевым. Простота приготовления, удобство примене-
ния, а также возможность хранения красящих бумаг в тече-
ние неограниченно долгого времени явились основанием для
широкого их использования при различных способах окраски.
Рецепты приготовления красок и реактивов, применяемых
при окраске бактериальных препаратов, даны в приложении
(с. 341).
29
Окраска мазков красящей бумагой. На высу-
шенный и фиксированный препарат наносят несколько ка-
пель воды, кладут окрашенные бумажки величиной 2X2 см.
В течение всего времени прокрашивания бумага должна
оставаться влажной и плотно прилегать к поверхности стекла.
При подсыхании бумагу дополнительно смачивают водой.
Продолжительность окрашивания мазка определяется мето-
дом окраски. По окончании окраски бумагу осторожно сни-
мают пинцетом, а мазок промывают водопроводной водой
и подсушивают на воздухе или фильтровальной бумагой.
Окраска мазков растворами красителей. На
высушенный и фиксированный препарат пипеткой наносят
краситель в таком количестве, чтобы он покрывал весь ма-
зок. При окраске мазков концентрированными растворами
красителей (карболовый фуксин Циля, карболовый генциа-
новый или кристаллический фиолетовый) окрашивание произ-
водят через фильтровальную бумагу, задерживающую части-
цы красителя: на фиксированный мазок кладут полоску
фильтровальной бумаги и на нее наливают раствор краси-
теля.
Простая окраска
При простых способах окраски применяется какой-нибудь
один краситель: метиленовый синий или водно-спиртовой рас-
твор фуксина. Последним красят 1—2 мин, метиленовым си-
ним — 3—5 мин. Окрашенные препараты промывают водо-
проводной водой, подсушивают и микроскопируют с иммер-
сионной системой.
Простыми способами окраски пользуются для обнаруже-
- ния в микроскопируемом материале микробов, определения
их количества, формы и расположения. Препараты, содержа-
щие, кроме бактерий, тканевые и клеточные элементы, кра-
сят метиленовым синим, который окрашивает фон препарата
значительно слабее, чем тела микробных клеток.
Сложные дифференциальные методы окраски
При сложных способах окраски на мазок воздействуют
двумя красящими веществами, из которых один является ос-
новным, а другой—дополнительным. Кроме красящих ве-
ществ, при сложных способах окраски применяют различные
обесцвечивающие вещества: спирт, кислоты и т. д.
Окраска по методу Грама. Особенностью окраски по Гра-
му является неодинаковое отношение различных микробов
к красителям трифенилметановой группы: генциановому, ме-
тиловому или кристаллическому фиолетовому. Микробы, вхо-
дящие в группу грамположительных, например стафилокок-
ки, стрептококки, дают прочное соединение с указанными
30
красителями и йодом. Окрашенные микробы не обесцвечива-
ются при воздействии на них спиртом, вследствие чего при
дополнительной окраске фуксином грамположительные мик-
робы не изменяют первоначально принятый фиолетовый цвет.
Грамотрицательные микроорганизмы (гонококки, менинго-
кокки, возбудители кишечных заболеваний и др.) образуют
с генциановым кристаллическим или метиловым фиолетовым
и йодом легко разрушающееся под действием спирта соеди-
нение, в результате чего они обесцвечиваются и затем окра-
шиваются фуксином, приобретая красный цвет.
Отношение микроорганизмов к окрашиванию по Граму
имеет большое диагностическое значение.
Методика окраски. 1. Мазок, фиксированный на
огне, окрашивают через фильтровальную бумагу основным
красителем — раствором основного карболового кристалли-
ческого фиолетового (рец. 3, с. 342). Прокрашивание длится
1—2 мин.
2. Снимают бумагу, сливают избыток красителя и, не про-
мывая препарата водой, наливают раствор Люголя (рец. 21,
с. 347) на 1—2 мин до почернения препарата.
3. Раствор Люголя сливают. Предметное стекло для обес-
цвечивания мазка погружают несколько раз в стаканчик сэ
спиртом, процесс обесцвечивания считается завершенным,
когда от мазка перестают отделяться окрашенные в фиоле-
товый цвет струйки жидкости.
4. Препарат тщательно промывают водопроводной водой.
5. Докрашивают спирто-водным раствором фуксина
(рец, 7, с. 343) 2 мин.
Результаты, окраски. Грамположительные бактерии окра-
шиваются основным красителем в темно-фиолетовый цвет,
грамотрицательные бактерии, воспринимая дополнительную
окраску, приобретают ярко-малиновый цвет.
В настоящее время более широкое применение в практи-
ке бактериологических исследований находит видоизменен-
ный способ окраски Грама по Синеву.
Основной краситель в виде раствора заменяют фильтро-
вальной бумагой, пропитанной 1% спиртовым раствором
кристаллического фиолетового (см. технику приготовления
красящей бумаги по Синеву, с. 345). На препарат помещают
красящую бумажку и наносят на нее 2—3 капли воды. Окра-
шивание идет в течение 1—2 мин. Затем бумажки снимают
и дальнейшую окраску препарата ведут общепринятым спо-
собом.
Окраска кислотоустойчивых бактерий. Кислотоустойчивыми
называют тех микробов, которые, будучи окрашены карболо-
вым фуксином, не обесцвечиваются под действием концентри-
рованных минеральных кислот. Особенностью микробов этой
группы является то, что они плохо воспринимают окраску.
31
Для того чтобы окрасить кислотоустойчивые микроорганиз-
мы, приходится применять более концентрированные раство-
ры красителя в подогретом состоянии с протравами и удли-
ненным сроком окраски.
К кислотоустойчивым патогенным микробам относятся
возбудители туберкулеза (см. рис. 29) и проказы.
Методика окраски. 1. Фиксированный на пламени
горелки мазок окрашивают в течение 3—5 мин раствором
карболового фуксина Циля или окрашенной фуксином бу-
мажкой с подогреванием до появления паров, но не доводя
краситель до кипения.
2. Дают препарату остыть, бумажку снимают, сливают
избыток красителя, препарат промывают водой.
3. Окрашенный препарат обесцвечивают 5% серной кис-
лотой в течение 3—5 с или 95% этиловым спиртом, содержа-
щим 3% по объему хлористоводородной кислоты, несколько
раз погружая стекло в стаканчик с раствором.
,4. После обесцвечивания остаток кислоты сливают й пре-
парат тщательно промывают водой.
5. Докрашивают дополнительно метиленовым синим Леф-
флера 3—5 мин.
6. Окрашенный препарат промывают водой, подсушивают
и микроскопируют.
При окраске препаратов по методу Циля — Нильсена кис-
лотоустойчивые бактерии окрашиваются фуксином в рубино-
во-красный цвет и не обесцвечиваются кислотой.
Некислотоустойчивые бактерии, а также элементы ткани
и лейкоциты под действием кислоты становятся бесцветными
и приобретают цвет дополнительного красителя.
Окраска по Романовскому — Гимзе. Краситель Романов-
ского—Гимзы состоит из смеси азура, эозина и метиленово-
го синего. Непосредственно перед употреблением к 10 мл ди-
стиллированной воды (pH 7,0—7,2) прибавляют 10 капель
имеющегося в продаже красителя Романовского — Гимзы.
Приготовленный раствор красителя тотчас наливают на фик-
сированный мазок или предметное стекло с окрашиваемым
препаратом погружают в стаканчик с красителем. Через час
краситель сливают, препарат промывают водой и высушива-
ют на воздухе.
Краситель Романовского — Гимзы, имеющий в растворе
сине-фиолетовый цвет, окрашивает цитоплазму форменных
элементов ткани в голубовато-синий цвет, а ядра клеток,
так же как и микробные тела, в фиолетово-красный (см.
рис. 30).
Окраска спор микробов. Споры имеют вид круглых или
овальной формы образований, находящихся в теле микроб-
ной клетки. Различают три вида расположения спор по отно-
шению к длинной оси палочки: центральное — спора находит-
32
ся в центре тела микроба, субтерминальное — спора располо-
жена ближе к одному из ее концов, терминальное — спора
располагается на конце палочки. Диаметр споры может не
превышать диаметр тела микробной клетки, вследствие чего
форма палочки при спорообразовании не изменяется. В дру-
гих случаях диаметр споры больше поперечного размера
микробной клетки и тело ее в месте образования споры утол-
щается.
Форма, величина и расположение спор постоянны для
каждого вида бацилл.
Плотная оболочка спор, непроницаемая для воды, окра-
шивается с большим трудом, поэтому при обычных методах
окраски споры имеют вид неокрашенных пустот внутри клет-
ки. Для окраски спор пользуются специальными методами
с применением протрав (кислоты или щелочи). Протравы
разрыхляют оболочку споры, облегчая проникновение в нее
красителя. Окрасившиеся споры обладают кислотоустойчи-
востью в отличие от вегетативного тела микробной клетки,
обесцвечивающегося под действием кислоты. Поэтому прин-
цип окраски спор и кислотоустойчивых бактерий одинаков:
препарат окрашивают основным красителем, затем обесцве-
чивают кислотой и докрашивают дополнительно в какой-ни-
будь контрастный цвет.
Окраска спор методом Ожешко. 1. На высу-
шенный нефиксированный препарат (мазок готовится тол-
стым и на краю стекла) наливают несколько капель 0,5%
раствора хлористоводородной кислоты и подогревают 1 —
2 мин над пламенем горелки до закипания, после чего остат-
ки кислоты сливают.
2. Остывший препарат промывают водой, подсушивают и
фиксируют на пламени горелки.
3. Окрашивают карболовым фуксином Циля (рец. 6,
с. 343) с подогреванием до появления паров.
4. Обесцвечивают 5% раствором серной кислоты в течение
нескольких секунд.
5. Промывают водой.
6. Докрашивают метиленовым синим (рец. 9, с. 343) или
1% водным раствором малахитового зеленого (рец. 16)
3—5 мин.
Споры, окрашенные фуксином, имеют рубиново-красный
цвет, вегетативные тела микробных клеток при докрашива-
нии синькой Леффлера — синий цвет, при применении мала-
хитового зеленого — зеленый цвет.
Способы выявления и окраски каг^ул микробов. Некото-
рые виды бактерий продуцируют слизистое вещество, кото-
рое, концентрируясь вокруг тела микробной клетки, образует
капсулу. При обычных методах окраски капсулы остаются
бесцветными. Это позволяет применять простые методы окра-
3 Лабинсжая А. С. 33.
ски для выявления капсульных микроорганизмов в мазках
из органов и тканевой жидкости.
Для выявления капсул применяют специальные способы
окраски.
Выявление капсул по способу Б у р р и. На уз-
кий конец предметного стекла наносят каплю туши и петлю
исследуемого материала. Смесь тщательно перемешивают
петлей, делают мазок, как мазок из крови, высушивают и,
не фиксируя, микроскопируют с иммерсионной системой. Фон
препарата окрашен в темно-дымчатый цвет, микробные тела
и их капсулы не окрашиваются тушью и остаются бесцвет-
ными, вследствие чего этот способ получил название нега-
тивного.
Окраска капсул по способу Гинса. 1. Приго-
товляют негативно окрашенный по способу Бурри препарат.
2. Фиксируют любым химическим способом: метиловым
спиртом, смесью Никифорова или другими смесями
(с. 29).
3. Промывают водой.
4. Окрашивают 3—5 мин карболовым фуксином Циля,
разведенным в соотношении 1: 3.
5. Промывают водой, высушивают и микроскопируют с
иммерсионной системой.
При микроскопировании на темном фоне препарата конт-
растно выделяются неокрашенные капсулы, внутри которых
находятся бактерии ярко-малинового цвета.
Окраска зерен волютина. Среди патогенных микробов
включения нуклеопротеидов в виде зерен волютина могут
быть обнаружены только у возбудителей дифтерии и сапа.
Окраска зерен волютина по способу Нейс-
сера. 1. Фиксированный на пламени горелки мазок окра-
шивают 1—2 мин синькой Нейссера (рец. 11, с. 344).
2. Синьку сливают, на препарат наносят несколько капель
раствора Люголя (рец. 21) на 1 мин.
3. Мазок промывают водой, подсушивают фильтроваль-
ной бумагой.
4. Докрашивают раствором хризоидина или везувина
2—3 мин.
5. Промывают водой, подсушивают и микроскопируют.
Зерна волютина окрашиваются в синий цвет, тела микроб-
ных клеток — в светло-коричневый (см. рис. 25).
ОСНОВЫ ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНЫХ СРЕД
Питательные среды служат для выделения из исследуемо-
го материала чистых культур микробов и изучения их
свойств. Питательные среды являются основой бактериологи-
ческих работ, нередко определяя своим качеством результа-
ты исследования.
.34
В состав сред, применяемых для выращивания бакте-
рий, входят необходимые для построения белков цитоплазмы
органогены: азоты, углерод, водород, кислород, неорганиче-
ские соединения, содержащие фосфор, калий, серу, натрий,
магний, железо, микроэлементы: кобальт, йод, марганец, бор,
цинк, молибден, медь и др. Все перечисленные элементы
должны находиться в питательной среде в удобоусвояемом
для данного микроорганизма соединении, причем требования
различных микробов в этом отношении неодинаковы. Потреб-
ность в кислороде и водороде бактерии удовлетворяют глав-
ным образом за счет поступающей в клетку воды.
По характеру усвоения азота патогенные микроорганиз-
мы делятся следующим образом: оДни из них извлекают
азот из простых аммонийных соединений, другие нуждаются
в аминокислотах, третьи расщепляют высокомолекулярные
вещества — пептоны, представляющие собой продукты непол-
ного ферментативного переваривания белков. Строго пара-
зитические виды бактерий размножаются только в присут-
ствии нативного, т. е. неизмененного, белка.
Источником углерода для патогенных бактерий являются
главным образом различные углеводы: сахар, многоатомные
спирты, органические кислоты и их соли.
Потребность бактерий в неорганических элементах удов-
летворяется прибавляемыми к питательной среде солями: NaCl,
КН2РО4, К2НРО4 и т. д. Микроэлементы, выполняющие роль
катализаторов химических процессов, необходимы в ничтож-
но малых количествах и поступают в питательную среду с
пептоном, неорганическими солями и водой.
Наряду с перечисленными органическими и неорганиче-
скими элементами бактерии нуждаются в ростовых факторах,
которые по своей роли соответствуют витаминам для живот-
ных. Источником факторов роста являются прибавляемые к
питательной среде продукты растительного и животного про-
исхождения, содержащие в своем составе никотиновую, пан-
тотеновую, парабензойную кислоты, витамины А, В, С и др.
Питательные вещества могут усваиваться микробами
только при определенной реакции питательной среды, так
как проницаемость оболочек микробных клеток изменяется
в зависимости от pH среды.
Потребность в питательных веществах и физических усло-
виях у различных видов микробов неодинакова и этим ис-
ключается возможность создания универсальной питательной
среды.
По консистенции различают плотные и жидкие пи-
тательные среды. Плотные питательные среды готовят из
жидких посредством прибавления к ним клеевых веществ:
агара или желатина. Агар-агар (по-малайски желе) —про-
дукт растительного происхождения, добываемый из морских
3* 3S>
водорослей. В воде агар-агар растворяется при температуре
80—86° С, застудневает при 36—40° С. Применение агаровых
сред благодаря их способности сохранять плотность при тем-
пературе 37* С дало возможность выращивать патогенных
микробов при оптимальной для большинства из них темпера-
туре на плотных средах. Желатин — вещество белковой при-
роды животного происхождения. В теплой воде при темпера-
туре 32—34® С он набухает и растворяется, а при более низ-
кой температуре превращается в студень. Однако при pH
ниже 6,3 и выше 7,0 плотность желатина уменьшается и он
плохо застывает.
Исходные продукты для приготовления пи-
тательных сред. Для приготовления питательных сред
используют:
1. Продукты животного происхождения (мясо, рыба, ка-
зеин, молоко, яйца, кровь и т. д.).
2., Продукты растительного происхождения (картофель
и др.).
3. Органические и неорганические соединения определен-
ного химического состава.
Питательные среды, приготовленные из продуктов расти-
тельного и животного происхождения, несмотря на то что
они не могут быть стандартны и не имеют определенного
химического состава, находят широкое применение в прак-
тике микробиологии. Синтетические питательные среды, со-
ставленные из химических соединений, используют пре-
имущественно для изучения обмена веществ микробной
клетки.
Требования, предъявляемые к питатель-
ным средам. Питательные среды должны: 1. Содержать
необходимые для питания микроба питательные вещества.
2. Иметь реакцию pH, оптимальную для выращиваемого
вида микроба.
3. Иметь достаточную влажность, так как микробы пита-
ются по законам диффузии и осмоса.
4. Обладать изотоничностью.
5. Быть стерильными, обеспечивая тем самым возмож-
ность выращивания чистых культур микробов.
Питательные среды подразделяются на среды общего
назначения и специальные. К первой группе отно-
сятся мясо-пептонные: агар, бульон, питательный желатин.
Среды общего назначения используют для выращивания мно-
гих патогенных микробов и применяют в качестве основы
для приготовления специальных сред, добавляя к ним кровь,
сахар, молоко, сыворотку и другие ингредиенты, необходи-
мые для размножения того или иного вида микроба.
К специальным питательным средам относятся электив-
ные (избирательные) и дифференциально-диагностические.
36
Элективные (избирательные) среды. Принцип создания
элективных питательных сред основан на удовлетворении ос-
новных биохимических и энергетических потребностей того
вида микроба, для культивирования которого они предназна-
чаются. Определенный состав и концентрация питательных
веществ, микроэлементов, ростовых факторов при строго
определенном значении pH обеспечивают оптимальные усло-
вия для выращивания одного или нескольких видов микро-
организмов.
При посеве на них материала, содержащего смесь раз-
личных микроорганизмов, раньше всего будет проявлять-
ся рост того вида, для которого данная среда будет электив-
ной.
Дифференциально-диагностические питательные среды.
Дифференциально-диагностические питательные среды ис-
пользуют для определения видовой принадлежности иссле-
дуемого микроба, основываясь на особенностях его обмена
веществ. По своему назначению дифференциальИо-диагности-
ческие питательные среды подразделяются следующим об-
разом:
1. Среды для выявления протеолитической и гемолитиче-
ской способности микробов, содержащие в своем составе бел-
ковые вещества: кровь, молоко, желатин, свернутую кровя-
ную сыворотку и т. д.
2. Среды с индифферентными химическими веществами,
которые служат источником питания для одних видов микро-
бов и не усваиваются другими видами.
3. Среды с углеводами и многоатомными спиртами для
обнаружения соответствующих ферментов.
4. Среды для определения редуцирующей способности
микробов.
В состав дифференциально-диагностических сред, пред-
назначенных для выявления сахаролитйческих и окислитель-
но-восстановительных ферментов, вводят индикаторы: ней-
тральную красную, метиленовый синий, лакмусовую настой-
ку, кислый фуксин, бромтимоловый синий, водный голубой
краситель и розоловую кислоту (ВР). Изменяя свою окраску
при различных значениях pH, индикатор указывает на нали-
чие или отсутствие расщепления, окисления или восстанов-
ления введенного в среду ингредиента. Однако индикатор не
является обязательной составной частью сред, предназначен-
ных для выявления ферментов. Так, наличие желатиназы и
других протеолитических ферментов в культуре определяют
по разжижению желатина, свернутого яичного или сыворо-
точного белка.
Сухие питательные среды. Приготовление питательных
•сред — один из наиболее ответственных и трудных участков
работы бактериологической лаборатории.
37
В настоящее время медицинской промышленностью Со-
ветского Союза организовано производство консервирован-
ных сред. Сухие питательные среды представляют собой гиг-
роскопические порошки, растворяющиеся в воде.
Наряду с обычной средой — мясо-пептонным агаром про-
изводится много специальных питательных сред сложного
рецептурного состава для выращивания микробов кишечной
группы (например, среды Эндо (рец. 79, с. 365), Левина
(рец. 80), сухой бактоагар Плоскирева (рец. 81), КУА
(рец. ПО, с. 377).
Сухие питательные среды поступают в продажу в стек-
лянных банках с плотно завинчивающимися пластмассовыми
крышками, обеспечивающими герметичность. В таком же ви-
де они должны храниться в лаборатории.
ОПРЕДЕЛЕНИЕ pH ПИТАТЕЛЬНЫХ СРЕД
Реакция среды определяется концентрацией содержащих-
ся в ней водородных и гидроксильных ионов. Преобладание
ионов водорода обусловливает кислую реакцию, преоблада-
ние гидроксильных — щелочную, равенство их — нейтральную
реакцию среды. Опытным путем было установлено, что ней-
тральная реакция соответствует концентрации гидроксильных
и водородных ионов, равной 0,0000001, или 10~7 ион/л:
(Н+) = (ОН-) = 10-’ г-иоп/л.
Произведение концентрации водородных и гидроксильных
ионов равно константе:
К = (Н-7) X (ОН-7) = 10-“.
Таким образом, значения Н+ и ОН- связаны с постоянной
величиной произведения: изменение одной из них влечет за
собой соответствующее увеличение или уменьшение другой.
Вследствие этого для характеристики реакции среды доста-
точно определить в растворе содержание каких-либо одних
ионов — водородных или гидроксильных. В настоящее время
принято определять реакцию среды по содержанию в ней
ионов водорода.
Концентрация водородных ионов, выраженная в г-ионах
на 1 л, получила название водородного числа. В воде и био-
логических жидкостях водородное число представляет собой
ничтожно малую величину, неудобную для практического ис-
пользования. Поэтому для выражения концентрации водо-
родных ионов в жидкости был введен водородный показа-
тель, обозначаемый символом pH; pH представляет собой
логарифм величины Н (абсолютной концентрации водород-
ных ионов), взятый с обратным знаком. В принятом обозна-
чении нейтральной реакции соответствует pH 7,0. Показа-
38
Рис. 4. Компаратор Уольполя — Михаэлиса.
1 вид спереди; 2 — вид сзади; 3 — схема расположения пробирок в компараторе.
тель ниже 7,0 (6,9—1,0) указывает на кислую реакцию рас-
твора, выше 7,0 (7,1 —14,0) — на щелочную реакцию.
Определение pH раствора производят колориметрическим
и электрометрическим способами. В микробиологических ла-
бораториях преимущественное распространение получил пер-
вый из упомянутых способов.
Определение pH среды колориметрическим способом.
В основу колориметрического определения pH положена спо-
собность некоторых веществ, называемых индикаторами, из-
менять цвет или интенсивность окраски в зависимости от
pH раствора. В связи с этим две жидкости с одинаковой тол-
щиной слоя, содержащие один и тот же индикатор, могут
иметь полное совпадение цвета только при равных значени-
ях pH. Для колориметрического определения pH в растворе
пользуются обычно прибором Уольполя — Михаэлиса, пред-
ставляющим собой компаратор и набор индикаторов.
Компаратор Михаэлиса имеет вид деревянного бруска, на
верхней поверхности которого высверлено 6 отверстий для
пробирок, расположенных по 3 в два ряда. Для удобства ра-
боты гнезда имеют условную нумерацию: отверстия ряда,
обращенного к глазу наблюдателя, обозначены цифрами 1,
2, 3; отверстия ряда, обращенного к свету, — 4, 5, 6. Про-
бирки на половину своей длины входят в гнезда, как в обыч-
ный штатив. У основания через стенку просверлены три
сквозных канала для прохождения лучей света и наблюде-
ния за пробирками, находящимися в соответствующем ряду.
На задней стенке имеются специальные зажимы для придер-
живания светофильтров (рис. 4).
39
К компаратору приложены 2 светофильтра — стеклянные
пластинки (матовая и синяя) и 4 "стандартные пробирки,
диаметр и форма которых соответствуют пробиркам стандар-
тов-индикаторов.
К прибору Михаэлиса прилагаются 4 индикатора, из кв-
торых каждый изменяет окраску от бесцветной до интенсив-
но желтой в пределах указанного значения pH:
метанитрофеиол — от pH 6,8 до 8,4
лараинтрофеиол — от pH 5,4 до 7,0
гамма-нитрофеиол — от pH 4,0 до 5,4
альфа-нитрофенол —от pH 2,8 до 4,4
Соответственно этим индикаторам в приборе имеются
4 шкалы стандартов-индикаторов в запаянных пробирках.
Стандарты располагаются в следующем порядке.
Первый ряд: стандарты для метанитрофенола—9 проби-
рок (pH 6,8—8,4).
Второй ряд: стандарты для паранитрофенола — 9 проби-
рок (pH 5,4—7,0).
Третий ряд: стандарты для гамма-нитрофенола — 8 про-
бирок (pH 4,0—5,4).
Четвертый ряд: стандарты для альфа-нитрофенола —
9 пробирок (pH 2,8—4,4).
На каждой пробирке стандарта наклеена этикетка, обо-
значающая величину pH, которой соответствует данный стан-
дарт. Разница pH двух рядом стоящих пробирок соответст-
вует 0,2. Набор имеющихся индикаторов и прилагаемые к
ним стандарты допускают определение pH раствора в преде-
лах 2,8—8,4.
Наряду с перечисленными индикаторами, предназначен-
ными для точного определения pH, в пробирке имеется так
называемый универсальный индикатор для ориентировочного-
определения pH исследуемых жидкостей. К нему прилагается
фарфоровая палетка и разноцветная шкала на бумажной
карточке. Каждая цветная полоска этой шкалы соответству-
ет определенному значению pH «универсального индика-
тора».
Техника определения pH раствора колори-
метрическим способом. В фарфоровую палетку на-
ливают 2—3 мл исследуемой жидкости, прибавляют 2—
3 капли «универсального индикатора» и смешивают стеклян-
ной палочкой; образующуюся при этом окраску сравнивают
с цветной бумажной шкалой. pH определяют на основании
полного совпадения цвета смеси исследуемого раствора и
индикатора с одной из цветных полосок шкалы, под которой
имеется соответствующее цифровое обозначение. Определив
ориентировочно pH раствора, выбирают соответствующий ин-
дикатор Михаэлиса.
41
В стандартную пробирку наливают 2 мл исследуемой
жидкости, 4 мл дистиллированной воды и 1 мл выбранного
индикатора. Пробирку ставят во второе отверстие компара-
тора. Рядом с ней, справа и слева (отверстия 1 и 3), ставят
иробирки, содержащие по 2 мл исследуемого раствора и
5 мл дистиллированной воды.
В отверстие 5 помещают пробирку с 7 мл дистиллирован-
яой воды, а с обеих ее сторон, в отверстия 4 и 6, стандарты
с тем же индикатором, который добавлен к исследуемой сре-
де. Стандарты подбирают до тех пор, пока интенсивность их
окраски и исследуемой жидкости не станет одинаковой.
При исследовании растворов, окрашенных в желтый цвет,
в компаратор вставляют светофильтр синего цвета. Жидкость
при этом приобретает зеленый цвет, оттенки которого улав-
ливаются значительно легче, чем желтого. При работе с мут-
ной жидкостью вставляют матовый светофильтр, скрываю-
щий мутность исследуемой среды.
pH исследуемого раствора будет соответствовать величи-
не, указанной на этикетке стандарта, с цветом которого он
полностью совпадает.
Приготовление растворов с определенным
значением pH. Приготовление раствора (среды) с опре-
деленной реакцией начинают с ориентировочного определе-
ния в нем pH с помощью «универсального индикатора». Ес-
ли pH ниже заданного, раствор подщелачивают, если вы-
ше— подкисляют. В первом и втором случаях точно учиты-
вают количество кислоты или щелочи, истраченной на изме-
нение pH до нужного значения.
Расстановка пробирок в компараторе при приготовлении
раствора с определенным значением pH такая же, как опи-
сано выше. Однако в гнездах 4 и 6 устанавливают стандарты
с заведомо определенным значением pH, которое нужно соз-
дать в опытном растворе. Например, для установления в рас-
творе р*Н 7,3 берут стандарты pH 7,2 и 7,4.
В опытную пробирку 2 градуированной пипеткой прибав-
ляют по каплям децинормальный раствор едкого натра для
подщелачивания или децинормальный раствор хлористово-
дородной кислоты для подкисления до тех пор, пока цвет
содержимого в опытной и стандартной пробирках не совпа-
дет полностью. За изменением цвета в опытной пробирке
наблюдают все время через отверстие, расположенное на пе-
редней стенке у основания штатива.
Для уточнения полученных данных исследование повторя-
ют. К опытному раствору прибавляют заранее то же коли-
чество кислоты или щелочи и повторно проверяют величину
полученного значения pH.
По окончании исследования приступают к расчету: зная
количество щелочи (или кислоты), затраченное для создания
41;
определенного значения pH в 2 мл раствора, легко вычис-
лить, сколько потребуется ее для приготовления 1 л раство-
ра с тем же значением pH.
Пример. Чтобы установить в 2 мл мясо-пептонного бульона pH 7,6,
понадобилось 0,2 мл децннормального раствора едкого натра. Следователь-
но, на 1000 мл того же раствора едкого натра нужно в 500 раз больше.
Количество щелочи или кислоты, необходимое для при-
готовления любого объема раствора с определенным значе-
нием pH, можно рассчитать по следующей формуле:
АХВ
Х~ С ’
где х — искомое количество щелочи (или кислоты), А— ко-
личество децннормального раствора едкого натра, прибав-
ленного к исследуемой пробе, В — общее количество пита-
тельной среды, С — количество среды, взятой для опытного
определения pH.
При стерилизации питательных сред в автоклаве pH, как
правило, снижается, поэтому перед стерилизацией pH среды
превышают обычно на 0,2 выше требуемой величины и после
автоклавирования реакцию среды проверяют повторно.
Фильтрование питательных сред. Жидкие и желатиновые
питательные среды фильтруют через фильтровальную бума-
гу, среды с агаром — через ватно-марлевый фидьтр. Перед
фильтрованием монтируют вспомогательную установку.
В кольце универсального штатива закрепляют воронку, под
трубку ее подставляют приемник для фильтрата.
Ватно-марлевые фильтры для агаровых сред готовят сле-
дующим образом. Стеклянную воронку покрывают квадрат-
ным куском марли, углы которой перегибают через край во-
ронки. На марлю кладут слой гигроскопической ваты. Перед
началом фильтрования поверхность ватно-марлевого фильт-
ра, так же как и бумажного, осторожно смачивают дистил-
лированной водой или фильтруемой средой.
Фильтрование при нагревании. Питательные
среды с желатином и агаром фильтруют, предварительно
расплавив и подогрев до кипения. Фильтрование с подогрева-
нием удобно проводить в горячем автоклаве, открыв крышку
и выключив источник обогрева.
Осветление питательных сред. Осветление питательных
сред применяют в том случае, когда в процессе приготовле-
ния они мутнеют и приобретают темный цвет. Осветление мо-
жет быть основано на коагулировании взвешенных частиц,
что способствует более быстрому выпадению их в осадок,
и на адсорбции, т. е. способности различных веществ осаж-
дать на свою поверхность взвешенные частицы.
42
Существует несколько способов осветления питательных
сред.
1. К 1 л среды, охлажденной до температуры 50° С, при-
бавляют один белок свежего куриного яйца, взбитый в пену,
с двойным объемом холодной воды. После добавления белка
среду хорошо размешивают и кипятят на сильном огне в те-
чение 10 мин или нагревают в автоклаве в течение 30 мин
при температуре 105° С. Белок можно заменить нормальной
лошадиной сывороткой, прибавляемой на 1 л среды в коли-
честве 30—40 мл. Иногда прибавление белка усиливает мут-
ность питательной среды.,. Поэтому приступая к ее осветле-
нию, нужно для пробы взять 10 мл питательной среды, при-
бавить 0,3 мл белка или сыворотку и вскипятить.
2. В питательную среду, охлажденную до температуры
40—45° С, вносят па каждый литр среды 20—30 г мяса, про-
пущенного через мясорубку и растертого в ступке с бульоном
до получения однородной массы. Среду с прибавленной к ней
мясной кашицей тщательно размешивают и помещают на
1 ч в текучепаровой аппарат.
3. Фильтрацию и осветление агара можно заменить декан-
тацией, т. е. отделением осадка путем его отстаивания. Для
этого расплавленную среду с агаром наливают в широкий
сосуд высоким слоем и ставят в горячий автоклав на ночь
для осаждения взвешенных частиц, обусловливающих мут-
ность среды. На следующий день посуду с застывшим ага-
ром слегка подогревают в водяной бане, перевертывают
вверх дном, вытряхивают агар и срезают придонную часть
его, содержащую осадок.
Разливка питательных сред. После осветление и фильтра-
ции питательные среды разливают в колбы, флаконы, про-
бирки или матрацы.
Среды уже стерильные или стерилизуемые текучим па-
ром, или под давлением 0,5 атм разливают в стерильную
посуду, среды, подлежащие стерилизации при давлении
1 атм, — в чистую, но нестерильную посуду.
Для разливки жидких питательных сред пользуются од-
ной из описанных ниже установок.
1. На конец воронки, закрепленной в кольце штатива, на-
девают резиновую трубку, оканчивающуюся стеклянным на-
конечником. На резиновую трубку накладывают зажим Мо-
ра. Под воронку подставляют сосуд для приема профильтро-
ванной среды.
2. Для отмеривания и разливки определенных объемов
среды пользуются градуированной бюреткой или собирают
специальную установку (рис. 5). Стеклянную воронку и гра-
дуированную бюретку соединяют резиновыми трубками с
двумя коленами стеклянного тройника, на третье колено его
надевают резиновую трубку, заканчивающуюся стеклянным
43
наконечником. На резиновые трубки,
соединяющие воронку с тройником, на
тройник и наконечник накладывают за-
жимы Мора. Ослабляя первый зажим,
наполняют градуированный цилиндр
жидкостью, затем, открыв второй за-
жим, выпускают отмеренное количе-
ство жидкости в сосуд для питатель-
ной среды. Первые порции жидкости
до вытеснения воздуха из трубок не
учитываются.
При разливке сред края посуды
нельзя смачивать питательной средой,
так как ватно-марлевые пробки, при-
клеиваясь к стеклу во время стерили-
зации, вынимаются с трудом и остав-
ляют в просвете отверстия сосуда
ворсинки ваты. Попадая в среду, они
могут вызвать загрязнение ее по-
сторонней микрофлорой.
Поверх ватно-марлевой пробки на
колбы и флаконы с питательными сре-
дами надевают бумажные колпачки.
Разливка плотных сте-
рильных питательных сред в
чашки Петри. Плотную питатель-
ную среду (агар, желатин) во фла-
конах или пробирках растапливают в
водяной бане (сняв предварительно-
бумажные колпачки). После тога
как среда станет жидкой, сосуд берут
в правую руку, левой рукой над огнем
держат между мизинцем и ладонью, а
Рис. 5. Прибор для раз-
ливания определенных
количеств жидкости.
вынимают пробку и
края флакона или пробирки обжигают. Открытую посуду со
средой держат в наклонном положении, чтобы избежать
попадания в среду микробов из воздуха. В то же время левой
рукой приподнимают с одной стороны крышку на чашке
Петри и выливают в нее питательную среду в количе-
стве 15—20 мл, слегка покачивая чашку, чтобы среда рас-
пределялась равномерным слоем по всей ее поверхности
(рис. 6).
Во Всесоюзном научно-исследовательском институте анти-
биотиков Ю. Э. Бартошевич и А. И. Чепурным (1969) скон-
струирован универсальный прибор-автомат1 для разливки
1 Универсальный прибор-автомат для разлнвкн агаризированных пита-
тельных сред изготовляется по индивидуальным заказам Московским хими-
ко-фармацевтическим заводом имени Л. Я. Карпова.
44
Рис. 6. Разливка агара в чашки Петри.
агаризированных сред в чашки Петри, обеспечивающий вы-
сокую стерильность и точное дозирование разливаемых сред.
Прибор-автомат представляет собой настольную установ-
ку размером 300X500X120 мм, работающую от электросети
однофазного переменного тока (рис. 7). В конструкции при-
бора различают следующие рабочие узлы: на верхней панели
корпуса укреплен магазин для загрузки нескольких чашек
Петри. Дно нижней чашки находится на подвижном столике,
возвратно-поступательные движения которого совершаются в
вертикальном и горизонтальном направлениях.
Диаметр отверстия, расположенного в основе магазина,
меньше, чем крышка чашки Петри, но больше, чем диаметр
ее донышка. За счет этой разницы при движении столика
вниз по вертикали крышка чашки остается над отверстием
верхней панели, а дно ее вводится во внутреннюю стериль-
ную камеру, смещается в горизонтальном направлении и
устанавливается под дозатором.
Стерильность камеры, в которой происходит разливка пи-
тательной среды, обеспечивается бактерицидной лампой
БУФ-15, смонтированной таким образом, чтобы среда, нали-
ваемая в чашки, не подвергалась прямому действию ультра-
фиолетовых лучей.
Рядом с магазином на верхней панели установлен штатив
для закрепления матраца с расплавленной питательной сре-
дой. Горлышко матраца посредством резиновой прокладки
герметически соединено со съемным дозатором, который
представляет собой мерный стаканчик с клапаном двусторон-
него действия, соединенный с электромагнитным приводом.
45
Рис. 7. Универсальный прибор — автомат для разлива агаризнрованных пи-
тательных сред в чашки Петри.
Под давлением чашки в момент установки ее под дозато-
ром электромагнит срабатывает, открывая нижнее и прикры-
вая верхнее отверстие дозатора, вследствие чего агаровая
среда в объеме, строго обусловленном камерой дозатора, вы-
ливается в чашку.
После определенной экспозиции под дозатором столик с
чашкой перемещается с горизонтальной плоскости в сторону
отверстия магазина, а затем вертикально вверх до уровня
верхней панели так, чтобы донышко чашки вошло под свою
крышку. Затем чашка Петри, заполненная питательной сре-
дой и закрытая крышкой, с помощью рычажка кривошипного
механизма выталкивается на рабочий стол, с которым в од-
ной плоскости расположена верхняя панель аппарата.
При застудневании агара образуется большое количество
конденсационной воды, которая оседает на внутренней сто-
роне крышки и увлажняет поверхность среды. Поэтому перед
посевом среды подсушивают: чашку в открытом виде поме-
щают в термостат таким образом, чтобы крышка служила
опорой для края ее дна, перевернутого средой вниз. Чтобы
избежать образования конденсационной влаги, чашки с рас-
плавленным агаром тотчас после разливки накрывают сте-
рильным листом фильтровальной бумаги, которую стерили-
зуют вместе с чашкой. Бумага не должна касаться поверхно-
сти среды. Когда среда совершенно остынет, фильтровальную
бумагу снимают, а чашки закрывают крышками.
46
Стерилизация питательных сред. Стерилизацию питатель-
ных сред осуществляют различными способами в зависимо-
сти от тех ингредиентов, которые входят в их состав.
1. Синтетические среды и все агаровые среды, не содер-
жащие в своем составе нативного белка и углеводов, стери-
лизуют 15—20 мин в автоклаве при температуре 115—120° С4
2. Среды с углеводами и молоком (в состав которого вхо-
дит лактоза), питательный желатин стерилизуют текучим
паром при температуре 100° С дробно или в автоклаве при
112° С.
3. Среды, в состав которых входят белковые вещества
(сыворотка крови, асцитическая жидкость), обеспложивают-
ся тиндализацией или фильтрованием.
4. Для стерилизации питательных сред, содержащих в
своем составе нативные белки, пользуются фильтрацией че-
рез мембранные фильтры Зейтца.
Подготовленные к употреблению питательные среды про-
веряют на стерильность. Для этого их ставят в термостат при
температуре 37° С. Среды, простерилизованные в автоклаве,
выдерживают в термостате 1 сут, простерилизованные теку-
чим паром — 3 сут.
ТЕХНИКА ПОСЕВА, КУЛЬТИВИРОВАНИЯ
И ВЫДЕЛЕНИЯ ЧИСТОЙ КУЛЬТУРЫ АЭРОБНЬХ
И АНАЭРОБНЫХ МИКРОБОВ
Бактериологический метод — выделение чистых культур
микробов и их последующая идентификация — имеет боль-
шое значение в диагностике инфекционных заболеваний, при
профилактических обследованиях на носительство патогенных
бактерий кишечной группы, бактерий дифтерии, при изуче-
нии санитарно-гигиенического состояния объектов внешней
среды (вода, воздух, почва, продукты питания) и исследова-
нии их по эпидемиологическим показателям на зараженность
патогенными видами микробов.
Материалом для посева могут быть пересеваемые культу-
ры бактерий, различные выделения животных и человека,
ткани трупа, вода, почва, продукты питания.
Жидкий материал для посева берут петлей или пипеткой.
При взятии петлей жидкость должна образовать в кольце
петли тонкую прозрачную пленку — «зеркало». Пипетками
пользуются в том случае, когда материал засевают в боль-
шом или точно отмеряемом объеме.
Способ взятия плотного материала определяется его кон-
систенцией. При посевах чаще всего пользуются бактериаль-
ной петлей.
Все манипуляции, связанные с посевом и выделением
микробных культур, производят над пламенем горелки. Бак-
47
термальную петлю прокаливают над пламенем непосредст-
венно перед взятием материала, затем петлю остужают. Для
этого при пересеве микробной культуры с пробирки горячую
петлю погружают в конденсационную жидкость, а при пере-
севе с чашек Петри прикасаются к поверхности питательной
среды, свободной от микробного роста. Достаточно остужен-
ная петля не вызывает шипения конденсационной жидко-
сти и не растапливает агар при соприкосновении со
средой. После окончания посева петлю прожигают
повторно для уничтожения находящейся на ней микроб-
ной культуры или инфицированного микроорганизмами ма-
териала.
Пипетки и шпатели используемые для посевов, так же
как и бактериальные петли, перед посевом прожигают, а по-
сле посевов опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на про-
бирках в верхней трети надписывают название засеянного
материала или ставят номер анализа и дату посева.
Техника посевов на плотные и жидкие питательные среды.
1. При посеве в жидкую питательную среду петлю с находя-
щимся на ней материалом погружают в среду. Если матери-
ал вязкий и с петли не снимается, его растирают на стенке
сосуда, а затем смывают жидкой средой. Жидкий материал,
набираемый в пастеровскую или градуированную пипетку,
вливают в питательную среду.
2. При посеве на скошенный мясо-пептонный агар про-
бирку берут в левую руку между I и II пальцами, чтобы ос-
нование пробирки находилось на поверхности кисти руки и
посев осуществлялся под контролем глаза. Пробку из про-
бирки вынимают правой рукой V и IV пальцами, не прика-
саясь к той части пробки, которая входит внутрь пробирки.
Остальные 3 пальца правой руки остаются свободными для
взятия бактериальной петли, посредством которой произво-
дится посев. Петлю держат, как писчее перо. После вынима-
ния пробки пробирку с питательной средой держат в наклон-
ном положении во избежание попадания в нее посторонних
микроорганизмов из воздуха.
Петлю с находящимся на ней пересеваемым материалом
вводят в пробирку до дна, опускают плашмя на поверхность
питательной среды и скользящими движениями наносят
штрих снизу вверх, от одной стенки пробирки к другой
(рис. 8).
3. При посеве на поверхность плотной питательной среды
в чашки Петри чашку держат в левой руке. Дно ее с одной
стороны придерживают I и II пальцами, а с другой—IV
и V пальцами. Крышку, приоткрытую настолько, чтобы в об-
разовавшуюся щель свободно проходили петля или шпатель,
фиксируют I и III или I и II пальцами (рис. 9). Небольшое
48
количество исследуемого материала втирают бактериальной
петлей в поверхность питательной среды у края чашки. За-
тем петлю прожигают, чтобы уничтожить избыток находяще-
гося на ней материала. Линию посева начинают с того ме-
ста, в котором находится материал. Бактериальную петлю
кладут плашмя на питательную среду, чтобы не поцарапать
ее поверхности, и проводят штрихи по всей среде или по сек-
торам, разграфив предварительно дно чашки (при условии,
что среда прозрачна) на 4, 8 или 16 равных частей. Нужно
стараться, чтобы штрихи, наносимые петлей, располагались
как можно ближе друг к другу, так как это удлиняет общую
линию посева и дает возможность получить изолированные
колонии микробов.
4 ЛаСинская А. С.
4»
Рис. 9. Посев па плотную питательную среду в чашкн Петри.
Для равномерного распределения засеваемого материала
по поверхности плотной питательной среды можно пользо-
ваться вместо петли тампоном или шпателем.
При обилии в засеваемом материале микробов они растут
в виде пленки, покрывающей всю поверхность питательной
среды. Такой характер микробного роста получил название
сплошного, или газонного. Посев газоном производят, когда
нужно получить большие количества микробной культуры
одного вида.
4. Из материала, подлежащего посеву в толщу плотной
питательной среды, готовят взвесь в стерильной водопровод-
ной воде или в изотоническом растворе. Набирают 0,1 — 1 мл
взвеси в пипетку (в зависимости от степени предполагаемого
микробного загрязнения) и выливают в пустую стерильную
чашку Петри. Вслед за этим чашку заливают 15—20 мл мя-
со-пептонного агара, расплавленного и остуженного до тем-
пературы 40—45 °C (при такой температуре пробирка со сре-
дой, приложенная к щеке, не должна вызывать ощущения
ожога). Для равномерного распределения исследуемог© ма-
териала в питательной среде закрытую чашку с содержимым
слегка вращают по поверхности стола.
5. Посев уколом в столбик питательной среды произведят
в пробирку со средой, застывшей в виде столбика. Пробир-
ку берут в левую руку, как обычно, и в центре столбика до
дна пробирки вкалывают петлю с находящимся на ней мате-
риалом.
БАКТЕРИАЛЬНЫЙ СТАНДАРТ МУТНОСТИ И РАБОТА С НИМ
При некоторых микробиологических исследованиях возни-
кает необходимость посева определенного количества мик-
робных тел в жидкую или плотную питательную среду. В та-
50
ких случаях из микробной культуры, предназначенной для
посева, пользуясь бактериальным стандартом, готовят взвесь,
содержащую в единице объема (1 мл) заданное количество
микробных тел.
Стандарт мутности для определения концентрации мик-
робной взвеси, выпускаемый Государственным научно-иссле-
довательским институтом стандартизации и контроля биоло-
гических препаратов имени Л. А. Тарасевича, представляет
собой взвешенные в дистиллированной воде частицы стекла
«Пирекс» диаметром от 0,5 до 3,5 мкм. Взвесь этого стекла
химически устойчива, не коагулирует при седиментации ча-
стиц, при взбалтывании осадка образует взвесь исходной дис-
персности и мутности.
Стандарт состоит из трех запаянных пробирок-эталонов,
эквивалентных по степени мутности 5, 10 и 20 международ-
ным единицам мутности. Мутность стандарта на 10 единиц
соответствует следующей концентрации микроорганизмов:
850 млн./мл микробов кишечной группы
10 млрд./мл микробов коклюшной группы
1,5 млрд, бруцеллезных микробов
2 млрд./мл холерных вибрионов
4,5 млрд./мл туляремийных микробов
К комплекту бактериальных эталонов прилагаются шриф-
товая таблица, содержащая набор различных шрифтов, и две
пустые пробирки, диаметр, толщина стенок и цвет стекла ко-
торых точно соответствуют пробиркам-эталонам, так как
при сравнении микробной взвеси одной концентрации, содер-
жащейся в пробирках разных диаметров, мутность жидкости
будет неодинаковой.
Для приготовления микробной взвеси обычно пользуются
18—24-часовыми микробными культурами, выращенными на
скошенном мясо-пептонном агаре или другой плотной среде.
Старые культуры микробов непригодны, так как они содер-
жат большое количество погибших микробных клеток.
В пробирку с культурой наливают 5 мл изотонического рас-
твора хлорида натрия и осторожно, чтобы не намочить проб-
ку, встряхивают или вращают ее между ладонями обеих рук
в одну и затем в другую сторону до тех пор, пока с поверх-
ности агара не смоется весь налет микробного роста. Иногда
приготовить смыв описанным способом не удается. Тогда
пленку микробного роста предварительно снимают с поверх-
ности среды шпателем, сделанным из пастеровской пипетки.
Небольшое количество (десятые доли миллилитра) полу-
ченного смыва набирают в стерильную градуированную пи-
петку емкостью 1—2 мл и переносят в стандартную пробир-
ку или близкую к ней по диаметру и толщине стенок. Далее
к содержимому этой пробирки небольшими, но точно учиты-
ваемыми порциями приливают изотонический раствор хло-
4*
51
рида натрия, сравнивая при этом мутность опытной пробир-
ки с выбранным эталоном (в качестве его рекомендуется
пользоваться эталоном на 10 единиц).
Сравнение степени мутности в опытной и эталонной про-
бирках производят невооруженным глазом при хорошем
дневном освещении в лучах падающего света, подложив под
обе пробирки шрифтовую таблицу.
После уравнения мутности в опытной пробирке с этало-
ном мутности на 10 единиц производят с целью контроля
сравнение опытной пробирки с эталоном на 5 и 20 единиц.
Приготовленная взвесь должна быть более мутной, чем со-
держимое первого, и более прозрачной, чем содержимое вто-
рого эталона. Зная количество изотонического раствора хло-
рида натрия, прибавленное к определенному объему исход-
ной микробной взвеси, можно определить число микробных
тел, содержащихся в 1 мл исходной бактериальной взвеси,
и приготовить микробную взвесь любой концентрации.
МЕТОДЫ ВЫДЕЛЕНИЯ ЧИСТЫХ КУЛЬТУР
Чистой культурой микробов называют популяцию
микроорганизмов одного вида, полученную из изолированной
микробной колонии. Под микробной колонией подразумевает-
ся, потомство бактерий, возникающее в результате размно-
жения одной микробной клетки.
Выделение чистой культуры микробов является обяза-
тельным этапом всякого бактериологического исследования.
Чистая культура необходима для изучения морфологических,
культуральных, биохимических и антигенных свойств, по со-
вокупности которых определяется видовая принадлежность
исследуемого микроорганизма.
Для выделения чистых культур микробов из материалов,
содержащих обильную смешанную микрофлору, предложено
много различных методов. Наибольшее распространение по-
лучил метод механического разъединения микроорганизмов,
находящихся в исследуемом материале, с целью получения
изолированных колоний на поверхности или в глубине пита-
тельной среды.
Очень широко применяются элективные питательные сре-
ды, стимулирующие развитие тех микроорганизмов, чистую
культуру которых предполагается выделить.
Некоторые виды микробов обладают высокой чувствитель-
ностью к воздействию определенных факторов внешней сре-
ды. Индивидуальная устойчивость микробов к тому или ино-
му фактору -была использована для разработки методов вы-
деления чистых культур путем умерщвления сопутствующей
микрофлоры. Этим способом производится выделение споро-
вых форм микробов, устойчивых к действию высокой темпе-
62
ратуры, микобактерий туберкулеза, безразличных к действию»
концентрированных растворов минеральных кислот, в отли-
чие от остальных микробов, содержащихся в мокроте.
При выделении чистой культуры патогенных микробов из-
патологического материала, загрязненного посторонней мик-
рофлорой, прибегают иногда к заражению лабораторных жи-
вотных, восприимчивых к тому виду микроба, который пред-
полагается выделить из исследуемого материала. Биологи-
ческий метод выделения чистой культуры применяется при
исследовании мокроты на содержание в ней пневмококков,
микобактерий туберкулеза.
Получение чистой культуры методом рассева в глубине
среды (по Коху). Три пробирки, содержащие по 15 мл мясо-
пептонного агара, ставят в водяную баню для расплавления
агара. Расплавленную среду остужают до температуры 43—
45 °C. В пробирку вносят одну бактериальную петлю иссле-
дуемого материала. Для лучшего перемешивания материала
со средой засеянную пробирку вращают несколько раз, зажав,
между ладонями. После этого прокаленной и остуженной;
петлей содержимое 1-й пробирки переносят во 2-ю и таким
же образом из 2-й в З-го. Приготовленные разведения мик-
робов выливают из пробирок в стерильные чашки Петри,
обозначенные номерами, соответствующими номерам про-
бирок.
После застудневания среды с исследуемым материалом
чашки помещают в термостат. Количество колоний в чашках
с питательной средой уменьшается по мере разведения мате-
риала.
Выделение чистой культуры по способу Дригальского..
Расплавленную питательную среду разливают в три чашки
Петри. Застывшую среду обязательно подсушивают, так как.
влажная поверхность ее способствует образованию сливаю-
щегося роста. В первую чашку вносят одну каплю исследуе-
мого материала и стерильным шпателем втирают его в по-
верхность питательной среды. Далее, не прожигая шпателя^
и не набирая нового материала, шпатель переносят во вто-
рую и третью чашки, втирая в поверхность питательных сред,
оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригаль-
ским, является наиболее употребительным для получения чи-
стой культуры микробов. Вместо шпателя можно пользовать-
ся петлей. Материал на питательной среде распределяют па-
раллельными штрихами по всей чашке в одном направлении..
Затем, повернув чашку на 180°, проводят штрихи в направле-
нии, перпендикулярном первым штрихам. При таком способе-
посева материал, находящийся на петле, расходуется посте-
пенно, и по линиям сетки, нанесенным в конце посева, вы-
растают изолированные колонии микробов.
53*
Выращивание и выделение чистых культур анаэробов. По
характеру дыхания все микробы делятся на аэробы и анаэро-
бы. Аэробы для своего существования нуждаются в кисло-
роде. Процесс дыхания у них протекает по типу окислитель-
ной реакции. Анаэробы растут и размножаются в условиях,
исключающих доступ кислорода воздуха. Молекулярный кис-
лород оказывает на них токсическое действие. Необходимую
для существования энергию анаэробы получают путем рас-
щепления органических и неорганических соединений, входя-
щих в состав питательной среды.
Между крайними группами облигатных, т. е. стро-
гих аэробов и анаэробов, имеются микроорганизмы, способ-
ные менять аэробный тип дыхания на анаэробный в зависи-
мости от среды обитания. Такие микроорганизмы получили
название факультативных, т. е. условных, анаэробов.
К их числу относится преобладающее большинство патоген-
ных микроорганизмов.
Для выращивания анаэробов необходимо создать опреде-
ленные условия, сущность которых заключается в удалении
молекулярного кислорода из питательной среды и простран-
стве, окружающего эти культуры. Другим обязательным
условием, обеспечивающим выделение анаэробов из иссле-
дуемого материала, является внесение большого количества
посевного материала в питательную среду.
Единственным отличием питательных сред, применяемых
для выращивания анаэробов, служит пониженное содержание
в них свободного кислорода. Самым простым способом уда-
ления растворенного кислорода является кипячение. Не-
посредственно перед посевом материала пробирки с питатель-
ными средами кипятят в водяной бане в течение 10—20 мин.
При кипячении из среды вытесняется воздух и, следователь-
но, удаляется кислород. Свежепрокипяченную питательную
среду быстро охлаждают, погружая в лед или подставляя
под струю холодной воды, чтобы не дать ей насытиться кис-
лородом воздуха, и используют для посева. Для уменьшения
диффузии кислорода из воздуха питательные среды залива-
ют сверху стерильным вазелиновым или парафиновым мас-
лом (толщина слоя 1—1,5 см). Засев среды производят пи-
петкой сквозь масло в наклонном положении пробирки.
В качестве редуцирующих веществ используют глюкозу,
аскорбиновую кислоту, цистеин, гликокол, глютатиои. Актив-
но связываются с кислородом животные ткани паренхима-
тозных органов. На этом свойстве животных клеток основано
приготовление питательной среды Китта—Тароцци
(рец. 113), широко применяемой для выращивания анаэро-
бов. В жидкие питательные Среды помещают иногда пори-
стые вещества: вату, пемзу, которые адсорбируют на своей
поверхности пузырьки воздуха.
54
Для создания бескислородных условий используют ф и-
зические, химические и биологические фак-
торы.
Физические способы культивирования анаэробов. 1. Спо-
соб Виньяля—В е й о н а. Берут 4—5 пробирок с 0,5%
расплавленным и охлажденным до температуры 40—45°C
сахарным агаром (рец. 114). В содержимое одной из них вно-
сят пипеткой небольшое количество исследуемого материала
и тщательно размешивают. Для уменьшения концентрации
материала с целью получения изолированных колоний засе-
янную среду в количестве, соответствующем объему внесен-
ного материала, переносят из 1-й пробирки во 2-ю, из 2-й
в 3-ю. Затем содержимым каждой пробирки заполняют ка-
пилляры трех пастеровских пипеток.
Чтобы предупредить застывание питательной среды в мо-
мент насасывания ее в пипетки, кончик их, пока он не обло-
ман, погружают на 3—5 мин в стерильную воду температу-
ры 45—50 °C. После заполнения вытянутый конец трубки
запаивают и помещают в стеклянный цилиндр с ватой на
дне. Через 2—3 сут в столбике агара вырастают ясно види-
мые колонии микробов-анаэробов. Выросшие колонии легко
изолировать. Для этого капилляр надрезают напильником
выше уровня намеченной колонии, надламывают, а колонию
микроба, находящуюся в агаре, извлекают петлей и пересе-
вают в свежую питательную среду.
2. Выращивание анаэробов в условиях ва-
куума. Вакуумные условия для выращивания анаэробов
создают в анаэростате или эксикаторе. Исследуемый мате-
риал или культуру микробов засевают в пробирки с жидкой
средой или в чашки Петри с плотной питательной средой.
Посевы помещают в анаэростат, затем присоединяют его к
насосу и выкачивают воздух. Степень разреженности возду-
ха определяют по показаниям вакуумметра. Колонии анаэро-
бов в вакуумных условиях растут на поверхности плотной
питательной среды.
Химические методы выращивания анаэробов (метод Ари-
стовского). Материал, исследуемый на наличие анаэробов,
засевают на среду в чашки Петри и помещают их в экси-
катор, на дно которого кладут химический поглотитель кис-
лорода: гидросульфит натрия или пирогаллол. В расширен-
ную часть сосуда устанавливают на подставке чашки с по-
севами. Прибор помещают в термостат при температуре 37 °C
на 24—48 ч.
Биологический метод выращивания анаэробов (по Форт-
неру). В чашку Петри наливают толстым слоем 5% кровяной
агар с 1—2% глюкозы. Посередине чашки в питательной
среде вырезают стерильным скальпелем канавку шириной
1—1,5 см, которая делит питательную среду на две полови-
55
ены. Одну из них засевают культурой анаэробов или иссле-
дуемым на их наличие материалом, другую половину—куль-
турой аэробов: чудесной палочкой (Serratia marcescens) или
кишечной палочкой (Е. coli). Перед посевом чашки подсуши-
вают в термостате, чтобы аэробы вместе с капельками влаги
-не могли попасть на другую сторону чашки. Засеянные чаш-
ки закрывают, а свободное пространство между дном и
крышкой заклеивают лейкопластырем, чтобы предупредить
поступление в чашку кислорода извне. В термостате чашки
устанавливают вверх дном. Быстрорастущие аэробы, погло-
щая находящийся в чашке кислород, создают тем самым бла-
гоприятные условия для роста анаэробов.
Анаэростат для культивирования анаэробов. Анаэростат —
прибор для выращивания микробов в анаэробных услови-
ях — представляет собой толстостенный металлический
•цилиндр с герметически привинчивающейся крышкой, на ко-
торой имеются вакуумметр и два крана для присоединения к
•вакуум-насосу.
МЕТОДЫ ИЗУЧЕНИЯ КУЛЬТУРАЛЬНЫХ СВОЙСТВ МИКРОБОВ
Культуральные признаки микробов определяются харак-
тером роста их на питательных средах. Будучи постоянными
.для каждого вида микроба, они являются важным диагно-
стическим признаком.
Рост микробов на плотной питательной среде. Для изуче-
ния свойств колоний микробы культивируют на плотных пи-
тательных средах в чашках Петри. При посеве материала
-стараются получить изолированный рост колоний. Чашки с
посевом просматривают сначала невооруженным глазом или
-через лупу, затем помещают их на столик микроскопа вверх
дном и просматривают колонии в проходящем свете с объ-
ективом малого увеличения и с суженной диафрагмой.
Колонии характеризуют по величине, форме, контуру
• края, рельефу, поверхности, цвету, структуре и консистенции.
Величина колонии определяется ее диаметром. В за-
висимости от диаметра различают колонии точечные (диа-
метр меньше 1 мм), мелкие (диаметр 1—2 мм), средние
(диаметр 2—4 мм) и крупные (диаметр 4—6 мм и более).
Форма колонии бывает правильная — круглая, непра-
вильная — амебовидная, ризоидная — корневидная, напоми-
нающая переплетающиеся корни деревьев.
Характер контура края определяют при рассмотре-
нии колонии под лупой или микроскопом с малым увеличе-
нием. Различают ровные края в виде четко выраженной ли-
нии и неровные. Последние делят на:
1) фестончатый край, состоящий из крупных, слегка округ-
лых или уплощенных зубцов правильной формы;
2) волнистый край, который несколько отличается от фе-
стончатого тем, что крупные зубцы его выражены нечетко;
3) эрозированный, илн зазубренный, край, состоящий из--
острых зубцов различной величины и формы;
4) бахромчатый край, имеющий нежные ворсинки.
В некоторых случаях четко выраженная линия, отграни-
чивающая колонию от поверхности среды, отсутствует. Такой
край колонии называется расплывчатым.
Рельеф колонии характеризуется приподнятостью ее-
над поверхностью питательной среды и контуром формы в.
вертикальном разрезе. Определяется рельеф колонии нево-
оруженным глазом или с лупой при рассматривании сверху
н сбоку. Различают:
1) каплеобразные и куполообразные колонии правильной
круглой формы с различно выраженной степенью выпукло-
сти, которые в вертикальном разрезе представляют собой
сегмент шара и отличаются только длиной радиуса. Коло-
нии слабовыпуклые имеют большую длину радиуса; куполо-
образные — меньшую;
2) колонии плоско-выпуклые с плоским верхом, пологими
или круто обрывающимися краями; имеют в вертикальном
разрезе форму трапеции;
3) колонии конусообразные, имеющие в вертикальном
разрезе форму треугольника;
4) колонии с приподнятой в виде соска серединой и ва-
ликом по периферии;
5) колонии с вдавленным центром;
6)' колонии плоские, стелющиеся по поверхности среды.
Поверхность колонии изучают с помощью лупы или
под микроскопом при малом увеличении. Поверхность коло-
ний бывает матовая или блестящая с глянцем, сухая или
влажная, гладкая или шероховатая. Гладкие колонии обозна-
чают буквой S (smooth), шероховатые — буквой R (rough),
что означает соответственно «гладкий» и «шероховатый». Ме-
ханизм формирования гладких и шероховатых форм колоний
обусловлен различием процессов клеточного деления. Мик-
робные клетки в колониях S-форм располагаются, соприка-
саясь своими боковыми поверхностями, клетки R-форм,
сохраняя при делении цитоплазматические мостики, об-
разуют цепочки, которые, накладываясь друг на друга, об-
условливают шероховатую поверхность и неровный край
колонии.
Переход S-форм в R-формы наблюдается при диссо-
циации. Явление диссоциации у патогенных микробов на-
блюдается под действием антибиотико- и химиотерапии, фак-
торов специфического иммунитета, формирующихся в течение
инфекционного процесса, а также при попадании микробе
в» внешнюю среду.
57
Среди шероховатых форм колоний различают: складча-
тые, гирозные, по виду напоминающие исчерченную извили-
нами поверхность мозга; бородавчатые, концентрически или
радиально исчерченные; шагреневые, т. е. мелкозернистые.
Цвет колонии определяется пигментом, который проду-
цирует культура микробов. Преобладающее большинство
патогенных бактерий пигмента не образует, вследствие чего
колонии их бесцветны или молочно-мутного цвета, похожи
на опал. В проходящем свете такие колонии в большей или
меньшей степени прозрачны. Пигментообразующие виды мик-
робов дают колонии различных цветов: кремовые, желтые,
золотисто-оранжевые, синие, красные, сиреневые, черные
и др.
Структура колоний определяется в проходящем све-
те при слабом увеличении микроскопа, суженной диафрагме
или при несколько опущенном конденсоре. У пигментирован-
ных колоний и колоний, не пропускающих света, она не опре-
деляется.
По характеру структуры различают следующие виды ко-
лоний:
1) гиалиновые — бесцветные, прозрачные, без видимой
определенной структуры;
2) зернистые, которые в зависимости от величины зерен
разделяются на мелко- и грубозернистые;
3) нитевидные или волокнистые, характеризующиеся на-
личием длинных, густо переплетающихся нитей в толще ко-
лонии.
Колонии бывают однородные и неоднородные. Строение
первых одинаково во всех частях, у вторых центральная
часть отличается от периферической или отдельные сектора
имеют строение, неодинаковое с остальной массой.
Консистенцию колонии, определяющую ее физиче-
ское состояние, исследуют посредством прикосновения или
взятия из нее части материала бактериальной петлей.
По характеру консистенции колонии бывают:
1) пастообразные, легко снимающиеся и размывающиеся
по поверхности питательной среды наподобие сливочного
масла;
2) вязкие или слизистые, прилипающие и тянущиеся за
петлей;
3) волокнистые или кожистые, плотные, снимающиеся с
поверхности питательной среды в виде упругой пленки, соот-
ветствующей величине и форме колонии;
4) хрупкие, сухие, рассыпающиеся при прикосновении
петли.
Особенности микробного роста на жидких питательных
средах. На жидких питательных средах характер роста мик-
робов менее разнообразен, чем на плотных питательных сре-
58
дах. Однако и здесь выявлены следующие формы роста бак«
терий.
1. Рост бактерий с равномерным помутив'
нием среды, цвет которой остается неизмененным или из-~
меняется в соответствии с цветом водорастворимого пигмен-
та, образующегося в культуре микроба. Такой рост хараК'
терен для многих патогенных бактерий, относящихся к груп-
пе факультативных анаэробов.
2. Придонный рост бактерий характеризуется обра-
зованием осадка на дне пробирки с жидкой питательной сре-
дой. Осадок может быть скудным или обильным, крошковид-
ным, гомогенным, волокнистым или в виде крупных рыхлых
хлопьев, по консистенции вязким, слизистым, хрупким или
пастообразным. Питательная среда над осадком может быть
прозрачной или мутной. Цвет осадка и среды, находящейся
над ним, определяется наличием пигмента, продуцируемого,
культурой микробов. Если культура пигмента не образует,
цвет среды не изменяется, а осадок приобретает, как правит
ло, серовато-белый или желтоватый цвет. Придонный рост
специфичен для бактерий с анаэробным типом дыхания.
3. Пристеночный рост бактерий выражается в том,,
что питательная среда, находящаяся в пробирке, остается
совершенно прозрачной. Бактерии растут, образуя более или
менее крупные рыхлые хлопья или, наоборот, компактные-
зерна, прикрепленные к внутренней поверхности стенок со-,
суда, с которых в зависимости от вида бактерий снимаются
легко или с трудом.
4. Поверхност н ы й рост бактерий характеризуется
появлением на поверхности жидкой питательной среды
пленки, внешний вид и характер которой могут быть раз-,
личны:
а) пленка тонкая, нежная, бесцветная, имеет вид едва,
заметного налета, исчезающего при встряхивании пробирки-
и взбалтывании среды;
б) пленка влажная, толстая, хорошо видимая простым-
глазом, вязкой, слизистой консистенции, прилипает к петле-
и тянется за ней;
в) пленка плотная, сухая, внешним видом напоминает ку-.
сочки кожи и при попытке взятия из нее материала сни-.
мается целиком в виде круглого диска, соответствующего,
диаметру пробирки:
г) пленка плотная, сухая, со сморщенной, а иногда боро-.
давчатой поверхностью, краями прикрепленная к стенкам со-,
суда; при взбалтывании жидкости или прикосновении бакте-
риальной петли разбивается на кусочки, погружающиеся в.
глубь жидкости.
Цвет пленки, как и питательной среды, зависит от пигмент
та, вырабатываемого растущей культурой микробов. Рост
5S
бактерий в виде поверхностной пленки характерен для мик-
робов-аэрофилов.
Рост на полужидкой питательной среде. Для выявления
особенностей микробного роста на полужидкой питательной
среде исследуемую культуру засевают в столбик 0,2—0,5%
полужидкого агара. Для того чтобы особенности роста про-
являлись наиболее четко, прокол среды делают в непосред-
ственной близости к стенке пробирки. Посев, произведенный
таким образом, дает возможность выявить подвижные расы
микробов идифференцировать их от неподвижных.
Подвижные микробы в столбике полужидкого агара вы-
зывают выраженное помутнение, распространяющееся более
или менее равномерно по всей толщине среды.
Неподвижные формы микробов растут только по ходу
прокола среды, напоминая сосульки цилиндрической или ко-
нической формы. При этом окружающая среда остается со-
вершенно прозрачной.
БИОХИМИЧЕСКИЕ СВОЙСТВА МИКРОБОВ
И МЕТОДЫ ИХ ИЗУЧЕНИЯ
В жизнедеятельности микробов ферменты играют боль-
шую роль. Они являются обязательными участниками разно-
образных биохимических реакций, лежащих в основе функ-
ций питания, дыхания, размножения. По характеру связи с
цитоплазменными структурами и по месту проявления своего
действия ферменты делятся на внутри- и внеклеточные. Каж-
дый вид микроорганизмов продуцирует постоянный для него
набор ферментов, одни из которых расщепляют в разной сте-
пени белки и углеводы, а другие вызывают окисление и вос-
становление различных субстратов.
Стабильность ферментативных систем бактерий позволя-
ет использовать биохимические свойства бактерий в сочета-
нии с их морфологическими, культуральными и другими по-
стоянными признаками для определения видов и типов бак-
терий.
Для обнаружения ферментов исследуемую культуру мик-
робов засевают на специальные дифференциально-диагности-
ческие питательные среды (с. 37).
Сахаролитические ферменты микробов. Свойство расщеп-
лять углеводы и высокоатомные спирты, которые принято
объединять в одну группу, именуемую сахарами, присуще
многим патогенным микробам. Под действием сахаролитиче-
ских ферментов бактерий сахара расщепляются на альдегиды
и кислоты. Конечными продуктами их расщепления явля-
ются газообразные вещества: СО2 и Н2.
Характерно, что различные виды и даже разновидности
микробов относятся по-разному к одним и тем же сахарам.
«Р
Так, например, одни бактерии, ферментируя лактозу, оста-
ются нейтральными в отношении глюкозы, другие, наоборот,
сбраживают глюкозу, а третьи, наиболее активные, вызыва-
ют расщепление и глюкозы, и лактозы.
Для обнаружения сахаролитических ферментов исследуе-
мую культуру бактерий засевают в питательные среды Гис-
са, называемые также «пестрым» рядом. «Пестрый» ряд
Гисса содержит обычно 5 пробирок: с глюкозой, лактозой,
маннитом, мальтозой и сахарозой. При некоторых исследова-
ниях для более углубленного изучения биохимических
свойств выделенного микроба ряд Гисса дополняют дульци-
том, сорбитом, ксилозой, арабинозой и некоторыми другими
сахарами.
Название «пестрый» ряд обусловлено тем, что под дей-
ствием ферментов микроба одни углеводы остаются неизмен-
ными и, следовательно, цвет питательной среды не меняет-
ся, в то время как другие сахара расщепляются, образуя
кислые продукты распада, которые изменяют цвет индикато-
ра и соответственно цвет питательной среды.
Среды Гисса бывают жидкими и полужидкими (с добав-
лением 0,2—0,5% агар-агара). В пробирки с жидкими сре-
дами Гисса для обнаружения газов, являющихся конечными
продуктами распада сахаров, опускают «поплавок» — трубоч-
ку диаметром 0,5—0,7 см, запаянную с одного конца. «По-
плавок» помещают запаянным концом кверху; при стерили-
зации он полностью заполняется питательной средой. При
образовании в среде газообразных продуктов они вытесняют
часть жидкости, находящейся в «поплавке», вследствие чего
у запаянного конца его собирается воздушный пузырек.
Для выявления газообразных продуктов, образующихся
в жидкой среде при культивировании микроорганизмов,
Я. 3. Зимин (1969) вместо «поплавков» предложил пользо-
ваться поролоновой губкой. Ее нарезают кубиками такой ве-
личины, чтобы, находясь в пробирке, они не касались ее сте-
нок. Кусочки поролона опускают в питательную среду до ее
стерилизации. При автоклавировании пузырьки газа из пор
губки вытесняются паром и после остывания заполняются
питательной средой, в связи с чем губка опускается на дно
пробирки. Если в среде, засеянной микроорганизмами, обра-
зуется газ, он задерживается в порах губки и она всплывает
на поверхность среды. При этом сквозь полупрозрачную
ткань поролона хорошо видны образующиеся пузырьки газа.
В полужидких средах Гисса газообразование определяют
по наличию мелких пузырьков газа в толще среды и стой-
кой пены на ее поверхности.
Таким образом, при изучении сахаролитических фермен-
тов, выделяемых микробами, учитывают не только явления
расщепления тех или иных сахаров по кисл о тооб разовая ню.
64
но и глубину ферментативного процесса по наличию в пита-
тельной среде конечных газообразных продуктов.
Пробирки с набором сред Гисса ставят в штатив в один
ряд. На каждой пробирке надписывают название сахара, со-
держащегося в среде. На первой пробирке каждого ряда,
кроме названия сахара, указывают номер или вид исследуе-
мой микробной культуры. Культуру берут на кончик петли
в очень небольшом количестве и засевают по общепринятой
методике (с. 48).
Протеолитические ферменты микробов. Некоторые виды
микроорганизмов продуцируют и выделяют во внешнюю сре-
ду протеолитические ферменты — протеазы, катализирующие
расщепление белков. В результате расщепления молекулы
белка образуются высокомолекулярные промежуточные про-
дукты распада — пептоны, альбумозы и полипептиды. Под
действием других протеолитических ферментов пептоны в
свою очередь расщепляются на полипептиды (соединения
двух или нескольких аминокислот) и отдельные аминокис-
лоты.
Для выявления протеолитических ферментов исследуемую
культуру микроба засевают в питательную среду, содержа-
щую тот или иной белок. Чаще всего для этой цели приме-
няют желатин, реже — свёрнутую лошадиную сыворотку, коа-
гулированный яичный белок, молоко или кусочки вареного
мяса.
Протеолитическая активность одного и того же микроба
при определении ее на разных питательных средах будет
проявляться неодинаково, что обусловлено специфичностью
ферментов. Поэтому для разных видов микробов рекоменду-
ют питательные среды различного состава.
Определение протеолитической активно-
сти микробов, а) На желатине. Мясо-пептонный
желатин (рец. 50) разливают в пробирки столбиком по 5—
6 мл. Посев производят уколом, погружая петлю с исследуе-
мой культурой в глубь питательной среды до дна пробирки.
Микробы, способные расти при низкой температуре, остав-
ляют стоять в комнате при 20—22 °C. Остальные посевы ин-
кубируют в термостате при 37 °C. Вместе с опытными про-
бирками в термостат ставят одну или две пробирки с неза-
сеянным желатином для контроля. При температуре 37 °C
желатин плавится, поэтому после инкубации пробирки, вы-
нутые из термостата, опускают в холодную воду или ставят
в холодильник. После застудневания желатина в контроль-
ных пробирках приступают к просмотру роста и учету изме-
нений в питательной среде опытных пробирок. Там, где под
действием фермента желатиназы произошло расщепление
белков желатина, отмечается разжижение питательной сре-
ды. Пробирки, в которых после суточного инкубирования сре-
62
да остается без изменения, оставляют в термостате. Наблю-
дение за изменением среды ведется в течение 20 сут. В прото-
коле исследования обязательно отмечают день появления
признаков разжижения среды, степень и характер ее разжи-
жения.
б) Н а мо лочном агаре Эйкмана. Молочный агар
Эйкмана (рец. 51), разлитый и остуженный в чашках Петри,
засевают исследуемой культурой микробов. Посев делают
петлей или шпателем так, чтобы получить изолированные ко-
лонии. Через 24—48 ч инкубации в термостате культуры,
продуцирующие протеолитический фермент, обусловливают
пептонизацию молочного белка — казеина, в результате чего
вокруг таких колоний образуются прозрачные зоны, четко
выделяющиеся на общем молочно-мутном фоне среды.
в) На свернутой кровяной сыворотке. Куль-
туру исследуемых аэробных микробов засевают на чашки,
анаэробных — уколом в столбик свернутой лошадиной сыво-
ротки (рец. 52), инкубируют в термостате при 37 °C. Штам-
мы, продуцирующие протеолитические ферменты, разжижая
питательную среду, образуют углубления вокруг колоний или
на поверхности столбика среды.
г) В бульоне с куриным яичным белком.
В пробирку с мясо-пептонным бульоном или бульоном Хот-
тингера, содержащим кусочек свернутого куриного белка
(рец. 53), вносят одну петлю исследуемой культуры микроба.
Посевы просматривают ежедневно в течение 5 дней. Протео-
литически активные культуры микробов расщепляют коагу-
лированный яичный белок; кусочки белка, содержавшиеся в
среде, заметно уменьшаются в размере, превращаясь в крош-
кообразную массу, или полностью растворяются.
Аналогичным образом проявляются протеолитические
свойства микробов в средах с кусочком вареного мяса.
Некоторые виды патогенных микробов с выраженной про-
теолитической активностью обладают способностью расщеп-
лять белок и пептон до продуктов глубокого распада: индо-
ла, сероводорода, мочевины и аммиака.
При определении видов и дифференциации разновидно-
стей патогенных микробов наибольшее значение имеет выяв-
ление двух первых продуктов: индола и сероводорода.
Определение индола в культуре микроор-
ганизмов. Индол образуется при расщеплении сложной
гетероциклической кислоты — триптофана. Для выявления
индолообразования петлю исследуемой культуры засевают в
среду Строгова (рец. 54) или другие среды, рекомендуемые
для обнаружения индола (рец. 55). Тотчас после посева в
пробирку вносят полоску индикаторной бумаги, пропитанную
раствором щавелевой кислоты (рец. 31), так, чтобы индика-
торная бумага не касалась питательной среды. Для этого
63
верхнюю треть бумажной полоски прижимают пробкой к
стенке пробирки. Посевы инкубируют 24—48 ч при темпера-
туре 37 °C. Образование индола определяют по окрашиванию
нижнего конца индикаторной бумаги в бледно-розовый цвет,
хорошо заметный в проходящем свете.
Определение сероводорода. Сероводород яв-
ляется конечным продуктом расщепления аминокислот: ци-
стина, цистеина и метионина, содержащих серу. Петлю ис-
следуемой культуры микробов засевают в пробирку с мясо-
пептонным бульоном или бульоном Хоттингера. Тотчас после
посева в пробирку вносят пропитанную ацетатом свинца по-
лоску индикаторной бумаги на определение сероводорода
(рец. 30, с. 349). В положительных случаях образующийся в
культуре сероводород вступает в соединение с бесцветным
ацетатом свинца и превращается в сульфат свинца, который
придает индикаторной бумаге черно-бурое окрашивание.
Окончательный учет результатов на образование индола
и сероводорода проводят на 7—10-й день после посева, так
как процесс ферментативного расщепления белка и образова-
ния конечных продуктов распада происходит иногда в тече-
ние длительного времени.
Окислительн о-в осстановительные фермен-
ты. В культуре микробов могут быть обнаружены окисли-
тельно-восстановительные ферменты, связанные главным об-
разом с дыхательной функцией микроорганизма.
Как известно, процесс окисления субстрата может про-
исходить посредством присоединения к нему кислорода с
участием ферментов оксидаз или в результате отщепления
от него водорода с участием ферментов дегидраз. Для этого
типа реакции характерно то, что окисление какого-либо од-
ного вещества всегда сопровождается восстановлением (ре-
дукцией) другого органического вещества. Первое вещество,
от которого отщепляется водород, называют донатором, а то
вещество, к которому он присоединяется, — акцептором.
Акцептором водорода чаще всего является кислород воз-
духа, однако им могут быть также многие органические со-
единения, способные легко окисляться и восстанавливаться.
С целью выявления ферментов дегидраз и определения
их активности в практике микробиологических исследований
предложен метод, основанный на введении в питательную
среду органической краски, выполняющей роль акцептора
водорода. В результате присоединения водорода краситель
восстанавливается, превращаясь в бесцветное соединение,
называемое лейкобазой. При обильном доступе кислорода
оно может вновь окислиться и приобрести прежний цвет.
В качестве акцептора водорода используют метиленовый
синий, лакмусовую настойку, малахитовый зеленый, индиго-
кармин, нейтральный красный и др.
64
Для выявления редуцирующих свойств микроба указан-
ные красители добавляют к обычным питательным средам:
мясо-пептонному бульону, мясо-пептонному агару, молоку.
Один и тот же вид микроба ведет себя неодинаково по
отношению к краскам разного состава. Это свойство микро-
ба использовано в микробиологической практике в качестве
дифференциального признака. Бактерии брюшного тифа ре-
дуцируют метиленовый синий, но не редуцируют лакмуса и
не изменяют нейтрального красного в противоположность ки-
шечной палочке, которая остается нейтральной в отношении
метиленового синего, но восстанавливает лакмус и нейтраль-
ный красный.
Определение редуцирующей способности.
1. В 5 мл среды — молока е метиленовым синим (рец. 48) —
засевают петлю исследуемой культуры с плотной питательной
среды или 0,1 мл 18-часовой бульонной культуры и после
24 ч инкубации учитывают результаты роста. При положи-
тельной реакции на редукцию метиленового синего среда из
голубой становится кремового цвета, а при слабоположи-
тельной — приобретает зеленоватое окрашивание.
2. Пробирки с лакмусовым молоком, средой Минкевича
(рец. 49) засевают так же, как молоко с метиленовым синим,
суточной культурой с плотной или жидкой питательной сре-
ды. Посевы инкубируют в термостате в течение 10 дней, еже-
дневно наблюдая за изменением цвета среды. Редукция лак-
муса проявляется полным обесцвечиванием молока, имеюще-
го розовато-сиреневый цвет до посева. В протоколе иссле-
дования редукцию лакмуса обозначают буквой Р.
Среда Минкевича позволяет также выявлять кислото- или
щелочеобразование, выражающееся соответственно в покрас-
нении или посинении молочной среды. Образование кислоты
обозначается буквой К, щелочи — буквой Щ.
Определение фермента каталазы. Некоторые
виды микроорганизмов, принадлежащие к группе аэробов,
в процессе дыхания образуют перекись водорода, являющую-
ся клеточным ядом. Количество перекиси водорода в культуре
никогда не достигает высоких концентраций, так как по ме-
ре образования перекись расщепляется на воду и молекуляр-
ный кислород при участии фермента каталазы. На поверх-
ность микробной культуры, выращенной на плотной пита-
тельной среде в чашке Петри, наносят 1—2 мл 1% раствора
перекиси водорода так, чтобы она покрывала поверхность
культуры тонким слоем. Появление пузырьков газа в слое
нанесенной жидкости свидетельствует об образовании кис-
лорода в результате расщепления перекиси водорода под
действием каталазы. Подобный результат в протоколе опыта
отмечается знаком + как положительный результат реакции
на каталазу.
5 Лабинская А. С. 65
МЕТОДЫ ИЗУЧЕНИЯ МИКРОБНОГО АНТАГОНИЗМА
И ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ
ПАТОГЕННЫХ БАКТЕРИЙ К АНТИБИОТИКАМ
Явления антагонизма в мире микробов распространены
очень широко. Антагонистические взаимоотношения проявля-
ются в невозможности совместного существования некоторых
микробных видов вследствие того, что одни из них препят-
ствуют размножению других, задерживая или вызывая их
гибель. Так, например, установлено, что представители нор-
мальной микрофлоры человеческого тела проявляют антаго-
низм в отношении многих патогенных и гнилостных бактерий,-
Изучение явлений микробного антагонизма привело к от-
крытию специфических антибактериальных веществ, проду-
цируемых бактериями и грибами в окружающую среду. Они
получили название антибиотиков (от греч. anti — против и
bios — жизнь).
В настоящее время существует много антибиотиков, вы-
деленных из бактерий, грибов и актиномицетов. Однако прак-
тическое применение в качестве лечебных препаратов нашли
только немногие из них.
Каждый антибиотик действует на определенные чувстви-
тельные к нему виды бактерий.
Рациональная антибиотикотерапия инфекционных заболе-
ваний основывается на результатах бактериологической диа-
гностики заболевания с выделением и идентификацией воз-
будителя. При этом очень важно располагать сведениями о
чувствительности возбудителя болезни к антибактериальному
препарату, избранному для лечения.
В клинической практике чувствительными к антибиотикам
считаются те микроорганизмы, на которые испытуемый ан-
тибиотик в концентрации, достигаемой в очаге инфекции,
оказывает бактериостатическое или бактерицидное действие.
При лабораторном испытании мерой чувствительности мик-
роорганизмов к антибиотикам является минимальная кон-
центрация препарата, подавляющая рост возбудителя забо-
левания при стандартных условиях постановки опыта.
Деление микроорганизмов на устойчивые и чувствитель-
ные осуществляется на основании соотношения минимальной
ингибирующей рост микроорганизмов концентрации препара-
та (определенной в лабораторных условиях) и концентрации
этого же препарата, создаваемой в очаге инфекции при вве-
дении терапевтических доз. При соотношении:
МИК (минимальная ингибирующая концентрация антибиотика)
К (концентрация препарата в очаге инфекции) <
можно говорить о чувствительности возбудителя к исследуе-
мому антибиотику.
66
По степени чувствительности к антибиотикам патогенные
микроорганизмы подразделяются на 4 группы:
. 1) чувствительные — обычные терапевтические до-
зы антибиотиков оказываются достаточными для достижения
лечебного эффекта при общих заболеваниях;
2) среднечувствительные — лечебный эффект пре-
парата при общих заболеваниях достигается только в резуль-
тате назначения повышенных доз антибиотиков;
3) умеренно устойчивые — лечебный эффект до-
стигается только при локализации инфекционного очага в ме-
сте, где происходит концентрация антибиотика, или если ан-
тибиотик может быть введен непосредственно в очаг ин-
фекции;
4) устойчивые — лечебный эффект при назначении
антибиотика отсутствует.
Определение чувствительности возбудителя имеет особен-
но большое значение при выборе антибактериальных пре-
паратов для лечения больных с хроническими, затяжны-
ми, вялыми формами инфекции, которые сопровождают-
ся угнетением иммунологической реактивности макроор-
ганизма.
Изучение чувствительности возбудителя к антибиотикам
играет не менее важную роль в тех случаях, когда для ле-
чения больных используются препараты, в отношении кото-
рых легко формируются устойчивые формы микроорганизмов
(стрептомицин, тетрациклин, рифампицин и др.).
В настоящее время предложены критерии чувствительно-
сти микроорганизмов только для некоторых антибиотиков
(табл. 5).
Культуры микробов для исследования на чувствитель-
ность следует выделять из организма больных до начала ле-
чения, так как под воздействием назначаемых антибактери-
альных препаратов рост возбудителей заболевания может
быть полностью угнетен.
Материал для посева рекомендуется брать из очага ин-
фекции непосредственно, а в тех случаях, когда это невыпол-
нимо, из соответствующего отделяемого (моча при пиелонеф-
рите, мокрота при воспалительных процессах в легких
и т. д.).
При обнаружении в патологическом материале несколь-
ких видов условно-патогенных микроорганизмов необходимо
установить, какой из них является ведущим в происхождении
текущего инфекционного процесса. В решении этого вопро-
са большое вспомогательное значение имеют методы коли-
чественного учета микроорганизмов, так как преобладание, в
патологическом материале какого-либо одного вида микро-
бов свидетельствует, как правило, о причастности его к этио-
логии данного патологического процесса.
5*
67
Таблица 5
Классификация микроорганизмов по степени чувствительности
к антибиотикам (МИК в мкг/мл или ЕД/мл)
Антибиотик Группа микроорганизмов
I п III IV
чувствитель- ные среднечув- ствительные умеренно устойчивые устойчивые
Пенициллин Пенициллин Метициллин* Ампициллин* Карбенециллии Цефалоспорины Стрептомицин* Канамицин* Неомицин* Г ентамицин Левомицетин* Препараты тетрацик- линового ряда Эритромицин Линкомицин* 0,25 0,25 2 0,25 X 2 4 4 4 0,5 1 1 1 16 4 X 16 16 16 X X X 4 8 4 4 128 128 X 128 128 128 128 128 128 64 X 64 64 128 128 X 128 128 128 128 128 128 64 X 64 65
Примечание. + означает, что критерии чувствительности относятся ко всем
лекарственным формам названного антибиотика, х — группа не установлена.
Если выяснение истинного возбудителя болезни не удает-
ся или патологический процесс вызван микробной ассоциа-
цией, чувствительность к антибиотикам необходимо исследо-
вать раздельно у всех видов микроорганизмов (входящих в
состав ассоциации), выделенных в чистой культуре.
Чувствительность микробов к антибиотикам определяется
методом диффузии в агар с применением стандартных
бумажных дисков или методом разведения в
жидких и плотных питательных средах.
Определение чувствительности микробов к антибиотикам
методом диффузии в агар с применением дисков. Стандарт-
ные диски, выпускаемые отечественной промышленностью
(Московский завод медицинских препаратов № 2), представ-
ляют собой кружки диаметром 5 мм, приготовленные из опре-
деленных сортов фильтровальной бумаги и пропитанные ан-
тибиотиками такой концентрации, которая обусловливает
одинаковый диаметр зон задержки роста (28—32 мм) чув-
ствительных тест-микробов. Для удобства работы диски с
различными антибиотиками окрашивают в контрастные цве-
та (желтый, зеленый, голубой, сиреневый и др.). Метод диф-
фузии в агар для определения чувствительности микробов к
антибиотикам вследствие простоты и доступности выполнения
в настоящее время используется всеми практическими лабо-
68
раториями. Соблюдение стандартных условий при постанов-
ке опытов способствует получению более точных результатов,
обеспечивая тем самым 'возможность их сопоставления.
Техника постановки опыта. Стерильные чашки
Петри диаметром 100 мм устанавливают на строго горизон-
тальную поверхность, наливают в них 2% мясо-пептонный
агар (pH 7,2—7,4) в количестве 20 мл для создания опти-
мальной толщины слоя, равной 4—5 мм. Для тех видов мик-
робов, которые не растут на мясо-пептонном агаре, как, на-
пример, стрептококки, пневмококки и др., применяют 5% кро-
вяной или сывороточный агар. Перед посевом чашки со сре-
дой подсушивают в термостате для лучшей диффузии засе-
ваемого материала в питательную среду.
Для засева чашек используют чаще всего 18—20-часовые
(при интенсивном росте 4—5-часовые, при замедленном ро-
сте 2—3-суточные) бульонные и агаровые культуры микро-
бов. Из агаровых культур готовят микробную взвесь, содер-
жащую 1 млрд, микробных тел в 1 мл.
На поверхность подсушенной среды наносят исследуемую
культуру микробов в объеме 1 мл. Посредством покачивания
чашки культуру равномерно распределяют по поверхности
среды с последующим отсасыванием избытка жидкости пи-
петкой. Засеянные чашки 30—40 мин подсушивают при ком-
натной температуре, затем на поверхность засеянной и под-
сушенной среды с помощью стерильного остроконечного пин-
цета кладут диски, пропитанные разными антибиотиками.
Каждый диск слегка прижимают браншами пинцета, чтобы
он плотно прилегал к поверхности агара. Диски должны на-
ходиться на равном расстоянии друг от друга и на расстоя-
нии 2—2,5 см от края чашки. Каждая чашка может служить
для одновременного испытания штамма к действию 5—
8 антибиотиков. Засеянные чашки с нанесенными на них
дисками на 18 ч помещают в термостат при 37 °C вверх дном,
чтобы избежать попадания конденсационной воды на по-
верхность посевов.
Антибиотическое вещество, находящееся в диске, диффун-
дирует в агар, формируя вокруг диска зону угнетения роста
чувствительных к нему бактерий. Провес диффузии анти-
биотика в агар заканчивается через 3—4 ч после нанесения
диска. Наибольшая концентрация антибиотика отмечается
в месте расположения диска; по направлению к периферии
содержание его снижается.
Бактерии, чувствительные к антибиотикам, образуют во-
круг соответствующих дисков зоны угнетения роста, четко
выделяющиеся на фоне сплошного микробного роста. Изме-
рение зоны угнетения производят с помощью циркуля или
миллиметровой линейки. Измеряемый диаметр зоны должен
проходить через центр диска.
69
При зоне задержки роста микроба диаметром до 10 мм?
штамм расценивается как малочувствительный, зона задерж-
ки микробного роста более 10 мм свидетельствует о чувстви-
тельности штамма к исследуемо'му антибиотику’.
Определение чувствительности бактерий к антибиотикам?
методом серийных разведений. Сущность данного метода сво-
дится к выявлению роста исследуемой микробной культуры
в ряду пробирок с питательной средой, содержащей разные-
концентрации антибиотиков.
Метод серийных разведений позволяет определить мини-
мальную концентрацию антибиотика, ингибирующую рост
изучаемого микроорганизма.
Техника постановки опыта относительно проста.
Из порошка антибиотика (желательно стандарта) делают
навеску и растворяют стерильной дистиллированной водой из
такого расчета, чтобы в 1 мл раствора содержалось
2000 мкг/ЕД. Некоторые антибиотики в указанной концент-
рации в воде не растворяются, для этого нужно специальные
растворители.
Например, антибиотики группы тетрациклина (хлортетра-
циклин, террамицин) растворяют в 0,01 N растворе соляной
кислоты. Для растворения левомицетина и синтомицина при-
меняют 96% этиловый спирт (0,3 мл спирта на 1 мг антибио-
тика), а для эритромицина — химически чистый метиловый
спирт (0,1 мл спирта на 1 мг препарата). После полного рас-
творения антибиотиков в спирте приливают дистиллирован-
ную воду из такого расчета, чтобы общий объем растворите-
ля равнялся 1 мл на 200 мкг препарата.
Из полученного основного раствора готовят все после-
дующие разведения антибиотиков, руководствуясь табл. 6.
Диапазон серии разведений определяется установленными
критериями чувствительности микроба. Для приготовления
основного раствора антибиотика и добавления его в первую1
пробирку рекомендуется пользоваться отдельной стерильной
пипеткой. В дальнейшем отдельные пипетки используются
для каждой группы разведений (пробирки 2, 3, 4; пробир-
ки 5, 6, 7 и т. д.). Полученные растворы антибиотиков раз-
ливают в стерильные пробирки по 1 мл. Для этой цели мо-
жет быть использована одна пипетка при условии, что раз-
ливка антибиотиков по пробиркам будет осуществляться от
меньших к большим концентрациям раствора.
Для разведения антибиотиков служат стандартные пита-
тельные среды (мясо-пептопный бульон, бульон на переваре
Хоттингера, pH 7,2—7,4), обеспечивающие оптимальные усло-
1 «Об унификации методов определения чувствительности микроорга-
низмов к химиотерапевтическим препаратам». Приказ Министерства здраво-
охранения СССР № 250 от il 3 марта 1975 г.
70
вия роста исследуемого вида и не содержащие веществ, по-
давляющих действие антибиотиков.
В приготовленные разведения антибиотика вносят бульон-
ные культуры микроорганизмов в логарифмической или ран-
ней стационарной фазе роста. Для большинства патогенных
микроорганизмов этот период соответствует 16—18 ч; для не-
которых видов, рост которых замедлен, — 48 ч культивирова-
ния. В соответствии с действующим приказом № 250 от
13 марта 1975 г. «Об унификации методов определения чув-
ствительности микроорганизмов к химиотерапевтическим
препаратам» вместо бульонных культур допускается исполь-
зование агаровых культур, которые разводят бульоном и
стандартизируют до содержания 105—106 микробных тел в
1 мл. Бульонную культуру или взвесь агаровой культуры ис-
следуемых бактерий в бульоне добавляют в объеме 1 мл к
каждому разведению антибиотика. При этом концентрация
антибиотика в пробирке становится в 2 раза ниже. Все ряды
пробирок включают по одной контрольной пробирке, содер-
жащей 1 мл бульона без антибиотика и 1 мл культуры каж-
дого испытываемого штамма.
После внесения микробной культуры штатив с пробирка-
ми помещают в термостат при 37 °C на 16—20 ч. По истече-
нии указанного срока инкубации учитывают полученные ре-
зультаты, отмечая последнюю пробирку с отчетливо види-
мой задержкой микробного роста. Количество антибиотика
в этой пробирке представляет собой минимальную ингиби-
рующую концентрацию для испытываемого штамма, опре-
деляющую степень чувствительности его к данному антибио-
тику.
Определение содержания антибиотиков в жидкостях и тка-
нях организма методом серийных разведений. Эффективность
действия антибиотиков при лечении инфекционных заболева-
ний определяется не только чувствительностью микробов к
применяемому препарату, но и той концентрацией его, кото-
рая создается в организме в процессе проводимой антибио-
тикотерапии.
Среди методов определения содержания антибиотиков в
жидкостях и тканях организма особого внимания заслужи-
вает метод серийных разведений Флеминга, модифицирован-
ный 3. В. Ермольевой и Е. А. Ведьминой.
Техника постановки опыта. Необходимые ингре-
диенты:
1) сыворотка крови (или другая жидкость), исследуемая
на концентрацию содержащегося в ней антибиотика;
2) питательная среда Гисса (pH 7,2) с глюкозой и инди-
катором Андреде (рец. 44);
3) раствор антибиотиков-стандартов;
4) стандартная взвесь тест-микроба.
71
Таблица &•
Схема приготовления разведений антибиотиков для метода серийных
разведений
№ пробирки Приготовление разведений антибио- тиков Концентрация антибиотиков в полученном растворе, ЕД/мл или мкг/мл Окончательная кон- центрация антибио- тика в мкг/мл или ЕД/мл в смеси 1 мл раствора антибиоти- ков и 1 мл инокулята в бульоне
раствор антибио- тика. мл концентрация раствора антибиотика, мкг/мл объем до- бавляе- мого бульона, мл
1 (2 2000 13,62 256 -'' 'Я. 128
2 2 256 2 128 64
3 1 256 3 64 32
4 ; 1 256 7 32 16
5 2 32 2 16 8
6 1 32 3 8 4
7 1 32 7 4 2
8 2 4 2 2 1
9 1 4 3 1 0,5
10 1 4 7 0,5 0,25
11 2 0,5 2 0,25 0,125
12 1 0,5 3 0,125 5 0,063
13 1 0,5 7 0,0631 0,031
14 1 0,063 2 *"» 0.03Р 0,016
Для определения концентрации пенициллина, антибиоти-
ков тетрациклинового ряда и эритромицина в качестве тест-
микроба используют культуру золотистого стафилококка-
(штамм Р-209).
В штатив устанавливают два ряда стерильных пробирок
(10 в первом и 9 во втором ряду). Первый ряд пробирок
предназначен для разведения стандарта-антибиотика, вто-
рой— для разредения сыворотки (или другой жидкости), ис-
следуемой на концентрацию содержащегося в. ней антибио-
тика. Неизвестная активность антибиотика (содержащегося
в пробирках второго ряда) сопоставляется со стандартом
того же антибиотика (пробирки первого ряда), активность
которого известна в каждой пробирке ряда.
В пробирки обоих рядов разливают по 0,5 мл среды Гис-
са, зараженной культурой золотистого стафилоккока (штамм
Р-209), из расчета 1000 микробных тел на 1 мл питательной
среды. В 1-ю пробирку первого ряда прибавляют 0,5 мл рас-
твора соответствующего антибиотика-стандарта с заведомо
известным количеством единиц в 1 мл. Содержимое пробир-
ки тщательно перемешивают, после чего 0,5 мл переносят из
1-й пробирки во 2-ю, из 2-й в 3-ю и т. д. до 9-й пробирки
включительно. Последняя, 10-я, пробирка, являющаяся кон-
тролем роста стафилококка, антибиотика не содержит.
К содержимому 1-й пробирки второго ряда прибавляют
0,5 мл исследуемой сыворотки. Как и в предыдущем случае,.
72
содержимое пробирки тщательно перемешивают, после чего
Ф,5 мл из 1-й пробирки переносят во 2-ю, из 2-й — в 3-ю
и т. д. до 9-й пробирки включительно. Из последней про-
бирки лишние 0,5 мл выливают в банку с дезинфицирующим
раствором. В результате получается ряд последовательных
двукратных разведений исследуемой сыворотки (1:2, 1:4,
1:8, 1 :16... 1 :512). Штативы с пробирками ставят в термо-
стат при 37 °C на 16—18 ч, затем учитывают полученные ре-
зультаты.
Рост стафилококка сопровождается не только помутнени-
ем, но и окрашиванием среды в розовый цвет вследствие
сбраживания глюкозы и смещения pH в кислую зону. Кон-
центрация антибиотика в исследуемой жидкости, выраженная
в единицах на 1 мл, определяется умножением наибольшего
разведения исследуемой сыворотки, задерживающего рост
тест-микроба (последняя пробирка с прозрачной средой, не
изменившей своей окраски, во втором ряду пробирок), на ми-
нимальную концентрацию стандарта-антибиотика, задержи-
вающую рост того же тест-микроба в первом ряду пробирок.
МЕТОДЫ ИЗУЧЕНИЯ СВОЙСТВ БАКТЕРИОФАГА
И ЯВЛЕНИЯ БАКТЕРИОФАГИИ
В 1917 г. французский ученый д’Эрелль отметил, что
фильтрат испражнений человека, выздоравливающего после
дизентерии, обладает способностью вызывать просветление
бульонной культуры одноименных бактерий. Просветление
микробной взвеси было обусловлено лизисом, т. е. растворе-
нием находящихся в ней микробных клеток.
Агент, вызывающий растворение микробных клеток,
д’Эрелль назвал бактериофагом, а явление в целом — фено-
меном бактериофагии, что в дословном переводе означает
«пожирание бактерий». \
При дальнейшем изучении оказалось, что бактериофаг
представляет собой разновидность вирусов, вызывающих по-
ражение и гибель бактерий. Как и все вирусы, бактериофа-
ги ведут паразитический образ жизни, хозяевами их являются
бактерии. Размножение бактериофага возможно только в
живых клетках, находящихся в стадии деления. В процессе
размножения фагов были выявлены последовательные этапы:
1) адсорбция частиц фага на поверхности микробной клетки;
2) проникновение фага в микробную клетку; 3) образование
внутри бактериальной клетки фаговых частиц; 4) лизис клет-
ки и освобождение активных частиц фага.
Период от момента инфицирования клетки бактериофагом
и началом ее лизиса называется латентным. Продолжитель-
ность латентного периода у одних фагов исчисляется мину-
тами, у других — часами. Количество корпускул, образую-
73
щихся в теле микробной клетки, может колебаться от не-
скольких десятков до несколько сотен.
При некоторых условиях бактериофаг, проникая в мик-
робную клетку, включается в геном клетки и существует в-'
ней, не вызывая лизиса. Такой симбиоз микробной клетки с
фагом получил название лизогении, а культуры, которые
содержат фаг, не лизируясь, были названы лизогенными.
Следовательно, лизогенные культуры устойчивы к фагу, ко-
торый они несут. Соответственно фаги, находящиеся в
лизогенных бактериях, получили название умеренных в
отличие от фагов вирулентных, которые вызывают ли-
зис культуры микробных клеток и освобождение размножаю-
щегося фага.
Связь, имеющаяся между фагом и лизогенной культурой,
стойко передается по наследству.
В настоящее время доказано существование огромного
количества фагов, каждый из которых паразитирует в опре-
деленном виде бактерий.
Специфичность различных фагов выражена неодинаково:
одни из них лизируют культуры микробов определенного ви-
да (моновалентные фаги), другие — только отдельные штам-
мы или варианты внутри одного и того же микроба (типо-
вые фаги), третьи, так называемые поливалентные фаги, вы-
бывают лизис клеток различных родственных видов микро-
бов. В практике микробиологии специфичность моновалент-
ных фагов используют для определения видов микробов, вы-
деляемых из патологического материала и объектов внешней
среды. Резко выраженные избирательные свойства типовых
фагов позволяют разделить микробов одного и того же вида
на различные фаготип ы. В естественных условиях фаго-
тип бактерий характеризуется большой стабильностью. На-
пример, при обследовании больных было установлено, что на
протяжении всего заболевания из организма обследуемых
высеваются культуры микробов одного и того же типа. В ре-
зультате длительного хранения и частых пассажей на искус-
ственных питательных средах фаготип микроба также не из-
менялся.
ВЫДЕЛЕНИЕ БАКТЕРИОФАГА ИЗ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА И ОБЪЕКТОВ ВНЕШНЕЙ СРЕДЫ
Как отмечено выше, фагу присущи резко выраженные па-
разитические свойства, обусловливающие возможность су-
ществования и размножения его только в культурах соответ-
ствующего вида микроба. На этом основании присутствие-
бактериофага можно рассматривать как косвенный показа-
тель загрязненности исследуемого материала соответствую-
щей микрофлорой. Определенные фаги можно искать там,,
где обитают пх хозяева— микробы.
74
В практике микробиологии обнаружение бактериофага
^производят в том случае, когда выделение культуры микро-
•ба не дает положительных результатов, например вследствие
чрезмерно малого количества этих микробов в исследуемом
'субстрате или сильного загрязнения его посторонней микро-
флорой.
В настоящее время разработаны различные методы каче-
ственного обнаружения фага в исследуемом материале.
В основу всех методов положен феномен бактериофагии
д’Эрелля, для проявления которого исследуемый материал
засевают совместно с гомологической культурой микробов
на плотные и жидкие питательные среды. Культуры микро-
бов, чувствительные к выделяемому бактериофагу, принято
называть тест-культурами.
Прямой метод выделения бактериофага из
исследуемого материала. Исследуемую жидкость
фильтруют от микробов. Твердый исследуемый материал
(образцы почвы, пищевые продукты, оформленные испраж-
нения) предварительно измельчают в ступке, эмульгируют,
•фильтруют вначале через бумажный, а затем через бактери-
альный фильтр. Наличие фага в полученном фильтрате опре-
деляют в жидких питательных средах или на плотных средах
по методу Отто или Грациа (см. с. 76).
Выделение бактериофага методом обога-
щения «без подсева». Исследуемый материал засева-
ют в жидкую питательную среду, являющуюся наиболее пол-
ноценной для развития тех микроорганизмов, против кото-
рых ищут бактериофаг. Посевы ставят в термостат и инку-
бируют яри оптимальной температуре 18—20 ч. По истечении
указанного срока сосуды с посевами вынимают из термоста-
та и фильтруют предварительно через бумажный, а затем
через бактериальный фильтр. \
Полученные фильтраты испытывают на присутствие в них
'бактериофага на плотных и жидких питательных средах.
В основу этого метода положен принцип создания наибо-
лее благоприятных условий для размножения находящихся
в исследуемом материале бактерий и соответствующего им
бактериофага, который предполагается выделить.
Выделение бактериофага методом обога-
щения «с подсевом». Жидкий исследуемый материал
непосредственно, а плотный после предварительного измель-
чения в ступке засевают в мясо-пептонный бульон или дру-
гую жидкую питательную среду. Одновременно с исследуе-
мым материалом в питательную среду вносят 0,5—1 мл су-
точной бульонной культуры бактерий, гомологичных выде-
.ляемому фагу. Для контроля культуру бактерий, применяе-
мую для обогащения, засевают в стерильную питательную
-среду.
75
Сосуды с посевами ставят в термостат при 37 °C на 18—
24 я. После инкубации из опытной и контрольной пробирок
берут по нескольку миллилитров жидкости и фильтруют от-
дельно через бактериальные фильтры. Полученный фильтрат
исследуют на присутствие бактериофага, гомологичного бак-
териям, примененным для обогащения.
Сущность данного метода заключается в предваритель-
ном обогащении исследуемого материала клетками того мик-
роорганизма, к которому ищут бактериофаг. Бактерии, вне-
сенные в исследуемый материал, начинают размножаться,,
и вместе с ними увеличивается количество фага.
КАЧЕСТВЕННЫЕ ПРОБЫ ДЛЯ ОБНАРУЖЕНИЯ
БАКТЕРИОФАГА В ЖИДКИХ И НА ПЛОТНЫХ
ПИТАТЕЛЬНЫХ СРЕДАХ
Обнаружение бактериофага в жидкой пита-
тельной среде. Два сосуда (пробирки или колбы) с пи-
тательными средами засевают одной и той же культурой мик-
роба, гомологичной искомому фагу. Одновременно с посе-
вом или после 3—4-часового инкубирования в термостате в.
один из сосудов (опытный) вносят фильтрат исследуемого
материала. Второй сосуд, содержащий питательную среду,
засеянную культурой микробов, является контролем. Оба со-
суда ставят в термостат при 37 °C и через 24 ч учитывают
результаты.
При учете результатов (по Уварову) возможны следую-
щие варианты.
1. Содержимое опытного сосуда прозрачно, в контроле —
помутнение питательной среды. Полученные данные указыва-
ют на содержание в исследуемом фильтрате бактериофага'
высокой активности.
2. В опытном сосуде имеется менее выраженное по срав-
нению с контролем помутнение среды. Это^свидетельствует
о содержании в исследуемом материале бактериофага сред-
ней активности.
3. При одинаковом помутнении в обоих сосудах для окон-
чательного заключения об отсутствии бактериофага необхо-
димо произвести дополнительное исследование: высев на
плотную питательную среду содержимого опытной и конт-
рольной пробирок. Высев делают на среду в чашки Петри
шпателем, чтобы получить оплошной рост микробов. Чашки
ставят в термостат и после 24 ч инкубирования при 37 °C
учитывают результаты. Посев из контрольного сосуда дает-
сплошной рост микробов. При наличии фага в исследуемом
материале на фоне сплошного роста микробов появляются;
стерильные пятна — колонии бактериофага.
Обнаружение бактериофага на плотных пи-
тательных средах по методу Отто. Мясо-пептон-
76
ный агар 1,5% разливают в чашки Петри (более высокая кон-
центрация агара угнетает развитие негативных колоний
бактериофага). После застудневания питательную среду за-
севают 16—18-часовой бульонной культурой бактерий, гомо-
логичных искомому фагу. Для получения сплошного роста
2—3 капли культуры, нанесенные в центре чашки, растирают
шпателем равномерно по всей ее площади. Спустя 5—10 мин
после посева на подсушенную поверхность питательной среды
наносят каплями исследуемый фильтрат. На одной чашке
можно поставить несколько проб. Для этого по дну чашки
намечают разделение питательной среды на секторы и в
каждый сектор вносят по капле фильтрата. После того как
жидкость впитается в среду, чашки перевертывают вверх
дном и ставят в термостат при 37 °C на 18—24 ч.
Учет результатов: доказательством наличия бактериофага
служит полное отсутствие роста культуры в месте попадания
капли фильтрата (активный бактериофаг) или появление в
этом участке мелких стерильных пятен — колоний бактерио-
фага (бактериофаг слабой активности).
Обнаружение -бактериофага на плотных пи-
тательных средах двухслойным методом Гра-
ц и а. Мясо-пептонный агар 1,5% разливают в чашки Пет-
ри в количестве 25—30 мл (первый слой). После застудне-
вания среды чашки ставят на Р/г—2 ч для подсыхания.
В пробирку с 2,5 мл 0,7% расплавленного и остуженного до
температуры 45 °C агара вносят 1 мл исследуемого фильтра-
та и 0,1 мл густого смыва суточной агаровой культуры, соот-
ветствующей искомому фагу. Содержимое пробирок быстро
перемешивают, чтобы не произошло застудневания агара,
и выливают .в ту же чашку вторым слоем. После застуднева- \
ния агара посев ставят в термостат при 37 °C. Учет результа-
тов, как правило, возможен через 5—8 ч инкубации в термо-
стате. Присутствие бактериофага определяют по наличию
прозрачных пятен, хорошо видимых на матовом фоне глубин-
ного роста бактерий.
ТИТРОВАНИЕ БАКТЕРИОФАГА
После выявления бактериофага в исследуемом материале
необходимо определить его количественное содержание или,
как принято говорить, найти титр фага.
Для выражения титра бактериофага можно пользоваться
двумя показателями: количеством активных корпускул бакте-
риофага, содержащихся в 1 мл исследуемой жидкости бакте-
риофага, или величиной наибольшего разведения исследуе- ,
мой жидкости, при котором бактериофаг проявляет свое ли-
тическое действие. Полученную при этом величину выражают
отрицательным логарифмом 10, где степень указывает разве:
дение фага. Средний титр бактериофага составляет 10~7.
77
Для титрования бактериофага предложены различные ме-
тоды, однако наибольшее распространение получили способ
титрования фага в жидкой питательной среде, предложенный
Аппельманом, и метод агаровых слоев Грациа.
Титрование бактериофага в жидкой пита-
тельной среде по методу Аппельмана. Метод
Аппельмана основан на внесении различных количеств тит-
руемого бактериофага в бульон, засеянный одной и той же
дозой культуры гомологичных микробов, с целью получения
феномена бактериофагии.
Двенадцать пробирок, содержащих по 4,5 мл мясо-пеп-
тонного бульона, ставят в штатив в один ряд. В 1-ю пробир-
ку стерильной пипеткой вносят 0,5 мл исследуемого фага.
Содержимое пробирки перемешивают и 0,5 мл жидкости из
1-й пробирки переносят во 2-ю, из 2-й — в 3-ю и т. д. до 10-й
включительно. Из 10-й пробирки лишние 0,5 мл выливают1;
11-я и 12-я пробирки контрольные. Переносят жидкость из
одной пробирки в другую каждый раз отдельной стерильной
пипеткой емкостью 1 мл. Таким образом, в 10 пробирках по-
лучают разведения бактериофага от 1 : 10 до 1 : 10-10.
Во все 10 пробирок приготовленного ряда разведений вно-
сят по 0,2 мл 18—24-часовой бульонной культуры бактерий,
одноименных титруемому фагу. Прибавляемая культура не
должна содержать устойчивых к фагу клеток.
Густота микробной взвеои, прибавляемой в пробирки с
титруемым бактериофагам, существенного значения не име-
ет, так как опытным путем (Л. Д. Переметана) было уста-
новлено, что изменение микробной концентрации в пределах
100000—4 500 000 в 1 мл не оказывает заметного влияния па
исход титрования бактериофага. Пробирка 11-я — контроль
культуры, содержит 5 мл бульона и 0,2 мл бульонной куль-
туры микробов. Пробирка 12-я — контроль на стерильность,
содержит 5 мл бульона без добавления культуры и фага.
Штатив с пробирками помещают в термостат\при 37 °C на
18—20 ч.
Учет результатов производят через 18—20 ч после инку-
бации в термостате при 37°C. Титром считают то макси-
мальное разведение бактериофага, при котором наблюдается
полный лизис чувствительной к нему культуры. Практически
это соответствует той последней пробирке в ряду, в которой
бульон еще остается совершенно прозрачным.
Титрование бактериофага на плотной пи-
тательной среде по методу агаровых слоев
Грациа. Метод агаровых слоев Грациа основан на вне-
сении различных разведений титруемого бактериофага в со-
1 При получении серийных .разведений с целью экономии сред и бакте-
риофага можно уменьшить объемы в 5 раз: вместо 4,5 мл мясо-пептонпого
бульона брать 0,9 мл и вместо 0,5 мл фага — 0J1 мл.
78
ответствующую культуру бактерий и посеве смеси на плот-
ную питательную среду с целью получения негативных коло-
ний бактериофага.
Накануне постановки опыта готовят питательные среды.
В чашки Петри разливают 1,5% мясо-пептонный агар в ко-
личестве 25—30 мл. Для подавления роста воздушной мик-
рофлоры к расплавленному агару перед разливкой прибав-
ляют 0,004% спиртовой раствор генцианового фиолетового
из расчета 0,1 мл краски на каждые 100 мл мясо-пептонного
агара. Агар покрывают стерильной фильтровальной бумагой
и подсушивают 30 мин в термостате или 2—3 ч при комнат-
ной температуре, после чего закрывают крышкой и оставля-
ют на ночь в комнате.
Подготовленный агар должен быть совершенно сухим, так
как даже незначительное увлажнение может изменить коли-
чественные показатели содержания корпускул фага в иссле-
дуемой жидкости.
Мясо-пептонный агар 0,7%, разлитый в пробирки по
2,5 мл и простерилизованный в них, может быть приготовлен
за несколько дней до постановки опыта. Количество чашек
Петри, как и пробирок с 0,7% мясо-пептонным агаром, долж-
но соответствовать числу пробирок с разведением фага.
В день постановки опыта из жидкости, содержащей тит-
руемый фаг, готовят в пробирках ряд последовательных де-
сятикратных разведений (так же, как при титровании фага
на жидких средах по методу Аппельмана). Для разведений
фага можно пользоваться стерильным бульоном или изотони-
ческим раствором хлорида натрия.
Затем в пробирки с 0,7% мясо-пептонным агаром, рас-
плавленным в водяной бане и остуженным до температуры
44—46 °C, приливают по 1 мл разведений титруемого фага.
Одновременно с фагом в каждую пробирку вносят по 0,1 мл
одноименной чувствительной к фагу культуры. Содержимое
пробирок перемешивают, быстро вращая пробирки между
ладонями, и выливают вторым слоем в чашки с 1,5% ага-
ром. После остывания среды чашки с посевом переносят в
термостат при 37 °C.
Учет результатов производят после 5—7 ч инкубации по-
севов в термостате, подсчитывая количество стерильных пя-
тен на 2—3 чашках, засеянных фагом с наиболее высоким
разведением. Из этих данных выводят среднее арифметиче-
ское число колоний и полученную величину умножают на сте-
пень максимального разведения. Например:
разведение фага 110~в 92 колонии
» » 10~т 61 колония
» » 10_ 8 27 колоний
Среднее число колоний бактериофага на чаш-
ке — 60. Титр исследуемого бактериофага равен:
60Х.10-8.
79
ФАГОТИПАЖ БАКТЕРИЙ И МЕТОДЫ ФАГОТИПИРОВАНИЯ
Специфические бактериофаги являются очень точными
индикаторами, определяющими видовую и типовую принад-
лежность бактерий. Поэтому они нашли широкое применение
для идентификации бактерий, выделяемых из организма
больного и инфицированных объектов внешней среды.
В настоящее время наиболее полно и тщательно разрабо-
таны методы фагодиагностики стафилококков и бактерий
брюшного тифа и паратифов. По отношению к микробам
тифо-паратифозной группы найдены фаги, с помощью кото-
рых можно с большой точностью определять виды бактерий
и четко разграничивать определенное количество типов в пре-
делах этих видав.
Техника ф а готи п и р о в а ни я микробов по мо-
дифицированному методу Креджи и Йенсена.
В основу фаготипирования положен принцип совместного вы-
ращивания типируемой культуры с типовым бактериофагом.
Наступление лизиса является индикаторным признаком,
определяющим типовую принадлежность бактерий.
Для фаготипирования бактерий рекомендуется применять
хорошо подсушенный 1,5% мясо-пептонный агар с 5% гли-
церина.
Суточную агаровую культуру исследуемого штамма отсе-
вают на бульон и помещают в термостат при 37 °C. С появ-
лением заметного роста культуру набирают в пастеровскую
пипетку с тонко оттянутым капилляром и наносят небольши-
ми каплями на поверхность хорошо подсушенной питатель-
ной среды. Расположение капель на поверхности агара мож-
но наметить заранее. С этой целью на поверхности среды
донышком стерильной бактериальной пробирки делают вмя-
тины в виде лунок. Таким образом не только намечают ме-
ста будущих капель наносимой культуры, до и предотвра-
щают растекание их по поверхности среды. Количество ка-
пель должно соответствовать числу типовых фагов плюс
1 капля для контроля роста культуры. Каплям культуры да-
ют возможность впитаться, для чего требуется 3—10 мин.
Затем на поверхность каждой капли наносят эксцентрично по
1 капле типового фага с таким расчетом, чтобы часть куль-
туры оставалась свободной от воздействия бактериофага.
Сектор, оставшийся свободным от воздействия бактериофага,
является контролем роста культуры. При постановке опыта
для каждого типа бактериофага берут отдельную пипетку.
Типовой бактериофаг применяют в критическом тест-разве-
дении, т. е. в наибольшем разведении, при котором исследуе-
мый бактериофаг вызывает на плотной питательной среде,яв-
ный лизис культуры гомологичного фаготипа и не лизирует
культуры других гетерологических типов. После того как
80
бактериофаг впитается в питательную среду, чашки с посе-
вом помещают в термостат при 37 °C. Через 6—8 ч произ-
водят учет результатов фаготипирования. Непрерывное 6-ча-
совое инкубирование чашек в термостате можно заменить.
2-часовой инкубацией, после которой чашки переносят в хо-'
лодильник, а на следующий день их снова на 3—4 ч поме-
щают в термостат и затем учитывают результаты.
Наличие хорошо выраженного лизиса исследуемой куль-
туры с одним из типовых фагов указывает на принадлеж-
ность культуры к данному фаготипу. Появление выраженных
признаков лизиса одновременно в нескольких каплях указы-
вает на то, что степень разведения типовых фагов, взятых в
опыт, недостаточна. В этих случаях опыт следует повторить
с большими разведениями бактериофагов.
Учет фаготипирования производят как в проходящем,.так
и в падающем свете. Интенсивность лизиса отмечают с по-
мощью' четырехкрестной системы.
ЛАБОРАТОРНЫЕ ЖИВОТНЫЕ
И ЭКСПЕРИМЕНТАЛЬНАЯ ИНФЕКЦИЯ
Методы исследования, связанные с применением живот-
ных, называются биологическими, или экспериментальными,
а используемые для этой цели животные — эксперименталь-
ными, или лабораторными. Наиболее широко в микробиоло-
гических лабораториях используют кроликов, морских сви-
нок, белых мышей и крыс.
Лабораторные животные являются донорами, у которых'
систематически берут кровь для получения сыворотки, плаз-
мы, эритроцитов, лейкоцитов, необходимых при постановке
многих серологических реакций и для приготовления кровя-
ных питательных сред. Лабораторные животные служат так-
же для диагностики некоторых инфекционных заболеваний,
моделирования экспериментальных острых и хронических ин-
фекционных процессов, установления вирулентности и токси-
генности изучаемых штаммов микробов, определения актив-
ности приготовленных вакцин и исследования их на безвред-
ность.
СОДЕРЖАНИЕ ЛАБОРАТОРНЫХ ЖИВОТНЫХ И УХОД ЗА НИМИ
Помещение для содержания лабораторных животных, ис-
пользуемых в экспериментальных целях, называется вива-
рием (от лат. vivas — живой). В структуру вивария входят:
1) отделение для карантинирования и адаптации вновь'
поступивших животных;
2) экспериментально-биологическая клиника для содер-
жания животных, находящихся в опыте;
6 Лабинская А. С.
3) изоляторы для подозрительных на инфекционные за-
болевания и заведомо больных животных, уничтожение ко-
торых по условиям эксперимента нежелательно;
4) экспериментальное помещение (или манипуляцион-
ная), в котором осуществляются взвешивание, термометрия,
заражение, вакцинация животных, взятие у них крови и не-
которые другие процедуры.
Оборудование экспериментального помещения опреде-
ляется в каждом конкретном случае задачами и условиями
проводимых научных исследований.
Карантинное отделение, отделение для подопытных и изо-
лятор для инфицированных животных размещаются в поме-
щениях, строго изолированных одно от другого и от всех
остальных помещений вивария.
Кроме основных перечисленных выше структурных еди-
ниц, в составе вивария должны находиться: а) кормокух-
ня— из двух смежных помещений для переработки и изго-
товления кормов с самостоятельными выходами в коридор
из каждого помещения, кладовая со специально оборудован-
ными ларями (металлическими или обитыми внутри жестью)
и холодильниками для хранения запаса кормов, б) дезинфек-
ционно-моечное отделение из 2 комнат, объединенных пере-
ходным автоклавом или сухожаровой камерой.
Работа дезинфекционно-моечного отделения определяется
состоянием материала, поступающего на обработку. Инфи-
цированный материал, например клетки, подстилки, кор-
мушки, вначале дезинфицируют, а затем подвергают механи-
ческой чистке и мойке. Материал, не представляющий опас-
ности для заражения, вначале подлежит механической очист-
ке, а затем (при необходимости) стерилизации.
Моечное помещение в правильно организованном вива-
рии имеет мусоропровод для удаления нечистот и грузоподъ-
емник для доставки в виварий материала и оборудования.
Рядом с дезинфекционно-моечным отделением размеща-
ются склад чистого (запасного) инвентаря с клетками, поил-
ками, кормушками и т. п., бытовые помещения и санитарный
блок (душевая и туалет) для обслуживающего персонала.
В соответствии с существующими санитарными правила-
ми1 виварий размещается в отдельно расположенном здании
или на верхнем этаже лабораторного корпуса. При размеще-
нии вивария в лабораторном корпусе он должен быть полно-
стью изолирован от всех других помещений.
Помещение для содержания лабораторных животных
должно быть теплым, светлым и сухим с центральным отоп-
1 Санитарные правила по устройству, оборудованию и содержанию
экспериментально-биологических клиник (вивариев) утверждены Главным
государственным санитарным врачом СССР П. Н. Бургасовым 6 апреля
1973 .г., № 1045—73.
82
лением, естественным и искусственным освещением, прину-
дительной приточно-вытяжной вентиляцией, подводкой горя-
чей и холодной воды.
Полы в виварии делают из водонепроницаемого материа-
ла, без плинтусов, с уклоном к отверстиям или желобам,
присоединенным к канализации. Стенки покрывают глазу-
рованной плиткой, потолки и двери окрашивают масляной
краской.
Правила пополнения вивария новыми животными. Попол-
нение вивария новыми лабораторными животными проводят
из государственных специализированных питомников в со-
провождении ветеринарного свидетельства, удостоверяюще-
го, что животные поступают из хозяйства, благополучного по
инфекционным заболеваниям, и клинически здоровы. Живот-
ных принимают в чистые, заранее продезинфицированные
клетки, размещают в карантинном отделении сроком на
3 дня для адаптации к новым условиям. В период карантина
за животными ведется регулярное клиническое наблюдение
с ежедневной термометрией и регистрацией общего состоя-
ния в специальном журнале по приводимой ниже форме.
Журнал регистрации поступления и распределения лабораторных
животных в экспериментально-биологической клинике (виварии)
Дата посту- пления Вид живот- ных Пол Масса тела, воз- раст Пос- тав- щик Распреде- ление (№ клетки) Наблю- дение во время ка- рантина Дата окончания карантина Кому вы- даны жи- вотные
Для животных, полученных не из государственных питом-
ников, устанавливаются следующие сроки карантинирования:
для мышей и крыс—14 дней, для морских свинок и кроли-
ков— 21 день.
В целях предупреждения заноса и распространения ин-
фекции в виварии уход и наблюдение за животными, нахо-
дящимися в карантине, осуществляются персоналом, закреп-
ленным за данным отделением. По этим же соображениям
запрещается выносить из карантинного отделения в другие
помещения вивария корма, спецодежду и инвентарь.
Чистка и мойка посуды, клеток и другого инвентаря из
карантинного помещения производится в общем дезинфек-
ционно-моечном отделении вивария только после предвари-
тельного обеззараживания. Методы дезинфекции в каждом
конкретном случае определяются соответственно специфике
работы учреждения.
В случае появления в карантинном отделении подозре-
ния на инфекционное заболевание животные подвергаются
6* 83
бактериологическому обследованию. При подтверждении ин-
фекции вся поступившая партия животных уничтожается.
При возникновении массовых заболеваний среди живот-
ных, находящихся в карантине, или при обнаружении в пе-
риод экспериментов отдельных случаев инфекционных за-
болеваний, особо опасных для лабораторных животных, в ви-
варии проводится необходимый комплекс профилактических
мероприятий. В этих случаях опыты на животных временно
прекращаются.
Правила содержания экспериментальных животных в ви-
варии. По истечении карантинного срока животных перево-
дят в экспериментальную секцию. Мышей, крыс, морских сви-
нок и кроликов содержат в клетках, установленных на ме-
таллических стеллажах. Грызуны содержатся в клетках со
сплошным Дном на подстилке или с сетчатым дном-полом.
Подстилочным материалом могут служить древесные опил-
ки, стружка, волокнистый торф, мягкая солома. Подстилки
заранее автоклавируют или дезинфицируют в сухожаровой
печи при температуре 150—180 °C в течение 15—20 мин. При
размещении животных по клеткам следует исходить из при-
водимых ниже нормативов (табл. 7).
Таблица 7'
Нормы площади для содержания лабораторных животных
Вид животных Минимальная площадь дна клетки на одно живот- ное, см^ Максимально допустимое число живот- ных в клетке Число животных на 1 м2 пло- щади пола помещения
Мыши 40 15 65 взрослых или 240 молод- няка
Крысы 150 10 20 взрослых или 100 молод- z няка
Морские свинки 300 5 .15—18
Кролики 2000 1 3—4
Примечание. Для примерного определения производственной площади сле-
дует исходить нз расчета, что 1 см2 площади дна клетки должен приходиться на 1 г
массы животного. Стеллажи размещаются в основном вдоль стен и должны занимать
примерно 0,4 м производственной площади.
В каждом отдельном помещении вивария рекомендуется
содержать только один вид животных. Если по условиям
эксперимента в одной секции совместно содержатся живот-
ные разных видов, размещать их следует на разных стел-
лажах. На каждой клетке с животными вывешивают паспор-
та, образец которого приводится ниже.
На клетках подопытных животных, которые могут явить-
ся источником заражения человека, укрепляют паспорта яр-
кого цвета. Животные, наиболее опасные в смысле возмож-
84
Образец этикетки (паспорта)
Отделение (лаборато- рия) Клетка №... Вид, линия, пол живот- ных Возраст... Дата поступления (фамилия экспери- ментатора) Начало эксперимента Окончание экспери- мента Особые отметки
ности заражения окружающих, содержатся в изоляторе в ме-
таллических клетках или стеклянных банках в металличе-
ской оправе.
При уходе за животными, зараженными особо опасными
инфекциями, персонал должен надевать два халата, резино-
вый фартук, нарукавники, резиновые перчатки, маску и га-
лоши.
В заразное помещение разрешается входить только рабо-
чим, обслуживающим животных, и научно-техническим со-
трудникам, участвующим в опыте.
Трупы животных, погибших в ходе эксперимента, до
вскрытия хранятся в специальном холодильнике (не более
суток). Вскрытие животных производится экспериментато-
ром. В случае гибели животного вне зависимости от опыта
на вскрытии присутствует представитель вивария. Каждый
случай падежа или вынужденного забоя животных фикси-
руется в специальном журнале по приводимой ниже форме.
Журнал регистрации павших или вынужденно забитых животных
Дата Вцд ЖИ- ВОТ- НЫХ Секция живот- ных Предполагае- мый диагноз Результат вскрытия Кто произво- дил вскрытие Результат экспертизы
После вскрытия трупы заразных животных сжигают под.
контролем ответственного лица, выделенного администраци-
ей, трупы незаряженных животных сдают утильзаводу в во-
донепроницаемых металлических ящиках с обязательным
оформлением соответствующей документации.
Работа по уходу и содержанию лабораторных животных
строится в соответствии с распорядком дня и регламентом
работы, утвержденным руководителем учреждения. В рас-
порядке дня предусматривается время на'санитарную обра-
ботку помещения и оборудования, раздачу кормов и прове-
дение экспериментальных работ и манипуляций.
85
Уборка и дезинфекция вивария. Уборку вивария произво-
дят ежедневно в утренние часы, придерживаясь определен-
ной последовательности. Начинают с осмотра животных, вы-
являя заболевших и погибших. Из клеток вынимают кор-
мушки и поилки. Пол каждой клетки чистят веником и ме-
таллическим скребком. Находящиеся в клетках кал, остат-
ки пищи соскабливают в совок, сбрасывают в металлический
бак с плотно закрывающейся крышкой. После чистки каждой
клетки скребок обеззараживают, погружая его на несколько
минут в банку с дезинфицирующим раствором (карболовая
кислота или лизол). Вынутые из клеток кормушки и поилки
моют горячей водой с зольным щелоком или содой, а затем
обдают кипятком. Переставлять кормушки и поилки из од-
ной клетки в другую нельзя.
Очистив клетки, служитель вивария приступает к уборке
помещения вивария: протирает пол, стены и подоконники
горячей водой с мыльно-карболовым раствором, 1% раство-
ром хлорамина или другим дезинфицирующим веществом.
Для поддержания чистоты и предупреждения заноса ин-
фекции у входа в каждую комнату вивария кладут плотную
мешковину, натянутую на лист железа. Один или 2 раза в
день 'мешковину смачивают 3—5% раствором лизола или
карболовой кислоты.
Работу, связанную с уборкой клеток и помещения, слу-
жители вивария производят в специальной одежде: халате,
фартуке, косынке и резиновых перчатках.
Периодически, примерно один раз в Р/г—2 нед, клетки
животных моют горячей водой и дезинфицируют 5% раство-
ром карболовой кислоты или горячим зольным щелоком или
прожигают пламенем паяльной лампы в целях профилакти-
ки инфекционных паразитарных заболеваний и размножения
насекомых.
В период текущей дезинфекции животных пересаживают
в чистые, заранее продезинфицированные: клетки с подго-
товленными подстилками, кормушками й поилками. Осво-
бождающиеся при этом клетки передают для дезинфекции
и обработки в дезинфекционно-моечное отделение. Чистка,
дезинфекция, мойка клеток, кормушек и поилок производятся
рабочими, специально закрепленными за дезинфекционно-
моечным отделением.
По окончании уборки весь собранный в виварии мусор
(кал, остатки пищи, опилки, сено, солома и т. д.) сжигают
или утилизируют, согласуй этот вопрос в каждом конкрет-
ном случае с местными органами и учреждениями СЭС.
При работе с инфицированным материалом производится
обязательное обеззараживание отходов автоклавированием
или обработкой дезинфицирующими веществами. По воз-
можности весь собранный в виварии мусор сжигают в печи
86
с дополнительным бункером, исключающим разбрасывание-
близ топки заразного материала.
Правила личной гигиены работников вивария. Каждый ра-
ботник вивария обеспечивается персональной спецодеждой,
спецобувыо, полотенцем и мылом. В его распоряжении на-
ходится индивидуальный шкаф с двумя отделениями. Одно
из них предназначается для хранения в течение рабочего
дня домашней одежды и обуви, которые работник вивария
обязан снимать, приходя на работу; в другом отделении во-
внерабочее время находится спецодежда. Индивидуальные
шкафы периодически, не реже одного раза в месяц, дезин-
фицируются.
По окончании каждого этапа работы, а также перед при-
емом пищи работники вивария должны обязательно мыть-
и дезинфицировать руки. Для этого в каждой секции вива-
рия около раковины умывальника на полках находятся бу-
тыли с дезинфицирующими растворами (2% раствор лизола
или хлорамина). После дезинфекции руки протирают вазели-
ном или детским кремом, чтобы предупредить появление тре-
щин на коже.
По окончании работы персонал вивария обязан пройти
обработку в санитарном блоке (принять душ или ванпу).
Все лица, принимаемые на работу с лабораторными жи-
вотными, проходят медицинское обследование, включающее
исследование на носительство возбудителей туберкулеза и
всей группы кишечных инфекций. В дальнейшем обследова-
ния производятся периодически, не реже одного раза в год.
Больные туберкулезом, кожными и другими заразными забо-
леваниями к работе в виварии не допускаются. При проведе-
нии на животных экспериментов с возбудителями, опасными
для людей, обслуживающий персонал вивария подвергается
профилактической иммунизации.
Для всех принимаемых в виварий сотрудников проводит-
ся инструктаж по вопросам охраны труда, и техники без-
опасности, правилам внутреннего распорядка в зависимости
от выполняемой работы. Ответственность за проведение ин-
структажа возлагается на заведующего виварием.
Правила кормления лабораторных животных. В экспери-
ментальных исследованиях правильное содержание и корм-
ление лабораторных животных как до, так и во время опыта
имеет очень большое значение.
Нарушение режима и рациона питания, несоблюдение ги-
гиенических мероприятий при кормлении способствуют ослаб-
лению организма животных и повышению их восприимчиво-
сти к различным инфекционным и соматическим заболевани-
ям. Возникновение их в течение опыта может привести к
искажению результатов исследования и, следовательно, к не-
правильным заключениям.
87
Лабораторных животных рекомендуется кормить 2—3 ра-
за в сутки в строго установленные часы, распределяя суточ-
ный рацион так, чтобы разные виды кормов чередовались в
течение дня.
Основным видом питания лабораторных животных (гры-
зунов) являются зерна злаковых, масличных и бобовых куль-
тур: овес, пшеница, просо, ячмень, кукуруза, горох, семена
подсолнечника, льна, конопли. Семена злаковых и масличных
культур дают в натуральном виде, кукурузу и бобовые куль-
туры—дроблеными. Во избежание заражения животных
зерновую смесь перед употреблением подвергают стерилиза-
ции в автоклаве при температуре 105 °C или в сухожаровой
печи в течение 30 мин. Наряду с зернами и семенами ис-
пользуются продукты их переработки: крупа, мука, отруби,
жмых. Перед употреблением отруби и жмых увлажняют или
смешивают с вареным картофелем. В рацион кроликов, осо-
бенно молодняка, вводить отруби не рекомендуется, так как
они способствуют развитию у них кокцидий1.
В последнее время для кормления лабораторных грызунов
применяют выпускаемые промышленностью неполнорацион-
ные брикетированные и гранулированные корма, изготовляе-
мые с учетом оптимальной потребности животных в питатель-
ных веществах по трем рецептам. Брикеты, приготовленные
по рецепту № 1, предназначены для кормления крыс и
мышей, по рецепту № 2 — для кроликов и морских свинок, по
рецепту № 3 — для кроликов.
При даче лабораторным животным неполнорационных
брикетированных кормов необходимо давать дополнительно:
мышам и крысам — молоко, зелень, рыбий жир и подсолнеч-
ное масло, кроликам и морским свинкам — сочные и зеленые
корма, сало, рыбий жир. Обязательным условием успешного
перехода на брикетированные корма служит бесперебойное
обеспечение животных чистой водой.
Необходимым дополнением к концентрированным кормам
являются корма животного происхождения, минеральные и
витаминные добавки. Корма животного происхождения (мо-
локо, творог, рыбная и мясо-костная мука) служат источни-
ками полноценного протеина, улучшают переваривание дру-
гих кормов и способствуют лучшему росту молодняка.
Сочные корма, сахарная и кормовая свекла, капуста,
'брюква представляют собой источники легко перевариваемых
углеводов и витаминов. Корнеплоды и овощи дают только
сырые, тщательно очищенные, промытые и нарезанные кус-
ками. Мышам и крысам сочные корма желательно вводить
1 Кокцидии — одноклеточные животные класса споровиков — парази-
тируют в эпителиальной ткани кишечника кроликов и вызывают заболева-
ние — кокцидиоз.
88
в рацион в течение всего года, кроликам — при отсутствии в
рационе зеленых кормов. Для морских свинок крайне важ-
но введение в рацион зимой н весной свежей белокочанной
капусты, богатой витамином С.
В зеленых кормах содержится большое количество пол-
ноценного протеина, углеводов, минеральных солей и вита-
минов. Для мелких грызунов (мыши, крысы) зеленые кор-
ма вводят в рацион в небольшом количестве в течение все-
го года. Для морских свинок и кроликов они служат одним
из основных видов кормов в летнее время. В качестве зеле-
ного корма могут быть использованы почти все дикорасту-
щие, луговые, степные и лесные травы, а для кроликов, кро-
ме того, листья и побеги деревьев и кустарников. При раз-
даче зеленого корма необходимо следить, чтобы в нем не
было вредных и ядовитых растений (дурман, болиголов, че-
мерица, наперстянка, ландыш, лютик едкий, вех ядовитый).
В зимнее время года для кроликов и морских свинок се-
но служит одним из основных видов корма, а для других
лабораторных животных (грызунов) оно является всего лишь
дополнительным источником минеральных веществ и вита-
минов.
В рацион лабораторных животных должна вводиться ми-
неральная и витаминная подкормка. Источником кальция и
фосфора служат костная мука и трикальцийфосфат, натрия
и хлора — хлорид натрия. Для обогащения кормов витами-
нами А и D вводится свежий витаминизированный рыбий
жир. Мышам и крысам рыбий жир дают в течение всего го-
да, морским свинкам и кроликам — если в рационе нет тра-
вы. Источником витаминов группы В являются пивные и
пекарские дрожжи. Перед скармливанием дрожжи кипятят:
кипячение предотвращает брожение кормов и обусловливает
разрушение убитых дрожжевых грибов, способствуя осво-
бождению содержащихся в них витаминов. Источником ви-
тамина С служат капуста, настой свежей хвои, хвойная му-
ка, а также водный раствор аскорбиновой кислоты. В ка-
честве источников витаминов Е и К используются сочные
корма и зелень.
В клетках лабораторных животных должна постоянно
находиться вода. При недостатке ее животные плохо перева-
ривают пищу, утрачивают аппетит, худеют. Для бесперебой-
ного обеспечения животных чистой водой применяют автопо-
илки. Примером самой простой автопоилки может служить
стеклянный флакон емкостью 200—250 мл с резиновой проб-
кой, в отверстие ее вставлена изогнутая под углом 120—130°
стеклянная или металлическая трубка с внутренним диамет-
ром 6 мм. Поилку укрепляют на боковой стороне клетки
или на крышке под небольшим наклоном, чтобы конец труб-
ки заходил в клетку на расстояние, удобное для слизыва-
89
'ния животными капли, висящей на конце трубочки. Если
автопоилок нет, в клетках мышей и крыс должны постоянно
находиться мисочки с чистой водой. Кроликов и морских сви-
нок следует поить 2 раза в сутки, а в жаркое время года не
менее 3 раз.
При составлении рационов питания нужно исходить из
норм кормления подопытных животных, разработанных на-
учно-исследовательскими учреждениями для каждого вида
животных и утвержденных Министерством здравоохранения
СССР (приказ № 163 от 10 марта 1966 г.).
Подготовка животных к опыту. Перед постановкой опыта
отбирают группу животных определенного вида, возраста,
массы тела и, если нужно по условиям опыта, какого-либо
одного пола.
Животные должны быть совершенно здоровы. Отобран-
ных животных рассаживают по клеткам и в течение несколь-
ких дней, предшествующих опыту, взвешивают и термомет-
рируют. Кроликам и морским свинкам надевают метки. При
нормальном питании и развитии по массе тела животного
в период роста можно приблизительно определить его воз-
раст.
Термометрия лабораторных животных. Нормальная тем-
пература у разных видов лабораторных животных неодина-
кова (табл. 8).
Таблица 8
Нормы температуры лабораторных животных
Вид животного
Средняя нормаль-
ная температура
по Цельсию
Белые мыши
Белые крысы
Морские свинки
Кролики
37—39°
38,5—39,5°
\ 37,3—39,5°
37,7—38,8°
Температуру тела животным измеряют в прямой кишке,
белым мышам — специальным маленьким трехгранным тер-
мометром, а остальным лабораторным животным — обычным
медицинским термометром. Перед употреблением термометр
протирают ватой, смоченной в спирте или 3—5% растворе
хлорамина, вытирают насухо и смазывают вазелином. Глу-
бина введения термометра должна быть всегда постоянной,
так как от нее зависит температура. С этой целью на термо-
метр на определенной высоте от ртутного резервуара наде-
вают резиновое колечко, ограничивающее глубину введения
термометра в прямую кишку. Измерение температуры в каж-
90
Рис. 18. Бляшка с номером
для метки лабораторных /
животных. ’ \
дой группе животных в течение всего периода наблюдений
производят одним термометром в одно и то же время.
Удаление волос и обработка операционного поля у живот-
ных. В области операционного поля накануне операции вы-
стригают шерсть. У кроликов, морских свинок и крыс шерсть
выстригают ножницами с закругленными концами. Чтобы не-
поранить кожу в месте выстригания волос, ее растягивают
I и II пальцами левой руки. Для полного удаления шерсти
пользуются депилятором. На обрабатываемом участке тела
выстригают ножницами шерсть и накладывают на 2—6 мин
толстый слой депилятора, предварительно разведенного во-
дой до густоты сметаны. Через указанное время депилятор
смывают теплой водой, а кожу вытирают чистой мягкой тря-
почкой и смазывают ланолином или детским кремом. При
обработке операционного поля депилятором иногда наблю-
дается раздражение кожи, поэтому пользоваться им нужно,
за 2—3 дня до постановки опыта.
Нумерация лабораторных животных. Кроликов и морских
свинок нумеруют специальными металлическими бляшками,
которые продевают в уши. Бляшка имеет расширенную цент-
ральную часть с номером и два отходящих от нее в стороны
острых шипа (рис. 10). Перед употреблением бляшки погру-
жают на 3—4 ч в спирт. Ухо животного перед проколом так-
же протирают спиртом, а затем эфиром для обезболивания.
После дезинфекции в участке ушной раковины, лишенной
кровеносных сосудов, остроконечными ножницами или скаль-
пелем делают два отверстия и через них на внутреннюю по-
верхность уха выводят шипы бляшки, загибая их внутрь или
в стороны.
Крыс и мышей нумеруют непосредственно во время опы-
та, пользуясь для этой цели красками, дающими стойкое
окрашивание, например насыщенным спиртовым раствором
фуксина, насыщенным водным или спиртовым раствором
пикриновой кислоты или насыщенным водным раствором
перманганата калия. У подопытных животных окрашивают
разные части тела. Одной краской, как правило, метят пер-
вые 9 номеров. Сочетание двух различных красок позволяет
пометить до 100 животных.
Ниже в качестве примера приводится одна из схем нумерации. Метки
пикриновой кислоты соответствуют единицам, метки фуксином обозначают
десятки. Окрашенные таким образом животные в зависимости от места рас-
положения пятна и его окраски будут иметь следующие условные номера:
левая передняя лапа — № 1, левый бок — № 2, левая задняя лапа — № 3,
голова — № 4, спина — № 5, область крестца — № 6, правая передняя ла-
91
па— № 7, правый бок — № 8, правая задняя лапа — № 9. Нанесение фук-
сина яа те же места (вместо пикриновой кислоты) будет означать соответ-
ственно: 10, 20, 30, 40, 50, 60, 70, 80, 90.
При комбинации двух красок может быть получен любой двузначный
номер, например: лапа левая передняя '(фуксин) + лапа левая передняя
(пикриновая кислота)—№ 11, лапа правая задняя (фуксин) + лапа левая
задняя (пикриновая кислота) — X» 93.
Фиксация лабораторных животных. Перед опытом живот-
ное фиксируют, т. е. придают ему положение, наиболее удоб-
ное для проводимой операции, с ограничением подвижности
в этом положении.
Существуют различные приемы и приспособления для
фиксации лабораторных животных.
Фиксация кроликов в положении, удобном
для термометрии. Кролика плотно завертывают поло-
тенцем, прижимая передние лапы к груди, а задние к жи-
воту, оставляя свободной голову. У фиксированного таким
образом животного легко измерять температуру. Для этого
лаборант кладет его себе на колени так, чтобы голова нахо-
дилась под локтем левой руки. Той же рукой он приподнима-
ет хвост животного, а правой рукой вводит в прямую кишку
термометр.
Указанным способом фиксации можно пользоваться при
заражении или взятии крови из краевой вены уха. Туловище
кролика плотно зажимают между коленями или прижимают
локтем левой руки, оставляя свободной для проведения необ-
ходимых манипуляций голову животного, повернутую вправо.
Фиксация головы кролика. Для этого удобно
пользоваться боксом (рис. 11), имеющим вид ящика с верх-
ней выдвижной крышкой. Передняя стенка ящика состоит из
двух частей: нижней, укрепленной неподвижно, и верхней
выдвигающейся. Посередине передней стенки имеется круг-
лое отверстие диаметром 5 см, состоящее из двух половин:
одна половина вырезана на нижней, др'угая — на верхней вы-
двигающейся части передней стенки. \Через это отверстие
выводят наружу и фиксируют голову кролика. В задней ча-
сти ящика с внутренней стороны на обеих боковых стенках
набито по нескольку вертикальных планок, между которыми
находятся пазы. Вставляя вертикально фанерную дощечку
в тот или иной паз, можно увеличивать или уменьшать дли-
ну бокса.
Длина бокса 40 см, ширина 15 см, высота 15,5 см (высо-
та нижней передней стенки 9 см, верхней — 6,5 см). Фикса-
ция кролика в боксе описанной конструкции осуществляется
следующим образом. Выдвигают верхнюю крышку бокса и
вынимают верхнюю половину передней стенки. В ящик са-
жают кролика так, чтобы шея его проходила через выемку
нижней половины передней стенки, после чего голову живот-
ного фиксируют, опуская на нее верхнюю половину перед-
92
Рнс. 11. Бокс для фиксации головы кролика.
ней стенки. В один из пазов вдвигают фанерную дощечку,
ограничивая тем самым возможность движений кролика в
ящике, а затем закрывают верхнюю крышку, которая фикси-
рует подвижную часть передней стенки.
Фиксация кролика и других лабораторных
животных (морские свинки, крысы) в лежачем поло-
жении на спине или животе. Для фиксации кроли-
ков и других животных (морские свинки, крысы) в лежачем
положении на спине или животе пользуются специальными
станками. Наиболее просто устроенный станок представляет
собой обычную доску на низких ножках, по размерам соот-
ветствующую тому или другому виду животного. На ребрах
боковых сторон доски имеется по 2 крючка или петли. У од-
ного из узких краев находится приспособление для фикса-
ции головы животного — головодержатель. Он представляет
собой надеваемое на голову животного кольцо, соединенное
со штативом. При помощи винтов высоту кольца на стойке
штатива можно регулировать.
Животное кладут в удобном для опыта положении, спи-
ной или животом кверху. Все 4 лапы продевают в петли,
сделанные из бинта, которые затем плотно затягивают. Сво-
бодные концы тесемок из бинта (в первую очередь от перед-
них лап и во вторую — от задних) привязывают к крючкам
или петлям доски. Фиксацию животного к станку производят
с помощником.
Фиксация морской свинки руками. Морскую
свинку брюшком кверху или наружу (рис. 12) берут левой
рукой так, чтобы II палец находился под шеей, а I и III паль-
цы— под передними конечностями животного. Правой рукой
свинку поглаживают по животу до тех пор, пока она не
успокоится, и только после этого приступают к намеченной
операции, придерживая задние лапы животного правой
рукой.
Фиксация крыс. Складку кожи в области затылка
захватывают корнцангом, плотно прижимая голову живот-
ного к поверхности стола. Другой рукой берут хвост крысы
93
Рис. 12. Фиксация морской свинки руками.
Рис. 13. Фиксация крысы руками при работе без помощника.
Рис. 14. Фиксация (:!') и заражение (2) мыши при работе без помощника.
и, приподняв ее над поверхностью стола, держат в таком по-
ложении, чтобы голова слегка оттягивалась корнцангом
(рис. 13).
Фиксация мышей. Мышь пускают по столу, придер-
живая ее I и II пальцами правой руки за кончик хвоста.
Когда, продвигаясь в каком-либо направлении, мышь натя-
нет хвост, быстрым движением левой руки хватают ее за
складку кожи в области затылка, ближе к ушам, чтобы она
ие могла поворачивать голову. Подняв мышь над столом, по-
мощник держит ее на весу одной рукой за хвост, другой —
за складку кожи на затылке, несколько растягивая в поло-
жении, удобном для экспериментатора.
Работать с мышами можно и без помощника, фиксируя
их левой рукой: I и II пальцами левой руки животное за-
хватывают за складку кожи в области затылка, а остальны-
ми 3 пальцами, прижав их к запястью, придерживют хвост
н кожу в области крестца. При таком способе фиксирования
правой свободной рукой можно производить различные опе-
рации (рис. 14).
СПОСОБЫ ЗАРАЖЕНИЯ ЛАБОРАТОРНЫХ ЖИВОТНЫХ
В зависимости от цели исследования пользуются различ-
ными способами заражения: внутрикожным, подкожным,
внутримышечным, внутрибрюшинным, внутривенным, перо-
ральным или интраназальным. При перечисленных способах,
за исключением перорального и интраназального, заражение
осуществляется с помощью шприца.
Взвесь микробной культуры, эмульсию из зараженных ор-
ганов или кровь больного осторожно набирают в шприц, по-
сле чего конец иглы закрывают кусочком ваты, смоченным
5% раствором хлорамина, 5% раствором карболовой кисло-
ты или спиртом. Повернув шприц иглой кверху, осторожно
выпускают из него -пузырьки воздуха. Загрязненную вату
бросают в банку с дезинфицирующим раствором.
95
Внутрикожный способ заражения. При этом способе при-
меняют тонкие (№ 18—20) острые иглы с небольшим скосом.
Кожу в месте введения материала растягивают I и II паль-
цами левой руки, правой рукой вводят иглу под очень острым
углом, почти касаясь кожи. Конец иглы должен быть виден
. через эпидермис: при введении материала эпидермис при-
поднимается в виде четко ограниченного бугорка, кожа над
ним становится прозрачной и пористой, вследствие чего ее
* сравнивают иногда с лимонной корочкой. Материал вводят
в объеме до 0,1 мл обычно в кожу спины или живота.
Подкожный способ заражения. Кожу в месте введения
материала берут у ее основания, приподнимают I и II паль-
цами левой руки. Иглу шприца вкалывают снизу образовав-
шейся складки. Проколов кожу и пройдя вглубь на несколь-
ко миллиметров, иглу отклоняют вправо или влево и затем
медленно вводят материал, содержащийся в шприце. Изме-
нять направление иглы под кожей рекомендуется для того,
чтобы введенное вещество не выступало через прокол кожи
наружу. Затем складку кожи опускают, на место укола на-
кладывают ватный тампон, смоченный спиртом или спирто-
вым раствором, а иглу быстро вынимают. Наиболее удобны-
ми местами для подкожного введения материала у кроликов
и морских свинок являются область спины и боковые поверх-
ности несколько ниже подмышечных впадин, у крыс и мы-
шей— область спины, крестца и затылка. Количество жид-
кости, вводимой подкожно, не должно превышать 30 мл для
кроликов, 15 мл—для морских свинок, 10 мл-—для крыс и
1 мл — для мышей.
Внутримышечный способ заражения. Выбирают участок
тела с наиболее развитым мышечным слоем. У кроликов,
морских свинок, крыс и мышей таким местом является на-
ружная верхняя треть бедра задней лапы. Захватывают I
и II пальцами левой руки толстую мышечную складку и
вводят иглу почти под прямым углом в глубь мышц. Объем
жидкости, допустимый для внутримышечного введения, со-
ставляет для кроликов 8 мл, для морских свинок — 5 мл, для
крыс — 3 мл, для мышей — 0,5 мл.
Внутрибрюшинный способ заражения. Помощник держит
животное вниз головой. В этом положении кишечник смеща-
ется в сторону диафрагмы, что в значительной мере умень-
шает возможность его повреждения в момент прокола. У жи-
вотных (за исключением мышей) в нижней трети живота, не-
сколько отступя от средней линии, делают скальпелем или
остроконечными ножницами надсечку кожи длиной 2—3 мм
и через нее вводят притупленную иглу, держа шприц перпен-
дикулярно к брюшной стенке. Преодолевая сопротивление,
очень осторожно, буравящими движениями иглу продвигают
вглубь. Чувство «провала», исчезновение ощущения сопротив-
96
ления на пути говорят о проникновении иглы в брюшную по-
лость. После этого иглу переводят в вертикальное положение
и вводят содержащийся в шприце материал в полость брю-
шины. Внутрибрюшинно можно вводить до 30 мл жидкости
кроликам, до 10 мл — морским свинкам, до 5 мл — крысам,
до 2 мл — мышам.
Внутривенное заражение кроликов. Кроликов заражают
в краевую вену уха. Вдоль наружного края уха выщипывают
шерсть, затем это место слегка пощелкивают кончиками
пальцев, чтобы вызвать гиперемию сосудов, и протирают ва-
той, смоченной в 70% спирте. После явного набухания вены
под ухо подводят II палец левой руки. Прокол вены следует
делать ближе к верхушке уха, так как при частых уколах
возможна облитерация сосуда в этом месте, но проксималь-
ный участок вены остается неповрежденным. Чтобы удостове-
риться, правильно ли введена игла, вводят сначала неболь-
шое количество материала. При нахождении иглы В полости
вены материал вводится свободно, в противном же случае
жидкость из шприца вытекает с трудом, а на ухе в месте
введения образуется вздутие. Если игла не попала в вену, ее
вынимают и вводят повторно в другое место, ближе к осно-
ванию уха. По окончании введения нижний участок вены
слегка придавливают, а к месту укола прикладывают кусо-
чек стерильной ваты, смоченной спиртом или спиртовым рас-
твором йода, после чего из вены извлекают иглу. Внутривен-
но кроликам можно вводить до 20 мл жидкости..
Внутривенное заражение крыс и мышей. Крыс и мышей
заражают в боковую вену хвоста. Непосредственно перед
введением материала хвост животного, чтобы вызвать гипе-
ремию сосудов, погружают в сосуд с водой, подогретой до
50 °C, смазывают ксилолом или толуолом. После того как со-
суды заметно набухают, корень хвоста сдавливают пальцами.
Для введения материала лучше всего пользоваться туберку-
линовыми иглами, очень тонкими и короткими, с косым сре-
зом. При введении иглы в вену шприц держат под острым
углом, почти параллельно оси хвоста. Иглу повертывают от-
верстием наружу. Корень хвоста освобождают от сдавлива-
ния. Как и в предыдущем случае, нахождение иглы в вене
определяют по'легкости введения материала и отсутствию
заметного уплотнения в месте, где находится игла. Взрослым
белым крысам допускается вводить до 6 мл жидкости, мы-
шам— до 0,5 мл.
Заражение через пищеварительный тракт. Заразить жи-
вотное через рот можно двумя способами. Материал, предна-
значенный для заражения, примешивают к корму или питью
животного. Такой способ является наиболее простым и есте-
ственным, однако в лабораторной практике применение его
ограничено, поскольку количество материала, попадающее в
7 Лабинская А. С.
97
Рис. 15. Заражение мыши через пищеварительный тракт.
организм заражаемого животного, не подлежит точному уче-
ту. Поэтому значительно чаще материал, предназначенный
для заражения, вводят животному шприцем, игла которого
имеет незначительный изгиб и утолщение на конце в виде
оливы. Наличие изгиба допускает введение иглы-в пищевод’
животного. Диаметр иглы для мышей должен быть не более
1 мм, для крыс—1—1,5 мм, длина — соответственно 35—45
и 70—75 мм.
Крыс и мышей фиксируют перед заражением в вертикаль-
ном положении: одной рукой помощник держит животное за
складку кожи на затылке, около ушей, другой — за корень
хвоста. Животным открывают рот браншами пинцета, встав-
ляя их между нижней и верхней челюстями. Иглу, введенную
в рот, продвигают по задней стенке глотки на глубину 1 см
у мышей и 2—2,5 см у крыс. На указанной глубине игле при-
дают вертикальное положение. Процесс введения иглы, как
правило, затруднений не представляет, конец ее проникает
непосредственно в желудок или нижний отдел пищевода. Ко-
личество материала, вводимого за один раз в желудок мы-
шей, должно быть не более 1 мл, взрослым крысам — не бо-
лее 3,5 мл (рис. 15).
98
A. E. Попова (1972) при пероральном введении жидкостей
мелким лабораторным животным предложила пользоваться
вместо металлического зонда с оливой полихлорвиниловой
трубкой, представляющей собой наружную оболочку одного
провода многожильного телефонного кабеля, из которого уда-
лен проводник. Длина трубки 15—17 см, наружный диаметр
1—1,5 мм, внутренний просвет 0,5—0,7 мм.
В отличие от металлического зонда, часто попадающего
в дыхательные пути и вызывающего гибель животных от ас-
фиксии, а при глубоком введении повреждающего стенку же-
лудка и пищевода, эластический зонд при незначительном
усилии легко проникает из полости рта в пищевод и желудок
животного, не требуя строгого ограничения глубины введения,
так как даже при излишне глубоком введении стенки желуд-
ка не повреждаются.
Вводимая жидкость дозируется с помощью шприца, иа со-
сок которого надевают эластический зонд.
Морских свинок и кроликов перед заражением per os фик-
сируют в нормальном для животного положении. Удобнее
всего завернуть их в полотенце и посадить к помощнику на
колени.
Заразный материал вводят через эластический зонд. Для
этой цели обычно выбирают катетер из наиболее мягкой и
эластичной резины длиной 7,5—8 см и толщиной не более
0,3—0,5 см.
Перед введением зонда в рот животному вставляют ро-
торасширитель или, как его называют, «зевпик», который
представляет собой дощечку с круглым отверстием в
середине. Ширина дощечки для кролика равна 2 см, для мор-
ской свинки — 1 см. Через отверстие вставленного в рот «зев-
ника» осторожно вводят в пищевод зонд, смазанный вазели-
ном или глицерином. Для того чтобы облегчить введение
зонда, животному вливают пипеткой в рот несколько капель
воды, вызывая глотательные движения, во время которых
зонд легко, без внешнего воздействия продвигается в глубь
пищевода. Наружный конец введенного зонда присоединяют
к шприцу, наполненному материалом, который вводят в же-
лудок медленно в количестве 2,5—3,5 мл морским свинкам
и 3,5—5 мл кроликам.
Заражение через дыхательные пути (интраназальное зара-
жение). Животному, фиксированному па доске, прикладыва-
ют к носу кусочек ваты, смоченной эфиром или хлороформом.
К заражению приступают после того, как у животного поя-
вится состояние легкого наркоза. Зараженный материал с
помощью шприца вводят в нос небольшими каплями на глу-
шину 1—1,5 мм мышам, 2—3 мм крысам, 4 мм кроликам и
морским свинкам. Чтобы не поранить слизистые оболочки,
для введения материала берут абсолютно тупую иглу.
7*
99
ТЕХНИКА ВЗЯТИЯ У ЛАБОРАТОРНЫХ ЖИВОТНЫХ КРОВИ
' И ПОЛУЧЕНИЯ ИЗ НЕЕ ОТДЕЛЬНЫХ ИНГРЕДИЕНТОВ
Небольшое количество крови получают у кроликов и мор-
ских свинок из вен уха, у мышей и крыс — из вен хвоста, а
большие количества — из сердца. В особых случаях прибега-
ют к полному, или тотальному, обескровливанию, после кото-
рого животное погибает.
В табл. 9 приведены данные о максимальных количест-
вах крови и интервалах времени, через которые можно брать
кровь у животных.
Таблица 9
Схема взятия крови от животных-доноров
Вид животного Масса тела донора, г Максимальное количество крови, допускаемое для взятия одномомент- но, мл Интервалы времени между взятием кровн Максимальное количество крови, получаемое при тотальном обес- кровливании, мл
Кролики Морские свин- ки Крысы 3000—3500 400—500 180—200 25—30 10—12 6—8 10—15 дней 10—15 > 10—15 > 120—15 30—40 20—25
Для пункции сердца животных фиксируют к доске брюш-
ком кверху. Шерсть в области груди тщательно выстригают,
кожу обрабатывают спиртовым раствором йода и после этого
приступают к проколу, который в зависимости от вида жи-
вотного имеет некоторые различия.
Пункция сердца кроликов. Определяют II пальцем, обра-
ботанным спиртом и смазанным спиртовым раствором йода,
сердечный толчок, т. е. точку наиболее сильно выраженной-
пульсации сердца. Обычно она прощупывается в третьем
межреберье. Прокол грудной клетки делают в области сер-
дечного толчка на расстоянии 2—4 мм от левого края гру-
дины; иглу ведут в направлении к средней линии на глубину
2—2,5 см. При попадании иглы в полость сердца рука, в ко-
торой находится шприц, начинает ощущать ритмичные толч-
ки, связанные с пульсацией сердца и приподнимающие иглу.
Поршень шприца легко выдвигается наружу и в цилиндре
его тотчас появляется кровь. Взятие крови должно произво-
диться по возможности быстрее во избежание ее свертыва-
ния. По этой же’причине шприц и иглу рекомендуется промы-
вать перед опытом стерильным раствором цитрата или окса-
лата натрия. Взяв необходимое количество крови, быстрым
движением, без рывка, вынимают иглу и на месте укола на-
кладывают ватный тампон, пропитанный спиртовым раство-
ром йода. Животному подкожно вводят подогретый до тем-
пературы тела стерильный изотонический раствор хлорида
100
«атрия или глюкозу в количестве, равном двойному объему
взятой крови. Пункцией сердца можно получить у кролика
25—30 мл крови.
Пункция сердца у морских свинок. Кончиками III—IV
пальцев левой руки нащупывают сердечный толчок, в на-
правлении которого вертикально на глубину 1,5—2 см вка-
лывают иглу, отступя на 1—2 мм от левого края грудииы.
У морских свинок можно получить таким образом 10—12 мл
крови.
Пункция сердца у крыс. Как и в предыдущих случаях,
пальпаторно определяют место сердечного толчка. На 1 см
выше от установленной точки и на 1—2 мм левее от края гру-
дины делают прокол на глубину 1,5—2 см, держа иглу вер-
тикально. Одномоментно у крыс можно получить 6—8 мл
крови.
Тотальное обескровливание кролика. Вскрывают одну из
сонных артерий, расположенных по обеим сторонам трахеи.
Для получения стерильной крови руки оперируемого должны
быть тщательно вымыты и обработаны спиртом или спирто-
вым раствором йода, все инструменты предварительно необ-
ходимо простерилизовать.
Подготовленного для кровопускания кролика привязывают
ж станку брюшком кверху, фиксируя голову кольцом к шта-
тиву. Шерсть на шее тщательно выстригают, кожу дезинфи-
цируют. К носу животного прикладывают кусочек ваты, смо-
ченной эфиром. После того как наступит состояние наркоза,
скальпелем делают разрез по средней линии шеи и разводят-
края раны пинцетом. Сонные артерии проходят по бокам тра-
хеи в яремном желобке между веной и нервом. Сверху арте-
рия прикрыта грудино-подъязычной и грудино-щитовидной
мышцами. Поэтому для обнаружения нервно-сосудистого пуч-
ка эти мышцы разделяют тупым концом скальпеля или бран-
шами пинцета. Артерию освобождают от окружающей соеди-
нительной ткани и подводят под нее две лигатуры. Ближай-
шую к головке лигатуру завязывают двойным узлом, позади
второй лигатуры на расстоянии 0,3—0,5 см накладывают пе-
ан. Между лигатурой и пеаном маленькими остроконечными
ножницами делают продольный разрез сосуда длиной не бо-
лее 1,5—2 мм, вставляя в него канюлю (стеклянную трубочку
с оттянутым капилляром, кончик которой скошен и хорошо
оплавлен). Кончик вставленной канюли укрепляют второй
лигатурой. После этого под резиновую трубку, надетую на
расширенную часть канюли, подставляют пробирку или фла-
кон и снимают пеан с артерии, чтобы кровь могла вытекать
свободно (рис. 16). Обескровливание морских свинок про-
изводят так же, как и кроликов.
Взятие крови из вены уха кролика. Для получения крови
«з краевой вены нужно прежде всего вызвать гиперемию уха,
101
Рис. 16. Введение канюли в
артерию при обескровлива-
нии животных.
потирая его ладонями рук и слегка ударяя кончиками паль-
цев. Затем вдоль наружного края уха удаляют пушок и про-
тирают ватой, увлажненной 70% спиртом. Если в результате
всех перечисленных процедур сосуды не инъецируются, ухо<
смазывают ксилолом Или толуолом. После того как сосуды
набухнут и четко обозначатся на поверхности ушной ракови-
ны, наружную поверхность ее покрывают тонким слоем жид-
кого парафина (во избежание быстрого свертывания крови)
и делают прокол вены.
Для получения небольшого количества крови (менее 1 мл)
прокалывают одну из небольших периферических ветвей, а
для получения больших объемов крови (5—10 мл) вскрывают
краевую вену уха. С этой целью иглу шприца вводят в вену
почти параллельно поверхности уха, чтобы не повредить про-
тивоположную стенку вены. При проколе вены иглой шприца
кровь, как правило, выходит отдельными каплями с боль-
шими интервалами и кровотечение прекращается быстро.
Для того чтобы вызвать обильное кровотечение, нужно сде-
лать ранку с рваными краями. С этой целью пользуются об-
ломком тонкого капилляра пастеровской пипетки. При таком
способе прокола из уха кролика получают до 30 мл крови.
После взятия крови к проколу вены прикладывают на 2—
3 мин кусочек сухой стерильной ваты, не нажимая сильно на
стенку сосуда, так как при этом кровотечение может усилить-
ся. Если кровотечение долго не прекращается, хорошие ре-
зультаты дает нанесение на ранку нескольких капель пе-
рекиси водорода.
Взятие крови из вен у морских свинок, крыс и мышей.
У морских свинок кровь в количестве 0,3—0,5 мл получают
после нанесения насечек на край уха или прокола мягких по-
душек лапы.
У белых крыс и мышей для получения 1—3 капель кро-
ви приходится прибегать к ампутации кончика хвоста пос-
ле продолжительного прогревания его в воде температуры
45—50 °C или протирания ксилолом. Взяв кровь, рану
прижигают перекисью водорода.
112
В. М. Концова (1968) предложила способ, позволяющий
«юлучить у крыс 0,5—1 мл крови из венозного сплетения, ле-
жащего в орбите, позади глазного яблока. Взятие крови про-
изводят стеклянной пипеткой с оттянутым капилляром (на-
ружный диаметр 0,6 мл), острие которого сточено под уг-
лом 45°.
Животное берут I и II пальцами левой руки со стороны
-спины за шею и слегка сдавливают с боков, вызывая легкое
^выпячивание глаз. Вращательным движением пипетки дела-
ют прокол конъюнктивального мешка в медиальном углу гла-
за между глазным яблоком и орбитой. После прокола пипет-
ку ведут в направлении гортани на глубину 4—5 мм. Попа-
дание в венозное сплетение сопровождается заполнением ка-
пилляра пипетки кровью.
Получение дефибринированной крови. Кровь
животного сливают в стерильную колбу со стеклянными бу-
сами и непрерывно в течение 10—15 мин встряхивают. В ре-
зультате встряхивания находящийся в крови фибрин выпада-
ет в осадок, обволакивая бусы, а дефибринированная кровь,
слитая в другую колбу или пробирку, утрачивает способ-
ность свертываться.
Приготовление взвеси эритроцитов. Для ос-
вобождения от пленок фибрина дефибринированную кровь
фильтруют через трехслойный марлевый фильтр. Фильтрат
наливают в центрифужные пробирки и центрифугируют при
2000—3000 об/мин в течение 10—15 мин. Эритроциты оседают
на дно пробирки, а прозрачная, слегка желтоватого цвета
плазма образует надосадочный слой. После центрифугирова-
ния уровень жидкости в пробирке отмечают карандашом, от-
сасывают плазму пастеровской пипеткой, эритроциты промы-
вают, доливая до метки стерильный изотонический раствор
хлорида натрия, и вновь центрифугируют. Промывание эрит-
роцитов с добавлением свежего раствора производят 2—3 ра-
за, чтобы последняя порция промывной жидкости была бес-
цветна.
Из промытых эритроцитов готовят 3% или 5% взвесь, при-
бавляя к 3—5 мл эритроцитов соответственно 97—95 мл изо-
тонического раствора хлорида натрия (для получения мень-
ших количеств взвеси объемы обоих ингредиентов уменьша-
ют в одинаковое число раз).
Взвесь эритроцитов можно хранить в холодильнике при
температуре 3—4 °C в течение 5—6 дней.
Приготовление сыворотки крови. Кровь, со-
бранную в стерильную пробирку, закрывают ватно-марлевой
пробкой, ставят на 20—30 мин в термостат или водяную ба-
ню, отрегулированную на 37 °C, так как в тепле кровь свер-
тывается быстрее и лучше. Во время свертывания сгусток
крови обычно прилипает к стенкам пробирки. Поэтому после
103
взятия пробирок из термостата сгусток отделяют от стенок
пробирки круговым движением капилляра стерильной пасте-
ровской пипетки или стеклянной стерильной палочкой.
После отделения сгустка сыворотку ставят в холодильник
при температуре 3—4 °C. В течение 3—4 ч сыворотка обычно
отделяется полностью, и ее можно отсосать стерильной пасте-
ровской пипеткой. Для того чтобы во время отсасывания со-
держимое пробирки было хорошо видно, пастеровскую пи-
петку соединяют со стеклянной трубкой — «мундштуком» (ре-
зиновая трубка длиной 20—25 см). При отсасывании кончик
пипетки не должен соприкасаться со сгустком крови, чтобы в
сыворотку не попали эритроциты.
Окрашенную в розовый цвет сыворотку центрифугируют
при 2000—3000 об/мин в течение 10—15 мин для осаждения
форменных элементов крови.
При взятии крови вскоре после кормления животных, а
также при повторных кровопусканиях с короткими интерва-
лами возникает иногда липемия, т. е. появление избытка жи-
ровых веществ в крови. Сыворотки, получаемые во время ли-
пемии, бывают мутные (хилезные), иногда опалесцирующие,
и это очень затрудняет чтение диагностических реакций, осо-
бенно реакции преципитации. Во избежание получения мут-
ных сывороток кровь у животных берут натощак. Просветле-
ние липемической плазмы наступает также при введении в-
кровеносное русло животного гепарина, способствующего по-
вышению концентрации в крови фермента, называемого фак-
тором просветления. С этой целью кроликам весом 2—2,5 ki
в краевую вену уха вводят за 1—Р/г ч до обескровливания
60 мг гепарина.
Форменные элементы из крови удаляют центрифугирова-
нием. В слитой с осадка плазме через короткое время после
центрифугирования образуется сгусток фибрина, который уп-
лотняется при перемешивании крови стеклянной палочкой.
Затем этот сгусток удаляют. В некоторых случаях фибрин из
плазмы выпадает не полностью. Для удаления остатков фиб-
рина и выявления полноты его удаления к сыворотке при-
бавляют несколько капель тромбина. Освобожденную от фиб-
рина сыворотку фильтруют через асбестовые фильтры. Полу-
ченная таким способом сыворотка совершенно прозрачна и не
имеет признаков опалесценции.
Приготовление цитратной крови. Полученную
из сердца или вены кровь сливают в пробирку с 5% раство-
ром цитрата натрия (10 мл крови, 1 мл цитрата натрия). Цит-
ратная кровь не свертывается.
Приготовление плазмы крови. Цитратную кровь
ставят на 18—20 ч в холодильник или подвергают центрифу-
гированию. В результате над осадком эритроцитов образуется
прозрачный слой жидкости желтоватого цвета — плазмы.
104
УМЕРЩВЛЕНИЕ И ВСКРЫТИЕ ЛАБОРАТОРНЫХ ЖИВОТНЫХ
В лабораторной практике приняты способы умерщвления,
которые характеризуются простотой приемов и вызывают
быструю смерть животного. Мышей, крыс, морских свинок по-
мещают в стеклянную, плотно закрывающуюся банку с ку-
сочком ваты, пропитанным хлороформом или эфиром. Жи-
вотные засыпают и гибнут в течение 3—5 мин. Кроликов
умерщвляют посредством воздушной эмболии. Для этого в
краевую вену уха по направлению к его основанию вводят иг-
лу шприца. Появление капельки крови свидетельствует о том,
что игла находится в вене. После этого иглу соединяют с пу-
стым 10-граммовым шприцем, поршень которого вытянут до
конца. При надавливании на поршень в кровеносную систе-
му животного поступает находящийся в цилиндре шприца
воздух, вызывая эмболию и быструю смерть.
Вскрытие животных. Трупы лабораторных животных
вскрывают с целью выяснения причин гибели, выделения вве-
денного возбудителя, выявления механизма распространения
микробов в организме и места их локализации, изучения па-
тологоанатомических изменений, наступающих в результате
перенесенной инфекции. Вскрытие трупов животных произво-
дят стерильными инструментами, соблюдая правила асеп-
тики.
На столе должны находиться стакай, наполненный до по-
ловины спиртом, стерильные ножницы, скальпель, анатомиче-
ские и хирургические пинцеты, бактериальная петля, стериль-
ные чашки Петри, пробирки и чашки с питательными среда-
ми, стерильные пастеровские пипетки, предметные стекла, сте-
рильный изотонический раствор хлорида натрия, банка с дез-
инфицирующим раствором, ватные тампоны, спички и го-
релки (спиртовая и газовая). Вскрытие трупов следует произ-
водить таким образом, чтобы предупредить внесение микро-
организмов с поверхности в глубину тканей, а также перенос
микробов из одного органа в другой. С этой целью рекомен-
дуется вскрывать животных в агональном состоянии, усыпив
их эфиром, или тотчас после наступления смерти, так как в
ближайшие часы после нее проницаемость тканей нарушается
и бактерии из одного органа могут проникнуть в другой. Осо-
бую опасность в этом отношении представляет кишечник, со-
держимое которого изобилует микробами.
Труп животного брюшком кверху кладут на деревянную
доску или лоток с пластинкой застывшего парафина, растяги-
вают пинцетом все 4 лапы и в таком положении фиксируют
их булавками или небольшими острыми гвоздиками к по-
верхности дерева или парафина. Грудь и брюшко протирают
ватой, смоченной 5% раствором карболовой кислоты или 5%
раствором хлорамина, или, лучше, смачивают спиртом и под-
105
жигают шерсть, чтобы содержащиеся на ней микробы, в том
числе спороносные палочки, не разлетались и не загрязняли
стерильные инструменты и органы вскрытия трупа. В процес-
се вскрытия придерживаются общепринятого порядка. Сна-
чала исследуют наружные покровы н подкожную клетчатку,
затем проводят вскрытие, исследование и взятие материала
из органов грудной полости, а в последнюю очередь вскрытие,
исследование и взятие материала из органов брюшной по-
лости.
Обработанную кожу разрезают по средней линии живо-
та протяженностью от симфиза до грудино-ключичного со-
членения. На уровне передних и задних лап делают боковые
надрезы. Кожные лоскуты отсепаровывают от подкожной
клетчатки и отворачивают в стороны, прикалывая булавками
к доске.
В протоколе вскрытия отмечают состояние подкожной
клетчатки и лимфатических узлов в паху и подмышечных
впадинах. Подкожная клетчатка может быть развита сильно,
слабо или умеренно. Подмышечные и паховые узлы обнару-
живаются легко. При осмотре узлов обращают внимание на
их величину, форму и цвет. Для бактериологического иссле-
дования лимфатические узлы раздавливают стерильным пин-
цетом и погружают в жидкую питательную среду или втира-
ют в поверхность плотной питательной среды.
Сменив или простерилизовав использованные для вскры-
тия кожных покровов инструменты, приступают к вскрытию
грудной клетки. Грудину, захваченную пинцетом, слегка при-
поднимают, делают под ней небольшой надрез, вводят в него
браншу ножниц и перерезают ребра вначале с одной, а за-
тем с другой стороны. Если в грудной полости есть экссудат,
из него делают мазки и посев. Вновь сменив ножницы или
протерев их ватой, смоченной спиртом, разрезают перикард,
обнажая поверхность сердца. Накаливают на пламени го-
релки бранши пинцета или скальпель, прижигают поверх-
ность сердца, затем стерильным пинцетом оттягивают квер-
ху ушко правого предсердия и после этого через прижженное
место вводят в полость желудочка или предсердия капилляр
пастеровской пипетки. Кровь, поднявшуюся по капилляру пи-
петки, засевают в питательную среду.
Далее приступают к осмотру органов, расположенных в
грудной полости, регистрируя в протоколе имеющиеся в них
изменения, например наличие экссудата в полости плевры,
абсцессы, гиперемию (багрово-красное окрашивание) или, на-
оборот, ишемию (малокровие) в легких. Кусочки легкого е
выявленными в нем изменениями вырезают для бактериоло-
гического исследования.
После этого, сменив инструменты, переходят к исследова-
нию органов брюшной полости. Передний листок брюшины
106
вскрывают ножницами. При наличии экссудата в брюшной
полости делают из него мазок и производят посев в пита-
тельную среду. Затем осматривают печень, селезенку, почки,
•отмечая цвет, величину органов, характеризуя их консистен-
цию (нормальная, дряблая, уплотненная, хрупкая) и имею-
щиеся очаги поражения, например абсцессы.
При локализации инфекционного процесса в желудочно-
кишечном тракте делают посев содержимого желудка и ки-
шечника, набирая его в пастеровскую пипетку через приж-
женную желудочную и кишечную стенки. Таким же образом
для посева берут экссудат, содержимое абсцессов, желчного
« мочевого пузыря.
Из паренхиматозных органов (печень, почки, селезенка)
взятие материала и засев его производят одним из следую-
щих способов.
1. У стерильной пастеровской пипетки обламывают кон-
чик и проводят ее через пламя горелки. Затем капилляром
иипетки прокалывают прижженный участок исследуемого ор-
гана и насасывают в нее тканевую жидкость, которую засе-
вают в питательную среду. Пипетки после использования опу-
скают в банку с дезинфицирующим раствором.
2. Прижженную поверхность органа надрезают стериль-
ным скальпелем и из глубины надреза соскабливают бакте-
риальной петлей небольшое количество материала, которое
затем вносят в питательную среду.
3. На прижженной поверхности органа делают надрез,
остроконечными ножницами из глубины его вырезают ма-
ленький кусочек, раздавливают между браншами пинцета
и опускают в жидкую питательную среду или срезом ку-
сочка делают отпечатки на поверхности плотной питательной
среды.
Изменения, обнаруженные при вскрытии трупа, а также
результаты бактериологического исследования вносят в про-
токол вскрытия и бактериологического исследования трупно-
го материала, составленный примерно по такому образцу:
1. Вид лабораторного животного, взятого в опыт.
2. Время заражения (месяц, число, час).
3. Материал, примененный для заражения (взвесь микро-
бов с плотной питательной среды, бульонная культура, взвесь
патологического материала и т. д.).
4. Время гибели животного (месяц, число, час).
5. Изменения, обнаруженные при вскрытии животного в
-месте введения заразного материала, состояние подкожной
клетчатки, лимфатических узлов; изменения, найденные во
внутренних органах.
6. Вид микроба, выделенного из трупного материала, его
основные морфологические, культуральные, биохимические и
серологические свойства.
107
После вскрытия трупы животных складывают в металличе-
ские бачки с плотно закрывающимися крышками и засыпа-
ют сухой хлорной известью. Трупы мелких лабораторных жи-
вотных можно заливать раствором различных дезинфициру-
ющих веществ: 5% раствором карболовой кислоты, 3—5%
мыльно-карболовым раствором,. 3—5% раствором хлорамина.
Трупы животных, погибших от заражения споровыми форма-
ми микробов, заливают хлорноизвестковым молоком или 5—
10% осветленным раствором хлорной извести. В дезинфици-
рующем веществе трупы животных хранят до момента их
сжигания.
ОПРЕДЕЛЕНИЕ ВИРУЛЕНТНОСТИ МИКРОБОВ
Вирулентность — биологическое свойство микроба, харак-.
теризующее степень его патогенности в момент исследования.
В отличие от патогенности вирулентность является не видо-
вым, а индивидуальным признаком микроба, который может
усиливаться или ослабляться вплоть до полного исчезнове-
ния под влиянием различных факторов внешней среды.
Для характеристики вирулентности пользуются количест-
венными показателями, определяющими способность иссле-
дуемой микробной культуры вызывать гибель искусственно»
зараженных ею подопытных животных. Изучение вирулент-
ности бывает сопряжено с рядом трудностей, так как она оп-
ределяется не только комплексом культурно-морфологиче-
ских, токсигенных и биологических свойств микроба, но и ре-
зистентностью микроорганизма, подверженной большим
колебаниям в связи с видом, возрастом животных, режимом
их питания, температурой внешней среды, а также способом
заражения, принятым в опыте. Поэтому при установлении ви-
рулентности микроба очень важно вести исследование, точно-
соблюдая стандартность всех условий опыта.
Для определения вирулентности микробных культур чаще-
всего используют белых мышей. В том случае, когда белые
мыши невосприимчивы к исследуемому возбудителю заболева-
ния, пользуются другими видами животных: крысами, морс-
кими свинками или кроликами.
Для определения вирулентности применяют молодую
культуру микроба, так как старые культуры содержат боль-
шое количество мертвых клеток.
Культуру микроба для заражения выращивают на мясо-
пептонном агаре или другой плотной питательной среде, так
как бульон, представляя собой сложный белковый субстрат,,
небезразличен для животного организма и может извращать
результаты опыта. Исследуемую культуру микроба, выра-
щенную на скошенном мясо-пептонном агаре, смывают изото-
ническим раствором хлорида натрия и стандартизуют по оп-
108
тическому стандарту так, чтобы в 1 мл этого раствора содер-
жалось определенное количество микробных тел. В зависимо-
сти от вида культуры, патогенности ее для животных, взятых
в опыт, а также от цели и задач исследования количест-
во микробных тел, содержащееся в 1 мл взвеси, может коле-
баться от единиц до миллиардов. В тех случаях, когда по ка-
ким-либо причинам получить агаровую культуру невозможно,
пользуются суточной бульонной культурой. Для определения
Dim из бульонной культуры готовят ряд последовательных
десятикратных разведений: 1:10, 1:100, 1:1000, 1:10000,.
1 :100 000 и т. д.
Исследуемую взвесь бактерий вводят различными спосо-
бами: внутривенно, внутрибрюшинно, внутримышечно, под-
кожно, интраназально — в зависимости от целей и задач ис-
следования.
Отстандартизованную взвесь микробов в изотоническом
растворе хлорида натрия, а также разведения бульонной
культуры готовят с таким расчетом, чтобы различные дозы
микроба, используемые в опыте, содержались в одинаковых
объемах жидкости.
Каждую дозу культуры вводят одновременно нескольким
животным. При определении минимальной смертельной до-
зы учитывают и отмечают в протоколе опыта следующие дан-
ные:
1) количество микробов, введенных в организм животного;
2) способ их введения;
3) масса тела зараженного животного;
4) сроки гибели после заражения.
Степень вирулентности чаще всего характеризуют тремя
следующими показателями:
1) Минимальная смертельная доза Dim (Dosis letalis mi-
nima), т. e. наименьшая доза микробов, которая при опреде-
ленном способе заражения, в определенных условиях опы-
та вызывает гибель около 95% подопытных животных.
2) Наименьшая безусловно смертельная доза Del (Dosis
certe letalis) — наименьшая доза микробов, являющаяся
смертельной для всех 100% животных, взятых в опыт.
3. Средняя смертельная доза микробов LD50 (Dosis leta-
lis 50%) —доза микробов, вызывающая гибель 50% зара-
женных животных.
Показатель LD50 позволяет получить более достоверные
результаты, и потому он чаще других используется в практи-
ке экспериментальных исследований.
В отличие от Dim и Del, определявшихся непосредственно
по результатам опыта, LD50 вычисляется путем довольно
сложных математических расчетов. Более прост метод Кер-
бера, в котором простота расчета удачно сочетается с доста-
точно высокой точностью получаемых результатов.
109
Метод Кербера предусматривает: а) введение в опыт оди-
накового количества животных на каждую испытуемую дозу
микробов; б) постоянство величины отношений каждой после-
дующей дозы микробов к предыдущей.
При этом расчет DLi50 ведется по следующей формуле:
lg DLii0 = 1g Dn — 8 (2Zz = 0,5);
LDm = anti lg DLi^,
•где Dn — максимальная доза микробов, взятая в опыт; б —
•логарифм отношения каждой последующей дозы к предыду-
щей, т. е. логарифм кратности испытанных разведений; Li —
отношение числа погибших к общему числу животных, кото-
рым введена данная доза; 2Li — сумма значений Li, найден-
ных для всех испытанных доз.
Пример. В табл. 10 приведены данные по установлению вирулентно-
сти культуры риккетсий цуцугамуши. В опыте использовано пять различ-
ных доз культуры, взятых в разведении 10-3, 10-4 ... 10-7. Каждая испы-
туемая доза вводилась 6 подопытным мышам.
Таким образом, наибольшая из испытуемых доз в этом опыте состав-
ляет 10-3, следовательно lg £>n=—3.
Кратность разведений равна 10, отсюда d=lg 10=1,0. Наконец, сумма
значений Li, найденных для всех испытанных доз, 2 Li=4,00. Тогда по фор-
муле:
lgLD50=lgDN—6(2Li—0,5) =—3—1,OX (4,0—0,5) =—6,5
LD60 anti lg (—6,5) = 1/3160000 мл.
Таким образом, в 1 мл исходной микробной взвеси содержится
3 160 000 ld50.
Таблица 10
Определение вирулентности риккетсий
цуцугамуши
Доза (разве- дение) исход- ной взвеси Число погиб- ших живот- ных Отношение числа погиб- ших к общему числу жи- вотных. которым введена данная доза (Li)
IO"3 6 1
10-4 6 1
10-5 6 1
IO-» 4 0,67
10-7 2 0,33 2Li—4
ОПРЕДЕЛЕНИЕ ТОКСИГЕННОСТИ МИКРОБОВ
В патологии человека большую , роль играют токсигенные
микроорганизмы, к которым относятся палочки ботулизма,
столбняка, газовой анаэробной инфекции, дифтерии, а так-
же некоторые штаммы бактерий дизентерии Григорьева —
Шига, стафилококка и стрептококка.
110
Экзотоксины, вырабатываемые различными представите-
лями этой группы микробов, обладают резко выраженной
токсичностью, высокой избирательностью действия с пораже-
нием отдельных органов и тканей и способностью при парен-
теральном введении в организм вызывать образование анти-
тел— антитоксинов, способных нейтрализовать соответствую-
щие им экзотоксины.
Продуцируемые в процессе жизнедеятельности микроба
экзотоксины легко диффундируют из клетки в окружающую
их питательную среду. Бульонную культуру микроба выдер-
живают в термостате в течение 2—3 нед для накопления в
ней токсина, затем фильтруют через бактериальный фильтр.
Получаемый при этом прозрачный фильтрат содержит нераз-
веденный токсин.
Токсигенность микробов определяют по тому же принципу,
что и вирулентность. Единицами измерения токсигенности,
как и вирулентности, являются минимальная смертельная до-
за (Dim) и средняя смертельная доза (LD50).
Для определения Dim и LD50 фильтрат бульонной
культуры разводят стерильным изотоническим раствором
хлорида натрия в сотни, тысячи и миллионы раз. Каж-
дую дозу токсина испытывают одновременно на 6—10 жи-
вотных. Для постановки проб подбирают животных, наибо-
лее чувствительных к исследуемому токсину. Например, диф-
терийный токсин титруют на морских свинках, столбнячный
токсин — на мышах.
При учете полученных результатов в протоколе опыта от-
мечают дозу введенного токсина, способ его введения, массу
тела животного и время наступления его гибели после введе-
ния токсина,
ИММУНИТЕТ И МЕТОДЫ ЕГО ИЗУЧЕНИЯ
Под термином «иммунитет» (от лат. immunitas — избав-
ление от дани) подразумевают систему наследственно полу-
ченных и индивидуально приобретенных защитных анатомо-.
физиологических признаков, которые обеспечивают посто-
янство внутренней среды макроорганизма, определяют
невосприимчивость его к действию патогенных микробов и их
токсинов.
Иммунитет может быть врожденным и приобретенным.
Врожденный иммунитет, являясь преимущественно
видовым признаком, развивался в процессе длительной эво-
люции взаимоотношений макроорганизма и патогенного
микроба. В результате в организме животного и человека фор-
мировались тканевые и гуморальные защитные приспособле-
ния, обусловливающие состояние невосприимчивости к неко-
111
торым инфекционным заболеваниям, передающимся по нас-
ледству.
Примером видового иммунитета может служить невос-
приимчивость человека к куриной холере, животных — к ди-
зентерии, птиц—к сибирской язве, лягушек — к столбняку.
Напряженность видового иммунитета настолько высока, что
заражение естественно резистентных экспериментальных жи-
вотных заведомо смертельными дозами вирулентных микро-
бов не нарушает присущего им иммунитета и не вызывает за-
болевания.
Приобретенный иммунитет по характеру происхож-
дения делится на естественный и искусственный,
а по механизму своего действия — на активный и пас-
сивный.
При активных формах естественно и искусственно
приобретенного иммунитета организм сам вырабатывает ан-
титела — защитные вещества белковой природы, действие
которых направлено против микробов и продуктов их жизне-
деятельности. Современной наукой установлено, что антитела
вырабатываются лимфоидной системой, клетки которой скон-
центрированы в лимфоидных органах (селезенка, лимфати-
ческие узлы, вилочковая железа) и рассеяны в подкожной
клетчатке и подслизистых слоях пищеварительного, дыхатель-
ного тракта и мочеполовой системы.
Естественно приобретенный активный имму-
нитет возникает в результате перенесенного инфекционного
заболевания или повторных инфицирований организма, не
сопровождающихся клинически выраженными симптомами
болезни.
Искусственно приобретенный активный имму-
нитет создается в результате вакцинации, когда в ответ на
введение живых ослабленных или убитых микробов, а также
продуктов их жизнедеятельности в организме животных или
человека образуются антитела, аналогичные тем, которые воз-
никают при естественно приобретенном активном иммунитете.
Приобретенный активный (естественный или искусствен-
ный) иммунитет не передается по наследству и для многих
инфекционных заболеваний, не будучи пожизненным, утра-
чивается с годами.
При пассивном иммунитете в организм вводятся го-
товые антитела. Естественно приобретенный пассивный им-
мунитет к некоторым инфекционным заболеваниям имеют но-
ворожденные, приобретая антитела в период внутриутробного
развития через плаценту и после рождения — через молоко
матери.
Искусственный пассивный иммунитет воспроизводится по-
средством введения в организм животных и человека иммун-
ных сывороток, содержащих антитела. Защитное действие ие-
!!2
кусственно приобретенного пассивного иммунитета начина-
ется в ближайшие часы после введения иммунной сыворотки
и прекращается через 2—3 нед вследствие разрушения вве-
денных в организм антител.
Для активных и пассивных форм естественного и искусст-
венного иммунитета характерна высокая специфичность, обу-
словленная тем, что защитные антитела, формирующиеся в
процессе иммуногенеза или введенные в организм с иммунной
сывороткой, реагируют только с теми бактериями и продукта-
ми жизнедеятельности тех микробов, против которых они вы-
рабатывались.
Наряду со специфическими механизмами иммунитета в
комплексе защитных реакций организма большая роль при-
надлежит факторам естественной невосприимчивости, кото-
рые, не обладая какой-либо иммунологической специфич-
ностью, обеспечивают защиту организма при встрече его с
различными видами патогенных и непатогенных микробов.
Неспецифическая защита организма осуществляется с уча-
стием клеточных систем в виде фагоцитоза и местной воспа-
лительной реакции, препятствующих распространению микро-
бов в организме, а также гуморальных факторов, в частно-
сти лизоцима и комплемента, которые в совокупности обу-
словливают бактериостатическое и бактериолитическое дейст-
вие сыворотки.
СЕРОЛОГИЧЕСКИЕ МЕТОДЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ИЗУЧЕНИЯ
ФАКТОРОВ ГУМОРАЛЬНОГО ИММУНИТЕТА
Во всех иммунологических реакциях основным компонен-
том является антиген— вещество белковой природы, об-
ладающее двумя свойствами: способностью вызывать имму-
нологический процесс в организме и соединяться с антитела-
ми в серологических реакциях.
Микробная клетка представляет собой сложный антиген-
ный комплекс. С телом ее связан соматический (от лат.
soma — тело) антиген, обозначаемый буквой «О». У подвиж-
ных микробов обнаружен жгутиковый антиген «Н». Мик-
роорганизмы, находящиеся в капсульной форме, имеют кап-
сульный антиген.
Разные виды микробов имеют различные видовые ан-
тигены, специфические для каждого вида, и типовые ан-
тигены, обусловливающие существование различных сероло-
гических типов внутри вида.
Родственные между собой виды микробов могут иметь об-
щие, или групповые, антигены. Они обнаружены у пред-
ставителей бактерий кишечной группы: бактерий брюшного
тифа, паратифа А, В и др.
При введении в организм животного каждый антиген сти-
мулирует образование особых белковых веществ — антител,
в Лабинская А. С.
113
относящихся к у-глобулиновой фракции сыворотки. Отличи-
тельной особенностью антител является их способность обра-
зовывать специфические соединения с соответствующими анти-
генами. Антитело можно обнаружить in vitro. Для этого к
сыворотке крови, содержащей антитела, прибавляют бакте-
рии, вызвавшие их образование, или белок микробов, полу-
ченный посредством разрушения бактериальных тел. Внешним
проявлением реакции взаимодействия антигена с антите-
лом в пробирке может быть агглютинация, т. е. обра-
зование видимых хлопьев вследствие скучивания и склеива-
ния целых микробных клеток; преципитация — осажде-
ние видимого осадка, состоящего из вступивших друг с дру-
гом в соединение белков — антигена и антител; бактерио-
лиз — растворение микробных тел и др.
Реакции взаимодействия антитела с антигеном получили
название серологических от лат. serum — сыворотка.
Серологические реакции отличаются высокой специфич-
ностью. Это позволяет использовать их при решении двояко-
го рода задач: 1) для обнаружения в сыворотке крови анти-
тел к тому или иному микробу с помощью известного специ-
фического антигена (при серодиагностике заболевания);
2) для установления вида или типа выделенного микроба по
его антигенной структуре с помощью диагностической сыво-
ротки, содержащей известные специфические антитела.
Посуда и аппаратура для постановки серологических ре-
акций. Посуда. Пробирки бактериологические или химиче-
ские, агглютинационные, преципитационные и центрифужные.
Колбы Эрленмейера и плоскодонные. Пипетки пастеровские
и пипетки (без вредного пространства) объемом 10 и 5 мл
с делениями по 0,1 мл; пипетки объемом 1—2 мл с делениями
по 0,01 мл. Градуированные цилиндры различной емкости.
Посуда для серологических реакций должна быть чистой и
сухой. Для обработки ее не должны применяться дезинфици-
рующие средства, кислоты и щелочи. Посуду кипятят в про-
стой воде. Вымытые пипетки просушивают этиловым спиртом.
Стерилизовать серологическую посуду не обязательно.
Аппаратура. Штативы с гнездами, соответствующими
диаметру пробирок. Термостат и водяная баня с терморегуля-
торами. Центрифуга на 2000—3000 об/мин. Агглютиноскоп.
Микротитратор «Такачи». В последнее время при постановке
серологических реакций стеклянные пробирки стали заменять-
ся полистероловыми панелями с лунками объемом от 0,5 до
1,2 мл, а при работе с малыми количествами сыворотки ока-
зались незаменимыми микротитраторы системы «Такачи»
(Венгрия).
Микротитратор «Такачи» имеет три основные части:
1) полистероловые прозрачные пластинки (129X93 мм)
с лунками, заменяющие пробирки;
114
2) приспособления для взятия и разбавления исследуемых
сывороток — разбавители. По размеру различают 2 типа раз-
бавителей: меньший, рассчитанный на взятие жидкости в ко-
личестве 0,025 мл, и больший — на 0,05 мл. Размер разбави-
телей стандартен и при пользовании не требует дополнитель-
ной калибровки;
3) стеклянные пипетки с капельницами для разливки стан-
дартных (предусмотренных условиями опыта) объемов рас-
творителя.
Каждая пластинка имеет на своей поверхности 8 ря-
дов по 12 лунок. Различают пластинки типа U с полусфери-
ческим профилем сечения лунок, предназначенные для реак-
ции связывания комплемента, и пластинки типа V — с кони-
ческим профилем сечения для постановки реакции гемагглю-
тинации.
Разбавители — приспособления для взятия и разбав-
ления исследуемой сыворотки, представляют собой тонкие
стержни из термостойкого металла. На одном конце стержня
находится легкая металлическая рукоятка, на другом — на-
конечник, представляющий собой головку полусферической
формы, состоящую из платиновых пластин с вертикальными
прорезями. Верхние концы пластин спаяны с осью стержня,
нижние образуют по его окружности капиллярную щель.
Конец оси, выступающий на каркас разбавителя, служит
опорой, предохраняющей головку от деформации во вре-
мя работы, облегчает возможность ее вращения и предотвра-
щает образование царапин на дне лунок полистероловых
пластин.
Принцип действия разбавителя основан на свойстве капил-
лярности и поверхностного натяжения жидкости. Капилляр-
ность обеспечивает проникновение и заполнение полости го-
ловки исследуемой жидкостью в момент соприкосновения с ее
поверхностью, поэтому погружать головку в глубину жидко-
сти нет никакой необходимости. При отделении разбавителя
от поверхностного слоя жидкости она удерживается в поло-
сти головки силой поверхностного натяжения. Поскольку при
постановке серологических реакций чаще всего готовят не-
сколько параллельных рядов разведений, брать исследуемую
сыворотку целесообразно несколькими разбавителями одно-
временно, держа их в руке, как веер (рис. 17).
Стеклянные пипетки с капельницами для
приготовления серийных разведений снабжены конусом Луе-
ра, посредством которого капельная насадка надевается на
пипетку, как игла на шприц. Капельные насадки представля-
ют собой пластмассовый конус с вделанной в него стальной
трубочкой, конец которой оформлен таким образом, что при
заполнении пипетки изотоническим раствором хлорида нат-
рия, буферным раствором, а также белковым раствором с
8* 115
Рис. 17. Прибор Такачи—
аппарат для серологиче-.
скоро микротитроваиия.
Приготовление серий-
ных разведений.
1 — общий вид; 2 — схема
работы с аппаратом Такая»
(объяснение в тексте}.
6
концентрацией белка до 10% образуется капля стандартной
величины, равная 0,025 мл.
При стекании жидкости через пипетку формирование кап-
ли происходит на конце трубочки. В исключительно редких
случаях, когда пипетка долгое время находится в раствори-
теле, капля может образоваться на наружной боковой по-
верхности трубки. В этих случаях пипетку следует протереть
ватой или лигнином.
Пользуясь капельной насадкой пипетки, разливают рас-
творитель (буферный или изотонический раствор хлорида
натрия) в лунки пластин по одной (0,025 мл) или две
(0,05 мл) капли в соответствии с условиями реакции. При
разливке жидкости пипетку для правильного образования
капель держат вертикально, на высоте 1 см от пластин, ре-
гулируя темп образования капель указательным пальцем од-
ной руки и направляя трубочку пипетки в середину лунок
пальцами другой руки так, чтобы образующиеся капли пада-
ли на дно лунок, а не стекали по ее стенке.
После заполнения лунок растворителем головки разба-
вителей, содержащие исследуемую сыворотку, помещают в<
первый ряд лунок так, чтобы ось, выступающая за каркас го-
ловки, упиралась в дно лунок, а концы рукояток, располо-
женные в один ряд, было удобно вращать вокруг оси рукой.
Вращение головки разбавителя обусловливает интенсивное
перемешивание жидкости, основанное на засасывании раство-
рителя через капиллярную щель снизу и удалении его под
действием центробежных сил через вертикальные боковые
прорези платиновых пластинок. После 4—5-кратного враще-
ния головки разбавителя, обеспечивающего надежное пере-
мешивание и разведение сыворотки в 2 раза, его переносят из
первого ряда лунок во второй, повторяя в нем предыдущую-
операцию.
По окончании приготовления последних разведений, оп-
ределяемых в каждом конкретном случае условиями реакции,
разбавители на несколько секунд оставляют в горизонталь-
ном положении на смоченном лигнине для освобождения
полости головки от находящейся в ней жидкости. После
этого их промывают дистиллированной водой, повторяют
операцию с лигнином и затем обжигают на пламени горел-
ки до появления желтого окрашивания платиновых пла-
стин.
В приготовленные таким образом серийные разведения
сывороток с помощью капельной пипетки вносят необходи-
мые реактивы. При этом перемешивание веществ в лунках
обеспечивается завихрением жидкости, вызываемым падением
капли.
В принципе с помощью микротитратора можно воспроиз-
вести любую серологическую реакцию, основанную на серий-
117
ном разведении сыворотки, составив предварительно схему
ее постановки и рассчитав оптимальные концентрации ее ин-
гредиентов.
РЕАКЦИЯ АГГЛЮТИНАЦИИ
Агглютинацией называется обнаруживаемое невооружен-
ным глазом склеивание и выпадение в осадок микробных тел
при взаимодействии их со специфическими антителами —
агглютининами. Видимая фаза агглютинации наступа-
ет в присутствии раствора электролита. Агглютинины содер-
жатся в сыворотке крови человека и животных, перенесших
инфекцию или искусственно иммунизированных соответству-
ющим видом микроба.
Благодаря специфичности и простоте постановки реакция
агглютинации получила широкое распространение в микро-
биологической практике для диагностики многих инфекци-
онных заболеваний.
Существуют различные модификации постановки реакции
агглютинации. Из них наибольшее значение имеют:
1. Макроскопическая объемная агглютинация в пробирках
(классический метод).
2. Ускоренная ориентировочная реакция агглютинации на
•предметном стекле.
Постановка развернутой реакции агглютинации объемным
способом. Для постановки реакции агглютинации требуется:
1) сыворотка крови, подлежащая исследованию, в количест-
ве 0,1—0,2 мл; 2) изотонический раствор хлорида натрия;
3) корпускулярный антиген: взвесь живых или убитых бак-'
•терий (диагностикум).
Приготовление разведений сыворотки
'больного. Из сыворотки, с которой предполагается ставить
реакцию агглютинации, готовят ряд последовательных дву-
хкратных разведений, чаще всего от 1 :50—1 : 100 до 1 : 1600—
1:3200. В отдельной пробирке готовят первое, основное, раз-
ъел ение сыворотки, обычно 1 :50 или 1 : 100. Для этого гра-
дуированной пипеткой емкостью 1 мл набирают 0,1 мл сыво-
ротки, другой пипеткой емкостью 10 мл прибавляют к ней
4,9 мл (1:50) или 9,9 мл (1:100) изотонического раствора
ххлорида натрия. Жидкость в пробирке тщательно перемеши-
ъают, набирая ее в пипетку и выдувая в пробирку. Основной
'раствор сыворотки используют для приготовления ряда по-
следовательных разведений.
В штатив устанавливают ряд агглютинационных проби-
рок. На первой пробирке ряда пишут наименование антиге-
на, который будет введен в реакцию, и указывают номер ис-
следуемой сыворотки. На каждой пробирке ряда обозначают
степень разведения находящейся в ней сыворотки. Две по-
118
следние пробирки ряда предназначены для контроля антиге-
на и сыворотки. На них ставят условные обозначения: КА —
контроль антигена и КС — контроль сыворотки.
Во все пробирки, за исключением первой и последней
(КС), наливают по 1 мл изотонического раствора хлорида
натрия, пользуясь для этой цели градуированной пипеткой
емкостью 5—10 мл. Затем из сосуда с основным разведени-
ем сыворотки (например, 1: 100) берут 3 мл и наливают по
1 мл в 1-ю, 2-ю и в последнюю пробирку (КС). Далее 1 мл
содержимого 2-й пробирки переносят в 3-ю, из 3-й пробирки
такое же количество — в 4-ю, из 4-й — в 5-ю. Из 5-й пробир-
ки (последняя опытная) 1 мл содержимого выливают в банку
с дезинфицирующим раствором для сохранения одинакового
объема (1 мл) во всех пробирках.
Таким образом, разведение сыворотки в первой пробирке
соответствует основному ее разведению (1:100); в последу-
ющих пробирках получается ряд последовательных двукрат-
ных разведений: 1 : 200, 1 : 400, 1 : 800, 1 : 1600.
Вместо 1 мл можно разливать в пробирки по 0,5 мл изо-
тонического раствора хлорида натрия и соответственно при-
бавлять по 0,5 мл основного разведения сыворотки, в ре-
зультате чего объем окончательных разведений сыворотки во-
всех пробирках будет составлять 0,5 мл.
По окончании разведений во все пробирки ряда, за исклю-
чением КС, прибавляют по 1—3 капли антигена, содержаще-
го 2 млрд, живых или убитых микробных тел в 1 мл. После
этого жидкость в пробирках становится слегка мутноватой.
После добавления антигена к разведенной сыворотке шта-
тив с пробирками встряхивают для лучшего перемешивания
сыворотки с изотоническим раствором хлорида натрия, ста-
вят на 2 ч в термостат при 37°С, а затем учитывают предва-
рительный результат реакции. Окончательный результат ре-
гистрируют через 18—20 ч стояния пробирок при комнатной
температуре (табл. И).
Таблица 11
Схема постановки реакции агглютинации объемным методом
Ингредиент № пробирки КА КС
1-я 2-я З-я 4-я 5-я 6-я 7-я
Изотонический раствор хлорида натрия, мл — 1 1 1 1 1 —
Сыворотка, мл 1 1 1 1 1 — 1
Полученное разведение 1 : 100 1.200 1.400 1.800 1:1600 — —-
Антиген, капли 3 3 3 3 3 3
119
Положительный результат реакции агглютинации харак-
теризуется образованием на дне пробирки осадка с выражен-
ным просветлением надосадочной жидкости. Остаток на дне
пробирки, образовавшийся в результате склеивания микроб-
ных тел, называется агглютинатом. По характеру аг-
тлютината различают мелкозернистую (О) и круп-
ен о х л опчатую 1(H) агглютинацию. О-агглютинины, воз-
никшие в организме под действием соматического О-антигена,
-обусловливают склеивание микробных тел с образованием
компактного мелкозернистого осадка, оседающего на дно
пробирки в виде кучки. Мелкозернистая агглютинация про-
текает медленно, учитывается после 2-часового пребывания
в термостате и 18—20-часового выдерживания пробирок при
комнатной температуре. Н-агглютинины, появляющиеся-в ор-
ганизме в ответ на введение жгутикового антигена, вызыва-
ют склеивание бактериальных клеток посредством их жгути-
ков с образованием крупных хлопьев, похожих на снежинки.
Выпадая на дно пробирки, крупнохлопчатый агглютинат
приобретает форму опрокинутого вниз зонтика. Крупнохлоп-
чатая агглютинация наступает и заканчивается в течение 2 ч
пребывания пробирок в термостате. Жгутиковые агглютини-
ны, как правило, достигают более высокого титра, чем сома-
тические. Крупнохлопчатый Н-агглютинат легко обнаружива-
ется простым глазом.
Для выявления мелкозернистого О-агглютината приходит-
ся пользоваться агглютиноскопом или вогнутым зеркалом.
Учет результатов реакции агглютинации начинают с про-
смотра контрольных пробирок. Реакция может считаться по-
ложительной лишь в том случае, если в пробирках с контро-
лями жидкость остается совершенно однородной: в КА —
слегка мутной, в КС — прозрачной.
Для регистрации результатов реакции агглютинации
пользуются четырехкрестной системой обозначения:
+ + + полная агглютинация, при которой большой осадок на дне рас-
полагается кучкой или в форме открытого перевернутого зонтика;
надосадачная жидкость в пробирке совершенно прозрачна;
+ + почти полная агглютинация; осадок такой же, как в предыдущем
случае; жидкость почти прозрачная;
слабая агглютинация; небольшой осадок, жидкость непрозрачная;
+ отмечают следы агглютинации: осадок едва заметен; жидкость
непрозрачная;
— отрицательная реакция: содержимое пробирок равномерно мутное,
без осадка, ло виду неотличимо от содержимого пробирки КА.
Последнее разведение сыворотки, в котором наблюдается
•агглютинация, считают ее титром.
Определение серологического типа выделенного микроба.
Серологическая идентификация микроба посредством агглю-
тинации соответствующей специфической сывороткой явля-
120
ется завершающим этапом в изучении многих микробных
культур.
Неизвестный штамм микроба испытывают в реакции аг-
глютинации с разведенной до титра иммунной диагностиче-
ской сывороткой. За титр принимают конечное
разведение сыворотки, при котором проис-
ходит еще отчетливая агглютинация соот-
ветствующего ей вида микроба.
Предположим, что иммунная сыворотка агглютинирует
соответствующий ей микроб до разведения 1:12 800. Следо-
вательно, титр данной сыворотки равен 1 : 12 800.
Подготовка антигена (неизвестный ингре-
диент реакции). Из микробной культуры, выращенной
на скошенном мясо-пептонном агаре, готовят взвесь в изото-
ническом растворе хлорида натрия, содержащую в 1 мл
2 млрд, микробных тел по оптическому стандарту.
Приготовление разведений диагностиче-
ской иммунной сыворотки. При определении вида
микроба пользуются набором диагностических агглютинирую-'
щих сывороток. Их готовят в лаборатории, иммунизируя кро-
ликов соответствующим антигеном, или получают в готовом
виде из производственных институтов, изготовляющих бакте-
рийные препараты. Сыворотки выпускают в высушенном ви-
де. На этикетках ампул указаны срок годности и титр сыво-
ротки.
Перед употреблением ампулу вскрывают, содержащуюся-
в ней сыворотку растворяют в 1 мл изотонического раствора
хлорида натрия и готовят из нее 3—4, в зависимости от титра-
сыворотки, основных разведения: 1:100, 1:1000, 1:10 000„
1:100 000. Приготовление нескольких основных разведений
сыворотки обусловлено необходимостью составления длинно-
го ряда сыворотки в каждой последующей пробирке ря-
да по сравнению с предыдущей увеличивается примерно-
в 1,2—1,4 раза. Разведения сыворотки готовят следующим-
образом:
А. 0,1 мл неразведенной сыворотки (из ампул),+ 9,9 мл
изотонического раствора хлорида натрия = 1:100.
Б. 1 мл (разведения А) + 9 мл изотонического раствора
хлорида натрия =. 1:1000.
В. 1 мл (разведения Б) + 9 мл изотонического раствора
хлорида натрия =. 1 :10000.
Г. 1 мл (разведения В) + 9 мл изотонического раствора>
хлорида натрия =. 1 :100 000.
Из основных разведений сыворотки, условно обозначен-
ных А, Б, В и Г, готовят необходимые для постановки реак-
ции разведения, придерживаясь при этом схемы расчета, дан--
ой в табл. 12.
121'
В состав каждого агглютинационного ряда вводят разве-
дения диагностической сыворотки, начиная от 1:100 и кончая
титром сыворотки, указанной на ее этикетке.
При проведении основного опыта в штатив устанавлива-
ют ряд агглютинационных пробирок, количество которых оп-
ределяется титром иммунной сыворотки. Количество рядов
•соответствует числу диагностических сывороток, участвую-
щих в опыте.
На 1-й пробирке каждого ряда указывают название аг-
глютинирующей сыворотки. На каждой пробирке надписывав
ют степень разведения находящейся в ней сыворотки. После
этого из приготовленного ряда разведений берут по 1 мл сы-
воротки и переносят последовательно в ряд агглютинацион-
ных пробирок так, чтобы степень разведения сыворотки со-
ответствовала надписи на пробирке. В предпоследнюю про-
бирку ряда (контроль антигена) сыворотку не наливают.
В последнюю пробирку (контроль сыворотки) наливают 1 мл
.наименьшего разведения сыворотки, содержащегося в 1-й
пробирке данного ряда. Перенос сыворотки из пробирок ос-
новного ряда в пробирки агглютинационные, начиная от
«больших разведений и переходя к меньшим,
можно производить одной и той же пипеткой. В пробирки с
разведениями сыворотки прибавляют по 0,5 мл антигена —
взвеси изучаемого микроба, содержащей 2 млрд, микробных
тел в 1 мл. Затем штатив с пробирками встряхивают и ставят
в термостат на 2 ч, после чего производят предварительный
учет результатов. Окончательный результат регистрируется
после 18—20 ч стояния пробирок при комнатной темпера-
туре. Учитывают получаемые результаты так же, как при вы-
явлении агглютининов в исследуемой сыворотке больного
(см. с. 120).
Соответствие между видом или типом микроба и диагно-
стической агглютинирующей сывороткой считается достовер-
ным при условии четко выраженной реакции агглютинации
в пробирках с разведением сыворотки в пределах 3/4 ее титра
и выше (табл. 12).
Ориентировочная (пластинчатая) реакция агглютинации.
Пластинчатой реакцией агглютинации на предметном стекле
часто пользуются для определения вида микроба. На поверх-
ность хорошо обезжиренного предметного стекла наносят с
помощью пастеровской пипетки 2 капли агглютинирующей
сыворотки и 1 каплю изотонического раствора хлорида нат-
рия. Капли располагают на некотором расстоянии друг от
друга, чтобы исключить возможность их слияния.
Затем в каплю изотонического раствора хлорида натрия
(КА) и в одну из капель агглютинирующей сыворотки вносят
исследуемую бактериальную культуру, снятую с поверхности
плотной питательной среды. Ко второй капле (КС) культуру
122
не добавляют. Внесенную культуру тщательно перемешива-
ют, чтобы капля жидкости сделалась равномерно мутной. Ре-
акция протекает при комнатной температуре. Результат учи-
тывают с помощью лупы через 5—10 мин. Учет реакции можно,
производить и через больший промежуток времени (30—
40 мин), но для этого предметные стекла, на которых постав-
лена реакция, кладут в чашку Петри с влажным комочком
ваты и закрывают крышкой (влажная камера), исключая та-
ким образом испарение и высыхание капель. При положи-
тельной реакции в капле с сывороткой отмечается скучивание
бактерий в виде зернышек или хлопьев, хорошо видимых че-
рез лупу (Х5) при покачивании стекла. Жидкость в КА оста-
ется равномерно мутной, а в КС — прозрачной.
Групповая реакция агглютинации и способ ее устранения
по Кастеллани. Некоторые микроорганизмы, кроме специфи-
ческих видовых антигенов, содержат групповые антигены, об-
щие для родственных видов бактерий. При парентеральном
введении таких бактерий в организме животного и человека
появляются двоякого рода антитела-агглютинины: специфиче-
ские, соответствующие видовым антигенам, и неспецифиче-
ские, возникающие под действием групповых антигенов.
Сыворотка, содержащая групповые агглютинины, агглю-
тинирует различные родственные между собой микробные ви-
ды, имеющие общий групповой антиген.
Реакция агглютинации, при которой один и
тот же микроб агглютинируется различными
сыворотками или одна сыворотка агглютини-
рует различные микробы, получила назва-
ние групповой.
Для ее устранения итальянским ученым Кастеллани пред-
ложен метод специфической адсорбции антител. Сущность его
заключается в том, что при насыщении иммунной сыворотки
гомологической культурой бактерий на них адсорбируются
как специфические, так и групповые агглютинины, тогда как-
насыщение сыворотки гетерологическим штаммом делает воз-
можным удаление из нее групповых и сохранение специфиче-
ских антител.
Метод адсорбции антител находит широкое применение
при изучении антигенной структуры микроорганизмов, при
иммунологическом анализе антисывороток, а также при из-
готовлении диагностических сывороток.
Адсорбированные сыворотки. В настоящее время для
устранения групповой реакции агглютинации пользуются
строго специфическими сыворотками, которые содержат в сво-
ем составе только видовые или типовые антитела и соответст-
вуют определенному виду или типу микроба.
Эти сыворотки получили название адсорбированных
м моноредепторных. Адсорбированные сыворотки мо-
133-
гут быть монорецепторными, т. е. содержать только один вид
агглютининов, или поливалентными — содержать два рецеп-
тора или больше.
В Советском Союзе адсорбированные сыворотки готовят
для идентификации дизентерийных бактерий, сальмонелл, хо-
лерных и нехолерных вибрионов, бруцелл. Для производства
адсорбированных и монорепепторных сывороток подбирают
и селекционируют штаммы микробов, предназначенные спе-
циально для иммунизации животных.
Для устранения групповых антител сыворотки насыщают
последовательно культурами родственных микробов, которые
адсорбируют содержащиеся в сыворотке групповые агглю-
тинины.
Адсорбированные агглютинирующие сыворотки применяют
в реакции агглютинации на стекле с целью идентификации и
изучения антигенной структуры микробов.
Реакция непрямой (пассивной) гемагглютинации
Сущность непрямой, или пассивной, реакции гемагглюти-
нации (РИГА) заключается в том, что эритроциты, обладая
способностью адсорбировать на себе антигены, становятся
«чувствительными» (сенсибилизированными) к соответствую-
щей иммунной сыворотке. Под воздействием специфических
антител сенсибилизированные эритроциты склеиваются и вы-
падают в осадок, образуя на дне пробирки гемагглютинат.
Отличаясь высокой чувствительностью и специфичностью,
РИГА позволяет обнаруживать минимальные количества-ан-
тител и неполноценные антигены полисахаридной природы.
Для постановки РИГА требуются:
1. Сыворотка, подлежащая исследованию.
2. Растворимый антиген для сенсибилизации эритроцитов.
3. Эритроциты.
4. Изотонический раствор хлорида натрия.
Реакцию непрямой гемагглютинации ставят в пластинках
из органического стекла с лунками.
1. Подготовка эритроцитов для постанов-
ки РГА. Для постановки этой реакции пользуются свежими
или консервированными эритроцитами барана, быка или че-
ловека, полученными из дефибринированной крови. Для кон-
сервации эритроцитов используют раствор Олсвера (рец. 22,
с. 347) или Мигулиной (рец. 23).
Из крови берут осадок эритроцитов в объеме 0,1—1 мл и
.2—3 раза отмывают его от остатка сыворотки в десятикрат-
ном объеме стерильного изотонического раствора хлорида
натрия. После каждого центрифугирования (при 2000—
3000 об/мин) надосадочную жидкость сливают, заменяя све-
жим изотоническим раствором хлорида натрия.
<24
Отмытые эритроциты могут быть использованы в течение
48 ч в случае хранения их в холодильнике при температуре
3—4°С.
После промывания эритроцитов приступают к сенсибили-
зации их антигеном. Отмытые эритроциты в объеме от 0,1
до 1 мл смешивают с антигеном, количество которого опре-
деляется его качеством и способностью адсорбироваться на
эритроцитах. Смесь антигена с эритроцитами помещают в
термостат на 1—2 ч, а иногда, по условиям опыта, на более
продолжительное время. После инкубации взвесь сенсибили-
зированных эритроцитов центрифугируют, отмывают 2—3 ра-
за изотоническим раствором хлорида натрия и из промытого
осадка готовят 0,5—1% взвесь эритроцитов для постановки
реакции гемагглютинации. Приготовленная взвесь может хра-
ниться в холодильнике при температуре 3—4°С до появления
признаков гемолиза.
Однако описанный способ сенсибилизации эритроцитов
пригоден только для тех случаев, когда антиген относится к
группе полисахаридов. Антигены белковой природы адсорби-
руются эритроцитами очень слабо и поэтому при добавлении
соответствующей иммунной сыворотки реакция гемагглютина-
ции не наступает.
Для адсорбции крупномолекулярных антигенов белковой
природы эритроциты предварительно обрабатывают танином,
который уплотняет и изменяет физико-химические свойства их
поверхности и повышает адсорбционную способность. Взвесь
эритроцитов (2,5%) в изотоническом растворе хлорида нат-
рия pH 7,2 смешивают с равным объемом раствора танина
1:20 000, приготовленного на обычном изотоническом раство-
ре хлорида натрия, и ставят на 10—15 мин в термостат или
водяную баню при 37°С. По истечении указанного времени
смесь центрифугируют, надосадочную жидкость сливают, а
осадок эритроцитов промывают фосфатно-буферным раство-
ром при pH 7,2. Надосадочная жидкость может быть окраше-
на в желтый или желтовато-розовый цвет, что обусловлено
токсическим влиянием танина на эритроциты.
После обработки танином устойчивость эритроцитов, взве-
шенных в изотоническом растворе хлорида натрия, снижает-
ся. Поэтому для приготовления стойкой взвеси пользуются
стабилизатором — раствором нормальной сыворотки кролика.
Сыворотку, полученную от кроликов-доноров, инактивируют
при температуре 56°С в течение 30 мин, истощают от неспе-
цифических гемагглютининов, прибавляя к 1 мл инактивиро-
ванной сыворотки 0,5 мл осадка отмытых нормальных эрит-
роцитов. Смесь выдерживают 30 мин при комнатной темпе-
ратуре, центрифугируют, отсасывают сыворотку и непо-
средственно перед использованием разводят ее в 100
али 250 раз.
125
2. Подготовка исследуемых сывороток для
постановки РГА. Сыворотку, подлежащую исследованию,
разводят в 2—10 раз изотоническим раствором хлорида нат-
рия и удаляют из нее неспецифические антитела. Для этого
к 1 мл разведенной сыворотки прибавляют по 2 капли нор-
мальных отмытых эритроцитов барана. Смесь выдерживают
15—20 мин при комнатной температуре, после чего центри-
фугируют. Операцию адсорбции неспецифических антител по-
вторяют 3 раза на одних и тех же эритроцитах. После послед-
него центрифугирования надосадочный слой, представляющий
собой разведенную сыворотку, освобожденную от неспеци-
фических гемагглютининов, отсасывают пастеровской пипет-
кой и инактивируют 30 мин при температуре 56°С.
Для устранения неспецифических гемагглютининов вместо
адсорбции можно пользоваться прогреванием исследуемых
сывороток при температуре 65°С в течение 20 мин.
Техника постановки реакции. Из исследуемой
сыворотки готовят ряд последовательных разведений (с уче-
том того разведения, которое было сделано до прибавления
эритроцитов). При серодиагностике разных видов инфекций
пределы разведений сыворотки различны. Приготовленные
разведения сыворотки разливают в лунки по 0,5 мл. К каж-
дому разведению исследуемой сыворотки прибавляют от 0,1
до 0,5 мл (в зависимости от частного случая) 0,5—1% взвеси
сенсибилизированных эритроцитов. Каждый опыт сопровож-
дается постановкой контролей на отсутствие спонтанной аг-
глютинации (1 и 2) и контролем на специфичность реакции
(Зи4):
1. 0,5 мл изотонического раствора хлорида натрия + рабо-
чая доза сенсибилизированных эритроцитов.
2. 0,5 мл изотонического раствора хлорида натрия + рабо-
чая доза несенсибилизированных эритроцитов.
3. Иммунная сыворотка, взятая в разведении, соответст-
вующем ее титру (последнее разведение, дающее положитель-
ную реакцию в РИГА), + рабочая доза сенсибилизированных
эритроцитов.
4. Нормальная сыворотка, нс содержащая специфических
антител, + рабочая доза сенсибилизированных эритроцитов.
Результат реакции агглютинации учитывают после осаж-
дения эритроцитов в контрольных пробирках непосредственно
после инкубации в термостате при температуре 37°С или по-
сле дополнительного выдерживания при комнатной темпера-
туре в течение 18—24 ч.
Результаты оценивают по внешнему виду осадка эритро-
цитов в лунках. В положительном случае, обозначаемом зна-
ком + , эритроциты равномерно в виде «зонтика» покрывают
почти все дно пробирки или лунки. При наклоне из осадка
образуются хлопья. При отрицательном результате (—) эрмт-
126
роциты оседают в зависимости от дна пробирки в форме ком-
пактного комочка, «пуговки» или маленького колечка в са-
мом низком месте дна. При наклоне образуется равномер-
ная муть. Сомнительные случаи, обозначаемые знаком + ,
требуют повторения постановки реакции в целях ее
уточнения.
Реакция торможения непрямой гемагглютинации
Реакция торможения непрямой агглютинации (РТНГА),
предложенная для обнаружения и титрования в исследуемых
субстратах микробных антигенов и антител, основана на уча-
стии трех компонентов: антигенов, антител и эритроцитов с
адсорбированными на них антигенами (если задачей реак-
ции является выявление и титрование антител) или антитела-
ми (если реакция ставится в целях обнаружения соответству-
ющих специфических антигенов). РТНГА ставят в пластинках
из органического стекла с лунками в объеме 1,5—2 мл или
в микротитраторе «Такачи». Перед постановкой реакции из
исследуемых сывороток, разведенных в 2—10 раз изотониче-
ским или буферным раствором хлорида натрия, удаляют не-
специфические гемагглютинины.
Определяют рабочую дозу антигена в РИГА. Для этого
готовят двукратные разведения антигена в объеме 0,5 мл (при
работе с микротитратором — в объеме 0,05 мл). Во все лун-
ки приготовленных разведений антигена вносят по 0,25 мл
(или соответственно по 0,025 мл) .1% взвеси эритроцитов,
•сенсибилизированных антителами, гомологичными титруемо-
му антигену. Содержимое лунок тщательно перемешивают
путем легкого постукивания по углам панели и оставляют на
1—1 */г ч при комнатной температуре до полного оседания
эритроцитов. За 1 антигенную единицу (АЕ) связывания при-
нимают наибольшее разведение антигена, образующего оса-
док эритроцитов в виде перевернутого зонтика. В качестве
рабочей дозы для РТНГА используют 4 АЕ.
После удаления неспецифических гемагглютининов из ис-
следуемой сыворотки и определения рабочей дозы антигена
приступают к постановке РТНГА. Из исследуемой сыворот-
ки готовят ряд последовательных разведений с учетом того
разведения, которое было сделано при удалении из нее не-
специфических гемагглютининов. При постановке реакции
обычным способом сыворотку разводят в объеме 0,5 мл, при
постановке в микротитраторе — в объеме 0,025 мл.
Постановке реакции сопутствуют два контроля: КС и КА.
1. КС: 0,5 мл (или 0,025 мл) взятого в опыт наименьшего
разведения исследуемой сыворотки с добавлением вместо ан-
тигена равного объема буферного или изотонического раство-
ра хлорида натрия.
127
2. KA: 0,5 мл (или 0,025 мл) антигена в рабочей дозе с
добавлением вместо сыворотки равного объема буферного или
изотонического раствора хлорида натрия.
К каждому разведению сыворотки (кроме КС) добавляют
рабочую дозу антигена в объеме 0,5 мл (или 0,025 мл). Со-
держимое лунок тщательно перемешивают и оставляют при
комнатной температуре или температуре термостата (в соот-
ветствии с условиями реакции) на время, необходимое для
нейтрализации системы антиген — антитело.
По истечении времени, необходимого для осуществления
реакции, во все лунки ряда, в том числе в лунки с КС и КА,
добавляют в объеме 0,1—0,5 мл (при микрореакции—в объе-
ме 0,025 м) 1% взвесь сенсибилизированных эритроцитов с
предварительно оттитрованной рабочей дозой антигена.
Для лучшего перемешивания смеси панель постукивают
по углам и оставляют при комнатной температуре или тем-
пературе термостата на время, которое по условиям реакции
необходимо для агглютинации сенсибилизированных эритро-
цитов гомологичным антигеном.
Результат реакции оценивают по внешнему виду осадка
эритроцитов. При положительной реакции на дне лунки обра-
зуется диск или кольцо из осевших эритроцитов. Это свиде-
тельствует о наличии в исследуемой сыворотке антител, го-
мологичных добавленному антигену, вследствие чего агглю-
тинации эритроцитов не происходит. При отрицательной
реакции сенсибилизированные эритроциты, агглютинирован-
ные свободными антителами, располагаются в виде перевер-
нутого на дне лунки зонтика.
Реакция преципитации
Реакция преципитации относится к числу наиболее про-
стых и ускоренных методов серологического анализа. В осно-
ве реакции лежит образование видимого осадка, состоящего
из вступивших друг с другом в соединение антител и моле-
кулярных антигенов (например, бактериальных бел-
ков или полисахаридов, образовавшихся при разрушении мик-
робных тел). По своей сущности реакция преципитации ана-
логична реакции агглютинации. Основным различием между
ними является то, что в первом случае применяется корпуску-
лярный антиген, а во втором — антиген представляет собой
коллоидное вещество белковой или полисахаридной природы.
Другим существенным различием является то, что агглю-
тинация представляет собой количественный метод исследо-
вания, с помощью которого устанавливают титр агглютини-
нов, содержащихся в исследуемой сыворотке крови. Реак-
ция преципитации— качественный метод исследования,
при котором диагностическое значение имеет появление ©сад-
ка в реагирующих жидкостях.
128
Для обозначения антигенов, участвующих в реакции пре-
ципитации, принят термин «п р е ц и п и т и н о г е н», для ан-
тител — «п р е ц и п и т и н», для специфического осадка, об-
разующего в результате реакции — «преципитат». Пре-
ципитат, возникающий вследствие укрупнения коллоидных
частиц антигена, может иметь вид кольца, формирующегося
на границе антигена с иммунной сывороткой, или аморфного
осадка, выпадающего на дно пробирки.
Реакцию преципитации используют для: 1) выявления спе-
цифических антител в исследуемой сыворотке на основе при-
менения определенных антигенов; 2) обнаружения антигенов
белковой или полисахаридной природы с использованием из-
вестной специфической преципитирующей сыворотки.
Для постановки реакции преципитации необходимы:
1. Сыворотки (в зависимости от задач опыта — исследуе-
мые или иммунные — преципитирующие).
2. Антигены (также в зависимости от задач анализа —
исследуемые или диагностические).
3. Изотонический раствор хлорида натрия pH 7,0—7,2.
4. Пастеровские пипетки с тонко оттянутым капилляром.
5. Преципитационные пробирки (диаметром 2—3 мм и вы-
сотой 2—3 см для реакции кольцепреципитации, диаметром
4 мм и высотой 4—6 см для реакции преципитации по типу
флокуляции). В узких пробирках реакция преципитации на-
ступает значительно скорее и проявляется более четко, чем в
пробирках большого диаметра.
Антигены, применяемые для постановки реакции преципи-
тации, представляя собой, как указано выше, коллоидные ве-
щества в состоянии тонкой дисперсности, обязательно долж-
ны быть в растворимом состоянии. В качестве антигенов для
реакции преципитации используют фильтраты бульонных
культур, экстракты микробных тел, полученные различными
способами, «полный» антиген Буавена, экстракты поражен-
ных органов, спинномозговую жидкость, гной, мокроту и дру-
гие материалы, содержащие продукты распада возбудителей
болезни. Способы приготовления антигена для постановки ре-
акции преципитации даны в разделе частной микробиологии
конкретно для каждого случая.
Преципитирующие сыворотки, приготовленные против раз-
личных видов микробов, реагируют с антигенами, получен-
ными только от этих видов микробов. Однако наличие общих
антигенов у родственных видов бактерий может обусловли-.
вать возникновение групповой реакции преципитации.
Участвующие в реакции ингредиенты должны быть совер-
шенно прозрачны. Для этого их центрифугируют или фильтру-
ют через бактериальный фильтр.
Реакцию преципитации можно ставить в виде смеси раз-
личных разведений антигена с антителом или в виде реакции
9 Лабинская А. С.
129;
кольцепреципитации с наслоением одного компонента на дру-
гой.
При постановке реакции преципитации в отличие от реак-
ции агглютинации титр преципитирующих сыворо-
ток определяют по наибольшему разведе-
нию антигена, при котором еще наблюдает-
ся образование преципитата. Это объясняется тем,
что в реакции преципитации участвуют мицеллы (частицы)
коллоидного раствора, величина которых во много раз мень-
ше корпускулярных антигенов и которые для образования
видимого преципитата требуют в 10 000 раз большего коли-
чества антител, чем бактериальные клетки, образующие аг-
глютинат.
Избыток антигена препятствует образованию и выпадению
преципитата, вызывает задержку реакции преципитации, а
иногда даже обусловливает ее отсутствие. Это явление полу-
чило название «зоны задержки».
Техника постановки реакции преципитации. I. В штатив
устанавливают два ряда преципитационных пробирок. В про-
бирках первого ряда готовят несколько последовательных
разведений антигена (степень начального и конечного раз-
ведений определяется способом приготовления и активностью
антигена). Экстракты микробных культур разводят обычно
от 2 до 64 раз.
«Полный» антиген Буавена, представляющий собой комп-
лекс полисахаридов и липоидов, извлеченных из тела мик-
робной клетки, разводят в десятки и сотни тысяч раз.
В каждую пробирку второго параллельного ряда вносят
0,5 мл цельной или разведенной 1 :2 преципитирующей сыво-
ротки. Затем разведенный антиген, находящийся в пробирках
первого ряда, переносят в объеме 0,5 мл в соответствующие
пробирки второго ряда.
Для предупреждения возможных ошибок при оценке ре-
зультатов реакции рекомендуется ставить следующие конт-
роля:
1) нормальная сыворотка от животного того же вида, ко-
торого иммунизировали для получения преципитирующей сы-
воротки, + исследуемый антиген;
2) специфическая преципитирующая сыворотка-(-изотони-
ческий раствор хлорида натрия;
3) специфическая преципитирующая сыворотка-(-заведомо
соответствующий ей антиген.
Смесь антигена с сывороткой после тщательного переме-
шивания ставят на 2 ч в термостат, а затем на 18—20 ч остав-
ляют при комнатной температуре. Реакцию учитывают про-
стым глазом или при помощи лупы. В случае положительно-
го результата в прозрачной жидкости образуют хлопья пре-
ципитата, оседающие в виде рыхлого осадка на дно пробирки.
130
Предельное разведение антигена, с которым сыворотка обра-
зует преципитат, считается титром сыворотки.
II. При постановке реакции кольцепреципита-
ц и и в ряд маленьких узких пробирок вносят с помощью па-
стеровской пипетки с длинным и тонко оттянутым капилля-
ром по 0,1—0,2 мл сыворотки так, чтобы не смочить ею внут-
реннюю поверхность стенок пробирки. Затем на-поверхность
сыворотки наслаивают различные разведения антигена в ко-
личестве, равном объему сыворотки, содержащейся в про-
бирке *.
Чтобы не произошло смешивания жидкостей, пробирку в
момент наслаивания антигена держат в наклонном положе-
нии, а антиген отдельными каплями наливают по внутрен-
ней поверхности стенки, пользуясь для этой цели пастеров-
ской пипеткой с длинным, очень тонким капилляром. В ре-
зультате правильного наслоения антигена в пробирке обра-
зуются два четко отграниченных, не смешивающихся при
стоянии слоя. Реакция кольцепреципитации сопровождается
постановкой трех обязательных контролей (см. с. 130). По-
сле добавления антигена пробирки помещают в штатив и ос-
тавляют при комнатной температуре.
При положительной реакции преципитации, отмечаемой
знаком +, в течение 5—30 мин на границе соприкосновения
двух жидкостей появляется хорошо видимое на темном фоне
кольцо молочно-белого цвета, четко отграниченное сверху и
снизу. При стоянии пробирок толщина кольца увеличивается,
а четкость линий исчезает.
В контрольных пробирках, за исключением 3-й (специфи-
ческая преципитирующая сыворотка + соответствующий ей
антиген), кольца помутнения не появляются.
Реакция преципитации в агаре. В последнее время в прак-
тике иммуномикробиологических исследований широкое рас-
пространение получила реакция специфической преципитации
в агаре, предложенная Уденом и разработанная Аухтерлони.
Реакция преципитации в агаре используется для изучения
состава сложных антигенных смесей, обнаружения состава
сложных общих антигенов у микроорганизмов, принадлежа-
щих к различным токсономическим единицам, и для контроля
степени очистки биологических препаратов.
Метод основан на том, что в силу различной дисперсности
частиц антиген и антитела за определенный промежуток вре-
мени проходят в агаре различные расстояния, создавая при
этом постепенно убывающие концентрации. При встрече со-
ответствующих антигенов и антител в зоне оптимальных кон-
1 При постановке реакции преципитации антиген наслаивается ^обычно
на сыворотку, которая по своей относительной плотности тяжелее^нтигена.
Однако если антиген имеет большую относительную плотность, чей сыво-
ротка, порядок распределения ингредиентов в пробирке меняется.
в* 131
центраций образуются видимые простым глазом белые линии
преципитата. Антиген, вступая во взаимодействие с гомо-
логичным антителом, образует только одну линию преципита-
та; при участии в реакции иескольких антигенов и антител
каждая система ведет себя независимо друг от друга; число
образующихся зон преципитации равно или меньше ко-
личества присутствующих в растворе систем антиген — анти-
тело. Несоответствие между числом полос преципитации и
количеством участвующих в реакции комплексов антиген —
антитело может быть обусловлено:
А. Совмещением линий преципитации, образуемых двумя
различными системами антиген — антитело.
Б. Отсутствием видимой линии преципитата из-за очень
высокой или, наоборот, низкой концентрации антигенного
компонента.
Таким образом, реакция приципитации, представляя собой
метод качественного анализа, позволяет изучать антигенный
состав бактериальных препаратов.
По технике постановки реакции преципитации различают:
а) метод простой диффузии, при котором одно реагирую-
щее вещество (обычно антиген) диффундирует в агар, содер-
жащий постоянную концентрацию другого реагирующего
вещества, — иммунную сыворотку;
б) метод двойной диффузии, когда оба реагента, анти-
ген и антитело, движутся навстречу друг другу через нейт-
ральный слой агара, не содержащий ни одного реагента.
В настоящее время предложено большое количество раз-
личных вариантов и модификаций как первого, так и второго
метода преципитации в агаре.
Метод простой диффузии. Агар, приготовленный специаль-
но для постановки реакции преципитации (рец. 24), растап-
ливают в водяной бане. К расплавленной и охлажденной
до температуры 45—50° С среде приливают равное количе-
ство преципитирующей сыворотки, смесь осторожно переме-
шивают, чтобы не произошло вспенивания, и разливают в
чашки Петри, расположенные на строго горизонтальной по-
верхности.
Чашки для постановки опыта подбирают одинакового раз-
мера (диаметр 90—95 мм), с ровным дном, без царапин и
других изъянов, затрудняющих чтение реакции и учет резуль-
татов.
В каждую чашку наливают 6—8 мл среды, чтобы все дно
чашки было равномерно покрыто агаром, слой которого дол-
жен равняться примерно 3 мм. После застудневания агара
осторожно, чтобы не повредить поверхность среды, устанав-
ливают матриксы (металлические цилиндры диаметром 0,5—
0,7 см) в количестве, соответствующем числу исследуемых ан-
тигенов.
132
Недопустимо, чтобы дном лунки являлась стеклянная по-
верхность дна чашек Петри, так как добавляемый антиген
растечется между стеклом и пластинкой агара.
Располагают матриксы на расстоянии не менее 1 см друг
от друга по схеме, заранее вычерченной и подложенной под
дно чашки. После установки матриксов в чашку наливают
еще один слой агара высотой 3—4 мм, для чего требуется
12—16 мл среды.
После застудневания второго слоя агара матриксы выни-
мают с помощью пинцета. Для того чтобы при этом не появ-
лялись трещины в агаре, матрикс вначале слегка поворачи-
вают вокруг своей оси. Образующиеся после вынимания мат-
рикса лунки в среде заполняют исследуемыми антигенами,
после чего чашки на 3—5 ч оставляют при комнатной темпе-
ратуре, а затем сохраняют в холодильнике при 3°С в течение
10—14 дней. Чтобы избежать высыхания среды и испарения
антигенов из лунок, чашки со стороны дна заклеивают лейко-
пластырем или помещают во влажную камеру.
При положительном результате реакции обычно на 7—
10-й день после постановки опыта появляются зоны преци-
питации мутно-белого цвета в форме концентрических ок-
ружностей, расположенных вокруг лунок. Возникновение
преципитационных линий следует учитывать ежедневно.
Чем тоньше слой агара в чашке, тем быстрее происходит
в нем диффузия антигена и тем скорее образуется преци-
питат.
Метод двойной диффузии. В стерильные чашки Петри на-
ливают 2% агар без добавления сыворотки. Так
же как в предыдущем случае, при постановке реакции мето-
дом простой диффузии устанавливают матриксы и наливают
еще один слой среды.
Взаимное расположение и расстояние матриксов друг от
друга (1—3 см) может варьировать в зависимости от усло-
вий опыта. Одну лунку заполняют преципитирующей сыво-
роткой, а в другую лунку, находящуюся на некотором рас-
стоянии от нее, наливают антиген. Чашки хранят при ком-
натной температуре или в холодильнике в течение 2 нед.
Растворимые антигены и сыворотка диффундируют в окру-
жающий агар во всех направлениях. При положительном ре-
зультате реакции по линии контакта между двумя диффун-
дирующими веществами происходит реакция преципитации,
внешним проявлением которой служит возникновение между
лунками, заполненными сывороткой и антигеном, поперечной
полоски молочно-белого цвета, хорошо видимой на фоне про-
зрачной среды.
При использовании в опыте сложных антигенных смесей -
в агаре, разделяющем лунки, образуется спектр линий. Число
линий соответствует числу пар антиген — антитело, однако.
линий может быть меньше количества пар; это бывает в тех
случаях, когда реагенты содержатся в слишком малых кон-
центрациях, чтобы дать видимый комплекс.
Реакция гемолиза
Парентеральное введение животным эритроцитов другого
вида животных сопровождается появлением в крови специ-
фических защитных антител — гемолизинов, способных
нарушать связь гемоглобина со стромой эритроцитов и обус-
ловливать гемолиз, т. е. выхождение его в окружающую
среду.
Реакцией гемолиза в иммунобактериологической практике
пользуются главным образом для определения титра гемоли-
тических сывороток. Гемолитическая сыворотка представляет
собой сыворотки кролика, иммунизированного эритроцитами
барана. Гемолитическую сыворотку выпускают институты
бактерийных препаратов. На этикетке каждой ампулы ука-
зан титр сыворотки и обозначен срок ее годности. Перед упо-
треблением, особенно если ампулы хранились длительное вре-
мя, проверяют титр гемолитической сыворотки (табл. 12).
Титром гемолитической сыворотки называет-
ся максимальное разведение ее в объеме 0,5 мл, при котором
наблюдается полный гемолиз 0,5 мл 3% взвеси бараньих
эритроцитов в присутствии 0,5 мл комплемента, разведенного
1:10, после выдерживания пробирок в течение часа в термо-
стате при 37°С.
Реакция гемолиза протекает при обязательном участии
трех компонентов:
1) гемолитической сыворотки, содержащей специфические
антитела — гемолизины;
2) 3% взвеси эритроцитов барана (антиген, которым им-
мунизировались кролики);
3) неспецифического фактора — комплемента (см. с. 149).
Техника постановки реакции гемолиза при определении
титра гемолитической сыворотки сводится к следующему.
К 0,1 мл инактивированной сыворотки прибавляют 9,9 мл изо-
тонического раствора хлорида натрия, получая таким обра-
зом основное разведение сыворотки 1 : 100. Из основного раз-
ведения, пользуясь схемой (табл. 13), готовят ряд разведе-
ний — от 1 : 1000 до 1 :4500.
Из каждой пробирки приготовленного ряда разведений бе-
рут по 0,5 мл, переносят в свободные пробирки с надписями,
соответствующими степени разведения внесенной в них сыво-
ротки. Для переноса сыворотки из одной пробирки в другую
можно пользоваться одной пипеткой, начиная работу с наи-
больших разведений сыворотки.
В приготовленный ряд разведений гемолитической сыво-
ротки, разлитой в равных объемах по 0,5 мл, прибавляют
134
Таблица 12
Схема приготовления последовательных разведений сыворотки1
Разведения : 100 (А)=0,1 мл сы- воротки + 9,9 мл изотонического раствора хлорида натрия Разведения 1: 1000 (Б) = 1 мл разве- дения А + 9 мл изотонического рас- твора хлорида натрия Разведения 1: 10 000 (В) = 1 мл раз- ведения Б + 9 мл изотонического рас- твора хлорида натрия Разведения 1 : 100 000 (Г) — 1 мл разведения В + 9 мл изотоиичес- ского раствора хлорида натрия
разве- денне^А изотонический раствор хлори- да натрия получаемые разведения разве- дение Б изотонический раствор хлори- да натрия получаемые разведения разве- дение В изотонический раствор хлори- да натрия получаемые разведения разве- дение Г изотонический раствор хлори- да натрия получаемые разведения
в мл в мл в мл в мл
0,5 0,5 1 : 200 0,5 0,5 1 : 2000 0,5 0,5 1 : 20 000 0,5 0,5 1:200 000
0,5 1,5 1 400 0,5 1,0 1 :3000 0,5 0,75 1:25 000 0,5 0,75 1:250 000
0,5 2,5 1Т 600 0,5 1,5 1 : 4000 0,5 1,0 1 : 30 000 0,5 1,0 1:300 000
0,5 3,5 1 .• 800 0,5 2,5 1 : 6000 0,5 1,5 1 : 40 000 0,5 1,25 1:350 000
0,5 5,5 1:1200 0,5 4,5 1 : 10 000 0,5 3,0 1 : 70 000 0,5 2,0 1:500 000
0,5 6,5 1 : 1400 0,5 5,5 1 : 12 000 0,5 3,5 1 : 80 000
0,5 9,5 1:2000 0,5 8,0 1 : 17 000 0,5 4,5 1 : 100000
0,5 12,0 1:25000 0,5 7,0 1 : 150 000
0,5 9,5 1:200 000
1 См. «Микробиологические методы исследования при инфекционных заболеваниях». Под ред. Г. Я. Синай и О. Г. Биргера, М., 1949.
Таблица 13-
Схема разведения гемолизина1
№ про- бирки Гемолизин, мл Изотова* чеекяй раствор, мл Полученные разведе- ния гемолизина
1 0,1 9,9 1:100 (основное
разведение)
2 0,5 основного разведения 4,5 1:1000
3 5,5 1 i 1200
4 0,5 » » 7,0 1: 1500
5 0,5 » » 8,5 1:1800
6 0,5 » » 10,0 1:2100
7 0,5 » » 11,5 1:2400
8 0,5 » » 13,0 1 :2700
9 0,5 » » 14,0 1:3000
10 0,5 » » 22,0 1:4500
1 См. Б. Е. Предтеченский. Руководство по клиническим
лабораторным исследованиям. М., 1960.
равные количества (по 0,5 мл) 3% взвеси эритроцитов и 10%
раствора комплемента, после чего общий объем жидкости в
каждой пробирке доводят изотоническим раствором хлорида
натрия до 2,5 мл (табл. 14).
При постановке реакции гемолиза и титрования гемоли-
тической сыворотки ставят три обязательных контроля:
1. Контроль на инактивацию комплемента (Ki).
2. Контроль комплемента на отсутствие в нормальной сы-
воротке морских свинок специфических антител (Кг)-
3. Контроль на устойчивость эритроцитов при выдержива-
нии их в термостате при 37 °C (Кз)-
После того как смешают все перечисленные ингредиенты,,
участвующие в реакции, штатив с пробирками энергично
встряхивают и ставят в термостат на 1 ч и затем учитывают
результат реакции (рис. 18).
Интенсивность гемолиза характеризуется различной сте-
пенью разрушения эритроцитов.
Реакция связывания комплемента
Реакция связывания комплемента (РСК) основана на том,
что взаимодействие антигена с соответствующим специфиче-
ским антителом происходит только при участии комплемен-
та. Реакция протекает в две фазы с участием двух систем:
бактериальной и гемолитической.
В первой реакции (специфическая) участвуют антиген4-
+ антитело + комплемент.
136
Таблица 14
Схема реакции титрования гемолитической сыворотки
Номер пробирки __ и разведение гемо- литической сыворотки Ингредиент Z.1 2 3 4 5 К 6 IK? 8 9 10 К, к,
1:1000 1:1200 1:1600 1:1800, 1:2100 1:2400 1:2700 1:3000 1:4500 1:1000
Гемолитическая сыворотка 0.5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 — —
3% взвесь бараньих эритроцитов 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5
Комплемент ЫО 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 0,5 — 0,5 —
Изотонический раствор хлорида натрия 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,0 1,5 1,5 0
Результаты реакции Ш Гемо- лиз гатиф с Гемо- лиз пробщ Гемо- лиз жами и Гемо- лиз смещают на 1 ч в термостат при температуре 37°С Задержка гемолиза
Положительный результат реакции, наступающий при со-
ответствии антител антигену, характеризуется образованием
специфического бактериального комплекса антиген — антите-
ло с адсорбированным, или, как говорят, «связанным», комп-
лементом. Оставаясь невидимым, комплекс не вызывает ни-
каких внешних изменений той среды, в которой он образо-
вался.
Отрицательный результат РСК имеет место при отсутст-
вии специфического сродства между антигеном и антителом
сыворотки и характеризуется сохранением ’свободного ак-
тивного комплемента.
Первая фаза РСК может проводиться в термостате при
37°С (1—2 ч) или в холодильнике при 3—4°C (18—20 ч).
При длительном образовании иммунного комплекса анти-
ген— антитело на холоду происходит более полное связыва-
ние комплемента и вследствие этого чувствительность реак-
ции увеличивается.
При постановке сравнительных опытов советским иммуно-
логом акад. В. И. Иоффе и его учениками было показано, что
в условиях длительного связывания комплемента на холоду
можно уловить в 100—500 раз меньшие количества антигена
и получить положительные результаты при больших разве-
дениях иммунной сыворотки, чем в опыте связывания комп-
лемента при температуре 37 °C в течение 1—2 ч.
Вторая фаза реакции (индикаторная) происходит между
реагентами гемолитической системы (смесь 3% взвеси эрит-
роцитов и гемолитической сыворотки в равных объемах) при
температуре 37 °C только при наличии комплемента, оставше-
гося свободным от первой фазы реакции (реакция отрица-
тельная) .
При отсутствии свободного активного комплемента гемо-
лиза эритроцитов под действием специфических гемолизинов
не наступает (реакция положительная).
Реакцию связывания комплемента можно применять для:
1) выявления специфических антител в неизвестной сыво-
ротке на основании взаимодействия их с антигеном известной
природы;
2) изучения свойств антигена в реакции с известной спе-
цифической сывороткой.
Подготовка ингредиентов для постановки РСК. 1. Сыво-
ротку крови, полученную для исследования, накануне по-
становки реакции прогревают в водяной бане при 56 °C в те-
чение 30 мин для инактивации ее собственного компле-
мента. Инактивированная сыворотка может храниться при
температуре 3—4 °C в течение 5—6 дней. В день постановки1
опыта сыворотку разводят изотоническим раствором хлорида
натрия в соотношении 1:5 (0,1 мл исследуемой сыворотки
,+ 0,4 мл изотонического раствора хлорида натрия).
138
2. Антигеном для постановки РСК могут быть культу-
ры разнообразных микробов, бактериальные белки и экст-
ракты, полученные из микробных культур, патологически из-
мененных и нормальных органов и тканей. Особенности при-
готовления антигена определяются характером инфекционно-
го процесса и особенностями его возбудителя.
3. Комплементом является смесь сывороток, получен-
ная от 3—5 здоровых морских свинок, или сухой комплемент
в ампулах. Непосредственно перед употреблением сыворотку
морской свинки разводят изотоническим раствором хлорида
натрия в отношении 1 : 10, получая основной раствор,
4. Гемолитическую сыворотку перед постанов-
кой опыта инактивируют прогреванием при температуре 56 °C
в течение 30 мин. Для постановки основного опыта РСК, а
также для титрования комплемента и антигена применяют
гемолитическую сыворотку в тройном титре. Например, если
титр гемолитической сыворотки 1: 1800, в реакции применя-
ют разведение сыворотки 1 : 600.
5. Эритроциты получают из дефибринированной кро-
ви барана. Кровь для удаления пленок фибрина фильтруют
через трехслойный марлевый фильтр. Полученный фильтрат
центрифугируют, сыворотку отсасывают и сливают, а эритро-
циты промывают 3—4-кратным центрифугированием с изото-
ническим раствором хлорида натрия. При последнем промы-
вании эритроцитов надосадочный слой жидкости должен быть
совершенно прозрачным. Из отмытых эритроцитов готовят 3%
взвесь в изотоническом растворе хлорида натрия (см. с. 103).
Подготовив указанным выше способом ингредиенты, участ-
вующие в РСК, приступают к титрованию гемолитической сы-
воротки, комплемента и антигена.
Титрование комплемента. Перед постановкой опыта натив-
ный или консервированный комплемент подвергают обяза-
тельному титрованию, т. е. определяют то наименьшее коли-
чество комплемента, которое, будучи смешанным с 0,5 мл ге-
молитической сыворотки (в тройном титре), гемолизирует
Ю,5 мл 3% взвеси эритроцитов в течение 30 мин.
Для титрования пользуются основным разведением комп-
лемента (1:10). Основное разведение комплемента разлива-
ют в ряд пробирок от 0,05 до 0,5 мл. Затем в каждую пробир-
ку прибавляют изотонический раствор хлорида натрия, дово-
дя общий объем жидкости во всех пробирках до 1,5 мл. Шта-
тив с пробирками помещают в термостат и через 45 мин во
все пробирки добавляют гемолитическую систему в объеме
1 мл (табл. 15).
Титрование комплемента сопровождается двумя обяза-
тельными контролями: контроль гемолитической системы
(1 мл гемолитической системы 4-1,5 мл изотонического рас-
твора хлорида натрия) и контроль комплемента (0,5 мл основ-
139
Схема реакции титрования комплемента
я
сг
в
я
ного разведения компле-
мента+0,5 мл взвеси эрит-
роцитов + 1,5 мл изото-
нического раствора хло-
рида натрия). После до-
бавления гемолитической
системы пробирки тща-
тельно встряхивают и
снова помещают в термо-
стат на 30 мин.
Титром компле-
мента называется та
минимальное количества
его, в присутствии кото-
рого 0,5 мл гемолитиче-
ской сыворотки, в трой-
ном титре, лизирует 0,5 мл
3% взвеси эритроцитов
барана в течение 30 мин
при температуре 37 °C.
При постановке РСК
пользуются не титром, а
рабочей дозой компле-
мента, представляющей
собой титр комплемента,
увеличенный на 20—30%.
Практически это соот-
ветствует тому количест-
ву комплемента, которое
имеется в предпоследней
пробирке с гемолизом.
Необходимость увеличе-
ния дозы комплемента
вызвана тем обстоятель-
ством, что активность
комплемента при поста-
новке основного опыта
иногда подавляется дру-
гими ингредиентами ре-
акции — антигеном и сы-
вороткой.
Разведение ' компле-
мента для постановки ре-
акции производят так,,
чтобы одна рабочая доза
его (рассчитанная на со-
держимое одной опытной
140
или контрольной пробирки) содержалась в объеме
0,5 мл.
Для приготовления рабочего раствора комплемента поль-
зуются приведенной ниже схемой расчета.
Пример. Рабочая доза комплемента равна 0,25 мл. Это значит, что
в 0,25 мл основного разведения (1:10) содержится 0,025 мл нативной
сыворотки. Для постановки реакции, рассчитанной иа 60 пробирок, тре-
буется нативной сыворотки:
0,025 мл X 60—1,5 мл
Полученную путем такого расчета дозу сыворотки (1,5 мл) разводят
в 30 мл изотонического раствора хлорида натрия, так как в каждую опыт-
ную пробирку наливают только по 0,5 мл рабочего раствора комплемента.
Титрование антигена. Ввиду того что антиген может ока-
зывать антикомплементарное действие, его подвергают пред-
варительному титрованию. Для этого из основного разведения
антигена готовят ряд последовательных разведений. Основ-
ным разведением антигена может быть взвесь микробов, со-
держащая 500 млн. или 1 млрд, микробных тел в 1 мл изо-
тонического раствора хлорида натрия.
В ряд пробирок, установленных в штатив, вносят несколь-
ко последовательно уменьшающихся доз основного разведе-
ния антигена от 0,5 до 0,05 мл, доливают до 1 мл изотони-
ческим раствором хлорида натрия, прибавляют по 0,5 мл ра-
бочей дозы комплемента и по 0,5 мл изотонического раство-
ра хлорида натрия. Штатив с приготовленной смесью хорошо
встряхивают и помещают в термостат при 37 °C на 1 ч. По
истечении указанного времени во все пробирки прибавляют
по 1 мл гемолитической системы, после чего штатив с пробир-
ками снова помещают в термостат на 1 ч (табл. 16).
Таблица 16
Схема реакции титрования антигена
№ пробирки
Ингредиент 1 2 3 4 5 6
Антиген основного разведения, мл 0,5 0,4 0,3 0,2 0,1 0,5
Изотонический раствор хлорида 0,5 0,6 0,7 0,8 0,9 0,95
натрия, мл Рабочая доза комллемеита, мл 0,5 0,5 0,5 0,5 0,5 0,5
Штатив с пробирками помещают на 1 ч в термостат при 37 °C
Гемолитическая система, мл
1,0 1,0 1,0 1,0
1,0
Штатив с пробирками помещают на 1 ч в термостат при 37 °C
141
Титром антигена считается его наименьшая доза, при
которой прекращается задержка гемолиза и, следовательно,
отсутствует его комплементарное действие. Для постановки
РКС берут рабочую дозу антигена, составляющую примерно
V2—2/з ее титра (во избежание антикомплементарного дейст-
вия антигена при постановке реакции).
Техника постановки основного опыта. От-
титрованные ингредиенты (антиген, комплемент и гемолити-
ческая сыворотка) разводят изотоническим раствором хлори-
да натрия таким образом, чтобы рабочая доза каждого из
них содержалась в объеме 0,5 мл. Реакцию ставят в общем
объеме 2,5 мл. В случае недостаточного количества исследуе-
мого материала допускается снижение общего объема до
1,25 мл и соответственно каждого ингредиента до 0,25 мл.
При наличии микротитратора «Такачи» РСК можно ставить
с сывороткой в объеме 0,025—0,05 мл.
При постановке реакции сначала смешивают исследуемую
сыворотку, антиген и комплемент, смесь выдерживают в тер-
мостате при температуре 37 °C в течение часа или комнатной
температуре в течение 18—20 ч. По истечении указанного
срока в пробирки добавляют гемолитическую систему (после
предварительного выдерживания ее в термостате). Смесь всех
ингредиентов после энергичного встряхивания помещают в
термостат при 37 °C на 1 ч (табл. 17).
Таблица 17
Схема поставовки РСК
Фаза ре- акции № ин- греди- ента Ингредиенты, участвующие в реакции № пробирки
1 (опыт- ная) 2 (конт- роль 1) 3 (конт- роль 11)
1 Исследуемая сыворотка, разведенная изотониче- ским раствором 1:5 мл 0,5 0,5 —
Первая 2 Антиген в рабочей дозе 0,5 __ 0,5
3 Комплемент в рабочей дозе 0,5 0,5 0,5
4 Изотонический раствор хло- рида натрия, мл — 0,5 0,5
В термостат при 37 °C на 1 ч
Вторая | 1 1 Гемолитическая система 1,0 1,0 1,0
В термостат при 37 °C на 1 ч
142
В данном примере 1-я пробирка является опытной, 2-я и 3-я — служат
контролем. В контрольных пробирках должно наступить явление гемолиза,
так как в них не могло произойти связывание комплемента первой фазой.
В 1-й, опытной, пробирке при наличии соответствия антитела с антигеном
происходит связывание комплемента и, следовательно, задержка гемолиза.
Степень интенсивной реакции оценивают по схеме:
+ + + + полная задержка гемолиза, жидкость бесцветна, значительный
осадок эритроцитов
+ + + ясная задержка гемолиза, жидкость бледно-розового цвета, зна-
чительный осадок эритроцитов
+ + частичная задержка гемолиза, жидкость интенсивно окрашена,
, довольно компактный осадок эритроцитов
+ слабая задержка, жидкость интенсивно окрашена, осадок эритро-
цитов небольшой
± следы задержки, почти полный гемолиз, осадок в виде облачка
— полный гемолиз, «лаковая» кровь, отсутствие осадка
ФАКТОРЫ ЕСТЕСТВЕННОЙ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА,
МЕТОДЫ ИХ ИЗУЧЕНИЯ
Фагоцитоз
Явление фагоцитоза было открыто и изучено русским уче-
ным И. И. Мечниковым. Он установил, что фагоцитоз (от
греч. phagos — пожирающий, cytos — клетки)—это врожден-
ная реакция организма, проявляющаяся в способности кле-
ток— фагоцитов — захватывать проникающие в тело живот-
ного инородные частицы с последующим их перевариванием.
Отождествляя собой функцию внутриклеточного пищева-
рения, свойственную простейшим организмам, фагоцитоз фи-
логенетически является наиболее древним защитным механиз-
мом, общим для всех видов беспозвоночных и позвоночных
животных. У человека и высших животных фагоцитарной спо-
собностью обладают клетки ретикулоэндотелиальной систе-
мы: лейкоциты крови и лимфы, фиксированные купферовские
клетки печени, ретикулярные клетки селезенки, костного моз-
га, лимфатических узлов, эндотелий кровеносных и лимфати-
ческих сосудов, гистиоциты рыхлой соединительной ткани.
В борьбе с патогенными микробами большую роль игра-
ют лейкоциты. Судьба микроорганизмов, захваченных лейко-
цитами, может иметь три исхода:
1) полное внутриклеточное переваривание микробов, при-
водящее к их исчезновению в лейкоците, — завершенный
фагоцитоз;
2) выталкивание микробов из лейкоцитов в окружающую
среду; %
3) активное размножение микробов внутри лейкоцитов—
незавершенный фагоцитоз.
В последнем случае фагоцитоз приобретает отрицательное
значение для организма, так как микробы, находящиеся внут-
ри клеток, становятся менее доступными действию антител.
143
Находясь в цитоплазме лейкоцитов, микробы не только оста-
ются живыми, но и сохраняют способность к размножению.
Явление незавершенного фагоцитоза имеет место при заболе-
вании туберкулезом, бруцеллезом, туляремией, гонореей.
При изучении процесса фагоцитоза было обнаружено, что
разные виды микробов имеют различные защитные приспо-
собления, которые повышают устойчивость их в отношении
фагоцитов. К числу таких приспособлений относится образо-
вание капсул, препятствующих фагоцитозу бактерий чумы,
пневмококков и некоторых типов стрептококка; продуцирова-
ние микробными клетками токсических веществ, поступаю-
щих в окружающую среду и вызывающих повреждение лейко-
цитов (например, лейкоцидин, вырабатываемый некоторыми
штаммами стафилококков).
Установлено, что приобретение специфического активного
иммунитета после перенесения инфекционного заболевания
или вакцинации сопровождается повышением фагоцитарной
активности лейкоцитов в отношении соответствующего возбу-
дителя инфекции. Связано это с наличием в иммунной сыво-
ротке специфических антител — опсонинов, которые, воз-
действуя на объект фагоцитоза, изменяют его, делая легкодо-
ступным для поглощения и переваривания фагоцитами.
Для оценки фагоцитарной функции лейкоцитов служат
три основных показателя: а) активность фагоцитоза (АФ) —
процент активно фагоцитирующих клеток;
б) интенсивность фагоцитоза (ИФ) — среднее число мик-
роорганизмов, приходящихся на одну фагоцитировавшую
клетку;
в) завершенность фагоцитоза (ЗФ) — процент фагоцитов,
полностью переваривших фагоцитированные микроорганизмы.
Определение фагоцитарной активности лейкоцитов. Фаго-
цитарная активность лейкоцитов выражается процентом ак-
тивных лейкоцитов (фагоцитов) к общему числу подсчитан-
ных нейтрофильных лейкоцитов. Определение фагоцитарной
активности лейкоцитов осуществляется следующим образом.
В стерильную центрифужную пробирку наливают 0,2 мл 2%
раствора цитрата натрия, прибавляют 0,1 мл исследуемой
крови, взятой из мякоти пальца, и 0,05 мл микробной взвеси,
содержащей по оптическому стандарту мутности 25 млн. мик-
робных тел (500 млн. микробных тел в 1 мл).
В зависимости от задач и цели исследования для поста-
новки опыта может быть использован любой вид живых или
убитых микроорганизмов: кишечная палочка, стафилококк,
стрептококк и т. д.
Пробирку с приготовленной смесью осторожно встряхива-
ют и помещают на 30 мин в термостат. По истечении указан-
ного срока смесь центрифугируют при 2000—3000 об/мин до
расслоения жидкости на верхний соломенно-желтый прозрач-
144
ный слой плазмы, нижний — слой эритроцитов и среднюю се-
ребристую пленку между ними — слой лейкоцитов. Пастеров-
ской пипеткой с тонко оттянутым капилляром отсасывают
вначале верхний слой, затем очень осторожно снимают сред-
ний слой, делают из него 3—5 мазков (по способу приготов-
ления мазков крови) и окрашивают методом Романовского —
Гимза (см. с. 32).
При микроскопии мазка подсчитывают число фагоцитиро-
вавших нейтрофильных лейкоцитов из общего числа подсчи-
танных лейкоцитов. Для получения достоверных результатов
количество должно быть не менее 100. Полученный результат
выражают в процентах.
Определение фагоцитарного индекса. Фагоцитарный ин-
декс, характеризуя интенсивность фагоцитоза, определяется
средним числом фагоцитированных микробов, приходящихся
на один лейкоцит. Для определения фагоцитарного индекса
служат те же мазки, по которым определялась фагоцитарная
активность лейкоцитов. В препаратах, приготовленных опи-
санным выше способом, подсчитывают не менее 100 нейтро-
фильных лейкоцитов и количество поглощенных ими микроб-
ных тел. Вычисляется фагоцитарный индекс путем деления
числа фагоцитированных бактерий на общее число подсчи-
танных нейтрофилов.
Пример. При просмотре мазка установлено, что 100 лейкоцитов фа-
гоцитировали 650 микробных тел. Следовательно, фагоцитарный индекс
650 „ .
равен—=6,б-
Техника определения о п с о н о-ф а г о цит ар но-
го индекса. Опсоно-фагоцитарным индексом называется
отношение фагоцитарного индекса иммунной сыворотки к фа-
гоцитарному индексу нормальной сыворотки.
Для постановки опыта необходимы:
1. Исследуемая сыворотка, полученная у больного или им-
мунизированного.
2. Сыворотка, полученная от практически здорового орга-
низма.
3. Взвесь лейкоцитов, полученная из крови здорового ор-
ганизма.
4. Микробная взвесь, содержащая по оптическому стан-
дарту мутности 500 мл микробных тел в 1 мл.
На двух пастеровских пипетках стеклографом делают от-
метки на высоте 1,5—2 см от конца капилляра. По сделанной
метке набирают последовательно лейкоциты, затем бактери-
альную взвесь и сыворотки (в одну пипетку берут иммунную
сыворотку, в другую — сыворотку нормальную). Повторным
втягиванием и выдуванием на двух предметных или часовых
стеклах сыворотку хорошо перемешивают с взвесью лейкоци-
тов и микробных тел. Затем смесь втягивают в капилляр той
10 Лабинская А. С. 145
же пастеровской пипетки, запаивают его конец и помещают
в термостат. Спустя 15—30 мин кончик капилляра отламыва-
ют, содержимое пипетки выдувают на предметное стекло и
готовят препарат по способу приготовления мазка крови, ок-
рашивая его водно-спиртовым раствором метиленового сине-
го (рец. 9).
При микроскопии препаратов для определения фагоцитар-
ных индексов в исследуемой иммунной и нормальной сыво-
ротках подсчитывают по 100 нейтрофильных лейкоцитов и
количество поглощенных ими микробов.
Опсоно-фагоцитарный и1.деКс=Фаг0Ц»таРн-?й инДекс иммунной сыворотки »
фагоцитарный индекс нормальной сыворотки
Пример. В 100 лейкоцитах нормальной сыворотки обнаружено 150 фа-
гоцитированных бактерий. Следовательно, фагоцитарный индекс нормаль-
150 . »
нои сыворотки равен = 1,5.
В 100 лейкоцитах иммунной сыворотки обнаружено 300 фагоцитирован-
ных бактерий. Следовательно, фагоцитарный индекс иммунной сыворотки
300
равен-- = 3.
На основании .полученных данных вычисляется опсоно-фагоцитарный
3
индекс: — =2.
1,5
Опсоно-фагоцитарная реакция. Опсоио-фагоцитарная реак-
ция, так же как и фагоцитарный индекс, характеризует со-
стояние макроорганизма и его взаимодействие с микробом-
возбудителем. Указанная реакция нашла применение при диа-
гностике некоторых инфекций, например бруцеллеза, дифте-
рии, сыпного тифа.
Опсоно-фагоцитарную реакцию ставят следующим обра-
зом. В центрифужную пробирку наливают и тщательно пере-
мешивают 0,25 мл 2% раствора цитрата натрия и 0,25 мл
исследуемой крови больного. Затем туда же добавляют
0,25 мл двухмиллиардной взвеси микробов, т. е. 500 млн.
микробных тел, соответствующих возбудителю предполагае-
мого заболевания (при подозрении на бруцеллез прибавляют
взвесь бруцелл, содержащую 4 млрд, микробных тел в 1 мл).
Пробирку с приготовленной смесью помещают на 30 мин в
водяную баню, отрегулированную на 37 °C. После прогревания
смесь центрифугируют и пастеровской пипеткой отсасывают
верхний слой образовавшегося осадка, состоящий из лейко-
цитов. Каплю его наносят на поверхность хорошо обезжи-
ренного предметного стекла, приготовляют мазок по типу
мазка крови, высушивают, фиксируют смесью Никифорова
(см. с. 29) и окрашивают по способу Романовского—Гимзы
(см. с. 32).
Окрашенный мазок микроскопируют, подсчитывая при
этом количество микробов, фагоцитированных 25 лейкоцита-
146
ми, находящимися в различных полях зрения. Каждый фаго-
цит в зависимости от количества фагоцитированных им мик-
робов относят к определенной группе (табл. 18).
Таблица 18
Схема учета опсоно-фагоцитарной реакции
Количество фагоци-
тированных микробов
в одном лейкоците
Оценка
фагоци-
тоза
Количество
лейноцитов
Вычисление пифро-
квого показателя
фагоцитоза
0 0 2 2X0=0
1—20 + 5 5X1=5
21—40 ++ 4 4X2=8
41 и более +++ 14 14X3=42
0+5+8+42=55
Для оценки опсоно-фагоцитарной реакции В. А. Штритер
предложил числовой показатель, представляющий собой сум-
му произведений, полученных в результате перемножения ко-
личества лейкоцитов на число соответствующих им плюсов,
характеризующих интенсивность фагоцитоза. Таким образом,
максимальный показатель опсоно-фагоцитарной реакции мо-
жет быть равен 75 (25x3=75).
Принято считать, что цифровой показатель в пределах
10—24 характеризует слабоположительную реакцию, 25—49—
ясно выраженную и 50—75 — резко положительную опсоно-
фагоцитарную реакцию.
У здоровых людей цифровой показатель опсоно-фагоци-
тарной реакции в большинстве случаев равен 1—3.
Завершенный фагоцитоз. Со времени работ И. И. Мечни-
кова известно, что процесс фагоцитоза складывается из ряда
последовательных фаз, финалом которых является разруше-
ние микробов в фагоцитах. Последнее явление определяет фа-
гоцитоз как защитную реакцию организма. Однако устано-
вить завершенность фагоцитарного процесса трудно в связи
с отсутствием достоверных методов оценки физиологического
состояния микробов, поглощенных лейкоцитами.
В. М. Берман и Е. М. Славская, разрабатывая метод, при-
годный для систематического изучения процесса отмирания
фагоцитированных микробов, предложили в качестве крите-
рия жизни и гибели использовать наличие или отсутствие у
микробов способности к росту, т. е. способности давать в пер-
вые часы своего развития гигантские формы.
Завершенность фагоцитоза определяется по отсутствию
роста микробов внутри лейкоцитов и наличию признаков их
разрушения.
Техника определения показателя завершенного фагоцито-
за относительно проста. В мерную центрифужную пробирку
10* 147
Рнс. 19. Препарат-отпечаток с завершенным (А) и незавершенным (Б) фа-
гоцитозом кишечной палочки.
с 5—10 мг оксалата натрия вносят 0,5—1 мл крови, подле-
жащей исследованию. После тщательного перемешивания в
эту же пробирку прибавляют равное количество 2 млрд, взве-
си микробов (стафилококк, кишечная палочка или Вас. sub-
tilis). После перемешивания смесь помещают в термостат
при 37 °C на 30 мин. Затем несколько капель исследуемой лей-
коцитарно-микробной взвеси вносят в чашку Петри с застыв-
шим хорошо подсушенным 2% мясо-пептонным агаром и рас-
пределяют их по поверхности среды скользящим движением
предметного стекла с отшлифованными краями так же, как
при обычном изготовлении мазков крови. Засеянные чашки
помещают в термостат при 37 °C для подращивания микробов
и наступления третьей фазы фагоцитарной реакции, т. е. за-
хватывания микробов фагоцитами. Время экспозиции чашек
в термостате может варьировать в зависимое™ от задач
опыта и видов микробов, взятых в опыт. Для получения по-
стоянных и демонстративных результатов время инкубации
в термостате должно быть установлено в предварительных
опытах.
После окончания установленного срока инкубации присту-
пают к изготовлению мазков-отпечатков. Для этого хорошо
очищенные и обезжиренные предметные стекла подогревают
на пламени горелки и, положив на поверхность агара, слег-
ка прижимают их к мазку крови, находящемуся на поверхно-
сти агаровой среды. Приготовленные таким образом мазки-
отпечатки высушивают, фиксируют 3 мин метиловым спиртом
и окрашивают по способу Романовского—Гимзы (см. с. 32).
148
При микроскопировании препаратов, приготовленных из
лейкоцитарно-микробной взвеси, инкубированной в термоста-
те, отчетливо видны различия между жизнеспособными и не-
жизнеспособными клетками микроорганизмов. Первые харак-
теризуются своими гигантскими размерами, вторые в силу от-
сутствия роста сохраняют исходную величину.
В случаях, когда процесс фагоцитоза носит завершенный
характер, внутри лейкоцитов отмечаются фрагменты разру-
шенных клеток, имеющих разнообразную форму, и отдельные
микробные тела значительно меньших размеров, чем в лейко-
цитах с незавершенным фагоцитозом (рис. 19).
Для оценки степени завершенного фагоцитоза применяет-
ся так называемый показатель завершенного фагоцитоза,
определяемый количеством клеток с завершенным фагоци-
тозом на 100 фагоцитировавших сегментоядерных нейтро-
филов.
ГУМОРАЛЬНЫЕ ФАКТОРЫ ЕСТЕСТВЕННОЙ РЕЗИСТЕНТНОСТИ
ОРГАНИЗМА И МЕТОДЫ ИХ ИЗУЧЕНИЯ
Комплемент, техника его определения
Комплемент (от лат. complementum — дополнение) пред-
ставляет собой сложный комплекс белков сыворотки крови
глобулиновой природы, обозначаемый символом С. В состав
его входят 9 компонентов: С'1, С'2, С'З, С'4, С'5, С'6, С'7, С'8
и С'9. Все компоненты различны по своему химическому со-
ставу, физическим и биологическим свойствам. Активным яв-
ляется весь комплемент в целом, но не отдельные его компо-
ненты. Комплемент находится в крови человека, всех тепло-
кровных и многих холоднокровных животных. Наиболее
постоянное и высокое содержание комплемента выявлено в
сыворотке крови морских свинок. Поэтому при постановке се-
рологических реакций, основанных на участии комплемента,
в качестве его используют смесь сывороток, полученных от
3—4 морских свинок.
Основные функции комплемента сводятся к тому, что он
способствует: 1) лизису сенсибилизированных бактерий в при-
сутствии бактериолизинов; 2) лизису сенсибилизированных
эритроцитов; 3) опсонизации (подготовке) бактерий к фаго-
цитозу.
Сам по себе комплемент оказывает слабое антимикробное
действие, но, вступая в контакт и адсорбируясь на поверхно-
сти специфических антител, усиливает их действие. В отсут-
ствие комплемента активность некоторых антител полностыа
утрачивается. Поэтому содержание и уровень комплемента в
крови можно использовать как тест, характеризующий со-
14»
стояние естественной резистентности макроорганизма: высо-
кое содержание комплемента в крови считается благоприят-
ным признаком; снижение уровня комплемента, наблюдае-
мое при некоторых патологических состояниях, является от-
рицательным прогностическим показателем.
При определении комплемента в сыворотке крови и по-
становке серологических реакций с участием комплемента не-
обходимо учитывать большую лабильность комплемента в от-
ношении многих физических и химических воздействий. Раз-
рушение его происходит при механическом встряхивании, под
действием тепла, ультрафиолетовых лучей, кислот, щелочей,
эфира, алкоголя. Для инактивации комплемента пользуются
прогреванием сыворотки при температуре 56 °C в течение
30 мин. 4
Консервирование комплемента. Для продолжительного
«сохранения биологических свойств комплемента рекомендуются химические
и физические способы его консервирования. Лучший метод химического
«консервирования предложили С. И. Гинзбург и В. С. Калинин. Метод за-
ключается в добавлении 0,5 г кристаллического сульфата натрия и 0,4гх.ч.
борной кислоты к 10 мл свежей консервируемой сыворотки. Добавляемые
химические вещества предохраняют комплемент от микробного загрязнения
и стабилизируют свойства комплемента, благодаря чему активность его со-
храняется на протяжении нескольких месяцев.
Физический способ консервирования сводится к замораживанию сыво-
роток и хранению нх при температуре от—20° до —40 °C. При таком спо-
собе хранения сывороток активность комплемента не утрачивается в тече-
ние Р/а—2 мес. Однако после оттаивания сыворотки необходимо немедлен-
но использовать, так как при повторном замораживании активность ком-
племента резко снижается.
В настоящее время наибольшее практическое применение для консер-
вирования комплемента нашел метод лиофильного высушивания.
Сущность его заключается в быстром замораживании консервируемой
сыворотки или другого биологического препарата с последующим высуши-
ванием его в условиях глубокого вакуума. При этом вода из высушивае-
мого материала удаляется путем превращения льда непосредственно в пар,
минуя жидкую фазу и не нарушая тем самым молекулярной структуры
•комплемента. Высушенное вещество имеет вид губчатой массы, которая
может сохраняться без изменения в течение многих месяцев и при необхо-
димости быстро и полностью растворяться, восстанавливая присущие исход-
ному состоянию физические, химические и биологические свойства.
Сухой комплемент, расфасованный в ампулы, является коммерческим
препаратом, выпускаемым советской медицинской промышленностью. Перед
употреблением ампулу надламывают и содержимое ее растворяют в 1 мл
изотонического раствора хлорида натрия, что соответствует нативной сыво-
ротке.
Определение титра комплемента гемолитическим методом.
Гемолитический метод в силу своей доступности и возможно-
сти точного определения уровня комплемента получил широ-
кое применение при его титровании. Степень гемолиза при
постановке опыта может быть определена с помощью фото-
колориметра, спектрофотометра или визуально посредством
сопоставления гемолиза в опытных пробирках со стандарт-
ной шкалой лизированных эритроцитов. Последний способ
наиболее прост, не требует для постановки реакции дефицит-
но
ной, дорогостоящей аппаратуры и дает достаточно точные ре-
зультаты.
Для постановки реакции определения титра комплемента'
гемолитическим методом с визуальным определением степени’
гемолиза требуются:. 1) сыворотка крови, подлежащая ис-
следованию, взятая в день постановки опыта или полученная
заранее и законсервированная; 2) изотонический раствор;
3) эритроциты барана; 4) гемолитическая сыворотка.
Постановка опыта начинается с приготовления стандарт-
ной шкалы лизированных эритроцитов по способу, предло-
женному А. П. Кониковым. Для этого к 5 мл гемолитической'
системы добавляют 5 мл дистиллированной воды. Гемолизи-
рованную жидкость разливают в ряд пробирок, как указано в
схеме разведений, приведенной в табл. 19.
Таблица 19'
Схема определения степени гемолиза
Ингредиент № пробирки
1 2 3 4 5 6 7 8
Гемолитическая 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9-
система, разве- денная вдвое, мл Дистиллирован- 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1'
ная вода, мл Гемолиз, % 20 30 40 50 60 70 80 90
При просмотре пробирок шкалы видно, что различия меж-
ду смежными степенями гемолиза в двух рядом расположен-
ных пробирках наиболее отчетливо проявляются в зоне 50%
гемолиза.
Сыворотку, в которой определяют титр комплемента, раз-
водят 1 : 10, разливают в 10 пробирок от 0-,05 до 0,5 мл с раз-
ницей в объеме между отдельными дозами 0,05 мл (табл. 20)
Таблица 20
Схема определения титра комплемента сыворотки
Ингредиент № пробирки
1 2 3 4 5 6 7 8 9 10 11
Исследуемая сыворот- ка, разведенная 1:10, мл 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45 0,5 —
Изотонический рас- твор, мл 1,45 1,4 1,35 1,3 1,25 1,2 1,15 1,1 1,05 1,0 1,5
Гемолитическая сис- тема 1,5 1,5 1,5 1,5 1,5 1,5 1,5 1,5 1,5 1,5 1,5
151
и в каждую пробирку приливают изотонический раствор хло-
рида натрия с таким расчетом, чтобы общий объем жидкости
во всех пробирках ряда был одинаковым (1,5 мл).
После этого к разведениям сыворотки добавляют 1,5 мл
гемолитической системы (смесь равных объемов 3% взвеси
эритроцитов барана и гемолитической сыворотки в утроенном
титре; см. с. 139). Приготовленную смесь помещают на 45 мин
в термостат, затем охлаждают 10 мин в холодильнике при 3—
5 °C, центрифугируют 10 мин при 2000 об/мин и приступают
к учету результатов.
Титр комплемента выражают в 50% гемолитических еди-
ницах, обозначаемых С'Н5о-
За одну 50% гемолитическую единицу принимают коли-
чество комплемента, способствующее 50% лизису 0,5 мл сен-
сибилизированных эритроцитов в течение 45 мин при темпе-
ратуре 37 °C. Эта единица является условной, поскольку ее
величина зависит от концентрации эритроцитов, их стойкости,
количества сенсибилизирующих антител, времени и темпера-
туры реакции.
Учет результатов реакции осуществляется следующим об-
разом: пробирку № 4 из шкалы гемолиза с одной 50% едини-
цей комплемента сравнивают с пробирками ряда сыворотки,
исследуемой на титр комплемента. Если содержимое пробир-
ки № 4 по цвету и прозрачности соответствует, например, со-
держимому пробирки № 5 из ряда титрования комплемента
исследуемой сыворотки, расчет ведется следующим образом:
0,025 мл сыворотки ± 1 C'Hjo
1 мл сыворотки — X единиц С'НМ
1X1 Ю00
Х=0^5 = -^=40СН-
Оценка получаемых результатов по учету 50% гемолиза
обусловлена новейшими данными исследований, которые по-
казали, что процесс лизиса сенсибилизированных эритроци-
тов при графическом изображении имеет не линейный, а
S-образный характер. Форма этой кривой указывает на то,
что в центральной части 30—50% гемолиза кривая идет кру-
то и степень лизиса изменяется при небольших колебаниях
в количествах комплемента. В зоне 30—100% интенсивность
гемолиза изменяется постепенно. Для осуществления лизиса
последних 10% клеток необходимо относительно большое уве-
личение количества комплемента. Поэтому зависимость про-
цента гемолиза от количества комплемента наиболее точно
может быть определена в зоне частичного гемолиза, соответ-
ствующего 50%, которая находится в центральной части
S-образной кривой.
152
Лизоцим и методы его титрования
Лизоцим—фермент, широко распространенный в природе,
обладающий свойством лизировать живые и мертвые клетки
Micrococcus lysodeikticus и целый ряд других, в основном
грамположительных, микроорганизмов. Присутствие лизоци-
ма установлено у всех представителей животного мира и у
значительной части растений. В организме человека лизоцим
находится в слезной жидкости, слюне, секрете слизистых обо-
лочек носа, желудочном и дуоденальном соке, грудном моло-
ке, сыворотке крови, экстрактах, полученных из различных
тканей и органов.
Лизоцимы, выделенные из различных источников, разли-
чаются по своей ферментативной активности, химическому
составу и физическим свойствам.
Биологическое назначение лизоцима в животных и расти-
тельных организмах окончательно не установлено. Основы-
ваясь на антибактериальных свойствах лизоцима, большин-
ство исследователей склонны рассматривать его как фактор
неспецифического иммунитета. Эту точку зрения подтвержда-
ет высокое содержание лизоцима в слезной жидкости, секрете
слизистых оболочек полости рта и верхних дыхательных пу-
тей, т. е. в тех органах, которые являются первым барьером
на пути проникновения микроба в организм. По материалам
экспериментальных исследований, кроме основного антибак-
териального действия, лизоцим стимулирует естественную ре-
зистентность живого организма, что играет большую роль в
исходе инфекционного процесса.
Наиболее точными способами определения лизоцима в сы-
воротке крови и других субстратах организма следует счи-
тать:
1. Метод турбидиметрического определения лизоцима, ос-
нованный на определении уменьшения степени мутности тест-
микроба под действием лизоцима в определенный интервал
времени. Постановка этого метода связана с использованием
спектрофотометра, ФЭК или нефелометра.
2. Метод диффузии в агар, основанный на том, что рас-
твор лизоцима, диффундируя из лунок, лизирует взвешенный
в агаре тест-микроб, вследствие чего вокруг лунок с лизоци-
мом образуются прозрачные зоны, диаметр которых соответ-
ствует концентрации находящегося в них лизоцима.
Определение активности лизоцима методом диффузии в
агар, отличаясь относительно простой техникой постановки
опыта, в то же время, при соблюдении стандартных условий,
дает точные, хорошо воспроизводимые результаты, позволя-
ющие рекомендовать его в практику.
Прежде чем приступить к постановке опытов по опреде-
лению активности лизоцима в исследуемых субстратах, не-
153
«обходимо изготовить в количестве, достаточном для прове-
дения всей серии предполагаемых экспериментов, ацетоновый
порошок убитой культуры М.. lysodeikticus. Применение уби-
той культуры тест-микроба стандартизирует условия проводи-
мых опытов, исключает необходимость многократных пересе-
вов культуры, позволяет вести исследование без соблюдения
условий стерильности.
Техника приготовления ацетонового порошка убитой куль-
туры М. lysodeikticus сводится к следующему. Суточную, а
при слабом микробном росте двухсуточную культуру микро-
ба, выращенную в пробирках на 2% мясо-пептонном агаре
(рец. 38, с. 352), смывают 5 мл изотонического раствора хло-
рида натрия. Полученной микробной взвесью засевают по-
верхность мясо-пептонного агара, разлитого в матрацы. На
каждый матрац расходуется 2 мл микробной культуры. Затем
матрацы помещают в термостат с температурой 37 °C в гори-
зонтальном положении засеянной поверхностью кверху.
По истечении срока инкубации выросшую культуру микро-
ба смывают с поверхности среды каждого матраца 75—
100 мл изотонического раствора хлорида натрия. Газон мик-
робного роста смывается легко. Образующуюся гомогенную
взвесь сливают в центрифужные пробирки через два слоя
марли для задержания комочков агара, центрифугируют на
холоде при 3000 об/мин в течение 20 мин, затем отмывают
2 раза изотоническим раствором хлорида натрия и один раз
дистиллированной водой. Промытую таким образом микроб-
ную массу переносят небольшими порциями при постоянном
помешивании стеклянной палочкой в десятикратный объем
безводного ацетона, в результате чего образуется хлопьевид-
ная взвесь. Ее помещают в холодильник при 3—4 °C на 1—
2 ч. По истечении указанного времени взвесь микробов в
ацетоне после тщательного перемешивания вливают в ворон-
ку Бюхнера, на дно которой кладут два обеззоленных фильт-
ра, смоченных дистиллированной водой. Микробный осадок,
остающийся на поверхности фильтра, промывают 4 раза хо-
лодным ацетоном и 2 раза эфиром. После этого микробную
массу, остающуюся на фильтре, высушивают на воздухе при
комнатной температуре и измельчают в фарфоровой ступке
до полной гомогенности. Приготовленная таким образом су-
хая культура в виде мелкого желтовато-серого порошка мо-
жет длительное время храниться в пузырьках из-под пеницил-
лина, плотно закрытых резиновыми пробками.
Тест-культуру М. lysodeikticus, приготовленную таким спо-
собом, перед использованием в опыте испытывают на лизи-
руемость лизоцимом. Для этого, пользуясь микробным стан-
дартом мутности (см. с. 50), готовят микробную взвесь, со-
держащую 1 млрд, микробных тел в 1 мл, и разливают ее в
две пробирки. В одну из них — опытную — добавляют 8 мкг
154
лизоцима, растворенного в 1 мл изотонического раствора хло-
рида натрия. Таким образом, конечная концентрация лизоци-
ма в растворе составляет 4 мкг/мл. Во вторую — конт-
рольную — пробирку прибавляют равное количество изото-
нического раствора хлорида натрия. Пробирки выдерживают
при комнатной температуре в течение 30 мин. Культура счи-
тается пригодной для работы, если за указанный период в
опытной пробирке произойдет полный лизис находящихся в
ней клеток.
Турбидиметрический метод количественного определения
лизоцима в сыворотке. Для определения лизоцима в сыво-
ротке крови и других жидкостях организма методом Перри в.
модификации X. Я. Грант и соавт. (1970) необходимо иметь:
1. Ацетоновый порошок М.. lysodeikticus.
2. Кристаллический лизоцим *.
3. Спектрофотометр.
Определение лизоцима в исследуемой жидкости начинает-
ся с изготовления стандартной взвеси тест-микроба и основ-
ного раствора лизоцима. Для этого:
А. 50 мг ацетонового порошка М. lysodeikticus взвешива-
ют в 100 мл 0,007 М фосфатного буфера pH 6,2.
Б. 10 мг кристаллического лизоцима растворяют в 100 мл
того же 0,006 М фосфатного буфера pH 6,2.
Из основного раствора, содержащего 100 мкг лизоцима в
1 мл, путем дальнейших разведений готовят рабочие раство-
ры, содержащие 12,5; 6,25; 3,13; 1,56 мкг/мл, необходимые-
для получения калибровочной кривой.
В. Подготавливают для испытания сыворотку или другой
субстрат, подлежащий исследованию. В кварцевую кювету
(рабочая толщина 1 см) вносят:
1,5 мл свежеприготовленной взвеси М.. lysodeikticus,
0,5 мл 0,3 М. раствора хлорида натрия,
1 мл исследуемой сыворотки, разведенной в 10 раз.
Все ингредиенты вносят в указанной последовательности,
быстро размешивают стеклянной палочкой и спектрофотомет-
рируют при длине волны 540 нм. Одновременно с помещени-
ем кювет в спектрофотометр включают секундомер и опреде-
ляют экстинкцию через 15 с (Ео) и 180 с (Es). Эти сроки вы-
браны как оптимальные на основании многократных прове-
рочных исследований. В качестве контроля служит предва-
рительно подготовленная и помещенная в спектрофотометр
вторая кювета, содержащая 3 мл буферного раствора.
По результатам определения активности лизоцима в стан-
дартных растворах, содержащих 12,5; 6,25; 3,13 и 1,56 мкг
лизоцима в 1 мл, строят калибровочную (стандартную) кри-
5 Кристаллический лизоцим из яичного порошка в настоящее время
производится Олайискнм заводом химических реактивов Латвийской ССР.
15&
вую. Активность лизоцима в стандартных растворах опреде-
ляется так же, как в образцах исследуемых сывороток. Ре-
зультаты измерения экстинкции наносят на сетку графика,
где по оси абсцисс отложена концентрация лизоцима в мик-
рограммах на 1 мл, по оси ординат — разница величин экс-
тинкции (Eq—Es). В пределах концентрации 1,56—
12,5 мкг/мл нанесенные на сетку точки соединяют прямой,
устанавливая таким образом линейное соответствие количе-
ства лизоцима степени его мутности.
После получения калибровочной кривой рассчитывают со-
держание лизоцима в исследуемых сыворотках. При этом на
оси ординат находят число экстинкции (рассчитанное по раз-
нице Ео—Es) и определяют соответствующую ему концентра-
цию лизоцима (мкг/мл) на оси абсцисс.
Количественное определение лизоцима методом диффузии
в агаре. При отсутствии спектрофотометра, ФЭК, нефеломет-
ра содержание лизоцима в сыворотке крови и других жидко-
стях может быть определено методом диффузии в агаре, пред-
ложенным Чариоти (модификации Л. А. Каграмановой).
Для проведения исследований этим методом необходимо
иметь:
1. Фталатовый агар (рец. 25, с. 348).
2. Ацетоновый порошок М. lysodeikticus.
3. Раствор бифталата калия pH 6,2.
4. Стандартный раствор лизоцима.
А. Растапливают в водяной бане фталатный агар из рас-
чета 15 мл на каждую опытную чашку. Из ацетонового по-
рошка убитой культуры тест-микроба готовят взвесь. На каж-
дые 10 мл среды берут 150 мг высушенной микробной мас-
сы, вносят в маленькую фарфоровую ступку и, непрерывно
растирая пестиком, приливают небольшими порциями 10 мл
раствора бифталата калия pH 6,2. Микробную взвесь, при-
готовленную таким' образом, приливают к расплавленному и
остуженному до температуры 45 °C агару. Смесь хорошо пе-
ремешивают и разливают мерной пипеткой по 15 мл в чаш-
ки, предварительно установленные на строго горизонтальной
поверхности стола для равномерного распределения в них
слоя среды.
Б. Рабочий стандарт лизоцима готовят следующим обра-
зом: 10 мг кристаллического лизоцима растворяют в 50 мл
дистиллированной воды. Полученный раствор, содержащий
200 мкг лизоцима в 1 мл, разливают по 3—4 мл в химически
чистые флаконы из-под пенициллина, закрывают их резино-
выми пробками, парафинируют и хранят в замороженном со-
стоянии при температуре —20 °C.
Непосредственно перед постановкой опыта лизоцим раз-
мораживают, берут 2 мл и разводят 48 мл дистиллированной
воды. Полученный исходный раствор, содержащий 8 мкг ли-
156
зоцима в 1 мл, служит для приготовления рабочих стандар-
тов, содержащих 4, 2 и 1 мкг лизоцима в 1 мл:
1 мл исходного раствора+1 мл дистиллированной воды=4 мкг/мл.
0,4 мл исходного раствора+1,5 мл дистиллированной воды = 2 мкг/мл.
0,25 мл исходного раствора+1,75 мл дистиллированной воды = 1 мкг/мл.
В. В застывшем агаре пробочным сверлом из нержавею-
щей стали вырезают на равном расстоянии друг от друга
5 лунок диаметром по 6—8 мм каждая. Расположение лунок
должно быть во всех опытах стандартным, что достигается
применением рисунка-трафарета, который подкладывают под
дно чашки перед вырезыванием лунок. В 3 лунки вносят по
2 капли рабочих стандартов лизоцима, содержащих 1, 2 и
4 мкг в 1 мл раствора; две другие лунки заполняют мате-
риалом, подлежащим исследованию на лизоцим. Материал
вносят в неразведенном состоянии и в разведении 1 :2 (сы-
воротка крови) или 1 : 10 (слезная жидкость, белок куриного
яйца или другой субстрат, богатый лизоцимом). После за-
полнения лунок стандартными количествами лизоцима и ис-
следуемым веществом чашки помещают в термостат при
37 °C на 24 ч.
Учет полученных результатов. На всех опыт-
ных чашках измеряют в двух направлениях диаметр зон ли-
зиса, образующихся вокруг лунок с рабочими стандартами
лизоцима. Диаметр зон лизиса, пропорциональный концентра-
циям лизоцима в соответствующих луиках составляет в
среднем 17 мм для 1 мкг лизоцима, 23 мм для 2 мкг и 26 мм
для 4 мкг лизоцима. Полученные величины складывают и вы-
водят средние арифметические отдельно для каждой дозы ли-
зоцима. Затем, пользуясь полулогарифмической сеткой, стро-
ят калиброванную кривую, откладывая на оси абсцесс диа-
метр зон лизиса, а на оси ординат количество микрограммов
лизоцима. По вычерченной калиброванной кривой определя-
ют содержание лизоцима в исследуемых субстратах.
ЧАСТЬ ВТОРАЯ
СПЕЦИАЛЬНАЯ ЧАСТЬ
ТЕХНИКА СОБИРАНИЯ У БОЛЬНОГО МАТЕРИАЛА
ДЛЯ БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
В постановке диагноза заболевания решающее значение
имеет клиническое обследование больного, позволяющее не-
редко уже в первые дни и даже часы болезни выявить харак-
терные для того или иного заболевания симптомы.
Лабораторные методы исследования, в том числе и им-
мунобактериологические, облегчают раннюю диагностику ин-
фекционного заболевания, позволяют дифференцировать но-
зологические формы, имеющие общность в клиническом про-
явлении и течении болезни, дают лечащему врачу объектив-
ные фактические доказательства полной достоверности
поставленного диагноза.
В диагностике инфекционных болезней пользуются бак-
териоскопическими, бактериологическими, биологическими,
серологическими методами исследования и методом аллер-
гических проб.
Микроскопический метод, предусматривающий
обнаружение в патологическом материале бактерий, морфо-
логически сходных с возбудителем предполагаемого заболе-
вания, дает основание для постановки ориентировочного диа-
гноза.
Бактериологический метод, основанный на по-
лучении чистой культуры возбудителя болезни с последую-
щим ее изучением, имеет большое значение в диагностике
большинства инфекционных болезней.
Биологический метод — заражение лабораторных
животных—используется при диагностике зоонозных инфек-
ций.
Серологический метод исследования применяют
только в поздние сроки болезни (с конца 1-й—начала 2-й
педели заболевания), когда в крови больного накапливаются
специфические антитела к возбудителю заболевания.
Метод аллергических проб позволяет обнару-
жить повышенную чувствительность макроорганизма при не-
которых инфекционных заболеваниях. Выбор материала для
лабораторного исследования определяется локализацией па-
тологического процесса, особенностями патогенеза болезни и
биологическими свойствами возбудителя.
Успех бактериологического исследования в значительной
степени зависит от правильности взятия патологическог» ма-
15»
териала. Очень часто неправильность взятия и несвоевремен-
ность доставки материала в лабораторию обусловливают низ-
кую высеваемость из него возбудителя болезни. Патологи-
ческий материал для бактериологического исследования
рекомендуется брать у больного до начала специфического
лечения, так как под влиянием сульфаниламидов, антибиоти-
ков, иммунной сыворотки и других лечебных средств бакте-
рии изменяются и утрачивают способность к росту на искус-
ственных питательных средах.
Взятие крови венепункцией. Кровь в количестве 5—10 мл
получают из вены локтевого сгиба. Больного (если позволяет
его состояние) сажают на стул. Руку его, разогнутую в лок-
тевом суставе, кладут на стол. Плечо несколько выше локте-
вого сустава стягивают резиновым жгутом, чтобы приоста-
новить венозный отток крови, не нарушая при этом артери-
ального кровообращения (проверяется по наличию пульса в
лучевой артерии). После наложения жгута кожу в месте взя-
тия крови дезинфицируют спиртом. Больному предлагают не-
сколько раз медленно, но с силой сжать кисть в кулак. При
этом вены на предплечье сильно набухают. Одну из наиболее
сильно набухших вен локтевого сгиба фиксируют I пальцем
левой руки, а правой рукой вкалывают иглу шприца в вену
по направлению тока крови. Попадание иглы в вену сопро-
вождается поступлением крови в цилиндр шприца при оття-
гивании поршня. Кровь, взятую в нужном количестве, слива-
ют в стерильную пробирку. После этого ослабляют жгут, из-
влекают иглу из вены, а место прокола плотно прижимают
кусочком стерильной ваты, смоченной йодом, и перевязывают.
Взятие крови из мякоти пальца. Кровь в небольшом коли-
честве (до 1 мл) можно получить из мякоти пальца. Кончик
IV пальца левой руки, кожа которого обычно более тонкая,
обтирают ватой со спиртом и эфиром и подсушивают (на
влажной коже не образуется концентрированной, хорошо сте-
кающей капли).
После обработки места укола лаборант фиксирует палец
больного, взяв его за ногтевую фалангу I и II пальцами ле-
вой руки. В это же время правой рукой устанавливают иглу
шприца или оспопрививательный ланцет перпендикулярно
кончику пальца, плотно прижимают к коже и делают прокол
на глубину 2—3 мм в зависимости от толщины кожи у боль-
ного и количества крови, которое предполагается взять. После
прокола конец пальца слегка сжимают, чтобы вызвать крово-
течение из ранки. Кровь, стекающую отдельными каплями,
собирают в стерильную агглютинационную пробирку.
После взятия необходимого количества крови к месту про-
кола прикладывают кусочек ваты, смоченной йодом.
Получение сыворотки крови и способ ее транспортировки.
Способ получения сыворотки крови описан подробно на
159
с. 103. Сыворотки, предназначенные для продолжительного
хранения или пересылки в отдаленные места, консервируют,
прибавляя 2% раствор х. ч. борной кислоты (0,1 г борной
кислоты на 5 мл сыворотки).
Если взято несколько капель крови, из которых
получить нужное количество сыворотки не представля-
ется возможным, поступают следующим образом. Кровь
смешивают с изотоническим раствором хлорида натрия при-
близительно из расчета 1 :10, центрифугируют и затем па-
стеровской пипеткой отсасывают прозрачный слой жидкости,
содержащий сыворотку. Степень разведения полученной та-
ким образом сыворотки равна примерно 1 :20, если исходить
из положения, что объем сыворотки составляет примерно 50%
от общего объема крови.
Для пересылки небольшого количества сыворотки иа большие расстоя-
ния 2 капли крови, нанесенные на прямоугольный кусочек бумаги размером
5x8 см, подсушивают при комнатной температуре нли в термостате. После
подсыхания крови бумагу свертывают в форме пакетика аптечного порошка
каплями внутрь и отправляют по назначению. В лаборатории высохшие
пластинки крови, снятые с бумаги скальпелем, ссыпают в пробирку, залива-
ют 1 мл изотонического раствора хлорида натрия и помещают для раство-
рения на 1—2 ч в термостат. Полученная прозрачная жидкость соответст-
вует разведению сыворотки 1:20, так как объем 2 капель крови составляет
приблизительно 0,1 мл, а объем сыворотки в ней — 0,05 мл. Разведение
1:20 является основой для приготовления рабочих разведений сыворотки.
Сыворотка крови, направляемая в лабораторию для се-
рологического анализа, должна иметь сопроводительный до-
кумент со следующими данными:
1) фамилия, имя и отчество;
2) возраст больного;
3) предполагаемый клинический диагноз;
4) день заболевания;
5) отметка о прививке в прошлом вакциной, антиген ко-
торой соответствует возбудителю предполагаемого заболева-
ния;
6) отметка о заболевании в прошлом болезнью, предпола-
гаемой в данный момент.
Взятие слизистого отделяемого верхних дыхательных пу-
тей тампоном и методом кашлевых пластинок. Слизистое от-
деляемое верхних дыхательных путей для бактериологическо-
го исследования следует брать натощак или 2 ч спустя после
приема пищи и полоскания носа и горла дезинфицирующим
раствором.
Взятие слизистого отделяемого полости
носа. При взятии материала со слизистых оболочек носа
кожу в окружности наружных отверстий носа протирают ва-
той, смоченной 60% спиртом. После этого тампон вводят в
глубь полости носа и снимают слизь со стенки носовой пере-
городки. Забирать материал из разных ноздрей можно одним
тампоном.
160
Взятие слизи тампоном со слизистых обо-
лочек зева. Больного усаживают на стул против света и
предлагают широко раскрыть рот. Корень языка придавли-
вают шпателем, который вводят в рот обследуемого левой ру-
кой так, чтобы введенный конец был несколько ниже того, за
который его держат. Язык стараются придавить книзу и при-
двинуть кпереди, чтобы лучше осмотреть зев. Тампон в по-
лость рта вводят правой рукой осторожно, не касаясь по-
верхности языка, содержащего обильную микрофлору. Сни-
мая налет и слизь с миндалин, дужек мягкого неба и задней
стенки глотки, обращают внимание на видимые измененные
участки слизистой оболочки.
Взятие материала из области хоан и зад-
ней стенки глотки. Материал из области хоан и зад-
ней стенки глотки берут тампоном, укрепленным на легко
гнущейся алюминиевой проволоке. Перед употреблением ко-
нец проволоки на 2—3 см от края сгибают о край пробирки
под тупым (примерно 150°) углом. ;В широко раскрытый рот
больного вводят сначала шпатель, прижимая язык книзу, а
затем тампон. Загнутый кверху конец тампона заводят за
язычок неба, протирают им заднюю стенку носоглотки и сни-
мают слизь из хоан.
Получение слизистого отделяемого тра-
хеи и бронхов. Метод кашлевых пластинок.
При взятии материала с помощью кашлевых пластинок чаш-
ку Петри с питательной средой, элективной для того вида
микроба, который предполагается выделить, устанавливают
вертикально на расстоянии 10—15 см от рта больного. Во
время приступа кашля крышку с чашки снимают и выделяю-
щиеся капельки, содержащие в основном микроорганизмы,
обитающие в бронхах и бронхиолах, попадают на плотную
питательную среду, на которой затем и растут. При получе-
нии материала методом кашлевых пластинок приходится ожи-
дать наступления приступа кашля, что усложняет работу, осо-
бенно если она связана с обследованием детских коллекти-
вов и лиц со слабо выраженными и редкими приступами
кашля.
Метод гортанных тампонов. Обследуемому пред-
лагают открыть рот, после чего шпателем нажимают на ко-
рень языка, а тампон, введенный в полость рта, продвигают
вглубь так, чтобы опущенный конец его навис над входом в
гортань. У большинства людей при этом появляется кашлевой
рефлекс, сопровождающийся выделением слизи, значительная
часть которой попадает на тампон.
Взятие мокроты для микробиологического исследования.
Утреннюю порцию мокроты, выделяющуюся во время присту-
па кашля, собирают в стерильную склянку с хорошо подо-
бранной пробкой. У детей, которые не умеют откашливать
11 Лабинская А. С.
161
мокроту, искусственно вызывают кашель, раздражая корень
языка тампоном.
Взятие рвотных масс для бактериологического исследова-
ния. Рвотные массы собирают в широкогорлую банку, жела-
тельно стерильную. Отверстие ее закрывают вощаной бума-
гой, обвязывают ниткой и отправляют в лабораторию. Рвот-
ные массы должны быть собраны и при необходимости от-
правлены в лабораторию для исследования в любое время
суток, так как рвота может не повториться.
Взятие испражнений для бактериологического исследова-
ния. Испражнения собирают в стерильные картонные тарелки
или в подкладные судна и эмалированные лотки, предвари-
тельно обеззараженные раствором хлорной извести (но не ли-
зола и не карболовой кислоты) и затем многократно промытые
горячей водой для уничтожения следов дезинфицирующих ве-
ществ. Стерильным деревянным шпателем из разных мест по-
лученной порции кала отбирают 1—2 г испражнений, помеща-
ют их в пробирки или склянки с хорошо закрывающимися
пробками. При наличии патологических включений (слизь,
гной) их обязательно вносят в посевной материал.
Исследуемый материал, который не может быть своевре-
менно доставлен в лабораторию, консервируют. В качестве
консервантов могут быть использованы глицериновая смесь
(рец. 69), 1,5—3% раствор хлорида натрия, среды обогаще-
ния: желчный бульон (рец. 76), среда Мюллера (рец. 72),
среда Кауфмана (рец. 73). Нативные испражнения могут
сохраняться в течение 1—2 сут (если невозможно произве-
сти посев) на холоду при температуре 3—4°С.
Получить испражнения для исследования можно, не ожи-
дая акта дефекации, пользуясь для этой цели ректальными
трубками. Последние представляют собой трубки, сделанные
из стекла, диаметром от 5 мм (для детей) до 10 мм (для
взрослых) и длиной около 20 см. Нижний конец трубки за-
паян, а на расстоянии 20—25 мм от запаянного конца имеют-
ся два опаяннйх отверстия, расположенных друг против дру-
га одно несколько ниже другого. Открытый конец трубки за-
крывают кусочком ваты, трубку опускают в пробирку через
ватно-марлевую пробку и в таком виде стерилизуют. Для взя-
тия материала ректальные трубки вводят в прямую кишку на
глубину 8—10 см у детей и 12—15 см у взрослых. Для до-
ставки взятого материала ректальные трубки помещают в
пробирки с консервантом.
Взятие мочи для бактериологического исследования. Мо-
чу берет медицинская сестра через катетер в стерильную
склянку в количестве 25—30 мл.
Отделяемое из влагалища и шейки матки. Берут его на
гинекологическом кресле под контролем зеркала с помощью
ватного тампона или бактериальной петли.
' 162
Взятие гноя из абсцесса и отделяемого раны. Поверхность
невскрывшихся абсцессов, пустул и везикул обрабатывают ва-
той, смоченной спиртом, затем эфиром. После дезинфекции
кожи делают прокол, набирая содержимое в шприц. К шпри-
цу подбирают иглы с каналом широкого диаметра. Гной из
вскрывшихся абсцессов, гнойников, фурункулов и отделяемое
ран берут из глубины стерильным тампоном.
Взятие материала для бактериологического исследования
от трупа. При проведении посмертного бактериологического
исследования вскрытие трупа должно быть произведено в
первые часы после смерти, так как при трупном разложении
вульгарная микрофлора кишечника наводняет все ткани и
органы. От трупа берут кровь и кусочки внутренних органов.
Кровь удобнее всего брать из правого желудочка сердца. Для
этого его поверхность площадью примерно 2 см2 прижигают
накаленным скальпелем или шпателем и через прижженный
участок вводят стерильную пастеровскую пипетку, набирая
в нее необходимое количество крови. Полученную кровь сли-
вают в стерильную пробирку или засевают непосредственно в
питательные среды.
Из паренхиматозных органов — селезенки, печени, почек,
а также из мозга, лимфатических сосудов, легких после пред-
варительного прижигания их поверхности вырезают стериль-
ными ножницами из глубины кусочки величиной с горошину.
Вырезанные кусочки помещают в стерильные пробирки или
стеклянные баночки с притертыми пробками.
Для взятия желудка накладывают две лигатуры на пище-
вод, выше желудочка на 1—2 см, и две другие лигатуры на
двенадцатиперстную кишку, на таком же расстоянии от же-
лудка. Линии разреза делают между двумя лигатурами так,
чтобы оба конца желудка были перерезаны. Точно так же бе-
рут для исследования отрезок кишечника. Вырезанный желу-
док и участок кишки помещают в стерильную банку с притер-
той пробкой. Содержимое кишечника и желудка в количестве,
необходимом для бактериологического исследования, мож-
но получить также с помощью прокола желудочной или ки-
шечной стенки шприцем. Желчный пузырь после перевязки
протока вырезают вместе с кусочком печени.
Патологический материал, направляемый в лаборато-
рию для бактериологического исследования, должен иметь
сопроводительное отношение, содержащее следующие све-
дения:
1. Фамилия, имя, отчество и возраст больного.
2. День заболевания. Температура тела.
3. Предполагаемый на основании клинических данных диа-
гноз или повод для исследования (например, по эпидемиче-
ским показаниям, предполагаемое бактерионосительство и
т. д.).
II* 163
4. Наименование объекта, направляемого на бактериоло-
гическое исследование (кал, мокрота, кровь и т. д.). При кон-
сервировании материала указать, какой консервант приме-
нен.
5. Цель исследования.
6. Наименование учреждения и фамилия врача, направля-
ющего материал на исследование.
При направлении на бактериологическое исследование ис-
пражнений, спинномозговой жидкости необходимо указать
время взятия пробы. При направлении трупного материала
важно отметить время наступления смерти, вскрытия трупа
н взятия материала.
ПАТОГЕННЫЕ КОККИ
К группе патогенных (гноеродных) кокков относятся ста-
филококки, стрептококки, пневмококки, менингококки и гоно-
кокки.
По тинкториальному признаку они делятся на две группы:
грамположительные (стафилококки, стрептококки и пневмо-
кокки) и грамотрицательные (менингококки и гонококки).
СТАФИЛОКОККИ
Стафилококки представляют собой широко распростра-
ненную в природе группу микроорганизмов, объединяющую
в себе наряду с сапрофитическими болезнетворные формы
микробов с различно выраженной степенью их патогенности
и вирулентности.
Стафилококки являются возбудителями гнойничковых за-
болеваний кожи, фурункулов, абсцессов, флегмон. В ослаб-
ленном организме проникновение стафилококка в кровь со-
провождается развитием сепсиса с образованием вторичных
абсцессов во внутренних органах: печени, легких, почках.
Наиболее часто стафилококковые заболевания наблюдаются
у рожениц и новорожденных (послеродовой сепсис, маститы,
пиодермиты и пневмонии новорожденных).
Некоторые штаммы стафилококка, попадая в пищевые
продукты и размножаясь в них, становятся причиной пище-
вых отравлений.
Однако выделение стафилококков из материала, содержа-
щего смешанную микрофлору, не является доказательством
его этиологического значения, принимая во внимание широ-
кую распространенность стафилококков в природе и большую
вариабельность их биологических свойств.
Выделение монокультуры стафилококка из закрытых гной-
ных очагов, независимо от свойств штамма является бес-
спорным доказательством его патогенности.
164
Обнаружение в очагах инфекции стафилококков в ассо-
циации с другими видами микроорганизмов требует специаль-
ных доказательств того, что выделенные штаммы стафило-
кокков причастны к этиологии текущего воспалительного про-
цесса.
Для дифференциации патогенных стафилококков рекомен-
дован комплекс тестов, среди которых плазмокоагулирую-
щей и лецитовителлазной активности принадлежит видное
место.
В настоящее время для решения вопроса о стафилококко-
вой природе того или иного заболевания пользуются бакте-
риологическими и серологическими методами исследования,
применяя их порознь иди во взаимном сопоставлении.
Материал для исследования. В зависимости от
характера заболевания и локализации патологического очага
материалом для исследования служат:
1. Гной из очагов поражения при гнойничковых заболева-
ниях кожи, фурункулах, флегмонах и т. д.
2. Кровь при подозрении на сепсис.
3. Слизистое отделяемое зева и носоглотки при заболева-
ниях верхних дыхательных путей и выявлении стафилококко-
вого носительства.
4. Мокрота при пнемонии.
5. Рвотные массы и промывные воды желудка, а также
остатки пищи, подозреваемые в качестве причины интоксика-
ции при пищевых отравлениях.
Микробиологический диагноз заболеваний, вызванных
стафилококками. В лаборатории для диагностики стафило-
кокковых заболеваний используют бактериологический метод
исследования — посев патологического материала на пита-
тельные среды с последующим выделением чистой культуры
и изучением свойств, характеризующих ее патогенность.
Первый день. Для посева материала, исследуемого на
зараженность стафилококками, очень важно подобрать пита-
тельную среду.
1. При исследовании гноя открытых ран, отделяемого ран
или свищей, мокроты, рвотных масс, промывных вод желуд-
ка, пищевых продуктов, изъятых при пищевых отравлениях,
и другого подобного материала, в котором можно предпола-
гать содержание обильной, посторонней микрофлоры, лучше
всего пользоваться желточно-солевым агаром Чистовича
(рец. 61) или молочно-солевым агаром Петрович (рец. 62).
Эти среды обладают элективными свойствами, обусловлен-
ными высоким содержанием хлорида натрия, а желточно-со-
левой агар, кроме того, позволяет брлее четко, чем кровяной
агар, дифференцировать патогенные и непатогенные штаммы
стафилококка. Для засева солевых сред берется большое ко-
личество материала, который втирают в поверхность пита-
165.
тельной среды шпателем. Срок инкубации при температуре
37Х увеличивают до 2 сут.
2. При посеве гноя из иевскрывшихся абсцессов, флегмон,
экссудата, полученного из закрытых полостей, можно поль-
зоваться обычным мясо-пептонным или 5% кровяным агаром.
Исследуемый материал наносят на питательную среду в ко-
личестве 1—2 капель и затем распределяют по всей поверх-
ности чашки.
Инкубация посевов при температуре 37°С длится 18—;
24 ч.
3. Кровь в количестве 10—15 мл засевают в 100—150 мл
0,25% сахарного бульона (рец. 42) или по методу Френкеля
в 80—100 мл среды Китта — Тароцци '(рец. 113) с добавлени-
ем 0,15% агар-агара. Перед посевом крови среду Китта — Та-
роцци регенерируют 20—30 мин в кипящей водяной бане (см.
с. 54) и быстро охлаждают. Предложенный метод основан
на том, что патогенные бактерии при выделении их из орга-
низма больного значительно лучше развиваются в анаэроб-
ных условиях, чем в аэробных.
Среды, засеянные кровью, выдерживают в термостате в
течение 10 сут, производя каждые 2 сут высевы на 5% кро-
вяной агар и желточную среду Чистовича (рец. 63).
Второй день. 1. Просматривают посевы исследуемого
материала на мясо-пептонном, молочно-солевом, желточно-со-
левом и кровяном агаре. Колонии стафилококка на плотных
питательных средах круглые, слегка выпуклые, с ровными
краями, влажной глянцевой поверхностью. По цвету коло-
нии, в зависимости от продуцируемого пигмента, стафилокок-
ки подразделяются на эмалево-белые (Staphylococcus albus),
лимонно-желтые (Staphylococcus citreus) и золотистые (Stap-
hylococcus. aureus).
Для лучшего выявления пигмента посевы на молочно-со-
левом агаре выдерживают 2—3 дня при комнатной темпера-
туре. На кровяном агаре вокруг колоний стафилококка мо-
жет обнаруживаться гемолиз. На желточно-солевом ага-
ре большая часть патогенных стафилококков, образующих
лецитиназу, дает лецитовителлазную (желточную) реакцию,
проявляющуюся в образовании вокруг колонии зоны помут-
нения с радужным венчиком по периферии.
2. Из колонии с типичными для стафилококка признака-
ми делают мазок для окраски по Граму. При наличии стафи-
лококков видны характерные гроздевидные скопления кокков,
окрашенных по Граму положительно.
3. Две — три колонии с положительной лецитовителлазной
реакцией отсевают для дальнейшего изучения в пробирки со
скошенным мясо-пептонным агаром.
Третий день. С культурами микроорганизмов, выра-
щенными на скошенном агаре, ставят реакцию плазмокоагу--
166
ляции. Штаммы, продуцирующие фермент плазмокоагу-
л азу, вызывают свертывание плазмы, вследствие чего она
превращается в желеобразную массу, не выливающуюся при
перевертывании пробирок.
Для постановки реакции пользуются асептично взятой
кроличьей или человеческой плазмой, стабилизированной при
помощи 1—4% цитрата или 0,1% оксалата1. Нестерильно
взятая плазма, а также плазма, полученная от людей или
животных, перенесших стафилококковое заболевание, для по-
становки реакции плазмокоагуляции непригодна, так как в
ней может находиться антикоагулаза, препятствующая свер-
тыванию плазмы. Реакцию плазмокоагуляции ставят ускорен-
ным способом на стекле «Слид тест» и в преципитационных
пробирках. Ускоренным способом постановки реакции поль-
зуются при массовых обследованиях, связанных с изучением
большого количества микробных культур.
При изучении штаммов ускоренным методом на предмет-
ное стекло наносят каплю воды и в ней тщательно, до обра-
зования равномерной мутности, суспендируют исследуемую
бактериальную культуру. После этого к капле микробной
взвеси добавляют каплю разведенной 1 : 5 плазмы крови кро-
лика. При положительной реакции плазма коагулирует в
ближайшие 15—60 с, при сомнительной — после 1 мин, при
отрицательной реакции образование сгустка не происходит
в течение 3 мин.
При постановке реакции пробирочным способом в две сте-
рильные преципитационные пробирки наливают по 0,5 мл
плазмы, разбавленной ex tempore 1 : 5 изотоническим раство-
ром хлорида натрия (1 мл плазмы +4 мл изотонического
раствора хлорида натрия), после чего в каждую пробирку
вносят по 1 петле 18—20-часовой культуры стафилококка.
Одну пробирку (опытную) засевают исследуемой культурой,
вторую (контроль)—заведомо патогенным, плазмокоагули-
рующим штаммом стафилококка. Засеянные пробирки выдер-
живают в течение 3 ч. Если за указанное время коагуляции
плазмы не происходит, пробирки оставляют при комнатной
температуре еще па 18 ч. Если и через это время свертыва-
ния плазмы не произойдет, испытуемая культура является
коагулазоотрицательной. Одновременно в термостат ставят
несколько пробирок с незасеянной плазмой (второй конт-
роль). В тех случаях, когда хотя бы в одной пробирке второ-
го контроля наступает коагуляция плазмы, обусловленная
микробным загрязнением* результат опыта не учитывается.
1 В настоящее время предприятие по производству бактерийных препа-
ратов Научно-исследовательского института эпидемиологии и микробиоло-
гии Министерства здравоохранения БССР выпускает сухую цитратную
ллазму кролика специально для постановки реакции плазмокоагуляции.
167
Тесты дифференциации патогенных и непатогеиных ста-
филококков. Для установления патогенности стафилококков
рекомендуется с выделенными штаммами возбудителя ставить
реакцию плазмокоагуляции и лецитовителлазную пробу. Куль-
туры микроорганизмов, коагулирующие плазму и обладаю-
щие лецитовителлазной активностью, независимо от характе-
ра продуцируемого ими пигмента и гемолитической активно-
сти должны рассматриваться как потенциально патогенные.
Между тем при исследовании посевов крови и другого па-
тологического материала нередко высеваются культуры коа-
гулазоотрицательных стафилококков. При получении такого
рода результатов возникает необходимость в решении вопрос
са, является ли выделенный микроб этиологическим факто-
ром болезни или следствием загрязнения посевов вульгарной,
микрофлорой.
По результатам однократного посева патологического ма-
териала делать какие-либо выводы очень трудно. Поэтому ис-
следование необходимо повторить. При повторном выделении
из патологического материала коагулазоотрицательных ста-
филококков необходимо установить тождество выделенных
культур по морфологическим, культурально-биохимическим
признакам и антибиотикограммам. Возбудители заболеваний,,
повторно выделяемые из организма, обычно обладают тожде-
ственной характеристикой.
В тех случаях, когда у больных выделяют вначале типич-
ные патогенные стафилококки, а затем начинают высевать-
ся коагулазоотрицательные штаммы, необходимо все микроб-
ные культуры, полученные в динамике заболевания, подверг-
нуть сравнительному фаготипированию, так как известно, что
дегенерирующие под влиянием антибиотиков стафилококки
изменяют морфологические, культуральные и биохимические
свойства, но стойко сохраняют присущий им фаготип.
Фаготипирование стафилококков. При возникновении мас-
совых заболеваний стафилококковой этиологии (в родильных
домах, детских и больничных учреждениях) большое значе-
ние приобретает выявление источников инфекции и установ-
ление эпидемических связей. Решение этой задачи возможно
только методом фаготипирования стафилококков, подтверж-
дающим идентичность микроорганизмов, выделяемых у боль-
ных, носителей и объектов внешней среды. В настоящее время
для фаготипирования плазмокоагулирующих стафилококков
Международным подкомитетом по фаготипированию стафило-
кокков рекомендован набор из 20 типовых фагов *, разделен-
ных по литическому сродству на 4 группы (табл. 21).
1 Наборы стафилококковых бактериофагов выпускаются производствен-
ным отделом Института эпидемиологии и микробиологии АМН СССР имени
Н. Ф. Гамалеи.
16S
Рис. 20. Приспособление
для иаиесеиия капель
фагов на поверхность
плотной питательной сре-
ди. .
1 — стеклянная трубка: 3 —
резиновая трубка: 3 — инъ-
екционная игла.
Отобранные для фаготипирования
плазмокоагулирующие штаммы стафи-
лококка засевают на скошенный мясо-
пептонный агар и инкубируют 18—24 ч
при 37°С. На следующий день агаро-
вую культуру пересевают в пробирки
с 2,5 мл бульона Хеттингера (рец. 37)
или бульона Мартена (рец. 40) и
ставят в термостат при 37°С. Буль-
онную 3—4-часовую культуру стафи-
лококка пересевают на чашки со све-
жеприготовленным и подсушенным
1,25% агаром (pH 7,2—7,4), содер-
жащим 0,4% глюкозы и 0,02% хло-
рида кальция (стерильный 10% раст-
вор хлорида кальция в объеме 0,2 мл
добавляют к 100 мл расплавленного
агара непосредственно перед разли-
вом среды). Культуру в количест-
ве нескольких капель наносят на по-
верхность среды, распределяют шпате-
лем по всей площади чашки, а избыток
ее отсасывают пастеровской пипеткой.
Засеянные чашки в течение 30—40
мин подсушивают в термостате. Пос-
ле подсушивания дно чашки расчер-
чивают карандашом по числу фагов на 20 квадратов и в каж-
дый квадрат засеянной среды, всегда в одном и том же поряд-
ке, стандартной петлей (диаметр 2 мм) или пастеровской пи-
петкой с тонко оттянутым капилляром наносят по капле соот-
ветствующего фага. После нанесения на чашку одного из фа-
гов петлю прожигают. При пользовании пипеткой фаг наносят
таким образом, чтобы кончик пипетки не касался поверхности
засеянной среды, исключая тем самым возможность переноса
культуры с одной чашки на другую или внесения культуры
в пробирки с типовым фагом.
Таблица 21
Группа Фаг
I 29 52 52А 79 80
II ЗА ЗС 55 71
III 6,75 42Е.77 47,83А 53,84 54,85
IV 42Д
169
Н. И. Леонене и В. А. Вайчювенас (1971) упростили и
значительно ускорили технику нанесения капель фага на за-
сеянные чашки Петри, предложив для этой цели пользовать-
ся трубкой диаметром 5 мм, на конце которой с помощью
резинового кольца закрепляют инъекционную иглу (рис. 20).
Иглу подбирают с таким расчетом, чтобы при открытом верх-
нем конце трубки жидкость через иглу стекала самопроиз-
вольно с промежутком времени между отделением 2 капель,
достаточным для того, чтобы, не закрывая конца стеклянной
трубки, успеть перенести ее от одной чашки Петри к другой,
затем к третьей и т. д. При соблюдении указанных условий
капли получаются одинаковыми по размеру и форме. При
подсыхании капель фагов чашку переворачивают крышкой
вниз и инкубируют 18—20 ч при 30°С или 5—6 ч при 37°С.
Для типирования применяют два рабочих разведения фа-
гов: одно из них соответствует 1 ТР (тест-разведение), кото-
рое должно быть не ниже Ю-3, другое — 100 ТР, соответст-
венно не ниже 10-1. Фаготипирование штаммов начинают ра-
бочим разведением фагов, соответствующим 1 ТР. Штаммы,
с которыми получают отрицательный результат (отсутствие
учитываемого лизиса хотя бы одним фагом), на следующий
день типируют повторно разведением фагов, соответствую-
щим 100 ТР.
Результаты фаготипирования регистрируют с учетом сте-
пени лизиса по четырехкрестной системе:
+ + + + сливной (полный) лизис
+++ полусливной (незначительный) лизис, рост культуры в зоне лизиса
+ + наличие в месте нанесения капли фага свыше 50 колоний фага
(пятен лизиса)
+ от 20 до 50 колоний фага
± менее 20 колоний фага
— полное отсутствие лизиса
Для упрощения схемы учета степеней лизиса обозначения
4-4-4-4-, 4-4-4- и 4-4- относят к «сильным реакциям» и вы-
ражают 4-4-. Штаммы стафилококка считаются типирован-
ными, если хотя бы один фаг вызвал явления лизиса на 4-4-/
Более слабые степени лизиса не учитывают. Следовательно,
если при первичном типировании штамма (1 ТР) один или
несколько фагов дали лизис на 4-, такие штаммы следует
типировать повторно 100 ТР. Если при повторном типирова-
нии штамма имеет место лизис на 4-, такие штаммы счита-
ют нетипируемыми.
При регистрации результатов типирования против каждо-
го исследованного штамма записывают: номер фага, давшего
лизис на 4-4-, а также степень разведения фага (1 ТР и 100
ТР). В скобках можно отметить номер фагов, давших лизис
на 4- или ±. Учет такого лизиса, не являясь достаточно по-
казательным для характеристики штамма, может, однако,
170
помочь установлению идентичности нескольких штаммов, что
имеет значение при эпидемиологическом обследовании.
Штаммы стафилококков лизируются чаще всего не одним,
а несколькими фагами, что дает для каждого штамма харак-
терную фагомозаику. В зависимости от фагов штаммы стафи-
лококков могут относиться к какой-либо одной (I, II, Ш или
IV) группе или к смешанным группам (например, I и III).
Определение энтеротоксина стафилококков. Штаммы ста-
филококков, выделенные при пищевых отравлениях, испыты-
вают на наличие энтеротоксина следующим образом. Одну
петлю суточной агаровой культуры стафилококка вносят в
колбу, содержащую 50 мл питательной среды, предназначен-
ной специально для накопления стафилококкового энтероток-
сина (рец. 64). Колбу помещают в эксикатор, в котором воз-
дух замещен 20% углекислотой. Для этого на дно сосуда ем-
костью 2 л насыпают 2 г двууглекислой соды. Крышку экси-
катора смещают по ранту, смазанному смесью вазелина с ла-
нолином в отношении 1 : 1 так, чтобы осталась небольшая
щель, через которую можно ввести пипетку и влить в соду
17 мл 10% серной кислоты. После этого крышку плотно при-
тирают к эксикатору. Посевы инкубируют в термостате при
37°С, ежедневно насыщая среду эксикатора новой порцией
углекислоты. На 4-й день колбу с засеянной средой вынима-
ют из термостата и содержимое ее фильтруют через мембран-
ные фильтры № 3 или 4 (см. с. 24). Полученный фильтрат
в количестве 10—15 мл смешивают с равным количеством
теплого молока и скармливают котятам 4—8-недельного воз-
раста с массой тела 350—600 г.
При наличии энтеротоксина в исследуемом фильтрате
спустя несколько минут после приема его котята начинают
проявлять беспокойство, а через 1—3 ч возникают симптомы
гастроэнтерита: многократный понос с выделением испражне-
ний слизистого характера, в редких случаях с примесью кро-
ви, рвота. Понос, являясь обязательным симптомом стафи-
лококковой интоксикации, продолжается иногда в течение
2—3 дней; в тяжелых случаях котята погибают.
Определение стафилококкового антитоксина в сыворотке
-крови. Многие заболевания стафилококковой этиологии, осо-
бенно с глубокой локализацией патологического очага (осте-
омиелиты, септикопиемические процессы), сопровождаются
постоянным поступлением больших количеств стафилококко-
вого антигена в русло крови, стимулируя тем самым форми-
рование специфических антител, одним из которых является
стафилококковый антитоксин, нейтрализующий гемолитиче-
ские свойства стафилококкового токсина. У здоровых людей,
так же как у лиц, перенесших стафилококковую инфекцию
кожных покровов или гнойное хирургическое заболевание,
титр стафилококкового антитоксина не превышает 2 АЕ.
171
Определение стафилококкового антитоксина в сыворотке
крови приобретает большое значение при диагностике септи-
копиемических процессов, когда жизнь больного находится
в опасности, а бактериологические исследования, проводи-
мые на фоне массивной антибиотикотерапии, как правило,
остаются безрезультатными.
Определение антистафилолизина в сыворотках, содержа-
щих менее 1 АЕ в 1 мл. Для титрования сывороток, содер-
жащих в 1 мл крови менее 1 АЕ, используют метод нейтрали-
зации гемолитических свойств стафилококкового токсина —
Lh (Limes haemolyticus).
Лимитом гемолитического действия Lh считается количе-
ство его, которое, будучи связано с 1 АЕ стафилококкового
антитоксина, вызывает почти полный гемолиз кроличьих эрит-
роцитов.
Для определения Lh в ряд пробирок разливают стафило-
кокковый токсин в дозах: 0,08; 0,1; 0,12; 0,15; 0,18; 0,2; 0,22;
0,24; 0,26; 0,28; 0,3; 0,32; 0,35; доводят общий объем до 1 мл
изотоническим раствором, затем в каждую пробирку добав-
ляют стандартную антистафилококковую сыворотку по 1 АЕ
в 1 мл и после тщательного перемешивания смеси вносят по
капле (0,05 мл) кроличьих эритроцитов, разведенных из рас-
чета 1 мл отмытых эритроцитов+ 2 мл изотонического рас-
твора хлорида натрия.
Для контроля в одну пробирку наливают 2 мл изотониче-
ского раствора хлорида натрия, к которым добавляют 1 кап-
лю тех же эритроцитов. Пробирки в течение часа выдержи-
вают в термостате при 37°С и затем 1 ч — при комнатной
температуре, после чего учитывают результаты реакции.
Наименьшую дозу токсина, которая в смеси с 1 АЕ сыво-
ротки дает гемолиз эритроцитов, принимают за Lh токсина.
При определении титра антистафилолизина сыворотки
больных или иммунизированных, подлежащие исследованию,
предварительно инактивируют 20 мин при температуре 56°С,
а затем разводят в 5 раз (1 мл испытуемой сыворотки + 4 мл
изотонического раствора хлорида натрия).
Одновременно готовят 4 разведения стафилококкового
токсина: Lh/5, Lh/10, Lh/20, Lh/40. Например, если по пас-
портным данным, указанным на этикетке, Lh токсина равен
0,2, то:
Lh/ 5=-0,2: 5=0,04
Lh/10=0,2:10=0,02
Lh/20= 0,2:20 = 0,01
Lh/40=0,2:40=0,005
На каждую исследуемую сыворотку берут 6 пробирок»
В 4 из них наливают по 1 мл исследуемой разведенной сы-
воротки, прибавляют к ней по 1 мл приготовленных разве-
дений токсина и после тщательного перемешивания в каж-
172
дую Пробирку вносят по 0,05 мл (одна капля) трижды отмы-
тых, (разведенных в пропорции 1 : 3 кроличьих эритроцитов.
Опытный ряд пробирок сопровождают два контроля: конт-
роль Эритроцитов (5-я пробирка), в котором находится 2 мл
изотопического раствора хлорида натрия и 0,05 мл взвеси
эритроцитов; контроль токсина (6-я пробирка), содержащий
1 мл наибольшей дозы стафилококкового токсина (Lh/5),
1 мл изотонического раствора и 0,05 мл взвеси эритроцитов.
Смесь всех ингредиентов после тщательного перемешивания
выдерживают 1 ч в термостате при 37°С и 1 ч при комнат-
ной температуре, после чего приступают ж учету результа-
тов. Чтение реакции начинают с контролей. В 6-й пробирке
с контролем токсина эритроциты должны быть полностью
лизированы, в 5-й пробирке — контроль эритроцитов — отме-
чается полная задержка гемолиза.
Количество сыворотки, в смеси с которой минимальная
доза токсина, взятая в опыт, вызывает полную задержку ге-
молиза или дает слабый гемолиз, оцениваемый + или + +,
принимают за титр разведенной сыворотки. Для определе-
ния титра неразведенной сыворотки полученную величину
умножают на степень разведения сыворотки.
Пример. Если 1 мл сыворотки, разведенной в 5 раз, нейтрализовал
1X5
Lh/40 токсина, титр ее равен ~ = 0.125 АЕ.
При отсутствии нейтрализации гемолиза во всех пробир-
ках дают заключение, что испытуемая сыворотка содержит
меньше 0,125 АЕ в 1 мл.
Методика титрования сывороток, содержащих более 1 АЕ
в 1 мл. Из исследуемой сыворотки готовят ряд разведений
по табл. 22. Применяемый для титрования сывороток стафи-
лококковый токсин берется в одном разведении — Lh/5.
К 1 мл каждого разведения исследуемой сыворотки прибав-
ляют по 1 мл разведенного Lh/5 стафилококкового токсина.
После тщательного перемешивания к полученной смеси до-
бавляют 0,05 мл отмытых и разведенных изотоническим рас-
твором хлорида натрия в пропорции 1:3 эритроцитов кроли-
ка. К опыту ставят два контроля: контроль эритроцитов (2 мл
изотонического раствора хлорида натрия и 1 капля взвеси
эритроцитов) и контроль токсина (1 мл токсина в опытном
разведении, 1 мл изотонического раствора хлорида натрия и
0,05 мл эритроцитов).
Штатив с опытными и контрольными пробирками выдер-
живают 1 ч в термостате и 1 ч при комнатной температуре,
после чего учитывают результаты реакции.
Максимальное разведение сыворотки, в смеси с которым
Lh/5 токсина дает гемолиз, содержит 'ЛАЕ. В 1 мл неразве-
денной сыворотки содержится в 5 раз больше антитоксических
единиц. Для определения их количеств в различных разведе-
173
Табл и,ц а 22
Схема разведения и учета полученных результатов при титровании
'сывороток, содержащих стафилококкового антитоксина от 1 до 18 АЕ
в 1 мл
№ про- бирки Сыворотка, МЛ Изотони- ческий раствор хлорида натрия, мл Разведе- ние Количество, АЕ
1 Неразведенная 0,6 2,4 1:5 1
2 Из 1-й пробирки 2,0 2,0 1:10 2
3 » 2-й » 1,0 0,5 1:15 3
4 » 2-й » 1,0 1,0 1:20 4 (вылить 0,5 мл)
5 » 3-й » 0,5 0,5 1:30 6
•6 » 4-й » 0,5 0,5 1:40 8
7 » 2-й » 0,2 0,8 1:50 10
« » 2-й » 0,2 1,0 1:60 12 (вылить 0,2 мл)
9 » 2-й » 0,2 1,2 1:70 14 (вылить 0,4 мл)
10 » 2-й » 0,2 1,4 1:80 16 (вылить 0,6 мл)
И » 2-й » 0,2 1,6 1:90 18 (вылить 0,8 мл)
ниях исследуемой сыворотки удобно пользоваться готовым
расчетом, приведенным в табл. 22.
стрептококки
Стрептококки (Streptococcus pyogenes) представляют со-
бой обширную группу, объединяющую' патогенные и непато-
генные разновидности.
По характеру роста на кровяном агаре стрептококки де-
лятся па три группы: ^-гемолитические стрептококки (Str.
haemolyticus) вызывают гемолиз эритроцитов, а-зеленящие
стрептококки (Str. viridans) образуют вокруг колоний зеле-
ную зону гемометаморфоза, негемолитические у-стрептококки
(Str. anhaemolyticus) не изменяют эритроцитов и не вызы-
вают гемолиза кровяного агара. Раньше гемолитическую спо-
собность стрептококков расценивали как критерий патоген-
ности микроба. В настоящее время установлено, что р-гемо-
литические стрептококки в патологическом процессе участву-
ют значительно чаще, чем пегемолитические. Однако гемо-
литические штаммы обнаруживают иногда в группе стрепто-
кокков, непатогенных для человека, а патогенные виды стреп-
тококков под действием антибиотиков и других факторов
внешней среды утрачивают гемолитическую активность.
Таким образом, гемолитические свойства, не являясь диф-
ференцирующим тестом, облегчают выявление патогенных
штаммов стрептококка.
Единственным методом дифференциации патогенных и не-
патогенных стрептококков является серологический метод
174
Ленсфилд. Ленсфилд обнаружила в клеточной стенке стреп-
тококка поверхностно расположенный группоспецифи-
ч е с к\и й полисахаридный антиген, который позво-
лил разделить в основой гемолитические и отчасти зеленя-
щие стрептококки на 17 групп, обозначенных условно заглав-
ными буквами латинского алфавита от А до S. Наиболее
изученной является' группа А, объединяющая большинство
штаммов, патогенных для человека.
Кроме группоспецифического полисахаридного антигена,
на поверхности клеточной стенки стрептококков группы А
расположены протеиновые типовые антигены Т
и М, которые могут быть выявлены с помощью реакции аг-
глютинации и преципитации.
В настоящее время культуры стрептококков, выделяемые
у больных скарлатиной, ангиной, фарингитом, другими стреп-
тококковыми инфекциями и здоровых носителей, могут быть
подразделены на 53 типа. Из них 49 входят в состав группы
А, 3 типа (7, 20 и 21) — в группу С и один тип (16) — в груп-
пу G. Определение серологических типов стрептококка очень
важно при проведении исследований, имеющих эпидемиоло-
гическое значение. Распространение и участие в’ патологии че-
ловека остальных групп стрептококка изучено недостаточно.
Стрептококки серологической группы А вызывают у че-
ловека заболевания верхних дыхательных путей: ангину, фа-
рингит, ларинготрахеит, синусит, хронический тонзиллит и др.
Острые стрептококковые инфекции осложняются и могут
привести к тяжелым хроническим заболеваниям (нефрит, эн-
докардит, ревматизм). Стрептококки всегда обнаруживаются
в зеве больного скарлатиной и в настоящее время признают-
ся этиологическим фактором этого заболевания. Они явля-
ются причиной послеродовых сепсисов, иногда осложняют те-
чение послеоперационных ран и ран военного времени, вы-
зывая их нагноение.
В патогенезе стрептококковых инфекций большое значе-
ние принадлежит эритрогенному токсину, стрепто-
лизину=0 и ферментам — гиалуронидазе, стрепто-
киназе и протеиназе, являющимися факторами агрес-
сии стрептококка.
Патологическим материалом для исследования на стреп-
тококки являются:
1. Налет и слизь с миндалин и слизистых оболочек зева
при ангине и скарлатине.
2. Гной из очагов поражения.
3. Кровь при явлениях септического характера и подозре-
нии на эндокардит.
Для выделения стрептококков применяют специальные
среды, содержащие глюкозу или нативный белок (сыворотка
крови или кровь).
175
Схема микробиологического исследования на стрептокок-
ки. В основу лабораторной диагностики стрептококковых за-
болеваний положен бактериологический метод исследова-
ния — посев патологического материала на питательные сре-
ды с последующим выделением чистой культуры стрептокок-
ка, определением ее серологической группы по Ленсфилд, а
при эпидемиологических исследованиях — типированием
штаммов, относящихся к группе А.
Первый день. Чаще всего для обнаружения стрепто-
кокков приходится производить посев крови и слизистого от-
деляемого носоглотки.
Для выделения гемокультуры стрептококка целесообраз-
но кровь, поступившую на исследование, засевать параллель-
но в 3 флакона, содержащих 50 мл полужидкого агара
(0,15—0,2%) с 10% кровяной сыворотки, бульон Левинталя
(рец. 57, с. 359) с 5% дефибринированной крови и печеноч-
ный бульон Китта'—Тароцци (рец. 113, с. 378). В каждую
среду вносят по 3—4 мл исследуемой крови. Посевы выдер-
живают в термостате в течение Р/г—2 мес, так как при ле-
чении антибиотиками и сульфаниламидами рост микробов
очень замедлен. Для обнаружения роста стрептококка каж-
дые 2—3 дня из всех 3 флаконов с соблюдением правил асеп-
тики производят контрольные высевы на 3% кровяной агар.
Материал слизистых оболочек носоглотки, находящийся
на тампонах, засевают в чашки Петри с 3% кровяным ага-
ром. Для получения изолированного роста колоний отпеча-
ток тампона, сделанный на поверхности среды, легкими дви-
жениями стеклянного шпателя растирают равномерно по всей
площади чашки. Посевы на кровяном агаре выдерживают в
термостате при 37°С не более 18—20 ч.
Второй день. 1. Просматривают первичные посевы на
чашках с кровяным агаром. Штаммы стрептококков сероло-
гической группы А, наиболее патогенные для человека, могут
образовывать колонии трех видов:
а) мукоидные — крупные, до 2—2,5 мм в диаметре, бле-
стящие, гомогенные, прозрачные в проходящем свете, вязкой
консистенции. Такой вид колоний характерен для свежевы-
деленных вирулентных штаммов стрептококка;
б) шероховатые (matt) — мелкие, диаметром 0,5—0,8 мм,
плоские, с шероховатой поверхностью, зернистой структурой,
изрезанным краем;
в) гладкие (glossy) — глянцевые, мелкие колонии серова-
то-зеленого цвета в проходящем свете; характерны для сла-
бовирулентных и невирулентных штаммов стрептококка.
Гемолитические стрептококки образуют вокруг колонии
четко выраженную прозрачную зону гемолиза, ширина кото-
рой может изменяться от десятых долей миллиметра до не-
скольких миллиметров. Зеленящие стрептококки образуют
176
вокруг колонии ореол зеленоватого цвета с несколько повы*
шейной прозрачностью агара. Негемолитические стрептокок-
ки не вызывают никаких изменений при росте их на кровя-
ном агаре.
2. Из колоний с признаками, характерными для стрепто-
кокка, бактериальной петлей берут небольшое количество ма-
териала и готовят мазок для окраски по Граму. При микро-
скопировании в препарате, приготовленном из культуры с
плотной питательной среды, стрептококки располагаются па-
рами, короткими цепочками, образуют иногда скопления, на-
поминающие грозди стафилококка. Морфологические свойст-
ва стрептококков непостоянны: наряду с мелкими, шарооб-
разными, слегка уплощенными кокками в материале обнару-
живаются иногда крупные, грубые кокки, вытянутые в дли-
ну. В одной и той же цепочке кокки могут различаться по ве-
личине и форме.
3. Колонии, окруженные зоной гемолиза, отвивают для оп-
ределения групповой принадлежности. Отобранные колонии
снимают петлей и пересевают в пробирки с комбинированным
мясным бульоном (рец. 60, с. 360), бульоном Мартена (рец.
40, с. 353) или кровяным бульоном. Полученную на одной из
указанных выше сред шестичасовую культуру стрептококка
высевают в 25 мл бульона Мартена с 0,25% глюкозы для
приготовления группового антигена по Ленсфилд.
Третий день. 1. Просматривают рост стрептококка во
флаконах с бульоном Мартена. В жидких питательных сре-
дах при характерном росте стрептококка бульон остается со-
вершенно прозрачным и только на дне и стенках пробирки
-образуется крошковидный осадок беловато-кремового цвета.
Характер роста обусловлен длиной цепочек: чем длиннее це-
почки, тем лучше выражена зернистость.
Однако многие штаммы стрептококка, выделенные у боль-
ных хроническими стрептококковыми инфекциями, длитель-
ное время леченных антибиотиками, при росте на жидких
питательных средах вызывают их равномерное помут-
нение.
2. С солянокислыми экстрактами, полученными из бульон-
ной культуры стрептококка, ставят реакцию преципитации
для определения серологической группы по Ленсфилд.
Методика определения серологической группы стрептокок-
ка по Ленсфилд. Для приготовления полисахаридного С-ан-
тигена суточную культуру стрептококка, выращенную на
бульоне Мартена, центрифугируют 15 мин при 3000 об/мин.
Надосадочную жидкость сливают в банку с дезинфицирую-
щим раствором. Полученный осадок заливают изотоническим
раствором хлорида натрия, снова центрифугируют и надоса-
дочную жидкость сливают. Микробный осадок из всех цент-
рифужных пробирок сливают в одну пробирку и прибавля-
(2 Лабинская А. С.
177
ют 0,4 мл 0,2 N раствора хлористоводородной кислоты, при-
готовленного на изотоническом растворе хлорида натрия.;
Приготовленную смесь помещают в водяную баню и ки-
пятят 15 мин. Во время прогревания пробирку, содержащую
смесь культуры с хлористоводородной кислотой, неоднократно»
встряхивают для равномерного прогревания осадка. После ки-
пячения охлаждают и вновь центрифугируют.
Полученную после центрифугирования прозрачную жид-
кость — экстракт, содержащий полисахарид С, — сливают в
чистую пробирку и нейтрализуют 0,2 N раствором едкого
натра до pH 7,0—7,4, прибавляя в качестве индикатора
0,01 мл 0,04% раствора бромтимолового синего (рец. 27, с. 349).
Во время нейтрализации экстракт из соломенно-желтого ста-
новится зеленоватым, а затем лазурно-голубым (при pH 7,0'
оливково-зеленый, при 7,4 лазурно-голубой). При добавле-
нии щелочи экстракт иногда мутнеет; в таких случаях его
центрифугируют повторно до полной прозрачности.
Техника постановки реакции преципита-
ции. В две преципитационные пробирки диаметром 2 мм на-
ливают примерно по 0,1 мл групповой сыворотки и нормаль-
ной кроличьей сыворотки (для контроля). Затем в обе про-
бирки осторожно, чтобы не произошло смешивания жидко-
стей, наслаивают по стенке примерно такое же количество»
исследуемого солянокислого экстракта. Для этого удобнее
всего пользоваться пастеровской пипеткой с длинным и тонко-
оттянутым капилляром. При положительном результате реак-
ции преципитации через 10—15 мин в опытной пробирке на
границе экстракта и сыворотки появляется тонкое, четко вы-
раженное кольцо молочно-белого цвета, отсутствующее в
контроле. Практически важно дифференцировать стрептокок-
ки группы А, патогенные для человека, от остальных сероло-
гических групп. Поэтому в реакции преципитации чаще всего-
ограничиваются использованием только одной групповой сы-
воротки А. При изучении культур, выделенных из крови боль-
ных септическим эндокардитом, имеет значение выявление
устойчивых к пенициллину культур стрептококка, принадле-.
жащих к группе D. При изучении микробного пейзажа носо-
глотки выделяемые штаммы стрептококка проверяют парал-
лельно с антистрептококковыми групповыми сыворотками
А, С, G, Н, соответствующими наиболее распространенным
группам стрептококка, обитающим на слизистых оболочках
верхних дыхательных путей.
Определение серологических типов стрептококка методом
Гриффитса. Определение серологических типов стрептококка
имеет значение только при решении вопросов эпидемиологи-
ческого значения.
Культуры гемолитического стрептококка группы А, кото-
рые предполагается типировать, засевают для получения го-
178
могенной микробной взвеси в пробирки с 5 мл бессолевого
комбинированного мясного бульона (рец. 60) и выращивают
в течение 48 ч при температуре 22—27°С. Через 2 сут выра-
щенную бульонную культуру сливают в центрифужные про-
бирки, центрифугируют, полученный осадок разводят 0,5—
1 мл изотонического раствора хлорида натрия и используют
для постановки реакции агглютинации.
В целях экономии дефицитных типоспецифических сыво-
роток каждый исследуемый штамм стрептококка типируют
сначала с несколькими смесями, состоящими из различных
типовых сывороток, разведенных изотоническим раствором
хлорида натрия в отношении 1 : 10.
Пример. Смесь А состоит из сывороток типа 1, 2, 3, 5, 12, 27; смесь
Б содержит типы 6, 8, 9, 10, 15; смесь В — типы 11, 13, 14; смесь Г — типы
17, 18, 22, 23; смесь Д — типы 4, 24, 26, 28, 29 и 30 сывороток. Состав сме-
сей подбирается произвольно, однако в первую очередь берут сыворотки
тех типов, которые встречаются на территории проводимого исследования.
Техника постановки реакции проста. На одно или два
предметных стекла наносят по капле разных смесей типовых
сывороток, разведенных 1 : 10. Затем в каждую каплю сыво-
ротки бактериальной петлей вносят небольшое количество
микробной массы исследуемого штамма стрептококка. Смесь
тщательно перемешивают. Учет результатов реакции произ-
водят общепринятым способом (см. с. 120) спустя 3—5 мин.
При наступлении агглютинации стрептококка с одной из при-
мененных сывороточных смесей исследуемую культуру типи-
руют со всеми входящими в ее состав сыворотками, разве-
денными 1 : 5—1 : 10.
Приготовление групповых стрептококковых сыво-
роток. Групповые и типовые антистрептококковые сыворотки медицин-
ская промышленность Советского Союза не производит. Их получают в от-
дельных лабораториях, занимающихся изучением стрептококковых инфек-
ций.
Для иммунизации кроликов применяют вакцины, приготовленные сле-
дующим образом; суточные культуры эталонных штаммов стрептококка,
принадлежащие к определенным серологическим группам, отмывают трое-
кратно изотоническим раствором хлорида натрия от примеси питательной
среды. Из осадка культуры, полученного после центрифугирования при
отмывании, готовят 2 млрд, взвесь в изотоническом растворе хлорида на-
трия и прогревают ее в водяной бане при температуре 56 °C в те-
чение 1 */2 ч. Кроликов с массой тела 2,5—3 кг вакцинируют внутривен-
но по 4 дня подряд с трехдневными перерывами в течение месяца, что
составляет полный цикл иммунизации. Дозу вводимой вакцины изменяют
в зависимости от срока вакцинации. В течение 1-й недели вводят 0,25 мл
(500 млн. микробных тел), 2—3-й недели — по 0,5 мл (1 млрд, микробных
тел), в течение 4—5-й недели — по 1 мл (2 млрд, микробных тел).
Сыворотки достаточно высокого титра получают обычно после двух
циклов вакцинации с полуторамесячным перерывом между ними.
Техника приготовления типовых стрептококковых
сывороток. Для приготовления типовых стрептококковых сывороток
пользуются эталонными типовыми штаммами стрептококка серологической
группы А. В течение 2 нед кроликов иммунизируют внутривенно вакциной,
12*
179
убитой нагреванием, так же как при изготовлении групповых стрептококко-
вых сывороток. Затем в течение 2 нед (по 4 дня в неделю) вводят внутри-
венно живую культуру стрептококка в дозе 500 млн. микробных тел в Тече-
ние 1-й недели и 1 млрд, микробных тел в течение 2-й недели. 1
Для изготовления типовых стрептококковых сывороток проводят не ме-
нее 4 циклов вакцинации с интервалом между ними Р/а—2 мес.
Полученные типовые стрептококковые сыворотки адсорбируют культу-
рой стрептококка группы А I типа, автоклавированной в течение Р/j чпр»
температуре 130 °C. При автоклавировании в клетках стрептококка сохра-
няется групповой полисахаридный антиген и разрушаются типовые анти-
гены М и Т.
К 1 мл адсорбируемой сыворотки добавляют 360 млрд, микробных тел,
помещают в термостат на 2 ч при 37°С и затем на 18—20 ч в холодильник.
После этого смесь центрифугируют для удаления из сыворотки микробных
тел. Полностью адсорбированные типовые сыворотки не содержат антител
к групповому полисахариду С и потрму не должны давать реакцию агглю-
тинации с автоклавированной культурой стрептококка и реакцию преципи-
тации с солянокислым экстрактом из культур стрептококка группы А гете-
рологических типов.
Адсорбированная таким образом сыворотка содержит антитела Т и по-
этому реагирует в реакции агглютинации с живыми культурами стрепто-
кокка гомологичного типа.
Серологическая диагностика острых и хронических стреп-
тококковых инфекций. При некоторых острых, но главным
образом при хронических стрептококковых заболеваниях
(хронический тонзиллит, ревматизм, нефрит) больные, как
правило, длительное время получают большие дозы антимик-
робных препаратов: сульфаниламидов, антибиотиков. Выде-
ление же возбудителя из слизистого отделяемого носоглотки,
мокроты, гноя ран, абсцессов и крови представляет большие
трудности. Поэтому проведение трудоемких бактериологиче-
ских исследований на стрептококки в таких случаях оказы-
вается безрезультатным. В то же время проведение полного
серологического анализа с обнаружением в крови стрепто-
коккового антигена и определение титра стрептококковых ан-
тител может оказать большую помощь в установлении этио-
логического фактора болезни.
Серологическое обследование больных в целях выявления
стрептококковой инфекции предусматривает определение в
крови стрептококкового антигена и титра стрептококковых
антител к токсинам: стрептолизину-0 (СЛО) и стрептогиа-
луронидазе (СГ), которым придают большое значение в па-
тогенезе стрептококковых инфекций.
Обязательным условием серологической диагностики яв-
ляется повторность проведения исследований для наблюде-
ния за динамикой изучаемых показателей.
Определение стрептококкового антигена в сыворотке кро-
ви. Появление стрептококкового антигена в крови является
следствием декомпенсации инфекционного очага и, следова-
тельно, одним из убедительных доказательств активно теку-
щего инфекционного процесса. Для обнаружения антигенов
стрептококка применяют РСК на холоду.
180
Для постановки реакции необходимы следующие ингре-
диенты:
1. Сыворотка больного, подлежащая исследованию.
2. Антистрептококковая иммунная сыворотка.
3. Сыворотка кроличья нормальная (для контроля). Сыво-
ротки, подлежащие исследованию, и кроличьи (иммунная и
нормальная) перед постановкой опыта прогревают 30 мин
при 56°С для инактивации собственного комплемента.
4. Комплемент.
5. Гемолитическая сыворотка.
6. Эритроциты барана (3% взвесь).
7. Изотонический раствор хлорида натрия pH 7,0—7,2.
В предварительном опыте в РСК оттитровывают рабочую
дозу иммунной сыворотки с солянокислым антигеном, приго-
товленным из штамма стрептококка типа I, которым вакци-
нировали животных. Иммунную сыворотку разводят по схе-
ме, приведенной в табл. 23.
Таблица 23
Схема разведения иммунной сыворотки
№ пробирки Объем иммунной сыворотки, мл Изотонический раствор хлорида натрия, мл Полученные разведения
1 0,1 2,9 1:30
2 0,1 3,9 1:40
3 1 (1) 1 1:60
4 2 (2) 2 1:80
5 0,1 9,9 1:100
6 1 (4) 1 1:160
7 1 (5) 1 1:300
Примечание. Цифры в скобках означают номера про-
бирок, из которых берется указанный в таблице объем разве-
денной сыворотки для получения каждого последующего раз-
ведения.
Из солянокислого антигена готовят ряд последовательных
разведений (табл. 24).
Титрование рабочей дозы иммунной сыворотки осущест-
вляется следующим способом. В 14 параллельных рядов про-
бирок разливают по 0,1 мл солянокислого антигена в после-
довательных разведениях (от 1 :40 до 1 :2560). Затем в про-
бирки каждого нечетного ряда добавляют по 0,1 мл иммун-
ной сыворотки. В пробирки 1-го ряда добавляют иммунную
сыворотку в разведении 1 : 30, в пробирки 3-го ряда прибав-
ляют тот же объем иммунной сыворотки, разведенной 1 : 60,.
и т. д. В четные (контрольные) ряды пробирок с последова-
тельными разведениями солянокислого антигена вносят по
0,1 мл нормальной кроличьей сыворотки в разведениях, со-
181
Таблица 24
Схема разведения антигена
№ пробирки Солянокислый антиген, мл Изотонический раствор хлорида натрия, мл Полученные разведения
I 0,2 7,8 1:40
2 3 (1) 3 1:80
3 3 (2) 3 • 1 : 160
4 3 (3) 3 1 : 320
5 3 (4) 3 1 : 640
6 3 (5) 3 1 : 1280
7 3 (6) 3 1:2580
Примечание. Цифры в скобках означают номера про-
бирок, из которых берется указанный в таблице объем разве-
денного антигена для получения каждого последующего разве-
дения.
ответствующих разведениям иммунной сыворотки. Далее в
пробирки всех рядов доливают по 0,1 мл изотонического рас-
твора хлорида натрия и по 0,1 мл комплемента в рабочей
дозе.
Штатив с пробирками встряхивают для лучшего переме-
шивания всех ингредиентов и помещают в холодильник при
температуре 3—4°С на 18—20 ч. По истечении указанного
срока во все пробирки опытных и контрольных рядов добав-
ляют по 0,2 мл гемолитической системы и через 10—45 мин
выдерживания в термостате при 37°С после прохождения ре-
акции в контроле производят учет результатов общеприня-
тым способом (см. с. 143). За рабочую дозу иммунной сыво-
ротки принимают то наименьшее разведение, при котором
она, не проявляя антикомплементарного действия, реагирует
с наибольшим разведением солянокислого антигена. Чаще
всего рабочая доза соответствует разведению сыворотки
1 : 60—1 : 100. Однако при постановке опыта иммунную сы-
воротку используют в разведении, предшествующем рабочей
дозе. Так, в приведенном нами примере рабочая доза иммун-
ной сыворотки — 1/80, следовательно, опытная доза ее— 1/160.
Постановка основного опыта, предусматривающего опре-
деление стрептококкового антигена в сыворотке крови, осу-
ществляется по схеме, приведенной в табл. 25. Учет реакции
производят общепринятым способом по четырехкрестной си-
стеме (см. с. 143) в момент появления гемолиза в контроль-
ных пробирках.
За титр антигена принимается наибольшее разведение ис-
следуемой сыворотки, вызывающее задержку гемолиза не ме-
нее чем на ++.
Определение титра аитистрептолизина-0 по способу Рен-
ца и Рендела, модифицированному Институтом эпидемиоло-
182
Таблица 25
Схема постановки основного опыта
Ингредиент реакции, мл Опытный ряд пробирок Контроль на специфичность реакции Контроль исследуемой сыворотки на антиком п лементарность Контроль иммунной сыворотки на антн- компле- ментар- ность Контроль нормальной сыворотки на анти- компле- ментар- ность
разведение исследуемой сыворотки
1 : 20 1 : 40 1:80 1 : 160 1:20 1 : 40 1 : 80 1 : 160 1 :20 1 : 40 1 : 80 1 : 160
Исследуемая сыворотка о,1 0,1 о,1 0,1 0,1 о,1 о,1 о,1 0,1 о,1 0,1 о,1 __
Иммунная сыворотка со- ответственно ее титру 0,1 0,1 0,1 0,1 *— — — — — — — — о,1 —
Нормальная сыворотка кролика, разведенная соответственно титру иммунной сыворотки 0,1 0,1 0,1 0,1 0,1
Изотонический раствор хлорида натрия — — — — — — — — 0,1 0,1 0,1 0,1 0,1 0,1
Комплемент (рабочая до- за) 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1 0,1
Выдерживание в холодильнике при 3—4 °C в течение 18—20 ч
Гемолитическая система 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2.’ 0,2 0,2
Выдерживание в термостате при 37 °C в течение 20—30 мин
183
гии и микробиологии АМН СССР имени Н. Ф. Гамалеи. Спо-
собность стрептолизина-0 вызывать гемолиз эритроцитов in
vitro утрачивается частично или полностью при добавлении
к нему антистрептолизина-О, содержащегося в крови боль-
ных и выздоравливающих от стрептококковой инфекции.
Этот феномен положен в основу методики определения ан-
тистрептолизина-0 в сыворотке крови, которую предложили
Ренц и Рендель.
Для постановки реакции необходимы следующие ингреди-
енты: 1. Сыворотка крови, подлежащая исследованию, про-
гретая при температуре 56°С 30 мин (хилезные, гемолизиро-
ванные и проросшие сыворотки для титрования антистрепто-
лизина-0 непригодны).
2. Препарат стрептолизина-О, полученный из фильтрата
продуцирующей его культуры 1 стрептококка.
3. Фосфатный буфер pH 6,5—6,7. Пропись: NaCl 7,4 г,
КН2РО4 3,17 г, Na2HPO4 1,81 г. Доливают до 1 л дистилли-
рованной водой. Добавляют 0,1 N раствора NaOH до полу-
чения указанного значения pH. Готовый буфер должен хра-
ниться в холодильнике при температуре 4—10°С.
4. Взвесь эритроцитов кролика (5%) готовят общеприня-
тым способом (см. с. 103) на фосфатном буфере в день по-
становки опыта.
При определении титра антистрептолизина-О, кроме эрит-
роцитов кролика, можно пользоваться эритроцитами барана
и человека, так как результат реакции не зависит от видо-
вой принадлежности эритроцитов.
Постановку реакции титрования антистрептолизина-О на-
чинают с приготовления рабочих разведений исследуемых сы-
вороток и растворения высушенного препарата стрептолизи-
на-О.
Сыворотки, подлежащие исследованию на антистрептоли-
зин-0, разводят фосфатным буфером соответственно приве-
денному ниже расчету:
А. 1:50—0,1 мл сыворотки+4,9 мл буфера.
Б. 1 : 250—0,5 мл (разведения А) +2 мл буфера.
Стрептолизин-О растворяют фосфатным буфером непо-
средственно перед добавлением его в пробирки, как указано
на этикетке ампулы. Разведенный таким образом препарат
стрептолизина-0 содержит д объеме 0,3 мл одну рабочую
дозу, т. е. то количество стрептолизина-О, которое почти
полностью (+ + ) нейтрализует половину AEStO (StO — меж-
дународная единица стандарта стрептолизина-О).
1 Коммерческий препарат лиофилизированного расфасованного в ампу-
лы стрептолизииа-О изготовляет предприятие по производству бактериаль-
ных препаратов Ленинградского научно-исследовательского института вак-
цин и сывороток.
184
Разведенные сыворотки и другие ингредиенты реакции
разливают в ряд пробирок в последовательности, указанной
в схеме опыта (табл. 26).
Результаты реакции учитывают после наступления пол-
ного гемолиза эритроцитов в 13-й пробирке с контролем
стрептолизина-О. Для обозначения полученных результатов
пользуются знаками + и —:
+ + + положительная реакция, отсутствие гемолиза, в осадке иерастворен-
иые эритроциты
+ + положительная реакция, слабый гемолиз
+ , ± сомнительная реакция, в пробирке почти полный гемолиз.
— отрицательная реакция, в пробирке полный гемолиз.
Титр исследуемой сыворотки выражают числом AEStO в
1 мл. В табл. 26 приведено число AEStO в 1 мл при нейтра-
лизации стрептолизина-0 разными разведениями исследуемой
сыворотки.
Определение антистрептогиалуронидазы методом Мак
Клина, модифицированным И. М. Лямперт и Э. А. Гальпе-
риным. Определение антистрептогиалуронидазы основано на
способности сывороток, содержащих антитела, нейтрализо-
вать активность стрептогиалуронидазы, предотвращая тем
самым деполимеризацию молекул гиалуроновой кислоты и
снижение ее вязкости.
При добавлении сыворотки, содержащей антистрептогиа-
луронидазу, гиалуроновая кислота, находящаяся в смеси с
гиалуронидазой, сохраняет присущую ей способность обра-
зовывать нерастворимый комплекс с белками, который при
подкислении среды выпадает в виде компактного осадка.
В контрольной пробирке, содержащей гиалуронидазу и
гиалуроновую кислоту без сыворотки, сгусток муцина не об-
разуется.
Для определения титра антистрептогиалуронидазы необ-
ходимы следующие ингредиенты:
1. Сыворотка, подлежащая исследованию на титр анти-
стрептогиалуронидазы, прогретая при температуре 56°С
30 мин (хилезные, гемолизированные и проросшие сыворот-
ки для титрования непригодны).
2. Препарат стрептококковой гиалуронидазы *, полученный
из гиалуронидазоактивной культуры стрептококка группы А.
3. Гиалуроновая кислота.
4. Уксусная кислота 15% (15 мл х. ч. ледяной уксусной
кислоты + 85 мл дистиллированной воды).
5. Изотонический раствор хлорида натрия.
1 Коммерческие препараты стрептококковой гиалуронидазы, высушен-
ные лиофильным способом и расфасованные в ампулы, выпускает производ-
ственный отдел Института эпидемиологии и микробиологии АМН СССР
имени Н. Ф. Гамалеи.
185
Таблица 26
Схема титрования аитистрептолизина-0 в сыворотках
Разведение сыворотки 1 :50 1 :250 1 : 1000 Контроль
эритро- цитов 1 « стрепто- 1 лизина
№ аробиркн 1 2 3 4 5 6 8 9 10 » 12 13
Доза сыворотки, мл 0,4 0,2 0,15 0,1 0,4 0,3 0,25 0,2 0,1 0,25 0,15 -
Фосфатный буфер pH 6,5—6,7 0,1 0,3 0,35 0,4 0,1 0,2 0,25 0,3 0,4 0,25 0,35 0,8 0,5
Стрептолизин-0 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 —— 0,3
Выдерживание в термостате при 37 °C 15 мин
5% взвесь эритроцитов, мл 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2
Выдерживание в термостате при 37 °C 1 час
Число AEStO в 1 мл, ИЕ 63 125 165 250 313 413 500 625 1250 2000 3000
Примечание. Титр антистрептолизина-О до 250 АЕ в 1 мл, обнаруживаемый у практически здоровых лиц, считается в пределах
нормы.
А. Приготовление гиалуроновой кислоты.
В день перед постановкой опыта из пупочных канатиков но-
ворожденных готовят гиалуроновую кислоту. Для этого мел-
ко нарезанные кусочки свежей пуповины освобождают, поль-
зуясь пинцетом, от сосудов, отмывают дистиллированной во-
дой от остатков крови и измельчают ножницами до получе-
ния кашицеобразной массы. Подготовленную таким образом
массу заливают двойным объемом дистиллированной воды и
помещают на 3 ч или более в холодильник при 3°С.
После настаивания в холодильнике смесь нагревают, до-
водя ее до кипения (но не кипятят!), фильтруют через 2—
3 слоя стерильной марли и определяют рабочую дозу гиалу-
роновой кислоты по относительной вязкости (а) или по спо-
собности ее образовывать муциновый сгусток в кислой среде
'(б). Определение рабочей дозы гиалуроновой кислоты необ-
ходимо проводить перед каждым опытом титрования анти-
стрептогиалуронидазы.
а) При титровании антистрептогиалуронидазы в сыворот-
ке крови рекомендуется использовать раствор гиалуроновой
кислоты с относительной вязкостью, равной 3. С этой целью
сопоставляют время истечения дистиллированной воды и рас-
твора гиалуроновой кислоты при температуре 36—37°С в вис-
козиметре Освальда. Расчет относительной вязкости раство-
ра гиалуроновой кислоты производят следующим образом.
Например, время истечения гиалуроновой кислоты 27 с, а
время истечения воды 9 с; следовательно, относительная
вязкость раствора гиалуроновой кислоты равна 3 (27:9).
В том случае, если эта величина больше 3, раствор разводят
дистиллированной водой до получения нужной вязкости и в
качестве рабочей дозы берут 0,3 мл.
б) Рабочую дозу гиалуроновой кислоты по образованию
муцинового сгустка определяют по табл. 27.
После добавления в пробирки всех ингредиентов штатив
с пробирками несколько раз встряхивают и приступают к уче-
ту результатов. За рабочую дозу гиалуроновой кислоты при-
нимают минимальное количество ее, которое при добавлении
раствора уксусной кислоты образует плотный сгусток муци-
на величиной с горошину при полном просветлении среды.
Чаще всего рабочая доза гиалуроновой кислоты составляет
0,2—0,3 мл.
Б. Разведение исследуемых сывороток. Сы-
воротки, подлежащие исследованию, разводят изотоническим
раствором хлорида натрия соответственно приведенному ни-
же расчету:
1) 1:50—0,1 мл сыворотки + 4,9 мл изотонического рас-
твора хлорида натрия
2) '1 : 250—0,5 мл разведения 1 + 2 мл изотонического рас-
твора хлорида натрия
187
Таблица 27
Определение рабочей дозы гиалуроновой кислоты
Ингредиент № пробирки
1 2 3 4 5 6 7
Изотонический раствор хлорида натрия, мл 0,85 0,8 0,75 0,7 0,65 0,55 0,5
Гиалуроновая кислота, мл 0,15 0,2 0,25 0,3 0,35 0,45 0,5
Уксусная кислота 15%, мл 0,1 0,1 0,1 0,1 0,1 0,1 0,1
3) 1 : 1000—0,5 мл (разведения 2) +1,5 мл изотоническо-
го раствора хлорида натрия.
В. Разведение гиалуронидазы. Содержимое ам-
пулы с коммерческим препаратом стрептококковой гиалуро-
нидазы растворяют изотоническим раствором хлорида натрия,
как указано на этикетке. Разведенная гиалуронидаза долж-
на содержать в 0,2 мл одну опытную дозу, т. е. то количест-
во гиалуронидазы, которое нейтрализуется одной единицей
рабочего стандарта антистрептогиалуронидазы.
При определении титра антистрептогиалуронидазы разве-
денные сыворотки и другие ингредиенты реакции разливают
по пробиркам, как указано в табл. 28.
После прибавления раствора уксусной кислоты в пробир-
ки опытного и контрольного рядов приступают к учету ре-
зультатов. В контроле гиалуроновой кислоты (пробирка
№ 13) должен находиться плотный сгусток муцина, величи-
ной с горошину, при полном просветлении среды. В контроле
гиалуронидазы (пробирка № 12) молекулы гиалуроновой кис-
лоты под действием гиалуронидазы деполимеризуются и сгу-
стка не образуется.
Результаты титрования обозначают знаками + и —:
+ положительная реакция, сгусток и просветление среды
— отрицательная реакция, мутная среда без сгустка
± сомнительная реакция, в содержимом пробирки хлопья и нити
Титр сыворотки выражают числом единиц антигиалурони-
дазы в 1 мл сыворотки. За 1 АЕ HyS принимают то мини-
мальное количество сыворотки, которое нейтрализует одну
опытную дозу гиалуронидазы. В табл. 28 приведено число
единиц HyS в 1 мл при нейтрализации стрептококковой гиа-
луронидазы различными разведениями сыворотки.
ПНЕВМОКОККИ
Пневмококки (Streptococcus pneumoniae) являются специ-
фическими возбудителями крупозной пневмонии и могут вы-
зывать различные заболевания верхних дыхательных путей:
188
Таблица 28
Схема титрования антистрептогиалуронидазы в сыворотках
Разведение сыворотки I : 60 t: 250 1 :1000 Контроль гиалуро- нидазы Контроль гиалуро- новой кислоты
№ пробирки 1 2 3 4 5 6 7 8 9 10 11 12 13
Количество сыворотки, мл 0,4 0,2 0,15 0,1 0,4 0,3 0,25 0,2 0,1 0,25 0,15 — —
Изотонический раствор хлорида на- трия До общего объема 1 мл 1
Одна опытная доза гиалуронидазы В объеме 0,2 мл на каждую пробирку
Гиалуроновая кислота Выдерживание в термостате при 37 °C 30 мии
По одной рабочей дозе в каждую пробирку
Выдерживание в термостате при 37 °C 10 мин
Выдерживание в холодильнике при 3°С 10 мин
Уксусная кислота По 3 капли в каждую пробирку
Число АЕ HyS в 1 мл *125 25№ 330 550 625 825 1000 1250 2500 4000 6000 |
1 ОбщаВ объем всех ингредиентов, участвующих в реакции, должен быть равен 1 мл. Он складывается из количества разведенной сы-
воротки больного, гиалуронидазы, рабочей дозы гиалуроновой кислоты и изотонического раствора хлорида натрия.
eg ’ Титр антистрептогиалуронидазы до 300 АЕ HyS, обнаруживаемый у практически здоровых лиц. считается в пределах нормы.
ангину, бронхопневмонии, бронхит, абсцесс легкого. Тяжелое
течение пневмонии осложняется иногда сепсисом и менинги-
том.
Для бактериологического исследования на пневмококки
могут быть использованы:
1) мокрота при крупозной пневмонии и бронхопневмонии;
2) слизистое отделяемое зева и носоглотки при ангине и
катаре верхних дыхательных путей;
3) кровь при подозрении на сепсис;
4) спинномозговая жидкость при менингите;
5) гной при абсцессах.
Патологический материал тотчас после его получения на-
правляют в лабораторию на исследование. Если по каким-
либо причинам транспортировка задерживается, материал
должен находиться в леднике, однако не свыше 2 ч, так как
при более продолжительном хранении пневмококки погиба-
ют.
В лаборатории материал подвергают бактериоскопическо-
му исследованию (кроме крови). Выявление в материале кап-
сульных диплококков характерной формы дает основание
предположить наличие пневмококка.
Идентификация выделенной культуры с пневмококком ос-
новывается на изучении морфологии микроба, капсулообра-
зования в организме зараженного животного и больного че-
ловека, растворимости микробов в желчи, реакции агглюти-
нации со специфическими противопневмококковыми сыворот-
ками.
По антигенной структуре пневмококки разделяются более
чем на 70 типов, обозначаемых римскими цифрами I, II, III,
и группу X, объединяющую все остальные типы. В патологии
человека основная роль принадлежит пневмококкам I, II,
III типов. Типирование пневмококков производят с помощью
типовых антипневмококковых сывороток.
Схема микробиологического исследования мокроты на
пневмококки. Первый день. 1. Из мокроты, поступившей
на исследование, готовят в соответствии с существующими
правилами (см. с. 27) два тонких мазка для микроскопиче-
ского исследования. Один Мазок окрашивают по Граму, дру-
гой — для обнаружения капсул — по методу Бурри (см.
с. 34).
При микроскопировании мокроты в мазках, окрашенных
по Граму, пневмококк обнаруживается в виде грамположи-
тельных парно расположенных кокков. Та сторона, которой
они соприкасаются друг с другом, уплощена, противополож-
ная сторона вытянута и несколько заострена. Форму клеток
пневмококка иногда сравнивают с формой ланцета, называя
его ланцетовидным диплококком (Diplococcus lanceolatus).
В мазке, обработанном специально для выявления капсул, в
190
окружности клеток пневмококка обнаруживается хорошо вы-
раженная капсула, которая образуется только в организме
животного или человека.
2. Для выделения культуры пневмококка из мокроты ре-
комендуется биологический способ. При обычном посеве на
питательные среды рост пневмококков угнетается размноже-
нием посторонних микробов, которыми изобилует мокрота.
В организме мышей, несмотря на сопутствующую микрофло-
ру, пневмококки размножаются очень быстро, вызывая сеп-
сис, приводящий к гибели животных. Мокротой, поступившей
на исследование, заражают внутрибрюшинно двух белых мы-
шей по методике, описанной выше (см. с. 96).
Признаки заболевания появляются обычно через 4—6 ч
после заражения. В конце того же дня животных с явными
признаками заболевания вскрывают под эфирным наркозом.
Кровь, полученную из сердца, и кусочки внутренних орга-
нов (печени, селезенки) засевают в сывороточный бульон и
на кровяной агар, которые помещают в термостат при 37°С
на 18—20 ч.
Второй день. 1. Просматривают пробирки с сыворо-
точным бульоном и чашки с кровяным агаром, засеянные ма-
териалом, взятым у животного, зараженного исследуемой
мокротой.
а) На кровяном агаре пневмококки образуют мелкие (ди-
аметром 0,5—1,2 мм) колонии, прозрачные в проходящем све-
те. В падающем свете колонии пневмококков имеют зелено-
вато-серый цвет, темный в центре и более светлый по пери-
ферии. Вокруг колоний очень часто отмечается зеленоватый
отсвечивающий ореол, возникающий вследствие превращения
гемоглобина в метгемоглобин. По внешнему виду колонии
пневмококка трудно отличить от колоний зеленящего стреп-
тококка.
б) В пробирках с сывороточным бульоном пневмококки
вызывают равномерное помутнение среды с пылевидным
осадком на дне, поднимающимся в виде легкого облачка при
взбалтывании среды.
2. Из бульонной культуры выделенного микроба и из ко-
лоний с признаками, характерными для пневмококка, дела-
ют мазки, окрашивают их по Граму и микроскопируют. При
наличии пневмококка в мазках обнаруживаются грамполо-
жительные кокки, расположенные парами или в виде цепо-
чек наподобие стрептококка. Расположение в виде цепочек
особенно характерно для сывороточно-бульонной культуры.
На основании морфологических свойств и культуральных
признаков трудно дифференцировать пневмококки от зеле-
нящих стрептококков. Поэтому для определения принадлеж-
ности выделенной культуры к пневмококкам и отличия ее от
191
зеленящих стрептококков определяют способность разлагать
инулин и ставят реакцию на растворение в желчи.
3. Для проверки на желчеустойчивость 2—3 мл исследуе-
мой культуры, выращенной на сывороточном бульоне, засе-
вают в 5 мл 10% желчного бульона, после чего он становит-
ся мутным. Пробирку с посевом ставят в термостат на сутки.
Если после суточного содержания в термостате происходит
полное просветление среды, наступающее вследствие лизиса
микробных тел, исследуемую культуру следует отнести к
пневмококкам, так как зеленящие стрептококки, устойчивые
к бычьей желчи и желчнокислым солям, в указанной среде
не лизируются.
МЕНИНГОКОККИ
Менингококк (Neisseria meningitidis) является возбуди-
телем у человека менингококковой инфекции — не только це-
реброспинального эпидемического менингита, но и других
клинических форм болезни: менингококцемии (сепсис без по-
ражения мозговых оболочек), менингококкового эндокардита,
менингококкового назофарингита. Менингококки могут быть
также обнаружены на слизистых оболочках носоглотки прак-
тически здоровых людей. Бессимптомное менингококковое но-
сительство встречается обычно среди людей, имевших кон-
такт с больными менингитом или перенесших незадолго до
обследования менингококковую инфекцию.
Патологический материал для исследования на менинго-
кокки. Объектом лабораторного исследования на менингокок-
ковую инфекцию могут служить спинномозговая жидкость
(ликвор), носоглоточная слизь, кровь, трупный материал.
1. Взятие спинномозговой жидкости (ликвора) проводят
с соблюдением правил асептики в день поступления больно-
го в стационар. Первую порцию жидкости, около 1 мл, берут
в отдельную пробирку для общего ликворологического иссле-
дования. Вторую порцию, предназначенную для бактериоло-
гического исследования, наливают в стерильную пробирку.
Полученный материал (если невозможно немедленно доста-
вить его в лабораторию) может сохраняться в течение не-
скольких часов в термостате при 37°С.
2. Анализ носоглоточной слизи на менингококк проводит-
ся при обследовании больных с подозрением на менингокок-
ковый назофарингит и при выявлении носителей менингокок-
ка. Исследуют отделяемое задней стенки носоглотки и слизь,
полученную тампоном на уровне хоан (см. с. 161).
3. Трупный материал (кровь, гной с мозговых оболочек,
из кожных поражений и т. д.) в связи со слабой жизнеспо-
собностью менингококка имеет смысл брать на исследование
только в первые часы после смерти, пока не произошло осты-
вание трупа.
192
Материал, подлежащий исследованию на менингококки,
тотчас после взятия направляют в лабораторию. При пере-
сылке в холодное время года материал необходимо оберегать
от охлаждения, утепляя его ватой и резиновыми грелками с
водой, подогретой до температуры 40 °C.
Схема исследования спинномозговой жидкости. Первый
день. 1. Спинномозговую жидкость центрифугируют и затем
2—3 капли осадка жидкости засевают на поверхность сыво-
роточного агара (рец. 59) в чашке Петри. Поскольку менин-
гококки растут только в условиях повышенной влажности,
отличаясь при этом большой чувствительностью к малейшим
отклонениям температуры от оптимума (37°C), посевы пер-
вичного материала и пассирование микробных культур произ-
водятся только иа свежеприготовленные питатель-
ные среды, предварительно прогретые в термостате.
2. Из этого же осадка делают мазок, окрашивают его вод-
ным раствором метиленового синего (рец. 9) или водным рас-
твором основного фуксина (рец. 7) и микроскопируют.
В мазке спинномозговой жидкости характерно наличие дип-
лококков, расположенных внутри и вне лейкоцитов, напоми-
нающих своей формой кофейные зерна, обращенные плоски-
ми сторонами друг к другу. Вокруг клеток нередко выявля-
ется нежная капсула, исчезающая при пассировании возбу-
дителя на искусственных питательных средах (рис. 21).
Обнаружение в мазках морфологически типичных менин-
гококков является основанием для выдачи лечащему врачу
предварительного ответа в следующей формулировке:
«В спинномозговой жидкости при прямой бактериоскопии
предварительно идентифицирован менингококк».
Оставшийся от посева и микроскопирования осадок спин-
номозговой жидкости для «обогащения» менингококками за-
ливают 5 мл полужидкого (0,1%) агара и оставляют На сут-
ки в термостате при 37 °C.
Второй день. 1. Просматривают сделанные накануне
посевы спинномозговой жидкости. На сывороточном агаре
менингококк образует бесцветные мелкие (от 0,5 до 1,5 мм в
диаметре) колонии с ровными краями, слегка уплощенные.
Под микроскопом при боковом освещении они слабо опалес-
цируют, в проходящем свете имеют матовый центр и прозрач-
ную периферию. Консистенция колоний вязкая.
Так как гнойные менингиты могут иметь различную этио-
логию, то на сывороточном агаре, кроме менингококков, мо-
гут размножаться культуры других микроорганизмов (стафи-
лококки, стрептококки и пневмбкокки). Культуры, не соот-
ветствующие по морфологическим и культуральным призна-
кам роду нейссерий, отсеваются и изучаются.
3. Из выросших на поверхности сывороточного агара ко-
лоний делают мазки, окрашивают их методом Грама в мо-
13 Лабинская А. С.
193
.Дификации Калины. Техника окраски сводится к следую-
щему.
В каплю исследуемой микробной взвеси вносят петлю
0,5% спиртового раствора бриллиантового зеленого, после
чего общепринятым способом (см. с. 27) готовят мазок, под-
сушивают его на воздухе и фиксируют однократным прове-
дением над пламенем горелки. Фиксированный мазок окра-
шивают Р/2—2 мин основным красителем Калины (рец. 19).
Затем промывают водой, обесцвечивают спиртом до отхож-
дения облачков краски, промывают водой повторно и докра-
шивают в течение 2 мин водным раствором фуксина. При
микроскопии препарата грамотрицательные бактерии имеют
ярко-розовый, грамположительные — зелено-черный или тем-
но-фиолетовый цвет.
Обнаружение в мазке беспорядочно расположенных поли-
морфных кокков, неравномерно окрашенных по Граму, дает
основание отнести выделенные микроорганизмы к роду нейс-
«серий.
На основании результатов проведенного исследования на
2-е сутки возможна выдача предварительного ответа, конста-
тирующего, что при прямом посеве спинномозговой жидко-
сти на сывороточном агаре получен рост нейссерий.
3. Колонии с культуральными и морфологическими при-
знаками, типичными для менингококка, отвивают в две про-
бирки со скошенным сывороточным агаром и в одну пробир-
ку со скошенным мясо-пептонным агаром (рец. 38).
При пересеве исследуемого материала засевают пробирку
с сывороточным агаром, а остаток его, содержащийся на пет-
ле, наносят частым штрихом на поверхность мясо-пептонно-
го агара. После этого петлю прожигают и новую порцию ис-
следуемого материала засевают на вторую пробирку с сыво-
роточным агаром. Посевы на сывороточном агаре выращи-
вают параллельно при температуре 37° и 22 °C, на мясо-пеп-
тонном агаре — при 37 °C. Одновременное культивирование
выделенного возбудителя на простых и сывороточных пита-
тельных средах при температуре 22° и 37 °C является про-
стым и надежным тестом, позволяющим дифференцировать
менингококки, неспособные расти на сывороточной среде при
22 °C и на бессывороточной среде при 37 °C, от сходных с
ними по морфологическим и культуральным признакам N. са-
tarrhalis.
При скудном росте (1—2) колоний в посевах первичного
материала отсев производят только на сывороточный агар с
последующим подращиванием при температуре 37 °C, вслед-
ствие чего дифференциация выделениях микроорганизмов с
N, catarrhalis передвигается на сутки.
Третий день. 1. Просматривают посевы, сделанные
накануне. На поверхности сывороточного агара менингококки
194
образуют нежный влажный налет сероватого цвета, прозрач-
ный в проходящем свете.
2. Из пленки микробного роста берут небольшое количе-
ство материала, готовят мазок, окрашивают его по Граму в
модификации Калины, микроскопируют для определения чи-
стоты выделенной культуры и подтверждения тинкториальной
и морфологической идентичности выделенных бактерий с
бактериями рода Neisseria.
3. Учитывают результаты посевов, сделанных с целью
дифференциации менингококка от N. catarrhalis на сыворо-
точном агаре, инкубированном при 22 °C, на мясо-пептонном
агаре при 37 °C (табл. 29). Следует иметь в виду, что обиль-
ное нанесение материала на бессывороточную среду в некото-
рых случаях сопровождается скудным микробным ростом в
начале штриха. В этих случаях культура идентифицируется
по характеру роста на сывороточной среде, инкубированной
при 22 °C. На этом этапе исследования возможна выдача
окончательного положительного ответа.
Таблица 29
Морфологические, культуральные и биохимические свойства нейссерий,
встречающихся наиболее часто в носоглотке
Вид
нейссерий
Отношение к условиям Отношение
культивирования к углеводам
N, meningitidis
Я. catarrhalis
. sicca
N. qerflava
N. flava
N. subflava
N. flavescens
N. lactamicus
+
4-ИЛИ—
—редко +
+ргдко—
+редко—
+или—
-j-или—
—редко+
+редко—
4-или—
—редко+
Примечание. Среди биохимических признаков важным является наличие
фермента оксидазы, имеющегося у всех представителей рода нейссерий. Сахаролнти-
ческие свойства выражены нечетко.
Если прямой посев спинномозговой жидкости на сыворо-
точном агаре не дал роста колоний, прибегают к повторному
высеву из смеси ликвора с полужидким агаром, инкубиро-
ванным в термостате. При отрицательных результатах высев
иэ обогащенного ликвора повторяют ежедневно в течение 2—
7 дней инкубации его в термостате. Если получен рост коло-
1в* 195
ний, их исследование проводится тем же путем, что и при
прямом посеве спинномозговой жидкости.
Схема исследования носоглоточной слизи. Первый
день. Полученную для исследования слизь из носоглотки
засевают у постели больного на питательные среды: сыворо-
точный агар (рец. 59) и ристомициновую среду (рец. 67).
Ристомициновая среда содержит антибиотик — ристомицин,
подавляющий рост грамположительных кокков, которыми
изобилует слизистая оболочка носоглотки. Нейссерии мало-
чувствительны к ристомицину, и при его концентрации в сре-
де порядка 100—150 ЕД/мл их рост почти не подавляется.
Исследуемый материал втирают в поверхность небольшого
участка питательной среды всеми сторонами тампона. Затем
этим же тампоном внесенный материал растирают штрихом
(с отрывом) по всей площади чашки. При использовании
обеих сред сначала делают посев на сектор ('/4—Чб} чашки
с ристомициновой средой, затем засевают ’/г чашки с сыворо-
точным агаром. В случае ристомициновой среды материал от
одного лица засевают на 2 чашки с сывороточным агаром.
При транспортировке в холодное время года материал, за-
сеянный на чашки, оберегают от охлаждения. Транспортиров-
ка незасеянных тампонов в лабораторию не допускается.
Второй день. 1. Просматривают посевы. При этом ре-
комендуется пользоваться бинокулярной стереоскопической
лупой (МБС-1 или МБС-3). На поверхности сывороточного
агара, кроме бактерий рода нейссерий, наблюдается обиль-
ный рост многочисленных грамположительных кокков, веге-
тирующих на слизистой оболочке зева.
На среде с ристомицином вырастают только грамотрица-
тельные бактерии, преимущественно представители рода
нейссерий.
При просмотре отбирают колонии, характерные для ме-
нингококка и N. catarrhalis. Колонии пигментообразующих
нейссерий дифференцируются по желтому пигменту, интен-
сивность которого усиливается при выдерживании чашек на
свету в течение 2—3 сут.
2. С колониями, подозрительными в отношении рода, нейс-
серий, ставят оксидазную реакцию. Для этого в месте их ско-
пления на поверхность питательной среды наносят каплю све-
жеприготовленного биметилпарафенилендиамина (рец. 32).
Если колонии принадлежат к представителям рода нейссе-
рий, для которого характерно наличие фермента оксидазы
(см. табл. 29), то под действием реактива они приобретают
розовую окраску.
3. Колонии, по результатам оксидазного теста относящие-
ся к роду нейссерий, в течение ближайших 2 мин (во избе-
жание гибели бактерий под влиянием реактива) пересевают
на сектор чашки с сывороточным агаром.
J96
Дальнейшее изучение выделенных культур в плане диф-
ференциации менингококка от N. catarrhalis ведется так же,
как при исследовании спинномозговой жидкости.
гонококки
Гонококки (Neisseria gonorrhoeae) являются возбудите-
лем гонореи — гнойного воспаления слизистых оболочек мо-
чеполового тракта и бленнореи — специфического поражения
конъюнктивы глаз. Гонококки поражают только человека,
животные обладают врожденной невосприимчивостью к гоно-
кокковой инфекции.
Материал для бактериологического исследования. При
острой форме гонореи материалов для бактериологического
исследования у мужчин служит отделяемое уретры, у жен-
щин— отделяемое уретры, влагалища, шейки матки, которое
берут тампоном непосредственно из пораженного органа.
При хронической форме гонореи, а также к концу лече-
ния острой гонореи, когда количество выделений резко умень-
шается или они прекращаются, у мужчин исследуют слизи-
сто-гнойные нити или хлопья, содержащиеся в моче. Для ис-
следования берут 10—15 мл утренней мочи.
Материалом для исследования при поражении глаз слу-
жат гнойные выделения конъюнктивы глаза.
За 2—3 дня до взятия материала для бактериологическо-
го исследования больному гонореей не вводят антибиотики,
антисептические средства и не делают спринцеваний. Мате-
риал тотчас после взятия засевают на питательные среды,
так как гонококки очень чувствительны к температурным ко-
лебаниям, высыханию и даже в гнойном содержимом гибнут
в течение нескольких часов.
Бактериоскопическое исследование патологического мате-
риала— основной метод лабораторной диагностики гонореи.
Простота и доступность этого метода способствуют широкому
применению его в лабораториях дермато-венерологических
учреждений. Однако в связи с изменившимся течением ин-
фекции однократное обследование больных для обнаружения
возбудителя часто бывает недостаточным. Поэтому в целях
улучшения диагностики гонореи М. В. Януха и В. Г. Шрай-
^ерг (1974) рекомендуют больным, у которых в отделяемом
из очагов при первичном обследовании гонококки не обнару-
живаются, назначать провокацию (инъекция гоновакцины в
дозе 50 млн. микробных тел и местное смазывание очагов
1 % люголевским раствором на глицерине) с дальнейшим
ежедневным, в течение 3—7 дней, бактериоскопическим ис-
следованием отделяемого из всех возможных очагов заболе-
вания.
При хронической форме гонореи, а также в случаях ост-
рой гонореи, леченной антибиотиками и сульфаниламидами,
количество гонококков в патологическом материале резко
уменьшается, а оставшиеся микроорганизмы изменяют прису-
щую им форму и расположение. В таких случаях приходится
прибегать к бактериологическому методу — посеву исследуе-
мого материала на искусственные питательные среды. К пи-
тательным средам гонококк чрезвычайно требователен. Для
выращивания его применяют среды, содержащие нативный
белок: человеческую кровь или сыворотку крови. Другим
обязательным условием является достаточная влажность сре-
ды. Для выделения гонококков рекомендуется сывороточный
агар (рец. 59) и среда Бейли с асцитической жидкостью
(рец. 66). При отрицательных результатах бактериологиче-
ского исследования и при хронической гонорее ставят реак-
цию связывания комплемента (реакция Борде—Жангу). По-
ложительный результат реакции отмечается в 85—100% слу-
чаев с 3-й недели от начала заболевания и держится на всем
его протяжении независимо от формы течения.
Бактериоскопический метод исследования при гонорее.
Гной, выделяющийся из уретры, наносят непосредственно на
предметное стекло. Мазок из гноя делают так же, как из мо-
кроты (см. с. 27), и направляют в лабораторию для окраски
и микроскопирования. Из исследуемой мочи вылавливают и
наносят на предметное стекло гнойные комочки и нити или
используют для этой цели осадок, образующийся в результа-
те центрифугирования мочи.
Из каждого образца материала готовят не менее двух
мазков, высушивают их и фиксируют. Затем один мазок ок-
рашивают слабым раствором водного метиленового синего
(метиленовый синий разводят дистиллированной водой до
такой степени, чтобы он окрашивал в светло-голубой цвет
ядра лейкоцитов), а другой — по Граму. Окраска по Граму
имеет основное дифференциально-диагностическое значение
для распознавания гонококков.
В положительных случаях в мазках, приготовленных из
гнойного секрета, обнаруживаются парно расположенные
кокки бобовидной формы, обращенные друг к другу вогну-
тыми, несоприкасающимися сторонами. Преобладающее
большинство гонококков находится в цитоплазме лейкоцитов.
Явление незавершенного фагоцитоза свойственно
гонококковой инфекции (рис. 22). Для гонококков, находя-
щихся в эпителиальных клетках, нередко характерно распо-
ложение правильными рядами.
В препаратах, окрашенных синькой Леффлера, гонококки
имеют темно-синий цвет, в то время как клетки тканей и
слизь окрашиваются в бледно-голубой цвет. В мазках, окра-
шенных по Граму, гонококки грамотрицательны, однако в
выделениях больного хронической гонореей, а также у лечен-
ных сульфаниламидами и антибиотиками наряду с грамотри-
191
дательными встречаются грамположительные гонококки, по-
лучившие название форм Аша, и дегенеративные формы
в виде гигантских или карликовых клеток неправильной
формы.
Бактериологическое исследование патологического мате-
риала на гонококки. Первый день. При подозрении на го-
норею материал немедленно после взятия засевают на све-
жеприготовленные прогретые в термостате питательные сре-
ды, сывороточный агар или среду Бейли (рец. 59, 66). Мате-
риал, нанесенный на плотную питательную среду, втирают
шпателем для получения изолированных колоний гонококка.
Чашки с посевами помещают на 24 ч в термостат при 36—
37®С.
При невозможности проведения посева на месте пересы-
лать материал в лабораторию рекомендуется в среде обога-
щения (рец. 68). В этих случаях материал берут тампоном,
который предварительно обрабатывают фосфатно-буферным
раствором и импрегнируют тонко измельченным древесным
углем. После взятия материала тампон возможно глубже по-
гружают в столбик со средой обогащения. Сверху пробирку
закрывают резиновым колпачком. В лаборатории материал
пересевают с тампоном на чашки с сывороточным агаром или
средой Бейли. Для подавления роста сопутствующей флоры
к питательной среде рекомендуется добавлять полимиксин в
концентрации 25 ЕД или ристомицин — 20 ЕД на 1 мл сре-
ды. Эти антибиотики, не оказывая пагубного действия на го-
нококки, угнетают рост сопутствующей банальной микрофло-
ры, способствуя, таким образом, выделению возбудителя из
исследуемого материала.
Второй день. 1. Просматривают чашки с посевами
для выявления колоний гонококка. При скудном росте микро-
бов па поверхности питательной среды чашки с посевами ос-
тавляют в термостате на 2 сут.
Колонии гонококка на поверхности питательных сред на-
поминают капельки росы диаметром 1—2 мм, прозрачные, го-
лубоватого цвета, с гладкой блестящей поверхностью, ров-
ными краями. При взятии петлей они имеют консистенцию
масла. При старении колонии гонококка становятся матовы-
ми и приобретают сероватый цвет.
2. Из колоний, характерных для гонококка, делают мазки
и окрашивают их по Граму. В чистой культуре гонококки
имеют вид грамотрицательных кокков круглой, реже бобо-
видной формы, в большинстве своем неодинаковых по вели-
чине и расположенных беспорядочно.
Дифференциальная диагностика гонококков. Гонококки
приходится дифференцировать с менингококком, а также с
другими грамотрицательными диплококками, обитающими на
слизистых оболочках верхних дыхательных путей. При диффе-
199
ренциации гонококка прежде всего следует уточнить место,
откуда выделен диплококк: как отмечено выше, гонококки
обнаруживаются преимущественно на слизистых оболочках
мочеполового тракта, при поражении глаз — на слизистой
оболочке конъюнктивы. В редких случаях гонококковой сеп-
тицемии и пиемии гонококки находят в крови.
Менингококки и катаральные диплококки располагаются
на слизистых оболочках верхних дыхательных путей, их поч-
ти никогда не находят в мочеполовых органах.
СЕМЕЙСТВО КИШЕЧНЫХ БАКТЕРИЙ
(ENTEROBACTERIACEAE)
Семейство кишечных бактерий, естественным местом ло-
кализации которых является кишечный тракт, представляет
обширную группу микроорганизмов, включающую сапрофит-
ные, условно патогенные п патогенные виды. Родоначальни-
ком их является, очевидно, кишечная палочка Е. coli, веду-
щая образ жизни комменсалов кишечника.
Единство источника происхождения и генетическая связь
патогенных и непатогенных кишечных бактерий подтвержда-
ются структурой их антигенного аппарата. В нем наряду с
видовыми специфическими антигенами определяются и об-
щие родовые антигены, свидетельствующие о родственной
связи между отдаленными на первый взгляд видами кишеч-
ных микроорганизмов.
С позиций медицинской микробиологии в семействе ки-
шечных бактерий основное значение имеют три рода микро-
организмов: Escherichia, Salmonella и Shigella.
Обширная группа условно патогенных микроорганизмов
Enterobacteriaceae представлена родом Escherichia. В нор-
мальных условиях постоянного места обитания, т. е. в ки-
шечнике человека и животных, эшерихии не только не вызы-
вают заболеваний, но даже играют положительную роль, про-
являя антагонистическое действие по отношению к патоген-
ным видам кишечных бактерий и синтезируя в процессе сво-
ей жизнедеятельности витамины комплекса В. Однако среди
условно патогенных эшерихий имеются мутанты, так называ-
емые энтеропатогенные эшерихии, обладающие свойствами
истинных патогенных бактерий. Энтеропатогенные формы
Е. coli вызывают тяжелые колиэнтериты у новорожденных
и детей грудного возраста, а также дизентерие- и холеропо-
добные заболевания у детей старшего возраста и взрослых.
Патогенные виды кишечных микроорганизмов подразде-
ляются на тифопаратифозную группу бактерий, относящуюся
К роду сальмонелл (Salmonellae), и дизентерийные бактерии,
принадлежащие к роду шигелл (Shigellae).
2W
Все микроорганизмы семейства кишечных бактерий пред-
ставляют собой мелкие (1,5—4 мкм в длину), грамотрица-
тельные, не образующие спор палочки. Одни из них (боль-
шая часть представителей рода Escherichia и рода Salmonel-
la) имеют перитрихиалыю расположенные жгутики и способ-
ны к активному движению, другие (бактерии рода Shigel-
la) — лишены жгутиков и неподвижны.
При культивировании в лабораторных условиях микро-
организмы хорошо растут на обычных питательных средах.
Семейство кишечных бактерий отличается большой стабиль-
ностью биохимических признаков, характеризующих особен-
ности питания и обмена веществ каждого отдельного пред-
ставителя этой группы. Наиболее выраженной ферментатив-
ной активностью обладают эшерихии, что обеспечивает им
большие возможности приспособления к существованию в ки-
шечнике различных видов животных и длительному сохране-
нию в условиях внешней среды. С повышением патогенности
снижается биохимическая активность кишечных микроорга-
низмов, так как, приобретая паразитические свойства, они
утрачивают способность к воспроизведению многих ненуж-
ных ферментов.
В соответствии со сказанным показатели ферментации уг-
леводов и некоторых других химических соединений имеют
большое значение при бактериологической диагностике ки-
шечных инфекций.
ЭШЕРИХИИ
Кишечная палочка — Escherichia coli — названа так в
честь немецкого ученого Эшериха, выделившего ее из ис-
пражнений.
Эшерихии, относящиеся к категории условно патогенных
микроорганизмов, при попадании в желчные и мочеполовые
пути способны вызывать тяжело протекающие -воспалитель-
ные процессы: цистит, пиелит, холецистит, оканчивающиеся
иногда колисепсисом.
Энтеропатогенные кишечные палочки отличаются от ус-
ловно патогенных только по антигенной структуре, постоян-
ной и характерной для каждого штамма. Морфологические
и культуральные свойства у них одинаковы.
Изучение антигенного строения патогенных эшерихий по-
казало, что они имеют три антигена:
1. О-антиген (соматический)—термостабильный, не раз-
рушается при длительном кипячении и автоклавировании
при температуре 120° С.
2. К-антиген — комплекс поверхностно расположенных ан-
тигенов, среди которых различают термолабильные (L, В,
Vi) и термостабильные (А, М) антигены.
3. Н-антиген — жгутиковый термолабильный антигеи.
201
Современная дифференциально-диагностическая схема
энтеропатогенных кишечных палочек строится на основе их
антигенной структуры. Диагностическое значение имеют все
три комплекса антигенов. К настоящему времени патогенные
формы кишечных палочек подразделяются на 149 разновид-
ностей по О антигену, на 94 серологическую разновидность
по К-антигену и на 56 серологических разновидностей по
Н-антигену.
Для обозначения энтеропатогенных кишечных палочек
пользуются антигенными формулами. Для разделения анти-
генов в формуле ставится двоеточие. Например, 020: К84
(В) : Н34. В сокращенных антигенных формулах опускают
символы О, К, Н, так как порядок их расположения посто-
янен. При этом приведенная выше формула приобретает сле-
дующий вид: 20:84 (В) :34.
Для дифференциации энтеропатогенных кишечных пало-
чек пользуются реакцией агглютинации со специфическими
О- и OK-сыворотками. При постановке реакции агглютина-
ции для определения О-антигена нужно помнить, что К-анти-
ген тормозит агглютинацию живых кишечных палочек в го-
мологичной О-сыворотке. Это явление получило название фе-
номена О-инагглютинабельности. Устранить его можно инак-
тивацией оболочечно-комплексных антигенов посредством
длительного прогревания культуры.
На основании серологического различия возбудителей, а
также патогенетической, клинической и эпидемиологической
неоднородности вызываемых ими заболеваний энтеропато-
генные кишечные палочки в настоящее время подразделя-
ются на две категории.
Энтеропатогенные кишечные палочки первой катего-
рии вызывают у грудных детей тяжелые формы энтерита
(воспаление тонкого кишечника), у новорожденных — токси-
ко-септические заболевания с явлениями интоксикации, за-
канчивающиеся иногда летально. К возбудителям кишечной
коли-инфекции у детей раннего возраста относятся преиму-
щественно следующие серологические типы патогенных эше-
рихий: 0111 :В4; 055 :В5; 026 : В6; 028 :В8; 020: В (145).
Энтеропатогенные кишечные палочки второй кате-
гории являются возбудителями острых кишечных заболе-
ваний у взрослых и детей старше года. Эшерихии, входящие
в состав второй категории, делятся в свою очередь по био-
химическим, антигенным и патогенетическим признакам на 3
группы.
Группа первая — дизентериеподобные эшерихиозы —
объединяет 10 серологических групп рода Escherichia, вызы-
вающих у человека заболевания, сходные по клинической?
картине с легкими формами дизентерии. В числе их сероло-
гическая группа 0124: В17, имеющая три серологических ти-
202
иа. Особенностью культур энтеропатогенных кишечных пало-
чек этой серологической группы является идентичность их
термостабильного соматического антигена с антигеном ди-
зентерийных бактерий Ларджа—Сакса 3, а также способ-
ность свежевыделенных культур в отличие от других энтеро-
патогенных палочек, подобно шигеллам, вызывать керато-
конъюнктивит у морских свинок. Таким образом, названные
признаки характеризуют близость энтеропатогенных кишеч-
ных палочек 0124: В17 к представителям рода шигелл.
Группа вторая, представитель — «Крым», является
возбудителем дизентериеподобного заболевания с очень лег-
ким течением. Почти в половине случаев выделения этого
возбудителя наблюдаются бессимптомные формы инфекции.
Группа третья, представленная четырьмя серологи-
ческими группами эшерихиозов, изучена недостаточно. При
попадании в организм человека они вызывают заболевания,
клиническое течение которых сходно с легкой формой холеры.
Основные антигенные и биохимические признаки эшери-
хий, обусловливающих заболевания у взрослых и детей, да-
ны в табл. 30.
Общность клинической картины колиэнтеритов с дизенте-
рией, гастроэнтеритами сальмонеллезпой этиологии, а в неко-
торых случаях с легкими формами холеры определяет реша-
ющее значение бактериологического исследования в диагно-
стике заболевания и, следовательно, в проведении рацио-
нальных терапевтических, противоэпидемических и профилак-
тических мероприятий.
Схема бактериологической диагностики колиэнтеритов.
Бактериологическая диагностика эшерихиозов, предусматри-
вающая выделение и установление серологического типа воз-
будителя, является основой дифференциации сходных по ха-
рактеру клинического течения коли-инфекций. Бактериологи-
ческому исследованию на содержание энтеропатогенных ки-
шечных палочек подвергают испражнения, а при наличии
рвоты — рвотные массы. Взятие материала, учитывая быст-
ротечность клинической картины эшерихиозов, следует про-
водить без промедления, при первом обращении больных за
медицинской помощью, до приема антибиотиков. У новорож-
денных и грудных детей с токсико-септической формой за-
болевания производится также посев слизистого отделяемого
носа и зева. При летальном исходе материалом для бакте-
риологического исследования служит содержимое топких и
толстых кишок, кровь из сердца, кусочки легкого, печени, се-
лезенки и почек. Если материал не может быть доставлен в
лабораторию в первые 2 ч с момента взятия, его сохраняют
в леднике при температуре 1—4° С, но не дольше суток.
Первый день. Посев материала осуществляется с уче-
том создания оптимальных условий для выделения энтеро-
203
Антигенное строение и ферментативные свойства энтеропатогенных эшерихий
Таблица 30
К в Q. Q говяая ппа S 5 'g Л Антиген егоза се 8 в Ё Я се 8 сх се се « о й § ё S ё SJ Л ё 18. § я S ХО се i се 8 я к S g Ё 8 g S CQ С § жиже- жела- а Характер вызываемого
d § а 2 5 К о я S v я заболевания
>» & га н к 5.1 О S (=4 <3 ч Си 0 S £ S £ S н
Пер- вая 0111 055 58(В4) 59(В5) +1 + + + + + + + + X — (+) (+) :(+} + + (+) + + + (+) — — — Колиэнтерит детей грудного возраста
026 020 «145» 60(В6) К84(В) + + + + + + + (±) + + — (+) н + + + + + +1+ X (+) — — + — ' Токсико-септи- ческие заболе- вания новорож- денных
025' (+) + + (+) + —. (+) + + (+) + (+) — — + — Заболевания,
028а, с В18 (+) + + (+) + —. (+) + + (+) + (+) — — + — протекающие
0112а, с а2 Ви (+) + + (±) (+) (+) + + + (+) (+) — — + — по типу легкой
0115 (±) + + + (+) + + (+) (+) + — формы дизенте-
0124 А3 В17 рии
I (+) + + — (+) —. — (+) + + (+) —— — — + —
Вто- II (+) + + — + (+) + + + — — — — + —.
1 III + + + — + (+) + + + + + + —
рая 1 0129 в» . . . + + + — + — (+) (+) + + + (+) — — +
0135 В4 ± + + — + — + + + (+) (+) — + —
0136 В22 (+) + + — (+) (+) — — + (+) — —.
0143 С8 Вх1 (+) + + (+) — 1 — + + + + — — + —
0144 ВХ2 (+) + (+) + (+) (+) + + (+)
Продолжение
Категория Условная группа Возбудитель Антиген Лактоза Глюкоза Маннит Сахароза Мальтоза Адонит Дульцит Сорбит Арабнвоза Ксилоза Рамноза Салицин Инозит Мочевина 1 S Разжижение желатина Характер вызываемого заболевания
о к
2 Крым I II 01 06 0112а, в 0148 С15 В18 (+) + + + 1+ + +++ + + + + (+) + + (+) + 1 1+ + +1 + (+) (+) (+) (+) (+) + (+) + + (+) + + + ± + (*) (+) + + + (+) + (+) + (т) ( + ) + (+) (+) III 1 1 + Illi II 1+ + +++ II 1111 Очень легкие дизентериепо- добные формы заболевания и бессимптомное носительство Заболевания, протекающие по типу легких форм холеры
Условные обозначения: + ферментация; — ферментация не происходит;±позднее ферментирование; х — воможны вариан-
ты; ± признак непостоянный.
патогенных кишечных палочек, дизентерийных бактерий и
сальмонелл. С этой целью посев производят параллельно на
среды Плоскирева (рец. 81), Вильсона—Блер (рец. 82), а
также на среды обогащения: Мюллера (рец. 72) и Лейфсона
с селенитом (рец. 74). Для выделения энтеропатогенных ки-
шечных палочек исследуемый материал высевают на среды
Эндо (рец. 79), Левина (рец. 80) и Аселя—Либерманна (рец.
83). При посеве испражнений небольшое количество мате-
риала эмульгируют в изотоническом растворе хлорида нат-
рия (примерно в соотношении 1:10) и оставляют на несколь-
ко минут. После оседания крупных частиц с поверхности
жидкости берут 1—2 капли, вносят в чашку Петри и на не-
большом участке питательной среды растирают досуха сте-
рильным стеклянным шпателем. Затем шпатель отрывают от
поверхности агара и, не прожигая его, распределяют остаток
материала по остальной поверхности чашки. Для посева во
2-ю и 3-ю чашки материал берут заново.
Второй день. 1. Просматривают посевы, сделанные
накануне. Колонии энтеропатогенных кишечных палочек не
отличаются от колоний условно патогенных кишечных пало-
чек. На чашках со средой Эндо они имеют круглую форму,
ровный, четко очерченный край, матовую поверхность, мали-
ново-красный цвет, который зависит от способности бакте-
рий расщеплять лактозу с образованием кислоты, но без
металлического блеска. На среде Левина колонии кишечной
палочки темно-синего цвета, в остальном они не отличаются
от колоний кишечной палочки на среде Эндо. На среде Асе-
ля—Либерманна колонии энтеропатогенных кишечных пало-
чек имеют розовый цвет, на среде Плоскирева они подобны
колониям дизентерийных бактерий.
2. Анализ на патогенные эшерихии начинают с серологи-
ческого типирования, так как ни культуральные признаки,
ни ферментативные свойства не дают достаточных основа-
ний для дифференциации патогенных эшерихий. Из несколь-
ких колоний берут материал для постановки пробной агглю-
тинации на стекле. При наличии нескольких типов колоний
в агглютинации испытывают по 3—4 колонии каждого типа.
С материалом каждой колонии отдельно ставят реакцию аг-
глютинации на стекле с поливалентной ОК-сывороткой',
представляющей собой смесь типовых OK-сывороток к наи-
более распространенным типам энтеропатогенных палочек.
При положительном результате реакции агглютинации ис-
следуемая культура в первую же минуту наблюдения обра-
зует хорошо видимые простым глазом крупные хлопья агглю-
тината.
1 Агглютинирующие поливалентные и типовые ОК-«оли-сыворотки вы-
пускаются производственными лабораториями институтов вакцин и сывв-
роток.
296
Каждую агглютинировавшуюся колонию отмечают с про-
тивоположной стороны чашки карандашом или чернилами по
стеклу.
В тех случаях, когда все колонии не агглютинируются
смесью сывороток, дается отрицательный ответ.
3. Характерные для кишечной палочки колонии отсеива-
ют: а) на скошенный мясо-пептонный агар; б) на трехсахар-
ный агар с мочевиной по Олькеницкому (рец. 87), на среду
Ресселя (рец. 84, 85) или короткий «пестрый ряд» Гисса
(рец. 44) (глюкоза, лактоза, маннит, мальтоза, сахароза,
пептонная вода) для установления сахаролитических свойств
и выявления индола и сероводорода; в) в полужидкий (0,2—
0,5%) питательный агар для определения активной подвиж-
ности бактерий.
Третий день. 1. Просматривают посевы. Учитывают
результаты ферментации углеводов, отмечают образование
индола, сероводорода и подвижность бактерий по характеру
роста в полужидком агаре. Руководствуясь данными, приве-
денными в табл. 30, отбирают культуры, которые по фермен-
тативным признакам могут относиться к энтеропатогенным
кишечным палочкам.
2. Для установления серологической группы выделенных
культур: а) ставят реакцию агглютинации на стекле с поли-
валентными OK-сыворотками; б) отбирают штаммы бакте-
рий, давшие с поливалентной ОК-сывороткой в течение бли-
жайших 2 мин отчетливо выраженную крупнохлопчатную аг-
глютинацию, для постановки реакции на стекле с каждой
типовой ОК-сывороткой, входившей в состав поливалентной
смеси. Контролем реакции служит взвесь микробов в капле
изотонического раствора хлорида натрия. Реакция агглюти-
нации на стекле с живой культурой имеет только ориентиро-
вочное значение, указывая на наличие в ней соответствую-
щего К-антигепа, и не может служить основанием для отне-
сения выделенного штамма к той или иной О-группе.
3. Для окончательной идентификации культур по О- и К-
антигену ставят развернутую реакцию агглютинации в про-
бирках с той ОК-сывороткой, которая агглютинировала куль-
туру на предметном стекле. Если положительная агглютина-
ция на стекле имела место с несколькими типовыми сыворот-
ками, развернутую агглютинацию ставят со всеми этими
сыворотками. Принадлежность культуры к серологическому
типу в таком случае определяют по наивысшему титру с той
или иной сывороткой. При постановке развернутой реакции
агглютинации готовят два ряда разведений типовой агглюти-
нирующей OK-сыворотки от 1:50 до титра, указанного на
этикетке ампулы. Разведенную сыворотку разливают по 0,5—
1 мл. Для определения К-антигенов в каждую пробирку
добавляют трехмиллиардную взвесь живой исследуемой куль-
207
туры кишечной палочки. При определении О-антигена поль-
зуются этой же микробной взвесью, но после предваритель-
ного кипячения ее в водяной бане в течение часа для инакти-
вации поверхностнооболочечных антигенов и устранения таким
образом феномена О-инагглютинабельности. Последние
две пробирки ряда — контрольные: контроль антигена (КА)—
исследуемая культура в изотоническом растворе хлорида нат-
рия и контроль сыворотки (КС) —сыворотка в разведении
1 :50. Штатив с пробирками встряхивают для лучшего пере-
мешивания сыворотки с антигеном и ставят в термостат на
20 ч.
Положительный ответ дают в том случае, если выделен-
ная культура по антигенному строению соответствует той или
иной серологической группе энтеропатогенных эшерихий.
При этом живая культура образует крупнохлопчатый агглю-
тинат с полным просветлением жидкости над осадком не
менее чем в 2—3 разведениях сыворотки; прогретая культу-
ра выпадает в виде мелкозернистого агглютината до пре-
дельного разведения той же сыворотки или до % титра, ука-
занного на этикетке *. Такого рода результат указывает на
принадлежность выделенной культуры к соответствующей се-
рологической группе энтеропатогенных кишечных палочек.
Образование мелкозернистого агглютината в ряду проби-
рок с живой и прогретой культурой, в разведениях сыворотки
до 3/< ее титра по О-аптигену свидетельствует о принад-
лежности культуры к соответствующей О-группе и отсутст-
вии или низком содержании в ней поверхностных соматиче-
ских К-антигенов (В или L). Реакция считается положитель-
ной.
Отсутствие агглютинации в пробирках с гретой культурой
указывает па принадлежность выделенной культуры к другой
О-группе. Если прогретая культура агглютинируется только
в начальных разведениях сыворотки, это свидетельствует о
ее принадлежности к другой группе, имеющей антигенное
родство с соответствующей О-группой. Реакция считается
отрицательной.
САЛЬМОНЕЛЛЫ
Бактерии рода Salmonella представляют обширную груп-
пу микроорганизмов, включающую более 1600 серологиче-
ских типов. Значение серологических типов сальмонелл в па-
тологии человека различно. В числе их находятся возбудите-
* Сказанное относится к энтеропатогенным кишечным палочкам второй
категории, обладающим поверхностным соматическим К-антигеном В или L,
препятствующим О-агглютинации и инактивирующимся прогреванием в те-
чение 1 ч. Энтеропатогенные кишечные палочки «Крым» не имеют К-анти-
гена и поэтому агглютинируются в живом и убитом состоянии гомологич-
ной сывороткой до ее предельного титра.
208
ли брюшного тифа (S. typhi), паратифа A (S. paratyphi А)
и паратифа В (S. schottmulleri), которые, адаптировавшись
к паразитированию в организме человека, стали причиной са-
мостоятельных нозологических форм заболеваний, подлежа-
щих отдельной регистрации.
Хозяевами подавляющего большинства других типов
сальмонелл являются различные представители домашних и
диких животных, птицы, рыбы, рептилии. Однако, будучи по-
липатогенными микроорганизмами, многие из этих бактерий
опасны не только для животных, но и для людей.
Морфологически все бактерии, относящиеся к роду саль-
монелл, представляют грамотрицательные палочки (длиной
2—4 мкм), не образующие спор. Подавляющее большинство
из них подвижно благодаря наличию перитрихиально распо-
ложенных жгутиков.
Видовая идентификация тифопаратифозной группы бакте-
рий основана на изучении ферментативных свойств и обна-
ружении видо- и типоспецифических антигенов. Все предста-
вители рода сальмонелл различаются между собой двумя
основными антигенами: термостабильным соматическим О-ан-
тигеном и термолабильным жгутиковым Н-антигеном.
Жгутиковый Н-антиген у подавляющего большинства саль-
монелл имеет две фазы: I — специфическую и II — неспецифи-
ческую.
Структура антигенного аппарата, детально изученная
Кауфманом и Уайтом, легла в основу современной сероло-
гической классификации сальмонелл. По общности строения
соматических антигенов бактерии этого рода были разделе-
ны на серологические группы (А, В, С, D, Е и т. д.). Бак-
терии, входящие в состав каждой серологической группы, по
совокупности I и II фаз Н-антигенов в свою очередь подраз-
деляются на серологические типы. Установление серологиче-
ской группы и серологического типа сальмонелл основано на
определении формулы их антигенного строения по идентифи-
кации рецепторов соматических О-антигенов и жгутиковых
Н-антигенов I и II фаз в реакции агглютинации с моноре-
цепторными сыворотками.
В настоящее время род сальмонелл по рекомендации
Международного номенклатурного комитета подразделен на
4 вида (табл. 31). Вид I, обозначенный S. kauffmani, объеди-
няет большую часть патогенных для человека сальмонелл се-
рологических групп А, В, С, D, Е.
Ко II виду, S. salamal, отнесены представители, отлича-
ющиеся от I вида некоторыми биохимическими признаками,
в частности способностью разжижать желатин и расщеплять
малонат натрия.
Вид III, S. arisona, отличается от двух предыдущих видов
способностью ферментировать (большей частью замедленно)
14 Лабинская А. С.
209
Таблица 31
Род сальмонелл по Кауфману
Признаки Виды (подроды.)
I Н III IV
Серологи ческие о н А, В, С, D, Е 60% Чаще 013-60 Чаще слож- ные двух- фазные комплексы Чаще 017-65 Чаше —^67 0-7, 16, 40, 45, 53 и др. Только монофазные (I фаза) Q—Z4—Zie
Фермента- тивные Лактоза Дульцит Салицин Желатин Малонат натрия d-Тартрат (сегнетова соль) + + 1 i ++।+। и х к I 1 1 ++ § + 1 + + — ИЛИ X
Условные обозначения: + наличие ферментации; — отсутствие; х—воз-
можны варианты.
лактозу и относиться индифферентно к дульциту. Бактерии
этого вида выделяются у птиц, рептилий, млекопитающих.
У человека S. arisona обнаруживаются при лихорадочных со-
стояниях с явлениями диареи и гастроэнтерита. В последние
годы описания заболеваний людей, причиной возникновения
которых авторы считают бактерии Arisona, значительно уча-
стились.
К IV виду, S. houtenae, отнесены изъятые из II вида «ати-
пичные» в биохимическом отношении сальмонеллы, фермен-
тирующие салицин и растущие в присутствии цианида калия.
Чувствительность к цианиду калия отражает, по-видимому,
определенную общебиологическую закономерность: все пато-
генные для человека кишечные бактерии чувствительны к
цианиду калия и не растут в его присутствии (шигеллы,
сальмонеллы); все непатогенные виды кишечных бактерий
способны расти на средах с цианидом калия. Бактерии рода
Escherichia и Arisona, включающие патогенных для человека
представителей, подобно шигеллам и сальмонеллам чувстви-
тельны к этому яду.
Клинические проявления сальмонеллезных инфекций чрез-
вычайно разнообразны. Наряду с типичной клинической кар-
тиной брюшного тифа и острых токсикоинфекций с гастро-
интестинальными симптомами могут наблюдаться симпто-
мокомплексы, подобные дизентерии, холере, а иногда и сеп-
тическая форма течения.
210
В последние годы отмечается учащение случаев стертого
и атипичного течения сальмонеллезов, обусловленное, оче-
видно, широким, но не всегда правильным применением ан-
тибиотиков при кишечных заболеваниях инфекционной при-
роды.
Многообразие клинических форм сальмонеллезной инфек-
ции определяет ведущую роль бактериологического метода
исследования в их выявлении и дифференциальной диагно-
стике, указывая на необходимость поиска всех возмож-
ных представителей патогенных микроорганизмов кишечной
группы.
Схема бактериологического обследования больных на ти-
фопаратифозную инфекцию. Материалом для бактериологи-
ческого исследования при подозрении на инфекцию сальмо-
неллезной этиологии служат кровь, испражнения, рвотные
массы или промывные воды желудка, дуоденальное содержи-
мое, моча, а в тех случаях, когда заболевание заканчивается
летально,— секционный материал (кусочки паренхиматозных
органов, кровь из сердца, желчь, мезентериальные лимфати-
ческие узлы, содержимое и отрезок тонкой кишки). Выбор
материала для лабораторного исследования определяется ха-
рактером развития инфекционного процесса.
Наиболее ранним и достоверным методом диагностики
сальмонеллезов является выделение гемокультуры, по-
скольку бактериемия у больных возникает в конце инкуба-
ционного периода и сохраняется в течение всего периода ли-
хорадочного состояния. Кровь для посева берут из вены лок-
тевого сгиба в количестве 5—10 мл.
Исследование испражнений при острых кишечных забо-
леваниях повторяют многократно; со дня поступления боль-
ного и до дня выписки его из стационара. Поскольку при
сальмонеллезных инфекциях патологический процесс разви-
вается в тонком кишечнике, пробы для бактериологического
исследования следует брать из последней, более жидкой пор-
ции испражнений. В соответствии с этим для взятия материа-
ла не следует пользоваться ректальными трубками. При
брюшном тифе интенсивное выделение бактерий начинается
на 3-й неделе заболевания, так как в этот период патологиче-
ский процесс и соответственно возбудитель заболевания сос-
редоточиваются в лимфатическом аппарате кишечника. Од-
нако следует иметь в виду, что в дуоденальном содержимом
тифопаратифозные бактерии обнаруживаются в 1'/г—2 раза
чаще, чем в испражнениях, поэтому естественно, что бакте-
риологическое исследование желчи дает лучшие результаты,
чем бактериологическое исследование кала.
Зондирование производят в лечебных учреждениях по на-
значению лечащего врача. Пробы содержимого двенадцати-
перстной кишки берут натощак. Примерно через 15 мин по-
14* 211
еле введения дуоденального зонда начинает выделяться свет-
лый дуоденальный сок — порция А. После этого в двенадца-
типерстную кишку через зонд вводят 30—50 мл стерильного,
слегка подогретого раствора сульфата магния, который вызы-
вает сокращение и опорожнение желчного пузыря (порция
В темно-зеленого или коричневого цвета) и выход желчи из
желчных протоков (порция С светло-желтого цвета). Для
бактериологического исследования используют порции В и С;
они могут быть засеяны отдельно или же делают общий по-
сев из смеси обоих порций.
Исследование рвотных масс и промывных вод желудка
производят при всех кишечных заболеваниях, сопровождаю-
щихся рвотой, и в случаях промывания желудка.
Первичный посев и выделение сальмонелл из крови. Пер-
вый день. Кровь больного засевают немедленно после взя-
тия во флакон с 10—20% желчным бульоном (рец. 76) или
в среду Рапопорт (рец. 77). Желчь, содержащаяся в пита-
тельных средах, способствует росту тифопаратифозных бак-
терий, подавляет действие антител и предотвращает сверты-
вание крови. Высокий процент высеваемости тифопаратифоз-
ных бактерий отмечается также при посеве крови на голод-
ную среду Клодницкого (рец. 78).
Объем питательной среды для подавления бактерицидных
свойств сыворотки должен в 10 раз превышать количество
засеваемой крови.
Второй день. 1. Просматривают колбы с посевами.
Размножение бактерий тифопаратифозной группы в среде
Рапопорт проявляется уже через 24—48 ч; питательная сре-
да, совершенно прозрачная до посева, становится мутной. На
дне сосуда обнаруживается желто-серый гомогенный осадок
белков крови. Изменяется и цвет питательной среды: из жел-
той она становится розоватой вследствие восстановления ин-
дикатора Андреде, что свидетельствует о расщеплении с об-
разованием кислоты входящих в ее состав глюкозы или ман-
нита. Размножение паратифозных бактерий сопровождается
появлением газа в поплавке.
Размножение бактерий в желчном бульоне или стериль-
ной воде (при посеве крови по Клодницкому) в первые 2—3
дня после произведенного посева не всегда сопровождается
помутнением среды.
2. Из среды с первичным посевом крови независимо от то-
го, имеются ли в ней внешне выраженные признаки микроб-
ного ' роста, делают высев на чашки с внсмут-сульфитным
агаром (рец. 82), средой Плоскирева (рец. 81), Эндо (рец.
79) и Левина (рец. 80).
Засеянные среды помещают в термостат вместе с первич-
ным посевом крови; его сохраняют для повторных высевов
на тот случай, если на плотных питательных средах не обна-
212
ружатся колонии, характерные для тифопаратифозных бак-
терий. Повторные высевы со сред обогащения производят на
2-е, 3-и, 5-е, 7-е и 10-е сутки. В случае отсутствия характер-
ных колоний после высева, произведенного на 10-е сутки, ла-
боратория дает отрицательный ответ и прекращает исследо-
вание.
Первичный посев и выделение сальмонелл из дуоденаль-
ного содержимого. Желчь, полученную для бактериологиче-
ского исследования, засевают: а) на плотные питательные
среды Плоскирева (рец. 81), висмут-сульфитный агар (рец.
82), среду Левина (рец. 80) и Эндо (рец. 79); б) во флаконы
с бульоном так, чтобы соотношение между исследуемым ма-
териалом и питательной средой составляло 1:10.
Оставшийся от посева материал, являющийся питатель-
ной средой, благоприятной для бактерий, ставят в термостат
вместе с посевами. В течение 10 дней из него производят вы-
севы на плотные дифференциально-диагностические среды.
При обнаружении колоний, подозрительных на патоген-
ные бактерии кишечной группы, дальнейшее изучение посе-
вов крови и дуоденального содержимого ведется по общей
схеме, приводимой ниже.
Первичный посев и выделение сальмонелл из кишечного
содержимого. Бактериологическое исследование испражнений
ведут по методике, обеспечивающей возможность выделения
любого представителя патогенных кишечных 'бактерий, кото-
рые могут содержаться в исследуемом материале: патогенные
эшерихии, сальмонеллы, шигеллы. Из этих соображений по-
сев материала производят параллельно на несколько сред,
каждая из которых способствует преимущественному выделе-
нию того или иного возбудителя. Для выделения сальмонелл,
в том числе бактерий брюшного тифа, паратифов, исследуе-
мый материал высевают на дифференциально-диагностиче-
ские среды: висмут-сульфитный агар, среду Плоскирева и на
среды обогащения—селенитовую среду накопления Лейерсона
(рец. 74) или па магниевую среду <кМ» (рец. 75). Наряду с
перечисленными выше средами обогащения можно применять
также жидкую среду Мюллера (рец. 72) и Кауфмана (рец.
73). При посеве в среды обогащения соотношение между за-
севаемым материалом и питательной средой должно оста-
ваться постоянным, равным 1 : 5.
Поступившие в лабораторию испражнения в консерванте
или в среде обогащения эмульгируют в соответствующей
жидкости. Испражнения, доставленные без консерванта,
эмульгируют в стерильном изотоническом растворе хлорида
натрия в соотношении 1 : 10. Приготовленную взвесь ставят
для оседания крупных частиц, после чего приступают к по-
севу. Каплю взвеси пастеровской пипеткой или бактериаль-
ной петлей наносят на поверхность одной из названных вы-
213
ше питательных сред близ бортика чашки. Нанесенный ма-
териал стеклянным стерильным шпателем втирают на огра-
ниченном, в виде небольшого круга или овала участке пита-
тельной среды. Затем, отняв шпатель от этого участка и не
прожигая его на пламени горелки, производят засев осталь-
ной поверхности среды.
Схема идентификации выделенных бактерий с бактериями
рода сальмонелл. Идентификация культур, выделенных из
испражнений, крови и других материалов, подвергшихся ис-
следованию, является самым ответственным и самым труд-
ным этапом бактериологической диагностики кишечных забо-
леваний. Идентификация микробных культур, выделенных у
больных и бактерионосителей, начинается с отграничения ко-
лоний сальмонелл от сходных с ними колоний патогенных и
непатогенных представителей семейства кишечных бактерий.
Второй день исследования. 1. Просматривают
посевы, сделанные на дифференциально-диагностических сре-
дах, простым глазом и через лупу (Х5 или ХЮ), чтобы не
пропустить мелкие колонии. Если через 24 ч после произве-
денного посева на висмут-сульфитной среде роста колоний,
характерных для сальмонелл, не видно, чашки оставляют в
термостате еще на сутки.
Различные представители бактерий рода сальмонелл на
плотных дифференциально-диагностических средах образуют
колонии с признаками, описанными в табл. 32.
2. Из колоний, подозрительных на сальмонеллы, делают
мазок, окрашивают его по Граму и микроскопируют.
3. Три—пять колоний с признаками, характерными для ти-
фо-паратифозных бактерий, отсевают на среду Ресселя (рец.
84, 85) или на скошенный столбик агара с мочевиной (рец.
86) для накопления чистой культуры и определения фермен-
тативных свойств в отношении глюкозы и лактозы. На ком-
бинированной среде посев делают сначала на скошенную
поверхность, а затем уколом в глубину столбика.
4. В этот же день производят высевы со сред обогащения
по аналогии первичного посева на две чашки со средой Пло-
скирева и висмут-сульфитной средой. Дальнейшее исследова-
ние этих посевов ведут по общепринятой схеме с задержкой
на 1 день (рис. 23 и 24).
Третий день. 1. Для определения чистоты выделен-
ных культур со среды Ресселя или скошенного столбика ага-
ра с мочевиной делают мазки, окрашивают их по Граму и
микроскопируют.
2. Учитывают ферментативные свойства микробов, вырос-
ших на среде Ресселя и агаре с мочевиной. Тифопаратифоз-
ные бактерии, не расщепляющие лактозы, не изменяют окрас-
ки скошенной поверхности, но окрашивают в соответствии с
изменением цвета индикатора столбик среды вследствие фер-
214
Таблица 32
Характер роста бактерий тифопаратифозиой группы иа дифференциально-
диагностических средах
Среда Тип сальмеаелл Особенности роста колоний
Мясо-пептон- Подавляющее больший- Круглые, слегка выпуклые, с
ный агар ство типов сальмонелл S. schottmiilleri S. abortus equi, S. cho- lerae suis S. schottmiilleri, S. typhi- murium S. paratyphi, A. S. sendai, S. abortus ovis, S. chole- rae suis, S. gallinarum ровным краем, приподнятым центром, 2—4 мм в диамет- ре. Глянцевые, прозрачные или полупрозрачные Формирование по наружному краю колоний слизистого, круто поднимающегося вали- ка («феномен валообразова- ния») Склонность к образованию до- черних колоний Скудный рост с образованием мелких колоний
Эндо Все серотипы Прозрачные или полупрозрач- ные, бесцветные нли бледно- розового цвета
Левина Все серотипы Прозрачные, бесцветные, иног- да с нежно-розовым или ро- зовато-фиолетовым оттенком
Плоскирева и бактоагар Ж Все серотипы Прозрачные, бесцветные или бледно-розового цвета
Внсмут-суль- фит-агар Виль- S. typhi Мелкие, серовато-зеленые с черным центром
сова — Блер S. paratyphi A S. schottmiilleri Все серотипы Мелкие, очень нежные, зелено- ватого цвета в 1-е сутки, зе- леновато-черного цвета в центре, со светлым, блестя- щим ободком ло периферии на 2-е сутки Крупные, коричневые с метал- лическим блеском В местах роста колоний на пи- тательной среде образуются точки темно-коричневого или черного цвета
меытации глюкозы с образованием кислоты (при наличии ин-
дикатора Аидреде столбик среды окрашивается в розовый
цвет). Паратифозные бактерии, расщепляющие глюкозу с
кислото- и газообразованием, не только изменяют окраску
столбика среды, по и вызывают в нем появление пузырьков
газа.
Культуры, сбраживающие на среде Ресселя лактозу и
глюкозу с образованием кислоты л газа (разновидности ки-
215
шечной палочки) или расщепляющие в скошенном столбике
мочевину (протей), больше не исследуют. Дается ответ «Па-
тогенных бактерий семейства кишечных в исследуемом ма-
териале не обнаружено».
3. Культуры, индифферентные в отношении лактозы, но
сбраживающие глюкозу с образованием кислоты или кисло-
ты и газа (изменение цвета в столбике среды, вспенивание
конденсационной жидкости, иногда разрыв агара), как подо-
зрительные на сальмонеллы засевают для определения под-
вижности уколом в полужидкий (0,2—0,5%) мясо-пептонный
агар (рец. 38) или в 1 мл подогретого до температуры 37° С
мясо-пептонного бульона (рец. 35).
В тот же день из 4—5-часовой бульонной культуры гото-
вят для микроскопирования препарат «раздавленной» или
«висячей» капли. Бактерии рода сальмонелл обладают ак-
тивной подвижностью.
4. Для более полной биохимической характеристики куль-
туры выделенного микроба пересевают на среды Гисса с ман-
нитом, мальтозой, сахарозой, сорбитом, адонитом, салици-
ном, дульцитом, в бульон Хоттингера для определения серо-
водорода, в среду Строгова (рец. 54) или другие среды (рец.
55) для определения индола, в столбик питательного желати-
на и в пробирку с лакмусовым молоком (см. табл. 34).
5. В тот же день приступают к изучению антигенной
структуры выделенных бактерий с применением адсорбиро-
ванных сальмонеллезных поливалентных и монорецепторных
сывороток. Принцип серологической идентификации бакте-
рий группы сальмонелл заключается в том, что в первую оче-
редь определяется групповая принадлежность по О-соматиче-
ским сывороткам, затем в пределах установленной группы оп-
ределяют типовую принадлежность бактерий с помощью Н-
сывороток к специфическим фазам Н-антигена (табл. 33).
Идентификация выделенных культур ведется по следую-
щей схеме.
1. Исследуемую культуру прежде всего испытывают в ре-
акций агглютинации на стекле с поливалентной сальмонел-
лезпой О-сывороткой, содержащей агглютинины к специфиче-
ским антигенам групп А, В, С, D и Е. Представители перечи-
сленных выше групп составляют более 98% культур
сальмонелл, выделяемых у больных и носителей в Советском
Союзе и за рубежом. При положительном результате реакции
агглютинации, подтверждающем принадлежность исследуе-
мой микробной культуры к роду сальмонелл, приступают к
определению ее серологической группы. Для решения этой
задачи вначале ставят реакцию агглютинации отдельно с
каждой О-сывороткой, входящей в состав смеси. Используе-
мые для этой цели сыворотки содержат только «обязатель-
ные» для соответствующей серологической группы антигены:
216
Таблица 33
Схема антигенного строения наиболее распространенных сальмонелл
Серо- логи- ческая группа Серологический тип О-антиген H-антиген
фаза 1 фаза 2
А S. paratyphi А (1), 2, 12 а 1,2
S. schottmulleri (1),4,(5), 12 ь 1,2
S. Stanley 4,5,12 d 1,2
S. saint-paul 1,4,5,12 e,h 1,2
S. Chester 4,12 e,h e, n, x
В S. reading 1,4,12 e,h 1,5
S. derby (1),4,(5)12 f.Q —
S. typhimurium 4,12 i 1,2
S. brandenburg 4,5,12 l,v l.n, z15
S. heidelberg S. Stanleyville 4,5,12 1,4,12 r z4» z23 1,2
С-1 S. paratyphi C Vi, 6,7 C 1,5
S. cholerae suis 6,7 c 1 >5
S. typhi suis 6,7 c 1,5
S. mission 6,7 d 1.5
S. montevideo 6,7 g, m, s —
S. Oranienburg 6,7 t, m k —
S. thompson 6,7 1,5
S. concord 6,7 1, v 1,2
S. potsdam 6,7 1, v e, n., Zi5
S. bareibly 6,7 У 1,5
S. infantis 6,7 z2« —
С-2 S. muenchen 6,8 d 1,2
S. newport 6,8 1, h 1,2
S. kottbus 6,8 e, h 1,5
S. bovis morbificans 6,8 z 1,5
D S. typhi Vi, 9,12 d —
S. enteritidis 9,12 g, m ——
S. dublin 1,9,12 У, 1,9,12 £ g, P ——
S. gallinarum-pullorum — .
Е S. muenster 3,10 e, h •‘1'Л
S. anatum 3,10 e, h 1,6'
S. meleagridis 3,10 e, h 1
S. london 3,10 I, V 1,6
S. give 3,10 >, V 1,7
S. lexington 3,10 Z, 0 d, s, t 1,5
Дру- гие груп- пы S. Senftenberg 1,3,19 От 11 до 64
217
02 — серологической группы А
04 — серологической группы В
07 — серологической группы С, подгруппы С-1
08 — серологической группы С, подгруппы С-2
09 — серологической группы D
Определив принадлежность выделенных бактерий к той
или иной серологической группе, приступают к выявлению ос-
тальных О-антигенов, характеризующих сальмонеллы данной
серологической группы. Изучение полного комплекса О-анти-
генов дает возможность, во-первых, установить серологиче-
скую подгруппу (в серологических группах С и Е) и выявить
серологические варианты, что имеет значение для эпидемио-
логического анализа (в серологических группах А, В и D).
В настоящее время для диагностики бактерий группы
сальмонелл медицинская промышленность Советского Союза
выпускает следующий набор сывороток.
1. Агглютинирующая адсорбированная поливалентная сальмонеллезная
О-сыворотка (группы А, В, С, D, Е).
2. Агглютинирующая адсорбированная поливалентная сальмонеллезная
О-сыворотка редких групп (по рецепторам).
3. Агглютинирующие адсорбированные сальмонеллезные О-сывороткн,
рецепторы (с 1-го по 53-й).
4. Агглютинирующие адсорбированные сальмонеллезные Н-сывороткн,
рецепторы (a, b, с, d, е — до z 36; 1,5; 1,6; 1,7).
5. Агглютинирующая неадсорбированная брюшнотифозная сыворотка.
6. Агглютинирующая неадсорбированная паратифозная А-сыворотка.
7. Агглютинирующая неадсорбированная паратифозная В-сыворотка.
8. Агглютинирующая неадсорбированная сыворотка S. typhimurium.
9. Агглютинирующая неадсорбированная сыворотка S. cholerae suis.
10. Агглютинирующая неадсорбированная сыворотка S. newport.
.11. Агглютинирующая неадсорбированная сыворотка S. enteritidis.
Сухие адсорбированные поливалентные и монорецептор-
ные сыворотки разводят 1—2 мл (как указано на этикетке
ампулы) стерильного изотонического раствора хлорида нат-
рия, что соответствует первоначальному объему сыворотки до
высушивания. Растворенные сыворотки используют в реакции
агглютинации на стекле без дополнительного разведения.
Культуры бактерий, не реагировавшие со смесью сыво-
роток; А, В, С, D и Е, испытывают со смесью О-сывороток
редко встречающихся групп сальмонелл: F, Q, Н, I и т. д. и
затем п-ри положительном результате реакции агглютинации
испытывают раздельно с каждой монорецепторной О-сыво-
роткой, входившей в состав смеси.
2. После установления серологической группы определя-
ют серологический тип выделенного возбудителя с адсорби-
рованными монорецепториыми Н-сыворотками сальмонелл,
входящих в данную группу. При этом Н-сыворотки применя-
ют в порядке, соответствующем распространению типов саль-
монелл в данной местности. После определения первой
218
специфической фазы Н-антигена культуру испытывают с сы-
воротками против 2-й неспецифической фазы Н-антигена. Та-
ким образом устанавливается антигенная формула выделен-
ной культуры.
Для реакции агглютинации с О-сыворотками культуру бе-
рут с верхней части скошенного агара, для агглютинации с
Н-сыворотками — из конденсационной воды (наиболее по-
движные особи).
Четвертый день. 1. Учитывают характер роста иссле-
дуемых культур на средах Гисса, в пробирках с бульоном
Хоттингера, пептонной водой, питательным желатином и лак-
мусовым молоком.
Данные о ферментативных свойствах различных типов
сальмонелл приведены в табл. 34.
2. Повторяют реакцию агглютинации на стекло е О- и Н-
монорецепторными сыворотками, агглютинировавшими на-
кануне исследуемую культуру.
Четвертый день исследования является днем выдачи окон-
чательного ответа.
В тех случаях, когда культура по морфологическим и фер-
ментативным свойствам, а также по результатам серологи-
ческого анализа, выполненного с применением монорецеп-
торных сывороток, соответствует определенному типу саль-
монелл, дается заключение об обнаружении бактерий этой
группы с указанием серологического типа.
Фаготипирование бактерий брюшного тифа. В последние
годы в практике эпидемиологического обследования широкое
распространение получил метод фаготипирования брюшноти-
фозных бактерий. Исходя из представлений, что фаготип яв-
ляется одним из постоянных признаков патогенных микробов,
следует прийти к заключению, что совпадение фаготипов
культур, выделенных в очаге инфекции у разных лиц или из
разных объектов, указывает на их эпидемиологическую связь.
Таким образом, при проведении эпидемиологического об-
следования метод фаготипирования бактерий дает возмож-
ность: i) устанавливать или исключать предполагаемые ис-
точники инфекции; 2) прослеживать эпидемические связи,
3) отличать местные случаи от «привозных» и спорадические
заболевания от эпидемических.
В настоящее время существует всемирно признанная схе-
ма типировапия S. typhi, разработанная Креджи и Фелик-
сом. Имеющимся набором типовых брюшнотифозных Vi-бак-
териофагов удается типировать 90—100% штаммов S. typhi,
находящихся в Vi-форме (т. е. содержащих Vi-антиген). Для
типирования бактерий применяется 78 специфических Vi-бак-
териофагов. Бактериофаги и соответствующие им штаммы
бактерий обозначаются прописными буквами латинского ал-
фавита (от А до Т), для части фагов приняты обозначения
219
§
Основные биохимические свойства сальмонелл
Таблица 34
Серология еекая группа Биохимические свойства, общие для всех сальмонелл Биохимические свойства представителей отдельных серологических групп
глюкоза маннит лактоза сахароза индол мальтоза сорбит адонит салицин мочевина фогеспрос- кауэр метиловый красный арабиноза дульцит ииознт рамноза трегалоза ксилоза бульон Штерна сероводо- род желатин тартрат
А ++ ++ — — — + + (+) — — — + + + (+) — + + — — + — —
В ++ ++ — — + + — — — — + + + (+) + + + (+) + (+) + + (+) +
С-1 ++ ++ — — — + + (+) — — — + + + (+) + + (+) + (+) + + + (+) +
С-2 ++ ++ • — — — + + — — — — + + + + + + + + + — +
D + + +- ++ +— — — — + (+) + — — — + + + + + + + + + + (+) +
Е ++ ++ — ““ + . + — + + + + + + + +' + +
Условные обозначения: + наличие ферментации; — отсутствие ее. В скобках указана замедленная ферментация.
арабскими цифрами (от 25 до 46) . Культуры бактерий, не со-
держащие Vi-антигена, Vi-бактериофагами не типируются.
Техника типирования. Суточную агаровую культу-
ру исследуемого штамма S. typhi проверяют на содержание
Vi-антигена в реакции агглютинации с монорецепторной VI-
сывороткой. При наличии указанного антигена культуру за-
севают в пробирку с 4 мл мартеновского бульона pH 6,8—
7,2 (рец. 40) или бульона Хоттингера (рец. 37) и помещают
в термостат на 3—4 ч. По истечении указанного срока буль-
онную культуру высевают на чашку со слабощелочным пита-
тельным агаром. Посев производят петлей диаметром 5 мм
в виде отдельных капель, число которых должно соответст-
вовать количеству используемых типовых бактериофагов. По-
сле того как нанесенная культура впитается в агар и засеян-
ные участки подсохнут, на них наносят петлей несколько
меньшего диаметра капли типовых бактериофагов в тест-раз-
ведениях (см. с. 80). После подсыхания капель бактериофага
чашки помещают в термостат при 37—37,5° С.
Фаготипирование брюшнотифозных бактерий сопровожда-
ется постановкой двух контролей: посева исследуемого штам-
ма без добавления бактериофага (контроль роста культуры)
и посева культуры с нанесением неразведенного Vi-бактерио-
фага для определения Vi-антигена в исследуемом штамме.
Результаты поставленного опыта учитывают дважды: че-
рез 5—6 и 18—20 ч инкубирования в термостате. Учет резуль-
татов производят невооруженным глазом и с помощью лупы
(Х5) через дно чашки, пользуясь прямым или косым Осве-
щением. Для оценки полученных результатов приняты услов-
ные обозначения. Определение фаготипа культуры произво-
дят в соответствии со схемой, прилагаемой к наборам выпу-
скаемых бактериофагов.
При фаготипировании S. typhi могут быть получены ре-
зультаты, не соответствующие данным схемы. К таким от-
клонениям относятся:
а) культура исследуемых бактерий не лизируется ни од-
ним из типовых фагов, но лизируется Vi-фагом, нанесенным
в качестве индикатора на содержание Vi-антигена. Такие
культуры обозначаются как нетипирующиеся Vi-штаммы.
б) культура богата Vi-антигеном, но проявляет чувстви-
тельность к нескольким типовым фагам. Это так называемые
полилизабельные, или деградированные, штаммы. Для опре-
деления их фаготипа рекомендуется рассеять культуру на
чашки и затем несколько изолированных колоний подверг-
нуть повторному типированию, так как некоторые из них со-
храняют признаки определенного фаготипа;
в) культуры, лишенные Vi-антигена, не могут быть типи-
рованы Vi-бактериофагами. Такие культуры получили назва-
ние W-форм.
221
Атипичные свойства бактерий рода сальмонелл и методы
их идентификации. Трудность идентификации сальмонелл
возникает тогда, когда при обследовании больных и носите-
лей выделяются микроорганизмы с атипичными культураль-
но-морфологическими, ферментативными и антигенными при-
знаками. Поэтому при исследовании выделенных возбудите-
лей следует знать не только типичные признаки сальмонелл,
но и те отклонения от типичных свойств, которые не препят-
ствуют отнесению их к роду сальмонелл.
Данные о наиболее частых отклонениях от характерных
свойств сальмонелл приведены в табл. 35. Большие трудности
возникают при определении видовой принадлежности бакте-
рий, сходных с сальмонеллами биохимически, но не агглюти-
нирующихся сальмонеллезпыми сыворотками, или, наоборот,
бактерий, дающих агглютинацию, но атипичных по фермен-
тативным свойствам. В этих случаях необходимо прежде все-
го убедиться в чистоте выделенных культур. Для этого
исследуемую культуру рассеивают на чашки со средой Эндо,
отбирают наиболее типичные колонии и подвергают их до-
полнительному исследованию.
Для уточнения ферментативной характеристики определя-
ют способность бактерий расщеплять салицин. Возможность
ферментации салицина даже в поздние сроки, как правило,
исключает принадлежность бактерий к роду сальмонелл. Од-
нако следует учесть, что сальмонеллы IV вида (см, табл. 30)
салицин расщепляют.
Сели выделенная культура обладает суммой характерных
для сальмонелл биохимических признаков, но не агглютини-
руется сальмонеллезпыми О- и Н-сыворотками, следует испы-
тать ее способность лизироваться сальмонеллезным О-фагом.
Чувствительность сальмонелл к О-фагу, по данным различ-
ных авторов, колеблется от 97 до 99%. Прочие кишечные
бактерии (кроме бактерий дизентерии, которые в небольшом
проценте случаев чувствительны к этому фагу) лизируются
не более чем в 0,6—0,7% случаев.
Для определения чувствительности культур к О-фагу
пользуются методикой В. А. Килессо (1963). Исследуемую 4—
18-часовую культуру пастеровской пипеткой с топко оттяну-
тым капилляром в количестве двух изолированных капель
высевают па поверхность слабощелочного агара (pH 7,2—
7,4) в чашки Петри. После подсыхания микробной взвеси на
поверхность одной капли наносят сальмонеллезный бактерио-
фаг в тест-разведении, на другую — контрольную каплю
(стерильный бульон). На одной чашке можно испытать 8—
10 микробных культур одновременно. Результаты лизиса учи-
тывают через 6—18 ч инкубации чашек при 37° С. Положи-
тельную реакцию (наличие лизиса) определяют по появлению
на месте нанесения фага четко очерченной зоны сливного
222
Отклонения, не препятствующие отнесению микробных культур к роду сальмонелл
Т а б л и ц а 35
Свойства • Отклонения
их характер । серологические типы частота
Морфологиче- ские Культуральные Ферментатив- ные Антигенные Подвижность Характер роста на мясо-пеп- тонном агаре Характер роста на элективных средах Маннит Мальтоза H2S О-антиген Н-антиген ОН-антиген Отсутствие подвижности Скудный рост, мелкие колонии Шероховатые формы На висмут-сульфит-агаре отсутствие почернения среды (или отсутствие роста) На бактоагаре Ж — слизистый рост Замедленная ферментация Отсутствие ферментации Отсутствие ферментации Отсутствие способности образовы- вать H2S Частичная или полная потеря антиге- на (переход в шероховатую форму, неспецифичеокое выпадение культуры в сыворотке) Временная (или полная) утрата: Н-антигена одной из фаз Н-антигена Временная или постоянная утрата способности агглютинироваться в го- мологичных ОН-сыворотках Многие S. paratyhi, A, S. abortus ovis, S. typhi suis, S. sendai, S. gallinarum Bee S. typhi cholerae suis, S. typhimurium S. hyphimurium S. dublin S. saintpaul, S. enteritidis и др. S. gallinarum—pullorum S. typhi suis S. paratyphi A, S. paratyphi B, S. typhimurium, S. cholerae suis, S. en- teritidis S. paratyphi A. S. Senftenberg, S. ty- phi, S. barelly Bee Bee Bee Bee Часто Как правило Редко Постоянно Очень редко Редко Очень часто Часто Очень редко Часто Редко У свежевыде- ленных культур редко Редко Довольно часто Часто
лизиса или отдельных негативных колоний. Отрицатель-
ная реакция (отсутствие лизиса) проявляется сплошным ро-
стом микробной культуры в месте нанесения фага, не отли-
чающимся от контроля. Чувствительность к О-фагу свиде-
тельствует о принадлежности выделенной культуры к роду
сальмонелл.
В тех случаях, когда выделенная культура обладает био-
химическими свойствами сальмонелл, но не агглютинируется
ни О-, ни Н-сыворотками и не лизируется О-фагом, необхо-
димо уточнить, не является ли она разновидностью бактерий
рода Escherichia с замедленной ферментативной активностью.
Для решения этого вопроса выделенные штаммы засевают в
среду Гисса с 4% лактозы и пониженным количеством пепто-
на (0,3—0,'5%). Среда с повышенным содержанием лактозы
угнетает рост сальмонелл (I и II вида), не препятствуя раз-
множению и ферментации лактозы бактериями рода Arisona
и Escherichia.
Следует иметь в виду, что свежевыделенные из организ-
ма больного культуры сальмонелл довольно часто не агглю-
тинируются ни О-, ни Н-сальмонеллезными сыворотками.
Для восстановления агглютинабельности такие культуры
рекомендуется пассировать на слабощелочном агаре
или в желчном бульоне. Этим же способом пользуются
в тех случаях, когда свежевыделенная культура агглюти-
нируется одновременно несколькими гетерогенными сыворот-
ками.
Свежевыделенную микробную культуру, биохимически
сходную с бактериями брюшного тифа, но не агглютинирую-
щуюся брюшнотифозной сывороткой, испытывают с моноре-
цепторной Vi-сывороткой, а затем ставят реакцию агглютина-
ции прогретой культуры с О-сывороткой.
Бактерии брюшного тифа, обладающие хорошо выражен-
ным Vi-антигеном, расположенным более поверхностно, чем
О-антиген, очень часто не агглютинируются О-сыворотками.
Для инактивации Vi-антигена исследуемую культуру перед
постановкой реакции агглютинации подвергают кипячению
в водяной бане в течение 30 мин.
При серологической идентификации сальмонелл основные
трудности возникают обычно при исследовании жгутиковых
Н-аптигепов, имеющих сложную структуру. Чаще всего это
связано с утратой подвижности либо с преобладанием у по-
пуляции той или иной фазы Н-антигена. Для восстановления
подвижности используют феномен «роения». Сущность его за-
ключается в следующем: 1 каплю 3-часовой бульонной куль-
туры исследуемого штамма наносят на середину чашки с
0,5% питательным агаром. При размножении бактерий на
полужидкой среде наиболее подвижные особи перемещаются
и располагаются по периферической части колонии.
224
Для восстановления отсутствующей фазы жгутикового Н-
антигена пользуются способом Свена Гарда. Принцип его за-
ключается в том, что добавление к питательной среде моно-
рецепторной Н-сыворотки, гомологичной выявленной фазе Н-
антигена, угнетает или полностью подавляет развитие ее, спо-
собствуя формированию противоположной фазы, не подверга-
ющейся влиянию сыворотки. Для воспроизведения этого фе-
номена заготовляют 2% мясо-пептонный агар, расфасован-
ный по 15 мл, и мясо-пептонный быльон, разлитый по 16—
17 мл. Перед постановкой опыта к расплавленному агару до-
бавляют бульон, получая 0,8—1,0% агар (консистенция ага-
ра должна быть такой, чтобы он не «сползал» с чашек).
К слегка охлажденному агару прибавляют 4—5 капель не-
разведенной монорецепторной сыворотки, гомологичной ус-
тановленной фазе Н-антигена. Сразу после добавления сы-
воротки и тщательного перемешивания агара среду выливают
в чашки Петри. После застудневания и подсушивания агара
в термостате (не более 5—10 мин) в центр агаровой пластин-
ки осторожным прикосновением петли наносят культуру с
нижнего участка скошенного агара. После 18—24 ч инкуба-
ции посевов в термостате при 37° С с микробной культурой,
взятой с периферии выросшей макроколонии, ставят реак-
цию агглютинации с монорецепторной Н-сывороткой иско-
мой фазы.
Серологическая диагностика тифопаратифозных заболева-
ний. В связи с тем что высеять возбудителя болезни не всег-
да удается, значительную помощь в лабораторной диагно-
стике кишечных заболеваний оказывают серологические ис-
следования.
В крови больных брюшным тифом и паратифами с 8—
10-го дня болезни появляются антитела к О-и Н-антигенам
соответствующего возбудителя. Образующиеся антитела лег-
ко обнаружить с помощью реакции агглютинации Видаля
или реакции пассивной Vi-гемагглютинации.
Реакция агглютинации Видаля. Реакция Видаля для диа-
гностики тифопаратифозных заболеваний применяется очень
широко, однако ее нельзя считать основным диагностическим
методом, так как имеются формы заболевания, при которых
иммунологические сдвиги в организме выражены очень слабо
или совершенно не проявляются. В то же время положитель-
ная реакция Видаля появляется после ранее перенесенного
заболевания («анамнестический Видаль») или вакцинации
соответствующим антигеном («прививочный Видаль»),
Для постановки реакции Видаля необходимы:
1. Исследуемая сыворотка больного.
2. Набор 4 диагностикумов:
а) брюшнотифозный диагностикум ОН, в котором преоб-
ладает Н-антиген;
15 Лабинская А. С.
225
б) брюшнотифозный диагностикум О;
в) паратифозный В-диагностикум (ОН) с преобладанием
Н-антигена;
г) паратифозный А-диагностикум (ОН) с преобладанием
Н-антигена.
Изотонический раствор хлорида натрия.
Реакцию Видаля ставят, как обычную реакцию агглюти-
нации (см. с. 118). Из исследуемой сыворотки больного го-
товят 4 ряда последовательных двукратных разведений от
1: 100 до 1: 1600—1 : 3200. Разведенную сыворотку разлива-
ют в пробирки по 0,5—1 мл. Затем в количестве 0,5 мл до-
бавляют диагностикум: в первый ряд пробирок — брюшноти-
фозный (ОН), во второй ряд — брюшнотифозный (О), в тре-
тий ряд — паратифозный В (ОН) и в четвертый ряд — пара-
тифозный А (ОН). Последняя пробирка каждого ряда слу-
жит контролем антигена. Контроль сыворотки (один на все
4 ряда) представляет собой исследуемую сыворотку больно-
го, взятую в минимальном разведении (1:100). Штатив с
пробирками, содержащими смесь сыворотки с антигеном,
встряхивают, ставят на 2 ч в термостат и затем на 12—18 ч
оставляют при комнатной температуре. Результат реакции
Видаля учитывают общепринятым для реакции агглютинации
способом (см. с. 120). Положительным результатом реакции
Видаля у непривитых людей считают титр агглютинации в
разведении 1 : 100 при соответствующих клинических показа-
телях.
У ранее привитых больных титр О-антител в разведении
1 :200 не является надежным диагностическим признаком.
Диагностический титр Н-антител у таких больных должен
быть не менее 1 :400.
При заболевании брюшным тифом наблюдается характер-
ная реакция агглютинации в ряду пробирок с брюшнотифоз-
ным О-антигеном, так как в крови больного брюшным тифом
прежде всего накапливаются антитела к О-антигену возбу-
дителя. Подтверждением активно текущего инфекционного
процесса является нарастание титра О-агглютининов в период
болезни. В то же время накапливаются Н-агглютинины,
обусловливающие положительную агглютинацию с брюшно-
тифозным Н-диагностикумом.
При иммунизации брюшнотифозной вакциной О-антитела
к брюшному тифу обнаруживаются в крови вакцинирован-
ных недолго. Н-агглютинины сохраняются продолжительное
время.
Реакция пассивной Vi-гемагглютинации. Для выявления
хронического носительства бактерий брюшного тифа широкое
практическое применение в настоящее время нашла реакция
непрямой гемагглютинации с эритроцитарным Vi-диагности-
226
кумом для обнаружения Vi-антител в сыворотке больных и
переболевших брюшным тифом.
Для постановки реакции гемагглютинации необходимы
следующие ингредиенты:
1. Стандартный формалинизированный эритроцитарный
Vi-диагностикум
2. Подлежащая исследованию сыворотка, прогретая перед
постановкой реакции в течение 30 мин при 56°С для разру-
шения групповых агглютининов.
3. Контрольная Vi-сыворотка.
4. Контрольная О-сыворотка.
Из исследуемой сыворотки готовят ряд последователь-
ных двукратных разведений от 1 : 10 до 1: 1280 в объеме
0,5 мл.
К ряду приготовленных разведений сыворотки, разлитых
в лунки полистероловых пластин, добавляют эритроцитарный
Vi-диагностикум в объеме 0,25 мл. Опытный ряд пробирок
сопровождается контролями диагностикума:
а) постановка реакции с адсорбированной монорецептор-
ной Vi-сывороткой. Реакция должна быть положительной
до предельного титра сыворотки, указанного на этикетке
ампулы;
б) постановка реакции с О-сывороткой. Результат реак-
ции должен быть отрицательным.
Учет реакции производят общепринятым способом (см.
с. 126) через 2 ч после осаждения эритроцитов в контроле
(предварительно) и через 24 ч стояния пластин при комнат-
ной температуре (окончательно).
Диагностическое значение имеет реакция агглютинации
эритроцитов на + + + в разведении сыворотки 1:40 и выше.
Всех здоровых людей, сыворотки которых дают положитель-
ную реакцию с эритроцитарным Vi-диагностикумом в разве-
дении 1 :80 и выше, относят к подозрительным на носитель-
ство бактерий брюшного тифа. Они подлежат тщательному
многократному обследованию. Однако окончательный диа-
гноз носительства может быть поставлен только после выде-
ления культуры палочек брюшного тифа из желчи, испраж-
нений или мочи.
Реакция пассивной гемагглютинации применяется в на-
стоящее время для диагностики не только брюшного тифа,
но и других сальмонеллезных заболеваний. С этой целью
применяют групповые сальмонеллезные В, С, D и Е эритро-
цитарные диагностикумы.
1 Эритроцитарный Vi-диагностикум производит Московский иаучпо-
исследовательский институт эпидемиологии и микробиологии Министерства
здравоохранения РСФСР.
15*
227
ШИГЕЛЛЫ
Возбудителями дизентерии являются бактерии, объединен-
ные общим родовым названием Shigella в честь японского
ученого Шига, доказавшего роль этих бактерий в этиологии
заболевания.
В 1962 г. Комитетом по номенклатуре патогенных бакте-
рий была утверждена советская классификация шигелл, ос-
нованная на совокупности антигенных и биохимических при-
знаков, присущих основным представителям указанной груп-
пы микроорганизмов.
Согласно принятой классификации, шигеллы разделяются
на две группы: маннитотрицательные и маннитположитель-
ные (см. табл. 38).
К первой группе относятся три вида: бактерии Григорье-
ва—Шига (Sh. grigoriew-shigae), бактерии Штуцера—Шмит-
ца (Sh. stutzeri-schmitz) и бактерии Ларджа—Сакса (Sh. 1аг-
ge-sachsii), объединяющие 8 типов, различающихся по анти-
генной структуре.
Группа маннитположительных шигелл включает два ви-
да: бактерии Флекснера (Sh. flexneri) и бактерии Зонне
(Sh. sonnet).
Вид Флекснера по своим ферментативным и серологиче-
ским свойствам делится на три подвида: собственно Флексне-
ра (Sh. flexneri), Ньюкасл (Sh. neucastle) и Бойда (Sh. boy-
dii).
Подвид Флекснера серологически неоднороден: он состо-
ит из 5 серологических типов (1, 2, 3, 4, 5), которые в свою
очередь подразделяются на подтипы: la, 1b; 2а, 2Ь; За, ЗЬ, Зс;
4а, 4в, 5(х+), 5(х—) и два варианта — х и у.
Бактерии Ньюкасл серологических вариантов не имеют,
но. по биохимическим свойствам они неоднородны, что послу-
жило основанием для деления их на три биохимические раз-
новидности: Бойд 88, Дантон и Манчестер, Ньюкасл (табл.
36).
Таблица 36
Биохимические варианты подвида Ныокастл
Биохимический тип Вариант Ферментация
глюкоза маниит дульцит
Бойд 88 1 к к
2 к к К1
Дантои 1 кг кг кг
•Манчестер 2 кг кг —
Ньюкасл 1 кг — кг
2 к —
3 к — к
1 Обозначения в скобках означают замедленную реакцию,
наблюдение которой ведется в течение 15 сут при 37'С.
228
В подгруппе Бойда в настоящее время насчитывается 15
типов. Биохимически они сходны с бактериями Флекснера, но
имеют четкую антигенную специфичность со слабовыражен-
ными групповыми реакциями.
Бактерии вида Зонне в классификационной схеме на типы
не подразделяются. Однако, по данным Новгородской, в нем
выделяют четыре ферментативных типа, различающихся по
способности расщеплять рамнозу и ксилозу. К I типу отно-
сятся культуры, сбраживающие рамнозу в первые сутки и не
ферментирующие ксилозу; ко II типу — поздно сбраживаю-
щие рамнозу и не ферментирующие ксилозу; к III типу —
ферментирующие рамнозу и ксилозу в первые сутки; к IV ти-
пу — расщепляющие рамнозу в первые сутки и замедленно
ферментирующие ксилозу (табл. 37).
Таблица 37
Ферментативные типы шигелл Зонне
Биохимический тип Срок ферментации углеводов, сут
рамноза ксилоза мальтоза
1а +(1) +(1-2)
1b +(1) — +(>2)
ng +02) — +(1-2)
Пе +(>1) — +(>2)
Hid +(1) +(1) +(1-2)
IIIc +(1) +(!) +(>2)
IVf +(1) +(2 и позже) +(1 и позже)
Условные обозначения: + ферментация;
— отсутствие ее.
Типирование шигелл Зонне имеет большое значение при
эпидемиологическом обследовании очагов инфекции (табл.
37).
Серологических подвидов и типов бактерии Зонне не име-
ют, характеризуются склонностью к диссоциации на плотных
питательных средах. В процессе диссоциации образуется
два варианта колоний: небольшие (до 2 м в диаметре), проз-
рачные, бесцветные с ровными краями (S-форма) и более
крупные (3—4 в диаметре), плоские, шероховатые, с изрезан-
ными краями, менее прозрачные, чем колонии I типа (R-фор-
мы). Обе формы нестойки и при рассеве на плотных пита-
тельных средах легко расщепляются.
Материал для лабораторной диагностики. Бактериологи-
ческому исследованию при подозрении на дизентерию под-
вергают испражнения больного, способ взятия которых изло-
жен на с. 162.
Время с момента получения кала до его посева на искус-
ственные питательные среды не должно превышать 2 ч. При
229
невозможности осуществления посева в течение первых 2 ч
после взятия материала для сохранения жизнеспособности
дизентерийных бактерий пользуются консервантами: глицери-
новой смесью (рец. 69), консервантом Изралимского и Теп-
лицкой (рец. 70), 1,5—3% гипертоническим раствором хлори-
да натрия. В консервант, налитый в пробирки или склянки
по 10 мл, вносят 2—3 г испражнений и ставят их в холодиль-
ник при температуре 4°С. При соблюдении указанных усло-
вий испражнения могут сохраняться 12—24 ч.
Для выделения бактерий дизентерии применяется селени-
товая среда накопления Лейфсона (рец. 74). Селенит натрия
стимулирует размножение дизентерийных бактерий и подав-
ляет развитие сопутствующих микробов-сапрофитов. Испраж-
нения вносят в пробирку с селенитовой средой в таком коли-
честве, чтобы по отношению к среде они составляли пример-
но ’/s ч. Смесь тщательно перемешивают и помещают в тер-
мостат на 18—20 ч.
Схема бактериологического исследования. Первый
день. Из испражнений, поступивших на исследование без
консерванта, бактериальной петлей извлекают слизисто-гной-
ные комочки, промывают их в небольшом количестве изото-
нического раствора хлорида натрия (для удаления посторон-
ней микрофлоры, находящейся на поверхности), наносят у
края чашки на поверхность плотных питательных сред, рас-
тирают на небольшой площади (1X2 см2) и затем шпателем
втирают досуха по всей поверхности чашки.
Слизисто-гнойные комочки, полученные из испражнений,
залитых консервантом, засевают на питательные среды без
предварительного промывания их в изотоническом растворе
хлорида натрия.
При исследовании испражнений с целью обнаружения
бактерий дизентерии пользуются элективными питательны-
ми средами: Плоскирева (рец. 81), Левина (рец. 80) и Эндо
(рец. 79). Исследуемый материал рекомендуется засевать
одновременно на 2—3 среды.
Поскольку вероятность выделения возбудителя возраста-
ет с увеличением количества исследуемых испражнений, ре-
комендуется при засеве каждой чашки брать новую порцию
материала.
Среда Плоскирева имеет перед средами Левина и Эндо
два преимущества. Во-первых, она в значительно большей
степени, чем другие среды, подавляет размножение сапрофи-
тов, обусловливая тем самым возможность увеличивать коли-
чество высеваемого на нее материала; во-вторых, обладает
антифаговым свойством, что обеспечивает более высокую ча-
стоту высеваемости возбудителей дизентерии. Однако наряду
с отмеченными положительными качествами среда Плоски-
рева в отдельных случаях угнетает рост дизентерийных мик-
230
робов, главным образом бактерий Григорьева — Шига и Шту-
цера — Шмитца.
Появление в последние десятилетия большого количества
штаммов, устойчивых к синтомицину и левомицетину, послу-
жило основанием при выделении возбудителя из исследуемо-
го материала пользоваться наряду с обычными питательны-
ми средами средами с добавлением антибиотиков. Примене-
ние сред с антибиотиками привело к повышению высеваемо-
сти антибиотикоустойчивых и зависимых форм бактерий ди-
зентерии. При этом лучшей из многих испытанных модифика-
ций оказалась среда Плоскирева, содержащая на 1 мл среды
50 мкг синтомицина или 25 мкг левомицетина.
Второй день. 1. Посевы, сделанные накануне, про-
сматривают с лупой Х5, чтобы не пропустить мелкие коло-
нии, подозрительные на бактерии дизентерии.
На- средах Левина, Плоскирева бактерии дизентерии обра-
зуют бесцветные прозрачные колонии круглой формы, слег-
ка приподнятые над поверхностью питательной среды, с глян-
цевой поверхностью и ровным краем. Бактерии дизентерии
Зонне часто растут в R-форме, образуя плоские, распластан-
ные по поверхности питательной среды колонии с зазубрен-
ными краями. При отсутствии на плотных питательных сре-
дах характерного для дизентерийных бактерий роста произ-
водят высев на эти же питательные среды с селенитовой сре-
ды обогащения.
2. Из колоний, характерных для бактерий дизентерии, де-
лают мазки, окрашивают их по Граму и микроскопируют.
3. Колонии с признаками, перечисленными выше, в коли-
честве 3—5 шт. отсевают на среду Ресселя с мочевиной (рец.
84 и 85), среду Олькеницкого (рец. 87) или «пестрый» ряд
Гисса (рец. 44) с лактозой и глюкозой. При использовании
в работе жидких сред Гисса исследуемые штаммы для испы-
тания на подвижность засевают параллельно в столбик по-
лужидкого (0,2—0,5%) мясо-пептонного агара.
Тр етий день. 1. Просматривают и учитывают резуль-
таты посевов, сделанных накануне (табл. 38).
а) Штаммы, ферментирующие лактозу, а также расщеп-
ляющие мочевину, регистрируют как непатогенные и дают
заключение, что в исследуемом материале бактерий дизен-
терии не обнаружено.
б) Штаммы, расщепляющие глюкозу без образования га-
за, подвергают дальнейшему изучению как подозрительные
на шигеллы.
в) По характеру роста в полужидких средах Гисса или в
«раздавленной капле» с мясо-пептонного бульона определя-
ют подвижность выделенных микроорганизмов. Шигеллы —
неподвижные формы семейства кишечных бактерий, растут
только по ходу прокола среды петлей.
231
Таблица 38
Биохимические свойства возбудителей дизентерии
Обозначение по советской схеме 1962 г. Глюкоза Мальтоза Маннит Лактоза 1 Сахароза I S Обозначение по междуна- родной схеме
ПОДВИД ТИПОВОЙ антиген серо- тип под- группа
Флекс- Флекснер 1-5 + (±) + - (±) ± 1—5 в
вер Ньюкасл 6 + (±) ± — —. 6
Бойд 1 + + — — —.- 1 с
2 + — (+) — — — 2
3 + (±) + . — — 3
4 + (+) + — — — 4
5 + (±) + — — + 5
6 + + — — — 6
7 + (±) + — — + 7
8 + + — — 8
9 + (±) + (+) — + 9
10 + + — —— 10
И + (+) — — — + 11
12 + + — (±) 12
13 + — + — + 13
14 + (±) + + — 14
15 + + — —. + 15
Зонне + (+) + (+) (±) D
Григорьева- Шига Штуцера— 1 + — — 1 А
2 + — — + 2
Шмитца Ларджа— 3 + (±) — __ 3
Сакса 4 + (±) —- — — — 4
5 + —— —— — —— 5
6 + (±) —- — — 6
7 + (±) — —- — + 7
Провизорные 8 + + —- — — + 8
9 + (±) —— — — — 9
10 + (±) — — 10
Условные обозначения: + ферментация в первые сутки; ( + )
ферментация замедленная; отсутствие ферментации
г) Из отобранных штаммов, подозрительных в отноше-
нии шигелл, готовят мазки, окрашивают их по Граму и мик-
роскопируют для установления чистоты выделенных культур.
2. С чистыми культурами грамотрицательных неподвиж-
ных бактерий ставят ориентировочную реакцию агглютина-
ции на стекле.
а) Сначала исследуемую культуру испытывают в реакции
агглютинации со смесью дизентерийных сывороток Флексне-
ра, Зонне, Ньюкасл (смесь № 1), соответствующих наиболее
распространенным в Советском Союзе штаммам дизентерии.
232
При отрицательном результате реакцию повторяют, применяя
смесь № 2, состоящую из агглютинирующих сывороток Бой-
да, Григорьева—Шига и Штуцера—Шмитца.
б) При положительном результате реакции агглютинации
бактерий со смесью сывороток № 1 исследуемую культуру
испытывают в реакции агглютинации отдельно с адсорбиро-
ванной поливалентной сывороткой Флекснера, сывороткой
Зонне и сывороткой Ньюкасл. При положительном результа-
те реакции агглютинации со смесью сывороток № 2 исследуе-
мую культуру испытывают отдельно с адсорбированными сы-
воротками Бойда, Григорьева — Шига и Штуцера — Шмитца.
в) При положительном результате реакции с поливалент-
ной сывороткой Флекснера необходимо определить тип и под-
тип выделенного микроба (в соответствии с принятой номен-
клатурой) .
г) При положительном результате реакции агглютинации
с сывороткой Бойда культуру испытывают с типовыми адсор-
бированными сыворотками (№ 1—15) для определения серо-
логического типа. Сыворотки для агглютинации берут в по-
рядке, соответствующем распределению в данной местности
типов и подтипов возбудителей дизентерии.
д) При положительном результате реакции со смесью № 1
и отрицательной реакции с поливалентной сывороткой Флекс-
нера выделенную культуру испытывают последовательно с
адсорбированными сыворотками Зонне и Ньюкасл.
е) При положительном результате реакции со смесью № 2
и отрицательной реакции агглютинации с поливалентной сы-
вороткой Бойда ставят реакцию агглютинации с сывороткой
Штуцера—Шмитца и Григорьева — Шига.
ж) Если же выделенная культура не агглютинировалась
на стекле в смеси сывороток № 1 и 2, ее испытывают в реак-
ции агглютинации с поливалентной сывороткой Ларджу —
Сакса. При положительной реакции с ней продолжают иден-
тификацию типовыми сыворотками этого вида.
При типичных культурально-морфологических и биохими-
ческих свойствах с хорошо выраженной реакцией агглютина-
ции на стекле с соответствующей видовой, типовой и группо-
вой агглютинирующей сыворотками уже на 3-й день можно
дать предварительный ответ: «Выделена палочка, подозри-
тельная на шигеллу».
3. Для окончательной идентификации выделенной культу-
ры с бактериями дизентерии производят посев:
а) в среды Гисса с маннитом, мальтозой, сахарозой для
определения ферментации углеводов (пробирка со средой
Ресселя, определяющая отношение микроба к лактозе и глю-
козе, остается от предыдущего исследования);
б) в пробирку с бульоном Хоттингера для определения
сероводорода;
233
в) в среду Строгова (рец. 54) или другие среды (рец. 55),
пригодные для определения индолообразования;
г) на среду Симмонса (рец. 148), в которой единствен-
ным источником азота и углерода является цитрат аммония.
Основанием для положительного ответа о выделении ши-
гелл служат следующие признаки: грамотрицательная непод-
вижная палочка, не сбраживающая лактозу и салицин. Не-
которое исключение представляют в этом отношении бакте-
рии Зонне, расщепляющие лактозу и салицин в поздние сро-
ки. В отношении маннита, сахарозы, глицерина, ксилозы,
рамнозы, мальтозы биохимическая активность шигелл раз-
лична и зависит от вида и типа бактерий. Но если они фер-
ментируют тот или иной углевод, то только с образованием
кислоты. Исключение составляют бактерии подвида Ньюкасл,
отдельные варианты которого расщепляют углевод до кисло-
ты и газа.
При изучении аминокислотного обмена установлено, что
шигеллы не образуют индол и сероводород, не растут на сре-
дах, в которых единственным источником углерода и азота
является цитрат аммония.
Основные биохимические и антигенные признаки, поло-
женные в основу дифференциации шигелл от других пред-
ставителей семейства энтеробактерий, приведены в табл. 36
и 38.
Типирование шигелл по феномену колициногении. Многие
микроорганизмы, в том числе представители семейства энте-
робактерий, обладают способностью синтезировать антибио-
тические вещества особого рода, способные вызывать гибель
родственных видов бактерий. Эти вещества получили назва-
ние колицинов, а процесс их образования — колицино-
гении. Способность бактерий продуцировать колицины
является стойким наследственным свойством и определяет-
ся наличием- в цитоплазме микроба специфических генетиче-
ских структур, названных фактором колицин оген-
н о с т и.
Наличие колициногенных факторов обусловливает потен-
циальную летальность для микробной клетки, в которой они
содержатся. При обычных условиях культивирования синтез
колицинов осуществляется небольшой частью клеток (при-
мерно одной на 1000). При этом образующийся колицин
диффундирует в среду, а продуцирующие его клетки погибают.
Таким образом, биологическое действие колицинов сво-
дится к тому, чтобы своим угнетающим действием задержи-
вать развитие бактерий, родственных штамму, продуцирую-
щему колицип. При этом ценой гибели части клеток, синте-
зирующих колицин, популяция микробных клеток в целом
получает селективное преимущество в сложном микробном
ценозе по сравнению с неколициногенпыми культурами.
234
В настоящее время известно 25 типов колицинов, разли-
чающихся по спектру действия на бактерии, чувствительно-
сти к протеолитическим ферментам и антигенным свойствам.
Колицины принято обозначать прописными буквами латин-
ского алфавита.
Особенностью колицинов является их специфичность. Она
определяется биологическими свойствами колицина и нали-
чием на поверхности бактериальных клеток, чувствительных
к каждому колицину, рецепторов, на которых происходит
адсорбция только одного типа колицина, вызывающего ги-
бель клетки. Установлено, что штаммы, чувствительные к од-
ному колицину, имеют один вид рецепторов, тогда как штам-
мы, чувствительные к двум или нескольким колицинам, не-
сут на своей поверхности соответственно два или несколько
рецепторов, соответствующих тем колицинам, действию кото-
рых они подвержены.
Действие колицинов сводится к тому, что, адсорбируясь
на поверхности микробной клетки, они нарушают клеточный
метаболизм с прекращением синтеза белка. Убивая микроб-
ную клетку, колицины в противоположность фагам в ней не
размножаются. Это основной признак, отличающий колицины
от бактериофагов.
Феномен колициногении не только представляет теорети-
ческий интерес, но и имеет большое практическое значение.
Определением колициногенности и установлением спектра
чувствительности к колицинам в настоящее время пользуются
в качестве дополнительного метода дифференциации шигелл,
ферментирующих маннит, от эшерихий, сбраживающих угле-
воды до кислоты без газообразования.
Особенно большое значение методы типирования шигелл
на основе колициногении приобретают при проведении ис-
следований в целях эпидемиологического анализа.
Метод колицинотипирования шигелл с помощью колици-
ногенных штаммов. Метод колицинотипирования шигелл ос-
нован на чувствительности изучаемых штаммов к определен-
ным колицинам.
Определение спектра чувствительности шигелл к колици-
нам осуществляется с помощью эталонных колициногенных
штаммов Фредерика: Е. coli СА-18 продуцирует КОЛИЦИН в
Е. coli CA-23 » D
Е. coli CA-38 » » E + l
Е. coli CA-42 » » F
Е. coli CA-53 » » I
Е. coli CA-235 » К
Е. coli CA-62 » » I + I
Е. coll CA-7 » V
Sh. boydii P-1 » » St
Sh. sonnei P-9 » » S3 4~ 1
Sh. dispar P-14 » » s5
235
Таблица 39
Индикаторные штаммы
Наименование раци- номер
оригинального штамма s 3
CX 5
Sh. sonnei 2 100031
Sh. sonnei 56 100032
Sh. sonnei 17- 100033
Sh. sonnei 2M 100034
Sh. sonnei 38 100035
Sh. sonnei 56/56 100036
Sh. sonnei 56/98 100037
Sh. sonnei Ri 100038
Sh. sonnei Re 100039
Sh. dysenteriae 2M19 РТГ* 8218
Sh. sonnei 2/7 100040
Sh. sonnei 2/64 100041
Sh. sonnei 2/15 100042 100043
E. coli K-12 100044
Регистрационные номера индика-
торных штаммов указаны в соответст-
вии с перечнем Международного спра-
вочного центра (Лондон). В повседнев-
ной работе удобно обозначать индика-
торные штаммы последними цифрами
соответствующих номеров (31, 32, 33
и т. д.).
реформа. Для этого на 40
Колицины дают четкие зо-
ны угнетения роста шигелл,
позволяя подразделить их на
колицинотипы.
Техника постановки опыта
заключается в следующем.
В чашки Петри разливают по
20 мл 1,5% мясо-пептонного
агара с генцианом фиолето-
вым (2—4 капли 0,1% водно-'
го генциана фиолетового на
100 мл среды). Перед поста-
новкой опыта среды подсуши-
вают в термостате. Затем дно
чашек по числу эталонных
колициногенных культур рас-
черчивают на 12 квадратов.
В каждый квадрат чашки
уколом петли засевают эталон-
ную суточную культуру коли-
циногенного штамма, выра-
щенную на среде Ресселя (рец.
84 и 85). Перед посевом каж-
дого следующего штамма пет-
лю прожигают. Среды, засе-
янные колициногенными куль-
турами, инкубируют 22—24 ч
при 37°С, после чего выросшие
колонии убивают парами хло-
50 мин чашки размещают па
столе вверх дном, а на внутреннюю поверхность крышек на-
носят по 8—12 капель хлороформа. После этого 0,1 мл иссле-
дуемой бульонной 24-часовой культуры шигелл вносят в
2,5 мл расплавленного и охлажденного до 45°С полужидкого
(0,7%) агара. Смесь тщательно перемешивают и наслаивают
равным слоем в чашки поверх убитых колоний колициноген-
ных культур. Каждый штамм испытывают параллельно на
двух чашках.
После 16—20-часовой инкубации в термостате вокруг ко-
лоний, к колицинам которых исследуемый штамм шигелл
чувствителен, образуются зоны задержки роста. Величину
зон оценивают в крестах. Ширина зоны в 2 мм обозначается
+ , от 2 до 5 мм ++, от 5 до 10 мм + + +, более 10 мм
+ + + +. Культура считается чувствительной к колицину, ес-
ли ширина зоны задержки роста больше 2 мм.
Результаты типирования культур записываются в виде
спектра их чувствительности к колицинам. Если у испытуе-
мого штамма спектр чувствительности к колицинам одноти-
236
Таблица 40
Схема типирования шигелл Зоине (по Аббо и Шеннону)
Условные обозначения: + наличие зоны торможения индикаторного
штамма; — отсутствие ее; V — вариабельные результаты.
пен на обеих чашках, опыт проведен правильно. При расхож-
дении результатов чувствительность штамма к колицинам
определяют повторно.
Методика колициногенотипирования шигелл Зонне по
Аббо и Шеннону. Установлено, что большая часть культур
шигелл Зонне обладает способностью продуцировать коли-
цины. Поскольку колициногенность и тип продуцируемого ко-
лицина являются стойкими наследственными признаками,
бактерии вида Зонне оказалось возможным подразделить на
1'5 типов, различающихся по своему действию на специально
подобранные индикаторные штаммы (табл. 39).
Типы колициногенных бактерий Зонне обозначают циф-
рами: см. от 1а до 15. Штаммы, не синтезирующие коли-
цинов, относятся к типу 0. Техника постановки опыта относи-
тельно проста. В чашки Петри разливают по 20 мл 1,5% мясо-
пептонного агара, к которому для усиления колициногении
прибавляют генциан фиолетовый (2—4 капли 0,1% раствора
красителя на 100 мл среды).
Культуры шигелл, подлежащие исследованию и выращен-
ные в бульоне в течение суток, засевают на чашки бактери-
альной петлей двумя штрихами, параллельно диаметру чашки,
на расстоянии 3—4 см друг от друга. Каждый штамм за-
севают одновременно на две чашки. Засеянные чашки в те-
чение суток инкубируют в термостате, после чего выращен-
237
ную микробную культуру убивают хлороформом (см. с. 236).
Убитую культуру снимают с поверхности среды узким краем
стерильного шлифованного предметного стекла, после чего
среду вновь стерилизуют парами хлороформа в течение 30—
40 мин.
Затем чашки открывают и производят посев 4-часовой
бульонной культуры индикаторных штаммов в виде парал-
лельных штрихов, перпендикулярных направлению линий по-
севов исследуемых культур и пересекающих их на равном
расстоянии друг от друга. Учет результатов производится
по наличию или отсутствию зон торможения роста индика-
торных культур. Культуру считают чувствительной, если зо-
на торможения ее роста в месте пересечения с линией посе-
ва исследуемой (удаленной) культуры более 4 мм.
Тип штамма определяют по табл. 40.
ВОЗБУДИТЕЛИ ХОЛЕРЫ
Холерный вибрион (Vibrio cholerae) —возбудитель остро-
го инфекционного заболевания, протекающего с явлениями
гастроэнтерита на фоне общей интоксикации. Тяжелое кли-
ническое течение, высокая летальность и возможность, в от-
носительно короткий срок поражения больших контингентов
населения на обширных территориях явились основанием
для отнесения холерного вибриона к группе возбудителей
карантинных инфекций.
Возбудитель холеры по ферментативным и ряду других
биологических признаков подразделяется на два биотипа:
классический холерный вибрион (V. cholerae biotype chole-
rae) и вибрион Эль Top (Vibrio cholerae biotype eltor). Кро-
ме холерных вибрионов, к роду Vibrio относятся и другие па-
тогенные и непатогенные для человека вибрионы, выделяе-
мые из открытых водоемов и кишечного содержимого живот-
ных и человека, отличающиеся от холерных вибрионов отсут-
ствием агглютинабельности холерными О- и OR-сыворотка-
ми, но имеющими общий с холерными вибрионами жгутико-
вый антиген.
Материал для бактериологического исследования. Испра-
жнения больного и рвотные массы берут в индивидуальное,
отмытое от дезинфицирующего раствора судно, на дно кото-
рого помещают меньший по размеру сосуд, удобный для
обеззараживания кипячением, или листы пергамента. Выде-
ления в объеме 10—20 мл стерильной металлической, дере-
вянной или картонной ложкой переносят в стеклянные сте-
рильные банки с плотно закрывающимися стеклянными или
корковыми пробками.
Взятие материала можно производить ректальными труб-
ками (см. с. 162). Больным с выраженным гастроэнтеритом
238
для взятия испражнений вводят в прямую кишку резиновый
катетер, другой конец которого опускают в банку или про-
бирку. При этом жидкие испражнения набираются в сосуд
свободно при легком надавливании на брюшную стенку.
При обследовании реконвалесцентов, а также здоровых
лиц, соприкасавшихся с источником инфекции или заразным
материалом, взятие материала производят после приема сла-
бительного (25—30 г сульфата магния), чтобы получить ис-
пражнения из верхней части кишечника.
Если материал, подлежащий бактериологическому иссле-1
дованию, в ближайшие 2—3 ч после его взятия невозможно
доставить в лабораторию, необходимо использовать консер-
вант Венкантрамана — Рамакришнана (рец. 89), щелочную
пептонную воду (рец. 90) или щелочную пептонную воду с
теллуритом калия (рец. 91). Последние две среды обладают
свойствами обогащения, что позволяет выделить холерный
вибрион даже при содержании единичных клеток его в ис-
следуемом материале.
При постановке посмертного диагноза берут содержимое
из трех отрезков тонкого кишечника (верхней, средней и ниж-
ней части длиной около 10 см каждая), а желчный пузырь
после перевязки протока извлекают целиком. Взятые образцы
органов трупа укладывают отдельно в стерильные банки с
притертыми стеклянными или корковыми, хорошо подогнан-
ными пробками, которые закрывают сверху двойным слоем
пергаментной бумаги и завязывают.
Каждый образец материала подробно этикетируют. На
этикетке указывают имя и фамилию больного (реконвалес-
цента), название образца материала, место и время его взя-*
тия, предполагаемый диагноз и фамилию бравшего материал.
При пересылке исследуемого материала в отдаленные ла-
боратории банки с ним плотно укладывают в металлическую
тару (биксы, ведра, кастрюли), перекладывают бумагой,
стружкой, помещают в ящик с надписью: «Верх, Осторожно!»
и в таком виде пересылают с нарочным.
Схема бактериологического исследования. Бактериологи-
ческий анализ материала, поступившего в лабораторию для
исследования на холеру, ведется в соответствии с инструктив-
но-методическими указаниями по профилактике, лаборатор-
ной диагностике, лечению и борьбе с холерой, утвержденны-
ми Министерством здравоохранения СССР 20 января 1975 г.
Первый этап. 1. Из поступившего материала готовят
несколько мазков для микроскопического исследования.
Мазки высушивают на воздухе, фиксируют 20 мин этиловым
спиртом или смесью Никифорова (см. с. 29), окрашивают
фуксином Пфейферера (рец. 7) и по Граму. При микроскопии
окрашенные грамотрицательные холерные вибрионы имеют
вид тонких, слегка изогнутых палочек. Наряду с типичными
239
клетками в мазке можно обнаружить кокковидные, спирале-
видные формы и палочки, сходные с микробами тифопарати-
фозной группы.
2. Исследуемый материал (испражнения, рвотные массы,
содержимое желчного пузыря, а также суспензия, приготов-
ленная из комочков слизистой оболочки кишечника трупа)
высевают на жидкие и твердые питательные среды. В качест-
ве жидких питательных сред обогащения рекомендуются ще-
лочная 1% пептонная вода (рец. 90) или 1% пептонная во-
да с теллуритом калия 1 : 100 000 (рец. 91).
На плотные питательные среды (щелочной мясо-пептон-
ный агар (рец. 92) или агар TCBS (рец. 93) исследуемый ма-
териал засевают петлей так, чтобы получить изолированные
колонии. Поэтому перед использованием среды должны быть
хорошо подсушены.
Посевы инкубируют в термостате при 37°С на 1% щелоч-
ной пептонной воде 6—8 ч, на пептонной воде с теллуритом
калия 16—18 ч, на щелочном агаре 12—14 ч и на среде
TCBS 18—24 ч.
Второй этап. 1. Просматривают посевы на 1-й среде
накопления, изучают характер роста на ней. При росте хо-
лерного вибриона на жидких питательных средах вначале от-
мечается легкая опалесценция, затем на поверхности среды
появляется тонкая нежная пленка, хорошо заметная на стен-
ке колбы при небольшом ее наклоне. В более поздние сроки
(8—18 ч) образуется отчетливо видимая голубоватая пленка
(при выделении холерных вибрионов классического биоти-
па) или пленка беловатого цвета (при выделении вибрионов
биотипа Эль Тор).
2. Производят пересев с 1-й на 2-ю среду накопления.
Для этого с поверхностного слоя 1-й среды берут 2—3 петли
материала и вносят его в 5—8 мл 1 % пептонной воды (2-я
среда накопления). Параллельно петлей берут материал с
поверхности пленки жидкой среды и высевают его на чаш-
ки с плотными питательными средами (щелочной мясо-пеп-
тонный агар и среда TCBS).
Третий этап. 1. Делают высев из 2-й пептонной воды
на твердые питательные среды.
2. Изучают характер микробного роста на чашках с посе-
вами нативного материала, отбирая колонии, подозритель-
ные на холерный вибрион. Они имеют достаточно характер*
ный вид:
а) На щелочном агаре колонии холерного вибриона круп-
ные, диаметром 1—2 мм, плоские, круглые, гладкие, голубо-
ватого цвета в падающем, прозрачные — в проходящем све-
те, серовато-зеленые в косопроходящих лучах при просмотре
через стереоскопический микроскоп. Консистенция колоний
маслянистая, они легко снимаются петлей и эмульгируются
240
в изотоническом растворе хлорида натрия. В более поздние
сроки (после 18 ч) колонии мутнеют.
Наряду с колониями описанного типа в посевах патоло-
гического материала, полученного преимущественно у вы-
здоравливающих, а также у лиц, леченных антибиотиками,
встречаются мутные колонии с беловатым или кремовым от-
тенком. При микроскопии в проходящем свете у таких коло-
ний заметны желтоватая или коричневатая окраска, зерни-
стость и даже складчатость в центре (шероховатые, плохо
эмульгирующиеся OR-, реже R-варианты).
б) На среде TCBS колонии холерного вибриона крупные,
плотные, желтые на фоне голубовато-зеленого цвета среды.
При стоянии из желтых становятся зелеными. Сопутствую-
щая микрофлора на средах TCBS, как правило, не растет,
за исключением некоторых видов протея, образующих коло-
нии темно-желтого цвета.
3. Из материала колоний с признаками, типичными для
холерного вибриона:
а) ставят ориентировочную реакцию агглютинации с хо-
лерной О-сывороткой;
б) готовят препарат висячей или раздавленной капли для
установления подвижности;
в) при положительной реакции агглютинации и достаточ-
ном количестве подозрительных колоний ставят ориентиро-
вочную реакцию агглютинации с типовыми сыворотками Ога-
ва и Инаба.
Положительный результат реакции агглютинации с холер-
ной О-сывороткой, сочетающийся с типичными для холерно-
го вибриона морфологическими и культуральными свойства-
ми, является на данном этапе исследования основанием -для
предварительного положительного ответа.
4. Агглютинирующиеся колонии для окончательной иден-
тификации отсевают на полиуглеводную лактозо-сахарозную
среду (рец. 94), среду Клигера (рец. 95) или Ресселя (рец.
84, 85) и в пробирку со скошенным щелочным агаром.
Четвертый этап. 1. Изучают результаты роста на по-
лиуглеводных средах. Отбирают для окончательной иденти-
фикации культуры, расщепляющие сахарозу без газа и не
ферментирующие лактозу (на сахарозо-лактозной среде и
среде Ресселя — изменение цвета столбика без изменения
цвета скошенной части и полное пожелтение среды Клиге-
Ра)-
2. В препаратах, окрашенных по 1 раму, проверяют чисто-
ту микробных культур, выделенных с полиуглеводных сред.
3. С полученными чистыми культурами ставят реакцию
агглютинации с видо- и типоспецифическими сыворотками и
проводят окончательную идентификацию выделенных куль-
тур.
16 Лабинская А. С. 241
4. Просматривают чашки со щелочным агаром с высева-
ми из 1-й пептонной воды и посевами нативного материала
на элективных питательных средах.
Пятый этап. 1. Учет окончательной идентификации
культур, выделенных с посевом нативного материала. При
положительном результате анализ считается законченным,
при отрицательном или сомнительном исследовании продол-
жают.
2. Дальнейшее изучение культур, отобранных при высеве
из 1-й среды накопления (см. четвертый этап).
3. Просмотр чашек с высевом со 2-й среды накопления,
отбор и изучение колоний, подозрительных в отношении ко-
лоний холерного вибриона (см. третий этап, п. 2).
Шестой этап. 1. Учитывают результаты идентифика-
ции культур, выделенных с первой пептонной воды. При по-
ложительном результате анализ считается законченным, при
отрицательном — продолжается.
2. Ведется дальнейшее изучение культур, выделенных при
высеве со 2-й среды накопления (см. четвертый этап, п. 1).
Седьмой этап. 1. Окончательная идентификация ко-
лоний, выделенных со 2-й пептонной воды. При положитель-
ных результатах дают ответ о выделении холерного вибрио-
на. При отсутствии в посеве подозрительных колоний иссле-
дования, предусмотренные данной схемой, не проводят.
Положительный ответ при бактериологическом исследова-
нии может быть выдан в пределах 18—48 ч; при использова-
нии элективных и полиуглеводных питательных сред продол-
жительность анализа увеличивается на 12—24 ч. Отрицатель-
ный результат анализа может быть выдан в течение 24—48 ч.
Идентификация выделенных культур с холерными вибрио-
нами. Культуры, подозрительные на холерный вибрион, вы-
деленные на различных этапах исследования, изучают с
целью определения принадлежности их к роду Vibrio и виду
V. cholerae.
Предварительная идентификация выделенных культур
проводится на основании характерных культуральных приз-
наков, морфологии, подвижности и результатов ориентиро-
вочной реакции агглютинации на стекле с видоспецифической
холерной О-сывороткой, разведенной 1 : 100, и типоспецифи-
ческими сыворотками Огава и Инаба, разведенными 1 :50.
Окончательная идентификация выделенных культур, пре-
дусматривающая определение биотипа холерного вибриона,
осуществляется по ряду основных и дополнительных призна-
ков. К основным дифференциально-диагностическим призна-
кам биотипов холерных вибрионов относятся серологические
свойства, определяемые в развернутой реакции агглютинации
с видоспецифической холерной О-сывороткой и типоспецифи-
ческими сыворотками Огава и Инаба; чувствительность к ди-
242
агностическим фагам — классическому IV типа фагу Мукерд-
жи и фагу Эль Тор; чувствительность к полимиксину; агглю-
тинация куриных эритроцитов. Дополнительными признаками
считают гемолитическую активность и реакцию на ацетилме-
тилкарбинол (табл.41).
Таблица 41
Дифференциальные признаки биотипов холерных вибрионов
Признак V. cholerae V. eltor
Агглютинация холерной О-сывороткой + +
» » сывороткой Огава + (-) + (-)
» » » Инаба -(+) -(+)
Чувствительность к холерным фагам:
классический (IV Мукерджи) С + —
Эль Top II — +
Агглютинация куриных эритроцитов — +
Чувствительность к 50 ЕД полимиксина + —
Гемолитическая активность — (±)
Образование ацетилметилкарбинола +
Условные обозначения: + положительный признак; + (—) признак ча-
ще положительный; — отрицательный признак; — (+) признак чаще отрицательный;
(±) признак варьирует.
Исследование антигенной структуры вибрионов. Холерный
вибрион содержит два антигена: соматический О-антиген,
специфический для холерных вибрионов, и жгутиковый Н-ан-
тиген, общий с нехолерными вибрионами. Для определения
видовой принадлежности вибрионов применяют агглютиниру-
ющую холерную О-сывороТку. Цельную агглютинирующую
О-сыворотку разводят изотоническим раствором хлорида нат-
рия, начиная с 1 :50. К 0,5 мл каждого полученного разведе-
ния сыворотки прибавляют по 0,5 мл взвеси исследуемой
микробной культуры, содержащей 1 млрд, микробных тел в
1 мл по стандарту мутности ГИСК. Таким образом, величина
разведений сыворотки удваивается. Последнее разведение
должно соответствовать титру сыворотки, указанному на эти-
кетке. Реакция агглютинации, как обычно, сопровождается
контролем антигена (0,5 мл взвеси культуры +0,5 мл изото-
нического раствора хлорида натрия) и контролем сыворотки
(0,5 мл сыворотки в разведении 1 :50+0,5 мл изотонического
раствора). После перемешивания содержимого пробирок пу-
тем встряхивания штативов их помещают на 2 ч в термостат
при температуре 37 °C. По истечении указанного срока пред-
варительно учитывают результаты. Окончательный учет про-
водят через 20 ч выдерживания пробирок при комнатной тем-
пературе. Оценка результатов ведется по общепринятой ме-
тодике.
16*
243
Культуру следует считать специфической при условии по-
ложительной реакции агглютинации в разведении сыворотки
от '/2 титра до титра, указанного на этикетке.
Слабоагглютинирующиеся штаммы с признаками холер-
ного вибриона испытывают в реакции агглютинации с RO-сы-
воротками. Техника постановки реакции аналогична описан-
ной выше с применением О-сыворотки. Однако взвесь иссле-
дуемой микробной культуры (антиген) готовят на дистилли-
рованной воде.
С эпидемиологической точки зрения очень важно устано-
вить тип выделенного вибриона (Инаба, Огава, Гикошима).
Для определения серотипа холерного вибриона ставят реак-
цию агглютинации на стекле с типовыми сыворотками Инаба
и Огава. При положительной ориентировочной реакции агглю-
тинации ставят развернутую реакцию с той же сывороткой,
разведенной до титра.
Положительная реакция с одной из типовых сывороток
указывает, к какому серологическому типу принадлежит изу-
чаемая культура холерного вибриона.
Тесты с холерными бактериофагами. Для дифференциа-
ции классического типа холерного вибриона и вибриона Эль
Тор применяют холерные бактериофаги: классический холер-
ный бактериофаг С (IV Мукерджи) и бактериофаг Эль Тор.
Для постановки реакции используют чашки Петри, залитые
1,5—2% питательным агаром pH 7,4—8,0. После предвари-
тельного подсушивания питательной среды дно чашки делят
на сектора по количеству 10-кратных разведений фага (начи-
ная от цельного до рабочего), указанному на этикетке ампу-
лы. В пробирку с 3 мл 0,7% агара Хоттингера, расплавлен-
ного и охлажденного до температуры 46 °C, добавляют 0,1 мл
3—4-часовой бульонной культуры изучаемого штамма виб-
риона. Культуру тщательно перемешивают и выливают на
поверхность агара в чашку Петри. После застывания слоя
агара чашки подсушивают 30 мин при комнатной температу-
ре и затем в центр секторов наносят петлей (диаметр 2—
3 мм) по капле фагов в соответствующих разведениях. На
одну чашку наносят разведение фага С, на другую — фага
Эль Top II. Для подсыхания капель фага чашки выдержи-
вают при комнатной температуре 15—20 мин, затем перевер-
тывают кверху дном и помещают в термостат при 37 °C. Про-
смотр чашек начинают после 2—4 ч выдерживания в термо-
стате. Окончательный учет результатов фаголизиса осущест-
вляется через 12—14 ч инкубации.
Бактериофаг С активен только в отношении классическо-
го варианта холерного вибриона, бактериофаг Эль Top II
действует только на вариант Эль Тор. Наличие лизиса в ви-
де одного «стерильного» пятна или группы мелких пятен на
месте нанесения бактериофага в рабочем разведении оцени-
244
вается как положительный результат реакции с холерным
бактериофагом.
Реакция агглютинации с куриными эритроцитами. На
предметное стекло помещают каплю изотонического раство-
ра хлорида натрия и растирают в ней петлю 18-часовой ага-
ровой культуры исследуемых вибрионов до получения густой
взвеси, затем добавляют каплю 2,5% взвеси куриных эрит-
роцитов, отмытых дважды изотоническим раствором. Взвесь
эритроцитов и вибрионов смешивают легким покачиванием
стекла.
Реакция сопровождается двумя контролями—2,5%
взвесью эритроцитов, размешанной в капле изотонического
раствора хлорида натрия (контроль эритроцитов), и взвесью
испытуемых вибрионов в капле этого же раствора (контроль
антигена).
При положительном результате реакции (при отрица-
тельных контролях) склеивание эритроцитов происходит в те-
чение минуты.
Холерные вибрионы биотипа Эль Тор агглютинируют ку-
риные эритроциты ’, классические холерные вибрионы не вы-
зывают их агглютинации.
Чувствительность к полимиксину. Чувствительность мик-
робных культур к полимиксину определяется путем посева
исследуемой микробной культуры на чашки питательного ага-
ра pH 7,6, содержащего полимиксин М или В из расчета
50 ЕД на 1 мл среды. На застывшие пластинки агаровой сре-
ды с полимиксином засевают петлю культуры исследуемого
вибриона.
Результаты роста учитывают после инкубации посевов
при температуре 37°C в течение 18 ч. Вибрионы Эль Тор рас-
тут на полимиксиновой среде; классические холерные виб-
рионы на ней не растут.
Определение гемолитической активности (проба Грейга).
К 1 мл суточной культуры испытуемых вибрионов, выращен-
ных на бульоне с 1 % глицерина, добавляют 1 мл 1 % взвеси
эритроцитов барана, трижды отмытых изотоническим раство-
ром хлорида натрия. Смесь культуры и эритроцитов осторож-
но перемешивают и помещают на 2 ч в термостат при 37 °C,
а затем до следующего дня в холодильник. Учет результа-
тов производят через 2 ч предварительно и через 18—30 ч
окончательно. При положительном результате реакции в
опытной пробирке происходит лизис эритроцитов, (лако-
вая кровь); в контрольной пробирке, содержащей бульон
(1 мл) и взвесь эритроцитов (1 мл), лизис эритроцитов не
наступает.
1 При отсутствии куриных эритроцитов можно пользоваться эритроци'
тами барана или морской свинки.
245
Реакция Фогеса — Проскауэра. Эта реакция заключается в
способности микробной культуры образовывать ацетилметил-
карбинол. Для ее выявления исследуемую культуру засевают
в глюкозофосфатный бульон Кларка (рец. 96). После 1—
3 сут инкубирования посевов в термостате при 37 °C к 1 мл
исследуемой культуры добавляют 0,6 мл 6% спиртового рас-
твора альфа-нафтола и 0,2 мл 40% раствора едкого кали.
Пробирки встряхивают и помещают на 1 ч в термостат. При
положительном результате реакции, свойственной вибрионам
Эль Тор, наступает розовое или рубиново-красное окрашива-
ние среды вследствие образования ацетилметилкарбинола.
Определение принадлежности микроорганизмов к роду
Vibrio.
При обследовании и выделении у больных с желудочно-кишечными
заболеваниями штаммов, сходных с холерными вибрионами, но не агглю-
тинирующихся холерными диагностическими сыворотками, возникает необ-
ходимость установления принадлежности их к роду Vibrio. С этой целью
культуры микробов, подлежащие идентификации, исследуют по ряду тес-
тов, позволяющих дифференцировать представителей рода Vibrio от сходных
с ними бактерий Aeromonas, Plesiomonas и Pseudomonas. В качестве основ-
ных дифференциально-диагностических тестов рекомендуются определение
оксидазы, типа расщепления глюкозы, выявление декарбоксилазы лизина
и орнитина и дигидролазы аргинина, установление протеолитических
свойств и уреазной активности (табл. 42).
Таблица 42
Дифференциальные признаки микроорганизмов рода Vibrio и сходных
с ними бактерий
Основные признаки Vibrio Aeromonas Plesiomonas Pseudomonas
Наличие оксидазы + + + ±
Расщепление глюкозы: аэробное (окисление) К КГ (±) К К
анаэробное (фермента- К КГ (±} к —
ция) Образование декарбокси- лазы: лизииа + + .
орнитина + — + —
Образование дигидрола- зы: аргинина * + +(-) +(-)
Разложение мочевины — +(-) —— +(-)
Разложение желатина + + — +—
Образование индола + + —F —
Условные обозначения: К — кислота, КГ — газ; + реакция положи-
тельная •— отрицательная.
Тест на оксидазу. На поверхность 18-часовой агаровой культуры
наносят:
а) каплю 1% водного раствора парааминодиметиланилииа (гидрохло-
рида или оксалата), добавляют каплю 1% спиртового раствора альфа-
246
нафтола. Положительная реакция на оксидазу характеризуется ярко-синей
окраской, появляющейся через 1—3 мии.
б) несколько капель 1 % водного раствора тетраметилпарафениленди-
амина .(гидрохлорида) или диметилпарафеиилендиамина (дигидрохлорнда),
после чего чашку быстро наклоняют на бок. Положительная реакция, воз-
никающая через 20—30 с, проявляется окрашиванием колоний в темно-кра-
сный цвет.
Определение типа расщепления глюкозы (тестХью—
Лейфсона). Среду Хью—Лейфсона (рец. 97), разлитую столбиком в две
пробирки, засевают уколом исследуемой культуры. После засева в одной
из пробирок поверхность среды'заливают 1 мл стерильного вазелинового
масла. Посевы инкубируют при 37°С в течение 1—4 дней. Окисление опре-
деляют в аэробных, ферментацию — в анаэробных условиях по изменению
цвета среды из болотно-зеленого в желтый.
Определение декарбоксилазной активное ти. Пробир-
ки с питательной средой Меллера (рец. 98) или Фалькоу '(рец. 99), в состав
которых входят глюкоза и одна из аминокислот (лизин, орнитин, аргипин)
засевают одной петлей 18-часовой исследуемой культуры. Поверхность за-
сеянных питательных сред заливают 1 мл стерильного вазелинового масла.
Учет результатов производится на 1—4-е сутки инкубации в термостате
при 37 °C. Вследствие ферментации глюкозы вначале происходит сдвиг pH
в кислую зону, в дальнейшем декарбоксилирование аминокислот ведет к
защелачиианию сред.
Определение протеолитической активности. Для вы-
явления протеолитической активности 18-часовую исследуемую культуру
засевают уколом в столбик желатина. Посевы инкубируют в течение 2—
3 сут при 22—23 °C или 18 ч при 37 °C. Учет результатов производят после
20-минутпого выдерживания пробирок в холодильнике. При положительном
результате реакции желатин остается жидким, при отрицательном—затвер-
девает, как в контрольной пробирке.
Определение уреазной активности. Испытуемую куль-
туру засевают петлей на агар Кристенсена (рец. 100). Засеянную среду
выдерживают 24—48 ч при 37 °C. Расщепление мочевины определяют по
переходу цвета среды от желтого к красно-фиолетовому.
Таким образом, бактерии, относящиеся к роду Vibrio, дифференцируют-
ся главным образом по типу расщепления глюкозы в аэробных и анаэроб-
ных условиях от сходных с ними бактерий рода Pseudomonas, расщепляю-
щих глюкозу только в аэробных условиях, и от Aeromonas, ферментирую-
щих глюкозу в аэробных и анаэробных условиях с образованием кислоты
и газа. Основным признаком, отличающим вибрионов от негазообразующих
аэромонад, служит их отношение к аминокислотам. Вибрионы ферментиру-
ют лизин и орнитин и не расщепляют аргинин. Представители рода Aero-
monas ферментируют аргинин и остаются инертными к лизину и орнитину.
Вибрионы не расщепляют мочевину, обладают протеолитической актив-
ностью и образуют индол.
Метод иммобилизации вибрионов под влиянием специфи-
ческой холерной О-сыворотки. Метод иммобилизации и мик-
роагглютинации вибрионов под влиянием специфической хо-
лерной О-сыворотки дает возможность поставить диагноз в
течение нескольких минут при концентрации возбудителя не
менее 4,3-10 клеток в 1 мл исследуемого материала.
На предметное стекло наносят две капли испражнений,
смыва с ректального тампона или каплю поверхностного слоя
1-й (2-й) пептонной воды. Первую каплю накрывают покров-
ным стеклом (контроль), ко второй — добавляют каплю О-сы-
воротки в разведении 1 :100, смесь перемешивают и накрыва-
247
ют покровным стеклом. Раздавленную каплю рассматривают
под микроскопом при увеличении в 400—600 раз, используя
конденсор темного поля.
При наличии в исследуемом материале холерных вибрио-
нов в первой капле отмечается характерная подвижность, во
второй — подвижность вибрионов прекращается через 2—
3 мин. Реакция иммобилизации специфична и позволяет дать
первый сигнальный ответ через 15—20 мин после начала ис-
следования.
Методика быстрого обнаружения холерного вибриона в
питьевой воде при использовании реакции агглютинации. При
заболевании холерой наряду с выявлением источников инфек-
ции — больных и вибриононосителей — большое значение
приобретает бактериологическое исследование объектов вне-
шней среды. Особенно важно своевременно определить зара-
женность холерными вибрионами источников водоснабжения,
которые способствуют быстрому распространению возбуди-
теля среди населения’ и возникновению больших эпидемий
холеры.
Для обнаружения холерного вибриона в воде предложен
очень простой по выполнению ускоренный метод исследова-
ния, в основу которого положена способность холерного виб-
риона быстро размножаться и давать хорошо видимую реак-
цию агглютинации в присутствии специфической холерной
О-сыворотки. Предел чувствительности данного метода равен
приблизительно 100 вибрионов в 1 мл исследуемой воды.
Техника постановки опыта. 1. К чистой воде не-
посредственно, а к загрязненной — после предварительного
фильтрования ее через стерильный фильтр из обычной филь-
тровальной бумаги добавляют слабощелочной концентриро-
ванный раствор пептона (сухого пептона 100 г, хлорида нат-
рия 50 г, воды 1000 мл, pH 7,2—7,4) из расчета 1 ч питатель-
ной среды на 9 ч исследуемой воды. Смесь перемешивают
взбалтыванием.
2. С полученной смесью ставят развернутую реакцию аг-
глютинации со специфической холерной агглютинирующей
О-сывороткой. Для этого в штатив устанавливают ряд про-
бирок. В 1-ю пробирку наливают 9 мл исследуемой воды,
смешанной с раствором пептона, во все остальные пробирки
вносят эту же смесь по 1 мл. Затем в 1-ю пробирку прибав-
ляют 0,1 мл агглютинирующей холерной О-сыворотки, полу-
чая разведение 1 :100. Жидкость в пробирке тщательно пере-
мешивают, после чего 8 мл выливают в банку с дезинфици-
рующим раствором, а 1 мл переносят во 2-ю пробирку ряда,
в которой получается разведение сыворотки 1:200. После
перемешивания 1 мл жидкости переносят из 2-й в 3-ю про-
бирку, где разведение становится равным 1:400. Таким обра-
зом, готовят ряд последовательных разведений до титра сы-
248
воротки. Последняя пробирка ряда (контроль) содержит
1 мл испытуемой смеси без добавления сыворотки. Штатив с
пробирками помещают в термостат при температуре 37 °C.
3. Через 6 ч инкубации в термостате производят учет ре-
зультатов. При положительном результате агглютинации в
пробирках, содержащих агглютинирующую сыворотку, появ-
ляются хлопья, легкоразличимые простым глазом. В конт-
рольной пробирке жидкость прозрачна. При отрицательной
реакции хлопья отсутствуют во всех пробирках.
4. При положительном результате реакции из контрольной
пробирки делают мазок, фиксируют его и окрашивают фук-
сином Пфейффера. В мазках обнаруживаются вибрионы.
5. При положительном результате агглютинации в ответе
указывают не только факт обнаружения в исследуемой воде
холерного вибриона, но и титр, в котором вибрионы агглю-
тинируются специфической холерной агглютинирующей О-сы-
вороткой. Убедительной является положительная реакция аг-
глютинации в титре 1 :800—1 : 1600 при использовании сыво-
ротки среднего титра (1 : 2000—1 : 3200).
Так как данный метод не обнаруживает холерных вибрио-
нов при малом содержании их в воде, он может считаться
только ориентировочным. Положительный результат должен
быть в дальнейшем подтвержден выделением чистой культу-
ры вибриона с последующей идентификацией ее по общепри-
нятой методике.
ПАТОГЕННЫЕ АНАЭРОБЫ
К группе патогенных анаэробов принадлежат возбудите-
ли столбняка, газовой гангрены, ботулизма. Особенностью
этих микробов является повышенная чувствительность к кис-
лороду, вследствие чего культивирование их на искусствен-
ных питательных средах возможно только в условиях анаэро-
биоза.
ВОЗБУДИТЕЛЬ СТОЛБНЯКА
Столбняк — острая раневая инфекция, развивающаяся в
результате проникновения возбудителя столбняка (Clostridi-
um tetani) в организм через поврежденную ткань кожи или
слизистых оболочек.
Наибольшая распространенность столбняка, связанная с
массовым травматизмом, наблюдается во время войн. В ра-
ну бациллы столбняка переносятся обычно с почвой, куда по-
падают с испражнениями животных и человека. В организме
споры столбняка прорастают в вегетативные формы, размно-
жаются и выделяют экзотоксин, который, распространяясь
по нервным стволам, поражает центральную нервную систе-
249
Рис. 25. Бациллы столбняка
в чистой культуре.
му. Бациллы столбняка остаются при этом в месте их внед-
рения.
Материал для лабораторной диагностики. К микробиоло-
гической диагностике столбняка прибегают в редких случаях,
когда болезнь протекает в атипичной форме и правильность
клинического диагноза вызывает сомнения. Для постановки
лабораторного диагноза столбняка берут кусочки поражен-
ных мышц и кожи, иссекаемые при обработке раны, раневое
отделяемое или обнаруженные в ране инородные тела (ос-
колки снаряда, занозы и т. д.). При посмертном диагнозе
на исследование берут материал из раны (если она имеется),
воспалительных очагов, старых рубцов. В связи с возможно-
стью в некоторых случаях генерализации процесса лабора-
торному исследованию (на содержание столбнячного токсина
и самого возбудителя) подвергают кровь, кусочки печени и
селезенки.
Схема исследования. Первый день. 1. Из патологиче-
ского или секционного материала, поступившего на исследо-
вание, готовят несколько мазков-отпечатков. Мазки окраши-
вают по способу Ожешко для обнаружения спор. Наличие в
патологическом или секционном материале крупных грампо-
ложительных палочек с терминально расположенной спорой,
придающей микробу вид барабанной палочки, вызывает по-
дозрение на присутствие Cl. tetani (рис. 25).
2. Материал разрезают на мелкие кусочки стерильными
ножницами, растирают в стерильной ступке с двойным объ-
емом изотонического раствора хлорида натрия и добавляют
стерильное кварцевое стекло до образования однородной мас-
сы. Гомогенат, приготовленный из исследуемого материала,
оставляют в течение часа при комнатной температуре для
250
Рис. 26. Воспроизведение экспериментального столбняка на мышах.
экстрагирования токсина. Образующийся при отстаивании по-
лупрозрачный надосадочный слой жидкости фильтруют через
ватно-марлевый или бумажный фильтр. Приготовленный та-
ким образом фильтрат делят на две порции и к одной из них
добавляют противостолбнячную сыворотку: на 1 мл исследуе-
мого экстракта — 0,5 мл сыворотки, содержащей 200 АЕ ан-
титоксина. Смесь в течение 40 мин выдерживают при ком-
натной температуре для нейтрализации токсина антитокси-
ном.
Реакцию нейтрализации ставят на 4 белых мышах. Пер-
вой паре мышей вводят внутримышечно в верхнюю треть
бедра исследуемый экстракт в объеме 0,5—1 мл, второй па-
ре— смесь экстракта и антитоксином по 0,75—1,5 мл. На-
блюдение за подопытными животными ведется в течение 4—
5 дней.
Второй — четвертый день. При наличии в исследуе-
мом материале бацилл столбняка или столбнячного токсина
признаки заболевания у мышей возникают обычно на 1—3-и
сутки. Клиническая картина экспериментального столбняка
очень характерна: у мышей появляются взъерошивание шер-
сти, напряженность хвоста и мышц, ближайших к месту инъ-
екции заразного материала, в результате чего хвост подни-
мается вверх трубой. Задняя лапа со стороны, соответствую-
щей введению материала, содержащего столбнячный токсин,
вследствие паралича отечна, вытянута, при движении живот-
ного волочится, не касаясь поверхности пола. Несколько поз-
же развивается ригидность (напряженность) мышц спины,
вызывающая искривление позвоночника. Животные погибают
в характерной позе: поджав передние и вытянув задние лапы
(рис. 26). У мышей, получивших токсин с противостолбнячной
сывороткой, симптомы столбняка отсутствуют.
251
ВОЗБУДИТЕЛИ ГАЗОВОЙ ГАНГРЕНЫ
Газовая гангрена — тяжелое инфекционное заболевание,
осложняющее заживление огнестрельных ран, тяжелых сель-
скохозяйственных, уличных и бытовых травм, сопровождаю-
щихся повреждением и загрязнением обширных участков
мягких тканей. Это — полимикробное заболевание, вызывае-
мое группой анаэробных микробов (Cl. perfringens, Cl. oede-
matiens, Cl. histolyticum, Cl. septicum, Cl. sordelli, Cl. falax)
обычно в сочетании с кокками — стафилококками и стрепто-
кокками.
Из ран, осложненных анаэробной инфекцией, чаще всего
высевают Cl. perfringens, затем Cl. oedematiens, реже находят
Cl. septicum и Cl. histolyticum. Кроме перечисленных возбу-
дителей газовой гангрены, в очаге поражения очень часто об-
наруживаются непатогенные анаэробы Cl. putrificus, Cl. ter-
tium и др.
Роль микробных ассоциаций в развитии газовой гангре-
ны изучена недостаточно.
Материал для лабораторной диагностики. При подозре-
нии на газовую гангрену бактериологическому исследованию
подвергают некротизированную ткань из различных участков,
расположенных вблизи здоровой ткани, кусочки пораженных
мышц весом не менее 2—3 г, иссекаемые при хирургической
обработке ран, отечную жидкость, набираемую шприцем на
границе со здоровой тканью, кровь из вены (5—10 мл).
Трупный материал (участки травмированной кожи и пато-
логически измененные мышцы, иссеченные в окружности ра-
ны, кусочки печени, селезенки, кровь из сердца) берут в бли-
жайшие часы после смерти, до проникновения в ткани трупа
анаэробной микрофлоры из желудочно-кишечного тракта.
Банки или пробирки с материалом обертывают ватой или
легнином, помещают в металлический футляр вместе с со- .
проводительным бланком и немедленно пересылают в лабо-
раторию для микробиологического исследования.
Схема бактериологического исследования. Первый
день. 1. Из материала, поступившего на исследование, гото-
вят мазки-отпечатки для микроскопического исследования.
Один мазок окрашивают по Граму, другой для обнаружения
капсул —по Гинсу (стр. 34). При регистрации результатов
микроскопирования в протоколе отмечают все формы микро-
бов, обнаруженных в мазке. Основанием для подозрения на .
газовую гангрену является содержание в мазке патологиче- .
ского материала большого количества грамположительных
грубых или полиморфных палочек, большей частью в соче- t
тании с кокками. В препаратах, окрашенных по Гинсу, могут ,
быть обнаружены капсулы, образованные Cl. perfringens
(табл. 43).
252
2. После предварительного микроскопирования патологи-
ческий материал подготавливают к посеву: а) некротизиро-
ванные участки кожи, патологически измененную ткань
мышц, кусочки печени и селезенки, соблюдая правила сте-
рильности, измельчают ножницами, а затем, добавив неболь-
шое количество кварцевого песка и изотонического раствора
хлорида натрия, растирают в ступке до образования гомоге-
ната; б) поступившие на исследование отечную жидкость и
кровь центрифугируют при 3000 об/мин в течение 30 мин.
3. Приготовленный гомогенат ткани и осадок крови или
отечной жидкости засевают петлей на плотные питательные
среды: кровяной агар (рец. 116 или 118), агар Вильсона —
Блер (рец. 115), бензидиновый агар (рец. 120), среду Вил-
лиса и Хоббса (рец. 119).
Параллельно с посевом на плотные питательные среды
взвесь исследуемого материала в объеме 1 мл засевают под
слой вазелинового масла в 5 пробирок со средой Китта—Та-
роцци (рец. 113).
Непосредственно перед посевом эту среду регенерируют
кипячением в течение 10—20 мин с последующим быстрым
охлаждением. После посева 1 пробирку оставляют без про-
гревания, остальные 4 прогревают в водяной бане (при 80 °C
в течение 15 мин 1 пробирку, при 100 °C в течение 5, 10 и
20 мин 3 пробирки) для уничтожения посторонней вегетатив-
ной микрофлоры, которая может подавить развитие анаэро-
бов — возбудителей газовой гангрены.
Второй — пятнадцатый день. 1. Посевы на плот-
ных питательных средах инкубируют 1 сут в анаэростате,
просматривая чашки каждые 2 дня; посевы в жидких пита-
тельных средах выращивают в обычных условиях в термоста-
те в течение 15 сут, просматривая их ежедневно.
а) Колонии, подозрительные в отношении возбудителей
газовой гангрены (см. табл. 43), исследуют бактериоскопи-
чески. При обнаружении грамположительных грубых или по-
лиморфных палочек материал из нескольких колоний отсева-
ют для накопления чистой культуры в среду Китта—Тароцци
(рец. 113).
б) Из пробирок с посевами первичного мате-
риала, в которых отмечается помутнение среды с образо-
ванием пузырьков газа, свидетельствующих о развитии и на-
коплении в ней микробов-анаэробов, готовят мазки для бак-
териоскопии. При выявлении в них грубых или полийорфных
грамположительных палочек производят высев на плотные
питательные среды (кровяной агар, среда Вильсона — Блер
или Виллиса и Хоббса) для получения роста изолированных
колоний и выделения чистых культур.
2. Чистую культуру микробов-анаэробов, выращенную в
жидких питательных средах, исследуют бактериоскопически,
253
s
Культурально-морфологические свойства патогенных и непатогениых клостридий
Таблица 43
Название клостридий Морфология Подвиж- ность Споры Особенности роста микробных колоний
в глубине агара на поверхности кровяного агара на среде Вильсона— Блер иа среде Виллиса и Хоббса
1 2 3 4 5 6 7 8
Cl. perfrin- Толстая, грубая, — Овальной фор- Дискообразные, Круглые, влаж- Интенсивно Покраснение
gens иногда корот- кая палочка. В организме жи- вотных и чело- века образует капсулы мы, расположе- ны субтерми- иально, реже центрально. Споры бацилл типа А перено- сят кипячение от 1 до 6 ч, ти- пов В, С, D, Е— в течение 15— 30 мин реже мохнатые, в виде плотных комочков ваты ные, серовато- оливкового или зеленого цвета с зоной гемоли- за черные с почер- нением среды под колонией и вокруг нее. Об- наруживают че- рез 4—6 ч пос- ле посева среды с орео- лом опалесцен- ции
Cl. oedema- Толстая, длин- + Овальной фор- Пушистые ко- Сочные, выпук- Крупные, с зер- Полупрозрач-
Hens пая палочка с закругленными концами, часто располагается цепочками мы, расположе- ны центрально или субтерми- нально. Выдер- живают кипяче- ние до 1 ч лонии с уплот- ненным цент- ром и тонкими пушинками по периферии лые со слегка зернистой по- верхностью, ок- руженные зо- ной гемолиза нистой или ше- роховатой по- верхностью се- ровато-зелено- го цвета ные, опалесци- рующие, ,с пер- ламутровым ореолом по пе- риферии
Cl. septicum Тонкая палочка с закругленны- ми концами, образует длин- ные нити + Овальной фор- мы, расположе- ны субтерми- нально. Выдер- живают кипя- чение до 40 мин
Cl. histolyti- cum Мелкие, с за- кругленными концами палоч- ки + Овальной фор- мы, расположе- ны субтерми- нально. Выдер- живают кипя- чение от 30 до 9 ч
Cl. sordellii Мелкие, грубые полиморфные палочки + Овальной фор- мы, расположе- ны центрально илн субтерми- иально
8 сл
В виде чечеви- Нежный рост в Блестящие, Блестящие, по-
цы с древовид- но разветвляю- щимися отрост- ками виде извитых нитей и завит- ков с узкой во- ной гемолиза крупные, интен- сивно черные, вызывающие почернение сре- ды вокруг ко- лонии лупрозрачные, с зоной поро- зовения среды вокруг колоний
Плотные, вет- вистые, темио- желтого цвета Мелкие, глян- цевые, напоми- нающие капли росы, без гемо- лиза или с уз- кой зоной гемо- лиза Мелкие, полу- сферические, блестящие, зе- леновато-чер- ного цвета Светлые, полу- прозрачные, с зоной просвет- ления вокруг колоний
Чечевицеобраз- ные, иногда с выростами Слегка выпук- лые, серовато- белого цвета, с зоной узкого гемолиза Мелкие, полу- прозрачные, с зоной опалес- ценции и про- светления
Таблица 45
Схема постановки реакции нейтрализации на мышах1
Про- бирки Центрифу- гат культуры, мл Антитоксическая сыворотка Изотониче- ский рас- твор хлори- да натрия
Cl. perfrin- gens типа А Cl. oedema- tiens типов А и В Cl. septi- cum Cl. histo- lyticum Cl. sordellii
1 0,9 0,6 МЛ (50 ME) — — — — —
2 0,9 — 0,6 мл (50МЕ) — —- — —
3 0,9 —- — 0,6 мл (100 ME) — — —
4 0,9 •— — — 0,6 мл (100 ME) — —
5 0,9 — — —- — 0,6 мл (100 ME)
6 (конт- роль) 0,9 о,6
1 В кн.: Руководство по микробиологической диагностике инфекционных болезней.
Под ред. К. И. Матвеева. М.» «Медицина», 1973, с. 377.
приготовляя: а) мазок для окраски по Граму для обнаруже-
ния грамположительных грубых или полиморфных палочек,
среди которых возможно наличие споровых форм; б) препа-.
рат «висячей капли» для выявления активной подвижности
изучаемых микроорганизмов.
3. Биохимические свойства выделенных возбудителей оце-
нивают по способности их при посеве и культивировании в
анаэробных условиях сбраживать углеводы в средах «пест-
рого ряда» Гисса (рец. 44), изменять цвет лакмусового мо-
лока (рец. 49), разжижать питательный желатин (рец. 50)
и свернутую сыворотку (рец. 52) или яичный белок (рец. 53)
(табл. 44).
4. Видовую принадлежность выделенного микроба-анаэро-
ба определяют с помощью биологической пробы на мышах
методом нейтрализации токсинов специфическими противо-
гангренозными сыворотками. Для постановки опыта исполь-
зуют центрифугат 24-часовой культуры, выращенной на среде
Китта—Тароцци и смешанной с антитоксическими сыворотка-
ми Cl. perfringens типа A, Ci. oedematiens типа А и В, С1.
septicum, Cl. histolyticum и Cl. sordellii. Из названных выше
сывороток в соответствии с указанными на этикетке данны-
ми готовят разведения из такого расчета, чтобы в объеме
0,6 мл содержалось по 50 ME антитоксина Cl. perfringens ти-
па A. Cl. oedematiens типов А и В и по 100 ME антитоксинов
Cl. septicum, Cl. histolyticum и Cl. sordellii. Разведенные сы-
воротки в объеме 0,6 мл. смешивают с 0,9 мл центрифугата
256
17 Лабинская А.
Основные ферментативные свойства клостридий
Таблица 44
Название клостридий Протеолитические свойства Сахаролитические свойства Гемолиз иа кровяном агаре Патогенность для животных
желатин свернута я сыворотка свернутый яичный белок индол глюкоза 1 левулеза лактоза галактоза сахароза мальтоза инулин маннит дульцит салицин глицерин крахмал лакмусовое молоко
Cl. perfringens ± ± — — + + + + + "Г — — — ± 4- Свертывание с образованием сгустка Газовая гангре- на
Cl. oedematiens + — — —- + — — — — — — — — — Медленное (не- сколько дней) свертывание + То же
Cl. septicum + — — — + — + — — + — — — + — То же -Г
Cl. histolyticum + + + — Пептонизация + Газовая гангре- на с расплавле- нием мышц
S. sordellii + + + + + — — — — + -- — — __ — То же + Газовая гангре- на
Условные обозначения; + наличие ферментации; — отсутствие ферментации.
культуры микробов-анаэробов (исследуемый токсин). Приго-
товленную таким образом смесь выдерживают 40 мин при
температуре 20 °C в темном месте и затем вводят 2 мышам
по 0,5 мл внутривенно (табл. 45).
Результаты биологической пробы учитывают в ближай-
шие 3 сут, чаще всего в первые 5—6 ч, по действию гомоло-
гичной антитоксической сыворотки, нейтрализующей токсин.
Действие ее определяется по выживанию одной пары под-
опытных животных при гибели контрольных мышей, получив-
ших токсин без антитоксической противогангренозной сыво-
ротки, а также по заболеванию и гибели всех остальных под-
опытных животных вследствие несоответствия исследуемого
токсина противогангренозной антитоксической сыворотке.
ВОЗБУДИТЕЛЬ БОТУЛИЗМА
Ботулизм — тяжелая пищевая токсикоинфекция, возника-
ющая в результате употребления в пищу продуктов, зара-
женных клостридиями ботулизма или загрязненных ботули-
ническим токсином. Cl. botulinum вырабатывает экзотоксин
различных типов. В патологии человека имеют значение кло-
стридии ботулинуса, вырабатывающие экзотоксины типов А,
В, С и Е. Отличаясь специфичностью, каждый тип токсина
нейтрализуется антитоксинами соответствующего типа.
Лабораторный диагноз заболевания, подозрительного на
ботулизм, ограничивают обычно постановкой биологической
пробы для обнаружения в исследуемом материале ботулини-
ческого токсина.
Биологическая проба и реакция нейтрализации токсина.
Для постановки биологической пробы используют материал,
полученный у больного, рвотные массы, промывные воды же-
лудка, кровь, материал от трупа и пищевые продукты, подо-
зреваемые как причина отравления.
Из глубины продуктов, поступивших на исследование, вы-
резают несколько кусочков. Содержимое консервных банок
извлекают из участков, расположенных ближе к центру. Вы-
резанные кусочки тщательно растирают в ступке с двойным
объемом изотонического раствора хлорида натрия (соленые
продукты растирают в дистиллированной воде). Приготовлен-
ную взвесь оставляют при комнатной температуре на 2 ч для
экстрагирования токсина. Экстракт центрифугируют, образу-
ющийся прозрачный слой надосадочной жидкости используют
для постановки биологической пробы. Аналогичным образом
подготавливают секционный материал. Промывные воды же-
лудка больного при подозрении на ботулизм сливают в сте-
рильную посуду, а содержащиеся в них частицы пищи поме-
щают в стерильную ступку; тщательно растирают, прибав-
258
ляя небольшие количества промывных вод. Подготовленную
взвесь оставляют на 2 ч при комнатной температуре для экс-
трагирования токсина, затем центрифугируют, используя над-
осадочный слой для постановки биологической пробы. Кровь
вводят без предварительной подготовки.
Техника постановки биологической про-
б ы. Экстракт исследуемого материала делят на две порции.
Одну из них подвергают 30-минутному прогреванию в водя-
ной бане при 100 °C и затем каждую порцию отдельно вво-
дят подкожно или внутрибрюшинно лабораторным животным
(мыши или морские свинки). Мышам массой тела 16—18 г
вводят 1 мл исследуемого экстракта, морским свинкам мас-
сой тела 300—350 г — 3 мл.
Животных выдерживают под наблюдением в течение 10
дней. При наличии токсина ботулинуса в исследуемом мате-
риале животные, получившие негретый экстракт, погибают
на 3—4-е сутки при характерной клинической картине. У мы-
шей развивается парез конечностей, бока вследствие парали-
ча диафрагмы втягиваются, образуя так называемую осиную
талию. У морских свинок даже при легкой степени отравле-
ния наблюдается расслабление всей мускулатуры: живот-
ные неподвижно лежат на животе. Дыхание, вначале учащен-
ное, впоследствии становится замедленным. Отмечается за-
держка мочеиспускания. При вскрытии погибших животных
наблюдаются гиперемия внутренних органов, очаги пневмо-
нии в легких, переполнение желудка, мочевого и желчного
пузырей.
При наличии в исследуемом материале токсина ботули-
нуса погибают только те животные, которым вводят негре-
тый материал. Животные, получившие прогретый экстракт,
не погибают, так как под действием высокой температуры
токсин инактивируется.
Нейтрализация токсина антитоксином позволяет
определить наличие в исследуемом материале токсина и его
типовую принадлежность, что очень важно для назначения
специфического лечения. Для постановки реакции нейтрали-
зации необходимы:
1. Антиботулиничсские сыворотки типов А, В, С, Е (исхо-
дя из титра, обозначенного на этикетке, содержимое ампулы
разводят изотоническим раствором хлорида натрия так, что-
бы в 1 мл приготовленного разведения содержалось 100—
200 ME).
2. Экстракт, приготовленный из исследуемого материала'
или испытуемая кровь. Разливают их в 5 пробирок по 1 мл.
Затем в первые 4 пробирки прибавляют по 1 мл противобо-
тулинических сывороток типов А, В, С, Е. В 5-ю (контроль-
ную) пробирку прибавляют 1 мл нормальной сыворотки. По-
сле добавления сыворотки пробирки ставят в термостат на
17*
259
30 мин для нейтрализации токсина антитоксином. Затем
смесь из каждой пробирки вводят 2 мышам по 1 мл подкож-
но. Каждую пару мышей метят соответственно номеру про-
бирки, из которой была взята жидкость. Результаты реакции
учитывают на 4—5-е сутки после введения материала. При
наличии в исследуемом материале ботулинического токсина
выживает только одна пара мышей вследствие нейтрализа-
ции токсина антитоксической сывороткой соответствующего
типа. Таким образом, тип ботулинического токсина определя-
ется типом сыворотки, которая нейтрализовала его действие.
ЗООНОЗЫ
Группу зоонозных инфекций составляют чума, туляремия,
бруцеллез, сибирская язва.
К бактериологической диагностике этих заболеваний до-
пускаются только врачи и лаборанты, прошедшие специаль-
ную подготовку для работы с особо опасными инфекциями.
При проведении бактериологических исследований, свя-
занных с диагностикой перечисленных выше зоонозов, соб-
людаются меры предосторожности, регламентированные дей-
ствующей инструкцией о режиме работы с материалом, за-
раженным или подозрительным на зараженность чумой, ту-
ляремией, бруцеллезом и сибирской язвой.
ВОЗБУДИТЕЛЬ ЧУМЫ
Чума (возбудитель Jersinia pestis) относится к карантин-
ным особо опасным инфекциям, поэтому бактериологическая
диагностика ее допускается только в специальных противо-
чумных учреждениях, где режим гарантирует персонал лабо-
ратории от заражения. К числу мероприятий, обеспечиваю-
щих полную безопасность работы с материалом, зараженным
или подозрительным на зараженность возбудителями чумы,
относятся надежная текущая и заключительная дезинфекция,
правильное хранение заразного материала, допуск к нему
только лиц, овладевших техникой работы с чумным материа-
лом, обязательное ношение противочумного костюма при взя-
тии патологического материала и его исследовании. Проти-
вочумный костюм состоит из комбинезона, сапог, резиновых
перчаток и полотенца, смоченного дезинфицирующим раство-
ром (находится за поясом с правой стороны). На голове ка-
пюшон с завязками, на глазах — очки-консервы шоферские
или авиационные, на лице — ватно-марлевая маска, скрыва-
ющая нос, рот и подбородок. Поверх костюма надевается
медицинский халат.
Взятие материала у больного с подозрением на чуму. Вы-
бор материала для бактериологического исследования на чу-
260
му определяется клинической формой заболевания. При бу-
бонной и кожно-бубонной форме чумы берут пунктат из бу-
бона, при наличии выраженного отека вокруг бубона — пунк-
тат из отечной жидкости, содержимое везикул, пустул, кар-
бункулов. Тканевую жидкость насасывают в иглу шприца
в количестве не более 1—2 капель. При легочной форме чу-
мы исследуют мокроту. В случае подозрения на септическую
форму чумы берут кровь. Из взятой крови непосредственно
у постели больного делают 2—3 мазка и производят посев
1—2 капли крови на чашки с агаром и 3—5 мл в 200 мл
бульона. При вскрытии трупов людей, умерших от заболева-
ния, подозрительного на чуму, для бактериологического ис-
следования берут легкие, печень, селезенку, лимфатические
узлы, кровь, участки кожи с какими-либо изменениями (кро-
воизлияния, пустулы, карбункулы, язвы и т. д.). При развив-
шемся гниении трупа выпиливают кусочек трубчатой кости и
1—2 кусочка костей с миелоидной тканью (грудина, ребра).
Весь собранный материал укладывают в широкогорлые
банки с притертыми пробками и очень тщательно упако-
вывают.
Шприц с тканевой жидкостью опускают в пробирку и за-
крывают ее ватно-марлевой пробкой. Чашки, флаконы с по-
севами, склянки с патологическим и трупным материалом
заворачивают в марлевую салфетку, смоченную 5% раство-
ром карболовой кислоты, помещают в бюкс и опечатывают.
При пересылке материала на дальние расстояния, особенно
в жаркое время года, материал для консервации рекоменду-
ется помещать в смесь Берлина и Башевой (рец. 121) или в
жидкость Брока (рец. 122). Исследуемый материал пересы-
лают на ближайший противочумный пункт с врачом или ла-
борантом на специально выделенном транспорте. Материал
сдают под расписку. К каждой отсылаемой пробе прилага-
ют направление с указанием всех необходимых сведений
о ней.
Микробиологический диагноз чумы. Материал, подозри-
тельный на чуму, подвергают бактериоскопическому, бакте-
риологическому и биологическому исследованию. Диагноз
первых случаев заболевания чумой должен быть обязатель-
но подтвержден выделением и идентификацией выделенного
возбудителя болезни.
Первый день. 1. Из патологического материала, по-
ступившего для исследования на чуму, готовят несколько пре-
паратов-мазков и фиксируют их 20 мин смесью Никифорова
с последующим обязательным сжиганием спирта на стекле.
Один мазок окрашивают метиленовым синим, другой — по
Граму. Обнаружение в мазке беспорядочно расположенных
грамотрицательных палочек овоидной формы, концы которых
окрашены более интенсивно, чем центральная часть (бипо-
261
лярная окраска), при соответствующих клинических и эпи-
демиологических данных позволяет поставить предваритель-
ный диагноз чумы.
2. Жидкий патологический материал — кровь, тканевую
жидкость из бубона, мокроту засевают без предварительной
подготовки в мясо-пептонный бульон и на мясо-пептонный
агар. Материал, полученный в небольшом количестве, на-
пример жидкость из бубона, предварительно разводят
в 0,3—0,5 мл мясо-пептонного бульона, насасывая его
в шприц.
На простых питательных средах бактерии чумы размно-
жаются только при высокой посевной дозе (не менее 10 000
микробных тел) в исходном материале.
Значительно лучшие результаты были достигнуты при ис-
пользовании агара Мартина (рец. 41) или агара, приготов-
ленного на бульоне Хоттингера (рец. 37) с добавлением сти-
муляторов роста: сульфита натрия, лизированной крови, при-
готовленной ex tempore, перевара Филдса (рец. 123), сти-
мулятора Карпзиди (фильтрат сарцин) или манифестатора
Покровской (фильтрат культур В. mesentericum siscus). Для
подавления роста посторонней микрофлоры к среде добав-
ляют генциан фиолетовый. Лучшей средой для выделения
чумного микроба из любого материала является агар
Хоттингера с сульфитом натрия и генцианом фиолетовым-
(pH 7,2).
Из трупного материала готовят суспензию в изотониче-
ском растворе хлорида натрия и засевают ее на среду с геп-
цианом фиолетовым Туманского (рец. 124), которая стимули-
рует рост чумной палочки и подавляет развитие гнилостных
бактерий.
Выращивание бактерий чумы производят при температуре
28—30 °C в течение 12—24 ч.
Второй день. 1. Просматривают посевы. На поверхно-
сти плотной питательной среды бактерии чумы образуют ко-
лонии круглой формы, слегка выпуклые. Центральная часть
колонии, возвышающаяся над поверхностью питательной сре-
ды, более плотная, серовато-белого цвета. Вокруг нее имеет-
ся хорошо заметная, очень нежная, почти прозрачная фестон-
чатая кайма беловатого цвета.
В пробирках с мясо-пептонным бульоном отмечается рост
в виде хлопьев, взвешенных в совершенно прозрачной среде
с рыхлым осадком на дне пробирки. При длительном стоянии
посевов на поверхности среды образуется нежная пленка, от
которой в глубь среды отходят отростки, получившие назва-
ние «чумных» сталактитов.
2. Из бульонной культуры выделенного микроба готовят
мазок и окрашивают его по Граму. Биполярно окрашенные-
палочки чумы при росте в бульоне образуют цепочки.
262
’ 3. Из колоний, типичных для бактерий чумы, берут пет-
лей небольшое количество материала, пересевают его на ско-
шенный мясо-пептонный агар для накопления чистой куль-
туры.
Выделенные бактерии чумы важно дифференцировать от
палочки псевдотуберкулеза (табл. 46), так как по своим
морфологическим и культуральным признакам они очень по-
хожи.
В целях * дифференциации ставят пробу с бактериофагом.
Исследуемой культурой микроба засевают поверхность мясо-
пептонного агара для получения газонного роста. После под-
сыхания на засеянную среду наносят 1 каплю чумного бак-
териофага и наклоняют чашку для ее стекания. Посевы ста-
вят в термостат при 28 °C на сутки.
Третий день. 1. Просматривают посевы, сделанные на-
кануне. На поверхности скошенного мясо-пептонного агара
бактерии чумы образуют нежный налет серовато-белого цве-
та, плохо смачивающийся изотоническим раствором хлорида
натрия.
2. При положительной реакции с бактериофагом на фоне
сплошного микробного роста остается стерильная дорожка
в месте нанесения и стекания бактериофага.
3. Чистую культуру микроба, выращенную на скошенном
мясо-пептонном агаре, пересевают: а) на среду Бессоновой
с рамнозой (рец. 126); б) на голоднокислый агар по Бессо-
новой (рец. 125); в) на скошенный мясо-пептонный агар для
определения подвижности бактерий, выращенных при 18—
20°C; г) в лакмусовое молоко для наблюдения за изменени-
ем реакции среды в процессе роста.
Четвертый день. 1. Просматривают посевы, сделан-
ные на среду с рамнозой и лакмусовым молоком. Бактерии
чумы в отличие от бактерий псевдотуберкулеза не сбражива-
ют рамнозу и вызывают медленное подщелачивание лакмусо-
вого молока.
2. На голоднокислом агаре Бессоновой бактерии чумы не
растут.
3. В «висячей капле», приготовленной с агаровой культу-
рой, выращенной при 18—20 °C, бактерии неподвижны (см.
табл. 46).
Биологическую пробу на морских свинках ставят
в первый день исследования, используя для заражения жи-
вотных часть патологического материала, оставшуюся от
микроскопирования и посева. Заражают морских свинок раз-
личными способами в зависимости от характера патологиче-
ского материала. Материал, содержащий постороннюю мик-
рофлору, например мокроту, загнивший материал, получен-
ный от трупа, втирают в скарифицированную кожу живот-
ного. Для этого на участке кожи разменом 5—6 см2, пред-
263
Таблица 46
Дифференциально-диагностические признаки возбудителей чумы
и псевдотуберкулеза
Признак Чума Псевдотуберкулез
Форма колонии Выпуклые, шероховатые, большей частью с рез- ко отграниченной от центра каемкой Мутноватые, хромоген- ные (типичные штам- мы) Выпуклые, шероховатые с нерезко отграничен- ной от центра каемкой, полупрозрачные, ахро- могенные
Подвижность Неподвижные Подвижность выявляется при выращивании куль- туры при .20 °C
Посевная доза (минимальная) Несколько тысяч клеток Несколько десятков кле- ток
Рост на голоднокис- Отсутствует Наблюдается
лом агаре Бессоно- вой
Патогенность для ла- Убивает морских свинок Убивает морских свинок,
бораторных живот- и крыс с характерными реже крыс. У свинок
ных изменениями при подкожном зара- жении в типичных слу- чаях узелки в печени и селезенке, при вну- трибрюшинном зара- жении утолщение саль- ника, палет на кишках
Отношение к чумному Лизируется до титра Как правило, не лдзи-
бактериофагу (кроме измененных ва- риантов) руется
Отношение к псевдо- Пе лизируется Лизируется
туберкулезному фа- гу
Изменение • лакмусо- Медленное ощелачивание Быстрое ощелачивание
вого молока (исход- ный pH 5,7)
Рост на среде Бессо- новой с рамнозой Редко с образованием кислоты С кислотообразованнем
назначенном для заражения, выбривают или выщипывают
шерсть. Место заражения протирают стерильным изотониче-
ским раствором хлорида натрия, снимают скальпелем по-
верхностный слой эпидермиса, наносят па него исследуемый
патологический или секционный материал и втирают шпате-
лем в течение 2—3 мин под прикрытием крышки от чашки
Петри. Материал, не содержащий посторонней микрофлоры
(кровь, тканевая жидкость), вводят под кожу внутренней
поверхности бедра, нижней части живота или внутрибрюшин-
но. Свинки, зараженные внутрибрюшинно, погибают обычно
264
через 2—3 дня, зараженные подкожно — спустя 3—7 дней,
через кожу посредством втирания — через 7—9 дней.
У свинок, погибших в первые 2—4 дня при внутрибрю-
шинном заражении, отмечают геморрагический или серозно-
геморрагический выпот в брюшную полость, гиперемию лег-
ких, печени и селезенки.
При заражении подкожном и посредством втирания в ме-
сте введения материала обнаруживают резко выраженную
инъекцию подкожных сосудов, геморрагический инфильтрат,
увеличение регионарных, т. е. ближайших, лимфатических
узлов, инфильтрацию окружающей ткани. Лимфатические уз-
лы на разрезе геморрагичны, красного цвета. Если животное
не погибает до 5—7-го дня, его забивают. В месте введения
материала обнаруживают гнойно-некротический инфильтрат,
регионарные лимфатические узлы сильно увеличены и спая-
ны с окружающей тканью. Селезенка и печень увеличивают-
ся и содержат большое количество некротических узелков.
В мазках из экссудата и крови, в отпечатках из внутренних
органов в типичных случаях, если гибель свинок наступает
в первые 5 сут после заражения, находят большое количест-
во грамотрицательных биполярно окрашенных палочек.
ВОЗБУДИТЕЛЬ ТУЛЯРЕМИИ
Бактерии туляремии (Francisella tularensis) возбудители
острого заразного заболевания, которое в зависимости от
пути заражения и места внедрения возбудителя может да-
вать различные клинические проявления.
Работа с подозрительным на заражение Fr. tularensis ма-
териалом и культурами Fr. tularensis требует такой же осто-
/ рожности, как и работа с возбудителем чумы. Поэтому ее
выполнение разрешается только в специальных лаборатори-
ях, где режим обеспечивает безопасность работы с возбуди-
телями особо опасных инфекций.
Лабораторный диагноз заболевания, подозрительного на
туляремию, ставят на основании реакции агглютинации, ре-
акции пассивной гемагглютинации и результатов постановки
биологической пробы.
Бактериологический метод, предусматривающий посев
исследуемого материала на искусственные питательные среды
с целью выделения и идентификации чистой культуры возбу-
дителя, в диагностике туляремии не находит применения.
Серологический диагноз туляремии. Вполне падежным
методом диагностики туляремии является двукратное иссле-
дование сыворотки больного в реакции агглютинации с туля-
ремийным диагностикумом. Развернутую реакцию
агглютинации ставят общепринятым методом (с. 118)
с разведениями сыворотки от 1 :50 до 1 : 1600 и выше, исполь-
265
зуя в качестве антигена готовый туляремийный диагностикум.
Реакция сопровождается постановкой контролей: 0,5 мл ан-
тигена и 0,5 мл изотонического раствора хлорида натрия
(контроль антигена) и исходное разведение сыворотки без
добавления антигена (контроль сыворотки).
Результаты учитываются по четырехкратной системе по-
сле 2 ч выдерживания пробирок в термостате и 18—20 ч при
комнатной температуре. Для определения титра агглютини-
нов в динамике кровь больного рекомендуется исследовать в
конце 2-й недели заболевания, затем спустя 7—10 дней. Диа-
гностическим титром является титр сыворотки 1:100 при
условии, что в течение болезни он увеличивается в 2 раза
или больше.
Более чувствительным методом диагностики туляремии
служит реакция пассивной гемагглютинации,
дающая положительный результат с конца 1-й недели забо-
левания. Реакцию ставят объемным способом в полистеро-
ловых пластинах с лунками. Перед постановкой реакции ис-
следуемые сыворотки инактивируют прогреванием при 56 °C
в течение 30 мин и истощают бараньими эритроцитами (см.
с. 103). Из инактивированной сыворотки готовят ряд после-
довательных двукратных разведений (от 1:10 до 1 :2560) на
изотоническом растворе хлорида натрия с 1% нормальной
кроличьей сыворотки. Приготовленные таким образом разве-
дения разливают в лунки пластин по 0,5 мл. В качестве анти-
гена используют туляремийный эритроцитарный диагно-
стикум, представляющий собой взвесь консервированных
формалином бараньих эритроцитов, сенсибилизированных ту-
ляремийным антигеном. К каждому разведению сыворотки
прибавляют по 1 капле 2,5% взвеси диагностикума.
Постановка реакции сопровождается 4 контролями:
1) испытуемая сыворотка, взятая в наименьшем разведе-
нии, с добавлением несенсибилизированных эритроцитов;
2) контрольная туляремийная сыворотка с добавлением
сенсибилизированных эритроцитов;
3) контрольная туляремийная сыворотка с добавлением
несенсибилизированных эритроцитов;
4) растворитель сыворотки (изотонический раствор хлори-
да натрия с 1 % нормальной кроличьей сыворотки и сенси-
билизированными эритроцитами).
Пластинки выдерживают 2 ч при комнатной температуре
и 18 ч в рефрижераторе, после чего приступают к учету ре-
зультатов реакции (см. с. 126). Гемагглютинационный титр
сыворотки больных туляремией достигает разведения 1:2800
и выше.
Экспериментальное заражение животных. Отделяемое язв,
пунктат из пораженного лимфатического узла, слизь, снятую
с миндалин и слизистых оболочек зева, вносят в пробирку
266
-с I—1,5 мл изотонического раствора и тщательно размешива-
ют (кровь больного разводят вдвое изотоническим раствором
хлорида натрия, из секционного материала готовят эмульсию
в изотоническом растворе хлорида натрия). Подготовленный
таким образом материал вводят подкожно в количестве
0,5 мл 3—5 белым мышам.
Четвертый (5—10-й) день. 1. Гибель мышей при
массивной зараженности введенного материала наступает на
4—5-е сутки, при небольшом количестве введенных микро-
бов—на 6—10-е сутки. Выживших мышей умерщвляют на
15-й день после заражения. У белых мышей, погибших от ту-
ляремии, имеются характерные патологоанатомические изме-
нения: в месте введения материала плотный инфильтрат, уве-
личение и уплотнение регионарных (расположенных наибр-
лее близко к месту заражения) лимфатических узлов. Внут-
ренние органы (селезенка, печень) уплотнены и гипереми-
рованы.
2. Из органов вскрытого животного делают два мазка-от-
печатка. Один из них окрашивают по Граму, другой — по Ро-
мановскому— Гимзе для обнаружения возбудителя туляре-
мии. Бактерии туляремии имеют грамотрицательную окраску.
При окрашивании по Романовскому — Гимзе приобретают
красно-фиолетовый цвет. В мазках из органов животных на-
ряду с мелкими овоидными палочками обнаруживается боль-
шое количество кокков.
3. Материал из печени и селезенки высевают на скошен-
ную поверхность свернутой желточной среды Мак-Коя (рец.
127), прикладывая свежесрезанную поверхность кусочка ор-
гана к среде последовательно, начиная с нижней части про-
бирки. Посевы ставят в термостат при 37 °C.
Пятый (6—10-й) день. Признаки роста бактерий туля-
ремии при обилии их в исследуемом материале появляются
через 18—24 ч. При незначительном количестве засеянных
микробов рост бактерий становится заметным на 3—5-е сут-
ки. Колонии этих бактерий на свернутой желточной среде
мелкие (1—1,5 мм в диаметре), блестящие, выпуклые, с ров-
ным краем. При обилии туляремийных бактерий на поверх-
ности среды появляется бесцветный блестящий налет.
Для идентификации выделенного микроба с бактериями
туляремии из микробной культуры, выращенной на желточ-
ной среде Мак-Коя, производят высев: а) в 3 пробирки для
накопления чистой культуры; б) в 1 пробирку на скошенный
мясо-пептонный агар. Посевы помещают в термостат и инку-
бируют при 37 °C в течение 1—2 сут.
Седьмой (8—9-й) день. 1. Из культуры микроба, вы-
ращенной на свернутой желточной среде, делают мазки, ок-
рашивают их по Граму или по Романовскому — Гимзе для оп-
ределения чистоты культуры.
267
2. Просматривают посевы, сделанные на мясо-пептонном
агаре и мясо-пептонном бульоне.
3. Для определения видовой принадлежности культуру
выделенного микроба (5-миллиардная микробная взвесь) ис-
пытывают в реакции агглютинации с туляремийной диагно-
стической сывороткой титром не менее I : 20 000. Микробную
массу для постановки реакции снимают с поверхности жел-
точной среды бактериальной петлей и суспендируют в изото-
ническом растворе хлорида натрия. Смывать налет микроб-
ного роста не рекомендуется, так как при этом в суспензию
попадают частицы желточной среды, затрудняющие в даль-
нейшем учет результатов реакции агглютинации. Положи-
тельным результатом считается агглютинация микробов до
2/з титра агглютинирующей сыворотки.
Идентификация бактерий туляремии основывается на со-
вокупности следующих признаков: характерной морфологии
и окраске микробных клеток в мазках, специфичности мик-
робного роста на свернутой желточной среде Мак-Коя, отсут-
ствии роста на мясо-пептонном агаре, агглютинации микроба
специфической туляремийной сывороткой, патогенности бак-
терий в отношении белых мышей с воспроизведением типич-
ной патологоанатомической картины.
ВОЗБУДИТЕЛЬ БРУЦЕЛЛЕЗА
Бруцеллы вызывают у человека инфекционное заболева-
ние— бруцеллез, или мальтийскую лихорадку, с чрезвычайно
полиморфной клинической картиной, затрудняющей диагноз
болезни. Бруцеллы подразделяются на три типа: возбудитель
инфекционного аборта коз и овец — Brucella melitensis, возбу-
дитель бруцеллеза крупного рогатого скота — Br. abortus bo-
vis и возбудитель бруцеллеза свиней — Вг. suis.
Материал для бактериологического исследования. Иссле-
дуют мочу, кровь, костный мозг, получаемый в условиях ста-
ционара посредством пункции костного мозга. Для установ-
ления посмертного диагноза берут кровь, материал из селе-
зенки, лимфатических узлов, в которых бруцеллы локализу-
ются наиболее постоянно. По эпидемическим показаниям бак-
териологическому исследованию на содержание бруцелл под-
вергаются молоко и молочные продукты.
Лабораторный диагноз заболевания ставят на основании
серологических методов исследования — реакции агглютина-
ции Райта и Хеддлсона. Проведение бактериологического ис-
следования с выделением чистой культуры высококонтагиоз-
ных бруцелл допускается в лабораториях, где предусмотре-
на возможность работы с возбудителями особо опасных ин-
фекций.
Серологическая диагностика бруцеллеза. Реакция Хед-
длсона. Реакция Хеддлсона представляет собой ускореи-
268
ный метод диагностики бруцеллеза, отличающийся высокой
специфичностью. Ингредиенты реакции: совершенно прозрач-
ная сыворотка больного, исследуемая на бруцеллез, антиген
Хеддлсона — убитые нагреванием окрашенные кристалличе-
ским фиолетовым или бриллиантовым зеленым бруцеллы,
взвешенные в 12% карболизированном растворе хлорида нат-
рия, в концентрации 10 млрд, микробных тел в 1 мл.
Техника постановки реакции Хеддлсона.
На чистую, хорошо обезжиренную стеклянную пластинку
размером 20x12 см наносят микропипеткой 4 дозы исследуе-
мой сыворотки: 0,04; 0,02; 0,01; 0,02 мл. В первые 3 капли
прибавляют антиген Хеддлсона в количестве 0,03 мл. Чет-
вертая капля является контролем, обязательным для каж-
дой исследуемой сыворотки. К ней прибавляют 0,03 мл 12%
раствора хлорида натрия. Различные дозы сыворотки берут
нс для определения ее агглютинационного титра, а для соз-
дания и выявления наиболее оптимальных соотношений ан-
тител с антигеном, позволяющих с достоверностью опреде-
лить результат реакции. В отдельной капле ставят контроль
антигена: 0,03 мл антигена, смешанного с 0,03 мл изотониче-
ского раствора хлорида натрия. Капилляром запаянной пи-
нетки смешивают сыворотку с антигеном, переходя от малой
к большой дозе сыворотки. Через Р/г-—2 мин просматривают
контроль и учитывают результаты. Контроль сыворотки и
контроль антигена должны быть гомогенны, без. каких-либо
признаков образования хлопьев.
При положительной реакции Хеддлсона, отмечаемой + +
или + + +, в дозах сыворотки 0,02—0,01 мл в течение пер-
вых минут происходит полное просветление жидкости с об-
разованием хорошо различимых хлопьев, располагающихся
по периферии капли. При сомнительных результатах реакции
(±) агглютинация появляется только в дозе 0,04 мл. В этих
случаях реакцию следует повторить через 7—10 дней.
Реакция Хеддлсона оказывается положительной с 1-й не-
дели заболевания, однако, будучи качественным методом, не
позволяет определить агглютинационный титр сывороток, ис-
следуемых на бруцеллез.
Реакция агглютинации Райта. Обладая высокой
специфичностью, реакция Райта, как правило, дает положи-
тельный результат со 2-й недели заболевания и сохраняется
на протяжении первого года болезни, а затем титр ее начи-
нает снижаться. Реакцию Райта рекомендуется ставить с сы-
воротками, положительно реагирующими в реакции Хеддлсо-
на. Для постановки реакции необходимы:
1) прозрачная сыворотка больного, подлежащая исследо-
ванию;
2) диагностикум — формализированный антиген, который
перед употреблением разводят изотоническим раствором
269
хлорида натрия так, чтобы в 1 мл его содержался 1 млрд,
бруцелл (институт вакцин и сывороток имени И. И. Мечни-
кова в Одессе выпускает единый цветной бруцеллезный диа-
гностикум, применяемый для реакций Райта и Хеддлсона).
Реакцию Райта ставят по принципу реакции агглютина-
ции (см. с. 118). Результаты реакции учитывают по общепри-
нятой четырехкрестной системе после выдерживания проби-
рок в термостате в течение 18—20 ч.
При просмотре пробирок иногда обнаруживается такое
же явление, как и в реакции Хеддлсона: положительному ре-
зультату реакции в разведении сыворотки 1 :200 или выше
предшествует отрицательный или слабоположительный ре-
зультат. Результат реакции оценивают следующим образом:
положительная реакция агглютинации при титре 1 :50—1: 100
признается сомнительной, при титре 1:200—1:400 — поло-
жительной, 1 : 1000 и выше — резко положительной.
Бактериологический диагноз бруцеллеза. При бактериоло-
гической диагностике бруцеллеза необходимо иметь в виду,
что Br. melitensis и Br. suis хорошо размножаются в аэроб-
ных условиях, тогда как для выращивания Br. abortus bovis
требуется повышенное содержание углекислого газа. Поэтому
каждый образец материала, поступающего в лабораторию
для исследования на бруцеллез, выращивают параллельно в
обычных аэробных условиях и при повышенном содержании
углекислоты. Для этого на дно эксикатора (на каждый литр
объема сосуда) насыпают 0,4 г бикарбоната натрия и нали-
вают 0,35 мл концентрированной хлористоводородной кис-
лоты. После внесения чашек Петри и пробирок с посевами
эксикатор закрывают крышкой и слегка наклоняют, соеди-
няя бикарбонат натрия с кислотой. В пробирках или колбах
повышенное содержание углекислоты создается поджигани-
ем внутреннего конца ватной пробки с последующим протал-
киванием ее в глубь сосуда и заливкой наружно конца
пробки воском или парафином.
Посев крови и костного мозга для выделения •
бруцелл рекомендуется проводить по методу Кастенеды. Для
посева крови пользуются прямоугольными флаконами емко-
стью 100 мл ,в которые разливают по 20 мл питательного
агара. После стерилизации флаконы кладут так, чтобы сре-
да распределилась и застыла равномерным слоем на поверх-
ности одной из граней флакона. После этого во флаконы вно-
сят стерильный печеночный бульон или бульон Мартена (рец.
40) в количестве 15—20 мл. В каждый флакон засевают по
5—10 мл крови. Для того чтобы она не свернулась в жид-
кую питательную среду, прибавляют 0,5% цитрата натрия.
Посев костного мозга производят в пробирки со скошен-
ным агаром и тем же печеночным или мартеновским буль-
оном. Для выделения миелокультур в пробирки с 5—7 мл
270
жидкой среды вносят несколько капель исследуемого костно-
го мозга. Посевы инкубируют в термостате при 37°C парал-
лельно в аэробных условиях и в условиях повышенного со-
держания углекислого газа.
Пятый (5—15-й) день. Каждые 5 дней из колб с посе-
вами делают высевы на агар Мартена (рец. 41), печеночный
агар (рец. 128) или глюкозо-глицериновый агар (рец. 129),
разлитый толстым слоем в чашки Петри.
Рост бруцелл на искусственных питательных средах при
посеве патологического материала появляется в редких слу-
чаях на 7-й, значительно чаще на 15-й день, а в некоторых
случаях на 30-е сутки.
Идентификация бруцелл. Первый день. 1. Посевы,
сделанные на плотные питательные среды, просматривают
ежедневно, начиная с 5-го дня инкубации в термостате. Куль-
туральные признаки для всех типов бруцелл совершенно оди-
наковы: а) на плотной питательной среде колонии правиль-
ной круглой формы, выпуклые, диаметром от 1 до 3 мм, про-
зрачные в проходящем и матово-белые в падающем свете;
структура колоний гомогенная или нежно-зернистая; б) в
жидкой питательной среде бруцеллы вызывают равномерное
помутнение.
2. Из культур с жидких и плотных питательных сред го-
товят мазок для окраски по Граму и препарат «висячей кап-
ли» для определения подвижности. В препарате, окрашенном
по Граму, бруцеллы имеют вид грамотрицательных, беспоря-
дочно расположенных бактерий палочковидной, овоидной или
шаровидной формы. В препарате «висячей капли» активного
движения бактерий не наблюдается.
3. Несколько колоний с признаками, характерными для
бруцелл, высевают в 3—5 пробирок с печеночным или глю-
козо-глицериновым агаром для получения чистой культуры.
Третий день. 1. Просматривают 2-суточный рост куль-
туры на скошенном печеночном или глюкозо-глицериновом
агаре (при повторных высевах культуры бруцелл на искус-
ственных питательных средах растут более быстро, чем при
выделении их из патологического материала). На поверхно-
сти скошенного агара бруцеллы растут в виде густо распо-
ложенных мелких колоний или сплошного налета с оттенком
сероватого цвета.
2. Для определения видовой принадлежности выделенную
культуру, испытывают в развернутой реакции агглютинации
со специфическими противобруцеллезными сыворотками.
Учет и регистрацию результатов производят после 18—20-ча-
сового выдерживания пробирок в термостате. Выделенные
культуры можно отнести к бруцеллам, если они агглютини-
руются специфической противобруцеллезной сывороткой, раз-
веденной не менее чем на 2/з ее титра.
27Г
3. Вторым тестом, рекомендуемым для идентификации вы-
деленных культур с бруцеллами, является проба на лизируе-
мость культуры поливалентным бруцеллезным фагом. Глю-
козо-глицериновый или мартеновский агар (1,2—1,5%, pH 7,2)
разливают в две чашки Петри толстым слоем. После подсы-
хания поверхность среды каждой чашки засевают 0,1 мл ис-
следуемой микробной взвеси, содержащей от 500 млн. до
1 млрд, микробных тел в 1 мл. Исследуемую культуру рас-
пределяют шпателем для получения газонного роста. На се-
редину чашки наносят 1 каплю бактериофага. В контрольную
чашку бактериофаг не вносят. Посевы инкубируют в термо-
стате при 37 °C в течение 24—48 ч.
Четвертый день. 1. Учитывают результаты реакции
агглютинации. Культуры бруцелл независимо от типовой при-
надлежнстн дают обычно положительную реакцию агглюти-
нации до 2/з или до полного титра противобруцеллезной сы-
воротки.
2. Учитывают лизис бактерий в чашках с бактериофагом.
Если выделенная культура принадлежит к бруцеллам, в ме-
сте нанесения бактериофага на фоне газонного роста микро-
бов обнаруживается более или менее четко выраженная зо-
на отсутствия микробного роста.
Таким образом, для определения принадлежности выде-
ленной культуры к бруцеллам достаточно изучения морфоло-
гических и культуральных свойств, постановки реакции аг-
глютинации со специфической агглютинирующей сывороткой
и лизиса культуры специфическим, поливалентным бруцел-
лезным бактериофагом.
Определение типа бруцелл основано на неодинаковом
действии на бактерии некоторых анилиновых красок. Как
видно из табл. 47, Вг. melitensls растут на средах Мейера и
Цобеля (рец. 130), содержащих основной фуксин и тионин,
Вг. abortus bovis — только в присутствии основного фуксина,
Вг. suis — в присутствии тиопина.
Таблица 47
Основные особенности различных типов бруцелл
Тип бруцелл Условия культивирования < Бактериостатическое действие красок Образова- ние серо- водорода
фуксин 1 : 50 000 ТИОНИН 1 : 25 000
Вт. melitensis Вг. suis Вт. abortus bovis Аэробные Пр и >5—10% СО2 + + + + + - + +
Условные обозначения: 4- наличие роста микробов или образование
сероводорода; — отсутствие микробного роста или сероводорода.
272
ВОЗБУДИТЕЛЬ СИБИРСКОЙ ЯЗВЫ
Бациллы сибирской язвы (Вас. anthracis) вызывают у че-
ловека острое инфекционное заболевание — сибирскую язву,
протекающую в кожной, легочной или кишечной форме.
Материал для исследования иа сибирскую язву. При по-
дозрении на легочную форму сибирской язвы исследуют мок-
роту, на кишечную форму — кал, при кожной форме — сероз-
но-кровянистое содержимое сибиреязвенного карбункула.
При вскрытии трупа человека, умершего от заболевания, по-
дозрительного на сибирскую язву, для бактериологического
исследования берут кровь и селезенку. Пересылка патологи-
ческого и секционного материала, подозрительного на зара-
женность сибиреязвенными бациллами, производится по пра-
вилам работы с особо опасными инфекциями.
Схема микробиологического исследования. Первый
день. 1. Из мокроты и содержимого сибиреязвенного кар-
бункула делают несколько мазков. Один из них окрашивают
по Граму (см. с. 30), другие, для выявления капсул, — по спо-
собу Гинса (см. с. 34). В материале, полученном у больного
сибирской язвой, обнаруживают крупные грубые грамполо-
жительные палочки с обрубленными или втянутыми внутрь
клетки концами. Основанием для постановки диагноза сибир-
ской язвы является содержание в патологическом материале
грамположительных, окруженных капсулой палочек, распо-
ложенных в виде коротких цепочек. Однако капсульная фор-
ма возбудителя встречается, как правило, только в крови
больных в септической фазе заболевания.
2. Материал, поступивший на исследование, засевают на
чашки с мясо-пептонным агаром и в пробирки с мясо-пептон-
ным бульоном (pH срд. 7,2). Посевы инкубируют в термоста-
те при 37°С 18—24 ч.
3. Для выявления способности возбудителя образовывать
капсулы исследуемый материал засевается на сывороточно-
кровяные среды:'Государственного института ,(peix. 131), или
Томова .(рец. 432), или Буза (рец. 133). Инкубация посевов
производится 18—24 ч при 37qC в микроанаэростате в ат-
мосфере 20—40% углекислого газа.
4. С суспензией патологического материала ставят био-
логическую пробу (см. с. '275).
Вт орой день. 1. Просматривают посевы, сделанные
накануне. Бациллы сибирской язвы образуют:
а) на чашках с мясо-пептонным агаром крупные сухие ко-
лонии серовато-белого цвета с неровно очерченным краем,
напоминающим под малым увеличением микроскопа перепле-
тающиеся, опутанные волосы;
б) в бульоне — осадок в виде комочка ваты на дне проз-
рачной среды;
18 Лабинская А. С. 273
в) на средах Томова и ГКИ — гладкие глянцевые колонии
слизистой консистенции (S- и SM-форма);
г) на среде Буза — гладкие слизистой консистенции ко-
лонии, окруженные желто-зеленым ореолом, в отличие от сап-
рофита Вас. cereus, образующего на этой среде зону отчет-
ливо выраженного гемолиза.
2. Выращенные культуры микроскопируют:
а) в «висячей капле» из бульонной культуры палочки не-
подвижны;
б) в мазке, окрашенном по Граму, грамположительны,
располагаются парами и цепочками;
в) в мазках приготовленных со сред ГКИ, Томова или
Буза, встречаются капсульные формы.
3. Колонии, подозрительные на возбудителя сибирской яз-
вы, отсевают на мясо-пептонный агар для получения чистой
культуры.
Третий день. 1. Определяют вирулентность выделен-
ной культуры. С этой целью 2—3 белым мышам с массой те-
ла 18—20 г вводят внутрибрюшинно или подкожно взвесь
бацилл в объеме 0,2 мл. Наблюдение за зараженными жи-
вотными ведут до их гибели, но не более 10 сут. Мыши от
сибирской язвы погибают в конце 1-х или в начале 2-х суток.
Из крови, селезенки и печени погибших животных делают
высев на мясо-пептонный бульон и мясо-пептонный агар и
мазки на предметные стекла, окрашивают их указанным вы-
ше способом и микроскопируют. Нахождение в мазках пало-
чек, окруженных капсулой, дает основание сделать заключе-
ние о специфической патогенности исследуемого микроорга-
низма.
2. С культурой выделенного возбудителя для идентифика-
ции его с бациллой сибирской язвы ставят тест «жемчужного
ожерелья» (метод Йенсена и Клеемейера в модификации
Груз). Для этого в сывороточный бульон с пенициллином
(0,5 ЕД/мл), разлитый в пробирки по 2—3 мл, вносят по 2
капли бульонной или 1 петлю агаровой культуры исследуе-
мого микроорганизма. Посев инкубируют в течение 3 ч при
37°С. После указанного срока из бульонной культуры гото-
вят мазки, фиксируют их жидкостью Корнуа (см. с. 29),
окрашивают метиленовым синим в течение 20—30 с и микро-
скопируют. Бациллы при выращивании в среде с пеницилли-
ном образуют цепочки, состоящие из клеток, шарообраз-
ной формы, напоминающие ожерелье. Вас. cereus и другие
сапрофитные бациллы сохраняют присущую им форму
палочек.
3. Исследуемую культуру проверяют на лизабельность
сибиреязвенным фагом. Для этой цели в чашки Петри раз-
ливают расплавленный и остуженный до 5°С 1,5% мясо-пеп-
тонный агар. После застудневания и подсушивания агара в
274
термостате дно чашек расчерчивают на квадраты (2X2 см).
В каждый квадрат петлей диаметром 5 мм наносят каплю
6-часовой бульонной культуры исследуемого микроорганиз-
ма. После этого чашки подсушивают в течение 30 мин в тер-
мостате и затем в середину каждой подсохшей капли нано-
сят петлей диаметром 2 мм каплю сибиреязвенного фага.
Учет результатов производится через 5—6 ч инкубации посе-
вов при 37°С. При положительном результате на месте нане-
сения фага отмечается лизис колоний.
Постановка биологической пробы при сибирской язве.
Биологическую пробу ставят с суспензией патологического
материала или гомогенатом трупного материала, растертыми
в изотоническом растворе хлорида натрия, в первый день ис-
следования. Исследуемый материал вводят подкожно белым
мышам по 0,1—0,2 мл или морским свинкам по 0,2—0,5 мл.
Зараженные животные находятся под наблюдением в тече-
ние 10 дней. Мыши, заболевшие сибирской язвой, погибают
обычно на 2-й день, а морские свинки — через 2—4 сут. При
вскрытии погибших животных под кожей в месте введения
материала обнаруживают студенистый отек, во внутренних
органах (главным образом в селезенке) наблюдается гипе-
ремия. Из внутренних органов готовят препараты для мик-
роскопирования и при исследовании отмечают наличие в них
типичных для сибирской язвы коротких цепочек из палочек,
окруженных капсулой.
Окончательный бактериологический диагноз сибирской яз-
вы ставится на основании выделения чистой культуры возбу-
дителя, способного образовывать капсулы па сывороточно-
кровяных средах (ГКИ, Сомова, Буза) в атмосфере угле-
кислого газа, лизироваться специфическим сибиреязвенным
фагом, давать феномен «жемчужного ожерелья» при выра-
щивании на среде с пенициллином и обладать специфической
патогенностью.
Постановка реакции преципитации по Асколи. В тех слу-
чаях, когда выделить возбудителя сибирской язвы не удает-
ся, прибегают к реакции преципитации по Асколи с целью
обнаружения антигена сибиреязвенных бацилл. Для поста-
новки реакции необходимы: преципитирующая сибиреязвен-
ная сыворотка, сибиреязвенный стандартный антиген для
контроля (готовят централизованным порядком в институтах
вакцин и сывороток) и антиген из материала, подлежащего
исследованию, подготовленный следующим образом. Исследу-
емый материал (кожа, шкура, шерсть, кусочки органов и
т. д.) заливают изотоническим раствором хлорида натрия из
расчета 10 мл раствора на 1 г материала. (Пробирку ставят
в водяную баню и экстрагируют кипячением на слабом огне
в течение 10—20 мин. Полученный экстракт фильтруют через
бумажный фильтр до полной прозрачности.
18*
275
В три преципитационные пробирки пастеровской пипеткой
наливают по 0,2—0,3 мл преципитирующей сыворотки. В 4-ю
пробирку вливают такое же количество нормальной сыворот-
ки животного, от которого получена преципитирующая сыво-
ротка. Затем в первую пробирку (опытную) по стенке насла-
ивают 0,2—0,3 мл испытуемого экстракта. Во 2-ю пробирку
(контроль преципитирующей сыворотки) добавляют стан-
дартный сибиреязвенный антиген. В 3-ю пробирку /(второй
контроль преципитирующей сыворотки) прибавляют экстракт,
приготовленный из материала, аналогичного тому, из которо-
го приготовлен опытный антиген, ио от заведомо здорового
животного. В 4-ю пробирку .(контроль антигена) к нормаль-
ной сыворотке прибавляют стандартный сибиреязвенный ан-
тиген.
В случае положительной реакции Асколи па границе двух
жидкостей образуется тонкое кольцо молочно-белого цвета.
Такое же кольцо должно быть во 2-й контрольной пробирке.
ВОЗБУДИТЕЛИ КОКЛЮША И ПАРАКОКЛЮША
Бактерии коклюша (Bordetella pertusiss, Борде—Жангу)
вызывают острое заболевание верхних дыхательных путей с
поражением интерстициальной ткани легких и локализацией
в них возбудителя. Коклюш поражает детей преимущест-
венно дошкольного младшего школьного возраста.
Очень сходную с коклюшем клиническую картину заболе-
вания вызывает другой возбудитель, также относящийся к
роду Bordetella,— паракоклюшная палочка В parapertussis.
Коклюш и паракоклюш — два самостоятельных заболевания.
Дети, переболевшие коклюшем, могут заразиться и заболеть
паракоклюшем и наоборот. Дифференциальная диагностика
этих заболеваний возможна только на основании бактериоло-
гического исследования, роль которого в последние годы ста-
ла особенно велика в связи с частым появлением атипичных
и стертых форм заболевания, обусловленных массовой про-
филактической иммунизацией детей против коклюша и широ-
ким использованием антибиотиков для лечения этого заболе-
вания.
Материал для лабораторной диагностики коклюша. В пе-
риод болезни возбудители коклюша и паракоклюша находят-
ся на слизистых оболочках дыхательного тракта. Соответст-
венно этому материал для посева и выделения возбудителя
берут с задней стенки глотки и глубоких отделов дыхатель-
ных путей с помощью тампонов — маленьких кусочков ваты,
плотно накрученной на конец тонкой эластичной проволоки.
Брать материал можно через рот и пос. При взятии мате-
риала через рот тампон, слегка согнутый под тупым углом,
276
вводят за мягкое небо и снимают слизь с задней стенки глот-
ки, стараясь при этом не коснуться корня языка и миндалин.
У маленьких детей тампон в носоглотку удобнее вводить че-
рез ноздрю. Эта процедура в большинстве случаев сопровож-
дается приступом кашля, который не препятствует взятию
материала и до прекращения которого удалять тампон из но-
соглотки не следует.
Метод кашлевых пластинок при обследовании на каклюш
не находит широкого применения, так как в последние годы
в результате вакцинации стали преобладать легкие и стертые
формы болезни без характерного спастического кашля.
Схема бактериологического исследования. Первый
день. Для постановки микробиологического диагноза кок-
люша и паракоклюша пользуются посевом исследуемого ма-
териала на казеиново-угольный агар (рец. ПО). Для подав-
ления роста сопутствующих сапрофитических микробов, пре-
пятствующих размножению палочки коклюша, рекомендует-
ся из расчета на 1 мл питательной среды добавлять по 0,25—
0,5 ЕД пенициллина или в поверхность питательной среды за
11/2—2 ч до посева втирать шпателем 0,1 мл раствора пени-
циллина, содержащего 10 ЕД. .Взятый материал круговыми
движениями тампона засевают по краю чашки так, чтобы все
стороны тампона коснулись поверхности питательной среды.
В центре чашки тампоном наносят штрихи. Этим же тампо-
ном делают точно такой же посев на вторую чашку с пита-
тельной средой. Нанесенные в центре чашки штрихи расти-
рают для получения изолированных колоний шпателем, от-
дельным для каждой чашки. Чашки с посевами помещают в
термостат вверх дном. Обязательным условием культивирова-
ния коклюшных палочек является достаточная влажность в
термостате, достигаемая путем помещения в пего открытого
сосуда с водой. Оптимальная температура роста для коклюш-
ных палочек 36°iC ,(±1°).
Третий и четвертый дни. 1. После 2—3-суточного
инкубирования чашки с посевами вынимают и просматрива-
ют с лупой X 10, выявляя колонии, характерные для коклю-
ша и паракоклюша.
Рост В. pertusiss на казеиново-угольном агаре появляется
обычно через 70—80 ч инкубации. Колонии бактерий коклю-
ша мелкие (0,5—1 мм в диаметре), выпуклые, блестящие,
четко контурированные, с блестящей поверхностью, серовато-
кремового цвета, по консистенции напоминающие густую сме-
тану. С поверхности питательной среды легко снимаются пет-
лей и легко эмульгируются в изотопичском растворе хлори-
да натрия.
Колонии В. parapertussis по внешнему виду очень похожи
на колонии В. pertussis, но более крупные и появляются уже
через 24 ч после инкубации в термостате.
277
Если на чашках с питательной средой подозрительные ко-
лонии очень малы или единичны и материала для постанов-
ки реакции агглютинации недостаточно, делают пересев с ка-
зеиново-угольной среды на среду Борде—Жангу (рец. 1'11).
2. Из колоний с признаками, характерными для бактерий
коклюша и паракоклюша, берут небольшое количество мате-
риала, готовят на предметном стекле мазки и окрашивают их
по Граму. Бактерии коклюша и паракоклюша представляют
собой короткие овоидной формы палочки, окрашивающиеся
по Граму отрицательно. Располагаются палочки поодиночке,
парами и в редких случаях цепочками.
3. На предметном стекле ставят реакцию агглютинации
выделенной микробной культуры с иммунной противокок-
люшной сывороткой, разведенной 4 : 10 (при титре сыворотки
1 : 10 000). При положительном результате агглютинация бак-
терий наступает почти немедленно, в очень редких случаях —
в течение 5—10 мин; в контрольной капле (изотонический
раствор хлорида натрия) агглютинации не происходит, жид-
кость сохраняет равномерное помутнение.
Вследствие наличия у коклюшных и паракоклюшных бак-
терий общих антигенов паракоклюшная палочка агглютини-
руется коклюшной сывороткой в обычно применяемых для
реакции на стекле разведениях сыворотки.
Для исключения перекрестных реакций в настоящее вре-
мя применяют адсорбированные видоспецифические сыворот-
ки, содержащие антитела к агглютинину 4 (видоспецифиче-
ский для В. pertussis) и к агглютинину 14 (видоспецифиче-
ский для В. parapetrussis).
4. Несколько колоний с признаками, характерными для
бактерий коклюша, пересевают в чашки или на скошенный
агар той же питательной среды, которая использовалась для
выделения возбудителя из патологического материала. Посе-
вы помещают в термостат при 37“С на сутки. При посеве ма-
териала на чашку среду делят па несколько секторов и каж-
дую колонию отсевают в отдельный сектор, тщательно вти-
рая материал в поверхность питательной среды.
5. Для дифференциации коклюшной и паракоклюшной па-
лочек производят высев выделенной культуры на скошенный
мясо-пептонный агар с добавлением 0,4 % тирозина.
Пятый день. 1. Просматривают рост микробов на пи-
тательных средах, засеянных в предшествующий день. Па-
ракоклюшная палочка дает рост на мясо-пептонном агаре и
вырастает уже через 24 ч. Рост коклюшной палочки появля-
ется не ранее чем через 48 ч только на специальных средах.
При просмотре посевов обращают внимание на изменение ок-
раски среды. При обильном росте паракоклюшной палочки
происходит изменение цвета питательной среды. Казеиново-
угольный агар окрашивается диффузно в буровато-коричпе-
278
вый цвет, хорошо заметный в проходящем свете; глицерино-
во-картофельный агар Борде заметно темнеет. При росте кок-
люшной палочки цвет питательных сред не изменяется.
2. Для определения чистоты выделенной культуры готовят
из нее 2—3 препарата, окрашивают их по Граму и микроско-
пируют.
3. Просматривают посевы на мясо-пептонном агаре с ти-
розином. Коклюшная палочка на агаре не растет; рост пара-
коклюшной палочки, сопровождающийся диффузным окра-
шиванием среды в коричневый цвет, появляется в первые
18—20 ч после произведенного посева.
Для окончательной идентификации выделенного микроба
ставят пробу на уреазу. В агглютинационную пробирку на-
ливают 0,3 мл среды Закса (рец. 112), прибавляют 1—2 пет-
ли исследуемой культуры, затем пробирки встряхивают и по-
мещают на 30 мин в термостат. Паракоклюшные бактерии,
продуцирующие уреазу, расщепляют мочевину с образовани-
ем аммиака. Положительная реакция на уреазу проявляется
изменением цвета индикатора (фенолфталеина) в малиново-
красный цвет. Окончательный учет реакции на уреазу произ-
водят через 2 ч.
Таким образом, бактерии коклюша и паракоклюша сход-
ны по морфологии, отношению к окраске по Граму, по куль-
туральным признакам; вступают в перекрестную реакцию аг-
глютинации с агглютинирующими коклюшными и паракок-
люшными сыворотками в низких разведениях. В основу диф-
ференциации их положена способность паракоклюшных пало-
чек расти на простых питательных средах, изменять окраску
питательных сред и расщеплять мочевину с образованием
аммиака (табл. 4'8).
Таблица 48
Основные свойства бактерий коклюша и паракоклюша
Бактерии Срок появления ко- 1 лоний на специаль- ных питательных средах, ч Размер колоний через 72 ч роста, мм Морфология и тннкториальные свойства Реакция агглютинаций на стекле с коклюш- ной агглютинирующей сывороткой Проба на уреазу Рост на мясо-пептон- ном агаре с тирози- ном Изменение цвета питательной среды
Коклюш Паракоклюш 48—72 24-48 1—2 2-4 Грамотрица- тельиые, овоидиые палочки + + 1 + + 1 +
Ответ выдается на 3—5-е сутки. Предварительный поло-
жительный ответ: «Обнаружены микробы, подозрительные на
279
возбудителя коклюша или паракоклюша, исследование про-
должается»— может быть выдан на 3-и сутки. Окончатель-
ный положительный ответ получают на 5-е сутки. Отрица-
тельный ответ: «Коклюшные и паракоклюшные микробы не
обнаружены» — выдают через 5 сут.
ВОЗБУДИТЕЛЬ ДИФТЕРИИ
Дифтерийные палочки (Oorynebacterium diphtheriae) вызы-
вают тяжелое заболевание, поражающее преимущественно
детей. По культуральным и биохимическим свойствам бакте-
рии дифтерии подразделяются на три типа: gravis, mitis, in-
termedins.
Материал для лабораторной диагностики дифтерии опре-
деляется локализацией патологического процесса. Чаще всего
дифтерия поражает слизистые оболочки верхних дыхатель-
ных путей, поэтому для исследования берут одновременно
слизь из зева и носа. При дифтерии носа материал берут из
глубины носовых ходов одним тампоном сначала из здоро-
вой, а затем из пораженной половины носа. Для взятия ма-
териала из зева и носа пользуются разными тампонами.
Пленки и слизь снимают сухим тампоном на границе налета
и непораженной ткани. Для получения большого количества
материала тампон поворачивают вокруг оси, стараясь захва-
тить кусочек пленки, плотно спаянной с подлежащей тканью.
При транспортировке материала на далекие расстояния,
занимающей более Зч, тампон перед употреблением смачива-
ют 5% раствором глицерина, приготовленным на изотониче-
ском растворе хлорида натрия (pH глицерина доводят до 7,6
с помощью 2% раствора Na^HPC^, или используют среды
обогащения: полужидкий сывороточный агар (рец. 102), сре-
ду Пергола (рец. 101), в которые погружают тампон тотчас
после взятия материала.
На каждый анализ дается сопроводительный бланк, в ко-
тором указывают фамилию и адрес лица, от которого взят
материал для исследования, происхождение взятого материа-
ла, название учреждения, направляющего на анализ, и цель
обследования (диагноз заболевания, по эпидемическим пока-
заниям, профилактическое обследование).
Схема лабораторного диагноза дифтерии. В настоящее
время инструкция и методические указания предусматрива-
ют проведение полного бактериологического анализа с выде-
лением чистой культуры возбудителя и его последующей
идентификацией, так как на слизистых оболочках верхних
дыхательных путей и на коже иногда встречаются морфоло-
гически сходные с возбудителем дифтерии, но не патогенные
для человека сапрофиты: ложнодифтерийные бактерии и диф-
тероиды, а также дифтерийные палочки с нехарактерными
280
морфологическими признаками, возникшие под влиянием ши-
рокого и не всегда правильного применения антибиотиков.
Первый день. 1. Патологический материал, поступив-
ший для исследования на дифтерию, засевают на среды, из-
бирательные для коринебактерий: свернутую сыворотку (рец.
103), теллурит-кровяную среду Клауберга '(рец. 104), хино-
зольную среду Бунина (рец. 105) или среду Тиндаля (рец.
106). Для лучшего и более быстрого роста микробов пита-
тельную среду перед посевом прогревают в термостате. За-
сев материала, взятого из зева и носа одного и того же боль-
ного, производят раздельно.
Для получения изолированных колоний материал, нахо-
дящийся на тампоне, втирают вначале на небольшую пло-
щадь (2X1 см2) питательной среды. При засеве тампон по-
ворачивают всеми сторонами поверхности. Затем нанесенный
па среду материал этим же тампоном распределяют штриха-
ми по всей площади чашки. Посевы помещают в термостат
при 37°1С на сутки.
Тампоны, доставленные в лабораторию в средах обогаще-
ния, помещают в термостат. Исследуемый материал, находя-
щийся в полужидкой сывороточной среде, инкубируют 5—6 ч,
а в среде Пергола — 20—24 ч. После указанных сроков ин-
кубации высев материала производят отжатым о стенки про-
бирки тампоном на четверть или половину чашки Петри с
плотной питательной средой.
2. Бактериоскопию патологического материала («мазок с
тампона») производят только по требованию врача. Для при-
готовления мазка исследуемый материал берут отдельным
тампоном и, прикасаясь разными сторонами его к поверхно-
сти предметного стекла, делают ряд отпечатков. Высохшие
на воздухе мазки фиксируют над пламенем горелки и окра-
шивают одним из следующих красителей: щелочным метиле-
новым синим Леффлера (рец. 10), ацетатом толуидинового
синего (рец. 12), ацетатом кристаллического или метилового
фиолетового (рец. 4).
Особенностью возбудителя дифтерии является сильно вы-
раженный полиморфизм: в мазке наряду с длинными, тонки-
ми, прямыми или слегка изогнутым» палочками можно
обнаружить короткие, толстые. Характерна также неравномер-
ность окраски тела палочки, что иногда придает ей вид це-
почки. Концы палочек очень часто имеют колбовидные взду-
тия, вследствие чего они приобретают форму булавы (согу-
пе). Характерным признаком бактерий дифтерии являются
включения зерен волютина, находящиеся на концах палочки
(рис. 27). В патологическом материале бактерии дифтерии
лежат обычно под углом друг к другу, напоминая римскую
цифру V, в отличие от ложнодифтерийных бактерий, распо-
лагающихся параллельно друг другу в виде частокола. Лож-
281
нодифтерийные палочки (С. pseudodiphtheriae) значительно
короче, грубее бактерий дифтерии и, как правило, не содер-
жат зерен волютина.
При обнаружении в исследуемом материале подозритель-
ных на дифтерию форм микробов дается ответ: «Дифтерий-
ные палочки, обнаружены, исследование продолжается».
Второй день. 1. С помощью лупы X б просматривают
микробный рост на поверхности засеянных питательных сред.
При отсутствии подозрительных колоний просмотр чашек по-
вторяют через 48 ч.
а) В пробирках на свернутой сыворотке колонии бактерий
дифтерии имеют кремовый цвет, круглую, хорошо очерчен-
ную форму, ровный край. Растут колонии, не сливаясь, вслед-
ствие чего поверхность питательной среды приобретает буг-
ристый характер.
б) На теллурит-кровяной среде Клауберга бактерии диф-
терии, восстанавливая теллурит калия в металлический тел-
лур, образуют колонии серовато-черного цвета. Бактерии ти-
па gravis образуют серо-черные или черные колонии с шеро-
ховатой поверхностью, напоминающие цветок маргаритки.
Колонии бактерий типа mitis — выпуклые, черные, блестящие,
с ровным краем и гладкой поверхностью. Бактерии типа in-
termedins растут скудно, образуют мелкие колонии черного
цвета с прозрачной каймой по краю.
Кроме бактерий дифтерии, на теллурит-кровяном агаре
растут стафилококки, стрептококки, ложнодифтерийная па-
лочка. Микробы кокковой группы растут медленно. Колонии
стафилококка к концу 2-х суток становятся крупными, серого
или черного цвета с коричневыми оттенками. Колонии лож-
нодифтерийных палочек в 1-е сутки роста гладкие, слизистые,
с черным центром; на 2-е сутки вся поверхность колонии при-
обретает черную окраску.
в) При росте на среде Бучина бактерии дифтерии восста-
навливают индикатор, вследствие чего в местах их образова-
ния среда приобретает фиолетовый цвет. Колонии палочек
дифтерии окрашиваются в синий цвет, дифтероиды образуют
бесцветные колонии, ложнодифтерийные палочки — коло-
нии голубоватого цвета.
2. Из культуры микробов со свернутой сыворотки готовят
препараты для микроскопирования. Материал берут прерыви-
стыми движениями петли из нескольких колоний, приготов-
ляют мазок и окрашивают его 2—3 мин щелочным метилено-
вым синим Леффлера. При обнаружении в мазке единичных
полиморфных палочек с утолщением и более интенсивной
окраской на концах, характерной для зерен волютина, гото-
вят второй мазок для окраски по способу Нейссера.
3. Из материала 1—2 колоний, подозрительных на дифте-
рию, производится высев параллельно на три среды:
282
а) одну половину колонии засевают в виде хорошо рас-
тертой «бляшки» на поверхность среды для определения ток-
сигенности (рец. 109);
б) после засева «бляшки» той же петлей без прожига-
ния, производят посев в столбик среды (рец. 107) для опре-
деления цистиназы (проба Пизу);
в) вторую половину колонии снимают после предвари-
тельного прокаливания петли и пересевают в пробирку на
скошенную поверхность свернутой сыворотки или сывороточ-
ного агара.
4. Из нескольких других колоний, подозрительных на диф-
терию, производят посев на среду для определения токсиген-
ности еще в виде двух «бляшек». Для высева одной «бляш-
ки» берут материал 5—6 колоний, учитывая, что среди них
могут находиться одновременно токсигенные и нетоксиген-
ные разновидности дифтерийных палочек.
Третий день. Просматривают сделанные накануне по-
севы. 1. Из микробной культуры со свернутой лошадиной сы-
воротки или сывороточного агара делают мазки для микро-
скопического исследования.
Обнаружение в мазке чистых культур кокков, дрожжей
или спороносных палочек позволяет прекратить дальнейшее
изучение выделенных бактерий.
2. Учитывают результаты постановки пробы Пизу. При на-
личии фермента цистиназы в результате образования суль-
фида свинца среда приобретает черно-бурый цвет по ходу
укола и вокруг него в виде коричневого «облачка» особенно
характерного в глубине среды, на расстоянии 1 см от по-
верхности. Такое изменение среды характерно только для
бактерий дифтерии. В случае отрицательного результата цвет
среды не изменяется или появляется слабое помутнение по
ходу укола.
3. Производят просмотр чашек и учитывают результаты
реакции на токсигенность бактерий дифтерии.
При обнаружении в мазке коринебактерий с положитель-
ной реакцией на цистиназу (пробу Пизу), но не образующих
токсина, чашки с культурой оставляют в термостате еще на
24 ч для окончательного решения вопроса о токсигенности
выделенной культуры.
Культуры коринебактерий с отрицательной реакцией на
цистиназу и нетоксигенные после 48 ч инкубации в термоста-
те подвергают дальнейшей идентификации. С этой целью
производят:
а) посев на среды Гисса с сахарозой, глюкозой (рец. 46)
и крахмалом (рец. 47);
б) посев в пробирки со средой Закса (рец. 108) для оп-
ределения уреазы. Пробирки с засеянными средами закры-
вают пробками и ставят в термостат на 30 мин. Бактерии,
283
образующие фермент уреазу, за указанный период расщеп-
ляют мочевину с образованием аммиака, который, смещая
pH среды в щелочную зону, изменяет цвет индикатора фено-
лового красного в красный.
Четвертый день. 1. Регистрируют результаты роста
па средах Гисса. Бактерии дифтерии, подразделяемые на три
типа (см. выше), к различным углеводам относятся по-разно-
му. Глюкозу представители всех трех типов ферментируют с
образованием кислоты без газа; крахмал расщепляют только
бактерии типа gravis. В отношении сахарозы бактерии диф-
терии всех типов остаются, как правило, инертными.
Основные дифференциально-диагностические биохимиче-
ские свойства дифтерийных, ложнодифтерийных бактерий и
дифтероидов приведены в табл. 49.
Таблица 49
Основные свойства возбудителей дифтерии и близких к ним дифтероидов
У глеводы
Вид
Токси-
ген-
ность
Уреаза
Цисти-
наза
сахароза
глюкоза крахмал
С. diphtheriae
—, gravis
— mitis
— intermedius
Cl. ipseudodiphtheriae
C. xerosis
C. enzymicus
C. pyogenes
Определение токсигенности дифтерийных бактерий. Опре-
деление токсигепности имеет особенно большое значение при
изучении культур, выделенных от носителей, так как патоген-
ность возбудителей дифтерии обусловлена их токсигепностью.
В основу метода определения токсигенности положен
принцип взаимодействия дифтерийного токсина и антитокси-
ческой противодифтерийной сыворотки, диффундирующих в
толщу агара и образующих в нем зоны преципитации (рис.
28). Однако при испытании дифтерийных культур на токси-
генность нужно иметь в виду, что появление преципитатов в
агаровом геле у дифтерийных культур возможно за счет вза-
имодействия не только токсина с антитоксином (специфиче-
ские преципитаты), но и антибактериальных антител с соот-
ветствующим антигеном микробной клетки (неспецифические
преципитаты). Неспецифические преципитаты могут образо-
вываться у токсигенпых и нетоксигенных дифтерийных куль-
тур. От специфических эти преципитаты отличаются слабой
выраженностью, нечеткостью контуров и более поздним обра-
284
Рис. 28. Линии преципитации в агаре при определении токсигенности диф-
терийных бактерий.
зованием'(48—72 ч). При образовании контрольным штам-
мом нескольких линий преципитации специфическими явля-
ются наиболее четкие и наиболее рано появляющиеся линии
преципитата.
Техника определения токсигенности диф-
терийных бактерий. В стерильные чашки Петри, име-
ющие равное, дно и диаметр 10 см, наливают 12 мл расплав-
ленной и охлажденной до 50°'С готовой питательной среды.
После застывания агара на середину чашки помещают сте-
рильную фильтровальную бумагу размером 1,5x8 см, пропи-
танную антитоксической противодифтерийной сывороткой, со-
держащей 500 ME в 1 мл. Затем 15—20 мин чашки подсуши-
вают в термостате.
Культуры бактерий, подлежащие исследованию на токси-
гепность, засевают в виде «бляшек» диаметром 1 см вдоль
обеих сторон фильтровальной бумаги, пропитанной антиток-
сином, на расстоянии 0,5 см друг от друга и от краев бумаж-
ной палочки. Для посева пользуются материалом из двух от-
дельных колоний и из 5—6 колоний одновременно, засевая
его одной «бляшкой». На одной чашке испытывается одно-
временно 10 «бляшек», в том числе 4 культуры исследуемые
и 6 контрольных. Контролем служит заведомо токсигенный
штамм, который засевается между исследуемыми культура-
ми. Чашки с посевами помещают в термостат при 37qC, про-
сматривая их через 24 и 48 ч инкубации. Просмотр чашек
производят с лупой, на темном фоне в проходящем свете.
При учете полученных результатов могут быть следующие
варианты в образовании преципитата:
285
а) исследуемая дифтерийная культура токсигенпа: обра-
зуемые ею линии преципитата сливаются или идут на соеди-
нение с соответствующими специфическими линиями заведо-
мо токсигепного штамма;
б) исследуемая культура нетоксигенна: линии преципита-
ции располагаются так, что концы их не могут слиться с кон-
цами специфических линий контрольного штамма. Линии ис-
пытуемого штамма перекрещиваются со специфическими ли-
ниями и сливаются с неспецифическими линиями контрольно-
го штамма. Линии преципитации испытуемого штамма слива-
ются с песпецифическими линиями контрольного штамма.
ВОЗБУДИТЕЛЬ ТУБЕРКУЛЕЗА
Микобактерии туберкулеза (Mycobacterium tuberculosis)
являются возбудителем тяжелого инфекционного заболева-
ния—туберкулеза. Местом локализации туберкулезного про-
цесса у человека могут быть любая ткань и орган: кишечник,,
почки, твердые мозговые оболочки, кости, кожа, лимфатиче-
ские узлы, но чаще всего — легкие.
Кроме человека, туберкулезом болеют домашние живот-
ные. Различают следующие типы бактерий туберкулеза: Ту-
pus humanus — человеческий тип, Typus bovinus — бычий тип
и Typus avium — птичий тип. Заболевания у человека вызы-
вают в основном два первых типа.
Чаще всего для бактериологического исследования берут
мокроту и промывные воды желудка и брон-
хов.
Микроскопическое исследование патологического материа-
ла. Микроскопическое исследование мокро-
т ы. Мокроту, поступившую на исследование, выливают в
чашку Петри, поставленную на стекло, под которое положе-
на черная бумага. Деревянной остроконечной палочкой выби-
рают из мокроты несколько желто-зеленых гнойных комоч-
ков, хорошо заметных на темном фоне, переносят па пред-
метное стекло, готовят тонкий мазок <(см. с. 27) и окраши-
вают его по Цилю — Нильсену. При окраске по этому способу
(см. с. 31) фон препарата, представленный клеточными эле-
ментами и слизис.ым веществом мокроты, имеет голубовато-
синий цвет. Кислотоустойчивые микобактерии туберкулеза в
отличие от некислотоустойчивых микроорганизмов, находя-
щихся в мокроте, окрашены фуксином в рубиново-красный
цвет. В большинстве случаев микобактерии туберкулеза
очень мелкие (2—4 мкм), тонкие, прямые или слегка изо-
гнутые (рис. 29). В теле микобактерий обнаруживаются иног-
да более темно окрашенные зерна.
Микобактерии туберкулеза склонны к полиморфизму, ко-
торый наиболее отчетливо проявляется под влиянием анти-
286
биотиков и химиотерапевтических препаратов. В мокроте
больных, леченных антибиотиками, часто встречаются формы
туберкулезных микобактерий в виде длинных и тонких или
толстых и грубых палочек с колбообразными расширениями
па концах, палочки, похожие на кокков. В мокроте больных
туберкулезом микобактерии располагаются поодиночке, иног-
да группами по 2—3, и в редких случаях образуют массив-
ные скопления беспорядочно расположенных микробов. Коли-
чество микобактерий туберкулеза, обнаруживаемых в мазке,
может быть различно.
При отрицательном результате микроскопического иссле-
дования прибегают к методу флотации, позволяющему в не-
большом объеме исследуемого материала концентрировать
микобактерии туберкулеза, содержащиеся в мокроте, собран-
ной в течение суток.
Метод флотации предложен в 1931 г. Петенжером и осно-
ван на том, что прибавленный к гомогенизированной мокроте
бензол или ксилол разбивается при взбалтывании ее на мель-
чайшие капельки, которые, поднимаясь кверху, адсорбируют
па своей поверхности микобактерии туберкулеза. К 10—15 мл
исследуемой мокроты, налитой в склянку емкостью 250 мл
прибавляют равное количество 0,5% раствора едкого натра
или едкого кали. Склянки плотно закрывают резиновой или
хорошо притертой стеклянной пробкой и после этого встря-
хивают в течение 15—20 мин в электровстряхивателе до пол-
ной гомогенизации мокроты. Затем склянку с гомогенизиро-
ванной мокротой помещают в водяную баню, нагревают при
температуре 55°С в течение 30 мин и после этого прилива-
ют 2 мл ксилола (бензола или толуола) и 100 мл дистилли-
рованной воды. Смесь снова в течение 15—20 мин встряхи-
вают, а затем отстаивают в течение часа при комнатной тем-
пературе. При стоянии на поверхности жидкости появляется
сливкообразный слой — флотационное кольцо, состоящее из
всплывших кверху капелек ксилола с находящимися на их
поверхности микобактериями туберкулеза. Образовавшееся
кольцо отсасывают пастеровской пипеткой с резиновым бал-
лончиком и переносят на два предметных стекла, нагретых
заранее до температуры 60°С. На предметные стекла сливко-
образную массу наносят по 5—6 раз, каждый раз после под-
сыхания предыдущей порции. Подсохшие мазки фиксируют
и окрашивают фуксином Циля с подогреванием в течение
10 мин. Дальнейшая окраска производится по Цилю—Ниль-
сену.
Микроскопия промывных вод желудка.
Больному натощак дают стакан дистиллированной воды. Че-
рез стерильный желудочный зонд извлекают около 250 мл
желудочного содержимого. К полученной жидкости прибав-
ляют 2 мл 0,5% водного раствора едкого кали, тщательно в
287
течение нескольких минут перемешивают, затем туда же до-
бавляют 2 мл ксилола или бензола, после чего склянку со
смесью помещают на 10 мин в электровстряхиватель, а затем
оставляют на 30 мин при комнатной температуре. Приготов-
ление мазков для микроскопирования ведется по описанно-
му выше методу исследования мокроты.
Техника обработки материала перед по-
севом. Для экспериментального заражения и посева на пи-
тательные среды мокроту и промывные воды желудка или
бронхов обрабатывают минеральными кислотами с целью
освобождения от посторонней микрофлоры. Для этого к ис-
следуемому материалу, представляющему собой осадок гемо-
генизированной мокроты, цептрифугат промывных вод желуд-
ка или мочи в объеме 3—5 мл, прибавляют равный объем
2—4% водного раствора стерильной серной кислоты. Смесь в
течение 10 мин энергично встряхивают, затем переливают в
стерильные центрифужные пробирки (с ватно-марлевыми
пробками) и центрифугируют в течение 45—20 мин. После
центрифугирования надосадочный слой жидкости сливают в
банки с дезинфицирующим раствором, осадок нейтрализуют
1—2 каплями 3% раствора едкого натра и используют для
постановки биологической пробы или посева на питательные
среды.
Спинномозговую жидкость, гной из певскрывшихся абс-
цессов, не содержащие посторонней микрофлоры, использу-
ют для посева и заражения без предварительной обработки.
Бактериологический метод. Посев патологического мате-
риала на искусственные питательные среды является обяза-
тельным в тех случаях, когда микроскопическое исследование
с применением методов обогащения дает отрицательный ре-
зультат. Патологический материал, обработанный кислотой,
набирают пастеровской пипеткой и засевают по 1 капле па
поверхность скошенной в пробирках среды Левенштейна —
Йенсена (рец. 135), Петраньяпи (рец. 436) или Гельберга
(рец. 137).
Явные признаки роста микобактерий туберкулеза на плот-
ных питательных средах появляются обычно на 3—4-й неделе
после посева. Поэтому очень важно, чтобы в течение всего
периода среда сохраняла достаточную влажность. С этой
целью посев производят на свежеприготовленные питатель-
ные среды с конденсационной водой на дне пробирки. При
отсутствии конденсационной воды в пробирки до посева на-
ливают по 0,5—0,7 мл стерильного изотопического раствора
хлорида натрия. После посева пробирки закрывают как обыч-
но ватно-марлевыми пробками, надевая сверху резиновые
колпачки или заливая их расплавленным парафином. Про-
бирки с посевами выдерживают в термостате при 37°С в те-
чение 1—3 мес.
288
Посевы просматривают каждую неделю, отмечая время
появления микробного роста. Наиболее часто признаки роста
микобактерий туберкулеза появляются на 20—40-й день в ви-
де сухого бугристого налета белого или слегка желтоватого
цвета, напоминающего цветную капусту. При отсутствии
выраженного роста после 6—8 нед выдерживания в тер-
мостате с поверхности питательной среды делают соскоб,
готовят из него мазок и с помощью окраски по Цилю —
Нильсену выявляют содержание в нем кислотоустойчивых
бактерий.
Выделение микрокультур бактерий тубер-
кулеза способом Прайса. На стеклянных пластин-
ках размером 70X12 мм, простерилизованных в сухожаровой
печи, готовят из исследуемого материала несколько препара-
тов-мазков, как для микроскопии. После подсыхания пред-
метные стекла с мазками захватывают стерильным пинцетом
и погружают па 5 мин в стерильный б°/о раствор серной кис-
лоты. Препараты, обработанные кислотой, промывают сте-
рильным изотоническим раствором хлорида натрия, а затем
погружают целиком в склянку с питательной средой Прайса
(рец. 134). Для предотвращения роста посторонней микро-
флоры в питательную среду добавляют раствор пенициллина
из расчета 10 ЕД антибиотика на 1 мл среды. Посевы инку-
бируют в термостате при 37°'С. Через 7—10 дней на препара-
тах-мазках появляется рост микобактерий туберкулеза. Для
обнаружения выросших микроорганизмов мазки отмывают от
крови, погружая осторожно пластинки стекла в стаканчик с
водопроводной водой. После этого стекла высушивают, ма-
зок-микроколонию фиксируют над огнем и окрашивают по
Цилю — Нильсену. Под микроскопом микрокультуры мико-
бактерий туберкулеза имеют вид «жгутов» или массивных
беспорядочных скоплений палочек.
Заражение морских свинок. Морские свинки очень чувст-
вительны к туберкулезной инфекции. Для воспроизведения
прогрессирующего генерализованного туберкулеза в организм
морской свинки достаточно ввести одну или несколько мико-
бактерий туберкулеза. Установлено, что морские свинки мо-
гут болеть, заражаясь туберкулезом от окружающих их лю-
дей. Использование для постановки биологической пробы жи-
вотных, зараженных туберкулезом, может послужить источ-
ником ошибочного диагноза. Поэтому морской свинке за 2
дня перед постановкой опыта вводят внутрикожно 0,1 мл ту-
беркулина, разведенного 1 :10. У здорового животного в ме-
сте введения туберкулина не отмечается каких-либо выра-
женных изменений. У животных, зараженных туберкулезом,
на месте введения туберкулина через 24—48 ч появляются
гиперемия и инфильтрат. Такие животные для опыта непри-
годны.
19 Лабинская А. С.
289
Заражение морских свинок для постановки диагноза ту-
беркулеза производят следующим образом. Исследуемый па-
тологический материал (мокрота, гной, моча после предвари-
тельной обработки серной кислотой) вводят в объеме 1—
1,5 мл двум морским свинкам в область паха. При наличии
в патологическом материале вирулентных бактерий туберку-
леза в месте введения материала уже на 6—10-й день появ-
ляется уплотнение, увеличивающееся со временем. На по-
верхности его образуется незаживающая язва, из которой по-
стоянно выделяется густой гной. Увеличиваются регионарные
лимфатические узлы, достигая иногда величины грецкого оре-
ха. При появлении местных изменений, характерных для ту-
беркулеза, животных умерщвляют. Из гноя язвы и лимфа-
тических узлов делают мазки, окрашивают их по Цилю—
Нильсену. При рассматривании под микроскопом в мазках
обнаруживают в большом количестве микобактерии туберку-
леза. Животных, у которых в месте введения патологическо-
го материала и в регионарных лимфатических узлах измене-
ний не обнаруживается, забивают через 6—8 нед после зара-
жения. При вскрытии животных, заболевших туберкулезом,
в лимфатических узлах брюшины и бронхов, в селезенке и
почках отмечается большое количество хорошо заметных
обычным глазом бугорков величиной с просяное зерно; не-
которые из них некротизированы.
ПАТОГЕННЫЕ СПИРОХЕТЫ
Патогенные спирохеты представляют собой группу микро-
бов, занимающую промежуточное положение между бакте-
риями и простейшими. Под микроскопом спирохеты имеют
вид тонких нитей со штопорообразными завитками. Спиро-
хеты подвижны, могут совершать поступательные и сгиба-
тельные движения.
Спирохеты широко распространены в природе. Среди них
есть несколько видов, патогенных для человека. К их числу
относятся спирохеты, вызывающие возвратный тиф, сифилис,
а также возбудители лептоспирозов: инфекционной желтухи
и водной лихорадки.
ВОЗБУДИТЕЛИ ВОЗВРАТНЫХ ТИФОВ
В СССР встречаются две формы возвратного тифа: сред-
неазиатский возвратный тиф (возбудитель Borrelia sogdia-
num и кавказский (возбудитель Borrelia caucasica), переда-
ющиеся через клещей. Европейский возвратный тиф, вызы-
ваемый спирохетой Обермейера (Spirochaeta obermeyeri или
Borrelia recurrentis), передающийся через платяную вошь, в
настоящее время в Советском Союзе не встречается.
*290
Возбудители возвратных тифов вызывают у человека ост-
рое заболевание, при котором приступы лихорадки чередуют-
ся с периодами удовлетворительного состояния и нормальной
температуры.
При европейском возвратном тифе во время приступа спи-,
рохеты обнаруживаются в крови в большом количестве. При
нормализации температуры, в период между приступами,
найти спирохеты в крови не удается.
Возбудители среднеазиатского и кавказского возвратно-
го тифа могут быть обнаружены в крови больного в единич-
ных случаях как в лихорадочном, так и в межприступном
периодах болезни.
Материалом для исследования при подозрении на воз-
вратный тиф является кровь, взятая во время приступа. Про-
калывают мякоть пальца и из выступившей в месте укола
крови готовят три препарата: два тонких мазка и препарат
толстой капли (см. с. 27). Тонкий мазок готовят обычным
способом с помощью шлифованного стекла. После высыха-
ния мазок фиксируют 5 мин в метиловом спирте или смеси
Никифорова (см. с. 29) и окрашивают карболовым фуксином
Циля, разведенным дистиллированной водой в 2—3 раза,
или краской Романовского—Гимзы в течение 30—40 мин.
При микроскопировании мазка в препарате среди эритроци-
тов обнаруживаются тонкие, длинные, превышающие в 3—6
раз диаметр эритроцитов спиралевидные нити — спирохеты
возвратного тифа (имеющие от 4 до 12 завитков) с заострен-
ными концами.
При европейском возвратном тифе спирохет в препарате
очень много (если кровь исследуют во время приступа). Рас-
полагаются они поодиночке и в виде клубков. .При клещевом
возвратном тифе встречаются единичные спирохеты, которые
чаще всего можно обнаружить только в толстой капле. На
препарат толстой капли, высохший, но не фиксированный,
наносят несколько капель краски Романовского—Гимзы, при-
готовленной на дистиллированной воде, чтобы вызвать лизис
эритроцитов. Окрашивание препарата длится 35—40 мин.
При микроскопировании препарата толстой капли спирохеты
возвратного тифа, окрашенные в фиолетовый цвет, находятся
среди «теней» эритроцитов. При клещевом возвратном тифе
обнаруживаются единичные спирохеты. При европейском воз-
вратном тифе спирохеты содержатся в большом количестве,
образуя клубки разной величины.
ВОЗБУДИТЕЛИ ЛЕПТОСПИРОЗОВ
Род лептоспир (Leptospira) широко распространен в при-
роде и объединяет большое количество сапрофитических и
патогенных видов спирохет. Патогенные лептоспиры относят-
19* 29L
ся к группе зоонозов. Они поражают различные виды жи-
вотных: крупный и мелкий рогатый скот, свиней, лошадей,
собак, диких животных, грызунов. У человека лептоспиры вы-
зывают острое лихорадочное заболевание, при котором воз-
будитель локализуется в крови и тканях различных органов.
По характеру клинических проявлений различают желтуш-
ную и безжелтушную формы лептоспироза.
.В Советском Союзе от больных людей с разными клини-
ческими формами лептоспироза выделено 16 серотипов леп-
тоспир, различных по биологическим свойства1м и структуре
антигенного аппарата.
Материал для исследования. При подозрении
на лептоспироз берут кровь из вены локтевого сгиба в коли-
честве 6 мл. Для микроскопического исследования 2 мл кро-
ви, тотчас после ее взятия, наливают в пробирку с 4 мл
1,5% цитрата натрия. Предназначенные для посева 4 мл кро-
ви выливают в пробирку с питательной средой.
Для серологического исследования кровь берут в более
поздние сроки заболевания в сухую пробирку в количестве
2—2,5 мл. Образующуюся сыворотку разливают в стериль-
ные ампулы или агглютинационные пробирки и запечаты-
вают.
'Спинномозговую жидкость в количестве 4—6 мл берут ис-
ключительно по клиническим показаниям при наличии ме-
нингеальных явлений. Мочу для исследования собирают в
стерильные склянки.
Схема лабораторного исследования при диагностике леп-
тоспирозов. 1. Бактериоскопическое исследова-
ние. Морфологию лептоспир изучают в живом состоянии в
темном поле. Бактериальными красителями они почти не ок-
рашиваются. Для микроскопического исследования цитрат-
ную кровь оставляют в пробирках при комнатной темпера-
туре на 1—dV2 ч. Верхний прозрачный слой отстоявшейся
плазмы используют для приготовления микроскопиче-
ских препаратов. Значительно лучшие результаты дает
микроскопия осадка сыворотки, полученного в результа-
те центрифугирования при 10 000—12 000 об/мин в течение
часа.
В редких случаях возбудителя болезни обнаруживают в
мазках из осадка спинномозговой жидкости, которую цент-
рифугируют так же, как сыворотку.
Мочу в целях обнаружения лептоспир исследуют с конца
1-й недели заболевания и в течение последующих 3 мес бо-
лезни. 'Осадок получают из 30—50 мл мочи. Для обнаруже-
ния лептоспир микроскопируют 10—15 препаратов «раздав-
ленной» капли, приготовленных из осадка патологического
материала на абсолютно чистых стеклах толщиной не более
1,2 мм.
292
Микроскопическое исследование препаратов производят в
темном поле с сухой системой (объектив Х40); серебристо-
белые лептоспиры четко выделяются на темном фоне препа-
рата. Так как просмотр материала ведется при сравнительно
небольшом увеличении, первичные завитки спирохеты не об-
наруживаются.
Лептоспиры имеют вид тонких, длинных палочек с дву-
мя крючками на концах. Они обладают способностью
совершать активные поступательные движения и по-
движностью вокруг своей продольной оси. При движении
лептоспиры образуют фигуры, напоминающие гимнастические
гири или букву S.
2. Бактериологическое исследование. Пато-
логический материал тотчас после получения засевают в про-
бирки со средой Уленгута (рец. 138) или средой Терских
(рец. 139). Посев крови производят в 3 пробирки: в 1-ю за-
севают 0,5 мл, во 2-ю 1 мл, в 3-ю — 2 мл крови. Асептично
собранную мочу засевают по 0,5—1 мл в 4—5 пробирок. В та-
ком же объеме делают посев спинномозговой жидкости. Раз-
множение лептоспир значительно лучше происходит в усло-
виях анаэробиоза. Поэтому среду в пробирках заливают
0,5—1 мл стерильного вазелинового масла. Вазелиновое мас-
ло до разливки по пробиркам стерилизуют в автоклаве
30 мин при температуре 120°С (после стерилизации масло
мутнеет).
Рост лептоспир начинается с 7—10-го дня после посева.
Однако размножение их не сопровождается помутнением сре-
ды в пробирках. Рост лептоспир выявляется в препарате раз-
давленной капли. Материал для приготовления препарата бе-
рут из-под слоя вазелинового масла следующим образом:
пробирку с посевом осторожно наклоняют почти до горизон-
тального положения так, чтобы все масло перешло на ниж-
нюю стенку пробирки. После этого пастеровскую пипетку
вводят в питательную среду по верхней стенке пробирки над
слоем вазелинового масла. Препарат раздавленной капли,
приготовленный из засеянной питательной среды, просматри-
вают в темном поле. Наблюдение за ростом лептоспир в пи-
тательной среде производится каждые 5 дней в течение 3 мес.
При отсутствии роста в течение указанного срока результат
посева считается отрицательным.
3. Серологический метод и с с л ед о в а н и я. Ан-
титела против лептоспир в крови человека в достаточном для
обнаружения титре появляются обычно в конце 1-й — начале
2-й недели заболевания. После перенесения болезни они со-
храняются в течение многих лет.
Серологическая диагностика лептоспирозов состоит в по-
становке реакции агглютинации — лизиса. Методи-
ка постановки реакции агглютинации при лептоспирозе не
293
отличается от таковой при других инфекциях, кроме учета ре-
зультатов, который производят под микроскопом в темном
поле зрения. Сложность постановки этой реакции заключа-
ется в том, что патогенные лептоспиры объединяют 124 серо-
логических типа, входящих в состав Г8 серологических групп.
На территории Советского Союза обнаружены представите-
ли 8 серологических групп. Естественно, что постановка реак-
ции со всеми 124 серотипами лептоспир невозможна, а реак-
ция с произвольно выбранными, например «местными», штам-
мами не обеспечивает полного
Таблица 50 выявления больных. Учитывая
Диагностические штаммы
лептоспир
Серогруппа Отечественные штаммы
Icterohaemorr- hagiae Судьин
Javanica Sorex
Canicola Каширский'
Autumnalis Erinaceus 6701
Australis Еж 1
Pomona Шали
Grippotyphosa Moskva
Hebdomadis Гамзулин1
Batavide Mycromis minu- tus 167
Tarassovi Perepelicin Б. Ш.1
Semaranga
1 Штаммы не соответствуют зару-
бежному эталону по серотипу.
это, научная группа по лепто-
спирозным заболеваниям при
ВОЗ (1965) рекомендует поль-
зоваться для постановки реак-
ции агглютинации — лизиса на-
бором штаммов, представля-
ющим серологические группы,
которые обладают наиболее
полным набором внутригруп-
повых антигенных связей и,
следовательно, могут обеспе-
чить наиболее достоверный
серологический диагноз. Пе-
речень эталонных культур для
диагностики лептоспирозов на
территории Советского Союза
приведен в табл. 50.
Применение единого для
всей страны диагностического
набора штаммов обеспечивает
серогрупповой диагноз и позволяет получить сравнимые дан-
ные о краевой распространенности лептоспирозов разных
серологических групп.
Для постановки реакции агглютинации необходимы сле-
дующие ингредиенты: 1) сыворотка больного, подлежащая
исследованию; 2) изотонический раствор хлорида натрия;
3) живые культуры лептоспир. Перечисленные штаммы выпи-
сывают из Московского научно-исследовательского института
вакцин и сывороток имени И. И. Мечникова. Для постановки
реакции агглютинации — лизиса применяют 7—10-дневные
культуры, содержащие в поле зрения 50—100 лептоспир и бо-
лее с активной подвижностью, без признаков спонтанной аг-
глютинации (клубочки, узелки из лептоспир).
Из сыворотки больного, подлежащей исследованию, гото-
вят ряд последовательных разведений — от 1 : 50 до 1 : 6400.
Приготовленные разведения разливают по 0,2 мл в агглютина-
ционные пробирки или лунки полистероловых пластин, в 1J
294
параллельных рядов 1 с 9 пробирками или лунками в каждом
ряду. В последнюю, контрольную, лунку (пробирку) каждого
ряда наливают по 0,2 мл изотонического раствора хлорида
натрия. Затем во все пробирки одного ряда, включая и кон-
трольную, прибавляют равные количества (0,2 мл) культу-
ры лептоспир одного или того же серологического типа. По-
сле добавления антигена к сыворотке штатив с пробирками
встряхивают и оставляют при комнатной температуре на 2 ч,
по истечении которых учитывают результаты реакции под
микроскопов в темном поле зрения.
При регистрации результатов отмечают феномены агглю-
тинации и лизиса, которые наступают одновременно. Фено-
мен лизиса проявляется зернистым набуханием лептоспир,
утратой подвижности с последующим распадом на отдельные
фрагменты. Иногда лизис протекает настолько энергично,
что в первых пробирках с малыми разведениями сыворотки
все лептоспиры оказываются растворенными. Феномен агглю-
тинации характеризуется склеиванием отдельных лептоспир
в виде так называемых паучков, отсутствующих в контроль-
ной пробирке. Реакция агглютинации, не сопровождающаяся
лизисом, не может считаться специфической. Титром реакции
агглютинации считают то максимальное разведение исследу-
емой сыворотки, при котором обнаруживаются склеивающие-
ся лептоспиры {«паучки»), отсутствующие в содержимом
контрольной пробирки. Агглютинационный титр при лепто-
спирозе достигает больших величин (1 : 6400—1 : 12 800).
Литическим титром считают максимальное разведение сы-
воротки, при котором имеются резко выраженная зернистость
и набухание лептоспир, отсутствующие в контрольной про-
бирке. Литический титр, как правило, ниже агглютинацион-
ного. За диагностический титр при лептоспирозе принимают
титр, равный 1 : 400.
С целью упрощения развернутой реакции агглютинации
В. С. Киктенко рекомендует исследовать участвующие в ней
штаммы лептоспир предварительно в ориентировочной реак-
ции на стекле. На предметное стекло наносят три капли: кап-
лю исследуемой сыворотки больного в разведении 1 :50, кап-
лю той же сыворотки в разведении 1 :500 и каплю изотони-
ческого раствора хлорида натрия (контроль). К каждой кап-
ле прибавляют равные количества соответствующей культу-
ры лептоспир, вследствие чего фактическое разведение
сыворотки удваивается, достигая в первой капле 1 : 100, во
второй—1 : 1000. Смесь сыворотки с культурой лептоспир тща-
тельно перемешивают углом другого предметного стекла и
слегка подогревают.
* По числу 11 диагностических штаммов лептоспир, приведенных в
табл. 50.
295
Результат реакции учитывают спустя 3—5 мин посредст-
вом приготовления препарата раздавленной капли и микро-
скопирования его в темном поле зрения. Штаммы лептоспир,
положительно реагирующие с сывороткой больного в опыте
на предметном стекле, используются для постановки развер-
нутой реакции агглютинации. Таким образом, число рядов в
ней значительно уменьшается.
ВОЗБУДИТЕЛЬ СИФИЛИСА
Бледная спирохета i(Treponema pallidum), получившая
название в связи с плохой окрашиваемостью анилиновыми
красителями, является возбудителем сифилиса — заболева-
ния, свойственного только человеку.
По характеру клинических проявлений в течении сифили-
са различают четыре периода. Лабораторная диагностика за-
болевания определяется периодом болезни. В первом перио-
де, при развитии местных явлений, лабораторный диагноз за-
болевания основывается на микроскопическом исследовании
отделяемого твердого шанкра. Во втором и третьем периодах
микроскопическому исследованию подвергают отделяемое
кожных поражений (розеолы, пустулы).
Начиная с третьего периода, в лабораторной диагностике
сифилиса ведущее значение приобретают серологические ме-
тоды исследования, к числу которых относятся реакция Вас-
сермана и осадочные реакции Кана и Закса — Витебского.
Культивирование бледных спирохет в лабораторных усло-
виях сопряжено с большими трудностями, поэтому в диагно-
стике сифилиса бактериологический метод исследования не
используется.
Материал для лабораторной диагностики сифилиса. Мате-
риалом для исследования с 3—4-й недели заболевания слу-
жит тканевая жидкость, взятая из первичной язвы. Ткане-
вую жидкость получают следующим образом. Язву очищают
кусочками стерильной ваты, смоченной очищенным бензином
или изотоническим раствором хлорида натрия. После этого-
края язвы слегка сдавливают I и II пальцами левой руки.
Сдавливание производят с перерывами в течение нескольких
секунд. В результате такой манипуляции на поверхности яз-
вы появляется капля прозрачной жидкости желтоватого цве-
та, которую набирают в пастеровскую пипетку и наносят на-
предметное стекло. Брать материал из твердого шанкра сле-
дует обязательно в резиновых перчатках. С 4—5-й педели по-
сле заражения материалом для микроскопирования служит
тканевая жидкость, полученная посредством пункции регио-
нарных лимфатических узлов.
Для постановки реакции Вассермана берут кровь натощак
из вены локтевого сгиба в количестве. 5—7 мл и получают из--
нее сыворотку.
296
Микроскопическое исследование при диагностике сифили-
са. Из капли тканевой жидкости, нанесенной на предметное
стекло, готовят препарат раздавленной капли и микроскопи-
руют его в темном поле зрения микроскопа (см. с. 26). При
микроскопировании препарата обнаруживают спирохеты, об-
ладающие характерными для возбудителя сифилиса плавны-
ми, медленными движениями. Поступательные движения ча-
сто сопровождаются вращением вокруг продольной оси и от-
ступлением назад. При движении вперед спирохета как бы
перегибается пополам, совершая при этом маятникообразные
колебания. При микроскопировании препарата, приготовлен-
ного по способу Бурри, на темно-дымчатом фоне обнаружива-
ют светлые спирохеты в виде тонких, нежных нитей с мелкими
завитками (10—12) одинаковой величины и правильной
формы.
'Окрашивание по Романовскому — Гимзе производят горя-
чей краской в течение 1—2 ч, после чего препарат промыва-
ют водой и высушивают между двумя листками фильтро-
вальной бумаги. При таком способе окраски спирохета при-
обретает бледно-розовый цвет (рис. 30).
Серологическая диагностика сифилиса. Серологические
методы исследования находят широкое применение для диа-
гностики скрытых форм сифилиса, при обследовании доноров,
беременных для профилактики врожденного сифилиса у де-
тей; результаты серологических реакций служат также кри-
терием эффективности лечения, которыми руководствуются пе-
ред снятием с учета больных сифилисом и при выдаче им
разрешения на брак.
Реакция Вассермана. Реакция Вассермана, основанная на
принципе РСК, заключается в том, что глобулины сыворотки
больных сифилисом в отличие от здоровых людей способ-
ны вступать в соединение с липоидными вытяжками, по-
лученными из печени сифилитического плода или мышцы
бычьего сердца здоровых Животных (кардиолипиновый анти-
ген) .
Образующийся комплекс :(глобулин сыворотки крови—ли-
поидный антиген) адсорбирует комплемент. Адсорбция ком-
племента комплексом определяется только при добавлении
индикаторной системы, состоящей из эритроцитов барана и
гемолитической сыворотки — гемолизина (см. с. 139).
В настоящее время реакцию Вассермана ставят с тремя
антигенами: № 1 — песпецифический антиген, состоящий из
двух очищенных компонентов (фосфолипид и лецитин), полу-
ченных из мышц бычьего сердца; № 2 и № 3 — специфиче-
ские, высокочувствительные антигены, приготовленные из
культур бледных трепонем.
Антиген для реакции Вассермана должен удовлетворять
следующим требованиям: 1) не вызывать гемолиза эритроци-
297
тов; 2) не инактивировать и не адсорбировать комплемента;
3) не образовывать с сывороткой здоровых лиц специфиче-
ский комплекс, способный адсорбировать комплемент.
Для разведения антигенов, так же как и всех других ин-
гредиентов реакции Вассермана, пользуются свежепрокипя-
ченным для удаления углекислоты изотоническим раствором
хлорида натрия (рец. 20).
Техника постановки реакции Вассермана.
Сыворотку, подлежащую исследованию, прогревают в водя-
ной бане 30 мин при 56°С для инактивации содержащегося
в ней комплемента, разливают в 4 пробирки по 0,1 мл, до-
бавляют изотонический раствор хлорида натрия: в первые
3 пробирки (опытные) по 0,4 мл, в 4-ю (контрольную) —
0,9 мл.
После этого в пробирки с опытным разведением сыворот-
ки вносят по 0,5 мл антигенов (№ 1, № 2 и № 3), разведен-
ных изотоническим раствором хлорида натрия до титров,
указанных на этикетке ампулы, и затем по 0,5 мл комплемен-
та в рабочей дозе.
Четвертая пробирка каждого ряда (0,5 мл исследуемой
сыворотки, разведенной в отношении 1 : 5+0,5 мл изотониче-
ского раствора хлорида натрия+ 0,5 мл комплемента) явля-
ется контролем на содержание в сыворотке веществ, которые
сами по себе, без добавления антигена, могут задерживать
гемолиз.
После прибавления антигена и комплемента к исследуе-
мым и контрольным сывороткам штатив с пробирками встря-
хивают и помещают в термостат на 45 мин. Пока штатив с
пробирками находится в термостате, его примерно каждые
10—15 мин встряхивают. По истечении указанного периода во
все опытные и контрольные пробирки добавляют 1 мл гемо-
литической системы, после чего штатив с пробирками снова
помещают в термостат на 40—60 мин в зависимости от на-
ступления гемолиза в контролях.
Результат реакции Вассермана при исследовании на си-
филис оформляют в виде следующего ответа:
RW положительная — в том случае, когда результат реакции соответ-
ствует + + + + или + + +
RW слабо положительная — результат реакции отмечается + +
RW сомнительная — результат реакции отмечен + или ±
RW отрицательная — результат реакции отмечается —.
Осадочные реакции (реакции преципитации) в диагности-
ке сифилиса. В комплекс серологического метода диагности-
ки сифилиса в настоящее время вошли осадочные реакции
Кана и Закса — Витебского, в основу которых положено об-
разование видимого простым глазом хлопьевидного осадка
при добавлении к сыворотке больного сифилисом липоидных
антигенов.
298
Для постановки реакции необходимо иметь: 1) сыворотку
больного, йнактивированную в день постановки реакции;
2) антиген, представляющий собой экстракт липоидов из мы-
шечной ткани бычьих сердец, к которому для повышения чув-
ствительности прибавляют 0,6% холестерина.
При постановке реакции антиген разводят согласно тит-
ру, указанному на этикетке ампулы, соблюдая следующие
правила: в одну пробирку наливают необходимое количество
изотонического раствора хлорида натрия, в другую — экст-
ракт антигена. Содержимое 1-й пробирки быстро вливают во
2-ю (не наоборот!); для лучшего перемешивания смесь пе-
реливают из пробирки в пробирку 6—7 раз и после этого ос-
тавляют на 10 мин при комнатной температуре для созрева-
ния.
Схема постановки р е а к ц и и. Разведенный анти-
ген после 10-минутного выдерживания наливают микропипет-
кой в 3 опытные и 3 контрольные пробирки, не касаясь их
стенок. В 1-ю пробирку наливают 0,6 мл, во 2-ю — 0,025 мл
и в 3-ю пробирку — 0,0125 мл антигена; такие же количества
антигена разливают соответственно в три контрольные про-
бирки. Во все опытные пробирки наливают по 0,15 мл иссле-
дуемой сыворотки, в контрольные — такое же количество изо-
тонического раствора. Штатив с пробирками в течение 3 мин
энергично встряхивают, чтобы произошло перемешивание сы-
воротки с антигеном, и после этого ставят в термостат при
37°С на 10 мин.
После выдерживания в термостате в 1-ю опытную и 1-ю
контрольную пробирки прибавляют до 1 мл изотонического
раствора хлорида натрия, во 2-ю и 3-ю опытную и контроль-
ную пробирки — по 0,5 мл этого раствора.
Появление ясно выраженного преципитата отмечается как
положительный результат реакции, слабо выраженный пре-
ципитат — как слабо положительный, отсутствие преципита-
та — как отрицательный.
Осадочная реакция Кана модифицирована Заксом и Ви-
тебским. Авторы использовали концентрированный антиген
и это привело к более быстрому выпадению грубодисперсных
частиц, что позволило учитывать результат реакции тотчас.
РИККЕТСИИ
Под названием «риккетсий» объединяется своеобразйая
группа микроорганизмов, которые по своим свойствам зани-
мают промежуточное положение между бактериями и виру-
сами.
Риккетсии имеют морфологическое сходство с бактериями.
Они неподвижны, имеют вид грамотрицательных кокков, кок-
кобактерий или палочек величиной 0,3—0,5 мкм.
299
Подобно вирусам, риккетсий неспособны размножаться на
искусственных питательных средах. При попадании в орга-
низм восприимчивого животного риккетсии поселяются и раз-
множаются внутри клеток, являясь, таким образом, внутри-
клеточными паразитами.
Некоторые представители этой группы патогенны для че-
ловека, вызывая различные заболевания. Например, риккет-
сии Провачека вызывают эпидемический сыпной тиф, риккет-
сии Музера — крысиный тиф, риккетсии Конора — марсель-
скую лихорадку, риккетсии Бернета — лихорадку Ку.
РИККЕТСИИ ПРОВАЧЕКА
Риккетсии Провачека '(Rickettsia prowazekii) являются
возбудителем острого заразного заболевания — эпидемиче-
ского сыпного тифа, при котором риккетсии в течение всего
периода болезни циркулируют в крови. Сыпной тиф от боль-
ного человека здоровому передается через платяную вошь/
Для лабораторной диагностики сыпного тифа рекомендуется
использование трех серологических реакций: РСК, реакции
непрямой гемагглютинации и реакции агглютинации риккет-
сий.
Реакция связывания комплемента с риккетсиозным анти-
геном. Постановка РСК применяется для дифференциальной
диагностики эпидемического и эндемического сыпного тифа.
Для этой цели исследуемые сыворотки испытывают парал-
лельно с двумя антигенами — из риккетсий Провачека и Му-
зера.
Диагностическим титром РСК при сыпном тифе и крыси-
ном риккетсиозе считают разведение от 1 : 80 на 6—8-й день
болезни и 1 : 1280—1 : 5.120 на 2—4-й педеле заболевания.
Реакция непрямой гемагглютинации. Для постановки
РИГА при диагностике сыпного тифа необходимы: 1) сыво-
ротка больного, подлежащая исследованию, инактивирован-
ная общепринятым способом и истощенная бараньими эрит-
роцитами для удаления неспецифических агглютининов;
2) эритроциты барана, 2—3 раза отмытые изотоническим рас-
твором хлорида натрия и сенсибилизированные антигеном из
риккетсий Провачека (к 4 мл осадка отмытых эритроцитов
добавляют 0,1 мл антигена в рабочей дозе). Диагностическим
титром реакции гемагглютинации при сыпном тифе считают
разведение сыворотки 1 : 250.
Реакция агглютинации риккетсий. Реакция агглютинации
с риккетсиями Провачека ставится по общепринятой методи-
ке. Ввиду того что реакция агглютинации риккетсий
высокоспецифична, диагностическим титром считается разве-
дение сыворотки 1 : 100 не менее чем на + + + +-
ЧАСТЬ ТРЕТЬЯ
'\
САНИТАРНАЯ МИКРОБИОЛОГИЯ
Санитарная микробиология занимается изучением микро-
флоры и микробиологических процессов, происходящих в
объектах внешней среды, осуществляет контроль за санитар-
но-бактериологическим состоянием воды, воздуха и пищевых
продуктов.
Перечисленные исследования выполняются бактериологи-
ческими лабораториями СЭС в плановом порядке и по эпи-
демическим показаниям.
Непосредственное обнаружение патогенных микробов в;
объектах внешней среды, как правило, сопряжено с больши-
ми трудностями, так как встречаются они непостоянно, глав-
ным образом в период эпидемических вспышек и в окруже-
нии бактерионосителей, представляя ничтожно малую вели-
чину по сравнению с постоянной, непатогенной микрофлорой
исследуемого объекта. Поэтому возможное загрязнение внеш-
ней среды патогенными микробами определяют на основании
косвенного показателя — обнаружения так называемых сани-
тарно-показательных микробов: кишечных палочек, а-зеленя-
щих и р-гемолитических стрептококков и стафилококков.
Присутствие санитарно-показательных микробов в объектах
внешней среды указывает на зараженность их выделениями
человеческого организма.
Кишечная палочка, будучи постоянным представителем
нормальной микрофлоры кишечника человека, является по-
казателем фекального загрязнения. На загрязненность ки-
шечными палочками исследуют воду, почву, пищевые продук-
ты. Санитарно-показательными бактериями, указывающими
на фекальное загрязнение объектов внешней среды, принято
считать все цитратотрицательные грамнегативные бактерии,
ферментирующие с образованием кислоты и газа лактозу,
глюкозу, маннит, мальтозу и в некоторых случаях сахарозу.
Обязательному учету подлежат также штаммы Е. coli, не
сбраживающие лактозу, выделяемые у лиц преимуществен-
но с заболеваниями кишечного тракта.
Цитратположительные разновидности кишечной палочки,
растущие на цитратных питательных средах Козера и Сим-
монса, к микробам — показателям фекального загрязнения
не относятся. Возможность ассимиляции углерода из солей
лимонной кислоты указывает на длительное пребывание этих
301
I
бактерий вне организма животных и на приспособление их к
существованию в объектах внешней среды. I
Идентификация выделенных микробов с бактериями ки-
шечной палочки осуществляется следующим образодя.
1. На среде Эндо отмечают колонии с признаками, харак-
терными для кишечной палочки. К их числу относятся крас-
ные колонии с металлическим блеском и без него, розовые
колонии, бесцветные с розовым центром, бесцветные колонии.
2. Из отмеченных колоний, характерных для группы бак-
терий кишечной палочки, готовят мазки, окрашивают их по
Граму и микроскопируют.
3. Из колоний, состоящих из грамотрицательных неспоро-
носных бактерий, производят высев в пробирку со средой
Гисса, содержащей глюкозу, и в пробирки с цитратной сре-
дой Симмонса или Козера.
4. При учете результатов отмечают цитратотрицательные
штаммы кишечной палочки, сбраживающие глюкозу с обра-
зованием кислоты и газа. Образование газа позволяет отне-
сти выделенные культуры бактерий к санитарно-показатель-
ным разновидностям кишечной палочки, являющимся индика-
торами фекального загрязнения.
Интенсивность фекального загрязнения объектов внешней
среды характеризуется двумя показателями: коли-титром и
коли-индексом.
Под титром подразумевается наименьшее количество
исследуемого материала (выраженное в миллилитрах или
граммах), в которохИ обнаруживается кишечная палочка.
Коли-индеке — количество особей кишечной палочки,
найденное в 1 л жидкости или 1 г плотного вещества.
Установив коли-титр исследуемого вещества, можно про-
извести пересчет на коли-индекс и наоборот. Для перевода
коЛи-титра в коли-индекс необходимо 1000 разделить на чис-
ло, выражающее коли-титр.
Пример. Коли-титр равен 25 мл; следовательно, коли-индекс будет:
1000
—— =40, т. е. в 1 л исследуемон жидкости содержится 40 кишечных
25
палочек.
Для перевода коли-индекса в коли-титр необходимо 1000 разделить иа
число, выражающее коли-индекс.
Пример. Коли-нндекс равен 250; коли-титр в таком случае будет
1000
раврн;—=4мл.
Стрептококки и стафилококки, постоянно обитающие на
слизистых оболочках полости рта и верхних дыхательных пу-
тей, являются индикаторами обсеменения воздушной среды
микрофлорой дыхательных путей.
Чем выше концентрация санитарно-показательных микро-
бов в исследуемом материале, тем больше он загрязнен вы-
302
делениями человеческого организма и тем вероятнее в нём со-
держание патогенных микробов — возбудителей инфекцион-
ных заболеваний. Санитарно-бактериологические исследова-
ния многих объектов внешней среды регламентируются
ГОСТами й инструкциями, утвержденными Министерством
здравоохранения СССР.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ ВОДЫ
Санитарно*бактериологическое исследование воды заклю-
чается в следующем:
1. Определяют общее количество микробов в 1 мл.
2. Определяют титр кишечной палочки.
Взятие проб воды для санитарно-бактериологического ис-
следования. Воду для санитарно-бактериологического иссле-
дования отбирают в количестве 500 мл в бутылки, предвари-
тельно простерилизованные в бумажных пакетах, с ватно-
марлевой пробкой, покрытой сверху бумажным колпачком.
К горлышку бутылки привязывают пакетик с завернутой в
него запасной пробкой.
Пробы воды из открытых водоемов — колодцев, бассей-
нов, рек и т. д. отбирают с помощью батометров, представ-
ляющих собой металлический каркас с массивным свинцовым
дном-грузилом (рис. 31). В металлический каркас вставляют
бутылку. Батометр погружают на заданную глубину и от-
крывают бутылку, потягивая за веревку, привязанную к проб-
ке. После наполнения ее батометр извлекают и закрывают
бутылку стерильной пробкой.
Пробы воды из открытых водоемов рекомендуется брать
на глубине 10—15 см от поверхности воды и на таком же
расстоянии от дна при малой глубине водоема.
Из кранов водопроводных сооружений пробы берут в пе-
риод наибольшего расхода воды после предварительной сте-
рилизации кранов обжиганием пламенем горящего тампона,
смоченного спиртом, и последующего спуска воды в течение
10—15 мин при полностью открытом кране.
Пробы хлорированной воды берут во флаконы с дехлора-
тором, так как под действием хлора микробы в воде погиба-
ют. В качестве дехлоратора на 500 мл исследуемой воды до-
бавляют 10 мг серноватистокислого натрия.
К отобранным пробам воды прилагают сопроводительный
документ с указанием следующих данных:
11) место расположения крана;
2) дата отбора пробы с указанием года, месяца, числа и
часа;
В) особые обстоятельства при отборе пробы (время спус-
ка воды из крана, условия транспортировки и т. д.)« .
303
Рис. 31. Батометр — при-
бор для взятия проб во-
ды.
4) цель исследования: сделан ли
отбор пробы в порядке /текущего
санитарного надзора или пр особым
показаниям. /
Бактериологический анализ воды
должен быть произведен / не позднее
2 ч с момента ее взятия./ Указанный
срок может быть увеличу»! до 6 ч при
условии сохранения или,' транспорти-
ровки пробы воды при температуре
от 1 до 5°С, что достигается с помо-
щью резиновых мешков, наполненных
зимой теплой водой, а 'летом — льдом.
ГОСТ 2874-73 нормирует следующие
бактериологические показатели питье-
вой водопроводной воды:
а) общее число бактерий при посе-
ве 1 мл неразведенной воды, опреде-
ляемое числом колоний на мясо-пеп-
тонном агаре после 24-часового выра-
щивания при температуре 37°С (не
более 100); б) количество кишечных
палочек в 1 л воды, определяемое
числом колоний на среде Эндо с при-
менением концентрации бактерий на
мембранных фильтрах (не более 3).
ОПРЕДЕЛЕНИЕ ОБЩЕГО ЧИСЛА МИКРОБОВ В ВОДЕ
Общее микробное загрязнение определяется количеством
микроорганизмов в 1 мл воды, которые при посеве на мясо-
пептонный агар и инкубации при 37±0,5°С в течение 24 ч
образуют колонии, видимые простым глазом или при уве-
личении в 2—5 раз.
В зависимости от степени предполагаемого загрязнения
производят посев не менее двух различных объемов воды,
выбранных с таким расчетом, чтобы на чашках вырастало от
30 до 300 колоний. Водопроводную воду и воду артезианских
колодцев засевают в неразведенном виде по 1 мл.
При бактериологическом исследовании загрязненных вод
(воды шахтных колодцев, речные воды и т. д.) делают посе-
вы разведенной воды. Разведения готовят следующим обра-
зом. Берут несколько пробирок, содержащих по 9 мл стериль-
ной водопроводной воды. Исследуемую воду в количестве
1 мл набирают стерильной пипеткой и вносят в 1-ю пробир-
ку. При этом пипетка должна быть опущена ниже воды не
более чем на 3 мм, чтобы избежать смывания бактерий с ее
наружной поверхности. Другой стерильной пипеткой проду-
304
ванием воздуха тщательно перемешивают содержимое про-
бирки. Таким образом, получают первое разведение 1 : 10. За-
тем из 1-^ пробирки набирают 1 мл и переносят его во 2-ю
пробирку-у получают второе разведение >1 : <100. Из 2-й про-
бирки такое же количество переносят в 3-ю и т. д. Для при-
готовления раждого разведения следует применять новую
стерильную 'пипетку. ,
Из исследуемого образца неразведенной воды и из про-
бирок с ее разведениями в соответствии со степенью пред-
полагаемого загрязнения берут по 1 мл, вносят в стерильные
чашки Петри и заливают <10—12 мл растопленного и осту-
женного до 45°С мясо-пептонного агара. Круговыми движе-
ниями руки, вращая чашки по горизонтальной поверхности
стола, распределяют их содержимое равномерным слоем
по всей площади дна. После застудневания агара чашки с
посевами вверх дном помещают в термостат при 37±0,5°С
на сутки.
После указанного срока выращивания приступают к под-
счету колоний, выросших как на поверхности, так и в глуби-
не агара. Подсчет колоний ведется с помощью лупы (Х5)
или прибора для счета колоний (см. с. 308). Для этого кла-
дут чашку вверх дном на темный лист бумаги (обеспечивая
тем самым лучшую видимость колоний). Для удобства каж-
дую подсчитанную Колонию отмечают со стороны дна чашки
карандашом или чернилами для стекла. Оценивают только те
разведения, при посеве которых на чашках вырастает от 30
до 300 колоний.
Если в чашке с наиболее высоким разведением выросло
свыше 300 колоний и анализ нельзя повторить, колонии под-
считывают при помощи пластинки с сеткой и лупы при силь-
ном боковом освещении. Подсчитывают в разных местах чаш-
ки не менее 20 квадратов площадью 1 см2 каждый. Затем вы-
водят среднее арифметическое число колоний, приходящееся
на 1 см2, и умножают его на площадь чашки в квадратных
сантиметрах.
Результаты анализа выражают количеством бактерий на
1 мл исследуемой воды, для чего число выросших на чашке
колоний умножаемся на степень разведения воды.
За окончательное количество бактерий принимается сред-
нее арифметическое результата подсчета на двух параллель-
ных чашках. При оформлении протокола количество микро-
организмов, определенное в 1 мл исследуемой воды, округля-
ют (табл. 51).
Прибор для счета микробных колоний. Прибор состоит
из металлического корпуса, на верхней панели которого
вмонтирована круглая пластинка из матового термостойкого
стекла с сеткой, на которую вверх дном устанавливают чаш-
ки Петри.
20 Лабинская А. С.
305
При включении прибора в электросеть, включается источ-
ник освещения, в результате чего растровая сетка /вместе с
находящейся на ней чашкой приобретает равномерную осве-
щенность.
Подсчет колоний, выросших в глубине и на поверхности
питательных сред, производят
Таблица 51
Запись результатов определения
микробного числа воды
При количестве олений в 1 мл Запись результата анализа
От 1 до 100 Конкретная ци- фра подсчета
101—1000 Округленная до 10
1001—10 000 Округленная до 100
10001—100000 Округленная до 1000
100 001—1 000 000 Округленная до 10 000
в результате чего к автоматическому счетчику поступает
электроимпульс, сопровождающийся появлением цифры иа
таблице импульсного счетчика. При каждом нажиме на перо
показатель счетчика увеличивается на единицу. Отсчет коли-
чества колоний бактерий производится путем вычисления
разности показаний импульсного счетчика до начала отсчета
и после его окончания.
через лупу Х2, укрепленную на
подставке. С помрщью специ-
альных винтов-за^кимов лупе
придают такое положение, при
котором колоний микробов в
чашке видны наиболее отчет-
ливо (рис. 32). / Подсчет коло-
ний осуществляется посред-
ством специального электро-
пера, соединенного через авто-
ручку с автоматическим счет-
чиком. Техника подсчета про-
ста. Авторучку наполняют
чернилами и в местах нахож-
дения колоний наносят черниль-
ные точки. При этом в "мо-
мент надавливания иа перо
электроконтакт, находящийся
в корпусе ручки, замыкается.
Рис. 32. Прибор для счета колоний в чашках Петри.
50S
МЕТОДЫ ^ОПРЕДЕЛЕНИЯ ТИТРА КИШЕЧНОЙ ПАЛОЧКИ В ВОДЕ
Коли-титр в питьевой воде, согласно действующему ГОСТу
ПЯЮЗ^УЗ, определяют методом мембранных фильтров и бро-
дильным методом. Выбор метода зависит от качества иссле-
дуемой воды. При исследовании чистой, хорошо фильтру-
ющейся воды удобнее пользоваться методом мембранных
фильтров. При исследовании воды, содержащей коллоидные
вещества и посторонние примеси, затрудняющие процесс
фильтрования, пользуются бродильным методом.
Определение титра кишечной палочки методом мембран-
ных фильтров. Сущность метода заключается в концентри-
ровании бактерий из определенного объема воды на мембран-
ных фильтрах с подращиванием их на среде Эндо при 37°С,
дифференцированием выросших колоний и последующим
Подсчетом количества бактерий группы кишечных палочек
в 1 л воды.
Первый день. 1. Подготовка мембранных
фи л ьтро в. Для фильтрования воды отбирают мембран-
ные фильтры № 3 (без изъянов), помещают их в подогретую
до температуры 80°С дистиллированную воду и ставят на
слабый огонь до закипания. Кипячение фильтров производят
трижды по 110 мин. После первого и второго кипячения воду
сливают. После последнего кипячения воду не сливают и
фильтры оставляют в ней до употребления.
2. Подготовка фильтровального аппарата.
Перед посевом воды фильтровальный аппарат протирают
ватным тампоном, смоченным спиртом, и обжигают в целях
стерилизации. На охлажденный после прожигания столик
фильтровального аппарата помещают с помощью стерильного
пинцета с гладкими кончиками мембранный фильтр. Во избе-
жание повреждения фильтра под него подкладывают кружок
стерильной фильтровальной бумаги. Если вода содержит
большое количество взвешенных веществ или клеток фито-
планктона, ее сначала фильтруют через предварительный
фильтр № 6, помещая его поверх фильтра № 3.
На фильтровальный столик с положенными на него фильт-
рами устанавливают и закрепляют верхнюю часть прибора—
воронку.
3. Фильтрование воды. В воронку фильтровального
аппарата стерильно наливают исследуемый объем воды и с
помощью водоструйного насоса создают вакуум в приемном
сосуде.
При анализе воды, поступающей в водопроводную сеть,
необходимо брать объем не менее 333 мл. На этапах очистки
исследуют не менее двух десятикратных объемов воды, вы-
бранных так, чтобы на фильтре вырастало не более 30 коло-
ний бактерий группы кишечных палочек. Для этого следует
20*
307
ориентироваться на результаты предыдущих анализов воды
в этих же пунктах. Так, например, для воды поел? первич-
ного хлорирования рекомендуется брать объемы 1(У и 100 мл;
для необеззараженной воды — 0,1; 1; 10 мл. При анализе воды
неизвестного качества следует засевать 3—4 десятикратных
объема. Например, из водопроводной сети можно фильтро-
вать 3; 30; 100; 200 мл воды, на этапах очистки — 0,1; 1;
10; 100 мл.
Воду открытых источников хозяйственно-питьевого водо-
снабжения фильтруют в объемах, соответствующих предпо-
лагаемой степени ее загрязнения. При анализе воды незагряз-
ненных шахтных колодцев фильтруют количества, равные
100; 10; 1 и ОД мл.
Фильтруют сначала меньшие, а затем большие объемы
воды через один фильтровальный аппарат, меняя каждый
раз фильтры. При фильтровании небольших объемов воды
(1 мл и меньше) в воронку сначала наливают .10 мл сте-
рильной воды, а затем вносят анализируемую воду. По окон-
чании фильтрования снимают воронку прибора, фильтр
захватывают обожженным пинцетом и накладывают на по-
верхность среды Эпдо в чашки Петри.
При пользовании предварительным фильтром на среду Эн-
до кладут оба фильтра (№ 6 и № 3). На одну чашку можно
поместить 4—5 фильтров. Под каждым фильтром делают
надпись с указанием даты, номера анализа и объема про-
фильтрованной воды. Посевы инкубируют в термостате 18—
24 ч при 37°С.
Второй д е н ь. 1. По окончании сроков инкубации про-
изводят просмотр посевов:
а) отсутствие микробного роста на фильтрах или обнару-
жение на них колоний, не характерных для бактерий кишеч-
ной группы (губчатые, пленчатые с неровной поверхностью
и краем), позволяет на этом этапе анализа закончить иссле-
дования (18—24 ч) с выдачей отрицательного результата на
присутствие кишечных палочек в анализируемом объеме
воды;
б) при обнаружении на фильтре колоний, характерных
для кишечных палочек (темно-красных с металлическим
блеском или без него, розовых и прозрачных), исследование
продолжают. Из нескольких колоний каждого типа готовят
мазки, окрашивают их по Граму, микроскопируют. Отсутст-
вие в мазках грамотрицательпых, неспороносных палочек
является основанием для прекращения анализа с регистра-
цией отрицательного результата.
При обнаружении в мазке грамотрицательных палочек,
морфологически сходных с кишечной .(возможны удлинен-
ные, нитевидные формы или крупные полярно окрашенные
палочки), ставится оксидазная проба.
308
2. Оксидазный тест предложен для дифференциации бак-
терий семейства Enterobacteriaceae от грамотрицатель-
ных бактерий семейства Pseudomonadaceae и других водных
сапрофитов, которые в отличие от кишечных бактерий
вырабатывают фермент оксидазу, окисляющую фенилен-
диаминовые соединения до индофенола, имеющего ярко-си-
ний цвет.
Для постановки оксидазного теста мембранные фильтры
с выросшими на них колониями переносят (не переворачивая)
на лист фильтровальной бумаги, предварительно смоченный
реактивом для выявления оксидазы (рец. 32). Результат
реакции учитывают через 2—4 мин.
Колонии микроорганизмов, продуцирующие оксидазу (не
относящиеся к семейству кишечных бактерий), при взаимо-
действии с добавленным реактивом, приобретают синий обо-
док np*i периферии или окрашиваются в синий цвет пол-
ностью (положительная реакция).
Колонии семейства Enterobacteriaceae, не продуцирующие
фермент оксидазу, не изменяют своего первоначального цвета
(отрицательная реакция).
При обнаружении на мембранных фильтрах однотипных
лактозоположительных колоний (темно-красных с металли-
ческим блеском или без него), не вырабатывающих оксидазы,
анализ воды заканчивается на данном этапе подсчетом вы-
росших колоний.
При обнаружении на мембранных фильтрах розовых и
бесцветных колоний с отрицательной оксидазной активностью,
их подсчитывают и подтверждают принадлежность к бакте-
риям группы кишечпых палочек посевом 2—3 изолирован-
ных колоний каждого типа в полужидкую среду с глюкозой
(рец. 44). Результаты роста учитывают через 4—5 ч инкуба-
ции в термостате при 37°iC. При образовании кислоты и газа
результат считается положительным, при отсутствии кислото-
и газообразования — отрицательным. При наличии только
кислоты пробирки оставляют в термостате для окончатель-
ного учета результатов роста через 24 ч. При отсутствии
газообразования через сутки получают окончательный отри-
цательный результат, при наличии газообразования — поло-
жительный результат.
Вычисление коли-индекса. Результат выражают
в виде коли-индекса, определяемого посредством суммиро-
вания колоний кишечных палочек, выросших на поверхности
мембранных фильтров в одной пробе воды, и пересчитывают
это количество на 1 л воды.
Пример. При исследовании пробы воды профильтровано 3 объема
по 100 мл. На первом и втором фильтрах выросло по 3 колонии, на треть-
ем — 9 колоний. Всего выросло 15 колоний. Таким образом, коли-индекс
исследуемого образца воды равен: 1000X15:300=50.
309
Питьевая вода удовлетворяет требованиям ГОСТа 2874-73
в том случае, когда коли-индекс не превышает 3.
При установлении бактериальной загрязненности воды
свыше допустимых норм прибегают к повторному исследо-
ванию воды на наличие бактерий свежего фекального загряз-
нения (преимущественно Escherichia coli), способных фер-
ментировать лактозу до кислоты и газа при 43±0,5°С, в при-
сутствии ингибиторов посторонней микрофлоры. Исследуемый
образец воды фильтруют через мембранный фильтр с после-
дующим подращиванием его на среде Эндо в течение 24 ч
при 37°С.
При повторном обнаружении на фильтрах лактозополо-
жительных темно-красных колоний с металлическим бле-
ском и без него параллельно определению коли-индекса
эти колонии в количестве не более 15 засевают в лактозную
среду с борной кислотой (рец. 143), предварительно нагретую
в водяной бане до 43°1С, и 24 ч инкубируют в термостате при
43°С. Вместо указанной среды можно пользоваться желчно-
лактозной средой с бриллиантовым зеленым (рец. 142), с
инкубацией посевов при 44,5*41
Помутнение с образованием кислоты и газа в посевах
является показателем свежего фекального загрязнения; появ-
ление микробного роста (помутнение среды) без газообразо-
вания не учитывается.
Определение титра кишечной палочки бродильным мето-
дом. Сущность бродильного метода заключается в посеве
определенных объемов исследуемой воды, инкубации ее при
37°С в средах накопления с последующим высевом на среду
Эндо, дифференциацией выросших колоний и определением
наиболее вероятного числа бактерий группы кишечных пало-
чек в 1 л воды по таблицам.
Первый день. Для установления титра кишечной па-
лочки бродильным методом воду в зависимости от характера
водоисточника засевают во флаконы и пробирки с глюкозо-
пептонной '(рец. 140) или лактозо-пептонной средой (рец.
141) с поплавками или комочками ваты для выявления
газообразования:
а) при исследовании воды на этапах очистки и обезза-
раживания засевают: 100; 10; 1; 0,1 мл;
б) на выходе в водопроводную сеть — три объема по
100 мл; три объема по 10 мл; три объема по 1 мл.
Посев воды в объеме 100 и 10 мл производится во флаконы
и пробирки, соответственно с 10 и 1 мл концентрированной
питательной среды. Посев воды в объеме 1 и 0,1 мл засева-
ется в пробирки с 10 мл среды нормальной концентрации.
Флаконы и пробирки с засеянными средами инкубируют в
термостате 24 ч при 37°С.
Второй день. 1. Учитывают результаты посевов:
310
а) отсутствие помутнения и образования кислоты и газа
во флаконах и пробирках является показателем отрицатель-
ного результата на наличие бактерий группы кишечной палоч-
ки в исследуемом объеме воды, дающим право закончить
исследование через 24 ч;
б) при помутнении питательной среды с образованием
кислоты и газа или помутнении и кислотообразовании (на
глюкозо-пептонной среде) или только помутнении (на лакто-
зо-пептонной среде) производится высев на среду Эндо.
Высев делается бактериальной петлей, густым штрихом, для
получения изолированных колоний. Чашки с посевами инку-
бируют 16—18 ч при 37°С.
Третий день. 1. Просматривают посевы на среде
Эндо:
а) отсутствие микробного роста или наличие пленчатых,
губчатых колоний с неровной поверхностью и краями, а
также плесневых и других не характерных для кишечной
палочки колоний является основанием для отрицательного
ответа;
б) при обнаружении лактозоположительных темно-крас-
ных колоний с металлическим блеском или без него необ-
ходимо установить принадлежность выросших микроорганиз-
мов к семейству кишечных бактерий. С этой целью произ-
водится микроскопирование материала колоний и постановка
оксидазного теста.
2. Оксидазный тест при исследовании воды бродильным
методом ставится следующим образом. Со среды Эндо бак-
териальной петлей или стеклянной палочкой снимают по
2—3 колонии каждого типа. Снятую таким образом микроб-
ную массу наносят штрихом на фильтровальную бумагу,
смоченную реактивом (рец. 32). При отрицательном резуль-
тате оксидазного теста бумага в месте нанесения бактери-
альной культуры цвета не изменяет. При положительном
результате — в течение минуты — приобретает ярко-синюю
окраску. При постановке данного теста одним из обязатель-
ных условий является исследование изолированных колоний,
так как примесь оксидазоположительных бактерий может
привести к ложному посинению материала и необосно-
ванному исключению при подсчете колоний кишечных
палочек.
Наличие в мазках грамотрицательных неспороносных
палочек с отрицательной реакцией оксидазного теста позво-
ляет немедленно дать положительный ответ о наличии бак-
терий группы кишечной палочки в исследуемой воде.
При исследовании питьевой воды учитывают розовые и
бесцветные колонии. В этих случаях из 2—3 колоний разно-
го типа делают мазки, окрашивают по Граму, макроскопи-
руют. При обнаружении грамотрицательных неспороносных
311
Таблица 52
Определение индекса бактерий группы кишечных палочек
при исследовании 300 мл воды
Количество положительных результатов анализа воды из Коли-нидекс Пределы индекса (доверительные границы) Коли-титр
3 флаконов по 100 мл 3 пробирок по 10 мл 3 пробирок по 1 мл нижний верхний
0 0 0 Менее 3 — Более 333
0 0 1 3 0,5 9 333
0 1 0 3 0,5 13 333
1 0 0 4 0,5 20 250
1 0 1 7 1 21 143
1 1 0 7 1 23 143
1 1 1 11 1 36 91
1 2 0 11 3 36 91
2 0 0 9 1 36 111
2 0 1 14 3 37 72
2 1 0 15 3 44 67
2 1 1 20 7 89 50
2 2 0 21 4 47 48
2 2 1 28 10 149 86
3 0 0 23 4 120 43
3 0 1 39 7 130 26
3 0 2 64 15 379 16
3 1 0 43 7 210 23
3 1 1 75 14 230 13
3 1 2 120 30 380 8
3 2 0 93 15 380 И
3 2 1 150 30 440 7
3 2 2 210 35 470 5
3 3 0 240 36 1300 4
3 3 1 460 71 2400 2
3 3 2 1100 150 4800 0,9
3 3 3 Более 1100 —. — Менее 0,9
палочек с колониями каждого типа ставится оксидазный
тест.
При наличии грамположительных или спорообразующих
бактерий и положительном результате оксидазного теста на
40—42-м часу ведения анализа дается отрицательный резуль-
тат на наличие бактерий кишечной группы в исследуемом
объеме воды.
3. При выявлении в воде грамотрицательных, бесспоро-
вых, оксидазоотрицательных бактерий из 2—3 колоний
различного типа берут микробную культуру для высева в
полужидкую среду с глюкозой. Результат роста учитывают
после 4—5 ч инкубации в термостате при 37°С:
а) при обнаружении кислоты и газа в посеве дается
положительный ответ;
б) при отсутствии кислоты и газа дается отрицательный
ответ;
312
Таблица 53
Определение коли-индекса при исследовании 500 мл воды
Количество положитель- ных результатов из 5 флаконов по 100 мл Коли-индекс Пределы индекса (доверительные границы) Колн-титр
нижний верхний
0 Ченее 2 0 6,0 Более 455
1 2 0.1 12,6 455
2 5 0,5 19,2 196
3 9 1,8 29,4 109
4 16 3,3 52,9 62
5 Более 16 8,0 — Менее 62
Примечание. Данные таблицы могут быть применены в тех случаях, когда
воду на выходе в водопроводную сеть или из нее исследуют в объеме 500 мл.
в) при наличии в посевах только кислоты пробирки остав-
ляют еще па 24 ч для окончательного учета. При отсутствии
газообразования на 2-е сутки дается окончательный отрица-
тельный результат, при появлении газа — окончательный
положительный результат.
4. Вычисление коли-индекса. Результат анализа выража-
ют в виде коли-индекса: наиболее вероятного числа бактерий
группы кишечных палочек в 1 л воды. Величину коли-индекса
определяют по таблицам. При анализе питьевой воды на
выходе в водопроводную сеть и из нее коли-индекс опреде-
ляют по табл. 52 и 53, на этапах очистки и обеззаражи-
вания — по табл. 54.
Табл. 59—61 для вычисления результатов анализа водо-
проводной воды бродильным методом заимствованы из Меж-
дународного стандарта качества питьевой воды (1964).
В рекомендуемые таблицы введены индексы при всех положи-
Таблнца54
Определение колн-индекса при исследовании воды по этапам очистки
Объем исследуемой воды, мл Колн-индекс Коли-тнтр
100 10 1 0,1
Менее 9 Более 111
- — —- 4- 9 111
— + — 10 105
+ 23 43
+ — + — 94 10
+ + — 230 4
+ + + 960 1
+ + + 2380 0,4
+ + 4- + Более 2380 Менее 0,4
313
тельных и всех отрицательных результатах и даны титры
(т. е. наименьшее количество воды, в котором содержится
хотя бы одна микробная клетка), рассчитанные по формуле:
1000
coli-титр = ----
индекс
По таблицам определяют наиболее вероятную величину
индекса бактерий группы кишечных палочек, соответству-
ющую полученным комбинациям положительных и отри-
цательных результатов.
Доверительные интервалы определяют верхний и нижний
пределы, в диапазоне которых может колебаться истинное
количество бактерий с 95% вероятностью. При регистрации
результатов анализа доверительные границы не указывают.
Для определения индекса кишечных палочек на этапах
очистки и обеззараживания пользуются табл. 54 в соответст-
вии со схемой посева четырех десятикратных объемов воды.
При таком ограниченном количестве объемов доверительные
границы не могут быть рассчитаны и результаты следует
считать ориентировочными.
При анализе воды большей степени загрязнения умень-
шают объем воды в 10 или 100 раз для того, чтобы в послед-
нем объеме получить отрицательные результаты При этом
соответственно увеличивают в 10 или 100 раз индекс и умень-
шают в 10 или 100 раз титр.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ ПОЧВЫ НАСЕЛЕННЫХ МЕСТ
Санитарно-бактериологический анализ почвы включает:
1) определение общего микробного числа в 1 г почвы; 2)
установление титра кишечной палочки; 3) обнаружение в поч-
ве Cl. perfringens.
При наличии эпидемических показаний производят иссле-
дование почвы на зараженность бактериями тифо-паратифоз-
ной группы, клостридиями столбняка и ботулизма.
Санитарное состояние почвы оценивают по количеству
содержащихся в ней микробов, титру кишечной палочки и
титру Cl. perfringens (табл. 55).
Техника взятия проб почвы. На обследуемой
территории до 1000 м2 выделяют два участка по 25 м2. Один
должен быть расположен близ источников загрязнения (вы-
гребные ямы, мусорные ящики и т. д.), другой — в отдалении
от них.
На каждом участке намечают 5 точек: четыре — по углам
участка и одну — в центре его, чтобы составить точное пред-
ставление о санитарном состоянии исследуемой территории.
314
Таблица 55
Схема санитарной оценки почвы по бактериологическим показателям
Оценка поим Общее чиело бактерий в 1 г почвы Титр в г Титр в мл
Чистая Слабо загрязненная Умеренно загрязненная Сильно загрязненная 10 000 Не более 10 000 100000—900000 1 000 000 и выше Выше 1 1—0,01 0,01—0,001 До 0,001 Выше б, 1 0,1—0,001 0,001—0,0001 До 0,001
Для исследования поверхностного слоя почвы выкапывают
лопатой цельный кусок почвы. Затем с одной из боковых по-
верхностей его прокаленным на огне ножом срезают пласт
толщиной 1—1,5 см и из середины куска на заданной глубине
от верха набирают стерильной ложкой 200—300 г почвы.
Взятие образцов из глубинных слоев почвы производят
буром Некрасова (рис. 33), который представляет собой
штангу, снабженную на верхнем конце рукояткой для вра-
щения. В нижней части бура имеется полость, остающаяся
закрытой во время бурения. При достижении заданной глу-
бины бур поворачивают в обратную сторону, вследствие чего
полость его открывается, наполняясь почвой, подлежащей
исследованию.
Приготовление почвенной взвеси (болтуш-
ка). Навеску почвы в количестве 30 г или больше высыпают
в стерильную колбу емкостью 500 мл и доливают стерильной
водопроводной водой из расчета 1 : 10. Полученную таким
образом почвенную болтушку взбалтывают в течение 10—
15 мин, а затем в течение 2—5 мин отстаивают. Из первого
разведения (1 : ГО) готовят несколько последовательных
разведений (см. с. 306). При исследовании чистых почв огра-
ничиваются 3—4 разведениями (до 1 : 1000, 1 : 10 000); при
исследовании сильно загрязненных почв готовят 6—7 разве-
дений, исследуя разведения 1 : 100 000—1 : 1 000 000.
Определение общего микробного числа в почве. Общую
микробную обсемененность почвы определяют так же, как
микробную загрязненность воды. Из каждой пробы исполь-
зуют для посева не менее двух различных разведений (в за-
висимости от степени предполагаемого загрязнения почвы).
Посевы помещают в термостат при 37О,С на 24 ч. Подсчет
выросших колоний и пересчет на количество микробов, со-
держащихся на 1 мл исследуемой почвы, производят, как
описано выше.
Определение титра кишечной палочки почвы. Для опреде-
ления загрязнения почвы бактериями кишечной палочки
различные количества почвы засевают в среду Кесслера
(рец. 144).
315
Рис. 33. Почвенный бур
Некрасова.
/ — головка с рукояткой;
2—-основная штанга; 3—
шпонка; 4—муфта; 5 —
крышка; 6 — дополнитель-
ная йгтаига; 7 — коробка;
8 — нож; 9 — бур в собран-
ном виде.
Чистую почву засевают от 1 до 0,001 г, загрязненную — от
0,001 до 0,000001 г, для посевов пользуются различными
разведениями почвенной взвеси. Для посева 1 г почвы наби-
рают стерильной пипеткой 10 мл первого разведения (1 : 10)
и вносят его в колбу с 50 мл среды Кесслера. Меньшие коли-
чества почвы берут из соответствующих разведений по 1 мл
и засевают пробирки с поплавками, содержащими по 5 мл
среды. Для посева 0,1 г набирают 1 мл первого разведения,
для посева 0,001 г —0,1 мл из разведения 1 :1000 и т. д. Колбы
и пробирки с засеянной средой Кесслера помещают в термо-
стат при 43°С. Дальнейший ход анализа и учет полученных
результатов ведутся так же, как при исследовании воды.
Определение титра Cl. perfringens в почве. Для определе-
ния титра Cl. perfringens пользуются разведениями почвен-
ной взвеси. Чистую почву засевают в разведении 1 : 10—
1:1000, загрязненную —1:10 000— 1:100 000; 1 мл из каж-
дого разведения почвенной взвеси вносят в пробирки с 5 мл
молочной среды Тукаева (рец. 117). Для освобождения от
посторонней неспороносной микрофлоры посевы прогревают
316
в водяной бапе при 80°С в течение 15 мин и затем выращи-
вают в термостате при 43°'С (можно при 37°) в течение
12—20 ч. Размножение Cl. perfringens сопровождается ха-
рактерным свертыванием молока. Предельное разведение поч-
венной взвеси, которое дает на молочной среде размноже-
ние Cl. perfringens, означает титр этого микроба в почве.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ ВОЗДУХА
В атмосферном воздухе содержится большое количество
микробов — почвенных сапрофитов, попадающих в воздух с
мельчайшими частицами почвы. Среди них находятся споро-
образующие палочки, пигментные бактерии, грибы и дрожжи.
В воздухе закрытых помещений обнаруживаются микро-
организмы, выделяемые постоянно со слизистых оболочек
верхних дыхательных путей человека. От больных с локали-
зацией патологического процесса в полости рта и верхних
дыхательных путях наряду с условно патогенными микроор-
ганизмами — стафилококками и зеленящими стрептококка-
ми — выделяются в окружающую среду патогенные микро-
бы — гемолитические стрептококки группы А, бактерии диф-
терии, коклюша, микобактерии туберкулеза и др., в зависимо-
сти от этиологии заболевания. Микробиологический анализ
воздуха на патогенную флору производят только по эпиде-
мическим показаниям.
В плановом порядке пробы воздуха для бактериологиче-
ского исследования берутся в операционных блоках, после-
операционных палатах, отделениях реанимации, интенсивной
терапии и других помещениях, требующих асептических усло-
вий. По эпидемическим показаниям бактериологическому ис-
следованию подвергают воздух ясель, детских садов, школ,
заводов, кинотеатров и т. д.
Для санитарно-гигиенической оценки воздуха определяют:
1) общее количество микробов, находящихся в 1 м3 воз-
духа;
2) количество в том же объеме воздуха санитарно-показа-
тельных микробов (0-гемолитические, а-зеленящие стрепто-
кокки и гемолитические стафилококки). По концентрации
этих микробов определяют степень загрязнения воздушной
среды аналогично тому, как по титру кишечной палочки оце-
нивают качество питьевой воды.
Обнаружение в воздухе закрытых помещений 0-гемолити-
ческого стрептококка группы А и стафилококка, обладающе-
го признаками патогенности, является показателем эпидеми-
ческого неблагополучия данного объекта.
Нормативов по оценке бактериальной загрязненности воз-
духа в настоящее время нет. Критерием для оценки чистого
317
Рис. 34. Аппарат Крото-
ва (схема конструкции)-
1 — цилиндрический корпус;
2— основание корпуса; Л —
электромотор; 4 — центро-
бежный вентилятор; 5 —
восьмилопастная крыльчат-
ка; 6 —диск; 7 — пружины;
в — чашка Петри; 9 — крыш-
ка прибора; 10 — накидные
замки; // — диски из плек-
сигласа: /2 — клиновидная
щель; 13 — разрезное коль-
цо; 14 — штуцер с диафраг-
мой; /5 — выводная трубка.
и загрязненного воздуха помещений могут служить показа-
тели, приведенные в табл. 56.
При исследовании воздуха закрытых помещений большое
значение имеет способ выделения микроорганизмов из возду-
ха. В зависимости от принципа улавливания бактерий микро-
биологические методы исследования воздуха разделяют на
седиментациойные, фильтрационные и аспи-
рационные. В настоящее время наиболее широкое рас-
пространение находит аспирационный метод с применением
аппарата Кротова.
Отбор воздуха аспирационным методом с применением
аппарата Кротова. Конструкция аппарата Кротова основана
на принципе ударного действия струи воздуха (к аппарату
Кротова прилагаются подробное описание прибора и прави-
ла его эксплуатации).
Аппарат состоит из трех частей: узла для отбора проб
воздуха, микроманометра и электромотора (рис. 34). Узел
для отбора проб воздуха, вмонтированный в металлический
корпус, имеющий форму цилиндра, представляет собой элект-
ромотор, на оси которого укреплен центробежный вентиля-
тор, а в ротор вделана малая крыльчатка. Одновременно с
вращением центробежного вентилятора начинает вращаться
малая крыльчатка, на диске которой с помощью трех пру-
жин укрепляется чашка Петри, заполненная плотной пита-
тельной средой.
Для определения общей микробной обсемененности взятие
проб воздуха производят на 2% мясо-пептонный агар, для
выделения стафилококков — на молочио-солевой (рец. 62)
3»
Таблицам
Бактериологические показатели, рекомендуемые для санитарно-гигиенической оценки воздуха лечебно-профилактических
учреждений
Нмшенованяе объекта Условия Допустимые показателя Источив»
микробное число в 1 м3 содержание
патогенных стафилококков патогенных стрептококков
Операционные До операции До 500
После операции > 1000
Послеоперационные па- латы, отделение реани- мации > 750
Родильный дом, родиль- ные залы При поступлении рожениц н прие- ме родов > 1500
Послеродовые палаты > 2000
Палаты новорожденных > 1500
Перевязочные, предопе- рационные палаты До начала работы > .750
Летом » 3500
Зимой > 5000
Не должно быть То же » > Не должно быть То же » » Временные методические рекоменда- ции по организации и проведению комплексных санитарно-гигиениче- ских мероприятий в отделениях, больницах, клиниках, клиниках и институтах хирургического профи- ля X» 1142—73 от 29 декабря 1973 г.
» » До 16 сумм До 12 > » » арно Временные методические указания по санитарной бактериологии для ро- дильных домов № 679—67 от 19 июля 1967 г.
Не должно быть До 24 > 52 Не должно быть До 16 > 36
сэ
5
или желточно-солевой агар (рец. 61), для выделения стреп-
тококков — на среду Гарро (рец. 65). Для выделения других
патогенных микроорганизмов подбирают соответствующие им
элективные питательные среды.
Корпус прибора герметически закрывают крышкой, цент-
ральная часть которой представляет собой прозрачный диск
из плексигласа с радиально расположенной клиновидной
целью. Ширина щели у края диска 1,2 мм, а у центра —
0,1 мм.
При вращении вентилятора воздух засасывается через
щель крышки, ударяется о поверхность питательной среды и
оставляет на ней большую часть микроорганизмов, содержа-
щихся в порции поступающего воздуха. Вращение чашки с
примерной скоростью 60 об/мин гарантирует равномерное
распределение микробов по всей поверхности питательной
среды, находящейся в чашке. Воздух, поступивший в при-
бор, выделяется наружу через воздухопроводную трубу,
соединенную с микроманометром, с помощью которого реги-
стрируется скорость просасывания воздуха через прибор. Ап-
парат позволяет пропускать от 25 до 50 л воздуха в минуту.
Порядок работы с аппаратом Кротова. При-
бор включают в электросеть. Снимают крышку, укрепляют
на диске открытую чашку Петри с питательной средой, сооб-
щая ей некоторые движения от руки по часовой стрелке.
Крышку прибора закрывают и отмечают начальное время по-
ступления воздуха в прибор. Устанавливают скорость проса-
сывания воздуха, равную 25 л/мин. Для определения общей
обсемененности ограничиваются просасыванием 100 л, для
выявления кокковой и другой патогенной микрофлоры объем
исследуемого воздуха увеличивают до 250 л.
Чашки с «посевом воздуха» инкубируют 24—48 ч при
температуре 37 °C. При просмотре микробного роста через
указанный промежуток времени из колоний, подозрительных
на тот или иной вид микроба, готовят мазки, окрашивают их
по Граму и микроскопируют, а затем выделяют чистую куль-
туру для изучения ее свойств и определения видовой принад-
лежности, пользуясь для этой цели общепринятыми метода-
ми, изложенными в соответствующих разделах частной мик-
робиологии. Результаты анализа выражают средним числом
микроорганизмов, обнаруженных в 1 м3 воздуха.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ МОЛОКА И МОЛОЧНЫХ ПРОДУКТОВ
Санитарно-бактериологический анализ молока и молочных
продуктов предусматривает определение общей микробной
обсемененности продукта и количественного содержания в
нем бактерий группы кишечной палочки.
320
При наличии эпидемических показаний молочные продук-
ты исследуют на содержание патогенных микробов.
В табл. 57 приведены нормы содержания микробов в мо-
локе и некоторых наиболее употребительных молочных про-
дуктах. •
Отбор проб молока и молочных продуктов
производится в соответствии с ГОСТ 3622-57. Молоко, слив-
ки, кефир, простоквашу и другие жидкие продукты после
тщательного перемешивания стерильным черпаком, щупом
или шпателем отбирают в количестве 50 г/мл. Пробы моро-
женого в том же количестве берут из середины массы, для
чего с поверхности ее снимают стерильной ложкой верхний
слой толщиной 2,5 см. Пробы творога и сливочного масла по
20 г забирают щупом из глубины в 2—3 различных точках
после тщательного зачищения верхнего слоя. Из расфасован-
ных продуктов берут по два образца в оригинальной упаков-
ке. При взятии проб сыра поверхность его протирают ватой,
смоченной этиловым спиртом, а затем прожигают ее. Сте-
рильный щуп вводят наклонно в середину сыра на 3Д его
глубины и отбирают около 10 г. Молоко сухое, сливки сухие
с сахаром и без сахара берут из разных мест в количестве
50 г стерильной ложкой. Молочные консервы (сгущенное мо-
локо и сливки с сахаром, кофе и какао с сахаром и сгущен-
ным молоком) отбирают для бактериологического исследова-
ния по две банки от каждой варки.
Подготовка молочных продуктов для бакте-
риологического исследования. Из образца продук-
тов жидкой и полужидкой консистенции готовят ряд последо-
вательных десятикратных разведений в стерильном изотони-
ческом растворе хлорида натрия. Для этого образцы масла
и мороженого помещают в стерильную посуду и растапли-
вают в водяной бане при температуре 40—45 °C до образова-
ния однородной массы.
Банки с молочными консервами промывают чистой теплой
водой со щеткой и вытирают. Перед вскрытием банку флам-
бируют смоченным в спирте и зажженным факелом из ваты.
Вскрытие банок производят стерильным консервным ножом.
Образцы творога, изделий из него и сыра, полученные из
различных участков продукта, перемешивают стерильным
шпателем. Из каждого подготовленного таким образом про-
дукта в стерильную посуду берут навески по 10 г, добавля-
ют к ним 90 мл стерильного изотопического раствора хлори-
да натрия, подогретого до 40—45 °C, и затем тщательно в те-
чение 3—5 мин взбалтывают до получения^ однородной эмуль-
сии.
Приготовленное основное разведение (1:10) используют
для получения всех дальнейших разведений. Выбор разведе-
ния для посева на общую микробную обсемененность проив-
21 Лабинская А. С.
321
Таблица 57
Допустимые нормы содержания микробов в молоке и молочных
продуктах
Наименование и сорт продукта Общее количество бактерий, допусти* мое в 1 мл (г) молочного продукта Кишечиая палочка в 1 мл молочного продукта
Молоко пастеризованное - в бутылках и пакетах: сорт А сорт Б Пастеризованное во флягах и цистернах Оливки сухие и сливки сухие с сахаром: сорт высший сорт I Мороженое (все сорта) Молоко коровье цельное сухое: сорт высший сорт I Молоко сухое для детей грудного воз- раста Молоко консервированное, сгущенное с сахаром 75000 150 000 300 000 50 000 100 000 100 000 50 000 70 000 25000 50 000 3 0,3 0,3 Не допускается » » 0,3 Не допускается » » » » 0,3
водится с учетом наиболее вероятного микробного обсемене-
ния для каждого вида продукции в соответствии с данными,
приведенными в табл. 57.
Определение общей микробной обсемененности молока и
молочных продуктов. Общее количество бактерий определя-
ют в 1 мл/г исследуемого молока или молочного продукта.
Выбранные для посева разведения продукта вносят по 1 мл
(каждого разведения) в одну чашку Петри и заливают 12—
15 мл расплавленного и остуженного др температуры 45 °C
мясо-пептонного агара. Посевы помещают в термостат при
37 °C на 48 ч.
Подсчет колоний и определение общего микробного числа
в 1 г исследуемого продукта производят в соответствии с об-
щепринятой методикой (см. с. 306). У молочнокислых про-
дуктов (кефир, простокваша, ацидофильное молоко и др.)
общую микробную обсемененность не опред еляют, так как они
содержат производственную молочнокислую микрофлору:
Str. lactis, Str. cremoris, Str. diacetillactis, Str. thermophilus,
Lactobact. bulgaricum в виде диплококков, цепочек и палочек.
Определение титра кишечной палочки в молоке и молоч-
ных продуктах. Обсемененность молока и молочных продук-
тов бактериями группы кишечной палочки определяется бро-
дильным методом, сущность которого заключается в следую-
щем.
.322
Первый день. Из разведений исследуемых образцов
продуктов (табл. 58) берут по 1 мл и засевают в пробир-
ки со средой Кесслера (рец. 144). Засеянные пробирки поме-
щают на 18—‘24 ч в термостат при 43 °C.
Таблица 58
Продукт Засеваемое разведение Количество пробирок со средой, засеваемое из каждого разведения
Молоко и сливки пастеризованные, сгущенное молоко с сахаром, ке- фир, кумыс, ацидофильное молоко, простокваша, ряжеика, кисломолоч- ный напиток «Южный», йогурт 1; 1:10 .3
Молоко и слив.ки сырые От 1:10 до 1:10 000 1
Мороженое, коктейли из мороженого 1:10 3
Масло 1; 1:10; 1:100; 1:1000 2
Сыр От 1:10 до 1:100 000 2
Творог, сметана От 1:10 до 1:100 000 1
Второй день. Учитывают результаты первой бродиль-
ной пробы. Из пробирок с наличием газа в поплавках дела-
ют высевы на среду Эндо. Посевы инкубируют при 37 °C в
течение 20—24 ч.
Третий день. Просматривают результаты микробного
роста на среде Эндо. Отбирают колонии, характерные для
бактерий группы кишечной палочки, готовят из них мазки,
окрашивают по Граму и микроскопируют. При наличии в
1мазке грамотрицательных палочек, подозрительных в отно-
шении группы кишечных бактерий, производят Высев: а) в
‘Среду Гисса с глюкозой (2-я бродильная проба); б) в среду
Козера (рец. 147) для выявления цитр.а’пположительных раз-
новидностей Е. coli, которые, согласно указаниям ГОСТ
9225-68, при определении коли-титра молока и молочных про-
дуктов не учитываются.
Четвертый день. Просматривают посевы, сделанные
накануне.
1. Представители кишечных бактерий — показатели фе-
кального загрязнения объектов внешней среды, не усваиваю-
щие углерод из солей лимонной кислоты, на среде Козера
расти неспособны. Рост не подлежащих учету цитратполо-
жительных разновидностей бактерий группы кишечной па-
лочки сопровождается изменением цвета среды из оливково-
зеленого в васильковый.
21*
323
2. На среде Гисса с лактозой отмечают результат второй
бродильной пробы и устанавливают коли-титр исследуемого
продукта, руководствуясь указаниями ГОСТ 9225-68.
Для пастеризованного молока, сливок, кефира, кумыса,
ацидофильного молока, молочнокислого напитка «Южный»,
коли-титр вычисляется в соответствии с данными,, приведен-
ными в табл. 59.
Таблица 59
Вариант Кишечная палочка обнаружена в следующих объемах, мл Вычисление коли-титра, мл
I 1 1 0,1 0,1 0,1
а — — — — — — >3
б + — — — — — 3
в + + + + +
+ + — + + + <0,3
4- + + + + +
а) Если ни в одном из засеянных объемов продукта не
обнаруживаются кишечные палочки, коли-титр считается
«более 3 мл».
б) Если в одном из трех засеянных объемов по 1 мл про-
дукта обнаруживаются кислота и газ, коли-титр считается
равным «3 мл».
в) Если кишечная палочка обнаруживается в посевах 5
объемов или во всех 6 объемах продукта, коли-титр считает-
ся «менее 0,3 мл».
Во всех остальных случаях коли-титр принимается за
«0,3 мл».
Для мороженого и молочных коктейлей коли-титр уста-
навливают, руководствуясь данными табл. .60.
а) Если кислота и газ не обнаруживаются ни в одном из
трех засеянных объемов по 0,1 мл, коли-титр считается «бо-
лее ОД мл».
Таблица 60
.Вариант Кишечная палочка обнаружена в следующих объемах, мл Вычисление коли-титра, мл
0,1 0,1 0.1
а - - >о,3
б + — — 0,3
.в + + — <0,3
+ + +
324
б) Если кислота и газ обнаруживаются в одном из трех
засеянных объемов по 0,1 мл, коли-титр считается ранным
«0,3 мл».
в) Если кислота и газ обнаруживаются в двух или трех
засеянных объемах по 0,1 мл, коли-титр «менее 0,3 мл».
Для остальных продуктов коли-титр устанавливают, ру-
ководствуясь данными табл. 61.
Таблица 61
Вариант Кишечиая палочка обнаружена в следующих объемах, мл Вычисление коли-титра, мл
1 0,1 0,01 0,001 0,0001
а __ __ — >1.1
б + + + + <0,0001
в + — —— 1.1
г + + — — — 0,1
д + + + — 0,01
а) Если ни в одном из засеянных объемов продукта не
обнаружено кислоты и газа, коли-титр считается больше
суммы засеянных объемов.
б) Если кислота и газ обнаружены во всех засеянных
объемах продукта, коли-титр считается менее наиминыпего
засеянного объема или массы продукта.
в) Если кислота и газ обнаруживаются только в одном
из засеянных объемов, коли-титр равен общему засеянному
объему (массе) продукта.
г) Если кислота и газ обнаруживаются в первых двух
засеянных объемах, коли-титр считается «равным 0,1 мл».
д) Если кислота и газ обнаруживаются в нескольких за-
сеянных объемах, за коли-титр принимают количество про-
дукта в наибольшем разведении, давшем рост кишечной па-
лочки. Если кишечная палочка обнаруживается в меньшем
засеянном объеме и не обнаруживается в большем исследо-
вание необходимо повторить.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ ИЗДЕЛИЙ ИЗ КРЕМА
Санитарно-бактериологическое исследование кондитерско-
кремовых изделий в соответствии с методическими указания-
ми, утвержденными Министерством здравоохранения СССР
(1351-75), предусматривает: 1) установление титра кишечной
палочки и 2) определение плазмокоагулирующих стафилокок-
ков в 1 г изделий из крема.
325
Возникновение стафилококковых интоксикаций после упо-
требления изделий из крема становится возможным при на-
рушении санитарных условий изготовления, хранения и реа-
лизации этих изделий. Загрязнение изделий из крема стафи-
лококками происходит при несоблюдении правил личной
гигиены и при плохом санитарном состоянии кондитерских
цехов.
Отбор проб крема 1И подготовка их для бактериологиче-
ского исследования1. Крем из различных участков продукта
снимают стерильной ложкой в количестве около 50 г, поме-
щают в стерильную колбу и ставят в термостат или водя-
ную баню при 43—45 °C. Для посева используют нижний
слой растопленного крема.
Определение титра кишечной цалочки в изделии из крема.
Первый день. Для определения титра кишечной палочки
из нижнего слоя растопленного крема берут 1 мл и вносят
в пробирку с 9 мл стерильной пептонной воды или изотони-
ческого раствора хлорида натрия. Из полученного таким
образом основного (1 : 10) разведения готовят ряд последо-
вательных десятикратных разведений.
Исследуемый продукт засевают в объеме 1; 0,1; 0,01 и
0,001 мл. Высев 1 мл осуществляется посредством засева
10 мл исходного разведения (1 : 10) крема в колбу с 50 мл
среды Кесслера (рец. 144). Все остальные объемы засевают
в количестве 1 мл соответствующего разведения в пробирки
со средой Кесслера, разлитой по 5 мл. Посевы исследуемого'
материала инкубируют 18—24 ч при 43 °C.
Второй день. Из всех пробирок со средой Кесслера
независимо от наличия в ней признаков роста производят
высев на сектора чашек со средой Эндо. Засеянные чашки
помещают в термостат с температурой 37 °C на 18—24 ч.
Третий день. Просматривают результаты микробного
роста на среде Эндо. При отсутствии колоний, характерных
для бактерий группы кишечной палочки, на всех секторах
чашек дают отрицательный ответ. Из колоний, подозритель-
ных в отношении Е. coli, готовят мазки для окрашивания по
Граму. Наличие в препаратах грамнегативных палочек ука-
зывает на присутствие бактерий группы кишечных палочек.
Вычисление коли-титра кондитерских изделий из крема
производится в соответствии с табл. 58 (ГОСТ 9225-68).
Выявление в креме коагулазоположительных стафилокок-
ков. 1. Из нижнего слоя крема, растопленного при 45°С, на-
бирают в пипетку 0,1 мл и засевают его на поверхность мо-
1 При текущем надзоре за предприятиями кондитерско-кремовых изде-
лий объектом бактериологического исследования являются: яичная масса
(мелаиж), масло сливочное, сироп, крем на различных этапах его изготов-
ления, крем готовых изделий, а также смывы с рук персонала, спецодежды*
инвентаря и оборудования.
326
лочно-солевогю агара (рец. 62); Засеваемый материал тща-
тельно втирают в поверхность питательной среды. Засеян-
ные чашки выдерживают 18—24 ч в термостате при 37 °C
или 48 ч при комнатной температуре.
2. Параллельно посеву на плотную питательную среду
исследуемый крем в объеме 0,5 мл высевают в пробирки с
5 мл среды накопления — солевым (6,5—10%) бульоном. По-
севы инкубируют при 37 °C в течение суток.
Второй день. 1. Просматривают посевы, сделанные на
молочно-солевом агаре. Из колоний с признаками, характер-
ными для стафилококка (см. с. 165), делают мазки, окраши-
вают их по Граму и микроскопируют.
2. Три — пять отмеченных колоний отсевают в чашки с 5%
кровяным агаром для определения гемолитической актив-
ности.
3. Первичные посевы на молочно-солевом агаре сохраня-
ют в течение нескольких дней при комнатной температуре
для выявления пигмента стафилококков. При отсутствии ха-
рактерных колоний через 48 ч производят высев со сред на-
копления на кровяной агар и в чашки с молочно-солевым
агаром.
Третий день. 1. Отмечают характер роста на кровя-
ном агаре (см. с. 166).
2. Ставят реакцию плазмокоагуляции (см. с. 166).
3. Определяют характер пигмента на молочно-солевом
агаре (см. с. 166). При наличии соответствующих показаний
выделенные штаммы стафилококка испытывают в биологиче-
ской пробе на энтеротоксин (см. с. 171).
Для количественного учета стафилококков в 1 г/мл иссле-
дуемого материала все выросшие на плотной среде колонии,
характерные для стафилококков, подлежат подсчету и перес-
чету на 1 г/мл исследуемой пробы по общепринятой методи-
ке (см. с. 306).
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ МЯСО-КОЛБАСНЫХ ИЗДЕЛИИ
Бактериологическое исследование колбасных изделий и
продуктов из мяса (ГОСТ 9958-74) предусматривает опреде-
ление: 1) общего числа бактерий; 2) присутствия бактерий
группы кишечной палочки; 3) наличия бактерий рода саль-
монелл.
Из каждого образца колбасных изделий, подлежащих
бактериологическому исследованию, берут навески массой по
20 г, помещают их в стерильные стаканы гомогенизатора
или фарфоровые ступки и растирают с 2—3 г стерильного
кварцевого песка, добавляя небольшими порциями стериль-
ный изотопический раствор хлорида натрия. Приготовленную
327
таким образом гомогенную массу оставляют на 15 мин при
комнатной температуре.
Посев на общую микробную обсемененность. Для опреде-
ления общей микробной обсемененности из каждого исследу-
емого образна продукта делают 2 посева по 0,1 и 0,01 г, что-
бы получить на чашках от 30 до 300 колоний. Для высева
0,1 г стерильной пипеткой с широким концом отбирают
0,5 мл исходной взвеси и переносят ее в стерильную чашку
Петри. Для noceBia 0,01 г берут ту же взвесь в объеме 0,5 мл
и вносят в пробирку с 4,5 мл изотонического раствора хлори-
да натрия. После тщательного перемешивания из содержимо-
го пробирки набирают 0,5 мл и переносят во вторую чашку
Петри. Обе чашки заливают 12—15 мл расплавленного и ос-
туженного до 40—45°C мясо-пептонного агара. После засту-
дневания на поверхность агара наливают 4—5 мл голодного
агара для' образования слоя толщиной 3—4 мм, предотвра-
щающего ползущий рост протея.
Подсчет выросших колоний производят по общепринятой
методике через 48 ч инкубации посевов при 37°С.
Исследование колбасных изделий на содержание кишеч-
ной палочки. Определение обсемененности колбасных изде-
лий бактериями группы кишечной палочки основано на спо-
собности бактерий ферментировать маннит с образованием
кислых продуктов, изменяющих цвет индикатора в средах
«ХБ» (рец. 146) и Хейфеца (рец. 145), и расщеплять глюко-
зу с образ О(в ан и ем кислоты и газа при росте на среде Кес-
слера (рец. 144). В пробирки, содержащие по 10 мл среды
Кесслера, «ХБ» или Хейфеца двойной концентрации, вносят
по 5 мл первого и второго разведения исследуемой колбас-
ной взвеси. Инкубацию посевов осуществляют при 43 °C в
течение 18—20 ч.
При наличии роста кишечных палочек среды «ХБ» и Хей-
феца приобретают желтый цвет, а на среде Кесслера обра-
зуется пузырек газа в поплавке. Идентификация выросших
бактерий с бактериями группы кишечной палочки осущест-
вляется по способу, описанному выше (см. с. 303).
Исследование колбасных изделий на содержание сальмо-
нелл. Для обнаружения в колбасных изделиях бактерий рода
сальмонелл приготовленную исходную взвесь в объеме 25 мл
засевают во флаконы со 100 мл среды Мюллера (рец. 72),
Кауфмана (рец. 73) или магниевой среды «М» (рец. 75). По-
севы исследуемого материала инкубируют при 37 °C в тече-
ние 18—24 ч. На 2-е сутки со сред обогащения производят
высев в чашки со средами Эндо (рец. 79) и средой Вильсо-
на—Блер (рец. 82). Дальнейшее исследование, направленное
на всестороннее изучение и определение вида выделенных
культур, ведется по методике, принятой для изучения указан-
ной группы микробов (см. с. 208).
328
Санитарно-'бактериологический анализ кулинарных изде-
лий из рубленого мяса (котлеты, биточки, шницели жареные)
производится так же, как исследование колбасных изделий.
БАКТЕРИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
БАНОЧНЫХ КОНСЕРВОВ
Мясные, овощные и рыбные консервированные продукты
(в металлических и стеклянных банках), находящиеся в то-
варопроводящей сети, подвергают бактериологическому ис-
следованию при наличии факторов, вызывающих сомнение в
качестве продукта.
Образцы консервов, доставленные в лабораторию, реги-
стрируют в специальном журнале, отмечая все данные, обо-
значенные на этикетке банки и в сопроводительном докумен-
те. Затем банки освобождают от этикеток и делают в журна-
ле запись обо всех обнаруженных при внешнем осмотре
дефектах (бомбаж, деформация коробок, ржавчина, следы по-
теков и пр.). Банки с нарушенной герметичностью бактерио-
логическому исследованию не подлежат.
Герметические банки с консервами, предназначенные для
выявления аэробных и анаэробных мезофильных бактерий,
помещают в термостат на 5 сут при 37 °C.
Подготовка банок с консервами для бакте-
риологического исследования. Бактериологическое
исследование консервов проводится в боксах со строгим соб-
людением правил асептики. При этом в боксе должны на-
ходиться:
1. Стерильные стеклянные трубки диаметром 7—9 мм, за-
крытые с одного конца ватой.
2. Пробойник (металлический стержень, один конец ко-
торого имеет форму копья).
3. Питательные среды: 1% сахарный бульон и среда Та-
роцци без масла, но с добавлением 0,15% агара, регенери-
рованная перед посевом 35-минутным прогреванием в водя-
ной бане с последующим быстрым охлаждением до 40 °C.
Вскрытие банок. Исследуемую банку, предваритель-
но обмытую горячей водой с мылом, насухо вытертую поло-
тенцем, обтирают спиртом; верхнюю крышку обжигают.
Затем на середину крышки на тот участок, в котором предпо-
лагается пробить отверстие для взятия пробы, кладут кусо-
чек ваты, смоченный спиртом, и зажигают. Под горящую ва-
ту подводят острие профламбированного пробойника под
углом 30—40° к поверхности крышки и нажимом на ручку
прокалывают ее. Получающееся при этом отверстие вполне
достаточно для введения стеклянной трубки. После извлече-
ния про1бойника из банки отверстие тотчас закрывают сте-
рильной половинкой чашки Петри.
329
Посев содержимого консервных банок на питательные
среды. Материал для посева набирают из банки через от-
верстие, сделанное в крышке, слепка приоткрыв прикрываю-
щую его половинку от чашки Петри. В стеклянную трубку
насасывают жидкую массу с плотными частицами и засева-
ют ее в питательные среды для выделения аэробной и
анаэробной микрофлоры.
Посев на обнаружение аэробн ых. б акт е р и й.
Исследуемый материал в количестве 1—1,5 мл засевают в
две пробирки с мясо-пептонным бульоном, посевы помещают
в термостат при 37 °C на 5 сут. За состоянием посевов ведут
повседневное наблюдение.
1. Из пробирок с признаками микробного роста в период
инкубации в термостате делают мазок и производят высев на
окошенный мясо-пептонный агар.
2. Выросшие на мясо-пептонном агаре колонии микроско-
пируют. При обнаружении грамотрицательных неспороносных
палочек производят пересев на дифференциально-диагности-
ческие среды (Левина или Эндо). Выделенную чистую куль-
туру идентифицируют с бактериями группы кишечной палоч-
ки (см. с. 303) или бактериями группы сальмонелл (см.
с. 208).
3. При обнаружении в консервах микробов с культураль-
но -морфо логическим и признаками, характерными для стафи-
лококка, исследование проводят, руководствуясь методикой,
описанной на с. 166.
4. При обнаружении в посевах Вас. subtilis и Вас. mesen-
tericus исследование на данном этапе заканчивают и резуль-
тат отмечают в протоколе исследования.
При отсутствии явно выраженных признаков микробного
роста на 5—6-е сутки инкубирования посевов в термостате из
содержимого пробирок делают мазии, окрашивают их по Гра-
му и микроскопируют.
Одновременно производят высев на скошенный мясо-пеп-
тонный агар. Дальнейшее исследование проводят по опи-
санной выше схеме.
Посев на обнаружение анаэробных бакте-
р и й. Исследуемый материал цо 3—4 г засевают в две про-
бирки, содержащие по 15—20 мл среды Тароцци, предвари-
тельно регенерированной кипячением.
После засева одну из пробирок прогревают в водяной ба-
не при температуре 80 °C в течение 20 мин для уничтожения
сопутствующей вегетативной микрофлоры. Обе засеянные
пробирки помещают в термостат при 37 °C на 5 сут. Затем
независимо от наличия или отсутствия признаков микробного
роста готовят мазки, окрашивают их по Граму и микроско-
пируют. При обнаружении в мазках из анаэробных посевов;
грамположителыных палочек со спорами овальной формы,
330
расположенными субтерминально, дальнейшее исследование
проводят в плане идентификации выделенного микроба с воз-
будителем ботулизма (см. с. 258).
ИССЛЕДОВАНИЕ ПЕРЕВЯЗОЧНОГО И
ХИРУРГИЧЕСКОГО МАТЕРИАЛА НА СТЕРИЛЬНОСТЬ
В микробиологическую лабораторию для исследования на
стерильность поступает перевязочный 'материал (бинты, мар-
левые салфетки, ватные шарики и тампоны), шовный хирур-
гический материал (шелк, кетгут), простериливованный в ле-
чебно-профилактических учреждениях. Материал для иссле-
дования направляют в лабораторию в день его стерилизации.
Перевязочный материал доставляют в лабораторию в закры-
тых и опечатанных биксах. Пробы кетгута и шелка берет хи-
рургическая сестра в условиях чистой операционной по одно-
му мотку из каждой башки с подготовленным для операции
шовным материалом.
Для проведения посевов в боксе необходимы:
1. Набор стерильных инструментов'—ножницы, корнцан-
ги, анатомические пинцеты.
2. .Стерильный гипосульфит, 10% раствор.
3. Дистиллированная стерильная вода.
4. Набор питательных сред.
Посев исследуемого материала производят: а) для выде-
ления аэробной микрофлоры в мясо-пептонный бульон с 0,5%
глюкозы; б) для выделения анаэробных микроорганизмов в
среду Кмтта—Тароцци с 0,15% агара.
Исследуемый хирургический материал (бинты, тампоны,
марля, ватные шарики) достают из разных мест бикса сте-
рильным пинцетом над пламенем горелки и опускают в 2 про-
бирки с сахарным бульоном и в 2 пробирки со средой Кцт-
та—Тароцци.
Кетгут обычно сохраняют в спиртовом растворе йода, по-
этому перед посевом на стерильность необходимо йод нейтра-
лизовать. Для этого:
а) моток кетгута помещают на 24 ч в колбу с 30 мл сте-
рильного 10% раствора гипосульфита;
б) по 'Истечении указанного времени кетгут из раствора
гипосульфита переносят в колбу с 30 мл стерильной дистил-
лированной воды на 24 ч;
в) непосредственно перед посевам моток кетгута извлека-
ют стерильным пинцетам из колбы с дистиллированной во-
дой, кладут в чашку Петри, простерилизованную вместе с
кружком фильтровальной бумаги, разрезают стерильными
ножницами на куски длиной 2—4 см.
В 2 пробирки с сахарным бульоном и в 2 пробирки со
средой Китта—Тароцци вносят по нескольку кусочков иссле-
дуемого кетгута.
331
Посев шелка производят так же, как и посев кетгута. Вви-
ду того что шелк сохраняют в спирту, перед посевам моток
шелка выдерживают 24 ч в стерильной дистиллированной
воде.
Пробирки и колбы с посевами ставят в термостат при
37°C. .Посевы, сделанные в сахарный бульон для выделения
аэробной микрофлоры, инкубируют 6—7 дней; посевы, сде-
ланные на среду Китта—Тароцци для выделения анаэробной
микрофлоры, — 10—<12 дней. Просмотр посевов производят
каждые 1—2 дня. Если в течение указанного времени среда,
в которую посеян исследуемый материал, остается прозрач-
ной, материал признается стерильным.
Из пробирок с признаками микробного роста делают маз-
ки, окрашивают их по Граму и микроскопируют. Дальнейший
ход исследования определяется характером обнаруженной
при .микроскопическом исследовании микрофлоры. Материал
признается нестерильным, если признаки микробного роста
обнаруживаются в двух или в (большем количестве засеянных
пробирок.
САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОЕ
ИССЛЕДОВАНИЕ СМЫВОВ С РУК И ПРЕДМЕТОВ
ОКРУЖАЮЩЕЙ ОБСТАНОВКИ
Изучение бактериальной загрязненности рук и различных
предметов инвентаря производится в целях:
а) оценки санитарно-гигиенического состояния исследуе-
мого объекта;
б) установления путей распространения инфекции при
эпидемиологических обе л вдов а ниях;
в) лабораторного контроля эффективности обработки ко-
жи рук (главным образом хирургов).
В зависимости от цели проводимого ‘исследования и ха-
рактера контролируемых объектов в полученных смывах оп-
ределяют:
а) общую микробную обсемененность обычно с пересчетом
на 1 см2 исследуемой поверхности;
б) наличие бактерий группы кишечной палочки как по-
казателей фекального загрязнения, свидетельствующих о на-
рушении санитарного режима;
в) наличие патогенных бактерий кишечной группы, обна-
ружение которых является безусловным показателем эпиде-
мического неблагополучия;
г) наличие стафилококков и других микроорганизмов.
Для получения смывов пользуются стерильными ватными
тампонами или марлевыми салфетками. В день взятия смыва
в каждую пробирку с тампоном наливают по 2 мл стериль-
332
ной водопроводной воды или изотонического раствора‘хлори-
да натрия так, чтобы ватный тампон находился над уровнем
жидкости. Марлевые салфетки размером 5X5 см завертыва-
ют по одной в бумажные пакеты. К каждой салфетке готовят
заранее пробирку ю 2 мл стерильной воды для омачивания.
Непосредственно перед взятием смыва пробирку наклоняют,
увлажняя (Находящийся в ней тампон. В случае применения
салфеток их захватывают кончиком стерильного пинцета,
прокаленного над пламенем горелки, и увлажняют стериль-
ной водой из пробирки.
Увлажненный водой тампон или салфетку дают в руки
обследуемому, предлагая протереть им сначала кожу левой,,
а затем правой руки в такой последовательности (от участ-
ков с меньшей к участкам с (большей загрязненностью): тыл
кисти, ладонную поверхность, межпальцевые пространства,
ногтевые ложа. По окончании процедуры салфетки или там-
поны помещают в пробирку, в которой они находились.
При взятии смывов с предметов, имеющих большую по-
верхность, исследуемый участок ограничивают рамкой—тра-
фаретом площадью 25, 50 или 100 см2. Трафарет, изготовлен-
ный из проволоки, после каждого смыва и перед употребле-
нием прожигают над пламенем горелки.
При исследовании мелких предметов смыва делают со
всей их поверхности.
Бактериологическое исследование смывов. Для определе-
ния общего числа микробов в исследуемом смыве к 2 мл во-
ды, которая ’была использована для увлажнения тампона,
прибавляют еще 8 мл воды. Тампон тщательно в течение
2—3 М1ин отмывают, получая исходное разведение. Из него
готовят ряд последовательных десятикратных разведений
(см. с. 306). Затем из различных разведений смыва берут по
1 мл, вносят в стерильные чашки Петри, заливают мясо-пеп-
тонным агаром. Посевы выдерживают 24 ч при 37 °C и 24 ч
при комнатной температуре, после чего производят подсчет
выросших колоний.
1. Устанавливают количество микробов в 1 мл исходного'
разведения смыва. Для этого подсчитывают число колоний на
агаре в чашке и полученную величину умножают на степень
разведения смыва.
2. Определяют количество микробов в 10 мл смыва, соот-
ветствующее общему числу микробов, находящихся на той
площади, с которой производился смыв. Для этого величину,
соответствующую количеству микробов в 1 мл смыва, умно-
жают на 10.
3. Определяют количество микробов в 1 ом2 исследуемой
поверхности. Для этого велич'ину, характеризующую количе-
ство микробов в 1 мл смыва, делят на число квадратных
сантиметров, с которых сделан смыв.
333
Исследование смывов на содержание бактерий кишечной
группы. Для выявления бактерий группы кишечной палочки
можно пользоваться прямым посевом исследуемого материа-
ла на чашки со средой Эндо. Для этого материал, находя-
щийся на тампоне, втирают в поверхность питательной сре-
ды. Однако значительно лучшие результаты получены при
использовании сред обогащения (желчный 10% бульон, сре-
да Кесслера и среда Мюллера). Посевы на плотных пита-
тельных средах инкубируют в термостате при 37°C, посевы
на жидких средах обогащения — при 43 °C в течение 18—
24 ч. На 2-й день из флаконов с признаками микробного
роста производят высев на чашки со средой Эндо. Дальней-
ший ход исследования полностью соответствует методике изу-
чения штаммов кишечной палочки (см. с. 303).
Для выявления патогенных бактерий кишечной группы
содержащийся на тампоне материал тщательно втирают в по-
верхность плотных питательных сред Левина, Вильсона—
Блер, Плоскирева. После произведенного посева тампон, сня-
тый с палочки, и оставшуюся в пробирке жидкость — смыв
засевают в среду обогащения (10% желчный |бульон).
Через 24—48 ч инкубации в термостате при 37°С про-
сматривают посевы, сделанные на плотные питательные сре-
ды, выявляя прозрачные и полупрозрачные бесцветные ко-
лонии, характерные для патогенных бактерий кишечной
группы. Идентификация выделенных микробов с бактериями
группы сальмонелл и бактерий дизентерии производится по
' методам, изложенным в соответствующих разделах руковод-
ства (см. с. 208).
Исследование смывов на содержание стафилококков. Для
выявления в исследуемом смыве стафилококка производят
посев 0,5—1 мл смыва на молочно-солевой агар Петрович и
в среду накопления (7,5—10% солевой бульон). Колонии
микробов с признаками, характерными для стафилококка,
изучают описанным выше способом (см. с. 166).
ПРИЛОЖЕНИЕ
НАИБОЛЕЕ УПОТРЕБИТЕЛЬНЫЕ
ДЕЗИНФИЦИРУЮЩИЕ СРЕДСТВА и ПРОПИСИ
ПРИГОТОВЛЕНИЯ ИЗ НИХ РАБОЧИХ РАСТВОРОВ
ХЛОРСОДЕРЖАЩИЕ СРЕДСТВА
Дезинфицирующее действие хлорсодержащих средств ос-
новано на расщеплении молекул их вещества с выделением
хлора и кислорода, действующих бактерицидно.
Хлорная известь. Обладает высокой бактерицидной
способностью и даже в слабых концентрациях вызывает пи-
бель микробов в воде и на поверхности различных предме-
тов. В органическом материале, содержащем белки, бактери-
цида! ость хлорной извести уменьшается, однако и в этих ус-
ловиях при повышении ее концентрации отмечается хороший
бактерицидный эффект.
При употреблении хлорной извести нужно иметь в виду,
что она нарушает эластичность текстильных тканей и обес-
цвечивает их, а на металлических изделиях вызывает корро-
зию.
Бактерицидный эффект хлорной извести зависит от со-
держания в ней активного хлора, т. е. хлора, который может
быть вытеснен при воздействии на известь кислотой. Количе-
ство активного хлора выражают в процентном отношении к
массе извести. При хранении содержание активного хлора в
хлорной извести уменьшается, вследствие чего понижается ее
бактерицидность.
Техника определения количественного содержания
активного хлора в хлорной извести. В конической колбе рас-
творяют 0,5 г хлорной извести в 24—30 мл дистиллированной воды, раствор-
тщательно размещают стеклянной палочкой и добавляют последовательно-
10 мл 10% раствора йодида калия, 10 мл 20% раствора хлористоводород-
ной кислоты и 1 мл 1% раствора крахмала (индикатор). Жидкость при
этом окрашивается в синий цвет. Содержимое колбы титруют 0,1 N рас-
твором тиосульфата до полного обесцвечивания. Химический процесс, про-
исходящий при этом в колбе, можно выразить следующнги уравнением:
1. С12 + 2К1 ->- 2КС1 + 12
2. I2+2Na2SO3 --► 2Na + Na^O,,.
Количество активного хлора во взятой навеске хлорной извести опре-
деляется по количеству тиосульфита натрия, израсходованного на связы-
335
ванне свободного йода, вытесненного из йодида калия активным хлором.
Расчет активного хлора в процентах производят по формуле:
а-0,00355-100
0,5
где а — количество миллилитров 0,1 N раствора тиосульфита натрия, ис-
пользованного для титрования; 0,00355 — количество активного хлора, тре-
бующееся для вытеснения йода, содержащегося в !' мл 0,1 N раствора
гипосульфита натрия.
Пример, а = 30 мл. Активного хлора в исследуемом образце нахо-
дится:
30-0,00355-100
-----Щ5------=21,3%.
Хлорную известь используют в микробиологической
практике в виде порошка, 10—00% хлорноизвесткового мо-
лока и 0,2—10% осветленного раствора.
Хлорноизвестковое молоко. В табл. 62, состав-
ленной на основании соответствующих расчетов, показана
взаимосвязь между содержанием активного хлора в хлорной
извести и ее количеством, необходимым для приготовления
10 л хлорноизвесткового молока 10—20% концентрации.
Отвешенное соответственно данным табл. 62 количество
хлорной извести высыпают в глиняную или эмалированную
посуду. Часть воды, отмеренную для приготовления хлорно-
известкового молока, вливают в хлорную известь и тщатель-
но размешивают деревянной лопаткой для получения одно;
родной массы. Затем при постоянном помешивании вливают
остальную часть воды. Для растворения хлорной извести
применяют холодную водопроводную воду.
Таблица 62 Схема приготовления хлорноизвесткового молока
Концентрация Хлорноизвесткового молока, % Количество хлоркой извести (в г) на 10 л воды при содержании в ней активного хлора. %
16 18 20 22 24 25 26 28 30 32
10 20 1560 3120 1380 2760 1250 2500 1140 2280 1040 2080 1000 2000 960 1920 890 1780 830 1660 780 1560
Осв е т л е нн ы е р аств ор ы хлорной извести: Сли-
вают 10% хлорноизвестковое молоко в бутыли темного стек-
ла, закрывают деревянными пробками и оставляют на сутки.
Над образовавшимся осадкам отстаивается слой прозрачной
жидкости'—основной 10% раствор. Основной раствор осто-
рожно, чтобы нс взмутить осадка, сливают с помощью сифо-
336
«а в другую посуду через несколько слоев марли. Количест-
во основного раствора, необходимое для приготовления 0,2—
10% осветленных растворов хлорной извести, приведено в
табл. 63.
Таблица 63
Схема приготовления растворов хлорной извести
Концентрация хлорной извести в рабочих (осветленных) растворах. % Количество основного раствора (10%) для приготовления 10 л осветленного рабочего раствора, мл Примечание
0,2 200 Процент рабочего раствора опреде-
0,5 500 ляется по весовому количеству
1,0 1 000 хлорной извести, взятой для приго-
3,0 3 000 товления хлорноиэвесткавого мо-
5,0 5 000 лока
10 Основной раствор
Основной осветленный раствор хлорной извести, находя-
щийся в темном сосуде, закрытом деревянной пробкой, может
храниться в прохладном помещении до 10 дней. Рабочие рас-
творы необходимой концентрации готовят из основного рас-
твора непосредственно перед их употреблением.
Хлорамин. Кристалличе-
кое вещество белого или слег-
ка желтоватого цвета, содер-
жащее 25—26,5% активного
хлора.
В микробиологических ла-
бораториях пользуются 0,2—
10% растворами хлорамина.
В воде хлорамин растворяется
хорошо, поэтому растворы его
можно готовить непосредствен-
но перед употреблением. В по-
суде из темного стекла с
притертой пробкой раствор
сохраняется в течение 15 сут
Таблица 64
Схема приготовлении различных
растворов хлорамина
Количество хлорамина
(в г) на
% 1л 10 л
0,2 2 20
0,5 5 50
1 10 100
2 20 200
5 50 500
10 100 1000
от момента изготовления, не
утрачивая бактерицидности.
Для растворения препарата пользуются водой комнатной
температуры или подогретой до 50—60°С. При растворении
в горячей воде обеззараживающая способность хлорамина
увеличивается. Растворяют хлорамин в стеклянной или эма-
лированной посуде.
Соотношение между процентной концентрацией раствора
и количеством хлорамина в граммах на 1 и 10 л раствора
приведено в табл. 64.
22 Лабинская А. С.
337
ДЕЗИНФИЦИРУЮЩИЕ СРЕДСТВА ГРУППЫ ФЕНОЛА
К группе фенола относится ряд веществ, обладающих
сильно выраженным бактерицидным свойством. Из них в ми-
кробиологической практике применяют фенол (карболовая
кислота).
Обладая способностью хорошо растворяться в липоидах,
фенол накапливается в бактериальной клетке, вступает в со-
единение с белками ее цитоплазмы, денатурирует их, нару-
шая жизненно важные функции микроба.
Карболовая кислота. Карболовая кислота — крис-
сталлическое вещество с резким своеобразным запахом. Кри-
сталлы его игольчатой формы, бесцветные, под действием
света, воздуха и влаги окрашиваются в малиново-розовый
цвет. Обладая большой гигроскопичностью, карболовая кис-
лота поглощает из окружающей среды влагу и становится
жидкой. Жидкая карболовая кислота содержит 90% кристал-
лического фенола и 10% воды.
В микробиологических лабораториях применяют холодные
и горячие 3—б % растворы карболовой кислоты. Горячие ра-
створы обладают более выраженным бактерицидным свойст-
вом. Готовят их из кристаллического фенола или жидкой
карболовой кислоты по схеме, приведенной в табл. 65.
Таблица 65
Схема приготовления различных растворов карболовой кислоты
Концентрация рабочего раствора карболовой КИСЛОТЫ, % Количество кристаллической кислоты (в г) для приготовления Количество жидкой карболовой кислоты (в мл) для приготовления •
1 л 10 л 1 л 10 л
3 30 300 33 330
5 50 300 55—60 550—600
При изготовлении кристаллы отвешивают в нужном ко-
личестве, помещают в металлическую или стеклянную посу-
ду, прибавляют отмеренный объем воды, подогретой до тем-
пературы 45—50 °C.
Карболовая кислота действует токсически на клетки раз-
личных тканей, особенно нервной системы. Поэтому при ра-
боте с ней надевают резиновые перчатки или в крайнем слу-
чае смазывают руки вазелином.
ПРИГОТОВЛЕНИЕ ХРОМОВОЙ СМЕСИ
Пропис ь пе р в а я. В колбу емкостью 200 мл наливают
150 мл концентрированной серной кислоты, туда же всыпа-
ют 25 г измельченного бихромата калия. Полученную смесь
338
взбалтывают и оставляют стоять до растворения. Через сут-
ки раствор темно-оранжевого цвета может быть применен
для мытья посуды. Перед употреблением смесь следует подо-
греть до температуры 45—50 °C. Изменение темно-оранже-
вого цвета хромовой смеси на темно-зеленый свидетельству-
ет об ее непригодности.
Пропись вторая. В 1000 мл дистиллированной воды
растворяют 10 г неочищенного измельченного бихромата ка-
лия и затем, перемешивая жидкость, тонкой струей вливают
в нее 1000 мл концентрированной серной кислоты.
При приготовлении хромовой смеси и мытье ею посуды
нужно надевать резиновые перчатки, так как попадание на
кожу хромовой смеси вызывает болезненные ожоги; нельзя
насасывать хромовую смесь в пипетки ртом; в хромовую
смесь, содержащую кислоту, нельзя вливать воду.
РЕЦЕПТЫ КРАСИТЕЛЕЙ И РЕАКТИВОВ,
НЕОБХОДИМЫХ ДЛЯ ОКРАШИВАНИЯ
БАКТЕРИАЛЬНЫХ ПРЕПАРАТОВ
Принцип приготовления насыщенных спиртовых растворов
красителей. В основе приготовления многих красящих pac-i
творов лежит применение насыщенных спиртовых растворов
красителей, изготовление которых очень просто и в принципе
одинаково для всех.
Порошки в количествах, указанных ниже конкретно для
каждого красителя, высыпают во флаконы, заливают спир-
том и ставят на 18—24 ч в термостат при 37°C, периодичес-
ки взбалтывая. В течение указанного времени значительная
часть красителя растворяется и на дне флакона остается
лишь небольшой осадок, свидетельствующий о насыщении
раствора.
Насыщенные растворы могут храниться долгое время во
флаконах из темного стекла.
Принцип приготовления спирто-водных растворов краси-
телей. Спирто-водные растворы красителей готовят из насы-
щенных спиртовых растворов. Для этого насыщенный спирто-
вой раствор красителя смешивают в различных соотношениях
(в зависимости от красителя) с дистиллированной водой.
КРИСТАЛЛИЧЕСКИЙ ФИОЛЕТОВЫЙ
1. Кристаллический фиолетовый — насыщенный спиртовой
раствор
Кристаллический фиолетовый .... 10 г
Спирт этиловый.........................100 мл
22:
339
Вместо кристаллического фиолетового можно пользоваться
генцианом фиолетовым или метиловым фиолетовым.’
2. Кристаллический фиолетовый — спирто-водный раствор
1 мл насыщенного спиртового раствора разбавляют 10 мл
дистиллированной воды
3. Кристаллический фиолетовый — карболовый раствор
Кристаллический фиолетовый .... 1г
Карболовая кислота кристаллическая . 2 »
Спирт 96%............................. 10 мл
Вода дистиллированная.................100 »
Карболовый раствор кристаллического генцианового или
метилового, фиолетового готовят аналогично первой прописи
карболового раствора фуксина Циля (см. ниже) или смеши-
вают 10. мл'насыщенного спиртового раствора краски со
100- мл карболовой кислоты; полученную смесь тщательно
взбалтывают и фильтруют через бумажный фильтр. Раство-
ры крирталличеекого метилового, генцианового фиолетового
нестойки, поэтому их приготовление в большом количестве
^расчетом на длительное хранение не рекомендуется.
4. Кристаллический фиолетовый йцетат
Кристаллический фиолетовый (насыщенный
раствор) ............................. 0,25 мл
Уксусная кислота 5%....................100 »
Приготовленную смесь тщательно взбалтывают и фильт-
руют через бумажный фильтр. Вместо кристаллического фио-
летового можно использовать насыщенный раствор метилово-
го фиолетового. Краситель нестойкий, хранится не более ме-
сяца во флаконе темного стекла.
ФУКСИН
5. Фуксин — насыщенный спиртовой раствор
Основной фуксин................8—9 г
Спирт этиловый.................100 мл
Фуксии — спирто-водный раствор
1 мл насыщенного спиртового раствора фуксина разбав-
ляют 10 мл дистиллированной воды.
340
6. Фуксин Циля карболовый
Основной фуксин в порошке........................ 1г
Карболовая кислота кристаллическая ... 5 »
Глицерин......................................0,5 мл
Спирт 96%.....................................10 »
Вода дистиллированная.........................100 »
П роп и сь п е рв а я. 1 г основного кристаллического фук-
сина Циля растирают в фарфоровой ступке с 5 г кристал-
лической карболовой кислоты и несколькими кашлями глице-
рина. Во время растирания небольшими порциями прибавляют
спирт. После того как краситель хорошо разотрется, при-
ливают при постоянном помешивании 100 мл дистиллирован-
ной воды. Раствор красителя фильтруют через влажный бу-
мажный фильтр. Функсин Циля очень стойкий и может хра-
ниться долгое время во флаконе темного стекла с притертой
пробкой.
Пропись вторая. К 10 мл насыщенного .спиртового
раствора основного фукоина приливают 90 мл 5%, карболовой
кислоты (карболовую кислоту вливают в краситель, а не. на-
оборот). Смесь в течение нескольких минут энергично встря-
хивают, фильтруют через бумажный фильтр, а затем сливают
во флакон для хранения.
7. Фуксин спирто-водный (раствор Пфейффера)
К 1 ч. карболового фуксина Циля приливают 9 ч. дистил-
лированной воды. Раствор очень нестойкий, поэтому его го-
товят в небольших количествах непосредственно перед ис-
пользованием.
МЕТИЛЕНОВЫЙ СИНИЙ
8. Метиленовый синий — насыщенный спиртовой раствор
Метиленовый синий................... 8—9 г
Спирт этиловый 96%..................100 мл
9. Метиленовый синий — спирто-водный раствор
1 мл насыщенного спиртового раствора метиленового си-
него разбавляют 30 мл дистиллированной воды.
10. Метиленовый (синий (Леффлера)
Насыщенный спиртовой раствор метиле-
нового синего......................... 30 мл
Дистиллированная вода................ 99 »
Едкое кали 1%......................... Г »
311
Насыщенный раствор метиленового оинего фильтруют че-
рез бумажный фильтр, прибавляют едкое кали и разбавля-
ют дистиллированной водой. Приготовленный таким образом
раствор красителя может храниться во флаконе в течение
длительного времени, не изменяя свойств.
11. Синька Нейссера
Готовят отдельно два основных раствора
Первый р а створ:
Метиленовый синий..................... 0,1 г
Этиловый спирт 96%...................... 2 мл
Ледяная уксусная кислота................ 5 »
Дистиллированная вода..................100 >
Второй раствор:
Кристаллический фиолетовый .... 1г
Этиловый спирт 96%..................... 10 мл
Дистиллированная вода.................. 300 >
Для окраски зерен волютина (непосредственно перед ок-
раской смешивают 2 ч. первого раствора с 1 ч. второго рас-
твора.
12. Толуидиновый |синий — >ацетат
Толуидиновый синий................0,25—0,5 г
Ледяная уксусная кислота .... 2 мл
Этиловый спирт 96%.............. 5 »
Дистиллированная вода...............до 100 мл
13. Хризоидин — водный раствор
Хризоидин в порошке..................... 1г
Дистиллированная вода..................150 мл
В воронку на бумажный фильтр насыпают отвешенное
количество краски, после чего вливают указанное количест-
во кипящей воды.
14. Везувин, или коричневый краситель
Везувин в порошке........................ 2 г
Эпирт этиловый 96%...................... 60 мл
Дистиллированная вода................. 40 »
Перечисленные ингредиенты смешивают, нагревают до
кипения на слабом огне й после остывания фильтруют через
бумажный фильтр.
342
15. Нейтральный красный — водный раствор
Нейтральный красный (0,5% раствор) . . . 0,5 г
Нейтральный красный (,1% раствор) . . . 1,0 »
Нейтральный красный ('1,5% раствор) . . . 1,5 »
Дистиллированная вода (кипящая) . . . 100 мл
16. Малахитовый зеленый — водный раствор
Малахитовый зеленый в порошке ... 5 г
Дистиллированная вода............100 мл
Указанное количество малахитового зеленого ссыпают во
флакон и заливают горячей дистиллированной водой, ставят
на сутки в термостат, периодически взбалтывая. На дне фла-
кона остается небольшой осадок, свидетельствующий о на-
сыщенности раствора.
17. Краситель Романовского—Гимзы
Краситель Романовского-—Гимзы представляет собой
смесь азура (органический краситель, получаемый .из мети-
ленового синего), эозина и метиленового синего. В растворен-
ном виде краситель, имеет фиолетово-синий цвет. Продает-
ся в готовом виде.
18. Тушь для окраски препаратов по Бурри
Тушь черная ....
Дистиллированная вода
5 мл
15 »
К 1 г объему черной туши прибавляют 3 объема дистил-
лированной воды. Разведенную тушь наливают в центрифуж-
ную пробирку и центрифугируют 15—20 мин при 2000—
3000 об/мин для осаждения крупных частиц туши. После
центрифугирования пробирку быстро перевертывают, сливая
надосадочиый слой туши, и стерилизуют в автоклаве при
0,5 атм в течение 30 мин.
19. Реактив Калины
Раствор йодида калия 0,5%.....................96 мл
Спиртовой раствор основного фуксина 5% . . 2 »
Спиртовой раствор йода 5%.................... 2 »
ПРИГОТОВЛЕНИЕ КРАСЯЩИХ БУМАЖЕК ПО СИНЕВУ
Для приготовления красящих бумажек пользуются стан-
дартной фильтровальной бумагой, которую предварительно-
испытывают на пригодность. Для этого отрезают полоску бу-
маги и погружают в спиртовой раствор красителя; затем вы-
343.
сушиВают на воздухе. Хорошая бумага окрашивается равно-
мерно, без пятеи. Затем от нее отрезают небольшой кусок
и кладут на стекло с несколькими каплями воды. Пригодная
для окраски бумага сразу пропитывается водой и через не-
сколько секунд «отдает» краситель, вследствие чего вода
вокруг становится интенсивно окрашенной в соответствую-
щий цвет. Если этого не происходит, бумага для приготовле-
ния красящих бумажек непригодна.
Техника приготовления красящих бумажек.
Краситель, предназначенный для пропитывания бумаги, на-
ливают в лоток или глубокую тарелку. Бумагу нарезают в
ваде полосок шириной 2—2,5 см и длиной 30—50 см. Полос-
ку погружают на несколько секунд в краситель так, чтобы
смачивались обе ее поверхности. Окрашенные полосы выни-
мают пинцетом, дают красителю стечь и подвешивают на ве-
ревке для .высушивания. Бумагу сушат на воздухе при ком-
натной температуре или в термостате при 37—50 °C. Высу-
шенные полоски бумаги разрезают на кусочки размером 2x2
или 2X4,5 см.
Прописи растворов красителей для
приготовления бумаги.
1. Кристаллический генциановый или метиловый фиолето-
вый для окраски ио Граму
Кристаллический фиолетовый .... 1г
Спирт этиловый 96%....................100 мл
Глицерин............................... 5 »
2. Фуксин (основной)
Фуксин................................. 2 г
Спирт этиловый 96%....................100 мл
Глицерин............................... 1 »
3. Фуксин карболовый Циля
Пропись обычная: на 100 мл приготовленного красителя добавляют
I—2 мл глицерина.
4. Метиленовый синий
Метиленовый синий..................... 1г
Спирт этиловый 96%.................. 400 мл
Глицерин.............................. 1 »
5. Малахитовый зеленый
Малахитовый зеленый................... 5 г
Дистиллированная вода горячая ... 100 мл
Глицерин.............................. 5 »
344
РАСТВОРЫ
20. Изотонический раствор хлорида натрия
8,5 г хлорида натрия растворяют в 1 л дистиллированной
воды. Раствор доводят до кипения, остужают, фильтруют че-
рез бумажный фильтр, разливают в колбы или пробирки и,
стерилизуют в автоклаве при 1—1,5 атм в течение 20 мин.
21. Раствор Люголя
Кристаллический йод..................... 1г
йодид калия......................... 2 »
Дистиллированная вода................. 300 мл
йодид калия растворяют в 5—'10 мл дистиллированной во-
ды, затем прибавляют кристаллический йод, оставляют на
несколько часов до полного его раютвор1ения и после этого
приливают остальное количество воды.
22. Раствор Олсвера для хранения эритроцитов
Дистиллированная вода.................100 мл
Трехзамещенный цитрат натрия . . . 800 мг
Лимонная кислота...................... 55 »
Хлорид натрия.........................418 »
Глюкоза (х.ч.)...................... 1866 »
Реакция приготовленного раствора должна соответство-
вать pH 6,4.
23. Раствор Мигуновой для хранения эритроцитов
Дистиллированная вода.................100 мл
Глюкоза................................ 6 г
Хлорид натрия........................ 850 мг
АГАРОВЫЕ СРЕДЫ, ПРИМЕНЯЕМЫЕ ПРИ
ПОСТАНОВКЕ ИММУНОЛОГИЧЕСКИХ РЕАКЦИЙ
24. Агар для постановки реакции преципитации
2% агар, приготовленный на дистиллированной водег
разливают в горячем состоянии в ванночки слоем толщиной
1—1,5 см. После застывания агаровую пластинку разрезают
на кубики величиной 0,5—1 см3, которые промывают в те-
чение 2 сут проточной водопроводной водой, а затем сутки—
дистиллированной водой, меняя ее за это время 3—4 раза.
После промывания агар по возможности освобождают от
свободной воды, разогревают и разводят в горячем состоя-
345-
гнии в 2 раза 1,7% раствором хлорида натрия, чтобы конеч-
ная концентрация агара была 1%, а концентрация NaCl —
4),85 %.
Горячий агар трижды фильтруют через бумажный фильтр
и консервируютмертиолатом из расчета 1 объем 1% мертио-
лата на 100 объемов агара. Готовый агар разливают в колбы
приблизительно по 25—30 мл, чтобы не происходило изме-
нения его консистенции при многократных разогреваниях.
Агар хранят на холоду или при комнатной температуре. Пе-
ред употреблением его разогревают на водяной бане, затем
охлаждают примерно до температуры 50—60 °C и разливают
.в чашки. Агар должен быть предельно осветленным и проз-
рачным.
25. Бифталатный агар (pH 6,2) для определения лизоцима
1. 20,42 г бифталата калия растворяют в 1 л дистиллиро-
ванной воды (0,1N раствор бифталата калия). Заданное зна-
чение pH получают добавлением 8—10 мл 10 N или 2—3 мл
1N раствора едкого натра.
2. К 100 мл приготовленного раствора бифталата калия
с pH 6,2 добавляют 1 г агара Дифко, смесь нагревают на
слабом огне до полного растворения агара, доводят до кипе-
ния, стерилизуют 15 мин при, температуре 115°С в авто-
клаве.
РЕЦЕПТЫ ИНДИКАТОРОВ
Индик а торами называют различные химические вещест-
ва, которые с изменением pH среды изменяют свою окраску.
Различают одноцветные и двухцветные индикаторы. У одно-
цветных индикаторов в зависимости от pH среды изменяется
тон окраски, у двухцветных — цвет. Каждый индикатор спо-
собен изменять свою окраску только в определенных преде-
лах значения pH.
26. Лакмусовая настойка
Продажный лакмус в кусках помещают в фарфоровую
ступку, измельчают в порошок и экстрагируют 3 сут при тем-
пературе 37 °C в десятикратном количестве 96% спирта, еже-
дневно меняя его. Затем спирт сливают, осадок высушивают
ав термостате. Сухой осадок заливают 10-кратным количест-
вом дистиллированной воды и после трехдневного настаива-
ния при комнатной температуре фильтруют. В кислой среде
лакмусовая настойка имеет красноватую окраску, в щелоч-
ной среде — синюю.
Настойка лакмуса в темном месте в хорошо закрытом
флаконе может сохраняться долгое время.
346
27. Индикатор бромтимоловый синий
Бромтимоловый синий позволяет определить изменение
реакции среды в пределах pH 6,0—7,6. В щелочной зоне pH
7,6 индикатор имеет синий цвет, в кислой зоне pH 6,0 — жел-
тый. При изменении pH в указанном диапазоне бройтимоло-
вый синий изменяет окраску через различные оттенки зеле-
ного цвета. В нейтральной точке pH 7,0 индикатор имеет ха-
рактерный, легко запоминающийся травянистый оттенок.
В работе применяют раствор бромтимоловый синий, при-
готовленный по следующей прописи.
Бромтимоловый синий 0,4 г растворяют в 40 мл дистил-
лированной воды, нагревая ее до кипения. После этого к ра-
створу прибавляют 6,4 мл децннормального раствора едкого
натра, в результате чего жидкость приобретает зеленоватый
цвет, и доливают дистиллированной водой до 100 мл. При-
готовленный таким образом индикатор может сохраняться
в темном месте в склянке, закрытой притертой пробкой в те-
чение длительного времени.
28. Индикатор розоловая кислота
Розоловую кислоту (1 г) растворяют в 500 мл этилового
спирта. Если раствор окрашен в желтый цвет, прибавляют
едкий натр до появления красноватого оттенка. В кислой сре-
де индикатор имеет лимонно-желтый цвет, в щелочной—ро-
зово-красный. Переходная зона pH 6,8—7,0.
29. Индикатор Андреде
Фуксина кислого 0,5 г растворяют в 16,4 г N раствора
гидрата окиси натрия, прибавляют 100 мл дистиллированной
воды, настаивают 24 ч при 37 °C, стерилизуют при температу-
ре 100 °C в течение 5 мин. Сохраняют во флаконах темного
стекла с притертой пробкой. Приготовленный таким образом
индикатор имеет соломенно-желтый цвет. При смещении pH
в кислую зону .индикатор Андреде приобретает ярко-малино-
вую окраску.
30. Индикаторная бумага на сероводород
Для выявления сероводорода полоски фильтровальной
бумаги смачивают в растворе следующего состава:
дистиллированная вода................100 мл
ацетат свинца ....................... 20 г
бикарбонат натрия ................... 1 >
Бумагу высушивают, нарезают полосками шириной 0,2—
0,4 мм и длиной 5—6 ом. Перед употреблением бумага бес-
цветна, а при образовании микробной культурой сероводо-
рода приобретает черно-бурый цвет.
347'
31. Индикаторная бумага на индол
Полоски фильтровальной бумаги пропитывают следующим
реактивом: парадиметиламидобензальдегид— 5 г, спирт эти-
ловый 96% —50 мл, фосфорная кислота (очищенная концент-
рированная) —10 мл. После растворения порошка получен-
ной тепловатой жидкостью смачивают полоски фильтроваль-
ной бумаги, высушивают и хранят их в банке темного стек-
ла. Цвет бумажек желтый, при наличии индола — серовато-
розовый до интенсивно малинового.
32. Индикатор для обнаружения оксидазы
Нафтола 30—40 мг растворяют в 2,5 мл этилового спирта-
ректификата, добавляют 7,5 мл дистиллированной воды и
растворяют 40—60 мг диметил-П-фенилендиамина.
РЕЦЕПТЫ ОСНОВНЫХ ПИТАТЕЛЬНЫХ СРЕД
33. Мясная вода
Парную говядину или конину освобождают от костей, жи-
ра, сухожилий, пропускают через мясорубку. 1 кг получен-
ного мясного фарша заливают 2 л водопроводной воды и ки-
пятят в течение часа, накипь снимают. После кипения мясную
воду остужают для застывания жира, который легко при
этом удаляется, фильтруют через ватно-марлевый фильтр до
полной прозрачности, затем доливают водопроводной водой
до первоначального объема, разливают в бутыли и стерили-
зуют 20 мин при температуре 120 °C.
Вместо мясной воды можно применять плацентарную во-
ду, приготовляемую следующим образом. Свежую, промытую
и освобожденную от оболочки человеческую плаценту пропу-
скают через мясорубку. Фарш заливают двойным объемом
воды, кипятят в течение 30 мин, фильтруют, разилвают в бу-
тыли и стерилизуют 30 мин в автоклаве при температуре
120 °C.
Полученную таким образом мясную воду стерилизуют в
бутылях, закрытых ватно-марлевыми пробками, 20 мин при
температуре 120 °C или дробно текучим паром. Стерильная
мясная вода, являющаяся основой для приготовления многих
питательных сред, может сохраняться длительное время.
34. Пептонная вода
К дистиллированной воде прибавляют 1—2% пептона и
0,5% хлорида натрия, устанавливают необходимое значение
348
pH, кипятят 30 мин, проверяют pH, фильтруют через бумаж-
ный фильтр до полной прозрачности .и стерилизуют при тем-
пературе 120 °C в течение 30 мин.
35. Мясо-пептонный бульон
К 1 л мясной воды добавляют 1% сухого пептона и 0,5%
хлорида натрия, устанавливают необходимую реакцию, кипя-
тят в течение 30 мин, после чего доводят уровень воды до
первоначального объема. Затем фильтруют через бумажный
фильтр, окончательно устанавливают насыщенным раствором
гмдрокарбоната натрия или 10% раствором едкого натра тре-
буемую реакцию, стерилизуют 15—<20 мин при температуре
120 °C. Если после стерилизации в мясо-пептонном бульоне
выпадает осадок, его фильтруют вторично и снова стерилизу-
ют. Вторичная стерилизация производится при более низкой
температуре, чем предшествующая, для предотвращения вы-
падения осадка.
36. Триптический перевар Хоттингера
Говяжье мясо освобождают от костей, жира, сухожилий,
нарезают мелкими кусочками, взвешивают и опускают в ки-
пящую воду из расчета 1 кг мяса на 1 л воды. Мясо кипя-
тят в течение 15—20 мин, затем вынимают и пропускают че-
рез мясорубку. Бульон смешивают с фаршем и сливают в
бутыль с таким расчетом, чтобы '/з бутыли оставалась сво-
бодной. К горлышку бутыли подбирают хорошо пригнанную
резиновую пробку. Смесь подщелачивают 20% раствором
питьевой соды до pH 7,8—8,0, прибавляют очищенную от
жира, соединительной ткани и дважды пропущенную через
мясорубку поджелудочную железу в количестве 10% к'имею-
щемуся объему (на 1 л жидкости 100 г железы). Вместо
панкреатической железы можно прибавить панкреатин в ко-
личестве 0,5% и выше в зависимости от его активности. Че-
рез 1—2 ч после добавления фермента проверяют реакцию
перевара и подщелачивают его повторно до pH 7,4—7^5. От-
сутствие сдвига реакции смеси в сторону окисления после
прибавления фермента указывает на его недоброкачествен-
ность.
Содержимое бутыли тщательно перемешивают, добав-
ляют хлороформ из расчета 10—80 мл на каждый литр пере-
вара. Бутыль плотно закрывают резиновой пробкой и ста-
вят в термостат при 37 °C на 7—10 сут. В течение первого
дня содержимое бытыли перемешивают вначале каждые
15—20 мин, затем через 2—8 ч, а в последующие дни — по
нескольку раз в день, открывая при этом пробку для выхода
избытка паров хлороформа.
349
При стоянии в термостате мясо ферментируется, превра-
щаясь в однородный осадок серовато-желтого цвета, а жид-
кость из мутно-серой становится совершенно прозрачной,,
соломенно-желтого цвета. Об окончании переваривания судят
по образованию триптофана, обнаруживаемого следующим
образом: в пробирку наливают 3—4 мл фильтрованного пере-
вара, добавляют 3—4 капли бромной воды. При наличи»
триптофана жидкость принимает розово-фиолетовый цвет.
Приготовление бромной воды. На 100 мл дистиллированной
воды берут 3—3,5 мл чистого брома для получения насыщенного раствора.
Хранят в склянке темного стекла (не на свету!).
По окончании гидролиза перевар фильтруют через бумаж-
ный фильтр, разливают в бутыли и стерилизуют 30 мип при
температуре 120 °C.
37. Бульон на переваре Хоттингера
Для приготовления бульона основной перевар Хоттингера
разводят в несколько раз дистиллированной или водопровод-
ной водой, добавляя 0,5% хлорида натрия, 0,1% даузамещен-
ного фосфата калия, устанавливают pH 7,4—7,6 и кипятят
15—20 мин.
Приготовленный таким образом бульон фильтруют через
ватно-марлевый или бумажный фильтр, разливают во флако-
ны или пробирки и стерилизуют при температуре 120 °C в те-
чение 20—30 мин.
38. Мясо-пептонный агар
К мясной воде прибавляют 1% пептона и 0,5% хлорида
натрия, кипятят на слабом огне при постоянном помешива-
нии до полного растворения добавленных ингредиентов. При-
готовленный таким образом бульон фильтруют, устанавли-
вают слабощелочную реакцию (pH 7,2—7,4) и добавляют
0,2—2% измельченного агар-агара (в зависимости от каче-
ства агар-агара и назначения среды). После добавления
агар-агара жидкость кипятят на слабом огне при постоянном
помешивании до полного растворения агара. При помутнении
среды ее просветляют одним из указанных способов (см.
с. 42). Приготовленный агар фильтруют или декантируют,
разливают в пробирки или во флаконы и стерилизуют в-авто-
клаве при температуре 120 °C в течение 20 мин.
39. Основной пептон Мартена
Свиные желудки тщательно очищают от пленок, жира и
грубого содержимого, н е промывая внутренней час-
т и, разрезают на куски и пропускают через мясорубку. Полу-
ченный фарш помещают в бутыли, доливают водопроводной
350
водой, подогретой до температуры 50°С (на 200 г фарша при-
бавляют 1 л воды), а затем добавляют 10 мл концентриро-
ванной соляной кислоты.
Содержимое бутыли хорошо перемешивают и ставят на
сутки в термостат при 45—48 °C. Первые 6—7 ч бутыль пе-
риодически встряхивают, а затем дают жидкости отстояться.
К концу 2-х суток жидкость окрашивается в интенсивно жел-
тый цвет и вместо крупного фарша на дне бутыли образуется
небольшое количество гомогенного, похожего на желтый пе-
сок осадка. Надосадочный слой полученного таким образом
основного пептона Мартена осторожно сливают, прогревают
при температуре 80°C в течение 10 ь!ин для прекращения
действия ферментов.
Пептон Мартена стерилизуют текучим паром 30 мин, хра-
нят в сухом и прохладном месте. Употреблять его можно не
ранее чем через 5 сут после приготовления.
40. Бульон Мартена
Накануне приготовления бульона готовят мясную воду.
Для этого 500 г мясного фарша заливают 1 л воды, добав-
ляют 4 г хлебных прессованных дрожжей, разведенных в не-
большом количестве воды, помещают в термостат при 37 °C
на 12—14 ч, фильтруют через ватно-марлевый фильтр, кипя-
тят и вновь фильтруют.
Затем смешивают равные количества мясной воды и пеп-
тона Мартена (рец. 39). Смесь кипятят 10 мин, подщелачи-
вают 10% раствором едкого натра до pH 8,0—8,2, добавляют
0,5% ацетата натрия, кипятят 5 мин, фильтруют и разлива-
ют в матрацы. Бульон Мартена стерилизуют дробно текучим
паром 2 дня подряд по 40 мин.
41. Агар Мартена
В бульон Мартена, подогретый до температуры 50—60 °C,
опускают мелко нарезанный промытый агар-агар из расчета
25 г на 1 л, периодически помешивая, жидкость доводят до
кипения для полного растворения агар-агара. В горячем сос-
тоянии агар фильтруют через ватно-марлевый фильтр, раз-
ливают в посуду и стерилизуют в автоклаве 30 мин при тем-
пературе 120 °C.
42. Сахарный бульон (бульон с глюкозой)
•
к мясо-пептонному бульону нейтральной реакции прибав-
ляют глюкозу в количестве 0,25—2%. Перед добавлением к
бульону глюкозу растворяют в небольшом количестве дистил-
лированной воды. Приготовленную среду стерилизуют теку-
351
чим паром 3 дня подряд по 30 мин или однократно в авто-
клаве при температуре 115 °C 30 мин.
43. Сахарный агар (агар с глюкозой)
К расплавленному мясо-пептонно<му агару прибавляют от
0,5 до 2% глюкозы, предварительно растворенной в небольг
шом количестве дистиллированной воды. Приготовленную
среду стерилизуют дробно, 3 дня по 20 мин или 15 мин при
температуре 115°C в автоклаве.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ОПРЕДЕЛЕНИЯ
ФЕРМЕНТАЦИИ УГЛЕВОДОВ
44. Цветные среды Гисса с углеводами
К 100 мл дистиллированной воды прибавляют 1 г пептона,
0,5 г хлорида натрия. Пептон и соль растворяют при нагре-
вании воды в течение нескольких минут, фильтруют через бу-
мажный фильтр так, чтобы раствор был совершенно прозрач-
ным, устанавливают pH 7,0—7,4, прибавляют 0,5—1 г одно-
го из необходимых углеводов (лактоза, глюкоза, сахароза,
маннит и т. д.), а затем индикатор Андреде в количестве 1 мл
на 100 мл среды или 0,1 мл 1,6% раствора индикатора бром-
тимолового синего.
Готовую среду разливают по 3 мл в пробирки, простери-
лизованные вместе с поплавками, расположенными запаян-
ным концом кверху. Среду стерилизуют текучим паром Здня
подряд по 30 или 20 мин при температуре 112°С. Во время
стерилизации поплавки заполняются доверху питательной
средой. Основой сред, применяемых для определения фер-
ментации углеводов, является пептонная вода. Мясной буль-
он для этой цели непригоден, так как он содержит различ-
ные углеводы, что может привести к получению неправиль-
ных результатов. Среды Гисса с индикатором Андреде име-
ют соломенно-желтый цвет, с индикатором бромтимоловым
синим—болотно-зеленый (pH 7,0—7,2). В результате роста
бактерий, сопровождающегося расщеплением углевода с об-
разованием кислых продуктов распада, цвет среды изменя-
ется: в первом случае она приобретает ярко-розовый цвет;
во вторам — желтый.
Образование газа в среде определяют по наличию пузырь-
ков газа, собирающихся в поплавке.
45. Среды Гисса с сывороткой крови
К готовым средам Гисса добавляют 10—30% стерильной
лошадиной сыворотки. Для контроля сыворотки выдержива-
ют в течение 3 дней в термостате.
352
46. Среды Гисса на сыворотке
Стерильную лошадиную сыворотку разводят стерильной
дистиллированной водой (1:5), прогревают в текучепаровом
аппарате при температуре 100°С в течение 30 мин. Прибав-
ляют 0,5% углеводов (глюкоза, мальтоза или сахароза), ус-
танавливают pH 7,6 и прибавляют 1 мл 1% водного раство-
ра кислого фуксина на 100 мл среды, разливают по пробир-
кам и стерилизуют при температуре 100°С 3 дня подряд в
течение 10 мин.
Приготовленная среда почти бесцветна. Перед употребле-
нием ее выдерживают для проверки на стерильность в тер-
мостате в течение 2 сут. При расщеплении углеводов с обра-
зованием кислоты среда краснеет и сыворотка свертывается.
Срок наблюдения над изменением среды 2—3 сут.
47. Среды Гисса с крахмалом
Обычный картофельный крахмал в количестве 25 г не-
сколько раз промывают теплой дистиллированной водой для
удаления растворимых частиц. Затем заваривают 500 мл го-
рячей дистиллированной воды и отстаивают. Надосадочный
слой крахмальной воды сливают для дальнейшего использо-
вания. Отдельно готовят пептонно-сывороточную воду: раство-
ряют 5 г пептона и 1 г двузамещенного фосфата натрия в
1250 мл .дистиллированной воды, добавляют 250 мл лошади-
ной сыворотки, устанавливают pH 7,6. Крахмальную воду
(325 мл) смешивают с 1250 мл пептонно-сывороточной воды,
к смеси прибавляют 40 мл 0,02% спиртового раствора фе-
нолового красного и все кипятят в водяной бане в течение ча-
са, затем фильтруют через бумажный фильтр, разливают в
пробирки по 5 мл и стерилизуют текучим паром 3 дня под-
ряд по 30 мин. Приготовленная среда имеет насыщенно ро-
зовый цвет. Результат ферментации крахмала учитывают че-
рез 3 сут после произведенного засева культуры. При рас-
щеплении крахмала цвет среды изменяется в желтый и она
свертывается.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ОПРЕДЕЛЕНИЯ
РЕДУЦИРУЮЩЕЙ СПОСОБНОСТИ БАКТЕРИЙ
48. Молоко с метиленовым синим
Свежее молоко доводят на огне до кипения, оставляют в
прохладном месте на сутки, освобождают от сливок, вторич-
но кипятят, оставляют снова на сутки и вторично снимают
верхний слой. Обезжиренное таким образом молоко фильтру-
ют через толстый слой ваты, подщелачивают 10% раствором
карбоната натрия до pH 7,2.
23 Лабинская А. С.
353
К 100 мл молока добавляют 2 мл 1% водного раствора
метиленового синего. Приготовленную среду разливают по
5 мл в стерильные пробирки и стерилизуют текучим паром
3 дня подряд по 30 мин. Среда после остывания имеет на-
сыщенно голубой цвет, при редукции метиленовым синим
обесцвечивается и приобретает кремовый цвет.
49. Лакмусовое молоко (в прописи Минкевича)
100 мл свежего молока подщелачивают 10% раствором
питьевой соды до слабощелочной реакции (по лакмусу), ки-
пятят и прибавляют 100 мл дистиллированной воды и 5 мл
лакмусовой настойки. Приготовленную таким образом среду
сливают в бутыли, прибавляют на 1 л 10 мл хлороформа, за-
крывают плотно резиновой или корковой пробкой, хорошо
встряхивают н ставят на 2—3 дня в темное место. Будучи тя-
желее воды, хлороформ оседает на дно, увлекая за собой
растворившиеся в нем сливки. Обезжиренную таким образом
среду осторожно сливают, разливая по пробиркам по 5 мл,
и стерилизуют 20 мин при температуре 115 °C.
Вынутая из автоклава среда вследствие редукции лакму-
са имеет желтый цвет, и только через несколько часов при-
обретает характерный для нее бледно-фиолетовый оттенок.
В результате роста различных видов бактерий лакмусо-
вое молоко изменяется неодинаково. Изменение среды отме-
чают в протоколе исследования, пользуясь условными обоз-
начениями:
N — рост бактерий, не сопровождающийся изменением
реакции среды и, следовательно, изменением ее цвета.
К — кислотообразование в среде с четко выраженным по-
розовением ее.
NK — слабовыраженное кислотообразование, вызывающее
изменение оттенка среды, улавливаемое только при сопостав-
лении опытной пробирки с контрольной (незасеянная среда).
Щ — щелочеобразование, сопровождающееся явно выра-
женным посинением среды.
МЩ — слабовыраженное щелочеобразование, сопровожда-
ющееся изменением оттенка среды, улавливаемое только при
сопоставлении ее с цветом контрольной пробирки.
Р — редукция лакмуса, проявляющаяся полным обесцве-
чиванием лакмуса.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ОПРЕДЕЛЕНИЯ
ПРОТЕОЛИТИЧЕСКОЙ СПОСОБНОСТИ БАКТЕРИЙ
50. Питательный желатин
К мясо-пептонному бульону прибавляют мелко нарезан-
ный желатин из расчета 10—15 г на 100 мл. Желатину да-
ют набухнуть и затем раствориться при медленном нагрева-
354
нии в водяной бане, доведенной до температуры!'40_45°С.
Устанавливают pH 7,0, прибавляя к расплавленном^ желати-
ну 10% раствор бикарбоната натрия.
При более щелочной реакции желатин застывает плохо,
а иногда совсем не застывает. После установления pH среды
фильтруют через складчатый бумажный фильтр. Процесс
фильтрации протекает очень медленно. Чтобы желатин не
застывал, процесс фильтрации производят в горячем авто-
клаве. Полученный фильтрат, как правило, бывает совершен-
но прозрачным. Профильтрованную среду разливают в про-
бирки по 5—8 мл так, чтобы не намочить края и верхнюю
часть пробирки, соприкасающуюся с пробкой. Стерилизацию
среды производят дробно 3 дня по часу при температуре
100°С или однократно при 110*С в течение 20 мин. После
стерилизации среду охлаждают в строго вертикальном поло-
жении, чтобы верхняя часть столбика при застудневании ос-
тавалась совершенно равной.
51. Молочный агар Эйкмана
К Ю мл стерильного расплавленного на водяной бане мя-
со-пептонного агара добавляют, соблюдая правила асептики,
2,5—3 мл снятого стерильного молока. Содержимое пробирки
тщательно перемешивают и выливают в чашку Петри. Среду
используют без дополнительной стерилизации, так как сов-
местная стерилизация молока с агаром неприменима вслед-
ствие свертывания казеина с образованием хлопьев.
52. Свернутая сыворотка
Стерильную лошадиную сыворотку (не содержащую кон-
серванта) разливают в стерильные пробирки в количестве
4—5 мл для приготовления среды со скошенной поверхностью
и по 7—10 мл для приготовления столбиков. Пробирки поме-
щают в водяную баню, подогревая воду до температуры
65°С (по 45 мин в течение 3 дней подряд). При указанной
температуре сыворотка свертывается. Для приготовления
свернутой сыворотки со скошенной поверхностью пробирки
прогревают в наклонном положении. Для получения сверну-
той сыворотки столбиком пробирки прогревают в вертикаль-
ном положении.
53. Бульон с кусочками вареного куриного белка
К пробирке со стерильным мясо-пептонным бульоном
нейтральной реакции прибавляют кусочки вареного куриного
белка, нарезанные в форме кубиков с гранями '5—8 мм. Бе-
лок куриного яйца нарезают в стерильной посуде и затем
стерилизуют в течение 20 мин при температуре 120°С. Про-
стерилиэованные кубики коагулированного белка прибавля-
ют к стерильному бульону, соблюдая асептические условия.
54. Среда Строгова для определения индола
Хлорид натрия...........................0,5 г
Двузамещенный фосфат калия..............0,25 »
Триптофан...............................0,25 »
Дистиллированная вода...................100 мл
После полного растворения всех ингредиентов среды (можно
при подогревании) среду разливают по 2—3 мл в пробирки
и стерилизуют 40 мин при 100°С.
55. Среды для определения индолообразования
В качестве основной питательной среды применяют буль-
он Хоттингера, мясной или казеиновый бульон или пептон-
ную воду. Среда должна обязательно содержать триптофан,
который катализируется триптофапазой бактерий и расщеп-
ляется с образованием индола.
Поэтому для большей достоверности в указанные среды
рекомендуется добавлять Z-триптофан (50 мг на 1 л среды).
Среда, применяемая для выявления индолообразования, не
должна содержать углеводов, так как они препятствуют об-
разованию индола.
Для выявления образовавшегося индола пользуются инди-
каторными бумажками (способ приготовления см. Приготов-
ление индикаторов, рец. 31).
РЕЦЕПТ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ ОПРЕДЕЛЕНИЯ
ГЕМОЛИТИЧЕСКОЙ АКТИВНОСТИ
56. Кровяной агар
Расплавляют определенное количество 2% мясо-пептонно-
го стерильного агара, охлаждают его до температуры 45°С (не
выше!) и прибавляют 5—10% дефибринированной стерильно
взятой крови лошади, кролика или барана. Добавление кро-
ви производят, соблюдая правила стерильности. Готовую сре-
ду разливают в стерильные чашки Петри (предварительно
нагретые в термостате), дают ей застыть и подсушивают в
термостате. Слой агара должен быть равномерно окрашен в
красный цвет.
356
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
кокков
57. Бульон и агар из мяса по Левинталю
1. Двуосновный фосфат натрия в количестве 8 г раство-
ряют в 1 л дистиллированной воды, подкисляют хлористово-
дородной кислотой до pH 5,6—6,0 (буферный раствор).
2. 100 г мясного фарша, 300 мл стерильной'дистиллиро-
ванной воды, 10 мл гидрокарбоната натрия хорошо переме-
шивают и оставляют при температуре 37°С на 2 ч. Добавля-
ют 0,5 г панкреатина, растворенного в 20 мл воды, 2 мл N
раствора соды и 10 мл хлороформа; герметически закрывают
и оставляют на 24 ч при температуре 37°С, периодически
встряхивая. Через сутки производят предварительную пробу,
для чего смешивают 20 мл буферного раствора и 20 мл рав-'
номерно взболтанной мясной кашицы и кипятят 1 мин, филь-
труют через бумажный фильтр, охлаждают, определяют pH,
который должен быть равен 6,9—7,2. В случае несоответствия.
pH среду подщелачивают или подкисляют. Для приготовле-
ния бульона смешивают равные количества мясной кашицы и
буферного раствора, кипятят, фильтруют через ватно-марле-
вый фильтр, исправляют реакцию до pH 7,2—7,4, снова кипя-
тят, разливают в пробирки и стерилизуют ,3 дня подряд в те-
кучепаровом аппарате (пептон и соль не добавляют).
Для приготовления агара по Левинталю:
1. К 1 л двуосновного фосфата натрия добавляют 3% ага-
ра (после 2 ч разбухания), расплавляют в текучепаровом ап-
парате, декантируют, не осветляя, устанавливают pH 5,5—
6,0. ’
2. Расплавленный и охлажденный до температуры 70—
80 °C буферный агар смешивают с равным объемом мясной
кашицы, кипятят 1 мин, декантированный, нарезанный комоч-
ками агар переносят в колбу и еще раз дают вскипеть, филь-
труют через бумажный фильтр горячим, подщелачивают 10%
раствором бикарбоната натрия до pH 7,6—7,8, разливают в
пробирки и стерилизуют 3 дня подряд при температуре
100 °C в течение 10—15 мин. Среда должна быть прозрач-
ной.
58. Сывороточный бульон
Смешивают 1 ч. свежеприготовленного мясо-пептонного
бульона pH 7,6 и 2 ч. свежей кровяной сыворотки (бычьей
или лошадиной). Мартеновский бульон и сыворотку смеши-
вают в соотношении 1:1. Сыворотку перед прибавлением ее
к питательной среде инактивируют прогреванием в течение
30 мин в водяной бане при температуре 56°C.
59. Сывороточный агар
В качестве основы используют 3% мясо-пептонный агар,
pH 7,4—7,6, расплавленный и остуженный до 45—50°C, к
которому, соблюдая правила асептики, добавляют 10—25%
стерильной лошадиной или бычьей сыворотки, без консер-
ванта или консервированной хлороформом.
Смесь тщательно перемешивают, следя за тем, чтобы не
образовалась пена, и разливают в чашки или пробирки для
застудневания.
60. Комбинированный мясной бульон (для производства
скарлатинозного токсина)
Смешивают 900 мл триптического мясного гидролизата,
900 мл мартеновского пептона и 5 г хлорида натрия, посте-
пенно нагревают, подщелачивают до pH 7,8. Кипятят в тече-
ние 15 мин. Добавляют 0,5% мальтозы или глюкозы, после
чего бульон фильтруют, разливают по 100—200 мл во фла-
коны, стерилизуют дробно текучим паром по 30 мин в тече-
ние 3 дней.
61. Желточно-солевой агар (Чистовича)
Для приготовления желточно-солевого агара готовят
впрок мясо-пептонный агар (pH 7,2—7,4) с содержанием
10% хлорида натрия. После разливки во флаконы по 100—
200 мл агар стерилизуют в автоклаве в течение 20 мин при
температуре 120 °C. Перед употреблением растапливают, ох-
лаждают до 45—50 °C и добавляют 20% (по объему) сте-
рильной желточной взвеси (1 желток куриного яйца на 150—
200 мл стерильного изотонического раствора хлорида на-
трия). Среду быстро перемешивают, разливают в стерильные
чашки, которые продолжительное время могут сохраняться в
холодильнике.
62. Молочно-солевой агар Петрович
К расплавленному мясо-пептонному агару pH 7,2—7,4, со-
держащему 5—7,5% хлорида натрия, добавляют 10% сте-
рильного теплого хорошо обезжиренного молока, тщательно
перемешивают и разливают в чашки.
63. Желточная среда Чистовича
Мясо-пептонный питательный агар готовят по общеприня-
той прописи и добавляют к нему 20% желточной взвеси
(1 желток на 150—200 мл стерильного изотонического раство-
ра хлорида натрия). Желточную взвесь готовят, соблюдая
правила асептики.
358
64. Среда для получения стафилококкового
энтеротоксина
На 1000 мл дистиллированной воды прибавляют пептона
20 г, однозамещенного фосфата калия 1 г, хлорида натрия
5 г, хлорида кальция ИД г, хлорида магния 0,2 г, агар-агара,
мелко нарезанного и промытого, 0,8 г. Устанавливают’pH
7,0—7,2. Приготовленную смесь ставят на слабый огонь, до-
водят до кипения. Разливают во флаконы по 500 мл, стери-
лизуют в автоклаве в течение 20 мин при температуре 115 °C.
65. Среда Гарро
К 100 мл расплавленного и остуженного до 45 °C мясо-
пептонного агара (pH 7,4) добавляют 3—5% крови кролика
или барана и 0,2% водного 0,1% раствора генцианового фио-
летового.
66. Среда Бейли
Агар (30 г) промывают в водопроводной воде и погру-
жают в 1 л дистиллированной воды на 8—10 ч, затем ставят
в автоклав на 20 мин при давлении 1 атм, фильтруют через
марлю, охлаждают до температуры 58°C, добавляют 250 г
мелко нарезанного мяса и 250 г бычьего сердца. Смесь нагре-
вают при температуре 80 °C в течение 30 мин, процеживают
через марлю, прибавляют 1% пептона и 0,5% хлорида нат-
рия, подщелачивают едким натром до установления pH 7,3—
7,5. Приготовленную таким образом среду переливают в ста-
каны и оставляют до следующего дня. На следующий день
с застывшего агара срезают прозрачную верхнюю часть, сте-
рилизуют ее текучим паром 3 дня подряд по 15 мин при тем-
пературе 100 °C. Перед посевом к среде стерильно добавля-
ют 25% асцитической жидкости.
67. Ристомициновая среда
Готовят 20% сывороточный агар (рец. -59), добавляя од-
новременно с сывороткой 0,75 мл (или другое количество в
зависимости от результатов предварительного титрования)
водного раствора ристомицина, содержащего 20 000 ЕД в
1 мл. Раствор антибиотика готовят в стерильной воде и сои
храняют в холодильнике. После добавления сыворотки и ан-
тибиртика среда готова для использования в течение 48 ч
при хранении ее в холодильнике. Перед употреблением обя-
зательно подсушивание.
68. Среда обогащения для гонококков
I. Дистиллированная вода, свободная от хлора 1000 мл
Агар-агар.......................... 30 г
24*
359
II. Дистиллированная вода, свободная от хлора 900 мл
Тиогликолевая кислота . . *................... 2 »
Едкий натр, раствор..........................100 »
Однозамещенный фосфат натрия, 20% раствор 100 »
Хлорид кальция, 10% раствор...................20 »
Вторую смесь прибавляют к свежеприготовленному агару
(1-я смесь), устанавливают pH 7,3—7,4. Приготовленную та-
ким образом среду разливают в стерильные пробирки по
10 мл, стерилизуют текучим паром в течение часа.
РЕЦЕПТЫ ПРИГОТОВЛЕНИЯ ПИТАТЕЛЬНЫХ СРЕД
ДЛЯ ВЫРАЩИВАНИЯ ПРЕДСТАВИТЕЛЕЙ
СЕМЕЙСТВА КИШЕЧНЫХ
БАКТЕРИЙ
СРЕДЫ ДЛЯ КОНСЕРВИРОВАНИЯ ИССЛЕДУЕМОГО МАТЕРИАЛА
69. Глицериновая смесь
Пропись первая. 330 мл нейтрального глицерина сме-
шивают с 670 мл 0,6% раствора хлорида натрия. Для созда-
ния щелочной реакции (pH 7,0—7,2) к смеси прибавляют
20% раствор фосфата натрия.
Пропись вторая. 1 л 0,75% раствора хлорида натрия
смешивают с 500 мл х. ч. нейтрального глицерина и прибав-
ляют 20% раствор фосфата натрия в таком количестве, чтобы
получить pH 8,0. Приготовленный консервант стерилизуют
дробно или в течение 10 мин при температуре 112 °C. После
стерилизации pH снижается до 7,6—7,8.
70. Боратная смесь Изралимского и Теплицкой
В 1 л дистиллированной воды растворяют 10,4 г буры,
16,8 г борной кислоты и 19,8 г хлорида натрия. Устанавлива-
ют pH 8,3 и разливают по 5 мл в стерильные пробирки.
71. Консервант Шустовой
К 100 мл 2% мясо-пептонного агара, растопленного и ох-
лажденного до 45—50°С, добавляют 10 мл 50% раствора
серноватистокислого натрия и 2 мл раствора йода в йодиде
калия (см. среду Мюллера, рец. 72).
360
СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ
БАКТЕРИЙ СЕМЕЙСТВА КИШЕЧНЫХ
72. Среда Мюллера \ j
Колбу, содержащую 4,5 г мела, стерилизуют сухим жаром,
после чего в нее наливают 90 мл мясо-пептонного бульона,
стерилизуют в автоклаве в течение 30 мин при температуре
120 °C. В асептических условиях в колбу прибавляют 2 мл
раствора Люголя и 10 мл раствора серноватистокислого на-
трия. Раствор Люголя: 20 мл йода, 25 г йодида калия и
100 мл дистиллированной воды. Раствор серноватистокислого
натрия: к 50 г серноватистокислого натрия добавляют 100 мл.
дистиллированной воды, стерилизуют в аппарате Коха 30 мин.
После добавления каждого ингредиента смесь тщательно
взбалтывают. Среду разливают по 8—10 мл в стерильные
пробирки или во флаконы по 90 мл.
Тетратионатовая соль натрия, образующаяся в результате
взаимодействия серноватистокислого натрия и йода, подав-
ляет рост кишечной палочки и способствует росту тифонара-
тифозных бактерий.
73. Среда Кауфмана
К 100 мл среды Мюллера добавляют 1 мл водного раство-
ра бриллиантового зеленого (1 : 1000) и 5 мл стерильной бы-
чьей желчи. Приготовленную смесь стерилизуют текучим па-
ром в течение 30 мин. Среда сохраняется длительное время.
До стерилизации среда зеленого цвета, после стерилизации
она приобретает зеленовато-коричневый тон.
74. Селенитовая среда накопления Лейфсона
Селенит натрия кислый (без примеси теллура) 4 г
Пептон импортный чешской фирмы «Спофа»
или венгерской фирмы «Рихтер» ... 5 »
Фосфат натрия двузамещенный безводный ( 7 »
Фосфат натрия однозамещенный .... 3 »
Лактоза..................................... 4 »
Дистиллированная вода .................... 1000 мл
, Среду готовят из двух основных растворов. Прежде всего
экспериментально определяют точную пропорцию двузаме-
щенноро и однозамещенного фосфата натрия, которая с ис-
пользуемым образцом пептона и кислого селенистокислого
натрия дает pH не выше 6,9—7,1, что регулируется изменени-
ем соотношения фосфатов. Такая предварительная подтит-
ровка производится всякий раз, когда меняется серия любого
из входящих в среду основных ингредиентов (пептон, кислый
селенистокислый натрий, фосфаты).
361
После установления указанных соотношений к приготов-
ленному раствору фосфатов добавляют пептон и лактозу,
разливают во флаконы по 50 мл и стерилизуют текучим паром
2 дня по 30 мин или при температуре 112°С однократно в
течение 30 мин.
Отдельно на стерильной воде готовят 10% раствор кисло-
го селенита натрия. Перед началом работы на каждый фла-
кон с 50 мл основного раствора добавляют 2 мл раствора
кислого селенита натрия. Приготовленную среду разливают
•в стерильные пробирки по 5—7 мл и закрывают плотно при-
гнанными пробками.
75. Среда обогащения «М» (магниевая среда с малахитовым
зеленым в прописи Г. П. Калины и В. Л. Шигановой)
Раствор А. Пептон отечественный (семипа-
латинский) .............................
Хлорид натрия .......................
Дрожжевой диализат1 .............
Фосфат калия.........................
Дистиллированная вода................
Раствор Б. Хлорид магния................
Дистиллированная вода................
Раствор В. Бриллиантовый зеленый (водный
раствор 0,5%)...........................
0,42 г
0,7 »
0,9 мл
0,15 г
89 мл
0,36 г
9 мл
0,09 »
Все три раствора смешать, простерилизовать при 100°С
в течение 30 мин.
76. Желчный бульон
К мясо-пептонному бульону, приготовленному на перева-
ре Хоттингера, добавляют нативную желчь, устанавливают
pH 7,6.
900 мл бульона-)-100 мл желчи=>10% желчный бульон
800 мл бульона+200 мл желчи=20% желчный бульон.
Приготовленный желчный бульон стерилизуют в автокла-
ве 20—30 мин при температуре 120°C.
77. Среда Рапопорт
К 1 мл мясо-пептонного бульона добавляют 100 мл жел-
чи, 20 г глюкозы или 10 г маннита и 10 мл индикатора Анд-
реде (рец. 29). Индикатор Андреде может быть заменен 0,1—
1,6%. спиртовым раствором индикатора бромкрезола пурпур-
ного. При этом индикаторе первоначально фиолетовый цвет
среды при сбраживании сахаров и смещении pH среды в кис-
1 Производства Института эпидемиологии и микробиологии АМН
СССР имени Н. Ф. Гамалеи.
362
лую зону переходит в желтый. Чувствительность этого инди-
катора выше, чем фуксинового, и изменение цвета гораздо
резче.
Приготовленную среду разливают во флаконы по 50 мл с
опущенными в них трубочками-поплавками, которые на 3—
3,5 см должны возвышаться над уровнем налитой жидкости.
Среду стерилизуют текучим паром 3 дня подряд по 30 мин.
Во время стерилизации среда заполняет поплавки доверху.
78. Голодная среда Клодиицкого
К дистиллированной воде добавляют 0,1% агара, доводят
до кипения, разливают по 75—100 мл во флаконы, стерилизу-
ют в автоклаве в течение 20 мин при температуре 120 °C.
79. Среда Эндо
Мясо-пептонный (100 мл) агар pH 7,4 растапливают и ох-
лаждают до температуры 70°C, прибавляют 1 г х. ч. лактозы,
предварительно растворенной в стерильной пробирке в не-
большом количестве дистиллированной воды и прокипячен-
ной.
В отдельных пробирках приготовляют:
1. 2—3 мл спиртового насыщенного основного фуксина.
2. 10 мл 10% водного раствора сульфида натрия.
В стерильную пробирку отмеривают 1 мл фуксина и при-
бавляют раствор сульфида натрия до обесцвечивания фукси-
на (бледно-розовый цвет). Приготовленную смесь вливают в
растопленный агар, хорошо перемешивают и разливают по
чашкам. Горячий агар имеет бледно-розовый цвет, а при за-
стывании становится бесцветным. Среду готовят в день ее ис-
пользования.
80. Среда Левина (агар с эозином и метиленовым синим)
К 100 мл расплавленного мясо-пептонного ргара (pH 7,2—
7,4) добавляют в указанной последовательности 2 мл 0,5%
водного раствора метиленового синего, предварительно подо-
гретого в водяной бане, 1,5 мл 2% раствора эозина желтого,
2,г лактозы и 0,2 г двуосновного фосфата калия. Растворы
красок готовят на дистиллированной воде, стерилизуют теку-
чим паром в течение часа и сохраняют впрок. Лактозу и
двуосновный фосфат калия перед добавлением к агару раз-
водят в небольшом количестве стерильной дистиллированной
воды и кипятят в пробирке.
После добавления всех ингредиентов среду хорошо пе-
ремешивают и стерильно разливают в чашки. Среда имеет
красно-фиолетовый цвет.
363
81. Среда Плоскирева и бактоагар Плоскирева
Среда Плоскирева и бактоагар Ж, предназначенные для
выделения бактерий тифопаратифозной и дизентерийной
групп микробов, выпускаются медицинской промышленностью
в виде сухих порошков, представляющих собой готовые пита-
тельные среды. Согласно указанию, имеющемуся на этикетке
банки со средой, отвешивают необходимое количество сухой
среды, растворяют ее в соответствующем количестве воды
при подогревании, кипятят и разливают в стерильные чашки
ПеТри.
82. Висмут-сульфитная среда Вильсона—Блер (по прописи
Минкевича)
1. Расплавляют в водяной бане 100 мл 3% мясо-пептон-
ного агара (pH 7,0—7,1). Одновременно нагревают в
той же водяной бане 50 млл стерильной дистиллированной
воды.
2. Приготовляют «предварительную смесь». В стерильную
колбу емкостью 50 мл отвешивают 1 г глюкозы, 1,5 г суль-
фата натрия в порошке и 1 г кристаллического фосфата на-
трия. Смесь перечисленных ингредиентов растворяют в 20 мл
горячей (70—80 °C) стерильной дистиллированной воды, кото-
рую вносят в колбу стерильной пипеткой.
3. Параллельно готовят висмутовый раствор из цитрата
висмут-аммония. В стерильную пробирку вносят навеску
0,45 г висмут-аммония-цитрата, добавляют 5 мл горячей
(70—80 °C) стерильной дистиллированной воды и растворяют
при энергичном встряхивании. После растворения прибавля-
ют 0,1 мл 10% раствора едкого натра, отчего раствор ста-
новится молочно-мутным.
4. «Окончательная смесь» получается путем внесения вис-
мутового раствора из пробирки в колбу с «предварительной
смесью» («окончательная смесь» слегка мутновата).
5. Приготовляют 8% раствор закисного сульфата железа
(железный купорос): отвешивают 0,2—0,4 г закисного суль-
фата железа и прибавляют к нему 2,5—5 мл горячей стериль-
ной дистиллированной воды.
6. Приготовляют 1% раствор бриллиантового зеленого на
дистиллированной воде (раствор можно приготовить впрок и
хранить месяцами).
7. В расплавленный и охлажденный до 60°C агар добав-
ляют подготовленные ингредиенты в следующем порядке:
а) 1 мл раствора сульфата железа, хорошо перемешивая
его с агаром;
б) «окончательную смесь» в приготовленном объеме; пос-
ле добавления содержимое колбы хорошо перемешивают;
364
в) 0,4 мл 1% водного раствора бриллиантового зеленого,
хорошо перемешивая с агаром.
Приготовленная среда бесцветная, молочно-мутная, pH
8,0—8,1. Разлитую в чашки Петри среду подсушивают в тер-
мостате.
Рост колоний на среде Вильсона—Блер:
1. Бактерии брюшного тифа образуют плоские колонии
темно-дымчатого цвета. К концу 2-х суток роста они увеличи-
ваются в размере и принимают темно-зеленоватую окраску,
иногда более светлую на периферии.
2. Паратифозные бактерии дают влажно-слизистые, слегка,
выпуклые колонии черного цвета, с темными ореолами. Ки-
шечная палочка обычно не вырастает или дает единичные ко-
лонии, коричневого оттенка.
Примечание. В настоящее время среды Эндо, Левина, Вильсона —
Блер изготовляются медицинской промышленностью Советского Союза и-
выпускаются централизованным порядком в виде сухих порошков.
83. Среда Аселя—Либерманна
На 1 л мясо-пептонного агара добавляют 10 г лактозы и
0,6 г конго .красного. Агар, содержащий 1% лактозы, стери-
лизуют 2 раза текучим паром. Среду можно приготовить
впрок и длительно хранить в лаборатории. Краситель пред-
варительно растворяют в пробирке с 3—4 мл дистиллирован-
ной воды при подогревании на пламени горелки (не кипя-
тят!).
84. Среда Ресселя
К ЮО мл 1,5% мясо-пептонного агара (pH 7,2) прибавля-
ют 1% лактозы, 0,1% глюкозы и 1 мл индикатора Андреде
(рец. 29). Среду разливают в пробирки в количестве 5—6 мл,
стерилизуют в автоклаве при 112 °C в течение 20 мин и ска-
шивают так, чтобы на 2—3 см от дна пробирки агар оставал-
ся в виде столбика.
В работе пользуются также модификациями среды Рессе-
ля, в которых сочетание лактозы и глюкозы заменяют соче-
танием сахаров: маннита и лактозы, лактозы и сахарозы,
маннита и сахарозы.
Одна пробирка среды Ресселя заменяет скошенный мясо-
пептонный агар и среды Гисса с двумя сахарами; глюкозой и
лактозой. Микробную культуру со скошенной поверхности
среды, так же как культуру с мясо-пептонного агара, исполь-
зуют для приготовления мазков, пересева на другие пита-
тельные среды и постановки ориентировочной реакции агглю-
тинации.
Ферментацию лактозы определяют по появлению малино-
вой окраски соответственно добавленному индикатору Андре-
36 &
.де в скошенной части среды, сбраживание глюкозы — по ок-
раске столбика среды. При сбраживании лактозы и глюкозы
происходит резкое покраснение всей среды: столбика и ско-
шенной его части.
Характер изменения цвета среды Ресселя определяется
неодинаковой интенсивностью расщепления микроорганизма-
ми азотистых веществ и образованием щелочных продуктов
в аэробных и анаэробных условиях. Более интенсивное ще-
лочеобразование, происходящее на поверхности агара, приво-
дит к быстрой нейтрализации кислоты, образующейся при
расщеплении глюкозы (присутствующей в среде в небольшом
количестве), поэтому в «косяке» кислота обнаруживается
только при ферментации лактозы. В столбике, где щелоч-
ные продукты образуются в ничтожном количестве, выявля-
ется процесс ферментации глюкозы.
Газообразование в среде определяют по вспениванию кон-
денсационной жидкости на дне пробирки, а также по образо-
ванию трещин и разрывов в агаре.
85. Среда Ресселя из сухих питательных сред
На 950 мл дистиллированной воды берут 40 г сухого пи-
тательного агара с индикатором ВР и лактозой и 5 г сухого
питательного агара. Смесь растворяют при нагревании до ки-
пения. В 50 мл дистиллированной воды растворяют 1 г глю-
козы и добавляют к указанной выше смеси.
Приготовленную среду разливают в стерильные пробирки
по 5—6- мл, стерилизуют текучим паром 2 раза по 30 мин.
Среду скашивают так, чтобы на дне пробирки оставался не-
большой столбик.
Свежеприготовленная среда имеет фиолетовый или розо-
вато-серый цвет. При кислотообразовании цвет среды изме-
няется на синий.
86. «Скошенный столбик» с мочевиной
Среду рекомендуется готовить в два этапа: 1. К 1000 мл
бульона или пептонной воды добавляют 0,75—1% агар-агара
я 20 мл комплексного индикатора: 100 мл индикатора Андре-
де и 0,4 г тимолового синего. Эту часть среды стерилизуют в
автоклаве 30 мин при 120 °C.
2. В стерильной посуде со 100 мл стерильной дистиллиро-
ванной воды растворяют 1 г глюкозы, 10 г лактозы и 10 г
мочевины. Полученный раствор добавляют к основной среде
;и разливают в стерильные пробирки по 5—6 мл. Стерилизу-
ют текучим паром в течение 30 мин. Среду скашивают так,
•чтобы оставался столбик. Цвет среды чуть желтоватый, при
кислой реакции — красный, при щелочной — синий или си-
не-фиолетовый.
366
87. Трехсахарный агар с мочевиной по Олькеницкому
К 100 мл стерильного питательного агара добавляют 1 г
лактозы, 0,02 г соли Мора, 0,03 г гипосульфита, 1 г сахаро-
зы, 0,1 г глюкозы, 1 г мочевины и 0,4 г 0,4% раствора фено-
лового красного.
Предварительно растворяют соль Мора с гипосульфитом в
одной пробирке с небольшим количеством воды, а в другой —
мочевину с углеводами. После растворения все смешивают
с агаром и профильтровывают через стерильную марлю. Сте-
рилизуют текучим паром 3 дня подряд по 20 мин. Горячую
среду скашивают, как среду Ресселя. Незасеянная среда име-
ет бледно-розовый цвет. Механизм действия среды Олькениц-
кого тот же, что и среды Ресселя.
Покраснение скошенной части столбика указывает на об-
разование кислоты в результате расщепления лактозы, саха-
розы или обоих сахаров, добавляемых к среде в равных ко-
личествах (по 1%). Покраснение столбика среды свидетель-
ствует о расщеплении глюкозы.
Эта среда позволяет выявлять расщепление мочевины. Под
действием фермента уреазы происходит расщепление мочеви-
ны с образованием NH3 и СОг. При этом аммиак нейтрали-
зует кислоту, образующуюся в результате расщепления глю-
козы, и восстанавливает цвет столбика среды до исходного
цвета.
Добавление к трехсахарному агару вместе с мочевиной
соли Мора (сульфата железа) и гипосульфита позволяет так-
же обнаруживать способность изучаемой культуры к образо-
ванию сероводорода на основании почернения среды разной
интенсивности (от темной линии по месту прокола среды до
разлитого почернения всего столбика среды) в результате
превращения сульфата железа в сульфид, имеющий черный
цвет.
88. Бульон глицериновый по Штерну ,
К 100 мл мясо-пептонного бульона прибавляют 5 капель
насыщенного спиртового раствора основного фуксина, 1 мл
глицерина и 2 мл свежеприготовленного 10% раствора суль-
фата натрия. Разливают в пробирки по 5—6 мл, стерилизуют
при НО—112°C в течение 10—15 мин. Среда золотисто-жел-
того цвета. При расщеплении глицерина розовеет.
267
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
ХОЛЕРНЫХ ВИБРИОНОВ
СРЕДЫ ДЛЯ КОНСЕРВАЦИИ И ОБОГАЩЕНИЯ
ИССЛЕДУЕМОГО МАТЕРИАЛА
89. Консервант Венкатрамена—Рамакришнана
Приготовление основного раствора: а) 12,405 г борной
кислоты и 14,912 г хлорида калия растворяют в 800 мл горя-
чей дистиллированной воды. По охлаждении объем жидкости
доводят до 1 л;
б) 250 мл основного раствора смешивают со 133,5 мл
0,8% раствора едкого натра. После перемешивания состав-
ных частей объем жидкости доводят дистиллированной водой
до 1 л (буферная смесь);
в) 20 г морской соли или хлорида натрия растворяют в
1 л буферной смеси. Полученный раствор фильтруют через
бумажный фильтр, разливают по 10 мл в стеклянные широ-
когорлые склянки и стерилизуют в автоклаве в течение
20 мин при 120 °C.
Приготовленный таким образом консервант имеет pH 9,2
и сохраняется в течение нескольких месяцев.
90. Щелочная пептонная вода
Основной раствор пептона готовят по следующей прописи:
Пептон................................ 100 г
Хлорид натрия ......................... 50 »
Нитрат калия............................ I »
Карбонат натрия ....................... 25 »
Дистиллированная вода .... 1000 мл
pH..........................., . 8,2—8,4
Смесь пептона с хлоридом натрия и карбонатом натрия
растирают в ступке и после этого растворяют в дистиллиро-
ванной воде при нагревании; затем прибавляют нитрат ка-
лия. Раствор автоклавируют при 120 °C в течение 20 мин.
Основной раствор пептона (10% пептонная вода) сохра-
няется длительное время (до 6 мес). Для получения 1% пеп-
тонной воды основной раствор пептона разводят в 10 раз. По-
лученную пептонную воду разливают в соответствующую по-
суду и стерилизуют, доводя предварительно pH до 8,2—8,4.
Срок хранения среды 2 мес.
91. Щелочная пептонная вода с теллуритом калия
В 1% пептонную воду после автоклавирования добавляют
теллурит калия в конечном разведении 1 : 100000 или
1:200 000 (концентрация теллурита должна быть предвари-
тельно оттитрована на культуре холерного вибриона).
368
Среду готовят непосредственно перед употреблением или
не ранее чем за 24—48 ч до ее использования.
СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ
ХОЛЕРНЫХ ВИБРИОНОВ
92. Щелочной мясо-пептонный агар
Мясная вода................ 1000 мл
Пелтон............................... 10 г
Хлорид натрия ......................... 5 »
Агар-агар............................. 20 »
pH 7,8—8,8
В мясную воду вносят пептон и хлорид натрия. Смесь пе-
ремешивают и подщелачивают 20% раствором едкого натра
до pH 8,3—8,4. Затем добавляют агар-агар и содержимое по-
мещают в автоклав для варки среды вначале текучим паром
в течение 30 мин, а затем при 1 атм 20 мин. Если мясо-пеп-
тонный агар варят на плите, среду кипятят до полного рас-
плавления агар-агара1 при постоянном помешивании. Приго-
товленную среду осветляют одним из общепринятых способов
(см. с. 42), устанавливают щелочную реакцию среды, после
чего разливают ее в посуду и стерилизуют при 0,7 атм 20 мин.
Срок хранения среды в прохладном месте 3 мес.
93. Бактоагар TCBS
Бактоагар TCBS — сухая среда для диагностики холеры
(pH 8,6). Выпускается фирмой Дифко (Детройт, штат Мичи-
ган, США).
На 1 л дистиллированной воды берут 89 г сухой среды,
нагревают до кипения (до полного растворения). Среду, не
стерилизуя, разливают в чашки Петри.
94. Лактозо-сахарозная полиуглеводная среда'
Пептон ................................ 0,5 г
Хлорид натрия.......................... 0,5 »
Лактоза.................................. 1 »
Сахароза................................0,1 »
Агар-агар................................ 1 »
Индикатор Андреде........................ 4 мл
Вода дистиллированная...................100 »
pH...................................7,2—7,4
Готовую среду после стерилизации скашивают, как сре-
ду Ресселя, и посев на нее производят по общепринятой ме-
тодике.
Холерные и холероподобные вибрионы, расщепляя саха-
369
розу, дают покраснение среды в столбике без образования
газа. Дизентерийные и тифопаратифозные бактерии не из-
меняют цвета среды. Эшерихии образуют кислоту с газом
как в столбике, так и в скошенных участках среды.
95. Среда Клигера
К мясо-пептонному агару (1,5—1,7%) добавляют 10 г
лактозы, 10 г сахарозы и 1 г глюкозы. После растворения уг-
леводов добавляют по 10 мл 2% раствора сульфата железа,
0,8% раствора тиосульфита натрия (Na2S2O3—7Н2О) и 0,4%
раствора сульфата натрия (Na2SO3). Эта смесь солей служит
реактивом на сероводород. В нее же добавляют 24 мл 1 %
водно-спиртового раствора фенолового красного (pH 7,2—
7,4). Среду разливают в пробирки по 3—5 мл, скашивают
столбиком, засевают по скошенной поверхности штрихом и в
столбик — уколом. Культуры вибрионов и других сахарозо-
и глюкозопозитивных микроорганизмов в этой среде дают по-
желтение столбика; цвет скошенной поверхности не изменя-
ется. При образовании культурами сероводорода агар чернеет.
96. Среда Кларка
(для реакции Фогеса—Проскауэра и реакции с
метиловым красным)
В 1 л дистиллированной воды растворяют 5 г калия дву-
замещенного (К2НРО4), 5 г пептона, 5 г глюкозы.
Среду нагревают до кипения, фильтруют, разливают в
пробирки по 2—3 мл и стерилизуют при 0,5 атм в течение
30 мин. Каждую культуру засевают в 2 пробирки.
97. Среда Хью—Лейфсона
Пептон.......................... 2 г
Хлорид натрия ........................... 5 »
Фосфат калия двузамещенный . . 0,3 г
Глюкоза............................... Ю »
Бромтимоловый синий .... 0,03 »
Агар-агар....................... 3 »
Дистиллированная вода .... 1000 мл
pH............................... 7,1-7,2
К воде добавляют пептон, хлорид натрия и агар-агар.
Смесь подогревают до расплавления агара, вносят фосфат
калия и глюкозу, продолжают кипятить 2—3 мин. Смесь под-
щелачивают 20% раствором едкого натра до pH 7,4—7,5, до-
водят объем среды до первоначального и добавляют 3 мл 1 %
водного раствора бромтимолового синего. Приготовленную
таким образом среду фильтруют через ватно-марлевый
370
фильтр, разливают по 3—4 мл в стерильные пробирки и сте^
рилизуют при 0,5 атм 20 мин. Цвет среды до стерилизации'
синий, после стерилизации — травянистый (pH 7,1—7,2). При;
кислой реакции среда желтеет.
СРЕДЫ ДЛЯ ОПРЕДЕЛЕНИЯ ДЕКАРБОКСИЛАЗ АМИНОКИСЛОТ
98. Среда Меллера
Экстракт молодого мяса (1 кг мяса+1 л ди-
стиллированной воды) ........................ 5 г
Пептон........................................ 5 »
Бромкрезоловый красный (1»6%) . . . . 0,6 мл
Крезоловый красный (0,2%).....................2,5 »
D-глюкоза ................................... 0,5 г
Пиродоксаль (можно витамин В6) ... 5 мг
Дистиллированная вода....................... 1000 мл
pH 6,0
99. Среда Фалькоу
Гидролизат казеина .......................... 5 г
Дрожжевой экстракт . ................ 3 »
D-глюкоза ................................ 1 »
Бромтимоловый синий (0,1% раствор в 20%
спирте)...................................... 45 мл
Дистиллированная вода...................... 1000 »
pH 6,0
При отсутствии гидролизата казеина в состав среды вво>
дят 1 л мясной воды, разведенной 1 : 1 дистиллированной во-
дой, и 0,5% пептона.
Все компоненты по прописи сред (рец. 98 и 99) растворя-
ют при нагревании, устанавливают pH среды 6,0, затем до-
бавляют соответствующий индикатор и делят среду на 4 рав-
ные части. В одну часть аминокислоты не добавляют, эта
порция ' служит контролем. В остальные порции вносят соот-
ветственно: в первую — 1% лизина, во вторую —?1%
орнитина, в третью — 1% аргинина. Аминокислоты должны
быть в L-формё. Если имеются DL-аминокислоты, то добав-
ляют 2%, так как микроорганизмы активны только в отно-.
тении L-форм. После добавления аминокислоты перед стери-
лизацией исправляют реакцию среды до 6,0. Аргинин и орни-.
тин pH не изменяют, а лизин защелачивает среду до pH 8,8.
Среду разливают по 1—2 мл в стерильные пробирки и стери-
лизуют при 0,5 атм 20 мин.
Среда Меллера фиолетового цвета, при кислой реакции
желтеет, при щелочной — изменяется до красно-фиолетового
цвета. Среда Фалькоу травянисто-зеленого цвета, при кислой
реакции желтеет, при щелочной — приобретает синий цвет.
371
100. Среда с мочевиной (Кристенсена)
Пептон......................................... 1г
Хлорид натрия ................................ 5 »
Фосфат калия однозамещенный .... 2 »
Глюкоза ...................................... 1 »
Феноловый красный..........................0,012 »
Агар-агар.................................... 20 »
Мочевина..................................... 20 »
Дистиллированная вода...................... 1000 мл
pH 6,8
Предварительно промытый агар вносят в воду и нагрева-
ют до расплавления, затем добавляют пептон, соли и глюко-
зу. Дают агару закипеть, после чего вносят феноловый крас-
ный, предварительно растворенный в 0,1 N растворе едкого
натра. Учитывая количество щелочи, пошедшей на растворе-
ние индикатора, приливают к смеси остальное количество ее
до общего объема 25 мл. Смеси дают снова закипеть. Среду
разливают в пробирки по 5 мл и стерилизуют при 0,5 атм
20 мин. После охлаждения среды до 50 °C в каждую пробир-
ку добавляют по 0,5 мл 20% раствора мочевины
(20 г мочевины растворяют в стерильной дистиллиро-
ванной воде и кипятят в водяной бане в течение 30 мин). По-
лученную среду охлаждают в наклонном положении для по-
лучения скошенного агара. Цвет готовой среды желтовато-
зеленый. При щелочеобразовании цвет среды становится
красно-фиолетовым.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
ДИФТЕРИЙНЫХ БАКТЕРИЙ
СРЕДЫ ДЛЯ КОНСЕРВАЦИИ И ОБОГАЩЕНИЯ
ИССЛЕДУЕМОГО МАТЕРИАЛА
101. Среда Пергола
(жидкая сывороточно-желточная среда с теллуритом калия)
Куриное яйцо предварительно моют щеткой, мылом и
опускают в спирт на 15 мин, затем смазывают спиртовой на-'
стойкой йода и надбивают стерильным скальпелем. Белок
удаляют, желток переносят в банку с бусами и добавляют к
100 мл нормальной лошадиной сыворотки. Туда же добавля-
ют 1 мл 2% раствора теллурита калия. Полученную смесь
взбалтывают и разливают по 2—3 мл в стерильные пробир-
ки. Пробирки со средой помещают в водяную баню и инак-
тивируют сыворотку при 56 °C в течение часа. После инакти-
вации среду выдерживают 2 сут в термостате для контроля
на стерильность.
372
102. Полужидкая сывороточная среда
Полужидкий 0,1% мясо-пептонный агар или 0,1% агар на
переваре Хоттингера (pH 7,6) разливают в пробирки по 5 мл.
Среду стерилизуют в автоклаве 30 мин при 120 °C. Перед ис-
пользованием в каждую пробирку с питательной средой, со-
блюдая правила асептики, прибавляют 0,5 мл нормальной
лошадиной сыворотки или сыворотки крупного рогатого ско-
та, инактивированной при 56°C, 1 каплю (0,5 мл) 2% раство-
ра теллурита калия.
СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ
БАКТЕРИИ ДИФТЕРИИ
103. Свернутая сыворотка
Для приготовления свернутой сыворотки используют нор-
мальную лошадиную сыворотку или сыворотку крупного ро-
гатого скота. Для свертывания сыворотку стерильно разли-
вают в стерильные пробирки по 3 мл. Пробирки укладывают
в ряд (скос должен начинаться от дна пробирки) в аппара-
те для свертывания, подогретом до 50 °C. Температуру дово-
дят постепенно до 80 °C и держат в пем пробирки 1 ч. Затем
пробирки со свернутой сывороткой вынимают (так как даль-
нейшее нахождение их в свертывателе ведет к высыханию сы-
воротки) и охлаждают при комнатной температуре. Сверну-
тая сыворотка должна обязательно содержать конденсацион-
ную воду. Приготовленные среды контролируют выборочно
на стерильность в термостате. Если при контрольном прогре-
вании они прорастают кокковой микрофлорой, их повторно
прогревают при 80°С в течение 2 ч.
104. Теллуровая среда Клауберга
Первая смесь. Предварительно, за Р/г мес, готовят глице-
риново-кровяную смесь, смешивая 20 мл бараньей или лоша-
диной крови и 10 мл х. ч. глицерина. В день приготовления
среды готовят две другие смеси.
Вторая смесь. Растапливают 50 мл мясо-пептонного агара
и охлаждают до 50 °C, после чего к нему прибавляют 2,5 мл
глицериново-кровяной смеси.
Третья смесь. Смешивают 17 мл бараньей крови с 33 мл
дистиллированной воды (смесь готовят стерильно), подогре-
вают в водяной бане до 50 °C. Соединяют вторую и третью
смеси, добавляют 4 мл 1% раствора теллурита калия, быст-
ро все перемешивают и разливают в чашки. Среда прозрач-
ная, цвета красного вина.
373
105. Сухая хинозольная индикаторная среда Бучина
К 100 мл холодной воды (pH 7,6—7,8) добавляют соглас-
но прописи на этикетке порошок сухой хинозольной среды,
тщательно размешивают его и нагревают на слабом огне до
полного расплавления агара. Среду кипятят 2—3 мин до об-
разования крупнопузырчатой, быстро оседающей пены. К
приготовленной и охлажденной до 50 °C среде прибавляют
5 мл (лучше 10—15 мл) дефибринированной крови (кролика,
барана или донорскую кровь). Среду тщательно перемеши-
вают, разливают в чашки Петри слоем 3—4 см. Готовая сре-
да темно-синего цвета, может сохраняться 3—4 сут при
4—10 °C.
106. Цистин-теллурит-сывороточная среда Тиндаля
( модифицированная )
К 100 мл 2% питательного агара, расплавленного и ох-
лажденного до 50°C, добавляют следующие ингредиенты:
1% раствор цистина на 0,1 N растворе серной 12 мл
или хлористоводородной кислоты
0,1 N раствор едкого натра..............12 »
2% раствор теллурита калия.............1,8 »
2,5% раствор гипосульфита натрия . . . . 1,8 »
Нормальная лошадиная или бычья сыворотка 20 »
Цистин нерастворим в воде, поэтому его вводят в среду
в виде 1% раствора на 0,1 N растворе серной или хлористо-
водородной кислоты. Раствор едкого натра добавляют к сре-
де для нейтрализации соответствующего количества кислоты.
Раствор гипосульфита натрия (2,5%) готовят на стерильной
дистиллированной воде.
После добавления каждого ингредиента среду тщательно
перемешивают. Чашки с готовой питательной средой могут
сохраняться в холодильнике при 10 °C не более 3—4 сут.
107. Среда для определения цистиназы
(для пробы Пизу)
К 90 мл расплавленного 2% мясо-пептонного агара (pH
7,6) добавляют 2 мл раствора цистина (1% раствор цистина
в 0,1 N растворе едкого натра), тщательно перемешивают и
добавляют такой же объем 4,1 N раствора серной, кислоты.
Среду стерилизуют 30 мин при 112 °C. К расплавленной и
остуженной до 50°C среде добавляют 1 мл 10% раствора
ацетата свинца (стерилизованного двукратно текучим па-
ром), перемешивают и добавляют 9 мл нормальной лошади-
ной сыворотки. Среду стерильно разливают по маленьким
пробиркам по 2 мл. Посев производят уколом.
374
108. Среда Закса для определения фермента уреазы
А. К 4 мл дистиллированной воды добавляют 4 мл 96%
этилового спирта и 2 г мочевины. Раствор не стерилизуют,
хранят при 4—10°С.
Б. К ЮО мл дистиллированной воды добавляют 1 мл фе-
нолового красного (0,2% раствор), 0,1 г фосфата калия од-
нозамещенного, 0,1 г двузамещенного фосфата калия, 0,5 г
хлорида натрия.
Перед употреблением смешивают 1 ч раствора А и 19 ч
раствора Б. Полученную смесь разливают в узкие пробирки по
0,1 мл. Посевы помещают на 30 мин в термостат. При на-
личии уреазы среда краснеет.
109. Сухой питательный агар для определения
токсигенности дифтерийных культур
Сухой порошок, согласно прописи, растворяют в воде из
расчета 3 г на 100 мл, тщательно перемешивают и на слабом
огне при постоянном помешивании нагревают до полного
расплавления агара. Среду кипятят 5—7 мин. После кипяче-
ния среду фильтруют через ватно-марлевый или полотняный
фильтр, разливают в стерильные флаконы (по 70—80 мл)
или в пробирки (по 12 мл), стерилизуют однократно текучим
паром 30 мин. Перед разливкой в чашки Петри к растоплен-
ному и охлажденному до 50°C агару добавляют 20% нор-
мальной лошадиной сыворотки.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
БАКТЕРИЙ КОКЛЮША И ПАРАКОКЛЮША
ПО. Казеиново-угольный агар (КУА)
К 1000 мл дистиллированной воды добавляют гидролиза^
та казеина 20 мл, хлорида натрия 5 г, хлорида калия 0,2 г,
хлорида кальция 0,002 г, карбоната натрия 0,4 г, хлорида
магния 0,025 г, фосфорно-двукалиевой соли 0,24 г, крахмала
растворимого 1 г, цистина 0,01 г, агара 20 г.
Среду варят, как обычную агаровую среду, устанавлива-
ют pH 7,2, разливают по бутылям, стерилизуют в автоклаве
под давлением 0,5 атм в течение 30 мин.
Перед употреблением в растопленный и остуженный до
50°C агар добавляют 3% дрожжевого экстракта и 0,2% су-
хого активированного угля (стерилизованного в автоклаве).
Приготовление дрожжевого экстракта. 1000г
прессованных дрожжей размельчают и смешивают с 825 мл
дистиллированной воды. Взвесь нагревают до 90—92 °C и
сразу же фильтруют через складчатый бумажный фильтр, а
375
затем через фильтр Зейтца. Для проверки на стерильность
2—3 мл дрожжевого экстракта засевают в 10 мл сахарного
мясо-пептонного бульона и выдерживают 3 сут при 28—30 °C.
Дрожжевой экстракт готовят впрок и хранят в холодном
месте.
111. Картофельно-глицериновый агар по Борде—Жангу
Очищенный и нарезанный тонкими ломтиками картофель
(200 г) промывают дистиллированной водой, заливают 400 мл
4% раствора х. ч. глицерина и варят на медленном огне при
постоянном помешивании, пока картофель не разварится.
Жидкость сцеживают и фильтруют через марлю. К фильтра-
ту прибавляют дистиллированную воду до первоначального
объема. К 500 мл картофельно-глицеринового бульона добав-
ляют 1,5 л дистиллированной воды, 17 г хлорида натрия и
50—60 г агар-агара. Варят в автоклаве 30 мин, устанавлива-
ют pH 7,4, кипятят на огне, фильтруют, разливают, стерили-
зуют. На 100 мл растопленного и охлажденного до 45 °C ага-
ра Борде прибавляют 25% нагретой до 45°C дефибриниро-
ванной крови (бараньей или человеческой). Среду разливают
по пробиркам н чашкам и ставят на сутки в термостат для
контроля.
112. Среда Закса для определения уреазы
А. К 4 мл дистиллированной воды добавляют 4 мл 96%
этилового спирта и 2 г мочевины. Раствор без стерилизации
хранят при 4—10 °C.
Б. К ЮО мл дистиллированной воды добавляют 1 мл фе-
нолового красного (0,2% раствор), 0,1 г фосфата калия од-
нозамещеиного, 0,1 г фосфата калия двузамещенного, 0,5 г
хлорида натрия.
Перед употреблением смешивают 1 часть раствора А и 19
частей раствора Б. Полученную смесь разливают в пробирки
по 0,1 мл.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
ПАТОГЕННЫХ АНАЭРОБОВ
113. Среда Китта — Тароцци
Печень животного, обычно говяжью, нарезают кусочками
по 1—1,5 г, прибавляют по весу тройное количество мясо-
пептонного бульона или бульона Хеттингера нейтральной
реакции, кипятят 30 мин. Бульон отфильтровывают, печень
промывают под краном на сите. Отфильтрованный бульон
разливают по 7—10 мл в пробирки. В каждую пробирку кла-
376
дут по 4—5 кусочков отмытой печени. Бульон сверху зали-
вают слоем вазелинового масла и стерилизуют в автоклаве
при давлении 0,5 атм 30 мин.
114. Полужидкий агар для трубок Вейона
К 0,5% глюкозному мясо-пептонному бульону или бульону
Хоттингера прибавляют 0,5% агара, стерилизуют дробно при
100° 30 мин 3 дня подряд.
115. Среда Вильсона—Блер
Растапливают 100 мл 3% мясо-пептонного агара с 1%
глюкозы'в водяной бане, добавляют 10 мл 20% раствора
сульфита натрия и 1 мл 8% раствора хлорида железа. Оба
раствора готовят на стерильной дистиллированной воде и
кипятят. Среду разливают в пробирки по 7 мл.
116. Кровяной агар Цейсслера
К 3% мясо-пептонному агару прибавляют 1% глюкозы,
устанавливают pH 7,2, разливают во флаконы по 100 мл, сте-
рилизуют при давлении 0,5 атм 30 мин. Перед употреблени-
ем к расплавленной и охлажденной до 45 °C среде прибав-
ляют 20% свежевзятой дефибринированной крови. Среду
разливают в чашки Петри.
117. Молоко по Тукаеву
К 1% пептонной воде прибавляют 5—6% обезжиренного
молока, среду стерилизуют дробно при 100 °C 3 дня подряд
по 30 мин.
118. Кровяной сахарный агар
Агар 2% на бульоне Хоттингера в объеме 100 мл расплав-
ляют и охлаждают до 45 °C, после чего добавляют к нему
10—15 мл свежевзятой стерильной дефибринированной крови
кролика, барана или крупного рогатого скота и 10 мл 20%
стерильного раствора глюкозы. Смесь взбалтывают так, что-
бы не образовалось пузырей и пены, и разливают по чашкам.
Среда служит для выделения чистых культур анаэробов.
119. Среда Виллиса и Хоббса1
Бульона Хоттингера 400 мл, агара 4,8 г, лактозы 4,8 г и
1% раствора нейтрального красного 1,3 мл смешивают, авто-
клавируют, охлаждают до 50—55 °C. Затем добавляют 15 мл
1 При выделении анаэробов во все жидкие среды после разливки в про-
бирки и флаконы перед стерилизацией вливают жидкое вазелиновое масло
слоем 0,25—0,5 см и подвергают регенерации — кипячению в течение 15 мин
для удаления кислорода.
25 Лабжаская А. С.
377
суспензии желтка куриного, смешанного с равным объемом
изотонического раствора хлорида натрия и 60 мл стерильно-
го обезжиренного молока.
120. Бензидиновый агар
Бензидин.............................0,26 г
Хлористоводородная кислота, 1 N рас-
твор .............................0,3 мл
Вода...................................50 »
Приготовленный раствор стерилизуют кипячением и до-
бавляют к стерильному агару из расчета 10 мл раствора на
100 мл агара.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
МИКРООРГАНИЗМОВ, ВЫЗЫВАЮЩИХ ЗООНОЗЫ
121. Консервант Берлина и Башевой
Консервант представляет собой смесь нейтральных жиров
следующего состава:
вазелиновое масло........ 3 весовые части
парафин ................. 1 весовая часть
Смесь подогревают при 45 °C, тщательно перемешивают
и разливают в широкогорлые банки с хорошо притертыми
пробками.
Кусочки органов величиной 2—3 см3 вносят в подогретый
до 45 °C расплавленный состав и тщательно размельчают в
нем с помощью пинцета. Затем банки закрывают пробками и
смесь взбалтывают. В этом консерванте материал сохраня-
ется в течение нескольких недель.
122. Жидкость Брокэ
Нейтральный глицерин.................20 мл
Дистиллированная вода................ 80 »
Карбонат кальция ..................... 2г
В банки с 5—10 мл жидкости помещают подлежащие ис-
следованию кусочки органов величиной 1—2 см3. В этом
консерванте материал может сохраняться несколько дней.
123. Перевар Филдса
Во флаконе емкостью 250 мл (с притертой пробкой) сме-
шивают:
Изотонический раствор хлорида натрия . . 150 мл
X. ч. хлористоводородная кислота ... 6 »
Дефибрииированиая кровь барана ... 50 »
Пепсин........................................ 1г
378
Смесь энергично встряхивают (до растворения), ставят
в водяную баню при 55 °C на срок до 24 ч, изредка взбалты-
вают. Затем к смеси прибавляют 12 мл 20% раствора едкого
натра, после чего испытывают реакцию среды с раствором
крезолового красного (0,1% спиртовой или водный раствор).
Если не получится окраски, напоминающей цвет пермангана-
та, прибавляют тот же раствор едкого натра до получения
такой окраски. После этого наливают по каплям концентри-
рованную хлористоводородную кислоту до получения пробы
с крезоловым красным цвета перманганата, а е феноловым
красным — красного цвета. Затем прибавляют 0,25% хлоро-
форма, смазывают пробку стерильным оливковым маслом,
взбалтывают содержимое до растворения хлороформа и зак-
рывают пробку бумажным колпачком.
Приготовляя среду для выращивания чумного микроба,
берут 1 мл этого перевара на 100 мл агара.
124. Среда Туманского
К 100 мл расплавленного и остывшего до 50 °C агара при-
бавляют водно-спиртовой раствор генцианового фиолетового
в разведении от 1 : 50 000 до 1 : 200 000 и 1—2 мл гемолизиро-
ванной крови.
Приготовление раствора генцианового фиолетового: 0,1 г
генцианового фиолетового растворяют в 1 мл этилового спир-
та и прибавляют к 100 мл дистиллированной воды.
Гемолизированную кровь готовят по следующей прописи:
к 9 мл стерильной дистиллированной воды прибавляют 1 мл
крови барана, кролика, морской свинки или коровы. Гемоли-
зированную кровь разливают в стерильные ампулы и сохра-
няют в прохладном месте. Срок хранения ее до 5 лет. Рас-
творы генцианового фиолетового и гемолизированной крови
предварительно испытывают и подтитровывают.
Среда считается пригодной, если на ней полностью подав-
ляется рост стафилококков и спороносных микробов и в то
же время не угнетается рост чумных бактерий, засеянных на
среду в количестве 100 микробных тел.
125. Голоднокислый агар Бессоновой
Готовят 3% агар на изотоническом растворе хлорида на-
трия, устанавливают pH 5,9—6,1, стерилизуют среду в авто-
клаве при температуре 120 °C в течение 20 мин. Чумной мик-
роб в отличие от бактерий псевдотуберкулеза на этой среде
не растет.'
126. Среда с рамнозой Бессоновой
К пептонной воде, содержащей 0,5% пептона, прибавляют
0,5% хлорида натрия и 1% рамнозы.
25*
378*
127. Желточная среда Мак-Коя
Свежие куриные яйца моют щеткой и мылом в теплой во-
де, обтирают спиртом и быстро проводят через пламя горел-
ки. Желтки,* отделенные от белков, сливают отдельно в гра-
дуированный стерильный сосуд и доливают стерильным изо-
тоническим раствором хлорида натрия в следующей пропор-
ции: 60 ч желтков и 40 ч раствора pH 7,0—7,2. После пере-
мешивания желточную смесь набирают стерильной пипеткой,
разливают в стерильные пробирки по 4—5 мд и помещают в
аппарат для свертывания сыворотки в наклонном положении
для получения скошенной поверхности.
Свертывание желтка производят в течение 2 дней: 1-й
День при температуре 74—75 °C в течение часа, на 2-й день
при температуре 82—85° С в течение 30 мин. Приготовленную
среду ставят на 48 ч в термостат прн 37 °C, проверяя на сте-
рильность, и сохраняют в холодильнике для предотвращения
высыхания. Правильно свернутая среда должна иметь на дне
пробирки конденсационную жидкость.
128. Печеночный агар
Свежую печень 'крупного рогатого скота освобождают от
пленок и жира, пропускают через мясорубку. Фарш залива-
ют двойным объемом водопроводной или дистиллированной
воды и оставляют на холоде в течение 2 ч, затем кипятят
1 ч, фильтруют через ватно-марлевый фильтр и доливают во-
дой до исходного объема. Полученную таким образом пече-
ночную воду стерилизуют в автоклаве 30 мин при 120 °C.
Для приготовления печеночного бульона к печеночной во-
де прибавляют равное количество водопроводной воды, за-
тем 1% пептона и 0,5% хлорида натрия. Приготовленный та-
ким образом бульон подщелачивают до pH 6,8—7,0 и стери-
лизуют в автоклаве в течение 30 мин при ПО °C.
К приготовленному печеночному бульону прибавляют 2—
3% хорошо промытого измельченного агар-агара. Смесь про-
гревают, доводя до кипения, устанавливают pH 6,8—7,0,
фильтруют, разливают во флаконы и стерилизуют в авто-
клаве в течение 30 мин при 110 °C.
129. Мясо-пептонный глюкозо-глицериновый агар
К расплавленному и профильтрованному мясо-пептонному
агару прибавляют 1%. глюкозы и 2% х. ч. глицерина, уста-
навливают pH 6,8—7,0, разливают в необходимую посуду и
стерилизуют в автоклаве 20 мии при 115 °C.
380
130. Полужидкий агар Мейера и Цобеля
Смешивают 500 мл мясной воды с 500 мл дистиллирован-
ной воды, прибавляют 5 г хлорида натрия, 2 г пептона и 2 г
хорошо промытого агар-агара. После стерилизации в авто-
клаве устанавливают pH 6,8—7,0. Среду стерилизуют в авто-
клаве в течение 20 мин при 115 °C. После стерилизации pH
снижается до 6,8. Перед употреблением к расплавленной и
остуженной до 45—60 °C среде прибавляют стерильно основ-
ной 0,1% раствор красителя: фуксина 2 мл (концентрация
красителя 1:25000), тионина 4 мл (концентрация красителя
1 : 50000) на 100 мл среды.
Приготовление раствора красителей—фук-
сина и тионина. 0,1 мл красителей — фуксина или тио-
нина— растирают в ступке, прибавляя постепенно 20 мл эти-
лового спирта. После полного растворения к красителю при-
бавляют 80 мл бидистиллированной воды. Приготовленный
0,1% раствор красителя хранят в плотно укупоренном флако-
не в темном месте.
131. Среда Государственного контрольного института
имени Л. А. Тарасевича (ГКИ)
Среда ГКИ состоит из раствора Хенкса с добавлением
40% стерильной бычьей сыворотки, предварительно инактиви-
рованной при температуре 56 °C в течение 30 мин. Среду до-
водят с помощью бикарбоната натрия до pH 7,2—7,4 и раз-
ливают в пробирки по 2 мл. Посевы инкубируют при 37° С
в течение 16—18 ч, после чего из выросшей культуры готовят
мазки для выявления капсульных палочек.
132. Среда Томова
Агар 10%......................... . 50 мл
Пептон...................................2,5%
Хлорид натрия.................... . 6,5%
Белок куриного яйца.....................50 мл
Гемии 0,4% в N/100 растворе едкого
натра.................................. 25 »
Уксусная кислота N/100 ................ 25 »
В стерильной склянке смешивают говяжью сыворотку и
яичный белок, нагревают до 50 °C и добавляют к расплавлен-
ному и охлажденному до 50 °C пептонному агару. Содержи-
мое колбы тщательно перемешивают, после чего в нее добав-
ляют раздельно стерильный подогретый раствор гемина и
уксусной кислоты в указанных выше количествах. Готовую
среду (pH 7,4—7,6) разливают в чашки Петри.
381
133. Среда Буза
Готовится из 30% голодного агара (без пептона) pH 7,4, к
^которому добавляют 15% дефибринированной крови барана.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
ТУБЕРКУЛЕЗНЫХ МИКОБАКТЕРИИ
134. Среда Прайса
Кровь кролика или барана смешивают с цитратом натрия
в соотношении 10 мл крови на 2 мл 5% цитрата. Цитратную
кровь разводят дистиллированной водой: на 1 ч крови берут
2—4 ч дистиллированной стерильной воды. Среду разливают
в стерильные пробирки по 5 мл.
135. Среда Левенштейна—Йенсеиа
В 600 мл дистиллированной воды, содержащей 12 мл гли-
церина, растворяют аспарагина 3,6 г, фосфата калия (одноза-
мещенного) 2,4 г, сульфата магния 0,24 г, цитрата магния
0,6 г, картофельной муки 5 г, малахитового зеленого 0,4 г.
Полученную смесь стерилизуют в автоклаве 15 мин при
120 °C.
Приготовляют 1000 мл однородной взвеси из свежих яиц.
Для этого предварительно вымытые мылом со щеткой в про-
точной воде яйца (примерно 20—25 шт.) помещают в 70%
спирт на Р/г—2 ч, затем разбивают их в стерильную кругло-
донную колбу с бусами (из каждого десятка яиц отбрасы-
вают 2 белка). Добавляют стерильно в яичную взвесь основ-
ной солевой раствор, подогретый до 45—60 °C, тщательно пе-
ремешивают, избегая появления пузырьков воздуха, фильтру-
ют через ватно-марлевый фильтр, разливают по пробиркам и
скашивают при 85 °C в течение 45 мин.
136. Среда Петраньяни
В стерильную литровую колбу с бусами помещают 150 мл
молока, 6 г картофельной муки, 1 г пептона и нарезанную
мелкими кусочками небольшую картофелину (величиной с
куриное яйцо). Колбу ставят в водяную баню (кипящую) на
10 мин и помешивают, пока не образуется клейстер. Затем
понижают температуру воды до 56 °C и оставляют в ней кол-
бу со средой на 1 час, выливают в смесь 4 цельных яйца и
желток пятого.
Массу фильтруют через стерильную марлю, вливают 12 мл
глицерина и 10 мл 2% водного раствора малахитовой зелени.
Среду асептично разливают по стерильным пробиркам и про-
382
гревают при температуре 85 вС 2*/2 ч в наклонном положении
для образования скоса среды. В последующие 2 дия среду
стерилизуют нагреванием при 75°C в течение 30 мин. Поверх
пробок (для предупреждения высыхания среды) надевают
резиновые колпачки или заливают их парафином.
137. Среда Гельберга
1. Приготовление молока. Сырое молоко в стериль-
ной посуде ставят на сутки в холодильник. Затем с него
снимают сливки, разливают по ПО мл в колбы, стерилизуют
2 дня текучим паром: 1-й день —15 мин, 2-й день—10 мин.
2. П р и гото в л е н и е картофельного агара.
Картофель моют мылом со щеткой в проточной воде, очища-
ют и заливают двойным количеством водопроводной воды.
После кипячения в течение 15 мин отвар отстаивают, филь-
труют через фильтр, сделанный из марли и ваты, и разливают
по 110 мл. Стерилизуют отвар в автоклаве, доводя темпера-
туру до 120 °C, после чего автоклав выключают.
3. Приготовление солевого раствора. На 1 л
дистиллированной воды берут следующее количество:
Фосфат калия двуосяовной .... 1г
Цитрат натрия........................... 1 »
Сульфат магния . ....................... 1 »
Пептон.................................. 5 »
Глицерин................................ 30 »
Стерилизуют раствор в автоклаве, доводя температуру до
120 °C, затем автоклав выключают.
4. Приготовление красителя малахитового
зеленого. 2 г красителя растовряют в 100 мл дистиллиро-
ванной воды. Стерилизуют в автоклаве в течение 30 мин при
115°С.
Приготовление среды Гельберга. 10 яиц тща-
тельно моют, затем кладут на 3 мин в 5% раствор карболовой
кислоты, протирают спиртом, обжигают на легком огне. Под-
готовленные таким образом яйца разбивают и стерильно йы-
ливают в колбу из расчета 6 яиц цельных и 4 желтка. В кол-
бу добавляют 100 мл молока, 100 мл картофельного отвара,
100 мл солевого раствора, 7,5 мл 2% раствора малахитового
зеленого, 5 мл 10% стерильного раствора лимонной кислоты.
Все ингредиенты хорошо встряхивают. Среду разливают и
стерилизуют при температуре 85 °C 2 дня по 30 мин.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ ВЫРАЩИВАНИЯ
СПИРОХЕТ
138. Среда Уленгута
Смешивают 1 ч стерильной кроличьей или лошадиной сы-
воротки с 10 ч водопроводной воды, стерилизованной 3 дня
383
подряд по 1 ч при температуре 100 °C, разливают по 3 мл й
пробирки, заливают 1 мл стерильного жидкого парафина.
139. Среда Терских
Среда Терских состоит из фосфатной смеси Зеренсена и
кроличьей сыворотки.
Фосфатная смесь:
1. Фосфат натрия двузамещенный . . 11,876 г
Вода дистиллированная.................. 1000 мл
2. Фосфат калии однозамещенный . . . 9,078 г
Вода дистиллированная.................. 1000 мл
Первый и второй растворы могут храниться в темном ме-
сте месяцами. Приготовляют смесь с pH 7,2—7,3. Для этого
берут первого раствора 90 мл и второго раствора 10 мл. К
ним прибавляют 900 мл свежей дистиллированной воды. По-
лученный раствор разливают по 5 мл в пробирки из невыще-
лачивающегося стекла, стерилизуют при 1,5 атм в течение
20 мин. В каждую пробирку прибавляют асептично 6—8 ка-
пель инактивированной при температуре 56 °C сыворотки
кролика.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД, ПРИМЕНЯЕМЫХ
ПРИ САНИТАРНО-БАКТЕРИОЛОГИЧЕСКИХ
ИССЛЕДОВАНИЯХ
140. Глюкозо-пептонная среда
А. Концентрированная среда Эйкмана. В 1 л
воды растворяют 100 г пептона, 50 г хлорида натрия, нагре-
вают смесь до кипения, фильтруют, прибавляют 100 г глю-
козы, устанавливают pH 7,4—7,6, разливают по 10 мл в кол-
бы или склянки емкостью 250—500 мл с поплавками и п©
1 мл в пробирки с поплавками. Стерилизуют при 112°С.
Б. Разведенная ср ед а. Готовят так же, как концент-
рированную, но количество всех ингредиентов, кроме воды,
уменьшают в 10 раз.
141. Лактозо-пептонная среда
Готовят так же, как глюкозо-пептонную среду, заменив
глюкозу лактозой.
142. Желчно-лактозный бульон с бриллиантовым зеленым
Пептона 10 г, лактозы 10 г, свежей фильтрованной желчи
крупного рогатого скота 200 мл (или сухой обезвоженной
желчи, растворенной в 200 мл дистиллированной воды) раст-
384
воряют при нагревании в 700 мл дистиллированной Воды, ус-
танавливают pH 7,2—7,4, прибавляют 13,3 мл 1%. водного
раствора бриллиантового зеленого, доливают дистиллирован-
ной водой до общего объема 1 л, фильтруют через ватно-мар-
левый фильтр, разливают по 5 мл в пробирки с поплавками»
стерилизуют при 112 °C в течение 12 мин или 3 дня при
100 °C. Срок хранения среды 2 нед.
143. Борнокислая буферная среда с лактозой
Пептона 10 г, фосфата калия двузамещенного (безводно-
го) 12,2 г, фосфата калия однозамещенного (безводного)
4,1 г, борной кислоты 3,2 г, лактозы 5 г растворяют в 1 л
дистиллированной воды, разливают по 5 мл в пробирки с
поплавками, стерилизуют при 112°C в течение 12 мин. Срок
хранения среды 2 нед.
144. Среда Кесслера
Пептона 10 г, желчи 50 мл, воды дистиллированной
1000 мл кипятят 20—30 мин, фильтруют через вату, добавля-
ют 10 г лактозы и доводят объем до 1 л, устанавливают pH
7,4—7,6, добавляют 4 мл 1% водного раствора генциана фио-
летового. Среду разливают в пробирки с поплавками по 50 мл
и стерилизуют при давлении 0,5 атм в течение 15 мин. Среда
имеет фиолетовый цвет.
145. Среда Хейфеца
В 1 л водопроводной воды (для среды двойной концент-
рации— в 500 мл) растворяют 10 г пептона, 5 г хлорида на-
трия, 5 г маннита. После установления pH 7,4—7,6 среду
нагревают до кипения, фильтруют, прибавляя 1 мл 5% спир-
тового раствора розоловой кислоты и 2,5 мл 0,1% раствора
метилового голубого. Среду стерилизуют однократно 20 мин>
в текучепаровом аппарате или кипячением в течениеч5 мин.
Простерилизованную среду, разлитую в пробирки по 8—10 мл»
скашивают со столбиком. Цвет среды красно-фиолетовый.
146. Среда «ХБ>
(хииозол-бромкрезолпурпурная среда)
В 1 л водопроводной воды (для среды двойной концент-
рации в 500 мл) растворяют 10 г пептона, 5 г хлорида на-
трия, 5 г маннита. Приготовленную смесь кипятят 15—20 мнн»
устанавливают pH 7,4—7,6, фильтруют через бумажный
фильтр, вновь кипятят 10 мин и охлаждают до 60 °C, после-
чего стерильно добавляют 30 мл дрожжевого автолизата.
385-
15 мл желчи крупного рогатого скота, 10 мл раствора хино-
зола (1 : 1000) и 10 мл 1,6% спиртового раствора бромкрезо-
ла пурпурного. Среду разливают в стерильные пробирки по
7—8 мл.
Растворы красок готовят следующим образом: 0,8 г по-
рошка бромкрезола пурпурного заливают 50 мл этилового
спирта-ректификата. Через день раствор готов к употребле-
нию.
Порошка хинозола 0,7 г растворяют в 100 мл стерильной
дистиллированной воды.
Приготовление дрожжевого автолизата: 100 г прессованных
хлебных дрожжей суспендируют в 600 мл стерильной воды,
в которой разведено 1 г фосфата калия однозамещенного и
0,1 г сульфата магния.
В колбу с суспензией дрожжей наливают 8—10 мл хлоро-
форма. Колбу закрывают ватной пробкой, которую сверху
покрывают колпачком из вощаной бумаги (для предотвра-
щения испарения). Суспензию дрожжей помещают в термо-
стат при 45—47 °C на 10 сут, затем ставят в водяную баню
и кипятят 20 мин, фильтруют и стерилизуют 15 мин при
112,5 °C.
147. Среда Козера (модифицированная)
К 1 л дистиллированной воды добавляют 1,5 г фосфата
натрий-аммония, 1 г фосфата калия однозамещенного, 0,2 г
сульфата магния, 2,5—3 г цитрата натрия. Раствор стерили-
зуют в автоклаве при 1 атм 15 мин, прибавляют к нему 10 мл
0,5% спиртового раствора бромтимолового синего и разли-
вают в стерильные пробирки.
148. Цитратный агар Симмонса
Растворяют в 1 л дистиллированной воды сульфата маг-
ния 0,2 г, фосфата натрия-аммония 1,5 г, одноосновного фос-
фата калия 1 г, цитрата натрия кристаллического 3 г. Смесь
стерилизуют в автоклаве. Прибавляют 20 г агар-агара, на-
гревают до его расплавления, устанавливают pH 7,2 и затем
прибавляют 1 мл 1,5% спиртового раствора бромтимолового
синего.
149. Среда Сабуро
Помещают 18 г агара в 1 л дистиллированной воды и дают
ему набухать 30 мин, нагревают, помешивая, пока не раство-
рится агар, добавляют 10 г пептона и 40 г глюкозы или маль-
тозы. Пробирки со средой стерилизуют 15 мин при 115 °C.
386
СОДЕРЖАНИЕ
ЧАСТЬ ПЕРВАЯ. ОБЩАЯ МИКРОБИОЛОГИЯ
Бактериологическая лаборатория................................
Помещение бактериологической лаборатории и оборудование рабо-
чего места.....................................................
Правила работы и поведения в лаборатории .....................
Порядок хранения, обращения и отпуск культур патогенных микробов
Уборка лабораторного помещения................................
Мытье и обработка лабораторной посуды.........................
Дезинфекция...................................................
Стерилизация ............... , ..............................
Виды стерилизации.............................................
Микроскопические методы исследования..........................
Кроскопия микроорганизмов в живом состоянии...................
роскопня микроорганизмов в окрашенном виде . . . . .
Простая окраска...........................................
Сложные дифференциальные методы окраски...................
Основы приготовления питательных сред . ‘.....................
Определение pH питательных сред...............................
Техника посева, культивирования и выделения чистой культуры
аэробных и анаэробных микробов ...............................
Бактериальный стандарт мутности и работа с ним................
Методы выделения чистых культур...............................
Методы изучения культуральных свойств микробов................
Биохимические свойства микробов и методы их изучения
Методы изучения микробного антагонизма и определения чувстви-
тельности патогенных бактерий к антибиотикам..................
Методы изучения свойств бактериофага и явления бактериофагии
Выделение бактериофага из патологического материала и объектов
внешней среды..................................................
Качественные пробы для обнаружения бактериофага в жидких н на
плотных питательных средах.....................................
Титрование бактериофага.......................................
Фаготипаж бактерий и методы фаготипирования...................
Лабораторные животные и экспериментальная инфекция . ...
Содержание лабораторных животных и уход за ними ....
Способы заражения лабораторных животных.......................
Техника взятия у лабораторных животных крови и получения из нее
отдельных ингредиентов ........................................
Умерщвление и вскрытие лабораторных животных..................
Определение вирулентности микробов............................
Определение токсигенности микробов............................
Иммунитет и методы его изучения...............................
Серологические методы, применяемые для изучения факторов гумо-
рального иммунитета............................................
Реакция агглютинации .........................................
Реакция непрямой (пассивной) гемагглютинации .
3
3
5
6
10
11
15
27
30
30
34
38
47
50
52
56
60
66
73
74
76
77
80
81
81
95
100
105
108
1.10
111
113
118
124
387
Реакция торможения непрямой гемагглютинации . . . 127
Реакция преципитации..........................................128
Реакция гемолиза..............................................134
Реакция связывания комплемента..............................136
Факторы естественной резистентности организма, методы их изучения 143
Фагоцитоз.................................................... 143
Гуморальные факторы естественной резистентности организма и ме-
тоды их изучения..................................................149
Комплемент, техника его определения...........................149
Лнзоцим и методы его титрования...............................153
ЧАСТЬ ВТОРАЯ. СПЕЦИАЛЬНАЯ ЧАСТЬ.
Техника собирания у больного материала для бактериологического
исследования
Патогенные
кокки ..............................................
158
164
Стафилококки ............. .............................
Стрептококки .................................................
Пневмококки...................................................
Менингококки..................................................
Гонококки ....................... ............................
Семейство кишечиых бактерий (Enterobacteriaceae)...............
Эшер их ии....................................................
Сальмонеллы...................................................
Шигеллы...................... . . .......................
Возбудители холеры.............................................
Патогенные анаэробы...........................................
Возбудитель столбняка.........................................
Возбудители газовой гангрены..................................
Возбудитель ботулизма.........................................
Зоонозы .......................................................
Возбудитель чумы..............................................
Возбудитель туляремии.........................................
Возбудитель бруцеллеза ........................................
Возбудитель сибирской язвы....................................
Возбудители коклюша и паракоклюша..............................
Возбудитель дифтерии...........................................
Возбудитель туберкулеза........................................
Патогенные спирохеты..........................................
Возбудители возвратных тифов..................................
Возбудители лептоспирозов ....................................
Возбудитель сифилиса..........................................
Риккетсии......................................................
Риккетсии Провачека...........................................
164
174
188
192
197
200
201
208
228
238
24»
249
252
258
260
260
265-
268
273
276
280
286
290
290
291
296
299
300-
ЧАСТЬ ТРЕТЬЯ. САНИТАРНАЯ МИКРОБИОЛОГИЯ
Санитарио-бактериологическое исследование воды....................303
Определение общего числа микробов в воде...........................304
Методы определения титра кишечной палочки в воде .... 307
Санитарно-бактериологическое исследование почвы населенных мест 314
Санитарно-бактериологическое исследование воздуха.................317
Санитарно-бактериологическое исследование молока и молочных про-
дуктов ............................................................329
Саиитарио-бактериологиЧеское Исследование изделий из крема . 325
Санитарно-бактериологическое исследование мясо-колбасных изделий 327
Бактериологическое исследоваиие баночных коисервов .... 329
Исследование перевязочного и хирургического материала иа стериль-
ность . '..........................................................331
388
Саиитарио-бактериологичрское исследование смывов с рук предме-
тов окружающей обстановки .........................................332
ПРИЛОЖЕНИЕ
Наиболее употребительные дезинфицирующие средства и прописи
приготовления из них рабочих растворов .....................
Хлорсодержащие средства.....................................
Дезинфицирующие средства группы фенола......................
Приготовление хромовой смеси................................
Рецепты красителей и реактивов, необходимых для окрашивания бак-
териальных' препаратов ...................... ..............
Кристаллический фиолетовый ...... ...
1. Кристаллический фиолетовый — насыщенный спиртовой рас-
твор ....................................................
2. Кристаллический фиолетовый — спирто-водный раствор
3. Кристаллический фиолетовый — карболовый раствор .
4. Кристаллический фиолетовый ацетат....................
Фуксин......................................................
5. Фуксин — насыщенный спиртовой раствор................
6. Фуксин Циля карболовый............................
7. Фуксии спирто-водный (раствор Пфейффера).............
Метиленовый синий...........................................
8. Метиленовый синий — насыщенный спиртовой раствор
9. Метиленоиый синий — спирто-водный раствор . . . .
10. Метиленовый синий (Леффлера).........................
11. Синька Нейссера......................................
12. Толуидиновый синий — ацетат . .......................
13. Хризоидин—водный раствор.............................
14. Везувии, или коричневый краситель....................
15. Нейтральный красный — водный раствор.................
16. Малахитовый зеленый — водный раствор.................
17. Краситель Романовского — Гимзы.......................
18. Тушь для окраски препаратов по Бурри.................
19. Реактив Калины.......................................
Приготовление красящих бумажек по Синеву....................
Растворы ...................................................
20. Изотонический раствор хлорида натрия ................
21. Раствор Люголя.......................................
22. Раствор Олсвера для хранения эритроцитов.............
23. Раствор Мигуновой для хранения эритроцитов ....
Агаровые среды,. применяемые при постановке иммунологических
реакций . . ......................................... . . 5.
24. Агар для постановки реакции преципитации.............
25. Бифталатный агар (pH 6,2) для определения лизоцима
Рецепты индикаторов ........................................
26. Лакмусовая настойка...............................
27. Индикатор бромтимоловый синий........................
28. Индикатор розоловая кислота.......................
29. Индикатор Андреде....................................
30, Индикаторная бумага иа сероводород ......
31. Индикаторная бумага на иидол.........................
32. Индикатор для обнаружения оксидазы...................
Рецепты основных питательных сред...........................
33. Мясная вода .........................................
34. Пептонная вода.......................................
35. Мясо-пептонный бульон................................
36. Триптический перевар Хоттингера......................
37. Бульон на переваре Хоттингера........................
s assess
38. Мясо-пептониый агар .... ...... 350
39. Основной пептон Мартена.................................350
40. Бульон Мартена........................................ 351
41. Агар Мартена............................................351
42. Сахарный бульон .'(бульон с глюкозой)...................351
43. Сахарный агар (агар с глюкозой).........................352
Рецепты питательных сред для определения ферментации углеводов 352
44. Цветные среды Гисса с углеводами........................352
45. Среды Гисса с сывороткой крови..........................352
46. Среды Гисса на сыворотке................................353
47. Среды Гисса с крахмалом.................................353
Рецепты питательных сред для определения редуцирующей способно-
сти бактерий...................................................353
48. Молоко с метиленовым синим.............................353
49. Лакмусовое молоко (в прописи Минкевича).................354
Рецепты питательных сред для определения протеолитической спо-
собности бактерий..............................................354
50. Питательный желатин..................................: 354
51. Молочный агар Эйкмаиа...................................355
52. Свернутая сыворотка.....................................355
53. Бульон с кусачками вареного куриного белка .... 355
54. Среда Строгова для определения индола...................356
55. Среды для определения инодолообразования................356
Рецепт питательной среды для определения гемолитической активности 356
56. Кровяной агар...........................................356
Рецепты питательных сред для выращивания кокков................357
57. Бульон и агар из мяса по Левинталю......................357
58. Сывороточный бульон.....................................357
59. Сывороточный агар ......................................358
60. Комбинированный мясной бульон (для производства скарла-
тинозного токсина)..........................................358
61. Желточно-солевой агар Чистовича.........................358
62. Молочно-солевой агар Петрович...........................358
63. Желточная среда Чистовича...............................358
64. Среда для получения стафилококкового энтеротоксина . . 359
65. Среда Гарро.............................................359
66. Среда Бейли........................................... 359
67. Ристомицииовая среда....................................359
68. Среда обогащения для гонококков.........................359
Рецепты приготовлении питательных сред для выращивания предста-
вителей семейства кишечных бактерий............................360
Среды для консервирования исследуемого материала .... 360
69. Глицериновая смесь......................................360
70. Боратная смесь Изралимского и Теплицкой.................360
71. Консервант Шустовой.....................................360
Срды для выделения и идентификации бактерий семейства кишечных 361
72. Среда Мюллера...........................................361
73. Среда Кауфмана..........................................361
74. Селенитовая среда накопления Лейфсона...................361
75. Среда обогащения «М».................................. 362
76. Желчный бульон..........................................362
77. Среда Рапопорт..........................................362
78. Голодная среда Клодницкого..............................363
79. Среда Эндо..............................................363
80. Среда Левина.......................................... 363
81. Среда Плоскирева и бактоагар Плоскирева.................364
82. Внсмут-сульфитная среда Вильсона — Блер.................364
83. Среда Аселя — Либерманна................................365
84. Среда Ресселя...........................................365
85. Среда Ресселя нз сухих питательных сред.................366
390
86. «Скошенный столбик» с мочевиной . ....... 366
87. Трехсахарный агар с мочевиной по Олькенидкому . . . 367
88. Бульон глицериновый по Штерну......................., 367
Рецепты питательных сред для выращивания холерных вибрионов 368
Среды для консервации н обогащения исследуемого материала 368
89. Консервант Венкатрамена и Рамакришиана...................368
90. Щелочная пептонная вода................................ 368
91. Щелочная пептонная вода с теллуритом калия .... 368
Среды для выделения и идентификации холерных вибрионов . . 369
92. Щелочной мясо-пептонный агар........................... 369
93. Бактоагар TCBS......................................... 369
94. Лактозо-сахарозиая полиуглеводная среда..................369
95. Среда Клигера............................................370
96. Среда Кларка.............................................370
97. Среда Хью—Лейфсона.......................................370
Среды для определения декарбоксилаз аминокислот.................371
98. Среда Меллера.......................................... 371
99. Среда Фалькоу............................................371
100. Среда с мочевиной (Кристенсена) . . . , . . . . 372
Реценты питательных сред для выращивания дифтерийных бактерий 372
Среды для консервации и обогащения исследуемого материала . 372
101. Среда Пергола...........................................372
102. Полужидкая сывороточная среда...........................373
Среды для выделения и идентификации бактерий дифтерии . . 373
103. Свернутая сыворотка.......................... . . ч 373
104. Теллуровая среда Клауберга..............................373
105. Сухая хинозольиая индикаторная среда Бучина .... 374
il06. Цистин-теллурит-сывороточная среда Тиндаля (модифициро-
ванная) ............................................... , . 374
107. Среда для определения цистнназы (для пробы Пизу) . . 374
108. Среда Закса для определения фермента уреазы .... 375
109. Сухой питательный агар для определения токсигенности диф-
терийных культур.............................................375
Рецепты питательных сред для выращивания бактерий коклюша и па- (
ракоклюша.......................................................375
ПО. Казениово-угольный агар (КУА)............................375
111. Картофельно-глицериновый агар на Борде —Жангу . . . 376
112. Среда Закса для определения уреазы......................376
Рецепты питательных сред для выращивания патогенных анаэробов 376
113. Среда Китта—Тароцци.....................................376
114. Полужидкий агар для трубок Вейона.......................377
115. Среда Вильсона — Блер...................................377
116. Кровяной агар Цейсслера............................С • 377
117. Молоко по Тукаеву.......................................377
118. Кровяной сахарный агар..................................377
119. Среда Виллиса и Хоббса..................................377
120. Бензидиновый агар.......................................378
Рецепты питательных сред для выращивания микроорганизмов, вызы-
вающих зоонозы...............................................
. 121. Консервант Берлина н Башевой ........................
122. Жидкость Брокэ.......................................
123. Перевар Филдса.......................................
>124. Среда Туманского.....................................
125. Голоднокислый агар Бессоновой.........................
126. Среда с рамнозой Бессоновой
127. Желточная среда Мак-Коя........................•
128. Печеночный агар...................................
129. Мясо-пептонный глюкозо-глицернновый агар.............
130. Полужидкий агар Мейера и Цобеля......................
131. Среда ГКИ............................................
378
378
378
378
379
379
379
380
380
380
381
381
4
132. Среда Томова............................................'381
133. Среда Буза...............................................382
Рецепты питательных сред для выращивания туберкулезных микобак-
терий ...........................................................382
134. Среда Прайса ..........................................382
135. Среда Левеиштейна—Йенсена...............................382
136. Среда Петраньяин........................................382
137. Среда Гельберга.........................................383
Рецепты питательных сред для выращивания спирохет .... 383
138. Среда Уленгута . 383
139. Среда Терских...........................................384
Рецепты питательных сред, применяемых при санитарно-бактериоло-
гических . исследованиях . . ................................384
140. Глюкозо-пептонная среда . 384
141. Лактозо-пептонная среда.................................384
142. Желчно-лактозный бульон с бриллиантовым зеленым . . 384
143. Борнокислая буферная среда с лактозой ...................385
144. Среда Кесслера . 385
145. Среда Хейфеца.......................................... 385
146. Среда «ХБ» (хииозол^бромкрезолпурпурная среда) . . . 385
147. Среда Козера (модифицированная)..........................386
148. Цитратный агар Симмонса .................................386
149. Среда Сабуро........................................... 386
ИБ № 1390
Лабинская Ариадна Семеновна
МИКРОБИОЛОГИЯ С ТЕХНИКОВ
МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИИ
Редактор С. А. Ефремова
Художественный редактор И. И. Синякова
Корректор М. X. Яшина
Техн, редактор В. И. Табенская
Переплет художника В. С. Сергеевой
Сдано в набор 24/VII 1977 г. Подписано к печати 15/Х 1977 г. Формат бу-
маги 60х90*/1б> 24,5 печ. л. + 0,25 печ. л. вкл. (условных 23,83 л.) 24,48 уч.-
нзд. л. Бум. тип. № 2 Тираж 50 000 экз. Т 17233 МУ-42. Цена 84 коп.
Издательство «Медицина». Москва, Петроверигский пер., 6/8
Заказ 2002. Московская типография № 11 Союзполиграфпрома при Госу-
дарственном комитете Совета Министров СССР по делам издательств, по-
лиграфии и книжной торговли. Москва, 113105,-Нагатинская, 1.
К стр. 136
Рис. 18. Реакция гемолиза.
v
К стр. 193
Рис. 21. Менингококк в спинномозговой жидкости
(окраска метиленовым синим).
К стр. 198
Рис. 22. Гонококк в гное (окраска метиленовым
синим).
Рис. 23. Колонии бактерий тифопаратифозной
группы на среде Плоскирева.
К стр. 214
Рис. 24. Колонии бактерий тифопаратифозной
группы на среде Вильсона — Блер.
Рис. 27. Бактерии дифтерии. Окраска по Нейссеру.
К стр. 286
Рис. 29. Бактерии туберкулеза (окраска по Цилю —
Нильсену).
Рис. 30. Бледные спирохеты в отделяемом из твердого
шанкра (окраска по методу Романовского —
Гимзы).
К стр. 297