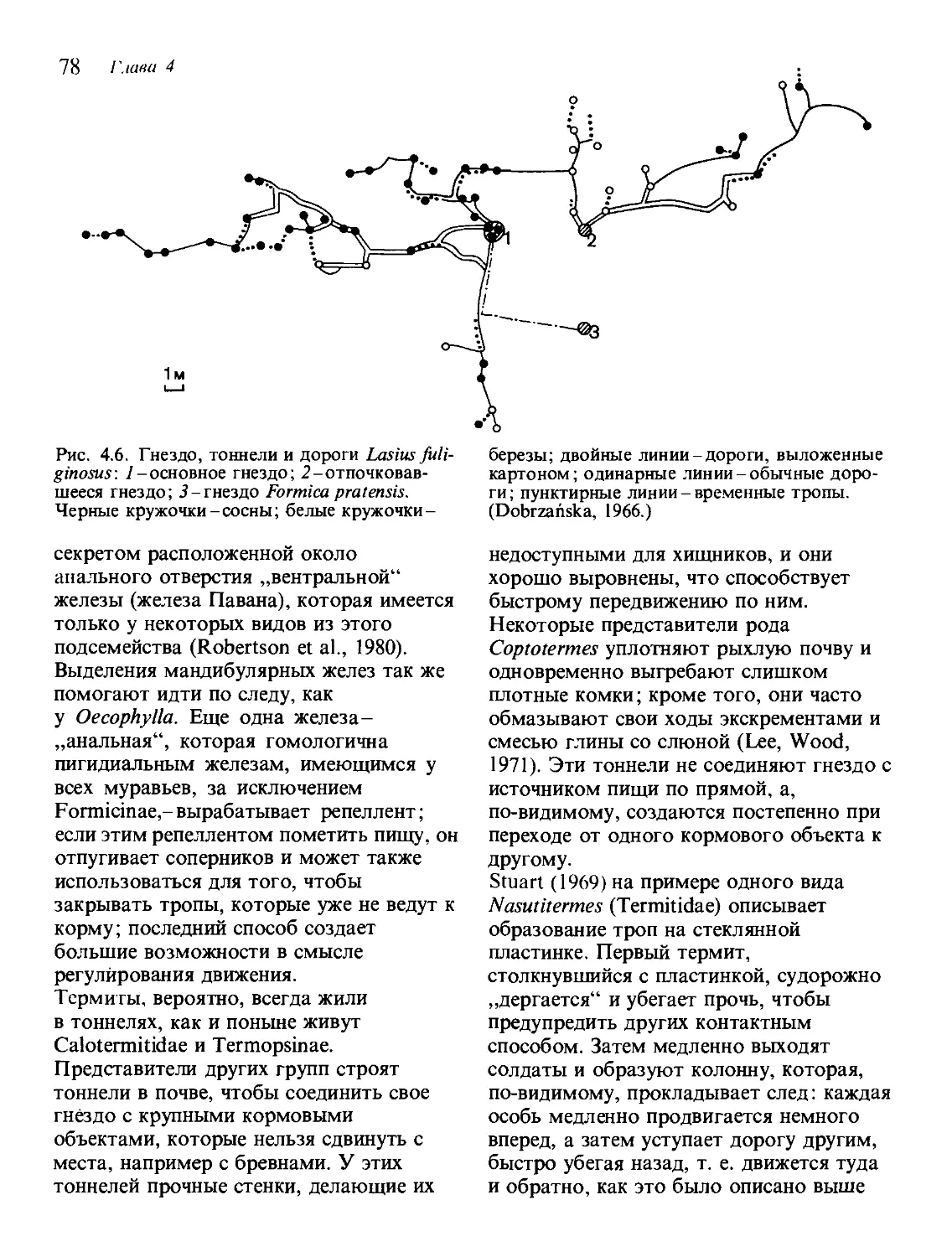
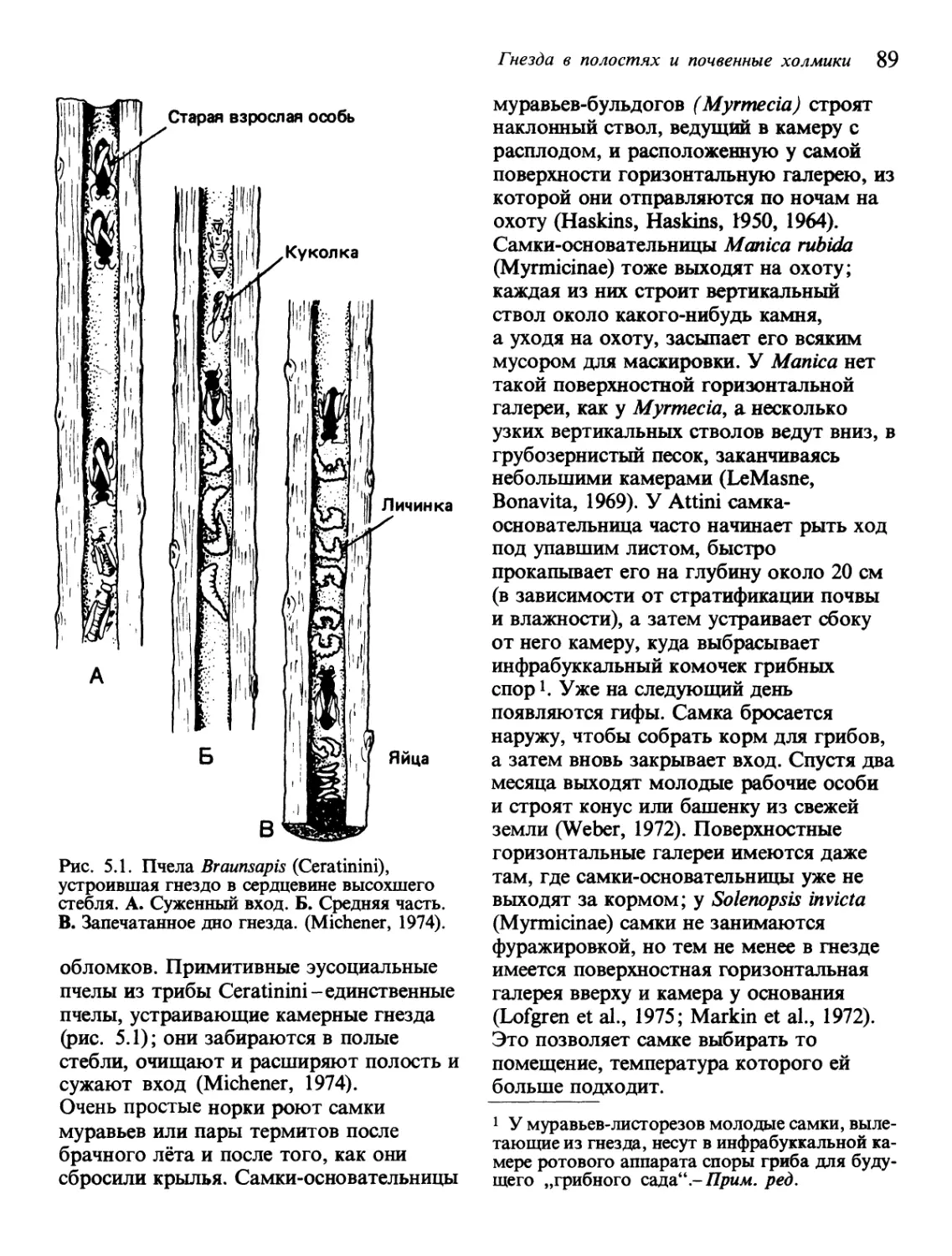
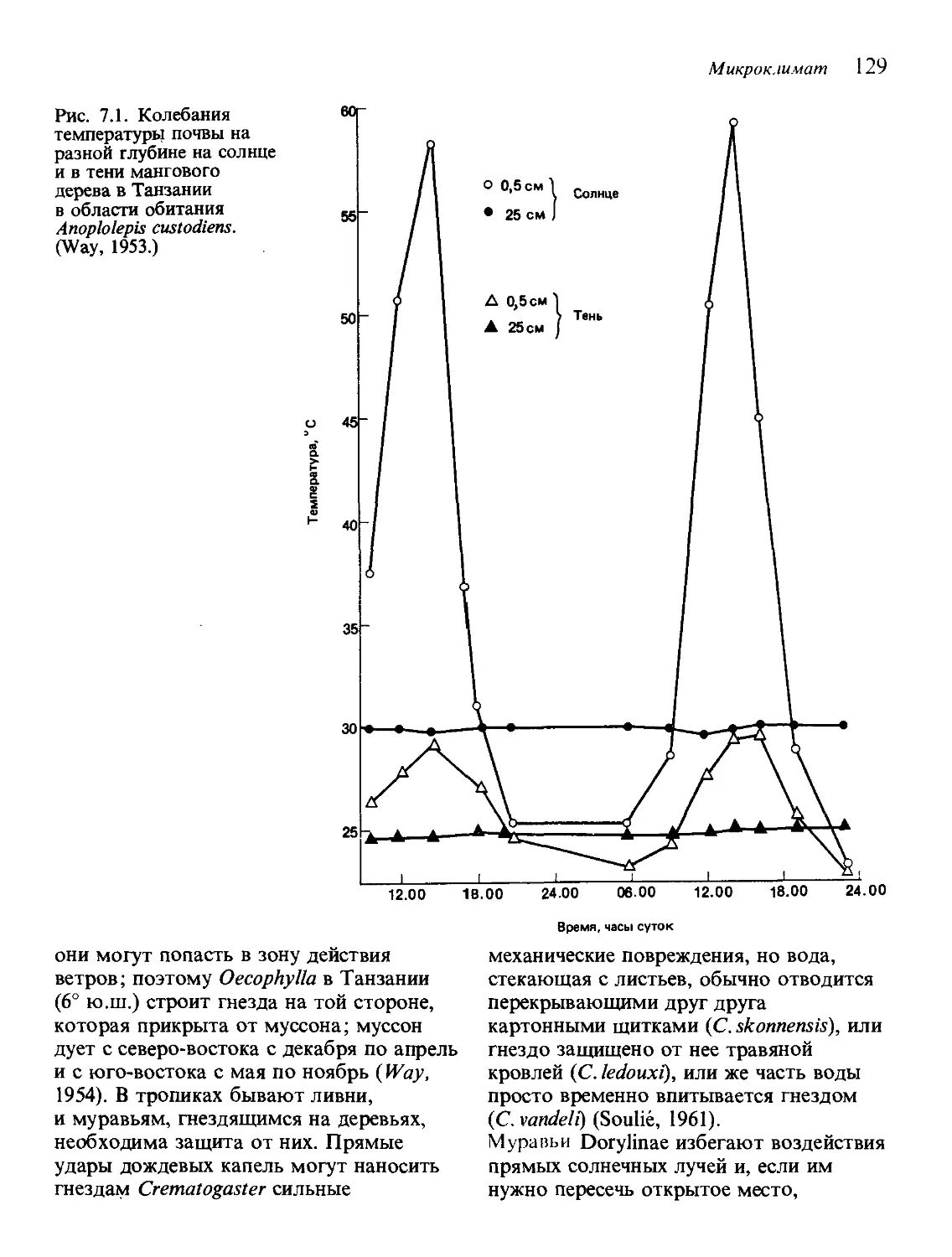
Текст
М.Брайен
Общественные
насекомые
Экология
и поведение
Social
Insects
Ecology
and Behavioural
Biology
M. V. Brian
London New York
Chapman and Hall
М.Брайен
Общественные
насекомые
Экология
и поведение
Перевод с английского
Т. Сидоровой
под редакцией
д-ра биол. наук Г. М. Длусского
Москва „Мир“ 1986
ББК 28.691.89
Б87
УДК 591.5 + 595.7
Брайен М.
Б87 Общественные насекомые: Экология и поведение: Пер. с англ.-М.: Мир,
1986.-400с., ил.
В книге известного английского ученого изложены основные вопросы, связанные с обеспечением
сообществ насекомых пищей, с гнездостроением, поддержанием микроклимата, процессами роста и
созревания общины. Особое внимание уделено вопросам экологии различных общественных насекомых,
в том числе сравнительной экологии видов в различных зональных ландшафтах.
Предназначена для энтомологов, этологов и экологов.
Б 2005000000-177 13g_86 j ББК 28.691.89
041/01/—86
Редакция литературы по биологии
© М. V. Brian 1983
This book was originally published in the
English language by Chapman a. Hall Li-
mited of London
© перевод на русский язык, „Мир“, 1986
Предисловие редактора перевода
Общественные насекомые-муравьи, термиты, осы
и пчелы - играют важнейшую роль практически во всех
экосистемах суши. Осы и большая часть муравьев выступают
как хищники, термиты, особенно в тропических
экосистемах,- как важнейшие разрушители растительных
остатков, а общественные пчелы являются основными
опылителями многих диких и культурных растений. Очень
часто, особенно в пустынях и саваннах, по совокупной
численности и биомассе общественные насекомые значительно
превосходят всех остальных животных, вместе взятых.
Казалось бы, любое комплексное экологическое
и биогеоценологическое исследование невозможно без изучения
этих насекомых. Между тем, если взять подавляющее
большинство такого рода работ, в том числе и отечественных,
можно увидеть, что авторы либо вообще не обращают
внимания на общественных насекомых, либо ограничиваются
некоторыми общими фразами об их возможной роли
в биогеоценозах; иной подход является скорее исключением.
Дело в том, что для изучения общественных насекомых, как
правило, не годятся стандартные подходы и методы,
применяемые экологами при исследовании всех остальных
наземных беспозвоночных. Так, например, для них непригодны
стандартные методы учета численности (исследование
почвенных проб, применение биоценометров, кошение сачком
и т. и.). Особые методы требуются для определения таких
важнейших параметров, как биомасса, продукция, потребление
пищи. Оценка деятельности общественных насекомых требует
от эколога особого подхода и знания некоторых важных
моментов их образа жизни.
О биологии общественных насекомых написано много.
Имеются и большие обзорные монографии, лучшей среди
которых безусловно является книга Е. О. Wilson „The insect
societies", и обширная научно-популярная литература,
например прекрасные книги И. А. Халифмана. Но в этих
книгах основное внимание уделяется таким вопросам, как
коммуникация, разделение функций в семье, происхождение и
эволюция социальности, различные формы социального
паразитизма, механизмы поддержания гомеостаза и т. д.
Безусловно, все эти вопросы крайне важны для понимания
сущности общественного образа жизни насекомых, но эколог,
специально не занимающийся общественными насекомыми, из
6 Предисловие редактора перевода
таких книг вряд ли сможет почерпнуть много такого, что он
мог бы использовать в своей непосредственной практической
работе.
Предлагаемая читателю книга М. Брайена занимает
в литературе об общественных насекомых особое место. Эта
книга написана для зоологов и экологов, специально не
занимающихся этой проблемой. В ней сравнительно немного
внимания уделено вопросам, о которых говорилось выше, но в
то же время подробно обсуждаются взаимоотношеня
общественных насекомых как между собой, так и с другими
организмами. Особенно подробно рассмотрена динамика
численности общественных насекомых (гл. 9-12).
М. Брайен хорошо известен как автор многочисленных работ
по экологии муравьев луговых экосистем Великобритании, а
главное-серии исследований, посвященных динамике
численности семей и регуляции каст у муравьев, главным
образом видов рода Myrmica. „Общественные насекомые“-не
первая его книга. В 1965 г. вышла его первая книга „Social
insect populations", сыгравшая важную роль в развитии
экологии общественных насекомых. Во время проведения
Международной биологической программы М. Брайен был
председателем рабочей группы по общественным насекомым
секции „Экосистемы суши". Итогом этой международной
работы была коллективная монография „Production ecology of
ants and termites" (1978), главным редактором и одним из
авторов которой был автор этой книги. Таким образом, сейчас
М. Брайен является наиболее компетентным специалистом в
области экологии общественных насекомых, особенно
в вопросах динамики численности муравьев и термитов.
Не все разделы книги получились одинаково удачными. Если
главы, посвященные регуляции состава семьи, динамике
развития семей или структуре многовидовых сообществ
написаны на высоком профессиональном уровне, то разделы, в
которых автор обращается к вопросам эволюции или
систематики общественных насекомых, несколько
поверхностны. Некоторые гипотезы автора весьма спорны.
Так, например, гипотеза о происхождении социального
паразитизма из полигинии, основанная на изучении
своеобразной ситуации с микрогинами у Myrmica,
противоречит большому числу случаев, когда социальные
паразиты не родственны их хозяевам. Также весьма спорна
гипотеза о происхождении „рабовладения" (куколочного
паразитизма) у муравьев из хищничества. При экологических
построениях для упрощения можно условно рассматривать
„рабовладельцев" как хищников, поскольку их воздействие на
популяцию хозяина сходно с воздействием хищника на
популяцию жертвы. Однако мнение автора, что эти муравьи
Предисловие редактора перевода 7
поедают значительное число похищенных куколок,
представляется необоснованным. Это происходит либо
в случае ошибочного нападения паразита на гнезда тех видов
муравьев, которые не могут быть использованы в качестве
„рабов“, либо при лабораторных опытах, когда неправильное
кормление может привести к поеданию не только чужого, но и
своего расплода.
К сожалению, автор, как и большинство других западных
ученых, мало знаком с советской литературой, хотя
исследования в этой области, касающиеся главным образом
муравьев, весьма интенсивно ведутся в нашей стране. За
последние 20 лет было опубликовано несколько сотен статей и
5 монографий, посвященных экологии и биологии
общественных насекомых (см. приводимый ниже список
дополнительной литературы). Хотя в книге и упомянуты
работы всех ведущих советских мирмекологов, однако их
данные в книге почти не отражены.
В первую очередь это касается вопросов биологии рыжих
лесных муравьев (группа Formica rufa), в частности проблемы
терморегуляции в гнездах. Эти муравьи составляют главный
объект изучения наших мирмекологов. Цитируемая в книге
работа Brandt хотя и была опубликована в 1980 г., лишь
повторяет, причем на более низком уровне, исследования,
проведенные Э. К. Гринфельдом в 30-х годах, а гипотеза
Coenen-Straas et al. (1980) противоречит экспериментальным
данным, полученным А. Мартином и мною в 70-х годах
(Длусский, 1980). На самом деле поддержание высокой
постоянной температуры в зоне выведения расплода
происходит не за счет разложения материала гнезда, а за счет
тепла, выделяемого муравьями при быстром расщеплении
сахара.
Наибольших успехов советские исследователи достигли
в изучении сложных форм обучения общественных насекомых
(Лопатина, 1971; Мазохин-Поршняков, 1974; Длусский, 19816;
Резникова, 1983) и поведенческой структуры одновидовых
сообществ муравьев (Захаров, 1972, 1980, 1981, 1984). Если
первая область исследований лишь косвенно связана
с основными проблемами, обсуждаемыми в книге, то вторая
имеет к ним самое прямое отношение. Характер структуры
поселения определяет способ использования кормового участка
и в конечном счете-характер взаимодействия данного вида с
другими элементами экосистемы.
При переводе этой книги мы столкнулись с рядом трудностей
терминологического характера. Во-первых, стремясь, видимо, к
большей простоте изложения, автор не всегда строго
придерживается даже терминологии, принятой в англоязычной
литературе, заменяя порой термины образными выражениями.
8 Предисловие редактора перевода
Мы старались придерживаться стиля автора, но это удавалось
не всегда. Во-вторых, в ряде случаев в советской литературе
существует более детальная терминология. Но, используя
отечественную терминологию в полном объеме, мы
фактически приписали бы автору точку зрения, которая у него
отсутствует. Поэтому было выбрано компромиссное решение.
Хотя автор не различает выделяемых в нашей литературе
уровней структурной организации поселений муравьев,
английский термин „colony" в большинстве случаев
соответствует русскому „семья"; так он и переводился. Автор
не делает различий между колониями и поликалическими
семьями, называя и то и другое „polycalic colony". В тех
случаях, когда из текста было очевидно, что имеется в виду
колония (система семей, которые связывает обмен расплодом,
самками и молодыми особями, например у рыжих лесных
муравьев), мы переводили это словосочетание как „колония";
во всех остальных случаях-как „поликалическая семья" (т. е.
семья, занимающая несколько гнезд). Автор не делает
различий между понятиями „кормовой участок"
и „территория", называя и то и другое „territory". Поскольку
из текста далеко не всегда ясно, что имеется в виду, обычно
этот термин переводился как „кормовой участок", и лишь в
тех случаях, когда автор писал „protected territory", мы
переводили это как „охраняемая территория". Любые
постоянные дороги автор называет „tracks", а временные
дороги и пахучие следы одиночных фуражиров-„trails".
Соответственно „track" переводилось как „дорога", a „trail"
либо как „тропа", либо, если речь шла о следе, оставляемом
одиночными фуражирами или небольшими группами,-как
„пахучий след". Английский термин „population"
в зависимости от контекста переводился как „население"
(colony population-население гнезда), „совокупность" (worker
population-совокупность рабочих особей) и лишь в тех
случаях, когда речь явно шла о большой группе семей,
населяющих определенную территорию,-как „популяция".
Для обозначения каст общественных перепончатокрылых в
англоязычной литературе используется более детальная
терминология, чем в русской. Применяются термины „females"
(самки по полу, т. е. собственно самки и рабочие особи),
„gynes" (самки, способные к репродукции) и „queens"
(оплодотворенные самки). В русской литературе о муравьях
используются только термины „рабочая особь" (английское
worker или neuter), „самка" и „самец" (английское male), а в
литературе о пчелах-соответственно „рабочая пчела"
(„работница"), „матка" и „трутень". По ряду соображений мы
не хотели менять принятой в нашей литературе терминологии
и поэтому термин „female" обычно переводился как „женская
особь", a ,,gyne“ и „queen" как „самка" для муравьев и
Предисловие редактора перевода 9
термитов или „матка“ для пчел и ос. В случае необходимости
добавлялись соответствующие определения:
„самка-основательница", „оплодотворенная самка" и т. д.
В заключение хотелось бы отметить, что книга М. Брайена
рассчитана на подготовленного читателя, знакомого
с биологией общественных насекомых хотя бы на уровне
серьезной научно-популярной литературы. В качестве такой
литературы можно порекомендовать книгу А. А. Захарова
„Муравей, семья, колония" и книги И. А. Халифмана об
общественных насекомых.
В целом книга М. Брайена безусловно представляет важный
шаг в изучении общественных насекомых. Мы надеемся, что
собранный в ней обширный фактический материал, четкое
выделение неясных и нерешенных проблем, множество новых,
хотя и не всегда бесспорных идей привлекут внимание
советских читателей. Не вызывает сомнений, что эта книга
будет способствовать дальнейшему развитию экологии
общественных насекомых в нашей стране и окажется полезной
многим зоологам и экологам.
Г. М. Длусский
Список дополнительной литературы
Длусский Г. М. Муравьи рода Формика.-М.: Наука, 1967.
Длусский Г. М. Температурный режим в гнездах некоторых видов и
пути эволюции терморегуляции у муравьев рода Formica. В кн.:
Физиологическая и популяционная экология животных. Изд.
Саратовского университета, 1980, с. 13-36.
Длусский Г. М. Муравьи пустынь-М.: Наука, 1981.
Длусский Г. М. Принципы коммуникации у муравьев. В кн.: Чтения
памяти Н. А. Холодковского.-Л.: Наука, 1981, с. 34-58.
Жужиков Д. А. Термиты СССР.-М.: изд. МГУ, 1978.
Захаров А. А. Внутривидовые отношения у муравьев,-М.: Наука,
1972.
Захаров А. А. Муравей, семья, колония.-М.: Наука, 1978.
Захаров А. А. Экология муравьев. В кн.: Итоги науки и техники.
Зоология беспозвоночных.-М.: ВИНИТИ, 1980, т. 7, с. 132-202.
Захаров А. А. Поведенческая организация семьи у муравьев. В кн.:
Чтения памяти Н. А. Холодковского.-Л.: Наука, 1981, с. 34-58.
Захаров А. А. Специфика организации сообществ у социальных
перепончатокрылых. В кн.: Системные принципы и этологические
подходы в изучении популяций. Пущино, 1984, с. 91-107.
Лопатина Н. Г. Сигнальная деятельность в семье медоносной
пчелы-Л.: Наука, 1971.
Мазохин-Поршняков Г. А. Проблема опознания образов и зрительное
поведение насекомых. В кн.: Чтения памяти Н. А. Холодковского.-
Л.: Наука, 1974, с. 3-17.
Мариковский П. И. Муравьи пустынь Семиречья.-Алма-Ата.: Наука,
1979.
Резникова Ж. И. Межвидовые отношения муравьев.- Новосибирск.:
Наука, 1983.
Предисловие
Эта книга-руководство по экологии общественных насекомых.
Она предназначена для экологов и энтомологов, а также для
студентов и тех, кто только приступает к изучению
общественных насекомых; однако даже опытному
исследователю может оказаться интересным сравнение
различных групп этих своеобразных организмов.
Автор старался избегать специальной терминологии,
пользуясь, насколько это возможно без ущерба для точности,
общепонятным языком, однако без научных названий обойтись
нельзя. Читатели постепенно привыкнут к этим названиям
(хотя они не всегда смогут представить себе стоящее за
каждым из них насекомое) и поймут, что из всей массы
существующих видов до сих пор изучены лишь очень
немногие! Ссылки на оригинальные работы тоже необходимы:
они дадут возможность углубиться в обширнейшую научную
литературу, которая с каждым месяцем увеличивается. В тех
случаях, когда я цитирую какого-нибудь автора, ссылаясь на
работу другого автора, это означает, что я не читал
оригинальной работы и ответственность за точность
изложенных данных несет этот второй автор.
Создавать эту книгу мне помогали многие-и головой, и
руками. Я благодарю всех своих коллег, бывших и нынешних,
за их терпеливую, хотя и критическую поддержку. Особенно
приятно мне выразить признательность Е. J. М. Evesham за
выполнение схематических рисунков; J. Free, D. J. Stradling и
J. Р. Е. С. Darlington-за предоставление фотографий;
D. Y. Brian и R. A. Weller-за тщательную литературную
обработку текста; G. Frith и R. М. Jones-за проверку
библиографии.
Глава 1
Введение
Термин „экология" используется в этой
книге в широком смысле, включающем
также популяционную генетику, рост,
развитие и дифференцировку популяций,
поведение животных и их общение друг с
другом, взаимоотношения внутри вида и
между видами и структуру сообществ.
Термин „общественные насекомые"
используется в узком смысле-для
обозначения только настоящих
общественных форм, т. е. тех, у которых
один или оба пола делятся на касты. Это
означает, что здесь будут
рассматриваться только термиты
и осообразные, к которым я отношу
также муравьев и пчел; общественных
жуков, клопов, бабочек и пауков я, к
сожалению, вынужден исключить. Для
насекомых, при всем изяществе их
строения, характерны малая величина
отдельных особей; они никогда не
достигают таких размеров, как
некоторые моллюски и позвоночные, в
особенности динозавры
и млекопитающие. Этому есть веские
физиологические причины. В качестве
компенсации насекомые
скооперировались и образовали
организованные группы индивидуумов,
превратившиеся в процессе эволюции в
сообщества (семьи), которые
интегрированы в столь высокой степени,
что это уже, в сущности, новые
индивидуумы - сверхорганизмы.
Успех, достигнутый общественными
насекомыми, не вызывает сомнений. В
настоящее время они распространены по
всей суше и достигают высокой
экологической активности. Термиты (или
равнокрылые, Isoptera), будучи довольно
примитивными насекомыми, образуют
огромные и высокодифференцированные
сообщества. Они-главные
преобразователи веществ в почве от
тропиков до зоны пустынь; они
разрыхляют и перемешивают почву и с
помощью бактерий, простейших и грибов
разрушают волокна целлюлозы,
возвращая их компоненты в общий
круговорот веществ. Муравьи, пчелы и
осы (перепончатокрылые, Hymenoptera)
произошли в процессе эволюции от более
высокоорганизованных насекомых
с более тонкой структурой и более
развитыми органами чувств, не боящихся
света и способных использовать его и
распространенных ныне от экватора до
полярных областей. Они тоже начинали
как „мусорщики" и охотники, но
в дальнейшем вступили в множество
разнообразных мутуалистических
взаимоотношений с растениями
и с другими насекомыми, выступая в
роли хищников, „мусорщиков",
потребителей пади, опылителей
и переносчиков семян. Их сообщества
могут быть крошечными или
огромными, подвижными или
стационарными,
высокоинтегрированными и с сильно
развитым обменом информацией. И тем
не менее насекомые, не образующие
семей, продолжают существовать
в экологических нишах между семьями
общественных насекомых или даже
вступают с ними в ассоциации, так что
вновь и вновь встает вопрос: почему
возник общественный образ жизни
и почему он до сих пор достиг полного
развития только у термитов и в группе
жалящих перепончатокрылых? Почему не
у ложноскорпионов, пауков, клопов,
жуков или бабочек, которые все
в довольно значительной степени
12 Г./ава I
проявляют заботу о потомстве, но
опекают его не так долго и не так
тщательно? Казалось бы, остается еще
немало простора для развития новых
общественных форм.
Термиты происходят от
тараканоподобных насекомых,
относившихся к Exopterygota. У всех у
них имеются нитевидные усики
и грызущие мандибулы (жвалы); к груди
прикреплены две пары больших крыльев
со сложным жилкованием, при помощи
которых термиты совершают неуклюжий
и медленный полет при расселении.
Грудь незаметно переходит в трубчатое
брюшко. Термиты образуют пары на всю
жизнь. Вылупляющиеся из яиц личинки
имеют вид взрослых особей
в миниатюре, отличаясь от них лишь
отсутствием крыльев и репродуктивной
системы. Рост сопровождается линьками;
к концу роста из наружных зачатков
развиваются крылья и половые органы.
Ювенильные особи выполняют разные
работы в гнезде; у эволюционно
наиболее продвинутых семейств покровы
личинок отвердевают, а окраска темнеет,
и они могут выходить из гнезда, но за
это им приходится расплачиваться
перманентной стерильностью. Все
термиты диплоидны, пол у них
определяется хромосомами X и Y,
общественный образ жизни
и полиморфизм характерны для обоих
полов, хотя у высших термитов
генетический пол определяет, к какой
касте будет принадлежать данная особь.
Термиты делятся на пять семейств,
состоящих исключительно из
общественных видов (рис. 1.1). Самое
примитивное семейство Mastotermitidae,
наиболее сходное с тараканами, в эоцене
было распространено по всему земному
шару, однако ныне представлено лишь
одним видом Mastotermes darwiniensis,
обитающим в Австралии.
К отличительным признакам этого
семейства относятся пятичлениковая
лапка, наличие на задних крыльях
анальной лопасти и наличие яйцевой
капсулы. Другое притимивное, но
широко распространенное
семейство - Calotermitidae (суходревесные
термиты); эти насекомые выгрызают
ходы в бревнах, лежащих на земле под
открытым небом. Семейство
Введение 13
Рис. 1.2. Термит-жнец Hodotermes mossambi-
cus. А. Крылатая репродуктивная особь. Б. Ра-
бочая особь. В. Солдат. (Harris, 1961.)
Hodotermitidae, ископаемые
представители которого известны из
среднемеловых отложений Лабрадора,
сохраняет ряд примитивных признаков.
Оно делится на два подсемейства:
Termopsinae-обитатели гниющей сырой
древесины (влажнодревесные термиты), и
Hodotermitinae (термиты-жнецы),
которые срезают траву и запасают ее в
своих гнездах (рис. 1.2). Следующее
семейство, Rhinotermitidae, получило свое
название в связи с наличием у этой
группы „носатых41 солдат с выростом на
голове, через который они выбрасывают
на противника струю отпугивающей
жидкости. К самому
высокоорганизованному семейству
Рис. 1.3. Разные формы термита Amitermes
hastatus (Amitermitinae). А. Рабочая особь.
Б. Солдат. В-Д. Три типа репродуктивных
самок: бескрылая нормальная (В), неотениче-
ская, образовавшаяся из нимфы (Г), и неоте-
ническая, образовавшаяся из личинки (Д).
Е. Яйцо, изображенное в том же масштабе.
Длина тела рабочей особи 5 мм. (Skaife, 1954.)
Termitidae относится множество видов, у
которых бесполые особи имеют
пигментированные и склеротизированные
покровы. Наиболее примитивное
подсемейство-Amitermitinae (рис. 1.3).
Termitinae, происходящие из Эфиопской
области, примечательны тем, что у их
солдат имеются мощные
защелкивающиеся мандибулы;
Macrotermitinae разводят грибы
в специальных грибных камерах, а у
Nasutitermitinae солдаты выбрызгивают
14 Глава /
струи ядовитого и клейкого вещества.
Дальнейшие подробности о биологии
термитов можно найти у Krishna,
Weesner (1970) и Hermann (1979-1982). В
настоящее время повсюду, кроме
областей с недостаточно теплым
климатом, термиты-главная группа
животных, разрушающих растительные
остатки. Они проникли глубоко в почву и
поднялись до верхушек деревьев. Они
отыскивают любые остатки целлюлозы
везде, где только можно, и переносят их
в запечатанные холмики с постоянными
условиями температуры и влажности, где
целлюлоза разлагается с выделением
энергии. Вуд и Сэндс (Wood, Sands, 1978)
представили роль термитов
в экосистемах в виде схемы, приведенной
на рис. 1.4.
Пока у зермитов в меловое или
домеловое время начиналось развитие
общественного образа жизни, у других
насекомых-жуков, мух и жалящих
Hymenoptera-в процессе их эволюции
возникли более пластичные одиночные
формы с хорошо развитыми органами
чувств и более энергичным
и маневренным полетом. Отряд
Hymenoptera все еще в значительной
мере состоит из одиночных видов, очень
искусно откладывающих свои яйца
в ткани растений или беспозвоночных
(или на поверхность их тела), а также
форм, которые роют или строят ячейки,
помещают в них мелких животных или
пыльцу и откладывают в каждую из них
яйцо, оставляя его на произвол судьбы.
Самка достигает поразительно высокого
искусства в том, чтобы откладывать свои
яйца в защищенную естественную или
специально созданную питательную
среду (одиночные осы и пчелы).
В отличие от этого самцы специально
приспособлены к тому, чтобы находить
самок и спариваться с ними. Так как
самка может запасать сперму
в количестве, которого ей хватает на всю
жизнь, самец после копуляции гибнет.
Самцы гаплоидны и развиваются
партеногенетически из
неоплодотворенных яиц, а самки
диплоидны и обычно получаются из
оплодотворенных яиц. Произойдет ли
оплодотворение или нет, откроется ли
семеприемник или останется
закрытым,-это зависит от условий среды
и от состояния данной самки, которая
таким образом способна регулировать
пол потомства как у паразитических, так
и у общественных Hymenoptera.
..Искусство" откладки яиц обусловлено
большой подвижностью сочленений
между частями тела самки, чрезвычайно
точными двигательными реакциями
и компактной центральной нервной
системой, получающей сигналы от
весьма совершенных органов чувств.
Членистые усики, кончики которых могут
сводиться вместе, обследуют
пространство; ротовые части (у пчел)
вытянуты в сосущую трубочку; „шея“
способна изгибаться; передние и задние
крылья скреплены при помощи крючков
и действуют в унисон; на ногах имеются
гребни для чистки усиков и лапок и
корзиночки для пыльцы (у пчел);
передние сегменты брюшка сужены,
образуя как бы „талию", и насекомое
может, подгибая брюшко между ногами,
дотянуть его до рта. Кольца сегментов
парализующего яйцеклада
телескопически втягиваются, и насекомое
использует его для защиты, вводя с его
помощью яд врагу. Яйца просто
выталкиваются из полового отверстия и
подхватываются челюстями. Искусство
самок, в дополнение к их способности
регулировать пол потомства, дает им
возможность создавать однополые
сообщества.
Различаю! три группы общественных
Hymenoptera. Это, во-первых,
Sphecoidea-группа роющих ос, которые
охотятся за определенной жертвой, жалят
I Запасенный
j корм
I Собранный
J___корм
отребленный
корм
Навоз
Травоядные
Потери от других
вредителей
Собранные
1ожары ;
Р Экскреты
Хищники Г
Главные пути переноса энергии
и питательных веществ
Важные детерминирующие факторы
Агротехн жеские
мероприятия
Инсектициды
Культивация
I_____Севооборот
Корм и фуражировка
Злаки
| остатки
Подстилка Гумус
Повреждение
Надземная
растительность
и корни
Растительные
(остатки I
Дыхание
рЪст семьи
Крылатые
особи---
Семья термитов
(численность!
Органические
вещества
лыеы
Просачивание и запасание
4 воды
Пористость, аэрация
Система гнезд, ее размеры,
протяженность, стабильность
Холмики,
наземные галереи
Структура и
стабильность
Разделение на
горизонты
Перераспределение частиц
почвы, органических и
минеральных веществ
Состояние
питательных
веществ _
инеральньк
вещества
Почва
Подземные
гнезда и норки
Главные потери
Дыхание^
Другие почвенные
животные и
ми кроорганизмы
Рис. 1.4. Роль термитов в экосистемах. Схе- тов, связанные с постройкой гнезда и перера-
матически показаны все воздействия терми- боткой пиши. (Wood, Sands, 1978.)
16 I'.iaaa 1
(Xylocopini)
Рис. 1.5. Филогения об-
щественных пчел. Ука-
заны только те трибы, в
которых есть обще-
ственные виды; род-
ственные трибы, в ко-
торых нет общественных
видов, взяты в скобки.
(Michener, 1974.)
alictini
ее и утаскивают в свои подземные норки;
наивысшие представители этой
группы-покрытые волосками пчелы,
питающиеся пыльцой (Apoidea).
Во-вторых, Vespoidea-насекомые с более
прочной грудью, переносящие жертву в
ячейки, которые часто находятся над
землей и у эволюционно наиболее
продвинутой группы (сем. Vespidae)
построены из картона. В-третьих,
Formicoidea (одно семейство -Formicidae),
происходящие от эктопаразитических ос
группы Tiphioidea, представители
которой находят в земле личинок
насекомых, парализуют их
и откладывают на них яйца; в процессе
эволюции от этих ос произошли
разнообразные муравьи. Из названных
трех групп только муравьи представлены
одними лишь общественными видами, а
среди ос и пчел много одиночных видов.
У ныне живущих пчел (Apoidea)
общественный образ жизни характерен
для трех семейств. В семействе Halictidae
(рис. 1.5) имеется широкий диапазон
различных уровней общественной
организации вплоть до настоящих
сообществ; большинство видов роет
подземные гнезда и строит ячейки,
помещая в них комочки пыльцы.
В семействе Anthophoridae, которое тоже
в основном представлено одиночными
формами, есть одна триба (Ceratinini)
общественных пчел; они, что необычно
для пчел, строят гнезда без ячеек в
полостях растений. Большинство
Apidae-общественные насекомые. К ним
относятся важные опылители Bombinae
(шмели) и Apinae, среди которых есть
одна триба (Meliponini) безжалых пчел,
обитающих в тропиках,
Ii>;et>entic 17
и распространенная по всему земному
шару триба Apini-пчелы, снабженные
жалом и обладающие способностью
вырабатывать и запасать огромные
количества меда. У всех Apinae имеется
длинный трубчатый хоботок, а тело
покрыто волосками, к которым
Рис. 1.6. Наскальный рисунок (примерно 7000
лет до н. э.) из пещеры в Испании: изображен
один из первых людей, вынимающих соты из
пчелиного гнезда в расселине скалы. (Budel,
Herold, 1960.)
прилипает пыльца; это одна из самых
высокоразвитых групп общественных
насекомых. Вид Apis mellifera-
единственное общественное насеко-
мое, вступившее в мутуалистические
отношения с человеком, в результате
чего оно имеет теперь почти такой же
широкий ареал, как и Homo sapiens
(рис. 1.6).
К современным осам (Vespoidea,
Vespidae) кроме субсоциального
подсемейства Stenogastrinae, обитающего
в индо-малайской области
и отличающегося очень тоненьким
стебельком, относятся еще два
подсемейства. Одно из них, Polistinae,
распространено по всему земному шару,
но наибольшего разнообразия
и наивысшего уровня общественной
организации достигает в тропиках, где
обитает триба Polybiini, известная
высокой степенью развития полигинии и
разнообразной конструкцией гнезд.
Другое подсемейство, Vespinae,-обычные
осы умеренного пояса, у которых матки
резко отличаются по величине от
рабочих особей, строящих бумажные
гнезда с хорошей термоизоляцией.
Муравьи вначале представляли собой
группу хищников, обитавшую в земле, но
затем вышли на поверхность и даже
поднялись на деревья, где они поедают
различные продукты растительного
происхождения. Как и у термитов (тоже
первоначально обитавших в почве), у
муравьев в процессе эволюции появилась
способность обламывать свои крылья
после окончания расселения
и копуляции!, а бесполые касты у них
бескрылы от рождения. У многих видов
даже репродуктивные самки не имеют
крыльев, и их находят летающие самцы.
У эволюционно продвинутых видов
муравьев самки высокополиморфны; не
говоря уже об очень большой разнице в
величине между самками и рабочими
особями (которые выводятся из яиц
разного типа), сами рабочие могут быть
весьма различных размеров, что связано
с многообразием выполняемых ими
функций-от легкой работы
в муравейнике до тяжелой работы и
функций защиты, требующих силы. В
отличие от термитов у муравьев функции
1 У термитов в отличие от муравьев крылья
сбрасываются до копуляции, которая происхо-
дит уже в гнезде, выкопанном царской парой.-
Прим. ред.
i 8 / и i in i I
„солдат" обычно не ограничиваются
защитой муравейника, и из первых
партий яиц, отложенных молодой
самкой, солдаты, как правило, не
развиваются. Муравьи приобрели
сходство с термитами не только
в отношении способности обламывать
крылья, но и по многим другим
признакам; один из них-
мутуалистические взаимоотношения
с грибами, разрушающими растительные
ткани. В сущности, переход муравьев от
образа жизни охотников со
специализированным рационом
к питанию смешанной растительной
пищей приблизил их к термитам.
В упорядоченной и простой мировой
экосистеме будущего, в которой будет
господствовать человек, им,
по-видимому, уготована роль факторов
биологической регуляции;
муравья-портного Oecophylla используют
в Китае для защиты цитрусовых уже на
протяжении тысячелетий.
Единственное семейство Formicidae
делится на несколько подсемейств. Два
из них (Myrmeciinae и Ponerinae)
считаются примитивными и близкими к
исходной линии, а четыре (Dorylinae,
Dolichoderinae, Formicinae
и Myrmicinae)-более продвинутыми.
Филогения этих подсемейств пока еще
очень неясна (Brown, личное сообщение,
1982). Упрощенные филогенетические
схемы других групп и дальнейшие
подробности см. Hermann (1979-1982).
Киша iiocipociia по следующему плану:
сначала рассматривается сбор пищи,
затем ее переработка в специальных
гнездах и превращение в биомассу
общественных насекомых, а после
этого-увеличение их численности; это
подводит к проблеме размножения,
расселения и образования ограниченных
сообществ (семей); далее, после экскурса
в область генетики и происхождения
общественного образа жизни, мы
переходим к проблеме видообразования,
сосуществования видов
и переплетающейся мозаики семей, члены
которых растекаются из гнездовых
центров для освоения природных
ресурсов. В давно сложившихся
сообществах все это превращается
в комплекс взаимоотношений
сотрудничества и конкуренции.
Глава 2
Пища
Пиша необходима для того, чтобы
поддерживать живые ткани
и обеспечивать цх рост, строить
и восстанавливать отдельные структуры
организма и снабжать всю систему
энергией. Термиты поедают
растительный материал во многих его
видах: опавшие листья, древесину, помет
травоядных животных, семена, траву.
При участии симбиотических бактерий и
простейших они переваривают
целлюлозу (один из волокнистых
полисахаридов) и используют
заключенную в ней энергию. В отличие
от термитов муравьи и общественные
осы начинали свою эволюцию как
хищники; для получения энергии они
переваривали жиры и углеводы,
а позднее стали использовать
и растительные сахара. Эта ассоциация с
растениями в процессе эволюции все
больше усиливается, пока в конце концов
высшие муравьи не становятся
вегетарианцами, питаясь только
семенами и зелеными листьямиПчелы,
как потомки сфекоидных ос, начавшие
питаться пыльцой еще до того, как они
перешли к общественному образу жизни,
все больше совершенствуются в искусстве
сбора пыльцы. Основание экологической
пирамиды образуют, конечно, растения,
поскольку они улавливают солнечный
свет и синтезируют органические
вещества; концентрируемая ими энергия
дает возможность некоторым насекомым
поддерживать высокую постоянную
1 Фактически муравьи-листорезы питаются не
самими листьями, а грибами, выращенными на
субстрате из листьев.- Прим. ред.
численность и занимать в своей среде
прочное доминирующее положение.
Пиша должна содержать витамины. Из
группы водорастворимых витаминов
всем насекомым необходимы рибофлавин
(витамин В2), цианкобаламин (витамин
В12), L-аскорбиновая кислота (витамин С)
и миоинозитол, хотя потребность в тех
или иных витаминах у разных видов
различна, а некоторые насекомые
получают витамины от различных
микроорганизмов, обитающих в их
кишечнике (Rockstein, 1978).
К жирорастворимым витаминам
относятся некоторые полиненасыщенные
жирные кислоты, каротин (витамин А) и
а-токоферол (витамин Е). Эти витамины
широко распространены в свежих
растительных и животных тканях, но в
пище термитов их может оказаться
недостаточно; возможно, термитам
удается получать нужное количество этих
витаминов при помощи кишечных
симбионтов, а также благодаря тому, что
они поедают мертвых особей своего
вида.
2.1. Термиты как разрушители
растительных остатков
Вполне возможно, что первоначально
термиты были полифагами и питались
разнообразным органическим
материалом. Наиболее примитивный из
современных видов Mastotermes
darwiniensis, обитающий в Австралии,-
полифаг; он поедает помет
животных, растительные остатки
и древесину. К полифагам относится и
африканский термит Psammotermes
hybostoma, который не брезгует почвой из
20 Глава 2
Рис. 2.1. Места, где термиты потребляют дре-
весину в лесу Пасох-Форест, Западная Малай-
зия. 7-гнезда вокруг стволов (например, Mic-
rocerotermes); 2-поверхности вблизи основа-
ний деревьев; 3-центральная часть ствола;
4- отмершие ветки живых деревьев; 5-пни
или неповалившиеся высохшие деревья; 6-по-
валившиеся стволы; 7-опавшие ветки
и листья; S-гумус в почве. (Abe, 1979.)
подземных ходов и всевозможными
отбросами. В выростах задней кишки у
всех термитов обитают микроорганизмы,
помогающие им переваривать пищу. У
представителей наиболее примитивных
семейств (Calotermitidae, Hodotermitidae и
Rhinotermitidae) облигатные
симбионты - жгутиковые
простейшие - осуществляют
внутриклеточное переваривание пищи;
симбионты
Тermitidae - бактерии - переваривают
целлюлозу. Задняя кишка термитов
выстлана кутикулой, которая
периодически сбрасывается, но благодаря
тому, что особи обмениваются между
собой пищей, реинокуляция обеспечена.
Это одно из важных преимуществ
общественного образа жизни термитов.
В наши дни термиты играют важную
роль в разложении мертвых деревьев в
тропиках (рис. 2.1). Они очень
разборчивы в пище. Например,
в Австралии Nasutitermes exitiosus не
нападает на один из видов Pinus, потому
что содержащиеся в нем пинены служат
феромонами тревоги для этого термита и
их присутствие вызывает у него
беспокойство. Это может показаться
невероятным, но многие другие виды
поедают эту сосну, a N. exitiosus нападает
на дерево с еще более сильным
запахом -Eucalyptus marginata, которого
большинство других термитов избегает.
Ниш j -1
Рис. 2.2. Стадии разложения бревна. А. Тер-
миты проникают через ходы, проделанные жу-
ками, собирают почву и прилепляют ее к ниж-
ней поверхности бревна. Б. Термиты проделы-
вают в бревне галереи и приносят дополни-
тельные количества почвы. В. Галереи расши-
ряются, превращаясь в камеры, и бревно на-
чинает погружаться в почву. Г. Бревно разру-
шается, термиты начинают покидать его, и
оно разваливается. (Abe, 1980.)
Мягкие ткани термиты, по-видимому,
предпочитают твердым (Wood, 1978);
важное значение имеет также стадия
разложения (рис. 2.2). Выделения грибов
могут либо привлекать, либо отпугивать
термитов в зависимости от их вида
(Sands, 1969); при этом грибы иногда
способны разрушать такие отпугивающие
насекомых вещества, как скипидар.
Привлекательность древесного метериала
для термитов зависит также от его
величины; например, в сухих лесах
Южной Австралии N. exitiosus пожирает
упавшие стволы и пни эвкалипта, а два
других вида-только тонкие ветки.
Большинство видов, питающихся
древесиной, не трогают живые деревья, а
многие явно предпочитают либо сухую
древесину (Calotermitidae и др.), либо
влажную (например, Termopsinae, сем.
Hodotermitidae).
Древесина-это в основном смесь
целлюлозы и лигнина, находящихся на
разных стадиях разложения.
Целлюлоза - полимер глюкозы,
а лигнин - полимер, состоящий из
фенилпропановых единиц, образующихся
из коричных спиртов. Соотношение
22 Г uiea 2
лигнин/целлюлоза варьирует у разных
видов в пределах от 0,4 до 0,8. Calotermes
flavicollis, принадлежащий
к примитивному семейству
Calotermitidae, переваривает 70-90% всей
целлюлозы, тогда как Nasutitermes
ephratae (сем. Termitidae) может
использовать ее более чем на 90%.
Лигнин переваривается гораздо хуже: не
более одной трети у Calotermes flavicollis
и около половины у Nasutitermes ephratae
(La Fage, Nutting, 1978; Lee, Wood, 1971;
Wood, 1978).
Представители подсемейства Termitidae
(сем. Macrotermitinae) устраивают
„сады“, в которых выращивают
базидиальный гриб Termitomyces.
По-видимому, нет сомнений в том, что
эти сады устраиваются на частично
переваренных экскрементах и что ни одно
одиночное насекомое не могло бы
создавать их. Показано (Josens, 1971а),
что пища (древесные опилки
с добавленной в качестве метки сажей)
проходит через кишечник
и откладывается термитами на
поверхность сада; за 5-8 недель меченый
субстрат опускается до основания сада,
где поедается рабочими особями.
Образующая сад масса содержит очень
мало глиноподобного материала,
находящегося в кишечнике рабочих
особей, и она не похожа на их обычные
экскременты. Симбиоз термитов
с базидиомицетом, который растет
в этой массе и разрушает здесь лигнин и
целлюлозу, дает возможность полнее
использовать волокнистые растительные
остатки, собранные рабочими. Гриб
Фото 1. Грибной сад, выращиваемый в зе-
мляном гнезде муравья-листореза Асготугтех
octo 'spinosus. «Сад» представляет собой губча-
тую массу, на которую сверху добавляется
новый субстрат, а муравьи объедают снизу на-
растающие плодовые тела гриба. [D. I. Strad-
ling.) (Здесь и далее в квадратных скобках ука-
концентрирует питательные вещества в
богатых белком клетках конидиеносцев,
хитиновые стенки которых термиты
легко переваривают-так же легко, как в
случае надобности они переваривают
кутикулу своих сотоварищей по гнезду,
если их окажется слишком много. Хотя
биохимическая сторона симбиоза
в деталях еще не вполне ясна, нет
сомнений в том, что гриб служит для
термитов полезной добавкой к их пище
(La Fage, Nutting, 1978; Rohrmann,
Rossman, 1980) (см. фото 1 и 2).
Mac rot ernes michaelseni в Кении собирает
вместо мертвой древесины траву,
особенно в середине сухого сезона, в
период роста половых особей. Термиты
М. bellicosus в саванновом редколесье в
Нигерии (Моква, 9° с. ш.) собирают
ежегодно 177 кг/га древесины и 64 кг/га
опавших листьев, что составляет
примерно 6,4% общего количества
лесного опада, образующегося за год.
Термиты в целом собирают 24% (Collins,
1981a,b), но у Macrotermitinae уровень
потребления пищи на единицу
собственного веса вообще выше, чем у
термитов из других групп; это,
несомненно, обусловлено тем, что их
„одомашненный" гриб в отличие от
„диких" микроорганизмов активен на
протяжении всего сухого сезона.
Некоторые Hodotermitidae срезают сухую
траву по ночам, выходя на поверхность,
или днем, прячась под почвой. Это
делают также представители двух
подсемейств Тermitidae - Тermitinae
и Nasutitermitinae. Hodotermes
mossambicus в Южной Африке
заны лица, любезно предоставившие фотогра-
фии для публикации в настоящей книге.}
Фото 2. Грибной сад термита Macrotermes
subhyalinus. «Сад» занимает одну из камер
гнезда, где он располагается на маленьких ко-
нических подпорках (см. также фото 16).
[J.P.E.C. Darlington.]
I ина 2
1 мм
Прямая кишка
Смешанный сегмент
Средняя кишка
Клапаны с шипиками
Мальпигиевы сосуды
Слепой вырост
Кутикулярные шипики
Рис. 2.3. Кишечный тракт термита Procubiter-
mes. Показаны огромные размеры и слож-
ность строения задней кишки, т. е. участка,
расположенного позади мальпигиевых сосу-
дов. (Bignell et al., 1980.)
предпочитает траву, а не кустарники, и
притом не свежую зеленую траву,
а сухую.
Trineriitermes geminatus предпочитает
злаки с нежными, а не грубыми листьями
и отказывается от Cymbopogon,
имеющего запах лимона; в Нигерии он
усиленно поедает Andropogon (Ohiagu,
Wood, 1976; Wood, 1978). T. trinervius
поедает 9 видов злаковых, но не трогает
растущие рядом бобовые; он срезает
мертвые растения, даже если они еще
зеленые, но в отличие от некоторых
других видов не делает запасов (Bodot,
1967). Вероятно, наиболее специали-
зированы в отношении питания термиты,
обитающие в индо-малайской области и
собирающие лишайники с верхушек
деревьев (Hospitalitermes) или же
поедающие картон, из которого
построены гнезда других термитов. Хотя
термиты в общем вегетарианцы, все они
поедают избыточных или раненых
собратьев по гнезду, возвращая таким
образом компоненты их тканей в общий
Пища 25
круговорот веществ.
Другая особенность питания,
неоднократно возникавшая в процессе
эволюции термитов,-это поедание
органического вещества (гумуса),
содержащегося в почве. Это свойственно
трем подсемействам Termitidae:
Termitinae, Apicotermitinae
и Nasutitermitinae. К числу
бактериальных симбионтов Termitinae,
питающихся гумусом, принадлежат
спирохеты и свободноживущие
актиномицеты. Нити последних
поддерживаются гибкими кутикулярными
шипами, имеющимися в задней кишке
(рис. 2.3), а в средней кишке они
обитают в жидкости, заполняющей
пространство за пределами
перитрофической мембраны, где обычно
находятся патогенные микроорганизмы
(Bignell et al., 1981). Актиномицеты,
живущие в почве, секретируют
фенолоксидазы, которые разрушают
древесинные компоненты гумуса,
и возможно, что кишечные актиномицеты
делают то же самое. Благодаря этим
симбионтам эффективность переработки
пищи у термитов достигает 54-93%, т. е.
очень высока по сравнению с 27% у
тараканов, 30-40% у двупарноногих
многоножек, 33% у равноногих раков или
14% у клещей (Wood, 1978).
2.2 Осы и муравьи
как хищники
Одиночные осы, принадлежащие как к
Sphecoidea, так и к Vespoidea,
парализуют свою жертву с помощью
жала, затаскивают ее в норку или в
ячейку, а затем откладывают на нее яйца.
У роющих ос наблюдается значительная
специализация в отношении жертвы: они
используют кузнечиков, пауков, гусениц и
личинок жуков, но каждый вид ос
специализируется на определенном виде
жертвы. Самые примитивные осы
(вероятные предки всех других)
объединены в надсемейство Scoliodea. К
этой группе, в которую входит семейство
Tiphiidae, принадлежит род Methocha;
личинки этих ос выкармливаются на
личинках жука-скакуна Cicindela. Оса
жалит личинку жука в шею и затаскивает
ее в норку, затем жалит ее еще раз и
откладывает одно яйцо, после чего
запечатывает норку (Wilson, Parish, 1973).
Такая пищевая специализация
сохранилась и у примитивных муравьев.
Например, Amblyopone pallipes (Ponerinae)
жалит многоножек, но не переносит их в
свое гнездо, а размещает вокруг них свой
расплод (Traniello, 1978). Drugie
Ponerinae (это в основном тропическое
подсемейство с 52 родами) тоже
специализированы для питания
определенной группой беспозвоночных
(Brown, 1973). В Ламто (Берег Слоновой
Кости, Западная Африка) пищевая
специализация сопровождается
распределением по вертикали. Platythyrea
питается на деревьях, главным образом
гусеницами совок (Noctuidae),
составляющими 71% поедаемых
насекомых; на поверхности почвы
Leptogenys поедает мокриц (Isopoda), а
Megaponera-термитов. В почве два вида
Amblyopone и один вид Аротугта
поедают губоногих (Geophilidae), два
вида Pletroctena-кивсяков (Julidae),
Нуроропега питается ногохвостками
(Collembola), Centromyrmex - термитами,
Paltothyreus - олигохетами,
a Discothyrea-яйцами разных
членистоногих. Кроме того,
представители по крайней мере девяти
родов муравьев поедают термитов
(Levieux, 1977), а одна из триб
Ponerinae - Cerapachyini - целиком
специализировалась на питании другими
муравьями. В пищу муравьев входят
лишь очень немногие слизни и улитки.
Megaponera foetens в районе Моквы
(Нигерия) во влажной саванне поедает
26 ! :
только термитов из подсемейства
Macrotermitinae; чаще всего это
Macrotermes bellicosus (72%)
и Odontotermes (22%). «Первый из этих
видов выедается так сильно, что
ежегодное обновление популяций
несколько превышает биомассу
популяций в каждый данный момент
времени» (Longhurst et al., 1978). Таким
образом, эти относительно примитивные
муравьи-хищники, истребляющие
широкий круг других членистоногих и
червей, в том числе общественных
термитов и муравьев. С развитием
общественного образа жизни у хищников
наблюдается также явная тенденция
выбирать более мелкую жертву, которую
можно одолеть без помощи жала, но
зато в большем числе. Это возможно в
тех группах, в которых особи
обмениваются между собой пищей.
i , 'iciiciBo Myrmicinae, включающее
примерно 130 родов и распространенное
по всему земному шару (Brown, 1973),
позволяет еще раз проиллюстрировать
эту тенденцию: одна из относящихся к
нему триб, Dacetini,1 специализируется на
поедании ногохвосток, а это довольно
мелкие насекомые, и для создания одной
новой особи муравья их требуется много.
1 Общие рассуждения автора в предыдущем аб-
заце справедливы, но Dacetini-вряд ли
удачный пример. По другим данным, у этих му-
равьев хорошо развито жало, семьи немного-
численны и обмен пищей практически отсут-
ствует ; большинство этих муравьев имеют
очень мелкие размеры (порядка 1-2 мм), впол-
не сравнимые с размерами ногохвосток, на ко-
торых они охотятся-Прим. ред.
Рабочие особи подкрадываются к своей
жертве, а когда оказываются на
расстоянии нескольких миллиметров от
нее, отводят усики назад и складывают
их за челюстями, которые широко
раздвигаются, схватывают жертву
и пронзают ее своими острыми зубцами
(Wilson, 1953). Другие Myrmicinae
специализируются на питании
термитами; например, муравьи рода
Carebara с очень мелкими рабочими
особями, длиной всего в несколько
миллиметров, фактически живут
в гнездах термитов. У видов этого рода
самка по объему в 2000 раз больше
рабочих (Wheeler, 1936); после копуляции
она перелетает в новый термитник,
перенося на своих ногах уцепившихся за
них рабочих особей.
Oi Ponerinae происходит обширное
подсемейство муравьев-кочевников
Dorylinae. Это гораздо менее
разнообразное подсемейство, чем два
рассмотренных выше; к нему относятся
только три рода, обитающие в Африке и
в индо-малайской области, и шесть
центральноамериканских родов (Brown,
1973; Wilson et al., 1967). Среди них есть
как высокоспециализированные, так
и неспециализированные хищники,
причем у последних общественная
организация достигает высочайшего
уровня. Род Aenictus содержит много
видов и распространен от Африки до
Новой Гвинеи1; большинство видов
1 Северная граница рода проходит через Арме-
нию, Иран и Афганистан-Прим. ред.
Фото 3. Ротовые части личинки Myrmica по-
следнего возраста (х 70). Вйдны (начиная
сверху по часовой стрелке): верхняя губа, за-
остренные мандибулы, максиллярные щупики
и нижняя губа. Ротовое отверстие расположе-
но между верхней губой и мандибулами, а
протоки слюнных желез открываются на ниж-
ней губе.
Фото 4. Ротовые части личинки Myrmica по-
следнего возраста (х 1750). Можно видеть
обломанный кончик одной мандибулы и ряды
эпикутикулярных «зубов», вероятно помогаю-
щих удерживать и заглатывать пищу. [Фото 3
и 4-С. Hawkins, Univ, of Southampton.]
2S l шва 2
охотятся-под землей и лишены зрения, но
некоторые, например A. gracilis и
A. laeviceps, охотятся на поверхности
земли. Установлено, что они поедают
муравьев по меньшей мере девяти видов, а
также многих других беспозвоночных, и их
считают хищниками, охотящимися на
муравьев вообще (Schneirla, 1971; Wilson,
1964). Эволюционно более продвинутые
представители этого подсемейства
охотятся на термитов под землей, как,
например, Апотта kohli', наивысшего
уровня организации достигли виды,
образующие огромные семьи со многими
миллионами полиморфных рабочих
особей, которые в период выкармливания
личинок заняты поисками жертв; таковы,
например, кочующие муравьи Апотта в
Африке и Eciton в Америке. Они
уничтожают множество различных
беспозвоночных, в том числе других
муравьев и ос, и могут даже нападать на
оцепеневших млекопитающих и поедать
их. Wilson (1971) высказал пред-
положение, что именно они изгнали
муравьев трибы Cerapachyini (Ponerinae)
отовсюду, кроме таких недоступных для
них мест, как Мадагаскар, острова
Фиджи и Австралия. Таким образом,
важным источником пищи для муравьев
служат не только термиты, но и другие
общественные насекомые.
2.3. Сахара как источник
энергии, уменьшающий
потребность
в животной пище
Многие осы охотятся на животных
только тогда, когда у них есть личинки,
поскольку трупы животных трудно
запасать впрок. Виды рода Vespula
Фото 5. Мандибулы рабочей особи Myrmica.
Эго молодая особь с острыми кутикулярными
зубцами, вцепившимися в частицу пищи
( х 70).
охотятся, летая около листвы и цветков и
схватывая самых разнообразных мелких
мягкотелых насекомых при помощи
одних только челюстей; осы посещают
также раскрывшиеся цветки, из которых
собирают сахара (Proctor, Yeo, 1973;
Spradbery, 1973а).
Крупные австралийские муравьи-
бульдоги (Myrmecia) охотятся
даже на таких насекомых, как пчелы,
убивают их с помощью жала, разрывают
на части и кладут около своих крупных
личинок, которые ими кормятся. После
того как личинки окуклились, взрослые
особи начинают кормиться сами,
высасывая сахаристые выделения
растений. В подсемействе Myrmicinae у
примитивных форм жало редуцировано,
а у эволюционно продвинутых -
видоизменено. Даже у примитив-
ных родов оно неспособно доста-
точно эффективно парализовать
жертву, поэтому для того, чтобы
схватить ее, раздавить, разорвать или
проткнуть дырки в ее кутикуле, обычно
используются челюсти; затем хищник
высасывает из жертвы соки. Эти муравьи
собирают также соки плодов и нектар,
извлекая энергию из содержащихся в них
сахаров; тем самым они экономят белки,
большую часть которых получают из
мертвых беспозвоночных, а не
в результате охоты. В лабораторных
условиях Myrmica вполне
довольствуются рационом, состоящим из
насекомых и воды, но если добавить к
этому раствор сахарозы, число
метаморфизирующих личинок
и откладываемых яиц возрастает.
Муравьи при этом даже поедают меньше
насекомых и выделяют прозрачную мочу
вместо беловатой с зернышками мочевой
Фото 6. Мандибулы старой рабочей особи
Myrmica. Зубцы изношены, а одни из них пол-
ностью обломан (х 70). [Фото 5 и 6-С. Haw-
kins, Univ, of Southampton.]
30 / лава 2
кислоты.. Очевидно, сахара стимулируют
активность рабочих особей
и используются ими в качестве источника
энергии, тогда как белки расходуются на
образование яиц и выкармливание
личинок (Brian, 1973а).
,Др\ I им обычным источником сахаров
служит падь, которую выделяют
различные насекомые, сосущие соки
растений; это главным образом
представители Aphidae, Coccidae
и Aleurodidae. Три вида Camponotus
(Formicinae), живущие на деревьях
в Восточной Африке, активно
используют для этого алейродид, а также
щитовок и тлей, реже-насекомых,
относящихся к трем другим группам
(Levieux, 1977). Эти муравьи собирают
камеди, выделяемые растениями,
и охотятся на личинок из семи
и взрослых особей из девяти отрядов
насекомых. Другая группа, Membracidae,
питающаяся в восточной части Северной
Америки на золотарнике, привлекает
муравьев нескольких разных видов.
Самый крупный из них-один из видов
Formica-уничтожает листоядных
насекомых, и если он присутствует в
данной местности большую часть года,
то это может способствовать росту
золотарника и образованию его семян
(Messina, 1981).
Тли выделяют через анальное отверстие
жидкий секрет, попадающий обычно на
листья, которые становятся липкими и
покрываются плесенью, если муравьи,
осы и пчелы не соберут этот секрет. Он
содержит не только растительный сок (за
вычетом того, что использовали для себя
тли), но также выделения самих тлей
(Way, 1963). Интересные данные были
получены недавно в опытах с тлей Myzus
persicae, которую культивировали на
редьке (Raphanus sativus), выращиваемой
в цветочных горшках. Эти растения
содержат глюкозу и фруктозу, а падь
содержала, кроме того, трегалозу,
мелецитозу и сахарозу; растения
содержат семь карбоновых кислот и пять
кислот-производных фенола, а в пади их
содержалось 8 и 18 соответственно.
Другие соединения-растительные
гормоны ауксин и гиббереллин, а также
цитокинины и ингибиторы роста-
попадают в падь из растения, но
аммиак добавляют в нее тли, что ведет к
повышению pH (Hussain et al., 1974).
Падь содержит от 9 до 23 аминокислот и
амидов, составляющих 2-3% ее сухого
вещества; как и следовало ожидать,
состав пади варьирует в зависимости от
вида как насекомого, так и растения, а
также от времени года (Auclair, 1963).
Падь содержит также небольшие
количества многих других веществ,
полученных от растения или
синтезированных тлей.
В умеренных областях осы и пчелы с
короткими хоботками регулярно
потребляют падь. Залетая на верхушки
деревьев в тех районах, где муравьев
мало, они могут без всякой конкуренции
собирать ее в больших количествах; это
особенно ценно для них в периоды, когда
подходящих распустившихся цветков
мало или они недостаточно активно
выделяют нектар вследствие засухи. Из
выделений растительноядных сосущих
насекомых получается очень хороший
мед.
Случайный сбор пади с листьев
в процессе эволюции перерос в прямую
связь донор-реципиент. В настоящее
время существуют тли, которые не
выделяют свой жидкий секрет до тех пор,
пока к ним не прикоснется муравей, а
после этого они сразу отдают его в виде
капельки, которая держится на волосках,
окружающих анальное отверстие. При
этом тли подавляют свои обычные
защитные реакции, такие как
выбрасывание клейкого вещества из
соковых трубочек. Поскольку муравьи
отпугивают хищников и паразитов
IlliUftJ 31
и часто строят укрытия от ветра и дождя,
кооперирующиеся с ними насекомые
имеют больше шансов выжить
и оставить потомство, чем другие. Даже
если их связь с муравьями носит еще
факультативный характер, популяции
этих насекомых получают от муравьев
заметную выгоду; Уэй (Way, 1963) в
своем обзоре отмечает, что тли, помимо
защиты, могут получать, возможно, еще
целый ряд прямых и косвенных
преимуществ: они поглощают больше
пищи и выделяют больше пади,
образуют более многочисленные
скопления, и плотность их популяций
повышается. Это оказывает
успокаивающее действие, в результате
которого число бродячих особей
снижается и каким-то еще не вполне
понятным образом появление крылатых
половых форм происходит позднее, чем
это было бы в обычных условиях при
данной плотности популяции. Быть
может, муравьи производят выбраковку
среди молодого потомства тлей?
Лесные муравьи (Formica rufa и близкие
виды) собирают огромные количества
пади с тлей, которые кормятся как на
лиственных, так и на хвойных деревьях в
лесах северной умеренной зоны. Большая
полигинная семья F. lugubris, живущая в
горах Юры (Швейцария/Франция),
охотится на насекомых, почти равных по
величине самим муравьям; среди их
жертв много сосущих насекомых. По
мнению Cherix (1980), муравьи
уничтожают так много насекомых, что
насекомоядные птицы не могут жить в
этих местах. Многие их жертвы
относятся к растительноядным сосущим
насекомым, но, кроме того, начиная с
июня лесные муравьи собирают также
падь у нескольких видов тлей, особенно у
Cinara pruinosa, которая кормится на
пихте (Picea abies). Позднее Cinara тоже
становится жертвой муравьев; Cherix
(1980) описывает свои наблюдения над
рабочими особями муравьев, напавшими
на тлей, которые покинули свою группу и
производили необычные движения; были
ли они заражены паразитами или же
просто одряхлели? Ясно, что граница
между защитой и хищничеством весьма
зыбкая.
Биология питания лесных муравьев
усиленно изучается ввиду потенциальной
возможности использовать их для
биологической борьбы с гусеницами,
поедающими листву; натуралисты
указывают на зеленые островки деревьев
с пышной листвой вблизи гнезд лесных
муравьев. Formica rufa у северной
границы своего ареала на Британских
островах вылавливают весной тлей
Drepanosiphwn platanoides, причем пик
уничтожения тлей совпадает с пиком их
численности. Муравей никогда не
заботится об этих тлях. К числу его
жертв относятся также многие
двукрылые, в том числе толстоножка
(Bibio), и гусеницы, главным образом
гусеницы зимней пяденицы (Operophtera
brummata), которых он собирает
с дубовых деревьев (Quercus), особенно в
мае (Skinner, 1980b). Падь этот муравей
берет от другой тли-Periphyllus
testudinaceous-на платанах
(Pseudoplatanus sp.); ее сбором занимается
более 60% сборщиков, и она обеспечивает
больше половины всего энергетического
материала. Этот муравей хватает всех
мелких насекомых, обитающих на земле
и на деревьях, если их много и их
нетрудно ловить. Интересным примером
служит объедающая листву гусеница
зеленой дубовой листовертки (Tortrix
viridana): хотя, по данным Иноземцева
(1974), муравьи сократили численность
популяции листовертки на одну треть,
Скиннер сообщает, что они уничтожили
меньше особей, чем можно было
ожидать, но указывает на то, что учет
мог быть неточным, поскольку муравьи,
возможно, разрывают гусеницу на части,
а затем заглатывают ее прямо на месте.
Если с помощью липких лент преградить
муравьям доступ к Drepanosiphum
platanoides, то численность тлей
возрастает (Skinner, Whittaker, 1981).
Муравьи снижают также численность
популяции гусеницы, особенно на нижних
ветках; по имеющимся оценкам, на тех
деревьях, где охотятся муравьи, площадь
листвы, съеденной гусеницами,
составляет лишь 1,2%, а на деревьях, где
муравьев нет,-8,5%. Таким образом,
Formica rufa уменьшает вред, наносимый
гусеницами листьям, и несколько снижает
численность популяций некоторых тлей,
но общая численность тлей-главных
продуцентов пади-возрастает
и количество производимой пади
довольно значительно (3,5 107 Дж на
одно дерево). Соотношение ущерба и
выгоды для дерева вычислить очень
трудно (см. также Wellenstein, 1980).
Хороший пример сложности
взаимоотношений в системах
„муравей - тля-дефолиатор-дерево44
рассмотрен в работе (Laine, Niemela,
1980), проведенной в северной Финляндии
(70° с. ш.) на Formica aquilonia (лесном
муравье, обитающем на севере Европы),
березе пушистой (Betula pubescens)
и поедающей ее листву гусенице Oporima
autumnata. Этот муравей стабилизирует
плотность своей популяции в лесах на
высоте ниже 240 м на уровне примерно 5
гнезд на гектар, используя кормящуюся
на березе тлю, выделяющую падь. Он
способен при этом нападать на гусениц
Oporima, когда они появляются,
и препятствовать нанесению большого
вреда березам. Однако муравьи
действуют наиболее активно вблизи
своих гнезд; например, в один обычный
год повреждение листьев упало с 67 до
43% в 40 м от гнезда, а в год „взрыва44
численности гусениц муравьи смогли
предотвратить серьезную дефолиацию
лишь вокруг своего муравейника, где
сохранился „зелёный остров44. Таким
образом, березы, которые дают приют
тлям, снабжающим муравьев пищей, и
сбрасывают веточки, пригодные для
постройки муравьиного гнезда, имеют
больше шансов на процветание, чем те,
которые этого не делают; но если они
разрастутся чересчур пышно, то они
могут затенить муравейник, что заставит
муравьев уйти,- значит, вся эта система
находится в состоянии очень тонкого
метастабильного равновесия (Wielgolaski,
1975).
Неко юрые лесные муравьи, охотятся на
одних тлей, а падь берут у других, а
некоторые используют один и тот же вид
тлей в обеих целях, но в разное время
года. Обитающий на деревьях
тропический муравей-портной Oecophylla
longinoda (Formicinae)-жестокий хищник,
но он выращивает несколько видов
насекомых. Одно из них-щитовку
Saissetia zanzibarensis (Coccidae) - он
защищает, обращается с ним мягко и
собирает его падь; но как только рабочие
насытятся сахаристой жидкостью, они
становятся более агрессивными, убивают
щитовок, поедают их сами ради белка и
скармливают своим личинкам. Уэй (Way,
1954, 1963) обнаружил, что между
популяциями щитовок и муравьев
существует приблизительное равновесие.
В Европе другой муравей, Lasius flavus,
живет почти постоянно под землей,
образуя облигатные ассоциации со
многими видами корневых тлей. Эти тли
могут обходиться без крылатых половых
форм, так как муравьи не только
защищают их, но и расселяют; муравьи
даже собирают и прячут яйца тлей, а
молодых особей переносят на листья
кормовых растений. В одном сообществе,
которое изучал Pontin (1978), семь видов
тлей жили под землей на корнях
различных злаков. Этот автор установил
существование стабильной зависимости
хищник-жертва, выражающейся в том,
Нища 33
что часть молодых тлей первой
возрастной стадии муравьи скармливают
своим личинкам; он вычислил, что одна
семья Lasius flavus, занимающая 5-7 м2
луговины, может существовать и расти
благодаря одной только этой
мутуалистической зависимости, хотя
муравьи, несомненно, поедают и других
почвенных насекомых.
При изучении сообщества муравьев в
западной части Шотландии, в которое
входило 6 видов, Muir (1959) обнаружил,
что они связаны с 14 видами тлей,
кормящихся на 21 виде травянистых
растений. Большая часть этих
тлей-облигатные сожители муравьев
(мирмекофилы), принадлежащие к трем
видам-полифагам. Например, Forda
formicaria, которую выращивают муравьи
пяти видов, кормится под землей на 12
видах растений (девять из них-злаки);
Tetraneura ultni, которую выращивают
муравьи пяти видов, кормится под
землей на 9 видах растений (все
они-злаки). Все три мирмекофила
предпочитают и чаще всего поедают
Agrostis alba, A. tenuis и Festuca rubra. Тем
не менее муравьи используют
дополнительно и ряд других видов тлей,
кормящихся на различных растениях над
землей и под землей. Уэй (Way, 1963)
приводит и много других примеров
ассоциаций муравьев с сосущими
насекомыми.
Примере лесными муравьями позволяет
думать, что присутствие муравьев может
оказаться довольно выгодным для
деревьев, что они могут даже приютить
больше тлей, выделяющих падь, чем
других тлей. Существует, однако, более
прямой способ обеспечить это,
зависящий от самого дерева: надо, чтобы
нектарники, находящиеся на тех частях
побега, которые нуждаются в защите,
были активны только в период, когда эта
защита необходима.
У североамериканской поздней черемухи
(Prunus serotina) на молодых листьях есть
нектарники, выделяющие нектар
в течение примерно трех недель сразу
после раскрытия почек, и именно в это
время вылупляются питающиеся
листьями гусеницы рода Malacosoma.
Муравей Formica obscuripes (из группы
лесных муравьев) посещает эти
нектарники и, встретив там маленькую
гусеницу, утаскивает ее в свое гнездо;
более крупным гусеницам удается
избежать этого. Tilman (1978) сумел
показать, что этот муравей может так
сильно понизить численность гусениц
Malacosoma первых возрастов, что
впоследствии больших гусениц окажется
недостаточно для серьезной дефолиации.
Другие примеры можно найти у Bentley
(1977).
Многолетний подсолнечник Helianthella
quinquenensis (Asteraceae) растет на
высотах свыше 2500 м в Скалистых
горах; его нектарники, расположенные по
краям прицветников соцветия, выделяют
секрет, не только богатый сахарозой, но
и содержащий 19 аминокислот
в концентрации, в 16 раз более высокой,
чем в нектарниках цветков. Это
привлекает к каждому соцветию до 40
различных видов муравьев, главным
образом опять-таки Formica obscuripes.
Они приходят из своих гнезд,
находящихся в почве, и собирают нектар
из прицветников, оставляя нектар
цветков шмелям, опыляющим эти
растения. Было показано (Inouye, Taylor,
1979), что на высотах свыше 3000 м
муравьи отпугивают насекомых,
пытающихся отложить яйца в цветки и
тем самым воспрепятствовать
завязыванию семян (рис. 2.4). Так как
другие растения того же семейства
используют для защиты от насекомых
системные репелленты, возникает вопрос
(на который пока нет ответа): какой из
этих двух способов легче может
выработаться в процессе эволюции, более
34
Г. шва 2
Рис. 2.4. Зависимость
между числом муравьев,
находящихся днем на
одном соцветии НеНап-
thella, и процентом по-
врежденных семян.
(Inouye, Taylor, 1979.)
эффективен и требует меньших затрат?
Тропическое растение Costus woodsonii
секретирует из прицветников нектар,
богатый сахарами и аминокислотами.
Доминируют на нем, сменяя друг друга в
зависимости от времени года, два вида
муравьев: Camponotus platanus
(Formicinae) и Wasmannia auropunctata
(Myrmicinae)-первый в засушливый
период, а второй в период дождей
(рис. 2.5). Schemske (1980) показал, что
они защищают плоды от мухи, которая
откладывает яйца под прицветники, так
что ее личинки уничтожают семена и
присеменники. Camponotus прогоняет
самок, откладывающих яйца, а более
мелкие Wasmannia пролезают между
прицветниками и поедают личинок.
Семена распространяют птицы, если
только маслянистые присеменники не
были уничтожены (без них семена не
созревают). Schemske указывает, что вид
W. auropunctata-широко распростра-
ненный в тропиках вид, лишь
недавно проникший в нарушенные
тропические местообитания, и что вряд
ли он мог играть какую-то роль
в эволюции нынешней ассоциации
муравей-растение. Хотя экстра-
флоральным нектарникам удается
избежать посягательств насекомых,
высасывающих растительные соки, эта
система привлечения на помощь
муравьев может иметь успех лишь при
достаточном числе муравьиных гнезд в
непосредственной близости от деревьев.
У некоторых тропических деревьев
способы привлечения муравьев достигли
своего логического завершения: у них
имеются не только экстрафлоральные
нектарники, содержащие сахара, но и
подходящие места для устройства
муравьиных гнезд и даже твердый
белковый и жировой корм. Многие виды
Acacia (Papilionaceae) привлекают
муравьев с помощью нектарников,
расположенных на стеблях, но некоторые
виды предоставляют им также твердый
Пища 35
Рис. 2.5. Число соцветий на тропическом рас-
тении Costus woodsonii в разное время года и
частота нахождения на них двух видов му-
равьев -Camponotus platanus и Wasmannia auro-
punctata. (Schemske, 1980.)
корм, богатый белками и жирами, в виде
„пищевых телец" (тельца Бельта),
находящихся на кончиках листочков; они
обеспечивают муравьям свыше 90%
твердого корма. У этих видов Acacia
стеблевые нектарники в изобилии
выделяют нектар и могут продуцировать
до 40 г глюкозы и фруктозы в день.
Кроме того, полости в специализи-
рованных вздутых колючках служат
местами для устройства гнезд, и в них
живет один из видов Pseudomyrmex
(Pseudomyrmecinae). У этих муравьев
крепкие жала, и они кусают, жалят и
убивают насекомых-фитофагов,
прилетающих на растение; некоторых
они затем съедают, а других просто
бросают. Создается впечатление, что
муравьи относятся к такому
„гнездовому" дереву как к своей
территории и поэтому защищают его
более эффективно. Они не только
нападают на млекопитающих, но
и очищают от травы некоторый участок
вокруг дерева и уничтожают тянущиеся к
нему ветви других деревьев. Эта защита
от других растений предоставляет,
конечно, дереву больше места и, кроме
того, препятствует распространению огня
(Jansen, 1966). Защитники деревьев есть и
в другом подсемействе муравьев-
Dolichoderinae: виды Azteca живут
на деревьях рода Cecropia, которые
предоставляют им пищу и жилье,
а волоски, имеющиеся у основания
каждого черешка, содержат помимо
прочих питательных веществ гликоген
(Stradiing, 1978b; Wheeler, 1942).
Эти последние примеры демонстрируют
высшую ступень мутуалистических
взаимоотношений между муравьями и
растениями: обеспечивая дереву защиту,
муравьи в свою очередь получают
36 / ia«a 2
территорию, удовлетворяющую все их
потребности в пространстве и пище. В
последующих разделах будут описаны
менее тесные отношения, существующие
между муравьями и семенами или
зелеными листьями и между пчелами или
осами и пыльцой.
2.4. Потребители семян
(карпофаги)
Муравьи Myrmicinae часто в добавление
к животной пище потребляют семена.
Даже представители рода Brachyponera
(Ponerinae)-обитатели саванн
и в основном хищники-в период засухи
собирают и запасают семена; многие из
этих семян остаются несъеденными, и это
способствует расселению
соответствующих растений (Levieux,
Diomande, 1978b). Пищевой рацион
Atopomyrmex (Myrmicinae), живущего в
засушливых районах эфиопской области,
состоит на 48% из животных и на 28% из
семян и пади, выделяемой алейродидами;
четвертую часть животной пищи
составляют щитовки (Levieux, 1976).
Семена заменяют животную пищу и у
Tetramorium caespitum в областях
с умеренно теплым климатом. Рабочие
особи собирают с земли или прямо из
коробочек по одному мелкие семена
вереска (Calluna vulgaris) и переносят их в
верхние галереи своих гнезд, прежде чем
раздробить их и съесть. Эти муравьи
предпочитают семена Calluna более
крупным семенам Erica cinerea, хотя
биомасса последних вдвое больше (Brian
et al., 1965, 1967); они собирают также
семена злаков и хранят их до весны, а
весной вырезают из семян зародыши и
скармливают их своим личинкам.
Несомненно, эта пища представляет
собой ценный источник жира и белка и
служит основной диетой для полового
потомства, которому предстоит вылететь
в июне. Два вида Novomessor, которых
изучали в пустыне Чиуауа в Северной
Америке,-факультативные карпофаги и
хищники (Whitford et al., 1980), тогда как
два вида Pogonomyrmex в Калифорнии
(рис. 2.6) резко различаются между
собой: обитатель горных районов
Р. montanus приносит в гнездо цветки,
листья, смолу, насекомых,
весной - экскременты позвоночных,
а живущий на равнинах Р. rugosus
круглый год собирает почти одни лишь
семена, причем главным образом семена
Erodiutn cicutarium (MacKay, 1981).
( смена, конечно, не только богаты
питательными веществами,
необходимыми зародышу растения,
а значит, ценными и для муравьев, но к
тому же идеально приспособлены для
запасания: в сухом темном месте они
1 могут храниться годами. В трибу
Myrmicini входит много
высокоспециализированных карпофагов
(муравьев-жнецов), таких как Messor в
Евразии и Африке и Veromessor
в Америке. На юго-западе Франции виды
Messor предпочитают собирать семена, а
не охотиться, к охоте же прибегают
только при недостатке пищи; они
собирают и поедают даже зеленые
незрелые семена. М. structor потребляет
семена злаков (особенно Роа annua) еще в
мае, а М. capitatus-семена Helianthemum.
Незрелые семена не могут храниться и
должны быть съедены сразу, но позднее,
когда семена созревают, муравьи сначала
складывают их у входа в гнездо, а затем
переносят в специальные
зернохранилища. Сохранность запасов
обеспечивается тем, что муравьи
выбирают для постройки гнезд места с
хорошо дренируемой почвой, устраивают
большие, хорошо проветриваемые
камеры, собирают семена в сухую
погоду, а влажные семена сначала сушат
на солнце; все семена, начинающие
прорастать, отбрасываются (Delage,
1968). Муравьи предпочитают выедать
Нищи 37
Рис. 2.6. Состав пищи американских муравь-
ев-жнецов Pogonomyrmex. А. Р. montanus. Б.
P.rugosus. (MacKay, 1981.)
зародыши растений, хотя это и не
обязательный элемент процесса
запасания. Messor galla в африканской
саванне в засушливый период собирает
семена различных злаков, а в период
дождей, вместо того чтобы охотиться на
насекомых, собирает семена других
растений, например Evolvulus
(Convolvulaceae): рабочие залезают на
стебель и срезают цветоножки, получая в
результате каждой такой операции до
1455 семян. Этот вид иногда поедает
термитов (Levieux, Diomande, 1978а).
Муравьи Messor arenarius питаются
главным образом злаком Aristida pungens,
весьма обычным в местах расположения
их гнезд. Взбираясь вверх по стеблю, они
срезают соцветия сначала у ближайших
растений, но затем отходят на расстояние
примерно до 20 м; срезанные соцветия
муравьи складывают в кучки на земле. В
мае они собирают зерна с поверхности
земли, из углублений, куда их сносит
ветром. Этот вид поедает также
насекомых, главным образом термитов,
и трупы мелких животных.
Нища муравьев Veromessor pergandei в
Калифорнийской пустыне (Tevis, 1958) на
93% состоит из семян, принадлежащих
более чем 12 видам растений. Муравьи
разгрызают коробочки, когда семена еще
не созрели, и лишь позднее собирают
выпавшие семена с земли. Если семян
много, они отдают предпочтение
семенам Oenothera, Malvastrum
и Mentzelia-, последние настолько
привлекают муравьев, что те
выстраиваются у коробочек в очередь.
После продолжительной засухи
V. pergandei готовы собирать семена
Pectocarya и Plantago, а также
всевозможные несъедобные объекты.
Семена и мякина беспорядочно
сваливаются в поверхностных камерах
для последующей очистки; затем
муравьи переносят семена в нижние
галереи, а мякину выбрасывают.
Благодаря этому V. pergandei могут
просуществовать несколько лет, даже
38 Г.шва 2
если однолетние растения не прорастают
из-за слишком сухой погоды. Так как
муравьи собирают и поедают
значительную часть семян, то возникает
вопрос: в какой мере мутуалистичны их
взаимоотношения с растениями? Имеет
ли смысл для растения жертвовать
какой-то долей семян ради того, чтобы
увеличить распространение остальных
семян?
Один из способов выяснить это состоит в
том, чтобы поместить семя в ткань
какого-либо плода, который едят
муравьи и осы, или приклеить к нему
присеменник, содержащий
привлекательные для насекомых жиры.
Хотя обитающий в областях с более
умеренным климатом муравей Myrmica
не потребляет жиров, других
представителей того же подсемейства они
привлекают. Например, огненный
муравей (Soleriopsis invicta), теперь
обитающий в Северной Америке от
Южной Каролины до Техаса, хотя он в
основном ест различных мелких
беспозвоночных, охотно поедает соевое
масло, а также углеводы или белок
соевых бобов (Glunn et al., 1981); более
того, он, подобно Tetramorium caespitum,
использует жиры, запасенные в зобу
маток, для снабжения энергией новых
семей; эти жиры постепенно переходят в
фарингеальную железу и перевариваются,
так как это не слюнная железа, а, в
сущности, один из слепых выростов
кишечника (Vinson et al., 1980). Две
растворенные в этих жирах
кислоты - линолейая и линоленовая-
играют роль вкусовых добавок
(Lofgren et al., 1975).
Lasius alienus (Formicinae)-хороший
пример муравьев, которые собирают
семена, но не поедают их: они
перетаскивают семена карликового
утесника (Ulex minor) в свое гнездо, но
только удаляют с них присеменник. Эти
муравьи строят гнезда на открытых
местах между кустами и непрерывно
выбрасывают наверх землю, так что
засыпанные ею семена успешно
закрепляются в идеальном
местообитании, свободном от
конкуренции, где они не могут быть
съедены позвоночными; кроме того, под
землей они защищены от огня. На
зрелых растениях Ulex муравьи
устраивают земляные навесы, под
которыми живут тли Aphis ulicis,
снабжающие муравьев падью,
а возможно, также и твердой белковой
пищей. Вот почему эта троица-муравей,
растение и тля-так тесно связаны между
собой в своем распространении на
вересковых пустошах (Brian et al., 1976).
Аналогичные взаимоотношения между
растениями и муравьями широко
распространены в сухих скрэбах
в Австралии; по оценке Berg (1975),
полторы тысячи видов растений,
принадлежащих к 24 семействам,
используют муравьев для того, чтобы
они зарывали или сажали в землю их
семена. Большая часть этих
растений-кустарники, произрастающие в
сухих местах; семена сначала
выстреливаются растением на землю, а
затем муравьи собирают их, уносят в
свои гнезда и поедают присеменники.
В О1личис от Австралии в других частях
земного шара известно лишь около 300
видов растений, связанных таким
образом с муравьями. Это главным
образом травы, растущие во влажных
лесах умеренного пояса. Их плоды
открываются с нижней стороны, и семена
с мягкими спадающимися
присеменниками высыпаются, а не
выстреливаются. Превосходным
примером служит осока Carex pedunculata
(Сурегасеае); ее семена снабжены
присеменниками, богатыми жирами, ради
которых муравьи и собирают их. После
того как присеменник съеден, муравьи
либо выбрасывают семена, либо просто
Пища 39
"Ранг" вида
до 12 м, особенно в стабильных
местообитаниях. Дальность переноса
зависит от величины муравья; например,
Camponotus pennsylvanicus длиной 9,3 мм
уносит семена гораздо дальше, чем Lasius
alienus длиной всего 3,0 мм (Pudlo et al.,
1980).
Виды Viola рассеивают свои семена,
выстреливая их, а семена шести видов
распространяются муравьями, главным
образом видами Aphaenogaster -, в этом
случае муравьи тоже приносят семена в
свое гнездо и поедают присеменники.
Главная выгода для растения состоит,
по-видимому, в том, что если семена
закопаны в землю, то птицы и мыши
уничтожают их в меньшем количестве, а
так как муравьи иногда переносят свои
гнезда на новые места (Culver, Beattie,
1978), то вполне возможно, что они
помогают растениям Viola закрепиться в
подходящих местообитаниях.
В цен ipe других, еще более сложных
взаимоотношений стоит
высокоспециализированный муравей
Crematogaster longispina (Myrmicinae)
Рис. 2.7. Распределение видов растений, рас-
пространяемых (/) и ие распространяемых (II)
муравьями. (Handel et al., 1981.)
оставляют их в гнезде, которое часто
бывает построено в гниющих древесных
стволах, лежащих в лесу. Такие семена
сразу прорастают, что с самого начала
дает им возможность обогнать
в развитии другие родственные виды,
семена которых зимуют в состоянии
покоя; однако позднее эти последние
восполняют свое отставание, так как
обладают некоторыми преимуществами в
конкуренции (Handel, 1976, 1978). Таким
образом, муравьи, особенно
Aphaenogaster rudis, который в Америке
обычен в подстилке в лесах умеренного
пояса, переносят семена Carex pedunculata
на новые подходящие места, переходя от
гнезда к гнезду; муравьи распространяют
13 из 45 видов трав (рис. 2.7; Handel et
al., 1981). В Северной Америке муравьи
переносят также семена Sanguinaria
canadensis (Papaveraceae) на расстояния
40 Г. шва 2
длиной всего лишь 2-3 мм,
устраивающий гнезда из волокнистого
картона на эпифитном вьющемся
растении Codonanthe crassifolia
(Geraniaceae) во влажных низинных лесах
и на плантациях Коста-Рики. Это
растение цветет круглый год, и его
флоральные нектарники после
завязывания семян заменяются
экстрафлоральными, расположенными у
основания плода; на этом растении
живут также сосущие насекомые, над
которыми муравьи строят картонные
навесы. Муравьи поедают мякоть плодов
и присеменник, оставляя нетронутыми
семена, которые они каким-то образом
прикрепляют к картону или заделывают
в него. Поскольку муравей поедает трупы
насекомых и обильно испражняется, он,
несомненно, снабжает питательными
веществами и растение, у которого от
каждого междоузлия отходят корешки.
Эта многосторонняя микросистема не
является облигатной, так как муравьи
Azteca, принадлежащие к другому
подсемейству (Dolichoderinae), могут
играть ту же роль, что и Crematogaster
(Kleinfeldt, 1978).
Поскольку создается впечатление, что
муравей „высаживает** семена растений,
то можно задать вопрос: не занимаются
ли зерноядные муравьи в засушливых
местообитаниях „садоводством**? Можно
ли считать, что такие муравьи, как
Messor, сажают растения возле своих
гнезд, когда они выносят прорастающие
семена и набрасывают на них
всевозможные остатки? Существуют ли
муравьи, которые в самом деле роют
ямки или разрыхляют землю, прежде чем
поместить в них семена? Несомненно,
многие семена прорастают
и благополучно образуют новые растения
вблизи от гнезд, тогда как вокруг царит
пустыня (Hermann, Leese, 1956). Быть
может, растения обосновываются
в гнезде и вынуждают муравьев
переселяться? Такие взаимоотношения,
очевидно, дают возможность паре
растение-муравей проникать даже
в очень засушливые местообитания.
2.5. Муравьи-листорезы
Другие муравьи подсемейства Myrmicinae
подошли к садоводству по-иному. Они
выращивают грибы на растительном
субстрате и поедают нарастающие
зачатки их плодовых тел, богатые
питательными веществами (см. фото 1).
Все эти муравьи близко родственны друг
другу и образуют одну трибу, Attini,
которая распространена только в Новом
Свете, между 44° ю. ш. и 40°с. ш. (Weber,
1972). Самые ранние формы, вероятно,
питались дрожжами, которых они
подкармливали экскрементами гусениц;
Cyphomyrmex- маленький муравей,
образующий небольшие семьи,-делает
это до сих пор. Позднее место дрожжей
заняли биохимически более ценные
мицелиальные грибы, и муравьи начали
собирать растительные остатки, листья и
цветки, которые эти грибы
перерабатывают; в наше время
Trachymyrmex smithi собирает листочки
эфедры (Prosopis) в пустыне Чиуауа,
цветки Nama и семена бобовых растений;
в более позднее время года он использует
почки Eriogonum trichopes (Schumacher,
Whitford, 1974). Эволюционно наиболее
продвинутый род-4/nz Количество
рабочих особей разной величины
в каждой семье этого муравья
исчисляется миллионами, а различные
виды распространены от зоны пустынь
до влажных тропических лесов. Муравьи
Atta кормят выращиваемый ими гриб,
специально срезая для него свежие
листья, цветки и плоды, а также
используя другие растительные
материалы; предполагается, что это
базидиомицет, сходный с тем, который
выращивают термиты (R. J. Powell,
Пища 41
личное сообщение). Этот гриб образует
„стафилы", представляющие собой
скопления питательных веществ.
Koi да в гнездо поступают свежие листья,
рабочие сначала перетирают
и разжевывают их, чтобы удалить
покрывающий их слой воска (который
обладает антибиотическими свойствами),
что позволяет гифам гриба прорастать в
полученную массу; одновременно
рабочие извлекают из листьев жиры,
служащие источником энергии для них
самих (Peregrine, Mudd, 1974). К этому
субстрату рабочие добавляют свои
экскременты, которые содержат
азотистые отходы метаболизма и, как
это ни удивительно, некоторые ферменты
гриба-протеиназу и хитиназу, которые
вместе с целлюлазой гриба способны
разлагать пектин, белок, целлюлозу,
крахмал, ксилан, хитин и сложные эфиры
(Boyd, Martin, 1975; Martin et al., 1975;
обе эти работы цит. по Stradling, 1978b).
Рабочие могут собирать слюну личинок,
богатую протеиназой, и также снабжать
ею гриб. Так или иначе, образуемые
грибом стафилы пережевываются
рабочими, которые извлекают из них сок,
содержащий углеводы, главным образом
трегалозу и маннитол (полисахаридов в
нем не обнаружено). Сам по себе этот
сок недостаточно богат энергией, но
служит добавкой к жирам, которые
рабочие выдавливают из свежих листьев
(Quinlan, Cherrett, 1979). Остаток,
содержащий белки и аминокислоты,
получают личинки, для которых он
служит хорошей и достаточной пищей
(Martin et al., 1969). Грибные сады Attini
подвержены заражению „сорными"
грибами и бактериями; для борьбы с
ними рабочие регулярно вылизывают все
поверхности гнездовой камеры,
а возможно, также выделяют из своих
метаплевральных желез такие
антибиотические вещества, как
фенилуксусная кислота и (3-оксидекановая
кислота. Они выделяют, кроме того,
гетероауксин, способствующий росту
гриба.
Самое резкое различие - помимо типа
выращиваемого гриба-между Attini
и Macrotermitinae состоит в том, что
первые используют свежие, нередко
зеленые, растительные ткани,
а вторые-сухие, мертвые, деревянистые
или волокнистые ткани. Живое растение
богаче белками и минеральными
веществами, чем мертвые ткани,
используемые термитами: сухие листья
березы содержат только 35% белка, 53%
фосфора и 44% калия, имеющихся
в свежих зеленых листьях (ссылки на
литературу см. у Quinlan, Cherrett, 1979);
соответствующие цифры для дубовых
листьев-31, 75 и 78%. Гриб,
культивируемый термитами, разрушает
лигнин и освобождает связанную
целлюлозу, которую он переваривает и
превращает в различные сахара, быть
может синтезируя затем из них гликоген.
Гриб, выращиваемый муравьями,
переваривает белок, содержащийся
в свежей, освобожденной от жиров
листовой пульпе, а затем муравьи
объедают нарастающие плодовые тела
этих грибов, получая из них углеводы и
белки, которые перевариваются гораздо
легче, чем исходные вещества, особенно
их основными потребителями-
личинками. По-видимому, у муравьев
гораздо большую роль играет обмен
ферментами, но это еще твердо не
установлено.
Сырье для устройства грибных камер
муравьи сначала собирают беспорядочно,
срезая по листку то здесь, то там, но
после того, как они облюбуют себе
определенное место, кусты и деревья
вскоре совершенно оголяются. Atta
cephalotes в дождевом лесу Гайаны
собирает листья с деревьев 61 вида, но
предпочитает Terminalia amazonica (11%)
и Emmotum fagifolium (10%), избегая
42 Глава 2
объедать самое распространенное
местное дерево Marlierea montana
(Cherrett, 1968, 1972). Высказывалось
мнение, что деревья защищают себя от
нападения муравьев-листорезов при
помощи таннинов, содержащихся
в старых листьях (Rockwood, 1976), или
клейкого латекса (Stradling, 1978b). Тем
не менее A.mexicana в пустыне Сонора
срезает листья и цветки с креозотового
куста {Larrea tridentata) -, насекомые
обычно избегают кормиться на этом
растении с резким запахом, и если
муравьи его используют, то, по-види-
мому, их симбионты-грибы быстро
разрушают креозот (Mintzer, 1979).
2.6. Потребители пыльцы
Помимо семян и зеленых листьев
растения образуют пыльцу.
Первоначально пыльца, вероятно,
переносилась с одного растения на
другое ветром, но, находясь на „цветке",
она неизбежно привлекала
разнообразных насекомых, так как
представляла собой ценную пищу. Быть
может, растение впервые начало
секретировать нектар, чтобы привлекать
предковые формы ос, которые были
хищниками и поэтому очищали цветки от
их врагов; позднее сами осы могли
начать поедать пыльцу. Некоторые
Пища 43
Рис. 2.9. Цветки и нектарники Impatiens glan-
dulifera (А и Б) и Lamium album (В и Г). Спра-
ва нектарники изображены в разрезе, чтобы
показать обычное местонахождение нектара.
(Corbet et al., 1979.)
Vespoidea (например, Masaridae) все еще
собирают пыльцу ртом и отрыгивают ее
в ячейки с расплодом; так же ведут себя
некоторые Sphecoidea, с которыми
современные пчелы находятся в близком
родстве (Малышев, 1966; Michener, 1974).
Растения в свою очередь переключились
на опыление животными (мухами,
жуками, бабочками, птицами и др.), и
многие из них стали на путь коэволюции
с пчелами. Еще в то время, когда пчелы
были одиночными, у них появились
волоски, дающие им возможность
44 /. шва 2
удерживать на себе пыльцевые зерна, а
их поведение, связанное с обычной
чисткой тела, превратилось в перенос
пыльцы в особые корзиночки,
расположенные на нижней поверхности
брюшка или на ногах (Jander, 1976). Это
позволяло им выкармливать личинок
комочками, состоящими из пыльцы и
нектара. Цветки в процессе эволюции
приобретали аромат и окраску,
помогающие пчелам узнавать их,
а форма цветков из радиально-
симметричной стала двусторонне-
симметричной, что соответствует
строению тела пчелы и дает ей
возможность так подлетать к цветку,
чтобы пыльца высыпалась на те части
тела, на которых она быстро
переносится, не теряя свежести, на
рыльце другого растения (рис. 2.8).
Ротовые части пчел вытянулись
и образовали хоботок, а венчик цветка
приобрел трубчатую форму; таким
образом, длинные хоботки пчел
и удлиненные трубочки венчиков
развивались одновременно (Free, 1970;
Percival, 1965). Такое изменение формы
цветка не только предотвращает
посещение его мухами и пчелами
с коротким хоботком, но и обеспечивает
более постоянный запас нектара и менее
изменчивую его концентрацию. Оно
защищает цветок от дождя и солнечного
света и препятствует чрезмерному
испарению влаги, которое может
происходить даже при весьма высокой
влажности воздуха. Испарение могут
также уменьшить волоски, сужающие зев
венчика (рис. 2.9), липидные
мономолекулярные пленки
и содержащиеся в них химические
добавки (Corbet et al., 1979).
Пыльца-превосходная пища для
растущего организма, она содержит
7-30% белка со всеми необходимыми
аминокислотами, все нужные витамины и
холестерин (Herbert et al., 1980), а также
вкусовую добавку-ненасыщенный
С18-алкан (Johansson, Johansson, 1977).
Нектар из флоральных нектарников
представляет собой раствор сахарозы с ее
двумя гексозами-глюкозой и фруктозой;
он содержит также много разных
аминокислот. Медоносным пчелам (Apis
mellifera) приходится выпаривать из
нектара большое количество воды,
прежде чем откладывать его про запас, а
поэтому им невыгодно собирать нектар,
содержащий меньше 20% сахара,-он
годится только для немедленного
использования. Шмели запасают только
жидкий мед, который они расходуют в
течение нескольких дней. Сахара
доставляют энергию для полета, для
поддержания активности в улье и для
создания тепла, а пыльца, смешанная с
медом, либо сразу же скармливается
личинкам, либо используется для
изготовления маточного молочка,
предназначенного для молодых личинок
и маток. По данным Ribbands (1949), для
того чтобы собрать одну порцию
пыльцы, пчела должна посетить от 7 до
120 цветков, а чтобы наполнить нектаром
зоб, требуется от 250 до 1446 посещений.
В своих эксперимен iax с медоносными
пчелами Фри (Free, 1971) установил, что
хотя окраска цветков важна, еще большее
значение имеет их запах. Это интересный
факт, поскольку молодые пчелы,
очевидно, научаются различать запахи
цветков, находясь в темном улье, еще до
того, как они выйдут наружу и увидят
сами цветки. Фри установил также, что
пчелы предпочитают радиальную
симметрию двусторонней, что грубый
разорванный контур привлекает их
сильнее, чем тонкий и простой, и что
указатели нектара, особенно если это
прерывистые линии, не только служат
ориентирами, но и привлекают пчел.
Пчелы не видят цветки так, как видим их
мы; они воспринимают
ультрафиолетовый, синий и зеленый
Пища 45
участки спектра (Wehner, 1976).
У медоносных пчел наблюдается
врожденное предпочтение к цветкам
некоторых растений, например люцерны
(Medicago sativa) (Mackensen, Nye, 1969).
Free и Williams (1973) ввозили в Англию
маток из разных стран, помещали их
вместе и установили, что пчелы
некоторых линий предпочитают ежевику
(Rubus fruticosus), другие-липу (Tilia),
третьи собирают больше пыльцы
с клевера ползучего (Trifolium repens).
Интересно было бы выяснить, каким
образом пчелы координируют свою
сезонную активность с временем
цветения различных растений. Bombus
после зимовки может выйти из своего
подземного убежища в ответ на
повышение в нем температуры
(Prys-Jones, 1982).У одиночных пчел
целая генерация может быть „привязана14
к цветкам одного вида растений,
например к Andrena или одуванчику
(Taraxacum officinale). У общественных
форм такого ограничения нет, и они
активны на протяжении всего сезона,
хотя у одних видов Bombus циклы
короткие, а у других длинные,
в зависимости от того, обитают ли они в
высоких или в низких широтах. Весенний
расплод, выращиваемый пчелами, может
использовать запасенную на зиму смесь
из пыльцы и дрожжей (перга), но обычно
пчелы добывают свежую пыльцу с таких
лесных деревьев, как вяз (Ulmus), тополь
(Populus) и ива (Salix), которые вместе
дают 11 % всей пыльцы, собираемой
пчелами в Англии (Synge, 1947). Позднее
главными источниками пыльцы служат
луговые травы и культурные растения,
особенно бобовые, а кустарники
семейства Rosaceae обеспечивают
большую часть летних сборов. Плющ
(Hedera helix) доставляет пыльцу поздней
осенью (в октябре), и эта пыльца может
быть использована для выкармливания
личинок только ранней весной.
Глава 3
Индивидуальная фуражировка
Все члены данного сообщества
насекомых потребляют пищу,
имеющуюся в гнезде, но лишь некоторые
особи выходят из гнезда, чтобы добыть
ее; эти фуражиры обычно бывают
старше, и размеры их превышают
средние. При увеличении семьи или при
возникновении новых видов с более
обширными семьями потребность в пище
возрастает, и ее приходится искать и
доставлять в гнездо из более далеких
мест. Это создает не только проблемы,
связанные с ориентацией, способность к
которой высоко развита даже
у необщественных насекомых, но также
проблемы поиска, выбора, обмена
информацией, доставки корма и защиты
(о фуражировке у насекомых см. Hassell,
Southwood, 1978). В этой книге способы и
организация сбора пищи будут
рассмотрены в порядке увеличения их
сложности. В настоящей главе описана
система фуражировки, при которой
отдельные особи мало общаются друг с
другом; в этом случае первостепенное
значение имеют методы, используемые
каждым отдельным фуражиром. В главе
4 обсуждается система, в которой
к независимым индивидуальным
действиям может добавляться передача
информации об источниках корма,
обнаруженных исследовательскими
группами (для этого используются
прокладывание следов, разного рода
указатели и символы), и отдельная особь
должна принимать решение, следует ли
ей мобилизовать своих товарищей по
гнезду или нет. И наконец, будет описана
система, в которой от гнезда
в окружающее местообитание отходят
многочисленные тропы, служащие как бы
продолжением гнезда, и таким образом
возникает „территория*4.
3.1. Стратегия фуражировки
У общественных пчел Halictidae
и Bombini (Apidae) сбор пищи
производится отдельными особями,
которые не кооперируются друг с другом
для выполнения этой задачи (Michener,
1974). Это не означает, что рабочие
особи, достигшие достаточно зрелого
возраста и достаточно крупные, не могут
получить полезную информацию от
других особей, прилетающих обратно в
гнездо: особый звук, издаваемый при
полете возвращающимися
шмелями-фуражирами, отличает даже
человек (Schneider, 1972, цит. по
Michener, 1974). Вряд ли можно также
сомневаться в способности пчел
распознавать цветки, послужившие
источником корма, по пыльце,
приставшей к фуражирам, или же по
вкусу отрыгиваемой ими жидкости. В
результате насекомые могут
сосредоточить свои усилия на нескольких
из большого числа возможных кормовых
растений, растущих по соседству, как
сообщает Free (1970) относительно
Bombus lucorum. Осы тоже способны
информировать членов своей семьи о
наличии корма; возможно, в этом
участвует обоняние, так как известна
необычайная чувствительность ос
к химическим веществам (Holldobler,
1977). Вылеты и возвращения в гнездо
как шмелей, так и ос распределены во
времени не случайным образом, однако
Индивидуальная фуражировка 47
анализ данных о В. affinis, проведенный
Плоурайтом (Plowright, 1979), позволяет
предполагать, что причина
этого-внешние изменения, связанные с
погодой, а не поведение других особей.
В природе виды Bombus используют
цветки, глубина венчика которых
соответствует длине их хоботка, хотя эта
корреляция никогда не бывает очень
тесной, так как и насекомым, и цветкам
свойственна большая внутривидовая
изменчивость по величине, а нектар
удается иногда достать даже при
длинной трубочке венчика. Например,
синяк обыкновенный (Echium vulgare)
вырабатывает нектар со скоростью,
зависящей от температуры воздуха, и
пчела, у которой хоботок относительно
короткий, может добраться до нектара
только в сырую погоду, когда он более
обилен, хотя и менее концентрирован.
Наблюдалось, что медоносные пчелы
собирали нектар даже в сухую погоду на
одном месте, где у растений были
необычно короткие венчики (Corbet et al.,
1979), а к клеверу луговому (Trifolium
pratense) они подлетают только тогда,
когда нектар поднимается в трубке
венчика достаточно высоко, чтобы они
могли до него дотянуться (Free, 1970). У
многих видов Bombus (например,
у В. hortorum) хоботки очень длинные, что
позволяет им быть единственными
потребителями нектара растений
с глубоко расположенными
нектарниками.
Вероятно, пчел разных видов привлекают
цветки различного типа,
соответствующие длине их хоботков,
однако мало что известно о том, какими
указаниями они при этом пользуются. До
того как пчела вылетит из гнезда, она
может располагать сведениями лишь о
вкусе и запахе, но не об окраске и форме
цветков; поэтому возможно, что в самом
начале ее деятельности как сборщицы
главную роль играют вкусовые
и обонятельные реакции. Между тем
окраска тоже имеет значение при выборе
цветка, так как цветки с короткими
венчиками чаще бывают белыми или
желтыми, а цветки с длинными
венчиками - синими или пурпурными
(Knuth, 1906-1909, цит. по Proctor, Yeo,
1973). Три вида Bombus чаще выбирали
желтые или оранжевые искусственные
цветы, чем синие или пурпурные, а реже
всего-красные или белые (Brian A. D.,
1967). Кроме того, шмелей легче
приучить к синим, чем к белым
искусственным цветам; в опытах
с белыми цветами вознаграждение
должно быть больше, а приобретенный
навык забывается быстрее (Heinrich et al.,
1977). Возможно, однако, что имеет
значение и форма, так как у цветков
с длинными венчиками она
чаще бывает неправильной или
двусторонне-симметричной; это обычно
одиночные цветки, свисающие вниз, так
что пчелам приходится подлетать к ним
снизу. В отличие от этого цветки
с короткими венчиками часто образуют
соцветие, например головку, как
у Compositae; такие цветки привлекают к
себе Bombus lapidarius (Prys-Jones, 1982).
Некоторые шмели стараются сесть на
цветок, на котором уже сидят другие
пчелы (Brian A. D., 1957); конечно, такое
поведение, хотя оно, возможно,
в основном носит агрессивный характер,
могло бы сильно сокращать поиски,
приводя фуражиров к подходящим
кормовым растениям.
Шмели научаются узнавать цветки,
которые им подходят, и приобретают
опыт, как лучше всего подлетать к ним и
проникать в них. Heinrich (1979) выпускал
молодых насекомых на природный луг,
защищенный сетками от других диких
пчел; шмели перепробовали пять видов
растений, прежде чем остановились на
бальзамине (Impatiens)- растении
с двусторонне-симметричными цветками
48 /' taea 3
20
CD
i Ю
о
о
>s
5
s
s
о
I— --------------r_J____________________l___________________l___________________i
0 30 40 50 60
Концентрация сахара, %
Рис. 3.1. Число шмелей, собирающих нектар
из цветков липы (Tilia) в зависимости от кон-
центрации сахара в нектаре. (Corbet et al.,
1979.)
и глубоко расположенными
нектарниками. Но первые посещения
даже этого цветка были неудачными:
шмели садились на верхнюю часть
венчика, а не на губу, и только после 60
попыток они приобрели достаточный
навык и могли наполнить свой зоб,
40
30
Обилие источников нектара
посетив 20 цветков за 6,2 мин. В отличие
от этого для посещения
радиально-симметричных головчатых
соцветий астры (Aster) и золотой розги
(Solidago) они не нуждались в опыте, но и
пользу извлекали при этом
минимальную. Важное значение запасов
нектара в цветке выявилось, когда всех
пчел выпустили сразу: запасы нектара в
цветках бальзамина уменьшились до
одной четверти, в клевере луговом и
астрах-наполовину, а в золотой розге
вовсе не уменьшились. Таким образом,
конкуренция заставила некоторых
насекомых отдавать предпочтение
клеверу по сравнению с бальзамином.
Далее, если клевер ползучий (Trifolium
repens) и горошек мышиный (Vieta сгасса)
на определенном участке были защищены
от пчел сеткой и накопили запасы
нектара, то Bombus vagans будет позднее
оказывать им больше внимания, чем
цветкам тех же видов в других местах
(Morse, 1980). Шмели обычно
предпочитают более концентрированный
Рис. 3.2. Зависимость между обилием шмелей
и обилием источников нектара. (Pleasants,
1981.)
Индивидуальная фуражировка 49
Рис. 3.3. Сезонные изме-
нения количества нектара
(J) и численности шмелей
Bombus bifarus (И), ко-
торые собирали нектар
во время 30-минутных
наблюдений. (Pleasants,
1981.)
нектар (рис. 3.1), но вязкость может
затруднить шмелям с их длинным
хоботком высасывание слишком густого
нектара, так что имеется некий оптимум
концентрации, при котором „чистая
прибыль" в отношении энергии будет для
насекомого максимальной (Prys-Jones,
1982). Pleasants (1981) показал, как
изменяется численность шмелей на
протяжении сезона в соответствии
с обилием цветов (рис. 3.2 и 3.3; данные
для одного района Скалистых гор в шт.
Колорадо).
До сих пор мы рассматривали сбор
нектара. Сомнительно, чтобы шмели с их
длинными хоботками когда-либо
собирали пыльцу без нектара; они
принадлежат к очень специализированной
ассоциации цветок-насекомое. Другие
пчелы не таковы - они посещают
annuus), дающий и нектар и пыльцу,
насекомые, если они собирают пыльцу,
посещают лишь те цветки соцветия, у
которых только что лопнули пыльники.
Пыльца высыпается, после того как
насекомое потрясет пыльники
подсолнечника, а у цветков других типов
пчелы „выдаивают" или откусывают
пыльцу, либо собирают, когда она уже
высыпалась (Eickwort, Ginsberg, 1980).
Сборщицы нектара могут посетить те же
места и оказаться усыпанными пыльцой,
которую они перенесут на более старые
цветки в том же соцветии подсолнечника,
ползая по нему. Однако нередко они
счищают пыльцу своими щеточками и
выбрасывают ее; но не потому, что
пыльца им не подходит,-просто
в данный момент она их не интересует.
Несмотря на такое поведение, они могут
и цветки, дающие только пыльцу,
например мак (Papaver). А на таких
растениях, как подсолнечник (Helianthus
превосходить других насекомых как
опылители (Free, 1970). У пчел
с высокоразвитым общественным
50 / .tuhii J
образом жизни сбор пыльцы и нектара
нередко происходит во время разных
вылетов при посещении разных цветков,
а сборщицы пыльцы, готовясь к походу,
пьют запасенный в улье мед. Такие виды
могут также собирать воду для
разбавления запасенного меда;
количества главных пищевых продуктов
(нектара, воды, пыльцы), которые нужно
собрать, несомненно, регулируются
путем обмена информацией внутри
гнезда.
Опыление было бы более эффективным,
если бы данное насекомое в течение
некоторого времени посещало растения
одного вида, вместо того чтобы
беспорядочно перелетать от одного вида
к другому. Удалось ли растениям
принудить насекомых к такой тактике? В
случае медоносной пчелы почти удалось,
так как в ее сборах смешанная пыльца
составляет всего 6%. С Bombus дело
обстоит хуже: у В. lucorum такой пыльцы
уже 34%, а у В. pascuorum-bf^ (Free,
1970). Это может помочь перекрестному
опылению травянистых растений
и мелких кустарников, но не деревьев,
так как насекомое скорее перейдет с
одной ветки данного дерева на другую,
чем на какое-то новое дерево. Чтобы это
не приводило к самоопылению, у многих
деревьев в процессе эволюции
образовались отдельные мужские
и женские цветки (Maynard Smith, 1978а,
р. 136). Пыльца деревьев-опылителей,
посаженных в плодовом саду, все же
переносится на соседние деревья;
предполагают, что этот перенос
происходит в результате
последовательных посещений шмелей,
так как пыльца, приставшая к их
волоскам, сохраняет жизнеспособность
несколько часов (Free, Williams, 1972).
Содержание сахара в нектаре
и количество пыльцы варьируют
в течение дня и зависят от внутренних
ритмов раскрывания цветков,
освобождения пыльцы
и чувствительности рыльца, а все эти
факторы изменяются в зависимости от
погодных условий. Например, у бобов
(Vicia faba) цветок в первый день
раскрывается для того, чтобы выбросить
пыльцу, во второй день-чтобы
воспринять ее (рыльце созрело), а на
третий день он вянет и уже не привлекает
шмелей. У этой группы растений
соцветие обычно представляет собой
побег, на котором вместо листьев растут
цветки; у него есть верхушечная точка
роста, производящая молодые бутоны,
каждый из которых приобретает окраску,
раскрывается, источает аромат,
сбрасывает пыльцу, образует рыльце,
готовое к ее приему, и наконец увядает и
становится незаметным. Такая
программа обеспечивает шмелям
возможность сесть у основания соцветия
и нанести свежую пыльцу на зрелые
рыльца, а затем перейти или перелететь
(в зависимости от расстояния между
цветками) на самый верхний из
раскрывшихся цветков; после этого
шмель доставляет новую порцию свежей
пыльцы самому старому, наиболее низко
расположенному цветку на соседнем
растении, и так далее (Free, 1970). Пайк
(Руке, 1978, 1979) изучал, как Bombus
appositus кормится на аконите (Aconitum
columbianum), одновременно опыляя его,
и установил, что этот шмель не
поднимается систематически по
возрастной спирали. Он, летая между
цветками, чаще всего (в 90% случаев)
переходит на ближайшего соседа сверху,
а не на следующий более молодой цветок
по спирали. Это сокращает летное время,
хотя ведет к тому, что некоторые из
цветков данной спирали будут
пропущены; Пайк сформулировал
следующее правило поведения шмелей:
„лети на любой из самых ближайших
цветков, расположенных выше, но не на
тот, который посетил только что...“.
Индивидуальая фуражировка 51
Фото 7. Пчела-сборщица, возвратившаяся
с собранной пыльцой.
Фото 8. Шмель, собирающий на цветке кре-
стовника нектар, который при этом смеши-
вается с пыльцевыми зернами. [Фото 7 и
8-J. В. Free.]
52 Г шва 3
Конечно, наблюдались и нарушения
этого правила: один раз из пяти шмель
перемещается вниз, а не вверх, а два раза
из трех он покидает соцветие между
основанием и верхушкой, т. е. посещает
самый молодой цветок реже чем один
раз из пяти. Тем не менее эта система
работает, и в каждом отдельном вылете
вторичные посещения данного цветка
составляют лишь 1,2% общего числа
посещений. Пайк указывает, что план, по
которому следует переходить на
ближайший цветок, а не на следующий
цветок в спирали, хорош до тех пор, пока
колоски (или растения) находятся не
слишком далеко друг от друга. Если же
расстояния между ними велики, то лучше
сосредоточиться на одном соцветии и
посетить все цветки без пропусков.
Друз ой случай, когда выгоден более
поспешный сбор нектара,-это посещение
цветков губовника линейного (Chilopsis
liniaris) шмелями Bombus sonorus.
В каждом цветке нектар, стекая по пяти
желобкам, образует большую каплю. По
утрам самки облетают цветки
и высасывают эту каплю, получая
1,7 мкл нектара за 2 с; затем они
возвращаются и опустошают желобки,
получая за 5 с только 2,4 мкл нектара.
Уитхэм (Whitham, 1977) вычислил, что
при этом шмели получают на 25%
больше нектара, чем если бы они
высасывали его сразу за одно посещение
цветка; это выгодно и растению, так как
число посещений цветка оказывается
вдвое больше.
Более крупные шмели не только
обладают большей силой, но и быстрее
перемещаются от соцветия к соцветию,
хотя и не от цветка к цветку; однако
затраты энергии при полете возрастают
пропорционально весу тела, так что
крупный шмель расходует больше
энергии, чем маленький. Оптимальные
(наиболее экономичные) размеры для
Bombus appositus, кормящегося на
аконите, соответствуют весу 0,24 г, что
близко к фактическому среднему весу,
равному 0,28 г (Руке, 1978). Модель,
которую построил Пайк, предсказывает
также, что чем больше нектара в каждом
цветке, тем крупнее должен быть
посещающий его шмель; и в самом деле,
В. appositus и В. kirbyellus кормятся на
дельфиниуме и аконите, выделяющих в
сутки по 2-4 мкл нектара, тогда как
В. bifarius и В. sylvicola посещают
соцветия сложноцветных, отдельные
цветочки которых имеют венчики
с короткой трубкой, причем
одновременно раскрыты бывают лишь
несколько цветочков (Proctor, Yeo, 1973).
В другой модели, описывающей сбор
нектара шмелем, рассматриваются три
состояния-шмель в гнезде, шмель
в полете и шмель в цветке-и
предполагается, что насекомое
возвращается в гнездо после наполнения
зоба (Oster, Wilson, 1978). Время,
проведенное в цветке, зависит от
строения цветка и количества
содержащегося в нем нектара,
а временной интервал между
посещениями двух цветков - от их
взаимного расположения (в частности, от
расстояния между ними) и от скорости
полета шмеля с учетом расхода энергии
на взлет, посадку и на самый полет. При
этом крупные шмели оказываются более
эффективными при фуражировке
в крупных цветках с большим
количеством нектара, если только цветки
расположены достаточно далеко друг от
друга. Авторы предлагают формулу,
выражающую прирост энергии на одного
фуражира, который возрастает
с увеличением плотности расположения
цветков до известного предела,
и предсказывающую оптимальные
размеры фуражира при различной
величине цветков. В общем более
крупные шмели оказываются более
эффективными фуражирами, но, конечно,
Ипдивидуа.1ьна.ч фуражировка 53
для создания их самих требуются
большие затраты.
Идея об оптимальной фуражировке
стимулировала изучение факторов,
влияющих на эксплуатацию данного
„пятна" корма. Фуражир должен
привести все „пятна", находящиеся на
одинаковых расстояниях от его гнезда, к
единому уровню в смысле поставки
нектара; этот уровень соответствует
ожидаемой скорости всасывания нектара,
оцениваемой путем обобщения прошлого
опыта (Charnov, цит. по Hassell,
Southwood, 1978). Чем дальше от гнезда
находится „пятно" корма, тем полнее
оно должно быть использовано. Ходжес
(Hodges, 1981), наблюдая за самками
Bombus appositus, собирающими нектар
на Delphinium nelsoni в Скалистых горах в
шт. Колорадо, получил данные,
согласующиеся с моделью Чарнова.
Количество нектара в цветках одного
соцветия (одного „пятна") было
примерно одинаковым, так что шмелю
достаточно было обследовать один
цветок, чтобы решить, стоит ли
продолжать сбор или лучше перейти на
другое соцветие. Когда количество
нектара было экспериментально
увеличено, шмели стали дольше
задерживаться на каждом соцветии
и посещать все его цветки (их обычно
около трех).
Несмотря на превосходную систему
обмена информацией, существующую у
медоносных пчел, иногда отдельные их
особи трудятся поодиночке. Поведение
таких пчел при сборе нектара изучали
Butler et al. (1943), а при сборе
пыльцы-Ribbands (1949). В обоих
случаях отдельные пчелы были связаны с
определенной группой цветков на
небольшом участке, даже если данное
растение занимало большую площадь.
Пчелы посещали эти цветки до тех пор,
пока запасы нектара или пыльцы
оставались достаточными, но покидали
их еще до того, как эти запасы иссякали
полностью, хотя другие пчелиные все еще
использовали их. Очевидно, данная пчела
перепробовала другие растения
и „... степень ее склонности к перемене
определяется тем, что она помнит о
прежних урожаях..." (Ribbands, 1949,
р. 63). Ribbands подчеркивает, что
пчелам свойственны „непрерывные
попытки делать выбор..." Короче говоря,
они непрерывно обследуют источники
пищи и используют наилучший из тех,
которые им доступны. Weaver (1957)
предполагает, что они начинают
исследовательскую деятельность после
того, как насытятся на главном
источнике нектара.
Существует еще одно своеобразное
явление; некоторые шмели собирают
нектар, прокусывая трубку венчика еще
до того, как раскроется цветок,
а насекомые, не способные к этому,
используют дырки, проделанные другими
видами (или даже птицами). В Европе
таким разбойным нападениям
подвергаются по крайней мере 300 видов
растений (Brian A. D., 1954). По мнению
некоторых исследователей (Heinrich,
Raven, 1972), воровство нектара просто
заставляет шмелей-опылителей
с длинным хоботком посещать большее
число цветков, тем самым способствуя
аутбридингу. Такой „незаконный" сбор
нектара означает, что цветок одного
растения, например бобов, может
обеспечить энергией опыление цветков
другого, неродственного вида, например
мака, который не вырабатывает нектара.
Это действует эффективно и, возможно,
обусловлено отчасти тем флористическим
хаосом, который по воле человека
сменил прежние стабильные или, во
всяком случае, медленно изменяющиеся
экосистемы. Старомодные шмели
с длинными хоботками, получающие всю
свою пищу от растений одного вида, как,
например, Bombus hortorum-or окопника
лекарственного (Symphytum officinale)
(Prys-Jones, 1982), быть может, в очень
близком будущем сохранятся только в
заповедниках.
3.2. Вариабельность
рабочих особей
Рабочие особи различаются по размерам,
восприимчивости органов чувств
и активности. Это создает в каждой
семье полезное разнообразие типов.
Работы, выполняемые в гнезде,
нетяжелы, но сложны; работы,
выполняемые вне гнезда, тяжелы
и опасны, они требуют умения
распознавать все то, с чем приходится
сталкиваться во внешней среде, и гибко
реагировать на это. Поэтому в идеале
фуражиры должны быть и старше, и
крупнее; это и в самом деле имеет место
благодаря различной скорости развития,
в результате чего у изначально более
крупных особей жесткие
пигментированные покровы
и положительная реакция на свет
развиваются быстрее, чем у мелких, так
что они становятся фуражирами раньше1
(сводку данных о муравьях, пчелах и осах
см. Lenoir, 1979а). Для развития
поведения, связанного с фуражировкой,
период жизни в темноте гнезда имеет
лишь ограниченное значение и может
быть без вреда сокращен.
Остается нерешенным вопрос: в какой
мере изменчивость размеров тела
определяется генетически,
а в какой-фенотипически? Различие в
величине взрослых особей, обусловленное
неодинаковым количеством пищи,
получаемым на личиночной
стадии,-явление обычное. Например, у
Vespula личинки, находящиеся у входа в
1 У многих муравьев фуражирами бывают
средние и мелкие, но не самые крупные особи,-
Прим. ред.
гнездо и в центре сота, бывают крупнее,
потому что они ближе к каналу, по
которому поступает корм; некоторые из
личинок Bombus, питающихся пыльцевой
массой, имеют к ней более легкий
доступ, чем другие. Становятся ли
фуражирами раньше те особи, которые
на личиночной стадии получали больше
корма? Или такое ускоренное развитие
обусловлено генетически?
У большинства истинно общественных
муравьев, пчел и ос кривая распределения
рабочих особей по размерам
унимодальна и приближается
к нормальной кривой, отличающейся от
кривой для половых особей. Такие
рабочие „мономорфны". У некоторых
муравьев, однако, распределение
асимметрично и приближается
к логнормальному, а в крайних случаях
может иметь две или даже три моды
(полиморфизм)1; это должно иметь
генетическую основу. Такому увеличению
диапазона изменчивости по размерам
сопутствует и большая изменчивость
формы, обусловленная способностью к
аллометрическому росту после того, как
в процессе развития детерминировались
основные признаки касты рабочих.
Аллометрический рост означает, что
некоторые части организма, в данном
случае ротовые органы и некоторые
связанные с ними железы головы, растут
относительно быстрее, чем другие его
части. Г рафик роста одной части тела
относительно общего роста, построенный
в логарифмическом масштабе, имеет вид
либо одной прямой линии, либо
нескольких отрезков с разными
наклонами. Это указывает на то, что
скорость относительного роста на разных
1 Автор использует здесь терминологию Wil-
son (1971), который называет полиморфизмом
полифазную аллометрию. Обычно под поли-
морфизмом понимают наличие двух или более
дискретных форм (каковы, например, рабочие и
солдаты у Pheidole).- Прим. ред.
Индивидуальная фуражировка 55
Рис. 3.4. Диаграмма, показывающая, что у
фуражиров Bombus morio (черные столбики)
крылья длиннее, чем у гнездовых рабочих осо-
бей (белые столбики). (Garofalo, 1978.)
стадиях развития различна (полифазный
рост), но конкретная форма графика
зависит от используемых параметров
(Brian М. V., 1979а). Некоторые данные с
хорошим приближением описываются
многочленами (Baroni Urbani, 1974).
Изменчивость общих размеров
мономорфных рабочих обусловлена не
просто неравномерностью или
„ошибками’14 в распределении корма,
хотя пониженное снабжение пищей,
несомненно, уменьшает средние размеры.
Несмотря на то, что рабочие особи у
муравьев, пчел и ос принадлежат все к
одному полу, они не являются
результатом клонирования и друг для
друга не более чем сестры. Снабжение
пищей-переменная, зависящая от
времени года и от организации
сообщества, и она взаимодействует
с генетическими различиями. Таким
образом возникают рабочие особи
с известным диапазоном изменчивости в
отношении размеров, скорости развития
и поведения, что в общем соответствует
потребностям семьи, хотя степень этого
соответствия не.известна; возможно, что
некоторые особи загружены не
полностью.
У термитов к другим генотипическим
эффектам добавляются еще половые
различия, детерминированные
хромосомами; у Macrotermitinae более
крупные рабочие-самки,
56 I'.iana 3
и фуражировкой занимаются главным
образом они (Noirot, 1969, 1974).
У Hodotermes mossambicus
(Hodotermitidae) рабочие особи,
срезающие траву, старше, сильнее
и окрашены темнее всех, кто работает в
гнезде (Watson, 1973). У шмеля Bombus
morio фуражиры крупнее средних
размеров (рис. 3.4), а у B.pascuorum
крупные фуражиры собирают больше
пыльцы, чем мелкие; не возникла ли эта
тенденция благодаря ее полезности?
Более крупные размеры придают
шмелям больше силы, необходимой для
проникновения в цветок, а большая
поверхность тела помогает собирать
пыльцу. У европейских лесных муравьев
(группа Formica rufa) более крупные
фуражиры обычно охотятся, а более
мелкие собирают падь; кроме того,
крупные фуражиры дальше отходят от
гнезда и от протоптанных дорог
и проявляют особые формы активности,
например вступают в драки (Brian М. V.,
1969а; Mabelis, 1979а), но развитие этих
различий в поведении еще не изучено.
Рабочие особи Formica кооперируются,
если им попалась крупная жертва (Sudd,
1965, 1967). То же самое делают рабочие
особи Oecophylla-другого представителя
Formicinae, у которого фуражиры
относительно крупные (Holldobler,
Wilson, 1977а). Среди Myrmicinae так же
ведут себя рабочие особи Myrmica, но
гораздо более мелкие рабочие
Tetramorium, которые поодиночке очень
успешно собирают мелкие семена
вереска, обычно расчленяют крупную
добычу и перетаскивают ее в гнездо
небольшими частями. У Pheidole dentata
популяция рабочих особей диморфна;
она состоит из мелких нормальных
особей, с одной стороны, и крупных
„солдат" с аномально большими
головами и челюстями-с другой. В то
время как нормальные рабочие
расчленяют на части крупную добычу,
„солдаты" их защищают (Oster, Wilson,
1978).
Рабочие особи Solenopsis invicta
„подбирают" Жертву в соответствии с
собственными размерами:
в лабораторных условиях крупные особи
никогда не охотятся на мелких термитов
(Oster, Wilson, 1978).
Ikbiaiaior. что такое соответствие
(„resource matching")-важный принцип в
эволюции муравьев. Цитированные
авторы сравнивают величину муравьев с
размерами их добычи из числа
беспозвоночных и высказывают мысль,
что такие новые пришельцы, как
S. invicta, придя с юга в Северную
Америку, приобрели целый ряд новых
кормовых видов и оказались в условиях
„экологического раздолья". По мнению
этих авторов, возникновение более
широкого диапазона размеров
в результате какого-то генетического
сдвига могло быть важной адаптацией,
расширяющей круг подходящих жертв,
хотя эффективность такой адаптации
проблематична.
У муравья Atta cephalotes, обитающего в
тропическом дождевом лесу,
распределение рабочих особей по
размерам в выборках, взятых из гнезд,
дает кривую логнормального
распределения (рис. 3.5) (Stradling,
1978а). На их тропах очень мелкие
рабочие почти не встречаются; лишь
единичные особи сидят на кусочках
листьев и слизывают с них выделения.
Разрезают эти листья рабочие средних
размеров, а те, что покрупнее,
по-видимому, берут на себя более
жесткие ткани. Самые крупные рабочие
особи несут оборонные функции
и выходят из гнезда, если его
потревожить (Autuori, 1974; Lowenthal,
1974; Weber, 1972).
Муравей Atta sexdens по своему
полиморфизму сходен с A. cephalotes',
Вильсон (Wilson, 1980) оценивал
Индивидуальная фуражировка 57
Рис. 3.5. Ширина головы
у рабочих особей Atta
cephalotes. А. Рабочие,
выполняющие различные
функции в гнезде. Б. Ра-
бочие, идущие по тропе.
В. Рабочие, несущие ку-
сочки листьев. Г. Рабо-
чие, сидящие на кусочках
листьев. (Stradling,
1978а.)
эффективность рабочих этого вида,
измеряя скорость, с которой особи
различных размерных классов срезают
листья, и сопоставляя полученные
величины либо с весом муравьев, либо с
интенсивностью их дыхания. Оказалось,
что у рабочих, срезающих листья, длина
тела несколько больше (по моде и по
средней), чем у тех, которые срезают
более мягкие части растений, например
лепестки. Кривая эффективности
использования энергии имеет более
Ширина головы, мм
острый пик в области более крупных
размеров для рабочих, срезающих
листья, чем для рабочих, срезающих
лепестки (рис. 3.6), и теоретические
оптимальные размеры муравьев-
листорезов совпадают с их
фактическими размерами. Вильсон
приходит к выводу, что эффективность
использования энергии „у этого вида
отличается... всего на 10% от
оптимальной...“ Короче говоря,
у A.sexdens в процессе эволюции
5S HiuliiHiiOvu.ibHu.'i фуражировка
Ширина головы, мм
Рис. 3.6. Энергетическая эффективность рабо-
чих особей Atta sexdens разной величины при
разрезании мягких лепестков и жестких листь-
ев. По оси ординат отложено отношение веса
срезанных растительных тканей (мг) к количе-
образовалась отдельная категория
рабочих особей, занятых резкой листьев;
они слишком велики для того, чтобы
работать в гнезде, и слишком малы,
чтобы обеспечивать защиту. Эти рабочие,
по-видимому, умеют выбирать листья,
соответствующие их размерам и силам. В
эволюционно наиболее продвинутых
ству О,, потребленному в процессе этой ра-
боты. В экспериментах подбирались группы
рабочих с одинаковой шириной головы. (Wil-
son, 1980 b.)
родах подсемейства Dorylinae
наблюдаются сходные различия
в размерах (рис. 3.7); охотой занимаются
рабочие средней величины, каждый из
которых тащит добычу, примерно
соответствующую по размерам ему
самому. Более крупные особи стоят в
оборонительных позах (Topoff, 1971).
Фото 9. Солдат Atta cephalotes (Attini) в Три-
нидаде. Эти солдаты защищают гнездо, а не
своих собратьев, занятых фуражировкой. Они
выходят на поверхность при сотрясении почвы
и могут больно укусить, но ;шстья они не
разрезают.
Фото 10. Рабочие особи Atta cephalotes в Три-
нидаде, несущие кусочки разрезанных ими
листьев. Очень мелкие рабочие, разрезая лист,
влезают на него и слизывают выделяющийся
при этом сок; нередко они возвращаются в
гнездо на кусочке листа, который тащат дру-
гие рабочие. Как показал Wilson (1980), более
крупные рабочие разрезают более жесткие
листья. [Фото 9 и 10-D. J. Stradling.]
60 Глава 3
Рис. 3.7. Головы рабо-
чих особей Dorylus affinis,
изображенные в одном
масштабе, чтобы пока-
зать различия в их разме-
рах и в числе члеников
антенн. (Wheeler W.,
1910.)
Рабочие особи различаются также по
своей реактивности. Wallis (1962),
наблюдая за Formica fusca, заметил, что
некоторые рабочие спонтанно выходят из
гнезда для добывания пищи, и высказал
предположение, что наличие таких особей
служит важным фактором,
инициирующим фуражировку у муравьев.
Совсем недавно Lenoir (1979а) пришел к
сходному выводу, изучая Lasius niger.
Генетическая изменчивость может быть
значительной даже в семьях, возникших
от потомков одной матки, и это
обеспечивает существование лидеров, или
„активистов1 11, способных организовать
своих собратьев по гнезду на выполнение
любой необходимой работы
и направлять эту работу. Эффективность
семьи, таким образом, почти равна
эффективности наиболее активных
и восприимчивых рабочих особей >.
Остер и Вильсон (Oster, Wilson, 1978)
подчеркивают роль определенного
1 Различия в активности фуражиров во многом
определяются также внешними факторами, в
частности положением особи в иерархической
структуре семьи,- Прим. ред.
„темперамента11 семьи: спокойствия или
возбудимости, осмотрительности или
живости, склонности к вспышкам бурной
деятельности или к целенаправленной
методичности. Поведение первого рода
типично для муравьев, принадлежащих к
подсемействам Ponerinae и Myrmicinae, а
второго-для Dorylinae и Dolichoderinae.
Быстрое неориентированное движение,
возможно, необходимо при способе
охоты, свойственном представителям
Dorylinae. Склонность отступать
и оставаться незамеченными - нередкая
особенность небольших молодых семей,,
тогда как большие семьи муравьев того
же вида могут позволить себе вступать в
столкновения. Повышенная
„темпераментность11 семьи, возможно,
представляет собой важное условие для
ее разделения, но вряд ли имеет
генетическую основу, а скорее всего
обусловлена такими факторами
общественной жизни, как скученность и
возрастная структура.
Подводя итоги, можно сказать, что
существует немало сообществ ос и пчел,
в которых сбор пищи обеспечивают
отдельные особи, изучившие характер
Индивидуальная фуражировка 61
распределения ресурсов в данной
местности и продолжающие часто
обследовать ее. Они собирают тот корм,
которого много и который легко
доступен; помимо основного корма
имеются различные дополнительные его
виды, к которым можно прибегнуть в
случае временного или постоянного
сокращения пищевых ресурсов,
вызванного сезонными изменениями или
появлением эффективных конкурентов.
Успех сообщества такого типа сильно
зависит от качеств этих особей-
сборщиков, и у многих видов для них
характерна значительная изменчивость
размеров, активности, восприимчивости
и других полезных признаков. Одна
особь может повести за собой других,
передавая информацию (в особенности
добавочные запаховые указания) особям,
находящимся в гнезде. На этой основе у
муравьев и термитов создалась
„планируемая" частота разных
размерных классов, в рамках которой
могут возникать особи с гипертрофи-
рованной передней частью тела, что
чрезвычайно усиливает их челюсти и тем
самым придает им способность
выполнять особо тяжелую работу.
У фуражиров отмечается также
тенденция подбирать размеры жертвы
(или-у Atta-жесткость листьев)
в соответствии с размерами собственного
тела; по-видимому, рабочие особи
выясняют путем проб, с чем они могут
справляться наиболее успешно.
Глава 4
Групповая фуражировка
4.1. Передача информации
о корме
11 рос г сйптП способ передать другим
особям сведения о найденном источнике
корма состоит в том, чтобы, вернувшись
в гнездо, совершить определенные
демонстративные действия.
Одновременное выделение секрета из
мандибулярных желез может
активизировать потенциальных
фуражиров и снабдить их запаховыми
указаниями о типе корма и его
местонахождении. Если гнездо имеет
несколько входов, то вход, к которому
вернулся фуражир, может указывать, в
каком секторе лучше всего вести поиски.
Дальнейшими указателями могут
служить пахучие метки-секреты
мандибулярных желез или
экскременты,- оставляемые где-нибудь
снаружи, так что прямая, соединяющая
выход из гнезда с такой меткой,
указывает направление, в котором надо
следовать. Стимулирующие химические
вещества содержатся и в метках,
оставляемых с помощью других желез.
Для большей надежности особь,
обнаружившая пищу, может собрать
группу рабочих и вывести их из гнезда,
используя свою зрительную
топографическую память и метки, чтобы
вернуться к найденному источнику корма
и помочь другим не терять связи между
собой.
Наиболее совершенная из всех
выработанных в процессе эволюции
систем - это указание направления при
помощи пробежки, выполняемой
в гнезде; при этом передается даже
информация о расстоянии до источника
корма: частота вибраций, совершаемых
при пробежке, коррелирует с временем,
необходимым для того, чтобы добраться
до этого источника.
У большинства ос сообщение
о найденном корме сводится к тому, что
оса проявляет некоторое оживление,
вернувшись в гнездо; возможно, что при
этом передаются какие-то указания при
помощи запахов, как у Vespula
(Maschwitz et al„ 1974; цит. no Jeanne,
1980), но у Vespa помощники могут
следовать за лидером, возвращающимся
к корму. Пчелы Meliponinae оставляют
простые метки, например представители
рода Trigona на пути от источника корма
к гнезду наносят на растения пахучие
метки из выделений мандибулярных
желез. Они делают это медленно
и методично, а на некотором расстоянии
от гнезда метки кончаются, причем
расстояние это видоспецифично: так, у
T.postica оно равно 8 м, а интервалы
между метками составляют по 1 м
(Lindauer, Kerr, 1958, 1960). У этого вида,
как и у всех других, секрет
мандибулярных желез представляет
собой смесь летучих соединений,
в которой преобладает бензойный
альдегид, но содержатся также
тридекан-2-он и пентадекан-2-он.
У Т. subterranea секрет состоит из
альдегидов монотерпенового ряда
(нераля и гераниаля - двух
стереоизомеров цитраля),
а у Scaptotrigona-из карбонильных
соединений (Blum, Brand, 1972).
Вернувшись в гнездо, эти насекомые
возбуждают и активизируют других
зигзагообразными пробежками
и жужжанием, которые видоспецифичны,
Групповая фуражировки 63
но не несут конкретной информации.
Затем пчела-информатор летит
к источнику пищи, сопровождаемая
завербованными ею сборщицами. Таким
образом, мобилизация сборщиц у Trigona
включает три элемента: оставление
следа, зигзагообразные пробежки
и следование за лидером.
Муравьи Ponerinae, подобно
мелипонинам, чтобы привлечь
помощников, используют мандибулярные
железы. Odontomachus troglodytes,
обладающий сильно развитым жалом,
нападает на жертву, равную по размерам
ему самому; кусая и жаля других особей
своего вида, он заставляет их оказывать
ему помощь в перетаскивании жертвы, а
выделяемая им смесь алкилпиразинов
активизирует других муравьев,
привлекает их и побуждает к нападению
(Longhurst et al., 1978). Когда муравей
Bothroponera soror находит крупную
жертву, его мандибулярные железы
выделяют феромон, привлекающий
других рабочих, находящихся в радиусе
20 см. В состав этого феромона входит
не менее 21 соединения, однако все те
реакции, которые он вызывает,-
вытягивание антенн вперед,
приближение, смыкание челюстей
и вонзание жала-можно вызвать при
помощи смеси ундекан-2-ола,
2-метил-6-метилсалицилата
и ундекан-2-она в соотношении 40 :10 :1.
Муравьи этого вида также привлекают
помощников к тому месту, откуда нужно
перетащить очень крупную добычу
(Longhurst et al., 1980), но у других видов
рабочая особь вербует себе помощников,
возвращаясь в гнездо и приглашая
других муравьев следовать за собой; она
выбегает наружу, а другой муравей
бежит за ней, прикасаясь к ее брюшку и
ногам. Такому „тандему" способствует
пигидиальная железа, расположенная
между сегментами в дорсальной части
брюшка (Holldobler, Traniello, 1980а;
Maschwitz et al., 1974); эта железа может
использоваться для создания пахучего
следа: бегущий муравей загибает кончик
брюшка вниз и трется им о землю,
оставляя за собой след. У некоторых
муравьев такое поведение дает
возможность мобилизовать сразу
нескольких рабочих, которые следуют по
„одноколейному" пути, проложенному
разведчиками (Fletcher, 1973;'Holldobler,
Traniello, 1980b).
У муравья Megaponera foetens (Ponerinae),
облигатно питающегося термитами,
кривая распределения рабочих особей по
размерам трехвершинная (van Boven,
1970); этот муравей ориентируется по
кронам деревьев (Holldobler, 1980).
Обнаружив свежие следы деятельности
термитов в почве, муравей-разведчик
прокладывает мобилизационный след к
своему гнезду. Спустя примерно 5 мин он
снова выходит наружу в сопровождении
нескольких крупных и множества мелких
рабочих; если на этом этапе удалить
разведчика, то возникнет хаос, несмотря
на то что имеется проложенный путь
(рис. 4.1; Longhurst, Howse, 1978). Когда
муравьи доходят до зоны термитов,
крупные рабочие снимают слои почвы, а
мелкие проникают в почву
и вытаскивают из нее термитов,
складывая их в кучки снаружи, пока
операция не закончится. По-видимому,
нападение координируется
и сосредоточивается в одном месте
благодаря выделению мандибулярными
железами феромона, состоящего главным
образом из диметилдисульфида
и диметилтрисульфида. Спустя примерно
10 мин муравьи выстраиваются
в колонну и возвращаются сомкнутыми
рядами, по 3-5 муравьев в ряду; крупные
рабочие идут в авангарде и готовы
отбить нападение грабителей. На
обратном пути муравьи движутся со
скоростью 4,6 см/с-быстрее, чем они
шли от гнезда (3,8 см/с) (Fletcher, 1973;
64 1idea 4
Рис. 4.1. Фуражировочные следы Megaponera
foetens. А. Семья, у которой следы начинаются
от двух входов гнезда. Б. Семья, у которой
следы начинаются от трех входов. Направле-
ние может контролироваться разведчиками.
Объектом охоты служат термиты Macrotermes.
(Longhurst, House, 1979а.)
Longhurst, Howse, 1978, 1979a; Longhurst
et al., 1979). Муравьи рода Megaponera,
подобно многим другим Ponerinae,
производят довольно хорошо слышное
стрекотание (Markl, 1973), главным
образом если их потревожить или
поймать, однако неизвестно, помогает ли
это им при фуражировке. В Кении
наблюдается три пика охотничьей
активности в день; в среднем один
муравейник поедал ежедневно 653
термита, главным образом Macrotermes
subhyalinus (Lepage, 1981а).
Подсемейство Myrmicinae отличается
большим разнообразием, чем Ponerinae.
Представители рода Myrmica обитают в
травянистых и кустарниковых зонах
умеренного пояса и питаются падью,
живыми мелкими животными и их
трупами; при фуражировке и других
передвижениях они пользуются зрением,
ориентируясь по контуру горизонта,
отдаленным объектам, поляризации света
неба или положению солнца. Его реакции
на пищу варьируют: обнаружив воду или
мелкую добычу, муравей-разведчик
прокладывает с помощью жала ядовитый
след и возвращается в гнездо
нагруженным [Kugler (1979а) описывает
эволюцию жала в „писчее перо“
у Myrmicinae], В гнезде он ведет себя
спокойно, побуждая лишь нескольких
рабочих выйти и направиться по
оставленному им следу. Если же
обнаружена крупная жертва или много
мелких, то разведчик сначала оценивает
ситуацию, а затем возвращается в гнездо
без груза; как и в первом случае, он
оставляет метки, выделяя яд из жала, но
добавляет к этому секрет дюфуровой
железы, особенно вблизи гнезда и вокруг
найденной пищи. Войдя в гнездо, он
начинает энергично и быстро бегать,
бросаясь из стороны в сторону, так что
десятки рабочих устремляются по следу в
сопровождении разведчика или без него
Групповая фуражировка 65
(Cammaerts, 1978). Яд представляет собой
в основном раствор белков и аминов, но
содержит также слабо полярное
низкомолекулярное летучее
соединение-следовой феромон
(Cammaerts-Tricot et al., 1977).
В дюфуровой железе синтезируются
линейные углеводороды с цепью из 13-19
атомов углерода, три фарнезина
(терпеноиды) и четыре
низкомолекулярных вещества,
содержащих кислород: ацетальдегид,
этанол, ацетон и бутанон в соотношении
35 :3 :40 :25 (Morgan et al., 1979). Эта
смесь постепенно испаряется, начиная с
низкомолекулярных спиртов, альдегидов
и кетонов, которые возбуждают рабочих
и указывают им направление; затем
испаряются терпеноиды и, наконец,
углеводороды. Такая последовательность
дает рабочим возможность оценить
свежесть следа. Так обстоит дело
у Myrmica rubra и М. scabrinodis, причем
муравьи этих двух видов могут следовать
по дорогам, проложенным особями как
своего, так и другого вида. Однако, хотя
дюфурова железа у М. scabrinodis
секретирует те же летучие вещества, что
и у М. rubra, в секрете этого последнего
вида содержатся иные, менее летучие
соединения, используемые для того,
чтобы метить территорию (Cammaerts et
al., 1977, 1978); при нанесении меток
муравей медленно передвигается по
территории, оставляя капельки секрета.
Мандибулярные железы видов Myrmica
вырабатывают также много химических
веществ, которые выделяются при
встрече с жертвой и привлекают на
помощь находящихся поблизости
сотоварищей по гнезду (Morgan et al.,
1978; Parry, Morgan, 1979). Например, у
M. scabrinodis секрет этих желез содержит
49% октан-3-она, 18% октан-3-ола, 12%
декан-3-она и по меньшей мере 16
близких к ним соединений-от этанола до
ундекан-3-она. У М. rubra имеется
сходный набор соединений, но в иных
соотношениях (Cammaerts et al., 1981а).
У Monomorium venustum рабочие особи,
для того чтобы заставить других рабочих
выйти из гнезда, устраивают довольно
сложную демонстрацию, состоящую из
особых движений-виляний из стороны в
сторону, толчков головой, ударов
усиками и судорожных пробежек. По
мере иссякания источника корма
демонстрация упрощается: сначала
отпадает виляние, затем удары усиками
и, наконец, пробежки (Szlep, Jacobi, 1967).
Crematogaster, перешедший к жизни на
деревьях примерно в середине третичного
периода (Brown, 1973), в настоящее время
использует для нанесения меток секрет
особых тибиальных желез, находящихся
на задних ногах, которыми он быстро и
энергично барабанит по субстрату, с тем
чтобы кончики лапок распространяли
феромоны (Fletcher, Brand, 1968;
Leuthold, 1968). Один из видов
Novomessor может привлекать
помощников с расстояния до 2 м,
поднимая брюшко и выделяя из кончика
жала летучее вещество; он также
выводит наружу своих сотоварищей по
гнезду, прокладывая ядовитый след, но
не использует для оставления следов
пигидиальную железу. Стридуляция
создает звуки, распространяющиеся через
субстрат и усиливающие реакцию на
феромоны (Holldobler et al., 1978; Markl,
Holldobler, 1978).
Аналогичный ряд последовательных
этапов в процессе мобилизации
существует у Formicinae. Wallis (1964)
не смог обнаружить никаких признаков
мобилизации помощников у Formica
fusca, однако возможно, что эти
муравьи прокладывают
мобилизационный след при помощи
материала, выделяемого задней кишкой,
и возбуждают потенциальных
фуражиров, производя виляющие
движения (Moglich, Holldobler, 1975).
Camponotus pennsylvanicus ведет себя
66 / лава 4
Рис. 4.2. Соотношение между расстоянием до
источника пищи и длительностью звукового
сигнала у Apis mellifera и Melipona quadrifascia-
ta. (Esch et al., 1965.)
подобно F. fusca, с той разницей, что
он добавляет к следу еще муравьиную
кислоту (Traniello, 1977). С. socius
уделяет больше внимания вербовке
помощников; разведчик прокладывает
след из выделений задней кишки
(возможно, это экскременты
с добавлением секрета ректальных
желез), ведущий прямо к гнезду,
устраивает в гнезде демонстрацию
с вилянием брюшком и предложением
пищи, собирает несколько десятков
помощников, а затем ведет их за собой
по следу; муравьиная кислота,
выделяемая ядовитой железой
разведчика, активизирует следующих
за ним особей (Holldobler, 1971).
У С: sericeus разведчик медленно
выходит наружу, а за ним следует
лишь одна особь, прикасающаяся к нему;
в случае утраты контакта ведущий
останавливается, чтобы восстановить
связь, используя след в качестве
путеводной нити (Holldobler et al., 1974;
Maschwitz, 1975a).
Melipona - один из родов безжалых
пчел-ведет группы рабочих особей
к корму после того, как поднимет
других пчел жужжанием и пробежками;
разведчица движется зигзагами в нужном
направлении, а за ней летят другие
пчелы. Они пролетают таким образом
всего 30-50 м (М. quadrifasciata) или
10-20 м (М. seminigra). Хотя
теоретически этого достаточно, чтобы
установить направление, требуется
повторить такой путь много раз,
прежде чем мобилизованные
рабочие-помощницы начнут искать корм
дальше того места, до которого
их доводят (Holldobler, 1977).
Длительность жужжания коррелирует
с расстоянием до корма (рис. 4.2),
поэтому возможно, что сведения
о расстоянии передаются при помощи
звуков, хотя это еще не подтверждено
(Esch, 1967; Esch et al., 1965).
Apis mellifera тоже издает жужжание,
Групповая фуражировка 67
продолжительность которого
пропорциональна расстоянию до
источника корма и которое передается
восприимчивым пчелам в виде вибрации
сота (Wenner, 1962). Этим жужжанием
пчелы сопровождают свой знаменитый
«виляющий танец» (в основном это
пробежка по прямой, во время которой
брюшко движется из стороны
в сторону). С расстоянием до корма
коррелирует также то, на какой глубине
в улье исполняется танец, его
продолжительность, длина прямой
пробежки и число совершаемых при
этом виляний. Таким образом, танец
содержит избыточную информацию, что
характерно для языков вообще, и трудно
решить, какой элемент (если таковой
существует) играет наиболее важную
роль1.
Apis Jlorea часто танцует на площадке
поверх своих сотов и способна указать,
в каком направлении находится пища;
разумеется, расстояние при этом
уменьшено (Free, Williams, 1979).
A. dorsata танцует на своих
вертикальных сотах, но преобразует
указание «к солнцу» в указание «вверх»:
направление указывается как угол,
который оно образует с направлением
«вверх», а не «к солнцу», т. е. так же,
как у A. mellifera. Такое преобразование
свойственно не только пчелам; муравьи,
бежавшие по горизонтальной пластинке
под определенным углом к солнцу,
побегут под тем же углом
к направлению вверх, если поставить
пластинку вертикально (Markl, 1964).
При этой системе не учитывается
высота источника корма над землей.
। Поскольку молодые пчелы могут считывать
информацию, содержащуюся в танце, только
после обучения (Лопатина, 1971), можно пред-
полагать, что для разных особей информа-
тивными могут быть разные элементы танца-
Прим. ред.
Однако, обнаружив источник корма,
расположенный на некоторой высоте
или на земле вблизи улья, пчела
выполняет «круговой танец», сообщая
своим подругам, что следует искать
пищу поблизости. Медоносные пчелы
разных подвидов исполняют круговой
танец при разных расстояниях до
источника корма: A. mellifera ligustica-
в том случае, если корм находится
в радиусе 100 м, А. т. carnica-
в радиусе 85 м, А. т. fasciata-
12 м, A. indica-всего лишь 2 м
(Holldobler, 1977). При больших
расстояниях наблюдается постепенный
переход к виляющему танцу.
Медоносные пчелы обладают
прекрасной памятью, хорошо развитым
чувством времени, хорошим обонянием,
цветовым зрением и способностью
легко осваиваться с процедурой
эксперимента, а также с присутствием
и действиями экспериментатора
(Wells, 1973; Wenner, 1974). Помимо
внешнего вида и запаха
экспериментатора пчеле приходится
привыкать к запахам, возникающим,
когда люди топчут растения, скашивают
траву или метят пчел красками,
а также осваиваться с различиями
в естественной растительности
и ландшафте. Если приучить пчел
к раствору сахарозы с определенным
запахом, а затем дать раствору
высохнуть, то достаточно вдуть
немного душистого воздуха в улей,
чтобы пчелы вылетели и устремились
к знакомому блюдцу или к любому
другому блюдцу, издающему тот же
аромат. Пчел привлекают также другие
пчелы-как своим видом, так и запахом,
который от них исходит; возможно, это
тот же запах, что в улье и у входа
в улей (Ferguson, Free, 1979). Таким
образом, существует много источников
ошибок при проведении экспериментов,
и необходим тщательный контроль.
68 /' шва 4
Чтобы избежать всего этого, Gould
(1976) использовал то обстоятельство,
что пчелы ориентируют свой танец
относительно внутреннего источника
света в улье таким же образом, как
если бы это было солнце. Заклеивая
разведчицам глаза, он смог понизить
их чувствительность к источнику света,
помещенному в улье, так что они
не обращали на него внимания и
исполняли танец как обычно,
направляясь вверх по сотам; однако
мобилизованные ими новички,
способные видеть свет, так как их
глаза не были заклеены, воспринимали
указания о направлении неверно.
Реакция на запах не оказала бы такого
влияния.Паратион сокращает длину
прямого пробега при виляющем танце,
который при этом неверно указывает
более близкое расстояние, чем на самом
деле; пчелы следуют этому указанию
и направляются к более близкому
месту, чем надо, игнорируя сигналы,
поступающие от местных запахов
(Gould, 1976). В настоящее время нет
сомнений в том, что медоносные пчелы
общаются друг с другом при помощи
символов, однако все еще остается
неясным, в какой мере они их
используют. Очень часто танцы,
сообщающие об источниках корма,
не привлекают внимания; на них
реагируют только молодые, неопытные
сборщицы, причем им надо наблюдать
эти танцы по многу раз, чтобы понять
заключенное в них сообщение. У более
старых пчел, у которых уже
выработались определенные привычки,
по-видимому, имеется пристрастие к тем
или иным цветкам, раскрывающимся
в разное время дня; поэтому они сидят
в каком-нибудь укромном уголке улья,
пока одна из вернувшихся разведчиц
не сообщит, что «их цветок» готов;
сигналом здесь может быть только
запах. Во всяком случае, пчелы
примерно знают, в какое время дня
раскрывается тот или иной цветок,
и ждут подтверждения от
возвращающихся разведчиц.
Небольшие ошибки в танцах пчел,
указывающих направление, можно
объяснить наличием в передней части
брюшка магнитных гранул,
чувствительных к магнитному полю
Земли. Эти ошибки можно устранить
наложением магнитного поля
противоположного знака. Кроме того,
Tomlinson et al. (1981) показали, что
если около пчелы, исполняющей
обычный танец, поместить магнит, то
продолжительность танца сокращается
с 34 до 19 с; это подтверждает, что
пчелы чувствительны к магнитному
полю, и показывает, что очень
неоднородное поле тоже может
повлиять на танец. Наконец, у Meliponini
наблюдается даже элемент мобилизации
путем привода: после того как две
группы меченых пчел получали корм
на кормушках, расположенных на
разной высоте и закрытых ширмой,
некоторые из этих пчел возвращались
из гнезда, сопровождаемые новыми
(немечеными) особями, которым они,
очевидно, служили проводниками
(Wellington, Cmiralova, 1979). Описаны
и другие эксперименты,
подтверждающие это представление
(Friesen, 1973).
Apis mellifera издает запах, исходящий
от желез Насонова (возможно,
гомологичных пигидиальным железам
муравьев); этот запах распространяется
в воздухе и, по-видимому, используется
в тех случаях, когда природных запахов
мало, например при движении роя
и образовании роевого клуба (Free,
1968). Важную роль играют также менее
летучие вещества, распространяемые
лапками пчел, когда они ходят около
корма, поедают его или же входят
в улей (Ferguson, Free, 1979). Эти
Групповая фуражировка 69
вещества специфичны для каждой семьи
и, по-видимому, выделяются
межсегментными железами,
расположенными на дорсальной стороне
брюшка, а не железами Насонова; оно
летуче и может привлекать фуражиров
к источникам пищи.
4.2. Групповые рейды
муравьев-
рабовладельцев» 1
Leptothorax acervorum (Myrmicinae)-
мелкие муравьи, живущие небольшими
семьями. В Европе на них охотятся
другие муравьи - Harpagoxenus sublaevis,
принадлежащие к той же трибе. Они
осаждают гнезда Leptothorax и убивают
всех рабочих особей, пытающихся
спастись бегством, откусывая у них
усики и ноги своими чрезвычайно
сильными, хотя и лишенными зубчиков
мандибулами. Прежде чем начать осаду,
Н. sublaevis собирает группу особей,
выводя их из гнезда по одной после
«призыва», выражающегося в выделении
капельки яда. Куколок, личинок и яйца
грабители уносят в свое гнездо
и сортируют; яйца и личинки
выбрасываются, но некоторым куколкам
удается выжить; они развиваются во
взрослых особей, которые выполняют
функции рабочих в гнезде Harpagoxenus,
и их вполне обоснованно называют
«рабами», так как их труд идет на благо
только их хозяевам (Moglich, 1975;
Winter, 1979).
В восточной части Северной Америки
Harpagoxenus americanus использует
1 „Рабовладение" у муравьев-это одна из
форм социального паразитизма-куколочный
паразитизм. Паразиты („рабовладельцы") на-
падают на гнезда хозяина („раба") и похищают
его куколок. Рабочие, вышедшие из этих куко-
лок, выполняют в гнезде паразита различные
работы по выращиванию расплода, постройке
гнезда и т. а..-Прим. ред.
муравьев Leptothorax longispinosus
и другие виды. Разведчики
отправляются на поиски в одиночку
или небольшими группами, в которые
могут входить даже несколько рабов.
Если одиночный разведчик находит вход
в гнездо подходящего вида, он сразу
поворачивает назад, активизирует
потенциальных фуражиров и менее чем
через минуту возвращается, волоча свое
жало по земле, а за ним следует
цепочка его сотоварищей по гнезду,
после чего сразу предпринимается атака.
Если же гнездо находит группа
разведчиков, то некоторые из них
возвращаются в гнездо за
подкреплением, а другие немедленно
начинают атаку. По-видимому, этот вид
легко одолевает своих жертв, возможно
с помощью какого-то репеллента,
выделяемого мандибулярными
железами. Рабочие и половые особи
вида-жертвы спасаются бегством, но
Н. americanus перехватывает всех
рабочих, несущих личинок и яйца, и
отнимает их. Хищник съедает яйца
и личинок, но не куколок и не взрослых
половых особей; из куколок выходят
рабочие, а половые особи получают
возможность основать новые семьи-это
выгодно обоим видам. Рабочие-рабы,
участвующие в этих набегах, не могут
вызвать паники и никогда не играют
в них ведущую роль, хотя в своем
гнезде они дерутся с представителями
собственного вида (Alloway, 1979).
Leptothorax duloticus в той же области
нападает на те же самые виды
Leptothorax, что и Harpagoxenus, но
менее умело; мобилизация у него
проходит медленно, жертва энергично
сопротивляется, и много муравьев
гибнет. Хищник может проникнуть в
гнездо жертвы, но вместо того, чтобы
забрать с собой яйца, личинок и
куколок, он удаляет мертвых особей
и пожирает большую часть расплода,
70 I'.шва 4
в том числе куколок половых особей
(Alloway, 1979). Поведение этого вида-
одна из стадий в эволюции
взаимоотношений хищник-жертва
и «рабовладелец-раб» от
предшествующего состояния
межвидовой конкуренции (Wilson, 1975;
см. также Biischinger et al., 1980).
В Европе Formica sanguinea нападает на
F. fusca и другие близкие виды подрода
Serviformica, обращая их в рабство.
«Рабовладельцы» чрезвычайно
придирчивы в выборе «рабов», и, как
правило, в каждой данной семье все
рабы принадлежат к какому-то одному
виду; возможно даже, что
рабовладельцы выбирают рабов,
относящихся к определенной расе
(Dobrzanska, 1978). В Северной Америке
аналогичные отношения существуют
между F. subintegra (рабовладелец) и
F. pergandei (раб); разведчики,
несомненно, прокладывают след,
мобилизуют других особей и приводят
их к гнезду жертвы (Regnier, Wilson,
1971). F. subintegra использует секрет
своих необычайно сильно развитых
дюфуровых желез, чтобы вызвать
панику среди рабочих особей
вида-жертвы, которые, что весьма
разумно, не оказывают сопротивления,
а разбегаются, часто взбираясь на
растения. Об усиленном
использовании дюфуровых желез
у F. sanguinea данных нет; неизвестны
и приемы, которые этот вид применяет
при нападении на жертву, за
исключением того, что он использует
при этом свои снабженные зубчиками
мандибулы. Оба вида извлекают из
гнезд жертвы куколок и уносят их
к себе; многих они поедают, но из
некоторых выходят рабочие,
увеличивающие число «рабов». Это
всего лишь своего рода отбор, так как
личинки и яйца развиваются и дают
зрелых особей.
В Европе и Северной Америке есть
группа видов, принадлежащих к роду
Polyergus (муравьи-амазонки), -
облигатных «рабовладельцев».
Относительно обитающего в Европе
Р. rufescens неизвестно, прокладывает
ли он след для мобилизации
помощников, но североамериканский
вид Р. lucidus это делает, и множество
рабочих отправляется по следу за
разведчиком. В таких набегах могут
участвовать сотни муравьев.
Представители рода Polyergus, несмотря
на свои серповидные мандибулы,
по-видимому, избегают убивать жертву,
а просто создают панику, чтобы извлечь
из гнезда куколок и унести к себе.
Они, возможно, используют при этом
феромоны, но не обычный муравьиный
яд (муравьиную кислоту), который
у Polyergus вырабатывается в очень
малых количествах (Czechowski, 1977;
Dobrzanska, 1978). Эволюционная
конвергенция между рабовладельческими
видами Formicinae и Myrmicinae
поразительна.
4.3. Тоннели и дороги1
Большинство высокоорганизованных
муравьев и все термиты прокладывают
дороги (tracks) на поверхности земли
или подземные ходы (тоннели), ведущие
из их гнезд в окружающую местность.
Эти дороги образуются на месте часто
посещаемых пахучих троп (trails), и их
постоянно подновляют, так что они
сохраняются и после зимовки; в тех
случаях, когда насекомые применяют
посторонние материалы, например
картон, уместен термин «шоссе».
Тропы и тоннели, поверхность которых
1 Терминология этого раздела не совпадает с
принятой в нашей литературе. См. предисловие
редактора перевода.- Прим. ред.
Групповая фуражировка 71
выравнивается и с которых убираются
различные препятствия, позволяют
быстрее передвигаться, и их легче
защищать от грабителей. Где есть
дороги, там прокладываются и следы
для мобилизации помощников и
фуражиров, и всякого рода танцы и
другие демонстрации тоже обыкновенно
происходят на дорогах, а не в гнезде;
таким образом, эти дороги служат
своего рода продолжением гнезда, и
обычно на них находится некоторый
резерв потенциальных фуражиров. Их
охраняют, и зоны, которые они
обслуживают, тоже используются
и монополизируются, так что
территория около гнезда превращается
в охраняемую кормовую территорию.
Приводимые ниже примеры
расположены в порядке увеличения
сложности: сначала идут те, которые
относятся к муравьям, а затем-
относящиеся к термитам. Myrmica
ruginodis устраивает над скоплениями
своих тлей земляные навесы и охраняет
их. Эти обособленные участки
структурно не объединены, но поскольку
муравьи постоянно переходят от одного
из них к другому, они преимущественно
охотятся в одних и тех же местах, так
что перекрывание между зонами
фуражировки уменьшается. Этот
и другие виды рода Myrmica используют
менее летучие фракции секрета
дюфуровых желез для того, чтобы
метить территорию (см. гл. 3).
У таксономически близких видов
М. ruginodis и М. rubra эти фракции
содержат неразветвленные насыщенные
и мононенасыщенные углеводороды,
тогда как у двух других видов-
М. scabrinodis и M.sabuleti, тоже близких
друг другу,-они содержат фарнезин и
его гомологи. Первые два вида не
могут отличать свои территории
от территорий другого вида, так как
феромоны, содержащиеся в выделяемом
их жалом секрете, не обладают
видоспецифичностью (Cammaerts-Tricot
et al., 1977; Cammaerts et al., 1981b).
Это не означает, что особи этих двух
видов не различают своих и чужих;
такое различение возможно даже на
уровне семей.
Monomorium pharaonis прокладывает
прерывистые следы с помощью своей
ядовитой железы, и вблизи гнезда, где
эти следы накладываются друг на друга,
они образуют заметные дороги (Sudd,
1960). Следы создает смесь алкалоидов
(по меньшей мере пяти типов) и одного
бициклического ненасыщенного
углеводорода-С]8НЗО (Ritter et al., 1975).
Яд используется для того, чтобы
отпугивать других муравьев от корма, а
мобилизация фуражиров производится
при помощи определенного поведения и
секрета дюфуровой железы (Holldobler,
1973). Американские муравьи-жнецы
Pogonomyrmex rugosus и Р. barbatus
прокладывают мобилизационные следы с
помощью жала, используя секреты
ядовитых и дюфуровых желез;
в последнем преобладают алканы с 12-15
атомами углерода в цепи, как линейные,
так и с боковыми метильными группами
(Regnier et al., 1973); малые
кислородсодержащие молекулы,
имеющиеся у Myrmica, у Pogonomyrmex,
по-видимому, отсутствуют, так же как и
терпеноиды. Пахучие тропы со временем
превращаются в дороги, причем дороги
одной семьи могут располагаться между
дорогами другой (рис. 4.3), но не
пересекаются и не сливаются с ними
(Holldobler, 1976а). У этого вида, как и у
Р. badius, обычно бывает по нескольку
дорог, как правило, менее 5 м в длину, из
которых одна - главная; с этих дорог они
занимаются фуражировкой, передвигаясь
по территории, которая не охраняется
целиком, но заходить на которую члены
соседних семей явно избегают (Harrison,
Gentry, 1981).
72 I .шва 4
Рис. 4.3. Расположение гнезд, троп и следов
или кормовых участков у трех видов Pogo-
nomyrmex (Р. maricopa, Р. rugosus и Р. barbatus)
в штате Аризона. Прерывистые линии - Р. ma-
ricopa; квадратики из четырех точек -Р. rugo-
sus; черные квадратики-Р. barbatus; белые
кружки - места драк между Р. rugosus и Р. bar-
batus; черные кружки-места внутривидовых
драк между особями Р. rugosus или Р. barbatus.
(Holldobler, 1976а.)
У Veromessor pergandei - муравья,
обитающего в пустынях Северной
Америки,-по-видимому, имеются первые
зачатки постоянных дорог, ведущих к
местам сбора семян, находящимся на
расстоянии до 45 м от гнезда; утром
рабочие внезапно покидают гнездо,
отправляясь по той же дороге, по
которой ходили накануне (Tevis, 1958).
Сначала все муравьи движутся от гнезда
к корму, но когда температура воздуха
достигает 32°С, выход из гнезда
прекращается, а при 44°С все муравьи
находятся под землей. Многие
возвращаются без корма. Такой
коллективный выход в течение короткого
периода благоприятного освещения
и температуры говорит, пожалуй, о том,
что эти муравьи систематически
используют пищевые ресурсы, а не
следуют за разведчиком, обнаружившим
источник корма; однако характер
организации их деятельности все еще
остается неясным (Holldobler, Moglich,
1980). Bernstein (1975) высказала мнение,
что муравьи ежедневно обследуют сектор
с центральным углом 15°; она считает
также, что в горах, где семян больше,
радиус зоны фуражировки короче
и поворачивается медленнее.
Групповая фуражировка 73
У Pheidole militicida-муравья, у которого
рабочие особи распадаются по размерам
на два класса, дороги достигают 2 см в
ширину и тянутся примерно на 40 м,
однако они существуют лишь несколько
недель, после чего сохраняются только
вблизи гнезда (Holldobler, Moglich, 1980).
Для этих муравьев характерна
территориальность: в месте пересечения
дорог, принадлежащих разным семьям,
рано или поздно возникают драки,
особенно если рабочие, возвращаясь, по
ошибке попадают в чужое гнездо.
Дороги прокладываются рабочими,
которые собирают корм у одного из
многочисленных входов в гнездо
и медленно движутся туда и обратно,
оставляя следы из выделяемого жалом
яда и секрета дюфуровой железы; спустя
несколько часов группа движется по
новому пути. Эти дороги ведут в новые
места; они возникают не из хорошо
освоенных пахучих троп, как дороги
Monomorium, и свидетельствуют
о групповом обследовании.
Solenopsis invicta в североамериканских
грасслендах строит тоннели; от каждого
гнездового холмика отходит примерно
по шесть ходов, расположенных на
глубине около 1 см от поверхности земли
и многократно ветвящихся на
протяжении 20 м. От них на некотором
расстоянии друг от друга отходят
вертикальные стволы, ведущие на
поверхность. Разведчики S. invicta
оставляют следы из секрета дюфуровой
железы, представляющего собой,
по-видимому, смесь ненасыщенных
углеводородов, большей частью
видоспецифичных; этих следов
оказывается достаточно для мобилизации
рабочих-никаких демонстраций не
требуется (Wilson, 1962). Следы
S. geminata и 5. xyloni сходны между
собой, но отличаются от следов S. invicta
и S.richteri (Barlin et al., 1976). Свежие
следы привлекают муравьев сильнее, чем
старые, вероятно из-за содержащихся в
них летучих соединений. Diplorhoptrum
fugax, родственный Solenopsis, живет в
гнездах муравьев, значительно
превосходящих его по размерам
(обычно это Formica), в качестве
специализированного хищника: он
проделывает ходы к их камерам
с расплодом, чтобы добраться до
личинок, которых он поедает;
используемые ходы помечены секретом
дюфуровых желез. Хищник метит
личинок Formica отпугивающим
ядовитым веществом, содержащим
алкалоид, близкий к тому, который
содержится в секрете Monomorium
pharaonis’, это заставляет рабочих,
охраняющих личинок, разбегаться (Blum
et al., 1980; Holldobler, 1973).
Наиболее продвинутые в эволюционном
отношении Attini могут проходить
расстояния в несколько сот метров,
чтобы добыть пищу для своих грибов.
Дороги разных видов Асготугтех
различаются по ширине, длине и числу.
Рабочие особи одного из видов,
обитающего в пустыне,-Л. versicolor,
которого изучал Gamboa (1975)
в Аризоне, занимаются фуражировкой в
одиночку, собирая после дождя вокруг
гнезда зеленую растительность, но
вместе с тем прокладывают несколько
дорог шириной 10-14 см и длиной до
17 м, которые они очищают от растений.
Фуражиры сходят с этих дорог, чтобы
срезать листочки: для этого они
обхватывают стебель своими
зазубренными мандибулами и движутся
вокруг него из стороны в сторону, как бы
перепиливая его. Как обычно бывает,
часть дороги, которая ближе к гнезду,
выражена лучше, чем дистальная ее
часть. Виды Atta, семьи которых состоят
из миллионов рабочих, строят еще более
крупные дороги-шириной до 30 см и
длиной до 250 м; они время от времени
расчищают дорогу, ловко срезая
74 Глава 4
растения; кроме того, ее вытаптывают
непрерывно снующие по ней муравьи
(Weber, 1972). По этим дорогам
возвращаются разведчики, прокладывая
следы с помощью секрета своих
ядовитых желез, который содержит
специфический алкалоид (Tumlinson et al.,
1971), мобилизующий рабочих на
фуражировку в новых местах. Robinson et
al. (1974) описали использование следов
рабочими особями у четырех видов Atta.
A tta cephalotes обитает в дождевом лесу,
и рабочие ходят более чем за 200 м,
чтобы срезать кусочки листьев; на
вырезание каждого кусочка уходит по
2 -3 мин. Ненагруженные рабочие
проходят по 2 м в минуту по свободным
тропам, но движутся вдвое медленнее,
если тропа забита. Несмотря на это, нет
никаких признаков регулирования
движения. На острове Тринидад
ежедневная фуражировка начинается
в любое время суток, хотя чаще ночью, и
достигает полного развития по
прошествии 2 ч; затем она продолжается
в среднем 7,5 ч днем и 12 ч ночью.
Выходы из разных гнезд и даже из
разных секций одного гнезда часто не
согласованы во времени, возможно из-за
неожиданностей при обнаружении пищи.
Следы, идущие от гнезд разных семей, не
перекрываются; вероятно, при их
прокладке муравьи из разных семей
просто избегают друг друга, так как
никаких драк не наблюдается. Таким
образом, эти пахучие тропы служат
структурной основой системы,
поддерживающей распределение особей
на кормовом участке (Lewis et al., 1974;
см. также Stradling, 1978а).
В лабораторных условиях муравьи Atta
cephalotes прокладывают след от зеленого
корма к гнезду; разведчики пробегают
несколько раз взад и вперед, но сами не
срезают листья и не перетаскивают их,
хотя рабочие особи, которые переносят
листья, тоже прокладывают следы (Jaffe,
Howse, 1979). Число муравьев, занятых
фуражировкой, после периода быстрого
увеличения устанавливается на каком-то
постоянном уровне, так как разведчики,
вместо того чтобы прокладывать следы,
начинают собирать корм. Это, вероятно,
реакция на плотность рабочих особей,
занятых сбором корма, или на
накопление нарезанных листьев
в наружных камерах гнезда. Если на
время лишить муравьев пищи, они
начинают собирать больше корма.
Наблюдаются также определенные
предпочтения-фуражиры даже готовы
совершать более дальние походы за
более лакомой пищей. Возможно, что те
рабочие, которые активнее
и сообразительнее других, способны
оценивать запасы корма, его качество и
местонахождение и стараются вести
других на лучшие места. Помимо
нанесения следов жалом A. cephalotes
метит незнакомые участки пахучим
секретом желез, расположенных
у основания створок яйцеклада; для
этого они медленно водят из стороны в
сторону кончиком брюшка по земле (ср.
Pheidole militicida). Как только
какой-нибудь участок помечен этим
секретом, у рабочих больше не
наблюдается характерного проявления
беспокойства, которое выражается
в поднятии брюшка. Этот „терри-
ториальный секрет" специфичен для
каждого вида и для каждой семьи, но,
что несколько странно, при 27°С он уже
через час улетучивается и его нужно
постоянно возобновлять (Jaffe et al.,
1979). В самых засушливых частях своего
ареала-в восточном Техасе- Atta texana
проделывает подземные тоннели,
тянущиеся от гнезда, чтобы уберечь
фуражиров от обезвоживания.
A. mexicana-вид, еще более
приспособленный к условиям пустыни,-в
пустыне Сонора проделывает на глубине
30 см тоннели длиной около 10—60 м;
Группова фуражировка
75
выходя на поверхность, они
превращаются в заметные дороги,
которые тянутся еще примерно на 70 м, а
затем теряются (Mintzer, 1979).
По-видимому, эти тоннели создаются
постепенно, по мере роста популяции;
они связаны с поверхностью стволами,
отходящими от них через определенные
промежутки.
Приведем лишь несколько примеров,
относящихся к другим подсемействам,
чтобы проиллюстрировать разнообразие
муравьиных дорог и их использование.
Читатели, которых это интересует, могут
обратиться к оригинальным работам. На
острове Шри Ланка (Цейлон) муравьи
Leptogenys occilifera (Ponerinae) охотятся
на червей и термитов с постоянных
охраняемых дорог; найдя червяка,
разведчик возвращается к ближайшей
тропе и мобилизует помощников, чтобы
вытащить червя и разрезать его на части.
Термиты складываются в кучки, а затем
рабочие, мобилизованные на дорогах,
уносят их в гнездо. Никаких специальных
демонстраций разведчики не устраивают;
запах мобилизационного следа приводит
к нужному месту сотни дополнительных
рабочих (Maschwitz, Schomegge, 1977).
Дороги лесных муравьев Formica rufa,
F. opaciventris и других дают возможность
рабочим добираться до кормовых
деревьев и возвращаться назад со
скоростью, лимитируемой только
загруженностью самих этих дорог.
Муравьи используют уже существующие
твердые поверхности, например дорожки,
протоптанные людьми, или стволы
деревьев, но их рабочие особи создают
также собственные дороги, непрерывно
протаптывая и специально расчищая их.
Поскольку насекомые пользуются своими
дорогами до глубокой осени, не
удивительно, что вблизи гнезда они
сохраняются до весны и их можно
бывает восстановить (Mabelis, 1979b).
Фуражиры, найдя добычу, не бросаются с
ней к ближайшей дороге; они сначала
оценивают ее с количественной
и качественной стороны, обследуя
местность, а затем прокладывают след,
используя выделения задней кишки.
Выйдя на дорогу, они мобилизуют
рабочих, энергично демонстрируя им
определенное поведение, после чего
мобилизованные особи отправляются на
сбор корма. С наступлением сумерек
рабочие отдыхают в гнезде, но на
следующее утро число их вновь
увеличивается; это свидетельствует
о том, что память о месте и событии за
ночь не стерлась (de Bruyn, Mabelis,
1972). Отдельные фуражиры совершают
один и тот же путь день за днем,
подобно медоносным пчелам. Более
старые рабочие, сильнее реагирующие на
свет, начинают трудиться раньше
и стимулируют молодых особей, которые
лучше поддаются влиянию
и отправляются в места с более
оживленным движением (Rosengren,
1977). Старые фуражиры задерживаются
на куполе гнезда и охраняют его; кроме
того, они служат кладезем информации и
резервом рабочей силы: если удалить
фуражиров с одной из дорог, эти
охранники выводят из гнезда новых им
на смену. Для того чтобы блокировать
одну из дорог, надо удалить с нее
фуражиров, убрать муравьев-охранников
и поставить поперек нее какую-либо
физическую преграду (рис. 4.4); тогда
муравьи сделают новую дорогу в обход
препятствия, вдоль этой преграды, пока
не дойдут до ближайшей радиальной
дороги (Zakharov, 1980). Лесные муравьи
охраняют свои дороги от вторжения
членов других семей или видов, и все их
дороги в совокупности образуют
организованную территорию. Дороги не
пересекаются, и обычно бывает только
по одной дороге на каждое дерево; если
их две, то они отходят от проти-
воположных сторон ствола (рис. 4.5).
76 Г.шва 4
--- Первоначальные дороги
----Добавленные участки
---- Дороги, существовавшие до
устройства стенки
Рис. 4.4. Дороги Formica rufa, ведущие от
гнезда к деревьям, на которых есть тли. После
того как одна дорога была перегорожена стен-
кой, другие дороги были продлены, а перего-
роженная исчезла. (Захаров, 1980.)
Черный как смоль Lasius fuliginosus
фуражирует на поверхности почвы. Его
тоннели тянутся от гнезда на много
метров, иногда располагаясь просто под
слоем мха, но обычно глубже-даже в
корнях берез (Dobrzanska, 1966). Тоннели
выложены картоном, так же как и гнездо,
продолжением которого они служат. У
оснований деревьев располагаются
„станции" (которые служат просто
укрытием от солнца и в которых муравьи
могут оставаться до двух часов),
соединенные ходами и выложенные
картоном (рис. 4.6). Эти муравьи тоже
устраивают набеги на гнезда других
муравьев, например Formica pratensis, и
воруют у них куколок. Этих куколок они
сваливают на станциях или на дорогах в
кучки, напоминающие кучки термитов,
создаваемые муравьями Ponerinae. По
мнению Dobrzanska, каждая особь Lasius
может выполнять более разнообразные
функции по сравнению с Formica rufa, но
при этом не выходит за пределы
ограниченного участка, так что каждый
участок имеет собственную группу
рабочих с разносторонней
„квалификацией". Феромон,
используемый для прокладки следов,
видоспецифичен; он накапливается
в ректальной жидкости, а следы
прокладываются от местонахождения
добычи до одной из дорог. Этот
феромон содержит шесть алифатических
кислот (от гексановой до додекановой) с
нормальной цепью (Huwyler et al., 1975);
рабочие особи реагируют на этот
феромон без всякого демонстративного
поведения со стороны разведчиков.
11 ре. ic I ави 1 ели полностью древесного
рода Oecophylla (муравьи-портные),
обитающие в Африке и в индо-малайской
области, охотятся и собирают падь на
участке, состоящем из крон нескольких
деревьев (рис. 4.7). Они прокладывали с
помощью ректальной железы следы от
приманки из сахарного сиропа
(Holldobler, Wilson, 1978), а затем, после
соответствующей демонстрации,
мобилизовали с помощью стернальной
железы крупных рабочих на защиту
кормушки (рис. 4.8). В большинстве
случаев один фуражир может поймать и
перетащить добычу, если она не больше
I рупповая фуражировка 7
Рис. 4.5. Территории, занимаемые Formica ро-
lyctena и Lasius fuliginosus в редколесье в райо-
не Бирлапа (Нидерланды) в 1968 г. (Mabelis,
1979а.)
медоносной пчелы, но если ему нужна
помощь, он не прокладывает след, а
использует, подобно некоторым
Ponerinae, свои мандибулярные железы.
Когда мандибулы смыкаются на жертве,
у их основания выступает жидкость,
распространяющая приятный кисловатый
запах (Bradshaw et al., 1979а).
Что представляет собой этот
сигнал-адаптацию к древесному образу
жизни или сохранившийся древний
признак? В состав жидкости входит более
30 летучих соединений, но главные сред!
них - гексаналь и 1 -гексанол. Альдегид
заставляет насторожиться, спирт
привлекает, а второстепенные
компоненты жидкости направляют
и концентрируют поведение рабочего.
Именно в такой последовательности онг
улетучиваются: сигнал должен сначала
насторожить воспринимающую особь, г
затем привлечь к тому месту, где ей
предстоит действовать.
Iridomyrmex humilis (Dolichoderinae)-Tar
называемый „аргентинский муравей"-
делает дороги и, кроме того,
прокладывает пахучие тропы для
мобилизации рабочих; следы он метит
78 Г. шва 4
Рис. 4.6. Гнездо, тоннели и дороги Lasius fuli-
ginosus: /-основное гнездо; 2-отпочковав-
шееся гнездо; 3-гнездо Formica pratensis.
Черные кружочки-сосны; белые кружочки -
березы; двойные линии-дороги, выложенные
картоном; одинарные линии - обычные доро-
ги ; пунктирные линии - временные тропы.
(Dobrzaiiska, 1966.)
секретом расположенной около
анального отверстия „вентральной"
железы (железа Павана), которая имеется
только у некоторых видов из этого
подсемейства (Robertson et al., 1980).
Выделения мандибулярных желез так же
помогают идти по следу, как
у Oecophylla. Еще одна железа-
„анальная", которая гомологична
пигидиальным железам, имеющимся у
всех муравьев, за исключением
Formicinae,- вырабатывает репеллент;
если этим репеллентом пометить пищу, он
отпугивает соперников и может также
использоваться для того, чтобы
закрывать тропы, которые уже не ведут к
корму; последний способ создает
большие возможности в смысле
регулирования движения.
Термиты, вероятно, всегда жили
в тоннелях, как и поныне живут
Calotermitidae и Termopsinae.
Представители других групп строят
тоннели в почве, чтобы соединить свое
гнездо с крупными кормовыми
объектами, которые нельзя сдвинуть с
места, например с бревнами. У этих
тоннелей прочные стенки, делающие их
недоступными для хищников, и они
хорошо выровнены, что способствует
быстрому передвижению по ним.
Некоторые представители рода
Coptotermes уплотняют рыхлую почву и
одновременно выгребают слишком
плотные комки; кроме того, они часто
обмазывают свои ходы экскрементами и
смесью глины со слюной (Lee, Wood,
1971). Эти тоннели не соединяют гнездо с
источником пищи по прямой, а,
по-видимому, создаются постепенно при
переходе от одного кормового объекта к
другому.
Stuart (1969) на примере одного вида
Nasutitermes (Termitidae) описывает
образование троп на стеклянной
пластинке. Первый термит,
столкнувшийся с пластинкой, судорожно
„дергается" и убегает прочь, чтобы
предупредить других контактным
способом. Затем медленно выходят
солдаты и образуют колонну, которая,
по-видимому, прокладывает след: каждая
особь медленно продвигается немного
вперед, а затем уступает дорогу другим,
быстро убегая назад, т. е. движется туда
и обратно, как это было описано выше
I рупповая фуражировка 79
Рис. 4.7. Основания
деревьев (черные кружки)
и территории Oecophylla
longinoda в одном из
заповедников в Кении.
(Holldobler, 1979.)
для муравьев. Так создается
исследовательская тропа,
представляющая собой заявку на новую
территорию; одновременно она служит
продолжением гнезда, хотя никогда не
будет использоваться для выращивания
расплода. Стернальная железа
(рис. 4.9)-межсегментная железа,
подобная пигидиальной, только
расположенная на вентральной
стороне,- поставляет секрет для
прокладки следов и имеется у всех
изученных термитов (Stuart, 1969). Если
разведчики обнаружат пищу,
добавляются новые следы, а если этой
пищи хватает надолго, на следовой тропе
появляются пятна экскрементов
и образуется хорошо заметная дорога,
вдоль которой выстраиваются солдаты
головами наружу; такие дороги
в природе достигают ширины 1 см, а
длина их может составить 50 м и более.
Затем, по мере того как термитам
приходится дробить на части большие
пищевые объекты и переносить их, над
дорогой строится защитное сооружение
из кусочков пережеванной древесины,
скрепленной „анальным
цементом11,-сначала около источника
пищи, а затем вблизи гнезда, после чего
заполняется промежуток. Солдаты стоят
на возводимых стенах до тех пор, пока не
будет построена крыша; в результате
дальнейшего цементирования стены
становятся непрозрачными. Таким
образом исследовательская тропа
превращается в мобилизационную,
а затем в дорогу.
Следует упомянуть об одной интересной
особенности: одно из „щупалец44
80 Г. шва 4
Рис. 4.8. Рабочие особи
Oecophylla, метящие
новую территорию при
помощи ректальной
железы (А, Б)
и мобилизующие
с помощью стернальной
железы крупных рабочих
особей, чтобы они
помогали защищать ее
(В). (Holldobler, 1978,
Vol. 1.)
А
Групповая фуражировка 81
Рис. 4.9. Продольный разрез через
стернальную железу нимфы Zootermopsis
nevadensis (Stuart, 1964, по Krishna, Weesner,
1970, p. 205.)
термитника простирается в новую
местность, и от него отходят ветви к
пищевым объектам, находящимся
достаточно близко для того, чтобы
разведчики могли их обнаружить.
Конечно, трудно установить, в какой
мере термиты используют
предварительные сведения о данной
местности, выбирая направление такого
„щупальца14, но самый метод напоминает
создание аналогичных дорог у таких
муравьев, как Oecophylla
и Pheidole,-дорог, с которых они затем
отправляются на охоту или на сбор
ресурсов.
Термиты Nasutitermes costalis строят
закрытый ход над искусственным следом,
проложенным с помощью спиртовой
вытяжки из экскрементов (Jones, 1980);
при этом они срезают углы и несколько
выпрямляют след. Сначала рабочие
создают каркас из кусочков твердого
материала, размягченного слюной,
а затем заполняют щели экскрементами.
Рабочий, обнаруживший щель,
поворачивается к ней задней частью тела
и заталкивает в нее экскременты, виляя
кончиком брюшка из стороны в сторону.
После того как щели заделаны, мелкие
неровности на еще влажной поверхности
выглаживаются ротовыми частями
с использованием слюны; в результате
получается гладкая прочная стенка.
Казалось бы, все это прекрасно
распланировано, однако на самом деле
многое зависит от случая: если двое
рабочих сталкиваются друг с другом на
дороге, то оба останавливаются и стоят
до тех пор, пока не получат стимула,
побуждающего к деятельности. Рабочие
разного пола, разного возраста
и принадлежащие к разным кастам
реагируют на стимулы по-разному.
Trinervitermes geminatus строит маленькие
холмики, которые служат укрытиями или
„станциями11 для снаряжения экспедиций
за кормом. К источнику пищи-сухой
траве-термиты прокладывают
подземные галереи, а затем проделывают
отверстие, выходящее на поверхность.
Сначала выходят мелкие солдаты,
которые становятся вокруг отверстия
головами наружу, затем собираются
рабочие, снующие взад и вперед, пока не
Фото 11. Крытые ходы для фуражировки,
пост роенные Macrotermes на веточках Balanites
в округе Каджиадо в Кении. [J.P.E.C.
Darlington.]
образуется плотная подвижная колонна,
по 3-4 особи в ряд, с мелкими солдатами
по бокам (все это занимает 30-45 мин).
Такая колонна отходит на 2-3 м от
отверстия, а затем рассыпается по
травяной кочке; на одной кочке может
быть 500-800 рабочих, причем 40-50
особей могут перегрызать один и тот же
стебель или травинку на кусочки длиной
2-20 мм, которые затем уносятся. Когда
спустя примерно два часа фуражировка
будет закончена, рабочие возвращаются к
отверстию сплошным потоком
ненагруженные, а мелкие солдаты быстро
движутся вокруг колонны отчасти для
того, чтобы отпугивать муравьев,
а отчасти-чтобы загонять в колонну
отбившихся рабочих. Затем отверстие
заделывается, а не успевшие войти
внутрь термиты становятся добычей
муравьев. По-видимому, фуражировка
разных семей синхронизирована и все
отверстия открываются в течение
получаса (Ohiagu, Wood, 1976).
Некоторые травоядные термиты слепь.
как, например, Trinervitermes bettonianw.
Когда они выходят на разведку
колоннами, состоящими из рабочих и
солдат, они прокладывают походные
тропы, которые ветвятся и которые
термиты в дальнейшем дополнительно
метят экскрементами, превращая их в
дороги. Эти дороги дают возможность
фуражирам вернуться на базу (к от-
верстию открывающемуся из галереи на
поверхность), так как каждое
разветвление снижает эффективность
воздействия тропы или дороги и таким
образом дает информацию
о направлении. Обнаружив корм,
термиты прокладывают
мобилизационный след и привлекают к
нему внимание других особей, совершаг
резкие движения головой; эти сигналы ш
крайней мере в пять раз более
эффективны, чем исследовательская
тропа, и мобилизуют много новых
особей (Oloo, Leuthold, 1979). Конечно,
исследовательская тропа может
маркироваться главным образом
экскрементами, а мобилизационный
след-прокладываться с помощью
секрета стернальной железы, что
создавало бы качественное различие
между ними, но вопрос этот еще не
вполне ясен. У Т. trinervoides рабочие,
числом до пяти, могут проложить
стернальной железой след,
сохраняющийся примерно 20 мин; этот
след привлекает 100 и более новых
рабочих, сопровождаемых солдатами,
которые следуют за разведчиками
(Tschinkel, Close, 1973).
1ерми1ы рода Hodotermes (Hodoter-
mitinae, Termitidae), в отличие от только
что описанных Trinervitermes, черного
цвета, имеют глаза и способны в дневное
время использовать небесные ориентиры.
Они выходят из своих галерей
независимо от освещения, проводят в
поисках примерно четверть часа, а затем
устанавливают направление для
фуражировки, ведущее к определенному
и, по-видимому, „согласованному"
месту, обычно в пределах 3 м от гнезда
(Leuthold et al., 1976). По этой тропе они
откладывают метки феромоном,
интенсивность которых уменьшается по
мере удаления от выходного отверстия.
Дойдя до места назначения, они влезают
на травинки, отгрызают кусочки длиной
2 -6 см, обычно сухие, и складывают их в
кучки; другие рабочие переносят траву в
гнездо. Таким образом, несмотря на
некоторую способность использовать
зрение, они ориентируются с помощью
исследовательской тропы. В целом
создается впечатление, что в поведении
термитов и слепых муравьев, строящих
тоннели, существует конвергентное
сходство: и те и другие прокладывают
ГрПИЮЧИЧ ф\ 1Ч1.Ж ИроЫЧ. 8.'
исследовательские химические следы от
гнезд или ходов, а также применяют
специальные способы мобилизации
рабочих на сбор корма. Муравьи,
использующие небесные ориентиры,
могут при этом прокладывать дороги, но
последние нужны не для ориентации, а
только для расширения территории,
установления ее границ и большей
быстроты и легкости передвижения.
Ин ।ересеп способ нахождения корма
подземными термитами. Можно было бы
ожидать, что эти термиты находят корм
по какому-либо химическому веществу,
выделяющемуся из древесины,
растительных остатков или
разрушающего их гриба; однако этот
способ, по-видимому, играет
второстепенную роль, во всяком случае у
видов, обитающих в пустыне Чиуауа
(Ettershank et al., 1980). Виды
Gnathamitermes и Amitermes днем уходят в
тень или в прохладное место, а ночью
стараются сберечь тепло, после чего
вновь отправляются на поиски.
4.4. Кочевая фуражировка
Dory linac (муравьи-кочевники) охотятся
на беспозвоночных, примерно
соответствующих им по размерам,
причем свойственный им способ охоты
заставляет их часто менять
местоположение своего гнезда1.
Большинство видов этой группы,
особенно в индо-малайской области и в
Африке, слепы и ведут подземный образ
жизни; они строят временные тоннели от
своих гнезд, и можно даже сказать, что
они проводят почти все время
1 Обычно применительно к муравьям-кочевни-
кам используется термин „бивуак", так как на-
стоящих гнезд они не строят и либо используют
готовые полости, либо (у Eciton) просто обра-
зуют плотное скопление на поверхности почвы,
прикрывая своими телами самку и расплод.-
Прим. ред.
84 /шва 4
в движении по тоннелю или дороге (если
она проложена на поверхности земли),
соединяющей их последовательно
сменяемые жилища. От этой базы они
отправляются на поиски пищи,
прокладывают мобилизационные тропы,
коллективными усилиями собирают
пищу, прячут ее временно на дороге или
около нее, а затем, после периода
набегов, переносят свое потомство
(главным образом личинок) и самку в
новое гнездо, вместо того чтобы
вернуться в старое. Рабочие в возрасте
всего нескольких дней уже выходят из
гнезда и участвуют в набегах в качестве
„загонщиков": они вспугивают жертву, а
старшие особи ее ловят. Дорога
создается, по словам Schneirla (1971),
„путем прокладки следа по эстафете...
муравьи головного отряда не разведчики,
а первопроходцы..." Каждый муравей,
дойдя до конца следа, резко
останавливается, а затем медленно, с
остановками, движется вперед, проходя
каждый раз всего несколько
сантиметров; при этом он трется
брюшком о землю. Проложенные дороги
служат прежде всего для ориентации и
напоминают исследовательские тропы
Veromessor. Pheidole и некоторых
термитов. Колонна муравьев,
прокладывающая тропу, вероятно,
отправляется в путь в ответ на
повышенную потребность в корме для
вновь вылупившихся личинок; они
обычно движутся к участкам с хорошими
пищевыми ресурсами, возможно по
объединяющимся мобилизационным
следам. Eciton hamatum, выходя на охоту,
образует исследовательские колонны
длиной 100 и более метров, расходящиеся
в разных направлениях от их убежища.
Исследовательские дороги используются
для ориентации и прокладываются
с помощью выделений из задней кишки,
как у термитов; их устройством
занимается последовательный ряд
рабочих, каждый из которых медленно
проходит несколько сантиметров, а затем
возвращается. Мобилизационные следы,
проложенные разведчиками,
возвращающимися в гнездо от источника
пищи, вызывают у рабочих качественно
иную реакцию и, вероятно, состоят из
секрета пигидиальной железы (Chadab,
Rettenmeyer, 1975; Holldobler, Engel,
1978). Однако во избежание чрезмерного
упрощения необходимо отметить, что
дорога не только указывает путь, но и
усиливает реакцию на мобилизационные
феромоны (Blum, Portocarrero, 1964).
Такое „приближение гнезда к пище" и
сотрудничество всех особей в процессе
вспугивания и поимки добычи дает
возможность этим муравьям
использовать крупную добычу, например
целые гнезда ос или мелких позвоночных.
Рейд принадлежащих к этой группе
муравьев Neivamyrmex nigrescens,
обитающих в Центральной Америке и
фуражирующих ночью, начинается
с возобновления активности старых
рабочих, которые находятся на
периферии и образуют передовой отряд,
выступающий в ответ на мобилизацию
разведчиками. При наличии
подрастающих личинок эти муравьи
ежедневно передвигаются к месту нового
гнезда по исследовательской дороге,
образовавшейся в результате соединения
троп, идущих от источников корма;
старые рабочие движутся по краям
потока, а более молодые-в середине
(Topoff, Mirenda, 1978). Эти
исследовательские дороги содержат,
возможно, и тактильные сигналы, так как
в тех случаях, когда химические метки
выражены слабо, рабочие
придерживаются оснований больших
камней, стволов деревьев и других
местных ориентиров (Topoff, Lowson,
1979). Однако химического
мобилизационного следа достаточно,
чтобы начать мобилизацию и привлечь к
Группова.ч фуражировка 85
Рис. 4.10. Пути, по которым одна семья
Апотта wilverthi в Конго совершала рейды из
своего гнезда в июне и июле (сплошные
линии). Более толстой прерывистой линией
показан путь в северо-западном направлении,
по которому 12-14 июля семья переселилась в
новое гнездо. (Raignier, van Boven, 1955,
р. 128.)
делу вторичных вербовщиков, которые
бегают быстрее. Таким образом, „волна
возбуждения" распространяется среди
этих муравьев так же быстро, как по
поверхности гнезда лесного муравья
(Topoff et al., 1980а, b). Кроме того, как
показали лабораторные и подтвердили
полевые исследования, муравьи обычно
мигрируют туда, где имеются хорошие
запасы корма и подходящее место для
гнезда. Перекормленные семьи все еще
мигрируют, но далеко не так активно,
как те, которые получали мало корма
(Mirenda, 1980; Topoff et al., 1981).
Африканские Dorylinae почти никогда не
появляются на поверхности земли.
Апотта wilverthi высылает из гнезда
колонны, передвигающиеся под слоем
почвы (рис. 4.10), особенно на солнечных
участках и в ясные дни (Raignier, van
S6 I land -I
Boven, 1955). Ширина колонны достигает
2-6 см, на 1 см2 приходится примерно 13
муравьев, вползающих друг на друга;
они никогда не движутся по прямой, так
что тропы могут раздваиваться,
а немного дальше соединяются вновь. У
этого вида 36% колонн движутся под
землей, а у A.nigricans-52%. Когда
неорганизованное скопление
переселяющихся муравьев покидает
гнездо, стимулом для этого, видимо,
служит требование пищи со стороны
личинок; возбуждение передается
крупным рабочим, находящимся
снаружи, но направление выбирается,
вероятно, случайно, если не считать того,
что муравьи, по-видимому, редко
направляются на восток! Отдельные
особи разбегаются в разные стороны,
обнюхивая и ощупывая поверхность
площадью в сотни квадратных метров и,
наверное, прокладывая ректальный след.
Это скопление постепенно удаляется, и в
течение некоторого времени в него
вливается несколько колонн новых
муравьев из гнезда, но в конце концов
муравьи начинают возвращаться назад с
кормом и направление изменяется на
обратное, так что любой рабочий,
пытающийся выйти из гнезда,
оттесняется назад.
AiKiinnid kohli нападает на гнезда
Cubitermes под землей и медленно, на
протяжении нескольких дней,
завоевывает их (Williams, 1959). Один из
видов Dorylus (принадлежащий к подроду
Typhlopone), который строит подземные
галереи, выходит на поверхность только
во время активной охоты; он поедает
дождевых червей и различных почвенных
насекомых, но время от времени
нападает также на других
муравьев-кочевников. Leroux (1979b)
описывает длительную битву под землей,
начавшуюся с нападения одного из видов
Typhlopone на движущуюся колонну
Апотта nigricans и окончившуюся
в гнезде последних, причем хозяева
разбежались во все стороны.
Нападающие провели под землей 5 ч и
лишь после этого стали выходить на
поверхность и складывать в кучи личинок
Апотта, которых затем, построившись в
колонну, унесли на свою базу. У рабочих
особей Typhlopone короткие и плоские
мандибулы, легко перерезающие
бродячих муравьев. После 12-часового
набега остатки семьи Апотта
попрятались в какой-то щели; самка
была найдена обезглавленной, так что
семья эта могла бы просуществовать
лишь несколько недель, пока все рабочие
не вымрут. Leroux не обнаружил никаких
признаков того, что в этой семье сможет
появиться новая самка.
1Иак. благодаря обмену информацией
наиболее активные и восприимчивые
особи, нашедшие хороший источник
корма, могут призвать на помощь других
особей, чтобы воспользоваться этим
источником до того, как это сделают
члены других семей или другие виды.
Следует, однако, отметить, что
разведчики не торопятся сразу вернуться
на базу, а сначала оценивают количество
и качество корма и в зависимости от
этого реагируют более или менее
интенсивно. Они прокладывают
химические направляющие следы,
усиливают отдельные участки этих
следов другими материалами, выводят из
гнезда своих сотоварищей или отпускают
их одних. Медоносные пчелы передают
информацию о направлении, в котором
следует лететь к корму, и о расстоянии
до него при помощи танцев,
исполняемых в гнезде; однако даже у
пчел может быть так, что танец только
возбуждает рабочих особей, уже
приучившихся к определенному набору
растений. После того как в результате
мобилизации создалась достаточная
группа сборщиков, стимул к передаче
информации ослабевает и число
Групповая фуражировка 87
фуражиров стабилизируется.
И муравьи, и термиты прокладывают
исследовательские тропы; они, вероятно,
создают их лишь после того, как ряд
разведчиков возвращается из
какого-нибудь богатого пищей места.
Эти тропы, которые прокладываются
медленно и систематично и по которым
могут свободно передвигаться
мобилизованные рабочие, охватывают
территорию подобно щупальцам. Но они
могут также служить для
систематического обследования
местности, как в тех случаях, когда
радиус, по которому движутся муравьи,
ежедневно поворачивается на некоторый
угол. У муравьев Dorylinae это
в процессе эволюции перешло
в постоянный кочевой образ жизни,
причем сбор пищи у них происходит
главным образом в периоды роста
личинок. Способность к обмену
информацией достигает причудливой
крайней степени у муравьев-„рабовла-
дельцев“, которые большими группами
вторгаются в заранее найденные гнезда
своих жертв и атакуют их своими
ядовитыми секретами, получая
возможность выбрать и унести с собой
расплод определенного возраста, но
оставляя семью в таком состоянии, что
она может быстро восстановиться.
Глава 5
Гнезда в полостях и почвенные
холмики
общественные насекомые способны
выгрызть камеру в мягкой древесине, в
почве или в сердцевине растения
и закрыть входное отверстие пробкой.
Даже виды, строящие очень сложные
гнезда, часто проходят через стадию, на
которой одна самка или пара половых
особей строит вертикальный ствол
и камеру и сужает вход. Из этого
простого гнезда, первоначально
строившегося для защиты от непогоды и
врагов и для создания удобного
„рабочего места" для выращивания
потомства, в процессе эволюции
возникли огромные сооружения
с кондиционированным воздухом,
в которых обитают многочисленные
семьи. Создание таких сооружений
потребовало тщательного отбора
материалов и развития желез,
выделяющих цементирующие вещества, а
в некоторых случаях даже и самый
строительный материал. Повышение
точности и сложности производимых
операций сопровождалось все большим
сотрудничеством в процессе
строительства. Хотя многие достаточно
сложные гнезда, например соты ос, могут
быть построены одной самкой-
основательницей, для устройства других
необходима совместная деятельность
целой группы особей, чтобы помещение
получилось прочным или теплым; на
вершине эволюции гнездостроения в нем
участвуют разные возрастные группы,
каждая из которых выполняет свои
особые задачи, что приводит
к созданию обширных, тщательно
„спроектированных" гнезд, структуру
которых можно приспосабливать
к текущим потребностям насекомых и
которые достаточно независимы от
условий окружающей среды.
Существуют гнезда двух главных типов.
В одних каждая камера рассчитана на
большое число потомков, которые либо
самостоятельно передвигаются (личинки
термитов), либо их переносят рабочие
особи, распределяющие их по стадиям
развития в разные камеры (у муравьев); в
других расплод распределен по
одиночным ячейкам; личинка может
немножко двигаться в собственной
ячейке, но рабочие особи не переносят ее
из одной ячейки в другую (пчелы и осы).
В этой главе мы опишем конструкцию и
постройку нескольких видов гнезд;
микроклимат гнезд и способы их защиты
от врагов обсуждаются в главах 1 и 8.
5.1. Полости и норки
Осы семейства Tiphiidae, от которых
происходят муравьи, несомненно,
парализовали свою жертву
и откладывали яйца на нее или. в ее
норку, как это делает в настоящее время
Methocha (Wilson, Farish, 1973). Даже
муравей АтЫуоропе pallipes (Ponerinae)
иногда переносит свое потомство на
свою жертву-многоножек (Traniello,
1978). Многие муравьи (например,
Cyphomyrmex и другие примитивные
Attini) все еще используют природные
полости в скалах и камнях, а также
галлы и раковины (Weber, 1972).
Насекомые обычно расчищают эти
полости, а их входное отверстие часто
бывает заблокировано головой
рабочего-сторожа или крышкой из всяких
Гнезда в полостях и почвенные холмики 89
Рис. 5.1. Пчела Braunsapis (Ceratinini),
устроившая гнездо в сердцевине высохшего
стебля. А. Суженный вход. Б. Средняя часть.
В. Запечатанное дно гнезда. (Michener, 1974).
обломков. Примитивные эусоциальные
пчелы из трибы Ceratinini-единственные
пчелы, устраивающие камерные гнезда
(рис. 5.1); они забираются в полые
стебли, очищают и расширяют полость и
сужают вход (Michener, 1974).
Очень простые норки роют самки
муравьев или пары термитов после
брачного лёта и после того, как они
сбросили крылья. Самки-основательницы
муравьев-бульдогов (Myrmecia) строят
наклонный ствол, ведущий в камеру с
расплодом, и расположенную у самой
поверхности горизонтальную галерею, из
которой они отправляются по ночам на
охоту (Haskins, Haskins, 1950, 1964).
Самки-основательницы Monica rubida
(Myrmicinae) тоже выходят на охоту;
каждая из них строит вертикальный
ствол около какого-нибудь камня,
а уходя на охоту, засыпает его всяким
мусором для маскировки. У Manica нет
такой поверхностной горизонтальной
галереи, как у Myrmecia, а несколько
узких вертикальных стволов ведут вниз, в
грубозернистый песок, заканчиваясь
небольшими камерами (LeMasne,
Bonavita, 1969). У Attini самка-
основательница часто начинает рыть ход
под упавшим листом, быстро
прокапывает его на глубину около 20 см
(в зависимости от стратификации почвы
и влажности), а затем устраивает сбоку
от него камеру, куда выбрасывает
инфрабуккальный комочек грибных
спор 1. Уже на следующий день
появляются гифы. Самка бросается
наружу, чтобы собрать корм для грибов,
а затем вновь закрывает вход. Спустя два
месяца выходят молодые рабочие особи
и строят конус или башенку из свежей
земли (Weber, 1972). Поверхностные
горизонтальные галереи имеются даже
там, где самки-основательницы уже не
выходят за кормом; у Solenopsis invicta
(Myrmicinae) самки не занимаются
фуражировкой, но тем не менее в гнезде
имеется поверхностная горизонтальная
галерея вверху и камера у основания
(Lofgren et al., 1975; Markin et al., 1972).
Это позволяет самке выбирать то
помещение, температура которого ей
больше подходит.
1 У муравьев-листорезов молодые самки, выле-
тающие из гнезда, несут в инфрабуккальной ка-
мере ротового аппарата споры гриба для буду-
щего „грибного сада“-Прим. ред.
90 / ии;ч 5
У 1ерми гов царица никогда не бывает
одна; ее брачный партнер помогает ей
рыть норку и охраняет гнездо от других
самцов. Термиты не только заделывают
вход в гнездо землей, но и запечатывают
его быстро твердеющей жидкостью,
которая состоит из выделений задней
кишки с примесью экскрементов (Nutting,
1969, р. 263); стенки гнезда иногда тоже
обмазываются экскрементами. Пары
Allodontotermes, которых содержали
в лаборатории в пробирках, совместными
усилиями выкапывали вертикальный
ствол диаметром 5-8 мм и длиной
8-10 см; этот ствол вел
в горизонтальную камеру длиной 2 и
шириной 0,5 см, с плоским полом
и гладкими блестящими стенками,
закрывавшуюся перегородкой, имеющей
гранулированную структуру (Bodot,
1967). Даже на этой стадии эволюции
термиты отделывают свои гнезда лучше,
чем муравьи.
У муравьев зрелые семьи часто
развиваются в гнездах не сложнее тех,
которые строит самка-основательница, и
представляющих собой просто их копию.
Так обстоит дело, например,
у Paltothyreus tarsatus-крупных
представителей Ponerinae длиной почти
2 см, обитающих в африканской саванне,
которые вырезают частички почвы
и складывают их кучками на
поверхности. Их наклонные ходы ведут в
камеры, расположенные на глубине не
более 50 см (Levieux, 1976). Так просто
устроены гнезда многих
неспециализированных Myrmicinae, но
муравьи-жнецы, живущие в сухих степях
или саваннах, строят достаточно хорошо
дифференцированные гнезда.
Муравей-жнец Pogonomyrmex
occidentale - обитатель сухих, но
закрепленных дюн Северной Америки,
собирающий семена,-строит до пяти
почти вертикальных стволов, которые
несколько раз ветвятся и доходят до
глубины не менее 2 м (Lavigne, 1969).
Гнездо имеет несколько входов, число и
расположение которых различны
в разное время года: больше всего их
бывает в июне, а меньше всего-в
сентябре. К каждому вертикальному
стволу примыкают на разных уровнях
овальные камеры; верхние камеры
большие, и в них выращивают расплод, а
нижние-маленькие, в них муравьи
зимуют. Messor ebeninus, обитающий на
аллювиальных равнинах Сахельской
саванны (Африка), строит в верхних
слоях почвы, на глубине до 55 см, целую
сеть галерей (горизонтальных
и наклонных) диаметром 3-5 мм
и использует их для хранения семян. На
глубине 60-100 см у него расположены
более крупные камеры (4—6 см
в диаметре), а на глубинах от 180 до
220 см и более-ряд камер для расплода
и самки (Tohme, 1972).
Число галерей зависит от размеров
семьи: встречаются все варианты от
единственного убежища, вырытого
самкой, до огромных сооружений под
участками в 50-100 м2, уходящих на
несколько метров в глубину. Рабочие
расчищают весной верхние галереи, а во
время дождей роют глубже, так как
влага, просачиваясь в почву, делает ее
мягкой и облегчает вынесение наверх
комочков почвенных частиц. В этом деле
муравьям помогает псаммофор-
„борода“ из волосков на
нижней стороне головы. Родственный
вид Messor arenarius необычен тем, что он
живет в перевеваемых дюнах (рис. 5.2). В
Сахаре этот муравей на небольшой
глубине роет лапками или плотно
сжимает челюсти и загребает ими, пятясь
назад, подобно настоящему экскаватору;
на больших глубинах он с помощью
передних лапок, жвал и подогнутого под
себя брюшка скатывает из песка комочек
и выносит его в „корзинке",
образованной волосками „бороды". Эти
I in ><io •: no.iocni.-ix и почвенные холмики 91
Рис. 5.2. Гнездо Messor arenarius, построенное
в песке. А. Продольный разрез. Б. План.
(Delye, 1971.)
комочки муравей складывает так, что они
образуют удивительно правильную
полукруглую воронку. Наклонные стволы
очень пологие-на протяжении 10 м они
спускаются всего на 2 м. Боковые
галереи, высотой 1 см и шириной 3-5 см,
обычно пустуют, но рабочие особи
собираются в них, перед тем как выйти
на фуражировку. Каждый вечер рабочие
удаляют из поверхностных галерей
нанесенный в них песок. „Амбары" этих
муравьев, расположенные на глубине 2 м,
представляют собой просторные камеры
размером 40 х 10 см, но высотой всего
2 см; они часто бывают наполнены
семенами злаков. Расплод помещается в
близлежащих камерах (Delye, 1971).
I не г и муравьев-листорезов сильно
варьируют по сложности. Cyphomyrmex,
как уже говорилось, селится в раковинах
моллюсков; многие виды Асготугтех
живут в ямах, прикрытых сверху
соломой. Другую крайность
представляют муравьи рода Atta,
которые роют на глубине нескольких
метров огромные, почти сферические
камеры диаметром 20-30 см (Weber,
1972). Вынимаемая при этом земля
выносится наверх, так что в конце концов
образуется холмик, через который
проходят новые галереи. На грибной сад
муравьи укладывают тщательно
размятые растительные ткани, а снизу
удаляют переработанный материал.
\ прими! ивных муравьев Formicinae
(Sudd, 1969, 1970а, b) рытье сводится
главным образом к тому, что они при
помощи жвал захватывают почву
с поверхности и либо уносят крупные
частички по одной, либо накапливают
мелкие частички, пока не образуется
кучка, которую можно сгрести передними
ногами. Formica fusca начинает
действовать около вертикальной
поверхности, например у камня, или в
каком-нибудь углублении и роет ствол,
идущий прямо вниз, отклоняясь только в
том случае, если на пути окажется
крупная галька, и удаляя крупные
незакрепленные выступающие частицы
92 I'.taea 5
почвы; в конце строительства щели и
углубления заполняются песчинками
средней величины. Выглаживание
сомкнутыми челюстями производится
редко. У европейских муравьев F.fusca на
поверхность выходит одно лишь
отверстие, прикрытое сверху всякими
обломками, предположительно для того,
чтобы затруднить его обнаружение
представителями рабовладельческого
вида F. sanguinea и другими социальными
паразитами (Dobrzanska, 1978).
Представители близкого вида F.japonica,
обитающие в Японии, на зиму затыкают
отверстие гнезда землей, в мае
открывают его и увеличивают число
отверстий вплоть до июля-времени,
когда из большой, расположенной под
самой поверхностью горизонтальной
галереи вылетают половые особи.
В верхнем слое почвы на глубине до
20 см имеются многочисленные сложные
ходы и камеры 2,5-5,5 см длиной
и 1-2 см высотой; у одной луговой
формы некоторые вертикальные стволы
проникают в подпочву на глубину до 3 м,
но у лесных форм они гораздо короче
(Kondoh, 1968). В Европе северный вид
F. lemani строит галереи близко
к поверхности, тогда как южный F.fusca
роет глубокие ходы и камеры; неясно,
однако, обусловлено ли это различной
инсоляцией в разных широтах или
представляет собой адаптивный видовой
признак.
Сакагами и Хаясида (Sakagami,
Hayashida, 1962) изучали в лаборатории
взаимодействие во время строительства
между Formica fusca1 и двумя видами,
обращающими его в „рабство".
Муравьев помещали в стеклянную
пробирку, до половины заполненную
почвой, и измеряли количество почвы,
которое они переносили. У F. fusca с
1 В настоящее время японскую форму выде-
ляют в особый вид F. japonica.-Прим. ред.
увеличением числа особей средняя
производительность отдельной особи
снижалась. Факультативный
„рабовладелец" F. sanguinea мог работать
самостоятельно, хотя и менее
эффективно, чем F.fusca, причем
с увеличением числа особей его
производительность снижалась сильнее.
Наконец, облигатный рабовладелец
Polyergus samurai совершенно не был
способен работать, и его присутствие не
стимулировало, но и не снижало
производительности F.fusca. Высокая
индивидуальная производительность
муравьев F.fusca и их система
перетаскивания почвенных частиц по
эстафете делает их желанными „рабами".
Число праздных рабочих особей
с увеличением общего числа рабочих
возрастает, но в ограниченном
пространстве существует некая
оптимальная для хода работы плотность
особей; поэтому в целом лучше, если
некоторые рабочие остаются без дела,
чем если они вмешиваются и затрудняют
работу другим. Особенно активных
особей, способных работать при
плотности выше средней, можно
называть „лидерами" (Chen, 1937) или
„активистами" (Wallis, 1964).
Camponotus - очень разнообразный род, в
настоящее время один из самых
распространенных (Brown, 1973; Wilson,
1976d). В травянистой саванне Берега
Слоновой Кости (Западная Африка)
С. acvapimensis роет до глубины 45 см,
чтобы избежать обезвоживания в сухой
сезон, но его широко раскинувшееся
гнездо лежит под участком поверхности
площадью не менее 15м2; Levieux (1971)
вычислил, что этот муравей выносит на
поверхность 0,5% всего объема
почвенного слоя до глубины 25 см; ясно,
что этот вид играет важную
экологическую роль. В областях с более
прохладным климатом
муравьи-древоточцы устраивают гнезда в
Гнезда в по.юст.чх и почвенные xo.imuku 93
мертвой, но твердой сухой древесине.
Рабочие особи европейского вида
Camponotus vagus отрывают полоски
древесины вдоль волокон, но муравьи
строят также из этих полосок
перегородки, в результате чего
образуются камеры неправильной
формы, а кора и твердый центральный
цилиндр остаются нетронутыми (Benois,
1972). Некоторые виды оставляют
в своих гнездах очень тонкие деревянные
перегородки, и плотничье искусство этих
муравьев поразительно.
Устройство видоспецифичного гнезда не
соответствует образу жизни некоторых
муравьев, и они используют самые
разнообразные возможности. Anoplolepis
longipes (Formicinae), который вполне
способен выкопать себе гнездо в земле,
часто живет в пустотах под камнями, в
дренажных канавах или просто под
повалившимися деревьями и опавшими
листьями. Особи этого вида даже
взбираются на кокосовые пальмы
и поселяются в кронах. Поскольку для их
семей характерна полигиния (на
Сейшельских островах-в среднем 40
самок и 3800 рабочих особей), семьи
имеют возможность в случае
необходимости переходить на новые
места и даже разделяться (Haines, Haines,
1978). Другим примером служат
кочующие муравьи: Ecitonini
в тропических областях Америки
устраивают днем бивуаки под бревнами
и камнями, где они прячутся от солнца
(Schneirla, 1971).
Термиты выгрызают в твердом дереве
(Calotermitidae) или в мягком сыром
дереве (Termopsinae) ходы, а затем
обмазывают их экскрементами, которые
у них более волокнисты и пластичны, чем
у муравьев, так как термиты не
фильтруют пищу L Они нередко строят
1 У муравьев пища сначала поступает в предро-
товую (инфрабуккальную) камеру, где она про-
чечевицеобразные перегородки толщиной
до 2 мм, устанавливая песчинки
и цементируя их экскрементами (Lee,
Wood, 1971). Когда Zootermopsis
прогрызает ходы в древесине, он
выбрасывает вырезанные кусочки
и отпихивает их ногами назад; часто эту
работу производит цепочка из нескольких
особей. Впоследствии эти кусочки
древесины могут использоваться для
заполнения щелей или даже съедаются.
Обычный способ строительства состоит в
том, что рабочий берет кусочек
древесины или комочек сухих
экскрементов и отправляется на место
постройки; здесь он сначала,
повернувшись брюшком, откладывает
капельку жидких экскрементов, а затем,
повернувшись головой, кладет на эту
мокрую массу принесенный твердый
материал; после этого весь цикл
повторяется снова и снова. Stuart (1969)
полагает, что строители мобилизуют
помощников, ударяя головой по
субстрату. Несколько особей работают
совместно, реагируя на ситуации,
созданные другими особями, так, как
если бы они создавали их сами,-явление,
которое Grasse назвал „стигмэргией" *.
Macrotermitinae (Termitidae) смешивают
секрет слюнных желез с глиной, а затем
используют эту смесь для обмазывания
галерей и устройства перегородок или же
в качестве раствора, в который они
погружают песчинки (Lee, Wood, 1971).
Многие представители этой группы
живут под землей, строя камеры,
соединенные лабиринтом галерей; эти
камеры предназначаются для половых
пускается через своеобразный фильтр. В пище-
вод поступают лишь жидкие и очень мелкие
компоненты пищи, а более крупные твердые
частицы скапливаются в предротовой камере и
периодически „выплевываются".-Прим. ред.
1 Подробнее о теории стигмэргии на русском
языке можно прочесть в работах Шовена (1965,
1972).- Прим. ред.
94 Г шва 5
Рис. 5.3. Вертикальный
разрез через гнездо
Pseudacanthotermes
militaris, вырытое
в земле. (В его стенке
показаны галереи инкви-
лина Adaphrotermes.)
(Josens, 1972.)
особей („царской пары“), для грибных
садов или для молоди. Jones (1972)
установил, что самец и самка обычно
постоянно живут в одной и той же
камере, а грибные сады, хотя они широко
разбросаны, находятся главным образом
в кормовой зоне, часто довольно далеко
от репродуктивной камеры. В старых
гнездах Ancistrotermes cavithorax
репродуктивная камера имеет 5 см
в длину, 3 см в ширину и 2 см в высоту;
пол у нее горизонтальный, а крыша
сводчатая. Стены обмазываются до
гладкости красноватой глинистой землей,
выбранной, очевидно, за ее
тонкозернистость, а сверху покрываются
экскрементами так, чтобы толщина
смазки достигала 3 мм, а углов не
оставалось. Попасть в эту камеру можно
по двум узким ходам, через которые
репродуктивные особи уйти не могут;
рабочие приносят им всю необходимую
пищу и уносят отложенные ими яйца.
Камеры с грибными садами лишь
I'neiiia в полостях и почвенные холмики 95
Рис. 5.4. Последова-
тельные стадии рытья
норы и устройства в ней
ячеек у трех видов Lasio-
glossum. A. L. malachurus.
Б. L. linearis. В. L.nigri-
pes. Черным показана вы-
рытая полость, штрихов-
кой-выброшенная земля,
белым-ячейки. (Plateaux-
Quenu, 1972.)
немного больше и тоже обмазаны
глиной, но пол у них вогнутый, что
обеспечивает доступ к нижней
поверхности и циркуляцию воздуха; у
Pseudacanthotermes militaris грибные сады
стоят на конических ножках или на
столбиках (рис. 5.3). Этот вид
складывает кучки из растительных
остатков в камеры, расположенные на
глубине всего лишь 1-2 см от
поверхности, но, подобно другим
термитам и в отличие от
муравьев-листорезов, закладывает
грибные сады на экскрементах.
Пчелы, относящиеся к трибе Halictini, как
общественные, так и одиночные, строят
длинные вертикальные стволы с умело
изготовленными ячейками (Michener,
1974; Plateaux-Quenu, 1972). Эти пчелы
выглаживают и уплотняют внутреннюю
поверхность каждой ячейки своими
челюстями, а затем выстилают секретом
слюнных и дюфуровых желез; воск они
не применяют. Входное отверстие
обычно такое узкое, что в нем
помещается только одна пчела.
Lasioglossum malachurum строит группу
ячеек, а затем выгрызает вокруг нее
некоторое свободное пространство, так
что создается впечатление, будто ячейки
построены в камере (рис. 5.4).
Парасоциальные пчелы строят общий
главный вертикальный ствол, но боковые
отнорки и группы ячеек у каждой из них
собственные.
В саваннах и в лесах тропического пояса
встречаются поразительные примеры
устройства гнезд в полостях ветвей
96 Глава 5
Рис. 5.5. Акация, в ши-
пах которой живет один
из видов Pseudomyrmex.
1 - вздутые шипы с отвер-
стиями, прогрызенными
муравьями для входа;
2-лист с экстрафло-
ральным нектарником у
основания и пищевыми
тельцами (тельца Бельта)
на кончике каждого ли-
сточка; 3 -увеличенный
кончик листочка. (Whee-
ler, 1910.)
деревьев и кустарников. В деревьях
одного вида, Cordia alliodora
(Boraginaceae), обитает 54 вида муравьев
(Wheeler, 1942), а муравьи Azteca longiceps
(Dolichoderinae) встречаются в 85%
стеблей разнообразных растений.
Муравей строит в стеблях картонные
перегородки, так что получаются
отдельные камеры. В нескольких случаях
эти взаимоотношения между муравьем и
растением стали очень специфичными и
облигатными. Представители рода
Pseudomyrmex (Pseudomyrmeciinae) живут
в растениях Acacia (Leguminosae),
у нескольких видов которых имеются
полые вздутые колючки (рис. 5.5).
Муравьиная самка прогрызает себе вход
в такую колючку и основывает в ней
семью, которая, разрастаясь, заполняет в
конце концов весь куст. Подобным же
образом Tetraponera aethiops,
относящаяся к тому же подсемейству,
обитает в кустарнике Barteria fistulosa,
входящем в подлесок тропического
дождевого леса. Самки проникают
в слегка вздутые полые ветки длиной
10-20 см, и по мере роста семья
расселяется во вновь отрастающие
веточки, в полостях которых уже
находятся щитовки и грибы (Jansen,
1972). Все, что остается сделать
самке-основательнице,-это иден-
тифицировать дерево нужного вида и
прогрызть вход-действие, на которое
вполне способно большинство
пресоциальных насекомых.
Хотя в этом разделе было рассмотрено
только рытье гнезд, из всего сказанного
ясно, что необходимые для этого навыки
очень разнообразны. Некоторые
насекомые строят простой вертикальный
ствол и камеру, у других есть еще и
поверхностная горизонтальная галерея, а
Фото 12. У стебля Cecropia peltata имеется
слабое место, через которое муравьи рода
Azteca (Dolichoderinae) проникают в его
полую сердцевину (А), расчищают ее и из
обломков строят горизонтальные перегородки
(Б). [D. J. Stradling.]
98 Г.шна 5
третьи камуфлируют входное отверстие
или даже запечатывают его. В результате
дальнейшего совершенствования камеры
дифференцируются на амбары, грибные
сады, помещения для расплода или для
зимовки. Термиты добавляют к этому
репродуктивную камеру и специальные
конструкции для выращивания грибов.
Все постройки могут различаться по
степени утолщения стен, устранения
углов и гладкости внутренней выстилки.
Многие виды строят также перегородки.
5.2. Земляные холмики
На кучах земли под действием дождя
образуется корка, в которой поселяются
растения; после того как такие кучи
стабилизируются, насекомые начинают
устраивать в них гнезда, превращая их в
гнездовые холмики. Многие муравьи и
термиты пропускают эту стадию
и строят холмики сами, используя камни,
бревна, побеги или ветви растений в
качестве строительных лесов или более
постоянных механических опор. Другие
реже прибегают к этому и приготовляют
ячеистую пену из измельченной почвы
или древесины, которая не нуждается в
каркасе. Преимущества такого
специально построенного холмика
состоят в том, что при этом нет риска
наткнуться на камни или ветки и что
гнездо легко запечатать, чтобы закрыть
доступ насекомым-врагам.
Примитивные Myrmicinae строят в траве
небольшие холмики высотой до 10 см и
либо не делают внутри никаких
перегородок (Myrmica ruginodis), либо
устраивают много мелких укрепленных
влажной землей камер (М. scabrinodis).
Гнезда последнего типа более устойчивы
к высыханию и к вторжению врагов.
Представители рода Myrmica,
несомненно, заполняют щели жидкими
коричневыми экскрементами,
и некоторые данные указывают на то,
что эта жижа застывает, образуя
слоистый хрупкий цемент, но еще не
ясно, как он используется. Эволюционно
более продвинутый вид Solenopsis invicta
строит холмики, в которых суммарный
объем камер достигает 40 л. Первые
мелкие рабочие особи, выращенные
самкой-основательницей, строят камеры
и выносят почву на поверхность. Спустя
три месяца образуется холмик,
достигающий 7 см высоты при том же
диаметре. Строятся дополнительные
вертикальные стволы (около десятка), а
от них расходятся фуражировочные ходы,
так что к 5 месяцам холмик напоминает
губку, сквозь которую прорастают
растения. Спустя 2-3 года он становится
куполообразным и покрывает комплекс
камер и вертикальных стволов, которые
все больше углубляются в почву, пока,
наконец, не дойдут до уровня грунтовых
вод. На глинистых почвах склоны
холмика могут быть более крутыми
(Markin et al., 1973). Tetramorium
caespitum в умеренных областях Европы
строит аналогичные холмики и системы
ходов, хотя в местах с песчаной почвой
они очень легко разрушаются и гнезда
большей частью лежат прямо под
поверхностной коркой между кустами
(Brian, Downing, 1958).
Гнезда Lasius отличаются
разнообразием: L.alienus никогда не
строит холмиков, L. niger либо
использует холмики, выстроенные
L.flavus, либо устраивает гнезда под
камнями. L. flavus не использует камни в
качестве прикрытия для гнезда,
а насыпает поверх подземного гнезда
земляной холмик. В Европе этот вид
строит на лугах холмики, в которые
прорастают корни и корневища растений,
укрепляющие все сооружение. Муравьи
выбирают из подпочвы глину, из которой
можно построить более прочные холмики
с более крутыми склонами, чем из песка.
Многие травянистые растения
Гнезда в полостях и почвенные холмики 99
Рис. 5.6. Зоны растительности вокруг
размываемого дождями гнезда Odontotermes
на склоне в Лоита-Плейнс в Кении.
Разрушению гнезда положили начало
трубкозубы (Orycteropus afer). (Glover et al.,
1964.)
встречаются только на этих
холмиках-либо потому, что они
вырастают из покрытых почвой побегов
(например, Helianthemum или Thymus),
либо потому, что их семена попадают на
рыхлый слой свежей почвы,
покрывающей холмик (например, Festuca
ovina и разные однолетние
крестоцветные). Эти растения укрепляют
холмики, связывая почвенные частицы с
корешками, но некоторые из них растут
слишком быстро и создают слишком
большую тень, например Brachypodium
pinnatum. Холмики муравьев привлекают
диких кроликов (Oryctolagus cuniculosus),
вероятно потому, что они теплые, дают
хороший обзор и возможность пощипать
вкусные травы (такие, как Festuca)', даже
крупные травоядные прогуливаются
между муравьиными холмиками
и щиплют траву с их верхушек (King,
1977). Муравейники Lasius растут не так
быстро, как у Solenopsis invicta [по
данным Waloff, Blackith (1962),
существует определенное соотношение
между их возрастом и высотой].
В первые 2-3 года муравейник растет
очень быстро, и в местах с хорошо
дренируемым толстым слоем почвы
муравьи выкапывают обширную систему
галерей и камер на глубинах до 2 м.
Lasius flavus не может строить холмики
на склонах и в местах с тонким слоем
почвы; североамериканская форма
100 I'.uiHii ?
вообще не строит холмики (Wilson, 1955),
однако ее гнездам не вредит вода и их
можно встретить по берегам ручьев
(Talbot, 1965). На европейских солончаках
холмики L.flavus возвышаются над
уровнем воды; на них растет Festuca и
кормятся кролики, а на южной стороне
растет даже средиземноморский
кустарник Frankenia laevis (King, 1977;
Woodell, 1974). Еще более примечательны
муравьи Dolichoderinae, живущие
в приливно-отливной зоне на заросшей
галофитами илистой отмели в Мексике
(Yensen et al., 1980); когда начинается
прилив, фуражиры уходят в гнездо, а
другие рабочие приносят частицы почвы
и складывают их на край отверстия
гнезда. Они прекращают работу, когда
приливная волна накрывает муравейник,
а когда она отступает-появляются
вновь, пережив период затопления
в воздушных пузырях внутри гнезда.
Гермиюв. подобно муравьям, можно
расположить в ряд, который грубо
отражает эволюцию гнездостроения от
простого рытья нор до сооружения
холмиков. В отличие от муравьев они
создают чрезвычайно сложные и прочные
гигантские ,,дома“ (это слово во многих
случаях подходит к ним больше, чем
„холмики11), которые могут оказывать
длительное влияние на экосистему
(рис. 5.6). Маленькие холмики из земли,
не больше тех, что насыпают многие
муравьи, часто встречаются в тропиках
на горных лугах. Гумусоядный Cubitermes
в Кении строит равномерно
распределенные холмики с плоской
вершиной из минеральных зерен,
мельчайших частичек почвы
и переваренных остатков пищи, которые
он укладывает слоями; сверху они
покрыты злаками и другими травами
(Harris, 1955). Amitermes vitiosus
в северной части Австралии строит
холмики высотой 0,5 м в местах с бедной
или песчаной почвой, но там, где почва
содержит больше глины, его постройки
достигают 1,5 м в высоту, имеют
коническую форму и лишены
растительности. Как пишут Ли и Вуд
(Lee, Wood, 1971, р. 30), рабочие особи
Nasutitermes exitiosus и Coptotermes lacteus
кладут песчинки на нужное место
и скрепляют их глиной и слюной,
создавая открытое губчатое сооружение,
которое затем заполняется приносимыми
частицами почвы и приобретает
аморфный вид; чем дольше термиты все
это делают, тем прочнее получается
постройка. Наружная оболочка холмика
у Macrotermes bellicosus имеет такой же
вид, и опять-таки от интенсивности
заполнения отверстий зависит прочность
готового сооружения. Термиты
Microcerotermes arboreus к обмазывающей
смеси добавляют экскременты, как это
делают и только что упоминавшиеся
Nasutitermes exitiosus и Coptotermes lacteus
при внутренней отделке стен и камер для
расплода. Другие виды отделывают
гнездо главным образом волокнистыми
экскрементами без добавления почвы;
так поступает, например, Mastoterm.es
darwiniensis, сухие шарики которого,
будучи спрессованы, образуют стенки,
имеющие гранулярную структуру (Lee,
Wood, 1971, р. 35).
Постройку гнезда у Nasutitermes costalis
(Nasutitermitinae, Termitidae) изучал
в лабораторных условиях Jones (1979).
Расширение гнезда производится
эпизодически и без видимой связи
с потребностями; за один раз его объем
может быть увеличен на 10%. Сначала во
внешней оболочке гнезда прорезаются
группы отверстий, солдаты и рабочие
особи выходят наружу, чтобы
исследовать обстановку, а спустя
несколько минут рабочие начинают
строить выступы на поверхности
холмика. Если рабочим открыт доступ к
термитнику со всех сторон, то они
сооружают столбики диаметром 3 мм и
J'neida в полостях и почвенные хол мики 101
Фото 13. Земляные холмики Lasius flaws
(Formicinae), поддерживаемые живыми
злаками и другими травами, в Дорсете
(Англия). Такие холмики часто бывают
расположены рядами вдоль скотопрогонных
троп на выпасаемых лугах, где почва богата
известью; там. где почва глинистая, склоны
холмиков бывают очень крутыми.
Фото 14. Земляные холмики Lasius flaws в
Дорсете (Англия) образуют с поверхностью
почвы тупой угол из-за слабого сцепления
между частичками почвы и обусловленного
этим эрозионного скольжения. Верхушки
холмиков часто бывают покрыты вереском.
102 / ’.iaea 5
Рис. 5.7. Выживание, lx
(кривая I), и ожидаемая
средняя продолжитель-
ность жизни, ех (кривая
II), семей Macrotermes
bellicosus. (Collins, 1981а.)
высотой около 6 мм; затем они
начинают строить круглую крышу.
Стены возводятся только с одной
стороны и представляют собой,
в сущности, ряды сливающихся столбов.
Они вверху расширяются, сближаясь с
другими столбами, и либо сливаются с
ними, после того как их подгоняют по
высоте, либо разделяются. Наконец,
строится оболочка, иногда с шипами и
вентиляционными отверстиями; она
накрывает все сооружение, причем под
ней остается еще некоторое свободное
пространство. Солдаты в это время стоят
на страже; они не участвуют в работе. У
Drepanotermes (Termitinae) строят только
рабочие последних возрастных стадий, а
солдаты выходят наружу для охраны
(Watson, McMahan, 1978).
Самые впечатляющие постройки создают
Macrotermitinae. Это могут быть либо
округлые холмики диаметром 20-30 м у
основания и высотой более 6 м,
покрытые растительностью, либо
монолитные остроконечные конусы
с крутыми склонами; последние могут
достигать высоты 8-9 м при диаметре
основания не больше 2-3 м. Кривая
выживания одного вида из этого
подсемейства, Macrotermes bellicosus,
представлена на рис. 5.7. Представители
этого вида начинают строить гнездо под
землей, где молодая пара роет
вертикальный ствол и устраивает камеру
Гнезда в полостях и почвенные холмики 103
Фото 15. Сильно разбросанные дисковидные
холмики Odontotermes sp. в саванне близ
Каджиадо. Почва в промежутках между
холмиками-глина, изрезанная глубокими
на глубине около 20 см, а затем
выращивает несколько маленьких
рабочих особей (Grasse, Noirot, 1955,
1961). Эти рабочие приносят под землю
древесину и закладывают миниатюрный
грибной сад, засеянный грибами из
экскрементов взрослых особей. Сад
заключен в оболочку из глины толщиной
1 мм с отверстием наверху, и на его
устройство уходит всего одна ночь; в
сущности, весь этот микрокосм может
быть создан за 100 дней. Вновь
образующиеся холмики разрывают
голый поверхностный слой почвы после
дождя и растут с равномерной скоростью
(Pomeroy, 1976). Grasse (1944, 1945, 1949)
описал стадии их роста и развития
(рис. 5.8) до приобретения окончательной
структуры, которая, согласно Collins
(1979), на одной и той же почве
трещинами, с небольшими пятнами
растительности; на холмиках эта глина
рыхлая и ломкая и покрыта густой
дерновиной. [J.P.E.C. Darlington.]
с одинаковым дренажем может
относиться к одному из двух типов.
Возможно, что эти два типа гнезд
принадлежат разным видам, поскольку
гнезда одного типа встречаются на
высоте больше 1700 м, а гнезда
другого-на высотах меньше 1400 м
(Werff, 1981). В гнездах одного типа
репродуктивная камера, грибной сад и
галереи для молоди покоятся на
конических столбиках, стоящих в яме,
называемой “погребом”
и представляющей собой расширенную
первоначально вырытую полость; от нее
отходят открытые трубы (рис. 5.9).
Постройки другого типа встречаются на
высоте менее 1400 м; их называют
„соборами” из-за их заостренных полых
верхушек. Они могут достигать 6 м в
высоту при диаметре у основания 3-4 м;
1 04 Г.шаа 5
А
Рнс. 5.8. Ранние стадии устройства грибного
сада у Macrotermes natalensis. А. Царская пара
в камере, вырытой в глине. Б. Грибной сад,
окруженный оболочкой, и шарик из
репродуктивная камера, грибной сад и
галереи для расплода образуют здесь
шаровидную структуру, расположенную
примерно на уровне почвы, на пластинке
диаметром 3,5 м. Эта пластинка
поддерживается единственным столбом,
хотя и не прикреплена к нему. От
погреба идут в почву на глубину до 3 м
очень широкие ходы диаметром до 20 см,
которые, возможно, используются для
добывания глины. С пластинки в погреб
свисают клапаны или плоские спирали
толщиной до 2,5 см, покрытые
кристаллами соли. Стенка холмика
состоит из глины и картона, возможно
образованного из экскрементов, а внутри
обмазана главным образом глиной,
смешанной со слюной, но с добавлением
некоторого количества извести (Grasse,
Б
пережеванной древесины; все это создано
рабочими, вышедшими на поверхность через
прорытый ими вертикальный ход. (Grasse,
Noirot, 1955.)
Noirot, 1961). Даже в песчаных пустынях,
таких как Калахари, термиты собирают
материалы для постройки выборочно
(Bouillon, 1970). Macrotermes michaelseni
больше использует материалы, лежащие
на поверхности, чем глину из глубинных
слоев, как М. bellicosus (Leprun, Roy-Noel,
1977). Если в лабораторных условиях
поместить царицу одного из этих
термитов на открытом месте, то рабочие
особи строят для нее укрытие (Bruinsma,
Leuthold, 1977): сначала они ставят
вокруг нее столбики высотой 1,5-2 см, а
затем строят почти горизонтальные
пластинки, так что получается сводчатая
камера лишь с одним или двумя
проходами. Если направить на рабочих
слабый поток воздуха, к которому они
очень чувствительны, то с подветренной
IhcsOh в no.inan.4x н почвенные хо imuku
105
Рис. 5.9. Два типа гнезд у Macrotermes
bellicosus. А. Гнездо со спиральной
пластинкой. Б. Обычный тип. /-главный
вертикальный ствол; 2-запасы корма;
3-оболочка капсулы; 4-грибные сады;
стороны они строят укрытие ближе к
царице; это позволяет предположить, что
в узнавании участвует хеморецепция.
Еще многое предстоит выяснить
относительно организации термитников.
Помимо больших пирамидальных
холмиков они устраивают шарообразные
гнезда в подземных полостях, как,
например, Apicotermes (Termitinae). Эти
постройки имеют правильную форму и
сложную планировку, их этажи
соединяются пандусами и окружены
Б
5-царская камера, б-галереи с личинками;
7-основная пластинка со спиральными
структурами (А) или поддерживающими
конусами (Б); 8~столб; 9-«погреб». (Collins,
1979.)
галереями, а все вместе покрыто
перфорированной оболочкой, форма пор
которой видоспецифична (Noirot, 1970).
В этой главе было показано, что вначале
общественные насекомые скромно
обитали в полостях, которые они
находили в природе или устраивали
сами, приспосабливая их для своих нужд
и уделяя особое внимание защите
входного отверстия и выравниванию
стен. Жилые камеры располагались,
когда это было возможно, на разных
106 Глава 5
Фото 16. Гнездо в виде холмика, построенное
Macrotermes subhyalinus в африканской
саванне. Видны большие вентиляционные
отверстия («) и более мелкие отверстия, через
которые недавно вылетели половые особи (б).
Фото 17. Гнездовой холмик в разрезе. Можно
видеть три зоны. В центральной зоне обычно
располагаются камеры, в которых
выращивается расплод. Ее окружают камеры
для выращивания грибов (см. также фото 1 г
2). В самой наружной зоне находятся
вентиляционные ходы. [Фото 16 и 17-J.P.E.C
Darlington.]
Гнезда в полостях и почвенные холмики 10~
Фото 18. Холмик Odontotermes sp.
в Лойта-Плейнс (Кения); видны «трубы».
Фото 19. Грибной сад Odontotermes monoaon ir
situ; вентиляционные ходы окрашены в белы!
цвет. [Фото 18 и 19-J.P.E.C. Darlington.]
1 OS / ./</«</ 5
уровнях и постепенно стали
подразделяться на предназначенные для
выращивания расплода или для
запасания корма, а у термитов к этому
добавлялась еще и камера для
репродуктивной пары. Осы и пчелы при
переходе к общественному образу жизни
обладали гораздо более развитыми
строительными навыками, чем муравьи и
термиты, а у ос с одногодичным циклом
развития самки до сих пор умеют в
одиночку строить довольно сложные
миниатюрные гнезда.
Коллективное гнездостроение в его
простейшей форме сводилось, возможно,
к тому, что рабочие выстраивались в
цепочку, одни выгрызали или вырезали
нужный материал, другие уносили
добытые кусочки и из образующейся
кучи получались холмики, которые
включали стебли растений, служившие
им опорой. Затем в этих холмиках
выкапывались полости, строились
специальные помещения, а в конечном
счете создавались микроэкосистемы,
метаболическая активность которых
превышает среднюю для данной
местности. Термиты стали строить
чрезвычайно сложные гнезда, часто
достигавшие огромных размеров
и весьма долговечные.
Глава 6
Гнезда из растительных волокон,
шелка и воска
6.1. Холмики из растительных
материалов
и гнезда на деревьях
Земля-неудобный материал для
устройства гнезд на деревьях, и как
термиты, так и муравьи, живущие на
деревьях, чаще используют для этого
растительные волокна или пережеванную
древесину (картон). Среди термитов
только роды подсемейств Amitermitinae и
Nasutitermitinae (оба принадлежат к сем.
Termitidae) стали использовать эти
материалы. Их гнезда часто создаются
на основе галерей в отмерших сухих
ветках и сохраняют обычную форму, т. е.
состоят из толстостенной
репродуктивной камеры и окружающей
ее оболочки с небольшим входным
отверстием. Некоторые виды Bulbitermes
и Lacessitermes строят шарообразные
гнезда из картона, расположенные
в кустах на высоте до 1 м от земли.
Муравьи обоих главных подсемейств
успешно строят на деревьях гнезда,
вместо того чтобы использовать готовые
полости в стеблях или шипах. Это
делает, например, Tetramorium
(Myrmicinae) в тропиках (Bolton, 1980); в
лесах Западной Африки, где листва очень
густая, Т. aculeatum заполняет
пространства между листьями
„грубоватой на вид легкой массой из
разложившегося растительного
материала" (Wheeler, 1922, р. 188),
который нередко бывает скреплен
грибным мицелием. Crematogaster (тоже
из Myrmicinae) строит гнезда во всех
ярусах - от почвы до крон деревьев. На
первой эволюционной стадии муравьи,
гнездящиеся в земле, строят гнезда у
древесных стволов и вползают на деревья
к растительноядным сосущим
насекомым, которых они прикрывают
смесью глины и растительными
волокнами, возможно размягченной
с помощью слюны (Soulie, 1961).
Древесные виды расширяют эти укрытия
и перебираются к сосущим насекомым.
Муравьи С. impressa в регулярно
выгорающих саваннах живут в пустотах
веток и в стеблях трав (Delage-Derchen,
1974), но когда распускаются листья, они
строят маленькие гнезда (шириной до
8 см) с перегородками из смеси рыхло
соединенных растительных волокон
и минеральных обломков. Картон
получается лучшего качества, если
муравьи используют меньше глины и
дольше пережевывают растительные
волокна, добавляя к жвачке слюну,
которая может содержать секрет
мандибулярных желез (Delage, 1968).
Гнезда обычно строятся вокруг веток; у
них один главный вход снизу, и они
разделены на камеры тонкими
перегородками, благодаря которым
расстояние от пола до потолка камер
остается довольно постоянным, но
в расположении этих перегородок нет
определенного порядка и гнездо в целом
производит впечатление пространства,
разделенного случайным образом. Ближе
к поверхности гнезда камеры становятся
больше похожи на галереи и образуют
ясно выраженную оболочку. Эта
1 10 Глава 6
Фото 20. Картонные i незда муравья Azieca
chartifex (Dolichoderinae) (А) и термита
Nasutitermes sp. на лимонном дереве (Б) в
Тринидаде. У обоих видов основой для гнезда
служат древесные волокна, но в качестве
цементирующего вещества муравьи
применяют секрет слюнных желез,
а термиты-экскременты. [D. J. Stradling.]
оболочка уплотнена, а иногда и покрыта
чешуйками, по которым стекает вода.
Упоминавшийся выше муравей
Crematogaster impressa строит картонные
гнезда, в которых закрепляется своими
корешками эпифит Codonanthe-, это,
вероятно, помогает связать воедино
материал гнезда. Если в естественных
условиях заменить Crematogaster impressa
другим муравьем, Solenopsis, то гнездо
распадается, корни эпифита обнажаются,
и он падает.
Lasius fuliginosus (Formicinae) прогрызает
галереи в гниющей древесине и строит в
них картонные перегородки, заходящие
также в фуражировочные галереи
и станции у основания деревьев, на
которых эти муравьи фуражируют.
Картон приготовляется из кусочков
древесины, размягченных падью или
нектаром; секрет мандибулярных желе
для этого не используется, вопреки
существовавшему ранее мнению
(Maschwitz, Holldobler, 1970). Виды
Formica знамениты своими огромным!
холмиками высотой до 1 м с диаметрок
основания 2 м; один из представителе!
этого рода, F. ulkei, использует смесь
почвы и растительного материала, из
которой образуется твердая корка,
покрытая сверху растительными
остатками. Купол гнезда
асимметричен-на солнечной стороне or
шире. Европейские рыжие лесные
муравьи (F. rufa и близкие виды)
устраивают еще более крупные холмикг
из веточек, черешков листьев, почечньг*
чешуек, хвои и других растительных
Гнечда ич растительных во.юкон. шейка и воска 11 1
остатков. Одни рабочие приносят все это
на верхушку холмика, а другие
укладывают. В результате весь этот
материал меньше сползает вниз и все
впадины оказываются заполненными; но
все же дождь и ветер разрушают
верхушку холмика, так что слой
растительных остатков приходится
непрерывно подновлять (Chauvin, 1970).
Этот слой не образует ровную
«соломенную крышу», а представляет
собой выпуклую поверхность, с которой
вода стекает; так как никакого
цементирующего вещества эти муравьи
не применяют, требуется большое
мастерство, чтобы уложить весь
материал прочно и надежно; как показал
Dobrzanski (1971), квалификация рабочих
возрастает по мере увеличения их опыта.
У разных родов трибы Camponotini
выработались разные способы постройки
гнезд. Camponotus выкапывает их в земле,
выгрызает в твердой сухой древесине или
же строит картонные гнезда на деревьях,
а некоторые виды, например С. senex,
используют для склеивания материалов
слюну личинок. Как полагают (Sudd,
1967), это связано с особенностью
поведения, общей для всех Phormicinae:
они засыпают землей и различными
растительными остатками личинок,
достигших полного развития, до того как
те начинают плести кокон, так как им
необходим какой-то внешний предмет, к
которому можно было бы прикреплять
шелковые нити. Шелк синтезируется в тех
же лабиальных железах, которые на
более ранних стадиях развития
секретируют протеазы. Dendromyrmex
смешивает шелк с растительными
волокнами, применяемыми для
изготовления картона, а некоторая его
часть используется в чистом виде для
выстилания гнезда и для маскировки
входа в него. Личинки часто заплетаются
в кокон без помощи рабочих особей,
вырабатывая общую паутинную сеть, в
которой каждая из них окукливается в
маленьком коконе; иногда, однако,
рабочие носят личинок по гнезду, и те
выделяют нити, повышающие прочность
картона, из которого построено гнездо.
Таким образом, рабочие особи активно
руководят применением шелка (Wilson,
1981).
Виды рода Polyrachis, обитающие
главным образом в тропических областях
Азии и Африки, различаются по степени
использования шелка, вырабатываемого
личинками. Р. simplex, встречающийся в
Израиле, скрепляет шелком частицы
почвы и растительные остатки и таким
образом строит себе хорошо
замаскированное гнездо; только
движение рабочих снаружи выдает его
местонахождение (Ofer, 1970). Эти
муравьи устраивают гнезда в расщелинах
скал, в стволах деревьев, под
корой, под камнями или на земле среди
опавших листьев. Они создают также
укрытия для тлей на гребенщике
(Tamarix). Ofer описывает, как рабочие
заделывают дыру в стенке гнезда:
примерно дюжина рабочих стягивает с
наружной стороны разорванные края,
тогда как другие подносят к дыре
больших личинок, готовых секретировать
шелк. Рабочий держит личинку
челюстями за задний конец тела так,
чтобы ее голова и грудь могли свободно
двигаться; затем он начинает медленно и
осторожно передвигаться вдоль дыры,
ощупывая своими усиками личинку,
которая периодически сгибает тело
и прикасается к материалу гнезда
ротовыми частями. Тонкая шелковая
нить, которую она выделяет, невидима.
Плетением занимается менее десятка
рабочих, тогда как другие собирают
песчинки и растительный материал
и прикрепляют их секретом собственных
мандибулярных желез. Плетение-это не
только реакция на повреждение гнезда;
муравьи, по-видимому, занимаются им
112 /' юна 6
почти все время, даже по ночам, и в
обычном гнезде может быть до девяти
слоев шелка. Толщина каждого волокна
составляет 0,7-1,0 мкм, а длина-около
2 мм. Содержащийся в этом волокне
белок сходен с белком нитей
шелковичного червя, но не вполне
идентичен ему: шелк муравьев содержит
30% аланина, 13% серина, 13%
глутаминовой кислоты и 9% глицина, а
шелк червя-45% глицина, 30% аланина,
12% серина и 5% тирозина, причем
серусодержащие аминокислоты-
метионин и цистеин-в нем отсут-
ствуют (Ofer, 1970).
Высшею мастерства в устройстве гнезд с
применением шелка достигли
муравьи-портные Oecophylla,
представленные всего лишь двумя
видами. У эй (Way, 1954) приводит 89
видов деревьев (из 35 семейств), на
которых эти муравьи устраивают гнезда
в Восточной Африке. Их рабочие-
очень искусные строители: они совместны-
ми усилиями сшивают листья шелком,
выделяемым личинками, и устраивают
таким образом камеры. Землю или
мертвые растительные материалы они не
используют вовсе; более того, если
какой-нибудь лист отмирает, они строят
новое гнездо. Как пишет Уэй, примерно
за день до начала строительства гнезда
на гвоздичном дереве на месте будущего
гнезда медленно ползают крупные
рабочие особи. Затем эти крупные
рабочие, нередко цепочками до 12
особей, начинают сближать листья:
первый рабочий в такой цепочке
держится челюстями за край листа, а
остальные-за стебелек брюшка муравья,
находящегося впереди; последний
рабочий держится также коготками за
край другого листа. Несколько цепочек
удивительным образом сотрудничают
друг с другом, иногда изменяя
расположение листьев более удобным
для себя образом. Стянув листья, одни
рабочие удерживают их в этом
положении, а другие несут личинок
средних размеров, которых они держат
определенным образом и непрерывно
ощупывают своими усиками (в отличие
от Dendromyrmex), направляя их так,
чтобы они сшивали края листьев шелком,
выделяемым их слюнными железами.
Личинки, из которых развиваются
рабочие особи, дают примерно в 10 раз
больше шелка, чем личинки самцов. Это
интересный факт, поскольку у муравьев
Formicinae, как правило, величина
мужских и женских коконов почти
одинакова. Wilson и Holldobler (1980)
пришли к выводу, что это различие,
вероятно, возникло после того, как
муравьи стали плести гнезда
коллективно, и что оно отражает
существенно больший вклад самок
в устройство гнезда. Как только
накручивание шелка закончено, рабочие
особи уходят. В то время как крупные
рабочие трудятся снаружи, мелкие плетут
гнездо изнутри (Hemmingsen, 1973);
ночью те и другие работают снаружи.
Устройство таких гнезд начинают
в одиночку самки-основательницы,
которые сами не питаются, а селятся в
щелях и выкармливают личинок до тех
пор, пока те не достигнут такого
возраста, что смогут начать оплетать
шелковой сетью вход в гнездо. Садд
(Sudd, 1967) составил полезную сводку
данных о поведении Oecophylla,
полученных Леду (Ledoux) и Шовеном
(Chauvin).
6.2. Соты
Пчелы-галикты (Halictidae) выкапывают
в земле вертикальные ходы, от которых
отходят горизонтальные ячейки
с плоским дном; каждая ячейка изнутри
гладко обмазана глиной, а затем
выстлана секретами дюфуровых
Гнезда из растительных волокон, шелка и воска I I 3
Самый внутренний слой стенки гнезда
Рис. 6.1. Гнездо Bombus terrestris (в разрезе)
на ранней стадии; можно видеть самку,
инкубирующую расплод в восковой ячейке.
(Alford, 1975.)
и мандибулярных желез. Слепо
заканчивающиеся отнорки служат для
дренажа. Некоторые виды роют
вертикальные ячейки такой же формы, а
иногда галикты выкапывают комплексы
ячеек, поддерживаемые всего лишь
несколькими столбиками или корешками
растений, причем земляные стенки между
ячейками могут быть очень тонкими.
Другие ячейки строятся путем
добавления материала к стенкам; такие
ячейки могут использоваться повторно
после обновления их выстилки, хотя
Halictinae большей частью просто
засыпают использованные ячейки землей.
Обычно гнезда строятся совместными
усилиями многих особей, но самка все
еще способна в одиночку построить
целое гнездо. Переход к общественному
образу жизни не связан со способностью
строить тщательно отделанные группы
ячеек (Michener, 1974; Plateaux-Quenu,
1972).
Шмели обходятся без рытья, используя
норки и гнезда грызунов, которые они
расчищают и выстилают наново; они
могут даже воспользоваться старыми
птичьими гнездами в кустах (Alford,
1975). Затем они делают „медовую чашу“
из воска, выделяемого межсегментными
железами брюшка (рис. 6.1). Этот воск
плавится при температуре от 35 до 40°С
и имеет очень сложный состав. Углеводы
составляют в нем 37%, простые
моноэфиры с 40-50 атомами
углерода-29%, а остальные 34%-это
смесь смол, сложных этиловых эфиров и
! 1 4 Г iana 6
спиртов. Tulloch (1970) указывает
главные различия между этим воском и
воском медоносных пчел: в воске шмелей
есть двухатомные спирты и больше
ненасыщенных соединений и соединений
с разветвленной цепью, содержащих на
4-6 атомов углерода меньше; его
температура плавления на 25°С ниже, чем
у пчелиного воска.
Неправильный по форме или
пирамидальный конгломерат ячеек,
характерный для шмелей, не образует
симметричной или упорядоченной
структуры, подобной сотам, но тем не
менее хорошо вписывается в гнезда
грызунов. Вначале это всего одна
восковая камера (личиночник), в которую
матка откладывает несколько яиц; из яиц
вылупляются личинки, которые
продолжают жить все вместе вокруг
запаса пыльцы. Несколько позже камера
разделяется шелком, вырабатываемым
личинками, а перед самым окукливанием
каждая личинка плетет себе кокон,
образующий новую, индивидуальную
стенку. Со старых стенок соскребается
воск, из него строится новый личиночник,
и весь цикл повторяется. Поскольку воск
вырабатывается межсегментными
железами, шмели расходуют его очень
экономно; чтобы сделать его более
пластичным, они добавляют к нему
водянистый компонент, возможно из
мандибулярных желез. Воск используется
Гнезда из раапительы.х волокон, шелка и воска 115
Фото 21. Гнездо шмеля Bombus lucorum.
Ячейки образуют скопление, окруженное
обрывками растительных тканей из гнезда
мыши. Справа лежат пять коконов, с которых
шмель соскоблил воск для постройки новых
яйцевых ячеек.
Фото 22. Гнездо медоносной пчелы
в естественной полости в стволе дерева.
Видны девять сотов неправильной формы, на
нижнем краю которых находятся трутневые
ячейки. [Фото 21 и 22 J. В. Free.]
116 Г. ими 6
многократно. Мед, а нередко и пыльца
хранятся в старых личиночниках, края
которых иногда наращиваются воском
(Alford, 1975).
Безжалые пчелы (Meliponinae) тоже
гнездятся в природных пустотах; они
расчищают их и запечатывают
церуменом- смесью воска из дорсальных
желез и смолы, собираемой с деревьев
(Kerr et al., 1967). Некоторые очень
мелкие пчелы (например, Trigona portoi)
используют полые внутри веточки,
другие-более крупные ветви, стволы
деревьев, расщелины в скалах, постройки
или даже старые грибные камеры
муравьев-листорезов. Некоторые виды
часто живут в занятых гнездах термитов
или муравьев. Один из видов мелипон,
поселяясь в гнезде, где обитают термиты
Nasutitermes, начинает с устройства
трубки в форме кувшина, в которой
находятся несколько пчел; затем эта
трубка постепенно увеличивается
в размерах и углубляется внутрь
термитника, выстилается цементом, в ней
устраиваются соты и поселяются матка и
большее число рабочих особей (Wille,
Michener, 1973). В гнезде Crematogaster,
опустошенном панголином, поселилась
семья Trigona oyani; пчелы поместили в
центральную камеру запасы и расплод и
заблокировали ее толстой прочной
перегородкой (,,батумен“); такие
перегородки эти пчелы делают из смолы,
воска или глины или же из смеси всего
этого (Darchen, 1971).
Независимо от того, где расположено
гнездо, оно обычно строго разделено на
зоны. Непосредственно под защитной
оболочкой помещаются ячейки для
хранения запасов (рис. 6.2)-больших
горшочков с медом или пыльцой; на
верхней стороне этих ячеек имеются
отверстия, которые позже
запечатываются (у одного вида мелипон
пыльца хранится в конусовидных
горшочках). В отличие от Bombus,
использующего для хранения запасов
отремонтированные старые личиночники,
мелипоны строят для этой цели
специальные ячейки. Насколько
позволяет выбранная ими полость, они
устраивают второй панцирь-своего рода
обшивку или вторую линию
обороны-между оболочкой и камерой
для расплода; сама эта камера находится
в перфорированной капсуле,
поддерживающей ячейки для расплода,
собранные в комки, грозди,
горизонтальные пластинки или даже
спирали. Каждая шарообразная ячейка,
состоящая из мягкого церумена,
открывается вверху; иначе и не могло бы
быть, так как ее наполняют жидким
питательным веществом, откладывают в
нее яйцо, запечатывают и больше не
трогают. Ячейки строятся независимо
одна от другой, а не в виде сота; только
часть стенок у них общие,
и относительное расположение ячеек
фиксируется подпорками и столбиками
из церумена (Roubik, 1979). Поскольку
каждая ячейка структурно независима, то
после того, как личинка сплетет кокон,
ячейка сохраняет целостность и без
церумена; кроме того, после вылета
имаго данная ячейка может быть
разрушена, а в группе, расположенной
несколько выше, начато строительство
новой ячейки, как у Bombus, но на
достаточно большом расстоянии, на
подпорках, служащих временными
лесами.
Часто к гнезду ведет длинная
и тщательно отделанная входная трубка,
построенная главным образом из глины
или смолы; в ней могут быть клапаны,
перекрывающие ее на ночь, клейкие
участки, служащие ловушкой для
вторгшихся насекомых, или губчатая
структура из подпорок, образующая
вестибюль-галерею, расположенную
близко к поверхности, где сидят
пчелы-караулыцицы. Виды, гнездящиеся
Рис. 6.3. Гнездо Dactylurina staudingeri
в разрезе. (Michener, 1974.)
в земле, строят трубки для дренажа. У
одного вида {Dactylurina staudingeri)
гнездо устроено иначе (рис. 6.3); эта
пчела располагает свои соты
вертикально, так, что они соприкасаются
задними сторонами, а ячейки лежат на
боку. Новые ячейки строятся в нижней
части сота, так что сот растет вниз, как и
у Apis, но не обладает такой же
механической жесткостью
и долговечностью. В каждом гнезде есть
несколько двойных сотов, а также
маточники, расположенные у нижнего
края, опять-таки как у Apis (Darchen,
1972; Michener, 1974, р. 341; Wille,
Michener, 1973).
Можно сказать, что у безжалых пчел
пирамидальное скопление ячеек,
характерное для Bombus, превратилось в
многоярусную подвесную башню.
Жесткость создается каркасом из
подпорок и более регулярным
расположением общих стенок у ячеек
(особенно после того, как сплетен кокон),
так что шестиугольные в поперечном
сечении ячейки образуют сот. Логическое
продолжение этого состоит
в расположении сотов так, чтобы они
соприкасались задними поверхностями,
что дает возможность полнее
использовать пространство и достигнуть
большей прочности; при этом
приходится строить ячейки, лежащие на
боку, в результате чего получаются
вертикальные соты. Как именно
произошел этот поворот на 90°,
совершенно не известно.
Безжалые пчелы постоянно ведут
общественный образ жизни и строят
118 / . HHHI 6
Рис. 6.4. Форма гнезда у
разных видов Polistes.
1 - Р. goeldii-
2-Р. canadensis-,
3-Р. annularis-,
4-Р. major; 5-P.flavus;
6-P.fuscatus.
(West-Eberhard, 1973.)
6
гнезда совместными усилиями. В отличие
от этого у шмелей самка может
в одиночку начать строить гнездо,
которое в миниатюре соответствует
законченному гнезду. У ос самка-
основательница тоже может сама
построить ножку сота, набор сотов и
даже внешнюю оболочку; появляющиеся
позже рабочие только достраивают
гнездо. Многие одиночные виды
проявляют большое строительное
мастерство. Evans и West-Eberhard (1973,
р. 76), расположившие ос в порядке
возрастания сложности их гнезд,
перечисляют в своем списке пять
семейств ос, которые ведут полностью
одиночное существование; другие строят
грозди глиняных ячеек, и у них
наблюдается зарождение общественного
образа жизни-таковы, например,
некоторые Stenogastrinae и несколько
видов Polybia (Polistinae).
I не nfn и ! /’</< munic ihiihix но./окон. шпака и воска 1 1 9
Рис. 6.5. Гнезда некоторых общественных ос.
(Evans, West-Eberhard, 1973.)
Все Polistinae-общественные формы, и
их гнезда отличаются большим
разнообразием. Это, вероятно,
обусловлено использованием для
постройки гнезд пульпы, которая
получается при пережевывании
растительных волокон с секретом
мандибулярных желез и, застывая,
превращается в твердый блестящий лак,
не пропускающий воду. Осы Polistes
строят висячую ножку (рис. 6.4),
к которой прикреплен сот из ячеек; у
Р. goeldi ячейки цилиндрические
и прикреплены к ножке таким образом,
что общих стенок у них всего несколько;
у Р. canadensis ячейки шестигранные,
имеют общие стенки и образуют
вытянутый в длину сот, по отношению к
которому ножка расположена
асимметрично; у P.fuscatus и Р. gallicus
соты с такими же шестигранными
ячейками расположены по отношению к
ножке симметрично (West-Eberhard,
1969). Гнездо Ropalidia cincta (Polistinae)
подвешено на очень гибкой ножке
к нижней стороне пальмового листа.
Ячейки, общим числом около 200,
расположены эксцентрично и свисают в
виде нескольких групп неправильной
формы (Darchen, 1976). У них очень
много общих стенок, и это, так же как и
довольно массивный картон, придает
гнезду прочность.
После всего того, что было сказано о
безжалых пчелах, может показаться
странным, что осы могут выращивать
потомство в ячейках, открывающихся
снизу. Дело в том, что ячейка у них не
содержит корма, яйцо прикрепляется к
бумажной стенке клейким веществом и
личинка так плотно входит в ячейку, что
не выпадает из нее (по мере роста
личинки стенки ячейки удлиняются), а
пищу она получает небольшими
порциями прямо в рот.
Все представители трибы Polybiini живут
в тропиках, и их гнезда чрезвычайно
разнообразны (рис. 6.5), хотя
происходят, вероятно, от одной общей
формы типа гнезда Polistes (Evans,
West-Eberhard, 1973; Jeanne, 1975;
Richards, 1971, 1978). Соты могут
располагаться ярусами и прикрепляться
друг к другу и к стенкам подвесками, а у
некоторых видов сот имеет
цилиндрическую или концентрическую
структуру. Цилиндрическим может быть
и само гнездо; к его прочным стенкам по
всей окружности прикрепляются соты, а
осы передвигаются вверх и вниз по
имеющемуся в центре каналу. Бывают
также гнезда, не имеющие ножки, так что
плоский сот, закрытый оболочкой, лежит
прямо на ветке. Несмотря на такую
сложность структуры, в гнездах ос нет
специальных ячеек для хранения корма,
как у пчел.
120 / Ki/iii f>
Рис. 6.6. Гнездо Vespula
rufa в разрезе.
1 - перегрызенный
корень; 2-входное
отверстие; 3-мелкие
камешки; 4-муравьиные
ходы; 5-крупные камни;
6-вход в гнездо;
7-второй вход. (Из
Edwards, 1980, по Janet.)
Особенный интерес в этой трибе
представляют осы Polybioides tabidus,
которые строят несколько листовидных
сотов, свисающих вниз с какой-нибудь
ветки и покрытых с каждой стороны
оболочкой (Richards, 1969). Видимо,
каждый такой сот развивается из
эксцентрически закрепленной ножки,
а все гнездо состоит из нескольких таких
единиц, закладываемых в тесной
близости друг с другом. Соты не
ориентированы все в одну сторону; два
центральных сота обращены друг к другу
задними поверхностями, но их основные
пластинки не сливаются и между ними
остается промежуток, в котором может
поместиться оса. Помимо этих двух есть
еще несколько сотов, обращенных
наружу, но не повернутых друг к другу
задней стороной. Любопытно отметить,
что у всех центральных ячеек
(за исключением 3-10 ячеек, образующих
наружный край) донышки отрезаются,
как только личинки вырастут; это
облегчает уборку экскрементов, которые
иногда даже выпадают сами. Личинки
сплетают шапочки на обоих концах
кокона, но на заднем конце шапочка
меньше и впоследствии рабочие особи
убирают ее. После появления на свет
новых рабочих особей остальные
шапочки тоже снимаются,
и в ячейки-хотя они и открыты с обоих
концов-вновь откладываются яйца. У
Belonogaster griseus рабочие тоже
проделывают в ячейках дырки, чтобы
удалить остатки экскрементов личинок, а
затем заделывают дыру прозрачным
затвердевающим секретом (вероятно, из
мандибулярных желез) (Jeanne, 1980).
1 оризон I а. । ьны it сот Polistes,
обращенный вниз, получил дальнейшее
развитие у ос подсемейства Vespinae
(рис. 6.6). Они строят несколько сотов,
соединенных подвесками и окруженных
тонкими перекрывающимися
оболочками, в дупле или в почве;
имеющуюся полость они при надобности
расширяют, придавая ей нужную форму.
Прочность этим гнездам обеспечивает их
внутренний каркас, образуемый ячейками
и поддерживающими их подвесками, а не
оболочки (как у многих Polybiini),
которые разрушаются внутри
и отстраиваются снаружи по мере роста
гнезда.
Как уже отмечалось, самка-осно-
вательница может построить
миниатюрное гнездо, законченное во всех
отношениях, за исключением того, что в
нем нет больших ячеек-маточников для
выращивания репродуктивных самок.
Строительство продолжают ее
потомки - рабочие особи; при этом ясно,
что как бы они ни измеряли величину
ячейки, они не могут соотносить ее с
/'/<<-<<)</ 111 растительных: волокон. шелка и воска 121
размерами собственного тела, которые
очень сильно отличаются от размеров
матки. Законченная ячейка,
шестиугольная в сечении, открывается
книзу, но она начинается в углу, равном
120°, который образуют две более ранние
смежные ячейки (Edwards, 1980), и ее
наружный край сначала бывает
закруглен, а позднее ячейка становится
шестигранной. Рабочие строят ячейки,
прилепляя комочки пульпы к краю, а
затем разглаживают и разравнивают ее
несколько раз, пятясь задом и ощупывая
усиками соседние ячейки (West-Eberhard,
1969). До тех пор пока оба их усика
ощущают наличие стенки, они строят
новую стенку прямо, но если один усик
теряет контакт, стенка на соответ-
ствующей стороне закругляется.
Таким образом, обычное пересечение
ячеек по прямой обусловлено
ограничением, налагаемым соседними
ячейками.
До сих пор излагались известные факты,
однако интересно немножко оторваться
от них и порассуждать. Идеальная форма
для ячейки-цилиндрическая, так как она
лучше всего соответствует телу личинки.
Чтобы полнее использовать
пространство, цилиндры нужно уложить
рядами, сдвинутыми относительно друг
друга на пол-ячейки, так что каждые три
смежные ячейки образуют
равносторонний треугольник. Чтобы
сэкономить материал, каждая из них
должна иметь общие стенки со своими
соседями, а поскольку у каждой
окружности шесть соседей, это означает
переход к шестиугольной форме. При
этом устраняются потери пространства
между ячейками и создается
максимальная механическая прочность.
Итак, шестиугольник (в сечении)
сообщает прочность и сберегает
пространство и материал. Это, между
прочим, одна из трех фигур, которыми
можно целиком замостить плоскую
поверхность; две другие-треугольник и
квадрат-вряд ли пригодны для
цилиндрической личинки! Остается,
однако, загадкой, каким образом
определяются размеры ячейки: быть
может, существует некая „осиная
единица"? Такой единицей мог бы быть
радиус окружности, в которую
вписывается каждый шестиугольник, и,
что удобно, можно получить
шестиугольник, проведя шесть хорд,
равных по длине этому радиусу. Если
осы используют такую единицу, то им
необходим лишь какой-нибудь эталон, и
естественно предположить, что это
какая-нибудь часть их тела (как для нас,
например, дайна стопы); однако размеры
тела у ос варьируют, причем различие
между маткой, начинающей
строительство гнезда, и рабочими
особями, для которых она его строит,
весьма значительно.
Еще одно затруднение (даже если мы
найдем используемую меру длины или
такой эталон, как радиус) возникает при
попытке объяснить, как строятся
большие шестигранные ячейки для
выращивания репродуктивных самок.
Здесь можно только высказать догадку,
что это могло бы зависеть от того,
строится ли ячейка непосредственно
внутри или снаружи воображаемой
окружности после разметки на ней шести
точек с помощью эталонного радиуса.
Если от точки к точке проводятся хорды,
то получается маленькая ячейка, а если
через те же точки проводятся
касательные, то получается большая
ячейка. В таком случае отношение
площади маленькой ячейки к площади
большой должно составлять 0,75;
у Vespula vulgaris оно равно 0,763
(Spradbery, 1971).
Строят ли осы большие или маленькие
ячейки, зависит от их физиологического
состояния, в частности от их возраста, от
того, являются ли они матками, а если
122 1 ши (>
это рабочие особи, то старая или
молодая у них матка. Молодые матки
Vespa orientalis в Израиле строят большие
ячейки до наступления зимы и маленькие
после; Ishay (1976) показал, что для
такого сдвига в поведении необходимо
кратковременное воздействие
температуры около 5°С. Он установил
также, что при воздействии
фенобарбитала осы строят все более и
более обширные ячейки по мере
увеличения дозы; это наводит на мысль,
что для строительства больших ячеек
необходимо ареактивное состояние
нервной системы. В развитии поведения у
ос наблюдаются и другие любопытные
особенности. Например, особи,
вылетающие из куколок в темноте, не
способны строить упорядоченные соты,
пока не пробудут некоторое время на
свету; после этого они могут строить
обычные соты даже в темноте! И другой
факт: отдельные рабочие особи, если их
очень рано изолировать от семьи, могут
строить в одиночку ячейки и по мере
накопления опыта делают это все лучше.
Но если их изолировать позднее, после
того как они уже прошли через фазу
социальной индукции, их зависимость от
социальных стимулов к строительству
становится настолько сильной, что
подавляет имеющиеся у них
строительные навыки и делает
необходимым присутствие матки (Kugler,
1979; Motro et al., 1979).
У медоносной пчелы каждый сот состоит
из двух слоев шестигранных ячеек,
обращенных друг к другу задними
поверхностями, но сдвинутых так, что
каждая ячейка одного слоя соприкасается
своим основанием с тремя смежными
ячейками другого, т. е. каждая треть ее
основания (представляющая собой
плоский ромбический участок) служит
одновременно частью основания одной
из ячеек противоположного слоя. Таким
образом, система шестигранников одного
слоя соответствует такой же системе
другого со сдвигом по вертикали,
равным радиусу одной ячейки. При этом
пространство используется полностью!
Другая особенность состоит в том, что,
за немногими исключениями, помимо
четырех косо расположенных граней
шестигранник имеет две вертикальные, а
не две горизонтальные грани. Кроме
того, каждая ячейка слегка
приподнимается от основания
к отверстию, образуя с горизонталью
угол около 13°; благодаря этому жидкое
содержимое ячеек не выливается. Соты
являются самонесущими и выдерживают
тяжесть меда, расплода и самих пчел.
Apis mellifera строит несколько таких
двойных сотов, расположенных обычно
параллельно друг другу в полости,
обмазанной изнутри пчелиным клеем
(прополисом), а не церуменом. A.florea и
A.dorsata строят один двойной сот,
подвешенный к ветке и не имеющий
никакой оболочки, кроме слоя самих
пчел, которые скапливаются на нем,
располагаясь определенным
образом-головой вверх, брюшком вниз.
Распространение этих видов ограничено
тропиками, но A. mellifera и близкая к ней
А. сегапа проникли в леса умеренной
зоны-отчасти благодаря своему
метамерному гнезду, а также потому, что
у них в процессе эволюции возникла
способность к зимовке; они стали
устраивать гнезда в разного рода
полостях, что дает им возможность
перезимовать за счет своих запасов, а не
мигрировать, подобно другим видам Apis
(рис. 6.7).
Как и Vcspinae, все виды Apis строят
шестигранные ячейки двух размеров, но
большие ячейки предназначены у них для
выращивания самцов (трутней), а не
репродуктивных самок. Для таких самок
весной строятся специальные овальные
ячейки (маточники), прикрепленные
к соту своим широким концом
I iieuia in растите.!ьных во.юкои, ше./ка и воска 123
Рис. 6.7. Гнездо
медоносной пчелы
в дупле дерева. (Seeley,
Morse, 1976.)
и сужающиеся книзу; обычно эти ячейки
располагаются на нижнем крае сотов, но
в случае необходимости они могут
отходить от сота с шестигранными
ячейками под прямым углом; обычно
они бывают направлены вниз; это,
по-видимому, имеет какое-то важное
значение, однако неясно, какое именно. У
A.mellifera трутневые ячейки обычно
располагаются блоками, а у A.dorsata
они разбросаны среди ячеек, в которых
выращиваются рабочие особи.
Специальных ячеек для запасания корма
у Apis нет; пыльца хранится в обычных
ячейках, расположенных для удобства
вблизи ячеек с расплодом,
а мед-подальше, в наружных сотах, так
что он накрывает расплод как бы
одеялом, обеспечивая одновременно
и теплоизоляцию, и запас сахара. Пчелы
не разрушают старые ячейки, с тем
чтобы вновь переработать их материал, а
многократно используют их. Нормальное
для одиночного образа жизни
„инстинктивное" поведение развивается у
пчел по-иному в условиях
общественной жизни, где важнейшую
роль играют стимулы, исходящие
от матки.
Усыновлено, что у рабочих особей ос
(Polistes и Vespinae) и у шмелей
(Montagner, 1966; West-Eberhard, 1969)
1 24 I шва л
существует определенная корреляция
между строительной активностью,
местом, занимаемым в сообществе, и
развитием яичников; в сущности,
высокая строительная активность-это
элемент широко распространенного
„материнского синдрома",
сопровождающегося также увеличением
corpora allata (Roseler et al., 1980).
Все медоносные пчелы (Apini) строят
соты из воска, который состоит
в основном из мирицилпальмитата, но
содержит также некоторые другие
кислоты, высшие спирты
и углеводороды. Как установил Tulloch
(1970), среди кислот главное место
занимает 15-гидроксипальмитиновая
кислота, а среди углеводородов 35%
составляют сложные моноэфиры,
24%-эфиры гидроксикислот,
12%-диэфиры и 8%-свободные кислоты.
Спирты содержат 30-32 атома углерода.
Таким образом, пчелиный воск примерно
наполовину состоит из
бифункциональных гидроксикислот
и двухатомных спиртов, а воск шмелей
не содержит ни тех, ни других.
Насыщенные соединения
с неразветвленной цепью тоже чаще
встречаются у Apis, чем у Bombus.
Благодаря такому химическому составу
пчелиный воск тверже и прочнее,
поддается обработке при температуре
улья (35°С) и не плавится вплоть до 62°С.
Соты вертикальные, они прикрепляются
к потолку гнезда по всей своей длине, без
ножек или подвесок; они свешиваются
вниз фестончатым краем, вдоль которого
добавляются новые ячейки. Со временем
соты чернеют и утрачивают
привлекательность для матки, несмотря
на то что рабочие особи специально
выстилают их каким-то неизвестным
материалом. Никаких больших запасов
воска нет; пчелы сразу используют его,
приклеивая к краям строящихся ячеек
или запечатывая им ячейки с куколками и
с медом. Таким образом, для того чтобы
иметь однотипную повторяющуюся
структуру сотов, пчелы отказались от
создания специальных ячеек с запасами.
Своеобразные овальные
ячейки-маточники, быть может,
представляют собой единственный
остаток какой-то более ранней
эволюционной стадии.
Воск выделяют межсегментные железы,
расположенные на нижней стороне
брюшка; пчелы при этом свисают
гирляндами из середины скопления
(клуба), в котором поддерживается
постоянная температура около 35°С. От
этих пчел воск переходит к группе
„жевалыциц", которые смешивают его с
водянистым секретом мандибулярных
желез и превращают из хрупкого
материала в пластичный. После этого
воск можно сразу использовать для
постройки сотов (Darchen, 1980). Воск
этот синтезируется в организме рабочих
пчел из сахаров, для сбора которых, так
же как для сбора глины или
растительных волокон, приходится
расходовать энергию; кроме того, и сама
выработка воска требует энергетических
затрат. Тем не менее сахар-широко
распространенное сырье, используемое в
улье и для других целей, тогда как воск,
будучи однажды выработан, не может
быть вновь ассимилирован организмом,
и его никак нельзя рассматривать как
пищевой запас.
Каким образом Apis mellifera создает
свои ячейки, вымеряет их, подгоняет
углы с точностью до нескольких
градусов, выравнивает и отшлифовывает
стенки, делая их поразительно тонкими,
понято далеко не полностью. Ribbands
(1953) составил хороший обзор ранних
работ П. Хьюбера, Ч. Дарвина и других
исследователей. В отличие от ос пчелы не
могут строить сот в одиночку, и не
просто потому, что одни особи
секретируют воск, другие эмульгируют
Гнезди ui /ч1стшпе.1Ы1ы.\ ко iokoh, ihc.ikh и воски
'-25
его и помещают на края ячеек, а третьи
придают ему нужную форму и полируют,
но еще и потому, что строители ячеек
подгоняют расстояния по-разному
в зависимости от того, какого типа
ячейку они строят (для выращивания
рабочей особи или трутня), и оставляют
между сотами такое пространство, чтобы
пчелы могли перемещаться в нем
и имели доступ к ячейкам.
Дарвин писал о том, как пчелы,
оказавшись в трудном положении, строят
ячейки, разрушают их
и перестраивают-особенно в ульях,
сделанных человеком, когда
искусственная вощина вставлена
неправильно. Darchen (1954)
перепробовал разные деформации;
например, он вставлял в улей вместо
обычной плоской рамки изогнутую
пластинку и обнаружил, что пчелы
подгоняют глубину ячеек таким образом,
чтобы расстояние между двумя
поверхностями сота было примерно
одинаковым. В соломенных ульях,
в которые никогда не вкладывают рамок,
соты не всегда параллельны; они могут
искривляться, но пчелы всегда стараются
заполнить пространство так, чтобы
оставался только проход, достаточный
для передвижения. Любые посторонние
предметы, помещенные в улей, пчелы
либо убирают, либо включают
в структуру сота с минимальным
нарушением его общего плана. Пчелы
быстро заделывают дыры в стенках или
основаниях ячеек, но раздавленные
ячейки восстанавливают с трудом; по
каким-то причинам они не хотят
разрушать такие ячейки и отстраивать их
вновь.
Обычно мелкие „рабочие" ячейки на
одной стороне сота вынуждают пчел
строить такие же ячейки и на другой
стороне, так как основания ячеек должны
соответствовать друг другу; это
относится и к трутневым ячейкам.
Даршен (Darchen, 1958) разрезал соты
вдоль, параллельно дну ячеек, а затем
соединял их так, чтобы с одной стороны
сота были ячейки для рабочих пчел, а с
другой-более крупные трутневые ячейки.
Если при этом сохранялось дно
трутневых ячеек, пчелы расширяли
ячейки для рабочих, а если, наоборот,
сохранялось дно более мелких ячеек, то
они перестраивали трутневые ячейки.
При этом пчелы не разрушали их до
основания, чтобы затем построить вновь,
а расщепляли стенки примерно от
середины. Когда Даршен прикреплял
мелкие ячейки с основаниями на крупные
ячейки тоже с основаниями, пчелам было
очень трудно разрешить задачу, и они
прорывались сквозь основания ячеек.
Медоносные пчелы, по-видимому, не
любят ломать и строить заново, на что
легко идут безжалые пчелы с их более
вольным стилем построек. Быть может,
дело в том, что воск медоносных пчел
теряет пластичность? Кроме того,
медоносным пчелам трудно справляться
с углами, отличными от 60 и 120е
(Naulleau, Montagner, 1961). И еще один
вопрос остается без ответа: как они
устраивают наклон под углом 13°?
Хотя пчелы всегда трудятся сообща
целыми группами, одна пчела в одиночку
может построить очень тонкую
стенку-толщиной 73 мкм для рабочей и
92 мкм для трутневой ячейки (1 мкм =
= 10-6м). Чем тоньше становится стенка
в результате выравнивания ее челюстями,
тем быстрее она возвращается в прежнее
положение после деформации, вызванной
давлением изнутри; сразу, не колеблясь,
она возвращается в положение
равновесия и остается в нем, будучи
полностью демпфирована (Martin,
Lindauer, 1966). Для проявления этого
свойства необходима постоянная
температура 35°С и нужна смесь воска и
секрета мандибулярных желез
в определенном соотношении. Это
i 26 /' шин 6
Рис. 6.8. Изменение двигательной активности
пчел при наложении магнитного поля, /-без
магнитного поля; //-при периодическом (по
10 мин) воздействии магнитного поля (черные
прямоугольники вверху). (Hepworth et al.,
1980.)
свойство стенки ячейки варьирует
в зависимости от ее положения. На
усиках и на мандибулах имеются органы
чувств, которые, вероятно, используются
в процессе утончения стенки; если
отрезать или десенсибилизировать
кончики усиков, то хотя рабочие все еще
сохранят способность строить правильно
ориентированные ячейки, стенки этих
ячеек будут двойными, причем
промежуток будет заполнен комочками
необработанного воска.
Важную роль в чувстве равновесия
играют поля щетинок на шее пчелы, и
если пчела лишена возможности
свободно пользоваться ими, она не в
состоянии даже начать строительство.
Что же касается усиков, то без них пчела
может обойтись, хотя они, возможно,
используются для измерения расстояний
и углов. Центробежные силы,
возникающие при вращении, могут
повлиять на ориентацию ячеек
(Gontarski, 1949, цит. по Martin, Lindauer,
1966), так же как и магнитное поле
Земли. Если лишить пчел зрительных и
тактильных ориентиров, то они строят
соты, располагая их определенным,
специфичным для данной семьи образом
относительно направления магнитного
I'licithiuiiwiminw. ‘hiihiv ho.iokoh, те./ка и носки 12/
поля (Pickard, 1973). В экспериментах с
магнитными полями такой
напряженности, с какой, вероятно, пчеле
приходится сталкиваться в обычных
условиях, было показано, что скорость
ползанья пчел в темноте можно
увеличить, периодически воздействуя на
них магнитным полем (рис. 6.8).
Латентный период при этом довольно
велик-от 40 до 60 мин, так что нельзя
объяснить это простым нарушением
функции магнитных гранул, имеющихся в
брюшке пчелы. Кроме того, под
действием магнитного поля
продолжительность танца у пчел
сокращается с 34 секунд до 19 (Tomlinson
et al., 1981).
Ранее в этой главе мы уже проследили за
постепенным усложнением гнезд
муравьев-от кучек земли под „кровлей14
из сухих растений (у лесных муравьев)
через все возрастающее использование
переработанного растительного волокна
(картон) видами, гнездящимися на
деревьях, до стадии, достигшей своего
апогея у одной трибы (Camponotini),
некоторые представители которой
используют шелк, вырабатываемый
личинками, для устройства общего
гнезда-кокона. Это строительство
требует развитого сотрудничества
и разделения функций между личинками
и взрослыми муравьями при
использовании секрета прядильных желез
личинок. Одни рабочие стягивают
листья, другие плетут, причем более
крупные особи работают снаружи,
а мелкие - внутри гнезда.
Гермшы. которые строят из
минеральных частиц и картона очень
сложные и сильно дифференцированные
холмики и гнезда на деревьях, не плетут
коконов, поэтому у них никогда не
бывает гнезд из шелка. И муравьи, и
термиты строят гнезда камерного типа,
тогда как осы и пчелы выработали
чрезвычайно эффективную ячеистую
структуру, используя в качестве
материала либо картон, либо особый
вырабатываемый организмом воск,
который они размягчают секретом
мандибулярных желез и смешивают со
смолой.
Почему система „по одной ячейке на
личинку11 оказалась столь эффективной у
пчел и ос? Дело в том, что при этом
получается плотно упакованная,
упорядоченно организованная
в пространстве инкубационная камера,
которую легко обслуживать и которая
очень экономна. Единственное
необходимое осам сырье-это древесина,
а пчелам-сахар и смола. Можно ли
считать более гибкую систему,
характерную для безжалых пчел,
компромиссом между концентрическими
камерами и правильными
шестигранными ячейками,
компромиссом, который допускает
одновременно и плотную упаковку
индивидуальных „чуланчиков11, и доступ
к ним, необходимый для уборки
и перестройки, а также хранение запасов
отдельно от расплода и вместе с тем
использование их в целях
термоизоляции?
Глава 7
Микроклимат
С\ I очные колебания температуры
обычно особенно велики на поверхности
почвы, что связано со свойствами
электромагнитного излучения; эти
колебания демпфируются водой в виде
водяных паров, капелек или водной
внутренней среды растений. Каждое
насекомое ищет подходящий для себя
микроклимат, делая выбор из того
диапазона, который ему доступен.
Общественные насекомые ведут себя
таким же образом во время
фуражировки, если не считать тех
случаев, когда они устраивают укрытия
для тлей или станции для отдыха. Эти
станции и настоящие гнезда составляют
то, что отличает общественных
насекомых от всех других и позволяет им
изменять микроклимат места, где они
живут. Гнездо предназначено служить
убежищем от плохой погоды и создавать
постоянную среду, в которой происходит
превращение пищи в биомассу данной
популяции. Цель при этом состоит в том,
чтобы демпфировать происходящие
в природе возмущения и поддерживать
микроклимат как можно ближе
к уровню, оптимальному для
жизнедеятельности. На первом этапе
эволюции, ведущей к полному контролю
микроклимата, общественные насекомые
перемещают расплод вверх и вниз в
соответствии с суточными колебаниями
микроклиматических условий на разной
глубине; следующий этап-использование
гнезда для запасания больших количеств
дефицитных ресурсов;
затем - термоизоляция гнезда для
сбережения метаболической энергии и,
наконец, восприятие отклонений от
оптимума и их активная корректировка
(гомеостаз). Эти адаптации не
исключают друг друга, и эволюционно
наиболее продвинутые общественные
насекомые, способные к регуляторным
реакциям, одновременно обеспечивают
терморегуляцию своего гнезда
и используют его для запасания корма.
Следус! отметить, что лишь в очень
немногих частях биосферы микроклимат
действительно соответствует
потребностям насекомых. Даже
в тропиках климат недостаточно жаркий,
в пустыне же в некоторые часы суток
может быть слишком жарко, а на
протяжении большей части
года-слишком сухо. Таким образом,
общественные насекомые повсюду
сталкиваются с той или иной проблемой,
которую им приходится решать.
7.1. Выбор мест
с подходящими условиями
В дождевом тропическом лесу
температура круглый год колеблется в
пределах около 25-30°С, так как тепло
ежесуточно поступает в течение 12 ч в
виде солнечных лучей и в значительной
мере удерживается биомассой, водой и
почвой. Однако для многих
общественных насекомых даже
25°С - недостаточно высокая
температура, и им приходится принимать
меры к большему поглощению
солнечного тепла. У муравьев,
обитающих в кронах деревьев,
наблюдается видоспецифическая
зональность, которая будет описана в
главе 16. В погоне за солнечными лучами
Микроклимат
129
Рис. 7.1. Колебания
температуры почвы на
разной глубине на солнце
и в тени мангового
дерева в Танзании
в области обитания
Anoplolepis custodiens.
(Way, 1953.)
они могут попасть в зону действия
ветров; поэтому Oecophylla в Танзании
(6° ю.ш.) строит гнезда на той стороне,
которая прикрыта от муссона; муссон
дует с северо-востока с декабря по апрель
и с юго-востока с мая по ноябрь (Way,
1954). В тропиках бывают ливни,
и муравьям, гнездящимся на деревьях,
необходима защита от них. Прямые
удары дождевых капель могут наносить
гнездам Crematogaster сильные
механические повреждения, но вода,
стекающая с листьев, обычно отводится
перекрывающими друг друга
картонными щитками (С. skonnensis), или
гнездо защищено от нее травяной
кровлей (С. ledauxi), или же часть воды
просто временно впитывается гнездом
(С. vandell} (Soulie, 1961).
Муравьи Dorylinae избегают воздействия
прямых солнечных лучей и, если им
нужно пересечь открытое место,
130 Г.idea 7
дожидаются, пока солнце скроется за
облаком; многие виды этой группы ведут
ночной образ жизни. Почвообитающие
муравьи, однако, стремятся использовать
солнечное тепло и ведут свои
вертикальные стволы глубоко в землю,
по температурному градиенту, чтобы
избежать прямых солнечных лучей, ветра
и дождя, хотя при этом они подвергают
свои гнезда риску затопления. Anoplolepis
custodiens в Восточной Африке (6° ю.ш.)
выбирает участки оголенной почвы, где
температура на солнце достигает 60°С
(Way, 1953). В его гнездах есть несколько
вертикальных стволов, идущих в глубину
на 2 м и более, и камеры, расположенные
с промежутками 10 - 15 см; в этих
гнездах на глубине 25 см температура
может постоянно оставаться на
оптимальном уровне-около 30°С, как на
поверхности земли ночью (рис. 7.1). На
Сейшельских островах тот же вид
гнездится под упавшими стволами
деревьев, под камнями и в канавах,
возможно из-за того, что почва здесь
слишком твердая и ее трудно рыть
(Haines, Haines, 1978).
Муравьи, обитающие в саванне,
перемещаются вверх и вниз
в зависимости от суточных колебаний
температуры, избегая заниматься
фуражировкой в те часы, когда на
поверхности слишком жарко или
слишком холодно. Например, в сухой
саванне Берега Слоновой Кости (около
10° с.ш.) день длится от 6 до 18 часов и
температура почвы на глубине 1 см
повышается с 16°С в 10 часов до 34°С
перед самым заходом солнца. Messor
regalis собирает семена утром между 8 и
11 часами и после полудня между 15 и 18
часами, a M.galla делает это ночью.
Brachyponera senaarensis в этой же
области собирает семена от 8 до 12
часов, а затем от 15 до 17 (Levieux,
Diomande, 1978а, b). Solenopsis invicta из
Мату-Гросу (12° ю.ш.), ввезенный из
Южной Америки в Северную, строит во
Флориде свои гнездовые холмики так,
чтобы их длинная ось была направлена с
севера на юг (Hubbard, Cunningham,
1977); видимо, это уменьшает
поглощение солнечных лучей.
В пустыне Аризоны (33° с.ш.)
температура на поверхности почвы
бывает то слишком высокой, то слишком
низкой. Acromyrmex versicolor не
фуражирует в жаркое послеполуденное
время, когда температура на поверхности
превышает 44°С, и ночью, когда она
падает ниже 8°С (Gamboa, 1975, 1976).
Июль-тяжелый месяц: между 10 и 20
часами бывает очень жарко, так что
муравьи трудятся на поверхности
в основном ночью. Рабочие особи,
оказавшиеся в жаркое время вне гнезда,
стараются укрыться в тени
и прижимаются к относительно менее
нагретой (32°С) поверхности почвы.
Дождей в июле и августе выпадает мало,
и влаги едва хватает на то, чтобы
проросли семена и зазеленела
растительность. Trachymyrmex smithi
в пустыне Чиуауа (33° с.ш.) занят
сборами только при температуре от 10
до 37°С, a Formica perpilosa трудится в
тени кустов и устраивает гнезда у их
основания, избегая таким образом
соприкосновения с горячим песком
(Schumacher, Whitford, 1974); муравей
Atta sexdens в Парагвае (22° ю.ш.)
активен ночью, если температура на его
тропах днем превышает 30°С (Fowler,
Robinson, 1979).
В сухой африканской саванне диффузное
гнездо живущих под землей
Macrotermitinae вряд ли позволяет
сохранять влагу, но обычно воздух,
находящийся в поровых пространствах
почвы, имеет высокую влажность, даже
когда почва „сухая“. То, что у этих
подземных видов нет камер, соединенных
вертикальными стволами, несомненно,
обусловлено наличием основательно
Фото 23. Гнездо Acantholepis custodiens,
вырытое в земле,-превосходный пример
камер, находящихся на разных уровнях и
соединенных вертикальными стволами, что
позволяет муравьям выбирать уровень
с оптимальной для их расплода температурой.
(М. О. Way, 1953.)
132 Глава 7
построенных постоянных
репродуктивных и грибных камер, но
разные виды этого подсемейства живут в
почве на разной глубине (Josens, 1972). В
очень сухих условиях пустыни их
вертикальные стволы доходят до
грунтовых вод; такие стволы строят и
термиты Psammotermes в Сахаре.
Микроклимат в холмике Trinervitermes
geminatus (не очень большом для
термитов-40 см в высоту при диаметре
основания 50 см) изучался в саванне
Берега Слоновой Кости (6° с.ш.) (Josens,
1971b). Расположенная под земляной
корочкой система галерей заполнена
теплоизолирующим материалом-
срезанными кусочками травы,
которые позднее используются в
пищу; за ними лежат сравнительно
пустые галереи и, наконец, внутри
находятся галереи для расплода, которые
тянутся под землей так же далеко, как и
над землей; есть также вертикальные
стволы, уходящие на глубину в несколько
метров, где термиты добывают глину и
воду 1. На поверхности холмика
температура может достигать 50°С при
температуре воздуха в тени 35°С, а в
галереях для расплода
поддерживается-вероятно, круглый
год-постоянная температура 28°С,
особенно в больших гнездах. В холмиках
без термитов, но находящихся в хорошем
состоянии, диапазон колебаний
температуры шире, но средний уровень
такой же, как в обитаемых холмиках;
Josens приходит поэтому к выводу, что
жилище термитов сохраняет тепло,
поступающее извне, и что вклад
метаболизма самих термитов
незначителен. Волна повышения
температуры, вызываемая солнечными
лучами в дневное время,
! Аналогично устроены гнезда Anacanthotermes
в пустынях Средней Азии.- Прим. ред.
распространяется внутри холмика
быстрее, чем в окружающей почве,
теплоемкость которой ниже; однако
все-таки в почве, находящейся
непосредственно под холмиком, спустя
час тоже отмечается температурный пик.
Таким образом, холмики Т. geminatus
поглощают солнечное тепло и сохраняют
его, постепенно отдавая галереям, где
находится расплод. Нет сомнений в том,
что холмики термитов часто строятся
так, чтобы улавливать и сохранять
солнечное тепло. В случае Amitermes
meridionalis и других видов это приводит
к тому, что основание холмика имеет
форму эллипса с длинной осью,
направленной с севера на юг, благодаря
чему угол падения солнечных лучей
уменьшается, поглощение тепла
несколько сдерживается и его
распределение в течение дня становится
более равномерным (Lee, Wood, 1971).
Каким образом термиты строят гнездо
такой формы и определяют нужную
ориентацию, не известно.
Картонные гнезда, которые термиты
строят на деревьях, не промокают;
дождевая вода скатывается по
специальным чешуйкам, покрывающим
гнездо, или же поток ее отклоняют
продольные выступы на стволах.
В тропических дождевых лесах холмики
встречаются очень часто (Abe,
Matsumoto, 1979); подобно гнездам на
деревьях, они не пропускают воду, но
лишь до тех пор, пока живы их
обитатели: когда термиты гибнут,
холмики быстро разрушаются, вероятно
из-за отсутствия ремонта. В местах,
подверженных затоплению водой,
термиты обычно строят холмики
повыше, как, например, Macrotermes и
различные виды, питающиеся злаками,
на севере Австралии. У гумусоядного
Cubitermes fungifaber, строящего
„шляпки", несколько напоминающие
шляпки грибов, в более влажных частях
Микроклимат 133
ареала постройки бывают крупнее.
Опять-таки в Австралии большее число
видов Amitermes и Nasutitermes строят
холмики в жарких тропических областях,
чем в областях с более прохладным
климатом (Lee, Wood, 1971). Может
показаться, что это противоречит
картине, наблюдаемой у муравьев,
которые используют холмики, чтобы
продвинуться в более прохладные зоны,
однако возможно, что холмики термитов
служат для охлаждения, а не для
обогрева.
Чем дальше от экватора, тем холоднее
зимы, хотя лето может быть долгим и
жарким. Муравьи-жнецы Pogonomyrmex
occidentalis устраивают в засушливых
злаковых прериях гнезда с камерами,
соединенными вертикальными стволами,
и с очищенным от растений участком
диаметром около 3 м вокруг входа. В
таких гнездах они перемещаются вверх и
вниз в зависимости от времени года
(Lavigne, 1969). В марте нулевая
температура проникает в почву на
глубину до 2 м, и в это время рабочие
особи и самка без расплода бывают
тесно сбиты в кучу в 1-2-метровой зоне.
К маю рабочие вместе с самкой
поднимаются ближе к поверхности, где
температура на глубине 10 см все еще не
превышает 10°С; в конце июля
температура на поверхности достигает
максимума -30°С, а на глубине 1 м она в
это время равна всего лишь 21-24°С. В
ноябре температура на глубине 10 см
падает до 2°С, а на глубине 1 м до 5-6°С.
Р. occidentalis следует за сезонной волной
тепла вниз, где его и застает холод.
В лесах умеренной зоны и в горных лесах
тропиков муравьи представлены
небольшим числом видов. Brown (1973),
отмечая бедность фауны муравьев на
высоте 2300-2500 м в Андах, на
Мадагаскаре и в южных областях Индии,
пишет: „...даже на высоте 2100 м
в тропических горных лесах муравьи
крайне малочисленны...", а между тем
выше, в безлесной зоне, они могут быть
местами обильны. Он указывает, что
жизненно важный фактор для
них-солнечная радиация. Ни один вид
муравьев не сумел приспособиться
к тому, чтобы гнездиться под густым
пологом леса в умеренной зоне; все они,
за немногими исключениями, вынуждены
закладывать свои гнезда на прогалинах,
которым травоядные млекопитающие не
дают зарасти, или же там, где старые
деревья отмерли и повалились. В таких
местах большая часть муравьев обитает в
мертвых ветвях или строит холмики. Они
готовятся к зиме, следуя определенной
программе выращивания расплода,
в соответствии с которой развитие
личинок на определенной стадии
прекращается, а у взрослых особей
развивается „синдром запасания корма".
Физиологические адаптации обычно
ведут к снижению пороговых температур,
необходимых для откладки яиц, развития
расплода и метаморфоза. Это безусловно
относится к виду Myrmica rubra,
у которого оптимум лежит вблизи 21 °C,
вместо того чтобы превышать 30°С. Если
поместить семью этих муравьев
в температурный градиент в насыщенном
влагой воздухе, то муравьи выбирают
температуру 20°С; сначала они переносят
расплод из участков с более высокой
температурой, затем-медленнее-из
более прохладных зон, вплоть до 5°С.
Самки иногда передвигаются сами,
а иногда их переносят или перетаскивают
волоком (Brian, 1973b). Многие муравьи
уходят на новое место при локальном
охлаждении среды-если, например,
в результате роста деревьев их гнезда
оказываются в тени.
При перемещении семьи М. rubra из
одного гнезда в другое сначала наиболее
активные рабочие особи находят новые
места и обследуют их, чтобы убедиться в
их пригодности, затем прокладывают
134 Глава 7
следы, указывающие направление, после
чего возвращаются в гнездо
и демонстрируют там определенное
поведение-двигаются толчками,
направляясь к рабочим особям, которые
вскоре складывают ноги и дают поднять
себя и унести. За лидером следуют
другие рабочие, а затем переносят и
расплод. Весь „переезд11 осуществляют
немногие рабочие особи (Abraham,
Pasteels, 1980). Tapinoma erraticum
(Dolichoderinae), доходящая в своем
распространении до умеренных широт,
устраивает небольшие холмики из
растительности и почвы; этот вид
с готовностью переходит на новое место,
после того как активисты обследуют его,
проложат след и несколько рабочих
перенесут расплод. Meudec (1977)
показал, что если выделить группу
рабочих особей, будь то активных или
неактивных, то в ней устанавливаются
новые взаимоотношения и возникают
новые лидеры и последователи.
Очевидно, активность одних особей
подавляет активность других.
Подрод Serviformica представляет собой
очень хорошо приспосабливающуюся
группу видов Formicinae, обитающих в
лесах и кустарниковых зарослях
северного умеренного пояса. В Японии
на широте 36° с.ш. Formica japonica
строит типичное гнездо с вертикальными
стволами и камерами. В марте муравьи
находятся на глубине более 80 см, но в
начале мая они поднимаются выше, на
глубину 10 см, куда переносят с собой и
яйца; в июне расплод, главным образом
в виде куколок, распределен в почве от
самого верхнего слоя до глубины 140 см.
Диапазон годичных колебаний
температуры на поверхности составляет
25° (от 3°С в январе до 28°С в августе),
но в гнезде, где температура никогда не
падает ниже 13°С в апреле и не
поднимается выше 29°С в октябре, он
сужен всего лишь до 16° (Kondoh, 1968).
Таким образом, кривая годичных
колебаний температуры в гнезде
сдвинута примерно на два месяца, так же
как и в обычной почве. Вид F.fusca на
Британских островах, гнездо которого
устроено сходным образом, заходит даже
до 54° с.ш., однако дальше на север его
замещает вид-двойник F. lemani,
у которого больше галерей,
расположенных под самой поверхностью,
и который, вероятно, лучше использует
лучи солнца, не поднимающегося высоко
над горизонтом. F.fusca легко
переселяется; разведчик, найдя более
подходящее место для гнезда, начинает
бегать взад и вперед, прокладывая след с
помощью выделений задней кишки;
после этого он входит в гнездо
и исполняет особый „танец11, который
состоит из быстрых коротких пробежек,
виляний и движений из стороны
в сторону. Он может схватить одного из
своих сотоварищей, протащить его
немного вперед, а потом поднять; тот в
ответ складывает ноги и усики
и выставляет брюшко вперед,
а разведчик переносит его на новое место
(Moglich, Holldobler, 1975). Таким
образом переносят многих молодых
рабочих особей и весь расплод, но самка
идет сама в окружении группы рабочих,
которые ее охраняют. Даже
самки-основательницы выбирают теплые
места и защищают их
от конкурентов.
Lasius niger выкапывает камеры под
плоскими камнями, которые служат для
сохранения тепла, а также защищают
муравьев от затаптывания. В отличие от
этого L.flavus строит свои холмики на
хорошо дренируемых южных склонах
(Waloff, Blackith, 1962). Сообщалось, что
их холмики трехгранные, с вершиной,
направленной на север (Hubbard,
Cunningham, 1977), хотя это не всегда
так; несомненно, эти губчатые холмики
способны поглощать и сохранять
Микроклимат
135
Рис. 7.2. Направление
ветра и циркуляция
воздуха в гнездовом
холмике Macrotermes
subhyalinus. (Weir, 1973.)
большие количества тепла. Муравьи
L.flavus подавляют рост растений,
обгрызая их корни.
7.2. Метаболическая регуляция
Большие семьи могут выделять много
тепла, влаги и углекислоты. Их проблема
состоит в том, чтобы рассеивать СО2 и
сохранять тепло и влагу соответственно
своим потребностям: в прохладном
климате надо сохранять тепло
и избавляться от влаги,
а в сухом-наоборот. Углекислота очень
легко диффундирует сквозь почву и,
несомненно, именно так удаляется из
гнездовых холмиков, хотя из гнезд таких
чувствительных к СО2 насекомых, как
медоносные пчелы, этот газ приходится
активно удалять путем проветривания.
Тепло обычно сохраняется благодаря
теплоизоляции, т. е. использованию
пространств, в которых застаивается
воздух, плохо проводящий тепло. Влага,
если ее испарение не происходит
достаточно быстро, удаляется при
проветривании вместе с потоками
воздуха. Тем не менее точно
отрегулировать эти три переменные-
задача весьма непростая.
Сохранение метаболического тепла
в гнездах некоторых термитов хорошо
установлено; например, у Nasutitermes
exitiosus в обитаемых холмиках
температура почти на 10° выше, чем в
„мертвых" гнездах, а в камерах для
расплода-всегда выше, чем поблизости в
почве или воздухе (Holdaway, Gay, 1948);
в Австралии температура в гнездах
Coptotermes, расположенных
в центральной части древесных стволов,
колеблется от 33 до 38° С, что на 13-20°
выше, чем в таких же деревьях, где нет
термитов. В огромных и сложных
136 Г.шяа 7
термитниках Macrotermes
к метаболическому теплу самих термитов
добавляется тепло, выделяемое
грибными садами. Сохранение этого
тепла очевидно, и именно оно - причина
того, что температура в участках гнезда,
где много термитов, на 5° выше;
температура в обитаемых холмиках
равна в среднем 30° С с амплитудой
колебаний в 4°. Далеко не все
выделяемое тепло сохраняется,
и возможно, что каналы и трубы, по
которым циркулирует воздух, на самом
деле охлаждают гнездо, а не собирают
тепло. Воздух поднимается от грибных
садов в верхушку холмика или в трубы и
возвращается назад в полость или
погреб. Это движение воздуха может
быть конвекционным, но оно может
также быть обусловлено ветром над
трубами, высасывающим воздух наружу,
или ветром на уровне почвы,
задувающим его внутрь. Weir (1973)
установил, что термиты Macrotermes
устраивают отверстие на уровне земли;
когда он закрывал это отверстие, стенки
гнезда становились очень влажными и
оно разваливалось. Weir высказал
предположение, что сухие
послеполуденные ветры охлаждают
и осушают гнездо. Кристаллы солей,
обнаруженные в погребах, могли выпасть
из почвенных растворов после испарения
влаги. Вентиляционный поток воздуха
почти наверное способствует удалению
углекислоты, хотя значительная ее часть
может диффундировать через земляную
корочку (рис. 7.2).
Термиты приспосабливают структуру
своих гнезд к данному местообитанию.
В сухой местности им приходится
добавлять к метаболической воде еще
воду, добываемую из глубины почвы.
Cubitermes exiguus выстилает свое гнездо
большим количеством экскрементов, а
некоторые виды Macrotermes в сухих
местах устраивают гнезда на большей
глубине. Macrotermes natalensis строит
холмики в областях с прохладными
зимами, например на плато в южной
части Африки. Nasutitermes exitiosus в
засушливых областях Австралии
сохраняет воду так эффективно, что
относительная влажность в его камерах
редко бывает ниже 92%; поэтому
полагают, что метаболической воды ему
достаточно, так как наружная оболочка
его холмиков толщиной 1-4 см состоит
из глины, сцементированной
экскрементами и, возможно, слюной
(Lee, Wood, 1971, р. 63). В южных
районах этот вид строит холмики на
южных склонах, и обитатели гнезда в
прохладную погоду собираются в его
внутренней области, но зимней спячки в
строгом смысле у них нет.
Лесные муравьи группы Formica rufa
смогли прижиться в лесах умеренного
пояса в значительной мере благодаря
своим холмикам, построенным из
растительных остатков. Некоторые
муравьи, например F. exsectoides
в северо-восточной части Северной
Америки (Janzen, 1969, р. 152),
уничтожают траву, кустарники
и проростки деревьев на площади
в несколько метров вокруг гнезда. F. ulkei
вблизи Чикаго (4 Г с.ш.) в лесу из дуба и
гикори в большинстве случаев начинает
строить свои холмики на краю леса, и в
дальнейшем они растут
асимметрично-более широкая сторона
обращена к свету. Их расположение
определяется главным образом тем,
откуда падают солнечные лучи, а не
направлением магнитного поля Земли.
Холмики непроницаемы для воды
благодаря кровле толщиной 5 см из
растительных остатков и земли; поэтому
внутри гнезда круглый год бывает суше,
чем в окружающей почве, и каждый
холмик явно поглощает и накапливает
тепло, так что на глубине 5 см на
солнечном склоне температура в них
Микроклимат 137
достигает 47° С (Scherba, 1958, 1959,
1962).
Холмики европейского вида Formica
polyctena несколько крупнее и более
рыхлые, а в их симметричном куполе,
по-видимому, меньше минеральных
веществ. Эти муравьи фуражируют на
поверхности земли как в тени, так и на
солнце, а также в кронах деревьев, но
строят гнезда на краю леса, и если
холмик оказывается затененным, то
переходят на новое место. Изучая
поведение фуражиров F. rufa у северной
границы их ареала на Британских
островах, Skinner (1980а) установил, что
они избегают дождя и темноты, но в
остальном интенсивность их
фуражирования зависит от температуры.
Изучая рассеивание тепла в двулетних
гнездах Formica polyctena, Брандт (Brandt,
1980) установил, что в этих гнездах
благодаря их структуре ежедневная волна
тепла распространяется быстрее, чем в
беспорядочных кучах материала, из
которых они построены, или даже
в кучах обычной почвы из тех же мест. В
гнезде тепловая волна полностью
затухает на глубине 20-30 см, а в почве
или в куче гнездового материала-на
глубине 10 см. Благодаря этому гнездо
очень хорошо прогревается, сохраняет
максимум тепла на ночь и в нем
создаются прекрасные условия для
созревания расплода. Брандт даже
высказывает мнение, что гнездовой
холмик по своим термическим
характеристикам эквивалентен камню, и
отмечает, что муравьи, в сущности,
выигрывают, если кусты частично
заслоняют гнездо от солнца,- это
предотвращает чрезмерное нагревание
поверхности (скажем, до 50° С). В гнездах
больших размеров метаболическое тепло
и тепло, выделяемое при аэробном
разложении гнездового материала, может
играть более важную роль. Coenen-Stass
et al. (1980) нашли, что хотя все
обитатели муравейника создают больше
тепла, чем равное по массе количество
гнездового материала, однако ввиду
того, что этого материала гораздо
больше, его теплопродукция тоже
больше; 82 кг гнездового материала
давали в 7 с лишним раз больше тепла,
чем 1 кг муравьев. В целом гнездо
давало 16,21 Вт, а его население-2,62 Вт,
что в сумме составляет около 19 Вт
(рис. 7.3).
Остается рассмотреть роль, которую
играет во всем этом поведение рабочих;
они выбирают места, обогреваемые
солнцем, обрабатывают материал,
идущий на построение гнезда, открывают
и закрывают входные отверстия, выходят
на солнце и снова прячутся. Но можно ли
считать, что муравьи собирают для
приготовления компоста наилучший
материал? Действительно ли хвоинки,
почечные чешуйки и веточки наиболее
пригодны для этого или просто их легче
всего собирать? Лесные муравьи строят
холмики, которые поглощают
и сохраняют тепло солнечных лучей и,
медленно разлагаясь, дают довольно
значительное количество „фонового1*
тепла. Кроме того, муравьи сохраняют
собственное метаболическое тепло,
однако все еще остается нерешенным
вопрос: увеличивают ли они свою
теплопродукцию при действительном или
ожидаемом понижении температуры
в гнезде?
Относительное постоянство гнезд у ос и
пчел связано с тем, что их микроклимат
в большей мере зависит от выбора места
и от способности этих насекомых
корректировать отклонения от оптимума
своим поведением. Например, если
у гнезда нет оболочки, то осы или пчелы
прикрывают его от солнца или дождя
своими телами; если же нужно создать
сквозняк или распылить воду,
чтобы она испарялась, то они машут
крыльями.
Гнезда Polistinae, подвешенные на ножке,
часто бывают расположены под
1 38 Глава 7
Температура воздуха 13,6° С
О 20 40 60 80 ЮО 120 140 см
Б I—I—I—I—I—I—I—I—I—I—I—I—I—I—I---------
Рис. 7.3. Распределение температуры (°C) в плотность муравьев в это же самое время (Б)
гнездовом холмике Formica polyctena (А) и (Coenen-Stass et al., 1980.)
Микроклимат 139
каким-нибудь укрытием, но если гнездо
ничем не защищено, то осы сидят на нем,
„свесив хвосты", так что дождевая вода
стекает по их крыльям и брюшку.
Оболочки, если они есть, защищают
расплод от прямых солнечных лучей, а
регуляция температуры, влажности
и концентрации углекислоты в гнезде
достигается вибрацией крыльев, хотя в
результате мышечных сокращений
температура тела осы может при этом
повыситься на 3° (Evans, West-Eberhard,
1973). В сухом климате осы Polistes
собирают воду, чтобы охлаждать свои
гнезда.
В вырытых в земле норках пчел
Halictidae надлежащий микроклимат
обеспечивается, по-видимому, выбором
места для норки и ее глубиной, как и у
одиночных видов. Иногда, однако, эти
пчелы производят вентиляцию,
располагаясь у входа в норку (Sakagami,
Michener; 1962). Пчелы Meliponinae либо
избегают неподходящих мест, либо
регулируют микроклимат в гнезде. К
первому типу относится Leurotrigona
mulleri, совершенно неспособная
регулировать среду в гнезде, но
обитающая обычно в гнездах термитов;
Trigona (Apotrigona) nebulata аналогичным
образом устраивается в расположенных
на деревьях шарообразных гнездах
одного из видов Nasutitermes диаметром
30-50 см. Пчелы, живущие в норах,
которые они выстилают церуменом, если
их поселить в искусственные ульи, часто
оказываются неспособными регулировать
температуру (Darchen, 1973).
Meliponinae в саванне нередко строят
гнезда в заброшенных холмиках
Macrotermes или Trinervitermes. Старые
холмики сначала разрушаются
позвоночными и вновь заселяются
другими термитами (например,
Amitermes, Ancistrotermes) или муравьями
(представителями Camponotus,
Crematogaster или других родов); позднее
в центре этого комплекса поселяются
пчелы, устраивающие длинную
извилистую трубку, ведущую от их
гнезда наружу.
В отличие от этих форм другие
Meliponini способны очень эффективно
регулировать температуру. В Бразилии
Trigona spinifer поддерживает в своих
гнездах температуру 33-36°С при
температурах окружающей среды от 8 до
30°С (Zucchi, Sacagami, 1972). Так же
обстоит дело у Dactylurina, которая
поселяется в густых зарослях растений,
где она строит шарообразные гнезда с
толстой (9 см) пенистой обшивкой из
галерей и тонкой смолистой оболочкой
толщиной всего 0,5 см. Пчелы
вентилируют гнездо, махая крыльями;
для более эффективной вентиляции они
проделывают отверстие на стороне,
расположенной против входной трубки,
или же делают несколько мелких
отверстий в оболочке. Трудно поверить,
каким громким может быть шум их
вибрирующих крыльев в жаркий полдень.
Маленькие пчелы Hypotrigona, живущие в
полостях веток, вентилируют гнездо,
выстроившись в ряды головами к центру
гнезда (Darchen, 1973). Несколько видов
безжалых пчел благодаря своей
способности регулировать температуру
смогли проникнуть в Южную Америку
до областей с холодными зимами; здесь
они зимой не размножаются, но и не
делают никаких специальных
приготовлений к зимовке.
Открытое гнездо обитающей в тропиках
Азии пчелы Apis dorsata бывает покрыто
тремя или более слоями пчел, которые
висят на нем брюшком вниз,
зацепившись коготками. По этой
„завесе" очень хорошо стекает дождевая
вода, а кроме того, она защищает
расплод от солнца и способствует
сохранению тепла. Если температура
падает ниже 30°С, пчелы сбиваются в
кучу, чтобы уменьшить потерю тепла;
140 Iшва 7
Рис. 7.4. Температура внутри и вокруг клуба
Eciton hamatum, измерявшаяся ежедневно на
протяжении полного цикла их активности.
(Schneirla, 1971.)
если же становится слишком жарко, они
начинают вибрировать крыльями или
даже собирают воду, которая затем
испаряется. Все это позволяет им
поддерживать в соте температуру
30-31 °C при внешних температурах от 20
до 34°С (Morse, Laigo, 1969; цит. по
Michener, 1974). То же самое
проделывает A.florea в восточной Африке
(20° с.ш.), удерживая температуру
в гнезде на уровне 33-37°С при
температурах среды от 18 до 33°С (Free,
Williams, 1979). Ни тому, ни другому
виду Apis, по-видимому, нет нужды
генерировать тепло днем; для
поддержания нужной температуры им
достаточно теплого климата,
нормального метаболизма
и теплоизоляции, создаваемой слоем
пчел. В равной мере это относится и к
муравьям-кочевникам Eciton hamatum
(рис. 7.4).
Такая реакция, направленная на
обогревание гнезда, могла возникнуть из
инкубационного поведения, когда
взрослые особи путем тесного контакта
своих тел с расплодом создают для него
подходящий микроклимат. На это
указывают данные о тех галиктах,
которые строят грозди ячеек под землей.
Шершни и осы прижимаются к расплоду
и поочередно втягивают и растягивают
брюшко, распространяя тепло,
вырабатываемое в груди, и одновременно
усиливая газообмен. Они не инкубируют
пустые коконы, но будут инкубировать
кусочки фильтровальной бумаги,
смоченные экстрактом из
куколок,-несомненный признак
химического опознавания (Ishay, 1972).
Молодая самка осы Vespula плотно
прижимается к своим первым ячейкам с
расплодом, что вполне может повысить
их температуру, а поскольку ячейки
покрыты оболочкой, то и температуру
воздушного пространства. Однако
наивысшего искусства в инкубировании
расплода достигает Bombus. Самка,
начинающая строить гнездо, делает в
первом личиночнике неглубокую канавку,
в которую плотно входит ее тело (Alford,
1975). Запас меда в медовой чаше,
Микроклимат 141
расположенной в пределах досягаемости,
служит „топливом" для процесса
дыхания, и температура расплода
становится значительно выше
окружающей температуры (Michener,
1974). Heinrich (1974) сумел показать, что
самка в состоянии поддерживать
температуру груди на уровне 35-38°С, а
температуру брюшка на уровне 31-36°С.
Это дает ей возможность согревать
расплод до 25°С при температуре среды
5°С и до 33°С при температуре среды
30°С, т. е. она явно способна
к терморегуляции. С понижением
температуры среды потребление самкой
кислорода повышается; очевидно, она
оценивает степень отклонения от
оптимума и соответственно повышает
свой метаболизм за счет активности
летательной мускулатуры, т. е. действует
подобно простому гомеостату. Успех
этой реакции зависит от ее быстроты и
от термоизоляции гнезда; в более
благоприятном положении окажутся,
конечно, те самки, которые выбрали (или
которым посчастливилось найти)
подходящее место для гнезда. Должно ли
оно находиться на солнце или в тени? В
одном случае экономится топливо,
в другом обеспечивается более
постоянный режим. По мере увеличения
числа рабочих особей терморегуляция
улучшается, особенно при постройке
навеса. При этом температура в гнезде
поддерживается на уровне 30°С
с колебаниями в диапазоне менее чем 3°,
и остается лишь предотвращать перегрев,
вдувая в гнездо прохладный воздух;
собирать воду при этом не приходится.
Vespinac, обитающие в умеренном
климате в подземных гнездах,
выстланных бумагой, тоже превосходно
регулируют температуру гнезда,
особенно летом, в период наибольшей
численности населения; зимой они живут
в одиночку, а их самки диапаузируют,
подобно большинству насекомых.
Оптимальная температура для их
расплода около 30-33°С, и они могут
поддерживать ее даже при температуре
среды 10°С; для охлаждения гнезда
применяется вентиляция, а в случае
необходимости-сбор воды и ее
испарение (Edwards, 1980).
У Apis mellifera и близкого к ней вида
А. сегапа кондиционирование среды
в гнезде приближается к совершенству.
Эти виды распространены во всех
областях с умеренным климатом, где они
могут жить без помощи человека
в запечатанных полостях
с термоизоляцией, так как запасают
очень много меда и медленно
используют его на протяжении всей
зимы. Они не должны допускать
слишком сильного снижения
температуры в гнезде: при 8°С рабочие
особи уже гибнут. Подготовка к зиме
начинается с укорочением дня, задолго
до наступления зимних холодов; матка
прекращает откладку яиц, а молодые
личинки уничтожаются, так что зимуют
только взрослые особи.
Когда температура падает ниже 18°С,
пчелы сбиваются в клуб, наружный слой
которого образуют плотно прижавшиеся
друг к другу неподвижные пчелы,
создающие термоизоляцию, тогда как
особи, находящиеся внутри клуба,
активно двигаются и „дрожат", чтобы
продуцировать тепло (летательные
мышцы могут вибрировать, не приводя в
движение крылья). Эти две группы пчел
редко меняются местами. Внутри клуба
может поддерживаться температура
выше 20°С при температуре среды,
близкой к нулю. Любопытно, что соты
почти не мешают формированию клуба и
движению в нем пчел; только пчелам
Apic сегапа приходится проделывать в
сотах отверстия, чтобы стали
возможными поперечные передвижения.
Поглощаемый в этот период сироп очень
густой, но пчелы поддерживают нужную
1 42 Г. idea 7
влажность за счет метаболической воды.
Они удерживают в организме свои
(жидкие) экскременты и вылетают
наружу лишь весной, с возвращением
яркого солнца и тепла.
Весной пчелы доводят температуру
в небольшой части гнезда с расплодом
до 35°С. Возможно, они больше
реагируют на длину дня, чем на
внешнюю температуру, которая сильно
варьирует. Летом, когда численность
населения в улье велика, температура
расплода может регулироваться
с точностью почти до 0,5° (Btidel, 1968).
Такой стабильности способствует
большая масса расплода и меда, которые
весьма эффективно сохраняют тепло,
хотя слабо продуцируют его (в этом
отношении даже вклад расплода
пренебрежимо мал). Влажность обычно
бывает достаточной; пчелы вентилируют
гнездо не только для того, чтобы
удалить из него нагретый воздух, но и
для того, чтобы впустить сухой воздух,
необходимый для испарения воды из
нектара во время созревания меда, что
тоже способствует охлаждению улья. Все
это приводит к тому, что пчелы лучше
чувствуют себя в сухой атмосфере, чем
во влажной (Michener, 1974). При
исключительно жаркой и сухой погоде
пчелы собирают воду и распыляют ее по
сотам. Lensky (1963, цит. по Darchen,
1973) показал, что Apis mellifera ligustica
(итальянская раса) в Израиле может
поддерживать в гнезде с расплодом
температуру 34-38°С при наружных
температурах от 22 до 50°С. Такая
терморегуляция, по-видимому,
недоступна одному из африканских
подвидов -A. mellifera adansonii, который
старается избежать перегрева, поселяясь
в разного рода пустотах между корнями
деревьев, ограничивая численность семей
путем частого роения и мигрируя
в новые места (Darchen, 1973). Пчелы
реагируют таким образом не только на
перегрев во время сухого сезона, но и на
недостаток пищи в период дождей (как,
например, A.cerana indica-, Woyke, 1976)
или на нападение млекопитающих,
муравьев или других членистоногих,
например пчелиной огневки (Fletcher,
1975). Готовясь к переселению, пчелы
выбрасывают личинок из запечатанных
ячеек, прекращают откладку яиц
и поедают запасы меда. Вероятность
переселения выше для семей, которые
недавно роились, и некоторые виды
склонны к этому больше, чем другие
(Winston et al., 1979). Переселение явно
представляет собой необычную форму
миграции, характерной для A.florea и
A. dorsata.
Во время вентиляции из гнезда, конечно,
удаляется углекислота, хотя пчелы
способны выдержать довольно высокое
ее содержание в воздухе, вплоть до 3%.
При повышении концентрации СО2 Apis
mellifera начинает вентилировать гнездо,
даже если температура ниже
оптимальной; в очень больших семьях
содержание СО2 регулируется более
эффективно, чем в маленьких (Seeley,
1974).
Подведем итоги. Муравьи выбирают
подходящее место и строят
многокамерное гнездо, где представлено
широкое разнообразие микроклиматов,
по которым можно распределить
расплод. В прохладном климате они
используют для накопления тепла такие
природные объекты, как плоские камни,
и строят на освещаемых солнцем местах
холмики, поглощающие и сохраняющие
тепло; есть виды, способные даже
использовать тепло, выделяющееся при
аэробном разложении растительных
материалов, которые они собирают в
кучу, а другие виды, может быть,
способны генерировать метаболическое
тепло и в ответ на понижение
температуры среды. В жарком сухом
климате муравьи избегают солнца,
Микрок.т мат 143
добывают воду из глубоких слоев почвы
и из растений или собирают росу.
Термиты менее подвижны, чем муравьи,
так как у них репродуктивные камеры
гнезда часто бывают жестко
фиксированными, но они тщательно
выбирают места для постройки гнезда,
покрывают его оболочкой, по которой
скатывается вода, и регулируют потоки
воздуха, изменяя величину отверстий,
ведущих в ходы и полости. Холмики
имеют теплоизоляцию, что позволяет
термитам сохранять или рассеивать
метаболическое тепло в зависимости от
обстоятельств. Осы и пчелы могут
инкубировать свой расплод и покрывать
гнезда теплоизолирующими
материалами; они могут также при
колебаниях температуры покрывать
гнездо плотной живой оболочкой из
собственных тел, продуцировать тепло,
повышая интенсивность своего
метаболизма при нехватке тепла, или же
рассеивать тепло (а также газообразные
отходы и водяные пары) путем
вентиляции и испарения воды при угрозе
перегрева. Медоносные пчелы способны
очень тонко регулировать температуру
летом и не допускать охлаждения гнезда
зимой. Эта активная регуляция
микроклимата требует расхода энергии,
но необходима из-за неподвижности
расплода. После специальной
подготовки, проводимой летом, целые
семьи могут переходить на новое место,
захватив с собой большую часть запасов.
Пчелы и осы, а в меньшей степени и
муравьи переселяются, вероятно, в ответ
на серьезную угрозу климатического или
биотического характера, и если это
случается регулярно, то переселения
могут перейти в миграции. Дальнейшие
подробности см. Seeley, Heinrich (1981).
Глава 8
Защита
Для многих организмов семьи
общественных насекомых, нередко
чрезвычайно многочисленные, весьма
привлекательны как источник пищи
(расплод, запасы корма, крылатые особи,
материалы гнезда), а сами гнезда-как
теплые убежища с постоянной
температурой и влажностью.
Болезнетворные бактерии и грибы,
паразитические нематоды и другие черви,
клещи, которые питаются падалью,
воруют корм или являются хищниками,
пауки и многие другие
членистоногие-все эти организмы
нападают на сообщества насекомых и
используют их самыми разными, порой
неожиданными способами. Если говорить
о позвоночных, то даже рыбы поедают
половых особей, попавших на
поверхность воды, а жабы залезают в
гнезда. Другие общественные насекомые,
относящиеся к тому же или близкому
виду, могут конкурировать с данным
видом за одни и те же ресурсы или
делать попытки к социальному
паразитизму. В этой главе
рассматриваются способы защиты,
применяемые общественными
насекомыми против членистоногих
и позвоночных, в двух аспектах:
1) используемое оружие и 2) необходимая
при этом организация. Дать здесь
полный обзор всей проблемы врагов
общественных насекомых невозможно,
однако много упоминаний о них читатель
встретит во всех главах книги.
8.1.2. Болезненные
и парализующие
впрыскивания
Первым оружием перепончатокрылых
было жало (рис. 8.1). Жало происходит
от яйцеклада паразитических
перепончатокрылых; оно, вероятно,
использовалось эктопаразитами для
парализации хозяев и в конце концов
совершенно перестало служить для
откладки яиц (Малышев, 1966).
У некоторых примитивных подсемейств
муравьев (Ponerinae и Myrmeciinae) оно
все еще используется для парализации
жертвы. Рабочие жалят жертву
и одновременно призывают на помощь,
выделяя из своих мандибулярных желез
феромоны тревоги. Феромон
Odontomachus обладает запахом
шоколада, создаваемым
алкилпиразинами, который побуждает
рабочих собираться толпой и хватать все
что движется, в том числе собственных
сестер. Многих муравьев, в частности
представителей Dorylinae, достаточно
сдавить жвалами, чтобы убить, однако
Odontomachus, схватив жертву, еще
и впрыскивают в нее яд (Wheeler, Blum,
1973). Другой представитель
Ponerinae-Paltothyreus tarsatus, охраняя
колонны своих сородичей,
возвращающихся с добычей, выделяет
алкилсульфиды; то же самое делает
Megaponera foetens. Австралийский
муравей Myrmecia gulosa использует жал<
А Межсегментная мембрана
Отверстие
Канал жала
дюфуровой железы
Рис. 8.1. Жало Vespula. А. Медиальный
разрез через брюшко и жало. Б. Поперечный
разрез через собственно жало. В. Продольный
разрез через дюфурову железу. (Из Edwards.
1980, по Schlusche.)
146 Г.шва 8
как для умерщвления жертвы, так и для
обороны обычно весьма успешно; его яд
содержит гистамин, гиалуронидазу
и белковые компоненты (Cavill, Robertson,
1965).
Pseudomyrmeciinae используют жало
больше для защиты, чем для нападения
на жертву. К этому подсемейству
относятся два -рода-Pseudomyrmex
и Tetraponera, живущие на растениях,
которые предоставляют им и пищу, и
кров. Один из видов Tetraponera,
обитающий на небольшом дереве
Barteria, очень эффективно использует
свое жало даже против слонов. Как
пишет Janzen (1972), эти муравьи падают
на человека с дерева по нескольку сразу,
находят участки кожи, не прикрытые
одеждой, вонзают в них жало
и впрыскивают яд; боль возникает не
сразу, но, начавшись, продолжается
несколько дней, носит пульсирующий
характер и ощущается глубоко
в мышцах. Люди и травоядные
позвоночные быстро приучаются
избегать деревьев, населенных
муравьями. Стратегия нападения
и оружие этих муравьев, по-видимому,
больше подходят для того, чтобы
отпугивать позвоночных, а не
беспозвоночных. В отличие от этого
Pseudomyrmex (обитающий в колючках
Acacia) нападает массами и наносит
множество слегка раздражающих уколов,
которые быстро проходят, хотя нередко
муравьи вводят в кожу снабженные
зубчиками ножны жала (Jansen, 1966).
Это быстрые и ловкие существа, у них
большие сложные глаза, и они охотятся в
одиночку. Поймав насекомое, они жалят
его, не вводя, однако, ножны жала, а
затем могут бросить жертву, вместо того
чтобы съесть ее, так как кормовые
растения обеспечивают этих муравьев
жирами и белком, содержащимся
в тельцах Бейтса, или пищевых тельцах.
Эти „муравьиные" деревья
(мирмекофиты) используют своих
муравьёв для защиты от других
растений. В лесном пологе такая защита
состоит в перегрызании молодых побегов
лиан и веток кустарников, что уменьшает
опасность затенения. Кроме того,
муравьи расчищают от травы
и проростков некоторый участок земли
вокруг дерева, что снижает опасность в
случае пожара. Tetraponera поддерживает
под деревьями Barteria участки
диаметром 2-3 м в чистоте, многократно
перекусывая растения. Муравей Azteca,
обитающий на Cecropia (Могасеае)
в тропических областях Америки, не
защищает дерево от беспозвоночных или
позвоночных, но очень эффективно
сдерживает рост лиан и эпифитов,
а также растений, находящихся по
соседству (Janzen, 1969).
Все осы семейства Vespidae имеют жало,
которым они пользуются только для
обороны. Они очень чувствительны к
звукам и запахам, обладают острым
зрением, и их часовые могут направиться
к любому постороннему объекту,
появившемуся вблизи. Конечно, такое
поведение варьирует в зависимости от
вида и от величины семьи; чем больше
семья, тем ее члены агрессивнее. Осы,
гнездо которых покрыто оболочкой и
имеет входное отверстие, всегда
выставляют несколько часовых,
дежурящих, видимо, поочередно. Они
проверяют каждого пришельца и умеют
отличать чужаков, даже принадлежащих
к тому же виду; таких незваных гостей
прижимают к субстрату и жалят.
У Vespula есть феромон тревоги,
выделяемый ядовитыми железами
(Maschwitz, 1964, цит. по Jeanne, 1980).
Яд содержит амины и белки и свободные
аминокислоты. В число аминов входят
гистамин, катехоламины, дофамин
и серотонин, которые воздействуют на
сердечно-сосудистую систему
млекопитающих. Белки-это главным
Защита 147
образом пептиды, такие как кинины ос,
снижающие кровяное давление, а также
различные ферменты. Из ферментов
наиболее важны фосфолипаза,
останавливающая свертывание крови, и
гиалуронидаза, повышающая
проницаемость соединительной ткани и
способствующая распространению ядов в
организме. Дозы яда, содержащейся даже
в одном жале, достаточно, чтобы
причинить боль, напугать и предостеречь
от повторной атаки позвоночное и убить
беспозвоночное животное (Edwards,
1980).
Некоторые осы. прежде чем напасть,
честно предупреждают пришельцев. Осы
Synoecia surinamus, обитающие
в тропических областях Америки
в гнездах с плоскими сотами, если им
кто-нибудь досаждает, начинают
ритмически барабанить по твердой
оболочке сотов; при дальнейшем
нарушении покоя рабочие особи выходят
наружу и начинают поднимать
и опускать крылья в такт ударам по
оболочке. В качестве последнего средства
они прибегают к своим зазубренным
жалам, которые остаются в тканях врага
до тех пор, пока весь яд не будет
впрыснут (Evans, West-Eberhard, 1973,
р. 180).
Для защиты от беспозвоночных, главным
образом от муравьев, некоторые осы
втирают в ножку гнезда репелленты. Для
самок-основательниц это служит
эффективной мерой защиты гнезда даже
во время их отлучек, и к такой мере
широко прибегают виды Polistes,
обитающие в умеренных широтах.
Репеллент выделяет стернальная железа,
расположенная на последнем сегменте
брюшка (Jeanne, 1975; Post, Jeanne,
1981).
Полигинные роящиеся осы в случае
нападения нередко покидают гнезда и
расплод, а позже либо возвращаются
назад, либо строят новое гнездо. Polybia
sericea, используя зрительную
информацию, образует рой
у поврежденного гнезда. Найдя место
для нового гнезда, лидеры метят его
секретом вентральных желез
и прокладывают следы, оставляя пятна
секрета на хорошо заметных объектах.
Затем, совершая беспорядочные
пробежки, лидеры поднимают рой, и осы
летят по следу, чтобы начать строить
новое гнездо (Jeanne, 1981). Более
коварным нападениям подвергаются осы
Polistes canadensis в низовьях Амазонки,
где они строят открытые гнезда на
деревьях: 56% семей заражены
гусеницами моли (сем. Tineidae), которые
поедают меконии *. При этом они
проделывают дырки из одной ячейки в
другую, нанося вред как соту, так и
куколкам. В ответ на это осы строят
несколько сотов поблизости друг от
друга и при заражении одного сота
переходят в другой (Jeanne, 1979b).
Пчелы Halictinae сужают вход в гнездо и
охраняют его от вторжения муравьев,
паразитических ос-немок (сем. Mutillidae),
пчел-кукушек (Nomada) и пчел своего
собственного вида, но принадлежащих к
другим семьям. Пчелы Agapostemon, у
которых несколько самок, пользуются
общим входным отверстием, но строят
каждая собственные ячейки, отходящие
от главного ствола, поочередно
охраняют гнездо, сменяясь через каждый
час, и не допускают в него муравьев,
мокриц и других беспозвоночных.
Пчела-кукушка (Nomada) тоже пытается
проникнуть в гнезда этих пчел
и отложить яйца в их ячейки, после чего
ее личинка уничтожает личинку хозяев и
использует запасенный для нее корм.
Самки Agapostemon, живущие
поодиночке, не могут отразить такие
1 Меконий-комок экскрементов, отклады-
ваемый личинкой перед окукливанием.- Прим,
ред.
148 Г. шва 8
вторжения (Abrams, Eickwort, 1981).
Lasioglossum zephyrum в лабораторных
условиях научается распознавать набор
запахов, принадлежащих обитателям
гнезда и самому гнезду (Kukuk et al.,
1977). Это достигается легче, если пчелы
связаны родством или выращивались
вместе; в других же случаях необходимо
продолжительное социальное
взаимодействие, причем запах
неродственных пчел быстро забывается.
В таких ситуациях кооперирование
создает очевидные преимущества: пока
одна особь стоит на страже, другие
занимаются строительством и сбором
корма. Караульщицы гораздо легче
пропускают в гнездо родственных
особей, чем неродственных; инбредные
двоюродные сибсы, имеющие 74% общих
генов, приравниваются в этом смысле к
сестрам (75% общих генов). Несомненно,
пчелы научаются распознавать запах
родственных особей в раннем возрасте
(Greenberg, 1979). У Bombus
мандибулярные железы караульщиц
выделяют репелленты; феромон,
выделяемый В. lapidarius, содержит
масляную кислоту и два кетона с 5-13
атомами углерода (Cederberg, 1977).
Менее агрессивные виды Bombus
переворачиваются на спину и выставляют
жало, которое может выделять
репеллент; такое поведение
сопровождается жужжанием. В отличие
от этого В. atratus, обитающий
в тропических областях Америки,
известен своей агрессивностью, которую
он проявляет в случае угрозы для гнезда.
В трибе Apini такой способ защиты
достигает степени, наблюдаемой еще
только у некоторых представителей
Vespidae. Жало Apis снабжено
зазубринами, расположенными на
ланцетах; они помогают проникновению
жала в тело жертвы и прочно
удерживают его там, так что яд
продолжает вводиться в ткани (Hermann,
1971). Пчелиный яд сходен с ядом ос, и
хотя среди содержащихся в нем
биогенных аминов нет серотонина
и адреналина, в нем есть зато два
пептида-апамин и мелиттин. Из
ферментов он содержит, в частности,
кислую и щелочную фосфатазы, а также
эстеразы (Benton, 1967). Пчелы,
ужалившие позвоночных, гибнут
в результате «аутотомии», принося
пользу своему сообществу, но во вред
самим себе; поэтому такая особенность
могла возникнуть только у эусоциальных
перепончатокрылых (Hermann, 1971).
Феромоны тревоги и мобилизационные
феромоны A. mellifera вырабатываются
железами, расположенными вблизи
самого жала; в секрете этих желез
содержатся по крайней мере 8 ацетатов,
три спирта и ряд нормальных алканов и
алкенов. Изопентилацетат сам по себе
возбуждает пчел и привлекает их
к кончику жала, но он не обладает таким
сильным действием, как вся
содержащаяся в жале смесь веществ.
A. florea и A. dorsata реагируют на
пентиловый эфир дольше, чем A. mellifera
и А. сегапа (6-15 мин по сравнению с
3 мин); другой, менее летучий эфир
(2-децен-1-ол-ацетат), имеющийся
в секрете первой пары видов, продлевает
у них чувство тревоги. Пчелы выделяют
эти ацетаты в воздух, поднимая брюшко
и покачивая им из стороны в сторону при
выдвинутом наружу жале. Помимо
демонстрации жала и выделения
феромонов тревоги у пчел есть еще набор
феромонов, секретируемых
мандибулярными железами, которые
выделяют пчелы-караульщицы, если их
непрерывно тревожат. Главный
компонент этого секрета-2-гептанон. Он
вызывает массовый выход из гнезда
рабочих, которые бросаются на врага; те,
кто не может вонзить в него жало,
крепко схватывают его и угрожающе
жужжат.
Защита 149
Некоторых медведей и многих людей
привлекает мед, запасаемый Apis
mellifera. Пчелы очень чутко реагируют
на появление у своих ульев больших
темных движущихся фигур, особенно
если последние трясут улей. При
вибрации улья пчелы на мгновение
прекращают свое жужжание вразнобой, а
А.сегапа буквально шипит с частотой
700 Гц. Это само по себе снижает их
агрессивность (Koeniger, Fuchs, 1973)!
A.dorsata может долго оставаться
агрессивной. Будучи потревожена, пчела
возвращается на сот и совершает
быструю пробежку; поверхность сота
тотчас же покрывается сверху донизу
множеством пчел. Спустя несколько
мгновений они спадают с сота, опускаясь
почти до уровня земли, и улетают
группами: от 50 до 5000 пчел могут
начать погоню за агрессором в ответ на
призыв одной потревоженной пчелы. Не
обнаружив врага, пчелы быстро
прекращают погоню, но если одна из них
вонзит в него жало, то
распространяющийся по ветру ацетат
служит пчелам ориентиром и они быстро
направляются в нужное место или к
жалам, расставленным
экспериментатором. После такого
происшествия вся семья в течение
нескольких дней не может прийти
в норму. Koeniger указывает, что
A. dorsata-дикие пчелы. Пчелы, живущие
в ульях, менее агрессивны; очевидно, они
либо привыкли к людям (Koeniger, 1975),
либо принадлежат к более миролюбивой
линии, создавшейся в результате
одомашнивания.
Медоносные пчелы защищают
с помощью жала свой улей от многих
насекомых, в частности от разных видов
Vespa и Vespula, однако осам благодаря
их проворству и настойчивости удается в
конце сезона разрушать слабые семьи.
При очень неблагоприятных
обстоятельствах-высокой влажности или
регулярных многократных вторжениях
пчелиной огневки или человека-пчелы
покидают гнездо. У A.mellifera этому
предшествуют приготовления:
прекращается выращивание расплода, и
каждая пчела нагружается запасами;
особенно склонны к переселениям
западноафриканские расы медоносной
пчелы и A.adansonii, а также A.florea,
которая перебирается с места на место,
перенося с собой запасы (Free, Williams,
1979). Наиболее ярко выражена
склонность к переселениям у A.dorsata,
предпринимающей регулярные сезонные
миграции, которые уже были описаны.
8.2. Ядовитые мазки и
репелленты
Эволюционно продвинутые муравьи
утратили способность применять жало
как для защиты, так и при охоте. Они
пользуются либо токсичным
репеллентом, выделяемым их
зачаточным жалом, либо своими
мощными жвалами. Последнее стало
возможным благодаря преимуще-
ственному росту (аллометрия)
передней части тела, в результате
которого образуются большие жвалы
и приводящие их в движение сильные
мышцы. При крайней степени такой
аллометрии крупные рабочие особи уже
не могут заниматься фуражировкой или
выращиванием расплода, а берут на себя
функции, требующие силы и агрес-
сивности; например, у Dorylinae
крупные рабочие выстраиваются вдоль
троп, выставив жвалы в стороны от
тропы. У таких муравьев, как Labidus и
Eciton, и у наземных видов Aenictus жало
все еще используется во время охоты, но
оно недостаточно сильно, чтобы
причинить боль человеку (Hermann,
Blum, 1967; Kugler, 1979а). У других
родов, живущих в общем под землей,
таких как Апотта (рис. 8.2) и Dorylus, и
150 /'.шва 8
Рис. 8.2. Касты Апотта
nigricans. Рабочие особи
(А-В) и самка (Г)
бескрылые, а самец
(Д)-крылатый. (Из
Grasse, 1951, по Forel.)
г
у большинства видов Aenictus жало еще
слабее, но они совершают нападения
большими группами (Schneirla, 1971).
В секрете мандибулярных желез
Neivamyrmex nigrescens и, вероятно,
других муравьев-кочевников содержится
антибиотик скатол (метилиндол),
убивающий некоторые бактерии и грибы
(Brown et al., 1979).
Несколько примеров, относящихся
к Myrmicinae, помогут представить себе
весь диапазон разнообразия-от
муравьев, охотящихся при помощи жала,
до таких, которые используют его только
для прокладки следов или
разбрызгивания репеллента (Kugler,
1979а). Примером наиболее
примитивного состояния служат виды
Защита 151
Myrmica. Их жало не имеет зазубрин и
слабо склеротизировано; яд содержит
смесь белков и аминов; у них есть также
полярный и летучий следовой феромон
иной химической природы
(Cammaerts-Tricot et al., 1977). Кроме
того, эти муравьи используют продукты
секреции дюфуровой железы, чтобы
повысить эффективность следов и метить
занятые участки вокруг гнезда, само
гнездо и места скопления тлей; у М. rubra
в число этих продуктов входят ряд
углеводородов и терпеноид фарнезин.
Углеводороды представлены в основном
гептадеценом (С17:1), нонадеценом
(С 19:1), пентадеканом (С 15)
и гептадекадиеном (Cammaerts et al.,
1981b). Секрет мандибулярных желез
М. rubra представляет собой в основном,
водный раствор белка, но они выделяют
также октан-3-ол, октан-3-он,
ацетальдегид и бутанон. Это феромоны
«тревоги», которые побуждают муравьев
к активности (особенно октан-3-он)
и направляют их движение (в особенно-
сти октан-3-ол), создавая тем
самым возможность призвать помощь
туда, где возникла угроза вторжения.
Этилкетоны, такие как октан-3-он
и 4-метилгептан-3-он,-особенно
характерные компоненты секрета
мандибулярных желез Myrmicinae (Blum,
Brand, 1972). В секрете других видов
Myrmica содержится тот же набор
соединений в различных соотношениях;
данные об этом суммированы в статье
Cammaerts et al. (1981а). Ранее уже
говорилось, что виды Leptothorax
в случае нападения муравьев-
рабовладельцев варьируют способы
защиты; если на них напали L. duloticus,
то они кусают и жалят, но при нападении
Harpagoxenus americanus они впадают в
панику; предполагается (по аналогии с
Formica), что муравьи Harpagoxenus,
нападая на гнездо Leptothorax,
выпускают в него какой-то репеллент
(Alloway, 1979).
Solenopsis invicta - «огненный муравей»,
хорошо известный из-за своей
склонности нападать на человека,-
вцепляется в жертву жвалами и глубоко
вонзает в нее жало, впрыскивая ядовитую
смесь диалкилпиперидиновых алкалоидов
(Blum, Brand, 1972). Все эти необычные
соединения липофильны и хорошо
распространяются по кутикуле, когда
Solenopsis нападает на других
членистоногих. Его дюфуровы железы
выделяют аттрактант, содержащий
углеводороды, в том числе н. гептадекан.
Pogonomyrmex тоже прославился своим
жалом; в сущности, это единственный
род муравьев, обладающий автономным
жалом (Hermann, 1971). Его яд-самый
токсичный из всех ядов насекомых и
более опасен для человека, чем яд
шершня или медоносной пчелы (Schmidt,
Blum, 1978). Он содержит факторы,
вызывающие боль (гистамин
и серотонин), гиалуронидазу, которая
способствует его распространению
в организме, фосфолипазы,
разрушающие форменные элементы
крови и тучные клетки, и другие
ферменты-липазу, кислую фосфатазу и
эстеразу. Этот «алгогенный» яд мог
возникнуть в процессе эволюции как
средство защиты от хищников-
позвоночных, например ящериц,- на
беспозвоночных он почти не действует
(Hermann, 1971).
У муравьев-листорезов жало гладкое, без
зазубрин, и слабое; оно используется для
прокладки следов (Hermann, 1971).
Большинство представителей этой
группы не проявляют враждебности, если
потревожить их гнездо, а начинают
спасать расплод и свои грибные сады
(Weber, 1972). Однако Atta во множестве
выходят из отверстий гнезда и кусают
врагов до крови. В качестве оружия они
используют жвалы, которые могут
наносить позвоночным глубокие раны,
152 Глава 8
Рис. 8.3. Полиморфизм самок у Pheidole.
А-Е. Рабочие особи. Ж. Бескрылая матка. 3.
Самец. (Wheeler, 1910.)
прорывая кожные покровы, подобно
стилетам Apis. У Atta texana
и A. cephalotes мандибулярные железы
хорошо развиты; их секрет содержит
4-метил-З-гептанон как одну из
составных частей феромона тревоги и
мобилизации. В отличие от этого
A.sexdens выделяет два изомера цитраля,
играющие роль токсинов, а не
феромонов тревоги (Blum, 1974, р. 239).
Интересно отметить, что этот вид
гораздо более чувствителен к цитралю,
чем к соответствующему 2-гептанону
(Moser et al., 1968, цит. по Blum, Brand,
1972).
Pheidole- обширный, разнообразный
и высокополиморфный род (рис. 8.3).
Пигидиальная железа Ph. biconstricta
вырабатывает репеллент, который
активизирует сотоварищей по гнезду, а
при нанесении на тело агрессора
оставляет липкое токсичное пятно
(Kugler, 1979b). У крупных особей
(солдат) Ph. fallax необычайно большие
ядовитые железы, выделяющие скатол
(метилиндол)-репеллент, который они
наносят кончиком жала (Kugler, 1979а).
Солдаты Ph. pallidula и Ph. teneriffana
стремятся к участию в обороне, и в
экспериментальных условиях их трудно
заставить направиться к корму; в гнезде
они заняты размельчением семян
(Szlep-Fessel, 1970). У Ph. dentata
существует система мобилизации солдат
на защиту сотоварищей. Обнаружив
опасность, мелкие фуражиры
возвращаются в гнездо, прокладывая
след, и устраивают демонстрации перед
солдатами; в ответ на это солдаты,
составляющие 10-20% всей семьи,
выходят из гнезда, идут по следу и
своими сильными жвалами (при слабом
жале) разрывают врагов на части. Wilson
(1976а) сообщает, что особи Solenopsis
geminata - аборигенного северо-
Фото 24. Крупная рабочая особь или солдат
Eciton burchelli (Dorylinae) в Тринидаде.
Солдаты Dorylinae могут образовать
защитную „оболочку“ вокруг колонны
рабочих, а также перетаскивают крупную
добычу; эти функции варьируют у разных
видов.
Фото 25. Семья Eciton burchelli, отдыхающая
днем под камнем. Муравьи образуют
„бивуак“, подвесившись к нижней поверхности
камня и друг к другу с помощью коготков,
имеющихся на их лапках, и могут
поддерживать внутри скопления температуру
на несколько градусов выше температуры
окружающей среды. [Фото 24
и 25-D. I. Stradling]
1 54 Глава 8
Рис. 8.4. Касты
Zacryptoceros varians. А,
Б. Солдат. В. Голова
солдата. Г. Рабочая
особь. Д. Крылатая
самка. Е. Самец.
(Wheeler, 1910.)
американского вида,-если их
много, стремятся найти гнездо Pheidole и
могут врываться в него, выпуская через
высоко поднятые жала струю летучей
жидкости. Тогда внезапно, пока солдаты
Pheidole продолжают защищаться, кусая
агрессора, мелкие рабочие особи
начинают выносить из гнезда расплод и
разбегаются в разные стороны вместе с
самкой. Wilson высказывает предполо-
жение, что эти два вида
муравьев - привычные, даже
потомственные враги и что они
обладают особой чувствительностью
друг к другу. Солдаты Ph. militicida стоят
в радиусе 5 м от гнезда на тропах и
охраняют половых особей, выходящих
наружу для брачного лёта. Если тропы,
принадлежащие двум соседним гнездам,
пересекаются, то хотя рабочие особи не
проявляют взаимной враждебности,
солдаты, находящиеся у гнезда,
обезглавливают рабочих, которые
направились по чужому следу (Holldobler,
Moglich, 1980).
Наконец, в подсемействе Myrmicinae
существует ряд необычных способов
защиты. Zacryptocerus varians обитает в
полых веточках на мангровых болотах.
Крупные рабочие особи (рис. 8.4)
защищают свои гнезда от других
муравьев, затыкая входные отверстия
собственными головами, которые точно
соответствуют им по величине (Wilson,
1974а, 1976b). У этого Вида нет
функционирующего жала, но имеется
очень большая дюфурова железа,
а секрет мандибулярных желез содержит
4-гептанон и 4-гептанол; эти вещества
заставляют фуражиров остановиться и
Защити 155
Рис. 8.5. Поза тревоги и обороны у Formica
polyctena (А) и Crematogaster ashmeadi (Б).
Справа изображен муравей в обычной позе,
слева-в позе тревоги. (Holldobler, 1977.)
прижаться распластанными телами
к веткам. Любопытно, что эти муравьи
могут с одинаковой быстротой бегать
как вперед головой, так и назад (Olubajo
et al., 1980). У Crematogaster
лопатообразные жала, из которых они
выбрасывают репелленты и токсины
(рис. 8.5), отпугивающие гораздо более
крупных муравьев, чем они сами (но
бессильные против позвоночных). Враги,
не внявшие предупреждению, получают в
рот порцию секрета, который
превращается в клейкую массу. У одного
вида Crematogaster дюфурова железа
увеличена и содержит липофильный
репеллент, который выбрасывается во
время драки из основания
редуцированного жала. Метаплевральная
железа обычно секретирует органические
кислоты, которые, растекаясь по
поверхности тела, убивают
микроорганизмы, но у некоторых видов
из вздувшихся желез выделяется
напоминающий смолу эксудат,
отпугивающий врагов и склеивающий их;
это вызывает также тревогу у их
собратьев по гнезду (Maschwitz, 1974,
1975b). Использование метаплевральных
желез, имеющихся только у муравьев,
изучали Maschwitz et al. (1970).
У Myrmicinae секрет этих желез обычно
имеет кислую реакцию и лишен запаха;
исключение составляют виды Atta,
у которых он пахнет медом и содержит
фенилуксусную, индолуксусную
и гидроксидекановую кислоты;
полагают, что этот секрет подавляет рост
плесневых грибов, засоряющих грибные
сады.
Dolichoderinae известны своими
ядовитыми секретами. У некоторых
видов (например, у Iridomyrmex humilis)
сохранились рудименты жала, но они не
используются для впрыскивания яда
(Раvan, Ronchetti, 1955),
вырабатываемого хорошо развитой
пигидиальной железой, резервуар
которой открывается около анального
отверстия (Holldobler, Engel, 1978).
Рабочие особи наносят этот секрет на
своих противников и быстро убегают.
Секрет содержит феромоны тревоги, он
токсичен и, высыхая, становится вязким и
липким; в состав его входят вещества,
относящиеся к классу циклопентано-
идных монотерпенов, в том
числе иридомирмецин (два изомера) и
долиходиаль. Два последних соединения
родственны исходному иридодиалю
(Cavill, Robertson, 1965); они токсичны
для насекомых и других организмов.
Возможно, что успешная эволюция
подсемейства Dolichoderinae обусловлена
именно тем, что их большая
пигидиальная железа выделяет эти
вещества (Wheeler et al., 1975).
В тропиках муравьи Azteca часто живут в
картонных гнездах или в мирмекофитах;
их рабочие особи набрасываются
большой группой на потревожившего
гнездо человека и больно кусают; они
выделяют три циклопентилкетона,
которые вызывают тревогу,
156 Г .шва X
способствуют массированности
нападения и отпугивают других
муравьев. Интересное структурное
приспособление для борьбы
с захватчиками обнаружено
у австралийского Iridomyrmex purpureus, в
гнездах которого много отверстий,
ведущих в камеры и галереи,
оканчивающиеся слепо. Ettershank (1968)
предполагает, что это затрудняет
проникновение и распространение в их
гнездах муравьев Camponotus consobrinus,
которые после вторжения замазывают
галереи черной смолой.
В io время как в других подсемействах
впрыскивание ядов сменилось нанесением
на тело противника липких токсичных
пятен, из которых испаряются
репелленты, Formicinae выпускают на
врага струю простейшей из всех
органических кислот-муравьиной,
содержащей только один атом углерода.
Хотя эта кислота очень летуча, ее
летучесть уменьшают алканы с короткой
цепью (главным образом ундекан),
выделяемые дюфуровой железой. Тот
или другой из них, с добавлением
примерно 40 спиртов, ацетатов
и сесквитерпенов, порождает тревогу
(Bergstrom, Lofquist, 1972; Blum, 1974).
Муравьиная кислота эффективна как
против насекомых, так и против
млекопитающих, действуя на них либо
сразу, либо после прокусывания кожи.
У муравьев-рабовладельцев Formica
pergandei и F. subintegra большие
дюфуровы железы, содержащие ацетали
спиртов с 10, 12 и 14 атомами углерода.
Они обрызгивают этим секретом гнездо
вида-раба и, пользуясь замешательством
хозяев, уносят их куколок (Regnier,
Wilson, 1971). Крупные рабочие особи
видов-рабов могут спуститься в гнездо и,
загородив своими телами галереи,
преградить нападающим доступ
к расплоду (Мариковский, 1963). Это
заставляет вспомнить Zacryptoceros
(Myrmicinae). Сходным образом
Camponotus (Colobopsis), тоже живущий в
веточках на мангровых болотах, затыкает
отверстия, ведущие в гнездо, собственной
головой. У Colobopsis крупные особи
меньше специализированы, чем
у Zacryptoceros, так как они служат
резервуарами (плерэргатами) для
запасания жидкой пищи, поэтому
Colobopsis может позволить себе иметь
по одной крупной рабочей особи на трех
мелких вместо соотношения 1 :10.
Подробное сравнение репертуаров
выполняемых ими функций произвели
Wilson (1974с, 1976b) и Cole (1980). Два
других вида Colobopsis на Малайском
архипелаге используют для защиты не
ядовитые, а мандибулярные железы,
смазывая противника желтой
маслянистой жидкостью, лишенной
запаха, которая становится липкой
и склеивает их. Эти железы заполняют у
них большую часть тела, включая
брюшко, и жидкость выделяется
в результате мышечного сокращения,
разрывающего брюшко муравья
(Maschwitz, 1975а,b). Однако такие
необычные самоубийственные методы
защиты встречаются редко.
Широко распространенный род Lasius,
чтобы вызвать тревогу, использует
муравьиную кислоту и метилкетоны,
выделяемые дюфуровой железой. У этого
рода, в отличие от Formica,
мандибулярные железы содержат весьма
разнообразные терпеноиды и фураны
(циклические терпены), такие как,
например, цитраль и цитронеллаль. Один
из фуранов-дендролазин-токсичен
и полезен для защиты от врагов под
землей; он обнаружен у Lasiusfuliginosus,
обладающего большими
мандибулярными железами (Bernardi et
al., 1967). Их использование-проявление
конвергентного сходства со способами
защиты, свойственными Dolichoderinae
(Wilson, Regnier, 1971). У муравьев
Защита 157
Рис. 8.6. Рабочая особь
Oecophylla longinoda
в угрожающей позе.
(Holldobler, Wilson,
1977а.)
Oecophylla, если их потревожить,
наблюдается градуированная реакция
(рис. 8.6); они возбуждают и привлекают
на помощь своих сотоварищей по гнезду
с помощью феромона из мандибулярных
желез. Этот феромон состоит (у крупных
рабочих) из сильно летучего гексанала,
стимулирующего подвижность, менее
летучего 1-гексанола, действующего как
аттрактант на расстоянии 10 см, но как
репеллент-на более близком расстоянии,
и по меньшей мере 30 еще менее летучих
соединений. Их функция, возможно,
сводится лишь к ослаблению действия
летучих веществ и их распространения,
хотя они, быть может, помогают
локализовать объект нападения
и индуцировать кусание; в число этих
соединений входят 2-бутил-1-октеналь и
ундекан-3-он. Позднее, если враждебные
действия продолжаются, Oecophylla
выделяют из ядовитой железы
муравьиную кислоту, а из дюфуровой
железы-смесь углеводородов, главным
образом н.ундекан. Кетоны
с неразветвленной цепью, спирты
и ацетаты в их секретах отсутствуют
(Bradshaw et al., 1979а, b, с). Сводка
данных о химическом составе феромонов
и поведении муравьев содержится
в работе Parry, Morgan (1979).
Пчелы Meliponinae, подобно высшим
муравьям, лишены жала, и у них тоже
возникло вместо него другое оружие,
причем они используют для защиты в
основном мандибулярные, а не ядовитые
или дюфуровы железы. Они часто
вылетают из гнезда плотным жужжащим
роем и, кусая врага, выделяют из своих
мандибулярных желез токсичные,
раздражающие и вызывающие боль
вещества. Выделяемый одновременно
феромон тревоги возбуждает рабочих и
указывает направление, в котором
следует атаковать врага. У Trigona
(Scaptotrigona) этот феромон содержит
гептан-2-он и нонан-2-он; у Trigona
(Geotrigona) subterranea он содержит
цитраль, обнаруженный также в одном из
следовых феромонов (Blum, Brand, 1972).
Meliponinae в смысле защиты полагаются
главным образом на то, что их гнезда
хорошо спрятаны и что в них ведут
длинные и часто извилистые трубки, вход
1 58 Глава 8
в которые замаскирован, сужен и нередко
окружен липкими отпугивающими
веществами. Пчелы Lestrimelitta cubiceps
добывают большую часть меда, пыльцы
и церумена в гнездах Trigona
(Hypotrigona) braunsi, вторгаясь в них
целыми группами. Найдя узкий скрытый
вход в гнездо, грабители должны
преодолеть преграду из липкого меда.
Это задерживает их и даже временно
удовлетворяет (Portugal-Araujo, 1958).
Американская Lestrimelitta limao выделяет
из своих мандибулярных желез цитраль
(Blum, 1974), имеющий запах лимона,
который, по-видимому, нарушает
оборонительное поведение Trigona.
В эволюции термитов никогда не было
стадии, на которой яйцеклад служил бы
одновременно жалом, как это было в
группе жалящих перепончатокрылых.
Оружие у термитов находится на
переднем конце тела и, так же как у
муравьев, у них образовалась особая
каста «солдат» с крепкими мандибулами
(у некоторых видов они способны
вцепиться мертвой хваткой) и с железами
ротовых частей, выделяющими
репелленты, токсины, тягучие клейкие
вещества и феромоны тревоги (Noirot,
1974). У некоторых солдат над ротовыми
частями выступает «нос», из которого
выбрасывается струя секрета
фронтальной железы; у других видов
защитные вещества вырабатываются
межсегментными железами.
Солдаты Mastotermes darwiniensis с их
большими мускулистыми головами
и массивными жвалами справляются с
членистоногими, равными им по
величине. Они выбрасывают изо рта
жидкость, которая темнеет, застывает,
приобретая каучукоподобную структуру,
и обездвиживает врага. Затвердевание
этого вещества подобно «дублению» и,
по-видимому, происходит в результате
соединения и-бензохинона с белком,
приводящего к образованию склеротина.
Вероятно, хинон выделяется головной
железой, которая открывается на лбу или
на головном выступе, а белок поступает
из лабиальной железы (Moore, 1968).
Весьма возможно, что хинон вызывает
тревогу и заставляет обитателей гнезда
собраться вместе.
У Zootermopsis nevadensis (Termopsinae)
существует два способа распространения
тревоги: во-первых, рабочие особи могут
ударять головой по деревянному
субстрату, производя шум, и, во-вторых,
могут бесшумно раскачиваться из
стороны в сторону. Нет никаких данных
в пользу того, что производимый
рабочими особями шум воспринимается
или что они выделяют какой-то феромон,
но эти особи собираются и заделывают
повреждения с помощью экскрементов и
обломков под охраной солдат, которые
выставляют из отверстия головы (Stuart,
1969).
У двух групп термитов - Rhinotermitidae
и Nasutitermitinae (Termitidae) - развились
знаменитые „носы“ (удлиненные выступы
головы, на вершине которых открывается
отверстие фронтальной железы). Их
челюсти атрофировались, а челюстные
мышцы теперь используются для того,
чтобы сжимать резервуар фронтальной
железы и выбрасывать токсины
и клейкие вещества. Эти высоко-
специализированные солдаты
находятся в зависимости от рабочих
особей, которые снабжают их пищей.
Они могут идти по следу, но не могут
сами прокладывать его, поскольку у них
нет стернальных желез. У муравьев
Schedorhinotermes (Rhinotermitidae) «нос»
развит слабо, а солдаты сохраняют
жвалы, хотя редко пользуются ими;
вместо этого они трутся о кожу врага
верхней губой, покрытой выделениями,
содержащими пять кетонов, в том числе
два ядовитых для насекомых
Защита 159
винилкетона. У другого вида этого рода
найдено три кетона (Prestwich, 1975,
р. 149). К этому же семейству относится
Coptotermes lacteus, «нос» которого
выделяет млечную жидкость-секрет
фронтальных желез. Она состоит из
н.алканов с 24 атомами углерода,
эмульгированных в насыщенном водой
мукополисахариде, состоящем главным
образом из глюкозаминовых единиц. На
воздухе этот эксудат превращается
в эластичную пленку. У Nasutitermes
(Nasutitermitinae) фронтальная железа
вырабатывает клейкие каучукоподобные
соединения, а также феромоны,
обладающие стимулирующим
и аттрактантным действием. У шести
видов этого рода секрет железы содержит
главным образом а-пинен, а у некоторых
видов также Р-пинен и лимонен.
Trinervitermes (из того же подсемейства)
выделяет те же пять кетонов, что и
Schedorhinotermes, в том числе
и винилкетоны, а также а-пинен; но состав
выбрасываемых им клейких веществ
неизвестен (Quennedy, 1973).
Три вида Amitermes (Amitermitinae)
различаются главным компонентом
выделяемого секрета-это может быть
терпинолен, лимонен или а-фелландрен.
Чаще всего у них встречается а-пинен,
индуцирующий энергичные кусательные
движения. Вещества, вызывающие
тревогу, и мобилизующие соединения,
используемые Amitermes, еще не
идентифицированы, но у шести видов
Macrotermitinae солдаты выделяют во
время драки секрет лабиальной железы,
содержащий хиноны (Maschwitz, Tho,
1974). Солдаты Macrotermes carbonarius,
сопровождающие фуражировочные
колонны, захватывают и кусают врага
своими серповидными челюстями,
а затем выбрызгивают на него из
лабиальной железы коричневый
водянистый секрет, содержащий главным
образом толухинон, а также некоторое
количество бензохинона (Maschwitz et al.,
1972). Таким образом, у этой группы
слюнная железа стала органом защиты и
солдаты стали зависеть от рабочих в
отношении питания.
У Macrotermes natalensis мелкие солдаты,
развивающиеся из личинок ранних
возрастов, охраняют поврежденные
участки гнезд во время починки их
рабочими, но вне гнезда охрану
фуражировочных колонн несут крупные
солдаты. Термиты, которые строят над
своими дорогами навесы, например
Nasutitermes corniger, работают под
охраной солдат, выстраивающихся в ряд
головами наружу. Термиты
Hospitalitermes monoceros
(Nasutitermitinae) прокладывают на
стволах деревьев, куда они залезают в
поисках лишайников, дороги шириной
1 см. По обе стороны этих дорог встают
солдаты, способные быстро реагировать,
несмотря на свою слепоту; в качестве
сигнала тревоги они, вероятно, выделяют
из своей фронтальной железы
терпеноиды (Maschwitz, Muhlenberg,
1972).
Доля солдат в сообществе термитов
поддерживается, вероятно, на возможно
более низком уровне, так как они
совершенно непродуктивны.
У Trinervitermes geminatus доля крупных
солдат составляет 1 /6 всех стерильных
особей, у Macrotermes natalensis-l/40, у
Apicotermes desneuxi-1/143
и у Acanthotermes acanthothorax-1/3QQ
(Bouillon, 1970, p. 197). У Macrotermes
bellicosus солдаты составляют примерно
4% взрослых бесполых особей (Collins,
1981а). Имеются экспериментальные
данные о том, что доля солдат в семье
подвержена саморегуляции (рис. 8.7).
Особенно ярким примером
конвергентного сходства с муравьями
могут служить термиты Globitermes
160 Глава 8
Рис. 8.7. Положительная
зависимость между
числом солдат и общим
числом термитов после
12 недель содержания в
группах „рабочих"
у Coptotermes formosanus.
(Havarty, 1979.)
sulphureus, солдаты которых, защищая
семью, лопаются, выбрасывая клейкую
желтую жидкость, подобно тому как это
происходит у Colobopsis (Maschwitz,
1975a,b).
Итак, основной способ защиты,
применяемый всеми общественными
насекомыми, состоит в устройстве
оболочки или вертикального ствола с
узким входным отверстием, охраняемым
сменяющимися особями или одной
особью, которая либо бдительно следит
за появлением возможной опасности и
нападает на врага, либо затыкает вход в
гнездо своей забронированной головой,
точно соответствующей отверстию.
Репелленты, покрывающие ножку гнезда,
или выделение репеллентов головными
железами (обычно мандибулярными)
относятся к этой же категории
оборонительных действий; иногда они
несут двойную функцию - предупреждают
врага и призывают других особей на
помощь. Это относится в особенности к
тем насекомым, у которых имеется каста
солдат, т. е. к некоторым группам
высокоразвитых муравьев и ко всем
термитам, но не к осам или пчелам.
У муравьев солдаты менее
специализированы, чем у термитов; они
обычно кормятся сами и могут
выполнять тяжелую работу, которую
нельзя отнести к защитным функциям в
строгом смысле.
Общественным насекомым приходится
иметь дело с двумя главными группами
врагов-позвоночными и насекомыми, в
том числе с другими общественными
насекомыми. В обоих случаях они
применяют одно и то же средство-жало,
гомологичное яйцекладу, которое,
естественно, могут использовать только
Защита 161
самки ос, пчел и муравьев;
впрыскиваемый ими яд вызывает очень
сильную боль, эффективно отпугивает
врага и в большинстве случаев убивает
его. Однако наиболее продвинувшиеся в
эволюционном отношении пчелы
и муравьи отказались от жала
и выпускают на врага ядовитую струю
либо из анального отверстия, либо из
мандибулярных желез. Во втором случае
челюсти обычно сильно развиты, с тем
чтобы сначала нанести рану. В этом
отношении перепончатокрылые
обнаруживают конвергентное сходство с
многими термитами, с той разницей, что
у термитов зависимость солдат от
рабочих в смысле получения корма
зашла гораздо дальше, так что солдаты
могут использовать слюнные железы для
синтеза токсичных смолоподобных
веществ. Наивысшего развития
использование ядовитой струи достигло у
тех термитов, у которых в процессе
эволюции появились фронтальная железа
и «нос». Помимо слюнных и ядовитых
желез яды у них секретируют еще и
межсегментные железы. Солдаты
охраняют не только гнездо, но
и фуражировочные галереи.
Глава 9
Переработка пищи
В । незде пища в зависимости от ее
характера либо распределяется между
обитателями, либо складывается про
запас. Компоненты, доставляющие
энергию,-липиды и углеводы-достаются
главным образом рабочим особям,
которые являются двигателем
сообщества; белки, необходимые для
роста, получают самки, откладывающие
яйца, и личинки, вылупляющиеся из этих
яиц; молодые взрослые особи, особенно
самки муравьев, пчел и ос, тоже
потребляют наряду с источниками
энергии большое количество белка
(рис. 9.1 и 9.2). Превращение пищи в
биомассу общественных насекомых
должно происходить быстрее, чем гибель
особей и их разложение (на всех стадиях
развития), хотя потери несколько
снижаются благодаря вторичному
использованию части вещества,
входившего в состав яиц и молоди.
Разумеется, с увеличением численности
особей возникает необходимость
в большем пространстве и большее
количество отходов метаболизма
приходится использовать в качестве
строительного материала или удалять.
В этой и последующих главах будут
рассмотрены все эти превращения.
Сначала мы опишем обработку
и концентрирование пищи,затем
распределение ее гнездовыми рабочими,
далее основание семьи самками или
репродуктивными парами и, наконец,
резкий рост численности, следующий за
основанием семьи.
Очень важно, чтобы молодые особи
начинали работать как можно раньше и
работали как можно больше. В гнезде
есть много дел, которые под силу
бледным, несклеротизированным,
физически слабым и мелким особям:
уход за расплодом, уборка, сортировка и
распределение пищи, освобождение
линяющих особей от шкурок и коконов.
За измельчение пищи молодые особи
могут приняться позднее, когда зубцы их
жвал будут хорошо склеротизированы.
Для не тяжелой, но сложной работы
внутри гнезда небольшие размеры могут
оказаться даже выгодными, и, как
правило, рабочие особи, выполняющие
эти функции, бывают моложе и мельче
тех, кто действует за пределами гнезда.
У низших термитов к труду
привлекаются личинки старших
возрастов (тогда их называют
псевдоэргатами или «ложными
рабочими»), а у муравьев и пчел ресурсы
внутригнездовой рабочей силы
увеличиваются путем замедления
созревания мелких рабочих-иногда до
такой степени, что самые мелкие рабочие
вообще никогда не выходят из гнезда. У
жалящих перепончатокрылых личинки
так сильно отличаются от имаго, что
могут использоваться для таких
специальных целей, как выработка шелка,
запасание воды, сахара и жиров, а также
в качестве источника протеолитических
ферментов.
J1 у |лаву можно было бы с равным
правом назвать «эволюция класса
кормилиц», так как развитие процессов
очистки и концентрирования пищи
сопровождалось все большим
удлинением периода, который взрослые
особи проводят в гнезде, прежде чем
выходят из него для фуражировки.
Предполагается, что на самом
примитивном уровне фуражиры просто
Переработка пищи 163
Рис. 9.1. График,
показывающий, что сахар
распространяется
в популяции рабочих
особей быстрее, чем
белок. Перед началом
эксперимента рабочих
особей не кормили
в течение 4 суток.
(Markin, 1970.)
приносят корм в гнездо и бросают его
там, предоставляя половым особям и
молоди брать его самим. На следующем
этапе эволюции рабочие пережевывают
корм, затем смешивают его
с собственными пищеварительными
соками, далее собирают пище-
варительные соки личинок (у Нутепо-
ptera) и добавляют их к корму и,
наконец, поглощают пережеванную массу
и отрыгивают ее личинкам. На еще более
поздней стадии эволюции они сами
поглощают пищу и концентрируют
основной содержащийся в них продукт в
своих железах, а затем секретируют его и
скармливают личинкам, выделяя воду
обычным путем. Это сопряжено
с большей затратой усилий взрослыми
особями и меньшей-личинками, но зато
рост и созревание ускоряются и взрослые
особи у полиморфных видов получают
возможность регулировать эти важные
процессы. Это имеет особенно большое
значение у перепончатокрылых, так как в
кишечнике их личинок между средним и
задним отделами есть перегородка,
отфильтровывающая все коллоидные
частицы, которые могут пройти через их
крайне узкий пищевод; частицы эти
выбрасываются вместе с перитрофи-
ческой мембраной только после
прекращения кормления.
164 Глава 9
Время после
Рис. 9.2. Распределение меченого
(радиоактивного) корма между самками (/),
мелкими личинками (II), рабочими особями
(III) и крупными личинками (IV) Iridomyrmex
humilis. (Markin, 1970.)
9.1. Пережевывание,
экстрагирование
и отрыгивание
Лабиальные железы самок Vespula на
стадии основания ими гнезда выделяют
протеазу для переваривания добычи
(Landolt, Акте, 1979). Хотя самка
начинает свою деятельность как обычная
рабочая особь, она прекращает
фуражировку и остается в гнезде либо
после того, как приобретает
«подчиненных», как это часто бывает в
подсемействе Polistinae, либо тогда,
когда первые рабочие особи начинают
добывать корм. Теперь она принимает от
рабочих приносимых ими животных или
пульпу и, поев сама, кормит личинок и
продолжает строить гнездо. У ос разные
касты мало отличаются друг от друга;
кормления, дни
даже у Vespinae различия между ними
касаются главным образом размеров и
репродуктивного поведения, а не общего
облика и деталей строения.
Соответственно и различия между
молодыми и старыми рабочими особями
очень невелики, так как кутикула только
что выведшихся рабочих быстро твердеет
и темнеет, и они выходят из гнезда на
фуражировку. У Dolichovespula sylvestris
только что появившиеся имаго спустя
несколько часов начинают размельчать
мух, приносимых в гнездо другими
особями, и накладывают полученную
пасту на ротовые части личинок, давая
более крупные порции более крупным
личинкам. Они выходят из гнезда
охотиться на мух в первый или второй
день. Степень предварительной
обработки пищи варьирует: у D. sylvestris
на это уходит всего лишь одна минута,
но личинка выбрасывает хитиновые
остатки в виде комочка, выпадающего из
гнезда, тогда как у Vespula germanica
рабочие обрабатывают мух того же вида
несколько минут, превращая их в сильно
Переработка пищи 165
измельченную массу, которую личинки
глотают сразу. Это повышает
эффективность экстрагирования, но зато
увеличивает объем остатка внутри
личинки, если только взрослая особь не
отфильтровывает крупные частички сама,
в чем нет уверенности (Brian, Brian, 1952).
Какая же система лучше? У V.germanica
молодые осы, приняв добычу
у фуражиров, занимаются как
приготовлением корма, так и его
распределением (Edwards, 1980); таким
образом, в течение нескольких дней они
составляют группу кормилиц.
У Vespula vulgaris только что выведшиеся
рабочие в первые пять дней до 20%
времени отдыхают в ячейках, а после
этого начинают ухаживать за личинками
и распределяют добычу, приносимую в
гнездо рабочими старшего возраста
(Roland, 1976). В общем можно,
по-видимому, говорить об усилении
кооперирования между рабочими
особями ос от трибы Polistini к трибе
Polybiini и далее к подсемейству
Vespinae; рабочие выходят из гнезда на
фуражировку в несколько более позднем
возрасте, а в период созревания
распределяют или перерабатывают корм,
приносимый старшими рабочими. Давняя
проблема в отношении питания ос
касается обмена жидкостями между
личинками и взрослыми особями:
получив от взрослых корм, личинки
отдают им слюну, хотя не обязательно
сразу. У личинок Vespula слюна содержит
протеазы и амилазы (Maschwitz, 1966),
которые взрослые особи используют для
переваривания животной пищи,
поскольку железы их собственных
ротовых частей эти ферменты не
вырабатывают; правда, в средней кишке
они содержатся в большом количестве,
однако это слишком глубоко для того,
чтобы переваренную пищу можно было
отрыгивать (Edwards, 1980; Grogan,
Hunt, 1977). Потребность у рабочих в
ферментах личинок сильно выражена у
шершня (Vespa orientalis); у этого вида
взрослые особи тоже занимаются
механической переработкой корма,
а личинки поставляют ферменты, хотя
иногда личинкам скармливают
непереработанную животную пищу
(Ishay, 1968). Крупных личинок рабочие
особи посещают почти по сто раз в час;
если дать осам белок, меченный |4С, то
пик выделения меченых протеаз
слюнными железами наблюдается спустя
30 мин, а затем они продолжают
выделяться в течение еще 2 ч. Таким
образом, переработка пищи связана с
мутуализмом между взрослыми особями
и личинками: они обеспечивают
механическую ее часть, а другие-
химическую.
Дело, однако, не только в ферментах:
слюна личинок содержит 9% сахаров
(главным образом трегалозу и глюкозу),
тогда как в гемолимфе их концентрация
вчетверо ниже (Maschwitz, 1966); что
касается аминокислот и белка, то
в слюне содержание их в пять раз ниже,
чем в гемолимфе. Между тем выделение
сахара после дачи корма, меченного 14С,
происходит позднее, чем выделение
протеаз: оно начинается спустя примерно
3 ч после получения корма
и продолжается в течение 20 ч (Ishay,
Ikan, 1968); таким образом, у личинок
протекает целый ряд метаболических
процессов, и хотя трудно поверить, что
личинки ос дезаминируют для рабочих
особей белки, которые наверняка очень
нужны им самим, вполне возможно, что
они переваривают липиды, которых
много бывает в животной пище,
и ресинтезируют сахара. Если это так, то
ранним утром личинки могут служить
богатым источником энергии для ос,
готовых начать рабочий день. Следует
рассмотреть еще три момента.
Во-первых, когда взрослые особи
размельчают пищу, не «снимают» ли они
166 / tafia 9
с нее жиры, отправляя их в свои
фарингеальные железы (подобно
некоторым муравьям)? Но в этом случае
им нет надобности получать сахар от
личинок. Во-вторых, осы добывают сахар
из нектара и пади и отдают по крайней
мере часть его своим личинкам (Brian,
Brian, 1952); почему же личинки позже
возвращают им сахар? Быть может, они
играют роль хранилищ и не в состоянии
удовлетворить потребности имаго
в сахаре, хотя, как считает Maschwitz,
одной порции слюны должно хватить
рабочей особи на полдня. В-третьих, осы
не могут регулировать содержание воды
в организме с помощью мальпигиевых
сосудов, так как увлажнение гнезда
повредило бы его структуру; поэтому
было высказано предположение, что
содержание воды регулируется
слюнными железами. Таким образом,
возможно, что личинки ос помимо своей
основной функции-превращения корма в
собственные ткани-выполняют три
дополнительные задачи: синтезируют
ферменты, синтезируют сахара
и выделяют воду.
Го п,ко у самых примитивных муравьев
молодые особи начинают работать
с самого юного возраста. Имаго
Amblyopone pallipes, самостоятельно
выйдя из кокона, сразу же начинают
заботиться о своих сестрах-куколках. Уже
через 5 дней их кутикула становится
твердой и темнеет, они выходят из гнезда
и отправляются на охоту. Traniello (1978),
наблюдая за восьмью различными
видами деятельности этих муравьев, не
обнаружил никакой связи с возрастом.
Они парализуют жертву, но никогда не
подвергают корм предварительной
переработке, а просто кладут на него
личинок. Случайный успех в том или
ином виде деятельности приводит к ее
подкреплению, причем некоторые особи
реагируют на нужды семьи активнее
других, и их можно назвать «лидерами».
9.2. Желточные пищевые
добавки
Муравьи Dorylinae не могут иметь
специализированной группы кормилиц;
их кочевой образ жизни делает
необходимым быстрое созревание
молодых рабочих особей, отвердевание и
потемнение их покровов (даже у видов,
активных ночью), а у Neivamyrmex
nigre sc ens еще совсем бесцветные рабочие
особи в возрасте 3-7 дней участвуют в
набегах (Topoff, Mirenda, 1978). Особи,
принадлежащие к разным классам,
различаются в основном размерами;
мелкие рабочие кормят личинок внутри
бивуака (временного скопления
муравьев), окруженного многослойной
оболочкой из крупных рабочих (Schneirla,
1971). Производят ли эти муравьи
кормовые яйца, твердо не установлено.
Schneirla описывает оболочки яиц Eciton
hamatum, остающиеся после того, как их
содержимое было выедено, однако
предполагается, что это были обычные
яйца «с толстой оболочкой».
У Myrmeciu, так же как и у высших
муравьев, деятельность зависит как от
размеров, так и от возраста. У M.gulosa
некоторые очень мелкие рабочие особи
никогда не фуражируют (Gray, 1973, цит.
по Brian, 1979а), но у других видов таких
различий нет, даже если размеры особей
различаются вдвое (Haskins, Haskins,
1980). Тем не менее молодые рабочие
особи М. forceps остаются в гнезде до
месячного возраста и обладают особыми
адаптациями для кормления личинок,
главная из которых-способность
продуцировать в своих яичниках
очищенную пищу в виде
инкапсулированного желтка, или
«кормовых» яиц (Freeland, 1958). Эти
яйца в отличие от настоящих яиц
покрыты тонким гибким хорионом, они
мягкие, шарообразные, их легко
проткнуть и высосать; они стерильны в
Переработка пищи 1 67
обоих смыслах этого слова - неспособны
к дальнейшему развитию и свободны от
микроорганизмов. Ими кормятся особи
всех возрастных и социальных категорий,
и выделение их, по-видимому, можно
стимулировать, массируя половое
отверстие. Можно ли представить себе
лучший источник пищи? Хотя этот
желток не совсем такой, как в обычных
яйцах, он, возможно, лучше
соответствует по составу потребностям
личинок и имаго; однако это еще не
установлено.
У Myrmicinae период времени,
проводимый молодыми рабочими
в гнезде, зависит от их размеров; если
они мелкие, то они могут оставаться в
гнезде всю свою жизнь, а если крупные,
то всего несколько недель, но тем не
менее у них имеются все необходимые
кормилицам органы-овариальные
желточные железы, фарингеальные
железы и жвалы с острыми зубцами. У
Myrmica фуражиры приносят добычу в
гнездо и бросают ее; фуражировкой
занимаются крупные рабочие особи
старшего возраста, имеющие более
темную коричневую окраску
и сношенные зубцы. Кормилицы
протыкают жертву своими еще острыми
зубцами, вводят в нее пищеварительные
соки и высасывают содержащиеся в ней
жидкости. Превращенные в пульпу ткани
жертвы кормилицы кладут на брюшко
крупных личинок, лежащих на спине;
личинки дотягиваются до пищи своими
ротовыми частями и добавляют к ней
собственную слюну (Abbott, 1978). От
пищи остается только комочек обломков
хитина. Некоторое количество протеазы
поступает из мандибулярных желез
рабочих особей, но большая ее часть, как
и у ос, содержится в слюне личинок
(Ohly-Wiist, 1977). При втягивании этой
переваренной вне кишечника пищи в зоб
рабочего она подвергается двум
обработкам. Во-первых, взвешенные
частицы отфильтровываются
и собираются в инфрабуккальной камере,
где они спрессовываются в комочек,
имеющий форму лимона, который
в подходящий момент выбрасывается в
зону отбросов. Во-вторых, капельки жира
«снимаются», подобно сливкам с молока,
поступают в глотку и добавляются к
маслянистому содержимому
фарингеальных слепых выростов, откуда
всасываются прямо в гемоцель. Наконец,
водный раствор аминокислот и белков
проходит по тонкому пищеводу в зоб,
находящийся в передней части брюшка.
Здесь этот раствор остается до тех пор,
пока не выталкивается вперед и не
отрыгивается для кормления мелких
личинок или же не проходит дальше, в
среднюю кишку для окончательного
переваривания и всасывания. Все эти
перемещения регулируются специальным
клапаном, препятствующим обратному
движению пищи при ее отрыгивании.
По-видимому, если рабочая особь не
может найти личинок, чтобы покормить
их, этот клапан расслабляется и пища
всасывается, а позднее из нее образуется
желток. Основная масса жиров из
фарингеальных слепых выростов
всасывается, и вполне возможно, что она
служит важным источником энергии для
рабочих особей. Могут ли жиры
непосредственно передаваться от
кормилицы фуражиру, точно неизвестно;
не исключена также возможность того,
что фарингеальные выросты иногда несут
секреторные функции и синтезируют
пищу для личинок. Таким образом, у
рабочих особей Myrmica имеется весьма
совершенный механизм для
переваривания, фильтрации
и фракционирования жертвы.
О । кладка кормовых яиц рабочими
особями происходит как реакция на пакет
яиц независимо от того, состоит ли этот
пакет из собственных репродуктивных
яиц (отложенных в отсутствие самки) или
168 Г.шва 9
Рис. 9.3. Яйца,
откладываемые рабочими
особями Myrmica
в яйцевых трубках.
А. Быстро продуци-
руемые кормовые яйца.
Б. Репродуктивные яйца,
образующиеся более
медленно, после слияния.
(Brian, Rigby, 1978.)
из яиц самки. Наилучшим стимулом
служит плодущая самка; чем больше она
откладывает яиц, тем больше кормовых
яиц она индуцирует и тем выше
становится концентрация пищи,
предназначенной ей самой (рис. 9.3).
Кроме того, кормовые яйца могут
месяцами оставаться в пакете,
и вылупляющиеся личинки без труда
прогрызают их и высасывают (в отличие
от обычных яиц), т. е. благодаря этим
яйцам личинки не нуждаются в уходе со
стороны рабочих особей вплоть до
следующей личиночной стадии. Молодые
рабочие особи реагируют на секрет
дюфуровой железы, но не на феромоны
тревоги, выделяемые мандибулярной
железой, и в их ядовитых железах очень
мало яда (Cammaerts-Tricot, 1975; цит. по
Brian, 1979а).
Выработка желточного корма
определенными особями-кормилицами,
по-видимому, весьма обычна среди
низших Myrmicinae; например,
у Temnothorax recedens (Leptothoracini)
она может индуцироваться самками и
личинками (Dejean, 1974; Dejean, Passera,
1974). У Messor capitatus рабочие особи
откладывают яйца обычной формы и с
нормальным хорионом, но эти яйца
стерильны и организация желтка у них
нарушена; такие яйца тоже
откладываются под влиянием
стимуляции, исходящей от самки (Delage,
1968), и, по-видимому, занимают
промежуточное положение между
обычными и кормовыми яйцами.
У муравьев этого рода имеется
возрастная функциональная группа
кормилиц, и рабочие начинают
фуражировать не ранее чем в месячном
возрасте (Goetsch, Eisner, 1930).
Муравьи-листорезы тоже могут
производить кормовые яйца. У Atta
sexdens эти яйца вдвое крупнее
репродуктивных, и их подносят самке
ухаживающие за ней рабочие особи
средней величины; они дают ей также
шарики из грибов (Wilson, 1980а).
Рабочие особи этого эволюционно
продвинутого вида, разводящего грибы,
весьма различны по общим размерам
тела и распадаются по этому признаку на
пять «каст». Самые мелкие (средняя
ширина головы 1,0 мм) ухаживают за
грибным садом и за расплодом; они
также возвращаются в гнездо, сидя на
листьях, которые фуражиры тащат
в гнездо. Несколько более крупные
рабочие (ширина головы 1,4 мм)
Переработка пищи
169
превращают листья в пульпу и отделяют
от нее жиры, которые накапливают в
своих фарингеальных железах (Peregrine
et al., 1973); те из них, которые позже
становятся фуражирами, в молодом
возрасте играют роль кормилиц. Рабочие
особи с шириной головы 1,4—1,6 мм
помогают личинкам при линьке,
с шириной головы 1,8-2,2 мм
приносят субстрат в гнездо, а самые
крупные (ширина головы >2,2 мм)
смолоду не делают ничего. Позднее они
разрезают на части и перетаскивают
листья, роют и защищают гнездо.
Messor capitatus извлекает из семян
жиры; этот вид, так же как
Pogonomyrmex, не собирает сахаристых
жидкостей и не распределяет их между
членами сообщества. Кроме того,
у Messor нет мандибулярной железы, так
что в пищеварительном тракте рабочих
пища подвергается действию протеазы
только в средней кишке, если, конечно,
их лабиальные железы не выделяют
этого фермента (Delage, 1968). Эти
странности пока еще не получили
объяснения.
Было высказано предположение
(Ohly-Wiist, 1973), что Myrmica,
Monomorium pharaonis и другие муравьи
включают в круговорот пищи в семье
содержимое прямой кишки личинок. Это
водянистая жидкость, которая собирается
в задней кишке личинки, куда она
попадает из мальпигиевых сосудов и,
возможно, в результате фильтрации через
перегородку средней кишки. Во всяком
случае, у Myrmica она часто бывает
мутной, с гранулами кристаллической
мочевой кислоты из мальпигиевых
сосудов; рабочие собирают эту жидкость
и либо выпивают ее, либо уносят в своих
открытых челюстях и выбрасывают в
отходы. У М. pharaonis в этой жидкости
были, однако, обнаружены аминокислоты
и белки, обладающие протеазной
активностью; вполне возможно, что они
проникают из средней кишки
и заслуживают того, чтобы собирать их и
использовать в семье.
Большинство самых примитивных видов
пчел, подобно муравьям, практически
вовсе не перерабатывают корм. Halictidae
смешивают пыльцу с медом и скатывают
ее в шарики, однако подобная забота о
потомстве свойственна и одиночным
пчелам и безусловно не представляет
собой прерогативы общественной жизни.
У рабочих особей Bombus наблюдается
зависимость выполняемых функций от
возраста и размеров данной особи: у
B.pascuorum крупные рабочие особи
выходят на работу вне гнезда
в пятидневном возрасте, а мелкие-в
возрасте около 15 дней. Многие шмели
Bombini складывают запасы пыльцы в
восковой карман, помещая его в центре
группы личинок, которые кормятся ею
сами; приносимая в гнездо пыльца
просто складывается в такой карман. У
В. atratus-тропического вида, который
строит восковые карманы для пыльцы
вскоре после вылупления личинок,
а позднее, с ростом личинок, расширяет
их,-личинки начинают плести шелковые
перегородки, когда они закончат питание
и принимают горизонтальное положение.
Позже рабочие особи прогрызают
в воске отверстия и просовывают в них
один усик, чтобы проверить, в каком
состоянии находится личинка, прежде
чем ввести ей жидкий корм. В конце
концов личинки располагаются
вертикально и окукливаются в шелковом
коконе (Sakagami, Zucchi, 1965; Sakagami
et al., 1967a). Высшие представители
Bombus, как правило, отрыгивают пищу,
что дает рабочим возможность
поддерживать контакт с личинками и
контролировать их развитие. Жидкая
пища, которую они дают личинкам,-это
смесь пыльцы и меда (мед состоит в
основном из гексоз, но содержит
и аминокислоты). Большая часть меда
170 Г. шва 9
используется почти сразу же после его
сбора, но часть может сохраняться про
запас благодаря содержащейся в нем
глюкозооксидазе; при этом мед
концентрируется так, чтобы в нем было
лишь около 20% воды, и хранится в
запечатанных воском ячейках (Alford,
1975). Какую роль при этом играют
пищеварительные железы взрослых
особей, в частности гипофарингеальные,
не ясно. Секреты этих желез содержат
карбогидразы и другие белки
(Delage-Darchen et al., 1979). Как пыльцу,
так и нектар сами фуражиры помещают в
особые отдельные ячейки сразу по
возвращении в гнездо, так как взрослые
особи Bombus редко обмениваются
кормом, хотя запасы делают общие.
О г какой-1 о подобной стадии идет линия
Meliponini. В стандартную ячейку для
рабочей особи они кладут корм, главным
образом смесь пыльцы и меда
с добавлением некоторого количества
«пчелиного молочка» из гипо- или
профарингеальных желез; на эту порцию
корма матка откладывает одно яйцо, и
рабочие запечатывают ячейку, в которой
личинка растет и развивается, пока она
не будет готова начать плести кокон,
расположенный вертикально. Пчелам не
нужно проверять, каких размеров или
какой стадии развития достигла личинка,
но они выясняют, жива ли она и сплела
ли кокон: когда кокон готов, они
убирают наружную восковую оболочку.
Такой порядок вещей представляется
идеальным, и нельзя не удивляться,
почему высшие Bombini и все Apini
уделяют так много времени кормлению
личинок. Помимо снабжения ячеек
кормом и запечатывания их рабочие
особи Meliponinae в это же время
откладывают яйца (Michener, 1974).
Матка обычно съедает эти яйца,
фактически она даже требует, чтобы они
были отложены, но у некоторых видов
они, очевидно, остаются внутри ячеек,
так что их получают не матки, а личинки
(Beig, 1972).
Хо । я via I ка индуцирует откладку
кормовых яиц или даже добивается ее, в
этом участвуют и внутренние факторы. У
Melipona quadrifasciata правый яичник
больше левого и (в отличие от
большинства других насекомых)
активность corpora allata приводит
к уменьшению, а не к увеличению
размеров яиц. У Scaptotrigona postica
кормовые яйца, откладываемые вблизи
от маток, крупны, дряблы, лишены ядер
и поэтому генетически стерильны. Хотя
как у самок, так и у рабочих особей
яичники содержат по четыре яйцевых
трубочки, на каждой стороне развивается
лишь по одной из них, и будут ли они
производить кормовые или
репродуктивные яйца, зависит от
возраста рабочих. Репродуктивные яйца
чаще образуются в левых яичниках у
молодых рабочих, а кормовые-в правых
яичниках у старых рабочих 1 У этих двух
видов белковые компоненты яичного
желтка появляются в гемолимфе через 5
дней после выхода имаго, и содержание
их возрастает вплоть до 14-го дня, когда
яйца заметно увеличиваются в размерах.
Однако примерно после 4 недель они
рассасываются, а через 7 недель яйцевые
трубочки остаются пустыми (Engels,
Engels, 1977). Быть может, данная
рабочая особь может откладывать те или
другие яйца в зависимости от
обстоятельств? Из репродуктивных яиц
выходят самцы, и нет никаких указаний
на то, что матки подавляют откладку
таких яиц (da Cunha, 1979). Тем не менее
процедура снабжения ячеек кормом и
откладки яиц-сначала маткой, а затем
рабочими особями, после чего
происходит поедание яиц,-напоминает
то, что наблюдается у Myrmica,
у которых плодущая матка,
по-видимому, ускоряет образование яиц у
рабочих особей, заставляя их тем самым
Переработки пищи
171
откладывать кормовые яйца. Имеются ли
какие-нибудь данные о том, что
Meliponini перешли от желточной пищи к
пище, секретируемой железами, как это
сделали муравьи? Ни одна из
исследованных до сих пор пчел не
утратила полностью своих яичников,
подобно некоторым муравьям, так что
если такой переход и произошел, то он
не является облигатным. Гипо- или
профарингеальные железы Apotrigona
nebulata очень бедны ферментами,
особенно карбогидразами, а головная
доля лабиальной железы содержит
бесцветный липид, который тоже беден
ферментами и назначение которого, как и
у Apis, неизвестно; поэтому возможно,
что все эти железы секретируют пищу
(Delage-Darchen et al., 1979). Грудная
доля лабиальной железы и средняя кишка
особенно богаты ферментами,
гидролизующими сахара,
и цитированные авторы полагают, что
это может быть связано с плодовой
диетой Apotrigona.
9.3. Трофические железы
головы
О । июль не все Myrmicinae продуцируют
кормовые яйца, а у рабочих особей таких
эволюционно продвинутых родов, как
Tetramorium, Monomorium и Solenopsis,
яичников уже нет вообще. Альтернативой
желточному корму мог бы служить корм
для личинок и матки, вырабатываемый в
постфарингеальной железе, но
убедительных данных о существовании
такого корма у муравьев пока нет
(Abbott, 1978). У Solenopsis invicta, так же
как у Myrmica, эти железы, несомненно,
используются для того, чтобы отделять
жиры от переваренной пищи (Glancey et
al., 1973); жиры могут храниться в зобах
крупных рабочих особей и репро-
дуктивных самок до тех пор, пока они не
понадобятся для основания новой семьи.
Содержимое зоба состоит из углеводов,
стеролов, глицеридов и свободных
жирных кислот. Все рабочие, включая
кормилиц, обмениваются сахаристой
жидкостью и поглощают сахара из
своего зоба (так!); растворимые
белковые соединения остаются в зобу для
отрыгивания их личинкам (Howard,
Tschinkel, 1980). Однако фарингеальные
железы, хотя они активно включают 32Р
из раствора фосфатов, не поглощают
введенные в гемолимфу реактивные
триглицериды или жирные кислоты, так
что вряд ли эти железы вырабатывают
жиры (Philips, Vinson, 1980; Vinson et al.,
1980). Постепенный отказ от желтка в
качестве корма можно проследить
у Dolichoderinae (Torossian, 1979).
Рабочие особи Dolichoderus
quadripunctatus (вместе с самками)
продуцируют капельки желтка, которые
выводятся наружу, не будучи окружены
плотным хорионом; рабочие высасывают
этот желток и скармливают его
личинкам. В отсутствие матки рабочие
способны откладывать репродуктивные
яйца, дающие самцов, но только 4% этих
самцов полностью сформированы
и могут индуцировать выделение желтка.
У Tarinoma erraticum капельки желтка
мелкие и появляются нечасто,
а у Iridomyrmex humilis- совсем редко.
Последний вид использует свои
фарингеальные железы для того, чтобы
вместо желтка продуцировать иной
сходный с ним корм. Markin (1970)
установил, что у рабочих особей фосфат,
меченный 32Р, поступает в эти железы,
тогда как у маток он накапливается в
яичниках; этот автор высказал
предположение, что, поскольку I. humilis
никогда не кормит своих личинок
твердой пищей, фарингеальные железы
используются у этого муравья для
концентрирования аминокислот,
извлеченных из пади. Содержимое этих
172 Глава 9
желез переходит в зоб, а затем
отрыгивается для маленьких личинок и
плодущих самок, хотя, конечно, самки
имеют и прямой доступ к корму.
Молодые рабочие особи Tapinoma
erraticum получают в течение 2-3 дней
пищу в гнезде, где они обычно остаются
среди расплода, вблизи от самки,
сохраняя неподвижность. Позднее,
выполняя функции нянь, они
вылизывают, распределяют
и складывают в кучки личинок, хотя не
обязательно кормят их; такой уход
предотвращает развитие
микроорганизмов на поверхности
личинок. Примерно две трети молодых
рабочих особей заняты выращиванием
личинок; особенно хорошо они делают
это в возрасте 10-15 дней, когда они
получают измельченную животную пищу,
высасывают ее и отрыгивают соки
личинкам. Остальная треть молодых
рабочих периодически занимается
фуражировкой-некоторые выходят из
гнезда уже в возрасте 4-5 дней. Молодые
фуражиры очень неохотно отдают свою
добычу кормилицам, но с возрастом эта
особенность ослабевает и одновременно
повышается склонность к фуражировке.
Этот возрастной эффект накладывается
на заметное с раннего возраста
предрасположение либо к уходу за
расплодом, либо к фуражировке (Lenoir,
1979b).
У Formicinae переработка корма
многообразна. У Plagiolepis pygmaea
рабочие особи в присутствии самки
откладывают мелкие стерильные яйца с
непрочной оболочкой, которые
используются в качестве пищи
и „трофический" характер которых
очевиден (Passera, 1969); они возникают в
результате раннего прекращения
активности питающих клеток и,
возможно, сами представляют собой
питающие клетки (трофоциты).
У Camponotus vagus рабочие особи
откладывают только такие
репродуктивные яйца, из которых
развиваются самцы, и притом тогда,
когда нет ни самок, ни личинок; яичник
не используется у них в качестве
кормовой железы, и вся пища проходит
через рот. Предпочтение, отдаваемое той
или другой работе, зависит от возраста и
от размеров тела: рабочие особи малой и
средней величины чаще ухаживают за
расплодом и собирают падь, тогда как
крупные и более старые занимаются
рытьем и фуражировкой, хотя в этом
отношении имеется большая
индивидуальная изменчивость (Benois,
1969). Рабочие особи Lasius niger
откладывают неоплодотворенные яйца,
как диплоидные, так и гаплоидные, из
которых развиваются соответственно
самки и самцы (Brian, 1980). Они больше
остаются в гнезде; даже после 40 дней
только половину рабочих особей можно
считать фуражирами, а некоторые из
самых мелких никогда не выходят из
гнезда (Lenoir, 1979а). Крупные рабочие
особи развиваются быстрее, чем мелкие,
и вскоре становятся фуражирами; уход за
личинками ускоряет это изменение,
однако оно трудно обратимо-после того
как рабочая особь перешла
к фуражировке, ей бывает нелегко
вернуться к уходу за личинками.
У Oecophylla рабочие особи в отсутствие
самки регулярно откладывают яйца; как
и у Lasius, это яйца двух типов: обычные
крупные гаплоидные, дающие самцов, и
мелкие некормовые, но диплоидные, из
которых партеногенетически развиваются
самки. У Cataglyphis cursor самка
оказывает влияние на формирование яиц,
и ооциты рассасываются; эти муравьи
тоже не производят желточного корма,
но в отсутствие самки рабочие особи
могут продуцировать как диплоидные,
так и гаплоидные репродуктивные яйца
(Suzzoni, Cagniant, 1975). Таким образом,
в подсемействе Formicinae рабочие особи,
Переработка пищи
173
как правило, продуцируют яйца, но эти
яйца в основном служат для
размножения, а не для питания. Тонкая
регуляция формирования яиц у рабочих
особей, осуществляемая самкой
и позволяющая использовать яичник в
качестве желточной железы без риска
произвести на свет самцов, по-видимому,
если и достигается, то редко; возможно,
дальнейшие исследования прольют
больше света на эту проблему. Schmidt
(1974) пишет, что Formica polyctena
откладывает кормовые яйца в конце
сезона и что яичники рабочих вырастают
весной за счет запасов, содержащихся в
жировом теле. Откладывают ли они в
это время репродуктивные яйца?
Имеющиеся данные указывают на то, что
весной используются ротовые
трофические железы, так как
фарингеальные железы действительно
секретируют жиры; установлено, что
введенный рабочим меченый триолеин
накапливается в этих железах, а затем он
появляется у самок и личинок. Запас
жиров, возможно, полезен для
метаболизма во время метаморфоза
(Peakin, Josens, 1978). У F. polyctena
имеется также профарингеальная железа,
гомологичная гипофарингеальной железе
Apis (Emmert, 1968), но ее функция пока с
достоверностью не известна (Abbot,
1978). В группе Formica rufa склонность
рабочих особей к выполнению тех или
иных функций опять-таки зависит от их
возраста и общих размеров: в первые
несколько дней рабочая особь остается
на месте, занимается грумингом и готова
к переноске1; спустя три дня она
принимает корм, который ей приносят, а
затем начинает сама ухаживать за
1 У многих муравьев старые особи регулярно
переносят молодых (точнее, это связано не
столько с возрастом, сколько с иерархическим
положением). При этом переносимые особи
принимают характерную позу-подгибают
брюшко и прижимают конечности - Прим. ред.
расплодом; наконец, после некоторого
переходного периода она отправляется на
фуражировку. Это подтверждают многие
исследователи, например Rosengren
(1977). Рабочие особи, „родившиеся" в
конце июня, возможно, впадают
в спячку, прежде чем начать
фуражировку, так как они проводят в
гнезде не меньше месяца.
В ранний период жизни имаго
происходит значительное развитие
поведения (инстинктивного, или
видоспецифичного). У Formicinae рабочие
особи должны помогать личинкам плести
кокон, а имаго-освобождаться из него.
Во время этих действий новички узнают
запах своего вида. Рабочие Formica
polyctena, которых в течение двух недель
содержали вместе с коконами F. sanguinea
или F. pratensis и даже Camponotus vagus
или Lasius niger, впоследствии проявляли
склонность ухаживать за расплодом
„привычного" для них, а не своего
собственного вида. Если при этом
присутствовали еще и самки, то реакция
усиливалась (Jaisson, 1975). Наиболее
чувствительная в этом отношении
стадия-два дня после вылупления
(Fresneau, 1979; Jaisson, Fresneau, 1978).
Аналогичные результаты получены для
F. rufa и F. lugubris (Le Moli, Passetti,
1978). Однако неопытные рабочие особи
могут приобретать надлежащее
поведение в том возрасте, когда оно
становится необходимым, просто
подражая старшим рабочим (Le Moli,
1978). У Myrmica рабочие, появившиеся в
семье без самки (или в экспери-
ментальном фрагменте семьи),
впоследствии, в более позднем возрасте,
реагируют на присутствие самки, но
реакция, эта выражена у них слабее, чем у
рабочих, испытавших присутствие самки
в раннем возрасте (Сагг, 1962). Это было
подтверждено (Brian, Evesham, 1982), и
накапливается все больше данных о том,
что в развитии рабочих особей есть
174 г. шеи 9
период особой чувствительности
к стимулам, исходящим от самки; этот
период соответствует возрасту 3-4 недель
(Evesham, 1982).
Дру1 ой аспект поведения, связанного с
выкармливанием личинок,-это роль
случайных факторов в развитии рабочих
особей. Этот вопрос уже поднимался в
связи с изучением АтЫуоропе pallipes
(Traniello, 1978). У американских
медовых муравьев (Myrmecocystus,
Formicinae) в зобу некоторых рабочих
особей накапливается столько меда, что
их брюшко непомерно раздувается, они
теряют способность двигаться и висят на
потолке камеры. Wallis (1964) считает,
что эти особи становятся „медовыми
бочками" в результате каких-то
случайных событий в их раннем возрасте,
однако у других муравьев жидкость
запасают в своих зобах, как правило,
крупные особи, в частности крупные
рабочие и солдаты. Сахарные растворы
сохраняются благодаря предварительной
обработке глюкозооксидазой,
приводящей к выделению перекиси
водорода, которая убивает
микроорганизмы, как это происходит и у
медоносной пчелы (Burgett, 1974).
Используемая пчелами смесь пыльцы и
меда, называемая пергой, во время
хранения подвергается брожению, но
образующаяся при этом молочная
кислота служит вкусовой добавкой.
Сильно развитые у пчел головные железы
продуцируют корм, а желточного корма
пчелы не вырабатывают вовсе, хотя
репродуктивные яйца часто поедаются. У
рабочих особей имеются яичники, и они
могут откладывать яйца, но обычно
матка полностью подавляет эту
функцию, и хотя одно время думали, что
выделяемый мандибулярными железами
рабочих феромон-9-оксодекановая
кислота-подавляет активность их
corpora allata, однако теперь это кажется
сомнительным. Трофические железы-это
гипо(про)фарингеальные и лежащие возле
них мандибулярные железы (Beetsma,
1979; Emmert, 1968). Apis использует
секрет первых для приготовления пищи,
которую называют „молочком" для
личинок в обычных и трутневых ячейках
(worker jelly), а для выращивания маток
они приготовляют так называемое
„маточное молочко" (gyne jelly)-смесь
обычного „молочка" с секретом
мандибулярных желез. „Молочко"
богато белками, ио содержит 74% воды,
4% сахаров и некоторые липиды. На
этом корме личинки быстро растут, но не
могут метаморфизировать; для
метаморфоза им необходим сахар (мед),
который им дают после кормления в
течение трех дней чистым „молочком".
Пыльца содержится в их корме только в
виде примеси (Bailey, 1952; Simpson,
1955). Гипофарингеальные железы
продуцируют также всю необходимую
пчелам глюкозидазу и глюкозооксидазу и
тем самым участвуют в приготовлении
меда, так как нектар проходит
длительный процесс созревания,
включающий гидролиз сахарозы,
образование перекиси водорода и,
наконец, концентрирование путем
выпаривания, нередко с хоботка рабочей
пчелы. В конце концов мед
запечатывается воском в периферических
ячейках. Гипофарингеальные железы
могут участвовать и в переваривании
пыльцы (Arnold, Delage-Darchen, 1978;
Simpson, 1960). Липиды с длинной цепью,
содержащиеся в пыльце, не
перевариваются, а всасываются
непосредственно; помимо их очевидной
роли как богатых источников
концентрированной энергии они
содержат в качестве примеси витамины, в
том числе холестерол (Herbert et al.,
1980). Секрет гипофарингеальной железы
содержит также фосфатазу
и фосфоамидазу, участвующие
в белковом синтезе. Изучение
Переработка пищи
175
зависимости синтеза белка от возраста
рабочей особи (Haberstadt, 1980)
показало, что соотношение различных
белков в этом секрете во многом
отличается от их соотношения
в „маточном молочке11, значительную
долю которого составляет секрет
мандибулярных желез. Если секрет этот
содержит ряд ферментов у пчел всех
возрастов, даже молодых, то
в „маточном молочке11 они присутствуют
лишь в следовых количествах. У пчел в
возрасте 30 дней, а также у роящихся
пчел секрет мандибулярных желез
отличается высоким содержанием
сахаразы, которая, конечно, используется
для освобождения энергии углеводов при
полете. Зрелые пчелы, кроме того,
инициируют приготовление меда, хотя по
возвращении в улей они отдают свой
взяток кормилицам.
Предпочтение пчелами той или другой
работы преимущественно определяется
их возрастом, а не размерами, хотя в
среднем фуражиры несколько крупнее
кормилиц (Kerr, Hebling, 1964). Период
времени, проводимый в гнезде, варьирует
от 5 до 41 дня и составляет в среднем 20
дней (Michener, 1974). Молодые пчелы
приспособлены к работе в улье, и у них
происходит ряд изменений, которые
строго не запрограммированы
и подвержены влиянию текущей ситуации
в семье и случайных контактов. Однако
после того, как определенная система
желез вступила в действие, она сохраняет
активность в течение нескольких дней.
Кормилицы используют секрет желез
ротовых частей для кормления, а свои
брюшные межсегментные железы-для
получения воска, служащего
строительным материалом; активность
обеих систем может начаться
в двухдневном возрасте. Молодая пчела,
выйдя из своей ячейки, начинает убирать
другие ячейки и выстилать их
неизвестным материалом, который
побуждает матку откладывать в них
яйца. Затем она может заняться
строительством сотов, если в этом есть
нужда (как перед роением), или же-в
быстро растущей семье-уходом за
личинками. При кормлении она не отдает
предпочтения мелким или крупным
личинкам, как думали раньше. Няни
подготавливают ячейки для хранения
пыльцы, принимают нектар и, наконец,
совершают ориентировочные полеты,
предшествующие фуражировке (Free,
1965). Таким образом, у Apis имеется
система хранения запасов;
пищеварительная система взрослых
особей, доставляющая все необходимые
ферменты без участия личинок; корм,
вырабатываемый железами головы, но не
желточный корм; непрерывный контакт с
личинками и система распределения
выполняемых работ в зависимости
главным образом от возраста, но
частично и от размеров тела, причем в
случае длительного периода работы в
улье эта система реагирует на
потребности семьи. При крайней
необходимости даже направление
онтогенеза (обычно от кормилиц
к фуражирам) может измениться на
обратное (см. Brian, 1979а). Остается еще
многое узнать о том, как происходят все
эти «подгонки», какие стимулы их
вызывают и в какой мере случайные
контакты влияют на поведение отдельной
особи.
У термитов многие работы выполняют
молодые особи, которые просто мельче и
слабее взрослых и имеют более бледную
окраску, но обладают всем необходимым
для работы в гнезде. У Zootermopsis
nevadensis (Termopsinae) стерильные
личинки и нимфы роют и строят, тогда
как более молодые личинки
распределяют пищу (Howse, 1968, 1970).
В гнездах Hodotermes (Hodotermitidae)
более молодые бледноокрашенные особи
перерабатывают и распределяют траву,
176 Глава 9
собранную более темными старшими
рабочими (Hewitt et al., 1969а,b, цит. по
Brian, 1979а; Nel, 1968); у термитов, так
же как у муравьев и пчел, общие размеры
оказывают влияние на выполняемые
функции. Так, у Н. mossambicus рабочие
особи, происходящие от личинок 5-го
возраста, крупнее рабочих, развившихся
из личинок 4-го возраста, и выполняют
более тяжелые функции, связанные
с защитой.
У Termitidae даже работы внутри гнезда
выполняют пигментированные,
склеротизированные и активные рабочие,
развивающиеся из личинок в результате
всего лишь одной линьки; они могут
находиться в это время на разных
стадиях развития и поэтому
превращаются в рабочих разной
величины. Выполняемая работа тоже
зависит у них от возраста; у молодых
рабочих Nasutitermes lujae первого
возраста слюнные железы развиты
лучше, и они ухаживают за расплодом,
тогда как у старших рабочих лучше
развиты стернальные железы, и они ,
собирают корм (Pasteels, 1965). Тип
выполняемой работы зависит также от
пола, поскольку пол влияет на величину
и силу особи; например,
у Macrotermitinae самцы мельче и они
несут функции кормилиц, тогда как более
крупные самки занимаются
фуражировкой (Noirot, 1969, 1974).
По-видимому, у термитов нет общего
правила относительно того, какой пол
крупнее.
Переваривание растительного материала
у термитов происходит в кишечнике.
Челюсти играют важную роль,
размельчая пищу, а у гумусоядных,
например, на них можно видеть явные
признаки износа. После заглатывания
пища подвергается дальнейшему
измельчению в мускульном желудке и
поступает в заднюю кишку, где имеются
один или несколько расширенных
карманов, содержащих симбионтов.
Кишечный клапан препятствует
прохождению симбионтов вперед. Как
полагают, у Termitidae многие ферменты
вырабатываются кишечными бактериями,
которые могут даже связывать азот. У
низших термитов симбиотические
простейшие способны гидролизовать
целлюлозу и лигнин, хотя для последнего
процесса нужен кислород, которого
обычно нет в глубоких отделах
кишечника (La Fage, Nutting, 1978). Пища
термитов бедна липидами-в частности, в
древесине их обычно меньше 1%; однако
грибные сады Macrotermitinae содержат
до 17% липидов. Липиды накапливаются
также у нимф и имаго (репродуктивная
линия), и эти запасы, вероятно, имеют
жизненно важное значение как источник
энергии в период основания семьи, так
как могут пройти годы, прежде чем у
термитов произойдет атрофия
летательных мышц (Noirot, 1969, цит. по
La Fage, Nutting, 1978). Потребности
термитов в витаминах неизвестны.
Слюна термитов представляет собой
прозрачную опалесцирующую жидкость,
которая накапливается в резервуарах.
Изначально она, конечно, служила
пищеварительным соком, и у Calotermes
flavicollis она содержит амилазу, но
вообще слюнные железы служат
трофическими железами. Слюна может
также использоваться как
цементирующий материал или даже как
фунгистатик. У Odontotermes она служит
для борьбы с грибами, засоряющими
грибные сады (Batra, Batra, 1966). Слюна
может быть кормом для молоди,
репродуктивных особей и солдат,
которые все бедны кишечными
бактериями (Noirot, Noirot-Timothee,
1969). Секрет слюнных желез содержит
Переработка пищи 1 77
различные липиды и, вероятно, богат
белками. У Nasutitermes lujae слюну
выделяют рабочие первого возраста,
которые остаются в гнезде и ухаживают
за формами, неспособными существовать
самостоятельно (Pasteels, 1965). Слюна
передается от особи к особи через рот, а
не отрыгивается, подобно содержимому
зоба, которое представляет собой пасту
или пульпу из гумуса и у некоторых
видов скармливается солдатам (оно
переваривается в начальных участках
кишечника).
Анальная пища-не то же самое, что
экскременты (Noirot, Noirot-Timothee,
1969). Это вязкая жидкость,
выделяющаяся из задней кишки
и содержащая взвесь мельчайших частиц
древесины и симбиотических простейших.
Она потребляется только термитами, не
относящимися к сем. Termitidae,
и главная ее функция, несомненно,
состоит в передаче жгутиковых-
симбионтов только что перелинявшим
особям. Однако она, вероятно, содержит
не только этих простейших, но и какие-то
питательные вещества, и у Calotermes
flavicollis ее можно рассматривать как
обычный компонент пищевого рациона
(Alibert-Berthot, 1969). Хотя анализ этой
жидкости не производился, весьма
возможно, что она содержит какие-то
продукты переваривания.
Итак, во всех основных группах
общественных насекомых взрослые особи
затрачивали все больше времени
и энергии на приготовление пищи для
молоди. Предпосылки к этому уже
имелись у необщественных насекомых в
форме родительской заботы о потомстве.
У общественных насекомых это может
приводить к обмену ферментами, при
котором взрослые особи пережевывают
пищу, смачивая ее пищеварительными
соками, взятыми у личинок. Затем
полученный экстракт очищается
фильтрованием или осаждением
и концентрируется в виде секрета,
в который входит желток из яичников,
функционирующих одновременно и как
трофические железы, и как продуценты
яиц. Такая система свойственна муравьям
и безжалым пчелам, но она не
универсальна; по-видимому, некоторые
муравьи и медоносные пчелы используют
пищеварительные (слюнные) железы в ка-
честве трофических желез, хотя играющие
эту роль железы у них не гомологичны.
Такая тенденция к большей заботе о
питании потомства неизбежно
сопровождается тенденцией к большей
дифференциации касты кормилиц [т. е.
группы рабочих особей, которые либо
моложе, либо мельче средних (или и
моложе, и мельче) и железы которых
способны разрастаться и производить
корм; эти особи могут вносить
эффективный вклад в жизнь семьи до
того, как их пигментация и наружный
скелет достигнут такого развития, что
они смогут заниматься фуражировкой
вне гнезда]. Наивысшего выражения эта
тенденция достигает у Pogonomyrmex
owyheei, у которых фуражировкой занято
менее 10% рабочих особей,
а продолжительность их жизни после
выхода из гнезда составляет всего 14
дней (Porter, Jorgensen, 1981). Еще до
того, как эти муравьи выходят наружу,
зубцы их жвал снашиваются, запасы
питательных веществ в тканях
истощаются и, возможно, дегенерируют
органы чувств; иначе говоря, их ранняя
гибель запрограммирована.
Число каст у общественных насекомых
никогда не бывает очень большим. У
Atta sexdens есть четыре касты,
различающиеся по общим размерам тела
1 78 Г.шва 9
и пропорциям (аллометрия), причем у
трех меньших по размерам каст имеются
различия, связанные с возрастом, что в
целом дает максимум семь каст (Wilson,
1980а). Невыгодность чрезмерной
морфологической специализации можно
усмотреть в том, что при возрастающей
дифференциации функций требуется
большее число особей для выполнения
определенного набора операций (Oster,
Wilson, 1978; Wilson, 1979). Это приводит
к повышению «стоимости» поддержания
семьи и функций распределения. Здесь
под распределением имеется в виду не
просто надлежащее распределение корма,
а еще и создание такой ситуации, в
которой каждая рабочая особь
функционирует наиболее эффективно,
т. е., в сущности, нахождение для нее
подходящей работы.
Глава 10
Ранние этапы роста семьи
У муравьев, пчел и ос белковая фракция
корма распределяется главным образом
между репродуктивными особями
и личинками, а жиры и углеводы делятся
между рабочими. Это не результат
беспорядочного расхватывания корма,
которое у Hymenoptera полностью
исключено, так как их личинки по
меньшей мере неподвижны, как
у муравьев, или даже закреплены, как у
пчел и ос. У термитов яйца переносятся,
а молодь может перемещаться
самостоятельно, но мы мало что знаем о
правилах распределения корма или
регуляции больших скоплений особей. У
муравьев, пчел и ос личинки,
вылупляющиеся первыми, получают
наилучший уход и обеспечивают себе
постоянно возрастающее преимущество.
Матки могут отбирать корм у личинок и
поедать его сами, а в полигинных семьях
они силой отнимают его у подчиненных
особей. Однако у Melipona favosa матке
редко удается отнять пищу у рабочих,
хотя она захватывает их головы
передними ногами и усиками. Она берет
себе часть корма, предназначенного для
личинок, непосредственно перед тем, как
начинает откладывать яйца, и поедает все
кормовые яйца, которые откладываю!
рабочие особи ( Sommeijer, 1982). Что
касается медоносных пчел, то хотя и есть
сообщения о быстрой передаче у них
корма, это не обязательно верно во всех
случаях. Взаимные соприкосновения
рабочих ротовыми частями во многих
случаях очень кратковременны и совсем
не связаны с кормом; среди рабочих
особей существуют «просители»
и «доноры», статус которых определяется
более глубокими физиологическими
факторами, нежели содержимое их зобов.
Бывает даже, что «проситель» просит
пищу, находясь возле нее (Korst, Velthuis,
1982). Рабочие особи кормят маток всего
лишь около шести раз в час (Seeley,
1979), и гораздо более вероятно, что при
соприкосновении ротовых частей
происходит передача феромонов.
10.1. Распределение корма
У двух видов Bombus, запасающих
пыльцу (В. terrestris и В. terricola), личинки
находятся в общих ячейках (камерах) до
последнего возраста. Рабочие особи
проделывают в воске дырочку, чтобы
проверить, как обстоят дела, а затем
вновь ее заделывают; на последней
личиночной стадии она остается
открытой все время. Промежутки между
осмотрами (в среднем 11 мин) примерно
вдвое короче, чем между кормежками (в
среднем 20 мин). Кормление происходит
нерегулярно, потому что рабочим особям
часто приходится стоять в очереди за
пыльцой у складов; это может занимать
у них до 5 мин. Объясняется ли это
недостатком складских помещений или
самой пыльцы? Когда в одном
эксперименте (Pendrel, Plowright, 1981)
удалили часть рабочих особей, другие
компенсировали это, повысив скорость
кормления на 28%. Но если шмели
способны на такие усилия, то можно
полагать, что обычно они не слишком
утруждают себя в гнезде.
Подобное «обобществление» запасов
пыльцы-явление необычное; даже
пресоциальные пчелы распределяют свой
расплод по нескольким ячейкам,
снабженным комочками пыльцы. Эти
180 Г uieu 10
комочки могут быть двух разных
размеров; некоторые виды Evylaeus, как
общественные, так и одиночные,
откладывают неоплодотворенные яйца на
маленькие комочки пыльцы,
а оплодотворенные яйца-на большие,
т. е. комочки, предназначенные самцам,
меньше, чем комочки для самок (Кпегег,
1977). У принадлежащей к той же группе
Lasioglossum zephyrum матка, как только
она выделилась из группы равноправных
самок, занимает в гнезде место,
с которого она может оказывать влияние
на деятельность рабочих особей,
например в конце цепочки пчел у входа в
гнездо или в месте разветвления
тоннелей. Заняв такую позицию, она
встречает и «подталкивает» рабочих. Она
проводит также короткие осмотры ячеек,
и Buckle (1982) высказал предположение,
что она собирает информацию о ходе
строительства ячеек, с тем чтобы
направлять рабочих туда, где в них есть
надобность. У Ceratinini, строящих
камерные гнезда, пыльца не подвергается
специальной обработке и не запасается,
как у других пчел; смешав ее
с жидкостью, отрыгиваемой из зоба
(возможно, это нектар), рабочие
помещают ее около личинок, которые
кормятся все вместе. У других видов
рабочие кладут кусочки корма прямо на
тела личинок так, чтобы они могли
дотянуться до него ротовыми частями.
У Ехопеига личинки, по-видимому,
сигнализируют о том, что им нужен
корм, движениями челюстей и головы; в
ответ на это рабочие захватывают их
своими челюстями и отрыгивают им в
рот прозрачную жидкость (Sakagami,
1960). В линейных гнездах, устроенных в
полых стеблях, личинки нередко бывают
расположены очень упорядоченно: яйца
откладываются в конце гнезда,
противоположном входу, а личинки по
мере развития продвигаются вперед и в
конце концов окукливаются около входа
(Michener, 1974). Такой порядок
создается постепенно, он не
устанавливается рабочими особями
в результате прямой реакции на
существование личинок разных классов.
У безжалой пчелы Melipona favosa
строить ячейку начинают
многочисленные пчелы-строительницы,
но лишь несколько рабочих особей (от 5
до 8) заканчивают ее и снабжают
кормом; в каждую ячейку кладется от 10
до 18 порций корма. Матка, находящаяся
обычно на дне гнезда или в зоне запасов,
время от времени инспектирует новые
ячейки, и если обнаруживает ячейку с
гладким воротничком, то начинает
барабанить по ней. В ответ на это она
редко получает корм, так что, возможно,
это сигнал об откладке яиц.
Непосредственно перед тем как отложить
яйцо, матка поедает часть корма,
предназначенного личинкам,
а в дальнейшем съедает все кормовые
яйца, если их откладывают рабочие
особи, отделывающие ячейки
и снабжающие их кормом (Sommeijer et
al., 1982).
У медоносной пчелы весной не бывает
недостатка в ячейках, поскольку зимой в
улье нет расплода; однако матке
приходится откладывать яйца только в
вычищенные и выстланные внутри ячейки
в той части улья, где рабочие особи
способны поддерживать температуру на
нужном уровне. Это, конечно, зависит от
численности рабочих. Матка питается
слюной, которую они вырабатывают из
имеющихся в их организме резервов и из
запасенной пыльцы; летом матку
усиленно облизывают и скребут
мандибулами. Пчела-кормилица,
гипо(про)фарингеальные железы которой
активно вырабатывают секрет,
внимательно осматривает каждую
ячейку, прежде чем поместить капельку
жидкости на стенку ячейки или на
личинку (по-видимому, она не удаляет из
Ранние )пшпы роста семьи 181
ячейки слюну или мочу). Если пища
дается личинкам такими крошечными
порциями, то неудивительно, что число
«кормовых» посещений невероятно
велико и одна пчела за всю свою жизнь
может вырастить лишь двух или трех
личинок. Не следует думать, что каждая
кормилица занимается одной
определенной группой ячеек,-она может
носить корм многим сотням, если не
тысячам личинок. Существует, однако,
важная регуляторная особенность: когда
корма мало, кормилицы снабжают им
только обитателей немногих смежных
ячеек (Gontarski, 1949), причем
распределение корма целиком
контролируется рабочими особями, так
как личинки, отделенные от своих
соседей стенкой ячейки, никак не могут
конкурировать за корм.
Хотя у пчел личинки не «кормят»
рабочих особей, как это случается у ос,
рабочие иногда обмениваются между
собой пищей. Проситель вводит свой
язычок в ротовую область
потенциального донора, который
выделяет капельку нектара, чего он не
сделал бы без такого стимула (Free, 1959,
р. 194). Без сомнения, донор, у которого
зоб пуст, при первой возможности
выходит из гнезда и отправляется
фуражировать. Пыльцу, которую
поедают пчелы-кормилицы, приносят
сборщицы и кладут в подготовленные
ячейки для временного хранения;
сборщицы, которые не могут
освободиться таким образом от груза,
неохотно отправляются на дальнейшую
фуражировку, так что по мере
накопления пыльцы в гнезде
интенсивность ее сбора снижается.
Личинки стимулируют молодых пчел,
чтобы те их кормили; при этом они
используют главным образом
тактильные стимулы, но частично также
и обонятельные. Матки стимулируют
сбор пыльцы даже в отсутствие расплода
(Free, 1967; Free, Williams, 1971).
Семья муравья Amblyopone pallipes
состоит всего лишь из одной самки и
9-16 рабочих особей. Откладка яиц
происходит в августе, а выращиваемый
из них расплод достигает зрелости в
августе следующего года и дает как
половых особей, так и рабочих. Таким
образом, в каждый данный момент в
семье преобладает расплод, находящийся
на какой-то одной стадии развития;
многолетний цикл развития у этого вида
строго упорядочен и связан с временами
года (Traniello, 1978). У Myrmicinae
маленькие личинки получают
отрыгиваемую рабочими жидкую пищу, а
крупные - кусочки твердой пищи, либо
животной, либо растительной (семена)
(Le Masne, 1963). Личинки первого
возраста получают кормовые яйца, если
они есть; личинкам второго возраста к
этому добавляют отрыгиваемые соки, а
личинкам третьего возраста-кусочки
животной пищи. Третья личиночная
стадия продолжается долго и включает
два периода спячки, связанные
с прекращением роста летом для
подготовки к зимовке. Первый такой
период блокирует рост личинок, развитие
которых идет по «рабочему» пути, а
второй-рост личинок, развивающихся в
репродуктивных самок. Хотелось бы для
простоты считать, что существуют
личинки двух типов-дающие рабочих и
дающие репродуктивных самок; однако
последние на самом деле лабильны в
отношении касты и могут переключаться
обратно на путь развития рабочей особи.
Зимой у Myrmica численное отношение
рабочие / личинки варьирует около
среднего 0,88, причем существует
корреляция между числом личинок
и числом рабочих и еще более тесная
корреляция между их весами. Это
обусловлено тем, что число рабочих
особей определяет число яиц,
откладываемых самкой, выживание этих
182 //<;«<; It)
яиц и вылупляющихся из них личинок, а
также рост личинок; особенно это
относится к личинкам третьего возраста,
так как на этой стадии их вес
увеличивается по меньшей мере втрое
(Brian, 1965, 1979а). Все это так, когда
корм имеется в достаточном количестве;
если же количество корма ограничено, то
его получает лишь небольшое число
крупных личинок, а остальные личинки
уничтожаются, обычно во время линьки.
Вероятно, наличие «голодных» рабочих
особей с сильными хищническими
наклонностями и слабых, не так легко
распознаваемых рабочими
личинок-достаточное условие для
уничтожения последних.
О । бор более крупных личинок
и резервных куколок также
целесообразен, поскольку они наиболее
близки к зрелости и могут раньше начать
помогать рабочим особям в гнезде,
освобождая старших рабочих для охоты.
Впавшие в спячку личинки третьего
возраста могут продержаться без пищи
довольно долгое время даже при
температуре, подходящей для развития,
но если они протянут слишком долго, то
им придется вступить в конкуренцию с
вновь вылупившимися весенними
личинками, которым рабочие особи
отдают предпочтение. В природных
выводковых камерах личинки третьего
возраста распределены достаточно
свободно, каждая из них лежит на спинке
и к каждой есть свободный доступ с
потолка или со стен, кормят их довольно
равномерно; в экспериментах, в которых
личинок помещают на плоские
пластинки, рабочие особи складывают их
в кучки (вероятно, для того, чтобы их
можно было окружить рабочими,
обеспечивающими защиту), и хотя эту
кучку постоянно обследуют
и переворачивают, верхние личинки
получают больше корма и растут
быстрее. Таким образом, равномерность
распределения корма, даже когда его
вполне достаточно, зависит от
устройства камеры, которая должна
иметь скошенные стенки и скаты
и обеспечивать физически прочную
структуру, в которой рабочие особи
могут расположить личинок, не опасаясь
постороннего вторжения.
Наряд) с устройством гнезда присутствие
самок тоже способствует равномерному
распределению корма, возможно потому,
что они вообще стимулируют его
раздачу. Это не связано с тем, что они
сами потребляют много пищи (тело
мертвой самки оказывает почти такое же
стимулирующее действие); это просто
одно из проявлений катализирующего
влияния самок на их семьи, повышающее
эволюционную приспособленность семьи.
У видов рода Myrmica личинки
(рис. 10.1) ведут себя довольно
сдержанно; обычно, если только они не
слишком голодны, личинки ждут, пока
им предложат корм, который они иногда
принимают, а иногда отвергают;
последнее, видимо, невыгодно для них,
так как личинок, упорно не желающих
брать корм, рабочие переводят
в неактивную группу, т. е. в группу, где
находятся диапаузирующие личинки
третьего возраста и личинки,
переставшие принимать пищу незадолго
до метаморфоза (предкуколкй); у первых
«аппетит» может быть стимулирован
вниманием со стороны рабочих особей.
Хотя голова этих личинок привлекает
внимание рабочих, а вытягивание головы
и ее повороты из стороны в сторону
служат сигналом, что личинка готова
принять пищу, именно способность
личинок брать пищу у кормилиц, съедать
ее и затем снова брать заставляет
кормилиц в свою очередь отправляться к
фуражирам и просить у них корм (Brian,
Abbott, 1977).
Возможность побудить личинок
к дальнейшему поглощению корма
Ранние „папы роста семьи 1 83
Певый и правый
протоки слюнных
желез
Заднеголовная складка гиподермы
Жировое тело
Аорта
Брюшная нервная
цепочка
Пищевод—J
Corpus paracardiacum
Дейтоцеребрум
Зачаток усика
Corpus allatum
Глотка
.Жвала
Общий проток
слюнных желез
Окологлоточное
нервное кольцо
Подглоточный
ганглий
Надглоточный ганглий
("мозг")
Рис. 10.1. Продольный разрез головы
личинки Myrmica последнего возраста. (Weir,
1959.)
в сочетании со способностью самки
стимулировать его распределение влияет
на определяемое внутренними факторами
«решение» о том, расти ли личинкам
прямо до превращения в имаго или же
диапаузировать и провести зиму на
последней личиночной стадии. При
температурах ниже 22°С рабочие отдают
предпочтение личинкам, проявляющим
явную тенденцию метаморфизировать;
однако и многим менее склонным
к метаморфозу личинкам удается
получить достаточно корма, чтобы
преодолеть первый физиологический
барьер к росту-первичную диапаузу, и
они завершают развитие, превращаясь в
рабочих особей до начала зимы. Размеры
остатка, как мы видели, зависят он
численности и веса рабочих. Зимовка
семьи, в которой имеются личинки, а не
только взрослые особи,-это способ
вместить в данный год еще один цикл
развития потомства; в результате
получаются два цикла-летний от яиц до
взрослых особей и зимний, в котором
личинки активны осенью и весной, а
середину зимы проводят в спячке,
находясь в третьем возрасте. Летний
цикл дает рабочих особей,
а зимний - репродуктивных особей
и рабочих.
На следующий год новая партия яиц
может начать развиваться раньше, чем
личинки предыдущей партии достигнут
зрелости; хотя при этом создается
перекрывание и расплоды конкурируют
за приносимые рабочими ресурсы, но
зато рабочие особи получают
возможность продлить период своей
активности, захватив часть зимы,-до тех
пор, пока личинки способны поглощать
1 84 I’.шва 10
корм, а это они могут делать даже при
понижении температуры примерно до
10°С (Brian, 1965).
При построении модели сообщества
Myrmica (Brian et al., 1981) было трудно
включить в нее конкуренцию за корм
между самками и личинками так, чтобы
модель оставалась стабильной. С этой
целью было введено предположение, что
имеющийся корм распределяется между
этими двумя категориями потребителей в
соотношении, соответствующем весовому
отношению между яйцом и куколкой,
так что на каждую образовавшуюся
куколку откладывается только по одному
яйцу, которое должно ее заменить. Таким
образом поддерживается непрерывный
поток развивающихся единиц,
проходящих через кормовую камеру,
распределяется нагрузка на рабочих
особей и обеспечивается постоянное
наличие личинок, поскольку приток яиц и
отток куколок происходят с одинаковой
скоростью. Другой способ, позволяющий
уменьшить колебания численности
населения,-это запасание корма.
У Myrmica, после того как большинство
личинок метаморфизировало, в пакетах
яиц, отложенных самкой, оказывается
много кормовых яиц. Поэтому
в периоды, когда личинок мало,
фуражиры могут продолжать сбор
корма, а кормилицы перерабатывают его
и запасают в виде желтка (Brian, 1977).
10.2. Основание семьи
Новые семьи основываются одиночными
самками, парами термитов, группами
самок или роями, состоящими из
рабочих особей и самок. Как это
происходит, будет описано в одной из
последующих глав, а здесь мы
рассмотрим ранние стадии роста семей
нескольких типов.
У всех ос и пчел самки-основательницы
фуражируют до тех пор, пока не
появляются на свет рабочие; это очень
рискованный период, и активность за
пределами гнезда лучше всего свести в
это время к минимуму. Для этого можно,
например, собраться всем маткам
и установить „градиент власти", или
иерархию, которая усиливает небольшие
первоначальные различия в размерах,
активности и, возможно, в „интеллекте",
имеющиеся между ними в момент их
присоединения к данной группе. Это
позволяет одной самке, которая
становится главной, или маткой,
получать в первую очередь любой корм,
приносимый в гнездо, и пополнять свой
рацион яйцами, если они будут
откладываться другими особями.
Благодаря этому, а также возможности
отдыхать она может в случае надобности
активно вмешиваться во все
происходящее в гнезде и тем самым
поддерживать свое положение.
Дискомфорт и лишения, которые
испытывают в гнезде подчиненные самки,
вероятно, заставляют их выходить
наружу и отправляться на поиски корма.
На первый взгляд кажется удивительным,
что эти самки возвращаются назад,
вместо того чтобы устроить себе новое
гнездо; однако при высокой плотности
популяции место для нового гнезда
найти трудно, и возможно, что
подчиненные самки преодолевают свой
„инстинкт", толкающий их на
обследование таких мест, даже если
жизнь в гнезде не изменила их
естественных склонностей. Принято
считать, что голодание или просто
недостаточный отдых подавляет
активность corpora allata (а тем самым и
яичников) и дает этим самкам
возможность избежать агрессивной
конкуренции за места для откладки яиц.
Обычно активность яичников и corpora
allata связана с доминированием
в иерархической системе сообщества и
Ранние этапы роста семьи 1 85
ведет к образованию репродуктивного
синдрома (примеры см. у Brian, 1979а).
У живущей в тропиках осы
Parischnogaster mellyi (Stenogastrinae)
гнезда в большинстве случаев
основывают одиночные самки, однако
иногда это делают совместно несколько
(до четырех) самок (Hansell, 1982).
Старшая самка, которая иногда может
быть матерью остальных, принимает от
них корм, но сама никогда не отдает
его - разве только в некоторых случаях
кормит личинок; остальные самки
обмениваются друг с другом пищей,
кормят личинок, а подчас даже и самцов,
которые (даже если самки „бодают" их)
никогда не отвечают им тем же. Самки
обычно сталкиваются головами, после
чего они либо прижимаются к земле и
замирают, либо вообще никак не
реагируют; реже за этим следует обмен
комочком пищи или отрыгнутой
жидкостью. Старшая самка получает
таким образом возможность оставаться в
гнезде, вблизи его верхушки; ее яичники
при этом развиваются, и все яйца
откладывает она одна, хотя иногда она
участвует в строительстве ячеек
и кормлении личинок. В сущности,
поскольку дочерние самки, остающиеся в
гнезде, приобретают технические навыки
и могут даже в конце концов занять
место старшей самки, им, вероятно,
имеет смысл оставаться в гнезде в роли
помощниц, особенно если мать стара.
Очень интересно, что у некоторых
полигинных Polybiini, например
у Metapolybia, рабочие особи и самки
закладывают новые семьи совместно:
вначале рабочие признают
и „приветствуют" всех молодых самок,
но потом они научаются отличать тех,
которые демонстрируют подчинение и
отрыгивают пищу, от тех, которые
реагируют агрессивно. Самок,
занимающих подчиненное положение,
они преследуют до тех пор, пока те не
покидают гнездо навсегда или не
становятся рабочими особями в полном
смысле слова и даже отдыхают вместе с
настоящими рабочими в нижних зонах
гнезда. Таким образом, на этой стадии
развития семьи рабочие особи
объединяются, чтобы избрать в качестве
матки одну самку-ту, которую труднее
всего запугать. Если эта самка погибает
или если ее удалить экспериментально, ее
функции берут на себя несколько
младших самок и семья снова на
некоторое время становится полигинной
(West-Eberhard, 1973, 1977). Итак,
рабочие особи активно выбирают матку,
не давая корма или даже отнимая его у
всех других претенденток; часть
вырученного при этом корма,
несомненно, достается матке или ее
личинкам. Наличие помощниц
благоприятно для доминантной самки,
поскольку оно позволяет ей сократить
опасную деятельность вне гнезда
и уменьшить затраты энергии.
У Polities fuscatus образование пар
повышает шансы гнезда на выживание,
но продуктивность при этом не
возрастает (Gibo, 1974, цит. по Brian,
1979а). У Р. metricus если у главной
самки нет надежных защитников, то в ее
отсутствие ее место может захватить
другая самка, так что при высокой
плотности популяции одиночным
самкам-основательницам приходится
туго (Gamboa, 1978; Gamboa et al., 1978).
Гнезда, заложенные раньше, привлекают
к себе других особей и развиваются
лучше (Gamboa, 1980). Часто конфликты
между самками отнимают у них слишком
много времени и энергии, нарушая
нормальное развитие гнезда, как,
например, у Р. canadensis, у которой
самки иногда сперва начинают строить
гнездо, а затем уже спариваются
(West-Eberhard, 1969), и у Р. annularis
(Hermann, Dirks, 1975). Установление
иерархии протекает легче, если самки
186 1 .шва 10
связаны родством, например если они
сестры или имеют одного общего
родителя (Klahn, 1979; Metcalf, Whitt,
1977а; West-Eberhard, 1969). У другого
представителя Polistinae - Mischocyttarus
mexicanus, изученного во Флориде,-
склонность к кооперированию различна в
разное время года: она сильно выражена
осенью и слабо-весной, когда
устанавливается строгая иерархия
и эффективная моногиния. Litte (1977)
высказывает предположение, что
изобилие пищи весной дает возможность
самкам быстро собирать ее, сокращая
периоды, когда гнездо остается без
присмотра. Однако гнезда с одной
самкой, хотя они меньше подвержены
нападениям птиц, не в состоянии
защищаться от муравьев. Экологическая
ситуация достаточно сложна. Тем не
менее существует хорошая
положительная корреляция между
числом построенных ячеек и числом
самок, начавших строить гнездо, если это
число не превышает шести. Такие семьи
лучше выживают, и в случае повреждения
гнезда шансы на его восстановление
выше.
У Polistes несколько самок часто
основывают гнездо совместно, и имеются
убедительные данные в пользу
выгодности такого сотрудничества.
В одиночку одна самка может построить,
в зависимости от вида, 20-30 ячеек и
отложить в них яйца, а затем она
прекращает строительство, так как после
вылупления первой личинки ей надо
начинать кормить личинок свежим
кормом (в том числе и яйцами). Менее 10
из этих личинок окукливаются
и развиваются в рабочих особей;
в ожидании их выхода матка снова
начинает откладывать яйца в пустые
ячейки (дальнейшие подробности см.
Brian, 1965). И все же многие гнезда,
основанные одиночными самками, не
доживают до времени появления рабочих
особей либо потому, что самки не могут
достаточно хорошо инкубировать яйца,
либо потому, что они гибнут во время
фуражирования.
Самки 1)ч!iclwvespula sylvestris (Vespinae)
начинают строить гнезда в одиночку и
убивают особей, желающих к ним
присоединиться, или потенциальных
узурпаторов. Они строят ячейки,
окружают их оболочками, число которых
может доходить до четырех,
откладывают в ячейки яйца и кормят
вылупляющихся личинок, несколько
снижая в это время откладку яиц.
Кормлению личинок самка явно отдает
предпочтение по сравнению с откладкой
яиц, вероятно из-за подвижности
личинок, их запаха и, возможно, секрета
их слюнных желез. Взрослые особи в
состоянии оценивать величину личинок:
более крупным личинкам дают более
крупные комки, и они явно получают
более крупные кусочки пищи.
У некоторых Vespinae крупные личинки
скребутся о стенки ячеек, и если записать
производимые при этом звуки, а затем
воспроизвести их, то они привлекают ос
и побуждают их давать личинкам корм
(Ishay, Schwartz, 1973; Jeanne, 1980). Эти
личинки с готовностью принимают пищу,
и вполне возможно, что производимые
ими звуки делают ее распределение более
равномерным, уменьшая преимущество
для личинок, занимающих ячейки около
входа в гнездо, по сравнению
с обитателями внутренних ячеек.
В среднем самка D. sylvestris строит 40
ячеек, из которых 38 содержат расплод:
7-с куколками в коконах, 19-с личин-
ками и 12-с яйцами (Archer, 1981а).
Можно считать, что у этого вида
откладывается избыточное число яиц, так
как многие личинки, которых самка
начинает выкармливать, впоследствии
голодают. Из них получаются, после
того как кормление переходит к рабочим
особям, имаго-недомерки, которые даже
Ранние >1Папы роста семьи 1 87
мельче первых рабочих, полностью
'выкормленных одной самкой-
основательницей (Brian, Brian, 1952).
Трудно, однако, решить, что выгоднее в
неопределенной экологической
ситуации - меньшее число крупных или
большее число мелких особей. Самки
сильно варьируют по уровню активности,
и только 10% из них производят
большую армию рабочих; самое крупное
гнездо, построенное одиночной самкой,
имеет обычно четыре оболочки. Archer
(1981b) заметил, что картон,
изготовленный самкой- основательницей,
бывает бледнее, чем более поздние его
слои, изготовляемые рабочими; он
показал, что размеры первоначального
вклада этой самки коррелируют
с окончательными размерами гнезда.
По-видимому, после того как найдено
подходящее место, дальнейший успех
зависит от энергии самки и от ее
способности координировать работы-не
строить слишком много ячеек,
пренебрегая при этом оболочкой гнезда,
и не откладывать слишком много яиц,
оставляя без достаточного внимания
личинок. Устройство оболочки весьма
выгодно, так как это, в сущности,
идеальный способ занять
время.
У Bombus самки, как и у Vespula,
чрезвычайно нетерпимы весной к другим
самкам, но, несмотря на это, они
подвергаются социальному паразитизму
со стороны видов, обладающих
соответствующей тактикой
проникновения, например толстокожего
Psithyrus. Рост семьи, вероятно,
лимитируется способностью
вырабатывать воск; это, возможно,
спасает шмелей от перепроизводства яиц;
яйца обычно сначала откладываются,
числом около дюжины, в маленькую
общую восковую ячейку, и самка в своем
утепленном волокнистой массой гнезде
держит их около себя, охраняя их и
инкубируя. Самка должна заниматься
сбором пыльцы и нектара, чтобы
кормить личинок и добывать сахара,
необходимые для выработки воска
и тепла, расходуемого при
инкубировании. Личинки, вырастая,
начинают плести в ячейке стенки,
отделяющие их друг от друга, а позднее
плетут коконы; воск, соскребаемый со
стенок ячеек, используется для
построения новых яйцевых ячеек,
начинающих новый цикл. У шмелей
Bombus, строящих восковые пакеты,
несколько личинок кормятся на одном
комке пыльцы (рис. 10.2); когда они
окукливаются, различия в их размерах
ясно показывают, что личинки,
находившиеся ближе к центру, растут
быстрее тех, которые оказались сбоку.
На величину взрослых особей влияет
также численное соотношение рабочих и
личинок (Plowright, Jay, 1968). Это
показывает, как важно, чтобы в период
роста семьи число рабочих
соответствовало числу личинок; это
особенно важно потому, что величина
рабочих особей влияет на то, какого рода
работу они будут предпочитать. Для
создания рабочих особей требуется всего
три недели, а еще через несколько дней
крупные рабочие уже способны начать
фуражировку, освободив от этой
нагрузки матку.
Примитивным муравьям, так же как и
Amblyopone pallipes, необходимо
длительное время, чтобы основать
семью. Самка-основательница Myrmecia
forficata откладывает примерно 8 яиц, из
которых спустя 4 месяца получаются в
среднем три рабочих особи; у М. regularis
на развитие рабочих особей уходит до 8
месяцев (Haskins, Haskins, 1950).
У Myrmica семьи основываются
одиночными самками или группами
самок, а также образуются в результате
разделения существующих семей. Самки
немного занимаются фуражировкой
188 г.швч К)
Кокон
Воск
Рис. 10.2. Пять стадий в развитии Bombus
atratus от пакета яиц до куколки. А. Яйца в
восковой ячейке. Б. Личинки, которые
кормятся из одного скопления пыльцы,
лежащей поверх воскового кармана.
В. Личинки, плетущие шелковые перегородки.
Г. Личинки, достигшие окончательных
размеров. Д. Коконы, замещающие воск,
который соскребается и используется для
построения новой яйцевой ячейки. (Sakagami
et al., 1967а.)
и превращают запасы своего жирового
тела и летательные мышцы в яйца. Одна
самка-основательница может отложить
25 яиц и произвести в первый сезон трех
новых мелких рабочих особей и пять
зимующих личинок (Brian, 1951). На это
уходит 9-10 недель, т. е. у муравьев все
происходит гораздо медленнее, чем у
пчел и ос с одногодичным циклом
развития; отчасти это обусловлено тем,
что муравьиная самка неспособна
инкубировать расплод и целиком
полагается на те микроклиматические
условия, которые ей удастся найти на
месте. Вначале выращиваются очень
мелкие рабочие особи; характерная черта
самок-основательниц-откладка яиц, из
которых непременно разовьются рабочие
особи. Создание небольшой группы
рабочих до наступления зимы может
быть очень важным делом для некоторых
видов. Проникновение Tetramorium
Ранние чпшпы роста семи
189
caespitum на север, по-видимому, зависит
от их способности совершать брачный
лёт в достаточно ранние сроки, чтобы их
потомки могли пройти весь цикл
развития до наступления осени. Самки
этого вида запасают в зобу
и фарингеальных железах жир
оранжевого цвета и начинают
откладывать яйца, как только их
подземная камера готова. Они могут
произвести около дюжины куколок, из
которых через два месяца получается до
десятка рабочих особей.
У Solenopsis invicta семьи закладывают
одиночные самки, которые не
занимаются фуражировкой; при
температуре 30° С примерно через 20
дней появляются мелкие рабочие особи
(Markin et al., 1972). Самка начинает
откладывать яйца через 2-3 дня после
того, как закончит строительство
камеры, и накапливает 20-50 яиц; когда
на 5-й день из этих яиц начинают
вылупляться личинки, большая часть
других яиц (возможно, стерильных)
поедается. Самка извлекает личинок по
одной из пакета, состоящего из яиц и
личинок, и кормит их, отрыгивая жидкий
корм, который образуется в результате
автолиза летательных мышц; при
выращивании потомства она теряет
таким образом половину своего веса. В
природных условиях у этого вида обычно
бывает по одной самке на семью, однако
иногда число их достигает пяти (реже
больше). В лабораторных условиях, где
насекомых никто не тревожит и где
исключено нападение хищников,
дополнительные самки не дают
существенного преимущества. Если,
например, увеличить их число с 1 до 4, то
число отложенных яиц возрастает с 35 до
86 (в 2,5 раза), а число рабочих-с 14 до
22. Однако выживание при двух и трех
самках возрастает с 62 до 73 и 80%, а при
четырех падает до 45% вследствие
заражения паразитическим грибом. Как
показали лабораторные исследования,
три самки при совместном содержании
дают гораздо меньше рабочих особей
(18), чем если их содержат по
отдельности (42), так что совместное
существование, очевидно, имеет много
невыгодных сторон.
У Messor aciculatum в популяциях
с высокой плотностью иногда бывает
одновременно до четырех
самок-основательниц (Taki, 1976). Число
самок не влияет на время, необходимое
для получения первой рабочей особи, но
общее число рабочих, выращиваемых в
экспериментальных условиях восьмью
самками, увеличивается до предела,
близкого к 50. Этот предел,
по-видимому, обусловлен возрастающей
смертностью среди личинок
и взаимодействием между самками, так
как в больших группах они теряют в весе
меньше, чем в маленьких, а потеря в весе
коррелирует с числом выводящихся
рабочих особей. Таким образом, число
рабочих, производимых на одну самку,
вероятно, бывает наибольшим, если
самка в семье одна, а наибольшее обшее
число-при восьми самках; оптимальным
же вариантом будет наличие примерно
четырех самок.
У Lasius niger и L.flavus
самки-основательницы проявляют
тенденцию к кооперированию; некоторая
напряженность ощущается лишь
в короткие периоды откладки яиц
(Waloff, 1957)1. Хотя при наличии
нескольких самок общее число яиц
больше, на одну самку их приходится
меньше (и меньше яиц будет съедено);
при этом кажется вероятным, что
некоторые самки в откладке не
участвуют. Однако при наличии двух или
трех самок рабочие особи появляются
1 Более детально образование семьи группами
самок Lasius niger описано Кипятковым
(1979).-77/>и.и. ред.
190 I'./ава 10
через 4 месяца, а при одной самке-через
7 месяцев. С наступлением окукливания
самки расселяются либо мирно (L.flavus),
унося с собой куколок, либо
с проявлениями антагонизма (L. niger).
Для последнего вида типична моногиния,
a L.flavus в этом отношении более
либерален. Поскольку с каждой
добавочной самкой прирост числа
рабочих особей уменьшается,
оптимальным следует считать наличие
менее чем пяти самок. При этом не
учитывается возможное использование
сверхкомплектных самок для защиты
гнезда или же риск заболеваний,
создаваемый высокой плотностью.
Самки-основательницы Oecophylla
longinoda начинают строить гнездо
в одиночку, и при температуре 30°С
личинки вылупляются через 10 дней. Эти
личинки используются для того, чтобы
сплести шелковый навес над полостью, в
которой расположено гнездо, а спустя 18
дней появляются рабочие особи (ср. с
Solenopsis). Таким образом, у Oecophylla и
Solenopsis при 30°С рабочие особи
появляются примерно через три недели,
т. е. в очень ранний срок по сравнению с
Tetramorium (4-5 недель), Messor (10 не-
дель) и уж конечно Myrmica (12 не-
дель); для последнего рода, однако,
оптимальная температура равна не 30, а
20°С. Следует коротко упомянуть еще о
необычных особенностях, наблюдаемых у
двух представителей подсемейства
Myrmicinae- Самки Carehara, живущие в
термитниках и питающиеся их
обитателями, производят таких мелких
рабочих особей, что эти последние могут
прицепляться к ногам самки во время ее
брачного полета и позднее помогают при
основании гнезда (Wheeler, 1936); это
значительно экономит время и снижает
степень риска. У самок Асготугтех
octospinosus имеется достаточное
количество резервов, чтобы производить
мелких рабочих особей, однако
самка-основательница отправляется на
сбор листьев, чтобы заложить сад,
который она засевает гифами грибов,
принося их из родительского гнезда в
предротовой (инфрабуккальной) камере.
Первые рабочие особи появляются спустя
40 дней, после чего остается запас
листьев еще по крайней мере на две
недели (Jutsum, Fisher, 1979).
У гермитов новую семью основывает
пара особей-самец и самка. У Calotermes
flavicollis, который питается сухой
древесиной, первые 10-20 молодых
особей, вылупляющиеся почти через
8 недель, кормятся секретом одной из
пищеварительных желез,
а позднее-перетертой древесиной. Через
год семья состоит из 50-60 особей, 65%
которых-солдаты; по мере роста семьи
эта цифра постепенно снижается до 3%
(Liischer, 1961; цит. по Brian, 1965).
Neotermes tectonae, принадлежащий
к тому же семейству и обитающий в
тропиках, устраивает гнездо в отмерших
частях деревьев; спустя два года в его
семье может быть всего 30-60 рабочих
особей (в том числе 3-7 солдат)
(Kalshoven, 1959; цит. по Brian, 1965). В
лабораторных условиях две семьи,
заложенные рядом, слились в одну и
одна пара репродуктивных особей была
элиминирована. Таким образом, развитие
семьи у термитов протекает гораздо
медленнее, чем у муравьев в сравнимых
климатических условиях, и можно
предположить, что это обусловлено
низким содержанием белка в пище, за
счет которой происходит рост, после
того как внутренние резервы
репродуктивных особей истощены.
У Reticulitermes hesperus (Rhinotermitidae),
тоже питающегося древесиной,
начальный период роста протекает еще
медленнее. Откладка яиц начинается
только через месяц, а инкубация
продолжается два месяца; спустя пять
месяцев в гнезде не больше 12 особей.
Ранние лианы роста семьи 191
Первая и вторая личиночные стадии
занимают всего 17 и 20 дней, но третья
продолжается от 18 дней до 6 месяцев в
зависимости от интенсивности
конкуренции. У этих термитов солдат
тоже бывает больше в небольших
группах, а у R. lucifugus самец кормит
молодых особей через рот (Buchli, 1950).
У Termitidae пара репродуктивных
особей быстро роет гнездо и производит
потомство за счет своих резервов.
Tenuirostritermes tenuirostris
(Nasutitermitinae) начинает с откладки
пяти яиц в день через 3 дня после
копуляции, но к концу месяца в гнезде
бывает всего лишь 60 яиц (Light, Weesner,
1955, цит. по Brian, 1965). Молодых
личинок кормят секретом слюнных
желез, и они растут так быстро, что через
два месяца после образования пары
могут собирать сухую траву; носатые
солдаты составляют 25-35% первого
потомства. У Ancistrotermes guineensis
(Macrotermitinae) откладка яиц тоже
происходит быстро, так как взрослые
особи имеют внутренние резервы; самка
откладывает по 5 яиц ежедневно
в течение 10 дней, к 60-му дню в гнезде
появляются мелкие и крупные рабочие
особи и солдаты, но только на 75-й день
они выходят наружу и начинают
устраивать грибные сады, используя
шарики из экскрементов (Sands, 1960). По
сравнению с Асготугтех у этого вида
весь процесс носит гораздо менее
регулярный характер.
У одною из видов Macrotermes
(Macrotermitinae), который устраивает
под землей небольшие грибные сады и
соединяет их с галереями, пары половых
особей роют вертикальный ствол
и камеру, копулируют и через 3-4 дня
начинают откладку яиц (Johnson, 1981).
Самец в полном смысле слова
обслуживает самку и помогает ей
откладывать яйца; при этом время от
времени происходит копуляция. Самка
начинает с откладки четырех яиц в день;
а через 11 дней число яиц снижается до
одного в день; по прошествии 28 дней,
после вылупления первых личинок,
откладка яиц прекращается. Когда
пройдет 13 недель, в гнезде может быть
20 крупных рабочих особей (самцов), 15
мелких (самок) и 4 солдата (самки).
Такое соотношение полов близко
к единице. Через неделю 10 мелких
рабочих особей перемещаются ближе к
поверхности почвы, а спустя несколько
дней закладывают грибной сад в виде
комочков из экскрементов, образующих
столбик. Гриб, по-видимому, вырастает
из спор, находившихся в кишечнике
родительской пары. Термиты собирают
мягкую древесину и добавляют ее, вместе
с дополнительным количеством
экскрементов, к саду, однако обычно
грибы используются в пищу лишь спустя
5 недель.
Sands (1965) сравнивал скорость
образования семьи у пяти видов
Trinervitermes. Откладка яиц у всех
начинается в первые сутки после
копуляции, но затем скорость откладки
постепенно снижается. Так же как и у
Tenuirostritermes, у них через 12 дней
бывает по 30-60 яиц, хотя у Trinervitermes
suspensus яиц меньше, чем у других
видов. Скорость вылупления личинок
варьирует, и это сглаживает пик,
связанный с откладкой яиц.
Склеротизированные рабочие особи
проходят две непигментированные
личиночные стадии, и все они женского
пола. Самцы проходят четыре
личиночные стадии, в том числе стадию
просолдата, предшествующую
дефективной стадии мелкого солдата.
Так как у самцов все стадии короче,
солдаты успевают созревать примерно в
те же сроки, что и рабочие особи. У них
также более поздние стадии занимают
больше времени, возможно из-за
недостатка пищи. Доля рабочих особей к
192 Глава 10
Фото 26. Вертикальный разрез через камеры
Macrotermes subhyalinus. Видны
горизонтальный пол и.сводчатый потолок.
[I. Р. Е. С. Darlington.]
Фото 27. Камера Macrotermes subhyalinus, с
которой снята крыша, так что можно видеть
двух цариц на гладком полу, окруженных
мелкими рабочими, несколько крупных солдат
и одного самца (слева).
Ранние этапы роста семьи 193
моменту создания первого хода, по
которому они выбираются на
поверхность, весьма различна:
у Т. ehenerianus она составляет 70,5%, у
Т. carbonarius-55,5%,
у T.oeconomus- 60,10%,
у Т. auritermes-55,9%,
а у Т. suspensus-66,5%.
Поскольку самец и самка уже составляют
согласованно действующую „бригаду“,
причем самец не только помогает
строить и защищать гнездо, но
и поставляет пищу, выделяемую
слюнными железами, кооперация между
несколькими парами вряд ли могла бы
дать какое-то добавочное преимущество
и встречается редко. Судя по имеющимся
данным, пары обычно настроены
враждебно друг к другу, и даже если
стерильные касты объединяются в одну
семью, половые особи вступают в драку
(Nutting, 1969). В начальный период
создания семьи термиты, вероятно,
используют в качестве корма яйца, но
наибольшее различие между термитами и
муравьями состоит в том, что у термитов
солдаты появляются гораздо раньше.
10.3. Взрыв численности
При достаточном количестве рабочих
особей и, если это необходимо, солдат и
при наличии найденных и охраняемых
источников пищи семья может быстро
наращивать число рабочих. Хотя,
казалось бы, и так ясно, что чем больше
рабочих, тем больше проделанная
работа, это нетрудно проверить
экспериментально и установить
численное соотношение между этими
двумя величинами. У Myrmica rubra одна
самка, если предоставлять ей все
возрастающее число рабочих особей,
увеличивает число откладываемых яиц,
но только до известного предела,
который достигается всего лишь при 20
рабочих (Brian, 1969). Поскольку число
рабочих, приходящихся на одну самку, у
этого полигинного вида равно в среднем
76 (Elmes, 1973), остается еще много
рабочих для ухода за личинками, и нет
оснований думать, что самка не может
продолжать откладывать максимальное
число яиц, когда большинство рабочих
особей (скажем, две трети) ухаживают за
расплодом. Чем меньше рабочих
приходится на одну самку, тем меньше
яиц откладывает в среднем каждая из них
(Brian, Rigby, 1978); некоторые самки,
возможно, страдают от конкуренции за
пищу и могут даже не выдержать этой
конкуренции. Оптимальное число самок,
при котором выход яиц достигает
максимума, а неблагоприятные
взаимодействия минимальны,
с увеличением числа рабочих особей
возрастает, но оптимальное число самок
при данной группе рабочих, безусловно,
не соответствует оптимальному для этой
группы числу личинок, которых они
должны кормить. Эти проблемы требуют
экспериментального изучения и анализа
путем численного моделирования.
Можно показать, что численность
рабочих особей имеет также важное
значение для выживания яиц.
Эксперименты, в которых группам
рабочих Myrmica ruginodis числом от 3 до
40 давали по 50 яиц, показали, что число
вылупляющихся личинок сначала
возрастает с увеличением числа рабочих,
а затем, достигнув максимума (около 12),
начинает снижаться (Brian, 1953); на
самом деле для получения 11 личинок
нужно всего 20 кормилиц. Учитывая
эффективность группы в целом
и индивидуальную эффективность
рабочих особей, можно считать, что
наиболее экономными были бы группы
по 11 рабочих, способные вырастить 7-8
личинок. Такие же эксперименты можно
провести для более поздних стадий
развития. Так, группам рабочих особей
разной численности-от 5 до 320-давали
194 Глава И)
по 50 личинок третьего возраста сразу
после зимовки; оказалось, что для
получения максимального роста
и максимального выхода куколок при
очень малой смертности достаточно 80
рабочих особей. Поскольку
с увеличением численности группы вклад
каждой особи снижается, наиболее
экономным вариантом будут группы по
42 рабочих, которые обеспечат примерно
две трети максимального выхода. При
этом оптимальное соотношение рабочих
и личинок составит 0,84, а это
практически равно тому, что было
найдено в диких семьях, собранных
только за один сезон,-0,88. Это
позволяет думать, что гнезда в природе
функционируют в отношении
выращивания расплода на уровне,
близком к оптимальному. А из этого,
конечно, следует, что экономичному
функционированию благоприятствует
естественный отбор, а не то, что рабочие
особи всегда способны эффективно
выполнять свои функции.
В I ораздо большей выборке семей,
относящихся к разным видам Myrmica и
имеющих разную численность,
отношение рабочие/личинки составляло в
среднем 0,85 при 2000 рабочих особей
(Elmes, Wardlaw, 1981). У всех семи
изученных видов наблюдалась сходная
зависимость между числом рабочих и
числом личинок, но она не была
линейной: при 1100 рабочих отношение
рабочие/личинки было равно 1, при 1000
рабочих-1,14, а при 100 рабочих
достигало 3. Таким образом,
с увеличением числа рабочих это
отношение, вместо того чтобы
возрастать или хотя бы оставаться
постоянным (как следовало бы ожидать,
если бы с повышением плотности
эффективность падала), на самом деле
слегка уменьшается. Это может означать,
что более крупные семьи эффективнее в
отношении выращивания расплода, чем
мелкие. Эффективность может снижаться
из-за дублирования, избыточности,
нарушений в передаче информации,
столкновений или просто попыток
избежать их. В условиях сильной
скученности, когда, например, большое
число рабочих особей пытается
добраться до нескольких личинок,
подаваемые личинками сигналы могут
просто не дойти до рабочих,
находящихся в отдалении, и те будут
спокойно ожидать, оставаясь на краю
группы. Это хорошо, так как при этом
уменьшается группа суетящихся рабочих,
которые стремятся обслужить личинок.
Поскольку рабочие особи выращивают
рабочих, т. е. создается положительная
обратная связь, приводящая
к экспоненциальному росту, все еще
трудно представить себе, сколь
динамична популяция общественных
насекомых на самом деле. Некоторые
примеры могут помочь нам в этом.
Матка пчелы Evylaeus marginatus
откладывает в первый год только шесть
яиц, а позднее, когда ей уже помогают
рабочие, она за 5 лет своей жизни
производит больше 1000 яиц; рабочие
особи живут не более года
(Plateaux-Quenu, 1962). У Bornbus
pascuorum откладка яиц сначала идет
медленно, но затем ускоряется, достигая
максимума -12 яиц в день; у этих
шмелей точное соответствие между
приростом числа яиц и приростом
взрослых особей достигается путем
откладки яиц на коконы, wo
обеспечивает в среднем соотношение 3
яйца : 1 кокон (A. D. Brian, 1951, 1952).
Данные об этой содержавшейся
в помещении семье В. pascuorum (и одной
семье В. humilis), обитатели которой
могли свободно вылетать наружу,
показывают, что личинки развиваются из
71% яиц, 73% этих личинок окукливаются
и из 90% куколок выходят взрослые
особи. Это дает вогнутую кривую
Ранние этапы роста семьи 195
Рис. 10.3. Кривые
выживания фуражиров (7)
и гнездовых шмелей (2)
Bombus morio. (Garofalo,
1978.)
выживания: оно описывается
экспоненциальной функцией
с отрицательным показателем при
постоянной смертности 4% в день,
средней продолжительности жизни 25
дней и периоде полужизни 17,5 дня.
Таким образом, простая модель
с приростом 12 яиц в день дает 4 новые
особи в день и может обеспечить
постоянную численность семьи в 100
шмелей, уравновешиваемую гибелью
насекомых со скоростью 4% в день
(Brian, 1965). Для живущего в тропиках
В. morio, у которого фуражиры крупнее и
старше, средняя продолжительность
жизни кормилиц 73 дня,
а фуражиров - только 36 дней (рис. 10.3)
(Garofalo, 1978). Кривая выживания
кормилиц имеет полунормальную форму,
а кривая для фуражиров-вогнутая, но те
и другие менее подвержены
случайностям, чем у европейских видов
шмелей. У Bombus atratus, обитающего в
субтропиках Южной Америки,
с расплодом дело обстоит примерно так
же (Sakagami et al., 1967b), однако
сведений о выживании взрослых особей
не приводится.
У Polistes необходимость создания
основы для ячеек ограничивает откладку
яиц до двух в день-всяком случае, до тех
пор, пока соотношение рабочие/личинки
высокое, как это бывает после появления
на свет первой партии рабочих особей.
Первостепенное значение, несомненно,
придается выращиванию личинок, так
что при низких отношениях
рабочие/личинки строительство ячеек и
откладка яиц снижаются, несмотря на то
что недавно освободившиеся ячейки
используются повторно. Данные о диких
семьях Dolichovespula sylvestris и Vespula
vulgaris были использованы для
построения модели, описывающей
историю развития средней семьи (Archer,
1981а). Каждая маленькая ячейка
довольно долго (около 45-50 дней)
бывает заполнена расплодом.
У D. sylvestris строительство ячеек
продолжается непрерывно в течение 40
дней; число их достигает примерно 300,
прежде чем освобождаются первые
ячейки, которые можно использовать
вновь. У V. vulgaris ячейки строятся на
протяжении 80 дней, число их достигает
7000, а затем строительство
прекращается. Эти цифры показывают,
что у обоих видов одна рабочая особь
196 Глава 10
строит чуть больше одной ячейки в день;
просто у V. vulgaris это продолжается
дольше, а поскольку число рабочих
растет в геометрической прогрессии, вся
система ячеек оказывается гораздо
больше. У обоих видов матки способны
обеспечивать все ячейки расплодом, хотя
матка D. sylvestris откладывает только по
13 яиц в день, а у И. vulgaris она начинает
с 34 яиц в день и доходит до 348. Это
относится только к семьям, не
достигшим полной зрелости; в зрелой
семье D. sylvestris с большими
маточниками матка может дойти до 65
яиц в день. Вероятно, даже в очень
большом гнезде она не в состоянии
достигнуть такого уровня, как матка
V. vulgaris, хотя, конечно, мы этого не
знаем.
Максимальная численность рабочих
у Dolichovespula sylvestris равна 175, а у
Vespula vulgaris -2200, но в общей
сложности у первого вида выводится 330
рабочих, а у второго-10293. Фактически
средний возраст рабочих особей
в момент их гибели составляет всего 10,3
дня у V. vulgaris (исключая ювенильные
стадии) и около 14 дней у D. sylvestris, но
о последнем виде данных мало;
у шершней (Vespa) рабочие особи живут в
среднем около 5 недель. Кривая
зависимости смертности от возраста у
Vespula vulgaris асимметрична, с модой 9
дней и медианой между 8-м и 9-м днями,
что позволяет объяснять значительную
часть смертности разного рода
случайностями при фуражировке.
Период, когда насекомые находятся в
гнезде и ухаживают за расплодом, очень
короткий или отсутствует вовсе.
Стационарная численность взрослых
рабочих, возможная для модели Vespula
vulgaris с 10%-ной смертностью в день,
зависит от числа мелких ячеек, от
продолжительности периода развития от
яйца до взрослой особи и от выживания
расплода при обилии корма. Если,
предположим, имеется 5000 подходящих
ячеек для рабочих особей, а период
развития равен 25 дням, то ежедневный
прирост рабочих составит 200 особей, и
если они живут в среднем 10 дней, то
стационарная численность их должна
составлять 2000. В случае V. vulgaris такая
численность существует только три
недели-с 74-го по 95-й день. При
размножении роением 10%-ная
смертность - это очень много, но при
очень большом числе ячеек
и потреблении достаточного количества
пищи число рабочих может
поддерживаться на высоком уровне.
У Apis mellifera матка в зависимости от
расы может откладывать до 2000 яиц в
день; если в соте не хватает места, то она
их просто бросает и их поедают рабочие
особи. Число откладываемых яиц
достигает пика в первый и второй годы
жизни, а затем снижается; кроме того,
наблюдается сезонный пик весной. Матка
лишь в редких случаях располагает
условиями, необходимыми для полного
проявления своих возможностей: зимой,
когда на сотах много свободного места,
ее лимитирует то, что пчелы могут
обеспечить теплом лишь небольшой
участок сота, а летом, когда тепла
достаточно, ее сначала ограничивает
скорость построения ячеек,
а позднее-пространство, занятое
запечатанным расплодом,
развивающимся из ранее отложенных
яиц. Таким образом, так же как и у ос,
пчелиную матку ограничивает
в основном число рабочих особей,
выступающих в роли источников тепла,
воска или пищи, и скорость роста семьи
зависит в первую очередь от этих
факторов, до тех пор пока соотношение
рабочие/личинки не падает слишком
низко. Матка может отложить
в „рабочие" ячейки некоторое количество
неоплодотворенных яиц; они должны
быть уничтожены вместе
Ранние этапы роста семьи 197
с оплодотворенными, но
нежизнеспособными яйцами, и доля
неразвивающихся яиц может возрасти до
50%, хотя обычно она составляет меньше
трети. На стадиях личинки и куколки, так
же как и у ос, смертность незначительна,
если только нет заболеваний и хищников
(например, клещей); в хорошем улье в
слоях запечатанных ячеек с расплодом
пустых мест бывает мало. Из 100 яиц
могут вылупиться 94 личинки, 86 из них
окукливаются и со временем дают 85
рабочих особей (Fukuda, Sakagami, 1968).
У медоносной пчелы рабочие особи
живут значительно дольше, чем у ос, и
кривая их выживания имеет „выпуклую"
форму; смертность постепенно
повышается с возрастом, достигая
у фуражиров примерно 3%. Она зависит
также от времени года: в марте
продолжительность жизни фуражиров
составляет 5 недель, в июне-4 недели, а
затем вновь увеличивается с появлением
сонных зимующих пчел, которые могут
прожить всю зиму, особенно если они
поздно появились на свет (Free,
Spencer-Booth, 1959). Осенью, как и у
большинства других насекомых,
интенсивность метаболизма у пчел
понижена и они склонны к запасанию
различных веществ в жировом теле
(Maurizio, 1946). Если их удается
побудить к выращиванию потомства, их
выживаемость несколько снижается, но
они обычно вовремя прекращают заботу
о расплоде, так что зимой в улье
остаются одни только имаго. По мнению
Avitabile (1978), подготовка к зиме
начинается вскоре после летнего
солнцестояния вследствие
чувствительности рабочих особей
к укорочению дня, а удлинение дня после
зимнего солнцестояния, возможно,
побуждает к возобновлению
выращивания расплода. Социальный и
физиологический механизм этих реакций
неизвестен (Kefuss, 1978). Одна из
африканских рас медоносной пчелы, Apis
mellifera adansonii, которую разводят в
Бразилии, где летние температуры
близки к 24°С, а зимние-к 18°С, не
впадает в спячку; у этой расы нет особей,
способных к зимовке, так что их средняя
продолжительность жизни равна 26,3 дня
летом и 24,3 дня зимой (Terada et al.,
1975).
В стационарной семье, состоящей
примерно из 60000 пчел (сильная семья в
июне) с общей смертностью 3% (1800
особей) в день матка должна
откладывать (при выживаемости 70%)
2600 яиц в день, что близко к пределу
возможного в хороших условиях. Модель
такой системы, созданная McLellan et al.
(1980), предусматривает график откладки
яиц, при котором число их быстро
возрастает, достигая пика в мае-июне, а
затем постепенно снижается, доходя в
октябре до нуля (кривая из семейства
кривых, соответствующих уравнению
у = хе-х). Авторы исходили из
следующих данных: 1-1,2 тысячи яиц в
день; продолжительность развития до
имаго в среднем 20 дней; 10%-ная
смертность среди молоди; время жизни
имаго 30 дней летом и 200 дней зимой.
Эта модель хорошо согласуется с тем,
что известно об истории жизни семьи
медоносной пчелы, и легко приложима к
другим многолетним общественным
насекомым, так как форма кривой
биомассы достаточно универсальна (ср.
кривую для Myrmica у Brian, 1965).
У Apis mellifera adansonii в Южной
Америке цикл роения продолжается
примерно два месяца (Winston, 1979).
Через 20 дней после роения появляются
новые рабочие особи и снижение
численности семьи прекращается; спустя
еще 20 дней число пчел начинает резко
расти, и образуется рой. Как указывает
Winston, семьи роятся в период быстрого
роста населения в улье, а в своем резюме
он отмечает: „...Рои возникают перед
198 Гкто 10
Рис. 10.4. Сравнение кривых выживания
Nannotrigona postica (/) и Apis mellifera (2).
(Garofalo, 1978.)
высокими пиками скоростей роста..."
Шестьдесят процентов рабочих особей,
особенно молодых, уходят со старой
маткой; за 20 дней до роения новые
рабочие особи составляют 40-60% имаго.
После этого с молодыми самками может
уйти еще до четырех роев, но их может и
не быть вовсе; число дополнительных
роев пропорционально объему
запечатанного расплода. После того как
рой покинул улей, выживание расплода
снижается до 50%, но после появления
молодых пчел оно вновь повышается,
хотя семье приходится ждать еще 20
дней, прежде чем у нее появится новая
плодущая матка. Этот двухмесячный
цикл может быть причиной августовского
вторичного пика частоты роения,
наблюдаемого в областях с умеренным
климатом (см. ниже).
Для Meliponini с их ясно выраженной
внутригнездовой фазой выкармливания
расплода характерно такое же увеличение
смертности с возрастом, как
и у медоносной пчелы. Garofalo (1978),
изучавший Nannotrigona postica и Plebeia
droryana, нашел, что у последнего вида
средняя продолжительность жизни на 42
дня больше, чем у Apis mellifera
(рис. 10.4). Ни у одной безжалой пчелы,
насколько известно, не бывает особых
долгоживущих зимних пчел.
Для низших термитов характерна малая
плодовитость, порядка 2 - 300 яиц в год у
Calotermitidae и Termopsidae, но
у Macrotermes число яиц, откладываемых
царицей, достигает астрономических
величин: 30-40 тысяч в день (табл. 10.1 ;
другие данные см. Brian, 1965).
О выживании молоди сведений мало;
определить его трудно, так как молодые
особи обычно не остаются на одном
месте и часто линяют (Nielsen, Josens,
1978). В популяциях M.hellicosus доля
личинок снижается с 60-64% общей
численности до 28% в семьях старше 10
лет (Collins, 1981а). На протяжении 5 лет
после достижения численности в 10 тысяч
Ранние этапы роста семьи 199
Таблица 10.1. Число яиц, откладываемых самками некоторых видов муравьев
и термитов (Brian, 1978)
Вид Число яиц на 1 самку Источник данных
Муравьи Monomorium pharaonis 400-500 в год Peacock, 1950
Myrmica rubra 400-800 в год Brian, Hibble, 1964
Formica polyctena 2,1 • 103 в год Gosswald, 1951a, b
Formica rufa 6,3 104 в год Gosswald, 1951a, b
Eciton burchelli 2 • 105 в месяц Schneirla, 1971
Dorylus nigricans 3-4 • 106 в месяц Raignier, van Boven, 1955
Термиты Некоторые Calotermitidae 200-300 в год Grasse, 1949
Cryptotermes havilandi 8 в день Wilkinson, 1962
Apicotermes gurgulifex, Apico- 400-500 в день Bouillon, 1964
termes desneuxi Trinervitermes geminatus 500-1000 в день Josens (неопубликованные
Microcerotermes arboreus 1690 в день данные Emerson, 1938
Nasutitermes surinamensis 3917 в день Emerson, 1938
Macrolermes subhyalinus 36000 в день Gresse, 1949
Odontotermes obesus 26208 в день Arora, Gilotra, 1960
Odontotermes obesus 86400 в день Roonwal, 1960
Cubitermes severus Незрелое сообщество (<10000 (= 1 в секунду) 500-200 в день
особей) Зрелое сообщество (10000-40000 До 600 в день Bodot, 1966
особей) Стареющее сообщество (>40000 80 в день
осо ей)
особей семьи растут в геометрической
прогрессии, а затем в результате
дальнейшего роста число особей может
превысить миллион. Естественный
годовой прирост составляет 78%, т. е.
того же порядка, что и у Neotermes
tectonae, у которого он равен 106% (Brian,
1965).
У муравьев диапазон столь же широк:
самка Amhlyopone pallipes откладывает
всего несколько яиц, тогда как у Eciton
hurchelli самка, по имеющимся оценкам,
дает каждые пять недель 1,2- Ю5 яиц, т. е.
в среднем по 3500 яиц в день. Число яиц
у маток Myrmica rubra составляет от 410
до 826 в год (рис. 10.5). Рекорд,
по-видимому, принадлежит обитающему
в индо-малайской области термиту
Odontotermes obesus: одно яйцо в секунду!
К сожалению, данными о выживании и
продолжительности жизни мы пока не
располагаем.
Несколько простых моделей семей
общественных насекомых, растущих по
экспоненте, описал Brian (1965, р. 40). Во
всех группах таких насекомых есть виды
с большими семьями: из многих тысяч
особей у ос и пчел, из миллионов особей
у муравьев и термитов. Такие сообщества
обладают большей мощностью
200 Глава IO
Рис. 10.5. Еженедельная продукция яиц и вес
яиц (мкг) самок из трех семей Myrmica rubra.
Каждая кривая построена по данным
о средней продуктивности четырех самок.
Яйца, предрасположенные к развитию
в рабочих особей, начинают появляться в
период пика продуктивности, между 2-й и 3-й
неделями, а затем их число медленно сходит
на нет. (Brian, Hibble, 1964.)
и стабильностью, однако с увеличением
возможностей сбора корма должна
возрастать и их плодовитость (или число
половых особей). Повышение
плодовитости достигается за счет
кормления самки-основательницы
очищенной концентрированной пищей, за
счет увеличения числа и удлинения
яйцевых трубочек в каждом ее яичнике (и
расширения брюшка, чтобы они могли в
нем поместиться), а также развития ее
эндокринной системы, в особенности
corpora allata, которые снабжают яичники
неотонином. У многих муравьев число
самок может достигать нескольких сотен;
как правило, наблюдается именно это, а
не увеличение продолжительности жизни
рабочих особей. Фактически время их
жизни обычно сокращается; например, у
Myrmecia оно составляет 2 года (Haskins,
Haskins, 1980), а у Monomorium
pharaonis-примерно 7 недель.
У последнего вида может быть более 100
самок, откладывающих по 1,5 яйца в
день каждая, и если хотя бы одна особь
из трех доживает до взрослого
состояния, как у Myrmica, то это
уравновешивает потерю двух процентов
особей в день, так что каждая самка
способна поддерживать стационарную
популяцию в 25 рабочих особей (Peacock,
Baxter, 1950; цит. по Brian, 1965). При
смертности 2% в день средняя
продолжительность жизни-величина,
обратная смертности,-составляет 50
дней. Это не связано с тем, что
М.pharaonis-тропический вид; ведь
Lasius alienus живет в среднем несколько
недель (Nielsen, 1972). И все же по мере
расширения внутригнездовых функций
становится возможным увеличить также
выживание молодых рабочих особей при
сокращении жизни старых фуражиров. В
чем преимущество высокой скорости
обновления? Главным образом в том,
что рабочая особь может
специализироваться на кратковременном,
эфемерном источнике пищи. Для пчел это
Ранние этапы роста семьи 201
цветки какого-то одного вида растений;
для ос-определенный вид жертвы; для
муравьев-возможно, семена какого-то
одного растения, а для термитов - особый
тип подстилки или вид злаков. Рабочих
можно вырастить, получить от них то,
что положено, когда они выработают
нужный навык, а потом избавиться от
них. Они могут не обладать
способностью к последовательному
освоению нескольких навыков, подобно
своим более простым эволюционным
прототипам, которые живут дольше и,
обладая большей гибкостью, непрерывно
учатся и переучиваются. Возможно, что
упрощение функций позволяет
стандартизировать и упрощать
морфологию рабочих особей, но пока
точных данных об этом очень мало.
В этой главе были рассмотрены стадии
превращения корма в биомассу семьи.
После того как рабочие особи берут себе
пищу, доставляющую энергию, личинки
и репродуктивные особи (у перепон-
чатокрылых это самки) получают корм,
необходимый для роста. Молодые личин-
ки и взрослые особи, откладывающие
яйца, получают наиболее очищенный
и концентрированный пищевой материал,
а личинки старшего возраста - смесь или
просто непереработанный корм.
Возможно, что крупные размеры
помогают привлечь внимание кормилиц,
так как корм распределяется
неслучайным образом. В главе 11 будет
описано, как под влиянием половых
особей некоторые личинки получают
ограниченное количество корма
и поэтому из них развиваются мелкие
рабочие особи. Подчеркивается важность
конкуренции между самками
и личинками и ее значение для
стабильности сообщества, поскольку эта
конкуренция обеспечивает соответствие
между количеством эмбрионов
и количеством корма; вырисовываются
три альтернативных способа повышения
общей плодовитости: 1) увеличение
яичников у одной самки; 2) увеличение
числа самок и 3) откладка рабочими
особями яиц, дающих самцов, в период,
когда продуктивность самки понижена.
Семьи могут возникать в результате
расщепления старой семьи, их могут
основывать пары половых особей
(у термитов) или осемененные самки -
в одиночку или небольшими группами.
В небольших новых семьях откладка яиц
не составляет проблемы, но возможны
разного рода помехи и нападения со
стороны хищников при фуражировке, и в
смысле защитных функций групповое
существование дает преимущество.
Одиночные самки хорошо заметны, и
риск подвергнуться нападению до того,
как они начинают создавать семью, для
них больше, чем после этого. Несколько
заточённых в гнезде самок могут
откладывать яйца в один общий фонд и
использовать их для кормления
вылупляющихся личинок; небольшие
группы от этого выигрывают, но если
группа слишком велика, то она
подвержена заболеваниям. После того
как семья создана, численность ее
возрастает, но точно так же возрастают и
ее организационные проблемы.
Глава 11
Созревание семьи
Резкое увеличение численности,
вызванное положительной обратной
связью от растущей массы рабочих
особей, в конце концов затухает
и переходит в стабильное состояние, при
котором численность либо постоянна,
либо закономерно колеблется. Один
очевидный ограничивающий фактор - это
плодовитость самки или самок,
обсуждавшаяся в главе 10. Менее
очевидны пространственные ограничения:
для выращивания потомства, для входа в
камеры с расплодом и выхода от них,
для хранения запасов корма и для
бездействующих фуражиров необходимо
место. Устройство дополнительных
помещений может породить
непреодолимые архитектурные
проблемы, связанные, например,
с кондиционированием воздуха
и механической прочностью. А сверх
всего этого с ростом семьи возрастают
энергетические затраты на добывание
пищи-ведь чем больше рабочих, тем
больше требуется корма, чтобы заменять
и обслуживать их, и тем дальше от
гнезда приходится его собирать. Поэтому
маршруты удлиняются, движение
становится более оживленным, и,
несмотря на проложенные тропы,
возникают „заторы". В сущности,
именно слово „затор" лучше всего
отражает состояние, которое грозит
быстро растущей семье. В этой главе
будет показано, что семьи насекомых
„спроектированы", или запрограм-
мированы, таким образом, что такие
„заторы" могут быть предотвращены.
Насекомые избегают их, размножаясь и
расселяясь в то время, когда скорость их
роста еще максимальна. Тем самым они
максимизируют свой вклад в последу-
ющие поколения, т. е. максимизируют
приспособленность в ее эволюционном
смысле.
11.1. Простые модели
размножения
Простейшие модели строятся с учетом
взрослых особей только двух
категорий- рабочих и половых особей;
количество яиц и снабжение кормом
предполагаются достаточными. В одной
модели число рабочих, имеющихся
в данном интервале времени, есть
экспоненциальная функция от их числа в
предыдущем интервале (при показателе
степени меньше 1), а образование
молодых самок пропорционально числу
рабочих (Brian, 1965). В такой семье
возможно образование столь большого
числа половых особей, что они
уничтожат или по крайней мере сильно
подорвут ее возможности в смысле
производства рабочих особей,
или-другая крайность - половых особей
может возникать так мало, что
продуктивность сообщества окажется
пониженной, если измерять ее как
соотношение репродуктивные
самки/рабочие особи. Между этими
крайними состояниями неустойчивости и
неподвижности существует состояние,
приближающееся к равновесию в режиме
затухающих колебаний. В этом случае,
конечно, есть опасность того, что
случайные отклонения могут привести к
вымиранию, так что продукция
благополучного многолетнего
сообщества окажется ниже, а не выше
Созревание семьи 203
Возраст семьи, дни
Рис. 11.1. Теоретические кривые динамики
развития семей Dolichovespula sylvestris
и Vespula vulgaris, рассчитанные на ЭВМ.
Показана зависимость числа личинок в мелких
(7) и крупных (77) ячейках от возраста семьи.
(Archer, 1981а.)
нормы. Вместе с тем семья может
выдерживать ежегодное вымирание
благодаря тому, что специально
подготовленные плодовитые самки
переживают зиму, как, например,
у Vespula или Bombus, и это дает
возможность семье достигать высоких
скоростей продукции половых особей и
204 Глава 11
высокой продуктивности на одну
рабочую особь в летнее время. Такой
результат возможен при полном
переключении с производства рабочих
особей на продуцирование половых
особей, однако в этом случае
чрезвычайно важны сроки. Если такое
переключение произойдет слишком
поздно, то не останется времени для
копуляции и подготовки к зиме, а если
слишком рано, то будут напрасно
потеряны продуктивные летние дни;
таким образом, проблема опять-таки
заключается в том, чтобы согласовать
цикл развития семьи со сменой времен
года.
Lovgren (1958) смоделировал это для ос.
Archer (1981а), составивший обзор
различных моделей и построивший
модели годичных циклов двух
европейских представителей Vespidae,
обнаружил различия в том, каким
образом производство половых особей
связано у них со временем года
(рис. 11.1). У Dolichovespula sylvestris
первые крупные ячейки для
репродуктивных самок и самцов строятся
в тот период, когда скорость
строительства мелких ячеек для рабочих
максимальна, а возраст семьи всего лишь
30 дней. Это соответствует теории
максимизации производства половых
особей. В отличие от этого Vespula
vulgaris начинает постройку крупных
ячеек, когда скорость создания мелких
ячеек начинает снижаться (на 7-8 недель
позднее, чем D. sylvestris), и таким
образом создает гораздо большее число
рабочих особей. В то время как
D. sylvestris целиком переключается
с производства рабочих на выведение
половых особей, V. vulgaris, начав строить
крупные ячейки, некоторое время
продолжает строить и мелкие. Это не так
странно, как кажется, потому что у этого
вида значительная часть самцов
развивается в мелких ячейках и их
продолжающуюся постройку можно
рассматривать как часть программы
создания половых особей. Поскольку у
V. vulgaris это длится дольше, у нее в
конечном итоге получается больше
молодых самок на одну матку, но
рабочие используются гораздо менее
эффективно: если говорить
о соотношении молодых самок
и рабочих, то у V. vulgaris оно равно 0,18,
а у D.sylvestris-1,66. Более обширное
гнездо V. vulgaris позволяет поддерживать
достаточно высокую температуру
поздним летом и делает возможным
более быстрое развитие, что опять-таки
снижает расходы на создание одной
репродуктивной особи. Таким образом,
благодаря более продолжительному
сезону размножения и выведению
репродуктивных особей в конце сентября,
а не в конце июля у V. vulgaris продукция
молодых самок выше, хотя они
используют своих рабочих менее
эффективно. Быть может, этот вид мог
бы существововать и в более теплом
климате, где ему не надо было бы
готовиться к зимовке? Spradbery (1973b)
нашел, что V.germanica-близкая
родственница V. vulgaris,
интродуцированная на
Тасманию,-действительно способна
к этому. С другой стороны, вид
D. sylvestris, несомненно, вполне мог бы
обитать в местах с более коротким
летом; Archer перечисляет 20 признаков,
по которым D. sylvestris отличается от
V. vulgaris и которые, по-видимому,
делают его более приспособленным к
жизни в областях с коротким летом, в
более высоких широтах и на большей
высоте, чем V. vulgaris.
Модель, пригодную для многолетних
сообществ любых видов (например,
Myrmica), которые собирают корм
и откладывают яйца в зависимости от
его количества, разработали Brian et al.
(1981а) и в еще более общем виде Frogner
Созревание семьи 205
Рис. 11.2. Модель семьи Myrmica. В этой
численной модели семьи с одной самкой
скорость сбора корма зависит от числа
рабочих особей (кривая а). Прямая
/(-количество корма, необходимого для
поддержания численности рабочих особей на
постоянном уровне. Поэтому а — h
соответствует количеству корма, который
может быть использован для производства
репродуктивных особей. Оно достигает
максимума при W = W*. Это, однако, не
соответствует тому количеству корма,
который обеспечивает генетически
оптимальный вклад в производство таких
особей (см. гл. 2); наименьшая численность
семьи, при которой этот избыток делится
поровну между двумя полами, равна И'”. и
И/о> и/ + . Если семья находится в наилучшем
для нее местообитании с источником корма
соответствующей плотности, то отношение
собираемого корма к численности рабочих
особей будет описываться кривой е, а прямые
с и d будут соответствовать распределению
этого избытка между самцами (с) и самками
(</). Точка пересечения с и d соответствует
случаю, когда вклад в самцов и в самок
одинаков; при этом W — 400, т. е. все еще
выше И70, которое соответствует состоянию,
когда семья получает достаточное количество
корма. (Brian et al., 1981а.)
206 Глава 1!
(1980). В первой модели рассматривается
семья, начало которой кладут самка,
несколько рабочих особей и расплод,
выращиваемый за счет запасов,
содержащихся в мышцах и жировом теле
самки. Для новых рабочих особей
характерна определенная
продолжительность жизни, они способны
собирать и перерабатывать корм, но по
мере роста их числа они становятся
менее эффективными из-за
перенаселенности; поэтому с увеличением
общей численности семьи количество
собранной пищи в пересчете на одну
рабочую особь возрастает гораздо
медленнее. Модель исходит из того, что
потребность в энергетическом материале,
пропорциональная числу рабочих,
приводит к максимуму сбора корма
раньше, чем начинает сказываться
потребность большой армии рабочих в
энергии. Этот максимум все еще
значительно больше того количества
пищи, которое необходимо для
замещения гибнущих рабочих особей, и
ее избыток используется для
выращивания половых особей (рис. 11.2);
если же последнее из модели исключить,
то этот избыток будет расти до тех пор,
пока самка не прекратит откладку яиц
или пока из-за помех, связанных
с излишком рабочих особей, сбор кор.ма
не снизится настолько, что его будет едва
хватать на замещение гибнущих рабочих.
Достижению такого равновесия
предшествует фаза затухающих
колебаний, обусловленных тем, что
между откладкой яйца и появлением
рабочей особи должно пройти некоторое
время (период развития) (Maynard Smith,
1974), и поэтому число рабочих,
определяющее темп откладки яиц
в каждый данный момент, не равно тому
их числу, к которому позднее добавятся
новые особи, развившиеся из этих яиц.
В главе 12 будет описана модель
продуктивности Myrmica limanica,
в которой учитывается различие во
вкладах особей разного пола (Uchmanski,
Petal, 1982).
11.2. Регуляция каст
со стороны семьи
У муравьев, ос и пчел на касты делятся
только самки, а у термитов - и самки, и
самцы. В этом разделе рассматривается
способность репродуктивных (половых)
особей регулировать образование особей
той или иной касты. Вообще такая
регуляция может быть связана
1) с определенным периодом
в жизненном цикле или развитии семьи и
2) с определенным временем года,
подходящим для успешного выведения
половых форм. В простых сообществах
проблема касты решается
доминированием маток над особями,
равными ей по рангу; если же матка не
способна сохранить свое положение
вследствие какого-либо повреждения,
возраста или снижения плодовитости, то
это открывает дорогу ее преемницам.
Например, у Mischocyttarus
drewseni- неотропического представителя
Polistinae-no мере роста семьи
стареющая матка уже не может
заставлять всех появляющихся на свет
самок становиться рабочими, так что
появляются репродуктивные самки
(и одновременно с ними самцы) (Jeanne,
1972). У другой осы, Metapolybia
aztecoides, молодая самка скорее всего
станет рабочей особью, если в момент ее
появления на свет в семье уже имеются
матки; в противном случае она будет
копулировать и станет маткой
(West-Eberhard, 1978). У одной из
Halictinae-£vy/<7<?u.v calceatus-в первом
потомстве бывает несколько самок,
которые крупнее других и остаются в
гнезде. Если самка-основательница
терпит неудачу, они способны
копулировать и сразу начать
откладывать яйца (Platcaux-Quenu, 1978,
Созревание семьи 207
1979). У других видов Evylaeus, например
у Е. marginatus, в детерминировании
касты участвуют самцы, так как без
самцов самки не могут копулировать и у
них не развивается обычное
репродуктивное поведение, свойственное
молодым маткам. Поэтому в таких
случаях появление самцов приводит к
развитию самок (Brian, 1980).
Существует и совсем другая проблема: в
каком состоянии должна находиться
семья, чтобы переключиться
с производства рабочих особей на
выведение репродуктивных самок? Таким
состоянием может быть высокое
отношение числа рабочих особей к числу
личинок. Это отношение начнет
снижаться только тогда, когда
плодовитость матки начнет падать или
приблизится к своему пределу, поэтому
оно не служит хорошим показателем
состояния, наиболее подходящего для
размножения. Тем не менее у многих
примитивных общественных насекомых
этот показатель, по-видимому,
эффективен, например у видов Bombus,
строящих восковые пакеты. На довольно
ранних стадиях развития сообщества,
если экспериментально повысить
отношение рабочие/личинки, добавив
рабочих особей или удалив часть
личинок, появляются репродуктивные
самки. В данном случае это всего лишь
сверхкрупные самки, которые
интерградируют по величине к рабочим
особям, но у которых возникают
репродуктивная диапауза и склонность к
копуляции (Brian, 1980). Из данных
Cumber (1949, цит. по Brian, 1965)
следует, однако, что при появлении
половых особей откладка яиц самкой не
снижается. Кроме того, у B.pascuorum,
который тоже строит восковые пакеты,
численность колоний до образования
половых особей варьирует в пределах от
30 до 150 особей, так что ввиду наличия у
них одной матки отношение
рабочие/матки вряд ли может быть
решающим фактором. И в самом деле,
экспериментальные исследования
показали, что в этой группе видов
Bombus матки не влияют на поведение
рабочих особей, связанное
с выращиванием расплода. Таким
образом, можно, по-видимому,
заключить, что главные факторы, от
которых зависит формирование половых
самок,- это запасы корма вне гнезда и
отношение рабочие/личинки в гнезде.
У ос Polistes умеренного пояса каста
самок при надобности детерминируется
уже после выведения имаго под влиянием
таких сезонных факторов, как
температура и длина дня (см. Brian,
1980). Возможно, хотя еще твердо не
установлено, что здесь играет роль также
доминирование матки, так как в начале
сезона размножения экспериментально
повышенное отношение рабочие/личинки
приводит к появлению только крупных
рабочих особей, но не репродуктивных
самок. У осы Р. canadensis место данной
особи в иерархии имеет большее
значение, чем сезонные изменения, очень
незначительные в тропиках, и с ростом
семьи доля репродуктивных самок
постепенно возрастает (West-Eberhard,
1969). С этой тенденцией коррелируют
отношение рабочие/матки
(Р. canadensis - полигинный вид),
отношение рабочие/личинки и, конечно,
средний возраст маток. Таким образом, у
более примитивных пчел и ос
жизнеспособную популяцию рабочих
особей создает та матка, которая
обеспечивает их „занятость" путем
непрерывных требований корма
и регулярной высокой интенсивности
откладки яиц.
У Lasioglossum zephyrum в группе
осемененных сестринских особей
в результате их взаимодействия через
несколько дней выделяется матка
(доминирующая самка). Она начинает
208 Глава 11
вести себя определенным образом:
проявляет более выраженное стремление
к дальнейшей копуляции, к образованию
и откладке яиц, подталкивает рабочих
особей, которые стараются избегать ее,
сидит около входа в гнездо у конца
очереди, образуемой здесь рабочими, а
также занимает другие позиции,
позволяющие ей контролировать
перемещения рабочих и их деятельность.
Она совершает также много коротких
посещений ячеек - выясняет, в каком
состоянии находится их строительство и
снабжение кормом; полученные сведения
позднее могут быть использованы для
того, чтобы координировать
и направлять деятельность рабочих
особей (Buckle, 1982).
У шмелей (Bombus), которые все время
кормят своих личинок отрыгиваемой
пищевой смесью, матки, несомненно,
регулируют кастовую принадлежность
своих потомков женского пола.
Эволюция этого нового регулирующего
фактора отодвигает на второй план роль
отношения рабочие/личинки, поскольку
меньшее количество корма просто
означает меньшее число репродуктивных
самок, а не большее число рабочих.
Непрерывное наблюдение за личинками
(Pendrell, Plowright, 1981) дает рабочим
особям возможность распознавать, какие
из них склонны развиваться
в репродуктивных самок; затем рабочие
путем непрерывного и обильного
кормления стимулируют полное развитие
потенциальных задатков таких личинок
(в тех случаях, когда матка ослаблена
или отсутствует) или же (если матка
полна сил) противодействуют этому; они
либо разбавляют корм, либо вовсе
перестают кормить личинок, так что
последние не могут полностью
реализовать программу своего развития
и потому становятся рабочими особями.
Какого поведения будут придерживаться
рабочие по отношению к личинкам
женского пола, зависит от частоты их
контактов со своей маткой;
по-видимому, им нужен подлинный
физический контакт с ней по крайней
мере раз в день (Roseler, 1977; Roseler,
Roseler, 1977, 1978). Поэтому способность
матки Bomhus контролировать
деятельность рабочих особей зависит от
числа последних (строго говоря, от
отношения рабочие/матка) и от
активности матки и ее способности
вырабатывать феромоны, которая
с возрастом снижается и, вероятно,
зависит от длины дня и температуры.
Кроме того, возможно, что рабочие
особи разного возраста и разной
величины неодинаково восприимчивы к
контактам с маткой. Главная
особенность матки как регулятора,
видимо, состоит в том, что она способна
суммировать все эти факторы и резко
изменять поведение, с тем чтобы
в определенное время года все усилия
семьи полностью и бесповоротно
переключались на выведение
репродуктивных самок вместо рабочих
особей.
Meliponini не прибегают к системе
непрерывного наблюдения и кормления,
как высшие представители рода Bombus.
Они просто устраивают для самок
крупные ячейки с большими запасами
корма, но у них должна быть какая-то не
известная пока система, которая
регулирует число этих ячеек. Молодым
репродуктивным самкам, возможно,
обеспечивается заботливое попечение в
их ячейках, и их кормят через дырочки,
выпуская наружу только тогда, когда
рабочие особи „решают", что нужно
устроить „конкурс" самок. В этом
конкурсе, описанном Imperatriz-Fonseca
(1977) у Paratrigona subnuda, рабочие
особи вначале, по-видимому, бывают
пристрастны к некоторым самкам, но
позднее принимают его исход как
должное. По всей вероятности, рабочие
Созревание семьи 209
Фото 28. Передача корма от одних рабочих
особей Vespula sp. другим на соте, ячейки
которого содержат куколок и запечатаны
шелком и картоном. Обратите внимание на
личинок, расположенных по периферии.
Фото 29. Рабочие особи медоносной пчелы
образующие „свиту" вокруг своей матки. Вс:
они обращены к матке головами, и их усик:
вытянуты вперед. [Фото 28 и 29-J. В. Free.
210 Глава / /
особи всегда чувствуют функциональную
потенцию матки-быть может, по
агрессивности, которую она проявляет во
время церемонии откладки яиц, или по
частоте этого события, или, возможно,
благодаря вырабатываемым ею
феромонам. У некоторых видов Melipona
репродуктивные самки имеют такие же
размеры, как рабочие особи (этих самок
принято называть микрогинами). Как
полагают, личинки, склонные к развитию
в репродуктивных самок, генетически
чем-то отличаются от других, но им
необходимо несколько больше
корма - только в этом случае доля таких
самок может достигнуть максимума (25%
всего потомства). Данные в пользу этого
представления суммировал Brian (1980).
У ос Vespinae производство
репродуктивных самок начинается тогда,
когда впервые строятся большие ячейки.
Стимулом для этого служит подача
маткой нового сигнала, а не затухание
прежнего сигнала. Хотя матка все время
проявляет неоспоримое доминирование,
активизирует рабочих особей
и организует их жизнь в сообществе с
помощью феромона контактного
действия (Landolt et al., 1977), на
определенном этапе своей жизни она
начинает выделять какое-то новое
вещество. Это противоположно тому, что
происходит у Bombus, и, несомненно,
входит в программу изменений, которую
определяет в основном возраст, но на
которую, безусловно, оказывают также
влияние длина дня, наличие пищи
и место в иерархии сообщества. У Vespa
orientalis активным компонентом этого
вещества служит лактон с 16 атомами
углерода, возможно продукт
мандибулярной железы. Было показано,
что он стимулирует строительство ячеек,
даже если его предъявляют рабочим в
отсутствие матки на каком-либо инерт-
ном, неструктурированном материале,
например на бумаге (Ishay, 1975).
У Apis mellifera наступление зрелости
семьи знаменуется устройством
маточников; постройка этих ячеек
начинается в том случае, если весной
плотность пчел высока (Lensky, Slabezky,
1981). Самка обычно способна
остановить строительство „запасных"
ячеек в зоне расплода с помощью
нескольких механизмов; самый важный
из них-это, несомненно, секреция
мандибулярными железами
ненасыщенной жирной кислоты с низкой
летучестью - 9-оксодекановой кислоты
(9-ОДК). Это вещество распространяют в
сообществе рабочие особи, которые
образуют эллипс, или „свиту", вокруг
матки всякий раз, когда она
останавливается. Они прикасаются к ней
своими усиками и ротовыми частями, а
затем убегают в состоянии
гиперактивности и передают полученный
химический сигнал другим рабочим
пчелам (Ferguson, Free, 1980; Seeley,
1979). У А. сегапа рабочие особи
прикасаются к матке менее часто и обмен
информацией между рабочими
соответственно меньше. 9-ОДК сама по
себе привлекательна для рабочих пчел,
хотя они не образуют „свиту" вокруг
кусочка смоченной этим веществом
бумаги или пробки, как они это делают
вокруг живой матки. Это вещество,
несомненно, эффективно на протяжении
большей части года, однако в мае и
июне-главном сезоне
размножения-необходимы очень
большие искусственные дозы, чтобы
предотвратить постройку маточников. В
это время в дополнение к 9-ОДК могут
потребоваться другие факторы, например
следовой феромон, вырабатываемый
тарзальной железой и оставляемый
лапками матки на краях сотов.
Плодущие матки оставляют гораздо
более обильный бесцветный маслянистый
след, чем может оставить рабочая особь
(Lensky, Slabezki, 1981). Сам по себе этот
Созревание семьи 21 1
Рис. 11.3. Цикл размножения африканской
расы медоносной пчелы. Роение происходит
через 20 - 30 дней (звездочки) после того, как
средний возраст рабочих снижается до 10
дней. (Winston, 1972.)
след не очень активно подавляет даже
запечатывание маточников, но
в сочетании с секретом мандибулярных
желез он очень эффективен. В этом
участвует также феромон, выделяемый
брюшком, который, по-видимому,
водорастворим, но о котором пока мало
что известно (Brian, 1980). У A. mellifera,
как и у А. сегапа, в роевом клубе
информация о присутствии матки
передается вверх, но не вниз по цепи
пчел, сцепленных друг с другом ногами,
причем передача сигнала, как бы она ни
происходила, может преодолевать
разрывы в 2, но не в 4 мм! Сигнал
передавался и в экспериментах
с раздавленными матками, так что он,
очевидно, имеет химическую, а не
поведенческую природу, но при этом не
требуется непрерывной передачи
химического вещества вверх по цепи
рабочих пчел (Rajashekharappa, 1979).
Даже молодые репродуктивные самки,
еще находясь в своих ячейках, могут
подавлять строительство других
маточников (Boch, 1979).
Уинстон и Тэйлор (Winston, Taylor, 1980),
специально изучавшие стимулы для
выращивания репродуктивных самок у
Apis mellifera (африканская раса, живущая
в Южной Америке на 5° с. ш.),
установили, что целый комплекс таких
стимулов суммируется, достигая
некоторого порогового триггерного
уровня. Главную роль среди них играют
численность семьи, площадь сотов
и число взрослых особей; значения всех
этих факторов должны быть высокими и
должны возрастать, хотя пчелы могут не
заполнять всю полость гнезда. По
212 Глава ll
данным Уинстона и Тэйлора, в ульях
объемом 20-25 л пчелы переставали
строить маточники, когда они покрывали
0,8-1 м2 поверхности сотов. Необходимы
были также большой процент молодых
пчел, сильная их скученность в зоне,
занятой расплодом, где пчелы стараются
протиснуться внутрь, и локальный
избыток пищи (рис. 11.3). Эти факторы
приводят к разбавлению феромонов
матки и к временному снижению или
прекращению их секреции. На 5° с. ш.,
где длина дня почти не изменяется, а
зимы не бывает вовсе, у пчел
наблюдаются циклы
продолжительностью около 50 дней.
После того как ячейки построены
и матка отложила в них яйца, она не
может прекратить кормление личинок.
Однако после окукливания
и запечатывания ячеек она может
непосредственно атаковать их, и если
только она проделает в ячейке отверстие,
рабочие особи разрушают ее до конца. В
больших перенаселенных ульях рабочие
пчелы особенно активно защищают
ячейки с куколками от нападений матки и
первых появляющихся репродуктивных
самок; вслед за их появлением
происходит многократное роение
(Simpson, 1974). Рабочие пчелы
исполняют своего рода вибрирующий
танец, который, как считают, успокаивает
этих агрессивных самок (Fletcher, 1978а).
У муравьев самки тоже играют важную
роль в регулировании размножения,
влияя на образование как молодых
самок, так и самцов. У Odontomachus
haematoides (Ponerinae) рабочие особи при
наличии в гнезде самки игнорируют
требование корма со стороны крупных
личинок, которые склонны
к превращению в репродуктивных самок
и из которых экспериментатор может
вырастить таких самок. Иными словами,
у муравьев в отличие от медоносной
пчелы самка может регулировать
кормление. Решающее значение,
несомненно, имеет количество корма на
поздних стадиях личиночного развития, а
не его качество (Colombel, 1978, цит. по
Brian, 1980). У Eciton удаление самки
приводит к высокой смертности мелких
личинок, из которых должны развиться
рабочие особи; это, вероятно,
объясняется плохим уходом за ними и
созреванием нескольких новых самок,
предположительно из обычных личинок
женского пола, которым уделяется
особое внимание и отдается
переработанный корм. В засушливый
сезон, к которому, несомненно,
чувствительна вся семья, самку
изолируют в той части находящегося в
покое сообщества, где нет расплода, а в
другой его части, иногда отделенной
какой-нибудь физической преградой
вроде бревна, выращивается обширное
потомство из личинок мужского
и нескольких личинок женского пола.
Последние становятся репродуктивными
самками. Границы между этими двумя
зонами нередко вызывают конфликты
между рабочими особями.
Предполагается, что яйца, из которых
разовьются самки, откладываются
самкой незадолго до разделения на зоны;
неизвестно, однако, откладываются ли
,,самцовые“ яйца самкой или рабочими
особями, лишенными возможности
контактировать с самкой (Schneirla, 1971).
Аналогичный процесс имеет место
у Апотта (Raignier, 1972). Создается
впечатление, что всю эту систему
создают рабочие в ответ на какое-то
сезонное изменение, но первые
небольшие сдвиги, возможно, происходят
в самке и связаны с утратой ею
способности эффективно вырабатывать
какой-то феромон или откладывать яйца,
а скорее всего-с тем и другим.
У представителей неспециализированного
рода Myrmica семьи достигают
репродуктивного состояния вследствие
Созревание семьи 21 3
ослабления влияния матки на поведение
рабочих-как прямого влияния, так и в
результате образования рабочих особей,
не реагирующих на ее присутствие.
Семьи М. ruginodis созревают при
численности рабочих особей от 900 до
3000. Как полагают, рост их численности
на этом не прекращается; он может
продолжаться и после того, как появятся
половые особи, подобно тому как это
происходит у многих организмов.
Поскольку М.ruginodis-хюлтттлтл вид,
высокая вариабельность численности при
достижении зрелости объясняется числом
самок. Критическая цифра составляет
примерно 1000 рабочих на одну самку
(Brian, 1965, р. 57; Brian et al., 1981b).
Первоначально предполагалось, что
у М. rubra, еще более полигинного вида,
самки собираются вместе и образуют
единую группу; так оно бывает весной,
когда они выходят наверх, чтобы
погреться, но в общей форме это
неверно: они агрегируют лишь
в незначительной степени. В сущности,
матки относятся друг к другу враждебно
и рассеиваются по разным участкам
гнезда, где за ними лучше ухаживают и
где они в большей мере общаются с
рабочими особями, чем если бы они,
подобно маткам Apis, передвигались
вместе со свитой (Evesham, 1982).
Основа этого „эффекта разбавления"-то,
что самке необходимо время от времени
прикоснуться к каждой рабочей особи,
чтобы сохранить возможность управлять
ее поведением, связанным
с выращиванием расплода. Мертвая
самка обладает таким же действием, но
после экстрагирования из нее липидов
оно совершенно исчезает. Нет никаких
указаний на то, что информация о самке
в семье может передаваться от одной
рабочей особи другой, хотя полностью
исключить такую возможность нельзя
(Brian, 1973с); может быть, такая
передача осуществляется путем
соприкосновения ротовых частей, как у
медоносных пчел, или с помощью
какого-либо иного церемониального
поведения, эффект которого не
передается через тонкую металлическую
сетку с такими мелкими ячейками, что
рабочая особь пролезть через них не
может.
У Myrmica, так же как и у Odontomachus,
регуляция состоит в недостаточном
кормлении личинок, из которых
получаются репродуктивные
самки,-по-видимому, их кормят
водянистой отрыгиваемой пищей, а не
слегка пережеванной животной пищей
(табл. 11.1). У них наблюдаются также
иные действия (не обнаруженные
у Ponerinae): они упорно и энергично
кусают брюшко личинки, что вызывает
метаморфоз, приводящий к образованию
рабочей особи. Эта агрессивная
деятельность (ибо она производит
именно такое впечатление) против
репродуктивных самок возбуждается в
рабочих особях легче и распространяется
от самки сильнее-как во времени, так и
в пространстве,-чем подавление
активности, связанной с кормлением.
Если рассматривать ее как результат
передачи некоторой информации, то она
проникает в сообщество глубже, чем
информация, запрещающая уделять
внимание личинкам репродуктивных
самок. Последняя хорошо действует
только вблизи от самки, но в смысле
регуляции каст она более надежна, чем
агрессивное поведение, которое сильно
варьирует по своей интенсивности.
Однако торможение кормления легче
снимается в результате социальных
взаимодействий, и с ростом сообщества
этот используемый самкой
регулирующий фактор исчезает в первую
очередь. Самки, выступая в роли
стимуляторов трудовой деятельности,
заставляют также личинок женского пола
пропускать одну важную стадию роста и
Таблица 11.1. Влияние маток у муравьев Myrmica на поведение рабочих
особей по отношению к личинкам и откладке яиц
Тип поведения В присутствии самок В отсутствие самок
(1) По отношению к личинкам, из которых развива- ются рабочие особи Кормилицы активно кормят этих личинок в ущерб другим; ли- чинки метаморфизи- руют, превращаясь в рабочих особей Этими личинками пренебрегают, и они перестают рас- ти, достигнув сере- дины третьего воз- раста
(2) По отношению к лабильным личин- кам женского пола Рабочие особи (главным образом фуражиры) нападают на этих личинок весной, когда они сигнализируют о своей способности превратиться в репродуктивных самок при помощи кутикуляр- ной секреции брюшка И рабочие особи, и фуражиры кормят этих личинок твер- дой пищей, богатой белками, ухаживая одновременно за ограниченной их группой
(3) По отношению к личинкам муж- ского пола Ими пренебрегают, но на них не напа- дают Их кормят лучше, чем личинок, из которых должны развиться ра- бочие особи, но ху- же, чем лабильных личинок женского по- ла, способных дать репродуктивных самок
(4) В отношении образования и откладки яиц До тех пор, пока самка откладывает яйца или пока в гнезде есть куч- ка яиц, независимо от того, дают ли они сам- цов или самок, молодые рабочие-кормилицы от- кладывают неполноцен- ные яйца, пригодные только в качестве кор- ма (кормовые яйца). Очень молодые ра- бочие особи (в возрас- те менее трех недель) откладывают репродук- тивные яйца, которые формируются до того, как эти рабочие начи- нают реагировать на присутствие самки Молодые рабочие осо- би откладывают круп- ные, полноценные ре- продуктивные яйца, которые не оплодотво- рены, но способны развиваться партено- генетически, давая самцов
Созревание семьи 215
метаморфизировать в рабочих особей.
Эта проблема будет рассмотрена в главе
12-
Рабочие особи, испытавшие на себе
воздействие маток вскоре после
появления на свет, лучше реагируют на
них в дальнейшем, когда начинают
выкармливать личинок (Brian, Evesham,
1982; Carr, 1962); они обращаются с
лабильными в смысле будущей кастовой
принадлежности личинками более
решительно: при наличии самки морят
их голодом, а в ее отсутствие -
перекармливают. Первые 3 или 4 недели,
очевидно, имеют решающее значение для
такого обучения рабочих; неясно, однако,
надо ли рабочим особям просто
познакомиться со своей самкой, или они
нуждаются в ее помощи, чтобы
научиться отрыгивать пищу личинкам,
или же, что более сложно, общение с
самкой как-то вводит их в общественный
образ жизни. Smeeton (1981) показал, что
они „рождаются" в физиологическом
состоянии, соответствующем одиночному
образу жизни, и будут откладывать
репродуктивные яйца, если не испытают
влияния плодущих самок. Поэтому если
при недостатке в сообществе новых
рабочих особей в нем существует
дефицит самок (т. е. отношение
рабочие/самки высокое), то весьма
вероятно, что впоследствии многие
рабочие не будут реагировать на влияние
последних.
У Leptothorax nylanderi воздействия семьи
также играют большую роль, чем
снабжение пищей и отношение
рабочие/личинки, причем самки
варьируют по своей способности
подавлять развитие новых самок; так же
как и у Myrmica, их власть увеличивается
с возрастом и достигает пика в начале
каждого сезона (Plateaux, 1970, 1971).
Наряду с различиями в силе воздействия
самки в зависимости от времени года и
возраста сами рабочие особи варьируют
по своей реактивности, отчасти,
несомненно, по причинам, указанным
выше. Более крупные и более старые
рабочие особи, главным образом
фуражиры, сильнее реагируют на самок,
чем мелкие и молодые, которые по
большей части несут функции кормилиц.
С ростом семьи средние размеры
рабочих особей вначале возрастают. Это,
в частности, хорошо установлено
у Myrmica ruginodis (Brian, Brian, 1951), у
M.sabuleti (Elmes, Wardlaw, 1982a) и у
Lasius niger (Boomsma et al., 1982). У
Lasius доля самок среди крылатых
половых особей возрастает с увеличением
размеров рабочих до предела, равного
примерно 0,8, а затем возрастание
прекращается, вероятно из-за того, что
образование самок нарушает
воспроизводство рабочих. Таким
образом, по мере роста семьи самка
получает все большую поддержку, так
как крупные старые рабочие особи в
присутствии самок нападают на личинок,
а в их отсутствие возвращаются
к работам в гнезде и помогают кормить
личинок. Это может быть обусловлено
сенсибилизацией рабочих особей
к влиянию самки в начале их жизни в
семье меньших размеров, где частота их
контактов с самкой была выше. Однако
по мере того, как семья растет со все
большей скоростью, молодых рабочих
особей становится все больше, и уже по
одной этой причине они будут
недостаточно сенсибилизированы,
поскольку их контакты с самкой (или
самками) не могут быть частыми. Такая
структура характерна для семьи,
постоянно увеличивающейся
в геометрической прогрессии, а не для
семьи с постоянной численностью, и это
именно то состояние, в котором
воспроизведение должно достигать
максимума (Brian, Jones, 1980). Таким
образом, созревание семьи обусловлено
большим приростом рабочих особей,
216 Глава 11
недостаточно сенсибилизированных
к влияниям, исходящим от их самки, в
результате чего они не обеспечивают
достаточного кормления личинок,
потенциально способных дать
репродуктивных самок.
У Myrmica и Leptothorax наблюдается
еще одно изменение, на этот раз
касающееся самок и связанное с их
возрастом. Для личинок, вылупляющихся
из яиц, которые самки откладывают в
первый год, вероятность
метаморфизировать в рабочих особей
выше, чем для личинок из яиц более
старых самок; эти „поздние" личинки
чаще развиваются в направлении
репродуктивных самок, хотя это развитие
не обязательно доходит до конца.
Имеющиеся в настоящее время данные
не подтверждают мнения
о существовании яиц двух типов (см.
выше); скорее, все яйца укладываются в
непрерывный ряд-от таких, в которые
изначально заложен ранний метаморфоз,
приводящий к формированию рабочих
особей даже при низких температурах
(20°С), до таких, которые
метаморфизируют в рабочих особей
только в том случае, если
рабочие-кормилицы уделяют им активное
внимание весной, в присутствии самок и
при стимуляции со стороны последних.
Без такого внимания они впадают в
диапаузу, если только температура не
окажется высокой (например, выше
25°С). Диапаузирующие личинки
перезимовывают и медленно (при низкой
температуре) приобретают способность
развиваться в репродуктивных самок; но
они лабильны в отношении касты, т. е.
их развитие в самок не детерминировано.
Самки по мере своего созревания
откладывают все меньше яиц,
детерминированных к развитию
в рабочих особей, и больше яиц,
лабильных в отношении касты, которые
потенциально способны дать самок и
только ожидают подходящих социальных
условий, чтобы созреть. Однако даже у
самок, которым больше года, весной есть
короткий период, когда они могут
откладывать некоторое количество яиц
для выведения рабочих. Важную роль
здесь, вероятно, играет быстрота
откладки, а не малые размеры яиц; это
позволяет думать, что наклонность
к развитию в рабочих особей
обусловлена каким-то дефектом,
нарушающим эмбриогенез и ростовые
потенции личинок, но не подавляющим
развитие полностью, как в случае
кормовых яиц. Индуцируемая самкой
детерминация яиц в отношении касты
неизвестна у пчел и ос, но обычна у
муравьев; ясно, что это результат
каких-то процессов, происходящих
в организме самки, передаваемый ею
сообществу через яйца (Brian, 1980).
У Monomorium pharaonis этот аспект
развития очень четко выражен. Молодые
самки откладывают яйца, большая часть
которых дает мелких рабочих особей
(хотя сами яйца крупные); созревая,
самки начинают откладывать яйца, из
которых могут развиваться крупные
рабочие особи, и, наконец, к концу
120-дневного цикла -яйца, дающие
личинок, предрасположенных к развитию
в самок. Эти личинки выглядят
по-иному: они толстые, лишены волосков
и покрыты золотистыми точками. Матки
откладывают некоторое количество
неоплодотворенных яиц, и из них
развиваются самцы. После производства
половых особей и копуляции в гнезде
цикл возобновляется (Petersen-Braun,
1977, цит. по Brian, 1980). Важно, однако,
указать, что в этом цикле есть гарантии
от ошибок, так как только крупные,
произведенные в середине цикла рабочие
особи вместе со стареющими самками
будут выращивать личинок, дающих
самок; в других случаях их убивают и
поедают, возвращая их компоненты в
Созревание семьи 217
общий круговорот веществ. Самки,
помимо своего материнского воздействия
на яйца, оказывают сильное
ингибирующее влияние на производство
половых особей через поведение рабочих;
это влияние недостаточно тонко, чтобы
переключить личинок с пути развития
самок на путь рабочих особей, как у
Myrmica,- оно просто приводит к их
уничтожению (Edwards, 1982). Рабочие
особи узнают своих самок по нелетучему
липиду на поверхности их тела, как и у
Myrmica (Berndt, 1977; Berndt,
Nitschmann, 1979; Brian, 1980); кроме
того, самки выделяют из расположенной
за заднем конце тела экзокринной железы
неоцембрен, и это служит для рабочих
особей сигналом начать нападение на
личинок, предрасположенных к развитию
в самок (Edwards, 1982). Таким образом,
все черты социального развития,
свойственные обитающим в умеренном
поясе видам Myrmica, есть
и у тропического Monomorium
с циклическим развитием; у Myrmica
бывает по два цикла в год-один
с половыми особями, а другой без них,
тогда как у Monomorium ежегодно бывает
по три полных цикла, в каждом из
которых производятся половые особи.
Как рабочие особи или самки
Monomorium узнают личинок, из которых
должны развиться половые особи, не
известно, хотя для человека они явно
различаются как по форме тела, так и по
текстуре поверхности. Кроме того, их
поверхность, несомненно, обладает
какими-то химическими особенностями,
как и у муравья Myrmica rubra, кожные
железы которого выделяют жир,
плавящийся при 20-25°С (Brian, 1980).
Разные виды Myrmica относятся
нейтрально к лабильным личинкам не
своего вида, но из личинок собственного
вида выращивают только тех, которые
должны дать рабочих особей. Можно
предполагать, что у всех видов данного
рода личинки, обладающие потенциями
для развития в половых особей, имеют
один и тот же опознавательный признак
(Brian, 1975; Elmes, Wardlaw, 1982с). У
Solenopsis invicta личинки, развивающиеся
в половых особей, возможно,
секретируют триолеин. Если пропитать
этим липидом фильтровальную бумагу и
разрезать ее на кусочки величиной с
личинок, то рабочие особи будут
собирать эти кусочки и складывать их
вместе со своими предкуколками,
дающими половых особей; они их не
съедают, хотя муравьи этого вида очень
любят жирную пищу (Bigley, Vinson,
1975).
Зрелые самки Pheidolepallidula-другого
представителя Myrmicinae-тоже
откладывают более лабильные яйца, в
основном ранней весной.
Вылупляющиеся из этих яиц личинки
имеют характерную грушевидную форму,
и их выкармливают только в том случае,
если в гнезде имеется примерно 1400
рабочих особей, так как у этого вида
никогда не бывает больше одной самки
(Passera, 1980а). Вполне возможно, что
материнское влияние на эти яйца
обусловлено ювенильным гормоном,
содержащимся в гемолимфе, так как
обработанные этим гормоном самки
откладывают более лабильные яйца
(Passera, Suzzoni, 1979).
Вилы Myrmica различаются по уровню,
которого успевают достигнуть в своем
развитии эти лабильные личинки до
наступления зимы. У М. scabrinodis они
неотличимы от других личинок по
величине и внешнему виду, но у М. rubra
и особенно у М. sulcinodis иногда бывают
гораздо крупнее, чем зимующие личинки
рабочих особей (Elmes, Wardlaw, 1981).
Тем не менее они все еще способны
сделать „шаг в сторону" и стать
рабочими, в отличие от зимующих
личинок Tetramorium caespitum, дающих
самок: эти личинки настолько крупнее
218 / лава 11
личинок рабочих особей, что в этом
случае возможность переключения на
другую касту сомнительна (см. Brian,
1974а). Может быть, этот эволюционно
продвинутый представитель Myrmicinae,
подобно Pheidole и Monomorium, просто
уничтожает и поедает личинок, кастовая
принадлежность которых детер-
минирована, а не „трансформирует11
личинок, лабильных в отношении касты.
Возможно, что причина утраты рабочими
яичников-то, что путь их развития
определяется уже на стадии яйца.
У Plagiolepis pygmaea (Formicinae)
регуляцию каст осуществляет самка;
пока она имеет сперму в сперматеке и
сохраняет активность, она может
стимулировать у личинок рабочих особей
ранний метаморфоз, как у только что
рассмотренных Myrmicinae; всякая
личинка, зашедшая в своем развитии
слишком далеко, уничтожается
и возвращается в круговорот веществ.
По-видимому, стимулятором служит при
этом какой-то феромон, так как если
смочить самку ацетоном, то ее
воздействие на личинок прекращается
(Passera, 1974, 1980). Лабильные личинки
зимуют, находясь в третьем возрасте
(т. е. на более продвинутой стадии, чем
личинки, дающие рабочих особей или
самцов); поэтому можно думать, что
они, вероятно, развиваются из яиц,
отложенных в начале предыдущего лета,
и что для полного развития им
необходим период прохладной зимней
погоды, как и у Myrmica. Таким образом,
их жизненный цикл связан со сменой
времен года (Brian, 1977).
Прежде чем обсуждать лесных муравьев,
нам следует рассмотреть особый случай
социальных паразитов. Plagiolepis
grassei - паразит Р. pygmaea - способен
предотвращать развитие новых самок у
своего другого хозяина (L. acervorum).
sublaevis (Leptothoracini, Myrmicinae)
могут заставить уже осемененных самок
одного из своих хозяев (Leptothorax
muscorum) прекратить откладку яиц, но
не оказывают такого действия на самок
своего другого хозяина (L. acervorum).
Создается впечатление, что паразит
регулирует образование половых особей
у своего хозяина. У этого паразита матки
часто бывают бескрылыми, хотя яичники
и сперматеки у них вполне развиты; по
данным Buschinger (1978), бескрылость
обусловлена у них единичным
доминантным геном. Возможно, что и
самки Strongylognathus testaceus- паразита
Tetramorium caespitum - подавляют
образование половых самок
у вида-хозяина. По-видимому, все эти
паразиты продуцируют большее
количество ингибирующего феромона,
чем самка хозяина, или же их феромон
действует сильнее.
Известно, что Formica polyctena
откладывает яйца двух типов и что яиц
промежуточных типов у них мало или
нет вовсе (Gosswald, Bier, 1953; Bier,
1953). Яйца, откладываемые в начале
каждого сезона, лабильны, но в природе
из них развиваются только самки, так
как плодущие самки, отложив эти яйца в
теплых поверхностных камерах, уходят в
глубь гнезда, предоставляя рабочим
одним выращивать расплод. Это,
конечно, тем легче, чем больше семья, и
может рассматриваться как один из
путей ослабления власти самки у данного
вида. После периода отдыха в глубинной
зоне гнезда самки откладывают мелкие
яйца, из которых развиваются рабочие
особи независимо от того, находятся ли
эти яйца вблизи самки или нет; они
детерминированы к развитию в рабочих
особей. Однако Гёссвальд и Бир
показали, что если их перенести в гнездо
другого, менее полигинного вида
F.pratensis, то из них могут развиться
репродуктивные самки; таким образом,
они „детерминированы11 только
в естественной обстановке-в гнезде
Созревание семьи 219
собственного вида. Различие между
яйцами этих двух типов обусловлено
температурой и скоростью оогенеза;
помимо прочего, мелкие яйца не
содержат РНКL В чем состоит влияние
самок на выращивание рабочих особей,
остается неизвестным, однако кажется
вероятным, что самки заставляют
рабочих убивать и возвращать в общий
круговорот веществ личинок, способных
развиться в самок, поскольку таких
личинок можно легко распознать начиная
со второго возраста: у них меньше
волосков и более крупные головы
(Schmidt, 1974).
Сходная регуляция существует
и у термитов: если удалить
репродуктивную пару, то формируются
замещающие особи (псевдогины).
У низших термитов они образуются из
личинок и нимф, у которых половые
органы созревают столь преждевременно,
что крылья и глаза не развиваются
должным образом. У Termitidae это
невозможно, и крылатые формы должны
развиваться у них обычным путем в
нормальные сроки, как и у муравьев.
После этого они образуют пары,
замещающие удаленных репродуктивных
особей. Некоторые термиты,
по-видимому, различаются по своей
способности прибегать к одному или
другому из этих способов. Если они
находятся на стадии небольшой молодой
семьи с множеством мелких личинок, то
они создают замещающих особей, а на
стадии зрелой семьи-крылатых взрослых
особей. Здесь снова проявляется элемент
сезонности: перезимовавшие личинки
наиболее чувствительны и с наибольшей
вероятностью превращаются в нимф, а
затем, после дальнейших линек,- в имаго
1 Следует учитывать, что цитируемые работы
были сделаны в 50-х годах, когда методика
определения РНК была очень грубой,- Прим,
ред.
(Brian, 1979а). Так же как и у медоносной
пчелы, образуется избыток замещающих
особей; они вступают в драки, а рабочие
приканчивают раненых, с тем чтобы
сохранилась одна пара. Действительно ли
при этом происходит борьба не на жизнь,
а на смерть, приводящая к отбору
наиболее приспособленных, проверить
трудно.
В регуляции замещения участвуют оба
пола, хотя их роли довольно различны.
Казалось бы, каждый пол должен
регулировать собственное замещение,
однако это не так. У Calotermes удаление
самца действительно ведет
к образованию новых самцов, но при
удалении самки образуются не только
новые самки, но и новые самцы.
Очевидно, самец не способен
самостоятельно подавлять свое
замещение; ему необходима помощь
самки или, как это ни странно, помощь
другого самца (Luscher, 1964). Наличие
компаньона даже того же пола явно
играет важную роль в функционировании
пары: деятельность репродуктивной пары
не сводится к созданию зигот. Вполне
возможно, что половые особи более
активно обмениваются информацией
друг с другом, чем с представителями
других каст, а это может означать более
тесную связь и вытекающую отсюда
более сильную стимуляцию метаболизма.
У Neotermes jouteli опять-таки
разнополые пары могут регулировать
замещение особей и того и другого пола,
однако однополые пары, состоящие как
из двух самок, так и из двух самцов,
могут подавлять всех самок, но не
полностью всех самцов. Этот процесс
явно связан с сотрудничеством между
взрослыми особями и зависит не от
одних только ингибиторов, специфичных
в отношении пола (Nagin, 1972). Конечно,
высказывались мнения об участии в этом
феромонов, распространяемых с пищей
(Luscher, 1974, 1976), и о важной роли
220 Глава 11
контакта (Springhetti, 1972). Если покрыть
всего термита, кроме ротовых частей,
лаком, то это не нарушает регуляторную
функцию; в настоящее время полагают,
что одна из желез головы вырабатывает
ингибирующие феромоны, передаваемые
через рот. Это, несомненно, слишком
упрощенное представление: в такой
регуляции участвует и какой-то
поведенческий сигнал (Brian, 1979а).
11.3. Самцы общественных
перепончатокрылых
У гсрмитов образование
самцов - проблема, не связанная
с поведением; подобно самкам, они
формируются из зигот, и пол у них
определяется хромосомами. Это не
означает, конечно, что отношение полов
должно быть равно единице, однако
вклад обоих полов на стадии имаго
неизбежно будет одинаковым. Проблемы
возникают лишь в том случае, когда этот
механизм не обеспечивает оптимального
численного отношения между
стерильными кастами (рабочие/солдаты),
как у Termitidae и в других семействах,
где пол влияет на вероятность
образования солдат вследствие
генетических различий между самцами и
самками.
Для перепончатокрылых характерен
гапло-диплоидный механизм определения
пола, и большинство диплоидов-самки,
при условии строгого аутбридинга.
Гаплоиды-всегда самцы и развиваются
из неоплодотворенных яиц; эти яйца
могут быть отложены либо самками,
либо рабочими особями. Поскольку у
общественных перепончатокрылых, за
исключением очень немногих видов
муравьев, самцы никогда не выполняют
никаких работ в гнезде и не защищают
его, их производство представляет собой
напрасное расходование энергии и других
ресурсов и его необходимо
контролировать, с тем чтобы самцы
достигали зрелости только в тех семьях,
которые могут выдержать такие затраты,
или в семьях, которым может оказаться
выгодным замедлить скорость своего
роста. Это означает, что при некоторых
обстоятельствах самцов можно
рассматривать как фактор, замедляющий
рост семьи на ранних этапах ее развития,
а реализуемую ими отрицательную
обратную связь - как стабилизирующее
воздействие. Конечно, они во всякое
время служат носителями генов,
потенциально способными
распространять гены самки или рабочей
особи.
Примитивные пчелы, сообщества
которых все еще представляют собой
всего лишь ассоциации осемененных
самок, часто производят смешанное в
отношении пола потомство. Матка у них
просто крупнее и старше других особей;
она вмешивается в их поведение
и стимулирует их активность по
выкармливанию расплода, например у
Lasioglossum zephyrus (Breed, Gamboa,
1977). Нередко другие самки,
образующие семью вместе с данной
маткой, остаются неосемененными
и могут откладывать только такие яйца,
из которых развиваются самцы; хотя они
не могут заменить матку, они могут
нанести ущерб ее шансам на успех,
откладывая яйца и производя самцов на
слишком раннем этапе жизни семьи. У
Evylaeus calceatus матка может
предотвращать копуляцию самцов
с другими самками; для этого
достаточно ее присутствия, в активном
вмешательстве с ее стороны нет
надобности. Если матке не удается
прекратить откладку яиц другими
самками или рабочими особями, она
разрушает и поедает их яйца (например,
у Bombus). Более изощренный способ
состоит в том, чтобы морить их
потомство голодом на личиночной
Созревание семьи 221
стадии, в результате чего из таких
личинок развиваются мелкие особи,
похожие на рабочих (например,
у Evylaeus malachurus).
Обитающие в умеренных областях осы
Polistes проявляют по всем этим чертам
конвергентное сходство с пчелами
(West-Eberhard, 1969, 1973). У P.fuscatus
образование самцов сопровождается
высокой скоростью откладки яиц, и хотя
это может означать, что свою долю здесь
вносят и рабочие особи, возможно и то,
что матки откладывают яйца слишком
быстро и поэтому некоторые из яиц
остаются неоплодотворенными: так
обстоит дело у паразитических
перепончатокрылых, а по мнению
Фландерса (Flanders, 1962, 1969),- и у
общественных Hymenoptera.
У Metapolybia-одной из Polybiinae,
образующей большие полигинные семьи,
размножающиеся роением, матки
настроены агрессивно по отношению к
только что появившимся
репродуктивным самкам, яичники
которых могут развиться до того, как
они примут участие в копуляции
(West-Eberhard, 1977). Докопуляционная
откладка яиц, дающих самцов,
встречается у паразитических
перепончатокрылых, и эксперимен-
тальное вмешательство на этой стадии
может привести к регрессии яичников
(Flanders, 1969). Однако у Protopolybia
pumila рабочие особи и откладывают
яйца, и сами же поедают как собственные
яйца, так и яйца, отложенные матками,
хотя последние охраняют свои яйца в
течение некоторого времени после их
откладки. Высокое отношение
рабочие/матки приводит к увеличению
доли потомков мужского пола, что
позволяет предполагать количественную
регуляцию откладки яиц рабочими
особями со стороны матки (Naumann,
1970; West-Eberhard, 1977). Эти роящиеся
Polybiini со многими репродуктивными
самками, рабочими и постоянно
присутствующими в семье самцами,
по-видимому, адаптировались к условиям
тропического леса, где они часто
подвергаются нападению птиц
и муравьев. Такая разнообразная
структура семьи дает им возможность
быстро переселяться и восстанавливать
семью где-нибудь в другом месте (Jeanne,
1979).
Ос । ас гея еще кое-что добавить
относительно таких видов Bombus, как
пчела-чесальщица и виды, строящие
восковые пакеты. У В. hypnorum матка в
начале сезона нападает на рабочих
особей, откладывающих яйца, очевидно
распознавая их по запаху или поведению;
позднее ситуация становится,
по-видимому, хаотичной, и она нападает
на всех без разбора (Roseler, Roseler,
1977). Эта общая агрессивность связана с
неспособностью оплодотворить свои
яйца. У высших Bombus доминирование
мало проявляется до конца сезона;
теперь достаточно хорошо установлено,
что мандибулярная железа вырабатывает
феромон, подавляющий откладку яиц
рабочими особями (Honk et al., 1980).
Этот феромон снижает активность их
corpora allata, причем действие его
распространяется по сенсорным
и центральным нервным путям (Roseler
et al., 1981). Это подтверждает данные о
том, что матка оказывает влияние на
corpora allata подчиненных ей рабочих
(Roseler, 1977). Honk et al. указывают,
что в этом, возможно, участвуют также
поведенческие эффекты, поскольку
рабочие особи толпятся около матки,
откладывают вместе с ней яйца
и поедают их друг у друга. Среди них
выделяются более активные особи, они
подчиняют себе других и в свою очередь
подавляют у них откладку яиц (хотя не
могут заставить их прекратить
выращивание новых самок). Это более
старые рабочие особи, и они могут
222 Глава 11
жалить матку до тех пор, пока она не
погибнет. Такая совместная откладка яиц
с их последующим поеданием наводит на
мысль, что яйцекладущая самка способна
привлекать к себе других особей со
сходными тенденциями, которые могут
затем поедать свежие яйца и в результате
откладывать больше собственных яиц;
это напоминает откладку кормовых яиц у
муравьев и у пчел Meliponinae.
У многих (но не у всех) видов безжалых
пчел рабочие особи в отсутствие самки
откладывают репродуктивные яйца;
сразу после откладки яиц рабочие особи
запечатывают ячейки (Beig, 1977), а позже
из них выходят самцы. У одного вида
Scaptotrigona postica рабочие особи
откладывают репродуктивные яйца даже
в нормальных семьях, управляемых
матками. Эти яйца крупнее тех, которые
откладывает матка; рабочая
пчела-узурпатор кладет свое яйцо поверх
корма, после того как матка отложила
свое, а затем запечатывает ячейку.
Самцы вылупляются спустя 65 ч, а не
67 ч, как самки; они крупнее и активнее и
очень скоро продырявливают женское
яйцо и поедают его и личинку. Самцы
всегда выходят из ячеек, содержащих два
яйца (Beig, 1972). Рабочие особи
откладывают эти яйца в обычные ячейки,
в которых количество корма меньше
среднего, хотя причины этого непонятны,
если только не окажется, что самцам для
удовлетворительного развития нужно
меньше пищи (Beig et al., 1982).
Цитируемые авторы полагают, что
рабочие особи, откладывающие яйца,
конкурируют за эти ячейки, после того
как матка удалилась, и что количество
корма не имеет значения - важно, чтобы
над кормом оставалось большее
пространство; но почему?
Успех личинок мужского пола
в конкуренции с личинками женского
пола был продемонстрирован в опытах
на Myrmica (Brian, 1969; Brian, Carr,
1960). Трудно представить себе, чтобы в
применявшихся искусственных гнездах
личинка мужского пола в буквальном
смысле поедала личинку женского пола;
по-видимому, рабочие особи как-то
распознают личинок. В тех случаях,
когда они откладывают мужские яйца,
вылупляющиеся личинки - их сыновья,
так что можно предполагать наличие у
них некоторого предпочтения, обуслов-
ленного генетическими факторами.
У Vespinae матка обладает неоспоримым
превосходством в молодых семьях; она
полностью подавляет откладку яиц
рабочими особями и стимулирует
социальное поведение. Было высказано
предположение, что, как и у Bombus
terrestris, она вырабатывает феромон,
регулирующий развитие яичников
у рабочих особей, но доказать это пока
не удалось (West-Eberhard, 1977). Если
удалить из семьи матку, воцаряется
анархия: рабочие особи дерутся между
собой и пренебрегают уходом за
личинками; затем они устанавливают
собственную иерархию, и тогда откладка
яиц становится прерогативой лишь
немногих особей высшего ранга, из яиц
которых развиваются самцы. Обычно
стареющая матка начинает откладывать
неоплодотворенные яйца, утрачивает свое
доминирующее положение
и подвергается атакам со стороны
бунтующих рабочих особей, которые
изгоняют ее и принимаются производить
самцов (Montagner, 1966). Несомненно,
рабочие особи могут отложить много
яиц, но какую долю яиц они производят,
не установлено (Kugler et al. 1976).
Специальных ячеек для самцов не
строится, и у некоторых видов, например
у Vespula vulgaris, самцы развиваются в
ячейках для рабочих особей, а у других,
например у Dolichovespula sylvestris,- в
больших ячейках. Быть может, рабочие
особи, откладывающие яйца, менее
разборчивы, чем матки?
Созревание семьи 223
У медоносной пчелы для выведения
самцов необходима предварительная
постройка специальных „трутневых"
ячеек, которые в семьях, растущих в
природных условиях, создаются на
периферических участках строящихся
сотов, непосредственно перед тем как
вдоль краев строятся маточники. Это
делается только в достаточно больших
сообществах, но как только эти ячейки
построены, матка методично
откладывает в них неоплодотворенные
яйца, по многу за раз, а не по одному.
Этот процесс регулируется маткой, так
как оплодотворение этих яиц происходит
крайне редко. Любые ошибки,
допущенные маткой, исправляют рабочие
пчелы: они очень тонко разбираются в
личинках, легко распознают личинок
диплоидных трутней или репродуктивных
самок, оказавшихся не в своих ячейках, и
уничтожают их. Нет сомнений, что у
медоносной пчелы яйца, дающие самцов,
обычно откладывает матка; однако в
отсутствие матки некоторые рабочие
особи откладывают яйца, хотя
и неупорядоченным образом-как
в маленькие, так и в большие ячейки. У
большинства рас яйца, отложенные
рабочими пчелами, дают самцов, однако
у одной южноафриканской расы, Apis
т. capensis, они способны производить
диплоидные яйца, из которых
развиваются рабочие особи, и фактически
половые особи имеются в избытке.
Матка полностью подавляет откладку
яиц рабочими особями. У этой пчелы не
бывает „полуразвитых" кормовых яиц.
Как полагают, 9-оксодекановая кислота,
выделяемая маткой, ингибирует функцию
corpora allata; однако для того, чтобы
рабочие особи прекратили откладку яиц,
необходимы очень большие дозы 9-ОДК,
и местное применение ювенильного
гормона не стимулирует функцию их
яичников, а превращает их из кормилиц в
сборщиц, у которых яичники не
функционируют. Эта необычная реакция,
возможно, зависит от дозы гормона.
Создается впечатление, что у Apis corpora
allata или не вырабатывают
гонадотропного гормона, как
у большинства насекомых, или же
необычайно чувствительны
к концентрации ювенильного гормона в
крови. Удаление corpora allata у матки не
препятствует нормальному образованию
яиц (Rutz et al., 1976, цит. по Brian, 1980).
Чем же тогда регулируется оогенез?
Строительству трутневых ячеек
благоприятствуют большие размеры
семьи, а присутствие матки тормозит его.
Судя по имеющимся данным (Free,
Williams, 1975; Free, 1977), рабочие особи
в состоянии определять соотношение
трутневых и рабочих ячеек; возможно,
что эта их способность имеет
хеморецепторную природу, однако
никаких химических различий между
разными ячейками пока не обнаружено.
Обычно трутневые ячейки строятся
раньше, чем маточники, но
в экспериментальных условиях
маточники, содержащие личинок,
индуцируют постройку трутневых ячеек,
и между устройством ячеек этих двух
типов, видимо, существует какая-то
связь. После того как трутневые ячейки
готовы, самка, очевидно, не может
удержаться от того, чтобы не отложить в
них весной неоплодотворенные яйца,
однако рабочие особи уничтожают эти
яйца как несвоевременные. В конце лета
матка не станет откладывать яйца в
трутневые ячейки, хотя рабочие пчелы
строят их. Таким образом, самцы
появляются между этими двумя
периодами, т. е. в нужное время!
В августе, при подготовке к зиме, самцов
обрекают на голод и изгоняют; рабочие
особи жалят их, если в улье имеется
матка, но не в ее отсутствие. Итак, вся
система регуляции зависит от величины
семьи, времени года и существования
224 Глава 11
функционирующей матки, которая
препятствует не только образованию яиц
у рабочих особей, но и постройке ячеек
для самцов. Только в больших семьях с
достаточным количеством корма рабочие
пчелы могут преодолеть такую
оппозицию со стороны матки.
Во всех подсемействах муравьев известны
примеры откладки рабочими особями
яиц, из которых развиваются самцы;
однако во многих случаях остается
неясным, происходит ли это регулярно и
повсеместно или только в случае
необходимости и при участии лишь
нескольких особей. У тех видов,
у которых факт откладки яиц молодыми
рабочими особями хорошо установлен,
рабочие, вероятно, производят многих,
если не всех, самцов, однако это
нуждается в проверке. Теоретически
такое предположение кажется
правдоподобным (Oster, Wilson, 1978). В
частности, соответствующие данные
о Myrmica rubra весьма убедительны
(Brian, 1969; Pearson, 1928b; Smeeton,
1981).
Plateaux (1981) использовал рецессивный
ген pallens, обусловливающий
у Leptothorax hylanderi бледную окраску и
хорошо проявляющийся у самцов, чтобы
показать, что самцов производят рабочие
особи. Очевидно, что у тех видов, у
которых рабочие обладают лишь
рудиментарными яичниками, все
неоплодотворенные яйца, так же как и
оплодотворенные, должна откладывать
самка. У таких видов, вероятно,
существует период, когда сперматека
закрыта; у Dorylinae этот период падает
на сухой сезон, а у Tetramorium
caespitum-на. конец лета. У последнего
вида в каждой семье существует
определенное численное соотношение
между самцами и самками; поэтому
возможно, что самка откладывает
отдельными партиями смесь
оплодотворенных и неоплодотворенных
яиц. Formica polyctena весной производит
яйца, из которых развиваются самцы, но
опять-таки неясно, откладывают ли их
рабочие или бескрылые репродуктивные
самки; уже давно известно, что рабочие
особи могут откладывать такие яйца, но
это, конечно, не означает, что так оно
обычно и происходит (Schmidt, 1974,
1982). Такие яйца дают самцов только
весной, когда молодые отдохнувшие
рабочие особи несут функции кормилиц.
Способы, которыми самки муравьев
заставляют рабочих особей прекращать
откладку репродуктивных яиц
в неподходящее время года, варьируют.
У Odontomachus haematodes рабочие
могут оказывать сопротивление
вмешательству самки; если их число
достигает примерно 50, они образуют
группу, которая не признает самку и
изгоняет ее (Colombel, 1974). У других
муравьев, например у Myrmica, самки
сами откладывают много яиц. Это ведет
к двум следствиям: во-первых, производя
больше потомков женского пола, матки
поддерживают „занятость'1 рабочих
особей, и, во-вторых, они индуцируют
откладку самими рабочими кормовых
яиц. У Myrmica rubra откладка яиц
маткой достигает пика ранней весной,
еще до того как яичники перезимовавших
рабочих особей будут способны
вырабатывать желток; когда они
начинают его вырабатывать, начинается
вылупление личинок женского пола.
Молодые рабочие, появившиеся в конце
предыдущего лета, могут откладывать
репродуктивные яйца даже в присутствии
самок, которые вначале не влияют на
них. Только достигнув 5-недельного
возраста, если позволяет температура,
они начинают откладывать кормовые
яйца. Эти новые рабочие особи при 20' С
могут начать откладку яиц в возрасте
всего лишь трех недель; возможно, что
эти яйца претерпевают некоторое
развитие, когда рабочие особи еще
('о гревание семьи 225
Рис. 11.4. Зависимость
числа репродуктивных
яиц, откладываемых
рабочими особями
Myrmica rubra, от числа
дней в неделю, которые
их самки проводят
в гнезде. (Brian et al.,
1981.)
находятся на стадии куколок (Smeeton,
1980, 1981). При полном отсутствии
самок рабочие откладывают больше
репродуктивных яиц при большей длине
дня. При подходящей длине дня
и температуре молодая самка может не
только остановить производство
рабочими репродуктивных яиц, но также
использовать откладываемые вместо них
кормовые яйца и продлить собственную
откладку яиц. Для того чтобы
осуществлять таким образом полный
контроль, самка должна все время
находиться в гнезде; даже в небольших
гнездах каждый лишний день пребывания
самки снижает наполовину число
репродуктивных яиц, откладываемых
рабочими особями (рис. 11.4) (Brian et
al., 1981b). Иными словами, если самка
проводит половину времени в одной
небольшой камере гнезда, а половину-в
другой, то только 10% яиц, отложенных
рабочими особями, оказываются
репродуктивными. Интересно отметить,
что самка должна активно откладывать
яйца и создать целый пакет яиц, чтобы
226 Г.шва 11
остановить производство самцов (Brian,
Rigby, 1978), но производство половых
самок может прекратиться при наличии
даже мертвой самки! Подобным же
образом недавно принятые самки могут
оказаться неспособными остановить
откладку рабочими особями некоторого
количества репродуктивных яиц, однако
они легко предотвращают образование
новых самок (Winterbottom, 1981).
Регуляция выведения самцов связана с
каким-то более специфическим аспектом
активности самки и, возможно, зависит
от узнавания рабочими особями
конкретных самок.
)iy концепцию подтверждает анализ
модели Myrmica-, как показала эта
модель, в бедных ресурсами
местообитаниях, способных обеспечить
пищей только небольшие семьи,
например у М. ruginodis на узких лесных
полянах, производство самцов (в отличие
от самок) не может быть подавлено. В
таком состоянии может находиться
любая семья, которая еще недостаточно
хорошо обосновалась, например
молодая; в первую очередь при этом
будут выводиться самцы и лишь во
вторую-самки, что слегка затормозит
рост семьи. Кроме того, виды, у которых
семьи делятся, будут производить
потомство, состоящее из одних самцов,
чтобы сбалансировать вклад обоих полов
в следующее поколение (см. гл. 12).
Было высказано мнение, что это
позволяет объяснить, каким образом у
муравьев М. sabuleti, живущих в весьма
однородном местообитании при сильной
конкуренции со стороны других видов
(Brian, 1972), могут быть семьи,
производящие только самцов и имеющие
в среднем примерно такие же размеры,
как семьи, производящие и самцов, и
самок. Plateax (1981) указывает, что
семьи Leptothorax nylanderi, в которых не
меньше 100 рабочих, производят только
самцов.
До сих пор мы исходили из
предположения, что рабочие особи
регулируют производство самцов перед
откладкой яиц, т. е. во время оогенеза.
Это справедливо лишь отчасти, так как у
Myrmica rubra личинки, развивающиеся в
самцов, получают недостаточно корма,
так же как и личинки, развивающиеся в
самок, если плодущая самка находится
где-то поблизости. Конечно,
недостаточное кормление не может
заставить их свернуть на путь развития в
„рабочих“-самцов или привести к гибели;
они просто развиваются в мелких
половозрелых особей. Кроме того,
личинки мужского пола не подвергаются
таким нападениям, как личинки, из
которых развиваются репродуктивные
самки,-их не кусают, и они,
по-видимому, не подают сигнала своим
брюшком. Они преуспевают
в конкуренции с личинками женского
пола, как только что говорилось,
и рабочие особи почти наверное
отличают их и в отсутствие маток
оказывают им предпочтение при
кормлении (Brian, 1981).
У других видов самцов, несомненно,
убивают на стадии личинок или даже
яиц, если самка обладает сильным
влиянием. Например, у Monomorium
pharaonis личинок самцов можно
обнаружить среди массы яиц на всех
стадиях развития семьи, но ни одна из
них не достигает зрелости (Peacock et al.,
1954, цит. по Brian 1980). у Oecophylla
рабочие особи откладывают очень
крупные репродуктивные яйца, из
которых развиваются самцы, и гораздо
более мелкие яйца, которые тоже не
оплодотворены и, развиваясь
партеногенетически, дают самок; и те и
другие откладываются в укромных
уголках сложного гнезда, куда,
по-видимому, не распространяется
влияние самки (Ledoux, 1950). От чего
зависит, будет ли партеногенез
Созревание семьи 227
гаплоидным или диплоидным, не
известно. У Cataglyphis cursor под
влиянием самок яйца у рабочих особей
рассасываются, но в отсутствие самок
опять-таки имеет место партеногенез, как
гаплоидный, так и диплоидный. Весной
рабочие могут выращивать особей того и
другого пола даже в присутствии самок
из неоплодотворенных яиц; плодущие
самки нужны только для того, чтобы
активизировать рабочих особей
и воздействовать на их поведение.
Периоды партеногенетического
размножения позволяют уменьшить
расход ресурсов на самцов
и распространить линию, которая на
данный период оказалась хорошей
в генетическом отношении; при этом
периодически может происходить
и половое размножение, приводящее к
созданию новых признаков (Maynard
Smith, 1978а).
11.4. Общие представления
о созревании семьи
Регуляция пола у перепончатокрылых,
которая возможна благодаря
гапло-диплоидному механизму,
позволила исключить из структуры
сообщества самцов; они служат всего
лишь носителями генов. В самом деле,
если не считать тех случаев, когда самцы
появляются в мощных семьях
в подходящее время года, они наносят
серьезный ущерб ресурсам и могут
мешать выполнению социальных
функций самками. В отличие от
перепончатокрылых термиты не
обладают способностью регулировать
пол, и в их сообщества входят самцы; в
конечном итоге термиты используют
генетические половые различия, чтобы
сделать более разнообразной кастовую
структуру сообщества. По-видимому,
вначале неосемененные самки
перепончатокрылых (т. е. рабочие особи)
откладывают яйца, из которых
развиваются самцы; это порождает в них
склонность производить гаплоидные яйца
и отдавать предпочтение личинкам
мужского пола. Вся эта система
действует до тех пор, пока осемененные
самки имеют возможность откладывать
много диплоидных яиц, из которых при
недостаточном кормлении личинок или
плохом уходе за ними развиваются
дополнительные рабочие особи.
Когда механизм размножения
функционирует в полную силу,
в сообществе происходит переключение с
доминирования самки на ее подчиненное
положение и созревают самцы, так как,
по-видимому, сложнее прекратить
образование самцов, чем репродуктивных
самок. Численность рабочих особей
продолжает некоторое время возрастать.
Яйцо, дающее самца, если его удалось
отложить, может остаться незамеченным,
и вылупившаяся из него личинка либо
убивает личинок женского пола, либо
каким-то образом пересиливает их. Для
того чтобы полностью подавить развитие
репродуктивных яиц, отложенных
рабочими особями, самка должна
откладывать свои яйца очень быстро, и
когда из яиц, отложенных рабочими,
вылупляются личинки, им приходится
конкурировать с самками; у самцов нет
бесполой касты. Этот компромисс между
рабочими особями, производящими
самцов, и самками, производящими
самок, приводит в процессе эволюции к
тому, что самка откладывает яйца того и
другого пола. При этом у муравьев
рабочие особи полностью утрачивают
яичники и развиваются из соответственно
детерминированных яиц, а у пчел и ос
рабочие особи кастрируются с помощью
химических веществ и утрачивают
способность к поведению, необходимому
для откладки яиц. Затем самка
откладывает партию яиц, дающих
самцов (сперматека закрыта), и партию
228 Г.шва 11
яиц, дающих самок (сперматека
открыта), регулируя таким образом
соотношение полов. Однако рабочие,
занимаясь выращиванием расплода, все
еще могут существенно влиять на его
рост и выживание, и они это делают,
выкармливая самцов только
в подходящее время года и на
подходящей стадии цикла развития
семьи; таким образом, надлежащее
соотношение откладываемых яиц
заменяется избирательным выживанием.
В семьях общественных насекомых
происходят циклические изменения,
связанные с возрастными изменениями
единственной осемененной самки или
нескольких таких самок. Этот цикл
влияет на соотношение взрослых особей
и расплода, на соотношение рабочих и
половых особей и на состав и поведение
рабочих особей. Таким образом, между
половыми и рабочими особями
существует некое взаимодействие,
ведущее к инверсии доминирования (оно
может быть либо явным и физическим,
либо более тонким и химическим). Пока
семья молода и численность ее невелика
(опять-таки будь она моногинной или
полигинной), самки в состоянии
подавлять откладку рабочими особями
яиц, дающих самцов, а рабочие особи не
выращивают самцов, с которыми самки
могли бы копулировать. Самки способны
также воспрепятствовать тому, чтобы
рабочие давали чрезмерное количество
корма каким-либо личинкам женского
пола, лабильным в отношении касты, и
поощряют активную агрессию против
них; однако у муравьев (но не у пчел и
ос) главный способ подавления касты
репродуктивных самок заключается
в откладке яиц с тенденцией к развитию
в рабочих особей, что в конечном итоге
почти наверное ведет к откладке яиц двух
типов-дающих рабочих особей
и лабильных в отношении касты. Таким
образом, самки благоприятствуют
образованию рабочих особей,
а рабочие-образованию половых особей,
и в результате этого конфликта
власть переходит от самки к рабочим.
У I ерми гов в той же роли, что
и плодущая самка (матка)
у общественных перепончатокрылых,
выступает пара половых особей, хотя в
этом отношении самка сильнее самца, а
две особи, принадлежащие к какому-то
одному полу, более эффективны, чем
одна особь. Это показывает, что
регуляторная роль не связана целиком с
одной лишь способностью производить
зиготы; способность обмениваться
информацией с другой половой особью,
возможно, каким-то образом усиливает
ее физиологические потенции. По тем же
причинам у муравьев группа самок
может осуществлять более эффективный
контроль, чем одна самка.
Изменения характеристик рабочих особей
менее очевидны. Рабочие особи
становятся в среднем крупнее, возможно
в результате улучшенного снабжения
кормом, за которым не может поспевать
откладка яиц. Далее, по мере того как
после периода экспоненциального роста
возрастная структура семьи
приближается к стабильности, в ней
становится больше молодых рабочих
особей. Имеются данные о том, что
молодые рабочие реагируют на самку
слабее, чем более старые. Возможно, что
это просто возрастная особенность,
однако в конечном итоге может
оказаться, что если они появляются на
свет в большой семье (т. е. в семье с
высоким отношением рабочие/самки), то
им не удается встретиться с самкой во
время критического периода-в первые
несколько недель после выхода из
куколки; это приводит к более слабой
реакции на самку в дальнейшем. Таким
образом, сочетание стареющей
популяции самок с растущей и более
молодой популяцией рабочих особей
переключает силы семьи на производство
молодых половых особей.
Глава 12
Воспроизводство
После того как сообщество достигло
зрелости, перед ним встает проблема
расселения, и в этой главе она будет
рассмотрена в логической
последовательности: сначала мы
опишем, как половые особи
дифференцируются от рабочих,
затем-как они расселяются
и копулируют, а в некоторых случаях
расселяются вновь. Будут приведены
также некоторые данные о количестве
производимых половых особей.
12.1. Морфогенез каст
12.1.1. Термиты и муравьи
У 1срми1ов (за исключением сем.
Termitidae) рабочие особи мало чем
отличаются от личинок, если не считать
того, что их покровы несколько жестче и
слегка пигментированы, а сами они более
активны и более общительны. Развитие
их протекает постепенно и не
сопровождается какими-либо
изменениями в строении зачатков
крыльев или гонад. Линька создает
возможность для роста и развития, хотя
эти процессы имеют место не всегда, а
„стационарная" линька означает, что
число стадий развития может
варьировать. Тем не менее существует
ряд определенных типов развития.
Например, у Mastotermes darwiniensis,
самого примитивного из ныне
существующих термитов, имеются пять
личиночных стадий и одна стадия
рабочего; на этой последней стадии
особи окрашены темнее и занимаются
фуражировкой. Но это не завершающая
стадия, так как рабочая особь может
перелинять и превратиться в нимфу с
явно выраженными зачатками крыльев, а
затем, после трех нимфальных стадий,
стать крылатой половозрелой формой с
функционирующей половой системой
(мужской или женской). Таким образом,
всего здесь 10 стадий. Даже нимфа не
детерминирована к тому, чтобы
непременно превратиться в имаго, так
как она может встать на путь развития,
приводящий к солдату. Для этого она
должна сначала перелинять
в промежуточную форму, называемую
просолдатом; на стадии просолдата
происходит перестройка, а затем, после
новой линьки, получается взрослый
солдат; у Mastotermes это просто более
крупная бескрылая особь с массивными
челюстями и недоразвитыми гонадами.
Это превращение, подобно превращению
в имаго, сопровождается утратой
морфогенетических потенций: состояние
солдата резко отличается от
метастабильной стадии рабочего,
который может оставаться рабочим,
проходя „стационарные" линьки, или же,
пройдя через нимфальные стадии,
превратиться в половую особь или в
солдата и закончить на этом свой
жизненный цикл. В небольших семьях
могут формироваться узкоголовые
солдаты, возможно в результате
преждевременного метаморфоза,
стимулируемого царской парой (Watson,
1974). Для представителей семейства
Calotermitidae (например, Calotermes,
Zootermopsis) характерен такой же
однонаправленный морфогенез; личинки
старших возрастов выполняют различные
работы, ожидая, когда настанет их
очередь превратиться в имаго или
230 Г. шва 12
Имаго
Нимфа 2-го возраста
Нимфа 1-го возраста
Псевдоэргат
।
Личинка 5-го возраста
Личинка 4-го возраста
Личинка 3-го возраста
!
Личинка 2-го возраста
Личинка 1-го возраста
f
Яйцо
Просолдат -------Солдат
Просолдат -------*- Солдат
Просолдат * Солдат
Просолдат ---------> Солдат
----Просолдат
Солдат
Просолдат ---------> Солдат
Рис. 12.1. Возможные пути онтогенетического
развития у Calotermes flavicollis. Каждая
стрелка соответствует одной линьке;
пунктирная стрелка означает варьирующее
число линек. (Liischer, 1976.)
солдат; при этом они проходят через
несколько нимфальных стадий или через
одну стадию просолдата (рис. 12.1). В
этом семействе нимфы могут в случае
необходимости превращаться в половых
особей, бескрылых или с недоразвитыми
крыльями, но вполне эффективных
в смысле размножения. Нимфы могут
также превращаться в солдат.
У Rhinotermitidae (например,
у Reticulitermes) еще сохраняются две
общие для всех особей личиночные
стадии. В дальнейшем единый ствол
лабильных в отношении касты особей
расщепляется на два. Новой
особенностью является ветвь, ведущая к
развитию почти исключительно
стерильных каст, т. е. рабочих и солдат.
Этот путь развития состоит из пяти
личиночных стадий; личинки выполняют
различные работы, однако они могут
превращаться в просолдат или
бескрылых замещающих половых особей,
но никогда не превращаются в нимф или
имаго. Они явно утратили способность к
развитию крыльев, но развитие гонад у
них еще возможно. Другая, лабильная,
ветвь состоит из шести нимфальных
стадий, которые могут превращаться в
замещающих половых особей или же
полностью завершать цикл-до крылатых
имаго; это не рабочие особи, и они не
могут развиться в солдат. Однако эта
ветвь лабильна в том смысле, что нимфы
способны регрессировать в личинок, т. е.
утрачивать свои зачаточные крылья;
после этого они могут участвовать в
работах, а в дальнейшем превращаться в
солдат, пройдя переходную стадию
просолдата. У большинства
Rhinotermitidae переход к развитию по
Воспроизводство 231
стерильной ветви зависит от времени
года и от питания, а также от размеров
семьи, но у представителей рода
Schedorhinotermes эта ветвь для самцов
закрыта, так что все работы в семье и ее
защита лежат на самках.
У Termitidae бескрылых или почти
бескрылых замещающих половых особей
нет-они, видимо, исчезли в процессе
эволюции. Очевидно, крылатые имаго
могут обеспечить достаточное
замещение, несмотря на то, что они
появляются только в определенное время
года, как у муравьев. Рабочими особями
здесь также служат не личинки
с затвердевшими покровами, а особи,
развивающиеся из личиночных стадий в
результате одной-единственной
линьки-обычно окончательной, хотя в
отличие от имагинальных стадий у этих
рабочих сохраняются проторакальные
железы. Несмотря на то что гонады у
них недоразвиты, особей разного пола
можно различить на личиночной стадии,
и теперь можно считать установленным,
что вероятность развития по
стерильному пути каким-то образом
связана с полом. После того как этот
путь выбран, вероятность превращения в
солдат тоже зависит от пола; например,
у Nasutitermitinae солдатами обычно
становятся самцы, а у Macrotermitinae и
Termitinae-самки. У тех видов,
у которых представители данной касты
бывают двух разных размеров, это чаще
обусловлено различием в стадии
созревания, чем половыми различиями
(Brian, 1979а; Noirot, 1969, 1974).
У Termitidae репродуктивная
и стерильная ветви расходятся после
всего лишь одной стадии, возможно даже
на стадии яйца (Noirot, 1969). На пути
развития половых особей имагинальной
стадии предшествуют семь стадий
(рис. 12.2). У такого примитивного вида,
как Amitermes evuncifer, между яйцом и
первой личинкой, выполняющей функции
рабочего, имеются две личиночные
стадии, а затем три или четыре возраста
рабочих. Солдаты, развивающиеся из
личинок того и другого пола, образуются
большей частью из рабочих первого
возраста. У Microtermes (Amitermitinae)
рабочие мужского пола после двух
личиночных стадий проходят еще три
стадии, а рабочие женского пола-четыре
стадии и в результате бывают крупнее
рабочих-самцов; просолдаты тоже
дивергируют рано, от рабочих первого
возраста. Другие примеры можно найти
у Noirot (1974) и Brian (1979а). В общем
можно сказать, что у Termitidae
дивергенция репродуктивной
и стерильной линий происходит рано,
возможно на стадии яйца; что
личиночных стадий у них меньше,
а нимфальных больше; что солдаты
развиваются обычно из личинок
определенного пола, а рабочие-
одинаково из мужских и женских
личинок; что особи разного пола
и находящиеся на разных стадиях
созревания различаются по размерам.
Люшер (Luscher, 1976) обнаружил
у Termitidae (Macrotermes subhyalinus)
материнский эффект, обусловленный
различным содержанием ювенильного
гормона (ЮГ) в яйце. В тот период,
когда плодущая царица откладывает
яйца, дающие нимф, уровень ЮГ в ее
крови низок. В отличие от этого
у молодых цариц уровень ЮГ в крови
высокий, и все отложенные ими яйца
развиваются по стерильной линии.
Люшер разработал на основе этих
данных общую теорию о роли ЮГ в
регуляции каст у термитов; согласно
этой теории, ЮГ-подобное вещество,
выделяемое в пищевой поток парой
половых особей, может приостановить
образование замещающих особей во
время чувствительной стадии цикла
линек. Их способность синтезировать
ЮГ, несомненно, очень велика; им нужно
Самцы
Самки
Имаго
I
Нимфа 5-го возраста
Крупный солдат
Крупный рабочий
Большая личинка
3-го возраста
1
Большая личинка
2-го возраста
Нимфа 4-го возраста
I
I
Нимфа 3-го возраста
!
Нимфа 2-го возраста
Нимфа 1-го возраста
Личинка 1-го возраста
Большой просолдат
Пигментированный
мелкий рабочий
4 Мелкий солдат
Мелкий рабочий
4 Маленький просолдат
Маленькая личинка 1-го возраста
Маленькая личинка 2-го возраста
Яйцо
Рис. 12.2. Возможные пути онтогенетического
развития у Macrotermes bellicosus. Каждая
стрелка соответствует одной линьке, за
исключением пунктирной, которая означает
пигментацию без линьки. (Liischer, 1976.)
большое количество этого гормона,
чтобы производить яйца, но остается ли
его достаточно для циркуляции в семье
(рис. 12.3)? Солдаты, по мнению
Люшера, выделяют какое-то
анти-ЮГ-вещество, прекращающее
дальнейшее образование солдат;
убедительно показано, что добавление
аналогов ЮГ к культурам термитов,
содержащим личинок в чувствительной
стадии (первые 6 дней третьей
личиночной стадии у М. michaelseni,
согласно Okot-Kotber, 1980), повышает
формирование просолдат (Brian, 1979а;
Nijhout, Wheeler, 1982). Можно думать,
что ЮГ делает возможным дальнейший
аллометрический рост, ведущий
к характерной гипертрофии головы.
Высказано предположение (Nijhout,
Wheeler, 1982), что сроки выбросов ЮГ в
кровоток важнее, чем общее его
содержание в крови.
Данных о морфогенезе каст
у примитивных муравьев пока еще мало.
У Odontomachus (Ponerinae) количество
пищи может до очень поздних стадий
влиять на кастовую дифференциацию;
здесь существует один главный
лабильный путь развития, но мы не
знаем, не отходит ли от него ветвь на
более ранней стадии или даже не бывает
ли определенного кастового „уклона",
заложенного матерью в яйцо. У Myrmica
действуют те же регулирующие факторы,
что и у Ponerinae, и, кроме того,
существует несколько способов, при
помощи которых самки могут управлять
этим процессом. Одна, а может быть, и
две линьки заменены пластификацией
кутикулы, и в регулировании
морфогенеза каст участвуют железы.
Можно выделить два дискретных
и взаимоисключающих физиологических
состояния, различающихся по
соотношению скоростей роста
Воспроизводство 233
Фото 30. Касты Neotermes jouteli. развитыми челюстями и челюстными
А. Крылатые репродуктивные формы, рабочие мышцами. [J. В. Free.]
особи и яйца. Б. Крупный солдат с сильно
234 Г.шва 12
Крылатая самка
Рис. 12.3. Эндокринные системы взрослых
особей Macrotermes subhyalinus. (Liischer, 1976.)
„зародыша** имаго и роста личинки в
целом (под „зародышем** здесь имеется в
виду совокупность имагинальных дисков,
имеющихся в личинке). При формиро-
вании репродуктивной самки,
соответствующем обычному процессу
развития насекомого, „зародыш** растет
медленно и большая часть пищи,
поглощаемой личинкой, откладывается в
жировом теле. Это продолжается до тех
пор, пока головной мозг личинки не
переместится в грудной отдел, где вокруг
него формируется голова взрослой особи.
После этого „зародыш** растет
изометрически, у него развиваются
крылья, разделенные яичники,
сегментированные усики и ноги;
начинается видимая дифференцировка
всех частей организма, необходимых
взрослой репродуктивной самке. Эти
процессы становятся возможными
в период прохладной погоды (обычно
зимой), когда возобновляется активность
corpora allata. Развитие „зародыша**
метастабильно и может быть нарушено
Воспроизводство 235
Рис. 12.4. Яичники
личинок Myrmica
последнего возраста,
развивающихся
в репродуктивных самок
(А) и в рабочих особей
(Б).
голоданием при температуре выше 23°С.
„Зародыш41 увеличивается в размерах и
изменяет форму: увеличиваются почки
ног, но не почки крыльев и не зачатки
яичников, что нетрудно увидеть сквозь
кутикулу личинки. В целом это приводит
к увеличению относительной массы
тканей „зародыша11 в личинке.
Происходящие изменения необратимы и
сопровождаются утратой
морфогенетических потенций:
детерминируется развитие рабочей особи.
Быстрый переход „зародыша11 из одной
формы в другую-это переход между
двумя стабильными состояниями,
и промежуточных форм в естественных
условиях не образуется, если не считать
тех случаев, когда под влиянием
паразитов нарушается питание.
В процессе роста „зародыша11 рабочей
особи крылья остаются небольшими, а
во время метаморфоза вообще исчезают,
включаясь в наружный скелет; маленький
гермарий не распадается на трубочки, как
у репродуктивной самки, а соединяется с
яйцеводом, образуя яичник с одной
яйцевой трубочкой (рис. 12.4).
А чем объясняется меньшая величина
рабочих особей? Освободившись от
крыльев и яичников и увеличившись в
размерах, „зародыш11 продолжает свое
развитие, и питание личинки
прекращается на 2-3 дня раньше, чем это
бывает при развитии репродуктивной
самки; в результате рабочие особи
оказываются мельче. Детерминация
развития в направлении рабочей особи
может быть сравнительно поздним
236 Глава 12
Рис. 12.5. Рост
крыловых имагинальных
дисков у личинок
Myrmica.
I-репродуктивные
самки; //-крупные
рабочие особи;
///-средние рабочие
особи; /И-мелкие
рабочие особи. Стадии
дифференцировки
взрослых особей
обозначены цифрами 0,6;
0,8; 1; 2; 3. (Brian, 1974а.)
отклонением от лабильной линии,
ведущей к развитию репродуктивной
самки (рис. 12.5); оно может произойти
уже после того, как личинка накопила
питательные вещества, диапаузировала,
перезимовала и вновь обрела
способность к росту; таким образом,
здесь проявляется известное сходство с
нимфой Schedorhinotermes, которая
регрессирует в рабочую особь, хотя,
конечно, при этом не бывает линьки и все
описанные изменения происходят внутри
личиночной кутикулы. Между тем многие
рабочие особи (возможно, большинство
их) образуются из „зародышей44,
дивергировавших от лабильного ствола
задолго до фазы накопления запасов
перед диапаузой; в их число входят все
рабочие особи, происходящие из яиц,
детерминированных к развитию рабочих.
После такой детерминации
дифференцировка обычно замедляется,
личинки перестают кормиться и внезапно
метаморфизируют; дифференцировка
„зародыша44 и его превращение в куколку
внутри личиночных покровов после
BocnpOU XKItlcnW: 23
прекращения питания-вполне
определенный процесс, и он может
занимать при развитии рабочей особи
столько же времени, что и при развитии
репродуктивной самки. Тем не менее
детерминацию к развитию рабочей особи
можно рассматривать как шаг
к метаморфозу, поскольку она вызывает
относительный рост „зародыша" внутри
личинки, сокращает время роста и тем
самым уменьшает окончательные
размеры рабочей особи. Это безусловно
преждевременный, но незавершенный
метаморфоз, необратимо искажающий
развитие „зародыша" (Brian, 1974а); его
формирование, по-видимому, запускается
каким-то сигналом, исходящим от
головного мозга, который подавляет
активность corpora allata, не включая
функцию проторакальных желез.
У Myrmica, как и у всех муравьев, только
самки делятся на два типа,
различающиеся по размерам,
морфологии, поведению и долговечности.
У самцов такого деления нет, и мужские
„зародыши" не подвержены такому
нарушению развития, как женские;
зачатки всех частей имаго
морфогенетически связаны между собой,
и рост „зародыша" протекает
изометрически. Роль ювенильного
гормона у обоих полов состоит в том,
чтобы ограничивать рост „зародыша" и
способствовать запасанию питательных
веществ в жировом теле личинки.
Перевязка corpora allata у женской
личинки, лабильной в отношении касты,
ведет к детерминации развития рабочей
особи, и ее можно приостановить только
с помощью аналогов ювенильного
гормона (Brian, 1974b). У Plagiolepis
pygmaea активность corpora allata зависит
не от числа, а от величины их клеток
(Suzzoni, Grimal, 1980). Итак, у муравьев
рабочие особи образуются из
„зародыша", который заключен
в червеобразной личинке, но созревает и
отделяется от нее, еще не достигнув
полного развития. Этот процесс
обособления от личинки прекращает ее
дальнейшее развитие, точно так же как
личинки высших термитов навсегда
становятся рабочими. В этом смысле
рабочие особи муравьев и термитов
гомологичны. Различия между ними
обусловлены лишь тем, что у термитов
ювенильные особи соприкасаются
с окружающей средой с самого начала,
тогда как у муравьев они вначале
заключены во временный „футляр",
совершенно отличный от них,
освобождение из которого кладет конец
пластичности их формы.
11 роцесс формирования солдат
у муравьев все еще остается неясным. У
Pheidole линия репродуктивных самок
отделена от бесполой линии уже на
стадии яйца, на развитие которого влияет
(см. выше) концентрация ювенильного
гормона в гемолимфе матери (Passera,
Suzzoni, 1979; Wheeler, Nijhout, 1981).
Личинки, дающие самок, толстые
и лишены волосков, а личинки бесполых
особей вытянутые и покрыты волосками.
Отклонение развития в сторону солдат
происходит на последней (третьей)
личиночной стадии, на которой кишечник
имеет золотистую окраску; личинок
солдат можно отличить по их более
крупным размерам, а также по тому, что
у них имеются почки передней пары
крыльев, но нет видимых почек задней
пары; у личинок рабочих особей совсем
нет крыловых почек (или, в редких
случаях, они очень малы). У всех этих
каст крыловые почки невелики по
сравнению с почками ног, но у куколок,
дающих солдат, на месте переднего
крыла можно видеть палочковидный
выступ (как у „крупных рабочих"
и интеркастов Myrmica, рис. 12.6).
Размеры солдат и рабочих не
перекрываются. Путем местного
введения ювенильного гормона во время
238 Глава 12
Рис. 12.6. A-В. Интеркасты Myrmica
с палочковидными крыловыми выступами;
эти особи развиваются из лабильных личинок,
которые не смогли дорасти до настоящих
репродуктивных самок и близки к касте,
известной как солдаты (например, у Pheidole).
Г. Солдат Zacryptoceros со сходными
палочковидными крыльями. (Wheeler, 1910.)
чувствительной фазы на последней
личиночной стадии можно получить
гигантского солдата; такое воздействие
приостанавливает начало метаморфоза и
создает возможности для
дополнительного роста, который носит
аллометрический характер и приводит к
характерной морфологии солдат. Оно
приводит также к увеличению размеров
рабочих особей, но лишь
незначительному, и создает ситуацию,
подобную естественному различию
между двумя видами Solenopsis-S. invicta
(эквивалент необработанных Pheidole) и
5. geminata (эквивалент Pheidole после
обработки ювенильным гормоном).
В естественных условиях солдаты
формируются только в присутствии
самки, при обилии пищи, высокой
температуре (26°С и выше) и большом
числе рабочих особей. Наличие взрослых
солдат подавляет дальнейшее их
Время, дни
Рис. 12.7. Зависимость
веса растущих личинок
Myrmica от времени
после начала сегментации
ног. Q-самки;
W (а)-нормальные
рабочие особи средних
размеров; W (О) и
W (В) - лабильные
личинки, которых
выращивали в культуре
перед началом зимы,
когда ростовой
потенциал низок;
W (S) - лабильные
личинки, которых
выращивали в культуре
после зимнего
восстановления
ростового потенциала, но
при этом сразу после
периода голодания при
высокой температуре
(25°С). W (О, В и S)-
прототипы
„солдат" (т. е. крупные
рабочие особи). (Brian,
1974а.)
Воспроизводство 239
образование, хотя этот эффект к концу
сезона размножения уменьшается. Дело
не в том, что солдаты-плохие
кормилицы и не могут снабжать
необходимой пищей личинок, дающих
солдат; наблюдаемый эффект зависит от
частоты контактов между особями и,
по-видимому, связан со способностью
разрушать ювенильный гормон (Edwards,
1982; Wheeler, 1982), как и у термитов.
Когда удастся разработать схемы
онтогенеза промежуточных типов,
интересно будет выяснить, каким
образом произошел переход от
онтогенеза, свойственного Myrmica,
с общим лабильным стволом и двумя
главными путями развития (дающими
мелких и крупных рабочих), к такой
картине, как у Pheidole, у которого пути
развития репродуктивных самок
и рабочих разделены со стадии яйца, а от
линии рабочих ответвляется еще линия
сверхкрупных солдат (рис. 12.7) (Brian,
1979а).
12.1.2. Осы и пчелы
У ос и пчел обе касты имеют крылья, и
возможно, что именно необходимость
крыльев для рабочих особей была
причиной, задержавшей эволюцию
сильно дифференцированной касты
рабочих. Маточники ос снабжаются
более обильной и, возможно, лучшей по
качеству пищей, содержащей больше
белка, вырабатываемого слюнными
железами (Montagner, 1966). Яйца не
предрасположены к развитию особей той
или другой касты, и большие различия в
размерах между личинками появляются
только после прохождения ими трех из
пяти стадий. Личинки, находившиеся в
маточниках, если перенести их
в маленькие ячейки, регрессируют, давая
рабочих особей, т. е. они лабильны в
отношении касты (Spradbery, 1978а), но
личинки из маленьких ячеек при переносе
в маточники дают интеркастов. Они не
детерминированы к развитию в рабочих
особей, и, быть может, в обычных
условиях каста определяется уже после
того, как личинка перестает принимать
пищу. После этого происходит
внутренняя оценка ее трофического
состояния, и метаморфоз идет
в направлении той или другой морфы,
приводя к образованию либо крупной
репродуктивной самки в состоянии
репродуктивной диапаузы, либо
маленькой недиапаузирующей рабочей
особи, у которой функция размножения
блокирована социальными факторами.
У Bombus ячейки располагаются
беспорядочно, но их содержимое часто
обследуется (Pendrel, Plowright, 1981).
Яйца не детерминированы. Некоторые
личинки утрачивают лабильность
в возрасте 3-4 дней, к концу первой
стадии, что примерно соответствует
четверти личиночной жизни, и их
развитие направляется в сторону рабочих
особей. Рабочие умеют распознавать
личинок, обладающих потенциями
к развитию в репродуктивных самок, и
дают им больше корма, так что они
проводят три лишних дня в личиночном
состоянии и четыре лишних дня в виде
куколок. В группах, где нет матки, число
личинок, развивающихся в самок,
регулируется отношением
рабочие/личинки, но в присутствии матки
это отношение может измениться на
обратное. Концентрация ювенильного
гормона у личинок последнего возраста,
дающих половых самок, выше, чем у
личинок рабочих особей, поэтому
возможно, что задержку метаморфоза
обусловливают corpora allata, как и у
Myrmica. Roseler (1977) высказал
предположение, что матки инактивируют
corpora allata личинок, но поскольку им
для этого не нужно непосредственно
прикасаться к личинкам, то, вероятно,
инактивирующий фактор передается
240 Г.шва 12
через рабочих особей. Быть может, матка
подает какой-то сигнал, на который
рабочие особи реагируют определенным
поведением, как у Myrmica.
У Meiiponini кастовые различия тоже
зависят от количества корма:
репродуктивные самки развиваются
в больших ячейках и могут при этом
получать тот же корм, что и все
остальные личинки, если количество
этого корма будет достаточным
(Darchen, Delage-Darchen, 1974, 1975).
Даже у Melipona количество корма может
иметь очень важное значение, реализуя
или усиливая латентные генетические
различия, связанные с гетерозиготностью
по двум аллелям. По-видимому,
детерминация осуществляется на
довольно поздних этапах личиночного
развития, перед самым метаморфозом,
так как обработка ювенильным
гормоном в этот период приводит к
увеличению числа самок и уменьшению
числа рабочих особей. Таким образом,
внутренняя оценка кастовых потенций
происходит после прекращения
кормления, сопровождаясь
гормональными изменениями,
необходимыми для соответствующего
морфогенеза.
У медоносной пчелы различия между
кастами самок выражены гораздо
сильнее, чем у всех других пчел. Хотя у
рабочих особей сохраняются крылья, у
них редуцируется половая система
и развиваются специфические системы
желез и особые формы поведения. Яйца
не детерминированы, и кастовые
различия развиваются постепенно, под
влиянием различных режимов кормления.
Личиночная жизнь матки продолжается
всего 5 дней, а рабочей пчелы-6 дней.
Если личинку в возрасте до трех дней
перенести из обычной ячейки в маточник,
то из нее развивается матка, но если
сделать это позднее, то разовьется
интеркаст с меньшим числом яйцевых
трубочек и небольшой сперматекой.
Такие особи часто гибнут сами по себе
или же изгоняются рабочими, которые
распознают их неполноценность.
Личинки, дающие рабочих особей,
в первые три дня отнюдь не голодают;
они получают богатую белком пищу,
синтезируемую в гипофарингеальных
железах молодых рабочих пчел
(молочко), и растут так же или даже
быстрее, чем личинки такой же величины,
дающие маток такого же размера
(рис. 12.8). Однако молочко (см.
разд. 9.3) не обеспечивает личинкам
возможность метаморфизировать,
и в течение последних трех дней им дают
смесь молочка и меда. В результате у
медоносной пчелы, в отличие от Bombus,
выкармливание личинок рабочих особей
и их метаморфоз занимают больше
времени, чем выращивание личинок
репродуктивных самок. Личинки,
находящиеся в маточниках, получают все
время один и тот же корм-маточное
молочко; этот хорошо сбалансированный
корм содержит 12% сахара вместо 4% в
обычном молочке и богат витаминами
(хотя они, по-видимому, не имеют
решающего значения). Эти и другие
качественные различия в снабжении
кормом (здесь были перечислены лишь
некоторые из них) играют важную роль,
поскольку диплоидные личинки,
выращиваемые в трутневых ячейках и
получающие большое количество
обычного молочка, превращаются
в крупных рабочих особей, а не в маток.
Маточное молочко при хранении теряет
свои свойства, и из личинок, которые его
получают, развиваются рабочие пчелы;
его порча, возможно, обусловлена
кристаллизацией гексоз, потому что, если
добавить к обычному молочку гексозы,
оно становится почти таким же хорошим
кормом, как маточное молочко. Если же
добавить еще и один из аналогов
ювенильного гормона, оно не будет
Воспрои leodemeo 241
Рис. 12.8. Рост личинок
самок и рабочих особей у
медоносной пчелы.
(Wirtz, 1973.)
уступать ему ни в чем. Личинок,
находящихся в маточниках, кормят
секретом не только гипофарингеальных,
но и мандибулярных желез, и притом в
10 раз чаще, чем личинок в рабочих
ячейках, и они, несомненно, все время
получают хорошо сбалансированный
корм. Это имеет важнейшее значение
(Beetsma, 1979; Brian, 1979а, 1980).
Здесь можно провести интересное
сравнение с Myrmica. У личинок рабочих
особей в возрасте 1-3 дней не
откладывается в жировом теле гликоген,
тогда как у личинок, развивающихся в
маточниках, это происходит. Подобное
же различие можно обнаружить
у личинок последнего возраста Myrmica',
оно означает, что для морфогенеза самок
характерны высокий уровень запасания
питательных веществ и медленный рост
242 Г.шва 12
„зародыша" имаго, тогда как при
формировании рабочих особей вся
потребляемая пища сразу же идет на
развитие физиологически доминантного и
активного „зародыша". Это, как и у
Myrmica, вероятно, обусловлено высокой
концентрацией ювенильного гормона у
личинок, из которых развиваются самки,
что весьма интересно, так как было
показано, что у развивающихся
в репродуктивную самку личинок Apis в
возрасте трех дней концентрация этого
гормона в крови в 10 раз выше, чем у
личинок рабочих особей (Beetsma, 1979).
Как показали эксперименты, ювенильный
гормон вызывает „включение" сразу
всего комплекса особенностей
репродуктивных самок.
Прекоцен - фактор, разрушающий corpora
allata, но не снижающий потребления
корма, может иногда препятствовать
развитию репродуктивных самок. Таким
образом, синдром запасания корма и
формирования репродуктивных самок,
вызываемый высоким уровнем
ювенильного гормона в крови,
наблюдается и у муравьев, и у пчел.
Эти различия в концентрации
ювенильного гормона продолжают
влиять на метаморфоз, когда на
личиночной стадии впервые появляются
кастовые отличия будущей матки
медоносной пчелы, у которой яичники
необычайно велики и содержат около 300
яйцевых трубочек; все эти трубочки
сохраняются, а у рабочих особей число
их, превышающее к концу личиночной
стадии сотню, сокращается примерно
до 12. Итак, самка, потенциально
(генетически) способная иметь 300
яйцевых трубочек, при образовании
рабочих особей вынуждена
эпигенетическим путем утратить из них
288. Материал, освобождающийся
в результате их дегенерации, во время
метаморфоза, несомненно, включается в
восковые железы, в приспособления для
сбора пыльцы и в другие специальные
структуры рабочих. Стабилизация
яичников у личинок рабочих особей
может быть достигнута за 1-2 дня в
маточнике, где потребление маточного
молочка ведет к увеличению corpora
allata и повышает уровень ювенильного
гормона в крови примерно в 10 раз.
Следует отметить еще один интересный
момент: даже в стеклянных ячейках в
лаборатории личинки, дающие
репродуктивных самок, после того как
они сплели кокон, ориентированы
вертикально головой вниз, тогда как
личинки рабочих особей лежат
горизонтально. Такое поведение первых
соответствует поведению всех Apidae, и
его можно индуцировать и у вторых с
помощью ювенильного гормона
(Beetsma, 1979). Личинки рабочих особей,
очевидно, адаптированы к жизни
в вертикальных сотах с почти
горизонтальными ячейками; некоторые
гены, определяющие терминальные
этапы развития, никогда не вступают у
них в действие.
Из всех данных, собранных многими
учеными за много лет (здесь упомянута
лишь небольшая их часть), становится
ясно, что различные пищевые режимы
приводят к различиям в развитии желез,
влияющих на план и процесс перестройки
и реорганизации развития на стадии
куколки. Пока не известно, каким
образом организм оценивает различия в
корме. Оказывает ли пища влияние на
нейроэндокринную систему после того,
как она всосалась из кишечника, т. е.
через трофику, или же дело в том, что
пища содержит какие-то вкусовые
вещества, стимулирующие рецепторы
ротовой области, и воздействует на
нейроэндокринную систему через них?
Иными словами, трофическое это
воздействие или сенсорное?
Beetsma (1979) и его сотрудники
придерживаются второй точки зрения;
Воспроизводство 243
они обнаружили в лабиальной области
личинки рецепторы, чувствительные
к сахарам. По их мнению, содержание
сахара в молочке в первые три дня не
настолько высоко, чтобы увеличить
потребление пищи. Тем не менее в эти
дни личинки в рабочих ячейках растут
так же быстро, как личинки
в маточниках, а значит, поедают столько
же пищи; лишь позднее, когда молочко
разбавляется медом, скорость роста
падает. О влиянии питания личинок на
эпигенетическую регуляцию морфогенеза
известно слишком мало; главную роль
сейчас приписывают corpora allata,
однако известно, что в регуляции
участвуют и проторакальные железы,
причем не только сами по себе, но и во
взаимодействии со всей системой
эндокринных желез (Brian, 1980).
Кастовые различия у всех общественных
насекомых .обусловлены различиями
в питании, направляющими развитие по
разным генетически детерминированным
каналам, т. е. в конечном счете
различиями в поведении рабочих особей.
У эусоциальных видов это поведение
зависит от матки. У высших муравьев и
термитов, но не у пчел и ос этот фактор
сочетается с глубоким влиянием,
исходящим от внутреннего состояния
матери во время формирования яиц. В
совокупности все эти факторы дают
возможность „зародышу имаго",
живущему и развивающемуся в футляре,
которым служит личинка, доминировать
в смысле поглощения пищи. „Зародыш",
конечно, зависит от личиночных
механизмов получения и переваривания
пищи, однако по мере своего роста он
затрудняет кормление личинки, что в
конечном итоге лишает пищи его самого,
и в результате он никогда не достигает
таких размеров, как „зародыши"
репродуктивных самок. Возможно, что в
организме матки фактором, влияющим
на детерминирование касты, служит
ювенильный гормон-так же, как
в личинке и куколке.
Судя по имеющимся данным, гены вряд
ли оказывают какое-либо действие
помимо создания ограниченного полом
диморфизма у самок, отсутствующего у
самцов ( Hymenoptera). У одного
муравья (Harpagoxenus) и у одной пчелы
(Melipona) было показано участие генов в
определении каст. Известно также
несколько случаев различий между
кастами муравьев по изозимам: при
скрещивании Solenopsis geminata
с S. xyloni все рабочие обладают
гибридными свойствами, но 95% самок
относятся к материнскому типу. Это
означает, что отцовские гены
подавляются только тогда, когда
гибриды развиваются в репродуктивных
самок (Hung, Vinson, 1977). У видов
Myrmecia рабочие особи тоже
отличаются от самок по генным
частотам, но во время написания обзора
Крозье (Crozier, 1980) это был
единственный известный случай.
Полиморфизм имеет генетическую
основу, но морфогенез касты зависит от
материнской гемолимфы и от режима
питания личинок.
12.2. Копуляция и расселение
Расселение имеет два аспекта-
генетический и экологический.
Первый отражает необходимость
обеспечить аутбридинг (по крайней мере
периодически), а второй-необходимость
находить и занимать новые
местообитания, если они свободны, или
вторгаться в уже занятые местообитания,
вытесняя другие виды. Обычная
последовательность событий такова:
скопление половых особей, образование
пар и копуляция, расселение и выбор
местообитания. Существует много
вариантов, особенно у тех общественных
насекомых, у которых отпочковываются
244 Г.шва 12
небольшие, но полноценные новые семьи.
Копуляция между сибсами в гнезде или
на гнезде наблюдается редко,
и существует много механизмов,
препятствующих этому. Гибельные
последствия инбридинга были
продемонстрированы на медоносной
пчеле при помощи искусственного
осеменения. Инбредные рабочие особи
плохо выживают, запасают меньше меда
и менее эффективны в отношении
терморегуляции. В свете гипотезы о том,
что гапло-диплоидные системы менее
устойчивы к инбредной депрессии, чем
диплоидные, эти данные заслуживают
внимания (Bruckner, 1980). Механизм
определения пола тоже может быть
нарушен. У Apis имеется только один
половой локус, но несколько половых
аллелей; гетерозиготность по этому
локусу дает самок, а геми- или
гомозиготность-самцов. При
инбридинге вероятность появления
гомозигот возрастает, а тем самым
повышается и частота диплоидных
самцов, которые в репродуктивном
отношении уступают гаплоидным.
Рабочие особи распознают их на стадии
личинки и уничтожают в однодневном
возрасте, точно так же как они
распознают репродуктивных самок,
оказавшихся не в своих ячейках (Woyke,
1980a,b).
Самцы Polistes пытаются копулировать в
гнезде, но самки их отвергают, а рабочие
особи прогоняют. Самцы собираются в
тех местах, где самки фуражируют перед
началом зимы, налетают на них, падают
на землю и копулируют в течение
короткого времени (например, Р. fusca-
lus; Evans, West-Eberhard, 1973). В от-
личие от этого самцы тропических
Р. canadensis приходят в новые гнезда и
копулируют с самками, которые уже
начали строительство без участия
рабочих особей. Так обстоит дело
с роящимися Polybiini вообще; при этом
обеспечивается аутбридинг и снижается
риск для репродуктивных самок. Самцы
Vespula летают по маршрутам между
участками растительности, хотя они не
оставляют ощутимого запаха (Calam,
1969); после копуляции молодые самки
уходят на зимовку и только после этого
разлетаются и ищут места для гнезд. У
самцов Bombus тоже есть маршруты
между рядами столбов или древесных
стволов, определенно помеченных
секретом их мандибулярных (Calam,
1969) или лабиальных желез (Bergstrom,
1975; Bergstrom et al, 1981). Эти секреты,
несомненно, помогают привлекать самок,
и они видоспецифичны; у В. pratorum это
терпеноидный спирт с 15 атомами С,
такой как фарнезол, у В. pascuorum-
алифатический спирт 7-гексадецен-1-ол,
у В. /apz'fifarzztf-пальмитолеиновый спирт
9-гексадецен-1-ол, а у В. lucorum,
представленного двумя формами,
светлой и темной,-этиловые эфиры:
этилмиристолеат у светлой
и этил додекан оат у темной формы.
Самки посещают места, помеченные
секретами самцов, копулируют,
возвращаются в гнездо, а позднее уходят
на зимовку. Помимо использования
различных химических меток разные
виды занимают различные ярусы
растительности.
Meliponini роятся круглый год или, как
африканская Hypotrigona, не делают
этого только в середине засушливого
сезона (Darchen, 1977). Процесс роения
состоит из ряда этапов. Сначала темные
старые сборщицы меда подготавливают
и выстилают полость, затем приходят
молодые, устраивают горшочки для
хранения запасов и наполняют их медом
и пыльцой, и наконец является самка с
целой толпой молодых рабочих особей,
которые строят ячейки для расплода.
Самцы держатся вокруг новых гнезд,
устраиваясь поблизости и готовые
копулировать, когда спустя два дня
Воспроизводство 245
самка выходит из гнезда; сразу после
этого она начинает откладывать яйца.
Эта система, видимо, уменьшает
инбридинг, так как в копуляции могут
участвовать самцы со всей округи; кроме
того, она снижает риск, которому
подвергается новая матка во время
перемещений и во время копуляции.
Вероятность того, что семье не удастся
обосноваться, невелика, так как
выбранное место хорошо обследуется,
прежде чем туда перейдет главная часть
новой семьи. В сущности, эту систему
можно считать почти идеальной, так как
она обеспечивает самке защиту все
время, кроме короткого периода
копуляции, и при этом создает
возможность для конкуренции между
чужими самцами.
Медоносная пчела подвергается гораздо
более многочисленным опасностям, так
как старая матка покидает гнездо
с группой рабочих особей,
переполненных медом, но ее не ожидает
заранее подготовленное гнездо. В старом
гнезде остаются ее враждебно
настроенные друг к другу дочери,
а прежде чем начинать восстановление
старого сообщества, необходим
рискованный брачный полет (Simpson,
1974). Приспособленность матки
в эволюционном смысле зависит от
максимизации числа и качества
производимых ею дочерей. Чтобы
добиться такой максимизации, она
сначала создает весной как можно
быстрее большое число рабочих особей
(это наблюдается у рас умеренного
пояса), а затем, пока рост еще
продолжает оставаться на максимальном
уровне, а скученность или неадекватное
распределение корма еще не стали
серьезной помехой для
жизнедеятельности семьи, строит
трутневые ячейки и маточники
и откладывает в них соответствующие
яйца. Это связано с увеличением длины
дня, наступлением тепла и обилием
цветов. Возможно, что непосредственной
причиной строительства трутневых ячеек
и маточников служит снижение
концентрации регуляторных феромонов
матки из-за высокой численности
рабочих особей и общей ареактивности
молодых рабочих, преобладающих
в популяции после периода быстрого ее
роста.
Один из факюров успеха состоит
в выборе для размножения наилучшего
времени года. Это дает возможность
старой матке основать новую семью,
подготовить гнездо, создать популяцию
и запасти достаточно меда, чтобы
пережить зиму. Роение происходит
главным образом в мае или июне
(рис. 12.9), так что на все это остается
примерно столько времени, сколько
может потребоваться в обычное лето,
поскольку дни длинные и большая часть
растений находится в цвету. Все же в
некоторых случаях рои возникают и в
августе, но тогда новую семью создать
не удается. Возможно, что такие
рои-рудимент прежнего тропического
цикла, длившегося около трех месяцев.
Другой фактор, от которого зависит
успех,-это, вероятно, выведение
оптимального числа новых
репродуктивных самок. Их должно быть
столько, чтобы им была обеспечена
достаточная поддержка рабочих особей,
т. е. чтобы образующийся рой имел
оптимальные размеры. Чем больше рой,
тем быстрее он может построить новое
гнездо и обосноваться в нем, создав
соты, яйца, расплод и запасы, но если
рой слишком велик, то это будет за счет
уменьшения других роев той части семьи,
которая осталась в старом гнезде.
По-видимому, одна семья может
и должна отпочковывать от себя
ежегодно по две или три новых семьи.
Лишь одну из них основывает
осемененная матка в возрасте более года,
246 J'.iaea 12
остальные закладываются молодыми
самками.
Как же все это организовано? По
крайней мере за 10 дней до роения
рабочие пчелы начинают поглощать мед, популяции (Butler, 1940), но наличие
такой подготовительной фазы означает,
а
о
5
готовясь покинуть улей вместе с маткой
Указывалось, что рабочие особи,
уходящие с маткой, составляют более
или менее случайную выборку из
что решение покинуть улей или остаться
принимается каждой пчелой не
спонтанно: некоторые рабочие особи по
той или иной причине более преданы
матке, чем другие. Быть может, у них
существует какой-то способ
распознавания генетического родства?
Следует ожидать, что склонность
к выработке воска для строительства
ячеек и последующему развитию
кормовых желез для кормления личинок
будет сильнее выражена у молодых пчел;
так обстоит дело у Apis mellifera
adansonii, у которой более четырех пятых
составляют особи моложе 8 дней
(Winston, Otis, 1978).
Рассмотрим сначала, что происходит в
улье, который зрелая матка оставляет в
наследство своим дочерям. Молодые
самки настроены друг к другу
враждебно; самка, вышедшая из ячейки
первой, старается ужалить более
молодых и в случае успеха возглавляет
новую семью. В других случаях
вмешиваются рабочие особи, которые
исполняют умиротворяющие танцы
и добавляют к маточникам воск, чтобы
помешать выходу молодых самок,
особенно в перенаселенных семьях
(Simpson, 1974); время от времени эти
Рис. 12.9. Сроки вылета
роев у медоносной
пчелы, по суммарным
данным за 5 лет
в Нью-Йорке, США. (Fell
et al., 1977.)
Воспроизводство 247
самки получают корм через дырку в
воске и созревают внутри ячейки, а их
кутикула твердеет. В период такого
одиночного содержания репродуктивных
самок они издают свое знаменитое
прерывистое „чириканье" с частотой
650 Гц, создаваемое вибрацией
сложенных крыльев, когда тело прижато
к восковому субстрату. Это „чириканье"
стимулирует роение и характерно для
больших семей с высокой плотностью,
которые способны образовать несколько
жизнеспособных дополнительных роев.
Если после выхода из ячеек молодых
самок дополнительные рои не возникают,
то эти самки уничтожают друг друга,
пока не остается только одна из них,
хотя сомнительно, чтобы это была
наиболее приспособленная. Возможно,
что происходят своего рода
„предвыборные дебаты", в которых
репродуктивные самки соревнуются,
пытаясь склонить на свою сторону
рабочих особей, как это делают молодая
самка и матка у Trigona subnuda
(Imperatriz-Fonseca, 1977).
Иногда матка не покидает гнездо вместе
с роем, а остается в нем, и ее заменяет
одна из ее дочерей. В таких случаях
строится меньше маточников, и все
выглядит так, как будто дело заранее
планировалось как замещение матки, а не
как роение-быть может, из-за того, что
сезон подходит к концу или что матка
плохо справляется с откладкой яиц
(Butler, 1957). Наименее рискованный
способ замещения для дочери состоит в
том, чтобы сначала копулировать,
а затем устранить старую матку, а для
матери, безусловно, лучше передать
гнездо осемененной дочери, чем
рисковать полной катастрофой
в результате несчастного случая при
брачном полете (Simpson, 1974).
При наличии соответствующих
условий-как внешних (длинные дни и
ясная теплая погода), так и внутренних
(запечатанные маточники) - некоторые
пчелы, более активные и чувствительные,
начинают исполнять в улье
активизирующий танец (buzz-dance),
который состоит из очень быстрых
пробежек по прямым линиям при
частично раскрытых крыльях,
вибрирующих с частотой 250 Гц. Когда
одна пчела соприкасается с другой, она
сохраняет с ней контакт в течение 5 с и
непрерывно (а не с перерывами, как
матка) „чирикает" с частотой 500 Гц.
Это побуждает другую пчелу
к активизирующему танцу, но только в
том случае, если она находится
в состоянии готовности; если такой танец
исполняется в нероящемся улье, то пчелы
„замирают" (Esch, 1967). В готовом к
роению улье реакция распространяется
до тех пор, пока эмигрирующие пчелы не
высыпают наружу все вместе, причем
гораздо быстрее, чем обычно,
и образуют плотное облако вблизи улья.
Пчелы не направляются прямо к новому
гнезду, а собираются на расстоянии до
10 м от улья, оставаясь на месте до тех
пор, пока там присутствует матка, а в
противном случае возвращаются в улей.
Распознавание матки-процесс сложный;
Ferguson et al. (1979) стабилизировали
безматочные рои при помощи
синтетического феромона, сходного
с секретом железы Насонова, который
содержит цитраль, нерол,гераниол
и фарнезол, а также 9-оксодекановую
кислоту и другие компоненты из
мандибулярной железы матки. Такой
сложный состав имеет важное значение,
поскольку Ambrose et al. (1979) показали,
что роящиеся пчелы могут отличать
свою собственную матку от других маток
и выбирают матку, сходную по возрасту
и репродуктивному состоянию со своей,
не принимая в качестве заместительницы
матку, которая отличается от прежней.
Они даже способны идентифицировать
собственную матку, если
248 Г.кта 12
экспериментатор пометит ее шеллаком
(Boch, Morse, 1979).
Найдя новое место для гнезда,
пчелы-разведчицы (примерно 5% пчел
роя) указывают своим товаркам
направление к этому месту и расстояние
до него, используя те же танцы, что и
для сообщений о корме. Если имеется
несколько возможных мест, то,
по-видимому, разведчицы посещают
каждое из них по отдельности
и оценивают их. Только после того, как
выбор будет одобрен всеми, роевой клуб
готов отправиться в путь, но пчелам
требуется еще некоторое время, чтобы
взлететь в воздух. Seely et al. (1979)
установили, что примерно за час до того,
как рой взлетает, разведчицы начинают
собираться на роевом клубе: некоторые
сохраняют неподвижность, другие
исполняют информационные танцы,
третьи - активизирующий танец. Этот
последний танец индуцирует высокие
чирикающие звуки, и цепи висящих пчел
распадаются, тогда как другие пчелы
взлетают и начинают описывать круги в
воздухе, и в конце концов все
отправляются в нужную сторону.
Пчелам, вероятно, помогают в этом
разведчицы, летающие взад и вперед
вдоль нужного направления, в то время
как другие разведчицы летят к месту
будущего гнезда, выделяя по пути
феромон, секретируемый железой
Насонова. Скорость их полета
увеличивается, достигая 8-10 км/ч при
высоте 3 м, и по мере движения рой
уплощается.
Местообитание, выбираемое роями диких
пчел,- это обычно редкий лиственный лес,
в котором можно найти старые деревья с
дуплами для гнезд и разнообразный
корм. Место для нового гнезда редко
бывает удалено от старого менее чем на
300 м, и иногда расстояние достигает
километра (рис. 12.10); пчелы
предпочитают устраивать гнезда
в полостях объемом около 40 л на
высоте 1-5 м, с расположенным
у основания отверстием величиной
12-75 см2, обращенным на юг (Seely,
Morse, 1977, 1978). Разведчицы
обследуют найденное место в течение
40 мин и, возможно, определяют
в темноте объем полости, сопоставляя
расстояния, которые они проходят в ней
в разных направлениях (Seeley, 1977).
Avitable et al. (1978) находили большую
часть диких семей на высоте более 3 м в
толстых зрелых кленах (Acer) и дубах
(Quercus)-n гнездах, обращенных на
юго-запад.
Поскольку самцы не прилетают к гнезду,
как у безжалых пчел, молодым самкам
приходится выходить из гнезда, чтобы
отыскивать их и копулировать. Самцы
летают и собираются в тех местах, где
сходятся восходящие воздушные потоки,
поднимающие их примерно на 10 м над
землей (без подзорной трубы их увидеть
нельзя, но можно слышать). У Apis
mellifera adansonii молодые матки
в хорошую погоду начинают
1-2-минутные ориентировочные полеты
вокруг гнезда через 3-4 дня после выхода
из ячейки. Они копулируют на 5-й день, а
некоторые повторяют копуляцию и на
следующий день; эти полеты
продолжаются по 13 мин и происходят
по большей части днем, около 15 часов
(Fletcher, 1978). Во время полета матка
выделяет из своей мандибулярной
железы след из привлекающих веществ,
которые воспринимаются особыми
клетками на усиках самцов. Самец
воспринимает 9-оксодекановую кислоту в
очень сильном разведении, что дает ему
возможность подлететь к самке против
ветра с большого расстояния. Однако
сейчас еще не выяснено, каким образом
репродуктивная самка находит скопления
самцов. После копуляции запас
сперматозоидов в сперматеке достигает
5-6 млн., а после откладки 100000 яиц
Воспроизводство 249
Расстояние, указанное разведчицами, м
Рис. 12.10. Расстояние от скопления пчел до
места нового гнезда, указанное роящимися
пчелами: первые столбики в каждой паре-по
Seeley, Morse (1977), вторые-по Lindauer
(1955).
число их снижается до 2-3 млн., т. е. в
среднем на каждое яйцо приходится 30
сперматозоидов. В каждое яйцо может
проникать до 10 сперматозоидов (НагЬо,
1979).
V' муравьев существует много типов
репродуктивного поведения. У некоторых
Ponerinae и у всех Dorylinae самки
бескрылые и проводят в семье всю свою
жизнь. Крылатые самцы отыскивают
самок, следуя по фуражировочным
тропам, как, например, у Megaponera
foetens (Longhurst, Howse, 1979). У Eciton
(Dorylinae) в расплоде бывают тысячи
самцов, но лишь несколько
репродуктивных самок. У этих муравьев
при разделении семьи образуются две
части-одна со старой самкой, а другая с
расплодом. Между этими двумя частями
проявляется некоторый антагонизм.
Молодую самку, пока она еще не
потемнела, окружает группа рабочих
особей, которые пробивают себе путь
наружу и образуют скопление на
расстоянии около метра от гнезда;
рабочие из этой группы,
увеличивающейся и достигающей 8-10 см
в диаметре, перемещаются вместе
с основной частью семьи. Спустя
несколько дней выходят из своих коконов
самцы, и, вероятно, начинается то
состояние возбуждения, которое Schneirla
(1971) назвал „стадией исхода самки": на
этой стадии старая самка выходит
наружу вместе с рабочими особями и
отправляется в путь по одной из троп.
250 Глава 12
Спустя примерно час первая молодая
самка, все еще в сопровождении рабочих,
уходит из гнезда по какой-нибудь другой
тропе, образуя отводок. Другие
репродуктивные самки выходят из
коконов слишком поздно, и им трудно
привлечь к себе рабочих особей; при
неблагоприятных условиях рабочие особи
изолируют самок, окружая их плотным
кольцом и держа за ноги. Тем не менее
некоторым молодым самкам удается
вырваться из этих скоплений и в конце
концов добиться того, что их принимает
какая-нибудь кочующая колонна, которая
в таком случае отказывается от
собственной самки; такая замена может
произойти и без разделения семьи, если
старая самка очень непривлекательна (ср.
Apis). У Eciton самцы обычно улетают и
стараются присоединиться
к какой-нибудь колонне муравьев своего
вида. В течение первого дня они
приобретают запах новой для них семьи,
теряют крылья, обламывая их
самостоятельно или позволяя сделать это
другим особям, а затем достигают
половой зрелости. Самцы не могут
копулировать, пока не сбросят крылья, а
после того, как произойдет копуляция,
они гибнут.
В саванне Ламто муравьи Апотта (по
данным Leroux, 1979а) обычно меняют
гнездо каждые 8 дней, но когда они
начинают размножаться, производя
много самцов и несколько самок, они
остаются на одном месте 2-3 недели,
непрерывно занимаясь охотой.
Некоторые семьи многократно делятся, а
другие не делятся никогда; в течение 134
дней одна семья разделилась трижды, но
из 46 семей, находившихся под
наблюдением, разделились только 14.
Поскольку самцы Dorylinae выслеживают
семьи, принадлежащие к их собственному
виду, и копулируют с избранными ими
самками, серьезному риску гибели
подвергаются у них только самцы.
Активность самцов ограничена; в сухой
сезон они часто прилетают в световые
ловушки, но сроки лёта у разных видов
различны; самцы летают во влажном
воздухе после дождя (Baldridge et al.,
1980). У Dorylinae, хотя у них самка не
способна к полету, вряд ли происходит
инбридинг, так как ее братья улетают
раньше, отправляясь на поиски семьи,
которая их примет. Рабочие особи
защищают самку в течение всей ее жизни,
и по сравнению с этим риск, которому
подвергается самка Apis во время
брачного полета, кажется огромным:-
если эту последнюю уничтожит хищник,
то погибнет вся новая семья, так как
теперь уже слишком поздно, чтобы
рабочие особи могли вернуться в прежнее
гнездо и начать все сначала; невольно
возникает мысль, не объясняется ли
такая беспечность медоносной пчелы ее
ассоциацией с человеком.
Бескрылым репродуктивным самкам не
всегда приходится ожидать, пока к ним
прилетит самец. Самки Rhytidoponera
metallica (Ponerinae) выходят из гнезда и
привлекают к себе самцов с помощью
феромона, выделяемого межсегментными
железами (рис. 12.11). У Нуроропега
eduardi самцы бывают как крылатые, так
и бескрылые, причем последние
копулируют с самками вскоре после
своего „рождения" (LeMasne, 1953).
У Myrmicinae в процессе эволюции
возникла выраженная в различной
степени зависимость от других
свободноживущих муравьев, и этот
социальный паразитизм часто
ассоциируется с бескрылостью
репродуктивных самок и самцов.
У Formicoxenus nitidulus есть как
крылатые, так и бескрылые
репродуктивные самки; последние
выходят из гнезда, взбираются на
какое-нибудь растение поблизости и,
приподнимая брюшко, выпускают яд из
кончика выдвинутого жала. Бескрылые
Воспроизводство 251
самцы направляются к жалу с расстояния
по меньшей мере 15 см, и после
некоторого „жеманничания" со стороны
самки происходит копуляция (Biischinger,
1975). Крылатые самцы, по-видимому,
никогда не летают и уже в первые два
дня обламывают свои крылья. Вероятно,
инбридинг происходит достаточно часто,
однако отсутствие крыльев у социальных
своего гнезда и часами сидит на них,
выдвинув жало с выпущенной из него
капелькой яда; это привлекает крылатых
самцов, находящихся на расстоянии
3-4 м. У Н. sublaevis бывают и крылатые
самки, а у Я. canadensis все самки имеют
крылья (Biischinger, 1978b), у Anergates
atratulus-паразита Tetramorium
caespitum- самцы очень похожи на
паразитов встречается только среди
Leptothoracini. Самка Harpagoxenus
sublaevis взбирается на растения около
куколок и копулируют со своими
сестрами вскоре после появления на свет
(Biischinger, 1974). Такой теснейший
инбридинг, вероятно, крайне вреден в
генетическом отношении, однако
А. atratulus - чрезвычайно
специализированный социальный
паразит, у которого нет касты рабочих, а
самки после копуляции летят к другому
гнезду Т. caespitum. Описано много
Рис. 12.11. Самка
Rhytidoponera metallica
привлекает самца,
выделяя из тергальной
железы, расположенной у
кончика брюшка, особый
феромон, после чего
происходит копуляция.
(Holldobler, Haskins,
1977.)
252 r.uiea 12
подобных случаев, и, как отмечает Wilson
(1975), эти кажущиеся неблагоприятными
особенности на самом деле дают
возможность их обладателям не терять
контакта с популяцией хозяев.
В тех подсемействах муравьев, в которых
репродуктивные самки большей частью
летающие, оба пола обычно покидают
гнездо и встречаются вне его.
Расстояние, которое они при этом
покрывают, варьирует в пределах от
нескольких сантиметров до нескольких
километров и может превосходно
обеспечить расселение. У Myrmica,
Pogonomyrmex и многих других муравьев
самцы отправляются к какому-нибудь
заметному объекту вроде скалы или
дерева и летят тесно сбитым
извивающимся роем на его
подветренную сторону, где они падают
на голую землю, чтобы копулировать.
Они выделяют при этом феромоны,
которые распространяются по ветру и
помогают самкам найти это место.
Разные виды могут использовать для
этого из года в год одно и то же место,
хотя и в разное время дня или
года - вероятно, потому, что у него есть
какие-то особенности, поскольку это не
может быть связано у них с традицией,
как постоянство токовищ у птиц. Быть
может, прав Wynne-Edwards,
предположивший, что скопления
муравьев связаны с некоторым половым
отбором. В результате отбора хорошо
летающих самок преимущество получают
особи с хорошо развитыми крыловыми
мышцами, т. е. обладающие наилучшими
запасами питательных веществ для
одиночной жизни во время основания
новой семьи. Самки Pogonomyrmex могут
копулировать с несколькими самцами
подряд, после чего они улетают, садятся,
обламывают крылья и отправляются
„пешком" на поиски места для гнезда
(Holldobler, 1976b).
Аттрактант самцов Pogonomyrmex
близок к 4-метил-З-гептанону или
соответствующему спирту (McGurk et al.,
1966, цит. по Holldobler, 1976). Ядовитая
железа самок продуцирует феромон,
который в сочетании с веществом,
выделяемым покровами, а также со
специфической морфологией
и поведением самок помогает самцам,
которых бывает по нескольку подряд,
спариваться. Звуковые сигналы при
спаривании не используются, кроме тех
случаев, когда удовлетворенная самка не
может уйти от самцов,-тогда она
прибегает к стридуляции (Markl et al.,
1977). Образование подобных скоплений
самцов и самок зависит, во-первых, от
примерно одновременного их созревания;
во-вторых, от выхода из гнезда
в подходящую погоду (обычно теплую,
безветренную и влажную)
и в определенное время дня, которое
варьирует у разных видов1; в-третьих,
муравьи должны лететь к какому-нибудь
заметному ориентиру, выделяя
характерный феромон; а после того как
сформировался рой, он может
привлекать к себе муравьев одним своим
видом.
Mhos ие муравьи, по-видимому,
обходятся без каких-либо особых
ориентиров,- они просто собираются на
участках, отражающих свет или
испускающих тепло; некоторые взлетают
на определенную высоту и держатся на
ней. Рабочие особи Solenopsis invicta
открывают выходные отверстия гнезда, и
самцы, вылетая из гнезд раньше самок,
примерно в полдень, остаются на высоте
90-150 м в течение нескольких часов
(Markin et al., 1971, цит. по Lofgren et al.,
1975). Брачный лёт происходит несколько
раз в году, чаще всего в июне и июле,
1 У пустынных муравьев вылет настолько синх-
ронизирован, что из всех гнезд одной популя-
ции самки и самцы вылетают в течение 1-2 ч
одновременно (Длусский, 1981а).- Прим. ред.
Воспроизводство 253
иногда около гнезда, иногда в отдалении
от него; обычно его наблюдают спустя
1-2 дня после дождя, особенно если
дождю предшествовала сухая погода, при
слабом ветре, относительной влажности
80% и температуре 24-32°С, но зимой
муравьи могут летать при 20-26°С
(Lofgren et al., 1975). Запоздалые брачные
полеты могут пробить серьезную брешь
в кормовых запасах семьи; поэтому
многие муравьи уничтожают половых
особей, не вылетевших из гнезда к концу
сезона размножения. Кроме того,
существует опасность, что самки,
оставшись неосемененными, начнут
все-таки откладывать яйца. Если эти яйца
съедобны, то самки просто помогут
семье; если же это будут репродуктивные
яйца, в семье в неподходящее время
появится слишком много самцов.
У S. invicta, по-видимому, существует
предохранительный механизм:
яйцекладущая самка вырабатывает
феромон, подавляющий сбрасывание
крыльев молодыми самками в гнезде до
копуляции. Если удалить старую самку,
молодые самки сбрасывают крылья,
пользуясь помощью рабочих особей, не
позднее чем на следующий день.
Несколько дней спустя рабочие начинают
убивать множество таких только что
сбросивших крылья самок, оставляя
лишь нескольких, у которых хорошо
развиты яичники. Новая „матка", хотя
она не осеменена, способна прекратить
дальнейшее сбрасывание крыльев
другими самками, вероятно с помощью
феромонов, вырабатываемых ею самой
(Fletcher, Blum, 1981 а, b). Этот феромон
покрывает тело самки (особенно
брюшко), и его можно смыть ацетоном;
он нелетучий, и рабочие особи либо
получают его при непосредственном
контакте с самкой, либо передают друг
другу на ротовых частях. Ввиду наличия
латентного периода в 1-2 дня между
удалением самки и началом сбрасывания
крыльев цитированные авторы высказали
мысль, что это вещество служит
„затравкой", проникающей в организм
молодых самок и изменяющей их
поведение путем прямого воздействия на
нервную систему, а не на
экстероцепторы. Эта ингибирующая
система очень сходна с той, с помощью
которой самки Myrmica останавливают
превращение лабильных личинок
в половых особей (Brian, 1970);
достаточно поместить их на 30 с в эфир,
чтобы смыть этот феромон.
Tetramorium caespitum, подобно Solenopsis,
по-видимому, относится к видам,
совершающим брачный полет на
определенной высоте. В отличие от
других видов, обитающих на
верещатниках и в грасслендах, эти
муравьи начинают летать, как только
лучи всходящего солнца коснутся
поверхности гнезда. Мандибулярная
железа самца секретирует
4 метил-3-гексанон и соответствующий
спирт; эти соединения имеются у рабочих
особей, но их нет у репродуктивных
самок (Pasteels et al., 1980).
lasius и Acanthomyops при брачном
полете тоже держатся в определенном
слое воздуха и выделяют терпеноиды и
индол в соотношении, различном
у разных видов; возможно, что самцы
сообщают о своем появлении при
помощи этих веществ. Данных о высоте
брачного лёта у разных видов пока нет,
однако известно, что он происходит в
разное время года: например, в Англии у
L.niger-в июле и августе, а у L.alienus-в
сентябре и октябре, часто даже слишком
поздно, когда погода уже испортилась, и
в таких случаях самцов поедают в гнезде
собственные рабочие особи. У L.flavus
брачный полет происходит в то же время
года, что и у L. niger, но ближе к вечеру:
в 17-19 вместо 13-17 часов (Boomsma,
Leusink, 1981); эти авторы полагают, что
каждый вид вылетает в то время, когда
254 I'.Kiea 12
температура среды примерно равна
температуре в гнезде, и избегают таким
образом термического шока. Благодаря
полетам на разной высоте при наличии
или отсутствии ориентации по
особенностям местности эти виды могут
обитать на лишенных деревьев
травянистых равнинах и в степях. Такие
массовые полеты хорошо известны, так
как они почти всегда привлекают
всевозможных неспециализированных
хищников: это не только птицы,
хватающие муравьев в воздухе, но также
рептилии и амфибии, млекопитающие и
паукообразные, жуки, хищные клопы и
другие насекомые, которые ловят
муравьев среди растительности и на
земле, во время копуляции или после нее.
Высказывается мнение, что, хотя
синхронизированные вылеты муравьев
привлекают разнообразных хищников,
такое массовое появление жертвы
рассредоточивает атаку последних
и позволяет немалой доле половых
особей и значительному числу самок
избежать гибели и приступить к закладке
новых семей.
Другие муравьи тоже прибегают
к уловкам бескрылых самок, чтобы
завлекать самцов. Это относится ко всей
группе Formica rufa', после копуляции,
происходящей обычно около гнезда,
самки возвращаются в него, а затем
переходят в один из отпочковавшихся
отводков, который временно сохраняет
связь с родительским гнездом, но в конце
концов либо резорбируется, либо
отделяется! (Mabelis, 1979b; Pamilo,
Varvio-Aho, 1979). Таким же образом
репродуктивные самки Monomorium
pharaonis используют секрет дюфуровой
1 Часто эта связь сохраняется постоянно, и
образуются комплексы родственных гнезд, ко-
торые называют колониями (см. предисловие
редактора перевода).- Прим, перев.
железы для привлечения самцов
(Holldobler, Wust, 1973).
Подводя итоги, следует сказать, что
существуют два главных способа
образования скоплений у муравьев:
1) самки летят к самцам, которые
собираются около какого-нибудь хорошо
заметного объекта или в зоне,
находящейся на определенной высоте над
землей; 2) самки привлекают к себе
кочующих самцов с помощью
„призывов1 11, не удаляясь от собственного
гнезда. Особый случай, наблюдаемый у
Dorylinae, когда семья принимает чужого
самца, после чего он осеменяет в ней
самку,-это, возможно, вариант второго
способа. Первый способ обеспечивает
максимальную дисперсию генов и семей,
а второй-достаточную дисперсию генов,
однако ввиду того, что впоследствии
семьи иногда разделяются или
почкуются, расселение вида происходит
при этом способе медленно, но зато
надежно. В первом случае
приспособленные самки-это самки
с мощной летательной мускулатурой, что
дает им возможность в одиночку
основать новую семью. Во втором же
случае это мелкие самки,
возвращающиеся в гнездо
и принимаемые собственной семьей или
поселяющиеся в семьях других видов как
социальные паразиты. Этим последним
самкам не нужны ни дальние полеты, ни
мощные летательные мышцы,
и расселение во вновь появляющиеся
незанятые местообитания не дает им
никаких преимуществ. Лучше всего им
оставаться около своих хозяев, чтобы их
не сдувало, а наличие у них крылатых
самцов может обеспечить дисперсию
генов. Для тех видов, у которых даже
самцы лишены крыльев и, появившись на
свет, копулируют со своими сестрами,
отсутствие риска потерять хозяина,
возможно, перевешивает выгоду,
связанную с аутбридингом.
Воспроизводство
255
Поспешность, с которой молодые самки
обламывают свои крылья (если они у них
есть) после копуляции, позволяет думать,
что они не очень-то усердно ищут
подходящее местообитание; во многих
случаях они, по-видимому, уже нашли
его раньше. В выборе местообитания
иногда участвуют и самцы (как,
например, у шмелей), но, вероятно, лишь
в самой общей форме (Wynne-Edwards,
1962; см. Brian, 1965). Lasius, у которого
самец так мал, что самка может нести
его на себе, когда копуляция еще
продолжается, служит примером поисков
места для гнезда, производимом
молодой самкой с воздуха. Судя по
некоторым данным, самки действительно
выбирают местообитание; например, у
L. niger и L.flavus в Европе они
предпочитают голые участки почвы на
капустных полях (Pontin, 1960), а самки
L. neoniger в Америке (луговой вид), пока
они еще не сбросили крылья, избегают
лесов, а случайно опустившись
в лесистой местности, улетают прочь
(Wilson, Hunt, 1966). Самки L. niger в
Европе обосновываются в более влажных
областях, чем самки L. alienus (Brian et
al., 1966). На травянистых пустошах и в
кустарниках самки Formica lemani,
Myrmica ruginodis и M. scabrinodis
выбирают открытые поляны или недавно
расчищенные места в лесу и строят
гнезда на хорошо прогреваемых участках
и на южной стороне старых пней (Brian,
1965).
Брачные поле ты термитов сходны
с таковыми у летающих муравьев с той
разницей, что они заканчиваются не
копуляцией, а образованием пары;
копуляция же происходит позднее, уже в
гнезде, и время от времени повторяется.
Очень немногие термиты активно
летают, и не известно ни одного вида,
который бы улетал за пределы
относительно спокойных нижних слоев
воздуха. Крылатые самки и самцы
Allognathotermes hypogeus собираются на
верхушках деревьев, разбросанных
с плотностью примерно по одному на
гектар; пары образуются в листве
деревьев, причем самец прикрепляется к
нижней поверхности тела самки, которая
затем слетает на землю, быстро
отламывает свои крылья и начинает
бродить в поисках места для гнезда. К
числу термитов, образующих брачные
скопления, относится также
Pseudacanthotermes militaris (Noirot, Bodot,
1964).
Самки Allodontotermes giffardi не летают,
хотя у них и есть крылья. Они
взбираются на травинки, подняв
брюшко, и машут крыльями; этим они
привлекают самцов, визуально или
акустически, а к концу, несомненно,
химическим путем (Bodot, 1967).
В отличие от муравьев, у которых
рабочие особи просто открывают
выходные отверстия, термиты строят
специальные „взлетные" платформы и
укрытия, охраняемые солдатами.
Синхронизация достигается, во-первых,
благодаря созреванию самцов и самок
примерно в одно и то же время и,
во-вторых, благодаря выбору
определенной погоды и определенного
времени суток. В обзоре на эту тему
Nutting (1969) пишет, что обычно
в областях с умеренным климатом
брачный лёт у термитов происходит
летом, а в пустыне-зимой, после
дождя *. В тропиках не у всех видов лёт
приходится на сезон дождей, у некоторых
он происходит в засушливый период;
это, по-видимому, частично зависит от
того, в какого рода местообитании им
предстоит рыть норку после брачного
полета, потому что дождевая вода
размягчает древесину и почву, но вместе
с тем заполняет щели в почве.
1 У среднеазиатских термитов лёт происходит
весной (Тутиков, 1979).-/Трим. ред.
256 J'.iaen /2
У некоторых видов и даже отдельных
семей брачный лёт происходит несколько
раз в год, что довольно выгодно для них
(у Pterotermes до 40 раз, по данным
Nutting). У некоторых видов время
брачного лёта непредсказуемо, но
у других его можно предсказать;
например, у пяти видов Amitermes он
происходит на следующий день после
дождя, а у одного вида Heterotermes
начинается через 10 мин после захода
солнца и продолжается всего час!
Пролетаемое термитами расстояние тоже
сильно варьирует: так, у Macrotermes из
нескольких тысяч вылетающих половых
особей некоторые могут пролететь
расстояние в несколько километров, а у
Calotermes flavicollis, у которого в каждом
лёте участвует по 30-60 половых особей
из каждой семьи, они пролетают лишь по
нескольку десятков метров.
Термиты способны в общих чертах
распознавать тип местообитания. Nutting
(1969) полагает, что виды, обитающие в
пустыне, узнают по очертаниям объекты,
которые могут предоставить им пищу и
убежище. Некоторые термиты летят
вдоль рядов деревьев или по улицам, как
бы рассматривая их, например Amitermes
в Аризоне. На территории Берега
Слоновой Кости Amitermes часто
поселяется вблизи холмиков
Trinervitermes geminatus (Josens, 1972), и
возможно, что он распознает их прежде
всего зрительно. Формирование пар
происходит на земле, причем самец
следует за самкой, поддерживая с ней
тесный тактильный и химический
контакт. Например, самка Trinervitermes
bettonianus привлекает самца,
находящегося на расстоянии 10 см от нее,
выделяя летучее вещество, а самец
ощупывает тергальную область самки,
помещая голову на область от 6-го до
10-го тергита. При утрате контакта
тергальные и стернальные железы
прокладывают эфемерные следы
(Leuthold, 1977). У Zootermopsis nevadensis
и Z. angusticollis, использующих для этого
стернальные железы (Pasteels, 1972),
самок привлекают вытяжки из особей
обоих полов, однако самцов привлекают
только вытяжки из самок; после
образования пары термиты обламывают
свои крылья. У примитивных термитов
это достигается путем трения
о какие-нибудь предметы, при помощи
задних лапок или при участии брачного
партнера, отгрызающего крылья у их
основания. Высшие термиты ставят
крыло перпендикулярно груди
и приподнимают крыловые пластинки до
тех пор, пока они не отламываются по
слабому шву около основания (Nutting,
1969). У Microtermes самка переносит
самца на нижней поверхности своего
тела, как у Allognathotermes hypogeus.
Самец сбрасывает крылья, а самка
обследует местность с воздуха и, выбрав
подходящее место, опускается и начинает
устраивать гнездо.
Термиты, живущие в древесине, обычно
проникают в нее через отверстия,
проделанные жуками, или через
различные трещины; чрезвычайно
большое значение для них имеет
состояние древесины - ее мягкость
и степень разложения. Термиты,
строящие гнезда под землей, часто
используют временные укрытия,
предоставляемые опавшей листвой
и растительными остатками, но очень
скоро начинают рыть вертикальный
ствол; большую часть работы выполняет
самка, а самец охраняет ее от самцов, не
нашедших пары. В конце ствола термиты
выкапывают камеру, которая иногда
бывает обмазана экскрементами и так
мала, что самка едва может в ней
повернуться. Отверстие ствола
закрывается перегородкой из
экскрементов и разного рода обломков,
различающейся по форме у разных
видов. Macrotermes natalensis роет
Воспроизводство 257
с помощью мандибул и отгребает
вырытую землю ногами. Microtermes
havilandi строит над входом небольшой
купол из уплотненной почвы, причем вся
эта операция занимает лишь около
10 мин, в течение которых самец и самка
работают поочередно (Nutting, 1969).
Во время брачного лёта на термитов, так
же как и на муравьев, нападают многие
неспециализированные хищники.
Миграции перелетных птиц могут быть
приурочены к лёту термитов в тропиках
весной и к лёту муравьев в умеренном
поясе осенью. Парам половых особей
необходимо построить как можно скорее
надежные убежища, а не оставаться
просто под слоем листьев, где они могут
стать добычей жуков, пауков и птиц,
роющихся в лесной подстилке. Хотя они
должны держаться вместе, поскольку у
них нет приспособления для хранения
спермы, они все же не подвергаются
такой опасности, как муравьи,
копулирующие на открытых местах;
кроме того, оставаясь вместе, они строят
гнездо общими усилиями.
12.3. Продукция
Существует несколько способов
измерения продукции (Brian, 1978). У
общественных насекомых
репродукционное отношение
(РО-среднее число молодых самок на
одну яйцекладущую самку) за время ее
жизни, очевидно, должно быть больше
единицы, но для его вычисления
необходимы данные о продолжи-
тельности жизни в природных условиях,
которые получить трудно. Семьи диких
Apis mellifera в восточной части
Северной Америки образуют 0,96 роя на
семью в первый год и 0,92-во второй
год (Seeley, 1978). В Канзасе, где сезон
размножения продолжается дольше,
отношение РО за сезон составляет 3,6
(включая дополнительные рои); РО
коррелирует с числом ячеек, занятых
рабочими особями, и с численностью
запечатанного расплода, но не с числом
запечатанных маточников (Winston,
1980). В первом рое бывает в среднем
16 033 + 1447 пчел, во втором
рое- 11 538 ± 1066,
а в последующих-всего 4000. Это
последнее число, вероятно, близко к тому
минимуму, при котором семья может
пережить ближайшую зиму в местных
климатических условиях. Очевидно,
матка, живущая 4 года (Brian, 1965),
произведет примерно 12 жизнеспособных
дочерей.
Данные о РО за год или просто о числе
половых особей в семье за год могут
быть полезны для проведения сравнений,
и получать эти данные легче. Второе
отношение соответствует отчуждаемому
избытку особей в данной семье *. Следует
учитывать также затраты на замещение
рабочих, погибших за выбранный
промежуток времени, поскольку это
необходимо для под держания всего
процесса продукции. Мы здесь
ограничимся лишь несколькими
примерами, относящимися к пчелам и
осам, так как данные о муравьях
и термитах были рассмотрены в недавно
опубликованных обзорах (см. Brian,
1978). По имеющимся оценкам, РО за
день равно для Evylaeus marginatus 0,04,
для тропических Polybia 0,06, для
Dolichovespula 0,07, для Bombus pascuorum
0,25 и для Vespula germanica 1,00 (Brian,
1967). Это отношение в целом возрастает
с уровнем развития общественного
образа жизни, хотя некоторые из
упомянутых насекомых-моногинные
виды умеренного пояса,
1 Это касается видов, у которых новые семьи
основываются одиночными самками или ре-
продуктивными парами. При расселении роями
или отводками нужно учитывать и рабочих осо-
бей, участвующих в образовании новой семьи.-
Прим. ред.
258 Г. idea 12
а другие-полигинные тропические.
Брайен и Элме (Brian, Elms, 1974)
несколько лет изучали продуктивность
Tetramorium caespitum на прибрежных
верещатниках Великобритании, измеряя
ее как новообразовавшуюся биомассу на
одну семью в год. Семья этого вида
состоит из одной самки и в среднем
около 11 000 рабочих особей общим
весом 6,31 г (сырой вес) и занимает
территорию в среднем 43,8 м2
с периметром 32,4 м. Продукция самцов
и самок коррелировала и составляет в
сумме 3,9 г (по данным для 28 семей за 6
лет), а общая продукция, вместе
с рабочими, равна 11,2 г; отсюда
биомасса, идущая на замещение рабочих
особей, составляет 7,3 г, т. е. значительно
больше половины общей продукции.
Общая продукция составляет 1,77 на 1,0 г
рабочих, так что каждая семья ежегодно
способна почти удваивать свое население.
Продукция биомассы равна
0,26 г/м2-удивительно низкая цифра,
если вспомнить, что растительность дает
250 г/м2, т. е. примерно в тысячу раз
больше (Chapman et al., 1975). На
продукцию Tetramorium caespitum в этом
районе Англии влияют суммарная
солнечная радиация за год, границы
территории и стадия восстановления
растительности после того, как весь
кустарник погиб от огня. По мере
постепенного восстановления
растительности относительное значение
разных факторов изменяется:
территория, занимаемая данной семьей,
играет менее важную, а биомасса
семьи-более важную роль. Во всем
верещатнике как слишком большая, так и
слишком малая биомасса невыгодна;
оптимальной будет величина
0,11 - 0,14 г/м2, что как раз соответствует
модальному значению- весьма
необычный пример адаптации.
Дру1 ой, более примитивный
представитель Myrmicinae-Myrmica
sabuleti-укивет в том же районе, но на
травянистых участках; средняя биомасса
его семьи, по данным за несколько лет,
равна 2,35 г, а продукция-3,21 г в год,
что в 1,4 раза больше общей массы всех
его рабочих особей (у Tetramorium
caespitum она выше в 1,77 раза).
Продукция рабочих возрастала вместе с
массой семьи и ежедневной солнечной
радиацией, но уменьшалась по мере
восстановления растительности. При
сравнении двух разных участков-одного
в прохладном месте с кислой почвой, а
другого в хорошо прогреваемом месте с
нейтральной почвой - оказалось, что на
втором из них семьи были крупнее и
производили ежегодно больше рабочих.
В больших зрелых семьях продукция
самцов коррелировала с размером
(и численностью), а продукция самок-со
средней величиной рабочих особей
(Elmes, Wardlaw, 1982а).
В обсуждавшейся ранее модели семьи
Myrmica при соответствии между
продукцией яиц и потреблением пищи и
достаточности обоих этих факторов
только треть пищевых единиц (800
единиц) шла на поддержание популяции
рабочих, тогда как две трети (1 600 еди-
ниц) расходовались на продукцию
половых особей. Таким образом, для
продукции новой биомассы требуется
2400 единиц, т. е. больше, чем для
поддержания биомассы семьи (800 еди-
ниц), и вдвое больше, чем потребляет
семья М. sabuleti в природе. Эта модель
представляет собой, в сущности,
обобщенную модель для рода Myrmica, и
она откорректирована таким образом,
чтобы быть максимально эффективной
при оптимальном производстве половых
особей, так что обнаруженное
расхождение не должно нас удивлять.
Продукцию Myrmica limanica на лугах в
Польше подробно изучала P?tal (1972,
1980). На основании полученных ею
данных-результатов многократного
Воспроизводство 259
взятия выборок на протяжении всего
года-была построена численная модель
(Uchmanski, P?tal, 1982), основанная на
двух предположениях: 1) продукция
пропорциональна массе рабочих особей
(оба показателя оценивались по сухому
весу), и 2) доля половых особей в общей
продукции возрастает пропорционально
смертности старых рабочих особей
в течение предыдущего лета. При этом
растет доля молодых рабочих особей,
которые ухаживают за личинками,
лабильными в отношении касты, отдавая
им предпочтение перед личинками,
предрасположенными к развитию
в рабочих особей, и не реагируют
активно на самку (Brian, Jones, 1980).
Фуражиры гибнут больше, когда пищи
недостает или когда ее слишком много,
так как в обоих случаях их внегнездовая
активность возрастает. Это способствует
стабилизации модели, однако ее возврат
в состояние равновесия после случайного
отклонения (вызванного, например,
зимней смертностью) задерживается
из-за производства половых особей и
идет так медленно, что за это время
может случиться другое событие,
ведущее к случайной гибели.
Самые высокие среди общественных
насекомых показатели продукции
наблюдаются, вероятно, у термитов
(Nielsen, Josens, 1978). Macrotermes
bellicosus, биомасса которого достигает
5001 г/га, продуцирует 132 мг сухой
биомассы на 1 г сырого веса в сутки,
согласно оценке Collins (1981), который
отмечает: „...в целом у Macrotermitinae
потребление пищи на единицу их массы
выше, чем у других групп термитов.
Конечно, им помогают в этом их
грибные сады.
Данных по этой проблеме все еще
слишком мало для того, чтобы делать
обобщения, но это одна из
развивающихся ветвей экологии
общественных насекомых. Мы уже знаем,
что самое большое РО не обязательно
служит признаком внутренней
эффективности (например, у Vespula-, см.
Archer, 1981а). И опять-таки
эволюционно самый продвинутый вид не
всегда использует свое местообитание с
наибольшей эффективностью, как видно
из сравнения двух представителей
Myrmicinae - высокоразвитого
Tetramorium (0,26 г/ml) и примитивного
Myrmica (3,21/4 = 0,80 г/ml) (данные
о фуражировке по Elmes, Wardlaw,
1982а). Следует иметь в виду, что такие
высокоорганизованные формы, как
Tetramorium, могут не допускать в те
области, которые они сами не
используют, другие виды.
12.4. Общие выводы
Механизм создания широкого
разнообразия особей по размерам
и форме, как выяснилось, в разных
группах общественных насекомых сходен.
В тех группах, где существует
ограниченный полиморфизм (у пчел, ос и
примитивных термитов),
дифференцировка наступает поздно,
иногда даже в конце личиночного
периода, и особи всех типов развиваются
по одному и тому же пути, начиная с
лабильного яйца. Затем происходит
оценка внутреннего трофического
состояния, и морфогенез регулируется на
стадии куколки сроками воздействия
ювенильного гормона и, возможно, его
концентрацией. Вся эта процедура
зависит от времени года и от потенций
половой особи (матки) или пары половых
особей. Эти особи оказывают свое
влияние с помощью химических сигналов
(феромонов), изменяющих поведение
рабочих, связанное с распределением
пищи. Интересно, что у примитивных
термитов рабочие-это ювенильные
особи, ожидающие своей очереди, чтобы
превратиться либо в половых особей,
260 Г.шва !2
обычных или неотенических, либо
в солдат. Солдаты представляют собой
первую функциональную касту,
возникшую в ходе эволюции у термитов,
но последнюю-у муравьев. Как
у высших муравьев, так и у высших
термитов физиологическое влияние самки
программирует созревание личинок
и превращение их в мелких рабочих
особей после быстрого и неполного
эмбриогенеза, в процессе которого они
утрачивают такие несущественные для
них органы, как крылья и гонады.
Преимущество такой заложенной
изначально касты состоит в том, что при
этом не нужно ограничивать кормление!
У муравьев солдаты образуются из круп-
ных рабочих особей, следующих ла-
бильным путем по направлению к впол-
не развитым самкам дальше тех, ко-
торые развиваются из детерминирован-
ных яиц. Эти полиморфизмы определя-
ются генетическими потенциями, реа-
лизация которых регулируется самкой,
влияющей на рационирование корма,
и запрограммированным развитием,
зависящим от материнского влияния на
формирование яиц.
Половые особи, производимые в такое
время года, чтобы они могли основать
новую семью при наилучших условиях
среды, не покидают старую семью сразу.
Рабочие могут ограничивать их
подвижность или даже держать их в
заточении, а позднее эти половые особи
могут стать причиной разделения семьи,
которое происходит путем образования
роев, обычно после тщательной
подготовки места для нового гнезда.
Молодые самки могут копулировать до
или после этого, либо принимая в своем
гнезде кочующих самцов, либо выходя
наружу, чтобы найти самцов поблизости
или в местах их скопления и привлечь к
себе. Виды, у которых самки
закладывают новую семью в одиночку,
обычно производят сначала самцов, а
затем уже самок. Самка может выйти из
гнезда, приманить самца, копулировать,
а затем вернуться в свое гнездо, чтобы
войти в состав отпочковывающейся части
семьи. Самки могут собираться на
каком-нибудь хорошо заметном объекте
или на определенном уровне над землей,
прежде чем копулировать. Затем они
могут основывать семью в одиночку или
совместно небольшими группами.
У самок, действующих в одиночку,
может оказаться достаточно резервов,
чтобы вовремя создать небольшую
группу рабочих особей. Местообитание
иногда выбирает самец, а конкретное
место для гнезда-самка. Так обстоит
дело у термитов, которые сначала
образуют постоянную пару, а затем
начинают вместе строить гнездо.
Исследование продукции (замещение
погибших рабочих особей плюс
производство половых особей) показало,
что еще почти нет самых необходимых
данных о продолжительности жизни
общественных насекомых и их
выживании в природе. Установлены
различные факторы, влияющие на
продукцию: суммарное число часов
солнечной радиации, состояние
местообитания, размеры территории,
биомасса семьи. Соотношение двух
последних величин, как выяснилось,
варьирует, но у одного вида муравьев его
мода близка к оптимальному значению.
Как правило, семья способна ежегодно
создавать большой избыток биомассы,
покидающий гнездо либо в виде половых
особей, либо в виде роев рабочих особей
с несколькими половыми особями.
Глава 13
Эволюция сообществ насекомых
..Приспособленность" того или иного
организма-это его способность
участвовать в создании грядущих
популяций. Один широко
распространенный способ обеспечить
такое участие состоит в том, чтобы
оберегать небольшое число потомков
(родительская забота); эта забота может
продолжаться до тех пор, пока потомки
не научатся сами выращивать своих
братьев и сестер. Затем их следует
вовремя выпустить из гнезда, чтобы они
могли применить приобретенные навыки,
выращивая собственных потомков;
в противном случае их
приспособленность понизится. Однако
между поколениями существуют
разногласия относительно того, в какое
время им лучше всего расставаться.
Другой способ усиления
приспособленности заключается
в кооперировании равноправных особей
друг с другом, с тем чтобы разделять все
заботы и в равной степени участвовать в
воспроизведении; в таких случаях
равновесие бывает неустойчивым и имеет
тенденцию сдвигаться в пользу одной
особи, которая играет доминирующую
роль в откладке яиц, отводя другим
второстепенную роль. У подчиненной
особи, по-видимому, нет возможности
изменить такое положение вещей;
правда, доминирующая особь может
начать сдавать и тогда предоставляет
другой занять ее место, но это может
произойти слишком поздно для того,
чтобы эта другая могла проявить себя
наилучшим образом в смысле
размножения. Таким образом, первый
шаг в сторону общественного образа
жизни совершается тогда, когда
какая-либо особь (альтруист) снижает
собственную плодовитость в пользу
другой особи. Возникает вопрос:
получает ли при этом „альтруист“
какую-то трудно уловимую выгоду, или
же он в самом деле не может избежать
того, чтобы оказывать помощь? Первой
точки зрения придерживаются
сторонники гипотезы о так называемом
отборе родичей (kin selection),
а второй - те, кто отдает предпочтение
гипотезе „материнского
манипулирования" (maternal
manipulation). Эти гипотезы, однако, не
исключают друг друга; оба принципа
могли бы одновременно способствовать
развитию общественного образа жизни.
13.1. Теории индивидуального
отбора
Существуют три главные теории,
основанные на естественном отборе
отдельных особей; это теории отбора
родичей, материнского манипулирования
и отбора в полигинных семьях. Все они
призваны объяснить, почему
гапло-диплоидная система определения
пола у перепончатокрылых,
по-видимому, оказалась столь
подходящей основой для развития
общественного образа жизни. Из групп с
обычным диплоидным механизмом
определения пола, свойственным
большинству насекомых (Crozier, 1979,
1980), сообщества имеются только
у термитов.
262 Г.tuna 13
13.1.1. Отбор родичей
Вначале казалось, что эта теория
превосходно объясняет эволюцию
общественного образа жизни, поскольку
генетическая асимметрия
в гапло-диплоидной системе означает,
что сестры сходны по 3/4 своих генов, а
мать с дочерью-лишь по 1/2 генов.
Hamilton (1964) утверждал, что
с генетической точки зрения самке
выгоднее выращивать своих сестер, чем
производить собственное потомство:
совокупная приспособленность окажется
при этом выше, чем непосредственная
приспособленность данной особи. Однако
самцы, имеющие только 1/4 общих генов
со своими сестрами, перечеркивают это
преимущество, если только, как
полагают Трайверс и Хэр (Trivers, Hare,
1976), здесь не используется асимметрия
в степени генетического родства и вклад
в самок не превышает втрое вклад в
самцов (см. ниже). При этом
предполагается, что у всех самок отец
один и тот же или по крайней мере
пакеты спермы от разных отцов не
должны смешиваться (Chamov, 1978).
Данных, которые подтверждали бы такое
предположение, пока фактически нет: у
общественных перепончатокрылых,
по-видимому, широко распространена
полиандрия, и хотя пакеты спермы от
разных самцов используются не
в одинаковой мере, нам еще не известно
ни одного случая, когда бы
одновременно использовался только
один пакет (Crozier, Bruckner, 1981). В
основе этой теории лежат также
предположения о случайной копуляции, о
моногинных группах, развивающихся как
семьи, и об откладке всех яиц только
доминирующими самками. Эти
затруднения обходятся различными
путями (см. Dawkins, 1976; Wilson, 1971),
которые мы можем теперь рассмотреть.
Главный, причем довольно слабый,
довод в пользу гипотезы отбора родичей
можно получить, изучая соотношение
полов и их относительный вклад
в следующее поколение.
Coi.iaciio генетической теории
естественного отбора (Fisher, 1930), гены
должны распределяться между двумя
полами поровну, иначе один из генов
быстро распространится в популяции и
отклонение будет погашено.
У общественных насекомых вклад может
выражаться в больших общих размерах
самки и большем количестве ее
внутренних резервов или же
в обеспечении репродуктивной самке
специальной защиты со стороны рабочих
особей (например, при роении). Таким
образом, если самки вдвое крупнее
самцов, то вклад в них примерно вдвое
больше, чем вклад в самцов, и для того
чтобы уравнять вклады, необходимо
произвести вдвое больше самцов; и если
мигрирующую самку сопровождает 1 кг
рабочих особей, то для компенсации
необходимо произвести 1 кг самцов. При
гапло-диплоидной системе определения
пола один или несколько локусов несут
множественные аллели и самки
получаются во всех тех случаях, когда
имеется гетерозиготность хотя бы по
одному локусу. Самцы возникают
в случае полной гомозиготности по всем
локусам и, разумеется, обычно также в
тех случаях, когда особь гемизиготна,
т. е. когда она возникла в результате
партеногенетического развития того или
другого из двух возможных ооцитов,
образующихся при мейозе (Crozier, 1980).
Диплоидные самцы были получены
путем искусственного осеменения или
контролируемого инбридинга у Apis
mellifera (Woyke, 1980) и у Melipona
quadrifasciata (Camargo, 1979).
У медоносной пчелы рабочие особи
уничтожают диплоидных трутней на
стадии личинки всего лишь через сутки, а
если выращивать таких трутней
Эволюция сообществ насекомых
263
искусственно вне улья, они оказываются
субфертильными.
Используя сухой вес как меру
относительного вклада и рассмотрев
сначала моногинные виды, у которых
рабочие особи не откладывают яиц,
Трайверс и Хэр (Trivers, Hare, 1976) на
основании достаточного количества
данных установили численное отношение
полов у пяти видов:
Отношение
самки/самцы
Leptothorax curvispinosus 3,24.
Solenopsis invicta 3,52
Tetramorium caespitum 2,99
Formica pallidefulva 4,14
Prenolepis imparis 3,04
У всех пяти видов самки превосходят по
массе самцов в 3—4 раза. В гнездах
первого из этих видов, L. curvispinosa,
обитают два социальных паразита,
относящихся к той же трибе
(Leptothoracini): Harpagoxenus sublaevis, у
которого отношение самки/самцы равно
1,25, и Leptothorax duloticus, у которого
оно равно 0,87. Если у обычных муравьев
это отношение, по-видимому,
соответствует интересам рабочих особей,
то у паразитов, расплод которых
выращивают рабочие особи хозяина, оно
соответствует интересам самок. Таким
образом, полученные данные совместимы
с представлением о том, что в системе с
гаплоидными самцами отбор родичей
влияет на распределение вклада
в последующую генерацию
в соответствии с предсказанием и что
распределение, оптимальное для рабочих
особей, противоположно таковому для
самок.
При дальнейшем изучении Tetramorium
caespitum сравнивался вклад в половых
особей в двух различных
местообитаниях, расположенных
достаточно близко одно от другого,
чтобы летающие половые особи могли
скрещиваться (Brian, 1979b). В более
влажных местах с более богатой
растительностью и большим
содержанием органических веществ
в почве семьи Т. caespitum занимают
постоянные смежные территории,
а кое-где между их гнездами вкраплены
гнезда Lasius alienus; напротив, в более
сухих местах со скудной растительностью
и песчаной почвой преобладает L. alienus,
ay Т. caespitum имеются лишь
изолированные гнезда. Оба эти вида
моногинны, и у обоих мужские яйца
откладывает репродуктивная самка. Оба
вида в наиболее подходящих для себя
местообитаниях делают больший вклад в
самок, чем в самцов, а у Lasius, кроме
того, репродуктивные самки крупнее; по
всей занимаемой Lasius области в целом
отношение вкладов в самцов и в самок
составляет 2,89 :1. Таким образом, эти
данные подкрепляют мысль о том, что
эти вклады контролируют рабочие особи,
но только в оптимальных для них
местообитаниях; в других местах вклады
способна контролировать самка.
11одобным же образом ведет себя
популяция Lasius niger (моногинный вид)
в понижениях между дюнами на
Фризских островах. В местах, где
растительность находилась на ранней
стадии сукцессии, в семьях было
в среднем по три самки, а там, где
сукцессия зашла дальше и где этот вид
подавлялся другим видом, L.flavus,- по
одной (Boomsma et al., 1982). Это
объясняется тем, что большие
продуктивные семьи L. niger на участках,
находящихся на ранней стадии сукцессии,
производят больше репродуктивных
самок. Здесь мы видим явное сходство с
муравьями, которых изучали в Дорсете.
Вес молодых репродуктивных самок (G)
всегда больше суммарного веса половых
особей (5), умноженного на логарифм
этого веса и на 0,6:
О 0,65 log 5.
264 / .шва 13
Можно ли считать такое соотношение
всеобщим, еще не известно.
Оптимальное соотношение полов
изменяется, если в семье имеется
несколько самок или если некоторые или
все яйца, дающие самцов, откладывают
рабочие особи (Oster, Wilson, 1978;
Trivers, Hare, 1976). В первом случае
приспособленность каждой самки
понижена (если все самки откладывают
яйца), так как участие ее в общей
продукции половых особей меньше.
Поскольку сообщество оберегает
добавочных самок, становится
необходимым компенсаторный вклад в
самцов, и следует ожидать, что
соотношение полов сдвинется в сторону
самцов. На примере Myrmica показано
(Трайверс и Хэр; данные о числе самок у
хорошо известных полигинных видов
этого рода суммировал Elmes, 1980), что
у видов с малым средним числом
самок-M.schenki (0,97), M.sulcinodis
(0,75) и М. ruginodis (macrogyna)
(0,88)-отношение вкладов в самок и в
самцов больше чем 1,5, а у видов с
большим средним числом
самок-Л/, sabuleti (1,74), М. rubra (15,9) и
M.ruginodis (microgyna) (6,33)-меньше
чем 0,5.
У этих видов отношение вкладов
самки/самцы, возможно, тоже сдвинуто в
пользу самцов, поскольку у Myrmica
рабочие особи откладывают
репродуктивные яйца. Согласно
Трайверсу и Хэру, оно у них должно
составлять 3 :4, а по другим данным
(Oster, Wilson, 1978)-1 :1. Увеличение
вклада в самцов возникает из-за того,
что коэффициент родства между
рабочими особями и их сыновьями равен
1/2, а между рабочими особями и их
племянниками-3/8, тогда как между
самкой и ее сыновьями он составляет
всего лишь 1/4. Поскольку у М. rubra, а
возможно, и у других видов большинство
рабочих особей откладывают яйца
в период, когда они выкармливают
личинок, эти особи вносят существенный
вклад в отток генов и разрешают свои
противоречия с собственной матерью,
ограничивая ее вклад в самок. Таким
образом, эти две касты могли достигнуть
равновесия с соотношением вкладов 1:1.
Oster и Wilson (1978) с помощью
построенной ими модели этой ситуации
пришли к выводу, что рабочие особи
скорее возьмут на себя производство
самцов, полностью отобрав его
у репродуктивной самки, чем частично
сохранят его за ней. Так, по-видимому,
обстоит дело у Myrmica (Brian, 1969;
Brian, Rigby, 1978), а возможно, и у
некоторых других муравьев, однако здесь
нужны дополнительные данные. Эти идеи
удалось включить в уже упоминавшуюся
модель для Myrmica, не вступая
в противоречие с известными фактами
(Brian et al., 1981а). На этой модели был
получен равный вклад в самок и самцов
при численности рабочих, очень близкой
к той, которая дает максимальный выход
половых особей. Модель предсказывает
также, что в малоподходящих
местообитаниях и во время разделения
семей будет наблюдаться избыток
самцов. Таким образом, имеются
некоторые данные в пользу того, что
гапло-диплоидная система
функционирует и создает некоторые
противоречия между самками
и рабочими особями. Правда, эти данные
не вполне убедительны, и существуют
другие объяснения неравного вклада в
самок и самцов.
Согласуется ли эта теория с данными о
почкующихся семьях муравьев? По
оценке Schneirla (1971), от одной семьи
Aenictus gracilis, в которой 85 000 рабочих
особей и одна самка, могут отделиться
две части из 20000 и 50000 рабочих,
возглавляемые новыми самками, а 15000
рабочих особей останутся со старой
самкой. Если всех рабочих особей
Эво.1юци.ч сообществ насекомых 265
в отпочковавшихся семьях рассматривать
как вклад в двух репродуктивных самок,
а 1367 самцов-как вклад в самцов,
равноценных по массе 25 тысячам
рабочих особей, то по расчетам
(Masevicz, 1979) отношение вкладов
самки/самцы составит 2,74:1, что
соответствует ситуации, контролируемой
рабочими особями.
Проделать аналогичные расчеты для
медоносной пчелы (Apis mellifera) не так
просто. Старая матка покидает улей
вместе с рабочими особями, унося с
собой мед, и можно, пожалуй, считать,
что настоящий отводок-это
репродуктивные самки, оставшиеся
в улье, причем некоторые из них вскоре
тоже покидают гнездо в составе
дополнительных роев. Поскольку они,
так сказать, унаследовали улей с его
запасами меда и пыльцы, готовыми
сотами, пчелиным расплодом, в том
числе множеством куколок рабочих
особей, и внушительным числом
взрослых рабочих особей, то они очень
хорошо обеспечены по сравнению со
старой маткой и ее свитой. Тем не менее
Masevicz рассматривал рой как отводок и
на основании данных о домашних пчелах
оценивал среднюю величину роя в 9080
рабочих особей (примерно треть всего
населения), что в сочетании со средней
продукцией самцов даст в пересчете на
сырой вес соотношение вкладов от 1,5 :1
до 5,1 :1. Такой сильный перевес в пользу
самок вызывает удивление, так как для
Apis, несомненно, характерна полиандрия
и самка копулирует по меньшей мере
десяток раз. В результате этого
родственные отношения между рабочими
особями сходны с соотношениями между
неродными и родными дочерьми:
коэффициент родства гораздо ниже 3/4,
так что во вкладе в самок и самцов нет
оснований ожидать перевеса в пользу
самок (обсуждение см. Crozier, 1980).
У одиночных пчел отношение полов
сдвинуто в сторону самцов (Trivers, Hare,
1976), но, так как самки весят несколько
больше, вклад в оба пола почти
одинаков; чем дешевле обходится сын по
сравнению с дочерью, тем больше эти.
пчелы могут произвести самцов, не
нарушая отношения 1:1.
У общественных видов иногда бывает
трудно с уверенностью различать касты
особей женского пола; тем не менее было
установлено, что для пяти видов Bombus
соотношение вкладов лежит в пределах
от 1,17 до 3,13, т. е. явно сдвинуто в
пользу самок. Поскольку, однако,
самцов, по всей вероятности, производят
рабочие особи, модели Oster и Wilson
лучше соответствовало бы отношение,
близкое к 1. Кроме того, как указывают
Owen et al. (1980), малозаметные мелкие
гнезда могут остаться невыявленными, а
между тем эти авторы нашли, что у
Bombus terricola в таких гнездах
производятся только самцы и притом в
начале сезона размножения. Согласно их
данным, вклады в самок и самцов
относятся в среднем как 1 :2,9, так что у
этого вида доля производимых самцов
выше, чем предсказывает любая теория!
К этой же проблеме оценки привлекает
внимание Herbers (1978, 1979),
собиравшая данные о муравье Formica
obscuripes в Северной Америке
и пришедшая к выводу, что
эволюционного равновесия здесь быть не
может. В одних семьях производятся
только самки, в других только самцы, в
третьих и те и другие. Herbers в отличие
от ряда исследователей не обнаружила
никаких признаков производства самцов
в начале сезона размножения. У ос, так
же как у примитивных пчел, трудно
различать касты без анатомирования или
длительных наблюдений за поведением
меченых особей. Noonan (1978) сообщает,
что у вида Polistes fuscatus в Северной
Америке, у которого большую часть
жизнеспособных яиц откладывает
266 Г. шва 13
самка-основательница, соотношение
вкладов составляет 1:1. Если
неоплодотворенные яйца действительно
откладывает матка (a Noonan ни разу не
наблюдал откладки яиц рабочими
особями), это свидетельствует
о регуляции вкладов маткой. Однако в
этом нет ничего удивительного,
поскольку откладка яиц, дающих самцов,
и вылупление последних происходит до
того, как начинают функционировать
рабочие особи, после чего остается
только отложить яйца, из которых
разовьются репродуктивные самки.
Итак, имеются некоторые (пока еще не
многочисленные) указания на то, что
гапло-диплоидная асимметрия
функционирует и приводит
к противоречиям между матками
и рабочими. Возможны, однако, и другие
объяснения неравенства вкладов в самок
и самцов; одно из таких
объяснений-конкуренция за брачных
партнеров при инбридинге.
13.1.2. Материнское манипулирование
Любая материнская особь имеет большие
возможности влиять на свое потомство,
однако ее вмешательство должно быть
достаточно тонким, иначе она оттолкнет
от себя потомков, вместо того чтобы
приручить их (Alexander, Scherman, 1977;
Michener, Brothers, 1974). Таким образом,
самке приходится перейти от простой
родительской заботы, обычной
у пресоциальных ос и пчел, которая
повышает как ее собственную
приспособленность, так
и приспособленность ее потомков,
к контролю над ранними стадиями
развития первых взрослых особей, с тем
чтобы они оставались в гнезде
и помогали ей. Как пишет Craig (1979),
„...родители, которые увеличивают
суммарный выход своих плодовитых
потомков, производя сначала стерильных
самок, помогающих им выращивать
последующие расплоды, окажутся более
приспособленными, чем те, которые не
делают этого", и будут обладать
селективным преимуществом. Crozier
(1979) добавляет: ,,...рабочие-это особи,
обладающие очень низкой
репродуктивной способностью
и запрограммированные на то, чтобы
жертвовать собой ради выращивания
братьев и сестер... отбор воздействует на
самок, чтобы они производили
послушных рабочих особей, которые
служили бы им помощниками..."
Эю могло бы достигаться разными
путями. Очевидный способ состоит
в том, чтобы материнская особь
производила как можно больше
потомков, большая часть которых была
бы субнормальной;это, однако,
рискованный способ, так как нет никакой
гарантии, что потомки станут помогать
ей, несмотря даже на „давление" со
стороны матери (для этого нужны также
аллели, предрасполагающие к помощи
родичам). Если же вместо этого матка
будет использовать особей,
субнормальность которых
детерминирована генетически, то не
приведет ли это к генетическому
определению кастовой принадлежности?
Этот способ подразумевает, что наиболее
приспособленные особи элиминируют
субнормальных как своих конкурентов,
используя их рабочую силу, в результате
чего потерь, сопровождающих обычно
внутривидовой отбор, удается избежать.
Предполагается, что сестры, будучи
однажды „приручены", уже не будут
обладать достаточной поведенческой
гибкостью, чтобы после смерти своей
матери снова стать индивидуалистами;
они, вероятно, создадут себе новую
матку из числа самых крупных или
старейших оставшихся особей. Dawkins
(1976) высказал мнение, что, хотя
материнская особь может обладать
Эволюция сообществ пасеко.мы.х 267
неоспоримой властью над своим
потомством, пока оно находится на
ювенильных стадиях, должна
существовать некая генетическая
симметрия, дающая возможность генам
„обмана" или „нонкооперации"
распространяться среди потомков, если
последние не получают никакой выгоды
от сообщества.
Один из механизмов, благодаря которым
гапло-диплоидная система может
облегчать возникновение сообществ,
состоит в регуляции пола потомства.
При этом самка перепончатокрылых
приобретает особенно большую власть,
так как она имеет возможность
препятствовать копуляции своих дочерей:
она может сделать так, что в ранних
расплодах не будет самцов, после чего ей
останется только „приручить" молодых
самок. Это, по-видимому, легче, потому
что при этом нет надобности включать у
них все системы поведения,
направленного на расселение и закладку
гнезд. Экономия энергии за счет того,
что самцы не производятся, довольно
существенна, как, например, при
партеногенетическом размножении
(Maynard Smith, 1978а). Кроме того,
самец предковой формы-одиночной
пчелы или осы-вряд ли может стать
хорошим рабочим: у него нет
строительных навыков и нет жала,
необходимого для защиты. Один из
способов вмешательства в судьбу
дочерей состоял бы тогда
в последовательном оплодотворении всех
первых яиц подряд. Весьма вероятно, что
в ранних сообществах неосемененные
самки откладывали яйца, дававшие
самцов. Установление такого порядка в
качестве постоянного представляет
собой, возможно, возврат к прошлому
того типа, какой имел в виду Dawkins,
говоря о возникновении генов „обмана".
Рабочие особи могут непосредственно
наводнить генофонд такими генами через
своих собственных потомков, хотя
каждая из них по отдельности не могла
бы произвести много самцов. Находясь в
безопасности внутри гнезда и не
подвергаясь риску, связанному
с постройкой гнезд и фуражировкой,
рабочие особи должны были бы только
избегать встреч с самкой.
Самка может также прибегнуть
к другому способу: закрепить
в популяции ген, определяющий наличие
чувствительной фазы в раннем периоде
имагинальной жизни. Во время этой
фазы у каждой дополнительной самки
мог бы произойти соответствующий
импринтинг, после чего она выполняла
бы функции рабочей особи, не требуя
никакого надзора. Реальность такой
детерминации касты на стадии имаго
подтверждается уже упоминавшимися
выше данными. Все эти системы
регуляции действительно существуют в
примитивных сообществах (Brian, 1980).
13.1.3. Полигинные семьи
West-Eberhard (1978а) исходит в своих
рассуждениях из того, что очень многие
общественные осы полигинны-либо все
время, либо периодически, и высказывает
предположение, что именно в такой
группе возникли стерильные помощницы.
Далее доминирование одной из самок в
репродуктивном отношении могло
привести к стабилизации моногинного
сообщества, состоящего из матери
и дочерей. Используя главным образом
примеры, относящиеся к тропическим
осам, она указывает, что у Belonogaster
griseus (Polybiini) несколько осемененных
самок (маток) кооперируются
с несколькими неосемененными (Pardi,
Marino, 1970). Эти то ли половые, то ли
рабочие особи не становятся далее,
насколько известно, матками, и создается
впечатление, что они неспособны
к копуляции. Возможно, что если им не
268 Г.шва 13
представился случай копулировать
в начале имагинальной жизни, они
теряют способность к этому
в дальнейшем (другие примеры у пчел и
ос см. Brian, 1980). Виды Ropalidia и еще
один вид Belonogaster, по-видимому,
сходны в этом отношении с B.griseus. У
Mischocyttarus flavitarsus только 12%
самок-основательниц живут достаточно
долго, чтобы их жизненный цикл
перекрывался с периодом имагинальной
жизни их дочерей, однако у этого вида
существуют и настоящие рабочие особи;
у М. drewseni, которую изучал Jeanne
(1972), есть категория рабочих особей,
которые выращивают как своих сибсов,
так и других особей, после того как их
мать прекращает откладку яиц.
В Колумбии (4° с.ш.) осемененные самки
Metapolybia aztecoides выполняют
различные работы в своем гнезде, пока
они молоды, а позднее помогают
в других гнездах, но сами не участвуют в
размножении. Плодущие самки,
неотличимые от других по величине и
форме тела, „сгибаются", принимая
угрожающую позу, вместо того, чтобы
исполнять танцы, как это делают рабочие
особи, не откладывающие яиц. Для этих
ос характерна лабильность
и обратимость в отношении касты; после
того как рой, состоящий из самок и
рабочих особей, обосновался, число
самок сокращается: одних изгоняют,
другие без видимых причин уходят с
новым роем, а третьи превращаются в
рабочих особей. На протяжении
нескольких месяцев в группе может быть
лишь одна самка, но после ее гибели ее
место занимают несколько молодых
самок, что побуждает рабочих особей к
танцам. В конце концов выводятся
самцы, но это происходит только
в больших постоянных полигинных
сообществах. Самки, которых
элиминируют после того, как они
отложат несколько яиц (дающих рабочих
особей), обычно ниже качеством и служат
примером элиминации менее
приспособленных. Таким образом,
прирост самок, сопровождаемый
монополией на размножение, может
представлять собой процесс социального
отбора.
West-Eberhard предположительно
выделяет в эволюции общественного
образа жизни четыре стадии:
1) одиночный образ жизни
с некоторыми различиями в репродук-
тивном успехе самок, генетическими по
своей природе и связанными с раз-
личием в размерах тела и агрессивности;
2) зачатки общественного образа
жизни-общие гнезда, присоединение
слабых особей к сильным,
предвосхищающее зарождение кастовых
различий;
3) появление „рабочих"-это молодые
особи, которые сначала помогают
в своем гнезде, а затем, став старше,
начинают откладывать яйца в других
местах (например, у Belonogaster,
Ropalidia, Metapolybia и, вероятно,
у многих Stenogastrinae);
4) высокоразвитый общественный
образ жизни с кастами стерильных
рабочих особей и системой чередования
моно- и полигинии (например, у Mischo-
cyttarus, Polistes и роящихся Polybiini).
От такого чередования, возникшего,
вероятно, как адаптация в с язи
с нападениями муравьев и птиц
в тропиках, в умеренных областях
произошел переход к перманентной
моногинии. Эта гипотеза отличается от
других тем, что она постулирует
постепенную эволюцию репродуктивного
доминирования после периода жизни в
виде недифференцированной группы, и
тем, что она не требует перекрывания
поколений для того, чтобы могли
образоваться семейные группы, хотя
некоторая степень родства для этого
необходима. Полигинная система делает
Эволюция сообществ насекомых 269
возможным отбор наиболее
приспособленных самок на уровне
сообщества.
13.2. Модели изложенных
теорий
Oster и Wilson (1978) построили модель
сообщества насекомых
с гапло-диплоидной системой
определения пола при наличии как
индивидуального отбора, так и отбора на
уровне семей. Соотношение вкладов в
самок и самцов на уровне семьи
соответствует тому, которое было бы
необходимо для гермафродитной семьи,
входящей в состав популяции семей,
свободно скрещивающихся между собой
на стационарном уровне, если
предположить, что все генотипы
происходят от одной пары основателей.
Авторы учитывают разницу в расходах
на производство особей каждого пола и
максимизируют эффективность всего
процесса воспроизведения. Как
показывает их модель, все яйца, дающие
самцов, откладываются либо рабочими
особями, либо маткой, однако ни в том,
ни в другом случае три участника
процесса-матка, рабочие особи и семья в
целом-не могут „договориться"
о наилучшем распределении ресурсов
между самками и самцами. Если все
яйца, дающие самцов, откладывают
рабочие особи, то для маток наилучшим
отношением было бы 1 :1, для рабочих
особей -1 :1, но для семьи -1 :2. В этом
случае, хотя касты, состоящие из самок,
„согласны" на равные вклады в оба пола,
семье выгоднее наличие перевеса
в пользу самцов. Если же все эти яйца
откладывает матка, то наилучшим
отношением для нее будет 1:1, для
рабочих особей-3 :1, а для семьи -1:1;
таким образом, в этом случае семья
оказывается на стороне матки, снижая
перевес в пользу самок, которого
требуют рабочие особи. В этих условиях
система может достигнуть стационарного
состояния, которое будет компромиссом,
или может колебаться вместе
с колебаниями условий среды.
Популяционные генетики создали ряд
моделей, в которых имеющиеся у матери
аллели, определяющие материнское
манипулирование, или аллели,
имеющиеся у потомков и заставляющие
их помогать матери (отбор родичей),
распространяются в популяции
и превращают ее из пресоциальной в
эусоциальную. Крэйг (Craig, 1979)
установил, что фактическое родство не
совпадает с тем, которое предсказывают
родословные,-оно варьирует
в зависимости от частоты генов и от
степени генетического доминирования.
Кроме того, для доминантных
и кодоминантных аллелей отношение
вкладов в самок и самцов, равное 3 :1, на
самом деле невыгодно для аллеля,
определяющего помощь матери, тогда
как отношение, сдвинутое в пользу
самцов, дает этому аллелю
преимущество. Крэйг ввел в свою модель
аллель, определяющий материнское
манипулирование и заставляющий
дочерей помогать матерям независимо от
их генотипа; рабочие особи при этом
совершенно стерильны. В этой модели
бесконечные популяции скрещиваются
случайным образом, копуляция
происходит только один раз
и образуются два выводка за один сезон
размножения (а в тропиках-два таких
цикла в год). Таким образом, здесь
вместо гена у потомков, побуждающего
их помогать матери (отбор родичей),
имеется ген у матери, побуждающий ее
заставлять своих потомков помогать ей.
Это, конечно, усиливает различие,
состоящее в том, что модель
с манипулированием не требует сдвига во
вкладах в пользу того или другого пола;
с генетической точки зрения потомство в
270 Г. шва 13
этой ситуации, оказывая помощь матери,
ничего не выигрывает, поскольку
у родительского (Р) и у дочернего (77)
поколений половина генов-общие, и эти
поколения реципрокны и симметричны.
Крэйг установил, что гены родительского
манипулирования должны сохраняться
отбором независимо от того,
доминантные они или рецессивные, до
тех пор, пока преимущество, которое они
дают матери, превышает потери,
которые они приносят потомкам. По
терминологии Гамильтона это означает,
что fc>l/rSH, где r-степень родства,
определяемая по родословной,
а к-выгода, получаемая выигрывающим
от всего этого родичем, за вычетом
потери для проигрывающего (чистый
выигрыш).
Но мнению Крэйга, ситуация, в которой
к>\, вполне реалистична. Он полагает,
что 1) самки, не откладывающие яиц,
располагают достаточной энергией,
чтобы выращивать своих сестер;
2) субфертильные дочери с большей
вероятностью станут трудиться,
благоприятствуя тем самым сохранению
аллелей материнского манипулирования,
что в конечном счете превратит эту их
деятельность в облигатную; 3) семья, 6
которой несколько взрослых особей,
может лучше защитить себя;
4) поскольку самки лучше выживают в
уже упрочившихся семьях, то и ген
манипулирования будет сохраняться
в них лучше. Ген материнского
манипулирования закрепляется даже
в том случае, если выгода, извлекаемая
матерью, меньше, чем потери для
потомка-донора (к< 1), т. е. фактически
при гораздо менее выгодных условиях,
чем те, которые необходимы для
распространения гена, определяющего
помощь родичам. Крэйг нашел, что при
к = 1/2 отбор равен нулю, что
согласуется с теорией, поскольку если
число выращенных дочерьми данной
матки других ее дочерей {к = 1/2, г = 1/2)
равно лишь половине числа внуков этой
матки, которых они могли бы произвести
(к= 1, г= 1/4), то получаемая выгода
просто уравновешивается. Судя по
низким значениям к, достаточным для
закрепления генов манипулирования,
контроль со стороны матери-более
вероятный первый шаг в эволюции
общественного образа жизни, чем отбор
родичей. Кроме того, множественное
осеменение при этом не играет роли, так
как степень родства не имеет в этом
случае такого значения, как при отборе
родичей.
Чарлсуор! (Charlesworth, 1978) показал,
что при подходящих условиях как модель
с отбором родичей, так и модель с
материнским манипулированием
благоприятствуют полной утрате
плодовитости помощниками. В его
модели отбора родичей прослежено
распространение аллеля, определяющего
помощь родичам (А), в популяции,
которая первоначально целиком состояла
из не-Л-особей и была бесконечной, со
случайным скрещиванием и дискретными
генерациями. Не всем носителям аллеля
А удается оказывать помощь родичам;
это зависит от условий среды и от
случая, поскольку такие особи
встречаются только в первом выводке и
помогают выращивать как А-, так и
не-Л-особей второго выводка. В модели
материнского манипулирования,
созданной Чарлсуортом, некий ген А,
заставляющий потомков трудиться,
происходит от отца или от матери и дает
возможность родителям подчинить себе
потомка путем либо физического, либо
химического влияния. Как показал
Чарлсуорт, вероятность того, что
4-генотип будет в самом деле полезен
данной группе, возрастает вместе
с получаемым от него выигрышем и „...в
каждом случае имеется некое критическое
значение к, которое должно быть
Эво.иоци.ч coooufecme насекомых 271
превзойдено, чтобы могла существовать
какая-то эволюционно стабильная
стратегия44. В случае родительского
манипулирования существует „...сильная
тенденция к выработке альтруизма...44
Чарлсуорт приходит к выводу, что
эволюция общественного образа жизни
протекает медленно и очень постепенно,
и выдвигает интересную мысль, что
отбор на отношение рабочие/матки в
отдельной семье может носить
„...довольно механический характер44. Его
модели, так же как и модели Крэйга,
показывают, что аллель, определяющий
материнское манипулирование,
распространяется при более низких
значениях к, чем аллель, определяющий
отбор родичей, и что при высоких
уровнях помощи существуют
эволюционно стабильные стратегии
независимо от числа копуляций,
в которых участвует данная
репродуктивная самка.
Обычное предположение о случайности
образования пар на самом деле
сомнительно, и сдвинутые в пользу самок
соотношения полов могут быть вызваны
конкуренцией за самцов (Alexander,
Sherman, 1977). При инбридинге
наилучшим для обоих полов является
отношение 2 :1 (самки : самцы) (Trivers,
Hare, 1976). Доля самцов составляет при
этом 1/3, и, следовательно, /-доля
скрещиваний между братьями
и сестрами-равно (10/2, т. е. тоже 1/3
(Maynard Smith, 1978b). Поскольку
большинство семей гермафродита ы,
возможен значительный инбридинг, хотя
существуют очевидные механизмы,
ограничивающие близкородственные
скрещивания, в том числе отсутствие
полового влечения между обитателями
одного гнезда. У многих муравьев этот
механизм к концу сезона размножения
исчезает, и у тех видов, у которых самки
привлекают самцов около самого гнезда,
возможен значительный инбридинг
в изолированных семьях. Это относится
и к социальным паразитам. Инбридинг
повышает коэффициент родства между
самкой и ее дочерьми, обычно равный
1/2, втрое, поскольку если /-число
потомков женского пола у данной самки,
то коэффициент родства дается
формулой (1 + 3/)/(1 + 7)2 (Oster, Wilson,
1978).
У термитов с их диплоидным
механизмом определения пола отбор
родичей еще менее вероятен, однако
родительское манипулирование у них
вполне мыслимо. Как уже говорилось, в
примитивных семействах термитов
большую часть работы в гнездах
выполняют ювенильные особи, которые в
дальнейшем всегда имеют шансы стать
либо замещающими, либо крылатыми
половыми особями. Их приспособлен-
ность-в классическом понимании этого
термина-никоим образом не снижается и
может даже возрасти благодаря опыту,
приобретенному на ранних стадиях
в родительском гнезде. Родительское
манипулирование, вероятно, приобретает
значение на более позднем этапе
эволюции-у Termitidae, у которых
ювенильные особи, созревая, утрачивают
лабильность в отношении касты.
Начиная с этого времени и далее их
эволюционная приспособленность всегда
оценивается на уровне группы
и пропорциональна степени, в какой они
помогают родителям выращивать своих
сибсов.
13.3. Групповой отбор
Последняя теория происхождения
общественного образа жизни, которую
нам предстоит рассмотреть,- это теория
„группового отбора44. Согласно этой
теории, каждая популяция распадается на
секции (демы), контактирующие между
собой в генетическом смысле лишь
212 Г.шва 13
кратковременно и редко. Внутри этих
демов особи свободно скрещиваются, но
эффективная величина популяции так
мала, что в ней возможен случайный
дрейф частоты аллелей, и его результаты
могут закрепляться. В дальнейшем таким
демам может представиться случай
распространиться в области, в которых
менее приспособленные демы вымерли.
Таким образом, „хорошая" популяция,
т. е. популяция, которая хорошо
организована и не эксплуатирует свое
местообитание чрезмерно, выживает.
Подобная система позволяет иногда
закрепиться признакам, которые, будучи
ценными для группы в целом, могут
быть неблагоприятными для отдельной
особи (как, например, стерильность).
Williams и Williams (1957) начинают с
рассмотрения семей (муравьев),
в которых некоторые потомки
выполняют работу, невыгодную им
самим как индивидуумам, но выгодную
группе, к которой они принадлежат,
поскольку такое поведение снижает
смертность в семье. Levin и Kilmer (1974)
создали модель популяции, разделенной
на демы, связанные между собой
миграционными перемещениями, но
подверженные периодическому
вымиранию, за которым снова следует
захват освободившихся ресурсов.
Вероятность выживания находится
в прямой зависимости от частоты
в данном деме генов, обусловливающих
помощь матери. Междемный отбор,
направленный на сохранение таких
аллелей, пересиливает направленный
против него индивидуальный отбор.
Ограничения, однако, весьма жестки:
поток генов должен быть ниже 5% на
одно поколение, а эффективная
численность популяции-менее 25 особей.
Дальнейшую разработку этого аспекта
проблемы предпринял D. S. Wilson
(1980).
Концепция группового отбора особенно
применима к семьям полигинных
муравьев и ос, самки которых не связаны
между собой родством. Процветающим
семьям, находящимся в равновесии со
своими ресурсами, требуется при этом
отрегулировать число своих самок,
используя механизм, основанный на
отношении рабочие/самки. Кандидаты в
матки могут приниматься на основании
отбора, а затем подвергаться еще
и дальнейшему совершенствованию. Это
дает возможность подвергать самок
испытанию в условиях общественной
жизни, во время которого они могут
конкурировать друг с другом за
внимание и преданность со стороны
рабочих особей. Успех их зависит,
следовательно, от того, насколько тесно
коррелированы привлекательность
и приспособленность в эволюционном
смысле. Семьи должны пройти цикл,
начинающийся с принятия самки, за
которым следуют рост численности
рабочих особей, производство половых
особей, копуляция и вновь принятие
самки. Таким образом, полигинная семья
может быть одним из демов в процессе
группового отбора.
Sturtevant (1938) указывает, что самка,
производящая больше яиц,
детерминированных к развитию
в репродуктивных самок, вначале будет
оставлять больше потомков, но позднее
может привести семью к гибели. Она
может в конце концов оказаться не в
состоянии откладывать яйца,
развивающиеся в рабочих особей, и в
смысле откладки таких яиц окажется в
зависимости от других самок, т. е.
фактически будет социальным паразитом.
Если эти другие самки тоже потерпят
неудачу, то локальная популяция или
семья вымрет и освободит территорию
для демов или семей с более удачным
набором самок. Известно лишь
Эво.иоци ч сообществ насекомых 273
несколько паразитических видов, не
имеющих рабочих особей; таков,
например, Anergates atratulus, который
использует семьи Tetramorium caespitum, а
затем уничтожает их.
13.4. Заключение
При таком количестве теоретических
рассуждений, указывающих возможные
способы возникновения и успешной
эволюции сообществ, остается неясным
лишь одно: почему сообщества столь
редки в классе насекомых в целом? Не
может ли быть, что гаплоидность самцов
у перепончатокрылых создает в этом
смысле какое-то преимущество? Это
кажется маловероятным, так как, с одной
стороны, галло-диплоидная система
определения пола встречается и в других
группах животных (например,
у коловраток и клещей), которые не
образуют сообществ, а с другой-
термиты с их общественным образом
жизни диплоидны. Вполне возможно, что
у термитов образованию сообществ
положили начало способные
к манипулированию родительские особи
или групповой отбор. Ни одна из
предложенных теорий не исключает
других, и можно думать, что у ос и пчел
отправной точкой послужили отбор
родичей и материнское манипулирование.
Гем нс менее гапло-диплоидная система
действительно имеет ряд преимуществ.
Одно из них-это возможность
детерминировать пол, регулируя доступ
сперматозоидов к яйцу. Это позволяет
исключать самцов из сообщества
и использовать их для распространения
генов. Кроме того, самцы могут служить
„стоком" для неблагоприятных
рецессивных аллелей, в том числе для
тех, которые постоянно возникают
в результате мутаций: Smith и Shaw
(1980) показали, что у паразитических
перепончатокрылых смертность
гаплоидных особей может быть на 10%
выше, чем диплоидных. Даже
у пресоциальных Hymenoptera самцы не
обладают такими качествами, как
способность строить, забота о потомстве
и „интеллект", и не могут, подобно
диплоидным самкам, производить
разнообразные генотипы,
приспособленные к различным
ситуациям. Благодаря тому что самцы
могут возникать партеногенетически,
становится возможным появление
полустерильной касты рабочих особей.
Они могут помогать маткам,
производящим самок, но при этом все
еще вносят непосредственный вклад в
генофонд. Сделав этот шаг, они
оказываются на полпути к полной
стерильности.
Глава 14
Семьи
Популяции каждого вида разделены на
семьи, в которых может быть по одной
или по нескольку самок. Семьи можно
распознать по их взаимной
враждебности. Семья-это
организованная система, которая
перерабатывает корм и воспроизводит
себя, устанавливает и охраняет свою
обособленность, препятствуя
проникновению на свою территорию как
чужих особей своего вида, так и многих
других организмов. Целостность семьи
зависит от способности ее членов
немедленно узнавать друг друга.
Узнавание необходимо не только для
защиты от хищников, социальных
паразитов и других интервентов; оно
дает возможность популяции
рассредоточиться по имеющимся
ресурсам. Схваток часто удается
избежать благодаря тому, что насекомые
научаются избегать тех мест, где они
могут подвергнуться нападению,
а у некоторых видов схватки
ритуализованы. Описаны и другие
гипотетические механизмы поведения,
направленные на расселение
и изменяющиеся в зависимости от
плотности популяции (Wynne-Edwards,
1962).
14.1. Обособленность семей
В основе различения членов своей
и чужих семей лежат химические
факторы, так как насекомые различают
представителей чужой семьи, даже если
они мертвы. Было показано, что члены
очень небольших групп способны
научиться узнавать друг друга по запаху.
Например, пчелы Lasioglossum, семьи
которых состоят из матки, сторожей и
нескольких сборщиц, не заимствуют
никаких характерных запахов из
окружающей среды; поэтому сторожа
допускают в свое гнездо только что
вышедших из куколок пчел из любого
другого гнезда, однако через два дня
после появления на свет у этих пчел
появляется особый запах, присущий
данной семье (Barrows et al., 1975).
Сторож может помнить свою товарку по
гнезду по крайней мере 7 дней, но через
12 дней забывает ее. Матка может
выполнять любые работы, но она плохой
сторож, и первая из ее дочерей (если в
семье нет самцов) принимает на себя
функции сторожа, блокирует входное
отверстие, а в случае необходимости
вступает в драку с врагами или
с представителями собственного вида,
относящимися к другим семьям (Breed,
Gamboa, 1977; Breed et al., 1978).
Сторожей вводят в их роль примерно в
двухдневном возрасте. В процессе своего
рода привыкания или импринтинга,
способность к которому связана
с возрастом, они научаются подавлять
стремление к атаке, когда они ощущают
запах своей матки, а несколько
позже-запах своих сестер.
В лабораторных условиях они не
допускают в пробирки ни одну пчелу из
чужой семьи, кроме молодых особей
возрастом менее суток; по-видимому,
именно через сутки экзокринные железы
пчел начинают испускать свой
характерный запах. Сторожа, которых
содержали в изоляции в течение пяти
дней, а затем возвращали в пробирки, не
допускали в них даже собственных
сестер, опять-таки, вероятно, потому, что
Семьи 275
они не знали их индивидуальных запахов
и не могли признать в них родичей.
Однако в другом случае степень
признания со стороны сторожей
коррелировала со степенью родства, и
они распознавали своих сестер, хотя
никогда прежде с ними не встречались
(Greenberg, 1979). По-видимому, запах
данной пчелы детерминирован
генетически, а не приобретается в жизни,
и сторожа, однажды выучив запахи своих
товарок по гнезду, могут распознавать и
их родственниц (Holldobler, Michener,
1980). Позднее пчелы не только узнают
друг друга как индивидуумов, но
и различают по роду активности-как
фуражиров, сторожа или матку. Даже
самцы могут запоминать запахи
отдельных репродуктивных самок
(Barrows, 1975).
В семьях, состоящих из сотен или тысяч
особей, нельзя ожидать индивидуального
узнавания, если речь не идет
о единственной самке или нескольких
самках. Здесь существуют только три
возможности: 1) особи получают
некоторую смесь химических веществ от
окружающих объектов; 2) они получают
ее от своей самки (самок); и 3) у них есть
собственный запах, присущий секретам
их желез и унаследованный от родителей.
В первом случае запах может быть
пищевого происхождения, будучи связан
с экскрементами или дыхательной
системой, или он может быть обусловлен
пахучими почвенными грибами или
другими находящимися поблизости
микроорганизмами. Во втором случае он
может исходить от самки (самок)
и передаваться другим особям через
кутикулу и даже с потоком пищи; при
этом каждая семья будет обладать
смешанным запахом, полученным
непосредственно от самки (самок) или
через других рабочих особей. В третьем
случае экзокринные железы рабочих
особей вырабатывают пахучий секрет,
детерминированный их генотипом.
Поскольку такой секрет наследуется от
обоих родителей, он должен быть более
изменчивым, чем запах, полученный от
самки (Crozier, Dix, 1979). Для того
чтобы узнавание могло иметь место, все
члены данной семьи должны нести хотя
бы по одному общему аллелю в каждом
из локусов, определяющих запах (а таких
локусов может быть много). Если только
запахи не смешиваются, то каждая
рабочая особь должна научиться
узнавать весь спектр фенотипов, которые
может создать одна родительская пара;
это возможно у Lasioglossum, но как
будет обстоять дело в более крупных
семьях, которые к тому же могут быть
полигинными?
Наиболее изученное общественное
насекомое-это монотонная медоносная
пчела (Apis mellifera), но даже здесь
ситуация не ясна. У входа в улей стоят
сторожевые пчелы, и они чрезвычайно
точно распознают пчел из чужих семей,
пытающихся проникнуть в гнездо по
ошибке или с грабительскими
намерениями, и немедленно вступают с
ними в схватку. В местах кормежки они
оставляют пахучий след, более
привлекательный для обитателей их
собственного улья, чем для других пчел
(Baroni Urbani, 1979; Ferguson, Free,
1979). У блюдечек с сиропом, после того
как он высыхает, пчелы из разных семей,
обычно живущие мирно, затевают драки
(Kahnus, Ribbands, 1952). Они явно
умеют распознавать различия между
семьями, находясь вне ульев;
следовательно, это такие различия,
которые фуражиры несут на себе.
У входа в улей ноги фуражиров
оставляют пахучую метку, состоящую не
из секрета тарзальных желез (как
у матки), а из выделений желез,
расположенных на теле и секретирующих
смесь, специфичную для данной семьи.
Однако генетическая изменчивость сестер
276 Г.шва 14
в одном сообществе должна быть
значительной, так как в общем у них
много разных отцов. Кроме того, пчелы
могут приобретать различные запахи.
Рабочие особи залетают в другие ульи
той же пасеки; эту их тенденцию можно
за три года усилить, подкармливая все
ульи пищей с одинаковым запахом, или
подавить, ставя в разные ульи подкормку
с разными запахами (Kohler, 1955).
Кроме того, пчел из различных ульев
можно объединить, если делать это
постепенно, особенно если придавать
корму сильный запах (например,
добавляя анисовое семя) и отвлекать
чем-нибудь внимание насекомых (скажем,
обсыпать их порошком, чтобы заставить
заняться грумингом). Семьи из разных
районов, перенесенные на вереск (Calluna
vulgaris), перестают проявлять
враждебность друг к другу (Kalmus,
Ribbands, 1952); напротив, если
разделить семью на две части и давать
им различный корм, а через несколько
недель снова объединить, то будут
наблюдаться проявления враждебности.
Может быть, пчелы приобретают запах
своей матки? Они распознают
собственную матку и даже обнаруживают
запах метки, нанесенной с помощью
краски (Seeley, 1979); если удалить матку,
то пчелы узнают об этом через несколько
минут. Более того, они примут другую
матку только в том случае, если удалить
прежнюю, а новую матку вводить
постепенно, чтобы пчелы могли
привыкнуть к новому запаху или
перенять его и распространить по всей
семье. Таким образом,
экспериментальные данные говорят
в пользу того, что у медоносных пчел
приобретенные запахи имеют важное
значение, хотя главная роль принадлежит
специфичным для каждой семьи
секретам, переходящим с тела насекомых
на их конечности.
У Mvrmica rubra семьи, хотя они
и полигинные, четко разграничены,
и между ними наблюдаются проявления
враждебности (Winterbottom, 1981).
Чужих рабочих особей члены данной
семьи могут узнавать по запаху-для
этого не нужны признаки, связанные с
движением или вообще с поведением.
Характерный для семьи запах
отсутствует у личинок и куколок
и появляется у молодых рабочих; если
они выводятся в чужой семье, то их тем
не менее принимают без проявлений
враждебности. На первый взгляд это
означает, что их запах смешался
с запахом рабочих данной семьи. Не
исключено, однако, что хотя последние
воздерживаются от нападения, они
способны отличить этих приемных
рабочих особей; если членам той же
семьи, которые прежде никогда не
встречались с этими рабочими (так как
содержались отдельно), представить
смешанную группу рабочих, они
нападают только на совсем посторонних
молодых рабочих, а не на тех, которые
были приняты их семьей. Возможно, что
постепенность появления запаха
у рабочих особей, перенесенных в чужую
семью, дает возможность членам этой
последней привыкнуть к ним. Однако эти
перенесенные в новую семью рабочие,
по-видимому, тоже изменяются, так как
прежняя семья их уже не принимает!
Единственное возможное истолкование
всех этих данных сводится к тому, что у
таких рабочих особей имеется какая-то
генетически детерминированная
химическая основа, на которую
накладывается приобретенный запах;
неопытные рабочие чужой семьи
нападают на них из-за этой основы, а
неопытные рабочие собственной
семьи-из-за приобретенного запаха.
Можно лишь утверждать, что
„признание" означает всего только
привыкание к чуждому запаху, а не
отсутствие способности отличать его.
Семьи 277
Winterbottom пыталась найти химические
вещества, обусловливающие
специфичный для семьи запах, но это ей
не удалось. Она, естественно, направила
свои поиски на дюфуровы железы,
поскольку было установлено, что
у разных видов Myrmica секрет этих
желез содержит различные вещества, и
Cammaerts et al. (1981b) показали, что он
используется для мечения незанятой
территории с тем, чтобы приучить к ней
фуражиров и отвадить чужих особей.
Вначале этот секрет не обладает чертами,
специфичными для данной семьи; такие
черты появляются лишь спустя несколько
дней, причем нет уверенности в том, что
они связаны с дюфуровыми железами.
Так или иначе, Winterbottom не смогла
обнаружить достаточно определенных
химических различий по этим железам
между разными семьями; очевидно, для
разрешения этой загадки нужно либо
использовать более чувствительные
методы анализа, либо расширить область
поисков. Возможно, что тело
покрывается каким-то нелетучим
веществом, которое распространяется
вниз по ногам, доходя до лапок
и оставляя пахучие следы, как у Apis и
Vespula (Butler et al., 1969).
Можно было бы думать, что гнездо
обладает запахом эндогенного
происхождения, который
распространяется и по незанятой
территории. Если рабочим особям
Solenopsis invicta предложить на выбор
землю из их собственного гнезда, из
чужого гнезда и просто обычную землю,
то они начинают копать землю из
собственного гнезда (Hubbard, 1974); так
же ведут себя рабочие особи
Pogonomyrmex badius (Hangartner et al.,
1970). Если семью Acromyrmex
octospinosus разделить на части, давать
этим частям разный корм, а затем снова
объединить их, то в поведении муравьев
наблюдаются лишь слабые проявления
агрессивности, т. е. и в этом случае
основной генетически детермини-
рованный запах не может быть
полностью замаскирован запахом,
приобретенным от пищи (Jutsum et al.,
1979). Wallis (1962) в результате своих
экспериментов на Formica fusca пришел к
выводу, что эндогенные запахи важнее
экзогенных; однако Mabelis (1979b),
работавший с F.polyctena, наблюдал
проявления враждебности в семье этих
муравьев, воссоединенной после
разделения на две части, одну из которых
кормили муравьями Lasius fuliginosus,
выделяющими сильно пахнущие
терпеноиды, а другую-представителями
их собственного вида, но из чужих семей.
Рабочие особи Oecophylla longinoda метят
территорию специфичной для каждой
семьи жидкостью из ректальной ампулы,
и это не просто дефекация, производимая
вне гнезда. Таким образом, и у муравьев,
и у пчел имеется некоторый основной
унаследованный запах и приобретаемый
поверхностный запах.
14.2. Число самок и экология
вида
Степень обособленности отдельной семьи
зависит от числа имеющихся в ней
яйцекладущих самок (маток).
Моногинные семьи всегда очень резко
обособлены, и их члены самоотверженно
защищают свое гнездо от всех животных,
за исключением некоторых паразитов,
которым удается в него проникнуть.
Полигинные же семьи весьма различны в
этом отношении: некоторые защищают
свое гнездо во всех случаях,
а другие-только от представителей иных
видов. У ос число маток зависит от
климата: род Polistes в значительной
степени полигенен в тропиках, но
моногинен в умеренных областях
(Yoshikawa, 1963). Обычно это объясняют
тем, что в тропиках такие хищники, как
278 Г.юва 14
муравьи и птицы, вездесущи и что при
наличии нескольких маток и большого
числа рабочих особей осиная семья
может в случае необходимости
разделиться, перелететь на другое место
и начать все сначала. В умеренных
областях необходимость пережить
долгую зиму дает преимущество
одиночным самкам, так как они могут
впасть в диапаузу и перезимовать в сухих
прохладных местах, а затем начать
самостоятельно строить гнездо. Кроме
того, весной корма очень мало и он
распределен диффузно, а поэтому
очень важно, чтобы насекомые
были сильно рассредоточены.
У одного из видов Mischocyttarus,
живущего во Флориде, где, конечно,
тепло и сезонные колебания климата
незначительны, семьи бывают
моногинными весной, но полигинными
осенью. Однако даже в тропиках
роящиеся Polybiini могут периодически
становиться моногинными, как,
например, Metapolybia aztecoides,
и создается впечатление, что это связано
с такими более серьезными причинами,
как необходимость естественного отбора
на уровне семей. Возможно, что
потребность в половом размножении,
расселении и отборе наиболее
приспособленных семей носит
периодический характер. Численность
семьи у полигинных Polistes достигает
20 000 особей (тогда как у тропических
моногинных Polistes-лишь около 200), и
у них выработалась способность
к обмену информацией, необходимому
для того, чтобы стимулировать
образование роя (Jeanne, 1981).
Враждебность между матками Vespula
germanica возникает только в тех случаях,
когда они выходят из диапаузы после
прохладной зимы; Spradbery (1973b)
отмечает, что на Тасмании, где зимы теп-
лые, матки относятся друг к другу друже-
любно и образуют гигантские семьи.
Род Bombus сходен с Polistes тем, что в
нем тоже известны виды (хотя их
относительно немного), которые
в тропиках образуют полигинные семьи
(например, В. atratus), хотя, кроме того,
самки основывают семьи и в одиночку
(Sakagami, 1967а). Для рода Apis
характерны моногинные семьи, а вид
Apis mellifera, распространенный по всему
земному шару, как в тропиках, так и в
умеренных областях, повсеместно
является строго моногинным. То же
самое можно сказать о Meliponini, у
которых репродуктивные самки
находятся в запечатанных ячейках, пока
не наступит время для соревнования
между ними или не будет найдено место
для нового гнезда. Очевидно, одна матка
со значительными возможностями
к экспансии может обеспечить семье все
необходимое количество яиц, а слишком
крупные семьи невыгодны-целе-
сообразнее разделяться и расселяться.
В то время как для ос моногиния-это
один из факторов, позволяющих им
проникнуть в умеренные зоны, для
муравьев эта проблема не связана
с климатом. Моно- и полигинные
муравьи встречаются во всех областях
земного шара; иногда полигинным
бывает даже один из видов-двойников
или же полигиния образует пятно
в популяции, которая в целом
моногинна. У моногинных видов
крылатые самки способны находить
новые места и основывать новые семьи в
одиночку, за счет собственных резервов;
они могут поэтому выступать в роли
первопроходцев, осваивая новые
местообитания, в частности начальные
стадии сукцессий. Полигинные формы
могут повысить плодовитость уже
существующей семьи быстрее, так что
она растет и расселяется, но поскольку
самки зависят от неспособных летать
рабочих особей, они все время
вынуждены передвигаться по земле.
Семьи 279
Таким образом, если у моногинных форм
самка независима, самостоятельна
и способна проникать в новые
местообитания по воздуху, то
у полигинных форм самки зависят от
рабочих особей и ограничены в своем
распространении теми новыми
местообитаниями, до которых рабочие
могут добраться по земле. Однако пешее
передвижение дает им важное
преимущество, так как в плотно
заселенных местах рабочие могут
испытывать и оценивать интенсивность и
природу конкуренции и затем, если будет
нужно, покидать эти места. Одни идут на
риск, а другие действуют осмотрительно.
В идеальном случае вид оставляет за
собой обе возможности, используя ту или
другую в зависимости от обстоятельств,
подобно тому как растения производят
семена (моногиния) и распространяются,
образуя корневища (полигиния).
Накапливается, однако, все больше
данных о том, что один и тот же вид
часто дивергирует по этим признакам,
т. е. происходит экологическое
разделение его на виды-двойники, один
из которых распространяется по воздуху,
а другой-по земле, один захватывает
свободные участки, а другой медленно
пробивается в занятые местообитания.
Приведем теперь несколько примеров.
14.2.1. Два вида Pseudomyrmex
В тропических районах Америки оба вида
живут в стеблях Acacia', у одного,
Pseudomyrmex ferruginea, в семье бывает
по одной самке, а у другого,
Р. venefica- по многу (Janzen, 1973)-.
Самцы Р. ferruginea собираются около
какого-нибудь хорошо заметного дерева,
к которому примерно в полночь
слетаются самки, тогда как самцы
Р. venefica не собираются вовсе,
а обследуют листву деревьев за
несколько часов до рассвета в поисках
привлекающих их самок. У обоих видов
копуляция происходит только один раз: у
Р.ferruginea-на земле около дерева, у
которого собираются самцы,
а у Р. venefica-на „брачном" дереве.
Затем самки обламывают свои крылья и
начинают передвигаться по земле. Ни
один из этих видов не летит на поиски
нового места. Самки Р. ferruginea ищут
молодые растения акации и часто уходят
за сотни метров от места сборища; успех
этих поисков может в значительной мере
зависеть от того, устроят ли самцы свое
сборище а подходящем месте. В отличие
от этого самки Р. venefica стараются
вернуться обратно на свое собственное
дерево, но могут встретить
сопротивление со стороны рабочих
особей, которые не дают им войти через
существующие отверстия и не позволяют
проделать новые отверстия. После
нескольких попыток самки падают на
землю и начинают искать новые побеги,
а не проростки. Ясно, что самая важная
проблема состоит для них в том, примут
их обратно рабочие особи или нет;
факторы, от которых это зависит,
неизвестны, но, вероятно, здесь играет
роль численное отношение рабочие/самки
в семье, а также генотип молодой самки.
У Р. ferruginea самки настроены очень
враждебно друг к другу и вступают в
драки из-за проростков акации, которые
они не хотят использовать совместно,
даже временно. Рабочие особи тоже
проявляют агрессивность по отношению
к любой самке, кроме собственной
матери, и к рабочим из любой другой
семьи; при схватках они кусают друг
друга и мажут ядом. В тех местах, где
кроны акаций, разрастаясь,
перекрываются, между семьями часто
происходят беспощадные побоища.
В отличие от этого самки Р. venefica не
пытаются устраивать гнезда
в проростках; у них выработалось иное
поведение: они отыскивают корневые
280 Г.шеи 14
побеги на растениях, размножающихся
вегетативно. Рабочие особи Р. venefica
относятся гораздо менее враждебно не
только к другим насекомым, но и к
чужим особям своего вида; если
в результате роста кустов, на которых
живут эти муравьи, они встречаются с
представителями другой семьи, то они не
конфликтуют, а просто смешиваются и
сливаются в единую группу.
Семьи Pseudomyrmex ferrugineus медленно
растут в своих проростках, но
обеспечивают им полную защиту от
других насекомых, повышая тем самым
вероятность быстрого возобновления
ресурсов, необходимых самим этим
муравьям. Зрелые семьи, в которых
бывает до 30000 рабочих особей,
производят самцов, когда численность
взрослых особей достигает 1-2 тысяч, а
затем производят как самцов, так
и крылатых самок. Самка и рабочие,
которые живут в особенно крупных
полых колючках акации, переселяются в
новые колючки примерно трижды в год;
их нельзя считать полностью оседлыми.
Самка перед этой миграцией прекращает
откладку яиц, так что она может легко
передвигаться и проникать в новые
колючки. Рабочие особи сопровождают
ее и могут даже переходить по земле от
одного дерева к другому. Это, конечно,
рискованно: если самку съест
какая-нибудь птица, то вся семья
погибнет, так как рабочие особи не
принимают новую самку и не
выращивают заместительницу, а остатки
семьи в течение некоторого времени
производят самцов. Семьи Р. venefica
растут быстрее, повышают свой
репродуктивный потенциал, принимая
обратно самок и перетаскивая с места на
место яйца, и они способны поспевать за
более быстрым ростом дерева, в котором
обосновались, хотя защищают его менее
активно. Границ между территориями
разных семей у них нет, поэтому
численность отдельной семьи определить
невозможно; Janzen считает, что на
нескольких тысячах старых деревьев
акации могут мирно существовать четыре
миллиона муравьев. Хотя между семьями
нет преград, они способны образовывать
секции без самок, в которых обитает
несколько сотен рабочих, выращивающих
половых особей.
Кроме rot о. как отмечает Janzen, самки у
этих двух видов различаются по
размерам, а также по поведению. Самки
Pseudomyrmex ferrugineus -хорошие
летуны с сильно развитыми крыловыми
мышцами, которые они используют в
качестве пищевого резерва в период
основания семьи. Их жвалы тоже очень
мощны и легко прогрызают колючку.
Очевидно, размеры и сила, в частности
развитие крыловых мышц и жвал,
способствуют успеху. Самки Р. venefica
мельче и слабее, и их успех определяется
такими более тонкими свойствами, как
способность привлекать брачных
партнеров, умиротворять
рабочих-привратниц и получать от
рабочих особей корм. Это дает им
возможность откладывать больше яиц,
производить больше рабочих
и оказывать влияние на рост
и воспроизведение семьи. Мало вероятно,
что рабочие особи в самом деле
оценивают способность самки к откладке
яиц, но вполне возможно, что
какой-нибудь сцепленный с этим признак
(например, уровень активности и энергии,
покорность и привлекательность),
коррелятивно связанный с пригодностью
к роли производительницы, периодически
подвергается оценке. Распределение
самок Р. venefica по величине
бимодально, и Janzen заметил, что
мелким самкам легче вторично
проникнуть в свои колючки, чем более
крупным (рис. 14.1). Такого рода
распределение по величине встречается у
муравьев нередко, причем более мелкие
Семьи 281
Рис. 14.1. Ширина груди у репродуктивных
самок (А) и у маток (Б) Pseudomyrmex venefica,
обитающих в колючках акации. (Janzen, 1973.)
самки всегда очень близки по размерам к
самым крупным рабочим особям; их
называют „микрогинами".
Итак, эти два обособленных вида живут
оба в тропическом поясе Нового Света в
колючках акации, но не скрещиваются
друг с другом; собственно, скрещивание
между ними невозможно-настолько
сильно они различаются по своей
биологии и по местообитаниям. Один
вид живет на акации, размножающейся
семенами, а другой-на акации,
размножающейся вегетативным путем
(с помощью корневых побегов).
Соответственно у каждого из этих видов
выработался способ размножения,
аналогичный способу размножения
растения-хозяина: в первом случае это
расселение в одиночку крупных,
перегруженных резервными веществами
самок-основательниц, во втором -
расселение отводками, состоящими из
мелких самок и рабочих особей, без
которых эти самки не могут обойтись.
Janzen указывает, что сами эти растения
встречаются в различных, хотя
и в значительной степени
перекрывающихся местообитаниях:
растения, которые размножаются
семенами, предпочитают более влажные
места, чем те, которые размножаются
корневыми побегами.
14.2.2. Виды Myrmica
11ары специализированных сходным
образом видов-двойников широко
известны у муравьев, хотя они обычно
бывают приспособлены к менее
специфичным местообитаниям, чем те,
которые мы только что рассмотрели.
Одна такая хорошо изученная пара-это
две формы Myrmica ruginodis, которые
можно считать видами-двойниками. У
одной формы (macrogyna, М) обычные
самки, способные в одиночку основать
семью и образующие перманентные
группы, в которые входит до шести
самок. У другой (microgyna, т)-
мелкие самки, или микрогины,
неспособные самостоятельно основать
семью, так что они отделяются
в сопровождении рабочих особей. Их
семьи расселяются путем почкования и
время от времени принимают новых
282 I .шва 14
самок. М производят „нетерпимых4'
рабочих особей, которые не примут
новую самку, даже если у них нет своей;
т толерантны и легко смешиваются с
представителями своего вида, но не
допускают к себе ни одну особь М. Для
М характерен аутбридинг; у них
происходит брачный лёт, часто на
скалистых хребтах, разделяющих
долины; самцы собираются у хорошо
заметных скал и деревьев, к которым
прилетают самки для копуляции. Эти же
места могут использовать и т, но они
большей частью копулируют поблизости
от гнезда и производят половых особей
лишь раз в несколько лет. Эта
периодичность в сочетании с ясно
выраженным предпочтением брачных
партнеров собственного вида
препятствует гибридизации (Brian, Brian,
1949, 1955).
Описанные репродуктивные различия
приводят к тому, что эти две формы
живут в разных стациях своего влажного
местообитания; обычно это верещатники
на кислых почвах (Elmes, 1978b).
Распространение М шире, и они могут
колонизировать многие совершенно
обособленные участки, как, например, в
центрах куртин вереска (Calluna vulgaris),
которые разрослись и покрылись мхом,
или на маленьких залитых солнцем
лесных полянках, тогда как т обитают в
таких местах, где растительность часто
выедается скотом. Elmes, обследовав 18
мест в Англии, в 14 из которых обитали
обе формы, нашел, что местообитания,
способные предоставить все необходимое
нескольким крупным семьям, заняты
видом М, а те, которые подходят для
многочисленных небольших, сильно
разбросанных секций, были заняты
видом т; эти последние стации были
более богаты злаками и регулярно
выедались скотом. Расселение этой
формы, несомненно, происходит органи-
зованно и при участии всего сообщества.
Эту пару видов рассматривали как
единый вид, потому что их нельзя
уверенно отличить друг от друга даже по
размерам самок; однако рабочие особи
распознают самок этих двух форм
(видимо, по запаху), хотя ширина головы
у них одинакова. Обе формы встречаются
вместе по всей палеарктической области
от Британских островов до Японии, так
что это не подвиды. Форма с мелкими
самками размножается в чистоте, а ее
рабочие особи лишь ненамного мельче,
чем у формы с крупными самками.
Вероятное объяснение состоит в том, что
форма т возникла в гнездах формы М,
основанных достаточно давно, чтобы в
них в результате мутаций и инбридинга
могла возникнуть микрогинная форма,
начавшая свое существование в качестве
социального паразита; в дальнейшем,
если местообитание может это
выдержать и если форма М вымирает,
форма т сменяет ее (Pearson, 1981;
Pearson, Child, 1980). Обследование Elmes
показало, что местообитания этого типа
привлекают к себе и другие виды
Myrmica, так что форме т приходится
существовать в условиях конкуренции,
которым хорошо соответствует их
расселение отводками. Таким образом,
создается впечатление, что у М. ruginodis
происходит симпатрическое
видообразование и притом непрерывно;
форма М адаптирована к жизни в местах
с постоянно изменяющимися,
эфемерными условиями, к которым
устремляются в одиночку ее самки, тогда
как форма т приспособлена
к стабильным местообитаниям,
в которые она расселяется, образуя
отводки. Редкость промежуточных форм
указывает, вероятно, на то, что они
находятся в смысле воспроизведения в
невыгодном положении по сравнению как
с М, так иски поэтому почти
полностью отметаются отбором.
Однажды был построен график
Семьи 283
Рис. 14.2. Рост личинок
после зимовки. Неко-
торые из них развились в
репродуктивных самок
(/), одна - в микрогину
(If), а некоторые-в
рабочих особей (ИГ). (По
данным Brian, 1955b.)
личиночного развития одной микрогины
(рис. 14.2). У этой особи наблюдалось
несколько остановок роста, однако ее
размеры все же превысили обычные для
личинки рабочей особи, хотя и не
достигли размеров, обычных для личинки
репродуктивной самки на решающей
стадии определения касты. Возможно
поэтому, что достаточно совсем простого
генетического изменения, влияющего на
рост личинки, чтобы из нее получилась
микрогина, а этого можно ожидать в
давно основанной популяции, которая
стала изолированной и размножается
путем инбридинга. Если только
микрогины смогут оставаться в семье,
где они возникли, или возвращаться в
нее, то, по-видимому, нет причин, почему
временный социальный паразитизм не
мог бы продолжаться бесконечно.
Myrmica rubra -вид, очень сходный
с М. ruginodis,-это настоящий
полигинный вид со средним числом
самок в семье, равным 16,
и отрицательным биномиальным
распределением их по весу тела
(рис. 14.3; Elmes, 1973). Отдельные самки
могут основывать семьи в одиночку, во
всяком случае в лабораторных условиях
(Brian, 1951), однако более вероятно, что
в природе они основывают семьи
небольшими группами, сопровождаемые
рабочими особями. У этого вида часть
молодых самок, несомненно,
возвращается назад в свою семью, а
возможно, принимаются также самки и
из других семей. Elmes (1973) обнаружил
обратную зависимость между числом
самок и их размерами, которая может
быть обусловлена перенаселенностью в
период их выращивания, генетически
детерминированным уменьшением их
величины в крупных, давно основанных
семьях или тенденцией принимать
обратно в гнездо мелких, но не крупных
самок (как у Pseudomyrmex venefica).
Таким образом, М. rubra в отличие от
пары видов М. ruginodis представляет
284 Г.ита 14
Рис. 14.3. Число самок,
имеющих данный сырой
вес, у Myrmica ruginodis
(А) и М. rubra (Б).
Графики показывают
резкое различие в весе
между микрогинами
(слева) и нормальными
самками (справа).
Прерывистыми линиями
показаны гипотетические
распределения внутри
общей бимодальной
кривой. Обратите
внимание на то, что мода
для нормальных самок
М. rubra меньше, чем для
нормальных самок
М. ruginodis, примерно на
1 мг, а для микрогин эта
разница даже несколько
превышает 1 мг; иными
словами, эти микрогины
очень мелкие-
фактически они
так малы, что не могут
производить рабочих
особей. (Elmes, 1975.)
собой один вид с обычными самками,
способный расселяться двумя способами:
во-первых, самки могут улетать
и основывать новые семьи без
посторонней помощи; во-вторых, семья
может пополняться молодыми самками и
отпочковывать отводки, которые по мере
созревания обособляются и становятся
самостоятельными семьями. М. rubra
производит большое число микрогин, так
Семьи 285
что иногда в семье их может быть много
наряду с обычными самками.
Поодиночке микрогин никогда не
находили (Elmes, 1976), и они,
по-видимому, не в состоянии создавать
жизнеспособные семьи. Одна из причин
этого-то, что микрогинам трудно
производить рабочих особей:
откладываемые ими яйца не
детерминированы к развитию в рабочих,
и они не могут регулировать
выращивание расплода рабочими. Таким
образом, микрогины обречены
существовать как паразиты особей
нормального типа.
Этим дело не кончается. У другого вида
Myrmica-М. sabuleti-йсхъ социальный
паразит, не имеющий касты рабочих
особей; это M.hirsuta, которого раньше
считали спорадической микрогиной.
Более того, возможно, что все не
имеющие рабочих социальные паразиты,
объединяемые теперь в род Sifolinia,
возникли таким образом, поскольку этот
род морфологически очень близок
к Myrmica (Elmes, 1878а). Это,
по-видимому, логическое следствие
преимущественного принятия в семью
мелких самок, как у Pseudomyrmex
venefica. Им может оказаться трудно
производить рабочих особей, и они
превращаются в социальных паразитов.
Микрогинная форма М. ruginodis,
способная вести относительно
независимое существование, несомненно,
представляет собой исключение.
Полигиния может выродиться
в социальный паразитизм и привести к
вымиранию в результате
сверхспециализации.
Принадлежащие к тому же подсемейству
часто встречающиеся роды Leptothorax и
Monomorium содержат полигинные виды,
но такие процветающие роды, как
Tetramorium, Solenopsis и Pheidole, а также
все Attini обычно моногинны.
У завезенного в Северную Америку
огненного муравья Solenopsis invicta, как
теперь известно, кое-где встречаются
полигинные семьи. В одной особенно
большой семье с 20 000 осемененных
самок (Glancey et al., 1975, 1976)
проявлялись признаки инбридинга,
о котором свидетельствовала высокая
доля диплоидных самцов: у 96%
изученных самцов семенников не было
или они были развиты слабо, а сперма
отсутствовала, тогда как в обычных
семьях с гаплоидными самцами
стерильность самцов составляла менее
1%. Несомненно, этот инбридинг вел и к
полигинии. Увеличение доли диплоидных
самцов совместимо с гипотезой о том,
что пол определяется генами, лежащими
в одном половом локусе, хотя в данном
случае у вида Solenopsis, завезенного из
Южной Америки, могла резко
уменьшиться генетическая изменчивость,
так что некоторые семьи могли стать
гомозиготными по нескольким главным
локусам, определяющим пол (Crozier,
1971). В штате Миссисипи найдено 15
полигинных семей (от 3 до 63 самок), а в
штате Джорджия их было больше; 90%
самок были осеменены и откладывали
яйца, хотя и не в таком количестве, как
нормальные крупные физогастрические
самки моногинных семей (Fletcher et al.,
1980). Полагают, что полигиния у этого
вида усиливается; по всей вероятности,
когда он впервые попал в Северную
Америку, в его семьях было по одной
самке.
14.2.3. Dorylinae и Formicinae
Rettenmeyer и Watkins (1978), специально
занимавшиеся группой Dorylinae
в Америке и изучившие 144 вида этого
подсемейства, обнаружили лишь один
вид, в семьях которого было более одной
самки,- Neivamyrmex carolinensis с числом
самок от 3 до 13. По мнению этих
авторов, полигиния может быть полезна
286 Г.шва 14
муравьям при их подземных миграциях в
климате с резкими сезонными
изменениями, но существует много видов
подземных Dorylinae, которые не
полигинны.
Среди Formicinae многие роды строго
моногинны (например, Oecophylla), но в
других родах (например, Lasius) есть
виды, образующие кое-где полигинные
семьи, а есть и целиком полигинные
виды. В семьях Lasius sakagami, по
морфологии и поведению очень близкого
к L. niger, от 0 до 309 самок (Yamauchi et
al., 1981). L. sakagami копулируют
в гнезде или около него, но крылатые
самки появляются не каждый год,
в отличие от L. niger. Самки L. sakagami
либо возвращаются в гнездо, либо
улетают (в последнем случае,
по-видимому, при низкой плотности) и,
подобно L. niger, начинают строить новое
гнездо. Самки L. sakagami менее
плодовиты, но их рабочие особи
толерантны к ним и принимают их
обратно в гнездо. В результате семьи у
этого вида сильно разрастаются
и содержат миллионы, а не десятки тысяч
особей. Местообитания L. sakagami очень
ограниченны: эти муравьи жувут на
песчаной почве со скудной травянистой
растительностью и строят подземные
гнезда, которые в отличие от гнезд
L. niger устойчивы к затоплению (ср.
L.flavus). L. niger гораздо более
эвритопный вид. Таким образом,
L. sakagami сохраняет способность как к
моно-, так и к полигинии (подобно
Myrmica rubra), тогда как L.niger- строго
монотипный вид.
14.2.4. Род Formica
Этот род очень интересен с точки зрения
числа самок в семье. Экологически
наиболее примитивный вид Formica fusca
совершенно независим от других, но
наряду со своими близкими родичами
(например, F. rufibarbis, F. neogagates)
служит хозяином многим муравьям из
группы F.rufa, а также муравьям-
рабовладельцам F. sanguinea и
Polyergus rufescens. Сам муравей
F. fusca -олигогинный вид в Европе
(Pamilo et al., 1978, 1979), а в Японии
варьирует от моногинного вблизи Токио
до перманентно полигинного в другой
части Японии (Higashi, 1979) С
У моногинной формы наблюдается
сезонная полигиния, создаваемая
в результате возвращения в конце лета в
семью недавно спарившихся самок
(Kondoh, 1968). По окончании зимы этих
самок изгоняют, часто с группой рабочих
особей, чтобы они основали новые
гнезда, и все же с приближением
следующей зимы их могут вновь принять
назад. Эта сезонная полигиния
напоминает полигинию, наблюдаемую у
некоторых тропических Polybiini. Давно
известно, что в Северной Америке семьи
F.pallidefulva могут быть как моно-, так и
полигинными (Talbot, 1946; обсуждение
см. Holldobler, Wilson, 1977b, р. 13).
Особенно интересна группа видов
F. microgyna, у которой бывают только
микрогинные самки, закладывающие
новые семьи путем временного
социального паразитизма
и использующие F.fusca, F. neogagates и
F.pallidefulva в качестве хозяев. Вид
F. microgyna широко распространен
и варьирует по хетотаксии, но не
обладает другими хорошими
диагностическими признаками (Letendre,
Huot, 1972). Не произошел ли он от
какого-то хозяина вроде F.fusca! Ряд все
возрастающей зависимости от хозяина
завершает вид F. talbotae-ae имеющий
рабочих особей социальный паразит,
1 В настоящее время дальневосточная форма,
обитающая, в частности, в Японии, рассматри-
вается как самостоятельный вид F.japonica-
Прим. ред.
Семьи 287
который даже еще мельче и имеет больше
волосков, чем типичная F.microgyna (Wil-
son, 1976с). Он использует в качестве
хозяина F.obscuripes (из группы F.rufa)',
нет нужды подчеркивать параллелизм
с Myrmica hirsuta.
В группе F. rufa имеются разнообразные
виды-от моногинных до полигинных.
Сам вид F. rufa представлен моногинной
формой на Европейском континенте
(Collingwood, 1979), но олигогинной-в
Англии1 1. Морфологически близкий
к нему вид F.polyctena ограничен
материком, и в его колонии,
объединяющей 50-100 гнезд на площади
в 30 га, может быть тысяча и более
мелких самок (Raignier, 1948). Этот вид
легче принимает новых самок поздней
осенью или ранней весной, а также сразу
после того, как от семьи начал
отпочковываться зачаток новой семьи
(Elton, 1958). Вопрос о том, существуют
ли семьи, несомненно защищающие свои
территории, вызывает разногласия;
защита муравьями своих границ,
по-видимому, зависит от плотности
популяции и от истории локального
местообитания. Mabelis (1979а) подробно
описывает схватки, возникающие при
защите границ, и указывает, что они
особенно часты весной, когда семьи
вновь устанавливают свои территории
после зимней спячки. Разделение семьи с
образованием одного или двух новых
гнезд за раз может занять больше месяца
и обычно начинается под действием
таких неприятных факторов, как
затенение, обнаружение того, что гнездо
находится недостаточно близко к центру
данной территории, или вторжение
других видов (Mabelis, 1979b). Рабочих
особей и расплод переносят при этом
взад и вперед, но в среднем большая
часть семьи переходит в новое гнездо;
1 В СССР найдены полигинные семьи F. rufa-
Прим. ред.
самка либо переходит сама, либо ее
переносят, но уничтожение самок
хищниками у полигинных видов не
приводит к таким катастрофическим
последствиям, как у моногинных.
Процент выживающих гнезд не очень
велик; по данным Klimetzek (1981),
обновляется от 8 до 32% гнезд. Welch
(1978) выявил значительное обновление
гнезд F. rufa в Англии.
У Formica opaciventr is -одного из
представителей группы exsecta
в Северной Америке t-новые семьи
образуются путем почкования (Scherba,
1964); F. exsecta в Польше-полигинный
муравей, которого много лет подробно
изучал Pisarski (1973)2. Семьи F.pratensis
в Евразии по большей части моногинны,
но в Сибири иногда их гнездо состоит из
центра, который окружен территорией,
перерезанной отходящими от центра
тоннелями, куда направляются рабочие и
где они ожидают сигналов,
мобилизующих их на поиски пищи; в
определенное время года эти
находящиеся в тоннелях группы
приобретают собственных самок
и отделяются (Резникова, 1979). В части
ФРГ и в Нидерландах этот вид
полигенен и обитает в тенистых лесах, в
связи с чем половое созревание наступает
у него позднее, чем в моногинных
семьях, живущих на открытых местах;
эти различия в сроках созревания
снижают частоту скрещивания между
разными семьями (Collingwood, 1979).
Вид F. lugubris в Ирландии моногинен
или слегка полигинен, с несколько
чрезмерно разбросанными гнездами,
существующими по 23-38 лет (Breen,
1 Палеарктические виды Coptoformica („группа
F. exsecta" по терминологии автора) не род-
ственны неарктическим видам из группы F. ех-
sectoides.
2 Писарский обнаружил в Польше две формы
F. exsecra-полигинную и моногинную.-77рил1.
ред.
288 I .idea 14
1977). Особенно большой комплекс гнезд
был найден в лесах Юры
(Франция-Швейцария) на высоте более
1300 м, где с октября до конца мая лежит
снег и ежегодно выпадает около 2 м
осадков, а среднегодовая температура
всего 4-5°С. Этот комплекс занимает
площадь 70 га, и в него входит 1200
гнезд, обитатели которых настроены
враждебно по отношению к другим
полигинным группам на их границах
(Cherix, 1980; Cherix, Gris, 1977). Столь
же обширный комплекс Formica truncorum
известен в Японии; в этой колонии
рабочие особи тоже совершают переходы
(или их переносят) от одного гнезда к
другому, но отдельные особи лишь в
редких случаях проходят больше 4 м
(Higashi, 1976, 1978).
Популяционная генетика европейских
видов Formica изучалась методом
изозимного анализа (Pamilo et al., 1978).
Географическая изменчивость у такого
вида, как F. sanguinea, очень
незначительна, но у полигинного лесного
вида F. aquilonia, имеющего разорванный
ареал, один и тот же локус содержит в
Финляндии и в Шотландии разные
аллели; то же самое обнаружено
у F. lugubris. Различия между локальными
популяциями обычно невелики: 5,1% у
Fpolyctena, до 24,7% у F.fusca, хотя у
F. aquilonia они превышают 50%. Генное
разнообразие очень мало-0,043
в отличие от 0,150 у диплоидных
насекомых (Pamilo et al., 1978, цит. по
Selander, 1976), что, несомненно,
обусловлено элиминацией рецессивных
субвитальных генов у гаплоидов; это
приносит пользу, устраняя вредные
последствия инбридинга, часто весьма
значительного у Formica.
В идеале отдельный вид должен
применять смешанную стратегию-иметь
достаточно крупных самок, способных
основать семью в одиночку, и наряду с
этим более мелких, которые могут
вернуться в основную семью
и отпочковаться, взяв с собой рабочих,
при наличии интенсивной конкуренции.
Возможно, что так обстоит дело
у Myrmica rubra. Однако чаще каждый
конкретный вид становится либо
моногинным, и самка улетает, чтобы
строить гнездо в одиночку, либо
полигинным, расселяясь в результате
роения (как у М. ruginodis). Не оказалась
ли смешанная стратегия неустойчивой в
эволюционном смысле? С этой дилеммой
сталкиваются многие цветковые
растения, которым приходится делать
выбор между рассеиванием семян
и вегетативным размножением; хотя
некоторые из них отдают предпочтение
одному или другому из этих способов,
есть и такие виды, которые сохранили
обе возможности и используют их в
подходящее время в подходящих
условиях (Harper, 1977). Многие виды
Formica выбрали иное решение: их самки
либо возвращаются в родное гнездо,
либо занимают гнездо другого вида и
расширяют свой ареал; самке никогда не
приходится основывать семью
в одиночку.
14.3. Взаимодействие между
самками и родственные
отношения между ними
Нет недостатка в данных о том, что у
моногинных видов самки настроены
враждебно друг к другу и что рабочие
особи наследуют эту враждебность,
проявляя ее ко всем особям, за
исключением родных и сводных сестер.
Благодаря этому семьи разделены
значительными промежутками.
14.3.1. Взаимоотношения
между самками
Враждебность между самками может на
время ослабевать; например, у Apis
mellifera и Formica fusca при замене
Семьи 289
старой самки молодой обе они некоторое
время сосуществуют. На стадии,
предшествующей роению, у медоносной
пчелы семья вновь временно становится
полигинной, но рабочие особи держат
самок вдали друг от друга, как это
бывает и во время деления семей у Eciton.
Во всех этих случаях рабочие действуют
заодно со своими самками и в их
интересах; недавно, однако, у рода
Leptothorax был описан интересный
случай терпимости рабочих особей
и враждебности самок (Provost, 1979,
1981). Если две семьи одного из
моногинных видов этого рода содержат в
лаборатории, так что между ними
имеется доступная той и другой арена, то
в 40% случаев одна из них начинает
двигаться в сторону другой, с тем чтобы
соединиться с ней; при этом сначала
переносятся расплод и рабочие особи, а
под конец самка. Пришлая самка сразу
вступает в схватку с „хозяйкой",
используя в качестве оружия не
мандибулы, а жало. Враждебность на
короткое время передается и рабочим
особям, которые хватают друг друга
мандибулами, но не делают попыток
ужалить, и драки между ними не бывают
смертельными. Затем рабочие в течение
длительного времени удерживают своих
самок (это напоминает „фиксацию"
молодых самок рабочими особями
Eciton). Обе они оказываются прижатыми
к субстрату, а потом одну из них (это
всегда бывает „пришлая" самка)
начинают медленно отпускать,
а „хозяйку" разрывают на части
и выбрасывают. Создается впечатление,
что активная группа завоевывает
пассивную. Рабочие смешиваются
и облизывают новую самку, но
неизвестно, привыкают ли они к двум
наборам запахов, которые они
различают, никак не проявляя этого, или
же эта новая самка выделяет феромон,
перекрывающий все другие запахи. У
Camponotus lateralis такое слияние семей
оказалось невозможным; если удаляли
одну самку, то слияние могло произойти
в половине случаев, если же удаляли
обеих самок, то семьи всегда сливались.
Эти эксперименты подчеркивают важную
роль самки в создании специфичности
семьи. При наличии самки семья
моногинного вида начинает защищать
свое гнездо и расплод, хотя
в лабораторных условиях она может
кормиться вместе с чужими особями на
общей арене.
Рабочие особи Apis mellifera заставляют
репродуктивных самок прекращать
драки; эти их действия известны под
названием „balling" (свивание в клубок),
и они нередко приводят к уничтожению
той матки, которую рабочие не хотят
признавать. Таким образом,
„запечатывание", „фиксация" или balling
может быть замедленным способом
нейтрализации и наконец уничтожения
самок, нежелательных для рабочих
особей. Мы уже упоминали
о соревновании между маткой и молодой
самкой у Trigona subnuda. Благодаря
участию рабочих особей весь процесс
протекает более активно, чем у Leptothorax.
Подобным же образом элиминируется
избыток репродуктивных особей
у термитов. После удаления
экспериментатором пары
особей-основателей наступает фаза
замещения, во время которой
производится очень большое число
замещающих особей. Между ними
возникают схватки, подробно описанные
Liischer (1974); тех термитов, которые
при этом бывают ранены, рабочие особи
приканчивают, так что в конечном счете
остается одна пара, принимающая на
себя репродуктивные функции.
У термитов описано также несколько
примеров слияния семей в природе; при
этом после объединения двух семей одну
из репродуктивных пар уничтожают, так
290 Глава 14
же как самку у Leptothorax. По крайней
мере у одного термита, Nasutitermes
comiger, хотя это в общем монотипный
вид, наблюдается факультативная
полигиния. В его семье может быть от 2
до 22 первичных самок (и самцов),
которые мирно живут в многокамерном
репродуктивном комплексе и все
откладывают яйца. Как и у муравьев, эти
полигинные семьи образуются
в результате объединения отводков по
инициативе самок, однако возможно и
кооперативное основание семей. Thome
(1982) обнаружил такие полигинные
семьи в районах Панамы
в восстанавливающемся вторичном лесу.
Очень интересные взаимоотношения
существуют между самками
у полигинных видов. У Camponotus
herculeanus каждая самка имеет в гнезде
собственную территорию (Holldobler,
1962). То же самое наблюдается у Bombus
atratus (Sakagami el al., 1967a). Там, где
нет такой территориальности, следовало
бы ожидать иерархической структуры,
основанной на доминировании. Скорее
всего, это выражается в не слишком
явной форме, и на положение данной
особи в иерархии указывает та зона
гнезда, в которой она находится,
очередность в получении пищи
и взаимоотношения с расплодом, как,
например, у полигинной осы Metapolybia.
В семьях Leptothorax curvispinosus число
самок может достигать трех; они,
по-видимому, относятся друг к другу
дружелюбно и вместе откладывают яйца,
но в каждой из двух групп, изученных
Wilson (1974а, Ь), одна из самок
относилась к собственным яйцам гораздо
более заботливо, чем к яйцам двух
других самок! Эта верховная самка „как
бы случайно" раздавливала и поедала
яйца других самок, а также рабочих
особей, и можно было видеть стычки
между ними из-за этих яиц, хотя рабочие,
по-видимому, сами никогда их не едят.
Большую часть пищи самок составляет
содержимое зоба рабочих особей,
которое те им отрыгивают; кроме того,
самки дополняют свой рацион
веществами, которые они берут изо рта
личинок. Рабочие, не имевшие корма,
который они могли бы предложить
самкам, избегали их или даже спасались
от них бегством; они, по-видимому,
узнавали самок, ощупывая их головы
своими усиками. Быть может, эти самки
занимали слишком низкое место в ряду
по степени предпочтения со стороны
рабочих особей. Wilson не мог найти
никаких указаний на то, что самки
узнавали друг друга, хотя они явно
отличали чужие яйца от своих
собственных. Те случаи, когда верховной
самке удавалось уничтожить яйца других
самок, можно рассматривать как случаи
функциональной моногинии,как,
например, у Myrmecina graminicola
(Baroni Urbani, 1968). Сходные ситуации
были обнаружены у рода Formicoxenus и
у вида Leptothorax gredleri (Biischirtger,
1979). У Lasius sakagamii-полигинного
вида, близкого к L. niger,- самки
скапливаются в густо населенных зонах
гнезда, отведенных для выращивания
расплода, но в каждой такой зоне они
обычно занимают разные камеры;
только в период, когда происходит набор
новых дочерних самок, в каждой камере
может находиться больше чем по одной
самке (Yamauchi et al., 1981).
Изучение взаимоотношений между
самками у Myrmica rubra показало, что
хотя их в среднем бывает по 16 на семью
(с диапазоном колебаний от 0 до более
чем 70; Elmes, 1973), они не образуют
скоплений, если не считать весны, когда
они выходят наверх, чтобы согреться. У
самок бывают „индивидуальные участки"
(но не настоящие территории), в пределах
которых они живут; самки сильно
различаются по подвижности-одни
ведут в основном сидячий образ жизни,
Семьи 291
Рис. 14.4. Перемещения
самок Myrmica rubra
в узкостенных садках в
лаборатории.
Передвижения самок
регистрировались
в течение 30 мин.
Обратите внимание на
обособление всех самок в
разных зонах и на
локальность их
перемещений. Самки
избегали друг друга
и иногда даже вступали в
драки. (Evesham, 1982.)
находясь все время в камере в глубине
гнезда, другие более активны, часто
поднимаются наверх и даже выходят на
поверхность почвы и убегают от гнезда
(рис. 14.4). Встретившись друг с другом,
такие самки вступают в короткую
схватку, действуя передними ногами и
усиками; изредка они пускают в ход
челюсти, но никогда не используют
жало. По-видимому, самки, ведущие
сидячий образ жизни, больше
привлекают к себе внимание рабочих
особей и откладывают больше яиц; им
оказывают предпочтение, их, вероятно,
лучше кормят, и можно сказать, что они
занимают в сообществе доминирующее
положение, проявляя минимум
агрессивности (Evesham, 1982). У этого
вида группы особей, лишь недавно
оставшиеся без самки, охотно
принимают самок из своей собственной
семьи и даже из чужих семей. Степень
предпочтения самки может быть
различной: если предложить муравьям
мертвую самку из другой семьи, то она
будет отвергнута и вынесена в камеру,
предназначенную для отбросов, тогда как
самку из той же семьи, хотя и мертвую,
муравьи вносят в гнездо и кладут на
расплод, т. е. принимают. Живые чужие
самки направляются в сторону камер с
расплодом, а рабочие особи могут либо
задержать их, либо позволить им
остаться и откладывать яйца. Этих яиц,
возможно, будет меньше, чем могла бы
отложить самка, принадлежащая к их
собственной группе, и их откладка не
обязательно заставит рабочих начать
откладывать кормовые яйца; фактически
они в таких условиях откладывают
значительную долю репродуктивных яиц
(Brian et al., 1981b; Winterbottom, 1981).
Таким образом, к этим самкам
проявляется терпимость, но они не могут
влиять на поведение рабочих особей и
косвенно воздействовать на функцию их
яичников. Группы рабочих, не имеющие
самки в течение многих недель, не
соглашаются принять даже самку,
принадлежащую к их собственной семье,
292 г. шеи 14
и относятся к ней, по крайней мере в
первое время, слегка враждебно, держа ее
в подчинении несколько часов или даже
дней. У некоторых муравьев такая
враждебность по отношению к самкам
может даже выйти за пределы гнезда,
распространяясь на окружающую
территорию через посредство рабочих
особей; это наблюдается, например, у
Lasius niger и L.flavus, которые оба
относятся весьма агрессивно к самкам
собственного вида (Pontin, 1961b).
Муравьи Pogonomyrmex, обнаружив на
своей территории самок, уносят их на
край гнезда, не причиняя им вреда, что
еще чрезвычайно любезно с их стороны
(Holldobler, 1976а)!
14.3.2. Степень родства между
самками
Кажется вероятным, что высокая степень
родства между самками (если, например,
они сестры) способствует их признанию
и дружественным взаимоотношениям в
гнезде. У Tetramorium caespitum самки
сотрудничают между собой только в том
случае, если они действительно
приходятся друг другу сестрами (Poldi,
1963). В ряде случаев меченых крылатых
самок обнаруживали впоследствии в их
родительском гнезде и даже
в близлежащих гнездах; это
наблюдалось, например, у Myrmica
sabuleti (Brian, 1972; Jones, личное
сообщение) и М. rubra (Elmes, 1973).
West-Eberhard (1969) и Klahn (1979)
показали, что у ос живущие вместе
самки - сестры, a Ross, Gamboa
(1981),-что самки ос предпочитают
объединяться с товарками по родному
гнезду и способны к этому даже после
пребывания в изоляции в течение 100
дней.
Metcalf и Whitt (1977а, Ь) на основании
анализа изозимов установили
существование сходной степени родства
между самками-основательницами
у Polistes metricus и обнаружили также
много других интересных черт их
общественной жизни. Семьи основывают
одна особь или две сестры (или
двоюродные сестры), каждая из которых
может копулировать дважды и получить
при этом смесь, в которой отношение
спермы от двух самцов будет составлять
9:1. Доминирующая самка производит
78% всех имеющихся в семье самок и
87% самцов, а остальных самок и самцов
производит подчиненная самка. Рабочие
особи редко откладывают яйца, если
самка жива; если же она погибнет, то
одна из рабочих особей занимает
доминирующее положение и откладывает
95% всех яиц. Инбридинг так редок, что
им можно пренебречь, и коэффициент
родства (г) между потомками
репродуктивной самки равен 0,66, если в
семье только одна самка, и 0,49-если их
две. Коэффициент родства между
репродуктивными самками и их матерью
равен 0,50, если это доминирующая
самка, и 0,32 - 0,36, если это подчиненная
самка; таковы же коэффициенты родства
самцов.
Гнезда, закладываемые двумя
самками-основательницами, лишь в 2,25
раза превосходили по успешности
развития гнезда, заложенные одной
основательницей, но приспособленность
доминирующей самки, оцениваемая на
уровне семьи, превосходит таковую
одиночной основательницы. Даже вторая
самка, хотя она присоединяется
к доминирующей самке и занимает
подчиненное положение, функционирует
не менее эффективно, чем если бы она
начинала устраивать гнездо в одиночку!
Тем не менее гнезда, в которых самок
две, имеют больше шансов на успех и
обычно терпят неудачу только в случае
гибели второй самки до того, как
рабочие особи в состоянии заменить ее;
самки гибнут от хищников или от
несчастных случаев, находясь вне гнезда.
Семьи 293
Metcalf и Whitt приходят к выводу, что
эти данные согласуются с объяснением
возникновения общественного образа
жизни на основе теории отбора родичей,
но причины объединения самок не ясны,
поскольку самки почти так же хорошо
справляются в одиночку.
Дополни гельную информацию дает
изучение рабочих особей и самок
в семьях, живущих в естественных
условиях, методом анализа изозимов'.
Pearson (1980) изучал две популяции
Myrmica rubra в соседних долинах; в
одной из них не было обнаружено
родства между самками, а в другой
самки находились в родстве в одном году
и не были родственны между собой в
следующем году-удивительный случай
изменчивости. У полигинного вида
Myrmecia pilosula самки родственны друг
другу примерно на уровне двоюродных
сестер, а родство между рабочими
особями весьма отдаленное (Craig,
Crozier, 1979). Частоты генотипов
в пределах каждой касты распределяются
в соответствии с законом
Харди-Вейнберга, т. е. позволяют
предполагать аутбридинг, не
сопровождающийся отбором.
В исследовании Crozier (1977),
проведенном на Aphaenogaster rudis,
однажды осемененная самка и ее
потомки-рабочие оказались родными
сестрами, а самцы происходили от самки
1 При этом методе фактически выясняется не
степень родства, а степень сходства геномов,
определяемая путем анализа изозимного соста-
ва изучаемых локусов. Отсюда и необычные вы-
ражения вроде „самка и ее дочери являются се-
страми". При гапло-диплоидном определении
пола генетическое сходство между матерью и
дочерьми теоретически должно быть 0,5, между
сестрами-0,75 (так как одна хромосома, полу-
ченная от отца, у них всегда одинакова), а ме-
жду двоюродными сестрами-0,375. Но факти-
ческое сходство может быть и выше, если
генотипы матерей и отцов сходны,-Прим. ред.
или (если самки не было) от рабочих
особей. У одной из форм Iridomyrmex
purpureus (Dolichoderinae), у Rhytidoponera
chalybaea и еще у одного вида (два
последних вида-моногинные) рабочие
особи приходятся друг другу родными
сестрами (Crozier, 1980); у полигинного
вида Rh. impressa рабочие особи связаны
менее близким родством.
При изучении у муравья-«рабовладельца»
Formica sanguinea в Финляндии одного
ферментного локуса, кодирующего
малатдегидрогеназу, было обнаружено
расщепление по четырем содержащимся в
нем аллелям (Pamilo, Varvio-Aho, 1979).
Моногиния в данном случае исключается,
так как 75% самок гетерозиготны (против
ожидаемых 35%) ив 10 из 92 гнезд
обнаружены рабочие особи, относящиеся
к трем или четырем различным
генотипам. Цитированные авторы
полагают, что в каждом гнезде яйца
откладывают несколько самок, связанных
между собой родством; возможно, это
пары мать - дочь, причем большую часть
яиц откладывает мать. Каждая самка
копулирует один раз. Географическая
изменчивость у этого вида
незначительна, и только 2,4% всей
изменчивости относится
к межпопуляционной. Методы
разделения белков позволят расширить
подобные генетические исследования.
Они дадут возможность изучать
родственные связи и механизмы,
используемые в сообществах.
Таким образом, организация
общественных насекомых в „семьях"
выражается в весьма разнообразных
формах-от строго семейной моногинной
группы до гораздо более рецептивной
полигинной группы с низким
коэффициентом родства между особями.
Группа первого типа-это прежде всего
приспособление для расселения, и она
регулирует плотность популяции при
помощи разного рода механизмов,
294 Г. шва 14
связанных с территориальностью, хотя
такая организация, несомненно,
сдерживает социальных паразитов
и других врагов. При высоких
плотностях популяции самки- или
пары-основательницы могут
объединяться и регулировать
производство яиц путем установления
доминирования. Там, где утверждаются
такие полигинные группы с циклическим
замещением самок, между самками
сходного типа существует определенная
система разделения, и это, вместе со
способностью рабочих особей выбирать
и регулировать плотность самок,
приводит к созданию популяции,
экономически соответствующей
имеющимся ресурсам. Сведений
о деталях используемого для этого
механизма и о том, насколько
эффективно он поддерживает наилучших
производителей, пока еще мало, однако
нет сомнений, что общественная
организация насекомых зависит от
условий среды. Накапливается все
больше данных в пользу того, что
разведывательная моногинная группа по
мере ее закрепления может перейти в
полигинное состояние, сопряженное
с конкуренцией.
Глава 15
Сравнительная экология видов,
принадлежащих к одному роду
Виды, выделяемые систематиками,
обычно различаются по образу жизни.
Многие из таких „видов", если
применить к ним цитологические методы,
т. е. изучить их хромосомы, или
биохимические методы, т. е. исследовать
их аллозимы или феромоны, окажется
возможным разделить на виды-двойники.
Однако в полевых условиях эти методы
применять трудно, поэтому таких
сравнительных исследований еще очень
мало. В нижеследующем обзоре мы
будем по возможности начинать
с описания взаимоотношений между
подвидами, способными скрещиваться
между собой, а затем переходить
к видам-двойникам и видам,
принадлежащим к одному роду.
15.1. Расы муравьев
и термитов
Изучение хромосом до недавних успехов
в разработке методов их окрашивания
было довольно ограниченным. Кроме
того, даже при обнаружении различий
между особями никогда нельзя
исключить возможность того, что мы
имеем дело с единым видом, но
подверженным цитологической
изменчивости (Crozier, 1968).
В результате исследования 105
австралийских видов муравьев было
установлено, что гаплоидное число
хромосом варьирует от 3 у Ponera scabra
до 42 у Myrmecia brevinoda (при моде 11 и
медиане 15). Какое состояние следует
считать примитивным, сказать
невозможно, однако Imai et al. (1977) на
основании своего анализа пришли
к выводу, что эти различия обусловлены
не полиплиодизацией, а в основном
расщеплением или слиянием отдельных
хромосом. По-видимому, между
кариотипической эволюцией данного
вида и его морфологической
примитивностью или продвинутостью
нет или почти нет корреляции.
Число хромосом может варьировать у
разных рас одного таксономического
вида. В смешанных лесах восточной
части Северной Америки Aphaenogaster
rudis (Myrmicini) образует моногинные
семьи, устраивающие гнезда под
камнями, в почве или поваленных
деревьях. Окраска этого вида подвержена
изменчивости: в Аппалачах муравьи
темно-коричневые, а на прибрежной
равнине - красновато-коричневые.
В одном месте в предгорьях, где эти две
формы встречаются на расстоянии 1 км
друг от друга, Crozier (1977) обнаружил,
что у „равнинной" формы гаплоидное
число хромосом равно 20,
а у „горной"-22. Промежуточных форм
найдено не было. При изозимном
анализе тоже находили в большинстве
случаев различия в частотах эстераз и
малатдегидрогеназ и очень мало
указаний на обмен генами между двумя
формами. Очевидно, у этого вида
происходит симпатрическое образование
видов-двойников, живущих на разной
высоте, что определяет климатические
различия между их местообитаниями и
соответственно целую плеяду различий,
связанных с растительностью. На одной
из гор помимо типичной популяции с 22
хромосомами в гаплоидном наборе
существует, главным образом у вершины,
другая популяция-с 18 хромосомами. И
опять-таки промежуточных форм между
296 Г шва 15
ними нет. Там, где эти формы
встречаются совместно, они, по
имеющимся сведениям, строят гнезда в
разных местах: первая под камнями, а
вторая в поваленных деревьях, хотя такая
специфичность муравьям не свойственна.
Кроме того, они несколько различаются
по окраске и по изозимам. Самцы этих
двух форм образуют скопления
поблизости друг от друга и, судя по
результатам анализа аллозимов,
различаются по частотам аллелей. Таким
образом, эти две формы на самом деле
представляют собой два
самостоятельных вида, использующих
разные микроместообитания в одной и
той же области; но каким образом
достигается их экологическое разделение,
остается неясным, так же как неясен и
способ, с помощью которого они
избегают перекрестных копуляций
в общих местах скопления. Crozier
приходит к выводу, что расы с 18-20 и с
22 хромосомами репродуктивно
изолированы во всех местах, где они
встречаются вместе, и что это отдельные
виды, несмотря на сходство морфологии,
окраски и других фенотипических
признаков; очевидно, между ними
существуют какие-то важные
поведенческие различия. Другой заметно
отличающийся вид, Aphaenogaster fulva,
имеет 18 хромосом и, возможно,
идентичен по своему кариотипу
18-хромосомному A.rudis, но отличается
от него по составу аллелей. Быть может,
изучение кариотипов не всегда позволяет
выявить группы видов-двойников, однако
изучение большого числа локусов,
вероятно, поможет в этом.
Среди термитов у широко
распространенного суходревесного вида
Cryptotermes brevis (Kalotermitidae)
имеются физиологические расы,
различающиеся по способу замещения
репродуктивных особей после
экспериментального удаления из гнезда.
В Австралии (27° ю.ш.) образуется много
замещающих особей, а затем всех их
убивают, оставляя только одну;
в Северной Америке (27° с.ш.),
по-видимому, сначала, до того как
неотенические особи достигают половой
зрелости, имеет место избирательная
выбраковка (Lenz et al., 1982).
15.2. Муравьи пустынь
Пустыня предоставляет своим
обитателям пищевые ресурсы, количество
которых меняется во времени и которые
к тому же распределены в пространстве
„пятнами". Следовало бы ожидать, что в
этих условиях видам, относящимся
к одному роду, должно быть трудно
избегать друг друга, если только
физическое непостоянство и скудость
местообитания не будет препятствовать
возникновению контакта и конкуренции
между популяциями.
В пустыне Чиуауа на юго-востоке
Северной Америки два вида Novomessor
различаются тем не менее по биологии
питания и потребляемой пище.
У N. cockerelli насекомые (муравьи
и термиты) составляют половину пищи, а
у N.albisetosus-всего лишь 7%. Эти
муравьи поедают также семена
многолетних кустарников и злаков; при
этом N. cockerelli поедает меньше семян
Acacia и злаков, но больше семян
Prosopis (Whitford et al., 1980).
Многие виды американских муравьев
рода Pogonomyrmex живут в областях с
кислой почвой, поросших кустарником
или пустынных. Между некоторыми из
них, например Р. rugosus и Р. barbatus,
по-видимому, нет существенных
экологических различий; оба потребляют
семена и половых особей термитов, если
они доступны, причем в сходных
количествах: в июне семена злаков
составляют 60-70% всей пищи,
в июле-только 30-40%, а затем
в рационе возрастает доля других семян,
особенно Eriogonum. Для того чтобы
выявить какие-то иные, пока не
замеченные различия, нужны дальнейшие
исследования. Семьи этих двух видов
разбросаны случайным образом, без
видимых различий в выбираемых
местообитаниях, и даже устройство
гнезда у них одинаково-это
вертикальный ствол с камерами,
открывающийся в центре расчищенной
круглой площадки (Whitford et al., 1976).
Их дороги, хотя они и проходят по
одним и тем же территориям, никогда не
пересекаются, и контакты между
фуражирами, принадлежащими к разным
видам, редки, хотя муравьи иногда
сходят с дорог. Очевидно, эти два вида
избегают друг друга; те же самые виды в
пустынях Аризоны и Нью-Мексико,
поросших акацией и мескитовым
деревом, рьяно защищают свой
гнездовой участок и основные дороги.
С наступлением сумерек оба вида
прекращают фуражировку, хотя
Pogonomyrmex barbatus в более жаркой
техасской пустыне фуражирует по ночам
(Holldobler, 1976а). Нет ли в питании
этих двух видов различий, оставшихся
незамеченными? Третий вид, P.maricopa,
менее активен, поедаемые им семена
меньше различаются по величине,
территориальность выражена у него
слабее, и он заходит на территорию двух
других видов'.
В некоторых областях пустынь на
юго-западе Северной Америки по
крайней мере пять видов Pheidole могут
жить вместе. Три из них используют
дороги и прокладывают
видоспецифические следы (Р. militicida,
Р. tusconica и Р. rugulosa), а два других не
1 Различия в питании видов Pogonomyrmex,
обитающих совместно, подробно изучили Han-
sen (1978) и Davidson (1977) (обзор: Длусский,
1981а)-Прим. ред.
Сравнительная жо.юги.4 видов одного рода 297
используют дорог и их следы не
видоспецифичны (Р. desertorum
и Р. vallicola). Дороги не всегда
обособлены, иногда они пересекаются,
как, например, у Р. tusconica и Р. militicida,
но два последних вида пользуются ими в
разное время суток. Р. tusconica начинает
фуражировку утром, но прекращает ее
при температуре 33-36°С, а затем после
полудня, когда температура опять
снижается, вновь выходит из гнезда и
продолжает сбор корма примерно до 20
часов; Р. militicida фуражирует ночью.
Однажды наблюдали, как солдаты
Р. tusconica, сопровождавшие группу
рабочих, напали на фуражиров
Р. militicida, хотя в других случаях
муравьи, например Р. militicida
и Р. desertorum, избегают встреч в местах
пересечения их дорог. В целом создается
впечатление, что обитающие в пустыне
муравьи, которые не могут
распределяться по разным ярусам из-за
недостатка растительности и отсутствия
постоянных источников пищи,
распределяются в пространстве
благодаря своей территориальности и во
времен и-благодаря активности в разное
время суток и различиям
в температурных предпочтениях.
15.3. Муравьи и термиты
в грасслендах
Даже в травяном ярусе имеется
несколько зон, к которым могут
специально приспособиться
общественные насекомые; это корни,
поверхность почвы и травостой. Смене
грасслендов формацией кустарников
и лесной формацией могут
препятствовать разнообразные
травоядные животные; или же
грассленды могут сохраняться благодаря
таким факторам, как отсутствие воды и
непрерывные неблагоприятные
вмешательства со стороны человека
298 Г. шва 15
(особенно пожары, в частности
в саванне). Мы рассмотрим обе эти
ситуации.
Solenopsis представлен в Северной
Америке комплексом из шести видов;
два из них были интродуцированы в
южные районы США и распространились
там. Один из них, S. richteri („черный
огненный муравей"), прибыл сюда
в 1918 г. из Аргентины и Уругвая, а
второй-5. invicta („красный огненный
муравей“)-в 1933-1945 гг. из Мату-Гросу
(Бразилия). Ни тот, ни другой не
изменился по сравнению с исходными
южноамериканскими популяциями,
и скрещивание их происходит редко
(Lofgren et al„ 1975). В настоящее время
распространение S. richteri ограничено
северными частями штатов Миссисипи и
Алабама, тогда как S. invicta широко
распространился от Техаса до Северной
Каролины. Обычно в семье бывает одна
самка, а иногда две, и известна по
меньшей мере одна высокополигинная
семья. Предполагается, что S. invicta,
отличающийся агрессивностью,
в большинстве районов вытеснил
S. richteri благодаря своей большей
способности выслеживать и уничтожать
самок S. richteri, собирающихся основать
семью. S. invicta подавил также местный
вид S. xyloni, так как оба они обитали в
грасслендах; однако четвертый вид,
S. geminata, сохранился в лесных
местностях, хотя первоначально он тоже
обитал в грассленде. Тем не менее
S. xyloni не вполне вытеснен, так как
Baroni Urbani и Kannowski (1974) нашли
его в грассленде вместе с S. invicta-,
однако он живет здесь лишь на участках,
находящихся в тени деревьев, на которых
он фуражирует, избегая таким образом
встреч с S. invicta. Даже если
расставлялись приманки с целью
увеличить контакты между этими
видами, они все же избегали друг друга и
дело никогда не доходило до прямых
схваток. Семьи S. invicta агрегированы,
что вызывает удивление, так как этот вид
обычно моногинен и имеет четко
ограниченные территории; можно
предположить, что какие-то условия
среды варьируют здесь случайным
образом. Wilson (1978) провел
сравнительное изучение видов S. invicta и
S. geminata. Он измерял время,
затрачиваемое рабочими особями разных
размерных групп на выполнение всего
репертуара своих функций. Оба вида
полиморфны, но крупные рабочие особи
у S. geminata намного больше, чем у
S. invicta. У обоих видов самые мелкие
рабочие остаются в гнезде, тогда как
крупные переносят частицы почвы
и пищи, соответствующие им по
величине. У S. invicta крупные рабочие
особи пережевывают семена и запасают
жиры, а у S. geminata они заняты
исключительно дроблением семян; они
даже не нападают на добычу. В природе
S. invicta более всеядны, чем S. geminata,
которые поедают семена многих типов.
Мyrmica- голарктический род со
многими видами (рис. 15.1). Низкий
температурный оптимум (20°С) делает
его приспособленным к жизни в областях
с прохладным летом. Для развития
потенций репродуктивной самки
требуется по меньшей мере 6-недельное
воздействие температуры около 10°С в
зимнее время; поэтому на юге этот род
встречается только в горах. Пара видов,
обычная для невозделываемых
травянисто-вересковых пустошей
в Европе,- это М. ruginodis
и М. scabrinodis, хорошо различимые по
величине и морфологии; Elmes (1978b,
1980а) провел биометрическое
исследование этих двух видов. Они
различаются по микроместообитаниям,
что можно связать с особенностями
поведения. М. scabrinodis устраивает
гнезда в низкой травянистой
растительности или под лишайниками
Сравните.1ыш.ч гко.юги.ч видов одного рода 299
Рис. 15.1. Биометрический анализ 10
европейских видов Myrmica, включая
микрогин (micr.j М.rubra и М. ruginodis.
(Elmes, 1980b).
между группами растений вереска; при
устройстве подземной части гнезда,
разделенной на мелкие камеры, эти
муравьи широко используют глину.
Такие гнезда превосходно поглощают
солнечное тепло, устойчивы к высыханию
и очень эффективны в качестве
укреплений, когда этот вид захватывает
гнезда М. ruginodis, занимая одну камеру
за другой. М. scabrinodis охотится
у поверхности почвы, между
основаниями стеблей, а компактное
строение его тела дает ему возможность
пробираться сквозь густую траву. Таким
образом, благодаря особенностям своего
образа жизни он может обитать в самых
жарких участках злаково-вересковой
ассоциации, на пятнах густой низкой
травы. М. ruginodis устраивает гнезда в
высокой траве и злаках, часто вблизи
кустов или даже в рыхлом мхе.
Надземные постройки его гнезда менее
массивны; это скорее оболочка или
полог, покрывающий обширную
поверхностную камеру, разделенную
несколькими тонкими перегородками.
Такое устройство гнезда позволяет им
подниматься к солнцу и поглощать тепло
лучей, пробивающихся сквозь высокую
траву, а если тень становится слишком
густой-перебираться на новое место;
300 Глава 15
однако гнездо не обладает
устойчивостью к высыханию и не
защищено от нападения врагов.
М. ruginodis кормится в травяном ярусе
выше, чем М. scabrinodis', он взбирается
на кусты, в чем ему очень помогают
длинные ноги и тонкие торчащие вперед
усики. Подобно М. scabrinodis, он
использует в пищу разнообразных
мелких животных, как живых, так
и мертвых, а также падь, но фуражирует
в верхних частях растений.
Итак, экология этих двух видов
достаточно различна, чтобы они могли
сосуществовать в местообитании одного
типа; у них выработались структурные и
поведенческие различия,
предотвращающие столкновения между
ними. Конфликты возникают только на
участках с густой низкой травой, где
селится М.scabrinodis', здесь он не только
защищает свою собственность, но
и активно отбрасывает М. ruginodis.
М. scabrinodis может осадить гнездо
М. ruginodis, и тогда всей семье
последнего в конце концов приходится
уйти на новое место, а М. scabrinodis
занимает гнездо и перестраивает его на
свой лад; если же М. ruginodis не уходит,
то М. scabrinodis вторгается в гнездо,
завоевывая одну камеру за другой. Сухая
погода помогает М. scabrinodis, так как
его собственные гнезда защищают их
обитателей от обезвоживания. Таким
образом, контакт между этими двумя
видами ослаблен благодаря тому, что
они фуражируют и гнездятся в разных
ярусах общего местообитания. В то
время как один вид (Л/, scabrinodis) может
полностью доминировать над другим на
теплых сухих участках и лучше
использует их, другой (М. ruginodis)
способен выжить за пределами этих зон,
где на него не оказывает давления
М. scabrinodis, но где подходящий
микроклимат распределен пятнами.
Элмер (Elmer, 1978а) изучал Myrmica в
вересковой пустоши на юге Англии и
подтвердил эти различия
в распространении между М. ruginodis и
М. scabrinodis, отметив, что второй из них
вытесняет первого в „... более бедные и
неоднородные вересковые районы", тогда
как сам он доминирует в „...более
однородных участках с развитой
дерновиной Calluna'’1'. Элмер высказывает
также мнение, что микрогинная форма
М. ruginodis „...дает этому виду
возможность полностью использовать
неоднородные районы..."
Дальше на восток, где климат теплее, а
почва более нейтральная, эта пара
комплементарных видов встречается еще
с двумя видами - М. rubra и М. sabuleti.
Из рис. 15.1 сразу видно, что каждому
виду северной пары соответствует свой
вид в южной паре: М. rubra
перекрывается с М. ruginodis,
а М.sabuleti-c М.scabrinodis. Это могло
бы затруднить их идентификацию, если
бы к таксономическим критериям не
добавлялись особенности поведения, на
которые натуралисты научились
полагаться. Хотя вид М. rubra по своему
телосложению, подобно М. ruginodis,
приспособлен к фуражированию в траве,
он живет на участках с нейтральной
почвой, т. е. в местах, обычно
используемых для выпаса скота, но не
для интенсивного сельского хозяйства.
Здесь растет чертополох, а на нем живут
тли; упавшие со стен камни
предоставляют муравьям готовые гнезда,
которым не угрожает затаптывание. В
грасслендах на известняках М. rubra
распространен пятнами, главным
образом в тенистых местах, где ему не
угрожает конкуренция со стороны Lasius
flavus, которому нужно больше солнца.
Несмотря на это, М. rubra, вероятно,
живет в более теплых местах, чем
М. ruginodis, который вытесняется
в разреженные кустарники и редколесье
(Elmes, Wardlaw, 1982). Вид М. sabuleti,
сходный по телосложению
с М. scabrinodis, фуражирует вблизи
Сравните.u>na.<i жо.юги.ч видов одного рода 301
поверхности земли и живет
в грасслендах, которые либо выпасаются
(если почва нейтральная), либо
растительность на них распределена
пятнами (если почва кислая); в обоих
случаях муравьи могут устраивать здесь
гнезда в местах, полностью освещаемых
солнцем, или строить небольшие
холмики. М. scabrinodis, судя по его более
южному географическому
распространению, больше нуждается в
тепле, чем М. sabuleti.
Описанные два вида сосуществуют
в грасслендах с кислой почвой (pH 5,2)
на юго-западе Англии. М. sabuleti лучше
чувствует себя в местах с более редкой
растительностью, тогда как М. scabrinodis
обитает на участках, заросших высокими
злаками; различие в высоте травы на тех
и других участках может быть
незначительным. В грасслендах
с известковой почвой (pH 7,8) примерно
на той же широте встречается только
М. sabuleti, но здесь на выеденных
и вытоптанных местах этот вид менее
обилен. Растительность вокруг гнезд
этого муравья отличается от остальной
местной растительности; лучшие гнезда
расположены на открытых местах,
и обычно вблизи от них растет Hieracium
pilosella (сложноцветные) (Elmes,
Wardlaw, 1982b). De Vroey (1979) показал,
что в Бельгии М. sabuleti и М. scabrinodis
пространственно разобщены, a Doncaster
(1981), исследовавший эти же два вида на
уэльском морском острове Рамси,
установил, что М.sabuleti-более
эвритопный вид и способен жить при
изменении двух главных факторов
среды-экспозиции склона
и дренирования-в гораздо более
широком диапазоне, чем М. scabrinodis.
По третьему, относительно менее
важному фактору-высоте, а также
наличию орляка и приморской
растительности, М. sabuleti отходит от
М. scabrinodis и характеризуется как
обитатель низких скалистых мест (края
утесов) с тонким слоем почвы
и лишайниками, хорошо освещаемых
солнцем и теплых. М. sabuleti обитает на
большей высоте, на холмах, где
прохладнее и где он тесно ассоциируется
с Lasius flavus.
Эти четыре вида Myrmica-M. ruginodis,
М. rubra, М. Scabrinodis
и М. sabuleti-делятся, таким образом, на
две пары, в каждую из которых входит
один южный и один северный
представитель, один обитатель низкой и
один-высокой травы. Если выращивать
перезимовавших личинок при
определенной температуре, то они
окукливаются в определенной
последовательности: если время до
окукливания М. ruginodis принять за
единицу, то для М. rubra оно составит
1,2, для М. scabrinodis 1,4 и для М. sabuleti
1,5 (Elmes, Wardlaw 1982с,d). У всех
видов Qio = 3. Средняя температура на
глубине 5 см в местообитании
М. ruginodis равна 13,1 °C,
М. rubra- 13,9°С, М.scabrinodis- 14,3°С и
М. sabuleti- 16,0°С, т. е. они
располагаются в той же самой
последовательности.
В роде Messor, возможно, наблюдается
такая же картина. На юго-западе
Франции встречаются два вида:
моногинный М. capitatus с крупными
рабочими и очень большими семьями, у
которого новую семью закладывают,
вероятно, одиночные самки,
и полигинный М. structor, в семьях
которого бывает до 17 самок (Delage,
1968). М. capitatus приурочен к сухим
склонам с известковой почвой, густо
поросшим злаками, где он процветает
(вместе с Pheidole pallidula), тогда как
гораздо менее специализированный
М. structor может занимать более
разнообразные местообитания, в том
числе долины и известняковые плато, где
он устраивает глубокие разветвленные
302 Г шва 15
гнезда, избегая тем самым
обезвоживания во время засухи; он часто
живет вокруг мест, занятых М. capitatus.
В сущности, можно задать вопрос: не
является ли пара видов М. structor
и М. capitatus экологическим
эквивалентом пары Myrmica ruginodis и
М. scabrinodis! Существует много видов
Messor, но особенно интересны два вида,
изученные в саванне Ламто (Берег
Слоновой Кости) (Levieux, 1979; Levieux,
Diomande, 1978а): М. galla живет
в местах, поросших редкой и низкой
травой, а М.regalis-в высокой траве; это
различие, снова заставляющее вспомнить
Myrmica, приводит к тому, что они
собирают семена разных видов злаков.
Как будто для того, чтобы встреча
между ними стала еще менее вероятной,
они фуражируют в разное время дня.
При возвращении фуражировочных
колонн Messor galla в гнездо 60-70%
рабочих особей бывают нагружены, и
они заняты сборами в саванне круглый
год. Муравьи М. regalis фуражируют в
одиночку и спорадически, если не считать
сухого сезона, когда корм имеется в
изобилии, и нагруженными
возвращаются только 40-50% рабочих.
Различны и гнезда этих двух видов: у
М. galla гнездо диффузное (и семья,
вероятно, полигинная), а М. regalis строит
купол примерно с тремя отверстиями по
10 см в диаметре каждое. Таким
образом, эти виды, принадлежащие к
одному роду, различаются по
местообитаниям, пище, времени
активности, способу сбора пищи
и строению гнезд-более чем достаточно
для экологической дифференциации.
Crematogaster - весьма многообразный
род Myrmicinae - представлен в саванне
Ламто двумя видами: один из них,
С. heliophila, живет на верхушках
деревьев, а другой, С. impressa,- в кустах,
у поверхности почвы (Delage-Darchen,
1971). Оба вида очень сходны
морфологически. С. heliophila строит
гнезда из картона; С. impressa обычно
обитает внутри веточек, строит также
непрочные картонные гнезда. Оба
питаются соками растений и продуктами
жизнедеятельности щитовок, но
насекомых они поедают разных,
поскольку охотятся в разных
растительных ярусах. В семьях
С. heliophila одна самка, они очень
агрессивны и могут занимать несколько
соседних деревьев. Семьи С. impressa
легко распадаются на фрагменты,
особенно после пожаров, и каждый
фрагмент принимает по нескольку новых
самок, хотя этот вид не всегда бывает
полигинным и число маток может
периодически уменьшаться, как у ос.
Распределение по ярусам усиливается, по
крайней мере отчасти, враждебностью
рабочих особей С. heliophila, хотя
возможно, что некоторое влияние
оказывает и выбор местообитания
самкой. Явное сходство с Myrmica
ruginodis и М. scabrinodis состоит здесь в
том, что С. heliophila занимает теплый
лесной полог и строит прочные гнезда,
вытесняя муравьев С. impressa в более
прохладные, менее стабильные слои, в
которых они выживают благодаря
большей подвижности, достигаемой за
счет снижения расхода энергии на
постройку гнезда.
Род Lasius (Formicinae) изучался
в грасслендах умеренного пояса Европы.
Pontin (1961a,b) исследовал
взаимоотношения между черным
наземным L. niger и желтым подземным
L.flavus в Англии; он обнаружил, что
первый вид поедает второй и оказывает
пагубное влияние на продукцию его
половых особей. Однако масштабы
уничтожения L.flavus муравьями L. niger
невелики из-за того, что
последние-плохие строители гнезд
и могут жить только там, где плоские
камни предоставляют им готовое
( paeiniine. 1ъная iKo./оги ч
видов одного рода 303
природное гнездо. Эти два вида тоже
кормятся в разных растительных ярусах:
L. flavus питается почти исключительно
почвенными членистоногими
и выращивает на корнях растений тлей
многих видов, тогда как L. niger
взбирается на травинки и кусты, собирает
„дикую“ падь, охотится и поедает
падаль. На любом пастбище с грубой
травой, где есть плоские камни
и немного кустарников, эти два вида
распределяются по разным ярусам
и сосуществуют, но при высоких
плотностях L. niger частично уничтожает
L. flavus.
Эта пара видов-важные члены
сообщества на о. Вадден (Нидерланды).
Lasius niger первым проникает на только
что заселенные растениями ложбины
между дюнами, a L. flavus и другие виды,
обитающие под землей, следуют за ним
только тогда, когда выше уровня
грунтовых вод образуется достаточный
слой почвы, который позволяет избегать
вредного засоления и делает возможным
рост таких злаков, как Festuca rubra
(Boomsma, van Loon, 1982). Затем
L. flavus может значительно превзойти по
численности L. niger и оказать сильное
отрицательное влияние на размеры его
рабочих особей и производство
репродуктивных самок, но не самцов.
Эти данные служат дополнением
к результатам исследований Pontin
в Англии (Boomsma et al., 1982).
Lasius alienus гораздо ближе к L. niger как
по строению, так и по поведению. Он
встречается в более южных районах, где
ему не грозит опасность со стороны
более крупных и более агрессивных
рабочих L. niger, но на юге Англии, где
обитают оба вида, L. alienus может лишь
избегать L. niger и, чтобы получить
необходимое ему тепло, выбирает сухие,
открытые склоны, хорошо освещаемые
солнцем (Brian, 1964; Brian et al., 1976).
Здесь он устраивает свои подземные
гнезда и прокладывает фуражировочные
тоннели, что обеспечивает ему защиту от
ветра, дождя и пожаров, периодически
возникающих на пустошах. Его основную
пищу составляют почвенные
членистоногие, особенно после пожара,
но, кроме того, он тесно связан с тлей
Aphis ulicis, обитающей на стелющихся
по земле побегах Ulex minor.
В отсутствие фуражиров L. niger рабочие
особи L. alienus выходят на поверхность и
взбираются на папоротники и кустарники
в поисках нектара и пади; рабочие
L. niger могут скопляться вокруг
выходных отверстий гнезд L. alienus и
нападать на муравьев, пытающихся
выйти наружу. Брачный лёт у L. niger
происходит в июле-сентябре,
а у L. alienus в сентябре-октябре, так что
существует некоторая опасность
гибридизации между ними; Pearson
(1982а) путем изозимного анализа
установил, что такая гибридизация
действительно происходит. Он показал
также, что у L. alienus возможен
хромосомный полиморфизм -
встречаются диплоидные числа хромосом
28 и 30.
Самки Lasius niger, по-видимому,
избегают сухих пустошей, служащих
излюбленным местообитанием L.alienus',
вероятно, для L. niger в июле там
слишком жарко и сухо, хотя они
и селятся на голой земле в садах (Pontin,
1960), подобно самкам американского
L. neoniger, которые избегают лесов, и
если поместить их туда после того, как
они сбросили крылья, отказываются
рыть гнезда (Wilson, Hunt, 1966).
В южной части Англии Elmes (1971)
перемещал L. niger в местообитания
L. alienus, и L. niger здесь постепенно
уничтожался. Таким образом, эти виды
созданы для различных местообитаний,
но иногда перекрываются; там, где это
происходит, приуроченность к разным
ярусам растительности дополняется
304 I'.idea 15
прямым поведенческим взаимодействием,
которое снижает продукцию половых
особей у обоих видов, а тем самым и их
приспособленность. Поэтому умение
молодых самок различать местообитания
приобретает большое значение.
На острове Рамси в грасслендах,
выедаемых кроликами, Lasius neoniger
селится вдали от побережья, у старых
стен, большие камни которых
предоставляют ему идеальные места для
гнезд (Doncaster, 1981). L.alienus,
напротив, встречается почти
исключительно на побережье и живет на
вершинах утесов в подземных тоннелях.
Свои диффузные гнезда он строит под
очень низкой травой или под
лишайниками; они открыты ветрам, но
также и солнечным лучам, и в начале
лета подвержены периодическому
иссушению. Применяя метод главных
компонент, Doncaster показал, что эти
два вида совершенно не перекрываются в
тех двух измерениях, от которых зависит
примерно 89% их дисперсии: L. neoniger
приурочен к укрытым, умеренно
влажным участкам, a L. alienus-
к открытым и сухим. Иными словами,
местообитание L. alienus на острове
примерно такое же, как в Англии; а
L. niger, вероятно, селится в садах и на
вересковых пустошах, т. е. в местах,
заменяющих его болотное местообитание
в Англии. L.flavus-наиболее широко
распространенный из всех видов,
живущих на острове Рамси; его
способность самому строить себе
холмики и фуражировать под землей
позволяет ему жить в тех местах, где не
очень сильное выедание травы кроликами
снижает ее рост; однако при высокой
плотности кроликов они могут
разрушать муравейники, раскапывая
землю когтями. Методом главных
компонент L.flavus можно четко
отличить от L. niger и L. alienus, введя
третью компоненту, отражающую
высоту, для которой характерны орляк
(Pteridium aquilinum) и прибрежная
растительность. Таким образом, эти три
вида хорошо дифференцированы по
своим экологическим особенностям
в трехмерном пространстве компонент со
следующими расстояниями: 3,14между
L.alienus и L. niger, 2,61 между L.alienus и
L.flavus и 2,66 между L.flavus и L. niger.
Camponoius представляет собой,
вероятно, самый обычный род муравьев
(Wilson, 1976d), распространенный от
тропиков до умеренных поясов. На одной
лишь территории Берега Слоновой Кости
(Западная Африка) описано 50 видов;
экологию некоторых из них изучал
Levieux (1976). C.acvapimensis-
обычнейший вид, обитающий в почве
саванны; его биомасса составляет 0,52 г/м2
в перегнойно-карбонатных почвах,
0,47 г/м2 в ферралитах и 0,2 г/м2
в гидроморфных почвах (по сухому весу).
Если самки после брачного лёта садятся
на занятую территорию, рабочие особи
уничтожают их. Другой вид, C.solon, у
которого рабочие достигают в длину
более 1 см, устраивает гнезда в стволах
высоких деревьев, далеко отстоящих
одно от другого (1-2 на гектар),
и питается выделениями растений,
собирая их в пологе деревьев, удаленных
от гнезда на расстояние до 60 м.
Единовременный кормовой участок
занимает несколько квадратных метров
листвы, но за год муравьи используют
несколько деревьев. Разведчики
поднимают свои семьи с наступлением
ночи, из гнезда выходит толпа муравьев,
которые вползают на дерево, а через час
возвращаются с наполненными
зобиками. Camponotus vividus устраивает
свои расположенные группами гнезда,
расширяя ходы, просверленные в ветках
жуками, и собирает корм в лесном
пологе на площади в сотни квадратных
метров, постепенно сменяя ярусы,
а иногда фуражируя даже на земле. Он
Сравните. 1ьна.ч эко.юги.ч видов одного рода 305
посещает белокрылок, собирая у них
падь, а также собирает различные
вещества, выделяемые растениями,
в особенности сухую белую смолу;
фактически 90% сборов этого
муравья-материал растительного
происхождения. Пики активности
приходятся на 6-8 часов и на 16-18
часов; в промежутках активность падает
на 20%. Температура никогда не
заставляет этих муравьев прекратить
фуражировку; они перестают собирать
пищу только в случае дождя. Таким
образом, у Camponotus в эксосистеме
тропической саванны наблюдается
несколько различных образов жизни
(Levieux, Louis, 1975).
Столь же четкая экологическая
дифференциация выявляется у видов
термитов, относящихся к одному роду.
Sands (1965) изучал пять видов
Trinervitermes (Nasutitermitinae)
в западноафриканской саванне, где
в августе количество осадков достигает
максимума (112-122 мм), а в декабре
трава выгорает. Sands обследовал три
биома: редколесье с травами высотой
1-2 м, кустарник со сходными травами и
область с одними только густыми
высокими травами. Ввиду обилия злаков,
которыми питаются все эти пять видов,
конкуренция между ними за пищу
маловероятна, но Sands обнаружил, что
они встречаются в разных зонах
и различаются по устройству гнезд.
Т. geminatus живет на открытых
солнечных участках в агрегированных
гнездовых холмиках и хорошо
приспособлен к своему местообитанию и
климату. Т. trinervius не занимается
активной фуражировкой и лучше
чувствует себя в более влажной саванне с
двумя пиками осадков, к которым лучше
адаптирован его жизненный цикл.
Т. togoensis явно неспособен строить для
себя прочные холмики и селится в старых
холмиках Т. geminatus и Cubitermes.
Т. oeconomus и Т. occidentalis имеют
светлую окраску и чувствительны
к солнечному свету; они непрерывно
собирают злаки, тогда как другие виды
создают запасы, которые изолируют
гнездо от перегрева на солнце и даже от
огня. Больше половины гнезд
Т. oeconomus находятся в холмиках
Macrotermes. Sands приходит к выводу,
что различия в гнездостроительных
способностях, в способах фуражировки и
кормления (хотя не обязательно в пище)
и адаптация к климату дают
возможность этим видам сосуществовать
в грассленде, где очень мало деревьев.
Различия в поведении при выборе
местообитания обеспечивают
пространственную разобщенность
видовых популяций, и эти термиты
проявляют агрессивность лишь при
случайных встречах с другим видом.
Microtermes (Macrotermitinae) - мелкие
термиты, которые живут под землей и
выращивают грибы; они строят камеры
диаметром 3-4 см, соединенные
подземными галереями. Wood (1981) в
Мокве (Нигерия, 9° с. ш.) изучал семь
видов этого рода, которые
репродуктивно изолированы. Брачный
лёт у большинства видов происходит
после дождя, но в разные сроки (через 1,
2 или 3-4 дня) и в характерное для
каждого вида время дня или ночи. У
некоторых видов половые особи находят
друг друга, собираясь у заметных
деревьев, а у других самки привлекают
самцов, сидя на растениях.
15.4. Лесные муравьи
и термиты
Деревья открывают дополнительные
возможности для экологической
дифференциации видов, хотя они
ослабляют или даже уничтожают
наземный травяной покров, если их
кроны смыкаются. Род Formica делится
306 I'.iiinn /5
sanguinea
rufa
polyctena
aquilonialpolyctena
aquilionia
lugubris
rufa/lugubris
pratensis
truncorum
exsecta
fusca
transcaucasica
cinerea
uralensis
rufibarbis
Рис. 15.2. Дендрограмма, показывающая
родственные связи между евразийскими
видами Formica (по данным о генетических
расстояниях). (Pamilo et al., 1979.)
на несколько подродов, в число которых
входят „рабовладельцы" Raptiformica,
свободноживущие виды, которые строят
маленькие холмики или не строят их
вовсе и собирают корм в кустах
(Serviformica), и рыжие лесные муравьи,
строящие большие холмики, способные
сохранять тепло, и фуражирующие на
деревьях {Formica s. str.). Изучение 13
европейских видов показало, что они
находятся в весьма тесном генетическом
родстве между собой. Среднее
генетическое расстояние между
популяциями одного вида равно 0,023,
между видами-0,283, а между
подродами-0,332. Все эти расстояния
меньше, чем обычно бывает у животных
(Pamilo et al., 1978, 1979). Группа F.rufa,
в которую входит шесть видов (Kutter,
1977), отличается от других (см.
дендрограмму на рис. 15.2), но эти виды
либо генетически очень сходны, либо,
дивергировав в разных географических
Рис. 15.3. Трансекта (с севера на юг) через
долину реки Гуайдир, систематизированная
так, чтобы показать местоположение гнезд
Расстояние, км
Сравнительная экология видов одного рода 307
областях, теперь все время скрещиваются
между собой. Относительно генетических
различий, необходимых для того, чтобы
прекратить обмен генами и инициировать
видообразование, практически ничего не
известно. Гибридизация возможна, так
как половые особи в Европе часто
появляются в одно и то же время, и
копуляцию между представителями
разных видов наблюдали неоднократно.
F. truncorum и F.pratensis сильно
отличаются от остальных, и их можно
различать по морфологическим
признакам (Длусский, 1967). У других
четырех видов дискретных
диагностических признаков найдено не
было, и сходство между
конспецифичными популяциями лишь
ненамного больше сходства между
видами. Любопытно отметить, что вид
F. aquilonia в Шотландии, ныне
представляющий собой изолированный
фрагмент популяции, больше сходен с
F. lugubris, обитающим чуть южнее, чем с
финской популяцией F. aquilonia
(отличающейся от шотландской формы
по двум локусам). В свою очередь
финская форма F. aquilonia более сходна с
F. lugubris из южной части Финляндии,
чем с шотландской F. aquilonia. Судя по
генетическим данным, эти два вида,
вероятно, дивергировали независимо
один от другого на противоположных
концах Европы1.
На Британских островах вид Formica
lugubris в общем распространен севернее,
a F. rufa южнее. Их ареалы соприкасаются
и заходят один в другой в центральной
части Уэльса, в Озерном округе, на
йоркширских верещатниках и, возможно,
на Пеннинских горах, но в Ирландии
существует только F. lugubris (Breen, 1977,
1 Скорее даже всей Палеарктики, поскольку
форма F. aquilonia, отмеченная в Финляндии,
очень обычна и широко распространена в Сиби-
ри,- Прим. ред.
1979). В Уэльсе вид F.rufa проявляет
свою потребность в тепле тем, что он
распространен от уровня моря до высоты
200 м на солнечных, обращенных на юг
склонах (в большинстве случаев это .
места заброшенных плавильных печей) с
постоянными открытыми участками,
окруженными дубовым мелколесьем
(рис. 15.3). В тех местах, куда вторгается
лес и кроны деревьев
смыкаются, этот вид исчезает. F. lugubris
может жить в более затененных участках;
его можно встретить на северных склонах
на высоте до 305 м (граница леса), и он
распространен шире, заходя даже
в посадки хвойных деревьев. В одном
месте эти два вида встречаются на
расстоянии 80 м один от другого: гнезда
F. rufa возле заброшенного медного
рудника, ставшего теперь теплой
солнечной укрытой поляной, усыпанной
камнями, а гнезда F.lugubris-в
прохладных и сырых местах под
сомкнутыми кронами дубов. Никакого
взаимодействия между ними не
обнаружено (Hughes, 1975).
Следовательно, в тех местах, где эти
виды соприкасаются, между ними
происходит экологическая
дифференцировка, отражающая их
различия в климатической адаптации,
хотя совершенно не известно, как все это
влияет на их фуражировочную
активность или поиски мест для гнезд.
Сходная зональность, связанная
с температурой, существует на
Британских островах и у другой пары
видов - Formica lemani и F. fusca: первый
обитает гораздо севернее второго, а в тех
местах, где их ареалы заходят один в
другой, F. lemani обычно живет на
прохладных северных склонах,
a F.fusca-в теплых открытых местах,
обращенных на юг. Возможно, что
F. lemani использует скудные солнечные
лучи лучше, так как строит гнезда под
самой поверхностью почвы.
308 Г.шва 15
В тропическом дождевом лесу
(Папуа-Новая Гвинея) обитают вместе
два вида Leptomyrmex (Dolichoderinae).
Крупные рабочие особи L. lugubris
поедают разнообразных насекомых (в
основном других муравьев), за которыми
они охотятся с хорошо выраженных, хотя
и временных дорог, а также занимаются
сбором растительных материалов. Вид
L.fragilis с более мелкими рабочими и
семьями меньшей величины
прокладывает много слабо выраженных
троп, на которых муравьи собирают
мелкие пищевые объекты, главным
образом крылатых насекомых. Для
L. lugubris помимо более крупных
размеров и приверженности к питанию
растительным материалом и муравьями
характерны также охраняемые
территории, на которые он не допускает
рабочих из других семей своего вида или
L.fragilis. Его гнезда расположены
вблизи определенных деревьев,
выделяющих эксудат, которые здесь
немногочисленны. L. lugubris может
занимать гнезда L.fragilis (обычно
расположенные в центре территории с
нечеткими границами) без всякой
борьбы, буквально „выставляя** из них
хозяев (Plowman, 1981). Ключевым
ресурсом для этих муравьев служит,
вероятно, надлежащий вид деревьев,
дающих эксудат; любое из таких
деревьев может быть захвачено
муравьями L. lugubris, но при этом
остается достаточно пространства
и пищи и для L.fragilis.
Способу использования тропического
дождевого леса на западе Малайзии
двумя видами Macrotermes,
составляющими вместе больше половины
биомассы термитов в этой области,
посвящена часть исследования Matsumoto
и Abe (1979). У обоих видов есть грибные
сады, которые они выращивают на
кусочках растительного материала,
главным образом сброшенных листьев;
однако в то время как М. carbonatus
(0,33-0,43 г/м2) подбирается к ним сверху
и строит гнездовые холмики,
М. malaccensis (1,06 г/м2) подходит к ним
снизу и строит гнезда под землей.
Муравьи М. carbonatus предпочитают
свежеопавшие листья, к которым они
приходят ночью целыми колоннами,
охраняемыми солдатами, нередко
удаляясь по поверхности земли на 10 м
от гнезда. М. malaccensis предпочитает
прелые листья, хотя их может оказаться
мало, но питается главным образом
древесиной поваленных деревьев, а опад
собирает только вблизи таких деревьев,
построив над ним земляной навес
и подходя к нему снизу. Таким образом,
оба вида используют один и тот же
пищевой ресурс - опавшую листву,
однако они выбирают листья,
находящиеся на разных стадиях
разложения, и собирают их по-разному:
один вид сверху и ночью, а другой-снизу
и под защитой навеса. Активная
популяция М. carbonatus может лишить
М. malaccensis пищи в виде опавших
листьев, однако у последнего вида еще
останутся при этом поваленные деревья.
15.5. Осы и шмели
Можно было бы ожидать, что осы и
шмели - летающие насекомые - должны
отличаться по своим межвидовым
взаимоотношениям от муравьев
и термитов, передвигающихся по земле.
В Северной Америке два вида, Polistes
fuscatus и Р. metricus, устраивают гнезда
очень близко один от другого
и фуражируют на одних и тех же
деревьях, отыскивая в листве мягких
личинок, которых они пережевывают,
превращая в пульпу, и относят в гнездо.
В поисках различий, которые свели бы к
минимуму конфликт, Dew и Michener
(1978) нашли, что осы Р. metricus более
крупные, улетают дальше от гнезда (в
Сравните.1вна.ч жо.юги.ч видов одного рода 309
среднем на 102,4 м) и фуражируют на
вершинах деревьев, тогда как P.fuscatus
удаляются лишь на половину этого
расстояния (в среднем на 48,1 м)
и фуражируют в более низком ярусе.
Сообщалось, что Р. annularis фуражирует
исключительно на деревьях; все эти
данные показывают, что у Polistes
существует вертикальная зональность в
отношении сбора корма.
Описана конкуренция между разными
видами Vespa за соки, ыделяемые
растениями (Sakagami, Fukushima, 1957).
Разные виды по их доминированию
можно расположить в следующем
порядке: V. mandarinia^V. dubowskii >
> V. analis>V. crabro>V. xanthoptera>
> V. tropica. Это несколько упрощенная
картина, так как V. analis никогда не
вступает в драки и взаимоотношения ее с
другими видами не вполне ясны;
V. mandarinia редко встречает
сопротивление, да и то лишь со стороны
осы V. dybowskii, непосредственно
следующей за нею. Этот последний вид
отличается свирепостью и, хотя его
самка-основательница может начать
строить гнездо без посторонней помощи,
нередко выгоняет ос V. crabro из их
гнезд; проникнуть в их гнездо ему
помогают толстая кутикула и резкий
неприятный запах.
Особенно интересны два обычных
европейских вида- Vespula germanica
и V. vulgaris. О мелких различиях в их
пище уже говорилось. Оба вида
устраивают гнезда в подземных пустотах,
но V. vulgaris строит гнездо из мягкой
гниющей древесины, которую она
превращает в ломкий картон, тогда как
V. germanica использует мертвую, но
здоровую древесину, изготавливая из нее
мягкий картон серого цвета. Поскольку
строение гнезда имеет чрезвычайно
важное значение для обороны и для
регуляции температуры, это различие
может уменьшить конкуренцию за сырье,
хотя в общем создается впечатление, что
недостатка в мертвой древесине, как
гниющей, так и здоровой, даже
в нынешние времена нет. Кроме того, и у
этих видов существует зональность.
V. germanica всегда строит гнезда под
землей, V. vulgaris-обычно под землей,
V. rufa-около поверхности почвы
(которую она не может выбрасывать),
V. sylvestris—на поверхности почвы или
над ней, a V.norvegica-на кустах
и небольших деревьях. У двух последних
видов гнездо покрыто прочной оболочкой.
Самки Bombus. несомненно, выбирают
для устройства гнезд и фуражировки
различные стадии растительной
сукцессии-злаки, разнотравье,
кустарники или лес; самцы тоже
идентифицируют в общих чертах стадию
восстановления растительности, когда
оставляют на ней запаховые метки. В
Европе В. lapidarius метит верхушки
деревьев, B.pascuorum
и В. pratorum- кусты и небольшие
деревья, В. terrestris и В. lucorum-травы, а
В. hypno turn-почву (Haas, 1949).
Соответственно B.pascuorum и В.pratorum
собирают корм с цветков в редколесье, а
В. lucorum и B.hortorum-в грасслендах и
в низкорослых кустарниках (A. D. Brian,
1957). Первая пара видов гнездится на
поверхности почвы или даже в кустах, а
вторая-под землей, где не грозит
вытаптывание тяжелыми травоядными
животными. Шмели, относящиеся
к разным зонам, различаются по длине
хоботка, что дает им возможность
посещать цветки разных типов:
у В. pratorum хоботок короче, чем
у B.pascuorum, а у В. lucorum-короче,
чем у В. hortorum. Два последних вида
различаются по многим признакам.
В. lucorum питается падью и нектаром
разнообразных цветков с открытым
венчиком и неглубокими нектарниками;
цветки с глубоко расположенными
нектарниками он прокусывает и ,,крадет“
310 Г.шва 15
из них нектар. В. hortorum приспособлен к
питанию на цветках с сильно
вытянутыми венчиками, из которых он
достает нектар длинным хоботком.
В. lapidarius предпочитает грозди
неглубоких богатых нектаром цветков.
Для каждого из этих видов характерна
определенная температура почвы, при
которой он появляется весной
(Prys-Jones, 1982). Такая приуроченность
к местообитаниям и цветкам
определенного типа почти устраняет
столкновения между разными видами, но
B.pratorum агрессивен и нападает на
других шмелей на цветках, прогоняя
B.pascuorum, но не В. lucorum. На первый
из этих видов B.pratorum может напасть
на лету и сбросить его на землю
(A. D. Brian, 1957).
Bombus lucorum-мелкая, отличающаяся
белым кончиком брюшка форма
В. terrestris, ареал которой сдвинут
к северу; в зонах перекрывания между
этими видами может происходить
гибридизация. В. lucorum ежегодно
появляется и начинает строить гнездо
раньше, чем В. terrestris, так как он может
выдерживать более низкую температуру
почвы. Это позволяет ему продвинуться
дальше на север, предположительно в
более прохладные области их общего
ареала, но одновременно подвергает его
опасности временного социального
паразитизма со стороны В. terrestris,
более крупные размеры которого
физически помогают ему при захвате
гнезда. У В. lucorum есть морфологически
неотличимая разновидность, самцы
которой используют иную запаховую
метку (Bergstrom, 1975), а у В. terrestris
главным компонентом метки служит
дигидрофарнезол, необычный для
данного рода (сводку по этим феромонам
см. Bergstrom et al., 1981).
Взаимоотношения трех видов Bombus в
Скалистых горах в штате Колорадо
изучал Inouye (1978). Для B.appositus с
длинным хоботком главным кормовым
растением служит Delphinium barbeyi.
B.flavifrons, у которого хоботок короче,
использует главным образом аконит
(Aconitum columbianum), а В. occidentalis
прогрызает венчики и „крадет" нектар.
После экспериментального удаления
B.flavifrons с аконита мелкие особи того
же вида, которых прежде не было видно,
выходят из гнезда и начинают
фуражировать; кроме того, на аконите
появляется большее число особей
B.appositus', это позволяет предположить,
что обычно присутствия на этом
растении B.flavifrons достаточно, чтобы
для В. appositus было невыгодно
использовать его. После удаления
В. appositus с Delphinium его нектарники
наполняются, что привлекает к цветкам
шмелей B.flavifrons с их более коротким
хоботком. Такого рода малозаметная
конкуренция с использованием
возникающих возможностей, вероятно,
встречается чаще, чем обычно думают.
Наблюдения над конкуренцией между
двумя видами шмелей за цветки
каролинской розы {Rosa Carolina), которая
предоставляет им пыльцу, но на цветке
которой помещается лишь один
фуражир, показывают, что рабочие особи
В. terricola могут быть вытеснены
рабочими В. vagans такой же или
несколько большей величины. Эти
шмели, по-видимому, фуражируют без
определенных закономерностей
и встречаются друг с другом на 1 цветке
из 15; однако есть также данные о том,
что эти шмели избегают уже занятых
цветков, снижая тем самым частоту
столкновений (Morse, 1978). Это
дополняет наблюдения, согласно
которым B.pratorum может нападать на
шмелей, сидящих на цветках, поскольку
хорошо известны межвидовые
различия в агрессивности этих
насекомых.
Хотя осам и пчелам не свойственно
доминирование на определенных
участках территории, у них существует
Сравнительная >ко.юги.ч видов одного рода 311
множество способов уменьшить
перекрывание в пространстве и во
времени. Они появляются и становятся
активными при разных температурах,
достигая пика в разное время года при
разной продолжительности жизненных
циклов (Prys-Jones, 1982). Они
фуражируют, улетая от своего гнезда на
разные характерные для каждого вида
расстояния, нередко на разной высоте, и
могут также строить гнезда в разных
ярусах. Они могут выбирать разные
стадии растительной сукцессии,
использовать разные пищевые ресурсы
или один и тот же ресурс, но
в соответствии с принципом
доминирования. Как показывает
использование цветков различными
видами шмелей, одних привлекают
цветки с неглубокими венчиками или
грозди таких цветков, тогда как другие
посещают цветки с глубокими венчиками.
Самцы могут способствовать
привлечению самок в местообитания,
находящиеся на определенной стадии
сукцессии. Проявления враждебности к
представителям других видов редки и
связаны исключительно с небольшими,
ограниченными источниками корма
(соки, выделяемые растениями, цветки).
15.6. Высшие пчелы
Трибы Meliponini и Apini удобно
рассматривать вместе. Trigona fuscipennis
и T.fulviventris- пчелы одинаковой
величины; обе они питаются пыльцой на
кустах Cassia, вскрывая пыльники
(Johnson, Hubbell, 1974, 1975). На
прибрежной равнине Коста-Рики эти
растения цветут во время сухого сезона.
T.fiiscipennis обычно фуражирует
группами на кустах, растущих также
группами на расстоянии в среднем 1,5 м
от ближайшего соседнего куста, тогда
как T.fulviventris посещает либо
одиночные растения, либо редко
разбросанные цветки на кустах, растущих
группами при среднем расстоянии 8,1 м
от ближайшего соседа. Это различие
частично обусловлено характером
взаимоотношений между двумя видами:
Т. fulviventris избегает T.fiiscipennis,
которая демонстрирует свою
агрессивность, „зависая" в воздухе на
расстоянии 1 см от рабочих особей
T.fulviventris, пока те не улетят.
T.fulviventris вообще не подлетает даже к
незанятым гроздьям цветков, хотя
неизвестно, научились ли пчелы избегать
этих цветков в результате прежнего
опыта или их предупреждает пахучая
метка, оставленная Т.fuscipennis.
У T.fiiscipennis имеется видоспецифичный
феромон, и она подлетает к цветкам
группами, которые, возможно, ведет
разведчица; других насекомых эти пчелы
прогоняют, и их плотность достигает 22
особей на 1 м2. В отличие от этого
T.fulviventris не пытается вступать
в конфликты с другими насекомыми, и ее
плотность составляет всего лишь 3 особи
на 1 м2. Короче говоря,
Т.fuscipennis-агрессивный групповой
фуражир, расходующий энергию на то,
чтобы монополизировать и удерживать
за собой хорошие грозди цветков, тогда
как T.fulviventris фуражирует в одиночку
и затрачивает энергию на поиски новых
цветков; обе тактики оказываются
успешными.
Джонсон и Хаббелл (Hubbell, Johnson,
1978) ставили сахарные приманки,
привлекавшие до 9 видов пчел. В этом
эксперименте Trygona fulviventris из
нескольких разных семей, встречаясь в
центре приманки, вступали в схватку, но
ограничивались тем, что прогоняли друг
друга при помощи угроз и толчков
головой. Позднее Т.fuscipennis
возвращались большой группой под
предводительством разведчицы
и монополизировали несколько
приманок. Крупная черная пчела
312 Г шва 15
Т. sylvestriana без труда прогоняла
Т. fulviventris своим жужжанием, но не
очень эффективно использовала
завоеванные таким образом приманки.
Т. testaceicornis применяла совершенно
иную тактику: она пробиралась
к занятым приманкам и кормилась
вместе с другими пчелами, улетая только
в том случае, если ее обнаруживали;
однако ее численность могла достигать
такой величины, что позволяла ей
монополизировать приманки. Таким
образом, и у Trigona мы находим
различные способы, применяемые
в ситуациях, связанных с конкуренцией:
прямое нападение, пустые угрозы,
настойчивость и мобилизация
подкрепления или же попытки незаметно
„втереться"-с уходом в случае неудачи.
Джонсон и Хаббелл считают, что эти
стратегии выработались в результате
сосуществования и что они позволяют
свести к минимуму потери энергии при
конкурентных взаимодействиях.
Превосходные примеры межвидовых
экологических различий можно найти и в
роде Apis. Два вида- A. mellifera
и А. сегапа-таксономически очень
близки, и до того как человек стал
заниматься пчеловодством, они
распространялись соответственно на
запад и на восток из южной части Азии,
откуда они, вероятно, происходят. Это не
просто географические подвиды, так как
имеются бесспорные данные об
отсутствии скрещиваний между ними
(Ruttner et al, 1972, 1973). Дело в том, что
их самцы собираются в одних и тех же
местах, привлекаемые одним и тем же
феромоном (9-ОДК), который образуется
в мандибулярных железах
репродуктивных самок всех видов Apis.
Самцы A. mellifera, находясь на
расстоянии в несколько километров,
препятствуют осеменению самок
А. сегапа их самцами. И это несмотря на
то, что трутни А. сегапа летают быстрее и
при более низких температурах.
Возможно, что более крупный пакет
спермы самцов A. mellifera, у которых
сперма более жидкая, чем у А. сегапа,
разрушает пакет последнего вида после
копуляции, хотя это мало вероятно, так
как в Пакистане присутствие в данном
районе А. сегапа блокирует нормальную
копуляцию A. mellifera (Koeniger,
Wijayagunasekera, 1976)!
В Японии Apis сегапа-местный вид, но
A. mellifera была интродуцирована сюда
человеком, поскольку она запасает
больше меда и реже роится.
Взаимоотношения между этими видами
описал Sakagami (1959, 1960; см. также
Brian, 1965). У А. сегапа мощные жвалы,
при помощи которых она может
расширять разного рода полости,
увеличивая тем самым диапазон
полостей, пригодных для устройства
гнезда; возможно, что это способствует
более успешной зимовке. Однако
A. mellifera быстрее обнаруживает врагов
и жалит их, чем А. сегапа; она может
отгонять А. сегапа, не давая ей
возможности жалить в ответ; она
быстрее мобилизует сборщиц
и направляет их к блюдцам с сиропом, а
также устраивает групповые набеги на
семьи А. сегапа. Очевидно, A. mellifera
способна к более быстрой передаче
информации и к более эффективной
групповой активности. У пчел А. сегапа
существует, однако, некая уклончивая
тактика: они улетают, когда гнездо
подвергается нападению, а после ухода
врагов возвращаются назад. Это спасает
семью от полной гибели при нападении
хищного шершня (Vespa mandarinid); в
аналогичной ситуации A. mellifera
оказывает сопротивление и нередко
бывает уничтожена. Таким образом,
экологическое равновесие между этими
двумя видами Apis могло бы
поддерживаться хищным шершнем,
который поедает A. mellifera,
Сравните.1Ь.на.ч жо.юги.ч видов одного рода 313
и грабителем-человеком, который
выращивает их. Во всяком случае,
А. сегапа, по-видимому, лучше
приспособлена к жизни в естественных
условиях в горах.
В Пакистане Apis сегапа встречается с
A.florea и A.dorsata в горах, которыми
ограничено здесь ее распространение
(Ruttner el al., 1972). В Шри Ланке она
сосуществует с этими же видами, а также
с Trigona iridipennis (Meliponini) (Koeniger,
Vorwohl, 1979). Очевидно, на залежах, на
которых после их кратковременного
использования восстанавливается
растительность, пища имеется
в изобилии, особенно в связи с тем, что в
засушливые летние месяцы и A. dorsata, и
A.florea улетают в другие места. При
конкуренции за искусственный корм
взаимоотношения между особями
складываются не всегда одинаковым
образом, т. е. у них нет четко
выраженной иерархической системы;
однако в общем и целом Trigona
iridipennis доминирует над А. сегапа
и A.florea, но никогда не сталкивается с
A.dorsata', A.florea доминирует над
А. сегапа, а последняя - над A.dorsata. В
среднем наблюдаются взаимоотношения
Т. iridipennis> A. florea> A. cerana> A. dor-
sata, тогда как по размерам тела эти виды
расположатся в обратном порядке.
Авторы отмечают, что при таком
положении вещей самый мелкий вид, не
способный летать далеко, получает
возможность фуражировать поблизости
(примерно в 100 м) от гнезда без
затруднений, тогда как виды, способные
летать на большие расстояния, например
A. dorsatff (5 км), фуражируют
в отдаленных местах, улучшая таким
образом распределение видов
в пространстве. Только у А. сегапа
наблюдаются конфликты между семьями.
Все эти виды строят гнезда в совершенно
различных местах: полости,
используемые маленькой пчелой Trigona
iridipennis, меньше тех, в которых
устраивается А. сегапа, а у двух других
видов Apis гнезда открытые- A.florea
строит гнезда вокруг маленьких веточек,
а у Я. dorsata они свисают с больших
ветвей. Хотя у всех видов Apis
репродуктивные самки используют
в качестве полового аттрактанта 9-ОДК,
запах которого привлекает всех трутней,
гибридизация отсутствует, так как
у разных видов брачный лёт происходит
в разное время дня (рис. 15.4): у A.florea
в 12-15, у А.сегапа в 16-18, а у A.dorsata в
18-19 часов.
Медоносная пчела (Apis mellifera)-c
помощью человека или независимо от
него-распространилась по большей
части земного шара и образовала много
подвидов, которые в настоящее время
скрещиваются между собой. Существует
несколько африканских подвидов
(Fletcher, 1978b). Например, в южной
части пустыни Сахара в саванне,
поросшей колючим кустарником
и высокой травой, живет A.m.adansonii, а
в Центральной Африке сходное
местообитание, но с примесью
вечнозеленых и листопадных тропических
деревьев занимает другой подвид,
A.m. scutellata. Первый из этих подвидов
в 1956 г. был интродуцирован
в Бразилию, где он вступил
в конкуренцию с европейской A.mellifera,
завезенной раньше, а к 1971 г. эта
«африканизированная медоносная пчела»
распространилась почти по всей стране
(Michener, 1975).
Особенности этих подвидов состоят в
том, что у них рабочие особи и ячейки
мельче; гнезда они устраивают в любых
местах, защищенных от непогоды,
например в гнездах термитов,
расщелинах скал или зданий, в ящиках,
под деревьями и даже в почве, что делает
их весьма гибкими в выборе
местообитаний. Поведение, связанное с
зимовкой, у них отсутствует; у них не
314 I'.шва 15
Рис. 15.4. Различия во времени лёта трутней у
трех видов Apis: A.florea (1), А. сегапа (2) и
A. dorsata (5). (Koeniger, Wijayagunasekera,
1976.)
наблюдается снижения активности,
а образование клуба бывает
кратковременным; когда корма
становится мало, они легко
перебираются в другие места. Обе эти
черты указывают на приспособленность
скорее к тропическому, чем к умеренному
климату. Это активные трудолюбивые
фуражиры, быстро перелетающие
с цветка на цветок. Их система
мобилизации, указывающая направление
к корму даже при расстоянии всего лишь
50 м, а иногда и 10 м, отличается от
аналогичной системы А. т. ligustica-
главного европейского подвида-
более низкой частотой виляний
на единицу расстояния. Они тоже
собирают и запасают большие
количества меда. Их защитные действиг
хорошо координированы, что придает
реакции массовость, и они успешно
отгоняют врагов, хотя отдельные уколь.
жала у них не сильнее, чем у обычных
пчел. Короче говоря, они представляю-
собой эффективный тропический вариан-
типичной Apis mellifera.
Замещая в Бразилии европейскую пчелу
описанные подвиды выработали ряд
приспособлений. Одно из них состоит г
том, что благодаря своей способности
устраивать гнезда в несколько необычны
местах они сумели создать обширную
дикую популяцию. Это позволяет им
непосредственно вытеснять семьи Apis
mellifera путем грабежа и нападения, а и:
трутням дает больше шансов на
Сравнительная жо.юги.ч видов одного рода 315
успешную гибридизацию. Гибриды
сочетают в себе признаки обеих
родительских рас: они используют
стандартные ульи и вощину, они
активные фуражиры, хорошо
воспринимающие указания
о местонахождении корма, но вместе с
тем они легко снимаются с места и очень
чувствительны к нарушению их покоя и к
агрессии.
Как показываем этот обзор экологии
видов,, относящихся к одному роду,
существует множество способов, при
помощи которых виды избегают
взаимодействия в случае недостатка
пищи или мест для гнезда. У них могут
быть разные периоды сезонной
и суточной активности, что обычно
зависит от различия в критической
температуре. Благодаря разнице
в размерах тела отдельные виды могут
либо собирать более крупные кусочки
пищи, либо уходить дальше от гнезда на
ее поиски. Они могут устраивать гнезда
или кормиться на разных уровнях сильно
структурированных биомов, в результате
чего нередко потребляют различную
пищу. Гибридизация между близкими
видами может снижаться благодаря
тому, что брачный лёт происходит у них
в разное время суток или года.
Некоторые виды, по-видимому,
подразделяются на моно- и полигинные
формы-по своей экологии
соответственно первооткрыватели
и завоеватели. Есть и такие виды,
которые мигрируют в другие
географические районы, чтобы избежать
конкуренции в неблагоприятное время
года. В главе 16 эти группы видов,
относящихся к одному роду,
рассматриваются в контексте тех
сообществ, в состав которых они входят,
чтобы можно было представить себе их
взаимодействия в более широком плане.
Глава 16
Многовидовые сообщества
Теперь, после рассмотрения различий
между видами одного рода, можно
перейти к вопросу о том, как эти группы
видов вписываются в природные
сообщества. В этой главе многовидовые
сообщества описаны в географической
последовательности-от луговых
и лесных ценозов высоких широт,
включая сухие степи и саванны, до
пустынь и дождевого тропического леса.
16.1. Луговые и лесные
сообщества умеренной
зоны
16.1.1. Грассленды Европы
В умеренных областях проводится много
превосходных фаунистических
исследований, но лишь в некоторых из
них анализируются взаимоотношения
между видами. В морском климате
Стратклайда (56е с. ш.) на высотах
100-200 м над уровнем моря
в сообщество помимо двух видов
Myrmica входят еще два муравья:
небольшой Leptothorax acervorum
(Myrmicinae) и крупный Formica lemani
(Formicinae). Поскольку ни тот ни другой
не могут устраивать гнезда в траве, они
живут только в местах, поросших
кустарником, где есть участки голой
почвы или же разлагающиеся пни
и ветки. F. lemani строит гнезда под
корой на южной стороне пней, Myrmica
scabrinodis-в более прохладных местах,
на сторонах, обращенных к востоку и
западу, а М. ruginodis-в затененных
участках. Такая температурная
зональность устанавливается самими
самками, когда они закладывают гнездо,
а затем усиливается рабочими особями:
F. lemani выселяют или убивают
и съедают рабочих особей и расплод
Myrmica. Leptothorax acervorum избегают
уничтожения, устраивая тоннели
в твердой неразрушенной древесине, куда
за ними не могут последовать более
крупные муравьи. По мере разрушения
пней F. lemani переходят в растущую
поблизости низкую траву, и хотя они
могут нарушить рост травы, они не
способны строить холмики, так что в
конце концов затенение вынуждает их
переселяться. Если они не могут найти
подходящего места, они постепенно
вымирают. Myrmica выживают
в восстанавливающемся лесу, если на
земле есть участки, освещаемые солнцем.
Перед тем как в прошлом веке
в Шотландии были сведены леса, можно
было ожидать, что по мере появления
молодых деревьев здесь будут поселяться
F. lugubris и F. aquilonia, однако эти виды
не очень подвижны, и им может
понадобиться несколько десятилетий,
чтобы пройти несколько километров.
Помимо такого зонального
распределения гнезд разные виды
муравьев фуражируют на разных
уровнях. Formica залезает на кустарники
и молодые деревца; Leptothorax acervorum
фуражирует в нескольких метрах от
гнезда и забирается в кусты, но главный
источник его пищи неизвестен. Любые
лесные муравьи, конечно, заползают еще
выше, на деревья. F. lemani фуражирует
главным образом в середине дня
в солнечную погоду. Эта особенность
поведения F. lemani уменьшает
вероятность его контактов и конкуренции
с двумя видами Myrmica, которые
Мпоговидовые сообщества 317
фуражируют утром и в позднее
послеполуденное время, а также
в пасмурную (но не сырую и ветреную)
погоду. Ни. у одного из этих видов нет
охраняемых территорий; они энергично
защищают свое гнездо и несколько
скоплений тлей, прикрытых земляными
навесами, но между гнездами существует
лишь мало заметная система троп. Этот
небольшой набор видов муравьев
представляет собой сообщество,
поскольку они занимают общее
местообитание и делят его на сферы
влияния, которые лишь незначительно
перекрываются в пространстве и во
времени. Их стремление избегать друг
друга при изобилии ресурсов может
перейти во враждебность, если ресурсов
будет нехватать. В таких случаях система
доминирования одних видов над другими
может превратиться в пищевую цепь.
Взаимовыгодным может оказаться
кооперирование для защиты от
позвоночных. Несколько южнее (5Гс. ш.,
Дорсет) и всего лишь на 20 м выше
уровня моря среди кустов вереска, все
еще составляющего основную
растительность, там и сям попадается
Ulex minor. Это растение, возможно
фиксирующее азот с помощью корневых
клубеньков, дает семена, от которых
L. alienus отгрызает присеменники, а на
его стелющихся побегах обитают тли
(Aphis ulicis), за которыми этот муравей
ухаживает. L. niger обитает на дне
укрытых прохладных сырых лощин и в
относительно тенистых местах, заросших
кустарником, его поселения и территории
занимают площадь во много квадратных
метров. Взаимоотношения этой пары
видов мы уже обсуждали.
В центральной части этого сообщества
доминирует третий вид- Tetramorium
caespitum (Myrmicinae). Он происходит с
юга и занимает наиболее прогреваемые
зоны; для него характерны
территориальная организация
и подземные тоннели, в которых всегда
имеются муравьи, готовые в случае
надобности защищать гнездо от
вторжения или отправиться к найденному
фуражирами источнику пищи (рис. 16.1).
Кроме того, он использует семенные
ресурсы местообитания, не ограничиваясь
одними лишь семенами вересковых, но
собирая также семена различных злаков;
муравьи собирают их на земле, а семена
вереска в конце лета-прямо из
коробочек, хранят всю зиму и поедают
весной. Т. caespitum охотится также на
мелких членистоногих, выращивает тлей
и фактически обладает множеством
„экологических щупалец", глубоко
проникающих своими разветвлениями в
биом верещатника. Таким образом, ядро
этого местообитания состоит из одного
эволюционно продвинутого
представителя Myrmicinae и двух видов
Lasius. В нем встречаются также, хотя и
на периферии сообщества, представители
родов, обитающих севернее: Formica
lemani здесь замещен довольно сходным
с ним южным вариантом - F.fusca,
который не является доминирующим
видом, а по существу живет в ассоциации
с Т. caespitum', он устраивает гнезда на
территории последнего, но избегает
контактов благодаря тому, что в его
гнезде имеется лишь одно маленькое
входное отверстие, и фуражирует он на
более удаленных кустах и на большей
высоте; эти два вида, возможно, полезны
друг другу. На сухих верещатниках
Myrmica scabrinodis замещен видом
М. sabuleti, который больше нуждается в
тепле и может жить на грасслендах как с
нейтральной, так и с кислой почвой.
М. ruginodis на большей части
травянисто-кустарниковых участков
с нейтральной почвой замещен видом
М. rubra, но сохраняется в кустарниках, в
лесах и на верховых болотах.
В грасслендах с нейтральной почвой
М. rubra встречается с Lasius flavus, но
318 г. шеи 16
Рис. 16.1. Сообщество верещатника
в Дорсете. Толстыми линиями разделены
территории, занимаемые разными видами, а
тонкими-разными семьями. Lasius niger
занимает несколько иную микростацию,
более затененную, с широкими плоскими
камнями для гнезд; здесь он питается, по
крайней мере частично, за счет тлей,
живущих на травах. В местах, достаточно
хорошо прогреваемых солнцем, L.flavus
может вытеснить М. rubra и покрыть
землей камень, под которым жили эти
муравьи (Elmer, 1974). Лесные муравьи
опять-таки встречаются здесь
спорадически, но представлены южным
F. rufa, а не северными F. lugubris или
F. aquilonia.
обитает в тени крутого склона и в сырой
ложбине (пунктирная линия), L.alienus-в
более возвышенной местности к западу, а
Tetramorium caespitum- между ними.
Разви I не лесов приостанавливается из-за
вызываемых человеком пожаров. Лишь
небольшая доля муравьев гибнет
непосредственно от тепловой волны,
распространяющейся от поверхности
почвы вглубь, но последующий
недостаток корма может оказать
опустошающее действие. Муравьи,
обитающие в почве, могут еще питаться
членистоногими и собирать мелких
насекомых, падающих на землю во время
расселительных полетов, но необходимые
для этого более обширные поиски пищи
Многовидовые сообщества 319
вскоре приводят к встрече с соседними
семьями и видами. Lasius alienus
временно расширяет свои территории за
счет Tetramorium, но по мере
восстановления растительности на
прежних местах возвращаются на них и
эти муравьи, так что численность обоих
видов колеблется вместе с циклом
пожар-восстановление и никогда не
достигает стабильности. Как показывают
результаты анализа главных компонент,
в каждой микростации имеется один
представитель Formicinae
и один-Myrmicinae (Brian el al., 1976).
Очевидно, оба эти подсемейства
проникли в местообитания всех типов.
Мы уже рассматривали муравьев острова
Рамси-это виды, принадлежащие
к родам Lasius и Mymrica. Важное
различие между этими родами состоит в
том, что расположение их гнезд,
наиболее плотное у побережья,
различается по степени агрегации:
у Myrmica гнезда менее агрегированы,
чем у Lasius, а из трех видов Lasius
наименее агрегированы гнезда L.flavus.
Несмотря на агрегированность,
распределение плотностей этих видов
близко к случайному, причем большая
часть учетных площадок содержит по
одному виду или не содержит их вовсе, а
площадки, содержащие по 4 или 5 видов,
редки. Это может быть обусловлено
двумя противоположными тенденциями:
стремлением собирать корм в местах,
предпочитаемых всеми видами,
и взаимным ограничением плотностей в
результате конкуренции (Doncaster, 1981).
Сообщество острова Рамси служит
примером состояния, промежуточного
между ситуациями на западе Шотландии
и на юге Англии: хотя вид Formica lemani
замещен видом F. fusca, Myrmica ruginodis
и М. scabrinodis здесь присутствуют, так
же как и М. sabuleti. Tetramorium caespitum
встречается только в двух из наиболее
укрытых прибрежных местообитаний, но
ни в одном из них он не распространен
настолько, чтобы доминировать над всей
фауной муравьев, как это имеет место на
юге Англии. То же самое можно сказать
о Lasius niger, который вместе с L.flavus
преобладает в одной области, поросшей
злаками (Festuca rubra) и защищенной от
сильных ветров; он устраивает также
гнезда у каменных стен. Что касается
отношения к главным компонентам
среды, то виды Myrmica чувствительны к
дренированности почвы (выбирают
влажные поля в низинах) и, по-видимому,
безразлично относятся к освещенности,
которая влияет на распределение видов
Lasius: L. niger и L.flavus занимают
затененные места, a L.alienus-открытые.
Таким образом, в этой местности
выявляются только три локальные
системы доминирования: во главе одной
из них стоит Т. caespitum, другой-L. niger,
а третьей-L.alienus. На возвышенных
местах, заросших орляком, популяция
L.flavus достигает высокой плотности и
вытесняет другие виды в результате
более интенсивного потребления
ресурсов, так как это не агрессивный
муравей. В тех местах, где его биомасса
невелика, с ним сосуществуют другие
виды, живущие в почве ближе
к поверхности. Виды с широкой
адаптивной способностью (L.flavus,
Myrmica sabuleti и М. scabrinodis)
встречаются в разнообразных
местообитаниях, тогда как
специализированные доминанты
(Tetramorium caespitum, L. niger
и L. alienus) ограничены в своем
распространении и агрегированы. Во всех
местообитаниях имеются виды Myrmica и
Lasius. Myrmica чаще встречаются на тех
площадках, где обитают виды Lasius, чем
в тех, где их нет; в одной трети
площадок с L. alienus обитает
и какой-нибудь вид Myrmica. Виды
Myrmica могут сосуществовать с Lasius и
Formica, занимая более влажные
320 г.шеи 16
промежуточные участки, как в Дорсете.
Представителей рода Formica может
ограничивать отсутствие достаточно
толстого слоя почвы, необходимого им
для устройства гнезда и обеспечивающе-
го рост кустов, в которых можно было
бы фуражировать. Таким образом, на
острове Рамси сливаются сообщества
Стратклайда и Дорсета.
На высокогорных лугах в Апеннинах, на
известняковых скалах на высоте 1700 м
(42° с.ш.) Baroni Urbani (1969) также
изучал Tetramorium caespitum и Lasius
alienus. Здесь, выше границы леса, среди
злаков преобладают Brachypodium
pinnatum и Festuca ovina, а наряду с
главными видами муравьев -L. alienus
(55%) и Т.caespitum (36%)-встречаются
также Formica fusca, F. rufibarbis
и Myrmica sulcinodis. L. alienus более
обилен на сравнительно оголенной почве,
где растет Festuca, но никакой другой
зональности в распределении этих видов
не заметно, а гнезда L. alienus и
Т. caespitum распределены случайным
образом. Baroni Urbani не мог выявить
никаких признаков территориального
образа жизни, столь ясно выраженного в
Дорсете, но он заметил, что в августе
L. alienus был склонен фуражировать по
ночам и в одиночку. Обычно оба эти
вида начинают фуражировать с восходом
солнца, усиливают свою активность к
полудню, а затем отдыхают до вечера,
после чего пики их активности вновь
совпадают. У L. alienus наблюдается
более строгая периодичность, чем
у Т. caespitum. С чем связано отсутствие
территориальности у Т. caespitum
в Апеннинах-с климатом или
с условиями среды в грасслендах,-
остается не ясным; возможно, что
устройство горизонтальных тоннелей
в дернине слишком затруднено.
Муравьи заселяют и болота.
В верещатниках на юге Англии
в заболоченных местах обитают главным
образом Lasius niger, Myrmica ruginodis и
M. scabrinodis, но кое-где, на покрытых
травой кочках и других островках
растительности, устраивает свои гнезда
Formica transcaucasica (F.picea) >.
Lasius niger, несомненно, приспособлен к
жизни в местах, затопляемых водой. В
Венгрии (47° с. ш.) он живет
в ложбинках, прорытых ветром
в песчаной почве, a L. alienus строит
гнезда на разделяющих эти ложбинки
гребнях (Galle, 1980). На песчаной
прибрежной равнине между Северным
морем и Ваддензе L.niger проникает в
места, которые зимой оказываются под
водой, особенно на участки, где растет
лишь несколько злаков (главным
образом овсяница Festuca rubra), а другой
растительности мало. Myrmica rubra, но
не его северный двойник М. ruginodis,
встречается в нижней зоне дюн
в дернине, образованной овсяницей, и в
зарослях Linum catharticum на песчаной,
но не слишком засоленной почве.
М. scabrinodis в дюнах редок, но
встречается на небольших холмиках
между ними с дерниной, образованной
овсяницей, где почва содержит больше
ила и солей и где растут галофиты. Lasius
flavus здесь отсутствует, вероятно из-за
тонкозернистой скудной почвы
и недостатка растительности, однако он
очень часто встречается в близлежащих
местах (Boomsma, de Vries, 1980). L. flavus
выживает в соленой воде при 5°С в
течение нескольких дней (Nielsen, 1977), а
на юге штата Мичиган обитает по краям
водоемов, где он строит гнезда близко к
поверхности почвы, никогда не проникая
в глубину и не насыпая холмики
выбранной земли (Talbot, 1965). Другие
данные о том, что L. flavus может жить
по краям соленых маршей и что его
гнезда зарастают сверху овсяницей
1 В нашей литературе принято второе из этих
названий.- Прим. ред.
Многовидовые сообщества 321
Festuca rubra, которую щиплют кролики,
приводит Woodell (1974), изучавший этих
муравьев в восточной Англии. Он
обнаружил здесь на южной части
земляных холмиков Frankenia
laevis-кустарник, обычно встречающийся
в Средиземноморье. L.flavus выносит из
подпочвенных слоев частицы средних
размеров, и его гнездо имеет очень
пористую структуру.
16.1.2. Степь и кустарники
На Бри танских островах в сообществе
грасслендов виды Formica представлены
слабо, но в степях Западной Сибири есть
сообщества, в которых доминируют
F. pratensis и F. uralensis (Стебаев,
Резникова, 1972, 1974). Между
обширными территориями, занятыми
этими двумя видами, умещаются
небольшие территории других видов,
например F. subpilosa и F. transcaucasica.
Каждое утро территория этих видов
расширяется, а поздним вечером
сокращается, причем F. subpilosa, менее
трудолюбивый муравей, чем
F. transcaucasica, обычно фуражирует
только после того, как F. pratensis
удалится в гнездо на ночь (в 22 часа);
если же вид F. subpilosa занимает данную
территорию один, то пик его активности
приходится на 18 часов. Поселяющийся
между ними вид F. transcaucasica служит
временным хозяином для самок
F. uralensis (Collingwood, 1979); он, кроме
того, помогает F. uralensis отыскивать
спрятанные мясные приманки, но не
приманки, выставленные на виду.
Очевидно, у F. uralensis выработалась
привычка проверять, чем заняты муравьи
F. transcaucasica, или реагировать на
оставленный ими след
и мобилизационные феромоны.
В сущности, F. uralensis и F. transcaucasica
не враждебны друг другу; можно
предполагать, что последний вид
пользуется некоторым покровительством
со стороны F. uralensis в обмен на
помощь, оказываемую их
самкам-основательницам, и нахождение
для них пищи; их отношения носят
характер симбиоза (мутуализма), а не
парабиоза (разделения ресурсов).
В западной Сибири, где чистая степь
перемежается с березовыми колками,
можно встретить другое сообщество, в
которое входят Formica pratensis
и F. canicularia (вид, близкий к F. fused), а
также широко распространенные
Tetramorium caespitum, Lasius alienus и
Myrmica scabrinodis (Peznikova, Kulikov,
1978). Значительную часть их пищи
составляют живые и мертвые луговые
растительноядные беспозвоночные, в том
числе различные кобылки, сверчки, мухи,
цикадки и иные насекомые, но прежде
всего-другие муравьи, сменяющие друг
друга в сезонном цикле, среди которых
преобладают молодые особи.
В частности, у М. scabrinodis пища на 70%
состоит из высохших остатков, среди
которых 40% приходится на других
муравьев, главным образом Formica.
Однако 80% пищи самих Formica
составляют свежеубитые беспозвоночные
на ювенильных стадиях развития, причем
разнообразие потребляемых видов
у F. pratensis больше, чем у муравья
F. cunicularis, который поедает мелких
обитателей травяного яруса. На
кормовых территориях F. pratensis может
находиться 4-7 семей F. cunicularis,
а также 10-12 семей М. scabrinodis.
F. pratensis отправляется на охоту
группами, нападая на живых
прямокрылых, тогда как F. cunicularis
умеет находить этих насекомых, но не
может справиться с ними; как показала в
своих экспериментах Резникова (1971,
1975), F. cunicularis повышает
эффективность фуражировки F. pratensis,
отыскивая для них этих крупных
насекомых. Возможно, что F. pratensis
322 Г.шва 16
отнимает у F. cunicularis значительную
часть их крупной добычи; если
отгородить муравьев F.pratensis сеткой,
то они сами добывают для себя больше
крупных насекомых. Как указывает
Yasuno (1964а,b, 1965а-с), в Японии
виды муравьев с крупными рабочими
особями и большими семьями распреде-
лены независимо от видов с мелкими
рабочими и небольшими семьями.
К последней группе относятся
Tetramorium caespitum, Pheidole fervida и
Paratrechina flaviceps. Поскольку все
крупные виды принадлежат
к подсемейству Formicinae, а два из трех
мелких-к подсемейству Myrmicinae, мы
видим здесь явное сходство с картиной
сосуществования, наблюдаемой
в травянисто-верещатниковой
микростации в Дорсете.
В сообществе муравьев на одном
пастбище в штате Луизиана (31° с. ш.)
Baroni Urbani и Kannowski (1974)
обнаружили преобладание холмиков и
территорий Solenopsis invicta, однако там
обычны также Monomorium minimum и
Paratrechina arenivaga, тогда как
Cyphomyrmex rimosus встречается реже и
распределен независимо от этих видов, а
Solenopsis xyloni обитает только в тени
деревьев. М. minimum, многие семьи
которого живут в холмиках S. invicta,
нападает на последних, выбрасывая на
них струю репеллента, что заставляет
рабочих особей S. invicta заняться чисткой
тела, вместо того чтобы мобилизовать на
помощь своих товарок; эта тактика
оказывается успешной, даже если
М. minimum и не обитает в холмиках
S. invicta. С S. xyloni тот же вид
М. minimum справляется далеко не так
успешно; ему удается создать
популяцию, но затем рабочие S. xyloni
убивают этих муравьев, раздавливая их
своими челюстями. Таким образом, в
затененных местах М. minimum
оказывается в особенно невыгодном
положении. На открытых местах при
дневном свете малая величина муравьев
М. minimum компенсируется наличием у
них распыляемого репеллента; к тому же
они не часто встречаются с S. invicta,
который более активен в ночное
время.
Несколько севернее (39° с. ш.) во влажном
климате штата Мэриленд в листопадных
лесах (Quercus, Fagus, Сагуа) с сильно
развитым подлеском обитает 24 вида
муравьев; четыре главных вида-это
Aphaenogaster rudis (Myrmicinae) (27%),
Prenolepis imparis (Formicinae) (23%),
Paratrechina melanderi (Formicinae) (20%) и
Camponotus ferrugineus (Formicinae) (6%).
Lynch et al. (1980) установили, что
Prenolepis imparis живет большими
стабильными семьями в глубоких
постоянных гнездах, а в его наземной
активности наблюдаются два пика-в мае
и в ноябре. Он избегает температуры
26°С и выше, но достаточно активен при
таких низких температурах, как 10°С
(рис. 16.2). В период с июля по октябрь
A. rudis и Paratrechina melanderi активны
на поверхности земли днем, тогда как
С. ferrugineus активен ночью. Такое
распределение фуражировки во времени
предотвращает столкновения между
тремя из этих четырех видов, так что
периоды активности перекрываются
только у A. rudis и Paratrechina melanderi.
Последний вид с его мелкими рабочими
особями и небольшими семьями быстро
находит пищу, но рабочим приходится
привлекать помощников, чтобы унести ее
в гнездо. Prenolepis imparis сильно
превосходит другие виды по способности
мобилизовать помощников. Кормовые
ресурсы лучше всех защищает, конечно,
С. ferrugineus, который может убить
Р. imparis, но Р. imparis очень агрессивен и
занимает второе место в иерархии
доминирования. Только схватки между
этими двумя видами могут иметь
серьезные последствия; у других видов
дело ограничивается преследованием,
укусами и приставаниями. Р. imparis
Многовидовые сообщества
323
Рис. 16.2. Сезонная комплементарность
фуражировочной активности двух видов
муравьев на лесной подстилке в листопадном
лесу в штате Мэриленд. (Lynch et al., 1980.)
может занять половину сетки
с приманками за 15 мин, а затем
медленно распространиться на остальные
приманки; если муравьям предлагают
прямокрылых, то 66% забирает Prenolepis
imparts, 26°/0-Aphaenogaster rudis и только
4%- Paratrechina melanderi. Prenolepis
imparts не может помешать тому, чтобы
A. rudis забрал себе часть пищи, если она
дается в виде мелких приманок,
распределенных диффузно, но может
монополизировать крупные приманки,
расположенные отдельными пятнами.
Доминирующий вид (Camponotus
ferrugineus) ведет скрытный образ жизни
и фуражирует по ночам; следующий за
ним вид (Prenolepis imparis) живет
глубоко под землей и избегает летней
жары, предоставляя в это время
поверхность земли эвритопному
неспециализированному A.rudis
(Myrmicinae) с его спутником Paratrechina
melanderi (Formicinae). Подобное
распределение видов по времени
активности наблюдается на всем земном
шаре. В сообществах южной Австралии
виды Iridomyrmex занимают
доминирующее положение, активны днем
и не перекрываются в пространстве
(рис. 16.3); между их территориями
остаются промежутки, в которых могут
обитать виды, принадлежащие к другим
родам, таким как Camponotus
и Melophorus (Greenslade, 1979);
представители первого из этих
родов-крупные, трудноуловимые,
неспециализированные и могут
кормиться ночью, а представители
другого фуражируют в жаркие часы дня.
Iridomyrmex purpureus на юге Австралии
обитает только на открытых местах; ему
нужно солнце, и он плохо передвигается
по траве. Этот муравей обходит на
вытянутых ногах границы своей
территории и благодаря этой
демонстрации избегает смертельных
схваток (Greenslade, 1975); в этом он
сходен с Myrmecocystus mimicus
(рис. 16.4; Holldobler, 1976а).
Рабовладение известно только в трех
трибах муравьев: Tetramorini,
Leptothoracini (Myrmicinae) и Formicini
(Formicinae) (Biischinger et al., 1980). Эта
крайне сильная взаимозависимость
возникла только в травянисто-
324 Глава 16
Рис. 16.3. Распределение территорий
(границы очерчены прерывистыми линиями) и
гнезд (черные кружки) Iridomyrmex purpureus
(Greenslade, 1975а.)
кустарниковых сообществах
северного умеренного пояса с высокой
плотностью популяций видов-„рабов“:
2% видов являются социальными
паразитами и 17,5%-„рабовладельцами“.
Все это моногинные виды, использующие
в качестве хозяев также моногинные
виды, хотя некоторые из них
факультативно полигинные,
а один - Polyergus lucidus- может даже
быть в течение какого-то времени
полигинным, однако его добавочные
самки совершают набеги и вместе
с несколькими рабочими особями
основывают новое гнездо. Polyergus и
Strongylognathus сильными заостренным!
Многовидовые сообщества 325
Рис. 16.4. Демонстративное поведение
рабочих особей Myrmecocystus mimicus на
границе территории. (Holldobler, 1976а.)
челюстями прокалывают головы
непокорных рабов. Можно представить
себе много гипотетических стадий,
в результате которых возникает
рабовладение: сначала самки после
брачного полета могут попасть в гнезда
одного из близко родственных видов;
часто такой социальный паразитизм
бывает лишь временным, а затем
пришлая самка строит собственное
гнездо. Но если ее собственные рабочие
особи специализированы для набегов, то
ей придется „послать" их в набег на
соседние семьи „хозяина" за куколками.
Муравей Formica sanguinea, по-видимому,
занимает доминирующее положение
в травянисто-кустарниковых
местообитаниях в лесах Евразии. Он
ведет себя агрессивно по отношению к
F. rufa и F.pratensis, сначала унося из их
гнезд куколок, а затем уничтожая
рабочих особей; из некоторых куколок,
унесенных в гнездо F. sanguinea, выходят
взрослые особи, которые становятся
членами новой семьи и даже
отказываются признавать самок своего
вида. Рабочие F. fusca и F. rufibarbis
настроены к F. sanguinea менее
враждебно, и семьи этих видов могут
избежать уничтожения. Вид F. sanguinea
агрессивен также по отношению к Lasius
niger, L.flavus и Camponotus herculeanus и
может уничтожать их гнезда, но он
может также существовать
самостоятельно, питаясь падью
и насекомыми, например лесными
муравьями (Marikovsky, 1963). Более
специализированный социальный паразит
(рабовладелец) Polyergus rufescens
совершает набеги на гнезда F. fusca и
F. cinerea. Проведение набега зависит от
различий в реакции со стороны хозяев
(Dobrzanska, 1978): муравьи F. fusca, у
которых входы в гнездо закамуфли-
рованы, выносят свой расплод
и спасаются бегством, взбираясь на
растения; поликалический вид F. cinerea,
которому свойствен обмен рабочими
между гнездами, строит баррикады. Эти
способы защиты эффективны при
нападениях F. sanguinea, но атаки
Р. rufescens бывают так внезапны
и сокрушительны, что на оборону просто
не хватает времени. „Рабы",
находящиеся в гнезде, тоже ведут себя во
время набега по-разному: муравьи
F. fusca расширяют свои входные
отверстия и уменьшают заторы,
создаваемые возвращающимися Polyergus
rufescens; что касается F.cinerea, то они
просто подбирают своих куколок,
которых Р. rufescens бросает снаружи, и
326 Глава 16
даже могут отнимать их силой. Частично
такое поведение развивается в результате
научения, постепенно достигая
совершенства. У Р. rufescens, рабы
которых принадлежат к виду F. rufibarbis,
сезон активности начинается раньше.
Судя по имеющимся данным, вид
Р. rufescens не делится на расы,
различающиеся по своим „жертвам";
Dobrzanska даже сообщает о нескольких
случаях, когда в одной семье Р. rufescens
рабы относились к нескольким разным
видам.
Расселяющиеся полигинные формы
Formica rufa по мере своего
распространения вытесняют другие виды
и могут даже уничтожить F.fusca,
в гнездах которого молодые одиночные
самки F. rufa основывают новые семьи
как временные социальные паразиты.
Некоторые виды используют лесных
муравьев: Formicoxenus nitidulus
(Mirmicinae) устраивает гнезда в их
холмиках, Diplorhoptrum fugax
уничтожает их расплод, a Leptothorax
обитает в оболочке их холмика.
Распространяющийся на острове
Хоккайдо подвид Formica truncorum
yessensis, вероятно, вытесняет многие
более мелкие виды Lasius, Aphaenogaster и
Myrmica, но проворный F.japonica живет
на открытых местах, недоступных
F. truncorum yessensis, тогда как
и Diplorhoptrum, и Leptothorax
сосуществуют с F. t. yessensis (Higashi,
Yamauchi, 1979). Расселяющаяся
популяция F. lugubris в горах Юры не
уничтожает относящихся к Myrmicinae
Tetramorium caespitum, Leptothorax
acervorum, Manica rubida и три вида
Myrmica (Cherix, 1980). F. opaciventris (из
группы F.exsectoides) встречается только
в западной части Северной Америки, и
Scherba (1964) отмечает, что в штате
Вайоминг на высоте 2065 м на полынном
лугу, окруженном тополями, ивами и
соснами, его гнезда находятся на
расстоянии примерно 6 м одно от
другого; этот муравей, по-видимому, не
допускает на луга муравьев F. fusca,
которые живут только на открытых
местах в лесу. В тех местах, где эти виды
встречаются друг с другом, F. opaciventris
осаждает гнезда F. fusca, постепенно
уничтожает его рабочих особей и уносит
расплод, но он может делать это только
на лугах; в лесу F.fusca эффективно
сопротивляется, часто временно покидая
свое гнездо.
Еще один пример относится к Японии,
где Yasuno (1964а, Ь, 1965а-с) на высоте
до 600 м (41° с. ш) изучал сообщество
грассленда, окруженного буковым лесом.
В одних районах доминирует Formica
exsecta *, а в других -F. truncorum.
Последний поселяется на хорошо
прогреваемых лесных опушках, а если
удалить его, то его место занимает
F fusca 2, приходящий с открытых
грасслендов, или Camponotus
herculeanus - с травянисто-кустарниковых
участков. F. truncorum-поликалический
вид, создающий новые семьи, но он
может также использовать F. fusca
в качестве временного хозяина.
Polyergus rufescens избегает Formica
truncorum и даже не трогает гнезд F. fusca,
если они находятся на территории
F. truncorum, так что последний
фактически защищает F.fusca там, где
может. Непосредственно вокруг своего
гнезда Р. rufescens искореняет муравьев
F.fusca, которые, однако, обладают очень
высокой приспособляемостью и быстро
возвращаются назад, если удалить
Р. rufescens. Таким образом, F.fusca
составляет основу сообщества муравьев;
он пользуется защитой со стороны
доминантного вида (F. truncorum),
1 По современной номенклатуре F.japonica-
Прим. ред.
г По современной номенклатуре F.fukaii-
Прим. ред.
Многовибовые сообщества 327
который использует его в качестве
временного хозяина, и сам используется
подчиненным видом (Р. rufescens)
в качестве хозяина (раба). F. truncorum
удерживает также Myrmica ruginodis в
прохладных местах в глубине леса.
Рабовладельцы подчиняют себе самку
вида-хозяина (например, Strongylognathus
karawajewi), препятствуя развитию
половых особей из ее расплода;
по-видимому, все яйца мужского пола
(гаплоидные), которые она откладывает,
уничтожаются, а развитие диплоидных
яиц подавляется, если у личинок заметны
признаки развития в самок. Такая семья
может существовать лишь до тех пор,
пока жива самка вида-хозяина. В случае
ее уничтожения семье, чтобы продолжать
свое существование после гибели рабочих
вида-хозяина, приходится время от
времени добывать замещающих рабочих
(в виде куколок) из разных гнезд. Таким
образом, рабовладение возникает из
конкуренции или неэффективного
хищничества, при котором собранные
при набегах куколки не поедаются.
Развивающиеся из них рабочие особи
способны при этом научиться заниматься
тем, с чем они сталкиваются в своем
непосредственном окружении. Только
виды, проявляющие способность
к научению в раннем возрасте, могут
стать рабами; по всей вероятности, виды
с полностью врожденным поведением
(как, например, Lasius niger) не пригодны
для этого (Le Moli, 1980). Однако L. niger
нередко служит хозяином для самок
L. umbratus, которые оказываются в роли
временных социальных паразитов.
Рабовладение ведет к быстрой утрате
нормального независимого поведения
видом, использующим рабов.
Североамериканский Leptothorax duloticus
совершенно не способен собирать
и перерабатывать твердую пищу, хотя он
все еще умеет строить гнезда
и заботиться о расплоде. Если удалить
рабов (£. curvispinosus), его забота
о расплоде возрастает, но не в такой
степени, чтобы он мог самостоятельно
выжить (Wilson, 1975). L. duloticus,
добывающий личинок и куколок во
время набегов, обладает рядом мелких
морфологических особенностей,
облегчающих переноску крупных
объектов (эти же особенности имеются у
рабовладельческих видов Formica). Wilson
указывает также на черты поведения,
которые могут быть выгодными для
рабов; например, их рабочие особи
откладывают яйца и добавляют их к
кучке яиц, отложенных самкой
L. duloticus. Хотя некоторые из этих яиц
бывают съедены, рабы, возможно,
производят нескольких самцов, которые,
по-видимому, копулируют с молодыми
самками из гнезд без паразитов
и распространяют гены рабства.
Благодаря этому они могли бы
пользоваться покровительством
рабовладельцев в обмен на
выкармливание их молоди. Такого рода
мутуализм напоминает „парабиоз", при
котором фуражиры предоставляют свою
способность отыскивать пищу в обмен на
обеспечиваемую им защиту.
Этот беглый обзор сообществ муравьев в
областях с умеренным климатом
показывает, что межвидовая иерархия
доминирования построена по некоему
общему плану. Доминантный вид
удерживает за собой первоклассные
кормовые зоны с помощью силы
и жестокости отдельных особей, своей
организованности и „экономической
мощи“, но при этом вокруг остается
множество мест с субоптимальными
условиями, где могут существовать виды,
приспособленные к более низким
температурам, обладающие особыми
навыками в добывании корма или
устройстве гнезд или же просто
достаточно скрытные. В стабильных
условиях развивается полигиния, ведущая
328 Глава 16
к социальному паразитизму
и рабовладельчеству; но если рабы
способны размножаться партеногене-
тическим путем, то такие
отношения не обязательно выгодны лишь
одной стороне, так как рабы при этом
пользуются защитой со стороны
доминирующего вида.
16.2. Сообщества пустынь
Важными членами экосистем засушливых
местообитаний являются термиты
(табл. 16.1).
16.2.1. Термиты
Недавно Johnson и Wood (1979)
опубликовали обзор по распространению
термитов в аридных зонах Африки и
Аравийского полуострова. Род
Psammotermes (четыре вида),
относящийся к семейству Phinotermitidae,
встречается только в засушливых
областях. В Сахаре эти термиты живут в
оазисах и по краям пустыни; их гнезда
расположены под землей на глубине до
5 м, что позволяет им избегать вредных
последствий колебаний температуры,
перевевания песка и иссушения. Они
могут добывать воду для увлажнения
стенок своих гнезд из грунтовых вод на
глубине 40 м. Виды Psammotermes
фуражируют под прикрытием лепных
тоннелей, используя самую
разнообразную пищу: навоз, выкопанную
почву, подстилку, а в более влажные
периоды - древесину.
В штате Аризона в горах Санта-Рита на
высоте 950 м пять подземных видов
потребляют разную пищу при разных
способах питания (Haverti, Nutting, 1975;
Haverty et al., 1975). Один из них,
Heterotermes aureus (Rhinotermitidae),
поедает мертвую древесину на
поверхности почвы (56% Opuntia, 17%
Acacia, 13% Prosopis), тогда как другие
термиты предпочитают опунции акацию
и поедают также Cercidium или злаки. Lee
и Wood (1971) перечисляют 9 подземных
видов, обитающих в зарослях
кустарниковых эвкалиптов на юге
Австралии. В африканской саванне,
поросшей туссоковым злаком Loudetia,
Bodot (1966) нашел 20 видов термитов,
по большей части подземных, хотя
некоторые из них строят холмики. Эти
виды тоже различаются по своей пище;
многие срезают сухие злаки и запасают
их (Trinervitermes), другие поедают корни
злаков (Amitermes evuncifer). Есть также
гумусоядные виды, такие как Cubitermes
severus и два вида Trinervitermes, которые
кормятся одними и теми же злаками, но
используют их по-разному (Bodot, 1966).
Bodot описывает также, каким образом
тип почвы, влажность и растительный
покров влияют на распространение
термитов в саванне Берега Слоновой
Кости. В этом районе наблюдается
постепенное исчезновение Macrotermes
natalensis, возможно в результате
вмешательства человека или какого-то
изменения климата (или обоих этих
факторов). Amitermes evuncifer поселяется
в старых разрушающихся холмиках, а
также вторгается в холмики Cubitermes
severus и некоторых видов Trinervitermes,
перестраивая их на свой лад (Bodot,
1966). Половые особи, по-видимому,
падают на землю и обламывают крылья
вблизи этих холмиков, а затем
постепенно проникают в них; это
относится в особенности к T.geminatus
(Josens, 1972).
Как установил Josens, в Ламто (Берег
Слоновой Кости) Macrotermitinae,
вероятно, конкурируют за пищу, но не за
место для гнезда, поскольку
большинство из них строят диффузные
подземные гнезда; тем, кто строит
холмики, могут помешать найти
подходящее место другие термиты;
злаки, которыми они питаются, имеются
Таблица 16.1. Обилие и биомасса (живой вес) термитов в различных
системах (Wood, Sands, 1978)
Экосистема Вид или группа видов Тип гнезда1 Числен- ность на 1 м2 Масса, г/м2 Источник данных
Тепло-умеренная зона
Жестколистный лес, юг Nasutitermes exitiosus Холмик 600 3,0 Lea, Wood, 1971b
Австралии
Семиаридный грассленд, Gnathamitermes Подземное (1) 0-9127 0-22,21 Bodine, Ueckert, 1975
Северная Америка tubiformans Среднее за 3 года 2139 5,2
Кустарник / грассленд, Северная Америка Heterotermes aureus Подземное (1) 431 Haverty, Nutting, Fage, 1975
Сахельская саванна, Западная Африка Все виды Подземное + холмики (2) 229 1,0 Lepage, 1974b
Тропическая саванна
Саванновое редколесье, север Австралии Все виды Подземное (3) 2000 Lee, Wood, 1971b
Травяная саванна, Центральная Африка Cubitermes exiguus Холмик 612-701 1,3-1,9 Hebrant, цит. no Bouillon, 1970
Саванна Apicotermes „gUTguliflex” Подземное 70 Bouillon, 1962, 1964
Северогвинейская саванна, Западная Африка Trinervitermes geminatus Холмик 110-2860 Sands, 1965a,b
Южногвинейская саванна, Западная Африка Все виды Подземное + холмик (4) 4402 11,1 Wood et al., 1977 и неопубли- кованные данные
Вторичная южногвинейская » » Подземное (5) 2966 3,6 Wood et al., 1977
саванна, Западная Африка
Вторичная саванна, Западная Африка » » Подземное + холмик (6) 861 1,7 Josens, 1972
Тропический лес
Полулистопадный лес, Западная Африка » » Подземное (5) 3163 8,0 Wood, Johnson, неопублико-
ванные дан-
ные
Продолжение табл. 16.1
Экосистема Вид или группа видов Тип гнезда1 Числен- ность на 1 м* Масса, г/м2 Источник данных
Прибрежный лес, Все виды Подземное + 1000 11,0 Maidague, 1964
Центральная Африка Дождевой лес, Вест-Индия Дождевой лес, Южная » » Nasutitermes costalis холмик Подземное (7) Холмик 4450 87-104 0,1 Strickland, 1944 Wiegert, 1970
Америка Дождевой лес, Малайзия Четыре вида Холмик 1330 3,4 Matsumoto, 1976
А гроэк осистемы Выпасаемый луг, Все виды Подземное (5) 2010 2,8 Wood et al., 1977
Западная Африка Кукуруза (1-й год), » » » » 1553 1,7 Wood et al., 1977
Западная Африка Кукуруза (от 8 до 24 лет), » » » » 6825 18,9 Wood et al., 1977
Западная Африка Пробы почвы брались с глубины 30 см (1), 75 см (2), 8 см (3), 200 см (4), 100 см (5), 50-60 см (6) и 7,5 см (7). В работах
Josens (1972) и Lepage (1974b) пробы в случае подземных видов брались из ямок, выкопанных вручную; во всех остальных работах
использовались керновые пробы.
Многовидовые сообщества 331
Рис. 16.5. Горизон-
тальное распределение
грибных садов у двух
термитов - Ancistrotermes
cavithorax (белые кружки)
и Microtermes toumediensis
(темные кружки).
В центре изображены
основания двух деревьев
(концентрические
кольца). На этом участке
находятся две
репродуктивные камеры
A. cavithorax, возможно,
принадлежащие двум
разным семьям (большие
белые кружки). (Josens,
1972.)
в изобилии, и 90% обитающих в этой
области наземных термитов потребляют
злаки. Josens обнаружил здесь 26 видов,
из которых 11 встречаются очень редко.
Остальные 15 видов можно разделить на
следующие экологические группы:
наземные-жнецы рода Trinervitermes
(четыре вида) и один вид, питающийся
древесиной (Amitermes evuncifer);
подземные - Ancistrotermes cavithorax,
Microtermes toumediensis, Odontotermes
(вид неизвестен) и Pseudacanthotermes
militaris, выращивающие грибы, один
вид, питающийся древесиной без участия
грибов (Microcerotermes parvulus), и пять
гумусоядных видов (Josens, 1972).
Идентифицировать отдельные семьи
Macrotermitinae не удалось-имеются
лишь косвенные сведения
о существовании семей, и возможно, что
они слились; однако Josens произвел
подсчет среднего числа грибных камер на
гектар и получил следующие данные:
Ancistrotermes cavithorax -21 500,
Microtermes toumediensis -24 400,
Odontotermes -3300 и Pseudacanthotermes
militaris -8000. Были получены также
подробные сведения о составе этих
популяций, их биомассе и превращении
энергии (рис. 16.5 и 16.6). После
ежегодных пожаров растительных
остатков бывает мало, хотя кустарники и
деревья сбрасывают листву; в таком
случае между термитами должна быть
конкуренция, несмотря на их диффузные
гнезда, распределение по разным ярусам
и различия в питании. Из 9920 приманок
(связок травяных стеблей),
расположенных в шахматном порядке,
только 40 использовались одновременно
332 Глава lf>
20
40
60
Грибные сады на каждой глубине, %
10
20 30
~i------------------r
Pseudocanthotermes
и Microtermes
Odontotermes
Рис. 16.6. Вертикальное
распределение грибных
камер (в процентах от их
общего числа) четырех
видов термитов:
Ancistrotermes cavithorax;
Odontotermes spp.;
Pseudocanthotermes
militaris и Microtermes
toumediensis вместе.
(Josens, 1972.)
Ancistrotermes
natalensis явно препятствует устройству
гнезда Cubitermes sankurensis в радиусе
5-10 м. Такого рода конкуренция не
обязательно приводит к схваткам; она
связана с тем, что пища используется
более эффективно, если ее источник
находится вблизи гнезда, Hodotermes
mossambicus и Trinervitermes trinervoides
питаются злаками в одной и той же
местности и обычно избегают друг друга,
80
двумя видами (Ancistrotermes cavithorax и
Microtermes toumediensis). Поскольку
в одиночку A. cavithorax использовал
2485, a M. toumediensis-2Q59 приманок,
то, если эти виды безразличны друг
другу, число общих приманок должно
было бы составить 511. В тех случаях,
когда оба вида используют одну и ту же
приманку, они устраивают земляную
перегородку, чтобы отделиться друг от
друга.
Хотя примеры сообществ термитов и их
описания многочисленны (см. Krishna,
Weesner, 1970), прямых данных
о взаимодействиях термитов мало.
Согласно Noirot (1959), по крайней мере
разные роды избегают встреч, a Bouillon
(1970) приводит интересный пример
взаимодействия, когда наличие
гнездового холмика Macrotermes
а если их насильственно смешать, то
между ними возникают драки (Nel, 1968).
В южной Австралии разные виды
Coptotermes обитают в разных бревнах
(Calaby, Gay, 1956, цит. по Lee, Wood,
1971). Плотность Nasutitermes exitiosus
достигает 8,6-9,2 холмиков на гектар, а
при наличии в данной местности
Coptotermes lacteus-всего 2,4 на гектар;
они рассеяны по занимаемой ими
территории. У трех родов термитов,
питающихся злаками, тоже наблюдается
тенденция к дисперсии. Nasutitermes
triodei в присутствии Hemitermes laurensis
чаще покидает свои холмики; оба эти
вида питаются злаками, и хотя первый из
них поедает, кроме того, помет
животных и растительные остатки, это
его, очевидно, не спасает (Lee, Wood,
1971).
Сходные сообщества частично наземных
термитов изучал Josens (1972) в Ламто.
Он нашел на 1 гектаре в среднем 40,5
гнезда Trinervitermes geminatus (60% гнезд
МноговиОовые сообщества 333
и 80% всей биомассы термитов), 14,7
гнезда Т. togoensis, 3,2 гнезда Amitermes
evuncifer, 2,6 гнезда Т. oeconomus
и в меньшем числе гнезда двух других
видов Trinervitermes. В травяной саванне
(главным образом Loudetia) есть бугорки,
образовавшиеся из старых
распадающихся холмиков Macrotermes',
на этих хорошо дренируемых островках
обосновывается Т. togoensis, получая
таким образом возможность селиться в
сырых, покрытых травой местах.
Т. geminatus обитает на более открытых,
но поросших кустарником участках, а
численность Т. oeconomus достигает
максимума в очень густой кустарниковой
саванне. Гнезда Macrotermitinae, ведущих
подземный образ жизни, настолько
диффузны, что, по мнению Josens, они
конкурируют только за пищу; что же
касается наземных видов, среди которых
9/10 составляют термиты-жнецы, то, как
показывают его расчеты, из 4-5,5 т/ra (по
сухому весу) общего количества
собранного ими корма съедается только
несколько десятков килограммов.
Sand (1965), изучавший Trinervitermes в
саваннах Нигерии, уделял главное
внимание сравнению видов,
принадлежащих к одному роду, а не
исследованию сообществ; тем не менее
интересно отметить, что, как он
обнаружил, в гнездах Trinervitermes
обычно живут и другие термиты или же
муравьи, а иногда те и другие. Обычно
никаких контактов между разными
видами как будто бы не бывает, но если
вскрыть холмик, то „немедленно
возникает сумбурный конфликт11.
В гнездах Trinervitermes trinervius живет
один вид Microtermes, в гнездах
Macrotermes natalensis- другой вид, но
хозяева не обращают на них внимания.
Ввиду резкого различия в размерах
между сожителями эти взаимоотношения
можно, по-видимому, считать типичным
случаем парабиоза.
La Fage и Nutting (1978), изучая
взаимоотношения термитов в пустыне
вблизи Таксона (Аризона), помещали
бумажные приманки либо на сеточки,
либо под поверхностный слой почвы.
Термиты Heterotermes aureus
прокладывали к 53% этих приманок узкие
неровные галереи, a Gnathotermes
perplexus- более широкие и аккуратные
галереи к 96% приманок; к тем
приманкам, которые использовали оба
вида, каждый из них подходил по своим
галереям, избегая галерей, проложенных
другим видом.
Термиты нередко поселяются в гнездах
других видов в качестве сожителей.
Вид-сожитель часто бывает гораздо
мельче вида-хозяина и менее активен;
такие два вида могут быть либо
родственными, либо очень далекими
(Bouillon, 1970). Иногда этот парабиоз
бывает облигатным, оба вида могут
пользоваться одними и теми же
галереями, и их репродуктивные пары
находятся в тесной близости, а в других
случаях вид-хозяин изолирует от
сожителя свою царскую пару. Josens
(1972) обнаружил вокруг камеры термита
Ancistrotermes cavithorax и в ее стенках
галереи значительно более мелкого
гумусоядного термита, а также
аналогичные галереи в стенках
репродуктивной камеры
Pseudacanthotermes militaris. Помимо
такиях явных примеров использования
одним видом гнезда другого вида
термиты, строящие большие холмики,
разрыхляют почву, помогая другим
видам проникать в нее. В Южной
Америке Comitermes cumulans строит в
грассленде холмики высотой до 4 м. Если
эти термиты покидают свои холмики, то
в них поселяются общественные осы,
муравьи и даже рептилии, а также другие
термиты. Sands в своих экспериментах
показал, что некоторые виды термитов
предпочитают землю, взятую из холмика
334 Глава 16
другого вида, обычной почве. Термиты
размельчают не только почву; они могут
размельчать древесину, чтобы снабжать
гумусоядных термитов перегноем,
создавая тем самым сукцессию от видов,
питающихся древесиной, к гумусоядным
видам.
На термитов часто охотятся муравьи;
Camponotus, Crematogaster и Pheidole
поедают Trinervitermes. Megaponera
foetens не только охотится на многих
Macrotermitinae, но и поселяется в их
старых холмиках. В районе Моквы
(9° с. ш.) из 83 изученных гнезд этого
муравья 37 находились в заброшенных
холмиках Macrotermes bellicosus, 3-в
холмиках Trinervitermes, 36-в земле под
кустами и 7-на открытых местах
(Longhurst, Howse 1979а, b). Доля общих
гнезд с Trinervitermes geminatus варьирует
в зависимости от местообитания
и возрастает там, где много старых
холмиков. При парабиозе муравьи
обычно избегают термитов и безусловно
не нападают на них, пока термитник не
поврежден. Многие Dorylinae истребляют
термитов, солдаты которых либо
оказывают им сопротивление, защищая
шаг за шагом свое гнездо от
проникновения муравьев, либо уходят
колоннами, двигаясь по поверхности
земли, и возвращаются после
прекращения атаки. Апотта kohli может
затратить несколько дней, чтобы
проникнуть в большой холмик
Cubitermes. Среди термитов Macrotermes
bellicosus в Мокве, где их многочисленные
холмики беспорядочно разбросаны по
саванне, очень высока смертность от
нападения хищников, и, как считает
Collins (1981а), их плотность
регулируется скорее хищниками, чем
внутривидовой конкуренцией.
На одном гектаре в Ламто (Берег
Слоновой Кости) можно обнаружить
1,6 млн. собирающих или срезающих
траву термитов вместе с 4,5 млн. особей
гумусоядных видов и 5 млн. термитов,
выращивающих грибы (Josens, 1972).
Фуражиры или жнецы потребляют
30^50 кг сухой травы в год,
гумусоядные- примерно 30 кг целлюлозы
в год и перекапывают не менее 15 тонн
почвы за год, тогда как виды,
выращивающие грибы, ежегодно вносят
в почву около 1,3 тонны растительных
остатков (сухой вес).
16.2.2. Муравьи
Муравьям, для того чтобы они могли
выжить в пустыне, следует потреблять
разнообразную пищу и включать в свой
рацион такие растительные продукты,
как, например, семена и листья. Из 97
видов муравьев, обитающих в Сахаре, 55
используют подземные источники воды
(Delye, 1968); их кутикула менее
проницаема для воды, чем у сходных
европейских видов, и они активно
избегают чрезмерной жары и сухости.
Они устраивают гнезда везде, где есть
растения, например вокруг оазисов,
собирая и запасая семена во время
короткого влажного периода и потребляя
также насекомых, если они имеются. Ofer
et al. (1978) описали почвы и климат, а
также фауну муравьев (в общей
сложности 49 видов) по трансекте,
проведенной через пустыню в Израиле от
побережья к горам. По статистическим
данным о температуре, местообитания
здесь можно разделить на теплую
прибрежную пустыню, холмы и область
ручьев, стекающих по северным склонам;
оказалось, что в каждой зоне обитает
свой, характерный для нее вид, а в целом
виды, принадлежащие к одному роду,
занимают разные местообитания.
В самых прохладных районах был
обнаружен даже Lasius alienus'.
Обследование, проведенное в горах
Чирикауа в Аризоне, где прохладный
влажный лес сменяется на юге сухими
Многовидовые сообщества 335
кустарниками с примесью суккулентов
(Eastlake et al., 1980), показало, что
Myrmicinae обычны на северо-западе и
редки на юго-востоке, тогда как
Dolichoderinae редки на севере, обычны
на юго-западе и обильны на юго-востоке.
Из семи зерноядных видов пять
относятся к роду Pheidole
(все они-мелкие муравьи), но три
зерноядных вида, обычные на северном
склоне, значительно различаются по
величине и, возможно, поедают семена
разных растений.
Корреляция между величиной муравьев и
семян была установлена на трансекте,
проходящей через пустыни Мохаве
и Сонора (Калифорния и Нью-Мексико),
выбранной потому, что она
соответствует градиенту количества
осадков (Davidson, 1977). В Калифорнии,
где за год выпадает меньше 100 мм
осадков и средняя температура июля
29-34°С, было найдено три вида
зерноядных муравьев, а в Нью-Мексико
(225-275 мм и 26-27°С соответственно)-8
видов. Ни один вид не встречался по всей
трансекте, но некоторые имелись на 6 из
10 станций. В Калифорнии обычны
Veromessor pergandei и два вида
Pogonomyrmex, тогда как в Нью-Мексико
преобладают Novomessor cockerelli,
Solenopsis xyloni, Pogonomyrmex negosus и
Pheidole desertorum. Davidson нашла, что
во влажных продуктивных
местообитаниях не только больше видов,
но и семьи их расположены плотнее, чем
в более сухих местах. Дополнительные
виды-это главным образом виды
с мелкими рабочими особями (<3 мм в
длину), фуражирующими на расстоянии
не более 3-4 м от своих гнезд, но есть
также виды с крупными (>9 мм)
рабочими, например N. cockerelli,
Pogonomyrmex rugosus и Р. barbatus,
фуражирующие в радиусе до 40 м
(Holldobler, 1976а). Длина Veromessor
pergandei варьирует в пределах от 3,5 до
8,4 мм (при общем диапазоне длины
особей всех видов от 1,8 до 9,8 мм),
однако сильная конкуренция со стороны
других видов ограничивает размеры его
особей.
Все это позволяет предполагать, что
пища как лимитирующий фактор играет
более важную роль, чем место для
гнезда, хотя Davidson не могла собрать
веских данных, которые указывали бы на
распределение этих зерноядных видов по
разным зонам или разным ярусам или на
какое-либо иное разграничение,
обусловленное их биологией. Адаптация
к семенам определенной величины,
конечно, способствует подбору
сосуществующих видов, однако Davidson
(1977) приводит данные о том, что виды,
различающиеся по размерам тела,
сосуществуют только в том случае, если
они различаются также по способу
фуражировки. Виды, у которых рабочие
фуражируют в одиночку, собирают
семена на отдельно стоящих редких
растениях, а виды, для которых
характерна групповая фуражировка,
используют растения, образующие
плотные пятна. Таким образом, способ
фуражировки муравьев соответствует
характеру распределения их пищи. Виды,
фуражирующие группами, усердно
собирают семена при подходящей погоде
и складывают их про запас, тогда как
одиночные фуражиры работают все
время, при любой погоде. Согласно
Davidson, крупные виды могут
фуражировать как группами, так и в
одиночку (например, Pogonomyrmex
rugosus), но все мелкие виды фуражируют
группами (например, Pheidole).
Были обследованы пробные площадки в
пустыне Большого Бассейна (от 44 до 36°
с. ш.) и в пустыне Мохаве (35° с. ш.),
расположенные на разной высоте, вплоть
до 1500 м (Bernstein, 1975, 1979а, Ь;
Bernstein, Gobbel, 1979). Novomessor
pergandei был обнаружен только на
336 Глава 16
четырех нижних площадках (500, 610, 700
и 830 м), a Pogonomyrmex rugosus-только
на трех верхних (876, 1150 и 1500 м),
тогда как Р. californicus встречался на всех
площадках от 610 до 1500 м, хотя и
пятнами. На самых малых высотах-75 и
500 м-обитает шесть видов, в том числе
Veromessor pergandei, Р. californicus
и Conomyrma insana. На высоте 1500 м
V.pergandei и С. insana отсутствуют, но
Р. californicus все еще встречается вместе с
Р. rugosus, Pheidole xerophila и Iridomyrmex
pruinosum. Pogonomyrmex rugosus
и P. californicus фуражируют в одиночку,
а не группами; если только между
разными популяциями Р. rugosus нет
какого-то генотипического различия, то
придется предположить (основываясь на
наблюдениях Holldobler, 1976а), что они
могут фуражировать в одиночку в тех
случаях, когда их на это толкает характер
распределения пищи. Фуражировка
у V. pergandei может варьировать от
групповой, если семян мало и они
распределены пятнами, до
индивидуальной в период образования
семян, когда они распределены более или
менее равномерно.
Диапазон температур, при которых
муравьи отправляются на фуражировку,
расширяется с высотой над уровнем моря
и с широтой, а тем самым увеличивается
и перекрывание между разными видами
во времени. В жаркой и сухой
малопродуктивной пустыне сбор корма у
каждого вида ограничен коротким
периодом, когда корма много и собирать
его выгодно. Этот период, конечно, у
разных видов приходится на разное
время. Никаких признаков столкновений
между фуражирами из разных семей не
было. В исследованных диапазонах
высоты над уровнем моря и широты
обычна чрезмерная дисперсия гнезд
муравьев какого-либо одного вида,
обусловленная, вероятно,
столкновениями между фуражирами, т. е.
защитой кормовых участков. Переходя
от сообществ больших высот и высоких
широт к более низким местам и низким
широтам, можно заметить, что у всех
видов расположение семей группами,
характерное для пятнистой многолетней
растительности, которая создает
местообитание, разделенное на зоны и
ярусы, сменяется рассредоточенным
и более однородным. Места для гнезд
распределяются между видами
случайным образом (Byron et al., 1980).
Вообще, чем больше имеется видов, тем
меньше перекрывание кормовых
территорий независимо от широты или
высоты. Bernstein (1979b) изучал также
состав пищи муравьев. Муравьи
потребляют либо семена, либо животную
пищу, либо нектар. С уменьшением
высоты местности в пустыне Большого
Бассейна пища становится менее
разнообразной и перекрывание пищевых
спектров разных видов возрастает.
В пустыне Сонора конкуренция между
Novomessor cockerelli и Veromessor
pergandei в периоды недостатка пищи
усиливается, и в эти периоды первый из
них потребляет больше животных, живых
и мертвых, и меньше семян.
В пустыне Чиуауа были изучены
(Whitford, 1978) два местообитания:
бахада-широкий аллювиальный веер у
входа в старое озеро, поросший
креозотовым кустом (Larrea tridentata), и
плайя-область с песчаной почвой вокруг
высохшего озера, поросшая мескитовым
деревом (Prosopis) и юккой (Yucca). В
бахаде преобладают зерноядные
муравьи-пять видов Pogonomyrmex
и четыре вида Pheidole ', они активны
главным образом днем, и дожди
стимулируют у них фуражировку.
В плайе преобладают всеядные виды,
такие как Novomessor cockerelli, Formica
perpilosa, Iridomyrmex pruinosum
и Myrmecocystus, если наибольшее
разнообразие насекомых наблюдается
Многовидовые сообщества 337
ночью. Trachymyrmex smithi (Attini),
собирающий детрит для своего сада, и
хищный Neivamyrmex nigrescens
(Dorylinae) распространены в обоих этих
местообитаниях, хотя очевидно, что
различия в пище, способах питания и
изменения условий среды в течение суток
имеют важное значение. Whitford
установил также, Что сосуществование
видов облегчается различиями в общих
размерах и в сезонной активности.
Интересную форму межвидовой
конкуренции описали Moglich и Alpert
(1979). В горах Чирикауа в Аризоне
муравей Conomyrma bicolor
(Dolichoderinae) собирает мелкие
камешки и другие предметы и сбрасывает
их через входные отверстия в гнезда
других муравьев, в том числе трех видов
Myrmecocystus, Novomessor cockerelli
и Pogonomyrmex desertorum, с которыми
он конкурирует за тлей на юкке и за
термитов. Эти действия С. bicolor
препятствуют фуражировке видов
Myrmecocystus, но не Р. desertorum. Когда
муравьи С. bicolor находят гнездо,
единственное отверстие которого
охраняется привратниками, они
собирают камешки и бросают их внутрь
по одному или два в минуту; менее пяти
камешков достаточно, чтобы прекратить
фуражировку. Камешки не оказывают
никакого механического воздействия,
поскольку не производят эффекта, если
их бросает экспериментатор; видимо, на
них нет и феромона, однако они служат
угрозой, предупреждающей
о враждебных намерениях. Муравьи
Conomyrma bicolor активны круглые
сутки, за исключением полуденного
времени, когда слишком жарко, так что
они взаимодействуют с Myrmecocystus
mexicanus ночью, а с двумя другими
видами Myrmecocystus-днем. Если идет
дождь (что случается редко), С. bicolor
совершенно прекращает фуражировку и
все три вида Myrmecocystus выходят из
гнезд. Агрессивное поведение С. bicolor
выражается гораздо сильнее возле
многочисленных входов в его гнездо.
Moglich и Alpert показали также, что это
особое проявление общей реакции на
запахи, так как С. bicolor кладет камешки
на кусочки ваты, смоченной химическими
веществами. Это весьма
распространенная особенность поведения
у муравьев вообще. Myrmica прикрывает
растворы многих веществ (но не воду),
причем выраженность этой реакции
экспоненциально ослабевает
с увеличением расстояния от входного
отверстия собственного гнезда (Frith,
1979). Использование мелких камешков и
частичек почвы для блокирования
отверстий, ведущих в гнезда других
муравьев, заставляет также вспомнить о
баррикадах, которые строит Lasius flavus
во время подземных схваток.
16.3. Тропический дождевой
лес
16.3.1. Осы, пчелы и термиты
Постоянное тепло, ежедневные дожди и
12-часовой световой день в течение всего
года создают в тропиках необычайно
продуктивные экосистемы. Общественные
насекомые достигают в тропическом
дождевом лесу максимального видового
разнообразия, и хотя социальный
паразитизм и рабовладельчество у них
отсутствуют, здесь встречается много
типов межвидового сотрудничества. Так,
например, самки Mischocyttarus
immarginatus в относительно сухом лесу в
Коста-Рике конкурируют за места около
строящегося гнезда Polybia occidentalis
(Gorton, 1978). Эти самки в буквальном
смысле слова устраивали драки, кусая и
отталкивая одна другую, а после того
как гнезда были построены, проводили
время в набегах и столкновениях. Из 24
гнезд М. immarginatus 22 располагались
338 f'.iaea 16
около гнезда Р. occidentalis m возможно,
что его обитатели в какой-то мере
защищали их от ящериц и птиц. Деревья,
в которых обитают муравьи, нередко
тоже служат „защитными зонтиками11:
число осиных и даже птичьих гнезд
бывает здесь больше, чем можно было
бы отнести на счет простой случайности
(Evans, West-Eberhard, 1973). Рекордный
пример описали Richards и Richards
(1951): восемь гнезд Polybia rejecta,
два-различных видов Mischocyttarus,
одно - Protopolybia, одно - Metapolybia
и еще гнездо иволги. Осы покладисты и
удаляются в свои гнезда, тогда как
муравьи защищают дерево от всех
пришельцев. Хотя для тропиков
характерно сотрудничество, там
достаточно много и конкурентных
отношений. Они могут принимать очень
утонченные формы:
„африканизированные11 медоносные
пчелы (в Гвиане) сокращают время,
которое безжалые пчелы проводят на
цветках, собирая пыльцу (Roubik, 1978);
они оказывают влияние не на общее
число фуражиров, а только на время,
проводимое за сбором пьшьцы. У Apis
mellifera, интродуцированной несколько
веков назад в Америку, хоботок
примерно такой же длины, как у местных
видов Bombus, тогда как в Евразии,
откуда происходит род Apis и где он
эволюционировал, у многих шмелей
хоботки длиннее, и конкуренция с ними
менее сильна (Pleasants, 1981; Prys-Jones,
1982). Может быть, в Евразии
представителям Bombus пришлось
удлинить свои хоботки, чтобы выжить?
Не достаточно ли других различий,
существующих между Apis и Bombus?
В западной части Малайзии обитает 57
видов термитов, относящихся к 23 родам
из шести подсемейств (Matsumoto, Abe,
1979). На одном гектаре можно найти
представителей 52 видов! Биомасса
термитов достигает 3-4 кг/м2 (сырой вес),
или 2,2-2,6 г/м2 (сухой вес). Большинство
из них строит либо диффузные гнезда в
земле, либо башни высотой до 2 м,
иногда опирающиеся на основание дерева
(рис. 16.7). На деревьях и кустах они
либо выгрызают полости в отмерших
ветвях, либо строят в живых ветвях или
вокруг них картонные гнезда,
сообщающиеся с поверхностью почвы
крытыми галереями. Расстояния между
гнездами варьируют от вида к виду, но в
целом надземные гнезда распределены
случайным образом. Тридцать семь
видов питаются мертвой древесиной в
лесной подстилке, 24 вида-остатками
листьев, но есть также 17 гумусоядных
видов, а два вида поедают лишайники,
сдирая их со стволов деревьев, нередко
на высоте до 40 м от земли. Два главных
вида Macrotermes уже были рассмотрены.
Longipeditermes longipes спускаются
с деревьев вниз и под охраной солдат
Отрезают кусочки от лежащих на земле
листьев. Bulbitermes, гнезда которых
находятся на высоте 1-9 м, тоже
спускаются вниз по крытым галереям и
подбирают с земли кусочки
разлагающихся веточек и листьев.
Некоторые живущие под землей
гумусоядные формы поднимаются на
поверхность земли, которая, очевидно,
представляет собой зону очень активной
жизни. Все это показывает, что
стратификация гнезд мало связана с тем,
в каком растительном ярусе питается
данный вид, так как термиты готовы
преодолевать расстояние между гнездом
и источником пищи либо под эскортом
солдат, либо по крытым галереям. В
целом можно сказать, что в тропическом
дождевом лесу обитают многочисленные
виды термитов, образующие главный
компонент почвенной микрофауны, что
они устраивают гнезда в земле, на
деревьях и в кустах, что все они
питаются волокнистым растительным
материалом, часто не из того яруса, где
Многовидовые сообщества 339
Рис. 16.7. Стратификация гнезд термитов в
тропическом дождевом лесу Пасох-Форест в
западной части Малайзии.
RHI-Rhinotermitidae, три рода;
AMI-Amitermitidae, два рода;
TER-Termitinae, пять родов;
MAC-Macrotermitinae, три рода;
NAS-Nasutitermitinae, пять родов. (Abe,
Matsumoto, 1979.)
расположено гнездо, и что больше
половины видов находятся в симбиозе с
грибами. В девственном саванновом
редколесье обитает 23 вида термитов:
33% относятся к роду Microcerotermes,
26°/0-к Ancistrotermes и 25%-к Micro-
termes. Представители последнего
рода строят сухие диффузные гнезда,
могут жить на возделываемых участках и
проникать в корни кукурузы (Wood et al.,
1977, 1980).
Гнезда термитов привлекают многих
других беспозвоночных. На одном из
участков лесного резервата Доуала-Эдеа
(3° с. ш.) на берегу озера 52% гнезд были
построены термитом Cubitermes fungifaber
и 37% из них были заняты вторичными
хозяевами, но сожительство наблюдалось
редко (Collins, 1980). Обычно появление
нового хозяина не сказывается на
внешнем виде гнезда и его форме, однако
Noditermes покрывает гнездо свежим
материалом. Collins (1981) перечисляет 31
вид, использующий гнезда пяти
термитов, строящих холмики.
16.3.2. Муравьи в лесу
Число видов муравьев, населяющих
дождевые леса в тропиках, огромно.
Существует 29 родов, распространенных
во всех тропических областях. Кроме
того, 65 родов эндемичны для
неотропической области, а для менее
340 Глава 16
изолированной Африки-только 31 род. В
Инд о-Австралийской области, где
имеется 42 эндемичных рода, некоторые
роды несколько примитивнее
африканских, и это позволяет думать, что
африканские роды возникли позднее.
Пантропические роды также
представлены в Африке и в Южной
Америке разными видами. Brown (1973)
высказал предположение, что по крайней
мере четыре рода распространились по
земному шару в олигоцене-миоцене; это
Tetramorium, Pheidole, Crematogaster (все
они относятся к Mirmicinae) и Camponotus
(Formicinae). Он привлекает внимание к
тому факту, что Crematogaster, известный
лишь начиная с миоцена, теперь
распространен повсюду в тропиках
и проник в „адаптивную зону" (нишу),
которую прежде занимал Iridomyrmex,
доминировавший в фауне муравьев
олигоценаL В настоящее время эти роды
замещают друг друга: в Африке
Crematogaster представлен 175 видами, а
Iridomyrmex отсутствуем;
в индо-малайской области обитают 125
видов Crematogaster и 5 видов
Iridomyrmex', в Австралии-30 видов
Crematogaster и №-Iridomyrmex. Brown
(1973) указывает также, что в северном
полушарии со времен миоцена роды
Pheidole, Crematogaster, Tetramorium
и Myrmica, принадлежащие к Myrmicinae,
в значительной степени вытеснили роды,
относящиеся к Dolichoderinae. Род
Pheidole со времен олигоцена (балтийский
янтарь), по-видимому, образовал сотни
видов, расселившихся по областям
земного шара с теплым климатом 1 2
Tetramorium-тоже сложный род, очень
обычный в южных районах
1 Следует отметить, что муравьи эоцена и оли-
гоцена известны только из Европы и Северной
Америки, а о древней фауне нынешних тропиче-
ских областей мы ничего не знаем. В миоцено-
вом доминиканском янтаре найдены виды,
палеарктической области, в Африке, в
Индо-Малайской области и в северной
части Австралийской области, но
представленный в Америке всего одним
видом.
По данным Levieux (1975, 1977), в почве
галерейного леса обитает 30 видов
муравьев, тогда как рядом, в саванне, в
почве встречается 120 видов, из которых
лишь 20-общие для обоих
местообитаний. Конечно, в лесу мало
травы, и многие муравьи, которые здесь
фуражируют, спускаются, подобно
термитам, вниз из своих расположенных
на деревьях гнезд. Levieux указывает на
контраст между видами, особи которых
имеют крупные размеры и фуражируют
на обширных территориях, как,
например, Megaponera, и более мелкими,
такими как Crematogaster, с локальными
кормовыми участками. Хорошее
описание тропических муравьев дает
Bequaert (1922), рассматривающий
муравьев бассейна Конго в Африке.
Обеднение фауны хищных муравьев по
мере удаления от экватора ярко
продемонстрировал Jeanne (1979а),
приманивавший их на личинок ос
в низменных влажных местах в Америке
на пяти широтах: 2° ю. ш., 10°, 19°, 31° и
43° с. ш. В первом из этих мест он
поймал 74 вида, а в последнем - только
22. Леса обычно отличались большим
разнообразием видов, чем поля, причем в
лесах всех широт на земле встречалось
больше видов, чем на деревьях. Во всех
широтах наиболее обычным был род
Pheidole, a Solenopsis geminata оказался
наиболее широко распространенным
видом в полях к югу от 43° с. ш., где он
замещает Formica obscuriventris. Хищник
близкие к современным,- Прим. ред.
2 По современным представлениям, балтий-
ский янтарь, в котором доминируют виды Iri-
domyrmex (более 50% всех муравьев), датирует-
ся поздним эоценом-Прим. ред.
Многовидовые сообщества
341
Eciton, представленный здесь в изобилии,
никогда не приходил к приманкам.
Муравьи-кочевники (Dorylinae)
распространены по всему тропическому
поясу и играют очень важную роль как
хищники. Представители рода
Neivamyrmex могут подниматься в горы и
переносят короткие зимы, но большая их
часть обитает в местах с жарким, хотя и
не обязательно влажным климатом.
Многие виды живут под землей,
а другие-на земле и на деревьях.
Aenictus- род мелких лишенных глаз
мономорфных муравьев, представленных
многочисленными видами в тропических
районах Азии и Африки и живущих
главным образом под землей, однако
Schneirla (1971) специально изучал два
наземных вида этого рода-A. gracilis и
A. laeviceps. Эти муравьи отправляются в
свои рейды в сумерки, однако
освещенность не имеет для них значения,
и они могут отдыхать на поверхности
почвы. Каждый рейд продолжается час
или два, причем муравьи могут
покрывать расстояния до 25 м. На время
стационарной фазы, когда расплод
находится на стадии куколок
и происходит откладка яиц, муравьи
уходят под землю. Они поедают большое
количество расплода других муравьев,
термитов, ос и тараканов; очень быстро,
проворно и эффективно действуя своими
жалами, они обездвиживают жертву и
утаскивают ее совместными усилиями.
Эти виды справляются даже с такими
крупными муравьями, как Polyrachis и
Camponotus, и временно складывают их в
кучи у разветвлений троп. Schneirla
описывает также различия
в распределении Eciton burchelli
и Е. hamatum и в их стратегии при
набегах. Е. vagans, который охотится на
поверхности земли, возможно, поедает
больше муравьев, чем другие виды. Как
сообщает Schneirla, семьи Eciton
и Neivamyrmex относятся друг к другу
враждебно, и ни один из них не
использует троп, проложенных другим
видом. Подводя итоги, можно сказать,
что у муравьев-кочевников рабочие особи
имеют различные размеры, образуют
семьи разной величины и совершают
свои набеги на разных уровнях
экосистемы, используя различные
стратегии; все это расширяет диапазон
их экологических возможностей, однако у
нас пока еще очень мало сведений о*том,
каким образом они распределяются в
пространстве,-известно лишь, что при
разделении семей они перемещаются в
противоположных направлениях.
Колонну муравьев-кочевников нередко
сопровождают птицы, относящиеся
к нескольким семействам,-дрозды, совы
и муравьеловковые птицы из
неотропических Formicariidae. Они
поедают насекомых, которые идут
сплошным потоком. На острове
Барро-Колорадо (зона Панамского
канала) примерно три семьи Eciton
burchelli на 1 км2, движущиеся фронтом
шириной 20 м со скоростью 15 м/ч,
постоянно сопровождают птицы,
добывающие таким образом не менее
половины своей пищи (Willis, Oniki,
1978). Цитированные авторы
перечисляют по меньшей мере 50
„профессионалов11, среди которых 4 вида
кукушек, 13 древолазов, 5 танагр и 28
муравьеловок. Они делят между собой
зоны, причем доминантные виды
охотятся ближе всего к центру колонны
муравьев, а более мелкие подчиненные
виды-на периферии. Некоторые из этих
последних очень проворны, и их отнюдь
не отпугивает агрессивность
доминантных птиц. Промежутки между
зонами, принадлежащими „профессио-
нальным11 спутникам бродячих муравьев,
часто используют менее специализиро-
ванные птицы. Следуя за колонной
муравьев, эти птицы непрерывно кричат,
привлекая внимание других птиц.
342 Глава 16
Weber (1972) описывает листорезов
(Attini) как уживчивых муравьев. Он
наблюдал в Гайане представителей
Асготугтех, срезавших травинки на той
же кочке, что и термит Amitermes. Он
указывает также, что гнезда этих
насекомых частично вклиниваются друг в
друга; „материала, необходимого для
устройства гнезд, хватает на всех, и они
фуражируют рядом без всякой
враждебности", пишет Weber. При этом,
однако, они обычно избегают контакта с
другими видами. Weber наблюдал, как
цепочка Atta cephalotes встретилась
с колонной Eciton burchelli, как они
перемешались, не проявляя
враждебности, разделились и разошлись;
это особенно удивительно, так как
Dorylinae поедают многих Attini. Как и в
холмиках термитов, в холмиках крупных
Atta часто поселяются многие другие
муравьи. Weber упоминает Trachymyrmex,
Sericomyrmex и Myrmicocrypta, рабочие
особи которых фуражируют друг над
другом. Две семьи, содержавшиеся
в лаборатории, использовали одни и те
же цветки розы, но отрезали кусочки
каждый вид по отдельности; Weber
отмечает, однако, что Trachymyrmex
„явно занимал доминирующее положение
при отрезании субстрата", и если этого
требовали обстоятельства, выступал как
агрессор. Таким образом, у Attini
определенно существует межвидовая
враждебность, но в обычных условиях
они избегают проявлять ее. Jutsum (1979)
подтвердил, что представители разных
семей или разных видов довольно часто
кусают друг друга, однако по
возможности предпочитают избегать
этого. В Тринидаде Atta cephalotes
обычно обитает в лесу, а Асготугтех
octospinosus-на открытых местах, причем
создается впечатление, что самки
выбирают эти местообитания после
брачного лёта. Работа Jutsum не
оставляет сомнений, что, как
и у большинства других муравьев, после
того как самка выбрала тип
местообитания в целом, рабочие особи
находят конкретное место для гнезда.
В тропиках рабовладельцы среди
муравьев неизвестны, однако там
существует интересная альтернатива,
которая, возможно, встречается чаще,
чем предполагают. Известны случаи,
когда два (или более) вида муравьев
живут в одном и том же гнезде,
совместно пользуются галереями
и тропами, ухаживают за одними и теми
же сосущими растительноядными
насекомыми, хорошо относятся друг к
другу, но при этом содержат свой
расплод по отдельности. В описанных
случаях виды-сожители не связаны
родством и могут принадлежать
к разным подсемействам. Недавно Swain
(1980) изучал в Бразилии муравья
Crematogaster limata (Myrmicinae),
который объединяется либо с Camponotus
femoratus (Formicinae), либо с Monads
debilts (Dolichoderinae). Cr. limata
достигает всего 2,3 мм в длину, тогда как
длина Camponotus femoratus 5,0 мм,
а М. debilis 4,0 мм. Обитая вместе
с М. debilis, Cr. limata находит сахарные
приманки первым, но рабочие особи
М. debilis, которые сами никогда не
находят приманки, отнимают их, не
прибегая к насилию. Хотя Cr. limata
выставляет наружу свое жало
и поднимает брюшко, по всей видимости
выпуская репеллент, это не заставляет
М. debilis отступить. Таким образом,
М. debilis использует Cr. limata для
нахождения пищи. Если же в качестве
приманки используются личинки ос, то
Cr. limata не уступает их, и муравьям
М. debilis приходится искать приманки
самим.
Взаимоотношения между Crematogaster
limata и Camponotus femoratus яснее.
Особи Cr. limata все еще находят
приманку первыми, из чего бы она ни
Многовидовые сообщества 343
состояла, но если это сахарная приманка,
то C.femoratus приходят одновременно с
ними, нередко отстраняя Cr. limata; когда
же приманкой служит личинка осы, то
они перелезают через Cr. limata, но
вместо того чтобы, подобно последним,
разрезать ее на части, пытаются утащить
ее целиком. Муравьи Camponotus
femoratus обнаруживают
и монополизируют приманку, не
подпуская к ней Cr. limata- для этого они
подгибают брюшко; они могут просто
поднять рабочую особь Cr. limata,
ухватив ее своими челюстями, и унести в
сторону, но никогда не раздавливают ее.
Таким образом, C.femoratus полностью
доминируют в данном сообществе,
a Cr. limata не может воспользоваться
добычей, даже если она перенесена в
гнездо, так как камеры для расплода у
каждого вида свои. Swain указывает, что
хотя муравьи Cr. limata находят пищу для
других видов и занимают подчиненное
положение, они, возможно, получают
взамен защиту и гнездо, поскольку
именно C.femoratus строит гнездо,
в котором поселяется Cr. limata, а не
наоборот. Jeanne (1979а), описывая
результаты своих наблюдений на
трансекте, пересекавшей Америку с 2°
ю. ш. до 43° с. ш., отмечает, что
C.femoratus и Cr. limata пользуются
общими тропами и общими гнездами и
что добыча этих двух видов составляет
70% добычи всех хищников в подлеске
бразильских лесов.
16.3.3. Муравьи на плантациях
Сообществу муравьев на плантациях
кокосовой пальмы и шоколадного дерева
уделяется большое внимание, и они уже
были описаны автором этой книги (Brian,
1965); здесь мы рассмотрим некоторые
из более новых исследований
и проанализируем структуру сообществ.
На Соломоновых островах на кокосовых
пальмах совместно обитают четыре
массовых вида и свыше 60 более редких
(Brown, 1959; Greenslade, 1971). Два из
массовых видов-Iridomyrmex cordatus
(Dolichoderinae) и Oecophylla smaragdina
(Formicinae)-местные, а два
других-Pheidole megacephala (Myrmicinae)
и Anoplolepis longipes (Formicinae)-
завезенные. Более редкие виды лишь
иногда обитают на одних и тех же
деревьях с четырьмя главными, но есть
существенные исключения. Любую
попытку установить, каков порядок
доминирования среди этих четырех
видов, затрудняют необъяснимые
флуктуации у A. longipes
и Ph. megacephala. На одном
обследованном участке, где были все
виды, кроме Ph. megacephala,
ежемесячные проверки изменений
в составе обитателей показали, что
О. smaragdina сменила место в 136
случаях, A. longipes-в 96,
a I. cordatus-только в 6 случаях. Это
позволяет думать, что I.cordatus,
однажды заняв дерево, способен
удерживать его за собой; после
дальнейших наблюдений была
установлена такая последовательность:
I. cordatus > A. longipes = Ph. mega-
cephala > О. smaragdina. Последний вид
способен элиминировать все
второстепенные виды, хотя он это делает
не всегда. Когда по той или иной
причине Ph. megacephala погибает, его
место занимают субдоминанты.
Прямые способы борьбы занимают лишь
небольшое место среди факторов,
определяющих успех. Исследование,
проведенное на кокосовой плантации на
одном из океанических островов,
позволяет предположить, что важную
роль в этом играют шесть моментов;
1) Oecophylla smaragdina фуражирует в
жаркий солнечный полдень, у Anoplolepis
longipes фуражировка достигает пика в
сумерки, a Iridomyrmex cordatus и Pheidole
344 Глава 16
megacephala-ночные виды; 2) популяции
видов-иммигрантов A. longipes
и Ph. megacephala нестабильны; 3) по
величине отдельных особей виды
располагаются в следующем порядке (от
мелких к крупным): I. cordatus,
Ph. megacephala, A. longipes, O.smaragdina;
мелкие муравьи могут прятаться в щелях
и совместными усилиями справляются с
крупным муравьем, но рабочие особи
О. smaragdina, объединившись, могут
поймать и убить жертву, слишком
крупную для всех остальных;
4) О. smaragdina-единственный
моногинный вид в данном сообществе;
если самка в семье умирает, то муравьям
приходится начинать все сначала, а для
этого нужно отправиться на поиски
новых мест; полигинный вид I. cordatus
расселяется медленно и основательно,
занимая все доступные территории при
рациональной плотности; 5) полностью
древесный образ жизни, как
у О. smaragdina, не всегда дает
преимущество, так как гнезда, вырытые в
земле, служат убежищами, из которых
затем можно расселяться; I. cordatus
может строить гнезда в земле и вообще
обладает более высокой приспособ-
ляемостью, чем O.smaragdina;
6) способность некоторое время прожить,
питаясь одной только падью, дает
преимущество в случае осады, и в этом
отношении четыре вида располагаются в
следующем порядке: I. cordatus,
О. smaragdina, Ph. megacephala, A. longipes;
последний вид, будучи хищником,
подвергается опасным лишениям,
оказавшись отрезанным от гнезда на
верхушке дерева. В целом создается
картина флуктуирующей конкуренции
между четырьмя массовыми
и многочисленными более редкими
видами, которые устраиваются там и тут,
как только представляется удобный
случай. Возможно, что до появления
Ph. megacephala и A. longipes здесь
существовало некое равновесие между
двумя четко различающимися
древесными в идами-медленно
расселяющимся полигинным видом
I. cordatus с мелкими рабочими особями,
активными ночью, и способным
к быстрому расселению (летающие
молодые самки!), но легко уязвимым
моногинным видом О. smaragdina
с крупными рабочими особями,
активными днем.
В то время как распространение Pheidole
megacephala и Anoplolepis longipes на
Соломоновых островах сдерживается
двумя сильными местными видами, на
других тропических островах дело
обстоит иначе (Haskins, Haskins, 1965).
Гавайские острова в настоящее время
заселяют „аргентинский" муравей
Iridomyrmex humilis, который живет по
обе стороны от экватора в полосе между
30 и 36°, и Ph. megacephala из
экваториальной Африки. Эти два вида
обитают в разных зонах:
Ph. megacephala-в теплых низменных
местах, a I. humilis-в более прохладной
местности в горах, на высоте больше
1000 м; такое распределение
свидетельствует о том, что
окончательный выбор местообитания
зависит от того, откуда происходит
данный вид и к каким условиям он
приспособлен. Как указывают Flucker и
Beardsley (1970), Ph. megacephala исчезает
из той зоны, куда распространяется
I. humilis, но позднее может вернуться,
причем нередко за ним следуют другие,
субдоминантные муравьи, например
виды Tetramorium или Solenopsis
geminata-единственный вид,
основывающий в этой зоне семьи;
I. humilis нападает на его гнезда и иногда
затрачивает две недели на то, чтобы
истребить Solenopsis, причем
продвигается примерно на 30 м в глубь
их территории. На юге США S. invicta
задержал распространение I. humilis на
Многовидовые сообщества 345
север (Brown, 1973). Ph.megacephala,
защищаясь от нападения, цепляется за
ноги и усики врага, удерживая его до
прибытия солдат, которые разрывают
его на части. Рабочие особи
Ph. megacephala хотя и мельче, но
агрессивнее рабочих I. humilis-хе
становятся агрессивными лишь в том
случае, если на них нападают. Anoplolepis
longipes (Formicinae) на Гавайских
островах строит гнезда только под
большими камнями и в канавах; он
менее агрессивен, чем /. humilis
и A. longipes, хотя и способен
выбрасывать направленную струю
муравьиной кислоты.
На Бермудских островах дело обстоит
сложнее (Lieberburg et al., 1975). Pheidole
megacephala появился здесь в конце XIX
века и распространился по всей
территории; затем в середине XX века
прибыл Iridomyrmex humilis, который
начал в свою очередь быстро
расселяться; ожидалось, что он через
полвека вытеснит Ph. megacephala
и займет его место, однако продвижение
I. humilis к 1959 г. замедлилось (Crowell,
1968), и в некоторых районах
Ph. megacephala теперь вновь завоевывает
территорию. I. humilis вначале
расселяется путем отделения групп,
состоящих из рабочих и самки; это
происходит периодически, и во время
фазы экспансии муравей более
агрессивен, чем обычно. Можно видеть,
как колонны мигрирующих рабочих и
самок вторгаются в области, где обитает
Ph. megacephala. Солдаты Ph. megacephala
поднимаются на поверхность гнезда,
муравьи хватают друг друга челюстями,
и борьба продолжается несколько недель.
Помимо этих обычных для муравьев
действий Lieberberg и его сотрудники
описывают применяемую I. humilis
химическую атаку: эти муравьи
направляют кончик брюшка на головы
рабочих особей Ph. megacephala и за
несколько секунд ошеломляют их,
несомненно с помощью знаменитого
терпеноидного лактона иридомирмецина
(Cavill, Locksley, 1957). Подобное
химическое воздействие представляет
собой, вероятно, лишь одну из
особенностей фазы экспансии I. humilis.
Таким способом I. humilis может
вытеснить Ph. megacephala, но его
распространение лимитируется ростом
численности популяции, который в свою
очередь зависит от адаптации к климату
и местообитанию. Следует упомянуть
интересный факт, который может помочь
объяснить взаимоотношения между
этими видами: в то время как
Ph. megacephala отыскивает и охраняет
крупные приманки, I. humilis этого не
делает.
На восточном побережье Африки (в
Танзании) в свое время Way (1953, 1954),
а позднее Vanderplank (1960; обзор:
Brian, 1965) изучали сообщество муравьев
кокосовой плантации того же типа, что и
на Соломоновых островах. Oecophylla
longinoda и Pheidole (на этот раз
Ph.punctulata) были здесь местными
видами, a Anoplolepis longipes—завезен-
ным видом. Здесь О. longinoda подверга-
ется нападениям со стороны A. longipes и
Ph.punctulata, а также другого вида
Anoplolepis - А. custodiens,
который проявляет также враждебность к
A. longipes. Муравьи A. custodiens просто
хватают О. longinoda по одному
и убивают их, обрызгивая ядовитой
струей, когда они скапливаются для
обороны своего дерева у его основания;
но там, где наземная растительность
затеняет почву, A. custodiens,
по-видимому, не могут даже выжить, не
говоря уже о том, чтобы нападать на
О. longinoda. Муравей Ph.punctulata,
очевидно, не умеет справляться
с О. longinoda так, как справляется
Ph. megacephala с О. smaragdina на
Соломоновых островах. Он строит
346 Глава 16
гнезда у подножия деревьев в почве или в
щелях и уничтожает самок О. longinoda и
их небольшие зарождающиеся семьи.
Рабочие особи просто вцепляются в этих
муравьев, удерживая их, пока солдаты
разрезают их на части (но только в
сухую погоду!). Рабочие О. longinoda
могут оказаться также жертвами
некоторых видов Crematogaster. Таким
образом, вид О. longinoda хорошо
приспособлен к жизни на кокосовых
пальмах, но подвергается давлению со
стороны многих других муравьев.
Room (1971) сравнивал распределение
видов на разных кокосовых плантациях в
Гане и обнаружил 108 видов, живущих на
одних только кокосовых пальмах. Хотя
это старые деревья, они образуют не
вполне сомкнутый полог, и пятна
солнечного света попадают на траву,
покрывающую легкую суглинистую
почву. Большинство видов устраивает
гнезда в мертвой древесине на земле, но
10 видов обитают в пологе, в том числе
Oecophylla longinoda, Crematogaster
striatula, Cr.africana, Cr.clariventris
и Cr. depressa. Для них характерно
пятнистое распределение, причем их
семьи взаимно исключают друг друга, и
в разных местах доминирующее
положение занимают разные виды. Ни
один из них не элиминирует другие виды
полностью, так как они слегка
различаются по потребляемой пище, хотя
все собирают падь и используют для
постройки гнезда один и тот же материал
(картон), за исключением муравьев
О. longinoda, которые устраивают гнезда
из листьев, соединяя их шелком.
Солнечного тепла, доходящего до
поверхности почвы, недостаточно для
того, чтобы гнездящиеся в земле виды
могли создать мощную популяцию,
способную конкурировать с этими
древесными муравьями.
У каждого доминантного вида есть
набор ассоциированных с ним видов, но
только два вида действительно тесно
связаны между собой. Самое
удивительное из этих субсообществ то, в
котором доминирует вид Oecophylla
longinoda в ассоциации с Crematogaster
clariventris; эти два вида ассоциированы
на 90%. Их взаимоотношения истинно
парабиотические: территория
Cr. clariventris включена в территорию
О. longinoda, и его особи так тесно
связаны с семьей, в которой они живут,
что О. longinoda не нападает на них, хотя
нападает на особей этого вида,
принадлежащих к другим семьям. Как
полагают, присутствие О. longinoda
обеспечивает Cr. clariventris защиту от
других муравьев, однако не ясно, что
получают муравьи О. longinoda ', быть
может, Cr. clariventris отыскивают для
них пищу?
В одной очень неоднородной области
сомкнутость крон сильно
варьировала-от весьма разреженного
полога, подходящего для Camponotus
acvapimensis, до очень плотного, где
нашел приют Tetramorium aculeatum.
После того как Majer (1976а-с) удалил
гнезда доминантных видов,
Т. aculeatum-моногинный, хотя
и полидомный вид-распространился в
местах с более разреженным пологом;
это означает, что обычно его сдерживает
давление со стороны других муравьев.
Подобным же образом полигинный вид
Crematogaster striatula распространяется
на территории, занятые муравьем
Oecophylla longinoda, только после того,
как гнезда последнего будут срезаны.
Crematogaster depressa переселяется на
большую часть шоколадных деревьев
после удаления с них доминантных
видов, т. е. требования, предъявляемые
этим видом к местообитанию, не очень
специфичны. Вид О. longinoda, так же как
и подчиненные виды, к такому
переселению неспособен. Как
показывают эти эксперименты, каждый
Миоговидовые сообщества 347
вид-это часть системы доминирования,
обладающей гибкостью и чувствительной
к состоянию данного местообитания.
При обилии пищи агрессивное поведение
наблюдается очень редко, так как
конфронтации муравьи обычно избегают.
Драки начинаются лишь при недостатке
пищи. Однажды муравьи Oecophylla
longinoda захватили дерево, которое
занимал один из видов Crematogaster, и
стали облизывать щитовок, которых
Crematogaster не использовал; последний
отступил при этом в листву, а вид
О. longinoda приобрел источник пади.
Этот пример нельзя считать
конкуренцией за пищу; это просто
перераспределение территорий, которое
улучшает использование ресурсов
в целом и, вероятно, способствует
стабилизации сообщества.
Можно привести и другой пример.
Crematogaster clariventris зашел на
территорию, принадлежащую
Cr. depressa, и вступил с ним в схватку на
стволе тенистого дерева (не шоко-
ладного) на расстоянии не менее 14 м от
гнезда Cr. depressa и 9 м от гнезда
Cr. clariventris. Борьба продолжалась два
или три месяца; в конце концов
Cr. depressa разбил агрессора, вторгся на
его территорию и захватил его гнездо.
Majer тоже описывает весьма
показательное событие: дерево, которое
использовал вид Cr. depressa, упало на
территорию, занятую муравьями
Oecophylla longinoda, которые включили
его в свои владения. Majer высказывает
мнение, что эти сообщества
метастабильны. Территории,
принадлежащие семьям О. longinoda,
пластичны, подобно территориям Formica
polyctena и Tetramorium caespitum,
и благодаря этому на них могут
обосновываться также и подчиненные
виды. Хорошим примером такой
„подгонки", приводящей к ослаблению
трений, служит сдвиг периода активности
у Tetramorium aculeatum, позволяющий
этому виду избегать столкновений
с Crematogaster depressa. Сообщают, что
Т. aculeatum избегает таким же образом
встреч с Cr. clariventris (Aryeetey; см.
Leston, 1973); этот вид, очевидно,
обладает достаточной гибкостью.
Изучая другое сообщество, обитающее
на шоколадных деревьях в Гане (6° с. ш.),
Majer использовал радиоактивный
фосфор, чтобы определять форму
и размеры семей Crematogaster. Как
правило, виды этого рода занимают
здесь четко обособленные территории;
случаи совместного обитания с Oecophylla
longinoda редки. Если О. longinoda
и Tetramorium aculeatum используют одно
и то же дерево, то их территории строго
разграничены. В этой области
О. longinoda - самый многочисленный
муравей, составляющий 71% всей
биомассы муравьев, хотя он использует
только 12% деревьев (конечно, этот вид
отличается крупными размерами).
Второе место по численности
принадлежит Crematogaster striatula, хотя
он составляет только 14% всей биомассы
муравьев (по сырому весу). В другом
месте соотношение этих двух видов по
частоте было противоположным: 73%
Cr. striatula и только 3% О. longinoda.
В Нигерии имеется сходный набор
доминантных видов (рис. 16.8). При
обследовании 3800 деревьев на 33% из
них были найдены муравьи Oecophylla
longinoda, на 14%- Tetramorium aculeatum,
на 13%- Pheidole megacephala, на
12% - Crematogaster africana или
Cr. depressa; привязанность видов
к определенным деревьям была выражена
слабо (Taylor, Adedoyin, 1978). Вид
О. longinoda встречался чаще всех
остальных видов на кофейных
и шоколадных деревьях, но отсутствовал
на деревьях с неподходящими
листьями-слишком крупными, как
у бананов, слишком узкими, как
.'48 Глава 16
Дорога
Рис. 16.8. Распространение муравьев на
шоколадных деревьях на плантации иедалеко
от Ибадана (Нигерия). Белые кружочки-на
дереве не обнаружено никаких муравьев;
темные треугольники-Oecophylla longinoda;
белые треугольники острым углом
вверх-Pheidole megacephala; темные
кружочки - Crematogaster clariventris; темные
квадратики -Acantholepis capensis; белые
квадратики - Crematogaster sp. А; белые
треугольники острым углом
вниз - Crematogaster acvapimensis.
О распределении второстепенных видов см.
Taylor, 1977.
Расчищенный участок
у гвинейской масличной пальмы,
слишком мелкими и кожистыми, как у
анакардии. Этот муравей очень плохо
переносит дождь и ветер, а также,
конечно, опадение листьев в сухой сезон.
Crematogaster striatula часто встречался на
кофейных деревьях и на деревьях кола,
но редко-на шоколадных; возможно,
что это было связано с присутствием на
них Pheidole megacephala. Пазухи листьев
масличной пальмы служат прекрасным
местом для гнезд Ph. megacephala
и Acantholepis capensis, хотя обычно эти
два вида строят гнезда в земле.
Оказалось также, что очень важную роль
играет стадия развития плантации. Для
некоторых видов сомкнутость полога не
имеет значения, а для других она
является важнейшим лимитирующим
фактором. К стенотопным видам
относятся: Tetramorium aculeatum
и Crematogaster clariventris в густом
пологе; Cr.gabonensis в старых деревьях с
чешуйчатой корой; Acantholepis capensis и
Camponotus acvapimensis в местах
с разреженным пологом, где солнечные
лучи доходят до земли. Эвритопный вид
Pheidole megacephala широко
распространен на земле и на деревьях.
Taylor (1977) установил, что на 100
обследованных им местных
дикорастущих лесных деревьях
преобладали Oecophylla longinoda
и Crematogaster africana (46%), Camponotus
acvapimensis, Camponotus vividus
и Cataglyphis guineensis (44%); оставшиеся
10% составляли другие виды. О. longinoda
и Crematogaster подбирают мертвых
Многовидовые сообщество 349
муравьев и другие остатки, после того
как пройдут Dorylinae (Leroux, 1979b).
Фауна, ассоциированная с доминантными
видами муравьев, обитающих на
шоколадных деревьях в Гане, включает
85 видов растительноядных сосущих
насекомых, жуков, мух, бабочек
и прямокрылых, из которых 54
встречались часто. Для каждого из этих
видов были определены такие критерии,
как сомкнутость крон, затененность,
расстояние до опушки, расстояние до
леса, сезон развития листьев
и доминантный вид муравьев.
Наибольшее число ассоциированных
видов отмечено у следующих муравьев
(в порядке убывания): Crematogaster
striatula, Tetramorium aculeatum
и Oecophylla longinoda. Это означает, что
последний вид обитает, с точки зрения
человека, на самых „чистых11 деревьях, а
первый-на самых заселенных. Муравей
О. longinoda, будучи хищником, в то же
время культивирует щитовок и потому не
зависит от других насекомых и может
истребить их, тогда как Т. aculeatum, в
основном питающийся насекомыми, не
может обходиться без них. Majer (1978)
указывает, что при опрыскивании
деревьев для борьбы с клопами-слепня-
ками деревья, на которых обитают
О. longinoda, обрабатывать не следует.
Соблюдение интересов этого муравья
не противоречит интересам человека.
На плантациях шоколадного дерева в
Камеруне та же группа доминантных
видов мозаично распределена в листве
деревьев, но не доходит до уровня земли.
В подстилке обитает около 80 видов,
образующих иерархическую систему
доминирования, в соответствии
с которой между ними распределяются
места для устройства гнезд и пища, но
эти виды не могут образовать мозаику:
эта возможность, несомненно, зависит не
только от организации сообщества
муравьев, но и от строения дерева.
Кроме того, травам постоянно наносит
ущерб человек, скашивая их или
обрабатывая гербицидами (Jackson, 1982).
Сложность муравьиных сообществ
показал Samways (1981), изучавший их на
южноафриканских цитрусовых планта-
циях, где велась борьба
с щитовкой. Когда прекратили обработку
паратионом, разнообразие муравьев
возросло и возникла мозаика
доминантных форм. Спустя несколько
лет это привело к доминированию
одного муравья-Pheidole megacephala,
который, хотя он и питается падью
(в отличие от некоторых вытесненных
субдоминантов), ограничил свои
интересы злаками и другими травами,
растущими между деревьями, и не
наносил вреда цитрусовым. Samways
приходит к выводу, что „очевидно,
независимо ни от каких внешних влияний
иерархия видов муравьев относительно
постоянна и прочна... [и]... по-видимому,
представляет собой одну из основных
черт биологии сообществ муравьев".
16.4. Общие выводы
В заключение зададим себе вопрос:
существуют ли на самом деле
у общественных насекомых сообщества?
Ответ будет утвердительным. Разные
виды используют местные ресурсы
по-разному, и после фазы колонизации,
во время которой распределение ресурсов
еще не достигло совершенства, создается
система, сводящая трение между видами
к минимуму. Это частично обусловлено
различиями в выборе местообитания, а
частично-происходящими в процессе
конкуренции подгонками, в результате
которых складываются компактные,
тесно переплетающиеся ниши.
В длительно существующих сообществах
в дальнейшем развиваются полигиния,
социальный паразитизм,
рабовладельчество и различные уровни
сотрудничества - от использования общих
гнезд до территориального парабиоза.
Глава 17
Две темы
Настало время для некоторых
размышлений. Я выбрал две темы:
1) мутуалистические взаимоотношения с
растениями и 2) организация семьи
общественных насекомых.
17.1. Мутуалистические
взаимоотношения
с растениями
Очевидно, что многие мутуалистические
взаимоотношения могут быть очень
неопределенными и давать результаты не
скоро; таковы, например,
взаимоотношения термитов, питающихся
древесиной, и деревьев, ожидающих, пока
термиты предоставят им продукты
распада. Одна черта, возникшая
у общественных насекомых в процессе их
эволюции и отсутствующая у других
насекомых,- это создание запасов пищи в
гнездах, в которых находится и большая
часть популяции данного вида.
Обитатели гнезда защищают его,
поддерживают в нем чистоту,
постоянную температуру и влажность.
Такая необычайная концентрация особей
противоречит обычной стратегии,
выражающейся в стремлении
к расселению; у общественных
насекомых процесс расселения
осуществляется только на уровне самих
гнезд. Растения играют определенную
роль в этом распределении по гнездам и
фуражировочным участкам и доставляют
подходящую пищу и материалы для
постройки гнезда, извлекая взамен
разного рода пользу для себя.
Взаимовыгодные отношения растений с
насекомыми возникли в связи
с транспортировкой пищи. Некоторые
растения снабдили свои семена
привлекательными для насекомых
маслянистыми присеменниками и тем
самым обеспечили перенос своих семян
не просто на большие расстояния, но на
такие подходящие места, как муравейник,
расположенный на солнечном участке в
лесу. В таких случаях.велика вероятность
того, что семена окажутся
недосягаемыми для зерноядных птиц и
для мышей, так как они либо останутся в
муравейнике, либо будут погребены под
органическими остатками. Приманка в
виде присеменника, содержащего жиры,
вовсе не обязательна для тех муравьев,
которые уже „узнали", что семена
представляют пищевую ценность и что
их можно запасать в сухих хорошо
проветриваемых камерах (таковы
муравьи-жнецы). Очевидно, эти муравьи
переносят и зарывают в почву гораздо
больше семян, чем могут съесть;
прорастающие семена они, несомненно,
выносят из гнезда и складывают в кучу
вместе с другими пищевыми отбросами.
Эти взаимоотношения, конечно, нельзя
назвать тесным симбиозом, но их можно
рассматривать как мутуализм, хотя и
недостаточно четко выраженный. Такой
мутуализм может способствовать
закреплению какого-либо растения,
например злака, в засушливом
местообитании, в которое оно не могло
бы проникнуть самостоятельно. Многие
другие семена муравьи собирают
в качестве материала для постройки
гнезда, вовсе не используя их в пищу.
Таким образом, муравьи, собирая,
перенося и зарывая семена, способствуют
расселению растений.
Две темы 351
Друг ой интересный пример роли
общественных насекомых как
переносчиков касается пыльцы, которую
пчелы используют в пищу и при этом
переносят с одного цветка на другой-в
идеальном случае на другое растение
того же вида. При этом пчела не
обязательно должна принадлежать
к числу общественных видов; тем не
менее интересно было бы выяснить,
продвинулись ли общественные пчелы в
этом смысле дальше, чем одиночные. К
сожалению, с уверенностью ответить на
этот вопрос нельзя. Жизненные циклы
некоторых одиночных пчел тесно связаны
с определенной группой растений, и эти
пчелы, возможно, служат для них
идеальными опылителями.
Общественные пчелы имеют
возможность посещать много различных
растений, хотя они могут до некоторой
степени специализироваться: если шмели
собирают пыльцу с нескольких растений
и составляют из нее смешанный взяток,
то медоносные пчелы (Apis sp.)
предпочитают пыльцу какого-то одного
вида. Протекала ли эволюция Apis в
соответствии с интересами растений?
Этому трудно поверить, так как пчелы
всегда используют любую возможность:
они готовы собирать нектар и пыльцу,
прокусывая растительные ткани, или
заняться сбором пади, если ее легко
добыть. В сущности, растения,
предоставляющие пчелам только пыльцу,
могут оказаться в настоящее время в
выигрыше, так как медоносные пчелы,
собирающие пыльцу, не счищают ее со
своих волосков и не сбрасывают,
подобно тому как это делают сборщицы
нектара. Хотя медоносные пчелы сузили
круг видов, используемых в каждый
данный момент, они все же склонны
фуражировать на одном месте, а не
путешествовать по всей области, где
растет данный вид. Это, вероятно,
снижает их эффективность как
опылителей деревьев и кустарников.
Возможно, что способность медоносных
пчел выжидать, пока наступит время
цветения данного вида, и мобилизовать
на сбор пыльцы одновременно большое
число особей делает их более
совершенными инструментами опыления,
чем пчелы с менее общественным
образом жизни. Конечно, нам хотелось
бы представить себе то естественное
состояние, в котором находились пчелы
рода Apis до того, как человек перенес их
в свои ульи и стал охранять, используя в
качестве сборщиц меда и опылителей
культурных растений; однако создать
себе такое представление нелегко, и оно
может оказаться неверным.
Наиболее заметная группа растений,
поселяющихся в постоянном
микроклимате гнезда,-это грибы.
Первыми проникли в гнезда, вероятно,
дрожжи, занесенные с плодами, травой и
экскрементами гусениц. На отбросах в
камерах, уже не используемых для
выращивания расплода, легко могли
обосноваться многие нитчатые грибы.
Затем в результате длительной
совместной эволюции взаимоотношения
насекомых и грибов достигли
наблюдаемого ныне совершенства, когда
определенный вид грибов предоставляет
насекомому свои плодовые тела,
а насекомое срезает, собирает
и переносит в гнездо растительный
материал-необходимый для гриба
субстрат. Этот тесный симбиоз дал
возможность некоторым группам
муравьев и термитов заселить новые
местообитания. Термиты получают
мертвый растительный материал раньше,
чем до него могут добраться другие
разрушители, а многие муравьи
приобрели совершенно новую пищевую
нишу и теперь сосуществуют
в тропическом лесу с такими грозными
хищниками, как Dorylinae.
Различные организмы, вплоть до мелких
352 Г.юва 17
позвоночных, используют для своей
защиты особенности поведения
общественных ос, пчел и муравьев.
Зеленые растения обороняются с их
помощью от листоядных, сосущих
и галлообразующих насекомых, а также
от растительноядных позвоночных
и даже от других растений и пожаров.
Хотя растение может обеспечить себе
такую защиту при помощи
экстрафлоральных нектарников,
доставляющих привлекательный нектар в
нужном месте и в нужное время,
наилучшие результаты получаются в тех
случаях, когда растение предоставляет
муравьям место для гнезда, так как
муравьи энергично защищают свои
гнезда. Многие растения изначально
обладали полым стеблем, но
привлечению муравьев помогают и такие
более новые признаки, как вздутые
колючки, узлы с мягкими участками,
которые облегчают проникновение
насекомых и которые каким-то образом
находят самки-основательницы,
и „пищевые тельца".
В полых стеблях некоторых растений
живут щитовки, служащие
дополнительным средством привлечения
муравьев. Если растения используют
щитовок и других растительноядных
сосущих насекомых, чтобы привлечь
муравьев к участкам, нуждающимся в
защите, то возможно, что многие
взаимоотношения между этими
насекомыми и муравьями представляют
собой не дуэты, а трио. По-видимому,
растения в процессе эволюции нашли
способ, ограничивающий нападение
сосущих насекомых лишь некоторыми
участками и определенным временем.
Возможно, что первоначальная функция
муравьев состояла в уничтожении этих
насекомых. В дальнейшем
взаимоотношения муравьев с сосущими
насекомыми могли превратиться
в сбалансированные отношения
хищник-жертва, как в случае Oecophylla
и щитовок или Lasius flavus и корневых
тлей. Выгода, извлекаемая деревом из
системы первого типа, известна на
протяжении тысячелетий, тогда как
преимущество, которое дает злакам
система второго типа, менее очевидно и
требует дальнейшего изучения. Я думаю,
что дело здесь в улучшении структуры
почвы, происходящем в результате
разрывания муравьями глубоких ее
слоев, богатых минеральными
веществами, которые, как известно,
благоприятствуют росту растений.
Холмики муравьев привлекают кроликов,
которые „подстригают" злаки, не
позволяют разрастаться их
конкурентам-кустарникам и вносят
в почву свежие экскременты.
В результате всего этого на
муравейниках создается более теплый
микроклимат, что позволяет растениям,
процветающим в Средиземноморской
области, распространиться в виде
отдельных пятен в восточную часть
Англии. Не высаживает ли Lasius их
семена? Таким образом вокруг муравья
могла бы создаваться некая
микросистема или экологический узел,
для которого характерен интенсивный
обмен энергией.
17.2. Организация семьи
Все семьи общественных насекомых
можно рассматривать как системы,
вырабатывающие тот особый материал,
из которого они состоят, из
определенной пищи. Им необходимо
производить этот материал в таком
количестве, чтобы возмещать потери,
расти до подходящих с экономической
точки зрения размеров, а затем
воспроизводить себе подобных, не нанося
ущерба всей этой социальной машине. В
понятиях системного анализа они
представляют собой линейные системы
второго порядка. Вначале они имеют
Две темы 353
небольшие размеры, затем растут все
быстрее и быстрее, после чего рост
замедляется и переходит либо
в незатухающие колебания, либо
в некоторый стационарный режим.
В плохо регулируемых системах
колебания продолжаются до тех пор,
пока не приведут к гибели семьи, хотя
при этом возможно и некоторое
размножение. Частота колебаний зависит
от внутренней структуры системы,
в частности от времени развития от яйца
до взрослой особи, а в дальнейшем - от
количества энергии и материалов,
затрачиваемых на воспроизводство.
Истинная задача семьи общественных
насекомых, как и любой другой живой
системы,-это именно воспроизводство.
Оно должно начинаться медленно и так
же медленно возрастать до максимума,
поскольку необходимые для этого
ресурсы семья черпает из того же фонда,
за счет которого она поддерживает свое
существование. Максимум должен
наступить тогда, когда семья достигнет
наибольшей силы и будет располагать
наибольшим избытком материала-ведь
если этот избыток не „экспортируется11 в
виде крылатых репродуктивных особей
или рабочих, сопровождающих самку, то
эффективное функционирование семьи
прекращается. Помимо такого
„экспорта44 избытков с генетической
точки зрения очень важно уделять
определенную долю усилий каждому
полу. Правильное распределение
ресурсов между двумя полами зависит от
ряда факторов, в частности от того,
откладываются ли яйца, дающие самцов,
рабочими особями, от числа имеющихся
в данной семье яйцекладущих самок, от
того, размножается ли семья путем
разделения или же путем отделения
единичных репродуктивных особей, и от
того, насколько удачно она расположена
в экологическом отношении.
Даже если благодаря „экспорту44
репродуктивных особей семья постоянно
остается „в форме44, ей все еще важно
избегать значительного снижения
эффективности. Это снижение опять-таки
может быть вызвано рядом причин.
Наиболее очевидная причина-
перенаселенность или скученность,
ведущая к столкновениям и
прямым помехам для деятельности,
создаваемым отдельными рабочими
особями. Столь же важно избегать
перекрывания при поисках пищи (хорошо
известная в экологии проблема поиска
хозяина паразитами) или перекрывания
усилий, например при кормлении
личинок в гнезде. Последняя проблема
может быть решена путем обмена
информацией между особями, однако
проблема создания эффективной системы
доставки корма хоть как-то
приближается к решению лишь у видов с
наиболее развитой социальной
организацией. Конечно, по мере роста
семьи разыскивать пищу приходится все
дальше от гнезда и соответственно
приносить ее издалека. А для этого
нужны разведчики, лидеры, ориентиры,
постоянные дороги, склады для хранения
запасов и не в последнюю
очередь - коллективный труд. Несмотря
на все эти дополнительные факторы, по
мере роста семьи „стоимость44 пищи
повышается; это неизбежное следствие
концентрирования всего, что необходимо
для роста, в гнездовых центрах.
И гак, пища собрана и сложена для
переработки, но остается еще деликатный
вопрос о том, кто должен получать ее в
первую очередь. Распределение пищи не
может происходить стихийно, но как же
оно организовано? Должна ли самка
пользоваться приоритетом, чтобы она
могла производить яйца? Способна ли
она каким-то образом приводить
в соответствие откладку яиц
и потребление пищи? Принадлежит ли
вторая очередь самым крупным
354 Глава 17
личинкам,- поскольку им нужно меньше
всего пищи, для того чтобы
подготовиться к метаморфозу и вернуть
семье затраченные на них ресурсы (т. е.
работать на нее)? В целом создается
впечатление, что даже у тех
общественных насекомых, у которых
личинки выращиваются в ячейках, число
откладываемых яиц больше числа
созревающих личинок. Значительную
часть личиночной смертности можно
отнести на счет нарушений эмбриогенеза,
но некоторая ее доля, вполне возможно,
представляет собой „подгонку"
к снабжению пищей, измеряемому
в общем виде как число кормилиц и
количество пищи, которое они могут
предложить. Эта подгонка могла бы
быть связана с тем, что кормилицы,
которые лучше питаются, проявляют
большую заботу о личинках; каждая
личинка должна быть покрыта сверху
слоем химического вещества,
защищающего ее от поедания голодными
рабочими особями. Интересно отметить,
что, по имеющимся данным, такая
подгонка происходит при линьке,
разделяющей два личиночных возраста:
чем старше личинка, тем больше у нее
шансов избежать уничтожения.
Превращение личинок женского пола в
мелких рабочих особей позволяет,
конечно, обойтись меньшим количеством
пищи и ускоряет возврат произведенных
издержек. У муравьев, обитающих
в умеренном поясе, многие из зимующих
личинок находятся на пути превращения
в рабочих особей. В сущности, все
личинки женского пола должны пройти
через ряд испытаний; их подвергают
воздействиям, детерминирующим
развитие в рабочих особей, и определяют
таким образом стабильность их
морфогенетической направленности. При
этом развитие всех истощенных, а также
слабых по своим внутренним задаткам
личинок направляется по пути
формирования рабочих. Имеются также
данные, что ухаживающие за личинками
рабочие особи способны распознавать
состояние личинок, определять их
возраст и влиять на их дальнейшее
развитие-могут, например, разбавлять
их пищу или же кормить их вдоволь. На
одной из ранних стадий развития такие
воздействия заставляют личинок сразу
метаморфизировать, а на более поздней
стадии (после диапаузы) препятствуют их
превращению под влиянием ювенильного
гормона в хорошо упитанную,
полноценную особь, которая могла бы
стать репродуктивной самкой. Этому
помогает также массаж-процедура, при
которой личинку сдавливают жвалами,
но не повреждают; к этой процедуре
обычно прибегают фуражиры,
находящиеся в сильном подчинении у
самок.
Яйцекладущие самки (матки) фактически
оказывают сдерживающее влияние,
препятствующее тому, чтобы рабочие
особи целиком отдавались производству
самцов и репродуктивных самок, как они
это делают в отсутствие матки. Матки
предотвращают созревание семьи; иными
словами, они оказывают омолаживающее
воздействие, аналогичное воздействию
corpora allata на личинок, которое держит
постэмбриональное развитие под
контролем. В обоих случаях позднее
переключение онтогенеза (переход от
развития в рабочих особей к развитию в
репродуктивных особей) лучше; оно
более успешно как в качественном, так и
в количественном смысле, чем это было
бы в том случае, если бы оно было
ранним. Таким образом, матка во всей
семье, a corpora allata у отдельной
личинки просто сдерживают некую
эндогенную направленность развития,
как бы создавая такое давление на
семью, при котором, в случае если
дальнейшее сдерживание станет
невозможным, получаемый результат
Две темы 355
имел бы большие шансы на успех.
Возможности матки снижаются по
нескольким причинам. Во-первых,
происходит запрограммированное
старение, при котором направленность
яиц к развитию в рабочих особей,
закладываемая матерью, затухает, так
что яйца либо утрачивают такую
направленность, либо становятся
предрасположенными к развитию
в репродуктивных самок. Во-вторых, с
увеличением числа рабочих особей
ослабевает их контакт с маткой, так что
способность матки влиять на их
обращение с личинками также снижается:
либо полное переключение развития
происходит у меньшего числа личинок,
либо все личинки изменяются в меньшей
степени. Этот эффект разбавления
проявляется даже в том случае, если
рабочие особи могут сами
распространять феромоны самки.
В-третьих, после бурного роста
численности семьи в ней преобладают
молодые рабочие особи, а они слабее
реагируют на влияние маток либо
изначально, либо потому, что неизбежно
высокое соотношение рабочие/матки
препятствует их сенсибилизации в тот
короткий период после появления на
свет, когда они восприимчивы
к импринтингу.
Итак, семья общественных
насекомых-это организм. Она
закладывается, растет, созревает
и воспроизводится. Она столь же
обособленна и так же хорошо
регулируется, как и любая другая живая
система.
Литература
Abbott А. (1978). Nutrient dynamics of ants.
In: Production ecology of ants and termi-
tes (M. V. Brain, ed.), Cambridge Universi-
ty Press, Cambridge, pp. 233-244.
Abe T. (1979). Studies on the distribution and
ecological role of termites in a lowland ra-
in forest of West Malaysia. 2. Food and
feeding habits of termites in Pasoh Forest
Reserve, Japanese J. of Ecology, 29, 121-
135.
Abe T. (1980). Studies on the distribution and
ecological role of termites in a lowland
rain forest of West Malaysia. 4. The role
of termites in the process of wood de-
composition in Pasoh Forest Reserve, Re-
vue d’ecologie et de biologie de sol, 17 (1),
23-40.
Abe T., Matsumoto T. (1979). Studies on the
distribution and ecological role of termites
in a lowland rain forest of West Malaysia.
3. Distribution and abundance of termites
in Pasoh Forest Reserve, Japanese J. of
Ecology, 29, 337-351.
Abraham M., Pasteels J. M. (1980). Social be-
haviour during nest-moving in the ant
Myrmica rubra L. (Hym. Form.), Insectes
Sociaux, 27 (2), 127 147.
Abrams J., Eickwort G. C. (1981). Nest swit-
ching and guarding by the communal
sweat bee Agapostemon virescens (Hyme-
noptera, Halictidae), Insectes Sociaux, 28 (2),
105-116.
Alexander R. D., Sherman P. W. (1977). Lo-
cal mate competition and parental in-
vestment in social insects, Science, 196,
494-500.
Alford D. V. (1975). Bumblebees, Davis-Poyn-
ter, London, 352 pp.
Alibert-Berthot J. (1969). La trophallaxie chez
le termite a cou jaune, Calotermes flavicol-
lis (Fabr.), etudiee a 1’aide de radio-ele-
ments. I. Participation des differentes cas-
tes a la trophallaxie “globale”. Les cate-
gories d’aliments transmis, Annales des
sciences naturelles (Zoologie), Ser. 12, 11,
235-325.
Alloway T. M. (1979). Raiding behaviour of
two species of slave-making ants, Harpago-
xenus americanus (Emery) and Leptothorax
duloticus (Wesson) (Hymenoptera: Formici-
dae), Animal Behaviour, 27, 202 210.
Ambrose J. T., Morse R. A., Boch R. (1979).
Queen discrimination by honeybee swarms,
Annals of the Entomological Society of
America, 72 (5), 673-675.
Archer M. E. (1981a). A simulation model for
the colonial development of Paravespula
vulgaris (Linnaeus) and Dolichovespula syl-
vestris (Scopoli) (Hymenoptera: Vespidae),
Melanderia, 36, 59 pp.
Archer M. E. (1981b). Successful and unsuccess-
ful development of colonies of Vespula vul-
garis (Linn.) (Hymenoptera: Vespidae),
Ecological Entomology, 6 (1), 1 — 10.
Arnold G., Delage-Darchen B. (1978). Nouvelies
donnees sur 1’equipement enzymatique des
glandes salivaires de I’ouvriere d’Apis mel-
lifica (Hymenoptere Apide), Annales des
sciences naturelles, zoologie, Ser., 12, 20
(4), 401-422.
Auclair J. L. (1963). Aphid feeding and nutri-
tion, Annual Review of Entomology, 8,
439-490.
Autuori M. (1974). Der Staat der Blattschnei-
der-Ameisen. In: Sozialpolymorphismus bei
Insekten (G. H. Schmidt, ed.), Wiss. Ver-
lagsgesellschaft, Stuttgart, pp. 631-656.
Avitabile A. (1978). Brood rearing in honeybee
colonies from late autumn to early spring,
J. of Apicultural Research, 17 (2), 69-73.
Avitabile A., StafStrom D., Donovan K. J.
(1978). Natural nest sites of honeybee co-
lonies in trees in Connecticut, USA, J. of
Apicultural Research, 17 (4), 222-226.
Bailey L. (1952). The action of the proventri-
culus of the worker honeybee, Apis mel-
lifera L., J. of Experimental Biology,
29 (2), 310- 327.
Baldridge R. S., Rettenmeyer C. W., Watkins
J. F„ II (1980).
Seasonal, nocturnal and diurnal flight pe-
riodicities of Nearctic army ant males (Hy-
menoptera: Formicidae), J. of the Kansas
Entomological Society, 53 (1), 189-204.
Barlin M. R., Blum M. S., Brand J. M. (1976).
Fire ant trail pheromones: analysis of spe-
cies specificity after gas chromatographic
fractionation, J. of Insect Physiology, 22,
839-844.
Baroni Urbani C. (1968). Monogyny in ant so-
cieties, Sonderdruck aus Zoologischer An-
zeiger, 181 (3/4), 269-277.
.'lumepamvpa 357
Baroni Urbani C. (1969). Ant communities of
the high-altitude Appennine grasslands,
Ecology, 50, 488-492.
Baroni Urbani C. (1974). Polymorphismus in
der Ameisen-gattung Camponotus aus
morphologischer Sicht. In: Sozialpolymor-
phismus bei Insekten (G. H. Schmidt, ed.),
Wissenschaftliche verlagsgesellschaft, Stut-
tgart, pp. 543-564.
Baroni Urbani C. (1979). Territoriality in social
insects. In: Social Insects (H. R. Hermann,
ed.), Academic Press, London and New
York, pp. 91-121.
Baroni Urbani C., Karnowski P. B. (1974). Pat-
terns of the red imported fire ant settle-
ment of a Louisiana pasture: some demo-
graphic parameters, interspecific competiti-
on and food sharing, Environmental Ento-
mology, 3, 755-760.
Barrows E. M. (1975). Individually distinctive
odors in an invertebrate, Behavioral Biolo-
gy, 15, 57-64.
Barrows E. M., Bell W. J., Michener C. D.
(1975). Individual odor differences and their
social functions in insects. Proceedings of
the National Academy of Science, USA,
Zoology, 72 (7), 2824-2828.
Batra L. R., Batra S. W. T. (1966). Fungus-
growing termites of tropical India and as-
sociated fungi, J. of the Kansas Entomolo-
gical Society, 39, 725-738.
Beetsma J. (1979). The process of queen-worker
differentiation in the honeybee, Bee World,
60 (1), 24-39.
Beig D. (1972). The production of males in
queenright colonies of Trigona (Scaptotri-
gona) postica, J. of Apicultural Research,
11, 33-39.
Beig D. (1977). Endocrine control in Meliponi-
nae: “corpus allatum” activity and ovary
growth in stingless bees, Proceedings,
Vlllth International Congress of the Inter-
national Union for the Study of Social
Insects, Wageningen, pp. 228-231.
Beig D., Bueno О. C., da Cunha R. A., de Mo-
raes H. J. (1982). Differences in quantity
of food in worker and male brood cells
of Scaptotrigona postica (Latr. 1807) (Hy-
menoptera, Apidae), Insects Sociaux, 29
(2), 189-194.
Benois A. (1969). Etude morphologique, biolo-
gique et ethologique de Camponotus vagus
Scop, (pubescens Fab) (Hymenoptere, For-
micoides, Formicidae) Doctoral Thesis,
University of Toulouse.
Benois A. (1972). Etude ecologique de Campo-
notus vagus Scop. (= pubescens Fab.) (Hy-
menoptera, Formicidae) dans la region
d’Antibes: nidification et architecture des
nids, Insectes Sociaux, 19 (2), 111-129.
Bentley B. L. (19П). The protective function of
ants visiting the extrafloral nectaries of
Bixia orellana (Bixaceae), J. of Ecology,
65, 27-38.
Bequaert J. (1922). Ants in the diverse relati-
ons to the plant world. In: Ants of the
Belgian Congo W. M. Wheeler, Bulletin,
American Museum of Natural History, 45,
333-583.
Berg R. Y. (1975). Myrmecochorous plants in
Australia and their dispersal by ants.
Australian J. of Botany, 23, 475-508.
Bergstrom G. (1975). Development of an inte-
grated system for the analyses of volatile
communication substances in social Hyme-
noptera. In: Pheromones and defensive
secretions in social insects, Proceedings,
Symposium of the International Union for
the Study of Social Insects, Dijon,
pp. 173-187.
Bergstrom G., Lbfquist J. (1972). Similarities
between the Dufour’s gland secretions of
the ants Camponotus ligniperda (Larvi) and
Camponotus herculeanus (L), Entomologica
Scandinavica, 3, 225-238.
Bergstrom G., Svensson B. G., Appelgren M.,
Groth I. (1981). Complexity of bumble bee
marking pheromones: biochemical ecolo-
gical and systematical interpretation. Syste-
matics Association Special vol. 19, Bio-
systematics of Social Insects (P. E. Howse
and. J.-L. Glement, eds.), Academic Press,
London and New York, pp. 175-183.
Bernardi C., Cardani D., Ghiringhelli D., Sel-
va A., Baggini A., Pavan M. (1967). On
the components of secretion of mandibular
glands of the ant Lasius (Dendrolasius)
fuliginosus, Tetrahedron Letters, 40,
3893-3896.
Berndt К. P. (1977). The physiology of repro-
duction in the Pharaoh’s ant (Monomorium
pharaonis L.) 1. Pheromone mediated
cyclic production of sexuals, Wiadomosci
Parazytologiczne, 23, 163-166.
Berndt К. P., Nitschmann J. (1979). The phy-
siology of reproduction in the Pharaoh’s
ant (Monomorium pharaonis L.) 2. The
unmated queens, Insectes Sociaux, 26 (2),
137-145.
Bernstein R. A. (1975). Foraging strategies of
ants in response to variable food density
(Hym. Formicidae), Ecology, 56 (1),
213-219.
Bernstein R. A. (1979a). Schedules of foraging
activity in species of ants, J. of Animal
Ecology, 48 (3), 921-930.
358 Литература
Bernstein R. A. (1979b). Relations between spe-
cies diversity and diet in communities of
ants, Insectes Sociaux, 26 (4), 313-321.
Bernstein R. A., Gobbel M. (1979). Partitioning
of space in communities of ants, J. of
Animal Ecology, 48 (3), 931-942.
Benton A. W. (1967). Esterases and phospha-
tases of honeybee venom, J. of Apicultu-
ral Research, 6 (2), 91-94.
Bier К. H. (1953). Beziehungen zwischen
Nahrzellkemgrbsse und Ausbildung ribo-
nukleinsaurehaltiger Strukturen in den
Oocyten von Formica rufa rufopratensis
minor Gbsswald, Zoologische Anzeiger
Supplement, 16, 369-374.
Bigley W. S., Vinson S. B. (1975). Characte-
rization of a brood pheromone isolated
from the sexual brood of the imported
fire ant, Solenopsis invicta, Annals of the
Entomological Society of America, 68 (2),
301-304.
Bignell D. E., Oskarsson H., Anderson J. M.
(1980). Distribution and abundance of
bacteria in the gut of a soil feeding
termite Procubitermes aburiensis, J. of Ge-
neral Microbiology, 117, 393-403.
Bignell D. E., Oskarsson H.. Anderson J. M.
(1981). Association of Actinomycetes with
soil-feeding termites: a novel symbiotic
relationship? In: Actinomycetes (V. Schaal
and G. Pulverer, eds.), Zentralblatt fur
Bakteriologie Supfilementheft, vol. 11,
pp. 201-206.
Blum M. S. (1974). Pheromonal sociality in the
Hymenoptera. In: Pheromones (M. C. Birch,
ed.), North Holland, Amsterdam,
pp. 223-249.
Blum M. S., Brand J. M. (1972). Social insect
pheromones: their chemistry and function,
American Zoologist, 12, 553-576.
Blum M. S., Portocarrero C. A. (1964). Chemi-
cal releasers of social behaviour. IV. The
hindgut as the source of the odor trail
pheromone in the neotropical army ant ge-
nus, Eciton, Annals of the Entomological
Society of America, 57 (6), 793-794.
Blum M. S., Jones T. H., Holldobler B., Fa-
tes H. M., Jaouni T. (1980). Alkaloidal
venom mace: offensive use by a thief ant,
Naturwissenschaften, 67, 144.
Boch R. (1979). Queen substance pheromone
produced by immature queen honeybees, J.
of Apicultural Research, 18 (1), 12-15.
Boch R., Morse R. A. (1979). Individual re-
cognition of queens by honey bee swarms,
Annals of the Entomological Society of
America, 72 (1), 51-53.
Bodot P. (1966). Etudes ecologique et biologi-
que des Termites des savanes de Basse
C6te d’Ivoire, These, Universite d’Aix
Marseille.
Boomsma J. J., Leusink A. (1981). Weather
conditions during nuptial flights of four
european ant species, Oecologia, 50 (2),
236-241.
Boomsma J. J., van Loon A. J. (1982). Structu-
re and diversity of ant communities in
successive coastal dune valleys, J. of Ani-
mal Ecology, 51, 957-974.
Boomsma J. J., DeVries A. (1980). Ant species
distribution in a sandy coastal plain,
Ecological Entomology, 5 (3), 189-204.
Bouillon A. (1970). Termites of the Ethiopian
region. In: Biology of the termites, vol.
II (K. Krishna and F. M. Weesner, eds.),
Academic Press, New York, pp. 154-280.
Boven J. K. A. van (1970). Le polymorphisme
des ouvrieres de Megaponera foetens Fabr,
Publicaties van het Natuurhistorisch ge-
nootschap in Limburg, 20, 5-9.
Boyd N. D., Martin M. M. (1975). Faecal pro-
teinases of the fungus growing ant, Atta
texana: their fungal origin of ecological
significance, J. of Insect Physiology, 21
(11), 1815-1820.
Bradshaw J. W. S., Baker R., Howse P. E.
(1979a). Multicomponent alarm pheromones
in the mandibular glands of major wor-
kers of the African weaver ant, Oeco-
phylla longinoda, Physiological Entomology,
4, 15-25.
Bradshaw J. W. S., Baker R., Howse P. E.
(1979b). Caste and colony variations in the
chemical composition of the cephalic sec-
retions of the African weaver ant, Oeco-
phylla longinoda, Physiological Entomology,
4 (1), 27-38.
Bradshaw J. IV. S., Baker R., Howse P. E.
(1979c). Chemical composition of the poi-
son apparatus secretions of the African
weaver ant, Oecophylla longinoda, and their
role in behaviour, Physiological Entomolo-
gy, 4 (1), 39-46.
Brandt D. Ch. (1980). The thermal diffusivity
of the organic material of a mound of For-
mica polyctena Foerst in relation to the
thermoregulation of the brood (Hymenop-
tera, Formicidae), Netherlands J. of Zoolo-
gy, 30 (2), 326-344.
Breed M. D., Gamboa G. J. (1977). Control
of worker activities by queen behavior in
a primitively eusocial bee, Science, 195,
694-696.
Breed M. D., Silverman J. M., Bell IV. J.
(1978). Agonistic behaviour, social interac-
tions and behavioural specialization in a
primitively eusocial bee, Insectes Sociaux,
25 (4), 351-364.
Литература 359
Breen J. (1977). Patterns of distribution of
Formica lugubris Zett. nests in Irish plan-
tation woods (Hymenoptera, Formicidae),
Proceedings, VUIth International Congress
of the International Union for the Study of
Social Insects, Wageningen, p. 156.
Breen J. (1979). Worker populations of Formi-
ca lugubris Zett. nests in Irish plantation
woods, Ecological Entomology, 4, 1—7.
Brian A. D. (1951). Brood development in Bom-
bus agrorum, Entomologists Monthly Ma-
gazine, 87, 207-212.
Brian A. D. (1952). Division of labour and fo-
raging in Bombus agrorum Fabricius, J.
of Animal Ecology, 21, 223-240.
Brian A. D. (1954). The foraging of bumble-
bees, Bee World, 35, 61-67, 81-91.
Brian A. D. (1957). Differences in the flowers
visited by four species of bumble-bees and
their causes, J. of Animal Ecology, 26,
71-98.
Brian M. V. (1951). Summer population chan-
ges in colonies of the ant Myrmica, Phy-
siologia Comparata et Oecologia, 2 (3),
248-262.
Brian M. V. (1953). Brood-rearing in relation
to worker number in the ant Myrmica,
Physiological Zoology, 26 (4), 355-366.
Brian M. V. (1955a). Food collection by a
Scottish ant community, J. of Animal Eco-
logy, 24, 336-351.
Brian M. V. (1955b). Studies of caste dif-
ferentiation in Myrmica rubra L. 2. The
growth of workers and intercastes, Insec-
tes Sociaux, 2, 1-34.
Brian M. V. (1964). Ant distribution in a sou-
thern English heath, J. of Animal Ecology,
33, 451-461.
Brian M. V. (1965). Social Insect Populations,
Academic Press, New York and London,
135 pp.
Brian M. V. (1967). Production by social in-
sects. In: Secondary productivity of Ter-
restrial ecosystems (K. Petrusewicz, ed.),
Warszawa, pp. 835-839.
Brian M. V. (1969). Male production in the
ant Myrmica rubra L., Insectes sociaux,
16, 249-268.
Brian M. V. (1970). Communication between
queens and larvae in the ant Myrmica,
Animal Behaviour, 18 467-472.
Brian M. V. (1972.). Population turnover in
wild colonies of the ant Myrmica, Ekolo-
gia Polska, 20, 43-53.
Brian M. V. (1973a). Feeding and growth in
the ant Myrmica, J. of Animal Ecology,
42, 37-53.
Brian M. V. (1973b). Temperature choice and
its relevance to brood survival and caste
determination in the ant Myrmica rubra
L., Physiological Zoology, 46 (4), 245-252.
Brian M. V. (1973c). Queen recognition by bro-
od-rearing workers of the ant Myrmica
rubra L., Animal Behaviour, 21, 691-698.
Brian M. V. (1974a). Kastendetermination bei
Myrmica rubra L. In: Sozialpolymorphis-
mus bei Insekten (G. H. Schmidt, ed.),
Wissenschaftliche Verlagsgesellschaft, Stut-
tgart, 565-589.
Brian M. V. (1974b). Caste differentiation in
Myrmica rubra: the role of hormones, J.
of Insect Physiology, 20, 1351-1365.
Brian- M. V. (1975). Larval recognition by wor-
kers of the ant Myrmica, Animal Behaviour,
23, 745-756.
Brian M. V. (1977). The synchronisation of co-
lony and climatic cycles. Proceedings,
VUIth International Congress of the Inter-
national Union for the Study of Social In-
sects, Wageningen, pp. 202-206.
Brian M. V. (1978). Production ecology of ants
and termites. International Biological Pro-
gramme 13 (M. V. Brian, ed.), Cambridge
University Press, 409 pp.
Brian M. V. (1979a). Caste differentiation and
division of labour. In: Social Insects I
(H. Hermann, ed.), Academic Press, New
York, pp. 121-222.
Brian M. V. (1979b). Habitat differences in se-
xual production by two co-existent ants,
J. of Animal Ecology, 48, 943-953.
Brian M. V. (1980). Social control over sex
and caste in bees, wasps and ants, Biolo-
gical Review, 55, 379-415.
Brian M. V. (1981). Treatment of male larvae
in ants of the genus Myrmica, Insectes So-
ciaux, 28 (2), 161-166.
Brian M. V. Abbott A. (1977). The control of
food flow in a society of the ant Myr-
mica rubra L., Animal Behaviour, 25,
1047-1055.
Brian M. V., Brian A. D. (1949). Observations
on the taxonomy of the ants Myrmica
rubra L. and Myrmica laevinodis (Nylander)
(Hym., Formicidae), Transactions of the
Royal Entomological Society of London,
100, 393-409.
Brian M. V., Brian A. D. (1951). Insolation
and ant population in the west of Scot-
land, Transactions of the Royal Entomolo-
gical Society of London, 102, 303-330.
Brian M. V., Brian A. D. (1952). The wasp
Vespula sylvestris (Scop.): Feeding, fora-
ging and colony development. Transactions
of the Royal Entomological Society of
London, 103, 1-26.
Brian M. V., Brian A. D. (1955). On the two
forms macrogyna and microgyna of the
360 Литература
ant Myrmica rubra (L.), Evolution, 9,
280-290.
Brian M. V., Carr С. A. H. (1960). The in-
fluence of the queen on brood rearing in
ants of the genus Myrmica, J. of Insect
Physiology, 5, 81-94.
Brian M. V., Downing В. M. (1958). The nests
of some British ants. Proceedings Xth In-
ternational Congress of Entomology, Mon-
treal, 1956, vol. 2, pp. 539-540.
Brian M. V., Elmes G. W. (1974). Production
by the ant Tetramorium caespitum in a
southern English heath, J. of Animal
Ecology, 43, 889-903.
Brian M. V., Evesham E. J. M. (1982). The role
of young workers in Myrmica colony deve-
lopment. Proceeding IXth International
Congress of the International Union for
the Study of Social Insects, Colorado.
Brian M. V., Hibble J. (1964). Studies of caste
differentiation in Myrmica rubra L., 7. Caste
bias queen age and influence, Insectes
Sociaux, 11, 223-238.
Brian M. V., Jones R. M. (1980). Worker po-
pulation structure and gyne production in
the ant Myrmica, Behavioral Ecology and
Sociobiology, 7, 281-286.
Brian M. V., Rigby C. (1978). The trophic eggs
of Myrmica rubra L., Insects Sociaux,
25, 89-110.
Brian M. V., Hibble J., Stradling D. J. (1965).
Ant pattern and density in a southern
English heath, J. of Animal Ecology, 34,
545-555.
Brian M. V., Hibble J., Kelly A. F. (1966). The
dispersion of ant species in a southern En-
glish heath, J. of Animal Ecology, 35,
281-290.
Brian M. V., Elmes G., Kelly A. F. (1967). Po-
pulations of the ant Tetramorium caespitum
Latreille, J. of Animal Ecology, 36, 337-342.
Brian M. V., Mountford M. D., Abbott A., Vin-
cent S. (1976). The changes in ant species
distribution during ten years post-fire re-
generation of a heath, J. of Animal Eco-
logy, 45, 115-133.
Brian M. V., Clarke R. T., Jones R. M.
(1981a). A numerical model of an ant
society, J. of Animal Ecology, 50, 387-405.
Brian ,M. V., Jones R. M., Wardlaw J. C.
(1981b). Quantitative aspects of queen con-
trol over reproduction in the ant Myrmi-
ca, Insectes Sociaux, 28 (2), 161-1166.
Breed M. D. (1977). Interactions among indivi-
duals and queen replacement in an eusocial
halictine bee. Proceedings Vlllth Congress
of the International Union for the Study
of Social Insects, Wageningen, pp. 228-231.
Breed M. D., Gamboa G. J. (1977). Control of
worker activities by queen behaviour in a
primitively eusocial bee, Science, 195,
694-696.
Brown C. A., Watkins J. F., Eldridge D. W.
(1979). Repression of bacteria and fungi
by the army ant secretion: skatole, J. of
the Kansas Entomological Society, 52 (1),
119-122.
Brown E. S. (1959). Immature nutfall of coco-
nuts in the Solomon Islands. II Changes
in ant populations and their relation to
vegetation, Bulletin of Entomological Re-
search, 50, 523-558.
Brown W. L., Jr. (1973). A comparison of the
hylaean and Congo-West African rain fo-
rest ant Faunas. In: Tropical forest ecosy-
stems in Africa and South America: a
comparative review (B. J. Meggers, E. S.
Ayensu and W. D. Duckworth, eds.),
Smithsonian Institute Press, Washington
D. C„ pp. 161-185.
Brilckner D. (1980). Hoarding behaviour and li-
fe span of inbred, non-inbred and hybrid
honeybees, J. of Apicultural Research, 19
(1), 35-41.
Bruinsma O., Leuthold R. H. (\9TT). Pheromones
involved in the building behaviour of
Macrotermes subhyalinus (Rambur). Procee-
dings, Vlllth International Congress of
the International Union for the Study of
Social Insects, Wageningen, pp. 257-258.
Buchli H. (1950). Recherche sur la fondation
et le developpment des nouvelles colonies
chez le termite lucifuge (Reticulitermes
lucifugus (Rossi)), Physiologia Comparata
et Oecologia, 2, 145-160.
Bruyn G. D. de Mabelis A. A. (1972). Food
territories in Formica polyctena Forst. Pro-
ceedings, Xlllth International Congress of
Entomology, vol. 3, pp. 358-360.
Buckle G. R. (1982). Queen-worker behavior
and nestmate interactions in young colonies
of Lasioglossum zephyrum, Insectes Sociaux,
29 (2), 125-137.
Bildel A. (1968). Le microclimat de la ruche.
In: Traite de Biologie de 1’Abeille, vol.
4 (R. Chauvin, ed.), Masson, Paris, p.
379.
Biidel A., Herold E. (I960). Biene und Bienen-
zucht, Ehrenwirth, Munchen.
Burgett D. M. (1974). Glucose oxidase: A food
protective mechanism in social Hymenopte-
ra, Annals of the Entomological Society
of America, 67 (4), 545-546.
Bitschinger A. (1974). Polymorphismus und
Kastendetermination in Ameisentribus Lep-
tothoracini. In: Sozialpolymorphismus bei
Литература 361
Insekten (G. H. Schmidt, ed.), Wissen-
schaftliche Verlagsgesellschaft, Stuttgart,
pp. 604-623.
Biischinger A. (1975). Sexual pheromones in
ants. In: Pheromones and defensive secre-
tions in ants, symposium of the Internatio-
nal Union for the Study of Social Insects,
Dijon, pp. 225-233.
Biischinger A. (1978). Genetisch bedingte Ents-
tehung gefliigelter Weibchen bei der Skla-
venhaltenden Ameise Harpagoxenus sublae-
vis (Nyl.) (Hym. Form.), Insectes Sociaux,
25, 163-172.
Biischinger A. (1979). Functional monogyny
in the american guest ant Formicoxenus
hirticomis (Emery) (= Leptothorax hirticor-
nis), (Hym. Form.), Insectes Sociaux, 26
(1), 61-68.
Biischinger A., Ehrhadrt W., Winter V. (1980).
The organization of slave raids in dulotic
ants-a comparative study (Hymenoptera:
Formicidae), Zeitschrift fur Tierpsychologie,
53, 245-264.
Butler C. G. (1940). The ages of the bees in a
swarm, Bee World, 21, 9-10.
Butler C. G. (1957). The process of queen su-
persedure in colonies of honeybees (Apis
mellifera Linn.), Insectes Sociaux, 4 (3),
211-223.
Butler C. G., Jeffree E. P., Kalmus H.
(1943). The behaviour of a population of
honeybees on an artifical and on a natu-
ral crop, J. of Experimental Biology, 20
(1), 65-73.
Butler C. G., Fletcher D. J. C., Watler D.
(1969). Nest-entrance marking with phero-
mones by the honeybee Apis mellifera L.,
and a wasp, Vespula vulgaris L., Animal
Behaviour, 17, 142 147.
Byron P. A., Byron E. R., Bernstein R. A.
(1980). Evidence of competition between
two species of desert ants, Insectes Socia-
ux, 27 (4), 351-360.
Cagniant G. (1979). La parthenogenese thelyto-
que et arrhenotoque chez la fourmi Cata-
glyphis cursor Fonsc (Hym. Form.): Cycle
biologique en elevage des colonies avec
reine et des colonies sans reine, Insectes
Sociaux, 26 (1), 51-60.
Calaby J. H., Gay F. J. (1956). The distributi-
on and biology of the genus Coptotermes
(Isoptera) in Western Australia, Australian
J. of Zoology, 4, 19-39.
Calam D. H. (1969). Species and sex-specific
compounds from the heads of male bum-
blebees (Bombus spp.), Nature, 221, 856—
857.
Cammaerts M. C. (1978). Recruitment to food
in Myrmica rubra L., Biology of Beha-
viour, 4, 159-172.
Cammaerts M. C., Morgan E. D., Tyler R. C.
(1977). Territorial marking in the ant Myr-
mica rubra L. (Formicidae), Biology of
Behaviour, 2, 263-272.
Cammaerts M. C., Inwood M. R., Mor-
gan E. D. Parry K„ Tyler R. C. (1978).
Comparative study of the pheromones
emitted by workers of the ants Myrmica
rubra and Myrmica scabrinodis (Hym. For-
micidae), J. of Insect Physiology, 24 (3),
207-214.
Cammaerts M. C., Evershed R. P., Morgan
E. D. (1981a). Comparative study of the
mandibular gland secretion of four species
of Myrmica ants, J. of Insect Physiology,
27 (4), 225-231.
Cammaerts M. C., Evershed R. P., Morgan
E. D. (1981b). Comparative study of the
Dufour gland secretions of workers of
four species of Myrmica ants, J. of Insect
Physiology, 27, 59-65.
Cammaerts-Tricot M. C. (1975). Ontogenesis of
the defence reactions in the workers of
Myrmica rubra L. (Hymenoptera, Formici-
dae), Animal Behaviour, 23, 124-130.
Cammaerts-Tricot M. C., Morgan E. D., Ty-
ler R. C. (1977). Isolation of the trail phe-
romone of Myrmica rubra (Hym., Formi-
cidae), J. of Insect Physiology, 23 (3),
421-427.
Carmargo C. A. de (1979). Sex determination in
bees. XL Production of diploid males and
sex determination in Melipona quadrifa-
sciata, J. of Apicultural Research, 18,
77-84.
Carr С. A. H. (1962). Further studies on the
influence of the queen in ants of the ge-
nus Myrmica, Insectes Sociaux, 9, 197-211.
Cavill G. W. K., Locksley H. D. (1957). The
chemistry of ants. II. Structure and confi-
guration of irodolactone (isoiridomyrmecin),
Australian J. of Chemistry, 10 (3),
352-358.
Cavill G. W. K., Robertson P. L. (1965). Ant
venoms, attractants and repellents, Science,
149, 1337-1345.
Cederberg B. (1977). Chemical basis for defense
in bumblebees. Proceedings, VUIth Interna-
tional Congress of the International Union
for the Study of Social Insects, Wagenin-
gen, p. 77.
Chadab R., Rettenmeyer C. W. (1975). Mass
recruitment by army ants, Science, 188,
1124-1125.
Chapman S. B., Hibble J., Rafarel C. R. (1975).
Net aerial production by Calluna vulgaris
on lowland heath in Britain, J. of Ecolo-
gy, 63, 233-258.
Charlesworth B. (1978). Some models of the
evolution of altruistic behaviour between
362 Литература
siblings, J. of Theoretical Biology, 72,
297-319.
Charnov E. L. (1978). Sex-ratio selection in
eusocial Hymenoptera, The American Na-
turalist, 112, 317-326.
Chauvin R. (1970). The world of ants (Transl.
George Ordish), Victor Gollancz, London,
216 pp.
Chen S. C. (1937). The leaders and followers
among the ants in nest-building, Physiolo-
gical Zoology, 10 (4), 437-455.
Cherix D. (1980). Note preliminaire sur la
structure, la phenologie et le regime ali-
mentaire d’une super-colonie de Formica
lugubris Zett, Insectes Sociaux, 27 (3),
226-236.
Cherix D., Gris G. Ch. (1977). The giant co-
lonies of the red wood ant in the Swiss
Jura (Formica lugubris Zett). Proceedings,
VUIth International Congress of the In-
ternational Union for the Study of Social
Insects, Wageningen, p. 296.
Cherrett J. M. (1968). The foraging behaviour
of Atta cephalotes (L.) (Hymenoptera,
Formicidae) I. Foraging pattern and plant
species attacked in tropical rain forest, J.
of Animal Ecology, 37, 387-403.
Cherrett J. M. (1972). Some factors involved in
the selection of vegetable substrate by Atta
cephalotes (L.) (Hymenoptera, Formicidae)
in tropical rain forest, J. of Animal Eco-
logy, 41, 647-660.
Coenen-Stass D., Schaarschmidt B., Lamprecht I.
(1980). Temperature distribution and calo-
rimetric determination of heat production
in the nest of the wood ant, Formica
polyctena (Hymenoptera, Formicidae),
Ecology, 61 (2), 238-244.
Cole B. J. (1980). Repertoire convergence in
two Mangrove ants, Zacryptocerus varians
and Camponotus (Colobopsis) sp. Insectes
Sociaux, 27 (3), 265-275.
Collingwood C. A. (1979). The Formicidae (Hy-
menoptera) of Fennoscandia and Denmark.
Fauna Entomologica Scandinavica, vol. 8,
Scandinavian Science Press, Klampenborg,
Denmark, 174 pp.
Collins N. M. (1979). The nest of Macrotermes
bellicosus (Sneathman) from Mokwa, Nige-
ria, Insectes Sociaux, 26 (3), 240-246.
Collins N.M. (1981a). Populations, age structu-
re and survivorship of colonies of Macro-
termes bellicosus (Isoptera, Macrotermitinae),
J. of Animal Ecology, 50, 293-311.
Collins N. M. (1981b). The role of termites in
the decomposition of wood and leaf litter
in the Southern Guinea Savanna of Nige-
ria, Oecologia, 51, 389-399.
Colombel P. (1974). L’elevage artificial du
couvain d'Odontomachus eamatodes L. et la
differentiation trophogegique des ouvrieres
et des reines, Compte rendu de
I’Academie des Sciences, Paris, Ser. D,
279, 489-491.
Colombel P. (1978). Biologie d’Odontomachus
heamatodes, determinisme de la caste fe-
melle, Insectes Sociaux, 25, 141-151.
Corbet S. A., Unwin D. M., Prys-Jones О. E.
(1979). Humidity, nectar and insect visits
to flowers, with special reference to Cra-
taegus, Tilia and Echium, Ecological Ento-
mology, 4 (1), 9-22.
Craig R. (1979). Parental manipulation, kin se-
lection, and the evolution of altruism,
Evolution, 33 (1), 319-334.
Craig R„ Crozier R. H. (1979). Relatedness in
the polygynous ant Myrmecia pilosula,
Evolution, 33 (1), 335-341.
Crowell K. L. (1968). Rates of competitive
exclusion by the Argentine ant in Bermu-
da, Ecology, 49 (3), 551-555.
Crozier R. H. (1968). Interpopulation karyotype
differences in Australian Irodomyrmex of
the “Detectus” group. (Hymenoptera:
Formicidae: Dolichoderinae), J. of the
Australian Entomological Society, 7, 25-27.
Crozier R. H. (1971). Heterozygosity and sex-
determination in haplodiploidy, American
Naturalist, 105, 399-412.
Crozier R. H. (1977). Genetic differentiation
between populations of the ant Aphaeno-
gaster “rudis” in the south eastern United
States, Genetica, 47 (1), 17-36.
Crozier R. H. (1979). Genetics of sociality. In:
Social Insects, vol. 1 (G. H. Hermann, ed.),
Academic Press, New York and London,
pp. 223-286.
Crozier R. H. (1980). Genetical structure of so-
cial insect populations. In: Evolution of
social behaviour: Hypotheses and Empiri-
cal Tests (H. Markl, ed.), Dahlem Konfe-
renzen 1980, Verlag Chemie GmbH, Wein-
heim, pp. 129-146.
Crozier R. H., Briickner D. (1981). Sperm
clumping and the population genetics of
Hymenoptera, American Naturalist, 117,
561-563.
Crozier R. H., Dix M. W. (1979). Analysis of
two genetic models for the innate compo-
nents of colony odor in social Hymenopte-
ra, Behavioral Ecology and Sociobiology,
4, 217-224.
Culver D. C., Beattie A. J. (1978). Myrmecocho-
ry in Viola: Dynamics of seed-ant inte-
ractions in some West Virginia species, J.
of Ecology, 66, 53-72.
Литература 363
Cumber R. A. (1949). The biology of bumble-
bees, with special reference to the pro-
duction of the worker caste, Transactions
of The Royal Entomological Society of
London, 24, 119-127.
Cunha M. A. S. da (1979). Ovarian development
in Scaptotrigona postica Latr. 1807 (Hym.
Apidae) II. A quantitative study, Insectes
Sociaux, 26 (3), 196-203.
Czechowski W. (WIT). Pdikaliczne kolonie
mrowek, Przeglqd Zoologiczny, 11 (4),
284-298.
Darchen R. (1954). Quelques regulations sociales
dans la construction chez les Abeilles,
Insectes Sociaux, 1 (3), 219-228.
Darchen R. (1958). Construction et re-
construction de la cellule de rayons
d’Apis mellifica, Insectes Sociaux, 5 (4),
357-372.
Darchen R. (1971). Trigona (Axestotrigona)
oyani Darchen (Apidae, Trigoninae), une
nouvelle espece d’abeille africaine.
Description du nid inclus dans une fourmi-
liere, Biologia Gabonica, 7 (4), 407-421.
Darchen R. (1972). Ethologie comparative de
I’economie des materiaux de construction
chez divers apides sociaux, Revue du
Comportement Animal, 6 (3), 201-206.
Darchen R. (1973). La thermoregulation et
1’ecologie de quelques especes d’abeilles so-
ciales d’Afrique (Apidae. Trigonini) et Apis
mellifica var, Adansonii), Apidologie, 4 (4),
341-370.
Darchen R. (1976). Ropalida cincta, guepe so-
ciale de la savane de Lamto (Cote-d’Ivoire)
(Hym. Vespidae), Annales de la Societe
Entomologique de France (NS), 12 (4),
579-601.
Darchen R. (1977). L’essaimage chez les hy-
potrigones au Gabon: dynamique de quel-
ques populations, Apidologie, 8 (1), 33-59.
Darchen R. (1980). La cire, son recyclage et
son role probable a I’interieur d’une colo-
nie d' Apis mellifica, Apidologie, 11 (3),
193-202.
Darchen R., Delage-Darchen B. (1974). Les sta-
des larvaires de Melipona beechii, Compte
Rendu de I’Academie des Sciences, Paris,
278, 3115-3118.
Darchen R., Delage-Darchen B. (1975). Contri-
bution a 1’etude d’une abeille du Mexique
Melipona beechii B. (Hymenoptere: Api-
dae), Apidologie, 6 (4), 295-339.
Davidson D. W. (1977). Foraging ecology and
community organization in desert seed-
eating ants, Ecology, 58, 725-737.
Dawkins R. (1976). The selfish gene, Oxford
University Press, Oxford, p. 224.
Dejean A. (1974). Etude du cycle biologique
et de la reproduction de Temnothorax
recedens (Nyl.) (Insects, Formicidae),
Doctoral thesis, University of Toulouse.
Dejean A., Passera L. (1974). Ponte des
ouvrieres et inhibition royale chez la
fourmi Temnothorax recedens (Nyl.)
(Formicidae, Myrmicinae), Insects Sociaux,
21 (4), 343-356.
Delage B. (1968). Recherches sur les fourmis
moissoneuses du Bassin Aquitain: etholo-
gie, physiologie de 1’alimentation, Annales
des Sciences Naturelles (Zoologie), Ser. 12,
10 (2), 197-265.
Delage-Darchen B. (1971). Contribution a 1’etu-
de ecologique d’une savane de Cote d’Ivoire
(Lamto): les fourmis des strates herbacees
et arborees, Biologia Gabonica, 7 (4),
461-496.
Delage-Darchen B. (1974). Ecologie et biologie
de Crematogaster impressa Emery, Fourmi
savanicole d’Afrique, Insectes Sociaux, 21
(1), 13-34.
Delage-Darchen B., Talec S., Darchen R. (1979).
Enzymatic studies on the salivary and
midgut glands of the stingless bee,
Apotrigona nebulata (Sm.), (Hymenoptera,
Apoidea, Meliponidae), Annales des
Sciences Naturelles, (Zoologie), Paris, Ser.
13, 1, 261-267.
Delye G. (1968). Recherches sur 1’ecologie, la
physiologie et 1’ethologie des Fourmis du
Sahara, Theses, Faculte des sciences, Uni-
versite d’Aix-Marseille.
Delye G. (1971). Observations sur le nid et
le comportement constructeur de Messor
arenarius (Hymenopteres: Formicidae), In-
sectes Sociaux, 18, 15-20.
Dew H. E., Michener C. D. (1978). Foraging
flights of two species of Polistes wasps
(Hymenoptera: Vespidae), J. of the Kansas
Entomological Society, 51 (3), 380-385.
Длусский Г. M. (1967). Муравьи рода Formi-
ca, изд-во «Наука», М., 236 стр.
Dobrzanska J. (1966). The control of the
territory by Lasius fuliginosus Latr., Acta
Biologiae Experimentalis, Warsaw, 26 (2),
193-213.
Dobrzanska J. (1978). Problem of behavioural
plasticity in slave-making Amazon-ant Po-
lyergus rufescens Latr. and in its slave-
ants Formica fusca L. and Formica cinerea
Mayr, Acta Neurobiologiae Experimentalis,
38 (2-3), 113-132.
Dobrzdnski J. (1971). Manipulatory learning in
ants, Acta Neurobiologiae Experimentalis,
31, 111-140.
Doncaster С. P. (1981). The spatial distribution
of ants on Ramsey Island, South Wales,
J. of Animal Ecology, 50 (1), 195-218.
364 .lumepamypu
Eastlake О., Chew A., Chew R. M. (1980). Bo-
dy size as a determinant of small-scale
distribution of ants in evergreen woodland,
south-eastern Arizona, Insectes Sociaux, 27
(3), 189-202.
Edwards J. P. (1982). Control of Monomorium
pharaonis (L.) with methoprene baits:
implications for the control of other pest
species. In: The Biology of Social Insects,
Proceedings of the Ninth Congress of the
International Union for the Study of Social
Insects, Boulder, Colorado (M. D. Breed,
C. D. Michener and H. E. Evans, eds.),
Westview Press, Boulder, Colorado,
pp. 119-123.
Edwards R. (1980). Social wasps, their biology
and control, Rentokil Ltd, East Grinstead,
398 pp.
Eickwort G. C., Ginsberg H. S. (1980). Foraging
and mating behaviour in Apoidea, Annual
Review of Entomology, 25, 421-426.
Elmes G. IV. (1971). An experimental study on
the distribution of heathland ants, J. of
Animal Ecology, 40, 495-499.
Elmes G. W. (1973). Observations on the densi-
ty of queens in natural colonies of
Myrmica rubra L. (Hymenoptera Formici-
dae), J. of Animal Ecology, 42, 761-771.
Elmes G. W. (1974). The spatial distribution of
a population of two ant species living in
limestone grassland, Pedobiologia, 14,
412-418.
Elmes G. W. (1975). PhD. Thesis, University of
London.
Elmes G. W. (1976). Some observations on the
microgyne form of Myrmica rubra L. (Hy-
menoptera, Formicidae), Insectes Sociaux,
23, 3-22.
Elmes G. W. (1978a). A morphometric compa-
rison of three closely related species of
Myrmica (Formicidae), including a new
species from England, Systematic Entomo-
logy, 3, 131-145.
Elmes G. W. (1978b). Populations of Myrmica
(Formicidae) living on different types of
Calluna moorland-a semi-natural habitat of
southern England, Memorabilia Zoologica,
29, 41-60.
Elmes G. W. (1980a). Queen numbers in colo-
nies of ants of the genus Myrmica, In-
sectes Sociaux, 27, 43-60.
Elmes G. W. (1980b). The comparative mor-
phology of Myrmica, Annual Report of the
Institute of Terrestrial Ecology, NERC,
Swindon, pp. 51-54.
Elmes G. W., Wardlaw J. C. (1981). The quan-
tity and quality of overwintered larvae in
five species of Myrmica (Hymenoptera:
Formicidae), J. of Zoology, London, 193,
429-446.
Elmes G. W., Wardlaw J. C. (1982a). A popula-
tion study of the ants Myrmica sabuleti
and Myrmica scabrinodis, living in two si-
tes in the south of England. I. A com-
parison of colony populations, J. of Ani-
mal Ecology, 51 (2), 651-664.
Elmes G. W., Wardlaw J. C. (1982b). A popula-
tion study of the ants Myrmica sabuleti
and Myrmica scabrinodis living at two sites
in the south of England. II. Effect of abo-
ve-nest vegetation, J. of Animal Ecology,
51 (2), 665-680.
Elmes G. W., Wardlaw J. C. (1982c). A compa-
rison of the effect of a queen upon the
development of large hibernated larvae of
four species of Myrmica (Hym. Formici-
dae), Insectes Sociaux (in press).
Elmes G. W., Wardlaw J. C. (1982d). A compa-
rison of the effect of temperature on the
development of large hibernated larvae of
four species of Myrmica (Hym. Formici-
dae), Insectes Sociaux (in press).
Elton E. T. G. (1958). The artificial establish-
ment of wood ant colonies for biological
control in the Netherlands. Proceedings,
10th International congress of entomology,
pp. 573-578.
Emmert W. (1968). Die Postembryonalentwick-
lung sekretorischner Kopfdriisen von For-
mica pratensis Retz. und Apis mellifica L.
(Ins., Hym.), Zeitschrift fur Morphologie
und Okologie der Tiere, 63, 1-62.
Engels W., Engels E. (1977). Vitellogenin, and
Fertilitat bei Stachellosen Bienen, Insectes
Sociaux, 24, 71-94.
Esch H. (1967). The sounds produced by swar-
ming honeybees, Zeitschrift fur verglei-
chende Physiologie, 56, 408-411.
Esch H., Esch I., Kerr W. E. (1965). Sound:
An element common to communication of
stingless bees and to dances of the ho-
ney bee, Science, 149, 320-321.
Ettershank G. (1968). The three dimensional
gallery structure of the nest of the meat
ant Iridomyrmex purpureus (Sm.) (Hyme-
noptera: Formicidae), Australian J. of
Zoology, 16, 715-723.
Ettershank G., Ettershank J. A., Whitford W. G.
(1980). Location of food sources by sub-
terranean termites, Environmental Entomo-
logy, 9 (5), 645-648.
Evans H. E., West-Eberhard M. J. (1973). The
Wasps. David and Charles, Newton Abbot,
265 pp.
.‘lumepcnnvpii
365
Evesham E. J. M. (1982). Regulation of the pro-
duction of female sexual morphs in the
ant Myrmica rubra L., Doctoral thesis,
University of Southampton.
Fell D. R., Ambrose J. T., Burgett D. M. et al.
(1977). The seasonal cycle of swarming in
honeybees, J. of Apicultural Research, 16
(4), 170-173.
Ferguson A. W., Free J. B. (1979). Production
of a forage-marking pheromone by the ho-
neybee, J. of Apicultural Research, 18 (2),
128-135.
Ferguson A. W., Free J. B. (1980). Queen phe-
romone transfer within honeybee colonies,
Physiological Entomology, 5, 359-366.
Ferguson A. W., Free J. B., Pickett J. A., Win-
der M. (1979) Techniques for studying ho-
neybee pheromones involved in clustering
and experiment on the effect of Nasonov
and queen pheromones, Physiological En-
tomology, 4, 339-344.
Fisher R. A. (1930). The genetical theory of na-
tural selection, Oxford University Press,
272 pp.
Flanders S. E. (1962). Physiological prerequisites
of social reproduction in the Hymenopte-
ra, Insectes Sociaux, 9, 375 388.
Flanders S. (1969). Social aspects of facultati-
ve gravidity and agravidity in social Hy-
menoptera. Proceedings, Vlth International
Congress of the International Union for
the Study of Social Insects, Bern, pp.
47-53.
Fletcher D. J. C. (1973). “Army Ant” behaviour
in the Ponerinae: a reassessment. Procee-
dings, Vllth International Congress of the
International Union for the Study of Social
Insects, London, pp. 116-121.
Fletcher D. J. C. (1975-1976). New perspectives
in the causes of absconding in the African
bee {Apis mellifera adansonii L.), South
African Bee J., I, II, 47 (6), 11-14; 48
(1), 6-9.
Fletcher D. J. C. (1978a). The influence of vi-
bratory dances by worker honeybees on
the activity of virgin queens. Vibration of
queen cells by worker honeybees and its
relation to the issue of swarms with virgin
queens, J. of Apicultural Research, 17 (1),
3-26.
Fletcher D. J. C. (1978b). The African bee, Apis
mellifera adansonii, in Africa, Annual Re-
view of Entomology, 23, 151-171.
Fletcher D. J. C., Blum M. S- (1981a). Phero-
monal control of deflation and oogenesis
in virgin queen fire ants, Science, 212,
73-75.
Fletcher D. J. C., Blum M. S. (1981b). A bioas-
say technique for an inhibitory primer
pheromone of the fire ant, Sole-
nopsis invicta Buren, J. of the Georgia En-
tomological Society, 16 (3), 352-356.
Fletcher D. J. C. Brand J. M. (1968). Source of
the trail pheromone and method of trail
laying in the ant Crematogaster peringueyi,
J. of Insect Physiology, 14 (6), 783-788.
Fletcher D. J. C., Blum M. S., Whitt T. V.,
Temple N. (1980). Monogyny and polygyny
in the Fire Ant, Solenopsis invicta, An-
nals of the Entomological Society of Ame-
rica, 73, 658-661.
Fluker S. S., Beardsley J. W. (1970). Sympatric
associations of three ants: Iridomyrmex
humilis, Pheidole megacephala and Anop-
lolepis longipes in Hawaii, Annals of the
Entomological Society of America, 63 (5),
1290-1296.
Fowler H. G„ Robinson S. W. (1979). Foraging
by Atta sexdens (Formicidae: Attini): sea-
sonal patterns, caste and efficiency, Ecolo-
gical Entomology, 4 (3), 239-247.
Free J. B. (1959). Tile transfer of food bet-
ween the adult members of a honeybee
community, Bee World, 40, 193-201.
Free J. B. (1965). The allocation of duties
among worker honey bees. Symposium of
the Zoological Society of London, 14,
19 59.
Free J. B. (1967). Factors determining the col-
lection of pollen by honeybee foragers,
Animal Behaviour, 15 (1), 134-144.
Free J. B. (1968). The conditions under which
foraging honeybees expose their Nasonov
gland, J. of Apicultural Research, 7 (3),
139-145.
Free J. B. (1970). Insect Pollination of crops,
Academic Press, London and New York,
544 pp.
Free J. B. (1971). Effect of flower shapes and
nectar guides on the behaviour of foraging
honeybees, Behaviour, 24, 269-285.
Free J. B. (1977). The seasonal regulation of
drone brood and drone adults in a honey-
bee colony. Proceedings, VUIth Congress
of the International Union for the Study
of Social Insects, Wageningen, pp.
207-210.
Free J. B., Spencer-Booth Y. (1959). The longe-
vity of worker honeybees (Apis mellifera).
Proceedings of the Royal Entomological
Society of London (A), 34, 141-150.
Free J. B., Williams I. (1971). The effect of
giving pollen and pollen supplement to ho-
neybee colonies on the amount of pollen
collected, J. of Apicultural Research, 10
(2), 87-90.
Free J. G., Williams I. H. (1972). The transport
of pollen on the body hairs of honeybees
366 Литература
(Apis mellifera L.) and bumblebees (Bom-
bus spp. L.), J. of Applied Ecology, 9,
609-615.
Free J. B., Williams I. H. (1973). Genetic deter-
mination of honeybee (Apis mellifera L.)
foraging preferences, Annals of Applied
Biology, 73, 137-141.
Free J. B., Williams I. H. (1975). Factors deter-
mining the rearing and rejection of drones
by the honey-bee colony, Animal Beha-
viour, 23, 650-675.
Free J. B., Williams I. H. (1979). Communica-
tion by pheromones and other means in
Apis florea colonies, J. of Apicultural Re-
search, 18 (1), 16—25.
Freeland J. (1958). Biological and social pat-
terns in the Australian bulldog ants of the
genus Myrmecia, Australian J. of Zoology,
6, 1-18.
Fresneau D. (1979). Etude du role sensoriel de
1’antenne dans fethogenese des soins aux
cocons chez Formica polyctena Forst (Hym:
Form.), Insectes Sociaux, 26 (3), 170-195.
Friesen L. J. (1973). The search dynamics of
recruited honeybees, Biological Bulletin,
144, 107-131.
Frith G. (1979). Digging and related behaviour
in Myrmica ruginodis, Ph. D. Thesis,
University of Hull.
Frogner K. J. (1980). Variable developmental
period: intraspecific competition models
with conditional age-specific maturity and
mortality schedules, Ecology, 61 (5),
1099-1106.
Fukuda H., Sakagami S. F. (1968). Worker
brood survival in honeybees, Researches on
Population Ecology, 10, 31-39.
Galle L., Jr. (1980). Dispersion of high density
ant populations in sandy soil grassland
ecosystems, Acta Biological Szeged, 26
(1-4), 129-135.
Gamboa G. J. (1975). Foraging and leaf-cutting
of the desert gardening ant Acromyrmex
versicolor versicolor (Pergande) (Hymenop-
tera: Formicidae), Oecologia, 20, 103-110.
Gamboa G. J. (1976). Effects of temperature on
the surface activity of the desert leaf-cut-
ter ant, Acromyrmex versicolor versicolor
(Pergande) (Hymenoptera: Formicidae), The
American Midland Naturalist, 95 (2),
485-491.
Gamboa G. J. (1978). Intraspecific defense: ad-
vantage of social cooperation among paper
wasp foundresses, Science, 199, 1463-1465.
Gamboa G. J. (1980). Comparative timing of
brood development between multiple- and
single-foundress colonies of the paper
wasps, Polistes metricus, Ecological Ento-
mology, 5 (3), 221-225.
Gamboa G. J., Bradley D. H., Wiltjer S. L.
(1978). Division of labor and subordinate
longevity in foundress associations of the
paper wasp, Polistes metricus (Hymenopte-
ra: Vespidae), J. of the Kansas Ento-
mological society, 51 (3), 343-352.
Garofalo C. A. (1978). Bionomics of Bombus
(Fervidobombus) morio. 2. Body size, length
of life of workers, J of Apicultural Rese-
arch, 17 (3), 130-136.
Gibo D. L. (1974). A laboratory study on the
selective advantage of foundress associati-
ons in Polistes fuscatus (Hymenoptera: Ves-
pidae), Canadian Entomologist, 106,
101-106.
Glancey В. M„ Stringer С. E., Jr., Craig С. H.,
Bishop P. M., Martin В. B. (1973). Eviden-
ce of a replete caste in the fire ant So-
lenopsis invicta, Annals of the Entomologi-
cal Society of America, 66, 233-234.
Glancey В. M., Stringer С. E., Craig С. H., Bi-
shop P. M. (1975). An extraordinary case
of polygyny in the red imported fire ants,
Annals of the Entomological Society of
America, 68, 922.
Glancey В. M., St. Romain M. K., Gra-
zier R. H. (1976). Chromosome numbers of
the red and black imported fire ants, So-
lenopsis invicta and S. rechteri, Annals of
the Entomological Society of America, 69
(3), 469-470.
Glover P. E., Trump E. C., Waterridge L. E. D.
(1964). Termitaria and vegetation patterns
on the Loita plains of Kenya, J. of Eco-
logy, 52, 367-377.
Glunn F. J., Howard D. F., Tschinkel W. R.
(1981). Food preference in colonies of the
ant Solenopsis invicta, Insectes Sociaux, 28
(2), 217-222.
Goetsch W., Eisner H. (1930). Beitrage zur Bio-
logie Kornersammelnder Ameisen, II. Teil,
Zeitschrift fur Morphologie und Okologie
der Tiere, 16 (3-4), 371-452.
Gontarski H. (1949). Mikrochemische Futtersaf-
tuntersuchungen und die Frage der Koni-
ginentstehung, Hessische Biene, 85, 89-92.
Gorton R. E. (1978). Observations on the nes-
ting behaviour of Mischocyttarus immargi-
natus (Rich.) (Vespidae: Hymenoptera) in
a dry forest in Costa Rica, Insectes So-
ciaux, 25 (3), 197-204.
Gosswald K., Bier K. (1953). Untersuchungen
zur Kastendetermination in der Gattung
Formica. 2. Die Aufzucht von Geschlechts-
tieren bei Formica rufa pratensis (Retz.),
Zoologische Anzeiger, 151, 126-134.
Gould J. L. (1976). The dance-language contro-
versy, The Quarterly Review of Biology,
51 (2), 211-244.
Литература Ъ(Л
Grasse Р. Р. (1944). Recherches sur la biologie
des termites champignonnistes (Macrotermi-
tinae), Annales des Science Naturelles
(Zoologie), 6, 97-171.
Grasse P. P. (1945). Recherches sur la biologie
des termites champignonnistes (Macrotermi-
tinae), Annales des Sciences Naturelies.
(Zoologie), Ser. 11, 7, 115-146.
Grasse P. P. (1949). Order des Isopteres ou
termites. In: Traite de zoologie
(P. P. Grasse, ed.), vol. IX, Masson et Cie,
Paris, pp. 408-544.
Grasse P. P. (ed.) (1951). Traite de Zoologie,
Tome X, Masson et Cie, Paris.
Grasse P. P., Noirot C. (1955). La fondation de
nouvelles societes par Bellicositermes nata-
lensis Hav., Insectes Sociaux, 2 (3),
213-220.
Grasse P. P., Noirot C. (1961). Nouvelles re-
cherches sur la systematique et I’ethologie
des termites champignonnistes du genre
Bellicositermes. Emerson, Insectes Sociaux,
8, 311-359.
Gray B. (1973). A morphometric study of wor-
ker variation in three Myrmecia species
(Hymenoptera: Formicidae), Insectes Soci-
aux, 20, 323-331.
Greenberg L. (1979). Genetic component of bee
odor in kin recognition, Science, 206,
1095-1097.
Greenslade P. J. M. (1971). Interspecific compe-
tition and frequency changes among ants
in Solomon Islands coconut plantations,
J. of Applied Ecology, 8, 323-349.
Greenslade P. J. M. (1975). Dispersion and his-
tory of a population of the meat ant.
Iridomyrmex purpureus (Hymenoptera: For-
micidae), Australian J. of Zoology, 23,
495-510.
Greenslade P. J. M. (1979). A guide to the ants
of South Australia. Special Educational
Bulletin series, South Australian Museum,
Adelaide.
Grogan D. E., Hunt J. H. (1977). Digestive pro-
teases of two species of wasps of the ge-
nus Vespula, Insect Biochemistry, 7,
191-196.
Haas A. (1949). Arttypische Flugbahnen von
Hummelmannchen, Zeitschrift fur verglei-
chende Physiologie, 31, 281-307.
Haines I. H., Haines J. B. (1978). Colony struc-
ture, seasonality and food requirements of
the crazy ant, Anoplolepis longipes (Jerd.),
in the Seychelles, Ecological Entomology,
3 (2), 109-118.
Halberstadt K. (1980). Electrophoretische Unter-
suchungen zur Sekretionstatigkeit der Hy-
popharynxdriise der Honigbiene (Apis mel-
lifera L.), Insectes Sociaux, 27 (1), 61-78.
Hamilton W. D. (1964). The genetical evolution
of social behaviour. Parts I and II, J. of
Theoretical Biology, 7 (1), 1-52.
Handel S. N. (1976). Dispersal ecology of Carex
pedunculata (Cyperaceae), a new North
American myrmecochore, American J. of
Botany, 63 ( 8), 1071-1079.
Handel S. N. (1978). The competitive relation-
ship of three woodland sedges and its bea-
ring on the evolution of ant-dispersal of
Carex pedunculata, Evolution, 32, 151-163.
Handel S. N., Fisch S. B., Schatz G. E. (1981).
Ants disperse a majority of herbs in a
mesic forest community in New York Sta-
te, Bulletin of the Torrey Botanical Club,
108 (4), 430-437.
Hangartner W., Reichson J. M., Wilson E. O.
(1970). Orientation to nest material by the
ant Pogonomyrmex badius (Latreille), Ani-
mal Behaviour, 18, 331-334.
Hansell M. H. (1982). Brood development in
the subsocial wasp Parischnogaster mellyi
(Saussure) (Stenogastrinae, Hymenoptera),
Insectes Sociaux, 29 (1), 3-14.
Harbo J. R. (1979). The rate of depletion of
spermatozoa in the queen honeybee sper-
matheca, J. of Apicultural Research, 18 (3),
204-207.
Harper J. L. (1977). Population biology of
plants, Academic Press, London, 892 pp.
Harris W. V. (1955). Termites and the soil. In:
Soil Zoology (D. K. Me E. Kevan, ed.),
Butterworths, London, pp. 62-72.
Harris W. V. (1961). Termites, their recognition
and control, Longmans, Green and Co.,
London, p. 187.
Harrison J. S., Gentry J. B. (1981). Foraging
pattern, colony distribution and foraging
range of the Florida harvest ant, Pogo-
nomyrmex badius, Ecology, 62 (6), 1467-1473.
Haskins С. P., Haskins E. F. (1950). Notes on
the biology and social behaviour of the
archaic ponerine ants of the genera Myr-
mecia and Promyrmecia, Annals of the En-
tomological Society of America, 43 (4),
461-491.
Haskins С. P., Haskins E. F. (1964). Notes on
the biology and social behaviour of Myr-
mecia inquilina. The only known myrme-
ciine social parasite, Insectes Sociaux, 11 (3),
267-282.
Haskins С. P., Haskins E. F. (1965). Pheidole
megacephala and Iridomyrmex humilis in
Bermuda-equilibrium or slow replacement?
Ecology, 46 (5), 736-740.
Haskins С. P., Haskins E. F. (1980). Notes on
female worker survivorship in the archaic
ant genus Myrmecia, Insectes Sociaux, 27
(4), 345-350.
368 Литература
Hassell М. Р., Southwood Т. R. Е. (1978). Fora-
ging strategies of insects, Annual Review
of Ecology and Systematics, 9, 75-95.
Havarty M. I. (1979). Soldier production and
maintenance of soldier proportions in labo-
ratory experimental groups of Coptotermes
formosanus Shiraki, Insectes Sociaux, 26
(1), 69-84.
Havarty M. I., Nutting W. L. (1975). A simu-
lation of wood consumption by the sub-
terranean Termite Heterotermes aureus
(Snyder), in an Arizona desert grassland,
Insectes Sociaux, 22 (1), 93-102.
Havarty M. L., Nutting IV. L., LaFage J. P.
(1975). Density of colonies and spatial
distribution of foraging territories of the
desert subterranean termite, Heterotermes
aureus (Snyder), Environmental Entomolo-
gy, 4, 105- 109.
Heinrich B. (1974). Thermoregulation in bum-
blebees, I. Brood incubation by Bombus vo-
snesenskii queens, J. of Comparative Phy-
siology, 88, 129-140.
Heinrich B. (1979). Bumblebee Economics, Har-
vard University Press, Cambridge, Massa-
chusetts and London, England, 245 pp.
Heinrich B., Raven P. H. (1972). Energetics and
Pollination Ecology, Science, 176, 597-602.
Heinrich B., Mudge P. R., Deringis P. G.
(1977). Laboratory analysis of flower con-
stancy in foraging bumblebees: Bombus ter-
narius and B. terricola, Behavioral Ecology
and Sociobiology, 2, 247-265.
Hemmingsen A. M. (1973). Nocturnal weaving
on nest surface and division of labour in
weaver ants (Oecophylla smaragdina Fabri-
cius, 1775) (Hym. Formicidae), Videnskabe-
lige Meddelelser fra Dansk naturhistorik
Forening: Kj^benhavn, 136, 49-56.
Hepworth D., Pickard R. S., Overshott K. J.
(1980). Effects of the periodically intermit-
tent application of a constant magnetic
field on the mobility in darkness of wor-
ker honeybees, J. of Apicultural Research,
19, 179-186.
Herbers J. (1978). Trends in sex ratios of the
reproductive broods of Formica obscuripes.
(Hymenoptera: Formicidae), Annals of the
Entomological Society of America, 71,
791-793.
Herbers J. M. (1979). The evolution of sex-ratio
strategies in hymenopteran societies, The
American Naturalist, 114 (6), 818-834.
Herbert E. IV., Svoboda J. A., Thompson M. J.,
Shimanuki H. (1980). Sterol utilization in
honeybees fed on synthetic diet: effects on
brood rearing, J. of Insect Physiology, 26,
287-289.
Hermann H. R. (1971). Sting autotomy, a defen-
sive mechanism in certain social Hyme-
noptera, Insectes Sociaux, 18 (2), 111-120.
Hermann H. (ed.) (1979-1982). Social Insects,
vol. I, 437 pp., vol. II, 491 pp., vol. Ill,
459 pp., Academic Press, New York.
Hermann H. R., Blum M. S. (1967). The mor-
phology and histology of the hymenopterous
poison apparatus III. Eciton hamatum
(Formicidae), Annals of the Entomological
Society of America, 60 (6), 1282-1291.
Hermann H. R., Dirks T. F. (1975). Biology of
Polistes annularis, I. Spring behaviour, Psy-
che, 82, 97-108.
Hermann F. J., Leese В. M. (1956). A grass
(Munroa squarrosa) apparently cultivated by
ants, The American Midland Naturalist,
56 (2), 506-507.
Hewitt P. H„ Nel J. J. C„ Conradie S. (1969a).
The role of chemicals in communication
in the harvester termites Hodotermes mos-
sambicus (Hagen) and Trinervitermes triner-
voides (Sjostedt), Insectes Sociaux, 16,
79 86.
Hewitt P. H., Nel J. J. C., Conradie S. (1969b).
Preliminary studies on the control of cas-
te formation in the harvester termite Ho-
dotermes mossambicus (Hagen), Insectes So-
ciaux, 16, 159-172.
Higashi S. (1976). Nest proliferation by budding
and nest growth in Formica (Formica)
yessensis in Ishikari Shore, J. of the Fa-
culty of Science,-Hokkaido University, Se-
ries VI, Zoology, 20 (3), 359-389.
Higashi S. (1978). Analysis of internest drifting
in a supercolonial ant Formica (Formica)
yessensis by individually marked workers,
Kontyu, 46 (2), 176-191.
Higashi S. (1979). Polygyny, nest budding and
internest mixture of individuals in Formica
(Serviformica) japonica Motschulsky at
Ishikari Shore, Kontyu, 47 (3), 381-389.
Higashi S., Yamauchi K. (1979). Influence of a
supercolonial ant Formica (Formica) yessen-
sis Forel on the distribution of other ants
in Ishikari coast, Japanese J. of Ecology,
29, 257-264.
Hodges С. M. (1981). Optimal foraging in bum-
blebees: hunting by expectation, Animal
Behaviour, 29 (4), 1166-1171.
Holdaway F. G., Gay F. J. (1948). Temperature
studies of the habitat of Eutermes exitiosus
with special reference to the temperatures
within the mound, Australian J. of Scien-
tific Research, В, 1, 464-493.
Holldobler B. (1962). Zur Frage der Oligogynie
bei Camponotus ligniperda (Latr.) und
Camponotus herculeanus (L.) (Hym. Formi-
cidae), Sonderdruck aus Zoologischer an-
gewandte Entomologie, 49, 337-352.
. lumepamypa 369
Holldobler В. (1971). Communication between
ants and their guests, Scientific American,
224 (3), 86-93.
Holldobler B. (1973). Chemische Strategic beim
Nahrungserwerb der Diebsameise (Solenop-
sis fugax Latr.) und der pharaoameise
(Monomorium pharaonis L.), Oecologia, 11,
371-380.
Holldobler B. (1976a). Recruitment behaviour,
home range orientation and territoriality in
harvester ants, Pogonomyrmex, Behavioral
Ecology and Sociobiology, 1, 3-44.
Holldobler B. (1967b). The behavioral ecology
of mating in harvester ants (Hymenoptera:
Formicidae) (Pogonomyrmex), Behavioral
Ecology and Sociobiology, 1, 405-423.
Holldobler B. (1977). Communication in social
Hymenoptera. In: How animals communi-
cate (T. A. Sebeok, ed.), Indiana Universi-
ty Press, Bloomington, pp. 418-471.
Holldobler B. (1979). Territories of the African
Weaver ant (Oecophylla longinoda): a field
study, Zeitschrift fur Tierpsychologie, 51,
201-213.
Holldobler B. (1980). Canopy orientation: A
new kind of orientation in ants, Science,
210, 86-88.
Holldobler B„ Engel H. (1978). Tergal and ster-
nal glands in ants, Psyche, 85 (4),
285-330.
Holldobler B., Haskins С. P. (1977). Sexual cal-
ling behaviour in primitive ants, Science,
195, 793-794.
Holldobler B., Michener C. D. (1980). Mecha-
nisms of identification and discrimination
in social Hymenoptera. In: Evolution of
social behavior: Hypotheses and Empirical
Tests (H. Mark!, ed.), Dahlem Konferen-
zen 1980, Verlag Chemie GmBH, Wein-
heim, pp. 35-38.
Holldobler B., Moglich M. (1980). The foraging
system of Pheidole militicida (Hymenoptera:
Formicidae), Insectes Sociaux, 27 (3),
237-264.
Holldobler B., Traniello J. (1980a). Tandem run-
ning pheromone in ants, Naturwissenschaf-
ten, 67, 360.
Holldobler B., Traniello J. F. A. (1980b). The
pygidial gland and chemical recruitment
communication in Pachycondyla ( = Termi-
topone) laevigata, J. of Chemical Ecology,
6 (5), 883-893.
Holldobler B., Wilson E. O. (1977a). Weaver
ants, Scientific American, 237, 146-154.
Holldobler B., Wilson E. O. (1977b). The num-
ber of queens: an important train in ant
evolution, Naturwissenschaften, 64, 8-15.
Holldobler B., Wilson E. O. (1978). The multip-
le recruitment systems of the African wea-
ver ant Oecophylla longinoda, Behavioral
Ecology and Sociobiology, 3, 19-60.
Holldobler B., Wiist M. (1973). Ein Sexualphe-
romon bei der Pharaoameise Monomorium
pharaonis (L.), Zeitschrift fur Tierpsycholo-
gie, 32, 1-9.
Holldobler B., Moglich M., Waschwitz U.
(1974). Communication by tandem running
in the ant Camponotus sericeus, J. of Com-
parative Physiology, 90, 105-127.
Holldobler B., Stanton R. C., Markl H. (1978).
Recruitment and food-retrieving behaviour
in Novomessor (Formicidae, Hymenoptera).
I. Chemical signals, Behavioral Ecology
and Sociobiology, 4, 163-181.
Honk C. G. J., Velthuis H. H. W., Roseler P. F.,
Malotaux M. E. (1980). The mandibular
glands of Bombus terrestris queens as a
source of queen pheromones, Entomologia
Experimentalis et Applicata, 28, 191-198.
Howard D. F, Tschinkel W. R. (1980). The ef-
fect of colony size and starvation on food
flow and the fire ant, Solenopsis invicta
(Hymenoptera: Formicidae), Behavioral
Ecology and Sociobiology, 7, 293-300.
Howse P. E. (1968). On the division of labour
in the primitive termite Zootermopsis neva-
densis (Hagen), Insectes Sociaux, 15, 45-56.
Howse P. E. (1970). Termites, a study in So-
cial Behaviour, Hutchinson, London.
Hubbard M. D. (1974). Influence of nest mate-
rial and colony odour on digging in the
ant Solenopsis invicta (Hymenoptera,
Formicidae), J. of the Georgia Entomological
Society, 9, 127-132.
Hubbard M. D., Cunningham W. G. (1977).
Orientation of mounds in the ant Sole-
nopsis invicta (Hymenoptera, Formicidae,
Myrmicinae), Insectes Sociaux, 24 (1), 3-7.
Hubbell S. P., Johnson L. K. (1978). Comparati-
ve foraging behavior of six stingless bee
species exploiting a standardized recource,
Ecology, 59 (6), 1123-1136.
Hughes I. G. (1975). Changing altitude and ha-
bitat preferences of two species of wood-
ant (Formica rufa and F. lugubris) in
North Wales and Salop, Transactions of
the Royal Entomological Society of Lon-
don, 127 (3), 227-239.
Hung A. С. F, Vinson S. B. (1977). Interspecific
hybridization and caste specificity of pro-
tein in Fire Ant, Science, 196, 1458-1460.
Hussain A., Forrest J. M. S., Dixon A. F. G.
(1974). Sugar, organic acid, phenolic acid
and plant growth regulator content of ex-
tracts of honeydew of the aphid Myzus
persicae (Hom. Aphididae) and of its host
plant Raphanus sativus, Annals of Applied
Biology, 78 (1), 65-73.
370 . luiwpumvpa
Huwyler S., Grob K., Viscontini M. (1975). The
trail pheromone of the ant Lasius fuligi-
nosus: Identification of six components,
J. of Insect Physiology, 21, 299-304.
Imai H. T., Crozier R. H., Taylor R. IV. (1977).
Karyotype evolution in Australian ants,
Chromosoma, 59, 341-393.
Imperatriz-Fonseca V. L. (1977). Queen superse-
dure in Paratrigona subnuda, Proceedings,
VUIth International Congress of the Inter-
national Union for the Study of Social
Insects, Wageningen, p. 78.
Inouye D. IV. (1978). Resource partitioning in
bumblebees: experimental studies of fora-
ging behavior, Ecology, 59 (4), 672-677.
Inouye D. IV., Taylor O. R. (1979). A temperate
region plant-ant-seed predator system:
consequences of extra-floral nectar secretion
by Helianthella quinqueneruis, Ecology, 60
(1), 1-7.
Иноземцев A. A. (1974). Динамика трофичес-
ких связей рыжих лесных муравьев и их
роль в регуляции численности вредных
беспозвоночных в дубравах Тульской об-
ласти, Экология, 3, 63-71.
Ishay J. (1972). Thermoregulatory pheromones
in wasps, Experientia, 28, 1185-1187.
Ishay J. (1975). Caste determination by social
wasps: cell size and building behaviour,
Animal Behaviour, 23, 425-431.
Ishay J. (1976). Comb building by the oriental
hornet (Vespa orientalis), Animal Beha-
viour, 24, 72-83.
Ishay J., Ikon R. (1968). Food exchange bet-
ween adults and larvae in Vespa orienta-
lis F., Animal Behaviour, 16, 298-303.
Ishay J., Schwartz A. (1973). Acoustical com-
munication between the members of the
oriental hornet (Vespa orientalis) colony,
J. of the Acoustical Society of America,
63, 640-649.
Jackson D. A. (1982). The structure and organi-
sation of a tropical ant community: stu-
dies on a Camerounian Cocoa Plantation,
Ph. D. Thesis, University of Oxford.
Jaffe K., Howse P. E. (1979). The mass recruit-
ment system of the leaf cutting ant, Atta
cephalotes L., Animal Behaviour, 27 (2),
930-939.
Jaffe K„ Bazire-Benazet M., Howse P. E.
1979). An integumentary pheromone-secre-
ting gland in Atta sp: territorial marking
with a colony-specific pheromone in Atta
cephalotes, J. of Insect Physiology, 25,
833-839.
Jaisson P. (1975). L’impregnation dans 1’ontoge-
nese comportements de soins aux cocons
chez la jeune Fourmi rousse (Formica po-
lyctena Forst.), Behaviour, 52, 1-37.
Jaisson P., Fresneau D. (1978). The sensitivity
and responsiveness of ants to their cocoons
in relation to age and methods of mea-
surement, Animal Behaviour, 26, 1064-1071.
Jander R. (1976). Grooming and pollen mani-
pulation in bees (Apoidea): the
nature and evolution of movements invol-
ving the foreleg, Physiological Entomology,
1, 179-194.
Janzen D. H. (1966). Coevolution of mutualism
between ants and acacias in Central Ame-
rica, Evolution, 20 (3), 249-275.
Janzen D. H. (1969). Allelopathy by myrmeco-
phytes: the ant Azteca as an allelopathic
agent of Cecropia, Ecology, 50 (1),
147-153.
Janzen D. H. (1972). Protection of Barteria
(Passifloraceae) by Pachysima ants
(Pseudomyrmecinae) in a Nigerian rain fo-
rest, Ecology, 53 (5), 885-892.
Janzen D. H. (1973). Evolution of polygnous
obligate acacia in western Mexico, J. of
Animal Ecology, 42, 727-750.
Jeanne R. L. (1972). Social biology of the ne-
otropical wasp Mischocyttarus drewseni,
Bulletin of the Museum of Comparative
Zoology at Harvard College, 144 (3),
63-150.
Jeanne R. L. (1975). The adaptiveness of social
wasp nest architecture, Quarterly Review
of Biology, 50, 267-287.
Jeanne R. L. (1979a). A latitudinal gradient in
rates of ant predation, Ecology, 60 (6),
1211-1224.
Jeanne R. L. (1979b). Construction and utiliza-
tion of multiple combs in Polistes canaden-
sis in relation to the biology of a preda-
ceous moth, Behavioral Ecology and So-
ciobiology, 4, 293-310.
Jeanne R. L. (1980). Evolution of social beha-
viour in the Vespidae, Annual Review of
Entomology, 25, 371-396.
Jeanne R. L. (1981). Chemical communication
during swarm emigration in the social wasp,
Polybia sericea (Olivier), Animal Behavi-
our, 29, 102-113.
Johansson T. S. K., Johansson M. P. (1977).
Feeding honey-bees pollen and pollen subs-
titutes, Bee World, 58 (3), 105-118.
Johnson L. K., Hubbell S. P. (1974). Aggression
and competition among stingless bees:
field studies, Ecology, 55, 120-127.
Johnson L. K., Hubbell S. P. (1975). Contrasting
foraging strategies and coexistence of two
bee species on a single resource, Ecology,
56, 1398-1406.
Johnson R. A. (1981). Colony development and
establishment of fungus comb in Micro-
termes sp. nr. usambaricus (Sjostedt) (Iso-
. lunupamypa
371
ptera: Macrotermitinae) from Nigeria, In-
sects Sociaux, 28 (1), 3—12.
Johnson R. A., Wood T. G. (1979). Termites of
the arid zones of Africa and the Arabian
peninsula, Sociobiology, 5 (3), 279-293.
Jones R. J. (1979). Expansion of the nest of
Nasutitermes costalis, Insectes Sociaux, 26
(4), 322-342.
Jones R. J. (1980). Gallery construction by Na-
sutitermes costalis: Polyethism and the be-
haviour of individuals, Insectes Sociaux, 27
(1), 5-24.
Josens G. (1971a). Le renouvellement des meu-
les a champignons construites par quatre
Macrotermitinae (Isopteres) des savanes de
Lamto-Pacobo (Cote d’Ivoire), Compte
Rendu Hebdomadaire des Seances de
Г Academic des Sciences, Paris, Ser. D,
272, 3329-3332.
Josens G. (1971b). Variations thermiques dans
les nids de Trinervitermes geminatus Was-
mann, en relation avec le milieu exte-
rieur dans la savane de Lamto (Cote
d’Ivoire), Insectes Sociaux, 18 (1), 1-14.
Josens G. (1972). Etudes biologiques et ecolo-
giques des termites (Isoptera) de la savane
de Lamto-Pakobo (Cote d’Ivoire), Docto-
ral thesis, University of Brussels.
Jutsum A. R. (1979). Interspecific aggression in
leaf-cutting ants, Animal Behaviour, 27,
833-838.
Jutsum A. R., Fisher M. (1979). Reserves in se-
xual forms of Acromyrmex octospinosus
(Reich) (Formicidae, Attini), Insectes So-
ciaux, 26 (2), 111-120.
Jutsum A. R., Saunders T. S., Cherret J. M.
(1979). Intraspecific aggression in the leaf-
cutting ant Acromyrmex octospinosus, Ani-
mal Behaviour, 27 (3), 839-844.
Kalmus H., Ribbands C. R. (1952). The origin
of the odours by which honeybees distin-
guish their companions, Proceedings of the
Royal Society, (B), 140, 50-59.
Kalshoven L. G. E. (1959). Observations on the
nests of initial colonies of Neotermes te-
ctonae (Damm.) in teak trees, Insectes So-
ciaux, 6, 231-242.
Kefuss J. A. (1978). Influence of photoperiod on
the behaviour and brood rearing activities
of the honeybee, J. of Apicultural Re-
search, 17 (3), 137-151.
Kerr W. E., Hebling N. J. (1964). Influence of
the weight of worker bees on the division
of labor, Evolution, 18, 267-270.
Kerr W. E., Sakagami S. F., Zucchi R., Portu-
gal-Araujo V., de Camargo J. M. F. (1967).
Observances sobre a arquitetura dos nin-
hos e comportamento de algumas especies
de abelhas sem ferrao das vizinhancjas de
Manaus, Amazonas (Hymenoptera, Apoi-
dea), Atlas do Simposio sobre a Biota
Amazonica, Conselho Nacional de Pesqui-
sas, Rio de Janeiro, 5 (Zool.), 255-309.
King T. J. (1977). The plant ecology of ant
hills in calcareous grasslands, J. of Ecolo-
gy, 65, 235-315.
Klahn J. E. (1979). Philopatric and nonphilopat-
ric foundress associations in the social
wasp Polistes fuscatus, Behavioral Ecology
and Sociobiology, 5, 412-424.
Kleinfeldt S. E. (1978). Ant-gardens: the inte-
raction of Codonanthe crassifolia (Gesneria-
ceae) and Crematogastor longispina (For-
micidae), Ecology, 59 (3), 449-456.
Klimetzek D. (1981). Population studies on hill
building wood-ants of the Formica rufa
group, Oecologia, 48, 418-421.
Knerer G. (1977). Caste and male production
in halictine bees. Proceedings, VUIth Cong-
ress of the International Union for the
Study of Social Insects, Wageningen, pp.
132-133.
Knuth P. (1906-1909). Handbook of flower pol-
lination (Translator J. R. Ainsworth Davis)
vol. I, 1906; vol. II, 1908; vol. Ill, 1909,
Oxford University Press, Oxford.
Koeniger N. (1975). Observations on alarm be-
haviour and colony defence of Apis dor-
sata. Proceedings, International Union for
the Study of Social Insects, Dijon, pp.
153-172.
Koeniger N., Fuchs S. (1973). Sound production
as colony defense in Apis сегапа Fabr.
Proc. Vllth Internal. Congress of the
International Union for the Study of
Social Insects, London, pp. 199—
204.
Koeniger N., Verwohl G. (1979). Competition
for food among four sympatric species of
Apini in Sri Lanka (Apis dorsata, Apis
сегапа, Apis florea, Trigona iridipennis),
J. of Apicultural Research, 18 (2), 95-109.
Koeniger N., Wijayagunasekera H. N. P. (1976).
Time of drone flight in the three Asia-
tic honeybee species (Apis сегапа, Apis
florea, Apis dorsata), J. of Apicultural Re-
search, 15 (2), 67-71.
Kohler F. (1955). Wache und Volksduft im Bie-
nenstaat, Zeitschrift fur Bienenforschung,
3, 57-63.
Kondoh M. (1968). Bioeconomic studies on the
colony of an ant species, Formica japoni-
ca Motschulsky. I. Nest structure and sea-
sonal change of the colony members,
Japanese J. of Ecology, 18, 124-133.
Korst P.J.A.M., Velthuis H. H. W. (1982).
The nature of trophallaxis in honey bees,
Insectes Sociaux, 29 (2), 209-221.
372 . lumepamypa
Krishna К., Weesner F. M. (eds.) (1969-1970).
Biology of the termites, vols I and II,
Academic Press, New York and London.
Kugler C. (1979a). Evolution of the sting appa-
ratus in the Myrmicine ants, Evolution,
33 (1), 117-130.
Kugler C. (1979b). Alarm and defense: a func-
tion for the pygidial gland of the myrmi-
cine ant, Pheidole biconstricta, Annals of
the Entomological Society of America, 72,
532-536.
Kugler J., Orion T., Ishay J. (1976). The num-
ber of ovarioles in the Vespinae, Insectes
Sociaux, 23, 525-533.
Kugler J., Motro M., Ishay J. S. (1979). Comb
building abilities of Vespa orientalis L.
queenless workers, Insectes Sociaux, 26 (2),
143-149.
Kukuk P. F., Breed M. D., Sobti A., Bell W. S.
(WIT). The contributions of kinship and
conditioning to nest recognition and colony
member recognition in a primitively euso-
cial bee, Lasioglossum zephyrum (Hyme-
noptera: Halictidae), Behavioral Ecology
and Sociobiology, 2, 319-327.
Kutter H. (1977). Hymenoptera, Formicidae, In-
sectes Helvetica, 6, 1-298.
La Fage J. P., Nutting W. L. (1978). Nutrient
dynamics of termites. In: Production eco-
logy of ants and termites (M. V. Brian,
ed.), Cambridge University Press, pp.
165-232.
Laine K. J., Niemela P. (1980). The influence
of ants on the survival of mountain bir-
ches during an Oporinia autumnata (Lep.,
Geometridae) outbreak, Oecologia, 47,
39-42.
Landolt P. J., Akre R. D. (1979). Occurrence
and location of exocrine glands in some
social Vespidae (Hymenoptera), Annals of
the Entomological Society of America, 72,
141-148.
Landolt P. J., Akre R. D., Green A. (1977). Ef-
fects of colony division on Vespula atro-
pilosa (Sladen) (Hymenoptera: Vespidae),
J. of the Kansas Entomological Society, 50,
135-147.
Lavigne R. J. (1969). Bionomics and nest struc-
ture of Pogonomyrmex occidentalis, Annals
of The Entomological Society of America,
62, 1166-1175.
Ledoux A. (1950). Recherche sur la biologie de
la Fourmi fileuse (Oecophylla longinoda
Latr.), Annales des Sciences Naturelies:
Zoologie et Biologie Animale, 12, 313-461.
Lee К. E., Wood T. G. (1971). Termites and
Soils, Academic Press, London and New
York, 251 pp.
Le Masne G. (1953). Observations sur la bio-
logie de la fourmi Ponera eduardi Forel,
Insectes Sociaux, 3, 239-259.
Le Masne G., Bonavita A. (1969). La fondation
des societes selon le “type Myrmecia” chez
la Fourmi Manica rubida Latr., Proceed-
ings, Vlth International Congress of the
International Union for the Study of So-
cial Insects, Bern, pp. 137-147.
Le Moli F. (1978). Social influence on the ac-
quisition of behavioural patterns in the
ant Formica rufa L., Bollettino di Zoolo-
gia, Pubblicato dall’Unione Zoologica Ita-
liana, 45, 399-404.
Le Moli F. (1980). On the origin of slaves
in dulotic ant societies, Bollettino di Zoo-
logia, Pubblicato dall’Unione Zoologica
Italiana, 47, 207-212.
Le Moli F., Passetti M. (1978). The effect of
early learning on recognition, acceptance
and care of cocoons in the ant Formica rufa
L., Atti della Societa Italiana di Scienze
Naturali, e del Museo Civile de Storia
Naturale di Milano, 118 (1), 49-64.
Lenoir A. (1979a). Le comportement alimentaire
et la division du travail chez la Fourmi
Lasius niger, Bulletin biologique de la
France et de la Belgique. Tome CXIII
(2-3), 79-314.
Lenoir A. (1979b). Feeding behaviour in young
societies of the ant Tapinoma erraticum
L.: trophallaxis and polyethism, Insectes
Sociaux, 26 (1), 19-37.
Lensky Y. (1963). Etudes sur la physiologie et
I’ecologie de 1’Abeille (Apis mellifica L. var.
ligustica) en Israel, These, Universite Heb-
raique de Jerusalem.
Lensky Y., Slabezki Y. (1981). The inhibiting
effect of the queen bee (Apis mellifera L.)
foot-print pheromone on the construction
of swarming queen cups, J. of Insect Phy-
siology, 27 (5), 313-324.
Lenz M., McMahan E. A., Williams E. R.
(1982). Neotenic production in Crypto-
termes brevis (Walker): influence of geogra-
phical origin, group composition, and
maintenance conditions (Isoptera: Kalo-
termitidae), Insectes Sociaux, 29 (2),
148-163.
Lepage M. G. (1981a). Etude de la predation
de Megaponera foetens (F.) sur les popu-
lations recoltantes de Macrotermitinae dans
un ecosysteme semi-aride (Kajiado-Kenya),
Insectes Sociaux, 28 (3), 247-262.
Lepage M. G. (1981b). L’impact des populations
recoltantes de Macrotermes michaelseni
(Sjostedt) (Isoptera, Macrotermitinae) dans
un ecosysteme semi-aride (Kajiado-Kenya),
Insectes Sociaux, 28 (3), 297-308.
Leprun J. C., Roy-Noel J. (1977). Les caracteres
Литература 373
analytiques distinctifs des materiaux des
nids du genre Macrotermes au Senegal Oc-
cidental. Leurs rapports avec les sols, Pe-
dobiologia, 17, 361-368.
Leroux J. M. (1979a). Possibilities de scissions
multiples pour des colonies de dorylines
Annoma nigricans liliger, Hymenopteres:
Formicidae, en Cote d’Ivoire, Insects So-
ciaux, 26 (1), 13-17.
Leroux J. M. (1979b). Sur quelques modalites
de disparitions des colonies d'Annoma nigri-
cans liliger (Formicidae: Dorylinae) dans
la region de Lamto (Cote d’Ivoire), In-
sectes Sociaux, 26 (2), 92-99.
Leston D. (1973). The ant mosaic-tropical tree
crops and the limiting of pests and di-
seases, Pest Articles and News Summaries,
19, 311-341.
Letendre M., Huot L. (1972). Considerations
preliminaires en vue de la revision taxo-
nomique des fourmis du groupe microgy-
na genre Formica (Hymenoptera: Formici-
dae), Annales de la Societe entomologique
de Quebec, 17 (3), 117-132.
Leuthold R. H. (1968). A tibial gland scent-trail
and trail-laying behaviour in the ant
Crematogaster ashmeadi Mayr, Psyche.
Cambridge, 75 (3), 233-248.
Leuthold R. H. (1977). Post flight communica-
tion in two termite species, Trinervitermes
bettonianus and Hodotermes mossambicus.
Proceedings VUIth International Congress
of the International Union for the Study
of Social Insects, Wageningen, pp. 62-64.
Leuthold R. FL, Bruinsma O., van Huis A.
(1976). Optical and pheromonal orientation
and memory for homing distance in the
harvester termite Hodotermes mossambicus
(Hagen) (Isopt., Hodotermitidae), Behavior-
al Ecology and Sociobiology, 1 (2),
127-139.
Levieux J. (1971). Mise en evidence de la
structure des nids et de 1’implantation des
zones de chasse de deux especes de Cam-
ponotus (Hym., Form.) a 1’aide de radio-
isotopes, Insectes Sociaux, 18 (1), 29-48.
Levieux J. (1975). La nutrition des fourmis tro-
picales, Insectes Sociaux, 22 (4), 381- 390.
Levieux J. (1976). Deux aspects de Faction des
fourmis (Hymenoptera, Formicidae) sur le
sol d’une savane preforestiere de Cote-d’Ivoi-
re, Bulletin d’Ecologie, 7 (3), 283 295.
Levieux J. (1977). The nutrition of tropical ants:
V. Modes of exploitation of the resources
of the community (Hym., Formicidae), In-
sectes Sociaux, 24 (3), 235-260.
Levieux J. (1979). La nutrition des fourmis gra-
nivore. IV. Cycle d’activite et regime ali-
mentaire de Messor galla et de Messor
(= Cratomyrmex) regalis en saison des
pluies: fluctuations anuelles, Discussion, In-
sectes Sociaux, 26 (4), 279-294.
Levieux J., Diomande T. (1978a). La nutrition
des fourmis granivores. I. Cycle d’activite
et regime alimentaire de Messor galla et
de Messor (= Cratomyrmex) regalis (Hyme-
noptera, Formicidae), Insectes Sociaux, 25
(2), 127-139.
Levieux J., Diomande T. (1978b). La nutrition
des fourmis granivores. II. Cycle d’activite
et regime alimentaire de Brachyponera se-
naarensis (Mayr) (Hymenoptera Formici-
dae), Insectes Sociaux, 25 (3), 187-196.
Levieux J., Louis D. (1975). La nutrition des
fourmis tropicales. II. Comportement ali-
mentaire et regime de Camponotus vividus
(Smith) (Hym. Form.) comparaison intrage-
nerique, Insectes Sociaux, 22 (4), 391-404.
Levin B. R., Kilmer W. L. (1974). Interdemic se-
lection and the evolution of altruism: a
computer simulation study, Evolution, 28,
527-545.
Lewis T., Pollard G. V., Dibley G. C. (1974).
Micro-environmental factors affecting diel
patterns of foraging in the leaf-cutting ant
Atta cephalotes (L.) (Formicidae: Attini),
J. of Animal Ecology, 43, 143-153.
Lieberburg I., Kranz P. M„ Seip A. (1975). Ber-
mudan ants revisited: the status and inter-
action of Pheidole megacephala and Irido-
myrmex humilis. Ecology, 56, 473-478.
Light S. E, Weesner F. M. (1955). The incipient
colony of Tenuirostritermes tenuirostris
(Desneux), Insectes Sociaux, 2, 135-146.
Lindauer M. (1955). Schwarmbienen aus Woh-
nungssuche, Zeitschrift fur vergleichende
Physiologic, 37, 263-324.
Lindauer M., Kerr IV. E. (1958). Die gegenseiti-
ge Verstandigung bei den stachellosen Bie-
nen, Zeitschrift fur vergleichende Physiolo-
gic, 41 (4), 405-434.
Lindauer M., Kerr W. E. (1960). Communica-
tion between the workers of stingless bees,
Bee World, 41, 29-41, 65-71.
Litte M. (1977). Behavioral ecology of the so-
cial wasp Mischocyttarus mexicanus, Beha-
vioral Ecology and Sociobiology, 2,
229-246.
Lofgren C. S„ Banks W. A., Glancey В. M.
(1975). Biology and control of imported
fire ants, Annual Review of Entomology,
20, 1-30.
Longhurst C., Howse P. E. (1978). The use of
kairomones by Megaponera foetens (Fab.)
(Hymenoptera: Formicidae) in the detection
of its termite prey, Animal Behaviour, 26,
1213-1218.
Longhurst C., Howse P. E. (1979a). Foraging
374 Литература
recruitment and emigration in Megaponera
foetens (Fab.) (Hym. For.) from the Ni-
gerian Guinea savanna, Insectes Sociaux,
26 (3), 204-215.
Longhurst C., Howse P. E. (1979b). Some as-
pects of the biology of the males of Me-
gaponera foetens (Fab.) (Hymenoptera: For-
micidae), Insectes Sociaux, 26 (2), 85-91.
Longhurst C., Baker R., Howse P. E., Speed W.
(1978a) Alkylpyrazines in ponerine ants:
their presence in three genera, and caste
specific behavioural responses to them in
Odontomachus troglodytes (Hym., Formici-
dae), J. of Insect Physiology, 24 (12),
833-837.
Longhurst C., Johnson R. A., Wood T. G.
(1978b). Predation by Megaponera foetens
(Fabr.) (Hymenoptera: Formicidae) on
termites in the Nigerian Southern Guinea
Savanna, Oecologia, 32, 101-107.
Longhurst C., Baker R., Howse P. E. (1979).
Termite predation by Megaponera foetans
(Fabr.) (Hymenoptera: Formicidae): coordi-
nation of raids by glandular secretions,
J. of Chemical Ecology, 5, 703-719.
Longhurst C., Baker R., Howse P. E. (1980). A
multicomponent mandibular gland secre-
tion in the ponerine ant Bothroponera so-
ror (Emery), J. of Incest Physiology,
26, 551-555.
Lovgren B. (1958). A mathematical treatment
of the development of colonies of different
kinds of social wasps, Bulletin of Mathe-
matical Biophysics, 20, 119-148.
Lilscher M. (1961). Social control of poly-
morphism in termites, Symposium of The
Royal Entomological Society of London,
1, 57-67.
Luscher M. (1964). Die spezifische Wirkung
mannlicher and weiblicher Ersatzgeschlecht-
stiere auf die Entstehung von Ersatzge-
schlechtstieren bei der Termite Kalotermes
flavicollis (Fabr.), Insectes Sociaux, 11,
79-90.
Luscher M. (1974). Kasten und Kastendifieren-
zierung bei niederen Termiten. In: Sozial-
polymorphismus bei Insecten
(G. H. Schmidt, ed.), Wissenschaftliche
Verlagsgesellschaft, Stuttgart, pp. 694-762.
Liischer M. (1976). Evidence for an endocrine
control of caste determination in higher
termites. In: Phase and caste determination
in insects, Proceedings of the Section phy-
siology and biochemistry of the XVth In-
ternational Congress of Entomology, Wa-
shington, D. С. (M. Liischer, ed.), Perga-
mon Press, Oxford, pp. 91-104.
Lynch J. F., Balinsky E. C., Vail S. G. (1980).
Foraging patterns in three sympatric forest
ant species, Prenolepis imparts, Paratrechi-
na melanderi and Aphaenogaster rudis (Hy-
menoptera: Formicidae), Ecological Ento-
mology, 5 (4), 353-371.
Mabelis A. A. (1979a). Wood ant wars: the re-
lationship between aggression and preda-
tion in the red wood ant (Formica poly-
ctena Forst), Netherlands J. of Zoology,
29 (4), 451-620.
Mabelis A. A. (1979b). Nest splitting by the red
wood ant (Formica polyctena Foerster), Ne-
therlands J. of Zoology, 29 (1), 109-125.
MacKay W. P. (1981). A comparison of the
nest phenologies of three species of Pogo-
nomyrmex harvester ants (Hymenoptera:
Formicidae), Psyche, 88 (1-2), 25-74.
Mackensen O., Nye W. P. (1969). Selective
breeding of honeybees for alf-alfa pollen
collection; sixth generation and outcrosses,
J. of Apicultural Research, 8, 9-12.
McGurk D. J., Frost J., Eisenbraun E. J.,
Vick K., Drew W. A., Young J. (1966). Vo-
latile compounds in ants: Identification of
4-methyl-3-heptanone from Pogonomyrmex
ants, J. of Insect Physiology, 12,
1435-1441.
McLellan A. R., Rowland C. W., Fawcett R. H.
(1980). A monogynous eusocial insect
worker population model with particular
reference to honey bees, Insectes Sociaux,
27 (4), 305-311.
Majer J. D. (1976a). The maintenance of the
ant mosaic in Ghana cocoa farms, J. of
Applied Ecology, 13, 123-144.
Majer J. D. (1976b). The ant mosaic in Ghana
cocoa farms: further structural considera-
tions, J. of Applied Ecology, 13, 145-155.
Majer J. D. (1976c). The influence of ants and
ant manipulation on the cocoa farm fau-
na, J. of Applied Ecology, 13, 157-175.
Majer J. D. (1978). The influence of blanket
and selective spraying on ant distribution
in a west African cocoa farm, Revista
Theobroma (Brasil), 8, 87-93.
Малышев С. И. (1959). Перепончатокрылые,
их происхождение и эволюция, изд-во
«Советская наука», М.
Marikovsky Р. 1. (1963). The ants Formica
sanguinea (Latr.) as pillagers of Formica
rufa (Lin.) nests, Insectes Sociaux, 10,
119-128.
Markin G. P. (1970). Food distribution within
laboratory colonies of the Argentine ant,
Iridomyrmex humilis (Mayr), Insectes Soci-
aux, 17 (2), 127-157.
Markin G. P., Dillier J. H., Hill S. O.,
Blum M. S., Hermann H. R. (1971). Nup-
tial flight and flight ranges of the impor-
ted fire ant, Solenopsis invicta, Annals of
.7итерату pa 375
the Entomological Society of America, 66,
803—808
Markin G. P., Collins H. L., Dillier J. H.
(1972). Colony founding by queens of the
red imported fire ant Solenopsis invicta,
Annals of the Entomological Society of
America, 65, 1053—1058.
Markin G. P„ Dillier J. H., Collins H. L.
(1973). Growth and development of co-
lonies of the red imported fire ant, Sole-
nopsis invicta, Annals of the Entomological
Society of America, 66 (4), 803-808.
Markl H. (1964). Geomenotaktische Fehlorien-
tierung bei Formica polyctena Forster,
Zeitschrift fur vergleichende Physiologie, 48,
552-586.
Markl H. (1973). The evolution of stridulatory
communication in ants, Proceedings, Vllth
International Congress of the International
Union for the Study of Social Insects,
pp. 258-265.
Markl H., Holldobler B. (1978). Recruitment
and food-retrieving behaviour in Novomes-
sor (Formicidae, Hymenoptera). II. Vibra-
tion signals, Behavioral Ecology and Socio-
biology, 4, 183-216.
Markl H., Holldobler B., Holldobler T. (1977).
Mating behavior and sound production in
harvester ants (Pogonomyrmex, Formicidae),
Insectes Sociaux, 24 (2), 191-212.
Martin H., Lindauer M. (1966). Sinnesphysiolo-
gische Leistungen beim WaBenbau der
Honigbiene, Zeitschrift fur vergleichende
Physiologie, 53 (3), 372 404.
Martin M. M., Carman R. M., MacConnell J. G.
(1969). Nutrients derived from the fungus
cultured by the fungus-growing ant Atta
colombica tonsipes, Annals of the Entomo-
logical Society of America, 62 (1), 11 -13.
Martin M. M., Boyd N. D., Gieselmann M. J.,
Silver R. G. (1975). Activity of faecal fluid
of a leaf-cutting ant toward plant cell
wall polysaccharides, J. of Insect Physio-
logy, 21, 1887-1892.
Maschwitz U. (1966). Das Speichelsekret der
Wespenlarven und seine biologische Bedeu-
tung, Zeitschrift fur vergleichende Physiolo-
gie, 53 (3), 228-252.
Maschwitz U. (1974). Vergleichende Unter-
suchungen zur Funktion der Ameisen-
metathorakaldriise, Oecologia (Berl.), 16,
303-310.
Maschwitz (J. (1975a). Old and new trends in
the investigation of chemical recruitment
in ants. Pheromones and defensive secre-
tions in social insects. In: Pheromones
and defensive secretions in social insects.
Symposium of International Union for the
Study of Social Insects, Dijon, pp. 47-57.
Maschwitz U. (1975b). Old and new chemical
weapons in ants. In: Pheromones and de-
fensive secretions in social insects. Sympo-
sium of the International Union for the
Study of Social Insects, Dijon, pp. 41-46.
Maschwitz U., Holldobler B. (1970). Der Kar-
tonnestbau bei Lasius fuliginosus Latr.
(Hym. Formicidae), Zeitschrift fur verglei-
chende Physiologie, 66, 176-189.
Maschwitz U., Muhlenberg M. (1972). Campono-
tus rufoglaucus, eine wegelagernde Ameise,
Zoologischer Anzeiger Leipzig, 191 (5/6),
364-368.
Maschwitz U., Schoernegge P. (1977). Recruit-
ment gland of Leptagenys chinensis. A new
type of pheromone gland in ants, Natur-
wissenshaften, 64 (11), 589-590.
Maschwitz U., Tho Y. P. (1974). Chinone als
wehrsubstanzen bei einigen orientalische
Macrotermitinen, Insectes Sociaux, 21 (3),
231-234.
Maschwitz U., Koob K., Schildrnecht H. (1970).
Ein Beitrag zur Funktion der Metathora-
caldriise der Ameisen, J. of Insect Physio-
logy, 16, 387-404.
Maschwitz U., dander R., Burkhardt D. (1972).
Wehrsubstanzen und Wehrverhalten der Ter-
mite Macrotermes carbonarius, J. of Insect
Physiology, 18, 1715-1720.
Maschwitz U., Holldobler B., Moglich M.
(1974). Tandemlaufen als Rekrutierungs-
verhalten bei Bothroponera tesserinoda Forel,
Zeitschrift fur Tierpsychologie, 35, 113-123.
Masevicz S. (1979). Some consequences of
Fisher’s sex ratio principle for social hyme-
noptera that reproduce by colony fission,
The American Naturalist, 113 (3), 363-371.
Matsumoto T, Abe T. (1979). The role of
termites in an equatorial rain forest eco-
system of west Malaysia. II. Leaf litter
consumption on the forest floor, Oecolo-
gia, 38, 261-274.
Maynard Smith J. (1974). Models in Ecology,
Cambridge University Press, 146 pp.
[Имеется перевод: Смит M. Модели в
экологии,-М.: Мир, 1976.]
Maynard Smith J. (1978а). The evolution of
sex, Cambridge University Press, 209 pp.
[Имеется перевод: Дж. Мэйнард Смит.
Эволюция полового размножения,-М.:
Мир, 1981.]
Maynard Smith J. (1978b). Optimization theory
in evolution, Annual Review of Ecology
and Systematics, 9, 31 56.
Messina F. J. (1981). Plant protection as a
consequence of an ant-membracid mutua-
lism: interactions on goldenrod (Solidago
sp.), Ecology, 62 (6), 1433-1440.
Metcalf R. A., Whitt G. S. (1977a). Intra-nest
37(> . luiuepamvpa
relatedness in the social wasp Polistes
metricus: A genetic analysis, Behavioral
Ecology and Sociobiology, 2 (4), 339-351.
Metcalf R. A., Whitt G. S. (1977b). Relative
inclusive fitness in the social wasp Polistes
metricus, Behavioral Ecology and Socio-
biology, 2 (4), 353-360.
Meudec M. (1977). Le comportement de
transport du couvain lors d’une perturba-
tion du nid chez Tapinoma erraticum
(Dolichoderinae): Role de 1’individu,
Insects Sociaux, 24 (4), 345-352.
Michener C. D. (1974). The Social Behaviour
of the Bees, Harvard University Press,
Cambridge, Massachusetts, 404 pp.
Michener C. D. (1975). The Brazilian bee
problem, Annual Review of Entomology,
20, 399-416.
Michener C. D., Brothers D. J. (1974). Were
workers of eusocial Hymenoptera initially
altruistic or oppressed? Proceedings of the
National Academy of Science USA, 71 (3),
671-674.
Mintzer A. (1979). Foraging activity of the
Mexican leaf cutting and Atta mexicana
(F. Smith), in a sonoran desert habitat
(Hymenoptera, Formicidae), Insectes So-
ciaux, 26 (4), 365-372.
Moglich M. (1975). Recruitment of Leptotho-
rax. Proceedings, International Union for
the Study of Social Insects, Dijon,
pp. 235-242.
Moglich M. H. J., Alpert G. D. (1979). Stone
dropping by Conomyrma bicolor (Hyme-
noptera: Formicidae): A new technique of
interference competition, Behavioral Ecolo-
gy and Sociobiology, 6 (2), 105-114.
Moglich M., Holldobler B. (1975). Communica-
tion and orientation during foraging and
emigration in the ant Formica fusca, J. of
Comparative Physiology, 101, 275-288.
Montagner H. (1966). Le mecanisme et les
consequences des comportements trophal-
lactiques chez les guepes du genre Vespa,
Theses, Faculte des Sciences de 1’Universi-
te de Nancy, Nancy.
Moore В. P. (1968). Studies on the chemical
composition and function of the cephalic
gland secretion in Australian termites, J. of
Insect Physiology, 14 (1), 33-39.
Morgan E. D., Inwood M. R., Cammaerts M. C.
(1978). The mandibular gland secretion of
the ant, Myrmica scabrinodis, Physiological
Entomology, 3, 107-114.
Morgan E. D., Parry D., Tyler R. C. (1979).
The chemical composition of the Dufour
gland secretion of the ant, Myrmica scab-
rinodis (sic), Insect Biochemistry, 9 (1),
117-121.
Morse D. H. (1978). Size-related forading diffe-
rences of bumblebee workers, Ecological
Entomology, 3 (3), 189-192.
Morse D. H. (1980). The effect of nectar
abundance on foraging patterns of bumble-
bees, Ecological Entomology, 5 (1), 53-59.
Morse R. A., Laigo F. M. (1969). Apis dorsata
in the Philippines (including an annotated
bibliography), Monograph of the Philippine
Association of Entomologists, Inc., Uni-
versity of the Philippines, The College, La-
guna, P. I. No. 1, 96 pp.
Moser J. E., Brownlee R. G., Silverstein R. M.
(1968). The alarm pheromones of Atta te-
xana,'J. of Insect Physiology, 14, 529-535.
Motro M., Motro U., Ishay J. S., Kugler J.
(1979). Some social and dietary prerequisi-
tes of oocyte development in Vespa orienta-
lis L. workers, Insectes Sociaux, 26 (2),
150-164.
Muir D. A. (1959). The ant-aphid relationship
in west Dunbartonshire, J. of Animal Eco-
logy, 28, 133-140.
Nagin R. (1972). Caste determination in Neo-
termes jouteli (Banks), Insectes Sociaux, 19,
39-61.
Naulleau G., Montagner H. (1961). Construction
de cellules irregulieres chez Apis mellifica,
Insectes Sociaux, 8 (3), 203-211.
Naumann M. G. (1970). The nesting behaviour
of Protopolybia pumila in Panama (Hyme-
noptera, Vespidae), Ph. D. Dissertation,
University of Kansas.
Nel J. J. C. (1968). Aggressive behaviour of the
harvest termites Hodotermes mossambicus
(Hagen.) and Trinervitermes trinervoides
(Sjostedt), Insectes Sociaux, 15, 145-146.
Nielsen M. G. (Y)T2). An attempt to estimate
energy flow through a population of
workers of Lasius alienus (Forst) (Hyme-
noptera: Formicidae), Natura Jutlandica,
16, 99-107.
Nielsen M. G. (1977). Nests of Lasius flavus F.
on tidal meadow in Denmark. Proceedings,
VUIth Congress of the International
Union for the Study of Social Insects,
Wageningen, pp. 140-141.
Nielsen M. G., Josens G. (1978). Production by
ants and termites. In: Production ecology
of ants and termites (M. V. Brian, ed.),
Cambridge University Press, Cambridge,
pp. 45-54.
Nijhout H. F., Wheeler D. E. (1982). Juvenile
hormone and the physiological basis of
insect polymorphisms, Quarterly Review of
Biology, 57 (2), 109-133.
Noirot C. (1959). Remarques sur 1’ecologie des
termites, Annales de la Societe Royale
Zoologique de Belgique, 89, 151-169.
.'lumepamvpa У1 i
Noirot C. (1969). Formation of castes in the
higher Termites. In: Biology of Termites,
vol. I (K. Krishna and F. Weesner, eds.),
Academic Press, New York and London,
pp. 311-350.
Noirot C. (1970). The nests of termites. In:
Biology of Termites, vol. 2 (K. Krishna
and F. M. Weesner, eds.), Academic Press,
New York and London, pp. 73-125.
Noirot C. (1974). Polymorphismus bei hoheren
Termiten. In: Sozialpolymorphismus bei
Insekten (G. H. Schmidt, ed.), Wissen-
schaftliche Verlagsgesellschaft, Stuttgart,
pp. 740-765.
Noirot C., Bodot P. (1964). L’essaimage
d’Allognathotermes hypogeus Silv. (Isoptera,
Termitidae), Compte Rendu de I’Academie
des Sciences, Paris, 258, 3357-3359.
Noirot C., Noirot-Timothee C. (1969). The di-
gestive system. In: Biology of Termites,
vol. I (K. Krishna and F. M. Weesner,
eds.), Academic Press, New York and
London, pp. 49-88.
Noonan К. M. (1978). Sex ratio of parental in-
vestment in colonies of the social wasp
Polistes fuscatus, Science, 199, 1354-1356.
Nutting W. L. (1969). Flight and colony
foundation. In: Biology of Termites, vol. I
(K. Krishna and F. M. Weesner, eds.),
Academic Press, New York and London,
pp. 233-282.
Ofer J. (1970). Polyrachis simplex, the weaver
ant of Israel, Insectes Sociaux, 17 (1),
49-82.
Ofer J., Shulov A., Noy-Meir I. (1978). Asso-
ciations of ant species in Israel: a multi-
variate analysis, Israel J. of Zoology, 27,
199-208.
Ohiagu С. E., Wood T. G. (1976). A method
for measuring rate of grass harvesting by
Trinervitermes geminatus (Wasmann)
(Isoptera, Nasutitermitinae) and observation
on its foraging behaviour in southern
Guinea savanna, Nigeria, J. of Applied
Ecology, 13, 705 713.
Ohly-Wiist M. (1973). Stomodeale und procto-
deale Sekrete von Ameisenlarven und ihre
biologische Bedeutung. Proceedings, Vllth
International Congress of the International
Union for the Study of Social Insects,
London, pp. 412-418.
Ohly-Wiist M. (1977). Soziale wechselbe-
ziehungen zwischen Larven und Arbeiterin-
nen im Ameisenstaat, mit besonderer
Beachtung der Trophallaxis. Inaugural-
Dissertation, Johann-Wolfgan-Goethe-
Universitat zu Frankfurt am Main.
Okot-Kotber В. M. (1980). Histological and size
changes in corpora allata and prothoracic
glands during development of Macrotermes
michaelseni (Isoptera), Insectes Sociaux, 27
(4), 351-376.
Oloo G. W„ Leuthold R. H. (1979). The
influence of food on trail-laying and
recruitment behaviour in Trinervitermes
bettonianus (Termitidae: Nasutitermitinae),
Entomologia Experimentalis et Applicata,
26 (3), 267-278.
Olubajo O., Duffield R. M. Wheeler J. W.
(1980). 4-Heptanone in the mandibular
gland secretion of the nearctic ant,
Zacryptocerus varians (Hymenoptera:
Formicidae), Annals of the Entomological
Society of America, 73, 93-94.
Oster G. F., Wilson E. O. (1978). Caste and
Ecology in the Social Insects, Princeton
University Press, Princeton, 352 pp.
Owen R. E.., Rodd F. FL, Plowright R. C.
(1980). Sex ratios in bumble bee colonies:
complications due to orphaning, Behavioral
Ecology and Sociobiology, 7 (4), 287-292.
Pamilo P., Varvio-Aho S.-L. (1979). Genetic
structure of nests in the ant Formica
sanguinea, Behavioral Ecology and Socio-
biology, 6 (2), 91-98.
Pamilo P„ Rosengren R., Vepsalainen K.,
Varvio-Aho S.-L., Pisarski B. (1978). Po-
pulation genetics of Formica ants. I.
Patterns of enzyme gene variation, Here-
ditas, 89, 233-248.
Pamilo P., Vepsalainen K., Rosengren R.,
Varvio-Aho S.-L., Pisarski B. (1979). Po-
pulation genetics of Formica ants. II. Ge-
nic differentiation between species, Annales
entomologici fennici, 45 (3), 65-76.
Pardi L., Marino M. T. (1970). Studi sulla
biologia di Belonogaster (Hymenoptera,
Vespidae). 2. DifTerenziamento castale inci-
piente in B. griseus (Fab.), Monitore Zoo-
logica Italiano (n. s. Supplement III), 11,
235-265.
Parry K., Morgan E. D. (1979). Pheromones of
ants: a review, Physiological Entomology,
4, 161-189.
Passera L. (1969). Le role de la reine dans
I’ovogenese ouvriere chez la fourmi
Plagiolepis pygmaea Latr., Colloquium,
Centre National de la Researche Scienti-
fique, 189, 129-145.
Passera L. (1974). Kastendetermination bei der
Ameise Plagiolepis pygmeae Latr. In: So-
zialpolymorphismus bei Insekten
(G. H. Schmidt, ed.), Wissenschaftliche
Verlagsgesellschaft, Stuttgart, pp. 513-532.
Passera L. (1980a). La ponte d’oeufs
preorientes chez la fourmi Pheidole palli-
dula (Nyl.) (Hymenoptera: Formicidae),
Insectes Sociaux, 27 (1), 79-95.
37S Литература
Passera L. (1980b). La fonction inhibitrice des
reines de la fourmi Plagiolepis pygmaea
Latr.: role des pheromones, Insectes So-
ciaux, 27 (3), 212-225.
Passera L., Suzzoni J. P. (1979). Le role de la
reine de Pheidole pallidula (Nyl.) (Hy-
menoptera, Formicidae) dans la sexualisa-
tion du couvain apres traitment par
Thormone juvenile, Insectes Sociaux, 26
(4), 343-353.
Pasteels J. M. (1965). Polyethisme chez les
ouvrieres de Nasutitermes lujae (Termitidae
Isopteres), Biologia Gabonica, 1, 191-205.
Pasteels J. M., Verhaeghe J. C., Braekman J. C.,
Daloze D., Tursch B. (1980). Caste-de-
pendent pheromones in the head of the ant
Tetramorium caespitum, J. of Chemical
Ecology, 6 (2), 467-472.
Pavan M., Ronchetti G. (1955). Studi sulla
morfologia esterna e anatomia interna
dell’operaia di Iridomyrmex humilis Mayr, e
ricerche chimiche e biologiche sulla irido-
mirmecina. Atti della Societa Italiana di
Scienze Naturali, e del Museo Civile di
Storia Naturale di Milano, 94 (3-4),
379-477.
Peacock A. D„ Baxter A. T. (1950). Studies in
Pharaoh’s ant Monomorium pharaonis (L.).
3. Life History, Entomologist’s Monthly
Magazine, 86, 171- 178.
Peacock A. D., Smith I. C., Hall D. W..
Baxter A. T. (1954). Studies in Pharoah’s
ant Monomorium pharaonis. 8. Male pro-
duction by partheonogenesis, Entomolo-
gist’s Monthly Magazine, 90, 154-158.
Peakin G. J., Josens G. (1978). Respiration and
energy flow. In: Production ecology of
ants and termites (M. V. Brian, ed.),
Cambridge University Press.
Pearson B. (1980). The distribution of an este-
rase polymorphism in macrogynes and
microgynes of Myrmica rubra Latreille,
Evolution, 34 (1), 105-109.
Pearson B. (1981). The electrophoretic determi-
nation of Myrmica rubra microgynes as a
social parasite and the possible significance
of this with regard to the evolution of
ant social parasites. In: Systematics Asso-
ciation Special vol. 19, Biosystematics of
social insects (P. E. Howse and J.-L. Cle-
ment, eds.), Acdemic Press, London and
New York, pp. 75-84.
Pearson B. (1982a). The taxonomic status of
morphologically anomalous ants in the La-
sius niger/Lasius alienus taxon, Insectes
Sociaux, 29 (1), 95-101.
Pearson B. (1982b). Relatedness amongst
normal queens (macrogynes) in nests of the
polygynous ant Myrmica rubra Latreille,
Evolution, 36 (1), 107-112.
Pearson B., Child A. R. (1980). The distribution
of an esterase polymorphism in macrogy-
nes and microgynes of Myrmica rubra
Latreille, Evolution, 34 (1), 105-109.
Pendrel B. A., Plowright R. C. (1981). Larval
feeding by adult bumblebee workers (Hy-
menoptera: Apidae), Behavioral Ecology
and Sociobiology, 8, 71 76.
Percival M. S. (1965). Floral Biology, Pergamon
Press, Oxford.
Peregrine D. J.., Mudd A. (1974). The effect of
diet on the composition of the postpha-
ryngeal glands of Acromyrmex octospinosus
(Reich), Insectes Sociaux, 21 (4), 417-424.
Peregrine D. J., Mudd A., Cherrett J. M.
(V)Ti). Anatomy and preliminary chemical
analysis of the post-pharyngeal glands of
the leaf-cutting and Acromyrmex octospino-
sus (Reich), Hymenoptera, Formicidae, In-
sectes Sociaux, 20 (4), 355-363.
Peyal J. (1972). Methods of investigating the
productivity of ants, Ekologia polska, 20,
9 22.
Pejal J. (1978). The role of ants in ecosystems.
In: Production ecology of ants and termi-
tes (M. V. Brian, ed.), Cambridge Universi-
ty Press, pp. 293-325.
Pejal J. (1980). Ant populations, their regula-
tion and effect on soil in meadows,
Ekologia polska, 28 (3), 297-326.
Peterson-Braun M. (1977). Studies on the endo-
genous breeding cycle. In: Monomorium
pharaonis. Proceedings, VUIth International
Congress of the International Union for
the Study of Social Insects, Wageningen,
pp. 211-212.
Philips S. A., Vinson S. B. (1980). Source of
the post-pharyngeal gland contents in the
red imported fire ant, Solenopsis invicta
Buren, Annals of the Entomological So-
ciety of America, 73 (3), 257 261.
Pickard R. S. (1976). Bees, Magnetism and
Electricity. Lecture to the Central Asso-
ciation of Bee-Keepers, 25 September 1976,
Ilford, Essex, 12 pp.
Pisarski B. (1973). Struktura spoleczna Formi-
ca (C) exsecta Nyl. (Hymenoptera, Formi-
cidae i jej wplyw na morfologie ekologie
i etologie gatunku, PAN, Instytut Zoolo-
giczny, 134 pp.
Plateaux L. (1970). Sur le polymorphisme so-
cial de la fourmi Leptothorax nylanderi
(Forster). I. Morphologie et biologie
comparees des castes. Annales des Sciences
Naturelles (Zoologie), 12, 373-478.
Plateaux L. (1971). Sur le polymorphisme so-
ciale de la fourmi Leptothorax nylanderi. II.
Activite des ouvrieres et determinisme des
Литература 379
castes, Annales des Sciences Naturelles et
Biologie Animale, 13, 1-90.
Plateaux L. (1981). The Pallens morph of the
ant Leptothorax nylanderi: description,
formal genetics and study of populations.
In: Systematics Association Special vol. 19,
Biosystematics of Social Insects
(P. E. Howse and J.-L. Clement, eds.),
Academic Press, London and New York,
pp. 63-74.
Plateaux-Quenu C. (1962). Biology of Halictus
marginatus Brulle, J. of Apicultural Re-
search, 1, 41-51.
Plateaux-Quenu C. (1972). La biologie des
abeilles primitives, Collection „Les grands
problemes de la biologie”, monographie
11, Masson et Cie.
Plateaux-Quenu C. (1978). Les sexues de
remplacement chez Evylaeus calceatus
(Scop.) (Hym., Halicitinae), Insectes So-
ciaux, 25 (3), 227-236.
Plateaux-Quenu C. (1979). Qui remplace la
reine dans un groupe d’ouvrieres orphelines
Evylaeus calceatus (Scop.) (Hym., Halic-
tinae)? Annales de Sciences Naturelles
(Zoologie), Paris, Ser. 13, 1, 213-218.
Pleasants J. M. (1981). Bumblebee response to
variation in nectar availability, Ecology, 62
(6), 1648-1661.
Plowman К. P. (1981). Resource utilization by
two New Guinea rainforest ants, J. of
Animal Ecology, 50 (3), 903-916.
Plowright R. C. (1979). Social facilitation at the
nest entrances of bumble bees and wasps,
Insectes Sociaux, 26 (3), 223-231.
Plowright R. C., Jay S. C. (1968). Caste diffe-
rentiation in bumble-bees: The determina-
tion of female size, Insectes Sociaux, 15,
171-192.
Poldi B. (1963). Studi sulla fondazione dei nidi
nei Formicidi. 1. Tetramorium caespitum L.
Proceedings, IV th International Congress
of the International Union for the Study
of Social Insects, Symposia Genetica et
Biologica Italica, 12, 132-199.
Pomeroy D. E. (1976). Studies on a population
of large termite mounds in Uganda, Ecolo-
gical Entomology, 1 (1), 49- 61.
Pontin A. J. (1960). Field experiments on colo-
ny foundation by Lasius niger (L.) and L.
flavus (F.) (Hym., Formicidae), Insectes
Sociaux, 7, 227-230.
Pontin A. J. (1961a). The prey of Lasius niger
(L.) and L. flavus (F.) (Hym., Formicidae),
Entomologist’s Monthly Magazine, 97,
135- 137.
Pontin A. J. (1961b). Population stabilization
and competition between the ants Lasius
flavus (F.) and L. niger (L.), J. of Animal
Ecology, 32, 565-574.
Pontin A. J. (1978). The numbers and distribu-
tion of subterranean aphids and their
exploitation by the ant Lasius flavus
(Fabr.), Ecological Entomology, 3 (3),
203-207.
Porter S. D., Jorgensen C. D. (1981). Foragers
of the harvester Ant, Pogonomyrmex
owyheei: A disposable caste? Behavioral
Ecology and Sociobiology, 9, 247- 256.
Portugal-Araujo V. de (1958). A contribution to
the bionomics of Lestrimelitta cubiceps
(Hymenoptera, Apidae), J. of the Kansas
Entomological Society, 31 (3), 203-211.
Post D. C., Jeanne R. L. (1981). Colony de-
fense against ants by Polistes fuscatus
(Hymenoptera: Vespidae) in Wisconsin, J.
of the Kansas Entomological Society, 54
(3), 599-615.
Prestwich G. D. (1975). Chemical analysis of
soldier defensive secretions of several spe-
cies of East African termites. Proceedings,
Symposium of the International Union for
the Study of Social Insects, Dijon,
pp. 149-152.
Proctor M., Yeo P. (1973). The new natura-
list, The Pollination of flowers, Collins,
London, 418 pp.
Provost E. (1979). Etude de la fermeture de la
societe de Fourmis chez diverses especes de
Leptothorax et chez Camponotus lateralis
(Hymenopteres, Formicidae) Compte
Rendu de 1’Academie des Sciences, Paris,
Serie D, 288, 429-432.
Provost E. (1981). Aggressivity and the closure
of ant societies. XVIIe Conference Interna-
tionale d’Ethologie, Oxford, 1-9 Septembre
1981. Seance: „Species and individual re-
cognition”.
Prys-Jones О. E. (1982). Ecological studies of
foraging and life history in bumble bees,
Ph. D. Thesis, University of Cambridge.
Pudlo R. J., Beattie A. J., Culver D. C. (1980).
Population consequences of changes in an
ant-seed mutualism in Sanguinaria cana-
densis, Oecologia, 146, 52-37.
Pyke G. H. (1978). Optimal foraging in
bumblebees and coevolution with their
plants, Oecologia, 36, 281-293.
Pyke G. H. (1979). Optimal foraging in
bumblebees: rule of movement between flo-
wers within inflorescences, Animal Beha-
viour, 27, 1167-1181.
Quennedy A. (1973). Observations cytologiques
et chimique sur la glande frontale des
termites. Proceedings, Vllth International
Congress of the International Union for
the Study of Social Insects, London,
pp. 324-325.
Quinlan R. J., Cherrett J. M. (1979). The role
of fungus in the diet of the leaf-cutting
3<S() . lumepamvpu
ant Atta cephalotes (L.), Ecological Ento-
mology, 4 (2), 151-160.
Raignier A. (1948). L’economie thermique d’une
colonie polycalique de la Fourmi des
bois, La Cellule, 51 (3), 281-368.
Raignier A. (1972). Sur 1’origine des nouvelles
societes des fourmis voyageuses africaine,
Insectes Sociaux, 19, 153-170.
Raignier A., van Boven J. K. A. (1955). Etude
taxonomique, biologique et biometrique des
Dorylus du sous-genre Апотта (Hyme-
noptera: Formicidae), Annales du Mu see
Royale du Congo Beige, Ser. 4, Sciences
Zoologiques, 2, 1-359.
Rajashekharappa B. J. (1979). Queen recognition
and the rearing of new queens by
honeybee colonies (Apis сегапа), J. of
Apicultural Research, 18 (3), 173-178.
Regnier F. E., Wilson E. O. (1971). Chemical
communication and „propaganda” in slave
maker ants, Science, 172, 267-269.
Regnier F. E„ Neih M„ Holldobler B. (1973).
The volatile Dufour’s gland components of
the harvester ants Pogonomyrmex rugosus
and P. barbatus, J. of Insect Physiology,
19, 981-992.
Rettenmeyer C. W., Watkins J. E, II (1978).
Polygyny and monogyny in army ants
(Hymenoptera: Formicidae), J. of the
Kansas Entomological Society, 51 (4),
581-591.
Резникова Ж. И. (1971). Взаимодействие му-
равьев разных видов, обитающих на
одной территории. В кн.: «Муравьи и
защита леса», VI, М.
Резникова Ж. И. (1975). Неантагонистические
отношения муравьев, занимающих сход-
ные экологические ниши. Зоологический
журнал, 54 (7), 1020-1031.
Резникова Ж. И. (1979). Формы террито-
риальной организации у лугового му-
равья (Formica pratensis), Зоологический
журнал, 58 (10), 1490-1500.
Reznikova Zh. I., Kulikov A. V. (1978). Featu-
res of the feeding and interaction of
steppe ant species (Hymenoptera, Formi-
cidae), Entomological Review, 57 (1),
43-51.
Ribbands C. R. (1949). The foraging method of
individual honey-bees, The J. of Animal
Ecology, 18, 47-66.
Ribbands C. R. (1953). The Behaviour and So-
cial Life of Honey Bees, Bee Research
Association, London.
Richards O. W. (1969). The Biology of some
W. African social wasps, Memorie della
Societa Entomologica Italian a, 48, 79-93.
Richards O. W. (1971). The biology of the
social wasps (Hymenoptera, Vespidae),
Biological Review, 46, 483-528.
Richards O. W. (1978). The social wasps of the
Americas excluding the vespinae, British
Museum of natural history, London, pp.
580.
Richards O. W., Richards M. J. (1951). Observa-
tions on the social wasps of South Ame-
rica, Transactions of the Royal Entomo-
logical Society of London, 102 (1), 1-170.
Ritter F. J., Briiggemann-Rotgans I. E. M., Ver-
kuil E., Persoons C. J. (1975). The trail
pheromone of the Pharoah’s ant Monomo-
rium pharaonis'. components of the odour
trail and their origin. Pheromones and de-
fensive secretions in social insects: Sympo-
sium of the International Union for the
Study of Social Insects, Dijon, pp. 99-103.
Robertson P. L., Dudzinski M. L., Orton C. J.
(1980). Exocrine gland involvement in
trailing behaviour in the Argentine ant
(Formicidae: Dolichoderinae), Animal Be-
haviour, 28, 1255-1273.
Robinson S. W., Moser J. C., Blum M. S.,
Amante E. (1974). Laboratory investiga-
tions of the trail-following responses of
four species of leaf-cutting ants with notes
on the specificity of a trail pheromone of
Atta texana (Buckley), Insectes Sociaux,
21, 87-94.
Rockstein M. (1978). Biochemistry of Insects
(M. Rockstein, ed.), Academic Press, New
York, London, 649 pp.
Rockwood L. L. (1976). Plant selection and
foraging patterns in two species of leaf-
cutting ants (Atta), Ecology, 57, 48-61.
Rohrmann G. F., Rossmann A. Y. (1980).
Nutrient strategies of Macrotermes ukuzii
(Isoptera: Termitidae), Pedobiologia, 20,
61-73.
Roland C. (1976). Approche eco-ethologique et
biologiques des societes de Paravespula
vulgaris et germanica, Thesis, University of
Nancy.
Room P. M. (1971). The relative distribution of
ant species in Ghana’s cocoa farms, J. of
Animal Ecology, 40, 735-751.
Roseler P.-F. (1977). Juvenile hormone control
of oogenesis in bumble bee workers,
Bombus terrestris, J. of Insect Physiology,
23, 985-992.
Roseler P.-F., Roseler I. (1977). Dominance in
bumblebees. Proceedings, VUIth Interna-
tional Congress of the International Union
of the Study of Social Insects, Wagenin-
gen, pp. 232-235.
Roseler P.-F., Roseler I. (1978). Studies on the
regulation of the juvenile hormone titre in
bumble-bee workers Bombus terristris, J. of
Insect Physiology, 24, 707-713.
Roseler P.-F., Roseler I., Strambi A.
(1980). The activity of corpora allata in
. htntepamvpu
dominant and subordinated females of the
wasp Polistes gallicus, Insectes Sociaux, 27
(2), 97-107.
Roseler P.-F., Roseler I., van Honk C. G. J.
(1981). Evidence for inhibition of corpora
allata activity in workers of Bombus ter-
restris by a pheromone from the queens
mandibular glands, Experientia, 37,
348-351.
Rosengren R. (1977). The significance of age
polyethisum in social foraging of wood
ants (Formica rufa group). Proceedings,
Vlllth International Congress of the Inter-
national Union for the Study of Social
Insects, Wageningen, pp. 99-100.
Ross N. M., Gamboa G. J. (1981). Nestmate
discrimination in social wasps (Polistes
metricus Hymenoptera: Vespidae), Beha-
vioral Ecology and Sociobiology, 9,
163-165.
Roubik D. W. (1978). Competitive interactions
between neotropical pollinators and africa-
nized honey bees, Science, 201, 1030-1032.
Roubik D. W. (1979). Nest and colony cha-
racteristics of stingless bees from French
Guiana (Hymenoptera: Apidae), J. of the
Kansas Entomological Society, 52 (3),
443-470.
Ruttner F., Woyke J., Koeniger N. (1972).
Reproduction in Apis cerana. 1. Mating
behaviour, J. of Apicultural Research, 11
(3), 141-146.
Ruttner F., Woyke J., Koeniger N. (1973).
Reproduction in Apis cerana. 2. Repro-
ductive organs and natural insemination, J.
of Apicultural Research, 12 (1), 21-34.
Rutz W., Gerig L., Willie H., Liischer M.
(1976). On the function of juvenile hormo-
ne in worker honey-bees, J. of Insect Phy-
siology, 22, 1485-1492.
Sakagami S. F. (1959). Some interspecific rela-
tions between Japanese and European ho-
ney-bees, J. of Animal Ecology, 28, 51-68.
Sakagami S. F. (1960). Ethological peculiarities
of the primitive social bees, Allodape Le-
peltier and allied genera, Insectes Sociaux,
7, 231-249.
Sakagami S. F., Fukushima K. (1957). Vespa
dybowskii Andre as a facultative temporary
social parasite, Insectes Sociaux, 4, 1-12.
Sakagami S. F., Hayashida K. (1962). Work
efficiency in heterospecific ant groups
composed of hosts and their labour para-
sites, Animal Behaviour, 10, 96-104.
Sakagami S. F., Michener C. D. (1962). The
nest architecture of the sweat bees (Hali-
ctinae), University of Kansas Press,
Lawrence.
Sakagami S. F., Zucchi R. (1965). Winter-
's!
verhalten einer neotropischen Hummel,
Bombus atratus, innerhalb des Beobach-
tungskastens. Ein Beitrag zur Biologie der
Hummeln, J. of the Faculty of Science,
Hokkaido University, Zoology, 15,
712-762.
Sakagami S. F., Akahira Y., Zucchi R.
(1967a). Nest architecture and brood de-
velopment in a neotropical bumblebee,
Bombus atratus, Insectes Sociaux, 14 (4),
389-414.
Sakagami S. F., Laroca S., Moure J. S.
(1967b). Two Brazilian apid nests worth
recording in reference to comparative bee
sociology, with description of Euglossa
melanotricha Moure sp. n. (Hymenoptera,
Apidae), Annotationes Zoologicae Japo-
nenses, 40 (1), 45-54.
Sands W. A. (1960). The initiation of fungus
comb construction in laboratory colonies
of Ancistrotermes guineensis (Sylvestri), In-
sectes Sociaux, 7, 251-263.
Sands W. A. (1965). Alate development and co-
lony foundation in five species of Tri-
nervitermes (Isoptera, Nasutitermitinae) in
Nigeria, West Africa, Insectes Sociaux, 12
(2), 117-130.
Sands W. A. (1969). The association of termi-
tes and fungi. In: Biology of termites, vol.
1 (K. Krishna and F. M. Weesner, eds.),
Academic Press, New York and London,
pp. 495-524.
Samway s M. J. (1981). Comparison of ant
community structure (Hymenoptera: Formi-
cidae) in citrus orchards under chemical
and biological control of red scale, Aoni-
diella aurantii (Maskell) (Hemiptera:
Diaspididae), Bulletin of Entomological
Research, 71, 663-670.
Schemske D. W. (1980). The evolutionary signi-
ficance of extrafloral nectar production by
Costus woodsonii (Zingiberaceae): An expe-
rimental analysis of ant protection, J. of
Ecology, 68, 959-967.
Scher ba G. (1958). Reproduction, nest orienta-
tion and population structure of an aggre-
gation of mound nests of Formica ulkei
(Emery) (Formicidae), Insectes Sociaux, 5,
201-213.
Scherba G. (1959). Moisture regulation in
mound nests of the ant Formica ulkei,
American Midland Naturalist, 61, 499-509.
Scherba G. (1962). Mound temperatures of the
ant Formica ulkei Emery, American
Midland Naturalist, 67 (2), 373-385.
Scherba G. (1964). Analysis of inter-nest mo-
vement by workers of the ant Formica
opaciventris Emery (Hymenoptera: Formici-
dae), Animal Behaviour, 12, 508-512.
3S2 . lumepuniypil
Schmidt G. H. (1974). Sozialpolymorphismus
bei Insekten (G. H. Schmidt, ed.), Wissen-
schaftliche verlagsgesellschaft MBH, Stutt-
gart, 974 pp.
Schmidt G. H. (1982). Egg dimorphism and
male production in Formica polyctena
Foerster. In: The biology of social insects,
Proceedings of the Ninth Congress of the
International Union for the Study of So-
cial Insects, Boulder, Colorado
(M. D. Breed, C. D. Michener and
H. E. Evans, eds.), Westview Press,
Boulder, Colorado, pp. 243-247.
Schmidt J. O., Blum M. S. (1978). A harvester
ant venom: chemistry and pharmacology,
Science, 200, 1064-1066.
Schneider P. (1972). Akustische Signale bei
Hummeln, Naturvissenschaften, 59, 168.
Schneirla T. C. (1971). Army ants: a study in
social organisation (H. Topoff, ed.),
Freeman, San Francisco, 349 pp.
Schumacher A. M., Whitford W. G. (1974).
Spatial and temporal variation in Chi-
hauhuan desert ant faunas, Southwestern
Naturalist, 21, 1-8.
Seeley T. D. (1974). Atmospheric carbon dioxi-
de regulation in honey-bee (Apis mellifera)
colonies, J. of Insect Physiology, 20,
2301-2305.
Seeley T. D. (1977). Measurement of nest ca-
vity volume by the honeybee (Apis melli-
fera L.), Behavioral Ecology and So-
ciobiology, 2, 201-227.
Seeley T. D. (1978). Life history strategy of
the honey bee, Apis mellifera, Oecologia,
32, 109-118.
Seeley T. D. (1979). Queen substance dispersal
by messenger workers in honey-bee colo-
nies, Behavioral Ecology and Sociobiology,
5, 391-415.
Seeley T., Heinrich B. (1981). Regulation of
temperature in the nests of social insects.
In: Insect thermoregulation (B. Heinrich,
ed.), John Wiley, New York, pp. 160-234.
Seeley T. D., Morse R. A. (1976). The nest of
tire honeybee Apis mellifera, Insectes So-
ciaux, 23 (4), 495-512.
Seeley T. D., Morse R. A. (1977). Dispersal be-
havior of honey bee swarms, Psyche, 83
(3-4), 199-209.
Seeley T. D., Morse R. A. (1978). Nest site se-
lection by the honey bee Apis mellifera,
Insectes Sociaux, 25 (4), 323-337.
Seeley T. D., Morse R. A., Visscher P. K.
(1979). The natural history of the flight of
honey bee swarms, Psyche, 86 (2-3),
103-113.
Selander R. K. (1976). Genic variation in natu-
ral populations. In: Molecular evolution
(F. J. Ayala, ed.), Sinauer, Sunderland,
Massachusetts.
Simpson J. (1955). The significance of the
presence of pollen in the food of worker
larvae of the honey-bee, Quarterly- J. of
Microscopical Science, 96 (1), 117-120.
Simpson J. (1960). The functions of the salivary
glands of Apis mellifera, J. of Insect Phy-
siology, 4, 107-121.
Simpson J. (1974). The reproductive behaviour
of European honeybee colonies. Lecture to
the Central Association of bee-keepers, 14
March, 1974.
Skaife S. H. (1954). The black-mound termites
of the Cape, Amitermes atlanticus Fuller,
Transactions of the Royal Society of
South Africa, 34, 251-271.
Skinner G. J. (1980a). Territory, trail structure
and activity patterns in the wood-ant,
Formica rufa (Hymenoptera: Formicidae),
in limestone woodland in north-west
England, J. of Animal Ecology, 49 (2),
381-394.
Skinner G. J. (1980b). The feeding habits of
the wood-ant, Formica rufa (Hymenoptera:
Formicidae, in limestone woodland in
north-west England, J. of Animal Ecology,
49 (2), 417-434.
Skinner G. J., Whittaker J. B. (1981). An expe-
rimental investigation of interrelationships
between the wood-ant (Formica rufa) and
some tree-canopy herbivores), J. of Animal
Ecology, 50 (1), 313-326.
Smeeton L. (1980). Male production in the ant
Myrmica rubra L., Doctoral thesis, Uni-
versity of Southampton.
Smeeton L. (1981). The source of males in
Myrmica rubra L. (Hym. Form.), Insectes
Sociaux, 28 (3), 263-278.
Smith R. H., Shaw M. R. (1980). Haplodiploid
sex ratios and the mutation rate, Nature,
287, 728-729.
Sommeijer M. J., Beuvens F. T., Verbeek H. J.
(1982). Distribution of labour among
workers of Melipona favosa F.: con-
struction and provisioning of brood cells,
Insectes Sociaux, 29 (2), 222-237.
Soulie J. (1961). Quelques notes ethologiques
sur la vie dans le nid chez deux especes
mediterraneennes de Crematogaster (Hyme-
noptera-Formicoidea), Insectes Sociaux, 8
(1), 95-98.
Spradbery J. P. (1971). Seasonal changes in the
population structure of wasp colonies (Hy-
menoptera: Vespide), J. of Animal Ecolo-
gy, 40, 501-523.
Spradbery J. P. (1973a). Wasps, Sidgwick and
Jackson, London, 408 pp.
Spradbery J. P. (1973b). The european social
Литература 3X3
wasp, Paravespula germanica (F.) (Hy-
menoptera: Vespidae) in Tasmania, Aust-
ralia. Proceedings, Vllth International Con-
gress of the International Union for the
Study of Social Insects, London, pp. 375-
380.
Springhetti A. (1972). I feromoni nella differen-
ziazione della caste di Kalotermes flavicol-
lis (Fabr.) (Isoptera), Bulletino di Zoolo-
gia, 39, 83-87.
Stebaev I. V., Reznikova Y. I. (1972). Two in-
teraction types of ants living in steppe
ecosystem in South Siberia, USSR, Ekolo-
gia polska, 20 (11), 103-109.
Стебаев И. В., Резникова Ж. И. (1974). Сис-
тема пространственно-временных вза-
имоотношений в многовидовом поселе-
нии степных муравьев, Зоологический
журнал, 53 (8), 1200-1212.
Stradling D. J. (1978а). The influence of size on
foraging in the ant Atta cephalotes and the
effect of some plant defence mechanisms. J.
of Animal Ecology, 47 (1), 173-188.
Stradling D. J. (1978b). Food and feeding ha-
bits of ants. In: Production ecology of
ants and termites (M. V. Brain, ed.), Cam-
bridge University Press, Cambridge, pp.
81-106.
Stuart A. M. (1969). Social behaviour and
communication. In: Biology of termites,
vol. 1 (K. Krishna and F. M. Weesner, eds.),
Academic Press, New York and London,
pp. 193-232.
Sturtevant A. H. (1938). Essays on evolution.
II. On the effects of selection on social
insects, Quarterly Review of Biology, 13,
74-76.
Sudd J. H. (1960). The foraging method of
pharaoh’s ant, Monomorium pharaonis (L.),
Animal Behaviour, 8, 67 — 75.
Sudd J. H. (1965). Transport of prey by ants,
Behaviour, 25 (3-4), 234-271.
Sudd J. H. (1967). An introduction to the be-
haviour of ants, Arnold, London, 200 pp.
Sudd J. H. (1969). The excavation of soil by
ants, Zeitschrift fur Tierpsychologie, 26 (3),
257-276.
Sudd J. H. (1970a). Specific patterns of exca-
vation in isolated ants, Insectes Sociaux,
17 (4), 253-260.
Sudd J. H. (1970b). The response of isolated
digging worker ants (Formica lemani Bon-
droit and Lasius niger (L.) to tunnels, In-
sectes Sociaux, 17 (4), 261-272.,
Suzzoni J. P., Cagniant H. (1975). Etudes histo-
logiques des voies gen it ales chez I’ouvriere
et la reine de Cataglyphis cursor. Argu-
ments en faveur d’une parthenogenese the-
lytoque chez cette espece, Insectes Sociaux,
22, 83-92.
Suzzoni J. P., Grimal A. (1980). Variations bio-
metriques des corps allates pendant la
difierenciation des castes reine et ouvriere
chez Plagiolepis pygmaea Latr. (Hymenop-
tera: Formicidae), Insectes Sociaux, 27 (4),
399-414.
Swain R. B. (1980). Trophic competition among
parabiotic ants, Insectes Sociaux, 27 (4),
377-390.
Synge A. D. (1947). Pollen collection by ho-
neybees (Apis mellifera), J. of Animal Eco-
logy, 16 (2), 122-138.
Szlep R., Jacobi T. (1967). The mechanism of
recruitment to mass foraging in colonies
of Monomorium venustum Smith, M. subo-
pacum ssp. phoenicium Gm., Tapinoma
Israelis For. and T. simothi v. phoenicium
Em., Insectes Sociaux, 14 (1), 25-40.
Szlep-Fessel R. (1970). The regulatory mecha-
nism in mass foraging and the recruitment
of soldiers in Pheidole, Insectes Sociaux,
17 (4), 233-244.
Taki A. (1976). Colony founding of Messor
acicultatum (Fr. Smith) (Hymenoptera:
Formicidae) by single and grouped queens,
Physiology and Ecology, Japan, 17 (1/2),
503-512.
Talbot M. (1946). Daily fluctuations in
above ground activity of three species of
ants, Ecology, 27 (1), 65-70.
Talbot M. (1965). Populations of ants in a low
field, Insectes Sociaux, 12 (1), 19-48.
Taylor B. (1977). The ant mosaic on cocoa
and other tree crops in western Nigeria,
Ecological Entomology, 2, 245-255.
Taylor B., Adedoyin S. F. (1978). The abundan-
ce and inter-specific relations of common
ant species (Hymenoptera: Formicidae) on
cocoa farms in western Nigeria, Bulleten
of Entomological Research, 68, 105-121.
Terada Y., Garofalo C. A., Sakagami S. F.
(1975). Age-survival curves for workers of
two eusocial bees (Apis mellifera and
Plebeia droryana) in a subtropical climate,
with notes on worker polyethism in
P. droryana, J. of Apicultural Research,
14 (3/4), 161-170.
Tevis L., Jr. (1958). Interrelations between the
harvester ant Veromessor pergandei (Mayr.)
and some desert ephemerals, Ecology, 39,
695-704.
Thorne B. L. (1982). Polygyny in Termites:
multiple primary queens in colonies of
Nasutitermes comiger (Motschuis) (Isopte-
ra: Termitidae), Insectes Sociaux, 29 (1),
102-117.
384 . lumepaiiivpu
Tilman D. (1978). Cherries, ants and tent ca-
terpillars: timing of nectar production in
relation to susceptibility of caterpillars to
ant predation, Ecology, 59 (4), 686-692.
Tohme G. (1972). Le nid et le comportement
de construction de la fourmi Messor ebe-
ninus Forel (Hymenoptera, Formicoidea),
Insectes Sociaux, 19 (2), 95-103.
Tomlinson J., McGinty S., Kish J. (1981). Mag-
nets curtail honey bee dance, Animal
Behaviour, 29 (1), 307.
Topoff H. (1971). Polymorphism in army ants
related to division of labor and cyclic co-
lony behaviour, American Naturalist, 105,
529-548.
Topoff H., Lawson K. (1979). Orientation of
the army ant Neivamyrmex nigrescens: in-
tegration of chemical and tactile informa-
tion, Animal Behaviour, 27, 429-433.
Topoff H., Mirenda J. (1978). Presocial beha-
viour of callow workers of the army ant
Neivamyrmex nigrescens: importance of sti-
mulation by adults during mass recruit-
ment, Animal Behaviour, 26, 698-706.
Topoff H. Mirenda J. (1980). Army ants do
not eat and run: influence of food supply
on emigration behaviour in Neivamyrmex
nigrescens, Animal Behaviour, 28, 1040-
1045.
Topoff H„ Mirenda J., Droual R„ Herrick S.
(1980a). Behavioural ecology of mass rec-
ruitment in the army ant Neivamyrmex
nigrescens, Animal Behaviour, 28, 779-789.
Topoff H„ Mirenda J., Droual R., Herrick S.
(1980b). Onset of the nomadic phase in
the army ant Neivamyrmex nigrescens
(Cresson) (Hym. From.): distinguishing
between callow and larval excitation by
brood substitution, Insectes Sociaux, 27 (2),
175-179.
Topojf H., Rothstein A., Pujdak S., Dahlst-
rom T. (1981). Statary behaviour in noma-
dic clonies of army ants: the effect of
overfeeding, Psyche, 88, 151-161.
Torossian C. (1979). Importance quantitative
des oeufs abortifs d’ouvrieres dans le bilan
trophique de la colonie de la fourmi
Dolichoderus quadripunctatus, Insectes Soci-
aux, 26 (4), 295-299.
Traniello J. F. A. (1977). Recruitment behavior,
orientation, and the organization of fora-
ging in the carpenter ant Camponotus pen-
nsylvanicus DeGeer (Hymenoptera: Formi-
cidae), Behavioral Ecology and Sociobiolo-
gy, 2, 61-79.
Traniello J. F. A. (1978). Caste in a primitive
ant: absence of age polyethism in Amblyo-
pone, Science, 202, 770-772.
Trivers R. L.. Hare H. (1976). Haplodiploidy
and the evolution of the social insects,
Science, 191, 249- 263.
Tschinkel W. R., Close P. G. (1973). The trail
pheromone of the termite Trinervitermes
trinervoides (Isopt., Termitidae), J. of
Insect Physiology, 19 (3), 707-721.
Tulloch A. (1970). The composition of beeswax '
and other waxes secreted by insects, Li-
pids, 5, 247-258.
Tumlinson J. H., Silverstein R. M. (1971). Iden-
tification of the trail pheromone of a leaf-
cutting ant, Atta texana, Nature, 234, 348-
349.
Uchmanski J., Pejal J. (1982). Long-term stabi-
lity of ant colonies-a simulation model,
J. of Animal Ecology, 51, 349-362.
Fanderplank F. L. (1960). The bionomics and
ecology of the red tree ant, Oecophylla
sp., and its relationship to the coconut
bug Pseudotheraptus wayi (Brown) Corei-
dae), J. of Animal Ecology, 29, 15-33.
Finson S. B., Phillips S. A., Jr., Williams H. J.
(1980). The function of the post-pharyn-
geal glands of the red imported fire ant,
Solenopsis invicta Buren, J. of Insect Phy-
siology, 26, 645-650.
Froey C. De (1979). Relations interspecifiques
chez les fourmis. Proceedings, International
Union for the Study of Social Insects,
French section, Lausanne, pp. 107-113.
Wallis D. J. (1962). Aggressive behaviour in
the ant Formica fusca, Animal Behaviour,
10 (3-4), 267-274.
Wallis D. I. (1964). The foraging behaviour of
the ant Formica fusca, Behaviour, 23,
149-176.
Waloff N. (1957). The effect of the number of
queens of the ant Lasius flavus (Fab.)
(Hym. Formicidae) on their survival and
on the rate of development of the first
brood, Insectes Sociaux, 4, 391-408.
Waloff N., Blackith R. E. (1962). The growth
and distribution of the mounds of Lasius
flavus (F.) (Hymenoptera: Formicidae) in
Silwood Park, Berkshire, J. of Animal
Ecology, 31, 421-437.
Watson J. A. L. (1973). The worker caste of
the hodotermitid harvester termites, Insec-
tes Sociaux, 20, 1-20.
Watson J. A. L. (1974). The development of
soldiers in incipient colonies of Mastoter-
mes darwiniensis Froggatt (Isoptera),
Insectes Sociaux, 21, 181-190.
Watson J. A. L., McMahan E. A. (1978). Polye-
thism in the Australian harvester termite
Drepanotermes (Isoptera, Termitinae) (Ter-
mitidae), Insectes Sociaux, 25 (1), 53-62.
M. J. (1953). The relationship between
certain ant species with particular reference.
Литература 385
to biological control of the coreid, The-
raptus sp. Bulletin of Entomological Re-
search, 44, 669-691.
Way M. J. (1954). Studies of the life history
and ecology of the ant Oecophylla longi-
noda (Latr), Bulletin of Entomological Re-
search, 45, 93-112.
Way M. J. (1963). Mutualism between ants
and honeydew-producing Homoptera, An-
nual Review of Entomology, 8, 307-344.
Weaver N. (1957). Effects of larval age on di-
morphic differentiation of the female ho-
ney-bee, Annals of the Entomological So-
ciety of America, 50, 283-294.
Weber N. A. (1972). Gardening ants-The atti-
nes. Memoirs of the American Philosop-
hical Society, Philadelphia, vol. 92, 146, pp.
Wehner R. (1976). Polarised-light navigation by
insects, Scientific American, 235 (1), 106—
114.
Weir J. S, (1959). Changes in the retro-cerebral
endocrine system of larvae of Myrmica and
their relation to larval growth and de-
velopment, Insectes Sociaux, 6, 375-386.
Weir J. S. (1973). Air flow, evaporation and
mineral accumulation in mounds of Mac-
rotermes subhyalinus (Rambur), J. of Ani-
mal Ecology, 42, 509-520.
Welch R. C. (1978). Changes in the distribution
of the nests of Formica rufa L. (Hyme-
noptera: Formicidae) at Blean Woods Na-
tional Nature Reserve, Kent, During the
decade following coppicing, Insectes Soci-
aux, 25, 173-186.
Wellenstein G. (1980). Auswirkung hiigelbauxen-
der Waldameisen der Formica rw/a-Gruppe
auf forstschadliche Raupen und das Wach-
stum der Waldbaume, Zeitschrift fur An-
gewandte Entomologie, 89, 144-157.
Wellington W. G., Cmiralova D. (1979). Com-
munication of height by foraging honey
bees Apis mellifera ligustica (Hymenoptera,
Apidae), Annals of the Entomological So-
ciety of America, 72, 167-170.
Wells P. H. (1973). “Honey bees”. In: Inver-
tebrate Learning, vol. 2, Arthropods and
Gastropod Mollusks (W. C. Corning,
J. A. Dyal and A. O. D. Willows, eds.),
Plenum Press, New York, pp. 173-185.
Wenner A. M. (1962). Sound production during
the waggle dance of the honeybee, Ani-
mal Behaviour, 10, 79-95.
Wenner A. M. (1974). Information transfer in
honey-bees. A population approach. In:
Advances in the study of communication
and affect, vol. I. Non-verbal communica-
tion (L. Krames, P. Pliner and T. Allo-
way, eds.), Plenum Press, New York and
London, pp. 133-169.
Werff P. A. von der (1981). Two mound types
of Macrotermes near Kajiado (Kenya): in-
traspecific variation or interspecific dever-
gence? Systematics Association Special vol.
19, Biosystematics of Social Insects (P. E.
Howse and J. L. Clement, eds.), Academic
Press, London and New York, pp.
231-247.
West-Eberhard M. J. (1969). The social biology
of Polistine wasps. Miscellaneous publicati-
ons of the Museum of Zoology, Univer-
sity of Michigan, 140, 1-101.
West-Eberhard M. J. (\9T3). Monogyny in “po-
lygynous” social wasps. Proceedings, Vllth
International Congress of the International
Union for the Study of Social Insects,
London, pp. 396-403.
West-Eberhard M. J. (1977). The establishment
of reproductive dominance in social wasp
colonies. Proceedings Vlllth Congress of
The International Union for the Study of
Social Insects, Wageningen, pp. 223-227.
West-Eberhard M. J. (1978). Temporary queens
in Metapolybia wasps: non-reproductive
helpers without altruism? Science, 200,
441-443.
Wheeler D. E. (1982). Soldier determination in
Pheidole bicarinata: inhibition by workers.
In: The biology of social insects, Pro-
ceedings of the Ninth Congress of the In-
ternational Union for the Study of Social
Insects, Boulder, Colorado (M. D. Breed,
C. D. Michener and H. E. Evans), West-
view Press Boulder, Colorado, p. 257.
Wheeler D. E., Nijhout H. F. (1981). Imaginal
wing discs in larvae of the soldier caste
of Pheidole bicarinata vinelandica Forel
(Hymenoptera: Formicidae), International
J. of Insect Morphology and Embryology,
10 (2), 131-139.
Wheeler J. W., Blum M. S. (1973). Alkylpyra-
zine alarm pheromones in Ponerine ants,
Science, 182, 501-503.
Wheeler J. W., Evans S. L., Blum M. S., Tor-
genson R. L. (1975). Cyclopentyl ketones:
Identification and function in Azteca ants,
Science, 187, 254-255.
Wheeler W. M. (1910). Ants, their structure,
development and behaviour, Columbia bio-
logical series, vol. 9, Columbia University
Press.
Wheeler W. M. (1922). Ants of the American
Museum Congo Expedition. A contribution
to the myrmecology of Africa, Bulletin of
The American Museum of Natural Histo-
ry, 45, 1-1139.
Wheeler W. M. (1936). Ecological relations of
ponerine and other ants to termites. Pro-
ceedings of the American Academy of
386 Литература
Arts and Sciences, 71, 159-243.
Wheeler W. M. (1942). Studies of neotropical
ant-plants and their ants, Bulletin of the
Museum of Comparative Zoology at Har-
vard College, 90, 1-262.
Whitford W. G. (1978). Structure and seasonal
activity of Chihuahua desert ant communi-
ties, Insectes Sociaux, 25 (1), 79-88.
Whitford W. G., Johnson P. L., Ramirez. J.
(1976). Comparative ecology of the harvest-
er ants Pogonomyrmex barbatus (F. Smith)
and Pogonomyrmex rugosus (Emery),
Insectes Sociaux, 23, 117-132.
Whitford W. G., Depree E., Johnson P. (1980).
Foraging ecology of two Chihuahuan de-
sert ant species; Novomessor cockerelli and
Novomessor albisetosus, Insectes Sociaux,
27 (2), 148-156.
Whitham T. G. (1977). Coevolution of foraging
in Bombus and nectar dispensing in Chi-
lopsis: A last dreg theory, Science, 197,
593-596.
Wielgolaski F. E. (ed.) (1975). Fennoscandian
tundra ecosystems, Part I, Springer-Verlag,
Berlin, Heidelberg, New York.
Wille A., Michener C. D. (1973). The nest ar-
chitecture of stingless bees with special re-
ference to those of Costa Rica (Hymenop-
tera: Apidae), Revista de Biologia Tropi-
cal, Universidad de Costa Rica, 21 (1),
279 pp.
Williams G. C., Williams D. C. (1957). Natural
selection of individually harmful social
adaptation among sibs with special refe-
rence to social insects, Evolution, II, 32-39.
Williams R. M. C. (1959). Colony development
in Cubitermes ugandensis Fuller (Isoptera:
Termitidae), Insectes Sociaux, 6 (3),
291-304.
Willis E. O., Oniki Y. (1978). Birds and army
ants, Annual Review of Ecology and Sys-
tematics, 9, 243-263.
Wilson D. S. (1980). The natural selection of
populations and communities, Benjamino/
Cummings, Menlo Park, California, pp.
186.
Wilson E. O. (1953). The ecology of some
North American Dacetine ants, Annals of
the Entomological Society of America, 46
(4), 479-495.
Wilson E. O. (1955). A monographic revision
of the ant genus Lasius, Bulletin of the
Museum of Comparative Zoology at Har-
vard College, 113 (1), 1-199.
Wilson E. O. (1962). Chemical communication
among workers of the fire ant Solenopsis
saevissima (Fr. Smith). 1. The Organisation
of mass-foraging. 2. An information analy-
sis of the odor trail. 3. The experimental
induction of social responses, Animal Be-
haviour, 10 (1-2), 134-164.
Wilson E. O. (1964). The ants of the Florida
keys, Breviora, Museum of Comparative
Zoology, Cambridge, Mass., 210, 1-14.
Wilson E. O. (1971). The Insect Societies, The
Belknap Press of Harvard University
Press, Cambridge, Massachusetts, 548 pp.
Wilson E. O. (1974a). The population conse-
quences of polygyny in the ant Leptotho-
rax curvispinosus, Annals of the Entomo-
logical Society of America, 67 (5), 781-
786.
Wilson E. O. (1974b). Aversive behavior and
competition with colonies of the ant
Leptothorax curvispinosus, Annals of the
Entomological Society of America, 67 (5),
777-780.
Wilson E. O. (1974c). The soldier of the ant
Camponotus (Colobopsis) fraxinicola, as a
trophic caste, Psyche, 81, 182-188.
Wilson E. O. (1975). Leptothorax duloticus and
the beginnings of slavery in ants, Evo-
lution, 29, 108-119.
Wilson E. O. (1976a). The organization of colo-
ny defense in the ant Pheidole dentata
Mayr. (Hymenoptera: Formicidae), Beha-
vioral Ecology and Sociobiology, 1, 63-81.
Wilson E. O. (1976b) A social ethogram of the
neotropical arboreal ant Zacryptocerus va-
rians, Animal Behaviour, 24, 354-363.
Wilson E. O. (1976c). The first workerless pa-
rasite in the ant genus Formica (Hymenop-
tera: Formicidae), Psyche, 83 (3-4), 277-
281.
Wilson E. O. (1976d). Which are the most pre-
valent ant genera? Studia entomologica,
19 (1^4), 187-200.
Wilson E. O. (1978). Division of labor in fire
ants based on physical castes (Hymenop-
tera: Formicidae: Solenopsis), J. of the
Kansas Entomological Society, 51 (4), 615—
636.
Wilson E. O. (1979). The evolution of caste
systems in social insects. Proceedings of
the American Philosophical Society, 123
(4), 204-210.
Wilson E. O. (1980a) Caste and division of la-
bor in leaf-cutter ants (Hymenoptera: For-
micidae: Atta). I. The overall pattern in
A. sexdens, Behavioral Ecology and Socio-
biology, 1, 143-156.
Wilson E. O. (1980b). Caste and division of la-
bor in leaf-cutter ants (Hymenoptera: For-
micidae: Atta). II. The ergonomic optimi-
zation of leaf cutting, Behaviorial Ecology
and Sociobiology, 7, 157-165.
Литература 387
Wilson Е. О. (1981). Communal silk-spinning
by larvae of Dendromyrmex tree-ants (Hy-
menoptera, Formicidae), Insectes Sociaux,
28 (2), 182-190.
Wilson E. O., Parish D. J. (1973). Predatory
behaviour in the ant-like wasp Methocha
stygia (Say) (Hymenoptera: Tiphiidae),
Animal Behaviour, 21, 292-295.
Wilson E. O., Holldobler B. (1980). Sex diffe-
rences in cooperative silk-spinning by wea-
ver ant larvae, Proceedings of The Natio-
nal Academy of Siences USA, 77 (4),
2343-2347.
Wilson E. O., Hunt G. L. (1966). Habitat selec-
tion by the queens of two field-dwelling
species of ant, Ecology, 47 (3), 485-487.
Wilson E. O., Regnier F. E. (1971). The evolu-
tion of the alarm-defense system in the
Formicine ants, American Naturalist, 105,
279-289.
Wilson E. O., Carpenter F. M., Brown W. L.
(1967). The first mesozoic ants, Science,
157, 1038-1040.
Winston M. L. (1979). Intra-colony demography
and reproductive rate of the africanized
honeybee in South America, Behavioral
Ecology and Sociobiology, 4, 279-292.
Winston M. L. (1980). Swarming, afterswarm-
ing, and reproductive rate of unmanaged
honeybee colonies {Apis mellifera), Insectes
Sociaux, 27 (4), 391-398.
Winston M. L., Otis G. W. (1978). Ages of
bees in swarms and after swarms of the
Africanized honeybee, J. of Apicultural
Research, 17 (3), 123-129.
Winston M. L., Taylor O. R. (1980). Factors
preceeding queen rearing in the Africa-
nized honeybee (Apis mellifera) in South
America, Insectes Sociaux, 27 (4), 289-304.
Winston M. L., Otis G. W., Taylor O. R.
(1979). Absconding behaviour of the Afri-
canized honeybee in South America, J. of
Apicultural Research, 18 (2), 85-94.
Winter U. (1979). Untersuchungen zum
Raubzugverhalten der dulotischen Ameise
Harpagoxenus sublaevis (Nyl.), Insectes So-
ciaux, 26 (2), 121-132.
Winterbottom S. (1981). The chemical basis for
species and colony recognition in three
species of myrmicine ants. (Hymenoptera:
Formicidae), Doctoral thesis, University of
Southampton.
Wirtz P. (1973). Mededelingen von de Land-
bo uwhogeschool to Wageningen, Agricultu-
ral University of Wageningen, Wageningen.
Wood T. G. (1978). Food and feeding habits
of termites. In: Production Ecology of
ants and termites (M. V. Brian, ed.), Cam-
bridge University Press, pp. 55-80.
Wood T. G. (1981). Reproductive species of
Microtermes (Isoptera, Termitidae). In:
The Southern Guinea Savanna near Mok-
wa, Nigeria. Systematics Association Speci-
al vol. 19, Biosystematics of Social Insects
(P. E. Howse and J. L. Clement, eds.),
Academic Press, London and New York,
pp. 309-325.
Wood T. G., Sands W. (1978). Termites in eco-
systems. In: Production ecology of ants
and termites, International Biological Pro-
gramme vol. 13 (M. V. Brain, ed.), Cam-
bridge University Press, Cambridge, pp.
245-292.
Wood T. G., Johnson R. A., Ohiagu С. E.
(1977). Populations of termites (Isoptera)
in natural and agricultural ecosystems in
Southern Guinea Savanna near Mokwa,
Nigeria, Geo-Eco-Trop., 1 (2), 139-148.
Wood T. G., Johnson R. A., Ohiagu С. E.
(1980). Termite damage and crop loss
studies in Nigeria-a review of termite
(Isoptera) damage to maize and estima-
tion of damage, loss in yield and termite
(Microtermes) abundance at Mokwa, Tro-
pical pest management, 26 (3), 241-253.
Woodell S. R. J. (1974). Anthill vegetation in a
Norfolk salt marsh, Oecologia, 16 (3),
221-225.
Woyke J. (1976). Brood-rearing efficiency and
absconding in Indian honeybees, J. of
Apicultural Research, 15 (3/4), 133-143.
Woyke J. (1980a). Effect of sex allele homo-
heterozygosity on honeybee colony popula-
tions and on their honey production. I.
Favourable development conditions and
unrestricted queens, J. of Apicultural Re-
search, 19 (1), 51-63.
Woyke J. (1980b) Genetic background of sexu-
ality in the diploid drone honeybee, J. of
Apicultural Research, 19 (2), 89-95.
Wynne-Edwards V. C. (1962). Animal dispersion
in relation to social behaviour, Oliver and
Boyd, Edinburgh, London.
Yamauchi K., Kinomura K., Miyake S. (1981).
Sociobiological studies of the polygynic
ant Lasius sakagamii. I. General features
of its polydomous system, Insectes Soci-
aux, 28 (3), 279-296.
Yasuno M. (1964a). The study of the ant
population in the grassland at Mt. Hak-
koda. II. The distribution pattern of ant
nests at Kayano glassland, Science Reports
of the Tohoku University, 4th Series,
Biology, 30 (1), 43-55.
Yasuno M. (1964b). The study of the ant po-
pulation in the grassland at Mt. Hakkoda.
III. The effect of the slave making ant
Polyergus samurai upon the nest distribu-
388 Литература
tion pattern of the slave ant, Formica fus-
ca japonica. Science Reports of the Toho-
ku University, 4th Series, Biology, 30 (2),
167-170.
Yasuno M. (1965a). The study of ant popula-
tion in the grassland at Mt. Hakkoda. IV.
The stability of the ant population, Science
Reports of the T6hoku University, 4th Se-
ries, Biology, 31 (2), 75-81.
Yasuno M. (1965b). The study of ant popula-
tion in the grassland at Mt. Hakkoda. V.
The interspecific and intraspecific relation
in the formation of the ant population,
with special reference to the effect of the
removal of Formica truncorum yessensis,
Science Reports of Tokohu University, 4th
Series, Biology, 31 (3), 181-194.
Yasuno M. (1965c). Territory of ants in the
Kayano grassland at Mt. Hakkoda,
Science Reports of the Tohoku University,
4th Series, Biology, 31 (3), 195-206.
Series, Biology, 31 (3), 195-206.
Yensen N., Yensen E., Yensen D. (1980). Inter-
tidal ants from the Gulf of California,
Mexico, Annals of the Entomological So-
ciety of America, 73, 266-269.
Yoshikawa K. (1963). Introductory studies on
the life economy of polistine wasps, Osaka
City University.
Zakharov A. A. (1980). Observer ants: Stor-
ers of foraging area formation in Formica
rufa L. (Formicidae: Hymenoptera), In-
sectes Sociaux, 27 (3), 203-211.
Zucchi R., Sakagami S. F. (1972). Capacidade
termo-reguladora em Trigona spinipes e em
algumas outras especes de abelhas sem fer-
rao (Hymenoptera: Apidae: Meliponinae),
in Homenagem a W. E. Kerr, Rio Clara,
Brasil, pp. 301-309.
Предметный указатель
Анальная пища 177
Бельта тельца 35, 146
Вентиляция (гнезд) 135-143
Виляющий танец 67-68
Витамины 19
Воск пчелиный 124
Гнезда 113-123
Гормоны 217, 223, 231-232, 237-240, 242, 243,
259, 354
Грассленды 316-321
Дюфуровы железы 70, 71, 95, 112, 145, 155-157,
168, 277
Копуляция 243-257
Кормовые яйца 166-168, 170-171, 184, 224
Луговые и лесные сообщества 316-320
Материнское манипулирование 266-267
Маточное молочко 44, 170, 174
Мед (как корм) 169-170, 174
Медоносная пчела см. Apis
Муравьи в лесу 339-343
- в пустынях 334-337
- на плантациях 343-349
Насонова железа 69, 247
Однополые пары 219
Отбор групповой 271-273
- родичей 262-266
Падь 30-32
Перга 174
Полигенные семьи 267-269
Псевдоэргаты 162
Пчелы в тропических лесах 337-339
- общественные, филогения 16
Пыльца (как корм) 42-45. См. также Перга
«Рабовладение» 69-70, 324-327
Расселение 243-257
Степи 321-328
Термиты, сообщества в тропических лесах
337-339
- в пустынях 328-334
- роль в экосистемах 15
- филогения 12-13
Феромоны 63-65, 83, 84, 144, 146, 148, 151,
155-159, 108, 174, 179, 208, 210-212, 218-220,
222, 248, 250, 251, 253, 259
Шмели, фуражировка 46-54. См. также Bombus
Указатель латинских названий
Acacia 34, 35, 96, 146, 296, 328
Acantholepis capensis 348
- custodiens 131, 348
Acanthomyops 253
Acanthotermes acanthothorax 159
Acer 248
Aconitum columbianum 150, 210, 310
Acromyrmex 73, 91, 191, 342
- octospinosus 22, 190, 277
- versicolor 73, 130
Adaiphrotermes 94
Aenictus 26, 149, 150, 341
- gracilis 28, 264, 341
- laeviceps 28, 341
Agapostemon 147
Agrostis alba 33
- tenuis 33
Aleurodidae 30
Allodontotermes 90
- giffardi 255
Allognathotermes hypogeus 255, 256
Amblyopone 25
pallipes 25, 88, 166, 174, 181, 187, 199
Amitermes 83, 133, 139, 159, 256, 342
- evuncifer 231, 327, 331, 333, 334
- hastatus 13
- meridionalis 132
- vit iosus 100
Amitermitidae 339
Amitermitinae 12, 13, 109, 158, 231
Anacanthotermes 132
Ancistrotermes 139, 339
- cavithorax 94, 331-333
- guineensis 191
Andrena 45
Andropogon 24
Anergates atratulus 251, 273
Апотта 86, 149, 212, 250
- kohli 26, 86, 334
- nigricans 86, 150
- wilverthi 85
Anoplolepis custodiens 129, 130, 345
- longipes 93, 345
Anthophoridae 16
Aphaenogaster fulva 39, 296
- rudis 39, 293, 295, 296, 322, 323, 326
Aphidae 30
Aphis ulicis 38, 303, 317
Apicotermes 105
- desneuxi 159, 199
- gurgulifex 199, 329
Apicotermitinae 25
Apidae 16, 46
Apinae 16, 17
Apini 17, 123, 148, 170, 311, 312
Apis 117, 122-124,140, 148,171, 173-175,213,223,
242, 244, 250, 265, 277, 338, 351
- сегапа 122, 141, 148, 210, 211, 312-314
- - indica 142, 312
- dorsata 67, 122, 123, 139, 140, 142, 148, 149, 313,
314
- florea 122, 140, 142, 148, 149, 312-314
- indica 67
- mellifera 17, 44, 66-68, 122-124, 141, 142, 148,
149, 196, 198, 210, 211, 257, 262, 265, 278, 288,
289, 312-314, 338
— adansonii 142, 197, 246, 248, 313
- - capensis 223
- - carnica 67
— fasciata 67
- -- ligustica 67, 142, 314
— scutellata 313
Apoidea 16
Apomyrma 25
Apotrigona nebulata 139, 171
Aristida pungens 37
Asteraceae 33
Atopomyrmex 36
Atta 40, 61, 74, 91, 151, 155, 342
- cephalotes 41, 56, 57, 59, 73, 74, 152, 342
- mexicana 42, 74
- sexdens 56, 57, 59, 130, 152, 168, 177
- texana 74, 152
Attini 41, 88, 168, 285
Auglochlorini 16
Azteca 35, 40, 96, 146, 155
- chartifex 110
- longiceps 96
Balanites 82
Barteria 146
- fistulosa 96
Belonogaster 267, 268
• - griseus 120, 268
Betula pubescens 32
Bibio 31
Bombinae 16
Bombini 16, 46, 169, 170
Bombus 16, 45, 47, 50, 54, 116, 117, 123, 140, 148,
169, 170, 179, 187, 203, 207, 208, 210, 220, 221,
239, 240, 244, 265, 278, 309, 338
- affinis 47
Указатель латинских названий 391
- appositus 50, 52, 53, 310
- atratus 148, 169, 188, 195, 278, 290
- bifarius 49, 52
- flavifrons 310
- hortorum 47, 53, 309, 310
- humilis 194
- hypnorum 221, 309
- kirbyellus 52
- lapidarius 47, 148, 244, 309
- lucorum 46, 50, 115, 244, 309, 310
- morio 55, 56, 195
- occidentalis 310
- pascuorum 50, 56, 169, 194, 207, 244, 257, 309,
310
- pratorum 244, 309, 310
- sonorus 52
- sylvicola 52
- terrestris 113, 179, 222, 310
- terricola 179, 265, 310
- vagans 48, 310
Boraginaceae 96
Bothroponera soror 63
Brachypodium pinna turn 99
Brachyponera 36
- senaarensis 130
Braunsapis 89
Bulbitermes 109, 338
Calluna 276, 300
- vulgaris 36, 276, 300
Calotermes 219, 229
- flavicollis 22, 176, 177, 190, 230, 256
Calotermitidae 12, 20, 21, 78, 93, 199
Camponotini 111, 127
Camponotus 30, 92, 111, 139, 156, 304, 323, 334,
340-342
- acvapimensis 92, 304, 346
- consobrinus 156
- femoratus 346
- ferrugineus 322, 323
- herculeanus 290, 325, 326
- lateralis 289
- pennsylvanicus 38, 39, 65
- platanus 34, 35
- senex 111
- sericeus 66
- socius 66
- solon 304
- vagus 93, 172, 173
- vividus 304, 348
Carebra 26, 190
Carex pedunculata 38, 39
Carya 322
Cassia 311
Cataglyphis custor 172, 227
- guineensis 348
Cecropia 35, 146
- peltata 96
Centromyrmex 25
Cerapachyini 25, 28
Ceratini 16, 89, 172
Cercidium 328
Chilopsis liniaris 52
Cicindela 25
Cinara pruinosa 31
Coccidae 30, 32
Cpdonanthe 110
- crassifloria 40
Collembola 25
Colobopsis 156, 160
Comitermes cumulans 334
Conomyrma bicolor 337
- insana 336
Convolvulaceae 37
Coptoformica 287
Coptotermes 78, 135, 332
- formosanus 160
- lacteus 100, 159, 332
Coptotermitinae 12
Cordia alliodora 96
Cortus woodsonii 34, 35
Crematogaster 40, 65, 109, 116, 129, 139, 155, 302,
334, 340, 346
- africana 346-348
- ashmeadi 154
- clariventris 346-348
- depressa 346, 347
- gabonensis 348
- heliophila 302
- impressa 109, 110, 302
- ledouxi 129
- limata 342, 343, 347, 348
- longispina 39
- skonnensis 129
- striatula 346-349
- vandeli 129
Cryptotermes brevis 296
- havilandi 199
Cubitermes 86, 100, 305
- exiguus 136, 328
- fungifaber 132, 339
- severus 199, 327
- sankurensis 332
Cymbopogon 24
Cyperaceae 38
Cyphomyrmex 40, 88, 91
- rimosus 322
Dacetini 26
Dactylurina 139
- staudingeri 117
Delphinium barbeyi 310
• nelsoni 53
Dendromyrmex 111, 112
Digitalis purpurea 42
Diplorhoptrum fugax 73, 326
392 Указатель латинских названий
Discothyreus 25
Dolichoderinae 18, 35, 40, 60, 77, 96, 133, 156, 308,
335, 340
Dolichoderus quadripunctatus 171
Dolichovespula sylvestris 164, 186, 195, 196, 203,
204 222 257
Dorylinae 18,26, 59,60, 87,152, 249-250, 337, 341,
351
Dorylus 86, 149
- affinis 60
- nigricans 199
Drepanosiphum platanoides 31, 32
Drepanotermes 102
Echium vulgare 28, 47
Eciton 83, 149, 212, 249, 250, 289, 341
- burchelli 152, 199, 341, 342
- hamatum 84, 140, 166, 342
- vagans 341
Ecitonini 93
Emmotum fagifolium 41
Erica cinerea 36
Erigonum 297
- trichopes 40
Erodium cicutarium 36
Eucalyptus marginata 20
Euglossini 16
Evolvulus 37
Evylaeus 180
- calceatus 206, 220
- malachurus 194, 221
- marginatus TOT, 257
Exoneura 180
Exopterigota 12
Fagus 322
Festuca ovina 99
- rubra 33, 303, 319-321
Forda formicaria 33
Formica 30, 56, 73, 110, 151, 156, 286-288,
305^-308, 321, 327
- aquilonia 32, 288, 306, 307, 316, 318
- cinerea 306, 325
- cunicularia 321, 322
- exsecta 287, 306, 326
- exsectoides 136, 287
- fukaii 326
- fusca 60, 65, 66, 70, 91, 92,94, 277, 286, 288, 306,
307, 317, 319, 325, 326
- japonica 92, 134, 286, 326
- lemani 92, 134, 255, 307, 316, 317, 319
- lugubris 31, 173, 287, 288, 306, 307, 316, 318
- microgyna 286, 287
- neogagates 286
- obscuripes 33, 265
- obscuriventris 287, 340
- opaciventris 75, 287, 326
- pallidefulva 263, 286
- polyctena 306, 347
- pergandei 70, 156
- perpilosa 130, 336
- polyctena 77, 137, 138, 154, 173, 199, 218, 277,
287
- pratensis 76,78,173,218,287,288, 306, 307, 321,
322, 325
- rufa 31, 32, 56, 75, 110, 136, 137, 173, 199, 254,
287, 306, 307, 318, 325, 326
- rufibarbis 286, 306, 325, 326
- sanguinea 70, 92, 173, 286, 288, 293, 306, 325
- subintegra 70, 156
- suhpilosa 321
- tdlbotae 286
- transkaucasica 306, 320, 321
- truncorum 288, 306, 307, 326, 327
- ulkei 110, 136
- uralensis 306, 321
Formicidae 16, 18
Formicinae 18, 32, 38, 70, 93, 110, 172, 174, 218,
302, 316, 322, 323, 340
Formicini 323
Formicoidea 16, 30
Formicoxenus 290
- nitidulus 250, 326
Frankenia laevis 100, 312
Frodium cicutarium 36
Geophilidae 25
Geotrigona subterranea 157
Geraniaceae 40
Globitermes sulphureus 159-160
Gnatamitermes 83
- perplexus 333
- tubiformans 329
Halictidae 16, 46, 112, 139
Halictinae 113
Halictini 16, 95
Harpagoxenus 69, 243
- americanus 69, 151
- canadensis 251
- sublaevis 69, 218, 251, 263
Hedera helix 45
Helianthella quinquenensis 34
Helianthemum 35, 99
Helianthus annuus 49
Hemitermes laurensis 332
Heterotermes 256
- aureus 329, 333
Heterotermitinae 12
Hieracium pilosella 301
Hodotermes 83, 175
- mossambicus 13, 22, 56, 175, 332
Hodotermitidae 12, 13, 20, 22, 56, 175
Hodotermitinae 12, 13, 20, 83
Homo sapiens 17
Hospitalitermes 24
Указатель латинских названий 393
- monoceros 159
Hymenoptera 11, 14, 163, 179, 221, 243
Hypoponera 25
- eduardi 250
Hypotrigona 139, 244
- braunsi 158
bnpatiens 47
- glandulifera 43
Iridomyrmex 323, 340
- caudatus 343, 344
- humilis 77, 155, 164, 171, 344, 345
- pruinosum 336
- purpureus 156, 293, 323, 324
Isopoda 25
Isoptera 11
Julidae 25
Kalotermitidae 296
Lacessitermes 109
Lamium album 43
Larrea tridentata 42, 336
Lasioglossum 95, 274
- linearis 95
- malachurus 95
- nigripes 95
- zephyrum 148, 180, 207, 220, 253
Lasius 76, 98, 99, 172, 215, 255, 263, 286, 302, 317,
319, 326
- alienus 38, 39, 200, 253, 255, 263, 303, 304,
317-321, 334
- flavus 32, 33, 98-101, 134, 135, 189, 190, 253,
255, 263, 286, 292, 300-304, 317-321, 325, 337,
352
- fuliginosus П, 110, 156, 277
- neoniger 255, 303, 304
- niger 60, 98, 134, 172, 173, 189, 215, 253, 255,
263, 286, 290, 292, 302-304, 318-320, 325, 327
- sakagami 286, 290
- umbratus 327
Leguminosae 96
Leptogenys 25
- occilifera 75
Leptomyrmex 308
- fragilis 308
- lugttbris 308
Leptothoracini 168, 218, 251, 263
Leptothorax 69, 151, 216, 285, 289, 290, 326
- acervorum 69, 316, 326
- curvispinosus 263, 290, 327
- duloticus 69, 151, 263, 327
- gredleri 290
- longispinosus 69
- muscorum 218
- nylanderi 215, 226
- acervorum 218
Lestrimelitta cubiceps 158
- limao 158
Leurotrigona miilleri 139
Linum catharticum 320
Longipeditermes longipes 338
Loudetia 333
Macrotermes 64, 82, 132, 136, 139, 191, 198, 229,
256, 305, 308, 333, 338
- bellicosus 22, 26, 100, 102, 104, 105, 159, 198,
232, 259, 334
- carbonarius 159, 308
- malaccensis 308
- michaelseni 22, 104, 232
- natalensis 104, 136, 159, 256, 327, 332, 333
- subhyalinus 22, 106, 135, 192, 199, 231, 234
Macrotermitinae 12, 13, 22, 41, 55, 93, 130, 159,
176, 191, 231, 258, 305, 331, 334, 339
Malacosoma 33
Malvastrum 37
Manica rubida 89, 326
Marlierea montana 42
Masaridae 43
Mastotermes darwiniensis 12, 19, 100, 158, 229
Mastotermitidae 12
Medicago sativa 45
Megaponera 25, 64, 340
- foetens 25, 63, 64, 144, 249, 334
Melipona 66, 210, 240, 243
-favosa 179, 180
- quadrifasciata 66, 170, 262
- seminigra 66
Meliponinae 116, 139, 157, 170, 222
Meliponini 16, 139, 170, 171, 198, 240, 278, 311
Melophorus 323
Membracidae 30
Mentzelia 37
Messor 36, 40, 169, 190, 301, 302
- aciculatum 189
- arenarius 37, 90, 91
- capitatus 36, 168, 169, 301, 302
- ebeninus 90
- galla 37, 130, 302
- regalis 130, 302
- structor 36, 301, 302
Metapolybia 185, 221, 268, 290, 338
- aztecoides 206, 268
Methoca 25, 88
Microcerotermes 20, 338
- arboreus 100, 199
- parvulus 331
Microtermes 231, 256, 333, 339
- havilandi 257
- toumediensis 331
Mischocyttarus 268, 278, 331, 332, 338
- drewseni 206, 268
394 Указатель латинских названий
- flavitarsus 268
- immarginatus 337
- mexicanus 186
Monacis debilis 342
Monomorium 73, 171, 217, 218, 285
- minimum 322
- pharaonis 71, 73, 169, 199, 200, 216, 226, 254
- venustum 65
Moraceae 146
Myrmecia 28, 89, 166, 187, 200, 243
- brevinoda 295
- forceps 166
- forficata 187
- gidosa 144, 166
- pilosula 293
- regular is 187
Myrmeciinae 18, 144
Myrmecina graminicola 290
Myrmecocystus 174, 336, 337
- mexicanus 337
- mimicus 323, 325
Myrmica 26, 28, 38, 56, 64, 65, 98, 167-171, 173,
194, 197, 200, 204, 205, 212-218, 222, 226, 232,
235-242, 258, 259, 264, 277, 281-285, 298, 302,
316, 319, 326
- hirsuta 285, 287
- limanica 206, 258
- rubra 65, 133, 150, 193, 199, 200, 213, 217,
224-226, 264, 276, 283, 284, 286, 288, 290-293,
299, 318, 320
- ruginodisH, 98,193, 213, 215, 226, 281-285, 288,
298-300, 302, 316, 317, 319, 320, 327
— (macrogyna) 264, 281
- - (microgyna) 264, 281
- sabuletifi, 215, 226, 258, 264, 285, 292, 301, 319
- scabrinodis 65, 71, 98, 217, 298-302, 316, 317,
319-321
- schenki 264
- sulcinodis 217, 264
Myrmicinae 18, 26,28, 36, 39, 56, 60, 64, 70, 71, 89,
98, 109, 150, 151, 155, 156, 167, 181-184, 190,
218, 250, 316, 317, 323, 326, 335, 340
Myrmicocrypta 342
Myzus persicae 30
Nama 40
Nannotrigona postica 198
Nasutitermes 78, 110, 116, 133, 139, 159
- corniger 159, 290
- costalis 81, 100, 330
- ephratae 22
- exitiosus 20, 21, 100, 135, 136, 329, 332
- lujae 176, 177
- surinamensis 199
- triodei 332
Nasutitermitinae 12, 13,22, 100, 109, 158, 159, 191,
231, 305, 339
Neivamyrmex 341
- carolinensis 285
- nigrescens 84, 150, 166, 337
Neotermes jouteli 219, 233
- tectonae 190, 199
Noditermes 339
Nomada 147
Novomessor 36, 65, 296
- albisetosus 296
- cockerelli 296, 335-337
- pergandei 335
Odontomachus 144, 213, 232
- haematoides 212
- troglodytes 63
Odontotermes 26, 99, 103, 107, 176, 331, 332
- monodon 107
- obesus 199
Oecophylla 18, 32, 56, 76, 78, 80, 81, 112, 129, 157,
172, 226, 286, 352
- longinoda 32, 34, 79, 157, 190, 277, 345-349
- smaragdina 343-346
Oenothera 37
Oligohaeta
Operophtera brummata 31
Oporima autumnata 32
Opuntia 328
Orycteropus afer 99
Oryctolagus caniculosus 99
Paltothyreus 25
- tarsatus 90, 144
Papaver 49
Papaveraceae 39
Papilionaceae 34, 45
Paratrechina arenivaga 322
- flaviceps 322
- melanderi 322, 323
Paratrigona subnuda 208
Parischnogaster mellyi 185
Pectocarya 37
Periphyllus testudinaceous 31
Pheidole 81, 84, 152, 154, 217, 218, 237-239, 285,
334-336, 340
- biconstricta 152
- dentata 56, 152
- desertorum 297, 335
- fallax 152
- fervida 322
- megacephala 343-345
- militicida 73, 74, 154, 297
- pallidula 152, 301
- punctulata 345
- rugolosa 297
- teneriffana 152
- tucsonica 297
- vallicola 297
- xerophila 336
Picea abies 31
Указатель латинских ни маний 395
Pinus 20
Plagiolepis grassei 218
- pygmaea 172, 218, 237
Plantago 37
Platythyrea 25
Plebeia droryana 198
Pletroctena 25
Paa annua 36
Pogonomyrmex 36, 37, 71, 72, 151, 169, 252, 292,
296, 297, 335, 336
- badius 71, 72, 277
- barbatus 296, 297, 335
- californicus 336
- desertorum 337
- maricopa 72, 297
- montanus 36, 37
- negosus 335
- occidentalis 90, 133
- owyheei 177
- rugosus 36, 37, 71, 72, 296, 335, 336
Polistes 118-120, 123, 139, 147, 186, 195, 207, 221,
244, 268, 277, 278
- annularis 118, 185, 309
- canadensis 119, 147, 185, 207, 244
- jlavus 118
- fuscatus 119, 185, 221, 244, 265, 308
- gallicus 118
- goeldii 119
- major 118
- metricus 185, 292, 308
Polistinae 117-119
Polistini 165
Polybia 118, 257
- occidentalis 337, 338
- rejecta 338
- sericea 147
Polybiini 17, 120, 165, 221, 244, 267, 268
Polybioides tabidus 120
Polyergus 70, 324
- lucidus 70, 324
- rufescens 70, 286, 325-327
- samurai 92
Polyrachis 111, 341
- simplex 111
Ponera scabra 295
Ponerinae 18, 25, 26, 36, 60, 63, 144, 212, 232, 249,
250
Populus 45
Prenolepis imparis 73, 243, 263, 322, 323
Procubitermes 24
Prosopis 40, 296, 328, 336
Protopolybia 338
- pumila 221
Prunus serotina 33
Psammotermes 132, 328
- hybostoma 19
Psammotermitinae 12
Pseudacanthotermes militaris 94, 95, 255, 331-333
Pseudomyrmeciinae 35, 96
Pseudomyrmex 35, 96, 146, 279
- ferruginea 279, 280
- venefica 279-281, 283, 285
Pseudoplatanus 31
Psithyrus 187
Pteridium aquilinum 304
Pterotermes 256
Quercus 31, 248, 322
Raphanus sativus 30
Raptiformica 306
Reticulitermes 230
- hesperus 190
- lucifugus 191
Rhinotermitidae 12, 13, 20, 158, 190, .230, 339
Rhinotermitinae 12
Rhytidoponera chlybaea 293
- impressa 293
- metallica 250
Ropalidia 268
- cincta 120
Rosa Carolina 310
Rosaceae 45
Rubus fruticosus 45
Saissetia zanzibarensis 32
Salix 45
Sanguinaria canadensis 39
Scaptotrigona 62, 157
- postica 170, 222
Schedorhinotermes 158, 159, 231, 236
Scoliodea 25
Sericomyrmex 342
Serviformica 70, 133, 306
Sifolinia 285
Solenopsis 110, 171, 190, 138, 253, 285, 298, 344
- geminata 73, 152, 238, 243, 298
- invicta 38, 56, 73, 89, 98, 99, 130, 151, 171, 189,
217, 238, 251, 253, 263, 277, 285, 298, 340, 344
- picta 110
- richteri 73, 298
- xyloni 73, 298, 322, 335
Solidago 47
Sphecoidea 14, 25, 43
Stenogastrinae 17, 185, 268
Strongylognathus 324
- karawegi 327
- testaceus 218
Symphytum offinale 54
Synoecia surinamus 147
Tamar ix 111
Tapinoma erraticum 134, 171, 172
Taraxacum officinale 45
Temnothorax recedens 168
Tenuirostritermes tenuirostris 191
Terminalia amazonica 41
396 Указатель латинских названий
Termitidae 12, 13, 20, 22, 25, 83, 93, 100, 158, 176,
191, 220, 229, 231
Termitinae 12, 13, 22, 25, 78, 102, 105, 231, 339
Termitomyces 22
Termopsidae 199
Termopsinae 12, 13, 21, 78, 93, 158, 175
Tetramoriini 324
Tetramorium 56, 98, 109, 171, 190, 259
- aculeatum 109, 340, 346-349
- caespitum 36, 38, 98, 188-189, 217, 218, 251, 253,
258, 263, 273, 292, 317-322, 326, 347
Tetraneura ulmi 33
Tetraponera 146
- aethiops 296
Thymus 99
Tilia 45, 47
Tiphiidae 25
Tiphioidea 16
Tortrix viridana 31
Trachymyrmex 342
- smithi 40, 130, 337
Trifolium pratense 47
- repens 45
Trigona 62, 157, 158, 312
- braunsi 158
- fulviventris 311, 312
- fuscipennis 311
- iridipennis 313
- nebulata 139
- oyani 116
- portoi 116
- postica 62
- recursa 114
- spinifer 139
- subnuda 247, 289
- subterranea 62, 157
- sylvestriana 312
- testaceicomis 312
Trinervitermes 83, 139, 159, 191, 305, 328, 329, 331,
333, 334
- auritermes 193
- bettonianus 82, 256"
- carbonarius 193
- ebenerianus 193
- geminatus 24, 132, 159, 199, 256, 305, 328,
332-334
- occidentalis 305
- oeconomus 193, 305, 333
- suspensus 191, 193
- togoensis 305, 333
- trinervius 24, 305
- trinervoides 82, 332, 333
Typhlopone 86
Vlex minor 38, 303, 317
Ulmus 45
Veromessor 36, 84
- pergandei 37, 72, 335, 336
Vespa 62, 149, 309
- analis 309
- crabro 309
- dybowskii 309
- mandarinia 309, 312
- orientalis 122, 165, 210
- tropica 309
- xanthoptera 309
Vespidae 16, 17, 146
Vespinae 17, 120, 122, 123, 164, 165, 186, 210, 222
Vespoidea 17, 25, 43
Vespula 28, 54,62,120,140,145,146,149,164, 165,
187, 203, 209, 244, 258, 277
- germanica 164, 165, 204, 257, 278, 309
- norwegica 309
- rufa 120, 309
- sylvestris 309
- vulgaris 120, 165, 195, 196, 203, 204, 222, 309
Vicia cracca 47
- faba 50
Viola 39
Wasmannia auropunctata 34, 35
Xylocopini 16
Yucca 336
Zacryptoceros 156, 238
- varians 154, 155
Zootermopsis 93, 229
- angusticollis 256
- nevadensis 81, 158, 175, 256
Оглавление
Предисловие редактора перевода 5
Предисловие 10
Глава 1. Введение 11
Глава 2. Пища 19
2.1. Термиты как разрушители
растительных остатков 19
2.2. Осы и муравьи как хищники 25
2.3. Сахара как источник энергии,
уменьшающий потребность в
животной пище 28
2.4. Потребители семян (карпофаги) 36
2.5. Муравьи-листорезы 40
2.6. Потребители пыльцы 42
Глава 3. Индивидуальная
фуражировка 46
3.1. Стратегия фуражировки 46
3.2. Вариабельность рабочих особей 54
Глава 4. Групповая
фуражировка 62
4.1. Передача информации о корме 62
4.2. Групповые рейды муравьев-
«рабовладельцев» 69
4.3. Тоннели и дороги 70
4.4. Кочевая фуражировка 83
Глава 5. Гнезда в полостях и
почвенные холмики 88
5.1. Полости и норки 88
5.2. Земляные холмики 98
Глава 6. Гнезда из растительных
волокон, шелка и воска 109
6.1. Холмики из растительных
материалов и гнезда на деревьях 109
6.2. Соты 112
Глава 7. Микроклимат 128
7.1. Выбор мест с подходящими
условиями 128
7.2. Метаболическая регуляция 135
Глава 8. Защита 144
8.1. Болезненные и парализующие
впрыскивания 144
8.2. .Ядовитые мазки и репелленты 149
Глава 9. Переработка пищи 162
9.1. Пережевывание, экстрагирование и
отрыгивание 164
9.2. Желточные пищевые добавки 166
9.3. Трофические железы головы 171
Глава 10. Ранние этапы роста
семьи 179
10.1. Распределение корма 179
10.2. Основание семьи 184
10.3. Взрыв численности 193
Глава 11. Созревание семьи 202
11.1. Простые модели размножения 202
11.2. Регуляция каст со стороны
семьи 206
11.3. Самцы общественных
перепончатокрылых 220
11.4. Общие представления о созревании
семьи 227
Глава 12. Воспроизводство 229
12.1. Морфогенез каст 229
12.2. Копуляция и расселение 243
12.3. Продукция 257
12.4. Общие выводы 259
Глава 13. Эволюция сообществ
насекомых 261
13.1. Теории индивидуального отбо-
ра 261
13.2. Модели изложенных теорий 269
13.3. Групповой отбор 271
13.4. Заключение 273
Глава 14. Семьи 274
14.1. Обособленность семей 274
14.2. Число самок и экология вида 277
14.3. Взаимодействие между самками и
Oe.me.ieiiue
родственные отношения между
ними 288
Глава 15. Сравнительная экология
видов, принадлежащих к одному
роду 295
15.1. Расы муравьев и термитов 295
15.2. Муравьи пустынь 296
15.3. Муравьи и термиты в грасслен-
дах 297
15.4. Лесные муравьи и термиты 305
15.5. Осы и шмели 308
15.6. Высшие пчелы 311
Глава 16. Многовидовые сообщест-
ва 316
16.1. Луговые и лесные сообщества
умеренной зоны 316
16.2. Сообщества пустынь 328
16.3. Тропический дождевой лес 337
16.4. Общие выводы 349
Глава 17. Две темы 350
17.1. Мутуалистические взаимоотношения
с растениями 350
17.2. Организация семьи 352
Литература 356
Предметный указатель
Указатель латинских названий
МОНОГРАФИЯ
Майкл Воган Брайен
ОБЩЕСТВЕННЫЕ НАСЕКОМЫЕ
ЭКОЛОГИЯ И ПОВЕДЕНИЕ
Ст. научн. редактор Ю. И. Лашкевич
Мл. научн. редактор 3. В. Соллертинская
Мл. редактор Н. Ю. Плавинская
Художник Е. И. Волков
Художественный редактор Л. М. Кузнецова
Технический редактор В. П. Сизова
Корректор Т. П. Пашковская
ИБ № 5607
Сдано в набор 25.07.85.
Подписано к печати 27.08.86.
Формат 70 х 90V16
Бумага офсетная № 1
Печать офсетная. Гарнитура тайме
Объем 12,50 бум. л. Усл. печ. л. 29,25
Усл.кр.-отт. 58,50 Уч.-изд. л. 32,86 Изд. № 4/4119
Тираж 5.800 экз. Зак. 754 Цена 3 руб.
ИЗДАТЕЛЬСТВО «МИР»
129820, ГСП, Москва, И-110, 1-й Рижский пер., 2.
Можайский полиграфкомбинат Союзполиграфпрома
при Государственном комитете СССР по делам
издательств, полиграфии и книжной торговли.
143200, г. Можайск, ул. Мира, 93.