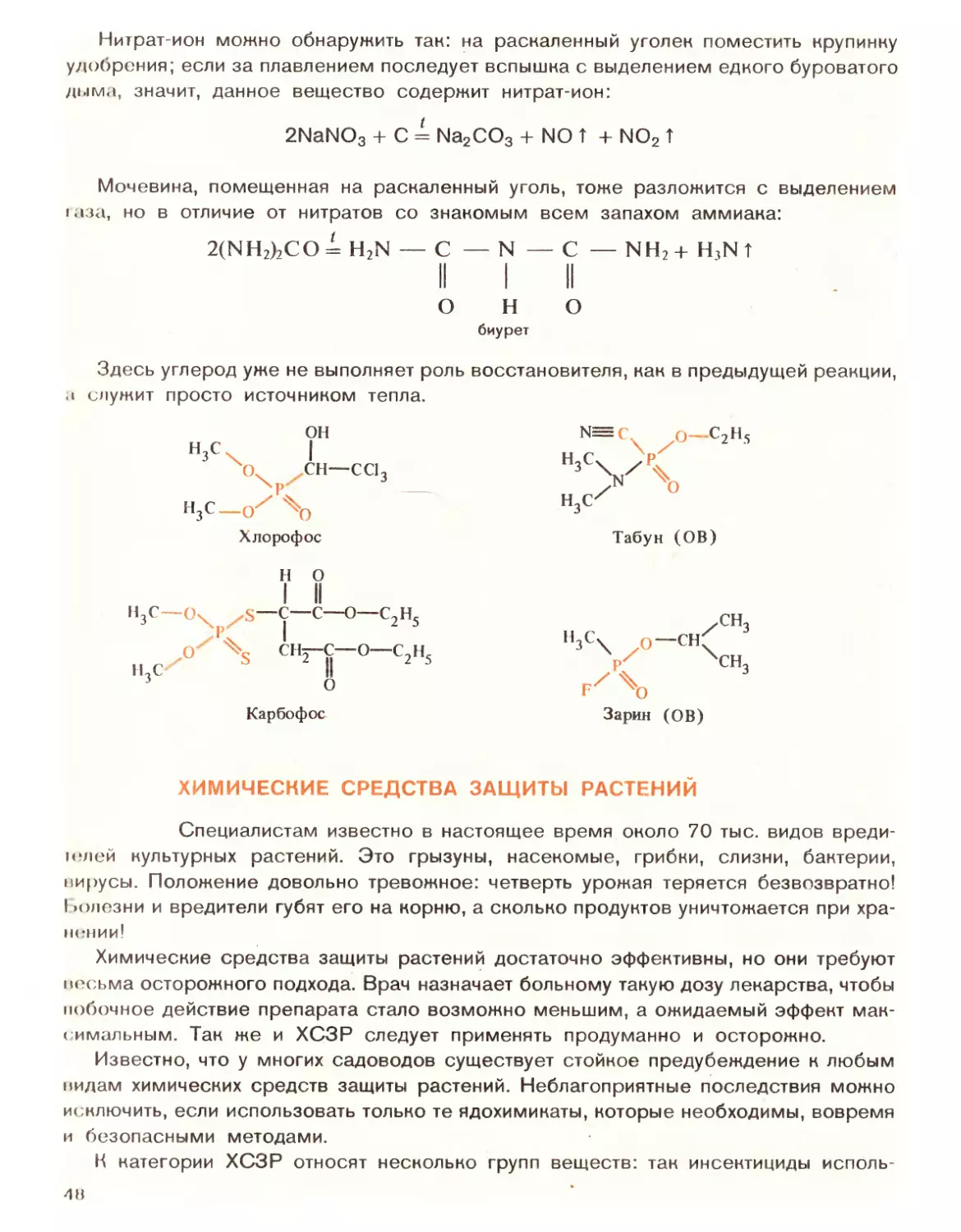
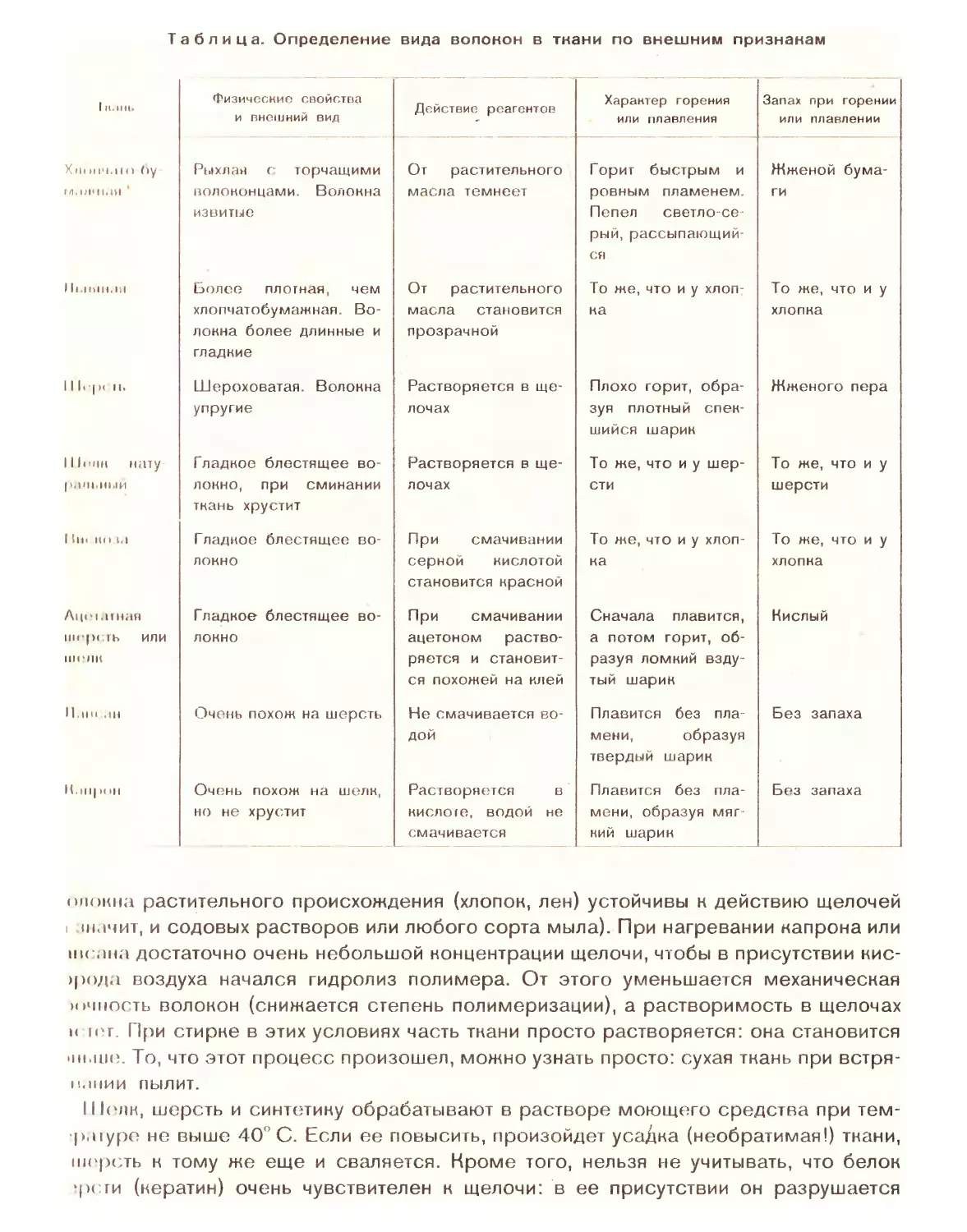
Автор: Попов В.А. Семенов А.С. Харлампович ГД.
Теги: химия аналитическая химия издательство просвещение история химия
Год: 1992
Текст
ГД. Харлампович
А.С.Семенов
В.А.Попов
МНОГОЛИКАЯ
химия „
Москва
«Просвещение»
1992
I >H 24
X21
XVI
Рецензенты: доктор химических наук МГУ им, М. В. Ломоносова Г. В. Лисичкин, кан-
дида1 химических наук института органической химии В. И. Бетанели, учитель химии
средней школы № 7 г. Миасса Л. П. Шлапакова
Харлампович Г. Д. и др.
Многоликая химия; Кн. для учащихся/Г. Д. Харлампович, А. С.
Семенов, В. А. Попов.-М.: Просвещение, 1992.-159 с: ил.-ISBN 5-09-
002628-9.
Как соединить полученные на уроках химии знания с окружающей нас жизнью? Как
применять эти знания на практике? На эти и другие вопросы ребята найдут ответы в этой
книге. Авторы приглашают юных читателей в увлекательное путешествие в мир
окружающих пас химических веществ. Одна из особенностей книги - обилие советов о
практическом использовании веществ при ремонте квартиры, авто- и мототранспорта, при
уходе за растениями на приусадебном участке.
4306020000-381 24190 (заназ по нв-и-ш» ББК24
103(03)92
ISHN 5-09-002628-9 © Харлампович Г. Д., Семенов А. С, Попов В. А., 1992
ПРЕДИСЛОВИЕ
Если Вы неравнодушны к домашним заботам, если Вам приятны
пешие походы, автомобильные путешествия и мотоспорт —прочтите эту
книгу.
Вы узнаете о том, почему не рекомендуется солить огурцы мелкой
солью и жарить картофель на сливочном масле, о том, как действуют
лекарственные препараты и стиральные порошки.
Вы решили заниматься ремонтом квартиры или автомобиля самостоя
тельно — не спешите сразу браться за такое серьезное дело: откройте
сперва эту книгу. Вы узнаете о достоинствах и возможностях
материалов, необходимых для ремонта, о разнице в составе красок для
автомобиля.
Книга подскажет Вам,-что необходимо взять в дальнюю дорогу, чтобы
обезопасить себя от комаров и других насекомых, как очистить воду для
питья, как подать сигнал товарищам, если Вы попали в беду или
заблудились.
■
Надеемся, что многим школьникам эта книга поможет в выборе
жизненного пути. Под ее влиянием кто-то найдет свое призвание в
профессии фармацевта, парфюмера или пиротехника.
Обратите внимание на цветную вклейку: предмету туристского снаря
жения и отделочные материалы, автокосметика и парфюмерия, моющие
средства, многие предметы быта —все это продукция современного
химического производства.
3
Оригинальное художественное оформление книги подчеркивает
индивидуальность ее содержания.
Книга познакомит Вас с секретами стойкости запаха духов и
одеколонов, с влиянием ароматических веществ на состояние организма и
настроение, с волшебными превращениями причесок под действием
специальных красящих и моющих средств.
Садоводством занимаются миллионы людей. Но лишь немногие из них
знакомы с секретами многочисленных «химических заводов»,
работающих в почве. В этой книге Вы найдете рекомендации по грамотному и
эффективному ведению основных практических работ на приусадебном
участке.
7
2шава
ш
г
химия пищи
(J)
ч^
актически нет ни одного пищевого продукта, который ныне не под-
вергся бы детальному анализу. Определены состав и физиологичес-
к.и1 роль важнейших веществ, попадающих ежедневно с пищей в наш организм. Уста-
ноилоно, какие именно вещества являются источниками запаха хлеба или земляники.
Разумеется, далеко не все уже известно, и здесь, конечно, ничего удивительного
нот: ведь большинство истин относительно, а процесс познания бесконечен. Удру-
чае! другое: знания, подтвердившиеся на практике, не применяются в нужной мере
вследствие традиционного консерватизма людей, так как
■
пинию к питанию создавались веками.
И .мой главе авторы знакомят читателей с химическим составом и свойствам
ычаи и привычки по отно
«■ /
важнейших пищевых продуктов и их отдельных компонентов, с изменениями, которые
происходят с этими веществами во время приготовления пищи, а также при заго-
тонко продуктов впрок.
Мы знаем, что пища состоит из органических компонентов: белков, жиров и угле-
водов. С пищей организм получает различные минеральные соли, витамины, воду.
Человеческий организм —своеобразный «химический комбинат». Здесь, как и в
линюм производственном цикле, своя продукция, свои отходы, проблемы с ремон-
том, у<аранением последствий аварий различного масштаба.
■
ш,^-.,,,^^,..^^^^», -.—-*; —»~~^~—— ■r.^.1-nrr iirttimHi**№^^ 1|ЦмШ1Ип>|1|1 miiiiiiaiiiiiiiMiiiiiiiiiiitoiiMi■тип шитики и..м.лтщ-..тм-атимши^иwi —г^т-итттшш—
тзддошшяятйК!
тжздиожшдоююья^тог ншммиянишш над
Продолжая аналогию с современным химическим производством, обратим
внимание на, необходимость тщательной подготовки сырья.
Обычно на обогатительных фабриках природное сырье очищают, вносят необходи
мые добавки, агломерируют получившиеся мелкие кусочки вещества для удобства
использования и транспортировки.
Похожая «обогатительная фабрика» существует в каждом доме, в каждой
квартире—это кухня. Здесь удаляют ненужные примеси, производят необходимое
измельчение и термическую обработку.
Человеческий опыт веками отбирал оптимальные методы приготовления пищи.
Сегодня мы можем взглянуть на них, оценить эти методы, вооружившись знаниями
химии, и проследить, что происходит при кулинарной обработке с основными компо
нентами нашего рациона.
ЖИРЫ
Люди очень давно научились выделять жир из натуральных объектов и
использовать его в повседневной жизни. Жир сгорал в примитивных светильниках,
освещая пещеры первобытных людей, жиром смазывали полозья, по которым в воду
спускали суда; атлеты древней Эллады натирали растительными маслами
обнаженные тела, чтобы сделать кожу более эластичной.
7
Неудивительно, что химикам давно хотелось разобраться в том, что же собой
представляет жир. Однако лишь в 1 779 г. великий шведский химик К. Шееле прибли-
аился н решению этой задачи. Нагревая оливковое масло с оксидом свинца, он полу-
чип осадок и какое-то сладкое, растворимое в воде вещество. Он назвал его «жиро-
вым сахаром». Только лет через 40—45 французский химик М. Шеврель определил
строение этого жирового сахара и назвал его глицерином (от греч. «гликос» —
сладкий). Он же доказал, что осадок представляет собой свинцовые соли так называемых
жирных кислот.
Главной составной частью жиров являются сложные эфиры — производные трех-
атмного спирта (глицерина) и некоторых органических кислот, имеющих в
углеводородном радикале от 5 до 24 атомов углерода. Однако в любом природном жире есть
и другие компоненты, с важнейшими из которых мы и познакомимся.
Фосфатиды— ближайшие родственники сложного эфира. Это они выпадают в
осадок в бутылках с растительным маслом и способствуют образованию вкуснейшей
корочки на поджаренном картофеле. В фосфатидах, кроме фрагментов молекул
глицерина и жирных кислот, можно обнаружить также остатки фосфорной кислоты и ее
производных. Примером фосфатида является лецитин, играющий важную
физиологическую роль, а также служащий прекрасным эмульгатором, что позволило использо-
вать его в производстве шампуней:
R—углеводородные
радикалы
Стерины — полициклические спирты сложного строения. Важнейшим представи-
гелем этого класса соединений является холестерин (провитамин D), который
встречаемся только в жирах. Его брутто формула С27Н4бО.
Жирорастворимые витамины. Ими богата печень рыбы и морского зверя, а
гакже летнее сливочное масло (витамины A, D), растительные жиры (Е, Н).
Пигменты — вещества, придающие окраску жирам. Из них хлорофилл придает
юленый оттенок конопляному маслу, каротиноиды окрашивают сливочное масло в
желтый цвет. Интересно, что летнее масло имеет окраску более интенсивную: пиг-
менты переходят в него из травы, а масло, полученное зимой, более бледно, так как
сено и солома пигментами бедны.
Вкусовые примеси и носители запаха. Состав их многообразен и сложен.
I >уког» аромата сливочного масла определяют по меньшей мере 27 соединений,
я
Н0С—О—СГ
I </>
НС—О—Сч
XR2
. он_
он
I
Н0С—О—Р=0
I
а—лецитин
Если обработать любой жир перегретым паром, цвет и запах исчезнут, жиры будут
отличаться только температурами плавления. Практически, кроме масла из
клещевины (касторового), все растительные и животные жиры пригодны в пищу, в том
числе моржовый, тюлений и китовый жиры, кокосовое масло и др.
Какова же роль жиров на нашем «химическом комбинате», куда они поступают и
что с ними происходит?
С химической точки зрения из всех компонентов пищевого рациона жиры найме
нее окислены. Вот почему биохимические процессы превращения жиров сопровож
даются выделением значительного количества энергии. Мы знаем, как быстро могут
загореться пары жира при неосторожном поджаривании пищи на сковороде. Про
должая аналогию, можно предположить, что в организме жиры как источник энергии
в первую очередь потребуются энергетическим станциям клетки — митохондриям
Обычно в запас отправляется малая толика жира, остальное расходуется по назначе
нию в процессе жизнедеятельности организма.
К сожалению, малоподвижный образ современной жизни не способствуем рас
ходу избытков энергетического запаса, и человеку грозит ожирение. Именно поэтому
необходимо рациональное питание, особенно в пожилом возрасте. «Если хочешь
продлить свою жизнь, укороти свои трапезы»,—сказал еще в XVIII в. известный уче
ный Б. Франклин.
Рациональное питание вовсе не означает, что жиры следует резко ограничит), в
рационе. Кроме источника энергии, они являются поставщиками необходимых
нашему организму соединений.
С жирами мы получаем незаменимые жирные кислоты, без которых нарушается
обмен веществ, витамины, а также холестерин. Организм может синтезировать
холестерин сам. Но если в крови холестерина слишком много, то его избыток осе
дает на стенках кровеносных сосудов и возникает серьезная болезнь — атероскле
роз. Если в рационе присутствуют растительные жиры, то холестерин усваивается
меньше. В растительных маслах содержатся жирные кислоты с несколькими двои
ными связями в углеводородных цепях (их называют полиненасыщенными жирными
кислотами), которые ускоряют обмен холестерина в организме, уменьшают его
содержание в крови и, следовательно, опасность отложения холестерина на стенках
кровеносных сосудов. А содержащиеся в масле растительные стерины тормозя!
поступление холестерина из кишечника в кровь и уменьшают его усвоение. Вт
почему для безаварийной работы «химического комбината» мы должны ежесуточно
употреблять 5—10 г ненасыщенных кислот или 20—25 г растительного жира.
Специалисты установили, что потребность человека в жирах с возрастом изме
няется. Это отнюдь не означает, что с возрастом каждый день придется съедать
половину пачки сливочного масла. Желательно другое: чтобы каждые сутки в меню
появлялось растительное масло объемом не менее одной столовой ложки для перво
классника и двух-трех ложек для выпускника средней школы. На потребность в расти
тельных жирах накладывает отпечаток и профессия—докеры должны получать в день
до пяти ложек растительного масла, а бухгалтеры — вдвое меньше.
Заботясь о рациональном питании, следует учитывать суммарное содержание
жиров во всех продуктах. Так, к примеру, в 100 г хлеба их не более 2 г, в той же
массе нежирной говядины—до 7,5, а в утином мясе —до 30 г!
Л гоперь поговорим о производстве, хранении и потреблении различных жиров.
Сливочное масло является конечным продуктом переработки «сока жизни» (так
назвал молоко Гиппократ). С химической точки зрения молоко —эмульсия жира в
поде. Стабильность этой системы поддерживается очень тонкой белково-лецитино-
-
пои оболочкой. Капельки жира заполняют все пространство водного слоя. Со
временам компоненты молока разделяются (у них неодинаковая плотность) и на поверх-
*****
шили возникает слой сливок. Здесь капельки все еще сохраняют свою оболочку.
_
Моному, чтобы из сливок получить масло, ее необходимо разрушить: сливки сби-
вают, после этого молочный жир слипается в сплошную массу (масло), а «кусочки»
полковой оболочки и остаток воды образуют «отход» масляного производства
naxiy.
Химические превращения фактически начинаются, когда сливки для увеличения
сроков хранения масла подвергают термической обработке. В этом случае часть
сахара подвергается «карамелизации», а масло в результате приобретает кремовый
оттенок, ореховый привкус и получает название «Вологодское».
Крестьянское» масло по сравнению с «Вологодским» более богато белками и
ииiаминами группы В. Но за счет добавления пахты в нем содержится до 25/о воды
(вместо 15% в «Вологодском»
Топленое масло самое богатое жиром (до 98%). Зато в нем практически нет ни
болка, ни витаминов: они разлагаются, когда сливочное сортовое масло подвергают
жесткой термической обработке. Так как влаги в готовом продукте остается не
более 1%, топленое масло хранится значительно дольше в тех же условиях, что
и другие сорта, ибо размножение микроорганизмов сдерживается в безводной
преде.
Актуальность роста производства растительных масел объясняется экономичес-
ними соображениями, а также возросшей возможностью промышленной перера-
ботни жидких жиров в продукты высокого потребительского спроса.
С глубокой древности известен метод прессования семян масличных культур.
Часть масла при таком способе, конечно, оставалась в жмыхе. Чтобы снизить потери
до минимума, в настоящее время технологи подоорали такие растворители, с
помощью которых удалось повысить степень извлечения масел до 98%>. Чаще всего в
ной роли выступают бензин и четыреххлористый углерод. Поскольку температура их
кипения много ниже, чем масла, полное отделение растворителя сложности не пред-
ставляет. Более того, растворитель используется многократно, что, естественно, зна-
чиюльно снижает себестоимость продукции.
Дополнительная обработка растительных масел включает и щелочную промыв
И этой стадии из хлопкового масла удаляется госсипол— соединение, окрашиваю-
V/ *0 W
щее его в непривычный для потреоителеи коричневый цвет.
На основе растительных масел готовят популярнейшие пищевые продукты — майо-
'
нез и маргарин. Твердение растительных жиров происходит в результате химических
процессов, в частности гидрирования.
кшн
Энергия химической связи в молекуле водорода относительно велика (435 гт^г).
По: и ому в автоклаве при 150—160° С жир выдерживается от 3 до 6 ч. Через него
непрерывно продувают водород, а для того чтобы обеспечить быстрейшее достиж
К)
ние химического равновесия, в систему вводят гранулированный медно-никелепыи
катализатор.
Продолжительность пребывания жира в реакторе зависит от того, для какой цели
его производят. Если гидрожир потом пойдет для маргарина, его не стоит глубоко
гидрировать: это приведет к появлению неприятного «сального» привкуса.
Кроме саломаса (так в СНГ называют гидрожир), из растительных масел полу
чают полуфабрикат для мыла и стеарина.
Процесс гидрогенизации жиров поставил перед технологами ряд проблем. Как
выяснилось, суть его состояла не только в присоединении водорода по месту двои
ной связи в молекулах ненасыщенных кислот. Дело в том, что в результате ряда
побочных реакций твердение жиров сопровождается образованием ацетальдегида
СН3СОН, формальдегида НСОН, муравьиной кислоты НСООН и даже метанола
СН3ОН. Поэтому, перед тем как поступить в следующий цикл производства, гидриро
ванные жиры проходят стадию рафинации-очень тщательной очистки от упомянугых
выше соединений, а также от мельчайших кусочков катализатора, остающихся после
отфильтровывания его гранул в саломасе.
А теперь речь пойдет о наиболее важном искусственном пищевом продуйте
маргарине, о котором иной раз можно услышать не совсем объективные суждения 01
людей, малосведущих в химии.
Впервые термин «маргарин» появился на свет более 100 лет назад для обозначь
ния продукта, полученного французским химиком Меж-Мурье в 1869 г. Император
Франции Наполеон Ш пообещал крупный приз тому, кто сумеет найти дешевый заме
нитель сливочного масла в рационе солдат. Меж-Мурье предложил схему про
изводства, сохранившуюся в своей основе вплоть до наших дней. Он представил на
конкурс несколько килограммов продукта, который был назван маргарином потому,
что в его составе предполагалось преобладание маргариновой кислом»!
CH3(CH2)i5COOH. Такая кислота действительно в маргарине есть, но ее не так уж
много —около 1% от остальных аналогичных соединений. Пожалуй, в выборе назва
ния немалое значение имел и внешний вид полупрозрачной голубоватой массы про
дукта (от греч. «маргон» —жемчуг).
Дешевизна получаемого по способу Меж-Мурье маргарина была весьма относи
тельной: сырьем для него служил высококачественный говяжий жир.
В 1930 г. маргарин начали получать в СССР. Перед остальными жирами мар
гарин обладает несомненными преимуществами, поскольку это сбалансирован
ный по физиологическим показателям состав (70% твердых и 30% жидких жиров)
и его эмульсионное строение способствует легкой усвояемости всех компонен
тов.
При создании рецептуры маргаринов технологи стараются учитывать традицион
ные вкусы потребителей, для этого воспроизводится внешний вид и другие качества
сливочного масла. Для придания продукту соответствующего запаха и вкуса в нею
вводят сквашенное молоко. Эта добавка повышает и антибактериальные свойства
маргарина. Губительную для микроорганизмов среду создают молочные кислоты
Белок молока и лецитин, создавая прочную пленку на микрокапельках жира в эмуль
сии, способствуют сохранению структуры продукта. Из всех добавок к основ
ному компоненту— жиру к разряду синтетических относится только диацетил
1 I
(\ 13СОСОСН3, усиливающий специфический аромат. Не только к маргарину
добавляют диацетил — он идет с той же целью и в сливочное масло, и в растворимый
кофе.
Вот состав самого массового, универсального маргарина, выпускаемого в нашей
стране: саломас —55%, растительное масло — 20%, жир морских животных—1 5%,
кокосовое масло—10%. Называется он «Столовый» и составляет 85% от общего
выпуска маргаринов. В другие сорта вводят сливочное масло («Сливочный»),
топленое4 масло («Российский»),
В последнее время пищевая промышленность приступила к освоению новой тех-
нологии производства маргарина, основанной на замене в молекуле основного
жирового вещества одних углеводородных остатков на другие. В этом принципиаль
нов отличие нового процесса переэтерификации жиров от исторически сложивше-
| ося гидрогенизации. Серийно выпускается по новой технологии маргарин
«Славянский», обогащенный витамином А. Антибактериальные свойства и специфический
вкус придает ему лимонная кислота.
А может ли жир состариться? Органические вещества, имеющие сложный со-
i ми, редко сохраняют свою стабильность при длительном хранении. Жир, к
сожалению, относится к категории скоропортящихся продуктов прежде всего из-за
взаимодействия с кислородом воздуха. 1
Исследование скоростей химических реакций в неоднородных системах показало,
что чем больше поверхность соприкосновения компонентов, тем активнее идет про-
цесс. К примеру, мука в мешке не загорается и от лучины, однако на мельницах раз-
рушительные взрывы взвешенной в воздухе мучной пыли происходят от небольших
искр.
Итак, чтобы уменьшить влияние внешней среды на жиры, необходимо
воспрепятствовать газообмену. Обычно в качестве упаковки используют специальную бумагу.
I в воздухонепроницаемость достаточна, чтобы обеспечить сохранность продукта в
указанные на упаковке сроки. Если же в магазине вам взвесили маргарин или другой
жир н обычную бумагу, дома его нужно поместить в стеклянную или фарфоровую
посуду. Скорость окисления жиров увеличивается с ростом температуры, при
освещении и т. д. Вот почему на этикетках упаковки маргарина или майонеза мы можем
увидеть указания на различные сроки хранения продукта в зависимости от темпера-
гурных условий.
Необязательно хранить жир в морозильной камере домашнего холодильника, но
обеспечить температуру не выше + 1 2° С следует непременно, иначе ускоряются
окислительные процессы и жиры портятся.
Следует учитывать, что многие вещества на свету теряют окраску или меняют ее
вследствие стимуляции химических превращений световыми квантами. Поэтому
жиры, как и другие пищевые продукты, лучше хранить в полной темноте: свет
способствует образованию пероксидных соединений и высокоактивных частиц —свободных
радикалов, за счет которых процесс окисления значительно ускоряется. Правда, в
жирах есть и «противоядие» —антиокислительные компоненты, например витамин Е
(ним символом обозначается целая группа соединений). Однако не стоит запасать
для длительного хранения рафинированное растительное масло: в нем витамина £
очень мало (он потерян во время очистки).
12
Какие же изменения происходят с жирами при упомянутых выше химических пре
вращениях? Здесь можно выделить несколько стадий процесса.
Прокисание. В конце гарантированного на этикетке срока хранения у жиров
может появиться кислый вкус. Появление кислот является следствием гидролиза
сложных эфиров:
?
Н2С—О—С—R
Q НлС—-ОН
НС
1 2| />
—О—С—R + ЗН.О *- НС—ОН + 3R—С
2 | N)H
Н2С—О—-С—R н2С—- ОН
О
Сложный эфир
Глицерин Жирная
кислота
Ясно, что маргарин с входящими в его состав 25% воды гораздо более подвер
жен прокисанию, чем топленое масло с минимальным содержанием влаги.
Прогоркание. Мы определяем время наступления этой стадии по тому, как
действуют на наши вкусовые рецепторы альдегиды и кетоны, образовавшиеся при старе
нии масла. Такой жир в пищу практически непригоден. Как показали исследования,
возникновение альдегидов и кетонов —каталитический процесс: он стимулируется,
в частности, металлическим железом. Поэтому ни в коем случае нельзя оставлять
на чугунной сковороде слой жира от сегодняшнего до завтрашнего обеда:
поверхность продукта, контактирующая с кислородом воздуха, велика —катализатор
рядом.
Прогорканию в кислородной среде способствуют и некоторые ферменты. В
частности, продукт их деятельности— «ржавая» селедка. Избавляться от ферментов не
резон: в плотно закрытых банках они способствуют таким превращениям, которые
придают селедке особый вкус и аромат, высоко ценящиеся любителями данного
продукта именно баночного (анаэробного, т. е. бескислородного) посола.
Осаливание —последний этап порчи жира. В его массе появляются оксикислоты
типа молочной Н3С —СН(ОН) — СООН, исчезает характерный желтоватый цвет,
изменяется к худшему запах и, что самое главное, вкус. Жир перестает достаточ
но быстро реагировать на ферменты слюны, и на языке появляется неприятное ощу
щение налета, который трудно устранить (кулинары называют его «салистый
привкус»).
Мы с вами рассмотрели сейчас те изменения, которые происходят с жирами за
относительно большой промежуток времени —до полугода в обычных условиях.
Далее речь пойдет о превращениях жиров на различных стадиях кулинарной обра
ботки.
Когда мы занимаем место у кухонной плиты, первая задача формулируется так:
«чтобы было вкусно». И очень редко вспоминаем о другой, гораздо более важной:
«чтобы было полезно». От того, насколько успешно сочетаются эти задачи, зави
13
' иi наше здоровье; поэтому необходимо хотя бы в общих чертах познакомиться
i ролью жиров и изменениями в их составе на различных стадиях кулинарной обра-
ботки.
Варна. Температура около 100° С, контакта продуктов с кислородом воздуха
почт пег. В этих условиях состав жира меняется незначительно за счет гидролиза
(см. ныше). Больше «достается» жирорастворимым витаминам: их термическая
устойчивость невелика, и при 90° С они уже трансформируются. Повышение кислот-
ности среды резко замедляет и гидролиз, и разрушение витаминов, так как
равновесие сдвигается в этом случае в сторону исходных продуктов (при гидролизе, как вы
■
помните, идет накопление кислот). Вот теперь, учитывая желательность сохранения
тиров и витаминов, рассудите, правильно ли перед приготовлением блюд из кислой
капусты промывать ее в нескольких водах.
А вот прием, которым варку можно значительно ускорить, однако... в журнале
Химия и жизнь», 1985, № 1, дан эпизод из жизни блокадного Ленинграда: «Анализ
i ;упа в одном из госпиталей показал, что витамина С там совсем нет. Несколько раз
момнни пробы— результат тот же. В чем дело? Решили побеседовать с поварихой:
как, мол, варите? Выяснилось: повариха пользовалась опытом некоторых домашних
хозяек —добавляла в суп питьевую соду. Так суп быстрее варился и экономилась
драгоценная энергия. Но при этом разрушалась аскорбиновая кислота, о чем жен-
типа не подозревала».
Действительно, добавление соды резко уменьшает жесткость воды, и проникно-
вение ее в клеточные мембраны облегчается. Клетки быстрее переполняются водой
и разрушаются, продукты развариваются эффективнее, но... разрушаются не только
клетки, но и витамины, и жиры.
Обжаривание. Эта операция проводится при 130 — 200°С и сопровождается
перемешиванием термически обрабатываемых продуктов.
В отличие от варки, где температура не превышает температуру кипения воды,
ишонсивность нагревания здесь значительно больше. Некоторые вещества перего-
няются вместе с перегретым водяным паром, выделяющимся при нагревании. Окис-
пения пищи не происходит.
Анализ состава обжаренных продуктов показывает, что в данном случае и гидро-
пиз проходит более глубоко, и продукты образуются несколько иные, в частности
окоикислоты и даже довольно длинные полимерные углеводородные «цепочки».
Для обжаривания годится не всякий жир. В топленом масле, например, уже через
I () минут жарения появляются оксикислоты, а в сливочном тем более. Так как из всех
видов жиров наибольшей термической устойчивостью обладает подсолнечное
масло, его и надо предпочитать всем иным видам жиров для высокотемпературных
кулинарных операций. Например, сырой картофель надо жарить на подсолнечном
масле, а вареный —на топленом масле. Тогда будет и вкусно, и полезно.
Марение во фритюре. Как показывает практика, при этой операции химико-тех-
иоло1ических нарушений бывает больше всего. Суть этого кулинарного приема
пофужение продуктов в сильно нагретый жир и выдерживание в нем до готовности.
Гаи жарят чебуреки, «хворост» и пирожки.
Расплавленный жир обладает способностью накапливать в себе и вещества из
обжариваемых продуктов, и те соединения, которые образуются при тепловом и
м
окислительном воздействиях. Для человека наибольшую неприятность представляет
акролеин, который в концентрации 70 мг/м3 смертельно опасен, а в меньших дозах
вызывает удушье и сильное слезотечение. Именно этими свойствами акролеина и
обусловлено действие кухонного чада;
н7с—он
2|
НС—ОН
н2с—он
Глицерин
из продуктов
гидролиза
жиров
нагревание
нх
2II
НС + 2Н00
I
нс=о
Акролеин
В принципе акролеин из жира можно удалить водой —в 100 мл воды его раство
ряется 40 г, да ведь не один акролеин портит вкус перегретого жира.
Конечно, неплохо было бы иметь несложное устройство для измерения темпера
туры на сковороде, а пока на помощь приходят компоненты жира, о которых мы неод
нократно говорили,—фосфатиды. Как только температура становится выше 200° С,
они темнеют и соответственно окрашивают продукт. Это сигнал к прекращению
нагревания, иначе даже самый термостойкий витамин А начнет интенсивно разру
шаться.
IB
УГЛЕВОДЫ
«Фруктовые воды несут нам углеводы» —это шутливое изречение
И. Ильфа и Е. Петрова недалеко от истины. Действительно, во фруктовых водах
■
можно обнаружить органические соединения, состав которых отвечает общей фор-
муле Сп(Н20)т; поэтому они получили название «углеводы».
Данной формуле отвечают альдегидоспирты или кетоспирты. Но конечно, к угле-
подам не относятся имеющие то же соотношение элементов общеизвестная
уксусная кислота СН3СООК, муравьиный альдегид НСОН и некоторые другие. Соедине-
мин с относительно небольшой молекулярной массой обычно называют сахарами,
упрощая химический термин «сахариды».
Углеводов человек должен получать не менее 500 г в сутки — примерно в 5 раз
больше, чем жиров. Именно жиры и углеводы—наш основной источник энергии.
Углеводы примерно вдвое менее калорийны, чем жиры. В то же время при
определенных условиях эти вещества в организме могут взаимопревращаться.
Когда глюкоза С6Н1206 поступает на «химический комбинат», ее энергетический
потенциал реализуется с помощью аденозинтрифосфорной кислоты (АТФ). Получен-
пая анергия используется при мышечных сокращениях, обеспечивает биосинтез и
в виде гликогена
иные процессы, без которых немыслим живой организм.
Углеводы могут откладываться в печени или в мы
(СбН10Об)п1 а в растениях —в виде крахмальных зерен. Отличие между этими веще-
санами есть: первое хорошо растворимо в воде, а второе —практически нет
Когда мы выполняем интенсивную физическую работу, гликоген подвергается
гидролизу: он деполимеризуется под действием воды, образуя молекулы глюкозы,
распространяющиеся по всему организму током крови. При этом у нас появляется
■
-
жажда не только из-за потери влаги с потом, но и из-за частичного расходования ее
на гидролиз гликогена. Поэтому, если на лыжной базе есть буфет, предпочтите всем
ят
о(аальным напиткам виноградный сок: два стакана сока утолят жажду и восп
расход глюкозы.
Читатель, по-видимому, ждет ответа на вопрос: а откуда все-таки человек в сут
набирает необходимые 500 г углеводов? (Доля сахара и крахмала в общей массе
*
получаемых нами углеводов меньше 40%.)
Давайте остановимся на «крупнотоннажных» углеводах и проследим, как они попа-
происходит и чем все эти превращения заканчи
/laioi в наш организм, что там с
ваются.
Гпюкоза. Ее большие таблетки с витамином С известны всем детям. Когда такую
тблетку отправляют в рот, не стоит забывать, что это в первую очередь медицинский
препарат, а уж потом средство удовлетворения потребности в сладком. Глюкоза
«
легко проникает в кровь, не задерживаясь в пищеварительной системе; она
поддерживает ослабленный организм, нормализует расстроенное пищеварение, поэтому
очень часто входит в состав лекарств. Этот моносахарид извлекают из
свекольной, картофельной, кукурузной патоки и даже из древесных опилок. Правда, в по-
следнем случае глюкозу используют как промежуточный продукт: при дальнейшем
-
го биохимическом превращении получают технический (гидролизный) этиловый
спирт.
и>
Фруктоза. Это тоже моносахарид, полностью сходный с глюкозой по составу,
но отличный по строению.
У фруктозы есть иное название —плодовый или фруктовый сахар. Ее можно на
звать и цветочным сахаром: из нектара пчелы переносят этот углевод в мед (там его
массовая доля достигает 50%). Конечно, из меда фруктозу извлекать невыгодно,
гораздо проще и дешевле подвергать соответствующей переработке обычный свен
ловичный или тростниковый сахар. Поскольку фруктоза примерно вдвое слаще саха
розы, ее использование в пищу желательно тем людям, у кого обмен веществ не
сколько нарушен. В лекарственные свойства меда вносит свою лепту и фруктоза.
Сахароза. Ее общая формула С^НггОц, она образуется из глюкозы и фруктозы
«за вычетом» одной молекулы воды.
С незапамятных времен знакомо человечество с сахарозой. Еще Александр
Македонский знал, что в Индии есть тростник, из которого можно получить мод без
помощи пчел. Жители Африканского континента извлекали сахарозу из пальмового
сока, североамериканские индейцы —из кленового. Сахароза, по существу, и есть
тот сахар (песок, рафинад), который является общеизвестным продуктом питания,
Массовое производство сахарозы из свеклы началось полтора века тому назад во
Франции.
В нашем организме в результате гидролиза из сахарозы (дисахарида) образую гея
оба упомянутых выше моносахарида в равных кол и цесхаах^^ *-. ■■ ^ ■■■■
Си с. - ',-: |у
катализатор
C12H22O11 + Н20 ' 2 С6Н1206
■
Катализаторами гидролиза в организме служат ферменты, однако и нагревание
может вызвать гидролиз. Поэтому, когда сиропы долго кипятят, они становятся
слаще — образуется фруктоза.
Лактоза. Этот углевод называют еще молочным сахаром, так как он преимуще-
ственно содержится в молоке животных. Лактоза, как и сахароза,—дисахарид, только
в ее молекуле вместо фруктозы с глюкозой связана галактоза. Глюкоза и галактоза
отличаются лишь взаимным расположением атома водорода и гидроксильной группы
мри одном из атомов углерода. Однако в сложных биохимических превращениях
пищи такое различие имеет огромное значение. С лактозой человек знакомится с
первых дней жизни, так как в материнском молоке нет других углеводов, кроме
лактозы.
Так же, как и глюкоза, лактоза может «бродить», только ей нужны для этого свои,
лактозные дрожжи. Тогда в продуктах брожения накапливаются соединения,
придающие молочным напиткам особый вкус.
Возьмем, например, кефир. Даже самый свежий, с клеймом на пробке, соответ-
сжующим завтрашнему числу, он уже пробыл на молокозаводе не менее четырех
суток. За это время в свежее пастеризованное молоко добавляют кефирную
закваску (до 50 кг/т молока), герметично закрывают его и выдерживают при
комнатной температуре около суток. Молоко свертывается, его охлаждают и выдерживают
еще трое суток. Смена температур ведет к изменению типа брожения —
молочнокислое* переходит в спиртовое:
О
/
при 18-20° С лактоза -> Н3С - НС(ОН) - С
\
ОН
при 6-10° С лактоза -> Н3С - С Н2 - О Н + С 02
При пониженной температуре процесс спиртового брожения идет очень мед-
пенно, но все-таки в готовом продукте появляется углекислый газ и незначительное
количество спирта. Дело в том, что кислота в составе кефира подавляет жизнедея-
гельность грибков и даже в несвежем продукте массовая доля этанола не
превышает 0,6%.
Другой молочный продукт такого же «комбинированного» брожения готовят из
кобыльего молока и называют кумысом. Поскольку температурный режим в походах
(кумыс национальный напиток многих кочевых племен) соблюдать было
затруднительно, то сложилась технология производства напитка с массовой долей спирта до
2,5%, что вполне сопоставимо с некоторыми сортами пива. Коран был против
использования спиртного, но не запрещал употребление кумыса. Быть может, поэ-
тму для кумыса продолжительность спиртового брожения стали удлинять... Оба про
дума (кефир и кумыс) обладают бактерицидным действием.
IB
Можно долго перечислять достоинства лактозы, но пора переходить к рассказу О
полимерных углеводородах.
Нрахмал. Степень полимеризации этого вещества чрезвычайно велика: его моле
кулярная масса исчисляется миллионами у. е.! Для растительных организмов крах
мал играет ту же роль, что и для животных гликоген: он подвергается гидролизу, и в
итоге снова образуется глюкоза.
Процесс гидролиза крахмала в организме человека сложный, но технологически
отработанный — крахмал уже на языке начинает свой ферментативный гидролиз;
н2о
(С6Н|о05)п -> (С6Н,0О5)х — С12Н22Ом
крахмал декстрин , мальтоза
Мальтоза не успевает превратиться в моносахариды за то время, которое мы
обычно затрачиваем на пережевывание, и процесс образования глюкозы из крах
мала заканчивается уже в пищеварительном тракте. Однако если содержащую крах
мал пищу (например, хлеб) пожевать, скажем, минуту или полторы, появляется отче!
ливый сладкий вкус.
Наш организм получает крахмал в основном с картофелем, однако массовая
доля этого углевода в клубнях не превышает 20%. Гораздо богаче крахмалом зерно
вые: рис — 80%, кукуруза—74%, пшеница—74%.
Целлюлоза (нлетчатна). Наконец речь пойдет о растительном полисахариде
сложного строения с такой же общей формулой, как и крахмал (С6Н10О,,)„.
Отличие крахмала от целлюлозы —в характере сочленений циклических фрагмен
тов глюкозы, из которых образованы оба полисахарида. В целом же в гигантских
молекулах целлюлозы (клетчатки) больше линейных, а в крахмале больше разветвлен
ных участков.
Примером чистой целлюлозы может послужить промокательная бумага или кусок
ваты. В растениях целлюлоза чаще всего соединена с другими органическими веще
ствами.
Поступая в наш организм с растительной пищей, клетчатка проходит желудок,
практически не изменяясь. Только травоядные животные и такие насекомые, как гер
миты, способны активно осваивать этот полимер: в их желудках находится особый
род бактерий, вырабатывающий фермент целлюлазу. Этим «ключом» легко размы
каются связи между мономерами глюкозы. Однако и в кишечнике человека в записи
мости от состава пищи переваривается лишь незначительная часть поступающей гуда
клетчатки. Остальная ее масса так и выводится из организма непереваренной, но
при этом целлюлоза способствует повышенному выделению пищеварительных соков
на всем своем пути, нормализуя работу кишечника.
БЕЛКИ
Не все, очевидно, задумываются над тем, сколько же мы реально исполу
зуем из той продукции, что дают нам нивы и пастбища. Не всякий читатель поверИ1
тому, что сейчас прочтет: в некоторых случаях мы получаем одну четвертую ч,и;ть
из того, что могли бы иметь, не будь многочисленных потерь от различных причин
10
Нужно заботиться не только о расширении пахотных площадей и повышении
урожайности, стоит подумать и над сокращением потерь на всех стадиях получения и
переработки пищевых продуктов.
Ученые подсчитали, что из основных компонентов пищи (белков, жиров,
углеводов) человечество острее всего ощущает дефицит в белках. Если по нормам,
установленным медиками, для взрослого здорового человека необходимо в день 80 —
100 г белков, то далеко не всегда этот минимум обеспечивается.
Чаще всего у человека, не очень сведущего в биохимии, понятие белка
ассоциируемся с куриным яйцом, точнее, с той его частью, которая после тепловой обработки
приобретает белый цвет. Следует заметить, однако, что в желтке белка больше, чем в
белке (14,6 и 10,6% соответственно). Чем же, с точки зрения химика, отличаются
белки от рассматриваемых ранее жиров и углеводов? Их главное отличие —в
чрезвычайной сложности строения белков и более разнообразном элементном составе.
Известно, что жиры и углеводы состоят в основном из трех химических элементов —
углерода, водорода, кислорода, а в состав белков обязательно входят азот, сера,
фосфор, а иногда в микродозах —и железо, иод, марганец, цинк, медь.
Структурными фрагментами белков являются аминокислоты (вспомните:
углеводы расщеплялись до глюкозы). Аминокислотный состав —причина большого
разнообразия белков по сравнению с другими известными нам структурами.
Особенность аминокислот —наличие двух функциональных групп: кислотной
( (ООН) и основной ( — NH2) — в одной молекуле. Они взаимодействуют друг с
другом (в соседних молекулах), образуя мостики:
-СООН+ -NH2= - CO-NH2- + Н20
Такими мостиками может быть соединено в цепи неограниченное число
различных аминокислот. А подвижность электронов азота и кислорода в амидной
группировке приводит к возникновению бесчисленных взаимодействий между цепями этих
биополимеров.
Какова же роль белков в организме? Распадаясь на структурные элементы
(аминокислоты), они служат строительным материалом во взрослом организме —для
«ремонтных работ», а в молодом, развивающемся—для «новостроек». Ведь белки —
это в конечном итоге сухожилия, мышцы, гемоглобин крови, кожа, ногти, волосы.
Кроме того, существуют белки, регулирующие процессы жизнедеятельности в
организме, белки, защищающие его от инфекции.
Представим теперь себе начальника управления капитального строительства
-химического комбината». Составляя заявку на материалы, которые необходимы для
строек, он заказывает не отдельные детали или строительные элементы, а чаще сразу
блоки и комплекты. Опытные прорабы могут на месте решить, что им из этого
комплекта использовать, что оставить про запас, а иной раз и списать за ненадобностью.
Однако есть такие элементы конструкций, которые ничем не заменишь и не изгото-
вишь в мастерских. Вот их-то и приходится дожидаться, а если они долго не
поступаю), то это вызывает тревогу.
В нашем организме имеются такие детали, они так и называются — незаменимые
аминокислоты. Для взрослого человека их всего 8 (триптофан, лейцин, изолейцин,
20
валин, треонин, лизин, метионин, фенилаланин), а для детей еще аргинин и гистидин,
Они обязательно должны содержаться в пище. А вот остальные, заменимые, ори
низм синтезирует сам —был бы в достатке связанный азот, без которого ни один
белок не может существовать.
Склады на «комбинате» небезграничны; поэтому, если они переполняются, 01
избытка «строительного материала» приходится избавляться. Вам знакомы костры из
строительного мусора, в котором тут и там видны вполне годные, но сию минуту
ненужные на стройке предметы? Так и на нашем «химкомбинате» лишний азот пере
ходит в мочевину, а часть аминокислот используется как источник энергии.
Но вот в результате каких-то недоразумений (а проще говоря, в результате непра
вильного, нерационального питания) в систему каждый день стали поступать гольно
самые дефицитные материалы, Как на это отреагирует «комбинат»? Оказывается,
точно таким же образом, как и на их нехватку. Начнется своеобразная «лихорадка»»
выбросить жалко, а использовать негде! Организм расстраивается от избытка не
меньше, чем от недостатка.
Пища измельчается зубами, смачивается слюной. Это очень важный момет в
пищевом конвейере, потому что здесь на продукты оказывается не только мехами
ческое, но и биохимическое воздействие слюны. Начинается гидролиз крахмала, час
тично жиров и белка.
В пищеводе пища долго не задерживается и попадает в желудок. Здесь пищевые
белки встречает пепсин— белок-хозяин, активность его обеспечивается соляной ки<
■ч
лотой, массовая доля которой в желудочном соке около 0,5%. За 6 — 1 2 ч, пока пища
находится в желудке, пепсин успевает уменьшить длину цепи белка-гостя в среднем в
20 раз, а иногда ему «удается» отщепить даже отдельные аминокислоты.
Из желудка пища поступает в кишечник, где биохимические превращения
вступают в новую фазу. Под действием других белковых ферментов пептиды (так назы-
вают цепочки аминокислот относительно небольшой длины —до 5 звеньев)
практически полностью распадаются на отдельные аминокислоты. Через лимфатическую
систему аминокислоты поступают в кровь, которая переносит их в печень. В печени
идет синтез белков из «кирпичиков» —аминокислот. Здесь же осуществляется
строжайший контроль за тем, что в печень поступило: все чужеродные организму
образования безжалостно уничтожаются, и это для нас величайшее благо. Стоит только
белку, не свойственному организму, попасть в кровь, как возникает мгновенный шок.
Это явление было хорошо известно людям издавна. Древние охотники, не зная химии,
смазывали наконечники стрел белком— ядом, чтобы парализовать добычу.
Из печени кровь разносит синтезированные аминокислоты по всему организму;
они попадают в распоряжение соответствующих органов —идет «ремонт» или рост
гканей. Судьба тех белков и аминокислот, которые в настоящий момент организму не
нужны, нам известна. Организм их «сжигает», при этом выделяется энергия и
образуются мочевина, аммиак, углекислый газ, вода.
Гидролиз белков и синтез новых материалов из продуктов гидролиза позволяют
22
уменьшить опасность белкового дефицита. Организм сам создает то, что ему необхо
димо, из глюкозы, жирных кислот и аминокислот.
Что же представляют собой белковые компоненты пищи? Животные белки
(молоко, яйца, мясо, кровь и т. д.) содержат все необходимые аминокислоты в доен
точном количестве, а в растительных белках некоторых аминокислот мало или совсем
нет. Вот почему приверженцам вегетарианства--любителям растительной нищи
нужно немало потрудиться: уж очень тщательно следует подбирать меню, чтобы
обеспечить нужный для полноценного питания минимум аминокислот.
Активные функциональные группы белка способны удерживать большое число
полярных молекул воды. Возникают своеобразные водные системы, где есть все
условия для развития микроорганизмов. Микробы разлагают белок до аммиака, ами
нов, фенола, органических кислот и т. д. Нередко среди них встречаются соединения
с весьма своеобразным, неприятным запахом (меркаптаны, скатол), и первый синим
о начале гниения белка мы получаем в большинстве случаев посредством обоняния
Чтобы замедлить процесс разложения белка, можно воспользоваться известным
правилом зависимости скорости химической реакции от температуры: чем холоднее,
тем медленнее размножаются микроорганизмы. Мороженое мясо, например, хра
нится месяцами без существенного изменения качества.
Можно уменьшить содержание в белке влаги, лишив микроорганизмы одного ИЗ
необходимейших условий развития. Вот почему сухой яичный или молочный порошон
можно хранить довольно долго. Кроме того, издавна с этой же целью использувт< я
провяливание или копчение. При этом продукты частично обезвоживаются, в их
поверхностном слое появляются бактерицидные вещества, придающие копченостям
своеобразный вкус и обеспечивающие их длительное хранение.
Общеизвестен также метод предохранения от гниения с помощью поваренной
соли. Солят многие продукты —от рыбы до арбузов. Здесь воздействие ,на микро
флору сложнее: сначала вода переходит из клеток в рассол (там содержание соли
гораздо выше, чем в клеточном соке), а когда наступает равновесие, начинается
обратное проникновение ионов соли через мембраны оболочек внутрь клетки. Эти
ионы подавляют активность микроорганизмов, и разложение резко замедляет* я
однако биохимические процессы затормаживаются не все. Ряд ферментов и в ра<
соле разлагают и белки, и жиры, придавая специфический вкус соленым продуктам
В процессе засолки немаловажное значение имеет размер кристаллов хлорид.
натрия. Разумеется, это обстоятельство учитывается только в гетерогенных проце*
сах, таких, как засолка рыбы или мяса, когда продукт пересыпается твердой СОЛЬЮ
Крупная соль в таких условиях растворяется медленно, и процесс гниения обгоняв
консервацию. Нежелательна и другая крайность— быстрое растворение мелкой СОЛ1
вызовет энергичный переход внутриклеточной жидкости наружу, и стенки клеток пои
нут. Получается дряблая ткань, и товарный вид продукта ухудшится. Воздействие < 0Л1
на качество пищи определяется также своевременностью введения. При варке i
несоленой воде проникновение растворителя обеспечивается быстрее, клетки разру
шаются и продукты развариваются. Получается великолепный бульон или рассыпч!
тая картошка. Однако, если мы решили готовить мясной салат с картофелем, необХ(
димо поступать как раз наоборот: мясо опускают не в холодную воду, а в кипято!
подсаливают через 30 мин, а не через час-полтора после начала варки. Гогда
моперхностом слое белок интенсивно свертывается и экстрактивные вещества из
мяса в бульон переходят медленнее. Большая часть их сохраняется внутри кусков.
Термическая обработка белка и других компонентов пищи положительно сказы-
вается на степени усвоения организмом необходимых ему веществ: белки, углеводы
и жиры подвергаются распаду, и с ними легче «работать» ферментам. Тем не менее
важно при этом не перегреть пищевые продукты и не разрушить витамины, аминокис-
поты и другие необходимые организму соединения. Может даже случиться так, что
мри длительной тепловой обработке в пище станут накапливаться трудноперевари-
ваемые и даже вредные для организма вещества.
В заключение обзора процессов, происходящих в пищевых продуктах, остано-
пимся на химизме превращений при консервировании.
Нагревание продуктов при температуре выше 100° С приводит практически к
полной гибели всей микрофлоры. Если после такой обработки немедленно герметизиро-
вать пищу, то ее можно хранить очень долго. Однако даже отработанная технология и
строжайший медицинский контроль на консервных заводах не дают полной гарантии
длительного хранения продукции. Возможно и повреждение стенок консервных
банок при транспортировке. К счастью, процесс гниения содержимого консервных
банок нередко заметен невооруженным глазом-днища их вздуваются. Специалисты
называют такое явление «бомбаж» недаром: если в банке проделать небольшое
отверстие, давлением газов оттуда выбросит пенную струю продуктов разложения.
И<>| почему не рекомендуется консервировать некоторые продукты в домашних усло-
виях, при которых трудно достичь необходимой стерильности.
Другим способом замедления или полного прекращения микробиологической
деятельности является добавление к пище различных консервантов, что вовсе не
исключает параллельной термической обработки продуктов.
Сахар практически не вызывает разрушения витаминов —в этом его неоспоримое
достоинство. Его следует добавлять не менее 60% от массы продукта, иначе варенье
может забродить. Но и избыток сахара нежелателен, особенно для пожилых людей.
Бензойная кислота — более эффективный, чем сахар, консервант, однако ее
повышенные дозы отрицательно сказываются на работе печени. Консервирующая
способность кислоты известна издавна: именно это вещество содержится в ягодах
брусники и клюквы, что позволяет долго хранить их даже без сахара. В настоящее
время бензойную кислоту применяют в основном для консервирования сельди в
банках (1% кислоты и 8% смеси соли с сахаром).
Сорбиновая кислота Н3С —(СН)4—- СООН в отличие от бензойной
практически не оказывает на организм нежелательного действия. Ее применяют в качестве
нспомогательного консерванта (это вещество слабо действует на бактерии).
СОЛИ В ПИЩЕ
Кроме хлорида натрия, в кулинарии и вообще в пищевой промышлен-
МОС1И находят применение и другие соли натрия— гидрокарбонат, нитрит и нитрат.
Мри атом добавленный в определенной норме нитрат натрия восстанавливается
некоторыми микроорганизмами до нитрита, который препятствует окислению и
сохраняет розовый цвет колбас и других мясных изделий. Если же в результате не-
ч
внимательности оператора доза соли превышена, может создаться опасная для
жизни концентрация нитрата, расстраивающего прежде всего функцию крови как
переносчика кислорода. Авторы не хотят запугать читателя, хочется лишь подчеркну и.
недопустимость применения нитратов и нитритов для домашнего употребления.
Карбонаты— соли нестойкой угольной кислоты, поэтому они могут разлагаться
под действием очень многих кислот, даже органических. Такая особенность известна
кулинарам, они издавна вводят карбонаты в рецептуру мучных изделий. Вам ведь
приходилось слышать о печенье, оладьях, замешенных на соде? Обычно в тесто в
этом случае добавляют кислоту в составе, например, молочнокислых продуктов с
высоким содержанием молочной кислоты. Тогда уже в момент замешивания теста
идет реакция
О О
// //
Н,С - СН - С + NaHCO, -» Н,С -.СН - С + Н20 + С02 т
I \ I \
ОН ОН ОН ONa
молочная кислота
Этот процесс существенно ускоряется при повышении температуры — гидрокар
бонат (питьевая сода) легко разлагается и без кислоты:
2 NaHC03 = Na2C03 + H20 + С02 Т
Образующийся карбонат натрия гораздо более термостоек.
Иногда в качестве разрыхлителя в кулинарии используется карбонат аммония
чрезвычайно интересное вещество. Если его поместить в открытый сосуд и оставить
в тепле на год или два, то к концу хранения сосуд оказывается, как правило, пустым.
Идет реакция (NH4)2C03 = 2H3N t + С02 t + Н20, ее газообразные продукты улету
чиваются, вода испаряется. Этими «неорганическими дрожжами» широко пользуются
при выпечке хлеба.
Человек —единственное существо на Земле, которое практически
всю свою пищу подвергает химической или термической обработке.
Когда мы читаем или слышим что-нибудь об искусственной пище, то у
многих это ассоциируется с чем-то необычным. На самом деле термин
«искусственный» относят к тому, что получают переработкой уже готового
природного материала. Таким образом, и хлеб, и сыр, и колбаса, и даже
сахар —это, по сути, искусственная пища.
Одним из видов сырья для производства душистого вещества вами
лина (им часто ароматизируют кондитерские изделия) в настоящее время
служит отход гидролиза древесины—лигнин.
Аромат жареному картофелю придает комплекс продуктов разложения
метионина — незаменимой аминокислоты.
2В
Технология приготовления масла «Вологодское» была разработана в
прошлом веке Н. В. Верещагиным— братом знаменитого художника.
Интенсивно-желтая окраска верхнего слоя бруска масла, которое
только что в магазине достали из ящика, вызвана продуктами окисления
ненасыщенных кислот.
Метилфенхиловый эфир а - L - аспартиламиномалоновой кислоты —
вещество, которое слаще сахара в 33 000 раз. Чтобы плитка шоколада
приобрела нужную сладость, достаточно нескольких долей миллиграмма
этого вещества. Такая масса даже цианида калия не оказывает
физиологического ВОЗДчЭЙСТВИЯ.
L-глутаминат натрия, мировое производство которого составляет в
год более 250 тыс. т, придает растительным блюдам привкус и аромат
мяса, однако избыток этого вещества в пище ведет к размягчению
костной ткани организма, образованию хрящевых участков, нарушает
функцию щитовидной железы. Между тем в Японии сосуд с глутаминатом
такая же привычная вещь на обеденном столе, как у нас перечница или
солонка.
с-(сн2)2-сн-с'
Соединение мальтол (2-метил-З-оксипирон) усиливает сладость
сахара. Добавка его в кондитерские изделия в соотношении 1:15 млн.
позволяет экономить до 15% сахара.
Когда в коллективе, руководимом академиком А. Н. Несмеяновым, была
получена искусственная икра, приглашенным высококвалифицированным
дегустаторам был неприятен внешний вид икры —она была окрашена в
зеленый цвет. Тогда дегустаторов посадили в затемненную комнату, и
продукт получил очень высокую оценку. После этого случая
искусственной икре стали придавать нужный цвет настоем чая.
Вкус —дело специфическое: французы поступают в лесу с белыми
грибами так же, как наши грибники с мухоморами.
/
7
Л_ ХИМИК
СТРОИТ ДОМ
шава / и ремонтирует
КВАРТИРУ
Г| оскольку к хлопотам по ремонту и строительству привлекаются
' ■ обычно все члены семьи, вам будет, без сомнения, интересно понять
суть процессов, происходящих со строительными материалами в ходе подготовки и
проведения ремонта.
ЦЕМЕНТ, ИЗВЕСТЬ
Для ремонтных строительных работ применяют цемент. Химический
энциклопедический словарь (1983 г.) дает определение цементу как вяжущему материалу
гидравлического твердения (т. е. он может обретать нужную прочность не только на
воздухе, но и под водой и сохранять прочность неопределенно долгое время). Этим
он ошичается от так называемых воздушных вяжущих веществ, которые, как гипс,
способны твердеть и сохранять прочность только на воздухе.
Сам термин «вяжущие» предопределяет роль для этих веществ что-то связывать,
объединять. Этим «чем-то» в строительной практике бывают наполнители мелкие
(песок, колошниковая пыль) и крупные (гравий, щебень), а также металлическая
арматура.
Основой цемента являются силикаты и алюмосиликаты, содержащие примеси
соединений железа и магния. Когда порошок цемента смешивают с водой, полу-
чается цементное «тесто», в котором тотчас же начинается образование насыщенных
растворов некоторых его компонентов (они все плохо растворимы в воде, и поэтому
растворы сразу становятся пересыщенными). Через некоторое время в этих
растворах возникают коллоидные частицы малорастворимых компонентов цемента,
связанные частицами воды:
ЗСаО • Si02 + 2 Н20 = 2 СаО • Si02 • Н20 + Са(ОН)2
Гидроксид кальция, как говорилось выше, образует насыщенный раствор, а
второй продукт, который можно представить как основную соль, дает коллоидный
раствор: 2 СаО • SiO • Н20 = Ca2(OH)2Si03. В это время цементное «тесто» очень
ппао1ично и легко заполняет малейшие неровности. Через несколько часов образо-
вавшиеся коллоидные растворы кристаллизуются, тонкие длинные иглы пронизывают
массу она теряет подвижность, но прочности пока не обретает, поскольку кри-
сталлы еще тонкие, малочисленные и ломкие. Строители называют эту стадию «схва-
гыванием».
I ели бы цементное «тесто» было прозрачным, мы бы увидели, как постепенно
тонкие кристаллы разрастаются, переплетаются друг с другом и связывают частицы
наполнителя. Механическая прочность массы растет, и наступает стадия твердения,
продолжающаяся интенсивно в течение ближайших нескольких дней с заметной
скоростью, а затем все медленнее и медленнее. Практически цементный камень наби-
paoi прочность в течение месяца.
Затвердевший цемент не боится воды, но кислотами он может с годами разру-
шаться. Этот процесс протекает вблизи промышленных городов особенно интен-
i ивно здесь в атмосферу попадают газообразные оксиды азота:
9Й
N02 + 02 + H20 -5Л HNOs*±H+ +N03~
Нитраты и сульфаты кальция, железа, алюминия в воде растворимы, поэтому
цемент с поверхности подвергается своеобразной «коррозии».
В современных зданиях постройки 80-х гг. мы все реже встречаемся с деревни
ными полами. Они уступили сейчас место бетонным, покрытым утепленным линолеу
мом. В целом теплопроводность у них больше, чем у деревянных, и приходится на пол
укладывать еще паласы, ковры и т. п. Однако палас не потребуется, если воспользе
ваться «газобетоном». Он может быть изготовлен даже в домашних условиях. Вот как
это делается. В первой стадии образования цементного «теста» среди продуктов
реакции образуется гидроксид кальция—довольно сильное основание. Если в сухой
цемент ввести алюминиевую пудру, обычно используемую в качестве «серебряной»
краски, и затем добавить воду, то образующийся гидроксид кальция вступит в рван
цию с защитной пленкой на поверхности алюминия:
А1203 + Са(ОН)2 + ЗН20 - Са[А1(ОН)4]2,
а затем очищенный от пленки металл станет реагировать с водой с выделением водо
рода:
2AI + 6Н20 = 2А1(ОН)3 + ЗН2 Т
Образующийся при этом малорастворимый гидроксид алюминия снова взаимо
действует с гидроксидом кальция, проявляя свой амфотерный характер:
Са(ОН)2 + 2А1(ОН)3 - Са[А1(ОН)4]2
Процесс будет идти до тех пор, пока не израсходуется полностью один из компо
нентов — гидроксид кальция, алюминий или вода.
Бетону можно придать красивую окраску, если ввести в смесь цветной пигмент.
Задача осложняется тем, что немногие пигменты устойчивы к действию щелочной
среды, создающейся в бетоне. В качестве пигментов, не изменяющих цвет в таких
условиях, можно использовать соединения меди, железа, кобальта. Масса добавки
пигмента для придания нужного оттенка и здесь определяется только эксперимон
тально.
Остановимся теперь на так называемых воздушных вяжущих материалах, т. е.
твердеющих только на воздухе. Наиболее ярким их представителем является
известь— основный оксид, который при взаимодействии с водой дает малораствори
мое основание —гидроксид кальция.
Известь чаще всего поступает к нам с известково-обжиговых установок, которые
обычно являются цехами предприятий, использующих образующийся в процессе
обжига углекислый газ:
СаС03 — ► СаО + С02Т ДН=+118 кДж
Процесс эндотермичен, и теплота, необходимая для его проведения, образуется
при сжигании топлива —каменного угля или природного газа.
Строители часто вместо термина «негашеная известь» используют другой, более
образный — «кипелка». Причиной этому является большой тепловой эффект образова
29
ния гидроксида кальция из оксида; поэтому при взаимодействии с водой темпера-
гура так возрастает, что жидкость закипает и разбрызгивается.
При гашении извести нельзя допустить сильного разогревания смеси, ибо
растворимость гидроксида кальция падает более чем вдвое при изменении температуры от
20 до 100° С. И наоборот, если мы используем медленногасящуюся магнезиальную
известь, к ней надо добавлять воду небольшими порциями, чтобы не охладить мас-
су, растворимость гидроксида магния с повышением температуры от 20 до 1 00° С
более чем вдвое увеличивается. Однако при использовании извести любого типа
непременным условием является постоянное и тщательное перемешивание, так как
скорость процесса растворения определяется скоростью самой медленной его
стадии (диффузии).
Обжиг известняков до извести весьма ответственная задача. Если температура
будет при этом ниже оптимальной, пойдет «недожог» —в массе окажутся включения
неразложившихся карбонатов. Поднимется температура выше, чем надо,—появятся
на поверхности кусков темные пятна силикатов, алюминатов, ферритов. При этом они
не голько снизят качество побелки, но и могут сработать еще как мины замедленного
действия: скорость гидратации у них чрезвычайно мала, но не равна нулю; поэтому
вовремя не погасившиеся частицы, попавшие в слой штукатурки, постепенно под
действием атмосферной влаги увеличат свой объем, и от этого места в разные стороны
зазмеятся трещины и трещинки месяца через 2—3 после новоселья.
Вот почему опытные мастера-отделочники тщательно отбраковывают куски
негашеной извести с желтоватыми включениями или черными подпалинами на боках и не
пользуются свежегашеной известью для штукатурных и кладочных работ.
Минимальный срок выдержки извести после гашения под штукатурку — месяц!
Но вот известь готова для гашения, и ее нужно смешать с водой. Если решить не-
( ножную химическую задачу и определить, какой объем воды надо взять для
превращения 1 кг оксида кальция в гидроксид, получится всего-навсего 321 мл. Практика
показала, что воды надо брать по крайней мере вдвое больше: ее много испаряется.
Бывает, что гашеная известь после необходимого периода выдержки еще долго
не используется. Тогда необходимо, так же как и во время выдержки, уменьшить, а
пучше и совсем предотвратить контакт извести с углекислым газом воздуха. Эта
реакция является началом последующего процесса твердения извести, и нужно сде-
пать так, чтобы он осуществился не в ящике или яме для хранения, а в слое штука-
гурни или строительного раствора:
Са(ОН)2 + С02 = СаС03 + Н20
Легко определить, есть ли карбонат в известковом «тесте» после хранения и
хорошо ли оно погашено. С этой целью пробу вещества смешивают со столовым
уксусом. Если карбонаты есть, смесь «вскипает» под действием образующегося
yi лекислого газа: >
СаС03 + 2СН3СООН - Са(СН3СОО)2 + Н20 + С02Т
I лким же образом можно отличить «известковое молоко» от «молока» из
суспензии гонкоизмельченного мела, который иногда используется по ошибке для побелки.
Гак почему же стены белят известью, а не мелом: ведь в конце концов она все
30
равно превратится в карбонат! Причина в том, что создающийся под действием угле
кислого газа карбонат в слое извести хорошо укрепляет последнюю, становясь
кристаллическим веществом. По этой же причине перестают отвинчиваться крышки с
лабораторных склянок, где хранятся щелочи: «мягкая» пыль гидроксида превра
щается в «жесткий» карбонат и крышка, как говорят, «запекается».
Обратимся снова к химическому процессу. При взаимодействии углекислого газа
с гашеной известью образуется еще и вода. Поэтому свежеоштукатуренные и побе
ленные известкой стены долго не сохнут: наружные участки подпитываются влагой
Процесс твердения извести необратим, и признаками этого являются образую
щиеся малодиссоциирующее вещество вода и малорастворимая соль карбонат каль
ция. В этой системе есть еще одно соединение, которое может помочь ускорим,
твердение,—оксид углерода (IV).
В домах-новостройках, где закончены отделочные работы, строители закрываю!
фанерой или картоном дыры в окнах, запирают входные двери, а в окна первого
этажа вводят трубы от громоздкого металлического сооружения размером с неболь
шой автобус. Внутри этой «установки» сжигают уголь или кокс, дающие мало дыма, и
горячими продуктами сгорания заполняют все пространство внутри дома. А,не лучше
ли было бы установить в каждой комнате небольшие нагреватели— калориферы или
еще лучше —подать в дом тепло по отопительной системе, пусть сохнет! Но главное
не в тепле, а в том углекислом газе, который попадает в помещение вместе с дымо
выми газами: повышение его объемной доли в воздухе ведет к резкому увеличению и
скорости твердения штукатурки и скорости высыхания побеленных потолков.
Образованием карбоната не заканчивается превращение извести. То, что уголь
ная кислота слабая и малоустойчивая (непрочная), играет в нашей жизни большую
роль: побеленные стены и потолки служат своеобразным дегазатором помещении не
только за счет поглощения паров воды и вредных газов (этот процесс называется
адсорбцией), но и за счет химического обезвреживания ядовитых загрязнении и
оксиды азота, и оксиды серы с влагой дают кислоты более сильные, чем угольная
Под их действием образуются сульфиты и сульфаты, нитриты и нитраты кальция, а В
воздух поступает практически неядовитый в этих условиях углекислый газ.
ПОЧЕМУ КЛЕЙ КЛЕИТ?
Потолок побелен, и ремонтники должны оклеить обоями или окрасить
масляной краской стены. Известно несколько сот марок клея. Они различны, как
различны и процессы, происходящие при образовании клеевого шва. Но каким бы ни
был клей, приемы во время работы с ним одни и те же: подготовка склеиваемых
поверхностей, приведение клея при необходимости в рабочее состояние, нанесение
клея и, наконец, совмещение деталей с последующим выдерживанием под нагруз
кой.
Эти операции производят при склейке обуви на фабрике, при нанесении заплаты
на прохудившуюся велосипедную камеру, при запечатывании письма и при наклейке
обоев.
Что же происходит, когда на стены наносится клей КМЦ, считающийся одним ил
лучших для наклейки обоев?
31
Аббревиатура КМЦ, которая могла встретиться на этикетках не только в
хозяйственном, но и в фотомагазине, означает карбоксиметилцеллюлоза:
О
[С6Н702 (ОН) 2] - О - СН2 - С
\
ONa
Как видно из формулы, КМЦ— простой эфир целлюлозы и гликолевой кислоты.
Дойствующим началом вещества как клея являются активные функциональные
группы —ОН в молекуле целлюлозы, входящей в состав КМЦ. Гликолевая кислота
резко увеличивает их активность, что положительно сказывается на прочности
склеивания.
Как только КМЦ оказывается между двумя поверхностями, начинается
химическое взаимодействие между функциональными группами клея и активными центрами
на поверхностях, например стены и бумаги. Роль активных центров могут выполнять
ионы кислорода. Тогда между протоном гидроксильной группы клея и ионом кисло-
рода возникнет водородная связь. Но это обычно только начало процесса. Как
правило, в системе поверхность —клей— поверхность проявляется комплекс
разнообразных типов связи— ковалентная, ионная, а также силы межмолекулярного взаимо-
32
действия... Иногда совместное действие этих связей так эффективно, что изделие
разрушается при нагрузке не по клеевому шву, а по самому материалу, даже такому,
как металл или стекло.
Первая операция в процессе приготовления КМЦ к работе —замачивание.
Набухшую КМЦ тщательно перемешивают с невпитавшейся водой, и получается клей,
который в отличие от других клеев, таких, как ПВА и «Бустилат», не оставляет
видимых следов на лицевой стороне обоев, а если и оставит, то тонкую прозрачную
пленочку.
Остановимся на механизме действия еще одного вида клеев —синтетического,
широко применяющегося, например, для ремонта мебели, фарфоровой (непищевой)
посуды и даже одежды.
Основой такого клея является полимер, способный отвердевать или под дей-
ствием нагревания, или под влиянием другого вещества, которое к нему
примешивают перед самой работой.
А теперь рассмотрим группу клеев БФ (аббревиатура от их технического
названия — бутварфенольные). В состав клея входят фенолформальдегидная смола (основа
клея) и еще одно органическое вещество —поливинилбутираль. Растворителем для
этих компонентов служит технический этиловый спирт:
Н
фенолформальдегидная
смола
поливинилбутираль
Теперь проследим за теми химическими (и частично физическими)
превращениями, которые происходят в процессе подготовительных операций и самого
склеивания.
Когда поверхность готовят для склеивания, ее обрабатывают так, чтобы место
[Склеивания имело наибольшую площадь за счет тех неровностей, которые при этом
образуются. Затем растворителем органического происхождения (спирт, бензин,
ацетон) поверхность очищают от следов обработки, а самое главное —от жирового
налета, который мог бы воспрепятствовать склеиванию. Конечно, для только что
сломанной ручки фарфоровой вазы обе эти операции излишни.
На высохшую поверхность наносят тонкий слой клея. В этот момент начинается
и< парение растворителя с одновременным заполнением пока еще жидким клеем
в< ох неровностей склеиваемой поверхности. Вот тут-то важно выдержать нужную
паузу и дать всему растворителю улетучиться. Минут через 10—15 легонько
прикоснемся каким-либо предметом к нанесенному клею. Если при этом почти не ощу-
щается прилипание, можно нанести на это место второй слой и после небольшой
подсушки плотно прижать поверхности склеиваемых предметов.
33
пикая химия
Следующая стадия — отвердение клея— проводится при температуре до 150° С в
гечение как минимум часа. За это время в результате процесса полимеризации
компонентов образуется жесткая трехмерная структура самого клея и обеспечивается
прочное схватывание шва с поверхностью. Клей может затвердеть и без
термообработки, но качество склейки будет неудовлетворительным: прочность шва окажется в
несколько раз меньше и он не приобретет той водо- и маслостойкости, которая
возникает при ведении процесса по указанному выше режиму.
Если в бутварфенольный клей ввести еще один компонент—пластификатор,
повышающий эластичность образующегося клеевого шва, то такая композиция может
использоваться и для волокнистых материалов. Марка БФ-6 присвоена именно
миому клею, который применяется даже в медицине для обработки микротравм.
Клей на коже держится очень прочно и не отслаивается до двух суток. Им же легко
<>| ремонтировать и поврежденную ткань. Только здесь необходимо термическое
воздействие: смоченную клеем заплатку накладывают на поврежденное место, слегка
придавливают, а потом приглаживают горячим утюгом через увлажненную ткань.
Обратите внимание на то, что ткань обязательно надо увлажнять: клей требует для
отвердения температуру до 100°С. Пока водяной пар образуется, температура выше
и не поднимется.
Но вот оклейка обоями завершена и решено, что стены в других помещениях
будут окрашены.
«...ДЛЯ HAF РАБОТ»
Любая краска обязательно состоит из двух компонентов — пигмента
определенного цвета и связующего вещества, т. е. того, в чем этот пигмент распределен.
Все остальное, что вводится в краску, служит для придания ей особых свойств.
Краски принято разделять по типу связующего вещества на масляные и эмале
вые, к которым относятся клеевые, силикатные, эмульсионные. Первые в качестве?
связующего компонента содержат олифу, вторые— синтетические смолы или другие
высокомолекулярные соединения, переведенные в раствор с помощью какого-либо
органического растворителя.
Самые распространенные в быту —масляные краски. Их можно наносить на
поверхность кистью, валиком или набрызгивать. Итак, первый слой нанесен, и в рван
цию вступает кислород воздуха. В олифе (на ее основе и готовят эту категорию кра
сок) происходят реакции окисления по месту двойных связей в наиболее характерных
для растительных масел остатках ненасыщенных органических кислот типа линоле
вой:
СН3 — (СН2 — СН = СН2) з — (СН2) 7 — С — ОН
Растительные масла подобно всем жирам, как вы помните из первой главы, пред
ставляют собой сложные эфиры глицерина и кислот (преимущественно ненасыщен
ных), и химически точное их название триглицериды:
Н С_0—R
'I
не—о—R2
н2с—о—К3
Rj 9 а —остатки жирных кислот
Когда мы говорим о высыхании выстиранного белья, луж после дождя или
растений во время засухи, то представляем этот общеизвестный процесс как испарение
езоды. Частично и во время высыхания олифы происходит испарение, но только не
воды (ее в составе олифы нет), а продуктов распада громоздких органических моле
кул. Эти продукты мы узнаем по запаху, который возникает в помещении при окраске.
Образующиеся по месту двойных связей органические пероксиды и гидроперок
сиды R — О — О — R или R -— О — О — Н служат инициаторами дальней
х о у z
шеи полимеризации. Запах в помещении вскоре пропадает, но это еще не значит, что
олифа высохла,—в пленке постепенно возникает полимер сетчатой структуры. Длится
этот процесс сутки, а то и дольше, пока не образуется прочная пленка.
Высыхание олифы ускоряется, если к ней добавлены вещества, способствующие
окислению. Их общее название — сиккативы. Это катализаторы и их «помощники»,
активизирующие действие первых. Типичнейшим сиккативом-катализатором является
линолеат кобальта (II) Co(C17H3iCOO)2, а активатором для него— нафтенат кальция.
В этих веществах важную роль играет ион кальция: именно он «помогает» линолеату
кобальта ускорять поглощение кислорода воздуха олифой. Излишек сиккатива в
олифе может привести впоследствии к разрушению краски, поэтому надо
ограничивать его расход рекомендуемыми нормами.
-ль
Вюрую большую группу составляют эмали или лаковые краски. Их пленка
образуемся не за счет химически необратимых реакций, а после испарения растворителя,
н котором было растворено твердое вещество. Оно-то и образует пленку, не
отличающуюся химически от полимера, находившегося в исходной эмали.
Растворитель вместе с пленкообразующим веществом принято называть лаком.
Гак, например, алкидные эмали, на банках с которыми стоят, кроме названия,
индексы ПФ или ГФ, состоят из ксилола (растворитель) и алкидных смол.
Многоатомные спирты (глицерин и пентаэритрит), фталевый ангидрид и
растительные масла при совместной переработке образуют вещество очень сложного сос-
гава, называемое алкидной смолой. Если в состав исходной смеси вводятся
глицерин и фталевый ангидрид, эмаль получает индекс ГФ. Замена глицерина пентаэритри-
к)м отражается в новом индексе на этикетке банки —ПФ.
После нанесения на поверхность эмали растворитель (в нашем случае ксилол)
улетучивается часа через два. Когда пленка перестает прилипать к пальцу при
прикосновении, можно считать, что первая стадия закончилась.
В дальнейшем характер процесса зависит от того, какова температура
окрашенной поверхности. К примеру, если красят эмалью горячие батареи (разумеется, пока
и/iei окраска, помещение следует хорошо проветривать), испарение растворителя и
последующее образование высокопрочной пленки происходит всего за полтора
(максимум два) часа. При этом возникает такая же, как и в пленке из масляной краски,
пространственная структура углеродно-кислородных цепей, придающая покрытию
устойчивость к воздействию не только горячей воды, но даже органических
растворителей, таких, как бензин и его «родственники» —керосин, лигроин, дизельное
топливо и минеральные масла.
Если же эмаль высыхает при комнатной температуре, то в соответствии с
законами химической кинетики процесс продолжается гораздо дольше (около суток), а
образующаяся пленка не приобретает стойкости даже к дождевой воде. Вот почему
алкидные эмали годны только для внутренних работ. Если предполагается красить
полы или стены садового домика, то эмали надо выбирать на основе сополимеров
винилхлорида (индекс ХС) или нитроцеллюлозные (НЦ). Правда, последние боятся
солнечных лучей и выдерживают только 2—3 года, а первые при нагревании могут
выделять хлороводород и поэтому совершенно неприменимы для покраски
отопительных устройств.
Подведем некоторые итоги. Эмали сохнут гораздо быстрее масляных красок,
дают прочную и эластичную пленку, но небезопасны в обращении: нитроэмали
чрезвычайно горючи, а пары их растворителей вредны; кроме того, они активно
действуют на незащищенную кожу. Быть может, есть менее вредные краски? Да, они
известны. И это в первую очередь клеевые краски, получившие свое название также
по связующему веществу — клею различного происхождения. Как «работает» клей,
мы уже рассказывали в этой главе. В клеевых красках сочетаются безопасность при
работе и водо- и светостойкость. Перед употреблением достаточно развести их
водой, если они выпущены в твердом виде. Эту операцию проделывал каждый из нас,
когда рисовал акварелью,—она не что иное, как разновидность клеевых красок.
С незапамятных времен мастера пользовались казеиновым, костным или
декстриновым клеями с примесями пигментов.
36
В настоящее время среди клеевых красок появились их новые разновидности под
названием водоэмульсионные. Ими пользуются при окраске бытовых и произвол
ственных помещений. В состав этих красок входит поливинилацетат, или поливинило
вый спирт:
—сн2—сн—
о=с—сн3
Отличительное качество этого полимера —исключительная способность прили
пать к пористым поверхностям (бумаге, коже, древесине, штукатурке).
Как только вода испаряется, частицы поливинилацетата сливаются, образуя проч
ную пленку, равномерно окрашенную соответствующим пигментом. Она не боится
воды, поэтому стены можно протирать влажной тряпкой и иногда даже мыть. В слое
краски, нанесенном на штукатурку, имеются многочисленные поры, и это является
важным преимуществом водоэмульсионной краски перед красками масляными и
эмалями, дающими сплошную пленку: пористый слой обеспечивает газообмен штука
турки и атмосферы, что важно для гигиены жилища.
Термин «цемент» ведет происхождение от латинского слова гвГПвП
turn, Так древние римляне называли битый камень (осколки старых нир
пичей, толченую вулканическую пемзу и т. д.), который в смени с
известью давал отличный строительный материал.
Цвет стен в помещении, несомненно, оказывает влияние на живущих в
нем людей и, по мнению ряда психологов, может создавать определен
ное настроение, например: красный — возбужденное, тревожное; оран
жевый — праздничное, радостное; желтый стимулирует работосп
ность; желто-зеленый создает жизнерадостное настроение; голубой
успокаивает; фиолетовый— навевает грустные мысли,
А какой пигмент вы выберете для окраски комнат квартиры или рабо
чего помещения?
Нужный оттенок краске очень часто придают смешиванием различных
пигментов. Однако здесь, если не учесть химической природы компонент
тов, могут быть сюрпризы. Например, смешение литопона и свинцовых
белил, одинаковых по цвету, дает... черную массу:
2РЬС03 • РЬ(ОН)2 —состав свинцовых белил
ZnS + BaS04-~ состав литопона
37
В результате обменной реакции образуется черный сульфид свинца:
Pb^f + S2 " = PbSi
Скорости образования7^ строительном растворе карбонатов и
силикатов кальция заметно отличаются: большая часть гидроксида кальция
превращается в карбонат в считанные месяцы, а оставшийся гидроксид
реагирует с оксидом кремния (песком) в течение столетий с
образованием в этих условиях чрезвычайно прочного кристаллического силиката
кальция. В значительной степени этим обстоятельством, а не только
искусством древних мастеров объясняется долговечность старых
каменных зданий.
Процесс образования силиката кальция резко ускоряется при
нагревании, и этим пользуются в промышленности при изготовлении так
называемого силикатного кирпича, который в отличие от обычного имеет цвет,
очень близкий к белому. С этой целью в автоклаве водяным паром
нагревают сформованные из смеси песка и гашеной извести кирпичи до
100° С, и многовековая реакция завершается за считанные часы.
7
щава
химия
В САДУ
И ОГОРОДЕ
\_
D настоящее время садоводством занимаются десятки миллионов
■■* людей. И здесь нет ничего удивительного: работа на чистом воздухе,
но/1 лучами летнего солнца — превосходная форма отдыха.
Геронтологи утверждают, что садоводы живут на 5—6 лет дольше тех, кто садовод-
ством не занимается. Пожилые садоводы в 1,5—2 раза реже обращаются к врачам,
ч<;м их ровесники.
Основа любого сада —его почва. С точки зрения химика, почва —сложнейшая
система органических и неорганических соединений. В результате их взаимодействия
в почве появляются вещества, необходимые для нормального развития растений.
Большое участие в процессе почвообразования принимают живые организмы: дож-
девые черви, насекомые и другие животные.
Увеличению плодородного слоя почвы способствует внесение органических
удобрений и почвообразующих компонентов. Одним из наиболее ценных органических
удобрений является навоз. В нем есть все необходимые для нормального развития
растений химические элементы; кроме того, это органическое удобрение способно
оiдавать питательные вещества постепенно и в определенной очередности. Так,
после внесения навоза растения сначала интенсивно извлекают из него калий, потом
фосфор и лишь затем азот. Это следует учитывать при расчете внесения
дополнительных доз минеральных удобрений.
40
С позиций химика, добавление в почву «свежего» материала в виде древесных
опилок, стеблей и листьев растений нерационально:— слой почвы увеличивается, а
питательная ценность падает, ибо в процессе разложения растительных остатков их
окисление идет за счет восстановления нитратов. Последние могут восстанавли
ваться до различных форм, в том числе и до молекулярного азота:
2NO^+ 10e--N2t +60 2
Итак, если в почву вносятся неперегнившие и неокислившиеся предварительно
компоненты, следует обеспечить свободный доступ кислорода воздуха, а также доба
вить азотное удобрение. Такие же условия должны быть соблюдены и для торфа, если
он вводится в почву именно с целью улучшения газопроницаемости и рыхлое т.
Структура почвы играет важную роль в жизни садовых растений. Следует учим,!
вать, к примеру, что в легких, воздухопроницаемых почвах органические удобрения
разлагаются вдвое быстрее, чем в тяжелых суглинистых. В песчаный грунт легко про
никает вода, но она же интенсивно вымывает из него питательные вещества.
На рост и развитие растений и микроорганизмов сильное влияние оказываем
такая чисто химическая характеристика почвы, как кислотность. Мало найдется сель
скохозяйственных культур, которые могли бы нормально развиваться, когда протонов
в почве становится то больше, то меньше нормы, разве что редис, картофель. Рим
почему настоящие садоводы должны обязательно быть еще и химиками-аналитиками
Определить хотя бы приблизительно кислотность почвы можно с помощью инди
каторной бумаги.
Итак, на том участке, где надо оценить кислотность, берут пробы земли граммов
по 50 из углов и середины территории. Землю смешивают, подсушивают и раздавай
вают все комочки крупнее горошины. Разравнивают пробу в виде круга и делят ei <>
на четыре равные части (в лабораторной практике эту операцию называют квартова
нием). Почву из 1-го и 3-го секторов отбрасывают, а в оставшихся секторах (2 и 4)
операцию повторяют до тех пор, пока объем земли не станет равным четверти обыч
ного стакана. В стакан доливают (до трех четвертей объема) кипяченую воду комна!
ной температуры и перемешивают содержимое 2 мин. Когда почва осядет, а жид
кость просветлеет, в стакан опускают индикаторную бумагу и определяют по прила
гаемой шкале значение водородного показателя рН. В современных условиях, когда
на почву попадают промышленная пыль и кислотные дожди, практически редко воз
никает необходимость в повышении кислотности почвы. Чаще всего ее рН необхо
димо уменьшать добавлением извести или известняка. Частично раскисление про
исходит и при внесении золы, содержащей карбонаты и основные оксиды:
СаО + 2Н+ -► Са2+ + Н20 - известкование
СО2!- 2Н+ -* Н20 + С02 t — раскисление карбонатами
Внесение в почву известняка (карбоната кальция) позволяет решить сразу фи
проблемы— снижение кислотности, обогащение углекислым газом припочвенно! о
слоя воздуха и повышение содержания ионов кальция. Последние способствуют уве
личению урожайности практически всех культур и улучшают структуру почвы,
Нехватку ионов Са2+ легко заметить: если почва обращается во время дождей в вяз
кий кисель, а в сухую погоду затвердевает как камень, то в ней мало этих ионов.
1 Л\
Вносить раскисляющие вещества надо обязательно в измельченном виде и не
просто рассыпать по участку, а тщательно перекапывать. Этим обеспечивают
надлежащую скорость гетерогенного процесса, которая определяется поверхностью
контакта реагирующих веществ: больше поверхность —больше скорость и
эффективность взаимодействия.
При выборе средства для известкования надо быть очень внимательным. Выше
мы упоминали о преимуществах карбонатов в этой роли. Оксиды и гидроксиды
кальция и магния тоже хороши, однако основания способствуют потере азота,
находящеюся в удобрениях в виде ионов аммония. Поэтому если известкование рести
параллельно с внесением навоза или аммофоса, то возможно такое разложение солей:
2H3Nt
/
Са(ОН)2 + (NH4)2HP04 = СаНР04 + 2NH4OH
\
2Н20
Образующийся гидрофосфат кальция малорастворим, аммиак легко удаляется в
воздух, поэтому равновесие реакции сильно сдвинуто вправо. В этом случае дозу
аммиачных удобрений приходится увеличивать. С другой стороны, излишнее раскис-
42
ление почвы может привести к нежелательным последствиям: у растений появляется
болезнь, называемая хлороз. Ее признаки — пожелтение или побеление листьев,
отставание в росте и развитии.
У хлороза могут быть и другие причины, но если рН водной вытяжки превышав!
7,5, придется вносить сульфат аммония—удобрение, которое способствует повыше
нию кислотности из-за того, что в почве происходит гидролиз:
(NH4)2S04 + Н20 т± NH4HS04 + H3N • H2Q
Водный раствор сульфата аммония, являющегося солью сильной кислоты и ела
бого основания, имеет рН около 4,5. Кроме того, растения поглощают катионЫЩ
быстрее, чем анион БО^который накапливается в почве и повышает ее кислотность,
Есть еще одна причина повышения кислотности почвы —излишняя влажность. Рас
смотрим приведенное выше уравнение гидролиза сульфата аммония на основе прим
ципа Ле-Шателье. Увеличение содержания влаги автоматически сместит положение
равновесия вправо, в сторону образования продуктов реакции. Кислотность при
переувлажнении возрастает еще и за счет кислот, содержащихся в почве. Их назы
вают гуминовыми. Состав у них очень сложный: они имеют много функциональных
групп и относительную молекулярную массу около 1500.
■
О МИНЕРАЛЬНЫХ УДОБРЕНИЯХ
Все минеральные удобрения, поступающие в розничную продажу, рас
считаны на длительное хранение и однократное применение; поэтому их выпускакл
порциями в запаянных полиэтиленовых пакетах обычно по 3—5 кг. Прежде неси»
необходимо внимательно изучить рекомендации на этикетках, где, кроме названия
удобрения, обязательно указывается массовая доля (процентное содержание)
одного питательного элемента, а у сложных удобрений — каждого элемента в отдель
ности. Обычно тут же приводится и норма внесения под различные культуры в грам
мах на определенную площадь. Если же таких указаний нет, то можно легко подсчи
тать, какое количество данного удобрения необходимо внести в почву. Подсче!
ведется по формуле
х = —
о
где х —доза вносимого удобрения, указанная в справочнике, чаще всего в граммах
на 10 м2 площади; а — норма внесения питательного элемента на эту площадь в грам
мах; Ь — массовая доля питательного элемента в процентах.
Допустим, что для подкормки томатов необходимо внести 40 г азота на 10 м
почвы. У садовода имеются аммиачная селитра и мочевина (карбамид). Определим
массовую долю азота в каждом из этих удобрений:
&1(Ы)= 2И8о100% =35% в NH4N03
0)2(Н) = 2'1460100% = 46,7о/о в (NH2)2CO
Если известно значение Ь (это о&А или со2), легко найти необходимую массу удоб
рения (дозу) на 10 м2:
43
xx =——— = 114 г/10 м в аммиачной селитре
Яо =—л~^— = 85,7 г/10 м2 в мочевине
4о,7
Как влияют минеральные удобрения на жизнедеятельность растений, на урожай?
Сложность этого вопроса определяется тем, что в почве удобрения претерпевают
разнообразнейшие физические, химические, биологические превращения. Компо-
ненты удобрений по-разному сорбируются почвой. При этом фосфор, калий, отчасти
ионы аммония могут переходить в неподвижные, неусвояемые растениями формы.
Азот. Это один из основных компонентов питания растений, поскольку он входит в
состав белков. Азот усваивается растениями в составе ионов аммония. Амидные
группы NH2 подвергаются гидролизу, а ионы N0^ восстанавливаются до иона NH4,
что для растения связано с большими затратами энергии.
Аммонийные удобрения обладают потенциально кислым характером из-за очень
быстрого усвоения растениями иона аммония, что приводит к накоплению в почвах
соответствующих кислотных ионов (скажем, ионов БО^при использовании сульфата
аммония и N0^ при использовании аммиачной селитры).
В среднем из почвы теряется 25—30% азотных удобрений. Одна из причин
потерь — биологические процессы нитрификации (микробиологическое окисление
аммония и амидов в нитраты) и денитрификации (превращение нитратов в
элементный азот и оксиды азота). Кроме того, при поверхностном внесении солей аммония и
карбамида идет гидролиз и выделяющийся свободный аммиак улетучивается в
атмосферу:
+ н о
NH2CONH2 —> (МН4)2СОз4±2НзЫТ +C02t + Н20
карбамид
Хорошо растворимые соли азотной кислоты вымываются и уходят в почвенные
воды. Эти потери намного меньше потерь, вызванных процессами нитрификации и
денитрификации.
Потери азота из почвы снижают эффективность использования удобрений и
уменьшают возможность управления ростом растений. Дело в том, что растениям
гребуется различное количество азота на разных стадиях развития. Если рано внести
удобрения, то быстрые процессы нитрификации и денитрификации обедняют почву
как раз в тот период, когда идет интенсивное формирование зерна или плодов.
Потому часто оказывается нужной дополнительная подкормка.
Фосфор. К недостатку Р2Об растения особенно чувствительны в начале развития.
Последствия дефицита не устраняются, даже если на последующих стадиях будет
внесено значительное количество фосфора. Отсутствие фосфора замедляет образо-
вание в растениях органических кислот из углеводов, что в свою очередь сдерживает
усвоение азота.
Основными формами, в которых фосфор усваивается растениями, являются ион
Н,Р04, образующий водорастворимые соли с двухвалентными катионами (Са2+), и
ион НРО4Т образующий соли, нерастворимые в воде, но растворяющиеся в водных
растворах лимонной кислоты или солей этой кислоты.
44
Высокое содержание в почвах ионов Са , Fe , AI приводит к связыванию фос
фат-ионов в нерастворимые и недоступные растениям соли. Этот процесс,
называемый ретроградацией, является основной причиной невысокой степени использования
фосфора (не более 20—30%) в первый год после внесения.
Калий. Его наличие в почве оказывает большое влияние на обменные процессы в
растениях. Калий стимулирует фотосинтез, способствуя оттоку углеводов из плас
тинки листа в другие органы, активизирует работу многих ферментов. При достаточ
ном обеспечении калием растения лучше удерживают воду, более стойки к легким
заморозкам и кратковременным засухам. При этом калий способствует более
интенсивному накоплению углеводов в растениях, повышает качество урожая: увеличи
вается содержание сахара в плодах и овощах, крахмала —в картофеле.
Роль калия, а также кальция и магния усиливается при хорошем азотном питании
растений: больше образуется белка, лучше усваивается азот, более прочным стано
вится стебель. В почве калия намного больше, чем азота и фосфора. Однако 99%
находится в виде малорастворимых алюмосиликатов, а водорастворимых солей
калия в почве очень мало.
Соединения кальция и магния не указываются на этикетках продающихся удобре
ний. Однако значение их для жизни растений ислючительно велико.
Если кальция мало, ослабляется развитие корневой системы, прекращается poci
стеблей. Нарушение роста растений неизбежно, если не хватает магния. Ведь
магний — важная составная часть хлорофилла —зеленого вещества, благодаря кото
рому в листьях из воды и углекислоты под действием солнечного света синтези
руются углеводы.
Еще больше влияние кальция и магния на почву: они поддерживают ее структуру,
препятствуют вымыванию органических и минеральных составляющих. Поэтому
известкование и гипсование крайне необходимы.
Азотные удобрения— самые дешевые и доступные1. Однако злоупотребление ими
ускоряет рост ботвы, а клубни картофеля или корнеплоды моркови становятся скоро
портящимися, невкусными и даже опасными для здоровья.
Неграмотное и неумеренное применение удобрений сделает бесполезными
расходы на их приобретение, может снизить урожаи и ухудшить качество плодов и ягод.
И в то же время умелый подход к удобрениям в несколько раз увеличивает урожаи.
При внесении удобрений необходимо соблюдать ряд условий, которые целиком
обусловлены химическими законами.
Скорость усвоения растениями питательных веществ зависит главным образом oi
растворимости последних в воде. Лежащие на поверхности крупные куски удобре
ний, как правило, бесполезны, во всяком случае именно тогда, когда они необходимы
растениям. Нельзя вносить удобрения в виде крупных кусков, ибо возникнут местные
повышения концентрации того или иного элемента, а отсюда неизбежно снижение
урожайности вместо ожидаемого роста. В то же время нежелательно применение
удобрений в виде мелкого порошка. Мелкие частицы быстро растворяются и уходят в
грунтовые воды, выдуваются из почвы, а при хранении удобрений они слеживаются в
прочные брикеты.
Лучшей формой удобрений справедливо считаются гранулы. Они не слеши
ваются, равномерно распределяются в почве и лучше усваиваются растениями.
4G
Очень удобно использовать комплексные удобрения, содержащие питательные
вещества в строго определенном соотношении, или самому научиться составлять
гакие комплексы.
Обычно в справочниках приводятся таблицы, указывающие, какие удобрения
можно смешивать, а какие нельзя. Давайте и мы обратимся к такой таблице и
прокомментируем ее с точки зрения химии.
Таблица. Совместимость удобрений
( ул ьфат
аммония
Сульфат
аммония
[ Нитрат
; аммония
+
Карбамид
+
Питрат 1 у
аммония
Мочевина
(карбамид)
(Суперфосфат
(двойной
суперфосфат)
Нитрат
калия
■
Хлорид
калия
Известь
1 la воз
+
X
X
+
-
X
X
+
X
—
—
+
X
х
X
X
Суперфосфат
(двойной
суперфосфат)
+
X
+
X
X
-
+
Нитрат
калия
X
+
X
X
X
X
—
Хлорид
калия
+
+
X
X
X
Известь
-
-
X
-
X
X
Навоз
-
—
X
+
-
+
X
+
1 —
—
46
Примечание. ( + ) — эти удобрения можно смешивать и даже хранить в виде смеси,
(X)—эти удобрения смешивать можно, но только перед самым внесением в почву;
(—) —эти удобрения смешивать нельзя.
Попробуем разобраться в причинах таких ограничений на совместное использо
вание удобрений.
Возьмем, к примеру, пару двойной суперфосфат —сульфат аммония. Когда из
фосфоритной муки получали на заводе двойной суперфосфат, фосфат-ион перево
дили в растворимую форму, специально обрабатывая сырье фосфорной кислотой до
образования кислой соли (дигидрофосфата кальция):
Саз(Р04)2 + 4Н3Р04 = ЗСа(Н2Р04)2 -суперфосфат
нераств. раств.
Однако при одновременном внесении двух вышеназванных удобрений происходи!
следующая реакция:
Са(Н2Р04)2 + (NH4)2S04 = CaS04 + 2NH4H2P04
раств. раств. нераств. раств.
Образующийся при этом нерастворимый сульфат кальция обращает рассыпчатую
смесь удобрений в сплошной твердый ком. Даже при измельчении полученной массы
питательная ценность этой смеси резко упадет —самые нужные ее компоненты она
жутся в «броне» из гипса.
Если суперфосфат смешать с известью, то избыток основания с кислой солью
даст снова среднюю соль:
Са(Н2Р04)2 + 2Са(ОН)2 = Са3(Р04)2 4 + 4Н20
Агрегатное состояние смеси при этом мало изменится, а вот усвояемоеп, фо<
фора растениями станет совсем маленькой, так как средняя соль (ортофосфаг каль
ция) в воде практически нерастворима.
Там, где в таблице на пересечении названий веществ стоит знак «X», взаимодеЙ
ствие различных веществ может уменьшить их ценность. Например, мочевина в кои
такте с нитрат-ионами может медленно разлагаться, выделяя аммиак и углекислый
газ. При длительном хранении смеси будет потеряна заметная часть мочевины
Попробуйте объяснить, почему несовместимы некоторые другие пары веществ.
Как распознать удобрения, если почему-либо нет маркировки, в случае утраты
этикетки или при хранении удобрений без заводской упаковки? Для этого достаточно
иметь гашеную известь в твердом виде и питьевую или кальцинированную соду. Разу
меется, в домашних условиях можно проводить лишь качественный анализ удобре
ний.
Смешивая равные объемы (по половине чайной ложки, не более) удобрения с
измельченной гашеной известью, можно обнаружить присутствие иона аммония в
этом удобрении, смесь будет иметь запах аммиака, усиливающийся при нагревании
NHj + OH" = H3NT + Н20
Водный раствор соды с раствором удобрения даст белый осадок, если в удобре
нии есть ионы Са2+:
Са2+ + СО§" = СаС03 I
А 7
Нитрат-ион можно обнаружить так: на раскаленный уголек поместить крупинку
удобрения; если за плавлением последует вспышка с выделением едкого буроватого
дыма, значит, данное вещество содержит нитрат-ион:
2NaN03 + С = Na2C03 + NO t + N02 t
Мочевина, помещенная на раскаленный уголь, тоже разложится с выделением
газа, но в отличие от нитратов со знакомым всем запахом аммиака:
2(NH2>CO L H2N — С — N — С — NH2 + H,N t
II I II
ОНО
биурет
-
Здесь углерод уже не выполняет роль восстановителя, как в предыдущей реакции,
а служит просто источником тепла.
ОН N=C о—-С2Нс
X хсн-сс13 3 V4
НзС^о^Ч) нзс
Хлорофос Табун (ОВ)
Н О
! II
н3с~-оч /S-c--c-o-c2h5 сн
? I н Сч п — ОТ
,„. S сн^-о-с,,,, у/> xCHj
3 о
Карбофос Зарин (ОВ)
ХИМИЧЕСКИЕ СРЕДСТВА ЗАЩИТЫ РАСТЕНИЙ
Специалистам известно в настоящее время около 70 тыс. видов вреди-
гелей культурных растений. Это грызуны, насекомые, грибки, слизни, бактерии,
иирусы. Положение довольно тревожное: четверть урожая теряется безвозвратно!
Болезни и вредители губят его на корню, а сколько продуктов уничтожается при
хранении!
Химические средства защиты растений достаточно эффективны, но они требуют
весьма осторожного подхода. Врач назначает больному такую дозу лекарства, чтобы
побочное действие препарата стало возможно меньшим, а ожидаемый эффект
максимальным. Так же и ХСЗР следует применять продуманно и осторожно.
Известно, что у многих садоводов существует стойкое предубеждение к любым
видам химических средств защиты растений. Неблагоприятные последствия можно
исключить, если использовать только те ядохимикаты, которые необходимы, вовремя
и безопасными методами.
К категории ХСЗР относят несколько групп веществ: так инсектициды исполь-
48
зуются против насекомых, фунгициды— против грибков, зооциды— против грызунов,
гербициды— против сорняков.
Многие из этих препаратов синтезированы на основе тех производных фосфора, у
которых его атом связан непосредственно с атомами углерода.
Помните! Многие химические средства защиты растений ядовиты!
Обратите внимание на структурные формулы инсектицидов и некоторых отрав
ляющих веществ.
Однако ряд препаратов, использующихся против грызунов, имеют не такие слот
ные химические формулы.
Например, зооцид —фосфид цинка, попав в желудок грызуна, разлагается там
кислотой желудочного сока:
Zn3P2 + 6HCI = 3ZnCI2 + 2PH3 t
Выделяющийся фосфористый водород (фосфин)— весьма сильный яд и быстро
убивает животное.
Самой простой (с химической точки зрения) является смесь для борьбы с грызу
нами на основе алебастра CaS04 • 1/2 Н20. Приманка в желудке животного превра
щается под действием воды в гипс CaS04 • 2Н20, который закупоривает пищевари
тельную систему.
Большинство препаратов, используемых как средства для борьбы с вредителями
сельского хозяйства, имеют узконаправленное действие и на человека заметного
влияния не оказывают. Однако существование ядохимикатов на основе производных
фосфора представляет немалую опасность и для людей. Вот почему во время их при
менения необходимо соблюдать определенные правила, цель которых —не допустиib
возможности поражения человеческого организма.
Мы не будем перечислять все известные рекомендации, а остановимся только на
некоторых из них.
Рот и нос при распылении ядохимикатов следует закрывать марлевой
повязкой или респиратором, чтобы не допустить попадания в дыхатоль
ные пути мелких капелек или пылинок препарата,
После работы необходимо вымыть руки и лицо с мылом. Дело в том,
что ядохимикаты растворимы в кожном сале, тончайшей пленкой поиры
вающем кожу. Мыло эмульгирует кожное сало, а вместе с ним и посто
ронние вещества.
В водных растворах ядохимикаты постепенно подвергаются гидро
лизу, и оборудование для распыления начнет интенсивно корродирован,.
Поэтому по окончании работы его обязательно надо промыть водой и
наносить новый защитный слой смазки.
49
«Химическая грелка». Навоз дает растениям тепло за счет
окислительных процессов, поэтому навозу принадлежит, кроме роли удобрения,
еще и роль биотоплива. Однако можно использовать с этой целью и
экзотермический процесс гашения извести.
В парнике или теплице перед посевом снимают верхний слой земли
(эта операция выполняется традиционно для удаления зимовавших там
вредителей культивируемых растений). Однако новый слой укладывают
не на старое место, а на «подушку» из негашеной извести на глубине до
60 см. Обязательным является закрытие насыпанной «кипелки» сверху
слоем газет: когда растения начнут поливать, бумага намокнет
равномерно и теплота «гашения» будет поступать к корням растений тоже
равномерно и постепенно. Такой подогрев в капризную весеннюю погоду —
надежная гарантия хорошего урожая.
К осени «грелка» свою работу закончит, и после уборки урожая
образовавшаяся гашеная известь («пушонка») может быть использована для
раскисления почвы.
Мыло добавляют в смеси для опрыскивания растений, потому что оно
резко понижает поверхностное натяжение воды. Иапельки, попавшие на
растение, хорошо его смачивают, образуя сплошную пленку и увеличивая
тем самым вероятность уничтожения паразитирующих на нем
микроорганизмов или насекомых.
Поскольку оксид серы (IV), образующийся при горении серы, более чем в
2 раза тяжелее воздуха, сжигать серу следует как можно ближе к полу
теплицы или другого помещения, в котором проводится окуривание.
Теплица должна быть плотно закрыта. Тогда тяжелый газ постепенно
заполнит весь объем помещения.
Определить, какой катион входит в состав минерального удобрения
можно по цвету пламени: в пламя спиртовки или газовой горелки вносят
небольшую пробу вещества; если в составе удобрения содержится
натрий, пламя желтеет, кальций придает пламени красноватый оттенок,
калий— фиолетовый, а медь —зеленоватый.
ава
МОЮЩИЕ
СРЕДСТВА
В БЫТУ
В литературе пользуются идеей «машины времени», чтобы заглянуть в
прошлое или будущее. Давайте же попробуем по примеру
современных сказочников совершить небольшое путешествие в прошлое.
ИЗ ИСТОРИИ МОЮЩИХ СРЕДСТВ
И вот мы с вами очутились в торговых рядах начала XIX в. Судя по
архивным данным, именно в это время началось производство мыла на промышленной
основе и применение его в широких масштабах. А что же было до этого, чем мылись
раньше: 100, 1000 лет тому назад? Оказывается, что наши прадедушки и
прабабушки о моющих средствах знали не понаслышке. Два направления можно выделить
здесь: природные соединения с высокими адсорбционными свойствами и вещества,
обладающие высокой поверхностной активностью. Популярнейшим средством с
давнею времени был щелок.
В древности женщины на Руси, стремясь сохранить мягкость, пушистость и блеск
полос, пользовались таким рецептом: в дубовом ведре тщательно размешивается со
свежей ключевой или дождевой водой добрый ковш золы, да золы не простой, а
пучше еловой или от подсолнечника. Постоит такая смесь сутки. Процедит осторожно
через чистую тряпочку или просто сольет девушка воду с осадка, разведет ее чистой
модой, подогреет на камельке в рубленой бане на берегу быстрой речки и вымоет
свои прекрасные косы. Что же за химический процесс проходит в той емкости с
водой, куда помещена зола?
В золе содержится много карбонат-ионов и ионов калия, что создает в ее водном
растворе щелочную среду и способствует умягчению воды за счет выведения ионов
кальция и магния в виде нерастворимых веществ.
Если теперь такой раствор использовать для мытья волос или стирки какой-
нибудь ткани, реакция гидролиза продолжится, но уже не для растворенной соли, а
для сложного эфира —соединения глицерина с высшими жирными кислотами:
СН(СН2)2 (СОО)з - (С17Н35)з + ЗН20 + КОН - СН(СН2)2 (ОН)3 + ЗС17Н35СООК
В результате получается хорошо растворимый в воде глицерин. Анионы же кис-
поты С17Н35СОО~ вместе с иными видами загрязнений образуют эмульсию, которая
выносится с раствором при ополаскивании.
Широко использовались в старину и растения, содержащие соединения сложного
состава —сапонины, резко понижающие поверхностное натяжение воды и поэтому
способствующие образованию очень устойчивой пены. Поскольку таким свойством
обладает и мыло, такие растения стали называть «мыльный корень», «мыльнянка» и
i д. Чемпион по содержанию сапонинов —«мыльный корень». Особенно популярно
это растение на Кавказе, где издавна применяют его при стирке. Правда, сейчас на
первое место выступило иное свойство «мыльного корня». Оказывается, в нем есть
биологически активные вещества и его с успехом применяют в качестве сырья для
производства инсектицидов.
Сапонины (хотя и в меньшей доле) содержатся также в плодах конского каштана,
горицвете, примуле, корнях шпината.
52
На территории нашей страны есть немало мест, где в качестве мыла использова
лись глинистые вещества, называемые на местных диалектах «кил», «мыловка».
Достаточно было натереть такой глиной для удаления грязи волосы или ткань, а затем
сполоснуть их проточной водой.
При необходимости операция повторялась с новой порцией «моющей глины». Тре-
тьего раза обычно не требовалось. Здесь важно было, конечно, не ошибиться в
выборе глины, а то после первого натирания понадобилось бы немало других мою
щих средств, чтобы спасти загубленную вещь. Сейчас такие средства получили
научные названия: бентонит, асканит, гумбрин, но суть моющего действия осталась преж-
ней — высокая адсорбционная способность мельчайших частичек этих веществ.
Согласитесь, однако, что применение щелока, «мыльного корня», «кила» было
только выходом из трудного положения. Ведь еще в I в. до н. э. в развитых центрах
Средиземноморья пользовались мылом, которое получали путем вываривании
животного жира с концентратом щелока или с содой, добываемой из отложений по
берегам некоторых озер севера Африки. Первые попытки создания мыла, по
свидетельству историка Плиния Старшего, делали еще древние галлы и германцы.
В Европу мыло проникло в XVII в. Доступно оно было в то время далеко не всем
из-за высокой стоимости и небольших масштабов его производства. Настоящая
мыловаренная промышленность развилась позже —в первой половине XIX в. благо
даря трудам французского химика М. Шевреля.
Немаловажное значение имело и то, что в 1820 г. другой предприимчивый фран
цуз Н. Леблан наладил массовый выпуск соды — обязательного компонента мылова
ренной технологии.
Со времени своего возникновения процесс промышленного производства одного
из важнейших моющих средств не претерпел заметных преобразований. Суть его
гидролиз жиров в щелочной среде. Образующаяся при этом смесь солей высших
жирных кислот, где преобладает стеарат натрия C17H35COONa, выделяется из реан
ционной массы и после дополнительной обработки превращается в мыло —хознй
ственное, туалетное, детское и т. д.
Хозяйственным мы обычно называем мыло для стирки. Его качество в соотвв!
ствии с назначением определяется содержанием жирных кислот, массовая доля
которых (в процентах) отпечатывается на одной из граней куска: чем она выше, к;м
обильнее пена, тем лучше моет и стирает мыло. Вторым критерием качества
является наличие свободной щелочи. Вот здесь наоборот: чем меньше ее, тем
лучше —ведь щелочь небезвредна и для кожи человека, и для тканей, особонмо
шерсти и шелка.
В последние годы для удешевления производства и экономии пищевых ресурсов
все более широкие масштабы приобретает производство хозяйственного мыла и;{
синтетических жирных кислот. Их получают неполным окислением нефтяного пара
фина. С этой же целью в состав мыла вводят немного моющих глин, в частности бои
тонита. Пенообразующую способность усиливает канифоль. Ее добавки придают
мылу темный цвет, однако на моющую способность практически не влияют.
Для получения мыла высших сортов ядровое мыло, образующееся в начальной
стадии технологического процесса, высушивают, перетирают 2—3 раза на вальцах,
смешивают с добавками (отдушка, красители, мягчители кожи и т. д.) и формую!
53
кусни мыла туалетного, банного, детского, медицинского и др. В таком продукте
массовая доля жирных кислот достигает 80%.
ЧЕМ И КАК СТИРАТЬ, БЕЛИТЬ, КРАХМАЛИТЬ?
Увеличение содержания синтетических волокон в обычных тканях при-
поди г в настоящее время к тому, что мыло вынуждено постепенно уступать место
CMC синтетическим моющим средствам, предназначенным как для синтетических
волокон, так и для любых других.
Компонентный состав современных CMC весьма разнообразен. Каждая состав-
ная часть имеет совершенно определенное назначение в моющем действии. Поэ-
гому приходится подбирать средства для различных тканей и разных видов
загрязнении, но все эти неудобства оправдываются легкостью исчезновения загрязнений.
В настоящее время CMC в зависимости от назначения можно разделить на
следующие группы:
Универсальные стиральные средства—для очень загрязненного белья, при-
годные для различных групп тканей: растительного происхождения (лен, хлопок),
животного происхождения и синтетические (шерсть, лавсан), а также для предвари-
гельного замачивания белья. Из них в быту наиболее широко распространен
■■/ lomoc».
Комплексные средства, которые помимо основного процесса —стирки оказы-
вакл дополнительное воздействие на ткань (дезинфекция и т. д.).
Отбеливающие средства - для удаления цветных загрязнений, оставшихся
после стирки, и отбеливания.
При незначительном остаточном загрязнении, что выясняется обычно уже после
полоскания, достаточно применить оптический отбеливатель, не оказывающий
никакою воздействия на структуру ткани. Он просто маскирует цветные пятна. Оптиче-
ские отбеливатели обладают способностью поглощать ультрафиолетовые лучи сол-
нечного спектра, преобразовывать их в синий или фиолетовый цвет. Таким образом
они компенсируют «дефицит» синевы в отраженном от желтоватой ткани свете. Ткани,
обработанные этими веществами, приобретают не только снежную белизну, но и
повышенную яркость. Но тут важно не превысить норму в дозировке препарата,
иначе эффект может почти пропасть из-за собственной окраски отбеливателя. Во
всем мире сейчас насчитывается более 200 разновидностей оптических отбеливате-
пей для всех без исключения видов тканей, пищевых продуктов, фотобумаг,
косметических средств и т. д^ Состав их довольно сложен. Вот как, например, выглядит струк-
гурная формула стильбена —оптического отбеливателя для целлюлозных материалов:
Если же после полоскания белья выясняется, что качество стирки недостаточно
высоное, можно применить химический отбеливатель, который разрушит не
поддавшиеся моющему раствору загрязнения и цветные пятна, а заодно и
продезинфицируем ткань.
Ъ4
Действующим началом химических отбеливателей служат атомарный кислород,
атомарный хлор и оксид серы (IV).
Кислородсодержащие отбеливатели имеют в своем составе, как правило,
пероксид-ион 02~ . Чаще всего для этого используют перборат натрия
NaB02 • Н202 • ЗН20, (его химическое название —перокситригидрат метабората на!
рия) и перкарбонат натрия Na2C03 • 1,5Н202 • Н20, больше известный под названием
«Персоль». Эти отбеливатели в горячей воде активно распадаются с выделенном
кислорода, поэтому их можно использовать только для хлопчатобумажных и льняных
тканей. Соединения, содержащие ион 0|~ , постепенно разлагаются во влажной
атмосфере и при обычной температуре; поэтому хранить их следует в сухом моею
Если в состав отбеливателя ввести катализатор, позволяющий понизить темпера
туру активного выделения кислорода с 80—90 до 50—60° С, то такой препарат (он
выпускается под названием «Универсальный») станет пригодным практически для
всех волокон, кроме шерсти.
Срок хранения хлорсодержащих отбеливателей небольшой. Если кислородсо
держащие отбеливатели частично освежают воздух, то хлорсодержащие заражаю!
его ядовитым хлором. Вот почему при пользовании препаратами «Арагац»,
«Белизна», «Белка», «Дихлор-1», «Дихлор-2» нужно хорошо проветривать помещение
и не отбеливать много белья сразу.
До настоящего времени для отбеливания тканей в промышленных масштабах мри
меняют «жавелевую воду» —водный раствор поваренной соли и гипохлорита натрия
NaCIO.
Серусодержащие отбеливатели, такие, как «Лепесток» или «Лилия», готовятся
на основе гидросульфита натрия NaHS03. Кислые соли всегда менее устойчивы тер
мически, чем средние; поэтому при нагревании в водном растворе это вещее то
разлагается, производя одновременно окислительное действие и образуя S02 газ,
который издавна известен как отбеливатель. С запахом его знакомы все: он обра
зуется в момент воспламенения спички. На организм S02 благоприятного действия
не оказывает; поэтому следует соблюдать такие же меры предосторожности, как и
при пользовании хлорсодержащими отбеливателями.
Подсинивающие средства в настоящее время утрачивают свое былое знача
ние. Раньше они использовались для ликвидации некоторой желтизны хлопчатобу
мажных и льняных тканей, появлявшейся после стирки мылом. В качестве основного
вещества выступает здесь «синька» —ультрамарин, производимый с 30-х гг. XIX в,
только синтетическим методом. До этого прачки^пользовались ультрамарином есте
ственного происхождения, получаемым из очень дорогого минерала ляпис-лазури
Диапазон применения ультрамарина велик: им подсинивают не только белье, но и
сахарный песок, вводят в состав художественных красок. Искусственный ультрама
рин представляет собой алюмосиликат натрия, содержащий серу. В зависимости oi
условий обработки исходных компонентов, а также их соотношения цвет ультрама
рина может меняться.
Наиболее распространен синий ультрамарин, имеющий общую формулу
Na6AI4Si6S4024.
В зависимости от условий получения ультрамарин имеет различные цвета (даже
зеленый и красный).
Б5
Эти пигменты достаточно устойчивы к солнечным лучам, не окрашивают ничего,
кроме ткани, м хорошо смываются при следующей стирке.
Однако использование оптических отбеливателей практически сводит на нет
надобность в подсинивании белья.
Антистатические средства служат для ликвидации или, по крайней мере,
резкого уменьшения концентрации электрических зарядов на синтетических тканях. Роль
антистатиков велика. Они не только избавляют нас от неприятных покалываний
микроразрядами, но и примерно наполовину продлевают срок сохранения белья в
относительной чистоте: частички загрязнений, и в особенности пыли, перестают к
нему притягиваться. В общем-то учитывая то, что при носке ткани загрязняются с
различной интенсивностью и приобретают заряды разного знака, можно создать неэлек-
физующиеся сорочки или платья: капрон, нейлон, шерсть, шелк заряжаются положи-
гельно, а нитрон, лавсан, ацетатный шелк— отрицательно. Приняв во внимание это
обстоятельство, читатель может выбрать себе комплект одежды, которая будет вести
себя электронейтрально.
А почему же не электризуются хлопок, лен? Причина проста: эти ткани очень
хорошо впитывают влагу (видели ли вы когда-нибудь нейлоновые полотенца и
простыни?) и удерживают ее достаточно прочно.
Ведь только абсолютно чистая вода— диэлектрик, но неизбежные в воде примеси
солей делают ее проводником. Поэтому увлажнение снимает статическое
электричество.
Антистатические свойства у ткани возникают не только после обработки
специальными препаратами типа «Лана» в аэрозольной упаковке. Эти качества
сохраняются у тканей и после полоскания в растворах средств типа «Антистатик».
Мягчители тканей придают волокнам хлопка, льна и вискозы приятную,
бархатистую структуру. Препараты «Комфорт», «Утюжок», «Полиэн» воздействуют на
третичную структуру белка, входящего в состав волокон. Водородные связи частично
разрушаются — жесткость ткани становится меньше. Стоит на 10 мин погрузить
простыню, полотенце в водный раствор препарата, а затем высушить, как ткань стано-
вится мягкой и приобретает ко всему прочему антистатические свойства.
Аппретирующие средства — своего рода антипод мягчителей. Основное их
назначение—придать ткани нужную жесткость. Применяют их также для того, чтобы
придать верхней одежде водонепроницаемость с одновременным сохранением
воздухопроницаемости. Традиционным средством, придающим несминаемость тканям,
является крахмал. Когда на полотнах художников вы увидите испанских грандов в
изящных жабо, знайте, что «соты» этих воротников не сминались только потому, что
прачка не жалела крахмала после стирки. Действительно, если взять до 10 г
крахмала на литр воды, воротники и манжеты после глажения приобретут нужный
внешний вид, но почти не изменят жесткости. Если же дозу крахмала увеличить впятеро,
произойдет так называемое «жесткое» подкрахмаливание —вещь будет хрустеть в
руках.
Механизм «твердения» изделий, пропитанных крахмальной суспензией, довольно
прост. Зерна крахмала в воде набухают, и когда мы погружаем вещь в
подкрахмаливающий раствор, он равномерно распространяется в порах ткани.
Прикосновение к подкрахмаленному изделию горячей подошвы утюга вызывает
56
интенсивное испарение воды и ускоряет обратимый процесс набухания и высыхания
крахмала. Вновь в структуре его появляются водородные связи и возобновляйте
очень длинные цепочки макромолекул полисахаридов. Больше крахмала среди воло
кон — прочнее структура ткани. Однако если температуру раствора довести до 60" С,
к зернам крахмала присоединится очень много воды, они сильно набухнут, вязкость
раствора повысится вплоть до киселеобразной. Эта стадия необратима, и, если вое
пользоваться для подкрахмаливания таким раствором, никакое глажение не помо
жет: изменится не жесткость ткани, а ее внешний вид, причем в худшую сторону из ы
продуктов разложения макромолекул углеводов.
Водоотталкивающие свойства придают тканям аппретирующие средства на
основе кремнийорганических соединений. Наносят их на поверхность плащей, доми
сезонных пальто по желанию заказчика на фабриках химчистки, однако операция эта
не настолько сложна, чтобы не проделать ее дома в соответствии с рекомендациями,
прилагаемыми, например, к упаковке с «Гидрофобом-1». После обработки на воло
кнах ткани образуется пленка, по которой влага в виде мелких капелек скатывается с
одежды. Неоспоримым преимуществом кремнийорганических веществ как аппрети
рующего средства является то, что они не просто оседают на ткань, а «прививаются-
к ней. Атомы кислорода связывают поверхность материала с атомом кремния, входя
щим в состав водоотталкивающей пленки. Стирка, а также действие большинства
растворителей неспособны разрушить этот прочный союз.
ХИМИЯ В СТИРАЛЬНОЙ МАШИНЕ
Авторы уже обращали внимание читателя на то, почему отвар древесной
золы служил вместо мыла в давние времена. Поскольку сейчас щелок практически
повсеместно сдал свои позиции стиральным порошкам, пастам и жидкостям,
разберемся в том, как и почему отстирывают белье современные CMC. В каком бы виде
ни использовалось моющее средство, для каких бы тканей оно ни предназначалось,
основу его составляет чаще всего натриевая соль одной из алкилсерных кисло!,
например, такого состава:
О
/
C12H2s — О — S — ONa^- С,2Н25 — О — SO, — Na
\
О
Это вещество очень хорошо растворимо в воде. Когда в результате диссоциации
в растворе появляются ионы R — О SO^, они сразу начинают показывать свои
двойственный характер. При этом алкилсульфат-ион своей гидрофобной частью
внедряется в частички загрязнений, а другой (гидрофильной) взаимодействует с молоку
лами воды. Реализуется правило, известное еще алхимикам: «Подобное раство
ряется в подобном». Этот процесс проходит во время замачивания тканей, он необ
ходим, но недостаточен, чтобы снять загрязнения.
При стирке в растворе CMC частички грязи отрываются от ткани и переходят в
раствор. Здесь возникают особые образования (их называют мицеллы) очень
маленького размера, одноименно заряженные и поэтому отталкивающиеся дру| 01
Б7
/ipyia. Частички грязи, заключенные внут
ицелл, не имеют возможности осесть
обратно на ткань или слипнуться вместе.
удерживает частички на поверхности раство
образование пены не является непременным п
стирки пена
ооильное
ысокого качества моющего
i родства. Если мы сти
го гут пены надо по
миропалась. В состав средст
памиды. В то же время
гкань как бы е
W
ткань, которой противопоказано
1
ильное смачивание
е меньше дефор
w
стаоилизатооы пень
*.*
Р
ательно: п
этом
ается, да и сам
*
•Л»
подавители пены, и
индекс «А», например «Лотос
то
ч
ебуются
г|и получают
»ь^
I
щи
Такие средства предназначены именно
для автоматической машинной стирки
голько пены бу
В состав с
ми можн
1
У.
1
ет меньше, чем ооычн
1
С входят
ные по
11ЛВ. По строен
на две группы:
и
хностноактивные вещест
их можно
«Д
и
S т
с а
Первая,
I \ нее входят ан
к. и ион, чаще всего Na+.
рода. Иногда она
я
•*"■*
а нес
ько г
a
оде на ан
эНО ДЛ
ют в сеоя и оензольное кольцо
очка, до 1 2 атомов угл
ело атомов углерода
i
я
О*
ное I 2, оптимальное
>~/
4ть, вещество станет плохо
\л\
воде; если укоротить, анион станет менее прочно связываться с загрязнениями и
моющая способность упадет.
Практически пользуются смесью соединений с разветвленными и неразветвлен
ными радикалами, которая носит название сульфанол и синтезируется из продутой
нефтепереработки. Лучшего качества ПАВ получаются, если цепочки длинные и
неразветвленные. Со сточными водами ПАВ попадают в водоемы. Вещества с длим
ными цепочками «съедают» бактерии, а разветвленные —более стойкие и дольше
сохраняются в воде. В результате по ручьям и рекам плавают шапки пены. Это явле
ние крайне нежелательно, так как в загрязненных водоемах вымирают многие живые
организмы, наносится непоправимый ущерб рыбному хозяйству.
Катионоактивные ПАВ уступают анионоактивным по масштабам применения,
однако обладают, кроме моющего, еще и дезинфицирующим действием. Эту способ
ность придают им радикалы различного характера, соединенные с атомом азота.
Неионогенные вещества не диссоциируют в растворе, однако они и ,без того обла
дают качествами, которые возникают у ионогенных веществ при диссоциации ПОД
действием воды. Гидрофобный радикал R по одну сторону бензольного кольца
растворяется в жирах и иных загрязнениях, а с другой стороны расположена углево
дородная цепочка с кислородными группами:
R —\С)/~0~~~( —СНГ"С| 'г-*0 \,■J
Последние хорошо связываются с водой.
Неионогенные ПАВ образуют сравнительно мало пены, и на их основе готовя!
средства для машинной стирки, об особенностях которой мы говорили выше. Однако
отстирать белье одним лишь сульфанолом практически не представляется возмож
ным.
Давайте познакомимся с составом некоторых наиболее популярных CMC и выяс
ним, какова же роль каждого компонента той смеси, которую мы называем стираль
ным порошком.
Моноамилимиды способствуют разрушению находящихся на ткани загрязнителей
белкового характера (крови, слюны и т. д.). Чаще всего в этом качестве выступаю!
имидхлориды.
Таблица. Состав стиральных порошков, % по массе
, Компонент
ПАВ (сульфанол и др.)
Моноамилимиды
Триполифосфат натрия
Перборат натрия
Силикат натрия
Карбонат натрия (сода)
Синтетическое моющее с
«Эра»
20
2
35
10-15
5
10-15
«Новость»
33
2
2
-
_
—
редство
«Лотос»
20
2
25
10
-
15
<><)
Продолжение
Компонент
(Сульфат натрия
К.1|)6оксиметилцеллюлоза (КМЦ)
Оптический отбеливатель
Ароматическая отдушка
11ода
Синтетическое моющее средство
«Эра»
«Новость»
«Лотос»
5-10 50 26
0,9 - 0,9
0,2 0,3 0,2
0,1-0,3 0,1-0,3 0,1-0,3
Остаток до 100%
Так как эти соединения не выдерживают нагревания выше 40° С, стирку белья с
белковыми загрязнениями ведут только в теплой воде. Кипячение тут не поможет —
голько повредит.
Триполифосфат натрия —одно из немногих хорошо растворимых в воде
соединении фосфорной кислоты общей формулы (NaP03)n. После растворения эта соль
диссоциирует и образует анионы РО^.
Взаимодействуя с находящимися в воде ионами Са2+ и Мд2 + , фосфат-ион
переводит их в осадок состава Са3(Р04)2 или Mg3(P04)2, и вода умягчается. Порошками
с моЕзышенной долей фосфатов, такими, как «Эра», «Нептун», можно с успехом
стирать даже в морской воде. Этим качеством CMC очень выгодно отличаются от
обычного мыла.
Жесткость воде придают магниевые и кальциевые соли. Пока ионы Са2+ и Мд2+
не будут выведены из воды, мыло мыть не станет. Иногда на ликвидацию «солей
жесткости» идет до 60% мыла. Помимо этого ион Р04~ удерживает частицы загрязнений в
моющем растворе, во взвешенном состоянии уже после того, как они оторвались от
гкани.
Карбонат натрия Na2C03 и силикат натрия Na2Si03 придают раствору
слабощелочную реакцию, препятствуя тем самым оседанию на материал коричневых
соединений железа, способствуют отстирыванию жировых загрязнений.
Перборат натрия —это химический отбеливатель, который начинает выполнять
свою функцию при кипячении и разрушает не только загрязнения, но и практически
все красители; поэтому пользоваться средствами типа «Эра» для цветного белья
можно только в чуть теплой воде.
Сульфат натрия служит главным образом стабилизатором мицелл, которые
образуются при обработке загрязнений ПАВ. В этом отношении он действует аналогично
фосфатам.
Карбоксиметилцеллюлоза [С6Н702(ОН)3_х(ОСН2СООНх]п (сокращенно КМЦ) в
составе стирального порошка выполняет роль стабилизатора пены. Особенно эффек-
гивна КМЦ для стирки целлюлозных волокон: полимерный анион ее
адсорбируется волокном и отталкивает частички загрязнений, также несущие отрицательный
заряд; поэтому резко уменьшается скорость обратного процесса —оседания грязи
на ткань.
Ароматическая отдушка, пожалуй, единственный компонент, не имеющий к
60
стирке прямого отношения. В этом качестве чаще всего выступает гераниол, напоми
нающий запах розы, или линалоол, обладающий запахом ландыша:
СН,
I
(СН02С = СН(СН2)2 — С — СН
I
он
Заканчивая разговор о стиральных порошках, авторы берут на себя смелое и,
дать несколько рекомендаций, основанных на химической сущности явлений при
стирке.
Если белье сильно загрязнено или долго лежало нестиранным, пользуйтесь
моющим средством типа «Эра».
Этот же порошок берите с собой в туристический поход продолжатель
ностью более двух недель, если маршрут лежит вдоль морского побережья
А как определить вид волокон ткани, чтобы не ошибиться в выборе моющего
средства?
Всемирно известный герой Конан Дойля, как вы, несомненно, помните, обладал
массой разнообразных талантов, и в их числе способностью по трубочному пеплу
определить сорт табака. Столь глубоко в следственную практику вдаваться нет необ
ходимости, а вот правильно определить род волокон, из которых состоит ткань, каж
дый в состоянии. Для этой операции не понадобится очень сложное оборудование)
достаточно внимательного взгляда, спички и капли растительного масла. В
отдельных случаях для контроля своих выводов можно применить серную кислоту и
ацетон.
Вы, конечно, понимаете, с какой целью авторы вспомнили о необходимости рас
познавать ткани. Ведь если ярлычок, помогающий нам принять решение о том, нести
вещь в химчистку или постирать ее дома, потерялся, то можно изделие испортить слу
чайным выбором моющего средства.
Рассмотрите внимательно приведенную таблицу. Здесь предусмотрены все слу
чаи, которые могут встретиться в практике. Если же вам не удается с достаточной
надежностью определить тип волокна, то следует обратиться к специалистам в хим
чистку.
Если в эксперименте получатся несколько противоречивые результаты, то, скорее
всего, испытывается композиционная ткань, состоящая из разнородных волокон
В этом случае надо попытаться вытянуть из нее отдельные волоконца и определить их
принадлежность к той или иной категории по указанным в таблице признакам.
Почему же так тщательно следует определять род ткани, подбирать для нее cooi
ветствующее моющее средство, выдерживать температурный режим обработки с
точностью до 10—20°С и не добавлять в воду порошок, пасту или моющую жидкость
вдвое-втрое больше рецепта в надежде почище отстирать вещь? На эти вопросы мы
также постараемся ответить с точки зрения химии.
61
СН?
— линалоол
Таблица. Определение вида волонон в тнани по внешним признакам
,„ь
но бу
я '
III
II.
н;пу
>1И
и»
нап
ь или
н
и
Физические свойства
и внешний вид
Рыхлая с торчащими
волоконцами. Волокна
извитые
Более плотная, чем
хлопчатобумажная.
Волокна более длинные и
гладкие
Шероховатая. Волокна
упругие
Гладкое блестящее
волокно, при сминании
ткань хрустит
Гладкое блестящее
волокно
Гладкое блестящее
волокно
Очень похож на шерсть
Очень похож на шелк,
но не хрустит
Действие реагентов
От растительного
масла темнеет
От растительного
масла становится
прозрачной
Растворяется в
щелочах
Растворяется в
щелочах
При смачивании
серной кислотой
становится красной
При смачивании
ацетоном
растворяется и
становится похожей на клей
Не смачивается
водой
Растворяется в
кислоте, водой не
смачивается
Характер горения
или плавления
Горит быстрым и
ровным пламенем.
Пепел
светло-серый,
рассыпающийся
То же, что и у
хлопка
Плохо горит,
образуя плотный
спекшийся шарик
То же, что и у
шерсти
То же, что и у
хлопка
Сначала плавится,
а потом горит,
образуя ломкий
вздутый шарик
Плавится без
пламени, образуя
твердый шарик
Плавится без
пламени, образуя
мягкий шарик
Запах при горении
или плавлении
Жженой
бумаги
То же, что и у
хлопна
Жженого пера
То же, что и у
шерсти
То же, что и у
хлопка
Кислый
Без запаха
Без запаха
олокна растительного происхождения (хлопок, лен) устойчивы к действию щелочей
i ;ш;1чит, и содовых растворов или любого сорта мыла). При нагревании капрона или
шсана достаточно очень небольшой концентрации щелочи, чтобы в присутствии кис-
>рода воздуха начался гидролиз полимера. От этого уменьшается механическая
ючность волокон (снижается степень полимеризации), а растворимость в щелочах
ютет. При стирке в этих условиях часть ткани просто растворяется: она становится
чп.шо. То, что этот процесс произошел, можно узнать просто: сухая ткань при встря-
И.П1ИИ ПЫЛИТ.
Шелк, шерсть и синтетику обрабатывают в растворе моющего средства при тем-
>ратуре не выше 40° С. Если ее повысить, произойдет усадка (необратимая!) ткани,
шерсть к тому же еще и сваляется. Кроме того, нельзя не учитывать, что белок
>рсти (кератин) очень чувствителен к щелочи: в ее присутствии он разрушается
(денатурируется), ткань теряет характерный блеск, снижается ее прочность. Те же
явления происходят и с шелком, поэтому шерсть и шелк нельзя стирать с помощью
средств для хлопчатобумажных тканей: эти CMC всегда содержат повышенную долю
щелочных присадок (соды, силиката натрия и т. д.).
Капрон, нитрон и лавсан мало отличаются по термической устойчивости в водных
растворах от шерсти и шелка —выдерживают 50° С. Поэтому для них пригодны те же
средства, что и для естественных волокон белкового происхождения.
Особо бережного отношения требует мохер. Изделия из него при стирке мою
щими средствами для синтетики нуждаются в добавлении глицерина (примерно чаи
ная ложка на литр воды).
Температурный режим при стирке должен тщательно выдерживаться при пользе
вании универсальными CMC («Лотос», «Сумгаит», «Кристалл» и т. д.). Их состав
подобран так, что при пониженной температуре (до 40° С) гидролиз компонентов
практически не происходит и среда в моющем растворе нейтральная, т. е. как раз
такая, какая необходима шелку, шерсти или синтетике. Однако стоит подогреть
раствор с CMC до 60-70° С, как скорость процесса Na2C03 + Н20 & NaOH i
+ NaHC03 резко возрастет (примерно в 8—10, а то и более раз), да и равновесие его
сместится в сторону продуктов реакции. Щелочность среды увеличивается. Это
улучшает стирку хлопка и льна, но приводит к интенсивному разрушению шерсти или
шелка.
В рецептуре CMC компоненты подобраны так, что именно при указанной на
упаковке концентрации достигается максимальная моющая способность ком
позиции в целом. Поэтому нельзя сыпать порошок «на глазок», если хотите
добиться после стирки нужной чистоты белья и экономно расходовать моющие
средства.
При пользовании стиральными порошками пыли образуется меньше,
если порошок заливать водой.
Если ввести в стиральный порошок немного воды, то из получишпе
гося теста можно скатать шарик. Через некоторое время он затвердеем,
и образовавшимся «мылом» можно пользоваться как кусковым. Тверде
ние идет из-за образования гидратов водоумягчающего средства iри
полифосфата натрия:
Na5P3O10 + пН20 - Na5P3O10 • nH20
В США на 1 л моечной воды принято класть 1 г CMC, в Колум
бии —4 г, а во Франции —5 г (в последнем случае, конечно, (-
явным избытком, но на этом «вкладе» настаивают фабриканты моющих
средств).
63
В состав жидких CMC умягчители воды не входят, поэтому стирать ими в
морской воде нельзя.
Категорически запрещается средствами для стирки белья мыть
кухонную посуду!
Полоскать шерстяные вещи следует водой с добавкой уксуса —это
позволит нейтрализовать остатки щелочи, адсорбированные плотной
тканью.
Приятную мягкость туалетному мылу придают калиевые соли высших
жирных кислот.
■'
rjgw
CMC
ПОМОГАЕТ
НАВОДИТЬ
ПОРЯДОК
Совсем недавно хозяйки тратили довольно много времени и усилий,
чтобы с помощью песка да толченого кирпича удалить с наружной и
(внутренней поверхности сковородок и кастрюль сложные продукты окисления,
полимеризации и поликонденсации. И если бы только посуду приходилось чистить!
На раковине, кафельной плитке, металлических предметах непрерывно
образуются мыльные, солевые и иные отложения, возникают оксидные, сульфатные,
карбонатные пленки. Стены городских квартир, оконные стекла, ковры, шторы, детали
радиоприемников и телевизоров покрываются пылью, скрепленной промышленными
выбросами и продуктами неполного сгорания бензина и дизельного топлива.
Непрерывно изменяющийся спектр загрязнений предопределяет значительные
Фудности их удаления. Вот почему химические чистящие средства неизбежно
должны быть сложного состава.
ЧТО ТАКОЕ АБРАЗИВ?
Если основу моющих средств для тканей составляют сложные
поверхностно-активные вещества, то у чистящих средств, особенно для посуды и кафе-
пя, непременным компонентом является абразив (от лат. abrazio —соскабли-
вание). Однако неумеренное употребление ведет к постепенному разрушению изде
лий.
Поэтому в некоторые современные чистящие средства абразивы и вовсе не
добавляют, чтобы сохранить, например, мягкие цветные металлы и сплавы на их
основе или позолоту фарфоровой посуды.
Чистящая способность абразивов обусловлена физическими причинами. Острые
грани частиц при механическом воздействии сдирают, разрушают самые прочные
налеты, но они же могут снять защитные покрытия, усилить коррозию.
Ну а что же происходит с современными абразивами, когда хозяйка долго rpei
ими, к примеру, загрязненную газовую плиту? Чистящая способность не снижается
напротив, материал подбирают таким образом, чтобы он постепенно раздавливался
Тогда с каждым движением руки число частиц, а значит, и острых граней рае мм
Абразив самозатачивается!
В современных чистящих средствах преобладают молотая пемза (природный
материал— застывшая вулканическая лава), каолин (минерал каолими!
А1203 • 2Si02 • 2Н2(Э с примесями кварца, полевого шпата, слюды), мел (карбом.м
кальция СаС03 —панцири обитателей доисторических морей и океанов), наждачный
порошок (корунд А!203, оксид хрома Сг2Оэ) и т. д. Выбор абразива обусловлен
в основном характером очищаемой поверхности, а не свойствами загрязнений,
В связи с этим на упаковках чистящих средств указывают род очищаемых пред
метов.
67
' -* ^Щр&тШЯЩЯЩ
* • ч
||Я1вМИ№К1И^^
^^^^
.'.%../'.-•
■лтзгти
i ■ VJ«
Кроме абразивов, в чистящие композиции вводят те же самые ПАВ, добавки, что
■
и в CMC, предназначенные для стирки белья. Отличия только в назначении добавок:
для защиты поверхности металлов от интенсивного окисления, смягчения действия
агрессивных щелочей на кожу рук, придания дополнительного блеска очищаемому
предмету.
Различные добавки определяют назначения чистящих средств.
Хлорная известь
2 '
входит в состав порошкоо
МН М
х средств
Когда порошок увлажняют, идет так называемый хлорный распад гипохлорита каль
ция:
НоО + СГ+СЮ
2
20Н- + СМ
2
*
■
Одновременно при распаде хлорной извести идет процесс образования
кислорода:
2СЮ
2СГ + 0
2
Сильнейшие окислители —хлор и кислород; в момент выделения, когда они еще
ицируют очищаемые поверхности,
находятся в атомар
состоянии, отлично дез
«нбеливают цветные пятна.
Щавелевая кислота (СООН)2 относится к числу довольно сильных органических
кислот. В обычном состоянии это твердое вещество, хорошо растворимое в воде.
Щавелевую кислоту вводят в чистящие средства для снятия ржавчины с
металлически
ких поверхностей. Эта кислота легко взаимодействует с оксидами, а металл пранти
чески не успевает разрушить. Нужно, однако, помнить, что и сама кислота, и ее соли
(оксалаты) вредны для здоровья; поэтому после работы с чистящими средствами
нужно хорошо вымыть руки с мылом. Для удаления ржавчины используются и другие
кислоты. Если активность их велика (как, например, у соляной кислоты), в состаа
непременно вводится ингибитор— вещество, осуществляющее функцию защитника
металла. Примерами таких веществ являются ортофосфорная (Н3Р04) и сульфамимо
вая (H2N — SO2 — ОН) кислоты. Последние две —в чистом виде твердые
вещества и входят в порошкообразные композиции. Если в чистящем средстве отсуг
ствуют ингибиторы, то изделие придется чистить непрерывно: агрессивные к за! рил
нениям добавки из состава средства могут разрушить очищаемую поверхность.
Нашатырный спирт — водный раствор аммиака с массовой долей вещее i
ва 10% —является непременным компонентом средств для очистки изделий из меди
и ее сплавов. Взаимодействуя с продуктами окисления, аммиак дает особый вид
химических соединений— аммиакаты [Cu(H3N)4]2+, очень хорошо в отличие от окси
дов растворимые в воде. Известный военнослужащим «Асидол» доводит до ослепи
тельного блеска бляхи солдатского ремня и медные пуговицы на гимнастерке.
Небольшой алюминиевый пузырек с этим средством— обычная принадлежноси.
военных.
БЕЗАБРАЗИВНЫЕ ЧИСТЯЩИЕ СРЕДСТВА
Действие безабразивных средств на загрязнения аналогично CMC: они
омыляют жир, создают устойчивую эмульсию из компонентов средства и налета на
очищаемом предмете. Несколько энергичных движений мягкой тряпочкой и
поверхность изделий засияет первозданным блеском. В крайнем случае, когда ста
раются придать средству повышенную чистящую способность, абразивы все маки
появляются в его составе, но чрезвычайно мягкие, такие, что термин «абразив» к ним
не сразу можно отнести. Это питьевая или кальцинированная сода, осажденный мол
(не панцири древних обитателей силурийских морей, а карбонат кальция, получим
шийся при взаимодействии углекислого газа с известковой водой). Иногда ветре
чаются безабразивные средства очень сложного, многокомпонентного сослана.
В них может входить до 11 различных веществ. Например, препарат «Идеал» может
справиться с жировыми, оксидными и сульфидными пленками, растворить налет кар
бонатов на изделиях из медных сплавов и т. д. И все это исключительно за счет хими
ческого воздействия на эти загрязнения углеводородных растворителей — уайт-еии
рита, олеиновой кислоты, триэтиламина, терпинеола, карбоксиметилцеллюлозы.
И все-таки, каким бы нежным ни было чистящее средство, вместе с пленкой
загрязнений тонкий слой металла теряется. Есть, однако, способ, благодаря кою
рому такой потери можно избежать.
Если на дно широкого стеклянного, фаянсового или эмалированного сосуда поло
жить кусок алюминиевой фольги (например, обертку от шоколада), а на него— издо
лия из серебра и все это залить теплым раствором гидрокарбоната натрия (питьевая
сода), то по прошествии некоторого времени поверхность серебра посветлеет и за
69
блестит. Здесь произойдет электрохимический процесс восстановления ионов
серебра на поверхности изделия. Потери серебра практически исключаются:
ЗАд+ + Al -* А!3+ + ЗАд
Сода придаст электропроводность раствору и очистит поверхность серебра от
налога оксидов. Продолжительность процесса зависит от многих факторов и может
длиться сутки. Если нужна срочная чистка серебряных изделий, можно поступить еще
проще: взять старую алюминиевую кастрюлю, погрузить в нее серебряные пред-
моты, залить содовым раствором, поставить на огонь и через несколько минут
извлечь очищенные изделия.
Кино- и фотолюбители для очистки серебряных изделий могут применить разбав-
пенный примерно в 10 раз свежий раствор нейтрального фиксажа (отработанный,
без разбавления). Содержащийся здесь гипосульфит натрия превращает только сое-
динения серебра в растворимую в воде форму. Сам же металл действию реактива
но подвержен.
Очистка серебряных изделий с помощью гипосульфита с точки зрения
сохранное а и металла занимает промежуточное положение между обработкой мягким
абразивом (например, зубным порошком) и восстановлением серебра из соединения
алюминием:
Ag+ + 2(S203)2~= [Ag(S203)2]3~ — дитиоаргентат-ион
Если положить в этот раствор серебряные предметы, то через несколько часов
процесс образования сложного комплексного соединения завершится и поверхность
изделия даже самой причудливой конфигурации засияет равномерным блеском.
ЧТО ТАКОЕ НАКИПЬ И КАК ЕЕ УДАЛЯЮТ
В пещерах спелеологи встречаются с красивейшими известковыми обра-
зованиями --свешивающимися со сводов сталактитами и растущими вверх
сталагмитами. С точки зрения химика, возникновение этих удивительных творений природы —
каменных сосулек —объясняется следующим образом.
Подземные воды на больших глубинах насыщены углекислым газом и представ-
мню i собой слабый раствор угольной кислоты. В этом растворе существуют условия
для образования гидрокарбонат-ионов, которые с ионами Са2+ и Мд2+ дают
растворимые в воде соли. Подземные воды просачиваются через трещины горных пород, и
вместо гидрокарбонат-ионов НСОз появляются карбонат-ионы СО|". Соединяясь с
нарбонат-ионами, ионы кальция и магния образуют осадок в виде известняка и
доломита.
Многие тысячелетия растут сталактиты и сталагмиты. А подобные отложения на
дне чайника или внутри самовара образуются за несколько дней и становятся
постепенно все толще и толще. Разница во времени отложения осадков в пещере и
чайнике велика, так как резко различаются температуры, но природа накипи и сталактита
одинакова.
Тонкий слой накипи на греющей поверхности вовсе не безобиден. Конечно, на
внус чая или супа он не влияет, но вот продолжительность нагревания через слой
70
накипи, обладающей малой теплопроводностью, постепенно возрастает, дно прого
рает все быстрее и быстрее —ведь металл охлаждается с каждым разом все медлен
нее, долго находится в прогретом состоянии.
В конце концов,может случиться так, что дно сосуда не выдержит и даст течь
Хозяйке на кухне это грозит в худшем случае ожогом. Но представьте себе паровой
котел, где масса воды исчисляется тоннами. Как только днище, покрытое накипью,
прогорит, нагретая выше температуры кипения (так как давление в котле значительно
превышает атмосферное) вода мгновенно обратится в пар. Нетрудно подсчитать, что
в этом случае 1 л ее даст около 2000 л пара! Взрывы котлов, увы, не были редкостью
со времен Ползунова и Стефенсона.
Взрыв обычному чайнику, естественно, не грозит, но пленку накипи желательно
удалить. С помощью химии это сделать довольно просто: нужно на соль слабой кис
лоты воздействовать кислотой более сильной. Последняя и занимает место угольной,
которая, будучи неустойчивой, разлагается на воду и углекислый газ. Накипь рас то
ряется, теряет прочность и отделяется от поверхности чайника или кастрюли
В состав накипи могут входить еще и силикаты, и сульфаты, и фосфаты. Но если
карбонатный «скелет» разрушить, то и эти соединения не удержатся на стенка*
сосуда.
Основу «антинакипинов» составляет сульфаминовая кислота. При комнатной гем
пературе накипь с ее помощью ликвидируется примерно за 12 ч, кипячение сокр.!
щает процесс в 10 раз.
В качестве средства для удаления накипи применяются также адипиновая кислота
НООС — (СН2)4 — СООН и малеиновый ангидрид. Эти вещества слабее суль
фаминовой кислоты, поэтому для снятия накипи необходимо кипячение.
Если в продаже отсутствует фабричный «антинакипин», то можно воспользоваться
уксусной кислотой или даже соляной, но в последнем случае понадобится ингибитор
(уротропин), чтобы кислота, уничтожив накипь, не начала разрушать металл. Необхо
димо учесть, что при пользовании кислотами нужно почаще перемешивать родержи
мое сосуда. В препаратах же заводского изготовления имеется стабилизатор суспен
зии, помогающий удерживать во взвешенном состоянии отделившиеся частицы.
«ичивание воды ведет к образованию рыхлых
• ib не отлагается. Более того, если по трубам, покрытым
шью, пропускать недели две омагниченную воду, плотнейший
и удаляется током воды, Механизм этого явления, и
•емени удовлетворительного объяснения иг
.
чистки пищевой посуды определяющим показат»
эшоируемость-~ способность практически полностью
я с повс за 12 ополаскивания чистой водой. А гн
льзя мыть пищевую посуду? В их состав
1
чие от специальных чистящих препаратов входит относительно много
поверхностно-активных веществ, которые очень стойко адсорбируются
стенками посуды. Чтобы их отмыть до безопасной для здоровья
концентрации, надо полоскать водой изнутри кухонную утварь не 1-2 раза, а 10
раз. Какая хозяйка станет на это тратить время?
В состав чистящей пасты «Редоракс» входят в качестве абразива
отходы производства синтетических рубинов. Это легко .проверить, если
чайную ложку пасты размешать минуты две в стакане с водой, жидкость
слить, а подсушенный или отжатый между листами фильтровальной
бумаги осадок рассмотреть под микроскопом при боковом освещении.
Опасность поверхностно-активных веществ из CMC и чистящих
препаратов в том, что, попадая в водоемы, они уменьшают поверхностное
натяжение воды. В результате бегающие по поверхности воды
клопы-водомерки начинают «проваливаться»: их лапки теряют способность скользить
по воде. Страдают, естественно, и другие обитатели водоемов: фосфаты
из этих же препаратов вызывают интенсивное размножение организмов и
водной растительности— вода мутнеет, «цветет», приобретает неприятный
запах из-за отмирающей микрофлоры. Рыба здесь гибнет от недостатка
кислорода,
Золотые изделия очищают смесью яичного белка и CMC с
отбеливателем.
I
/
ш
/ химия
И КОСМЕТИКА
SB)
Советский энциклопедический словарь 1983 г. термину «косметика»
дает два толкования: «учение о средствах и методах улучшения
внешней ли человека» и «средства для ухода за кожей, волосами, зубами и ногтями».
Искусством декоративной и лечебной косметики владели древние египтяне, греки и
римляне. Рецепты снадобий и методику выполнения процедур передавали из
поколения в поколение. Специалистов в этой области называли косметами. И в наше время
косметика занимает важное место в повседневной жизни, а средства ее
по-прежнему остаются товарами повышенного спроса.
С косметикой теснейшим образом связана парфюмерия (от франц. parfum
—приятый запах, духи). Этим термином объединяются изделия для ароматизиции волос,
одежды, а также освежения кожи (именно здесь контакт парфюмерии и косметики) и
промышленность, все это производящая. Поскольку сырье у парфюмерии и косме-
1ики в основном общее и технология во многом совпадает, и магазины, где они
продаются, одни и те же, рассматривать мы их станем вместе.
НОСИТЕЛИ ЗАПАХА
Начнем с веществ— носителей запаха. В настоящее время многие из
душистых веществ получают искусственным путем, но совсем недавно пользовались
голько природным сырьем. Так, розовое масло— ароматнейшее из эфирных масел —
арабы научились извлекать в X в. Измельченные лепестки обрабатывали водяным
паром и отжимали, извлекая таким образом более половины содержащегося в них
масла. Способ оказался настолько удачным, что его применяют и сейчас,—только
раньше остатки лепестков выбрасывали, а теперь из них варят варенье. Чтобы
экстрагировать 1 л масла, надо переработать до 2 т лепестков, но зато и цена такого
масла чрезвычайно высока. Розовое масло идет не только в сорта «Экстра»
парфюмерной продукции, но используется и как лекарственное средство.
С точки зрения химика, розовое масло —сложная многокомпонентная система,
состоящая в основном из спиртов: фенилэтилового (70—75%), гераниола (10—15%),
цитронеллола (5—6%).
Поскольку при современном уровне развития тонкого органического синтеза
появилась возможность получения в промышленном масштабе компонентов эфирных
масел, в настоящее время многие из них так и производят. Начало синтезу душистых
веществ было положено более 100 лет тому назад, когда обнаружили ароматические
свойства у производных бензола. В СССР душистые вещества синтетическим путем
стали получать с 1925 г., а к 1940 г. была освоена технология приготовления 70
нидов ароматной продукции. Сейчас производится более 300 разновидностей
душистых веществ, их общая масса достигает 10 000 т в год.
Множество запахов окружает нас с момента рождения. И если звук легко
зафиксировать, а затем воспроизвести с исключительной точностью, то с запахом все
юраздо сложнее. Опытные операторы могут по виду фонограммы на краю
кинопленки сказать немало о характере звукового сопровождения фильма. У химика,
взявшегося прогнозировать запах вещества по виду структурной формулы, возмож-
74
'•■■■■ ri'in-ll'll -1м I.
—•" -
fin ппп'
П л п Л П
. ' "
ностей дать конкретный ответ гораздо меньше. Однако кое-какие путеводные «звеэ
дочки» можно различить. К их числу относится наличие разветвленных цепей, слбж
ноэфирных групп, ароматических колец, а также таких сочетаний атомов, как
= С = О. Иногда небольшое вмешательство в состав вещества весьма сильно
влияет на его запах. Например, мускус, который с давних пор извлекали из же/км
самцов кабарги (небольшого, похожего на оленя животного), встречающегося на
Востоке нашей страны, содержит пахучее вещество мускон, которое относится и
циклическим кетонам:
н3с
О
НС—CHL,—С
\ /
(сн2)„
В зависимости от числа п в цепочке групп — СН2 — оттенок запаха меняется
так: при п — 5 мы ощущаем аромат горького миндаля, а при п = 6 -уже мяты. С рос
том длины цепочки появляются новые оттенки: п = 8—9 —запах камфоры, л= 9 13
кедровой смолы и, наконец, при п= 14—15 возникает неповторимый запах мускуса,
ценившийся модницами всех времен и не утерявший своего обаяния и сейчас
Но чтобы извлечь и передать парфюмерам 1 кг мускуса, требовалось истребим,
стадо в 700 голов! Современная химия, решив проблему синтеза данного цикличе
ского кетона с различным числом п, сберегла жизнь этим животным.
7В
Среди прочих мускус ценится не только эмоциональностью своего воздействия,
но и способностью маскировать, «забивать» другие запахи. Есть у мускуса еще одно
качество, которое обеспечило ему необычайную популярность. Это вещество
способно сохранять стойкость запаха духов, даже если оно добавлено к ним в исче-
зающе малых дозах. Так, в одном из городов Ирана до сих пор посетителей удивляет
необыкновенным ароматом мечеть, построенная несколько сот лет назад. По
преданию, в раствор, скрепивший камни стен, был добавлен мускус.
Коснемся теперь той области парфюмерии, основная задача которой — удовлет-
ворить эстетические потребности человека.
Специалисты различают три стадии запаха духов.
Начальный аромат покупатель ощущает, когда открывает флакон. Такой же запах
сохраняется в течение от 3 до 5 мин после нанесения духов на ткань. За это время
успевает испариться этанол и вместе с ним самая летучая часть душистых компонен-
гов.
Читатель уже понял, что аромат духов может впоследствии и не совпасть с
начальным.
Продолжительность основного аромата подавляющего большинства духов
укладывается в 20—25 ч. За время основной стадии испаряются именно те компонен-
гы, которыми оперировал создатель той или иной композиции, решая непростую
задачу объединения близких или далеких ароматов. Так, «Белая сирень» обрела
индивидуальность после смешения в определенных пропорциях веществ, по отдельности
воспроизводящих запахи ландыша, боярышника, гвоздики, гелиотропа и розы.
«Ядром» аромата послужил запах жасмина. Конечно, можно, применяя фиксаторы
запаха, такие, как мускус или амбру, продлить этот период (вспомните иранскую
мечеть).
Остаточный аромат — его продолжительность для всех духов одинакова: от 10
до 15 ч. За это время уходят или окисляются под действием факторов внешней
среды остальные компоненты духов. Интенсивность аромата резко падает, а иногда
меняется и его характер.
Заметим в заключение, что носителем и растворителем веществ могут быть не
юлько спирт и вода, но и жировые основы, а также адсорбенты, способные долго
удерживать ароматы. Отсюда повели свое начало концентрированные духи (в восках
или жирах) и сухие, где носителем является тальк.
Если духи наносить на кожу, то весьма велика вероятность легкого химического
ожога —следствие комбинированного воздействия этилового спирта и растворенных
в нем веществ. Не следует смачивать духами и одежду, особенно светлую: после
испарения растворителя пахучие компоненты интенсивно окисляются и могут дать
продукты, окрашенные отлично от цвета ткани. В химчистке такие пятна выводить
берутся редко.
Специалисты советуют подшить с изнанки платья небольшой лоскуток чистошер-
с1нной ткани. Этот-то лоскуток и надо смочить духами.
Важное место по значению и объему выпуска продукции парфюмерной
промышленности занимают одеколоны. Их главное назначение гигиеническое, и отдухов
они отличаются лишь меньшей долей ароматических веществ и спирта.
В среде этанола большинство микроорганизмов гибнет в считанные секунды
76
То, что из налета на коже не удалит вода, подчинится действию спирта: он снимп
загрязнения жирового происхождения и водорастворимые вещества.
Аромат одеколона влияет на кровяное давление (его увеличивают неприятные
запахи, а снижают запахи розы или ванили), зрение, слух... Неудивительно, что опре
деленные составляющие аромата воздействуют на наше настроение.
Менее популярным видом парфюмерной продукции (совершенно незаслуженно)
является туалетная вода. Здесь доля спирта и душистых веществ снижена до тот
минимума, который позволяет достичь точно такого же освежающе-гигиеничесно! о
эффекта, как и у одеколона, однако раздражающего действия практически нет.
А теперь коснемся такого сильнодействующего средства, как косметика. Воз
можности ее настолько велики, что в середине XVIII в. английский парламент вынуж
ден был принять специальный закон, по которому брак признавался недействитель
ным, если устанавливался факт пользования косметическими средствами со стороны
невесты. Аналогичные меры были предприняты примерно в то же время и в России в
период царствования Петра I.
С незапамятных времен человечество пользуется декоративной косметикой
Среди многочисленных находок на стоянках первобытных людей встречались и
остатки... губной помады, рецептура которой с тех пор изменилась мало. Гримом (в
современном понимании этого слова) пользовались и воины-мужчины, раскрашивая
свои лица и обнаженные торсы самыми причудливыми узорами, дабы напугать потен
циального противника и отличить соплеменника.
77
Высокого уровня развития достигло искусство декоративной косметики в Древ-
ном Египте. И хотя арсенал средств тогда был не столь обширен, как сейчас, рецеп-
турно-косметические папирусы существовали и во времена царицы Клеопатры.
Судя по содержанию папирусов, медицинский контроль за парфюмерно-космети-
ческими товарами во времена фараонов был не таким жестким, как сейчас. Зеленые
гени для век создавались с помощью основного карбоната меди (малахита)
Си2(ОН)2СОз, растертого в мельчайший порошок; разрез глаз удлинялся с помощью
сульфида сурьмы (III) (сурьмяного блеска) Sb2S3 или измельченным костным углем.
В современных рецептах соединения меди можно встретить чрезвычайно редко, а
сурьмы нет совсем: слишком велико их побочное физиологическое воздействие.
Современные красители, которые применяются в косметике, делят на две
■ руппы—для волос и для лица.
ВОЛШЕБНЫЕ ПРЕВРАЩЕНИЯ ПРИЧЕСОН
От красителей для волос требуется многое: они не должны раздражать
кожу, оказывать нежелательное влияние на организм, изменять существенно струк-
iypy волос, и, самое главное, обязаны прочно держаться.
Лучше всего фиксируются такие красители, механизм нанесения которых
заключается в предварительном пропитывании волос одним из компонентов с
последующим воздействием другого. Так, в косметике в качестве первого компонента исполь-
78
зуют разбавленные водные растворы хорошо растворимых солей свинца, серебра,
меди, висмута, иногда марганца. «Проявителем» для впитавшихся в волосы солей
является пирогаллол (1, 2, 3-трионсибензол). Образующаяся серная кислота ту г же
нейтрализуется нашатырным спиртом, входящим в состав красителя:
2 NH4OH + H2S04 - (NH4)2S04 + 2 H20
Под действием солей меди волосы приобретают, как правило, красноватый отлив
Если были взяты соли серебра, появляется серый с металлическим блеском оттенон
Ионы железа, восстановленные пирогаллолом, дают синевато-лиловый цвет.
Другую задачу решают желающие осветлить волосы. Эта химическая процедура
совершается с помощью 3%-ного раствора пероксида водорода. При этом соедине
ние разлагается с образованием в первый момент атомарного кислорода:
Н202-+Н20 + 0
Окислительное действие последнего велико: он разрушает пигменты волос. Но
при большей концентрации пероксида водорода начинают разрушаться и сами
волосы...
Поскольку устойчивость водных растворов пероксида водорода незначительна,
на практике применяют это вещество в виде комплекса с карбамидом
(NH2)2CO • Н202 и называют его гидроперитом. Таблетки гидроперита очень удобны
в обращении.
Химические превращения происходят и при пользовании красителем гила
«Гамма». К числу его основных компонентов относятся парафенилендиамин и реэор
цин. В зависимости от соотношения компонентов в результате их химического взаи
модействия волосы приобретают цвет от пепельного до черного. Аналогичные соеди
нения входят и в красящие шампуни.
С помощью химии можно не только изменить цвет волос, но и придать им опреде
ленную форму. Известно, что роговое вещество волоса сохраняет свои упругие
свойства вследствие многочисленных дисульфидных «мостиков». Если эти «мостики*
временно ослабить, волосы станут очень мягкими и податливыми — их можно уложить
в соответствии со вкусом клиента и мастерством парикмахера, В химическом спо
собе завивки роль разрушителя «мостиков» отводится тиогликолевой кислоте или «■<>
солям (сама кислота малоустойчива).
Последующая обработка уложенных волос соединениями типа CI — R CI,
например дихлорбутана, восстанавливает, а иногда даже усиливает упругость волос,
может сделать их жесткими.
А теперь рассмотрим некоторые химические аспекты мытья волос.
Мытье волос требует особого внимания. Обычным мылом, особенно хозяйствен
ным, волосы мыть не стоит: повышенная щелочность образующегося раствора вызы
вает необратимые изменения не только в структуре волоса, но и в волосяных «луко
вичках». Кроме того, если вода будет взята некипяченая, жесткая, возникнет грязно
ватый налет:
2C17H35COONa + Mg2+ = (C17H35COO)2 Mg i + 2Na+
Стеараты кальция и магния плохо растворимы и сцепляются с поверхностью, куда
они осели, весьма прочно.
70
Если нет специальных моющих средств —шампуней, допустимо применение дет-
оного мыла (его реакция практически нейтральна). Но при этом следует умягчить
поду: хорошенько ее прокипятить и обязательно дать отстояться (удаляется
временная жесткость):
Мд(НСО
3/2
t°
ССМ +HoO + COot
з
2
2
Затем воду с осадка осторожно сливают или фильтруют через вату. К фильтрату
4
добавляют питьевую соду из расчета /2 чайной ложки на 1 л, тщательно перемеши-
и а ют и оставляют отстаиваться не менее часа (удаляется постоянная жесткость
MgCI2 + 2NaHC03 = МдСОэ 4 + 2NaCI + Н20 + С02 t
Для шампуней эти проц
V/
не требуются. Более того, многие шампуни сохра
ннют свои свойства и в морской воде.
Вредное действие щелочи можно нейтрализовать добавлением в воду для опо-
паскивания слабой кислоты (лимонной или уксусной) из расчета 1 столовая ложка
6%-ного уксуса на 1 л воды. Можно взять и твердую лимонную кислоту ( /4 чайной
ложки на 5—6 л). Тогда гидроксид-ионы будут связаны протонами кислоты:
+
нг.+ о
НоО
2
Появившиеся в последнее время ополаскиватели для волос хорошо справляются
с этой задачей, кроме того, придают волосам спосооность притягивать влагу воздуха
во
(гидрофильность). После ополаскивания в таком растворе волосы покрываются гон
чайшей пленкой одного из поверхностно-активных веществ, способных удерживать
влагу, и хорошо знакомое каждому явление электризации волосам уже не грозит,
ПУДРЫ И АЭРОЗОЛИ
Косметика лица начинается с пудры. С точки зрения химика, пудра
великолепный адсорбент влаги. Ее водопоглощающая способность обеспечивается
входящими в ее состав рисовым крахмалом (высшего сорта), тальком
Mg3Si4O10(OH)2, каолином Al4[Si4O10](OH)8) стеаратом цинка Zn(C17H35COO)-,,
оксидами цинка и титана.
Конечно, «мощности» тонкого слоя пудры хватает только на поглощение выделе
ний потовых желез, работающих в обычном ритме. В жаркий летний день, когда обра
зевавшаяся на лице кашица закроет все поры, пудра принесет только вред.
Вторая функция пудры-защитная. В атмосфере сегодняшних городов немало
газообразных оксидов кислотного характера. Вместе с атмосферной влагой они
образуют мельчайшие взвешенные частички — капельки кислот. От них-то и защищаю!
кожу лица и шеи оксиды основного характера:
ZnO + H2S04 = ZnSQ4 + Н20
Каолин и тальк адсорбируют вредные вещества под пудрой и снаружи слоя и по
пропускают их к коже. Вот почему умело, без излишеств нанесенная на кожу лиц.»
пудра не только улучшает цвет лица, но и защищает кожу от химического воздействия.
Скоро уже полвека, как химия участвует еще в одном, имеющем непосредствен
ное отношение к парфюмерии и косметике процессе —распылении жидкостей. Гоч
нее сказать, химия здесь выступает в союзе с физикой. Суть процесса сводится к
тому, что в сосуд с жидкостью (например, одеколоном) вводятся легкоиспаряю
щиеся вещества, чаще всего так называемые фреоны или хладоны. К их числу ото
сятся галогенопроизводные углеводородов типа C2F2CI4, а также соединения цикли
ческого характера. Все они кипят уже при —30° С; поэтому их пары не только вы юн
кнут жидкость из баллона, но и, расширяясь, распылят ее мелкие капельки. Нужно
лишь при распылении держать баллон подальше от кожи и тем более от глаз: при
интенсивном испарении температура жидкости резко падает, и можно получить ожог.
В последние годы фреоны (хладоны) вытесняются другими веществами, включая и
низкокипящие углеводороды. Дело в том, что попадающие в атмосферу фреоны спо
собствуют разрушению озонного слоя, защищающего все живое на Земле от жест
кого космического и солнечного излучения.
О том, как создаются запахи, вы уже знаете. Но иногда приходится
решать задачу потруднее- экстренно уничтожать з^пах. В этой ситуации
химия — верная помощница. В помещении распыляют дезодорант, и мель
чайшие его капельки в считанные минуты поглощают (адсорбируют) паху
чее вещество. Поскольку большинство таких веществ по химической
природе спирты, основным компонентом дезодорантов являются их
81
аналогиглицерин, пропандиол-1, 2
подобном!
Модницы. Древнего Египта, Греции и
вали карбонат свинца РЬС03, а как румян
только не было кремов: паста из хлебных
молодых собак с протертыми я( i!.\.
В 1806 г. в, Париже вьш
один из первых одекопонов- «О де I
«Аромат» пиридина и толу i in i
зола и гераниола —остроту cj
Неумеренные дозы или ели
ших доз неприятных за
ния,
В последнее время во Франции еже
м е н о в а н и й ко с м ет и ч е с к и х i о в а | > о в, Р ас х о ды п< о i
ние косметики равны 15% оборонно!
О том, насколько непростая эта си<
судить из следующего: рецепryj
Москва» содержит 16 душ ж
9 базовых композиций.
Название «одеколон» пришло к
нии одеколона рассказы;
духи, но они сильно раздраж
награда тому, кто приду|
нашелся в Кельне. Предс1
содержал как раз то, что нужн .
Cologne) обрела вс *
После приготовления п,
выдерживают от 1 до 3 и
Италии дпп улучшения е ;
кость тонное
7
-аэава
ХИМИЯ
И ЗДОРОВЬЕ
В борьбе за здоровье химические препараты играют не последнюю
роль. С ними приходится сталкиваться на каждом шагу, в каждой
квартире. Множество эффективных препаратов защищают нас от недугов, помогают
преодолеть последствия заболеваний. Однако многие лекарства оказываются
крайне опасными для организма и даже жизни, если ими неправильно пользоваться.
В этой главе будет рассказано о том, что происходит с различными веществами,
когда они попадают в наш организм, какие химические процессы помогают нам
бороться с болезнями.
ЭКСКУРСИЯ ПО АПТЕЧКЕ
Люди стали искать и использовать лекарства много тысяч лет назад. Муд-
рецы и знахари передавали из рода в род сведения о травах, которые вылечивали
больных от горячки, желудочной немощи и других напастей. Многие из этих рецептов
перешли в первые «травные аптеки». Да и в современной фармакологии исполь-
зуется около 200 трав, упоминавшихся еще в древнеримских медицинских
наставлениях. Правда, совершенно иным стало понимание их действия, условия их
применении. Это и понятно: ведь по-настоящему лишь немногим более ста лет назад люди
в 4
начали узнавать истинные причины многих заболеваний. Кажется невероятным, но
еще в середине XIX в. подавляющее большинство врачей считали нелепостью саму
мысль о том, что болезни могут быть вызваны какими-то микроскопическими суще
ствами, кощунственной казалась идея наркоза и обеззараживания при операциях.
Вот почему в XVI в. средняя продолжительность жизни европейцев составляла не
более 21 года, да и в XIX в. в России она не превышала 30 лет.
Не зная особенностей организма, не ведая причин болезней, врачи недавнею
прошлого прибегали к домыслам, почти сказочным доводам. Наряду со средствами,
эффективность которых сегодня понятна и объяснена (это относится прежде всего к
ряду лекарственных растений), предлагались медикаменты совершенно нелепые, а
рекомендации по их использованию обосновывались мистическими положениями.
Так, в справочнике XVII в. «Мудрые наставления по лечению хворостей телесных»
совершенно серьезно рекомендовалось: «Для исцеления детской горячки завари
кипятком сушеных летучих мышей»; «Если ты шелудив, ящерицу сожги на пепел и
мажь тело».
Итак, присмотримся к пакетикам, баночкам, пузырькам, которые лежат в аптечке.
Это в основном результаты работы химиков и фармацевтов XIX—XX вв. Даже препа
раты, приготовленные из давно известных растений, сегодня принципиально отли
чаются от тех, что использовали в прошлом.
Вот несколько лекарств, которые наиболее часто используются в лечебной пран
тике: аспирин, амидопирин, анальгин.
85
Аспирин начали использовать как лекарство в 1899 г. Его именуют, используя
современную химическую номенклатуру, ацетилсалициловой кислотой:
о—с—-сн,
II 3
о
По структуре это один из наиболее простых препаратов; его широко применяют
как болеутоляющее, жаропонижающее, противовоспалительное и
противоревматическое средство. Интересно, что это лекарство несколько замедляет процесс
свертывания крови. Этим нередко пользуются врачи для предотвращения образования
тромбов после операций, а также при нарушении мозгового кровообращения.
Хорошо, когда кровь свертывается, но страшно, если этот процесс идет в
кровеносном сосуде, угрожая его закупоркой. Ацетилсалициловая кислота регулирует в
известной мере синтез в тканях физиологически активных соединений, называемых
простагландинами. Они влияют на обмен веществ и управляют многими функциями
организма. Именно замедлением образования простагландинов объясняют
способность аспирина укрощать воспалительные процессы и тормозить образование
тромбоцитов.
Однако эти свойства медикамента могут вызвать и неприятные последствия в
случае приема в больших дозах. Так, например, способность сдерживать свертывание
крови может вызвать... развитие кровотечений. Избыток аспирина способствует
появлению язвы желудка и внутренних кровоизлияний из-за раздражения слизистой
оболочки. Ведь сам аспирин — кислота, а при разложении его в желудке появляется
дополнительно и уксусная кислота.
Обычно неподалеку от аспирина лежат в аптечке и упаковки с амидопирином
(пирамидоном) и анальгином. Эти препараты уменьшают различные боли, снижают
температуру.
Анальгин действует быстрее и эффективнее амидопирина. Посмотрите на их
формулы и обратите внимание на то, что у анальгина вместо атома водорода имеется
группа S03Na, к которой «прицеплена» молекула воды.
сн3
ЬЦ С—С С N СН,
II
3 \N/
Амидопирин Анальгин
Именно эта группировка влияет на растворимость анальгина: он быстрее
всасывается и создает лечебную концентрацию в крови. При ипользовании смеси лекарств
86
удачно служат нам особенности каждого: быстрый эффект достигается благодаря
энергичному всасыванию анальгина и в то же время амидопирин, медленно поступая
в кровь, обеспечивает продолжительность действия препарата.
Эти лекарства в большинстве случаев не вызывают неблагоприятных побочных
явлений.
Для достижения большего лечебного эффекта составляют и многокомпонентные
смеси с участием других физиологически активных веществ. Чаще всего в них входиi
фенацетин, являющийся производным парааминофенола, известного фотографам как
составная часть проявителя. Фенацетин хорошо переносится и в отличие от аспирина
не вызывает изменений слизистой оболочки.
Во многие препараты от головной боли входит кофеин, относящийся к группе
алкалоидов. Он содержится в плодах и листьях некоторых растений. Кофеин получаю!
в настоящее время и синтетически. Он возбуждает нервную систему, активизируем
психическую деятельность, увеличивает умственную и физическую работоспосо(')
ность, уменьшает усталость и сонливость. Но следует помнить, что лишняя чашка
кофе вечером может нарушить сон и снизить тем самым работоспособность после
дующего дня. Какова же роль кофеина при головной боли?
Как правило, во время болезни у человека бывает угнетенное состояние вслед
ствие воздействия ядов, выделяемых микроорганизмами, на центральную нервную
систему и сердце. Добавка небольших доз кофеина повышает общий тонус и сопдо-
87
тивляемость организма, усиливает действие лекарства, позволяет организму
быстрее справиться с недугом.
Лекарства для лечения сердечно-сосудистой системы. Напряженный ритм
жизни, характерный для XX в., приводит к заметным нарушениям в работе
сердечнососудистой системы у людей разного возраста. Конечно, самое эффективное
средство против этих недомоганий— правильный режим дня, занятия спортом,
оздоровительный бег. Однако случается, что необходимы и лекарства.
Поэтому домашняя аптечка комплектуется и валидолом, и корвалолом, и даже
нитроглицерином. Что же такое валидол? Так называют препарат, в основе своей
имеющий 2-изопропил-5-метилциклогексанол-1. В медицине и быту его называют
проще —ментол. Валидол —это раствор ментола в ментоловом эфире изовалериано-
вой кислоты. Если вещество попадает на слизистые оболочки, то ощущается холодок,
легкое жжение и покалывание. Валидол вызывает рефлекторное расширение
коронарных сосудов и поэтому помогает в случает сердечных приступов.
Ментол еще и сильный антисептик. Воздушно-паровые ингаляции этим веществом
незаменимы при заболеваниях верхних дыхательных путей; защитой от насморка
служит бороментол — мазь из одной части ментола, 10 частей борной кислоты и 1 89
частей вазелина.
При сердечных расстройствах приходится применять и более эффективные
средства, в частности, таблетки нитроглицерина.
сн7—сн—сн.
12 I 12
0 0 0
J —нитроглицерин
А А
о оо Ьо Ч)
Маленький кружочек, рассасывающийся под языком менее чем за полминуты,
снимает спазмы сосудов сердца.
Разумеется, полагаться только на лекарства, даже самые могущественные,
нельзя: если беспокоит боль в сердце, необходимо безотлагательно обратиться к
врачу! И никакими снадобьями не заменить зарядку, правильный распорядок жизни с
самого раннего детства!
Кан ваша печень? Специалисты различных стран обращают внимание на то, что
по мере усиления воздействий человека на природу значительно учащаются
заболевания печени. В западноевропейских столицах число таких случаев за последние 10—
15 лет увеличилось в 3 раза. В ряде промышленных центров медики удаляют
желчных пузырей больше, чем аппендиксов. Причина этого, по-видимому, в резком
увеличении числа новых химических продуктов в окружающей среде, так как в итоге все
чужеродное выводится из организма с помощью печени. Изменилось и питание:
возрастает потребление жиров и жирного мяса. Все это создает для печени большую
нагрузку.
В домашних аптечках на случай внезапного расстройства печени имеются алло-
хол, но-шпа и никодин. Познакомимся с ними поближе.
Аллохол — лекарство биогенного происхождения. В его основе —сухая желчь
животных с добавлением экстрактов чеснока и крапивы, нанесенная на активирован-
88
ный уголь. Таблетки покрывают оболочкой, назначение которой— сохранить npenapai
в кислой среде желудка и позволить ему раствориться в щелочной среде кишечника
Лекарство усиливает секрецию поджелудочной железы, ускоряет расщепление и
всасывание жиров. Однако при нарушении режима питания, злоупотреблении жир
ной пищей никакой аллохол не поможет.
Совсем другой характер действия у но-шпы. Главная ее особенность — эффектив
ное снятие спазмов.
Но-шпа —это фирменное наименование лекарственного препарата. Номенкла
тура химических соединений рекомендует именовать ее несколько иначе: 1-(3,4-диэ
токсибензилиден)-6,7-диэтокси-1,2,3,4-тетрагидроизохинолина гидрохлорид.
При весьма положительной оценке целебных свойств но-шпы бросается в
глаза, что это все же средство борьбы с последствиями, а не с причиной заболева
ния.
Третий же препарат — никодин — хоть и не снимает спазмы, но улучшает работу
самой печени и помогает бороться с воспалительными процессами. В организме он
расщепляется на никотинамид (важнейший для печени препарат) и формальде! ил,
который выполняет бактерицидные функции в воспаленных желчных путях.
Витамины. Витамины, строго говоря, не лекарства, а жизненно необходи
мые организму вещества. Большую часть широко известных сегодня витаминои и
поливитаминных смесей стали целенаправленно использовать только последние 30
50 лет.
Нч
В руках умелого врача разнообразные витамины — могучее средство укрепления
организма, повышения общего тонуса, сопротивления заболеваниям. В наши дни
трудно поверить, что всего сто лет назад авитаминозы, цинга были причиной
многочисленных смертей не только в бедных хижинах, но и во дворцах правителей. Сытная,
изысканная пища богатых была нередко лишена самого необходимого —витамина С.
Сейчас нет надобности в особой рекламе витаминов: их принимают практически все,
и иногда в дозах, более чем необходимых. Вот парадокс: человек, глотающий походя,
как конфетки, витамин С с глюкозой... может заболеть цингой!
Известно, что для нормального существования нам необходима вполне опреде-
ленная доза витамина С, а если его окажется значительно больше, чем нужно, то в
организме усилится синтез соединений, разрушающих избыток витамина. Под их
сокрушающим действием расщепится и витамин С (L-аскорбиновая кислота), необ-
ходимый для нормального обмена веществ, а незадачливый любитель этого витамина
может испытать то же, что и моряк, находящийся в дальнем плавании лет
тому назад.
Вот еще один витамин —РР, или никотиновая кислота. Хотелось бы сразу преду-
предить: это вовсе не означает, что курящие получают этот витамин, вдыхая табачный
дым. Просто название препарата связано с тем, что впервые его создали при
окислении никотина —токсичного вещества, входящего в состав табачных листьев. Близок
w tx
по строению и свойствам к никотиновой кислоте и никотинамид, который поэтому
тоже называют витамином PP. Буквосочетание РР происходит от английских слов
pellagra preventing, что означает предупреждающий пеллагру. Еще сравнительно
недавно бедняки на юге США и Европы страдали непонятной болезнью. Белой
w
и шершавой становилась кожа, человека охватывала слаоость, наступали парали-
чи и смерть. Оказалось, что в зернах кукурузы мало витамина РР и
питавшиеся только ею неизбежно заболевали пеллагрой. Не случайно сейчас во всем
мире принято добавлять витамин РР в кукурузу, идущую на корм домашним
животным.
-
Никотиновая кислота не может считаться только лекарством против пеллагры
"
это одно из средств управления обменом веществ. Есть у нее, однако,
кратковременное побочное действие. Принятая натощак, она на 10—15 мин заставляет крас
неть лицо, руки и шею, к голове приливает кровь. Поэтому витамин РР рекомендуют
принимать после еды.
А вот картонная коробочка со склянкой, в которой перекатываются красные
прозрачные капсулы. На коробочке надпись «Витамин Е». Химики называют его 6-ацеток-
си~2-метил-2-(4,8,12-триметилтридецил)-хроман, или короче, а-токоферолацетат.
Сложные, многочисленные и не всегда благоприятные окислительные процессы
непрерывно протекают в тканях нашего организма. Токоферолы защищают его клетки
ч^
и ткани от окислительных разрушении, в определенной степени тормозят старение
организма.
Лекарства для лечения
й системы. В случае употребления
ч/
несвежей пищи, да и просто при нарушении простейших гигиенических правил в
кишечник могут проникнуть чужеродные микроорганизмы, размножиться там и вы-
ч/
звать тяжелое состояние, которое врачи называют диспепсией
Так как это заболевание нередко, в каждой семье обычно есть определенный
90
набор первичных средств для борьбы с ним. Наиболее популярен салол в чистом
виде или в виде компонента лекарственной смеси,
Салол, или фенилсалицилат (как и аспирин), в щелочной среде кишечника распа
дается в результате гидролиза на салициловую кислоту и фенол.
Оба вещества подавляют деятельность бесчисленных микроорганизмов, насе
ляющих кишечник,
Защита от микроорганизмов. Гигиена —одно из эффективнейших средой
охраны нашего здоровья. Вещи, воду, раны, царапины можно обеззараживать с
помощью различных препаратов. Один из них —пероксид водорода Н202, об окис
ляющем действии которого рассказывалось в предыдущей главе.
Не менее широко распространены антисептики-окислители: иод и пермангап.и
калия («марганцовка», как его неправильно называют в быту). Первый из них при
меняют в виде раствора в этаноле с массовой долей вещества 5% (этанол и сам
антисептик) или в виде водного раствора в йодистом калии, например раствор
люголя, которым смазывают горло при фарингитах, Йодистый калий способен при
соединять молекулярный иод, образуя соединение К13, диссоциирующее в водном
растворе на ионы К+ и 1з~. В меньшем количестве в растворе могут быть ионы 15, I/ и
даже \д. Раствор полииодида калия сравнительно легко отщепляет молекулярный иод,
являющийся относительно мягким окислителем:
12 + 2ё~ = 2Г "
Раствор перманганата калия очень быстро разрушается под действием кисло
рода воздуха. Такой раствор не имеет антисептических свойств.
Легко установить, когда приготовленный раствор перманганата калия уже него
ден: его цвет меняется от характерного фиолетово-розового до буро-коричневого,
который придает ему оксид марганца:
МпО; + 2Н20 + Зе~ -» Мп02 I + 40H"
Для антисептирования применяют и некоторые кислоты, в частности бензойную
С6Н5СООН и борную Н3В03. Обе эти кислоты в обычных условиях твердые
вещества, их вводят в порошкообразном виде в присыпки для раздраженной кожи
вместе с оксидом цинка, тальком и крахмалом. Раствором борной кислоты химики
промывают глаза, если туда случайно попадет щелочный раствор.
«Волшебные пули». Болезни сердца и печени, злокачественные опухоли сегодня
оказываются главной причиной преждевременной смерти. В 30—40-е гг. XX в.
химики передали в руки врачей набор «волшебных пуль», которые позволили резко
увеличить среднюю продолжительность жизни наших современников. Такие «пули»
наверняка есть в домашней аптечке, но в отличие от аспирина их без рецепта не про
дают.
Почему так важны строгие ограничения? Да потому, что эти лекарства действуют
не столько на клетки и ткани нашего организма, сколько воюют непосредственно с
микроорганизмами. Одни препараты коренным образом нарушают обмен веществ у
возбудителей болезни, вызывая их гибель; другие замедляют развитие бактерий и
позволяют защитным силам организма самим расправиться с непрошеными гостями.
Заметьте, однако, что поколения людей сменяются в среднем через 30 лет, a
91
микроорганизмы — каждые 20—50 мин, т. е. существуют отличные условия для
быстрого естественного отбора существ, наиболее приспособленных, наименее
подверженных действию лекарств. Через достаточно большое число поколений —а
произойдет это за две-три недели —может остаться разновидность микробов, не только
не боящихся данного препарата, но и даже плохо чувствующих себя без такого
привычного и приятного (на их вкус) средства.
Так вот, если не жалеть сильнейших антибиотиков, чтобы избавиться от насморка,
то можно в конце концов погибнуть от «пустяковой» ангины или от воспаления легких,
так как в организме появится клан стрептококков или пневмококков, приученных к
антибиотику.
Сульфаниламиды. В 1908 г. был синтезирован интенсивно красный краситель,
получивший название пронтозил. Только в 1934 г. химики и врачи в Германии и
СССР обратили внимание на то, что этот краситель (у нас его называли красный
стрептоцид) оказался эффективным средством против ряда инфекционных болезней,
например ангины и скарлатины. Сегодня эти болезни нами как-то всерьез не
воспринимаются. Проходят они, как говорят врачи, вяло и в подавляющем большинстве
случаев последующих неприятностей не влекут. Однако в довоенные годы от скарлатины
умирал каждый седьмой ребенок, у взрослых возникали тяжелые пороки сердца.
А сколько осложнений бывало после скарлатины! Причиной глухоты основателя
космонавтики К. Э. Циолковского была именно эта болезнь, перенесенная им в детстве.
Вскоре выяснилось, что гораздо большей антимикробной активностью обладает
сульфаниламид:
H2N~"\( )/~"^2 NH2 , который назвали белым стрептоцидом. Как установили
в дальнейшем физиологи, красный стрептоцид разлагается в организме, образуя
белый, который фактически и являлся активным началом препарата (поэтому
красный стрептоцид уже давно не производят в нашей стране).
Вслед за белым стрептоцидом химики создали много других лекарств,
обладающих подобным строением.
Очень много сделал для изучения химии и развития производства
сульфаниламидов уральский ученый, профессор, впоследствии академик Исаак Яковлевич Постов-
ский. В 1935 г. он синтезировал сульфидин, который спас от пневмонии и
инфекционных заболеваний после ранений сотни тысяч бойцов и тружеников тыла. Действие
сульфаниламидов заключается в нарушении обменных процессов у бактерий, так как
жизнедеятельность бактерий целиком зависит от парааминобензойной кислоты, а это
соединение по структуре, свойствам и размеру молекулы мало отличается от
сульфаниламидов:
Микроорганизмы захватывают совершенно непригодный для их развития
сульфаниламид, и происходит то же, что было бы с нами, если бы мы вздумали питаться
колбасой, приготовленной из глины, но очень похожей по внешнему виду на настоящую.
92
У некоторых больных сульфидин вызывал иногда осложнения в работе почек, поэ
тому препарат пришлось снять с производства. На смену ему появился норсульфа
зол, в котором в отличие от стрептоцида один атом водорода замещен на группу гиа
зола:
о | сн
сн
Эта замена оправдала себя, и медикамент сейчас широко используется в тех же слу
чаях, что и белый стрептоцид, но с гораздо большим успехом.
Для лечения дизентерии и других кишечных заболеваний широко применяется еще
один представитель сульфаниламидов —фталазол. Он .постепенно распадается в
кишечнике с образованием ортофталевой кислоты и норсульфазола.
Хотя по отношению к ряду болезней более сильными средствами оказываются
антибиотики, сульфаниламиды широко используются и сейчас, очень часто со
вместно с ними, взаимно дополняя друг друга.
Еще в середине прошлого века русские ученые А. Г. Полотебнов и В. А. Манас
сеин установили, что развивающаяся плесень мешает размножаться бактериям
В 1871 г. выдающийся английский хирург Листер нашел, что в присутствии плесени
«...микробы становились совершенно неподвижными и чахли». Через шесть лет Луи
Пастер вместе с учениками обратил внимание на то, что в соседстве с непатоген
ными болезнетворные микроорганизмы одной из самых страшных болезней — сибир
ской язвы —не в силах вызвать заболевания.
Наблюдения эти не получали развития вплоть до 1928 г., когда английский врач
Александр Флеминг в поисках средства, которое уничтожало бы патогенные
микробы, не вредя клеткам больного, натолкнулся на странное явление. В одну ия
чашечек, где в лабораториях обычно культивируют колонии бактерий, случайно
попала зеленая плесень. Во всех остальных чашках жидкость была желто-мутной и.ч
за расплодившихся там стафилококков, а вокруг зеленого пятнышка масса оказалась
чистой и бесцветной, как капелька росы. Флеминг стал помещать кусочки культуры в
другие чашки —она беспощадно уничтожала и стрептококков, и стафилококков, и
бацилл сибирской язвы.
Далее выяснилось, что для борьбы с микробами пригодна не только плесень, но и
жидкость, на которой она выращивалась. Значит, грибок продуцирует какое-то специ
фическое вещество, убивающее микроорганизмы. Достаточно сложным путем оно
было выделено из раствора и названо пенициллином— по латинскому наименованию
данного типа плесени «пенициллиум нотатум».
Создателем отечественного пенициллина стала профессор 3. В. Ермольева,
Черты ее биографии и жизненного подвига использованы В. Кавериным в «Открытой
книге».
Благодаря пенициллину и ряду других лекарств, образованных микроорганил
мами, перестали быть смертельными воспаление легких и заражение крови. Между
«и
тем еще в 30-е гг. по этой причине, да и от других инфекционных болезней гибли
десятки тысяч людей. Препараты эти назвали впоследствии антибиотиками.
Сейчас генетики вывели культуры плесени, которые продуцируют пенициллин в
сотни и тысячи раз быстрее, чем их дикая прародительница. Современные
антибиотики очень часто применяют в виде солей. Это увеличивает их растворимость и
способность проникать в ткани, так как ионы быстрее всасываются в кровь, оказывая
более длительное и стабильное действие.
Обычный бензилпенициллин разрушается желудочным соком, а его производное,
натриевую соль, феноксиметилпенициллина, можно принимать в виде таблеток:
©-
н о н н н
С—С—N—С—С СС 5
I | 1^нз
Н 0==С—-N——С—СОО
Н
натриевая соль бензилпенициллина
Однако ряд микроорганизмов устойчив к действию пенициллинов: они тут же
вырабатывают свое средство химической защиты— фермент пенициллиназу,
лишающий препарат активности. Позтому пенициллин бесполезно применять для лечения
жфа, туберкулеза, некоторых заболеваний кишечника, вирусных болезней.
Ассортимент лекарств растет. Мы рассказали лишь о некоторых, хотя история и
свойства каждого заслуживают самостоятельной популярной книги.
Хотелось бы обратить внимание на несколько важных проблем, связанных с
лекарствами в нашем доме.
Разумеется, если вы поцарапали палец, то не станете записываться на
прием к врачу. Достаточно обработать ранку раствором иода или бриллиантовой
зелени. Другое дело —неквалифицированное применение сильнодействующих
препаратов, которое ведет к очень тяжелым последствиям. Сульфаниламиды и антибиотики
дают необходимый эффект только при соблюдении соответствующей программы
лечения, а это возможно исключительно при постоянном врачебном контроле.
В первые послевоенные десятилетия в США был в моде аспирин, им пытались
обороняться от всех болезней. Это неплохое лекарство, но его неграмотное
применение стоило жизни многим любителям самолечения.
Великолепная вещь —витамин А. Но уверовавший в его чудодейственные
свойства английский ученый Браун пил регулярно три литра морковного сока в день
и умер от острого отравления витамином А
Лекарственные препараты —сильнодействующие средства, и ими надо
пользоваться осмотрительно. Непомерно высокая доза, неверное применение —и
пекарство может обратиться в яд!
94
ГЛАСНОСТИ
Химия облегчает наш труд, сохраняет здоровье, но может стать и смер
тельно опасной.
Выдающийся писатель-фантаст и ученый биохимик Айзек Азимов писал в одной ил
своих повестей: «Химия— это смерть, упакованная в банки и коробки». Сказанное
справедливо и по отношению к электричеству, радиоэлектронике, нашим механичен;
ким помощникам. Мы не можем жить без электричества, но оголенный провод смер
тельно опасен; мы с удовольствием смотрим телевизор, но за задней его стенкой
убийственное напряжение в тысячи вольт; автомобиль очень нужен, но под его коле
сами часто погибают люди. Современная техника требует высокой общей культуры и
высокой ответственности.
И поэтому надо с вниманием отнестись к химии в вашем доме и школе.
Даже лекарства могут быть исключительно опасными, если использовать их
неразумно. Вы знаете теперь о неприятных последствиях, которые могут быть вызваны
неграмотным применением. Еще опаснее, если кому-нибудь захочется ускорить их
лечебное действие повышенными дозами препаратов.
Героиню рассказа Марка Твена «Мак-Вильямсы и круп» страшно возму
щала рекомендация—давать лекарство от кашля по чайной ложке через чае.
«Через час! Как будто у нас целый год впереди для того, чтобы спасти ребен
на!.. А если давать столовую ложку каждые полчаса?» Вы понимаете, что такое
лечение может привести только к серьезным неприятностям для ребенка и родите
лей.
Пероксид водорода —отличный антисептик. Однако если прополоскать горло не
1—2%-ным раствором, а пергидролем, то придется вызвать «скорую помощь»- таким
сильным будет ожог полости рта.
Перманганат калия— обеззараживающее средство. Однако нам встречался
вполне грамотный, отягощенный учеными степенями химик, который попытался его
крепким раствором вылечить расстройство желудка. В результате «знатоку» при
шлось пробыть без малого месяц в больнице, избавляясь от последствий тяжелого
отравления.
Самолечение привычными медицинскими препаратами в известных дозах при
легком заболевании стало распространенным явлением. Фактически это как бы
выполнение предписаний, полученных ранее от врача в аналогичной ситуации.
Обычно это оканчивается благополучно. Но, увы, не всегда... Известны многочислен
ные факты, когда люди страдали из-за произвольной дозировки используемого
лекарства.
Возьмите, например, слабый раствор аммиака, он же нашатырный спирт. Аммиак
возбуждает дыхательный центр, и этим пользуются, чтобы вывести больного из
обморочного состояния. Есть аммиак и в нашатырно-анисовых каплях, которые
известны как отхаркивающее средство. Однако большие дозы аммиака могут остано
вить дыхание. Это вещество, попав в глаза, быстро проникает в ткани, вплоть до
зрительного нерва, и может нанести ему глубокие, иногда необратимые поврежде
ния...
95
Нас окружают в быту разноообразные химикаты: это моющие средства,
растворители для выведения пятен, для разбавления красок и подобных нужд. У
автомобилиста, как правило, найдутся серная кислота для электролита, смазочные масла и
антифриз. Наконец, в доме могут быть различные средста борьбы с вредителями
садового участка и многочисленными непрошеными гостями— насекомыми, в
первую очередь тараканами, клопами, мухами, а теперь еще и комарами, которые
плодятся в городских садах и подвалах.
Помните! Все бытовые химикаты потенциально опасны!
Нет ничего страшного, если на свежем воздухе просто протереть пятно ваткой,
смоченной небольшим объемом растворителя, но если в ванной комнате замочить в
растворителе платье, то возникнет реальная опасность. Большие концентрации
летучих органических веществ в воздухе очень быстро вызывают угнетение
нервной системы, вплоть до обморока. Если же человек, находящийся в
бессознательном состоянии, пролежит в такой атмосфере полчаса-час, то может
погибнуть.
Особую опасность представляют кислоты и щелочи, тем более растворители,
если хозяева проявляют небрежность при их хранении.
С химическими продуктами, как и с электричеством и газом, надо обращаться
осторожно. Прежде чем пользоваться аэрозолем или моющим средством,
лекарством или растворителем, надо внимательно прочитать правила обращения с ними,
понять их и неукоснительно выполнять.
Необязательно нарушение указаний повлечет за собой беду, но оно резко
увеличит ее вероятность. Для человека, который стал инвалидом по собственной
небрежности, сравнительно слабое утешение, что вероятность такой неприятности
составляла доли процента.
Химические вещества, которыми мы сегодня располагаем, позволяют экономить
время и силы, облегчают нашу жизнь, но требуют внимательного и грамотного
обращения с ними.
БЕРЕГИТЕ ДЕТЕЙ!
Ошибки взрослых делают опасными химикаты. Но если взрослые—
ответственные и знающие люди, то ничего подобного не случится. Достаточно
аккуратности, внимания к правилам техники безопасности не только на работе, в школе, но и
в особенности дома. С детьми— сложнее. Сама их психология требует особой
осторожности при хранении и использовании в быту различных химикатов.
Существуют особо опасные возрастные зоны.
В возрасте от года до пяти лет ребенку все интересно, он по-настоящему изучает
все кругом. Дошкольник —талантливейший исследователь, с которым не сравниться
Пржевальскому, Дэви, Пастеру, Лебедеву. Он не пропустит любую мелочь, особенно
в первые годы, а для надежности кое-что сразу тянет в рот. Естественно, малыш не
интересуется необходимой дозировкой, противопоказаниями при приеме тех или
иных препаратов. Конечно, как это нередко бывает, ребенку можно запретить, на
96
. л;
i
,
■■■■■•■
■
-.•-,'-. . -. ..... ■ .,. . ...... . .
'м ■. г
*'1*ави£
^
Шлам белитовый
■
.
i
.
я л
V9&
• -* ... > *
■ ■ •
1
> .„
«&-.
■
■ ; риме); ( i г i ■ • • избы тс *ой
М i)
- 2(
•■£.
.
J/ <
I •
I
А { {
Ю ■•■ 46
V,.-'
К- . ' /
■
■
.'
■ ' -Ч • ■■ '
-■■*
о
I
• *>4w >-*■ *■** - j ••
'■
- .v:-:VV-
'
*':'&шиш
..'•*. V.
.
■ ■
-.. .
'..
■ г'
.
-
..... '
■ ■ . ■ ;л*.
■ "■■•.-.•■.
n
i. • ■ :
:
- -Urn *1ф#*ШМ.
■'
■:'
-,:.
-
*-t*\
-, „.■£>>
.
.:•'.
У Л <>f. 14 НИИ
•■ -■ ■ ... . w(.,- : ■ ... . ,, ,■. . .„. , ,
.;■
Ц ' I .■■■:.. . ■ . , ...., .. ... . М ■ •'!
>-.;,,,. ... ., , . i . ..,..,
v; ... ' ...-..., ...: . ....... ....
*МИ»« и ■ ,,. ■ . ••* ' ■'- -■• ■•■ ■■ -
V; . . .: (" ■ ■ "■' ■ ■ -■ ■■■ > • • •- "■-■ ■•» « -•:■- ■ >н ■ ■ .
■
•ч-
W»
"
■■ ,
^'
.
■ТД'Я
41 ■ S
Л
-
■
.
•
'
■ ' . - . | . •.
f HUH . . ; - . , . ; . . .
' ■ i ■■ mi
йч#^ ■ ■■■••
■
.
i ...
ч - :
•
■ .. .
':.
V-
..'
•
.
f;..v
1ЙйШ||М^«тмшмй^
'^
№:
^
.■ ■.
: :
'■:■*'=
Г
*-
я»;/-
-,.&•
■
•'-.'J-*
^x
■■■•'.•J
**^e'
ж
№.
■
.1/,.
■.
.
IS
vV;-^
■:^;:
^Й
«.их»
'»':
Ш-
• y; ?- '
.
Ж-- да
■
гатч
.... •
ь
:;*i*': ■''.'■.■
I
&Ц
■^,
ш
нр
него можно кричать, нередко его даже бьют по рукам. Однако ничего хорошего из
этого не получается. Во-первых, запретный плод сладок, и малыш будет искать любые
возможные пути, чтобы добраться до заветной коробочки или пузырька. А во-вторых,
постоянные «нет» воспитывают человека пассивного, которого ничего не будет инк-
ресовать всю жизнь. Как же быть?
Надо сделать так, чтобы маленькому лекарства и химикаты просто не попадались,
и не только в руки, но даже и в поле зрения.
Дом, гараж, садовый участок должны быть безопасными для детей. Для этою
родители, старшие братья и сестры обязаны ежедневно осматривать все глазами
малышей, представлять себе, что их может заинтересовать, что может вызвать жела
ние потащить в рот, выпить, понюхать. Спрашивайте себя: «Есть ли опасность, что он
может это достать?» И если ответ будет положительным, немедленно уберите. Это
особенно важно, если ребенку от года до двух лет.
Детям дают порошки и таблетки, но ни в коем случае нельзя при этом называть
лекарства конфетками. Очень страшно, если между конфетками и таблетками малыш
поставит знак равенства. Тогда опасность неизмеримо возрастет.
Другой сложный возраст —после 10 лет, когда идет активное становление»
личности. Появляются и исчезают новые и новые увлечения. Коль скоро что-то
захотелось, старается этого добиться, даже если он понимает, что так делан,
нельзя...
Во время дезинфекции хлором или его соединениями атомы этого
элемента проникают в аминогруппы аминокислот микроорганизмов и
нарушают структуру их белка.
Действующим началом спирта как антисептика является его способ
ность поглощать воду: он отнимает ее у микроорганизмов, и они поги
бают.
Антибиотики с успехом применяются для лечения болезней не только
у людей и животных, но и у растений.
В грибах лисичках содержится витамина РР больше, чем в мясе, — 50
60 г этих грибов достаточно для удовлетворения суточной потребности
человека в этом витамине.
Иодированная соль представляет собой обычный хлорид натрия с
добавкой нескольких граммов иодида калия на тонну соли. Иодид ион
97
5 Многоликая химия
необходим для нормального развития организма, его недостаток ведет к
нарушению функции щитовидной железы.
Самым сложным по строению витамином в настоящее время
считается В12. Он представляет собой белковую молекулу, содержа
щую атом кобальта— крайне важного для нормального функциоии
*
рования клеток элемента. Лекарство энтероселтол, которое прини-
мают при определенных видах кишечно-желуд* ^иых заболеваний, как
раз и отнимает у бактерий этот атом. Лишенные его, наши микровраги
*
гибнут.
Одна из важнейших тем разговора после летних
каникул—путешествия и туристические походы.
Чтобы получить от похода максимум положительных эмоций, нужно проводить
подготовку к нему очень тщательно, со знанием дела. И если в помощники будет
призвана химия, успех обеспечен.
КАК ПОЛУЧАЮТ ВОДОНЕПРОНИЦАЕМУЮ ТКАНЬ
Достаточно полную информацию по этому поводу дает журнал «Химия и
жизнь», 1987, № 5; здесь же приводятся ссылки на использованную литературу.
Однако в нашу задачу входят, как вы понимаете, не переписывание методик и
рецептур, а комментарии по поводу химизма происходящих процессов.
Основная идея большинства рекомендаций —превращение мыла
водорастворимого в нерастворимое прямо на пропитываемой ткани. Когда ткань держат
несколько часов в теплом водном растворе, например, хозяйственного мыла, оно
глубоко проникает в волокна ткани. Затем «ванна» меняется —на смену мыльному
приходит концентрированный раствор алюмокалиевых квасцов, и тогда
ЗС17Н35СОО- + Al3+ = А1(С17Н35СОО)з 4
Алюминиевое мыло в воде нерастворимо, оно обладает интересующим нас
свойством не смачиваться водой. Такие мыла технологи называют «металлическими».
Вода через обработанную таким способом ткань не проникает, а воздух проходит
свободно. Штормовка из этой ткани защищает от дождя так же, как прорезиненная
плащ-палатка из комплекта одежды для военнослужащих, однако давящего
ощущения, духоты в ней уже не будет.
Обычно после осаждения «металлического» мыла на ткань ее обрабатывают
дополнительной водной эмульсией парафина и проглаживают не очень горячим
утюгом. Этот процесс не химический — равномерно распределенный по изделию
парафин плавится; его пленка, частично проникая в нити, на которых уже есть мыло,
усиливает водоотталкивающие свойства изделия и, кроме того, немного сужает просвет
между нитями ткани.
Алюмокалиевые квасцы можно заменить ацетатом свинца или известковым
молоком. «Металлическое» мыло в этом случае будет содержать ионы свинца или кальция.
Гидрофобные свойства тканям можно придать также пропиткой их раствором
поливинилхлорида. Растворителем для этого вещества могут служить тетрагидрофу-
ран или циклогексанон. Оба растворителя сильно раздражают слизистые оболочки.
Здесь идет чисто физический процесс, изменений с веществами не происходит.
ПОСУДА ТУРИСТА
Возможно малая масса и возможно большая вместимость— вот
основные критерии для этой неотъемлемой принадлежности туриста.
Два материала используются, как правило, для изготовления походных сосудов —
100
алюминий и полиэтилен. Оба славятся своей химической инертностью, за что и
ценятся пищевиками.
Что должен иметь в виду юный турист в отношении свойств этих материалов?
Полиэтилен совершенно не пропускает влагу, однако способен растворять в себе
некоторые вещества, например продукты собственного термического разложения
Это может происходить, в частности, в момент формирования кружки, фляжки и т. д
Ве^ь для того, чтобы материал легче принимал нужную форму, стенки матрицы обя
зательно нагревают; прилегающий к ним участок полиэтилена, бывает, подгораем и |
толщу размягченного пластика легко проникают парогазовые продукты разложения
Затем изделие быстро остывает, и эти продукты медленно выделяются, придавая
характерный аромат содержимому сосуда. Ощутимого вреда это обстоятельство
принести не может, но неприятный запах способен испортить настроение,
К счастью, процесс растворения продуктов разложения в полиэтилене обратим, и
мы можем воспроизвести обстановку, при которой в его массу проникли посторон
ние вещества, с тем чтобы вывести их оттуда. С этой целью надо перед походом
устроить всем полиэтиленовым сосудам «водяную баню». Их следует выдержан, в
воде при температуре около 100° С, но не выше, иначе есть риск, что изделие поте
ряет форму. Длительность «купания» определяется опытным путем и составляв!
1—2 ч. Чем чаще будет меняться вода, тем эффективнее пойдет удаление запаха
На сосудах из полимерных материалов чаще всего на днище имеется надпись,
содержание которой должно стать объектом пристального внимания туриста. ( )i
| ' ' ' - " ■ -! --
10
рекомендаций завода-изготовителя типа «только для сыпучих продуктов», «не для
пищевых продуктов», «для холодной воды» и т. д. отступать нельзя категорически вот
почему.
В процессе изготовления полимера в соответствии с технологией в его массу
вводят инициаторы полимеризации, пластификаторы и другие вещества. Конечно,
доля их относительно невелика, но есть риск, что, например, под действием горячей
воды, налитой в сосуд с маркировкой «для холодной воды», в жидкость может
перейти некоторая часть ионов титана или хрома, соединения которых используются
как катализаторы полимеризации при низком давлении. Это же в равной мере
относится и к полимерной пленке, которую очень часто в быту используют для упаковки.
Для горячей воды и пищевых продуктов изготовляют посуду из полиэтилена,
полученного с помощью высокого давления, где тоже используются катализаторы
полимеризации, но совсем безобидные, такие, как молекулярный кислород или
органические пероксиды.
Вот почему перед походом надо внимательно осмотреть все сосуды из
полимерных материалов и решительно отказаться от тех, где отсутствует специальная
маркировка.
О металлической посуде. Поверхностная оксидная пленка на алюминии хорошо
защищает металл от внешних воздействий, но она пористая и поглощает при
определенных условиях почти все, что на нее попадает, в частности сажу и другие продукты
горения дерева.
Закопченный снаружи котелок мы не советуем драить до блеска. Это сизифов
груд! Пленка оксида все равно образуется, а пребывание котелка над костром
немедленно возвратит ему прежний черный цвет. Рациональнее загодя сшить для
котелка плотный матерчатый мешочек, чтобы не пачкать окружающие предметы.
ХИМИЯ ВОКРУГ КОСТРА
Трудно себе представить поход без костра. И в этой книге полезно будет
напомнить о правилах разведения костров. Помните ли вы, что нельзя оставлять кос-
гер без присмотра, разводить его в запрещенных местах? Отступление от этих
правил грозит тем, что из маленького уютного очага под открытым небом он превратится
в необузданную стихию.
Может показаться странным, но часовое пребывание у костра равно по ущербу
для организма пятичасовому дежурству на обочине оживленной городской
автомагистрали. В дым и другие парообразные продукты горения переходят все те вредные
вещества, которые дерево накопило за время своего существования, Поэтому при
заготовке хвороста не берите придорожный валежник, а у костра располагайтесь так,
чтобы ветер дул в спину. Пусть уж комары покусают немножко, зато в легких не будет
избытка всякого рода нежелательных соединений. Наиболее опасны из них оксид
углерода (угарный газ) и различного рода канцерогены. Кроме того, отлетающие
искры и угольки, а иногда и языки пламени способны воспламенить одежды из
синтетики (а таких курток, ветровок сейчас не счесть!). Капрон и другие полимеры, из
которых делают верхнюю одежду, плавятся при температуре немногим выше 100° С,
горящий расплавленный материал прилипает к коже. Загоревшуюся куртку уже не
102
снимешь, и единственный выход в этом случае —сбивать огонь, катаясь по земле
Товарищи должны облить пострадавшего водой или сбить пламя лапником. Только
после того, как открытый огонь ликвидирован, надо решить вопрос о дальнейшей
помощи пострадавшему.
Эти неприятные по своей неожиданности моменты все равно не заставят отка
заться от костра. Подчас его разведение представляет (при отсутствии достаточной)
опыта) серьезную проблему, которую можно решить с помощью «сухого горючего-
Таблетки или брикетики этого вещества —вполне доступная вещь.
Этим термином принято называть гексаметилентетрамин (другие названия --ypoi
ропин, уризол) с очень красивой структурной формулой: 4
1^ N44bl
При горении уротропина образуются сравнительно безобидные продукты:
C6N4H12 + 902 = 6С02 + 6Н20 + 2N2. Однако если попытаться погасить пламя этого
вещества, накрыв его, например, металлической кружкой, пойдет сухая перегони.».
lot
возникнут разнообразные соединения переменного состава с очень неприятным
запахом, обусловленным образованием летучих соединений азота, так что лучше
жечь сухое горючее до конца на открытом воздухе. Если сухого горючего нет в
хозяйственных магазинах, можно воспользоваться и аптечным уротропином.
Для того чтобы добыть огонь в походных условиях, нужны сухие спички и сухая
намазка на коробке.
Известны спички, которые можно воспламенить трением о любую поверхность
(вспомните кадр из одного фильма с участием Чаплина: герой зажигает спичку,
чиркнув ее о подошву). Такое свойство придает им сульфид фосфора состава P4S3,
который воспламеняется на воздухе уже при 1 00° С. Для увеличения коэффициента
трения в спичечной головке есть молотое стекло, а от увлажнения ее защищает
животный клей. Окислителем в спичках является бертолетова соль.
А. А. Шидловский в книге «Основы пиротехники» (Ш ид л о в с к и й А. А. Основы
пиротехники.— 3-е изд. пер. и доп.— М.: Машиностроение, 1964) перечисляет еще и
другие, специальные спички, к сожалению, малодоступные: штормовые, горящие при
негре и проливном дожде; термические, дающие при горении головки очень много
юплоты; сигнальные, образующие цветное пламя, и фотографические, при зажигании
которых возникает яркая вспышка.
Костер согревает озябшие руки и готовую пищу, но это же можно сделать и с
помощью химии.
Во время зимнего похода, для того чтобы не проморозить продукты в рюкзаке,
можно воспользоваться еще одной полезной рекомендацией.
В стеклянную банку вместимостью 0,2 л сначала помещают свернутую спиралью
алюминиевую проволоку диаметром 2—3 мм, так чтобы металл прилегал к стеклу по
всей высоте сосуда, а также активной массой (в расчете на банку указанной выше
вместимости) следующего состава: 40 г медного купороса (около 3 чайных ложек),
20 г поваренной соли (2 чайные ложки) и 30 г древесных опилок (5 столовых ложек),
хорошо просушенных предварительно. Опилки не позволят смеси охлаждаться и
помогут равномерно пропитать ее водой.
В снаряженной грелке активная масса не должна доходить до верха банки на 2—
3 см —запас для «запала» (воды).
В результате обменной обратимой реакции с образованием хлорида меди
CuS04 + 2NaCI = CuCI2 + Na2S04
идет экзотермический процесс окисления металлического алюминия ионом меди (II):
2AI + 3CuCI2 = ЗСи. + 2AICI3
Банку плотно закрываем полиэтиленовой крышкой с 5—6 проткнутыми швейной
иглой отверстиями (они понадобятся для выхода водорода, небольшое количество
которого может образоваться при реакции освободившегося от оксидной пленки
алюминия с водой):
2А1 + ЗН20=А12Оз + ЗН2!
Заметим, что, поскольку химические реакции пойдут не в растворе, скорость их
будет определяться величиной поверхности реагирующих веществ; поэтому во время
I04
приготовления смеси твердые компоненты, кроме опилок, следует сначала измель
чить. Нельзя не учитывать то обстоятельство, что медный купорос, попадая на пов
режденную кожу, может вызвать сильное ее раздражение. Тщательное перемешива
ние компонентов должно завершить подготовительный процесс.
Перед употреблением в грелку наливают воду (около 40 мл для данной м юсы
смеси; проверьте сами: нужно, чтобы вся вода впиталась, сверху не должно быть
слоя жидкости) и, закрыв крышкой, устанавливают в рюкзак между продуктами
В качестве «оболочки» грелки можно использовать и полиэтиленовые сосуды, ган
как температура смеси не должна превышать 60° С. Продолжительность действия
грелки— до двух часов.
ХИМИЯ НА СТРАЖЕ ЗДОРОВЬЯ ТУРИСТА
В этом разделе речь пойдет о защите от комаров.
Дым костра помогает мало; стоит ему чуть-чуть рассеяться - и насекомые гул каи
тут. Дым сигарет приносит гораздо больше вреда, чем комары. До 1972 г. гуристы
брали с собой дымовые шашки с ДДТ, ставили их вокруг палаток и зажигали. '
дым на несколько минут застилал окрестности, потом вокруг долго никто не nei
не жужжал, а люди получали в организм очередную порцию яда. Запрет на исполь
вание ДДТ в начале 70-х гг. положил конец этому надругательству над природ»
Зато остались безотказно действующие на насекомых репелленты отпугиваю
щие средства.
Наибольшее распространение в качестве репеллента получил диметилфталат
(ДМФ)— соединение, внешне очень похожее на глицерин, такое же вязкое, тяжелее
воды, с довольно высокой температурой кипения (282° С).
О
©С
I
Обратите внимание на строение этого вещества: оно относится к классу сложных
эфиров, значит, должно хорошо испаряться. Однако значительная молекулярная
масса ограничивает его летучесть; поэтому защитное действие диметилфталата в
чистом виде, без добавок, длится не менее двух часов. От других репеллентов он
отличается меньшими раздражающими кожу свойствами.
Второй по значению и распространению репеллент— N, N-диэтил-мета-толуамид
(ДЭТА): О
Найдите в структуре этих веществ сходные фрагменты.
У ДЭТА температура кипения ниже, чем у ДМФ, а раздражает слизистые
оболочки сильнее; поэтому его меньше вводят в рецептуры смесей, обладающих
отпугивающими свойствами.
Бензоилпиперидин еще один репеллент. Он почти полный аналог другого
вещества с аналогичными свойствами, и если в рецептуре они встречаются вместе,
то усиливают действие друг друга. Речь идет о диэтиламиде никотиновой кислоты.
Итак, имея в своем распоряжении эти и некоторые другие репелленты,
специалисты комбинируют их, вводят добавки, помогающие удержать активные вещества на
поверхности, умерить их испаряемость, снизить раздражающее кожу действие.
Одна из главных по значению проблем в походе —питьевая вода.
Исследованиями гигиенистов-медиков показано, что одно только кипячение без дополнительной
обработки далеко не полная гарантия пригодности воды для питья, ибо если
микроорганизмы и погибнут, то не разрушатся выделяемые ими токсины,
выдерживающие температуру до 200° С.
Вот почему журнал «Турист» («Турист», 1985, № 7, с. 36) приводит довольно
подробный перечень способов обеззараживания воды, которая внешне выглядит
совершенно чистой.
Наиболее радикальным средством является препарат пантоцид, химическое
название которого N, N-дихлор-пара-карбоксибензолсульфамид. И хотя растворимость
его в воде мала, даже небольшие дозы активно воздействуют на микрофлору анало-
1ично другим сульфаниламидам, действие которых подробно описано в главе 7.
106
Ну а если пантоцида перед походом раздобыть не удалось, можно прибегнуть н
другим химикатам, однако в этом случае требуется, как правило, и термическое \и> \
действие в виде более или менее продолжительного кипячения с последующим
отстаиванием.
Что происходит, например, когда в воду добавляют алюмокалиевые квасцы? Идв1
растворение соли с последующей диссоциацией на ионы:
KAI(S04)2 - К+ + А13+ + 2SO^~
При гидролизе в осадок выпадает гидроксид алюминия. В то же время при и.и ре
вании происходит свертывание (денатурация) токсичных белковых веществ, которые
сорбируются на поверхности осаждающихся на дно хлопьев гидроксида алюминии
Избавиться от вредных примесей можно, добавляя в воду несколько кристаллов
перманганата калия- его окислительное действие на посторонние примеси общей l
вестно.
В качестве окислителя примесей рекомендуется и йодная настойка в расчете 20
капель на 1 л воды до появления устойчивого желтоватого оттенка воды. Несмотря
на то что рекомендация ограничивается лишь добавлением йодной настойки, после
дующее кипячение воды, по-видимому, не будет лишним:
12+Н20+±Н1 + НЮ
HIO-HI + 0
Атомарный кислород довершит окисление, начатое иодом.
frzr7m^rzrm^^^——~~™—^ — ,'.'ля■■„■„-..>•■-■• п.-; ■>■ и. ■•"тгтгт , ■„, ',i,;g,'„,.gg.i:'^»a
107
После того как вода продезинфицирована, для улучшения ее вкуса можно
воспользоваться такой рекомендацией: готовится смесь сухих порошков
гидрокарбоната натрия, лимонной кислоты (по массе 1 : 1) и добавляют в 5 раз большую массу
гонкоизмельченной карамели (без начинки!). На один стакан напитка расходуется
около 20 г смеси. Чтобы «шипучка» не начала действовать раньше времени, ее, как и
пиротехнические составы на основе нитратов, надо тщательно оберегать от
увлажнения.
Как показывает статистика, половину всех заболеваний в походах составляют
желудочно-кишечные, поэтому к материалу данного раздела надо отнестись с
особым вниманием.
КАК ПОДАТЬ СИГНАЛ ДРУГ ДРУГУ С ПОМОЩЬЮ ХИМИИ
В беспокойной жизни туриста всегда может возникнуть ситуация, когда
вовремя поданный сигнал может многое решить. И здесь на помощь приходит химия.
Иногда на фотографиях, снятых на фоне арктических или горных снегов, мы видим
в руках у людей цветные факелы с ярким дымом. Это так называемые ПСНД
—патроны сигнальные ночные (дневные).
Как же действуют эти патроны? Они заполнены термической смесью, состоящей
из окислителя, горюче.го и вещества, окрашивающего дым в нужный цвет.
Пиротехники решают непростую задачу. Нужно, чтобы краситель при интенсивном
испарении не загорался: продукты взаимодействия компонентов термической смеси
должны увлечь краситель в сферу горения, диспергировать его и по возможности
быстро «пронести» мимо зоны высоких температур.
Этим непростым условиям удовлетворяют лишь немногие органические
вещества, в частности молочный и свекловичный сахара.
Поскольку окисление идет в гетерогенном процессе, химическая кинетика
предписывает в этом случае тщательное смешение компонентов горючего и окислителя.
Смесь упаковывают в плотные картонные футляры, ибо доступ кислорода в
момент реакции ведет к воспламенению состава, и нужный эффект не достигается.
Дымовая масса очень гигроскопична, поэтому надо обеспечить сигнальным
устройствам соответствующие условия хранения.
Кроме дымовых, известны еще «свистящие» сигнальные составы с
повышенной массовой долей окислителя, что обусловливает очень
высокую скорость горения, а отсюда и истечения газов. При этом возникает
звук, частота которого зависит от длины трубки, куда запрессован состав:
длиннее трубка —меньше частота.
Перед походом смажьте «молнии» на ваших куртках парафином или
просто мылом. Это придаст им гидрофобность, если они металлические,
а также облегчит открывание и закрывание,
I08
Установлено, что при перегревании человек испытывает потребней гь
в некоторых органических кислотах, в первую очередь аскорбиновой и
лимонной, а также в солях калия и кальция.
Один из растворов, который не только хорошо утоляет жажду, \\п
снижает на некоторое время потребность в питье, состоит из лимонной
кислоты, хлорида калия и хлорида кальция. Поэтому перед походом при
готовьте несколько пакетов из непромокаемой бумаги со смесью сухи>
к
веществ, где сахара о г, лимонной кислоты
г, названных солеи ми
0,025 г. Расфасуйте смесь в кальку или другую непромокаемую бум.иу.
Содержимое одного пакета рассчитано на 1 л воды. Не исключай!и и i
рецепта горький хлорид кальция: ведь лимонная кислота способствут
выведению из организма ионов кальция и ваш солевой баланс можо!
быть существенно нарушен. Потребление жидкостей, содержащих более
1% сахара, повышает уровень обменных процессов в организме, усили
вая его перегрев.
Комары чувствуют присутствие человека на расстоянии до 100 м
Людей старше 50 лет они кусают гораздо реже, чем более молоды
Частое и обильное применение репеллента на основе ДЭТА и ДМ«1
может повредить куртки из синтетической ткани: нити набухают и ча<
тично растворяются.
»
К волокнам ткани можно добавить полимеры-носители, а потом пр(
питать ее репеллентом (его фирменное название карбоксид). Поскольку
такая композиция нелетуча, механизм действия репеллента, очевидно, <
запахом не связан.
У многих речных рыб икра ядовита, поэтому брюшную полость любой
■
рыбы после потрошения надо промыть не просто чистой водой, л насы
щенным раствором поваренной соли. Тогда для поддержания осмотиче<
кого давления клеточная жидкость, а вместе с ней и яд выйдут наружу.
В случае же промывания чистой водой движение жидкости будет напр.и
-
лено внутрь клетки.
Существуют репелленты не только для насекомых. В частности, моим
СО(СН2)8СН
совершенно но пер<
носимым для собак и кошек, которые имеют обыкновение гулять сами по
себе как раз там, где этого не хочется хозяевам. Достаточно обраб
i л и-
low
этим веществом любимую клумбу— и можно быть спокойным за ее
внешний вид.
Первые пластические массы появились еще в прошлом веке: эбонит
(1843 г.), целлулоид (1872 г.) и галалит (1897 г.).
Чемпион по химической стойкости— фторопласт. Он спокойно
переносит последовательную суточную обработку в концентрированных
кислотах—серной (при 290° С), азотной (при 100° С) и царской водке (при
100° С). Куда до фторопласта любому благородному металлу! А причина
проста: атомы фтора, расположившись «плечом к плечу», защищают от
внешних воздействий длинную углеродную цепочку.
Когда туристы покидают место стоянки, они обычно или зарывают в
землю или сжигают в костре образовавшийся мусор. Заметьте,
пожалуйста, что при неполном сгорании поливинилхлоридных пластиков
(например, прохудившиеся сапоги) выделяются хлороводород, оксид
углерода (II), свободный хлор и фосген. Оба, в особенности последний,
использовались в первую мировую войну как ОВ.
Возможность образования токсичных газов необходимо учитывать и
при сжигании изделий из полистирола (чаще всего это какие-нибудь
коробки): при горении образуются ядовитый мономер стирол, а также
циановодород и угарный газ.
В первую мировую войну в армиях воюющих держав использовались
в массовом масштабе карманные жидкостные грелки, в которых тепло
получалось за счет беспламенного каталитического окисления спирта или
бензина на платине в тонкодисперсном состоянии (процесс
гетерогенный—нужно, чтобы была возможна большая поверхность), нанесенной на
асбест.
В 1940 г. в СССР был разработан обогревательный пояс
—химическая грелка необычной формы. Это был обтянутый кожей медный
резервуар, который крепили на брючном ремне. Резервуар вмещал 200 г
смеси алюминиевого порошка и хлорида меди (II) в стехиометрическом
соотношении. Из баллончика, находящегося в нагрудном кармане, в
резервуар поступала вода. Принцип действия — выделение теплоты при
вытеснении меди алюминием:
2AI + 3CuCI2 = 2AICI3 + 3Cu
I К)
и
шва
Г
химия
личного
ТРАНСПОРТА
WT ыстрый, компактный, грузоподъемный, независимый, удобный5 неза-
■^ менимый в нашей жизни автомобиль стал составной частью быта
(временного человека. Древние греки говорили с презрением о малокультурном
еловеке: «Он не умеет ни плавать, ни читать!» Сегодня к этому с полным основа-
ием можно добавить: «...не умеет водить автомобиль».
И в то же время, садясь за руль автомобиля, каждый становится руководителем
ложного химического производства, в котором протекают разнообразные химичес-
ие процессы, взаимодействуют десятки различных материалов. От того, насколько
i.i разбираетесь в закономерностях этих химических процессов и умеете управлять
ми, зависят долголетие и экономичность автомобиля или мотоцикла.
Двигатель автомобиля или мотоцикла —это, по сути дела, химический реактор, и
■м отлично работает, если правильно выбрано и правильно сжигается топливо, если с
вниманием дела подобраны и применяются смазочные масла и охлаждающие жид-
(к;1и. Автомобиль подвержен холодному пожару— коррозии, но, разбираясь в
химиям :ких процессах этого явления, можно избежать превращения машины в решето.
владелец автомашины или мотоцикла должен бережно и с вниманием пользоваться
нкумулятором — химическим источником и копилкой электрического тока, должен
рамотно выбирать и грамотно лечить покрышки, без которых нет автомобиля и мото-
икла. И наконец, автомобиль может представить серьезную химическую
опасность для природы, для людей, для вас лично, если не научиться экологически гра-
ютно управлять химическими процессами, протекающими в его двигателе.
НЁУНОГО ИСТОРИИ
Многие сотни лет на дорогах царили запряженные лошадьми телеги.
Шестерки лошадей везли громоздкие и неудобные кареты или автобусы прошлого-
1илижансы, летели «птицы-тройки». До середины XVIII в. можно было только мечтать
каретах и телегах, передвигающихся без лошадей.
[Возможность превращения этой мечты в реальность приблизили
разрабатываются в конце XVII —начале XVIII вв. учеными и инженерами разных стран паровые
18ШИНЫ.
Однако конкуренцию с дилижансами, запряженными лошадьми и хорошо извест-
ыми читателям по «Запискам Пиквикского клуба», они не выдержали: слишком
него топлива и воды им нужно было везти, слишком неэкономичны были их паровые
ашины, чересчур трясло эти машины даже при небольшом увеличении скорости —
Зычные, как у телеги, колеса чувствовали каждую кочку и каждую выбоину.
Нужен был другой, более экономичный двигатель, для которого требовалось бы
шливо, обладающее высокой теплотворной способностью. Такое топливо появи-
х|. во второй половине XIX в., когда научились перерабатывать нефть и стали гото-
1ть жидкое углеводородное топливо: бензин и керосин. Их появление открыло путь к
>зданию двигателей внутреннего сгорания, компактных, мощных, экономичных.
Первый в истории патент на двигатель внутреннего сгорания получил кельнер
(мою из парижских ресторанов Жан Этьен Ленуар в 1860 г. Правда, его двигатель
12 ■
был рассчитан на сжигание газа, приготовляемого из угля. В 1863 г. Ленуар изгою
вил и первый бензиновый двигатель. Однако двигатели Ленуара не были использо
ваны для передвижных устройств.
Эстафету приняла Германия. В 1877 г. Николай Отто создал четырехтактный дви
гатель, во многом подобный тем, которыми мы пользуемся и сегодня. Однако и Оно
не сумел поставить двигатель на повозку. Честь создания первых автомобильных
моторов и первых автомобилей принадлежит двум другим выдающимся немецким
инженерам Готлибу Даймлеру и Карлу Бенцу. Даймлер изобрел карбюратор, что пол
волило использовать в качестве топлива не газ, а бензин. В 1885 г., немногим более
ста. лет назад, Даймлер изготовил первый в мире мотоцикл с бензиновым двигате
лем, на котором и стал ездить по улицам городка Каннштадта, где находилась его
мастерская. В том же году Бенц изготовил и запатентовал первый трехколесный
автомобиль (трицикл), а в 1886 г. Даймлер купил подержанную коляску и встроил в
нее бензиновый мотор —так появился первый четырехколесный автомобиль.
После Даймлера и Бенца во всем мире, поначалу в кустарных мастерских, начали
изготовлять самые разнообразные автомобили. При этом очень важно было решить
еще одну задачу — обуть колеса. Слишком плохо даже при небольших скоростях воли
себя обычные деревянные колеса с металлическим ободом. Но в конце XIX в. научи
лись перерабатывать каучук и изготовлять различные изделия из резины. Надувные
пневматические шины принимали на себя толчки и сотрясения, хорошо работали при
больших скоростях даже на не очень ровных дорогах. Пришлись весьма кстати и
1 1 3
получаемые из нефти смазочные масла, которые обеспечивали и уплотнение в двига-
W
теле, и поддержание определенной температуры в стенках цилиндра, и отведение
тепла, и сведение к минимуму трения между различными деталями автомобиля.
Первые автомобили изготовлялись только с бензиновым двигателем: в цилиндр
подавалась приготовленная в карбюраторе смесь воздуха и паров бензина, которая
поджигалась электрической искрой. В 1894 г. выдающийся немецкий инженер
Рудольф Дизель предложил другой тип двигателя внутреннего сгорания, названный в
ого честь дизельным двигателем, а начиная с 1897 г. начали изготовлять сначала ста-
ционарные установки, а потом и автомобили с двигателями этого типа. В отличие от
карбюраторного двигателя в цилиндре двигателя Дизеля сжимается воздух, который
нагревается при этом до 540 G, затем в цилиндр впрыскивается топливо, которое
j ^
мгновенно оОращается в пар и самовоспламеняется. Коэффициент полезного
действия двигателя Дизеля на 20—30% выше, чем у бензинового двигателя. Если
обычные «Жигули» с бензиновым двигателем расходуют на 100 км пути по хорошей
дороге в среднем 8,0—8,8 л бензина, то «Жигулям» с дизельным двигателем нужно
лишь 5,5 л дизельного топлива. К тому же для дизеля можно использовать топливо
более дешевое и доступное, чем бензин. Вот почему в наши дни происходит частич-
ная замена карбюраторных двигателей на дизельные.
В мире перерабатывают более трех миллиардов тонн нефти в год. На 65—75% ее
обращают в «светлые продукты» (так называют нефтепереработчики топлива для
двигателей внутреннего сгорания и для турбореактивных двигателей). Именно развитие
автомобильной промышленности привело к созданию многочисленных современных
процессов термической и каталитической переработки нефти, так как при простой
перегонке нефти нельзя было получить нужное количество бензина высокого
качества. Автомобильная промышленность вызвала к жизни и нефтехимическую про-
мышленность, производство различных мономеров и полимеров. Дело в том, что те
■
вещества, которые входят в состав высококачественных бензинов, получаемых при
каталитической или термической переработке нефтяного сырья (непредельные и аро-
матические углеводороды), являются либо мономерами для изготовления полимер-
ных материалов, либо полупродуктами для их приготовления. Получаемые же из
SS
мономеров конструкционные материалы и синтетический каучук очень широко при
меняются в автомобильной промышленности.
ПИТАЕТСЯ ДВИГАТЕЛЬ
Первая задача, которая возникает перед любым владельцем автомобиля
или мотоцикла,—чем его «накормить
»
Поршень сжимает бензиновоздушную смесь,, При этом температура в цилиндре
автомобильного двигателя повышается до 250—300° С, а давление достигает 1,0-1,5
a. i ю мере сжатия ооъем уменьшается и соотношение начального и конечного
объемов -так называемая степень сжатия -является важным показателем работы
■
двигателя, определяющим и требования к качеству топлива, и КПД двигателя. Не слу-
ч/
ч/
чаино в характеристиках двигателей ооычно указывается степень сжатия.
Увеличить степень сжатия выше этого уровня не позволяет топливо. Больший
КПД дизельных двигателей определяется возможностью повышения степени сжатия
1 14
до 14—1 7 МПа, так как в этих двигателях сжимают воздух, а не смесь его с парами
топлива.
Бензиновоздушная смесь поджигается электрической запальной свечой, в
результате чего в смеси со скоростью 10—30 м/с пробегает фронт пламени. В \<"\<>
ние сотых долей секунды бензин сгорает, температура в камере сгорания увеличи
вается до 2000° С, а давление —до 3,5—4,0 МПа.
Давайте разберем, почему нельзя увеличить степень сжатия в карбюраторном
двигателе, почему качество топлива и КПД двигателя так тесно связаны.
Дело в том, что химические процессы взаимодействия компонентов бензина <
воздухом начинают развиваться задолго до зажигания. Смесь сжимается, попы
шается ее температура и в бензине начинается «тихое горение»; образуются кисло
родсодержащие вещества— сначала главным образом гидропероксиды углеводоро
дов. Молекулы кислорода воздуха встраиваются между атомами углерода и по/и»
рода:
? "
Н—с—Н н—С—Н
н—с~-н н—с—о—о—н
н—с—н н—с—н
I I
н_о~н + о. —-*-- н—с—н
I I
н—с—-н н—с—н
н—с—н н—с—н
I I
н н
н-гексан Гидропероксид
Из гидропероксидов образуются спирты, эфиры, кислоты, которые сгораюi, обра
зуя воду и оксид углерода (II). Однако разложение гидропероксидов может пойти и
не таким спокойным путем. Если в смеси паров бензина с воздухом содержание? гид
ропероксидов велико, они могут разложиться со взрывом. Обычно в этом случав В
верхней части камеры сгорания идет спокойное горение, но когда движущийся со
скоростью 10—30 м/с фронт горения проходит большую ее часть, в неуспевшей
сгореть рабочей смеси возникает взрывоподобный процесс, называемый бетона
цией. Особенностью такого детонационного горения оказывается резкое увеличение
скорости распространения химического процесса —до 1500—2000 м/с, т. е. в 60 80
раз быстрее по сравнению с обычным горением. Возникает ударная волна, горение
становится неравномерным. Двигатель начинает работать жестко и неустойчиво.
Слышны резкие металлические стуки, появляется дымный выхлоп. При этом сни
жается мощность двигателя, уменьшается температура выхлопных газов, но очень
сильно повышается температура стенок цилиндра и в особенности его головни. Мри
длительной работе с детонацией двигатель перегревается, возникают механические
повреждения различных его деталей. Возможны даже прогар поршней и клапанов,
I IB
нарушение изоляции свечей, растрескивание вкладышей подшипников, пригорание
поршневых колец.
Опасность детонации серьезно ограничивает возможности бензиновых
двигателей. Дело в том, что хотя увеличение степени сжатия повышает КПД двигателя, но из-
за повышения температуры перед зажиганием возрастает опасность накопления гид-
ропероксидов, опасность детонации. Многое зависит и от того, насколько легко
образуются гидропероксиды и как быстро они превращаются в другие взрывобезопасные
вещества. Опасно, если они легко образуются, но медленно разлагаются.
Эти свойства гидропероксидов почти полностью зависят от свойства
углеводородов, содержащихся в бензине. Как известно читателю, бензин— сложная смесь
углеводородов, имеющих в молекуле от пяти до девяти атомов углерода и кипящих в
пределах 60—1 70° С. Углеводороды, входящие в состав бензинов, по строению
углеродного скелета могут быть разбиты на несколько групп. Это насыщенные
углеводороды—парафины с прямыми и разветвленными углеродными цепями, углеводороды,
содержащие двойные связи,—непредельные или олефины, углеводороды с
замкнутыми пятичленными или шестичленными кольцами — циклоалканы или нафтены —и,
наконец, углеводороды с шестичленными кольцами и чередующимися одинарными и
двойными связями в этих кольцах —ароматические углеводороды.
Легче всего образуют гидропероксиды парафиновые углеводороды с длинными
прямыми цепями. Бензин, в котором много таких углеводородов, представляет
наибольшую детонационную опасность. Если углеродный скелет парафина разветвлен,
то детонационная опасность уменьшается. Такой же эффект достигается, если в
молекуле имеются двойные связи. Меньше вероятность детонации, если цепь зам
кнута в кольцо. Наиболее велика устойчивость к детонации, если в бензине много
ароматических углеводородов. Гидропероксиды у них образуются с трудом, а
образовавшиеся легко распадаются.
Естественно, что в требованиях к качеству топлива для бензиновых двигателей
особое внимание уделяется стабильности к детонации. В стандартах на бензины
одним из наиболее важных показателей оказывается характеризующее
антидетонационные свойства бензина октановое число.
Для того, чтобы определить октановое число бензина, в специальных двигателях
сравнивают поведение испытуемого бензина и эталонных смесей двух
углеводородов: изооктана и нормального гептана.
Первый из них устойчив к детонации, второй малоустойчив. Если бензин ведет
себя как смесь 93% изооктана и 7% нормального гептана, то говорят, что его
октановое число 93. Становится понятной маркировка бензинов, например А-76, АИ-95
и т. п. Чем выше октановое число, тем большей может быть допустимая степень
сжатия в цилиндрах двигателя, тем большим может быть его КПД и меньшим расход
бензина на единицу мощности двигателя.
В бензинах, получаемых при простой перегонке нефти (их так и называют —пря-
могонными бензинами), обычно много углеводородов с прямыми цепями, а поэтому
их октановые числа невелики (не больше 50—60). Совершенствование
автомобильных двигателей еще в довоенные годы заставило искать пути улучшения качества
бензинов. С тех пор исследователи идут по двум путям. Первый из них предполагает
приготовление бензинов, в которых много углеводородов, обладающих высокими окта-
116
новыми числами. Второй—управление поведением гидропероксидов, при котором
можно препятствовать их образованию или заставить их ускоренно распадаться и не
накапливаться в бензиновоздушной смеси. Возможно, естественно, и сочетание.1 этих
двух способов.
Для приготовления высокооктановых бензинов широко используется так называв
мый каталитический риформинг низкооктановых бензинов. Во время этого процесса
бензины перерабатываются при высоких давлениях и температурах на платиновых
катализаторах или катализаторах, изготовленных из смесей благородных металлов
(платины, рения и др.). Парафины и нафтены обращаются в ароматические углеводе
роды, обладающие даже лучшими антидетонационными характеристиками, чем
изооктан. Каталитический риформинг не единственный способ получения высокоон
тановых бензинов. Синтезируют ароматические углеводороды и разветвленные пара
финовые углеводороды, а затем добавляют их в бензины.
Кроме того, в бензины вводят и специальные добавки, которые даже в небольших
дозах заметно увеличивают октановые числа. Чаще всего это жидкость, главным ком
понентом которой является тетраэтилсвинец (ТЭС, РЬ (С2Н5)4) В камере сгорания
двигателя она разлагается, выделяя активные свободные радикалы С2Н5, а ганже
металлический свинец. Свободные радикалы и свинец взаимодействуют с перокси
дами, разрушают их, прекращают реакции их образования, препятствуют их нанопле
нию. Добавление даже небольших количеств этиловой жидкости, содержащей, кром*
ГЭС, некоторые бромсодержащие органические вещества и бензин, значительно
повышает октановые числа бензинов, в особенности низкооктановых, главными ком
понентами которых являются парафиновые углеводороды.
Давайте посмотрим, что представляют собой наиболее распространенные бен
зины. Бензин А-72 с октановым числом 72. Его готовят, смешивая бензины прямой
перегонки, термического крекинга, каталитического крекинга, каталитического
риформинга. Правда, на автозаправочных станциях грузовые машины, такси и старые
легковые машины заправляют бензином А-76. Это тот же бензин А-72, но к нему
добавлено до 0,41 г ТЭС на 1 кг бензина.
Бензин АИ-93— основное топливо для легковых автомашин и мотоциклон, его
изготовляют как с тетраэтилсвинцом (этилированный), так и без тетраэтилсвинца
В основе и того и другого —смесь бензинов каталитического риформинга с толуо
лом. В этилированном бензине АИ-93 содержится до 0,82 г ТЭС на каждый кило
грамм бензина. Ввиду исключительной ядовитости тетраэтилсвинца, являющею» я
сильнейшим нервным ядом, этилированные бензины обычно окрашивают в зеленый
цвет. Проникая в организм с парами бензина, через рот и даже через неповреждон
ную кожу, сн резко тормозит обменные процессы, разрушает нервную систему,
вплоть до глубокого расстройства сознания и развития припадков, вызывает наруше
ние кроветворной системы, механизмов наследственности. При хроническом отрав
лении ослабевает память, развивается импотенция, нарушается зрение. Помним?!
ТЭС— яд! Поэтому никогда не засасывайте этилированный бензин ртом через
шланг, не мойте руки им, а после работы с ним сразу тщательно вымойте руки
теплой водой с мылом. ТЭС обладает немалым коварством: после отравления им
человек от нескольких часов до нескольких суток ничего не ощущает —ТЭС скрыто
разрушает нервную и кроветворную системы, систему обмена веществ.
I Г/
Не приходится говорить и о том, что при сгорании бензина соединения свинца
выносятся с выхлопными газами и большей частью оседают на траве и земле вдоль
автомобильной дороги или улицы. Каждый автомобиль, работающий на
этилированном бензине, распыляет за год несколько килограммов свинца —крайне опасного
для здоровья и жизни людей вещества. Поэтому в будущем человечество неизбежно
откажется от этилированных бензинов, а в Москве, Санкт-Петербурге и курортных
городах применение их запрещено и в настоящее время. Однако переход к
использованию неэтилированных бензинов неизбежно повысит их стоимость.
На практике автомобилисты и мотоциклисты нередко специально добавляют к
низкооктановым, но более дешевым и доступным бензинам те или иные
высокооктановые примеси. Такой примесью могут быть ароматический углеводород— толуол —
или авиационные бензины, обладающие значительно более высокими октановыми
числами, чем даже изооктан. Добавляя в бак к низкосортному бензину эти продукты,
можно избежать детонации. Однако использование в автомобильном или
мотоциклетном двигателе только авиационного бензина приводит к сильному перегреву
двигателя и может быстро вывести его из строя. К тому же в авиационных бензинах
значительно больше, чем в автомобильных, тетраэтилсвинца. Наконец, надо считаться с
тем, что топливо с очень высоким содержанием ароматических углеводородов
приводит к усилению отложения нагара в головке блока цилиндров, на свечах и на
поршне. Это объясняется тем, что при нагревании или неполном сгорании
ароматические кольца углеводородов способны соединяться в сложную систему
конденсированных колец, нелетучую и термически устойчивую. Чем больше нагара, тем
больше вероятность детонации и потери мощности двигателя. Нагар является как бы
возбудителем разложения гидропероксидов. Участвует в образовании нагара и тет-
раэтилсвинец. При работе автомобиля на этилированных бензинах на клапанах,
поршнях, свечах зажигания, головке блока цилиндров появляется серо-желтый налет
соединений свинца. Если вы будете разбирать двигатель, то сначала с помощью кисти
промойте эти детали керосином. Только после этого их можно будет взять руками.
Для горения топлива нужен воздух. Сколько? Теоретически чтобы превратить
бензин в смесь С02 и Н2От требуется 15 кг воздуха на 1 кг бензина (кто не верит, пусть
посчитает!). Такую смесь часто так и называют теоретической или нормальной.
Однако в реальных условиях состав смеси отличается от теоретически
необходимого.
Если увеличить соотношение вездух —бензин до 18, т. е. работать с некоторым
избытком воздуха на обедненной смеси, то скорость горения несколько уменьшится,
двигатель не разовьет наибольшей возможной мощности, но будет работать при этом
более экономично, а общий расход топлива уменьшится на 8—10%. Такую смесь
наиболее удобно использовать на ровных участках дороги. А если мотоциклисту или
водителю автомобиля надо взять крутой подъем или резко увеличить скорость,
быстро тронуться с места, то, оказывается, выгоднее работать с некоторым
избытком бензина. Обогащенная смесь горит быстрее нормальной, в результате чего
двигатель развивает большую мощность, но в этом случае бензин сгорает уже с
образованием не только С02, но и некоторых количеств ядовитого угарного газа. Кроме
юго, не в полной мере используется тепловой потенциал бензина —расход его
увеличивается.
I 18
Законы химической термодинамики и кинетики неумолимы. И если водитель
излишне увлечется открыванием или закрыванием дроссельной заслонки, го воз
можны и неприятности. Так, если в горючей смеси на 1 кг бензина окажем.я или
меньше 6 кг, или больше 22 кг воздуха, то такие смеси не воспламенятся вообще
Если же в смеси на 1 кг бензина приходится от 6 до 1 2 кг воздуха (так называемая
богатая смесь), такая смесь горит медленно; поэтому давление в цилиндре нарас
тает с недостаточной скоростью, мощность двигателя падает. При медленном горе
нии горячие газы перегревают стенки цилиндра, а выход отработанных газов сопро
вождается «выстрелами» —из выхлопной трубы вылетают черные с примесью сажи
выхлопные газы.
А причина «выстрелов» в том, что из-за недостатка кислорода в цилиндре ч;\{\\,
топлива вместе с горячими газами выбрасывается в глушитель, где, встречаясь с
воздухом, сгорает с хлопком.
Неприятности возникают и в том случае, если смесь излишне обеднена. И в этом
случае скорость горения уменьшается, падает мощность двигателя, перегреваются
его стенки. Горение смеси продолжается при такте выпуска, а к началу такта впусна,
когда новая порция горючей смеси поступает в цилиндр через открывшийся впус
кной клапан, горючая смесь, встречаясь с догорающими продуктами сгорания, вое
пламеняется и пламя перебрасывается во впускную трубу и в карбюратор. Появ
ляются вспышки, «чихание» в карбюраторе. Вспышки могут вызвать воспламенение
бензина в карбюраторе и пожар. Поэтому нужно очень внимательно регулировать
I I9
состав рабочей смеси, в связи с тем что работа двигателя как на переобедненной,
так и на переобогащенной смеси недопустима.
Непредельные углеводороды, входящие в состав бензинов, способны полимери-
зоваться, образуя смолистые вещества; смолистые вещества смогут образовывать и
некоторые другие углеводороды, особенно при длительном хранении под
действием кислорода воздуха. Поэтому ГОСТы предусматривают, чтобы индукционный
период этих бензинов, т. е. время, в течение которого бензин, находящийся в метал-
лической бомбе под давлением кислорода 0,7 МПа и температуре 100° С, практи-
чески не окисляется, должен быть не менее 900 мин.
Чем больше индукционный период, тем стабильнее бензины, тем медленнее они
осмоляются и тем дольше их можно хранить. Для того чтобы повысить стабильность
бензинов, в них вводят специальные добавки— антиокислители. О химизме их дей-
ствия речь пойдет в разделе, посвященном смазочным маслам.
А вот для грузового автотранспорта с каждым годом будет требоваться все
больше дизельного топлива. Чем отличаются требования к химическому составу
дизельного топлива от требований к бензину? Оказывается, во многом они пол-
ностью противоположны. Дело в том, что дизельное топливо вспрыскивается в
сжатый и нагревшийся воздух. Оно должно мгновенно испариться, а после испарения
самовоспламениться и полностью сгореть. Только при этих условиях возможна
мягкая работа двигателя. Оказалось, что такой способностью в наибольшей степени
обладают парафиновые углеводороды с длинной прямой цепью— те самые, у которых
минимальное октановое число. А вот ароматические углеводороды, у которых
максимальные октановые числа, имеют очень высокие температуры самовоспламенения
(500—600° С) и совершенно непригодны в дизельном топливе. Воспламенительные
характеристики дизельного топлива оцениваются по цетановым числам. За эталон с
цетановым числом 100 принимается нормальный цетан или гексадекан С16Н34, а
■
а-метилнафталин ctL имеет цетановое число, равное нулю. Предпочитают
использовать топливо с цетановыми числами 50—60. Если же цетановое число неве
лико, то добавляют вещества, способствующие быстрому воспламенению, в том
числе и пероксиды.
Обычно дизельное топливо получают из высококипящих по сравнению с бензином
фракций нефти. Так, зимнее дизельное топливо должно на 50% выкипать при темпе-
ратуре до 250° С, а летнее —даже до 280° С. 98% дизельного топлива марки «Л», т. е.
рассчитанного на применение при температурах выше 0°С, должно перегоняться при
температуре не выше 360° С. Топливо марки «3» —зимнее —на те же 98%
перегоняется при температуре не выше 335° С.
Таким образом, машины с дизельным двигателем не только экономичнее, но и
значительно менее пожароопасны, чем автомашины с бензиновым двигателем.
В 80-е гг. немалое внимание было уделено новым топливам для двигателей
внутреннего сгорания. Причина этого — в сокращении ресурсов дешевых нефтей и в поис-
ках новых видов доступного топлива.
120
Чем еще можно заменить бензин в карбюраторном двигателе? Большое внима
ние уделяют перспективам применения газообразного топлива. Уже во многих горо
дах появились красивые заправочные станции с изображением бронтозавров на
фронтоне. Перспектива замены бензина на природный газ вызвана прежде всего
экономическими соображениями, так как при равном пробеге газ обходится в 3 А
раза дешевле бензина. Ресурсы природного газа весьма велики. Важно и то, чт
каждый автобус, переведенный на природный газ, экономит за год около 30 i бен
зина, а каждый легковой автомобиль —4—6 т.
Метан— главный компонент природного газа — обладает октановым числом
порядка 1 20, высокими октановыми числами отличаются и входящие в состав ежи
женных газов пропан и бутан (90—110). Эта смесь (80% пропана и 20% бутана), кото
рая обычно транспортируется и хранится в емкостях и баллонах под давление 1м
1,6 МПа, обладает теплотой сгорания 46 мДж/кг. Использование природного газа
ограничено, так как запас хода двигателя на сжатом газе в два раза меньше, чем при
полной заправке бака бензином. Для дальних рейсов может использоваться смешан
ный вариант: при полном расходовании газа из баллонов двигатель переключается на
бензин.
Использование сжиженных газов или природного газа заманчиво и с экологиче
ских позиций: газ легче, чем пары бензина, смешивается с воздухом; поэтому болев
полно происходит сгорание, а в результате —меньше токсичных выбросов в атмос
феру. В отличие от бензина газы не могут смывать пленку смазочного масла oi сте
нок цилиндров и поршней, не разжижают масло, значительно уменьшают образов.i
ние нагара в двигателе. Тем самым увеличивается срок службы двигателя можно
реже менять масло.
Однако широкое использование природного и сжиженных газов серьезно сдер
живается из-за необходимости оснащать автомашины тяжелыми баллонами и из за
значительного сокращения пробега между заправками. В Бразилии, например, <
бензином конкурирует обычный этиловый спирт, приготовляемый из сельскохозпи
ственного сырья, отходов переработки древесины и сахарного тростника. Перемок
тивным видом моторного топлива может оказаться и метиловый спирт СН3ОН, при
готовляемый из природного газа, а в перспективе и из дешевых углей. По-видимому,
в недалеком будущем метиловый спирт будет близок по себестоимости к высокона
чественным бензинам, изготовляемым из нефти.
Спирты обладают великолепными антидетонационными свойствами. Их октановое
число составляет 125—130. Это связано как с быстрым разложением гидроперонси
дов, образующихся при окислении спиртов, так и с изменением условий pa6on,i дни
гателя. Дело в том, что одной из причин детонации часто оказывается перегрев дви
гателя. У спиртов скрытая теплота испарения в 3,5 раза больше, чем у бензина (в
расчете на единицу массы). Поэтому при испарении капелек топлива температура
горючей смеси в конце такта сжатия снижается и тем самым охлаждаются наиболее
нагретые части двигателя: поршни и клапаны. Это имеет важное значение, если
тепловой режим двигателя напряженный, как бывает при работе на обогащенном
смеси, при резко форсированном режиме работы двигателя, например у гоночных
мотоциклов, да и у обычного мотоцикла, при движении по пересеченной место
сти. Не случайно спирт оказывается основой топлива, используемого для го
l' > I
ночных двигателей. Правда, теплота сгорания у спиртов заметно меньше, чем у бен-
зина.
Следует отметить, что малая теплота сгорания спиртов дает положительный
результат: для полного окисления топлива требуется меньше воздуха, а значит,
количество топлива в заданном объеме горючей смеси будет больше. Это улучшает
охлаждение двигателя.
Другое преимущество спирта— его способность надежно воспламеняться от
жектрической искры даже при значительных колебаниях состава горючей смеси.
1 ели пределы воспламеняемости по коэффициенту избытка воздуха составляют для
бензина 0,5—1,4, то для спирта они расширены до 0,4—1,7. Это позволяет водителю
тмочното мотоцикла работать на очень обогащенной смеси. При этом увеличение
расхода топлива компенсируется значительным облегчением температурного
режима работы наиболее нагретых деталей и благодаря этому возможностью
увеличения мощности двигателя.
Часто говорят о возможности подачи воды в двигатель внутреннего сгорания и о
якобы достигающейся при этом огромной экономии топлива. Действительно, подача
it оонзино-воздушную смесь небольшой дозы воды уменьшает перегрев двигателя,
опасность детонации и благодаря этому несколько увеличивает мощность двигателя.
Однако в самодельных конструкциях обеспечить равномерную подачу воды сложно,
<i неравномерная подача воды нарушит работу двигателя.
Много говорят о водородной энергетике как об энергетике будущего. Водород
действительно экологически наиболее чистое топливо. Правда, стоимость его
производства достаточно велика. Пока самое дешевое сырье для изготовления
водорода-природный газ. Однако в двигателе автомобиля, конечно, выгоднее
использовать сам природный газ, а не полученный из него с немалыми затратами
ио до род.
Водород, полученный при электролизе воды, в два раза дороже, чем
изготовленный из природного газа. Получение водорода за счет использования тепла ядерных
реакторов пока что не прошло серьезного уровня инженерных разработок. Проб-
пемы же перевозки запасов водорода на автомобилях еще более серьезны, чем при
использовании природного газа. Так, масса бака для бензина и горючего для пробега
на 400 км составит в сумме около 67 кг. Если же использовать сжиженный водород,
го суммарная масса емкостей и водорода достигает 1374 кг!
Сказанное говорит о том, что еще долгие годы бензин будет основным видом
гоплива для легковых автомобилей и тем более для мотоциклов.
СМАЗОЧНЫЕ МАСЛА И ДВИГАТЕЛЬ
Температура, возникающая при воспламенении рабочей смеси (свыше
2 000° С) может расплавить металл двигателя, и поэтому стенки камеры сгорания и
цилиндра двигателя необходимо непрерывно охлаждать изнутри. Это делает пленка
масла, находящегося на стенках цилиндра. Масло передает воспринятое тепло
охлаждающей жидкости.
В двигателе тепло образуется не только от сгорания смеси. Металлические
детали, находящиеся в непрерывном и быстром движении друг относительно друга, в
I 22
результате трения нагревают двигатель. Задача масла —уменьшить это трение и
одновременно отвести выделяющееся тепло.
Раскаленные, находящиеся под высоким давлением, продукты сгорания давят на
движущийся поршень и, естественно, стремятся прорваться в зазор между стенками
цилиндра и поршневыми кольцами, в картер машины, к коленчатому валу. Им не дав!
сделать это опять же пленка масла, заполняющего мельчайшие зазоры между пор
шневыми кольцами и стенками цилиндра.
Работа масла трудна. И каждый раз, когда поршень совершает рабочий ход, часть
масла сгорает. Смазочное масло поистине проходит огонь, воду и медные трубы и в
самых тяжелых условиях должно постоянно и безукоризненно выполнять свои фунн
ции. Любые ошибки в выборе смазочного масла, в его эксплуатации нарушаю!
исполнение этих функций и могут вывести из строя двигатель.
Давайте посмотрим, какие требования предъявляют к смазочным маслам. Во
первых, необходимо, чтобы частицы масла хорошо сцеплялись с частицами металла.
Во-вторых, смазка должна обладать способностью создавать очень прочную пленку
на поверхности металла, выдерживать, не разрываясь, большие нагрузки. Если мае
ляная пленка разорвется, возникнет сухое трение с последующей порчей трущихся
поверхностей, появлением на них задиров.
Структура, физико химические свойства смазочных масел, их химический состав
тесно взаимосвязаны и существенно влияют на работу двигателя.
Трудно сказать, что является главным в техническом обслуживании автомобиля.
Все главное! Но пожалуй, решающим является смазка. Невнимание к смазке
самый верный путь к разрушению автомобиля. Для смазки автомобиля согласно
инструкциям применяется 13 различных масел и смазок. Кроме того, обычно упоми
нается еще порядка 16 заменителей. Каждое масло и каждая смазка имеют строго
определенное назначение.
Говорят: «Кашу маслом не испортишь». По отношению к автомашине эта поело
вица совершенно неприменима. Далеко не всегда увеличение расхода масла блаю-i
ворно сказывается на машине, а неправильно применяя сорта смазок и масел,
можно испортить ее.
Все виды смазочных материалов, применяемых автомобилистами и мотоцикли
стами, можно разбить на три группы. Это наиболее важные и ответственные маем;!
для двигателя, о которых мы уже начали разговор; это масла для смазки механизмон
трансмиссии и рулевого механизма автомобиля и это консистентные смазки но\о
кучие мазеобразные вещества, полученные из очищенных маловязких минеральных
масел, загущенных натриевыми или кальциевыми мылами (соответствующими
солями жирных кислот). Консистентные смазки используют для шестерней заднего
моста и крестовин карданного вала.
Давайте посмотрим, какие требования предъявляют к маслам для двигателей.
У масел определяют термоокислительную стабильность при 250° С, коррозионную
активность по отношению к металлам, моющие свойства, т. е. способность смывать
нагар и механические примеси с металла.
Многие из свойств масел, определяемых этими требованиями, понятны. Это ото
сится к кислотному числу, по которому оценивают количество кислых примесей,
способных вызывать коррозию двигателя, а также к температуре застывания,
1 23
*
показывающей при какой температуре масло перестает быть маслом, а обращается
в желе.
Одним из наиболее важных показателей масел является их вязкость. Дело —в
многообразии функций масла. Так, чем выше вязкость масла, тем легче добиться
уплотнения в цилиндрах двигателя, тем меньше опасность прорыва газа из камеры
сгорания в картер двигателя. В то же время чем больше вязкость, тем больше рас-
ход энергии на трение, тем хуже используется полезная мощность двигателя, тем
меньше скорость автомашины. Значит, надо подобрать вязкость масла так, чтобы
получить хорошее уплотнение и не перерасходовать топливо. Очень важно, чтобы
вязкость масла не очень сильно менялась с температурой. В самом деле, если
масло значительно уменьшает свою вязкость при нагревании, то может получиться,
что продукт, на котором трудно запустить двигатель при невысоких температурах,
просто вытечет из всех узлов трения, когда двигатель и масло, находящееся в нем,
прогреются.
Поэтому-то в большинстве стандартов и упоминают вязкость масла при разных
температурах.
Что служит сырьем для изготовления масел? Обычно высококипящие фракции
нефти. Вспомните, как перерабатывают нефть: сначала ее фракционируют на спе-
циальных аппаратах, ректификационных колоннах, отбирая последовательно по мере
повышения температуры кипения бензин, лигроин, керосин, соляр. Этот продукт,
используемый как сырье для дизельного топлива, получают, повышая температуру
нефти до 330° С. Сильнее нагревать нефть нельзя: составляющие ее углеводороды
при более высоких температурах разлагаются, выделяя газ и другие продукты. Такой
процесс —нагревание нефти до 400—500° С, называемый крекингом,—пригоден для
приготовления дополнительных количеств бензина, но не для получения масел. После
перегонки при атмосферном давлении все будущие масла остаются в тяжелом про-
дукте —мазуте.
Масла из мазута можно выделить, если вести последующую перегонку при
пониженном давлении (в вакууме). Вы знаете, что понижение давления позволяет значи-
*
тельно уменьшить температуру кипения любого вещества. Фракционируя мазут в
вакууме, получают дистилляты смазочных масел: солярового, веретенного, машин-
ного, цилиндрового. Тяжелый вязкий остаток, называемый гудроном, используется
для изготовления битумов и асфальта для дорог. Гудрон, приготовленный из некото-
рых масляных мазутов, используется для изготовления особо вязких масел.
Все эти дистилляты и остатки еще не масла. Чтобы приготовить из них масла, тре-
буется сложная переработка и очистка. Десятки цехов входят в состав масляных про-
изводств.
Масла, как и бензины,—сложная смесь углеводородов, хотя в них присутствуют и
другие группы химических соединений. Какие группы углеводородов дают лучшие
масла? Пожалуй, наибольшую ценность представляют однокольцевые аромати-
ческие и нафтеновые углеводороды с длинными боковыми цепями. Они обладают
высокой вязкостью и хорошими смазочными характеристиками. Вязкость аромати-
ческих и нафтеновых углеводородов с конденсированными ароматическими
кольцами и короткими боковыми цепями очень велика, но слишком сильно изменяется с
повышением температуры. Они плохо смачивают металл и образуют при работе в
124
двигателе отложения и нагар. Еще опаснее в этом отношении входящие в состав
полуфабрикатов масел высокомолекулярые соединения — асфальтосмолиои.к'
вещества. Вредны непредельные углеводороды, которые при нагревании, да еще в
присутствии воздуха также образуют смолы и отложения, загрязняющие масло. Нано
нец, опасен содержащийся в дистиллятах yi остаточных продуктах парафин: он очень
сильно увеличивает температуру застывания масел и мешает использовать их мри
невысоких температурах, загущает их. Ну и, конечно, в масле совершенно не нужны
находящиеся в дистиллятах нафтеновые кислоты, способные вызвать коррозию ДВИ1 а
теля.
Значит, дистилляты (а автомобильные масла изготовляют в основном из машин
ного дистиллята) надо очищать от всех этих ненужных и вредных примесей. Необходи
мость и важность очистки, как вы уже видели, отразилась даже в маркировке масел
Какие же свойства вредных примесей позволяют от них избавляться? Полицинли
ческие ароматические углеводороды, а также и асфальтосмолистые вещества взаи
модействуют с концентрированной серной кислотой, образуя растворимые в кислоте
и воде так называемые сульфокислоты, а также уплотненные смолистые вещества:
фенантрен - сульфо кислота
Перемешав маслянистый дистиллят с серной кислотой, можно затем отделить
кислоту с продуктами превращения асфальтосмолистых веществ и полициклических
ароматических углеводородов в специальном аппарате от масляного продукта кис
лотной очистки. Правда, при этом расходуется серная кислота, а в отвалах копится
неприятный вязкий продукт —так называемый кислый гудрон.
Это беда и любого другого чисто химического метода очистки: расходование pea
гентов и образование отходов, которые часто трудно использовать. Поэтому замам
чиво применить физические методы очистки.
Попробуйте решить задачу: надо разделить смесь мелкого речного и сахарного
песка. Правильно! Давайте зальем эту смесь водой. Сахар растворится и после
отфильтровывания сиропа останется чистый речной песок. А что если найти раство
рители, которые плохо растворяют вредные примеси, но лучше растворяют ценные
составные части масляных дистиллятов? Можно, конечно, пойти и по другому пути:
найти растворитель, который не растворяет основные (нужные) части масла, но
извлекает вредные примеси. Селективная очистка основана на этом последнем
принципе. Масляный дистиллят в специальной колонне противотоком промывается
фенолом, фурфуролом или каким-нибудь другим полярным растворителем. При этом
фенол растворяет нежелательные составные части дистиллята, а сверху из аппарата
отводится очищенное масло с небольшой примесью фенола. Температура кипения
фенола много меньше температуры кипения масла, и при нагревании он отделяется и
от масла, и от извлеченных продуктов и возвращается на очистку новых порций
12В
сырья. Извлеченный с помощью фенола продукт— ценное сырье для изготовления
разнообразных конструкционных материалов, углеродных изделий, а также сажи,
которая так нужна для производства автомобильных покрышек: в шинах по массе
50% сажи!
К сожалению, если в масле много асфальтосмолистых веществ, то селективная
очистка, например фенолом, не всегда позволяет добиться получения масла нужного
качества. В этом случае селективной очистке должна предшествовать специальная
деасфальтизация. Пропан, о котором мы уже говорили как о потенциальном топливе,
заменяющем бензин, при давлении 1,2—1,4 МПа обращается в жидкость. Этот
жидкий пропан смешивается с маслом и при повышенных температурах растворяет все
его компоненты, кроме асфальтосмолистых веществ. Последние легко осаждаются
из раствора. Деасфальтизация так же, как и селективная очистка осуществляется в
специальной колонне. При понижении давления пропан улетучивается из масла,
затем вновь сжимается компрессором и направляется на очистку новых порций
сырья.
Каждое масло при понижении температуры застывает, теряет свою подвижность.
Способность масла застывать зависит от количества содержащегося в нем
парафина. Как избавиться от парафина? Может, охладить масло и отделить из него
кристаллы парафина? Однако этот способ не подходит, потому что охлажденное масло
слишком вязко, и выделить из него мелкие кристаллы парафина не удается. Поэтому
надо уменьшить вязкость масла, добавляя к нему легкотекучий растворитель,
например ацетон или толуол. Масло смешивают при нагревании с растворителем, а затем
эту смесь постепенно в нескольких аппаратах охлаждают до —30—50° С. При
охлаждении в смеси появляются кристаллы парафина, которые и отделяются от раствора
масла в растворителе на специальных устройствах —фильтрах. Раствор на колоннах
освобождается от низкокипящего растворителя, а очищенное масло направляется на
дальнейшую переработку.
Однако даже очищенный от нежелательных примесей продукт еще не обладает
всеми качествами, необходимыми для полноценного масла. Поэтому очень часто в
масла вводят специальные добавки, которые чоущественно улучшают их свойства.
ПОГОВОРИМ О ПРИСАДКАХ
Как присадки улучшают вязкостные свойства масел. Хорошее
масло должно обладать достаточной подвижностью при низких температурах, когда
запускают двигатель, и в то же время обладать достаточной вязкостью, когда масло
разогреется. Из нефти такое масло получить нелегко. К хому же зимой нужны менее
вязкие масла, а летом— более вязкие. Легче всего это сделать с помощью
добавления вязкостных присадок. Обычно это полимер изобутилена —полиизобутилен:
13
-с-сн2-
си3
-
Цепочки загустителя — вязкостной присадки— обычно в десятки раз больше цепо
чек масляных молекул. Они мешают перемещению молекул масла и тем самым уве
личивают его вязкость. А при повышенных температурах нити полимера сворачи
ваются в клубки, которые и препятствуют резкому падению вязкости при высоких
температурах. В масле АСЗП-10 —до 8% этого полимера.
Улучшение смазывающей способности масла. Давайте посмотрим, с чем
связана большая или меньшая смазочная способность масла. Необходимо, чтобы
одни концы молекул, входящих в состав масла, достаточно прочно соединялись с
металлом, а противоположные их концы создавали поверхность, плоскость скольже
ния. С металлом лучше всего сцепляются полярные участки молекул, содержащие
кислород или серу, в какой-то мере— ароматические кольца. Очень глубоко очищен
ные, освобожденные от полярных групп масла совершенно непригодны как смазы
вающие материалы.
Чтобы масло лучше смачивало металл, в него вводят специальные присадки. v)m
могут быть растительные масла, олеиновая кислота, сложные эфиры органических
кислот.
Используют и другие полярные соединения, содержащие серу и фосфор. Добав
ление в масло 0,5% таких присадок в 1,5—2 раза уменьшает износ цилиндров авто
мобильных и мотоциклетных двигателей.
Кан понижают температуру застывания масел. Раньше уже шла речь о том,
что в маслах содержатся твердые углеводороды— парафины. При относительно
высоких температурах они растворены в масле, а при охлаждении масла в нем начи
нают образовываться мелкие кристаллы парафинов. Масло мутнеет, подвижность его
уменьшается. Считают, что износ трущихся деталей двигателя, в особенности поршни
и стенок цилиндра, на 50—70% происходит при запуске мотора, пока масло густое
Понизить температуру застывания масла удается благодаря депарафинизации
Однако даже этот процесс не позволяет полностью убрать парафин. Были пред/к>
жены специальные присадки, которые называют депрессаторами. Для этой цели
применяют разные продукты; окисленный парафин, мыла тяжелых металлов, напри
мер соли стеариновой кислоты и алюминия или марганца, ряд синтетических
продуктов. Как действуют такие присадки? Особенность застывания масла заключается в
том, что кристаллы парафина образуют своеобразную решетку — клетку, внутри кою
рой заключено жидкое масло. Парафина немного —всего несколько процентов. Но
попадая в такую клетку, молекулы масла теряют подвижность. Небольшого коли
чества присадки-депрессатора достаточно для того, чтобы нейтрализовать растущие
кристаллики, не дать им создать ловушку для масла.
Присадки, защищающие масло от окисления, а двигатель —от коррозии. Во
время работы в двигателе масло нагревается до высоких температур. При этом ком
поненты масла взаимодействуют с кислородом воздуха, окисляются, образуя про
дукты, вредные для работы двигателя: кислоты, смолы, лаковые отложения. Из этих
продуктов образуется нагар на поршне, поршневых кольцах; смолы и лаки загряз
няют масляную систему, ускоряют износ двигателя; кислоты способствуют коррозии
металла. Окисление, как мы уже говорили, приводит к изменению свойств бензин.»
при хранении.
Каков механизм этого неприятного процесса? Сущность его была установлена
127
выдающимся русским советским ученым, лауреатом Нобелевской премии Н. Н.
Семеновым. Оказалось, что реагировать с кислородом могут лишь молекулы,
обладающие повышенной активностью.
Сначала одна из молекул под влиянием нагрева теряет атом водорода и
превращается в свободный активный радикал:
Я — Н->Я"+"Н*
Свободный радикал легко присоединяет кислород, образуя пероксидный
радикал;
R + о2 -> R — О — О*
Последний уже легко реагирует со следующими молекулами, образуя знакомый
нам гидропероксид и новый свободный радикал:
R _ о — О' + RH-» R — О — О — H + R'
А этот радикал продолжает цепь, вовлекая в реакцию сотни и тысячи молекул.
Если посмотреть, как изменяется количество продуктов окисления масла, то
оказывается, что в течение определенного времени продукты глубокого превращения
масла не обнаруживаются, затем кривая резко идет вверх, а в конечной части своей
опять идет полого —замедляется образование новых продуктов окисления. Очень
важной характеристикой масла является начальная часть этой кривой; время,
отвечающее этому начальному периоду, характеризует индукционный период масла. Чем
дольше этот период, тем лучше масло, тем устойчивее оно к окислению.
Как удлинить индукционный период? Оборвать цепь окисления в самом начале.
Добавить в масло вещество, способное захватить свободный радикал, не позволить
ему вовлечь в цепь окисления сотни и тысячи молекул. Такой присадки нужно совсем
немного— 100 г, а то и меньше на 1 т масла. Такими присадками являются
азотсодержащие ингибиторы, некоторые фенолы, например соединение, называемое ионо-
лом:
ОН
Присадки значительно увеличивают срок службы и масел, и двигателей. Их
необходимо добавлять еще на заводе в только что полученное масло. Если масло уже
поработало и накопило продукты окисления, то от добавления противоокислительной
присадки (антиокислитель, ингибитор —от лат. ingibire — замедляю) никакой пользы
не будет. Не стоит увлекаться и увеличением расхода присадки. Если антиокислителя
добавить слишком много, то он сам начнет окисляться, образуя смолистые вещества,
и перестанет выполнять свою защитную функцию.
Одним из самых неприятных последствий окисления масел, накопления в них кис-
128
лот и гидропероксидов становится коррозия металлических поверхностей в двитате
лях. Особенно легко подвергаются коррозии сплавы цветных металлов, свинцови
стые бронзы, баббиты и др., использующиеся во вкладышах подшипников двигателей
Чтобы избавиться от коррозии, в масло вводят специальные присадки: эфиры фосфо
ристой кислоты-фосфиты, соединения серы. Эти вещества агрессивны, они Moiyi
реагировать с металлом, но одновременно они образуют плотную тонкую пленку про
дуктов реакции, надежно защищающую металл от коррозионно-опасных веществ,
находящихся в масле. Всего полпроцента такой присадки в 10—15 раз уменьшав!
скорость коррозии.
Моющие или противонагарные присадки» Окисляясь, минеральные масла и
топливо образуют многочисленные продукты, нарушающие нормальную работу дни
гателя. Они выпадают из масла и отлагаются на самых ответственных частях двига
теля, резко ухудшая его работу.
В камере сгорания на головке поршня накапливается нагар; в зоне поршня, где
температура 250—300° С, образуются липкие продукты окисления, которые забиваю!
поршневые кольца, покрывают стенки поршня и цилиндра слоем лака, ухудшающего
отвод тепла. Образование лака и особенно забивка поршневых канавок липкими
отложениями приводят к пригоранию колец и могут вызвать серьезную аварию. На
фильтрах масла, в картере двигателя, в шейках коленчатого вала отлагается осадок
шлам. Чего в нем только нет! Здесь и продукты окисления, и нагар, и частицы
металла, образовавшиеся при износе механизмов, и просто грязь. От всех этих отло
жений надо избавляться. Моющая присадка должна сделать устойчивой взвесь при
месей, нагара в масле. Присадка может способствовать разрыхлению отложений,
чтобы их было легче смыть. Наконец, присадка может образовать тонкую пленку и.»
поверхности металла и помешать лаку прилипать к этому металлу. Моющие присадки
бывают обычно сродни мылу. Только обычное мыло, как вы знаете, это натриевые и
калиевые соли жирных кислот. Такие мвгла хорошо растворимы в воде, но
нерастворимы в масле. А моющими присадками оказываются нерастворимые в воде соли
жирных кислот с такими металлами, как кальций, барий, цинк, алюминий и некоторые
другие.
В масло, кроме перечисленных присадок, вводят и полифункциональные при
садки: синтетические продукты, содержащие ряд активных групп, способные стаи,
одновременно и антиокислительными, и противокоррозионными, и моющими, и улуч
шающими смазочные свойства масел присадками.
Как пользоваться маслами. Процесс смазки двигателя у автомобилей и серии
ных мотоциклов неодинаков. У автомобиля смазочное масло сливается в поддон кар
тера, откуда специальным масляным насосом подается на фильтр грубой очистки, а
затем поступает в главную магистраль и частично в фильтр тонкой очистки. Из глав
ной магистрали поток масла по каналам в стенках блока подается к коренным под
шипникам коленчатого вала и к подшипникам распределительного вала. От подтип
ников по каналам в коленчатом валу масло приходит к шатунным подшипникам. При
вращении коленчатого вала масло, выдавливающееся из зазоров подшипников, раэ
брызгивается и образует масляный туман, который смазывает стенки цилиндром,
поршни, поршневые кольца, стержни клапанов. После смазки масло стекает в под
дон картера и вновь засасывается насосом.
1 29
6 Многоликая химия
У мотоциклов, если речь не идет о специальных, особо мощных машинах,
подобная организация смазки не всегда возможна. Смазку большей части двухтактных
двигателей производят маслом, примешиваемым к бензину. Оно заливается в топливный
бак вместе с бензином в соотношении 1:25 или 1:30. В период обкатки масла может
быть и больше (соотношение 1:20). Перед заправкой надо уделять очень большое
внимание тщательности перемешивания масла и бензина, точности дозирования
масла в горючую смесь. Не забывайте доливать масло в бензобак вместе с
бензином! Если масла будет мало, то ускоренно изнашивается двигатель, особенно
поршень и поршневые кольца. Плохо, если масла слишком много. В этом случае
затрудняется пуск двигателя, образуется нагар, забрызгиваются свечи, двигатель работает
с перебоями, дымит. Увеличение сверх необходимой доли масла в смеси с бензином
снижает октановое число смеси (хорошее масло отличается невысоким октановым
числом).
Для смазки мотоциклов используют те же масла, что и для двигателей
автомобилей, а также и более вязкие. Хотелось бы обратить внимание на опасность
использования авиационных масел для смазки автомобильных или мотоциклетных двигателей.
Авиационные масла МС-14, МС-20, МС-22 имеют вязкость в 2—3 раза большую,
чем автомобильные. Это означает, что при работе на них значительно уменьшится
эффективная мощность двигателя автомобиля или мотоцикла, ускорится его износ,
увеличится опасность преждевременного выхода механизма из строя.
Желая применить в двигателе своего автомобиля или мотоцикла самое лучшее
смазочное масло, автолюбители могут совершить серьезную ошибку.
Зимой масла иногда разбавляют более легким веретенным маслом. Однако
масла смешиваются плохо, если в двигатель сначала залито одно, а потом другое
масло. Их надо тщательно перемешать в заданной пропорции в чистой посуде, а
только после этого заливать в двигатель.
ХИМИЧЕСКИЙ ИСТОЧНИК ТОКА
Для автомобиля и мотоцикла необходима электроэнергия. Без нее нет
зажигания у карбюраторных двигателей, нет освещения дороги, сигналов приборов и
многого другого. Источник электроэнергии — генератор —динамо-машина работает
только во время работы двигателя. Однако электроэнергия необходима и для
запуска автомобиля, и после остановки двигателя хотя бы для включения сигнальных
огней. Поэтому-то и необходим накопитель электроэнергии— аккумулятор. Типы
аккумуляторов, которые могут быть использованы, приведены в таблице.
Таблица. Важнейшие типы аккумуляторов
Аккумулятор
Свинцовый
Никель-кадмиевый
Железоникелевый
Никель-цинковый
Электрохимическая
система
рьо2 / h2so4 / рь
NiOOH/KOH/Cd
NiOOH/KOH/Fe
NiOOH/KOH/Zn
Общее уравнение
процессов
PbO*2 + 2H2SO( *± PbS04 + 2H^O
2NiOOH + Cd + 2H20<^ 2Ni(OH), + Cd(OH)2
2NIOOH + Fe + 2H О *± 2Ni(OH), + F.e(OH)2
2МЮОН + Zn + 2H,0 *± 2Ni(OH)2 + Zn(OH),
эдс, в
2,1
1,36
1,4
1,7
130
Как видно из таблицы, наибольшей электродвижущей силой обладает кислотный
свинцовый аккумулятор, который чаще всего и используют. Свинцовый аккумулятор
был изобретен французом Камилем Форшем в 1881 г. Электролитом в нем являемся
35—40%-ный водный раствор серной кислоты. Раствор готовят из специальной (акку
муляторной) серной кислоты с концентрацией 92—94%, в которой очень жестко огра
ничивают содержание примесей: не более 0,006% железа и не более 0,00005%
хлора, марганца и мышьяка. Эту кислоту разбавляют дистиллированной водой, лучше
в керамической посуде (подумайте, почему не в стеклянной или металлической)
Вы, конечно, знаете, что при разбавлении лить надо тонкой струйкой кислоту в
воду, а не наоборот. Дело в том, что при растворении кислоты в воде происходит их
взаимодействие —гидратация, сопровождающаяся интенсивным выделением гепла
Добавляемая вода может даже закипеть, а пар — разбрызгать кислоту, что очень
опасно для того, кто готовит электролит. Обычно рекомендуют разбавлять кислоту до
плотности 1400 кг/м3, а затем уже, после охлаждения до комнатной температуры,
доводить до расчетной концентрации. Плотность определяют с помощью ареометра.
Готовый к употреблению свинцовый аккумулятор состоит из пластин, одни из кок»
рых заполнены диоксидом свинца РЬ02, а другие —металлическим губчатым евин
цом, к которому для увеличения механической прочности добавлена сурьма.
При разрядке аккумулятора происходит окисление свинца:
Pb° + SOl" -* PbS04 + 2е~
и восстановление диоксида свинца:
РЬ02 + 4Н+ + 2е~~ + SO^" - PbS04 + 2H2Q
Передача электронов происходит во внешней цепи. Ее мы и используем. В
электролите же ионы SC>4~ движутся к аноду, а ионы Н+ —к катоду. По мере падения
напряжения производят подзарядку аккумулятора. При этом происходит обратный
окислительно-восстановительный процесс: свинец восстанавливается, а двухвалет
ный свинец в сульфате свинца на аноде окисляется до РЬ02.
При разрядке аккумулятора меняется состав электролита и, следовательно, его
плотность, так как сульфат-ионы из раствора образуют сульфат свинца. Зная ПЛ01
ность электролита, можно оценить степень заряженности аккумуляторной батареи
Кстати сказать, чем сильнее разряжена батарея, тем больше опасность замерзания
электролита даже при небольших морозах.
При работе электролит испаряется, и при снижении уровня в батарее его следув1
доводить до нормы дистиллированной водой (ни в коем случае нельзя использовать
водопроводную воду!). Можно пользоваться водой, получаемой при оттаивании сне
говой шубы холодильника (это, по сути дела, дистиллированная вода).
При ежегодном пробеге 15—20 тыс. км аккумулятор служит в условиях умерен
ного климата 3—4 года, в жарком климате срок службы аккумулятора уменьшается
Это одна из причин, почему автомобиль не стоит слишком надолго оставлять под
лучами солнца.
При температуре ниже —35° С электролит густеет и аккумулятор перестает рабо
тать. Поэтому зимой в сильные холода аккумулятор стоит на ночь занести в теплое
место.
i:n
К аккумуляторной батарее с открытыми пробками нельзя приближать открытое
пламя или искрящие провода. Дело в том, что одним из побочных процессов,
прокисающих в батарее, является электролиз воды, приводящий к образованию смеси
водорода и кислорода-гремучего газа, крайне взрывоопасной газовой смеси.
Осторожно надо работать и с кислотой, и с электролитом. Лучше —в резиновых
перча жах, фартуке и защитных очках. Конечно, смелому море по колено, но ожоги глаз,
лица, дырки на одежде никому не доставят положительных эмоций.
Обычная автомобильная аккумуляторная батарея состоит из шести отдельных
днухвольтовых аккумуляторов, соединенных между собой последовательно, что и
обеспечивает получение в цепи рабочего напряжения в 1 2 В. Бак батареи изготовлен
из эбонита и разделен перегородками на шесть отделений. Положительные и отрица-
гельные пластины изолированы друг от друга сепараторами, изготовленными из
специально обработанной фанеры, мипора или мипласта. Все эти сведения отражены в
маркировке аккумуляторной батареи. Например, 6-СТ-68-ЭМ означает, что в
батарее шесть аккумуляторов, батарея стартерного типа, ее номинальная мощность 68
ампер-часов, бак изготовлен из эбонита, а сепараторы — из мипласта (М).
Мотоциклетные аккумуляторы меньше, а маркировка их выглядит следующим образом: 3-
СМТ-1 1 означает, что в батарее три аккумулятора, батарея пригодна для питания
стартера (С), она мотоциклетная (МТ) и имеет номинальную емкость 11 ампер-часов.
Заряжают аккумуляторные батареи с помощью какого-нибудь зарядного
устройства, чаще германиевого или селенового выпрямителя, подключенного к
осветительной сети. Клемму «плюс» батареи соединяют с положительной, а клемму
«минус» —с отрицательной клеммой выпрямителя. Полярность батареи, выпрямителя
и генератора можно проверить и без приборов. Опустите провода в подкисленную
воду. При пропускании электрического тока около отрицательного провода будут
интенсивно образовываться пузырьки газа (какого?). А если в свежий срез клубня
картофеля воткнуть два медных контакта (на расстоянии 2—3 мм друг от друга) и
замкнуть цепь, то около положительного провода мякоть клубня картофеля начнет
синеть.
ДВИГАТЕЛЬ НАДО ОХЛАЖДАТЬ
Система охлаждения двигателя должна отводить те 35% тепловой энер-
1ии, получаемой при сгорании топлива, которые расходуются на нагрев деталей
двигателя. У подавляющего большинства мотоциклов это тепло отбирает
непосредственно воздух, обтекающий двигатель. У автомобилей используется сложная
жидкостная система отвода тепла. Если двигатель не охлаждать, то смазочное масло
быстро превращается в нагар, который заклинивает движущиеся части мотора. При
жидкостном охлаждении создается принудительная система циркуляции
охлаждающей жидкости, которая отнимает тепло от стенок и головок цилиндров и рассеивает
его с помощью радиатора в окружающее пространство. С помощью термостата в
системе поддерживается стабильная температура. Пробка радиатора изолирует цикл
охлаждения от атмосферы и препятствует испарению жидкости.
Долгое время наиболее распространенной охлаждающей жидкостью была вода.
Правда, не всякую воду можно заливать в радиатор.
I32
Требования к воде сводятся к следующему:
1. Она не должна быть жесткой ( в ней должно быть не более 2 ммоль на I л
ионов Са2+ и Мд2+). В противном случае в радиаторе и во всем контуре охлаждения
неизбежно накопление накипи — нерастворимых солей: карбонатов, силикатов, фос
фатов и других солей магния и кальция. Эти вещества обладают низкой теплопровод
ностью и значительно ухудшают охлаждение двигателя.
2. В воде должно быть не более 1 г взвешенных частиц на 1 л, т. е. она не должна
быть мутной.
В домашних условиях воду можно смягчить добавлением антинакипинов (нитра!
аммония или гексаметафосфат натрия). Для смягчения очень жесткой воды надо
добавить на ведро воды 100 г нитрата аммония или 4 г гексаметафосфата натрия,
прокипятить, а затем отфильтровать воду. А как быть, если накипь уже образовала* ^Л*
Для этой цели можно промыть систему охлаждения раствором трилона Б — двузаме
щенной натриевой соли этилендиаминотетрауксусной кислоты:
Naooc—сн2Ч усн2—соон
n-(ch2)2--n(
НООС—СН/ XCH?OONa
Это вещество способно образовывать очень устойчивые растворимые в воде
комплексы с ионами Са2+ и Мд2+ и тем самым разрушать накипь:
о=с. .с=о
Н2С JTCaC CH2
N N
NaOOC—Н2(7 ХН2-— Сн/ СН2— COONa
Трилон Б неядовит, растворим в воде, не вызывает коррозии материалов, и даже
значительный избыток его в охлаждающей воде не причиняет ущерба. Обычно 6opyi
200 г трилона Б на 10 л воды, заливают этот раствор в радиатор перед поездной,
После шести-семи часов работы двигателя раствор заменяют свежим. Четыре пни,
смен раствора позволяют полностью удалить накипь. А после этого для профилен
тики можно добавлять по 1—2 г трилона Б к раствору охлаждающей жидности,
Вода может вызвать коррозию системы охлаждения. И поэтому использую! спе
циальные антикоррозионные присадки к воде. В их состав входят соли хрома, нт
раты, способные создать защитную пленку на поверхности металла, надежно защи
щающую его от коррозии. Уральский научно-исследовательский институт химии
(УНИХИМ) разработал специальную присадку к охлаждающей воде, названную
ИКАР-3. Добавление 320 г этой присадки на 10 л воды на время пробега 12 гыс. им
защищает двигатель от коррозии.
Серьезным недостатком воды как охлаждающей жидкости является ее застыва
ние в холодную погоду. Поэтому все больше автомобилей, и легковых, и грузовых,
переходит на использование антифризов вместо воды. Основным компонентом анти
фризов является этиленгликоль (НО —(СН2)2 — ОН).
Вода и этиленгликоль-- главные составные части антифризов. Кроме них
антифризы содержат около 3% различных присадок, препятствующих развитию коррозии
системы охлаждения и вспениванию антифриза. О составе присадок и механизме их
действия речь пойдет дальше. Используют антифризы ряда Тосола (Тосол А, Тосол А-
40, Тосол А-65) и атифризы марок 40, 65. Антифриз-65 имеет в основе 66%
технического этиленгликоля и 34% воды; антифриз-40—53% этиленгликоля и 47% воды; в
Тосоле А около 37% этиленгликоля. Тосол А замерзает при — 21,5° С, а температуры
замерзания остальных антифризов отвечают цифрам в их маркировке. Обычно
антифризы типа Тосол имеют сине-зеленую окраску, а антифризы 40,65 —оранжевую
окраску.
Антифризы рекомендуется заменять не реже одного раза в два года или после 60
тыс. км пробега машины по нескольким причинам. Во-первых, хотя этиленгликоль и
стабилен, но часть его из-за окисления переходит в вещества, значительно
усиливающие коррозию системы охлаждения. Изменяются и расходуются присадки, которые
перестают защищать от коррозии. Значит, большую часть (до 95%!) этиленгликоля
можно вернуть в дело, если убрать из отработавшего свой век антифриза вышедшие
из строя, химически изменившиеся присадки, а также продукты превращения части
этиленгликоля. Регенерация антифриза важна еще и потому, что для изготовления
одной тонны этиленгликоля (с учетом затрат сырья и энергии) расходуется до шести
тонн нефти. Выбрасывать отработанный антифриз не следует: этиленгликоль
ядовит! Почва, на которую слит отработанный тосол, на многие годы остается
мертвой.
К правилам обращения с антифризами на базе этиленгликоля относятся и
следующие.
Надо уделить особое внимание поддержанию герметичности системы, так как
этиленгликоль способен вытекать через мельчайшие отверстия, сквозь которые не
проходит даже вода.
При нагревании антифриз расширяется сильнее воды. Поэтому заливать антифриз
надо на 2—3 см ниже уровня горловины радиатора, так как иначе он может
переполнить систему.
При нагревании антифриза из него удаляются пары воды, так как температура
кипения этиленгликоля около 198° С, т. е. много больше, чем у воды. Поэтому по
мере необходимости надо доливать дистиллированную воду или ее заменители, о
которых речь была ранее.
Чтобы не ошибиться, надо контролировать плотность охлаждающей жидкости
ареометром. Если долить воды больше, чем требуется, повысится температура
замерзания охлаждающей смеси. Напомним, что плотность антифриза-40 1,08 г/см3,
а антифриза-65 1,09г/см3.
Нельзя всасывать антифриз ртом через шланг!
Старайтесь не допускать попадания антифриза на корпус автомобиля —
этиленгликоль растворяет лак.
Можно приготовить самодельную охлаждающую жидкость. Солевой антифриз
содержит 32% хлорид кальция, 7% хлорид натрия и 61% воды. Он замерзает при
-45°С. Недостаток его — возможность выпадения солей при упарке воды и
коррозионная опасность.
1 34
::===zr======^^—: i
Заканчивая рассказ об антифризах, обращаем внимание читателя на ту специфи
ческую коррозию, которую может вызвать этиленгликоль. Дело в том, что коррозия
под действием антифриза связана с комплексообразованием. В системе охлаждения
автомобиля используются самые разные металлы и сплавы: чугун, алюминий, а таили?
латунь (сплав меди и цинка). Этиленгликоль способен образовывать с цинком и
медью растворимые комплексные соединения.
А если этиленгликоль частично окислен и перешел в глиоксальальдегидоспир!, го
прочность образующегося комплексного соединения увеличивается. В холодной
зоне радиатора медь и цинк «вымываются» из металла, а при разложении комплен
сных соединений в горячей зоне выпадают в виде медного или цинкового зеркала,
Поэтому антифриз без антикоррозионных присадок может вызвать течь в радиаторе
Антикоррозионные присадки, в состав которых входят и нитраты, и соли борной кис
лоты, и фосфаты, и бензойная кислота, меняют свойства поверхности металла, покры
вают металл защитной пленкой и тем самым защищают его от коррозии.
...И ДРУГИЕ ЖИДКОСТИ
Для эксплуатации автомобилей и мотоциклов нужны и многие другие? жид
кости. Как их выбирают и что они собой представляют?
Тормозные жидкости. Их используют для заполнения гидравлической и гидро
пневматической тормозных систем и приводов включения сцеплений. От них. гре
136
пуются возможно меньшее изменение вязкости при изменении температуры, низкая
юмпература застывания (—40° С для умеренного климата и —65° С для севера), дос-
гаточно высокая температура кипения (не менее 11 5° С для барабанных и не менее
1Ч0°С для дисковых тормозов), хорошие смазочные свойства; тормозные
жидкости не должны разрушать металл и резину.
Какие же из жидкостей отвечают этим требованиям? «Нева»-сложная
композиции из гликолей, т. е. высококипящих спиртов с несколькими группами ОН,
антикоррозионных присадок и некоторых других компонентов. Хорошо работает в интервале
тмператур от —50° до +50° С, закипает при 190° С, т. е. пригодна для любых типов
гормозов, растворяется в горячей воде. Окраска светло-желтая. Ядовита!
Жидкость БСК —смесь бутилового спирта (С4Н9ОН) и касторового масла (1:1).
Работает до —20° С, для более низких температур рекомендуют разбавить вдвое
бутиловым или этиловым спиртом. Закипает при 1 1 5° С и поэтому для машин с
дисковыми тормозами не годится. Окраска красная. Нельзя смешивать с «Невой» и дру-
1ими тормозными жидкостями.
Жидкость ГТЖ-22 —смесь воды, гликолей, антикоррозионных присадок. Она
работает в том же диапазоне температур, что и «Нева», но закипает при 140° О и по
этой причине также не годится для дисковых тормозов. ГТЖ-22 зеленого цвета.
Ядовита!
Жидкости для мытья машин. Это, конечно, в первую очередь вода, лучше с
добавкой специальных средств —автошампуней, В эти растворы входят поверх-
ностно-активные вещества и антикоррозионные присадки — ингибиторы коррозии.
Заменять автошампуни обычным стиральным порошком не стоит: в нем не! них
антикоррозионных присадок. В настоящее время существует множество средств,
позволяющих быстро и эффективно очищать не только корпус автомобиля, но и вну1
реннюю обивку, детали двигателя, удалять нагар с головок цилиндров, свечей, клала
нов, поршней без разборки двигателя автомобиля или мотоцикла.
Жидкости для мытья стекол. Это чаще всего вода, а в зимних услови
ях-незамерзающее средство НИИС04 (79% изопропилового спирта
Н3С — СИ — ОН + 0,1% поверхностно-активного вещества сульфанола и Ьсталь
СН3
нее- вода). В зависимости от температуры воздуха применяют смеси этой жидко* ги
с водой в разных соотношениях в зависимости от температуры воздуха.
ИЗ ЧЕГО СДЕЛАН АВТОМОБИЛЬ
В странах с развитым автомобилестроением целые отрасли промышлин
ности производят сотни видов и марок различных материалов для изготовления авто
машин и мотоциклов. Конечно, в этой главе перечислить их все совершенно невоз
можно. Поговорим лишь о важнейших видах материалов, и в первую очередь, е< го
ственно, о металлах. Из них изготовлены главные составные части автомобиля дви
гатель, шасси, кузов.
Деталей из серого чугуна сравнительно немного (маховики, толкатели, распред
вал). Гораздо больше из стали: кузов, поршневые кольца, коленчатый вал, поддон
картера, многие детали трансмиссии, диски колес и т. д. Наиболее ответственные
детали, подвергающиеся повышенным нагрузкам, изготовляют из легированной
стали. Это, например, поршневые пальцы, шатуны, клапаны двигателя. Miioi/i.t в
полости выпускных клапанов помещают металлический натрий (температура плавле
ния 98° С). Расплав металлического натрия позволяет ускорить теплообмен и гем
самым снизить перегрев клапана. Кстати сказать, хорошая теплопроводное!i» и пил
кая температура плавления металлического натрия привели к тому, что он является
основным агентом для съема тепла в промышленных ядерных реакторах на быстрых
нейтронах.
Сплавы алюминия — силумин и другие -очень широко используются при изготов
лении деталей двигателя. Их легкость в сочетании с прочностью позволяет <:ущ<>
ственно уменьшить массу автомобиля или мотоцикла. Поэтому все чаще вместо
чугуна и стали эти сплавы используют для отливки цилиндров и их головок, поршней,
радиаторов, трубопроводов для топлива и др. Пока же для радиаторов широко
используют уже упоминавшуюся латунь.
В автомобилестроение все шире начинают проникать неметаллические мате
риалы. Они легче, чем металлы, их производство связано с меньшими энергетичес
кими затратами, чем производство металлов, они не боятся коррозии.
Значительное, почти в десять раз, увеличение стоимости нефти в 70-е гг., ограни
ченность ресурсов нефтяного сырья, неизбежное постепенное увеличение себестои
I 17
мости горючего стимулировали инженерные разработки по сокращению массы
автомобилей и мотоциклов за счет замены металла полимерными материалами.
В 80-е гг. число полимерных материалов, пришедших на смену металлу, в
автомобилях значительно увеличилось. Это при прежних размерах машин и прежней или даже
большей их комфортности позволило уменьшить массу автомобиля на 200—400 кг и
только за счет этого на 15—20% сократить расход горючего.
Очень перспективным материалом оказался графит —наиболее термически
стойкий из всех материалов, к тому же он обладает способностью резко сокращать
коэффициент трения и является своеобразным самосмазывающимся материалом.
В новых машинах иногда узлы заменяются конструкциями из графита, не требующими
смазки.
Новым конструкционным материалом является углепластик, основа которого —
миги из графитового волокна, значительно более прочные, чем стальные нити.
В экспериментальных моделях автомобилей углепластики применяют даже для
изготовления дисков колес и корпуса двигателей.
Конкурентами углепластиков являются стеклопластики — полимерные материалы,
армированные прочным стекловолокном. Эти волокна выполняют те же функции, что
и стальные прутья арматуры в толще железобетона. Стеклопластику можно придать
любую форму, например форму кузова автомобиля. Легковые автомобили с легким
несминаемым и не боящимся коррозии кузовом из стеклопластика изготовляются во
многих странах.
Все знают, что подушки сиденья автомобиля изготовляются из пористой
пластмассы—пенополиуретана, известного под названием поролона. Разнообразные
полимеры используются при изготовлении корпуса аккумулятора. Наименования этих
материалов проникли даже в условные наименования свинцовых аккумуляторных
батарей. Из пластмасс изготовляют корпус воздушного фильтра и амортизатор
бампера, коробку передач и трубу карданного вала, цилиндры гидроприводов и рулевое
колесо, панель приборов и топливный бак, стеклоочистители и внутреннюю обивку.
Все провода в автомобиле имеют пластиковую или резиновую изоляцию. Чаще всего
для этой цели используют полимеры на базе поливинилхлорида с добавлением плас-
жфикаторов — материалов, придающих полимерной композиции эластичность (чаще
всего дйоктилфталат, в некоторых изделиях —дибутилфталат), а также с добавлением
антиокислителей и красителей. Каждый провод для удобства соединения имеет свою
окраску. Поливинилхлоридные материалы работают в диапазоне температур от
40 до +70°С. Они стойки к действию бензина и смазочных масел.
Важный продукт химической промышленности, имеющий немалое значение для
нормального существования и автомобиля, и мотоцикла,—стекло. Стекла — ответ-
стенные детали машины и предмет неусыпных тревог и забот автолюбителей. К
стеклам предъявляют особые требования.
Первое —это прозрачность. Она зависит от состава стекла, чистоты сырья, из
которого выплавлено стекло и введения специальных добавок —осветлителей,
которые способствуют удалению газовых включений, искажающих прохождение лучей
света. Для габаритных и других фонарей нужны прозрачные цветные стекла. Для
этого в сырье добавляют пигменты. Так, например, сульфид кадмия CdS придает
стеклу желтую окраску, а серый селен — красную или рубиновую.
I38
Второе важное качество стекла — прочность. Этого удается добиться, если
ввести в шихту перед плавлением добавки, такие, как оксид алюминия, а также при
специальной обработке стекла— закалке, которая предполагает нагрев стекла до
660—670° С и последующее резкое его охлаждение холодным воздухом. При этом
создаются внутренние напряжения, резко увеличивающие прочность стекла. Такое
■
стекло выдерживает перепады температур до 270° С. Интересно, что при сильном
ударе такое стекло распадается на очень мелкие кусочки, что уменьшает опасность
травм для водителя. Очень заманчиво использование давно разработанного трех
слойного стекла —триплекса, получаемого при склеивании двух листов обычного
силикатного стекла с помощью прозрачного полимерного клея или с помощью поли
мерной пленки, заложенной между двумя слоями стекла. Такое стекло трудно разру
шить, но даже при разрушении по триплексу оегут трещины, а осколки не отвали
ваются.
А
\
Существует и более прочные стекла, например пентаплекс или полиплекс (назп;
ние даны по числу слоев стекла и связующего полимера). Такие стекла использую!
как бронестекла в военной технике.
Автомобилист и мотоциклист должны знать свойства и гарантийный срок службы
материалов, которые заложены в машину, правильно и дифференцированно ухажи
вать за деталями и конструкциями. Большинство наиболее ответственных узлов ашо
-
мобиля и мотоцикла изготовлено из металла. Наибольшую опасность для металлов
представляет коррозия. Как от нее избавиться и как ее предотвратить?
ЗАЩИТА ОТ ХОЛОДНОГО ПОЖАРА
чень неприятно, когда течет радиатор, когда машина обращаок л и
■
решето, когда начинают крошиться детали двигателя, когда совершенно неожиданно
отказывают тормоза. Очень часто бывает виной $сему этому коррозия.
авайте вспомним, что же это такое — коррозия металлов. Если поместить KVC0
чек стали в воду, то ионы металла покидают этот кусочек и уходят в раствор. Однако
в. металле появляется избыток электронов, который и препятствует уходу в рас тор
новых ионов:
-
Fe ~> Fe+2 +
Так устанавливается равновесие. Разность потенциалов, отвечающая ему, зави
сит от природы металла. Приведенную к стандартным условиям эту величину имо
нуют нормальным электродным потенциалом. В любом учебнике или справочник» •
можно найти ряды нормальных потенциалов.
Ситуация меняется, если соединить два металла, имеющих различные нормаль
ные потенциалы, например цинк и медь, медь и железо. В этом случае избыток алел
тронов от более отрицательного элемента по металлическому проводнику нопро
рывно перекочевывает к положительному. Равновесие нарушается, и идет растпоро
ние более отрицательного металла, например цинка. Так развивается электрохими
ческая коррозия. В металле, если он химически неоднороден, под пленкой воды идуг
-
электрохимические процессы, ведущие к появлению язв, трещин, к уменьшению
-
еханической прочности и разрушению металла.
Скорость коррозии растет, если металл испытывает механические напряжения,
ъ*
если на него воздействуют твердые частицы, если металл нагревается и охлаждается,
w
если он неровен, если в краске, покрывающей его, имеются трещины и если он
покрыт грязью. Запыленный или загрязненный металл подвергается гораздо более
интенсивной коррозии, даже если он химически однороден. Попробуем понять, в чем
же здесь дело.
Вот на днище автомобиля или на крыло мотоцикла попал комочек грязи. На
металле существует тонкая пленка воды. В этой воде растворяется кислород. Где его
концентрация окажется больше —на поверхности пленки воды или в воде под кусоч-
ком грязи? Правильно, под кусочком грязи кислорода меньше. Однако растворен-
w
мы и в воде кислород химически активен, и он начинает заоирать электроны
металла:
2 + 2Н20 + 4е~ = 40
Там, где отнято больше электронов, в металле возникает их дефицит. Именно
сюда и перекочевывают избыточные электроны из-под комочка грязи. Но это
означает, что там нарушается равновесие, ионы под комочком начинают переходить
раствор, lenepb именно здесь и развивается коррозия.
Сказанное приводит к двум важным выводам: во-первых, машину надо держать в
чистоте, а во-вторых, кузов машины должен оыть хорошо защищен.
Как защищают машину от коррозии при изготовлении» При изготовлении
W
металлического кузова автомашины проводится последовательно ряд операции для
защиты от коррозии. ! 1ервая из них — фосфатирование металла, т. е. нанесение
защитной пленки фосфатов железа и марганца на поверхность стального листа. Для этого
w
сталь тщательно очищают от загрязнении, оораоатывают для ооезжиривания органи
ческими растворителями, промывают, опускают на полчаса в ванну с
раствором фосфорной кислоты, ортофосфата натрия и других солеи, а потом смы-
вают с кузова остатки реагентов и сушат в термостате. После этого кузов грунтуют.
Чтбы слой грунтовки был возможно более равномерным, используют грунтование в
электростатическом поле. И наконец, снаружи корпус машины покрывают цветным
лаком. Покрытие корпуса автомашины выполняет не только декоративную роль— это
■
лащита металла от коррозии и экономия энергии, так как при быстром движении
W Ъ**
автомашины или мотоцикла на гладкой лакированной поверхности корпуса не возни-
■
кают микровихри, тормозящие автомашину и приводящие к дополнительному
перерасходу бензина. И наконец, к гладкой лакированной поверхности меньше, чем к
шероховатой, пристает грязь, да и смыть ее легче.
Однако слой краски довольно быстро повреждается... Ржавление начинается на
месте любой царапины, когда обнажается поверхность металла, а затем коррозия
распространяется с поврежденного участка и далее, под слой лака. Поэтому надо
оперативно бороться даже с небольшими повреждениями. И естественно, что п|
любом механическом повреждении автомобиля или мотоцикла надо красить маши
защищать ее от коррозии.
■
Живопись на нузове. О культуре водителя говорит внешний вид машины. Если
s/
на ее крыльях вмятины и царапины, если краска не отражает солнечных лучей, если
иод слоем лака «опухоли» и «язвы», водитель не любит машину. А мотоцикл и автомо-
оиль надо любить.
IЛ о
Итак, вы выровнили вмятины и исправили выпуклости на вашем мотоцикле. Пори
приступать к окраске. Но самое важное и грудное -подготовить к окраске попорх
ности, очистить место покраски от всех загрязнений, сиять сгарую краску. С малых
участков можно снять скребками, крупнозернистой шкуркой. Мо удаление старой
краски можно облегчить и специальными химическими приемами. Ее можно смочим.,
например, 25—30%-ным раствором каустической соды (NaOM). Сода омыляе! слож
ные эфиры, входящие в состав покрытия, и через 10 -12 ч размягченный слой краски
смойте горячей водой. Удобно пользоваться пастой, состоящей из V6% соды, П3%
негашеной извести, 10% нефти или мазуга, 22%, порошка мела и остальное поди
Через два часа после нанесения пасты на сгарую краску ее смывают водой. Можно
пользоваться смесью 50% бензола, 40% ацетона* и 10% парафина. Разрыхленную
краску снимают скребками. Отслаивающуюся краску или краску, на которой видна
сетка мелких трещин, необходимо удалять. Небольшую же царапину на «здоровой1
краске достаточно зашкурить.
* Очищенную поверхность покрывают грунтом -предпочтительно на основе глифш
левых смол по новой номенклатуре: ГФ-020. Грунг'хорошо сцепляется с металлом и
защищает его от коррозии-. Он создает падежную основу .для последующего иалош<
ния слоя краски.
Грунт наносят краскораспылителем или кистью,"а затем сушат. Сушка длится пол
часа при прогреве до 110 -130° С с помощью рефлектора либо 1,5 2 суi при ком
нагнои темп о <) ату})«),
Чтобы окончательно сгладить неровности, загрунтованный слой шпаклюют. II Inn
клевка изготовляется из мела, охры или сурика, затертых на разных лаках. Имейте и
виду: шпаклевка не защищает от коррозии. Ьолее тою, толстый слой шпаклевки да/ко
опасен: он легко растрескивается, нарушая прочность всего покрытия. Поэтому гол
щина слоя шпаклевки должна быть не больше 0,1 мм. Глубокие повреждения шпл
клевкой не заделаешь! После нанесения шпаклевки ее сушат около \\)i'x часов,
потом шлифуют водостойкой шкуркой, смачивая водой. На чистую шлифованную
поверхность краску наносят краскораспылителем или мягкой кистью. Небольшие]
поверхности можно окрасить и с помощью обычного пульверизатора. Мотоциклы
можно красить, пользуясь насосом для шин или бытовым пылесосом.
Из набора нитроэмалей, глифталевых и пентафталевых красок .для окраски кузова
предпочтительнее пользоваться глифталевыми красками. Они сохнут медленно, поп
тому их можно наносить мягкой кистью,
Нитроэмали, даже разбавленные растворителями, высыхают очень быстро, и мо
этому их наносят краскораспылителем под большим давлением. Понгафталопып
краски занимают по скорости высыхания промежуточное положение между глифш
лями и нитроэмалями. Для ускорения просушки эмали можно использовать рофдои
гор.
ОБУВЬ АВТОМОБИЛЯ И МОТОЦИКЛА
Как мы уже говорили, только пневматические шины обеспечили плавный
ход автомобиля. Но сначала надо было изобрести резину. А резины не было бы бо.ч
каучука. В 1735 г. французский исследователь Кондамин описал, как индейцы
I l !
Южной Америки многократно покрывают соком тропического растения гевеи
глиняные формы, а потом просушивают сырой каучук над костром. Образовавшийся элас-
1ичный и водонепроницаемый слой отделяли от глины, разбивая формы, и получали
фляги для жидкости. В Англии научились такой сырой каучук растворять в легких
фракциях каменноугольной смолы, получая резиновый, точнее каучуковый, клей.
Этим клеем пропитывали ткани, а чтобы ткань не становилась липкой, ее складывали
в два раза. Чтобы уменьшить липкость ткани, к ней добавляли разные порошки, в том
числе и молотую серу. В 1839 г. Чарлз Гудьир установил, что при нагревании каучука
с серой можно получить твердый материал — резину — сетчатый полимер,
образующийся при сшивании линейных полимеров каучука атомами серы. Этот процесс наз-
вали вулканизацией.
С тех пор как резиновые изделия стали завоевывать мир, их главным
потребителем стал автотранспорт. Резиновые шины были изобретены в 1845—1847 гг.
Р. У. Томпсоном. Кроме шин, в автомобиле еще сотни деталей из резины: манжеты,
прокладки, шланги и т. п. Но все-таки главное —это пневматическая шина колеса,
обеспечивающая быстрый и плавный ход, благодаря тому что она поглощает
небольшие толчки, вызванные мелкими неровностями почвы.
Современные шины подразделяют на камерные и безкамерные. Камерные шины
состоят из покрышки и камеры, а безкамерные имеют герметизирующий слой на
внутренней полости шины, который не пропускает воздух. В грузовом автотранспорте
чаще применяют камерные шины. Безкамерные шины меньше нагреваются при
движении и служат на 10—20% дольше камерных. И покрышка, и безкамерная шина
должны сочетать эластичность, прочность и износоустойчивость. Шины имеют
специальный упрочающий каркас —корд, который раньше изготовлялся из природных
волокон (хлопчатобумажных) и искусственных (целлюлозных), а теперь преимуще-
Ственнр из более прочных синтетических волокон (капрона, лавсана) и даже из
металла (металлокорд). В СНГ наиболее распространен капроновый корд, который
намного прочнее хлопчатобумажного. Наружная часть шины (протектор) изготовлен
ил прочной резины, так как износ протектора определяет срок службы шины. Между
протектором и каркасом по всей окружности покрышки проложена специальная
прослойка резины — подушечный слой (брекер), который защищает каркас от ударов,
получаемых протектором.
Шины быстро разрушаются, если на них попадает смазочное масло или горючее,
гак как эти жидкости растворяют резину. Но самые главные враги резины —это кис-
пород, в особенности озон воздуха. Под их влиянием происходит быстрое старение
шин (резины). На поверхности резины сначала появляются микротрещины, едва
видимо в лупу, а затем они разрастаются и становятся видны невооруженным глазом.
Гакая шина в дорожных условиях быстро разрушается и истирается. Для борьбы со
старением на стадии приготовления резины в исходную смесь вводятся различные
добавки. Эти добавки подобны применяемым для предотвращения старения
бензином и масел, но их требуется больше —0,5—2,5% от массы резины. Прочность резины
на разрыв во много раз увеличивают активные наполнители— так называемые усили-
гели. Это чаще всего мелкодисперсный углерод (технический углерод), или попросту
сажа, получаемая при неполном сгорании нефтяного или коксохимического сырья.
\ 1ередко сажа составляет около 50% от массы шин. Но все-таки главное, без чего не
I A 2
было бы резины,-это каучук. До начала 30-х гг. резину получали преимущественно
на основе натурального каучука. СССР в 1929 г. израсходовал около 50 млн. золо
тых рублей на закупку натурального каучука. Были найдены некоторые отечественные
растения — кок-сагыз и тау-сагыз, из корневищ которого можно было получить каучук.
Их культивировали в южных районах страны. Однако отечественные каучуконосы не
могли обеспечить потребности в натуральном каучуке. Автором первого синтетичен;
кого каучука был профессор С. В. Лебедев. Сырьем для первого синтетического илу
чука стал спирт. С. В. Лебедеву удалось найти катализатор, который одновременно
отщеплял от спирта и воду, и водород, давая газ бутадиен, при полимеризации кою
рого и образовывался каучук:
н н н н
I I ZnO + А1203
н—с—с—н + н— с—с—н *
II II
н он н он
*- н2с=сн—сн=сн2 + 2н2о + н2
Бутадиен
Спирт в то время получали из картофеля или зерна, что было очень невыгодно для
страны, не имевшей в предвоенные годы и в годы войны избытков продовольствия
На выручку пришла химия. В стране был пущен ряд гидролизных заводов, перераба
тывающих в спирт опилки. Одновременно велись большие работы по приготовлению
спирта из нефтяного сырья, а также освоено приготовление этанола из этилена:
Н SOd
н2с = сн2 + н2о -> н3с — сн2—он
Недостатком этой технологии оказалось получение в виде отхода больших коли
честв разбавленной серной кислоты. Тогда был создан более простой способ получе
ния бутадиена непосредственно из бутана путем отщепления водорода.
Бутадиеновый каучук по эластичности и ряду других качеств уступал натуральному
каучуку. В то же время промышленности были нужны новые каучуки со свойствами,
отличающимися от натурального (морозостойкость, устойчивость к бензину и мине
ральным маслам и др.). Исследования привели к созданию нового каучука, обладаю
щего во многом иными свойствами, полученного при взаимодействии бутадиена и
стирола (например, СКС-30 означает синтетический каучук стирольный с содержа
нием в исходном сырье 30% стирола). Но прочность таких каучуков была все же
ниже, чем у натурального каучука. И лишь в 60-е гг. был создан синтетический поли
изопреновый каучук (СКИ-3), который по свойствам практически не отличается oi
натурального каучука. Сырьем для получения этого каучука служит газ изопрен:
Н2С =С — СН= СН2
С Из
149
АВТОМОБИЛЬ И ПРИРОДА
Что поглощает автомобиль? Ответ очевиден: воздух и находящийся в
воздухе водяной пар. Но это далеко не все. Вместе с воздухом автомобиль вдыхает
пыль, находящуюся в воздухе и содержащую все, что угодно: от пылинок цветочной
пыльцы и до производственной пыли, количество которой неуклонно растет. Именно
для защиты от пыли перед карбюратором автомобиля установлен двухступенчатый
фильтр, где на первой ступени воздух фильтруется через нетканое синтетическое
полотно, а на второй— через фильтр из гофрированного картона.
Ну а что автомобиль или мотоцикл выделяет? Во-первых, естественно, азот, аргон
и другие инертные газы непревращенными проходят через двигатель и выходят, унося
с собой значительную часть тепла. Вы помните, что для полного сгорания 1 кг бен-
зина требуется теоретически около 1 5 кг воздуха (примерно 3,5 кг кислорода).
Значит, средний автомобиль, пробегающий за год 10 тыс, км и сжигающий около 10 т
бензина, расходует 35 т кислорода и выбрасывает в атмосферу 160 т выхлопных
i азов.
Теоретически при работе двигателя должны образовываться только оксид
углерода (IV) и вода:
2С8Н18 + 2502 - 16С02 + 18Н20
Как вы знаете, в реальных условиях, а тем более при неотрегулированном двига-
геле не все продукты успевают полностью сгореть. В четырехтактных, а особенно в
дмухтактных двигателях часть углеводородов может оказаться в выхлопных газах.
Даже при достаточном количестве кислорода часть углерода окисляется до оксида
углерода, т. е. до угарного газа (около 3%). В выхлопных газах оказываются и
многочисленные продукты частичного окисления углеводородов. При достижении
максимальных температур горения топлива в двигателе (около 2000° С) незначительная
часть азота воздуха окисляется до оксида азота:
N2 + 02-2NO
Азот, содержащийся в топливе и присадках, обращается в токсичные оксиды.
В итоге в выхлопных газах автомобиля и мотоцикла обнаружено более 200
различных веществ. Многие из них представляют опасность для человека, растений,
животных. Число токсичных веществ, выбрасываемых автомобилями и мотоциклами,
многократно возрастает при работе на форсированных режимах, на обогащенных и
богатых смесях, при недостатке воздуха. Некоторый выигрыш мощности сопровож-
дается многократным (в 7—10 раз) увеличением образования продуктов неполного
сгорания бензина, а также оксида углерода (II).
Наиболее опасен именно этот компонент выхлопных газов. Он не случайно носит
бытовое название угарный газ. Оксид углерода (II) много активнее, чем кислород,
соединяется с гемоглобином крови, блокируя дыхание. Именно в этом состоит
причина гибели многих людей при накоплении выхлопных газов в гаражах и других
помете мтиях. Поэтому ни в коем случае не следует прогревать мотор при закрытых
дверях гаража!
Другая опасность —свинец. Вспомните, что его около 5 г на 10 кг бензина. При
I44
сгорании этилированного бензина 50—75% свинца, находящегося в топливо, выде
ляется вместе с выхлопными газами. Размер частиц солей свинца 1 мк и менее. 11<>э
тому они находятся в атмосфере в виде тончайшей взвеси и свободно проникаю! в
организм человека, оседают на почве и растительности. Примерно половина свинца
концентрируется вблизи шоссейных дорог и оживленных городских улиц. В среднем
за год один автомобиль выделяет 2,5—3,0 кг свинца. В крупных промышленных цен
трах на каждого человека ежегодно приходится 30—50 г мелкодисперсного свинца
Поэтому отказ от этилирования бензина —одна из наиболее важных и актуальных
проблем. Свинец —сильный яд, поражающий практически все системы орга
низма!
Очень токсичны и оксиды азота. Их воздействие на организм человека примерно
в 10 раз сильнее угарного газа. Выбрасываемые с выхлопными газами углеводороды
и продукты их превращения оказывают на человека различное действие. Большая
часть их наркотически действует на центральную нервную систему и раздражае1 ели
зистые оболочки. А полициклические продукты термического превращения компо
нёнтов бензина и масел, такие, например, как бензпирен
стимулируют образование злокачественных опухолей. Они сорбируются на частицах
сажи и пыли и с ними проникают в дыхательные пути человека.
Один легковой автомобиль в среднем за год выбрасывает в атмосферу 800 ш
СО, 40 кг оксидов азота, около 200 кг углеводородов и их производных, несколько
килограммов свинца. Двухтактные двигатели мотоциклов и моторных лодок выделяю!
в несколько раз больше канцерогенов, чем автомобильные двигатели.
Во многих промышленных городах на долю автомобильного транспорта прихо
дится более 70% общего объема вредных выбросов. В зонах интенсивного автомо
бильного движения концентрации токсичных веществ нередко в десятки раз пре
вышают допустимые. И это, не считая тех 5—8 килограмм тонкой резиновой шипи,
которую ежегодно оставляет каждая машина за счет истирания шин при торможении,
и пролитых маслах и антифризах, на десятки лет уничтожающих микрофлору почвы.
Как быть? Отказаться от автомобилей и мотоциклов? Это пока невозможно. Без
резкого ухудшения условий жизни, без нарушения производственных, хозяйственных
связей от них не откажешься.
Значит, надо иначе эксплуатировать действующие и по-новому проектировать
новые автомашины.
Дело в том, что количество выбросов очень сильно зависит от культуры эксплуа
тации автомашины. Если двигатель эксплуатируется небрежно, если вы увлекаетесь
ездой на переобогащенной топливом смеси, долго разгоняете машину на промежу
точных передачах, если неудачно отрегулировано зажигание, то вы не только на
14В
15 40% увеличиваете расход бензина» но и в 6—8 раз повышаете долю токсичных
веществ в выхлопе вашего автомобиля или мотоцикла. Большая часть избыточно
потраченного бензина или масла обращается в токсичные вещества. Техническая
исправность и культура вождения даже без изменения конструкций автомобиля в
состоянии в несколько раз уменьшить выбросы и на 20—30% сократить расход
горючего.
Технические новшества открывают путь к уменьшению экологической опасности
автотранспорта. Одно из главных направлений в модернизации автомобиля —
оснащение его микропроцессорной техникой. Встроенный микропроцессор позволяет
гибко управлять работой автомашины, осуществляя ее движение в оптимальном
режиме с минимальным расходом бензина и минимальными вредными выбросами.
Ученые разрабатывают специальные насадки на выхлопные трубы, в которых на
поверхности катализаторов дожигаются оксид углерода и углеводороды. Это
уменьшает содержание в выхлопных газах СО на 70—95%, а углеводородов — на 50—80%.
Пока, к сожалению, их применение очень ограничено: дороги катализаторы,
основывающиеся на применении драгоценных металлов — платины и палладия; катализаторы
быстро выходят из строя (под действием свинца) и поэтому непригодны там, где
используется этилированный бензин.
Разрабатываются иные конструкции двигателей, которые в принципе могли бы
быть экологически более чистыми, но они пока очень далеки от широкого
использования.
В этом отношении интересен электрический двигатель. Однако трудно ожидать
быстрого появления массового электромобиля в настоящее время. Дело в том, что
нет пока достаточно легких и доступных аккумуляторов. Наиболее реальные свинцо-
во-кислотные аккумуляторы намного уступают бензину по энергоемкости. У бензина
она 11 кВт/ч на 1 кг, а у аккумуляторов 0,022—0,033, т. е. в 300 раз меньше.
Электромобиль с батареями массой не менее 250—300 кг может пройти до перезарядки,
которая длится 3—4 ч (60—80 км со скоростью 40—60 км/ч, а обычный автомобиль с
заправкой 30—40 кг бензина проходит 400—500 км со скоростью 80—100 км/ч).
Это сводит до минимума такие преимущества электромобиля, как отсутствие
выбросов, малая огнеопасность и бесшумность. К тому же надо учесть и новые
экологические проблемы, возникающие при массовом использовании электромобиля:
потребление больших количеств свинца и серной кислоты. Поэтому в ближайшие
десятилетия появление массового электромобиля не произойдет. В XXI в. человечество
войдет с автомобилями и мотоциклами, подобными современным, и решить
экологические проблемы удастся в основном за счет коренного повышения культуры обслу-
живания и эксплуатации этих испытанных машин.
Не стоит мыть автомобиль водой с содой: потускнеет лак.
Легковой автомобиль расходует кислорода в 45—60 раз больше, чем
его водитель.
146
Прежде чем покрасить металлическую поверхность, смочи к; ее
раствором уксусной кислоты и высушите. После этого краска лучше при
станет и будет прочнее держаться.
Скорая помощь при появлении течи радиатора водяного охлаждения;
засыпьте в радиатор несколько ложек сухой горчицы, она образует коп
лоидный раствор, который заполнит отверстие.
Эпоксидным клеем на определенное время можно восстановить сор
ванную резьбу у болта. Для этого очищенный болт покрывают слоем клея,
затем тонким слоем какой-нибудь смазки, ввертывают болт в гайку и
дают затвердеть.
Днище автомашины покрывают специальной мастикой, способной не
только сопротивляться коррозии, но и выдерживать удары камней, петя
щих из-под колес. Каучуковые мастики лучше противостоят износу, но
хуже защищают от коррозии. Мастики на основе битума — наоборог. Они
дешевле и доступнее.
Через 25-35 тыс. км пробега масло в картере надо сменим, из за
окисления и накопления осадков. Лучше сливать горячее масло. Затем
желательно промыть всю систему смазки рекомендованным специаль
ным промывочным маслом. Нельзя промывать систему смазки кероси
ном, бензином или маслом, разбавленным.растворителями. Дело в тм,
чтЪ на внутренних поверхностях двигателя образуется пленка высших
парафинов и смолистых веществ. Бензин их разрыхляет, но не раство
ряет. Если после промывки бензином залить в систему свежее'маоло,
эти отложения отрываются от стенок и могут забить фильтры, трубки,
отложиться в подшипниках, вывести систему смазки из строя.
В 1983 г. в стране в эксплуатации находилось около одиннадцати мин
лионов личных легковых автомобилей. В среднем автолюбитель наезжае1
в год около 11 тыс. км и сжигает около полутора тонн бензина.
Один из способов удаления нагара: чистый нафталин всыпать в непол
ный бензобак и выехать на шоссе. Когда бензин в баке будет на исходе,
I47
нагара в двигателе не останется. Это мероприятие стоит проводить не
чаще чем через 15—20 тыс, км пробега.
Злейший враг кузова автомашины— хлориды, в том числе и наиболее
часто встречающийся — поваренная соль NaCI. Ионы СГ —как бы
встраиваются в защитную пленку оксидов, покрывающую поверхность металлов,
делают ее проницаемой для агрессивных агентов. Скорость коррозии в
присутствии хлоридов возрастает в десятки раз. Поэтому не заливайте в
радиатор солоноватую воду и не увлекайтесь поездками по городу в зим
нее время, когда улицы посыпают песком, в который добавлена соль.
Влага попадает на поверхность кузова и в результате конденсации при
перепадах температур. Чем больше перепады, тем больше конденсация и
тем сильнее коррозия.
Что читать
1. Полл ер 3. Химия на пути в третье тысячелетие.—М.: Мир, 1982.
2. Юдин A.M., СучковВ. Н., К о р о ст ел и н Ю. А. Химия для вас—М.: Химия,
1987.
3. Химия нашими глазами/Под ред. Я. И. Герасимова.—М.:Просвещение, 1981.
4. Эль штейн Н.В. Диалог о медицине.—Таллинн: Знание, 1983,
5. Каспаров Г. Н. Основы производства парфюмерии и косметики.-2-е изд.,
пер. и доп.—М.: Агропромиздат, 1988.
6. Яременко О. В. С автомобилем на «ты».—М.: ДОСААФ, 1985.
7. Бекман В. В. Гоночные мотоциклы.—Л.: Машиностроение, 1983.
8 Чиня ев В. Г. Устройство и техническое обслуживание мотоциклов. М.
ДОСААФ, 1982.
9. Ш е сто п а л о в К. С, Ч и н я е в В. Г. Устройство и эксплуатация автомобиля.
М.: ДОСААФ, 1974.
10. М а л о в Р. В., Е р о х о в В. И., Щ е т и н а В. А. и др. Автомобильный транспор! и
защита окружающей среды.—М.: Транспорт, 1982.
11. Ер охо в В. И. Экономичная эксплуатация автомобиля.—М.: ДОСААФ, 1986.
12. Ольги н О. М. Опыты без взрывов.—2-е изд.—М.: Химия, 1986.
ВМЕСТО ЗАКЛЮЧЕНИЯ
Итак, человек сталкивается с химией на каждом шагу: в кухне и
столовой, при ремонте квартиры и стирке белья, умывая руки и работая в саду,
в аптеке и в автомобиле. Наша жизнь, наше здоровье, наше настроение
тесно связаны с бесчисленными химическими процессами вокруг нас и в
нас самих.
Прогресс, развитие человеческого общества сопровождаются все
более широким использованием новых материалов, новыми химическими
процессами. Но, к сожалению, очень многие плохо представляют себе
особенности химических превращений различных веществ и материалов,
их свойства, их воздействия на людей. А все неизвестное пугает. К тому
же, по неграмотности, можно неправильно использовать новые изделия,
новые вещества. Неправильный выбор лекарства ухудшает здоровье.
Неудачный подбор смазочного масла выводит из строя автомобиль.
Неудачное сочетание удобрений и ядохимикатов может сделать бесплодным
садовый участок, а если какие-то плоды и удастся вырастить, то они могут
оказаться опасными для здоровья, а то и жизни людей. Все это создает
мифы о крайней опасности химии и необходимости избавляться от
лекарств или иных синтетических продуктов, о том, что пользоваться
удобрениями и ядохимикатами недопустимо и что ими во всем мире уже
не пользуются, и т. п.
Да, химия дает в руки человеческие огромные силы, но этими силами
надо правильно и грамотно пользоваться.
В самом деле, было бы нелепо отказываться от пользования огнем по
той причине, что только в нашей стране ежедневно погибает во время
пожаров до тридцати человек, а ежедневный ущерб превышает миллион
рублей. Без огня мы просто не стали бы людьми, но огонь не терпит
небрежного к нему отношения.
Человечество, население развитых стран вступило в новую, третью
стадию научно-технической революции, которая обозначает в первую
очередь несравненно большие темпы научно-технического прогресса при
малых затратах природных ресурсов, затем — высокую осторожность во
150
взаимоотношениях с природой. Реализация этих двух условий возможна
только при широком применении химии во всех сферах деятельности
человека. И вот именно поэтому самой главной чертой этой стадии науч
но-технического прогресса становится увеличение роли каждого отдель
ного человека, его грамотности, его ответственности, всестороннего
понимания сущности химических процессов. От ошибок может быть
избавлен только тот, кто хорошо понимает, почему могут быть ошибки и
как их можно избежать.
Здоровье и долголетие —в руках каждого человека. Если каждый раз
бирается в сущности многочисленных химических и биохимических про
цессов, протекающих в его организме, то он может сознательно выбирать
образ жизни и систему питания, оптимальные для себя. Не случайно во
всех развитых странах на коробках и банках с продуктами питания мри
водят подробную информацию о составе каждого продукта, о соотноше
нии основных компонентов, о содержании каждого вида микропримесои
Это открывает путь к осознанному подбору оптимального рациона пита
ния.
Хотелось бы пожелать вам, дорогие читатели, успешно развивать спои
химические познания, и в особенности приучить себя пользоваться ими
практически, в любой ситуации суметь объяснить направления всех пол
можных процессов и выбрать нужный и лучший в этих условиях материал,
самое верное, самое правильное с позиции экологии, техники беэопас
ности и химии решение. Мы надеемся, что в этом вам noMoiyi и
сведения, изложенные во всех основных главах, и дополнительная инфор
мация, приведенная в завершающем разделе книжки, и, конечно, сведе
ния, которые вы извлечете из рекомендуемой дополнительной литера
туры.
ТУТТИ ФРУТТИ, ИЛИ ВСЯКАЯ ВСЯЧИНА
Как правильно принимать лекарства?
Знаете ли вы, как правильно принимать лекарства? Социологические
опросы больных приводят иной раз к неожиданным выводам. Так, лини.
18% из них достаточно представляют, что такое лекарства, которыми их
лечат, примерно половина понимает инструкцию о приеме лекарств, а 01
38 до 50% забывают принимать лекарство вовремя, так как считаю! это
обстоятельство не очень важным.
Почему, например, лекарства в желатиновых капсулах рекомендую!
принимать стоя или, на худой конец, сидя, но обязательно при этом запи
вая водой? Оказывается, что при нарушении этого требования каждая
четвертая, а то и каждая третья капсула приклеивается к стенке нище
вода и может оказаться причиной возникновения язвы.
Чем запивать лекарства? Может быть, молоком? В самом
деле, молоко обладает смягчающим действием, оно нейтрализует
соляную кислоту желудочного сока, которая постоянно
раздражает стенки желудка. Это хорошо, если принимаешь аспирин—
ацетилсалициловую кислоту. Стоит ли запивать молоком тетрациклин, который
также может раздражать стенки желудка? Увы, тетрациклин связывается
с кальцием, содержащимся в молоке, и в такой форме плохо
всасывается в кровь. В три-четыре раза снижается при этом эффективность
лечения.
Можно ли запивать лекарства чаем? В чае содержится таннин —
вещество, придающее своеобразное вяжущее действие крепким настоям
чая и оставляющее коричневую пленку на дне и стенках заварного
чайника. С азотсодержащими лекарствами он образует нерастворимые тан-
наты, которые не всасываются в кровь. А очень многие лекарства, как вы
знаете, содержат азот —это папаверин и кофеин, кодеин и амидопирин,
анальгин и эуфиллин, и многие другие. Поэтому-то лучше запивать
лекарства теплой кипяченой водой.
Почему одни лекарства рекомендуют принимать до, а другие
после еды? Многое зависит от взаимодействия лекарств с желудочным
соком.
Так, например, соляная кислота —важный компонент желудочного
сока —переводит сульфаниламиды (например, сульфадиметоксин,
сульфадимезин) в легкоусвояемые соли— хлоргидраты. В полном желудке
кислота «занята» перевариванием пищи, и это задерживает образование
хлоргидратов. К тому же частицы лекарства могут быть закрыты пленкой
продуктов превращения пищи. И поэтому эти препараты лучше принимать
через один-два часа после еды, когда пищи уже нет, а желудочный сок
еще выделяется.
Уротропин — гексаметилентетрамин — хорошее обеззараживающее
средство, применяемое, в частности, при заболеваниях почек,
мочевого пузыря. Однако под действием соляной кислоты он распадается
на аммиак и формалин, и поэтому важно, чтобы это произошло именно
в воспаленном органе, кислотность в котором обычно повышена.
Именно там и нужны аммиак и формалин. Если принять уротропин
во время еды или через некоторое время после еды, то он
распадается полностью в желудке. При этом, во-первых, лекарство не
попадет в больной орган, а, во-вторых, слизистая оболочка желудка
окажется обожженной либо аммиаком, либо фенолом. Поэтому-то
уротропин следует принимать за 30—40 мин до еды, когда кислоты в желудке
нет.
А вот для всасывания большинства витаминов нужна желчь. А она
выделяется в кишечник только после еды. Естественно, что тогда же
следует принимать витамины.
Химия и картофель
Картофель состоит, в основном, из крахмала и других углеводных си
стем. Содержит он и белковые вещества, и некоторое количество вита
минов, и различные ферменты, необходимые для жизнедеятельности кар
тофеля. Когда мы перерабатываем и едим картофель, нам надо учесть
сложные превращения этих компонентов.
Как лучше варить картофель? Чаще всего очищенный картофель зали
вают холодной водой, доводят до кипения и некоторое время варят. Но
пока картофель нагревается в воде, ферменты продолжают свою работу,
она даже ускоряется, до тех пор пока при 60—70°С не разрушаются сами
ферменты. При этом фермент с экзотическим наименованием «аскорба
токсидаза» разрушает, окисляет винамин С, а ферменты «амилазы» пре
вращают крахмал в сахар, который уходит в отвар. Если же картофель
положить прямо в кипяток, то ферменты мгновенно разрушаются, а
потери полезных веществ уменьшаются в два раза.
Можно ли варить картофель в кожуре, или, как говорят, в «мундире»?
Это не такой простой вопрос. С одной стороны, картофель, сваренный в
мундире, несравненно лучше сохраняет полезные питательные вещества
и минеральные соли, особенно соли калия. 14—15% питательных веществ
теряются, если варить очищенный картофель, и всего 0,1—0,2%, если
варить его в кожуре. Однако если картофель выращен в не самых эколо
гически хороших условиях, то варить его в кожуре может быть и опасно
Каждому из вас приходилось видеть клубни с зеленым боком. Как пра
вило, это клубни, почему-либо оказавшиеся на поверхности земли. В них
содержится ядовитый глюкозид — соланин. Из очищенного картофеля он В
значительной степени уходит в отвар, а кожура сохраняет его в клубнях
Из очищенного картофеля уходят в отвар почти полностью нитрат и
большая часть ядохимикатов —пестицидов.
Почему картофель темнеет на воздухе? Понятно, что речь идет об очи
щенных клубнях. Дело в том, что в картофеле содержится аминокислота
тирозин и некоторые другие легко окисляющиеся вещества. Под дои
ствием ферментов и воздуха они окисляются, а продукты окисления поли
меризуются, образуя очень стабильные темноокрашенные меланины,
которые для питания никакой ценности не представляют. Как с ними
бороться, с этими ферментами? В промышленности, при приготовлении
различных полуфабрикатов из картофеля, его специально обрабатываю!
сернистым газом, который дезактивирует ферменты. А в домашних уело
виях проще всего изолировать клубень от воздуха, погрузив его в поду
И, если уж ваша задача добиться, чтобы картофель совершенно не менял
окраски, лучше в кипяченую —в ней меньше кислорода, чем в сырой
воде.
Почему сырой картофель твердый, а вареный —мягкий?
' Как вы, конечно, знаете, клетки овощей покрыты оболочкой из целлю
лозы, гемицеллюлоз, пектиновых и других веществ. А они, в свою оче
1Й Э
редь, соединены мостиками из так называемого протопектина и белка —
экстенсина. Протопектин в воде не растворяется и надежно
цементирует группы клеток. Между собой его молекулы соединяются солевыми
мостиками из ионов кальция и магния. При нагревании в мостики из
протопектина проникают ионы натрия и калия. Они замещают,
вытесняют двухвалентные ионы кальция и магния. Солевые мостики
разрушаются. Протопектин превращается в растворимый пектин. В
результате значительно ослабевают связи между клетками, а механическая
прочность вареного картофеля оказывается в 25 раз меньше, чем у
сырого.
Почему вкусное пюре надо делать из горячего картофеля?
В клетках сырого картофеля крахмал находится в виде зерен. А если
клубни сварить, крахмал поглощает воду, набухает, превращается в
вязкий клейстер. Но у горячего картофеля клетки остаются целыми, клейстер
остается внутри оболочек и пюре получается пышным и аппетитным.
А вот если картофель остыл, пектин склеивает клетки, при протирании их
оболочки рвутся, клейстер вытекает, а пюре получается вязким, клейким
и невкусным.
Почему пахнет чеснок?
Вы, наверное, обращали внимание, что целый зубок чеснока не пахнет,
но достаточно разрезать его, как острый чесночный запах наполняет
комнату. Более того, содержащийся в чесноке и виновный в его пахучести
аллиин совершенно лишен запаха. Дело в том, что аромат чеснока
появляется из-за распада аллиина под действием особого фермента —аллиин-
лазы. В целом зубке вещество и фермент расположены в разных местах и
поэтому превращения не происходит. Но достаточно разрушить зубок и
скромный аллиин превращается в интенсивно пахнущий аллицин. Но
аллицином дело не кончается. Он также неустойчив и обращается в
относительно простое, очень устойчивое и на редкость душистое вещество —
диаллилдисульфид.
Чеснок очень полезен. Пожевав несколько минут дольку чеснока, вы
избавляетесь от всех бактерий, поселившихся во рту; вещества,
выделяющиеся из чеснока, вредоносны для самых разных микробов, чеснок
возбуждает аппетит, улучшает пищеварение, способствует отделению желчи,
расширяет сосуды, избавляет от головных болей и бессонницы. Недаром
в одном шутливом стихотворении дается такой рецепт диеты,
продляющей молодость и укрепляющей здоровье:
...Пейте мед, свекольный сок,
Налегайте на чеснок.
Да, чеснок при каждом блюде,
Пусть шарахаются люди,
Этим можно пренебречь,
Чтоб здоровие сберечь.
Но, оказывается, можно сделать так, чтобы люди не шарахались. Для
этого достаточно пожевать кусочек свежего корня петрушки или ее
зелень, или квашеную капусту.
ЗАЧЕМ НУЖЕН НАМ ВИТАМИН А?
итамин А обеспечивает рост людей, нормальное состояние кожи и
слизистой оболочки. А особенно зависит от витамина А наше зрение. Он
входит в состав светочувствительного вещества сетчатки глаз. И поэтому
осооенно заметным первым признаком нехватки в организме этого вит
мина оказывается нарушение зрения в сумерках —так называемая «кури-
ная слепота». Чуть стемнело и при нехватке этого витамина человек
теряет ориентировку, нечетко видит предметы, замедленно реагирует на
окружающее. Особенно опасна куриная слепота для водителей
транспорта, работающих в вечернее и ночное время. У детей недостаточное
количество витамина А приводит к отставанию в росте. 1,5 мг витамина Л
в день —такова потребность взрослого человека. Больше всего витамина
А в печени рыб и животных. 7 г рыбьего жира, или 10 г говяжей печени,
или 3 яйца содержат суточную дозу витамина А. Потребности людей п
этом витамине ооеспечивает желтое красящее вещество, содержащееся
во многих овощах и фруктах и называемое каротин. Действие его подобие
витамину А и называют его часто провитамином А. Больше всего каре
4J
тина в красной моркови и красном перце, а также в щавеле и зеленом
—
луке.
очему печь хлеб лучше из низкосортной муки?
Лет сто назад в японском флоте столкнулись со странной болезные.
Люди ощущали покалывания в конечностях, затем участки кожи юрнли
чувствительность, моряки начинали хромать, возникала мышечная ела
бость, болело сердце. Странная болезнь получила название «бери бери»,
что значило —ножные оковы, кандалы. Питание было достаточно обиль
ным, не были найдены и микроорганизмы. Как ни удивительно — болезнь
оказалась результатом... повышенной заботы о моряках. Для питания
на корабли поставлялся высокосортный шлифованный рис, освобожден
ный от наружной части зерна, от отрубей. Но именно в отрубях и
содержалось таинственное вещество, отсутствие которого привело
к этой странной эпидемии. Сегодня его называют —витамин В\,
В природе он содержится в дрожжах, зародышах и оболочках зорен
пшеницы, овса, гречихи, а также в хлебе, приготовленном из муки
■
простого помола. Пользуются и синтетическими препаратами (тиамин-
хлорид или тиаминбромид, которые соответствуют природному вша-
мину В-\). Действие витамина В^ поистине универсально. Это не
только препарат, предупреждающий неприятности, неизбежные при
IS!»
недостатке витамина в организме, но и средство, облегчающее лечение
различных невритов и невралгий, заболеваний кишечника и печени,
спазмов кровеносных сосудов, нарушений работы сердца и многих других
заболеваний.
1,5—2,0 мг витамина В^ требуется человеку в сутки. Потребность
в нем возрастает при напряженной умственной и физической
деятельности.
Сколько соли нужно человеку?
Ионы натрия, калия и хлора поддерживают неизменным
солевой состав крови и осмотическое давление, от которого в
значительной мере зависит количество воды, удерживаемое в крови и
тканях.
Именно эти соли обеспечивают необходимую электропроводность в
тканях нашего тела. Ведь многие системы управления в нашем
организме, как и в организме любых живых существ, а особенно в нервной
системе, носят электрохимический характер. Отдельные минеральные
соли по разному влияют на способность белков связывать воду. Эту
способность усиливают ионы натрия, а ионы калия и кальция
уменьшают. У здорового человека нервная и гормональная системы управляют
водно-солевым обменом. При этом количество солей, поступающих с
пищей, точно уравновешивается количеством солей, выделяемых из
организма. 10—15 г поваренной соли —хлорида натрия—требуется
человеку ежедневно. Из этого количества 3—5 г соли приходит с
натуральными пищевыми продуктами, 3—5 г соли содержится в ежедневно
съедаемом хлебе, еще 3—5 г соли применяется для приготовления
пищи, и, наконец, некоторое количество соли мы добавляем, подсаливая
еду.
Что будет, если соли выводится из организма больше, чем поступает?
Начинается обезвоживание организма, нарушаются нервные процессы,
судорожно сокращаются мускулы. Эти процессы возможны, если в
жаркое время при больших физических нагрузках много соли уходит с потом
и мочой. В этом случае необходимо добавлять в пищу или питье соль.
Чувство изнуряющей жажды, возникающее в жару и при перегрузках,—
это прежде всего реакция организма на потерю соли. Поэтому-то в
горячих цехах персонал пьет специально подсоленную газированную
воду.
Однако опасна и избыточная соль. Избыток соли приводит к
повышению артериального давления. Люди, привыкшие с детства есть
соленую пищу, обречены на гипертонию в зрелом возрасте. Поэтому-то в
развитых странах обращают внимание родителей на то, чтобы их дети
привыкали с самых ранних лет обходиться минимально возможным
количеством соли.
Избыточную соль надо выводить из организма. Для этого через почки
прокачивается огромное количество крови. В почках кровь осво
бождается от этой соли, которая выводится из организма с мочой
Чем больше соли нужно вывести, тем сильнее нагружены сердце
и почки, тем интенсивнее их износ, тем раньше человек заболе
вает.
Больное сердце не в состоянии прокачивать через почки необходи
мое количество крови, и соли задерживаются в организме. Особенно
опасны, естественно, соли натрия, так как они вызывают накопление в
организме воды. Появляются отеки, начиная с легкой отечности hoi и
лица и кончая массивной водянкой в полости живота. На сердце ложи юн
еще большая нагрузка, и врачи в этом случае решительно прибегаю! и
бессолевой диете.
ОГЛАВЛЕНИЕ
Предисловие 3
Глава 1. Химия пищи 5
Жиры 7
Углеводы 16
Белки 19
Соли в пище 24
Глава 2. Химик строит дом и ремонтирует квартиру 27
Цемент, известь . 28
Почему клей клеит? 31
«...для наружных и внутренних работ» 35
Глава 3. Химия в саду и огороде 39
О минеральных удобрениях 43
Химические средства защиты растений 48
Глава 4. Моющие средства в быту 51
Из истории моющих средств 52
Чем и как стирать, белить, крахмалить? 54
Химия в стиральной машине 57
Глава 5. CMC помогают наводить порядок 65
Что такое абразив? 66
Безабразивные чистящие средства 69
Что такое накипь и как ее удаляют 70
Глава 6. Химия и косметика 73
Носители запаха 74
Волшебные превращения причесон 78
Пудры и аэрозоли . 81
Глава 7. Химия и здоровье 83
Экскурсия по аптечке 84
Допустимо ли самолечение? 94
Химия и техника безопасности в вашем доме 95
Берегите детей! 96
i ни в a 8. Химия —помощник туриста 99
Нин получают водонепроницаемую ткань 100
М<»( уда туриста
Химии вокруг костра 102
Кимия на страже здоровья туриста 106
Как подать сигнал друг другу с помощью химии 106
I пава 9. Химия и автомобиль 111
IK много истории 112
Чом питается двигатель I I '1
Смазочные масла и двигатель 122
Мшоворим о присадках 126
Химический источник-тока 130
Двигатель надо охлаждать . 132
И другие жидкости li'>
Из чего сделан автомобиль 137
Защита от холодного пожара 139
< )бувь автомобиля и мотоцикла Ml
Лшомобиль и природа 144
Что читать (49
Вместо заключения 1!>о
Учебное издание
Харлампович Георгий Дмитриевич
Семенов Александр Семенович
Попов Владимир Афанасьевич
МНОГОЛИКАЯ ХИМИЯ
Зав. реданцией А. И, Соколов
Редакторы 3. В. Лариина, А. Н. Соколов
Младший редактор Т. Н. Нлюева
Художник А. М. Орлов
Художественный редактор И, В. Иороткова
Технический редактор Е. С. Юрова
Корректор М. Ю. Сергеева
ИБ № 12509
Сдано в набор 20.02.90. Подписано к печати 04.03.92. Формат 70X90'/ib- Бум.
офсетная № 2. Гарнитура Акцент Гротеск. Печать офсетная. Усл. печ. л. 11,7 +
+0,59 вкл.+0,37 форз. Усл. кр.-отт. 27,35. Уч.-изд. л. 11,40+0,60 вкл.+0,48 форз.
Тираж 45 000 экз. Заказ 1499
Ордена Трудового Красного Знамени издательство «Просвещение»
Министерства печати и информации Российской Федерации. 127521, Москва, 3-й проезд
Марьиной рощи, 41.
Отпечатано с диапозитивов Ордена Трудового Красного Знамени ПО «Детская
книга» Мининформпечати Российской Федерации, 127018, Москва, Сущевский
вал, 49, на Тверском ордена Трудового Красного Знамени полиграфкомбинате
детской литературы им. 50-летия СССР Министерства печати и информации
Российской Федерации. 170040, Тверь, проспект 50-летия Октября, 46.
&
МОСКОВСКОЕ ОБЩЕСТВО АГРОНОМОВ-СЕЛЕКЦИОНЕРОВ
предлагает к продаже для возделывания в любых климатиче
ских условиях семена овощных, цветочно-декоративных и лекар
ственных растений, а также (в ограниченном количестве) уникаль
ные саженцы суперморозостойкого винограда и смородинового
дерева.
Коллекция семян насчитывает свыше 100 сортов томатоп, а
также огурцы, перец, капусту, астры, мелиссу лекарственную и
другие растения. После сортоиспытания овощеводам и дачникам
предлагается от 40 до 60 сортов.
Вся продукция проходит тщательный отбор и проверку на всхо
жесть.
С набором семян общество высылает краткое описание техно
логии выращивания предлагаемых культур. Кроме того, вы можем с
заказать дополнительную литературу по обустройству садового
участка, выращиванию овощей в районах Крайнего Севера,
Сибири и Дальнего Востока, выращиванию грибов, а также хране
нию и переработке плодов и овощей в домашних условиях.
Заявки на приобретение продукции направляйте по адресу:
121357, Москва, МО АС, А. Д. Норневу.
Для получения информации высылайте, пожалуйста, конверт с
вашим обратным адресом.
V
**<*»
К( > 1 I I 'РОЛМП 111 Ч!П |( )|(
( |>( )Kl 111 !И I'M A
Kill II Л .ч- - i I I Mil)
i:< ) ИФЛЩ1 НА Ш IKM »|s i;
|< UAI1HI H'Q llll « I. (РОКА
ill' i HjM'i п
I
9