Текст
И. П. Бреслина
РАСТЕНИЯ
и водоплавающие
ПТИЦЫ
морских островов
КОЛЬСКОЙ
СУБАРКТИКИ
АКАДЕМИЯ НАУК СССР
КОЛЬСКИЙ ФИЛИАЛ им С М КИРОВА
ПОЛЯРНО-АЛЬПИЙСКИЙ БОТАНИЧЕСКИЙ САД-ИНСТИТУТ
И. П. БРЕСЛИНА
РАСТЕНИЯ
И ВОДОПЛАВАЮЩИЕ
ПТИЦЫ
МОРСКИХ ОСТРОВОВ
КОЛЬСКОЙ СУБАРКТИКИ
Ответственный редактор
М. Л. РАМЕНСКАЯ
е
ЛЕНИНГРАД
ИЗДАТЕЛЬСТВО «НАУК А»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
1987
УДК 581 526 + 598.4 (22 + 924 16)
Бреслина И. П. Растения и водоплавающие птицы морских островов Кольской
Субарктики. — Л.: Наука, 1987. — 200 с.
Выявлены различные аспекты взаимосвязей между растительностью прибрежных
островов Баренцева и Белого морей и водоплавающими птицами Составлен
аннотированный список растений, связанных с жизнедеятельностью птиц отрядов
веслоногих, пластинчатоклювых и ржанкообразных. Изложены основные прин-
ципы классификации островов Кольской Субарктики. Предложена ландшафтная
классификационная схема островов Кандалакшского залива и их экотопов как
среды обитания водоплавающих птиц Библиогр. 93 назв. Ил 57. Табл 43
Рецензенты:
А Д. АРМАНД, Н. А КОНСТАНТИНОВА
Б (02)Q8^ 248-87 — Ш ©^Издательство «Наука», 1987 г.
ПРЕДИСЛОВИЕ
В последние десятилетия роль ландшафтной экологии, вклю-
чающей наряду с обширным кругом вопросов углубленное изуче-
ние ландшафта как среды обитания животных, в комплексных
научных исследованиях все более возрастает.
Многие острова Кольской Субарктики являются местом назем-
ного (прежде всего в период размножения) обитания различных,
связанных с водной средой птиц — представителей отрядов весло-
ногих, пластинчатоклювых и ржанкообразных. В дальнейшем
они будут условно называться «водоплавающие».
В наше время во многих странах мира происходит резкое
сокращение площадей мест обитания таких птиц и, как следствие
этого, — резкое уменьшение численности птичьего населения. Эта
тенденция «все более заметно наблюдается и в нашей стране,
где в ряде районов создалось очень неблагоприятное положение»
(Резолюция Второго всесоюзного совещания. . ., 1969).
Причины этого кроются прежде всего в сельскохозяйственном
и промышленном освоении пойм рек, берегов озер, морских побере-
жий и островов. Кроме того, в связи с развитием всевозможных
транспортных средств все больше людей посещают ранее мало-
доступные места обитания водоплавающих птиц. Это нередко
меняет облик самих местообитаний водоплавающих птиц, делает
малопригодными для их жизни.
«В связи с этим встает большая и ответственная задача научной
разработки комплексного подхода к использованию природных
ресурсов водоемов, обеспечивающего их воспроизводство» (Иса-
ков, 1969, с. 44).
В 1971 г. была принята Международная Конвенция о водно-
болотных угодьях, имеющих международное значение, главном
образом в качестве местообитаний водоплавающих птиц. Согласно
«Конвенции о водно-болотных угодьях. . .», Кандалакшский залив
Белого моря относится к району, имеющему международное зна-
чение, главным образом как местообитание водоплавающих птиц.
Помимо гнездовий обыкновенной гаги, в Кандалакшском заливе
в большом количестве гнездятся морские колониальные птицы,
а также обитают различные пластинчатоклювые и околоводные
птицы. Множество самых разнообразных птиц останавливаются
в Кандалакшском заливе при весеннем и осеннем пролетах. Боль-
3
шой крохоль и гоголь собираются в Кандалакшском заливе на
линьку.
Острова Мурмана с их громадными колониями морских коло-
ниальных птиц и гнездовьями обыкновенной гаги для нашей
страны не менее значимы и интересны.
Настоящая работа явилась результатом многолетних исследо-
ваний (1963—1983 гг.), проводившихся на островах Кольской
Субарктики, затрагивающих многие аспекты взаимосвязи между
водоплавающими птицами 1 и растениями, как отдельными их
представителями, так и растительным покровом в целом. В различ-
ные годы интенсивность исследований в этом направлении была
неодинаковой. Чаще они носили целенаправленный характер,
в иные же годы проводились лишь попутно.
Работа осуществлялась в основном на островах Кандалакшского
заповедника, расположенных как в Баренцевом море вдоль побе-
режья Мурмана (Айновы острова, Гавриловские острова, Семь
Островов), так и в Кандалакшском заливе Белого моря. Однако
в Кандалакшском заливе достаточно широко обследовались также
и незаповедные острова.
Материал собирался непосредственно в экспедиционных усло-
виях. Для того чтобы уяснить, как водоплавающие птицы в те или
иные периоды своей жизни используют разные экотопы, и прежде
всего их растительность, были применены различные методические
приемы.
Выяснение роли морских колониальных птиц в сложении
и развитии растительного покрова их гнездовых территорий прово-
дилось методом картирования растительности на постоянных и
временных пробных площадях различных размеров по методикам
В. Д. Александровой (1964) и А. Г. Воронова (1964). Картирование
растительности в большинстве случаев сопровождалось почвенным
описанием и последующим лабораторным анализом почвенных
проб.
Геоботанических описаний по общепринятой методике было
сделано минимальное количество. Для целей наших исследований
обычные геоботанические описания мало подходят, поскольку
растительность птичьих колоний чрезвычайно пестра. Однако
картирование растительности всегда сопровождалось общеприня-
той геоботанической оценкой их основных выделов.
Непосредственные визуальные наблюдения, результаты учетов
и различных полевых анализов, литературные источники исполь-
зованы нами для характеристики экологических связей растений
с жизнедеятельностью водоплавающих птиц.
Флористические списки, геоботаническая и орнитологическая
оценки в основном мелких и мельчайших островов Кандалакшского
залива и в меньшей степени Восточного Мурмана послужили
1 Под термином «водоплавающие птицы» подразумеваются все птицы, связан-
ные с водной средой и околоводные
4
основой для суждения о роли морских колониальных птиц в станов-
лении флоры и растительности небольших морских островов
Кольской Субарктики.
Подробная физико-географическая характеристика, результаты
геоботанических и орнитологических исследований каждого из
обследованных 167 островов Кандалакшского залива и 23 островов
Мурмана легли в основу главы, посвященной островным ландшаф-
там Кольской Субарктики.
Латинские названия растений приводятся по книге «Анализ
флоры Мурманской области и Карелии» (Раменская, 1983),
птиц — по «Краткому определителю птиц» (Иванов, Штегман,
1978), соответствующим новейшей номенклатуре.
В разные годы в работе принимали непосредственное участие
лаборанты А. Е. Меньшенина и А. Л. Беляева, коллекторы С. В. Вла-
сов и К- А. Можаева, студенты-практиканты Н. А. Старшинова,
И. А. Бриеде, В. А. Судмале, И. М. Гравис, Л. П. Артемьева,
М. Ф. Соргин, В. В. Виноградова, В. Н. Александрова, В. И. Не-
чаева, Т. Г. Питьева, О. А. Шиматонова, Л. В. Тарасова, Л. Кушнир,
О. Мосягина, А. Бутин, Т. Виглиева. В процессе работы над книгой
сотрудники Кандалакшского государственного заповедника оказы-
вали автору консультации, помощь и содействие.
Всем им выражаем благодарность и признательность.
Глава 1
ПРИРОДНЫЕ УСЛОВИЯ МОРСКИХ ОСТРОВОВ
КОЛЬСКОЙ СУБАРКТИКИ
Морские острова Кольской Субарктики — это острова Белого и
Баренцева морей, расположенные сравнительно недалеко от мате-
рикового побережья (рис. 1). Они, как и побережье, находятся
в зоне медленного тектонического поднятия, которое продолжается
и поныне (Лаврова, 1960). Наиболее богат островами Кандалакш-
ский залив Белого моря. Здесь их 860 (Бианки, 1967). Значительно
меньше островов в губах и вдоль побережья Мурмана. По-види-
мому, до интенсивного освоения края все они были местом
гнездования морских колониальных птиц, но в настоящее время
большинство видов птиц в обилии гнездится в основном на остро-
вах, принадлежащих Кандалакшскому заповеднику: Айновых,
Гавриловских, Семи Островах (рис. 2).
Айновы острова расположены в западной части области, около
70° с. ш. Это два небольших (220 и 68 га) низких острова (наиболь-
шая высота 21 м над ур. м.). Их рельеф приближается к равнин-
ному. Берега пологи, слабо изрезаны. Сложены они аркозовыми
песчаниками, глинистыми сланцами, конгломератами, известня-
ками и доломитами палеозойского возраста (Парфентьева, 1969).
Как и другие острова Восточного Мурмана, Гавриловские и
Семь Островов круты, скалисты, нередко обрывисты. Острова эти
достаточно высокие (наивысшая точка 111.7 м над ур. м. на о-ве
Харлов, в архипелаге Семь Островов). Берега их изрезаны от-
весными щелями-пропастями, которые образовались в резуль-
тате выветривания либо диабазовых даек, либо вертикальных зон
повышенной трещиноватости. Сложены острова архейскими гра-
нитами и уже упомянутыми более молодыми дайками диабазов.
Рельеф островов, размеры которых превышают 15 га, — это плато-
образные возвышенности, перемежающиеся как широкими долино-
образными понижениями, так и «щелевыми лощинами» — узкими
каньонообразными ложбинами, являющимися продолжением ще-
лей и пересекающими, как правило, весь остров. Геоморфологи-
ческому очерку Семи Островов'посвящена работа А. Д. Арманда
(1969).
В понижениях Айновых островов, а на Семи Островах на
о-ве Харлов имеются озера, на некоторых же островах — неболь-
шие озерки.
Острова Кандалакшского залива Белого моря сложены грани-
тами, гнейсами и метаморфическими сланцами (Рихтер, 1946).
6
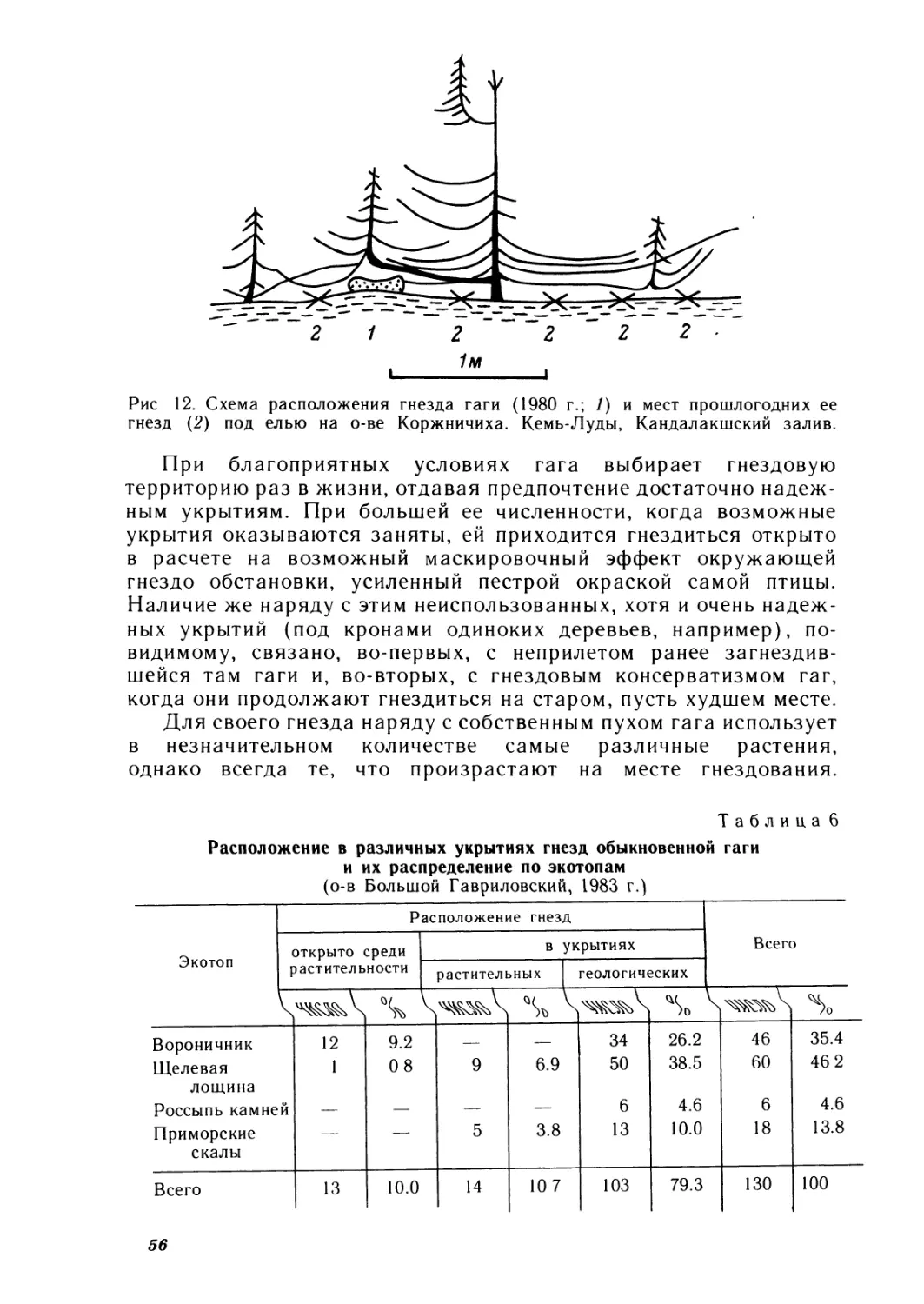
Рис. 1. Схема расположения обследованных островов Кольской Субарктики.
/ — Айновы острова; // — Гавриловские острова; /// — Семь Островов, IV — Кандалакш-
ский залив Белого моря
Рыхлые отложения, господствующие нередко на островах, — это
чаще всего перемытая морем морена. Современные морские отло-
жения песчаные, песчано-галечниковые или валунные. Большин-
ство островов гористы, и их невысокие возвышенности имеют вид
гряд. На некоторых островах есть озера. Особенно богат озерами
большой (6820 га), материкового типа о-в Великий.
Все остальные острова залива, кроме о-ва Великого, значительно
меньших размеров. Площадь наиболее крупных из них исчисляется
сотнями гектаров (у единиц достигает тысячи), мельчайших —
десятыми и даже сотыми долями гектаров.
Для климата наших островов характерно воздействие так
7
Рис. 2 Щель на северном берегу о-ва Харлов На ее стенах базар моевок. Семь
Островов, 1966 г.
называемого фактора океаничности (Бреслина, 1969). Он выра-
жается комплексом специфических показателей, и прежде всего,
по-видимому, большей по сравнению с побережьем влажностью
и наличием «морской пыли». Б. А. Юрцев (1966) отмечает, что
для «климата моря» характерны более ровные и низкие темпера-
туры, постоянные бризы и сильные ветры, туманы, более высокая
влажность воздуха, частые моросящие дожди. «Фактор океанич-
ности» воздействует на природу островов на фоне общего климата
региона.
Острова Мурмана, как и его побережье, относятся к приморской
арктической климатической области и, согласно «Агроклиматиче-
ским ресурсам Мурманской области» (1971), к I, наиболее холод-
ному агроклиматическому району. Безморозный период длится
здесь 88—119 дней, сумма температур выше 5 °C составляет
200—300 °C. Ясные дни редки, особенно осенью и зимой. Летом
может выпасть снег, но случается это в редкие годы. Летом часты
густые продолжительные туманы и преобладают северные, северо-
восточные и восточные ветры; зимой, весной и осенью — юго-за-
падные и южные. Штормовые дни наиболее часты зимой. Только
летом наблюдаются очень редкие и непродолжительные штили.
8
По сравнению с Мурманом климат Беломорских побережий
более континентален. Но и здесь погода довольно неустойчива
из-за частой смены циклонов. Зимой возможны оттепели, летом
нередки продолжительные дожди и холода. Туманы наблюдаются
реже, чем на Мурмане. При этом в Кандалакшском заливе по срав-
нению с другими районами Белого моря они наименее редки и
не такие густые. В районе Кандалакшского залива продолжитель-
ность безморозного периода даже короче, чем на побережье Барен-
цева моря, что объясняется большей континентальностью беломор-
ских территорий, однако сумма температур выше 5 °C составляет
здесь 1250—1400 °C. (Агроклиматические ресурсы Мурманской
области, 1971). Преобладают в Кандалакшском заливе юго-восточ-
ные и северные ветры. Летом нередки полные штили. Район
Кандалакшского залива относится к IV, наиболее теплому агро-
климатическому району Мурманской области.
Климат беломорских островов, в частности островов Канда-
лакшского залива, гораздо суровее, чем его побережья. Но на остро-
вах, расположенных в губах и в вершине Кандалакшского залива,
он мягче по сравнению с климатом островов более открытых
участков залива. Гористые берега залива затрудняют доступ холод-
ным ветрам, особенно северо-восточных и восточных направлений.
Чем глубже в море вдаются острова, тем суровее там климат.
Все острова Мурмана находятся в тундровой зоне. Они покрыты
сплошным слоем своеобразного сухого приморского торфа, даже
крутые склоны. Лишь на отвесных скалах и в зоне действия
морского прибоя торфа нет. Мощность торфяников — до 1 м,
редко более. На возвышенных частях плато мощность торфяного
слоя незначительна, в понижениях коренного рельефа увеличи-
вается. Этот приморский торф свойствен именно островам, на мате-
риковом побережье он практически отсутствует. Своим существо-
ванием он обязан наличию «фактора океаничности». В торфе
на глубине 30—50 см даже в конце лета присутствует многолетняя
мерзлота.
Основная климаксовая растительность сухих торфяников ост-
ровов Мурмана — вороничники. Ими заняты все острова, площадь
которых чаще всего более 5—7 га. Вороничники островов Мурмана
и безлесных островов Кандалакшского залива Белого моря нельзя
отождествлять с кустарничковыми тундрами — это особые экстра-
зональные тундрообразные ценозы, приуроченные к олиготрофным
приморским местообитаниям. Они близки верещатникам Атлан-
тики (Бреслина, 1971). Характеризуются вороничники абсолют-
ным господством представителей рода Empetrum в кустарничковом
ярусе (на островах Восточного Мурмана это Е. hermaphroditum,
на Айновых островах — Е. nigrum). В условиях островов Мурмана
вороничники представлены несколькими ассоциациями, из них
господствующие на плато и склонах островов — это вороничник
(чистый) и морошковый вороничник (рис. 3). Торф под чистыми
вороничниками, как правило, маломощный; под морошковыми
вороничниками его мощность более 50 см, и потому под морошко-
9
Рис 3. Морошковый вороничник. О-в Большой Лицкий. Семь Островов.
выми вороничниками обычна многолетняя мерзлота. На примор-
ских торфяниках, помимо вороничников, довольно широко распро-
странены, но не занимают при этом больших площадей, особые
тундрообразные травянистые приморские ценозы (деренник,
морошковый деренник, щавелевый морошечник, папоротниковый
морошечник и даже почти чистые папоротниковые заросли с Dry-
opteris expanse,). Все они характеризуются очень ограниченным
набором основных видов и приурочены к хорошо заснеженным
зимой участкам. При этом деренники чаще встречаются по скло-
нам в комплексе с вороничными ценозами; морошковый деренник
и щавелевый морошечник — в щелевых лощинах островов Восточ-
ного Мурмана, причем морошковый деренник на водоразделах
таких лощин; папоротниковый морошечник — преимущественно
по пологим склонам Айновых островов и широким лощинообраз-
ным понижениям; западинки днища логов и распадков на этих
островах заняты почти чистыми папоротниковыми зарослями.
В местах концентрации больших морских и серебристых чаек
растительный покров торфяников островных плато изменен и
представлен вторичными ’ орнитогенными ценозами, чему будет
посвящена особая глава. На Айновых островах это изменение
коснулось почти всей растительности плато обоих островов. На
Восточном Мурмане примерно таким же сильным фитоценотиче-
ским изменениям подвержены сравнительно небольшие острова.
На крупных островах: Харлов, Вешняк, Большой Лицкий и Боль-
шой Гавриловский изменение растительности под воздействием
ю
орнитогенного фактора носит локальный характер, хотя иногда и
захватывает большие площади.
Понижения рельефа на островах покрыты либо плоскобуг-
ристыми болотами, либо влажными торфяниками болотного проис-
хождения, особенно изобилует болотами о-в Большой Айнов.
Приморские луга на островах Мурмана не развиты. Однако
остров Большой Айнов опоясан почти сплошным полукольцом
крупнотравья. Его основные компоненты — Angelica archangelica,
Anthriscus sylvestris, Leymus arenarius, при высоте растений до
1.5—2 м. Здесь же нередки сплошные, почти чистые заросли
Leymus arenarius. На этом же острове, в наиболее отдаленных
от моря местах, но на рыхлых морских отложениях участками
расположены очень своеобразные и нигде более на, Кольском
Севере не встреченные колосниковые кочкарники. Кочкарник
представляет собой близко стоящие высокие (до 100—170 см)
отвесные торфяные кочки, густо поросшие колосником и сплошь
пронизанные его корневищами.
Растительность приморских скал в зоне действия морского
прибоя представлена галофитными лишайниками; выше по склону,
там, где отсутствуют колонии морских птиц, — редкими экземпля-
рами высшей галофитной растительности; в местах колоний —
весьма специфичной фрагментарной первичной орнитогенной
растительностью (см. гл. 4). Ею же, как правило, заняты центры
мелких скалистых островов, достаточно, однако, высоких, чтобы их
растительный покров не смывался высокими штормовыми волнами.
Состояние флоры и растительности островов Мурмана осве-
щалось в ряде работ: подробно— по Семи Островам (Бреслина,
1969), менее подробно—по Айновым островам (Парфентьева,
1969; Парфентьева, Бреслина, 1969). Работа, посвященная Гаври-
ловским островам (Георгиевский, 1981), к сожалению, не отражает
в полной мере состояние их растительности и отчасти флоры,1
а кроме того, в ней допущены некоторые серьезные неточности.
Большинство островов, расположенных в вершине Кандалакш-
ского залива или же в его многочисленных губах, как и берега
самого залива, заняты зональной северотаежной раститель-
ностью — различными сосняками и ельниками, а острова, лежащие
в открытых частях Кандалакшского залива, при прочих равных
условиях (рельеф, возраст), покрыты вороничниками, в основном
не отличающимися от вороничников Мурмана. Растительность
островов, лежащих вблизи материка и в некоторой степени испы-
тывающих на себе воздействие господствующих ветров, — воро-
1 В частности, недостаточно охарактеризованы вороничники — основная кли-
максовая растительность островов Восточного Мурмана. Чистые же вороничники,
характерные для о-ва Большого Гавриловского, в таблице вообще не указаны
для этого острова. Критика описания орнитогенной растительности приведена
в гл. 4 настоящей книги. Во флористической части работы Dendranthema hultenii
фигурирует как Leucanthemum vulgare и флористическая находка. Такой же
находкой представлена и Carex rariflora, отсутствующая якобы на Семи Островах,
где она на самом деле весьма обычна (Бреслина, 1969).
11
ничная, с лесными фрагментами и куртинами, а нередко и с отдель-
ными деревьями. Вороничниками покрыты также небольшие
безлесные островки — «луды», находящиеся в архипелаге леси-
стых и достаточно защищенных от ветров островов, а также
глубоко вдающиеся в море узкие мысы — «наволоки» лесистых
островов. На лудах и наволоках преобладают либо скелетные
почвы, либо сухоторфянистые. Толщина торфа редко превышает
0.5 м, торфяный слой залегает непосредственно на материнской
породе (скальной или моренной). По внешним признакам и,
по-видимому, по происхождению торф тундрообразных ценозов
островов Кандалакшского залива сходен с торфом островов Мур-
мана.
Берега островов, если они не скалистые и достаточно защищены
от волнобоя, заняты обычно неширокой, а нередко и прерывистой
полосой приморских лугов. Их растительность испытывает на себе
постоянное воздействие морской воды в связи с приливно-отлив-
ными ритмами. От характера и степени этого воздействия зависит
ее состав.
Геоботаническая и флористическая характеристики целого ряда
островов Кандалакшского залива приводились ранее в работах
ряда исследователей (Богданова, Вехов, 1969а, 19696; Вехов, 1969;
Бреслина, 1930а, 19806, 1984, 1985; Вехов, Георгиевский, 1981а,
19816).
И в Белом и Баренцевом морях уровень воды подвержен
регулярному приливно-отливному колебанию. Для разных участ-
ков побережья величина прилива неодинакова, поскольку на нее
влияют множество факторов, в том числе конфигурация береговой
линии. В среднем для берегов Мурмана она составляет 3.5 м,
для Кандалакшского залива около 2 м.
Обнажающееся в отлив морское дно (литораль) заселено много-
численными морскими животными и покрыто растениями, как
водорослями, так и, в меньшей степени, высшими. Литоральные
животные и отчасти растения — излюбленный корм многих мор-
ских птиц. Для беломорского побережья характерны обширные
литорали, на мурманском побережье площади их, как правило,
невелики.
В узких, суженных участках проливов приливно-отливные
течения образуют так называемые пороги — потоки морской воды,
несущейся с большей скоростью, в иных местах они напоминают
бурные участки горных рек. Дважды в сутки меняется их направле-
ние. В порогах особенно благоприятные условия для жизни ми-
дий — Mytilus edulis L. — основного корма обыкновенной гаги.
Дно порогов покрыто нередко сплошными «мидиевыми щетками».
Особенно богато порогами побережье Кандалакшского залива.
Отличительной особенностью Баренцева моря является господ-
ство приносимых Гольфстримом атлантических водных масс. У бе-
регов Мурмана оно не замерзает.
Гораздо суровее температурный режим Белого моря. Относи-
тельные теплые струи баренцевоморских вод, попадающие сюда
12
через Горло Белого моря, не могут существенно повлиять на его
тепловой баланс. На глубинах ниже 50 м здесь круглый год
держится отрицательная температура. Зимой большая часть Белого
моря (6 месяцев) скована льдом. Незамерзающие полыньи, как
правило, обычны в порогах. Нередки и большие многокилометро-
вые полыньи в центральной части моря и близ нее. Здесь же
обычен замкнутый циклический дрейф больших ледяных полей.
Острова благодаря их морскому окружению являются местом
гнездования преимущественно морских птиц. Число гнездящихся
видов лесных и прочих птиц на островах невелико, и чем дальше
в море находится остров, тем их меньше.
Орнитологическая характеристика островов Кольской Субарк-
тики приведена в целом ряде работ (Белопольский, 1957'; Гераси-
мова, 1958; Герасимова, Скокова, 1959; Герасимова, Баранова,
1960; Скокова, 1962, 1967; Модестов, 1967; Коханов, Скокова,
1967; Бианки, 1967; Татаринкова, 1981, 1982; Шкляревич 1981,
и др.).
Почти повсеместно на островах, включая и ряд облесенных
беломорских островов, разреженными колониями гнездится обык-
новенная гага — Somateria mollissima (L.). Она предпочитает
устраивать гнезда во всевозможных укрытиях: под деревьями и
в кустарниках, в россыпях камней и трещинах скал, в густой
траве приморских лугов и среди бревен выброшенного плавника,
а на Айновых островах — ив колосняковом кочкарнике. При
недостатке укрытий обыкновенная гага гнездится на открытых
участках — в вороничниках и на приморских скалах. Колониаль-
ные гнездовья большой морской, серебристой и сизой чаек —
Larus marinus L., L. agrentatus Pontopp., L. canus L., полярной
крачки — Sterna paradisea Pontopp. — располагаются на всевоз-
можных открытых возвышенных, ровных, более или менее пологих
участках островов. Правда, большая морская чайка на беломорских
островах очень редка. На Айновых островах она столь многочис-
ленна, что оттесняет других чайковых с плато, наиболее удобного
места для их гнездования, в другие местообитания (Татаринкова,
1975). Здесь же, на островах плато Мурмана, единично гнездится
короткохвостый поморник—Stercorarius parasiticus (L.). Гнез-
довья кайр — Uria aalge (Pontopp.), U. lomvia L. и моевки —
Rissa tridactyla (L.) очень плотные, они расположены на крутых,
обрывистых приморских скалах островов Мурмана, в том числе и
на Семи Островах. Они образуют так называемые птичьи базары
(см. рис. 2). По краям базаров в нишах обитают гагарка — А1са
torda L. Тупик—Fratercula arctica (L.) гнездится колониально,
и только на островах Мурмана. Он устраивает свои гнезда в норах,
вырытых в сухом торфе, на преимущественно пологих склонах.
Атлантическийчистик — Cepphus grylle (L.) гнездится повсеместно
разреженными колониями или единично во всевозможных естест-
венных глубоких и надежных укрытиях. Небольшими группами
и иногда поодиночке на островах как Мурмана, так и Кандалакш-
ского залива гнездится большой баклан — Phalacrocorax carbo
13
(L.), и только на островах Мурмана — хохлатый баклан — Ph.
aristotelis (L.).
Все эти колонии морских птиц существуют благодаря высокой
продуктивности моря. Причем кормовая база в Баренцевом море
несравнимо выше, чем в Белом, и потому там возможны гораздо
большие по сравнению с Белым морем колонии птиц, особенно
велики там птичьи базары, которых на Белом море нет. Считается
(Sobey, Kenworthy, 1979), что резкое увеличение численности
гнездящихся чаек на единицу площади целого ряда островов
Северной Атлантики произошло в последние десятилетия в резуль-
тате: 1) развития рыбного промысла и, как следствие этого,
появления большого количества ставших доступным чайкам рыб-
ных отходов и 2) сокращения удобных для чаек общего числа мест
их гнездования. Этот скачок численности коснулся и островов
Мурмана, причем особенно ощутимо Айновых островов.
Не колониально и в несравнимо меньшем количестве на остро-
вах Мурмана и Кандалакшского залива гнездятся морские кулики:
камнешарка — Arenaria interpres (L.), кулик-сорока — Haemato-
pus ostralegus L., галстучник — Charadrius hiaticula L. Использует
острова для гнездования и море для добывания корма целый
ряд неморских пластинчатоклювых, и среди них большой и длинно-
носый крохали — Mergus merganser L., М. serrator L., гоголь —
Bucephala clangula (L.), турпан — Meianitta fusca (L.), синьга —
M. nigra (L.), хохлатая чернеть — Aythya fuligula (L.). Гнездятся
на островах и держатся на островных озерах кряква — Anas
platyrhynchos L., свиязь — A. penelope L., широконоска — A. cly-
peata L., шилохвость — A. acuta L., чирок-свистунок — А. сгесса L.
На островах Кандалакшского залива на пролете большими стаями
держится гуменник — Anser fabilis (Lath.).
Ландшафты островов Кольской Субарктики, особенно мелких
и мельчайших, очень хрупки и ранимы. Они своеобразны и
нуждаются в особой охране. Вопрос о необходимости экологиче-
ского надзора за состоянием островных ландшафтов Кандалакш-
ского залива поднимался в печати (Бреслина, 1984). В той же
мере это должно относиться и к островам Мурмана.
14
Глава 2
ЭКОЛОГИЧЕСКИЕ СВЯЗИ РАСТЕНИЙ
С ЖИЗНЕДЕЯТЕЛЬНОСТЬЮ ВОДОПЛАВАЮЩИХ ПТИЦ
Птицы, в частности водоплавающие, используют раститель-
ность как среду своего обитания, либо приспосабливаясь к ней,
либо в той или иной степени изменяя ее. Рассмотрим в этом
аспекте флору островов Мурмана и Кандалакшского залива Белого
моря.
В аборигенной флоре, связанной с жизнедеятельностью водо-
плавающих птиц (табл. 1), можно различить: 1) растения, так или
иначе используемые птицами, и 2) растения, которые, образно
выражаясь, «сами используют птиц для своей жизнедеятельности»
(Бреслина, 1981а).
Используемые птицами растения — это ремизные,1 гнездостро-
ительные и кормовые растения. Ремизные растения используются
птицами как укрытия — или при гнездовании, или для птенцов.
Гнездостроительные растения служат материалом для постройки
гнезд. Кормовые растения употребляются птицами в качестве
основного, сезонного или попутного корма.
Растения, «использующие птиц для своей жизнедеятельности»,
это орнитофильные растения. Они активно положительно реаги-
руют на весь специфический комплекс экологических факторов,
обусловленных жизнедеятельностью птиц (в наших условиях
морских колониальных птиц).
Список видов растений,
связанных с жизнедеятельностью птиц
Dryopterisexpansa (С. Pres/) Fraser-Jenkins et Jermy — Шитов-
ник распростертый. На Айновых, Гавриловских и в меньшей
степени на Семи Островах его густые высокие заросли являются
надежным укрытием для подрастающих молодых чаек. Там же
сухие вайи папоротника при гнездостроении используются различ-
ными чайками, гагой, турпаном, турухтаном (Коханов, Скокова,
1967).
Picea abies (L.) Karst., P. obovata Ledeb. — Ель европейская,
ель сибирская. На островах Кандалакшского залива оба вида ели
1 Ремиз — старинный охотничий термин, означающий растительное укрытие
15
а»
Таблица 1
Экологические связи растений с птицами
Вид растения Ремизные Г нездостроительные Кормовые Орнитофильные
A В К А В К А В К А В К
Dryopteris expansa Picea- abtes, p. obovata + + +* 4- 4- 4-4-4- 4-4-4- +
Pinus friesiana Jumperus sibtrica + + 4- 4- 4-4-4- + +
Spar gamurn hyperboreum +
Zostera marina + 4-
Triglochin maritimum + + +
Anthoxantum alpinum 4-
Alopecurus arundinaceus Agrostis straminea 4- 4- + + + + + + + +
Calamagrostis groen- 4- 4- + + + +
landica
C. lapponica Phragmites australis 4- 4- + + + +
Lerchenfeldia flexuosa Poa alpina 4- + + + + + + +
P alpigena Catabrosa aquatica 4- 4- 4- + + + + + + + + + + 1 + + + 4-
Puccinelha maritima 1 + +
P asiatica P pulvinata 4- + + + _i_
+ + 4-
P. capillaris 4- +
P coarctata Festuca ovina F. rubra s. J. Leymus arenarius 4-4-4- 4-4-4- + 4-4- + + + + + + + + + + + + + + + 4- + + + + + + + + + + + + + + + + 4- + +
Enophorum polystahyon E. gracile 4-4-4- 4-4-4- 4- 4- + +
Eleocharis uliglumis
subsp. septentrionalis +
Примечание Знак «-I-» указывает на интенсивность связи А — Айновы острова, В — Восточный Мурман, К — Кандалакшский залив
* Слищком густые заросли играют в сохранности птенцов отрицательную роль
2 И П Бреслина
Вид растения Ремизные
A В К
Carex acuta С. aquatilis + + + + 4- 4-
С. buxbaumii 4-
С. Itmosa 4-
С livida 4-
С. rariflora С. rostrata + + 4-
С. tripartita С. vesicaria С subspathacea Juncus atrofuscus + 4-
Luzula wahlenbergii Populus tremula 4-
Salix glauca 4-4-4- +
S. phylicifolia + 4-4- 4- + + 4-
S. lanata + + +
S. lapponum S. herbacea, S tundricola + + + •
Betula папа В. callosa, В. subarctica, 4-
В. tortuosa, В. concinna
Pumex acetosella p tenuifohus P. acetosa + + 4- +
P. ihyrsiflorus P. aquaticus + +
P. pseudonatronatus + •
Polygonum viviparum A triplex kusenevae,
A. nudicaulis
Salicornia europaea,
S. pojarkovae
Таблица 1 (продолжение)
Г нездостроительные Кормовые Орнитофильные
А В К А В К А В К
4-4-4-
+ 4-4-4- 4- 4-4- + +
4- +
4- +
+ +
4- 4-
+ + 4-4-4- +
+ + + +
4- 4- + + +
4-4-4-
+ + 4-
+
4-
4-
+
+
4-
4-4-4- + 4- +
4-4-4- + 4- +
4-
+
4- + 4-
4- 4- 4- + +
4-
4- 4- 4-
00
Вид растения Ремизные
A В К
Montia fontana Stellaria graminea S humifusa S media S. nemorum
Cerastium holosteoides
C. alpinum Sagina nodosa Honkenya diffusa Spergularia marina Melandrium lapponicum Dianthus superbus Caltha palustris Ranunculus hyperboreus R. repens R. sceleratus 4-
R. polyanthemos Erisimum hieracifolium Draba incana Cochlearia officinalis C. arctica Rhodiola rosea R. arctica Sedum acre 4-4-4- 4- 4-
Saxifraga cespitosa Parnassia obtusiflora
Ribes acidum 4- 4-
Sorb us gorodkovii Rubus chamaemorus 4- 4-
R saxatilis Comarum palustre + 4- 4- 4-
** Только для Гавриловских островов
Таблица 1 (продолжение)
Г нездостроительные Кормовые Орнитофильные
А ‘ В К А В К А В К
+ 4- 4- + 4- 4- 4- । ** 4- 4- 4- 4- 4- 4-4-4- 4- 4-4-4- 4- 4- 4- 4- 4-4-4- 4- 4- 4- 4-4-4- 4-4-4- |_ ** 4- 4- 4- 4- 4- 4- 4- 4- 4-4-4- 4- 4- 4- 4- 4- 4- 4- -F
4- 4- 4-
4- 4- 4- т 4- + 4-4-4- 4- 4- 4- 4-4-4- 4- 4- 4- 4- 4- 4- 4-4-4- 4- 4-4-4- 4- 4- 4- 4- 4- 4- 4-4-4- 4-4-4- 4- 4- 4-
Вид растения Ремизные
A В К
Potentilla egedii Р. arctica
Rosa ma jails Vicia cracca 4-
Lathyrus aleuticus L. palustris Empetrum nigrum E. hermaphroditum Epilobium palustre Chamerion angustifolium + 4- 4-
Anthriscus Silvestris + + +**
Ligusticum scoticum Conioselinum tataricum + + 4-
Angelica archangelica + + + ** + 4- 4- 4-
Heracleum sibiricum 4-
Chamaepericlymenum + 4-
suecicum
Ledum palustre Arctous alpina 4-
Vaccinium myrtillus 4-
V. uliginosum V. vitis-idaea +
Oxycoccus palustris Trientalis europaea Menyanthes trifoliata Mertensia maritima + 4-
Veronica longifolia Euphrasia frigida 4-
Rhinanthus minor Plantago maritima,
P. schrenkii
Таблица 1 (продолжение)
Г нездрстроительные Кормовые Орнитофильные
А В К А В К А В К
+ + +
+ +
+ + +
+
+ + + + + + + + + + + + + + + + + + +
4-4-4- +• +
+ + + + + +
н- + + + 4- +
+
• + + + + + + + +
+
+ +
+ + +
+ + + + + + +
+ + + +
4- 4- + + + + + + + +
4- +
+
+ + + + + + + + +
+
+ + + + 4- 4- Н—1—h +
Таблица 1 (продолжение)
о 4- 4- + +4- + + + + + + + 4-
нитофильш СО + + + + +
о < 4- 4- 4-
(V 3 СО О о СО
<
г> 3 I + +++ <
з: о н о X) 4- 4- 4- 4-
(V г < 4- 4- 4-
4- +
емизные 20
< + 4-
Вид растения з.2 'о со 8 g a g £ з-з И Л -з « § gr§ •§ a?’® ® £ ° 2 Q.-3? 3 § 3 g ^-= g co м st Q S ~ 3 < «•Sa-e&eS'S.e-®.» 2 § о а 2 8 g S -2 2 и
являются отличным гнездовым
убежищем обыкновенной гаги.
Она устраивает гнезда под елью,
как в лесу, под густыми ее ветвя-
ми, так и в островных редколесь-
ях. В приморских вороничниках,
где ель обычно принимает стла-
никовую или же куртинообраз-
ную форму, гага предпочитает
ее полог почти всем другим есте-
ственным убежищам. Под ветвя-
ми тех елей, что стоят на откры-
тых местах, могут гнездиться
синьга и длинноносый крохаль.
Экологическая форма роста
елей, обычная для суровых ус-
ловий безлесных островов, поз-
воляет уткам очень хорошо
замаскировать свои гнезда.
Pinus friesiana Wichura —
Сосна лапландская. На остро-
вах Кандалакшского залива под
одинокими, стоящими на откры-
тых местах соснами, принимаю-
щими стланиковую или же по-
лустланиковую форму, нередко
гнездится обыкновенная гага,
а иногда и длинноносый кро-
халь. Однажды на о-ве Великом
на сосне на высоте около 3 м
сизая чайка устроила себе гне-
здо (А. И. Флеров, устное сооб-
щение). В 1976 г. на о-ве Малая
Топа в Бабьем море автором
было встречено гнездо сизой
чайки, построенное на нижних,
распростертых по земле ветвях
сосны. Однако оба эти случая —
исключение из общего правила.
На болотах сосны с сухими вер-
шинами или же просто сухие
сосны — излюбленное место как
токования, так и отвлечения
внимания от выводков у боль-
шого улита и у фифи.
Juniperus sibirica Burgsd. —
Можжевельник сибирский. На
островах Мурмана и Канда-
лакшского залива является не-
20
плохим гнездовым укрытием для обыкновенной гаги, длинноносого
крохаля и турпана, особенно в вороничниках и в островных редко-
лесьях беломорских островов (преимущественно прямостоячие
или полустелющиеся формы). Под ветвями стелющегося или
полустелющегося можжевельника предпочитает устраивать свои
гнезда камнешарка. По данным В. В. Бианки (1967), на островах
Кандалакшского залива в подобных укрытиях встречено 41.5 %
ее гнезд. Помимо другого материала, гнездовая лунка камнешарки
выстилается также иголочками можжевельника (Бианки, 1967).
По его же данным, серебристые чайки в небольшом количестве
поедают можжевеловые ягоды, а птенцы полярной крачки при
опасности прячутся под ветвями стелющегося можжевельника.
Можжевельник входит в состав растительности вороничных и
можжевелово-вороничных тундр — обычных мест гнездования
обыкновенной гаги, длинноносого крохаля, камнешарки, полярной
крачки, в меньшей мере сизой чайки.
Sparganium hyperboreum Laest. — Ежеголовка северная. Его
недозрелые семена, по наблюдениям А. И. Флерова (устное
сообщение), являются кормом для птенцов свиязи, держащихся
на озерах о-ва Великого (Кандалакшский залив).
Zostera marina L. — Взморник морской. В Кандалакшском
заливе являлся кормом пролетных лебедей (В. В. Бианки, В. Д. Ко-
ханов, Н. Н. Скокова, устное сообщение). В недалеком прошлом
в мае им питались серебристые чайки (Бианки, 1967). Однако
после 1960 г. кормовое значение взморника морского почти сведено
к нулю, поскольку в тот год обширные беломорские заросли
его в результате эпифитотии почти полностью погибли, сохрани-
лись лишь отдельные экземпляры. До 1960 г. мелководные, хорошо
защищенные от ветров, богатые зарослями взморника морские
заливы являлись местами отдыха и кормежки пролетных лебедей-
кликунов (В. В. Бианки, В. Д. Коханов, Н. Н. Скокова, устное
сообщение). В. В. Бианки (1967) отмечал, что в мае 1957 г.
серебристые чайки поедали особенно много взморника. До 1960 г.
взморник употреблялся серебристыми чайками для постройки
гнезд. В последние годы в Кандалакшском заливе началось естест-
венное восстановление зарослей взморника, особенно в мелковод-
ных губах, куда впадают ручьи и речки (Вехов, 1970).
Triglochin maritimum L. — Триостренник морской. В Канда-
лакшском заливе на весеннем и осеннем пролетах его сочными
побегами охотно кормятся гуменники. Наблюдения А. И. Флерова
(устное сообщение) показали, что птенцы свиязи, выкармливаемые
человеком, среди растительных кормов предпочитают наряду с рез-
кой морского подорожника и резку триостренника приморского.
Anthoxantum alpinum A. et D. Love — Душистый колосок
альпийский. Употребляется в пищу свиязью (А. И. Флеров,
устное сообщение).
Alopecurus arundinaceus Poir. — Лисохвост тростниковидный.
Являясь приморским луговым растением, обычен для птичьих
колоний островов Кандалакшского залива, расположенных на
21
приморских лугах и по кромке берега. В его густых зарослях
гнездится обыкновенная гага, и в этом случае из его листьев
состоит первоначальная травянистая выстилка ее гнезда. Изредка
в Кандалакшском заливе он встречается и в птичьих колониях
на невысоких приморских скалах, где растет по их трещинам,
обнаруживая мощный рост, иногда образуя при этом лентообраз-
ные дерновины.1 Нередко по этим трещинам слабо просачивается
солоноватая вода из вышерасположенных ванн. Морская вода
в них попадает во время сильных осенних штормов. Пробивающи-
мися из земли побегами лисохвоста тростниковидного кормятся
на весеннем пролете гуменники.
Agrostis straminea С. Hartm. — Полевица соломенно-желтая.
В Кандалакшском заливе обычна для приморских лугов — мест
гнездования, преимущественно сизых чаек. Там же встречается,
но редко в птичьих колониях на скалах, у границы несколько
солоноватых скальных ванн. Используется сизыми чайками как
гнездовой строительный материал. Служит пищей гуменникам,
особенно ее молодые ростки.
Calamagrostis groenlandica (Schrank) Kunth — Вейник грен-
ландский. Произрастает в орнитогенных ценозах островов Восточ-
ного Мурмана, чаще на месте бывших гнезд. Нередко оконтуривает
многолетние гнезда чаек, используется чайками в гнездостроении.
С. lapponica (Wahl.) Hartm. — В. лапландский. На островах
Кандалакшского залива произрастает в орнитогенных ценозах
и используется птицами так же, как и предыдущий вид.
Phragmites australis (Cav.) Trin.ex Steud. — Тростник обыкно-
венный. Заросли тростника в Кандалакшском заливе в кутах
губ и на озерах о-ва Великого являются очень хорошим выгулом
и убежищем для кормящихся птенцов кряквы, свиязи, чирка-
свистунка. Здесь обычно эти заросли достаточно густы и на мор-
ских берегах простираются от средней части литорали до заболо-
ченного леса. В затопляемой части зарослей предпочитают дер-
жаться утиные выводки. В то же время надо отметить, что густые
и достаточно сухие заросли тростника совсем не используются
пластинчатоклювыми для гнездования. В тростниковых зарослях
небольших лесных озер о-ва Великого линяют селезни чирка-
свистунка (А. И. Флеров, устное сообщение).
Lerchenfeldia flexuosa (L.) Schur. — Луговик извилистый.
Употребляется полярной крачкой для выстилки гнезда.
Роа alpina L. — Мятлик альпийский. На островах Кандалакш-
ского залива на приморских скалах, занятых птичьими (преиму-
щественно серебристых чаек) колониями, растет в лентообразных
дерновинах, расположенных в наиболее сухих и не подверженных
действию морской воды местах. На островах Восточного Мурмана
1 Здесь и далее «дерновины» употребляются в широком смысле этого слова.
«Лентообразные дерновины» — специфические вытянутые, приуроченные к скаль-
ным трещинам дерновины (см гл 4)
22
произрастает в тех же условиях, но гораздо реже. На торфяниках
островов Кандалакшского залива (в вороничниках) обычен для
участков вторичной орнитогенной растительности. Сухие стебли
мятлика альпийского используются серебристыми чайками в ка-
честве гнездового материала.
Р. alpigena (Blytt) Lindm. — М. высокогорный. На приморских
скалах, занятых птичьими колониями, образует дерновины по
трещинам высоких, не подверженных влиянию моря скал. На
торфяниках (в вороничниках) обычен для фрагментов вторичной
орнитогенной растительности. Здесь же, на месте старых гнезд
чаек, образует кольцеобразную дернину. Так же обычен он и для
вторичной скальной орнитогенной растительности. Сухие листья и
стебли его используются чайками в качестве гнездового материала.
Catabrosa aquatica (L.) Beauv. — Поручейница водяная. На
Айновых островах и на о-ве Яичном (район Семи Островов)
обычна на приморских скалах в местах гнездования крупных чаек,
где произрастает в сильно нитрофицированных лужицах, образуя
нередко сплошной плавающий ковер.
Puccinelliamaritima (Huds.) Pari., P.asiatica (Hadacet A. Love)
Czer. — Бескильницы морская и азиатская. Их молодые нежные
побеги охотно употребляют в пищу гуменники на весеннем про-
лете (визуальные наблюдения в Кандалакшском заливе).
Р. pulvinata (Fries) Kresz. — Бескильница подушковйдная.
Обычна в чаячьих колониях на приморских скалах. Здесь преры-
вистые цепочки ее дернинок постоянны в трещинах нижнего
пояса скал. Выше по склону они являются обязательным компо-
нентом лентообразных дерновин. Удобрение птичьим пометом явно
способствует ее росту и развитию, так как на тех приморских
скалах, где чайки не гнездятся, можно увидеть только редкие
экземпляры этого растения. В Кандалакшском заливе ей постоянно
сопутствует Rhodiola rosea. Возможно, что Puccinellia pulvinata
создает условия для поселения Rhodiola rosea. Сухие веточки
Puccinellia pulvita используются чайками как материал для гнезд.
В основном она произрастает на островах Кандалакшского залива.
Р. capillaris (Liljebl.) Jansen — Б. волосовидная. На островах
Кандалакшского залива произрастает там же и употребляется
морскими птицами так же, как и предыдущий вид.
Р. coarctata Fern, et Weath. — Б. сжатометельчатая. На остро-
вах Мурмана произрастает там же и употребляется морскими
птицами так же, как и два предыдущих вида.
Festuca ovina L. — Овсяница овечья. Обычна для вторичных
орнитогенных ценозов на торфянике и среди вороничника.
Здесь же, в вороничнике, на месте старых гнезд чаек образует
кольцеобразную дерновину. На приморских скалах, занятых разре-
женными чаячьими колониями, произрастает по трещинам доста-
точно высоких и защищенных от волнобоя скал. Ее сухие листья
и стебли используются чайками для постройки гнезд.
F. rubra L. — О. красная. На приморских скалах, занятых
колониями серебристых чаек, селится по скальным трещинам,
23
причем растет в местах, расположенных выше зоны заметного
воздействия морской воды. Нередко образует лентообразные дер-
новины. Обычна для вторичной орнитогенной растительности
торфяников. На островах Кандалакшского залива на приморских
лугах, занятых колониями сизых чаек, заметно усиливает свое
обилие и рост. Используется серебристыми и сизыми чайками
как гнездовой строительный материал. Служит наряду с другими
злаками пищей для кряквы (В. В. Бианки, устное сообщение)
и, по-видимому, для других растительноядных пластинчатоклю-
вых.
На островах Мурмана представлена подвидом Festuca rubra
ssp. arctica (Hack.) Govor.
Leymus arenarius (L.) Hochst. — Волоснец песчаный (колос-
няк). Заросли колосняка на безлесных островах Кандалакшского
залива, полосой отделяющие вороничники от литорали, — обычное
и излюбленное место гнездования обыкновенной гаги. Местами
здесь плотность ее гнездования достигает величины 1—2 гнезда
на 1 м2. И при этом лоток своего гнезда она делает из прошлогодних
колосниковых стеблей и листьев. Здесь же, в зарослях колосняка,
изредка гнездятся кряква, свиязь, синьга. На Айновых островах
колосняк образует высокие торфяные столбообразные кочки. Сово-
купность их — «колосниковый кочкарник» — излюбленное место
гнездования серебристых и сизых чаек, обыкновенной гаги. Среди
кочек в массе гнездится и обыкновенная гага и единично другие
пластинчатоклювые, в том числе чирок-свистунок и длинноносый
крохаль. Чирок-свистунок предпочитает при этом устраивать
гнездо под толстым пластом полегших стеблей прошлогоднего
колосняка в своеобразной «соломенной пещерке» (Коханов, Ско-
кова, 1967). Синузия колосняка, столь обычная для вороничников
беломорских островов, расположенных на рыхлых отложениях
островов, в случае, если на этих участках или близ них гнездятся
серебристые или сизые чайки, сильно разрастается, генеративные
стебли его достигают 1.5—2 м против обычных 0.8—1.2 м.
В птичьих колониях на скалах колосняк встречается редко, где
растет по трещинам невысоких скал. По данным В. В. Бианки
(1967), колосняк в небольшом количестве употребляется в пищу
сизыми чайками. Галстучник свое примитивно устроенное гнездо
(углубление в песке) выстилает отдельными стебельками трав,
в частности колосняка. Молодые побеги его служат пищей крякве
(В. В. Бианки, устное сообщение) и, по-видимому, другим расти-
тельноядным пластинчатоклювым.
Eriophorum polystachyon L., Е. gracile Koch. — Пушицы
многоколосковая, стройная. В их зарослях в зарастающих при-
брежных участках озер держатся выводки гоголей и речных
уток. На о-ве Харлов (Семь Островов) в колониях полярных
крачек, находящихся вблизи зарослей пушицы многоколосковой,
ее листья и стебли употребляются этой птицей в гнездостроении.
Eleocharis uliglumis (Link) Schult, subsp. septentrionalis
(Zinserl.) Egor. — Ситняг северный. На островах Кандалакшского
24
залива изредка встречается в чаячьих колониях на приморских
скалах в солоноватых скальных ваннах.
Carex acuta L., С. aquatilis Wahl., C. buxbaumii Wahi., C. limosa
L. C. livida (Wahl.) Willd., C. rostrata Stokes, C. vesicaria L. —
Осоки острая, водная, Буксбаума, топяная, синеватая, носатая,
пузырчатая. Между их дерповипами в непереувлажненных
участках располагаются гнезда турухтанов, круглоносых плавун-
чиков, краснозобых гагар. Осоковыми листьями они выставляют
свои гнезда (Коханов, Скокова, 1967). В зарослях осок в сильно
обводненных мочажинах болот и по зарастающим берегам озер
держатся выводки речных уток (В. В. Бианки, устное сообщение).
С. rariflora (Wahlb.) Smith. — О. редкоцветковая. Явля-
ется компонентом выстилки гнезда полярных крачек в случае,
если колония крачек расположена в осоково-морошковом воро-
ничнике.
С. tripartita АП. — О. трехраздельная. Обычна, но не обильна
как в первичных, так и во вторичных орнитогенных ценозах Семи
Островов. Там же используется крупными чайками при строитель-
стве гнезд.
С. subspathacea Womsk. ex Hornem. — О. оберточная. Ее моло
дые побеги в большом количестве употребляют в пищу на весеннем
пролете гуменники (визуальные наблюдения в Кандалакшском
заливе).
Juncus atrofuscus Rupr. — Ситник черно-бурый. Изредка
встречается в чаячьих колониях островов Кандалакшского залива
на приморских скалах по краям солоноватых скальных ванн,
иногда в лентообразных дернинах, если по трещинам, к которым
они приурочены, осуществляется ток солоноватой воды. Его моло-
дыми побегами на весеннем пролете кормятся гуменники (визуаль-
ные наблюдения в Кандалакшском заливе). По данным А. И. Фле-
рова (устное сообщение), вскармливаемые человеком птенцы
свиязи охотно поедают завязи и недозрелые семена ситника
черно-бурого.
Luzula wahlenbergii Rupr. — Ожика Валенберга. На островах
Восточного Мурмана входит в состав живого кольцевого валика
вокруг многолетних чаячьих гнезд.
Populus tremula L. — Осина. В карликовых порослевых
зарослях осины на вороничных лудах Кандалакшского залива
иногда устраивает свои гнезда обыкновенная гага.
Salix glauca L„ S. phylicifolia L., S. lanata L., S. lapponum L. —
Ивы сизая, филиколистная, мохнатая, лопарская. На Айновых
островах в густых ивняках в массе гнездится обыкновенная
гага, а также отмечены гнезда бекаса, пискульки, чирка-свистунка
длинноносого крохоля (Коханов, Скокова, 1967). На Семи Остро-
вах и на безлесных вороничных островах Беломорья одиночные
густые ивовые кусты — это хорошие гнездовые убежища для
обыкновенной гаги. На озерах некоторых беломорских островов
среди прибрежных полупогруженных в воду ивовых ветвей
держатся выводки гоголей и речных уток.
25
S. nerbacea L., S. tundricola Schlajk. — Ивы травянистая,
тундровая. Сухим листом изредка выстилает полярная крачка
лоток своего гнезда (о-в Харлов, Семь Островов).
Betula папа L. — Березка карликовая. Сухим листом изредка
выстилает полярная крачка лоток своего гнезда (о-в Харлов,
Семь Островов).
В. callosa Lindq., В. subarotica Orlova, В. tortuosa Ledeb.,
В. concinna Gunnarss. — Березы мозолистая, субарктическая,
извилистая, стройная. Кустарниковые формы берез в вороничных
тундрах беломорских островов являются хорошим гнездовым
убежищем для обыкновенной гаги. При этом гага оказывает
предпочтение очень небольшим локальным густым зарослям
кустарниковых берез, где гнездится очень плотно. На Кемь-
Лудах в кривоствольных березняках под пологом березовых
ветвей изредка также гнездится гага, но в этом случае она отдает
предпочтение опушкам.
Rumex acetosella В tenuifolius Wallr. — Щавель тонколистный.
Для островов Мурмана обычное растение птичьих колоний,
располагающихся на вороничных торфяниках, особенно обилен на
колониях тупиков. Пионер заселения обнаженных торфов.
R. acetosa L. — Щ. обыкновенный. Обычное растение птичьих
колоний, расположенных на вороничных торфяниках островов
Мурмана. Особенно обилен в затухающих и заброшенных коло-
ниях. В его густых, но невысоких зарослях затаиваются птенцы
чаек.
R. thyrsiflorus Fingerh — Щ. пирамидальный. На островах
Кандалакшского залива изредка произрастает во вторичных
орнитогенных ценозах вороничных торфяников.
R. aquatilis L. — Щ. водный. На приморских скалах беломор-
ских островов, занятых колониями серебристых чаек, растет по
берегам пресных ванн. Там же встречается в различных торфяни-
стых дерновинах, приуроченных к скальным трещинам, если по
ним, хотя бы периодически, осуществляется ток воды из выше-
расположенных ванн. Здесь растет очень пышно и достигает
высоты 1.5 м. И в Кандалакшском заливе и на Айновых островах
служит убежищем для затаивающихся птенцов чаек.
R. pseudonatronatus (Borb.) Murb. — Щ. ложносолончаковый.
На беломорских островах в колониях серебристых чаек на примор-
ских скалах произрастает так же, как и предыдущий вид, но встре-
чается гораздо чаще. Служит убежищем для затаивающихся
птенцов чаек.
Polygonum viviparum L. — Горец живородящий. Изредка
встречается во вторичных орнитогенных ценозах торфяников
островов, где обнаруживает более мощный рост и развитие,
особенно в щелевых лощинах Гавриловских островов. Употреб-
ляется в пищу кряквой (В. В. Бианки, устное сообщение).
Atriplex kusenevae N. Sem., A. nudicaulis Bogusl. — Лебеда
Кузеневой, л. голостебельная. На приморских скалах беломор-
ских островов, занятых чаячьми колониями, изредка встречаются
26
по скальным трещинам. На скалах же, где отсутствуют колонии
птиц, вообще не растут.
Salicornia europaea L., S. pojarkovae N. Sem. — Солерос
европейский, с. Поярковой. В Кандалакшском заливе охотно
поедается гуменниками на осеннем пролете и, по-видимому,
речными утками в течение всего лета.
Montia fontana L. — Монтия ключевая. В колониях серебри-
стых чаек на скалах растет по берегам скальных ванн с сильно
нитрофицированной водой, где может образовать сплошной ковер.
Встречается также в лентообразных торфянистых дерновинах,
если по трещинам, к которым она приурочена, просачивается
нитрофицированная вода. Особенно обильна на островах Мур-
мана, причем на островах Восточного Мурмана, кроме того,
густой «щеткой» произрастает по сочащемуся торфяному пласту
орнитогенных ценозов щелевых лощин.
Stellaria graminea L. — Звездчатка злаковидная. На бело-
морских островах во вторичных орнитогенных ценозах, не под-
верженных вытаптыванию птицами, растет сплошным ковром.
Ценозы ее очень фрагментарны, возникают от обильного поступле-
ния помета и встречаются среди вороничников, чаще всего у под-
ножия крупных камней или же обрывистых скал, на которых
сидят птицы. Сизые чайки используют звездчатку при постройке
гнезда.
S. humifusa Rottb. — 3. приземистая. На островах Восточного
Мурмана растет в переувлажненных участках вторичных орнито-
генных ценозов вороничных торфяников.
S. media (L.) Vill. — 3. средняя. Встречается в различных
орнитотенных иенозах V авриловских и Кировых островов. V» ИО-
следних, однако, произрастает редко и в небольшом количестве.
Один раз, и только в 1974 г., был обнаружен один-единственный
экземпляр в дерновине первичной орнитогенной растительности
приморских скал о-ва Зеленого (Кемь-Луды, Кандалакшский
залив), куда скорее всего S. media была занесена издалека
чайками, кормящимися на поселковых помойках.
S. nemorum L. — 3. дубравная. Встречается в различных
орнитогенных ценозах Айновых островов, но наиболее обычна
и мощна в колониях серебристых чаек, занимающих бугристые
болота и колосниковые кочкарники, где предпочтительно про-
израстает в понижениях.
Cerastium holosteoides Fries. — Ясколка костенецевидная.
Обычна для вторичных орнитогенных ценозов вороничных торфя-
ников, где особенно хорошо растет в местах, не подверженных
птичьему вытаптыванию. Используется чайками для постройки
гнезд.
С. alpinum L. — Я. альпийская. На островах Мурмана про-
израстает во вторичных орнитогенных ценозах вороничных
торфяников, в наиболее дренированных местах, используется
чайками для постройки гнезд.
Sagina nodosa (L.) Fenzl — Мшанка узловатая. На скалах
27
беломорских островов, занятых колониями чаек, встречается
не чаще, чем на скалах, где таковые отсутствуют. Однако в птичьих
колониях достигает более мощного развития. Высота ее здесь
до 15 см, число стеблей на один экземпляр — до 20 (при норме
3—7 см высоты и 5—10 стеблей). Мшанка приурочена к мелким
скальным трещинам и укореняется только в них. По ним осуще-
ствляется сток воды из вышерасположенных пресных или слабо-
солоноватых ванн. В птичьих колониях вода в таких ваннах
сильно нитрофицирована, и это определяет мощный рост мшанки.
Honkenya diffusa (Hornem.) A. et D. Love — Гонкения раски-
дистая. Ее сплошные дерновины встречаются среди фрагментов
первичной орнитогенной растительности песчаниковых приморских
скал о-ва Большой Айнов.
Spergularia marina (L.) Griseb. — Торичник морской. В ча-
ячьих колониях беломорских островов на приморских скалах
встречается редко. Растет по трещинам скал близ уреза воды
при приливе. В подобных местах селится только вблизи плотных
колоний чаек, по-видимому, потому, что только в этом случае
он может получить достаточное для него количество питательных
веществ. В обычных условиях растет на разлагающихся штормо-
вых выбросах.
Melandrium lapponicum (Simm.) Kuzen. — Смолевка лапланд-
ская (дрема лапландская). В массе произрастает во вторичных
орнитогенных ценозах вороничных торфяников Айновых и Гаври-
ловских островов, обычна для заброшенных тупичиных колоний.
Употребляется чайками для постройки гнезд.
Dianthus superbus L. — Гвоздика пышная. На беломорских
островах обычна для вторичных орнитогенных ценозов, располо-
женных среди вороничников, где растет небольшими куртинами
и отдельными экземплярами. Изредка укореняется в скалах,
занятых колониями чаек. Сухие стебли гвоздики используются
сизыми чайками в качестве гнездового материала. На островах
Восточного Мурмана встречается в местах обособленного гнездо-
вания отдельных пар крупных чаек.
Caltha palustris L. — Калужница болотная. На болотах
Айновых островов в местах гнездования серебристых чаек про-
израстает мощными куртинами и целыми зарослями, причем
размеры ее листьев здесь в 2—3 раза превышают обычные.
Там же, на кочкообразных возвышениях, образованных укоре-
нившейся калужницей, любят устраивать свои гнезда серебристые
чайки. На островах Восточного Мурмана ее орнитофильные
свойства существенно заметны только вблизи плотных и больших
колоний крупных чаек. В. Д. Коханов, Н. Н. Скокова (1967)
отмечают, что краснозобая гагара устраивает свое гнездо у кромки
озерной воды, между дерновинами калужницы.
Ranunculus hyperboreus Rottb. — Лютик гиперборейский.
На Семи Островах произрастает во вторичных орнитогенных
ценозах, расположенных на вороничном торфянике, но только
в переувлажненных блюдцеобразных понижениях.
28
R. repens L. — Л. ползучий. На осоково-разнотравных болотах
Айновых островов, где он обычен на участках колоний серебристых
чаек, растет очень мощными многостеблевыми экземплярами
и достигает высоты 80 см.
R. sceleratus L. — Л. ядовитый. На островах Кандалакшского
залива довольно обычен в скальных ваннах среди плотных колоний
серебристых чаек, где достигает мощного роста и развития.
R. polyanthemos L. — Л. многоцветковый. На островах Кан-
далакшского залива встречается в лентообразных дерновинах
вторичной скальной орнитогенной растительности.
Erysimum hieracifolium L. — Желтушник ястребинолистный.
На беломорских островах обычен для вторичных орнитогенных
ценозов, расположенных среди вороничников, а также для крлоний
чаек по береговой кромке. Изредка встречается в колониях на
скалах в качестве одного из компонентов лентообразных дерновин.
Draba incana L. — Крупка серая. Обычна во вторичных
орнитогенных ценозах, причем чаще произрастает по границе
вороничников со скалами. Может образовывать большие дер-
новины.
Cochlearia officinalis L. — Ложечница лекарственная (ложеч-
ная трава). Из Семи и Гавриловских островах образует заросли
в местах массового гнездования колониальных птиц. Они особенно
мощны на нежилых карнизах птичьих базаров и на площадках
над базарными обрывами. В орнитогенных ценозах имеет очень
хороший рост и развитие. Здесь ее высота достигает 20—40 см,
а диаметр листа до 10 см против 6—10 см высоты и 0.5—1 см
диаметра листа у экземпляров на приморских скалах, где нет
птичьих колоний. На Айновых островах ее роль в орнитогенных
ценозах менее значительна, а рост не столь гигантский.
С. arctica Schlecht. ex DC. — Л. арктическая. Орнитофильное
растение. На островах Кандалакшского залива изредка встре-
чается в чаячьих колониях на скалах, где растет по трещинам
в лентообразных дерновинах. Чаще всего здесь она произрастает
как примесь к другим орнитофильным видам. В орнитогенных
ценозах почти не обнаруживает более мощного роста.
Rhodiola rosea L. — Родиола розовая. На островах Кандалакш-
ского залива на приморских скалах в чаячьих колониях растет
в условиях резкого недостатка влаги в течение всего вегетацион-
ного периода, но при этом лишь там, где исключено ежегодное
окатывание скал осенними штормовыми волнами. В подобных
условиях обычна и обильна. Растет куртинами и лентами, приуро-
ченными к трещинам приморских скал. Куртина родиолы — это,
как правило, один разросшийся экземпляр. Она растет на неболь-
шой торфообразной подушке, скрепленной и удерживающейся
собственными корневищами (каудексами). При этом корни
родиолы проникают в трещины скал. В птичьих колониях боль-
шой плотности ее куртины смыкаются в ленты. В особо плотных
колониях родиола настолько разрастается, что образует сомкну-
тый первичный орнитогенный растительный покров. Родиола
29
Рис. 4. Гнездо гаги в колонии серебристых чаек на приморских скалах в кур-
тине Rhodiola rosea. О-в Воротиха, близ Кемь-Луд, Кандалакшский залив.
растет на птичьих колониях очень пышно. Здесь ее высота дости-
гает 40—60 см, а один экземпляр обычно имеет 100—200 стеблей
(иногда до 400). На приморских скалах, не испытывающих
заметного влияния морских колониальных птиц, ее высота состав-
ляет 15—25 см, а на один экземпляр приходится 10—20 стеблей.
К тому же здесь она растет очень рассеянно. Куртины и заросли ро-
диолы на приморских скалах, обязанные своему процветанию гнез-
дящимся здесь морским колониальным птицам (в основном сереб-
ристым чайкам), в свою очередь создают условия, способствующие
повышению эффективности их размножения, так как маленькие
птенцы могут прятаться от врагов в этой пышной растительности.
Сухие стебли родиолы используются серебристыми чайками
в качестве гнездостроительного материала. В ее куртинах, нахо-
дящихся в колонии серебристых чаек, любит гнездиться гага
(рис. 4).
R. arctica Boriss. — Р. арктическая. На Семи и Гавриловских
островах особенно мощна и обильна вблизи птичьих базаров
и на их нежилых карнизах. В остальных случаях растет в тех же
условиях и играет ту же роль, что и /?. rosea на Белом море.
На Айновых островах и орнитогенных ценозах приморских скал
менее обильна.
Sedum arce L. — Очиток едкий. На островах Кандалакшского
залива обычен для птичьих колоний приморских скал, где, подобно
родиоле, растет в условиях недостатка влаги в течение почти всего
вегетационного периода и в то же время там, где исключено резкое
воздействие на скалы морской воды (окатывание осенними штормо-
30
выми волнами). Часто сопутствует родиоле. Поселяется по краям
ленточного торфянистого слоя, занятого другими орнитофильными
растениями. Его стебли, разрастаясь, простираются на обнажен-
ную поверхность скал. Под ними накапливаются мелкие раститель-
ные остатки, экскременты, погадки. Все это способствует накопле-
нию органогенного субстрата, укоренению в нем других растений
и расширению лентообразных дерновин. Нередко очиток поселя-
ется в мелкой трещине, где и разрастается в дальнейшем. Обычен
очиток и на тех скалах, где морские птицы не гнездятся, но здесь
он растет единичными мелкими экземплярами и не образует
заметных дерновин. Очиток используется серебристыми чайками
при строительстве гнезд. Причем чайки приносят в гнезда живые
его стебельки, и он нередко в гнездах же продолжает вегетировать,
а в дальнейшем разрастается. Этим самым чайки способствуют
распространению очитка.
Saxifraga cespitosa L. — Камнеломка дернистая. На примор-
ских скалах островов Кандалакшского залива, занятых колониями
чаек, встречается нечасто. Произрастает на границе вороничников
со скалами. Может образовывать большие и мощные дерновины
(ширина 20—30 см, длина до 1 м), но обильное цветение в подоб-
ных дерновинах происходит далеко не ежегодно. В этом показате-
лен 1975 год, когда камнеломка очень обильно цвела, особенно
на приморских скалах, занятых колониями серебристых чаек.
В обычных условиях камнеломка растет маленькими дерновинками
на скалах, граничащих с приморскими.
Parnassia obtusiflora Rupr. — Белозор туполепестковый.
На островах Восточного Мурмана и Кандалакшского залива
встречается в плоских, переувлажненных, торфянистых пониже-
ниях на приморских скалах, занятых колониями чаек.
Ribes acidum Turcz. ex Pojark. — Смородина кислая. На остро-
вах Кандалакшского залива в вороничниках и на валунных
россыпях под пологом кустов смородины гнездится обыкновенная
гага, иногда длинноносый крохаль. Ягоды смородины поедают
серебристые чайки, однако существенного значения в их питании
они не имеют (Бианки, 1967).
Sorbus gorodkovii Pojark. — Рябина Городкова. Под пологом
густых кустарниковых рябин, встречающихся в вороничниках
островов Кандалакшского залива, гнездится обыкновенная гага.
Rubus chamaemorus L. — Морошка. На островах Мурмана
более обильна во вторичных орнитогенных ценозах вороничных
торфяников, чем в морошковом вороничнике. Лоток гнезда
короткохвостого поморника, полярной крачки, чернозобика,
кулика-воробья, турухтана нередко выстлан прошлогодними
морошковыми листьями (Коханов, Скокова, 1967). Ягоды мо-
рошки употребляют в пищу серебристые и сизые чайки, но они не
имеют существенного значения в их питании (Бианки, 1967).
Они же редкий осенний корм у тулеса (Белопольский и др., 1970).
R. saxatilis L. — Костяника. На островах Кандалакшского
залива сильно разрастается во вторичных орнитогенных ценозах,
31
испытывающих сильное воздействие гнездящихся птиц. Ягоды
костяники поедаются серебристыми и сизыми чайками, однако
они не имеют существенного значения в их питании (Бианки,
1967).
Comarum palustre L. — Сабельник болотный. На островных
озерах в его нередко чистых прибрежных плавающих зарослях
держатся выводки кряквы, шилохвости, широконоски, свиязи,
чирка-свистунка.
Potentilla egedii Wormsk. — Лапчатка Эгеде. Встречается
в чаячьих колониях на скалах у границы скальных ванн или же
в плоских переувлажненных понижениях, покрытых торфянистым
слоем.
Р. arctica Rouy — Л. арктическая. Являясь эндемом берегов
и островов Кандалакшского залива Белого моря, растет на примор-
ских скалах, в том числе и в птичьих колониях, где обильнее
цветет и достигает большего роста. Обычно селится по скальным
трещинам.
Rosa majalis Herrm. — Шиповник майский. В тундрообразных
ценозах и на приморских лугах островов Кандалакшского залива
изредка образует густую кустарниковую заросль, высота которой
определяется мощностью снежного покрова. Под этим пологом
устраивают свои гнезда камнешарка и обыкновенная гага, а из
сухопутных птиц — белая куропатка.
Vicia cracca L. — Горошек мышиный. На Чаячьей луде (архи-
пелаг Заяцкие луды в Кандалакшском заливе) част и обилен
на локальных травянистых участках вторичной орнитогенной
растительности, расположенных среди вороничника. На той же
луде широко используется серебристыми чайками при устройстве
гнезд. Для Кольского Севера мышиный горошек — заносное
растение. Попав на Чаячью луду, он натурализовался там и,
В массе размножившись, изменил даже физиономию острова.
Он не только стал фоновым растением фрагментов вторичных
орнитогенных ценозов, но и сильно засоряет вороничник, а на дне
даек, в щелевых лощинах, образует мощные заросли.
Lathyrus aleuticus (Greene) Pobed. — Чина алеутская (мор-
ская). Ее бобы с недозрелыми семенами — излюбленный корм
гуменников на осеннем пролете в Кандалакшском заливе. На Чая-
чьей луде (архипелаг Заяцкие луды) довольно обычна во фрагмен-
тах вторичной орнитогенной растительности, расположенных
среди вороничника.
L. palustris L. — Ч. болотная. На Чаячьей луде (архипелаг
Заяцкие луды в Кандалакшском заливе) довольно обычна во
фрагментах вторичной орнитогенной растительности, расположен-
ных среди вороничника.
Empetrum nigrum L., Е. hermaphroditum Hagerup — Водяника
черная, в. обоеполая (вороника). На Айновых островах произ-
растает только Е. nigrum, на остальной части области — Е. her-
maphroditum, а Е. nigrum возможна как редкая примесь. Под ве-
точным переплетенным вороничным пологом устраивает свои
32
гнезда камнешарка, веточки вороники широко используют при
строительстве гнезд серебристые, большие морские, сизые чайки
и особенно большие бакланы, а ее листочками выстилают гнезда
полярные крачки. Ягоды вороники играют существенную роль
в питании серебристых и сизых чаек (Бианки, 1967; Коханов,
Скокова, 1967), на осеннем пролете—средних крохалей, на
осеннем и весеннем пролетах — гуменников, а у золотистой
ржанки и малого веретенника они сезонный попутный корм
(Коханов, Скокова, 1967; Белопольский и др., 1970).
Epilobium palustre L. — Кипрей болотный. На островах
Кандалакшского залива обычен в переувлажненных торфянистых
понижениях приморских скал, занятых колониями чаек. Достигает
30 см высоты.
Chamerion angustifolium (L.) Holub— Иван-чай узколистный.
Заселяет бывшие участки птичьих колоний, расположенных на
вороничных торфяниках. Особенно обилен на заброшенных
участках колоний тупиков на Айновых островах, где образует
густые заросли. Там же, на Айновых островах, в его зарослях
гнездится обыкновенная гага и иван-чай хорошо скрывает ее
гнездо (Коханов, Скокова, 1967).
Anthriscus silvestris (L.) Hoffm. — Купырь лесной. Обычный
вид колосникового кочкарника Айновых островов — места массо-
вого гнездования серебристых и сизых чаек. Здесь, а также на
крупнотравных лугах этих островов достигает мощного роста
(до 120—150 см высоты). В его зарослях гнездится обыкновенная
гага, и они же великолепные укрытия для затаивающихся птенцов
серебристых чаек. Однако в сохранении птенцов заросли купыря
играют и большую отрицательную роль: во время нередких здесь
холодных продолжительных дождей у птенцов настолько намокает
перо и пух, что они гибнут. Особенно такие заросли губительны
для птенцов полярной крачки (Коханов, Скокова, 1967). Сухие
стебли купыря используются при гнездостроении серебристой
и сизой чайкой, полярной крачкой, турпаном, обыкновенной гагой.
Ligusticum scoticum L. — Лигустикум шотландский. Растет
в чаячьих колониях приморских скал по берегам пресных скальных
ванн или там, где по трещинам просачивается вода из вышераспо-
ложенных ванн. При этом может образовывать как куртины, так
и лентообразные дерновины, а иногда и небольшие заросли.
На островах Восточного Мурмана, кроме того, обычен для вторич-
ной орнитогенной растительности щелевых лощин. В орнитогенных
ценозах имеет мощный рост (высота до 1 м против обычной — 20—
50 см) и крупный лист. Служит убежищем для птенцов чаек.
Conioselinum tataricum Hoffm. — Гирчовник татарский.
На островах Кандалакшского залива изредка произрастает на
приморских скалах в колониях чаек, где обнаруживает более
мощный рост по сравнению с обычными условиями.
Angelica archangelica L. — Дудник дягилевый (дягиль).
На Айновых островах обычен в понижениях между кочками
колосникового кочкарника — в излюбленном месте гнездования
ЗИП Бреслина
33
серебристых и сизых чаек. На островах Восточного Мурмана
произрастает во вторичных орнитогенных ценозах щелевых
лощин, а также по берегам сильно нитрофицированных скальных
ванн и озерков, располагающихся в местах или вблизи птичьих
колоний. На островах Кандалакшского залива обычен для чаячьих
колоний на приморских скалах, где занимает берега пресных ванн
и переувлажненные торфянистые дерновины. Во всех этих место-
обитаниях достигает очень мощного роста (высота 1.5—2 м).
В Кандалакшском заливе вдоль кромки берега и на приморских
лугах, если там расположены колонии серебристых и сизых чаек,
дягиль растет в заметно большем обилии, чем на таких же участках,
но где нет колоний. Высота его на таких лугах 80—150 см. Дягиль
является отличным укрытием для птенцов чаек. Однако на Айно-
вых островах, как это было уже описано в случае с купырем, его
густая, мокрая от дождей листва может погубить птенцов (Коха-
нов, Скокова, 1967). В зарослях дягиля гнездятся обыкновенная
гага, турпан, синьга, длинноносый крохаль. На островах Канда-
лакшского залива гнездящаяся на приморских скалах в колониях
чаек обыкновенная гага предпочитает устраивать свои гнезда
в зарослях дягиля. Крупные, жесткие, сухие стебли дягиля исполь-
зуются большими бакланами на островах Кандалакшского
залива при постройке гнезд.
Heracleum sibiricum L. — Борщевик сибирский. На беломор-
ских островах обычен для птичьих колоний, расположенных
вдоль кромки берега. Является неплохим укрытием для гнездя-
щихся гаг и для затаивающихся птенцов чаек.
Chamaepericlymenum suecicum (L.) Aschers. et Graebn. —
Дерен шведский. Его сухим листом изредка выстилают свои
гнезда полярные крачки, а в низкорослых густых зарослях пря-
чутся их птенцы. Ягоды употребляются в пищу серебристыми
чайками, но в их питании они не имеют существенного значения
(Бианки, 1967).
Ledum palustre L. — Багульник болотный. На лесных остро-
вах Кандалакшского залива в густом багульнике ельника багуль-
никово-черничного иногда устраивает гнезда обыкновенная гага,
а при ее гнездовании под еловыми ветвями растущий здесь же
багульник дополнительно маскирует гнездо (Герасимова, Бара-
нова, 1960).
Arctous alpina (L.) Niedz.— Арктоус альпийский. Ягоды
обнаружены в желудках кряквы (В. В. Бианки, устное сообщение).
Vaccinium myrtillus L. — Черника. Ягоды употребляются
в пищу серебристыми и сизыми чайками, но они в их питании
не имеют существенного значения (Бианки, 1967). Средний
кроншнеп на осеннем пролете (конец июля—август) кормится
ягодами черники, растущей пятнами на неприморских скалах,
в тундрообразных вороничных ценозах и в других открытых
местах (визуальные наблюдения). Высокие и густые заросли
ее в ельниках и сосняках-черничниках дополнительно маскируют
гнездо гаги, расположенное под ветвями елей.
34
V. uliginosum L. — Голубика. Ягоды употребляются в пищу
серебристыми и сизыми чайками, но они, по-видимому, не имеют
существенного значения в их питании. Веточки голубики исполь-
зуются сизыми, реже серебристыми чайками в качестве строитель-
ного материала для гнезд. На островах Кандалакшского залива
в колониях чаек значительно лучше вороники выносит вытапты-
вание и при умеренной нагрузке разрастается и нередко растет
вместе с травянистыми орнитофильными растениями.
V. vitis-idaea L. — Брусника. Ягоды употребляют в корм
серебристые и сизые чайки, но они не имеют существенного значе-
ния в их питании (Бианки, 1967). В большом количестве кормятся
ее ягодами пролетные гуси при их остановках на вороничных
лудах. Для среднего кроншнепа они — попутный корм (Бело-
польский и др., 1970). Веточки брусники используются серебри-
crbfAfffy реже сизыми чайкамк в качестве гнездового строительного
материала. Сухим брусничным листом полярная крачка, камне-
шарка, а иногда и кулик-сорока выстилают лунку своего гнезда,
изредка среди веточек брусники устраивает свои гнезда камне-
шарка.
Oxycoccus palustris Pers. — Клюква болотная. На весеннем
пролете гуменники кормятся подзимней клюквой, растущей по
приморским болотцам островов и материковой полосы Канда-
лакшского залива (визуальные наблюдения).
Trientalis europaea L. — Седмичник европейский. Обычен на
участках вытоптанных птицами вороничников. В подобных местах
особенно обилен на Семи и Айновых островах.
Menyanthes trifoliata L. — Вахта трехлистная. На островных
озерах в воде среди прибрежных зарослей держатся выводки
гоголя и речных уток. На Айновых островах в береговых зарослях
вахты в первые дни после вылупления обитают выводки кругло-
носого плавунчика (Коханов, Скокова, 1967). Вахта обнару-
жена в желудках чирка-свистунка (В. В. Бианки, устное сооб-
щение) .
Mertensia maritima (L.) S. F. Gray — Мертензия морская.
Как в обычных условиях, так и в колониях чаек растет на прибреж-
ных песчаных, галечниковых или валунных берегах, но в птичьих
колониях островов Кандалакшского залива обнаруживает зна-
чительно больший рост и мощное развитие.
Veronica longifolia L. — Вероника длиннолистная. На островах
Кандалакшскогозалива изредка встречается посреди вороничников
во фрагментах вторичных орнитогенных ценозов в колониях
серебристых и сизых чаек. На приморских лугах в ее густом
травостое гнездится обыкновенная гага.
Euphrasia frigida Pugsl. — Очанка холодная. Обычна для
вторичных орнитогенных ценозов на вороничном торфянике.
Rhinanthus minor L. — Погремок малый. На островах Канда-
лакшского залива встречается во вторичных скальных орнитоген-
ных ценозах, изредка во вторичных орнитогенных ценозах торфя-
ника.
3
35
Plantago maritima L., P. schrenkii C. Koch — Подорожник
морской, п. Шренка. На Семи Островах обычны и обильны во
вторичных орнитогенных ценозах, возникших на месте воронич-
ников. И на Семи Островах и на островах Кандалакшского залива
изредка встречаются в птичьих колониях на приморских скалах,
где чаще растут по трещинам в нижнем поясе скал. На весеннем
и осеннем пролетах охотно поедаются гуменниками. По данным
А. И. Флерова (устное сообщение), птенцы свиязи, вскармливае-
мые человеком, из растительных кормов наряду с резкой три-
остренника морского предпочитали и резку подорожника морского.
Valeriana sambucifolia Mikan f. — Валериана бузинолистная.
На Айновых островах, помимо своего основного произрастания
на разнотравно-злаковых лугах, растет также и процветает на
болотах, в местах гнездования серебристых чаек.
Campanula rotundifolia L. — Колокольчик круглолистный.
На островах Кандалакшского залива обычен для вторичных
орнитогенных ценозов среди вороничников, где растет чаще
всего небольшими куртинами, а также для лентообразных дерно-
вин вторичной скальной орнитогенной растительности, занятых
колониями чаек. Используется для строительства гнезд сизыми,
реже серебристыми чайками.
С. groenlandica Berlin — К. гренландский. Произрастает на
островах Восточного Мурмана в орнитогенных ценозах и, как
и предыдущий вид, в Кандалакшском заливе, но встречается
гораздо реже. В тех же целях, но в значительно меньшем коли-
честве используется серебристыми и сизыми чайками.
Solidago lapponica With. — Золотарник лапландский. На остро-
вах Восточного Мурмана мощно разрастается в щелевых лощинах,
в местах обитания птенцов крупных чаек.
Tripolium vulgare Nees — Триполиум обыкновенный (морская
астра). На островах Кандалакшского залива встречается в ко-
лониях серебристых чаек, расположенных обычно на приморских
скалах, куда нередко во время осенних штормов обрушивается
морская волна. Изредка морская астра растет и среди куртин
ромашки и родиолы. Селится она, как и большинство орнитофиль-
ных растений, по трещинам скал. Однако она укореняется не
в растительных дерновинках, лежащих на поверхности скал
и потерявших или почти потерявших связь с трещинами, к которым
они приурочены, а в самих трещинах. Густых, смыкающихся
куртин морская астра не образует, однако растет в колониях
чаек очень пышно, имеет множество стеблей (до 20—35), листьев,
цветков. Ее высота нередко достигает 40—60 см, а ширина
листьев 4—7 см против обычного — 1—2 см. На ее пышное раз-
витие в чаячьих колониях Кемь-Лудского архипелага указывали
также Н. Е. Богданова и В. Н. Вехов (1969а). Серебристые чайки
иногда используют стебли морской астры как гнездовой материал.
Achillea apiculata Orlova — Тысячелистник остроконечный.
На островах Кандалакшского залива обычен для колоний преиму-
щественно сизых чаек, расположенных на вороничниках, в свою
36
очередь лежащих вдоль береговой кромки. Используется сизыми
чайками при строительстве гнезд.
Matricaria hookeri (Sch. Bip.) Czer. — Ромашка крупноцветко-
вая. На островах Мурмана обычна и обильна в различных орнито-
генных ценозах, особенно на свеженарушенных почвах, в частности
в колониях тупиков, где нередко образует различной густоты,
почти чистые аспектирующие заросли. Растет и на приморских
скалах, занятых чаячьими колониями; очень крупные ее куртины
постоянны на нежилых карнизах птичьих базаров. На островах
Кандалакшского залива обычна в колониях серебристых чаек,
расположенных на рыхлых морских отложениях (песчаных
и песчано-каменистых); нередко встречается и в колониях на
скалах (особенно в среднем поясе приморских скал)-, где пред-
почитает несколько увлажненные и сильно нитрофицированные
участки по трещинам скал. В орнитогенных ценозах достигает
мощного роста и развития (высота до 80 см, 20—40 стеблей
на один экземпляр). Служит хорошим укрытием для затаиваю-
щихся птенцов. Широко используется крупными чайками при
строительстве гнезд. На Гагаркиной луде (район Заяцких луд
в Кандалакшском заливе) большой баклан широко использовал ее
жесткие живые стебли для летней достройки гнезд.
Tanacetum vulgare L. — Пижма обыкновенная. На островах
Кандалакшского залива произрастает в птичьих колониях, распо-
ложенных на рыхлых морских отложениях, чаще вдоль кромки
берега. Является хорошим укрытием для затаивающихся птенцов
чаек. В зарослях пижмы устраивает гнезда обыкновенная гага.
Dendranthema hultenii (A. et D. Love) Tzvel. — Дендрантема
Гультена. На Семи и Гавриловских островах встречается как
примесь в орнитогенных ценозах, особенно вблизи птичьих база-
ров.
Senecio integrifolius (L.) Clairv. — Крестовник полевой. На ос-
тровах Восточного Мурмана, Кандалакшского залива произрастает
в вороничниках, испытывающих слабое воздействие гнездящихся
поблизости морских колониальных птиц.
Sonchus humilis Orlova — Осот приземистый. На островах
Кандалакшского залива обычен и обилен в колониях, располо-
женных на рыхлых отложениях (кромка берега, приморский луг).
Изредка растет на занятых чаячьями колониями приморских
скалах. Предпочитает участки близ солоноватых луж и близ
уреза воды при приливе, но там, где исключен волнобой. Сухие
стебли осота используются серебристыми чайками как гнездовой
строительный материал.
Crepis nigrescens Pohle — Скерда черноватая. На островах
Кандалакшского залива селится в хорошо сформированных
дерновинах, располагающихся по трещинам приморских скал
в чаячьих колониях. Чаще всего растет вместе с Rhodiola rosea
в местах, где исключено окатывание штормовыми волнами. Сухие
веточки скерды используются серебристыми чайками в качестве
гнездового строительного материала.
37
Помимо вышеперечисленных цветковых растений, с жизне-
деятельностью водоплавающих птиц связаны и многие водоросли,
мхи, лишайники и даже грибы.
Зеленые, бурые и красные водоросли встречаются в питании
чайковых и обыкновенной гаги. Нередко чайки, особенно сереб-
ристые, используют при постройке гнезд выброшенные прибоем
водоросли из родов Fucus и Ahnfeltiae. Из крупных экземпляров
их, а также из водорослей родов Laminaria и Alaria дёлают свои
массивные гнезда бакланы.
Гнезда серебристых и сизых чаек преимущественно состоят
из мхов и лишайников. Наиболее обычны из них Drepanocladus
uncinatus (Hedw.) Warnst., Hylocomium splendens (Hedw.) B. S.
G. Schimp. et Gumb., Pleurozium schreberi (Brid.) Mitt., Dicranum
sp., Cladonia alpestris (L.) Rabenh., C. mitis Sandst., C. rangiferina
(L.) Web., C. uncialis (L.) Web., Cetraria nivalis (L.) Ach.,
C. islandica (L.) Ach.
К орнитофильным растениям нужно причислить одноклеточ-
ные зеленые водоросли, к сожалению, оставшиеся неопределен-
ными, тонким слоем одевающие влажные вертикальные скалы
в местах больших скоплений птиц, а также лишайник Xanthoria
poly car pa (Ehrh.) Riber и мох Drepanocladus incinatus.
Xanthoria polycarpa очень широко распространена в птичьих
колониях, где корочкой покрывает сухие отвесные скалы. Drepa-
nocladus incinatus повсеместно встречается на приморских скалах
в чаячьих колониях небольшой плотности, а также на месте былых
больших и ныне резко деградирующих колоний. Он поселяется
обычно в верхней части скал, не испытывающих заметного воздей-
ствия морской воды. Здесь он растет в различных дерновинах,
нередко в дерновинах Rhodiola и, в Кандалакшском заливе,
Sedum acre. Разрастаясь ковром, может одевать скалы, чем
способствует формированию сомкнутой первичной орнитогенной
растительности. Растет Drepanocladus uncinatus также на
границе разомкнутой орнитогенной растительности скал и ра-
зомкнутых же пятен вороники на этих скалах. Он обычен и для
вторичной орнитогенной растительности торфяников, где посе-
ляется на месте вытоптанной птицами вороники. Следует упомя-
нуть и о редких находках шампиньонов — Agaricus campestris
Fr. В разные годы этот вид был встречен на о-ве Зеленом (Кемь-
Луды, Кандалакшский залив) в колонии серебристых чаек на
высоких приморских скалах, в дерновине из Cochlearia officinalis.
Для своей жизнедеятельности водоплавающие птицы исполь-
зуют растения с теми или иными нужными им свойствами. Каковы
они?
Ремизные растения. Густая, сомкнутая, расположенная почти
у самой земли крона кустарников (Salix phylicifolia, Ribes acidum)
и деревьев кустарникообразной формы роста (Betula spp., Sorbus
gorodkovii) — очень надежное укрытие для гнезд гаги, длинноно-
38
сого крохаля, турпана, некоторых речных уток. Они почти
несвойственны островам Восточного Мурмана, на Айновых
островах же образуют даже кустарниковые заросли. Одинокие
кустарники очень характерны для безлесных островов Кандалакш-
ского залива. Растущие там же, на беломорских островах,
одинокие хвойные деревья (Picea abies, Р. obovata, Pinus friesiana)
стланиковой, полустланиковой, а также различной другой ветро-
вой формы роста хотя и не имеют столь густой приземной кроны,
однако их нижние, нередко распростертые над землей ветви
и изогнутые стволы достаточно надежно скрывают гнезда этих
уток, создавая при этом должный маскировочный эффект.
Спускающиеся до самой земли еловые ветви с густой хвоей
и вся лесная обстановка ельников на островах Северного архипе-
лага Кандалакшского залива создают идеальные условия для
гнездования гаги.
Густой полог наших тундровых кустарничков: 'Empetrum,
Vaccinium vitis-idaea, стелющегося, кустарничковой формы Junipe-
rus sibirica, способен надежно прикрыть гнездо камнешарки,
создать над ним как бы естественную крышу.
Травостои приморских лугов, особенно заросли Leymus
arenarius, Alopecurus arundinaceus, куртины Angelica archange-
lica, Tanacetum vulgare, Heracleum sibiricum, достаточно хорошо
маскируют гнезда уток и морских куликов, хотя нередко здесь
гнездо с воздуха открыто или полуоткрыто. В этом случае хороший
маскировочный эффект достигается зрительным невосприятием
окраски птицы на фоне нередко разреженного, но высокого,
состоящего из живых и прошлогодних стеблей травостоя. Способ-
ность надежно укрыть или замаскировать гнездо — одно из
важнейших свойств ремизных растений.
Второе, не менее важное их свойство — создать хорошее
укрытие для птенцов или же способствовать маскировке затаиваю-
щегося птенца.
В колониях серебристых и сизых чаек их птенцы весьма
успешно прячутся в очень мощных куртинах Rhodiola, Matricaria
hookeri, Ligusticum scoticum, Melandrium lapponicum, Angelica
archangelica и других растений, очень мощных потому, что они
растут в специфических условиях чаячьих колоний.
Птенцы полярной крачки предпочитают затаиваться при
опасности и становятся при этом почти незаметными на фоне
окружающих растений — Empetrum spp., Juniperus sibirica,
Chamaepericlymenum suecicum, луговых злаков и др.
Идеальные защитные условия для выводков многих видов уток
создает сочетание открытой воды и достаточно, но не чрезмерно
густого травостоя на сильно обводненных болотах, по зарастаю-
щим берегам островных озер (рис. 5), в тростниковых зарослях
кутов морских губ.
Однако здесь же надо особо отметить пышную травянистую
растительность Айновых островов и указать на ее двоякую роль
в сохранении потомства чаек: с одной стороны, она представляет
39
Рис 5 Заросль водных растений близ топкого берега оз. Островного. О-в Лодей-
ный, Северный архипелаг, Кандалакшский залив.
собой великолепный ремиз, с другой — она губительна для птенцов
чаек и полярной крачки, которые нередко гибнут в густой мокрой
зелени при довольно обычных здесь затяжных холодных дождях
(Коханов, Скокова, 1967).
Гнездостроительные растения. Чем руководствуются птицы,
выбирая растения для постройки своих гнезд?
Обыкновенная гага растительную основу своего гнезда создает
из тех растений, которые произрастают в самом месте расположе-
ния гнезда. Если гнездо в Leymus arenarius, то это его прошлогод-
няя солома, если под Betula spp. или под Picea spp. — их веточки.
Гнездо полярной крачки—это «мелкая лунка со скудной
подстилкой из ,,подручного растительного материала11. Устройство
подстилки или ее увеличение может производиться и во время
насиживания» (Бианки, 1967, с. 228). Наши данные подтверждают
соответствие ботанического состава подстилки ее гнезда с геобо-
танической характеристикой конкретного места гнездования.
Серебристые и сизые чайки гнездовой материал уже приносят,
однако не издалека, а с близлежащих участков, часто с территории
самой колонии. Они предпочитают брать для постройки гнезда
достаточно мягкие прошлогодние растительные остатки.
Бакланы, наоборот, при строительстве гнезда используют
прямо противоположные свойства наших растений.
Если чайкам, особенно сизым, для гнезд нужен материал
упругий и мягкий, то баклану необходимы жесткие, каркасные
40
растения. Их гнезда состоят из грубых, затвердевших на воздухе
водорослей, выброшенных морем палок, а также жестких стеблей
Angelica archangelica, проволокоподобных, неоднолетних стеблей
Empetrum hermaphroditum и других кустарничков. А когда доста-
точно жесткого материала не хватает, они используют даже круп-
ные живые стебли Matricaria hookeri (баклан достраивает свое
гнездо в течение всего времени гнездования).
Кормовые растения. Подавляющее большинство видов птиц,
так или иначе связанных с водной средой, питается главным
образом животными кормами. Растительноядны только некоторые
представители пластинчатоклювых (речные утки, гуменники, ле-
беди). Однако и многие плотоядные птицы в той или иной мере
употребляют растительные корма. В. В. Бианки (устное сообще-
ние) считает, что для многих из них растения не являются
источником энергии, а служат, видимо, только для получения
некоторых витаминов, микроэлементов и других «добавок».
Среди кормовых растений для связанных с водной средой
птиц можно выделить ягодные растения, галофиты и болотно-
водные растения.
Ягодный корм сочен, богат витаминами и легко усвояемыми
сахарами. К тому же ягоды весьма урожайны. В Кандалакшском
заливе на безлесных островах наиболее урожайна вороника —
Empetrum hermaphroditum, в меньшей мере брусника —Vactinium
vitis-idaea (Барыкина, 1969). На островах Мурмана наряду с во-
роникой очень урожайна морошка (Бреслина, 1970). Питатель-
ная ценность, сочность и доступность ягод — вот основные
причины потребления их как растительноядными, так и многими
плотоядными водоплавающими птицами.
Галофиты — Triglochin maritimum, Puccinellia, Carex subspa-
thacea, Juncus atrofuscus ssp. gerardii, Salicornia ssp., Plantago
maritima — излюбленный корм гуменников и речных уток. Они
охотно поедают их мясистые солоноватые побеги. Распространены
галофиты в Кандалакшском заливе в верхней части литорали,
но особенно много их в защищенных от волнобоя местах.
Урожайность их невелика, поскольку в наших условиях они
растут чаще разреженными зарослями. Так, травостои Carex
subspathacea дают воздушно-сухой фитомассы с 1 м2 0.53 кг,
Puccinellia asiatica — 0.32, Plantago maritima — 0.23, Juncus
atrofuscus ssp. gerardii 0.42, а разреженный травостой Triglochin
maritima — 0.17 кг. Но наземная биомасса галофитов побережья
Кандалакшского залива вполне обеспечивает сочным солоноватым
кормом и пролетных гуменников, и гнездящихся на островах
и побережье речных уток, и даже многих наших млекопитающих.
Однако вопрос об употреблении в пищу птицами, связанными
с водной средой, травянистых частей тех или иных растений изучен
далеко не достаточно, и следует воздержаться от каких-либо попы-
ток их аналитического рассмотрения.
Орнитофильные растения растут в птичьих колониях в не-
одинаковых экологических условиях, что отражает особенности
41
их биологии и их требования к каждому из экотопов. В условиях
островов Мурмана и Кандалакшского залива не существует
облигатных орнитофилов. Все они растут вне птичьих колоний
в тех или иных, отвечающих их экологии местообитаниях (Брес-
лина, 1979, 1981). Поселение же здесь этих, а не любых случайных
видов свидетельствует об очень специфических условиях в коло-
ниях. Наиболее заметна эта специфичность на приморских скалах,
особенно в непосредственной близости от птичьих базаров, на дру-
гих участках колоний она не проявляется столь ярко.
Богатство субстрата объединяет разные и во многом непохожие
участки колоний. Разнятся они между собой: по водному режиму,
засоленности (неодинаковому воздействию морской воды), по раз-
личной степени задерненности растительным покровом.
По своим экологическим требованиям 1 орнитофильные расте-
ния можно объединить в следующие группы: типичные галофиты,
умеренные галофиты, нитрофил ы-гал офиты, нитрофил ы-влаго-
любы, нитрофилы-сухолюбы, сухолюбы и растения формирую-
щихся песчаных почв.
Все растения группы типичных галофитов (Гripoliutn vulgare,
Plantago maritima, P. schrenkii, Puccinellia pulvinata, P. capilla-
ris, P. coarctata) в обычных условиях растут в зоне ежедневного
или почти ежедневного затопления на более или менее богатых
органическими веществами, чаще всего заиленных почвах.
На птичьих колониях необходимые питательные вещества эти
растения в избытке получают с пометом птиц. Эта некоторая
засоленность субстрата, на котором они растут, и привлекает их
к птичьим колониям.
Растения группы умеренных галофитов (Ligusticum scoticum,
Mertensia maritima, Honkenya diffusa, Alopecurus arundinacea,
Agrostis straminea, Ledum palustre) предпочитают солоноватые
участки и положительно реагируют на обогащение субстрата.
Благодаря этим экологическим требованиям они и поселяются
в слабо засоленных местах колоний. Однако их потребности
в увлажнении неодинаковы, и если Ligusticum scoticum пред-
почитает слабо увлажненный субстрат, то Honkenya diffusa
и Leymus arenarius хорошо могут расти в местах, испытывающих
периодический недостаток влаги.
Нитрофил ы-галофиты (Cochlearia officinalis, С. arctica,
Matricaria hookeri, Spergularia marina, Sonchus humilis,
виды рода Atriplex) в обычных условиях предпочитают расти
на штормовых выбросах, т. е. на наиболее богатых органическими
веществами и одновременно достаточно засоленных участках.
Повышенная требовательность этих растений к богатству суб-
страта и привлекает их к птичьим колониям. Все они достаточно
требовательны к увлажнению и потому предпочитают занимать
участки, не испытывающие постоянного резкого недостатка влаги.
1 Имеются в виду экологические требования растений в условиях островов
Мурмана и Кандалакшского залива Белого моря.
42
Нитрофилы-влаголюбы (Catabrosa aquatica, Caltha palustris,
Angelica archangelica, Rumex aquaticus, R. pseudonatronatus,
Montia fontana, Sagina nodosa, Potentilla egede, Parnassia obtu-
siflora, Epilobium palustre, Valeriana sambucifolia, Anthriscus
silvestris, Conioselinum tataricum) в той или иной мере предпочи-
тают богатый, избыточно или сильно увлажненный и в то же время
малозасоленный субстрат. Подобные условия возникают на высо-
ких приморских скалах островов Кандалакшского залива , с не-
ровным микрорельефом,в щелевых лощинах островов Восточного
Мурмана, на болотах Айновых островов, по берегам скальных
ванн, на приморских лугах.
Нитрофилы-сухолюбы (Rhodiola arctica, R. rosea, Sedum acre,
Crepis nigrescens, Potentilla lapponica) на птичьих колониях
предпочитают участки с постоянным недостатком влаги. Им
достается только влага, аккумулированная тонким торфяным
слоем во время дождей и снеготаяния. В обычных условиях они
предпочитают аналогичные в смысле увлажнения участки.
На богатом субстрате скал, занятых колониями птиц, они пышно
разрастаются.
Растения группы сухоторфолюбов (Rumex acetosella В
tenuifolius, Chamanerion angustifolium, Melandrium lapponicum,
Campanula groenlandica, C. rotundifolia, Dianthus superbus,
Veronica longifolia, Saxifraga cespitosa, Euphrasia frigida, Tri-
entalis europaea) характерны в основном для вторичной орнито-
генной растительности сухих торфяников, где они поселяются
на месте вытоптанных птицами или же без вытаптывания погиб-
ших от обилия помета вороничников. Все они мирятся с перемен-
ностью, а нередко и с недостатком увлажнения, столь обычным
для торфяного слоя приморских вороничников и приморских скал.
Поэтому они легко селятся на месте вороники вытоптанной или же
отмершей от обильного удобрения пометом, с которой сами они
в обычных условиях не могут конкурировать. На беломорских
островах, судя по видовому составу вторичной орнитогенной
растительности, как правило, нет слишком богатых почв,
по-видимому, из-за небольшой плотности гнездования.
В группу растений формирующихся песчаных почв включены
Erysimum hieracifolium, Heracleum sibiricum, Tdnacetum vulgare,
Achillea apiculata. Все они характерны для птичьих колоний
песчаной кромке берега, а желтушник также и для вторичной
орнитогенной растительности. Все перечисленные растения, хотя
ных. Однако в колониях птиц они обнаруживают более мощный
рост. В местах, не испытывающих регулярного воздействия
гнездящихся птиц, они растут на формирующихся каменисто-
песчаных почвах. На птичьи колонии их привлекает обогащенность
субстрата и нарушенность почв, на которых легче поселиться,
не испытывая при этом конкуренции со стороны других видов.
43
Глава 3
РОЛЬ РАСТИТЕЛЬНОСТИ в жизни МОРСКИХ птиц
УТИНЫЕ
Обыкновенная гага
Обыкновенная гага — наиболее хозяйственно ценная птица
островов Кольской Субарктики. В Кандалакшском заливе она
самая многочисленная, на островах Мурмана ее численность
достаточно велика.
Приуроченность ее гнездования к тем или иным экотопам
в Кандалакшском заповеднике изучено достаточно полно, и этому
вопросу посвящена обширная литература (Благосклонов, 1960;
Герасимова, Баранова, 1960; Бианки, Бойко, 1968; Бианки, 1972;
Татаринкова, 1981, и др.). Подробно освещено использование
гагой различных конкретных укрытий (Герасимова, Баранова,
1960).
В Кандалакшском заливе большинство гаг гнездится на остро-
вах Северного архипелага, где их предпочтительные гнездовые
экотопы — ельники (рис. 6) на сравнительно небольших (до
100 га) островах.
Собственные исследования других архипелагов островов
Кандалакшского залива, многие из которых были присоединены
к заповеднику в последние десятилетия, позволили расширить
и изменить наши представления как о предпочтительных гнездо-
вых экотопах обыкновенной гаги, так и о степени использования ею
растительных укрытий.
На всех других архипелагах Кандалакшского залива, кроме
Северного, гага избегает лесистых островов. Если эти архипелаги
находятся в губах (заливах), например в Порьей или в Кузо-
коцкой, то гага гнездится преимущественно на небольших без-
лесных островах (лудах); если они прибрежные, например Кемь-
Луды, — то как на мелких, так и на крупных тундрового
или лесотундрового облика островах, расположенных ближе к от-
крытой части залива. В архипелагах, лежащих вдали от берегов,
гага в равной мере занимает как крупные тундрообразные острова,
так и баклыши — мелкие скалистые островки, если они не на-
столько мелки, чтобы их захлестывали летние штормовые волны.
Это скорее всего можно объяснить тем, что в Кандалакшском
заливе существует не одна популяция обыкновенной гаги и поведе-
ние во время выбора места гнезда у гаги Северного архипелага
отлично от привычек гаг, гнездящихся в других архипелагах
залива (Ф. Н. Шкяревич, устное сообщение).
44
Рис. 6 Ельник — основной гнездовый экотоп обыкновенной гаги на островах
Северного архипелага в Кандалакшском заливе.
Учет приуроченности гнезд гаги к различным экотопам
(табл. 2) показал, что в условиях прибрежного Кемь-Лудского
архипелага гага предпочитает гнездиться в открытых безлесных
местах (вороничная тундрообразная растительность, валунная
россыпь, скалы приморские и неприморские, приморские луга),
несмотря на то что на архипелаге есть много кривоствольных
березняков и еловых лесных куртин (о-в Красный, где гага почти
не гнездится, во внимание не принимается).
Однако в самих этих открытых экотопах гага стремится ис-
пользовать всевозможные укрытия растительного, геологического
или же антропогенного происхождения. Именно в таких укрытиях
было обнаружено три четверти ее гнезд (табл. 2). Причем
в укрытиях растительного происхождения гнездилась только треть
гаг архипелага (32.3%).
Т. Д. Герасимова и 3. М. Баранова (1960) классифицировали
гнезда гаги по характеру их расположения и по степени укрытости
их. Принимая во внимание эту классификацию и во многом руко-
водствуясь ею, мы проанализировали по экотопам различные
группы укрытий (полуукрытий) с целью выяснения роли расти-
тельности для гаги в период ее гнездования (табл. 3—5).
Укрытия растительного происхождения — это одиночные
деревья или кустарники (Picea abies, Р. obovata, Pinus friesiana,
Betula callosa, B. subarctica, B. tortuosa, B. concinna, Sorbus
gorodkovii, J uniper us sibirica, Ribes acidum, Salix phylicifolia,
45
Таблица 2
Расположение в различных укрытиях гнезд обыкновенной гаги и их распределение по экотопам
(Кемь-Луды, 1978 г.)
Экотоп Расположение гнезд Всего
открыто в укрытиях
среди растительности вне растительности растительных геологических антропогенных число %
число % число % число % число °/ /0 число %
Тундрообразная растительность 32 9.8 — — 19 5.8 42 12.7 — — 93 28.3
Валунная россыпь 4 1.2 11 3.3 12 3.6 — — — — 27 8.1
Скалы неприморские 14 4.3 2 0.6 19 5.8 46 13.9 — — 81 24.6
Скалы приморские 9 2.6 — — 14 4.3 20 6.1 12 3.6 55 16.6
Приморский луг 6 1.8 2 0.6 35 10.7 2 0.6 22 6.6 67 20.3
Березняк, лесные куртины — — 7 2.1 — — — — 7 2.1
Всего 65 19.7 15 4.5 106 32.3 НО 33.3 34 10.2 330 100
Таблица 3
Распределение по экотопам гнезд гаги обыкновенной, расположенных в растительных укрытиях
(Кемь-Луды, 1978 г.)
Растительное укрытие Экотоп Всего
тундрообраз- ная расти- тельность приморские скалы непримор- ские скалы приморский луг валунная россыпь березняк, лесные куртины по укрытиям по группам укрытии
число % число % число % число % число % число % число % число О/ /0
Одиночные деревья или
кусты: 5.3 0.9
ель 1 — — — — — — — 1
сосна 4 21.1 — — 2 10.5 — — — — — — 6 5.7
береза 2 10.6 — — 4 21.1 — — — — — — 6 5.7 49 46.2
можжевельник 8 41.8 1 7.1 13 68.4 — — 6 50 — — 28 26.4
рябина 1 5.3 — 1 0.9
смородина 2 10.6 — — — — — — 4 33.4 — — 6 1 5.7
шиповник 1 5.3 — — — — — — — — — — 0.9
Березняк, лесные куртины Травы (заросли или кур- — — — — — — — — — — 7 100 7 6.6 7
тины) : 12.3
родиола — — 13 92.9 13
широкотравье — — — — — — 10 28.6 1 8.3 — — 11 10.4
колосняк — — — — — — 21 60 1 8.3 — — 22 20.7 50 47.2
лисохвост — — — — — — 2 5.7 — — — — 2 1.9
прочие — — — — — — 2 5.7 — — — — 2 1.9
Всего 19 100 14 100 19 100 35 100 12 100 7 100 106 • 100 96 100
Таблица 4
Распределение по экотопам гнезд гаги обыкновенной, расположенных открыто среди не укрывающей их растительности
(Кемь-Луды, 1978 г )
Растительность Экотоп Всего
тундрообразная растительность приморские скалы неприморские скалы приморский луг валунная россыпь
число о/ /0 число % число % число % число % число %
Вороничник (чистый или латка) 32 100 1 111 1 7.1 — — 1 25 35 53.7
Низкотравье — — 7 77.8 8 57.2 — — 3 75 18 27.7
Моховые и лишайниковые подушки — — 1 11 1 5 35.7 6 100 — — 12 18.5
Всего 32 100 9 100 14 100 6 100 4 100 65 100
Таблица 5
Распределение по экотопам гнезд гаги обыкновенной, расположенных в геологических и антропогенных укрытиях
(Кемь-Луды, 1978 г )
Укрытие Экотоп Всего
тундрообразная растительность приморские скалы неприморские скалы приморский луг валунная россыпь
число % число о/ /о число О/ /0 число % число о/ /о число %
Геологическое:
скальная расщелина — 18 90 44 95 6 — — — — 62 56 3
подножие скальных 15 35 7 2 10 2 4.4 — — — — 19 17.3
уступов
камень 23 54 8 — — — — 2 100 — — 25 22.8
торфяная трещина 4 95 — — — — — — — — 4 36
Всего 42 100 20 100 46 100 2 100 — — НО 100
Антропогенное-
плавник — — 12 100 — — 22 100 — — 34 100
S. glauca), ветви которых достаточно хорошо скрывают гнездо;
густые куртины Rhodiola rosea, травостой высокотравных злаков —
Leymus arenarius, Alopecurus arundinaceus, широкотравье.
В древесно-кустарниковых укрытиях открытых местообитаний
(рис. 7) Кемь-Луд в 1978 г. гнездилось 49 гаг (14.9 %), причем
больше половины их среди низкорослого, обычно столообразного
можжевельника. Из других укрытий этого типа гага предпочитает
стланиковую, полустланиковую или иной ветровой формы сосну,
кустарниковые березу и рябину, иву с густой столообразной
кроной, стланиковую кислую смородину. Предпочитает она и ель
стланиковой, полустланиковой или иной ветровой формы роста,
но преимущественно на нелесных островах других архипелагов
(Двинские луды, например). На Кемь-Лудах же под елью гага
гнездится редко. Такие деревья и кустарники перечисленных выше
ветровых форм роста очень свойственны безлесным экотопам
островов Кандалакшского залива. Они произрастают там единич-
ными, далеко отстоящими друг от друга или даже единственными
экземплярами. В идеальных случаях, при большой численности
гнездящейся гаги, под каждым из них есть гнезда, и даже по 2—3
под каждым кустом.
В травянистых укрытиях Кемь-Луд в 1978 г. гнездилось
приблизительно столько же гаг, сколько и в древесно-кустарнико-
вых (50 гаг, или 15.3 %). В травостое сверху гнездо редко бывает
полностью укрыто (рис. 8), однако высокая трава в сочетании
с пестрой окраской птицы создает должный маскировочный эф-
фект. Обследование различных архипелагов Кандалакшского
залива показало, что на безлесных островах-лудах, сложенных
рыхлыми отложениями и покрытых вороничной тундрообразной
растительностью, гага в массе гнездится в окаймляющей луду
полосе Leymus arenarius. Особенно же излюблены ею мелкие,
сложенные рыхлыми отложениями и сплошь поросшие Leymus
arenarius лудушки. На одной из них, расположенной у входа
в Канеевскую губу о-ва Великого, гнездилось 12 гаг, при пло-
щади ее 0.12 га.
Среди куртин Rhodiola rosea на приморских скалах в колониях
серебристых чаек гнездится много гаги. На островах, находящихся
вдали от берегов, эти экотопы и эти укрытия для нее особенно
предпочтительны. Так, на Столбовых лудах, на о-ве Воротиха
(близ Кемь-Луд), на Средних лудах чайки и гаги гнездятся вместе
на приморских скалах с фрагментарными, приуроченными к скаль-
ным трещинам дерновинам Rhodiola rosea.
Несмотря на то что в кривоствольных березняках и еловых
лесных куртинах налицо идеальные укрытия для гнездования гаги,
она здесь почти не гнездится (7 га — 2.1 %). В чем причина
такого игнорирования лесных экотопов в большинстве архипелагов
Кандалакшского залива, кроме Северного? На этот вопрос должны
ответить зоологи.
На Кемь-Лудском архипелаге много гаг гнездится открыто,
вне каких-либо укрытий. Здесь ее гнезда нередки (65 гнезд —
4 И II Бреслина
49
a
1
2
Рис. 7. Схема расположения гнезда гаги в древесно-кустарниковых укрытиях
в открытых местообитаниях на островах Кандалакшского залива.
Под кронами- 1 — средне- (а) и низкорослого (б) можжевельника столообразной формы;
2 — кустарниковой (а) и псевдокустарниковой (б) березы.
50
3
Рис. 7 (продолжение).
Под кронами- 3 — сосен ветровых форм, стланиковой (а), полустланиковой (б), прямостоя-
чей со стелющейся ветвью (в)
4*
51
£
Рис. 7 (продолжение)
Под кронами 4 — кустарниковой рябины, 5 — ивы, 6 — кислой смородины
19.7 %) на вороничном тундрообразном ковре и среди низко-
рослых травянистых дерновин (рис. 9), а также на моховых
и лишайниковых подушках скал (рис. 10). В зависимости от усло-
вий основные компоненты этих дерновин — Festuca rubra, F. ovina,
Puccinellia pulvunata, P. coarctata, Agrostis straminea. Однако
и в таких условиях гнездящаяся гага не демаскирована. Маскиро-
вочный эффект здесь достигается, по-видимому, тем, что сидящая
на гнезде гага зрительно воспринимается как лежащий камень.
А окружающая, пусть низкорослая растительность, да и неров-
ности микрорельефа, усиливают этот эффект. Там же, на Кемь-
Лудах, в 1978 г. было обнаружено 15 гнезд (4.5 %), совершенно
открыто расположенных на камнях и скалах. Большинство из них
(11 гнезд) находилось среди валунных россыпей.
Наряду с укрытиями растительного происхождения гага ши-
роко употребляет геологические укрытия (табл. 5). Под ними
мы подразумеваем всевозможные неровности слагающей острова
породы. На Кемь-Лудах в 1978 г. треть гаг гнездилась в таких
укрытиях (ИО гнезд, или 33.3%). Однако можно считать, что
52
Рис. 7 {продолжение).
Под кронами 7 — елей ветровых форм стланиковой (в), полустланиковой {б), пря-
мостоячей со стелющейся или полустелющейся нижней ветвью (в)
53
Рис. 8. Схема расположения гнезда гаги в высокотравье на приморском лугу
на островах Кандалакшского залива.
1
2
1м________I
Рис. 9 Схема расположения гнезда гаги вне укрытий.
1 — вороничник; 2 — низкотравье.
Рис. 10. Схема расположения гнезда гаги на мохово-лишайниковой подушке,
лежащей на плоской скале.
/ — вид сверху, // — вид сбоку. 1 — гнездо гаги; 2 — мохово-лишайниковая подушка,
3 — скала.
54
1м
Рис. 11. Схема расположения гнезда гаги в геологических укрытиях. Архипелаг
Три Баклыша, Старшой баклыш, Кандалакшский залив.
1 — гнездо, 2 — Puccinelliapulvinata, 3 — Agrostis straminea; 4 — Tripolium vulgare (один
экземпляр); 5 — торфообразный слой дерновин, 6 — скала.
чисто геологические укрытия крайне редки. Растительность этих
укрытий (расщелин, подножий склонов, вокруг камней и вблизи
них) усугубляет их укрывающий и маскировочный эффект
(рис. 11). При гнездовании гаги в плавнике маскирующая роль
растений полностью или почти полностью отсутствует. Поскольку
плавник — это побочный результат хозяйственной деятельности
человека, укрытия, расположенные в плавнике, можно назвать
антропогенными.
По островам Мурмана наши наблюдения предпочтительных
гнездовых экотопов и гнездовых укрытий гаги в них в основном
попутны. Данные И. П. Татаринковой (1981) по Айновым остро-
вам свидетельствуют, что там гага наиболее плотно заселяет
ивняки (21.1 гнезд на 1 га) и колосниковые кочкарники (9.8 гнезд
на 1 га).
Визуальные наблюдения на островах Восточного Мурмана
показали, что там гага предпочитает устраивать гнезда в не-
глубоких щелевых лощинах у уступов (стенок) и в скальных
расщелинах. Растительные же укрытия чаще всего — это мощные
куртины или отдельные экземпляры Ligusticum scoticum, Rhodiola
arctica, Dryopteris expansa, используются гагой в значительно
меньшей степени. Учетные данные по о-ву Большой Гавриловский
за 1983 г. подтвердили эти наблюдения (табл. 6).
Многочисленные визуальные наблюдения свидетельствуют,
что гага сильно привязана к местам своего первого гнездования и,
если ей ничто не мешает, занимает одни и те же гнездовые террито-
рии (крону стланиковой ели, например, травостой колосняка,
скальную расщелину, трещину в торфе) из года в год. Но только
гнездовые территории, а не конкретную точку для устройства
гнезда. Обычно она не строит свое гнездо в той же точке,
что и в прошлом году. Каждый год оно бывает несколько смещено
относительно прошлогоднего (рис. 12).
55
2 1 2 2 2 2
1м
Рис 12. Схема расположения гнезда гаги (1980 г.; /) и мест прошлогодних ее
гнезд (2) под елью на о-ве Коржничиха. Кемь-Луды, Кандалакшский залив.
При благоприятных условиях гага выбирает гнездовую
территорию раз в жизни, отдавая предпочтение достаточно надеж-
ным укрытиям. При большей ее численности, когда возможные
укрытия оказываются заняты, ей приходится гнездиться открыто
в расчете на возможный маскировочный эффект окружающей
гнездо обстановки, усиленный пестрой окраской самой птицы.
Наличие же наряду с этим неиспользованных, хотя и очень надеж-
ных укрытий (под кронами одиноких деревьев, например), по-
видимому, связано, во-первых, с неприлетом ранее загнездив-
шейся там гаги и, во-вторых, с гнездовым консерватизмом гаг,
когда они продолжают гнездиться на старом, пусть худшем месте.
Для своего гнезда наряду с собственным пухом гага использует
в незначительном количестве самые различные растения,
однако всегда те, что произрастают на месте гнездования.
Таблица 6
Расположение в различных укрытиях гнезд обыкновенной гаги
и их распределение по экотопам
(о-в Большой Гавриловский, 1983 г.)
Экотоп Расположение гнезд Всего
открыто среди в укрытиях
растительности растительных геологических
Ч \ ^>0
Вороничник 12 9.2 — — 34 26.2 46 35.4
Щелевая лощина 1 08 9 6.9 50 38.5 60 46 2
Россыпь камней — — — — 6 4.6 6 4.6
Приморские скалы — — 5 3.8 13 10.0 18 13.8
Всего 13 10.0 14 107 103 79.3 130 100
56
ЧИСТИКОВЫЕ ПТИЦЫ
Кайры
Кайры (длинноклювая и короткоклювая) — одни из наиболее
многочисленных птиц Мурмана. Гнездится кайра только колони-
ально, образуя так называемые птичьи базары. При этом она
заселяет относительно широкие карнизы отвесных скал. Не-
редко эти карнизы имеют вид гигантских ступеней. На этих ступе-
нях, в местах скопления кайр, отсутствует всякая высшая расти-
тельность. Сами же кайры не нуждаются ни в ее окружении,
на в каком-либо другом ее использовании. Гнезда они не вьют,
и всякий намек на гнездо у них отсутствует. Единственное яйцо
они насиживают на голой скале.
Гагарка
Гагарка гнездится мелкими группами или же обособленно
в каком-нибудь неглубоком нишеобразном укрытии.
На Мурмане она делает гнездо преимущественно на периферии
«базаров» или же вблизи них, в нишах под нависшими уступами
скал или камней. На Айновых островах, где нет «базаров», —
в «крупнокаменистых россыпях, в пустотах под большими плос-
кими камнями, нависающими в виде кровли» (Коханов, Скокова,
1967). В Кандалакшском заливе, где гагарка очень малочисленна,
она предпочитает гнездиться на небольших скалистых островах
в россыпях камней (Бианки, 1967). Однако гнездится она и на до-
вольно больших вороничных островах, если там есть достаточно
удобные для них россыпи камней. Таковы острова Коржничиха
(Кемь-Луды), Песчанка (Роговые луды). Так же, как и кайра,
гагарка не делает никакого гнезда. Она ни коем образом не зави-
сит от растительности мест своего гнездования и ее не использует.
Атлантический чистик
Атлантический чистик предпочитает гнездиться в каменных
норах, нередко достаточно глубоких. В Кандалакшском заливе,
помимо того, чистик «гнездится под бревнами плавника, в торцевых
дуплах отдельно лежащих бревен и охотно занимает искусствен-
ные укрытия, сделанные для него из валунов и дерна. У гнезд, рас-
положенных рядом с валуном, одной стенкой служит камень,
другую стенку и крышу образует переплетение воронич-
ника, а иногда даже ветки стелющегося можжевель-
ника» (Бианки, 1967, с. 264—265, — разрядка наша). Так что
при общей тенденции чистиков гнездиться в тех или иных
естественных норах, обходясь при этом без растительности, на ост-
ровах Кандалакшского залива они все же используют «нору»
с растительной «крышей». Здесь, в Кандалакшском заливе, чистик
селится почти исключительно на безлесных островах (Бианки,
1967).
57
На Айновых островах, как отмечают В. Д. Коханов и Н. Н. Ско-
кова (1967), он предпочитает откладывать яйца в гнездовой нише
под отдельными камнями, лежащими среди зарослей песчаного
колосняка. Здесь в «гнезде» чистика, кроме обломков раковин,
окатанной морем сосновой коры и мелкого щебня, —к у с о ч к и
стеблей колосняка.
Тупик
Тупик гнездится колониями на островах Мурмана в глубоких
норах, которые он сам роет в мощных слоях торфа. Нора заверша-
ется гнездовой камерой, выстланной сухой травой из произрастаю-
щих на территории колонии растений, а также крупными перьями
чаек. В частности, Н. Н. Скокова (1967) отмечает выстилку гнезда
тупика из сухих стеблей дремы и листьев морошки.
Колонии тупиков, как правило, густо поросли травянистой
растительностью, в которой нередко преобладает Matricaria
hookeri. Буйная растительность тупичиных колоний — это след-
ствие воздействия тупиков, всего их наземного образа жизни
на растительный покров. Подробно об этом будет сказано
в следующей главе. Н. Н. Скокова (1967) отмечает, что буйная
растительность колоний, особенно высокие заросли крупноцветко-
вой ромашки, может отрицательно сказаться на численности
тупиков. Полегая от непогоды, ромашка забивает норы, и это
приводит к массовой гибели птенцов. К тому же густая раститель-
ность Айновых островов затрудняет выход птенцов к морю, причем
не только на территории колоний тупиков. «Однако подобные
случаи массовой гибели птенцов на Айновых островах очень
редки» (Скокова, 1967, с. 174). На других островах Мурмана
вообще не отмечено отрицательного воздействия растительности
на состояние колоний тупика.
ЧАЙКОВ Ы Е
Моевка
Моевка гнездится на отвесных скалах «птичьих базаров» Мур-
мана, где прикрепляет свое гнездо на мельчайших выступах
вертикальной скалы. Ее потребность в растительности лишь в том,
что она вьет гнездо из большого количества произрастающей
вблизи «базаров» травы. Нам, к сожалению, не удалось про-
анализировать ботанический состав ее гнездового материала.
В. М. Модестов (1967, с. 61) отмечает, что «строительным материа-
лом для гнезд моевок служат пучки прелой прошлогодней травы,
главным образом злаков, веточки вороники и листья морошки,
иногда небольшие обрывки фукусов и ламинарий».
58
Серебристая чайка
Серебристая чайка на островах Восточного Мурмана в основ-
ном гнездится на приморских скалах и в вороничнике, причем
при небольшой плотности ее гнездования — предпочтительно
на всевозможных повышениях микрорельефа или же на куполо-
образных выходах скальной породы, а при росте численности
и увеличении плотности гнездования ее колонии Местами
занимают весь вороничник. Отдельные пары чаек-хищников
гнездятся или вблизи «базара», или же непосредственно в верхней
части «базара».
На Айновых островах самые характерные стации их гнездова-
ния — кочкарники и заросли крупных зонтичных (Коханов, Ско-
кова, 1967), а также на болотах, где они гнездятся не только
на торфяных буграх, но и на переувлажненных болотистых
пространствах и понижениях между буграми. В конце 60-х годов
на этих островах произошло резкое увеличение численности
серебристых чаек, и они стали гнездиться на вороничниках,
занятых до этого преимущественно большими морскими чайками.
В. В. Бианки (1967) считает, что для серебристой чайки,
гнездящейся на островах Кандалакшского залива, важное значе-
ние в выборе места для гнезда имеют сроки его освобождения
от снега и просыхания. Именно этим он объясняет использование
серебристыми чайками для гнездования преимущественно
возвышенных мест — скал и вороничников, реже — приморских
лугов, «однако с наибольшей плотностью они занимают отдален-
ные от материка скалистые луды» (Бианки, 1967, с. 162). Причем
«гнездовой консерватизм у серебристых чаек развит сильно.
Большинство гнезд на заповедных островах из года в год бывает
сделано в одних и тех же местах, часто менее чем в 1 метре
от прошлогоднего места. Нередко используется и сохранившееся
старое гнездо» (там же, с. 165).
Однако при всех прочих равных условиях серебристые чайки
предпочитают гнездиться ближе к берегу.
Крупное гнездо серебристой чайки состоит из различных,
произрастающих чаще всего вблизи мест их гнездования растений.
Для Восточного Мурмана это злаки, стебли Empetrum hermaphro-
ditum, Matricaria grandiflora, Rhodiola arctica\ для Айновых
островов — «сухие стебли и листья крупных злаков с примесью
на лотке более мелких и мягких травянистых растений» (Коханов,
Скокова, 1967, с. 210). «На Белом море серебристая чайка делает
гнездо, как правило, очень крупное, с толстым дном, высокими
валиками вокруг лотка. Строительным материалом служат
прошлогодняя трава, кусочки водорослей (обычно фукуса и мха,
в меньшей степени используются анфельция, зостера, стебли
вороники, лишайники» (Бианки, 1967, с. 165). Однако в последние
годы в связи с эпифитотией Zostera marina на Белом море она
полностью потеряла свое гнездостроительное значение. Иногда
при так называемом осеннем ложном гнездовании (Бреслина,
1969) серебристые чайки начинают во второй половине лета
59
Таблица 7
Гнездостроительный материал серебристой чайки
Кандалакшского залива
(результаты глазомерного объемного ботанического
анализа 18 гнезд)
Гнездостроительный материал Встреча- емость, % Максимальная доля в общем объеме гнезда, %
Водоросли
Fucus sp 27 9 02
Ahnfeltae plicatae (Huds ) Fr 166 05
Лишайники
Cladonia alpestris 5.5 0.3
C mills 22.0 0.1
C rangiferina 16.6 0 1
C uncialis 16.6 0.1
Cetraria islandica 16.6 0 08
C nivalis 22.0 0 1
Peltigera aphtosa 5.5 +
Мхи
Dicranum sp 5.5 0.02
Pleurozium schreberi 5.5 02
Голосемянные
Juniperus sp (из гнезда мышевид- 5.5 +
ных)
Цветковые
Festuca ovlna 22 2 04
F. rubra 33 07
Puccinellia sp. 44.4 1
Leymus arenarius 16.6 04
Atriplex nudicaulis 11 0 05
Cochlearia arctica 16.6 0.01
Rhodiola rosea 66.6 05
Sedum acre 16.6 02
Lathyrus aleuticus 5 5 +
Empetrum hermaphroditum 22.2 0.5
Vaccinium vitis-idaea 5.5 +
V uliginosum 5.5 0.05
Tripolium vulgare 22 2 0 1
Matricaria hook eri 38.8 03
достраивать свои гнезда свежим, живым растительным материа-
лом (табл. 7).
Вороничники, самый распространенный плакорный экотоп
безлесных островов, весьма урожайны, особенно на Белом море.
В Кандалакшском заливе урожаи вороники таковы (0.23—
0.16 кг/м2), что часто обеспечивают потребляющих ее морских
колониальных и водоплавающих птиц (Бианки, 1972).
Как уже указывали многие авторы, и прежде всего В. В. Бианки
60
(1976), В. Д. Коханов и Н. Н. Скокова (1967), вороника является
одним из важнейших сезонных кормов серебристой чайки.
В. В. Бианки при этом указывает, что нередко в конце июля—
августе ее рацион на 50 % состоит из ягод вороники.
На островах Мурмана она также поедает и морошку (Бойко
и др., 1970). Другие растительные корма серебристая чайка
употребляет в несравнимо меньшем количестве, и не исключено,
что часть из них она заглатывает случайно.
Большая морская чайка
Большая морская чайка предпочитает гнездиться в, наиболее
возвышенных местах с хорошим обзором. На Айновых островах ее
«характерные стации гнездования — плоские скалы побережья,
воронично-папоротниковые участки на куполообразных вершинах
холмов о. Большого Айнова и возвышенная часть о. Малого
Айнова. Гнезда распределены рассеянно на расстоянии от несколь-
ких метров до нескольких десятков метров друг от друга. . . Гнезда
этих чаек, построенные из сухих стеблей дремы, вороники, мхов,
сухих папоротников, крупных перьев чаек, хорошо замаскированы
на однообразном буром фоне скал или сухих, не начавших вегета-
цию папоротников. В птенцовый период густые заросли папоротни-
ков, так же как и глубокие и узкие ниши скал, представляют собой
достаточно надежные убежища для подрастающих молодых чаек»
(Коханов, Скокова, 1967, с. 208).
На островах Восточного Мурмана большая морская чайка
гнездится рассеянно, преимущественно на куполообразных вы-
ходах скальной породы, возвышающихся посреди вороничника.
«Гнезда морских чаек на о. Харлове обычно вкраплены в колонии
серебристых чаек» (Модестов, 1967, с. 84).
В Кандалакшском заливе большая морская чайка редка.
В. В. Бианки (1967, с. 216) отмечает, что она «предпочитает
удаленные от материка скалистые луды, где часто селится вместе
с серебристой чайкой». Отдельные ее пары постоянны на доста-
точно отдаленных от материка и достаточно крупных вороничных
островах (лудах), в частности на островах Кемь-Лудского архи-
пелага, но в этом случае она предпочитает устраивать свои
гнезда на возвышенных участках приморских скал и скалистых
мысов.
Морская чайка употребляет при гнездостроении в основном
те же растения, что и сизая соответствующего региона. В период
массового созревания вороники она, так же как и серебристая
чайка, частично переходит на питание ее ягодами. Однако пока
недостаточно выявлено, насколько велика доля вороники в ее
рационе в это время.
61
Сизая чайка
Сизая чайка на островах Мурмана малочисленна. Она селится
небольшими колониями предпочтительно вблизи пресных водое-
мов. На Айновых островах, как отмечают В. Д. Коханов
и Н. Н. Скокова (1967), сизые чайки гнездятся преимущественно
в колосниковом кочкарнике, причем свои гнезда они . строят
на самой вершине кочек. Их птенцы держатся в непосредственной
близости от гнезда в течение 7—10 дней, скрываясь от опасности
в густой растительности. Однако «в связи с тем, что растительность
в кочкарнике очень густая и высокая (кипрей, дягиль, купырь,
колосняк, папоротник — высотой до 1 м и выше), большинство
птенцов погибает, особенно в холодную и дождливую погоду»
(Коханов, Скокова, 1967, с. 215).
На островах Кандалакшского залива она гораздо многочислен-
нее. Там «сизая чайка заселяет главным образом песчаные
или вороничные луды, приуроченные к мелководным частям за-
лива» (Бианки, 1967, с. 113), причем чайки «отдают предпочтение
приморским лугам. . . Вороничники заселяются ими тоже довольно
охотно. . . На скалах гнезда устраиваются в виде исключения»
(там же, с. 113). При поселении на скальных участках чайки
«выбирают для гнезда участки с луговой или можжевелово-
вороничной растительностью. . . На о. Великом несколько пар этих
чаек селятся посредине комплексных болот, на расстоянии
до 1.5 км от берега моря. . . На лугах и в вороничниках гнезда
бывают устроены на бревнах плавника, на кочках, на небольших
камнях, даже изредка на упругих ветвях стелющегося можжевель-
ника» (Бианки, 1967, с. 115).
Сизая чайка употребляет при гнездостроении сухие стебли
большинства растений, произрастающих вблизи ее колоний
(табл. 8).
Ягоды Empetrum играют в питании сизой чайки весьма су-
щественную роль. По данным В. В. Бианки (1967), в Канда-
лакшском заливе Белого моря она поедает ягоды вороники с на-
чала прилета и до отлета, однако доля вороники в ее питании
меньшая, чем у серебристой чайки. В недалеком прошлом,
до исчезновения обширных зарослей Zostera marina, изобилующих
на мелководьях вблизи островов, эта трава также была весьма
важным и значимым растительным кормом сизой чайки.
Полярная крачка
Полярная крачка на островах Мурмана предпочитает занимать
для гнездования вороничники, хотя и заселяет самые разнообраз-
ные растительные сообщества; в частности, на Айновых островах,
по В. Д. Коханову и Н. Н. Скоковой (1967),— это заросли папорот-
ника, сфагновые болота, заросли купальницы и зонтичных, осоко-
вое болото и злаковый кочкарник.
62
Таблица 8
Гнездостроительный материал сизой чайки
Кандалакшского залива
(результат глазомерного объемного ботанического анализа
31 гнезда)
Гнездостроительный материал Встреча- емость, % Максимальная доля в общем объеме гнезда, %
Водоросли
Fucus sp. 9.7 0.15
Ahnfeltiae plicatae 3.2 0.05
Лишайники
Cladonia alpestris 19.4 0.2
C. bellidiflora 32 0.02
C mitts 32.3 03
C. rangiferina 35.5 0.1
C uncialis 12.9 0.05
Alectoria sp. 3.2 0.01
Cetraria islandica 64 0.01
C nivalis 16.1 0.25
Nephroma arcticum 3.2 +
Мхи
Dicranum sp. 29.0 0.6
Drepanocladus uncinatus 32.2 0.95
Pleurozium schreberi 12.9 0.4
Мхи неопределенные 9.7 +
Г олосемянные
Juniperus sp. 6.4 0.05
Цветковые
Festuca ovina 70.9 0.9
F. rubra 22.6 0.8
Puccinellia sp 3.2 0.05
Poa alpigena 12.9 0.3
Alopecurus arundinaceus 6.4 0.5
Leymus arenarius 97 0.3
Злаки неопределенные 9.7 0.15
Betula subarctica (листья) 3.2 +
Cerastium holosteoides 3.2 +
Dianthus superbus 22.6 0.05
Erysimum hieracifolium 6.4 +
Cochlearia arctica 3.2 +
Rhodiola rosea 29.0 0.5
Sedum acre 3.2 0.2
Rubus saxatilis 3.2 0.1
Empetrum hermaphroditum 50 0.5
Ligusticum scoticum 3 2 0.1
Chamaepericlymenum suecicum 3.2 0.1
Примечание. Здесь и в табл 10 знак « + » означает при-
сутствие вида
63
Таблица 8 (продолжение)
Гнездостроительный материал Встреча- емость, о/ /о Максимальная доля в общем объеме гнезда, %
Vaccinium vitis-idaea 19.4 0 05
V uliginosum 29.0 0.2
Campanula rotundifolia 12.9 0 03
Achillea apiculata 97 0 05 •
Matricaria hookeri 162 0 05
Tanacetum vulgare 3.2 0 05
Стружка древесная 6.4 0.2
Таблица 9
Гнездостроительный материал полярной крачки
на о-ве Харлов, Семь Островов
(результат глазомерного объемного ботанического анализа
20 гнезд)
Гнездостроительный материал Встреча- емость, % Максимальная доля в общем объеме гнезда, %
Лишайники
Кустистые и листоватые 60 0.5
Ochrolechia tartarea 15 02
Зеленые мхи Цветковые 10 0 05
Lerchenfeldia flexuosa 5 03
Calamagrostis groenlandica 5 07
Злаки неопределенные (из гнезда мышевидных) 10 03
Eriophorum polystachyon 5 0.9
Carex rariflora 5 0 1
Salix tundricola 5 0 05
Betula папа 10 0.8
Rubus chamaemorus 65 0.5
Empetrum hermaphroditum 80 1
Chamaepericlymenum suecicum 25 08
Мышиный помет 10 0 1
На островах Кандалакшского залива полярные крачки
наиболее охотно заселяют приморские луга (Бианки, 1967).
В. В. Бианки (устное сообщение) также отмечает, что вороничник
для них не удобен, так как расчистить его для устройства гнездовой
лунки они не могут, а соорудить искусственную площадку поверх
вороничника не в состоянии.
Столь разное отношение полярных крачек к вороничникам
островов Мурмана и Кандалакшского залива скорее всего надо
объяснить различием этих достаточно удаленных друг от друга
и неодинаковых по широте мест. На островах Мурмана он низко-
64
Таблица 10
Гнездостроительный материал полярной крачки
Кандалакшского залива
(результат глазомерного объемного ботанического анализа
13 гнезд)
Гнездостроительный материал Встреча- емость, % Максимальная доля в общем объеме гнезда, %
Водоросли
Fucus sp. 7.7 0.4
Лишайники
Cladonia alpestris 153 0 03 .
С mitis 77 0 04
С rangiferina 7.7 0.03
Зеленые мхи
Pleurozium schreberi 153 +
Неопределенные 153 02
Цветковые
Alopecurus arundinaceus 30.7 0 7
Festuca ovina 53 9 1
F rubra 30 7 03
Poa alpigena 30 7 0.6
Puccinellia sp. 7 7 1
Stellaria graminea 7 7 +
Rhodiola rosea 15.3 0 25
Sedum acre 153 0.2
Empetrum hermaphroditum 38 5 05
Arctous alpina 77 0.1
Campanula rotundifolia 77 +
росл, к тому же на Восточном Мурмане с пятнами деградации.
На островах Кандалакшского залива его высота 10—15 см,
а веточки густо переплетены.
При гнездовании полярных крачек на приморских скалах,
что также нередко на островах Кандалакшского залива, полярная
крачка никогда не устраивает свое гнездо на голой скале, а всегда
на дерновинке со скудной растительностью, которая и на корню
нередко служит ей гнездовым материалом.
В. В. Бианки (1967) отмечает, что гнездостроительный мате
риал полярная крачка ниоткуда не приносит, а берет из непо-
средственного окружения гнезда, при насиживании она про-
должает «достраивать» свое чрезвычайно примитивное гнездо.
Наши данные по островам Восточного Мурмана и Кандалакшского
залива подтверждают строгое соответствие ботанического состава
материала ее гнезда с геоботанической характеристикой конкрет-
ного места ее гнездования (табл. 9, 10).
<5 И П Бреслина
65
ПОМОРНИКОВЫЕ
Короткохвостый поморник
Короткохвостый поморник гнездится на возвышенных участках
вороничника. Причем в Кандалакшском заливе гнездится всего
одна пара — на о-ве Малый Асафьев Кемь-Лудского архипелага.
На островах Мурмана он обычен, но немногочислен. В. Д. Коханов
и Н. Н. Скокова (1967, с. 204) отмечают, что на Айновых остро-
вах «гнездятся поморники на возвышенных участках вороничной
тундры, почти всегда вблизи колоний тупиков. Гнездо представ-
ляет собой неглубокую лунку в мягком ,,ковре“ вороничника.
Лоток — примятые стебли растущей вороники, сухие листочки
и стебельки морошки, единичные перья поморников».
РЖАНКОВЫЕ—МОРСКИЕ КУЛИКИ
Кулик-сорока
Об отношении кулика-сороки к наземной растительности
мы располагаем сведениями В. В. Бианки (1967), касающимися
островов Кандалакшского залива, очень краткими данными
Л. О. Белопольского и др. (1970) и некоторыми собственными
наблюдениями.
Для устройства гнезда кулику-сороке важно найти незаросшее
пытнышко, будь то на песке, среди вороничника, в трещине
скалы, на гниющем бревне или в старом гнезде чайки. Расчистить
место для гнезда среди вороничника ему, по-видимому, не под силу.
Кулик-сорока устраивает свое гнездо на песчаных, галечниковых
или валунных пляжах, на приморском лугу, в вороничнике, среди
скальной растительности, однако чаще всего — среди приморской
луговой растительности. В. В. Бианки (1967, с. 53) считает, что
«предпочтение луговой растительности (приморские луга и
марши) кулики-сороки оказывают, вероятно, последующим причи-
нам: среди луговой травы, особенно в разреженных участках,
на песке, птице легко делать гнездовую лунку; около низменных
берегов, покрытых приморскими лугами, всегда есть достаточно
широкая и кормная литораль; на многочисленных площадках
с редким травостоем более удобно наземное передвижение».
В примитивных гнездовых лунках кулика-сороки наряду
с раковинами, камушками, кусочками выброшенной морем сосно-
вой коры, жесткими сухими обрывками водорослей встречаются
также сухой брусничный лист и редкие стебельки приморских
растений.
Камнешарка
На островах Восточного Мурмана, в частности на о-ве Харлов,
камнешарка гнездится в вороничниках и нередко не в не-
посредственной близости от морского берега.
66
Об отношении камнешарки Кандалакшского залива к расти-
тельности указывают В. В. Бианки (1967), а также Л. О. Бело-
польский и др. (1970). Автор располагает и собственными
наблюдениями. В Кандалакшском заливе «камнешарка устраи-
вает свои гнезда в разнообразных местах: на приморском лугу,
в вороничнике, среди скальной растительности. На берегах лесис-
тых островов она гнездится на открытых мысах, поросших
вороникой. Гнездо обычно располагается на расстоянии 5—30 м
от берега, против каменисто-песчаной литорали» (Белопольский
и др., 1970, с. 42). Обычно камнешарка прячет свое гнездо.
Укрытием служат переплетенные веточки вороники, образующие
неплохую «крышу» над ее гнездом, ветви стелющегося'можжевель-
ника, реже густая трава приморских лугов.
В. В. Бианки (1967, с. 87) пишет: «Проследить зависимость
размещения гнезд от густоты и характера растительности на Се-
верном архипелаге не удается, но различия в поведении птиц
на том или ином месте хорошо заметны. Так, если по литорали,
голым скалам и другим ровным поверхностям камнешарки бегают,
то среди разнотравья и по воронике птицы ходят медленно.
Беспокоящаяся в этой стации птица всегда сидит, или, если
позволяет площадка, бегает по ровной поверхности валуна, бревна
и т. п., время от времени перелетая с одного места на другое
или подлетая проверить действия напугавшего ее человека. В тех
случаях, когда птица вынуждена идти среди густой растительности
(подход к гнезду, ведение выводка на берег после вылупления
птенцов), она делает это очень медленно». Гнездо у камнешарки
небольшое, имеет вид лунки с выстилкой из скудного раститель-
ного материала, чаще всего это сухой брусничный или вороничный
лист, хвоя можжевельника, короткие стебельки злаков.
Чем сильнее связь морских птиц с сушей, тем полнее и разно-
стороннее используют они наземную растительность в гнездовой
период своей жизни. Чистиковые птицы в ней не нуждаются
(кайры, гагарки) или почти не нуждаются (тупики, чистики).
Практически мало используют ее и морские кулики. Бакланам
наземная растительность необходима лишь для сбора некоторой
части гнездостроительного материала. Обыкновенная гага гнез-
дится на участках различного растительного покрова, но пред-
почтительно обладающего какими-либо ремизными свойствами,
используя при этом как укрытия либо отдельные, преимущественно
древесные растения кустарниковой или стланиковой формы роста,
либо различные заросли травянистых растений. Чем слабее на
острове ремизная роль растительности, тем интенсивнее исполь-
зует гага при гнездовании всевозможные нерастительные укрытия.
Чайковые гнездятся в различных, но предпочтительных для каж-
дого вида экотопах. Широко распространенные на островах ягод-
ники — вороничники и морошечники служат большинству чайко-
вых существенным источником сезонного корма.
5*
67
Глава 4
РОЛЬ МОРСКИХ КОЛОНИАЛЬНЫХ птиц
В СТАНОВЛЕНИИ И ИЗМЕНЕНИИ
РАСТИТЕЛЬНОГО ПОКРОВА
То или иное использование растительности большинством видов
наших водоплавающих птиц заметно не изменяет ее. Так, обычно
места гнездовий обыкновенной гаги, например, ничем не отлича-
ются от подобных же участков, в которых она не гнездится.
Место гнезда через год, два, иногда через несколько лет зарастает
той же растительностью, которая была здесь до гнездования
и которая характерна для этого конкретного экотопа. То же можно
сказать о гнездах других пластинчатоклювых, куликов и прочих
околоводных птиц. Кормовое использование растительности раз-
личными птицами также обычно не нарушает существующего
экологического равновесия. Так, гуменники, серебристые и сизые
чайки в вороничниках питаются ягодами Empetrum spp. — одним
из своих сезонных кормов; чайки, пролетные лебеди и гуменники
поедают Zostera marina. Но при этом ни с вороничниками, ни
с зарослями Zostera marina никаких заметных изменений не про-
исходит.
Однако в местах гнездования многих видов морских колониаль-
ных птиц возникает особая орнитогенная растительность. По
своему видовому составу, общему облику и характеру произра-
стания растений она резко отличается от обычной зональной,
свойственной тем или иным экотопам.
Качественная и количественная стороны воздействия морских
колониальных птиц на растительный покров островов зависят
от места, где они гнездятся, их поведения, и прежде всего от их
экскреторной и вытаптывающей деятельности. Атлантический чи-
стик, обыкновенная гага и полярная крачка не изменяют сколько-
нибудь заметно растительность своих гнездовых участков: атлан-
тический чистик — потому, что он гнездится в глубоких камен-
ных норах или же в завалах плавника; обыкновенная гага —
потому, что она очень плотно сидит на гнезде и испражняется
обычно в воду во время своих кратковременных отлучек, по
островам же она ходит только весной; полярная крачка из-за
своего малого размера оставляет на гнездовых участках неболь-
шое количество помета, и это не может существенно влиять
на их растительность.
Воздействие тупиков, кайр и моевок, больших морских серебри-
стых и сизых чаек на растительный покров наиболее ощутимо.
Тупики роют норы в торфяной толще, и уже один этот фактор
68
сильно сказывается на состоянии и составе окружающей расти-
тельности. Кайры и моевки на птичьих базарах и их ближай-
ших окрестностях оставляют громадное количество помета. Взрос-
лые большие морские, серебристые и сизые чайки пребывают
на гнездовых участках значительную часть своего времени.
Птенцы постоянно держатся здесь до своего подъема на крыло
и неизбежно вытаптывают окружающую растительность. Птицы
удобряют почву экскрементами. Нередко они при возбуждении и
территориальных столкновениях вырывают растения с корнем.
Опубликованы основные выводы о влиянии морских колониаль-
ных птиц на растительный покров Семи Островов (Бреслина,
Карпович, 1967; 1969; Бреслина, 1969; Карпович, Пилипас, 1975).
Для Айновых островов по этому вопросу приведены более общие
сведения (Скокова, 1962, 1967; Парфентьева, 1963, 1969; Коханов,
Скокова, 1967; Татаринкова, 1967, 1975). В публикации, касаю-
щейся, в частности, и орнитогенной растительности Гавриловских
островов (Георгиевский, 1981), имеется, к сожалению, ряд неточ-
ностей и ошибочных положений. По островам Кандалакшского
залива Белого моря опубликованы по сути дела лишь самые общие
результаты наших исследований (Бреслина, 1977). На остальной
территории советской Арктики особые нитрофильные раститель-
ные сообщества в районе массовых гнездовий морских колониаль-
ных птиц отмечали Хагеруп (Hagerup, 1927), Стеффен (Steffen,
1928), В. Д. Александрова (1956), Б. Н. Городков (1958), Б. А. Ти-
хомиров (1959). Х.-Э. А. Ребассо (1972; Rebassoo, 1973, 1975),
описывая растительность чаячьих колоний морских островков Со-
ветской Прибалтики, кратко излагает свои соображения о роли
морских птиц в формировании растительного покрова этих
островов.
По зарубежной Северной Атлантике этому вопросу посвящен
ряд работ (Gr^nlie, 1948; Gillham, 1956; Sobey, 1976; Sobey,
Kenworthy, 1979), причем в работах Соуби (Sobey, 1976), Соуби
и Кенуорти (Sobey, Kenworthy, 1979) достаточно подробно изучен
механизм влияния крупных чаек на растительный покров.
Установлено (Бреслина, Карпович, 1969; Бреслина, 1969, 1977),
что орнитогенный растительный покров в условиях островов
Кольской Субарктики может быть первичным — в случае его фор-
мирования на доселе лишенных растительности участках и вторич-
ным — при формировании на территории, уже покрытой расти-
тельностью.
ПЕРВИЧНАЯ ОРНИТОГЕННАЯ РАСТИТЕЛЬНОСТЬ
Первичный орнитогенный растительный покров может возник-
нуть на любых, лишенных растительности участках, если там
расположены колонии птиц. Это могут быть приморские скалы,
каменистые и валунные россыпи, формирующиеся песчаные или
песчано-каменистые береговые валы, а также завалы плавника,
если на них устраивают гнезда большие морские, серебристые
69
и сизые чайки. Однако в условиях островов Кольской Субарк-
тики первичная орнитогенная растительность, как правило, возни-
кает на приморских скалах. Во всех остальных случаях появление
растений предшествует поселению морских птиц.
Приморские скалы в местах колоний морских птиц, достаточно
обильно поливаемые пометом и не подверженные эпизодическому
окатыванию штормовыми волнами, нередко густо покрыты оран-
жевой корочкой нитрофильного лишайника из рода Xanthoria,
высшие же растения селятся на скалах и по их трещинам.
Именно они играют решающую роль в образовании и становлении
первичной орнитогенной растительности.
Различные стадии ее становления хорошо можно проследить на
приморских скалах, если там гнездятся серебристые и большие
морские чайки.
В нижнем поясе приморских скал, как занятых колониями
чаек, так и тех, где таких колоний нет, по скальным трещинам
из высших растений растут только единичные галофиты. На Семи
и Айновых островах — это в основном Puccinellia coarctata, на
беломорских — Р. coarctata и Р. pulvinata. Все они укореняются
в трещинах приморских скал. В массе они здесь не могут расти:
при неспокойном море силен волнобой, он-то и препятствует
укоренению растений. Выше прибойной полосы число укоренив-
шихся Puccinellia увеличивается. На тех приморских скалах, где
гнездятся морские колониальные птицы, условия роста видов рода
Puccinellia очень благоприятны, поскольку сюда поступает много
птичьего помета, и они, естественно, продуцируют больше орга-
нического вещества.1 В условиях островов Кольской Субарктики
минерализация растительных остатков очень слаба. Здесь же они
и консервируются в торфообразную массу. Поскольку на примор-
ских скалах растения приурочены к их трещинам (рис. 13),
где они только и могут укореняться, то и торфянистый слой
с годами тоже накапливается, концентрируется вдоль этих трещин.
В свою очередь это способствует еще более бурному росту и
развитию орнитофильных растений. Во-первых, в торфянистом
слое создаются весьма благоприятные условия для развития
корневой системы изначальных растений. Во-вторых, торфянистая
масса — это хороший субстрат для поселения новых растений,
корневая система которых уже не связана или слабо связана
со скальными трещинами. В-третьих, торфяной слой здесь хорошо
пропитан птичьим пометом (по сути дела это великолепный
естественный компост). Чрезмерный же рост и мощное развитие
растений в колониях чаек в свою очередь способствуют интен-
сивному и быстрому торфонакоплению. К тому же торфянистый
слой пронизан еще и другими продуктами жизнедеятельности
чаек. Это молотая ракушка, рыбьи кости и прочие отходы море-
1 Птицы гнездятся здесь не у границы с прибойной полосой, а выше по склону,
где в гнездовой период отсутствует губительное действие волн
70
Рис. 13 Дерновины первичной орнитогенной растительности на приморских скалах,
повторяющие собой сеть их трещин. О-в Большой Зеленец, Семь Островов, 1966 г.
продуктов, поступающие сюда с погадками, а также перья, останки
птенцов и т. п. Гнездовой материал, ежегодно приносимый пти-
цами, — это также прекрасный субстрат для поселения на нем
растений, и он тоже способствует торфонакоплению.
Образование своеобразной торфяной почвы «на каменистом
субстрате островов р. Нижней Таймыры на местах колоний бурго-
мистров и серебристых чаек» в результате ежегодного поступле-
ния большого количества мертвых растительных остатков от спе-
цифической растительности этих колоний было отмечено также
Б. А. Тихомировым (1959). Е. Е. Сыроечковский (1959) описы-
вает процесс образования первичных орнитогенных почв на участ-
ках птичьих базаров Антарктики. Правда, растительный покров
здесь представлен мхами и низшими споровыми, а органическое
вещество этих почв создается не растениями, а в основном
останками птиц и морских животных.
Однако в наших условиях в нижнем поясе приморских скал
никакой субстрат для формирования на нем орнитогенной расти-
тельности не может закрепиться. Все смывается во время зимних
и осенних штормов. Но острова, как и побережье Кольской
Субарктики, находятся в зоне медленного тектонического подня-
тия (Лаврова, 1960). Со временем эти участки оказываются выше
зоны достигаемости даже высоких штормовых волн.
Здесь и начинается становление собственно орнитогенной
растительности, расположенной, как правило, вдоль скальных тре-
71
[223? -ЖЗ И‘
'Е;.зз 'гаи ’И"0» <«
I 1м
72
щин и потому имеющей вид своеобразных лентообразных дерно-
вин, повторяющих сеть трещин коренной породы. Проникновение
корней растений в эти трещины способствует фиксации на скалах
торфянистого слоя дерновин.
В достаточно плотных колониях крупных чаек по мере подъема
по приморским скалам хорошо прослеживаются смыкание первич-
ной орнитогенной растительности скал и образование сплошного
растительного покрова (рис. 14).
В зарубежной литературе, посвященной растительности коло-
ний крупных чаек островов Средней Атлантики, не удалось найти
прямых указаний на образование первичного почвенно-расти-
тельного покрова приморских скал в местах гнездования чаек.
Специфичен ли этот процесс для островов Кольской Субарктики —
заключить пока трудно. Однако Соуби (Sobey, 1976), характери-
зуя растительность колоний серебристых чаек о-ва Мей (Велико-
британия) , очень кратко упомянул сообщества «скальных трещин»
с тремя основными доминантами {Poa annua, Cochlearia danica,
Atriplex hastata). По-видимому, эти сообщества «скальных тре-
щин» и есть вытянутые вдоль трещин «лентообразные дерновины»,
представляющие собой один из начальных этапов становления
растительности на приморских скалах в местах колоний морских
птиц.
На Семи, Гавриловских и Айновых островах с их многочислен-
ными и очень большими колониями морских птиц процесс образо-
вания сплошного покрова первичной орнитогенной растительности
““ ™ У'авдмакш<;« же оировах более ил» менее четкое
смыкание дерновин встречается редко.
На беломорских островах удалось выделить несколько поясов
скальной орнитогенной растительности. За нижним поясом при-
морских скал, где по трещинам поселяются отдельные галофиты
(помимо Puccinellia pulvinata, в небольшом количестве растет
Inpohum vulgarе и в еще меньшем — Spergularia marina} сле-
дует зона накопления торфянистого слоя и образования ленто-
образных дерновин. Здесь по-прежнему обычна Puccinellia pul-
vinata, но совсем отсутствует Spergularia marina и с высотой
постепенно пропадает Tripolium vulgare. Растительность ленто-
образных дерновин следующего, среднего пояса при ограничен-
ном наборе видов довольно пестра (табл. 11, рис. 15). Это большие
пятна”Гn^h?triCaria ^ookeri (иногДа она здесь преобладает),
пятна Cochlearta arctica, отдельные экземпляры, реже куртины
Рис. 14. Распределение растительности в колонии серебристых чаек на ппимоп
ских скалах, от верхнего до нижнего их пояса. О-в Асафьев, Кемь-Луды, Канда-
лакшский залив, 1976 г
гнездо серебристой чайки, /3-направление ската ' 12 ~
73
Таблица 11
Фрагменты (I—III) первичной орнитогенной растительности приморских скал в зоне накопления торфянистого слоя
Видовой состав Проективное покрытие, %
дерновины Matricaria hookeri дерновины Cochlearia arctica дерновины Festuca rubra дерновины Puccinellia pulvinata дерно- вины Sonchus humilis дерновины Ligusticum scoticum дерновины Alopecurus arundina- ceus
I II Ill I II I II I II III
Puccinellia pulvinata 30 30 + + — — — 95 95 60
Festuca rubra — — — — — 70 50 5 — — — 20 5
Роа alpigena — 10 15
Alopecurus arundinaceus — — — — — — — — — — — — 70
Cochlearia arctica — + 20 30 20 + + 5 + +
Rhodiola rosea — + — — — + + +
Sedum acre — — — — — + 5 5 +
Ligusticum scoticum — 70 +
Matricaria hookeri 50 40 50 7 — + — 8 — — — — +
Sonchus humilis — — — — — — + — + — 60
Tripolium vulgare — — — — — — +
Примечание. Здесь и в табл. 12 знак — присутствие вида
1м
2
k
6
8
Рис. 15. Распределение расти-
тельности в колонии серебристых
чаек в среднем поясе приморских
скал. О-в Коржничиха, Кемь-
Луды, Кандалакшский залив,
1978 г.
1 — скальная поверхность, 2 — Puc-
cinellia pulvinata, 3 — Cochlearia
ardica, 4 — Plantago maritima; 5 —
Matricaria hookeri, 6 — Rhodiola
rosea, 7 — гнездо и разбросанный
вокруг него гнездовой материал
(в центре—лоток гнезда); 8—
направление ската
75
Таблица 12
Фрагменты (I—VI) первичной орнитогенной растительности верхнего пояса
приморских скал
Видовой состав Проективное покрытие, %
I II III IV V VI
Puccinellia pulvinata + + — + — +
Festuca rubra + + + — ‘ +
Роа al pi ge па — + — +
Stellaria graminea — +
Sagina nodosa — + — +
Cochlearia arctica — — +
Rhodiola rosea 80 60 60 80 +
Sedum acre + — — — 80 95
Plantago maritima — +
Tripolium vulgare +
Crepis nigrescens +
Matricaria hookeri + + 5 +
Rumex pseudonatronatus, а на некоторых островах и Sonhus
humilis. Здесь же появляются злаки — Festuca rubra, Роа alpi-
gena, Agrostis straminea\ реже — Calamagrostis lapponica, Alope-
curus arundinaceus\ совсем редко — Leymus arenarius\ отдель-
ными экземплярами и небольшими куртинами появляются
Rhodiola rosea. По краям дерновин укореняются первые экзем-
пляры Sedum acre. Это уже гнездовой пояс. Здесь гнезда чаек.
Все орнитофильные растения этого пояса хорошо выносят обрызги-
вание морской водой при штормах. В осенне-зимнее время на эти
участки обрушиваются штормовые волны.
С высотой в лентообразных дерновинах начинает господство-
вать Rhodiola rosea (табл. 12; рис. 16, /), а как примесь в них
нередка Crepis nigrescens. Края дерновин, как правило, заняты
Sedum acre — растением, которое при избытке удобрений хорошо
разрастается вширь, наступает на голые скалы и способствует
расшрению покрытой растительностью площади скал и ее смы-
канию (рис. 16, II). Это идеальная схема.
В условиях островов Кандалакшского залива более или менее
четкое смыкание дерновин заметно на островах Кемь-Лудского
архипелага, на Малой Седловатой луде (район Порьей губы)
(рис. 16, ///), на луде Добрушка (Северный архипелаг), на
Скалистой луде (Красная губа).
На пористых мелкотрещиноватых, легко выветриваемых, кро-
шащихся скалах облик первичной орнитогенной растительности
не соответствует приведенной выше схеме. В Кандалакшском за-
ливе такие скалы были встречены в архипелаге Двинские луды
(близ Карельского берега). Здесь в колониях серебристых чаек
почти нет обычных лентообразных дерновин, а те, что имеются,
очень широкие (до 1 м) и расположены вдоль самых явных
76
EZH Ш2
»
Н? и*
I 1м
ш
Рис. 16. Распределение раститель-
ности в колонии серебристых чаек
в верхнем поясе приморских скал.
Кандалакшский залив, вход в Порью
губу, 1977 г.
/ — о-в Высокая Столбовая луда, Стол-
бовые луды; II — о-в Большая Кара-
вашка, Голые луды, /// — о-в Малая
Седловатая луда 1 — скальная поверх-
ность, 2 — Puccinellia pulvinata, 3 —
Festuca rubra, 4 — проростки Cochlearia
arctica; 5 — Matricaria hookeri, 6 —
Rhodiola rosea, 7 — Sedurn acre, 8 —
Erysimum hieracifolium, 9 — Conioseli-
num tataricum; 10 — направление ската
77
трещин. Основная же масса фрагментарной первичной орнитоген-
ной растительности пятнами «разбросана» на скалах. Это объяс-
няется тем, что корни растений в любом месте легко могут
проникнуть в рыхлую скальную породу. Здесь наряду с обыч-
ными скальными орнитофилами (Rhodiola rosea, Sedum acre,
Matricaria hookeri, Puccinellia pulvinata, Festuca rubra) растут
Mertensia maritima — растение песков и галечников, а также
Dianthus superbus и Campanula rotundifolia — обычные орнито-
фильные виды приморских торфяников, и даже совсем несвойст-
венный приморским скалам Chamerion angustifolium. Все орнито-
фильные виды в этих условиях весьма обильны, однако не отли-
чаются чрезмерным ростом и развитием, хотя они и мощнее ра-
стений тех же видов, но произрастающих вне колоний морских
птиц. Объяснение этому, скорее всего, в том, что Минеральные
элементы питания, поступающие с пометом птиц, здесь довольно
быстро с дождевой водой уходят через множество скальных тре-
щинок.
На приморских скалах Восточного Мурмана не удалось обна-
ружить такой четкой, как в Кандалакшском заливе, поясности
в распределении орнитогенных ценозов (возможная тому при-
чина — отсутствие акцентирования на этом вопросе во время
исследования). Здесь орнитогенная растительность приморских
скал представлена тремя основными ассоциациями: Cochlearia
officinalis, преобладающей по площади над всеми остальными ор-
нитогенными ценозами, Matricaria hookeri и Festuca rubra ssp.
arctica (табл. 13). Кроме того, в нижнем поясе приморских
скал обычны отдельные экземпляры и мельчайшие дерновинки
Puccinellia coarctata, с высотой они могут увеличиваться в раз-
мерах. По всем приморским скалам, кроме самого нижнего их
пояса, растет, иногда в очень большом количестве, крупными
экземплярами или реже куртинами Rhodiola arctica. Однако веду-
щая роль в становлении сплошного покрова первичной орнитоген-
ной растительности островов Восточного Мурмана принадлежит
Cochlearia officinalis (рис. 17).
Участие Matricaria hookeri в становлении растительного по-
крова большинства участков приморских скал островов Восточ-
ного Мурмана менее значительно. Однако на небольшом островке
Яичном, расположенном недалеко от Семиостровского матери-
кового побережья, западнее Лицкого мыса, образуются сплошные
заросли Matricaria hookeri в результате смыкания ее куртин.
На чаячьих приморских скалах Айновых островов (рис. 18)
за единичной Puccinellia coarctata и ее небольшими куртинками
господствуют в поясе накопления торфянистого слоя и образова-
ния лентообразных дерновин относительно чистые куртины Co-
chlearia officinalis, тут же постоянны, но в меньшем количестве
«подушки» Иonkenya diffusa и Festuca rubra ssp. arctica (табл. 14),
а также отдельные экземпляры Rhodiola arctica. С высотой Honke-
пуа diffusa исчезает, растительность лентообразных дерновин
становится более пестрой. Появляются скопления Matricaria
78
Таблица 13
Геоботаническая характеристика фрагментов (I—II) первичной орнитогенной растительности приморских скал Восточного Мурмана
(Семи Островов) в местах гнездования крупных чаек
Видовой состав Группировки Cochlearia officinalis Группировки Festuca rubra ssp arctica Группировки Matricaria hookeri
I II I 11 A Б
A Б A Б A Б A Б
Festuca rubra ssp. arctica Puccinellia coarctata Cochlearia officinalis Matricaria hookeri Stellaria humifusa Ligusticum scoticum Rhodiola arctica Salix arctica sp. sol. soc. “90" sp. sp. 20 10 30 20 25 sp. soc. "95" sol. 15 25 15 soc. “80" sol. sol. 20 7 15 soc. *60“ sol. sp- 5 cop3 30 sol. sol. 20 30 3 soc.(gr.) 1 sol. soc. “95“ sol. sol. 50
Примечание. А: числитель — обилие
(здесь и далее по шкале Друде), знаменатель — проективное покрытие, %; Б — высота, см
Рис. 17 Распределение растительного покрова на приморских скалах в колонии
серебристых чаек. О-в Вешняк, Семь Островов, 1967 г
1 — скальная поверхность, 2 — Puccinellia coarctata, 3 — Festuca rubra ssp arctica, 4 —
Cochlearia officinalis, 5 — Rhodiola arctica, 6 — Ligusticum scoticum, 7 — скальные лужи,
8 — направление ската
80
6 И П Бреслина
81
ИЕ
10 |»X| 11
© 13 | 14
^7
Рис. 18. Распределение растительности
на приморских скалах в колонии се-
ребристых чаек на о-ве Большой Айнов.
Айновы острова, 1968 г.
1 — скальная поверхность; 2 — Puccinellia
coarctata, 3 — Cochlearia officinalis, 4 —
Rhodiola arctica, 5 — Honkenya diffusa;
6 — Festuca rubra ssp. arctica, 7 — Cata-
brosa aquatica, 8 — Matricaria hookeri;
9 — Cerastium holosteoides, 10 — Ligusti-
cum scoticum, 11 — скальные лужи и
«ванны», 12 — древесные выбросы моря;
13 — гнездо серебристой чайки; 14 —
направление ската.
О О
hookeri, куртины и отдельные крупные экземпляры Ligusticum
scoticum, увеличивается количество Rhodiola arctica (табл. 14),
а сами дерновины, разрастаясь вширь, как правило, смыкаются.
Примечательно, что на скалах Айновых островов Cochlearia
officinalis, являясь одним из доминирующих растений птичьих
скал, не образует таких мощных, как на Восточном Мурмане,
куртин и зарослей. Присутствие Honkenya diffusa в составе
82
Таблица 14
Геоботани характеристика фрагментов (1—III) первичной орнитогенной растительности приморских скал Айновых островов
— Группировки
Видовой Cochlearia Festuca rubra Honkenya Matricaria Ligusti-
officinalis ssp. arctica diffusa hookeri cum sco-
ticum
I II Ill I II Ill I II I II III
—-—" soc. soc. cop.3 cop4 sp. sp.
Festuca rubra ssp. а^с^са — sp. sp. “90“ ~7б~ 50 — 20 —
Puccinellia coarctata sp. — — — — sp- cn
Catabrosa aquatica sol.
Rumex acetosa sp. sp.
Montia fontana Cerastium holosteoides — — sol. — 501. (gr.) — — — sp. sol.
sol. sol. soc. soc.
Honkenya diffusa ”95“ "95"
soc. soc. soc. cop4 sp. COP-2 cop.2 cop-1 cop-2 sp.
Cochlearia officinalis “er IT "85" 20 30 sp. ”40“ 15 24 40
Rhodiola arctica sol sol. cop-i sol. sol. sp. sp. sol.
10 sol.
Potentilla egedii — — — — — — — — — sp. —
Rubus chamaemorus Ligusticum scoticurri — — sol. — — sp. — — — — sp. sol. sol. cop.3 80
Anthriscus Silvestris — — — — — —
ChamaepericlymenUfF1' suecicum sol. sp. soc. cop.3 cop-3 sp.
Matricaria hookeri sp. ~80~ 70 70
Примем е Числитель — обилие; знаменатель — проективное покрытие, %.
00
орнитогенной растительности объясняется, по-видимому, тем, что
условия ее произрастания на песчаниковых скалах Айновых остро-
вов несколько сходны с таковыми на песках и галечниках. Этим же,
скорее всего, можно объяснить и менее мощный рост орнито-
фильных растений: питательные вещества, проникая сквозь пори-
стую породу, быстрее вымываются.
Созданию условий для обитания на приморских скалах первич-
ной орнитогенной растительности, кроме всего прочего, способ-
ствует гнездовой материал. Пропитанный пометом, он является
великолепным субстратом для укоренения растений. По много-
численным наблюдениям, серебристые чайки нередко из года в год
гнездятся в одном и том же гнезде. Двукратное (с двух-трех-
летним перерывом) картирование гнезд серебристых чаек на при-
морских скалах островов Кандалакшского залива показало, что
там, где все прошлогодние гнезда не смываются зимними штор-
мами, чайки предпочитают использовать старые гнездовые лунки
(рис. 19, /). Для того чтобы помешать им использовать свои
гнезда в последующие годы и тем самым проследить за их зараста-
нием, в центр некоторых гнезд был поставлен кол. Однако и
в этом случае чайки все равно продолжали там гнездиться,
либо повалив кол, либо чуть-чуть сдвинувшись в сторону от
прошлогоднего гнезда (рис. 19, 11, III).
Ежегодно в старые гнездовые лунки чайки приносят свежий
гнездовой материал. С годами он напластовывается. На многолет-
нем гнездовом материале функционирующих и тем более забро-
шенных гнезд поселяются обычные скальные орнитофилы. При-
чем, если это злаки (чаще всего Puccinellia, Festuca rubra,
Роа alplgena), с годами края гнезда превращаются уже в есте-
ственный, из живых растений, хорошо выраженный гнездовой валик
(рис. 20).
Материал гнезд на приморских скалах, естественно, способ-
ствует как созданию фрагментов первичной орнитогенной расти-
тельности, уже не приуроченных к скальным трещинам, так и
смыканию лентообразных дерновин.
Большая плотность гнездящихся чаек и достаточная высота
острова, исключающая возможность смыва штормовыми волнами
торфянистого слоя со скал, также способствуют созданию сомкну-
той скальной орнитогенной растительности. Это зависит в свою
очередь от степени защищенности острова от штормов. Не исклю-
чено, что во время особо сильных штормов, случающихся, быть
может, раз в столетие или даже реже, этот уже сформировав-
Рис. 19. Распределение растительности на приморских скалах вокруг гнезд сере-
бристых чаек Иллюстрация их гнездового консерватизма Острова Кандалакшского
залива.
/ — о-в Асафьев, Кемь-Луды, //, /// — о-в Малая Седловатая луда, вход в Порью губу
1 — скальная поверхность, 2 — Puccinellia pulvinata, 3 — Festuca rubra, 4 — Роа alpigena,
5 — Cochlearia arctica, 6 — Tripoliutn vulgare, 7 — Matricaria hookeri, 8 — Rhodiola rosea,
9 — гнездо и разбросанный вокруг него гнездовой материал, 10 — лоток гнезда, // —
прошлогодний гнездовой материал, 12 — нанообрывчик; 13 — кол
84
________________I_____________________
1978 г. 1980 г.
1м
85
Рис. 20. Схема распределения растительности вокруг гнезда серебристой чайки
на приморских скалах, образующей естественный гнездовой валик. О-в Пупырь,
Красная губа, Кандалакшский залив, 1976 г.
1 — скальная поверхность, 2 — Puccinellia pulvinata, 3 — Leymus arenarius, 4 — лоток
гнезда.
шийся, более или менее сомкнутый скальный орнитогенный расти-
тельный покров может быть уничтожен. Но постепенно, в процессе
поднятия суши формирующаяся орнитогенная растительность вы-
ходит из-под уничтожающего влияния морских волн.
Смыкание дерновин — процесс непростой и длительный. На не-
большом островке (луда Добрушка) в Кандалакшском заливе
двукратное, с десятилетним интервалом картирование участка
первичной орнитогенной растительности с некоторой тенденцией
к ее смыканию не обнаружило в ней ощутимых изменений (рис. 21).
В то же время на многих приморских скалах, где гнездятся
чайки, выявлена также и тенденция разрушения и уничтожения
птицами дерновин первичной орнитогенной растительности. В июле
в Кольской Субарктике, особенно на Белом море, нередка засуха.
Пересыхают торфяные дерновины, особенно мелкие, и пересохшие,
они слегка отстают от скал. Чайки же в состоянии возбуждения,
вызванного, возможно, стремлением к осеннему ложному гнездо-
ванию, обычно рвут на скалах траву, а вместе с ней легко
вырывают и сухие торфянистые дерновинки.
К первичной орнитогенной растительности приморских скал,
с некоторой оговоркой, следует отнести и растительность
птичьих базаров, столь обычную для многих островов Восточного
Мурмана. Подробнее об этом — в специальном подразделе.
Рис. 21. Распределение растительности в колонии серебристых чаек на скальной
вершине о-ва Добрушка. Северный архипелаг, Кандалакшский залив.
1 — скальная поверхность, 2 — Festuca ovina, 3 — Роа alpigena, 4 — Calamagrostis пе-
glecta, 5 — Alopecurus arundinaceus, 6 — Atriplex nudicaulis; 7 — Matricaria hookeri,
8 — Sedum acre; 9 — Potentilla arctica; 10 — Tanacetum vulgare; 11 — Heracleum sibiri-
cum, 12 — Ribes acidum, 13 — гнездо серебристой чайки
86
87
1978г.
Рис 22 Очаги первичной орнитогенной растительности на валунной россыпи.
Кемь-Луды, Кандалакшский залив.
/ — окраина плотной колонии серебристых чаек, расположенной на примыкающих к этой
россыпи приморских скалах, о-в Асафьев, // — разреженная колония полярных крачек,
о-в Малый Асафьев / — валунная россыпь, 2 — Festuca rubra, 3 — Festuca ovina, 4 —
Rhodiola rosea, 5 — Sedum acre, 6 — Rubus saxatilis, 7 — гнездо, 8 — лоток гнезда
88
Не занятые птичьими колониями приморские скалы островов
как Мурмана, так и Кандалакшского залива почти лишены
высшей растительности, лишь по некоторым трещинам здесь ра-
стут единичные галофиты. Только благодаря помету, вносимому
гнездящимися птицами, приморские скалы одеваются красочной,
яркой, буйной растительностью.
В том случае, когда на валунных россыпях гнездятся сереб-
ристые или сизые чайки, здесь также возникает первичная орцито-
генная растительность, неоднократно встреченная на островах
Кандалакшского залива. Однако до сих пор не удалось обнару-
жить ни одной колонии, сплошь занимающей валунные россыпи.
Обычно же на них селятся отдельные чайки из примыкающей
к валунным россыпям колонии. Чаще всего очаги первичной
орнитогенной растительности здесь формируются на месте суще-
ствующих или старых чаячьих гнезд, а также близ них. Преиму-
щественно произрастают сухолюбивые орнитофильные виды. Это
Rhodiola rosea, Sedum acre, Festuca ovina и F. rubra. Если же
чайки гнездятся или отдыхают на расположенных близко к урезу
воды во время прилива валунных россыпях, то здесь пышно
разрастается Mertensia maritima. На о-ве Асафьев на валунной
россыпи близ мыса Наблюдателей встречен очаг первичной орни-
тогенной растительности с некоторой тенденцией к смыканию
дерновин (рис. 22).
Удалось проследить такую же тенденцию к увеличению покры-
той растительностью площади валунной россыпи в месте гнездова-
ния полярной крачки (Кемь-Луды, Кандалакшский залив). Ее
гнездо и окружающие его растения были закартированы в 1978 г.
1 м
Рис. 23 Распределение
на завалах плавника
t -- скальная поверхность
89
А в 1980 г., когда крачка на этом участке уже не гнездилась,
он был перекартирован. Сопоставление обеих картосхем (рис. 22)
показало, что на месте бывшего гнезда укоренились ползучие
побеги соседствующей с ним Rubus saxatilis и разрослась росшая
поблизости Festuca ovina (это одно из немногих позитивных
наблюдений за влиянием полярной крачки на растительный по-
кров) .
Первичная орнитогенная растительность, формирующаяся на
завалах плавника (рис. 23), богаче, чем таковая в каменистых
россыпях. Гниющая дерновина, обильно удобренная пометом,—
очень хороший субстрат для поселения многих растений. К тому же
она еще и очень влагоемка. И наверное, поэтому на островах
Кандалакшского залива в подобных орнитогенных ценозах можно
встретить наряду с господствующей ромашкой и такие довольно
влаголюбивые растения, как Sonchus humilis, Alopecurus arundi-
naceus, Atriplex nudicaulis.
На островах Кандалакшского залива при ослаблении воздей-
ствия морских птиц на первичный орнитогенный растительный
покров на его дерновинах в большом количестве поселяется
Drepanocladus uncinatus.
Так, на Пинских лудах (близ Кандалакшского берега), обыч-
ном месте отдыха рыбаков-любителей, в прошлом на приморских
скалах была большая колония серебристых чаек (по рассказам
очевидцев и судя по облику их растительности). Чайки перестали
здесь гнездиться из-за частых посещений людьми этих островов
в последние годы (в чем повинен быстроходный маломерный
флот). А на скалах в лентообразных дерновинах очень разросся
Drepanocladus uncinatus, и здесь же на его подушках — свежие
поселения молодой Empetrum hermaphroditum. Это уже, воз-
можно, зачаточная стадия формирования приморских воронични-
ков — основной растительности безлесных островов в Кандалакш-
ском заливе.
Первичная орнитогенная растительность всегда возникает и
развивается на местах, доселе лишенных растительного покрова,
и в каждом регионе она имеет свой специфический видовой
состав. Растительность, имеющую свою историю и не зависящую
первоначально от жизнедеятельности птиц, нельзя причислять
к первичной орнитогенной, как это сделал А. Б. Георгиевский
(1981), отнеся к таковой, к примеру, заросли щитовника и заросли
калужницы, распространенные в щелевых лощинах Гавриловских
островов.
ВТОРИЧНАЯ ОРНИТОГЕННАЯ РАСТИТЕЛЬНОСТЬ
В условиях островов Кольской Субарктики вторичная орнито-
генная растительность чаще всего формируется на сухих воронич-
ных торфяниках, но может возникнуть среди любой другой расти-
тельной формации, если там загнездятся морские колониальные
птицы.
90
Рис. 24. Нора тупика. О-в Большой Зеленец, Семь Островов, 1966 г.
Рис 25 Разрушение торфяного пласта в результате роющей деятельности тупиков.
О-в Кувшин, Семь Островов, 1967 г.
91
Рис 26. Участок колонии тупиков Сетка натянута для картирования его раститель-
ности. О-в Кувшин, Семь Островов, 1967 г.
Вторичный орнитогенный растительный покров торфяников за-
висит как от видового состава и плотности птиц колонии, так
и от прошлой истории каждого конкретного участка. В разных
регионах Кольской Субарктики вторичная орнитогенная расти-
тельность вороничных торфяников несколько различается по фло-
ристическому составу слагающих ее ценозов.
Наиболее сильное воздействие на почву и растительный покров
оказывают колонии тупиков. Тупики копают и ежегодно рас-
чищают свои норы и при этом полностью уничтожают первона-
чальную вороничную растительность (рис. 24). Причем интенсив-
ная роющая деятельность тупиков в наиболее плотных участках
колоний может привести и к полному разрушению торфяного
пласта. Коренная порода при этом оголяется (рис. 25). Раститель-
ный покров тупиковых колоний очень пестр (рис. 26—28). Это
прежде всего разнообразнейшие сочетания Matricaria hookeri,
предпочитающей рыхлые, самые свеженарушенные почвы, и Co-
chlearia officinalis (она почти не растет на колониях тупиков
Айновых островов), а также Rutnex acetosa, R. acetosella 0 tenuifo-
lius, Festuca rubra ssp. arctica, а для колоний тупиков на Айно-
вых островах и в меньшей степени на Гавриловских — еще
и Melandrium lapponicum.
На большинстве колоний тупиков о-ва Кувшин (Семь Остро-
вов) и на одной из колоний о-ва Малый Айнов пышная орнитоген-
92
ная растительность перемежается с пятнами голого вытоптанного
торфа, и местами такие пятна даже преобладают над раститель-
ным покровом (рис. 27, //; 28, //; 29). Во всех остальных случаях
в колониях, даже очень плотных, почти отсутствовали вытоп-
танные участки (данные конца 60-х годов). Наблюдения показали
(И. И. Татаринкова, устное сообщение), что вытаптывающее воз-
действие тупиков на растительный покров обусловлено как плот-
ностью колонии, так и их поведением, выражающемся в более
или менее длительном пребывании тупиков на участке колонии
вне норы, в наличии или отсутствии их «клубной деятельности».
В свою очередь это прямо связано со степенью интенсивности
хищничества крупных чаек. При усилении хищничества е их сто-
роны тупик с моря летит прямо в нору, а из норы сразу в море.
Во второй половине 60-х годов на Айновых островах стали очень
интенсивно зарастать ранее сильно вытоптанные участки их коло-
ний. Это сокращение вытоптанных тупиками участков раститель-
ности, скорее всего, надо отнести за счет изменения поведения
тупиков, вызванного резким увеличением численности крупных
чаек на Айновых островах в 60-е годы.
На Айновых островах удалось проследить, что в тех участках,
где сильно вытаптывающее воздействие тупиков на растительный
покров, в основном растет Matricaria hookeri, а где вытаптывание
почти не выражено, — Rumex acetosa. Участки, интенсивно вытап-
тывавшиеся в прошлом, обычно зарастают Rumex acetosella (3
tenuifolius.
Т. Д. Герасимова и Н. Н. Скокова (1959) отмечают пласты
торфа с ассоциациями ромашки как предпочтительные гнездовые
стации для тупиков Айновых островов, не заостряя, однако,
внимания на том, что ассоциации ромашки возникают сами
вследствие поселения тупиков. В более поздней работе Н. Н. Ско-
ковой (1962) указывается, что на Айновых островах ромашка
селится на свеженарушенной почве колоний тупиков, и упомина-
ется ряд ассоциаций, видовой состав которых зависит от степени
и давности заброшенности тупиковых колоний.
Брошенные и затухающие колонии зарастают Rumex acetosa,
R. acetosella p tenuifolius, Rubus chamaemorus, а на Айновых
и Гавриловских островах еще и Melandium lapponicum. Только
на Айновых островах некоторые брошенные колонии нередко густо
поросли к тому же Chamerion angustifolium и Dryopteris exspansa
(рис. 30).
И на Айновых островах, и на о-ве Кувшин среди орнитогенных
ценозов заброшенных колоний обнаружены пятна Empetrum spp.
Обитание ее в подобных участках заброшенных колоний, по-
видимому, замыкает цикл смен растительного покрова тупиковых
колоний. Однако новых поселений тупиков среди вороничных
ассоциаций нигде, к сожалению, не удалось обнаружить.
Геоботанические описания, сделанные в тупиковых колониях
по обычной форме, не могут отразить всего своеобразия их расти-
тельности из-за ее пестроты и непостоянства (табл. 15—17).
93
эд
//
///
6 EWM @ 9 ® 10
1м
Рис 27. Распределение растительности в разных колониях тупиков (/—///) на
о-ве Кувшин. Семь Островов.
1 — скальная поверхность; 2 — Matricaria hookeri; 3 — Rumex acetosella 0 tenuifolius,
4 — Rumex acetosa; 5 — Cochlearia officinalis; 6 — Festuca rubra ssp. arctica, 7 — Cala-
magrostis groenlandica; 8 — обнаженный торф; 9 — жилая нора тупика, 10— заброшен-
ная нора тупика, 11 — направление ската.
Там, где на сухих торфяниках гнездятся большие морские,
серебристые и сизые чайки, первоначальная вороничная расти-
тельность также сменяется на вторичную орнитогенную. На Семи
и Гавриловских островах существуют как большие, площадью
более гектара, участки вторичных орнитогенных ценозов, так и
совсем маленькие «пятачки» — места обособленного гнездования
пары крупных чаек.
Влияние чаек на состав растительности проявляется как
в местах их гнездования, так и там, где они регулярно собираются
в больших количествах на отдых (гнезда в этих участках встре-
чаются крайне редко).
Вторичная орнитогенная растительность островов Восточного
Мурмана, возникшая под влиянием больших скоплений чаек, чаще
всего представлена группировками Cochlearia officinalis с незначи-
тельным присутствием других орнитофильных видов: Cochlearia
officinalis 4- Rubus chamaemorus; Plantago schrenkii (или P. mari-
tima) + Rubus chemaemorus; Rumex acetosa + Rubus chamaemo-
rus; Cochlearia officinalis + Matricaria hookeri; Festuca rubra ssp.
arctica + Cochlearia officinalis, а на Гавриловских островах
в подобных группировках в заметном количестве присутствует
еще и Melandrium rubrum. Empetrum hermaphroditum при этой
может полностью исчезнуть (табл. 18).
Исчезновение Empetrum hermaphroditum в местах массового
обитания чаек происходит постепенно. Это можно хорошо просле-
дить при следовании от участков, где чайки гнездятся более
95
I
II
96
Ill
6 (ЛЮ 7 (=j 8 9 & 10
e
1м
Рис. 28. Распределение растительности в колониях тупиков на Айновых островах
I, II — о-в Малый Айн>ов; /// — о-в Большой Айнов 1 — Matricaria hookeri, 2 — Rumex
acetosa, 3 — Melandrium lapponicum, 4 — Cochlearia officinalis, 5 — Dryopteris expansa,
6— Trientalis europaea, 7 — Rubus chamaemorus, 8 — обнаженный торф; 9 — жилая нора
тупика, 10— заброшенная нора тупика, 11 — гнездо серебристой чайки
разреженно, к местам плотного их поселения. Сначала к пер-
вичной вороничной ассоциации примешиваются отдельные орнито-
фильные растения, постепенно их обилие возрастает и появля-
ются плешины с сухими веточками отмершей Empetrum herma-
phroditum. Они увеличиваются, смыкаются, а живая Empetrum
hermaphroditum остается лишь в виде куртин; Rubus chamaemorus
же усиливает свое обилие. В свою очередь разрастается орни-
тогенная растительность. В центре плотной колонии чаек Empet-
rum hermaphroditum, как правило, отсутствует, a Rubus chamae-
morus порой смыкается. При этом на периферии плотной колонии,
где, по-видимому, в периоды подъема численности крупных чаек
происходят процессы отмирания Empetrum hermaphroditum и ста-
7 И П Бреслина 97
Рис 29 Участок колонии тупиков с пятнами вытоптанного птицами торфа, пере-
межающимися с куртинами Matricaria hookeri. О-в Кувшин, Семь Островов,
1967 г
новления орнитогенных ценозов, растительный покров наиболее
пестрый. Эта пестрота обусловлена пятнами живой и отмершей
Empetrum hermaphroditum, лишайниковыми пятнами (Ochrolechia
tartarea и Sphaerophorus globosus) и куртинами еще не установив-
шейся орнитогенной растительности. Растительные микрогруп-
пировки сменяют друг друга через каждые 20—30 см. Со временем
лишайники здесь отмирают, поверхность торфа обнажается и на
нем селятся орнитофильные растения. Но они могут расселяться
и непосредственно среди веточек Empetrum hermaphroditum.
В центре плотной колонии пестрота растительного покрова не-
значительна, хотя и имеется; Empetrum hermaphroditum, как пра-
вило, отсутствует, a Rubus chamaemorus и некоторые другие
виды образуют почти сомкнутые заросли. Пространственное ста-
новление вторичной орнитогенной растительности наиболее на-
глядно можно проследить в плотных чаячьих колониях небольших
островов (табл. 19; рис. 31).
В конце 70-х—начале 80-х годов, когда численность гнездя-
щихся на Семи Островах крупных чаек заметно упала, на участ-
ках многих их колоний, ранее почти сплошь занятых группиров-
ками вторичной орнитогенной растительности, значительно воз-
росли число контуров и общая площадь вороничника (Бреслина,
Георгиевский, 1983). Тем самым подтвердилось ранее сделанное
предположение (Бреслина, 1969), что при сокращении птичьих ко-
98
Таблица 15
Геоботаническая характеристика растительных группировок (I—VI) в колониях
тупиков о-ва Малый Айнов
Обилие (А) и проективное покрытие (Б, %)
Видовой состав
Rumex acetosa
Cerastium sp
Melandrium
lapponicum
Cochlearia offi-
cinalis
Rubus chamae-
moris
Trient alls
europaea
Matricaria
hookeri
sp
sol.
sol.
sol
soc. 85
soc. 70
sol.
sol
sol
sp.
cop.3
cop.
40
20
cop.3
sol.
cop4
soc.
Б
10
VI
А Б
сорч 15
sol.
cop.3 50
А Б А Б
Таблица 16
Геоботаническая характеристика растительных группировок (I — III) в затухающей
колонии тупиков на о-ве Большой Айнов
Видовой состав Обилие (А) и проективное покрытие (Б; %)
I II III
А Б A Б A Б
Dryopteris expansa — — sol
Rumex acetosa soc. 70 cop.2 20 sp
Cerastiumholosteoides — — sol.
Melandrium lappo- sol — sol. — sol.
nicum
Cochlearia officinalis sol — sol. — sol.
Rubus chamaemorus sol. — cop.3 40 cop.] 10
Trientalis europaea sol. — sp. — sp.
Euphrasia frigid a — sol
Matricaria hookeri k — 4
лоний возможен обратный процесс — процесс восстановления во-
роничника.
В разреженных чаячьих колониях некоторые пары чаек гнез-
дятся или же постоянно сидят (отдыхают) на обособленном
небольшом участке, предпочитая при этом небольшие возвышения.
Естественно, в таких местах среди вороничника образуются очаги
99
Таблица 17
Геоботаническая характеристика растительных группировок (I — VII) в колониях тупиков на Семи Островах
Видовой состав О-в Большой Зеленец О в Кувшин
I II III IV I II III IV V VI VII
Festuca rubra ssp arctica sol sol sol — sol cop 2 20 — soc. To" sol cop 3 50
Rumex acetosella P tenuifohus — — — — sol — soc — — — sp
R. acetosa sp 2 sol cop-1 20 SP 5 — — — — cop-3 60 sol sp 5
Cerastium alpinum — — sol sol — — — — sol
Cochlearia officinalis soc ~80~ CQP 2 45 sp 10 cop 1 15 sp 8 sp. sol. sp sp sol soc “90"
Empetrum hermaphro- ditum — — — sol
Plantago schrenku — — sol “0l5~ sp 6
Matricaria hookeri sol ““Г- COp.2 45 sp- 5 sol ~2~" soc ТЙГ soc ~w sol ~5“ sol. , cop 1 8 sp. sp 5
Примечание Числитель — обилие, знаменатель — проективное покрытие, %
Таблица 18
Геоботаническая характеристика растительных группировок вторичных орнитогенных ценозов Семи Островов
Видовой состав О-в Мал Лицкий О-в Бол Зеленец О-в Бол Зеленец О-в Кувшин О-в Кувшин О-в Мал Лицкий О-в Бол Гав- риловский
A Б A Б A Б A Б A Б A Б А Б
Festuca rubra ssp. arctica sp 1 cop j 5 sp. 0.5 — — sol — cop.3 40 сор 3 20
Calamagrostis groenlandica — — — — — cop i — — sol.
Carex tripartita sol. — — — sol.
Rumex acetosella p tenuifolius sol. — sp. 5 — — sol. — cop.3 30 sol. 1 sp. 5
R. acetosa sp. 5 COp4 8 sp. 1 cop.3 30 sp.
Cerastium alpinum sol — sp 4 sol — sol. — sol — sp. 2 сор.2 15
C. holosteoides sol. — sol
Melandrium lapponicum — — — — — — — — — — — сор.з 30
Cochlearia officinalis soc. 80 cop.3 30 sp 1 — — sp — cop.3 40 sol.
Rhodiola arctica сор 2 20
Rubus chamaemorus sp. 2 cop.3 40 COp.2 20 cop 3 40 cop.3 80 — 1
Empetrum hermaphroditum — — sol
Ligusticum scoticum — — sp. 5
Angelica archangehca sol. 1 — — — — — — — — sol 0.5
Trientalis europaea — — — — COp4 4 — — sp.
Plantago maritima sp. 2 — — — — — sol
P. schrenkii — sp 1 cop з 30 — — — — sol 05
Marticaria hookeri sp. 05 sp. 05 — sol — sp — — — сор.2 30
Senecio integrifohus — сор.. 10
Примечание А — обилие, Б — проективное покрытие, %
102
Таблица 19
Проективное покрытие растений в местах с различной плотностью гнездования
чаек на о-ве Большой Зеленец, %
Видовой состав Периферия плот- ной колонии Промежуточный участок Центр плотной колонии
Empetrum hermaphroditum 35 10 —
Rubus chamaemorus 15 20 40 •
Cochlearia officinalis + 2 30
Plantago schrenkii + 0.5 1
Rumex acetosella p tenuifolius + 0.1 5
R acetosa + 0.3 8
Marticaria hookeri — — ' 0.5
Cerastium holosteoides + + +
C alpinum 0.5 1 4
Trientalis europaea — 0.1
Carex tripartita + 1
Festuca rubra ssp. arctica 0 1
Calamagrostis groenlandia +
орнитогенной растительности (рис. 32, 33). Чаще всего это кур-
тины Matricaria hookeri, реже — Carex tripartita, Calamagrostis
groenlandica, Festuca rubra ssp. arctica, Cochlearia officinalis,
Plantago schrenkii, Rumex acetosella £ tenuifolius. В центре часто
имеется участок вытоптанной земли (торфа).
Вокруг таких очагов орнитогенной растительности, нередко
даже на значительном расстоянии от них, вороничник сильно
засорен орнитофильными видами. Здесь наряду с Empetrum
hermaphroditum обычны Cerastium alpinum, С. holosteoides,
Cochlearia officinalis, Trientalis europaea, Rumex acetosella p tenu-
ifolius, Plantago schrenkii, P. maritima, Campanula groenlandica,
Senecio integrifolius; Empetrum hermaphroditum при этом может
частично отмирать. В целом характер растительного покрова
засоренного орнитофильными видами вороничника тождествен ра-
стительности периферии плотных чаячьих колоний.
В разреженной колонии крупных чаек в вороничниках вокруг
многочисленных гнезд, где ежегодно гнездятся чайки, а также
у некоторых многолетних гнезд гаги существует естественная
стенка из Calamagrostis groenlandica, Festuca rubra ssp. arctica,
Luzula wahlenbergii, двудольных орнитофильных растений.
Иногда вокруг гнезда образуется валик из Drepanocladus unci-
Рис. 30. Распределение растительности на участке заброшенной колонии тупиков
в верхней части восточного склона о-ва Большой Айнов. Айновы острова, 1968 г.
1 — Dryopteris expansa, 2 — Rumex acetosa, 3 — Chamerion angustifolium, 4 — Melan-
drium lapponicum, 5 — обнаженный торф, 6 — Rubus chamaemorus, 7 — Matricaria hoo-
keri, 8 — Cerastium alpinum, 9— Trientalis europaea, 10 — пятна зеленых мхов, 11—
заброшенная нора тупика, 12— гнездо серебристой чайки
103
Периферия
EZP
Esh И*
13 :<V ® 15
Рис. 31 Распределение растительности на участке колонии серебристых чаек
(от периферии колонии к ее центру) на вороничном торфянике. О-в Большой Зеле-
1 нец, Семь Островов, 1966 г
1 — скальная поверхность, 2 — Empetrum hermaphroditum, 3 — Empetrum hermaphrodi-
tum + Rubus chamaemorus, 4 — Rubus chamaemorus, 5 — Plantago schrenku + Rubus
chamaemorus, 6 — Cochlearia officinalis + Rubus chamaemorus, 7 — Plantago schrenkii
+ Rubus chamaemorus + Cochlearia officinalis, 8 — Cochlearia officinalis, 9 — Festuca
rubra ssp arctica + Cochlearia officinalis + Rubus chamaemorus, 10— Cerastium alpinum,
11 — Festuca rubra ssp arctica, 12—пятна лишайников, 13— отмершая дерновина
выдела, 14 — отмирающая дерновина выдела, 15—гнездо серебристой чайки, 16 — тре-
щина в торфе, 17 — направление ската
104
Рис. 32 Куртина Matricaria hookeri на возвышенности среди вороничника —
место постоянного пребывания пары серебристых чаек. О-в Вешняк, Семь Островов.
1967 г
natus. Кольцеобразные злаковые дерновинки, нередко встреча-
ющиеся в вороничниках, скорее всего, растут вокруг мест, где
в прошлом были гнезда.
Л. О. Белопольский (1957) считает, что растения кольцевого
валика вокруг многолетних гнезд гаги на Новой Земле (злаки,
радиола, ива карликовая) защищают гнездо гаги и ее саму
от ветра и отчасти от хищников. На островах, расположенных
близко от о-ва Вайгач, по зарастающим лункам от старых гагачьих
гнезд даже можно судить, насколько часто гага гнездилась
здесь в прошлом (Карпович, Коханов, 1963).
Особое место среди торфяников островов Восточного Мурмана
занимают щелевые лощины с их своеобразным гидрологическим
режимом и особым растительным покровом. Основная преоблада-
ющая растительность щелевых лощин, как уже было отмечено
в 1-й главе, — деренный и щавелевый морошечники. В местах же
высачивания торфяных вод растут Caltha palustris и Angelica
archangelica. Однако в том случае, когда щелевые лощины пере-
секают большие колонии крупных чаек или проходят вблизи них,
растительный покров этих лощин заметно меняется. Чайки в самих
щелевых лощинах обычно не гнездятся. Однако их птенцы после
вылупления нередко уходят в ближайшие лощины и обитают там.
В результате в растительный покров таких лощин внедряется
целый ряд видов орнитофильных растений, в том числе Cochlearia
officinalis, Ligusticum scoticum, Rhodiola arctica, Senecio integri-
folius, Cerastium alpinum, Matricaria hookeri, Festuca rubra ssp.
105
Рис 33 Распределение растительности на участках (/—///) обособленного
пребывания отдельных пар крупных чаек посреди вороничника О-в Вешняк,
Семь Островов, 1967 г.
/ — Empetrum. hermaphroditum, 2 — Matricaria hookeri, 3 — Cochlearia officinalis-, 4 —
C officinalis + Rubus chamaemorus-, 5 — Cerastium alpinum, 6 — Calamagrostis groenlan-
dica, 7 — Trientalis europaea, 8 — Plantago maritima, 9 — Festuca rubra ssp arctica,
10 — обнаженный торф, 11 — скальная поверхность, 12 — отмершая растительность вы-
дела, 13—отмирающая растительность выдела
arctica. А на Гавриловских островах еще, и в очень большом
количестве, растет Melandrium lapponicum. В деренных морошеч-
никах исчезает Chamaepericlymenum suecicum. В самом излюблен-
ном месте пребывания птенца растительный покров утоптан. На
остальных участках он очень густой, и листья одного вида расте-
106
Таблица 20
Геоботаническая характеристика растительных группировок (I, II) вторичной
орнитогенной растительности щелевых лощин (Восточный Мурман)
Обилие (А) и проективное покрытие (Б, %)
I (о-в Мал. Гавриловский) II (о-в Мал Лицкий)
А Б А Б
Festuca rubra ssp. arctica sp. 2
Carex mackensiei — — sol.
Rumex acetosa СОр.2 20 сор.2 20
Montia fontana — — сор.2 15
Stellaria humifusa — — сор., 10
Cerastium alpinum sp. 3
Melandrium lapponicum сор.3 30
Caltha palustris — — sol
Cochlearia officinalis sol. — сор3 50
Rhodiola arctica sp. 10
Ligusticum scoticum sp. 10 sol.
Rubus chamaemorus сор-з 25 сор.з 30
Angelica archangelica — — sp. 15
Matricaria hookeri sol. — sol.
Senecio integrifolius sp 5
ний перекрывают листья другого (табл. 20). Caltha palustris и
Angelica archangelica, растущие в местах высачивания торфяных
вод, сильно разрастаются, проявляя при этом признаки гиган-
тизма. Сочащийся торфяной пласт нередко покрывает сплошная
густая «щетка» Montia fontana.
Больше всего под воздействием чаек меняется растительный
покров торфяников маленьких островов, где плотность гнездова-
ния птиц наиболее высока. Именно вследствие того что масса
птиц обитает на сравнительно небольшой территории, вся она
находится под сильным влиянием их жизнедеятельности. Так, на
о-вах Малый Лицкий и Малый Зеленец растительный покров в той
или иной степени изменен повсеместно. Наоборот, на крупных
островах (Вешняк, Большой Лицкий) изменения в растительности
происходят только в местах концентрированных поселений чаек.
Здесь вороничник полностью не исчезает, а лишь частично отми-
рает и засоряется другими видами. Основная растительность
крупных островов в промежутках между такими участками плот-
ного гнездования сохраняется без заметных изменений.
Орнитогенная растительность торфяников Гавриловских остро-
вов (плато, склонов, щелевых лощин) причислена А. Б. Георгиев-
ским (1981) к первичной орнитогенной. Он не оговорил критерий
выделения им первичных и вторичных орнитогенных ассоциаций,
а из анализа предложенной автором таблицы и наших наблю-
дений, проведенных на Гавриловских островах, можно заключить,
что им отнесен к первичным целый ряд вторичных орнитоген-
ных ассоциаций, в том числе «воронично-щавелево-трехребернико-
107
вая», «ложечницево-звездчатковая», «щавелево-трехреберниково-
холодоовсяницевая», « разы отрав но-ща вел ево-холодоовся ни де-
вая», «дремово-звездчатковая с дягилем», «мятликово-щавеле-
вая со щитовником» и даже «заросли щитовника» и «заросли
калужницы» (терминология А. Б. Георгиевского). Вторичные
орнитогенные ассоциации приведены им в одном списке с тундро-
образными. Судя из анализа таблицы, ко вторичным орнитоген-
ным ассоциациям А. Б. Георгиевский, по-видимому, относит
только «морошково-воронично-вейниковую», «щавелево-морош-
ково-вороничную», «ясколко-морошково-щавелевую» и «морош-
ковую».
Многочисленные орнитогенные группировки («ассоциации», по
А. Б. Георгиевскому), судя опять же из анализа таблицы, выде-
лены по формальному признаку (обилию видов). В результате
автор не обобщил свои наблюдения о растительности островов,
в том числе и орнитогенной, а представил их в раздробленном
виде, категорично подсчитав при этом даже число ассоциаций
всего архипелага.
На сухих торфяниках Айновых островов преимущественно
гнездятся большие морские чайки. Их гнездовья разреженно
разбросаны повсеместно. Плотные колонии редки. Местами
здесь же единично гнездятся серебристые чайки. В неда-
леком прошлом на обоих островах обитали тупики и плотность
их гнездования была чрезвычайно высокой (Скокова, 1962).
По этой причине на островах проходил процесс интенсивного
отмирания Empetrum nigrum и первоначальный растительный по-
кров сохранился большей частью только отдельными пятнами.
Основная же растительность плато Айновых островов представ-
лена ассоциацией Rubus chamaemorus + Rumex acetosa 4- Melan-
drium lapponicum, перемежающейся более или менее крупными
пятнами морошкового вороничника, сильно засоренного, однако,
орнитофильными видами. Повсюду здесь же разбросаны «клумбы»
Matricaria hookeri, реже «ковры» из Rumex acetosella р tenuifo-
lius (табл. 21; рис. 34). Это места интенсивного современного
локального воздействия крупных чаек. Лощинообразные пониже-
ния плато занимают заросли Drypteris expansa в сочетании
с Rubus chamaemorus в нижнем ярусе. Эти понижения обычны для
плато обоих Айновых островов. Как правило, чайки здесь не гнез-
дятся. Однако заросль Dryopteris expansa служит хорошей защи-
той для затаивающихся птенцов чаек при опасности. Поэтому
заросли папоротникового морошечника в той или иной мере
засорены орнитофильными видами, прежде всего Melandrium lap-
ponicum, Matricaria hookeri, Rumex acetosa. На Айновых островах,
во вторичных орнитогенных ценозах сухих торфяников редко и
единичными экземплярами встречается Cochlearia officinalis, столь
обычная для подобных ценозов Семи Островов.
Многие ценозы плато Айновых островов представляют собой,
скорее всего, последнюю стадию зарастания покинутых колоний
тупиков, и одновременно на этом фоне на растительный покров
108
Таблица 21
Геоботаническая характеристика различных участков (I—VI) вороничника, засо-
ренного орнитофильными видами, и вторичных орнитогенных ценозов плато
о-ва Большой Айнов
Обилие (А) и проективное покрытие (Б, %)
Видовой состав
III
Rumex aceto-
sella р tenui-
folius
R. acetosa
Cerastium
hoiosteoides
sol
Melandrium sol.
lapponicum
Cochlearia sol.
officinalis
Rubus cha- cop.3
maemorus
Empetrum
nigrum
Trientalis
europaea
Euphrasia
frigida
Matricaria
hookeri
soc
sol
sol
sol
25
80
sol.
sol
sp
soc
cop.i
sp.
sol.
cop 2 30
80 cop )
V
А Б
sol
sol
сорч 20
sp.
cop з 70
VI
А Б
soc 90
sp
sol.
sol.
sol
cop 2 20
А Б
накладывается еще очень существенное и интенсивное воздействие
гнездящихся здесь же больших морских чаек.
Для большинства вторичных орнитогенных ценозов торфяников
всех островов Мурмана характерно резкое усиление обилия Rubus
chamaemorus по сравнению с исходными ценозами. По мнению
И. Д. Богдановской-Гиенеф (1946), морошка является ценоти-
чески слабым растением. Ее разрастание, скорее всего, связано
с выпадением Empetrum spp. под влиянием жизнедеятельности
птиц и обогащения субстрата элементами питания. Rubus chamae-
morus, растущая в орнитогенных ценозах, очень хорошо плодо-
носит. Учет ее урожая (Бреслина, 1970), проведенный в 1967 г.
на архипелаге Семь Островов, на островах Большой Зеленец,
значительная часть площади которого занята вторичными орнито-
генными ценозами, и Большом Лицком, где отсутствуют большие
участки вторичной орнитогенной растительности, показал, что на
торфяниках о-ва Большой Зеленец средняя величина ее урожая
составила 73 кг/га, а на торфяниках Большого Лицкого — 33 кг/га.
Очень большой урожай морошки ежегодно отмечается, к сожале-
нию, правда, только лишь визуально, на о-ве Кувшин (Семь
Островов), славящемся своими птичьими базарами, первоначаль-
ная растительность которого сильно изменена комплексным влия-
нием множества гнездящихся на нем различных морских птиц.
109
Рис. 34. Распределение растительности на участке разреженной колонии больших
морских чаек на вороничном торфянике плато о-ва Большой Айнов, Айновы
острова, 1968 г.
1 — морошковый вороничникс примесью орнитофильных видов, 2 — Rubus chamaemorus +
Rumex acetosella 0 tenuifolius; 3 — Rubus chamaemorus -\-Rumex acetosa; 4 — Rubus cha-
maemorus 4- Matricaria hookeri; 5 — Matricaria hookeri; 6 — Rumex acetosella $
tenuifolius; 7 — Rumex acetosa; 8 — пятно обнаженного торфа, редко поросшее орнито-
фильными видами, 9 — гнездо большой морской чайки.
Wk ъглива в отли-
чие от островов Мурмана смена первичной вороничной раститель-
ности ИН
Ъжсъ VC&Vv И W<\ te\W В
тъ\вв¥днхси rbsktвлъности и осилив ънсу^смввтов Empetrum
ио
hermaphroditum отмирает. Чаще всего ее сменяет Euphrasia fri-
gida, Achillea apiculata, Rhinanthus minor, Campanula rotundifo-
lia, Dianthus superbus, Festuca ovina и F. rubra, Poa alpigena.
В вороничнике, в излюбленных местах постоянного локального
пребывания и гнездования чаек (чаще сизых), образуется крупная
(площадью несколько квадратных метров), плотная и хорошо
сформированная злаковая дернина. Обычно это Festuca ovina
(рис. 35). На Большой Средней луде (архипелаг Средние луды)
на месте отмершего вороничника обильно растет Trientalis euro-
paea и необычного габитуса Atriplex nudicaulis. При умеренном
воздействии чаек в подобных местах такие исконные растения
беломорских вороничников, как Vaccinium uliginosum и Rubus
saxatilis, не только не исчезают, а наоборот, разрастаются. Причем
Rubus saxatilis разрастается наиболее сильно и великолепно пло-
доносит (визуальные наблюдения).
Здесь, на островах Кандалакшского залива, чаще всего участки
с измененной птицами растительностью (табл. 22) тянутся по
гребню островной гряды прерывистой полосой и приурочены
к наиболее возвышенным участкам гребня. Это обзорные пло-
щадки чаек—излюбленные места их пребывания (рис. 36).
Для обзора еще более любимы ими незаторфованные, возвы-
шающиеся среди вороничника одиночные камни (рис. 37). Как
правило, их окаймляет бордюр из орнитофильных видов, обычно
это Stellaria graminea, Cerastium holosteoides, Achillea apiculata,
Рис. 35. Распределение растительности на пологом возвышении на участке постоян-
ного локального пребывания сизых чаек посреди вороничника. Кандалакшский
залив, о-в Малая Седловатая луда, вход в Порью губу, 1980 г.
1 — Empetrum hermaphroditum, 2 — Festuca ovina, 3 — Festuca ovina -|- Dianthus super-
bus, 4 — стелющийся Juniperus sibirica с примесью орнитофильного разнотравья; 5 — сте-
лющийся Juniperus sibirica (встречается в различных группировках, в самостоятельный
выдел не выделен) ; 6 — гнездо сизой чайки.
111
Таблица 22
Проективное покрытие растений на одном из наиболее возвышенных участков
гребня островной гряды, расположенной посреди вороничника — обзорной пло-
щадки чаек
(о-в Малая Коржничиха, Кемь-Луды)
Видовой состав Проективное покрытие, % Видовой состав Проективное покрытие, %
Festuca ovina 12 Vaccinium uliginosum ‘ 20
Rumex thyrsiftorus + V. vitis-idaea +
Dianthus superbus 10 Euphrasia frigida 5
Rubus chamaemorus 8 Campanula rotundifolia 3
R saxatilis 15 Зеленые мхи 30
Lathyrus aleuticus + Cetraria nivalis +
Empetrum hermaphroditum 5 C. islandica +
Примечание Здесь и в табл 23 — 25, 27, 28, 32, 37 знак « + » — присутствие
вида
Таблица 23
Проективное покрытие растений бордюра (1—IV) из орнитофиль-
ных видов, окаймляющего камень, расположенный в воронич-
нике, — обзорную площадку чаек
(острова Кандалакшского залива)
Видовой состав Проективное покрытие, %
I II III IV
Festuca rubra 5 20 90 5
F ovina +
Empetrum hermaphroditum + + +
Stellaria graminea 5 + — 70
Dianthus superbus + + — +
Rubus saxatilis 70 — 5 +
Ligusticum scoticum — — +
Conioselinum tataricum — — +
Chamaepericlymenum suecicum — +
Vaccinium uliginosum 15 5
Campanula rotundifolia — + — +
Achillea apiculata + 80 5 +
Rubus saxatilis, Festuca rubra и Роа alpigena (табл. 23). Иногда
сильно разрастается Rubus saxatilis. Здесь полностью исключено
вытаптывание первоначальной растительности птицами, орнито-
генная же растительность бордюра обязана своим существова-
нием обильному поступлению помета, который смывается с камня
к его подножию.
На островах Кандалакшского залива и серебристые, и сизые
чайки, гнездясь из года в год в одной и той же колонии, могут
ежегодно перемещать конкретную точку своего гнезда, но чаще
многократно в ней гнездиться.
112 .
1м
I_____I
Рис 36. Схематическое изображение гребня островной гряды. О-в Малая Коржни-
чиха, Кемь-Луды, Кандалакшский залив.
Наиболее возвышенные участки гребня с очагами вторичной орнитогенной растительности
выделены жирной линией
Рис 37 Схематическое изображение крупных камней, расположенных в воронич-
нике, и бордюра из орнитофильных видов вокруг них. Кемь-Луды, Кандалакшский
залив, 1976 г.
/ — о-в Большой Илейкин, Илейкины острова, // — о-в Малый Асафьев / — камень,
2 — Empetrum hermaphroditum, 3 — Festuca rubra, 4 — Festuca rubra + Campanula ro-
tundifolia, 5 — Achillea apiculata (в боковой проекции не виден), 6 — Rubus saxatilis,
7 — Stellaria graminea Вверху — боковая проекция, внизу — верхняя
При гнездовании в вороничнике однолетнее гнездо нередко
через несколько лет зарастает Empetrum hermaphroditum, Vacci-
nium uliginosum, Rubus saxatilis и другими исконными растениями
приморских вороничников. Но здесь же среди них могут поселиться
и орнитофильные растения. Чаще всего злаки — Festuca ovina и
F. rubra, Роа alpigena, реже Dianthus superbus и Campanula
rotundifolia. Поскольку в последующие годы птичий помет сюда
не буде1 поступать, эти орнитофилы оказываются разбросанными
среди вороничника.
8 И II Bpei.iHiia
113
1980 г.
Рис. 38. Распределение растительности в вороничнике вокруг гнезд сизых чаек.
Кандалакшский залив.
/ — однолетнее в 1978 г гнездо, о-в Малый Асафьев, Кемь-Луды, // — многолетнее гнездо,
Малая Седловатая луда, вход в Порью губу 1 — камень, 2 — вороничник (Empetrum
hermaphroditum)’, 3 — вороничник с примесью орнитофильных видов, 4 — мохово-лишай-
никовая группировка, 5 — Festuca ovina, 6 — Dianthus superbus, 7 — орнитогенная разно-
травно-злаковая дерновина; 8 — гнездо и гнездовой материал, 9 — лоток гнезда, 10 —
кол, // — можжевеловый вороничник (Empetrum hermaphroditum 4- стелющийся Junipe-
rus sibirica)
114
Рис. 39. Распределение растительности в вороничнике вокруг многолетних жилых
и заброшенных гнезд (Л //) сизых чаек. Малая Седловатая луда, вход в Порью
губу, Кандалакшский залив.
/ — Empetrum hermaphroditum, 2 — Empetrum hermaphroditum -|- стелющийся Juniperus
sibirica-, 3 — Festuca ovina, 4 — Dianthus superbus', 5 — моховая куртина; 6 — полуобна-
женный торф с ювенильными Festuca ovina, Vaccinium vitis-idaea; 7 — гнездо и гнездовой
материал, 8 — лоток гнезда, 9 — кол.
115
Однако сизые чайки при гнездовании в вороничнике пред-
почитают много лет подряд занимать одну и ту же гнездовую
лунку (рис. 38, /). Даже когда в центр гнезда был поставлен кол,
чтобы помешать гнездованию в ней и тем самым проследить за ее
зарастанием, чайки нередко продолжали гнездиться там же,
только чуть-чуть сместив свою гнездовую лунку (рис. 38, //).
При многолетнем гнездовании на вороничнике в одном и том же
гнезде, вокруг него, так же как и на островах Мурмана, поселяются
орнитофилы, свойственные вторичной орнитогенной раститель-
ности торфяников, чаще всего это Festuca ovina, F. rubra, Dianthus
superbus, Campanula rotundifolia (рис. 39, /). Co временем вокруг
гнезда формируется бордюр-валик из орнитофильных злаков
(рис. 39, //), чаще всего это Festuca ovina, реже F. rubra и
Роа alpigena. Этот бордюр играет роль живого и очень удобного
для чаек гнездового валика. И обычно место былых многолетних
гнезд в вороничнике можно определить по нередким здесь коль-
цевым злаковым дерновинам или же по локальным куртинам
других, свойственных вороничникам орнитофилов.
Вообще же в вороничниках островов Кандалакшского залива,
находящихся вблизи колоний чаек, где бы сами колонии ни были
расположены, как правило, в той или иной степени примеши-
ваются орнитофильные растения, свойственные вторичной орнито-
генной растительности торфяников (табл. 24).
На вороничных торфяниках островов Кандалакшского залива
и Восточного Мурмана наблюдается процесс, противоположный
тенденции смыкания первичной скальной орнитогенной расти-
тельности.1 Суть его состоит в том, что торфянистый слой под
влиянием вытаптывающей деятельности гнездящихся птиц, а воз-
можно и ряда климатических факторов, частично разрушается.
Если он лежит на скальной подошве, то скалы со временем
все больше оголяются. Обнажившийся торф вскоре зарастает
орнитофильными видами, которые свойственны вторичным орнито-
генным ценозам этих островов. В результате среди оголившихся
скал на торфяных остатках образуется вторичная скальная орни-
тогенная растительность. Неоднократно возобновляется разру-
шение этих участков и так же неоднократно на обнажившемся
торфе поселяются орнитофильные виды, свойственные в основном
вторичным орнитогенным ценозам.
Дерновины вторичной скальной орнитогенной растительности
нередко так же лентообразны, как и первичной, и приурочены
к скальным трещинам. Причина этого в том, что корни исконных
растений сухих приморских торфяников, проникшие в скальные
трещины еще до разрушения единого торфяного пласта, удержи-
вают остатки этого пласта также вдоль трещин. На островах
1 На Айновых островах подобные наблюдения не проводились, поскольку
в 1968 г. во время полевых работ на этих островах этот процесс еще не был
выявлен
116
Таблица 24
Проективное покрытие сосудистых растений в вороничниках (1—IV) островов
Кандалакшского залива
Видовой состав Проективное покрытие, %
основной вариант варианты с орнитофильными видами
1 1 11 1 111 IV
Polypodium vulgare — +
Juniperus sibirica — 5 4- + 4-
Festuca ovina + 5 3 3 15
Dianthus superbus — 5 5 + 10
Erisimum strictum — — — . — 4-
Rubus chamaemorus 4-
R saxatilis — 5 — 5 +
Lathyrus aleuticus 3 8
Empetrum hermaphroditum 75 50 60 40 70
Vaccinium uliginosum 15 3 8 10 +
V vitis-idaea 10 5 10 3 25
Trientalis europaea — — — — 2
Thymus subarcticus — 2
Veronica longifolia — — — 5
Eupharasia frigida — 1 1
Linnaea borealis — — — 4-
Campanula rotundifolia — + — + +
Achillea apiculata — 5
Solidago lapponica 4-
Кандалакшского залива это Juniperus sibirica, Vaccinium uligino-
sum и в меньшей мере Empetrum hermaphroditum} на островах
Восточного Мурмана — Empetrum hermaphroditum и Vactinium
uliginosum, если, конечно, последняя присутствует во флоре
острова. Со временем, если здесь продолжается интенсивное гнез-
дование чаек, на смену растениям вторичных орнитогенных цено-
зов постепенно приходят на островах Восточного Мурмана
Rhodiola arctica, Matricaria hookeri, Cochlearia officinalis, Ligusti-
cum scoticum, а на беломорских островах в основном Rhodiola
rosea, Matricaria hookeri, по краям же селятся Sedum acre и другие
типичные представители первичной скальной орнитогенной расти-
тельности. И только отдельные экземпляры Juniperus sibirica и
Vactinium uliginosum, реже Empetrum hermaphroditum и Vacci-
nium vitis-idaea, да иногда сухие веточки отмершей Empetrum
hermaphroditum свидетельствуют о том, что эти дерновины
в птичьих колониях на скалах вторичны (табл. 25).
На тундрообразных островах Кандалакшского залива подоб-
ные участки вторичной скальной орнитогенной растительности
можно встретить как у границы торфяника с приморскими скалами,
так и по куполообразным выходам скал на дневную поверхность,
разбросанным среди вороничника (рис. 40, /). Если же замкнутое
117
Таблица 25
Проективное покрытие сосудистых растений на дерновинках (I—IV)
вторичной скальной орнитогенной растительности островов
Кандалакшского залива
Видовой состав Проективное покрытие, %
I II III IV
Juniperus sibirica 8 + — 60
Festuca ovina 30 20 40 + ‘
Роа alpigena — 20
Puccinellia pulvinata +
Stellaria graminea 10 +
Cerastium alpinum — — +
C. holosteoides — 5
Dianthus superbus 2 15 2
Ranunculus polyanthemos + — — +
Erisimum hieracifolium — +
Draba incana — 3 + +
Rhodiola rosea + 5
Sedum acre — + + +
Saxifraga cespitosa 10 — +
Parnassia obtusiflora — +
Rubus saxatilis 3
Empetrum hermaphroditum 5 + +
Ligusticum scoticum +
Conioselinum tataricum 4- +
Angelica archangelica — +
(всходы)
Vaccinium uliginosum 2
V. vitis-idaea — + + +
Trientalis europaea + +
Veronica longifolia +
Euphrasia frigida 1 1
Rhinanthus minor + +
Campanula rotundifolia 15 20 8 +
Matricaria hookeri + 10
Senecio integrifolius — — — +
Achillea apiculata — — — 5
Crepis nigrescens + +
скальное обнажение невелико, и здесь продолжают держаться
чайки, орнитофильные растения селятся кольцеобразно по границе
с вороничником (рис. 40, //).
На островах Восточного Мурмана вторичная скальная орни-
тогенная растительность обычна на многочисленных скальных
куполах, возвышающихся среди вороничника (табл. 26; рис. 41,42),
на некоторых скальных участках небольших островов с высокой
численностью гнездящихся морских птиц.
118
Рис. 40. Распределение растительности в колониях серебристых и сизых чаек на
участках вторичной скальной орнитогенной растительности на островах Канда-
лакшского залива.
/ — плотная колония сизых чаек на гребне о-ва Коржничиха, Кемь-Луды, // — разрежен-
ная колония серебристых чаек на склоне о-ва Большая Каравашка, Голые луды, вход
в Порью губу. / — скальная поверхность, 2 — вороничник (Empetrum hermaphroditum)
со слабой примесью орнитофильных видов, 3 — вороничник с примесью орнитофильных
видов, 4 — Empetrum her maphroditum +стелющийся Juniperus sibirica; 5 — стелющийся
Juniperus sibirica co слабой примесью орнитофильных видов, 6 — стелющийся Juniperus
sibirica с орнитофильным разнотравьем, 7 — Juniperus sibirica, стелющийся на дернине
Festuca ovina, 8 — Festuca ovina, 9 — Festuca rubra, 10 — Poa alpigena; 11 — орнито-
фильная разнотравно-злаковая дерновина, 12 — Matricaria hookeri, 13 — Rhodiola rosea,
14 — Sedum acre, 15 — гнездо сизой чайки
В Кандалакшском заливе, на о-ве Озерчанка, расположенном
близ Порьей губы, встречен очень интересный вариант вторичной
скальной орнитогенной растительности. Площадь острова 12 га.
В прошлом его скальные гряды были одеты слоем приморского
торфа и поросли вороничником, а понижения между ними —
кривоствольными березняками. Однако лет сто тому назад (или
даже более того) остров горел. Торф полностью выгорел со
скальных гряд, обнажив их (судим обо всем этом по скудным
остаткам горелой древесины, с которых время сошлифовало даже
следы угольной черноты). На скальных грядах по всему острову,
кроме его северо-западной части, в большом количестве гнез-
дятся серебристые чайки, поскольку из-за пожара остров стал
скалистым и потому особенно пригодным для гнездования сереб-
ристых чаек.
119
Таблица 26 Геоботаническая характеристика дерновин (I—IV) вторичной скальной орнитогенной растительности островов Восточного Мурмана
Обилие (А) и проективное покрытие (Б-. %)
Видовой состав о-в Бол. Гав- риловский о-в Харлов
I II III IV
A Б А Б А Б A’ Б
Calamagrostis groenlandica Роа alpigena F rubra ssp. arctica Rumex acetosella 0 tenui- folius R. acetosa Cerastium alpinum Cochlearia officinalis Rhodiola arctica Empetrum hermaphroditum Trientalis europaea Plantago maritima Matricaria hookeri soc sol. sol cop. 2 70 15 SOC. sol. сор.2 sp. сор , sol. 50 20 5 SOC. СОр.2 sp. sol sol. sol. sol. 60 20 5 cop.t soc sp. C0P 1 sol. sol sol. cop.2 10 50 3 10 20
Вследствие большой плотности гнездящихся чаек на обнажив-
шихся скальных грядах возникла орнитогенная растительность.
Растительность гряд на о-ве Озерчанка — это лентообразные, при-
уроченные к скальным трещинам злаково-очитковые дерновины,
причем явно доминирует здесь Sedum acre. Среди злаков преобла-
дают Festuca rubra, F. ovina и Роа alpigena. Изредка здесь же
растет Matricaria hookeri, но почти отсутствует Rhodiola rosea.
Однако у берегов, на действительно приморских скалах, — уже
описанный вариант обычной скальной первичной орнитогенной ра-
стительности с Rhodiola rosea.
Помимо скал и сухих торфяников всех рассматриваемых групп
островов, на которых располагаются колонии морских птиц, суще-
ствуют еще своеобразные, только некоторым группам островов
присущие места гнездования колониальных птиц.
Так, на Айновых островах серебристые чайки гнездятся на
крупных кочках, образованных Leymus arenarius. Эти ценозы
очень необычны. Высокие крутые торфяные кочки пронизаны кор-
невищами Leymus arenarius. Расстояние между кочками раз-
лично — от 1 м и даже менее до 5 м. Пространство между
кочками или же занято пышно развитой (от удобрения пометом)
луговой растительностью, или же сильно вытоптано чайками и
подрастающими птенцами.
В первом случае, как правило, птенцы не держатся в кочкар-
нике после вылупления. И. П. Татаринкова (устное сообщение)
считает, что им мешают близкое (1—2 м) расположение кочек
и их большая крутизна.
120
Рис. 41 Вторичная орнитогенная скальная растительность (злаковая дернина),
приуроченная к трещинам скального купола в разреженной колонии больших мор-
ских чаек. О-в Вешняк, Семь Островов.
Из густого кочкарника чайки выводят птенцов сразу же
после их вылупления на ближайшие торфяные бугры, явно болот-
ного происхождения. Здесь, на буграх, птенцы, опекаемые роди-
телями, держатся вплоть до подъема на крыло.
Во втором случае кочкарник частично деградирован, кочки
большей частью пологи, расстояние между ними 3—5 м. Это
создает благоприятные условия для обитания птенцов, и поэтому
пространство между кочками, а также их бока заняты типичными
для Айновых островов орнитофилами — Trientalis europaea, Matri-
caria hookeri, Melandrium lapponicum, Rumex acetosa, R. acetosella
P tenuifolius. Торф вытоптан пятнами, на которых растительность
отсутствует (рис. 43). По данным И. П. Татаринковой (1976),
птицы не только вытаптывают растительный покров, но и выдерги-
вают растения, в результате чего образуется много плешин с раз-
рыхленным торфом.
Происхождение этих своеобразных кочкарников, столь обыч-
ных для Айновых островов, пока остается загадкой. Возможная
причина образования кочек такова. Благодаря особенностям свое-
образного морского климата Айновых островов в центрах куще-
ния колосняка накапливаются, почти не разлагаясь, растительные
остатки. Чайки, а возможно, и другие птицы веками устраивали
свои гнезда на образовавшихся в результате всего этого неболь-
ших возвышениях. Со временем эти возвышения уплотнялись,
к тому же на них накапливался гнездовой материал, собранный
здесь же, на территории колонии. Все это удобрялось пометом
121
ши
4
7
10,11,12,13
5
8
• 14
1м
mill
6
It »
Рис. 42. Распределение раститель-
ности в месте гнездования больших
морских чаек, на участке вторичной
скальной орнитогенной раститель-
ности, на скальном куполе посреди
вороничника. О-в Вешняк, Семь
Островов, 1967 г.
1 — скальная поверхность; 2 — Empe-
trum hermaphroditum, 3 — Empetrum
hermaphroditum -|- Rubus chamaemorus,
4 — Festuca rubra ssp arctica-, 5 —
Puccinellia coarctata, 6 — Poa alpigena-,
7 — Calamagrostis groenlandica, 8 —
Matricaria hookeri, 9 — обнаженный
торф, 10 — Carex tripartita-, 11 — Co-
chlearia officinalis, 12 — Cerastium al-
pinum, 13 — Rhodiola arctica, 14 — от-
мирающая растительность выдела;
15 — направление ската
122
t=| 7 h-20 8 0 9
Рис. 43. Распределение растительности в колосниковом кочкарнике в колонии
серебристых чаек. О-в Большой Айнов, Айновы острова, 1968 г.
1 — кочка Leymus arenarius, 2 — разрушающаяся кочка Leymus arenarius', 3 — Anthri-
scus silvestris, 4 — Angelica archangelica, 5 — орнитофильное разнотравье* Matricaria
hookeri, Melandium lapponicum, Urtica sondenii, Rumex acetosa, 6 — Dryopteris expansa\
7 — пятна обнаженного торфа, редко поросшие орнитофильными видами, 8 — обозначе-
ние высоты некоторых кочек, 9 — гнездо серебристой чайки.
и погадками и слабо разлагалось, не достигая стадии минерали-
зации. Кочка начинала расти, а чайки из поколения в поколение
продолжали здесь гнездиться, чем опять-таки способствовали ее
росту. И чем выше она становилась, тем оказывалась удобнее
для гнездования.
Пробы торфа, взятые из глубины кочки, причем ближе к ее
основанию, нередко содержат битую ракушку — косвенное под-
тверждение давнего обитания здесь чаек: ведь битая ракушка —
обязательный компонент их погадок. Со временем, исчисляемым
123
Рис 44. Распределение растительности рядом с колосниковой кочкой на примор-
ских скалах в колонии серебристых чаек. О-в Малая Седловатая луда, вход в Порью
губу, Кандалакшский залив, 1977
/ — скальная поверхность; 2—скальная лужа, 3 — Puccinellia pulvinata, 4 — двухвер-
шинная кочка Leymus arenarius, 5 — Tripolium vulgare, 6 — Plantago maritima, 7 —
Matricaria hookeri, 8 — Rhodiola rosea, 9 — гнезда серебристых чаек, состоящие только
из лотка (их стенки — живые стебли Leymus arenarius)
столетиями, весь этот процесс, по-видимому, привел к образова-
нию колосниковых кочек современного вида.
На островах Кандалакшского залива были встречены три «ко-
лосниковые кочки», внешне похожие на кочки из колосникового
кочкарника Айновых островов. Две из них находятся на лудах
Бревнушка и Малышка (Северный архипелаг), на приморском
лугу. Их высота 15 и 20 см соответственно. Уже много лет на
вершине этих кочек гнездится морская чернеть, на одной из кочек,
правда, не ежегодно. Третья, двухвершинная колосняковая кочка
находится на куполообразной приморской скале луды Малая
Седловатая, в районе Порьей губы (рис. 44). На обеих вершинах
этой кочки (высота 12 и 16 см) гнездятся серебристые чайки
(наблюдения 1977—1984 гг.). Скорее всего, все три кочки образо-
вались из колосниковых куртин. В результате очень длительного
гнездования на них их центры уплотнились за счет как механи-
ческого давления, так и приноса гнездового материала. Корневища
Leymus arenarius густо пронизывают всю кочку, а сам он очень
мощный и высокорослый (до 1 м высотой). Это несомненно связано
с обильным поступлением с пометом птиц элементов минераль-
ного питания растений (см. табл. 34). По этой же причине на Ма-
лой Седловатой луде в кочке укореняются и другие орнитофильные
виды — Matricaria hookeri, Cochlearia arctica, Rhodiola rosea,
Puccinellia pulvinata, Tripolium vulgare и Plantago maritima. По-
видимому, беломорские колосниковые кочки являют собой раннюю
стадию становления торфяных колосниковых кочек, столь свой-
124
ственных Айновым островам. В сформировавшемся виде на остро-
вах Кандалакшского залива их нет.
Кочкообразование в начальной стадии, возможно, существует
на маленькой и очень богатой птичьим населением Плоской луде
(Кемь-Луды, Кандалакшский залив). На ее южном берегу нами
обнаружены рыхлые подобия колосниковых кочек. Leymus arena-
rius составляет основу кочки, ее «скелет», но в кочкообразовании
принимает участие и Festuca rubra. Эти подобия кочек образова-
лись, по-видимому, потому, что чаячьи тропы и ходы изолируют
отдельные группы стеблей Leymus arenarius. Растительные
остатки прошлых лет L. arenarius и Festuca rubra способствуют
накоплению органического вещества в этих колосниковых обособ-
лениях. Однако там, где они вызваны только ходами чаек, кочка
очень рыхла и до самого ее подножия свободно проходит рука.
Но на некоторых кочкообразных возвышениях чайки гнездятся,
и это их уплотняет и удобряет. Однако торфообразования нет
и в этих «кочках», внутри они все равно рыхлые, соломенные,
хотя высота некоторых из них до 35 см.
Несмотря на то что все обнаруженные колосниковые кочки
расположены на островах Кандалакшского заповедника, их необ-
ходимо взять под особую охрану. Постоянные стационарные
наблюдения за их дальнейшим развитием, возможно, позволят
выявить причины возникновения и установить закономерности раз-
вития колосникового кочкарника.
На безлесных островах Кандалакшского залива на приморских
лугах и по границе приморского луга с вороничником из птиц
ощутимо воздействуют на растительный покров преимущественно
гнездящиеся здесь сизые чайки, но изредка устраивают свои гнезда
и серебристые чайки. Там, где на лугах находятся довольно
плотные колонии этих птиц, луговая растительность обогащается
такими нитрофильными видами и растениями нарушенных почв,
как Angelica archangelica, Heracleum sibiricum, Achillea apiculata,
Erisimum hieracifolium, видами рода Atriplex. Нередко приморский
луг, занятый очень плотными чаячьими колониями, сильно вытоп-
тан. Это с одной стороны, но с другой — он продуцирует зна-
чительно большее количество фитомассы по сравнению с подоб-
ным же лугом, на котором птицы не гнездятся. Такую картину
можно наблюдать на приморском лугу луды Большая Топа (губа
Бабье море). На луде площадью 1.5 га находится самая большая
в Кандалакшском заливе и очень плотная колония сизых чаек
(150 пар в конце 70-х годов), гнездится много гаг и, не ежегодно,
полярных крачек.
Чтобы проследить за динамикой формирования растительного
покрова приморского луга Большой Топы, на пробной площади
(20 м X 10 м), заложенной на этом лугу, дважды (в 1969 и 1979 гг.)
была закартирована растительность (табл. 27; рис. 45). В год
первого картирования, 1969 г., скачкообразно возросла числен-
ность водяной полевки, и это заметно отразилось на внешнем
облике растительности приморского луга — почти вся пробная
125
Таблица 27
Проективное покрытие растений на приморском лугу в колонии сизых чаек
на луде Большая Топа
(Кандалакшский залив, губа Бабье море, 1969, 1979 гг.)
Видовой состав Проективное покрытие, %
A* Б В Г
1969 1979 1969 1979 1969 1979 1969 ' 1979
Anthoxanthum alpi- + — + — + 2 3 3
num
Alopecurus arundi- + 30 + 10 + 5 + 5
naceus
Agrostis gigantea — 2 — +
Lerchenfeldia flexuosa + + + — 15 + 30 30
Poa prat ens is — 3 — 5 + 2 — 30
Festuca rubra 20 15 3 25 5 25 5 40
Elytrigia repens — — — — + +
Leymus arenarius + 15 + + + + + +
Rumex pseudonatro- + +
natus
R. thyrsif torus + + — — — — + +
Atriplex nudicaulis 5 + 15
Cerastium holo- + + — + + + + +
steoides
Coronaria flos-cuculi 2 + + 10 — 3 + +
Dianthus superbus — — — — — — + +
Ranunculus polyan- — 5 — 10 + 5 + 5
themos
Erisimum hieraci- 2 + 10
folium
Parnassia obtusiflora + + — — + + + +
Potentilla egedii + +
Empetrum herma- — — — — — — 5
phroditum
Ligusticum scoticum + + — — 4- 4- 4- 4-
Conioselium tataricum 4- 80 — 30 4- 25 4- 10
Angelica silvestris — — — — — 4- 4- 4-
Heracleum sibiricum — 15 — — — — — 4-
(всходы)
Chamaepericlymenum + — + + 50 80 4- 4-
suecicum
Trientalis europaea 4- + — 4- — 4- 1 4-
Veronica longifolia 5 5 12 20 5 5 5 5
Euphrasia frigida 4- — — 4- 4- 1 4-
Rhinanthus minor 4- — + — 4- 4- 4-
Sonchus humilis 5 5 — 5 — 5 — 4-
* Выдели А—Г — см рис 45
126
Рис 45 Распределение растительности (Д—Г) в колонии сизых чаек на примор-
ском лугу О-в Большая Топа, Бабье море, Кандалакшский залив
/ — норы водяной полевки, 2 — гнездо сизой чайки Расшифровку значений выделов см
в табл 27 Пояснения в тексте
площадь была изрыта ее норами, а травостой в значительной
мере был ею же поврежден. Надо отметить и то, что физиономия
растительного покрова и проективное покрытие растений как всего
приморского луга Большой Топы, так и рассматриваемой проб-
ной площади ежегодно меняются. Очень показателен при этом год
1976-й, когда его приморские луга на северном берегу, включая и
территорию пробной площади, были заняты очень высокими
(до 1), густыми и мощными зарослями Alopecurus arundinaceus
(очень кратковременный срок пребывания здесь не позволил сде-
лать даже геоботанические описания).
Часто сизые чайки гнездятся по самой границе приморского
луга с вороничником. В этом случае вороничник отступает, а его
место занимают представители тех из луговых элементов, которые
одновременно являются и орнитофилами, свойственными именно
приморским торфяникам (табл. 28; рис. 46).
Нередко на приморских лугах гнездится полярная крачка,
но размеры и места ее гнездовий не постоянны в разные годы.
К тому же она из-за своих небольших размеров оставляет на
гнездовой территории сравнительно мало экскрементов и заметно
не изменяет ее растительность. Однако на Кемь-Лудах обнару-
жены два близко расположенных многолетних гнезда (трехлет-
них по крайней мере) полярной крачки на приморском лугу
(возможно, вторичном). И сам факт ее многолетнего гнездования
в одной и той же гнездовой лунке, и плотные куртины Stellaria
graminea, к ней примыкающие, возможно, свидетельствуют о неко-
торой роли полярной крачки в изменении растительного покрова
в месте непосредственного своего гнездования (рис. 47).
На обширных высокотравных лугах о-ва Большой Айнов
(Айновы острова) чайки, как правило, не гнездятся. Там же, где
они обитают небольшими колониями, растительный покров чаще
всего сильно вытоптан. И здесь же поселяются Rumex acetosa,
Melandrium lapponicum, Matricaria hookeri. Настоящие же процве-
127
Таблица 28
Проективное покрытие растений растительных группировок
(I—IV) колоний сизых чаек, расположенных по границе примор-
ского луга с вороничником, острова Кандалакшского залива
Видовой состав
Проективное покрытие, %
i и I in iv
Juniperus sibirica
Festuca ovina
F. rubra
Rumex, pseudonatronatus
Stellaria graminea
Dianthus superbus
Sedum acre
Rhodiola rosea
Rubus saxatilis
Empetrum hermaphroditum
Ligusticum scoticum
Heracleum sibiricum
Conioselinum tataricum
Vaccinium vitis-idaea
Thymus subarcticus
Euphrasia frigida
Campanula rotundifolia
Achillea apiculata
Matricaria hookeri
30
40
+
+
+
+
5
3
+
1
5
70
5
2
*2
70
5
5
5
5
2
1
3
3
тающие заросли гигантских зонтичных расположены вне чаячьих
колоний. В литературе неоднократно высказывалось мнение (Ко-
ханов, Скокова, 1967; Парфентьева, 1969), что мощные луговые
заросли о-ва Большой Айнов возникли под воздействием гнездя-
щихся на острове морских колониальных птиц, выражающимся
в чрезмерном удобрении почвы лугов пометом во время пролета
над ними. С этим предположением трудно согласиться. В наиболее
плотных колониях морских колониальных птиц о-ва Большой
Айнов на гектар площади за сезон поступает 15—20 т помета,
в среднем же на гектар площади острова поступает около 1.5 т
помета (И. П. Татаринкова, устное сообщение). Следовательно,
на гектар луга, если птицы на нем не гнездятся, а только
пролетают, должно поступать менее 1.5 т помета, что недостаточно
для стимулирования гигантизма нитрофильных зонтичных.
Истоки гигантизма растений лугов о-ва Большой Айнов, скорее
всего, в том, что его современный луговой пояс, судя по его
положению в рельефе, сформировался в процессе тектонического
поднятия острова недавно, по-видимому в последние столетия.
Он образовался на месте обширной литорали, на которой шторма
напластовали громадное количество водорослевых выбросов.
Именно эти, веками накопившиеся, прослоенные песком и галькой
128
1 | | | | | | 2
№
7 8
ESS» Е8ЕЗ"
| w ggj»
1 1
1M
E^| <?
llllllllll
12
Рис 46 Распределение раститель-
ности в колонии сизых чаек, распо-
ложенной на границе приморского
луга с вороничником. О-в Коржни-
чиха, Кемь-Луды, Кандалакшский
залив, 1978 г
/ — скальная поверхность, 2 — воро-
ничник (Empetrum hermaphroditum)’,
3 — вороничник с примесью орнито-
фильных видов, 4 — Empetrum herma-
phroditum + стелющийся Juniperus si-
birica, 5 — стелющийся J uniper us sibi-
rica с орнитофильным разнотравьем,
6 — Rubus saxatilis, простирающаяся
«усами» на россыпи камней, 7 — мохово-
лишайниковое пятно, 8 — Festuca ovina’,
9 — Festuca rubra, 10 — Rhodiola rosea;
11 — гнездо и разбросанный вокруг
гнездовой материал, 12 — отмершая
дерновина выдела, 13 — направление
ската, 14 — орнитофил ьная разно-
травно-злаковая дерновина
останки водорослей привели к мощному развитию здесь преимуще-
ственно зарослей Anthriscus sylvestris — явно выраженного нитро-
фила.
Нельзя также предположить, что мощный луговой пояс о-ва
Большой Айнов сформировался в прошлом при несравнимо боль-
9 И П Бреслина
129
1378 г.
1980 г.
1 м
Рис. 47. Распределение растительности на приморском лугу вокруг многолетних
гнезд полярной крачки. О-в Асафьев, Кемь-Луды, Кандалакшский залив.
/ — скальная поверхность, 2 — стелющийся Juniperus sibirica с примесью орнитофильных
видов, 3 — Festuca ovina, 4 — Stellaria graminea, 5 — гнездо полярной крачки
шей, чем современная, численности чаек и этому обязан своим
гигантизмом, поскольку резкое увеличение их численности про-
изошло именно в нашем веке в результате воздействия ряда
антропогенных факторов. Косвенное подтверждение тому — нали-
чие на острове больших площадей морошкового вороничника,
правда, ставшего в настоящее время фрагментарным. Ведь если бы
такая большая численность морских птиц издавна существовала
на Айновых островах, вороничника как такового там просто не
могло бы быть.
На болотах обоих Айновых островов гнездится много сереб-
ристых чаек, причем они занимают не только крупные торфяные
бугры, достаточно сухие для гнездования, но также ровные и
влажные пространства верховых, переходных и даже низинных бо-
лот, избегая только мочажин с открытой водой. Кроме того,
на некоторых буграх постоянно обитают птенцы серебристых чаек,
переселившихся сюда из ближайших кочкарников вскоре после
вылупления.
Орнитогенная растительность крупных бугров — это прежде
всего куртины и заросли Matricaria hookeri', также здесь растут
и все другие виды, свойственные орнитогенным ценозам сухих
торфяников Айновых островов. Многие бугры на болотах или
покрыты сплошными орнитогенными ценозами, или же вытоптаны
птицами. Близ таких бугров мочажинообразные понижения заняты
не болотной, а крупнотравной растительностью с некоторыми пред-
ставителями низинных болот (табл. 29; рис. 48). Скорее всего,
130
Таблица 29
Геоботаническая характеристика растительных группировок (I—III) на бугристом
болоте о-ва Малый Айнов, в местах интенсивного гнездования серебристых чаек
Обилие (А) и проективное покрытие (Б, %)
Видовой состав
Dryopteris expansa
Carex aquatilis
Cerastium holosteoides
Melandrium lapponi-
cum
Stellaria nemorum
Cochlearia officinalis
Rubus chamaemorus
Anthricus silvestris
Trientalis europaea
Valeriana sambucifolia
Matricaria hookeri
понижения
бугры
I II HI
А Б A Б A Б
sol. — sol. — COp.2 50
— — sol. — sol.
sol. — sol. — COp.2 40
sol. — sol. sol. — — —
— — — — sp.
sol. — sp. — sol. —
— — sol. — sol.
сор.з 60 cop.3 50 sp. —
изменение характера растительности понижений плоскобугристых
болот (в прошлом они, возможно, имели вид мочажин) с болотного
на крупнотравное связано со значительным обогащением суб-
страта экскрементами птиц. Пока неясно, насколько давно
произошло это изменение.
Для верховых и переходных болот Айновых островов харак-
терно постоянное присутствие Rumex acetosa, типичного орнито-
фильного растения в условиях островов Мурмана и вообще несвой-
ственного зональной болотной растительности. Здесь же обычны
локальные бугорки, густо поросшие Matricaria hookeri, Rumex
acetosa, Valeriana sambucifolia, Melandrium lapponicum, реже
Cochlearia officinalis и рядом луговых растений. В их середине
растительность вытоптана чайками (рис. 49). Возможно, эти
бугорки образовались на месте многолетних чаячьих гнезд. На
низинных болотах чайки стараются гнездиться на микроповыше-
ниях, образованных укореняющейся Caltha palustris. Со временем
в этих местах образуется дернина из Festuca rubra ssp. arctica
(рис. 50). На переходных болотах места многолетнего гнездова-
ния чаек покрываются ее дерниной, а сфагновый покров исчезает
(табл. 30).
Зоолог Пиесон (Pearson, 1904), неоднократно посещавший
в конце прошлого—начале нашего века Айновы острова, отметил
буйную растительность на болотах вокруг озер и посчитал, что
тому причиной удобрение их пометом множества гнездящихся
морских птиц. Из этого можно заключить, что орнитогенное
изменение болотной растительности Айновых островов произошло
отнюдь не в последние десятилетия.
9"
131
i______i
1м
Illllllllll
0 9
Рис 48 Распределение растительности в колонии серебристых чаек, расположен-
ной на бугристом болоте о-ва Малый Айнов. Айновы острова, 1968 г
1 — Matricaria hookeri, 2 — Dryopteris expansa, 3 — Anthriscus silvestris, 4 — Caltha
palustris, 5 — Stellaria nemorum, 6 — Carex aquatilis, 7 — обнаженный торф, 8 — гра-
ница бугров (стрелки направлены в сторону бугра); 9 — гнездо серебристой чайки
На всех других группах островов Кольской Субарктики чайки
на болотах не гнездятся.
Таким образом, на Айновых островах почти весь растительный
покров, исключая кустарниковые заросли и крупнотравье, в той
или иной мере претерпел изменение орнитогенного характера.
В Восточном Мурмане изменения в основном коснулись раститель-
ного покрова небольших островов. В Кандалакшском заливе —
изменения преимущественно локальные, небольшими пятнами.
Вторичная орнитогенная растительность вкраплена среди основ-
ной растительности.
132
Рис 49 Распределение растительности в колонии серебристых чаек на сфагновом
болоте О-в Большой Айнов, Айновы острова, 1968 г.
1 — участок осоково-сфагнового болота (Sphagnum angustifolium — 100 % покрытия,
Carex aquatilis — 20, Festuca rubra— 15, Rumex acetosa— 10, Comarum palustre— 10,
Empetrum nigrum— 10, Rubus chamaemorus — 5%), 2— злаковая дернина (Festuca
rubra — 60 % покрытия, Rumex acetosa — 20, Carex aquatilis — 5, Rubus chamaemorus —
10, Comarum palustre — 10 %, пятнами Sphagnum angustifolium — 30 %), 3 — участки,
вытоптанные чайками; 4 — гнездо серебристой чайки
РАСТИТЕЛЬНОСТЬ ПТИЧЬИХ БАЗАРОВ
Растительность птичьих базаров и их ближайших окрестностей
сочетает в себе элементы как первичной, так и вторичной орни-
тогенной растительности. На островах Восточного Мурмана на
нежилых карнизах базаров господствуют очень мощные и чистые
заросли Cochlearia officinalis с исключительно крупными листьями,
в меньшем количестве, но постоянны крупные куртины Matricaria
hookeri (табл. 31; рис. 51). На почти отвесных стенках базаров
моевок обычны очень крупные, мощные, но разрозненные экзем-
пляры Rhodiola arctica (рис. 52).
133
6
’ |=b ESP ПИР ЕВР
Ж,
7 4 8 £х>-*9 * 1м
Рис. 50. Распределение растительности в колонии серебристых чаек на участке
низинного болота. О-в Большой Айнов, Айновы острова, 1968 г.
1 — мочажины с отдельными экземплярами Caltha palustris, Comarum palustre, Carex
aquatilis, 2 — Caltha palustris, 3 — Festuca rubra-, 4 — Rumex acetosa-, 5 — Montia fon-
tana 4- Stellaria humifusa, 6—Comarum palustre, 7 — Angelica archangelica, 8 — куст
Salix glauca, 9 — отмершая растительность выдела
Большое распространение и пышное развитие ложечной, или
«скорбутной», травы (по-видимому, Cochlearia officinalis) харак-
терно для птичьих базаров Шпицбергена (Бируля, 1910). На ба-
зарах Лофотенских островов наряду с Cochlearia officinalis
обычны также Melandrium rubrum, Festuca rubra, Rumex acetosa,
Anthriscus silvestris, Matricaria inodora, Silene maritima, Stellaria
media (Gr^nlie, 1948).
На жилых карнизах птичьих базаров никакая растительность,
по-видимому, не может закрепиться из-за большой скученности
134
Таблица 30
Геоботаническая характеристика группировок растительности на низинном
и переходном болотах о-ва Большой Айнов, в местах гнездования серебристых чаек
Видовой состав Обилие (А) и проективное покрытие (Б, %)
низинное болото переходное болото
А Б A Б A Б
Dryopteris expansa — — — — sol.
Calamagrostis neglecta — — sol
Роа pratensis — — sol. — sol.
Festuca rubra ssp. arctica сор.3 40 cop.2 15 soc. 60
Carex aquatilis sp. — cop 3 20 cop 2 5
C. canescens — — — — sol.
Salix glauca sol.
Rumex acetosa sp. — cop-! 10 cop-3 20
Montia font ana sp. — sol.
Cerastium holosteoides sol. — sol. — sol.
Melandrium lapponicum — — sol — sol.
Stellaria humifusa sp.
S media — — sol. — sol.
Caltha palustris COp.2 15 sol
Ranunculus repens — — — — sol.
Rubus chamaemorus — — sp 5 cop ! 10
Cochlearia officinalis sol
Comarum palustre sp. — cop.! 10 cop.! 10
Empetrum nigrum — — cop.! 10 sol.
Angelica archangelica sol.
Epilobium palustre sol. — sp — sol
Trientalis europaea — — sol. — sol.
Valeriana sambucifolia sol. — sol.
Matricaria hookeri sol.
Sphagnum angustifolium — — — 100 — 50
птиц и обилия помета (рис. 53). Растительность нежилых карни-
зов птичьих базаров являет собой один из примеров орнитоген-
ной растительности, возникшей на месте жилых карнизов при
уменьшении численности птиц, а следовательно, и сокращении
площади базара. Однако С. К. Красовский (1937, с. 59) считает,
что именно разрастание растительности на базарах сокращает их
полезную гнездовую площадь и что «наступление растительности
на обрывы есть одна из причин естественного разрушения базаров,
в значительной степени определяемая и обусловленная деятель-
ностью самого населения их, обильным удобрением подготавли-
вающего почву для заселения карнизов растениями. Есть уже
значительные площади, отнятые растениями у птиц, так как на
заросших растениями карнизах кайры уже не гнездятся». Л. О. Бе-
лопольский (1957) с этим не согласен. Он полагает, что зарастание
растительностью карниза есть следствие уменьшения количества
135
co
О»
Таблица 31
Геоботаническая характеристика растительности птичьих базаров Восточного Мурмана
Видовой состав Нежилые карнизы Нежилая стенка
о-в Кувшин о-в Бол Гавриловский о-в Кувшин э-в Бол Гавриловский о-в Харлов
А Б А Б А Б А Б А Б А Б А Б
Festuca rubra ssp. arc- tica — — — — — — — — — — — — sol (gr ) 30*
Cochlearia officinalis soc 40 soc 35 SOC. 40 SOC. 45 сор 3 30 СОР-2 25 Sp (gr.) 40*
150 120 150 180 70 30
Rhodiola arctica — — sol. 40 — — sol 50 — — — — cop-2 30 70*
Matricaria hookeri sp- 50 sol. 50 сор з 70 S0C 80 sp (gr ) 80*
5 60 90
Примечание А числитель — обилие, знаменатель — проективное покрытие, %, Б — высота растений, см
х Высота определялась визуально
Рис 51 Заросли Cochlearia officinalis на нежилых карнизах птичьего базара
О-в Кувшин, Семь Островов, 1967 г.
Рис. 52. Участок базара моевок. О-в Харлов, Семь Островов, 1966 г.
137
Рис. 53 Жилые карнизы базара кайр. О-в Кувшин, Семь Островов, 1967 г.
птиц на базарах. В противном случае зачатки растений будут
«сожжены» экскрементами птиц. При резком же росте числен-
ности кайр они могут занимать и покрытые растительностью кар-
низы, и примыкающие к базарам участки торфяников, в том числе
и территории тупиковых колоний. Это приводит к исчезновению
растительности и уничтожению торфяного слоя. В последние годы
подобное стало наблюдаться и на Семи Островах, где в связи
с ростом численности моевок стала увеличиваться площадь
птичьих базаров. На о-ве Харлов, например, расширение базаров
привело к тому, что моевки стали гнездиться на достаточно
крутых, но не отвесных приморских скалах, густо поросших
Rhodiola arctica и Cochlearia officinalis, и это приводит к резкому
угнетению, а в дальнейшем и к гибели растений. Пропитанный же
птичьим пометом, торф размягчается и под прямым механическим
воздействием гнездящихся птиц легко разваливается, обнажая го-
лые скалы. Обратный процесс — быстрое зарастание не занятой
птицами площади базара (о-в Тюлений, Охотское море) отмечает
Л. М. Беньковский (1968).
Поскольку численность птиц на базарах в течение всего
длительного периода их существования неизбежно подвергнута
тем и ли иным колебаниям, столь же неизбежны два противополож-
ных процесса — зарастание части карнизов при сокращении чис-
ленности птиц и уничтожение прибазарной растительности при ее
пике. И поскольку на одном и том же карнизе неоднократно
138
могут возникнуть и так же неоднократно изчезнуть густые орни-
тогенные заросли, мы в равной мере можем считать их как пер-
вичными, так и вторичными орнитогенными ценозами. Первич-
ными — коль они каждый раз возникают на голых скалах, вторич-
ными — потому, что появились они здесь не впервые.
Растительность птичьих базаров, как нежилых их карнизов, так
и их окраин, как правило, не испытывает никакого механического
воздействия гнездящихся птиц,1 и в то же время она обильно
обрызгивается пометом пролетающих птиц. Прибазарные участки
нередко имеют достаточно мощный торфяной слой (до 50 см и
более), на котором господствуют пышные заросли Cochlearia
officinalis с очень заметной примесью Matricaria hookeri, образу-
ющей зачастую самостоятельный ярус. Здесь же может встре-
чаться Rumex acetosa. Еще дальше от края базаров раститель-
ность становится разнообразнее, пестрее, появляются различные
орнитогенные группировки, постепенно переходящие в основную
растительность плато острова (табл. 32).
Трудно определить — первична или вторична прибазарная ра-
стительность. История ее становления и развития тесно связана
с жизнью базара, и не исключено, что целый ряд ее участков
не проходил стадии вороничников, а их растительность возникла и
развивалась одновременно с возникновением и развитием поселе-
ний морских колониальных птиц.
В Кандалакшском заливе птичьих базаров нет. Однако здесь
в колониях большого баклана существует растительность, близкая
растительности птичьих базаров. В настоящее время на мельчай-
ших островах Кандалакшского залива имеются три его колонии,
расположенные на плоской скальной поверхности. Одна из них —
постоянная на Бакланьем баклыше архипелага Средние луды
(1977 г. — 32 гнезда, 1978 г. — 34). Две другие — не ежегодные
на Светлом баклыше архипелага Три Баклыша, расположенном
близ Керетских островов (1 гнездо в 1976 г., 13 гнезд в 1978 г.,
полное негнездование в 1980 г.) и на Гагаркином баклыше (5 гнезд
в 1979 г.). Бакланы пребывают на своих гнездовых участках
дольше всех других морских птиц — с мая до середины сентября.
Колонии их очень плотные, нередко гнезда находятся друг от друга
на расстоянии несколько сантиметров. Птицы достаточно круп-
ные и продуцируют большое количество помета. Места их колоний
обильно им политы, и скальная поверхность покрыта сухой его
корочкой. Обилие свежего помета препятствует развитию высшей
растительности. Однако в 1980 г., когда на Светлом баклыше
(архипелаг Три Баклыша) бакланы не загнездились, на месте
старых их гнезд поселились несомкнутые между собой, но очень
мощные Cochlearia arctica и Tripolium vulgare, имеющие даже
для орнитофилов Беломорья исключительно крупные и мясистые
листья (см. гл. 2).
1 Исключение — участки колоний тупиков, иногда расположенные над
птичьими базарами, над их обрывами. •
139
Таблица 32
Проективное покрытие растений на участках (I — III)
около птичьих базаров, %
Видовой состав Крутой СКЛОН над базаром на о-ве Кувшин Участки плато над базарами на о-ве Харлов
I II III
Empetrum hermaphrodi- — — — 20
turn
Rubus chamaemorus — — 1 8
Cochlearia officinalis 90 70 8 1
Plantago schrenkii + — 0.5 0.5
Rumex acetosella 0 tenui- — +
folius
R acetosa 2 + 0.1
Matricaria hookeri 5 2 2 2
Cerastium holosteoides — — +
C alpinum — — + 0.5
Trientalis europaea — — + 2
Carex tripartita — — 70 0.1
Festuca rubra ssp. arctica — 05 05 3
Dendranthema hultenii — — 02 +
Euphrasia frigida — +
Calamagrostis groenlan- + — 05 0.5
dica
Ligusticum scoticum — — 1
Rhodiola arctica — 2 1 +
При расширении же площади бакланьих колоний погибает
выжженная птичьим пометом, уже сформированная на плоских
скалах первичная орнитогенная растительность. Это хорошо за-
метно на Бакланьем баклыше (Средние луды). Здесь погиб
единственный на острове экземпляр Rhodiola rosea, оказавшийся
у границы расширяющейся колонии бакланов.
МЕХАНИЗМ влияния МОРСКИХ КОЛОНИАЛЬНЫХ птиц
НА РАСТИТЕЛЬНЫЙ ПОКРОВ
Большинство авторов считает, что поступление большого коли-
чества птичьего помета имеет основное и решающее влияние на
становление и изменение растительности колоний морских коло-
ниальных птиц. Многие из них (Hagerup, 1927; Steffen, 1928;
Александрова, 1956; Городков, 1958; Тихомиров, 1959) называют
ее нитрофильной, подчеркивая тем решающую роль усвояемого
азота, поступающего с пометом птиц.
Н. Н. Скокова (1962), В. Д. Коханов и Н. Н. Скокова
(1967), И. П. Бреслина и В. Н. Карпович (1969). Соуби (Sobey,
1976) обратили внимание и на другие аспекты птичьего влияния
на растительность: 1) механическое разрушение первоначального
растительного покрова; 2) тот или иной вид рыхления почвы
птицами; 3) перенос зачатков на территорию колонии. Наиболее
детально различные стороны воздействия крупных чаек на расти-
140
тельный покров изучены в Великобритании на примере раститель-
ности о-ва Мей (Sobey, 1976; Sobey, Kenworthy, 1979). При этом
выявлены четыре типа активности чаек, воздействия на раститель-
ность их гнездовий: 1) вытаптывание при спаривании и хождении,
2) расчистка мест и сбор гнездового материала, 3) выдергивание
растительности и вытаптывание пограничных участков при тер-
риториальных конфликтах, 4) дефекация. Авторами вскрыты при-
чины поселения на различных участках колоний тех или иных
растений.
Механизм влияния морских колониальных птиц на раститель-
ный покров Кольской Субарктики изучался нами лишь попутно при
геоботанических исследованиях. Наибольшее внимание уделя-
лось выявлению химических характеристик торфообразного суб-
страта под орнитогенными ценозами. Полученные данные неполны,
методически не без погрешностей, к тому же из-за технических
трудностей нам не представилась возможность проанализировать
содержание усвояемого азота. Однако данные почвенных анализов
по кислотности, содержанию подвижного фосфора (вытяжка
0.2 HCI), обменного калия, ионов хлора, несмотря на очень
большой диапазон различий в пределах выборки, хорошо вскры-
вают причину существования орнитогенных ценозов (табл. 33).
Однако из-за малого объема выборки пришлось отказаться от
всякого математического осмысливания полученных данных.
На Семи Островах на большинстве участков орнитогенной
растительности по сравнению с контрольными вороничными цено-
зами кислотность верхнего торфяного слоя до глубины 5—7 см
значительно понижена (приблизительно на единицу pH). С глуби-
ной кислотность повышается. Это согласуется с выводами Гиллхем
(Gillham, 1956), показавшей, что помет морских птиц значительно
снижает почвенную кислотность.
Содержание подвижного фосфора в верхнем слое (5—7 см)
очень высокое, и во много раз больше, чем в нижележащих
слоях. Верхние почвенные слои под зарослями Cochlearia offici-
nalis содержат фосфора в 15—25 раз больше, под ассоциацией
Festuca rubra ssp. arcticaCochlearia officinalis — в 4—8 раз
больше, под ассоциацией Rumex acetosella р tenuifolius + Rubus
chamaemorus и под вороничником, засоренным орнитофилами, —
в 2—3 раза больше, чем те же слои под контрольными воронич-
ными ценозами.
Содержание обменного калия в ряде случаев несколько выше,
чем под вороничниками, но иногда оно не превышает такого
в вороничных ценозах; с глубиной содержание калия понижается.
По сравнению с вороничными ценозами почвы под чистыми за-
рослями одного из наиболее распространенных орнитофильных
видов — Cochlearia officinalis — содержат большее количество
хлора. Оно приближается к показателю засоленности торфяного
горизонта приморского луга, затопляемого в сизигийные приливы
(0.45 % С1~). Содержание хлора в почвах других орнитогенных
ценозов близко к таковому в почвах под вороничниками.
141
Таблица 33
Агрохимическая характеристика торфяных почв под орнитогенными ценозами
Семи Островов
Ценоз Глубина взятия образца,см pH солевой вытяжки Р2О5 к2о %ci-
мг/100 г почвы
Контрольные вороничные ценозы
Вороничник:
на плато 3—15 3.1 16.4 139.0 0.046
на склоне 3—15 2.9 22.8 92.5 0.107
морошковый 3—12 3.2 18.6 66.0 0.038
3—15 2.9 17.0 57.0 0.136
Орг [итогенные ценозы
Заросли:
Cochlearia officinalis 0—6 3.7 250.2 124.5 0.392
6—15 — 19.4 71.5 0.327
0—7 4.7 245.0 98.0 0.214
7—16 3.7 27.5 42.5 0.134
16—27 3.6 17.0 35.5 0.144
Cochlearia offccinalis + 0—6 4.4 180.0 76.5 0.161
Rubus chatnaetnorus 6—15 3.5 39.2 98.0 0.214
Cochlearia officina- 0—6 4.1 210.0 150.0 0.137
lis -|- Matricaria hoo- 6—11 3.4 26.4 68.0 0.061
keri 11 — 17 3.4 24.0 49.0 0.045
Ассоциация:
Festuca rubra ssp. arc- 0—7 4.1 85.0 131.0 0.092
tica-\-Cochlearia offi- 7—15 3.5 15.6 71.0 0.069
cinalis 15—20 3.5 10.4 49.5 0.062
Rumex acetosella 0 te- 0—5 3.3 28.41
nuifolius -|- Rubus cha- 5—14 2.9 13.96
maemorus 14—32 2.9 15.6
0—6 3.0 47.2
6—15 2.9 34.0
Отмирающий вороничник, 0—6 4.1 50.4 137.5 0.447
засоренный орнитофиль- 6—15 3.7 29.0 107.0 0.589
ными видами 0—5 3.6 26.5 97.0 0.016
5—15 3.6 11.8 76.5 0.015
Данные, полученные по почвам под орнитогенными ценозами
островов Кандалакшского залива, очень пестры (табл. 34, 35),
однако и по ним можно проследить общую тенденцию увеличения
содержания основных элементов питания растений и уменьшения
кислотности в них.
Можно полагать, что микробиологическая активность почв под
орнитогенными ценозами достаточно интенсивна. По мнению
Б. А. Тихомирова (1959), повышению микробиологической актив-
ности почвы способствует целый ряд биотических факторов, в осо-
бенности деятельность животных, приводящая к лучшему снаб-
жению почвы азотом. Косвенным подтверждением интенсивной
микробиологической активности почв под орнитогенными цено-
зами служит частичное истление бумажных этикеток, соприкасав-
142
Таблица 34
Агрохимическая характеристика торфообразного почвенного слоя под первичными
орнитогенными ценозами приморских скал островов Кандалакшского залива
Ценоз Глубина взятия образца,см pH солевой вытяжки Р2О5 . К2О %ci-
мг/1001 г почвы
Контрольные дерно! Лишайниковая наскальная подушка: и н ы на ( КОЛОН : к а л а х, и й лишен 1 Н Ы X П ' Г И Ч Ь И X
с Rhodiola rosea (о-в Красный, Кемь-Луды) — 8.5 18.0 46.0 0.04
с Festuca ovina (о-в Красный, Кемь-Луды) 0—7 7.9 22.0 76.0 0.1 Г
Зеленомошная наскальная подушка (о-в Красный, Кемь-Луды) 8.4 15.0 54.0 0.04
Дерновины на с Дерновины Rhodiola rosea: калах, за Н Я Т Ы X колони я м и ч а е к
о-в Воротиха 0—9 5.0 136.0 60.0 0.03
0—11 6.3 92.0 94.0 0.48
Малая Седловатая луда, близ Порьей губы 0—4 6.7 143.0 164.0 0.13
о-в Коржничиха, Кемь- 0—3 7.0 113.0 102.0 0.40
Луды 3—11 5.7 22.0 60.0 0.15
11 — 15 5.8 15.0 76.0 0.12
Дерновины Matricaria hoo- 15—26 5.8 18.0 76.0 0.11
keri: о-в Воротиха 0—7 6.0 310.0 84.0 0.05
0—8 6.7 35.0 70.0 0.05
Малая Седловатая луда, район Порьей губы 0—9 6.2 60.0 180.0 0.44
о-в Коржничиха, Кемь- 0—3 7.0 100.0 106.0 0.28
Луды 3—10 6.6 47.0 60.0 0.13
Дерновины Sedum acre: 10—14 5.9 18.0 50.0 0.07
о-в Воротиха 0—4 7.2 650.0 70.0 0.09
0—4 6.7 205.0 154.0 0.09
Малая Седловатая луда, район Порьей губы 0—4 7.0 205.0 100.0 0.07
о-в Воротиха 0—4 6.9 536.0 102.0 0.04
Крупный экземпляр Tripo- Uum vulgare в скальной трещине (о-в Воротиха) Крупный экземпляр Rumex pseudonatronatus: 0—6 6.8 325.0 230.0 0.59
о-в Воротиха 0—14 5.7 226.0 250.0 0.20
— 5.8 60.0 78.0 1.50
Куртина Angelica archange- lica (о-в Воротиха) — 5.5 25.0 150.0 1.57
Дерновина Ranunculus scele- ratus (о-в Воротиха) 0—4 7.1 210.0 90.0 0.19
143
I a 6 л и ц а ЗА (^продолжение)
Глубина pH 1 р2о5 К2О 1
Ценоз I взятия 1 солевой |- 1 % СГ .
образца,см 1 вытяжки 1 мг/100гпочвы 1
Дерновины Puccinellia pul-
vinata:
о-в Воротиха — 6.9 582.0 400.0 1.13
Малая Седловатая луда, 0—7 67 55.0 248.0 0.07
район Порьей губы 0—2 69 170.0 280 0 0 09
о-в Коржничиха 0—6 6.9 117.0 148.0 0 39
Дерновины Роа alpigena:
о-в Воротиха 0—11 63 126.0 84.0 0.08
луда Добрушка 0—5 7.2 268.0 ' 118.0 0.20
5—12 7 1 210.0 98.0 0.29
Дерновины Festuca rubra\
о-в Воротиха 0—6 6.8 168.0 100.0 0.27
Малая Седловатая луда, 0—4 7.0 200.0 238.0 0.16
район Порьей губы 4—10 6.5 225 0 140.0 0.27
Таблица 35
Агрохимическая характеристика торфяных почв под вторичными орнитогенными
ценозами, возникшими на месте вороничников на островах Кандалакшского залива
Ценоз Глубина взятия образца,см pH солевой вытяжки р2о5 к2о %ci-
мг/100 г почвы
Контроль > н ы е ворс ) н и ч н ы е ценозы
Вороничник:
о-в Коржничиха, Кемь- 0—4 4.6 20.0 164.0 0.07
Луды 4—8 3.5 20.0 60.0 0 07
8—14 3.4 15.0 38 0 0.05
Девичья луда, Северный ар- 0—5 5.7 35.0 170.0 0.16
хипелаг О р 1 5—11 iитоге н н। 4.4 ы е ц е н < 18 0 ) з ы 74.0 0 05
Вороничник, засоренный ор- 0—3 4.8 25.0 128.0 0 05
нитофильными видами 3—9 34 15.0 90 0 0.04
(о-в Коржничиха, Кемь- Луды) 9—14 3.7 15.0 136 0 0.05
Латка вороничника посреди смешанной колонии мор- ских птиц (Чистиковая луда, Северный архипелаг) 0—5 6.0 39.0 140.0 0 36
Отмирающий вороничник посреди смешанной коло- нии морских птиц (Чисти- ковая луда, Северный ар- хипелаг) 0—7 58 92.0 164.0 0.09
Дерновина Festuca ovina:
колония сизых чаек у 0- 2 6.5 43 0 184 0 0.07
границы вороничника 2—6 54 18.0 86.0 0.05
144
Таблица 35 (продолжение)
Ценоз । Глубина взятия образца,см pH солевой вытяжки р2о5 К2О % er
мг/100 I 'почвы
с приморским лугом (о-в Коржничиха, 6—12 4.0 1 18.0 80.0 0 05
Кемь-Луды) (I) 12—18 4.2 22.0 98.0 0.05
то же (II) 0—2 6.3 50.0 570.0 0.21
2—11 5.0 50.0 106.0 0.04
на месте отмершего во- 0—5 6.1 25.0 98.0 0.20
роничника в смешан- ной колонии морских птиц (Чистиковая лу- да, Северный архи- пелаг) 5—13 6.2 22.0 150.0 0.05
Дерновина Festuca rubra среди вороничника, на участке изолированного гнездования сизой чайки (Девичья луда, Северный архипелаг) 0—5 6.7 134.0 150.0 0.08
Мертвая злаковая дерновина 0—3 6.3 272.0 90.0 0.02
в очень интенсивной коло- 3—7 4.5 18.0 112.0 0.04
нии сизых чаек у границы 7—15 4.3 18.0 132.0 0.07
приморского луга с воро- ничником (о-в Коржни- чиха, Кемь-Луды) 0—3 5.1 175.0 76.0 0.09
Участок полуобнаженного 0—5 5.5 30.0 70.0 0.13
торфа на месте полностью вытоптанного птицами от- мирающего вороничника (Чистиковая луда, Север- ный архипелаг) 5—15 5.6 35.0 56.0 0.05
Таблица 36
Средняя многолетняя плотность гнездования
крупных (серебристых и больших морских) чаек
на островах архипелага Семь Островов
(по: Бреслина, Карпович, 1969)
Остров Площадь, га Плотность гнездования, пара на 1 га
Большой Лицкий 152.6 2.8
Вешняк 149.2 6.7
Большой Зеленец 22.0 11.7
Малый Зеленец 13.7 12.1
Малый Лицкий 6.7 15.7
10 И П Бреслина
145
шихся с почвенными образцами. Е. Е. Сыроечковский (1958)
отмечает высокую биологическую активность орнитогенных почв
Антарктики.
СТЕПЕНЬ ОРНИТОЛОГИЧЕСКОГО ВОЗДЕЙСТВИЯ
НА РАСТИТЕЛЬНОСТЬ В РАЗНЫХ ГРУППАХ ОСТРОВОВ
На Айновых островах, где плотность гнездящихся • крупных
чаек составляет около 60 птиц на гектар (Татаринкова, Краснов,
1984) и где, помимо того, находятся крупные колонии тупиков,
растительность претерпела большие изменения. Это подробно осве-
щено в предыдущем подразделе главы.
На островах Восточного Мурмана наиболее ощутимо воздей-
ствие крупных чаек на растительный покров при плотности их
гнездования, превышающей 10 гнезд на 1 га, однако на всех
Семи Островах на 1 га суши их приходится 2 особи (Татаринкова,
Краснов, 1984).
При сравнении орнитогенной растительности, развивающейся
на торфяниках островов Восточного Мурмана, выясняется, что
лишь на небольших островах,1 площадь которых всего лишь
несколько гектаров и где, как правило, наибольшая плотность
гнездования крупных чаек (табл. 36), возможны частичное или
даже полное исчезновение первоначальной растительности —
вороничника и морошкового вороничника и резкое изменение
структуры растительности щелевых лощин. Таковы в архипелаге
Семь Островов острова Большой и Малый Зеленец, о-в Кувшин
и особенно о-в Малый Лицкий, в архипелаге Гавриловских остро-
вов — Малый Гавриловский и особенно Большой Гусинец.
Большая часть плато о-ва Большой Зеленец занята вторич-
ными орнитогенными ценозами, представленными в основном
зарослями Cochlearia officinalis + Rubus chamaemorus, кое-где
Rubus chamaemorus 4- Rumex acetosa, Rubus chamaemorus +
+ Plantago schrenkii, различными соотношениями Rubus cha-
maemorus с целым рядом других орнитофильных видов. Северо-
западная часть островного плато покрыта дерниной из Festuca
rubra ssp. arctica и других растений птичьих колоний. Орни-
тогенные ценозы окаймлены участками отмирающего, засоренного
орнитофильными видами вороничника, постепенно переходящего
в обычный или морошковый вороничник.
Вся платообразная возвышенность о-ва Малый Зеленец занята
вороничником, очень сильно засоренным орнитофильными видами.
Местами Empetrum hermaphroditum совсем исчезает, уступая
место орнитогенным ценозам.
1 Речь идет именно о небольших островах, покрытых сухим торфяником,
но никак не о мельчайших, почвенно-растительный покров которых еще только
формируется. В этом случае надо говорить не об изменении растительности
под влиянием птиц, а об ее становлении.
146
На о-ве Малый Лицкий большая плотность гнездования при-
вела к тому, что первоначальный вороничный растительный покров
сохранился лишь на пологом юго-западном склоне острова
(рис. 54). Но и здесь Empetrum hermaphroditum отмирает и ее
живые пятна чередуются с сухими веточками и побуревшими
листьями. Весь участок сильно засорен орнитофильными видами.
Там, где Empetrum hermaphroditum уже почти совсем отмерла,
сильно разрослась Rubus chamaemorus с примесью Cochlearia
officinalis. Основная часть покрытой растительностью территории
острова совершенно лишена каких-либо остатков вороничника и
занята мощными зарослями Cochlearia officinalis, чистыми или,
реже, с Rubus chamaemorus в нижнем ярусе и примесью Plantago
maritima, Rumex acetosa, Matricaria hookeri. Среди зарослей
Cochlearia officinalis встречаются обычно небольшие по площади
олуговевшие участки с Festuca rubra ssp. arctica. Влияние птиц
сказалось и на других типах первичной растительности острова:
в щелевых лощинах среди Rumex acetosa и Angelica archangelica
в редких на острове фрагментах щавелевого морошечника растет
Cochlearia officinalis.
Ее заросли, по-видимому, давно господствуют на острове.
В пользу этого свидетельствует не только полное отсутствие в них
следов былого вороничника, но и малая встречаемость орнито-
фильных видов, обычных для отмирающего вороничника. Только
в некоторых ее зарослях растет Rubus chamaemorus. В северной
части острова очень хорошо прослеживается постепенное смыка-
ние растительного покрова на приморских скалах, начиная от
куртин Cochlearia officinalis, приуроченных к трещинам породы,
и кончая ее сплошными зарослями. Вероятно, большинство заро-
слей Cochlearia officinalis острова первично и не проходило
стадии вороничника, а образовалось от смыкания отдельных кур-
тин приморских скал и представляет собой первичные орнито-
генные ценозы. Только участки Cochlearia officinalis + Rubus
chamaemorus, возможно, являются вторичным орнитогенным рас-
тительным покровом. Четкая граница между сплошными чи-
стыми зарослями хорошо развитой, мощной Cochlearia officinalis
и ее зарослями с Rubus chamaemorus (где Cochlearia officinalis
развита несколько хуже) имеется в северо-западной части острова
(рис. 55). Не исключено, что здесь находится стыковая линия
двух тенденций в образовании орнитогенной растительности —
смыкания первичных и вторичных орнитогенных ценозов.
В архипелаге Семь Островов особое положение занимает
о-в Кувшин. Площадь его 8.5 га. Здесь имеется базар кайр
(в отдельные годы до 20 тыс. птиц), находятся колонии тупиков
(более 1 тыс. нор), сравнительно плотные гнездовья чаек и гаги
(до 20 и 35 гнезд на 1 га соответственно). Все эти птицы
оказывают разностороннее и взаимно дополняющее влияние на
растительный покров острова, который изменен очень сильно.
На плато вороничник отсутствует полностью и заменен орнитоген-
ными сообществами, в которых чаще всего преобладают в тех
10 =
147
1м
Рис 55. Распределение растительности
по границе стыковой линии смыкания
первичных и вторичных орнитогенных
ценозов. О-в Малый «Лицкий, северо-
восточная часть, Семь Островов, 1967 г.
1 — чистые заросли Cochlearia officinalis,
2 — Cochlearia officinalis Ц- Rubus cha-
maemorus, 3 — дерновины Festuca rubra
ssp arctica, образовавшиеся на месте быв-
ших гнезд чаек, 4 — направление ската
Рис. 54. Распределение растительности
на участке пологого юго-западного
склона о-ва Малый Лицкий. Семь
Островов, 1967 г
1 — вороничник (Empetrum hermaphrodi-
tum) , 2 — отмирающий вороничник с боль-
шой примесью орнитофильных видов; 3 —
Rubus chamaemorus с отдельными пятнами
еще не отмершей Empetrum hermaphrodi-
tum и с примесью орнитофильных видов,
4 — Rubus chamaemorus + Plantago mari-
tima s I 4- Cochlearia officinalis, 5 —
Festuca rubra ssp. arctica
148
Таблица 37
Геоботаническая характеристика фрагментов (I—V) растительности плато
о-ва Кувшин
Видовой состав
Calamagrostis gro-
enlandica
Festuca rubra ssp.
arctica
Rumex acetosella
P tenuifolius
R. acetosa
Cerastium alpinum
Cochlearia officinalis
Rubus chamaemorus
Matricaria hookeri
Проективное покрытие (А, %) и высота растени й (Б, см)
I П 111 IV V
А Б А Б А Б А Б А Б
— + 40
+ — — — — — 50 25
+ 8 80 15 35 15
— — — — + 15 4- 40 90 50
— — + — + 20 — — + 15
8 20 + 15 + 20
— — + 10 60 10 + 10 + 5
80 40 8 35 5 40 — — + 35
или иных сочетаниях Matricaria hookeri, Rumex acetosella p tenuifo-
lius, R. acetosa, Cochlearia officinalis при почти обязательном
присутствии Rubus chamaemorus (табл. 37; рис. 56, 57).
Определить, под воздействием каких именно птиц сложился
этот растительный покров, сейчас не представляется возможным.
Скорее всего, здесь сказывается суммарное влияние всех пере-
численных видов. Можно предположить, что все плато представ-
ляет собой давно заброшенную колонию тупиков, в пользу чего
говорят вытянутые, заплывшие торфом понижения поверхности
(возможно, следы обвалившихся нор). По мнению Н. Н. Скоковой
(1962), высказанному в отношении Айновых островов, на месте
заброшенных колоний тупиков измененная растительность оста-
ется десятки лет и лишь очень постепенно восстанавливаются
исходные ассоциации. Если же территория бывшей колонии про-
должает находиться под сильным влиянием жизнедеятельности
других птиц, как на о-ве Кувшин, то процесс, очевидно, может
пойти не по линии восстановления вороничника, а в направлении
становления каких-то других орнитогенных ценозов.
Растительный покров о-ва Малый Гавриловский испытывает
очень сильное орнитологическое воздействие. Остров относительно
полог с юга и обрывист с севера. На обрывах — небольшие
базары кайр и моевок. К тому же на острове расположена
большая колония серебристых чаек.
Южная часть острова занята вороничником, очень сильно изме-
ненным птичьей деятельностью. Он как таковой там уже не суще-
ствует. Остались лишь его небольшие пятна, редко более 1 м2 пло-
щадью. Все остальное между пятнами — вторичная орнитогенная
растительность.
Центр острова очень неровен и скалист. Однако буйная орнито-
генная растительность этих скал не первична. Они покрыты боль-
149
Рис. 56. Участок плато с аспектирующей Matricaria hookeri вблизи колонии
тупиков и базара кайр на о-ве Кувшин. Семь Островов, 1966 г.
шими пятнами и большими же пятнообразными дерновинами вто-
ричной скальной орнитогенной растительности. Остров пересекают
несколько щелевых лощин, растительность которых представляет
собой сильно засоренный орнитофильными видами, и прежде всего
Melandriutn lapponicum, щавелевый морошечник.
Исключительно сильно изменена птицами растительность о-ва
Большой Гусинец, отвесные северные склоны которого заняты
большими базарами кайр и моевок.
На острове в настоящее время вообще не осталось былого
вороничника. Его полностью сменили вторичные, в основном
щавелево-морошковые ценозы. Щелевые лощины этого острова
поросли мощным орнитофильным разнотравьем в самых различ-
ных сочетаниях.
На крупных островах Восточного Мурмана (Вешняк, Большой
Лицкий, Большой Гавриловский) изменения в растительности
происходят только в местах концентрированных скоплений чаек
да вблизи птичьих базаров.
В Кандалакшском заливе, несмотря на большую плотность
гнездования чаек на ряде его островов (табл. 38), не обнаружено
четкой зависимости между таковой и воздействием их на расти-
тельность. Как уже было отмечено выше, на островах Кандалакш-
ского залива отсутствуют большие участки вторичной орнитоген-
ной, возникшей на месте вороничников растительности. Они лишь
небольшими локальными пятнами «разбросаны» среди воронични-
ков. Это, скорее всего, можно объяснить тем, что подавляющее
150
1
8 0 9
Рис. 57. Распределение растительности на двух участках (I, II) торфяника плато
о-ва Кувшин в разреженной колонии серебристых чаек вблизи колонии тупиков
и базара кайр. Семь Островов, 1967 г.
/ — скальная поверхность; 2 — Rubus chamaemorus 4- Rumex acetosella 0 tenuifolius-, 3 —
Rubus chamaemorus -J- Rumex acetosa, 4 — Rumex acetosella 0 tenuifolius-, 5 — Rumex
acetosa, 6 — Cochlearia officinalis, 7 — Matricaria hookeri-, 8— Calamagrostis groenlan-
dica, 9 — гнездо серебристой чайки.
151
Таблица 38
Плотность гнездования чаек на островах Кандалакшского залива
(начало 80-х годов *)
Район исследования Площадь, га Плотность гнездования, пара на 1 га
серебристые и большие морские чайки сизые чайки
Район Порьей губы
I Столбовая луда 1.3 1.5
II Столбовая луда 4 8 0.3
III Столбовая луда 2.7 9.6 '0.4
Малая Седловатая луда 4.5 13.8 1.5
Озерчанка 11.7 18.9 102
Кем ь-Л уды
Плоская луда 0.4 17.5 212.5
Коржничиха 9 10 11 9.4
Малая Коржничиха 1.3 — 14.4
Совиный 3.1 0.6 97
Зеленый 15 2.7 3.6
Гусиный 4.8 8.3 3.1
Малый Асафьев | 13.2 2.1 2.3
* По В Н Карповичу (устное сообщение)
большинство крупных чаек обитает на приморских и, реже, на
неприморских скалах, а сизых чаек — по границе вороничников
с приморскими лугами. Даже на островах с наивысшей плот-
ностью гнездования вороничник не исчезает полностью. Раститель-
ность приморских скал Кандалакшских островов на островах
с наибольшей плотностью гнездования также не достигает той
мощности и густоты, как на Мурмане. К примеру, растительный
покров очень маленького, плотно заселенного птицами островка —
Плоской луды очень пестр (табл. 38). Это пятна сильно засорен-
ного орнитофильными видами вороничника, перемежающегося
с пятнами стелющегося и не менее засоренного Juniperus sibirica.
Между ними Festuca ovina с очень заметной примесью Dianthus
superbus, Campanula rotundifolia, Stellaria graminea. Среди мно-
гочисленных выходов валунов на дневную поверхность куртины
Angelica archangelica, Rhodiola rosea, Leymus arenarius.
Практически никаких изменений не претерпел вороничник на
о-ве Озерчанка, несмотря на высокую плотность гнездования на
нем чаек (см. табл. 29). Крупные чайки гнездятся здесь на
обнажившихся от торфа в результате очень давнего пожара
скальных грядах. На этих грядах сформировалась вторичная
скальная орнитогенная растительность (см. выше).
152
На Малой Седловатой луде, также характеризующейся боль-
шой плотностью гнездования крупных чаек (табл. 38), среди
вороничника заметно засоренного орнитофильными видами, име-
ются локальные участки вторичной орнитогенной растительности,
самый большой из которых (16 м2) представлен в основном
дерниной Festuca ovina. На этом же острове на приморских
скалах процветает фрагментарная первичная орнитогенная расти-
тельность с тенденцией к смыканию дерновин. Аналогичная кар-
тина наблюдается и на других островах Кандалакшского залива,
имеющих достаточно высокую плотность гнездования чаек.
Ослабление воздействия крупных чаек на растительный покров
островов Кандалакшского залива по сравнению с островами Во-
сточного Мурмана, при примерно одинаковой или даже в Канда-
лакшском заливе большей плотности их гнездования, нельзя
объяснить только тем, что суммарное воздействие всех гнездя-
щихся видов птиц несравнимо выше на островах Восточного
Мурмана. На ряде островов (Кувшин, Малый Гавриловский,
Большой Гусинец) это действительно так. Однако, к примеру,
на островах Большой и Малый Зеленец, где, помимо гнездя-
щихся чаек, имеются лишь небольшие локальные колонии тупиков,
суммарным воздействием гнездящихся видов это не объяснишь.
И в этом случае ослабление орнитологического воздействия
на растительный покров островов Кандалакшского залива при
равной с островами Восточного Мурмана плотности гнездования
чаек кажется парадоксальным. По мнению В. В. Бианки (устное
сообщение), возможная причина этого парадокса в том, что чайки
Кандалакшского залива и даже их подрастающие птенцы весьма
значительную часть своего времени проводят на литорали, зани-
мающей здесь большие площади, тогда как на островах Восточ-
ного Мурмана ее площади практически сведены к нулю. Тем
самым чайки Кандалакшского залива проводят на островной
суше гораздо меньше времени по сравнению с чайками Восточного
Мурмана. Не исключено, что в чем-то этот парадокс зависит
и от ряда климатических факторов (с возрастанием суровости
климата растительность реагирует на внешнее, в том числе и на
орнитологическое воздействие). При дальнейших исследованиях
причин существования орнитогенной растительности этому во-
просу надо уделить особое внимание.
Орнитогенные участки биоценозов суши, являясь местом гнез-
дования и отдыха морских птиц, тесно связаны с жизнью моря.
Птичий помет, погадки — это в большинстве своем переработан-
ные продукты морских биоценозов, привнесенные в биоценозы
островов и оказывающие значительное влияние на их экологи-
ческие характеристики. В итоге вещества, слагающие продукты
моря, консервируются на островах в виде торфообразной массы.
Всякое оскудение морских ресурсов, используемых морскими
птицами в питании, неизбежно приведет к снижению их числен-
ности и ослаблению их влияния на островные экосистемы.
153
Сама орнитогенная растительность представляет собой резуль-
тат прямого воздействия колониально гнездящихся птиц на по-
верхность островов, независимо от их внешнего облика — скалы,
сухие торфяники, луга, болота. Там, где исключено птичье влияние,
она не может ни возникнуть, ни существовать, и в этом ее
уникальность. Орнитогенная растительность различных островов
Мурмана и Кандалакшского залива, при наличии общих тенден-
ций ее возникновения, становления, развития, имеет свой харак-
терный состав и облик. Ее процветание возможно только при
процветании колоний морских птиц.
Несомненно, орнитогенные ценозы нуждаются в особой охране.
Вольное или невольное уничтожение их человеком, даже при
сохранении птичьих колоний, сильно обеднит природу островов
Кольской Субарктики. Для восстановления существующих вторич-
ных орнитогенных ценозов потребуются многие годы, первич-
ных же — возможно, и столетия. К тому же маловероятно, что
вновь восстановленные орнитогенные ценозы будут полностью со-
ответствовать прежним.
В усиленной охране на Мурмане и в Кандалакшском заливе
нуждаются следующие представители орнитогенной раститель-
ности:
1) уникальные колосниковые кочкарники Айновых островов,
сформировавшиеся, по-видимому, в результате многовекового вза-
имодействия чаек и растительности колосникового луга;
2) формирующиеся колосниковые кочки на островах Малая
Седловатая луда (вход в Порью губу), луда Малышка (Северный
архипелаг), Плоская луда (Кемь-Луды);
3) сплошные чистые заросли Cochlearia officinalis на о-ве Ма-
лый Лицкий (Семь Островов), возникшие, по-видимому, в резуль-
тате смыкания отдельных дерновин скальной первичной орнитоген-
ной растительности;
4) вторичная скальная орнитогенная растительность о-ва Озер-
чанка (близ Порьей губы), возникшая в результате гнездования
серебристых чаек на скальных грядах, торфянистый покров кото-
рых в давние времена был полностью уничтожен пожаром; струк-
тура скальной растительности этого острова своеобразна и от-
лична от структуры как первичной скальной орнитогенной расти-
тельности, так и от обычной, довольно широко распространенной
на островах Кандалакшского залива вторичной скальной орнито-
генной растительности;
5) первичная орнитогенная растительность приморских скал
всего района Кольской Субарктики; она наиболее легко может
быть уничтожена, поскольку ее торфянистые дерновины просто
лежат на скалах и только корнями некоторых растений «заякорены»
в трещинах, их без труда может оторвать человек;
6) растительность птичьих базаров и вблизи их; существовать
она может только вместе с «базаром», всякое же их разорение
или оскудение неизбежно ее изменит.
154
Г лава 5
ОСТРОВНЫЕ ЛАНДШАФТЫ КОЛЬСКОЙ СУБАРКТИКИ
И ХАРАКТЕР ИСПОЛЬЗОВАНИЯ ИХ
ВОДОПЛАВАЮЩИМИ ПТИЦАМИ
Специфичность островных и прибрежных ландшафтов обуслов-
лена прежде всего морским окружением на островах и морской
границей на побережье. Небольшая величина островов, малый на-
бор экотопов (фаций) на них, замкнутость территории, а также
совокупность особых морских климатических факторов («фактор
океаничности»), приливно-отливного режима, а нередко и орнито-
логического воздействия создают особые экологические условия
на островах Кольской Субарктики.
ЛАНДШАФТЫ ОСТРОВОВ КАНДАЛАКШСКОГО ЗАЛИВА
Первая классификация островов региона, а именно мелких
островов вершины Кандалакшского залива, была предложена
В. В. Бианки (1958). В основу классификации им были положены
геологический и флористический принципы, что позволило выде-
лить четыре основных типа этих островов, а также установить,
какие морские птицы предпочитают гнездиться на мелких остров*ах
того или иного типа.
На этой же основе, в зависимости от грунта и растительности,
классифицирует мелкие острова архипелага Валассарет в Ботни-
ческом заливе Хульден (Hulden, 1964). Но, к сожалению, оба ав-
тора классифицируют острова в одних случаях только по призна-
кам растительности, в других — только по геологическим приз-
накам.
Возраст, величина, удаленность от материковых берегов и,
как следствие этого, набор и сочетание экотопов (фаций, биогео-
ценозов) неодинаковы у различных островов региона. При этом,
чаще всего, неодинаковые по величине острова разновозрастны,1
поскольку все они образовались в результате поднятия морского
дна и поскольку этот процесс и поныне продолжается.
Все это позволило нам на основании детального многолетнего
обследования многочисленных островов Кандалакшского залива
предложить свою классификационную схему их ландшафтов, и
в частности экотопов как мест обитания водоплавающих птиц
(Бреслина, 1983). При этом мы руководствовались принципами
Обычно чем старше остров, тем он крупнее, но полной корреляции здесь пет
155
ландшафтной классификации территории, изложенными в работах
Ф. Н. Милькова (1967), Д. Л. Арманда (1975), А. Г. Исаченко
(1980), положениями Г. М. Игнатьева (1979) относительно остров-
ных ландшафтов, закономерностей их образования и строения,
а также идеями Ю. А. Исакова (1968), касающимися ландшафт-
ной классификации местообитаний водоплавающих птиц. Прин-
ципы предложенной классификации в большой степени основаны
на прямой зависимости ландшафтной усложненности островов от
их возраста.
Поморское население Кандалакшского залива Белого моря
испокон веков в своем постоянном общении с морем и островами
пользовалось своей, стихийно сложившейся ландшафтной класси-
фикацией островов, отраженной в собственной специфичной тер-
минологии. Ею на Белом море и по сей день широко пользуются,
и она вошла в «Лоцию Белого моря» (1957). В своей классифи-
кационной схеме мы также, по возможности, используем помор-
скую терминологию. Эта веками, стихийно сложившаяся термино-
логия употреблялась уже в первых работах, посвященных природе
Кандалакшского заповедника (Леганцев, 1934, рукопись), и
широко вошла во многие последующие научные публикации.
Характеристика основных наземных ландшафтов
Среди наземных ландшафтов Кандалакшского залива Белого
моря можно выделить пять основных ландшафтных единиц, «типов
местности» по Ф. Н. Милькову (1967), — четыре островных ланд-
шафта и один сборный — ландшафт материкового берега.
Островные ландшафты классифицируются нами по их положению
относительно материкового берега и открытой части залива.
Типы островных ландшафтов
1. Островные ландшафты губ — «губные» острова. «Губами»,
по вошедшей в литературу поморской терминологии, на Белом
море называют заливы. В губах Кандалакшского залива, как
правило, находится множество островов. Их величина различна.
Самые маленькие — несколько квадратных метров, крупные —
до сотни и более гектаров. Вблизи островов и внутри их групп
обычны мелководья. Глубины здесь невелики, но местами, осо-
бенно по фарватеру, они могут быть очень большими (до 50 м).
Коренные породы на этих островах обычно скрыты слоем (1 — 1.5 м)
рыхлых отложений — перемытой мореной. Однако почти на всех
островах встречаются и скальные обнажения, нередко обширные
по площади. Рыхлые отложения супесчаные, песчаные, песчано-
каменистые и очень редко крупновалунные.
Близость материковых берегов и определенная «скученность»
островов сильно ослабляют ветры всех направлений. В губах все
более или менее крупные острова (обычно более 5 га) в основном
лесисты. На островах меньшего размера господствуют воронич-
156
ники, на самых маленьких — приморское крупнотравье. Супроли-
тораль, сложенную рыхлыми отложениями, занимают приморские
луга, а скальную супролитораль — приморская скальная расти-
тельность. На лесистых островах Северного архипелага в большом
количестве гнездится обыкновенная гага. На лесистых островах
других губных архипелагов гага почти не гнездится. На безлесных
островах различных губных архипелагов при должной охране и
отсутствии фактора беспокойства существуют ее гнездовья боль-
шей или меньшей плотности. Многочисленна на безлесных остро-
вах сизая чайка. Здесь, в губных архипелагах, обычны обширные
литорали — основные ее кормовые угодья. Серебристая чайка
немногочисленна, и ее гнездовые колонии приурочены к тем остро-
вам, которые расположены ближе к открытой части залива.
Обычны в губных архипелагах морские кулики — кулик-сорока,
камнешарка, галстучник. Здесь много подходящих условий для их
гнездования и кормежки. Полярная крачка в губных архипелагах
достаточно многочисленна, но только в случае удаленности их от
городов и поселков. Чистик гнездится только на безлесных берегах
островов, расположенных недалеко от открытой части залива,
если эти берега сложены крупными валунами или если они
завалены плавником. И крупные валуны, и завалы плавника
нужны чистику для устройства своих гнездовых нор в образовав-
шихся пустотах.
2. Ландшафты островов, расположенных вблизи открытого
или слабо изрезанного материкового берега, — «бережные»
острова. Отмели вблизи таких островов встречаются редко, однако
внутри их архипелагов возможны большие литорали (например,
на Кемь-Лудах). Соотношение участков под рыхлыми морскими
отложениями (нередко это валунные отложения) и скальных,
прикрытых лишь торфянистым слоем, здесь примерно одинаково,
или даже скальные преобладают. И материковый берег, и сами
острова (если это архипелаг, а не отдельный остров) ослабляют
действие ветров только некоторых направлений. Растительность
достаточно крупных островов этого типа чаще всего напоминает
лесотундру.
Среди господствующих здесь вороничников растут единичные
ветровой формы деревья, реже их группы. А в понижениях между
скальными грядами на рыхлых отложениях обычны небольшие
елово-березовые леса или же, как например на Кемь-Лудах, —
первичные кривоствольные березняки. И только некоторые, как
правило, самые большие острова, такие как Торосиха (37.4 га)
и Вачев (107 га), по-настоящему лесисты (лес не только в пони-
жениях между грядами). Из-за значительной площади скал,
больших глубин и волнобоя даже в проливах приморские луга
здесь фрагментарны. Они встречаются в кутах загубин 1 и не-
больших губ да еще тянутся узкой (0.5—1.5 м) прерывистой
Неглубоко врезанная в берег губа
157
полосой вдоль нескальных берегов. На бережных островах нахо-
дятся большие колонии серебристых чаек. При наличии доста-
точно больших литоралей здесь охотно гнездятся сизые чайки,
в меньшем, однако, количестве, чем на губных островах. При
этом же условии на берегах этих островов обычны и морские
кулики — камнешарка и кулик-сорока. Однако галстучник здесь
очень редок, поскольку редки песчаные пляжи. Гнездовья поляр-
ной крачки многочисленны. Относительно пологие берега с боль-
шими завалами аварийной древесины — излюбленные места гнез-
дования чистика. Здесь, да еще среди валунных пляжей, он
находит подходящие укрытия для устройства своих гнездовых нор.
На бережных островах достаточно многочисленны гнездовья обык-
новенной гаги (разумеется, в случае их должной охраны и
отсутствия фактора беспокойства).
3. Ландшафты обособленных островов или, реже, архипелагов
открытых участков Кандалакшского залива — «голоменные»
(морские) острова. Отмелей вблизи островов, как правило, нет,
литорали очень малы. Только архипелаг Роговые луды полностью
сложен рыхлыми отложениями и окружен обширными литоралями.
Остальные острова скальные, а у их подножия могут быть крупно-
валунные отложения. Острова открыты ветрам всех направлений.
На достаточно крупных островах как положительные, так и отри-
цательные элементы рельефа покрыты слоем приморского торфа
(50—70 см), который нередко растрескан на многоугольники.
На приморском торфянике господствует вороничник или же мо-
рошковый вороничник, в лощинообразных понижениях — его бо-
лотные варианты или же осоково-сфагновые микроболотца. В не-
заболоченных западинах, там, где в приземном слое ослабля-
ется действие ветров, а на о-ве Наумиха и местами на южном
его склоне, растут невысокие, редко выше 1.5 м, кривоствольные,
стланиковой формы или же кустообразные березы, рябины, осины,
ели и сосны. Растут единично, очень редко группами. Приморские
луга отсутствуют. Только песчаная Роговая луда окаймлена узкой
полосой Leymus arenarius. На голоменных островах расположены
большие плотные колонии серебристых чаек, причем на скалистых
островках-баклышах могут быть колонии больших бакланов (неко-
торые из них неежегодные). В небольшом количестве гнездится
здесь полярная крачка. Сизая чайка для голоменных островов
малохарактерна. На некоторых островах в обломках от вывет-
ривания скальных пород гнездится гагарка. Чистик здесь очень
немногочислен — для него почти отсутствуют подходящие укры-
тия.
Обыкновенная гага гнездится повсеместно, как среди орнито-
фильного разнотравья приморских скал, так и в вороничных тун-
дрообразных ценозах. Морские кулики — галстучник, кулик-
сорока, камнешарка — несвойственны для голоменных островов,
потому что здесь почти отсутствуют обширные литорали — места
кормежки этих куликов. Такие острова открытой части Кандалакш-
ского залива можно было бы назвать морскими островами, однако
158
мы предпочли поморский термин «голоменные1 острова». Ведь
наши, даже самые отдаленные от берегов острова Кандалакшского
залива все-таки прибрежные, если их оценивать в планетарном
масштабе.
Не всегда мы можем четко определить, к какому типу остров-
ного ландшафта можно отнести тот или иной конкретный остров
(архипелаг). В некоторых губных архипелагах острова, располо-
женные на выходе из губы, имеют облик бережных или даже
голоменных островов (Северный архипелаг, Порья губа). И наобо-
рот, некоторые бережные архипелаги вблизи материкового берега
имеют острова, своим обликом и ландшафтными особенностями
очень схожие с губными островами (о-в Красный, Кемь-Луды).
4. Островной ландшафт о-ва Великого. По набору экотопов,
по развитию болотной, озерной и ручьевой сети этот самый круп-
ный в Кандалакшском заливе остров (6824 га, без литорали)
занимает в ландшафтном отношении особое положение среди всех
прочих островов. Этот остров образовался в результате поднятия
и соединения большого архипелага островов. Нередко в литературе
упоминается о том, что этот остров «материкового типа», и под
этим термином подразумевается, по-видимому, то, что ландшафт
о-ва Великого схож с ландшафтом соседнего карельского матери-
кового берега, от которого остров отдален тремя неширокими
проливами. Разве что характерная для материка речная сеть
заменена ручьевой сетью. Здесь, на многочисленных озерах, так же
как и на материке, гнездятся пластинчатоклювые (неморские виды)
и единично еще гагары, поганки, на болотах — различные ку-
лики, а иногда и серый журавль. Морские берега острова —
место гнездования морских куликов: кулика-сороки, камнешарки,
галстучника. Обыновенная гага на о-ве Великом почти не гнез-
дится.
Типы островов
Внутри каждого архипелага различные острова неодинаковы
в ландшафтном отношении. Это связано с неодинаковым количе-
ством и набором экотопов и обусловлено как возрастом острова,
так и степенью подверженности его волнобою. Величина прибой-
ности берегов острова в свою очередь зависит от его положения
относительно открытой части залива. Именно с количественной
характеристикой прибойности связано то обстоятельство, что
в разных островных ландшафтах (группах архипелагов) одновоз-
растные и геоморфологически однородные острова находятся на
разной стадии заселения их гнездящимися птицами и раститель-
ностью, а следовательно, и с неодинаковым набором экотопов.
В архипелагах одного ланшафтного типа (одной группы)
среди одновозрастяых и геоморфологически однородных островов
1 Голомень, по-поморски, — открытое море, море без берегов. (Меркурьев,
1979)
159
налицо заметная корреляциях между возрастом острова и набо-
ром его экотопов. Если же сравнивать подобные острова в архи-
пелагах разных групп, то в голоменных архипелагах на них обна-
руживается меньший набор экотопов, чем на прибрежных и тем
более на шхерных (губных) островах равного им возраста и
геологического строения.
Приводимая ниже характеристика основных островных типов
дается по признакам набора островных экотопов с учетом воз-
раста, происхождения и положения островов в той или иной
ландшафтной группе.
Корга — изолированный участок морского дна, обнажив-
шийся в отлив. Корга — это остров на стадии зарождения. Чаще
всего она скалистая, потому что при поднятии морского дна
обычно в первую очередь обнажаются скальные выступы. Однако
в Кандалакшском заливе не столь уж редки и корги, сложен-
ные рыхлыми отложениями, особенно в губных архипелагах. Но
такие корги существуют и в голоменном архипелаге Роговые
луды, да и сами эти луды — это одна-единственная, очень неболь-
шая луда и несколько обширнейших мелкокаменистых корг.
Скальная корга имеет единственный экотоп — литораль. Од-
нако из-за своих обычно очень малых размеров (несколько
метров в поперечнике) она очень мало используется морскими
птицами как кормовое угодье. Зато она привлекает их как место
отдыха — «клуб», по терминологии орнитологов.
Сложенная рыхлыми отложениями корга может иметь два
экотопа — литораль и приморский луг низкого уровня. Послед-
ний занимает ее наиболее возвышенные участки в губных архи-
пелагах, где прибойность невелика. На ее обширных песчаных
или каменистых литоралях кормятся чайки и морские кулики.
На приморских луговых экотопах останавливаются на пролете и
кормятся гуменники.
Камень — недавно (в геологическом масштабе времени)
возникший, очень маленький скальный островок, не затопляемый
в прилив, слегка возвышающийся над уровнем моря в полную
воду. Высшая растительность на нем чаще совсем отсутствует,
реже представлена 1—2 или несколькими экземплярами Pucci-
nellia pulvinata. Скальный грунт и практическое отсутствие выс-
шей растительности — основное отличие камня от других мельчай-
ших островков. А поскольку существование высшей раститель-
ности на приморских скалах прямо зависит от степени прибой-
ности, величина камней неодинакова в ландшафтах различных
архипелагов. В губных архипелагах их высота обычно менее 1 м,
в голоменных — до 2 м. Основной экотоп камня — лишенные выс-
шей растительности приморские скалы. Крутая скалистая лито-
раль занимает ничтожную площадь и не имеет значения в пита-
нии морских птиц. На камнях из-за систематического сильного
волнобоя они не могут гнездиться и используют их как «клуб».
Лудушка — небольшой, сложенный рыхлыми отложениями
островок обычно менее 1 м высотой, имеющий два экотопа —
160
достаточно обширную из рыхлых отложений литораль и примор-
ский луг низкого, среднего и высокого уровней. Последний нередко
с пятнами зарождающегося вороничника. Лудушка наиболее
типична для губных архипелагов. Приморские луга лудушки, осо-
бенно заросли Leymus arenarius, — хорошие убежища для гнездо-
вий обыкновенной гаги. На приморских лугах среднего и низкого
уровня на пролете могут останавливаться гуменники.
Б а к л ы ш — небольшой, скалистый, обычно круто возвыша-
ющийся островок, стадия роста острова в ряду «скальная корга—
камень—баклыш». На баклыше всего два экотопа — очень узкая
полоса крутой литорали и приморские скалы, нижний пояс которых
лишен растительности. Иногда на его вершине есть вороничные
фрагменты. Размеры баклыша невелики — в поперечнике от не-
скольких метров в губных архипелагах до нескольких десятков
метров в голоменных островах. Их наименьшие высоты 1—2 м
в губных архипелагах, наибольшие — до 5 м среди голоменных
островов.
На баклыше преимущественно гнездятся серебристые чайки и
они оказывают решающее влияние на становление его раститель-
ного покрова.
Л у д к а — ее характерный признак — присутствие воронич-
ника, основного плакорного элемента острова этого типа. Лудка
является стадией роста лудушки (в этом случае она сложена
рыхлыми отложениями) или баклыша (тогда она скальная).
Скальная лудка может иметь и рыхлые отложения у ее подножия
и даже на склонах в силу геоморфологических законов формирова-
ния береговой суши. Особенно это проявляется в губных архи-
пелагах, почти не выражено в голоменных. Рельеф лудки плато-
образный, с пологими склонами (в случае рыхлой подстилающей
почву породы) и достаточно крутыми, а то и обрывистыми
(при скальном фундаменте). Помимо господствующего на плакоре
вороничника, берега лудки опоясывают экотопы, уже упомянутые
при характеристике предыдущих ее возрастных стадий и свой-
ственные соответствующему для них грунту. На лудках в губных
и бережных архипелагах в вороничниках преимущественно гнез-
дятся сизые чайки, в голоменных же архипелагах на приморских
скалах и в меньшей мере на вороничниках — серебристые. Обык-
новенная гага охотно занимает для своего гнездования все ее
экотопы, кроме, разумеется, тех, где существует возможность
обрызгивания и тем более смыва ее гнезд при шторме.
Островок — небольшой остров, так же как и лудка с неиз-
резанной береговой линией, основной экотоп которого—лес.
Островок встречается только в губных архипелагах и сложен
преимущественно рыхлыми отложениями. Лес занимает почти всю
площадь островка, и только узкая прибрежная его часть опоясана
приморской луговой полосой и совсем узкой полоской пляжа.
Островок — стадия роста лудки. На Северном архипелаге в лес-
ной части островка гнездится обыкновенная гага. Пример такого
островка — о-в Круглый.
Illi 11 L>p^ blilJ
161
Луда и остров (в узком, употребляемом поморами
смысле, о чем ниже), следующие типы островов, характеризуются
большей ландшафтной усложненностью и большей величиной.
Все они старше рассмотренных выше мелких островов и образо-
вались в результате поднятия и объединения нескольких близле-
жащих островов. Поэтому их рельеф хотя бы элементарно рас-
членен. Здесь налицо две или больше возвышенности (чаше всего
платообразные) и более или менее выраженные лощинообразные
понижения между ними. По этой же причине береговая линия
более или менее изрезана. Геологическая почвоподстилающая
порода в губных архипелагах обычно перемытая морем морена
разного механического состава, но чаще песчаная, песчано-каме-
нистая, супесчаная, супесчано-каменистая. Скальные выходы,
иногда прикрытые слоем приморского торфа, невелики. В голомен-
ных архипелагах здесь так же, как и на более «молодых» островах
(в общепринятом широком смысле), господствуют скальные вы-
ходы, прикрытые слоем приморского торфа. В бережных архипела-
гах на лудах и островах (в узком смысле) перемытая морена
и скальные выходы занимают примерно одинаковые площади,
или же скальные выходы преобладают. Естественно, скальные
выходы занимают здесь положительные элементы рельефа, а пере-
мытая морена тяготеет к отрицательным.
Ландшафтная усложненность луд и островов (в узком смысле)
обусловлена их возрастом. Следствием более сложного геоморфо-
логического строения их является больший набор экотопов.
Для луды характерно безлесье. Все положительные, одетые
торфянистым слоем элементы рельефа покрыты вороничниками.
Вороничники господствуют и в лощинообразных понижениях.
Обычно это достаточно влаголюбивые или даже болотные их
варианты. Встречаются здесь и небольшие болотца различного
ботанического состава. В голоменных архипелагах на лудах де-
ревья и кустарники, если они есть, всегда скрыты рельефом
от губительных для них ветров; в бережных они растут открыто,
но приобретают при этом своеобразную ветровую форму; на лудах
же губных архипелагов деревья, чаще всего сосны, также растут
открыто, хоть и рассеянно, однако обнаруживают хороший рост и,
разрастаясь, образуют подобие паркового несомкнутого леса.
В дальнейшем, с появлением подроста, здесь образуется уже
настоящий лесок. На Девичьей луде в Северном архипелаге это
произошло на протяжении жизни одного поколения. Луда стала
превращаться в остров. Берега луд, если они скальные, заняты
приморской скальной растительностью; если же они сложены
рыхлыми отложениями, — приморской луговой полосой разных
уровней и узкой полосой пляжа, расположенного немного ниже
луга высокого уровня. Приморская луговая полоса тем сильнее
выражена, чем больше берега луды защищены от волнобоя.
Особенно это касается лугов низкого и среднего уровней. По этой
причине на лудах в губных архипелагах приморские луга зани-
мают большую площадь, чем в бережных. В голоменных архи-
162
пелагах на лудах приморские луга отсутствуют. На лудах гнез-
дятся обыкновенные гаги в самых разнообразных экотопах, но
предпочтительно в зарослях Leymus arenarius, под единично стоя-
щими в вороничниках деревьями и кустарниками ветровой формы
роста, на приморских скалах среди пышных куртин Rhodiola rosea.
У кромки приморского луга с вороничником нередки колонии сизых
чаек (в губных и бережных архипелагах), а на приморских
скалах — колонии серебристых чаек, особенно в голоменных и
бережных архипелагах. Обычно на лудах колонии чайковых птиц
располагаются не равномерно, а отдельными локальными участ-
ками. Плотность гнездования морских птиц на луде всегда намного
ниже, чем на лудке, а тем более на лудушке и баклыше.
Основная особенность острова (в узком, вполне определенно
употребляемом поморами смысле) — преобладание на нем леса.
Остров всегда лесист. На островах губных архипелагов еловый
или сосновый лес растет на плакорах. В бережных архипелагах
он произрастает на плакорах только достаточно крупных островов,
таких как о-в Красный на Кемь-Лудах (210 га) и о-в Торосиха
(37.4 га). Гораздо чаще он располагается здесь в лощинообразных
понижениях рельефа островов или на их склонах, укрывающих
его от господствующих ветров. Таковы на Кемь-Лудах острова
Избяной и Асафьев, где преобладают кривоствольные березняки.
Болота для островов нехарактерны, и площади их невелики.
Однако на достаточно крупных островах, таких, например, как
о-в Ряжков (397 га) и о-в Анисимов (75 га) в Северном архипе-
лаге, о-в Красный (210 га) на Кемь-Лудах, существуют настоящие
болота, преимущественно верхового типа. Для островов они доста-
точно крупны (до 15—20 га), хотя в сравнении с болотными
системами материкового побережья их площади незначительны.
На некоторых, чаще всего крупных, островах есть озера. Они
образовались в результате отшнуровки приглубых морских участ-
ков при подъеме суши. На крупных островах, таких как, к примеру,
о-в Ряжков и о-в Лодейный в Северном архипелаге, из них
вытекают небольшие ручейки. По ним осуществляется сток с болот
и озер. Нередко остров имеет сложную конфигурацию береговой
линии. Для него обычны губы и загубины. В губных архипелагах
в их кутах развиты приморские луга, иногда приморские болота.
Неизрезанные берега, как и обычно, заняты либо неширокой и
даже прерывистой приморской полосой, либо приморскими ска-
лами. Приморские луга низкого и среднего уровней в губных
архипелагах достаточно развиты. Для островов, расположенных
в этих архипелагах, не характерна тундрообразная раститель-
ность, а там, где она имеется, она занимает вытянутые и откры-
тые ветрам мысы (по-поморски, «наволоки»). Таковые два наво-
лока на о-ве Докучаиха в Северном архипелаге. Зато среди
бережных островов площади под вороничниками довольно зна-
чительны. Они занимают не только мысы, но нередко и плакоры,
как на о-ве Асафьев, например. Преимущественно на крупных
островах Северного архипелага в лесу, предпочтительно в ельни-
72п
163
ках, гнездится обыкновенная гага. Помимо леса, здесь она исполь-
зует для гнездования еще и приморские луга высокого уровня.
Особенно излюблены ею вороничные мысы о-ва Докучаиха. На
островах других архипелагов гага не гнездится, а если и гнездится,
то избегает лесных массивов. Несколько лет назад она неплохо
заселяла безлесные участки о-ва Асафьев. Однако пребывание
на этом острове лисицы в течение последних нескольких лет
заставило гагу покинуть его. Чайковые островов избегают, а если
и гнездятся на них, то в соответствующих им местообитаниях,
расположенных преимущественно на мысах.
Обычно остров крупнее луды, если оба они находятся в архи-
пелаге одного ландшафтного типа. Остров является дальнейшей
стадией «роста» луды. Наибольшее количество островов — в губ-
ных архипелагах. Почти совсем их нет среди голоменных.
Как уже было отмечено выше, совершенно особым в ланд-
шафтной типологии островов является о-в Великий. Он образо-
вался в результате поднятия и слияния воедино целого архипе-
лага островов, некоторые из которых даже при самом высоком
уровне древнего моря возвышались над его поверхностью.
Классификационная схема островных ландшафтов
и мест обитания в них связанных с морской средой птиц
На основании многочисленных учетов, визуальных наблюдений,
личных впечатлений, литературных источников нами обобщена
типология островных ландшафтов (табл. 39—42). В таблицах
приведены сведения, касающиеся характера пребывания основных
видов связанных с морской средой птиц в различных экотопах
в зависимости как от принадлежности этих экотопов к определен-
ному типу острова, так и от принадлежности самого острова
к архипелагу того или иного типа. Количественные данные отра-
жают степень характерности различных типов островов, долю
участия тех или иных экотопов в островном ландшафте. Предпо-
чтительность использования птицами тех или иных экотопов при-
ведена в таблицах по очень условной трехбалльной системе и
обозначена одним, двумя или тремя знаками «+». Для их уточ-
нения в целях предельной их достоверности необходим тщательный
анализ численных данных и специальная математическая обра-
ботка всего накопленного материала.
Предложенная ландшафтная классификация островов схема-
тична. При отнесении конкретного острова к тому или иному
ландшафтному типу могут возникнуть затруднения, поскольку
на самом деле мы имеем континуум и ландшафтов архипелагов,
и типов островов в них, а классификационная схема составлена
с учетом основных, наиболее общих и ярко выраженных призна-
ков четырех характерных типов островных ландшафтов и
нескольких типов островов, выделенных из очень большого их
количества.
164
Таблица 39
Классификационнная схема островных ландшафтов
Губные острова
Тип острова и частота его встречаемости Г рунт Экотоп и его доля в островном ландшафте Характер пребывания основных водоплавающих птиц, предпочтительность и интенсивность использования ими экотопов
Корга ( + +) Скальный Литораль ( + + +) Отдыхают’ серебристая чайка (+ ), сизая чай- ка (+ + + ), гага (+ + )
Корга (+ + +) Рыхлые отложения Литораль ( + + + ) Приморский луг низкого уровня ( -I- ) Кормятся: серебристая чайка ( + ), сизая чай- ка (+ + + ), кулик-сороКа, камнешарка Кормятся пролетные гуменники ( + )
Камень (+ + ) Скальный Литораль (+) Скала, лишенная расти- тельности (+ + +) Отдыхают: серебристая чайка (+ ), сизая чайка (+ + ), гага ( + +)
Лудушка (+ + + ) Рыхлые отложения Литораль (+ + ) Приморский луг низкого и среднего уровня ( + + ) Пляж песчаный или галеч- никовый (-1-) Пляж валунный ( + ) Приморский луг высокого уровня (+ + + ) Кормятся: галстучник (+ + + ), кулик-сорока (+ + + ), камнешарка (+ + + ), сизая чайка (+ + +)» сереб- ристая чайка (+) Держатся выводки: галстучник (+ + +), кулик-соро- ка (+ + +), камнешарка (+ + + ) Кормятся пролетные гуменники ( + ) Гнездятся: галстучник (+ + +), кулик-сорока (++), серебристая чайка ( + ) Гнездятся: кулик-сорока ( + ), серебристая чайка ( + ), чистик в каменных норах ( + ) Гнездятся: гага (+ + +), полярная крачка (+ + + ), кулик-сорока (+ + + ), камнешарка (+ + +), сизая чайка (+ + + )
СЛ Баклыш (+ +) Скальный Литораль ( +) Приморские скалы (+ + + ) Гнездятся: серебристая чайка (+ + ), кулик-соро- ка (+), полярная крачка (+ ), гага ( +)
С5
9>
Тип острова и частота его встречаемости Г рунт Экотоп и его доля в островном ландшафте
Лудка (+ +) Скальный с рыхлыми от- ложениями у подножия Литораль (4-) Приморские скалы ( 4- 4-)
Завалы плавника (4-) Крупнотравье на песчано- каменистых отложе- ниях (4-) Вороничник (4- 4- 4-)
Лудка (+ + +) Рыхлые отложения Литораль (4- 4-)
Приморский луг низкого и среднего уровня ( 4-)
Пляж песчаный или галеч- никовый (4-) Пляж валунный (4-) Завалы плавника (4-)
Приморский луг высокого уровня (4-)
I
Таблица 39 {продолжение)
Характер пребывания основных водой юзающих птиц,
предпоч I и те юность и ин гснсивность использования ими
зкогопов
Гнездятся: серебристая чайка (4-4-), кулик-соро-
ка (4-), полярная крачка (4-), гага (4-)
Гнездятся: гага (4-), чистик (4-)
Гнездится гага (4-4-4-)
Гнездятся: гага (4-), кулик-сорока (4-), полярная
крачка (4-4-), сизая чайка (4-)
Кормятся: серебристая чайка (4-4-), сизая чай-
ка (4—F)
Кормятся: кулик-сорока (4-4-4-), камнешар-
ка ( 4- 4- 4-), галстучник ( 4- 4- 4-), сизая чай-
ка (4- 4- 4-), серебристая чайка ( 4- 4- 4-), держатся
выводки: кулик-сорока (4-4-4-), камнешар-
ка (4- 4- 4-), галстучник (4- 4- 4-)
Кормятся пролетные гуменники (4-4-)
Гнездятся: галстучник (4- 4- 4-), кулик-сорока (4- 4-),
серебристая чайка (4-)
Гнездятся: серебристая'чайка (4-), чистик (4-)
Гнездятся: гага (4-), чистик (4-)
Гнездятся- кулик-сорока (4- 4-), камнешарка (4- 4-),
сизая чайка (4-4-4-), полярная крачка (4-4-),
гага (4-4-)
Вороничник ( 4- + + )
Островок (+ + + ) Рыхлые отложения обычно со скальными выходами Литораль ( + + +)
Приморский луг низкого и среднего уровня ( + ) Пляж песчаный или галеч- никовый (+) Пляж валунный ( + ) Приморский луг высокого уровня (+) Лес еловый (+ + + )
Луда ( + ) Рыхлые отложения со скальными выходами Лес сосновый (+ + + ) Литораль (-|- + +)
Приморский луг низкого и
среднего уровня (+ + )
Пляж песчаный или галеч-
никовый (+)
Пляж валунный ( + )
Приморский луг высокого
уровня (+)
Завалы плавника ( + )
Вороничник с редкими де-
ревьями (+ -|- + )
Гнездятся- сизая чайка (+ + ), полярная крачка ( + ),
камнешарка (+ + + ), гага ( + ), кормятся, серебри-
стая чайка (4-4-), сизая чайка (4-4-)
Кормятся сизая чайка (4- 4- +), серебристая чай-
ка (+), кулик-сорока (4-4-4-), галстучник
(+ + + ), держатся выводки кулик-сорока ( 4- 4- 4-),
галстучник (+ + + )
Гнездится галстучник ( + )
Гнездится кулик-сорока (+ + )
Гнездится кулик-сорока ( + )
Гнездится гага (+ + + ) (только на Северном архипе-
лаге)
Гнездится гага ( + ) (только на Северном архипелаге)
Кормятся: сизая чайка (4-4-4-), серебристая чайка
(+ + ), кулик-сорока (4- 4- 4-), галстучник ( 4- 4- 4-),
камнешарка ( 4- 4- 4-), держатся выводки: кулик-со-
рока (4-4-), галстучник (4-4-4-), камнешарка
( 4- 4- 4-)
Кормятся пролетные гуменники (4-4-)
Гнездятся: галстучник (4-4-), серебристая чайка (4-)
Гнездятся: кулик-сорока ( 4- 4- 4-), чистик (4-) (в пу-
стотах между камнями), серебристая чайка (4-)
Гнездятся: гага (4-4-4-), кулик-сорока (4-), камне-
шарка (4-), сиздя чайка (4- 4- 4-), серебристая чай-
ка (4-), полярная крачка (4-)
Гнездятся: гага (4-), чистик (4-)
Гнездятся: сизая чайка (4-4-), камнешарка (4-), гага
(4- 4-), полярная крачка (4-), кормятся- сизая чайка
(4- 4- 4-), серебристая чайка ( 4- 4- 4- ), гуменники на
пролете (4- 4- 4-)
168
Тип острова и частота его встречаемости Грунт Экотоп и его доля в островном ландшафте
Остров ( + + + ) Рыхлые отложения со скальными выходами Приморские скалы ( + ) Литораль (+ + )
Приморский луг низкого и среднего уровня ( + + ) Пляж песчаный ( + ) Пляж валунный ( + + ) Завалы плавника (4~) Приморский луг высокого уровня (+) Приморские скалы (+) Ельник ( + + + ) Сосняк ( + + + ) Болото, чаще верховое или переходное ( + ) Озера ( + )
Вороничник (на наволо- ках) ( + )
Таблица 39 (продолжение)
Характер пребывания основных водоплавающих птиц,
предпочтительность и интенсивность использования ими
экотопов
Гнездятся: серебристая чайка ( + ), гага (4-), камне-
шарка (-|-)
Кормятся: кулик-сорока (4-4-4-), сизая чайка
(4- 4- 4-), серебристая чайка (4- 4-); держатся вы-
водки: кулик-сорока (+ + + ), галстучник (4- 4- 4-)
Гнездятся: галстучник (+), кулик-сорока (++)
Гнездится кулик-сорока (4-4-)
Гнездятся: гага (+).
Гнездятся: гага ( + ), кулик-сорока (+ + )
Гнездится гага (+)
Гнездится гага (-Г + Ч-) (только на Северном архипе-
лаге)
Гнездится гага ( + ) (только на Северном архипелаге)
Гнездятся- большой улит ( + + + ), фифи (+ + + )
Гнездятся на берегах, кормятся в зарослях водной расти-
тельности, держатся выводки речных уток, гоголя,
длинноносого крохаля; линяет гоголь
Гнездятся- гага (+ + + ), сизая чайка (4- 4-), полярная
крачка (4-), камнешарка (4-4-); кормятся: сизая
чайка (4-4-), серебристая чайка (4-4-), гуменники
на пролете (4- 4-)
Таблица 40
to
S
3
Бреслина 169
Классификационная схема островных ландшафтов
Бережные острова
Тип острова и частота его встречаемости Грунт Экотоп и его доля в островном ландшафте Характер пребывания основных водоплавающих птиц, предпочтительность и интенсивность использования ими экотопов
Корга ( + + + ) Скальный Литораль (4- + 4-) Отдыхают: серебристая чайка (4-+ 4-)’, сизая чай- ка (+), кулик-сорока (4- 4- 4-), гага (4- 4- 4-), мор- ские кулики на пролете (4- 4- 4-)
Корга ( + ) Рыхлые отложения Литораль (4- 4- 4-) Кормятся- серебристая чайка (4-4-4-), сизая чай- ка ( 4- 4- 4-), кулик-сорока (4- 4- 4- )
Камень ( + + +) Скальный Литораль (4- ) Скала, лишенная раститель- ности (4- 4- 4- ) Отдыхают, серебристая чайка (4-4-4-), сизая чай- ка (4-), кулик-сорока (4-), морские кулики на про- лете ( 4- 4- 4- ), гага (?)
Лудушка (4-) Рыхлые отложения Литораль (4- 4- 4-) Пляж песчаный или галеч- никовый (4-) Пляж валунный (4-) Приморский луг высокого уровня (4- + 4- ) Кормятся- серебристая чайка (4-4-4-), сизая чай- ка (4- 4- 4-), кулик-сорока (4- 4- 4-), камнешар- ка (4- 4- 4-), галстучник (4- 4- 4-); держатся вывод- ки- кулик-сорока (4-4-4-), камнешарка (4-4-4-), галстучник (4- 4- + ) Гнездятся галстучник (4-), кулик-сорока (4-4-) Гнездятся: кулик-сорока (4- 4-), чистик (4- 4- ) (в ка- менных норах) Гнездятся: гага (4-4-4-), полярная крачка (4-4-4-), сизая чайка (+ + +), кулик-сорока (4- 4- 4-), камне- шарка (4- 4- 4-)
Баклыш (4- 4- 4-) Скальный Литораль (4-) Приморские скалы ( 4- 4- 4-) Отдыхают морские кулики на пролете (+4-4-) Гнездятся: серебристая чайка (+ + +), полярная крачка (+), гага (+ + )
о
Тип острова и частота его встречаемости Грунт Экотоп и его доля в островном ландшафте
Лудка (+) Рыхлые отложения Литораль ( + + +) Пляж песчаный или галеч- никовый ( +) Пляж валунный ( + ) Завалы плавника ( + ) Приморский луг высокого уровня (+ + + ) Литораль ( +)
Лудка (+) Скальный, возможны рыхлые отложения по берегам Приморские скалы (+) Вороничник ( + + +)
Луда (+ + +) • Скальный с рыхлыми от- ложениями (преиму- щественно в пониже- ниях и по склону) Литораль ( + +) Фрагменты приморского луга низкого и среднего уровня ( + ) Пляж песчаный или галеч- никовый ( + ) Пляж валунный ( + ) Завалы плавника ( + )
Таблица 40 (продолжение)
Характер пребывания основных водоплавающих птиц,
предпочтительность и интенсивность использования ими
экотопов
Кормятся: серебристая чайка (+ + + ), сизая чай-
ка (+ + +), кулик-сорока (+ + + ), камнешар-
ка (+ + +); держатся выводки: кулик-сорока (+ + ),
камнешарка (+ + +)
Гнездится кулик-сорока (++)
Гнездится чистик (+4-4-)
Гнездятся: гага ( + ), чистик (+ + +)
Гнездятся: гага (+ + +), кулик-сорока (+ + +), кам-
нешарка (+ + ), сизая чайка (+ + + ), полярная
крачка ( + +)
Гнездятся: серебристая чайка (+ + +), гага (+ + + ),
чистик ( + )
Гнездятся: гага (+ +), сизая чайка (+ + + ), серебри-
стая чайка ( + ) полярная крачка (+ + ), камне-
шарка ( + + +)
Кормятся: серебристая чайка (+ + + ), сизая чай-
ка (+ + +), кулик-сорока (+ + + ), камнешар-
ка (+ + +); держатся выводки: кулик-сорока
( + + +), камнешарка (+ + +)
Кормятся пролетные гуменники (++)
Гнездится кулик-сорока ( + + )
Гнездятся: кулик-сорока ( + ), чистик (+ + + )
Гнездятся: гага ( + ), чистик (+ + +)
Остров (4- 4-)
Скальный, с рыхлыми от-
ложениями по склонам
и в понижениях
Приморский луг высокого
уровня (4-)
Приморские скалы (4-4-)
Вороничник с единичными,
ветровой формы деревь-
ями (4-4-4-)
Фрагменты леса (березняк,
ельник) (4-)
Литораль (4- 4-)
Фрагменты приморского
луга низкого и среднего
уровня (4-)
Пляж песчаный или галеч-
никовый (4-)
Пляж валунный (4-)
Завалы плавника (4-)
Приморский луг высокого
уровня (4-)
Приморские скалы (4-4-)
Вороничник с единичными,
ветровой формы деревь-
ми (4- 4-)
Скалистая «тундра» («лесо-
тундра») (4-4-)
Лес:
березняк (4- 4- 4-)
ельник (4- 4- 4-)
сосняк (4-4-4-) (чаще
сосняк вороничный)
Болота (4-)
Озера (4-)
Гнездятся: гага (4- 4- +), кулик-сорока (4- 4- 4-), кам-
нешарка (4- 4-), сизая чайка (4- 4-), полярная крач-
ка ( + )
Гнездятся: серебристая чайка (4- 4-), гага (4- 4-)
Гнездятся: гага (4-4-4-), сизая чайка (4-4-), кор-
мятся пролетные гуменники (4-4-4-)
Гнездится гага (4-)
Кормятся: серебристая чайка (4-4-4-), сизая чайка
( 4- 4- 4-), кулик-сорока (4- 4- 4-), камнешарка
(4- 4- 4-); держатся выводки: кулик-сорока (4- 4- 4-),
камнешарка (4- 4- 4-)
Кормятся пролетные гуменники (4-4-)
Гнездится кулик-сорока (4-)
Гнездится чистик (4-)
Гнездятся: гага (4-4-), кулик-сорока (4-4-), камне-
шарка (4-), сизая чайка (4-)
Гнездятся: серебристая чайка (4-), гага (4-4-)
Гнездятся: гага (4-4-), сизая чайка (4-), полярная
крачка (4-), камнешарка (4-)
Гнездятся: большой улит (4-4-), фифи (4-4-)
Гнездятся на берегах, в зарослях водной раститель-
ности кормятся речные утки, там же держатся их
выводки (4-), линяет гоголь (4-4-4-)
Таблица 41
172
Классификационная схема островных ландшафтов
Голоменные острова
Тип острова и частота его встречаемости Г рунт Экотоп и его доля в ост- ровном ландшафте Характер пребывания основных водоплавающих птиц, предпочтительность и интенсивность использования ими экотопов
Корга ( + + + ) Скальный Литораль ( + + + ) Отдыхают, серебристая чайка (+ + + ), большой баклан (+), пролетные морские кулики (+ + + )
Корга (только в ар- хипелаге Рого- вые луды) ( + ) Рыхлые отложения Литораль (+ + + ) Отдыхают пролетные гуменники, пролетные кулики
Камень ( + + + ) Скальный Литораль ( +) Скалы, лишенные раститель- ности (+ + + ) Отдыхают: серебристая чайка (+ + + ), большой баклан (+ )
Баклыш (+ + +) Скальный Литораль (+ ) Приморские скалы (+ + + ) Россыпь камней — результат выветривания скальной поро- ды (+ ) Гнездятся: серебристая чайка (+ + + ), большой баклан (+), полярная крачка (+ + ), гага (+ + ) Гнездятся: гагарка (+ + + ), чистик (+ + + )
Лудка (+ + + ) Скальный, иногда с круп- новалунными отложе- ниями у подножия или в виде косы Литораль ( +) Приморские скалы ( + +) Крупновалунный пляж ( + ) Вороничник ( + + + ) Гнездятся: серебристая чайка (+ + + ), гага (+ + + ), полярная крачка ( + ) Гнездятся: серебристая чайка (+), чистик (+ + + ), гага (+) Гнездятся. серебристая чайка (+ ),гага (+ + ), по- лярная крачка (+)
Лудка (только Ро- говая луда) ( +) Рыхлые отложения Литораль (+ +) Отдыхают- пролетные гуменники (+ + + ), пролет- ные кулики (+ + +)» кормятся пролетные кули- ки ( + + + )
Таблица 41 (продолжение)
Тип острова и частота его встречаемости Грунт Экотоп и его доля в ост- ровном ландшафте Характер пребывания основных водоплавающих птиц, предпочтительность и интенсивность использования ими экотопов
Луда (4—F 4-) Скальный, в понижениях рельефа и по склонам возможен слой рыхлых отложений Приморский луг высокого уров- ня (заросль колосняка) (+ +) Вороничник (4- 4- 4- ) Литораль (4- ) Крупновалунный пляж (4-) Приморские скалы (4- + ) Заросль колосняка и примор- ского крупнотравья (4-) Вороничник (4-4-4-) Тундровые болота (4-) Фрагменты леса (4-) Гнездится гага (4-4-4-) Гнездится гага (4- 4- 4-) Гнездится чистик ( 4- 4- 4-) Гнездятся: серебристая чайка (4-+ 4-), гага (4-4-4-), полярная крачка (4-) Гнездится гага (4-4-4-) Гнездятся: гага (4- + ), серебристая чайка (4- + ), сизая чайка (4-) Гнездится гага ( + )
173
Таблица 42
Классификационная схема островных ландшафтов
Крупный, материкового типа остров
Тип острова и частота его встречаемости Грунт Экотопы и их доля в ост- ровном ландшафте Характер пребывания основных водоплавающих птиц, предпочтительное^ и интенсивность использования экотопов
О-в Великий Рыхлые отложения, ме- стами со скальными выходами Литораль (4- +) Приморский луг низкого и сред- него уровня (4-) Пляж песчаный или галечнико- вый (4-) Завалы плавника (4-) Приморский луг высокого уров- НЯ (+) Кормятся: серебристая чайка (+4-), сизая чайка (4-4-4-), кулик-сорока , камнешарка (4-4-4-), галстучник (4-^_|_); держатся вывод- ки: кулик-сорока (+ 4- 4-), камнешарка (4-4-4-), галстучник (4- 4- 4-) Кормятся пролетные гуменцИКи (+4-) Гнездятся: галстучник (4-), кулик-сорока (4-4-) Гнездятся: кулик-сорока (s + +) камнешарка ( + )
Приморские скалы (+) Лес — ельник и сосняк различ- ных типов (4- 4- 4-) Болота различных типов (4- 4-) Озера (4- 4-) Скалистая «тундра» (4-) Вороничник (на наволоках) ( + ) Гнездятся: большой улит, фифи, речные утки; кор- мятся: большой улит, фифи, речные утки в озеро- образных мочажинах среди ’зарослей водной растительности; там же Держатся их выводки Гнездятся на берегах, корм^тся в зарослях водной растительности, держатс^ выводки речных уток, гоголя, длинноносого крохаля; линяет гоголь Гнездится камнешарка (4- ); кормятся пролетные гуменники ( 4- 4- 4-)
ЛАНДШАФТЫ ОСТРОВОВ МУРМАНА
Принцип удаленности острова от материкового берега, его
возраст и величина и, как следствие этого, набор и сочетание
его экотопов целесообразно положить в основу любой ландшафт-
ной классификации островов. Применим он и для островов Мур-
мана. Однако знакомство с очень ограниченным числом этих
островов, а отсюда и недостаточность фактического материала
не позволили нам составить классификационную схему ландшаф-
тов по изложенному принципу.
Отказавшись от их классификации, остановимся все же на
основных моментах их ландшафтной характеристики.
На Мурмане, так же как и в Кандалакшском заливе, располо-
женный на сухом приморском торфе вороничник — типичный и
очень своеобразный островной экотоп. На материке он практи-
чески отсутствует, фрагментарно встречаясь лишь по побережью,
в непосредственной близости от моря (Бреслина, 1969). Воронич-
ник определяет лицо большинства Мурманских островов (если там
нет непомерно больших птичьих колоний).
Набор основных экотопов островов Восточного Мурмана в по-
рядке усложненности их ландшафтов следующий: скальная лито-
раль; приморские скалы, крутые северные склоны которых могут
быть заняты птичьими базарами; вороничники склонов и плато
с прорезающими их щелевыми лощинами (при сильном орнитоло-
гическом воздействии облик тех и других резко видоизменяется) ;
западины рельефа с осоково-морошковыми вороничниками, иногда
с нечетко выраженными болотами; озера; ручьи. Большая числен-
ность гнездящихся на островах птиц накладывает очень сильный
отпечаток на облик и структуру ландшафтов островов Восточного
Мурмана. Свойственные материковому побережью преоблада-
ющие экотопы — воронично-лишайниковые и кустарничковые
тундры — присущи островам только значительных размеров. Эта
тенденция здесь проявляется так же, как и в Кандалакшском
заливе, только на Восточном Мурмане она начинает действовать
при гораздо больших размерах его островов. Так, на достаточно
крупном о-ве Харлов (393 га) имеются лишь небольшие фраг-
менты экотопов, близкие материковым воронично-лишайниковым
кустарничковым тундрам.
Экотопы ландшафтов Айновых островов: скалистая или каме-
нистая литораль; крупнотравный луг; колосниковый кочкарник;
болота всех типов, сильно видоизмененные интенсивным орнитоло-
гическим воздействием; ивняки; озера; бывшие вороничники, ра-
стительность которых исключительно сильно видоизменена на
вторичную орнитогенную; папоротниковые морошечники.
Ландшафтам островов Кольской Субарктики свойственна опре-
деленная закономерность в сочетании экотопов в зависимости
от величины острова, его происхождения, удаленности от матери-
кового берега и, как следствие этого, от степени суровости
климатических условий. Заселенность этих экотопов водоплава-
175
ющими птицами зависит, во-первых, от кормности прилегающих
морских участков, во-вторых, от соответствия характера этих
экотопов гнездовым привычкам и гнездовому поведению птиц
(при резком увеличении численности птицы, однако, вынуждены
занимать и малоудобные для них экотопы), а также, в-третьих,
от того, насколько те или иные конкретные участки традиционны
для микропопуляции (птичьими базарами, к примеру, заняты
отнюдь не любые крутые склоны).
Островные экотопы Кольской Субарктики сформировались при
участии морских колониальных птиц, и нередко птицы опреде-
ляют их особенности и их физиономию.
176
Глава 6
РОЛЬ МОРСКИХ колониальных птиц
В СТАНОВЛЕНИИ ФЛОРЫ И РАСТИТЕЛЬНОСТИ
МЕЛКИХ ОСТРОВОВ КОЛЬСКОЙ СУБАРКТИКИ
Флора и растительность островов Кольской Субарктики сфор-
мировалась в процессе их поднятия. Морские колониальное птицы,
гнездящиеся на островах, во многом способствовали их становле-
нию (Бреслина, 1969, 1978, 1980, 1981). На огромную роль
гнездящихся и мигрирующих морских и прибрежных птиц в форми-
ровании флоры и растительного покрова морских островов запад-
ной Эстонии указывает Х.-Э. Ребассо (1972; Rebassoo, 1973).
Зоолог А. И. Гизенко (1955) также считает, что развитие расти-
тельного покрова островов Дальнего Востока непосредственно
связано с деятельностью колониальных птиц. Кроме того, он
соотносит богатство фауны морских колониальных птиц отдель-
ных островов с их возрастом, геоморфологией, растительностью
и историей их развития.
Поскольку процесс «рождения» и «роста» наших островов
продолжается и поныне, его можно проследить в пространстве
и с некоторой долей смелости интерполировать во времени.
Благодаря тектоническому поднятию суши обнажающиеся в от-
лив скальные от-мели — корги со временем превращаются в мель-
чайшие островки — «камни». В первый период своего существова-
ния они полностью находятся во власти прибойных волн, а на
Белом море и льдов, напирающих в зимне-осеннее время. Все это
не дает возможности высшим растениям закрепиться здесь.
Первыми по скальным трещинам на подобных островках посе-
ляются виды рода Puccinellia. Скорее всего, их семена попадают
сюда морским путем и во время больших штормов забрасываются
в скальные трещины выше зоны регулярного штормового волно-
боя, где и прорастают. Менее вероятен занос их семян на подобные
островки морскими колониальными птицами: на «камнях» они
еще не гнездятся (из-за возможной опасности смыва гнезд при
шторме), а только отдыхают. Однако не исключен и случайный
занос их семян на лапах или же с погадками. Несомненно,
что сюда тем же морским путем попадают семена многих других
растений, прежде всего галофитов, но они пока не могут закре-
питься здесь, в условиях периодического штормового волнобоя.
Голый баклыш из архипелага Средние луды, лежащего в центре
Кандалакшскогозалива, — пример такого «камня». Это небольшой
скальный купол (около 40 м в диаметре, высотой 2.5 м). Во время
штормов он полностью омывается морем. По этой причине здесь
не гнездятся птицы. Его растительность представлена единствен-
177
ным видом и единственной дерновинкой бескильницы подушковид-
ной, укорененной в скальной трещине. Голый баклыш, как и другие
подобные «камни», очень удобен как «клуб», по терминологии
орнитологов, — место постоянного отдыха морских птиц.
На этой возрастной стадии скального острова, на стадии
«камня», птичий помет, довольно часто смываясь штормовыми
волнами, еще мало способствует усиленному росту Puccinellia spp.
И еще не раз шторма и льды уничтожают ее дерновины.
Со столетиями островок «растет», и летние штормовые волны
все реже достигают его вершины. Это случается теперь преиму-
щественно во время сильных осенне-зимних штормов. На баклыше
появляются реальные условия для гнездования морских птиц,
и на нем возникает колония крупных чаек. С гнездовым мате-
риалом они и приносят зачатки будущей флоры. Он состоит
в основном из растений, свойственных прежде всего приморским
скалам и вороничникам — обычным местам обитания крупных
чаек. Вместе со стеблями неизбежно попадают неопавшие прошло-
годние семена, a Sedum acre в Кандалакшском заливе чайки
приносят живым, и он способен здесь же укореняться во вновь
построенном гнезде. Однако чайки приносят не только прошло-
годний гнездовой материал по весне, но и живые растения при
осеннем ложном гнездовании (Бреслина, 1969). Во второй поло-
вине июля—начале августа, когда подросшие птенцы уже подни-
маются на крыло, в гнезда, сооруженные еще весной, оказы-
ваются вновь наношены живые листья и стебли видов родов
Cochlearia, Rhodiola, Matricaria hookeri, стебельки злаков со спо-
собными дозреть в стадии восковой спелости семенами. Это
осеннее ложное гнездование удалось наблюдать как на Восточном
Мурмане, так и в Кандалакшском заливе. При этом надо особо
подчеркнуть, что это обнаружено на мельчайших островах, кото-
рые не имеют или почти не имеют своей растительности. Так,
на Большом Харловском баклыше (Семь Островов), в скальных
трещинах которого растут лишь два экземпляра Puccinellia соаг-
ctata и один экземпляр Cochlearia officinalis, а весь раститель-
ный материал может быть принесен только с близлежащих островов,
с расстояния 1 —1.5 км, гнезда были сооружены из Cochlearia
officinalis, Matricaria hookeri, Puccinellia coarctata, Festuca rubra
ssp. arctica, Rhodiola arctica, Empetrum hermaphroditum, Rubus
chamaemorus, а также из мхов и лишайников. Занос зачатков
с погадками — еще один важный путь распространения растений
на острова. Так, в период созревания ягод Empetrum hermaphro-
ditum, Rubus chamaemorus погадки с их семенами находят пов-
сюду, в том числе и на мельчайших островах — «баклышах»,
лишенных или практически лишенных растительности. Семена дру-
гих ягодных — Vaccinium myrtillus, V. uliginosum, V. vitis-idaea,
Chamaepericlymenum suecicum, хоть и в несравненно меньшем
количестве, разносятся тем же путем.
Однако не все зачатки, попавшие на баклыш, закрепятся
здесь. Если они и прорастут, то далеко не все окажутся жизнеспо-
178
собными. Это зависит от способности растений укореняться в тре-
щинах приморских скал или же на гнездовом материале, от их
выносливости к обрызгиванию и окатыванию соленой морской
водой и от их терпимости к слишком богатому, благодаря помету
птиц, субстрату. Именно поэтому на многих баклышах, время от
времени обрызгиваемых при сильных штормах, не растут или
почти не растут самые обычные наши приморские растения —
Rhodiola, Empetrum hermaphroditum, в Кандалакшском заливе
Sedum acre. Все они плохо выносят непосредственное обрызги-
вание.
На мельчайших скалистых островках — баклышах налицо две
противоположные тенденции: 1) натурализация привнесенных
видов и образование первичного орнитогенного почвенно-расти-
тельного покрова и 2) уничтожение уже сформировавшейся фраг-
ментарной скальной почвы и растительности редкими, но особо
сильными штормами, а следовательно, и исчезновение ряда видов
из флоры этих островов. Поэтому и их флористические списки
очень ограничены (чаще всего менее 20 видов).
Пример тому — Бакланий и Нелепый баклыши из архипелага
Средние луды (Кандалакшский залив), о-в Яичный из района
Семи Островов. Их флора и растительность находятся в стадии
становления.
В архипелаге Средние луды на Нелепом баклыше найдено
12 видов, на Бакланьем — 13; 9 видов найдено на обоих островах
(табл. 43), 8 из них — облигатные галофиты и один — Rumex
pseudonatronatus — факультативный галофит. Все они орнито-
филы. Это свойственно флорам именно таких баклышей. Из
табл. 43 видно, что размер острова сильно сказывается на богат-
стве его флоры. Формирование же островной флоры всегда начи-
нается с поселения галофитов, одновременно являющихся и орни-
тофилами. Так, в Семиостровье на трех баклышах (Большой Хар-
ловский баклыш, Высокая луда, Плоская луда) отмечены только
Puccinellia coarctata и Cochlearia officinalis, на Ромашковой
луде — Puccinellia coarctata, Festuca rubra ssp. arctica, Cochlearia
groenlandica, Matricaria hookeri. Морской путь заноса их зачатков,
конечно, не исключен, но в массе они попали на баклыш с гнездо-
вым материалом.
Во флоре Нелепого и Бакланьего баклышей нет ни одного вида,
отсутствующего на соседней с ними Большой Средней луде.1
Способствовало этому географическое положение Большой Сред-
ней луды — это ближайшая суша для колониальных птиц, и от-
туда поступал и продолжает поступать растительный гнездовой
материал, а с ним и зачатки. По-видимому, в условиях откры-
того моря, обрызгивания, а иногда и окатывания некоторые виды
растений лишь недавно начали поселяться на Бакланьем и Неле-
1 Флористический список архипелага Средние луды с указанием экологии
каждого вида опубликован ранее (Бреслина, 1980).
179
Таблица 43
Виды, общие для островов архипелага Средние луды
Вид Большая Средняя луда (6 га) Нелепый баклыш (0 4 га) Бакланий баклыш (1 га) Голый баклыш (0 15 га)
Agrostis straminea + + + —
Puccinellia capillaris + + + —
P coarctata + + + —
P pulvinata + + + +
Rumex pseudonatronatus + + + —
Atriplex nudicaulis + + +
Cerastium holosteoides + — + —
Cochlearia arctica + + + —
Rhodiola rosea + + — —
Sedum acre + + — —
Empetrum hermaphroditum + — + —
Ligusticum scoticum + + — —
Plantago maritima + — + —
Tripoli и m vulgare + + + —
Matricaria hookeri + + + —
Crepis nigrescens + — + —
Всего 65 12 13 1
Примечание Знак «4-» означает встречаемость вида, знак « —» его отсутствие
пом баклышах. Так, на Нелепом баклыше есть только одно очень
небольшое пятно Sedum acre, a Rhodiola rosea представлена там
всего несколькими экземплярами. На Бакланьем баклыше обитал
Sedum агсе, а один-единственный экземпляр Rhodiola rosea на-
ходился вблизи колонии бакланов и погиб от обилия помета.
При расширении этой колонии остались только мертвые каудексы
этого вида. На Бакланьем баклыше, в центре его, в небольшой
трещине, заполненной орнитогенной торфянистой массой, укоре-
нился единственный экземпляр Empetrum hermaphroditum. Ве-
точки ее длиной до 60 см стелются строго вдоль этой трещины
и укореняются среди небольших дерновин Matricaria hookeri.
На Нелепом баклыше Empetrum hermaphroditum нет. Но семена
ее в изобилии вместе с погадками попадают на эти баклыши.
Однако, чтобы им прорасти и закрепиться, нужны определенные
условия. Empetrum hermaphroditum очень чувствительна к слиш-
ком богатому субстрату, и не исключено, что и на Бакланьем
баклыше она погибнет при увеличении численности гнездящихся
здесь птиц. В дальнейшем ее семена где-нибудь смогут прорасти,
со временем же она снова погибнет, и так неоднократно. Но рано
или поздно с «ростом» острова и, как следствие этого, с уменьше-
нием плотности гнездящихся птиц она все же окончательно
закрепится.
180
На о-ве Яичном, площадь которого около полутора гектаров,
зарегистрировано 14 видов: Catabrosa aquatica, Puccinellia coar-
ctata, Festuca rubra (в том числе F. r. ssp. arctica), Salix arctica,
Montia fontana, Stellaria humifusa, Ranunculus hyperboreus, Co-
chlearia officinalis, Saxifraga cernua, Rhodiola arctica, Potentilla
egedii, Ligusticum scoticum, Angelica archangelica, Matricaria
hookeri. Примечательно, что и здесь отсутствует Empetrum herma-
phroditum — самый обычный вид «зрелых», со сформировавшейся
флорой островов Кольской Субарктики. Подавляющее большин-
ство видов флоры о-ва Яичного — все, кроме Catabrosa aquatica,
входит в ядро флоры Семи Островов (Бреслина, 1969). Они свой-
ственны всем или почти всем островам Семиостровского архипе-
лага и, по-видимому, отражают раннюю фазу становления остров-
ных флор Восточного Мурмана.
Почва и растительность подобных островков-баклышей цели-
ком сформировались под влиянием гнездящихся на них морских
птиц. Здесь преобладают преимущественно лентообразные, фраг-
ментарные, скальные первичные орнитогенные ценозы. Здесь как
раз имеет место специфичный для островов биологический фактор
почвообразования (Торгульян, 1978), возникший в связи с особен-
ностями биоты отдельных островов.
На некоторых баклышах (Сиротка — Кандалакшский залив,
близ о-ва Торосиха; о-в Яичный — Семиостровье) прослеживается
процесс смыкания лентообразных дерновин и образования отно-
сительно сплошного, первичного орнитогенного растительного по-
крова. В связи с этим заметно расширяется экологический диапа-
зон для закрепления во флоре баклышей большего числа видов.
С дальнейшим поднятием баклыша серебристые чайки пере-
стают гнездиться на участках сплошного сомкнутого (первичного
орнитогенного) растительного покрова. Они занимают соседние,
более молодые участки приморских скал, поскольку при стабиль-
ной их популяции они все же предпочитают для гнездования
приморские скалы. На участках сомкнутой растительности это
приводит к постепенному обеднению субстрата, поселению Empet-
rum hermaphroditum и выпадению из растительного покрова
орнитофильных растений. Со временем здесь формируются воро-
ничники. Таковы в Кандалакшском заливе достаточно крупные
голоменные острова, «луды» — Большая Средняя луда, Столбовые
луды, Воротиха, Наумиха, Голые луды, Песчанка; таковы на
Восточном Мурмане острова Семиостровского архипелага, о-в
Большой Гавриловский, острова, лежащие у входа в Дальнезеле-
нецкую бухту. Вторичная же орнитогенная растительность, местами
занимающая торфяники этих островов, — это результат уже более
поздних «всплесков» роста численности морских птиц.
В. С. Гунова и Р. М. Лебедева (1969) на основании данных
спорово-пыльцевого анализа пришли к выводу, что становление
растительного покрова на Семи Островах в начале атланти-
ческого периода началось с зарослей Cochlearia — растения
с сильно выраженными орнитофильными свойствами. Не исклю-
181
чено, что основная растительность островов в своем развитии
прошла орнитогенную стадию. В районе Семи и Гавриловских
островов крупные поселения морских птиц, скорее всего, суще-
ствовали в далеком прошлом, до возникновения растительного
покрова. В. М. Сдобников (1965), говоря о возможном богат-
стве фауны птиц в эпоху максимального оледенения, приводит
в пример орнитофауну и птичьи базары Гренландии, где по сей
день продолжается оледенение. Это подтверждает и существова-
ние огромных колоний птиц в Антарктике (Земский, 1960).
Однако нельзя преувеличивать роль птиц в становлении остров-
ной флоры и растительности. Так, в Кандалакшском заливе этот
процесс на сложенных рыхлыми отложениями островках менее
зависит от деятельности гнездящихся на них морских птиц.
Поселение первых растений здесь совсем не связано с заносом
зачатков птицами. Они попадают сюда морским путем, часто со
штормовыми выбросами, и представлены приморскими галофи-
тами. С «ростом» такого острова, «лудушки», расширяется эколо-
гический диапазон возможностей закрепления в его флоре новых
видов в зависимости от степени и продолжительности воздействия
морской воды.
После того как в процессе подъема лудушки возникнут за-
росли Alopecurus arundinaceus, Leymus arenarius и начнет фор-
мироваться растительность, свойственная приморским лугам вы-
сокого уровня, на ней появляются колонии полярных крачек
и сизых чаек. Полярные крачки, как уже отмечалось выше,
не оказывают заметного влияния на растительный покров. Под
влиянием же помета загнездившихся сизых чаек луговая расти-
тельность растет более мощно и у нее формируется густой высо-
кий травостой. По-видимому, это способствует более быстрому
накоплению верхнего торфообразного слоя.
Смываясь дождем, птичий помет просачивается и в глубь рых-
лых отложений. Если эти отложения каменисты, то процесс обра-
зования орнитогенного торфянистого слоя происходит не на днев-
ной поверхности, как на приморских скалах, а в пустотах между
камней. Это, по-видимому, происходит как за счет отмирания
корней, так и за счет поступления остатков отмершей растительной
массы .в промежутки между камнями. Только после этого торф
начинает накапливаться на дневной поверхности. Все это приводит
к сильному разрастанию злаков. Образуется дернина, что также
усиливает процесс торфонакопления.
Ослабление степени воздействия сизых чаек на растительность
лудушки приводит к внедрению в луговой травостой Empetrum
hermaphroditum и ее разрастанию. Со временем приморский воро-
ничник сменяет луговую растительность.
Изложенная схема влияния птиц на становление растительно-
сти мельчайших, сложенных рыхлыми отложениями островков,
к сожалению, недостаточно подкреплена цифровым исследователь-
ским материалом. В ней, однако, обобщены многолетние визуаль-
ные наблюдения.
182
ЗАКЛЮЧЕНИЕ
1. Морские острова Кольской Субарктики расположены в Ба-
ренцевом и Белом морях. Острова Мурмана безлесны в силу
географического положения. Острова Кандалакшского залива
расположены в подзоне северной тайги. Однако и здесь наряду
с лесистыми не защищенные от ветров острова безлесны.
Безлесные острова характеризуются рядом общих черт. Возвы-
шенные, удаленные от берега моря участки покрыты сплошным
слоем сухого торфа различной мощности, обязанного своим
происхождением «фактору океаничности». Его основная раститель-
ность — вороничник в различных модификациях — особая при-
морская экстразональная тундрообразная растительность, близкая
верещатникам Атлантики. Понижения рельефа достаточно круп-
ных островов заняты различными болотами. Особенно изобилует
болотами о-в Большой Айнов. Береговые склоны островов нередко
круты, а то и обрывисты и большей частью лишены сомкнутого
растительного покрова. Для многих островов Кандалакшского
залива обычны приморские луга, полосой опоясывающие пологие
участки их берегов. Для Айновых островов характерно: 1) наличие
весьма своеобразного колосникового кочкарника, являющего
собой совокупность близкорасположенных высоких и крутых тор-
фяных кочек, образованных Leymus arenarius-, 2) наличие крупно-
травных лугов из крупных зонтичных, полукольцом опоясывающих
о-в Большой Айнов. На островах, если они надлежащим образом
охраняются, находятся колонии морских птиц, из которых наибо-
лее многочисленны моевка, серебристая, большая морская и сизая
чайка, длинноклювая и короткоклювая кайра, тупик, обыкновен-
ная гага, полярная крачка.
2. Виды употребляемых водоплавающими и морскими птицами
растений подразделены на ремизные, гнездостроительные и кормо-
вые растения. Ремизные растения используются птицами как укры-
тия — при гнездовании или для затаивания птенцов. Гнездостро-
ительные растения служат материалом для постройки гнезд.
Кормовые растения употребляются птицами в качестве основного,
сезонного или попутного корма.
3. Большинство обыкновенных гаг Кандалакшского залива
гнездится на лесных островах Северного архипелага, преимущест-
венно в ельниках под еловыми кронами. В других архипелагах
Кандалакшского залива они гнездятся предпочтительно на безлес-
183
ных островах и избегают лесистых, предпочитая всевозможные
укрытия (полуукрытия) растительного, геологического или же
антропогенного происхождения. На Кемь-Лудском архипелаге
растительные укрытия использует только одна треть его гаг.
Пятая часть гаг архипелага гнездится вне укрытий, используя
маскировочный эффект окружающей растительности и неровнос-
тей микрорельефа. На островах Восточного Мурмана гага наибо-
лее предпочитает укрытия геологического происхождения. Расти-
тельные укрытия используются ею в значительно меньшей, чем
в Кандалакшском заливе, степени. На Айновых островах (Запад-
ный Мурман) гага наиболее плотно заселяет ивняки и колосни-
ковые кочкарники. Растительные компоненты гнезда гаги берутся
ею с непосредственно окружающих его растений.
В Кандалакшском заливе другие пластинчатоклювые гнездятся
в различных островных экотопах: большинство видов в основном
на приморских лугах и на участках с вороничной тундрообразной
растительностью, соответственно требованиям их экологии. Гу-
менники в районе Кандалакшского залива не гнездятся. На про-
лете они держатся на вороничнике, на приморских лугах и болотах.
Кайры длинноклювая и короткоклювая — одни из наиболее
многочисленных птиц Мурмана. Гнездится кайра только колони-
ально, образуя так называемые птичьи базары на крутых обрывис-
тых скалах. В местах непосредственного скопления кайр отсутст-
вует всякая высшая растительность. Кайры не нуждаются ни в ее
окружении, ни в каком-либо ее использовании. Гнезда они не вьют,
и всякий намек на гнездо у них отсутствует.
Гагарка гнездится мелкими группами или же обособленно
в каком-нибудь неглубоком нишеобразном углублении. Она так же,
как и кайра, не делает никакого гнезда и ни коим образом не зави-
сит от растительности мест своего гнездования и не использует ее.
Атлантический чистик предпочитает гнездиться в каменных
норах. Нередко он использует пустоты, обычные в завалах плавни-
ка. Его гнездо практически лишено всякой подстилки из расти-
тельного материала.
Тупик обитает колониями только на островах Мурмана в норах,
вырытых им в мощных слоях торфа. Его гнездовая подстилка —
это сухая трава из произрастающих на территории колонии расте-
ний.
Моевка занимает отвесные скалы птичьих базаров Мурмана,
прикрепляя свое гнездо на мельчайших выступах вертикальной
стены. Она вьет гнездо из произрастающей вблизи базаров травы,
в основном из злаков.
Серебристая чайка на островах Восточного Мурмана предпо-
читает гнездиться на приморских скалах и в вороничнике. При
небольшой численности ее гнездования — предпочтительно на
всевозможных повышениях микрорельефа или же на куполо-
образных выходах скальной породы, а при росте численности
и увеличении плотности гнездования ее колонии местами занимают
весь вороничник.
184
На Айновых островах серебристые чайки гнездятся преиму-
щественно в колосниковых кочкарниках, а также на болотах, где
они занимают не только торфяные бугры, но и переувлажненные
болотистые пространства и понижения между буграми. В Канда-
лакшском заливе они любят устраивать свои гнезда на возвышен-
ных местах: в скалах, на вороничниках, реже на приморских
лугах.
Большая морская чайка предпочитает гнездиться в наиболее
возвышенных местах с хорошим обзором.
Сизая чайка на островах Мурмана селится небольшими коло-
ниями в основном вблизи пресных водоемов. В Кандалакшском
заливе она гнездится преимущественно на приуроченных к мелко-
водным частям залива небольших островах, где занимает примор-
ские луга и, в меньшей мере, вороничники.
Для своих гнезд большие морские, серебристые и сизые чайки
используют произрастающие вблизи колоний растения; при гнездо-
вании на почти лишенных растительности мельчайших островах
материал для гнезд приносится ими с близлежащей суши.
Чайки, будучи плотоядными птицами, широко используют для
питания ягоды Empetrum hermaphroditum и в небольшом коли-
честве другие ягодные растения. В недалеком прошлом заметную
роль в их питании играла Zostera marina.
Полярная крачка на островах Мурмана предпочитает занимать
для гнездования вороничники, хотя и заселяет самые разнообраз-
ные экотопы. На островах Кандалакшского залива полярные
крачки наиболее охотно гнездятся на приморских лугах.
Для своего гнезда она использует только окружающие гнездо рас-
тения.
Кулик-сорока устраивает гнездо в различных экотопах мор-
ского берега, на любом, лишенном растительности пятнышке.
Камнешарка прячет свои гнезда в различных укрытиях недалеко
от морского берега, чаще всего под пологом стелющегося можже-
вельника, реже среди веточек вороники.
Большой баклан на островах Кандалакшского залива гнез-
дится колониями на плоских скальных мельчайших островках,
покрытых весьма фрагментарной растительностью. Для своего
большого гнезда он употребляет различный материал с каркас-
ными свойствами. По этому же принципу он отбирает для своего
гнезда и высшие растения.
Подавляющее большинство видов птиц морских островов Коль-
ской Субарктики, и среди них обыкновенная гага и полярная
крачка, так или иначе используя растительность как среду обита-
ния, заметно не изменяет ее. Однако в местах или вблизи гнездо-
вания большинства колониальных птиц (кайры, моевки, тупика,
большой морской, серебристой и сизой чайки, баклана)
растительный покров резко отличен от растительности подобных
же мест, но не испытывающих влияния гнездящихся птиц.
4. Виды, произрастающие в птичьих колониях и процветающие
там, объединены в группу орнитофильных растений. Однако растут
1 И1 11 Ьр< I IHH.1
185
они в птичьих колониях в неодинаковых экологических условиях,
что отражает особенности экологии и требование к условиям
среды каждого из них. Именно поселение в птичьих колониях
вполне определенных, а не любых случайных видов свидетельствует
о том, что орнитофильные растения в силу своей экологии
положительно реагируют на очень специфичные условия колоний,
и прежде всего на богатство субстрата, вызванное поступлением
большого количества птичьего помета.
Орнитофильные виды объединяет потребность в богатом суб-
страте. Прочие экологические требования у них в той или иной
мере разные. По ним орнитофильные растения объединены в сле-
дующие группы: типичные галофиты, умеренные галофитьц нитро-
фил ы-гал офиты, нитрофил ы-влаголюбы, нитрофил ы-сухолюбы,
факультативные сухолюбы и растения формирующихся песчаных
почв.
5. Поселившись в условиях птичьих колоний под влиянием
жизнедеятельности морских птиц, орнитофильные виды образуют
орнитогенную растительность.
В условиях островов Кольской Субарктики орнитогенный
растительный покров может быть первичным — при возникновении
его на доселе лишенных растительности участках, если там распо-
ложены колонии птиц, и вторичным, при формировании его на
участках, ранее покрытых той или иной растительностью.
6. В условиях островов Кольской Субарктики первичный
орнитогенный растительный покров в основном существует на при-
морских скалах, где он чаще всего фрагментарен. Большое коли-
чество птичьего помета вызывает усиленный рост случайно посе-
лившихся в скальных трещинах, но положительно реагирующих
на органическое удобрение растений и, как следствие этого, проду-
цирование большого количества наземной растительной массы.
Здесь она почти не минерализуется, а, частично разлагаясь,
консервируется на месте, вдоль скальных трещин, в виде торфо-
образной массы. Поэтому скальная растительность представляет
собой лентообразные, приуроченные к скальным трещинам дерно-
вины. На островах Восточного Мурмана в первичных скальных
орнитогенных ценозах преобладает Cochlearia officinalis, обычны
также Matricaria hookeri, Festuca rubra ssp. arctica, Rhodiola
arctica. На Айновых островах в подобных условиях преимущест-
ственно растут Rhodiola arctica, Ligusticum scoticum, Festuca
rubra ssp. arctica и Cochlearia officinalis. Однако Cochlearia
officinalis здесь не образует таких мощных, как на Восточном
Мурмане, куртин и зарослей. На островах Кандалакшского залива
в скальных первичных орнитогенных ценозах наиболее обычны
Rhodiola rosea, Sedum acre, Crepis nigrescens, Puccinellia pulvi-
nata, P. capillaris, P. coarctata, а к нижнему скальному поясу
тяготеет Tripolium vulgare. На приморских скалах с плотным
гнездованием морских птиц существует тенденция смыкания
лентообразных дерновин в сплошной первичный орнитогенный
растительный покров.
186
7. Вторичная орнитогенная растительность возникает в мес-
тах постоянного локального пребывания морских колониальных
птиц и вблизи птичьих базаров. В условиях островов Кольской
Субарктики она чаще всего формируется на сухих приморских
торфяниках, покрытых вороничниками. Однако она может возник-
нуть среди любой другой растительной формации, если здесь
загнездятся морские колониальные птицы.
Наиболее сильное воздействие на растительный покров торфя-
ников оказывают колонии тупиков. Тупики ежегодно роют и расчи-
щают свои норы, и первоначальная вороничная растительность
в местах их колоний полностью уничтожена. Растительный покров
тупичиных колоний на всех островах Мурмана очень пестр. Это
прежде всего разнообразнейшие сочетания Matricaria hookeri,
предпочитающей рыхлые свеженарушенные почвы, и Cochlearia
officinalis (она почти не растет на Айновых островах), Rumex
acetosa, R. tenuifolius, Festura rubra ssp. arctica. На Гавриловских
и Айновых островах обильно произрастает Melandrium lapponicum.
Все это перемежается с пятнами голого вытоптанного торфа.
Брошенные и затухающие колонии зарастают Rumex acetosa,
R. acetosella (3 tenuifolius, Rubus chamaemorus; на Гавриловских
и Айновых островах еще и Melandrium lapponicum, только на
Айновых островах — Chamerion angustifolium.
В местах гнездования больших морских, серебристых и сизых
чаек, на покрытых вороничником приморских торфяниках, процесс
становления вторичных орнитогенных ценозов происходит посте-
пенно, и различные его стадии хорошо прослеживаются при пере-
мещении плотной колонии от периферии к ее центру. В неплотных
колониях, а также в местах локального пребывания отдельных
пар крупных чаек вторичная орнитогенная растительность фраг-
ментарна и пятнами распределена среди вороничника.
На торфяниках Айновых островов преимущественно гнездятся
большие морские чайки. Их гнездовья разреженно разбросаны
повсеместно. Между ними вкраплены гнезда серебристых чаек.
В недалеком прошлом здесь еще обитали тупики и плотность их
гнездования была чрезвычайно высокой. В результате на Айновых
островах первоначальный вороничный растительный покров сохра-
нился большей частью отдельными пятнами. Основная раститель-
сть плато этих островов представлена ассоциацией Rubus cha-
maemorus 4- Rumex acetosa + Melandrium lapponicum, перемежа-
ющейся более или менее крупными пятнами морошкового воронич-
ника; весьма обычны здесь небольшие локальные заросли или
куртины Matricaria hookeri, означающие места интенсивного
современного локального воздействия крупных чаек.
На торфяниках островов Восточного Мурмана в центре коло-
ний крупных чаек полностью отсутствуют даже пятна перво-
начальной вороничной растительности. В растительном покрове
здесь наиболее обычны группировки Cochlearia officinalis + Rubus
chamaemorus, Plantago schrenkii-\- Rubus chamaemorus, Rumex
acetosa + Rubus chamaemorus, Rubus chamaemorus Rumex ace-
13
187
tosella p tenuifolius, заросли Cochlearia officinalis с разреженным
присутствием других орнитофильных растений; более редки
заросли Festuca rubra ssp. arctica + Cochlearia officinalis. На Гав-
риловских островах во всех этих ценозах присутствуют, кроме
того, Melandrium lapponicum. Empetrum hermaphroditum в подоб-
ных группировках исчезает полностью как вид, a Rubus chamaemo-
rus резко усиливает свое обилие. Подобные участки вторичной
орнитогенной растительности занимают здесь большие площади
(до 1 га). При гнездовании на вороничнике отдельных пар
крупных чаек в местах их пребывания образуются небольшие
очаги вторичной орнитогенной растительности.
На приморских торфяниках островов Кандалакшского залива
нет больших колоний чаек. Здесь в отличие от островов Мурмана
смена первичной вороничной растительности на вторичную орнито-
генную происходит на небольших участках непосредственно
в местах гнездования или постоянного отдыха чаек. В пятнах
вторичной орнитогенной растительности сильно разрастается
Rubus saxatilis, а нередко и Vaccinium uliginosum; в различных
сочетаниях появляются Euphrasia frigida, Festuca rubra, Dian-
thus superbus, Campanula rotundifolia, Cerastium holosteoides,
Achillea apiculata.
С приморскими торфяниками островов связан и процесс обра-
зования вторичной скальной орнитогенной растительности. Он про-
тивоположен тенденции образования первичной орнитогенной
растительности приморских скал. Под влиянием гнездящихся
птиц, а возможно, и ряда климатических факторов лежащий
на скалах торфянистый слой частично разрушается. Среди обна-
жившихся скал, на торфяных остатках и образуется вторичная
скальная орнитогенная растительность. Для нее характерны виды,
свойственные вторичным орнитогенным хуенозам торфяников. Дер-
новины вторичной орнитогенной растительности так же, как и
первичной, приурочены к скальным трещинам, поскольку корни
исконных растений торфяников, проникшие в скальные трещины
еще до разрушения торфяного пласта, удерживают вдоль трещин
остатки этого пласта. Со временем здесь поселяются также
типичные представители первичной орнитогенной растительности.
Колосниковые кочкарники Айновых островов, подверженные
воздействию серебристых чаек (гнездование или пребывание
пришедших из других мест птенцов), сильно видоизменены.
Пространство между кочками либо занято пышно развитой (от
удобрения пометом) луговой растительностью, либо занято типич-
ными для Айновых островов орнитофилами, либо его раститель-
ность сильно вытоптана чайками и подрастающими птенцами.
Возможно, что колосниковый кочкарник имеет орнитогенное про-
исхождение и что он образовался в результате многовекового
гнездования чаек в одном и том же гнезде, устроенном в зарослях
Leymus arenarius. Это привело-к росту кочки. Битая ракушка, обя-
зательный компонент чаячцих погадок, в пробах торфа, взятых
из глубины кочки, есть косвенное подтверждение очень давнего
188
пребывания в колосняке чаек. В Кандалакшском заливе встречено
несколько колосниковых кочек, образовавшихся на месте много-
летних гнезд. Это также подкрепляет предположение, что колос-
никовый кочкарник Айновых островов имеет орнитогенное про-
исхождение.
Гнездование серебристых чаек на болотах обоих Айновых
островов резко изменило болотную растительность. На участках
крупнобугристых болот на буграх она вообще не сохранилась,
там стали преобладать заросли Matricaria hookeri, а в мочажино-
образных межбугорных понижениях болотная растительность сме-
нилась на мощную луговую. Для остальных болот Айновых
островов, особенно для верховых и переходных, характерно
постоянное присутствие совсем несвойственного зональной болот-
ной растительности Rumex acetosa. На болотах, на месте локаль-
ного многолетнего гнездования серебристых чаек, обычны бугорки,
густо поросшие Matricaria hookeri, Rumex acetosa, Valeriana
sambucifolia, Melandrium lapponicum, реже Cochlearia officinalis,
а сфагновый покров исчезает. Co временем они покрываются
дерниной Festuca rubra ssp. arctica.
На островах Кандалакшского залива приморские луга в местах
гнездования сизых чаек обогащаются нитрофильными видами
и растениями нарушенных почв (Angelica archangelica, Heracleum
sibiricum, Tanacetum vulgare, Achillea apiculata, Erisimum strictum,
Atriplex nudicaulis) и продуцируют значительно больше фито-
массы против обычных условий.
Гигантизм растений высокотравных лугов Айновых островов,
где чайки, как правило, не гнездятся, не обусловлен высокой
численностью гнездящихся на островах морских птиц, как это счи-
талось до сих пор, поскольку количество помета, поступающее
на гектар во время пролета птиц над лугом, недостаточно для
стимулирования гигантизма произрастающих на лугах нитрофиль-
ных зонтичных. Причины этого явления должны быть иными.
8. На птичьих базарах островов Восточного Мурмана на нежи-
лых карнизах господствуют очень мощные и чистые заросли
Cochlearia officinalis с исключительно крупными листьями, в мень-
шем количестве, но постоянны крупные куртины Matricaria hookeri.
На почти отвесных нежилых стенках птичьих базаров обычны
очень крупные мощные экземпляры Rhodiola arctica.
На жилых карнизах птичьих базаров никакая растительность
не может закрепиться из-за большой скученности птиц и обилия
помета. Растительность их являет собой один из примеров орнито-
генной растительности, возникшей на месте жилых карнизов при
уменьшении численности птиц, а следовательно, и сокращении
площади базара.
Поскольку численность птиц на базарах за всю историю их
существования неизбежно колебалась, столь же неизбежны два
противоположных процесса — зарастание части карнизов при
сокращении численности птиц и уничтожение прибазарной расти-
тельности при ее пике. И поскольку на одном и том же карнизе
189
неоднократно могут возникнуть и там же неоднократно исчезнуть
густые орнитогенные заросли, мы в равной мере можем считать
их как первичными, так и вторичными орнитогенными ценозами.
Первичными — потому, что они каждый раз возникают на голых
скалах; вторичными — потому, что появились они здесь не впервые.
История становления и развития орнитогенной растительности
на примыкающей к базарам территории тесно связана с жизнью
самих базаров, и не исключено, что целый ряд ее участков и не про-
ходил стадии вороничников, а их растительность возникла и разви-
валась параллельно с возникновением и развитием поселений
морских колониальных птиц.
9. На становление орнитогенной растительности решающее
влияние оказывает поступление большого количества птичьего
помета. Помимо этого, птичье влияние на растительность выра-
жается также в механическом разрушении птицами первоначаль-
ного растительного покрова, в рыхлении почвы птицами и в пере-
носе зачатков на территории колонии.
10. Специфичность островных ландшафтов .обусловлена
прежде всего морским окружением. Небольшая величина подавля-
ющего большинства островов, малый набор их экотопов, замкну-
тость территории, а также совокупность ряда факторов — «фак-
тора океаничности», приливно-отливного режима, а нередко и
орнитологического воздействия создают особые экологические
условия на островах. Предложена классификационная схема
островов Кандалакшского залива и их экотопов как среды обита-
ния водоплавающих и морских птиц. Она основана на неодинако-
вости расположения различных островов в тех или иных участках
залива, их возраста, величины и, как следствие этого, набора
и сочетания их экотопов.
Среди островных ландшафтов Кандалакшского залива выде-
лены следующие ландшафтные единицы: 1) островные ландшафты
губ — «губные» острова; 2) ландшафты островов, расположен-
ных вблизи открытого или слабо изрезанного материкового бе-
рега — «бережные» острова; 3) ландшафты обособленных
островов или, реже, архипелагов открытых участков Кандалакш-
ского залива — «голоменные» (морские) острова; 4) крупный,
материкового типа остров. На голоменных островах экологические
условия наиболее суровы. На губных островах близость материко-
вого берега и определенная их скученность ослабляют ветры всех
направлений, и потому их экологические условия приближаются
к условиям материкового побережья. Экологические условия
крупного, материкового типа острова практически неотличимы от
таковых на побережье. Плакоры крупного, материкового типа
острова и губных островов покрыты сосняками и ельниками,
аналогичными материковым, а голоменных — вороничной тундро-
образной растительностью. На бережных островах встречаются
оба этих типа, но на плакорах господствует вороничная тундро-
образная растительность лесотундрового облика. Серебристые
чайки больше тяготеют к голоменным островам, сизые — к губным
190
и бережным. Современная приуроченность обыкновенной гаги
к губному Северному архипелагу, скорее, объясняется не его
ландшафтными особенностями, а длительным, 50-летним сроком
заповедания этого архипелага. На крупном, материкового типа
острове морские колониальные птицы практически не гнездятся,
а по морским берегам немногочисленны морские кулики.
В зависимости от набора экотопов, с учетом возраста, про-
исхождения и положения островов в той или иной ландшафтной
группе выделены типы островов Кандалакшского залива. Их наз-
вания позаимствованы из поморского диалекта. Они отражают
основные элементы стихийно сложившейся, неосознанной помор-
ской классификации островов.
Принцип удаленности острова от материкового берега, его
возраст и величина и, как следствие этого, набор и сочетание его
экотопов целесообразно положить в основу любой ландшафтной
классификации островов. Однако знакомство с очень органичен-
ным числом островов Мурмана, а отсюда и недостаточность
фактического материала не позволили составить классификацион-
ную схему их ландшафтов по изложенному принципу.
Лицо большинства Мурманских островов определяет воронич-
ник (если там нет непомерно больших колоний птиц). Очень силь-
ный отпечаток на облик и структуру ландшафтов этих островов
накладывает большая численность на этих островах морских птиц.
Преобладающие экотопы материкового побережья — воронично-
лишайниковые и кустарничковые тундры присущи островам
только значительных размеров.
Тенденция появления на островах экотопов материкового
побережья проявляется как в Кандалакшском заливе, так и на
Мурмане только на островах достаточно больших размеров.
На Мурмане, однако, она начинает действовать при гораздо
больших размерах его островов. Характер пребывания и числен-
ность морских птиц на островах зависят как от типа острова,
так и от того, к какой ландшафтной группе островов он отно-
сится.
11. Морские колониальные птицы оказывают существенное
влияние на формирование флоры и растительности мелких морских
островов Кольской Субарктики. Наиболее сильно это проявляется
на мельчайших скальных островках. С гнездовым материалом
они приносят на «растущий» остров зачатки растений будущей
флоры. Пионерные растения прорастают и закрепляются здесь
как в трещинах скал, так и на гнездовом материале. Становление
флоры и растительности на скальных островках-баклышах вклю-
чает два противоположных процесса: 1) образование первичного
орнитогенного растительного покрова и 2) уничтожение сформи-
ровавшейся фрагментарной скальной растительности редкими, но
особо сильными штормами и исчезновение ряда видов из флоры
этих островов. Однако постепенно, в процессе поднятия суши
и роста таких островков, формирующая орнитогенная расти-
тельность полностью выходит из-под уничтожающего влияния
191
морских волн, и процесс формирования орнитогенной раститель-
ности начинает преобладать.
В связи с образованием лентообразных дерновин вдоль скаль-
ных трещин, их расширением и, наконец, смыканием заметно
увеличивается экологический диапазон для закрепления во флоре
островка гораздо большего числа видов.
С дальнейшим поднятием островка серебристые чайки пере-
стают гнездиться на участках сплошного сомкнутого (первичного
орнитогенного) растительного покрова, поскольку предпочитают
занимать для гнездования приморские скалы. В свою очередь
это приводит к постепенному обеднению субстрата и исчезновению
в растительном покрове орнитофильных растений, поселению
вороники и образованию в дальнейшем вороничной тундрообраз-
ной приморской растительности.
На нередких в Кандалакшском заливе, сложенных рыхлыми
отложениями мельчайших островках этот процесс менее зависит
от деятельности гнездящихся на них морских птиц.
12. Природа морских островов Кольской Субарктики хрупка
и ранима. Она сложилась при взаимодействии разнообразнейших
процессов: геологических, климатических, экологических. В по-
следних непосредственную роль играет взаимодействие, взаимо-
влияние между растительным покровом островов и гнездящимися
на них морскими колониальными птицами. Орнитогенные ценозы
островов, являющиеся результатом такого взаимодействия, свое-
образны и уникальны. Вольное или невольное уничтожение их
человеком, даже при сохранении птичьих колоний, сильно изменит
и обеднит природу островов. Для восстановления существующих
вторичных орнитогенных ценозов потребуются многие годы, пер-
вичных же — возможно, и столетия. И маловероятно, что восста-
новленные орнитогенные ценозы будут полностью соответствовать
прежним. Поэтому морские острова Кольской Субарктики нужда-
ются в особой охране. Отрадно, что на значительной части этих
островов установлен заповедный режим. Биогеоценозы осталь-
ных, находящихся вне условий заповедности островов могут
существовать в ненарушенном виде только при условии
их рационального природопользования и охраны. Природные
ландшафты островов Кольской Субарктики являются нашим
национальным достоянием и должны развиваться по естественным
биосферным законам.
192
ЛИТЕРАТУРА
Агроклиматические ресурсы Мурманской области. Л., 1971. 91 с.
Александрова В Д. Растительность южного острова Новой Земли между 70° 56
и-72° 12 с. ш. // Растительность Крайнего Севера СССР и ее освоение. М ,
Л , 1956. Вып 2. С. 187—306.
Александрова В. Д. Изучение смен растительного покрова // Полевая геоботаника.
М; Л., 1964. Т. 3. С. 300—447.
Арманд А. Д Геоморфологический очерк Семиостровского отдела Кандалакшского
заповедника // Тр. Кандалакш. гос. заповедника. Мурманск, 1969. Вып. 7
С. 228—258.
Арманд Д. Л. Типологическое и индивидуальное районирование ландшафтной
сферы // Современные проблемы природного районирования. М., 1975.
С. 90—91.
Барыкина В. В. Урожаи некоторых ягодников на островах Кандалакшского
залива // Тр. Кандалакш. гос. заповедника. Мурманск, 1969. Вып. 7.
С. 178—189.
Белопольский Л. О. Экология морских колониальных птиц Баренцева моря
М.; Л., 1957. С. 1—460.
Белопольский Л. О., Бианки В. В., Коханов В. Д. Материалы по экологии
куликов (Limicolae) Белого моря // Тр Кандалакш. гос. заповедника
Мурманск, 1970. Вып. 8. С. 3—84.
Беньковский Л. М Заметки о птицах островов Тюлений и Монерон // Орнитология.
1968. Вып. 9. С. 222—227.
Бианки В. В. О гнездовании прибрежных птиц в районе Кандалакшского за-
лива // Тр. Кандалакш. гос. заповедника. Вологда, 1958. Вып 1. С. 51—71
Бианки В. В. Кулики, чайки и чистиковые Кандалакшского залива // Тр. Канда-
лакш. гос. заповедника. Мурманск, 1967. Вып. 6. С. 1—363.
Бианки В В. Урожайность ягод водяники на островах Кандалакшского залива
и потребление их животными // Продуктивность дикорастущих ягодников
и их хозяйственное использование. Киров, 1972. С. 207—209.
Бианки В. В. О пролете водоплавающих птиц на Белом море // Сообщения
прибалтийской комиссии по изучению миграции птиц. Тарту, 1983. № 16.
С. 3—13.
Бианки В В., Бойко Н. С. Эффективность размножения обыкновенной гаги
в Кандалакшском заливе // Обыкновенная гага (Somateria mollissima)
в СССР: Тр. Межвед. совещ. Эстония, май, 1966. Таллин, 1968. С. 50—56
Бируля А. Зоологические результаты русских экспедиций на Шпицберген // Еже-
годник Зоол. музея / Акад. наук. 1910. 15. С. 167—206.
Благосклонов К. Н. Птицы Кандалакшского заповедника и окрестностей Бело-
морской биологической станции Московского университета // Тр. Канда-
лакш. гос. заповедника. Мурманск, 1960. Вып. 2. С. 5—104.
Богданова Н. Е., Вехов В. Н. Флора сосудистых растений Кемь-Лудского архи-
пелага // Тр. Кандалакш. гос. заповедника. Мурманск, 1969а. Вып. 7.
С. 3—59.
Богданова Н. Е., Вехов В. Н. Флора сосудистых растений острова Великого // Тр.
Кандалакш. гос. заповедника. Мурманск, 19696. С. 126—177.
Богдановская-Гиенеф И. Д. О происхождении флоры бореальных болот "Евра-
зии // Материалы по истории флоры и растительности СССР. М.; Л.,
1946 Вып. 2. С. 425—468.
193
Бойко Н. С., Коханов В. Д., Татаринкова И. П. О способах добывания корма
большой морской и серебристой чайками на Мурмане и в Кандалакшском
заливе//Тр. Кандалакш. гос. заповедника. Мурманск, 1970. Вып. 8.
С. 120—148.
Бреслина И. П. Флора и растительность Семи Островов и прилегающего побе-
режья Восточного Мурмана // Тр. Кандалакш. гос. заповедника. Мурманск,
1969. Вып. 7. С. 259—382.
Бреслина И. П. Урожай морошки на Семи Островах (Восточный Мурман)
в 1967 г. и методические вопросы оценки ее урожайности // Продуктивность
биогеоценозов Субарктики. Свердловск, 1970. С. 19—21.
Бреслина И. П. Приморские вороничники — особые тундрообразные экстразо-
нальные ценозы//Природа и хозяйство Севера. Апатиты, 1971. Вып. 3.
С. 89—91.
Бреслина И. П. Уникальность орнитогенной растительности островов Белого и
Баренцева морей // Охрана ботанических объектов на Крайнем Севере.
Апатиты, 1977. С. 88—100.
Бреслина И. П. Вопросы становления флор мелких морских островов Кандалакш-
ского залива Белого моря на примере флоры Средних луд//Экология
и рациональное использование островных экосистем. Владивосток, 1978.
С. 17—18.
Бреслина И. П. Орнитофильная флора островов Кандалакшского залива Белого
моря //Экология. 1979. № 2. С. 42—52.
Бреслина И. П. Приморские луга Кандалакшского залива Белого моря / / Биолого-
флористические исследования в связи с охраной природы в Заполярье.
Апатиты, 1980а. С. 132—143.
Бреслина И. П. Флора Средних луд Кандалакшского залива Белого моря // Биоло-
го-флористические исследования в связи с охраной природы в Заполярье.
Апатиты, 19806. С. 72—82.
Бреслина И. П. Классификация растений островов и прибрежной материковой
полосы Кандалакшского залива Белого моря в их связи с жизнедеятель-
ностью водоплавающих птиц // Биологические проблемы Севера. IX сим-
поз.: Экология животных и др.: (Тез. докл.). Сыктывкар, 1981а. Ч. 2.
С. 10.
Бреслина И. П. Материалы к экологии приморских видов высших растений
Кандалакшского залива Белого моря //Ботан. журн. 19816. Т. 66, № 6.
С. 843—850.
Бреслина И. П. Роль морских колониальных птиц в становлении флоры и
растительности мелких островов Кандалакшского залива Белого моря //
Проблемы биосферы: Информационные материалы. М., 1981 в. Вып. 2.
С. 27—28.
Бреслина И. П. Ландшафтная классификация островов Кандалакшского залива
Белого моря и вопросы охраны островных экосистем // Природа и хозяйство
Севера. Мурманск, 1983. Вып. 2. С. 15—23.
Бреслина И. П. О необходимости экологического надзора за состоянием островных
и прибрежных ландшафтов Кандалакшского залива Белого моря //
Проблемы охраны природы в бассейне Белого моря. Мурманск, 1984.
С. 81—85.
Бреслина И. П. Флора острова Наумихи // Ботанические исследования за Поляр-
ным кругом. Апатиты, 1985. С. 18—23.
Бреслина И. П., Георгиевский А. Б. Орнитогенные сукцессии в растительном
покрове Семи Островов Баренцева моря//Тез. докл.: VII делегат, съезд
Всесоюз. ботан. о-ва. Л., 1983. С. 126—127.
Бреслина И. П., Карпович В. Н. Распределение морских колониальных птиц
по ландшафтам и их влияние на становление и состав растительно-
сти // Структура и функционально-биогеоценотическая роль животного
населения суши. М., 1967. С. 108—110.
Бреслина И. П., Карпович В. Н. Развитие растительности под влиянием жизне-
деятельности колониальных птиц//Ботан. журн. 1969. Т. 54, № 5.
С. 690—696.
Вехов В. Н. Растительность Кемь-Лудского архипелага//Тр. Кандалакш. гос.
заповедника. Мурманск, 1969. Вып. 7. С. 60—125.
194
Вехов В. И. Восстановление зарослей зостеры на Белом море // Биология Белого
моря. М., 1970. Т. 3. С. 149—153.
Вехов В. И., Георгиевский А. Б. Природные условия и растительный покров
Ковдского полуострова и острова Великого в Кандалакшском заповед-
нике // Флора и растительность заповедников РСФСР. М., 1981а.
С. 49—62.
Вехов В. Н., Георгиевский А. Б. Сосновые леса Ковдского полуострова и острова
Великого//Флора и растительность заповедников РСФСР. М., 19816.
С. 63—80.
Воронов А. Г. Изучение влияния наземных позвоночных на растительность // Поле-
вая геоботаника. М.; Л., 1964. Т. 3. С. 451—500.
Георгиевский А. Б. Флора и растительность Гавриловских островов//Флористи-
ческие исследования в заповедниках РСФСР. М., 1981. С. 20—46.
Герасимова Т. Д. К орнитофауне Айновых островов//Тр. Кандалакш. гос.
заповедника. Вологда, 1958. Вып. 1. С. 37—50.
Герасимова Т. Д., Баранова 3. М. Экология обыкновенной гаги (Somateria
mollissima) в Кандалакшском заповеднике // Тр. Кандалакш. гос. заповед-
ника. Мурманск, 1960. Вып. 3. С. 8—90.
Герасимова Т. Д., Скокова Н. Н. Орнитологическая характеристика Айновых
островов//Орнитология. 1959. Вып. 2. С. 91—98.
Гизенко А. И. Птицы Сахалинской обл. М., 1955. С. 1—328.
Городков Б. И. Анализ растительности зоны арктических пустынь на примере
о. Врангеля // Растительность Крайнего Севера СССР и ее освоение.
М.; Л., 1958. Вып. 3. С. 59—94.
Гунова В. С., Лебедева Р. М. История развития растительности на островах
Б. Лицком и Вешняк (Восточный Мурман) по данным спорово-пыльцевого
анализа // Тр. Кандалакш. гос. заповедника. Мурманск, 1969. Вып. 7.
С. 383—389.
Земский В. А. Животный мир Антарктики: (Звери и птицы) // М., 1960. С. 1 —180.
Иванов А. И., Штегман Б. К. Краткий определитель птиц СССР//Л., 1978.
С. 1—560.
Игнатьев Г. М. Тропические острова Тихого океана. М., 1979. С. 1—270.
Исаков Ю. А. Типология и классификация местообитаний водоплавающих
птиц // Ресурсы водоплавающей дичи в СССР, их воспроизводство и исполь-
зование. М., 1968. Вып. 1. С. 14—17.
Исаков Ю. А. Заключительное слово // Ресурсы водоплавающей дичи в СССР,
их воспроизводство и использование. М., 1969. Вып. 3. С. 44—45.
Исаченко А. Г. Оптимизация природной среды: Географический аспект. М., 1980.
С. 1—264.
Карпович В. И., Коханов В. Д. Учет численности охотничьепромысловых птиц
на о. Вайгач // Организация и методы учета птиц и вредных1, грызунов.
М., 1963. С. 91—99.
Карпович В. И., Пилипас Н. И. Участие крупных чаек в формировании почвы
на скалистых островах Мурмана//Роль животных в функционировании
экосистем. М., 1975. С. НО—113.
Коханов В. Д., Скокова И. И. Фауна птиц Айновых островов // Тр. Кандалакш.
гос. заповедника. М., 1967. Вып. 5. С. 178—184.
Красовский С. К. Биологические основы промыслового использования птичьих
базаров: Этюды по биологии толстоклювой кайры // Тр. Арктического ин-та.
1937. Т. 77. С. 32—92.
Лаврова М. А. Четвертичная геология Кольского полуострова. М.; Л., 1960.
С. 1—234.
Леганцев М. И. Отчет экспедиции Карело-Финского НИИ по обследованию
Кандалакшского гагачьего заповедника. Рукопись. Кандалакшский запо-
ведник, 1934.
Лоция Белого моря. 1957. 328 с.
Меркурьев И. С. Живая речь Кольских поморов. Мурманск, 1979. 184 с.
Мильков Ф. И. Основные проблемы физической географии. М., 1967.
252 с.
Модестов В. М. Экология колониально гнездящихся птиц // Тр. Кандалакш. гос.
заповедника. М., 1967. Вып. 5. С. 49—154.
195
Парфентьева Н С О положении Айновых островов Баренцева моря в схеме
геоботанического районирования Кольского полуострова // Науч. докл.
высшей школы. Биологические науки. 1963. № 2. С. 141 — 143.
Парфентьева Н. С. Растительность Айновых островов//Тр. Кандалакш. гос.
заповедника. Мурманск, 1969. Вып. 7. С. 413—424.
Парфентьева Н С., Бреслина И. П. Флора Айновых островов//Тр. Кандалакш.
гос. заповедника. Мурманск, 1969. Вып. 7. С. 390—412.
Раменская М. Л. Анализ флоры Мурманской области и Карелии. Л., 1983.
216 с
Ребассо Х.-Э. А. Формирование растительного покрова морских островков Запад-
ной Эстонии // Ботан. журн. 1972. Т. 57, № 12. С. 1525—1532.
(Ребассо Х.-Э. A.) Rebassoo Н. Е. Ornitchooria (lindlevi) osatahtsus Matsalu
Riikliku Looduskaitseala Laidudel // Matsalu maastik ja linnud Tallin, 1973
N 6. S. 10—15.
(Ребассо X-Э. A.) Rebassoo H.-E. Sea-shore plant communities of the Estonian
islands Tartu, 1975. 176 s. Tabl. 1 —136.
Резолюция Второго всесоюзного совещания по вопросам воспроизводства и исполь-
зования ресурсов водоплавающей дичи в СССР // Ресурсы водоплавающей
дичи в СССР, их воспроизводство и использование. М., 1969. Вып 3.
С. 90—103.
Рихтер Г. Д. Север Европейской части СССР: Физико-географическая характе-
ристика. М., 1946. 192 с
Сдобников В. М. Птицы Арктики // Изв. Всесоюз. геогр. о-ва. 1965. Т. 97, № 5.
С. 408—416
Скокова Н. Н. Тупик на Айновых островах // Орнитология. 1962. Вып. 5.
С. 7—12.
Скокова Н. Н. О факторах, определяющих состояние популяции тупика
в гнездовой период // Тр Кандалакш. гос. заповедника. М., 1967. Вып. 5.
С 155—177.
Сыроечковский Е. Е. Роль животных в образовании первичных почв в условиях
приполярной области земного шара (на примере Антарктики) // Зоол. журн.
1959. Т. 38, вып. 12. С. 1770—1775.
Татаринкова И. П. О влиянии птиц на растительность острова Большого Айнова
(Западный Мурман) // Структура и функционально-биогеоценотическая
роль животного населения суши. М., 1967. С. 111 —112.
Татаринкова И. П. Количественная характеристика экскреторной деятельности
крупных чаек и ее влияние на растительность // Роль животных в функцио-
нировании экосистем. М., 1975. С. 107—НО.
Татаринкова И. П. О некоторых факторах, определяющих размещение гнезд гаги
по стациям на Айновых островах//X Прибалтийская орнитологическая
конференция: Тез. докл Рига, 1981. Т. 1. С. 68—71.
Татаринкова И. П. Экология большой морской и серебристой чаек на Айновых
островах в период гнездования // Экология и морфология птиц на крайнем
Северо-Западе СССР. М., 1982. С. 66—80.
Татаринкова И. П., Краснов Ю. В. Синантропные тенденции и современная
роль чайковых птиц в заповедных орнитоценозах//Проблемы охраны
природы в бассейне Белого моря. Мурманск, 1984. С. 28—30.
Тихомиров Б. А. Взаимосвязи животного мира и растительного покрова тундры.
М.; Л., 1959. 104 с.
Шкляревич Ф. Н. Рост численности хохлатого баклана на островах Восточного
Мурмана в 1971 —1978 гг. как одна из причин изменения некоторых
сторон его биологии // X Прибалтийская орнитологическая конференция:
Тез. докл Рига, 1981. Т. 2. С. 202—205.
Юрцев Б. А. Гипоарктический ботанико-географический пояс и происхождение
его флоры // Комаровские чтения / АН СССР Ботан. ин-т. М.; Л.,
1966. 19. 94 с.
Gillham М. Е. Ecology of the Pembrokeshire islands. V Manuring by the colonial
seabirds and mammals, urta a note on sead distribution bygulls // J Ecol.
1956. Vol. 44, N 2 P 429—454.
196
Gr$nlie А М 1948 The ornithocoprophilous vegetation of the bird cliffs of
Norwaj // Nytt mag. naturvidenskapene. Oslo, 1948. 86. P. 27—49.
Hagerup О Communites of birds // Vid medd Dan. naturhist. foren Oecological
Studies 1927. Bd 82
Hulden O. Ecology of duck populations in the island group of Valassaaret, Gulf
of Bothnia//Ann. zool fenn 1964. Vol. 1, N 3. P. 127—156.
Pearson H J Three summers among the birds of Russian Lapland. London,
1904 169 p
Sobey D. The effect of herring gulls on the vegetation of the isle of May//Trans.
Bot Soc Edinburgh 1976 Vol. 42, pt 4 P. 469—485.
Sobey D G , Kenworthy J. В The relationship between herring gulls and the vegeta-
tion of their bricding colonies//J. Ecol. 1979. Vol. 67, N 2. P. 469—496.
Steffen H. Beitrage zur Flora und Pflanzengeographie von Nowaja Zemlja,
Waigatsch und Kolguew // Beih. Bot. Zentralbl 1928. Bd 44, Abt 2.
S 283—361
197
ОГЛАВЛЕНИЕ
Предисловие........................................................... 3
Г лава 1. Природные условия морских островов Кольской Субарктики 6
Глава 2. Экологические связи растений с жизнедеятельностью водопла-
вающих птиц.................................................... 15
Глава 3. Роль растительности в жизни морских птиц........... 44
Утиные......................................................... 44
Обыкновенная гага........................................... 44
Чистиковые птицы............................................... 57
Кайры....................................................... 57
Гагарка..................................................... 57
Атлантический чистик ....................................... 57
Тупик....................................................... 58
Чайковые...................................................... 58
Моевка...................................................... 58
Серебристая чайка.......................................... 59
Большая морская чайка..................................... 61
Сизая чайка............................................... 62
Полярная крачка........................................... 62
Поморниковые................................................ 66
Короткохвостый поморник................................... 66
Ржанковые — морские кулики.................................. 66
Кулик-сорока.............................................. 66
Камнешарка................................................ 66
Глава 4. Роль морских колониальных птиц в становлении и изменении
растительного покрова.......................................... 68
Первичная орнитогенная растительность........................ 69
Вторичная орнитогенная растительность........................ 90
Растительность птичьих базаров.................................133
Механизм влияния морских колониальных птиц на растительный
покров.......................................................140
Степень орнитологического воздействия на растительность в разных
группах островов.............................................146
198
Глава 5. Островные ландшафты Кольской Субарктики и характер исполь-
зования их водоплавающими птицами........................... 155
Ландшафты островов Кандалакшского залива................... 155
Характеристика основных наземных ландшафтов...............156
Типы островных ландшафтов............................ 156
Типы островов......................................... 159
Классификационная схема островных ландшафтов и мест обита-
ния в них связанных с морской средой птиц.......... 164
Ландшафты островов Мурмана................................. 175
Глава 6. Роль морских колониальных птиц в становлении флоры и
растительности мелких островов Кольской Субарктики...........177
Заключение....................................................... 183
Литература . . 193
199
Ирина Патрикиевна Бреслина
РАСТЕНИЯ
И ВОДОПЛАВАЮЩИЕ ПТИЦЫ
МОРСКИХ ОСТРОВОВ
КОЛЬСКОЙ СУБАРКТИКИ
Утверждено к печати
Полярно-альпийским ботаническим институтом
Кольского филиала им С М. Кирова
Академии наук СССР
Редактор издательства Г А Баре
Художник Е В. Кудина
Технический редактор Н Ф Соколова
Корректоры Э Г Рабиновичи? Г. Эдельман
ИБ № 33172
Сдано в набор 17 03 87. Подписано к печати 10 07 87
М-17213 Формат 60х90'/16 Бумага офсетная № 1
Гарнитура литературная Фотонабор Печать офсетная.
Усл печ л. 12 5 Усл кр-отт 12 74 Уч -изд. л 14 03
Тираж 1000 Тип зак 1376 Цена 2 р 30 к
Ордена Трудового Красного Знамени
издательство «Наука» Ленинградское отделение
199034, Ленинград, В-34, Менделеевская линия, 1
Ордена Трудового Красного Знамени
Первая типография издательства «Наука»
199034, Ленинград, В-34, 9 линия, 12