Текст
Novitates Systematicae Plantarum Vascularium
ОВОСТИ
ОВОСТИ
СИСТЕМАТИКИ
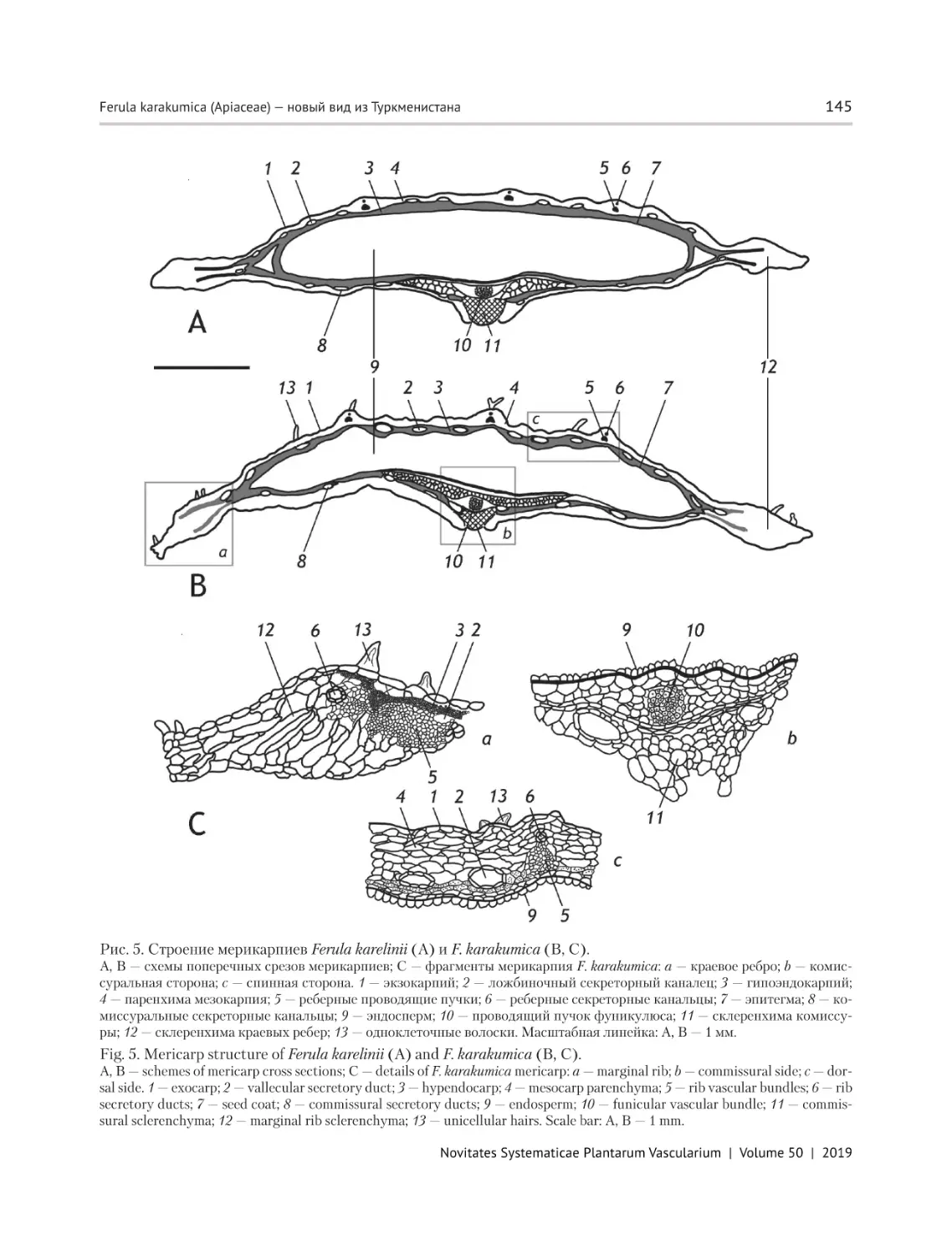
СИСТЕМАТИКИ
ВЫСШИХ
ВЫСШИХ
РАСТЕНИЙ
РАСТЕНИЙ
2019
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
2019
50
Федеральное государственное бюджетное учреждение науки
Ботанический институт им. В. Л. Комарова
Российской академии наук
Komarov Botanical Institute of the Russian Academy of Sciences
ISSN 0568-5443
Подписной индекс в каталоге Роспечати: 58288
Н
о
в
о
с
т
и
с
и
с
т
е
м
а
т
и
к
и
в
ы
с
ш
и
х
р
а
с
т
е
н
и
й
|
2
0
1
9
—
5
0
|
N
o
v
i
t
a
t
e
s
S
y
s
t
e
m
a
t
i
c
a
e
P
l
a
n
t
a
r
u
m
V
a
s
c
u
l
a
r
i
u
m
50
Федеральное государственное бюджетное учреждение науки
Ботанический институт им. В. Л. Комарова
Российской академии наук
Komarov Botanical Institute of the Russian Academy of Sciences
Санкт-Петербург
Saint Petersburg
2019
50
Novitates Systematicae Plantarum Vascularium
ОВОСТИ
СИСТЕМАТИКИ
ВЫСШИХ
РАСТЕНИЙ
Новости систематики
высших растений
2019, том 50
ISSN 0568-5443
© Авторы, 2019
© Ботанический институт им. В. Л. Комарова РАН, 2019
© Дизайн Н. Ю. Уварова, 2017
Печатается по решению Ученого совета Федерального государственного бюджетного
учреждения науки Ботанического института им. В . Л . Комарова
Российской академии наук
Журнал «Новости систематики высших растений»
Ботанический институт им. В. Л. Комарова РАН
Россия, 197376, Санкт-Петербург, ул. Профессора Попова, 2
Тел.: +7 (812) 372-54-51 | факс: +7 (812) 372-54-43 | novitates@binran.ru
www.binran.ru/journals/novitates/
Иллюстрации на обложке: Odontochilus umbrosus (Н. Л. Орлов), Astragalus
kasachstanicus (М. С. Князев), Salix acutifolia f. pendula (О. В. Епанчинцева),
Caelestium lazkovii, СЭМ-микрофотографии (О. В. Юрцева).
Редакционная коллегия
Редакционный совет
Контакты
Дмитрий Викторович Гельтман (ответственный редактор)
д-р биол. наук, Ботанический институт им. В. Л . Комарова РАН, Санкт-Петербург
Ирина Викторовна Соколова (заместитель ответственного редактора)
канд. биол. наук, Ботанический институт им. В. Л . Комарова РАН, Санкт-Петербург
Иван Владимирович Татанов (исполнительный редактор)
Ботанический институт им. В. Л. Комарова РАН, Санкт-Петербург
Марина Витальевна Легченко (секретарь)
Ботанический институт им. В. Л. Комарова РАН, Санкт-Петербург
Леонид Владимирович Аверьянов
д-р биол. наук, профессор, Ботанический институт им. В. Л. Комарова РАН, Санкт-Петербург
Дмитрий Александрович Герман
канд. биол. наук, Южно-Сибирский ботанический сад Алтайского государственного
университета, Барнаул; Гейдельбергский университет, Гейдельберг, Германия
Ян Киршнер
д-р естеств. наук, доцент, Институт ботаники Академии наук Чешской Республики, Прухонице,
Чешская Республика
Карол Мархольд
д-р естеств. наук, профессор, Институт ботаники Словацкой академии наук, Братислава,
Словацкая Республика; Карлов университет, Прага, Чешская Республика
Сергей Леонидович Мосякин
д-р биол. наук, член-корреспондент Национальной академии наук Украины, профессор,
Институт ботаники им. Н. Г. Холодного НАН Украины, Киев, Украина
Светлана Васильевна Овчинникова
д-р биол. наук, Центральный Сибирский ботанический сад Сибирского отделения РАН,
Новосибирск
Маринэ Эдгаровна Оганесян
д-р биол. наук, Институт ботаники им. А. Л. Тахтаджяна Национальной академии наук
Республики Армения, Ереван, Республика Армения
Михаил Георгиевич Пименов
д-р биол. наук, Ботанический сад Московского государственного университета
им. М. В. Ломоносова, Москва
Юрий Рафаэльевич Росков
канд. биол. наук, Институт прерий, Университет Иллинойса, Урбан-Шампейн, США
Алексей Петрович Серёгин
д-р биол. наук, Московский государственный университет им. М. В. Ломоносова, Москва
Валерий Николаевич Тихомиров
канд. биол. наук, Белорусский государственный университет, Минск, Республика Беларусь
Збигнев Целька
д-р философии, Университет им. Адама Мицкевича, Познань, Республика Польша
49 том опубликован 27 декабря 2018 года
Novitates Systematicae
Plantarum Vascularium
2019, vol. 50
ISSN 0568-5443
© Authors, 2019
© Komarov Botanical Institute of RAS, 2019
© Design by Nikita Uvarov, 2017
Published by the decision of Academic Council of the Komarov Botanical Institute
of the Russian Academy of Sciences
Journal «Novitates Systematicae Plantarum Vascularium»
Komarov Botanical Institute of the Russian Academy of Sciences
Russia, 197376, Saint-Petersburg, Professora Popova Str., 2
Tel.: +7 (812) 372-54-51 | fax: +7 (812) 372-54-43 | novitates@binran.ru
www.binran.ru/journals/novitates/
Cover illustrations: Odontochilus umbrosus (N. L . Orlov),
Astragalus kasachstanicus (M. S. Knyazev), Salix acutifolia f. pendula
(O. V. Epanchintseva), Caelestium lazkovii, SEM micrographs (O. V. Yurtseva).
Editorial board
Editorial council
Contacts
Dmitry Geltman (Chief editor)
Komarov Botanical Institute of the Russian Academy of Sciences, St. Petersburg, Russia
Irina Sokolova (Deputy chief editor)
Komarov Botanical Institute of the Russian Academy of Sciences, St. Petersburg, Russia
Ivan Tatanov (Executive editor)
Komarov Botanical Institute of the Russian Academy of Sciences, St. Petersburg, Russia
Marina Legchenko (Secretary)
Komarov Botanical Institute of the Russian Academy of Sciences, St. Petersburg, Russia
Leonid Averyanov
Komarov Botanical Institute of the Russian Academy of Sciences, St. Petersburg, Russia
Zbigniew Celka
Adam Mickiewicz University, Poznań, Republic of Poland
Dmitry German
The South-Siberian Botanical Garden of the Altay State University, Barnaul, Russia;
Heidelberg University, Heidelberg, Germany
Jan Kirschner
Institute of Botany of the Academy of Sciences of the Czech Republic, Průhonice, Czech Republic
Karol Marhold
Institute of Botany of the Slovak Academy of Sciences, Bratislava, Slovak Republic;
Charles University, Praha, Czech Republic
Sergey Mosyakin
M. G. Kholodny Institute of Botany of the National Academy of Sciences of Ukraine, Kiev, Ukraine
Svetlana Ovchinnikova
Central Siberian Botanical Garden of the Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, Russia
Marine Oganesian
Institute of Botany after A. L . Takhtajyan of the National Academy of Sciences of Republic of Armenia,
Yerevan, Republic of Armenia
Mikhail Pimenov
The Botanical Gardens of the M. V. Lomonosov Moscow State University, Moscow, Russia
Yuriy Roskov
Prairie Research Institute of the University of Illinois at Urbana-Champaign, Illinois, USA
Alexey Seregin
M. V. Lomonosov Moscow State University, Moscow, Russia
Valeriy Tikhomirov
Belarusian State University, Minsk, Republic of Belarus
Volume 49 was published 27 Deсember 2018
Об издании
About
«Новости систематики высших растений» — между-
народный научный журнал, учрежденный и издаваемый
Ботаническим институтом им. В. Л. Комарова Россий-
ской академии наук с 1964 г. Является преемником
изданий «Ботанические материалы Гербария Главно-
го ботанического сада РСФСР» / «Ботанические мате-
риалы Гербария Главного ботанического сада СССР»
(1919–1936 гг.)
—
«Ботанические материалы Герба-
рия Ботанического института им. В. Л. Комарова Ака-
демии наук СССР» (1937–1963 гг.) и, таким образом,
имеет 100-летнюю историю. Главными редакторами
этих изданий были выдающиеся ученые: Б. А . Фед-
ченко (1919–1924 гг.), В. Л. Комаров (1926–1946 гг.),
Б. К. Шишкин (1947–1963 гг.), И. А . Линчевский (1964–
1968 гг.), И. Т. Васильченко (1969–1978 гг.), В. И. Грубов
(1979–1987 гг.), Т. В. Егорова (1988–2007 гг.), Н. Н. Цве-
лёв (2008–2014 гг.).
В журнале публикуются оригинальные статьи по
систематике сосудистых растений, при этом предпо-
чтение отдается публикациям, в которых содержатся
критические ревизии, описания новых таксонов и иные
номенклатурные новации. Публикуются сведения о
наиболее важных флористических находках, данные о
хранящихся в Гербариях типовых образцах названий
таксонов; в разделе «Номенклатурные заметки» публи-
куются короткие сообщения, в которых обнародуются
новые номенклатурные комбинации (comb. nov.) и но-
вые названия таксонов (nom. nov.), указываются при-
оритетные названия таксонов и уточненные библиогра-
фические данные.
В журнале не публикуются статьи, состоящие только
из ключей для определения растений, работы, тожде-
ственные обработкам для «Флор», «Определителей» и
каталогов типовых образцов, работы по молекулярной
филогении без таксономической интерпретации полу-
ченных результатов, сведения о локальных флористи-
ческих находках (новинки для флоры частей региона,
особо охраняемых природных территорий и т. п.) .
Индексируется Российским индексом
научного цитирования — РИНЦ.
Пятилетний импакт-фактор — 0.122.
Языки публикаций: русский и английский
Периодичность выхода: 1 раз в год
«Novitates Systematicae Plantarum Vascularium» is an
international scientific journal, established and published
by the Komarov Botanical Institute of the Russian Acad-
emy of Sciences since 1964. The journal is the successor
of series of editions: «Notulae Systematicae ex Herbario
Horti Botanici Petropolitani» / «Notulae Systematicae ex
Herbario Horti Botanici U. S. S. R.» (1919–1936) — «Notu-
lae Systematicae ex Herbario Instituti Botanici Academiae
Scientiarum URSS» (1937–1963), and thus, has 100-year
history. Chief editors of the editions were outstanding sci-
entists: B. A . Fedtschenko (1919–1924), V. L. Komarov
(1926–1946), B. K. Schischkin (1947–1963), I. A . Lin-
czevski (1964–1968), I. T. Vassilczenko (1969–1978),
V. I. Grubov (1979–1987), T. V. Egorova (1988–2007),
N. N. Tzvelev (2008–2014).
The journal publishes original articles on the taxonomy
of vascular plants, with preference given to publications
that contain critical revisions, descriptions of new taxa and
other nomenclatural novelties. Also it publishes information
about the most important floristic records, data about type
specimens of names of taxa deposited in herbaria; the sec-
tion «Nomenclatural Notes» contains short texts with new
nomenclatural combinations (comb. nov.) and new names
of taxa (nom. nov.), indications of priority taxa names and
correct bibliographic data.
The journal does not publish the articles which consist
only of keys for plant identification, the works identical with
treatments for «Floras», regional «Manuals of plants» and
catalogues of type specimens, the works on the molecular
phylogeny without taxonomic interpretation of results, in-
formation about local floristic records (new taxa to the flo-
ras of minor regions and specially protected natural areas).
Indexed by Russian Science Citation Index.
The five-year impact factor is 0.122.
Languages: Russian and English
Periodicity: 1 volume per year
Юбилейные даты нашего журнала
Anniversaries of our journal
Д. В. Гельтман, М. В. Легченко,
И. В. Соколова, И. В. Татанов
Ботанический институт им. В. Л. Комарова РАН
Гербарий высших растений
ул. Профессора Попова, 2, Санкт-Петербург, 197376, Россия
novitates@binran.ru
D. V. Geltman, M. V. Legchenko,
I. V. Sokolova, I. V. Tatanov
Komarov Botanical Institute, Russian Academy of Sciences
Herbarium of Higher Plants
Professora Popova Str., 2, St. Petersburg, 197376, Russia
novitates@binran.ru
https://doi.org/10.31111/novitates/2019.50.5
Аннотация. В 2019 г. журнал «Новости систематики высших растений» отмечает двойной юбилей: выход 50-го тома и
столетие с начала серии «Ботанические материалы Гербария Главного ботанического сада РСФСР» — его предшествен-
ника. «Ботанические материалы...» были основаны в 1919 г. и выходили (с перерывами) до 1963 г. Редакторами издания
были выдающиеся русские ботаники Б. А . Федченко, В. Л. Комаров, Б. К . Шишкин. Было опубликовано 22 тома, со-
держащих 756 статей и заметок, а также один справочный том. «Новости систематики высших растений» стали преем-
ственным продолжением «Ботанических материалов...», они выходили под редакцией И. А. Линчевского, В. И . Грубова,
Т. В. Егоровой, Н. Н. Цвелёва. В нынешней ситуации редакция «Новостей систематики высших растений» стремится
найти место журнала в отечественной и мировой системе ботанической периодики, добиться включения его в авторитет-
ные международные системы цитирования. Сохраняя традиции, мы стремимся все более соответствовать современному
стилю международных изданий по систематике сосудистых растений.
Ключевые слова: систематика сосудистых растений, научные журналы, российская ботаника, история ботаники.
Abstract. In 2019, our journal celebrates a double anniversary: the publication of 50th volume and the centenary of the begin-
ning of its predecessor — the series “Notulae systematicae ex Herbario Horti botanici Petropolitani” (= “Botanicheskiye ma-
terialy Gerbariya Glavnogo botanicheskogo sada RSFSR”). “Notulae systematicae...” was founded in 1919 and was published
(intermittently) until 1963. Outstanding Russian botanists B. A . Fedtschenko, V. L . Komarov, B. K . Schischkin were its editors.
22 volumes containing 756 articles and notes (plus reference volume) were published. “Novitates systematicae plantarum vas-
cularium” (= “Novosti sistematiki vysshikh rastenii”) became a natural continuation of the “Notulae systematicae...”, the series
was edited by I. A . Linczevski, V. I. Grubov, T. V. Egorova, N. N . Tzvelev. Nowadays, the editorial board seeks to find the place of
the journal in the Russian and world system of botanical periodicals, to ensure its inclusion in authoritative international cita-
tion systems. Keeping traditions, we strive to more correspond to the modern style of international publications on the vascular
plants taxonomy.
Keywords: vascular plants taxonomy, scientific journals, Russian botany, history of botany.
У нашего журнала в этом году двойной юбилей:
выходит 50-й том «Новостей систематики высших
растений», а также исполняется 100 лет с начала
выхода серии «Ботанические материалы Гербария
Главного ботанического сада РСФСР» — его пред-
шественника.
«Ботанические материалы...» появились в труд-
ное время для страны и Ботанического сада, толь-
ко что ставшего из Императорского ботанического
сада Петра Великого Главным ботаническим садом
РСФСР1. Несмотря на сложные условия граждан-
1 Надо отметить, что идея такого издания возникла раньше.
В 1915 г. совет Ботанического сада одобрил идею издания
«Ботанические материалы Гербария Императорского
ботанического сада Петра Великого», которое выходило бы
Д.В.Гельтман, М. В. Легченко, И. В. Соколова, И. В. Татанов
D.V.Geltman, M.V.Legchenko, I.V.Sokolova, I.V.Tatanov
This year, our journal celebrates a double anniversary:
the 50th volume of “Novitates systematicae plantarum
vascularium” (= “Novosti sistematiki vysshikh rastenii”)
comes out, and the centenary of launching its predecessor,
the serial “Notulae systematicae ex Herbario Horti botani-
ci Petropolitani” (= “Botanicheskiye materialy Gerbariya
Glavnogo botanicheskogo sada RSFSR”) is marked.
“Notulae systematicae...” appeared in a hard time for
both the country and the Botanical Garden, which just
had gone from the Imperial Peter the Great Botanical
Garden to the Principal Botanical Garden of the RSFSR1
1 It should be noted that the idea of such an edition emerged
earlier. In 1915 the Council of the Botanical Garden approved
the concept of “Botanicheskiye materialy Gerbariya Impera-
torskogo botanicheskogo sada Petra Velikogo», which would
2019
50: 5–13
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
Поступила в редакцию | Submitted: 29.06.2019
Принята к публикации | Accepted: 10.12.2019
ской войны и разрухи, исследования в его Гербарии
продолжались. Традиционные издания сада («Тру-
ды» и «Известия»), хотя и выходили, но с большими
задержками и в значительно уменьшенном объеме.
Поэтому потребовалось новое продолжающееся из-
дание, в котором могли бы оперативно публико-
ваться полученные результаты. Появлению такого
издания способствовал и субъективный фактор: Бо-
танический сад сумел приобрести небольшой пе-
чатный станок (просуществовавший чуть ли не до
начала 1970-х гг.), на котором и были отпечатаны
первые, очень тонкие книжечки «Ботанических ма-
териалов».
Редактором нового издания стал Б. А. Федченко —
главный ботаник, руководитель Гербария сада. Как он
отмечал во введении к первому тому, главная задача
«Ботанических материалов» — «возможно быстрое
опубликование новых видов». И эта задача выполня-
лась, поскольку издание выходило отдельными выпу-
по мере накопления материала. В этом же году в его первом
выпуске воспроизведена работа Б. А . Федченко «Список
сорных растений Туркестана», которая впервые была
опубликована ранее в издании «Русский ботанический
журнал» (1914, No 2–4). Текст и верстка обоих вариантов
этой работы идентичны, т. е . фактически это был отдельный
оттиск уже опубликованной работы. Причины такой
повторной публикации неясны.
В 1919 г. была начата новая нумерация выпусков и
изменен профиль издания, главной целью которого стала
публикация описаний новых видов.
(Russian Soviet Federative Socialist Republic). Despite
difficult circumstances of the Civil War (1917–1922) and
economic destruction, its Herbarium staff was continu-
ing research. Traditional periodicals of the Garden (“Acta
Horti Petropolitani” (= “Trudy Glavnogo botanichesk-
ogo sada”) and “Bulletin du Principal jardin botanique
de la République Russe” (= “Izvestiya Glavnogo bo-
tanicheskogo sada RSFSR”)), though were published,
but severely delayed and in essentially reduced amount.
There was therefore a need for a new serial to publish
obtained results promptly. The appearance of such an
edition was also promoted by a subjective factor: the Bo-
tanical Garden managed to acquire a small printing press
(being in operation almost till early 1970s), which was
used to print first, very thin booklets of “Notulae system-
aticae”.
The new edition was headed by Boris Fedtschenko,
the principal botanist, the chief of the Herbarium of
the Garden. He noticed in the Preface to the 1st
vol-
be issued as the materials were gathered. Its first issue of the
same year contained the reproduced work by B. A. Fedtschen-
ko “Spisok sornykh rastenii Turkestana [List of weeds of Turke-
stan]”, which was first published earlier, in the serial “Journal
Russe de Botanique” (“Russkii botanicheskii zhurnal”, 1914,
No 2–4). The text and page design of the both papers are iden-
tical, i. e. it was in fact the reprint of the published work. The
reasons for this republishing are unclear.
In 1919, a new numbering of the issues was restarted, and the
scope of the serial changed; the publication of the descriptions
of new species became its main purpose.
Редакторы серии «Ботанические материалы Гербария Главного ботанического сада РСФСР» (1919–1926) — «Ботаниче-
ские материалы Гербария Ботанического института АН СССР» (1937–1963).
Editors of “Notulae systematicae ex Herbario Horti botanici Petropolitani” (1919–1926) — “Notulae systematicae ex Herbario
Instituti botanici Academiae scientiarum URSS” (1937–1963).
Б. А. Федченко
B. A. Fedtschenko
В. Л. Комаров
V. L. Komarov
Б. К. Шишкин
B. K. Schischkin
Д.В.Гельтман, М. В. Легченко, И. В. Соколова, И. В. Татанов
D.V.Geltman, M.V.Legchenko, I.V.Sokolova, I.V.Tatanov
Новости систематики высших растений | Том 50 | 2019
6
сками, которые затем объединялись в том. Первона-
чально каждый выпуск (в первом томе их было 7, во
втором — 48, в третьем — 50) включал только одну пу-
бликацию. Первым увидело свет описание Hedysarum
olgae B. Fedtsch. во втором выпуске (первый выпуск
содержал только введение и вышел позже второго),
на котором указана дата 15 мая 1919 г. Во втором и
последующих томах наряду с описаниями новых так-
сонов появились критические заметки и данные об
интересных новых флористических находках.
Выпуски первых шести томов выходили в 1919–
1926 гг. достаточно регулярно. Однако по непонят-
ным причинам во второй половине 1926 г. издание
было приостановлено (вышли 3 выпуска) и возоб-
новлено только в 1937 г. под названием «Ботаниче-
ские материалы Гербария Ботанического института
АН СССР» и под редакцией В. Л. Комарова1. Было
принято несколько иное оформление статей, кото-
рое без существенных изменений сохранялось до
прекращения издания в 1963 г. В томе было 12 вы-
пусков, они продолжали оставаться сравнительно
небольшими, содержащими 1–3 статьи. Фактически
тт. 7–9 выходили в 2–3 книжках, но каждый выпуск
имел самостоятельный титульный лист. Первые три
выпуска 9 тома вышли в 1941 г., а остальные — после
окончания войны, в 1946 г.
1 В справочных материалах, изданных в 1962 г. (Бота-
нические материалы..., 1962. Указатели и библиография к
томам 1–20), указано, что В. Л . Комаров возглавил издание
с т. 6 (1926 г.), однако на всех трех выпусках этого тома
редактором указан Б. А . Федченко.
ume, that the main task of “Notulae systematicae” was
“publication of new species as soon as possible”. And
this task was implemented, since the edition was issued
in fascicles, which then were gathered in a volume. Ini-
tially, each fascicle (the 1st
volume consisted of 7 fasci-
cles, the 2nd one of 48, the 3rd of 50) contained only one
paper. The description of Hedysarum olgae B. Fedtsch.
was the first to see the light in the 2nd fascicle dated 15
May 1919 (1st
fascicle contained only the Preface, and
appeared later than the 2nd one). The second and sub-
sequent volumes contained, along with descriptions of
new taxa, critical notes and data on noteworthy new
floristic records.
The fascicles of first six volumes were published in
1919–1926 quite regularly. However, for unclear reasons
the edition was suspended in the second half of 1926
(3 fascicles were issued), and only in 1937 was resumed
with the title “Notulae systematicae ex Herbario Insti-
tuti botanici Academiae scientiarum URSS” (= “Bo-
tanicheskiye materialy Gerbariya Botanicheskogo In-
stituta Akademii nauk SSSR”) under the editorship of
Vladimir Komarov1. Somewhat different design of the
papers was adopted, which was maintained without es-
sential modifications until the cessation of the serial in
1963. A volume consisted of 12 fascicles, they continued
1 It is mentioned in the reference volume published in 1962
(Botanicheskiye materialy..., 1962. Indices et bibliographia ad
tomos 1–20), that the edition was headed by V. L . Komarov
since the 6th volume (1926); however, it is B. A . Fedtschenko
who is specified as the editor on all three fascicles of that vol-
ume.
Редакторы издания «Новости систематики высших растений» (1964–1978).
Editors of “Novitates systematicae plantarum vascularium” (1964–1978).
И. А. Линчевский
I. A. Linczevski
С. К. Черепанов
S. K. Czerepanov
И. Т. Васильченко
I. T. Vassilczenko
Юбилейные даты нашего журнала
Anniversaries of our journal
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
7
С 1947 г. «Ботанические материалы» стали выхо-
дить как одна книга, не разделенная на выпуски. Ре-
дактором издания стал Б. К. Шишкин1. Надо отме-
тить, что с этого же тома в статьях стали появляться
отдельные списки литературы, тогда как ранее ли-
тературные источники обычно приводились непо-
средственно в тексте. Издание практически стало
ежегодным, хотя не выходило в 1949, 1956, 1958 гг.
Последний, 22 том вышел в 1963 г., уже после кон-
чины Б. К. Шишкина.
В 1962 г. был подготовлен справочный том к тт.
1–20 «Ботанических материалов». Он содержит
библиографические справки обо всех томах и вы-
пусках, сведения об изменении названия издания,
данные о редакторах, тираже, а также алфавитные
указатели всех работ, авторов (в латинской транс-
крипции) и упомянутых таксонов, при этом вновь
описанные таксоны отмечены полужирным шриф-
том. Также приведен указатель авторов при названи-
ях таксонов — первый указатель такого рода в отече-
ственной литературе.
«Ботанические материалы» сыграли чрезвычайно
важную роль в формировании стандартов описания
новых видов и таксономических публикаций в целом
в русскоязычной ботанической литературе. Как пра-
вило, в таких статьях на русском и латинском языках
приводилось подробное описание нового таксона,
1 Скорее всего, фактическое руководство изданием
Б. К. Шишкин осуществлял и ранее, в связи с большой
занятостью В. Л . Комарова работой в должности президента
АН СССР.
to be relatively small, containing 1–3 articles. In fact,
the vols. 7–9 were issued in 2–3 booklets, though each
fascicle had its own title page. The first three fascicles
of the vol. 9 were published in 1941, and the remaining
ones after the Second World War, in 1946.
Since 1947, “Notulae systematicae” were published as
a single book, not separated in fascicles. Boris Schisch-
kin became its Editor1. It should be noted that since this
volume, “References” as separate items of articles began
to appear, whereas previously cited literature sources
were usually referred to directly in the text. The serial
practically became an annual, though was not published
in 1949, 1956, and 1958. The last, 22
nd volume was issued
in 1963, after the Schischkin’s death.
In 1962, the reference volume to vols. 1–20 of “Not-
ulae systematicae” was compiled. It comprises biblio-
graphical information on all the volumes and fascicles,
on consecutive changes of the title, on the editors, cir-
culation, as well as alphabetical indexes of all the arti-
cles, authors (in Roman transliteration) and mentioned
taxa, newly described taxa being printed in bold. There
is also an index of the author’s names with their abbre-
viations cited at the taxa names, the first index of this
kind in the domestic literature.
“Notulae systematicae” have played a crucial role
in setting standards of description of new species and
taxonomic publications in general in Russian-language
1 Most probably, B. K . Schischkin took on the actual man-
agement of the edition earlier, due to heavy engagement of
V. L . Komarov as a President of the Academy of Sciences of
the USSR.
Редакторы издания «Новости систематики высших растений» (1979–2014).
Editors of “Novitates systematicae plantarum vascularium” (1979–2014).
В. И. Грубов
V. I. Grubov
Т. В. Егорова
T. V. Egorova
Н. Н. Цвелёв
N. N. Tzvelev
Д.В.Гельтман, М. В. Легченко, И. В. Соколова, И. В. Татанов
D.V.Geltman, M.V.Legchenko, I.V.Sokolova, I.V.Tatanov
Новости систематики высших растений | Том 50 | 2019
8
тип его названия, родство. Опыт, который накапли-
вался в процессе редактирования, способствовал
развитию культуры ботанической латыни в СССР,
передаче опыта в этом непростом деле: первые редак-
торы знали латынь еще с дореволюционных гимна-
зических времен и передавали свои знания и умения
более молодым коллегам, этот язык уже специально
не изучавшим. Всего в 22 томах «Ботанических ма-
териалов» было опубликовано 756 статей и заметок,
принадлежащих 189 авторам. Наиболее активными
из них были М. М. Ильин (36 публикаций), И. Т. Ва-
сильченко и Б. А. Федченко (по 26), А. И. Поярко-
ва (25), Н. В. Шипчинский и С. В. Юзепчук (по 20),
М. Г. Попов (19), В. Н. Васильев и Е. Г. Победимо-
ва (по 18), В. П. Бочанцев и Р. Ю. Рожевиц (по 17),
А. Г. Борисова и А. И. Толмачёв (по 16).
«По образу и подобию» ленинградских «Ботани-
ческих материалов» возникли похожие издания в
Алма-Ате, Ташкенте, Тбилиси и Томске.
Столь успешное издание имело все шансы для
продолжения, однако, насколько можно судить,
стало жертвой изменения советских издательских
стандартов. По воспоминаниям Н. Н. Цвелёва, при
очередной реформе научного книгоиздания было ре-
комендовано исключить из названий периодических
и продолжающихся изданий наименования научных
учреждений и их подразделений.
С 1964 г. Ботанический институт им. В. Л. Ко-
марова АН СССР (БИН) стал издавать новую еже-
годную серию, получившую название «Новости
систематики высших растений». В предисловии к
первому тому отмечено, что «в отношении своего
профиля Новости систематики высших растений
должны составить естественное продолжение вы-
пускавшихся ранее Ботанических материалов Гер-
бария Ботанического института им. В. Л. Комарова
АН СССР»1. На первых пяти томах (1964–1968) не
указывался их номер, основным идентификатором
был год (возможно, это тоже было требованием из-
дательских инструкций), что создавало ряд неу-
добств, особенно в том случае, когда фактически том
выходил уже в следующем году. С 1969 г. (т. 6) нуме-
рация томов все же появилась.
Руководство изданием «Новостей систематики
высших растений» осуществляли выдающиеся оте-
чественные ученые, как правило — хорошие знатоки
ботанической номенклатуры. В 1964–1968 гг. редак-
тором издания был И. А. Линчевский, его замести-
телем в 1965–1968 гг.
—
С. К. Черепанов. С 1965 г.
1 Аналогичная судьба постигла другое издание БИНа —
«Ботанические материалы Отдела споровых растений»,
которое стало называться «Новости систематики низших
растений».
botanical literature. Usually, such articles contained a
detailed description of a new taxon, its type and affin-
ity in both Russian and Latin languages. The experi-
ence that had evolved during the editing process pro-
moted the development of a culture of botanical Latin
in the USSR, and the transfer of expertise in this com-
plicated subject: the first editors knew Latin from their
pre-revolutionary gymnasium education, and trans-
ferred their knowledge and skills to their younger col-
leagues, who did not learned this language. In total, 22
volumes of “Notulae systematicae” contain 756 articles
and notes by 189 authors. The most active among them
were Modest Iljin (36 publications), Ivan Vassilczenko
and Boris Fedtschenko (26 publications each), Anto-
nina Pojarkova (25), Nikolai Schipczinzky and Sergei
Juzepczuk (20 each), Mikhail Popov (19), Viktor Vas-
siljev and Evgeniya Pobedimova (18 each), Viktor
Botschantzev and Roman Roshevitz (17 each), Anto-
nina Borissova and Alexander Tolmatchew (16 each).
“In the image, after the likeness” of the Leningrad
“Notulae systematicae”, there appeared similar editions
in Alma-Ata, Tashkent, Tbilisi and Tomsk.
Such a successful edition had a good chance for con-
tinuation. It appears, however, that it fell victim to the
change of the Soviet publishing standards. As Nikolai
Tzvelev recollected, another reform of scientific pub-
lishing recommended to exclude the names of research
institutions and their departments from the titles of pe-
riodicals and serials.
Since 1964, the Komarov Botanical Institute has
been publishing a new annual serial titled “Novitates
systematicae plantarum vascularium” (=
“Novosti
sistematiki vysshikh rastenii”). The Preface to the 1st
volume runs: “concerning its scope, Novosti sistematiki
vysshikh rastenii should serve a natural extension of pre-
viously published Botanicheskiye materialy Gerbariya
Botanicheskogo instituta Akademii nauk SSSR”1
.
The
first five volumes (1964–1968) had no numbers, with a
year served as a main identifier (probably this also was
a provision of publishing instructions), that caused in-
conveniences, especially when a volume was in fact is-
sued in the next year. Since 1969 (vol. 6), the number-
ing of volumes was added.
The edition “Novitates systematicae plantarum
vascularium” was guided by distinguished Russian
scientists, usually experts in botanical nomenclature.
Its Editor in 1964–1968 was Igor Linczevski, and the
Deputy Editor in 1965–1968 was Sergei Czerepanov.
Since 1965, there listed was an editorial staff, which
usually numbered 3–6 persons, including the Editor
1 A similar fate befell another edition by the Komarov Botani-
cal Institute, “Botanicheskiye materialy Otdela sporovykh ras-
tenii...” renamed to “Novosti sistematiki nizshikh rastenii”.
Юбилейные даты нашего журнала
Anniversaries of our journal
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
9
стал указываться состав редакции издания, в кото-
рую обычно входили 3–6 человек, включая редак-
тора и секретаря. В 1969 г. главным редактором се-
рии стал И. Т. Васильченко; должность заместителя
редактора была упразднена, но появилось указание
на «редактора тома», которым в 1969–1979 гг. был
Н. Н. Цвелёв. На практике именно редактор тома
выполнял всю основную работу по редактированию.
Следующее изменение состава редакции произошло
в 1979 г.: главным редактором стал В. И. Грубов, а
редактором тома — Т. В. Егорова, которая вошла в
состав редакции еще в 1969 г. В 1988 г. она стала от-
ветственным редактором серии и была также редак-
тором тома, возглавляла издание 20 лет — до своей
кончины в 2007 г. С 2009 г. ответственным редак-
тором стал Н. Н. Цвелёв, хорошо знакомый со спе-
цификой издания, а с 2015 г. — Д. В. Гельтман.
По мере необходимости, в связи с изменениями,
вносимыми в Международный кодекс ботанической
номенклатуры, несколько модифицировалась и схе-
ма описания новых таксонов. В частности, с 1966 г.
обязательным требованием стало указание акронима
гербарной коллекции, в которой хранится цитируе-
мый образец. Для унификации описаний в «Ново-
стях систематики высших растений» периодически
публиковались различные справочные материалы,
иногда они занимали весь том (как, например, в
1968 г.). С т. 13 (1976) для повышения достоверно-
сти данных о новых флористических находках обя-
зательным требованием стала присылка в Гербарий
БИНа подтверждающих гербарных образцов.
В 1964–1992 гг. издание выходило ежегодно, хотя
фактический выход в свет иногда приходился и на
первые месяцы следующего года. Допечатную под-
готовку и печать в этот период обеспечивало Ле-
нинградское отделение издательства «Наука» и его
типография, тогда располагавшие очень квалифици-
рованными кадрами.
Ситуация изменилась в начале 1990-х годов, по-
сле прекращения централизованного финансирова-
ния научного книгоиздания. В 1992 и 1994–1995 гг.
«Новости систематики высших растений» не выхо-
дили. Затем на протяжении 1996–2012 гг. (тт. 30–43)
издание серии практически ежегодно поддержива-
лось издательскими грантами Российского фонда
фундаментальных исследований. Тома выходили
в различных издательствах: «Мир и семья», Санкт-
Петербургской
химико-фармацевтической
ака-
демии, «Товариществе научных изданий КМК».
С 2013 г. (т. 44) издателем является Ботанический
институт им. В. Л. Комарова РАН, который переуч-
редил «Новости систематики высших растений» как
свое периодическое издание и взял на себя обеспече-
and the Secretary. In 1969, Ivan Vassilczenko became
the Chief Editor of the serial; the post of Deputy Edi-
tor was abolished, but the Volume Editor was indi-
cated, the duty performed in 1969–1979 by Nikolai
Tzvelev. In practice, it was the Volume Editor who car-
ried out the bulk of editorial work. The next change
in the editorial staff occurred in 1979, when Valery
Grubov became the Chief Editor, and Tatiana Egorova,
who had been in the editorial staff from 1969, became
the Volume Editor. Since 1988, she acted as both the
Chief Editor of the serial and the Volume Editor, and
headed the edition for 20 years, until her decease in
2007. Since 2009 the edition was led by N. N. Tzvelev,
who was very familiar with its specificity, and from
2015 on by Dmitry Geltman.
As and when necessary, in response to changes in
the International Code of Botanical Nomenclature, the
standard of describing new taxa was somewhat modi-
fied. In particular, since 1966 it was necessary to cite
the acronym of the collection where the cited specimen
was conserved. To harmonize descriptions, “Novitates
systematicae plantarum vascularium” periodically pub-
lished various reference materials, sometimes taking
up the whole volume (as, for example, in 1968). From
vol. 13 (1976), to improve the reliability of information
on new floristic records, it became necessary to send
voucher specimens to LE Herbarium.
In 1964–1992 the edition was published annually,
though an actual release sometimes took place in first
months of the next year. At that time, prepress and
printing processes were carried out by the Leningrad
Branch of “Nauka” Publishing House and its printing
house, which possessed highly skilled personnel.
The situation changed in early 1990s, following the
withdrawal of centralized funding of scientific publish-
ing. In 1992 and 1994–1995, “Novitates systematicae
plantarum vascularium” did not see the light. Then,
over 1996–2012 (vols. 30–43) the publication of the
serial almost every year was supported by publishing
grants from the Russian Foundation for Basic Research.
The volumes were issued by different publishers: “Mir i
Semia”, St. Petersburg Chemical Pharmaceutical Acad-
emy, “KMK Scientific Press”. Since 2013 (vol. 44), the
Komarov Botanical Institute has been the publisher:
the Institute has re-founded “Novitates systematicae
plantarum vascularium” as its periodical, and took over
the provision of the Editorial Board work, prepress and
expenses for printing.
In 2017 (vol. 48) substantial changes were made
in the design of the articles and the edition as a whole,
to bring them closer to a traditional journal format.
With the emergence of “Scientific Electronic Library”
(www.elibrary.ru), a digital version has been placed
Д.В.Гельтман, М. В. Легченко, И. В. Соколова, И. В. Татанов
D.V.Geltman, M.V.Legchenko, I.V.Sokolova, I.V.Tatanov
Новости систематики высших растений | Том 50 | 2019
10
ние функционирования редакции, допечатную под-
готовку и расходы по печати.
В 2017 г. (с т. 48) существенно изменен дизайн из-
дания и оформление статей, они приближены к тради-
ционному журнальному формату. С появлением «На-
учной электронной библиотеки» (www.elibrary.ru) на
ее платформе стала размещаться электронная версия
издания. В настоящее время там размещены полно-
текстовые версии томов (с разбивкой по статьям),
начиная с т. 34 (2003). Полнотекстовая версия с т. 40
(2008) доступна также на сайте Ботанического инсти-
тута им. В. Л. Комарова РАН (www.binran.ru/journals/
novitates), планируется разместить и более ранние
тома. С 2018 г. начато присвоение цифрового иден-
тификатора объекта — индекса DOI (Digital object
identifier) всем статьям, публикуемым во вновь выхо-
дящих томах. Полные тексты «Ботанических материа-
лов...» и «Новостей систематики высших растений»
(без разбивки по статьям) имеются также на сайте фун-
даментальной электронной библиотеки «Флора и фау-
на» (http://ashipunov.info/shipunov/school/sch-ru.htm).
Всего в 50 томах «Новостей систематики высших
растений» опубликовано 1548 статей, принадлежа-
щих 488 авторам. Наиболее активными из них явля-
ются Н. Н. Цвелёв (121 публикация), В. П. Бочан-
цев и Т. В. Егорова (по 43), И. Т. Васильченко (33),
Н. С. Пробатова (28), Д. В. Гельтман и М. А. Михай-
лова (по 26), С. С. Иконников (23), Р. В. Камелин
и Т. В. Крестовская (по 22), В. В. Бялт, Н. Н. Имха-
ницкая и Г. А. Лазьков (по 21), В. М. Виноградова и
О. В. Чернева (по 19), Е. Б. Алексеев и И. О. Бузуно-
ва (по 18), И. А. Линчевский (17), И. А. Грудзинская
и Е. Г. Победимова (по 15).
В журнале описаны 1669 новых таксонов: 3 се-
мейства, 61 род (в том числе 9 нотородов), 1289 ви-
дов и нотовидов, 118 подвидов, 182 разновидности
и 16 форм. Первую тройку по числу описанных ви-
дов и нотовидов составляют роды Oxytropis (73), Poa
(59) и Taraxacum (35). Обнародованы также 1549
номенклатурных комбинаций и названий в новом
ранге: 9 родов, 852 вида, 499 подвидов, 178 разно-
видностей, 11 форм. Значительно также число вновь
описанных внутриродовых (863) и внутрисемей-
ственных (13) таксонов.
«Новости систематики высших растений» — одно
из немногих изданий в России, в котором приняты
самые высокие стандарты рецензирования и редак-
тирования материалов с точки зрения соответствия
современным нормам ботанической номенклатуры.
Разумеется, это не исключает отдельных ошибок и
неточностей, однако каждый такой случай является
для редакции предметом внимательного анализа и
уроком на будущее.
on its platform. At present, the full-text versions
of the volumes (divided into articles), from vol. 34
(2003) on are placed there. The full-text versions from
vol. 40 (2008) on are also available on the site of the
Komarov Botanical Institute (www.binran.ru/journals/
novitates), earlier volumes are planned to place there
as well. Since 2018, all the articles in newly published
volumes are given digital object identifiers (DOI).
Full texts of “Notulae systematicae” and “Novitates
systematicae plantarum vascularium” (not divided into
articles) are available on the site of the fundamental
electronic library “Flora and Fauna” (http://ashipunov.
info/shipunov/school/sch-ru.htm).
In total, in 50 volumes of “Novitates systematicae
plantarum vascularium” there are 1548 articles by 488
authors. The most active among them were Nikolai
Tzvelev (121 publications), Viktor Botschantzev
and Tatiana Egorova (43 publications each), Ivan
Vassilczenko (33), Nina Probatova (28), Dmitry Geltman
and Marina Mikhailova (26 each), Sergei Ikonnikov
(23), Rudolf Kamelin and Tatiana Krestovskaya (22
each), Vyacheslav Byalt, Nadezhda Imkhanitskaya
and Georgy Lazkov (21 each), Vera Vinogradova
and Olga Tscherneva (19 each), Evgenii Alexeev and
Irina Buzunova (18 each), Igor Linczevski (17), Irina
Grudzinskaya and Evgeniya Pobedimova (15 each).
There are 1669 new taxa described in the journal:
3 families, 61 genera (including 9 nothogenera), 1289
species and nothospecies, 118 subspecies, 182 variet-
ies and 16 forms. The top three genera by the num-
ber of described species and nothospecies are Oxytro-
pis (73), Poa (59) and Taraxacum (35). Also there are
1549 published nomenclatural combinations and names
in new ranks: 9 genera, 852 species, 499 subspecies,
178 varieties, 11 forms. The number of described infra-
generic (863) and infrafamiliar (13) taxa is substantial
as well.
“Novitates systematicae plantarum vascularium”
is one of the few editions in Russia with the highest
standards of reviewing and editing manuscripts in
terms of their compliance with current provisions of
botanical nomenclature. Of course, his does not exclude
some errors and inconsistencies, each case becomes a
subject for thorough analysis by the editors and a lesson
for the future.
The editorial process is managed by a suffi-
ciently compact Editorial Board (D. V. Geltman —
Chief editor, I. V. Sokolova — Deputy chief editor,
I. V. Tatanov — Executive editor, M. V. Legchenko —
Secretary) and an international Editorial Council (sci-
entists from Armenia, Belarus, Czech Republic, Po-
land, Russia, Slovakia, Ukraine, USA). All members
of the Editorial Board and the Editorial Council are
Юбилейные даты нашего журнала
Anniversaries of our journal
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
11
Руководство издательским процессом обеспе-
чивает достаточно компактная редакционная кол-
легия (Д. В. Гельтман — ответственный редактор,
И. В. Соколова — заместитель ответственного ре-
дактора, И. В. Татанов — исполнительный редактор,
М. В. Легченко — ответственный секретарь) и меж-
дународный редакционный совет (входят ученые из
Армении, Белоруссии, Польши, России, Словакии,
США, Украины, Чехии). Все члены редакционной
коллегии и редакционного совета являются извест-
ными ботаниками-систематиками, авторитетными
знатоками правил ботанической номенклатуры. Ре-
шение о публикации принимается редколлегией на
основании результатов одностороннего слепого ре-
цензирования двумя рецензентами, в спорных случа-
ях привлекаются члены редакционного совета. Поль-
зуясь случаем, редакция сердечно благодарит своих
рецензентов, работающих во многих городах России
(Санкт-Петербург, Москва, Новосибирск, Томск,
Владивосток, Иркутск, Тольятти и др.) и в зарубеж-
ных странах (Армения, Белоруссия, Великобритания,
Киргизия, Китай, США, Словакия, Украина, Фин-
ляндия). Подготовку оригинал-макета вот уже более
20 лет обеспечивает Т. А. Горлина — непревзойденный
специалист в области верстки ботанических изданий.
В нынешней ситуации редакция «Новостей си-
стематики высших растений» стремится найти ме-
сто журнала в отечественной и мировой системе
ботанической периодики. Сделать это непросто как
из-за высокой конкуренции за хорошего автора, так
и по ряду субъективных причин, в первую очередь
well-known taxonomists of vascular plants, authori-
tative experts in botanical nomenclature. The deci-
sion on publication is taken by the Editorial Board on
the base of the results of single-blind peer review by
two reviewers, involving the members of the Edito-
rial Council in controversial cases. The Editorial Board
takes this opportunity to express cordial thanks to our
reviewers working in many places of Russia (St. Pe-
tersburg, Moscow, Novosibirsk, Tomsk, Vladivostok,
Irkutsk, Tolyatti and others) and abroad (Armenia,
Belarus, China, Finland, Great Britain, Kyrgyzstan,
Slovakia, Ukraine, USA). For more than 20 years now,
camera-ready copies have been composed by Tatiana
Gorlina, the unsurpassed master of making-up botani-
cal books and periodicals.
In the current situation, the editors of “Novitates
systematicae plantarum vascularium” are seeking to
find the place of the journal in the Russian and inter-
national systems of the botanical periodicals. This is
Редакционная коллегия, 2019 г. (слева направо): И. В. Татанов, И. В. Соколова, Д. В. Гельтман, М. В. Легченко.
Editorial board, 2019 (from left to right): I. V. Tatanov, I. V. Sokolova, D. V. Geltman, M. V. Legchenko.
Д.В.Гельтман, М. В. Легченко, И. В. Соколова, И. В. Татанов
D.V.Geltman, M.V.Legchenko, I.V.Sokolova, I.V.Tatanov
Новости систематики высших растений | Том 50 | 2019
12
из-за определенной дискриминации ежегодных из-
даний различными библиометрическими системами,
а также особенностей цитирования таксономических
публикаций. Несмотря на это, редакция надеется со
временем добиться того, чтобы «Новости системати-
ки высших растений» стали еще более авторитетным
и по-настоящему международным изданием и вошли
в основные международные системы цитирования.
Для этого редакция будет и далее усиливать требо-
вательность к рукописям на стадии рецензирования
и редактирования, сохраняя при этом неизменно
доброжелательное отношение к авторам. Постепен-
но меняется и характер подачи материала: сохраняя
традиции, мы стремимся все более соответствовать
современному стилю международных изданий по си-
стематике сосудистых растений.
Мы надеемся, что издание, начало которому
было положено 100 лет тому назад, будет и далее
успешно развиваться, опираясь на лучшие традиции
русской таксономической школы. Это зависит от на-
шей общей совместной работы: редакции, авторов и
рецензентов.
not an easy task because of both high competition for
good authors, and a number of subjective causes, in
particular for a certain discrimination of annual edi-
tions by different bibliometric systems, as well as for
specificity of citation of taxonomic publications. De-
spite this, the Editorial Board hopes, in time, to make
“Novitates systematicae plantarum vascularium” even
more authoritative and a really international edition,
and include it into international citation systems. To
achieve this, the Editorial Board will further increase
demands on the manuscripts at the stages of review-
ing and editing, while maintaining an invariably posi-
tive attitude towards our authors. The character of the
material submission is also gradually changing: while
preserving our traditions, we are seeking to meet the
contemporary style of international publications on the
taxonomy of vascular plants.
We hope that the edition initiated 100 years ago will
continue its successful development, drawing on the
best traditions of the Russian taxonomic school. This
depends upon our common work in collaboration: edi-
tors, authors and reviewers.
Юбилейные даты нашего журнала
Anniversaries of our journal
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
13
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae)
с Дальнего Востока России и из Восточной Сибири
New taxa in Agrostis, Deschampsia, Hyalopoa and Poa (Poaceae) from the Russian
Far East and East Siberia
Н. С. Пробатова
Федеральный научный центр биоразнообразия наземной
биоты Восточной Азии Дальневосточного отделения РАН
Лаборатория ботаники
пр. 100-летия Владивостока, 159, Владивосток, 690022,
Россия
probatova@biosoil.ru
Н. С. Пробатова
N. S. Probatova
Federal Scientific Center of the East Asian Terrestrial Biodiversity,
Far Eastern Branch of the Russian Academy of Sciences
Laboratory of Botany
Stoletiya Vladivostoka Ave., 159, Vladivostok, 690022, Russia
probatova@biosoil.ru
https://doi.org/10.31111/novitates/2019.50.14
Аннотация. С Дальнего Востока России и из Восточной Сибири (Забайкалье, Якутия) описаны шесть новых для на-
уки таксонов злаков (Poaceae): с Командорских о-вов (о. Беринга, мыс Северо-Западный) — Deschampsia komandorensis
Prob. (sect. Deschampsia), с Авачинского вулкана на Камчатке — Agrostis × avatschensis Prob. (A. kudoi Honda × A. mertensii
Trin.), из Амурской области и Якутии — Poa archarensis Prob. (sect. Stenopoa), для которого установлено число хромосом
2n = 28, из Магаданской области — Poa × alexandrae Prob. (sect. Stenopoa), из Хабаровского края (бассейн р. Амгунь) —
Hyalopoa amgunensis Prob. (H. aggr. lanatiflora), из Забайкалья — Poa turgensis Prob. (sect. Stenopoa).
Ключевые слова: Poaceae, Дальний Восток, Командорские о-ва, Камчатка, Магаданская область, Амурская область, Ха-
баровский край, Восточная Сибирь, Забайкалье, Якутия, новые таксоны.
Abstract. Six new taxa in the family Poaceae are described from the Russian Far East and from East Siberia: Deschampsia kom-
andorensis Prob. (sect. Deschampsia) from Commander Islands (Bering Island, North-West Cape), Agrostis × avatschensis Prob.
(A. kudoi Honda × A. mertensii Trin.) from Avachinskii Volcano in Kamchatka, Poa archarensis Prob. (sect. Stenopoa) (revealed
chromosome number 2n = 28) from Amur Region and Yakutia, Poa × alexandrae Prob. (sect. Stenopoa) from Magadan Region,
Hyalopoa amgunensis Prob. (H. aggr. lanatiflora) from Khabarovsk Territory (Amgun River basin), Poa turgensis Prob. (sect.
Stenopoa) from Transbaikalia.
Keywords: Poaceae, Far East, Commander Islands, Kamchatka, Magadan Region, Amur Region, Khabarovsk Territory, East
Siberia, Transbaikalia, Yakutia, new taxa.
При дальнейшем изучении в Гербарии VLA мате-
риалов (в том числе новых сборов) по злакам (Poa-
ceae Barnhart) с Дальнего Востока России были вы-
явлены 6 не известных до сих пор таксонов в родах
Agrostis L., Deschampsia P. Beauv., Hyalopoa (Tzvelev)
Tzvelev и Poa L.; два из них — гибриды в родах
Agrostis и Poa. Их описания приводятся ниже.
1. Agrostis × avatschensis Prob., nothosp. nova
(A. mertensii Trin. × A. kudoi Honda). — Полевица ава-
чинская.
Differs from A. mertensii Trin. by dense tufts, narrow
and short leaf blades, convolute and scabrous on both
sides or flat and scabrous on upper surface, as well as nu-
merous panicles. From A. kudoi Honda differs by short
(0.6–0.8 mm) anthers and sometimes flat leaf blades.
Holotype (Fig. 1): Russia, Far East, «Kamchatka,
south-east [of the peninsula], Avachinskii Volcano, 21
VIII 1993, O. A. Chernyagina» (LE: LE 01065502).
Гибрид характеризуется густыми дерновинами,
узкими короткими пластинками листьев — сверну-
тыми и шероховатыми с обеих сторон или плоски-
ми и сверху шероховатыми; вегетативные побеги
короткие, многочисленные; репродуктивные побеги
c метелками также многочисленные, вдвое длиннее
вегетативных; веточки метелок гладкие; пыльники
0.6–0.8 мм дл. Имеются зерновки.
Голотип (рис. 1): Россия, Дальний Восток,
«Камчатка, юго-восток, вулкан Авачинская сопка, 21
VIII 1993, О. А. Чернягина» (LE: LE 01065502).
В целом и габитуально гибрид уклоняется к
A. kudoi, но при этом имеет признаки A. mertensii (на-
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 14–24
Поступила в редакцию | Submitted: 11.11.2019
Принята к публикации | Accepted: 28.11.2019
Рис. 1. Голотип Agrostis × avatschensis (LE 01065502).
Fig. 1. Holotype of Agrostis × avatschensis (LE 01065502).
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока России и из Восточной Сибири
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока России и из Восточной Сибири
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
15
Рис. 2. Голотип Deschampsia komandorensis (LE 01065505).
Fig. 2. Holotype of Deschampsia komandorensis (LE 01065505).
Н. С. Пробатова
Новости систематики высших растений | Том 50 | 2019
16
Рис. 3. Голотип Hyalopoa amgunensis (LE 01065501).
Fig. 3. Holotype of Hyalopoa amgunensis (LE 01065501).
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока России и из Восточной Сибири
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
17
пример, мелкие пыльники и иногда плоские, хотя и
укороченные, листовые пластинки).
2. Deschampsia komandorensis Prob., sp. nova
(sect. Deschampsia). — Щучка командорскаая.
Plant 30–36 cm, forming dense tufts, culms erect,
the lower internodes may elongate. Vegetative shoots
numerous, up to 20 cm long, reaching panicles, the pan-
icles may remain partly in their sheaths at the base. Leaf
blades up to 17 cm long, 1–2 mm wide, conduplicate
or flat, their upper surface scabrous, the lower surface
and the sheaths glabrous. Panicles up to 15 cm long,
with few spikelets on long scabrous branches, the latter
without spikelets in their proximal part. Spikelets up to
7.5 mm, with 3 florets. Glumes acute, glabrous, the up-
per glume 6.5(7) mm long. Lemmas 5.5 mm long, the
straight awn proceeds from the lower 1⁄3–1⁄4 of the lem-
ma, almost equal or exceeds it by 0.3–0.5 mm, hairs on
the callus are 1⁄4–1⁄5 of the lemma. Palea almost equal to
lemma. Anthers 1.6–1.7 mm. 2n = ?
Holotype (Fig. 2): Russia, Far East, Kamchat-
ka Territory, «Commander Islands, Bering Island,
S[evero]-Zapadnoye, swamp meadow, 30 VII 1975,
P. N. Lukashenko» (LE: LE 01065505).
Affinity. Differs from a coastal species D. berin-
gensis Hultén by elongated vegetative shoots reaching
very lax panicles, few but large spikelets in panicles, and
by ecology.
Растение 30–36 см выс., образует плотные дерно-
винки. Стебли прямостоячие, их нижние междоуз-
лия могут удлиняться. Вегетативные побеги много-
численные, до 20 см дл., достигают метелок, которые
могут не полностью выступать из влагалища. Пла-
стинки листьев до 17 см дл., 1–2 мм шир., вдоль сло-
женные или плоские, сверху шероховатые, снизу,
как и влагалища, гладкие. Метелки до 15 см дл., с не-
многочисленными колосками на длинных шерохо-
ватых веточках, веточки в проксимальной части без
колосков. Колоски до 7.5 мм дл., с 3 цветками. Коло-
сковые чешуи острые, гладкие, верхняя из них 6.5(7)
мм дл. Нижние цветковые чешуи 5.5 мм дл.; ость
прямая, выходит из нижней 1⁄3–1⁄4 части чешуи, поч-
ти равна или превышает свою чешую на 0.3–0.5 мм;
волоски каллуса равны 1⁄4–1⁄5 длины чешуи. Верхняя
цветковая чешуя почти равна нижней. Пыльники
1.6–1.7 мм дл. 2n = ?
Голотип (рис. 2): Россия, Дальний Восток,
Камчатский край, «Командорские острова, о. Берин-
га, С[еверо]-Западное, болотистый луг, 30 VII 1975,
П. Н. Лукашенко» (LE: LE 01065505).
Родство. Отличается от прибрежноморского
D. beringensis Hultén удлиненными вегетативными
побегами, достигающими очень рыхлых метелок,
немногочисленными крупными колосками, а также
особенностями местообитания (болотистые луга, а
не морские побережья).
Распространение. Командорские о-ва: о. Бе-
ринга (у мыса Северо-Западный).
Возможно, этот вид имеет родство с прибреж-
номорским балтийским D. bottnica (Wahlenb.)
Trin. (= D. cespitosa (L.) P. Beauv. subsp. bottnica
(Wahlenb.) Tzvelev), распространенным по берегам
Ботнического залива. Они сходны габитуально, но
у D. bottnica (образцы в Гербарии LE) ости вдвое
длиннее и колоски располагаются на веточках ме-
телок от их основания. Н. Н. Цвелёв (Tzvelev, 1976)
предполагал, что с D. bottnica также имеют род-
ство азиатские D. turczaninowii Litv., D. beringensis и
D. obensis Roshev. (последние два были им приняты
в ранге подвидов), являющиеся остатками древнего
литорального вида. Таковым, вероятно, является и
наш новый вид.
3. Hyalopoa amgunensis Prob., sp. nova (H. aggr.
lanatiflora (Roshev.) Tzvelev).
—
Плёнчатомятлик
амгуньский.
Plant 16–22 cm, with long rhizomes. Stems erect,
thin, glabrous and smooth, uppermost node is located in
lower 1⁄4–1⁄5 of the stem. Sheaths of stem leaves closed
for about 1⁄2 of their length, glabrous and smooth. Leaf
blades up to 2 mm wide, flat, glabrous and smooth. Lig-
ule of the uppermost leaf 0.7–1.2 mm. Panicles 5 cm
long, contracted or poorly spreading, more or less
dense, branches ca. 3 cm long, slightly flexuous, smooth
or with minute sparse spinules. Spikelets 3.8–5(5.5)
mm, with 2–3 florets, variegated; spikelet rachilla gla-
brous and smooth. Glumes 2.3–3 mm, lanceolate-ovate,
distinctly unequal, with 1–3 veins, on margins and at
the apex membranous, acute, in some spikelets with
short awn, sometimes with sparse minute spreading spi-
nules along keels. Lemmas 3.5–3.7 mm, with 5 slightly
conspicuous veins, membranous in the upper 1⁄3, hairy
along keel and marginal veins in the lower 2⁄3, the lower
surface of lemma shortly pubescent between veins, apex
obtuse, rarely with very short awn. Callus with rather
long flexuous hairs. Paleas longer than lemmas, mem-
branous in upper part, with 2 veins forming scabrous
keels, which surpass the paleas like short awns. Anthers
1.6–2mm.2n=?
Holotype (Fig. 3): Russia, Far East, «Khabarovsk
Territory, Imeni Poliny Osipenko District, middle
course of the Kerbi River (tributary of the Nimelen
River, Amgun River basin), 3 VIII 1981, S. D. Schlot-
gauer» (LE: LE 01065501).
Affinity. Differs from H. lanatiflora (Roshev.)
Tzvelev s. str. by small size of plants, narrow leaf blades,
Н. С. Пробатова
Новости систематики высших растений | Том 50 | 2019
18
short ligule, sheaths closed on 1⁄2, smaller panicles,
spikelets and glumes, minute spinules on keels, callus
with cobweb hairs, paleas longer than lemmas, with
awn-like endings. From H. jurtzevii Prob. et Petrovsky
differs also by panicle shape with long branches, by the
absence of sessile clustered spikelets.
Растение 16–22 см выc., с ползучими подземны-
ми побегами. Стебли прямостоячие, тонкие, голые
и гладкие, верхний узел стебля расположен в ниж-
ней 1⁄4–1⁄5 части стебля. Влагалища стеблевых ли-
стьев на 1⁄2 длины от основания замкнутые, голые и
гладкие. Пластинки листьев до 2 мм шир., плоские,
голые и гладкие. Язычок верхнего стеблевого листа
0.7–1.2 мм дл. Метелки 5 см дл., более или менее
сжатые, со слабо извилистыми веточками около 3 см
дл., гладкими или с редкими едва заметными шипи-
ками. Колоски 3.8–5(5.5) мм дл., с 2–3 цветками, пе-
строватые; ось колоска голая и гладкая. Колосковые
чешуи 2.3–3 мм дл., ланцетно-яйцевидные, заметно
неравные, по краю и у верхушки перепончатые, не-
редко с острием, с 1–3 жилками, по килям изредка
с рассеянными мельчайшими шипиками. Нижние
цветковые чешуи 3.5–3.7 мм дл., с 5 слабо выдающи-
мися жилками, в верхней 1⁄3 перепончатые, по килю
и прикраевым жилкам снизу до 2⁄3 длины чешуи
длинноволосистые, между жилками коротковоло-
систые, на верхушке туповатые, изредка с коротким
острием. Каллус с довольно длинными извилисты-
ми волосками. Верхние цветковые чешуи превы-
шают нижние, в верхней части пленчатые, с 2 вы-
ступающими в виде килей жилками, выдающимися
остевидно на верхушке чешуи, по килям шерохова-
тые. Пыльники 1.6–2 мм дл. 2n = ?
Голотип (рис. 3): Россия, Дальний Восток, «Ха-
баровский край, район имени Полины Осипенко,
среднее течение р. Керби (притока р. Нимелен, бас-
сейн р. Амгунь), 3 VIII 1981, С. Д. Шлотгауэр» (LE:
LE 01065501).
Родство. От H. lanatiflora (Roshev.) Tzvelev s. str.
наш вид отличается небольшими общими размерами,
замкнутыми на 1⁄2 листовыми влагалищами, узкими
пластинками листьев, коротким язычком, более мел-
кими метелками, колосками и их чешуями, наличием
мельчайших шипиков на килях колосковых и цвет-
ковых чешуй, волосистым каллусом; верхние цветко-
вые чешуи превышают нижние, верхушки их килей
подобны остевидным окончаниям. От недавно опи-
санного нами (Probatova, Petrovsky, 2015) c Таймыра
H. jurtzevii Prob. et Petrovsky он отличается формой
метелки, длинными веточками ее и отсутствием си-
дячих, иногда сгруппированных колосков.
Распространение. Хабаровский край, бассейн
р. Амгунь.
Близкий вид H. lanatiflora распространен в Вос-
точной Сибири в низовьях Оленёка и Лены и вос-
точнее Лены (Tzvelev, 1976), на Дальнем Востоке —
в Тенькинском р-не Магаданской обл. (Sinelnikova,
2007). Находка H. amgunensis отодвигает южную
границу ареала этого, еще слабо изученного в целом
рода на юг.
4. Poa × alexandrae Prob., nothosp. nova (P. trans-
baicalica Roshev. × ?P. glauca Vahl). — Мятлик Алек-
сандры.
Hybrid plant densely cespitose, with caps on the
roots, reproductive shoots 30–45 cm, non-simultaneous
(appear not all at the same time), vegetative shoots nu-
merous, very short. Stems erect, the uppermost node is
located near the base, stems (especially the uppermost
internode) sharply scabrous throughout with the spi-
nules directed upward. Leaf sheaths also scabrous. Leaf
blades flat, sharply scabrous on both sides. Panicles 6–8
cm long, non-simultaneous, rather dense, but some-
times loose, with sharply scabrous ascending branches.
Spikelets 4.5–5.5 mm, glumes acute, some of them with
awn-like endings; spikelet axis with very short spinules.
Lemmas obtuse, between keel and marginal veins gla-
brous, callus with scanty hairs. Paleas between keels
very shortly pubescent. Anthers 1.3–1.6 mm.
Holotype (Fig. 4): Russia, Far East, «Magadan
Region, [near settlement] Snezhnaya Dolina, 1970,
M. Maksimova» (LE: LE 01065503; isotypes — VLA).
Гибрид характеризуется чехликами на корнях,
удлиненными скрытогенеративными (растянутыми
по времени формирования) репродуктивными по-
бегами 30–45 см дл.; вегетативные побеги при ос-
новании густых дерновин многочисленные, очень
укороченные. Стебли прямостоячие, верхний узел
расположен близ их основания, верхнее междоузлие
на всем протяжении острошероховатое от вверх на-
правленных шипиков. Влагалища листьев шерохо-
ватые. Пластинки листьев плоские, c обеих сторон
острошероховатые. Метелки 6–8 см дл., разновре-
менно созревающие, густые, реже рыхловатые, сжа-
тые, с восходящими острошероховатыми веточками.
Колоски 4.5–5.5 мм дл., колосковые чешуи острые,
иногда с остевидным окончанием. Членики оси ко-
лоска с очень короткими шипиками. Нижние цветко-
вые чешуи туповатые, между килем и прикраевыми
жилками голые, со скудным опушением на каллусе.
Верхние цветковые чешуи между килями с очень ко-
роткими волосками. Пыльники 1.3–1.6 мм дл.
Голотип (рис. 4): Россия, Дальний Восток,
«Магаданская область, [окрестности пос.] Снежная
Долина, 1970, М. Максимова» (LE: LE 01065503;
изотипы — VLA).
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока России и из Восточной Сибири
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
19
Рис. 4. Голотип Poa × alexandrae (LE 01065503).
Fig. 4. Holotype of Poa × alexandrae (LE 01065503).
Н. С. Пробатова
Новости систематики высших растений | Том 50 | 2019
20
Рис. 5. Голотип Poa archarensis (LE 01065506).
Fig. 5. Holotype of Poa archarensis (LE 01065506).
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока России и из Восточной Сибири
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
21
Этот гибрид, возможно, наиболее близок к
P. transbaicalica Roshev. (P. stepposa (Krylov) Ro-
shev.), если судить по острошероховатому по всей
длине верхнему междоузлию стеблей и по довольно
густым метелкам. Обращает на себя внимание раз-
витие у него скрытогенеративных побегов, форми-
рующихся разновременно (что часто встречается у
гибридов мятликов), наличие чехликов из песка на
корнях, раннее отрастание зимующих побегов сле-
дующего года. Вторым участником гибридизации
мог быть P. glauca Vahl, но у него стебли гладкие
(или под соцветием слабо шероховатые), влагалища
листьев гладкие, метелки рыхлые, членики оси ко-
лоска обычно опушенные и не бывает скрытогенера-
тивных побегов.
Таксон назван в память магаданского ботаника
Александры Наумовны Беркутенко.
5. Poa archarensis Prob., sp. nova (sect. Stenopoa
Dumort.). — Мятлик архаринский.
Plant 43–60 cm, densely cespitose. Stems stout,
rather thick, below the panicles glabrous or weakly sca-
brous, the uppermost node is located in their lower 1⁄3
or below. Ligule of the uppermost leaf 0.2–0.7 mm. Leaf
blades 3–9 cm long, narrow, flat or folded, early drying
up. Panicles 7–12 cm long, their branches adpressed or
weakly deviated from the panicle axis. Spikelets 5–6.3
mm, with 3–5 florets. Glumes 3.5–4.8 mm, unequal,
acute. The segments of spikelet axis glabrous or verru-
cose. Lemmas 3.5 mm, moderately pubescent along keel
and marginal veins. Callus with small bunch of cobweb
hairs. Paleas between keels with short trichomes. An-
thers 1.3–1.6 mm. 2n = 28. Early seed ripening. Germi-
nation capacity is high.
Holotype (Fig. 5): Russia, Far East, «Amur Re-
gion, Arkhara District, [railway] station Kundur, on
roadside, 29 VI 2004, E. V. Aistova, No 10526; 2n =
28 (E. G. Rudyka)» (LE: LE 01065506; isotypes —
LE 01065507, VLA).
Paratype: Russia, «Yakutskaya ASSR [Sakha Re-
public — Yakutia], Bulunskii District, left side of the
Lena River, near the former settlement Bulun, rubbly
slope of a hill, at the shrubs community, 11 VIII 1973,
N. S. Probatova, V. P. Seledets, R. S. Ivlieva» (VLA).
Affinity. Differs from P. skvortzovii Prob. by rela-
tively short stems, large panicles, narrow leaf blades
drying up earlier, by early seed ripening.
Растение 43–60 см выс., густодернистое. Стебли
прямые, довольно толстые, под метелкой гладкие
или слабо шероховатые, верхний узел стебля распо-
ложен в нижней 1⁄3 или ниже. Язычок верхнего листа
0.2–0.7 мм дл. Пластинки листьев 3–9 см дл., 2–2.5
мм шир., плоские или вдоль сложенные, рано засы-
хающие. Метелки 7–12 см дл., их веточки восходя-
щие, слабо отклоняющиеся от оси метелки. Колоски
5–6.3 мм дл., с 3–5 цветками. Колосковые чешуи не-
равные, острые, 3.5–4.8 мм дл. Членики оси колоска
голые или бородавчатые. Нижние цветковые чешуи
3.5 мм дл., умеренно опушенные вдоль киля и при-
краевых жилок, каллус с небольшим пучочком во-
лосков. Верхние цветковые чешуи между килями
с короткими трихомами. Пыльники 1.3–1.6 мм дл.
2n = 28. Раннее созревание семян. Всхожесть семян
высокая.
Голотип (рис. 5): Россия, Дальний Восток,
«Амурская обл., Архаринский р-н, [ж.-д.] ст. Кундур,
обочина дороги, 29 VI 2004, Е. В. Аистова, No 10526;
2n = 28 (Э. Г. Рудыка)» (LE: LE 01065506; isotypes —
LE 01065507, VLA).
Паратип: Россия, «Якутская АССР [Респу-
блика Саха — Якутия], Булунский р-н, левобережье
р. Лены, у бывшего пос. Булун, щебнистый увал, у
зарослей кустарников, 11 VIII 1973, Н. С. Пробато-
ва, В. П. Селедец, Р. С. Ивлиева» (VLA).
Родство. Отличается от P. skvortzovii Prob. от-
носительно короткими стеблями c крупными метел-
ками, составляющими 1⁄4(1⁄5) длины стебля, узкими
листьями и их ранним отмиранием, почти гладкими
стеблями и влагалищами листьев, ранним утолще-
нием стеблей, ранним созреванием семян. У P. ten-
kensis Prob. членики оси колоска опушенные, язычки
листьев, метелки и пыльники более крупные и не за-
метно явного утолщения стеблей по созревании се-
мян.
Распространение. Амурская обл. (верх-
няя часть бассейна Амура), Республика Саха (по
р. Лене).
Возможно, этот вид замещает P. skvortzovii на
Верхнем Амуре, а в Якутии, вероятно, — P. tenkensis.
6. Poa turgensis Prob., sp. nova (sect. Stenopoa Du-
mort.). — Мятлик тургинский.
Plant 13–20 cm, densely cespitose, with old sheaths
at the tuft base. Stems stout, smooth below the panicles.
Leaf blades 1.5–2.5 cm long, folded, smooth on lower
surface. Ligule 2–3.5 mm. Panicles 2–3(5) cm long,
very narrow, almost linear, their branches very short,
scabrous, some branches almost reduced. Spikelets
3.2–3.5 mm, with (1)2(3) florets. Glumes acute. Spike-
let axis pilose. Lemmas along keel and marginal veins
weakly pilose, between veins in lower part adpressedly
pilose. Callus without tuft of hairs. Paleas between keels
with short trichomеs. Anthers 1.2–1.3 mm. 2n = ?
Holotype (Fig. 6): Russia, «Trans-Baikal Territo-
ry, Olovyannaya District, near Yasnaya settlement, the
Turga River, floodplain meadow, 8 VII 2010, A. Gnu-
Н. С. Пробатова
Новости систематики высших растений | Том 50 | 2019
22
Рис. 6. Голотип Poa turgensis (LE 01065504).
Fig. 6. Holotype of Poa turgensis (LE 01065504).
Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока России и из Восточной Сибири
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
23
tikov, Yu. Gnutikova» (LE: LE 01065504; isotype —
VLA).
Affinity. Differs from P. argunensis Roshev. by nar-
row small panicles with shortened branches and small
spikelets, as well as by ecology.
Растения 13–20 см выс., густодернистые, со ста-
рыми влагалищами листьев у основания дерновин.
Стебли прямые, под метелками гладкие. Пластинки
листьев 1.5–2.5 см дл., вдоль сложенные, снизу глад-
кие. Язычок листа 2–3.5 мм дл. Метелки 2–3(5) см
дл., очень узкие (почти линейные), веточки их ко-
роткие, шероховатые, иногда почти полностью реду-
цированы. Колоски 3.2–3.5 мм дл., с 2(3) цветками.
Колосковые чешуи острые. Членики оси колоска
с волосками. Нижние цветковые чешуи по килю и
прикраевым жилкам слабо волосистые, между жил-
ками в нижней части прижато-волосистые. Каллус
без пучочка волосков. Верхние цветковые чешуи
между килями с короткими трихомами. Пыльники
1.2–1.3 мм дл. 2n = ?
Голотип (рис. 6): Россия, «Забайкальский край,
Оловяннинский р-н, окрестности пос. Ясная, р. Тур-
га, пойменный луг, 8 VII 2010, А. Гнутиков, Ю. Гну-
тикова» (LE: LE 01065504; изотип — VLA).
Родство. Близок к P. argunensis Roshev., от ко-
торого отличается очень узкими мелкими метел-
ками с сильно редуцированными веточками и мел-
кими колосками, а также экологией (P. argunensis
обитает на сухих остепненных каменистых склонах).
Распространение. Байкальская Сибирь, За-
байкальский край.
Благодарности
Автор благодарит А. А. Гнутикова (Санкт-Петер-
бург), С. Д. Шлотгауэр (Хабаровск) и О. А. Черня-
гину (Петропавловск-Камчатский) за ценные сборы,
послужившие материалом для нашего исследования.
И. В. Татанову (Санкт-Петербург) признательна за
консультации и разнообразную помощь на этапах
нашей работы. Э. Г. Рудыку (Владивосток) благода-
рю за участие в определении числа хромосом.
Литература | References
Probatova N. S., Petrovsky V. V. 2015. A new species in Hyalo-
poa (Tzvelev) Tzvelev (Poaceae) from the Taimyr Peninsu-
la, East Siberia // Novosti Sist. Vyssh. Rast. Vol. 46. P. 71 –
74. [In Russian with English abstract] (Пробатова Н. С.,
Петровский В. В. 2015. Новый вид рода пленчатомят-
лик (Hyalopoa (Tzvelev) Tzvelev, Poaceae) с полуострова
Таймыр, Восточная Сибирь // Новости систематики
высших растений. Т. 46. С . 71 –74).
Sinelnikova N. V. 2007. On the record of Hyalopoa lanatiflora
(Poaceae) in the Magadan Region // Bot. Zhurn. Vol. 92,
No 1. P. 169–170. [In Russian with English abstract] (Си-
нельникова Н. В . 2007. О находке Hyalopoa lanatiflora
(Poaceae) в Магаданской области // Бот. журн. Т. 92,
No 1. С . 169–170).
Tzvelev N. N . 1976. Zlaki SSSR [Grasses of the USSR]. Lenin-
grad: Nauka. 778 p. [In Russian] (Цвелëв Н. Н . 1976. Зла-
ки СССР. Л.: Наука. 778 с.).
Н. С. Пробатова
Новости систематики высших растений | Том 50 | 2019
24
New orchid species (Orchidaceae) in the flora of Laos
Новые виды орхидных (Orchidaceae) во флоре Лаоса
L. V. Averyanov1, Khang Sinh Nguyen2,
T. V. Maisak1, Hiep Tien Nguyen3,
N. L. Orlov4
, D. D. Slastunov5, I. V. Sokolova1
1 Komarov Botanical Institute, Russian Academy of Sciences
Herbarium of Higher Plants
Professora Popova Str., 2, St. Petersburg, 197376, Russia
av_leonid@binran.ru, av_leonid@mail.ru; isokolova@binran.ru
2 Institute of Ecology and Biological Resources, Vietnam Academy
of Science and Technology
18, Hoang Quoc Viet Road, Nghia Do, Cau Giay District, Hanoi,
Vietnam
khangnguyensinh@yahoo.com
3 Center for Plant Conservation
25/32, Lane 89, Lac Long Quan, Nghia Do, Cau Giay District,
Hanoi, Vietnam
centerforplantconservation@gmail.com
4
Zoological Institute, Russian Academy of Sciences
Universitetskaya Emb., 1, St. Petersburg, 199034, Russia
orlov52@gmail.com
5 Taxon Limited Liability Company
Institutsky Lane, 5, St. Petersburg, 194021, Russia
slastunov@gmail.com
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Л. В. Аверьянов1, Кхан Синь Нгуен2,
Т. В. Майсак1, Хьеп Тьен Нгуен3,
Н. Л. Орлов4
, Д. Д. Сластунов5,
И. В. Соколова1
1 Ботанический институт им. В. Л. Комарова РАН
Гербарий высших растений
ул. Профессора Попова, 2, Санкт-Петербург, 197376, Россия
av_leonid@binran.ru, av_leonid@mail.ru; isokolova@binran.ru
2 Институт экологии и биологических ресурсов Академии наук
и технологии Вьетнама
18, Хон Куок Вьет Роад, Ни До, Кай Зяу, Ханой, Вьетнам
khangnguyensinh@yahoo.com
3 Центр охраны растений
25/32, линия 89, Лак Лонг Куан, Ни До, Кай Зяу, Ханой,
Вьетнам
centerforplantconservation@gmail.com
4 Зоологический институт РАН
Университетская наб., 1, Санкт-Петербург, 199034, Россия
orlov52@gmail.com
5 ООО «Таксон»
Институтский пер., 5, Санкт-Петербург, 194021, Россия
slastunov@gmail.com
https://doi.org/10.31111/novitates/2019.50.25
Abstract. This paper continues the publication of new data obtained during field studies in remote and poorly studied regions of
Laos in 2015–2018. It provides descriptions of two new species (Bulbophyllum brachyscapum Aver. and Sunipia saccata Aver.),
emended descriptions of two previously published but insufficiently known species (Cleisostoma verrucosum Aver. and Oberonia
vesiculifera Aver.) and reports of eight species newly recorded in the flora of Laos (Biermannia calcarata Aver., Bulbophyllum
farreri (W. W. Sm.) Seidenf., Didymoplexiella trichechus (J. J. Sm.) Garay, Eria eriopsidobulbon C. S . P. Parish et Rchb. fil., Habe-
naria ciliolaris Kraenzl., Liparis caudata Aver. et K. S. Nguyen, Odontochilus umbrosus (Aver.) Ormerod, and Porpax ustulata
(C. S. P. Parish et Rchb. fil.) Rolfe). Appropriate citations of regional literature, color illustrations, data on types and distribu-
tion, descriptions, etymology, as well as notes on taxonomy and related species are provided for the studied species.
Keywords: Orchidaceae, Laos, flora, plant diversity, new species.
Аннотация. Статья продолжает серию публикаций новых данных, полученных в ходе полевых исследований в отда-
ленных и малоизученных районах Лаоса в 2015–2018 гг. Описаны два новых для науки вида: Bulbophyllum brachyscapum
Aver., Sunipia saccata Aver. Даны расширенные описания двух видов, описанных ранее недостаточно полно (Cleisostoma
verrucosum Aver. и Oberonia vesiculifera Aver.). Восемь видов впервые обнаружены во флоре Лаоса (Biermannia calcarata
Aver., Bulbophyllum farreri (W. W . Sm.) Seidenf., Didymoplexiella trichechus (J. J . Sm.) Garay, Eria eriopsidobulbon C. S. P. Par-
ish et Rchb. fil., Habenaria ciliolaris Kraenzl., Liparis caudata Aver. et K. S. Nguyen, Odontochilus umbrosus (Aver.) Ormerod,
Porpax ustulata (C. S . P. Parish et Rchb. fil.) Rolfe). Информация, приведенная при видах, содержит ссылки на протологи
и региональные сводки, цветные иллюстрации, данные о типах, распространении, этимологии, а также примечания о си-
стематике и родственных таксонах.
Ключевые слова: Orchidaceae, Лаос, флора, разнообразие растений, новые виды.
Поступила в редакцию | Submitted: 29.08.2019
Принята к публикации | Accepted: 14.12.2019
2019
50: 25–40
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
The orchid flora of Lao People’s Democratic Repub-
lic (Laos) is one of the richest in Indochina. Despite a
series of floristic accounts (Seidenfaden, 1992; Newman
et al., 2007; Schuiteman et al., 2008; Averyanov, 2013b;
Averyanov et al., 2016, 2018a, 2019; Kumar et al., 2016,
2018; Gale et al., 2018) and recent records of numer-
ous species (Schuiteman, Bonnet, 2008, 2009; Gruß et
al., 2014; Gale et al., 2016; Gale, Phaxaysombath, 2017;
Hu et al., 2017; Averyanov et al., 2018b; Schuiteman
et al., 2018) it remains poorly studied. This paper con-
tinues the publication (Averyanov, 2013b; Averyanov
et al., 2016, 2018a) of new data obtained during field
studies in remote and poorly studied regions of Laos in
2015–2018. It provides descriptions of two new spe-
cies (Bulbophyllum brachyscapum Aver. and Sunipia
saccata Aver.), emended descriptions of two previously
published but insufficiently known species (Cleisosto-
ma verrucosum Aver. and Oberonia vesiculifera Aver.)
and reports of eight species newly recorded in the flora
of Laos (Biermannia calcarata Aver., Bulbophyllum far-
reri (W. W. Sm.) Seidenf., Didymoplexiella trichechus
(J. J. Sm.) Garay, Eria eriopsidobulbon C. S. P. Parish et
Rchb. fil., Habenaria ciliolaris Kraenzl., Liparis caudata
Aver. et K. S. Nguyen, Odontochilus umbrosus (Aver.)
Ormerod, and Porpax ustulata (C. S. P. Parish et Rchb.
fil.) Rolfe). Appropriate citations of regional literature,
color illustrations, data on types and distribution, de-
scriptions, etymology, as well as notes on taxonomy and
related species are provided for the studied species.
The images of the cited specimens stored at LE Her-
barium are freely available on the database “Herbarium
LE” (http://en.herbariumle.ru).
Biermannia calcarata Aver. 1988, Bot. Zhurn.
(Moscow & Leningrad), 73: 429, fig. 8; id. 1994, Identi-
fication Guide Viet. Orch.: 237, fig. 19; Aver., Averyano-
va, 2003, Updated Checklist Orch. Viet.: 12.
—
Fig. 1:
1, 2.
Described from northern Vietnam.
—
Type: “Hai
Phong, Cat Hai, Cat Ba, on mossy branches of small
trees along freshwater lakeside in the central part of
the island, 21 XII 1986, Averyanov et al., LX-VN 3331”
(holotype — LE: LE 01055101).
Distribution. Laos, Vietnam.
Examined specimen. Lao PDR, Houa Phang
Prov., Xon Distr., Hay Lao village, around point 20°33′ N
103°83′ E, at elevation around 850 m a. s . l ., 6–11 IX 2017,
N. L . Orlov, L. K . Ioganssen, herbarium specimen prepared
4 IV 2018, N. L . Orlov, NLO 84 (LE 01048921).
Note. The only earlier known record of this species for
the flora of Laos (Phongsali Prov., P. Bonnet et al., PB265)
probably belongs to a new and not yet described species
(Schuiteman et al., 2008). Our plant (LE 01048921) is
indistinguishable from the type specimen.
Bulbophyllum brachyscapum Aver., sp. nova (sect.
Cirrhopetalum (Lindl.) Rchb. fil.). — Fig. 2.
Perennial, creeping, sympodial epiphyte. Rhizome
plagiotropic, thick, semi-woody, simple or branching oc-
casionally, pale dirty-brownish-gray, (8)10–20(25) cm
long, with pseudobulbs placed at (2.5)3–6(7) cm inter-
vals. Pseudobulbs 1-leaved, glossy green, erect, ovoid to
almost globose, (4.5)6–8(10) mm long, (4)5–6(7) mm
diam., with several thin, wiry, rigid roots at the base.
Leaves sessile, conduplicate, narrowly oblong-obovate,
(12)15–20(22) cm long, (2.5)3–4(4.5) cm wide, blunt
to rounded at apex, narrowing into petiole-like grooved
base, articulated with pseudobulb apex. Inflorescence
few-flowered, umbel (2.2)2.8–3.6(4) cm diam. Scape
arising from the base of pseudobulb, ascending to erect,
light green, heavily marked with dull dirty purple,
(3.5)4–5(6) cm long, 1.6–1.8 mm diam., with 1(2) ster-
ile brownish hyaline bracts at the middle and 2–3(4)
brownish bracts at the base; bracts triangular-ovate,
acute, (4.5)6–10(12) mm long and (3)4–6(8) mm wide
(when flattened). Flowers (4)5–7(8), simultaneously
opening, odorless. Pedicel and ovary light greenish, te-
rete, 3.5–4.5 mm long, ovary longitudinally grooved,
1.2–1.4 mm diam. Sepals and petals with entire mar-
gins, light lemon- or ochre-yellow, inside sparsely
marked with small purple dots, somewhat projecting
forwards. Median sepal ovate, concave, 5–6 mm long,
4–4.5 mm wide, blunt and somewhat cucullate at apex.
Lateral sepals oblique, narrowly oblong-triangular,
(10)10.5–11.5(12) mm long, (2)2.2–2.4(2.6) mm wide
near the base, joined in distal third, free and obliquely
acute at apex, with prominent saccate, subglobular fold
near the base. Petals narrowly triangular-ovate, obtuse,
3.5–4 mm long, 2–2.2 mm wide, with dark purple spot
at apex. Lip light yellow, with fine purple marks, simple,
triangular-conoid, recurved, adaxially slightly grooved,
2–2.2 mm long, 0.9–1.1 mm wide, movable. Column
white to yellowish-white, 1.6–1.8 mm tall and wide,
with prominent, straight, finger-like, white, forward
Fig. 1. New orchids in the flora of Laos.
1, 2 — Biermannia calcarata (NLO 84, LE 01048921); 3, 4 — Bulbophyllum farreri (AL 169 / K 395, LE 01055510); 5–9
—
Didy-
moplexiella trichechus (AL 1086, LE 01048691). Photos by N. Orlov (1, 2) and L. Averyanov (3–9), correction and design by
L. Averyanov.
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
26
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
27
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
28
projecting stelidia 0.8–1 mm long, laterally with broad
wings; stigma concave, broadly triangular; column foot
white, incurved, 1.8–2 mm long, narrowing to the apex.
Anther cap helmet-shaped, pale yellow, 0.7–0.8 mm tall
and wide, laterally with prominent triangular tips; pol-
linia 2, bright lemon-yellow, each consisting of two un-
equal halves. Fruits not seen.
Type: “Laos, Vientiane Prov., Vang Vieng Distr.,
close vicinity of Vang Vien Town, secondary degraded
evergreen forest on steep slopes of small rocky stream
on limestone at elevation 300–400 m, creeping epi-
phyte on tall tree, not rare, 12 XII 2015, L. Averyanov
et al., AL 178, herbarium specimen prepared 17 IV 2019,
L. Averyanov, AL 178.1” (holotype — LE: LE 01049506).
Analytical plate: 0351 / L. Averyanov AL 178.1
(http://go.herbariumle.ru/exs-herb-0351).
Etymology. The specific epithet refers to the
short scape of the inflorescence.
Distribution. Central Laos (Vientiane Prov-
ince, Vang Vieng District). Endemic to limestone areas
in central part of Laos.
Ecology, phenology and conservation
status. Primary and old secondary broadleaved for-
ests on karstic limestone at elevations of 300–400 m
a. s. l., usually a creeping epiphyte on tall trees along
stream. Not rare. Fl. III–V. Estimated IUCN status —
DD.
Note. The new species belongs to the group of
medium-sized species having flowers with sepals and petals
entire along their margins. This group is traditionally
placed into Bulbophyllum sect. Cirrhopetalum (Seidenfaden,
1979, 1992). In eastern Indochina, it includes such related
species as B. elatum (Hook. fil.) J. J. Sm., B. guttatum
Schltr., B. guttulatoides Aver., B. umbellatum Lindl., and
B. violaceolabellum Seidenf. However, our plant is very
distinct from these species in its specific floral morphology.
Among species of other regions, the new species may be
compared with the east Himalayan B. sarcophyllum (King et
Pantl.) J. J. Sm. from which it differs by having pale yellow
flowers marked with purple dots (vs. flowers evenly dark
purple-brown), glabrous sepals (vs. sepals densely glandular
hairy), larger pseudobulbs 4.5–10 mm long (vs. less than 4
mm long), short scape 3.5–6 cm long (vs. 7–10 cm long),
smaller flowers 10–12 mm long (vs. 18–20 mm long), and
protruding forward (vs. erect) stelidia. The new species has
tepals with striking purple markings, particularly in terms of
the large dark purple dots at the apex of the petals.
Bulbophyllum farreri (W. W. Sm.) Seidenf. 1974
(1973), Dansk Bot. Ark. 29, 1: 212, fig. 115; Aver. 1999,
Bot. Zhurn. (Moscow & Leningrad), 84, 10: 127; Aver.,
Averyanova, 2003, Updated Checklist Orch. Viet.: 14;
S. C. Chen, J. J. Verm. 2009, Fl. China, 25: 426. ≡ Cir-
rhopetalum farreri W. W. Sm. 1921, Notes Roy. Bot.
Gard. Edinburgh, 13: 196. — Fig. 1: 3, 4.
Described from northern Myanmar (“Upper Bur-
ma”). —
Type: “Coll. Farrer. Cult. R. B. G. Edinb. Oc-
tober 1920” (holotype — E00383625).
Distribution. Myanmar, China (Yunnan), Laos,
Vietnam.
Examined specimen. Laos, Champasak Prov.,
Bolaven Plateau, road Paksong — Ban Houay Kong, 1170 m
a. s. l ., 15°14.191 N 106°25.694 E, epiphyte in canopy of tall
tree, 26 IX 2015, E. Konstantinov et al., AL 169 / K 395,
herbarium specimen prepared 30 V 2018, L. Averyanov,
AL 169 / K 395 (LE 01055510).
Note. The discovered locality of the species considerably
extends its range southwards. The Laotian plant is almost
identical to those reported from Vietnam (Averyanov, 1999;
Averyanov, Averyanova, 2003) — LE 01055508.
Cleisostoma verrucosum Aver. 2019, Pl. Divers.
Fl. Veg. HNN NPA: 143–144, fig. 1208, 1209; descr.
emend. — Fig. 3.
Emended description. Perennial monopo-
dial lithophytic or epiphytic herb. Stem simple or few-
branched, rigid, ascending to erect, (15)20–25(30) cm
long, (6)7–8(10) mm diam., with few wiry, straight to
flexuous roots branching at apex; internodes (7)8–
10(12) mm long. Leaves dark green, sessile, dorsiven-
tral, fleshy, very rigid, almost perpendicular to stem
and slightly arcuate, conduplicate, oblong lanceolate,
(6)7–9(11) cm long, (6)8–10(11) mm wide, with
abruptly constricted, acute apex; leaf sheaths equitant,
rigid, verruculose. Inflorescence a lateral raceme (8)10–
14(16) cm long, scape and rachis light grassy green;
scape (6)7–12(14) cm long, erect, straight or slightly
flexuous, with 3–5 short, broad, light green sterile
bracts, rachis straight to curved, (1.2)1.5–2.5(3.5) cm
long, with many spirally arranged, lax flowers placed
at (2)3–4(4.5) mm intervals. Floral bracts minute, tri-
angular, acute, 1.4–1.6 mm long and wide. Pedicel and
ovary light green to almost white, perpendicular to ra-
chis, (5)5.5–7(7.5) mm long, 1–1.2 mm diam., slight-
Fig. 2. New orchids in the flora of Laos: Bulbophyllum brachyscapum, analytical plate (AL 178.1, LE 01049506).
a — flattened flowering plants; b — plants with intact inflorescences; c — pseudobulbs; d — intact inflorescences; e — flowers, front
view; f — flattened inflorescences; g — floral bract and ovary; h — flower, front and side views; i — flower with lateral sepal and
petal removed; j — median sepal, abaxial and adaxial views; k — lip, side, front and back views; l — column with lip and with lip
removed, side view; m — column with half removed operculum, side view; n — column with lip and with lip removed, front view;
o — operculum with pollinia; p — operculum with pollinia removed; q — pollinia. Photos, correction and design by L. Averyanov
and T. Maisak.
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
29
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
30
ly curved, terete, glabrous. Flowers widely opening,
(6.5)7–7.5(8) mm diam.; sepals and petals rather fleshy,
glabrous, spreading or median sepal somewhat for-
ward directed, pale yellow with large chestnut-brown
blotches; lip white, with light purple tint on sides of
median lobe and yellow near side lobes base; column
pure white; anther cap white with light yellow tint; pol-
linia bright yellow. Sepals narrowly obovate, slightly
concave, rounded at apex, (2.8)3–3.2(3.4) mm long,
(2)2.2–2.4(2.6) mm wide, lateral sepals slightly oblique.
Petals broadly oblong-lanceolate, blunt, as long as se-
pals, (1.4)1.5–1.7(1.8) mm wide, slightly oblique. Lip
spurred, (3.2)3.4–3.6(3.8) mm long (from spur apex to
the base of sepals), 3-lobed; side lobes filiform-subulate,
more or less straight, forward directed, (0.8)0.9–1(1.1)
mm long, strongly broadened at the base; median lobe
fleshy, triangular sagittate, (1.3)1.5–1.6(1.8) mm long,
(1.3)2.4–2.5(2.7) mm wide, acute, straight, forward di-
rected or slightly upright, smooth or finely irregularly
rough, longitudinally conduplicate concave, side lob-
ules narrowly triangular, acute, back directed (forming
sagittate structure), disc with 1 glossy inflation con-
tinuing into the spur in form of high almost glabrous
keel (incomplete septum); spur broadly conoid, dis-
tinctly dorsiventrally compressed, almost parallel to
ovary, (3.4)3.6–3.8(4) mm long, (2.2)2.4–2.6(2.8) mm
wide, with somewhat emarginate apex and incomplete
longitudinal septum inside. Backwall callus light lem-
on-yellow, in form of large stalked ovoid glossy smooth
swelling grooved longitudinally from abaxial side,
(1.2)1.3–1.4(1.5) mm long, (0.8)0.9–1(1.2) mm wide,
constricted at the base into short fleshy stalk. Column
short, broad, (2.3)2.4–2.5(2.6) mm high and wide,
with short semicircular lateral forward directed wings;
rostellum entire, conical, forward directed, furrowed
above; stigma obscurely triangular. Anther cap hemi-
spherical, 0.9–1 mm long and wide, with long, narrow-
ly triangular beak. Pollinarium comprising viscidium,
stipe and 2 pollinia. Pollinium ovoid to subglobular, in-
completely split into 2 hemispheric lobes. Stipe (tegula)
simple, linear filiform, 0.8–0.9 mm long; viscidium sim-
ple, in form of small circular gland, 0.15–0.2 mm diam.
Fruits not seen.
Type: “Laos, Khammouane Prov.,
Boualapha
Distr., herbarium specimen prepared 10 VIII 2018,
L. Averyanov, T. Maisak, AL 968/1” (holotype — LE:
LE 01048677).
Analytical plate: 0319 / AL 968/1 (http://
go.herbariumle.ru/exs-herb-0319).
Etymology. The species name refers to rugulose
leaf sheaths typical of species of Cleisostoma sect. Echio-
glossum (Blume) Seidenf.
Ecology, phenology and conservation
status. Lithophyte or epiphyte. Primary dry ever-
green and semideciduous broadleaved limestone forests,
commonly on tops of karstic hills at elevations of 400–
600 m a. s. l. Fl. VIII–IX. Locally common. Estimated
IUCN Red List status — DD.
Distribution. Central Laos (Khammoune Prov.,
Boualapha Distr., Hin Nam No Nature Protected Area).
Endemic.
Note. In floral morphology, this species is most closely
allied to C. paniculatum (Ker Gawl.) Garay, but differs by hav-
ing a verruculose stem (typical of species of C. sect. Echioglos-
sum), prominent constriction of apical part of leaf, subulate
side lobules of median lip lobe and stalked (placed on short
up-directed stalk) backwall callus.
Didymoplexiella trichechus (J. J. Sm.) Garay, 1954,
Arch. Jard. Bot. Rio de Janeiro, 13: 34; J. B. Comber,
2001, Orch. Sumatra: 111; H. A. Pedersen et al. 2014,
Fl. Thailand, 12, 2: 482; Tsukaya, Suleiman, Okada,
2014, Acta Phytotax. Geobot. 65, 2: 109, fig. 1C, D; 3.
≡ Didymoplexis trichechus J. J. Sm. 1920, Bull. Jard. Bot.
Buitenzorg, 3, 2: 19. — Fig. 1: 5–9.
Described from Bangka and Sumatra (“Banka:
Koba, Goenoeng Pading, 170 m., on dead wood in for-
est; rare. (H. A. B. Bünnemeijer n. 2169, December
1917). Suma[t]ra: Goenoeng Talamau on the western
slope, 600 m., in forest. (H. A. B. Bünnemeijer n. 559,
May 1917)”). — Lectotype not designated (BO?).
Distribution. Thailand, Laos, Sumatra, Bang-
ka, Kalimantan.
Examined specimen. Laos, Khammoune Prov.,
Boualapa Distr., Langkhang Village, steep southern slopes
of sandstone ridge allied to the road from the north between
points 17°34′02.2′′ N 105°42′42.6′′ E, 200 m and 17°34′51.1′′ N
105°43′01.2′′ E, 535 m a. s. l ., primary lowland semidecidu-
ous and evergreen dry forest on very steep rocky slopes, ter-
restrial achlorophyllous aphyllous herb to 20 cm tall on steep
rocky slope, flowers light violet to almost white, rare, 15 V
Fig. 3. New orchids in the flora of Laos: Cleisostoma verrucosum, analytical plate (AL 968/1, LE 01048677).
a — flattened flowering plants; b — portions of stem; c — leaves; d — apical part of leaf, abaxial and adaxial surface; e — portions of
inflorescence; f — flowers, front views; g — flower, side and adaxial views; h — column and lip, front view; i — flower with lateral
sepal and petal removed and sagittal flower section, side views; j — flattened sepals and petals, abaxial and adaxial views; k — lip,
top view; l — column and back wall callus; m — column, side view; n — column and back wall callus, side view; o — column with half
removed operculum and with operculum removed; p — operculum; q — pollinaria. Photos, correction and design by L. Averyanov,
D. Slastunov and T. Maisak.
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
31
2018, L. Averyanov, Khang Sinh Nguyen, T. Maisak, AL 1086
(LE 01048691).
Note. This discovery of the species is not surprising,
since it was recently reported from Thailand not very far from
its locality in Laos. Most probably the plant discovered in Vang
Vieng town area (Vientiane Province, central Laos) and pro-
posed for publication under the name D. laosensis S. W. Gale et
Kumar (S. W. Gale, pers. comm.) belongs to this species.
Eria eriopsidobulbon C. S. P. Parish et Rchb. fil.
1874, Trans. Linn. Soc. London, 30: 148; Seidenf. 1982,
Opera Bot. 62: 113, fig. 67; id. 1992, Opera Bot. 114:
187; Aver. 1994, Identification Guide Viet. Orch.: 235;
Aver., Averyanova, 2003, Updated Checklist Orch.
Viet.: 34. ≡ Pinalia eriopsidobulbon (C. S. P. Parish et
Rchb. fil.) Kuntze, 1891, Revis. Gen. Pl. 2: 679. — Fig.
4: 1–3.
Described from Myanmar (“...collected by the Rev.
E. C. Parish in the neighbourhood of Moulmein”).
—
Type: “Presented by Rev. C. Parish, April 1872, No 281”
(lectotype (Seidenfaden, 1982) — Herb. Reichenbach,
19957; isolectotype — K00082378).
Distribution. Myanmar, Thailand, Laos, Viet-
nam.
Examined specimen. Xiangkhouang Prov., Kham
Distr., Huad Village, Phou Tat Vinh Mt., around point 19°32′ N
103°39′ E, primary and secondary broadleaved evergreen and
semideciduous dry forest on very steep rocky slopes of lime-
stone highly eroded mountains composed by solid marble-like
limestone at elevation 1200–1400 m a. s. l ., epiphyte on tall
old trees along ridge edge, 4 IV 2015, N. T. Hiep, L. Averyanov,
N. S. Khang, N. Q. Hieu, T. Maisak, Pheng Phengsintham, her-
barium prepared 18 VII 2019, L. Averyanov, LA-VN 1093a /
TM 1264 (LE 01057892).
Note. The discovery of this species in Laos is quite ex-
pected, since it was earlier reported from Myanmar, Thailand
and Vietnam. We cannot accept recent reanimation of the ge-
nus Pinalia Lindl. (Ng et al., 2018) based on molecular studies
insufficiently supported by visual plant morphology.
Habenaria ciliolaris Kraenzl. 1893, Bot. Jahrb.
Syst. 16: 169; Seidenf. 1977, Dansk Bot. Ark. 31, 3:
95, fig. 56; id. 1992, Opera Bot. 114: 58, fig. 29, pl. 4;
Aver. 1994, Identification Guide Viet. Orch.: 69; Aver.,
Averyanova, 2003, Updated Checklist Orch. Viet.:
38; S. C. Chen, P. J. Cribb, 2009, Fl. China, 25: 155;
H. A. Pedersen et al. 2011, Fl. Thailand, 12, 1: 93, fig.
49; Xiaoxu Zhou et al. 2016, Phytotaxa, 276, 1: 69.
—
Fig. 4: 4–6.
Described from China (“Hongkong. Little Hong-
kong”). —
Type: “Habenaria ciliolaris mihi. Kränzlin.
Little Hongkong, Hongkong, 14 Aug. 1884, C. F[ord],
[No] 95” (holotype — K00079642).
Distribution. Continental SE China, Taiwan,
Laos, Vietnam.
Examined specimen. Laos, Khammoune Prov.,
Boualapha Distr., Nong Seng Village, Vang Phae Lay Mt.,
around point 17°31′02.7′′ N, 105°47′17.2′′ E, primary dry ever-
green and semideciduous broadleaved forest on very steep
rocky slope near karstic hill top composed with solid, mar-
ble-like highly eroded limestone at 300–530 m a. s . l ., litho-
phytic tuberiferous ephemeroid herb, 11 V 2018, L. Averya-
nov, Khang Sinh Nguyen, T. Maisak, Littideth Xaiyavongsa,
Siphanom Keovankham, herbarium specimen prepared 11 VII
2019, L. Averyanov, AL 912.2 (LE 01057741).
Note. The plant discovered in Laos and reported here is
almost identical morphologically with the plants collected in
Vietnam (LE 01058608, LE 01058609).
Liparis caudata Aver. et K. S. Nguyen, 2015, Wul-
fenia, 22: 162, fig. 9B, C; 10. — Fig. 4: 7–9.
Described from northern Vietnam. — T ype: “Thanh
Hoa Prov., Thuong Xuan Distr., Bat Mot Municipality,
Vin Village, Xuan Lien Natural Reserve, 1000–1200 m,
around point 19°58′51.6′′ N 104°59′38.08′′ E, 5 IX 2013,
L. Averyanov, N. T. Hiep, N. S. Khang, N. D. Thang,
L. V. Tien, CPC 6809” (holotype — LE: LE 01058641;
isotypes — Herbarium of the Center for Plant Conser-
vation (CPC), LE 01058642; paratypes — CPC 6787,
LE 01058643); epitype (Averyanov, designated
here) — LE: LE 01058644.
Distribution. Laos, Vietnam.
Examined specimens. Laos, Khammouane Prov.,
Boualapha Distr., Nong Seng Village, southern sandstone
slopes at summit of Phou Chuang (Poujeuang) Mt. around
point 17°35′00.3′′ N, 105°47′35.6′′ E, primary evergreen mixed
and coniferous dense wind-formed forest at elevation 1000–
1400 m a. s. l ., epiphyte on mossy trees on mountain top,
not common, 4 V 2018, L. Averyanov, Khang Sinh Nguyen,
T. Maisak, Littideth Xaiyavongsa, Siphanom Keovankham,
AL 676 (LE 01048747). Ibidem, herbarium specimen pre-
pared 10 X 2018, L. Averyanov, AL 676.1 (LE 01049000).
Vietnam, Thanh Hoa Prov., Thuong Xuan Distr., Bat Mot
Municipality, Vin Village, Xuan Lien Natural Reserve, 1000–
1200 m, around point 19°58′51.6′′ N 104°59′38.08′′ E, 5 IX
2013, L. Averyanov, N. T. Hiep, N. S . Khang, N. D . Thang,
L. V. Tien, herbarium specimen prepared 10 XI 2017, L. Aver-
yanov CPC 6809a (LE 01058645).
Note. This is not a surprising discovery of the species
regarded earlier as a strict endemic of Vietnam. It was found
not far from locus classicus. The newly discovered locality in
Laos extends the known species range about 150 km further
SSE.
Fig. 4. New orchids in the flora of Laos.
1–3
—
Eria eriopsidobulbon (LA-VN 1093a/TM 1264, LE 01057892); 4–6
—
Habenaria ciliolaris (AL 912.2, LE 01057741);
7–9
—
Liparis caudata (AL 676.1, LE 01049000).
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
32
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
33
Fig. 5. New orchids in the flora of Laos: Oberonia vesiculifera, analytical plate (AL 965/1, LE 01048682).
a — flowering plant; b, c — portion of inflorescence; d, e — flower, front and side views; f, g — intact lip, side and half side views;
h — intact lip, front view; i — lip margin. Photos, correction and design by L. Averyanov.
Oberonia vesiculifera Aver. 2019, Pl. Divers. Fl.
Veg. HNN NPA: 151–152, fig. 1292, descr. emend.
—
Fig. 5.
Emended description. Perennial, sympodial,
lithophytic herb. Stem simple, very short, ascending to
erect, (0.5)1–1.5(2) cm long, completely covered by
bases of dense equitant leaf bases. Leaves light green,
sessile, ensiform, laterally flattened, fleshy, erect to sub-
erect, (8)10–14(16) cm long, (6)8–10(11) mm wide,
apex acute. Inflorescence a subapical spike-like raceme
(4)5–7(8) cm long, scape and rachis light green; scape
(1.6)1.8–2(2.2) cm long, suberect, straight or slightly
curved, naked or with one small sterile bract, rachis
usually curved, (4.5)5–6(6.5) cm long, with many
dense, spirally arranged flowers. Floral bracts lanceo-
late, acuminate, 2–3 mm long, 0.3–0.4 mm wide, with
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
34
Fig. 6. New orchids in the flora of Laos: Odontochilus umbrosus (NLO 83, LE 01061433).
Photos by N. Orlov, correction and design by L. Averyanov.
erose denticulate margin. Pedicel and ovary light green,
at 45° to rachis, 1.6–1.8 mm long, 0.3–0.4 mm diam.,
terete, glabrous. Flowers widely opening, 2–2.2 mm
diam.; sepals and petals glabrous, spreading, bright yel-
low; column yellow; anther cap light green; pollinia yel-
low. Sepals subsimilar, ovate to narrowly ovate, with en-
tire margin, concave, obtuse, about 1 mm long, 0.8 mm
wide, lateral sepals often somewhat reflexed. Petals sim-
ilar to sepals in shape and size, with erose denticulate
margin. Lip spurless, more or less flat, 3-lobed, 1–1.2
mm long and wide; side lobes rectangular, truncate,
spreading, 0.6–0.7 mm long, 0.2–0.3 mm wide, with
many globular glands along the margin; median lobe
suborbicular, 0.7–0.8 mm across, with erose denticulate
margin, shallowly emarginate at apex, near base and
in center with many large subglobular gland-like cells;
disc at the center (near the base of side lobes) with 2
half-ovoid calli. Column simple, short, terete, 0.2–0.3
mm high and wide. Anther cap hemispherical, 1–1.2
mm diam., truncate at front. Pollinia light yellow, nar-
rowly ovoid, 0.8–0.9 mm long. Fruits light gray-brown-
ish, ellipsoid to obovoid, longitudinally ribbed, 3–4 mm
long, 1.5–2 mm diam.
Type: “Laos, Khammouane Prov., Boualapha Distr.,
Nong Seng Village, Chanh Daeng mountain, around
point 17°31′11.1′′ N, 105°46′41.4′′ E, primary dry ev-
ergreen and semideciduous broadleaved forest on very
steep rocky slope near karstic hill top composed with
solid, marble-like highly eroded limestone at 400–600 m
a. s. l., lithophytic herb on shady vertical cliff, common,
11 V 2018, L. Averyanov, Khang Sinh Nguyen, T. Mai-
sak, Littideth Xaiyavongsa, Siphanom Keovankham, AL
965/1” (holotype — LE: LE 01048682).
Analytical plate: 0320 / AL 965/1
(http://en.herbariumle.ru/?t=occ&id=65&rid=ima
ge_0004258).
Distribution. Central Laos (Khammouane
Prov., Boualapha Distr., Hin Nam No Nature Protected
Area). Endemic.
Ecology, phenology and conservation
status. Primary dry evergreen and semideciduous
broadleaved limestone forest, commonly on shady ver-
tical cliffs near mountain tops at elevation 300–600 m
a. s. l. Fl. IV–V. Locally common. Estimated IUCN Red
List status — DD.
Notes. The plant is close to the widespread O. ensifor-
mis (Sm.) Lindl., from which differs by having much smaller
habit (leaves three times shorter and narrower), spirally ar-
ranged (vs. whorled) flowers, tuberculate callosity on the lip
disc (vs. flat or slightly concave disc), and numerous large
dense spherical gland-like cells on the sides of the lip (vs. lip
with entire margin without large spherical cells). Both species
have two prominent calli on the lip base. This apomorphic fea-
ture segregates these two species from all other congeners oc-
curring in Indochina.
The supposition by D. L. Geiger (2019) on the identity
of this species and O. ensiformis does not fit well with a quite
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
35
different morphology of these two species (cf. O. ensiformis in
eastern Indochina — Averyanov, 2013a: 152, fig. 76b, c; 77h;
LE 01058571, LE 01061430, LE 01061431, LE 01061432).
Odontochilus umbrosus (Aver.) Ormerod, 2002,
Lindleyana, 17: 225. ≡ Pristiglottis umbrosa Aver. 1996,
Bot. Zhurn. (Moscow & Leningrad), 81, 10: 78, fig. 3. —
Fig. 6.
Described from southern Vietnam.
—
Type:
“S. Vietnam, Kon Tum Prov., Dak Gley Distr., about
15–18 km NW of Dak Gley Town, between Mang Khen
(Dak Che) and Dak Polo Villages, near Laos boundary,
primary evergreen mountain forest at 1250–1450 m alt.,
22 XI 1995, L. Averyanov, N. T. Hiep, P. K. Loc, VH 1932”
(holotype — LE: LE 01058603; isotypes — HN).
Distribution. Laos, Vietnam.
Examined specimen. Laos, Luong Nam Tha Prov.,
Nam Tha Distr., Nam Kong Village, Luang Nam Tha NP,
around point 21°12′ N 101°23′ E, at elevation about 1100 m
a.s.l., 26IX—2X2017,N.L.Orlov,L.K.Ioganssen,NLO83
(LE 01061433).
Note. For a long time, O. umbrosus was known only
from its type locality. Our finding of this rare species is the
second one, and new to the flora of Laos. It extends the known
species range 350 km further NW.
Porpax ustulata (C. S. P. Parish et Rchb. fil.) Rolfe,
1908, Orchid Rev. 16: 8; Seidenf. 1977, Bot. Tidsskr. 72,
1: 8, fig. 7; S. C. Chen, J. J. Wood, 2009, Fl. China, 25:
360; Xiaoxu Zhou et al. 2016, Phytotaxa, 276, 1: 123;
Aver. et al. 2018, Taiwania, 63, 3: 217, fig. 10C, D. ≡ Eria
ustulata C. S. P. Parish et Rchb. fil. 1874, Trans. Linn.
Soc. London, 30: 147. — Fig. 7.
Described from Myanmar (“...collected by the Rev.
E. C. Parish in the neighbourhood of Moulmein”).
—
Type: “Orchidaceae No 62 Eria (Conchidium) ustulata
Parish. Presented by Rev. C. Parish, April 1872” (lec-
totype (Seidenfaden, 1977) — K001085616; isolecto-
type — Herb. Reichenbach 31330).
Distribution. Myanmar, Thailand, S. China
(Yunnan), Laos, Vietnam.
Studied specimen. Laos, Khammouane Prov.,
Boualapha Distr., Nong Seng village, southern sandstone
slopes at summit of Phou Chuang (Poujeuang) Mt. around
point 17°35′00.3′ N, 105°47′35.6′′ E, primary evergreen mixed
and coniferous dense wind-formed forest at elevations of
1000–1400 m a. s. l ., clustering epiphyte and lithophyte, occa-
sional, 4 V 2018, L. Averyanov, Khang Sinh Nguyen, T. Maisak,
Littideth Xaiyavongsa, Siphanom Keovankham, AL 656/1b.
Analytical plate 0366 / AL 656.1b (LE 01055963).
Note. The previously known distribution of this species
comprises Myanmar, Thailand and China (southern Yunnan).
Its discovery in Laos (Khammouane Province) considerably
extends the species range southwards. The plants found in
Laos distinctly differ from the type by having smaller flowers
and almost glabrous sepals. They could be further segregated
as a separate variety, but that would need analysis of more ma-
terial.
Sunipia saccata Aver., sp. nova. — Fig. 8.
Creeping, rhizomatous epiphytic herb. Rhizome
rigid, dull yellowish to gray, (2)2.5–2.8(3) mm thick,
with (3)4–6(8) distant pseudobulbs and numerous
thin rigid wiry flexuose roots. Pseudobulbs erect, nar-
rowly ovate, (1.2)1.4–1.8(2) cm tall, (0.4)0.5–0.7(0.9)
cm wide, glossy green, young smooth, older finely ver-
ruculose and wrinkled, with 1 apical leaf. Leaves short-
ly petiolate; petiole almost terete, adaxially grooved,
(4)5–8(9) mm long; leaf blade coriaceous, erect, lan-
ceolate to narrowly oblong-lanceolate, conduplicate,
slightly unequally bilobed at apex, (6)7–10(12) cm
long, (6)8–10(12) mm wide. Inflorescence arising from
the base of pseudobulb, erect to patent, lax raceme with
(2)4(6) flowers; peduncle thin, green, straight, (4.5)5–
6(6.5) cm long, with (2)3(4) small tubular scarious
sterile bracts; rachis (1.5)2(2.5) cm long, slightly zig-
zag. Floral bracts pale yellowish to almost white, scari-
ous, narrowly triangular, acute, (5)6–7(8) mm long,
(1.6)2–2.5(2.8) mm wide near the base. Pedicel and
ovary ascending to erect, light glossy green, (5.5)6–
7(8) mm long, 0.5–0.7 mm wide, shallowly longitudi-
nally grooved. Flowers entirely light green, resupinate,
widely opening, with light sweet fragrance. Tepals very
thin, almost flat. Median sepal ovate, obtuse, (6.5)7–
7.5(8) mm long, (4.2)4.5–4.8(5) mm wide, with 3 indis-
tinct greenish nerves, with entire margin. Lateral sepals
oblique, narrowly ovate, acute, (8)8.5–9(9.5) mm long,
(3.2)3.4–3.6(3.8) mm wide, each with 1 nerve, joined at
the base at 0.25 of their length, with entire margin. Pe-
tals oblique triangular, roundish and shortly apiculate
at apex, (2.8)3–3.5(3.7) mm long and wide at the base,
with 1 nerve, finely irregularly serrulate along the mar-
gin. Lip green to light yellowish-green, fleshy, subor-
bicular, entire, saccate, pouch-shaped, (2)2.2–2.4(2.6)
mm long and wide, with entire straight incurved mar-
Fig. 7. New orchids in the flora of Laos: Porpax ustulata, analytical plate (AL 656.1b, LE 01055963).
a–c
—
flowering plants; d–h
—
intact flower, top, side, half side, back and front views; i — flower, bottom and top views; j — intact
flower, side view, flower with lateral sepal removed, flower with lateral sepal and petal removed, flower with lateral sepal, petal and
lip removed; k — intact lip, front view; l — column with operculum, front and side views, lip with operculum half removed; m — lip,
adaxial and abaxial views. Photos, correction and design by L. Averyanov and T. Maisak.
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
36
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
37
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
38
Fig. 8. New orchids in the flora of Laos: Sunipia saccata, analytical plate (LA-VN 931a/TM 1224, LE 01058572).
a — flattened flowering plants; b — pseudobulb; c — inflorescences; d — flower, front and back views; e — flower, half side view;
f — flattened sepals and petal; g — column and lip, front view; h — intact column and lip, front and side views; i — column and
lip, sagittal section, side view; j — lip, side, top and bottom views; k — column, front and half side views; l — column, front, back
and side views; m — operculum with pollinarium; n — pollinarium. Photos, correction and design by L. Averyanov and T. Maisak.
gins in basal part and slightly recurved at apex, with 5
prominent veins, abaxially longitudinally grooved, in-
side with large broad callus rising from the lip middle to
its base. Column light green, shortly cylindrical, 2–2.2
mm tall, 1.2–1.3 mm wide, at apex with prominent flat,
semicircular stelidia 0.8–0.9 mm long and wide and
fleshy slightly incurved column foot 2.2–2.4 mm long,
solidly fused with the lip base; stigma circular, concave;
rostellum fleshy arc-like. Operculum cap-shaped, with
no beak, light yellowish to almost white. Pollinaria 2,
each with 2 equal pollinia attached to narrowly deltoid
caudicle, 0.9–1.1 mm long, distally attenuate and termi-
nated with small hemispheric bright yellow viscidium;
pollinia solid, bright yellow, almost globular, 0.3–0.4
mm across. Fruits not seen.
Type: “Laos, Xiangkhouang Prov., Peak Distr.,
Oran village, around point 19°38′53′′ N 103°23′12′′ E,
primary and secondary broadleaved evergreen dry for-
est on shale sandstone slopes and along ridge edge at el-
evation 1750–1850 m a. s. l., epiphyte on tall mossy tree
along ridge edge, not rare, 2 IV 2015, T. Maisak, L. Ave-
ryanov, N. T. Hiep, N. S. Khang, N. Q. Hieu, Pheng
Phengsintham, herbarium specimen prepared 1 X 2018,
L. Averyanov, LA-VN 931a / TM 1224 (holotype — LE:
LE 01058572).
Analytical plate: 0322 / LA-VN931a/TM
1224 (http://go.herbariumle.ru/exs-herb-0322).
Etymology. Species name refers to the saccate,
pouch-like lip.
Distribution. Laos (Xiangkhouang Prov., Peak
Distr.). Endemic.
Ecology, phenology and conservation
status. Creeping branch epiphyte on tall trees. Pri-
mary broadleaved evergreen dry forest on shale sand-
stone. 1750–1850 m a. s. l. Fl. IX–X. Rare. Estimated
IUCN Red List status — DD.
Note. Sunipia saccata is a very distinct species, differing
from all its congeners by having an almost spherical, saccate,
pouch-shaped lip. This rare and potentially strictly endemic
plant has a very limited distribution in the mountainous re-
gions of northeastern Laos. In some recent surveys the ge-
nus Sunipia Buch. -Ham. ex Sm. is regarded as a synonym of
Bulbophyllum Thouars, nom. cons. (Pridgeon et al., 2014).
Despite this opinion Sunipia (= Ione Lindl.) remains well seg-
regated genus based on many morphological characters. We
accept it here as a well defined genus, which distinctly differs
from almost all Bulbophyllum species.
Acknowledgements
Fieldworks, the results of which are presented in
this paper, were financially supported in part by Inte-
grated Nature Conservation and Sustainable Resource
Management in the Hin Nam No Region (GIZ-Hin-
NamNo), a component of the German Development
Cooperation programme Protection and Sustainable
Use of Forest Ecosystems and Biodiversity (ProFEB),
implemented by the Deutsche Gesellschaft für Interna-
tionale Zusammenarbeit (GIZ) GmbH, USA National
Geographic Society, “Assessment of plant diversity in
main limestone areas of central Laos” (#9906-16), and
Russian Foundation for Basic Research “Plant taxo-
nomy, geography and biology in local floras of east-
ern Indochina” (15-04-00419А), and were carried out
in the framework of the institutional research proj-
ect of the Komarov Botanical Institute of the Russian
Academy of Sciences “Study of the flora of Indochina”
(АААА-А19-119031290052-1).
References
Averyanov L. V. 1999. Nomenclatural changes and new or-
chids (Orchidaceae) in the flora of Vietnam // Bot. Zhurn.
(St. Petersburg). Vol. 84, No 10. P. 126–130. [In Russian]
(Аверьянов Л. В. 1999. Номенклатурные комбинации
и новые виды орхидных (Orchidaceae) во флоре
Вьетнама // Бот. журн. Т. 84, No 10. С . 126–130).
Averyanov L. V. 2013a. The orchids of Vietnam: Illustrated
survey. Part 4. Subfamily Epidendroideae (tribes Are-
thuseae and Malaxideae) // Turczaninowia. Vol. 16, No 1.
P. 5 –163. (Аверьянов Л. В. 2013a. Иллюстрированный
обзор орхидных Вьетнама. Часть 4. Подсем. Epidendroi-
deae (трибы Arethuseae и Malaxideae) // Turczaninowia.
Т. 16, No 1. С. 5–163).
Averyanov L. V. 2013b. New and rare orchids (Orchida-
ceae) in the flora of Cambodia and Laos // Turczanino-
wia. Vol. 16, No 4. P. 26–46. (Аверьянов Л. В. 2013b.
Новые и редкие виды орхидных во флоре Камбоджи и
Лаоса // Turczaninowia. Т. 16, No 4. С . 26–46). https://
doi.org/10.14258/turczaninowia.16.4.7
Averyanov L. V., Averyanova A. L . 2003. Updated checklist
of the orchids of Vietnam. Hanoi: Vietnam National Univ.
Publ. House. 102 p. [In English and Vietnamese].
Averyanov L. V., Nguyen K. S., Maisak T. V., Konstanti-
nov E. L., Nguyen T. H., Bounphanmy S. 2016. New and rare
orchids (Orchidaceae) in the flora of Cambodia and Laos //
Turczaninowia. Vol. 19, No 3. P. 5 –58. (Аверьянов Л. В.,
Кхан Синь Нгуен, Майсак Т. В., Константинов Е. Л.,
New orchid species (Orchidaceae) in the flora of Laos
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
39
Тьен Хьеп Нгуен, Сомчан Бонфанами. 2016. Новые
и редкие виды орхидных во флоре Камбоджи и
Лаоса // Turczaninowia. Т. 19, No 3. С. 5–58). https://
doi.org/10.14258/turczaninowia.19.3.1
Averyanov L. V., Averyanova A. L., Sinh Khang Nguyen, Or-
lov N. L., Maisak T. V., Hiep Tien Nguyen. 2018a. New and
rare orchid species (Orchidaceae) in the flora of Cambodia
and Laos // Novosti Sist. Vyssh. Rast. Vol. 49. P. 24–41.
(Аверьянов Л. В., Аверьянова А. Л., Кхан Синь Нгуен,
Орлов Н. Л ., Майсак Т. В ., Хьеп Тьен Нгуен. 2018a.
Новые и редкие виды орхидных (Orchidaceae) во флоре
Камбоджи и Лаоса // Новости сист. высш. раст. Т. 49.
C. 24–41). https://doi.org/10.31111/novitates/2018.49.24
Averyanov L. V., Khang Sinh Nguyen, Maisak T. V. 2018b.
Chiloschista pulchella (Orchidaceae: Aeridinae) new orchid
species from Lao PDR // Taiwania. Vol. 63, No 4. P. 389 –
392. https://doi.org/10.6165/tai.2018.63.389
Averyanov L., Khang Sinh Nguyen, Maisak T. 2019. Plant
diversity, flora and vegetation of Hin Nam No Protected
Area. Saarbrucken: Lambert Acad. Publ. 431 p.; 15 tabs.,
1397 figs.
Gale S., Schuiteman A., Watthana S., Sando T., Souvanna-
khoummane K., Averyanov L.V., Suddee S. 2016. Studies
in Asian Nervilia (Nervilieae, Epidendroideae, Orchidaceae)
VI: N. mekongensis, a new species from Thailand, Cambo-
dia, Laos and Vietnam // Phytotaxa. Vol. 247, No 4. P. 267–
273. https://doi.org/10.11646/phytotaxa.247 .4.4
Gale S., Kumar P., Phaxaysombath T. 2018. A Guide to Or-
chids of Laos. Kota Kinabalu: Natural History Publications
(Borneo). 204 p.
Gale S., Phaxaysombath T. 2017. Studies in Asian Nervi-
lia (Orchidaceae) VII: Nervilia kasiensis, a new Lao
endemic // Blumea. Vol. 62, No 1. P. 1–5 . https://
doi.org/10.3767/000651917X694732
Geiger D. L . 2019. Studies on Oberonia 5 (Orchidaceae:
Malaxideae). Twenty-four new synonyms, and a cor-
rected spelling // Blumea. Vol. 64. P. 123–139. https://
doi.org/10.3767/blumea.2019.64.02.04
Gruß O., Rungruang N., Chaisuriyakul Y., Dionisio I. 2014.
Paphiopedilum rungsuriyanum, eine neue Art aus Nord-
Laos // OrchideenJournal. Jg. 21, Hf. 3. S. 3 –11 . http://
orchideen-journal.de/permalink/gruss_rungruang_yony-
outh_chaisuriyakul_dionisio_Paphiopedilum.pdf
Hu A.-Q., Ye D.-P., Gale S. W., Saunders R. M. K., Fisher G. A.,
Li J.-W. 2017. Bulbophyllum jingdongense (Orchidaceae), a
new species in the Cirrhopetalum alliance from South China
and Laos // Phytotaxa. Vol. 307, No 3. P. 199–204. https://
doi.org/10.11646/phytotaxa.307.3 .4
Kumar P., Gale S. W., Schuiteman A., Bouamanivong S.,
Fischer G. A. 2016. Identifying orchid hotspots for bio-
diversity conservation in Laos: the limestone karst veg-
etation of Vang Vieng District, Vientiane Province //
J. Threat. Taxa. Vol. 8, No 12. P. 9397–9417. https://
doi.org/10.11609/jott.2826.8 .12 .9397-9417
Kumar P., Gale S. W., Pedersen H. A ., Phaxaysombath T.,
Bouamanivong S., Fischer G. A . 2018. Additions to the or-
chid flora of Laos and taxonomic notes on orchids of the
Indo-Burma region // Taiwania. Vol. 63, No 1. P. 61–83 .
https://doi.org/10.6165/tai.2018.63 .61
Newman M. F., Ketphanh S., Svengsuksa B., Thomas P., Seng-
dala K., Lamxay V., Armstrong K. 2007. A checklist of the
vascular plants of Lao PDR. Edinburgh: Royal Botanic
Garden press. 394 p.
Ng Y. P., Schuiteman A., Pedersen H. A., Petersen G.,
Watthana S., Seberg O., Pridgeon A. M ., Cribb P. J.,
Chase M. W. 2018. Phylogenetics and systemat-
ics of Eria and related genera (Orchidaceae: Podochi-
leae) // Bot. J. Linn. Soc. Vol. 186, No 2. P. 179–201.
https://doi.org/10.1093/botlinnean/box088
Pridgeon A. M., Cribb P. J., Chase M. W., Rasmussen F. N .
2014. Genera Orchidacearum. Vol. 6: Epidendroideae (Part
3). Oxford: Oxford Univ. Press. 544 p.
Schuiteman A., Bonnet P. 2008. Eparmatostigma dives (Orchida-
ceae), a new generic record for Laos // Blumea. Vol. 53, No 2.
P. 341–344. https://doi.org/10.3767/000651908X607990
Schuiteman A., Bonnet P. 2009. Holcoglossum calcicola und
Paphiopedilum barbigerum var. sulivongii: Zwei attrak-
tive neue Orchideen der Kalksteinberge von Laos //
OrchideenJournal. Jg. 16, Hf. 1. S. 6–14. http://
www.vdof.de/pdf/artikel1_2009.pdf (Accessed 05.09 .2019).
Schuiteman A., Bonnet P., Svengsuksa B., Barthelemy D.
2008. An annotated checklist of the Orchidaceae of Laos //
Nordic J. Bot. Vol. 26, No 5–6 . P. 257–316. https://
doi.org/10.1111/j.1756-1051.2008.00265.x
Schuiteman A., Luang Aphay S., Iio Sh. 2018. Paphiopedi-
lum papilio-laoticus (Orchidaceae), a new species from
Laos // OrchideenJournal. Vol. 6, No 4. P. 3 –5. http://
orchideen-journal.de/permalink/OrchideenJournal_Vol6_4 .pdf
Seidenfaden G. 1977. Contributions to the orchid flora of Thai-
land VIII // Bot. Tidsskr. Bd. 72 (1). P. 1–14 .
Seidenfaden G. 1979. Orchid genera in Thailand VIII. Bulbo-
phyllum Thou // Dansk Bot. Ark. Vol. 33 (3). P. 1–228.
Seidenfaden G. 1982. Orchid genera in Thailand X. Trichotosia
Bl. and Eria Lindl. // Opera Bot. Vol. 62. P. 1 –157.
Seidenfaden G. 1992. The orchids of Indochina // Opera Bot.
Vol. 114 . P. 1 –502.
L. V. Averyanov, K. S. Nguyen, T.V.Maisak, H. T. Nguyen, N.L.Orlov, D.D.Slastunov, I. V. Sokolova
Новости систематики высших растений | Том 50 | 2019
40
Salix acutifolia f. pendula (Salicaceae) — a new form
Salix acutifolia f. pendula (Salicaceae) — новая форма
N. Y. Stepanova1, O. V. Epanchintseva2,
I. V. Belyaeva2,3
1 Tsitsin Main Botanical Garden, Russian Academy of Sciences
Botanicheskaya Str., 4, Moscow, 127276, Russia
ny_stepanova@mail.ru
2 Botanical Garden, Ural Branch of the Russian Academy of
Sciences
8 Marta Str., 202A, Yekaterinburg, 620144, Russia
olgae06@mail.ru
3 Royal Botanic Gardens Kew
Richmond, TW9 3AE, UK
i.belyaeva@kew.org, willow.belyaeva2017@yandex.com
N. Y. Stepanova, O. V. Epanchintseva, I. V. Belyaeva
Н. Ю. Степанова1, О. В. Епанчинцева2,
И. В. Беляева2,3
1 Главный ботанический сад им. Н. В. Цицина РАН
Ботаническая ул., 4, Москва, 127276, Россия
ny_stepanova@mail.ru
2 Ботанический сад Уральского отделения РАН
ул. 8 Марта, 202а, Екатеринбург, 620144, Россия
olgae06@mail.ru
3 Королевские ботанические сады Кью
Ричмонд, TW9 3AE, Великобритания
i.belyaeva@kew.org, willow.belyaeva2017@yandex.com
https://doi.org/10.31111/novitates/2019.50.41
Abstract. A new form, Salix acutifolia f. pendula I. V. Belyaeva, N. Y. Stepanova et O. V. Epanch., is described and its distribu-
tion is given. Existing confusion between the names, S. acutifolia ‘Duschanbensis’, S. acutifolia ‘Pendula’, S. acutifolia ‘Moscow
Cascade’, S. acutifolia var. duschanbensis and S. acutifolia [unranked] pendula is clarified.
Keywords: Salicaceae, Salix acutifolia, new form.
Аннотация. Приводится описание новой формы Salix acutifolia Willd. f . pendula I. V . Belyaeva, N. Y. Stepanova et
O. V. Epanch. Разъяснена существующая путаница в применении названий S. acutifolia ‘Duschanbensis’, S. acutifolia ‘Pen-
dula’, S. acutifolia ‘Moscow Cascade’, S. acutifolia var. duschanbensis и S. acutifolia [unranked] pendula.
Ключевые слова: Salicaceae, Salix acutifolia, новая форма.
Поступила в редакцию | Submitted: 05.09.2019
Принята к публикации | Accepted: 28.11.2019
Working on taxa described by Alexey K. Skvortsov
the authors of the current paper came across the name
Salix acutifolia var. duschanbensis that appeared on two
herbarium sheets at MHA (Figs. 1; 2) and was described
by Skvortsov (1968: 84) as a cultivar Salix acutifolia
‘Duschanbensis’. This plant was cultivated in the Bo-
tanical Garden of Dushanbe, Tajikistan, and brought
by Skvortsov for cultivation in the Botanical Garden
of Moscow State University and in the Tsitsin Main
Botanical Garden of the Russian Academy of Sciences,
Moscow for further research. From here this plant was
distributed into other botanic gardens in Russia and
abroad and also into private collections under the names,
S. acutifolia [unranked] pendula and S. acutifolia ‘Pen-
dula’, as a very distinctive ornamental tree with pendu-
lous branches (Fig. 3). Although the cultivar name was
published and established by Skvortsov according to the
rules of ICNCP (Brickell et al., 2016: Art. 27), the other
names, S. acutifolia [unranked] pendula, that was used
widely in garden practice, and S. acutifolia var. duschan-
bensis, which appeared on the labels of the herbarium
specimens, were not validly published (contrary to Art.
38.1 of ICN, Turland et al., 2018). Furthermore, the
cultivar names, S. acutifolia ‘Pendula’ and S. acutifolia
‘Moscow Cascade’ were not established (contrary to Art.
27 of ICNCP, Brickell et al., 2016) and make current ap-
plication of these names in garden practiсe unclear and
confusing. Moreover, because the cultivar name S. acuti-
folia ‘Duschanbensis’ was published in the regional «Flo-
ra» it did not come to the attention of all botanists and,
consequently, this cultivar name does not appear in the
Checklist for Cultivars of Salix (Kuzovkina, 2015: 32) al-
though two other cultivars of this willow are mentioned
in this checklist, S. acutifolia ‘Pendula’ and S. acutifolia
‘Moscow Cascade’. The author of the checklist states as
follows: «‘Moscow Cascade’ (syn. ‘Pendula’, nom inval.).
No description or published reference was found; there-
fore, the name is not established. This cultivar originated
at the Moscow Botanical Garden, Russia, and was first
called ‘Pendula’. This name is currently listed on some
gardening websites. Note: The original epithet ‘Pendula’
was replaced with ‘Moscow Cascade’ because it was not
2019
50: 41–46
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
Fig. 1. Holotype of Salix acutifolia f. pendula (MHA0032916).
N. Y. Stepanova, O. V. Epanchintseva, I. V. Belyaeva
Новости систематики высших растений | Том 50 | 2019
42
Fig. 2. Paratype of Salix acutifolia f. pendula (MHA0032915).
Salix acutifolia f. pendula (Salicaceae)— a new form
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
43
N. Y. Stepanova, O. V. Epanchintseva, I. V. Belyaeva
Новости систематики высших растений | Том 50 | 2019
44
valid in the Latin form which came in use after 1959».
Similar cases of confusion in the use of cultivar names
and the incorrect application of scientific names of Sa-
lix in cultivation were also described and clarified earlier
(Kuzovkina et al., 2016a, b; Belyaeva et al., 2018).
Weeping forms are known for many willows. There
are 4 such records for species and 24 records for infra-
specific taxa in International Plant Names Index (IPNI,
2019). There is in the section Daphnella Ser. ex Duby,
where S. acutifolia Willd. belongs, already one weeping
willow — Salix rorida Laksch. f. pendula Kimura. Thus,
it is not surprising that S. acutifolia includes plants
with a weeping crown as well. The authors of this pub-
lication, studying willows growing in the Urals (Belya-
eva, 1994; Belyaeva et al., 2006), have observed a few
individuals of S. acutifolia with pendulous branches in
natural populations, cuttings of which were collected
and plants grown from them were cultivated in the Bo-
tanical Garden of the Ural Branch of the Russian Acad-
emy of Sciences, Yekaterinburg. Herbarium material is
stored at SVER. Based on the observation of the afore-
mentioned weeping willows the authors of the current
paper describe a new form of S. acutifolia to achieve
clarity and set up a connection between all the existing
names mentioned above.
Salix acutifolia Willd. f. pendula I. V. Belyaeva,
N. Y. Stepanova et O. V. Epanch., forma nova.
Small tree to 3–3.5 m tall with long thin pendulous
branches. Branchlets yellowish to dark chestnut, gla-
brous, with a dense glaucous bloom. Buds dimorphic,
glabrous, adpressed to shoot, pubescent in the base
while young, glabrous later. Generative buds to 0.8–1
cm long with acute slightly divergent from the shoot
apex; vegetative to 0.3–0.4 cm long, acuminate. Leaves
lanceolate, 4–16 cm long and 0.7–1.7 cm wide, with
acute apex and cuneate base, thin-leathery, glabrous,
serrate, gland-dotted on margin, dark green, lustrous
above, blue grey glaucous below. Stipules lanceolate,
acute, glandular-dentate, length equal to half of peti-
ole, 1–1.7 cm, adnate with petiole. Petioles 0.7–2.2 cm
long, yellowish with red dots, glabrous. Catkins, female,
densely flowered, subsessile without leaflets at the base
2.5–3 cm long. Floral bracts oblong-ovate, 1–1.5(2)
mm long, acute at apex, dark brown or almost black,
densely pubescent with straight, long white hairs. Ova-
ry ovate-conical, 2–4 mm long, glabrous, laterally flat-
tened, on peduncle 0.7–1.5 mm long; styles connate, 0.5
mm; stigmas bifid, oblong, to 0.3 mm long. Nectary 1,
adaxial, rectangular, 0.2–0.4 mm long. Number of seed
scars in capsule 6.
Holotype: Russia, Moscow, cultivated in the Bo-
tanical Garden of Moscow State University, 13 V 1957,
A. Skvortsov, ♀ (MHA: MHA0032916!). — Fig. 1.
Paratypes. Tadzhikistan, Dushanbe [Stalinabad
1929–1961], cultivated in the Botanical Garden, 31 X 1954,
A. Skvortsov, ♀ (MHA0032915! — Fig. 2); Russia, Yekaterin-
burg, cultivated in the Botanical Garden of the Ural Branch
of the Russian Academy of Sciences, 26 VIII 2019, I. V. Belya-
eva, O. V. Epanchintseva, No 009, ♀ (SVER!, WSY!).
Affinity. Salix acutifolia f. pendula differs from
S. acutifolia f. acutifolia (see descriptions by Willdenow,
1806: 489; Nasarow, 1936; Belyaeva et al., 2006; Valya-
gina-Malyutina, 2018) in having pendulous branches
and branchlets and a more graceful habit with smaller
buds and catkins.
Etymology. The epithet ‘pendula’ derives from
Latin ‘pendulus’ that means ‘hanging down’ (Stearn,
2004) and describes the weeping form of the crown of
this willow.
Distribution. Described from cultivated plant.
Naturally occurs near Samara, Vyatka and Orenburg.
Currently, it is cultivated in Moscow, Novosibirsk,
Perm, Syktyvkar and Yekaterinburg (Russia), Lyd-
brook (United Kingdom), and Meise (Belgium).
Acknowledgements
The work was carried out in accordance with Institu-
tional research project No 118021490111-5. The authors
are grateful to anonymous reviewers for their useful
comments that helped to improve the original text of the
manuscript. The work of the editors of the journal is also
greatly appreciated. Many thanks to Sonja Deneve (BR)
for sharing the photo of S. acutifolia f. pendula.
References
Belyaeva I. V. 1994. Sem. Salicaceae Mirbel — Ivovyye [Fam.
Salicaceae Mirbel — Willow family] // Opredelitel so-
sudistykh rastenii Srednego Urala [Identification key
of vascular plants of Middle Ural] / P. L. Gorchakovsky
(ed.-in-chief). Moscow: Nauka. P. 149–157. [In Russian]
(Беляева И. В. 1994. Сем. Salicaceae Mirbel — Ивовые //
Определитель сосудистых растений Среднего Урала /
отв. ред. П . Л . Горчаковский. М .: Наука. С . 149–157).
Belyaeva I. V., Epanchintseva O. V., Shatalina A. A., Semkina
L. A . 2006. Willows of Ural: Atlas and identification key.
Yekaterinburg: Russian Academy of Sciences, Ural Branch.
Fig. 3. Salix acutifolia f. pendula.
1 — habit; 2 — fragment of trunk with bark; 3 — fragment of branch with glaucous bloom; 4 — leaves; 5 — fragment of shoot with
generative bud and stipule; 6 — fragment of branch with vegetative bud and stipule; 7 — fragment of branch with female catkins.
Photos: 1 — by Sonja Deneve; 2, 3, 7 — by Olga Epanchintseva; 4–6
—
by Irina Belyaeva.
Salix acutifolia f. pendula (Salicaceae)— a new form
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
45
173 p. [In Russian] (Беляева И. В., Епанчинцева О. В.,
Шаталина А. А ., Семкина Л. А. 2006. Ивы Урала: Атлас-
определитель. Екатеринбург: УрО РАН. 173 с.).
Belyaeva I. V., Epantchintseva O. V., Govaerts R. H. A .,
McGinn K., Hunnex J., Kuzovkina Y. A. 2018. The applica-
tion of scientific names to plants in cultivation: Salix vitel-
lina L. and related taxa (Salicaceae) // Skvortsovia. Vol. 4,
No 2. P. 42–70.
Brickell C. D., Alexander C., Cubey J. J ., David J. C ., Hoff-
man M. H. A., Leslie A. C ., Malécot V., Jin X. (eds.). 2016.
International Code of Nomenclature for Cultivated Plants
(ICNCP or Cultivated Plant Code). 9
th ed. Katwijk aan
Zee: Drukkerij Station Drukwerk. 190 p.
IPNI: International Plant Names Index. 2019. https://
www.ipni.org/ (Accessed 23.08 .2019).
Kuzovkina Y. A . 2015. Checklist for cultivars of Salix L.
(willow) / International Poplar Commission, FAO.
http://www.fao.org/forestry/44058-
0370ab0c9786d954da03a15a8dd4721ed.pdf
Kuzovkina Y. A ., Epantchintseva O. V., Belyaeva I. V. 2016a.
The application of scientific names to plants in cultivation:
Salix × cottetii Lagger ex A. Kern. (Salicaceae) // Skvortso-
via. Vol. 2, No 3. P. 32–43.
Kuzovkina Y. A ., Dodge M., Belyaeva I. V. 2016b. Clarify-
ing affiliations of Salix gracilistyla Miq. Cultivars and hy-
brids // HortScience. Vol. 51, No 4. P. 334–341. https://
doi.org/10.21273/HORTSCI.51.4 .334
Nasarow M. I. 1936. Rod Iva — Salix L. [Genus Willow — Salix
L.] // Flora URSS / V. L . Komarov (red. princip.). T. 5 .
Mosqua; Leningrad: Ed. Acad. Sci. URSS. P. 24–216. [In
Russian] (Назаров М. И . 1936. Род Ива — Salix L. //
Флора СССР / гл. ред. В. Л. Комаров. Т. 5 . М .; Л.: Изд-
во АН СССР. С . 24 –216).
Skvortsov A. K. 1968. Sem. Ivovyye — Salicaceae Mirbel [Wil-
low family — Salicaceae Mirbel] // Flora Tadzhikskoi SSR
/ P. N . Ovchinnikov (ed.-in-chief). T. 3. Leningrad: Nauka.
P. 56–114. [In Russian] (Скворцов А. К. 1968. Сем. Иво-
вые — Salicaceae Mirbel // Флора Таджикской ССР / гл.
ред. П. Н. Овчинников. Т. 3. Л.: Наука. С . 56–114).
Stearn W. T. 2004. Botanical Latin. 4
th ed. Portland, Oregon:
Timber Press. 560 p.
Turland N. J., Wiersema J. H ., Barrie F. R., Greuter W., Hawk-
sworth D. L., Herendeen P. S., Knapp S., Kusber W.-H., Li
D.-Z ., Marhold K., May T. W., McNeill J., Monro A. M.,
Prado J., Price M. J., Smith G. F. (eds.). 2018. Interna-
tional Code of Nomenclature for algae, fungi, and plants
(Shenzhen Code) adopted by the Nineteenth International
Botanical Congress Shenzhen, China, July 2017. Glashüt-
ten: Koeltz Botanical Books. (Regnum Vegetabile 159).
https://doi.org/10.12705/Code.2018
Valyagina-Malyutina E. T. 2018. Ivy Rossii: Illustrirovannyi
opredelitel [The willows of Russia: an illustrated
identification book]. Moscow: KMK Scientific Press. 372 p.
[In Russian] (Валягина-Малютина Е. Т. 2018. Ивы Рос-
сии: иллюстрированный определитель. М .: Т-во науч.
изд. КМК. 372 с.).
Willdenow C. L. 1806. Salix // Species plantarum / C. L . Will-
denow. Berolini. T. 4, ps. 2 . P. 653–710.
N. Y. Stepanova, O. V. Epanchintseva, I. V. Belyaeva
Новости систематики высших растений | Том 50 | 2019
46
Caelestium, genus novum (Polygonaceae, Polygoneae): evidence
bаsed on the results of molecular phylogenetic analyses of tribe
Polygoneae, established with consideration of the secondary structure
of the ITS nrDNA regions
Caelestium, genus novum (Polygonaceae, Polygoneae): обоснование,
представленное по результатам молекулярно-филогенетических анализов
трибы Polygoneae, предпринятых с учетом вторичной структуры локусов ITS1
и ITS2 ядерной рибосомной ДНК
O. V. Yurtseva, E.V. Mavrodiev
Поступила в редакцию | Submitted: 26.07.2019
Принята к публикации | Accepted: 14.12.2019
O. V. Yurtseva1
, E. V. Mavrodiev2
1 Lomonosov Moscow State University
Faculty of Biology, Department of Higher Plants
Leninskiye Gory, 1, Bld. 12, 119991, Moscow, Russia
olgayurtseva@yandex.ru
2 University of Florida
Florida Museum of Natural History
Gainesville, Florida, 32611, USA
evgmavrodiev@yandex.ru
O. В. Юрцева1, Е. В. Мавродиев2
1 Московский государственный университет имени
М. В. Ломоносова
Биологический факультет, кафедра высших растений
Ленинские горы, 1, стр. 12, Москва, 119991, Россия
olgayurtseva@yandex.ru
2 Университет Флориды
Флоридский музей естественной истории
Гейнсвилл, Флорида, 32611, США
evgmavrodiev@yandex.ru
https://doi.org/10.31111/novitates/2019.50.47
Abstract. The genus Bactria, recently described to house Atraphaxis ovczinnikovii from the Pamirs and Bactria lazkovii from the
Central Tien Shan, may also include Polygonum tianschanicum from the Eastern Tien Shan. In order to re-circumscribe Bactria
and to clarify the place of Polygonum tianschanicum in tribe Polygoneae, we performed Maximum Likelihood and Bayesian anal-
yses of combined regions of the plastid genome and ITS1–2 regions of nrDNA for 58 species of tribe Polygoneae, with special
attention to the secondary structure of pre-rRNA of the ITS1 and ITS2 loci. In all our analyses, Bactria lazkovii and Polygonum
tianschanicum formed a highly supported clade, sister to Bactria ovczinnikovii in the plastid trees, but separate from the latter,
as well as from the remaining genera in the ITS-based trees. Details of the secondary structure of pre-rRNA of the ITS1 and
ITS2 loci also confirmed the close relationships of Bactria lazkovii and Polygonum tianschanicum, quite different from Bactria
ovczinnikovii. Based on the molecular analyses, details of the secondary structure of pre-rRNA of the ITS1 and ITS2 loci, fine
morphological distinctions, and distributional data, we propose the new genus Caelestium Yurtseva et Mavrodiev, presumably of
hybrid origin, to include C. lazkovii and C. tianschanicum.
Keywords: Polygoneae, Atraphaxis, Bactria, Caelestium, new genus, incongruence, molecular analyses, pseudogene, rpl32–
trnL(UAG), secondary structure of pre-rRNA, trnL–trnF, Pamirs, Tien Shan.
Аннотация. Род Bactria, недавно установленный по результатам молекулярного и морфологического исследования три-
бы Polygoneae для Atraphaxis ovczinnikovii с Южного Памира и Bactria lazkovii с Центрального Тянь-Шаня, может вклю-
чать также морфологически близкий Polygonum tianschanicum, редкий эндемик Восточного Тянь-Шаня, который ранее
не был исследован с молекулярно-филогенетической точки зрения. Чтобы уточнить состав рода Bactria и выяснить фи-
логенетическое положение Polygonum tianschanicum в трибе Polygoneae, мы выполнили молекулярно-филогенетические
анализы (метод максимального правдоподобия и Байесов анализ) объединенных участков пластидного генома и участка
ITS ядерной рибосомной ДНК для 58 видов Polygoneae, с особым вниманием ко вторичной структуре пре-рРНК локу-
сов ITS1 и ITS2. Во всех наших анализах Bactria lazkovii и Polygonum tianschanicum образовали хорошо поддержанную
кладу, сестринскую к Bactria ovczinnikovii в пластидных деревьях, но обособленную от последнего вида (как и от прочих
родов Polygoneae) в анализе ITS. Детали вторичной структуры пре-рРНК локусов ITS1 и ITS2 также показали тесное
родство Bactria lazkovii и Polygonum tianschanicum, равно как и их существенные отличия от Bactria ovczinnikovii. Резуль-
таты молекулярных анализов пластидных и ядерных участков, различия вторичной структуры пре-рРНК локусов ITS1
и ITS2, морфологические отличия и географическое распространение позволяют выделить новый для науки род Caeles-
tium Yurtseva et Mavrodiev. Род имеет предположительно гибридогенное происхождение и включает два узколокальных
эндемика Тянь-Шаня: C. lazkovii (= Bactria lazkovii) из Кыргызстана и C. tianschanicum (= Polygonum tianschanicum) из
2019
50: 47–79
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
Северо-Восточного Китая. Полученные результаты обсуждаются в контексте уточненного состава трибы Polygoneae, ко-
торый определяется на основании интерпретации результатов молекулярно-филогенетических анализов.
Ключевые слова: Polygoneae, Atraphaxis, Bactria, Caelestium, новый род, неконгруэнтность, молекулярный анализ, псев-
доген, rpl32–trnL(UAG), вторичная структура пре-рРНК, trnL–trnF, Памир, Тянь-Шань.
(Meisner, 1857: 84) with two species, P. sect. Pseudo-
mollia Boiss. (Boissier, 1879: 1027) with two species,
and P. sect. Duravia S. Watson (1873: 665) with ca. 20
species. N. N. Tzvelev (1987: 78) added P. sect. Plebeja
Tzvelev for P. plebeium R. Br. Polygonella Michx. (Mi-
chaux, 1803: 240) was traditionally accepted as a sepa-
rate genus numbering 11 species (e. g., Meisner, 1857;
Bentham, Hooker, 1880; Dammer, 1893; Horton, 1963;
Freeman, 2005), but today it is also treated as part of
Polygonum (Ronse De Craene et al., 2004; Schuster et
al., 2011b, 2015). Hereinafter we attributed all the listed
sections of Polygonum and Polygonella to the genus Po-
lygonum s. l. in its “moderately narrow” circumscription,
and treat the Old World sections as Polygonum s. str.
As a result of Maximum Parsimony (MP) analysis
based on 51 morphological characters of 25 species of
Polygonum a priori accepted in a wide circumscription,
L.-P. Ronse De Craene et al. (2004) recognized P. sect.
Polygonum with subsect. Polygonum and subsect. Tephis
(Adans.) Ronse Decr. et S. P. Hong; P. sect. Pseudomol-
lia; and P. sect. Duravia with subsect. Duravia (S. Wat-
son) Ronse Decr. et S. P. Hong and subsect. Polygonella
(Michx.) Ronse Decr. et S. P. Hong.
Our phylogenetic analyses of nrDNA ITS1–2 data
of Polygonum s. l. (Yurtseva et al., 2010, 2012b) con-
firmed two major clades combining, first, mostly Eur-
asian species of P. sect. Polygonum (incl. P. sect. Pseu-
domollia); second, the North American P. sect. Duravia
and P. sect. Polygonella. These results were generally
confirmed by T. M. Schuster et al. (2011b, 2015).
Our preliminary study of the ITS sequence align-
ment of Polygoneae (Yurtseva et al., 2010, 2016) showed
that many taxa of Polygoneae have extensive indels in
the ITS1 and ITS2 regions, which cause some difficulties
in the alignment of the sequence data. These difficulties,
however, can be overcome by comparing the secondary
structures of pre-RNA of the rDNA loci, since it is a way
to align sequence regions more precisely and to clarify
the relations of organisms of different taxonomic ranks
more accurately (e. g., Denduangboripant, Cronk, 2001;
Gottschling et al., 2001; Goertzen et al., 2003; Wang et
al., 2007; Tippery, Les, 2008; Milyutina et al., 2010; Edg-
er et al., 2014; Giudicelli et al., 2017).
Despite intensive modern molecular-phylogenetic
studies of tribe Polygoneae (Schuster et al., 2011a, b,
2015), not much attention has been paid to the incon-
gruences of the plastid- and ITS-based trees. Sometimes
Introduction
Atraphaxis L. and Polygonum L. established by
C. Linnaeus (1753) are perhaps the most problematic
taxa of tribe Polygoneae (Polygonaceae Juss., Polygono-
ideae); their relationships and circumscriptions are still
not exactly clarified, despite several attempts (Ronse
De Craene et al., 2004; Yurtseva et al., 2010, 2012a, b,
2016, 2017; Schuster et al., 2011b, 2015). S. Tavakkoli
et al. (2015) recently transferred Polygonum sect. Avi-
cularia Meisn. “§” Spinescentia Boiss. (Boissier, 1879:
1027) to Atraphaxis as A. sect. Polygonoides S. Tavak-
koli, Kaz. Osaloo et Mozaff., but O. V. Yurtseva et al.
(2017) accepted it as the genus Persepolium Yurtseva et
Mavrodiev, which is sister to Atraphaxis. A new genus
Bactria Yurtseva et Mavrodiev was established recently
to include Atraphaxis ovczinnikovii (Czukav.) Yurtse-
va from the Pamirs (Yurtseva et al., 2014: 43), origi-
nally described in Polygonum (Czukavina, 1962: 64),
and Bactria lazkovii Yurtseva et Mavrodiev from the
Tien Shan (Yurtseva et al., 2016: 43). These two spe-
cies formed a monophyletic Bactria sister to the clade
(Atraphaxis s. str. + Persepolium) in plastid trees, but
showed paraphyly in ITS-based trees (Yurtseva et al.,
2016), which requires further research and reappraisal.
Polygonum tianschanicum Chang Y. Yang (Yang,
1983) from Xinjiang, China, strongly resembles Bactria
lazkovii in its habit, perianth, fruit and pollen morpho-
logy, and at the first approach may be treated as part of
Bactria. We fully agree with C. Y. Yang (2010) who cor-
rectly considered Polygonum popovii Borodina (1989:
104) from China as a synonym of P. tianschanicum. Based
solely on perianth and pollen morphology, P. popovii was
recently transferred to Atraphaxis as A. popovii (Boro-
dina) Yurtseva (Yurtseva et al., 2014). In this study we
aimed to clarify the phylogenetic placement of Polygo-
num tianschanicum within Polygoneae.
Because P. tianschanicum and Bactria ovczinniko-
vii (Czukav.) Yurtseva et Mavrodiev were originally de-
scribed in Polygonum, in our analyses we used selected
members of all intrageneric taxa currently accepted
in the genus numbering ca. 130 species. Traditionally,
four “main” sections were recognized in Polygonum in
a “moderately narrow” circumscription (e. g., Dam-
mer, 1893; Hedberg, 1946; Haraldson, 1978), namely:
P. sect. Polygonum (= Avicularia) with ca. 100 species
(Meisner, 1826: 43, 85), P. sect. Tephis (Adans.) Meisn.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
48
the ITS sequence data were just merged with the plas-
tid ones after exclusion of poorly aligned regions (e. g.,
Schuster et al., 2015), that obscured the difference in
phylogenetic signals.
The main goals of our present study were: (1) to up-
date the ITS phylogeny of tribe Polygoneae, but with
special attention to the secondary structure of pre-RNA
of the ITS1 and ITS2 regions, which has never been done
before; (2) to compare the ITS and plastid topologies in
more detail; (3) to clarify the circumscriptions of the
genera Bactria and Polygonum s. l., with special atten-
tion to the pre-RNA secondary structure of the ITS1 and
ITS2 regions.
Material and methods
Morphological study
The morphological study was based on the type and
verified specimens of Bactria ovczinnikovii, B. lazkovii,
and Polygonum tianschanicum (= P. popovii) deposited
in the Herbaria of the Komarov Botanical Institute of
RAS, St. Petersburg, Russia (LE) and Lomonosov Mos-
cow State University, Moscow, Russia (MW).
Sampling for molecular study
Our study involved selected members of the taxa of
Polygoneae analyzed by T. M. Schuster et al. (2011b), al-
though they took Polygonella as part of Polygonum s. l.:
Atraphaxis (10 species), Duma T. M. Schust. (3), Fal-
lopia Adans. (3), Polygonella (8), Polygonum sect. Po-
lygonum (11), P. sect. Duravia (6), P. sect. Pseudomollia
(1), and P. sect. Plebeja (1), Muehlenbeckia Meisn. (2),
Reynoutria Houtt. (2), and Knorringia (Czukav.) Tzvelev
(1). The list of taxa was supplemented by members of
Persepolium (5), Bactria (2), Polygonum tianschanicum
(1), and P. afromontanum Greenway (1), one of two
members of Polygonum sect. Tephis. Oxyria digyna Hill
(Rumiceae) was selected as an outgroup (Sanchez et al.,
2011; Schuster et al., 2011a, b). The names of taxa and
GenBank sequences (http://www.ncbi.nlm.nih.gov)
are presented in Appendix (see the journal's website:
www.binran.ru/journals/novitates/).
In total, 31 sequences of the cpDNA rpl32–trnL(UAG)
region representing 30 species were analysed: one se-
quence was generated for this study, 13 sequences
were obtained from our previous studies (Yurtseva
et al., 2016), and 17 sequences were downloaded from
GenBank. In total, 48 sequences of the cpDNA trnL
intron(UAA) + trnL–trnF IGS region were analysed: two
sequences were elaborated for this study, 14 sequences
were obtained from our previous studies, and the re-
maining ones were downloaded from GenBank. Finally,
the combined plastid alignment includes 60 accessions
of 58 species of Polygoneae.
The same set of taxa (60 accessions of 58 species)
was used for the analysis of nrDNA ITS1–5.8S–ITS2
regions. In total, 60 ITS sequences have been analysed;
two of them were sequenced for this study, 31 sequen-
ces have been obtained earlier (Yurtseva et al., 2010,
2012b), and 27 sequences were downloaded from Gen-
Bank.
DNA isolation, amplification and DNA sequencing
Methods of DNA extractions and amplification, as
well as the strategies of the phylogenetic analyses were
described in O. V. Yurtseva et al. (2016). The nrDNA
ITS region for most of the taxa was amplified using
external primers and, in some cases, internal primers
(Table 1). Due to the substantial problems with reading
of heterogeneous nrDNA ITS sequences of Bactria laz-
kovii, in this study we designed various primers as well
as PCR profiles. Specifically, we used internal primers
ITS2-BaN, ITS2-BaPSE, ITS3-BaN and ITS3-BaPSE
and combined them with external primers ITS1, E1128f
for amplification of the18S–ITS1 region, and with B,
R2, R3, R4, R5 for amplification of the ITS2–26S re-
gion. In the case of Polygonum tianschanicum, we used
the RCA technique (Brockington et al., 2008) to im-
prove the quality of weak DNA extraction.
Identification of putative pseudogenes
To distinguish the putative pseudogenic ITS region,
we examined nucleotide divergence, insertion-deletion
events, the secondary structures themselves, as well as
the methylation-induced substitution patterns (e. g.,
Buckler, Holtsford, 1996; Buckler et al., 1997; Mayol,
Rosselloó, 2001; Hughes et al., 2002; Bailey et al., 2003;
Harpke, Peterson, 2006; Bayly, Ladiges, 2007; Ochieng
et al., 2007; Zheng et al., 2008). The indel events and
nucleotide substitutions in the 5.8S region were used
as a primary criterion, while the lower GC-content, the
destruction of the secondary structure, and pattern of
substitutions of the ITS1–5.8S–ITS2 region were used
as additional criteria for ITS pseudogene identifica-
tion. Pairwise comparisons used to detect pseudogenic
sequences were conducted separately for the regions
with different levels of variation (ITS1, 5.8S, ITS2), as
C. D. Bailey et al. (2003) recommended. The nucleotide
composition of the sequences and p-distance were cal-
culated using MEGA V.6.0 (Tamura et al., 2013) using
Tamura three-parameter distance (Kimura, 1980) with
a gap treated as a complete deletion.
Strategies of sequence alignment
All sequences have been edited using BioEdit 7.0
(Hall, 1999). As before (Yurtseva et al., 2016), the com-
bined trnL–trnF and rpl32–trnL(UAG) sequences were
Caelestium, genus novum: molecular phylogenetic analyses
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
49
aligned using MAFFT (Katoh et al., 2002; Katoh,
Standley, 2013), and then adjusted manually. We fol-
lowed MAFFT’s L-INS-i alignment strategy (Yurtse-
va et al., 2016), with the default settings for gap open-
ing penalty and offset value strategy (Katoh et al.,
2002; Katoh, Standley, 2013).
Because the explored ITS1 and ITS2 loci
contained GC-rich repeats, forming several helices
in the secondary structure, we used two identical
ITS data sets aligned with two different alignment
strategies: MAFFT’s L-INS-i alignment strategy
mentioned above, and accurate manual adjustment of
the MAFFT-aligned matrix according to the general
architecture of the helices recognized in the secondary
structure of pre-rRNA of the ITS1 and ITS2 loci (see
below).
Modelling of the secondary structure of pre-rRNA
of the ITS regions
We modelled the secondary structure of pre-rRNA
of the ITS1 and ITS2 loci using program MFOLD
(Zuker, 2003), version 3.6 (http://mfold.rna.albany.
edu/). The 5′ and 3′ ends of the ITS1 and ITS2 re-
gions were determined using the available ITS se-
quences of Polygonaceae from GenBank. For each se-
quence, the optimal structure and a set of suboptimal
ones were determined. The choice of the secondary
structure model relied on the analysis of several spe-
cies for each genus. Generally, the thermodynamically
optimal model was chosen. However, in a few cases
(Polygonum minimum S. Watson, Duma florulenta
(Meisn.) T. M. Schust., Polygonella basiramea (Small)
G. L. Nesom et V. M. Bates) the subsequent analysis
considered thermodynamically suboptimal models,
which bore the most resemblance to the models of
closely related taxa.
Results
Combined plastid topology
The Maximum Likelihood (ML) and Bayesian
(BI) analyses (Figs. 1; 2) resulted in similar topolo-
gies. Knorringia sibirica (Laxm.) Tzvelev is a sister to
the remaining members of Polygoneae, which are sub-
divided in two major clades. The first one (the RFM-
clade sensu Schuster et al., 2011b) includes mono-
phyletic Reynoutria, Fallopia, and Muehlenbeckia.
The sister clade (the APD-clade sensu Schuster et al.,
2011b), includes Polygonum s. l. and a highly suppor-
ted clade (Bactria (Atraphaxis + Persepolium)). The
Duma clade is a non-supported sister of the latter.
Polygonum s. l. (as outlined above) is monophyletic
and highly supported. It combines the highly sup-
ported New World clade with subclades Polygonella
T
a
b
l
e
1
.
P
r
i
m
e
r
s
u
s
e
d
f
o
r
a
m
p
l
i
fi
c
a
t
i
o
n
o
f
t
h
e
I
T
S
1
–
5
.
8
S
–
I
T
S
2
r
e
g
i
o
n
,
p
a
r
t
i
a
l
s
e
q
u
e
n
c
i
n
g
o
f
t
h
e
1
8
S
a
n
d
2
6
S
n
r
D
N
A
,
t
r
n
L
i
n
t
r
o
n
+
t
r
n
L
–
t
r
n
F
I
G
S
c
p
D
N
A
,
a
n
d
r
p
l
3
2
–
t
r
n
L
(
U
A
G
)
I
G
S
c
p
D
N
A
L
o
c
u
s
F
o
r
w
a
r
d
p
r
i
m
e
r
R
e
v
e
r
s
e
p
r
i
m
e
r
N
a
m
e
S
e
q
u
e
n
c
e
5
t
o
3
S
o
u
r
c
e
N
a
m
e
S
e
q
u
e
n
c
e
5
t
o
3
S
o
u
r
c
e
I
T
S
1
–
2
I
T
S
1
T
C
C
G
T
A
G
G
T
G
A
A
C
C
T
G
C
G
W
h
i
t
e
e
t
a
l
.
,
1
9
9
0
I
T
S
B
G
A
T
A
T
G
C
T
T
A
A
A
C
T
C
A
G
C
C
G
M
i
l
y
u
t
i
n
a
e
t
a
l
.
,
2
0
1
0
I
T
S
1
–
2
I
T
S
3
G
C
A
T
C
G
A
T
G
A
A
G
A
A
C
G
C
A
G
C
W
h
i
t
e
e
t
a
l
.
,
1
9
9
0
I
T
S
2
G
C
T
G
C
G
T
T
C
T
T
C
A
T
C
G
A
T
G
C
W
h
i
t
e
e
t
a
l
.
,
1
9
9
0
I
T
S
1
–
2
N
N
C
-
1
8
S
1
0
A
G
G
A
G
A
A
G
T
C
G
T
A
A
C
A
A
G
W
e
n
,
Z
i
m
m
e
r
,
1
9
9
6
C
2
6
A
G
T
T
T
C
T
T
T
T
C
C
T
C
C
G
C
T
W
e
n
,
Z
i
m
m
e
r
,
1
9
9
6
1
8
S
–
I
T
S
1
E
1
1
2
8
f
A
A
A
C
T
T
A
A
A
G
G
A
A
T
T
G
A
C
G
I
s
h
i
i
e
t
a
l
.
,
2
0
1
5
I
T
S
2
-
B
a
N
I
T
S
2
-
B
a
P
S
E
C
G
T
T
C
T
T
C
A
T
C
G
A
T
G
C
G
A
G
A
G
C
T
A
T
T
C
T
T
G
A
T
C
G
T
G
C
G
A
G
A
G
T
t
h
i
s
p
a
p
e
r
I
T
S
2
–
2
6
S
I
T
S
3
-
B
a
N
I
T
S
3
-
B
a
P
S
E
G
C
T
C
T
C
G
C
A
T
C
G
A
T
G
A
A
G
A
A
C
G
A
C
T
C
T
C
G
C
A
C
G
A
T
C
A
A
G
A
A
T
A
t
h
i
s
p
a
p
e
r
R
2
T
A
C
T
T
G
T
(
C
/
T
)
(
G
/
C
/
T
)
C
T
A
T
C
G
V
a
n
d
e
r
A
u
w
e
r
a
e
t
a
l
.
,
1
9
9
4
I
T
S
2
–
2
S
I
T
S
3
-
B
a
N
I
T
S
3
-
B
a
P
S
E
G
C
T
C
T
C
G
C
A
T
C
G
A
T
G
A
A
G
A
A
C
G
A
C
T
C
T
C
G
C
A
C
G
A
T
C
A
A
G
A
A
T
A
t
h
i
s
p
a
p
e
r
R
3
C
T
C
C
T
T
G
G
T
C
C
G
T
G
T
T
T
C
A
A
G
A
C
G
G
V
a
n
d
e
r
A
u
w
e
r
a
e
t
a
l
.
,
1
9
9
4
I
T
S
2
–
2
6
S
I
T
S
3
-
B
a
N
I
T
S
3
-
B
a
P
S
E
G
C
T
C
T
C
G
C
A
T
C
G
A
T
G
A
A
G
A
A
C
G
A
C
T
C
T
C
G
C
A
C
G
A
T
C
A
A
G
A
A
T
A
t
h
i
s
p
a
p
e
r
R
4
G
C
T
A
T
C
C
T
G
A
G
G
G
A
A
A
C
T
T
C
G
G
V
a
n
d
e
r
A
u
w
e
r
a
e
t
a
l
.
,
1
9
9
4
I
T
S
2
–
2
6
S
I
T
S
3
-
B
a
N
I
T
S
3
-
B
a
P
S
E
G
C
T
C
T
C
G
C
A
T
C
G
A
T
G
A
A
G
A
A
C
G
A
C
T
C
T
C
G
C
A
C
G
A
T
C
A
A
G
A
A
T
A
t
h
i
s
p
a
p
e
r
R
5
G
T
T
G
T
T
A
C
A
C
A
C
T
C
C
T
T
A
G
C
G
G
A
V
a
n
d
e
r
A
u
w
e
r
a
e
t
a
l
.
,
1
9
9
4
t
r
n
L
i
n
t
r
o
n
t
r
n
L
(
U
A
A
)
(
c
)
C
G
A
A
A
T
C
G
G
T
A
G
A
C
G
C
T
A
C
G
T
a
b
e
r
l
e
t
e
t
a
l
.
,
1
9
9
1
t
r
n
L
(
U
A
A
)
(
d
)
G
G
G
G
A
T
A
G
A
G
G
G
A
C
T
T
G
A
A
C
T
a
b
e
r
l
e
t
e
t
a
l
.
,
1
9
9
1
t
r
n
L
–
t
r
n
F
I
G
S
t
r
n
L
(
U
A
A
)
(
e
)
G
G
T
T
C
A
A
G
T
C
C
C
T
C
T
A
T
C
C
C
T
a
b
e
r
l
e
t
e
t
a
l
.
,
1
9
9
1
t
r
n
F
(
G
A
A
)
(
f
)
A
T
T
T
G
A
A
C
T
G
G
T
G
A
C
A
C
G
A
G
T
a
b
e
r
l
e
t
e
t
a
l
.
,
1
9
9
1
r
p
l
3
2
–
t
r
n
L
(
U
A
G
)
I
G
S
r
p
l
3
2
F
C
A
G
T
T
C
C
A
A
A
A
A
A
A
C
G
T
A
C
T
T
C
S
h
a
w
e
t
a
l
.
,
2
0
0
7
t
r
n
L
(
U
A
G
)
C
T
G
C
T
T
C
C
T
A
A
G
A
G
C
A
G
C
G
T
S
h
a
w
e
t
a
l
.
,
2
0
0
7
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
50
and Polygonum sect. Duravia, and the highly supported
Old World clade Polygonum s. str. with two subclades.
Within Polygonum s. str., the subclade which includes
P. aviculare L., the nomenclatural type of the section,
was recognized as P. sect. Polygonum. Besides the species
of this section distributed worldwide, it includes also
P. molliiforme (the type of P. sect. Pseudomollia) from
Iran and Tajikistan, and P. plebeium (the type of P. sect.
Plebeja) distributed in Southeast Asia, Australasia and
Africa. The sister subclade includes P. afromontanum
(one of two members of P. sect. Tephis) from East Africa,
which is nested among the remaining members of P. sect.
Polygonum distributed in Central Asia, so this subclade
was recognized here as P. sect. Tephis.
The strongly supported (ML/BI = 0.86/0.99) clade
Bactria including B. ovczinnikovii is a sister of a highly
supported subclade (Polygonum tianschanicum plus
Bactria lazkovii), which is recognized here as the new
genus Caelestium.
Bactria lazkovii differs from B. ovczinnikovii by hav-
ing 43 nucleotide substitutions, 6 one-nucleotide and 8
larger (5–28 bp) indels on the combined 3-loci plastid
alignment 1218 bp long. The p-distance between Cae-
lestium (Bactria lazkovii and Polygonum tianschanicum)
and other genera varies from 9.3 % (for Bactria ov-
czinnikovii) to 16.5 % (for Fallopia), and these values
are the maximum among the estimates of total diffe-
rence over sequence pairs between genera compared in
tribe Polygoneae (Table 2). Bactria lazkovii differs from
Polygonum tianschanicum with 9 one-nucleotide substi-
tutions, 3 one-nucleotide and 3 non-single nucleotide
(4 and 28 nt long) indels of the combined 3-loci plas-
tid alignment 1324 bp long. For this group, the within-
group average p-distance is 14.9 %.
ITS topology based on the MAFFT alignment strategy
The ML and BI analyses of the MAFFT-based ITS
matrix demonstrated that Knorringia sibirica is a sister
to the rest of Polygoneae, which contain several highly
supported clades, although their relationships are not
well resolved (Figs. 3; 4).
Both ML and BI analyses confirmed the RFM-clade,
including Reynoutria, Fallopia, and Muehlenbeckia, but
Fallopia is monophyletic only on the BI tree. Duma ap-
peared as part of the RFM-clade (ML tree in Fig. 3), or
as part of the APD-clade, including Atraphaxis, Polygo-
num, and Duma (BI tree in Fig. 4); however, the posi-
tion of Duma is not supported in either case.
Polygonum s. l. is monophyletic, but non-supported
on the BI tree (Fig. 4), and paraphyletic on the ML
tree (Fig. 3). It includes the same highly supported Old
World clade Polygonum s. str. and the highly supported
New World clade with subclades Polygonella and Po-
lygonum sect. Duravia. The Old World clade Polygonum
s. str. combines two subclades. Like in plastid trees, the
subclade P. sect. Polygonum unites part of P. sect. Poly-
gonum (incl. P. aviculare), and the subclade P. sect. Te -
phis unites P. afromontanum (P. sect. Tephis) and the
rest of P. sect. Polygonum from Central Asia. Polygo-
num molliiforme (P. sect. Pseudomollia) and P. plebeium
(P. sect. Plebeja) fall into the latter subclade, in contrast
to their positions in P. sect. Polygonum on the plastid
trees (Figs. 1; 2).
Atraphaxis and Persepolium are highly supported, al-
though their combined clade is not supported. Bactria
is polyphyletic: B. ovczinnikovii is a highly supported
sister of the clade (Atraphaxis + Persepolium), while the
highly supported subclade Caelestium (Bactria lazko-
vii + Polygonum tianschanicum) is nested in Polygonum
s. l. on the ML tree (Fig. 3), or joins Polygonum s. l. on
the BI tree without support (Fig. 4).
ITS topologies based on the MAFFT alignment,
manually adjusted according to pre-rRNA secondary
structure of the ITS1 and ITS2 loci of Polygoneae
The ML and BI analyses based on the MAFFT
alignment, manually adjusted according to the second-
ary structure of pre-rRNA of the ITS1 and ITS2 loci of
Polygoneae (the secondary-structure based alignment,
SSBA hereinafter) show that Polygoneae include the
same several clades (Figs. 5; 6), with their relationships
being not fully resolved, as in the previous analyses
(Figs. 3; 4).
Polygonum s. l. is polyphyletic. The clade Polygo-
num s. str. is nested separately from the North Ameri-
can clade (Polygonella + Polygonum sect. Duravia); the
latter is part of the grade that also includes the RFM-
clade and Duma. Polygonella and Polygonum sect. Du-
Table 2. The number of differences per site over
Sequence Pairs between selected genera of Polygoneae
based on 21 sequences of combined plastid regions
(trnL intron + trnL–trnF IGS and rpl32–trnL(UAG) IGS),
excluding all positions that contain gaps and missing
data. A total of 1218 positions were analyzed in MEGA
6.0 (Tamura et al., 2013)
123456
[1] Fallopia
[2] Reynoutria
0.080
[3] Muehlenbeckia 0.067 0.037
[4] Atraphaxis
0.104 0.060 0.057
[5] Bactria
0.097 0.052 0.053 0.029
[6] Caelestium
0.165 0.127 0.125 0.107 0.093
[7] Polygonum s. l. 0.107 0.091 0.085 0.093 0.085 0.161
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
51
Bactria ovczinnikovii 2
Atraphaxis teretifolia
Reynoutria japonica
Polygonella basiramia
Fallopia dumetorum
Duma horrida
Polygonum equisetiforme
Polygonum pinicola
Muehlenbeckia platyclada
Polygonum ramosissimum
Polygonum cascadense
Polygonum boreale
Polygonum engelmannii
Fallopia baldschuanica
Polygonum arenastrum
Polygonum alpestre
Bactria lazkovii
Polygonum luzuloides
Polygonella robusta
Knorringia sibirica
Polygonella myriophylla
Polygonum plebeium
Polygonum arenarium
Persepolium dumosum
Duma florulenta
Oxyria digyna
Persepolium spinosum
Polygonum thymifolium
Polygonum minimum
Atraphaxis badghysi
Polygonum molliiforme
Atraphaxis atraphaxiformis 1
Atraphaxis seravschanica
Atraphaxis pyrifolia
Polygonella polygama
Polygonum douglasii
Persepolium khajeh-jamalii
Polygonella articulata
Bactria ovczinnikovii 1
Reynoutria sachalinensis
Atraphaxis ariana
Polygonum paronychioides
Polygonella macrophylla
Polygonum aviculare
Polygonum austiniae
Polygonella ciliata
Atraphaxis fischeri
Polygonum tianschanicum
Polygonum cognatum
Atraphaxis frutescens
Persepolium aridum
Polygonum vagans
Atraphaxis spinosa
Duma coccoloboides
Atraphaxis toktogulica
Atraphaxis atraphaxiformis 2
Fallopia convolvulus
Muehlenbeckia australis
Persepolium salicornioides
Polygonum afromontanum
0.991
1.000
0.976
1.000
0.921
0.997
0.861
0.932
0.994
0.848
0.851
0.975
0.957
0.999
1.000
0.879
0.991
0.939
0.996
0.998
0.994
0.909
0.955
0.932
0.990
0.909
0.934
0.813
0.989
Atraphaxis
(SE DQG Central
Europe, SW DQG
Central Asia)
Bactria
(Central Asia: Pamir)
Outgroups
Persepolium
(SW Asia: Zagros)
Tephis
(Eurasia DQG Africa)
Polygonum sect.
Polygonum sect.
(Worldwide)
Polygonum
RFM Clade
(SE Asia, Australia,
Central DQG South
America)
Polygonella
(N America:
East)
Polygonum sect.
Duravia
(N America:
West)
Duma
(Australia)
Caelestium (Central
Asia: TienShan)
0.948
0.993
1.000
0.943
APD
Clade
Polygonum
s.str.
Polygonum
s.l.
Fig. 1. ML phylogeny of Polygoneae based on the MAFFT-alignment of the plastid dataset: trnL intron + trnL–trnF
IGS and rpl32–trnL(UAG) IGS (log likelihood: –11015.339832 ). Numbers above or below branches indicate the aLRT
support values equal to or greater than 0.8.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
52
Fig. 2. Bayesian phylogeny of Polygoneae based on the MAFFT-alignment of the plastid dataset: trnL intron + trnL–
trnF IGS and rpl32–trnL(UAG) IGS. Numbers above branches indicate the posterior probabilities from BI analysis
equal to or greater than 0.9.
Polygonella robusta
Fallopia baldschuanica
Atraphaxis pyrifolia
Reynoutria japonica
Persepolium salicornioides
Polygonum ramosissimum
Atraphaxis atraphaxiformis 1
Polygonum equisetiforme
Polygonum molliiforme
Polygonella macrophylla
Atraphaxis seravschanica
Duma florulenta
Persepolium dumosum
Fallopia dumetorum
Bactria ovczinnikovii 2
Persepolium aridum
Polygonum plebeium
Atraphaxis frutescens
Bactria ovczinnikovii 1
Polygonum afromontanum
Atraphaxis spinosa
Oxyria digyna
Polygonella polygama
Polygonum arenarium
Polygonum aviculare
Bactria lazkovii
Reynoutria sachalinensis
Polygonum paronychioides
Atraphaxis badghysi
Polygonum minimum
Muehlenbeckia platyclada
Atraphaxis fischeri
Polygonella basiramia
Fallopia convolvulus
Muehlenbeckia australis
Atraphaxis teretifolia
Polygonum luzuloides
Atraphaxis toktogulica
Polygonum alpestre
Polygonum austiniae
Knorringia sibirica
Polygonum vagans
Persepolium khajeh jamalii
Polygonum douglasii
Persepolium spinosum
Polygonum cognatum
Polygonum cascadense
Atraphaxis atraphaxiformis 2
Polygonum thymifolium
Polygonella articulata
Polygonella ciliata
Polygonella myriophylla
Duma coccoloboides
Polygonum arenastrum
Polygonum engelmannii
Polygonum tianschanicum
Duma horrida subsp horrida
Polygonum pinicola
Atraphaxis ariana
Polygonum boreale
F
P
0.998
1.000
0.999
1.000
1.000
1.000
1.000
0.964
1.000
1.000
0.998
1.000
0.999
0.999
0.999
1.000
0.975
0.975
0.989
1.000
1.000
1.000
0.997
1.000
1.000
1.000
1.000
1.000
1.000
1.000
0.987
1.000
Atraphaxis
(SE DQG Central
Europe, SW DQG
Central Asia)
Bactria
(Central Asia: Pamir)
Outgroups
Persepolium
(SW Asia: Zagros)
Tephis
(Eurasia DQG Africa)
Polygonum sect.
Polygonum sect.
(Worldwide)
Polygonum
RFM Clade
(SE Asia, Australia,
CentralDQG South
America)
Polygonella
(N America:
East)
Polygonum sect.
Duravia
(N America:
West)
Duma
(Australia)
Caelestium (Central
Asia: TienShan)
Polygonum s.str.
APD
Clade
Polygonum s.l.
0.991
0.967
0.980
0.954
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
53
Fig. 3. ML phylogeny of Polygoneae based on the MAFFT-alignment of the ITS1–2 loci nrDNA (log likelihood:
–6 641.832866). Numbers above or below branches indicate the aLRT support values equal to or greater than 0.8.
Atraphaxis teretifolia
Polygonum plebeium
Persepolium aridum
Polygonum arenarium
Atraphaxis badghysi
Polygonum minimum
Polygonum cognatum
Atraphaxis spinosa
Polygonum equisetiforme
Polygonum ramosissimum
Polygonum molliiforme
Oxyria dygina
Polygonum afromontanum
Bactria ovczinnikovii 1
Polygonum paronychioides
Polygonum vagans
Polygonum douglasii
Polygonum engelmannii
Muehlenbeckia australis
Polygonella basiramia
Polygonum arenastrum
Atraphaxis ariana
Knorringia sibirica
Polygonella gracilis
Atraphaxis atraphaxiformis
Atraphaxis pyrifolia
Atraphaxis seravchanica
Polygonum tianschanicum
Polygonella myriophylla
Fallopia dumetorum
Polygonum cascadense
Bactria ovczinnikovii 2
Polygonella polygama
Fallopia convolvulus
Atraphaxis toktogulica
Fallopia baldschuanica
Polygonum alpestre
Polygonum austiniae
Polygonum aviculare
Persepolium salicornioides
Atraphaxis fischeri
Atraphaxis atraphaxiformis
Persepolium khajeh-jamalii
Atraphaxis frutescens
Persepolium dumosum
Persepolium spinosum
Reynoutria japonica
Polygonum boreale
Reynoutria sachalinensis
Polygonum luzuloides
Polygonella macrophylla
Muehlenbeckia platyclada
Polygonella ciliata
Duma florulenta
Duma coccoloboides
Polygonella robusta
Duma horrida
Polygonella articulata
Polygonum thymifolium
Bactria lazkovii
0.856
0.823
0.861
0.993
0.950
0.999
0.957
0.984
0.948
0.926
0.985
0.983
0.897
0.965
0.898
0.824
0.893
0.855
0.997
0.918
0.961
0.976
0.939
0.983
0.998
0.94
0.941
0.933
0.998
0.934
0.998
0.942
0.949
0.961
0.995
0.977
Atraphaxis
(SE DQG Central
Europe, SW DQG
Central Asia)
Persepolium
(SW Asia: Zagros)
Bactria
(Central Asia: Pamir)
Tephis
(Eurasia DQG Africa)
Caelestium
Polygonum sect.
Duravia
(N America:
West)
Polygonum sect.
RFM Clade
(SE Asia, Australia,
Central DQG South
America)
Outgroups
Duma
(Australia)
Polygonum sect.
Polygonella
(N America:
East)
(Central Asia:
TienShan)
(Worldwide)
Polygonum
Polygonum
s.str.
0.894
1
2
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
54
Fig. 4. Bayesian phylogeny of Polygoneae based on the MAFFT-alignment of the ITS1–2 loci nrDNA. Numbers
above or below branches indicate posterior probabilities from BI analysis equal to or greater than 0.9.
Atraphaxis spinosa
Bactria ovczinnikovii 1
Polygonum paronychioides
Polygonella myriophylla
Polygonum tianschanicum
Knorringia sibirica
Persepolium salicornioides
Oxyria dygina
Polygonella gracilis
Fallopia dumetorum
Reynoutria japonica
Polygonum cognatum
Polygonum cascadense
Reynoutria sachalinensis
Polygonella polygama
Persepolium dumosum
Muehlenbeckia platyclada
Persepolium khajeh-jamalii
Duma horrida
Polygonum equisetiforme
Atraphaxis ariana
Polygonum afromontanum
Polygonum molliiforme
Muehlenbeckia australis
Atraphaxis badghysi
Polygonum thymifolium
Polygonum ramosissimum
Fallopia baldschuanica
Polygonella ciliata
Atraphaxis teretifolia
Persepolium spinosum
Polygonum alpestre
Polygonum aviculare
Polygonella macrophylla
Bactria lazkovii
Persepolium aridum
Polygonum arenarium
Polygonum arenastrum
Duma coccoloboides
Atraphaxis atraphaxiformis 2
Polygonum austiniae
Polygonum engelmannii
Polygonum vagans
Polygonum plebeium
Polygonum luzuloides
Atraphaxis frutescens
Polygonum boreale
Polygonum minimum
Fallopia convolvulus
Atraphaxis pyrifolia
Polygonum douglasii
Bactria ovczinnikovii 2
Polygonella articulata
Duma florulenta
Atraphaxis toktogulica
Atraphaxis fischeri
Atraphaxis atraphaxiformis 1
Polygonella robusta
Atraphaxis seravchanica
Polygonella basiramia
0.9998
1.000
0.997
0.999
1.000
1.000
1.000
0.989
1.000
1.000
0.969
0.989
0.997
0.999
1.000
1.000
0.997
0.962
1.000
1.000
0.999
0.998
0.998
1.000
1.000
1.000
1.000
0.999
0.999
1.000
1.000
1.000
Atraphaxis
(SE DQG Central
Europe, SW DQG
Central Asia)
Persepolium
(SW Asia: Zagros)
Bactria
(Central Asia: Pamir)
Polygonum sect.
Tephis
(Eurasia DQG Africa)
Caelestium
Polygonum
sect.Duravia
(N America:
West)
RFM Clade
(SE Asia, Australia,
Central DQG South
America)
Outgroups
Duma
(Australia)
1.000
Polygonum sect.
Polygonella
(N America:
East)
(Central Asia:
TienShan)
Polygonum
s.str.
P
o
l
y
g
o
n
u
m
s
.
l
.
APD
Clade
1.000
(Worldwide)
Polygonum
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
55
ravia are both monophyletic and highly supported. The
clade Polygonum s. str. is highly supported only in ML
analysis (Fig. 5). It combines two strongly supported
subclades. The first includes the members of P. sect. Po-
lygonum (incl. P. aviculare) distributed worldwide. The
second subclade recognized as P. sect. Tephis combines
P. afromontanum (P. sect. Tephis) and the members of
P. sect. Polygonum from Central Asia. Polygonum mollii-
forme (P. sect. Pseudomollia) and P. plebeium (P. sect.
Plebeja) appear again in the same subclade, in contrast
to their positions in the subclade P. sect. Polygonum on
the plastid trees (Figs. 1; 2).
The clades Atraphaxis and Persepolium are highly
supported, however, the clade (Atraphaxis + Persepoli-
um) has no support. Bactria is clearly polyphyletic (Figs.
5; 6). Only on the BI tree it is associated with Atraphaxis
and Persepolium (Fig. 6). The position of Caelestium is
not resolved, but in either case it is not combined with
any genus of Polygoneae, in contrast to the sistership
with Bactria ovczinnikovii on the plastid trees.
Locus ITS1 and its pre-rRNA secondary structure
Since the phylogenetic analysis based on ITS region
did not show a resolved topology and the positions of
some taxa were not determined, we compared the pre-
rRNA secondary structure of their ITS1 and ITS2 loci.
The pre-rRNA secondary structure of the ITS1 has a
central loop with several inner and outer helices formed
by inverted repeats with high GC content. Maximum
(five) outer helices are present in pre-rRNA secondary
structure of the ITS1 of Reynoutria (Fig. 7: A), Fal-
lopia, Muehlenbeckia, Duma (Fig. 7: G), Atraphaxis
ariana (Grig.) T. M. Schust. et Reveal (Fig. 7: B) (and
also A. badghysi Kult., A. radkanensis S. Tavakkoli, Kaz.
Osaloo et Mozaff. absent from the analyses). Most spe-
cies of Atraphaxis (Fig. 7: C), as well as Persepolium and
Bactria ovczinnikovii (Fig. 7: D), have helix II, but lack
helix III. In contrast, Bactria lazkovii and Polygonum
tianschanicum recognized here as the members of the
new genus Caelestium, and the members of Polygonum
s. l. lack helix II, but have helix III (Fig. 7: E, F, H, I).
The outer helix I (12 nt) is formed by 5′-CUGC-3′
and 5′-GCAG-3′ inverted repeats.
The outer helix II (22–41 nt) is variable, but pres-
ent only in part of Polygoneae (Fig. 8; Table 3). Atra-
phaxis ariana, Persepolium, and Bactria ovczinnikovii
have a similar length (32–37 nt) and composition of
helix II (Fig. 8: A–D). In all of these taxa, the con-
served part of the stem is formed by inverted repeats
(5′-GGCGGGGG-3′ and 5′-UCCCCCCC-3′) shown
in a frame in Fig. 8. The differences are in several one-
nucleotide substitutions and one-nucleotide deletions.
Persepolium (Fig. 8: A) and some of Atraphaxis species
(Fig. 8: D) have additional GC pairs at the base of the
stem. Duma florulenta (Fig. 8: E) has the shortest he-
lix II (22 nt). It has the conserved part of the stem as
short as that in Reynoutria and Muehlenbeckia, but this
conserved part is even shorter in Fallopia (Table 3).
The members of the RFM-clade have the longest helix
II (41 nt) due to additional GC-rich inverted repeats
in the apical part of the stem, but lack base pairs in the
proximal part (Fig. 8: F).
The outer helix III (17–25 nt) (Fig. 9; Table 3) has a
stem formed by inverted repeats 5′-GCCCGGG-(nN)-
CCCGGGC-3′. Reynoutria, Muehlenbeckia, Fallopia,
and Duma have the identical composition of helix III
(Fig. 9: A). The same, or almost the same, composition
of helix III was found in some species of Polygonella and
in the Polygonum species, which fall within the subclade
Polygonum sect. Tephis on the ITS-based trees and grow
in Central Asia and Africa (Fig. 9: E, H; Table 3): P. mol-
liiforme (P. sect. Pseudomollia), P. plebeium (P. sect.
Plebeja), P. afromontanum (P. sect. Tephis), P. cognatum
Meisn., P. thymifolium Jaub. et Spach (among other Cen-
tral Asian members of P. sect. Polygonum).
The members of Polygonum sect. Duravia (P. mini-
mum S. Watson, P. douglasii Greene) and P. sect. Po-
lygonum (P. aviculare, P. boreale Small) have 1–2 extra
base pairs in the outer position and lack one of nucleo-
tids in the right arm of helix III (Fig. 9: F, G; Table 3).
Besides, the members of P. sect. Polygonum (P. avicu-
lare, P. boreale) have the largest terminal loop (Fig. 9:
F) of helix III.
Atraphaxis ariana (and also A. badghysi, A. rad-
kanensis) have an extra base pair (A–U) in the outer
position (Fig. 9: B) of helix III. Polygonum tianschani-
cum and Bactria lazkovii share the shortest helix III
(17 nt), which lacks one base pair (C–C) in the stem
(Fig. 9: C–D), and can be produced from helix III of
any taxon. Both have 5 nucleotids in the terminal loop,
like some species of Polygonum s. str. (e. g., P. plebeium,
P. boreale) and Polygonella (Table 3).
The outer helix IV (22–23 nt) is the most con-
served (Table 3). The stem is normally formed by 9 bp.
The motif GGCTY-(4–7n)-GYGYCAAGGAA not-
ed by J. S. Liu and C. L. Schardl (1994) as conserved
across plants is present in helix IV as 5′-GGCGC-
(GGA(U/C)U)-GCGCCAAGGAC-3′ in all members
of Polygoneae. Although the composition of helix IV is
almost the same in most of Polygoneae, one-nucleotide
substitutions are present in some non-related taxa.
Some members of Polygonella and Polygonum sect. Du-
ravia (P. minimum) lack one nucleotide in the left arm
of the stem. Duma florulentha (Meisn.) T. M. Schust.
and Polygonum douglasii have an extra base pair in the
stem, but smaller terminal loop.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
56
Outer helix V is the most variable in Polygoneae
(36–45 nt) (Table 3). Duma is close to the members of
the RFM-clade by the structure of helix V. The North
American Polygonella and Polygonum sect. Duravia
slightly differ from each other and from the Old World
Polygonum s. str. in the structure of helix V. The same
applies to the members of the subclades P. sect. Tephis
and P. sect. Polygonum (Table 3) as they appeared on
the ITS-based trees (Table 3; Figs. 3–6). Atraphaxis,
Bactria ovczinnikovii and Persepolium share the length
(40 nt) and structure of helix V, though some species
of Atraphaxis have extra base pairs in the inner posi-
tion. Bactria lazkovii and Polygonum tianschanicum have
unique structure of helix V, distinct in the proximal part
of the stem.
To summarize, Bactria ovczinnikovii, Persepolium, and
most of Atraphaxis species have the same set of helices
of similar length in the pre-rRNA secondary structure of
the ITS1 (Table 3). Polygonum sect. Duravia and Polygo-
nella differ from the rest of Polygonum s. l. by the length
and structure of helix V. The subclades P. sect. Polygo-
num and P. sect. Tephis, as they appeared in the results
of the ITS analyses, differ in the length and structure of
helices III and V. Duma is close to the members of the
RFM-clade in the whole secondary structure of pre-
RNA of the ITS1, and in the structure of helices II–V.
Polygonum tianschanicum and Bactria lazkovii resemble
Polygonum s. l. in the general pre-rRNA secondary struc-
ture of the ITS1 locus (Fig. 7: E, F, H, I), but differ in
having the unique structures of helices III and V.
Locus ITS2 and its pre-rRNA secondary structure
The pre-rRNA secondary structure of the ITS2 re-
gion has a central loop and four outer helices (Fig. 10).
Helices I and II have a common stem, and helices III
and IV are branched from the central loop. Helices I
and IV are the most variable, while helices II and III are
more conserved (Table 4).
The outer helix I 30–43 nt long includes two con-
served inverted repeats in the stem base (5′-CGCCCC-3′
and 5′-GGGGCG-3′, 5′-CCCCCC-3′ and 5′-GGGGGG-
3), but is rather polymorphic in the apical part (Table 4).
It is shortest in the RFM-clade and Duma, in some mem-
bers of Polygonum sect. Duravia and Polygonella, e. g.,
P. robusta (Small) G. L. Nesom et V. M. Bates (= Thy-
sanella robusta Small) (30–32 nt), and Polygonum tian-
schanicum (33 nt). Helix I is longest in P. afromontanum,
P. cognatum (P. sect. Tephis), and Bactria lazkovii (43 nt).
In some aspects, the structure of helix I of B. lazkovii and
Polygonum tianschanicum is similar to that of Polygonella
(Table 4). In contrast, Atraphaxis, Persepolium and Bac-
tria ovczinnikovii share the distinct length (38–40 nt)
and structure of helix I.
The outer helix II has a very conserved basal part
of the stem 12 bp long, which is formed by inverted re-
peats (5′-GGCCCCCCGUGC-3′ and 5′-G(C/U)GC-
GGCCGGCC-3′), but the apical part of the stem and
the loop vary in size and composition (Table 4). For
example, Atraphaxis has additional base pairs flanking
the terminal loop. Persepolium and Bactria ovczinnikovii
have a very similar composition of helix II, but Persepo-
lium lacks one nucleotide in the left arm and has two ex-
tra base pairs in the inner position. Bactria lazkovii and
Polygonum tianschanicum have identical structure and
length of helix II (38 nt), different from that of Bactria
ovczinnikovii, with one extra base pair in the apical part
of the stem and a compensatory substitution A–U →
U–A in the outer position. Polygonella and Polygonum
sect. Duravia are close to Duma and the members of the
RFM-clade in the structure of helix II. The members
of Polygonum s. str. demonstrate some differences, e. g.,
P. molliiforme (P. sect. Pseudomollia) has a much longer
apical part of the stem.
The outer helix III is the longest (61–82 nt) and
rather variable. The positions of inner loops in the stem
distinguish the taxa of Polygoneae from each other. Poly-
gonella differs from the rest of Polygonum s. l. in the
structure of helix III. The sections of Polygonum s. l. de-
monstrate slight, but definite distinctions. Polygonum
molliforme (P. sect. Pseudomollia) and P. plebeium (P. sect.
Plebeja) have a distinct proximal part of helix III, but are
close to the members of P. sect. Tephis in the apical part of
the stem. Polygonum sect. Tephis shares the proximal part
with P. sect. Polygonum. Bactria lazkovii and Polygonum
tianschanicum are close to Atraphaxis, Persepolium, and
Bactria ovczinnikovii in the structure of helix III (Table 4).
The outer helix IV is most variable; it strongly
changes its secondary structure depending on thermo-
dynamic conditions and is not reliable for comparing.
In summary, Duma is the most close to the members
of the RFM-clade by the structure of helices I, II, and
III. The New World Polygonella and Polygonum sect.
Duravia demonstrate slight, but definite differences in
the structure of helices I and III. The same applies to
the subclades of the Old World Polygonum s. str. Bactria
ovczinnikovii, Atraphaxis, and Persepolium have similar
structure of helices I and III, but Atraphaxis has longer
helix II. Bactria lazkovii and Polygonum tianschanicum
(the genus Caelestium) have unique structure of helix
II and share the structure of helix III with Bactria ov-
czinnikovii, Atraphaxis and Persepolium.
The “anomalous” ITS sequences of Bactria lazkovii
and their pre-rRNA secondary structure
As a result of applying multiple sets of primers and
PCR profiles, besides the putatively functional ITS(A),
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
57
Fig. 5. ML phylogeny of Polygoneae based on the pre-rRNA secondary structure on the related alignment of the ITS1
and ITS2 loci nrDNA (log likelihood: –6493.537870). Numbers above or below branches indicate the aLRT support
values equal to or greater than 0.8.
Polygonella macrophylla
Atraphaxis badghysi
Persepolium dumosum
Polygonum arenastrum
Polygonella articulata
Polygonum douglasii
Polygonum alpestre
Polygonum boreale
Polygonum plebeium
Polygonum aviculare
Polygonum austiniae
Bactria ovczinnikovii 1
Polygonum thymifolium
Atraphaxis toktogulica
Polygonum luzuloides
Reynoutria japonica
Polygonum engelmannii
Atraphaxis teretifolia
Polygonum afromontanum
Fallopia baldschuanica
Fallopia dumetorum
Atraphaxis frutescens
Duma florulenta
Polygonella ciliata
Atraphaxis pyrifolia
Duma horrida
Bactria lazkovii
Polygonella gracilis
Polygonella myriophylla
Oxyria dygina
Atraphaxis spinosa
Atraphaxis atraphaxiformis 1
Polygonum cognatum
Reynoutria sachalinensis
Muehlenbeckia platyclada
Polygonella polygama
Atraphaxis ariana
Polygonum tianschanicum
Polygonum arenarium
Muehlenbeckia australis
Atraphaxis fischeri
Polygonum molliiforme
Persepolium salicornioides
Persepolium aridum
Polygonella robusta
Bactria ovczinnikovii 2
Polygonum minimum
Polygonum equisetiforme
Polygonum paronychioides
Atraphaxis atraphaxiformis 2
Fallopia convolvulus
Persepolium khajeh-jamalii
Knorringia sibirica
Persepolium spinosum
Polygonum vagans
Polygonum cascadense
Duma coccoloboides
Polygonella basiramia
Atraphaxis seravchanica
Polygonum ramosissimum
0.934
0.876
0.946
0.973
0.960
0.965
0.941
0.956
0.882
0.962
0.885
0.885
0.996
0.987
0.941
0.924
0.987
0.994
0.990
0.913
0.998
0.951
0.906
0.988
0.987
0.948
0.895
1.000
0.973
0.955
0.974
0.974
0.908
0.901
0.989
Atraphaxis
(SE DQG Central
Europe, SW DQG
Central Asia)
Bactria
(Central Asia: Pamir)
Outgroups
Persepolium
(SW Asia: Zagros)
Tephis
(Eurasia DQG Africa)
Polygonum sect.
Polygonum sect.
(Worldwide)
Polygonum
RFM Clade
(SE Asia, Australia,
Central DQG South
America)
Polygonella
(N America:
East)
Polygonum sect.
Duravia
(N America:
West)
Duma
(Australia)
Caelestium (Central
Asia: TienShan)
Polygonum s. str.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
58
Fig. 6. Bayesian phylogeny of Polygoneae based on the pre-rRNA secondary structure and on the related alignment
of the ITS1–2 loci nrDNA. Numbers above or below branches indicate posterior probabilities from BI analysis equal
to or greater than 0.9.
Polygonum arenarium
Atraphaxis atraphaxiformis
Atraphaxis frutescens
Polygonum boreale
Polygonella myriophylla
Muehlenbeckia australis
Persepolium spinosum
Atraphaxis ariana
Polygonum vagans
Polygonum aviculare
Atraphaxis seravchanica
Polygonella polygama
Atraphaxis atraphaxiformis
Polygonum alpestre
Polygonella robusta
Persepolium aridum
Polygonum engelmannii
Polygonum cognatum
Atraphaxis teretifolia
Polygonum afromontanum
Fallopia baldschuanica
Muehlenbeckia platyclada
Atraphaxis spinosa
Persepolium dumosum
Reynoutria japonica
Polygonum thymifolium
Reynoutria sachalinensis
Polygonum minimum
Knorringia sibirica
Oxyria dygina
Duma horrida
Polygonum tianschanicum
Polygonum austiniae
Polygonum equisetiforme
Polygonum molliiforme
Polygonum cascadense
Fallopia convolvulus
Duma coccoloboides
Atraphaxis badghysi
Atraphaxis pyrifolia
Polygonella ciliata
Bactria ovczinnikovii 1
Duma florulenta
Persepolium khajeh-jamalii
Bactria ovczinnikovii 2
Polygonella macrophylla
Polygonum ramosissimum
Polygonella gracilis
Polygonum douglasii
Atraphaxis fischeri
Polygonella basiramia
Polygonella articulata
Atraphaxis toktogulica
Persepolium salicornioides
Polygonum paronychioides
Polygonum luzuloides
Bactria lazkovii
Fallopia dumetorum
Polygonum arenastrum
Polygonum plebeium
0.991
1.000
0.989
1.000
0.998
1.000
1.000
1.000
1.000
0.999
1.000
0.938
0.979
1.000
0.963
1.000
0.994
1.000
1.000
0.968
1.000
0.984
0.999
0.998
0.976
1.000
0.999
1.000
0.997
1.000
1.000
1
2 Atraphaxis
(SE DQG Central
Europe, SW DQG
Central Asia)
Outgroups
Polygonum sect.
(Worldwide)
Polygonum
Caelestium (Central
Asia: TienShan)
Persepolium
(SW Asia: Zagros)
Bactria
(Central Asia: Pamir)
Polygonella
(N America:
East)
Polygonum sect.
Duravia
(N America:
West)
RFM Clade
(SE Asia, Australia,
Central DQG South
America)
Duma
(Australia)
Tephis
(Eurasia DQG Africa)
Polygonum sect.
0.999
1.000
Polygonum
s. str.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
59
the putatively pseudogenic ITS(B) was amplified from
the same sample of Bactria lazkovii. External primers
NNC-18S10 and C26 resulted in amplification of most-
ly heterogenеous ITS sequences. The most of combina-
tions of selective internal primers for functional ITS
(ITS2-BaN and ITS3-BaN) with universal external
primers (Table 1), resulted in successful selective am-
plification of the fragments, including 3′-end of the 18S
region, the ITS1–5.8S–ITS2 region, and 5′-end of the
26S region. Combinations of selective internal primer
ITS2-BaPSE with external primers ITS1, E1128f were
used for amplification of the 18S–ITS3–5.8S region,
and combinations of selective internal primer ITS3-
BaPSE with B, R2, R3, R4, R5 were used for amplifi-
cation of the 5.8S–ITS2–26S region (Table 1), however
only the combinations ITS1 with B, and ITS3-BaPSE
with B and R2 resulted in successful amplification of
the 5.8S–ITS2–26S region for the pseudogenic ITS.
In total, four identical sequences of putatively func-
tional ITS(A) and five sequences of the highly variable
pseudogenic ITS(B) (excluded from the phylogenetic
analyses but used for further comparisons of the second-
ary structures) were successfully obtained.
The putatively pseudogenic ITS(B) of Bactria laz-
kovii differs from the functional ITS(A) by the pres-
ence of 75 nucleotide substitutions, mainly transitions
G→A (36 %) and C→T (33.3%) on the ITS1–2 region.
As we originally estimated, on average, the GC-con -
tent of the ITS1–2 region in Polygoneae is relatively
high (65.5–70.1 %), especially in Fallopia, Reynoutria,
and Muehlenbeckia. The pseudogenic ITS(B) of Bac-
tria lazkovii has a lower GC-content (59.4 %) than its
functional ITS(A) (68.8 %), or the ITS of other genera
of Polygoneae, except for the ITS of Polygonella, which
also has low (62.0 %) GC-content.
The functional ITS(A) of Bactria lazkovii shows
5.8–17.9 % range of p-distance from other genera on
the ITS1–5.8S–ITS2 region (ITS1, 6.8–27.0 %; ITS2,
6.5–28.3 %; 5.8S, 0.8–3.2 %). These values correspond
to the average level (5.3–22.9 %) of intergeneric di-
vergence in Polygoneae on the same region (ITS1, 7.0–
53.6 %; ITS2, 8.9–25.0 %; 5.8S, 0.3–3.5 %).
The pseudogenic ITS(B) of Bactria lazkovii has a
much higher range of p-distance on the ITS1–2: 17.7–
33.9 % (ITS1, 20.7–51.1 %; ITS2, 19.0–47.3 %; 5.8S,
10.5–15.6 %) from other genera of Polygoneae, and
17.9 % (ITS1, 17.6 %; ITS2, 23.2 %; 5.8S, 11.6 %) from
the functional ITS(A) of B. lazkovii.
For the 5.8S gene, the range of p-distance between
the functional ITS(A) of Bactria lazkovii and the ITS of
other genera of Polygoneae (0.8–3.2 %) is comparable
with the range of intergeneric (0.3–3.5 %) divergence
in Polygoneae. In contrast, the pseudogenic ITS(B) of
Bactria lazkovii has a much higher level of intergeneric
p-distance (10.5–15.6 %) for the 5.8S gene, which dif-
fers from the functional ITS(A) by 18 nucleotide sub-
stitutions and two one-nucleotide deletions.
In Bactria lazkovii, the pre-RNA secondary structure
of the pseudogenic ITS1(B) does not form helix I, but
forms helices II–V (Fig. 11: A; Table 3). In contrast to
the functional ITS1(A) of the same sample (Fig. 7: E),
its helix II (Fig. 11: A) is unique in Polygoneae: its basal
conserved part is as short as in Duma, Reynoutria, and
Muehlenbeckia (Fig. 8: F), but its apical part is as long as
that of Atraphaxis, Persepolium, and Bactria ovczinnikovii
(Fig. 8: A–D). Helix III of the ITS1 has 5 nucleotides
in the terminal loop of both functional and pseudogenic
variants, but the pseudogenic ITS1(B) has an extra nu-
cleotide in the stem (18 vs 17), that can be viewed as a
transitional state to its functional variant, which lacks
the whole bp (Fig. 9: C, D; Table 3). In the pseudogenic
ITS1(B), helix IV has an extra nucleotide in the stem
(24 vs 23 nt), helix V is shorter (38 vs 40 nt) than that
in the functional ITS1(A), but can be produced from the
latter (Fig. 11: A; Table 3). Thus, the pre-rRNA second-
ary structure of the pseudogenic ITS1(B) of B. lazkovii
can be produced from its functional ITS1(A), but has ad-
ditional helix II unique in Polygoneae.
The pseudogenic ITS2 of B. lazkovii has the same
four helices in the pre-rRNA secondary structure, like
the ITS2 of the rest of Polygoneae, but due to numerous
substitutions, the pseudogenic ITS2 of B. lazkovii differs
in the size and composition of the helices from its own
functional ITS2 (Fig. 11: B), these helices are absent
from Table 4.
Discussion
Incongruence of the plastid and ITS trees and
paraphyly of Bactria s. l.
Both BI and ML trees based on the ITS data (Figs.
3–6) and on the combined plastid matrix (Figs. 1; 2)
recovered the same eight highly supported clades: the
RFM-clade named by T. M. Schuster et al. (2011b),
including Reynoutria, Fallopia, and Muehlenbeckia; the
clade Duma; the clade Polygonum s. str.; the clade (Polyg-
onella + Polygonum sect. Duravia); the clade Atraphaxis;
the clade Persepolium; the clade Bactria ovczinnikovii
(two accessions of the same species); and the clade Cae-
lestium (Bactria lazkovii + Polygonum tianschanicum).
Our ML and BI plastid trees (Figs. 1; 2) are similar
to those obtained by Schuster et al. (2011b, 2015) for
the combined plastid plus ITS sequence data matrix,
and in general agree with our previous plastid trees
(Yurtseva et al., 2016). Our plastid data confirmed the
RFM-clade and the APD-clade revealed by Schuster et
al. (2011b, 2015).
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
60
Fig. 7. Pre-rRNA secondary structure of the ITS1 locus for some genera of tribe Polygoneae.
A — Reynoutria sachalinensis; B — Atraphaxis ariana; C — A. pyrifolia; D — Bactria ovczinnikovii; E — Caelestium lazkovii; F —
C. tianschanicum; G — Duma florulenta; H — Polygonella polygama; I — Polygonum afromontanum. I–V
—
outer helices.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
61
Fig. 8. Outer helix II of the pre-rRNA secondary structure of the ITS1 locus for some genera of tribe Polygoneae.
A — Persepolium salicornioides; B — Atraphaxis ariana; C — Bactria ovczinnikovii; D — Atraphaxis pyrifolia; E — Duma florulenta;
F — Reynoutria sachalinensis. The stem is formed by conserved poly-G and poly-C repeats (in frames). Arrows indicate nucleotide
substitutions.
The APD-clade recovered by Schuster et al. (2011b,
2015), was confirmed only by the analyses of com-
bined plastid data (Figs. 1; 2). It combines Atraphaxis,
Duma, and Polygonum s. l. On the plastid trees, Duma
is a weakly supported sister of the clade ((Atraphaxis +
Persepolium) Bactria) (Figs. 1; 2). It is associated with
the RFM-clade in the analyses of MAFFT-aligned ma-
trix of the ITS (Figs. 3; 4), and forms a weak grade with
the RFM-clade, Polygonella and Polygonum sect. Dura-
via on the ITS SSBA-based ML and BI trees (Figs. 5;
6), that agrees with the similarity of the pre-RNA sec-
ondary structure of the ITS1 and ITS2 (Tables 3, 4).
All variants of analyses confirmed the clade combin-
ing Atraphaxis s. str., Persepolium, and Bactria ovczin-
nikovii, which corresponds to the Atraphaxis s. l. broadly
treated by S. Tavakkoli et al. (2015). The highly sup-
ported clade that includes Atraphaxis and Persepolium
constantly appears on our previous (Yurtseva et al.,
2016: 8, fig. 2) and current plastid trees (Figs. 1; 2),
and on morphology-based trees (Mavrodiev, Yurtseva,
2017; Yurtseva et al., 2017), but it is not supported on
the ITS-based trees (Figs. 3–6, see also Yurtseva et al.,
2016: 7, fig. 1). Similarly, the clade ((Atraphaxis + Perse-
polium) + Bactria s. l.), circumscribed as Atraphaxis s. l.
(Tavakkoli et al., 2015), is supported on the plastid trees
(Figs. 1; 2), but not supported on the ITS ISSB-based
trees (Figs. 5; 6). That argues for generic independence
of Atraphaxis, Persepolium and Bactria, although these
taxa demonstrate great similarity in the pre-RNA sec-
ondary structure of the ITS1 and ITS2 (Tables 3, 4).
As we have mentioned above, and as we found be-
fore (Yurtseva et al., 2016), Bactria is monophyletic on
the plastid trees (Figs. 1; 2), but non-monophyletic on
all the ITS-based trees (Figs. 3–6). Although Bactria
ovczinnikovii is associated with Atraphaxis and Persepo-
lium on the plastid trees (Figs. 1; 2) and on most of the
ITS-based trees, the clade Caelestium (Bactria lazko-
vii + Polygonum tianschanicum) is separate from Bactria
ovczinnikovii in all the ITS-based trees (Figs. 3–6).
According to the trees that resulted from the analy-
sis of the MAFFT-aligned matrix of the ITS region
(Figs. 3; 4), the clade Caelestium might be interpreted
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
62
T
a
b
l
e
3
.
H
e
l
i
c
e
s
I
I
–
V
o
f
t
h
e
p
r
e
-
R
N
A
s
e
c
o
n
d
a
r
y
s
t
r
u
c
t
u
r
e
o
f
t
h
e
I
T
S
1
l
o
c
u
s
i
n
t
r
i
b
e
P
o
l
y
g
o
n
e
a
e
T
a
x
o
n
S
p
e
c
i
e
s
H
e
l
i
x
I
I
H
e
l
i
x
I
I
I
H
e
l
i
x
I
V
H
e
l
i
x
V
l
o
o
p
l
o
o
p
l
o
o
p
l
o
o
p
R
e
y
n
o
u
t
r
i
a
R
.
s
a
c
h
a
l
i
n
e
n
s
i
s
6
1
2
5
1
3
3
4
2
2
5
5
3
–
2
0
/
1
6
0
/
1
6
3
M
u
e
h
l
e
n
b
e
c
k
i
a
M
.
p
l
a
t
y
c
l
a
d
a
6
1
2
5
1
3
3
4
2
2
5
5
3
–
2
0
/
1
6
0
/
1
6
3
F
a
l
l
o
p
i
a
F
.
b
a
l
d
s
c
h
u
a
n
i
c
a
–
5
1
2
/
1
3
5
2
3
3
4
2
2
5
5
2
–
2
0
/
1
6
0
/
1
6
4
D
u
m
a
D
.
fl
o
r
u
l
e
n
t
h
a
2
6
1
4
1
3
3
4
2
2
5
+
1
5
–
2
3
–
2
0
/
1
6
0
/
1
6
–
1
4
+
2
P
o
l
y
g
o
n
e
l
l
a
P
.
p
o
l
y
g
a
m
a
–
–
–
–
1
3
3
4
2
1
/
2
5
5
3
0
/
1
3
0
/
1
8
0
/
1
3
4
+
2
P
.
g
r
a
c
i
l
i
s
–
–
–
–
1
3
/
2
3
5
2
1
/
2
5
5
2
0
/
1
3
+
1
0
/
1
8
1
/
2
3
4
P
.
a
r
t
i
c
u
l
a
t
a
–
–
–
–
?
?
?
?
2
2
5
5
2
0
/
1
3
0
/
1
6
1
/
2
5
4
P
o
l
y
g
o
n
u
m
P
.
m
i
n
i
m
u
m
–
–
–
–
1
3
/
2
3
+
2
4
2
1
/
2
5
5
5
0
/
1
2
0
/
1
8
0
/
1
4
4
P
.
s
e
c
t
.
D
u
r
a
v
i
a
P
.
d
o
u
g
l
a
s
i
i
–
–
–
–
1
3
/
2
3
+
1
4
2
2
5
+
1
5
–
2
5
0
/
1
2
0
/
1
8
0
/
1
4
4
P
.
s
e
c
t
.
P
s
e
u
d
o
m
o
l
l
i
a
P
.
m
o
l
l
i
i
f
o
r
m
e
–
–
–
–
1
3
3
4
2
2
5
5
3
–
2
0
/
1
2
0
/
1
1
0
4
P
.
s
e
c
t
.
P
l
e
b
e
j
a
P
.
p
l
e
b
e
i
u
m
–
–
–
–
1
3
/
4
3
5
2
2
5
5
3
–
–
0
/
1
2
0
/
1
1
0
4
P
.
s
e
c
t
.
T
e
p
h
i
s
P
.
a
f
r
o
m
o
n
t
a
n
u
m
–
–
–
–
1
3
3
4
2
2
5
5
3
–
–
0
/
1
2
0
/
1
1
0
4
P
.
c
o
g
n
a
t
u
m
–
–
–
–
1
3
3
4
2
2
5
5
3
–
0
/
1
2
0
/
1
1
0
4
P
.
t
h
y
m
i
f
o
l
i
u
m
–
–
–
–
1
3
3
4
2
2
5
5
2
–
0
/
1
2
0
/
1
1
0
4
P
.
s
e
c
t
.
P
o
l
y
g
o
n
u
m
P
.
a
v
i
c
u
l
a
r
e
–
–
–
–
1
3
/
2
3
+
2
5
+
3
2
2
5
5
3
2
0
/
1
4
1
/
2
7
4
P
.
b
o
r
e
a
l
e
–
–
–
–
1
3
/
2
3
+
2
5
2
2
5
5
3
2
0
/
1
4
1
/
2
7
4
C
a
e
l
e
s
t
i
u
m
C
.
t
i
a
n
s
c
h
a
n
i
c
u
m
–
–
–
–
1
2
3
5
2
2
5
5
3
0
/
1
2
+
2
0
/
1
7
0
/
1
5
4
C
.
l
a
z
k
o
v
i
i
(
A
)
–
–
–
–
1
2
3
5
2
2
5
5
3
2
0
/
1
7
0
/
1
5
4
C
.
l
a
z
k
o
v
i
i
(
B
)
1
6
5
3
1
3
/
2
3
5
2
2
/
3
5
5
3
2
0
/
3
4
1
/
2
5
–
1
4
+
2
B
a
c
t
r
i
a
B
.
o
v
c
z
i
n
n
i
k
o
v
i
i
2
7
/
8
5
3
–
–
–
–
2
2
5
5
2
–
2
0
/
1
8
0
/
1
4
4
P
e
r
s
e
p
o
l
i
u
m
P
.
s
a
l
i
c
o
r
n
i
o
i
d
e
s
3
8
5
–
1
3
+
2
–
–
–
–
2
2
5
5
2
–
2
0
/
1
8
0
/
1
4
4
A
t
r
a
p
h
a
x
i
s
A
.
a
r
i
a
n
a
2
8
/
7
5
3
1
3
3
+
1
4
2
2
5
5
3
–
2
0
/
1
8
0
/
1
4
4
A
.
f
r
u
t
e
s
c
e
n
s
5
8
5
3
–
–
–
–
2
2
5
5
3
–
2
0
/
1
8
0
/
1
4
4
A
.
p
y
r
i
f
o
l
i
a
4
8
5
–
1
3
+
2
–
–
–
–
2
2
5
5
3
0
/
1
2
+
2
0
/
1
8
0
/
1
4
4
N
o
t
e
.
T
h
e
n
u
c
l
e
o
t
i
d
e
s
i
n
t
h
e
t
e
r
m
i
n
a
l
l
o
o
p
o
f
a
h
e
l
i
x
a
r
e
d
e
s
i
g
n
a
t
e
d
i
n
b
o
l
d
.
T
h
e
r
e
s
t
n
u
m
b
e
r
s
d
e
s
i
g
n
a
t
e
t
h
e
n
u
m
b
e
r
o
f
b
a
s
e
p
a
i
r
s
i
n
t
h
e
s
t
e
m
;
0
/
1
—
t
h
e
n
u
m
b
e
r
o
f
n
u
c
l
e
o
t
i
d
e
s
i
n
t
h
e
l
e
f
t
/
r
i
g
h
t
a
r
m
o
f
t
h
e
h
e
l
i
x
.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
63
Fig. 9. Outer helix III of the pre-rRNA secondary struc-
ture of the ITS1 locus for some genera of Polygoneae.
A — Reynoutria sachalinensis and Duma florulenta; B — Atra-
phaxis ariana; C — Caelestium lazkovii; D — C . tianschanicum;
E — Polygonum afromontanum; F — P. aviculare; G — P. doug-
lasii; H — Polygonella polygama.
as a result of hybridization of Bactria with any lineage
from Polygonum s. l. However, the ITS SSBA-based
trees show the position of the clade Caelestium as a non-
supported sister of the group that combines the RFM-
clade, Polygonum s. l., and Duma. The clade Caelestium
is either grouped with the RFM-clade, Duma and the
North American Polygonella and Polygonum sect. Dura-
via (ML analysis, Fig. 5), or is weakly associated with
the same taxa and all the clades of Polygonum s. l. (BI
analysis, Fig. 6). Thus, the ITS secondary structure-
based reconstructions provide even less information
about the nature of Caelestium).
Such incongruence used to be technically inter-
preted as a result of ancient reticulation events, rapid
radiation and “incomplete lineage sorting”, higher di-
vergence rate of the ITS1–2 regions in comparison to
coding plastid regions, or other reasons (Rieseberg,
Soltis, 1991; Doyle, 1992; Baldwin et al., 1995; Soltis,
Kuzoff, 1995; Wendel, Doyle, 1998; Holder et al., 2001;
Álvarez, Wendel, 2003; Albach, Chase, 2004; Orthia et
al., 2005; Fehrer et al., 2007; Degnan, Rosenberg, 2009;
Mallet et al., 2016).
But why different alignment strategies of the same
ITS matrix resulted in so different topologies? The pre-
RNA secondary structure of the ITS1 and ITS2 loci
clear up the reasons of these distinctions.
Alignment strategies and the pre-rRNA secondary
structure of the ITS1 and ITS2 loci of Polygoneae
Both BI and ML trees based on the ITS SSBA (Figs.
5; 6) and on the “raw” MAFFT (Figs. 3; 4) alignment
of the ITS region recovered the same eight highly sup-
ported clades listed above, although their relationships
are not resolved. Similar unresolved topologies were ob-
tained by T. M. Schuster et al. (2015) from the analyses
of the ITS data set, or the combined plastid and nuclear
data sets after deletion of poorly aligned regions. Due to
the low support of the basal nodes (Figs. 3–6), the trees
based on different alignment strategies may be tenta-
tively treated as “softly” incongruent (Wendel, Doyle,
1998).
The ML tree based on the MAFFT-alignment of
the ITS data set is almost congruent to the ML plastid
tree and agrees with our previous results based on the
same alignment strategy (Yurtseva et al., 2016), or the
results by Schuster et al. (2011b, 2015) obtained for the
combined plastid and nuclear data sets. Although the
SSBA-based ML tree (Fig. 5) is generally incongru-
ent to the ML plastid tree (Fig. 1), the ITS SSBA-
based ML tree (Fig. 5) has a higher value of log like-
lihood than the MAFFT-based ML tree (Fig. 3)
(–6493.537870 (SSBA) vs –6641.832866 (MAFFT)).
Our thorough investigation of the ITS pre-rRNA
secondary structure of various taxa of Polygoneae (Figs.
7–10; Tables 3, 4) showed that MAFFT, if applied to
the raw sequences of the ITS1 regions lacking either he-
lix II, or helix III, simply aligned: the left arms of helix
II with the left arms of helix III; the right arms of helix
II with the right arms of helix III. Next, in the MAFFT
alignment, for the taxa that have a full set of helices on
the ITS1 (Reynoutria, Fallopia, Muehlenbeckia, Duma,
Atraphaxis ariana), the region of central loop is partly
homologized with the proximal part of the left arm of
helix II (in Persepolium, Bactria ovczinnikovii, most of
Atraphaxis species), or helix III (in Polygonum s. l., Bac-
tria lazkovii, Polygonum tianschanicum). Therefore, par-
adoxically, the strong congruence of the ITS MAFFT-
alignment based trees (Figs. 3; 4) and the plastid trees
(Figs. 1; 2) (see also Yurtseva et al., 2016) may be
viewed as an artifact of the MAFFT alignment strategy,
if applied to the regions with extensive indels.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
64
T
a
b
l
e
4
.
H
e
l
i
c
e
s
I
–
I
I
I
o
f
t
h
e
p
r
e
-
R
N
A
s
e
c
o
n
d
a
r
y
s
t
r
u
c
t
u
r
e
o
f
t
h
e
I
T
S
2
l
o
c
u
s
i
n
t
r
i
b
e
P
o
l
y
g
o
n
e
a
e
T
a
x
o
n
S
p
e
c
i
e
s
H
e
l
i
x
I
H
e
l
i
x
I
I
H
e
l
i
x
I
I
I
l
o
o
p
l
o
o
p
l
o
o
p
R
e
y
n
o
u
t
r
i
a
R
.
s
a
c
h
a
l
i
n
e
n
s
i
s
1
+
6
2
5
4
1
2
2
4
4
,
0
/
1
,
3
3
/
4
4
5
/
4
9
2
/
0
5
1
/
0
4
4
M
u
e
h
l
e
n
b
e
c
k
i
a
M
.
p
l
a
t
y
c
l
a
d
a
6
2
/
3
5
4
1
2
1
6
2
,
0
/
1
,
6
0
/
1
4
5
/
4
8
5
/
0
8
6
F
a
l
l
o
p
i
a
F
.
b
a
l
d
s
c
h
u
a
n
i
c
a
6
2
5
4
1
2
1
6
2
,
0
/
1
,
3
1
/
2
6
5
/
4
8
5
/
0
8
6
D
u
m
a
D
.
fl
o
r
u
l
e
n
t
a
6
2
5
4
1
2
2
4
2
,
0
/
1
,
3
1
/
2
6
3
/
2
1
0
2
/
0
4
2
/
1
4
3
D
.
h
o
r
r
i
d
a
1
+
6
2
5
6
1
2
2
4
2
,
0
/
1
,
3
1
/
2
6
3
/
2
1
2
3
/
3
6
6
P
o
l
y
g
o
n
e
l
l
a
P
.
a
m
e
r
i
c
a
n
a
1
+
6
0
/
1
7
/
6
6
1
2
2
4
4
0
/
1
4
5
/
4
7
4
/
2
5
2
/
1
4
3
P
.
p
o
l
y
g
a
m
a
1
+
6
0
/
1
6
5
1
2
2
4
4
0
/
3
6
5
/
4
7
4
/
2
5
2
/
1
4
3
P
.
b
a
s
i
r
a
m
e
a
1
+
6
1
/
2
5
5
1
2
2
4
7
1
/
0
7
4
/
2
5
2
/
1
4
3
P
.
r
o
b
u
s
t
a
1
+
6
1
/
2
5
4
1
2
2
4
2
0
/
1
1
2
1
/
2
9
4
/
2
5
2
/
1
4
3
P
o
l
y
g
o
n
u
m
P
.
m
i
n
i
m
u
m
6
2
6
8
1
2
2
4
6
0
/
1
4
5
/
4
9
2
/
0
5
2
/
1
4
3
P
.
s
e
c
t
.
D
u
r
a
v
i
a
P
.
d
o
u
g
l
a
s
i
i
6
0
/
1
5
5
1
2
2
1
4
+
2
4
5
/
4
9
2
/
0
5
2
/
1
4
3
P
.
s
e
c
t
.
P
s
e
u
d
o
m
o
l
l
i
a
P
.
m
o
l
l
i
i
f
o
r
m
e
6
+
5
0
/
1
8
5
1
2
7
/
6
4
1
0
,
0
/
1
,
2
2
/
0
9
2
/
0
5
2
/
1
4
3
P
.
s
e
c
t
.
P
l
e
b
e
j
a
P
.
p
l
e
b
e
i
u
m
6
1
/
2
6
5
1
2
3
–
1
4
+
2
–
1
0
1
/
0
9
2
/
0
5
2
/
1
4
3
P
.
s
e
c
t
.
T
e
p
h
i
s
P
.
a
f
r
o
m
o
n
t
a
n
u
m
6
4
/
4
9
5
1
+
1
2
3
–
1
4
+
2
2
,
0
/
1
,
3
1
/
2
7
,
0
/
1
,
2
2
/
0
9
2
/
0
5
2
/
1
4
3
P
.
c
o
g
n
a
t
u
m
6
2
/
3
9
1
0
1
2
3
–
1
4
+
2
2
,
0
/
1
,
3
1
/
2
8
,
0
/
1
,
2
2
/
0
9
2
/
0
5
2
/
1
4
3
P
.
t
h
y
m
i
f
o
l
i
u
m
6
4
/
2
7
4
1
2
3
4
2
,
0
/
1
,
3
1
/
2
7
,
0
/
1
,
2
2
/
0
9
2
/
0
5
2
/
1
4
3
P
.
s
e
c
t
.
P
o
l
y
g
o
n
u
m
P
.
a
v
i
c
u
l
a
r
e
6
1
/
2
6
4
1
2
3
4
2
,
0
/
1
,
3
1
/
2
7
,
0
/
1
,
2
2
/
0
9
3
/
1
4
2
/
1
4
3
P
.
b
o
r
e
a
l
e
6
1
/
2
7
3
1
2
3
4
2
,
0
/
1
,
3
1
/
2
5
,
0
/
1
,
2
2
/
0
9
3
/
1
4
2
/
1
4
3
C
a
e
l
e
s
t
i
u
m
C
.
t
i
a
n
s
c
h
a
n
i
c
u
m
1
+
6
1
/
2
6
4
1
2
5
a
4
2
0
/
1
6
,
0
/
1
,
4
5
/
4
9
2
/
0
5
2
/
1
4
3
C
.
l
a
z
k
o
v
i
i
(
A
)
1
+
6
1
/
2
6
+
4
4
–
1
1
2
5
a
4
2
0
/
1
6
,
0
/
1
,
4
5
/
4
9
2
/
3
2
0
/
1
4
8
B
a
c
t
r
i
a
B
.
o
v
c
z
i
n
n
i
k
o
v
i
i
6
2
/
3
6
/
7
+
2
4
1
2
4
b
4
2
0
/
1
6
,
0
/
1
,
4
5
/
4
9
2
/
3
2
0
/
1
4
8
P
e
r
s
e
p
o
l
i
u
m
P
.
s
a
l
i
c
o
r
n
i
o
i
d
e
s
6
3
/
3
7
+
2
4
2
+
1
1
/
1
2
4
b
4
2
0
/
1
6
,
0
/
1
,
4
4
/
2
1
0
/
1
1
2
/
3
2
0
/
1
4
8
A
t
r
a
p
h
a
x
i
s
A
.
a
r
i
a
n
a
6
3
/
3
7
+
2
4
1
2
7
/
8
9
3
0
/
1
5
,
0
/
1
,
4
5
/
4
9
2
/
3
2
0
/
1
4
8
A
.
f
r
u
t
e
s
c
e
n
s
6
2
/
3
7
/
8
+
2
4
1
2
7
/
8
5
3
0
/
1
5
,
0
/
1
,
4
5
/
4
9
2
/
0
5
2
/
1
4
3
A
.
p
y
r
i
f
o
l
i
a
6
2
/
3
7
/
8
+
2
4
1
2
7
/
8
5
3
1
6
,
0
/
1
,
4
5
/
4
9
2
/
0
5
2
/
1
3
5
N
o
t
e
.
T
h
e
n
u
c
l
e
o
t
i
d
e
s
i
n
t
h
e
t
e
r
m
i
n
a
l
l
o
o
p
o
f
a
h
e
l
i
x
a
r
e
d
e
s
i
g
n
a
t
e
d
i
n
b
o
l
d
.
T
h
e
r
e
s
t
n
u
m
b
e
r
s
d
e
s
i
g
n
a
t
e
t
h
e
n
u
m
b
e
r
o
f
b
a
s
e
p
a
i
r
s
i
n
t
h
e
s
t
e
m
;
0
/
1
—
t
h
e
n
u
m
b
e
r
o
f
n
u
c
l
e
o
t
i
d
e
s
i
n
t
h
e
l
e
f
t
/
r
i
g
h
t
a
r
m
o
f
t
h
e
h
e
l
i
x
.
T
h
e
l
e
t
t
e
r
s
a
a
n
d
b
i
n
H
e
l
i
x
I
I
d
e
s
i
g
n
a
t
e
d
i
ff
e
r
e
n
t
s
u
b
s
t
i
t
u
t
i
o
n
s
i
n
t
h
e
a
p
i
c
a
l
p
a
r
t
o
f
t
h
e
s
t
e
m
.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
65
Fig. 10. Pre-rRNA secondary structure of the ITS2 locus for some genera of tribe Polygoneae.
A — Reynoutria sachalinensis; B — Atraphaxis ariana; C — A. pyrifolia; D — Bactria ovczinnikovii; E — Caelestium lazkovii; F —
C. tianschanicum; G — Duma florulenta; H — Thysanella robusta; I — Polygonum afromontanum. I–IV — outer helices.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
66
Paraphyly of Bactria on the ITS-based trees is not
an artifact
Paraphyly of Bactria, which included B. ovczinniko-
vii and B. lazkovii, has been shown in our previous phy-
logenetic analyses of the ITS matrix, which were based
on MAFFT alignment strategy (Yurtseva et al., 2016),
and was confirmed in this study. Keeping in mind the
monophyly of the same genus on the plastid-based tree,
earlier we interpreted paraphyly of Bactria (Yurtseva et
al., 2016) as a result of reticulation of one of two spe-
cies, or as a putative artifact of the ITS sequence data,
such as pseudogenisation (Baldwin et al., 1995; Álvarez,
Wendel, 2003; Feliner, Rosselló, 2007; Poczai, Hyvönen,
2010). The addition of the new non-pseudogenic ITS
sequence of Polygonum tianschanicum to the ITS matrix
clearly revealed the close relationship of Bactria lazkovii
and Polygonum tianschanicum by the ITS and the sepa-
rate position of their common clade from Bactria ovczin-
nikovii in all the ITS-based trees (Figs. 3–6).
The detailed examination of the secondary structure
of pre-rRNA of the ITS1 locus of Polygoneae confirmed
the close relationship of Bactria lazkovii and Polygonum
tianschanicum, as well as the strong contrast with Bac-
tria ovczinnikovii. By the whole pre-rRNA secondary
structure of the ITS1 locus, B. lazkovii and Polygonum
tianschanicum are close to Polygonum s. l. (incl. Polygo-
nella) (Fig. 7: E, F, G, H), that agrees with the results
of ML analysis of the MAFFT-aligned ITS data set, but
they differ from Polygonum s. l. in their unique structure
of helices III and V (Fig. 7: C, D; Table 3). For the ITS2
locus, Bactria lazkovii and Polygonum tianschanicum
share the structure (but not a composition) of helix I
with some species of Polygonum s. l., but have a unique
structure of helix II, and share the structure of helix III
with Bactria ovczinnikovii, Atraphaxis and Persepolium.
In contrast, Bactria ovczinnikovii is close to Perse-
polium and most of Atraphaxis species (except species
having a full set of helices), by the pre-RNA secondary
structure of the ITS1 and ITS2 loci and the composi-
tion of shared helices (Fig. 7: B–D, 10; Tables 3, 4).
Thus, the ITS regions of Bactria lazkovii and Polygo-
num tianschanicum, on the one side, and that of Bactria
ovczinnikovii, on the other, are rather different in terms
of both first and secondary structures. Despite the fact
that Bactria lazkovii and Polygonum tianschanicum re-
semble Polygonum s. l. in the entire pre-rRNA second-
ary structure of the ITS1, the structure of the individ-
ual helices on the ITS1 and ITS2 does not allow this
group to be attributed to any subclade of Polygonum s. l.
or Bactria.
The most likely explanation for the incongruent po-
sitions of Caelestium in the plastid and ITS SSBA-based
trees and the difference in the pre-RNA secondary
structure of the ITS1 and ITS2 loci is that this group
appeared as a result of reticulation of Bactria as a ma-
ternal taxon and an unknown taxon, which served as a
putative donor of the ITS array(s) in the distant past,
before its splitting into B. lazkovii and Polygonum tian-
schanicum. The donor of the ITS is probably extinct or
missing from the analyses. However, due to a lack of
exact knowledge of the past, this explanation, even if it
seems simple, remains speculative.
The pseudogenic ITS is a primary state
for Bactria lazkovii?
The pseudogenic ITS1–2 of Bactria lazkovii detect-
ed in this study along with the functional one, is char-
acterised by abundant transitions and indels, including
the 5.8S gene, a low GC-content and a partly destroyed
pre-rRNA secondary structure of the ITS2 locus. The
pre-rRNA secondary structure of pseudogenic ITS1 lo-
cus partly matches that of its functional ITS, but has
helix II. That can be considered a pseudogenic paralog
of the functional ITS1–2, which preserved the primary
state of pre-rRNA secondary structure of ITS1 locus
with a full set of helices on the ITS1. Otherwise, it can
be considered as ITS obtained as a result of hybridiza-
tion of B. lazkovii with an unknown taxon that served as
a donor of additional ITS. In any case, the pseudogenic
ITS1–2 of B. lazkovii differs from the functional ITS1–2
of Bactria ovczinnikovii in terms of both the first and
secondary structures and cannot be considered as the
primary state for the latter.
A full set of helices on the pre-rRNA second-
ary structure of the ITS1 was apparently a primary
state not only for Bactria lazkovii, but for other taxa
of Polygoneae. For example, the members of Reynou-
tria, Fallopia, Muehlenbeckia, Duma, some Atraphaxis
(A. ariana, and also A. badgysi, A. radkanensis) have a
full set of outer helices (five in total) on the ITS1. It is
obvious that the same helices have been lost indepen-
dently in different genera of Polygoneae. The members
of Polygonum s. l., P. tianschanicum, and Bactria lazkovii
have lost helix II on the functional ITS1. In contrast,
most species of Atraphaxis, Persepolium, and Bactria
ovczinnikovii have lost helix III on the functional ITS1
(Fig. 7; Table 3). The species of Atraphaxis with a full
set of helices on the ITS1, or lacking helix III, have
similar structure and composition of shared helices, that
cannot be said about Bactria ovczinnikovii, on the one
hand, and B. lazkovii and Polygonum tianschanicum, on
the other hand.
Our study confirmed that the pre-rRNA secondary
structure of the ITS1 and ITS2 is a helpful tool for op-
timizing alignment and for making full use of the phylo-
genetic information of DNA sequences. This in itself is a
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
67
Fig. 11. Pre-rRNA secondary structure of the ITS1 (A) and ITS2 (B) loci of the pseudogenic ribotype B of Caeles-
tium lazkovii.
fairly useful taxonomic character (Mai, Coleman, 1997;
Gottschling et al., 2001; Wang et al., 2007; Tippery, Les,
2008; Giudicelli et al., 2017).
On ranks and circumscriptions
In general, we completely agree that any histori-
cal explanations (for example, the models of speciation,
current reconstructions of geological histories, puta-
tive problems with the climates that may have existed
in the past, even the discussions regarding the fossil re-
cords and molecular dating) that seem to be hypotheti-
cal or assumption-based by definition, should not be
confounded with the criteria used to distinguish taxa
(Wheeler, Platnick, 2000).
At the present stage of molecular-based studies, gen-
era and other taxa of higher ranks can and should be
congruent with a phylogenetic pattern. Many authors
(Backlund, Bremer, 1998; Entwisle, Weston, 2005;
Humphreys, Linder, 2009; Barraclough, Humphreys,
2015) provide the principles of phylogenetic classifica-
tion and propose the criteria for distinguishing the taxa.
Among them, monophyly of a taxon is a basic principle
(e. g., Stevens, 1985; Backlund, Bremer, 1998; Entwisle,
Weston, 2005). B. E. Pfeil and M. D. Crisp (2005)
agree that taxa should be monophyletic and discuss
the problem of paraphyletic groups which perpetuate
a classification, that obscures information and reduces
predictive power. A. Backlund and K. Bremer (1998)
also recommend minimising nomenclatural change and
maximising its stability, providing phylogenetic infor-
mation, and easing identification of the taxa. However,
strictly speaking, there are no formal criteria that would
clearly define the rank of a taxon, and the definition of a
genus is sometimes even more arbitrary than the defini-
tion of a species.
Backlund and Bremer (1998) and P. F. Stevens
(2001, 2002; see also Bentham, 1861) would not recom-
mend recognising a monotypic genus if it is a sister of
a larger genus. They believe that if a newly discovered
taxon is the sister to an existing named genus, this does
not mean that a new genus is needed for the newly de-
scribed taxon. However, if the new taxon makes the ge-
nus not-monophyletic, the latter cannot be adopted in a
broad circumscription (Stevens, 2001).
Thereby, the maintenance of paraphyletic Bactria,
as this genus appeared on the ITS trees (Yurtseva et al.,
2016 and this study) would be simply incorrect. The
same is true for Polygonum s. l., which demonstrates
monophyly on the plastid trees (Figs. 1; 2) but is poly-
phyletic on the ITS SSBA-based trees (Figs. 5; 6).
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
68
The split of the most inclusive genus Bactria into
two small monophyletic genera (monotypic Bactria
with a single species Bactria ovczinnikovii and Caeles-
tium including Bactria lazkovii and Polygonum tian-
schanicum) is a decision alternative to the single ge-
nus Bactria Yurtseva et Mavrodiev s. l. (Yurtseva et
al., 2016) with three species. As already discussed, the
clear sistership of the clade (Bactria lazkovii + Polygo-
num tianschanicum) and B. ovczinnikovii on the plastid
trees does not contradict the separation of B. lazkovii
and Polygonum tianschanicum from Bactria ovczinniko-
vii as distinct genera. The sisterhood of two taxa in it-
self provides absolutely no analytical reason for lump-
ing these two taxa into one taxon (for example, due to
the principle of monophyly), especially where there
are clear morphological and other differences between
sister taxa. The flowering plants and the gymnosperms
are an extreme example (Soltis et al., 2018). Another
example is the recently described genus Pseudoziziphus
Hauenschild (Rhamnaceae), which appeared as a sister
of the genus Condalia Cav. (Hauenschild et al., 2016),
which is confirmed by a clear difference in morphology
and biogeography. The papers of E. V. Mavrodiev et al.
(2014), M. B. Crespo et al. (2015) and S. L. Low et al.
(2018) contain similar examples.
As a result of the genus-rank separation of Caeles-
tium, we obtain the monotypic Bactria for B. ovczinniko-
vii, which was also viewed as part of a widely treated
Atraphaxis s. l. (Tavakkoli et al., 2015), including also
Persepolium and Bactria s. l. The similarity of the pre-
RNA secondary structure of the ITS1 and ITS2 sup-
ports the opinion by S. Tavakkoli et al. (2015). But the
weak support of their common clade on the ML and BI
ITS SSBA-based trees and the low support of the clade
(Atraphaxis + Persepolium) in all the ITS-based trees,
argue against their lumping. Sound distinctions in the
morphology of the shoots, ochreas, and pollen (Yurtse-
va et al., 2016, 2017), as well as distinct exocarp anato-
my (Yurtseva et al., 2019, in this issue) provide evi-
dences in favor of distinguishing these genera.
Some authors consider plastid markers to be more
significant than the ITS, in which case we should sup-
port the genus Bactria with three species. As we have
demonstrated, Caelestium (Bactria lazkovii and Polygo-
num tianschanicum) shows a maximum total difference
over sequence pairs from other genera of Polygoneae (Ta-
ble 2). For example, Bactria lazkovii differs from B. ov-
czinnikovii by one-nucleotide substitutions in 43 sites
and by numerous indels in 3-loci plastid alignment 1218
bp long. These results provide strong evidence for the
separation of B. lazkovii and Polygonum tianschanicum
from Bactria ovczinnikovii. Strong molecular distinctions
of B. lazkovii and Polygonum tianschanicum give no rea-
son for considering them a single species. They differ by
substitutions in 10 sites and two indels (1 and 9 bp long)
on the ITS region, and by substitutions in 7 sites and by
an indel 28 bp long on the combined plastid region.
Since W. Hennig (1966), the notion that sister taxa
need to have equal rank is common, as reviewed by
G. Giribet et al. (2016). Thus, Bactria ovczinnikovii and
Caelestium (Bactria lazkovii and Polygonum tianschani-
cum) can be accepted at the rank of genus. A small num-
ber of species in these genera is the result of their an-
cient origin and reduced diversity, which follows from
their highly isolated local distribution in the old moun-
tain systems of the Pamirs and Tien Shan.
Morphology and distribution of Bactria ovczinnikovii,
B. lazkovii and Polygonum tianschanicum
The morphology of the taxa is given in detail in
O. V. Yurtseva et al. (2019, in this issue) and is only
briefly summarized here. All three species, Bactria
ovczinnikovii, B. lazkovii and Polygonum tianschani-
cum, are dwarf shrubs 10–30 cm tall with leathery leaf
blades (but of different shapes). The combinations of
morphological traits that differentiate Caelestium (Bac-
tria lazkovii and Polygonum tianschanicum) from Bac-
tria ovczinnikovii are summarized in Table 5 (see also
Yurtseva et al., 2016). The perianth of all the taxa is di-
vided for 4⁄5–9⁄10 of its length in 5 (rarely 6) equal tepals,
which bear papillae at the edges (Fig. 12). The perianth
of B. ovczinnikovii resembles that of Persepolium, and
the perianth of Bactria lazkovii and Polygonum tian-
schanicum resembles that of Polygonum s. str.: Bactria
Fig. 12. Perianths.
A–C
—
Bactria ovczinnikovii; D–E
—
Caelestium lazkovii; F —
C. tianschanicum. Scale bars — 1 mm.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
69
ovczinnikovii has sepaloid tepals of the perianth, while
they are petaloid in B. lazkovii and Polygonum tian-
schanicum. All three taxa have perianth glabrous out-
side and bearing papillae only at the tepals edges, which
we have never seen in Polygonum s. str.
All three species have the microreticulate-foveolate
sporoderm ornamentation (Yurtseva et al., 2014, 2016),
which is quite different from any type of sporoderm
ornamentation observed in Polygonum s. l. (Hedberg,
1946; Hong et al., 2005): psilate, micropunctate, micro-
spinulose (palynotype Avicularia); rugulate or foveo-
late with microspinules around the colpi, semitectate-
reticulate at mesocolpia (palynotype Duravia); psilate
around the colpi, verrucate at 1⁄3 of mesocolpia and poles
(palynotype Pseudomollia).
Bactria ovczinnikovii and B. lazkovii demonstrate a
striking contrast in the structure of the exocarp cells of
their pericarp, which differ in the shape and size of the
lumen and pore channels, in the details of their walls,
which is combined with different shapes of fruits, styles,
and tepals (Yurtseva et al., 2019, in this issue).
The distributional ranges of three species are very
distant and divided by the high mountain ranges of
the Pamirs and Tien Shan. Bactria ovczinnikovii is a lo-
cal endemic of the Southwestern Pamir, where it grows
in several populations on the right bank of the Pyandj
River (Tajikistan, Khatlon reg., Shuroabad and Hama-
dony districts). It is part of the Turkestanian Province
of the Western Asian Subregion, the flora of which is re-
lated to the Armeno-Iranian flora in the west and to the
Central Asian and northwestern Himalayan flora in the
east and numbers no less than 50 endemic genera and
hundreds of endemic species (Takhtajan, 1986).
Bactria lazkovii and Polygonum tianschanicum are
endemics of two different regions of the Central Asian
Subregion (Takhtajan, 1986). B. lazkovii was collected
in a single locality in the Inner Tien Shan (Kyrgyzstan,
Naryn reg., Zhumgal distr.), part of the Central Tien
Shanian Province. The flora of this province includes
ca. 1800 species and only one endemic genus Tianschan-
iella B. Fedtsch. ex Popov (Takhtajan, 1986), though
G. A. Lazkov and A. R. Umralina (2015) listed numer-
ous endemic or subendemic genera of flowering plants
in the flora of Kyrgyzstan. Polygonum tianschanicum
is a local endemic of the Dzungaro-Tien Shanian Pro-
vince of the Central Asian Subregion, which contains
about 50 endemic species and several endemic genera
(Takhtajan, 1986).
The Pamir and Tien Shan Mountains are similar in
their floristic composition, but consistently have been
treated as separate biogeographical entities (e. g., Ko-
rovin, 1962; Takhtajan, 1986). As V. N. Pavlov (1980)
summarized, ca. 70 % of the species are common for
both floras; however, the number of endemic genera is
very high in the Pamir and Tien Shan regions (Nowak,
Nobis, 2010; Nowak et al., 2011; Safarov, 2013; Lazkov,
Umralina, 2015). In short, the floras of the Pamirs and
Tien Shan are closely related, but are quite different in
their composition. Similarly, Bactria ovczinnikovii and
Caelestium are closely related, but differ greatly in mor-
phology and molecular markers studied.
Morphology, distributions, and intrageneric taxa
recognized in Polygonum s. l.
In our current analyses, not only Bactria, but also
Polygonum s. l. are monophyletic on the plastid trees
(Figs. 1; 2), but non-monophyletic on ML and BI
trees based on the ITS SSBA matrix (Figs. 5; 6), that
is in agreement with ITS-based topologies obtained by
T. M. Schuster et al. (2015). Thus, we would like to de-
scribe a more general context of our current re-circum-
scription of the genus Polygonum s. l.
On the ITS SSBA-based trees, the North Ameri-
can clade (Polygonella + Polygonum sect. Duravia) is
grouped with the members of the RFM-clade and Duma
distributed in Southeast Asia, Australasia and South
America, but separately from the clade Polygonum
s. str. (Figs. 5; 6), which combines the species distrib-
Table 5. Morphological differences of Bactria and Caelestium
Morphological traits
Bactria
(B. ovczinnikovii)
Caelestium
(C. lazkovii, C. tianschanicum)
Perianth tepals
texture
sepaloid
petaloid
shape
lanceolate
broadly ovate
apex
acuminate
obtuse
color
greenish-purple
pinkish-white
Fruit
ribs
sharp
obtuse
faces
concave, matt
flat, glossy
Styles
shape
linear below stigmas
linear for the whole length
connation
connate at base
free from base
Stigmas
shape
mini-capitate
inconspicuous
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
70
uted mostly in Central Asia and the species distributed
worldwide in the regions with temperate climate.
Our results have shown that the North American
Polygonella and Polygonum sect. Duravia differ from Po-
lygonum s. str. (as well as from the rest of Polygoneae)
in the composition of helix V of the pre-rRNA second-
ary structure of the ITS1 (Table 3) and of the most con-
served helix III (Mai, Coleman, 1997; Coleman, 2003,
2007) of the pre-rRNA secondary structure of the ITS2
(Table 4). In addition, Polygonella differs from Polygo-
num sect. Duravia in the structure of helix III on the
ITS1 and helix III on the ITS2.
Polygonella and Polygonum sect. Duravia have a fair-
ly distinct palynotype Duravia (Hedberg, 1946; Hong
et al., 2005). MP analysis of morphological data (Ronse
De Craene et al., 2004) also combined Polygonum sect.
Duravia with Polygonella in a clade sister to the rest of
Polygonum s. l. In contrast to P. sect. Polygonum and
P. sect. Tephis, both having petioles with 4–6 bundles
and collenchyma in four strands, P. sect. Duravia and
Polygonella have the petioles with 1–3 bundles and
poorly developed collenchyma (Haraldson, 1978). In
addition, Polygonella differs from the rest of Polygonum
s. l. in having internodal branching, strongly reduced
vascularization of the flower, abruptly dilated inner fila-
ments, solitary flowers at the nodes, and conspicuous
scarious bracts (Watson, 1873; Horton, 1963; Ronse De
Craene et al., 2004).
The strong geographic isolation of the North Ameri-
can Polygonella and Polygonum sect. Duravia from Po-
lygonum s. str., which is distributed mostly in the Old
World, and clear differences in their morphology are
consistent with the separate positions of these taxa on
the ML and BI ITS SSBA-based trees (Figs. 5; 6), that
makes the inclusion of Polygonella and Polygonum sect.
Duravia into the broadly defined genus Polygonum s. l.
(Ronse De Craene et al., 2004; Schuster et al., 2011b,
2015) at least questionable. Thus, our current phylo-
genetic results are consistent with the narrow circum-
scription of Polygonella, which was previously consid-
ered as a distinct genus (Meisner, 1826, 1857; Bentham,
Hooker, 1880; Dammer, 1893), and Duravia (S. Wat-
son) Greene (1904: 23).
Two highly supported subclades of the clade Po-
lygonum s. str. which were recognized here as P. sect.
Polygonum (incl. P. aviculare) and P. sect. Tephis (incl.
P. afromontanum), are special in their distribution and
ecology. The subclade P. sect. Polygonum combines
mostly mesophytic or mesoxerophytic species distrib-
uted worldwide in regions with a temperate climate, as
pioneer species on sea or river banks, on the shores of
estuaries, irrigation canals and temporary streams, as
well as in disturbed steppes, urban and ruderal places.
Our results have shown that the subclades, which
correspond P. sect. Polygonum (incl. P. aviculare) and
P. sect. Tephis, as they appeared on the ITS-based trees,
differ from each other in the composition of helix III
and helix V of the pre-rRNA secondary structure of the
ITS1 (Table 3) and have slight differences in the com-
position of the most conserved helix III (Mai, Coleman,
1997; Coleman, 2003, 2007) of the pre-rRNA secondary
structure of the ITS2 (Table 4).
Our results have shown the place of P. afromonta-
num, one of two members of P. sect. Tephis from Africa,
in the subclade which includes the members of P. sect.
Polygonum distributed mostly in Southwest and Cen-
tral Asia and named here “P. sect. Tephis” (Komarov,
1936; Hara et al., 1982; Li et al., 2003).
M. Adanson (1763: 276) described the genus Te -
phis Adans. for Atraphaxis undulata L. (Linnaeus, 1753:
333), which presently is known as Polygonum undu-
latum (L.) P. J. Bergius (1767) from South Africa and
has a tetramerous perianth, dimerous ovary and short
internodes. Polygonum sect. Tephis (Adans.) Meisn.
was established by C. F. Meisner (1857) and accepted
by G. Bentham and J. D. Hooker (1880), U. Dammer
(1893), R. Jaretzky (1925), G. Roberty and S. Vautier
(1964). P. afromontanum was added to this section as
sharing the characteristics of stem and petiole anato-
my (Haraldson, 1978), perianth, and ovary (Ronse De
Craene, Akeroid, 1988). Both species have palynotype
Avicularia with densely microspinulose ornametation of
sporoderm (Hong et al., 2005), peculiar also for P. sect.
Polygonum.
The current position of P. afromontanum does not
contradict the position of P. undulatum in the clade
Polygonum s. l. as a sister to the group including P. avi-
culare in rbcL phylogeny (Galasso et al., 2009). Also it
does not contradict the results of MP analysis based
on morphology (Ronse De Craene et al., 2004), which
demonstrated the sisterhood of subsections Polygonum
and Tephis within P. sect. Polygonum. The latter, in turn,
appeared as a sister to P. sect. Duravia (incl. Polygo-
nella). It is likely that we can apply the name “Polygo-
num sect. Tephis” to the whole subclade of Afro-Asian
Polygonum species (Figs. 5–10), but the nomenclatural
decision is premature until analyses of P. undulatum, the
nomenclatural type of P. sect. Tephis.
Our results confirmed positions of Polygonum mollii-
forme (the nomenclatural type of P. sect. Pseudomollia)
and P. plebeium (the nomenclatural type of P. sect. Ple-
beja) in the subclade “P. sect. Tephis” in the ITS-based
trees, that was demonstrated earlier (Yurtseva et al.,
2010; Schuster et al., 2011b). Polygonum molliiforme
and P. plebeium share the structure of helices IV and V
of the pre-RNA secondary structure of the ITS1, but
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
71
P. plebeium differs from the rest members of “P. sect.
Tephis” by the structure of helix III. Both species have
also distinct structure of helices I, II, and III of the pre-
RNA secondary structure of the ITS2, P. molliiforme
having the longest helices.
Our results have shown incongruent positions of
P. molliiforme and P. plebeium on the plastid and ITS
trees. Both species fall into the subclade “P. sect. Tephis”
in our current ITS-based topologies (Figs. 3–6), but fall
in the sister subclade P. sect. Polygonum on the plastid
trees (Figs. 1; 2). The incongruent placement of P. mol-
liiforme and P. plebeium in two sister subclades might
be a result of introgression, or caused by other reasons
(Soltis, Kuzoff, 1995; Rieseberg, Soltis, 1991; Rieseberg
et al., 1996; Mallet et al., 2016), which makes the taxon-
omy of Polygonum molliiforme and P. plebeium question-
able. Extensive analyses of additional plastid markers
and a wider range of species are nessasary to clarify the
reticulation in Polygonum s. str., which was shown also
with ISSR and RAPD analyses (Yurtseva et al., 2006;
Voylokova et al., 2009).
Conclusions
1. Based on the results of molecular phylogenetic
analyses of combined plastid data and ITS data, on the
details of the pre-rRNA secondary structure of the ITS1
and ITS2 loci, morphological and distributional data,
we strongly recommend accepting the clade (Bactria
lazkovii + Polygonum tianschanicum) at generic rank.
This clade is presumably a result of ancient hybridiza-
tion of any taxon related to Bactria and an unknown
taxon, and demonstrates the role of hybridization in the
generic origin in tribe Polygoneae.
2. The new genus Caelestium Yurtseva et Mavrodi-
ev is established here to include two species (C. lazko-
vii and C. tianschanicum). This genus is endemic to the
Tien Shan Mountains (Central Asia).
3. Based on the standard molecular, as well as mor-
phological and distributional data, the broad circum-
scription of the genus Polygonum as including Duravia
and Polygonella seems questionable. Our current results
agree with the narrow treatment of Polygonella, Du-
ravia, and Polygonum s. str. A larger set of species and
additional markers are necessary to clarify the relation-
ships within Polygonum s. str.
Taxonomic treatment
Key to the genera Atraphaxis, Bactria, Caelestium,
Duravia, Persepolium, Polygonum s. str.,
and Polygonella
1. Branches adnate to stems, appearing to arise internodally
.......... .......... .......... .......... .......... .......... .......... .......... . 1 . Polygonella.
+ Branches not adnate to stems, not appearing to arise inter-
nodally ......................................................................................... 2.
2. Annual or perennial herbs ...................................................... 3.
+ Shrubs or subshrubs ................................................................ 4.
3. Stems rounded, finely 8–16-ribbed; leaf blade venation
pinnate, secondary veins conspicuous; worldwide ...............
......... .......... .......... .......... .......... ..... 2. Polygonum s. str. (in part).
+ Stems quadrangular in cross section, ribs obscure or ab-
sent; leaf blade venation parallel, secondary veins not con-
spicuous; mostly Western North America ......... 3 . Duravia.
4. Perianth tube long, filiform; perianth tepals 4–5, unequal;
2–3 inner tepals strongly accrescent in fruiting ....................
......... .......... .......... .......... .......... .......... ...... 4. Atraphaxis (in part).
+ Perianth tube short, funnel-shaped; perianth tepals 5,
equal, non accrescent in fruiting .......................................... 6.
6. Ochreas tubular, later lacerate in two aristate-subulate
lacinulas and finely serrate-incised middle portion ..............
......... .......... .......... .......... .......... .......... ...... 4. Atraphaxis (in part).
+ Ochreas tubular-lanceolate, later lacerate in two, four and
more lacinulas ............................................................................ 7.
7. Leaf blades linear-lanceolate, deciduous in fruiting; peri-
anth totally shortly velutinous puberulent outside; Zagros
......... .......... .......... .......... .......... .......... .......... .......... .
5. Persepolium.
+ Leaf blades ovate or lanceolate, preserved in fruiting; peri-
anth glabrous or papillate either only on the tube, or only
on the tepal margins ................................................................ 8.
8. Perianth glabrous, or papillose on tube; SW and Central
Asia ............................................ 2. Polygonum s. str. (in part).
+ Perianth glabrous, bear papillae on the tepal margins;
Pamirs, Tien Shan .................................................................... 9.
9. Perianth tepals sepaloid, lanceolate or oblong-elliptical;
purple with narrow pinkish margin; three outer tepals
keeled and cucullate; tube funnel-shaped; fruit with dis-
tinct ribs and concave matt faces; styles fused at base in a
stub; stigmas globular; SW Pamir ......................... 6 . Bactria.
+ Perianth tepals petaloid, broadly ovate or oblong-ellipti-
cal; green with wide pinkish-white margin; three outer te-
pals almost flat; tube cup-shaped or sacciform; fruit with
obtuse ribs and flat glossy faces; styles free from base, lin-
ear for their whole length; stygmas invisible; Tien Shan ....
......... .......... .......... .......... .......... .......... .......... .......... ... 7. Caelestium.
Bactria Yurtseva et Mavrodiev, 2016, PeerJ,
4 (e1977): 42, p. p., quoad B. ovczinnikovii. ≡ Atraphaxis
sect. Ovczinnikovia Yurtseva ex S. Tavakkoli, 2015, Pl.
Syst. Evol. 301 (4): 1167. —
Type: Bactria ovczinniko-
vii (Czukav.) Yurtseva et Mavrodiev.
Bactria ovczinnikovii (Czukav.) Yurtseva et Mav-
rodiev, 2016, PeerJ, 4 (e1977): 43. ≡ Polygonum ovczin-
nikovii Czukav. 1962, Izv. Akad. Nauk Tadzhiksk. SSR,
Otd. Est. Nauk, 2 (9): 64; ead. 1968, Fl. Tadzhiksk.
SSR, 3: 250; ead. 1971, Consp. Fl. Asiae Mediae, 2: 208.
≡ Atraphaxis ovczinnikovii (Czukav.) Yurtseva, 2014, Pl.
Syst. Evol. 300 (4): 763.
—
Holotype: “Tajikistan
[Khatlon Region, Shuroabad Distr.], the right bank of
the Pyandj River to the N of the village Bag [Bog], at
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
72
gravely ridges at the Schpilau River, 1100 m a. s. l., 1 VI
1960, S. Yunusov, No 1586” (LE: LE 01065511!; iso-
type — TAD).
Ic.: Fig. 12: A–C. —
For published figures see Czu-
kavina, 1962: fig. 1; Czukavina, 1968: tab. 44, figs. 2–6;
Yurtseva et al., 2014: figs. 1: A–C; 4: A–C; Yurtseva
et al., 2016: figs. 3: B; 4; 5; 16: A; 19: A, B; suppl. 10;
Yurtseva et al., 2017: 161, figs. 6: B, C; 9: A, B; 14: A–C;
15: K; 17: F.
Dwarf shrub. Woody shoots divaricately branched,
covered with gray bark, fibrously disintegrated. Annual
shoots leafy, shortly puberulent. Leaves thick, broadly
ovate, suddenly narrowed to a petiole, joined with ar-
ticulation. Ochreas lanceolate-tubular, later bilacerate
or bidentate. Thyrses terminal, leafy, with 3–7 clusters
of 1–2(3) flowers. Perianth campanulate, divided to
5⁄6–8⁄10 in 5(6) equal lanceolate or oblong-elliptical se-
paloid tepals. Three outer tepals keeled and cucullate,
papillate on the margins; tube funnel-shaped. Stamens
8(9). Styles 3, fused at base in a stub, stigmas globular.
Fruit ovoid, trigonous, ribs distinct, faces concave, dull.
Pollen tricolporate, oblong-spheroidal to spheroidal
(P/E = 1.1–1.4), elliptical in equatorial view, rounded-
trilobed in polar view, sporoderm ornamentation micro-
reticulate.
Distribution and ecology. Endemic to the
Southwestern Pamir (Tajikistan), grows on the right
bank of the Pyandj River (Tajikistan, Khatlon reg.,
Shuroabad and Hamadoni distr.). Records in the adja-
cent part of Afghanistan can be expected. Rocky and
gravelly slopes in the belt of forest-steppe, ca. 600 m
a. s. l. Fl. V–VI, fr. VI.
Additional specimens examined. South Taji-
kistan, Khatlon Region. Shuroabad District: Mts in environs
of the vill. Bag [Bog] near the Pyandj River, right bank of the
Shpilau River, lower reaches, creek bed on the mountainside,
1 VI 1960, G. N . Nepli (LE!); mts in environs of the vill. Bag
near the Pyandj River, red sandstones on the right bank of the
Shpilau River, 1 VI 1960, V. Botschantzev, T. Egorova, No 777
(LE!); mts in environs of the vill. Bag near the Pyandj River,
red and gray sandstones on the left bank of the Aarzy-Su River,
2 VI 1960, iidem, No 814 (LE!); right bank of the Pyandj River
between Bog and Bakhorak, at south slope, 1100 m a. s. l ., 2
VI 1960, S. Yunusov, No 1624 (LE!, TAD); right bank of the
Pyandj River between Bog and Bakhorak, 29 V 1961, S. Yu-
nusov, G. Kinzikaeva (LE!); mouth of the Surkh-Alam River,
red-gray sandstone, at gravely-stone ridges, 580 m a. s. l ., 25
VII 2013, U. Ukrainskaya et al., No 12 (MW!); Moskovsky Dis-
trict [now Hamadoni Distr.]: gorge Suleyman-Dara, near the
village Sarygor, gravely slope, 31 V 1961, G. Kinzikaeva (LE!)
(more in Czukavina, 1962, 1968).
Caelestium Yurtseva et Mavrodiev, gen. nov.
Type: Caelestium lazkovii (Yurtseva et Mavrodiev)
Yurtseva et Mavrodiev.
Dwarf shrub. Woody shoots divaricately branched,
covered with gray bark, fibrously desintegrated. Annual
shoots leafy, shortly puberulent. Leaves oblong-elliptical,
gradually narrowed to a petiole and articulated. Ochreas
lanceolate-tubular, later bilacerate or bidentate. Thyrses
terminal, leafy, with 3–7 clusters of 1–2(3) flowers. Peri-
anth campanulate, divided to 4⁄5–9⁄10 into 5 equal petaloid
tepals. Tepals oblong-elliptical or broadly ovate, almost
flat, papillate on the margins; tube cup-shaped or sacci-
form. Stamens 8. Styles 3, free from base, linear for their
whole length, stigmas inconspicuous. Fruit ovoid, trigo-
nous, with obtuse ribs and almost flat faces, glossy. Pol-
len tricolporate, oblong-spheroidal to spheroidal (P/E =
1.1–1.4), elliptical in equatorial view, rounded-trilobed
in polar view, sporoderm ornamentation microreticulate
to foveolate-perforate.
Affinity. Caelestium resembles Bactria (in our
revised circumscription) in the shrubby habit, lanceo-
late-bilacerate ochreas, campanulate perianth papillate
on the tepal margins, and microreticulate to foveolate-
perforate ornamentation of the sporoderm (Yurtseva et
al., 2016). The petaloid tepals, cup-shaped or sacciform
perianth tube, fruits with obtuse ribs and flat faces, and
free linear styles differentiate Caelestium from Bactria,
the latter having sepaloid tepals, funnel-shaped peri-
anth tube, fruits with distinct ribs and concave faces,
and styles connate at the base forming a stub, with
small capitate stigmas.
Caelestium resembles Polygonum s. str. in having a
campanulate perianth with five equal-sized tepals, and in
habit. However, Polygonum s. str. differs by lanceolate-
tubular ochreas with 4–18 veins, deeply lacerate-fimbri-
ate (Komarov, 1936; Brandbyge, 1993) and psilate, mi-
cropunctate, microspinulose sporoderm ornamentation
(Hedberg, 1946; Hong et al., 2005). Polygonum s. str.
lacks papillae on the tepal edges, though some species
(e. g., P. thymifolium Jaub. et Spach, P. biaristatum Aitch.
et Hemsl.) bear papillae on the perianth tube (Yurtseva,
pers. obs.).
Distribution. Locally distributed in the Inner
and Eastern Tien Shan.
Etymology. The name is originated from “caeles-
tis” (= heavenly, divinus).
Key to identification of species
1. Perianth divided for 4⁄5–5⁄6 of its length; tepals obtuse; leaf
blades 7–10 × 2.5 –3 mm, bright green, oblong-elliptical or
oblanceolate, acuminate; margin revolute; fruits 2.5–3 ×
1.8–2 mm; annual shoots reddish-brown ...... 1. C. lazkovii.
+ Perianth divided for 8⁄10–9⁄10 of its length; tepals obtuse or
slightly acuminate; leaf blades 7–8(15) × 3–5 mm, dark
green, oblong-elliptical, almost spathulate, obtuse; margin
flat; fruits 3–4 × 2–3 mm; annual shoots creamy or pale-
gray ............................................................. 2 . C . tianschanicum.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
73
1. Caelestium lazkovii (Yurtseva et Mavrodiev)
Yurtseva et Mavrodiev, comb. nova. ≡ Bactria lazkovii
Yurtseva et Mavrodiev, 2016, PeerJ, 4 (e1977): 43.
—
Holotype: “Kyrgyzstan, Naryn Region: Zhumgal Dis-
tr., Kavak-Too Ridge, 5 km N of the village Sary-Bulun,
on rocks, 7 VII 2006, G. Lazkov, No 24” (MW0595509!;
isotypes — B, LE).
Ic.: Fig. 12: D, E. — For published figures see Yurtse-
va et al., 2016: figs. 3: A; 6; 16: B; 19: K, L; suppl. 9.
Distribution and ecology. Kyrgyzstan,
the Inner Tien Shan, a single location on the southern
slopes of the Kavak-Too Ridge. Rocky slopes at eleva-
tion ca. 1500 m a. s. l. Fl. VI–VII, fr. VII–VIII.
2. Caelestium tianschanicum (Chang Y. Yang)
Yurtseva et Mavrodiev, comb. nova. ≡ Polygonum tian-
schanicum Chang Y. Yang, 1983, J. Aug. 1
st
Agric. Coll.
Xinjiang, 4: 55; id. 2010, Sylva Xinjiangensis: 114.
—
Type: “China, Xinjiang, Hejing Xian, Balguntay, in
promontoriis et declivibus montibus. Alt. 1400–1500
m. 15 VI 1981. Chang Y. Yang, Bing Wang, No 810295,
No 810290” (syntypes — XJA).
= Polygonum popovii Borodina, 1989, Pl. As. Centr.
9: 104; A. J. Li et al. 1998, Fl. Reipubl. Popularis Sin.
25(1): 7; A. J. Li et al. 2003, Fl. China, 5: 283. ≡ Atra-
phaxis popovii (Borodina) Yurtseva, 2014, Pl. Syst.
Evol. 300 (4): 763.
—
Polygonum vacciniifolium Pop-
ov, in sched., A. K. Skvortsov, in sched.; unpubl., non
P. vacciniifolium Wall. ex Meisn. 1832. —
Holotype:
China, Xinjiang, “Кашгария, юго-восточная часть
Тянь-Шаня, между Кучей и Курлей, горы у сел.
Ишма, в скалах, 20 VIII 1929, М. Г. Попов, No 609
[Kashgaria, SE part of Tien Shan, between Kucha and
Kurlya, mountains at Ishma village, in rocks, 20 VIII
1929, M. G. Popov, No 609]” (LE: LE 01013264!; iso-
type — LE 01013263!).
Ic.: Fig. 12: F. — For published figures see Yurtseva
et al., 2014: fig. 4: L, M.
Distribution and ecology. China (Xin-
jiang-Uyghur autonomous region), southern macro-
slope of the Eastern Tien Shan. Mountain slopes at
elevations of 1400–2600 m a. s. l. (Li et al., 2003). Fl.
VI–VII, fr. VII–VIII.
Additional specimen examined. China, Xin-
jiang, Dzungaria: declive siccum in via ab Urumczi [Ürümqi]
ad Karashar (на дороге от Урумчи до Карашар), 2300 m.
a. s . l ., 22 VII 1958, Li, Chu, No 6223 (LE 01013265! — para-
type of P. popovii Borodina, Fbr. 1988). Specimens cited by
A. E . Borodina (1989): Tien Shan, the upper reaches of the
river Algoy, 1800–2400 m a. s. l ., 12 IX 1879, A. Regel; 30 km
to East of Ürümqi, 1000 m a. s. l., on the slope, 21 VI 1958,
Li, Chu, No 7373; the mountain road from Bartu to the timber
mill in Khomot, 2160 m a. s. l ., 3 VIII 1958, Li, Chu, No 6980;
the Hanga river valley, 25 km NW of the village Balintoy (on
the road from Korashar [Karashar] to Yuldus), 1 VIII 1958,
Yunatov, Yuan, No 175 (all in LE).
Acknowledgements
We are grateful to G. A. Lazkov (Institute for Biol-
ogy and Pedology, National Academy of Sciences of the
Kyrgyz Republic, Bishkek) who kindly collected for us
material of Bactria lazkovii. We thank M. G. Pimenov,
E. V. Klujkov, U. A. Ukrainskaja, and E. A. Zakha-
rova (Lomonosov Moscow State University) for ad-
ditional material of Bactria ovczinnikovii; E. Kuzmina
and B. Khasanov (Severtsov Institute of Ecology and
Evolution of the Russian Academy of Sciences, Mos-
cow) collected for us material of Polygonum afromon-
tanum used in this study. We thank O. V. Tscherneva
and A. E. Grabovskaya-Borodina (Komarov Botanical
Institute of the Russian Academy of Sciences, St. Pe-
tersburg) for their kind permission to examine the type
specimens. We also thank M. V. Olonova (National Re-
search Tomsk State University) and Chen Wenli (In-
stitute of Botany of the Chinese Academy of Sciences,
Beijing, China) for help with some critical literature.
We would like to thank V. V. Alyoshin and I. A. Milyu-
tina (Lomonosov Moscow State University, Belozersky
Institute of Physico-Chemical Biology) for provid-
ing primers and help in the design of experiments. We
would like to thank D. E. Soltis (University of Florida
(UF), Department of Biology and Florida Museum
of Natural History (FLMNH)) and P. S. Soltis (UF,
FLMNH) for their long-term support.
The experimental part of the work (molecular ex-
periments) was partly carried out with the support (to
OVY) of the Russian Foundation for Basic Research
(project No 11-04-01300-a), and the support (to OVY)
of the Russian Science Foundation (project No 14-50-
00029). The Russian Science Foundation supported the
trip to the Herbarium of the Komarov Botanical Insti-
tute. The authors thank S. L. Mosyakin (M. G. Kholod-
ny Institute of Botany of the National Academy of
Sciences of Ukraine, Kiev, Ukraine) and V. S. Shneyer
(Komarov Botanical Institute) for their detailed re-
views of the manuscript, valuable comments and sug-
gestions. The authors are grateful to I. V. Sokolova and
D. V. Geltman (Komarov Botanical Institute) for their
helpful notes and comments.
Supplementary material (Appendix) to the article
is available on the journal website (www.binran.ru/
journals/novitates/).
References
Adanson M. 1763. Familles des plantes. T. 2 . Paris: Vincent.
640 p. https://doi.org/10.5962/bhl.title.271
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
74
Albach D. C ., Chase M. W. 2004. Incongruence in Veroniceae
(Plantaginaceae): evidence from two plastid and a nuclear
ribosomal DNA region // Molec. Phylogen. Evol. Vol. 32,
iss. 1. P. 183–197.
https://doi.org/10.1016/j.ympev.2003.12.001
Álvarez I., Wendel J. F. 2003. Ribosomal ITS sequences and
plant phylogenetic inference // Molec. Phylogen. Evol.
Vol. 29, iss. 3 . P. 417–434.
https://doi.org/10.1016/S1055-7903(03)00208-2
Backlund A., Bremer K. 1998. To be or not to be — principles
of classification and monotypic plant families // Taxon.
Vol. 47, No 2. P. 391–400. https://doi.org/10.2307/1223768
Bailey C. D ., Carr T. G ., Harris S. A., Hughes C. E . 2003. Char-
acterization of angiosperm nrDNA polymorphism, paralogy,
and pseudogenes // Molec. Phylogen. Evol. Vol. 29, iss. 3.
P. 435–455. https://doi.org/10.1016/j.ympev.2003.08.021
Baldwin B. G., Sanderson M. J ., Porter J. M., Wojciechows-
ki M. F., Campbell Ch. S ., Donoghue M. J . 1995. The ITS
region of nuclear ribosomal DNA: a valuable source of evi-
dence on angiosperm phylogeny // Ann. Missouri Bot. Gard.
Vol. 82, No 2. P. 247–277. https://doi.org/10.2307/2399880
Barraclough T. G ., Humphreys A. M. 2015. The evolutionary
reality of species and higher taxa in plants: a survey of post‐
modern opinion and evidence // New Phytol. Vol. 207,
No 2. P. 291–296. https://doi.org/10.1111/nph.13232
Bayly M. J., Ladiges P. Y. 2007. Divergent paralogues of ribo-
somal DNA in eucalypts (Myrtaceae) // Molec. Phylogen.
Evol. Vol. 44, iss. 1. P. 346–356.
https://doi.org/10.1016/j.ympev.2006.10.027
Bentham G. 1861. On the species and genera of plants, consid-
ered with reference to the practical application to system-
atic botany // The Natural History Review. New ser. Vol. 1,
No 2. P. 133–151.
Bentham G., Hooker J. D. 1880. Genera Plantarum. Vol. 3,
ps. 1. Londini: L. Reeve & Co. vii + 459 p.
https://doi.org/10.5962/bhl.title.747
Bergius P. J. 1767. Descriptiones plantarum ex Capite Bonae
Spei, cum differentiis specificis, nominibus trivialibus, et
synonymis auctorum justis. Stockholmiae: Laur. Salvii.
xxxvi + 360 p.
Boissier P. E . 1879. Flora Orientalis sive Enumeratio plantarum
in Oriente, a Graecia et Aegypto ad Indiae fines hucusque
observatarum. Vol. 4, fasc. 2. Genevae; Basileae: H. Georg.
P. 281–1276. https://doi.org/10.5962/bhl.title.20323
Borodina A. E . 1989. Polygonaceae Juss. // Rasteniya Tsentral-
noi Azii: Po materialam Botanicheskogo Instituta imeni
V. L . Komarova (Plantae Asiae Centralis (secus materies
Instituti botanici nomine V. L . Komarovii)) / V. I. Grubov
(ed.-in-chief). Fasc. 9: Salicaceae — Polygonaceae. Lenin-
grad: Nauka. P. 77 –129. [In Russian] (Бородина А. Е .
1989. Polygonaceae Juss. // Растения Центральной
Азии: По материалам Ботанического института имени
В. Л. Комарова / отв. ред. В. И. Грубов. Вып. 9: Иво-
вые — Гречишные. Л.: Наука. С. 77–129).
Brandbyge J. 1993. Polygonaceae // The families and genera of
vascular plants. Vol. 2: Flowering plants — Dicotyledons /
K. Kubitzki, J. G . Rohwer, V. Bittrich (eds.). Berlin: Sprin-
ger-Verlag. P. 531–544. https://doi.org/10.1007/978-3-
662-02899-5_63
Brockington S. F., Mavrodiev E. V., Ramdial J., Dhingra A.,
Soltis P. S., Soltis D. E . 2008. Keep the DNA rolling: mul-
tiple displacement amplification of archival plant DNA ex-
tracts // Taxon. Vol. 57, No 3. P. 944–948.
https://doi.org/10.1002/tax.573022
Buckler E. S., Holtsford T. P. 1996. Zea ribosomal repeat evolu-
tion and substitution patterns // Molec. Biol. Evol. Vol. 13,
No 4. P. 623–632.
https://doi.org/10.1093/oxfordjournals.molbev.a025622
Buckler E. S., Ippolito A., Holtsford T. P. 1997. The evolution
of ribosomal DNA divergent paralogues and phylogenetic
implication // Genetics. Vol. 145, No 3. P. 821–832.
Coleman A. W. 2003. ITS2 is a double-edged tool for eukaryote
evolutionary comparisons // Trends in Genetics. Vol. 19,
No 7. P. 370–375.
https://doi.org/10.1016/S0168-9525(03)00118-5
Coleman A. W. 2007. Pan-eukaryote ITS2 homologies revealed
by RNA secondary structure // Nucl. Acids Res. Vol. 35,
No 10. P. 3322–3329. https://doi.org/10.1093/nar/gkm233
Crespo M. B., Martinez-Azorin M., Mavrodiev E. V. 2015. Can
a rainbow consist of a single colour? A new comprehen-
sive generic arrangement of the ‘Iris sensu latissimo’ clade
(Iridaceae), congruent with morphology and molecular
data // Phytotaxa. Vol. 232. P. 1–78.
https://doi.org/10.11646/phytotaxa.232.1 .1
Czukavina A. P. 1962. Kustarnichkovyye vidy roda Polygonum
iz Tadzhikistana [Undershrub species of the genus Polygo-
num from Tajikistan] // Izv. Akad. Nauk Tadzhiksk. SSR.
Otd. biol. nauk. Vol. 2, No 9. P. 62–68 . [In Russian] (Чу-
кавина А. П. 1962. Кустарничковые виды рода Polygo-
num из Таджикистана // Изв. Акад. наук ТаджССР. Отд.
биол. наук. Т. 2, No 9. C. 62–68).
Czukavina A. P. 1968. Rod Kurchavka, Kolyuchaya grecha —
Atraphaxis L. Rod Gorets — Polygonum L. [Genus Goat’s-
Wheat — Atraphaxis L. Genus Knotweed — Polygonum L.]
// Flora Tadzhikskoi SSR. T. 3 / P. N. Ovchinnikov (ed.-
in-chief). Leningrad: Nauka. P. 216–224; 242–306. [In
Russian] (Чукавина А. П. 1968. Род Курчавка, Колючая
греча — Atraphaxis L. Род Горец — Polygonum L. // Флора
Таджикской ССР. Т. 3: Ореховые — Гвоздичные) / главн.
ред. П. Н. Овчинников. Л.: Наука. С. 216–224; 242–306).
Dammer U. 1893. Polygonaceae // Die natürlichen Pflanzenfa-
milien / A. Engler, K. Prantl (eds.). Teil 3, Abt. 1a. Leipzig:
W. Engelmann. S. 1–36.
https://doi.org/10.5962/bhl.title.4635
Degnan J. H ., Rosenberg N. A . 2009. Gene tree discordance,
phylogenetic inference and the multispecies coalescent //
Trends Ecol. Evol. Vol. 24, No 6. P. 332–340.
https://doi.org/10.1016/j.tree.2009.01.009
Denduangboripant J., Cronk Q. C . 2001. Evolution and align-
ment of the hypervariable arm 1 of Aeschynanthus (Gesneri-
aceae) ITS2 nuclear ribosomal DNA // Molec. Phylogen.
Evol. Vol. 20, iss. 2 . P. 163–172.
https://doi.org/10.1006/mpev.2001.0968
Doyle J. J. 1992. Gene trees and species trees: molecular sys-
tematics as one-character taxonomy // Syst. Bot. Vol. 17.
P. 144–163. https://doi.org/10.2307/2419070
Edger P. P., Tang M., Bird K. A., Mayfield D. R ., Conant G.,
Mummenhoff K., Koch M. A., Pires J. C . 2014. Second-
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
75
ary structure analyses of the nuclear rRNA internal tran-
scribed spacers and assessment of its phylogenetic utility
across the Brassicaceae (Mustards) // PLOS One. Vol. 9,
No 7. [Article] e101341. P. 1 –7.
https://doi.org/10.1371/journal.pone.0101341
Entwisle T. J., Weston P. H. 2005. Majority rules, when system-
atists disagree // Austral. Syst. Bot. Vol. 18, No 1. P. 1–6.
https://doi.org/10.1071/SB04013
Fehrer J., Gemeinholzer B., Chrtek Jr. J., Bräutigam S. 2007.
Incongruent plastid and nuclear DNA phylogenies reveal
ancient intergeneric hybridization in Pilosella hawkweeds
(Hieracium, Cichorieae, Asteraceae) // Molec. Phylogen.
Evol. Vol. 42, iss. 2. P. 347–361.
https://doi.org/10.1016/j.ympev.2006.07.004
Feliner G. N ., Rosselló J. A . 2007. Better the devil you know?
Guidelines for insightful utilization of nrDNA ITS in spe-
cies-level evolutionary studies in plants // Molec. Phylo-
gen. Evol. Vol. 44, iss. 2. P. 911–919.
https://doi.org/10.1016/j.ympev.2007.01.013
Freeman C. C . 2005. Polygonella Michx. // Flora of North
America North of Mexico. Vol. 5 / Flora of North America
Editorial Committee (eds.). New York; Oxford: Oxford
Univ. Press. P. 534–540.
Galasso G., Banfi E., De Mattia F., Grassi F., Sgorbati S.,
Labra M. 2009. Molecular phylogeny of Polygonum L. s. l .
(Polygonoideae, Polygonaceae), focusing on European taxa:
preliminary results and systematic considerations based
on rbcL plastidial sequence data // Atti Soc. Ital. Sci. Nat.
Mus. Civico Storia Nat. Milano. Vol. 150. P. 113–148.
Giribet G., Hormiga G., Edgecombe G. D . 2016. The meaning
of categorical ranks in evolutionary biology // Organisms
Diversity Evol. Vol. 16, No 3. P. 427–430.
https://doi.org/10.1007/s13127-016-0263-9
Giudicelli G. C ., Mäder G., Silva-Arias G. A ., Zamberlan P. M.,
Bonatto S. L., Freitas L. B . 2017. Secondary structure of
nrDNA Internal Transcribed Spacers as a useful tool to
align highly divergent species in phylogenetic studies //
Genet. Molec. Biol. Vol. 40, No 1. P. 191–199.
https://doi.org/10.1590/1678-4685-gmb-2016-0042
Goertzen L. R ., Cannone J. J., Gutell R. R ., Jansen R. K . 2003.
ITS secondary structure derived from comparative analysis:
implications for sequence alignment and phylogeny of the
Asteraceae // Molec. Phylogen. Evol. Vol. 29, iss. 2 . P. 216–
234. https://doi.org/10.1016/S1055-7903(03)00094-0
Gottschling M., Hilger H. H., Wolf M., Diane N. 2001. Se-
condary structure of the ITS1 transcript and its applica-
tion in a reconstruction of the phylogeny of Boraginales
// Pl. Biol. (Stuttgart). Vol. 3, No 6. P. 629–636 . https://
doi.org/10.1055/s-2001-19371
Greene E. L . 1904. Certain Polygonaceous genera // Leaflets
of botanical observation and criticism. Vol. 1. Washington,
D. C. P. 17–50.
Hall T. A. 1999. BioEdit: a user-friendly biological sequence
editor alignment and analysis program for Windows
95/98/NT // Nucleic Acids Symp. Ser. Vol. 41 . P. 95–
98.
Hara H., Chater A. O., Williams L. H . J. 1982. An enumeration
of the flowering plants of Nepal. Vol. 3 . London: British
Museum (Natural History). 854 p.
Haraldson K. 1978. Anatomy and taxonomy in Polygonaceae
subfam. Polygonoideae Meisn. emend. Jaretzky // Acta
Univ. Upsal., Symb. Bot. Upsal. Vol. 22, No 2. P. 1 –95.
Harpke D., Peterson A. 2006. Non-concerted ITS evolution
in Mammillaria (Cactaceae) // Molec. Phylogen. Evol.
Vol. 41, iss. 3. P. 579–593.
https://doi.org/10.1016/j.ympev.2006.05.036
Hauenschild F. A ., Favre G., Salazar A., Muellner-Riehl A. N .
2016. Phylogenetic relationships within the cosmopolitan
buckthorn family (Rhamnaceae) support the resurrection
of Sarcomphalus and the description of Pseudoziziphus
gen. nov. // Taxon. Vol. 65, No 1. P. 47–64. https://
doi.org/10.12705/651.4
Hedberg O. 1946. Pollen morphology in the genus Polygonum
L. s . l . and its taxonomical significance // Svensk Bot.
Tidskr. Vol. 40, No 4. P. 371–404.
Hennig W. 1966. Phylogenetic systematics. Urbana: Illinois
Univ. Press. 263 p.
Holder M. T., Anderson J. A ., Holloway A. K . 2001. Difficulties
in detecting hybridization // Syst. Biol. Vol. 50, No 6. P. 978–
982. https://doi.org/10.1080/106351501753462911
Hong S. -P., Oh I.-C ., Ronse De Craene L.-P. 2005. Pollen mor-
phology of the genera Polygonum s. str. and Polygonella
(Polygoneae: Polygonaceae) // Pl. Syst. Evol. Vol. 254,
No 1–2 . P. 13–30 . https://doi.org/10.1007/s00606-005-
0334-4
Horton J. H . 1963. A taxonomic revision of Polygonella (Poly-
gonaceae) // Brittonia. Vol. 15, No 3. P. 177 –203. https://
doi.org/10.2307/2805159
Hughes C. E ., Bailey C. D ., Harris S. A . 2002. Divergent and
reticulate species relationships in Leucaena (Fabaceae) in-
ferred from multiple data sources: insights into polyploid
origins and nrDNA polymorphism // Amer. J. Bot. Vol. 89,
No 7. P. 1057–1073. https://doi.org/10.3732/ajb.89 .7.1057
Humphreys A. M ., Linder H. P. 2009. Concept versus data
in delimitation of plant genera // Taxon. Vol. 58, No 4.
P. 1054–1074. https://doi.org/10.1002/tax.584002
Jaretzky R. 1925. Beiträge zur Systematik der Polygonaceae
unter Berücksichtigung des Oxymethylanthrachinon-
Vorkommens // Feddes Repert. Spec. Nov. Regni Veg.
Vol. 22, No 4–12. P. 49–83.
https://doi.org/10.1002/fedr.19250220402
Katoh K., Misawa K., Kuma K., Miyata T. 2002. MAFFT: a
novel method for rapid multiple sequence alignment based
on fast fourier transform // Nucl. Acids Res. Vol. 30, No 14.
P. 3059–3066. https://doi.org/10.1093/nar/gkf436
Katoh K., Standley D. M. 2013. MAFFT multiple sequence
alignment software version 7: improvements in perfor-
mance and usability // Molec. Biol. Evol. Vol. 30, No 4.
P. 772–780. https://doi.org/10.1093/molbev/mst010
Kimura M. 1980. A simple method for estimating evolution-
ary rate of base substitutions through comparative studies
of nucleotide sequences // J. Molec. Evol. Vol. 16. P. 111 –
120. https://doi.org/10.1007/BF01731581
Komarov V. L. 1936. Rod Gorets — Polygonum L. [Genus
Knotweed — Polygonum L.] // Flora URSS / V. L . Koma-
rov (red. princip.). Vol. 5. Mosqua; Leningrad: Acad. Sci.
URSS. P. 594–701; 717–726. [In Russian] (Комаров В. Л .
1936. Род Горец — Polygonum L. // Флора СССР / отв.
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
76
ред. В. Л. Комаров. Т. 5. М.; Л.: Изд-во АН СССР.
С. 594–701; 717–726).
Korovin E. P. 1962. Rastitelnost Srednei Azii i Yuzhnogo Ka-
zakhstana [Vegetation of Central Asia and Southern Ka-
zakhstan]. 2
nd ed. Vol. 2. Tashkent: Acad. Sci. Uzbeksk.
SSR. 547 p. [In Russian] (Коровин Е. П. 1962. Раститель-
ность Средней Азии и Южного Казахстана. 2 -е изд. Кн.
2. Ташкент: Изд-во Акад. наук УзССР. 547 с.).
Lazkov G. A ., Umralina A. R . 2015. Endemic and rare plant
species of Kyrgyzstan (Atlas). Ankara: FAO. 238 p. (Лазь-
ков Г. А ., Умралина А. Р. 2015. Эндемики и редкие виды
растений Кыргызстана (Атлас). Анкара: ФАО. 238 с.).
Li A. J., Grabovskaya-Borodina A. E ., Hong S.-P., McNeill J.,
Ohba H., Park C.-W. 2003. Polygonum Linnaeus // Flora of
China / A. J. Li (ed.-in-chief). Vol. 5 / Z. Y. Wu, P. H. Ra-
ven, D. Y. Hong (eds.). Beijing: Science Press; St. Louis:
Missouri Botanical Garden Press. P. 278–315.
Linnaeus C. 1753. Species plantarum. Т . 1 . Holmiae: L. Salvius.
560 p. https://doi.org/10.5962/bhl.title.37656
Liu J. S., Schardl C. L . 1994. A conserved sequence in inter-
nal transcribed spacer 1 of plant nuclear rRNA genes // Pl.
Molec. Biol. Vol. 26, No 2. P. 775–778.
Low S. L., Wong S. Y., Boyce P. C . 2018. Naming the chaos:
generic redelimitation in Schismatoglottideae (Araceae) //
Webbia. Vol. 73, No 1. P. 1–100.
https://doi.org/10.1080/00837792.2017.1409940
Mai J. C ., Coleman A. W. 1997. The internal transcribed
spacer 2 exhibits a common secondary structure in green
algae and flowering plants // J. Molec. Evol. Vol. 44, No 3.
P. 258–271. https://doi.org/10.1007/PL00006143
Mallet J., Besansky N., Hahn M. W. 2016. How reticulated are
species? // BioEssays. Vol. 38, No 2. P. 140–149. https://
doi.org/10.1002/bies.201500149
Mavrodiev E. V., Martinez-Azorin M., Dranishnikov P., Cre-
spo M. B . 2014. At least 23 genera instead of one: the case of
Iris L. s . l. (Iridaceae) // PLOS One. Vol. 9, No 8. [Article]
e106459. P. 1–8 .
https://doi.org/10.1371/journal.pone.0106459
Mavrodiev E. V., Yurtseva O. V. 2017. “A character does not
make a genus, but the genus makes the character”: three-
taxon statement analysis and intuitive taxonomy // Europ.
J. Taxon. Vol. 377. P. 1–7.
https://doi.org/10.5852/ejt.2017.377
Mayol M., Rosselloó J. A. 2001. Why nuclear ribosomal
DNA spacers (ITS) tell different stories in Quercus //
Molec. Phylogen. Evol. Vol. 19, iss. 2 . P. 167–176. https://
doi.org/10.1006/mpev.2001.0934
Meisner C. F. 1826. Monographiae generis Polygoni prodro-
mus. Genevae: A. Lador. 117 p.
https://doi.org/10.5962/bhl.title.51543
Meisner C. F. 1857. Ordo Polygonaceae // Prodromus sys-
tematis naturalis regni vegetabilis / A. de Candolle (ed.).
Ps. 14. Parisiis: V. Masson. P. 1 –186.
https://doi.org/10.5962/bhl.title.286
Michaux A. 1803. Flora boreali-americana. T. 1 . Parisiis; Ar-
gentorati: Levrault. 340 p.
https://doi.org/10.5962/bhl.title.330
Milyutina I. A., Goryunov D. V., Ignatov M. S., Ignato-
va E. A ., Troitsky A. V. 2010. The phylogeny of Schisti-
dium (Bryophyta, Grimmiaceae) based on the primary and
secondary structure of nuclear rDNA internal transcribed
spacers // Molec. Biol. Vol. 44, No 6. P. 883–897. https://
doi.org/10.1134/S0026893310060051
Nowak A., Nobis M. 2010. Tentative list of endemic vascular
plants of Zeravshan Mts in Tajikistan (Middle Asia): dis-
tribution, habitat preferences and conservation status of
species // Biodiv. Res. Conserv. Vol. 19. P. 65–80 . https://
doi.org/10.2478/v10119-010-0011-5
Nowak A., Nowak S., Nobis M. 2011. Distribution patterns,
ecological characteristic and conservation status of en-
demic plants of Tadzhikistan — A global hotspot of di-
versity // J. Nat. Conserv. Vol. 19. P. 296–305. https://
doi.org/10.1016/j.jnc.2011.05.003
Ochieng J. W., Henry R. J., Baverstock P. R ., Steane D. A.,
Shepherd M. 2007. Nuclear ribosomal pseudogenes resolve
a corroborated monophyly of the eucalypt genus Corym-
bia despite misleading hypotheses at functional ITS para-
logs // Molec. Phylogen. Evol. Vol. 44, iss. 2. P. 752–764.
https://doi.org/10.1016/j.ympev.2007.04.017
Orthia L. A ., Cook L. G., Crisp M. D . 2005. Generic delimi-
tation and phylogenetic uncertainty: an example from a
group that has undergone an explosive radiation // Aus-
tral. Syst. Bot. Vol. 18, No 1. P. 41–47.
https://doi.org/10.1071/SB04016
Pavlov V. N . 1980. Rastitelnyi pokrov Zapadnogo Tyan-Shanya
[Vegetation of the Western Tien Shan]. Moscow: MGU.
248 p. [In Russian] (Павлов В. Н. 1980. Растительный
покров Западного Тянь-Шаня. Москва: МГУ. 248 с.)
Pfeil B. E ., Crisp M. D . 2005. What to do with Hibiscus? A
proposed nomenclatural resolution for a large and well
known genus of Malvaceae and comments on paraphy-
ly // Austral. Syst. Bot. Vol. 18, No 1. P. 49–60. https://
doi.org/10.1071/SB04024
Poczai P., Hyvönen J. 2010. Nuclear ribosomal spacer re-
gions in plant phylogenetics: problems and prospects //
Molec. Biol. Rep. Vol. 37, No 4. P. 1897–1912. https://
doi.org/10.1007/s11033-009 -9630 -3
Rieseberg L. H ., Soltis D. E . 1991. Phylogenetic consequen-
ces of cytoplasmic gene flow in plants // Evol. Trends Pl.
Vol. 5, No 1. P. 65–84.
Rieseberg L. H., Whitton J., Linder C. R . 1996. Molecular
marker incongruence in plant hybrid zones and phyloge-
netic trees // Acta Bot. Neerl. Vol. 45, No 3. P. 243–262.
https://doi.org/10.1111/j.1438-8677.1996.tb00515.x
Roberty G., Vautier S. 1964. Les genres de Polygonacees //
Boissiera. Vol. 10. P. 7 –128.
[Ronse De Craene] Ronse DeCraene L.-P., Akeroyd J. R .
1988. Generic limits in Polygonum and related gen-
era (Polygonaceae) on the basis of floral characters //
Bot. J. Linn. Soc. Vol. 98, No 4. P. 321–371. https://
doi.org/10.1111/j.1095-8339 .1988.tb01706.x
Ronse De Craene L.-P., Hong S.-P., Smets E. F. 2004. What
is the taxonomic status of Polygonella? Evidence from flo-
ral morphology // Ann. Missouri Bot. Gard. Vol. 91, No 2.
P. 320–345.
Safarov N. M. 2013. Geographical analysis of the flora of the
Central Pamir-Alai // Dokl. Akad. Nauk Respubl. Tajiki-
stan (Rep. Acad. Sci. Republ. Tajikistan). Vol. 56, No 7.
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
77
P. 569–573. [In Russian with English summary] (Сафа-
ров Н. М. Географический анализ флоры Центрального
Памиро-Алая // Докл. Акад. наук Республ. Таджики-
стан. Т. 56, No 7. С . 569–573.)
Sanchez A., Schuster T. M ., Burke J. M., Kron K. A. 2011.
Taxonomy of Polygonoideae (Polygonaceae): a new tribal
classification // Taxon. Vol. 60, No 1. P. 151–160. https://
doi.org/10.1002/tax.601013
Schuster T. M., Wilson K. L ., Kron K. A . 2011a. Phylogenetic
relationships of Muehlenbeckia, Fallopia, and Reynoutria
(Polygonaceae) investigated with chloroplast and nuclear
sequence data // Int. J. Pl. Sci. Vol. 172, No 8. P. 1053–
1066. https://doi.org/10.1086/661293
Schuster T. M., Reveal J. L ., Kron K. A . 2011b. Phylogeny
of Polygoneae (Polygonaceae: Polygonoideae) // Taxon.
Vol. 60, No 6. P. 1653–1666.
https://doi.org/10.1002/tax.606010
Schuster T. M., Reveal J. L., Bayly M. J., Kron K. A. 2015. An
updated molecular phylogeny of Polygonoideae (Polygo-
naceae): Relationships of Oxygonum, Pteroxygonum, and
Rumex, and a new circumscription of Koenigia // Taxon.
Vol. 64, No 6. P. 1188–1208. https://doi.org/10.12705/646.5
Shaw J., Lickey E. B., Schilling E. E ., Small R. L. 2007. Com-
parison of whole chloroplast genome sequences to choose
noncoding regions for phylogenetic studies in angiosperms:
the tortoise and the hare III // Amer. J. Bot. Vol. 94, No 2.
P. 275–288. https://doi.org/10.3732/ajb.94.3.275
Soltis D. E ., Kuzoff R. K. 1995. Discordance between nuclear
and chloroplast phylogenies in the Heuchera group (Saxi-
fragaceae) // Evolution.Vol. 49, No 4. P. 727 –742. https://
doi.org/10.1111/j.1558-5646.1995.tb02309.x
Soltis D. E ., Soltis P. S., Endress P., Chase M. W., Manches-
ter S., Judd W., Majure L., Mavrodiev E. V. 2018. Phylog-
eny and evolution of the angiosperms. Rev. a. upd. ed. Chi-
cago: Univ. Chicago Press. 579 p.
Stevens P. F. 1985. The genus concept in practice: But for what
practice? // Kew Bull. Vol. 40, No 3. P. 457–465. https://
doi.org/10.2307/4109605
Stevens P. F. 2001 onwards. Angiosperm Phylogeny Website.
Version 14. July 2017 [continiously updated since]. http://
www.mobot.org/MOBOT/research/APweb/ (Accessed
July 2017).
Stevens P. F. 2002. Why do we name organisms? Some remind-
ers from the past // Taxon. Vol. 51, No 1. P. 11 –26. https://
doi.org/10.2307/1554959
Taberlet P., Gielly L., Pautou G., Bouvet J. 1991. Universal
primers for amplification of three non-coding regions of
chloroplast DNA // Pl. Molec. Biol. Vol. 17, iss. 5. P. 1105–
1109. https://doi.org/10.1007/BF00037152
Takhtajan A. 1986. Floristic regions of the world / transl. by
T. J. Crovello. Berkeley; Los Angeles (CA): Univ. Califor-
nia Press. 522 p.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. 2013.
MEGA6: Molecular Evolutionary Genetics Analysis ver-
sion 6.0 // Molec. Biol. Evol. Vol. 30, iss. 12 . P. 2725–2729.
https://doi.org/10.1093/molbev/mst197
Tavakkoli S., Kazempour Osaloo S., Mozaffarian V., Maassou-
mi A. A. 2015. Molecular phylogeny of Atraphaxis and the
woody Polygonum species (Polygonaceae): taxonomic im-
plications based on molecular and morphological evidence
// Pl. Syst. Evol. Vol. 301, No 4. P. 1157–1170. https://
doi.org/10.1007/s00606-014-1140-7
Tippery N. P., Les D. H. 2008. Phylogenetic analysis of the in-
ternal transcribed spacer (ITS) region in Menyanthaceae
using predicted secondary structure // Molec. Phylogen.
Evol. Vol. 49, iss. 2. P. 526–537.
https://doi.org/10.1016/j.ympev.2008.07.019
Tzvelev N. N. 1987. Notulae de Polygonaceis in flora Orientis
Extremi // Novosti Sist. Vyssh. Rast. Vol. 24 . P . 72–79. [In
Russian] (Цвелёв Н. Н . 1987. Заметки о Polygonaceae во
флоре Дальнего Востока // Новости сист. высш. раст.
Т. 24. С . 72–79).
Van der Auwera G., Chapelle S. R ., De Wächter R. 1994.
Structure of the large ribosomal subunit RNA of Phy-
tophthora megasperma, and phylogeny of the oomyce-
tes // FEBS Letters. Vol. 338, No 2. P. 133–136. https://
doi.org/10.1016/0014-5793(94)80350-1
Voylokova V. N., Yurtseva O. V., Bobrova V. K., Troitskiy A. V.
2009. Morphological and molecular evidences of hybrid
origin of Polygonum aschersonianum and P. samarense (Po-
lygonaceae) // Bot. Zhurn. Vol. 94, No 2. P. 161–187. [In
Russian] (Войлокова В. Н ., Юрцева О. В ., Боброва В. К .,
Троицкий А. В. 2009. Морфологические и молекуляр-
ные доказательства гибридного происхождения Polygo-
num aschersonianum и P. samarense (Polygonaceae) // Бот.
журн. Т. 94, No 2. С . 161–187).
Wang S., Bao Z., Li N., Zhang L., Hu J. 2007. Analysis of the
secondary structure of ITS1 in Pectinidae: implications
for phylogenetic reconstruction and structural evolu-
tion // Mar. Biotechnol. Vol. 9, No 2. P. 231–242 . https://
doi.org/10.1007/s10126-006-6113-6
Watson S. 1873. On section Avicularia of the genus Polygo-
num // Amer. Naturalist. Vol. 7. P. 662–665.
Wen J., Zimmer E. A . 1996. Phylogeny and biogeogra-
phy of Panax L. (the ginseng genus, Araliaceae): infer-
ences from ITS sequences of nuclear ribosomal DNA //
Molec. Phylogen. Evol. Vol. 6, No 2. P. 167–177 . https://
doi.org/10.1006/mpev.1996.0069
Wendel J. F., Doyle J. J. 1998. Phylogenetic incongruence:
Window into genome history and molecular evolution //
Molecular Systematics of Plants II / D. E . Soltis, P. S . Sol-
tis, J. J. Doyle (eds.). Boston: Springer. P. 265–296.
Wheeler Q. D., Platnick N. I. 2000. The phylogenetic species
concept (sensu Wheeler and Platnick) // Species concepts
and phylogenetic theory: a debate / Q. D . Wheeler, R. Mei-
er (eds.). New York: Columbia Univ. Press. P. 55 –69 .
White T. J., Bruns T., Lee S., Taylor J. 1990. Amplification
and direct sequencing of fungal ribosomal RNA genes for
phylogenetic // PCR Protocols: a Guide to Methods and
Application / M. A . Innis, D. H. Gelfand, J. J. Sninsky,
T. J. White (eds.). New York: Acad. Press. Vol. 18, No 1.
P. 315–322.
Yang C. Y. 1983. Polygonum tianschanicum Chang Y. Yang // J.
Aug. 1
st
Agric. Coll. Xinjiang. Vol. 4 . P. 55 .
Yang C. Y. 2010. Sylva Xinjiangensis. Beijing: China Forestry
Publ. House. 566 p.
Yurtseva O. V., Bobrova V. K., Voylokova V. N ., Troitsky A. V.,
Kramina T. E . 2006. Morphological variability and genetic
O. V. Yurtseva, E.V. Mavrodiev
Новости систематики высших растений | Том 50 | 2019
78
polymorphism of Polygonum aviculare group (Polygona-
ceae) // Bot. Zhurn. Vol. 91, No 5. P. 697–716. [In Russian]
(Юрцева О. В ., Боброва В. К., Войлокова В. Н ., Троиц-
кий А. В., Крамина Т. Е . 2006. Морфологическая измен-
чивость и генетический полиморфизм видов родства
Polygonum aviculare (Polygonaceae) // Бот. журн. Т. 91,
No 5. С . 697–716).
Yurtseva O. V., Troitsky A. V., Bobrova V. K., Voylokova V. N .
2010. On taxonomical revision of Polygonum s. str. (Po-
lygonaceae): phylogenetic and morphological data //
Bot. Zhurn. Vol. 95, No 2. P. 226–247. [In Russian] (Юр-
цева О. В., Троицкий А. В., Боброва В. К., Войлокова
В. Н. 2010. К ревизии системы рода Polygonum s. str.
(Polygonaceae): молекулярные и морфологические дан-
ные // Бот. журн. Т. 95, No 2. С. 226–247).
Yurtseva O. V., Levina M. S., Severova E. E ., Troitsky A. V.
2012a. Morphology and taxonomy of Polygonum cognatum
Meisn., P. alpestre C. A . Mey. and allied taxa from Cen-
tral Asia and the Caucasus (Polygonaceae) // Wulfenia.
Vol. 19. P. 141 –180.
Yurtseva O. V., Kuznetsova O. I., Severova E. E ., Troitsky A. V.
2012b. Taxonomy and morphology of Atraphaxis (Polygo-
neae, Polygonaceae) // Caryophyllales: new insights into
the phylogeny, systematics and morphological evolution of
the order: Proc. Symp. held on 24–27 September 2012 at
Moscow M. V. Lomonosov State University / A. K. Timo-
nin, A. P. Sukhorukov, G. H. Harper, M. V. Nilova (eds.).
Tula: Grif & Co. P. 114–118.
Yurtseva O. V., Severova E. E ., Bovina I. Yu. 2014. Pollen
morphology and taxonomy of Atraphaxis (Polygoneae,
Polygonaceae) // Pl. Syst. Evol. Vol. 300, No 4. P. 749–766.
https://doi.org/10.1007/s00606-013-0917-4
Yurtseva O. V., Kuznetsova O. I., Mavrodieva M. E ., Mavrodi-
ev E. V. 2016. What is Atraphaxis L. (Polygonaceae, Polygo-
neae): cryptic taxa and resolved taxonomic complexity in-
stead of the formal lumping and the lack of morphological
synapomorphies // PeerJ. Vol. 4 (e1977). P. 1–50. https://
doi.org/10.7717/peerj.1977
Yurtseva O. V., Severova E. E ., Mavrodiev E. V. 2017. Perse-
polium (Polygoneae): A new genus in Polygonaceae based
on conventional Maximum Parsimony and Three-taxon
statement analyses of a comprehensive morphological da-
taset // Phytotaxa. Vol. 314, No 2. P. 151–194. https://
doi.org/10.11646/phytotaxa.314.2.1
Yurtseva O. V., Lazkov G. A ., Ukrainskaja U. A ., Deviatov A. G .
2019. Caelestium (Polygonaceae, Polygoneae), evidence
bаsed on morphology // Novosti Sist. Vyssh. Rast. Vol.
50. P. 80 –100. (Юрцева О. В., Лазьков Г. А ., Украин-
ская У. A., Девятов А. Г. 2019. Caelestium (Polygonaceae,
Polygoneae): морфологические основания // Новости
сист. высш. раст. Т. 50. С . 80 –100).
https://doi.org/10.31111/novitates/2019.50.80
Zheng X., Cai D., Yao L., Teng Y. 2008. Non-concerted ITS
evolution, early origin and phylogenetic utility of ITS
pseudogenes in Pyrus // Molec. Phylogen. Evol. Vol. 48,
No 3. P. 892–903.
https://doi.org/10.1016/j.ympev.2008.05.039
Zuker M. 2003. Mfold web server for nucleic acid folding and
hybridization prediction // Nucl. Acids Res. Vol. 31, No 13.
P. 3406–3415. https://doi.org/10.1093/nar/gkg595
Caelestium, genus novum: molecular phylogenetic analyses
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
79
Caelestium (Polygonaceae, Polygoneae), evidence bаsed
on morphology
Caelestium (Polygonaceae, Polygoneae): морфологические основания
O. V. Yurtseva1, G. A. Lazkov2,
U. A. Ukrainskaja3, A. G. Deviatov1
1
Lomonosov Moscow State University
Faculty of Biology, Department of Higher Plants
Leninskiye Gory, 1, Bld. 12, Moscow, 119234, Russia
olgayurtseva@yandex.ru
2 Institute for Biology and Pedology, National Academy of
Sciences of the Kyrgyz Republic
Laboratory of Flora
Сhui Ave., 265, Bishkek, 720071, Kyrgyz Republic
3 Lomonosov Moscow State University
Faculty of Biology, Botanical Garden
Leninskiye Gory, 1, Bld. 12, Moscow, 119234, Russia
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A .G. Deviatov
О. В. Юрцева1, Г. А. Лазьков2,
У. A. Украинская3, А. Г. Девятов1
1
Московский государственный университет имени
М. В. Ломоносова
Биологический факультет, кафедра высших растений
Ленинские горы, 1, стр. 12, Москва, 119234, Россия
olgayurtseva@yandex.ru
2 Биолого-почвенный институт Национальной академии наук
Кыргызской Республики, Лаборатория флоры
пр. Чуй, 265, Бишкек, 720071, Кыргызская Республика
3 Московский государственный университет имени
М. В. Ломоносова
Биологический факультет, Ботанический сад
Ленинские горы, 1, стр. 12, Москва, 119234, Россия
https://doi.org/10.31111/novitates/2019.50.80
Abstract. Morphological characters and fruit anatomy were analysed for distinguishing the new genus Caelestium, containing
C. lazkovii (= Bactria lazkovii), endemic of the Central Tien Shan (Kyrgyzstan), and C. tianschanicum (= Polygonum tianschani-
cum), endemic of the Eastern Tien Shan (Xinjiang, China), from the genus Bactria in its updated circumscription, now contain-
ing only B. ovczinnikovii, endemic of the Pamir (Tajikistan). The genus Caelestium was established based on the results of mo-
lecular analyses and the details of the secondary structure of pre-rRNA of the ITS1 and ITS2 loci, but its morphology is poorly
known. The morphological characteristics of Bactria and Caelestium were compared, and the anatomy of fruit was examined for
these taxa and some species of Persepolium and Atraphaxis. Caelestium lazkovii and C. tianschanicum share the morphology of
their leaf blades, perianth, fruits and styles, but differ in the color of annual shoots, the size of the perianth and fruits. They re-
semble Bactria ovczinnikovii in their life form, morphology of shoots, ochreas, inflorescences, and sporoderm ornamentation, but
differ from the latter in the shape of leaf blades, fruits, and styles, micromorphology of tepals, and exocarp structure. SEM and
LM images illustrating morphological characters are provided. The geographic ranges of the taxa are presented on the distribu-
tion map. Morphological characteristics distinguishing Caelestium and Bactria from Atraphaxis, Persepolium, and Polygonum are
discussed.
Keywords: Polygoneae, Atraphaxis, Bactria, Caelestium, Persepolium, Polygonum, taxonomy, new genus, flower morphology, pol-
len, fruit anatomy.
Аннотация. Проанализированы морфологические признаки и анатомия плода для различения нового рода Caelestium,
содержащего два локальных эндемика, C. lazkovii (= Bactria lazkovii) из Центрального Тянь-Шаня (Кыргызстан) и
C. tianschanicum (= Polygonum tianschanicum) из Восточного Тянь-Шаня (Синьцзян, Китай), от рода Bactria в его об-
новленном объеме, эндемичного для Памира (Таджикистан) и в настоящее время включающего только B. ovczinnikovii.
Род Caelestium был установлен на основании результатов молекулярного анализа и деталей вторичной структуры пре-
рРНК локусов ITS1 и ITS2, но его морфология практически не изучена. Сопоставлены морфологические характери-
стики Bactria и Caelestium, исследована анатомия плода для этих таксонов и некоторых видов Persepolium и Atraphaxis.
Caelestium lazkovii и C. tianschanicum имеют сходную морфологию листьев, околоцветника, плодов и стилодиев, но от-
личаются по окраске однолетних побегов, размеру околоцветника и плодов. Они напоминают Bactria ovczinnikovii своей
жизненной формой, морфологией побегов, раструбов, соцветий и орнаментацией спородермы, но отличаются от послед-
него формой листьев, плодов и стилодиев, микроморфологией листочков околоцветника и структурой экзокарпия. Пре-
доставлены SEM и LM изображения, иллюстрирующие морфологические признаки. Географическое распространение
таксонов показано на карте. Обсуждаются морфологические особенности, отличающие Caelestium и Bactria от Atraphaxis,
Persepolium и Polygonum.
Ключевые слова: Polygoneae, Atraphaxis, Bactria, Caelestium, Persepolium, Polygonum, систематика, новый род, морфология
цветка, анатомия плода, пыльца.
Поступила в редакцию | Submitted: 29.07.2019
Принята к публикации | Accepted: 15.12.2019
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 80–100
The recent Maximum Likelihood and Bayesian anal-
yses of the combined regions of the plastid genome and
the ITS regions of nrDNA for 58 species of tribe Polygo-
neae (Yurtseva, Mavrodiev, 2019, in this issue) have
shown a monophyly of Bactria Yurtseva et Mavrodiev
in the plastid trees. In the ITS-based trees, the clade,
which combines Bactria lazkovii Yurtseva et Mavrodiev
(Yurtseva et al., 2016: 43) and Polygonum tianschani-
cum Chang Y. Yang (Yang, 1983: 55; 2010), showed a
sepatate position from Bactria ovczinnikovii (Czukav.)
Yurtseva et Mavrodiev (Yurtseva et al., 2016: 43), and
also from the rest genera of Polygoneae. Based on the
results of molecular analyses, the details of the second-
ary structure of pre-rRNA of the ITS1 and ITS2 loci,
fine morphological distinctions, and distributional data,
the genus Caelestium Yurtseva et Mavrodiev was estab-
lished to include Bactria lazkovii from the Central Tien
Shan, Kyrgyzstan, and Polygonum tianschanicum from
the Eastern Tien Shan, Xinjiang, China (Yurtseva, Ma-
vrodiev, 2019, in this issue). The morphology of these
rare endemics is, however, poorly known.
In this study we aimed to perform a detailed com-
parative morphological analysis of Bactria ovczinnikovii
and two representatives of Caelestium, and to find mor-
phological differences between Bactria, Caelestium and
related genera of tribe Polygoneae.
Originally, Polygonum ovczinnikovii Czukav. (Czu-
kavina, 1962: 64) and P. tianschanicum, which is the
earlier name for P. popovii Borodina (1989: 104), were
described in the genus Polygonum L., and in the frame-
work of the earlier taxonomic concept, both species were
once placed in Atraphaxis L. as A. ovczinnikovii (Czu-
kav.) Yurtseva (Yurtseva et al., 2014: 763) and A. popovii
(Borodina) Yurtseva (Yurtseva et al., 2014: 763). Thus,
we paid special attention to the differences between Bac-
tria, Caelestium, Polygonum, and Atraphaxis.
Recent molecular phylogenetic studies of Polygo-
naceae Juss. (Schuster et al., 2011; Tavakkoli et al.,
2015; Yurtseva et al., 2016) revealed the difficulties
with the taxonomic delimitation and diagnostic char-
acters of the genera Atraphaxis and Polygonum in tribe
Polygoneae. Generally, the most significant difference
between Atraphaxis and Polygonum is the morphology
of the perianth, which has five equal tepals in Polygo-
num, but two or three inner tepals enlarged in fruiting
in Atraphaxis (Jaubert, Spach, 1844–1846; Meisner,
1857; Komarov, 1936; Brandbyge, 1993; Li et al., 2003).
Part of Polygonum species, which have five equal-sized
tepals and share the habit and striate-perforate sporo-
derm ornamentation with Atraphaxis (Yurtseva et al.,
2014), were nested separately among the rest species
of the clade Atraphaxis (Yurtseva et al., 2010; Schus-
ter et al., 2011), so these species have been included in
Atraphaxis (Schuster et al., 2011). In contrast, Perse-
polium Yurtseva et Mavrodiev (Yurtseva et al., 2017:
185), which was originally described in Polygonum
as P. “§” Spinescentia Boissier (1879: 1027) and later
transferred to the widely circumscribed Atraphaxis
emend. S. Tavakkoli as Atraphaxis section Polygonoides
S. Tavakkoli, Kaz. Osaloo et Mozaff. in Tavakkoli et al.
(2015: 1167), was established as a new genus sister to
Atraphaxis in all molecular and morphological analy-
ses (Yurtseva et al., 2016, 2017; Mavrodiev, Yurtseva,
2017). Comparing the morphological characteristics of
Caelestium and Bactria with those of Atraphaxis and Po-
lygonum, we involved Persepolium in consideration.
Materials and methods
This morphological study is based on the nomencla-
tural types and other reliably identified specimens of
Bactria ovczinnikovii, Caelestium lazkovii, C. tianschani-
cum, Persepolium salicornioides, and Atraphaxis species
deposited in the Herbaria of the Komarov Botanical
Institute, Russian Academy of Sciences, St. Petersburg,
Russia (LE) and Lomonosov Moscow State University,
Moscow, Russia (MW). Appendix (see the journal's
website: www.binran.ru/journals/novitates/) contains
information on the origin of the material used in the
study.
Light microscopy (LM) images of flowers and fruits
were made with a stereoscopic microscope Stemi 2000-
C Carl Zeiss using a camera Axiocam-MR and a pro-
gram AxioVision LE 64, free edition. For scanning elec-
tron microscopy (SEM), dry material was transferred
onto aluminum stubs, coated with gold or platinum and
palladium using a JFC-1100E sputter coater, and stud-
ied under a scanning electronic microscope Camscan-S2
at 15–20 kV. SEM work was performed at the Electron
Microscopy Laboratory of Faculty of Biology of the Lo-
monosov Moscow State University.
Perianth and fruit surface is described using the ter-
minology by L.-P. Ronse Decraene and J. R. Akeroyd
(1988), S.-P. Hong et al. (1998), and Ronse Decraene et
al. (2000). Pollen morphology is described as suggested
by W. Punt et al. (2007) and M. Hesse et al. (2009).
The terminology of E. J. H. Corner (1976), W. Barth-
lott (1981), T. A. Fedotova (1991), and Ronse Decraene
et al. (2000) is used to descibe the anatomy and surface
of the fruit.
A comparison of the morphological characteristics
of Polygonum, Atraphaxis and Persepolium was per-
formed using observations of herbarium specimens de-
posited in LE and MW. In addition, comprehensive
observations from the following publications on Polygo-
neae were used: Ronse Decraene, Akeroyd (1988),
Ronse Decraene, E. F. Smets (1991), Hong (1995),
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
81
Hong et al. (1998, 2005), O. V. Yurtseva et al. (2010,
2012a, b, 2014, 2016) for Polygonum and Atraphaxis;
H.-F. C. Jaubert, E. Spach (1844–1846), E. Boissier
(1879), C. F. Meisner (1857), H. Gross (1913), V. Mo-
zaffarian (2012), A. R. Khosravi, S. Poormahdi (2008),
S. Tavakkoli et al. (2015), Yurtseva et al. (2016, 2017)
for Persepolium. For Caelestium tianschanicum (= Po-
lygonum tianschanicum, P. popovii, Atraphaxis popovii),
C. lazkovii, and Bactria ovczinnikovii, in addition to new
observations, data from A. P. Czukavina (1962, 1968),
C. Y. Yang (1983), A. E. Borodina (1989), and Yurtseva
et al. (2014, 2016, 2017) were compared.
For anatomical studies, mature fruits were softened
in alcohol : glycerol : water (1 : 1 : 1), cut in sections
10–20 μm thick, and stained with 0.1 % cresyl violet or
processed with 0.1 % phloroglucinol and concentrated
HCl. Fruit structure was studied in the middle part of
the side and at the ribs. The cross sections of the exo-
carp cells were studied with a microscope Carl Zeiss
Axioplan 2 using a camera Axiocam-MR and a program
AxioVision LE 64 free edition.
A distribution map was constructed using herbar-
ium speciments (LE, MW) and all known localities of
Bactria ovczinnikovii, Caelestium lazkovii, and C. tian-
schanicum (Czukavina, 1962, 1968; Borodina, 1989).
Results
Morphological comparison of Bactria and Caelestium
Life form and shoots. All three species are
divaricately branched dwarf shrubs 10–30(50) cm tall
(Fig. 1) with second-year shoots ca. 3–5 mm diam.,
and branchlets departing under 45°, all covered with a
fibrously disintegrated bark. Annual shoots are finely
ribbed, 5–8(12) cm long and 1 mm diam. with widely
spaced nodes, or 1–3 cm long, with congested nodes.
Leaves are alternate, petiolate, articulated at the base.
The annual shoots and leaf blades are covered with
short pointed trichomes 30–120 μm long in Bactria
ovczinnikovii, and 30–60 μm long in Caelestium laz-
kovii and C. tianschanicum. The trichomes are espe-
cially dense at the ribs of the shoot and at the bases of
ochreas (Figs. 2: I–J; 3: A, B; 4: A–D; 5: E, G). The an-
nual shoots of Bactria ovczinnikovii (Fig. 1: A) and Cae-
lestium tianschanicum (Fig. 1: C, H) are greenish-gray
or creamy. The second-year shoots have a pale-gray
bark and a pinkish wood. C. lazkovii (Fig. 1: B) differs
with foxy-brown annual shoots, a gray bark and a foxy-
brown wood of the second-year shoots.
Thyrses. Terminal frondose or frondulose thyrses
include 5–13 cymes of 2–3 flowers in the axils of devel-
oped leaf blades gradually reducing their size towards
the top of the thyrse. In all the species, the lower cymes
are spaced by internodes 10 mm long, the upper inter-
nodes are reduced to 2–3 mm. Pedicels 0.5–1 mm long
are hidden in ochreolas. The fruits of Bactria ovczin-
nikovii and Caelestium lazkovii are pendulous with bent
pedicels, breaking off easily (Fig. 1: A–B). The flowers
of C. tianschanicum have erect pedicels in flowering and
fruiting (Figs. 1: C, G; 2: J).
Leaf blades. Bactria ovczinnikovii has glaucous,
thick, ovate or broadly ovate leaf blades 5–7 × 3–6 mm
with a rounded or shortly mucronate apex and a rotun-
date-cuneate base suddenly narrowed into a wide peti-
ole 0.8–1 mm (Fig. 1: A; more in Yurtseva et al., 2016).
The leaf blades are finely crenulate and slightly revolute
at the margins, with a conspicuous midvein and two
oblique lateral veins on the low side. Stomata are more
numerous on the lower side. The both sides bear point-
ed trichomes 30–120 × 10 μm with a longitudinal stria-
tion, and are especially dense along the midvein below
(Fig. 3: A, B).
Caelestium lazkovii (Fig. 1: B) and C. tianschanicum
(Figs. 1: C; 2: G–I) share bright-green or dark-green,
leathery, oblong-elliptical, oblanceolate, or spatulate
leaf blades 7–10(15) × 2.5–3(5) mm with an obtuse or
acuminate apex and a cuneate base gradually narrowed
to the petiole 0.6–1 mm long. The leaf blades of C. laz-
kovii are 7–10 × 2.5–3 mm, revolute at the margins.
C. tianschanicum has leaf blades 7–15 × 3–5 mm with
flat smooth margins. In both species a conspicuous mid-
vein is dilated to the petiole on the low side. The upper
side of the leaf blade is almost glabrous. Rare trichomes
30–60 × 15–20 μm cover the petiole, the edges of the
leaf blade and the midvein below (Figs. 4: F–H; 5:
A–D). Stomata are especially numerous on the low side
(Figs. 4: I; 5: C).
Ochreas and ochreolas. In all the species
the ochreas are 2–4 mm long, oblique lanceolate-tubu-
lar, herbaceous, brownish and densely minutely puberu-
lent at the base, above membranous, semitransparent,
whitish, scarcely puberulent along the keel, later split in
two lanceolate lacinulas, each with a single hardly vis-
ible vein (Figs. 4: A–E; 5: E, G). In thyrses, the ochre-
olas are 2–3 mm long, broadly ovate, funnel-shaped or
cup-shaped, inflated under the petiole, greenish-brown,
herbaceous, densely minutely puberulent at the base,
above membranous, semitransparent, without veins,
bilacerate or bidentate, with entire or dentate-incised
margins (Fig. 2: A, J).
Perianth morphology. The perianth is divid-
ed in five equal-sized tepals, with a short tube (Figs. 1:
D–F;2:B–D,K;3:D;4:J–L;5:F,H,I;6:A).InBactria
ovczinnikovii and Caelestium tianschanicum the perianth
is divided to 5⁄6–9⁄10, in C. lazkovii — to 4⁄5–5⁄6, not enclos-
ing the mature fruit.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A.G. Deviatov
Новости систематики высших растений | Том 50 | 2019
82
Fig. 1. Type material.
A — Bactria ovczinnikovii, fragment of the holotype (LE 01065511); B — Caelestium lazkovii, fragment of the holotype
(MW0595509); C–F
—
Caelestium tianschanicum, fragments of the paratype of Polygonum popovii (LE 01013265); G, H — Cae-
lestium tianschanicum, fragment of the holotype of Polygonum popovii (LE 01013264).
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
83
Fig. 2. Details of morphology of two species of Caelestium.
A–F: Caelestium lazkovii, holotype (MW0595509): A — axillary cyme with a pedicel and two flower buds; B–D
—
mature fruits
in a perianth; E — fragment of the tepal with papillate edge; F — mature fruit.
G–L: Caelestium tianschanicum, paratype of Polygonum popovii (LE 01013265): G–I
—
leaf blade adaxially and abaxially; J —
thyrse top; K — young flower; L — outer tepal with two filaments inside. Scale bars — 1 mm.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A .G. Deviatov
Новости систематики высших растений | Том 50 | 2019
84
Fig. 3. SEM images of Bactria ovczinnikovii (Botschantzev, Egorova, No 814, LE).
A, B — leaf blade adaxially and abaxially; C — basal part of a perianth tube; D — young flower with dilated filaments inside; E, F —
base of a tepal with stomata; G — a tepal from the outside; H, I — a tepal, side view; J — a tepal from inside; K — a perianth with
filaments inside; L — filament surface. Scale bars: A, B, E, H —100 μm; C, F, G, I, J, L — 30 μm; D, K —300 μm.
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
85
Fig. 4. SEM images of Caelestium lazkovii (MW0595509).
A — a puberulent annual shoot below the ochrea; B — trichomes at the ochrea base; C — a bilacerate ochrea puberulent at the
base and along the keel; D, E — trichomes along the ochrea keel; F–I
—
fragments of abaxial leaf blade with trichomes along the
midvein (G, H) and stomata (I); J–K
—
a young flower; L — a basal part of the perianth tube. Scale bars: A, E — 100 μm; B–D,
H,I —30μm;C,F,G,J,K —300μm.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A.G. Deviatov
Новости систематики высших растений | Том 50 | 2019
86
Bactria ovczinnikovii differs with lanceolate to ovate
tepals 3–4 × 1.2–1.7 mm, all of them greenish-purple,
rigid, leathery, with a narrow petaloid pinkish margin,
which bear papillae inserted at the edge (Fig. 3: H, I).
The outer tepals are slightly acuminate, cucullate, with
narrow keels (Fig. 3: D), the inner tepals are almost
flat. The tube is funnel-shaped, 0.5–0.9 mm, gradually
narrowed to a filiform basal part 0.1–0.18 mm long
(Fig. 3: C).
Caelestium lazkovii and C. tianschanicum share broad-
ly elliptical to broadly ovate tepals 2–3.3 × 1.2–1.7 mm
(Figs. 2: B–E, J–L; 4: J, K; 5: H, I), flat, greenish-purple
along the midveins, with wide petaloid white-pinkish
margins and papillate at the edges (Figs. 2: E, K; 4: J,
K;5:L;6:C,G,H;7:A;8:A,B).Thetepalsareobtuse
in C. lazkovii, obtuse or slightly acuminate in C. tian-
schanicum. The perianth tube is widely cup-shaped or
sacciform, 0.5–0.7 mm long in C. tianschanicum, 0.5–0.9
mm in Bactria lazkovii, suddenly narrowed into a short
filiform basal part 0.1–0.13 mm long.
Perianth surface. The tepals of Bactria ov-
czinnikovii are covered abaxially with elongate-rect-
angular epidermal cells with straight anticlinal walls
and flat outer periclinal walls, the latter with a fine
oblique, longitudinal, or random cuticular striation
(Fig. 3: E–I). The tube is covered with rectangular or
5–6 -gonal epidermal cells with straight anticlinal walls
and dome-shaped or flat outer periclinal walls, the lat-
ters with deep irregular cuticular striations (Fig. 3: C).
Numerous stomata are randomly scattered across the
outside of the tube and the tepals, but are absent from
the narrow tepal margins (Fig. 3: E–I). The adaxial sur-
face of the tepals is lined with elongate-rectangular or
irregular epidermal cells with straight anticlinal walls
and flat outer periclinal walls with a prominent longitu-
dinal striation, the pavement cells are interspersed with
stomata (Fig. 3: J). The perianth is glabrous outside
and inside, but the cells of the tepal edges form papil-
lae 25 × 35 μm long, (5)8 × 11 μm diam. with a tightly
pressed longitudinal striation (Fig. 3: H, I). These pa-
pillae resemble the trichomes which are present on the
leaf blades, but are shorter.
In Caelestium lazkovii and C. tianschanicum, the
epidermal cells covering the tube and the bases of the
tepals externally are elongate-rectangular or irregular,
with straight anticlinal walls and flat outer periclinal
walls with a longitudinal striation (Figs. 4: L; 5: J; 6: A,
B, D, E). On the tepal margins, the epidermal cells be-
come strongly sinuate or undulate in outline (Figs. 5: K;
6: C, F–H; 8: A, B), their outer periclinal walls bear a
random cuticular striation. Stomata are scattered across
the abaxial side of the tepals along the midveins, but are
absent from the wide petaloid margins (Figs. 5: K; 6: C,
G, H; 8: A, B). In contrast to Bactria ovczinnikovii, the
stomata are absent from the inner surface of the tepals
(Figs. 5: L; 6: I). Papillae 30–35(40) μm long and 13–
20(40) μm diam. are inserted at the tepal edges (Figs. 5:
L;6:G,H;8:A,B).
Receptacle and stamens. All three spe-
cies have a hypanthium or receptacle formed by the
bases of the tepals, and eight stamens in two whorls.
The flattened bases of the filaments are inserted closer
to the base of the receptacle and are slightly fused to
it adaxially. The filaments of the five outer stamens are
lanceolate-subulate, gradually dilated to the base, 1–1.2
mm long and are half the length of the tepals (Figs. 3:
D, K; 7: A). The outer stamens are inserted higher than
the inner stamens at the hypanthium (Figs. 3: K; 7: A).
The inner stamens are 2–4 times wider and somewhat
longer, 1.4–1.9 mm long, strongly expanded at 1⁄3 of the
basal part (Figs. 2: L; 3: D, K; 7: A; 8: C).
The inner surface of the perianth tube (that could
be also interpreted as a concave receptacle) is lined be-
low and around the bases of the filaments by rounded or
polygonal nectar-secreting epidermal cells with smooth
convex outer periclinal walls (Figs. 3: K; 7: B; 8: D).
The filaments are covered with oblong-rectangular, al-
most linear epidermal cells with fine longitudinal or ir-
regular cuticular striations, resembling the epidermis
covering the adaxial sides of the tepals (Figs. 3: L; 7: C,
D; 8: G). Only Caelestium lazkovii has broadly conical
papillae 40–50 μm long and 45–50 μm diam. inserted
laterally at the filaments of the three inner stamens
(Fig. 7: D) and resembling the papillae inserted at the
tepal edges (Fig. 6: G, H). The filaments of C. tian-
schanicum and Bactria ovczinnikovii have no papillae
(Figs. 3: D, K; 8: C). The bases of the filaments of Cae-
lestium tianschanicum are covered with elongate-rect-
angular smooth nectar-secreting cells (Fig. 8: E, F). All
the species have orbiculate, dark-pink anthers.
Styles. The styles are partly fused at the base
and terminated with small capitate stigmas in Bactria
ovczinnikovii and free from the base and linear through-
out the length in Caelestium lazkovii and C. tianschani-
cum (see also Yurtseva et al., 2016: 19, fig. 5; Yurtseva et
al., 2017: 172, fig. 15: K).
Fruit morphology and surface. Bactria
ovczinnikovii bears fruits in May — June, Caelestium
lazkovii in July, and C. tianschanicum in July — August.
The fruits are ovoid, trigonous, slightly exserted from
the perianth, with almost winged distinct ribs and con-
cave sides in Bactria ovczinnikovii, with obtuse ribs and
flat sides in Caelestium lazkovii and C. tianschanicum.
They are larger in Bactria ovczinnikovii (4–5 × 2.5–2.8
mm), than in Caelestium lazkovii (2–3 × 2.5–2.8 mm)
and C. tianschanicum (3–4 × 2–3 mm). The light-brown
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
87
Fig. 5. SEM images of Caelestium tianschanicum, paratype of Polygonum popovii (LE 01013265).
A–C
—
fragment of the lower side of leaf blade with trichomes along the midvein (A–B) and stomata (C); D — fragment of the
upper side of leaf blade; E — trichomes on an annual shoot; F — perianth tube jointed to a pedicel; G — tubular-bilacerate ochrea
around an annual shoot; H, I — adaxial and abaxial view of the perianth; J, K — epidermis of perianth tube (J) and a tepal (K)
abaxial side; L — epidermis of tepal margin on adaxial side. Scale bars: A, E, F — 100 μm; B–D, J–L
—
30 μm; G–I
—
300 μm.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A .G. Deviatov
Новости систематики высших растений | Том 50 | 2019
88
Fig. 6. SEM images of Caelestium lazkovii (MW0595509).
A — a perianth tube jointed to a pedicel; B, D — epidermis on the perianth tube outside; C — the top of the tepal with stomata and
papillate edge, side view; E — epidermis on the tepal base outside; F — epidermis on the tepal edge outside; G, H — papillae at the
tepal edge outside; I — epidermis covering the tepal inside. Scale bars: A, B, D–I
—
30μm;C—300μm.
color and finely rough fruit surface of Bactria ovczinniko-
vii contrasts to the dark-brown, almost black color and
smooth glossy fruit surface of the species of Caelestium
(Figs. 2: F; 7: E, F; 8: H, I; see also Yurtseva et al., 2016:
19: fig, 5; 20, fig. 6; Yursteva et al., 2017: 172, fig. 15: K).
Pericarp anatomy. In cross section, the
shape of fruits is different (Fig. 9). The fruits of Bac-
tria ovczinnikovii have distinct, almost winged ribs. The
pericarp consists of one-layered exocarp, several layers
of parenchymatous mesocarp and 1–2 layers of endo-
carp, the latter is obliterated in mature fruits (Fig. 9:
A–C). The ribs are formed by expanded adjacent sides,
so that the inverted exocarp layers are connected by
several layers of mesocarp cells. In the ribs, below the
fused sides, the mesocarp includes a vascular bundle
consisting of a few phloem and xylem elements with
annular and helical thickening. In cross section, most
of the pericarp height is represented by exocarp cells,
which are higher in the ribs (Table 1).
In surface view, the exocarp cells of Bactria ovczin-
nikovii are strongly sinuate in outline, the lobes interdig-
itate (Fig. 7: J), that indicates a premature fruit. In cross
section, the exocarp cells have almost straight anticlinal
walls gradually thickening to the periphery. The lumen
is rectangular, broadened across the height and branched
in the outer periclinal wall (OPW) in several channels
directed into the lobes on the surface (Fig. 9: A–C). The
OPW strongly undulates, forming invaginations and
protrusions. The adjacent protrusions merge, providing
the thickening of the OPW, which has an irregular re-
lief, is finely pitted and covered with a cuticle 1 μm thick
on the surface. Vertical channels 1.6–4.5 μm diam. be-
tween the invaginations of the OPW end blindly near
the surface (Fig. 9: B, C). The walls of the exocarp cells
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
89
are colorless, the lumen is light-brown. The walls are lig-
nified in the ribs, but not in the sides, that also character-
izes a slightly premature fruit.
Caelestium lazkovii has the fruits with obtuse ribs and
a thicker pericarp, but the exocarp has similar height and
is higher in the ribs (Fig. 9: D–F; Table 1). In cross sec-
tion, the anticlinal walls of the exocarp cells are straight,
much thicker than in Bactria ovczinnikovii, the lumen
is broaden at the base, above suddenly narrowed into
a vertical channel, which is dendritically branched in
the OPW into channels 0.7–2 μm diam. The OPWs are
much thicker than in B. ovczinnikovii, the surface of the
OPWs is smooth, covered with a cuticle. The walls are
lignified, red-brown, the protoplast is dark-brown, that
agrees with almost black color of the fruits.
The exocarp cells of Bactria ovczinnikovii and Cae-
lestium lazkovii have similar size, but differ in the width
of the anticlinal walls and OPWs, the shape and size of
the lumen. These differences are due to a much stron-
ger thickening of the anticlinal walls and OPWs of the
exocarp cells in C. lazkovii, which leads to a significant
decrease of the lumen size and its dendritic branching in
the OPW in the latter.
We compared the exocarp of Bactria ovczinnikovii
and Caelestium lazkovii with those of Persepolium sali-
cornioides and some species of Atraphaxis. The fruits of
P. salicornioides are similar to those of Bactria ovczin-
nikovii in the shape, concave sides and distinct ribs. In
cross section, the exocarp cells (Fig. 9: G–I) are almost
rectangular, much wider than in Bactria and Caelestium,
with a vast trapezoidal lumen (Table 1). The anticli-
nal walls and OPWs are much thicker than in Bactria
ovczinnikovii and comparable with those in Caelestium.
Several channels 1.5–5.2 μm diam. go to the surface be-
tween the invaginations of the OPW, some of the chan-
nels enter the tubercles on the surface. The walls are
colorless and lignified, the lumen is colored brown with
phlobaphens. The cuticle is as thin as in Caelestium and
Bactria.
Atraphaxis demonstrates a wide diversity of exocarp
cells (in preparation) varying in: 1) the height; 2) the
shape and thickness of the anticlinal walls across the
height from strongly wavy to straight (Fig. 9: J–L);
3) the shape of the lumen from the trapezoidal, gradu-
ally narrowed outwards (Fig. 9: J, K), to the broadened
at base and suddenly tapering into a vertical channel,
dendritically branched in the OPW (Fig. 9: L); 4) in
the color of the walls from colorless to intensely red-
brown or purple. Some species have tubercles on the
fruit surface (Fig. 9: J). Thus, the variants of exocarp
cells found in Bactria ovczinnikovii and Caelestium laz-
kovii fall within the range of exocarp cells variability for
Atraphaxis.
Pollen. Bactria ovczinnikovii, Caelestium lazko-
vii, and C. tianschanicum have spheroidal to oblong-
spheroidal pollen grains 30–37 × 18–23 μm (P/E =
1.2); tricolporate, elliptical, or almost circular in equa-
torial view, rounded-trilobed in polar view; colpi dis-
tinct, long and deep; ora distinct, lalongate or circular
(Figs. 6: G, H, K; 8: J, K) (also in Yurtseva et al., 2014:
756, fig. 4: a–c, l, m, sub. Atraphaxis ovczinnikovii and
A. popovii; Yurtseva et al., 2016: 34, fig. 19: A–B, K–L;
Yurtseva et al., 2017: 175, fig. 17: F). Exine is tectate,
ca. 1.7 μm thick. The sporoderm ornamentation is mi-
croreticulate-foveolate, foveolate, or foveolate-per-
forate (Figs. 6: I, L; 8: L). In Bactria ovczinnikovii and
Caelestium tianschanicum, 4–6-angular pits 0.6–0.9 μm
diam. are sharply outlined or gradually smooth at the
edges and located at a distance 0.2–0.4 μm (Figs. 6: L;
8: L). C. lazkovii demonstrates a variability of sporo-
Table 1. Characteristics of exocarp cells in Bactria ovczinnikovii, Caelestium lazkovii, and Persepolium salicornioides
Characters
Caelestium lazkovii
Bactria ovczinnikovii
Persepolium salicornioides
In side
In rib
In side
In rib
In side
In rib
Pericarp height, μm
80–90
100–125
54–65
62–70
85–95
66–75
Exocarp cells height, μm
58–69
75–83
43–54
54–63
53–60
54–56
Exocarp cells width, μm
20–52
18–19
25–29
12–21
55–73
28–39
Anticlinal walls width in the middle, μm
8–17
7–9
5–6 .5
2.9–3 .3
8–11
8–10
Outer periclinal wall, thick, μm
18–28
17–24
6.5–13
4.1–8 .2
17–21
12–17
Diameter of lumen at base, μm
17–30
17–18
16–25
8.3–12.5
46–60
17–21
Diameter of lumen before branching, μm 1.6–3 .3
1.6–1 .7
10–19
14–21
17–38
12–15
Diameter of channels in the OPW, μm
0.8–2
0.7–0 .9
1.7 –4.5
1.6–3 .5
1.5–5 .2
2–3 .3
Cuticle thickness, μm
0.8–1
0.8–1 .1
0.8–1
0.8–1
0.8–1 .2
0.8 –1.1
Color of exocarp walls
red-brown
colorless
colorless
Color of lumina content
dark brown
light brown
light brown
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A.G. Deviatov
Новости систематики высших растений | Том 50 | 2019
90
Fig. 7. SEM images of Caelestium lazkovii (MW0595509) (A–I) and Bactria ovczinnikovii (Botschantzev, Egorova,
No 777, LE) (J–L).
A — fragment of the tepal adaxially with the filaments of inner and outer whorls; B — nectar-secreting zone of the receptacle;
C — epidermis on the filament; D — fragment of the filament with papillae inserted laterally, against the inner tepal; E — mature
fruit with the filaments; F, J — fruit surface; G, H, K — pollen grain, polar and equatorial view; I — foveolate-perforate sporoderm
ornamentation; L — microreticulate-foveolate sporoderm ornamentation. Scale bars: A, E — 300 μm; B–F, J — 30 μm; H, K —
10μm;G,I —3μm;L—1μm.
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
91
Fig. 8. SEM images of Caelestium tianschanicum, paratype of Polygonum popovii (LE 01013265).
A, B — papillae inserted in the tepal edge; C — the filament of the inner stamen; D — nectar-secreting zone of the receptacle;
E, F — nectar-secreting cells covering the base of the filament; G — epidermis covering the middle part of the filament; H — fruit
in the perianth; I — the fruit surface; J–L
—
pollen grains: polar view, equatorial view, microreticulate-foveolate sporoderm orna-
mentation.Scalebars:A,D,E,G —30μm;B,F,K —10μm;C—300μm;H—500μm;I—20μm;J,L —3μm.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A .G. Deviatov
Новости систематики высших растений | Том 50 | 2019
92
derm ornamentation in a single pollen sample, which
varies from the microreticulate-foveolate type with
the 4–6 angular pits peculiar for Bactria ovczinnikovii
(Fig. 6: L), to the foveolate-perforate type 0.7–1.5 μm
diam. (Fig. 6: I) with the rounded pits smooth at the
edges and located at a distance 0.7–1.7 μm. Some pits
bear perforations at the bottom. They are few and small
(0.1–0.2 μm) in B. ovczinnikovii and Caelestium tian-
schanicum, but larger (0.1–0.8 μm) in C. lazkovii, single
at the lumen, or rarely double.
Distribution and ecology of Bactria and Caelestium
Bactria ovczinnikovii is an endemic of the Southwest-
ern Pamir (Tajikistan), but records from Afghanistan can
be expected (Fig. 10). It grows on the right bank of the
Pyandj River in the Dasti-Zhum Nature Reserve (Tajiki-
stan, Khatlon Region, Shuroabad District), which flora
contains more than 80 endemic plant species (Kasirov,
2006). This region is located at the western border of the
Afgan-Tajik Depression and the Southwestern Pamir,
which belongs to the Western Asian climatic region.
This territory is characterized by warm semi-arid (medi-
terranean) climate (BSk, or cold steppe-desert climate
by Köppen climate classification, in Kottek et al., 2006;
Arnfield, 2016) with hot, dry summer, the lack of mois-
ture in the soil, high evaporation and frequent winds
from Afghanistan, which carry a lot of fine dust obstruct-
ing normal biological activity of plants. From March to
May, the territory is sufficiently provided with water
(Table 2), but plants suffer from a moisture deficit from
June to October (Kasirov, 2006).
Bactria ovczinnikovii blossoms in May, bears fruits
in June. It inhabits low ridges along the Pyandj River
at the elevations 600–1900 m a. s. l., where it grows on
the rocky and gravelly slopes, in the crevices or clefts of
the rocks composed of red and gray sandstone (Fig. 11)
(Czukavina, 1962, 1968). The habitats are located in
the belt of forest-steppe (shibliak) formed by mesoxero-
phytic and xerophytic mesothermal deciduous low trees
and shrubs: Pistacia vera L., Cercis griffithii Boiss., Rhus
coriaria L., Calophaca grandiflora Regel, Acer regelii
Pax, Ziziphus jujuba Mill. and others, or in grass semisa-
vannas (steppe) replacing the destroyed forest-steppe.
The grass group includes ephemeric Carex pachystylis
J. Gay, Poa bulbosa L., Aegilops sp., Bromopsis turkesta-
nica (Drobow) Holub, Elytrigia sp. (Stanyukovich,
1982; Khalimov, Saidzoda, 2017).
Caelestium lazkovii is a local endemic of the Inner
Tien Shan (Kyrgyzstan), where it was collected in a
single location on the southern slopes of the Kavak-Toö
Ridge (total 4144 m), 5 km N of Sary-Bulun, at the el-
evation ca. 1500 m (Fig. 10). It is a petrophyte growing
on the massive sheer cliffs of southern exposition, being
sheltered in the crevices of granite rocks, but is absent
from screes or circumdenudation mountains. The rocks
are free of vegetation, except a few plants of mesophytic
Spiraea lasiocarpa Kar. et Kir. Caelestium lazkovii blos-
soms and bears fruits in June — July.
Sary-Bulun has a moderate cold (boreal) climate
(Dsb, snow climate with dry warm summer, by Köp-
pen climate classification, in Kottek et al., 2006; Arn-
field, 2016). Below 3200 m the snow cover is unstable
(Table 2). According to the phytogeographical zonation
by R. V. Kamelin (2002), this area belongs to the Ko-
komeren district of the Central Asian province, which
is rich in endemic species. The Inner Tien Shan is a
plateau with wide and flat valleys and elevated plains
2000–4000 m high. Up to the 1500–2000 m the dry
inter-montane basin is occupied by Turan-Dzungar
semi-shrub deserts and solanaceous semi-deserts, which
predominate up to 2000 m and only at higher elevations
(2000–2500 m) are replaced by forest-steppe and dry
steppe (Murzaev, 1958).
Caelestium tianschanicum is an endemic of the
southern macroslope of the Eastern Tien Shan (China,
Xinjiang Uyghur Autonomous Region) (Fig. 10). It was
collected on rocks and dry stony slopes in the environs
of Balguntay, Korla, Karashar (Bayingholin Mongol
Table 2. Climatic characteristics of collection sites of Bactria and Caelestium (Climate-Data.org, Atlas..., 1987)
Dasti-Zhum
Sary-Bulun
Ürümqi
Climate by Köppen classification (Kottek
et al., 2006; Arnfield, 2016)
BSk, cold semi-arid
steppe climate
Dsb, moderately cold
(boreal)
BSk, cold semi-arid
steppe climate
The average annual t°
+14 °C
+7.5 °C
+7 °C
The average t° in January
+2.8 °C
–8.2 °C
–12 .9 °C
The average t° in July
+28.6 °C
+21 °C
+24.1 °C
Annual precipitation
543 mm
455 mm
230 mm
Maximum precipitation
March — April
May — June
June — August
Drought period
June — August
July — September
June — September
Precipitation for summer
3mm
91 mm
77 mm
Precipitation for the period with t° >10 °C
191 mm
254 mm
155 mm
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
93
Fig. 9. Fruit anatomy of Bactria ovczinnikovii (A–C), Caelestium lazkovii (D–F), Persepolium salicornioides (G–I),
Atraphaxis toktogulica (J), A. kopetdagensis (K), A. pyrifolia (L). Scale bars — 50 μm.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A.G. Deviatov
Новости систематики высших растений | Том 50 | 2019
94
Fig. 10. Distribution of Bactria ovczinnikovii ( ), Caelestium lazkovii ( ), and C. tianschanicum ( ) based on material
seen.
Autonomous prefecture), Kucha (Aksu prefecture),
and Ürümqi (Ürümqi prefecture) at the elevations
(1000)1400–2600 m (Li et al., 2003).
The Eastern Tien Shan has a semi-arid cold climate
(BSk, or cold steppe climate by Köppen climate clas-
sification, in Kottek et al., 2006; Arnfield, 2016) with
a very hot summer, frosty and snow-free winter. An-
nual precipitation totals 57 mm in Korla and Karashar,
76–117 in Kucha, 198–284 in Balguntay, 230–290 mm
in Ürümqi, however, the elevated Central ridges of the
Eastern Tien Shan get 400 and even 500 mm (Murza-
ev, 1966; Volkova, Rachkovskaya, 2009; Miao et al.,
2012).
The southern macroslopes of the Eastern Tien Shan
to the SW of Ürümqi at the elevations 1500–2400 m are
occupied by mountain steppes with Agropyron cristatum
(L.) Gaertn., Koeleria cristata (L.) Pers., Artemisia frigi-
da Willd., which are the most probable habitats for Cae-
lestium tianschanicum. The stony slopes at the elevations
1500–2600 m a. s. l. covered by Caragana jubata Poir.,
Atraphaxis, Ephedra L. are also suitable for it (Popov,
1931; Murzaev, 1966, Volkova, Rachkovskaya, 2009).
Discussion
Diagnostic characteristics which discriminate
Caelestium from Bactria
Both species of the genus Caelestium, C. lazkovii and
C. tianschanicum, share the morphology and micromor-
phology of leaf blades gradually tapering to the petiole
and covered with trichomes. Both species have a peri-
anth with five equal, broadly ovate to broadly elliptical
petaloid tepals, which bear broadly conical papillae at
the tepal edges. Conical papillae inserted laterally into
the filaments of the internal stamens of C. lazkovii re-
semble papillae inserted along the tepal edges, which is
probably the result of the expression of the genes which
are responsible for the petaloidy of tepals, in filaments
(Ferrario et al., 2004; Theissen, Melzer, 2007). Similar
examples of the homeotic conversion of epidermal cells
along the filament edges were found in the petal-stamen
intermediate organs of the AP2–5 mutants of Arabi-
dopsis thaliana (L.) Heynh. (Kunst et al., 1989), or the
mutant gp (green petal) of Petunia Juss. (Van der Krol,
Chua, 1993; Van der Krol et al., 1993). Both species of
Caelestium have broadly ovoid fruits with almost flat
faces, obtuse ribs, and free linear styles.
Although both members of Caelestium are similar
to Bactria ovczinnikovii in the shrubby habit, the mor-
phology of shoots, inflorescences, ochreas, and the orna-
mentation of sporoderm, they differ from Bactria in the
shape of leaf blades, the fruits with obtuse ribs and flat
sides, in the structure of exocarp cells, the linear styles,
the petaloid tepals bearing the papillae, which are twice
wider at the base than the papillae of Bactria.
Bactria differs from Caelestium by the ovoid to
broadly ovate leaf blades suddenly tapering to the peti-
ole, the sepaloid tepals, the fruits with concave faces,
distinct ribs and three styles partly fused at the base
and terminated with small capitate stigmas.
Bactria ovczinnikovii grows in a semi-arid climate
with warm winter, humid spring and very dry summer,
while Caelestium lazkovii and C. tianschanicum grow in
moderately cold semi-arid climates with cold winter and
sufficient precipitation in summer. The differences in the
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
95
Fig. 11. Habitats and habit of Bactria ovczinnikovii in Tajikistan, Khatlon Region, Shuroabad District.
A — the bank of the Shpilau River near the village Bag; B — a plant on a cliff face; C, D — a plant in a cleft of gray sandstone rock;
E, F — a plant on a red sanstone gravel. Photos by U. Ukrainskaja.
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A.G. Deviatov
Новости систематики высших растений | Том 50 | 2019
96
T
a
b
l
e
3
.
M
o
r
p
h
o
l
o
g
i
c
a
l
c
h
a
r
a
c
t
e
r
i
s
t
i
c
s
o
f
C
a
e
l
e
s
t
i
u
m
a
n
d
s
o
m
e
o
t
h
e
r
t
a
x
a
o
f
P
o
l
y
g
o
n
e
a
e
C
h
a
r
a
c
t
e
r
s
P
o
l
y
g
o
n
u
m
s
.
s
t
r
.
(
s
e
c
t
.
P
o
l
y
g
o
n
u
m
,
s
e
c
t
.
T
e
p
h
i
s
,
s
e
c
t
.
P
s
e
u
d
o
m
o
l
l
i
a
)
C
a
e
l
e
s
t
i
u
m
B
a
c
t
r
i
a
P
e
r
s
e
p
o
l
i
u
m
A
t
r
a
p
h
a
x
i
s
L
i
f
e
s
p
a
n
/
f
o
r
m
a
n
n
u
a
l
,
p
e
r
e
n
n
i
a
l
h
e
r
b
s
,
u
n
d
e
r
s
h
r
u
b
s
,
d
w
a
r
f
s
h
r
u
b
s
d
w
a
r
f
s
t
o
u
t
s
h
r
u
b
s
d
w
a
r
f
s
t
o
u
t
s
h
r
u
b
c
a
e
s
p
i
t
o
s
e
d
w
a
r
f
s
h
r
u
b
s
o
r
u
n
d
e
r
s
h
r
u
b
s
d
w
a
r
f
o
r
t
a
l
l
s
h
r
u
b
s
o
r
u
n
d
e
r
s
h
r
u
b
s
T
h
y
r
s
e
f
r
o
n
d
o
s
e
,
f
r
o
n
d
u
l
o
s
e
,
o
r
b
r
a
c
t
e
o
s
e
f
r
o
n
d
u
l
o
s
e
f
r
o
n
d
u
l
o
s
e
f
r
o
n
d
o
s
e
t
o
f
r
o
n
d
u
l
o
s
e
b
r
a
c
t
e
o
s
e
C
o
m
p
a
c
t
n
e
s
s
o
f
t
h
y
r
s
e
n
o
/
y
e
s
n
o
n
o
n
o
y
e
s
O
c
h
r
e
a
l
e
n
g
t
h
,
m
m
7
–
1
0
2
–
4
2
–
4
3
–
1
0
3
–
1
0
O
c
h
r
e
a
s
h
a
p
e
l
a
n
c
e
o
l
a
t
e
-
t
u
b
u
l
a
r
,
l
a
t
e
r
fi
m
b
r
i
a
t
e
-
l
a
c
e
r
a
t
e
,
w
i
t
h
(
5
)
7
–
1
7
v
e
i
n
s
l
a
n
c
e
o
l
a
t
e
-
t
u
b
u
l
a
r
,
l
a
t
e
r
b
i
l
a
c
e
r
a
t
e
,
w
i
t
h
o
u
t
v
e
i
n
s
l
a
n
c
e
o
l
a
t
e
-
t
u
b
u
l
a
r
,
l
a
t
e
r
b
i
l
a
c
e
r
a
t
e
,
w
i
t
h
o
u
t
v
e
i
n
s
t
r
u
n
c
a
t
e
-
t
u
b
u
l
a
r
,
l
a
n
c
e
o
l
a
t
e
-
t
u
b
u
l
a
r
,
w
i
t
h
0
–
6
v
e
i
n
s
t
u
b
u
l
a
r
,
w
i
t
h
t
w
o
l
i
n
e
a
r
-
l
a
n
c
e
o
l
a
t
e
l
a
c
i
n
u
l
a
s
c
o
n
n
e
c
t
e
d
b
y
s
e
r
r
a
t
e
-
i
n
c
i
s
e
d
m
i
d
d
l
e
p
a
r
t
,
w
i
t
h
2
v
e
i
n
s
P
e
r
i
a
n
t
h
p
a
r
t
i
t
i
o
n
1
⁄
2
–
5
⁄
6
4
⁄
5
–
9
⁄
1
0
5
⁄
6
2
⁄
3
–
3
⁄
4
1
⁄
3
–
3
⁄
4
(
9
⁄
1
0
i
n
A
.
t
e
r
e
t
i
f
o
l
i
a
)
T
e
p
a
l
s
i
n
f
r
u
i
t
i
n
g
e
q
u
a
l
e
q
u
a
l
e
q
u
a
l
e
q
u
a
l
e
q
u
a
l
o
r
i
n
n
e
r
a
c
c
r
e
s
c
e
n
t
T
e
p
a
l
s
h
a
p
e
o
b
l
o
n
g
-
e
l
l
i
p
t
i
c
a
l
,
b
r
o
a
d
l
y
o
v
a
t
e
,
o
r
o
b
o
v
a
t
e
b
r
o
a
d
l
y
o
v
a
t
e
,
b
r
o
a
d
l
y
e
l
l
i
p
t
i
c
a
l
l
a
n
c
e
o
l
a
t
e
o
b
l
o
n
g
-
e
l
l
i
p
t
i
c
a
l
t
o
o
b
l
o
n
g
-
o
v
a
t
e
o
b
l
o
n
g
-
e
l
l
i
p
t
i
c
a
l
t
o
r
o
t
u
n
d
a
t
e
a
n
d
r
e
n
i
f
o
r
m
T
e
p
a
l
c
o
n
s
i
s
t
e
n
c
e
p
e
t
a
l
o
i
d
p
e
t
a
l
o
i
d
s
e
p
a
l
o
i
d
s
e
p
a
l
o
i
d
p
e
t
a
l
o
i
d
S
u
r
f
a
c
e
o
f
t
e
p
a
l
s
a
b
a
x
i
a
l
l
y
g
l
a
b
r
o
u
s
o
r
p
a
p
i
l
l
a
t
e
a
c
r
o
s
s
t
h
e
t
u
b
e
g
l
a
b
r
o
u
s
g
l
a
b
r
o
u
s
s
h
o
r
t
l
y
v
e
l
u
t
i
n
o
u
s
-
p
u
b
e
r
u
l
e
n
t
g
l
a
b
r
o
u
s
o
r
p
a
p
i
l
l
a
t
e
a
c
r
o
s
s
t
h
e
t
u
b
e
P
a
p
i
l
l
a
e
o
n
p
e
r
i
a
n
t
h
t
u
b
e
,
μ
m
6
0
–
8
0
×
1
5
–
4
5
–
–
1
7
–
6
0
×
5
–
8
(
1
2
)
3
0
–
5
0
×
2
0
–
3
5
P
a
p
i
l
l
a
e
o
n
t
e
p
a
l
e
d
g
e
,
μ
m
–
3
0
–
3
5
(
4
0
)
×
1
3
–
2
0
(
4
0
)
2
5
–
3
5
×
(
5
)
8
–
1
1
2
5
–
3
5
×
1
0
3
5
×
3
0
P
e
d
i
c
e
l
l
e
n
g
t
h
,
m
m
1
.
5
–
2
0
.
5
–
1
0
.
5
–
1
0
.
5
–
1
1
–
6
P
e
r
i
a
n
t
h
t
u
b
e
l
e
n
g
t
h
,
m
m
1
–
1
.
2
0
.
5
–
0
.
9
0
.
5
–
0
.
9
1
.
3
–
2
1
–
7
.
5
F
i
l
i
f
o
r
m
b
a
s
e
o
f
p
e
r
i
a
n
t
h
t
u
b
e
l
e
n
g
t
h
,
m
m
–
0
.
1
–
0
.
1
3
0
.
1
–
0
.
1
8
0
.
1
–
0
.
3
(
0
.
5
)
0
.
5
–
7
S
t
i
g
m
a
s
c
a
p
i
t
a
t
e
l
i
n
e
a
r
c
a
p
i
t
a
t
e
l
i
n
e
a
r
c
a
p
i
t
a
t
e
S
p
o
r
o
d
e
r
m
o
r
n
a
m
e
n
t
a
-
t
i
o
n
p
s
i
l
a
t
e
,
m
i
c
r
o
p
u
n
c
t
a
t
e
,
m
i
c
r
o
s
p
i
n
u
l
o
s
e
(
A
v
i
c
u
l
a
r
i
a
)
;
p
s
i
l
a
t
e
a
r
o
u
n
d
t
h
e
c
o
l
p
i
,
v
e
r
r
u
c
a
t
e
a
t
1
⁄
3
m
e
s
o
c
o
l
p
i
a
a
n
d
p
o
l
e
s
(
P
s
e
u
d
o
m
o
l
l
i
a
)
m
i
c
r
o
r
e
t
i
c
u
l
a
t
e
-
f
o
v
e
o
l
a
t
e
t
o
f
o
v
e
o
l
a
t
e
-
p
e
r
f
o
r
a
t
e
m
i
c
r
o
r
e
t
i
c
u
l
a
t
e
-
f
o
v
e
o
l
a
t
e
f
o
v
e
o
l
a
t
e
,
f
o
v
e
o
l
a
t
e
-
p
e
r
f
o
r
a
t
e
,
m
i
c
r
o
r
e
t
i
c
u
l
a
t
e
-
f
o
v
e
o
l
a
t
e
,
s
t
r
i
a
t
e
-
p
e
r
f
o
r
a
t
e
s
t
r
i
a
t
e
-
p
e
r
f
o
r
a
t
e
,
r
a
r
e
l
y
r
e
t
i
c
u
l
a
t
e
-
p
e
r
f
o
r
a
t
e
(
A
.
t
o
k
t
o
g
u
l
i
c
a
)
A
c
h
e
n
e
s
i
d
e
s
c
o
n
c
a
v
e
t
o
fl
a
t
fl
a
t
c
o
n
c
a
v
e
c
o
n
c
a
v
e
c
o
n
c
a
v
e
t
o
c
o
n
v
e
x
A
c
h
e
n
e
r
i
b
s
o
b
t
u
s
e
o
b
t
u
s
e
s
h
a
r
p
,
w
i
n
g
e
d
s
h
a
r
p
,
w
i
n
g
e
d
s
h
a
r
p
,
w
i
n
g
e
d
t
o
o
b
t
u
s
e
A
n
t
i
c
l
i
n
a
l
w
a
l
l
s
o
f
e
x
o
-
c
a
r
p
c
e
l
l
u
n
d
u
l
a
t
e
t
o
s
t
r
a
i
g
h
t
s
t
r
a
i
g
h
t
s
t
r
a
i
g
h
t
s
t
r
a
i
g
h
t
u
n
d
u
l
a
t
e
t
o
s
t
r
a
i
g
h
t
O
u
t
e
r
p
e
r
i
c
l
i
n
a
l
w
a
l
l
o
f
e
x
o
c
a
r
p
c
e
l
l
u
n
d
u
l
a
t
e
t
o
s
t
r
a
i
g
h
t
s
t
r
a
i
g
h
t
u
n
d
u
l
a
t
e
u
n
d
u
l
a
t
e
u
n
d
u
l
a
t
e
t
o
s
t
r
a
i
g
h
t
L
u
m
e
n
o
f
e
x
o
c
a
r
p
c
e
l
l
r
e
c
t
a
n
g
u
l
a
r
,
t
r
a
p
e
z
o
i
d
,
d
e
n
d
r
i
t
i
c
a
l
l
y
b
r
a
n
c
h
e
d
i
n
t
h
e
o
u
t
e
r
p
e
r
i
c
l
i
n
a
l
w
a
l
l
d
e
n
d
r
i
t
i
c
a
l
l
y
b
r
a
n
c
h
e
d
i
n
t
h
e
o
u
t
e
r
p
e
r
i
c
l
i
n
a
l
w
a
l
l
r
e
c
t
a
n
g
u
l
a
r
r
e
c
t
a
n
g
u
l
a
r
t
r
a
p
e
z
o
i
d
,
d
e
n
d
r
i
t
i
c
a
l
l
y
b
r
a
n
c
h
e
d
,
t
r
i
a
n
g
u
l
a
r
,
l
o
w
-
d
o
m
e
d
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
97
environmental conditions and rainfall times caused some
differences in the flowering and fruiting times, as well in
the structure of the exocarp. The differences in the shape
of the perianth, fruits, styles, the micromorphology of
the tepals are apparently more significant, because they
are less affected by environmental conditions.
Diagnostic characteristics which discriminate
Caelestium and Bactria from other genera of
Polygoneae
Morphological characteristics that distinguish Cae-
lestium and Bactria from Atraphaxis, Persepolium, and
Polygonum s. str. (including the Old World sections
Polygonum, Pseudomollia Boiss., and Tephis (Adans.)
Meisn.) are summarized in Table 3. These characteris-
tics are based on own and reference data (see Materials
and methods).
Caelestium resembles some species of Polygonum in
the morphology of perianths and fruits, but differs in
the morphology of ochreas, the ornamentation of sporo-
derm (Hedberg, 1946; Hong et al., 2005), styles, papil-
lae along the tepal edges, which are absent from Polygo-
num (Table 3).
Bactria resembles Atraphaxis in the shrubby habit
and the morphology of shoots and thyrses, the shape
of leaf blades, but differs in the morphology of ochreas,
perianth, and the ornamentation of sporoderm. Bactria
resembles Persepolium in the morphology of perianth
and fruit, the ornamentation of sporoderm, the struc-
ture of exocarp cells, but has different habit and mor-
phology of shoots, ochreas, and leaf blades, and the gla-
brous perianth. The morphology of leaf blades, ochreas,
and the sporoderm ornamentation differentiate Bactria
from Polygonum.
Acknowledgements
We are very grateful to M. G. Pimenov, E. V. Kluj-
kov, and E. A. Zakharova (Lomonosov Moscow State
University) who helped to collect the specimens of
Bactria ovczinnikovii used in this study. We would like
to thank A. E. Grabovskaya-Borodina (Komarov Bo-
tanical Institute, Russian Academy of Sciences, St. Pe-
tersburg) for kind permission to examine the specimens
of Polygonum popovii and useful references, M. V. Olo-
nova (National Research Tomsk State University) and
Chen Wenli (Institute of Botany, Chinese Academy of
Sciences, Beijing, China) for providing some references.
We are grateful to the staff of the Electon Microscopy
Laboratory of Lomonosov Moscow State University,
Faculty of Biology, for assistance in SEM investiga-
tions. The support of the Russian Science Foundation
(RNF), grant No 14-50-00029 “Scientific basis of the
national biobank — depository of the living systems”
(“Plants”) is gratefully acknowledged for supporting the
examination of herbarium collections in St. Petersburg
(LE). Morphological study (SEM investigations) was
carried out in accordance to Government order for Lo-
monosov Moscow State University (project No AAAA-
A16-116021660045-2). We would like to thank S. L. Mo-
syakin (M. G. Kholodny Institute of Botany, National
Academy of Sciences of Ukraine, Kiev, Ukraine) and the
anonymous reviewer for useful suggestions which helped
to improve the text of the manuscript.
Supplementary material (Appendix) to the article
is available on the journal's website (www.binran.ru/
journals/novitates/).
References
Arnfield A. J . 2016. Köppen climate classification // Ency-
clopaedia Britannica / Encyclopaedia Britannica, Inc.
https://www.britannica.com/science/Koppen-climate-
classification (Accessed 16.11 .2019).
Atlas Kirgizskoi sovetskoi sotsialisticheskoi respubliki. 1987.
T. 1: Prirodnyye usloviya i resursy [Atlas of the Kyrgyz SSR.
T. 1: Natural conditions and resources]. Moscow: Glavn.
upravleniye geodezii i kartografii SSSR. 158 p. [In Rus-
sian] (Атлас Киргизской советской социалистической
республики. 1987. Т. 1: Природные условия и ресурсы.
М.: Главн. управление геодезии и картографии СССР.
158 с.).
Barthlott W. 1981. Epidermal and seed surface characters of
plants: systematic applicability and some evolutionary as-
pects // Nordic J. Bot. Vol. 1. P. 345–355.
https://doi.org/10.1111/j.1756-1051.1981.tb00704.x
Boissier E. 1879. Flora Orientalis, sive Enumeratio plantarum
in Oriente, a Graecia et Aegypto ad Indiae fines hucusque
observatarum. Vol. 4, fasc. 2. Genevae; Basileae: H. Georg.
P. 281–1276. https://doi.org/10.5962/bhl.title.20323
Borodina A. E . 1989. Polygonaceae Juss. // Rasteniya Tsentral-
noi Azii: Po materialam Botanicheskogo Instituta imeni
V. L . Komarova (Plantae Asiae Centralis (secus materies
Instituti botanici nomine V. L . Komarovii)) / V. I. Grubov
(ed.-in-chief). Fasc. 9: Salicaceae — Polygonaceae. Lenin-
grad: Nauka. P. 77–129. [In Russian] (Бородина А. Е .
1989. Polygonaceae Juss. // Растения Центральной Азии:
По материалам Ботанического института им. В. Л . Ко-
марова / отв. ред. В. И . Грубов. Вып. 9: Ивовые — Гре-
чишные. Л.: Наука. С . 77–129).
Brandbyge J. 1993. Polygonaceae // The families and genera of
vascular plants. Vol. 2: Flowering plants — Dicotyledons /
K. Kubitzki, J. G . Rohwer, V. Bittrich (eds.). Berlin: Spring-
er-Verlag. P. 531–544. https://doi.org/10.1007/978-3-
662-02899-5_63
Climate-Data.org. 2017 / OpenStreetMap contributors.
https://ru.climate-data.org/ (Accessed 31.10.2019).
Corner E. J. H. 1976. The seeds of dicotyledons. Vol. 1 . Cam-
bridge etc.: Cambridge Univ. Press. 311 p.
Czukavina A. P. 1962. Kustarnichkovyye vidy roda Polygonum
iz Tadzhikistana [Undershrub species of the genus Polygo-
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A .G. Deviatov
Новости систематики высших растений | Том 50 | 2019
98
num from Tajikistan] // Izv. Akad. Nauk Tadzhiksk. SSR.
Otd. biol. nauk. Vol. 2, No 9. P. 62–68 . [In Russian] (Чу-
кавина А. П . 1962. Кустарничковые виды рода Polygo-
num из Таджикистана // Изв. Акад. наук ТаджССР. Отд.
биол. наук. Т. 2, No 9. C . 62–68).
Czukavina A. P. 1968. Rod Kurchavka, Kolyuchaya grecha —
Atraphaxis L. Rod Gorets — Polygonum L. [Genus Goat’s-
Wheat — Atraphaxis L. Genus Knotweed — Polygonum
L.] // Flora Tadzhikskoi SSR. T. 3 / P. N. Ovchinnikov
(ed.-in-chief). Leningrad: Nauka. P. 216–224; 242–306. [In
Russian] (Чукавина А. П. 1968. Род Курчавка, Колючая
греча — Atraphaxis L. Род Горец — Polygonum L. // Фло-
ра Таджикской ССР. Т. 3: Ореховые — Гвоздичные / гл.
ред. П. Н . Овчинников. Л .: Наука. С . 216–224; 242–306).
Fedotova T. A. 1991. Polygonaceae // Anatomia seminum
comparativa. T. 3: Dicotyledones. Caryophyllidae — Dil-
leniidae / A. Takhtajan (red. princip.). Leninopoli: Nauka.
P. 83 –94. [In Russian] (Федотова Т. А . 1991. Polygona-
ceae // Сравнительная анатомия семян. Т. 3. Двудоль-
ные. Caryophyllidae — Dilleniidae / главн. ред. А. Тахтад-
жян. Л .: Наука. С . 83 –94).
Ferrario S., Immink R. G. H ., Angenent G. C . 2004. Conserva-
tion and diversity in flower land // Curr. Opin. Pl. Biol.
Vol. 7. P. 84–91. https://doi.org/10.1016/j.pbi.2003.11.003
Gross H. 1913. Beiträge zur Kenntnis der Polygonaceen //
Botanische Jahrbücher für Systematik, Pflanzengeschichte
und Pflanzengeographie Bd. 49, No 2. P. 234–348.
Hedberg O. 1946. Pollen morphology in the genus Polygonum
L. s . l . and its taxonomical significance // Svensk Bot. Tid-
skr. Vol. 40, No 4. P. 371–404.
Hesse M., Halbritter H., Zetter R., Weber M., Buchner R.,
Frosch-Radivo A., Ulrich S. 2009. Pollen terminology: An
illustrated handbook. Wien; New York: Springer. 264 p.
Hong S.-P. 1995. Pollen morphology of Parapteropyrum and
some putatively related genera (Polygonaceae — Atra-
phaxideae) // Grana. Vol. 34, No 3. P. 153–159. https://
doi.org/10.1080/00173139509429039
Hong S. -P., Ronse DeCraene L.-P., Smets E. F. 1998.
Systematic significance of tepal surface morphology in
tribes Persicarieae and Polygoneae (Polygonaceae) // Bot.
J. Linn. Soc. Vol. 127 . P. 91–116.
https://doi.org/10.1111/j.1095-8339.1998.tb02091.x
Hong S.-P., Oh I.-C ., Ronse De Craene L. -P. 2005. Pollen mor-
phology of the genera Polygonum s. str. and Polygonella
(Polygoneae: Polygonaceae) // Pl. Syst. Evol. Vol. 254,
No 1–2. P. 13–30. https://doi.org/10.1007/s00606-005-
0334-4
Jaubert H. -F. C ., Spach E. 1844–1846. Illustrationes planta-
rum orientalium. Vol. 2 . Paris: Roret. Tabs. 101–200.
Kamelin R. V. 2002. Predisloviye [Preface] // M. G. Pimenov,
E. V. Kljuykov. Zontichnyye (Umbelliferae) Kirgizii [The
Umbelliferae of Kirghyzia] / R. V. Kamelin (ed.) . Mos-
cow: KMK Scientific Press Ltd. P. 3–18. [In Russian]
(Камелин Р. В . 2002. Предисловие // М. Г. Пименов,
Е. В . Клюйков. Зонтичные (Umbelliferae) Киргизии / под
ред. Р. В . Камелина. М.: Т-во науч. изд. КМК. С. 3–18).
Kasirov K. 2006. Gosudarstvennyi zapovednik “Dashti-
Dzhum” [State Reserve “Dasti-Zhum”] // Strict nature
reserves of Central Asia / R. V. Jashenko (ed.-in-chief). Al-
maty: Tethys. P. 192–199 (Nature protected areas of Cen-
tral Asia. No 1). [In Russian] (Касиров К. 2006. Государ-
ственный заповедник «Дашти-Джум» // Заповедники
Средней Азии и Казахстана / под общ. ред. Р. В. Ящен-
ко. Алматы: Тетис. С . 192–199 (Охраняемые природные
территории Средней Азии и Казахстана. Вып. 1)).
Khalimov A., Saidzoda M. I. 2017. Types of plant vegetation
in the Dastizhum Reserve // T. Ch. Giyasov (ed.). Materi-
als of the Republican Conference “Achievements of modern
biology in Tajikistan”, Dushanbe 2017. Dushanbe: Balogat.
P. 142–144. [In Russian] (Халимов А., Саидзода М. И .
2017. Типы растительности и растительного покрова в
заповеднике Даштиджум // Материалы республ. конф.
«Достижения современной биологии в Таджикистане»,
Душанбе 2017. Душанбе: Балогат. С . 142–144).
Khosravi A. R ., Poormahdi S. 2008. Polygonum khajeh-jamali
(Polygonaceae), a new species from Iran // Ann. Bot. Fenn.
Vol. 45, No 6. P. 477–480.
https://doi.org/10.5735/085.045.0606
Komarov V. L. 1936. Rod Gorets — Polygonum L. [Genus
Knotweed — Polygonum L.] // Flora URSS. Vol. 5. Mo-
squa; Leningrad: Acad. Sci. URSS. P. 594–701; 717–726.
[In Russian] (Комаров В. Л. 1936. Род Горец — Polygo-
num L. // Флора СССР. Т. 5 . М.; Л.: Изд-во АН СССР.
С. 594–701; 717–726).
Kottek M., Grieser J., Beck C., Rudolf B., Rubel F. 2006.
World map of the Köppen-Geiger climate classification
updated // Meteorol. Z . Vol. 15, No 3. P. 259–263. https://
doi.org/10.1127/0941-2948/2006/0130
Kunst L., Klenz J. E ., Martinez-Zapater J., Haughn G. W. 1989.
AP2 gene determines the identity of perianth organs in
flowers of Arabidopsis thaliana // Pl. Cell. Vol. 1. P. 1195–
1208. https://doi.org/10.1105/tpc.1 .12 .1195
Li A. J., Grabovskaya-Borodina A. E ., Hong S.-P., McNeill J.,
Ohba H., Park C.-W. 2003. Polygonum Linnaeus // Flora of
China / A. J. Li (ed.-in-chief). Vol. 5 / Z. Y. Wu, P. H. Ra-
ven, D. Y. Hong (eds.). Beijing: Science Press; St. Louis:
Missouri Botanical Garden Press. P. 278–315.
Mavrodiev E. V., Yurtseva O. V. 2017. “A character does not
make a genus, but the genus makes the character”: three-
taxon statement analysis and intuitive taxonomy // Europ.
J. Taxon. Vol. 377. P. 1–7 .
https://doi.org/10.5852/ejt.2017.377
Meisner C. F. 1857. Ordo Polygonaceae // Prodromus system-
atis naturalis regni vegetabilis / Alph. de Candolle (ed.).
Ps. 14. Parisiis: V. Masson. P. 1 –186.
Miao Y., Herrmann M., Wu F., Yan X. L .,Yang S. L . 2012. What
controlled Mid–Late Miocene long-term aridification in
Central Asia? — Global cooling or Tibetan Plateau uplift:
A review // Earth-Sci. Rev. Vol. 112 . P. 155–172 . https://
doi.org/10.1016/j.earscirev.2012.02.003
Mozaffarian V. 2012. A revision of Polygonum L. sensu lato (Po-
lygonaceae) in Iran // Iranian J. Bot. Vol. 18, No 2. P. 159–
174. https://doi.org/10.22092/ijb.2012.13326
Murzaev E. M. 1958. Srednyaya Aziya: Fiziko-geograficheskaya
kharakteristika [Central Asia: Physiographical characteris-
tics]. Moscow: Acad. Sci. USSR Publ. 270 p. [In Russian]
(Мурзаев Э. М. 1958. Средняя Азия: Физико-географи-
ческая характеристика. М.: Изд-во АН СССР. 270 с.) .
Caelestium (Polygonaceae, Polygoneae), evidence bаsed on morphology
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
99
Murzaev E. M. 1966. Priroda Sindzyana i formirovaniye pustyn
Tsentralnoi Azii [Nature of Xinjiang and formation of des-
erts of Central Asia]. Moscow: Nauka. 381 p. [In Russian]
(Мурзаев Э. М. 1966. Природа Синьцзяна и формиро-
вание пустынь Центральной Азии. М.: Наука. 381 с.).
Popov M. G . 1931. Between Mongolia and Iran // Trudy Prikl.
Bot. Genet. Selekts. (Bull. Appl. Bot. Genet. Pl. -Breed.).
Vol. 26, No 3. P. 45–84. [In Russian and English] (По-
пов М. Г . 1931. Между Монголией и Ираном // Труды
прикл. бот. генет. селекц. Т. 26, вып. 3. С . 45–84).
Punt W., Hoen P. P., Blackmore S., Nilsson S., Le Thomas A.
2007. Glossary of pollen and spore terminology // Rev. Pa-
laeobot. Palynol. Vol. 143. P. 1 –81.
https://doi.org/10.1016/j.revpalbo.2006.06 .008
Ronse Decraene L. -P., Akeroyd J. R . 1988. Generic limits in Po-
lygonum and related genera (Polygonaceae) on the basis of
floral characters // Bot. J . Linn. Soc. Vol. 98, No 4. P. 321–
371. https://doi.org/10.1111/j.1095-8339.1988.tb01706.x
Ronse Decraene L.-P., Smets E. 1991. The floral nectaries of
Polygonum s. l . and related genera (Persicarieae and Polygo-
neae): position, morphological nature and semophylesis //
Flora. Vol. 185, No 3. P. 165–185.
https://doi.org/10.1016/S0367-2530(17)30468-1
Ronse Decraene L.-P., Hong S.-P., Smets E. 2000. Systematic
significance of fruit morphology and anatomy in tribes Per-
sicarieae and Polygoneae (Polygonaceae) // Bot. J. Linn.
Soc. Vol. 134, No 1–2 . P. 301–337.
https://doi.org/10.1111/j.1095-8339.2000.tb02356.x
Schuster T. M ., Reveal J. L ., Kron K. A. 2011. Phylogeny of
Polygoneae (Polygonaceae: Polygonoideae) // Taxon.
Vol. 60, No 6. P. 1653–1666.
https://doi.org/10.1002/tax.606010
Stanyukovich K. V. 1982. Rastitelnost [Vegetation] //
H. M. Saidmuradov, K. V. Stanyukovich (eds.) . Tadzhikistan:
Priroda i prirodnyye resursy [Tajikistan: Nature and natu-
ral resources]. Dushanbe: Donish. P. 358–430. [In Russian]
(Cтанюкович К. В. 1982. Растительность // Таджикистан:
Природа и природные ресурсы / отв. ред. Х. М. Саидму-
радов, К. В. Станюкович. Душанбе: Дониш. С . 358–430).
Tavakkoli S.,
Kazempour Osaloo S.,
Mozaffarian V.,
Maassoumi A. A. 2015. Molecular phylogeny of Atraphaxis
and the woody Polygonum species (Polygonaceae): taxo-
nomic implications based on molecular and morphological
evidence // Pl. Syst. Evol. Vol. 301, No 4. P. 1157–1170.
https://doi.org/10.1007/s00606-014-1140-7
Theissen G., Melzer R. 2007. Molecular mechanisms underly-
ing origin and diversification of the angiosperm flower //
Ann. Bot. (Oxford). Vol. 100, No 3. P. 603–619. https://
doi.org/10.1093/aob/mcm143
Van der Krol A. R ., Brunelle A., Tsuchimoto S., Chua N.-H .
1993. Functional analysis of petuniafloral homeotic
MADS-box gene pMADS1 // Genes a. Developm. Vol. 7 .
P. 1214–1228. https://doi.org/10.1101/gad.7 .7a.1214
Van der Krol A. R ., Chua N.-H . 1993. Flower development
in Petunia // Pl. Cell. Vol. 5. P. 1195–1203. https://
doi.org/10.1105/tpc.5 .10.1195
Volkova E. A., Rachkovskaya E. I. 2009. A contribution by
A. A . Yunatov to the knowledge of the vegetation of Xin-
jiang (to his 100th anniversary) // Rastiteln. Rossii (Vege-
tation of Russia). Vol. 15. P. 113–126. [In Russian] (Вол-
кова Е. А ., Рачковская Е. И. 2009. Вклад А. А . Юнатова
в познание растительности Синьцзяна (к 100-летию со
дня рождения) // Растительность России. Т. 15. С. 113–
126). https://doi.org/10.31111/vegrus/2009.15.113
Yang C. Y. 1983. Polygonum tianschanicum Chang Y. Yang // J.
Aug. 1
st
Agric. Coll. Xinjiang. Vol. 4 . P. 55 .
Yang C. Y. 2010. Sylva Xinjiangensis. Beijing: China Forestry
Publ. House. 566 p.
Yurtseva O. V., Troitsky A. V., Bobrova V. K ., Voylokova V. N.
2010. On taxonomical revision of Polygonum s. str. (Po-
lygonaceae): phylogenetic and morphological data //
Bot. Zhurn. Vol. 95, No 2. P. 226–247. [In Russian] (Юр-
цева О. В., Троицкий А. В., Боброва В. К ., Войлокова
В. Н. 2010. К ревизии системы рода Polygonum s. str.
(Polygonaceae): молекулярные и морфологические дан-
ные // Бот. журн. Т. 95, No 2. С . 226–247).
Yurtseva O. V., Levina M. S., Severova E. E ., Troitsky A. V.
2012a. Morphology and taxonomy of Polygonum cognatum
Meisn., P. alpestre C. A . Mey. and allied taxa from Cen-
tral Asia and the Caucasus (Polygonaceae) // Wulfenia.
Vol. 19. P. 141–180.
Yurtseva O. V., Kuznetsova O. I., Severova E. E ., Troitsky A. V.
2012b. Taxonomy and morphology of Atraphaxis (Polygo-
neae, Polygonaceae) // Caryophyllales: new insights into
the phylogeny, systematics and morphological evolution of
the order: Proc. Symp. held on 24–27 September 2012 at
Moscow M. V. Lomonosov State University / A. K. Timo-
nin, A. P. Sukhorukov, G. H. Harper, M. V. Nilova (eds.).
Tula: Grif & Co. P. 114–118.
Yurtseva O. V., Severova E. E ., Bovina I. Yu. 2014. Pollen
morphology and taxonomy of Atraphaxis (Polygoneae,
Polygonaceae) // Pl. Syst. Evol. Vol. 300, No 4. P. 749–766.
https://doi.org/10.1007/s00606-013-0917-4
Yurtseva O. V., Kuznetsova O. I., Mavrodieva M. E ., Mavrodi-
ev E. V. 2016. What is Atraphaxis L. (Polygonaceae, Polygo-
neae): cryptic taxa and resolved taxonomic complexity in-
stead of the formal lumping and the lack of morphological
synapomorphies // PeerJ. Vol. 4 (e1977). P. 1–50. https://
doi.org/10.7717/peerj.1977
Yurtseva O. V., Severova E. E ., Mavrodiev E. V. 2017. Perse-
polium (Polygoneae): A new genus in Polygonaceae based
on conventional Maximum Parsimony and Three-taxon
statement analyses of a comprehensive morphological da-
taset // Phytotaxa. Vol. 314, No 2. P. 151–194. https://
doi.org/10.11646/phytotaxa.314.2.1
Yurtseva O. V., Mavrodiev E. V. 2019. Caelestium, genus novum
(Polygonaceae, Polygoneae): evidence bаsed on the results
of molecular phylogenetic analyses of tribe Polygoneae,
established with consideration of the secondary structure
of the ITS nrDNA regions // Novosti Sist. Vyssh. Rast.
Vol. 50. P. 47–79. (Юрцева O. В., Мавродиев Е. В . 2019.
Caelestium, genus novum (Polygonaceae, Polygoneae):
обоснование, представленное по результатам молеку-
лярно-филогенетических анализов трибы Polygoneae,
предпринятых с учетом вторичной структуры локусов
ITS1 и ITS2 ядерной рибосомной ДНК // Новости
сист. высш. раст. Т. 50. С. 47 –79).
https://doi.org/10.31111/novitates/2019.50.47
O.V. Yurtseva, G.A. Lazkov, U.A. Ukrainskaja, A .G. Deviatov
Новости систематики высших растений | Том 50 | 2019
100
Towards a taxonomic revision of the genus Trollius (Ranunculaceae)
in the Asian part of Russia. I. Trollius chinensis: taxonomic and
geographical reconsiderations
К таксономической ревизии рода Trollius (Ranunculaceae) в азиатской части
России. I. Trollius chinensis: критический анализ таксономии и географии
M. M. Serebryanyi
Поступила в редакцию | Submitted: 03.09.2019
Принята к публикации | Accepted: 02.12.2019
M. M. Serebryanyi
Tsitsin Main Botanical Garden, Russian Academy of Sciences
Herbarium
Botanicheskaya Str., 4, Moscow, 127276, Russia
misha@florin.ru
М. М. Серебряный
Главный ботанический сад им. Н. В. Цицина РАН
Гербарий
Ботаническая ул., 4, Москва, 127276, Россия
misha@florin.ru
https://doi.org/10.31111/novitates/2019.50.101
Abstract. The present paper opens a series of publications by the author on taxonomy and geography of the genus Trollius L. in
the Asian part of Russia. Trollius chinensis Bunge was chosen as a focus of the paper, since the current status of knowledge of tax-
onomy and geography of this species appeared to be inadequate. Results of the research prove a vast distribution range of T. chi-
nensis in Russia within which there is a number of contact zones with other species of the genus, resulting in active interspecific
hybridization. Detailed adjusted morphological description and list of synonyms are elaborated, T. vitalii Stepanov and T. chi-
nensis subsp. macropetalus (Regel) Luferov are reduced to synonymy; combination T. macropetalus (Regel) F. Schmidt should be
considered invalidly published and withdrawn from usage. Occurrence of T. chinensis in Mongolia (Harhiraa Mountain Area) is
recorded for the first time.
Keywords: Trollius, T. chinensis, synonymy, distribution range, hybridization.
Аннотация. Настоящая работа открывает цикл публикаций автора по систематике и географии рода Trollius L. в азиат-
ской части России. В качестве основного объекта этой статьи выбран Trollius chinensis Bunge — вид, современные пред-
ставления о котором — от таксономических до географических — оказались не соответствующими действительности.
Результаты исследований доказывают обширный ареал T. chinensis на территории России и наличие многочисленных
зон контакта (и гибридизации) этого вида с другими купальницами. Уточнены диагноз и синонимика T. chinensis; T. vi-
talii Stepanov и T. chinensis subsp. macropetalus (Regel) Luferov отнесены к синонимам T. chinensis; показано, что комбина-
ция T. macropetalus (Regel) F. Schmidt недействительно обнародована; впервые доказано нахождение T. chinensis в Мон-
голии (горный массив Хархираа).
Ключевые слова: Trollius, T. chinensis, синонимика, ареал, гибридизация.
Trollius L. is a genus of ca. 30 (Kadota, 1985,
2016), 31 (Doroszewska, 1974) to 35 species (Luferov
et al., 2018) of perennial herbs distributed entirely
in the temperate/extratropical zones of the North
Hemisphere, often (even mainly) in mountain areas —
within forest-steppe, forest, subalpine, alpine — up
to tundra/goltsy — altitudinal belts. On flat terrain
Trollius species occur in wetlands (including wet forests
and meadows), often near water streams and on flood
plains.
Main reasons of uncertainty in the number of spe-
cies within the genus Trollius are:
—
still incomplete understanding of distribution
ranges of Trollius species occurring in Asia;
—
still unsatisfactory knowledge of variation range
within groups of critical species;
—
unlimited capability of almost all the species to
hybridize (also in natural plant communities);
—
treating of T. lilacinus Bunge and sometimes
T. chartosepalus Schipcz. (Khokhrjakov, 1977) within a
separate genus Hegemone Bunge;
—
absence of currently accepted monograph of the
genus: the effort by Alina Doroszewska (1974) is obso-
lete and full of well-known discrepancies.
Thus, I must admit that V. N. Siplivinsky’s eloquent
phrase: “The genus Trollius belongs to those genera of
our flora for which accumulation of material is far ahead
of taxonomic development” (Siplivinsky, 1972: 163) —
is still valid.
History of taxonomic study of the genus Trollius in
Asian part of Russia dates back about a century. Pri-
mary accumulation of material was connected with big
2019
50: 101–114
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
names of Russian botany: K. J. Maximowicz, V. L. Ko-
marov, E. L. Regel, A. A. Bunge and others. The first
monograph of the genus and treatment of Trollius for
Flora of USSR published by N. V. Schipczinsky (1924,
1937) became obsolete already up to beginning of
1960s; the works by V. V. Reverdatto (1943) and
L. I. Malyschev (1965) contributed a few new taxa but
did not contain in-depth taxonomic considerations. At
the same time the genus Trollius in Japan and Korea
was studied by Japanese botanists T. Nakai, K. Miyabe
and others. Their efforts were summarized by Miyabe
(1943). Siplivinsky (1972) published a paper “Genus
Trollius L. in Asia boreali et orientali” which became a
long-term extremely important source for the Asian
species of the genus. Two years later another mono-
graph of Trollius was published by Doroszewska (1974).
It contained an original intrageneric classification (the
genus was subdivided into 7 new sections) which is still
in use by taxonomists. However, this monograph has
not become a fundamental basis for further research,
since it contains a number of serious drawbacks: the au-
thor did not study type material of almost all the spe-
cies (clearly confirmed that in the monograph), did
not critically revise species in the Asian part of Russia
and did not compose satisfactory identification key to
the species. Until Trollius treatment for Flora Sibiriae
(Friesen, 1993) — which cannot be considered a value-
add to the taxonomic knowledge of the genus — only a
few articles were published, particularly those contain-
ing descriptions of new species: T. bargusinensis Sipliv.
(Siplivinsky, 1973) and T. aldanensis Volot. (Voloto-
vsky, 1990). N. V. Stepanov (1994) described a new spe-
cies from West Sayan — T. vitalii Stepanov (alongwith
several infraspecific taxa), and another one — T. kolonоk
Stepanov — from Kuznestk Alatau (Stepanov, 2018).
After a number of contributions (Kadota, 1985,
1987) Y. Kadota (2016) published a revision of the ge-
nus Trollius in Japan — a very important research, in
which — besides a description of three new species
(T. soyaensis Kadota, T. teshioensis Kadota and T. re-
bunensis Kadota) and one new section (Yezoinsulicola
Kadota) — substantiated a broad concept of T. riede-
rianus Fisch. et C. A. Mey. and commented on usage of
petals (nectaries) morphology as diagnostic (not just
morphometric) characters. Unfortunately, in a revision
of the genus Trollius in Far East of Russia (Luferov et
al., 2018; nine species recognized for the region) the
Kadota’s paper was completely ignored. Another re-
cent contribution on the genus Trollius in the flora of
the Altai Mountain Country (Erst et al., 2018) com-
prises only three species — T. asiaticus L., T. altaicus
C. A. Mey. and T. dschungaricus Regel. Despite the au-
thor’s statement on a geographical delimitation of the
researched region (comprising a whole Altai Mountain
Country, incl. Russian, Kazakh, Chinese and Mongolian
territories) absence of T. chinensis Bunge on the list of
species is doubtful.
Recently A. S. Erst et al. (2019) described a new
species from South Siberia — T. austrosibiricus Erst et
Luferov. The authors compared it with T. chinensis and
T. macropetalus (here considered as comb. inval.), i. e.
with T. chinensis. A “Key to identification species of the
genus Trollius from Russia” comprising 16 species was
given (again, the recent revision of the genus Trollius in
Japan by Kadota (2016) is ignored).
Trollius chinensis was chosen as a focus of the pres-
ent paper, since the current status of knowledge of tax-
onomy and geography of this species appeared to be in-
adequate, although its distribution range in the Asian
part of Russia is vast, morphological variation range is
significant and the number of contact zones with other
Trollius species is high.
Materials and methods
I have been studying taxonomy and geography of
the genus Trollius since 2013. All the authentic speci-
mens of Trollius in LE (alongwith a several type speci-
mens from P and K) have been thoroughly studied, as
well as important herbarium collections (LE, MW,
MHA, MWG and others). Field material was collect-
ed in 2019 in Tunkinskii District, Buryatia (S macro-
slope of East Sayan Mountains) and N macroslope of
Khamar-Daban Mountain Ridge, Baikal State Nature
Reserve, Kabansk District, Buryatia. Field observations
of previous years (1981–1992) in different regions of
Siberia (Altai, Kuznetsk Alatau, East Sayan, Khamar-
Daban, etc.) were analyzed. All the collected herbarium
specimens are deposited in MHA, living plants are cul-
tivated in Tsitsin Main Botanical Garden of RAS. Mo-
lecular genetic studies of species (currently T. chinensis
and T. asiaticus) and interspecific hybrids (plants from
hybrid populations T. chinensis × T. asiaticus) of the ge-
nus Trollius have been started.
Habitat data are recorded including:
—
inventory and mapping of Trollius species popula-
tions;
—
geobotanic descriptions of the plant communities
in which species of the genus Trollius occur.
Another important source of valuable information
is represented by photographs from natural habitats in
different parts of the species distribution range.
Taxonomic treatment
Trollius chinensis Bunge, 1833, Enum. Pl. China
Bor.: 3; id. 1833, Mém. Prés. Acad. Imp. Sci. St. Pétersb.
2 [marked “1835” on front page], 1–2: 77; Luferov,
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
102
Fig. 1. Syntype of Тrollius ledebourii var. macropetalus (P00194367,
https://science.mnhn.fr/institution/mnhn/collection/p/item/p00194367?listIndex=235&listCount=1193).
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
103
2004, Turczaninowia, 7 (1): 8; Luferov et al. 2018,
Turczaninowia, 21 (2): 112. ≡ T. asiaticus L. var. chi-
nensis (Bunge) Maxim. 1889, Enum. Pl. Mongolia,
1: 25; Finet et Gagnep. 1904, Bull. Soc. Bot. France,
4: 396; Craib, 1914, Curtis’s Bot. Mag. 140: tab.
8565; Schipcz. 1924, Izv. Glavn. Bot. Sada RSFSR,
23: 69; id. 1937, Fl. URSS, 7: 47; Sipliv. 1972, No-
vosti Sist. Vyssh. Rast. 9: 169–170; Dorosz. 1974,
Monogr. Bot. 41: 74.
Holotype (“lectotypus”, Grabovskaya-Boro-
dina, 2010: 372): “China, 1831, d[ed]. Bunge”, fl.
fragm. (LE: LE 01013585!).
Protologue: “Tr. sepalis 10–12 patulis, peta-
lis 20 ligulatis sepala aequantibus, stamina plus du-
plo superantibus. Hab. in Chinae borealis provincia
Schan-ssi, ubi flores in usum medicinalem colligun-
tur. Flores tantum exsiccatos vidimus”.
= Т. ledebourii Rchb. [var.] γ macropetalus Re-
gel, 1861, Мém. Acad. Imp. Sci. Pétersb., sér. 7, 4, 4
(Tent. Fl. Ussur.): 8. ≡ T. chinensis subsp. macrope-
talus (Regel) Luferov, 1991, Byull. Moskovsk.
Obshch. Isp. Prir., Otd. Biol. 96, 5: 74; id. 2004, Tur-
czaninowia, 7 (1): 8; Luferov et al. 2018, Turczanino-
wia, 21 (2): 113. — T. macropetalus (Regel) F. Schmidt,
1868, Мém. Acad. Imp. Sci. Pétersb., sér. 7, 12, 2
(Reisen Amur-Lande): 88, comb. inval.; Vorosch.
1982, Opred. Rast. Sovet. Dalnego Vostoka: 260.
Syntypes: “Coast of Manchuria, lat. 44–45 N,
1859, C. Wilford” (K, P00194367!). — Fig. 1.
Protologue: “floribus circiter 6-sepalis, se-
palis suborbicularibus quam petala brevioribus.
P. [corr.: T.] chinensis Max. prim. pag. 22 et Wilf. pl.
exsice. [corr.: exsicc.] Am Tatarischen Golf (Kusne-
tzoff). An der Küste der Mandschurei (Wilford)”.
= T. vitalii Stepanov, 1994, Florogenet. Analiz, 1:
101.
Holotype: [Krasnoyarsk Territory] Ерма-
ковский р-н, Западный Саян, хр. Кулумыс, окр.
Ойского озера, субальпийский луг [Yermakovs-
koye District, West Sayan, Kulumys Ridge, Ois-
koye Lake vicinity, subalpine meadow], 11 VI 1990,
N. Stepanov (NS0000407!, labelled “Isotype”); iso-
types — LE: LE 01038901!, KRAS (not seen).
Protologue: “Typus: Sajan Occidental[is],
trajectus Bujbinskij, vallis fl. Bolschaja Oja, pratum
subalpinum, 11 VI 1990, N. Stepanov (NS, isotypi —
LE, KRAS)... Тип: Западный Саян, хр. Кулумыс,
окр. Ойского оз., субальпийский луг [West Sayan,
Kulumys Ridge, Oiskoye Lake vicinity, subalpine
meadow], 11 VI 1990, Н. В. Степанов [N. V. Stepa-
nov] (NS, изотипы [isotypes] — LE, KRAS)”.
—
T. ledebourii auct. non Rchb.: Kom. 1903, Acta
Horti Petropol. 22, 1 (Fl. Manch. 2, 1): 230.
Perennial herbs with simple or branched (up from
the middle part) erect stems (20)30–120 cm tall, with
one or several (usually 2) flowers; stems smooth, stri-
ate, enclosed with fibrous remains of the previous
year’s petioles at the base. Rhizome short, with brown-
ish black thread-like roots. Basal leaves long-petioled,
(1–2)3–6(10), 3–5 -divided into more or less rhombic
lobes; those dissected, margins serrate-dentate, with
ovate to ovate-elliptic teeth shortly apiculate at the
apex. Petioles smooth, up to half of the stem length or
slightly longer, without pronounced geniculum in up-
per part. Leaf blade thin coriaceous (to coriaceous in
the plants growing at highest altitudes); upper surface
bright to dark green, velvety, with deeply impressed
veins, sometimes with purple spot at the centre; lower
surface contrastively silvery green, glossy, veins promi-
nent, pubescent with appressed hairs (the contrast pat-
tern persists in herbarium). Cauline leaves 3–7, lower
ones on petioles up to 13(15) cm long, similar to the
basal in shape, upper sessile, smaller (reduced); pedun-
cles 5–15 cm long, getting longer at frutescence (to
20 cm long). Flowers 4–6 cm in diam., shallow bowl-
shaped to saucer-shaped. Sepals of different tones of
orange, usually bright orange (often turning yellow in
herbarium specimens), slightly concave, broadly ovate
to broadly elliptic, sometimes erose at the apex (sepals
of the lower circle sometimes with a few teeth of ir-
regular shape at the apex, tinged green), (5)6–12(14);
petals (nectaries) about 20, getting (significantly)
longer in course of anthesis, (subequal or shorter than
sepals at the early flowering stage) longer (up to 2
times) than sepals, linear, more or less long aculeate
or acute towards the apex (in herbarium specimens —
to sword-like), 1.7–3 mm wide, same colour or slight-
ly darker than sepals (in herbarium specimens often
brighter than sepals), throughout the length fleshy
but not thickened; nectary pit in the shape of a flat
pocket, 1.5–3 mm from the base. Stamens two times
shorter than petals, 13–20 mm long, incl. the anther
length (2.5–4 mm), pale yellow to yellowish. Anthers
with short acumen at the apex. Ovary green, more or
less arcuate or curved, 3–3.5 mm long, style short-
er than ovary (or subequal), stigma yellow. Follicles
12–40, in a head 1–2 cm diam.; follicle up to 14 mm
long, with a beak up to 4.5(5) cm long; beaks straight,
sometimes bent outwards at the basis, slightly arcuate
(in herbarium specimens more often), (1.5)2–3.5(4)
mm long, purplish/tinged purple as well as the area
around their bases. Seeds 3–7 per follicle, dark brown,
matt, oval. Flowers in June — July; second flowering
(mid — late August) recorded in Amur Region and
Primorye Territory. 2n = 16 (Doroszewska, 1974).
—
Figs. 2–4.
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
104
Fig. 2. Trollius chinensis at anthesis.
1–3
—
Primorye Territory, Ussuriysk Municipal Region, Monakino vicinity, 2 VII 2008, photos by L. V. Kraynik; 4 — Kunashir
Island, Kurilskii State Nature Reserve, Filatov’s cordon vicinity, VII 2002, photo by Yu. V. Ovchinnikov; 5 — Khamar-Daban
Mountain Range, Snezhnaya River valley, 25 VII 2016 (plant of hybrid origin — T. chinensis × T. asiaticus), photo by Yu. V. Ovchin-
nikov; 6 — plant from old horticultural collection at Botanical Garden of Irkutsk State University, photo by S. S. Kalyuzhny.
1
4
56
2
3
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
105
Fig. 3. Trollius chinensis at fruiting.
1, 2 — fruiting plant: Republic of Buryatia, Tunkinskii District, Tubota River valley, study plot 2019-Tubota_main, 24 VII 2019,
photos by K. P. Savov; 3, 4 — fruiting heads: Primorye Territory, Shkotovskii District, Sukhodol River basin, Novonezhino vicin-
ity, 6 VII 2014, photos by L. V. Kraynik.
12
4
3
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
106
Table. Key characters to differentiate Trollius chinensis and T. ledebourii
Diagnostic character
Trollius chinensis
Trollius ledebourii
Petals per flower
About 20
Up to 10–12
Petals/stamens length ratio 2
1.2 –1.4
Petal apex
Long aculeate/acute
Rounded, often incised
Anther length and shape
Up to 4 mm, more or less cylindric
Up to 8 mm, elongate and flattened
Teeth of leaf blade margin More or less equal in size, ovate to ovate-ellip-
tic, shortly apiculate at the apex
Teeth of irregular size and shape, acute or acu-
leate at the apex
Leaf blade texture
Coriaceous, upper surface velvety
Thin to thin coriaceous (rarely and mostly in
hybrid plants), upper surface smooth
Beak of the follicle, length Up to 5 mm
Upto2mm
Comments to morphological descrip-
tion. All the leaves to illustrate intrapopulation vari-
ability of the basal leaf blades (Fig. 4) were collected
within the study plot 2019-Tubota_main (3.4 × 7.5 m2 ;
51.872618° N 102.802318° E; h = 1039 m a. s. l.).
Flowers with number of sepals around 14 could be
observed mostly in cultivated plants, often of hybrid
origin (Doroszewska, 1974). Forming follicles of T. chi-
nensis × T. asiaticus are often characterized by rather
big purple spots and red to purple sutures.
According to our observations, the beaks of mature
follicles remain straight up to opening, while in herbar-
ium specimens of the same plants the beaks could turn
arcuate in course of pressing and drying.
Affinity
Morphologically, T. ledebourii should be considered
the closest species to T. chinensis. Both species have shal-
low bowl-shaped or saucer-shaped flowers (almost oblig-
atory flat saucer-shaped in T. ledebourii) and long linear
and not thickened petals always longer than stamens. At
a superficial glance the plants with small number of se-
pals from T. chinensis populations are particularly close
to T. ledebourii. Some important diagnostic characters to
differentiate these species are presented in the Table.
In the contact zones of T. chinensis and T. ledebourii
distribution ranges (e. g., in Amur Region) these species
often form spontaneous hybrid populations, that causes
identification difficulties. Many horticultural hybrids of
these species have been originated long ago and still are
widely cultivated.
Taxonomic and nomenclatural notes
The history of Bunge’s publication “Enumeratio
plantarum, quas in China boreali collegit” (Bunge,
1833) which caused so many errors in nomenclature ci-
tations of the species, described by the author from his
collections in China (1830–1831), is analyzed in de-
tail by A. E. Borodina-Grabovskaya (2007). It appears,
though, it is 1833 that should be considered a year of
the actual publication of issues 1–2 of the second vol-
ume of “Mémoirs de l’Académie Impériale des Sciences
de St.-Pétersbourg... Tome second, 1re & 2me livrai-
son”. Besides that, I am supporting and following her
decision to cite the both preprint and the publication of
1833 at all those taxa.
The only known to the date original specimen of
T. chinensis, cited as the lectotype by Grabovskaya-Boro-
dina (2010), contains 8 flowers in different safe state,
stored in an envelope. No other authentic specimens
have been found so far (P, TU). Bunge notices in the
protologue: “Flores tantum exsiccatos vidimus [I have
seen dried flowers only]” (Bunge, 1833: 3), therefore
the cited specimen is most probably the only element
of the original material, i. e. holotype (Turland et al.,
2018: Art. 9.1(b)). According to Bunge (1833) flowers of
T. chinensis were used in traditional local medicine.
The history of the name T. macropetalus (Regel)
F. Schmidt is curious and paradoxical. Authors of many
taxonomic papers referred to the work by F. Schmidt
(1868: 88) as a place of valid publication of this com-
bination. As a matter of fact, one can find on that page
the only mention of the name T. macropetalus in a more
than 220-pages paper. It says: “An Kräutern in dieser
Region wüsste ich im Süden nur wenig Neues zu nen-
nen, so Trollius macropetalus und Lilium Glehni [I have
not known a lot about herbs in south of this region,
such as Trollius macropetalus and Lilium glehnii]”. In
contrary, neither of the researchers referred to the no-
menclature citation, diagnosis and taxonomic comment
for T. ledebourii var. macropetalus given by Schmidt on
pages 105–106 of the publication (within a Synopsis —
section Specieller Theil):
“18) Trollius Ledebourii var. macropetala Rgl. et
Maak fl. ussur. n. 24. T. chinensis Max. n. 38.
T. 1–2 pedalis, foliis supra glauscescentibus, sepalis
5–7 rotundatis patulis, petalis c. 20–25 erectis lineari-
lanceolatis aurantiacis sepala superantibus, quam stam-
ina duplo longioribus stylis rectis 1⁄4 carpellorum non
superantibus.
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
107
Fig. 4. Intra-population variability of basal leaves in Trollius chinensis: Republic of Buryatia, Tunkinskii District,
Tubota River valley, study plot 2019-Tubota_main, 24 VII 2019, photo by K. P. Savov.
Differt a. T. Ledebourii genuino petalis longioribus
stylisque rectis brevioribus; a. T. chinensi Bge. sepalis
paucioribus patulis.
T. japonicus Miq. l. c. III, p. 6 petalis stamina aequan-
tibus nec illa sub duplo superantibus differe videtur”.
V. N. Siplivinsky (1972) followed by A. N. Luferov
(1991) additionally referred to page 218 of the
Schmidt’s publication where one can find the following
paragraph: “Ich bin mehrfach in das bekannte Dilemma
von gutten und schlechten Arten gerathen, und es fin-
den sich noch jetzt unter meinen neuen Species einige,
die vielleicht mit mehr Recht als Varietäten bei schon
bekannten Arten untergebracht werden könnten,
währeud manche Varietäten wiederum von Anderen
als gute Species hingestellt werden moechten. Ich will
hier gleich auf diejenigen Species hinweisen, deren Ar-
trechte ich für zweifelhaft halte, wie auch diejenigen
Varitäten, die vielleicht wieder zu Species erhoben
werden duerften: Trollius Ledebourii var. macropetala,
die ich früher als eigene Species hingestellt hatte, kann
doch vielleicht eine gute Art sein. [I have repeatedly
fallen into the well-known dilemma of good and bad
species, and among my new species there are still some
which perhaps may be better treated as good variet-
ies, and some varieties, in turn, considered by others
to be good species I would rather like to discard. I will
immediately point out the species which I consider
doubtful, as well as the varieties which perhaps may
be raised to species level: Trollius Ledebourii var. mac-
ropetala which I had considered earlier to be a separate
species may appear to be a good species.]” (Schmidt,
1868: 218).
Trollius ledebourii var. macropetala opens a list of
doubtful taxa with no final taxonomic decision taken, so
it is the only accepted name for the taxon in this pub-
lication. Occasional usage of combination T. macropeta-
lus on p. 88 of the publication is most probably a lapse
and/or trace of the author’s reminiscences about evalu-
ating the status of this taxon. The construction “I had
considered earlier” on p. 218 refers to the time when
F. Schimdt had started to evaluate this taxon, not to the
previous episode in the publication. Page 105 should be
the only correct reference in the respective nomencla-
ture citation.
Thus, the combination “Trollius macropetalus” was
not explicitly accepted by Schmidt, therefore it was not
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
108
validly published (Turland et al., 2018: Art. 36.1) and
should be withdrawn from usage.
Treating of plants with a small number of strongly
deflexed sepals (6 according to the protologue; 5–7 ac-
cording to Schmidt (1868)) and petals up to 35 mm
long gradually tapering at the top as a separate subspe-
cies T. chinensis subsp. macropetalus (Regel) Luferov
(Luferov, 1991, 1995) appears to be an unsatisfactory
decision due to the following reasons:
—
number of sepals within a single population var-
ies significantly; the plants at the first anthesis are often
characterized by a small number (5–7) of sepals;
—
a long-lasting growth of petals often results in
changing the shape of apex (gradual tapering/sharp
narrowing) during anthesis;
—
sepals deflection angle also changes significantly
in course of anthesis.
Luferov (1991) suggested that there are grace-
ful transitions between type subspecies and T. chinen-
sis subsp. macropetalus in a form of clinal characters
change (from West to East): e. g., number of sepals re-
duction, petal length increase, petal shape change. That
is not corroborated by our data from different parts
of T. chinensis distribution range: e. g., in the Far East
populations plants with 7–10 sepals per flower were re-
corded many times while within the western sector of
the distribution range plants with 5–7 sepals per flower
are not rare.
Siplivinsky (1972) considered T. macropetalus as
a synonym of T. chinensis. He commented on intraspe-
cific variability of the species as follows: “Growing in
such a vast mountain territory T. chinensis does not re-
main stable in its morphological characters. E. g., in the
South, in Changbai Mountains, the most robust plants
with big flowers and leaves, petals 1.5–2 times longer
than sepals (5–8 per flower) could be observed. In the
North and East (e. g. Primorye) — in contrary, plants
with 5 sepals and shorter petals predominate. In the
West number of sepals varies from 8 to 12 and petals are
only slightly longer than sepals or subequal to them”
(Siplivinsky, 1972: 169–170, translated from Russian).
Taking into consideration lack of data from a significant
part of T. chinensis distribution range, a big number of
wrongly identified herbarium specimens and lack of
in-depth knowledge of variation within hybrid popula-
tions of the species I consider it premature and inaccu-
rate to argue the clinal characters change in T. chinensis.
A broad concept of T. chinensis is adequate and in-
strumental. However, a correct identification of her-
barium specimens imposes a simultaneous presence of
petals, basal leaves and anthers on the voucher, since
the labels almost never contain detailed information on
phenology/population patterns in the locality. For ex-
ample, plants of hybrid origin (T. chinensis × T. ledebou-
rii) are often characterized by 5–6 sepals and very long
petals gradually tapering to the apex, but petal shape
(rounded, often incised at the apex) and long anthers
on short and weak filaments) indicate “blood” of T. lede-
bourii in the plant.
N. V. Stepanov (1994) published one new species,
two its varieties and one form from West Sayan: T. vi-
talii Stepanov, T. vitalii var. forficuloides Stepanov, T. vi-
talii var. nadezhdae Stepanov, and T. vitalii f. asiaticifo-
lius Stepanov. As diagnostic characters of T. vitalii the
author mentioned long straight beaks of follicles (up to
3–3.5 mm long), petals shorter than sepals, curved ova-
ries, style as long as ovary. All those characters agree
with T. chinensis diagnosis and variation range, which
is completely corroborated by authentic specimens. It is
worth mentioning that the author stated in diagnosis/
description of T. vitalii that the number of its sepals var-
ies from 16 to 25. The number of sepals in the original
specimens (KRAS, LE and NSK) does not, however,
exceed 12. Comparatively short petals in flowers of the
original specimens indicate early flowering phase.
It is possible that the author did not consider T. chi-
nensis to be (at least) an affinity of T. vitalii, since none
of the available bibliographic sources contained infor-
mation on T. chinensis distribution in Siberia.
On the website of the Plantarium project (https://
www.plantarium.ru/), there is a gallery of T. vitalii im-
ages (Trollius vitalii Stepanov, 2007–2019), where all
the depicted plants are identified by N. V. Stepanov and
several ones are published by him. One of them (Stepa-
nov, 2009) is taken in locus classicus of T. vitalii, and il-
lustrates a plant with a flower of 14 sepals. Some other
photographs (e. g., Dragan, 2016; Pool, 2018) represent
plants of a hybrid origin (T. chinensis × T. asiaticus).
Hybrid genesis of the illustrated plants is corrobo-
rated by petals morphology, flower shape and other
characters. T. chinensis × T. asiaticus hybrids differ from
T. chinensis s. str. by broadly lanceolate multiveined
petals (similar to T. asiaticus) rarely exceeding sepals,
globose (not shallow bowl-shaped) flower of many se-
pals arranged in circles (similar to T. asiaticus).
In my opinion, T. vitalii should be placed in a syn-
onymy of T. chinensis; the infraspecific taxa described
by Stepanov should not be treated taxonomically but
taken into consideration from the perspective of study-
ing variation range, particularly in hybrid populations,
since they are, in fact, interspecific hybrids T. chinen-
sis × T. asiaticus.
Recently described Trollius austrosibiricus Erst et
Luferov (Erst et al., 2019) is most likely an interspecific
hybrid T. asiaticus × T. chinensis: morphological com-
parison between T. austrosibiricus and related species,
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
109
presented by the authors, does not contain diagnostic
differences, e. g. one can find lots of plants with simple
rhizomes within a single T. chinensis population; all the
morphometric differences mentioned are not in fact di-
agnostic. However, the shape of petals is very typical
of T. asiaticus × T. chinensis hybrids: it is very close to
that of T. asiaticus (broad and multiveined), except for
the apex which is not rounded but clearly acute. For
the time being (and until a thorough study of all the
authentic specimens of T. austrosibiricus — holotype
and six paratypes are cited) I will keep considering this
taxon as another T. asiaticus × T. chinensis hybrid. It is
weird, that the authors do not comment on T. vitalii al-
though one of T. austrosibiricus paratypes was collected
near locus classicus of the former species.
Distribution
General distribution range. Asian part
of Russia, 700–2100 m alt.; Mongolia (Uvs Province,
Harhiraa), ca. 2700 m alt.; North and North-East China
(Hebei, N Henan, W Jilin, W Liaoning, E Nei Mon-
gol, Shanxi provinces), 1000–2200 m alt. (“on grassy
slopes” — Li, Tamura, 2001); north of Korean Penin-
sula.
Distribution in Asian part of Russia.
Krasnoyarsk Territory. Yermakovskoye District: West
Sayan (Kulumys Ridge, Oiskoye Lake vicinity, Bol-
shoi Kebezh River upstream). Republic of Buryatia.
Tunkinskii and Okinskii Districts: East Sayan (Orlik
vicinity, Mondy vicinity, Arshan vicinity, Tubota River
valley); Zakamensk District: Jida uplands (Tsakirka
River upstream, Malyi Subutui River fountain); Ka-
bansk District: Khamar-Daban Mountain Range (Sne-
zhnaya River valley, 4 km upstream from Monomakh
Hat peak; Baikal Nature Reserve); Barguzin District,
near Bolshoi Chivyrkui River mouth; Bauntovskii
Evenkiiskii District. Trans-Baikal Territory. Amur Re-
gion (south). Sakhalin Region. Sakhalin (south-west,
Holmsk vicinity), Kunashir Island (Kurilskii State Na-
ture Reserve, Filatov’s cordon vicinity). Khabarovsk
Territory (near Grossevichi Bay). Primorye Territory
(Fig. 5).
The herbarium specimen from Mongolia (Harhiraa
Ridge, Tsagan-Dygl Mt., Ogureyeva (MWG!)) not only
proves the Mongolian locality but also marks the high-
est elevation (2700 m alt.) T. chinensis reaches within
its distribution range (Fig. 6). Occurrence of T. chinen-
sis in Mongolian Altai seems to be highly probable.
Previous views on T. chinensis distribution range in
the Asian part of Russia (Schipczinsky, 1937; Siplivin-
sky, 1972; Voroschilov, 1982; Luferov, 2004; Luferov
et al., 2018) should be radically changed. The material
studied during this research project (herbarium speci-
mens, living plants collected in the wild, photographs
from different parts of distribution range, etc.) proves a
vast distribution range of T. chinensis in the Asian part
of Russia (from West Sayan in the west to Kunashir
Island in the east). Moreover, it is the second-third in
area within the genus after T. asiaticus and T. sibiricus
Schipcz.
Fig. 5. Distribution of Trollius chinensis in the Asian part of Russia and Mongolia.
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
110
Fig. 6. Herbarium specimen of Trollius chinensis from Mongolia (MWG).
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
111
The distribution ranges of T. chinensis, T. asiaticus,
T. sibiricus, T. ledebourii and T. riederianus s. l. within
the Asian part of Russia overlap on a large area and ex-
tent, forming numerous contact zones and hybrid popu-
lations. Further studies should be focused on improving
the knowledge of the distribution ranges, revealing and
describing the hybrid populations and carrying out the
necessary molecular genetic research.
Habitat and ecology
Forest and forest-steppe altitudinal zones: swamp
coniferous forests — swamp larch open forest with
dwarf bog birch (tree and shrub strata dominants: Larix
gmelini (Rupr.) Kuzen., Betula pendula Roth, Salix beb-
biana Sarg.
—
Betula fruticosa Pall.) on a flat summit
of the coniform hill, h = 1090 m alt. (Selyutina, 2018,
pers. comm.); wet meadows on fertile soils, forest edges,
riversides and towpaths, open/thin forests at the upper
forest boundaries. Subalpine altitudinal zone: subalpine
meadows, often near water streams. Alpine (goltsy) al-
titudinal zone: meadows near headstreams, subniveal
small meadows, 1600 m a. s. l. (Khamar-Daban) — 2700
m a. s. l. (Harhiraa Ridge).
According to our observations in Tunkinskii Dis-
trict, Tubota River valley (July 2019) the populations
of T. chinensis were recorded within the higher part of
the forest altitudinal zone — in forest edges, riversides
and roadsides. One population was described in details
(results to be published elsewhere): Republic of Burya-
tia, Tunkinskii District, Tubota River valley, study
plot 2019-Tubota_main (3.4 × 7.5 m2 ); 51.872618° N
102.802318° E, h = 1039 m a. s. l. It comprised 47
plants: 15 fertile mature, 14 immature, 18 juvenile.
Cultivation
T. chinensis — one of the most attractive species of
the genus Trollius — was introduced in European hor-
ticultural collections at the end of 19th century along
with several other species of Globe Flower (Trollius).
A mess with names of cultivated plants existing at that
time resulted in another introduction (re-introduction)
of this species in the beginning of 20th century in the
UK by the company J. Veitch & Sons. The company
distributed the plants of the clone collected in China by
W. Purdom. Thus, T. chinensis gained a broad populari-
ty and won the praise of publication (and colour plate)
in Curtis’s Botanical Magazine (Craib, 1914).
Practically from the very beginning of the initial in-
troduction numerous horticultural cultivars were origi-
nated on the basis of T. chinensis and/or via its hybrid-
ization with other species. Few species were used for
hybridization: T. europaeus L. and T. ledebourii among
them (Doroszewska, 1965, 1970). As a result of the
both targeted and spontaneous hybridization in gar-
den collections many forms carrying labels T. chinensis
(being very different from the species morphologically)
became widespread across Europe. One of the conse-
quences of that tendency was a misconception of the
species which is still existing among horticulturalists.
Selection of the horticultural forms was aimed to
create tall, multi-flowered plants with big bright flow-
ers (of many sepals) and maximally long petals (Fig. 2:
6). That is why horticultural forms with extremely long
petals (often incised at the apex) are very popular.
Geographically representative selection
of collections studied
Herbarium specimens: Appendix 1 (see the journal's
website: www.binran.ru/journals/novitates/).
Photographs from natural habitats: Appendix 2
(see the journal's website: www.binran.ru/journals/
novitates/).
Acknowledgements
Keepers, curators and staff members of the following
Herbaria are greatly acknowledged for assistance: LE,
MHA, MW, MWG, P. I would like to thank K. P. Savov,
I. N. Urbanavichene and G. M. Serebryanyi for par-
ticipation in field research. I am very grateful to fel-
low botanists and plant amateurs, supplying me with
well-documented and high-quality images, particularly
to participants of the project Plantarium (www.plan-
tarium.ru) for long-term fruitful collaboration. Infor-
mal group of friends, colleagues and fellow botanists is
deeply acknowledged for providing photographs, ob-
servations and another important materials for study
(in alphabetical order): N. S. Gamova, S. S. Kalyuzhny,
L. V. Kraynik, Yu. V. Ovchinnikov, I. Yu. Selyutina,
M. V. Skotnikova, N. N. Voropaj. Dr. I. V. Sokolova is
sincerely acknowledged for reviewing and editing the
paper, particularly for the discussion on attributing the
date of the Bunge’s publication. Dr. A. N. Sennikov is
acknowledged for the discussion on Trollius macropeta-
lus. I am also grateful to Prof. G. N. Ogureyeva and Dr.
A. K. Sytin for valuable discussions. I am deeply grate-
ful to my family for support.
Supplementary materials (Appendices 1, 2) to the
article are available on the journal's website
(www.binran.ru/journals/novitates/).
References
Borodina-Grabovskaja A. E . 2007. Typificatio nominum plan-
tarum ab auctore A. Bunge in commentationibus “Enu-
meratio plantarum, quas in China borealis collegit Dr.
Al. Bunge, Anno 1831” descriptarum // Novosti Sist.
Vyssh. Rast. Vol. 39 . P. 313–319. [In Russian] (Бородина-
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
112
Грабовская А. E. 2007. Типификация названий растений,
описанных А. А. Бунге в работе «Enumeratio plantarum,
quas in China borealis collegit Dr. Al. Bunge, anno 1831»
// Новости сист. высш. раст. Т. 39. С . 313–319).
Bunge A. 1833. Enumeratio plantarum, quas in China boreali
collegit Dr. Al. Bunge, anno 1831 // Mém. Acad. Imp. Sci.
St. Pétersb. T. 2 [marked “1835” on front page], livr. 1–2
[publ. 1833]. P. 75–147.
Craib W. 1914. Trollius chinensis // Curtis’s Bot. Mag. Ser. 10.
Vol. 10 (140). Tab. 8565. P. 140–142 .
Doroczewska A. 1965. Observations on the Trollius chinensis ×
T. europaeus hybrids // Acta Soc. Bot. Poloniae. Vol. 34,
No 3. P. 451–469.
Doroczewska A. 1970. Hybrids of Trollius pumilus Don with
other species of the same genus // Acta Soc. Bot. Poloniae.
Vol. 39. P. 257–284.
Doroczewska A. 1974. The genus Trollius L.: A taxonomi-
cal study. Warszawa: Panstwowe wydawnictwo naukowe.
184 p. (Monogr. Bot. Vol. 41).
Dragan S. 2016. Image of Trollius vitalii Stepanov // Plantari-
um: open on-line atlas and key to plants and lichens of Rus-
sia and neighbouring countries. 2007–2019. (Драган С.
2016. Изображение Trollius vitalii Stepanov // Планта-
риум: открытый онлайн атлас-определитель растений и
лишайников России и сопредельных стран. 2007–2019).
https://www.plantarium.ru/page/image/id/461330.html
(Accessed 30.09 .2019).
Erst A. S., Luferov A. N., Troschkina V. I., Xiang K., Wang W.
2018. The genus Trollius L. (Ranunculaceae) in the flora
of the Altai Mountain Country // Sist. Zametki Mater.
Gerb. Krylova Tomsk. Gosud. Univ. No 118. P. 64–76. [In
English with Russian abstract] (Эрст А. С ., Луферов
А. Н ., Трошкина В. И., Ксианг К., Ванг В. 2018. Род
Trollius L. (Ranunculaceae) во флоре Алтайской гор-
ной страны // Сист. заметки по матер. Герб. Кры-
лова Томск. госуд. унив. No 118. С . 64–76). https://
doi.org/10.17223/20764103.118.5
Erst A. S., Luferov A. N., Troshkina V. I., Shaulo D. N.,
Kuznetsov A. A ., Xiang Kunli, Wang Wei. 2019. Trol-
lius austrosibiricus (Ranunculaceae), a new species from
South Siberia // PhytoKeys. Vol. 115. P. 83–92. https://
doi.org/10.3897/phytokeys.115.30863
Friesen N. V. 1993. Trollius L. —
Zharok, ili kupalnitsa [Trol-
lius L. — Globeflower] // Flora Sibiriae. T. 6. Novosibirsk:
Nauka. P. 103–108. [In Russian] (Фризен Н. В. 1993. Trol-
lius L. — Жарок, или купальница // Флора Сибири. Т. 6 .
Новосибирск: Наука, 1993. С . 103–108.).
Grabovskaja-Borodina A. E . 2010. Sem. Ranunculaceae Juss.
// Catalogue of the type specimens of East-Asian vascular
plants in the Herbarium of the Komarov Botanical Insti-
tute (LE). Pt. 2 (China). Moscow; St. Petersburg: KMK
Scientific Press. P. 361–372. [In Russian] (Грабовская-
Бородина А. Е . 2010. Сем. Ranunculaceae Juss. // Ката-
лог типовых образцов сосудистых растений Восточной
Азии, хранящихся в Гербарии Ботанического института
им. В. Л. Комарова (LE). Ч . 2 (Китай). М.; СПб.: Т-во
науч. изд. КМК. С . 361–372).
Kadota Y. 1985. Trollius L. // T. Yamazaki (ed.). Alpine flowers
of Japan. Tokyo: Heibonsha. P. 14, pls. 16–17. [In Japanese]
Kadota Y. 1987. Genus Trollius L. in Japan // Bull. Natl. Sci.
Mus. Tokyo. Ser. B. Vol. 13, No 3. P. 107–121.
Kadota Y. 2016. A revision of the genus Trollius (Ranuncula-
ceae) in Japan // J. Jap. Bot. Vol. 91. Suppl. P. 178–200.
Khokhrjakov A. P. 1977. De generis Trollius L. specie albi-
flora Asiae boreali-orientalis // Novosti Sist. Vyssh. Rast.
Vol. 14. P . 79–81. [In Russian] (Хохряков А. П. 1977. О
белоцветковой купальнице (Trollius L.) северо-восточ-
ной Азии // Новости сист. высш. раст. Т. 14. С . 79–81).
Li Liangqian, Tamura M. 2001. Trollius Linnaeus // Flora of
China. Vol. 6. / Z. Y. Wu, P. H . Raven, D. Y. Hong (eds.).
Beijing: Science Press; St. Louis: Missouri Bot. Gard. Press.
P. 137–142.
Luferov A. N. 1991. New nomenclatural combinations in taxo-
nomy of Far Eastern species of the family Ranunculaceae
Juss. // Byull. Moskovsk. Obshch. Isp. Prir. Otd. Biol.
Vol. 96, No 5. P. 74–76. [In Russian] (Луферов А. Н. 1991.
Новые номенклатурные комбинации в таксономии
дальневосточных видов семейства Ranunculaceae Juss.
// Бюл. Московск. общ. исп. прир. Отд. биол. Т. 96,
вып. 5. С. 74–76).
Luferov A. N. 1995. Rod kupalnitsa — Trollius L. [Genus Globe-
flower — Trollius L.] // Plantae vasculares Orientis Extremi
sovetici. T. 7 . St. Petersburg: Nauka. P. 15–21 . [In Russian]
(Луферов А. Н . 1995. Род купальница — Trollius L. //
Сосудистые растения советского Дальнего Востока.
Т. 7. СПб.: Наука. С . 15–21).
Luferov A. N . 2004. A taxonomic synopsis of Ranunculaceae
of the Far East of Russia // Turczaninowia. Vol. 7, No 1.
P. 5–84. [In Russian with English abstract] (Луферов А. Н .
2004. Таксономический конспект лютиковых (Ranuncu-
laceae) Дальнего Востока России // Turczaninowia. Т. 7,
вып. 1. С. 5–84).
Luferov A. N., Erst A. S., Luferov D. N ., Shmakov A. I.,
Wang W. 2018. The genus Trollius (Ranunculaceae) in the
Russian Far East // Turczaninowia. Vol. 21, No 2. P. 110–
116. [In English with Russian abstract] (Луферов А. Н.,
Эрст А. С ., Луферов Д. Н., Шмаков А. И., Ванг В. 2018.
Род Trollius (Ranunculaceae) во флоре российского
Дальнего Востока // Turczaninowia. Т. 21, No 2. С . 110–
116). https://doi.org/10.14258/turczaninowia.21.2 .12
Malyschev L. I. 1965. Flora alpina montium Sajanensium Ori-
entalium. Mosqua; Leningrad: Nauka. 368 p. [In Russian]
(Малышев Л. И . 1965. Высокогорная флора Восточного
Саяна. М.; Л.: Наука. 368 с.).
Miyabe K. 1943. On the species of Trollius in Japan // Acta
Phytotax. Geobot. Vol. 13. P. 1 –16.
https://doi.org/10.18942/bunruichiri.KJ00002992544
Pool V. Ye. 2018. Image of Trollius vitalii Stepanov // Plantari-
um: open on-line atlas and key to plants and lichens of Rus-
sia and neighbouring countries. 2007–2019. (Пооль В. Е .
2018. Изображение Trollius vitalii Stepanov // Плантари-
ум: открытый онлайн атлас-определитель растений и
лишайников России и сопредельных стран. 2007–019).
https://www.plantarium.ru/page/image/id/553469.html
(Accessed 30.09 .2019).
Reverdatto V. V. 1943. Zametki o Trollius L. iz Krasnoyarskogo
kraya [Notes on Trollius L. in Krasnoyarsk Territory] //
Sist. Zametki Mater. Gerb. Krylova Tomsk. Gosud. Univ.
Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of Russia. I.Trollius chinensis
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
113
No 1. P. 1 –2. [In Russian with Latin diagnoses] (Ревер-
датто В. В . 1943. Заметки о Trollius L. из Красноярского
края // Сист. заметки по матер. Герб. Крылова Томск.
госуд. унив. No 1. С . 1–2).
Schipczinsky N. V. 1924. Ueber die geographische Verbei-
tung und den genetische Zusammenhang der Arten der
Gattung Trollius // Izv. Glavn. Bot. Sada RSFSR. Lenin-
grad. T. 23. P. 55–73. [In Russian with German abstract]
(Шипчинский Н. В. 1924. О географическом распро-
странении видов рода Trollius и о генетической их свя-
зи // Изв. Главн. бот. сада РСФСР. Т. 23. С . 55–73).
Schipczinsky N. V . 1937. Rod Kupalnitsa — Trollius L. [Genus
Globeflower — Trollius L.] // Flora URSS. T. 7. Mosqua;
Leningrad: Ed. Acad. Sci. URSS. P. 42–53. [In Russian]
(Шипчинский Н. В. 1937. Род Купальница — Trol-
lius L. // Флора СССР. T. 7. М .; Л.: Изд-во АН СССР.
С. 42–53).
Schmidt F. 1868. Reisen im Amur-Lande und auf der Insel Sa-
chalin // Мém. Acad. Imp. Sci. Pétersb. Sér. 7 . T. 12, No 2.
P. 1 –227.
Siplivinsky V. N. 1972. Genus Trollius L. in Asia boreali et
orientali // Novosti Sist. Vyssh. Rast. Vol. 9 . P. 163–182.
[In Russian with Latin diagnoses] (Сипливинский В. Н .
1972. Род Trollius L. на севере и востоке Азии // Новости
сист. высш. раст. Т. 9. С . 163–182).
Siplivinsky V. N. 1973. Notulae de flora Baicalensi, 1 // Novos-
ti Sist. Vyssh. Rast. Vol. 10. P. 345–361. [In Russian] (Си-
пливинский В. Н. 1973. Заметки о байкальской флоре,
1 // Новости сист. высш. раст. Т. 10. С . 345–361).
Stepanov N. V. 1994. Florogeneticheskii analiz (na primere
severo-vostochnoi chasti Zapadnogo Sayana) [Floroge-
netic analysis (using an example of northeastern part of the
Western Sayan)]. Pt. 1. Krasnoyarsk: State Univ. 108 p. [In
Russian with Latin descriptions] (Степанов Н. В. 1994.
Флорогенетический анализ (на примере северо-восточ-
ной части Западного Саяна). Ч . 1 . Красноярск: Красно-
яр. гос. ун-т . 108 с.).
Stepanov N. [V.] 2009. Image of Trollius vitalii Stepanov //
Plantarium: open on-line atlas and key to plants and li-
chens of Russia and neighbouring countries. 2007–2019.
(Степанов Н. [В.] 2009. Изображение Trollius vitalii Ste-
panov // Плантариум: открытый онлайн атлас-опреде-
литель растений и лишайников России и сопредельных
стран. 2007–2019). https://www.plantarium.ru/page/im-
age/id/33464.html (Accessed 30.09.2019).
Stepanov N. V. 2018. New species of Trollius L. (Ranuncula-
ceae) from Kuznetzk Alatau Mountain // Sist. Zametki
Mater. Gerb. Krylova Tomsk. Gosud. Univ. No 117. P. 40–
45. [In Russian with English summary and diagnosis]
(Степанов Н. В . Новый вид Trollius L. (Ranunculaceae)
из Кузнецкого Алатау // Сист. заметки по матер. Герб.
Крылова Томск. госуд. унив. No 117. P. 40–45). https://
doi.org/10.17223/20764103.117.5
Trollius vitalii Stepanov. 2007–2019 // Plantarium: open on-
line atlas and key to plants and lichens of Russia and neigh-
bouring countries. (Trollius vitalii Stepanov. 2007–2019
// Плантариум: открытый онлайн атлас-определитель
растений и лишайников России и сопредельных стран).
https://www.plantarium.ru/page/view/item/46508.html
(Accessed 30.09 .2019).
Turland N. J., Wiersema J. H ., Barrie F. R., Greuter W., Hawk-
sworth D. L., Herendeen P. S., Knapp S., Kusber W.-H., Li
D.-Z ., Marhold K., May T. W., McNeill J., Monro A. M.,
Prado J., Price M. J., Smith G. F. (eds.). 2018. International
Code of Nomenclature for algae, fungi, and plants (Shen-
zhen Code) adopted by the Nineteenth International Bo-
tanical Congress, Shenzhen, China, July 2017. Glashütten:
Koeltz Botanical Books. (Regnum Vegetabile. Vol. 159).
https://doi.org/10.12705/Code.2018
Volotovsky K. A. 1990. Trollius aldanensis Volot. (Ranuncu-
laceae) — species nova ex Jacutia australi // Novosti Sist.
Vyssh. Rast. Vol. 27. P. 65–68. [In Russian with Latin diag-
nosis] (Волотовский К. А . Trollius aldanensis Volot. (Ra-
nunculaceae) — новый вид из Южной Якутии // Ново-
сти сист. высш. раст. 1990. Т. 27 . С . 65–68).
Voroschilov V. N. 1982. Opredelitel rastenii sovetskogo Dal-
nego Vostoka [The guide of plants of the Soviet Far East].
Moscow: Nauka. 672 р. [In Russian] (Ворошилов В. Н .
1982. Определитель растений советского Дальнего Вос-
тока. М.: Наука. 672 с.).
M. M. Serebryanyi
Новости систематики высших растений | Том 50 | 2019
114
Новый вид Corydalis (Fumariaceae) из провинции Ганьсу (Китай)
A new species of Corydalis (Fumariaceae) from Gansu (China)
М. А. Михайлова
Ботанический институт им. В. Л. Комарова РАН
Гербарий высших растений
ул. Профессора Попова, 2, Санкт-Петербург, 197376, Россия
mmikhailova@binran.ru
М. А . Михайлова
Поступила в редакцию | Submitted: 24.09.2019
Принята к публикации | Accepted: 28.11.2019
M. A. Mikhailova
Komarov Botanical Institute, Russian Academy of Sciences
Herbarium of Higher Plants
Professora Popova Str., 2, St. Petersburg, 197376, Russia
mmikhailova@binran.ru
https://doi.org/10.31111/novitates/2019.50.115
Аннотация. Описан новый для науки вид Corydalis qilianshanica Mikhailova из секции Strictae (Fedde) Wendelbo. Мате-
риал собран на хребте Циляньшань (Рихтгофена), горная система Наньшаня (Северо-Западный Китай, провинция Гань-
су). От C. stricta Stephan ex DC. отличается сохранением значительного количества прошлогодних побегов, как правило,
ветвящимся соцветием, дважды перистыми листьями с вееровидными сегментами, крупными прикорневыми листьями,
а также местообитанием (растет на приречных скалах).
Ключевые слова: Corydalis, секция Strictae, новый вид, Китай, Ганьсу, Наньшань.
Abstract. A new species Corydalis qilianshanica Mikhailova (sect. Strictae (Fedde) Wendelbo) is described from Northwest
China, Gansu Province, Nanshan mountain system, Qilian Shan (Richthofen Range). The species differs from C. stricta Stephan
ex DC. by growth form with numerous persistent last year’s old stems, usually branched racemes, bipinnate leaves with flabel-
late segments, and larger basal leaves, as well as by rocky habitat.
Keywords: Corydalis, section Strictae, new species, China, Gansu, Nanshan.
Секция Strictae (Fedde) Wendelbo объединяет
45 видов ксерофильных хохлаток, из них 10 можно
встретить в китайской провинции Ганьсу (Zhang et
al., 2008). Все представители секции связаны с сухи-
ми каменистыми или скальными местообитаниями.
В 2014 году нам удалось побывать в провинции
Ганьсу на хребте Циляньшань (Рихтгофена) горной
системы Наньшаня, где была собрана хохлатка, ко-
торая по совокупности признаков не может быть от-
несена ни к одному из известных видов и описывает-
ся нами в качестве нового для науки таксона.
Corydalis qilianshanica Mikhailova, sp. nova.
—
Хохлатка циляньшаньская.
Perennial herb 60–70 cm, with caudex and thick
root, making a hanging mat of numerous last year’s
stems. Caudex densely covered with persistent bases of
last year’s stems and petioles. Stems with grooves and
ribs. Leaves bipinnate, with 4–5 pairs of flabellate seg-
ments. Basal leaves 27–35 сm long including petioles,
blades broadly ovate, 19–20 × 7–8 сm. Cauline leaves
smaller, 14–25 сm long. Racemes branched, many-flow-
ered. Bracts herbaceous, narrowly lanceolate, mucro-
nate at apex, lower ones 10–14 × 2 mm. Pedicels 5 mm.
Sepals scarious, irregularly triangular, 5–6 × 1.5–2 mm,
dentate, acuminate at apex. Corolla yellow, 15–17 mm
long, at the base 2 mm wide. Spur short, 2.5 mm. Nec-
tary does not reach the spur end by 1.5 mm. Outer pet-
als mucronulate, with dentate crest 1 mm tall. Capsule
linear, 17–19 × 2 mm, style 5–6 mm. Mature seeds un-
known. — Figs. 1: 2, 3; 2.
Holotype (Fig. 3): NW China, Gansu Province,
Nanshan mountain system, Qilian Shan Mts. (Rich-
thofen Range), NE macroslope, 60 km west of Zhangye,
Dongcha River valley, left bank of Dayekou River, cliffs
above the river, 2900 m, 10 VII 2014, М. А. Mikhailo-
va, A. V. Sochivko (LE: LE 01053110; isotypes —
LE 01064306–LE 01064310).
Affinity. The species differs from the related
C. stricta Stephan ex DC. by growth form with numer-
ous persistent old stems, usually branched racemes, bi-
pinnate leaves with flabellate segments (vs. tripinnate
with ovate segments), basal leaves 27–35 cm (vs. 12–16
cm) with broadly ovate blade 19–20 × 7–8 cm (vs. nar-
rowly ovate 9–12 × 2–3 cm), by dentate (vs. undulate)
crest of outer petals, as well as by rocky habitat.
Травянистый многолетник 60–70 см выс., с кау-
дексом и толстым корнем, сохраняет многочислен-
ные сухие прошлогодние стебли, свисающие вниз.
Каудекс густо покрыт основаниями прошлогодних
2019
50: 115–119
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
Рис. 1. Местообитание (1) и общий вид растений (2, 3) Corydalis qilianshanica.
Fig. 1. Habitat (1) and habit (2, 3) of Corydalis qilianshanica.
1
2
3
М. А . Михайлова
Новости систематики высших растений | Том 50 | 2019
116
Рис. 2. Corydalis qilianshanica.
a — цветок; b — чашелистик; с — плод; d — рыльце; e — соцветие; f — прикорневые листья.
Fig. 2. Corydalis qilianshanica.
a — flower; b — sepal; с — fruit; d — stigma; e — inflorescence; f — basal leaves.
а
с
d
b
e
f
16 mm
1
8
m
m
Новый вид Corydalis (Fumariaceae) из провинции Ганьсу (Китай)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
117
Рис. 3. Голотип Corydalis qilianshanica (LE 01053110).
Fig. 3. Holotype of Corydalis qilianshanica (LE 01053110).
М. А . Михайлова
Новости систематики высших растений | Том 50 | 2019
118
стеблей и черешков. Стебли бороздчато-ребристые.
Листья дважды перисторассеченные, с 4–5 парами
вееровидных сегментов. Прикорневые листья 27–35
см дл., включая черешок, листовые пластинки ши-
рокоовальные, 19–20 см дл., 7–8 см шир. Стеблевые
листья мельче, 14–25 см дл. Соцветие — многоцвет-
ковая кисть, ветвящаяся в основании. Прицветники
травянистые, узколанцетные, с заостренной верхуш-
кой, нижние 10–14 мм дл., 2 мм шир. Цветоножки 5
мм дл. Чашелистики пленчатые, неправильно тре-
угольные, 5–6 мм дл., 1.5–2 мм шир., зубчатые по
краю, часто с оттянутой верхушкой. Венчик желтый,
15–17 мм дл., в месте прикрепления цветоножки 2
мм шир. Шпорец короткий, 2.5 мм дл. Нектарник
не доходит до конца шпорца на 1–1.5 мм. Наружные
лепестки с небольшим острием, с зубчатым гребнем
1 мм выс. Коробочки линейные, 17–19 мм дл., 2 мм
шир., столбик 5–6 мм дл. Сведений о зрелых семе-
нахнет. — Рис.1:2,3;2.
Голотип (рис. 3): СЗ Китай, пров. Ганьсу, гор-
ная система Наньшань, хр. Циляньшань (Рихтго-
фена), северо-восточный масросклон, в 60 км к за-
паду от города Джанье (Чжанье), долина Донгча,
левый берег р. Даиекоу, скалы над рекой, 2900 м
над ур. м., 10 VII 2014, М. А. Михайлова, А. В. Со-
чивко (LE: LE 01053110; изотипы — LE 01064306–
LE 01064310).
Китай: Ганьсу. На отвесных скалах над рекой,
2900мнадур.м. — Рис.1:1.
Родство. От C. stricta Stephan ex DC. отлича-
ется формой роста с сохранением значительного ко-
личества прошлогодних побегов, как правило, вет-
вящимся соцветием, дважды перистыми листьями с
вееровидными сегментами (а не трижды перистыми
с сегментами овальной формы), прикорневыми ли-
стьями 27–35 см дл. (а не 12–16 см дл.) с широко-
овальной листовой пластинкой 19–20 см дл., 7–8 см
шир. (а не узкоовальной 9–12 см дл., 2–3 см шир.),
зубчатым, а не волнистым гребнем наружных ле-
пестков, а также скальным местообитанием.
Благодарности
Работа выполнена в рамках реализации государ-
ственного задания согласно Плану НИР Ботаниче-
ского института им. В. Л. Комарова РАН «Сосудистые
растения Евразии: систематика, флора, растительные
ресурсы» (No АААА-А19-119031290052-1). Автор
выражает искреннюю благодарность А. В. Сочивко
за помощь в подготовке иллюстраций к статье.
Литература | References
Zhang M. L ., Su Z. Y., Lidén M. 2008. Corydalis DC. // Flora
of China. Vol. 7 . Beijing: Science Press; St. Louis: Missouri
Botanical Garden Press. P. 295–428.
Новый вид Corydalis (Fumariaceae) из провинции Ганьсу (Китай)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
119
М. С. Князев
Поступила в редакцию | Submitted: 04.04.2019
Принята к публикации | Accepted: 27.11.2019
Ревизия секции Helmia рода Astragalus (Fabaceae)
Review of the genus Astragalus section Helmia (Fabaceae)
М. С. Князев
Ботанический сад Уральского отделения РАН
Лаборатория экспериментальной экологии и акклиматизации
растений
ул. 8 Марта, 202б, Екатеринбург, 620144, Россия
knyasev_botgard@mail.ru
M. S. Knyazev
Botanical Garden, Ural Branch of the Russian Academy of
Sciences
Laboratory of Experimental Ecology and Acclimatization of Plants
8 Marta Str., 202B, Yekaterinburg, 620144, Russia
knyasev_botgard@mail.ru
https://doi.org/10.31111/novitates/2019.50.120
Аннотация. Проведена ревизия секции Helmia Bunge рода Astragalus L. Обосновано выделение секции Helmia в узком
объеме. Ранг A. helmii Fisch. ex DC. var. tergeminus Knjaz., Kulikov et E. G. Philippov повышен до видового — A . tergeminus
(Knjaz., Kulikov et E. G. Philippov) Knjaz. Показано, что A. gregorii B. Fedtsch. et Basil. является приоритетным названием
для A. tuvinicus Timokhina. Обозначен эпитип A. permiensis C. A . Mey. ex Rupr. Приводится оригинальная карта распро-
странения и ключ для определения видов и подвидов Astragalus секции Helmia.
Ключевые слова: Astragalus, секция Helmia, Северная Евразия, систематика, распространение.
Abstract. A taxonomic review of species and intraspecific taxa of the Astragalus L. section Helmia Bunge is presented. We treat
the section Helmia in a traditional, narrow scope, including only 9 species and subspecies: A. helmii Fisch. ex DC., A. tergemi-
nus (Knjaz., Kulikov et E. G . Philippov) Knjaz., A. permiensis C. A . Mey. ex Rupr., A. depauperatus Ledeb. (= A. chakassiensis
Polozhij), A. kasachstanicus Golosk. subsp. kasachstanicus, A. kasachstanicus subsp. coloratus Knjaz., A. gregorii B. Fedtsch. et
Basil. (= A. tuvinicus Timokhina), A. heptapotamicus Sumnev., A. ionae Palib. ex Gontsch. et Popov. With regard to the other 16
species of sect. Helmia in its widest sense, as accepted in the monograph by D. Podlech and Sh. Zarre (2013), we believe it more
correct to attribute them to other sections. The rank of A. helmii var. tergeminus Knjaz., Kulikov et E. G. Philippov is raised to
the species, A. tergeminus (Knjaz., Kulikov et E. G. Philippov) Knjaz. It is shown that A. gregorii is a priority name of A. tuvini-
cus. The epitype of A. permiensis is designated. An identification key and a map of distribution for all species and subspecies of
Astragalus sect. Helmia are presented.
Keywords: Astragalus, section Helmia, North Eurasia, systematics, distribution.
Настоящая статья завершает цикл публикаций
(Knyazev et al., 2006; Knyazev, 2017), посвященных
таксономии секции Helmia Bunge рода Astragalus L.
Материалы и методы
Хорологические, таксономические, кариологи-
ческие исследования представителей секции Helmia
проводились нами более 20 лет (Knyazev, Kulikov,
2003; Knyazev et al., 2006, 2017; Knyazev, 2014). Со-
бранный за этот период гербарный материал хра-
нится в Гербарии Института экологии растений
и животных УрО РАН (SVER), некоторые дубле-
ты переданы в Гербарий Ботанического института
им. В. Л. Комарова РАН (LE). При подготовке ре-
визии проведено критическое исследование всех
представителей секции Helmia в гербарных кол-
лекциях LE, MW, MHA, TK, NS, NSK, SVER, PVB,
PERM, ORIS. В 2014–2019 гг. изучены в природе
экологические особенности и внутривидовая из-
менчивость следующих таксонов: A. depauperatus
Ledeb. (6 популяций в Южном Зауралье и в приени-
сейских степях), A. helmii Fisch. ex DC. subsp. helmii
(5 популяций в Заволжье, Предуралье, на Южном
Урале), A. tergeminus (Knjaz., Kulikov et E. G. Philip-
pov) Knjaz. (3 популяции в Губерлинских горах на
Южном Урале), A. permiensis C. A. Mey. ex Rupr.
(5 популяций, в том числе на шихане Тратау в Баш-
кортостане), A. kasachstanicus Golosk. subsp. kasach-
stanicus (1 популяция на р. Нура в Акмолинской обл.
Казахстана), A. kasachstanicus subsp. coloratus Knjaz.
(4 популяции в Карагандинской обл. Казахстана),
A. ionae Palib. ex Gontsch. et Popov (3 популяции
в Хакасии и близ Красноярска), A. heptapotamicus
Sumnev. (1 популяция на горном массиве Бугулы в
Карагандинской обл. Казахстана). В 2016–2019 гг.
по программе гранта РФФИ No 16-04-00895-а для
большей части таксонов секции Helmia s. str. вы-
полнены исследования полиморфизма интрона
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 120–131
trnL UAA и региона trnF–trnV хлоропластной ДНК.
Предварительные данные по рестриктному анали-
зу опубликованы в кратком сообщении (Knyazev,
Philippov, 2019). Общие данные об особенности по-
лиморфизма полных последовательностей этих
участков хп-ДНК приведены в итоговом отчете
гранта РФФИ No 16-04-00895-а; соответствующая
публикация участников проекта (М. С. Князев,
Д. А. Кривенко, Е. Г. Филиппов) находится на ста-
дии подготовки. Конкретные результаты этого ис-
следования являются коллективной интеллектуаль-
ной собственностью и до публикации в совместных
статьях не могут быть приведены в данной работе,
однако они учтены в ревизии секции Helmia.
Распространение видов на территории бывшего
СССР указывается по районам «Флоры СССР», для
обозначения которых использованы сокращения,
общепринятые в отечественной таксономической
литературе.
Результаты и обсуждение
С широкой трактовкой секции Helmia s. l., как она
рассматривается в монографии D. Podlech, Sh. Zarre
(2013), нельзя согласиться; в таком объеме ее гра-
ницы размыты, отграничение от секций Laguropsis
Bunge, Cytisodes Bunge, Trachycercis Bunge, Craccina
(Steven) Bunge и др. становится проблематичным;
различия между отдельными видами и их агрегата-
ми оказываются очень резкими, зачастую явно меж-
секционного уровня. Включение в секцию Helmia
многих вновь описанных или перенесение из других
секций ряда ранее принятых видов не вполне четко
аргументировано, а в ряде случаев ошибочно.
Так, A. cupulicalycinus S. B. Ho et Y. C. Ho, судя
по описанию и превосходному рисунку (Ho, 1993:
tab. 70, fig. 8–15), весьма близок к A. kazymbeticus
Saposhn. ex Sumnev. (секция Laguropsis) и, возмож-
но, является его поздним синонимом. Поскольку
Podlech, Zarre (2013) не объединяют секции Helmia
и Laguropsis, то A. cupulicalycinus следует отнести к
последней.
A. nikitinae B. Fedtsch. ex Gontsch. et Popov авто-
рами вида (Gontscharov, Popov, 1946) был отнесен к
секции Cytisodes. В секции Helmia этот вид смотрится
вполне чужеродным, резко отличаясь весьма длин-
ными, 7–10 мм дл., прицветниками (у остальных
представителей секции 1–5 мм дл.), 9–15-цветко-
выми соцветиями (а не 2–9 -, очень редко 10-цветко-
выми), полуоттопыренным опушением цветоносов
и листочков (у остальных представителей секции
опушение прижатое), слегка вздувающимися ча-
шечками. Представляется, что авторы вида более
корректно определили его таксономическое поло-
жение. В равной степени не выглядит естественным
перенесение A. macropetalus Schrenk и A. pendulipeta-
lus S. B. Ho et Z. H. Wu из секции Cytisodes в секцию
Helmia: для них характерны желтые цветки с «банду-
ровидным» флагом (на верхушке б. м. оттянутым, в
нижней части пластинки с заметным перехватом).
В секции Cytisodes эти два вида выглядят типично; в
секции Helmia s. str. видов с такой окраской цветков
и подобным строением флага нет.
Таксономическое положение A. persimilis Podlech
et L. R. Xu дискуссионно, но совершенно непонятно,
почему он был отнесен к секции Helmia, поскольку
важнейший для этой группы признак у него не вы-
ражен: прилистники не срастающиеся в раструб, а
лишь едва сросшиеся при основании с черешком.
Линейные серповидные поникающие бобы и весьма
мелкие (до 1 мм дл.) прицветники A. persimilis также
резко отличают этот вид от всех остальных предста-
вителей секции Helmia (даже в ее широком объеме)
и сближают с некоторыми видами секции Craccina.
A. efoliolatus Hand.-Mazz. также имеет неясное
таксономическое положение; он обладает уникаль-
ным комплексом признаков, не свойственным ти-
пичным представителям секции Helmia: линейными
однолисточковыми листьями, (почти) сидячими со-
цветиями (у всех остальных видов секции Helmia,
даже в ее широком объеме, ножки соцветий хорошо
развиты), мелкими (до 8 мм) фиолетовыми цветка-
ми, продолговатыми, слегка изогнутыми, прижато
опушенными, позднее почти голыми бобами. На
наш взгляд, этот вид заслуживает выделения в осо-
бую монотипную секцию.
Объединение олиготипной секции Chomutoviana
B. Fedtsch. с секцией Helmia представляется неудач-
ным. Характерные для представителей секции Cho-
mutoviana полудвугнездные или (почти) одногнезд-
ные бобы, короче чашечки или равные ей (около
10 мм дл.), отличают их на межсекционном уровне
от типичных представителей секции Helmia s. str.
(бобы вдвое превышают чашечку, двугнездные).
Секцию Chomutoviana следует сохранить, но, конеч-
но же, в измененном составе относительно приня-
того у S. B. Ho (1993). В нее естественно перенести
еще два вида из секции Helmia s. l.: A. burtschumen-
sis Saposhn. ex Sumnev. и A. eerqisiensis Z. Y. Chang,
L. R. Xu et Podlech — цветки у них фиолетовые, как
и у A. chomutowii B. Fedtsch., а бобы, по крайней мере
у A. burtschumensis, также одногнездные (у A. eerqi-
siensis бобы неизвестны). С другой стороны, A. wen-
suensis S. B. Ho, по всей видимости (Podlech, Zarre,
2013), очень близок или идентичен A. heptapotamicus
(типичному представителю секции Helmia s. str.),
тогда как A. arnoldii Hemsl. et H. Pearson (= A. monti-
Ревизия секции Helmia рода Astragalus (Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
121
cola P. C. Li et C. C. Ni) скорее должен быть отнесен
к секции Craccina. В измененном составе: A. chomu-
towii, A. tekessicus Bajtenov, A. burtschumensis, A. eerqi-
siensis — секция Chomutoviana представляет вполне
естественный таксон ранга секции; примечательно,
что ее ареал в таком составе компактный, охваты-
вающий горные районы северо-западного Китая и
Киргизию. Отмечаемое некоторое сходство состав-
ляющих ее видов с типичными представителями
секции Helmia s. str. может быть конвергентным.
A. terektensis Fisjun по совокупности признаков:
продолговатые, голые или скудно прижато опушен-
ные, глубокобороздчатые на брюшке бобы, длинные,
рыхлые кисти цветков, линейные листочки — впол-
не естественно включается в секцию Craccina. Так-
же, на наш взгляд, еще 5 видов Helmia s. l.: A. vladi-
mirii-komarovii B. Fedtsch., A. dshangartensis Sumnev.,
A. arnoldii, A. choshanbaoensis Podlech et L. R. Xu,
A. saichanensis Sanchir — проявляют более выражен-
ное сходство с представителями секции Craccina.
Характерные для них продолговатые, рыхлеющие
при плодах соцветия, относительно мелкие цветки
(10–15 мм дл.), продолговатые, б. ч. полудвугнезд-
ные или почти одногнездные бобы, сросшиеся в рас-
труб прилистники типичны для многих представи-
телей секции Craccina, а такие ее представители, как
A. filiformis (DC.) Poir. и A. scopaeformis Ledeb., также
почти «бесстебельные» и имеют густое опушение
бобов. Во всяком случае, объединение перечислен-
ных видов с типичными представителями секции
Helmia выглядит более искусственным, чем включе-
ние в секцию Craccina, возможно, в ранге подсекции.
Более обоснованным выглядит включение в сек-
цию Helmia s. l. видов A. lachnolobus Kovalevsk. et
Vved. и A. involutivus Sumnev. Морфологические осо-
бенности этих видов можно оценить как промежу-
точные между секциями Trachycercis и Helmia: ножки
соцветий равны листьям или их превышают (у ти-
пичных представителей секции Trachycercis значи-
тельно короче листьев); с другой стороны, листочки
у них сверху скудно, снизу рассеянно опушенные (у
типичных представителей секции Helmia опушение
листьев равномерное и весьма густое); у A. involu-
tivus чашечка в конце цветения слегка вздувается, а
опушение бобов со значительной примесью черных
волосков; у A. lachnolobus соцветие рыхловатое — эти
признаки сближают их с некоторыми видами сек-
ции Trachycercis. Кроме того, у всех типичных пред-
ставителей секции Helmia s. str. волоски на бобах от-
ходят от верхушек мелких бугорков (если удалить
волоски, проявляется мелкобугорчатая фактура
поверхности боба). Podlech, Zarre (2013) отметили
эту особенность у A. kasachstanicus, однако она б. м.
выражена и у остальных представителей секции в
ее узком объеме. У A. lachnolobus и A. involutivus та-
кой особенности нет. Таким образом, перенесение
A. lachnolobus и A. involutivus в секцию Helmia до-
пустимо, но основания для сохранения их в секции
Trachycercis также существенны.
Предложение Podlech, Zarre (2013) о включении
A. ionae в секцию Helmia представляется нам вполне
обоснованным: этот вид действительно весьма бли-
зок к типичным представителям этой группы, мор-
фологически не всегда надежно, особенно во время
цветения, может быть отделен от A. depauperatus.
Несомненно, к секции Helmia s. str. следует от-
нести A. gregorii B. Fedtsch. et Basil. Сами авторы
вида (Fedtschenko, Basilevskaya, 1930), как и после-
дующие авторы флористических и таксономических
обзоров (Yakovlev et al., 1996; Ulziykhutag, 2003;
Podlech, Zarre, 2013), относили этот вид к секции
Trachycercis. Однако характерный комплекс призна-
ков лектотипа и синтипа (LE!), а также описание со-
ответствуют типичным представителям секции Hel-
mia s. str.: растение почти бесстебельное, прижатое к
субстрату; прилистники на треть сросшиеся между
собой и до половины длины с черешком (в прото-
логе ошибочно указано, что они свободные); листья
собраны в розетки, листочки в числе 1–2 пар, с двух
сторон густо опушенные прижатыми двуконечными
волосками; ножки соцветий немного превышают ли-
стья, соцветие 2–3 -цветковое, почти зонтиковидное;
цветки белые, с пурпурным пятном на верхушке ло-
дочки; бобы вдвое превышают чашечку, продолго-
ватые, около 2 см дл., 3.5 мм шир., густо оттопырен-
но опушенные. У типичных представителей секции
Trachycercis ножки соцветий значительно короче ли-
стьев, бобы примерно равны чашечке, прилистники
не срастаются между собой и с черешком с форми-
рованием раструба, охватывающего побег.
Вероятно, объективные доказательства, под-
тверждающие тот или иной объем секции Helmia,
могут быть получены при ДНК-анализе, например
некоторых регионов хп-ДНК и ITS. Однако в насто-
ящее время проведение достаточно полного скри-
нинга полиморфизма ДНК упомянутых выше видов
вряд ли осуществимо. До подтверждения генетиче-
скими методами обратного, консервативный подход
с сохранением узкого объема секции Helmia пред-
ставляется более объективным.
Обзор секции Helmia Bunge s. str.
Astragalus L. 1753, Sp. Pl.: 755.
Subgen. Cercidothrix Bunge, 1868, Mém. Acad.
Imp. Sci. St.-Pétersb., sér. 7, 11, 16: 94 (Gen. Astragali
Geront. 1).
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
122
Sect. Helmia Bunge, 1868, Mém. Acad. Imp. Sci.
St.-Pétersb., sér. 7, 11, 16: 111 (Gen. Astragali Geront.
1); Гонч. и Попов, 1946, Фл. СССР, 12: 545; Абдулл.
1981, Опред. раст. Ср. Азии, 6: 229; Л. И. Василье-
ва, 1987, Фл. европ. части СССР, 6: 70; Выдрина,
1994, Фл. Сиб. 9: 59; Yakovlev et al. 1996, Legum.
North. Euras.: 154, p. max. p., excl. A. krascheninniko-
vii; Podlech, Zarre, 2013, Taxon. Rev. Gen. Astragalus:
2025, p. min. p.
Typus: Astragalus helmii Fisch. ex DC.
Включаемые виды: A. helmii Fisch. ex DC.,
A. tergeminus (Knjaz., Kulikov et E. G. Philippov)
Knjaz., A. permiensis C. A. Mey. ex Rupr., A. depaupe-
ratus Ledeb. (incl. A. chakassiensis Polozhij), A. kasach-
stanicus Golosk., A. gregorii B. Fedtsch. et Basil. (incl.
A. tuvinicus Timokhina), A. heptapotamicus Sumnev.
(incl. A. polakovii Popov, incl. A. wensuensis S. B. Ho),
A. ionae Palib. ex Gontsch. et Popov.
1. A. depauperatus Ledeb. 1831, Fl. Alt. 3: 314; Кры-
лов, 1933, Фл. Зап. Сиб. 7: 1681; Гонч. и Попов, 1946,
Фл. СССР, 12: 546; Гамаюн. и Фисюн, 1961, Фл. Ка-
захст. 5: 216; Выдрина, 1994, Фл. Сиб. 9: 59; Yakovlev
et al. 1996, Legum. North. Euras.: 154; А. Л. Эбель, 2012,
Консп. фл. сев.-зап. части Алтае-Саян. пров.: 273,
p. p.; Podlech, Zarre, 2013, Taxon. Rev. Gen. Astragalus:
2031; Княз. 2017, Новости сист. высш. раст. 48: 96,
рис. 2, 6. — Lectotypus (Podlech, Sytin, 1996: 156):
«Loktewsk, Bunge, Hb. Meyer» (LE: LE 01055626!;
isolectotypi — P, ?MSB, ?W).
= A. eriolobus Bunge, 1835, Mém. Prés. Acad. Imp.
Sci. St.-Pétersb. 2: 591.
—
Lectotypus (Podlech,
Sytin, 1996: 156): «[Altai orientalis] prope Metallofodi-
nam Loktewsk, 1832, A. von Bunge» (LE!).
= A. chakassiensis Polozhij, 1954 [publ. 1955], Сист.
зам. Герб. Томск. унив. 77–78: 1; Положий, 1960,
Фл. Краснояр. края, 6: 37, p. p.
—
Typus: «Крас-
ноярский край, Хакасия, северная оконечность гор
Сак-сары между рр. Ниней и Камыштой; гора Сын,
южный склон, с цв., 27 V 1927, В. В. Ревердатто»
(holotypus — TK!).
—
A. helmii auct. non Fisch. ex DC.: Гонч. и Попов,
1946, цит. соч.: 548, p. p., quoad pl. ex Kasachstania; Га-
маюн. и Фисюн, 1961, цит. соч.: 218, p. p., quoad pl. ex
prov. Koktschetau et fl. Irtysch; Выдрина, 1994, цит.
соч.: 211.
Распространение и экология. Верх.-
Тоб. (Россия: Республика Башкортостан — юго-вос-
ток, Челябинская обл.
—
юг, Оренбургская обл.
—
юго-восток, Курганская обл.
—
с. Усть-Уйское;
Казахстан: Костанайская обл.
—
по р. Тобол), Ирт.
(Казахстан: Акмолинская обл. — Кокшетауский мел-
косопочник; Восточно-Казахстанская обл.
—
юго-
восток), Алт. (Россия: Алтайский край — юго-запад,
Республика Алтай — Чуйская степь и по р. Аргут;
Казахстан: Восточно-Казахстанская обл.
—
восток),
Анг.-Саян. (Россия: республики Хакасия и Тыва,
Красноярский край — юг приенисейских степей). —
Рис.: 1.
—
В петрофитных степях, в разреженных
растительных сообществах, на различных подстила-
ющих горных породах, в том числе на известняках,
доломитах, мергелях. Цв. V–VI(VIII).
Изученные образцы: Приложение 1 (см.
сайт издания: www.binran.ru/journals/novitates/).
2n = 32: Челябинская обл., Кизильский р-н, гора
Острая (Knyazev et al., 2006).
Указания на более широкое распространение на
юге Красноярского края (Polozhij, 1960; Cherepnin,
1963; Yakovlev et al., 1996) нуждаются в уточнении:
многие изученные нами образцы (LE, NS, NSK,
TK), ранее определенные как A. depauperatus, в дей-
ствительности относятся к A. ionae. По результатам
наших исследований, б. м. типичный A. depaupera-
tus распространен в южной части приенисейских
степей, тогда как севернее линии с. Ефремкино —
пос. Июс — пос. Первомайское замещается на A. io-
nae. Указания на более широкое распространение
A. depauperatus в Северном Казахстане (Knyazev et
al., 2006; Knyazev, 2017) необходимо скорректиро-
вать: ряд повторно изученных образцов был пере-
определен как A. kasachstanicus и A. heptapotamicus.
Тем не менее, в Кокшетауском мелкосопочнике
A. depauperatus — единственный вид секции Helmia;
также он спорадически встречается в Восточно-Ка-
захстанской обл. Казахстана. Все указания на рас-
пространение в Западной Монголии (Yakovlev et
al., 1996; Ulziykhutag, 2003) относятся к A. gregorii
(= A. tuvinicus).
A. depauperatus из Хакасии с более крупными
цветками и более узкими листочками А. В. Положий
(Polozhij, 1954) описала как A. chakassiensis. Одна-
ко, как отмечали другие исследователи, например
Л. М. Черепнин (Cherepnin, 1963), предложенные
Положий отличительные признаки «не работают».
По нашей оценке, хакасские образцы A. depaupe-
ratus s. l. в среднем отличаются более узкими ли-
сточками и их бóльшим числом: у некоторых осо-
бей в числе 5–6 пар; однако подобные особенности,
пусть как редкое исключение, отмечались нами и в
других частях ареала, например в Зауралье. Воз-
можно, A. chakassiensis представляет одну из форм
«гибридного роя», возникшего в процессе гибриди-
зации A. depauperatus × A. ionae. Однако, поскольку
A. ionae, в свою очередь, может быть гибридогенным
таксоном (A. depauperatus × ?A. angarensis) (Popov,
1949), представляется излишним придавать ка-
Ревизия секции Helmia рода Astragalus (Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
123
кой-либо самостоятельный таксономический статус
одному из вариантов вторичной гибридизации.
2. A. gregorii B. Fedtsch. et Basil. 1930, в Грум-
Гржим., Зап. Монголия и Урянх. край, 3, 2: 815;
Грубов, 1955, Консп. фл. МНР: 184; Санчир, 1982,
в Грубов, Опред. раст. Монг.: 162; Н. Улзийх. 1982,
Тр. Инст. бот. АН МНР, 8: 34; Грубов, 1984, Ново-
сти. сист. высш. раст. 21: 207; Yakovlev et al. 1996,
Legum. North. Euras.: 242. ≡ A. brevifolius subsp. gre-
gorii (B. Fedtsch. et Basil.) N. Ulziykh. 2003, Бобовые
Монголии: 195.
—
Lectotypus (Podlech, Sytin,
1996: 157): «Plantae a G. E. Grum-Grjimailo collectae.
Mongolia occidentalis. Склоны Китайского Алтая, оз.
Даин-гол, 28 VI 1903» (LE: LE 01018340!).
= A. tuvinicus Timochina, 1978, Сист. геогр. раст.
Сибири: 8; Выдрина, 1994, Фл. Сиб. 9: 61; Podlech,
Zarre, 2013, Taxon. Rev. Gen. Astragalus: 2043. —
Ty-
pus: «Тувинская АССР, Эрзинский р-н, окр. оз. Эр-
зин, 17 VII 1972, С. Тимохина, М. Сакович», цв., пл.
(holotypus — NS: NS0000460!).
—
A. depauperatus auct. non Ledeb.: Санчир, 1982,
в Грубов, Опред. раст. Монг.: 163; C. Y. Yang, 1985,
Claves pl. Xinjiang, 3: 157; Н. Улзийх. и Губанов, 1987,
Бюлл. Моск. общ. испыт. прир., отд. биол. 92, 5: 116;
Yakovlev et al. 1996, Legum. North. Euras.: 154, p.
Рис. Распространение представителей секции Helmia рода Astragalus.
1 — A . depauperatus; 2 — A . gregorii; 3 — A. helmii; 4 — A . heptapotamicus; 5 — A . ionae (исключая находку на р. Ангара); 6 —
A. kasachstanicus subsp. kasachstanicus; 7 — A . kasachstanicus subsp. coloratus; 8 — A . permiensis var. permiensis; 9 — A . permiensis
var. sacrimontis; 10 — A. tergeminus. «Классические местонахождения» таксонов показаны стрелками.
Fig. Distribution of Astragalus sect. Helmia.
1 — A . depauperatus; 2 — A . gregorii; 3 — A . helmii; 4 — A. heptapotamicus; 5 — A . ionae (excluding the finding at the Angara River);
6 — A . kasachstanicus subsp. kasachstanicus; 7 — A . kasachstanicus subsp. coloratus; 8 — A . permiensis var. permiensis; 9 — A . per-
miensis var. sacrimontis; 10 — A . tergeminus. «Loci classici» of the taxa are indicated by arrows.
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
124
min. p., quoad pl. ex Mongolia; Н. Улзийх. 2000, Раст.
Центр. Азии, 8в: 116, p. p., quoad pl. ex Mongolia; он
же, 2003, Бобовые Монголии: 188.
—
A. kasachstanicus auct. non Golosk.: Н. Улзийх.
и Губанов, 1987, Бюлл. Моск. общ. испыт. прир., отд.
биол. 92, 5: 113; Yakovlev et al. 1996, Legum. North.
Euras.: 155, p. min. p., quoad pl. ex Mongolia; Н. Ул-
зийх. 2000, Раст. Центр. Азии, 8в: 117, p. p., quoad
pl. ex Mongolia; он же, 2003, Бобовые Монголии:
189.
Распространение и экология. Анг.-
Саян. (Россия: Республика Тыва), Монг. (Монголия:
Котловина Больших Озер, хр. Хангай, Джунгарская
Гоби), Дж.-Кашг. (Монголия: Монгольский Алтай;
Китай: Джунгарский Алтай — «Toli»).
—
Рис.: 2.
—
В горных щебнистых степях, в разреженных расти-
тельных сообществах, на различных горных поро-
дах, на высоте 500–2500 м над ур. м.
Изученные образцы: Приложение 2 (см.
сайт издания: www.binran.ru/journals/novitates/).
Нам не удалось найти четких различий между
A. gregorii и A. tuvinicus — отмечаются лишь количе-
ственные. Лектотип и синтип A. gregorii (LE!) пред-
ставляют собой более мелкие растения с меньшим
числом пар листочков, чем голотип, изотип и пара-
тип A. tuvinicus (NS!, NSK!). Однако эти различия
могут быть объяснены менее благоприятными усло-
виями обитания в locus classicus A. gregorii (типовой
материал которого собран на высоте 2300–2400 м
над ур. м.), чем в locus classicus A. tuvinicus (близ оз.
Эрзин на высоте около 1000 м над ур. м.). Среди ис-
следованных образцов представлен весь спектр пе-
рехода от угнетенных, мелких растений, идентичных
или весьма близких по облику к типу A. gregorii, до
более развитых и мезофильных — соответствующих
типу A. tuvinicus. На основании проведенного иссле-
дования следует рассматривать A. tuvinicus как позд-
ний синоним A. gregorii.
Все изученные нами образцы из Монголии (LE),
ранее определенные как A. kasachstanicus, A. depau-
peratus и A. tuvinicus, следует отнести к A. gregorii.
3. A. helmii Fisch. ex DC. 1825, Prodr. 2: 301; Гонч.
и Попов, 1946, Фл. СССР, 12: 548, p. max. p.; Yakov-
lev et al. 1996, Legum. North. Euras.: 154, p. max. p.;
Княз. и др. 2006, Бот. журн. 91, 2: 283; Рябинина и
Княз. 2009, Опред. сосуд. раст. Оренб. обл.: 385, p. p.,
excl. var. tergeminus Knjaz., Kulikov et E. G. Philip-
pov; Podlech, Zarre, 2013, Taxon. Rev. Gen. Astragalus:
2034, p. p.; Княз. 2017, Новости сист. высш. раст. 48:
92, рис. 2, 3. — Typus: «Ural Australis, ad metallifo-
dinas Woskressenskoi, Helm» (holotypus — G -DC; iso-
typi — LE: LE 01036384!, H).
Распространение и экология. Волж.-
Дон. (Россия: Ульяновская обл.
—
с. Паньшино Ра-
дищевского р-на и урочище Форфос; Самарская
обл.
—
Жигулёвские горы), Заволж. (Россия: Са-
марская обл.
—
север; Оренбургская обл.
—
северо-
запад; Республика Башкортостан — лесостепная и
степная зоны к югу от 54°40′ с. ш.; Республика Та-
тарстан — юго-восток), Волж.-Кам. (Россия: Респу-
блика Башкортостан — гора Гладкая между селами
Сальевка и Ярославка Дуванского р-на; по р. Белая
в Бурзянском р-не). — Рис.: 3. — На скалах, по степ-
ным щебнистым склонам, обычно на известняках,
доломитах, мергелях, реже на гипсах.
Изученные образцы: Приложение 3 (см.
сайт издания: www.binran.ru/journals/novitates/).
2n = 16: Южный Урал, шихан Куштау северо-за-
паднее г. Стерлитамак (Gorchakovsky, Zueva, 1982);
шихан между селами Ярославка и Сальевка (Knya-
zev et al., 2006).
Указания для Челябинской обл. и Западной Си-
бири (Yakovlev et al., 1996; Knyazev et al., 2006) от-
носятся к A. depauperatus, для Среднего и Северно-
го Урала (Yakovlev et al., 1996) — к A. permiensis, для
Казахстана (Gamajunova, Fisjun, 1961; Abdullaeva,
1981; Yakovlev et al., 1996) — к A. tergeminus и A. de-
pauperatus.
Генетические исследования этого вида по участ-
кам trnL–F и trnF–trnV хлоропластной ДНК
(Knyazev, Philippov, 2019) показали обособленность
A. helmii от остальных изученных представителей
секции Helmia. Учитывая диплоидный кариотип
(2n = 16), а следовательно, вероятную близость к
предковому виду секции, можно предположить, что
A. helmii представляет независимую (сестринскую)
линию эволюционного развития секции. По морфо-
логическим особенностям A. helmii также обособлен
от остальных родственных видов: в частности, бобы
у него самые мелкие среди близких видов (10–15 мм
дл., 2.5–3 мм шир.).
4. A. heptapotamicus Sumnev. 1933, Сист. зам.
Герб. Томск. унив. 5–6: 7; Гонч. и Попов, 1946, Фл.
СССР, 12: 547; Гамаюн. и Фисюн, 1961, Фл. Ка-
захст. 5: 217; Абдулл. 1981, Опред. раст. Ср. Азии, 6:
230; S. B. Ho, 1993, Fl. Reip. Pop. Sinicae, 42, 1: 281;
Podlech, Zarre, 2013, Taxon. Rev. Gen. Astragalus:
2035.
—
Lectotypus (Podlech, Sytin, 1996: 158):
«Kazakhstan, Dshungarsky Alatau, distr. Kopal, Sujun
Tube, 17 VI 1909, Lipsky» (LE: LE 00050767!; isolecto-
typi — LE 00050768–LE 00050771!).
=
A. polakovii Popov, 1947, Бот. мат. герб. Бот.
инст. АН СССР, 10: 6; Гонч. и Попов, 1946, Фл.
СССР, 12: 547, descr. ross.; Гамаюн. и Фисюн, 1961,
Ревизия секции Helmia рода Astragalus (Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
125
Фл. Казахст. 5: 217, excl. tab. —
Typus: «Джунгар-
ское Алатау, на р. Сархан, каменистые участки на
горе Суок-тау, 23 VII 1934, П. П. Поляков и Л. А. Ку-
приянова» (holotypus — LE: LE 00050765!).
= ?A. wensuensis S. B. Ho, 1983, Bull. Bot. Res.,
Harbin, 3 (1): 60. —
Typus: «Xinjiang, Wensu Xian,
Po Cheng Zi, Kuleikidali, 2100 m, 13 V 1978, Chen-
Shao Yu» (holotypus — BJM 78-0412; isotypus —
KUN).
Распространение и экология. Прибалх.
(Казахстан: Карагандинская обл.
—
юго-восток;
Восточно-Казахстанская обл.), Дж.-Тарб. (Казах-
стан: Восточно-Казахстанская и Алматинская обл.),
Тянь-Шан. (Киргизия: котловины озер Иссык-куль,
Сон-кёль), Дж.-Кашг. (Китай: Кашгария, Вост.
Тянь-Шань, Джунгария).
—
Рис.: 4.
—
На высотах
2000–2500 м над ур. м. в разреженных петрофитных
горных сообществах; 500–1000 м над ур. м. — в гор-
ных степях. Цв. IV–V.
Изученные образцы: Приложение 4 (см.
сайт издания: www.binran.ru/journals/novitates/).
A. heptapotamicus, особенно его крупнолистные
образцы (= A. polakovii Popov), не вполне четко отде-
ляется от A. gregorii — большей частью габитуально,
представляя собой подушковидный кустарничек, а
не распростертый полукустарничек; кроме того, от-
личается более короткими яйцевидными (а не лан-
цетными) прицветниками и в среднем более корот-
кими цветоножками. Некоторые изученные нами
образцы было невозможно однозначно отнести к
какому-либо из этих двух видов. Казалось бы, пра-
вильнее было бы отнести A. polakovii к синонимам
A. gregorii, однако locus classicus A. polakovii находит-
ся практически в центре ареала A. heptapotamicus —
сомнительно совместное обитание в Джунгарском
Алатау двух весьма близких видов; скорее следу-
ет предположить случайное появление отдельных
«особей-двойников» на фоне генетического сходства
родственных видов и общей значительной морфоло-
гической изменчивости.
5. A. ionae Palib. ex Gontsch. et Popov, 1946, Фл.
СССР, 12: 887; Попов, 1957, Фл. Ср. Сиб. 1: 334;
Положий, 1960, Фл. Краснояр. края, 6: 38; Череп-
нин, 1963, Флора южн. части Краснояр. края, 4:
128; Выдрина, 1994, Фл. Сиб. 9: 68; Podlech, Zarre,
2013, Taxon. Rev. Gen. Astragalus: 2037.
—
Typus:
«Экспедиция в Красноярский и Ачинский уезды
Енисейской губ., обрывы на берегу Божьего озе-
ра, 17 VII 1912, И. В. Кузнецов» (holotypus — LE:
LE 01051432!; isotypi — LE 01051433!, LE 01051434!).
—
A. chakassiensis auct. non Polozhij, 1954: Поло-
жий, 1960, Фл. Краснояр. края, 6: 37, p. p.
—
A. depauperatus auct. non Ledeb.: Положий,
1960, Фл. Краснояр. края, 6: 37, p. p.; Черепнин,
1963, Флора южн. части Краснояр. края, 4: 124, p. p.;
А. Л. Эбель, 2012, Консп. фл. сев.-зап. части Алтае-
Саян. пров.: 273, p. p., quoad pl. ex Khakassia.
Распространение и экология. Обск.
(Россия: Кемеровская обл.
—
на рр. Колба и Кия),
Анг.-Саян. (Россия: Республика Хакасия; Красно-
ярский край — север приенисейских степей; Ир-
кутская обл.
—
правобережье Ангары близ устья
р. Оса). — Рис.: 5. — По аллювию на склонах речных
и озерных террас, реже по степным склонам увалов,
на глинисто-щебнистых субстратах в разреженных
растительных сообществах. Цв. V–VI(VII).
Изученные образцы: Приложение 5 (см.
сайт издания: www.binran.ru/journals/novitates/).
2n = ?110–120. По нашему мнению, уникальное
число хромосом 2n = 110–120, установленное для
«A. depauperatus» из окрестностей оз. Иткуль в Ха-
касии (Numeri..., 1990), в действительности относит-
ся к A. ionae как вероятному стабилизировавшемуся
гибриду (амфиплоиду) A. depauperatus × A. anga-
rensis s. l. (Popov, 1949). Ваучерных образцов, для
которых определено 2n = 110–120, мы не видели, но
оз. Иткуль относится к району, где A. depauperatus,
типичный для южной Хакасии, в значительной сте-
пени замещен A. ionae (далее к северу встречается
только последний).
По особенностям регионов trnL–F и trnF–trnV
хлоропластной ДНК A. ionae (образцы из окрест-
ностей Красноярска) проявляет значительное сво-
еобразие, но укладывается в общую систему секции
Helmia, образуя общую кладу с A. permiensis и A. hep-
tapotamicus (ориг., неопубл.).
6. A. kasachstanicus Golosk. 1957, Бот. мат. Герб.
Бот. инст. АН СССР, 18: 111; Гамаюн. и Фисюн,
1961, Фл. Казахст. 5: 219, tab. 29, fig. 3, p. max. p., excl.
pl. ex Ulutau; Абдулл. 1981, Опред. раст. Ср. Азии, 6:
230, p. p.; Yakovlev et al. 1996, Legum. North. Euras.:
155, p. p., excl. pl. ex Dzhezkazgan et Mongolia; Княз.
и др. 2006, Бот. журн. 91, 2: 284, рис. 2, 3; Podlech,
Zarre, 2013, Taxon. Rev. Gen. Astragalus: 2038; Княз.
2017, Новости сист. высш. раст. 48: 89.
—
Typus:
«Центральный Казахстан, бассейн р. Кон, р. Жаксы-
Шад, мергелистые сопки Кзыл-Жар, по каменистым
обнажениям, 18 VI 1949, В. Голоскоков», пл. (holoty-
pus — LE: LE 00050988!; isotypi — LE 00050989!, AA).
—
A. heptapotamicus auct. non Sumnev.: Павлов,
1935, Фл. Центр. Казахст. 2: 394.
6a. A. kasachstanicus subsp. kasachstanicus.
Распространение и экология. Ирт.
(Казахстан: Костонайская обл.
—
юго-восток, Кара-
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
126
гандинская обл., Акмолинская обл. — юго-запад). —
Рис.: 6. — На основных породах различного состава,
в разреженных петрофитных сообществах.
Изученные образцы: Приложение 6 (см.
сайт издания: www.binran.ru/journals/novitates/).
Указания для Восточно-Казахстанской области
Казахстана (Yakovlev et al., 1996) относятся к A. hep-
tapotamicus и A. depauperatus, для Монголии (Yakov-
lev et al., 1996; Ulziykhutag, 2003) — к A. gregorii
(incl. A. tuvinicus).
6b. A. kasachstanicus subsp. coloratus Knjaz. 2017,
Новости сист. высш. раст. 48: 91, рис. 2, 1.
—
Ty-
pus: «Казахская ССР, Карагандинская обл., в 30 км
к юго-юго-востоку от ст. Жана-Арка, мелкосопочник
гор Кинеллы, 12 V 1958, А. Пономарёва», цв. (holo-
typus — LE: LE 00050992!).
Распространение и экология. Прибалх.
(Казахстан: Карагандинская обл.
—
между верх-
ним течением рек Сарысу и Нура и северным по-
бережьем оз. Балхаш).
—
Рис.: 7.
—
По щебнистым
участкам на высотах 300–1000 м над ур. м., изредка
на известняках, чаще на основных метаморфических
и изверженных подстилающих горных породах, в
весьма разреженных петрофитных сообществах. Цв.
V–VI.
Изученные образцы: Приложение 6 (см.
сайт издания: www.binran.ru/journals/novitates/).
В мае 2019 г. мы провели исследование этого
астрагала in situ во время цветения и в начале пло-
доношения в южной части ареала по трансекте 60 км
между ж.-д. ст. Киик и Басага. Исследования в при-
роде на массовом материале показали, что по разме-
рам цветков и бобов A. kasachstanicus subsp. coloratus
не отличается от типового подвида. С другой сторо-
ны, отмечена весьма постоянная пурпурно-фиоле-
товая окраска цветков — небольшая изменчивость
заключалась лишь в более или менее выраженном
фиолетовом оттенке. Такая окраска цветков не свой-
ственна другим видам секции, в частности, у A. ka-
sachstanicus subsp. kasachstanicus цветки белые, ро-
зовые, редко светло-пурпурные, но без фиолетового
оттенка. Если дальнейшие исследования покажут,
что пурпурно-фиолетовая окраска цветков посто-
янна в других частях ареала A. kasachstanicus subsp.
coloratus, это может быть основанием для рассмотре-
ния его как самостоятельного викарирующего вида.
7. A. permiensis C. A. Mey. ex Rupr. 27 IV 1850,
Bull. Cl. Phys.-Math. Acad. Imp. Sci. St.-Pétersb.
8, 18–19: 275; id. VIII 1850, Beitr. Pflanzenk. Russ.
Reiches, 7: 5, 55 (n° 63), descr. ampl.; id. 1854, Fl.
Bor.-Ural.: 4, 32, tab. 2; Рупр. 1854, Фл. Сев. Ура-
ла: 4, 34, табл. 2; Княз. 1994, Опред. сосуд. раст. Ср.
Урала: 281; он же, 2017, Новости сист. высш. раст.
48: 94; С. Овёснов, 1997, Консп. фл. Перм. обл.: 153;
Княз. и др. 2006, Бот. журн. 91, 2: 287, рис. 1, 1; Ка-
мелин и С. Овёснов, 2007, Илл. опред. раст. Перм.
края: 498; Podlech, Zarre, 2013, Taxon. Rev. Gen.
Astragalus: 2041. ≡ A. helmii Fisch. ex DC. var. per-
miensis (C. A. Mey. ex Rupr.) Korsh. 1898, Зап. Акад.
наук, физ.-мат. отд., сер. 8, 7, 1 (Tent. Fl. Ross. Or.):
115; Сюзев, 1912, Консп. фл. Урала: 181; Крылов,
1933, Фл. Зап. Сиб. 7: 1682; Говор. 1937, Фл. Урала:
354. —
Lectotypus (Podlech, Sytin, 1996): «Exped.
Uralensis, ad fl. Wischera (61° N), 4 VI 1847, Branth»
(LE: LE 01063105!; isolectotypi — LE 01063102–
01063104!, LE 01063106!, LE 01063107!); epitypus
(hic designatus): LE: LE 01063102!
—
A. helmii auct. non Fisch. ex DC.: Гонч. и По-
пов, 1946, Фл. СССР, 12: 548, p. p.; Пономарёв, 1951,
Изв. естеств.-науч. инст. Перм. гос. унив. 13, 23: 244;
Л. И. Васильева, 1987, Фл. европ. части СССР, 6: 70,
p. min. p.; Yakovlev et al. 1996, Legum. North. Euras.:
154, p. min. p.
Название A. permiensis было обнародовано в
1850 г. в двух публикациях с одинаковым названи-
ем: «Ueber die Verbreitung der Pflanzen im nördlisch-
en Ural» (Ruprecht, 1850a, b). По всей видимости,
первой вышла короткая статья в журнале «Bulletin
de la classe physico-mathématique de l’Academie Im-
périale des sciences de St.-Pétersbourg» (в конце сдво-
енного выпуска 18–19 есть дата 27 апреля 1850 г.).
Сведений об A. permiensis в ней немного, однако до-
статочно, чтобы считать его обнародование действи-
тельным: название, краткое сравнение с наиболее
близким A. helmii Fisch. ex DC. на немецком языке, а
также место и две даты сбора (река Вишера, 4 и 7 VI
1847). Вторая публикация — в серии «Beiträge zur
Pflanzenkunde des Russischen Reiches» — вышла, по
всей вероятности, позднее — в августе того же года
(см. Stafleu, Cowan, 1983: 995); в ней воспроизведен
весь текст вышеупомянутой статьи, добавлены под-
робные описания маршрутов экспедиции Гофмана и
полный конспект видов; здесь дано весьма подроб-
ное описание A. permiensis на латыни и немецком,
выполненное К. А. Мейером (C. A. Meyer). Полная
версия работы с небольшими дополнениями (3 та-
блицы иллюстраций) была вновь опубликована в
1854 г. (Puprecht, 1854a) одновременно с ее перево-
дом на русский язык (Puprecht, 1854b); в этих пу-
бликациях помещен хороший, узнаваемый рисунок
A. permiensis.
А. К. Сытин и D. Podlech (Podlech, Sytin, 1996)
обозначили в качестве лектотипа A. permiensis сбор
Бранта от 4 VI 1847. Конкретный лист указан сле-
дующим образом: «sheet marked as lectotypus».
Ревизия секции Helmia рода Astragalus (Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
127
Очевидно, авторы имели в виду лист с пометкой
Р. В. Камелина «Lectotypus» (LE 01063105). На этом
экземпляре нет ни цветков, ни плодов, которые со-
вершенно необходимы для точного определения
астрагалов, поэтому мы обозначаем один из изо-
типов — гербарный образец из той же серии сборов
с сохранившимися цветками и незрелыми бобами
(LE 01063102) — в качестве эпитипа A. permiensis.
7a. A. permiensis var. permiensis.
Распространение и экология. Волж.-
Кам. (Россия: Пермский край — реки Вишера и
Чусовая; Свердловская обл.
—
р. Чусовая), Обск.
(Свердловская обл. — р. Тура). — Рис.: 8. — На усту-
пах и в расщелинах известняковых скал, редко на
осыпях у их подножья.
2n = 64: Северный и Средний Урал (Gorcha-
kovsky, Zueva, 1982; Knyazev et al., 2006).
Изученные образцы: Приложение 7 (см.
сайт издания: www.binran.ru/journals/novitates/).
7b. A. permiensis var. sacrimontis Knjaz. 2017,
Новости сист. высш. раст. 48: 95, рис. 2, 5.
—
Ty-
pus: «Башкирская АССР, Стерлитамакский район,
г. Шихан 6 км к юго-востоку от г. Стерлитамак, на
известняковых обнажениях, 16 VI 1960, П. Л. Горча-
ковский», цв., незрелые бобы (holotypus — SVER!;
isotypus — LE: LE 01039413!).
От типовой разновидности отличается опуше-
нием бобов извилистыми, спутанными в прядки
волосками (а не почти прямыми, не спутанными),
а также зубцами чашечек, не удлиняющимися при
плодах.
Распространение и экология. Заволж.
(Россия: Республика Башкортостан — шихан Тра-
тау к юго-востоку от г. Стерлитамак).
—
Рис.: 9.
—
По склонам в петрофитной степи, реже по уступам
и расщелинам известняковых обнажений. Приме-
чательно, что в пределах шихана Тратау из предста-
вителей секции распространен только A. permiensis
var. sacrimontis; здесь не встречается не только типо-
вая разновидность A. permiensis, но и родственный
A. helmii, хотя последний очень характерен в тех же
сообществах на более северных шиханах Юрактау и
Куштау.
Изученные образцы: Приложение 7 (см.
сайт издания: www.binran.ru/journals/novitates/).
Мы предполагали (Knyazev, 2017; Knyazev et
al., 2017) гибридное происхождение A. permiensis
(A. helmii × A. depauperatus?); однако по особенно-
стям участков trnL–F и trnF–trnV хлоропластной
ДНК (Knyazev, Philippov, 2019) A. permiensis четко
отличается от всех видов секции и несколько бли-
же к A. heptapotamicus. Таким образом, если A. per-
miensis s. l. и гибрид, то материнский или оба его
родительских вида, возможно, уже вымерли. Резко
дизъюнктивный ареал A. permiensis, и особенно ан-
клав его ареала на горе Тратау, окруженный место-
нахождениями A. helmii, позволяет предполагать,
что A. permiensis s. l. представляет более древний эле-
мент флоры Урала, в настоящее время практически
вытесненный более активными родственными ви-
дами.
8. Astragalus tergeminus (Knjaz.,
Kulikov et
E. G. Philippov) Knjaz., comb. et stat. nov.
≡ A. helmii Fisch. ex DC. var. tergeminus Knjaz., Ku-
likov et E. G. Philippov, 2006, Бот. журн. 91, 2: 283,
рис. 2, 2; Рябинина и Княз. 2009, Опред. сосуд. раст.
Оренб. обл.: 385, tab. 76, fig. 2; Podlech, Zarre, 2013,
Taxon. Rev. Gen. Astragalus: 2035. ≡ A. helmii subsp.
tergeminus (Knjaz., Kulikov et E. G. Philippov) Knjaz.
2017, Новости сист. высш. раст. 48: 93.
—
Typus:
«Оренбургская обл.,
Гайский р-н, Губерлинские
горы, на южном склоне сопки “Змеиные горы”, 9 VI
1978, Н. П. Салмина, В. Н. Зуева», пл. (holotypus —
LE: LE 01036382!; isotypus — SVER!).
—
A. helmii auct. non Fisch. ex DC.: Гонч. и По-
пов, 1946, Фл. СССР, 12: 548, p. p., quoad pl. ex Ka-
sachstania; Гамаюн. и Фисюн, 1961, Фл. Казахст. 5:
218, p. p., quoad pl. ex Aktobe prov. et mont. Ulutau;
Абдулл. 1981, Опред. раст. Ср. Азии, 6: 229; Yakovlev
et al. 1996, Legum. North. Euras.: 154, p. p., quoad pl. ex
Dzhezkazgan prov.
—
A. kasachstanicus auct. non Golosk.: Гамаюн. и
Фисюн, 1961, цит. соч.: 219, p. min. p., quoad pl. ex
mont. Ulutau.
Распространение и экология. Верх.-
Тоб. (Россия: Оренбургская обл.: юго-восток; Казах-
стан: Актобинская обл.
—
север), Арало-Касп. (Ка-
захстан: Карагандинская обл., горы Улутау). — Рис.:
10. — По петрофитным степям на различных подсти-
лающих породах, но избегает известняков и доломи-
тов. Цв. V–VI.
Изученные образцы: Приложение 8 (см.
сайт издания: www.binran.ru/journals/novitates/).
2n = 16: Южный Урал, Оренбургская обл., Губер-
линские горы (Gorchakovsky, Zueva, 1982; Knyazev
et al., 2006).
По морфологическим признакам A. tergeminus за-
нимает промежуточное положение между A. helmii и
A. kasachstanicus, но по особенностям регионов trnL–F
и trnF–trnV хлоропластной ДНК резко отличается от
первого (Knyazev, Philippov, 2019) и близок к послед-
нему. Поскольку хлоропластная ДНК наследуется у
цветковых растений по материнской линии, можно
было бы предположить, что A. tergeminus представ-
ляет стабилизировавшийся гибрид A. helmii × A. ka-
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
128
sachstanicus, где материнским видом был последний.
Однако для подобного гибрида следовало бы ожидать
полиплоидный кариотип, тогда как A. tergeminus — ди-
плоид (Knyazev et al., 2006). Поэтому более вероятно,
что A. tergeminus произошел непосредственно от A. ka-
sachstanicus, а его сходство с A. helmii конвергентно.
Сравнение видов и подвидов Astragalus секции
Helmia приведено ниже в ключе — это переработанная
версия ранее опубликованного варианта (Knyazev et
al., 2017).
Ключ для определения видов и подвидов Astragalus
sect. Helmia
1. Ось соцветия с 5–10 прицветниками (поскольку 1–3
верхних цветка обычно не развиваются, фактически
соцветие 5–7-цветковое) ..................................................... 2.
+ Ось соцветия с 1–4 прицветниками (соцветие
1–4 -цветковое) ........................................................................ 4.
2. Наиболее развитые листья с 3–4(5) парами листочков;
конечный листочек, хотя бы у некоторых листьев, на 1⁄4
длиннее и шире наиболее развитых боковых листоч-
ков. Цветки белые или розоватые. Бобы ромбически-
эллиптические, 4–6 мм шир. ................... 8. A . tergeminus.
+ Наиболее развитые листья с 5–7 (редко с 8–10) пара-
ми листочков; конечный листочек примерно равен или
несколько меньше боковых. Цветки молочно-белые,
кремовые. Бобы продолговатые или эллиптические,
2.5 –3 мм шир. ........................................................................... 3.
3. Бобы продолговатые, 15–25 мм дл., 2.5–3 мм шир.,
опушены оттопыренными, полуоттопыренными белы-
ми волосками около 1 мм дл. с примесью прижатых
белых или черных волосков. Листочки сверху зеленые,
рассеянно прижато опушенные двуконечными воло-
сками, ориентированными параллельно оси листочка,
так что волоски отстоят друг от друга на 2–3 и более
своей ширины ......................................................... 5. A . ionae.
+ Бобы эллиптические, 10–15 мм дл., 2.5–3 мм шир.,
опушены более длинными, 1–2 мм дл., оттопыренными
белыми волосками, отчасти отогнутыми верхушками
к основанию боба, спутанными в прядки. Обычно (ис-
ключая теневые формы растений) листочки очень гу-
сто опушенные (серебристые), так что волоски распо-
ложены без промежутков или лишь немного (на 1–1.5
своей ширины) отстоят друг от друга ........... 3. A . helmii.
++ Иное сочетание признаков: бобы 3–4(4.5) мм шир.,
продолговатые, ланцетные, но опушены длинными
(1–2 мм дл.) волосками ........................................................ 7.
4. Бобы 5–8 мм шир., ромбически-эллиптические, весьма
густо опушены оттопыренными, отчасти отогнутыми
назад (к основанию боба), извилистыми и спутанны-
ми в прядки волосками до 2 мм дл. Соцветия зонтико-
видные, 1–3-цветковые. Листья 1–3-парные; хотя бы у
некоторых листьев верхний листочек на 1⁄4 длиннее и
шире наиболее развитых боковых листочков .............. 5.
+ Бобы 3–4 мм шир., продолговатые, ланцетные, обычно
менее густо опушены оттопыренными и полуоттопырен-
ными волосками. Соцветия чаще 4-цветковые. Листья
чаще 4-парные; конечный листочек примерно равен или
несколько мельче наиболее развитых боковых ............. 6 .
5. Цветки белые, розовые, редко светло-пурпурные. Опу-
шение бобов белое .......................................................................
......... .......... ........ 6a. A . kasachstanicus subsp. kasachstanicus.
+ Цветки пурпурно-фиолетовые. Опушение бобов пер-
воначально белое, затем зеленоватое или желтоватое ...
......... .......... .......... ........
6b. A . kasachstanicus subsp. coloratus.
6. Подушковидное растение (многолетние побеги б. м .
прижаты друг к другу, веерообразно расходятся вверх
и косо в стороны, оканчиваясь на верхушках тесно
сближенными розетками). Наиболее развитые листья
с 4 парами эллиптических, обратнояйцевидных, обыч-
но очень мелких листочков. Соцветие почти зонтико-
видное; ось соцветия 1–4 мм дл., несет 1–4(5) яйце-
видных прицветников; цветки белые или розоватые,
с пурпурным (в гербарии синим) пятном на верхуш-
ке лодочки. Бобы ланцетные, 15–20 мм дл., 3–3 .5 мм
шир., обычно слегка серповидно изогнутые ......................
......... .......... .......... .......... .......... .......... .........
4. A . heptapotamicus.
+ Растения б. м . дернистые, но не подушковидные: мно-
голетние побеги рыхло расположены и распростерты
по субстрату. Наиболее развитые листья с 4–5(7) пара-
ми листочков. Сочетание других признаков иное ...... 7.
7. Бобы 20–27 мм дл., прямые, опушены косо вверх (к
верхушке боба) направленными, рыхло прижатыми
или полуоттопыренными волосками. Нижний при-
цветник 3–7 мм дл. Зубцы чашечки 2.5–3 мм дл., при
плодах 3–7.5 мм дл. Цветки 22–30 мм дл., белые; ло-
дочка чисто-белая или с небольшим бледно-розовым
(в гербарии синеватым) пятном на верхушке ...................
......... .......... .......... .......... .......... .......... .......... .........
7. A. permiensis.
+ Бобы 15–25 мм дл., иначе опушены, обычно со значи-
тельной примесью оттопыренных волосков. Прицвет-
ники и зубцы чашечки более короткие. Цветки мельче
и (или) иначе окрашены, обычно с более выраженным
пятном на верхушке лодочки ............................................. 8.
8. Цветки белые; лодочка с крупным, охватывающим
верхнюю треть — половину ее пластинки, пурпурным
(в гербарии синим) пятном. Бобы опушены оттопы-
ренными волосками. Наиболее развитые листья с
2–4(5) парами листочков ............................... 2 . A . gregorii.
+ Цветки кремовые, иногда розоватые; лодочка на вер-
хушке без пятна или с небольшим пятном, охватываю-
щим не более 1⁄4 ее пластинки. Бобы опушены оттопы-
ренными и полуоттопыренными волосками, обычно со
значительной примесью волосков, косо отклоненных к
верхушке боба. Наиболее развитые листья с 4–5 (ино-
гда с 6–7) парами листочков .............................................. 9.
9. Бобы ланцетные, 15–20 мм дл., 3.5–4 мм шир., обычно
слегка изогнутые, опушены длинными (1–2 мм дл.),
полуоттопыренными и оттопыренными белыми воло-
сками (у некоторых волосков верхушки б. м . отклоне-
ны к основанию боба). Листочки серебристые от очень
густого опушения ................................... 1. A . depauperatus.
+ Бобы продолговатые, 15–25 мм дл., 2.5–3 мм шир.,
прямые, реже слегка изогнутые, опушены оттопырен-
ными, полуоттопыренными белыми волосками около
1 мм дл., с примесью (особенно вдоль швов) прижатых
Ревизия секции Helmia рода Astragalus (Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
129
белых или черных волосков. Листочки зеленые (их
опушение более редкое) ...................................... 5. A . ionae.
Благодарности
Исследования проведены по теме НИР АААА-
А17-117072810011-1 «Исследование и охрана фено-
типического и генотипического разнообразия флоры
и растительности России», отчасти при финансо-
вой поддержке РФФИ в рамках научного проекта
No 16-04-00895. Приношу свою искреннюю благо-
дарность за сотрудничество по программе проекта
No 16-04-00895, а также за ценные консультации при
подготовке данной публикации Д. А. Кривенко (Си-
бирский институт физиологии и биохимии растений
СО РАН) и Е. Г. Филиппову (Ботанический сад УрО
РАН).
Дополнительные материалы (Приложения 1–8)
к статье размещены на сайте издания (www.binran.
ru/journals/novitates/).
Литература | References
Abdullaeva M. N . 1981. Rod Astragalus L. — Astragal... Sektsiya
Helmia Bge. [Genus Astragalus L. — Milkwetch... Section
Helmia Bge.] // Conspectus Florae Asiae Mediae. T. 6 /
R. V. Kamelin, S. S. Kovalevskaja, M. M. Nabijev (eds.).
Taschkent: Acad. Sci. UzSSR. P. 229–230. [In Russian]
(Абдуллаева М. Н . 1981. Род Astragalus L. — Астрагал...
Секция Helmia Bge. // Определитель растений Сред-
ней Азии. Т. 6 / ред. Р. В . Камелин, С. С . Ковалевская,
М. М. Набиев. Ташкент: ФАН Узб. ССР. С . 229–230).
Cherepnin L. M. 1963. Flora yuzhnoi chasti Krasnoyarskogo
kraya. Vypusk 4 [Flora of the southern part of Krasnoyarsk
Region. Part 4] // Uchen. Zap. Krasnoyarsk. Gosud. Peda-
gog. Inst. Vol. 24, iss. 4. P. 3–270. [In Russian] (Черепнин
Л. М. 1963. Флора южной части Красноярского края.
Выпуск 4 // Учен. зап. Красноярск. госуд. педагог. инcт.
Т. 24, вып. 4. С. 3–270).
Fedtschenko B. A ., Palibin I. V., Basilevskaja N. A . et al.
1930. Rasteniya, sobrannyye G. E . Grumm-Grzhimailo
v Zapadnoi Mongolii v 1903 godu [Plants collected by
G. E. Grumm-Grshimailo in Western Mongolia in 1903] //
G. Grumm-Grshimailo. Western Mongolia and the Urian-
khai Country. Vol. 3, pt. 2. Leningrad: Press of Russ. Geogr.
Soc. P. 806 –826. [In Russian] (Федченко Б. А ., Палибин
И. В ., Базилевская Н. А. и др. 1930. Растения, собран-
ные Г. Е . Грумм-Гржимайло в Западной Монголии в
1903 году // Г. Е . Грумм-Гржимайло (сост.). Западная
Монголия и Урянхайский край. Т. 3, вып. 2 . Л.: Гос. Рус.
геогр. о-во. С . 806 –826).
Gamajunova A. P., Fisjun V. V. 1961. Rod Astragal — Astraga-
lus L. ... Podrod Cercidotrix Bge. [Genus Milkwetch — As-
tragalus L. ... Subgenus Cercidotrix Bge.] // Flora Kazakh-
stana [Flora of Kazakhstan] / N. V. Pavlov (ed.-in-chief).
Vol. 5 . Alma-Ata: Acad. Sci. Kazakh. SSR. P. 184–299. [In
Russian] (Гамаюнова А. П., Фисюн В. В . 1961. Род As-
tragalus L. ... Подрод Cercidotrix Bge. // Флора Казахста-
на / гл. ред. Н. В. Павлов. Т. 5 . Алма-Ата: Изд-во АН
КазССР. С . 184–299).
Gontscharov N. F., Popov M. G . 1946. Rod Astragalus L.
—
Astragal... Sektsiya Helmia Bge. [Genus Astragalus L.
—
Milkwetch... Section Helmia Bge.] // Flora URSS. T. 12 .
Mosqua; Leningrad: Ed. Acad. Sci. URSS. P. 545–549. [In
Russian] (Гончаров Н. Ф., Попов М. Г . 1946. Род As-
tragalus L.
—
Астрагал... Секция Helmia Bge. // Флора
СССР. Т . 12. М.; Л.: Изд-во АН СССР. С . 545–549).
Gorchakovsky P. L ., Zueva V. N . 1982. Inter- and intrapopula-
tion variability of Ural endemic Astragalus sp. // Soviet J.
Ecolog. Vol. 13, No 4. P. 231–236. [Transl. from Russian]
(Горчаковский П. Л., Зуева В. Н . 1982. Внутрипопу-
ляционная и межпопуляционная изменчивость ураль-
ских эндемичных астрагалов // Экология. Т. 13, No 4.
С. 20–27).
Ho S. B. 1993. Astragalus Linn. ... subgen. Cercidotrix Bunge //
Flora Reipublicae Popularis Sinicae. T. 42 (1). Peking: Sci-
ence Press. P. 252–326 [In Chinese].
Knyazev M. S. 2017. Materials to the review of genus As-
tragalus section Helmia (Fabaceae) // Novosti Sist. Vyssh.
Rast. Vol. 48. P. 89–97. [In Russian with English abstract]
(Князев М. С . 2017. Материалы к ревизии секции Hel-
mia рода Astragalus (Fabaceae) // Новости сист. высш.
раст. Т. 48. С . 89–97).
Knyazev M. S., Filippov [Philippov] E. G., Dymshakova O. S.,
Belyaev A. Yu., Kutlunina N. A . 2017. Preliminary results
of population genetic studies (isozyme analysis) of spe-
cies and races of Astragalus sect. Helmia (Fabaceae) in the
Urals // Taxonomy and evolutionary morphology of plants:
Materials of the Conference dedicated to 85 anniversary of
V. N. Tichomirov (January 31 — February 3, 2017, Mos-
cow) / D. D. Sokoloff et al. (eds.). Moscow: MAKS Press.
P. 201–204. [In Russian] (Князев М. С., Филиппов Е. Г .,
Дымшакова О. С., Беляев А. Ю ., Кутлунина Н. А. 2017.
Предварительные результаты популяционно-генети-
ческого исследования (изоэнзимный анализ) видов
и рас Astragalus sect. Helmia (Fabaceae) на Урале //
Систематика и эволюционная морфология растений:
Материалы конф., посвящ. 85-летию со дня рождения
В. Н . Тихомирова (31 января — 3 февраля 2017 г., Мо-
сква) / ред. колл. Д. Д . Соколов и др. М .: МАКС Пресс.
С. 201–204).
[Knyazev] Knyasev M. S., Kulikov P. V., Philippov E. G. 2006.
Section Helmia of the genus Astragalus (Fabaceae) in the
flora of the Urals // Bot. Zhurn. Vol. 91, No 2. P. 278–290.
[In Russian with English abstract] (Князев М. С ., Кули-
ков П. В ., Филиппов Е. Г. 2006. Секция Helmia рода As-
tragalus (Fabaceae) во флоре Урала // Бот. журн. Т. 91,
No 2. С . 278–290).
[Knyazev] Knyasev M. S., Philippov E. G . 2019. Investigation
of chloroplast DNA variability of some representatives of
section Helmia of the genus Astragalus (Fabaceae) // AIP
Conference Proceedings. Vol. 2063: Modern synthesis
methodologies for creating drugs and functional materials
(MOSM 2018). Proc. of the II Int. Conf. 15–17 Nov 2018,
Yekaterinburg, Russia. https://doi.org/10.1063/1.5087359
Numeri chromosomatum Magnoliophytorum florae URSS:
Aceraceae — Menyanthaceae. 1990 / A. Takhtajan (red.).
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
130
Leninopoli: Nauka. 509 p. [In Russian] (Числа хромосом
цветковых растений СССР: Aceraceae — Menyanthaceae.
1990 / ред. А. Л. Тахтаджян. Л .: Наука. 509 с.).
Polozhij A. V. 1954. Species novae generis Astragali L. e Sibiria
media // Animadvers. Syst. Herb. Univ. Tomsk. = Sist. Za-
metki Mater. Gerb. Krylova Tomsk. Gosud. Univ. No 77–
78. P. 1–5 . [In Russian and Latin] (Положий А. В . 1954.
Новые виды рода Astragalus L. из Средней Сибири //
Сист. заметки матер. Герб. им . П . Н. Крылова Томск. го-
суд. унив. No 77–78. С . 1–5).
Polozhij A. V. 1960. Bobovyye — Papilionaceae [Legumes —
Papilionaceae] // Flora Krasnoyarskogo kraya [Flora of
Krasnoyarsk Region]. Vol. 6 . Tomsk: State Univ. Press.
P. 3 –94. [In Russian] (Положий А. В. 1960. Бобовые —
Papilionaceae // Флора Красноярского края. Вып. 6 .
Томск: Изд-во Томск. ун-та. С . 3–94).
Podlech D., Sytin A. K. 1996. Typification of Russian and some
other species of Astragalus. I // Sendtnera. Vol. 3 . P. 149–
176.
Podlech D., Zarre Sh. 2013. A taxonomic revision of the genus
Astragalus L. (Leguminosae) in the Old World. Vols. 1–3 .
Wien: Naturhistorisches Museum. 2439 p.
Popov M. G. 1949. 3316. Astragalus Jonae Palib. // Spisok
Rast. Gerb. Fl. S. S. S. R. Vol. 11, iss. 67. P. 62–63. [In Rus-
sian] (Попов М. Г . 1949. 3316. Astragalus Jonae Palib.) //
Список раст. герб. Фл. СССР. Т . 11, вып. 67. С . 62–63).
Ruprecht F. J . 1850a. Ueber die Verbreitung der Pflanzen im
nördlischen Ural // Bull. Cl. Phys.-Math. Acad. Imp. Sci.
St.-Pétersb. T. 8, No 18–19. S. 273–297.
Ruprecht F. J . 1850b. Ueber die Verbreitung der Pflanzen im
nördlischen Ural. St. Petersburg: Kaiserl. Akad. Wiss.
84 S. (Beiträge zur Pflanzenkunde des Russischen Reiches.
Lief. 7 . = Материалы к ближайшему познанию прозяба-
емости Российской империи. Кн. 7).
Ruprecht F. J . 1854a. Flora boreali-uralensis: Ueber die Ver-
breitung der Pflanzen im nördlichen Ural. St. Petersburg:
Kaiserl. Akad. Wiss. 49 S.; 3 Taf.
Ruprecht F. J . 1854b. Flora Severnogo Urala: O rasprostrane-
nii rastenii na Severnom Urale... [Flora of Northern Urals:
On distribution of plants on the Northern Urals...]. St. Pe-
tersburg: Imp. Acad. Sci. 51 p.; 3 pl. [In Russian and Latin]
(Рупрехт Ф. И . 1854b. Флора Северного Урала: О рас-
пространении растений на Северном Урале по резуль-
татам Географической экспедиции 1847 и 1848 годов.
СПб.: Имп. Акад. наук. 51 с.; 3 табл. рис.).
Stafleu F. A., Cowan R. S. 1983. Taxonomic literature. 2
nd ed.
Vol. 4: P–Sak. Utrecht; Antwerpen: Bohn, Scheltema &
Holkema; etc. 1214 p.
Ulziykhutag N. 2003. Bobovyye Mongolii (taxonomiya,
ekologiya, geografiya, filogeniya i khozyaistvennoye
znacheniye) [Legumes of Mongolia (taxonomy, ecology,
geography, phylogeny and economic importance)]. Ulaan-
baatar: Mong. Akad. Nauk. 588 p. [In Russian] (Улзийху-
таг Н. 2003. Бобовые Монголии (таксономия, экология,
география, филогения и хозяйственное значение). Ула-
анбаатар: Монг. акад. наук. 588 с.).
Yakovlev G. P., Sytin A. K ., Roskov Yu. R . Legumes of Nor-
thern Eurasia: A checklist. Kew, 1996. 724 p.
Ревизия секции Helmia рода Astragalus (Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
131
Виды родства Hedysarum ucrainicum (секция Multicaulia, Fabaceae)
Species of Hedysarum ucrainicum affinity (section Multicaulia, Fabaceae)
М. С. Князев
Поступила в редакцию | Submitted: 16.04.2019
Принята к публикации | Accepted: 27.11.2019
М. С. Князев
Ботанический сад Уральского отделения РАН
Лаборатория экспериментальной экологии и акклиматизации
растений
ул. 8 Марта, 202б, Екатеринбург, 620144, Россия
knyasev_botgard@mail.ru
M. S. Knyazev
Botanical Garden, Ural Branch of the Russian Academy of
Sciences
Laboratory of Experimental Ecology and Acclimatization of Plants
8 Marta Str., 202B, Yekaterinburg, 620144, Russia
knyasev_botgard@mail.ru
https://doi.org/10.31111/novitates/2019.50.132
Материал и методы
Виды родства Hedysarum ucrainicum Kaschm. ис-
следовались нами в течение ряда лет (Knyasev, 2011,
2013). Собранный гербарный материал хранится в
Гербарии Института экологии растений и животных
УрО РАН (SVER), дублеты переданы в Гербарий
Ботанического института им. В. Л. Комарова РАН
(LE). Проведено критическое исследование видов
родства H. ucrainicum в гербарных коллекциях LE,
MW, SVER, TK, NS, NSK. Проведено исследование
in situ экологических особенностей, изменчивости
морфологических признаков H. ucrainicum (близ
пос. Айдар и с. Нагольное Белгородской обл. Рос-
сии), H. schellianum Knjaz. (близ с. Новинка Кизиль-
ского р-на Челябинской обл. России, в окрестностях
пос. Атбасар и южнее г. Нур-Султан на р. Нура в Ак-
молинской обл. Казахстана) и H. villosissimum Knjaz.
(близ ж.-д. станций Жарык, Босага, Киик в Караган-
динской обл. Казахстана).
Распространение видов на территории бывшего
СССР указывается по районам «Флоры СССР», для
обозначения которых использованы сокращения,
общепринятые в отечественной таксономической
литературе.
Результаты и обсуждение
Критическое сравнение некоторых видов He-
dysarum секции Multicaulia (Boiss.) B. Fedtsch., рас-
пространенных в горных степях Казахского мелко-
сопочника, позволило установить, что они имеют
тесное родство с преимущественно европейским
меловым H. ucrainicum. Наибольшее сходство с
H. ucrainicum выражено у горностепного казахстан-
ского H. schellianum (Knyasev, 2011, 2013). Обна-
родуемые в этой статье H. villosissimum, H. ulutavi-
cum Knjaz. и H. tarbagataicum Knjaz. имеют меньшее
сходство с H. ucrainicum, но также относятся к этой
группе родства. Наконец, прибалхашский H. bec-
tauatavicum Bajtenov, на наш взгляд, также может
быть включен в эту группу. Ниже мы описываем
ряд Ucrainica Knjaz., который объединяет эти виды.
Представители ряда отличаются сохраняющимися и
поникающими при плодах цветками, узкими (около
3 мм шир.) бобами, покрытыми короткими (около
1 мм дл.) шипиками или без шипиков.
На наш взгляд, представители ряда Ucrainica
имеют несомненное сходство с группой западно-
тяньшаньских копеечников родства H. severzovii
Bunge и, возможно, происходят от них. Вероят-
Аннотация. Описаны новые для науки виды Hedysarum ulutavicum Knjaz. и H. tarbagataicum Knjaz.; ранг H. schellianum var.
villosum Knjaz. повышен до видового с новым названием H. villosissimum Knjaz. Для H. ucrainicum Kaschm. впервые приво-
дится обособленное местонахождение в Северном Казахстане. Дается карта распространения рассмотренных видов.
Ключевые слова: Hedysarum, секция Multicaulia, новые виды, Восточная Европа, Казахстан, систематика, распространение.
Abstract. The review of the species related to Hedysarum ucrainicum Kaschm. (sect. Multicaulia, Fabaceae) is given. The spe-
cies of the H. ucrainicum affinity are well distinct from all races of polymorphic H. gmelinii Ledeb. by persistent and hanging in
fruit (not directed upwards) flowers; differ from all species of the H. severzovii Bunge affinity (H. pavlovii Bajtenov, H. dmitrievae
Bajtenov, H. nikolai Kovalevsk. and others) by narrower beans (3–4 mm, vs. 6 –7 mm wide). New species H. ulutavicum Knjaz.
and H. tarbagataicum Knjaz. are described; the rank of H. schellianum var. villosum Knjaz. is increased up to the species, with a
replacement name H. villosissimum Knjaz. The distribution map of the studied species is given.
Keywords: Hedysarum, section Multicaulia, new species, East Europe, Kazakhstan, taxonomy, distribution.
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 132–140
но, в одну из предшествующих исторических эпох
(в позднем плейстоцене?) анцестор ряда Ucrainica
распространился к северу от высокогорий Цен-
тральной Азии в сопредельные участки Казахского
мелкосопочника. Адаптация к новым экологиче-
ским условиям потребовала достаточно глубоких
физиологических и некоторых морфологических
изменений; эти изменения оказались удачными, что
обусловило широкое распространение потомков
предполагаемого анцестора в степном Казахстане,
отчасти в Восточной Европе; дальнейший филогенез
ряда Ucrainica шел в направлении адаптации к тем
или иным конкретным условиям разных участков
общего ареала.
Таксономический обзор копеечников из родства
Hedysarum ucrainicum
Hedysarum L. 1753, Sp. Pl.: 745.
Sect. Multicaulia (Boiss.) B. Fedtsch. 1899, Bull.
Herb. Boiss. 7: 257.
Series Ucrainica Knjaz., ser. nova.
Plantae perennes, 15–35 cm alt., caulescentes, sub-
acaules, raro acaules. Racemi initio oblongo-capitati,
dein elongati, 8–30 -flori; floribus purpureis, fructifica-
tione siccescentibus sed persistentis, tempore eodem
nutantis. Calyx 2–3 -plo corolla brevior. Vexillum carina
longius. Legumina (2)3–4(5)-articulata; articuli 3–4
mm longi et lati, levi vel breviter aculeati. — Многолет-
ники 15–35 см выс., с развитыми или укороченны-
ми стеблями, редко бесстебельные. Кисти первона-
чально продолговато-головчатые, затем удлиняются,
8–30 -цветковые; цветки пурпурные, при плодах за-
сыхают, но сохраняются и в это время поникающие.
Чашечка в 2–3 раза короче венчика. Флаг длиннее
лодочки. Бобы из (2)3–4(5) члеников; членики 3–4
мм дл. и шир., гладкие или с короткими шипиками.
Ab omnibus speciebus H. gmelinii Ledeb. affini-
bus (H. gmelinii s. str., H. setigerum Turcz. ex Fisch. et
C. A. Mey., H. baicalense B. Fedtsch.) floribus post an-
thesin nutantibus differunt. Ab omnibus speciebus
H. severzovii Bunge affinibus (H. pavlovii Bajtenov,
H. dmitrievae Bajtenov, H. nikolai Kovalevsk. etc.) le-
guminibus 3–4 mm lt. (nec 6–7 mm lt.) distant. — От
всех видов родства H. gmelinii Ledeb. (H. gmelinii
s. str., H. setigerum Turcz. ex Fisch. et C. A. Mey., H. bai-
calense B. Fedtsch.) представители ряда отличаются
поникающими после цветения цветками. От всех ви-
дов родства H. severzovii Bunge (H. pavlovii Bajtenov,
H. dmitrievae Bajtenov, H. nikolai Kovalevsk. и др.) от-
личаются бобами 3–4 мм шир. (а не 6–7 мм шир.).
Typus (тип): Hedysarum ucrainicum Kaschm.
Species inclusae: H. bectauatavicum Bajte-
nov, H. schellianum Knjaz., H. tarbagataicum Knjaz.,
H. ucrainicum Kaschm., H. ulutavicum Knjaz., H. villosis-
simum Knjaz.
1. H. bectauatavicum Bajtenov, 1956, Вестн. АН
КазССР, 3: 102; Байтенов, 1961, Фл. Казахст. 5: 434,
табл. 58, рис. 6; он же, 1962, Иллюстр. опред. Бобовых
Казахст.: 298; Ковалевск. 1981, Опред. раст. Ср. Азии,
6: 311. —
Т ип: «Казахская ССР, Северное Прибал-
хашье, сопки Бектау-Ата, порфиритовые скалы, 3 VI
1937, А. Дмитриева», цв. (holotypus — AA). — Рис. 1: 1.
Распространение и экология. Прибалх.
(Казахстан: Карагандинская обл., северное Прибалха-
шье). — Рис. 2: 1. — По щебнистым и глинистым скло-
нам в разреженных степных сообществах. Цв. V–VI.
Практически все сборы этого вида относятся к
locus classicus (горному массиву Бектау-Ата); в Гер-
барии им. П. Н. Крылова мы выявили один образец,
собранный на 50 км севернее: «Карагандинская обл.,
Актогайский р-н, каменистая почва, на сопках Киек-
ты, 48° с. ш. и 44° в. д., VI 1941, П. И. Калякина», цв.
(TK!).
М. С. Байтенов относил этот вид к одновре-
менно описанной им секции Ferganensia Bajtenov
(“Ferganensae” — Bajtenov, 1956: 102). На наш взгляд,
исключая укороченные до розеток или полуро-
зеток годичные побеги, виды секции Ferganensia
(H. ferganense Korsh., H. lintschevskyi Bajtenov, H. kry-
lovii Sumnev.) существенно не отличаются от ви-
дов родства H. severzovii (H. pavlovii, H. dmitrievae,
H. nikolai и др.) и должны с ними объединяться в
общую группу родства — скорее всего, как особый
ряд секции Multicaulia. С другой стороны, H. bectau-
atavicum ближе к H. ulutavicum, чем к H. ferganense.
В частности, бобы у изученных нами образцов
H. bectauatavicum 3–4 мм шир., очень скудно при-
жато опушенные или голые, т. е. по характеру опу-
шения близки к H. ulutavicum, а по ширине такие
же, как у всех видов ряда Ucrainica. У H. ferganense,
как и у большинства схожих горноазиатских видов,
бобы почти вдвое шире. По нашему мнению, при-
знак ширины боба весьма важен, четко разделяя
представителей ряда Ucrainica и более южные горно-
азиатские родственные виды на уровне рядов.
2. H. schellianum Knjaz. 2011, Бот. журн. 96, 11:
1458, p. p., quoad typo. — H. gmelinii auct. non Ledeb.:
Байтенов, 1961, Фл. Казахст. 5: 433, p. p.; он же, 1962,
Иллюстр. опред. Бобовых Казахст.: 298, p. p., quoad
pl. invent. in area monticulosa Kasachskij Melkoso-
pocznik; Куликов, 2005, Консп. фл. Челяб. обл.: 244,
p. p.; он же, 2010, Опред. сосуд. раст. Челяб. обл.: 443,
p. p. — H. razoumowianum auct. non Helm et Fisch. ex
DC.: Yakovlev et al. 1996, Legum. North. Euras.: 401,
Виды родства Hedysarum ucrainicum (секция Multicaulia, Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
133
Рис. 1. Морфология Hedysarum bectauatavicum (1), H. schellianum (2), H. tarbagataicum (3), H. ucrainicum (4),
H. ulutavicum (5) и H. villosissimum (6).
a — флаг; b — лодочка; c — крыло; d — цветок; e — боб; f — нижний зубец чашечки (характер опушения на зубце чашечки).
Масштабные линейки — 1 см.
Fig. 1. Morphology of Hedysarum bectauatavicum (1), H. schellianum (2), H. tarbagataicum (3), H. ucrainicum (4),
H. ulutavicum (5), and H. villosissimum (6).
a — banner; b — keel; c — wing; d — flower; e — legume; f — lower calyx tooth (its indumentum). Scale bars — 1 cm.
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
134
p. min. p., quoad pl. invent. in Kasachstan, reg. Kosto-
nai.
—
Т ип: «Челябинская обл., Кизильский рай-
он, 2 км северо-западнее с. Новинка, 15 VIII 2005,
М. С. Князев» (holotypus — LE: LE 01063109!; isoty-
pus — SVER!). — Рис. 1: 2.
Распространение и экология. Верх.-
Тоб. (Россия: Челябинская обл., близ с. Новинка
Кизильского р-на и близ районного центра Варна),
Ирт. (Казахстан: юг Акмолинской обл., чаще близ
г. Нур-Султан), Прибалх. (Казахстан: Карагандин-
ская обл., к северу, востоку и западу от г. Караган-
да).
—
Рис. 2: 2.
—
По мелкосопочникам в горных
степях.
—
2n = 32 (Челябинская обл., с. Новинка —
Philippov et al., 2008).
Hedysarum schellianum проявляет наибольшее
сходство с меловым, преимущественно восточноев-
ропейским H. ucrainicum, устойчиво отличаясь лишь
примесью в опушении полуоттопыренных волосков
1–2 мм дл. (тогда как у H. ucrainicum волоски на
стеблях, черешках и др. не превышают 0.5 мм дл.);
менее четко отличается более редкими шипиками
на бобах и в среднем более широкими листочками
(Knyasev, 2011). С другой стороны, хорошо выра-
жены экологические и фенологические отличия:
H. schellianum не встречается на меловых обнажени-
ях, а его цветение продолжается с конца мая по июнь
(в Казахстане) или с июня по середину июля (на юге
Челябинской обл.); напротив, H. ucrainicum — ис-
ключительно меловой вид, практически непрерывно
цветущий с середины июня по середину сентября.
3. Hedysarum tarbagataicum Knjaz., sp. novа.
—
H. gmelinii auct. non Ledeb.: Байтенов, 1961, Фл. Ка-
захст. 5: 433, p. p.; он же, 1962, Иллюстр. опред. Бобо-
вых Казахст.: 298, p. p., quoad pl. invent. in Kasachstan
orient.
—
H. schellianum auct. non Knjaz.: Княз. 2011,
Бот. журн. 96, 11: 1458, p. p., quoad pl. invent. in Ka-
sachstan orient.
Рис. 2. Распространение видов ряда Ucrainica рода Hedysarum.
Fig. 2. Distribution of species of Hedysarum ser. Ucrainica.
1 — Hedysarum bectauatavicum; 2 — H. schellianum; 3 — H. tarbagataicum; 4 — H. ucrainicum; 5 — H. ulutavicum; 6 — H. villosissimum.
Виды родства Hedysarum ucrainicum (секция Multicaulia, Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
135
Planta perennis; caules 10–25 cm alt. numerosi, sub-
recti, pilis 0.5–1 mm lg. appressis et patulis tecti. Folia
inferiora longipetiolata, media brevipetiolata, foliolis
5–6 -jugis, oblongo-obovatis, oblanceolatis (2.5–4 -plo
longioribus quam latioribus), supra disperse appresse,
subtus dense sericeo-subappresse pilosis (pilis 0.5–1
mm lg.). Stipulae albido-scarioso-membranaceae, raro
brunnescentes, inferiores inter se ad 2⁄3, superiores
ad 1⁄2 connatae, 4–6 mm lg. Scapi 7–20 cm lg. Racemi
15–30-flori, laxiusculi, axibus patule pilosis. Flores pur-
purei, sub angulo 60–90° reclinati, fructificatione per-
sistentes, plus minusve nutantes. Bracteae lanceolateae,
5–6 mm lg. Calyx patente pilosus, campanulatus, tubo
3 mm lg., dentibus anguste-lanceolatis 4–6 mm lg., sat
dense patente pilosis. Vexillum obovatum, apice emar-
ginatum, 12–16 mm lg., 7–8 mm lt. Alae oblanceolatae,
apice rotundatae, 10–11 mm lg., 2–3 mm lt. Carina vex-
illo subaequilonga, lamina obovato-rectiangula, 11–14
mm lg., 6–7 mm lt. Legumina compressa, articulata, ad
15 mm lg., 3.5–4 mm lt., articulis 4–5, lentiformis, re-
ticulato-rugosis, dense subappresse breviter pilosis, ad
normam sine aculeolis. Fl. V–VI. — Fig. 1: 3. — Много-
летник; стебли 10–25 см выс., многочисленные, поч-
ти прямые, покрыты прижатыми или немного отсто-
ящими волосками 0.5–1 мм дл. Нижние листья на
длинных черешках, средние на коротких черешках,
листочки в числе 5–6 пар, продолговато-обратно-
яйцевидные, обратноланцетные (в 2.5–4 раза длин-
нее своей ширины), сверху рассеянно и прижато,
снизу густо полуприжато шелковисто опушенные
(волоски 0.5–1 мм дл.). Прилистники беловато ко-
жисто-перепончатые, редко коричневатые, нижние
между собой до 2⁄3, верхние до 1⁄2 сросшиеся, 4–6 мм
дл. Цветоносы 7–20 см дл. Кисти 15–30 -цветковые,
рыхловатые, по оси опушены отстоящими воло-
сками. Цветки пурпурные, отклоненные под углом
60–90°, при плодах сохраняются, б. м. поникающие.
Прицветники ланцетные, 5–6 мм дл. Чашечки от-
стояще опушенные, колокольчатые, с трубкой 3 мм
дл., с узколанцетными зубцами 4–6 мм дл., доволь-
но густо опушенными оттопыренными волосками.
Флаг обратнояйцевидный, на верхушке выемчатый,
12–16 мм дл., 7–8 мм шир. Крылья обратноланцет-
ные, на верхушке округлые, 10–11 мм дл., 2–3 мм
шир. Лодочка почти равна флагу, с пластинкой об-
ратнояйцевидно-треугольной, 11–14 мм дл., 6–7 мм
шир. Боб сплюснутый, четковидный, до 15 мм дл.,
3.5–4 мм шир., с члениками в числе 4–5, линзовид-
ными, сетчато-морщинистыми, густо полуприжато
коротко опушенными, обычно без шипиков. Цв. V–
VI. — Рис.1:3.
Typus (тип): «[Kasachstan] prov. Semipalatinsk,
distr. Zaisan, fl. Ajaguz in cursu superior inter Dzhen-
ishke et fodinas Grigorievskij, 26 VI 1914, V. Sapozh-
nikov, V. Genina», fl., fr.
—
«[Казахстан, северная
оконечность хр. Тарбагатай] Семипалатинская обл.,
Зайсанский уезд, у р. Аягуз вдоль верхнего тече-
ния от Дженишке до рудника Григорьевского, 26 VI
1914, В. Сапожников, В. Генина», цв., пл. (holoty-
pus — LE: LE 00050766!; isotypus — TK!).
Affinitas (родство). A H. gmelinii Ledeb. floribus
post anthesin nutantibus, leguminibus levis (nec acu-
leatis), foliolis supra plus minusve pilosis (nec glabris)
discrepat. A H. schelliano Knjaz. foliolis supra plus mi-
nusve pilosis (nec glabris) subtus dense sericeo-pilosis
(nec cinereo modice dense pilosis), leguminibus le-
vis (nec plus minusve aculeatis), stipulis albido-scar -
ioso-membranaceis (nec brunnescentibus, scariosis)
distat.
—
От H. gmelinii отличается цветками, пони-
кающими после цветения, гладкими бобами (а не с
шипиками), листочками сверху опушенными (а не
голыми); от H. schellianum отличается гладкими бо-
бами (а не с шипиками), листочками сверху б. м.
опушенными, снизу густо шелковисто опушенными
(а не голыми сверху, снизу умеренно густо сероопу-
шенными), прилистниками беловато кожисто-плен-
чатыми (а не коричневатыми, кожистыми).
Area geographica et oecologia (рас-
пространение и экология). Kasachstan orientalis, in
declivibus lapidosis stepposis jugis Tarbagataj, Saur,
Arkalyk, Czingiz-tau etc.
—
Fig. 2: 3.
—
Ирт. (Казах-
стан: горы Аркалык, Аркат, Альджан, степи западнее
Павлодара), Дж.-Тарб. (Казахстан: хребты Тарбага-
тай, Саур), Прибалх. (Казахстан: хребты Чингиз-тау,
Акшатау и др.), Алт. (Казахстан: окрестности Семи-
палатинска и Усть-Каменогорска). — Рис. 2: 3. — По
щебнистым степным склонам на участках с разре-
женной растительностью.
Паратипы. Казахстан: Семипалатинская обл.,
Павлодарский уезд, ст. Сартавская, 16 VI 1890, С. Кор-
жинский, цв., пл. (LE!); там же, Каркаралинский уезд, ст.
Сирлинская, 18 VI 1890, он же, цв., пл. (LE!); Тарбагатай,
группа Джельдытау, северные скалы до гребня хребта, 31
V 1904, В. Сапожников, цв., пл. (TK!); там же, долина Чи-
ликты от Кергеньтас до Кайчи, 20 VI 1904, он же, цв., пл.
(TK!); [хребет] Сайкан, долина р. Чакпактас, 8 VI 1904,
он же, цв. (TK!); Тарбагатай и его окрестности, переход
от Кайчи на Сарычеку, 28 VI 1904, Г. Н . Потанин, цв., пл.
(TK!); Семипалатинская обл., Зайсанский уезд, горы Саур,
склоны гор у выхода р. Темыр-су из гор, влево от долины,
24 VI 1907, Вл. и А. Резниченко, цв, пл. (LE!); там же, зап.
склоны водораздела между рр. Теректы и Киндерлик, 9 VII
1907, они же, пл. (LE!); там же, горы Саур, вершина во-
дораздела между рр. Киндерлик и Аба, 12 VII 1907, они
же, пл. (LE!); там же, р. Аягуз, верхнее течение близ Кен-
сай, 26 VI 1914, В. Сапожников, В. Генина, цв., пл. (TK!);
там же, водораздел Карабуга — Арчайлы, 28 VI 1914, они
же, цв., пл. (TK!); там же, Саур, р. Большой Джеминей в
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
136
среднем течении, 31 V 1914, Б. Шишкин, цв. (LE!); там же,
Саур, дорога Сары-чоку по гребню гор левой стороны р. Те-
ректы, 20 VI 1914, он же, цв., пл. (LE!); Семипалатинская
обл., Аркат — Альджан, 4 VI 1915, В. Сапожников, Т. Три-
политова, цв. (TK!); Усть-Каменогорск, гора Пригонная, 29
V 1931, Б. К. Шишкин, Л. Н . Чиликина, цв. (LE!); там же,
29 V 1931, Б. К . Шишкин, Е. Штенберг, Г. Сумневич, цв.
(LE!); Павлодарская обл., Баян-Аульский р-н, по зап. бере-
гу оз. Карасор, 3 VII 1955, Н. Н . Цвелёв, А. В . Калинина,
В. В. Карамышева, А. Д . Догадова, пл. (LE!); Карагандин-
ская обл., хр. Кент, 70 км к востоку от г. Каркаралинска, 19
VII 1968, Т. Г. Леонова, пл. (LE!); Центральный Казахстан-
ский мелкосопочник, 70 км к юго-востоку от г. Каркаралин-
ска, г. Аскурай (система гор Кент), h = 1513 м, 20 VII 1968,
З. В . Карамышев, Ю. А . Власов, Е. И . Рачковская, пл. (LE!);
Западный Тарбагатай, сев. макросклон, верховья р. Аягуз,
правобережье, в 19 км от с. Тарбагатай вверх по течению,
9 VI 1985, В. Грубов, Н. Медведева, А. Коробков, И. Тихме-
нёва, цв. (LE!).
Ранее мы ошибочно включили этот копеечник в
H. schellianum (Knyasev, 2011), не обратив внимания
на наличие у H. tarbagataicum комплекса оригиналь-
ных черт, вполне выдержанных в пределах четко
очерченного ареала в Восточном Казахстане (см. ди-
агноз вида и ключ на с. 139–140).
4. H. ucrainicum Kaschm. 1905, Изв. Петерб. бот.
сада, 5: 59; Б. Федч. 1948, Фл. СССР, 13: 301; Вiсюл.
1954, Фл. УРСР, 6: 502; она же, 1965, Визн. росл. Укр.,
вид. 2: 418; Голицин и В. И. Данилов, 1964, Бюлл. Общ.
естествоисп. Воронеж. унив. 13: 50; Chrtková, 1968, Fl.
Europ. 2: 187; Л. И. Васильева, 1987, Фл. европ. части
СССР, 6: 90; Yakovlev et al. 1996, Legum. North. Euras.:
406.
—
Lectotypus (I: Fedtschenko, 1948: 301; II:
hic designatus): «Флора Харьковской губ. Старобель-
ский уезд, Гаврилов хутор, меловое обнажение, 3 VIII
1904, Б. Ф. Кашменский, No 22» (LE: LE 01063110!;
isolectotypus — LE 01064305!). — Рис. 1: 4.
В. Ф. Кашменский в протологе вида ссылается
на собственные сборы 1904 г. с меловых обнаже-
ний «около Гаврилова хутора близ реки Айдара»
(1 июля и 3 августа) и «около слободы Ново-Бе-
ленькой на реке Беленькой» (6 июля), а также на
сборы Г. И. Ширяева из Ново-Беленькой 8 июля
1902 г. (Kaschmensky, 1905: 57–58). Б. А. Федченко
во «Флоре СССР» цитирует одно местонахожде-
ние и место хранения типа: «Описан с меловых гор
близ хутора Гаврилова, б. Старобельского уезда. Тип
в Ленинграде» (Fedtschenko, 1948: 301). Среди об-
разцов H. ucrainicum, хранящихся в LE, два экзем-
пляра с Гаврилова хутора относятся к первоначаль-
ному материалу. Оба они являются частями одного
сбора (3 VIII 1904, Кашменский). Таким образом,
указание Федченко фактически составляет первую
ступень лектотипификации (см. Turland et al., 2018:
Art. 9.17, Ex. 14). В последующих публикациях (см.,
напр., Krytska et al., 1999: 612) конкретный экзем-
пляр в качестве типа также не указывался, поэтому
потребовалась вторая ступень лектотипификации.
Распространение и экология. Днепр.
(Украина: север Луганской обл.), Волж.-Дон. (Рос-
сия: юг Белгородской и Воронежской областей),
Арало-Касп. (Казахстан: Актобинская обл., меловые
холмы 50 км севернее пос. Темир). — Рис. 2: 4. — На
меловых обнажениях.
В восточноевропейском фрагменте ареала рас-
пространение вида ограничено междуречьем верхне-
го течения р. Айдар и ее левого притока — р. Белой.
Мы предположили (Knyasev, 2013), что H. ucraini-
cum произошел от H. schellianum в процессе приспо-
собления к меловому субстрату. Косвенное под-
тверждение этого предположения получено недавно:
среди азиатского материала Гербария Московского
государственного университета им. М. В. Ломоносо-
ва (MW) мы выявили образец, собранный на мело-
вых горах севернее пос. Темир Актобинской обл. Ка-
захстана, неотличимый от типичного H. ucrainicum.
Это местонахождение относительно недалеко отсто-
ит от ближайших находок H. schellianum. Вероятно,
H. ucrainicum первоначально выделился из наиболее
западных популяций H. schellianum в процессе адап-
тации к меловому субстрату, широко распростра-
нился по меловым обнажениям от истоков Эмбы до
бассейна Северского Донца, но затем был вытеснен
более активными родственными меловыми видами:
в бассейне Дона H. cretaceum Fisch. ex DC., на Сред-
ней Волге и в Заволжье — H. razoumowianum Helm et
Fisch. ex DC., южнее и восточнее долины р. Урал —
H. tscherkassovae Knjaz. Только на периферии своего
первоначального ареала, куда перечисленные конку-
рирующие виды по тем или иным причинам не рас-
пространились, H. ucrainicum смог сохраниться, что
и объясняет его своеобразный резко дизъюнктивный
ареал.
5. Hedysarum ulutavicum Knjaz., sp. nova.
—
H. schellianum auct. non Knjaz.: Княз. 2011, Бот. журн.
11: 1458, p. p., quoad pl. invent. in Ulutau. — H. gmeli-
nii auct. non Ledeb.: Байтенов, 1961, Фл. Казахст. 5:
433, p. p., quoad pl. invent. in Ulutau; он же, 1962, Ил-
люстр. опред. Бобовых Казахст.: 298, p. p., quoad pl.
invent. in Ulutau.
Planta perennis; caules 1–10 cm alt. numerosi, sub-
recti, brevissime (pilis 0.1–0.2 mm lg.) appresse pilosi.
Folia inferiora longipetiolata; media (juxta scapum in-
fimum) petiolo 3–5 cm lg., foliolis 5–8 -jugis ellipticis,
oblongo-ovatis, rarius lanceolatis, 8–15(20) mm lg., 3–5
mm lt. (2.5–6 -plo longioribus quam latioribus), utrinque
Виды родства Hedysarum ucrainicum (секция Multicaulia, Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
137
sat dense pilis brevissimis (0.1–0.2 mm lg.) appresse
vestitis (cinerescentibus). Stipulae castaneae, coriaceo-
membranaceae, inferiorae inter se ad 2⁄3, superiorae ad 1⁄2
connatae, 3–5 mm lg. Scapi 7–20 cm lg., foliis 1.3–1.5(2)-
plo longiores. Racemi 15–30 -flori, laxiusculi, axibus pilis
appressis vestiti. Flores purpurei, sub angulo 60–90°
reclinati, fructificatione persistentes, plus minusve nu-
tantes. Pedicelli 1–2 mm lg. Bracteae lanceolatae, 1–3
mm lg., 0.5–0.7 mm lt. Calyx appresse pilosus, campanu-
latus, tubo 1–2 mm lg., dentibus anguste-lanceolatis,
3–6.5 mm lg. Vexillum obovatum, apice emarginatum,
10–14(16) mm lg., 6–9(10) mm lt. Alae oblanceolatae,
apice rotundatae, 7–9 mm lg., 2.5–3 mm lt. Carina vex-
illo 2–3 mm brevior, lamina obovato-triangulata, 8–13
mm lg., 6–7 mm lt. Legumina compressa, articulata,
ca. 14 mm lg., 3.5–4 mm lt., articulis 2–4(5), lentifor-
mis, reticulato-rugosis, brevissime appresse pilosis, acu-
leatis. Fl. V–VI.
—
Fig. 1: 5.
—
Многолетник; стебли
многочисленные, 1–10 см выс., почти прямые, очень
коротко прижато опушенные волосками 0.1–0.2 мм
дл. Нижние листья длинночерешчатые; средние (при
нижнем цветоносе) с черешком 3–5 см дл., с 5–8 па-
рами эллиптических, продолговато-яйцевидных,
реже ланцетных листочков, 8–15(20) мм дл., 3–5 мм
шир. (с длиной, в 2.5–6 раз превышающей ширину), с
двух сторон довольно густо опушены очень коротки-
ми (0.1 мм дл.) прижатыми волосками (сероватые).
Прилистники каштановые, кожисто-перепончатые,
нижние между собой до 2⁄3, верхние до 1⁄2 сросшиеся,
3–5 мм дл. Цветоносы 7–20 см дл., в 1.3–1.5(2) раза
превышают лист, из пазухи которого выходят. Кисти
15–30 -цветковые, рыхловатые, по оси соцветия опу-
шены прижатыми волосками. Цветки пурпурные,
отклоненные под углом 60–90°, при плодах сохраня-
ющиеся, б. м. поникающие. Цветоножки 1–2 мм дл.
Прицветники ланцетные, 1–3 мм дл., 0.5–0.7 мм шир.
Чашечки прижато опушенные, колокольчатые, с
трубкой 1–2 мм дл., с узколанцетными зубцами 3–6.5
мм дл. Флаг обратнояйцевидный, на верхушке выем-
чатый, 10–14(16) мм дл., 6–9(10) мм шир. Крылья
обратноланцетные, на верхушке округлые, 7–9 мм
дл., 2.5–3 мм шир. Лодочка на 2–3 мм короче флага,
с обратнояйцевидно-треугольной пластинкой, 8–12
мм дл., 6–7 мм шир. Бобы сплюснутые, членистые,
около 14 мм дл., 3.5–4 мм шир., с члениками в чис-
ле 2–4(5), линзовидными, сетчато-морщинистыми,
весьма коротко прижато опушенными, без шипиков.
Цв. V–VI. — Рис. 1: 5.
Typus (тип): «[Kasachstan], prov. Karagandins-
kaja, m. Ulutau. Alveus flumini exsiccati, 8 VIII 1957,
Z. V. Karamysheva», fr.
—
«Карагандинская область,
г. Улутау. По высохшему руслу, 8 VIII 1957, З. В. Ка-
рамышева», пл. (holotypus — LE: LE 00050751!).
Affinitas (родство). A H. gmelinii Ledeb. pu-
bescentia brevissima appressa (tota planta pilis 0.1–0.2
mm lg., nec pilis 0.5–4 mm lg. patulis vel patentibus
tecta), floribus post anthesin nutantibus, leguminibus
levis, appresse brevissime pilosis (nec aculeatis, plus mi-
nusve dense subpatente pilosis) discrepat. A H. schellia-
no Knjaz. pubescentia brevissima appressa, calycibus
brevioribus, leguminibus levis et appresse brevissime
pilosis (nec aculeatis, sat dense subpatente pilosis), pu-
bescentia axis inflorescentiae appressa (nec subpaten-
tia) distat. A H. ucrainico Kaschm. tubo calycis brevio-
re, leguminibus levis, appresse brevissime pilosis (nec
aculeatis, sat dense subpatente albo-pilosis), pubescen-
tia axis inflorescentiae appressa (nec subpatentia) dif-
fert. A H. bectauatavico Bajtenov caulibus plus minusve
evolutis (nec nullis), foliolis utrinque sat dense pilis
brevissimis appresse vestitis (nec imprimis subtus pilo-
sis), stipulis coriaceis castaneis (nec brunnescentibus,
margine pallidis, scariosis), calyce minore, dentibus ca-
lycis brevioribus bene differt. — От H. gmelinii отлича-
ется очень коротким, но густым, прижатым опуше-
нием (волосками 0.1–0.2 мм, а не б. ч. отстоящими,
0.5–4 мм дл.), цветками, поникающими после цве-
тения, бобами гладкими и очень коротко прижато
опушенными (а не б. м. густо отстояще опушенными
и с шипиками). От H. schellianum отличается более
коротким прижатым опушением, более короткой
чашечкой, гладкими и очень коротко прижато опу-
шенными бобами (а не с шипиками и б. м. густо от-
стояще опушенными), прижатым (а не б. м. оттопы-
ренным) опушением оси соцветия. От H. ucrainicum
отличается более короткой трубкой чашечки, глад-
кими и очень коротко прижато опушенными боба-
ми (а не шиповатыми, густо и б. м. отстояще бело-
опушенными), прижатым (а не б. м. оттопыренным)
опушением оси соцветия. От H. bectauatavicum хо-
рошо отличается б. м. развитыми стеблями, листоч-
ками с двух сторон (а не преимущественно снизу)
довольно густо опушенными очень короткими при-
жатыми волосками, каштановыми кожистыми (а не
буроватыми, по краю бледными, пленчатыми) при-
листниками, более мелкими чашечками, с более ко-
роткими зубцами.
Area geographica et oecologia (распро-
странение и экология). Area monticulosa Ulutau (Ka-
sachstan), in decliviis stepposis lapidosis. — Fig. 2: 5. —
Арал.-Касп. (Казахстан: Карагандинская обл.,
горный массив Улутау северо-западнее Жезказга-
на). — Рис. 2: 5. — По степным щебнистым склонам.
Паратипы. Казахстан. Ulutau, Karakingir, VI [1842]
[A. Schrenk]; in lapidoso ad margine fl. Kara-Kingir, VI 1842,
A. Schrenk. Акмолинская обл., Атбасарский уезд, горы
Улутау, 27 VI 1903, В. Петровский; там же, горы Улутау,
каменистый хребет г. Ак-мечети, 23 VIII 1910, Ф. Ф. Зе-
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
138
линский; там же, близ пикета Улутауского, 3 VII 1914,
С. С . Ганешин. Кзыл-Адырский округ, средняя часть Кор-
сакпайского района, ущелье центральной части г. Улутау,
20 VII 1929, Н. В. Шипчинский; там же, средняя часть
Корсакпайского района, долина р. Кара-Кингир, близ мо-
гилы Аласа-хан [мавзолея Алаша-хана], 8 VIII 1929, он
же; там же, Корсакпайский район, горы Улутау, 15 VII
1929, С. Липшиц; там же, Корсакпайский район, щеб-
нистые выходы в долине р. Джерыкыз вблизи ее впаде-
ния в р. Сары-тургай, 27 VII 1929, он же. Джезказганская
обл., Центральный Казахстанский мелкосопочник, горы
Улутау у пос. Улутау, 9 VI 1976, Р. В. Камелин, Н. М. Ка-
либернова, И. Н. Сафронова, В. И . Соловьёв (все в LE!).
Кзыл-Адырский округ, Корсакпайский район, горы Улутау,
щебнистый степной скат, 14 VII 1929, С. Липшиц (MW);
там же, шлейфы гор Улутау близ пос. Улутавского, 14 VII
1929, Н. В. Павлов (MW!).
Мы ошибочно включили этот оригинальный ко-
пеечник в H. schellianum (Knyasev, 2011), не придав
значения наличию у него комплекса особенностей,
хорошо выдержанных в пределах горного масси-
ва Улутау (Улытау). На своеобразие Hedysarum с
Улутау в свое время обратил внимание Р. В. Каме-
лин, рассматривая его как расу родства H. gmelinii
со значительной редукцией междоузлий и наметив
ее к описанию как «H. gmelinii var. subacaulis» (LE,
in schedulis). Однако оригинальность этих растений
не ограничивается укороченными побегами: они от-
личаются от H. gmelinii, H. schellianum, H. ucrainicum
и других родственных видов очень коротким (из во-
лосков 0.1–0.2 мм дл.), плотно прижатым опушени-
ем (все растение сероватое), бобами без шипиков и с
плотно прижатым, скудным опушением.
6. Hedysarum villosissimum Knjaz., nom. et stat.
nov. ≡ H. schellianum Knjaz. var. villosum Knjaz. 2011,
Бот. журн. 96, 11: 1458. —
Т ип: «Казахская СССР,
Карагандинская обл., Центральный Казахский мел-
косопочник, г. Кызыл-Рай, 27 VI 1956, А. П. Мишен-
кова» (holotypus — LE: LE 00050750!). — Рис. 1: 6.
Распространение и экология. Прибалх.
(Казахстан: Карагандинская обл., южная часть Ка-
захского мелкосопочника).
—
Рис. 2: 6.
—
По степ-
ным склонам, чаще на участках обнажений извест-
няка и мергелей.
Изученные экземпляры. Казахстан. Казах-
ский (Центрально-Казахстанский) мелкосопочник. Бас-
сейн р. Кон, урочище Кзыл-Жар, каменистый склон по
мергелям, 18 VII 1949, В. Голоскоков. Акмолинская обл.:
г. Байжанжал, 23 VII 1957, З. В. Карамышева. Карагандин-
ская обл.: г. Актау, 7 VI 1958, Т. А . Попова; горы Кызыл-
Райв9кмотпос.Жумускер,19VI1959,онаже;в6км
от Кужала, вост. склоны Коксенгира, 20 V 1959, Е. И. Рач-
ковская; Атасуйский р-н, горы Актау, 13 VI 1960, Е. Ва-
ривцева; 90 км к ЮВ от г. Караганды, г. Карашокы (Ну-
ришконь), 28 V 1965, В. И . Василевич, З. В. Карамышева,
Е. И . Рачковская; юж. оконечность системы гор Кызыл-
Рай (горы Бегазы), в 40 км к ЮВ от пос. Актогай, 9 VI
1969, А. П. Мишенкова (все в LE!); горный массив Бугу-
лы,10кмкСВотж.-д.ст.Жарык,26V2018,М.С.Кня-
зев (SVER!); увал 1 км к ЮВ от ж.-д . ст. Киик, 13 V 2019,
он же (SVER!); сопки 2 км к ЮВ от ж. -д. ст. Босага, 18 V
2019, он же (SVER!).
Мы рассматривали этот копеечник как расу
H. schellianum с густым оттопыренным опушением на
стеблях и листьях, описав ее как H. schellianum var. vil-
losum (Knyasev, 2011). Дальнейшие исследования по-
казали, что H. schellianum var. villosum имеет четкий,
вполне компактный ареал между истоками рек Са-
рысу, Нура и северным побережьем оз. Балхаш, где
типичный H. schellianum var. schellianum (с редкой
примесью оттопыренных волосков в опушении) не
встречается. В исследованных нами местонахож-
дениях в южной части Казахского мелкосопочника
северо-северо-восточнее ж.-д. ст. Жарык, юго-вос-
точнее ж.-д. ст. Босага и восточнее ж.-д. ст. Киик был
отмечен только H. schellianum var. villosum.
H. villosissimum резко отличается от всех видов
ряда Ucrainica строением бобов (обычно без шипи-
ков, но очень густо оттопыренно опушенных), а по
характеру опушения листьев и побегов может быть
смешан только с оттопыренно опушенной формой
западнотяньшаньского H. nikolai (= H. villosum Pav-
lov). От последнего, однако, он хорошо отличается
крыльями на треть короче лодочки (у H. nikolai в
2–3 раза короче), более узкими бобами иного стро-
ения (у H. nikolai бобы около 6 мм шир., с длинными
шипиками и опушены полуприжатыми волосками),
каштановыми (а не беловатыми) прилистниками.
Ключ для определения представителей ряда Ucrainica
рода Hedysarum
1. Листочки с двух сторон, черешки, стебли равномерно
и густо опушены оттопыренными волосками 1–2 мм
дл.; бобы весьма густо опушены оттопыренными, до-
вольно длинными (около 1 мм дл.) волосками, без ши-
пиков или с короткими (до 1 мм дл.) единичными ши-
пиками (острыми бугорками) ................. H. villosissimum.
+ Листочки, черешки, стебли опушены прижатыми или
полуоттопыренными волосками, иногда с примесью
редких оттопыренных волосков. Бобы опушены более
короткими (0.1–0 .5 мм дл.) прижатыми или отстоящи-
ми волосками, иногда голые ............................................... 2.
2. Все или нижние листья в розетках, полурозетках (2–4
нижних междоузлия годичного побега в сумме до 2 см
дл.); в целом побеги б. м . редуцированы, так что верх-
ний цветонос вместе с соцветием в 3–6 и более раз
длиннее суммарной длины предшествующих междо-
узлий. Бобы без шипиков, голые или с малозаметным
прижатым опушением из очень коротких (0.1 мм дл.)
волосков ..................................................................................... 3.
Виды родства Hedysarum ucrainicum (секция Multicaulia, Fabaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
139
+ Нижние листья не сближены в розетки (2–4 нижних
междоузлия годичного побега в сумме 3–5 см дл. и
более); в целом побеги хорошо развиты: верхний цве-
тонос вместе с соцветием равен, короче или до 2 раз
превышает суммарную длину предшествующих меж-
доузлий. Бобы обычно с шипиками, густо опушены
рыхло прижатыми или отстоящими волосками ......... 4.
3. Листочки с двух сторон б. м . густо опушены очень ко-
роткими (0.1–0 .2 мм дл.) прижатыми волосками (се-
ровато-зеленые); прилистники темно-каштановые, ко-
жистые, иногда с узким пленчатым окаймлением. Флаг
на 2–3 мм длиннее лодочки; крылья на треть или вдвое
короче лодочки. Генеративные побеги б. м . развиты:
междоузлие, предшествующее нижнему цветоносу, 1–5
см дл. .................................................................... H . ulutavicum.
+ Листочки сверху голые, снизу густо опушены волоска-
ми 0.3–0 .5 мм дл.; прилистники светло-бурые, кожи-
стые, по краю широко-белопленчатые. Флаг равен или
короче лодочки; крылья в 2–3 раза короче лодочки.
Все междоузлия годичного побега сильно укорочен-
ные: обычно растения «бесстебельные» (но отдельные
побеги могут быть развиты до 1–4 см) ................................
.......... .......... .......... .......... .......... .......... .......... ..
H. bectauatavicum.
4. Листочки средних листьев продолговатые, ланцетные,
с отношением длины к ширине 4–6. Черешки и стебли
опушены короткими волосками 0.3 –0.8 мм дл. (в 3–4
и более раз короче диаметра стебля). Чашечка, в том
числе зубцы, опушена рыхло прижатыми волосками
0.3 –0.5 мм дл. Членики бобов густо и равномерно по-
крыты тонкими, на верхушках немного согнутыми ши-
пиками ................................................................. H. ucrainicum.
+ Листочки средних листьев эллиптические, обратно-
яйцевидные, с отношением длины к ширине 2.5–4 .
Обычно в опушении черешков и нижних междоузлий
есть примесь полуоттопыренных волосков 1–2 мм дл.
(немного короче, длиннее или примерно равных диа-
метру стебля). Чашечка, в том числе зубцы, опушена
полуоттопыренными волосками 0.5–1 мм дл. Членики
бобов рассеянно покрыты более короткими, прямыми
шипиками, часто лишь единичными по краю члеников,
иногда лишь бугорками, или бобы без шипиков ......... 5.
5. Листочки сверху голые, снизу умеренно густо опу-
шены сероватыми волосками, обычно эллиптические
(с наибольшей шириной близ середины); прилистники
б. ч. бурые. Членики бобов с шипиками и бугорками,
очень редко без шипиков ............................. H . shellianium.
+ Листочки сверху равномерно опушены короткими
прижатыми волосками, снизу густо шелковисто опу-
шенные, обычно продолговато-обратнояйцевидные
(с наибольшей шириной в верхней трети); прилистни-
ки б. ч . беловатые. Членики бобов гладкие, очень редко
с единичными острыми бугорками .... H. tarbagataicum.
Благодарности
Исследования проведены по теме НИР Ботани-
ческого сада Уральского отделения РАН «Исследо-
вание и охрана фенотипического и генотипическо-
го разнообразия флоры и растительности России»
(АААА-А17-117072810011-1).
Литература | References
Bajtenov M. S. 1956. Novyye vidy roda Hedysarum DC. [New
species of genus Hedysarum DC.] // Vestnik Akademii
nauk Kazakhskoi SSR. No 3 (132). P. 99–107. [In Russian]
(Байтенов М. С . 1956. Новые виды рода Hedysarum DC.
// Вестник Академии наук Казахской ССР. No 3 (132).
С. 99–107).
Fedtschenko B. A . 1948. Rod Kopeyechnik — Hedysarum L.
[Genus Sweetvetch — Hedysarum L.] // Flora URSS.
Vol. 13. Mosqua; Leningrad: Ed. Acad. Sci. URSS. P. 259–
319. [In Russian] (Федченко Б. А . 1948. Род Копееч-
ник — Hedysarum L. // Флора СССР. Т. 13. М.; Л.: Изд-
во АН СССР. С . 259–319).
Kaschmensky B. F. 1905. Ueber Hedysarum ucrainicum und
verwandte Arten // Bull. Jard. Imp. Bot. St. -Pétersb.
T. 5, livr. 2. P. 57–65. [In Russian with German abstract]
(Кашменский Б. Ф . 1905. Hedysarum ucrainicum (sp. n.)
и смежные с ним виды // Изв. Имп. С .-Петерб. бот.
сада. Т. 5, вып. 2. С . 57–65).
Knyasev M. S. 2011. Notes on the chorology and taxonomy
of the Hedysarum (Fabaceae) species from the Urals and
Kazakhstan // Bot. Zhurn. Vol. 96, No 11. P. 1458–1464.
[In Russian with English abstract] (Князев М. С . 2011.
Заметки по хорологии и систематике рода Hedysarum
(Fabaceae) на Урале и в Казахстане // Бот. журн. Т. 96,
No 11. С . 1458–1464).
Knyasev M. S . 2013. The review of Eastern European and some
Siberian species of Hedysarum (Fabaceae) // Bot. Zhurn.
Vol. 98, No 10. P. 1261–1273. [In Russian with English
abstract] (Князев М. С . 2013. Обзор восточно-европей-
ских и некоторых сибирских копеечников (Hedysarum,
Fabaceae) // Бот. журн. Т . 98, No 10. С. 1261–1273).
Krytska L. I., Mosyakin S. L., Novosad V. V., Fedoron-
chuk M. M ., Tsarenko O. M., Shevera M. V. 1999. Typifica-
tion of species of vascular plants described from Ukraine:
Family Fabaceae Lindl. // Ukrayins’k. Bot. Zhurn. Vol. 56,
No 6. P. 606–616. [In Ukrainian] (Крицька Л. I., Мосякiн
С. Л ., Новосад В. В., Федорончук М. М., Царенко О. М.,
Шевера М. В. Типiфiкацiя видiв судинних рослин, опи-
саних з Украïни: родина Fabaceae Lindl. // Укр. бот.
журн. 1999. Т. 56, No 6. С. 606–616).
Philippov E. G., Kulikov P. V., Knyasev M. S. 2008. Chromo-
some numbers in Astragalus and Hedysarum (Fabaceae)
species of the Russian flora // Bot. Zhurn. Vol. 93, No 10.
P. 1614–1619. [In Russian with English abstract] (Филип-
пов Е. Г., Куликов П. В., Князев М. С . 2008. Числа хро-
мосом видов Astragalus и Hedysarum (Fabaceae) флоры
России // Бот. журн. Т. 93, No 10. С . 1614–1619).
Turland N. J., Wiersema J. H ., Barrie F. R., Greuter W., Hawk-
sworth D. L., Herendeen P. S., Knapp S., Kusber W.-H., Li
D.-Z ., Marhold K., May T. W., McNeill J., Monro A. M.,
Prado J., Price M. J ., Smith G. F. (eds.). 2018. International
Code of Nomenclature for algae, fungi, and plants (Shen-
zhen Code) adopted by the Nineteenth International Bo-
tanical Congress Shenzhen, China, July 2017. Glashütten:
Koeltz Botanical Books. (Regnum Vegetabile. Vol. 159).
https://doi.org/10.12705/Code.2018
М. С. Князев
Новости систематики высших растений | Том 50 | 2019
140
Ferula karakumica (Apiaceae) — новый вид из Туркменистана
Ferula karakumica (Apiaceae), a new species from Turkmenistan
А. В. Павленко
Поступила в редакцию | Submitted: 13.08.2019
Принята к публикации | Accepted: 02.12.2019
А. В. Павленко
Сердарский отдел Центра профилактики особо опасных
инфекций Министерства здравоохранения и медицинской
промышленности Туркменистана
ул. О. Акмамедова, 44, Сердар, 745150, Туркменистан
alexpavlenko1974@gmail.com
A. V. Pavlenko
Serdar Branch of the Center for Prevention of Special Danger
Infectious Diseases, Ministry of Health and Medical Industry of
Turkmenistan
O. Akmamedov Str., 44, Serdar, 745150, Turkmenistan
alexpavlenko1974@gmail.com
https://doi.org/10.31111/novitates/2019.50.141
Аннотация. Из Центральных Каракумов и песков Учтаган Туркменистана описан новый вид Ferula karakumica Geld. et
A. V. Pavlenko, близкий к F. karelinii Bunge по морфологии генеративных органов, но отличающийся от него габитуально
и по морфологии вегетативных органов. От других видов рода Ferula L. новый вид отличается стержневым корнем, снаб-
женным несколькими расставленными клубневидными утолщениями.
Ключевые слова: Ferula, новый вид, Учтаган, Центральные Каракумы, Туркменистан.
Abstract. A new species Ferula karakumica Geld. et A. V. Pavlenko is described from the Central Karakum and Uchtagan sands
(Turkmenistan). It resembles F. karelinii Bunge in morphology of its reproductive parts, but differs by general habit and mor-
phology of vegetative parts. The newly described species differs from other Ferula L. species in having roots with several well
spaced tuberiform thickenings.
Keywords: Ferula, new species, Uchtagan, Central Karakum, Turkmenistan.
В начале 1980-х годов в ходе летней экспедиции
в песках Учтаган (Северо-Западный Туркменистан)
профессор А. М. Гельдыханов собрал несколько эк-
земпляров растений из семейства Apiaceae Lindl. с
необычным строением корневой системы: главный
стержневой корень имел несколько расставленных
клубневидных утолщений. В разгар летнего перио-
да надземная часть была представлена полусухими
вегетативными органами, и описать новый вид не
представлялось возможным. Сборы Гельдыхано-
ва хранятся в Гербарном фонде Института общей и
прикладной биологии Инженерно-технологического
университета им. Огуз хана в Ашхабаде, Туркмени-
стан (ASH). Гельдыханов привел этот вид в доктор-
ской диссертации как Ferula karacumica Geld., nom.
nud. (Geldykhanov, 1995). В 2012 г. в Северо-Запад-
ном Туркменистане, в районе Нового Туркменского
озера автор настоящей статьи обнаружил несколько
растений, внешне сходных с F. karelinii Bunge. Они
были собраны без подземных органов. В 2019 г. в
двух точках Центральных Каракумов: на территории
нового заповедника «Берекетли Каракум» (северная
часть Центральных Каракумов) и по левому берегу
сухого русла Узбоя (западная часть Центральных
Каракумов) — нами было обнаружено еще несколь-
ко популяций того же вида с клубневидными взду-
тиями на стержневом корне. Было собрано 15 расте-
ний, которые послужили материалом для описания
нового вида.
Ferula karakumica Geld. et A. V. Pavlenko, sp.
nova.
—
F. karacumica Geld. 1995, Автореф. дис. ...
докт. биол. наук: 5, nom. nud. — Ферула каракумская.
Perennial. Root 20–40 cm long, deeply penetrating
into soil, with 3–4 tuberiform swellings (1–5 cm long
and 0.5–1.3 cm thick) along its length. Stem 20–40 cm
tall, single, glabrous, green, finely ribbed, the lower part
with conspicuous white stripes when dried (the stripes
less conspicuous on living plants); branched with
straight, almost vertical branches. Basal leaves long-
petiolate, sheaths slightly enlarged. Leaf blade rhom-
boid in outline, glabrous, 5–40 cm long and 3–20 cm
wide, 2–3 -pinnatisect; terminal segments linear, 1–5 cm
long and 1 mm wide, straight, semicylindrical in cross
section, with obscure veins. Umbels 3–11 cm across,
rays 3–7, glabrous, subequal, 1.5–7 cm long, finely
ribbed. Bracts absent. Umbellules 3–10 mm across,
flowers sessile. Bracteoles 6–8, lanceolate, acute, pubes-
cent, 2–4 mm long and 0.5–1 mm wide. Petals greenish-
yellow, pubescent, 1 mm long. Ovary pubescent. Styles
reflexed, twice shorter than ovary. Fruits 1–1.3 cm long
and 0.5–0.7 cm wide, covered with straight unicel-
2019
50: 141–147
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
Рис. 1. Голотип Ferula karakumica (ASH).
Fig. 1. Holotype of Ferula karakumica (ASH).
А. В. Павленко
Новости систематики высших растений | Том 50 | 2019
142
lular hairs, ellipsoidal, finely ribbed, slightly
twisted, on short pedicels (1 mm). Fl. IV(V),
fr. V(VI).
Holotype (Fig. 1): Turkmenistan,
«Western part of Central Karakum, northern
outskirts of Igdy water-well, left side of a dry
riverbed Uzboi, semifixed sands, 27 V 2019,
A. V. Pavlenko» (ASH; isotypes — ASH (5),
LE 01065508).
Paratypes: Turkmenistan, Central Kara-
kum: nature reserve «Bereketli Karakum», site Ka-
myshly, semifixed sands, 5 V 2019, I. Mommadov
(ASH); northern outskirts of Igdy water-well, semi-
fixed sands, 23 V 2019, A. V. Pavlenko (ASH (2),
LE 01065509).
Affinity. The species resembles F. kareli-
nii in the morphology of reproductive parts,
but distinctly differs from the latter in semicy-
lindrical terminal leaf segments (vs. flat with
involute margins in F. karelinii), distinctly
ribbed pubescent fruits, and in habit.
Distribution. Turkmenistan, Central
Karakum, slopes of sandy hills (Fig. 2).
Многолетник. Корень 20–40 см дл., несущий на
всем протяжении 3–4 расставленных клубневидных
утолщения 1–5 см дл. и 0.5–1.3 см толщ. Стебель 20–
40 см выс., одиночный, голый, зеленый, тонкоребри-
стый, в сухом виде в нижней части белополосатый, на
живых растениях белые полосы почти не выражены;
ветвистый с прямыми, почти вертикальными побега-
ми. Прикорневые листья на длинных черешках, пере-
ходящих в чуть расширенное влагалище. Пластинка
листа ромбическая, голая, 5–40 см дл. и 3–20 см шир.,
дважды или трижды перисторассеченная с конеч-
ными линейными дольками 1–5 см дл. и 1 мм шир.,
прямыми, в сечении полуцилиндрическими, с едва
заметными жилками. Зонтики 3–11 см в диам., с 3–7
голыми, слабо ребристыми равными лучами 1.5–7 см
дл. Обертка отсутствует. Зонтички 3–10 мм в диам.,
с сидячими цветками. Оберточка из 6–8 ланцетных
острых волосистых листочков 2–4 мм дл. и 0.5–1 мм
шир. Лепестки зеленовато-желтые, волосистые, до 1
мм дл. Завязь опушенная. Столбики отогнутые, в 2
раза короче завязи. Плоды 1–1.3 см дл. и 0.5–0.7 см
шир., эллиптические, слабо ребристые, слегка закру-
ченные по спирали, на ножке 1 мм дл., опушенные
торчащими одноклеточными волосками. Цв. IV(V),
пл. V(VI).
Голотип (рис. 1): Туркменистан, «Зап[адная]
часть
Центр[альных] Каракумов,
сев[ерные]
окр[естности] кол[одца] Игды, левый берег сухо-
го русла Узбоя, слабозакр[епленные] пески, 27 V
2019, А. В. Павленко» (ASH; изотипы — ASH (5),
LE 01065508).
Паратипы: Туркменистан, Центральные Кара-
кумы: запов[едник] «Берекетли Каракум», кордон Ка-
мышлы, слабозакр[епленные] пески, 5 V 2019, И. Мом-
мадов (ASH); сев[ерные] окр[естности] кол[одца] Игды,
слабозакр[епленные] пески, 23 V 2019, А. В . Павленко
(ASH (2), LE 01065509).
Родство. По морфологии генеративных орга-
нов вид близок к F. karelinii, но резко отличается от
последнего полуцилиндрическими (а не плоскими с
завернутыми краями) дольками листовой пластин-
ки, плодами с заметными ребрами и слабым опуше-
нием, иным габитусом.
Распространение. Туркменистан, Централь-
ные Каракумы, склоны песчаных гряд (рис. 2).
При изучении литературы отмечено, что в обра-
ботке семейства Apiaceae для «Флоры Туркмении»
Е. П. Коровин указывает для F. karelinii (Schuman-
nia karelinii (Bunge) Korovin) наличие одного клубня
(Korovin, 1950). Во «Флоре СССР» он же указывает
наличие у F. karelinii нескольких клубней (Korovin,
1951), как у нашего вида. Вызывает удивление тот
факт, что в региональных «Флорах» в последую-
щие годы признак нескольких клубней Коровиным
не упоминается (Korovin, 1959, 1963; Korovin et al.,
1984). Наличие клубней у F. karelinii приводят и дру-
гие авторы, но не указывают их количество (Korovi-
na et al., 1983; Leute, 1987).
Ареалы F. karelinii и F. karakumica совпадают, од-
нако первый вид по большей части приурочен к
глинистым такыровидным почвам или наносным
песчаным массивам с неглубоким залеганием под-
стилающих глинистых пород. F. karakumica всегда
связан с песчаными биотопами.
Рис. 2. Карта распространения Ferula karakumica.
Fig. 2. Distributional map of Ferula karakumica.
Ferula karakumica (Apiaceae)— новый вид из Туркменистана
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
143
F. karelinii был описан в XIX в. разными автора-
ми под разными названиями. Для Schumannia turco-
manica Kuntze (= Ferula karelinii) отмечены оттопы-
ренные (сильно отклоненные от стеблей) побеги и
листья, блестящие белополосатые стебли и широ-
кие, на концах загнутые белоокаймленные конечные
дольки листьев (Kuntze, 1887). А. Бунге при опи-
сании F. karelinii также указывал на оттопыренные
ветви, слабо надрезанные, серповидно загнутые ко-
нечные дольки листовых пластинок (Bunge, 1851).
Необходимо отметить, что ни один из авторов не
описывал подземную часть своих видов.
F. karelinii и F. karakumica прекрасно различимы
как в природе, так и в гербарии. Типичный F. kareli-
nii — это растопыренно-ветвистое сизое растение с
почти горизонтально отклоненными побегами и ли-
стьями, на которых очень четко выражены белые по-
лоски (рис. 3), F. karakumica — стройное зеленое рас-
тение с почти вертикальными побегами и листьями
с почти вертикальными пластинками (рис. 4).
Карпологическое описание. Мерикар-
пии F. karakumica 10–13 мм дл. и 5–7 мм шир., эл-
липтические, с развитыми краевыми ребрами, менее
заметными спинными ребрами, вогнутые с комиссу-
ральной стороны, слегка закрученные по спирали,
на ножке 1 мм дл., со спинной стороны опушенные
торчащими одноклеточными волосками. Экзокар-
пий однослойный с одноклеточными волосками.
Мезокарпий из двух слоев клеток: наружного — из
неодревесневших паренхимных клеток различной
формы, расположенных в 3–5 слоев, и внутренне-
го — гипоэндокарпия, состоящего из пористых тем-
ных клеток, расположенных в 2–3 слоя. В спинных
ребрах по одному проводящему пучку. Реберные
секреторные канальцы округлые, мелкие, располо-
жены по одному. Ложбиночные и комиссуральные
канальцы в 4–5 раз крупнее реберных, овальные,
расположены по 3 в ложбинках, на комиссуральной
Рис. 3. Ferula karelinii (май 2019), фото автора.
Fig. 3. Ferula karelinii (May 2019), photo by the author.
Рис. 4. Ferula karakumica (май 2019), фото автора.
Fig. 4. Ferula karakumica (May 2019), photo by the
author.
А. В. Павленко
Новости систематики высших растений | Том 50 | 2019
144
Рис. 5. Строение мерикарпиев Ferula karelinii (A) и F. karakumica (B, C).
A, B — схемы поперечных срезов мерикарпиев; C — фрагменты мерикарпия F. karakumica: a — краевое ребро; b — комис-
суральная сторона; c — спинная сторона. 1 — экзокарпий; 2 — ложбиночный секреторный каналец; 3 — гипоэндокарпий;
4 — паренхима мезокарпия; 5 — реберные проводящие пучки; 6 — реберные секреторные канальцы; 7 — эпитегма; 8 — ко-
миссуральные секреторные канальцы; 9 — эндосперм; 10 — проводящий пучок фуникулюса; 11 — склеренхима комиссу-
ры; 12 — склеренхима краевых ребер; 13 — одноклеточные волоски. Масштабная линейка: A, B — 1 мм.
Fig. 5. Mericarp structure of Ferula karelinii (A) and F. karakumica (B, С).
A, B — schemes of mericarp cross sections; C — details of F. karakumica mericarp: a — marginal rib; b — commissural side; c — dor-
sal side. 1 — exocarp; 2 — vallecular secretory duct; 3 — hypendocarp; 4 — mesocarp parenchyma; 5 — rib vascular bundles; 6 — rib
secretory ducts; 7 — seed coat; 8 — commissural secretory ducts; 9 — endosperm; 10 — funicular vascular bundle; 11 — commis-
sural sclerenchyma; 12 — marginal rib sclerenchyma; 13 — unicellular hairs. Scale bar: А, B — 1 mm.
Ferula karakumica (Apiaceae)— новый вид из Туркменистана
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
145
Рис. 6. Поперечные срезы конечных долек листьев Ferula karelinii (A) и F. karakumica (B, C).
1 — эпидермис; 2 — паренхима; 3 — проводящие пучки. Масштабная линейка: 1 мм.
Fig. 6. Cross sections of terminal leaf segments of Ferula karelinii (A) and F. karakumica (B, C).
1 — epidermis; 2 — parenchyma; 3 — vascular bundles. Scale bar: 1 mm.
стороне 8. Эндосперм в сечении изогнут, с выступа-
ми на уровне ребер мерикарпия, на концах тупо за-
острен.
Виды F. karelinii и F. karakumica по строению и ко-
личеству слоев клеток и по строению проводящей
системы мерикарпиев малоотличимы. В то же время
некоторые отличия у них имеются. В частности, ре-
бра более выражены на мерикарпиях F. karakumica,
на срезах же полуплодиков F. karelinii ребристость не
выражена (рис. 5). Вогнутость мерикарпия F. karaku-
mica с комиссуральной стороны придает иную фор-
му и эндосперму. У F. karelinii он плоский. Следует
отметить, что края эндосперма у последнего вида
округлые и ограничиваются воздушной прослойкой,
в разрезе треугольной. У F. karakumica эндосперм
свободного пространства не имеет, края его явно за-
остренные. Секреторные канальцы у нового вида не-
много крупнее, чем у F. karelinii.
На поперечных срезах конечных листовых долек
видно, что пластинка F. karelinii плоская, с загнуты-
ми вверх краями, а у F. karakumica — полуцилиндри-
ческая (рис. 6).
Местное население прекрасно различает эти
виды. Корневые утолщения F. karelinii имеют слад-
кий «морковный» вкус и нередко употребляются в
пищу. Клубни F. karakumica для этого непригодны,
поскольку имеют неприятный горчично-чесночный
привкус. Растения имеют разные названия: «kösük»
(клубень, боб) — F. karelinii и «dälije kösük» (дурной
клубень) — F. karakumica.
Среди 49 образцов F. karelinii в Гербарии Москов-
ского государственного университета им. М. В. Ло-
моносова (MW) (Seregin, 2019) два гербарных экзем-
пляра из Казахстана (MW0862863 и MW0862860)
имеют некоторое морфологическое сходство с новым
видом, что позволяет предположить произрастание
F. karakumica на территории этого государства.
Ниже приводим ключ для определения шести ви-
дов рода Ferula флоры Каракумов.
Ключ для определения видов рода Ferula флоры
Каракумов
1. Крупные растения с толстым (более 5 см в диам.) стеб-
лем более 1 м выс. ....................... F . foetida (Bunge) Regel.
+ Растения с тонким (менее 2 см в диам.) стеблем до 1 м
выс. .............................................................................................. 2.
2. Завязь и плоды опушенные ................................................ 3.
+ Завязь и плоды голые ........................................................... 5.
3. Корень веретеновидный, без клубневидных утолще-
ний, стебли и листья опушенные, плоды в очертании
округлые ........................................ F . litwinowiana Koso-Pol.
+ Корень имеет клубневидные утолщения, стебель и ли-
стья голые, плоды в очертании эллиптические ........... 4.
4. Корень с одним клубневидным утолщением; стебли и
листья четко белополосатые. Сизые растения с почти
горизонтальными побегами и листьями .............................
......... .......... .......... .......... .......... .......... .......... ..... F. karelinii Bunge.
+ Корень образует до 4 четкообразно расставленных
клубневидных утолщений. Зеленые растения с верти-
кальными побегами и листьями, белые полоски на сте-
блях и листьях на живых экземплярах почти незамет-
ны .............................. F . karakumica Geld. et A. V. Pavlenko.
5. Влагалища стеблевых листьев сильно вздутые, чаше-
видные или яйцевидные, стеблеобъемлющие, до 6 см
шир. Листья голые, их дольки до 40 мм дл. ........................
......... .......... .......... .......... .....
F. oopoda (Boiss. et Buhse) Boiss.
+ Влагалища стеблевых листьев немного вздутые, про-
долговатые, до 2 см шир. Листья с нижней стороны
А. В. Павленко
Новости систематики высших растений | Том 50 | 2019
146
опушенные, дольки их едва достигают 15 мм дл. .............
. .......... .......... .......... .......... .......... .......... .......... ..
F. szowitsiana DC.
Благодарности
Автор выражает благодарность А. М. Гельдыха-
нову (Туркменский государственный университет
им. Магтымгули, Ашхабад) за помощь при состав-
лении описания нового вида, рецензентам за цен-
ные замечания по материалам рукописи, А. П. Ко-
вальчуку (Университет Хельсинки) за перевод
описания вида на английский язык, И. В. Соколо-
вой и И. В. Татанову (Ботанический институт им.
В. Л. Комарова РАН) за помощь в решении техниче-
ских вопросов, а также Фонду М. Зуккова (Грайфс-
вальд, Германия), организовавшему экспедицию в
Центральные Каракумы в рамках проекта Central
Asian Desert Initiative (CADI).
Литература | References
Bunge A. A. 1851. Beitrag zur Kenntniss der Flor[a] Russ-
lands und der Steppen Central-Asiens. St. Petersburg:
Kaiserl. Akad. Wiss. 370 S. (Seors. impr.: Mém. Prés. Acad.
Imp. Sci. St. Pétersb. 1854. T. 7 . P. 177 –536). https://
doi.org/10.5962/bhl.title.51048
Geldykhanov A. M . 1995. Analiz flory Garagumov: Avtoreferat
dissertatsii... doktora biologicheskikh nauk [Analysis of the
flora of Garagum: Abstr. ... Diss. Doct. Sci.] Ashkhabad.
50 p. [In Russian] (Гельдыханов А. М . 1995. Анализ фло-
ры Гарагумов: Автореф. дис. ... докт. биол. наук. Ашха-
бад. 50 с.).
Korovin Ye. P. 1950. Sem. Umbelliferae — Zontichnyye [Fam.
Umbelliferae — Umbellifers] // Flora Turkmenii [Flora of
Turkmenia]. Vol. 5 . Ashkhabad: Ed. Turkm. Fil. Acad. Sci.
USSR. P. 171–250. [In Russian] (Коровин Е. П. 1950. Сем.
Umbelliferae — Зонтичные) // Флора Туркмении. Т . 5.
Ашхабад: Изд-во Туркм. фил. АН СССР. С . 171–250).
Korovin Ye. P. 1951. Rod Ferula — Ferula L. [Genus Ferula,
Giant Fennel — Ferula L.] // Flora URSS. T. 17. Mosqua;
Leningrad: Ed. Acad. Sci. URSS. P. 62–142 . [In Russian]
(Коровин Е. П . 1951. Род Ферула — Ferula L. // Флора
СССР. T. 17 . М .; Л.: Изд-во АН СССР. С . 62–142).
Korovin E.[Ye.] P. 1959. Sem. Umbelliferae — Zontichnyye
[Fam. Umbelliferae — Umbellifers] // Flora Uzbekistani-
ca. T. 4. Taschkent: Ed. Acad. Sci. UzSSR. P. 257–470. [In
Russian] (Коровин Е. П . 1959. Сем. Umbelliferae — Зон-
тичные // Флора Узбекистана. T. 4 . Ташкент: Изд-во
АН УзССР. С. 257–470).
Korovin Ye. P. 1963. Sem. Zontichnyye — Umbelliferae Moris.
[Fam. Umbellifers —Umbelliferae Moris.] // Flora Kazakh-
stana [Flora of Kazakhstan]. Vol. 6 . Alma-Ata: Ed. Acad.
Sci. KazSSR. P. 258–428. [In Russian] (Коровин Е. П .
1963. Сем. Зонтичные — Umbelliferae Moris. // Флора
Казахстана. T. 6. Алма-Ата: Изд-во АН КазССР. С . 258–
428).
Korovin Ye. P., Pimenov M. G ., Kinzikayeva G. K . 1984. Sem.
Zontichnyye — Umbelliferae Moriss. [Fam. Umbellifers —
Umbelliferae Moriss.] // Flora Tadzhikskoi SSR [Flora of
Tajik SSR]. Vol. 7. Leningrad: Nauka. P. 10–214. [In Rus-
sian] (Коровин Е. П., Пименов М. Г., Кинзикаева Г. К .
1984. Сем. Зонтичные — Umbelliferae Moriss. // Флора
Таджикской ССР. T. 7 . Л .: Наука. С . 10–214).
Korovina O. N., Bakhiyev A., Tadzhitdinov M. T., Sary-
bayev B. 1983. Illyustrirovannyi opredelitel vysshikh ras-
tenii Karakalpakii i Khorezma [Illustrated guide to higher
plants of Karakalpakia and Khorezm]. Vol. 2. Tashkent:
FAN. 216 p. [In Russian] (Коровина О. Н., Бахиев А.,
Таджитдинов М. Т., Сарыбаев Б. 1983. Иллюстрирован-
ный определитель высших растений Каракалпакии и
Хорезма. T. 2. Ташкент: ФАН. 216 с.).
Kuntze O. 1887. Plantae orientali-rossicae // Acta Horti Pet-
rop. T. 10, fasc. 1. P. 135–262.
Leute G. H. 1987. Schumannia // Flora Iranica. No 162. Graz:
Akad. Druck- u . Verl.-Anst. P. 434–435.
Seregin A. P. (ed.) . 2019. Moscow Digital Herbarium: Elect-
ronic resource. Moscow: Moscow State University. (Серё-
гин А. П. (ред.) . 2019. Цифровой гербарий МГУ: Элек-
тронный ресурс. М.: МГУ). http://plant.depo.msu.ru
(Accessed 20.07.2019).
Ferula karakumica (Apiaceae)— новый вид из Туркменистана
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
147
Craniospermum volkovae (Boraginaceae) — новый вид из Монголии
Craniospermum volkovae (Boraginaceae), a new species from Mongolia
С. В. Овчинникова
Центральный сибирский ботанический сад Сибирского
отделения РАН
Лаборатория систематики высших сосудистых растений и
флорогенетики
ул. Золотодолинская, 101, Новосибирск, 630090, Россия
sv-ovchin@yandex.ru
С. В. Овчинникова
Поступила в редакцию | Submitted: 04.09.2019
Принята к публикации | Accepted: 27.11.2019
S. V. Ovczinnikova
Central Siberian Botanical Garden, Siberian Branch of the
Russian Academy of Sciences
Laboratory of Systematics and Florogenetics
Zolotodolinskaya Str., 101, Novosibirsk, 630090, Russia
sv-ovchin@yandex.ru
https://doi.org/10.31111/novitates/2019.50.148
В соответствии с соглашением о научном сотруд-
ничестве между Центральным сибирским ботаниче-
ским садом Сибирского отделения РАН (г. Новоси-
бирск) и Институтом общей и экспериментальной
биологии Академии наук Монголии (г. Улан-Батор)
проводится ревизия видового состава Boraginaceae
Juss. Внешней Монголии.
Небольшой, но очень своеобразный род Cranio-
spermum Lehm. — черепосемянник — на основе ком-
плекса морфологических признаков был выделен
еще О. П. Декандолем (Candolle, 1845) в подтрибу
Craniosperminae DC. (≡ триба Craniospermeae DC.
ex Meisn.); справедливость этого положения под-
тверждают современные молекулярно-генетические
исследования (Chacon et al., 2016). В отличие от ро-
дов трибы Eritrichieae Guerke для рода характерен
долихоморфный лиловый или сине-фиолетовый
венчик без сводиков, низкопирамидальный, 1–1.5
мм выс., карпобазис с длинным столбиком, зажатым
между эремами, и головчато-дисковидным рыль-
цем и широкий, отогнутый набок брюшной киль на
эремах, который заканчивается довольно крупным,
выпуклым цикатриксом разной формы. На спин-
ке эремы несут слабо или заметно вздутое крыло
(Ovczinnikova, 2000, 2019a).
Виды рода Craniospermum — многолетние плот-
нокустовые травы, распространенные в полупу-
стынно-степной полосе Центрального Казахстана,
юга Сибири, Монголии и Северного Китая от 42°
до 55° с. ш. Как показали палиноморфологические
исследования, род Craniospermum можно отнести к
наиболее ранним представителям древнесредизем-
номорской флоры (Ovczinnikova, 2001). До насто-
ящего времени род включал 8 видов: C. subvillosum
Lehm. (секция Craniospermum) — эндемик литорали
озера Байкал в пределах Иркутской области и Ре-
спублики Бурятия; C. canescens DC. и C. desertorum
Ovczinnikova et A. Korolyuk (секция Leucolachnos
Ovczinnikova) — эндемики Русского и Монголь-
ского Алтая; C. subfloccosum Krylov — узкий энде-
мик Русского (Катунский хребет) и Казахстанского
(Нарымский хребет) Алтая, C. echioides (Schrenk)
Bunge — эндемик Джунгарии в пределах Казахстана,
Монголии и Китая, C. mongolicum I. M. Johnston —
эндемик Монголии и Китая в пределах северного
Синьцзяня и Внутренней Монголии, C. tuvinicum
Ovczinnikova — эндемик Тывы и Монгольского
Алтая (все из секции Diploloma (Schrenk) Popov);
C. pseudotuvinicum Ovczinnikova et A. Korolyuk — уз-
кий эндемик Монгольского Алтая (Ovczinnikova,
Аннотация. Из Центрально-Монгольско-Алтайской провинции Монголии описывается новый для науки вид
Craniospermum volkovae Ovczinnikova (Boraginaceae) из родства C. pseudotuvinicum Ovczinnikova et A. Korolyuk. Обсужда-
ются морфологические и эколого-ценотические особенности нового вида и обосновывается необходимость его выделе-
ния в самостоятельную секцию Pseudotuvinica Ovczinnikova.
Ключевые слова: Craniospermum, Boraginaceae, новый вид, новая секция, Монголия.
Abstract. A new species Craniospermum volkovae Ovczinnikova (Boraginaceae) from relationship of C. pseudotuvinicum
Ovczinnikova et A. Korolyuk, is described from the Central Mongolian-Altai province of Mongolia. Morphological and ecologo-
cenotic peculiarities of the new species are discussed, and the necessity of its treatment within a separate section Pseudotuvinica
Ovczinnikova is substantiated.
Keywords: Craniospermum, Boraginaceae, new species, new section, Mongolia.
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 148–153
2000, 2019b; Ovczinnikova, Orlov, 2005; Ovczinnikova,
Korolyuk, 2016).
При ревизии неопределенных гербарных матери-
алов по семейству Boraginaceae в коллекции сектора
Центральной и Восточной Азии Гербария Ботаниче-
ского института им. В. Л. Комарова РАН (LE) были
выделены образцы, определенные как новый для на-
уки вид. Ниже приводим его описание.
Craniospermum volkovae Ovczinnikova, sp. nova.
Perennial polycarpous plant with polycephalous
caudex, densely tufted, monopodially accrescent, with
primary rosette vegetative shoot and elongated axil-
lary generative shoots. Rosulate leaves lanceolate, long-
petiolate, 5–15 cm long, 0.5–2.5 cm wide, with distinct
veins, more or less densely pubescent with stiff long
(2–2.5 mm) squarrose bristles and squarrose short hairs.
Flowering stems 10–12 cm tall, simple, stubbly hairy,
slightly leaved, procumbent in fruit. Cauline leaves lan-
ceolate, 1–1.5 cm long, 2–3 mm wide, densely stubbly
hairy. Inflorescence of 2 coils with 5–8 flowers, almost
capitate, 1.3–1.5 cm diam. Floral bracts oblanceolate,
sessile, 0.8–2 cm long, 4–6 mm wide. Calyx softly pubes-
cent with tangled white hairs, with oblanceolate lobes,
(2.5)4–4.5(6) mm long. Corolla pink, saffron when dry,
5–6 mm long, dolichomorphic. Corolla teeth ca. 1 mm
long. Anthers 1.3–1.5 mm long, protruding from the
corolla. Stigma hidden inside the corolla. Carpobasis
pyramidal. Eremocarps 3.5–3.8 mm long, 1.6–1.8 mm
wide, greenish-gray, rugose-aculeate with microaculeate
ultrasculpture. Ala coriaceous, ruminate-aculeate, 3–3.2
mm long, 0.3–0.5 mm high, disk slightly visible. Margin-
ate laminae well distinct, membranous, 1.2–1.5 mm long.
Ventral keel broad. Cicatrix lanceolate, 1–1.2 mm long.
Holotype: Mongolian People’s Republic, Great
Lakes Depression, Jargalant-Uul Mt. in the system
of Bumbat-Khairkhan Ridge, alt. 2050 m a. s. l., pet-
rophyte-forb-wheatgrass (Agropyron nevskii) com-
munity on a scree southwestern slope, 23 VII 1983,
No 199, Е. А. Volkova, I. Yu. Sumerina, U. Beckett,
H. Buyan-Orshikh (LE: LE 01064110; isotype —
LE 01064111). — Fig. 1.
Affinity. Differs from C. pseudotuvinicum Ov-
czinnikova et A. Korolyuk in life-form with robust cau-
dex and denser rosette of leaves, more rigid pubescence
of squarrose bristles (vs. half-adpressed softer hairs),
lanceolate leaf blades with well-distinct veins, pink co-
rolla, and characters of eremocarps. — Fig. 2.
Distribution. Western Mongolia (Mongolian
Altai). Central Mongolian-Altai Province.
Habitat. Occurs in the driest petrophytic-forb-
grass communities on scree and rocks of southern expo-
sure.
Многолетний стержнекорневой с многоглавым
каудексом плотнокустовой моноподиально нараста-
ющий поликарпик с главным розеточным вегетатив-
ным побегом и удлиненными пазушными генератив-
ными побегами. Розеточные листья ланцетовидные,
на длинных черешках, 5–15 см дл., 0.5–2.5 см шир.,
с хорошо выраженными жилками, более или менее
густо опушенные жесткими длинными (2–2.5 мм)
оттопыренными щетинками и оттопыренными ко-
роткими волосками. Цветоносные стебли 10–12 см
выс., простые, отстояще-волосистые, слабо облис-
твенные, при плодах полегающие. Стеблевые ли-
стья ланцетовидные, 1–2 см дл., 3–4 мм шир., густо
оттопыренно-волосистые. Соцветие — двойной за-
виток из 5–8 цветков, почти головчатое, 1.3–1.5 см
в диам. Брактеи обратноланцетовидные, сидячие,
0.8–2 cм дл., 4–6 мм шир. Чашечка мягко спутанно-
беловолосистая с обратноланцетовидными долями,
(2.5)4–4.5(6) мм дл. Венчик розовый, при высыха-
нии шафрановый, 5–6 мм дл., долихоморфный. Зуб-
цы венчика около 1 мм дл. Пыльники 1.3–1.5 мм дл.,
выставляющиеся из венчика. Рыльце спрятано вну-
три венчика. Карпобазис пирамидальный. Эремы
3.5–3.8 мм дл., 1.6–1.8 мм шир., зеленовато-серые,
со складчато-шиповатой поверхностью и мелкоши-
поватой ультраскульптурой. Крыло эрема кожистое,
складчато-морщинистое с заметными шипиками,
3–3.2 мм дл., 0.3–0.5 мм выс., диск слабо виден. Пла-
стины оторочки хорошо видимые, перепончатые,
1.2–1.5 мм дл. Брюшной киль широкий. Цикатрикс
ланцетовидный, 1–1.2 мм дл.
Голотип: Монгольская Народная Республика,
Котловина больших озер, гора Джаргалант-Ула в си-
стеме хр. Бумбат-Хайрхан, выс. 2050 м над ур. м., пе-
трофитно-разнотравно-пырейное (Agropyron nevskii)
сообщество на осыпном склоне юго-западной экспо-
зиции, 23 VII 1983, No 199, Е. А. Волкова, И. Ю. Су-
мерина, У. Беккет, Х. Буян-Орших (LE: LE 01064110;
изотип — LE 01064111). — Рис. 1.
Паратипы: Монгольская Народная Республи-
ка, Кобдосский аймак, Цэцэг сомон, близ н. п . Цэцэг,
гора Цаст-Богдо-Ула, пойма ручья, склоны и скалы,
28 VII 1975, No 1020, О. В. Журба (MW: MW0188424,
MW0188425).
Вид назван в честь ботанико-географа Елены
Анатольевны Волковой (Исаченко), многие годы
посвятившей изучению флоры и растительности
Монгольского и Гобийского Алтая, собравшей уни-
кальные образцы реликтовых видов рода Craniosper-
mum с самых высоких и труднодоступных хребтов
Монголии.
Родство. От C. pseudotuvinicum Ovczinnikova
et A. Korolyuk отличается жизненной формой с
мощным каудексом и более плотной розеткой ли-
Craniospermum volkovae (Boraginaceae) — новый вид из Монголии
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
149
Рис. 1. Голотип Craniospermum volkovae (LE 01064110).
Fig. 1. Holotype of Craniospermum volkovae (LE 01064110).
С. В. Овчинникова
Новости систематики высших растений | Том 50 | 2019
150
стьев, более жестким опушением из оттопыренных
щетинок (а не полуприжатых более мягких воло-
сков), ланцетовидной формой листовых пластинок
с хорошо выраженными жилками, розовым цветом
венчика и признаками эремов. — Рис. 2.
Распространение. Западная Монголия (Мон-
гольский Алтай). Центрально-Монгольско-Алтай-
ская провинция.
Встречается в самых сухих петрофитно-разно-
травно-злаковых сообществах на осыпях и скалах
южной экспозиции.
Местонахождения вида — гора Джаргалант-Ула в
системе хребта Бумбат-Хайрхан и гора Цаст-Богдо-
Ула — находятся на высотах свыше 2000 м над ур. м.
в пределах Центрально-Монгольско-Алтайской про-
винции. В этой провинции располагаются самые вы-
сокие хребты Монгольского Алтая. Это самая сухая,
отграниченная от западного переноса влаги часть
горной страны. В нижней части склонов представле-
ны опустыненные степи, в которых доминируют как
степные злаки, так и пустынно-степной Stipa krylovii
Roshev., а также своеобразные монголо-алтайские
пырейные сообщества с Agropyron nevskii N. A. Iva-
nova ex Grubov. Выше по склонам господствуют
сухие дерновиннозлаковые степи, обычными доми-
нантами которых выступают широко распростра-
ненные степные виды: Poa attenuata Trin., Koeleria
cristata (L.) Pers, Stipa krylovii Roshev. Местообита-
ния преимущественно склоновые со слабо развиты-
ми каменистыми почвами, что отражается в высо-
кой активности петрофитных видов: Festuca lenensis
Drobow, Eremogone meyeri (Fenzl) Ikonn., Amblynotus
rupestris (Pall. ex Georgi) Popov ex Serg., Orostachys
spinosa (L.) C. A. Mey. и др. В силу значительной
расчлененности рельефа широкое распространение
на всех высотах имеют несомкнутые группировки
петрофитных растений, среди которых встречается
Craniospermum volkovae. Основные типы сообществ
Центрально-Монгольско-Алтайской провинции ха-
рактерны для Монголии или Центральной Азии в
целом, однако довольно большое число сообществ —
эндемичные монголо-алтайские или даже централь-
но-монголоалтайские типы (Volkova, 1994).
При построении системы рода Craniospermum ге-
терогенная секция Diploloma была разделена на две
подсекции: монотипную subsect. Floccosa Ovczin-
nikova c C. subfloccosum и subsect. Diploloma (Schrenk)
Ovczinnikova с видами C. echioides, C. mongolicum и
C. tuvinicum, последний был выделен в отдельный ряд
Tuvinica Ovczinnikova. Для представителей секции
Diploloma диагностическими являются следующие
признаки: крыло охватывает всю спинную площад-
ку эрема, открытое, вздутое, хрящевидно-кожистое,
диск хорошо виден, пластинки оторочки отчетливо
выражены, поверхность эрема поперечно-складча-
тая, голая или бугорчато-шипиковая (Ovczinnikova,
2000). Секция объединяет стержнекорневые полуро-
зеточные поликарпические растения, произрастаю-
щие на скалах и сухих каменистых склонах в полосе
степей и пустынь. При обнародовании C. pseudotu-
vinicum этот вид сравнивали с C. tuvinicum, и предва-
рительно он был отнесен к секции Diploloma. Однако
отмечалось, что, несмотря на внешнее сходство по
наличию листовых пластинок на длинных черешках,
превышающих длину цветоносных стеблей, строе-
нию соцветия и венчика, различия в опушении ли-
стовой пластинки и чашечки, в морфологии плода, в
жизненной форме показывают, что их нельзя считать
близкими видами (Ovczinnikova, Korolyuk, 2016).
На основании особенностей строения эремов с
учетом признаков жизненной формы, опушения,
строения цветка выделяем виды C. pseudotuvinicum
и C. volkovae из секции Diploloma в самостоятельную
секцию.
Sect. Pseudotuvinica Ovczinnikova, sect. nova.
Ala located in the upper half of eremocarp, cartila-
ginous-leathery, unswollen. Disk of eremocarp slightly
visible. Marginate laminas well visible. The eremocarp
surface rugate or rugose-aculeate. Plants of petrophy-
tic-grass steppes on scree southern slopes.
—
Крыло
расположено в верхней половине эрема, хрящевид-
но-кожистое, невздутое. Диск эрема слабо виден.
Пластинки оторочки отчетливо выражены. Поверх-
ность эрема складчатая или складчато-шиповатая.
Растения петрофитно-злаковых степей на осыпных
склонах южной экспозиции.
Type: Craniospermum pseudotuvinicum Ovczinni-
kova et A. Korolyuk.
Благодарности
Работа выполнена в рамках государственного
задания ЦСБС СО РАН по проекту АААА-А17-
117012610055-3 и при частичной финансовой под-
держке Российского фонда фундаментальных иссле-
дований в рамках проекта No 15-29-02429. Выражаю
искреннюю признательность А. Е. Грабовской-Бо-
родиной за предоставленный для работы гербарный
материал, И. В. Соколовой за редактирование ан-
глийского диагноза, М. В. Легченко за оформление и
сканирование типовых гербарных образцов.
Исследование органов растений проводилось
с помощью стереомикроскопа Carl Zeiss Stereo
Discovery V.12 с цветной цифровой камерой вы-
сокого разрешения AxioCam HRс и с программой
AxioVision 4.8 для получения, обработки и анализа
Craniospermum volkovae (Boraginaceae) — новый вид из Монголии
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
151
С. В. Овчинникова
Новости систематики высших растений | Том 50 | 2019
152
Рис. 2. Органография Craniospermum volkovae и C. pseudotuvinicum.
C. volkovae: 1 — форма верхней части и опушение листовой пластинки сверху; 2 — форма верхней части и опушение ли-
стовой пластинки снизу; 3 — средняя часть листовой пластинки снизу; 4 — вид эрема со стороны крыла; 5 — вид эрема со
стороны цикатрикса; 10 — поверхность эрема; 11 — поверхность крыла.
C. pseudotuvinicum: 6 — форма и опушение листовой пластинки сверху; 7 — форма и опушение листовой пластинки снизу;
8 — вид эрема со стороны крыла; 9 — вид эрема со стороны цикатрикса; 12 — поверхность эрема; 13 — поверхность крыла.
Масштабныелинейки:1–3,6,7 —2мм;4,5,8,9 —1мм;10,11,13—20мкм;12—50мкм.
Fig. 2. Organography of Craniospermum volkovae and C. pseudotuvinicum.
C. volkovae: 1 — shape and pubescence of the upper part of leaf blade, upper surface; 2 — shape and pubescence of the upper part of
leaf blade, lower surface; 3 — middle part of leaf blade, lower surface; 4 — eremocarp, view from the ala; 5 — eremocarp, view from
the cicatrix; 10 — eremocarp surface; 11 — ala surface.
C. pseudotuvinicum: 6 — shape and pubescence of the upper part of leaf blade, upper surface; 7 — shape and pubescence of the upper
part of leaf blade, lower surface; 8 — eremocarp, view from the ala; 9 — eremocarp, view from the cicatrix; 12 — eremocarp surface;
13 — ala surface.
Scalebars:1–3,6,7 —2mm;4,5,8,9 —1mm;10,11,13—20μm;12—50μm.
изображений и сканирующего электронного микро-
скопа Carl Zeiss EVO MA 10 (инженер И. Еремин).
Все исследования выполнялись в ЦКП микроскопи-
ческого анализа биологических объектов ЦСБС СО
РАН.
Литература | References
Candolle A. P. de. 1845. Ordo Borragineae // Prodromus
systematis naturalis regni vegetabilis. Ps. 9. Paris. P. 466–
559.
Chacon J., Luebert F., Hilger H., Ovchinnikova S., Selvi F.,
Cecchi L., Guilliams C. M., Hasenstab-Lehman K., Suto-
ry K., Simpson M. G ., Weigend M. 2016. The borage family
(Boraginaceae s. str.): a revised infrafamilial classification
based on new phylogenetic evidence, with emphasis on
the placement of some enigmatic genera // Taxon. Vol. 65,
No 3. P. 523–546. https://doi.org/10.12705/653.6
Ovczinnikova S. V. 2000. The system of the genus Cranio-
spermum (Boraginaceae) // Bot. Zhurn. Vol. 85, No 12.
P. 77–87. [In Russian with English abstract] (Овчинни-
кова С. В. 2000. Система рода Craniospermum (Boragina-
ceae) // Бот. журн. Т . 85, No 12. С. 77 –87).
Ovczinnikova S. V. 2001. Palynomorphology of the genus Cra-
niospermum (Boraginaceae) // Bot. Zhurn. Vol. 86, No 12.
С. 44 –50. [In Russian with English abstract] (Овчинни-
кова С. В . 2001. Палиноморфология рода Craniosper-
mum (Boraginaceae) // Бот. журн. Т . 86, No 12. С . 44 –50).
Ovczinnikova S. V. 2019a. Morphological peculiarities of fruits
in the Craniospermum species (Boraginaceae) // Sovre-
mennyye problemy morfologii i reproduktivnoi biologii
semennykh rastenii: Materialy vserossiiskoi s mezhduna-
rodnym uchastiyem konferentsii, posvyaschennoi pamya-
ti R. E . Levinoi: Sbornik nauchnykh statei. Ulyanovsk:
UlGPU. P. 65–71. [In Russian with English abstract] (Ов-
чинникова С. В. 2019a. Морфологические особенности
плодов у видов рода Craniospermum (Boraginaceae) //
Современные проблемы морфологии и репродуктив-
ной биологии семенных растений: Материалы всерос. с
междунар. участием конф., посвящ. памяти Р. Е . Леви-
ной: Сб. науч. статей. Ульяновск: УлГПУ. С . 65–71).
Ovczinnikova S. V. 2019b. Addition to the species composi-
tion of Boraginaceae of Outer Mongolia // Turczaninowia.
Vol. 22, No 3. С . 97–110. [In Russian with English abstract]
(Овчинникова С. В. 2019б. Дополнение к видовому
составу бурачниковых (Boraginaceae) Внешней
Монголии // Turczaninowia. Т. 22, No 3. С . 97–110).
https://doi.org/10.14258/turczaninowia.22.3 .5
Ovczinnikova S. V., Korolyuk A. Yu. 2016. New species of the
genus Craniospermum (Boraginaceae) from Mongolia //
Rastitelnyi mir Aziatskoi Rossii [Plant Life of Asian Rus-
sia]. No 3 (23). С . 33 –40. [In Russian with English abstract]
(Овчинникова С. В., Королюк А. Ю. 2016. Новые виды
рода Craniospermum (Boraginaceae) из Монголии // Рас-
тительный мир Азиатской России. No 3 (23). С . 33–40).
https://doi.org/10.21782/RMAR1995-2449-2016-3(33-
40)
Ovczinnikova S. V., Orlov V. P. 2005. Craniospermum subfloc-
cosum (Boraginaceae), a new species to the flora of Rus-
sia // Bot. Zhurn. Vol. 90, No 9. С . 1463–1464. [In Russian
with English abstract] (Овчинникова С. В., Орлов В. П .
2005. Craniospermum subfloccosum (Boraginaceae) — но-
вый вид для флоры России // Бот. журн. Т. 90, No 9.
С. 1463–1464).
Volkova E. A . 1994. Botanical geography of Mongolian and
Gobian Altai. St. Petersburg: Komarov Botanical Institute.
Part 14. 131 p. [In Russian] (Волкова Е. А. 1994. Бота-
ническая география Монгольского и Гобийского Алтая.
СПб.: Ботанический институт им. В. Л . Комарова РАН.
Вып. 14. 131 с.).
Craniospermum volkovae (Boraginaceae) — новый вид из Монголии
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
153
Заметка о Stachys mucronata (Lamiaceae) и его месте в системе
рода
Taxonomic note on Stachys mucronata (Lamiaceae) and its position in the genus
system
Т. В. Крестовская
Ботанический институт им. В. Л. Комарова РАН
Гербарий высших растений
ул. Профессора Попова, 2, Санкт-Петербург, 197376, Россия
tatyana.krestovskaya@binran.ru, stachys@mail.ru
Т. В. Крестовская
Поступила в редакцию | Submitted: 27.09.2019
Принята к публикации | Accepted: 14.11.2019
T. V. Krestovskaya
Komarov Botanical Institute, Russian Academy of Sciences
Herbarium of Higher Plants
Professora Popova Str., 2, St. Petersburg, 197376, Russia
tatyana.krestovskaya@binran.ru, stachys@mail.ru
Аннотация. Приведена критическая заметка о Stachys mucronata Sieber ex Spreng. (Lamiaceae), определено его место в си-
стеме рода. На основе обобщенных данных по морфологии и результатов филогенетических исследований, известных из
литературы, вид рассматривается в составе монотипной секции Mucronatae R. Bhattacharjee и подрода Eriostomum (Hoff-
manns. et Link) Krestovsk., последнее название обнародовано в новом ранге, приведено обоснование выделения этого
подрода. Обозначен лектотип названия S. mucronata.
Ключевые слова: Stachys mucronata, лектотип, систематика, подрод Eriostomum.
Abstract. Critical note on Stachys mucronata Sieber ex Spreng. (Lamiaceae) is given, its position in the genus system is estab-
lished. On the basis of data of its morphology and phylogenetic evidence known from the literature, the species is treated here
within the monotypic section Mucronatae R. Bhattacharjee and the subgenus Eriostomum (Hoffmanns. et Link) Krestovsk., the
latter is given a new rank. The lectotype of S. mucronata is designated.
Keywords: Stachys mucronata, lectotype, taxonomy, subgenus Eriostomum.
Stachys mucronata Sieber ex Spreng.
—
один из
наиболее своеобразных видов рода Stachys L. Он
представлен низкорослыми ветвистыми полукустар-
ничками 10–30 см выс. с двухцветковыми «мутов-
ками» и колючими заостренными зубцами чашечки.
Ареал вида — греческие острова Крит, Касос и Кар-
патос, где он является одним из элементов фриганы
и произрастает преимущественно на известняко-
вых склонах, поднимаясь до высоты 1000–1200 м
над ур. м. (Strid, 2016). Нам удалось наблюдать его
в природе, а также изучать в коллекциях в боль-
шинстве крупных европейских Гербариев. Положе-
ние этого вида в системе рода менялось со времени
его описания. В одной из последних систем рода
R. Bhattacharjee (1980) S. mucronata рассматривался
в составе монотипной секции Mucronatae R. Bhat-
tacharjee. В основу выделения этой секции автором
были положены признаки длинных прицветников,
двухцветковые мутовки и почти правильная чашеч-
ка с длинными заостренными зубцами. Вместе с тем,
по морфологии S. mucronata близок к видам секции
Eriostomum (Hoffmanns. et Link) Dumort.; их сближа-
ет присутствие розетки листьев в основании стебля,
длинноволосистое опушение верхней губы венчика,
кольцо волосков в зеве чашечки, а также одинаковое
число хромосом — 2n = 30.
Согласно молекулярно-филогенетическим иссле-
дованиям (Salmaki et al., 2019), основанным на из-
учении нуклеотидных последовательностей ядерной
рибосомальной ДНК (nrETS, 5S NTS), S. mucronata
вместе с видами секции Eriostomum образует единую
монофилетическую кладу. Однозначных таксономи-
ческих выводов авторы этой статьи не делают, кон-
статируя, что требуются дополнительные исследо-
вания, но предлагают два возможных варианта. По
одному из них, эта клада заслуживает ранга самосто-
ятельного рода (род был описан Hoffmannsegg, Link,
1809). Отметим, что принятие этой точки зрения
потребует многочисленных соответствующих но-
менклатурных изменений. Согласно другому вари-
анту, в род Stachys должны быть включены еще не-
сколько родов, включая род Sideritis L., и его объем
достигнет порядка 470 видов (вместо 300). На наш
взгляд, виды, объединенные в таксон Eriostomum, по
морфологическим признакам являются частью рода
Stachys, что нашло отражение и в последней, наибо-
https://doi.org/10.31111/novitates/2019.50.154
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 154–157
лее разработанной системе губоцветных (Harley et
al., 2004), построенной в том числе с учетом извест-
ных к тому времени данных по филогении семейства
и его родов (Lindquist, Albert, 2002; и др.). В пользу
этой общности свидетельствует отсутствие у видов
Eriostomum выраженных отличий родового ранга, ка-
сающихся явных особенностей цветка или плодов.
Вместе с тем отметим, что эта группа в целом
более явственно отличается по габитусу от других
секций рода, в том числе по ряду особенностей ве-
гетативной сферы, как то: многочисленные выра-
женные прицветники, многоцветковые «мутовки» и
др. В связи с этим, с учетом данных традиционной
систематики, основанных на морфологии, и резуль-
татов вышеуказанных молекулярных исследова-
ний, полагаем, что таксон Eriostomum целесообраз-
но рассматривать в ранге подрода рода Stachys с
двумя секциями: Eriostomum и монотипной секцией
Mucronatae. Основу комплекса признаков подрода
Eriostomum составляют наличие базальной розетки
листьев, многоцветковые мутовки (исключая S. mu-
cronata), многочисленные длинные прицветники,
длинноволосистое опушение верхней губы венчика,
кольцо волосков в устье трубки чашечки, а также
число хромосом 2n = 30; эти признаки отличают его
от типового подрода Stachys.
Stachys L. subgen. Eriostomum (Hoffmanns. et
Link) Krestovsk., stat. nov. ≡ Eriostomum Hoffmanns. et
Link, 1809, Fl. Portug. 1: 105. ≡ Stachys sect. Eriostomum
(Hoffmanns. et Link) Dumort. 1827, Fl. Belg.: 45.
—
Lectotypus (Pfeiffer, 1874: 1247): S. germanica L.
Многолетние травянистые растения или полуку-
старнички 15–120 см выс. с прикорневой розеткой
листьев (кроме S. hissarica Regel). Цветоносные стеб-
ли простые, реже ветвистые, густо-беловолосистые
или войлочно опушенные, реже редковолосистые
или прижато опушенные. Нижние стеблевые листья
продолговато-яйцевидные, продолговато-линейные
или продолговато-ланцетовидные, зубчатые или
почти цельнокрайные, в основании сердцевидные
или суженные, длинночерешковые; средние стебле-
вые листья более мелкие, короткочерешковые или
почти сидячие, постепенно переходящие в б. м. сидя-
чие прицветные листья. Соцветия (2–4)12–20-цвет-
ковые. Прицветники б. ч. многочисленные, длинные
(6–10 мм дл.), от яйцевидно-ланцетовидных до ли-
нейно-ланцетных, б. ч. мягкие (редко жесткие), на
верхушке заостренные или без заострения, с возрас-
том опадающие. Цветоножки 2–15 мм дл. Чашечка
б. м. двугубая или почти правильная, трубчато-ко -
локольчатая, изнутри (в зеве) с густым кольцом во-
лосков; зубцы неравной или почти равной длины,
на верхушке заостренные. Трубка венчика снабже-
на внутри косым волосистым кольцом, чаще почти
полностью заключена в чашечку; верхняя губа вен-
чика сверху густо войлочно или волосисто опушен-
ная (длина волосков превышает длину самой губы).
Эремы шаровидно-обратнояйцевидные (редко про-
долговато-обратнояйцевидные), узкокрылатые в ос-
новании, с развитым вентральным ребром. — 2n = 30
(кроме S. persica S. G. Gmel. ex C. A. Mey., у которого
2n = 24).
32 вида и 15 подвидов, распространенных в Атл.,
Центр., Южн. и Вост. Европе, на Кавказе, в Зап.
(кроме Аравийского п-ова), Средн., Южн. (сев.-зап.)
и Юго-Вост. (Индонезия) Азии и Сев. Африке (сре-
диземноморские р-ны).
1. Травянистые многолетники, «мутовки» многоцветко-
вые, чашечки слабо двугубые, на коротких цветонож-
ках .............................................................. 1 . Sect. Eriostomum.
+ Полукустарнички, «мутовки» 2(4)-цветковые, чашеч-
ки правильные, на длинных цветоножках ..........................
......... .......... .......... .......... .......... .......... .......... . 2. Sect. Mucronatae.
1. Stachys subgen. Eriostomum (Hoffmanns. et Link)
Krestovsk. sect. Eriostomum (Hoffmanns. et Link) Du-
mort.
—
Lectotypus (Pfeiffer, 1874: 1247): S. ger-
manica L.
31 вид, распространение по всему ареалу подрода.
2. Stachys subgen. Eriostomum (Hoffmanns. et
Link) Krestovsk. sect. Mucronatae R. Bhattacharjee,
1980, Notes Roy. Bot. Gard. Edinb. 38: 77 (“Mucrona-
ta”). —
Typus: S. mucronata Sieber ex Spreng.
= S. sect. Zietenia (Gled.) Benth. 1834, Lab. Gen.
Sp.: 563, p. p., excl. typo.
= S. sect. Stachyotypus Benth. § Fruticulosae Boiss.
1879, Fl. Or. 4: 716, p. p.
Низкорослые полукустарнички 10–30 см выс.,
в основании с несколькими вегетативными побе-
гами. Стебли ветвистые, c густым шерстистым или
войлочным опушением. Листья в основании стебля
продолговатые, зубчатые, в основании клиновидные
или усеченные, на длинных черешках. Стеблевые
листья мелкие, сходные по форме с базальными, си-
дячие. Прицветные листья не превышают парци-
альные соцветия. Парциальные соцветия («мутов-
ки») 2(4)-цветковые, расставленные. Прицветники
ланцетовидные, на верхушке заостренные, равные
по длине трубке чашечки. Цветоножки 5–15 мм дл.
Чашечка почти правильная, колокольчатая с 10 вы-
раженными жилками, в зеве густо опушенная, зубцы
почти равные, заостренные. Трубка венчика равна
трубке чашечки, внутри с кольцом волосков. Венчик
белый или розовый, по длине лишь слегка превосхо-
Заметка о Stachys mucronata (Lamiaceae) и его месте в системе рода
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
155
Рис. Лектотип Stachys mucronata.
Fig. Lectotype of Stachys mucronata
(HBG-518112, https://plants.jstor.org/stable/pdf/10.5555/al.ap.specimen.hbg518112).
Т. В. Крестовская
Новости систематики высших растений | Том 50 | 2019
156
дит чашечку. Эремы обратнояйцевидные, в основа-
нии слегка крылатые. — 2n = 30.
Монотипная секция.
1. S. mucronata Sieber ex Spreng. 1825, Syst. Veg.,
ed. 16, 2: 733; Benth. 1834, Lab. Gen. Sp.: 563; id. 1848,
in DC., Prodr. 12: 487; Boiss. 1879, Fl. Or. 4: 737; Briq.
1897, in Engl. u. Prantl, Nat. Pflanzenfam. 4, 3a: 265;
Turland et al. 1993, Fl. Cret. Area: 292; L. Chilton а.
Turland, 1997, Flora of Crete suppl.: 54; Strid, 2016, At-
las Aegean fl. 1: 376.
Описан с о. Крит («Creta»).
—
Lectotypus
(Krestovskaya, hic designatus): «Stachys mucronata.
Sieb. Stia» (HBG: HBG-518112 photo!; isolectotypi —
BR: BR0000005175291 — photo!, BR0000005175949 —
photo!; HAL: HAL0137350 — photo!; JE: JE00002193 —
photo!; K: K00928369!; M: M186086 — photo!; MO:
MO-2367780 — photo!; P: P03518461 — photo!; S:
S08-9493!; W: W0008236!, W0008237!, W1889-
0027588!, W1889-0185268!, W1889-0285102!; WU:
WU0073776 — photo!). — Рис.
Во фригане, на сухих скалистых склонах на из-
вестняках, иногда на скалах, на выс. от 0 до 1200 м
над ур. м.
—
Греция: острова Крит (вост.), Касос и
Карпатос.
Вид был описан C. Sprengel (1825) в «Systema
vegetabilium». Основой для описания послужи-
ли образцы (образец) из коллекции Ф. В. Зибера
(F. W. Sieber), собранные им во время путешествия
на о. Крит в 1817 г. Часть коллекции была приоб-
ретена К. Л. фон Рейхенбахом (C. L. von Reichen-
bach), а часть продана и разослана частным лицам и
во многие европейские Гербарии, в том числе в виде
эксикат (Stafleu, Cowan, 1985). Сборы по семейству
Labiatae были проданы и посланы И. А. Шмидту
(J. A. Schmidt) в Гейдельберг. Среди этой коллек-
ции («ex herb. J. A. Schmidt»), хранящейся сейчас в
Гербарии Университета Гамбурга (HBG), есть гер-
барный образец, снабженный рукописным ярлыком,
указывающим на его принадлежность к гербарию
К. Шпренгеля (C. Sprengel) — «Herb. Spreng.[el]»,
а также определением предположительно рукой
Шпренгеля — Stachys mucronata Sieb. На образце
кроме этого ярлыка также имеется печатная эти-
кетка «Stachys mucronata. Sieb. Stia. [Siteia]», общая
и для других экземпляров эксикат этого вида. Этот
экземпляр (HBG-518112) мы выбираем в качестве
лектотипа названия этого вида. Остальные вышеука-
занные образцы эксикат являются изолектотипами.
По морфологии S. mucronata ближе всего к ви-
дам секции Eriostomum из ближневосточной под-
секции Libanoticae Krestovsk. (Krestovskaya, 2011),
с которой его сближают малоцветковые мутовки и
чашечки с выраженными жилками. Возможно, это
обусловлено существовавшими в древности связями
между Критом и территорией Передней Азии. Его
обособленное положение по отношению к другим
видам подрода Eriostomum, в том числе и по морфо-
логии, скорее всего, связано с длительной островной
изоляцией.
Благодарности
Работа выполнена в рамках реализации госу-
дарственного задания согласно плану НИР Бота-
нического института им. В. Л. Комарова РАН по
теме «Сосудистые растения Евразии: системати-
ка, флора, растительные ресурсы» (No АААА-А19-
119031290052-1).
Литература | References
Bhattacharjee R. 1980. Taxonomic studies in Stachys II //
Notes Roy. Bot. Gard. Edinb. Vol. 38, No 1. P. 65–96.
Harley R. M., Atkins S. A., Budantsev A. L ., Cantino P. D.,
Conn B. J ., Grayer R., Harley M. M., de Kok R., Krestovs-
kaja T., Morales R., Paton A. J., Ryding O. 2004. Labiatae
// The Families and Genera of Vascular Plants / K. Ku-
bitzki, J. W. Kadereit (eds.). Vol. 7. Berlin; Heidelberg:
Springer-Verlag. P. 167–275.
Hoffmannsegg J. C ., Link H. F. 1809. Flore Portugaise. Т. 1.
Berlin. 458 p.
Krestovskaya T. V. 2011. The critical review of species of the
genus Stachys L. section Eriostomum Hoffmanns. et Link
(Labiatae) // Novosti Sist. Vyssh. Rast. Vol. 42. P. 198–
221. [In Russian] (Крестовская Т. В . 2011. Критический
обзор видов секции Eriostomum Hoffmanns. et Link рода
Stachys L. (Labiatae) // Новости сист. высш. раст. Т. 42.
С. 198–221).
Lindquist C., Albert V. A . 2002. Origin of the Hawaiian ende-
mic mints within North American Stachys (Lamiaceae) //
Amer. J. Bot. Vol. 89. P. 1709–1724 .
Pfeiffer L. 1874. Nomenclator Botanicus: Nominum ad finem
anni 1858 publici... Cassell: T. Fischeri. Vol. 1, ps. 2 . P. 809–
1876.
Salmaki Y., Heubl G., Weigend M. 2019. Towards a new classi-
fication of tribe Stachydeae (Lamiaceae): naming clades us-
ing molecular evidence // Bot. J. Linn. Soc. Vol. 190, No 4.
P. 345–358. https://doi.org/10.1093/botlinnean/boz021
Sprengel C. 1825. Systema vegetabilium. Ed. 16. T. 2 . Gottin-
gae: Sumtibus Librariae Dieterichianae. 939 p.
Stafleu F. A ., Cowan R. S. 1985. Taxonomic literature. 2
nd ed.
Vol. 5: Sal–Ste. Bohn: Scheltema a. Holkema; Utrecht.
305 p.
Strid A. 2016. Atlas of the Aegean flora. Part 1: Text and plates.
Berlin: Botanic Garden and Botanical Museum Berlin,
Freie Universitat Berlin. 700 p.
Заметка о Stachys mucronata (Lamiaceae) и его месте в системе рода
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
157
Новые виды рода Thymus (Lamiaceae) из Бурятии
и Северной Осетии
New species of the genus Thymus (Lamiaceae) from Buryatia and North Ossetia
В. М. Васюков
Институт экологии Волжского бассейна РАН — филиал
Самарского федерального исследовательского центра РАН
Лаборатория проблем фиторазнообразия
ул. Комзина, 10, Тольятти, 445003, Россия
vvasjukov@yandex.ru
В. М. Васюков
Поступила в редакцию | Submitted: 23.05.2019
Принята к публикации | Accepted: 27.11.2019
V. M. Vasjukov
Institute of Ecology of the Volga River Basin — Branch of the
Samara Federal Research Center of the Russian Academy of
Sciences
Department of Problems of Phytodiversity
Komzina Str., 10, Tolyatti, 445003, Russia
vvasjukov@yandex.ru
Аннотация. Описаны два новых для науки вида Thymus (Lamiaceae): T. chamarensis Vasjukov (sect. Serpyllum) с юга Вос-
точной Сибири (хребет Хамар-Дабан в Бурятии) и T. osseticus Vasjukov (sect. Kotschyani) с Северного Кавказа (Цейский
хребет в Северной Осетии).
Ключевые слова: Lamiaceae, Thymus, Россия, Бурятия, Северная Осетия, новые виды.
Abstract. Two new species of the Thymus (Lamiaceae) are described: T. chamarensis Vasjukov (sect. Serpyllum) from the south
of Eastern Siberia (Khamar-Daban in Buryatia), and T. osseticus Vasjukov (sect. Kotschyani) from the North Caucasus (Tsei
Range in North Ossetia).
Keywords: Lamiaceae, Thymus, Russia, Buryatia, North Ossetia, new species.
Род Thymus L. — один из наиболее крупных (око-
ло 300–350 видов) и таксономически сложных в
семействе Lamiaceae. В России, по нашим данным,
встречается около 140 видов рода, некоторые из них
требуют уточнения таксономического статуса.
В результате критической ревизии гербарного
материала (LE, MHA, MOSP, MW, PVB) и моногра-
фических обработок (Klokov, 1954, 1973; Menitsky,
1986; Doronkin, 1997; и др.) по роду Thymus нами
выявлены два новых вида; их описания приводятся
ниже.
Thymus chamarensis Vasjukov, sp. nova (sect. Ser-
pyllum (Mill.) Benth.). — Тимьян (чабрец) хамарский.
Subshrublet with thin (1–1.5 mm diam.) ascending
shoots 5–20 cm tall terminating in decumbent vegeta-
tive shoots. Reproductive shoots 1–2 cm tall, round-
ish, densely foliate, pubescent throughout; hairs short,
recurved and half-appressed. Shoots heterophyllous.
Lower leaves with blades equal to the petioles; median
leaves short-petiolate, elliptical or roundish, 2–5 mm
long and 1–2.5 mm wide, all leaves adaxially rather
sparsely pubescent with long hairs, abaxially glabrous
or with scattered hairs. Venation camptodromous, not
sharply expressed, glands noticeable. Inflorescence
dense, ca. 1 cm long, flowers with short (up to 1 mm
long) pedicels; calyx in anthesis ca. 3.5 mm long, violet,
with scattered long hairs throughout; teeth of the upper
lip shortly ciliate. Corolla ca. 5 mm long, pale purple.
Plant with lemon scent. Fl. VI–VII.
Holotype (Fig. 1): «Russia, Buryatia, Baikal Na-
ture Reserve, subalpine zone of Khamar-Daban Range,
south-facing slope, Dunda-Saga River basin, stony for-
mations among dwarf pines, near upper border of for-
est zone, 51°16′50.2′′ N, 105°17′20.9′′ E, 1537 m a. s. l.,
9 VII 2018, N. S. Gamova» (LE: LE 01064346; iso-
type — MW).
Affinity. The closely related T. eravinensis Serg.
distributed in Baikal region differs from the new spe-
cies by reproductive shoots 1.5–2.5 cm tall, absence of
heterophylly, linear or narrowly oblong leaves 2–5 mm
long and 0.5–2 mm wide adaxially covered with long
hairs and abaxially glabrous, and calyx ca. 3 mm in an-
thesis.
Distribution. Stony formations of Khamar-Da-
ban (Buryatia).
Полукустарничек с довольно тонкими (1–1.5 мм
в диам.) восходящими стволиками 5–20 см дл., за-
канчивающимися лежачими вегетативными побе-
гами. Генеративные побеги 1–2 см выс., округлые,
https://doi.org/10.31111/novitates/2019.50.158
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 158–162
Рис. 1. Голотип Thymus chamarensis (LE 01064346).
Fig. 1. Holotype of Thymus chamarensis (LE 01064346).
Новые виды рода Thymus (Lamiaceae) из Бурятии и Северной Осетии
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
159
Рис. 2. Голотип Thymus osseticus (MW0713366).
Fig. 2. Holotype of Thymus osseticus (MW0713366).
В. М. Васюков
Новости систематики высших растений | Том 50 | 2019
160
опушенные на всем протяжении недлинными вниз
полуприжатыми волосками, довольно густо облис-
твенные. Нижние листья с черешками, почти рав-
ными по длине всей пластинке (гетерофиллия резко
выражена), средние стеблевые листья довольно ко-
роткочерешковые, эллиптические до округлых, 2–5
мм дл. и 1–2.5 мм шир. Все листья сверху негусто
опушенные длинными волосками, снизу голые или
с редкими волосками; жилкование камптодромное,
нерезко выдающееся, точечные железки довольно
хорошо заметные. Соцветие плотное, около 1 см дл.;
цветоножки короткие, до 1 мм дл.; чашечки во вре-
мя цветения около 3.5 мм дл., фиолетовые, почти по
всей поверхности рассеянно длинноволосистые, зуб-
цы верхней губы чашечки по краю короткореснитча-
тые. Венчики около 5 мм дл., бледно-лиловые. Рас-
тение с лимонным запахом. Цв. VI–VII.
Голотип (рис. 1): «Россия, Бурятия, Байкаль-
ский заповедник, подгольцовье южного макроскло-
на Хамар-Дабана, басс. р. Дунда-Сага, каменистые
участки среди кедрового стланца, близ верхней гра-
ницы леса, 51°16′50.2′′ N, 105°17′20.9′′ E, 1537 м над
ур. м., 9 VII 2018, Н. С. Гамова» (LE: LE 01064346;
изотип — MW).
Родство. Отличительные признаки близкого
T. eravinensis Serg. (Прибайкалье): генеративные по-
беги 1.5–2.5 см выс.; гетерофиллия отсутствует, ли-
стья линейные или продолговато-линейные, 2–5 мм
дл. и 0.5–2 мм шир., сверху густо опушенные длин-
ными волосками, снизу голые; чашечки во время
цветения около 3 мм дл.
Распространение. Каменистые склоны Ха-
мар-Дабана в Бурятии.
Thymus osseticus Vasjukov, sp. nova (sect. Ko-
tschyani (Klokov et Des.-Shost.) Klokov).
—
Тимьян
(чабрец) осетинский.
Subshrublet with branched, short and thin (1–1.5
mm diam.) shoots terminating in reproductive shoots;
vegetative shoots present, ascending. Reproductive
shoots 5–10 cm tall, roundish, pubescent throughout;
hairs of two types: short, half-appressed, recurved tri-
chomes, and scattered, longer (ca. 1 mm), spreading tri-
chomes. Leaves short-petiolate, covered with scattered
long hairs on both sides; venation camptodromous,
not sharply expressed, glands barely noticeable. Lower
leaves 2–4 mm long and 2–4 mm wide, long-petiolate,
median leaves oblong, 5–10 mm long and 2–3 mm wide.
Inflorescence dense, 1–1.5 cm long, flowers with short
(up to 1 mm long) pedicels; calyx in anthesis ca. 3 mm
long, with scattered long hairs almost throughout; teeth
of the upper lip ciliate. Corolla 5–5.5 mm long, pale
purple. Fl. VI–VII.
Holotype (Fig. 2): Russia, «North Ossetia, Ar-
don River basin, Greater Caucasus Range system, east-
ern slope of Tsei Range above Buron village (left mar-
gin of Alagir ravine), above the road Buron — Tsei,
gravelly slope facing SE, 1300 m a. s. l., 20 VI 1976,
A. M. Amirkhanov» (MW: MW0713366).
Affinity. The closely related T. rariflorus K. Koch
distributed in South and East Transcaucasia and Dages-
tan differs from the new species by very shortly pubes-
cent stems (hairs recurved, up to 0.1 mm long), gla-
brous leaves (T. rariflorus var. dzawacheticus Ronniger
possesses shortly pubescent leaves) and non-ciliate ca-
lyx teeth.
Distribution. Gravelly slope of Tsei Range
(North Ossetia).
Полукустарничек с разветвленными, довольно
короткими и тонкими (1–1.5 мм в диам.) восходя-
щими стволиками, заканчивающимися генератив-
ным побегом; вегетативные побеги отходят от ство-
ликов, приподнимающиеся. Генеративные побеги
5–10 см выс., округлые, опушенные на всем протя-
жении короткими полуприжатыми вниз волосками
и рассеянными длинными (около 1 мм дл.) отсто-
ящими волосками. Листья короткочерешковые, с
обеих сторон покрыты рассеянными длинными во-
лосками; жилкование камптодромное, нерезко вы-
дающееся, точечные железки малозаметные. Ниж-
ние листья (2–4 мм дл. и 2–4 мм шир.) значительно
меньше остальных, с округлой пластинкой и доволь-
но длинным черешком; средние стеблевые листья
продолговатые, 5–10 мм дл. и 2–3 мм шир. Соцветие
плотное, 1–1.5 см дл.; цветоножки короткие, до 1 мм
дл.; чашечки во время цветения около 3 мм дл., поч-
ти по всей поверхности рассеянно-длинноволоси-
стые, зубцы верхней губы чашечки по краю реснит-
чатые. Венчики 5–5.5 мм дл., бледно-лиловые. Цв.
VI–VII.
Голотип (рис. 2): Россия, «Северо-Осетин-
ская АССР, бассейн р. Ардон, система Главного Во-
дораздельного хребта, восточный склон Цейского
хребта над пос. Бурон (левый борт Алагирского
ущелья), над дорогой Бурон — Цей, щебнистый
склон ЮВ экспозиции, 1300 м над ур. м., 20 VI 1976,
А. М. Амирханов» (MW: MW0713366).
Родство. Отличительные признаки близкого
T. rariflorus K. Koch (Южное и Восточное Закавка-
зье, Дагестан): стебли на всем протяжении опушен-
ные только очень короткими (до 0.1 мм дл.) вниз
направленными волосками, листья с обеих сторон
голые (редко коротко опушенные — var. dzawacheti-
cus Ronniger), чашечки во время цветения 3–3.5 мм
дл., зубцы верхней губы чашечки по краю без ресни-
чек.
Новые виды рода Thymus (Lamiaceae) из Бурятии и Северной Осетии
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
161
Распространение. Щебнистые склоны Цей-
ского хребта в Северной Осетии.
Благодарности
Автор благодарит А. П. Сухорукова за помощь в
подготовке статьи, Н. С. Гамову — за предоставлен-
ный материал для нашего исследования, А. П. Се-
рёгина и М. В. Легченко — за помощь в оформле-
нии иллюстративного материала, С. В. Саксонова и
И. В. Соколову — за ценные консультации.
Литература | References
Doronkin V. M. 1997. Thymus L. — Timyan, Bogorodskaya tra-
va [Thymus L. — Thyme] // Flora Sibiriae. T. 11. Novosi-
birsk: Nauka. P. 205–220. [In Russian] (Доронькин В. М .
1997. Thymus L. — Тимьян, Богородская трава // Флора
Сибири. Т. 11 . Новосибирск: Наука. С. 205–220).
Klokov M. V. 1954. Rod Timyan — Thymus L. [Genus Thyme —
Thymus L.] // Flora URSS. T. 21. Mosqua; Leningrad: Ed.
Acad. Sci. URSS. P. 470–590. [In Russian] (Клоков М. В.
1954. Род Тимьян — Thymus L. // Флора СССР. Т. 21.
М.; Л.: Изд-во АН СССР. С . 470–590).
Klokov M. V. 1973. Rasoobrazovaniye v rode timyanov — Thy-
mus L. na territorii Sovetskogo Soyuza [Race formation in
genus Thyme — Thymus L. on the territory of the Soviet
Union]. Kiev: Naukova Dumka. 190 p. [In Russian] (Кло-
ков М. В. 1973. Расообразование в роде тимьянов —
Thymus L. на территории Советского Союза. Киев: На-
укова думка. 190 с.).
Menitsky Yu. L . 1986. Conspectus specierum generis Thymus
L. (Lamiaceae) in flora Caucasi // Novosti Sist. Vyssh.
Rast. T. 23. P. 117–142 . [In Russian] (Меницкий Ю. Л.
1986. Обзор видов рода Thymus L. (Lamiaceae) флоры
Кавказа // Новости сист. высш. раст. Т. 23. С . 117–
142).
В. М. Васюков
Новости систематики высших растений | Том 50 | 2019
162
Номенклатурные заметки
Nomenclatural notes
Номенклатурные заметки о Myosotis jenissejensis
и Myosotis asiatica subsp. kolymensis (Boraginaceae)
Nomenclatural notes on Myosotis jenissejensis and Myosotis asiatica
subsp. kolymensis (Boraginaceae)
И. В. Соколова1, О. Д. Никифорова2
1 Ботанический институт им. В. Л. Комарова РАН
Гербарий высших растений
ул. Профессора Попова, 2, Санкт-Петербург, 197376, Россия
isokolova@binran.ru
2 Центральный сибирский ботанический сад СО РАН
Лаборатория систематики высших сосудистых растений
и флорогенетики
ул. Золотодолинская, 101, Новосибирск, 630090, Россия
nikiforovansk@yandex.ru
И. В. Соколова, О. Д. Никифорова
Поступила в редакцию | Submitted: 23.08.2019
Принята к публикации | Accepted: 03.09.2019
I. V. Sokolova1, O. D. Nikiforova2
1 Komarov Botanical Institute, Russian Academy of Sciences
Herbarium of Higher Plants
Professora Popova Str., 2, St. Petersburg, 197376, Russia
isokolova@binran.ru
2 Central Siberian Botanical Garden, Siberian Branch of the
Russian Academy of Sciences
Laboratory of Systematics and Florogenetics
Zolotodolinskaya Str., 101, Novosibirsk, 630090, Russia
nikiforovansk@yandex.ru
Аннотация. Валидизировано название Myosotis jenissejensis O. D. Nikif., sp. nova. Обозначен лектотип названия Myosotis
asiatica (Vestergr. ex Hultén) Schischk. et Serg. subsp. kolymensis O. D. Nikif.
Ключевые слова: Myosotis, Boraginaceae, действительное обнародование, типификация.
Abstract. The name Myosotis jenissejensis O. D. Nikif., sp. nova is validated. The lectotype of Myosotis asiatica (Vestergr. ex
Hultén) Schischk. et Serg. subsp. kolymensis O. D. Nikif. is designated.
Keywords: Myosotis, Boraginaceae, valid publication, typification.
Валидизация названия Myosotis jenissejensis
Myosotis jenissejensis O. D. Nikif., sp. nova; О. Д. Ни-
киф. 2008, Бот. журн. 93, 2: 340, publ. inval., sine Herb.
indicatione. — M. caespitosa Schultz var. jenissejensis Po-
pov, 1953, Фл. СССР, 19: 367, publ. inval., descr. ross.
Holotypus («typus», Никифорова, in sched.):
«Prov. Kemerovo, districtus Krapiviniensis, in adja-
centibus olim pagi Laczinovo, ripa sinistra fl. Laczinovs-
kaja kurja, arenoso-limosus syrtis, 17 VIII 2005 [fl., fr.],
G. I. Yakovleva».
—
Голотип: «Кемеровская обл.,
Крапивинский р-н, окр. бывшей дер. Лачиново, ле-
вый берег р. Лачиновская курья, песчано-илистая от-
мель, 17 VIII 2005 [цв., пл.], Г. И. Яковлева».
—
LE:
LE 01056841.
Паратипы:
1–3. «[Кемеровская обл.] Енисейская губ., Ени-
сейский уезд, Бельская волость, болото среди сме-
шанного леса, близ д. Лукьяновой, 24 VI 1914 [цв.,
пл.], И. В. Кузнецов». Этикетки образцов отлича-
ются полевыми номерами: No 4616 (LE 01056842),
No 4617 (LE 01056843, LE 01056844).
4. «[Красноярский край] Туруханский край, лес
у ст. Холмогорово, 17 IX 1914 [цв., пл.], Н. И. Кузне-
цов, В. В. Ревердатто, No 4284» (LE 01056845).
При обнародовании названия «Myosotis jenissejen-
sis» O. D. Nikif. (Nikiforova, 2008) в протологе не был
указан Гербарий, где хранится голотип. Тем самым
не были выполнены требования статьи 40.7 Между-
народного кодекса номенклатуры водорослей, гри-
бов и растений (ICN) (Turland et al., 2018), согласно
которой с 1 января 1990 года для действительного
обнародования названия таксона в ранге вида или
ниже необходимо указывать единственное учреж-
дение или коллекцию, где хранится типовой экзем-
пляр. Таким образом, название оказалось недействи-
тельно обнародованным.
https://doi.org/10.31111/novitates/2019.50.163
2019
50: 163–165
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
В Гербарии Ботанического института им. В. Л. Ко-
марова (LE) хранится образец, который был этике-
тирован О. Д. Никифоровой как тип M. jenissejen-
sis. Цитируя место его хранения, мы валидизируем
название. Также в типовом фонде LE хранятся еще
4 образца, процитированные при описании (Nikiforo-
va, 2008: 342), которые мы указываем здесь как пара-
типы, с несколько уточненными данными этикеток.
Примечание. Myosotis jenissejensis хорошо отличается
звездчато раскрытой чашечкой, глубоко, почти до основа-
ния, рассеченной на ланцетные острые доли (Nikiforova,
2008). У остальных видов рода Myosotis чашечка в разной
степени сросшаяся, и наибольшая степень ее срастания
характерна для видов типовой секции Myosotis, к которой
относится M. jenissejensis.
Большинство исследователей определяют образцы
этого вида как M. caespitosa, которому он близкородствен.
Если экземпляр собран в цветущем состоянии и у него от-
сутствуют плоды, то иногда его принимают за восточно-
азиатский вид Trigonotis myosotidea (Maxim.) Maxim.
(Red..., 2000) или за Strophiostoma sparsiflorum (J. C . Mikan
ex Pohl) Turcz., поскольку у этих видов чашечка также
звездчато раскрытая, т. е. ее доли несросшиеся.
Myosotis jenissejensis большей частью распространен
в южной части правобережья р. Оби — на Кузнецком
Алатау и Салаирском кряже, которые являются извест-
ными рефугиумами третичных неморальных реликтов.
Также он отмечен в двух пунктах юга Красноярского
края, на левобережье р. Енисея. Относительно недавно
вид был впервые собран в Томской области. Приводим
полную этикетку этого образца: «Томская обл., Томский
р-н, окр. с. Батурино, дол. р. Тугояковка, обочина сырой
грунтовой дороги, 4 IX 2016, А. Л . Эбель (A. L. Ebel)»
(NSK).
Лектотипификация Myosotis asiatica subsp.
kolymensis
Myosotis asiatica (Vestergr. ex Hultén) Schischk.
et Serg. subsp. kolymensis O. D. Nikif. 1997, Фл. Сиб.
11 (Pyrolaceae — Lamiaceae): 122.
Lectotypus (Nikiforova, hic designatus):
«С. А. Бутурлин: Колымская экспедиция 1905 г.
Якутск. обл., Колымск. окр., по пути из Походска на
Пантелеиху (заимку), правый берег р. Колымы, ска-
лы Толстого и Крестового мысов, 28 VII [1905] [цв.],
И. Шульга, No 352» (LE: LE 01056660); isolectotypi:
LE 01056659 (No 351), LE 01056661 (No 353).
Тип Myosotis asiatica subsp. kolymensis процити-
рован в протологе следующим образом: «Typus: dis-
trictus Kolyma, inter punctis Pochodsk et Panteleicha
(LE)... Между селами Походск и Пантелеиха — клас.
мест.» (Nikiforova, 1997: 122). Первоначальный ма-
териал этого подвида в типовом фонде LE представ-
лен 5 образцами, относящимися к двум сборам, и ни
один из этих образцов не был этикетирован автором
как тип:
1–3. «С. А. Бутурлин: Колымская экспеди-
ция 1905 г. Якутск. обл., Колымск. окр., по пути
из Походска на Пантелеиху (заимку), правый бе-
рег р. Колымы, скалы Толстого и Крестового мы-
сов, 28 VII [1905] [цв.], И. Шульга». Этикетки об-
разцов отличаются лишь полевыми номерами:
No 351 (LE 01056659), No 352 (LE 01056660), No 353
(LE 01056661).
4, 5. «ЯАССР, 35 км ЮВ Крестов Нижне-Колым-
ских, окр. пос. Пантелеихи, зл.-разнотр. кустарники,
9 VII 1950 [цв.], Г. Н. Непли, No 313». Текст этикеток
незначительно различается: на образце LE 01056657
есть указание: «склон к реке», отсутствующее на об-
разце LE 01056658.
Этикетки образцов LE 01056659–LE 01056661
соответствуют указанию местонахождения в про-
тологе. Местонахождение же образцов LE 01056657
и LE 01056658: «35 км ЮВ Крестов Нижне-Колым-
ских [совр. п. г. т. Черский], окр. пос. Пантелеи-
хи» — находится дальше Пантелеихи в направлении
из Походска, то есть не соответствует указанному в
протологе. Таким образом, несмотря на то что пер-
воначальный материал относится к двум сборам, в
протологе процитирован только один из них. В соот-
ветствии с ICN (Turland et al., 2018: Art. 40.2, Ex. 1)
указание типа названия таксона в ранге вида или
ниже как условие действительного обнародования
может быть достигнуто ссылкой на единственный
сбор или часть сбора. Так как указанный сбор пред-
ставлен более чем одним экземпляром, они являют-
ся синтипами (Turland et al., 2018: Art. 40.2, Note 1),
из числа которых мы выбрали обозначенный здесь
лектотип (Turland et al., 2018: Art. 9.3).
Примечание. Узколокальная эколого-морфологиче-
ская раса M. asiatica subsp. kolymensis была описана из
низовьев р. Колымы. Из-за небольшого объема материа-
ла из Гербариев LE, NSK, NS, на котором было основано
первоописание, у автора возникли сомнения в самосто-
ятельности подвида, и он был сведен в синонимы (Niki-
forova, 2009). В дальнейшем, изучение образцов арктиче-
ских растений M. asiatica из гербарных фондов Института
биологических проблем криолитозоны СО РАН (SASY),
особенно новых сборов его сотрудников, позволило вновь
признать subsp. kolymensis (Nikiforova, 2012). В пределах
циркумполярного вида M. asiatica подвид хорошо вы-
деляется высокорослостью, удлиненным корневищем,
более крупным, 7–8 мм в диам., венчиком и наличием в
опушении чашечки единичных крючковатых волосков.
Последняя особенность является одним из важных диа-
гностических признаков subsp. kolymensis. Вне пределов
распространения этого подвида M. asiatica слабо проявля-
ет изменчивость по данному признаку: чашечка опушена
только прямыми оттопыренными и серповидными воло-
сками, а крючковатые волоски в ее опушении полностью
отсутствуют. Наличие у M. asiatica subsp. kolymensis еди-
И. В. Соколова, О. Д. Никифорова
Новости систематики высших растений | Том 50 | 2019
164
ничных крючковатых волосков в опушении чашечки вво-
дило в заблуждение некоторых ботаников, и иногда рас-
тения с р. Колымы определялись как M. sylvatica Ehrh. ex
Hoffm. Однако последний вид относится к секции Sylvati-
cae (Popov ex Riedl) Tzvelev, для видов которой характер-
ны многочисленные (не единичные) крючковатые воло-
ски на чашечке и другая форма ареолы эремов (Nikiforova,
2001).
Благодарности
Работа О. Д. Никифоровой выполнена в рам-
ках государственного задания Центрального си-
бирского ботанического сада СО РАН по проекту
No АААА-А17-117012610055-3, работа И. В. Соколо-
вой — в рамках государственного задания Ботаниче-
ского института им. В. Л. Комарова РАН по проекту
No АААА-А18-118022090078-2.
Выражаем искреннюю благодарность г. н. с. ла-
боратории экологии и генезиса почвенно-раститель-
ного покрова Института биологических проблем
криолитозоны ФИЦ ЯНЦ СО РАН, д. б. н. Е. Г. Ни-
колину за предоставленный гербарный материал.
Литература | References
Nikiforova O. D . 1997. Myosotis L. — Nezabudka [Myosotis L. —
Forget-Me-Not] // Flora Sibiriae. T. 11: Pyrolaceae — La-
miaceae (Labiatae). Novosibirsk: Nauka. P. 119–131. [In
Russian] (Никифорова О. Д. 1997. Myosotis L. — Неза-
будка // Флора Сибири. Т. 11: Pyrolaceae — Lamiaceae
(Labiatae). Новосибирск: Наука. С . 119–131).
Nikiforova O. D. 2001. System of the genus Myosotis (Boragi-
naceae) // Bot. Zhurn. Vol. 86, No 12. С . 77 –86 . [In Russian
with English abstract] (Никифорова О. Д . 2001. Система
рода Myosotis (Boraginaceae) // Бот. журн. Т . 86, No 12.
С. 77–86).
Nikiforova O. D. 2008. The new species Myosotis jenissejensis
(Boraginaceae) from Siberia // Bot. Zhurn. Vol. 83, No 2.
P. 339–342. [In Russian with English abstract] (Никифо-
рова О. Д . 2008. Новый вид Myosotis jenissejensis (Boragi-
naceae) из Сибири // Бот. журн. Т. 93, No 2. С . 339 –342).
Nikiforova O. D. 2012. Semeistvo Boraginaceae Juss. [Family
Boraginaceae Juss. (part)] // Conspectus florae Rossiae
Asiaticae: Plantae vasculares / red. princip. K . S. Baikov.
Novosibirsk: Publ. House Sib. Branch Russ. Acad. Sci.
P. 374–379. [In Russian] (Никифорова О. Д. 2012. Се-
мейство Boraginaceae Juss. [Argusia, Onosma, Lithosper-
mum, Buglossoides, Stenosolenium, Echium, Brachybotrys,
Mertensia, Trigonotis, Cerinthe, Borago, Brunnera, Lycopsis,
Nonea, Pulmonaria, Symphytum, Myosotis, Strophiosto-
ma] // Конспект флоры Азиатской России: Сосудистые
растения / под ред. К . С. Байкова. Новосибирск: Изд-во
СО РАН. С . 374–379).
Red Data Book of the Kemerovo Territory: Rare and dis-
appearing plant and fungus species. 2000 / A. T. Malt-
seva, G. I. Yakovleva, P. A . Volobaev, L. O . Petunkina,
A. G . Egorov, O. V. Tulchinskaya, I. V. Tarasova; ed.-in-chief
I. M. Krasnoborov. Kemerovo: Book Publ. House. 243 +
[5] p. [In Russian] (Красная книга Кемеровской обла-
сти: Редкие и находящиеся под угрозой исчезновения
виды растений и грибов. 2000 / авт.-с ост. А . Т. Маль-
цева, Г. И . Яковлева, П. А. Волобаев, Л. О . Петункина,
А. Г. Егоров, О. В. Тульчинская, И. В. Тарасова; отв. ред.
И. М . Красноборов. Кемерово: Кн. изд-во. 243 + [5] с.).
Turland N. J., Wiersema J. H ., Barrie F. R., Greuter W., Hawk-
sworth D. L., Herendeen P. S., Knapp S., Kusber W.-H., Li
D.-Z ., Marhold K., May T. W., McNeill J., Monro A. M.,
Prado J., Price M. J ., Smith G. F. (eds.). 2018. International
Code of Nomenclature for algae, fungi, and plants (Shen-
zhen Code) adopted by the Nineteenth International Bo-
tanical Congress, Shenzhen, China, July 2017. Glashütten:
Koeltz Botanical Books. (Regnum Vegetabile. Vol. 159).
https://doi.org/10.12705/Code.2018
Номенклатурные заметки о Myosotis jenissejensis и Myosotis asiatica subsp. kolymensis (Boraginaceae)
Novitates Systematicae Plantarum Vascularium | Volume 50 | 2019
165
Алфавитный указатель новых названий таксонов
Alphabetical index to new taxa names
Agrostis × avatschensis Prob., nothosp. nova 14
Astragalus tergeminus (Knjaz., Kulikov et E. G. Philippov) Knjaz., comb. et stat. nov. 128
Bulbophyllum brachyscapum Aver., sp. nova 26
Caelestium Yurtseva et Mavrodiev, gen. nov. 73
—
lazkovii (Yurtseva et Mavrodiev) Yurtseva et Mavrodiev, comb. nova 74
—
tianschanicum (Chang Y. Yang) Yurtseva et Mavrodiev, comb. nova 74
Corydalis qilianshanica Mikhailova, sp. nova 115
Craniospermum Lehm. sect. Pseudotuvinica Ovczinnikova, sect. nova 151
—
volkovae Ovczinnikova, sp. nova 149
Deschampsia komandorensis Prob., sp. nova 18
Ferula karakumica Geld. et A. V. Pavlenko, sp. nova 141
Hedysarum L. ser. Ucrainica Knjaz., ser. nova 133
—
tarbagataicum Knjaz., sp. novа 135
—
ulutavicum Knjaz., sp. nova 137
—
villosissimum Knjaz., nom. et stat. nov. 139
Hyalopoa amgunensis Prob., sp. nova 18
Myosotis jenissejensis O. D. Nikif., sp. nova 163
Poa × alexandrae Prob., nothosp. nova 19
—
archarensis Prob., sp. nova 22
—
turgensis Prob., sp. nova 22
Salix acutifolia Willd. f. pendula I. V. Belyaeva, N. Y. Stepanova et O. V. Epanch., forma nova 45
Stachys L. subgen. Eriostomum (Hoffmanns. et Link) Krestovsk., stat. nov. 155
Sunipia saccata Aver., sp. nova 36
Thymus chamarensis Vasjukov, sp. nova 158
—
osseticus Vasjukov, sp. nova 161
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50: 166
Указатель обозначенных лектотипов и эпитипов
Index to designated lectotypes and epitypes
После названий таксонов указана категория типа: лектотип (LT) или эпитип (ET) — и авторы, обозна-
чившие типы.
The names of the taxa are followed by the category of type: lectotype (LT) or epitype (ET), and the name(s) of
designating author(s).
Astragalus permiensis C. A. Mey. ex Rupr. — M. S. Knyazev (ET) 127
Hedysarum ucrainicum Kaschm. — M. S. Knyazev (LT II) 137
Liparis caudata Aver. et K. S. Nguyen — L. V. Averyanov (ET) 32
Myosotis asiatica (Vestergr. ex Hultén) Schischk. et Serg. subsp. kolymensis O. D. Nikif. — O. D. Nikiforova (LT) 164
Stachys mucronata Sieber ex Spreng. — T. V. Krestovskaya (LT) 157
2019
50: 167
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
Содержание
Д. В. Гельтман, М. В. Легченко, И. В. Соколова, И. В. Татанов. Юбилейные даты нашего журнала ..
5
Н. С. Пробатова. Новые таксоны Agrostis, Deschampsia, Hyalopoa и Poa (Poaceae) с Дальнего Востока
России и из Восточной Сибири ...................................................................................................................................
14
Л. В. Аверьянов, К. С. Нгуен, Т. В. Майсак, Х. Т. Нгуен, Н. Л. Орлов, Д. Д. Сластунов, И. В. Соколова.
Новые виды орхидных (Orchidaceae) во флоре Лаоса .........................................................................................
25
Н. Ю. Степанова, О. В. Епанчинцева, И. В. Беляева. Salix acutifolia f. pendula (Salicaceae) — новая
форма ....................................................................................................................................................................................
41
O. В. Юрцева, Е. В. Мавродиев. Caelestium, genus novum (Polygonaceae, Polygoneae): обоснование,
представленное по результатам молекулярно-филогенетических анализов трибы Polygoneae,
предпринятых с учетом вторичной структуры локусов ITS1 и ITS2 ядерной рибосомной ДНК .......
47
О. В. Юрцева, Г. А. Лазьков, У. A. Украинская, А. Г. Девятов. Caelestium (Polygonaceae, Polygoneae):
морфологические основания .........................................................................................................................................
80
М. М. Серебряный. К таксономической ревизии рода Trollius (Ranunculaceae) в азиатской части
России. I. Trollius chinensis: критический анализ таксономии и географии ...................................................
101
М. А. Михайлова. Новый вид Corydalis (Fumariaceae) из провинции Ганьсу (Китай) .................................. 115
М. С. Князев. Ревизия секции Helmia рода Astragalus (Fabaceae)......................................................................... 120
М. С. Князев. Виды родства Hedysarum ucrainicum (секция Multicaulia, Fabaceae) ........................................ 132
А. В. Павленко. Ferula karakumica (Apiaceae) — новый вид из Туркменистана ................................................
141
С. В. Овчинникова. Craniospermum volkovae (Boraginaceae) — новый вид из Монголии ..............................
148
Т. В. Крестовская. Заметка о Stachys mucronata (Lamiaceae) и его месте в системе рода .............................
154
В. М. Васюков. Новые виды рода Thymus (Lamiaceae) из Бурятии и Северной Осетии ..............................
158
Номенклатурные заметки
И. В. Соколова, О. Д. Никифорова. Номенклатурные заметки о Myosotis jenissejensis и Myosotis
asiatica subsp. kolymensis (Boraginaceae) ..................................................................................................................... 163
Алфавитный указатель новых названий таксонов ......................................................................................................
166
Указатель обозначенных лектотипов и эпитипов .......................................................................................................
167
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443
2019
50
Contents
D. V. Geltman, M. V. Legchenko, I. V. Sokolova, I. V. Tatanov. Anniversaries of our journal ........................
5
N. S. Probatova. New taxa in Agrostis, Deschampsia, Hyalopoa and Poa (Poaceae) from the Russian Far East
and East Siberia ...................................................................................................................................................................
14
L. V. Averyanov, K. S. Nguyen, T. V. Maisak, H. T. Nguyen, N. L. Orlov, D. D. Slastunov, I. V. Sokolova.
New orchid species (Orchidaceae) in the flora of Laos ..............................................................................................
25
N. Y. Stepanova, O. V. Epanchintseva, I. V. Belyaeva. Salix acutifolia f. pendula (Salicaceae) — a new
form .........................................................................................................................................................................................
41
O. V. Yurtseva, E. V. Mavrodiev. Caelestium, genus novum (Polygonaceae, Polygoneae): evidence bаsed on
the results of molecular phylogenetic analyses of tribe Polygoneae, established with consideration of the
secondary structure of the ITS rDNA regions .............................................................................................................
47
O. V. Yurtseva, G. A. Lazkov, U. A. Ukrainskaja, A. G. Deviatov. Caelestium (Polygonaceae, Polygoneae),
evidence bаsed on morphology.........................................................................................................................................
80
M. M. Serebryanyi. Towards a taxonomic revision of the genus Trollius (Ranunculaceae) in the Asian part of
Russia. I. Trollius chinensis: taxonomic and geographical reconsiderations ..........................................................
101
M. A. Mikhailova. A new species of Corydalis (Fumariaceae) from Gansu (China) ............................................... 115
M. S. Knyazev. Review of the genus Astragalus section Helmia (Fabaceae) ............................................................. 120
M. S. Knyazev. Species of Hedysarum ucrainicum affinity (section Multicaulia, Fabaceae) .................................. 132
A. V. Pavlenko. Ferula karakumica (Apiaceae), a new species from Turkmenistan ................................................
141
S. V. Ovczinnikova. Craniospermum volkovae (Boraginaceae), a new species from Mongolia ............................
148
T. V. Krestovskaya. Taxonomic note on Stachys mucronata (Lamiaceae) and its position in the genus
system .....................................................................................................................................................................................
154
V. M. Vasjukov. New species of the genus Thymus (Lamiaceae) from Buryatia and North Ossetia ...................
158
Nomenclatural notes
I. V. Sokolova, O. D. Nikiforova. Nomenclatural notes on Myosotis jenissejensis and Myosotis asiatica subsp.
kolymensis (Boraginaceae) ................................................................................................................................................ 163
Alphabetical index to new taxa names .................................................................................................................................
166
Index to designated lectotypes and epitypes ......................................................................................................................
167
2019
50
Новости систематики высших растений
Novitates Systematicae Plantarum Vascularium
ISSN 0568-5443